
2008R0440 — SL — 23.07.2012 — 003.001
Ta dokument je mišljen zgolj kot dokumentacijsko orodje in institucije za njegovo vsebino ne prevzemajo nobene odgovornosti
|
UREDBA KOMISIJE (ES) št. 440/2008 z dne 30. maja 2008 o določitvi testnih metod v skladu z Uredbo (ES) št. 1907/2006 Evropskega parlamenta in Sveta o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) (UL L 142, 31.5.2008, p.1) |
spremenjena z:
|
|
|
Uradni list |
||
|
No |
page |
date |
||
|
L 220 |
1 |
24.8.2009 |
||
|
L 324 |
13 |
9.12.2010 |
||
|
L 193 |
1 |
20.7.2012 |
||
UREDBA KOMISIJE (ES) št. 440/2008
z dne 30. maja 2008
o določitvi testnih metod v skladu z Uredbo (ES) št. 1907/2006 Evropskega parlamenta in Sveta o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH)
(Besedilo velja za EGP)
KOMISIJA EVROPSKIH SKUPNOSTI JE –
ob upoštevanju Pogodbe o ustanovitvi Evropske skupnosti,
ob upoštevanju Uredbe (ES) št. 1907/2006 Evropskega parlamenta in Sveta z dne 18. decembra 2006 o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH), o ustanovitvi Evropske agencije za kemikalije ter spremembi Direktive 1999/45/ES ter razveljavitvi Uredbe Sveta (EGS) št. 793/93 in Uredbe Komisije (ES) št. 1488/94 ter Direktive Sveta 76/769/EGS in direktiv Komisije 91/155/EGS, 93/67/EGS, 93/105/ES in 2000/21/ES ( 1 ) ter zlasti člena 13(3) Uredbe,
ob upoštevanju naslednjega:|
(1) |
V skladu z Uredbo (ES) št. 1907/2006 je treba testne metode sprejeti na ravni Skupnosti za namene testiranja snovi, kadar so takšni testi potrebni za pridobitev informacij o bistvenih lastnostih snovi. |
|
(2) |
Direktiva Sveta 67/548/EGS z dne 27. junija 1967 o približevanju zakonov in drugih predpisov v zvezi z razvrščanjem, pakiranjem in označevanjem nevarnih snovi ( 2 ) je v Prilogi V določila metode za ugotavljanje fizikalno-kemijskih lastnosti, toksičnosti in ekotoksičnosti snovi in pripravkov. Priloga V Direktive 67/548/EGS je bila črtana z Direktivo 2006/121/ES Evropskega parlamenta in Sveta z učinkom od 1. junija 2008. |
|
(3) |
Testne metode iz Priloge V k Direktivi 67/548/EGS je treba vključiti v to uredbo. |
|
(4) |
Ta uredba ne izključuje uporabe drugih testnih metod, če je njihova uporaba v skladu s členom 13(3) Uredbe 1907/2006. |
|
(5) |
Načela nadomestitve, zmanjšanja in izboljšanja uporabe živali v postopkih se morajo popolnoma upoštevati pri oblikovanju testnih metod, zlasti če so na voljo ustrezne potrjene metode, ki lahko nadomestijo, zmanjšajo ali izboljšajo poskuse na živalih. |
|
(6) |
Določbe te uredbe so v skladu z mnenjem odbora, ustanovljenega v skladu s členom 133 Uredbe (ES) št. 1907/2006 – |
SPREJELA NASLEDNJO UREDBO:
Člen 1
Testne metode, ki jih je treba uporabiti za namene Uredbe 1907/2006/ES, so določene v Prilogi k tej uredbi.
Člen 2
Komisija bo po potrebi pregledala testne metode iz te uredbe, da se nadomestijo, zmanjšajo ali izboljšajo poskusi na vretenčarjih.
Člen 3
Vsi sklici na Prilogo V k Direktivi 67/548/EGS se razlagajo kot sklici k tej uredbi.
Člen 4
Ta uredba začne veljati dan po objavi v Uradnem listu Evropske unije.
Uporablja se od 1. junija 2008.
PRILOGA
DEL A: METODE ZA DOLOČANJE FIZIKALNO-KEMIJSKIH LASTNOSTI
|
KAZALO |
|
|
A.1 |
TALIŠČE/ZMRZIŠČE |
|
A.2 |
VRELIŠČE |
|
A.3 |
RELATIVNA GOSTOTA |
|
A.4 |
PARNI TLAK |
|
A.5 |
POVRŠINSKA NAPETOST |
|
A.6 |
TOPNOST V VODI |
|
A.8 |
PORAZDELITVENI KOEFICIENT |
|
A.9 |
PLAMENIŠČE |
|
A.10 |
VNETLJIVOST (TRDNE SNOVI) |
|
A.11 |
VNETLJIVOST (PLINI) |
|
A.12 |
VNETLJIVOST (STIK Z VODO) |
|
A.13 |
PIROFORNE LASTNOSTI TRDNIH SNOVI IN TEKOČIN |
|
A.14 |
EKSPLOZIVNE LASTNOSTI |
|
A.15 |
TEMPERATURA SAMOVŽIGA (TEKOČINE IN PLINI) |
|
A.16 |
RELATIVNA TEMPERATURA SAMOVŽIGA ZA TRDNE SNOVI |
|
A.17 |
OKSIDACIJSKE LASTNOSTI (TRDNE SNOVI) |
|
A.18 |
POVPREČNO ŠTEVILO MOLEKULSKE MASE IN PORAZDELITEV MOLEKULSKE MASE POLIMEROV . |
|
A.19 |
VSEBNOST POLIMEROV NIZKE MOLEKULSKE MASE |
|
A.20 |
OBNAŠANJE RAZTOPINE/IZVLEČKA POLIMEROV V VODI |
|
A.21 |
OKSIDATIVNE LASTNOSTI (TEKOČE SNOVI) |
|
A.22. |
GEOMETRIJSKI SREDNJI PREMER GLEDE NA DOLŽINO VLAKEN |
A.1 TALIŠČE/ZMRZIŠČE
1. METODA
Večina opisanih metod temelji na smernici za preskušanje OECD(1). Temeljna načela so navedena v virih (2) in (3).
1.1 UVOD
Opisane metode in naprave se uporabljajo za določanje tališča snovi brez kakršnih koli omejitev glede njihove stopnje čistosti.
Izbira metode je odvisna od narave preskusne snovi. Tako bo omejitveni dejavnik to, ali je snov lahko, težko ali nemogoče uprašiti.
Za nekatere snovi je primernejše določanje zmrzišča ali strdišča in standardi za te meritve so tudi vključeni v to metodo.
Kadar zaradi posebnih lastnosti snovi ni mogoče ustrezno izmeriti nobenega od navedenih parametrov, je morda primerna točka tečenja.
1.2 OPREDELITVE IN ENOTE
Tališče je opredeljeno kot temperatura, pri kateri pride do prehoda iz trdnega v tekoče agregatno stanje pri atmosferskem tlaku, in je enaka zmrzišču.
Ker fazni prehod številnih snovi poteka v temperaturnem območju, se pogosto opiše kot talilno območje.
Pretvorba enot (K v oC)
t = T - 273,15
|
t |
: |
Celzijeva temperatura, stopinja Celzija ( oC) |
|
T |
: |
termodinamična temperatura, kelvin (K) |
1.3 REFERENČNE SNOVI
Referenčnih snovi ni treba uporabiti vsakokrat, ko se preučuje nova snov. Predvsem naj bi se uporabljale za občasno preverjanje učinkovitosti metode in za omogočanje primerjave z rezultati drugih metod.
Nekatere snovi za umerjanje so naštete v virih (4).
1.4 PRINCIP PRESKUSNE METODE
Določi se temperatura (temperaturno območje) faznega prehoda iz trdnega v tekoče stanje ali iz tekočega v trdno stanje. To pomeni, da se med segrevanjem/hlajenjem vzorca preskusne snovi pri atmosferskem tlaku določita temperaturi začetne faze taljenja/zmrzovanja in končne faze taljenja/zmrzovanja. Opisanih je pet vrst metod, to so kapilarna metoda, metode z ogrevalno mizico, metode za določanje zmrzišča, metode termične analize in metoda za določanje točke tečenja (kakor je bila razvita za nafto).
V nekateri primerih je lahko pripravneje izmeriti zmrzišče namesto tališča.
1.4.1 Kapilarna metoda
1.4.1.1 Naprave za merjenje tališča s tekočinsko kopeljo
V kapilarno cevko damo majhno količino drobno zmlete snovi in jo dobro potlačimo. Cevko segrevamo skupaj s termometrom in med dejanskim taljenjem prilagodimo naraščanje temperature na manj kot približno 1 K/min. Določimo začetno in končno talilno temperaturo.
1.4.1.2 Naprave za merjenje tališča s kovinskim blokom
Kakor je opisano v 1.4.1.1, le da sta kapilarna cevka in termometer postavljena v ogrevan kovinski blok; opazujemo ju lahko skozi luknje v bloku.
1.4.1.3 Fotocelična detekcija
Vzorec v kapilarni cevki se avtomatično segreva v kovinskem valju. Skozi luknjo v valju se usmeri žarek svetlobe skozi snov na natančno umerjeno fotocelico. Optične lastnosti večine snovi se med taljenjem spremenijo, prej neprozorne postanejo prozorne. Jakost svetlobe, ki doseže fotocelico, naraste in pošlje signal za konec digitalnemu indikatorju, ki odčitava temperaturo na platinskem uporovnem termometru v grelni komori. Ta metoda ni primerna za nekatere močno obarvane snovi.
1.4.2 Ogrevalna mizica
1.4.2.1 Koflerjeva ogrevalna plošča
Za Koflerjevo ogrevalno ploščo se uporabita dva kosa kovine z različno toplotno prevodnostjo, električno ogrevana, s ploščo, zasnovano tako, da je vzdolž nje sprememba temperature skoraj linearna. Temperatura ogrevalne plošče je lahko od 283 do 573 K in se odčita s posebno napravo, ki vključuje premično kolesce s kazalcem in jezičkom, zasnovano za posamezno ploščo. Za določanje tališča, se snov v tanki plasti nanese neposredno na površino ogrevalne plošče. V nekaj sekundah se pojavi ostra razmejitvena črta med tekočo in trdno fazo. Temperatura na razmejitveni črti se odčita tako, da se nanjo naravna kazalec.
1.4.2.2 Talilni mikroskop
Za določanje tališča z zelo majhnimi količinami materiala se uporablja več mikroskopskih grelnih mizic. Pri večini grelnih mizic se temperatura meri z občutljivim termočlenom, vendar se včasih uporablja tudi živosrebrni termometer. Značilna mikroskopska aparatura z ogrevalnimi mizicami za določanje tališča ima grelno komoro, ki vsebuje kovinsko ploščo, na katero položimo vzorec na objektnem stekelcu. Na sredini kovinske plošče je luknjica, ki omogoča vstop svetlobe s kolektorja mikroskopa. Med uporabo je komora zaprta s stekleno ploščo, ki preprečuje vdor zraka v območje vzorca.
Segrevanje vzorca se uravnava z reostatom. Za zelo natančne meritve pri optično anizotropnih snoveh se lahko uporabi polarizirana svetloba.
1.4.2.3 Metoda z meniskusom
Ta metoda se uporablja posebej za poliamide.
Vizualno se določi temperatura, pri kateri se premakne meniskus silikonskega olja, ki je med ogrevalno mizico in krovnim stekelcem na preskusnem vzorcu poliamida.
1.4.3 Metoda za določanje zmrzišča
Vzorec se da v posebno epruveto, ta pa v aparaturo za določanje zmrzišča. Vzorec se ohlaja in ves čas rahlo meša in v primernih intervalih se meri temperatura. Ko je temperatura pri nekaj zaporednih odčitkih nespremenjena, se ta temperatura (popravljena z upoštevanjem napake termometra) zapiše kot zmrzišče.
Treba je preprečiti podhladitev, in sicer tako da se vzdržuje ravnotežje med trdno in tekočo fazo.
1.4.4 Termična analiza
1.4.4.1 Diferenčna termična analiza (DTA)
Pri tej tehniki se beleži razlika v temperaturi snovi in referenčnega materiala v odvisnosti od temperature, pri čemer se na snovi in na referenčnem materialu izvaja isti nadzorovani temperaturni program. Ko gre vzorec skozi fazni prehod, ki vključuje spremembo entalpije, se ta sprememba pokaže kot endotermni (tališče) ali eksotermni (zmrzišče) odmik od bazne črte zapisa temperature.
1.4.4.2 Diferenčna dinamična kalorimetrija (DSC)
Pri tej tehniki se beleži razlika v vnosu energije v snov in referenčni material v odvisnosti od temperature, pri čemer se na snovi in referenčnem materialu izvaja isti nadzorovani temperaturni program. Ta energija je energija, ki je potrebna za izenačitev temperature snovi in referenčnega materiala. Ko gre vzorec skozi fazni prehod, ki vključuje spremembo entalpije, se ta sprememba pokaže kot endotermni (tališče) ali eksotermni (zmrzišče) odmik od bazne črte zapisa toplotnega pretoka.
1.4.5 Točka tečenja
Ta metoda je bila razvita za nafto in je primerna za oljaste snovi z nizkim tališčem.
Po predhodnem segrevanju se vzorec ohlaja s točno določeno hitrostjo in v intervalih 3 K se opazujejo značilnosti tečenja. Najnižja temperatura, pri kateri se še opazi premikanje snovi, se zapiše kot točka tečenja.
1.5 MERILA KAKOVOSTI
Uporabnost in točnost različnih metod, ki se uporabljajo za določanje tališča/talilnega območja, sta navedeni v naslednji tabeli:
TABELA: UPORABNOST METOD
A. Kapilarne metode
|
Merilna metoda |
Snovi, ki jih je mogoče uprašiti |
Snovi, ki jih ni mogoče zlahka uprašiti |
Temperaturno območje |
Ocenjena točnost (1) |
Veljavni standard |
|
Naprave za merjenje tališča s tekočinsko kopeljo |
da |
le za nekatere |
273 do 573 K |
± 0,3 K |
JIS K 0064 |
|
Naprave za merjenje tališča s kovinskim blokom |
da |
le za nekatere |
293 do > 573 K |
± 0,5 K |
ISO 1218(E) |
|
Fotocelična detekcija |
da |
za številne z uporabo prilagoditvenih naprav |
253 do 573 K |
± 0,5 K |
|
|
(1) Odvisno od vrste instrumenta in stopnje čistosti snovi. |
|||||
B. Metode z ogrevalnimi mizicami in metode za določanje zmrzišča
|
Merilna metoda |
Snovi, ki jih je mogoče uprašiti |
Snovi, ki jih ni mogoče zlahka uprašiti |
Temperaturno območje |
Ocenjena točnost (1) |
Veljavni standard |
|
Koflerjeva ogrevalna plošča |
da |
ne |
283 do > 573 K |
± 1 K |
ANSI/ASTM D 3451-76 |
|
Talilni mikroskop |
da |
le za nekatere |
273 do > 573 K |
± 0,5 K |
DIN 53736 |
|
Metoda z meniskusom |
ne |
posebej za poliamide |
293 do > 573 K |
± 0,5 K |
ISO 1218 (E) |
|
Metode za določanje zmrzišča |
da |
da |
223 do 573 K |
± 0,5 K |
npr. BS 4695 |
|
(1) Odvisno od vrste instrumenta in stopnje čistosti snovi. |
|||||
C. Termična analiza
|
Merilna metoda |
Snovi, ki jih je mogoče uprašiti |
Snovi, ki jih ni mogoče zlahka uprašiti |
Temperaturno območje |
Ocenjena točnost (1) |
Veljavni standard |
|
Diferenčna termična analiza |
da |
da |
173 do 1 273 K |
do 600 K ± 0,5 K do 1 273 K ± 2,0 K |
ASTM E 537-76 |
|
Diferenčna dinamična kalorimetrija |
da |
da |
173 do 1 273 K |
Do 600 K ± 0,5 K do 1 273 K ± 2,0 K |
ASTM E 537-76 |
|
(1) Odvisno od vrste instrumenta in stopnje čistosti snovi. |
|||||
D. Točka tečenja
|
Merilna metoda |
Snovi, ki jih je mogoče uprašiti |
Snovi, ki jih ni mogoče zlahka uprašiti |
Temperaturno območje |
Ocenjena točnost (1) |
Veljavni standard |
|
Točka tečenja |
za nafto in oljaste snovi |
za nafto in oljaste snovi |
223 do 323 K |
± 3,0 K |
ASTM D 97-66 |
|
(1) Odvisno od vrste instrumenta in stopnje čistosti snovi. |
|||||
1.6 OPIS METOD
Postopki skoraj vseh preskusnih metod so opisani v mednarodnih in nacionalnih standardih (glej dodatek 1).
1.6.1 Metode s kapilarno cevko
Kadar se drobno uprašene snovi počasi segrevajo, se običajno pokažejo talilne faze s slike 1.

Pri določanju tališča zapišemo temperaturi na začetku taljenja in v zadnji fazi.
1.6.1.1 Naprave za merjenje tališča s tekočinsko kopeljo
Slika 2 prikazuje vrsto standardizirane steklene aparature za merjenje tališča (JIS K 0064); vse specifikacije so v milimetrih.

Izbrati je treba primerno tekočino. Izbira tekočine je odvisna od tališča, ki se določa, npr. tekoči parafin za tališča do največ 473 K, silikonsko olje za tališča do največ 573 K.
Za tališča, višja od 523 K, se lahko uporabi zmes treh delov žveplove kisline in dveh delov kalijevega sulfata (v masnem razmerju). Pri uporabi take zmesi je treba upoštevati primerne varnostne ukrepe.
Uporabljajo se lahko samo termometri, ki izpolnjujejo zahteve naslednjih ali njim enakovrednih standardov:
ASTM E 1-71, DIN 12770, JIS K 8001.
Suha snov se na drobno upraši v terilnici in da v na enem koncu zataljeno kapilaro, tako da je tesno natlačene snovi v kapilari približno 3 mm. Da bo vzorec enakomerno potlačen, je treba kapilaro z višine približno 700 mm spustiti skozi stekleno cevko navpično na urno steklo.
Napolnjena kapilarna cevka se postavi v kopel, tako da se srednji del bučke termometra z živim srebrom dotika kapilarne cevke na delu, kjer je vzorec. Običajno se kapilarna cevka vstavi v aparaturo pri temperaturi približno 10 K pod tališčem.
Tekočina kopeli se segreva tako, da temperatura narašča približno za 3 K/min. Tekočino je treba mešati. Pri približno 10 K pod pričakovanim tališčem se naraščanje temperature naravna na največ 1 K/min.
Tališče izračunamo na naslednji način:
T = TD + 0,00016 (TD - TĚ) n
pri čemer je:
|
T |
= |
popravljeno tališče v K |
|
TD |
= |
odčitana temperatura na termometru D v K |
|
TE |
= |
odčitana temperatura na termometru E v K |
|
n |
= |
število graduacij živosrebrnega stolpca na termometru D na delu, ki gleda iz tekočine. |
1.6.1.2 Naprave za merjenje tališča s kovinskim blokom
Sestavljajo jo:
— valjast kovinski blok, katerega zgornji del je votel in predstavlja komoro (glej sliko 3),
— kovinski zamašek z dvema ali več luknjami, ki omogočajo vstavljanje cevk v kovinski blok,
— grelni sistem za kovinski blok, na primer z električnim uporom, vgrajenim v blok,
— reostat za uravnavanje dovoda energije, če se uporabi električno gretje,
— štiri okenca iz stekla, odpornega proti vročini, v stranskih stenah komore, diametralno razporejenih pravokotno drug na drugega. Pred enim od okenc je postavljen okular za opazovanje kapilarne cevke. Ostala tri okenca se uporabljajo za osvetljevanje notranjosti komore z žarnicami,
Glej standarde, navedene v 1.6.1.1. Lahko se uporabijo tudi termoelektrični instrumenti s primerljivo točnostjo.
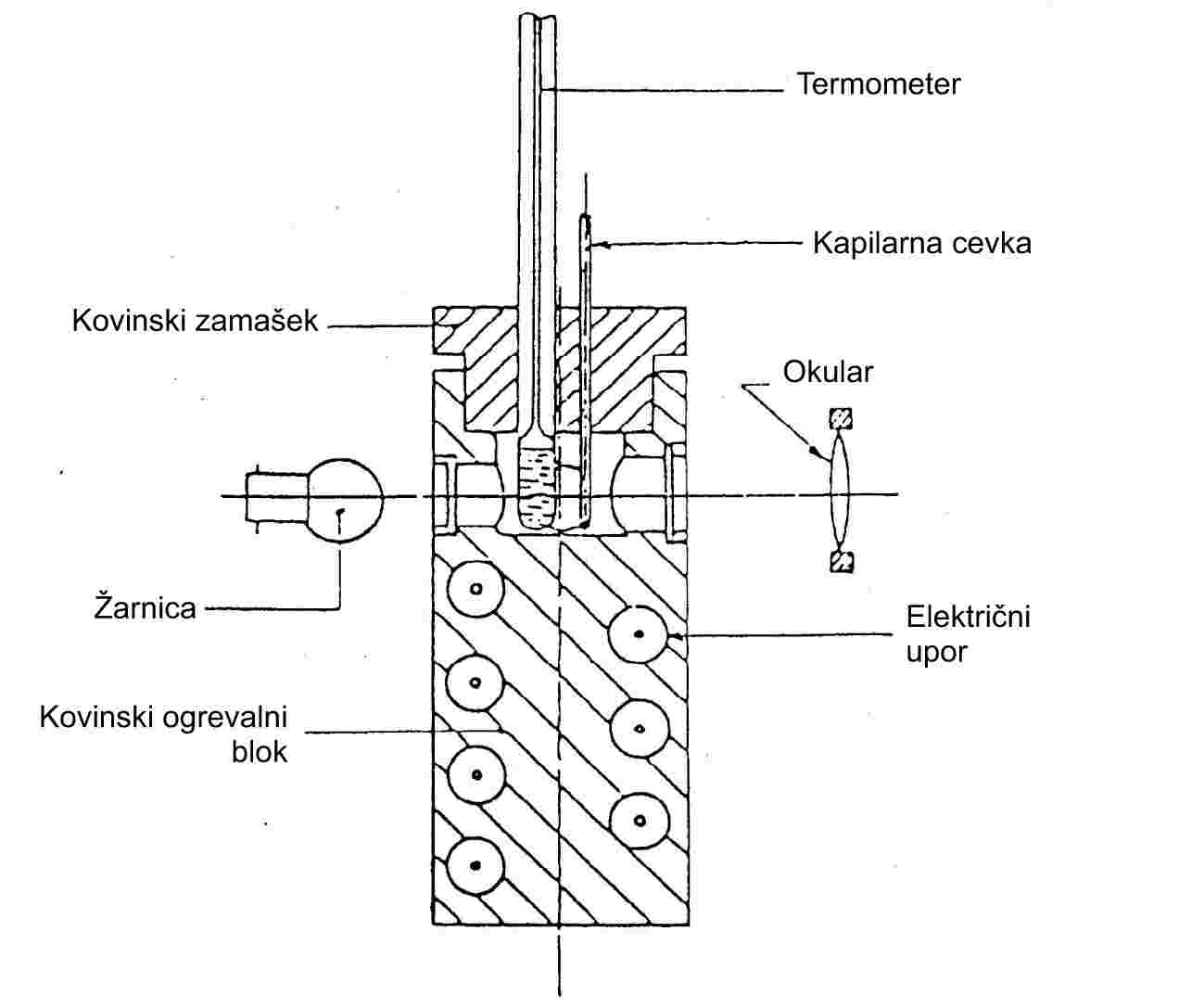
1.6.1.3 Fotocelična detekcija
Aparatura in postopek:
Aparaturo sestavlja kovinska komora z avtomatiziranim grelnim sistemom. Tri kapilarne cevke se napolnijo v skladu z 1.6.1.1 in postavijo v grelno komoro.
Za umerjanje aparature je na voljo več linearnih naraščanj temperature in primerno naraščanje temperature se električno naravna na vnaprej določeno konstantno in linearno hitrost naraščanja. Zapisovalniki kažejo dejansko temperaturo grelne komore in temperaturo snovi v kapilarnih cevkah.
1.6.2 Ogrevalne mizice
1.6.2.1 Koflerjeva ogrevalna plošča
Glej dodatek.
1.6.2.2 Talilni mikroskop
Glej dodatek.
1.6.2.3 Metoda z meniskusom (poliamidi)
Glej dodatek.
Hitrost segrevanja v območju tališča mora biti manjša od 1 K/min.
1.6.3 Metode za določanje zmrzišča
Glej dodatek.
1.6.4 Termična analiza
1.6.4.1 Diferenčna termična analiza
Glej dodatek.
1.6.4.2 Diferenčna dinamična kalorimetrija
Glej dodatek.
1.6.5 Delovanje točke tečenja
Glej dodatek.
2. PODATKI
V nekaterih primerih je potreben popravek termometra.
3. POROČANJE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— uporabljena metoda,
— natančna specifikacija snovi (identiteta in nečistote) ter predhodno prečiščevanje, če je bilo opravljeno,
— ocena točnosti.
Kot tališče se navede srednja vrednost najmanj dveh meritev, ki sta v območju predvidene točnosti (glej tabele).
Če je razlika med temperaturo na začetku taljenja in tisto v zadnji fazi taljenja znotraj meja točnosti metode, se kot tališče navede temperatura v zadnji fazi taljenja; sicer pa se navedeta obe temperaturi.
Če snov razpade ali sublimira, preden se doseže tališče, se navede temperatura, pri kateri so bile opažene te spremembe.
Navesti je treba vse informacije in opombe, pomembne za razlago rezultatov, zlasti glede nečstot in agregatnega stanja snovi.
4. VIRI
(1) OECD, Paris, 1981, Test Guideline 102, Decision of the Council C(81) 30 final.
(2) IUPAC, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London 1975, vol. II, str. 803–834.
(3) R. Weissberger éd.: Technique of organic Chemistry, Physical Methods of Organic Chemistry, 3rd éd., Interscience Publ., New York, 1959, vol. I, Part I, Chapter VII.
(4) IUPAC, Physicochemical measurements: Catalogue of reference materials from national laboratories, Pure and applied chemistry, 1976, vol. 48, str. 505–515.
Dodatek
Dodatne tehnične podrobnosti se lahko poiščejo na primer v naslednjih standardih.
1. Kapilarne metode
1.1 Naprave za merjenje tališča s tekočinsko kopeljo
|
ASTM E 324-69 |
Standard test method for relative initial and final melting points and the melting range of organic chemicals |
|
BS 4634 |
Method for the determination of melting point and/or melting range |
|
DIN 53181 |
Bestimmung des Schmelzintervalles von Harzen nach Kapillarverfahren |
|
JIS K 00-64 |
Testing methods for melting point of chemical products |
1.2 Naprave za merjenje tališča s kovinskim blokom
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
|
ISO 1218 (E) |
Plastics – polyamides – determination of „melting point“ |
2. Ogrevalne mizice
2.1 Koflerjeva ogrevalna plošča
|
ANSI/ASTM D 3451-76 |
Standard recommended practices for testing polymeric powder coatings |
2.2 Talilni mikroskop
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
2.3 Metoda z meniskusom (poliamidi)
|
ISO 1218 (E) |
Plastics – polyamides – determination of „melting point“ |
|
ANSI/ASTM D 2133-66 |
Standard specification for acetal resin injection moulding and extrusion materials |
|
NF T 51-050 |
Résines de polyamides. Détermination du „point de fusion“ méthode du ménisque |
3. Metode za določanje zmrzišča
|
BS 4633 |
Method for the determination of crystallising point |
|
BS 4695 |
Method for Determination of Melting Point of petroleum wax (Cooling Curve) |
|
DIN 51421 |
Bestimmung des Gefrierpunktes von Flugkraftstoffen, Ottokraftstoffen und Motorenbenzolen |
|
ISO 2207 |
Cires de pétrole: détermination de la température de figeage |
|
DIN 53175 |
Bestimmung des Erstarrungspunktes von Fettsäuren |
|
NF T 60-114 |
Point de fusion des paraffines |
|
NF T 20-051 |
Méthode de détermination du point de cristallisation (point de congélation) |
|
ISO 1392 |
Method for the determination of the freezing point |
4. Termična analiza
4.1 Diferenčna termična analiza
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
4.2 Diferečna dinamična kalorimetrija
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
5. Določanje točke tečenja
|
NBN 52014 |
Echantillonnage et analyse des produits du pétrole: Point de trouble et point d'écoulement limite – Monsterneming en ontleding van aardolieproducten: Troebelingspunt en vloeipunt |
|
ASTM D 97-66 |
Standard test method for pour point of petroleum oils |
|
ISO 3016 |
Petroleum oils – Determination of pour point |
A.2 VRELIŠČE
1. METODA
Večina opisanih metod temelji na smernici za preskušanje OECD (1). Temeljna načela so navedena v virih (2) in (3).
1.1 UVOD
Tukaj opisane metode in naprave se lahko uporabljajo za tekoče snovi in snovi z nizkim tališčem, pod pogojem da pri njih ne pride do kemične reakcije pri temperaturah pod vreliščem (na primer avtooksidacije, prerazporeditve, razgradnje itd.). Te metode se lahko uporabljajo za čiste in nečiste tekoče snovi.
Poudarjene so metode s fotocelično detekcijo in termično analizo, ker te metode omogočajo določanje tališča in vrelišča. Poleg tega je meritve mogoče opraviti avtomatsko.
„Dinamična metoda“ ima to prednost, da se lahko uporabi tudi za določanje parnega tlaka ter da ni treba popravljati vrelišča glede na normalni tlak (101,325 kPa), ker se med merjenjem z manostatom lahko naravna normalni tlak.
Opombe:
Vpliv nečistot na določanje vrelišča je v veliki meri odvisen od narave nečistote. Kadar so v vzorcu hlapne nečistote, ki bi lahko vplivale na rezultat, se snov lahko prečisti.
1.2 OPREDELITVE IN ENOTE
Normalno vrelišče je opredeljeno kot temperatura, pri kateri je parni tlak tekočine enak 101,325 kPa.
Če se vrelišče ne meri pri normalnem atmosferskem tlaku, lahko odvisnost parnega tlaka od temperature opisemo s Clausius-Clapeyronovo enačbo:
![]()
pri čemer je:
|
P |
= |
parni tlak snovi v paskalih |
|
AHV |
= |
izparilna toplota v J mol-1 |
|
R |
= |
splošna plinska konstanta = 8,314 J mol-1 K-1 |
|
T |
= |
termodinamična temperatura v K |
Vrelišče se navede glede na zračni tlak med meritvijo.
Pretvorbe
Tlak (enote: kPa)
|
100 kPa |
= |
1 bar = 0,1 MPa (enota „bar“ je še vedno dovoljena, vendar se ne priporoča) |
|
133 Pa |
= |
1 mm Hg = 1 tor (enoti „mm Hg“ in „tor“ nista dovoljeni) |
|
1 atm |
= |
standardna atmosfera = 101 325 Pa (enota „atm“ ni dovoljena). |
Temperatura (enote: K)
t = T - 273,15
|
t |
: |
Celzijeva temperatura, stopinja Celzija ( oC) |
|
T |
: |
termodinamična temperatura, kelvin (K) |
1.3 REFERENČNE SNOVI
Referenčnih snovi ni treba uporabiti vsakokrat, ko se preučuje nova snov. Predvsem naj bi se uporabljale za občasno preverjanje učinkovitosti metode in za omogočanje primerjave z rezultati drugih metod.
Nekatere snovi za umerjanje so naštete v metodah, navedenih v dodatku.
1.4 PRINCIP PRESKUSNE METODE
Pet metod za določanje vrelišča (vreliščnega območja) temelji na merjenju vrelišča, dve pa temeljita na termični analizi.
1.4.1 Določanje z uporabo ebulioskopa
Ebulioskopi so bili prvotno zasnovani za določanje molekulske mase glede na naraščajoče vrelišče, vendar so primerni tudi za natančno merjenje vrelišča. Zelo preprosta aparatura je opisana v ASTM D 1120-72 (glej Dodatek). Tekočina se segrejeva v tej aparaturi v ravnotežnih pogojih pri atmosferskem tlaku, dokler ne zavre.
1.4.2 Dinamična metoda
Ta metoda vključuje merjenje temperature rekondenzacije pare z ustreznim termometrom v povratnem toku med vretjem. Tlak se pri tej metodi lahko spreminja.
1.4.3 Destilacijska metoda za vrelišče
Ta metoda vključuje destilacijo tekočine in merjenje temperature rekondenzacije pare ter določanje količine destilata.
1.4.4 Metoda po Siwoloboffu
Vzorec se segreva v cevki, potopljeni v tekočino toplotne kopeli. V cevko z vzorcem se potopi zataljena kapilara, ki v spodnjem delu vsebuje zračni mehurček.
1.4.5 Fotocelična detekcija
Po Siwoloboffovem principu se izvede avtomatsko fotoelektrično merjenje z uporabo dvigajočih se mehurčkov.
1.4.6 Diferenčna termična analiza
Pri tej tehniki se beleži razlika v temperaturi snovi in referenčnega materiala v odvisnosti od temperature, pri čemer se na snovi in na referenčnem materialu izvaja isti nadzorovani temperaturni program. Ko gre vzorec skozi fazni prehod, ki vključuje spremembo entalpije, se ta sprememba pokaže kot endotermni (vrelišče) odmik od bazne črte zapisa temperature.
1.4.7 Diferenčna dinamična kalorimetrija
Pri tej tehniki se beleži razlika v vnosu energije v snov in referenčni material v odvisnosti od temperature, pri čemer se na snovi in referenčnem materialu izvaja isti nadzorovani temperaturni program. Ta energija je energija, potrebna za izenačitev temperature snovi in referenčnega materiala. Ko gre vzorec skozi fazni prehod, ki vključuje spremembo entalpije, se ta sprememba pokaže kot endotermni (vrelišče) odmik od bazne črte zapisa toplotnega pretoka.
1.5 MERILA KAKOVOSTI
Uporabnost in točnost različnih metod, ki se uporabljajo za določanje vrelišča/vreliščnega območja, sta navedeni v tabeli 1.
Tabela 1
Primerjava metod
|
Merilna metoda |
Ocenjena točnost |
Veljavni standard |
|
Ebulioskop |
ASTMD 1120-72 (1) |
|
|
Dinamična metoda |
± 0,5 K (do 600 K) (2) |
|
|
Destilacijski proces (vreliščno območje) |
± 0,5 K (do 600 K) |
ISO/R 918, DIN 53171, BS 4591/71 |
|
Po Siwoloboffu |
± 2 K (do 600 K) (2) |
|
|
Fotocelična detekcija |
± 0,3 K (do 373 K) (2) |
|
|
Diferenčna termična kalorimetrija |
± 0,5 K (do 600 K) ± 2,0 K (do 1 273 K) |
ASTM E 537-76 |
|
Diferenčna dinamična kalorimetrija |
± 0,5 K (do 600 K) ± 2,0 K (do1 1 273 K) |
ASTM E 537-76 |
|
(1) Ta točnost velja le za enostavne naprave, npr. tisto, opisano v ASTM D 1120-72; lahko se izboljša z bolj preciznimi ebulioskopi. (2) Velja le za čiste snovi. Uporabo v drugačnih razmerah je treba utemeljiti. |
||
1.6 OPIS METOD
Postopki nekaterih preskusnih metod so opisani v mednarodnih in nacionalnih standardih (glej dodatek).
1.6.1 Ebulioskop
Glej dodatek.
1.6.2 Dinamifha metoda
Glej preskusno metodo A.4 za določanje parnega tlaka.
Zapišemo temperaturo vrelišča, ugotovljeno pri tlaku 101,325 kPa.
1.6.3 Destilacijski proces (vreliščno območje)
Glej dodatek.
1.6.4 Metoda po Swiloboffu
Vzorec se segreva v aparaturi za določanje tališča, v cevki s premerom približno 5 mm (slika 1).
Slika 1 prikazuje vrsto standardizirane aparature za določanje tališča in vrelišča (JIS K 0064) (iz stekla, vse specifikacije v milimetrih).

Kapilarna cevka (vreliščna kapilara), stisnjena približno 1 cm nad spodnjim delom, se da v cevko za vzorec. Doda se toliko preskusne snovi, da je stisnjeni del kapilare pod površino tekočine. Cevka z vzorcem, v kateri je vreliščna kapilara, se bodisi pritrdi na termometer z elastiko bodisi fiksira s podporo s strani (glej sliko 2).
|
Slika 2 Princip po Siwoloboffu |
Slika 3 Prilagojeni princip |
|
|
|
Tekočina za kopel se izbere glede na vrelišče. Pri temperaturah do 573 K se lahko uporabi silikonsko olje. Tekoči parafin se lahko uporabi le do 473 K. Segrevanje tekočine kopeli mora biti sprva naravnano tako, da temperatura narašča 3 K/min. Tekočino kopeli je treba mešati. Pri približno 10 K pod pričakovanim vreliščem se segrevanje upočasni, tako da temperatura narašča manj kot 1 K/min. Ko se približujemo vrelišču, začnejo iz vreliščne kapilare hitro izhajati mehurčki.
Vrelišče je temperatura, pri kateri se ob trenutni ohladitvi ustavi izhajanje mehurčkov, tekočina v kapilari pa se začne nenadoma dvigati. Ustrezen odčitek s termometra je vrelišče snovi.
Pri prilagojenem principu (slika 3) se vrelišče določa v tališčni kapilari. Njen konec se raztegne v približno 2 cm dolgo tanko konico (a); vanjo se vsesa majhna količina vzorca. Odprti konec drobne kapilare se zatali, tako da je na koncu ostane zračni mehurček. Med segrevanjem v aparaturi za določanje tališča (b) se zračni mehurček razširi. Vrelišče sovpada s temperaturo, pri kateri zamašek iz snovi doseže nivo površine tekočine kopeli (c).
1.6.5 Fotocelična detekcija
Vzorec se segreva v kapilarni cevki znotraj segrevanega kovinskega bloka.
Skozi ustrezne luknje v bloku se usmeri svetlobni žarek skozi snov na natančno umerjeno fotocelico.
Med naraščanjem temperature vzorca iz vreliščne kapilare izhajajo posamezni mehurčki. Ko se doseže vrelišče, se količina mehurčkov zelo poveča. To povzroči spremembo v jakosti svetlobe, ki jo beleži fotocelica, kar da signal za konec indikatorju, ki odčitava temperaturo s platinskega uporovnega termometra znotraj bloka.
Ta metoda je se posebej uporabna, ker omogoča določanje vrelišča pri temperaturi, nižji od sobne, vse do 253,15 K (–20 oC) ne da bi bilo treba aparaturo kakor koli spreminjati. Instrument moramo le položiti v hladno kopel.
1.6.6 Termična analiza
1.6.6.1 Diferenčna termična analiza
Glej dodatek.
1.6.6.1 Diferenčna dinamična kalorimetrija
Glej dodatek.
2. PODATKI
Pri majhnih odstopanjih od normalnega tlaka (največ ± 5 kPa) se vrelišča normalizirajo na Tn po naslednji enačbi Sidneya Younga:
Tn = T + (fT × Δp)
pri čemer je:
|
Δp |
= |
(101,325 – p) [pazi na predznak] |
|
P |
= |
izmerjeni tlak v kPa |
|
fT |
= |
razmerje med spremembo vrelišča in tlakom v K/kPa |
|
T |
= |
izmerjeno vrelišče v K |
|
Tn |
= |
vrelišče, popravljeno na normalni tlak, v K |
V zgoraj navedenih mednarodnih in nacionalnih standardih so korekcijski faktorji za temperature, fT, in enačbe za njihove približke za mnoge snovi.
Na primer, metoda DIN 53171 navaja naslednje okvirne korekcije za topila v barvah:
Tabela 2
Temperatura – korekcijski faktorji fT
|
Temperatura T (K) |
Korekcijski faktor fT (K/kPa) |
|
323,15 |
0,26 |
|
348,15 |
0,28 |
|
373,15 |
0,31 |
|
398,15 |
0,33 |
|
423,15 |
0,35 |
|
448,15 |
0,37 |
|
473,15 |
0,39 |
|
498,15 |
0,41 |
|
523,15 |
0,44 |
|
548,15 |
0,45 |
|
573,15 |
0,47 |
3. POROČANJE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— uporabljena metoda,
— natančna specifikacija snovi (identiteta in nečistote) in predhodno prečiščevanje, če je bilo opravljeno,
— ocena točnosti.
Kot vrelišče se navede srednja vrednost najmanj dveh meritev, ki sta v območju predvidene točnosti (glej tabelo 1).
Navedejo se izmerjena vrelišča in njihova srednja vrednost ter tlak(i), pri katerih so bile meritve opravljene, v kPa. Tlak naj bo po možnosti blizu normalnemu atmosferskemu tlaku.
Navesti je treba vse informacije in opombe, pomembne za razlago rezultatov, zlasti glede nečistot in agregatnega stanja snovi.
4. VIRI
(1) OECD, Paris, 1981, Test Guideline 103, Decision of the Council C (81) 30 final.
(2) IUPAC, B. Le Neindre, B. Vodar, editions. Experimental thermodynamics, Butterworths, London 1975, Volume II.
(3) R. Weissberger edition: Technique of organic chemistry, Physical methods of organic chemistry, Third Edition, Interscience Publications, New York, 1959, volume I, Part I, Chapter VIII.
Dodatek
Dodatne tehnične podrobnosti se lahko poiščejo na primer v naslednjih standardih:
1. Ebulioskop
1.1 Naprave za merjenje tališča s tekočinsko kopeljo
|
ASTM D 1120-72 |
Standard test method for boiling point of engine anti-freezes |
2. Destilacijski proces (vreliščno območje)
|
ISO/R 918 |
Test Method for Distillation (Distillation Yield and Distillation Range) |
|
BS 4349/68 |
Method for determination of distillation of petroleum products |
|
BS 4591/71 |
Method for the determination of distillation characteristics |
|
DIN 53171 |
Losungsmittel fur Anstrichstoffe, Bestimmung des Siedeverlaufes |
|
NF T 20-608 |
Distillation:determination du rendement et de l'intervalle de distillation |
3. Diferenčna termična analiza in diferenčna dinamična kalorimetrija
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
A.3 RELATIVNA GOSTOTA
1. METODA
Opisane metode temeljijo na smernici za preskušanje OECD (1). Temeljna načela so navedena v viru (2).
1.1 UVOD
Opisane metode za določanje relativne gostote se uporabljajo za trdne in tekoče snovi, brez kakršnih koli omejitev glede njihove stopnje čistosti. Različne metode, ki se uporabijo, so navedene v tabeli 1.
1.2 OPREDELITVE IN ENOTE
Relativna gostota, D4 20, trdnih snovi ali tekočin je razmerje med maso volumna preskusne snovi pri 20 oC in maso enakega volumna vode pri 4 oC. Relativna gostota nima enote.
Gostota snovi, ρ, je količnik njene mase, m, in volumna, V.
Gostota, ρ, se v enotah SI izrazi v kg/m3.
1.3 REFERENČNE SNOVI (1) (3)
Referenčnih snovi ni treba uporabiti vsakokrat, ko se preučuje nova snov. Predvsem naj bi se uporabljale za občasno preverjanje učinkovitosti metode in za omogočanje primerjave z rezultati drugih metod.
1.4 PRINCIP METOD
Uporabljajo se štiri vrste metod.
1.4.1 Vzgonske metode
1.4.1.1 Hidrometer (za tekoče snovi)
Dovolj točno in hitro je gostoto mogoče določiti s plavajočimi hidrometri, ki omogočajo sklepanje o gostoti tekočine glede na globino potopitve z odčitavanjem z graduirane lestvice.
1.4.1.2 Hidrostatska tehtnica (za tekoče in trdne snovi)
Za določitev gostote vzorca se lahko uporabi razlika med njegovo maso, izmerjeno na zraku, in tisto, izmerjeno v primerni tekočini (npr. vodi).
V primeru trdnih snovi je izmerjena gostota reprezentativna le za uporabljeni vzorec. Pri določanju gostote tekočin, telo z znanim volumnom V, najprej stehtamo na zraku, potem pa še v tekočini.
1.4.1.3 Metoda s potopljenim telesom (za tekoče snovi) (4)
Pri tej metodi se gostota tekočine določi iz razlike med rezultati tehtanja tekočine pred in po potopitvi telesa z znanim volumnom vanjo.
1.4.2 Piknometrske metode
Za trdne snovi ali tekočine se lahko uporabijo piknometri različnih oblik in znanih volumnov. Gostota se izračuna iz razlike med maso polnega in maso praznega piknometra ter njegovega znanega volumna.
1.4.3 Piknometer s primerjanjem zraka (za trdne snovi)
Gostota trdne snovi v kakršni koli obliki se lahko izmeri s piknometrom s primerjanjem plina pri sobni temperaturi. Volumen snovi se izmeri na zraku ali v inertnem plinu v valju s spremenljivim umerjenim volumnom. Za izračun gostote se po končanem merjenju volumna opravi ena meritev mase.
1.4.4 Oscilacijski denzitometer (5) (6) (7)
Gostota tekočine se lahko izmeri z oscilacijskim denzitometrom. Mehanski oscilator, oblikovan kot U-cev, naj vibrira s svojo resonančno frekvenco, ki je odvisna od njegove mase. Ko se doda vzorec, se resonančna frekvenca oscilatorja spremeni. Aparaturo je treba umeriti z dvema tekočima snovema, katerih gostoti sta znani. Po možnosti se izbereta snovi, katerih gostoti pokrivata merjeno območje.
1.5 MERILA KAKOVOSTI
Uporabnost različnih metod za določanje relativne gostote je navedena v tabeli.
1.6 OPIS METOD
Primeri standardov, ki so vir dodatnih tehničnih podatkov, so navedeni v dodatku.
Preskusi morajo biti izvedeni pri 20 oC in vključevati najmanj dve meritvi.
2. PODATKI
Glej standarde.
3. POROČANJE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— uporabljena metoda,
— natančna specifikacija snovi (identiteta in nečistote) in predhodno prečiščevanje, če je bilo opravljeno.
Relativna gostota,
![]()
, se navede, kakor je opredeljeno v 1.2, skupaj z agregatnim stanjem merjene snovi.
Navesti je treba vse informacije in opombe, pomembne za razlago rezultatov, zlasti glede nečistot in agregatnega stanja snovi.
Tabela
Uporabnost metod
|
Merilna metoda |
Gostota |
Največja možna dinamična viskoznost |
Veljavni standardi |
|
|
trdna snov |
tekočina |
|||
|
1.4.1.1 Hidrometer |
da |
5 Pa s |
ISO 387, ISO 649-2 NF T 20-050 |
|
|
1.4.1.2 Hidrostatska tehtnica |
||||
|
(a) trdne snovi |
da |
ISO 1183 (A) |
||
|
(b) tekočine |
da |
5 Pa s |
ISO 901 in 758 |
|
|
1.4.1.3 Metoda s potopljenim telesom |
da |
20 Pa s |
DIN 53217 |
|
|
1.4.2 Piknometer |
ISO 3507 |
|||
|
(a) trdne snovi |
da |
ISO 1183(B), NF T 20-053 |
||
|
(b) tekočine |
da |
500 Pa s |
ISO 758 |
|
|
1.4.3 Piknometer s primerjanjem zraka |
di |
DIN 55990 Teil 3, DIN 53243 |
||
|
1.4.4 Oscilacijski denzitometer |
da |
5 Pa s |
||
4. VIRI
(1) OECD, Paris, 1981, Test Guideline 109, Decision of the Council C(81) 30 final.
(2) R. Weissberger ed., Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Chapter IV, Interscience Publ., New York, 1959, vol. I, Part 1.
(3) IUPAC, Recommended reference materials for realization of physico-chemical properties, Pure and applied chemistry, 1976, vol. 48, 508.
(4) Wagenbreth, H., Die Tauchkugel zur Bestimmung der Dichte von Flüssigkeiten, Technisches Messen tm, 1979, vol. II, 427–430.
(5) Leopold, H., Die digitale Messung von Flüssigkeiten, Elektronik, 1970, vol. 19, 297–302.
(6) Baumgarten, D., Füllmengenkontrolle bei vorgepackten Erzeugnissen -Verfahren zur Dichtebestimmung bei flüssigen Produkten und ihre praktische Anwendung, Die Pharmazeutische Industrie, 1975, vol. 37, 717–726.
(7) Riemann, J., Der Einsatz der digital en Dichtemessung im Brauereilaboratorium, Brauwissenschaft, 1976, vol. 9, 253–255.
Dodatek
Glede dodatnih tehničnih podrobnosti so lahko v pomoč na primer naslednji standardi:
1. Vzgonske metode
1.1 Hidrometer
|
DIN 12790, ISO 387 |
Hydrometer; general instructions |
|
DIN 12791 |
Part I: Density hydrometers; construction, adjustment and use Part II: Density hydrometers; standardized sizes, designation Part III: Use and test |
|
ISO 649-2 |
Laboratory glassware: Density hydrometers for general purpose |
|
NF T 20-050 |
Chemical products for industrial use – Determination of density of liquids – Areometric method |
|
DIN 12793 |
Laboratory glassware: range find hydrometers |
1.2 Hidrostatska tehtnica
|
ISO 1183 |
A metode: Methods for determining the density and relative density of plastics excluding cellular plastics |
|
NF T 20-049 |
Chemical products for industrial use – Determination of the density of solids other than powders and cellular products – Hydrostatic balance method |
|
ASTM-D-792 |
Specific gravity and density of plastics by displacement |
|
DIN 53479 |
Testing of plastics and elastomers; determination of density |
|
ISO 901 |
ISO 758 |
|
DIN 51757 |
Testing of mineral oils and related materials; determination of density |
|
ASTM D 941-55, ASTM D 1296-67 and ASTM D 1481-62 |
|
|
ASTM D 1298 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
|
BS 4714 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
1.3 Metoda s potopljenim telesom
|
DIN 53217 |
Testing of paints, varnishes and similar coating materials; determination of density; immersed body method |
2. Piknometrske metode
2.1 Za tekoče snovi
|
ISO 3507 |
Pycnometers |
|
ISO 758 |
Liquid chemical products; determination of density at 20 °C |
|
DIN 12797 |
Gay-Lussac pycnometer (for non-volatile liquids which are not too viscous) |
|
DIN 12798 |
Lipkin pycnometer (for liquids with a kinematic viscosity of less than 100 . 10-6 m2 s-1 at 15 °C) |
|
DIN 12800 |
Sprengel pycnometer (for liquids as DIN 12798) |
|
DIN 12801 |
Reischauer pycnometer (for liquids with a kinematic viscosity of less than 100 . 10-6 m2 s-1 at 20 °C, applicable in particular also to hydrocarbons and aqueous solutions as well as to liquids with higher vapour pressure, approximately 1 bar at 90 °C) |
|
DIN 12806 |
Hubbard pycnometer (for viscous liquids of all types which do not have too high a vapour pressure, in particular also for paints, varnishes and bitumen) |
|
DIN 12807 |
Bingham pycnometer (for liquids, as in DIN 12801) |
|
DIN 12808 |
Jaulmes pycnometer (in particular for ethanol – water mixture) |
|
DIN 12809 |
Pycnometer with ground-in thermometer and capillary side tube (for liquids which are not too viscous) |
|
DIN 53217 |
Testing of paints, varnishes and similar products; determination of density by pycnometer |
|
DIN 51757 |
Point 7: Testing of mineral oils and related materials; determination of density |
|
ASTM D 297 |
Section 15: Rubber products – chemical analysis |
|
ASTM D 2111 |
Method C: Halogenated organic compounds |
|
BS 4699 |
Method for determination of specific gravity and density of petroleum products (graduated bicapillary pycnometer method) |
|
BS 5903 |
Method for determination of relative density and density of petroleum products by the capillary – stoppered pycnometer method |
|
NF T 20-053 |
Chemical products for industrial use – Determination of density of solids in powder and liquids – Pyknometric method |
2.2 Za trdne snovi
|
ISO 1183 |
Method B: Methods for determining the density and relative density of plastics excluding cellular plastics |
|
NF T 20-053 |
Chemical products for industrial use – Determination of density of solids in powder and liquids – Pyknometric method |
|
DIN 19683 |
Determination of the density of soils |
3. Piknometer s primerjanjem zraka
|
DIN 55990 |
Part 3: Prüfung von Anstrichstoffen und ähnlichen Beschichrungsstoffen; Pulverlack; Bestimmung der Dichte |
|
DIN 53243 |
Anstrichstoffe; Chlorhaltige Polymere; Prüfung |
A.4 PARNI TLAK
1. METODA
Ta metoda je enakovredna OECD TG 104 (2004).
1.1 UVOD
Ta revidirana različica metode A.4(1) dodatno vključuje efuzijsko metodo: izotermično termogravimetrijo, namenjeno za snovi z zelo nizkimi tlaki (do 10–10 Pa). Odvisno od zahtev postopka, zlasti pri določanju parnega tlaka snovi z nizkim parnim tlakom, se ponovno ocenijo še drugi postopki za uporabo te metode glede na druga območja uporabe.
V termodinamičnem ravnotežju je parni tlak čiste snovi odvisen samo od temperature. Temeljna načela so opisana drugje (2)(3).
Ni enega samega merilnega postopka, ki bi bil uporaben za celotno območje parnih tlakov od manj kot 10–10 do 105 Pa. Ta metoda vključuje osem metod za merjenje parnega tlaka, ki jih je mogoče uporabiti za različna območja parnih tlakov. Različne metode se primerjajo glede na uporabnost in merilno območje iz tabele 1. Metode se lahko uporabljajo samo za snovi, ki v pogojih preskusa ne razpadejo. Kadar preskusnih metod zaradi tehničnih razlogov ni mogoče uporabiti, se parni tlak lahko tudi oceni, priporočena ocenjevalna metoda je navedena v Dodatku.
1.2 OPREDELITVE IN ENOTE
Parni tlak snovi je opredeljen kot tlak nasičene pare nad trdno ali tekočo snovjo.
Za tlak je treba uporabljati enoto SI, tj. pascal (Pa). V preteklosti uporabljane enote, skupaj s pretvorbnimi faktorji, so navedene spodaj:
|
1 torr |
= |
1 mm Hg |
= |
1,333 × 102 Pa |
|
1 atmosfera |
= |
1,013 × 105 Pa |
||
|
1 bar |
= |
105 Pa |
Enota SI za temperaturo je kelvin (K). Za pretvorbo stopinj Celzija v kelvine se uporablja naslednja formula:
T = t + 273,15
pri čemer je T temperatura v kelvinih ali termodinamična temperatura, t pa temperatura v stopinjah Celzija.
Tabela 1
|
Merilna metoda |
Snovi |
Ocena ponovljivosti |
Ocena obnovljivosti |
Priporočeno območje |
|
|
v trdnem stanju |
v tekočem stanju |
||||
|
Dinamična metoda |
nizko tališče |
Da |
do 25 % 1 do 5 % |
do 25 % 1 do 5 % |
103 Pa do 2 × 103 Pa 2 × 103 Pa do 105 Pa |
|
Statična metoda |
Da |
Da |
5 do 10 % |
5 do 10 % |
10 Pa do 105 Pa 10–2 Pa do 105 Pa (1) |
|
Izoteniskopska metoda |
Da |
Da |
5 do 10 % |
5 do 10 % |
102 Pa do 105 Pa |
|
Efuzijska metoda: parnotlačna tehtnica |
Da |
Da |
5 do 20 % |
do 50 % |
10–3 do 1 Pa |
|
Efuzijska metoda: Knudsenova celica |
Da |
Da |
10 do 30 % |
— |
10–10 do 1 Pa |
|
Efuzijska metoda: izotermična termogravimetrija |
Da |
Da |
5 do 30 % |
do 50 % |
10–10 do 1 Pa |
|
Metoda nasičenega plina |
Da |
Da |
10 do 30 % |
do 50 % |
10–10 do 103 Pa |
|
Metoda z rotorjem |
Da |
Da |
10 do 20 % |
— |
10–4 do 0,5 Pa |
|
(1) Pri uporabi manometra kapacitivnosti |
|||||
1.3 PRINCIP PRESKUSA
V splošnem se parni tlak določa pri različnih temperaturah. V omejenem temperaturnem območju je logaritem parnega tlaka čiste snovi linearna funkcija obratne vrednosti termodinamične temperature v skladu s poenostavljeno Clausius-Clapeyronovo enačbo:
![]()
pri čemer je:
|
p |
= |
parni tlak snovi v pascalih |
|
ΔHv |
= |
izparilna toplota v J mol–1 |
|
R |
= |
splošna plinska konstanta, 8,314 J mol–1 K–1 |
|
T |
= |
termodinamična temperatura v K |
1.4 REFERENČNE SNOVI
Referenčnih snovi ni treba uporabljati. Služijo predvsem za občasno preverjanje učinkovitosti metode, pa tudi za omogočanje primerjave med rezultati različnih metod.
1.5 OPIS METODE
1.5.1 Dinamična metoda (Cottrellova metoda)
1.5.1.1 Princip
Parni tlak se določi z merjenjem vrelišča snovi pri različnih točno določenih tlakih med približno 103 in 105 Pa. Ta metoda se priporoča tudi za določitev vrelišča. Za ta namen je uporabna do 600 K. Vrelišča tekočin so na globini 3 do 4 cm zaradi hidrostatičnega tlaka tekočine približno 0,1 °C višja kot na površini. Pri Cottrellovi metodi (4) se termometer namesti v paro nad površino tekočine, vrela tekočina pa se neprestano črpa prek bučke termometra. Bučko prekriva tanka plast tekočine, ki je v ravnotežju s paro pri atmosferskem tlaku. Termometer zato kaže pravo vrelišče, brez napak zaradi prevelikega segrevanja ali hidrostatičnega tlaka. Črpalka, ki jo je prvič uporabil Cottrell, je prikazana na sliki 1. Vrela tekočina je v cevki A. Platinasta žica B, ki je zatesnjena v dno, spodbuja enakomerno vrenje. Stranska cevka C je napeljana v kondenzator, obloga D pa mrzlemu kondenzu preprečuje stik s termometrom E. Ko tekočina v A vre, se mehurčki in tekočina, ki se ujamejo v liju, preko dveh ročic črpalke F razlijejo čez bučko termometra.
|
Slika 1 |
Slika 2 |
Cottrellova črpalka (4)
A: Termočlen
B: Vakuumski pufrski volumen
C: Merilnik tlaka
D: Vakuum
E: Merilna točka
F: Grelni element, približno 150 W
1.5.1.2 Aparatura
Zelo natančna aparatura, ki uporablja Cottrellov princip, je prikazana na sliki 2. Sestavljena je iz cevke z vrelnim delom v spodnjem delu, hladilnikom v srednjem delu in odtočno cevko ter prirobnico v zgornjem delu. Cottrellova črpalka se namesti v vrelni del, ki se segreva z električnim kartušnim grelnikom. Temperatura se meri s termočlenom v plašču ali uporovnim termometrom, ki se vstavi skozi prirobnico na vrhu. Izhod se poveže s sistemom za urejanje tlaka. Ta je sestavljen iz vakuumske črpalke, pufrskega volumna, manostata za spuščanje dušika za urejanje tlaka in manometra.
1.5.1.3 Postopek
Snov se namesti v vrelni del. Pri neuprašenih trdnih snoveh lahko nastanejo težave, ki pa se včasih lahko odpravijo s segrevanjem hladilnega plašča. Aparatura se zatesni pri robnici in snov razplini. Penečih snovi ni mogoče meriti s to metodo.
Nato se nastavi najnižji želeni tlak ter vključi gretje. Hkrati se senzor temperature poveže z zapisovalnikom.
Ravnotežje je doseženo, ko se pri konstantnem tlaku zabeleži konstantno vrelišče. Preprečiti je treba zlasti sunkovito udarjanje med vrenjem. Poleg tega se mora kondenzacija v hladilniku popolnoma končati. Kadar se določa parni tlak trdnih snovi z nizkim tališčem, je treba paziti, da se hladilnik ne zamaši.
Potem ko se zabeleži točka ravnotežja, se nastavi višji tlak. Postopek se nadaljuje na enak način, dokler ni dosežen tlak 105 Pa (skupaj približno 5 do 10 merilnih točk). Za potrditev je treba ponoviti točke ravnotežja pri padajočih tlakih.
1.5.2 Statična metoda
1.5.2.1 Princip
Pri statični metodi (5) se parni tlak pri termodinamičnem ravnotežju določi pri navedeni temperaturi. Ta metoda je primerna za snovi ter večkomponentne tekočine in trdne snovi v območju od 10–1 do 105 Pa in, ob zadostni pazljivosti, tudi v območju 1 do 10 Pa.
1.5.2.2 Aparatura
Oprema je sestavljena iz kopeli s konstantno temperaturo (z natančnostjo ± 0,2 K), posode za vzorec, povezane z vakuumsko cevjo, manometra in sistema za urejanje tlaka. Komora za vzorec (slika 3a) je povezana z vakuumsko cevjo preko ventila in diferencialnega manometra (U-cevke, ki vsebuje ustrezno manometrsko tekočino), ki služi kot ničelni indikator. Za uporabo v diferencialnem manometru so primerni živo srebro, silikoni in ftalati, odvisno od območja tlaka in kemijskih lastnosti preskusne snovi. Zaradi varovanja okolja pa se je treba uporabi živega srebra izogibati, če je to mogoče. Preskusna snov se ne sme vidno topiti v tekočini v U-cevki ali z njo reagirati. Namesto U-cevke se lahko uporabi merilnik tlaka (slika 3b). Za manometer se lahko uporabijo živo srebro za območje od normalnega zračnega tlaka do 102 Pa ter silikonska olja in ftalati pri območju pod 102 Pa do 10 Pa. Obstajajo tudi drugi merilniki tlaka, ki se lahko uporabljajo pod 102 Pa, membranski manometri, ki se lahko segrevajo, pa se lahko uporabljajo tudi pod 10–1 Pa. Temperatura se meri ob zunanji steni posode z vzorcem ali v sami posodi.
1.5.2.3 Postopek
S pomočjo aparature, kakor je prikazana na sliki 3a, se U-cevka napolni z izbrano tekočino, ki jo je treba pred odčitavanjem razpliniti pri zvišani temperaturi. V aparaturo se da preskusna snov in razplini pri znižani temperaturi. Pri večkomponentnih vzorcih mora biti temperatura dovolj nizka, da se sestava snovi zagotovo ne spremeni. Vzpostavljanje ravnotežja je mogoče pospešiti z mešanjem. Vzorec se lahko ohladi s tekočim dušikom ali suhim ledom, paziti pa je treba, da zrak ali tekočina v črpalki ne kondenzira. Ob odprtem ventilu nad vzorčno posodo se nekaj minut izsesava zrak. Postopek razplinjevanja se po potrebi večkrat ponovi.
|
Slika 3a |
Slika 3b |
Ko se vzorec segreva in je ventil zaprt, parni tlak narašča. To spremeni ravnotežje tekočine v U-cevki. Za izravnavo tega učinka se v aparaturo spusti dušik ali zrak, dokler ni indikator tlaka spet na ničli. Tlak, potreben za to, se lahko odčita z manometra ali zelo preciznega instrumenta. Ta tlak ustreza parnemu tlaku snovi pri tej merilni temperaturi. Pri uporabi aparature, prikazane na sliki 3b, se parni tlak odčita neposredno.
Parni tlak se določi pri ustrezno majhnih temperaturnih intervalih (skupaj približno 5 do 10 merilnih točk) do želenega maksimuma.
Za preveritev je treba meritve ponoviti pri nizkih temperaturah. Če vrednosti, dobljene pri ponovljenih meritvah, ne sovpadajo z dobljeno krivuljo za naraščajočo temperaturo, je to lahko posledica enega od naslednjih vzrokov:
(i) v vzorcu je še vedno zrak (npr. snovi z veliko viskoznostjo) ali snovi z nizkim vreliščem, ki se sprosti(-jo) med segrevanjem;
(ii) v proučevanem temperaturnem območju snov kemično reagira (npr. razpada, polimerizira).
1.5.3 Metoda izoteniskopa
1.5.3.1 Princip
Izoteniskop (6) temelji na principu statične metode. Ta metoda zajema namestitev vzorca v bučko, v kateri se ohranja konstantna temperatura in ki je povezana z manometrom ter vakuumsko črpalko. Nečistoče, ki so bolj hlapne kot snov, se odstranijo z razplinjevanjem pri znižanem tlaku. Parni tlak vzorca pri izbranih temperaturah se uravnava z znanim tlakom inertnega plina. Izoteniskop je bil razvit za merjenje parnega tlaka določenih tekočih ogljikovodikov, vendar ga je mogoče uporabiti tudi za proučevanje trdnih snovi. Ta metoda običajno ni primerna za večkomponentne sisteme. Pri vzorcih, ki vsebujejo nehlapne nečistoče, lahko rezultati vsebujejo majhne napake. Priporočeno območje je od 102 do 105 Pa.
1.5.3.2 Aparatura
Primer merilne naprave je prikazan na sliki 4. Popoln opis je mogoče najti v ASTM D 2879–86 (6).
1.5.3.3 Postopek
Pri tekočinah se sama snov uporabi kot tekočina v diferencialnem manometru. V izoteniskop se vlije zadostna količina tekočine, da se napolnita bučka in krajši krak manometrskega dela. Izoteniskop se pritrdi na vakuumski sistem in odzrači, nato pa napolni z dušikom. Odzračevanje in splakovanje sistema se dvakrat ponovi, da se odstrani ves kisik. Napolnjen izoteniskop se postavi v vodoraven položaj, tako da se vzorec razlije v tanko plast v vzorčni bučki in manometrskem delu. Tlak v sistemu se zmanjša na 133 Pa in vzorec se počasi segreva, dokler ravno ne začne vreti (odstranitev raztopljenih plinov). Izoteniskop se nato postavi tako, da se vzorec vrne v bučko in krajši krak manometra ter se oba popolnoma napolnita s tekočino. Vzdržuje se tlak 133 Pa. Podaljšana konica bučke z vzorcem se segreva nad majhnim plamenom, dokler se sproščene pare vzorca toliko ne razširijo, da izpodrinejo del vzorca iz zgornjega dela bučke in kraka manometra, ga potisnejo v manometrski del izoteniskopa, in tako ustvarijo s parami nasičen prostor brez dušika. Izoteniskop se nato postavi v kopel s konstantno temperaturo, tlak dušika pa se naravna tako, da je enak tlaku vzorca. Ob ravnotežju je parni tlak dušika enak parnemu tlaku snovi.
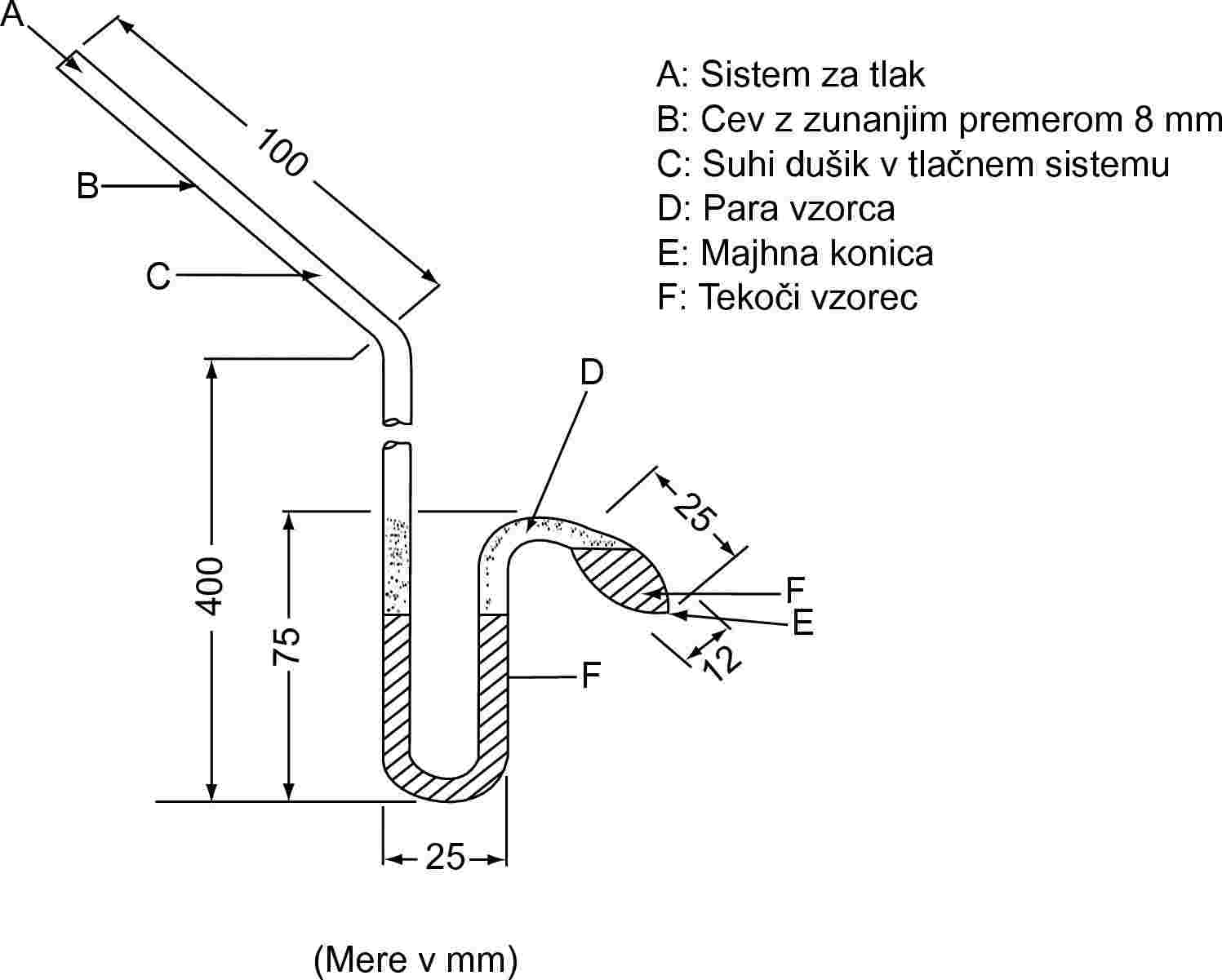
Pri trdnih snoveh se odvisno od območja tlaka in temperature uporabljajo manometrske tekočine, kot so silikonske tekočine ali ftalati. Izboklina na daljšem kraku izoteniskopa se napolni z razplinjeno manometrsko tekočino. Potem se preskusna trdna snov da v bučko in razplini pri zvišani temperaturi. Nato se izoteniskop nagne tako, da manometrska tekočina steče v U-cevko.
1.5.4 Efuzijska metoda: parnotlačna tehtnica (7)
1.5.4.1 Princip
Vzorec preskusne snovi se segreje v majhni peči in namesti v odzračen stekleni zvon. Peč se pokrije s pokrovom, na katerem so majhne luknje z znanimi premeri. Para snovi, ki uhaja skozi eno izmed lukenj, se usmeri v skodelico zelo natančne tehtnice, ki je tudi zaprta v odzračenem steklenem zvonu. Pri nekaterih različicah je skodelica tehtnice obdana s hladilno posodo, ki zagotavlja odvajanje toplote navzven s termično prevodnostjo, in se ohlaja s sevanjem, zato da uhajajoča para kondenzira na njej. Moment curka pare deluje kot sila na tehtnico. Tlak pare je mogoče izpeljati na dva načina: neposredno od sile na skodelico tehtnice, pa tudi iz hitrosti izparevanja s pomočjo Hertz-Knudsenove enačbe (2):

pri čemer je:
|
G |
= |
hitrost izhlapevanja (kg s–1 m–2) |
|
M |
= |
molska masa (g mol–1) |
|
T |
= |
temperatura (K) |
|
R |
= |
splošna plinska konstanta (J mol–1 K–1) |
|
p |
= |
parni tlak (Pa) |
Priporočeno območje je od 10–3 do 1 Pa.
1.5.4.2 Aparatura
Glavni princip aparature je prikazan na sliki 5.

|
A: |
Osnovna plošča |
F: |
Hladilna posoda in hladilna palica |
|
B: |
Inštrument z vrtljivo tuljavo |
G: |
Uparjalna peč |
|
C: |
Stekleni zvon |
H: |
Dewarjeva posoda s tekočim dušikom |
|
D: |
Tehtnica s skodelico |
I: |
Merjenje temperature vzorca |
|
E: |
Naprava za merjenje vakuuma |
J: |
Preskusna snov |
1.5.5 Efuzijska metoda: Knudsenova celica
1.5.5.1 Princip
Ta metoda temelji na oceni mase preskusne snovi, ki v obliki pare zapusti Knudsenovo celico (8) v časovni enoti skozi mikroodprtino v pogojih ultra visokega vakuuma. Masa izhajajoče pare se lahko ugotovi tako, da se bodisi določi izguba mase celice bodisi kondenzira para pri nizki temperaturi in določi količina izhlapele snovi s kromatografsko analizo. Parni tlak se izračuna z uporabo Hertz-Knudsenovega razmerja (glej točko 1.5.4.1) s korekcijskimi faktorji, ki so odvisni od parametrov aparature (9). Priporočeno območje je 10–10 to 1 Pa (10)(11)(12)(13)(14).
1.5.5.2 Aparatura
Glavni princip aparature je prikazan na sliki 6.

|
1: |
Povezava z vakuumom |
7: |
Navojni pokrov |
|
2: |
Luknje v platinskem uporovnem termometru ali sistemi za merjenje in nadzorovanje temperature |
8: |
Krilne matice |
|
3: |
Pokrov vakuumske posode |
9: |
Vijaki |
|
4: |
O-tesnilo |
10: |
Efuzijske celice iz nerjavečega jekla |
|
5: |
Aluminijasta vakuumska posoda |
11: |
Grelni vložki |
|
6: |
Naprava za pritrjevanje in odstranjevanje efuzijskih celic |
1.5.6 Efuzijska metoda: izotermična termogravimetrija
1.5.6.1 Princip
Ta metoda temelji na določitvi pospešenih hitrosti izhlapevanja preskusne snovi pri povišanih temperaturah in zračnem tlaku s postopkom termogravimetrije (10)(15)(16)(17)(18)(19)(20). Hitrosti izhlapevanja vT nastanejo pri izpostavljanju izbrane snovi počasi tekoči atmosferi inertnega plina in spremljanju izgube teže pri opredeljenih izotermičnih temperaturah T v kelvinih v ustreznih časovnih obdobjih. Parni tlaki pT se izračunajo iz vrednosti vT na podlagi linearnega razmerja med logaritmom parnega tlaka in logaritmom hitrosti izhlapevanja. Po potrebi se izvede ekstrapolacija na temperaturi 20 in 25 °C s pomočjo regresijske analize log pT v odvisnosti od 1/T. Ta metoda je primerna za snovi s parnimi tlaki do 10–10 Pa (10–12 mbar) in s čistostjo, ki je kar najbližje 100 %, da ne pride do napačne razlage izmerjenih izgub teže.
1.5.6.2 Aparatura
Glavni princip postavitve preskusa je prikazan na sliki 7.
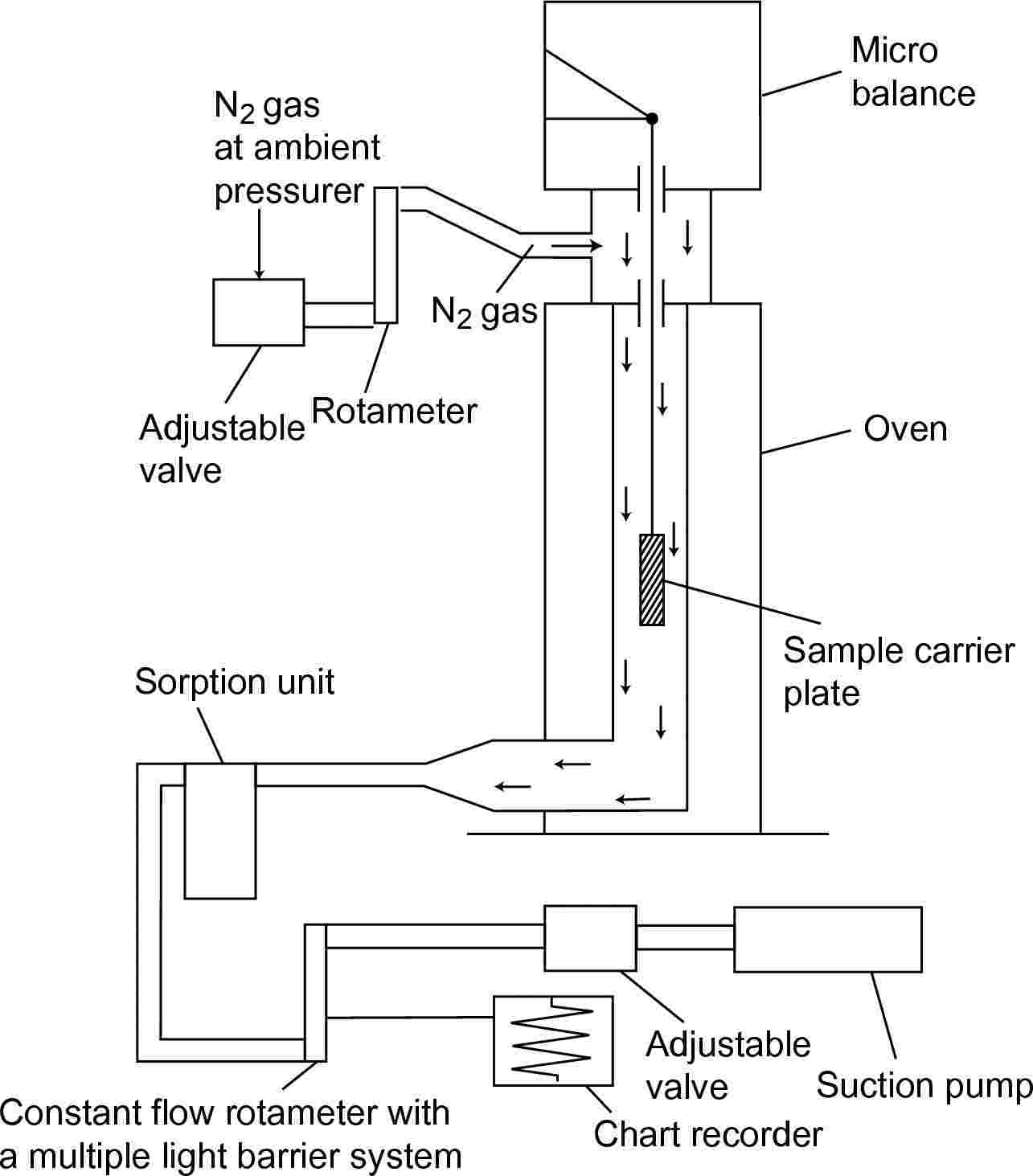
Mimo nosilne plošče z vzorcem, obešene na mikrotehtnici v komori s stalno temperaturo, je speljan tok suhega dušikovega plina, ki odnaša uparjene molekule preskusne snovi. Ko plinski tok zapusti komoro, se očisti v napravi za sorpcijo.
1.5.6.3 Postopek
Preskusna snov se nanese na površino hrapave steklene plošče v enakomerni plasti. Pri trdnih snoveh se plošča enakomerno zmoči z raztopino snovi v ustreznem topilu in posuši v inertni atmosferi. Za izvedbo meritev se prevlečena plošča obesi v termogravimetrični analizator, nato pa se izguba teže neprekinjeno meri kot funkcija časa.
Hitrost izparevanja vT pri dani temperaturi se izračuna iz zmanjšanja mase Δm plošče z vzorcem s pomočjo naslednje enačbe:
![]()
kjer je F površina prevlečenih preskusnih snovi, običajno površina plošče z vzorcem, t pa je čas, v katerem se je masa zmanjšala za Δm.
Parni tlak pT se izračuna na podlagi njegove funkcije hitrosti izparevanja vT:
Log pT = C + D log vT
kjer sta C in D konstanti, specifični za uporabljeno preskusno postavitev in odvisni od premera merilne komore ter hitrosti pretoka plina. Ti konstanti se določita enkrat, in sicer z merjenjem nabora snovi z znanimi parnimi tlaki in regresijo log pT v odvisnosti od log vT (11)(21)(22).
Razmerje med parnim tlakom pT in temperaturo T v kelvinih je podano z
Log pT = A + B 1/T
kjer sta A in B konstanti, pridobljeni z regresijo log pT v odvisnosti od 1/T. S to enačbo je mogoče z interpolacijo izračunati parni tlak za katero koli drugo temperaturo.
1.5.7 Metoda z nasičenjem plina (23)
1.5.7.1 Princip
Inertni plin se pri sobni temperaturi in pri znanem pretoku spelje skozi oziroma čez vzorec preskusne snovi, in sicer dovolj počasi, da se zagotovi nasičenje. Ključnega pomena je, da v plinski fazi nastopi nasičenje. Prenesena snov se ujame, običajno s pomočjo sorbenta, nato se določi njena količina. Za določitev količine snovi, ki jo prenese znana količina nosilnega plina, se namesto lovljenja pare in poznejše analize lahko uporabijo neposredne analitske tehnike, kot je kromatografija. Parni tlak se izračuna ob predpostavki, da se upošteva zakon idealnega plina in da je skupni tlak mešanice plinov enak vsoti tlakov posameznih plinov. Delni tlak preskusne snovi, tj. parni tlak, se izračuna iz znane skupne prostornine plina in iz teže prenesenega materiala.
Postopek z nasičenjem plina se lahko uporablja za trdne ali tekoče snovi. Uporabiti ga je mogoče za parne tlake do 10–10 Pa (10)(11)(12)(13)(14). Metoda je najzanesljivejša za parne tlake, nižje od 103 Pa. Pri tlakih nad 103 Pa so parni tlaki običajno precenjeni, najverjetneje zato, ker se tvorijo aerosoli. Ker se meritve parnega tlaka izvajajo pri sobni temperaturi, ni potrebe za ekstrapolacijo podatkov iz visokih temperatur, zato se ekstrapolacija pri visokih temperaturah, ki pogosto povzroča resne napake, ne izvaja.
1.5.7.2 Aparatura
Ta postopek zahteva uporabo posode s konstantno temperaturo. Na skici na sliki 8 je prikazana posoda s tremi pripravami za trdne in tremi pripravami za tekoče vzorce, ki omogočajo trojno analizo trdnega ali tekočega vzorca. Natančnost nadzora temperature je na ± 0,5 °C ali boljša.

Običajno se za inertni nosilni plin uporablja dušik, občasno pa je treba uporabiti tudi kak drug plin (24). Nosilni plin mora biti suh. Tok plina se razdeli na 6 tokov, ki jih nadzirajo igelni ventili (z odprtino približno 0,79 mm), in teče v posodo po 3,8 mm i.d. bakreni cevi. Po izenačitvi temperature plin teče skozi vzorec in sorbentno past, nato pa zapusti posodo.
Trdni vzorci se namestijo v 5 mm i.d. stekleno cev med čepe iz steklene volne (glej sliko 9). Na sliki 10 sta prikazana naprava za tekoče vzorce in sorbentni sistem. Najbolj ponovljiva metoda za merjenje parnega tlaka tekočin je, da se tekočina nanese na steklene kroglice ali na inerten sorbent, kot je na primer silicijev oksid, nato pa se naprava napolni s temi kroglicami. Alternativno se lahko nosilni plin spelje mimo hrapavega frita in v obliki mehurčkov skozi steber tekoče preskusne snovi.
|
Slika 9 |
Slika 10 |
Sorbentni sistem ima sprednji in pomožni sorbentni del. Pri zelo nizkih parnih tlakih sorbent zadrži le majhne količine, zato lahko adsorpcija na stekleni volni in steklenih ceveh med vzorcem in sorbentom povzroča velike težave.
Pasti, ohlajene s trdnim CO2, so še en učinkovit način za zbiranje uparjenega materiala. Ne povzročajo protitlaka na saturacijsko kolono, prav tako pa je mogoče zelo enostavno kvantitativno odstraniti ujeti material.
1.5.7.3 Postopek
Pretok iztočnega nosilnega plina se meri pri sobni temperaturi. Pretok se med preskusom pogosto preverja, da se zagotovi pravilna vrednost za skupno prostornino nosilnega plina. Zaželeno je spremljanje ves čas z merilnikom masnega pretoka. Nasičenje plinske faze lahko zahteva dolg čas stika in zato precej nizke hitrosti pretoka plina (25).
Ob koncu poskusa se sprednji in pomožni sorbentni del analizirata ločeno. Snov v vsakem delu se desorbira s topilom. Nastali raztopini se kvantitativno analizirata, da se določi teža desorpcije vsakega dela. Izbira analitične metode (prav tako tudi izbira sorbenta in desorbentne raztopine) je odvisna od vrste preskusnega materiala. Učinkovitost desorpcije se določi tako, da se znana količina vzorca injicira na sorbent, desorbira, nato pa analizira preostala količina. Pomembno je, da se preskusi učinkovitost desorpcije pri (ali blizu) koncentraciji vzorca pod preskusnimi pogoji.
Da se zagotovi nasičenost nosilnega plina s preskusno snovjo, se uporabijo tri različne hitrosti pretoka plina. Če izračunani parni tlak ne kaže odvisnosti od pretoka, se predpostavlja, da je nasičen.
Parni tlak se izračuna po enačbi:
![]()
pri čemer je:
|
p |
= |
parni tlak (Pa) |
|
W |
= |
masa uparjene preskusne snovi (g) |
|
V |
= |
volumen nasičenega plina (m3) |
|
R |
= |
splošna plinska konstanta 8,314 (J mol–1 K–1) |
|
T |
= |
temperatura (K) |
|
M |
= |
molska masa preskusne snovi (g mol–1) |
Izmerjene volumne je treba popraviti glede na razlike v tlaku in temperaturi med merilnikom pretoka in saturatorjem.
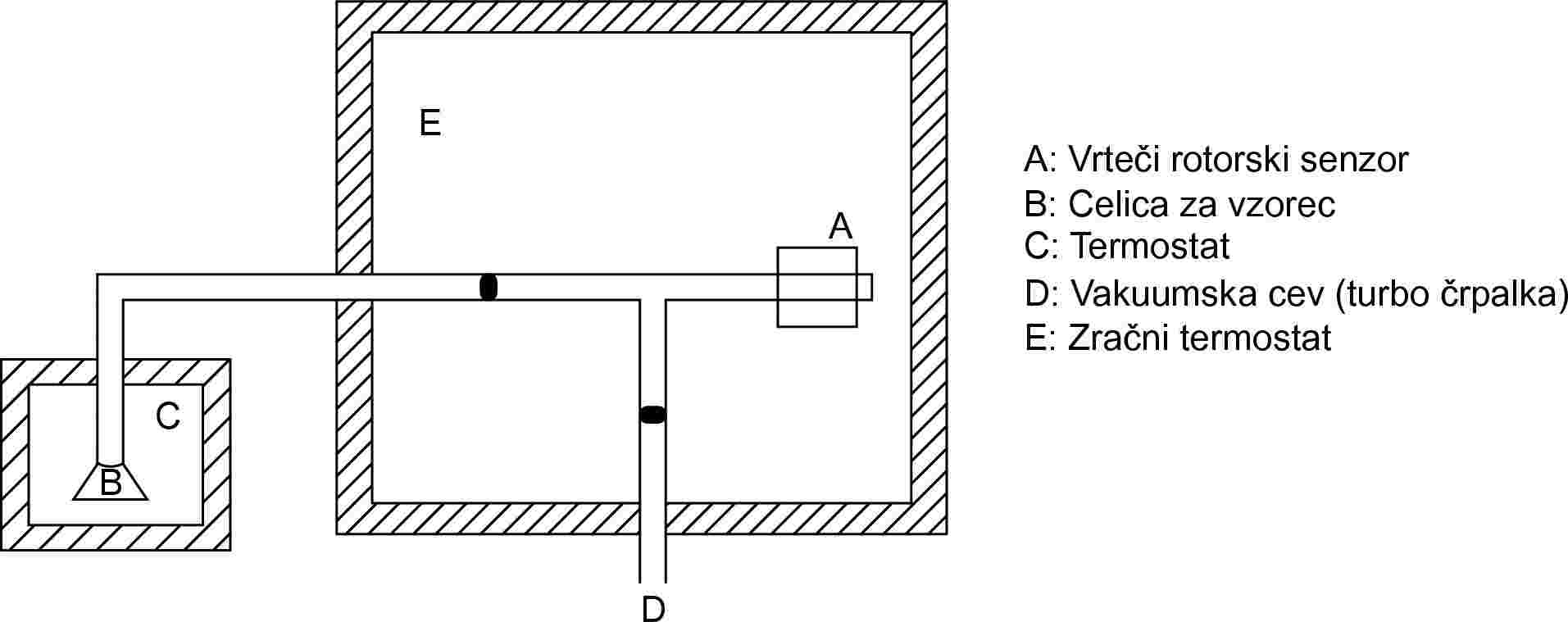
1.5.8 Rotorska metoda
1.5.8.1 Princip
Pri tej metodi se uporablja merilnik viskoznosti z rotorjem, v katerem je merilni element jeklena kroglica, postavljena v magnetno polje, tako da lebdi, njeno vrtenje pa povzročajo rotirajoča polja tuljave (26)(27)(28). Merjenje hitrosti njenega vrtenja omogočajo sprejemne tuljave. Ko kroglica doseže določeno hitrost vrtenja, običajno približno 400 vrtljajev na sekundo, se ustavi dotok energije in zaradi trenja, ki ga povzroča plin, se vrtenje upočasni. Padec vrtilne hitrosti se meri kot funkcija časa. Parni tlak se izpelje iz padca hitrosti kroglice, ki je posledica tlaka. Priporočeno območje je od 10–4 do 0,5 Pa.
1.5.8.2 Aparatura
Shema postavitve preskusa je prikazana na sliki 11. Merilnik se postavi v posodo s konstantno temperaturo, ki se uravnava na 0,1 °C natančno. Posoda z vzorcem se postavi v ločeno posodo, ki se tudi uravnava na 0,1 °C natančno. Vsi ostali deli sestava pa se vzdržujejo pri višji temperaturi, da se prepreči kondenzacija. Celotna aparatura je priključena na visokovakuumski sistem.
2. PODATKI IN POROČANJE
2.1 PODATKI
Pri kateri koli od navedenih metod je treba parni tlak določiti pri najmanj dveh temperaturah. Za preverjanje linearnosti krivulje parnega tlaka so zaželene najmanj tri temperature v območju od 0 do 50 °C. Pri efuzijski metodi (Knudsenova celica in izotermična termogravimetrija) in metodi z nasičenjem plina se priporoča temperaturno območje od 120 do 150 °C, namesto od 0 do 50 °C.
2.2 POROČANJE
V poročilo o preskusu se vključijo naslednje informacije:
— uporabljena metoda,
— natančna specifikacija snovi (identiteta in nečistoče) in predhodno prečiščevanje, če je bilo opravljeno,
— najmanj po dve vrednosti parnega tlaka in temperature, če je mogoče, pa tri ali več, v območju 0 do 50 °C (ali od 120 do 150 °C),
— vsaj ena od temperatur mora biti 25 °C ali manj, če je tehnično izvedljivo v skladu z izbrano metodo,
— vsi neobdelani podatki,
— krivulja log p v odvisnosti od 1/T,
— ocenjeni parni tlak pri 20 ali 25 °C.
Če pride do prehoda (spremembe stanja, razpada), je treba navesti naslednje podatke:
— vrsta spremembe,
— temperatura, pri kateri pride do spremembe pri atmosferskem tlaku,
— parni tlak pri 10 in 20 °C pod temperaturo prehoda in pri 10 in 20 °C nad to temperaturo (razen če gre za prehod iz trdnega v plinasto agregatno stanje).
Navesti je treba vse informacije in opombe, pomembne za razlago rezultatov, zlasti glede nečistot in agregatnega stanja snovi.
3. VIRI
(1) Uradni list Evropskih skupnosti, L 383 A, 26–47 (1992).
(2) Ambrose, D. (1975). Experimental Thermodynamics, Vol. II, Le Neindre, B., in Vodar, B., Eds., Butterworths, London.
(3) Weissberger R., ed. (1959). Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Vol. I, Part I. Chapter IX, Interscience Publ., New York.
(4) Glasstone, S. (1946). Textbook of Physical Chemistry, 2nd ed., Van Nostrand Company, New York.
(5) NF T 20–048 AFNOR (September 1985). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within a range from 10–1 to 105 Pa – Static method.
(6) ASTM D 2879–86, Standard test method for vapour pressure – temperature relationship and initial decomposition temperature of liquids by isoteniscope.
(7) NF T 20–047 AFNOR (September 1985). Chemical products for industrial use –Determination of vapour pressure of solids and liquids within range from 10–3 to 1 Pa – Vapour pressure balance method.
(8) Knudsen, M. (1909). Ann. Phys. Lpz., 29, 1979; (1911), 34, 593.
(9) Ambrose, D., Lawrenson, I.J., Sprake, C.H.S. (1975). J. Chem. Thermodynamics 7, 1173.
(10) Schmuckler, M.E., Barefoot, A.C., Kleier, D.A., Cobranchi, D.P. (2000), Vapor pressures of sulfonylurea herbicides; Pest Management Science 56, 521–532.
(11) Tomlin, C.D.S. (ed.), The Pesticide Manual, Twelfth Edition (2000)
(12) Friedrich, K., Stammbach, K., Gas chromatographic determination of small vapour pressures determination of the vapour pressures of some triazine herbicides. J. Chromatog. 16 (1964), 22–28.
(13) Grayson, B.T., Fosbraey, L.A., Pesticide Science 16 (1982), 269–278.
(14) Rordorf, B.F., Prediction of vapor pressures, boiling points and enthalpies of fusion for twenty-nine halogenated dibenzo-p-dioxins, Thermochimia Acta 112 Issue 1 (1987), 117–122.
(15) Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection; Pesticide Science 4 (1973) 137–147.
(16) Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection II. Application to Formulated Products; Pesticide Science 5 (1974) 393–400.
(17) Gückel, W., Kaestel, R., Lewerenz, J., Synnatschke, G., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection. Part III: The Temperature Relationship between Vapour Pressure and Evaporation Rate; Pesticide Science 13 (1982) 161–168.
(18) Gückel, W., Kaestel, R., Kroehl, T., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part IV: An Improved Thermogravimetric Determination Based on Evaporation Rate; Pesticide Science 45 (1995) 27–31.
(19) Kroehl, T., Kaestel, R., Koenig, W., Ziegler, H., Koehle, H., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part V: Thermogravimetry Combined with Solid Phase MicroExtraction (SPME); Pesticide Science, 53 (1998) 300–310.
(20) Tesconi, M., Yalkowsky, S.H., A Novel Thermogravimetric Method for Estimating the Saturated Vapor Pressure of Low-Volatility Compounds; Journal of Pharmaceutical Science 87(12) (1998) 1512–20.
(21) Lide, D.R. (ed.), CRC Handbook of Chemistry and Physics, 81th ed.(2000), Vapour Pressure in the Range -25 °C to 150 °C.
(22) Meister, R.T. (ed.), Farm Chemicals Handbook, Vol. 88 (2002).
(23) 40 CFR, 796. (1993). pp 148–153, Office of the Federal Register, Washington DC.
(24) Rordorf B.F. (1985). Thermochimica Acta 85, 435.
(25) Westcott et al. (1981). Environ. Sci. Technol. 15, 1375.
(26) Messer G., Röhl, P., Grosse G., in Jitschin W. (1987). J. Vac. Sci. Technol. (A), 5(4), 2440.
(27) Comsa G., Fremerey J.K., in Lindenau, B. (1980). J. Vac. Sci. Technol. 17(2), 642.
(28) Fremerey, J.K. (1985). J. Vac. Sci. Technol. (A), 3(3), 1715.
Dodatek
Ocenjevalna metoda
UVOD
Izračunane vrednosti parnega tlaka se lahko uporabijo:
— za izbiro primerne preskusne metode,
— za pridobitev ocene ali mejne vrednosti v primerih, kadar preskusne metode ni mogoče uporabiti zaradi tehničnih razlogov.
OCENJEVALNA METODA
Parni tlak tekočin in trdnih snovi se lahko oceni z uporabo prilagojene Watsonove korelacije (a). Edini potrebni s preskusom pridobljeni podatek je normalno vrelišče. Metoda je uporabna za območje tlaka od 105 Pa do 10–5 Pa.
Podrobne informacije o metodi so navedene v „Priročniku metod za ocenjevanje kemijskih lastnosti“ (b). Glej tudi OECD Environmental Monograph št. 67 (c).
RAČUNSKI POSTOPEK
Parni tlak se izračuna na naslednji način:

pri čemer je:
|
T |
= |
izbrana temperatura |
|
Tb |
= |
normalno vrelišče |
|
Pvp |
= |
parni tlak pri temperaturi T |
|
ΔHvb |
= |
izparilna toplota |
|
ΔZb |
= |
faktor stisljivosti (ocenjen na 0,97) |
|
m |
= |
empirični faktor, odvisen od agregatnega stanja pri izbrani temperaturi |
Nadalje
![]()
pri čemer je KF empirični faktor, ki upošteva polarnost snovi. V viru (b) so navedeni faktorji KF za več spojin.
Precej pogosto so na voljo podatki o vrelišču pri znižanem tlaku. Pri takih primerih se parni tlak izračuna na naslednji način:

pri čemer je T1 vrelišče pri znižanem tlaku P1.
POROČILO
Pri uporabi ocenjevalne metode, poročilo vključuje izčrpno dokumentacijo izračuna.
VIRI
(a) Watson, K.M. (1943). Ind. Eng. Chem, 35, 398.
(b) Lyman, W.J., Reehl, W.F., Rosenblatt, D.H. (1982). Handbook of Chemical Property Estimation Methods, McGraw-Hill.
(c) OECD Environmental Monograph No.67. Application of Structure-Activity Relationships to the Estimation of Properties Important in Exposure Assessment (1993).
A.5 POVRŠINSKA NAPETOST
1. METODA
Opisane metode temeljijo na smernici za preskušanje OECD (1). Temeljna načela so navedena v viru (2).
1.1 UVOD
Opisane metode se uporabljajo za merjenje površinske napetosti vodnih raztopin.
Pred izvajanjem teh preskusov je koristno imeti predhodne informacije o topnosti snovi v vodi, njeni zgradbi, hidrolitskih lastnostih in kritični koncentraciji za tvorbo micel.
Metode, ki sledijo, so uporabne za večino kemijskih snovi, brez kakršnih koli omejitev glede njihove stopnje čistosti.
Merjenje površinske napetosti z metodo tenziometra z obročkom je omejeno na vodne raztopine z dinamično viskoznostjo pod približno 200 mPa s.
1.2 OPREDELITVE IN ENOTE
Prosto površinsko entalpijo na enoto površine imenujemo površinska napetost.
Površinska napetost se navede v:
N/m (enota SI) ali
mN/m (podenota SI)
1 N/m = 103 din/cm
1 mN/m = 1 din/cm v zastarelem sistemu cgs
1.3 REFERENČNE SNOVI
Referenčnih snovi ni treba uporabiti vsakokrat, ko se preučuje nova snov. Predvsem naj bi se uporabljale za občasno preverjanje učinkovitosti metode in za omogočanje primerjave z rezultati drugih metod.
Referenčne snovi, ki zajemajo široko območje površinskih napetosti, so navedene v virih 1 in 3.
1.4 PRINCIP METOD
Metode temeljijo na merjenju največje navpične sile, ki jo je treba uporabiti na zanki ali obročku v stiku s površino preiskovane tekočine v merilni posodici, da bi ga ločili od te površine, ali na ploščici, katere rob se stika s površino, da bi potegnili nastali film navzgor.
Snovi, ki so topne v vodi vsaj pri koncentraciji 1 mg/l, se preskušajo v vodni raztopini pri eni sami koncentraciji.
1.5 MERILA KAKOVOSTI
Natančnost teh metod je večja, kot je to običajno potrebno za okoljsko presojo.
1.6 OPIS METOD
Pripravi se raztopina snovi v destilirani vodi. Koncentracija te raztopine mora biti 90 % koncentracije nasičene raztopine te snovi v vodi; kadar ta koncentracija presega 1 g/l, se za preskušanje uporabi koncentracija 1 g/l. Snovi, katerih topnost v vodi je manjša od 1 mg/l, ni treba preskušati.
1.6.1 Metoda s ploščico
Glej ISO 304 in NF T 73-060 (Površinsko aktivne snovi – določanje površinske napetosti z dviganjem tekočinskih filmov).
1.6.2 Metoda z zanko
Glej ISO 304 in NF T 73-060 (Površinsko aktivne snovi – določanje površinske napetosti z dviganjem tekočinskih filmov).
1.6.3 Metoda z obročkom
Glej ISO 304 in NF T 73-060 (Površinsko aktivne snovi – določanje površinske napetosti z dviganjem tekočinskih filmov).
1.6.4 Usklajena metoda OECD z obročkom
1.6.4.1 Aparatura
Za to merjenje so primerni na trgu dostopni tenziometri. Sestavljajo jih naslednji deli:
— premična mizica za vzorec,
— sistem za merjenje sile,
— merilno telo (obroček),
— merilna posoda.
1.6.4.1.1
Premična mizica za vzorec se uporablja kot podpora za termostatirano merilno posodo, v kateri je preskusna tekočina. Skupaj s sistemom za merjenje sile je nameščena na stojalu.
1.6.4.1.2
Sistem za merjenje sile (glej sliko) je nad mizico za vzorec. Napaka pri merjenju sile ne sme presegati ± 10-6 N, kar ustreza meji napake ± 0,1 mg pri določanju mase. Merilna skala na trgu dostopnih tenziometrov je v večini primerov umerjena v mN/m, tako da se lahko površinska napetost odčita neposredno v mN/m na 0,1 mN/m točno.
1.6.4.1.3
Obroček je običajno narejen iz platina-iridijeve žice, debele približno 0,4 mm, in s povprečnim obsegom 60 mm. Žičnati obroček visi v vodoravnem položaju s kovinske zaponke in žičnatega namestitvenega nosilca, tako da je povezan s sistemom za merjenje sile (glej sliko).
(Vse dimenzije so v milimetrih)
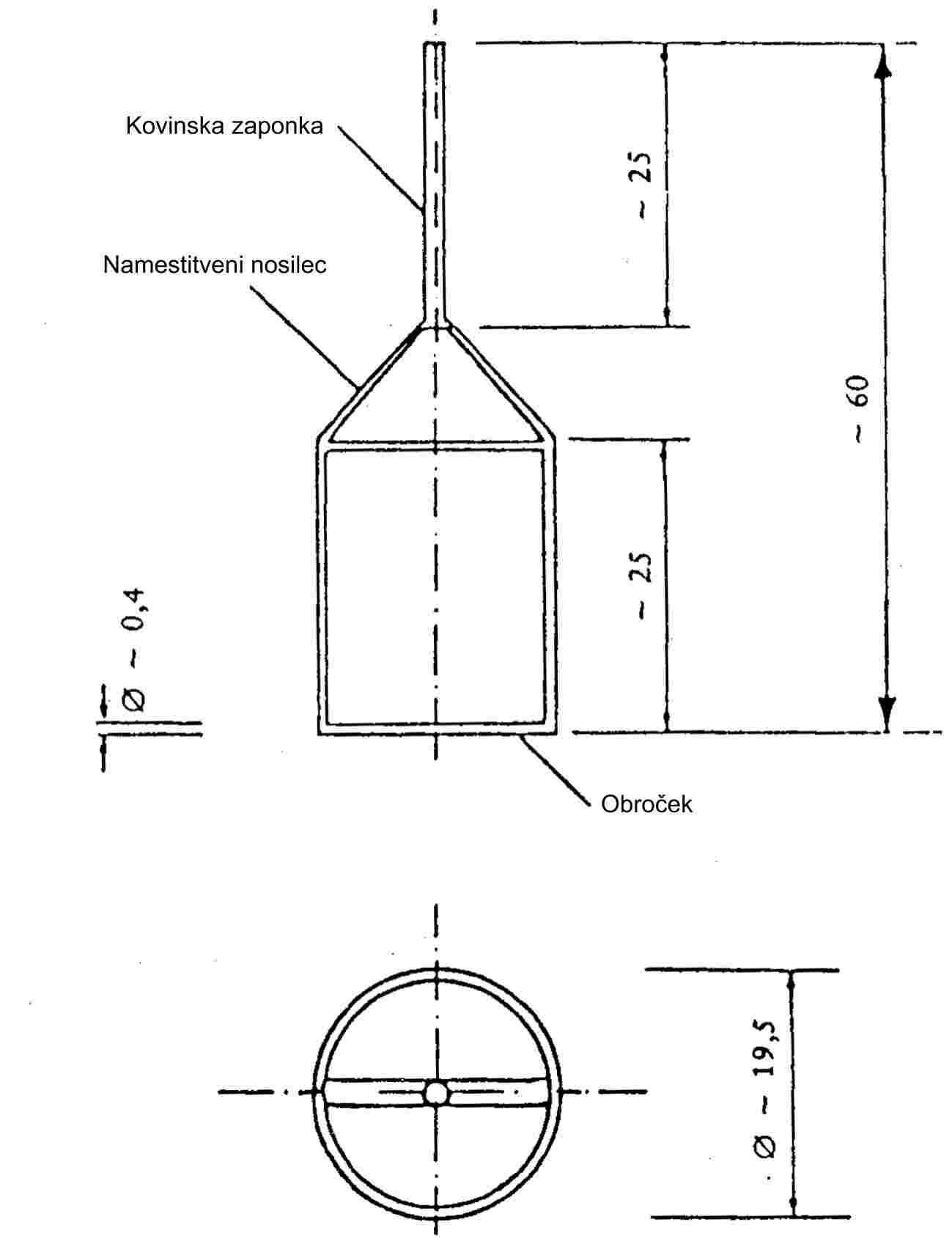
1.6.4.1.4 a
Merilna posoda, v kateri je preskusna raztopina, je termostatirana steklena posoda. Zasnovana je tako, da med merjenjem temperatura preskusne raztopine in plinske faze nad njeno površino ostane konstantna ter vzorec ne more izhlapeti. Sprejemljive so valjaste steklene posode z notranjim premerom najmanj 45 mm.
1.6.4.2 Priprava aparature
1.6.4.2.1
Steklene posode se temeljito očistijo. Če je potrebno, se operejo z vročo kromžveplovo kislino in nato z gosto tekočo fosforjevo kislino (83 do 98 masnih % H3PO4), temeljito sperejo pod tekočo vodo in nazadnje še z dvakrat destilirano vodo do nevtralne reakcije, nato se posušijoali splaknejo z delom preskusne tekočine.
Obroček se najprej temeljito splakne z vodo, da se odstranijo vse v vodi topne snovi, nato se za kratek čas potopi v kromžveplovo kislino, opere v dvakrat destilirani vodi do nevtralne reakcije ter na koncu na hitro segreje nad metanolnim plamenom.
Opomba:
Nečistote, ki niso topne ali razgradljive v kromžveplovi ali fosforjevi kislini, na primer silikoni, se odstranijo z ustreznim organskim topilom.
1.6.4.2.2
Validacija aparature obsega preverjanje ničelne točke in njeno naravnavo, tako da je omogočeno zanesljivo odčitavanje z instrumenta v mN/m.
Aparatura se izravna, na primer s pomočjo vodne tehtnice na osnovni plošči tenziometra, z nastavitvijo izravnalnih vijakov na osnovni plošči.
Po namestitvi obročka na aparaturo in pred potopitvijo v tekočino se tenziometer naravna na ničlo ter preveri, ali je obroček vzporeden s površino tekočine. V ta namen se površina tekočine lahko uporabi kot ogledalo.
Dejansko umerjanje se lahko opravi po enem od dveh postopkov:
(a) Z uporabo mase: postopek z uporabo jahačev z znano maso med 0,1 in 1,0 g, postavljenih na obroček. Umeritveni faktor Φa, s katerim je treba pomnožiti vse odčitke z instrumenta, se določi po enačbi (1):
|
|
(1) |
pri čemer je:
![]()
|
m |
= |
masa jahača (g) |
|
g |
= |
gravitacijski pospešek (981 cm s-2 na morski višini) |
|
b |
= |
povprečni obseg obročka (cm) |
|
σa |
= |
odčitek tenziometra po namestitvi jahača na obroček (mN/m). |
(b) Z uporabo vode: postopek z uporabo čiste vode, katere površinska napetost pri, na primer, 23 oC je 72,3 mN/m. Ta postopek je hitrejši od masnega umerjanja, vendar vedno obstaja nevarnost, da je površinska napetost vode napačna zaradi sledov onesnaženja s površinsko aktivnimi snovmi.
Umeritveni faktor Φb, s katerim je treba pomnožiti vse odčitke z instrumenta, se določi po enačbi (2):
|
|
(2) |
pri čemer je:
|
σo |
= |
površinska napetost vode, navedena v literaturi (mN/m) |
|
σg |
= |
izmerjena površinska napetost vode (mN/m), obe pri isti temperaturi. |
1.6.4.3 Priprava vzorcev
Pripravijo se vodne raztopine preskusnih snovi v potrebnih koncentracijah in ne smejo vsebovati nobenih neraztopljenih snovi.
Vzdrževati je treba konstantno temperaturo (± 0,5oC) raztopine. Ker se površinska napetost raztopine v merilni posodi spreminja s časom, se izvede več meritev ob različnih časih in izdela krivulja, ki prikazuje površinsko napetost kot funkcijo časa. Ko ni več nadaljnjih sprememb, je doseženo stanje ravnotežja.
Onesnaženje z drugimi snovmi v obliki prahu in plinov moti merjenje. Zato se delo izvaja pod zaščitnim pokrovom.
1.6.5 Preskusni pogoji
Merjenje se opravi pri približno 20 oC, ob vzdrževanju konstantne temperature ± 0,5oC.
1.6.6 Izvedba preskusa
Merjena raztopina se nalije v dobro očiščeno merilno posodo, pri čemer je treba paziti, da se ne peni, nato se merilna posoda postavi na mizico preskusne aparature. Vrh mizice z merilno posodo se dviga, dokler se obroček ne potopi pod površino merjene raztopine. Nato se vrh mizice postopoma in enakomerno spušča (s hitrostjo približno 0,5 cm/min), da bi se obroček odtrgal od površine, dokler se ne doseže največja sila. Tekoča plast, ki se drži obročka, se od njega ne sme ločiti. Po končani meritvi se obroček spet potopi pod površino in merjenja ponavljajo, dokler se ne doseže konstantna vrednost površinske napetosti. Za vsako meritev se zapiše čas, ki je minil od ulitja tekočine v merilno posodo. Vrednost se odčita pri največji sili, potrebni za odtrganje obročka od površine tekočine.
2. PODATKI
Za izračun površinske napetosti se vrednost, odčitana z aparature v mN/m, najprej pomnoži z umeritvenim faktorjem Φa ali Φb (odvisno od uporabljenega umeritvenega postopka). Dobljena vrednost je le približna in jo je treba popraviti.
Harkins in Jordan (4) sta empirično določila korekcijske faktorje za vrednosti površinske napetosti, izmerjene z metodo z obročkom, ki so odvisni od dimenzij obročka, gostote tekočine in njene površinske napetosti.
Ker je postopek določanja korekcijskega faktorja za vsako posamezno meritev iz Harkinsovih in Jordanovih tabel dolgotrajen, se lahko za izračun površinske napetosti vodnih raztopin uporabi poenostavljeni postopek odčitavanja popravljenih vrednosti površinskih napetosti neposredno iz tabele. (Za odčitke med vrednostmi v tabeli se uporabi interpolacija.)
Tabela
Popravljanje izmerjene površinske napetosti
Le za vodne raztopine, ρ = 1 g/cm3
|
r |
= 9,55 mm (povprečni polmer obročka) |
|
r |
= 0,185 mm (polmer žice obročka) |
|
Izmerjena vrednost (mN/m) |
Popravljena vrednost (mN/m) |
|
|
Umeritev z maso (glej 1.6.4.2.2(a)) |
Umertlev z vodo (glej 1.6.4.2.2(b)) |
|
|
20 |
16,9 |
18,1 |
|
22 |
18,7 |
20,1 |
|
24 |
20,6 |
22,1 |
|
26 |
22,4 |
24,1 |
|
28 |
24,3 |
26,1 |
|
30 |
26,2 |
28,1 |
|
32 |
28,1 |
30,1 |
|
34 |
29,9 |
32,1 |
|
36 |
31,8 |
34,1 |
|
38 |
33,7 |
36,1 |
|
40 |
35,6 |
38,2 |
|
42 |
37,6 |
40,3 |
|
44 |
39,5 |
42,3 |
|
46 |
41,4 |
44,4 |
|
48 |
43,4 |
46,5 |
|
50 |
45,3 |
48,6 |
|
52 |
47,3 |
50,7 |
|
54 |
49,3 |
52,8 |
|
56 |
51,2 |
54,9 |
|
58 |
53,2 |
57,0 |
|
60 |
55,2 |
59,1 |
|
62 |
57,2 |
61,3 |
|
64 |
59,2 |
63,4 |
|
66 |
61,2 |
65,5 |
|
68 |
63,2 |
67,7 |
|
70 |
65,2 |
69,9 |
|
72 |
67,2 |
72,0 |
|
74 |
69,2 |
— |
|
76 |
71,2 |
— |
|
78 |
73,2 |
— |
Ta tabela je bila sestavljena na podlagi Harkins-Jordanovega popravka. Podobna je tabeli iz standarda DIN (DIN 53914) za vodo in vodne raztopine (gostota ρ = 1 g/cm3) in velja za na trgu dostopen obroček z dimenzijami R = 9,55 mm (povprečni polmer obročka) in r = 0,185 mm (polmer žice obročka). V tabeli so popravljene vrednosti za meritve površinske napetosti, opravljene po umeritvi z utežmi ali vodo.
Druga možnost je, da se brez predhodne umeritve površinska napetost izračuna po naslednji enačbi:
![]()
pri čemer je:
|
F |
= |
sila, izmerjena z dinamometrom, tik preden film poči |
|
R |
= |
polmer obročka |
|
f |
= |
korekcijski faktor (1) |
3. POROČANJE
3.1 POROČILO O PRESKUSU
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— uporabljena metoda,
— vrsta uporabljene vode ali raztopine,
— natančna specifikacija snovi (identiteta in nečistote),
— rezultati merjenja: površinska napetost (odčitek), tako posamezni odčitki kot tudi njihova aritmetična sredina in popravljena aritmetična sredina (upoštevajoč faktor opreme in korekcijsko tabelo),
— koncentracija raztopine,
— temperatura preskusa,
— starost uporabljene raztopine; zlasti čas, pretekel od priprave do meritve raztopine,
— opis časovne odvisnosti površinske napetosti po prenosu raztopine v merilno posodo,
— informacije in opombe, pomembne za razlago rezultatov, zlasti glede nečistot in agregatnega stanja snovi.
3.2 RAZLAGA REZULTATOV
Glede na to, da je površinska napetost destilirane vode 72,75 mN/m pri 20 oC, je treba snovi, katerih površinska napetost pri pogojih te metode je manjša od 60 mN/m, šteti za površinsko aktivne snovi.
4. VIRI
(1) OECD, Paris, 1981, Test Guideline 115, Decision of the Council C(81) 30 final.
(2) R. Weissberger ed.: Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, Vol. I, Part I, Chapter XIV
(3) Pure Appl. Chem., 1976, vol. 48, 511.
(4) Harkins, W.D., Jordan, H.F., J. Amer. Chem. Soc., 1930, vol. 52, 1751.
A.6 TOPNOST V VODI
1. METODA
Opisane metode temeljijo na smernici za preskušanje OECD (1).
1.1 UVOD
Za izvajanje tega preskusa je koristno imeti predhodne informacije o strukturni formuli, parnem tlaku, disociacijski konstanti in hidrolizi (kot funkciji pH) snovi.
Na voljo ni nobene posamezne metode, ki bi zajela celotno območje topnosti v vodi.
Spodaj opisani metodi zajemata celotno območje topnosti, vendar nista primerni za hlapne snovi:
— prva, imenovana „metoda z izpiranjem kolone“, se uporablja za v glavnem čiste snovi z majhno topnostjo (< 10-2 gramov na liter), ki so stabilne v vodi,
— druga, imenovana „metoda z bučko“, se uporablja za v glavnem čiste snovi z večjo topnostjo (> 10-2 gramov na liter), ki so stabilne v vodi.
Na topnost preskusne snovi v vodi lahko znatno vpliva prisotnost nečistot.
1.2 OPREDELITVE IN ENOTE
Topnost snovi v vodi določa masna koncentracija nasičene raztopine te snovi v vodi pri določeni temperaturi. Topnost v vodi se izrazi v enotah mase na volumen raztopine. Enota SI je kg/m3 (lahko se uporabljajo tudi grami na liter).
1.3 REFERENČNE SNOVI
Referenčnih snovi ni treba uporabiti vsakokrat, ko se preučuje nova snov. Predvsem naj bi se uporabljale za občasno preverjanje učinkovitosti metode in za omogočanje primerjave z rezultati drugih metod.
1.4 PRINCIP PRESKUSNE METODE
Z enostavnim predhodnim preskusom je treba določiti približno količino vzorca in čas, ki sta potrebna, da se doseže koncentracija nasičenja.
1.4.1 Metoda z izpiranjem kolone
Ta metoda temelji na izpiranju preskusne snovi z vodo iz mikro-kolone, ki je napolnjena z inertnim pomožnim materialom, kot so steklene kroglice ali pesek, prevlečenim s presežkom preskusne snovi. Topnost v vodi se določi, ko je masna koncentracija eluata konstantna. To se pokaže kot konstantna raven koncentracije v odvisnosti od časa.
1.4.2 Metoda z bučko
Pri tej metodi se snov (trdne snovi je treba uprašiti) raztopi v vodi pri temperaturi, ki je nekoliko višja od temperature preskusa. Ko se doseže nasičenost, se zmes ohladi do temperature preskusa, nato se hrani pri tej temperaturi in meša, dokler se ne vzpostavi ravnotežje. Druga možnost je, da se meritev izvede neposredno pri temperaturi preskusa, če se z ustreznim vzorčenjem zagotovi, da je doseženo ravnotežje nasičenja. Nato se z ustrezno analitsko metodo določi masna koncentracija snovi v vodni raztopini, ki ne sme vsebovati nobenih neraztopljenih delcev.
1.5 MERILA KAKOVOSTI
1.5.1 Ponovljivost
Pri metodi z izpiranjem kolone se lahko doseže ponovljivost < 30 %; pri metodi z bučko je treba doseči ponovljivost < 15 %.
1.5.2 Občutljivost
Ta je sicer odvisna od analitske metode, vendar se masna koncentracija lahko določi do najmanj 10-6 gramov na liter.
1.6 OPIS METODE
1.6.1 Preskusni pogoji
Preskus se po možnosti opravi pri 20 ± 0,5oC. Če se domneva, da je topnost odvisna od temperature (> 3 % na oC), se izvede še pri dveh drugih temperaturah, najmanj 10 oC nad in pod izbrano temperaturo. V tem primeru je treba temperaturo vzdrževati na ± 0,1oC. Izbrana temperatura mora biti konstantna v vseh bistvenih delih opreme.
1.6.2 Predhodni preskus
Približno 0,1 g vzorca (trdne snovi je treba uprašiti) v 10 ml-merilnem valju s steklenim zamaškom se dodajajo vedno večje količine destilirane vode sobne temperature po korakih, prikazanih v spodnji tabeli:
|
0,1 g topen v „x“ ml vode |
0,1 |
0,5 |
1 |
2 |
10 |
100 |
> 100 |
|
Približna topnost (grami na liter) |
> 1 000 |
1 000 do 200 |
200 do 100 |
100 do 50 |
50 do 10 |
10 do 1 |
< 1 |
Po vsakem dodatku navedene količine vode se zmes 10 minut močno stresa, nato se vizualno preveri, ali so v vzorcu prisotni neraztopljeni delci. Če po dodatku 10 ml vode vzorec ali del vzorca ostane neraztopljen, se preskus ponovi v 100 ml-merilnem valju z večjimi količinami vode. Pri manjši topnosti je lahko čas, potreben za raztopitev snovi, občutno daljši (počakati je treba najmanj 24 h). Približna topnost je navedena v tabeli pod tisto količino dodane vode, pri kateri se je vzorec popolnoma raztopil. Če je snov še vedno navidez netopna, je treba počakati več kot 24 h (največ 96 h) ali pa jo je treba še dodatno razredčiti, da se ugotovi, ali je treba uporabiti metodo za določanje topnosti z izpiranjem kolone ali metodo z bučko.
1.6.3 Metoda z izpiranjem kolone
1.6.3.1 Nosilec, topilo in eluent
Nosilec pri metodi z izpiranjem kolone mora biti inerten. Možna materiala sta steklene kroglice in pesek. Za nanašanje preskusne snovi na nosilec je treba uporabiti ustrezno analitsko čisto hlapno topilo. Kot eluent je treba uporabiti vodo, dvakrat destilirano v stekleni ali kremenčevi aparaturi.
Opomba:
Ne sme se uporabiti voda neposredno iz organskega ionskega izmenjevalca.
1.6.3.2 Nanašanje na nosilec
Približno 600 mg nosilca se stehta in prenese v 50 ml-bučko z okroglim dnom.
Ustrezna stehtana količina preskusne snovi se raztopi v izbranem topilu. Primerna količina te raztopine se doda nosilcu. Topilo mora popolnoma upareti, npr. v rotavaporju, sicer se nosilec ne nasiti z vodo zaradi porazdelitvenih učinkov na površini nosilca.
Nanašanje na nosilec lahko povzroči težave (napačne rezultate), če se preskusna snov poseda kot olje ali drugačna kristalinična faza. Take težave je treba preučiti s poskusi in o tem poročati.
Nosilec z naneseno preskusno snovjo se pusti namakati približno dve uri v približno 5 ml vode, nato se suspenzija prenese v mikrokolono. Druga možnost je, da se v mikrokolono, napolnjeno z vodo, natrese nosilec z naneseno preskusno snovjo in nato pusti približno dve uri, da se vzpostavi ravnotežje.
Izpiranje snovi iz nosilca se lahko izvede na enega od naslednjih dveh načinov:
— z recirkulacijsko črpalko (glej sliko 1),
— z nivojsko posodo (glej sliko 4).
1.6.3.3 Metoda z izpiranjem kolone z recirkulacijsko črpalko
Shematski prikaz značilnega sistema je predstavljen na sliki 1. Ustrezna mikrokolona je prikazana na sliki 2, čeprav je primerna kakršna koli velikost, pod pogojem, da izpolnjuje merila glede ponovljivosti in občutljivosti. Kolona mora biti dovolj velika, da je volumen predkolone najmanj petkrat tolikšen kot volumen polnitve in da sprejme najmanj pet vzorcev. Velikost kolone se lahko tudi zmanjša, če se uporabi nadomestno topilo, ki nadomesti prvotnih pet volumnov polnitve, odstranjenih z nečistotami.
Kolono je treba povezati z recirkulacijsko črpalko, s pretočno zmogljivostjo približno 25 mLh. Črpalka se poveže s politetrafluoroetilenskimi (P.T.F.E.) in/ali steklenimi priključki. Ko sta kolona in črpalka sestavljeni, morata omogočati vzorčenje eluenta in vzpostavljanje ravnotežja v predkoloni pri atmosferskem tlaku. Material v koloni podpira majhen (5 mm) zamašek iz steklene volne, ki služi tudi za filtracijo delcev. Recirkulacijska črpalka je lahko na primer peristaltična črpalka ali membranska črpalka (treba je paziti, da material cevi ne povzroči onesnaženja in/ali absorpcije).
Tok se požene skozi kolono. Priporočljivo je, da se uporabi pretok približno 25 ml/h (to ustreza približno 10 volumnov polnitve za opisano kolono). Prvih pet (najmanj) volumnov polnitve se zavrže, da se odstranijo v vodi topne nečistote. Zatem naj vodna črpalka deluje do vzpostavitve ravnotežja, ki je opredeljeno s petimi zaporednimi vzorci, katerih koncentracije se med seboj ne razlikujejo za več kot ± 30 %. Časovni intervali med temi vzorci morajo ustrezati prehodu najmanj 10 volumnov polnitve.
1.6.3.4 Metoda z izpiranjem kolone z nivojsko posodo
Nivojska posoda: Nivojska posoda se priključi s spojko iz brušenega stekla, ki je povezana s PTFE cevjo. Priporočljivo je, da se uporabi pretok približno 25 ml/h. Zberejo se zaporedne frakcije eluata in analizirajo z izbrano metodo.
Za določitev topnosti v vodi se uporabijo frakcije eluata iz srednjega območja, kjer so koncentracije konstantne (± 30 %) pri najmanj petih zaporednih frakcijah,.
V obeh primerih (pri uporabi recirkulacijske črpalke ali nivojske posode) je treba opraviti drugo meritev pri polovičnem pretoku prve meritve. Če so rezultati obeh meritev skladni, je preskus zadovoljiv; če je pri manjšem pretoku navidezna topnost večja, je treba nadaljevati z razpolavljanjem pretoka, dokler ni topnost enaka pri dveh zaporednih meritvah.
V obeh primerih (pri uporabi recirkulacijske črpalke ali nivojske posode) je treba preveriti, ali frakcije vsebujejo koloidne snovi, na kar kaže prisotnost Tyndallovega efekta (razpršitev svetlobe). Prisotnost takšnih delcev razveljavi rezultate in preskus je treba ponoviti z izboljšano filtracijo v koloni.
Zapisati je treba pH vsakega vzorca. Drugo meritev je treba izvesti pri enaki temperaturi.
1.6.4 Metoda z bučko
1.6.4.1 Aparatura
Za metodo z bučko je potreben naslednji material:
— običajna laboratorijska steklovina in instrumentarij,
— naprava, primerna za mešanje raztopin pri nadzorovanih konstantnih temperaturah,
— centrifuga (po možnosti termostatirana), če je potrebna za emulzije, in
— oprema za analitsko določanje.
1.6.4.2 Merilni postopek
S predhodnim preskusom se oceni količina materiala, potrebna za nasičenje želenega volumna vode. Volumen potrebne vode bo odvisen od analitske metode in območja topnosti. V tri steklene posode s steklenimi zamaški (npr. centrifugirke, bučke) se zatehta po petkrat tolikšna količina snovi, kot je bila določena zgoraj. V vsako posodo se doda izbrani volumen vode, nato se posode tesno zamašijo. Vsebina zaprtih posod se meša pri 30 oC. (Uporabi se naprava za stresanje ali mešanje, ki je zmožna delovati pri konstantni temperaturi, npr. magnetno mešanje v termostatirani vodni kopeli). Po enem dnevu se ena od posod odstrani ter se 24 ur hrani na temperaturi preskusa in občasno pretrese, da se ponovno vzpostavi ravnotežje. Nato se vsebina posode centrifugira pri temperaturi preskusa in z ustrezno analitsko metodo se določi koncentracija preskusne snovi v bistri vodni fazi. S preostalima posodama se ravna podobno po začetnem vzpostavljanju ravnotežja pri 30 oC, ki naj traja pri eni dva in pri drugi tri dni. Če se dobljene koncentracije vsaj pri zadnjih dveh posodah ujemajo s predpisano ponovljivostjo, je preskus zadovoljiv. Če se pri posodah 1, 2 in 3 kaže težnja k naraščanju vrednosti, je treba celoten preskus ponoviti, pri čemer se uporabi daljši čas za vzpostavljanje ravnotežja,.
Merilni postopek se lahko izvede tudi brez predinkubacije pri 30 oC. Da se oceni hitrost vzpostavljanja ravnotežje nasičenja, se vzorči, dokler čas mešanja nič več ne vpliva na koncentracijo preskusne raztopine.
Zapisati je treba pH vsakega vzorca.
1.6.5 Analiza
Za takšna določanja je zaželena uporaba analitske metode, ki je najbolj primerna za posamezno snov, ker lahko majhne količine topnih nečistot povzročijo velike napake pri izmerjeni topnosti. Primeri takšnih metod so: plinska ali tekočinska kromatografija, titracijske metode, fotometrične metode in voltmetrične metode.
2. PODATKI
2.1 METODA Z IZPIRANJEM KOLONE
Za vsako ponovitev je treba izračunati srednjo vrednost najmanj petih zaporednih vzorcev, vzetih pri točki nasičenosti, in standardna deviacija. Rezultati se navedejo v enotah mase na volumen raztopine.
Primerjajo se srednje vrednosti, izračunane pri dveh preskusih pri različnih pretokih, in ponovljivost mora biti pod 30 %.
2.2 METODA Z BUČKO
Navesti je treba posamezne rezultate za vsako od treh bučk, nato se izračuna srednja vrednost tistih rezultatov, ki se štejejo za konstantne (ponovljivost pod 15 %), in se navede v enotah mase na volumen raztopine. Kadar je topnost zelo velika (> 100 gramov na liter) bo morda treba enote mase ponovno pretvoriti v volumske enote z uporabo gostote.
3. POROČANJE
3.1 METODA Z IZPIRANJEM KOLONE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— rezultati predhodnega preskusa,
— natančna specifikacija snovi (identiteta in nečistote),
— posamezne koncentracije, pretok in pH za vsak vzorec,
— srednje vrednosti in standardna deviacija za najmanj pet vzorcev, vzetih pri točki nasičenosti vsake ponovitve,
— povprečje dveh zaporednih, sprejemljivih ponovitev,
— temperatura vode med procesom nasičenja,
— uporabljena analitska metoda,
— vrsta uporabljenega nosilca,
— nanašanje na nosilec,
— uporabljeno topilo,
— dokazi o kakršni koli kemijski nestabilnosti snovi med preskusom in uporabljena metoda,
— vse informacije, pomembne za razlago rezultatov, zlasti glede nečistot in agregatnega stanja snovi.
3.2 METODA Z BUČKO
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— rezultati predhodnega preskusa,
— natančna specifikacija snovi (identiteta in nečistot),
— posamezne analitske določitve in povprečje, če je bilo za eno bučko določenih več vrednosti,
— pH vsakega vzorca,
— povprečje vrednosti različnih bučk, pri katerih so bili rezultati skladni,
— temperatura preskusa,
— uporabljena analitska metoda,
— dokazi o kakršni koli kemijski nestabilnosti snovi med preskusom in uporabljena metoda,
— vse informacije, pomembne za razlago rezultatov, zlasti glede nečistot in agregatnega stanja snovi.
4. VIRI
(1) OECD, Paris, 1981, Test Guideline 105, Decision of the Council C(81) 30 final.
(2) NF T 20-045 (AFNOR) (Sept. 85). Chemical products for industrial use – Determination of water solubility of solids and liquids with low solubility – Column elution method.
(3) NF T 20-046 (AFNOR) (Sept. 85). Chemical products for industrial use – Determination of water solubility of solids and liquids with high solubility – Flask method
Dodatek
Slika 1
Metoda z izpiranjem kolone z recirkulacijsko črpalko

Slika 2
Značilna mikrokolona
(Vse dimenzije so v milimetrih)
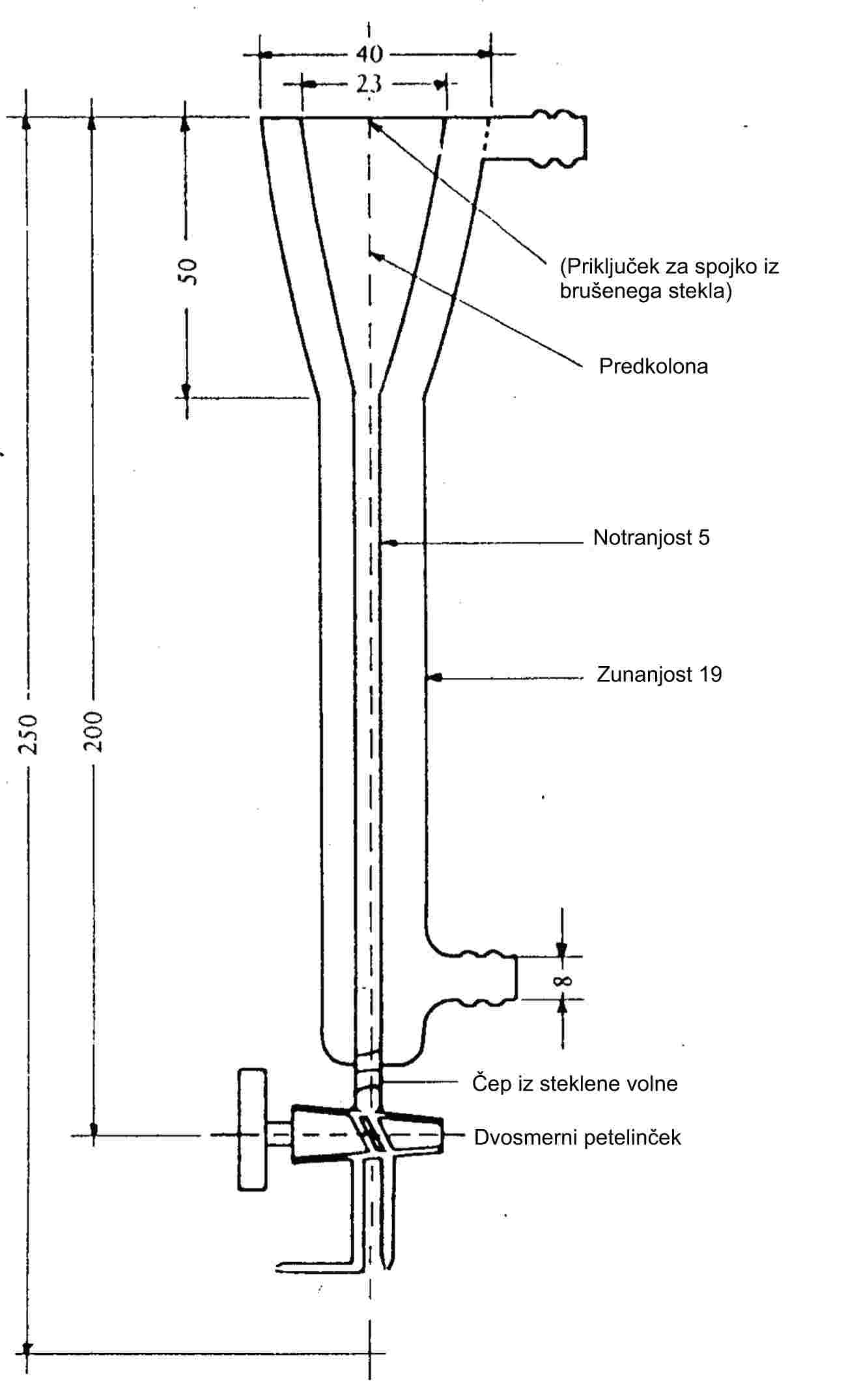
Slika 3
Značilna mikrokolona
(Vse dimenzije so v milimetrih)

Slika 4
Metoda z izpiranjem kolone z nivojsko posodo
A.8 PORAZDELITVENI KOEFICIENT
1. METODA
Opisana metoda „stresanja bučke“ temelji na smernici za preskušanje OECD (1).
1.1 UVOD
Za izvajanje tega preskusa je koristno imeti predhodne informacije o strukturni formuli, disociacijski konstanti, topnosti v vodi, hidrolizi, topnosti v n-oktanolu in površinski napetosti snovi.
Pri snoveh, ki tvorijo ione, je treba meritve opraviti le z njihovo neionizirano obliko (prosta kislina ali prosta baza), pridobljeno z uporabo ustreznega pufra s pH, ki je najmanj eno enoto pod (prosta kislina) ali nad (prosta baza) pK.
Ta preskusna metoda vključuje dva ločena postopka: metodo stresanja bučke in tekočinsko kromatografijo visoke ločljivosti (HPLC). Prvi se uporablja, kadar je vrednost log Pow (opredelitve glej spodaj) v območju od -2 do 4, in drugi, kadar je v območju od 0 do 6. Pred izvedbo katerega koli postopka, je treba pridobiti predhodno oceno porazdelitvenega koeficienta.
Metoda stresanja bučke se uporablja samo za v glavnem čiste snovi, topne v vodi in n-oktanolu. Ni uporabna za površinsko aktivne snovi (za katere je treba navesti izračunano vrednost ali oceno na podlagi topnosti v n-oktanolu in topnosti v vodi).
Metoda HPLC ni uporabna za močne kisline in baze, kovinske komplekse, površinsko aktivne snovi ali snovi, ki reagirajo z eluentom. Za te snovi je treba navesti izračunano vrednost ali oceno na podlagi topnosti v n-oktanolu in topnosti v vodi.
Metoda HPLC je manj občutljiva za prisotnost nečistot v preskusni snovi kakor metoda stresanja bučke. Vendar v nekaterih primerih lahko nečistote otežijo razlago rezultatov, ker postane določitev vrha negotova. Za zmesi, ki dajo nedoločen pas, se navedejo zgornja in spodnja meja log P.
1.2 OPREDELITVE IN ENOTE
Porazdelitveni koeficient (P) je torej količnik dveh koncentracij in se ponavadi navede v obliki logaritma z osnovo 10 (log P).
![]()
Porazdelitveni koeficient (P) je opredeljen kot razmerje ravnotežnih koncentracij (c) raztopljene snovi v dvofaznem sistemu, sestavljenem iz dveh topil, ki se v glavnem ne mešata. V primeru n-oktanola in vode:
1.3 REFERENČNE SNOVI
Metoda stresanja bučke
Referenčnih snovi ni treba uporabiti vsakokrat, ko se preučuje nova snov. Predvsem naj bi se uporabljale za občasno preverjanje učinkovitosti metode in za omogočanje primerjave z rezultati drugih metod.
Metoda HPLC
Za določitev soodvisnosti med rezultati meritev s HPLC za snov in njeno vrednostjo P, je treba izdelati umeritveno krivuljo log P v odvisnosti od kromatografskih podatkov z uporabo najmanj 6 referenčnih točk. Uporabnik sam izbere primerne referenčne snovi. Kadar je le mogoče, naj ima najmanj ena referenčna snov večji in ena manjši Pow kot preskusna snov. Za vrednosti log P, manjše od 4, umeritev lahko temelji na podatkih, dobljenih z metodo stresanja bučke. Za vrednosti log P, večje od 4, umeritev lahko temelji na validiranih podatkih iz literature, če so skladni z izračunanimi vrednostmi. Za večjo točnost je priporočljivo izbrati referenčne snovi, ki so strukturno sorodne preskusni snovi.
Na voljo so izčrpni seznami vrednosti log Pow za mnoge skupine kemikalij (2)(3). Če ni podatkov o porazdelitvenih koeficientih strukturno sorodnih snovi, se lahko uporabi bolj splošna umeritev z drugimi referenčnimi snovmi.
Seznam priporočenih referenčnih snovi in njihovih vrednosti Pow je v dodatku 2.
1.4 PRINCIP METODE
1.4.1 Metoda stresanja bučke
Za določitev porazdelitvenega koeficienta je treba vzpostaviti ravnotežje med vsemi medsebojno delujočimi komponentami sistema in določiti koncentraciji snovi, raztopljene v dveh fazah. Študija literature o tej temi kaže, da se v ta namen lahko uporabi več različnih tehnik, npr. temeljito mešanje dveh faz, ki mu sledi njuno ločevanje, da se ugotovi ravnotežna koncentracija preiskovane snovi.
1.4.2 Metoda HPLC
HPLC se izvaja z analitskimi kolonami, napolnjenimi z na trgu dostopno trdno fazo, ki vsebuje dolge verige ogljikovodikov (npr. C8, C18), vezane na silicijev dioksid. Snovi, injicirane v tako kolono, potujejo vzdolž nje z različnimi hitrostmi, zaradi različne stopnje porazdelitve med mobilno fazo in stacionarno fazo ogljikovodikov. Zmesi snovi se eluirajo v vrstnem redu po hidrofobnosti, pri čemer se prve eluirajo vodotopne snovi in zadnje tiste, topne v olju, sorazmerno z njihovim porazdelitvenim koeficientom ogljikovodik/voda. To omogoča določitev razmerja med retenzijskim časom v taki koloni (z reverzno fazo) in porazdelitvenim koeficientom n-oktanol/voda. Porazdelitveni koeficient se določi s sklepanjem iz faktorja kapacitete k, opisanega z enačbo: molekula topila, da pride skozi kolono (mrtvi čas).
![]()
pri čemer je tR = retenzijski čas preskusne snovi in to = povprečni čas, ki ga potrebuje molekula topila, da pride skozi kolono (mrtvi čas).
Kvantitativna analiza ni potrebna, treba je določiti le elucijske čase.
1.5 MERILA KAKOVOSTI
1.5.1 Ponovljivost
Da se zagotovi točnost porazdelitvenega koeficienta, je treba izvesti po dve vzporedni meritvi pri treh različnih preskusnih pogojih, pri čemer se lahko spreminjata količina navedene snovi in razmerje volumnov topil. Določene vrednosti porazdelitvenega koeficienta, izražene kot logaritmi z osnovo 10, morajo biti v območju ± 0,3 log enot.
Za povečanje zanesljivosti meritve, je treba izvesti dve vzporedni določitvi. Vrednosti log P, izpeljane iz posameznih meritev, naj bodo v območju ± 0,1 enot log.
1.5.2 Občutljivost
Merilno območje metode je določeno z mejo detekcije analitskega postopka. Ta bi morala omogočiti določitev vrednosti log Pow v območju od –2 do 4 (občasno, kadar so izpolnjeni pogoji, se to območje lahko razširi do vrednosti log Pow 5), kadar koncentracija topljenca v nobeni fazi ni večja od 0,01 mola na liter.
Metoda HPLC omogoča ocenjevanje porazdelitvenega koeficienta v območju log Pow od 0 do 6.
Navadno se porazdelitveni koeficient lahko oceni do ± 1 enote log vrednosti, dobljene z metodo stresanja bučke. Značilne soodvisnosti so navedene v literaturi (4)(5)(6)(7)(8). Običajno se lahko doseže večja točnost, kadar korelacijske krivulje temeljijo na strukturno sorodnih referenčnih snoveh (9).
1.5.3 Specifičnost
Nernstov porazdelitveni zakon velja samo pri konstantnih temperaturi, tlaku in pH za razredčene raztopine. Nanaša se le na čiste snovi, porazdeljene med dve čisti topili. Če se v eni ali obeh fazah istočasno pojavi več različnih topljencev, lahko to vpliva na rezultate.
Disociacija ali asociacija raztopljenih molekul lahko povzroči odstopanje od Nernstovega porazdelitvenega zakona. Na takšna odstopanja pokaže dejstvo, da postane porazdelitveni koeficient odvisen od koncentracije raztopine.
Ker ta preskusna metoda zajema več ravnotežij, se ne sme uporabljati za snovi, ki jih je mogoče ionizirati, ne da bi se upošteval popravek. Pri takšnih snoveh je treba presoditi o uporabi pufrskih raztopin namesto vode; pH pufra se mora najmanj za eno enoto pH razlikovati od pKa snovi, pri čemer je treba upoštevati pomen tega pH za okolje.
1.6 OPIS METODE
1.6.1 Predhodna ocena porazdelitvenega koeficienta
Porazdelitveni koeficient se po možnosti oceni z računsko metodo (glej dodatek 1) ali, kadar je primerno, iz razmerja topnosti preskusne snovi v čistih topilih (10).
1.6.2 Metoda stresanja bučke
1.6.2.1 Priprava
n-Oktanol: Določitev porazdelitvenega koeficienta je treba opraviti z zelo čistimi analitskimi reagenti.
Voda: treba je uporabiti vodo, destilirano ali dvakrat destilirano v stekleni ali kremenčevi aparaturi. Za snovi, ki jih je mogoče ionizirati, se uporabijo pufri, če je to upravičeno.
Opomba:
Ne sme se uporabiti voda, vzeta neposredno iz ionskega izmenjevalca.
1.6.2.1.1
Preden se določi porazdelitveni koeficient, se topili medsebojno nasitita s stresanjem pri temperaturi preskusa. To se najlaže izvede tako, da se dve veliki standardni steklenici zelo čistega analitskega n-oktanola ali vode, v vsaki od katerih je zadostna količina drugega topila, stresata 24 ur na mehanskem stresalniku, nato se pustita stati tako dolgo, da se fazi ločita in se vzpostavi stanje nasičenosti.
1.6.2.1.2
Celoten volumen dvofaznega sistema naj bo tolikšen, da skoraj v celoti napolni preskusno posodo. To bo pomagalo preprečiti izgubo topila zaradi izhlapevanja. Volumsko razmerje in količine snovi, ki se bodo uporabili, se določijo glede na:
— predhodno oceno porazdelitvenega koeficienta (glej zgoraj),
— najmanjšo količino preskusne snovi, potrebno za analitski postopek, in
— omejitvijo največje koncentracije v kateri koli fazi na 0,01 mola na liter.
Opravijo se trije preskusi. Pri prvem se uporabi izračunano volumsko razmerje n-oktanol/voda; pri drugem se to razmerje deli z dve; pri tretjem pa se pomnoži z dve (npr. 1:1, 1:2, 2:1).
1.6.2.1.3
Pripravi se osnovna raztopina v n-oktanolu, predhodno nasičenem z vodo. Preden se ta osnovna raztopina uporabi za določanje porazdelitvenega koeficienta, je treba natančno določiti njeno koncentracijo. Ta raztopina se hrani v pogojih, ki zagotavljajo njeno stabilnost.
1.6.2.2 Preskusni pogoji
Temperatura preskusa mora biti konstantna (± 1 oC) in v območju med 20 in 25 oC.
1.6.2.3 Merilni postopek
1.6.2.3.1
Za vsakega od preskusnih pogojev je treba pripraviti po dve preskusni posodi, ki vsebujeta potrebni, točno odmerjeni količini obeh topil ter potrebno količino osnovne raztopine.
Faze n-oktanola se merijo z volumni. Preskusne posode je treba bodisi namestiti na ustrezne stresalnike ali jih stresati ročno. Kadar se uporabljajo centrifugirke, je priporočena metoda hitro obračanje centrifugirke za 180o okrog njene prečne osi, tako da se morebitni ujeti zrak dvigne skozi obe fazi. Izkušnje so pokazale, da 50 takšnih obratov običajno zadostuje za vzpostavitev porazdelitvenega ravnotežja. Za večjo gotovost pa se priporoča 100 obratov v petih minutah.
1.6.2.3.2
Kadar je potrebno, se fazi ločita s centrifugiranjem. To se opravi z laboratorijsko centrifugo, v kateri se vzdržuje sobna temperatura, če pa se uporabi centrifuga brez termostata, se centrifugirke pustijo najmanj eno uro pred analizo pri temperaturi preskusa, da se vzpostavi ravnotežje.
1.6.2.4 Analiza
Za določitev porazdelitvenega koeficienta je treba določiti koncentracijo preskusne snovi v obeh fazah. To se lahko stori tako, da se vzame alikvot vsake izmed dveh faz iz vsake epruvete za vsak preskusni pogoj in se analizira po izbranem postopku. Izračunati je treba skupno količino snovi v obeh fazah in jo primerjati s prvotno vneseno količino snovi.
Vzorec vodne faze je treba odvzeti s postopkom, ki kar se da zmanjša tveganje, da bi se v njem pojavile sledi n-oktanola: v ta namen se lahko uporabi steklena brizga z zamenljivo iglo. Brizga se najprej delno napolni z zrakom. Ta zrak se počasi iztiska med potiskanjem igle skozi plast n-oktanola. V brizgo se vsrka primeren volumen vodne faze. Brizga se hitro potegne iz raztopine in igla se odstrani. Vsebina brizge se nato lahko uporabi kot vodni vzorec. Koncentracija v obeh ločenih fazah se po možnosti določi z metodo, ki je najbolj primerna za posamezno snov. Primeri morebitnih ustreznih analitskih metod so:
— fotometrične metode,
— plinska kromatografija,
— tekočinska kromatografija visoke ločljivosti.
1.6.3 HPLC metoda
1.6.3.1 Priprava
Potrebujemo tekočinski kromatograf, opremljen s črpalko s stabilnim pretokom in ustreznim detektorjem. Priporoča se uporaba injektorja z injicirnimi zankami. Prisotnost polarnih skupin v stacionarni fazi lahko resno zmanjša učinkovitost kolone HPLC. Zato mora imeti stacionarne faze le minimalni odstotek polarnih skupin (11). Lahko se uporabijo na trgu dostopna polnila za mikro kolone z reverzno fazo ali že pripravljene kolone. Med injektorskim sistemom in analitsko kolono se lahko namesti predkolona.
Topilo za eluiranje se pripravi iz metanola za HPLC in vode za HPLC ter pred uporabo razplini. Izvesti je treba izokratsko izpiranje. Uporabiti je treba razmerja metanol/voda z deležem vode najmanj 25 %. Običajno je zmes metanol/voda v razmerju 3:1 (v/v) zadovoljiva za eluiranje snovi z log P 6 v eni uri pri pretoku 1 ml/min. Pri snoveh z večjo vrednostjo log P bo morda treba skrajšati elucijski čas (in elucijski čas referenčnih snovi) z zmanjšanjem polarnosti mobilne faze ali podaljšanjem kolone.
Snovi z zelo majhno topnostjo v n-oktanolu dajo pri metodi HPLC velikokrat nenormalno majhne vrednosti log Pow; vrhove takih snovi včasih spremlja fronta topila. To se verjetno zgodi zato, ker je porazdelitveni proces prepočasen, da bi dosegla ravnotežje v času, ki je običajno potreben za ločitev s HPLC. V takem primeru je lahko učinkovit način za dosego zanesljive vrednosti zmanjšanje pretoka in/ali razmerja metanol/voda.
Preskusne in referenčne snovi morajo biti topne v mobilni fazi v zadostnih koncentracijah, da je omogočena njihova detekcija. Dodatki v zmesi metanol/voda se lahko uporabijo le izjemoma, saj spremenijo lastnosti kolone. Za kromatograme z dodatki je obvezna uporaba ločene kolone enake vrste. Če zmes metanol/voda ni primerna, se lahko uporabijo druge zmesi organsko topilo/voda, npr. etanol/voda ali acetonitril/voda.
Pri snoveh, ki disociirajo na ione, je pH eluenta zelo pomemben. Mora biti v delovnem območju pH kolone, ki je običajno med 2 in 8. Priporoča se dodajanje pufra. Preprečiti je treba obarjanje soli in razpadanje kolone, ki lahko nastaneta pri nekaterih zmeseh organske faze in pufra. Meritve HPLC s stacionarnimi fazami z osnovo iz silicijevega dioksida in pH nad 8 niso priporočljive, saj uporaba alkalne mobilne faze lahko povzroči hitro poslabšanje učinkovitosti kolone.
Referenčne snovi morajo biti čim bolj čiste. Snovi, ki se bodo uporabile za preskus ali umerjanje, se po možnosti raztopijo v mobilni fazi.
Med merjenjem se temperatura ne sme spreminjati za več kot ± 2 K.
1.6.3.2 Merjenje
Mrtvi čas to se lahko določi z uporabo bodisi homolognih vrst (npr. n-alkilmetil-ketoni) bodisi z organskimi spojinami, ki se ne zadržijo v koloni (npr. tiosečnina ali formamid). Za izračun mrtvega časa to z uporabo homolognih vrst se injicira niz najmanj sedmih spojin homologne vrste in določijo njihovi retenzijski časi. Izriše se krivulja dobljenih retenzijskih časov tr(nc + 1) v odvisnosti od tr(nc) ter določita presek, a, in naklon, b, regresijske enačbe:
tr(nc+1) = a + btr(nc)
(nc = število ogljikovih atomov). Mrtvi čas to je določen z:
to = a/(1 - b)
Naslednji korak je izdelava krivulje vrednosti log k v odvisnosti od log P za ustrezne referenčne snovi. V praksi to pomeni, da se hkrati injicira 5 do 10 standardnih referenčnih snovi, katerih log P je blizu pričakovanega območja, in določijo retenzijski časi, po možnosti na integratorju zapisovalniku, povezanem z detektorjem. Izračunajo se ustrezni logaritmi faktorjev kapacitete, log k, in nariše se krivulja log k v odvisnosti od log P, določenega z metodo stresanja bučke. Umerjanje se izvaja redno, najmanj enkrat dnevno, tako da se lahko upoštevajo morebitne spremembe v delovanju kolone.
Preskusna snov se injicira v najmanjšo možno količino mobilne faze. Določi se retenzijski čas (z dvema vzporednima meritvama), ki omogoča izračun faktorja kapacitete k. Iz korelacijske krivulje za referenčne snovi se lahko interpolira porazdelitveni koeficient preskusne snovi. Pri zelo majhnih in zelo velikih porazdelitvenih koeficientih je potrebna ekstrapolacija. V takih primerih je treba še posebej upoštevati meje zaupanja regresijske premice.
2. PODATKI
Metoda stresanja bučke
Zanesljivost določenih vrednosti P je mogoče preskusiti s primerjanjem srednjih vrednosti vzporednih določitev s skupno srednjo vrednostjo.
3. POROČANJE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— natančna specifikacija snovi (identiteta in nečistote),
— kadar metode niso uporabne (npr. pri površinsko aktivnih snoveh), je treba navesti izračunano vrednost ali oceno na podlagi topnosti v n-oktanolu in topnosti v vodi,
— vse informacije in opombe, pomembne za razlago rezultatov, zlasti glede nečistot in agregatnega stanja snovi.
Za metodo stresanja bučke:
— rezultat predhodne ocene, če je bila opravljena,
— temperatura določanja,
— podatki o uporabljenih analitskih postopkih za določanje koncentracij,
— čas in hitrost centrifugiranja, če je bilo uporabljeno,
— izmerjene koncentracije v obeh fazah za vsako določitev (to pomeni, da bo v poročilu skupaj 12 koncentracij),
— masa preskusne snovi, volumen vsake faze, uporabljene v vsaki posodi, in izračunana skupna količina preskusne snovi v vsaki fazi po vzpostavitvi ravnotežja,
— izračunane vrednosti porazdelitvenega koeficienta (P) in njihova srednja vrednost za vsak sklop preskusnih pogojev ter srednja vrednost vseh določitev. Če kar koli kaže na odvisnost porazdelitvenega koeficienta od koncentracije, je to treba vključiti v poročilo,
— standardna deviacija posameznih vrednosti P od njihove srednje vrednosti,
— srednja vrednost P vseh določitev mora biti izražena tudi z logaritmom (osnova 10),
— izračunana teoretična vrednost Pow, če je bila določena, ali če je izmerjena vrednost > 104,
— pH uporabljene vode in vodne faze med preskusom,
— če se uporabijo pufri, utemeljitev uporabe pufrov namesto vode, sestavo, koncentracijo in pH pufrov ter pH vodne faze pred in po preskusu.
Za metodo HPLC:
— rezultat predhodne ocene, če je bila opravljena,
— preskusna in referenčne snovi ter njihova čistost,
— temperaturno območje določitev,
— pH, pri katerem so bile opravljene določitve,
— podatki o analitski koloni in predkoloni, mobilni fazi ter načinu detekcije,
— podatki o retenziji in vrednosti log P iz literature za referenčne snovi, uporabljene za umerjanje,
— podatki o prilagojeni regresijski premici (log k v odvisnosti od log P),
— podatki o povprečni retenziji in interpolirana vrednost log P za preskusno snov,
— opis opreme in delovnih pogojev,
— elucijski diagrami,
— količine preskusne in referenčnih snovi, vnesene v kolono,
— mrtvi čas in kako je bil izmerjen.
4. VIRI
(1) OECD, Paris, 1981, Test Guideline 107, Decision of the Council C(81) 30 final.
(2) C. Hansch and A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979.
(3) Log P and Parameter Database, A tool for the quantitative prediction of bioactivity (C. Hansch, chairman, A.J. Leo, dir.) –Available from Pomona College Medical Chemistry Project 1982, Pomona College, Claremont, California 91711.
(4) L. Renberg, G. Sundström and K. Sundh-Nygärd, Chemosphere, 1980, vol. 80, 683.
(5) H. Ellgehausen, C. D'Hondt and R. Fuerer, Pestic. Sci., 1981, vol. 12, 219 (1981).
(6) B. McDuffie, Chemosphere, 1981, vol. 10, 73.
(7) W.E. Hammers et al., J. Chromatogr., 1982, vol. 247, 1.
(8) J.E. Haky and A.M. Young, J. Liq. Chromat., 1984, vol. 7, 675.
(9) S. Fujisawa and E. Masuhara, J. Biomed. Mat. Res., 1981, vol. 15, 787.
(10) O. Jubermann, Verteilen und Extrahieren, in Methoden der Organischen Chemie (Houben Weyl), Allgemeine Laboratoriumpraxis (edited by E.Muller), Georg Thieme Verlag, Stuttgart, 1958, Band I/1, 223–339.
(11) R.F. Rekker and H.M. de Kort, Euro. J. Med. Chem., 1979, vol. 14, 479.
(12) A. Leo, C. Hansch and D. Elkins, Partition coefficients and their uses. Chem. Rev., 1971, vol. 71, 525.
(13) R.F. Rekker, The Hydrophobic Fragmental Constant, Elsevier, Amsterdam, 1977.
(14) NF T 20-043 AFNOR (1985). Chemical products for industrial use – Determination of partition coefficient – Flask shaking method.
(15) C.V. Eadsforth and P. Moser, Chemosphere, 1983, vol. 12, 1459.
(16) A. Leo, C. Hansch and D. Elkins, Chem. Rev., 1971, vol. 71, 525.
(17) C. Hansch, A. Leo, S.H. Unger, K.H. Kim, D. Nikaitani and E.J. Lien, J. Med. Chem., 1973, vol. 16, 1207.
(18) W.B. Neely, D.R. Branson and G.E. Blau, Environ. Sci. Technol., 1974, vol. 8, 1113.
(19) D.S. Brown and E.W. Flagg, J. Environ. Qual., 1981, vol. 10, 382.
(20) J.K. Seydel and K.J. Schaper, Chemische Struktur und biologische Aktivität von Wirkstoffen, Verlag Chemie, Weinheim, New York 1979.
(21) R. Franke, Theoretical Drug Design Methods, Elsevier, Amsterdam 1984,
(22) Y.C. Martin, Quantitative Drug Design, Marcel Dekker, New York, Base 1, 1978.
(23) N.S. Nirrlees, S.J. Noulton, C.T. Murphy, P.J. Taylor; J. Med. Chem., 1976, vol. 19, 615.
Dodatek 1
Računske/ocenjevalne metode
UVOD
Splošni uvod v računske metode, podatki in primeri so na voljo v Priročniku metod za ocenjevanje kemijskih lastnosti (a).
Izračunane vrednosti Pow se lahko uporabijo:
— za izbiro primerne preskusne metode (območje metode stresanja bučke: log Pow: –2 do 4, območje HPLC: log Pow: 0 do 6),
— za izbiro ustreznih pogojev preskusa (npr. referenčne snovi za postopke HPLC, volumsko razmerje n-oktanol/voda za metodo stresanja bučke),
— kot notranje laboratorijsko preverjanje za odkrivanje možnih napak preskusa,
— za določitev ocene vrednosti Pow, kadar preskusnih metod ni mogoče uporabiti zaradi tehničnih razlogov.
OCENJEVALNA METODA
Predhodna ocena porazdelitvenega koeficienta
Vrednost porazdelitvenega koeficienta se lahko oceni na podlagi topnosti preskusne snovi v čistih topilih:Za to:
![]()
RAČUNSKE METODE
Princip računskih metod
Vse računske metode temeljijo na formalni fragmentaciji molekule na ustrezne podstrukture, za katere so znane zanesljive vrednosti povečanja log Pow. Vrednost log Pow cele molekule se nato izračuna kot vsota ustreznih vrednosti za njene fragmente, kateri se prišteje vsota členov korekcije za intramolekularne interakcije.
Na voljo so seznami konstant fragmentov in členov korekcije (b)(c)(d)(e). Nekateri se redno dopolnjujejo (b).
Merila kakovosti
Na splošno se zanesljivost računske metode manjša z večjo kompleksnostjo preučevane snovi. Pri enostavnih molekulah z majhno molsko maso in eno ali dvema funkcionalnima skupinama se lahko pričakuje odstopanje za 0,1 do 0,3 enote log Pow med rezultati različnih metod fragmentacije in izmerjeno vrednostjo. Pri bolj kompleksnih molekulah je območje napake lahko večje. To je odvisno od zanesljivosti in razpoložljivosti konstant fragmentov ter od zmožnosti prepoznavanja intramolekularnih interakcij (npr. vodikove vezi) in pravilne uporabe členov korekcije (manj težavno z računalniško programsko opremo CLOGP-3) (b). Pri snoveh, ki se lahko ionizirajo, je pomembno, da se pravilno upošteva naboj ali stopnja ionizacije.
Računski postopki
Izvirna konstanta hidrofobnih substituentov, π, ki jo je vpeljal Fujira et al. (f), je opredeljena z:
πx = log Pow (PhX) - log Pow (PhH)
pri čemer je Pow (PhX) porazdelitveni koeficient aromatskega derivata in Pow (PhH) porazdelitveni koeficient izhodne spojine
(npr. πCl = log Pow (C6H5Cl) - log Pow (C6H6) = 2,84 - 2,13 = 0,71).
Glede na svojo opredelitev je π-metoda uporabna predvsem za aromatsko substitucijo. Pripravljene so bile tabele π-vrednosti za veliko število substituentov (b)(c)(d). Uporabljajo se za izračunavanje log Pow za aromatske molekule ali podstrukture.
Po Rekkerju (g) se vrednost log Pow izračuna na naslednji način:
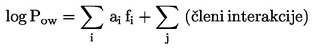
kjer fi predstavlja konstante za različne fragmente molekule in ai pogostnost njihovega pojavljanja v preiskovani molekuli. Členi korekcije se lahko izrazijo kot skupni zmnožek ene same konstante Cm (tako imenovane „magične konstante“). Konstante fragmentov fi in Cm so bile določene na podlagi seznama 1 054 vrednosti Pow, dobljenih s poskusi (825 spojin), z uporabo multiple regresijske analize (c)(h). Členi interakcije se določijo v skladu z določenimi pravili, opisanimi v literaturi (e)(h)(i).
Po Hanschu in Leu (c) se vrednost log Pow izračuna po enačbi:

kjer fi predstavlja konstante različnih fragmentov molekule, Fj člene korekcije ter ai in bj ustrezne pogostnosti pojavljanja. Z metodo poskusa in napake ter z izpeljavo iz vrednosti Pow, dobljenih s poskusi, sta bila sestavljena seznam vrednosti za atome in skupine ter seznam členov korekcije Fj (tako imenovanih „faktorjev“). Členi korekcije so bili razvrščeni v več različnih razredov (a)(c). Upoštevanje vseh pravil in členov korekcije je sorazmerno zapleteno in dolgotrajno. Razviti so bili programski paketi (b).
Izračunavanje log Pow kompleksnih molekul se lahko znatno izboljša, če se molekula razdeli na večje podstrukture, za katere so na voljo zanesljive vrednosti log Pow, bodisi iz tabel (b)(c) bodisi iz lastnih meritev. Taki fragmenti (npr. heterocikli, antrakinon, azobenzen) se nato lahko kombinirajo s Hanschovimi p-vrednostmi ali Rekkerjevimi ali Leovimi konstantami fragmentov.
Opombe
(i) Računske metode se lahko za delno ali popolnoma ionizirane snovi uporabijo le, kadar je mogoče upoštevati potrebne korekcijske faktorje;
(ii) če se lahko predpostavlja, da so intramolekularne vodikove vezi, je treba prišteti ustrezne člene korekcije (pribl. + 0,6 do + 1,0 enot log Pow) (a). Znaki prisotnosti takih vezi se lahko pridobijo iz stereo modelov ali spektroskopskih podatkov o molekuli;
(iii) če je možnih več tavtomernih oblik, mora izračun temeljiti na najbolj verjetni obliki;
(iv) pozorno je treba spremljati spremembe seznamov konstant fragmentov.
Poročilo
Kadar se uporabijo računske/ocenjevalne metode, se v poročilo o preskusu, če je možno, vključijo naslednje informacije:
— opis snovi (zmes, nečistote itd.),
— znaki kakršne koli možne intramolekularne vodikove vezi, disociacije, naboja in vseh drugih neobičajnih učinkov (npr. tavtomerija),
— opis računske metode,
— identifikacija podatkovne baze ali vir,
— posebnosti izbire fragmentov,
— izčrpno dokumentacijo izračuna.
LITERATURA
(a) W.J. Lyman, W.F. Reehl and D.H. Rosenblatt (ed.), Handbook of Chemical Property Estimation Methods, McGraw-Hill, New York, 1983.
(b) Pomona College, Medicinal Chemistry Project, Claremont, California 91711, USA, Log P Database and Med. Chem. Software (Program CLOGP-3).
(c) C. Hansch, A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979.
(d) A. Leo, C. Hansch, D. Elkins, Chem. Rev., 1971, vol. 71, 525.
(e) R.F. Rekker, H.M. de Kort, Eur. J. Med. Chem. – Chill. Ther. 1979, vol. 14, 479.
(f) T. Fujita, J. Iwasa and C. Hansch, J. Amer. Chem. Soc., 1964, vol. 86, 5175.
(g) R.F. Rekker, The Hydrophobic Fragmental Constant, Pharmacochemistry Library, Elsevier, New York, 1977, vol. 1.
(h) C.V. Eadsforth, P. Moser, Chemosphere, 1983, vol. 12, 1459.
(i) R.A. Scherrer, ACS, American Chemical Society, Washington D.C., 1984, Symposium Series 255, p. 225.
Dodatek 2
Priporočene referenčne snovi za metodo HPLC
|
Št. |
Referenčna snov |
log Pow |
PKa |
|
1 |
2-Butanon |
0,3 |
|
|
2 |
4-Acetilpiridin |
0,5 |
|
|
3 |
Anilin |
0,9 |
|
|
4 |
Acetanilid |
1,0 |
|
|
5 |
Benzilakohol |
1,1 |
|
|
6 |
p-Metoksifenol |
1,3 |
pKa = 10,26 |
|
7 |
Fenoksiocetna kislina |
1,4 |
pKa = 3,12 |
|
8 |
Fenol |
1,5 |
pKa = 9,92 |
|
9 |
2,4-Dinitrofenol |
1,5 |
pKa = 3,96 |
|
10 |
Benzonitril |
1,6 |
|
|
11 |
Fenilacetonitril |
1,6 |
|
|
12 |
4-Metílbenzil alkohol |
1,6 |
|
|
13 |
Acetofenon |
1,7 |
|
|
14 |
2-Nitrofenol |
1,8 |
pKa = 7,17 |
|
15 |
3-Nitrobenzojska kislina |
1,8 |
pKa = 3,47 |
|
16 |
4-Kloroanilin |
1,8 |
pKa = 4,15 |
|
17 |
Nitrobenzen |
1,9 |
|
|
18 |
Cimetov alkohol |
1,9 |
|
|
19 |
Benzojska kislina |
1,9 |
pKa = 4,19 |
|
20 |
p-Krezol |
1,9 |
pKa = 10,17 |
|
21 |
Cinamska kislina |
2,1 |
pKa = 3,89 cis 4,44 trans |
|
22 |
Anizol |
2,1 |
|
|
23 |
Metilbenzoat |
2,1 |
|
|
24 |
Benzen |
2,1 |
|
|
25 |
3-Metílbenzojska kislina |
2,4 |
pKa = 4,27 |
|
26 |
4-Klorofenol |
2,4 |
pKa = 9,1 |
|
27 |
Trikloroetilen |
2,4 |
|
|
28 |
Atrazin |
2,6 |
|
|
29 |
Etillbenzoat |
2,6 |
|
|
30 |
2,6-Diklorobenzonitril |
2,6 |
|
|
31 |
3-Klombenzojska kislina |
2,7 |
pKa = 3,82 |
|
32 |
Toluen |
2,7 |
|
|
33 |
1 -Naftol |
2,7 |
pKa = 9,34 |
|
34 |
2,3-Dichloroaniline |
2,8 |
|
|
35 |
Chlorobenzene |
2,8 |
|
|
36 |
Allyl-phenylether |
2,9 |
|
|
37 |
Bromobenzen |
3,0 |
|
|
38 |
Etílbenzen |
3,2 |
|
|
39 |
Benzofenon |
3,2 |
|
|
40 |
4-Fenilfenol |
3,2 |
pKa = 9,54 |
|
41 |
Timol |
3,3 |
|
|
42 |
1,4-Diklorobenzen |
3,4 |
|
|
43 |
Difenilamin |
3,4 |
pKa = 0,79 |
|
44 |
Naftalen |
3,6 |
|
|
45 |
Fenilbenzoat |
3,6 |
|
|
46 |
Izopropilbenzen |
3,7 |
|
|
47 |
2,4.6-Triklorofenol |
3,7 |
pKa = 6 |
|
48 |
Bifenil |
4,0 |
|
|
49 |
Benzilbenzoat |
4,0 |
|
|
50 |
2,4-Dinitro-6-.sek-butilfenol |
4,1 |
|
|
51 |
1,2,4-Triklorobenzen |
4,2 |
|
|
52 |
Dodekanojska kislina |
4,2 |
|
|
53 |
Difenileter |
4,2 |
|
|
54 |
n-Butylbenzene |
4,5 |
|
|
55 |
Fenantren |
4,5 |
|
|
56 |
Fluoroanten |
4,7 |
|
|
57 |
Dibenzil |
4,8 |
|
|
58 |
2,6-Difenilpiridin |
4,9 |
|
|
59 |
Trifenilamin |
5,7 |
|
|
60 |
DDT |
6,2 |
|
|
Druge referenčne snoví za majhne vrednosti log Pow |
|||
|
1 |
Nikotinska kislina |
- 0,07 |
|
A.9 PLAMENIŠČE
1. METODA
1.1 UVOD
Pred izvajanjem tega preskusa je koristno imeti predhodne informacije o vnetljivosti snovi. Preskusni postopek se lahko uporablja za tekoče snovi, katerih hlape je mogoče prižgati z viri vžiga. Preskusne metode, naštete v tem besedilu, so zanesljive samo za območja plamenišča, navedena pri posameznih metodah.
Pri izbiri metode je treba upoštevati možnost kemičnih reakcij med snovjo in posodo za vzorec.
1.2 OPREDELITVE IN ENOTE
Plamenišče je najnižja temperatura, popravljena glede na tlak 101,325 kPa, pri kateri tekočina razvije hlape, pri pogojih, opredeljenih v preskusni metodi, v takšni količini, da se v preskusni posodi tvori vnetljiva zmes hlapov in zraka.
Enote: oC
t = T – 273,15
(t v oC in T v K)
1.3 REFERENČNE SNOVI
Referenčnih snovi ni treba uporabiti vsakokrat, ko se preučuje nova snov. Predvsem naj bi se uporabljale za občasno preverjanje učinkovitosti metode in za omogočanje primerjave z rezultati drugih metod.
1.4 PRINCIP METODE
Snov se da v preskusno posodo in segreje ali ohladi do temperature preskusa v skladu s postopkom, opisanim v posamezni preskusni metodi. S poskušanjem vžiga se ugotavlja, ali vzorec vzplamti pri temperaturi preskusa ali ne.
1.5 MERILA KAKOVOSTI
1.5.1 Ponovljivost
Ponovljivost se spreminja glede na območje plamenišča in uporabljeno preskusno metodo; največ 2 oC.
1.5.2 Občutljivost
Občutljivost je odvisna od uporabljene preskusne metode.
1.5.3 Specifičnost
Specifičnost nekaterih preskusnih metod je omejena na določena območja plamenišča in odvisna od podatkov o snovi (npr. velika viskoznost).
1.6 OPIS METODE
1.6.1 Priprave
Vzorec preskusne snovi se vnese v preskusno aparaturo v skladu z 1.6.3.1 in/ali 1.6.3.2.
Zaradi varnosti se priporoča, da se pri energetsko bogatih ali strupenih snoveh uporabi metoda, pri kateri je vzorec majhen, pribl. 2 cm3.
1.6.2 Preskusni pogoji
Aparaturo je treba postaviti na mesto, kjer ni prepiha, če je to v skladu z varnostjo.
1.6.3 Izvedba preskusa
1.6.3.1 Ravnotežna metoda
Glej ISO 1516, ISO 3680, ISO 1523, ISO 3679.
1.6.3.2. Neravnotežna metoda
Glej BS 2000 del 170, NF M07-011, NF T66-009.
Glej EN 57, DIN 51755 del 1 (za temperature od 5 do 65 oC), DIN 51755 del 2 (za temperature pod 5 oC), NF M07-036.
Glej ASTM D 56.
Glej ISO 2719, EN 11, DIN 51758, ASTM D 93, BS 2000-34, NF M07-019.
Kadar je plamenišče, določeno z neravnotežno metodo iz 1.6.3.2, enako 0 ± 2 oC, 21 ± 2 oC ali 55 ± 2 oC, je treba to vrednost potrditi z ravnotežno metodo z uporabo iste aparature.
Za prijavo se lahko uporabijo le metode, s katerimi je mogoče določiti plamenišče.
Za določitev plamenišča viskoznih tekočin (barve, gume in podobno), ki vsebujejo topila, se lahko uporabijo samo aparature in preskusne metode, primerne za določanje plamenišča viskoznih tekočin.
Glej ISO 3679, ISO 3680, ISO 1523, DIN 53213, del 1.
2. PODATKI
3. POROČANJE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— natančna specifikacija snovi (identiteta in nečistote),
— navesti je treba uporabljeno metodo in kakršna koli možna odstopanja,
— rezultati in vse dodatne opombe, ki so pomembne za razlago rezultatov.
4. VIRI
Jih ni.
A.10 VNETLJIVOST (TRDNE SNOVI)
1. METODA
1.1 UVOD
Pred izvajanjem tega preskusa je koristno imeti predhodne informacije o morebitnih eksplozivnih lastnostih snovi.
Ta preskus je treba uporabljati samo za prašnate, granularne ali pastozne snovi.
Šteje se, da so lahko vnetljive samo snovi, katerih hitrost gorenja presega neko mejno vrednost, zato da ne bi bile mednje vključene vse snovi, ki jih je mogoče prižgati, ampak le tiste, ki gorijo hitro, ali tiste, katerih način gorenja je kakor koli posebej nevaren.
Posebej je nevarno, če se žarenje širi preko kovinskega prahu, zaradi težav pri gašenju. Kovinski prah se šteje za lahko vnetljivega, če omogoča razširjenje žarenja po celi masi v določenem času.
1.2 OPREDELITVE IN ENOTE
Čas gorenja izražen v sekundah.
1.3 REFERENČNE SNOVI
Niso določene.
1.4 PRINCIP METODE
Snov se oblikuje v neprekinjen trak ali pas prahu, dolg približno 250 mm, in opravi se predhodni presejalni preskus, da se ugotovi, ali se ob vžigu s plinskim plamenom gorenje širi s plamenom ali tlenjem. Če se v določenem času gorenje razširi čez 200 mm pasu, se opravi popoln preskus za določanje hitrosti gorenja.
1.5 MERILA KAKOVOSTI
Niso navedena.
1.6 OPIS METODE
1.6.1 Predhodni presejalni preskus
Snov se oblikuje v neprekinjen trak ali pas prahu, približno 250 mm dolg, 20 mm širok in 10 mm visok, na negorljivi, neporozni in toplotno slabo prevodni osnovni plošči. K enemu koncu pasu prahu se približa vroč plamen plinskega gorilnika (premer najmanj 5 mm), dokler se prah ne vname ali za najmanj 2 minuti (5 minut pri prahu iz kovin ali kovinskih zlitin). Zapiše se, ali se gorenje razširi vzdolž 200 mm pasu v 4 minutah preskusa (ali 40 minutah pri kovinskem prahu). Če se snov ne vname in se gorenje v 4 minutah (ali 40 minutah) trajanja preskusa ne razširi ne s plamenom ne s tlenjem vzdolž 200 mm pasu prahu, se šteje, da snov ni lahko vnetljiva, in nadaljnje preskušanje ni potrebno. Če se gorenje razširi po snovi do 200 mm dolžine pasu prahu v manj kot 4 minutah, ali manj kot 40 minutah pri kovinskem prahu, je treba izvesti spodaj opisani postopek (točka 1.6.2 in naslednje).
1.6.2 Preskus hitrosti gorenja
1.6.2.1 Priprava
Prašnate ali granularne snovi se narahlo natresejo v kalup, dolg 250 mm, s trikotnim prečnim prerezom z notranjo višino 10 mm in širino 20 mm. Na obe vzdolžni stranici kalupa je pritrjena kovinska plošča, kot stranska pregrada, ki sega 2 mm nad gornji rob trikotnega prečnega prereza (slika). Nato se kalup trikrat spusti z višine 2 cm na trdo podlago. Če je potrebno, se kalup dopolni. Nato se stranski pregradi odstranita in presežek snovi postrga stran. Na vrh kalupa se položi plošča iz negorljivega, neporoznega in toplotno slabo prevodnega materiala, nato se cela priprava obrne za 180o in kalup odstrani.
Pastozne snovi se nanesejo na negorljivo, neporozno in toplotno slabo prevodno osnovno ploščo v obliki 250 mm dolgega valja s prečnim prerezom približno 1 cm2.
1.6.2.2 Preskusni pogoji
V primeru snovi, občutljivih na vlago, je treba preskus opraviti čim prej po odstranitvi snovi iz vsebnika.
1.6.2.3 Izvedba preskusa
Kupček se namesti v digestorij, prečno na tok zraka.
Hitrost zraka mora biti zadostna, da dim ne uhaja v laboratorij, in se med preskusom ne sme spreminjati. Okrog aparature je treba namestiti zaslon, za zaščito pred prepihom.
Z vročim plamenom plinskega gorilnika (s premerom najmanj 5 mm) se prižge en konec kupčka. Ko kupček zgori do dolžine 80 mm, se izmeri hitrost gorenja naslednjih 100 mm.
Preskus se izvede šestkrat, vsakokrat s čisto, hladno ploščo, razen če se že prej dobi pozitiven rezultat.
2. PODATKI
Za vrednotenje sta pomembna čas gorenja iz predhodnega presejalnega preskusa (1.6.1) in najmanjši čas gorenja v do šestih preskusih (1.6.2.3).
3. POROČANJE
3.1 POROČILO O PRESKUSU
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— natančna specifikacija snovi (identiteta in nečistote),
— opis preskusne snovi, njeno agregatno stanje vključno z vsebnostjo vlage,
— rezultati predhodnega presejalnega preskusa in preskusa hitrosti gorenja, če je bil opravljen,
— vse dodatne opombe, pomembne za razlago rezultatov.
3.2 RAZLAGA REZULTATA
Prašnate, granularne ali pastozne snovi se štejejo za lahko vnetljive, če je čas gorenja v katerem koli od preskusov, opravljenih v skladu s preskusnim postopkom, opisanim v 1.6.2, manj kot 45 sekund. Prah kovin ali kovinskih zlitin se šteje za lahko vnetljivega, če ga je mogoče prižgati in se plamen ali območje reakcije razširi po celotnem vzorcu v 10 minutah ali manj.
4. VIRI
NF T 20-042 (September 85). Chemical products for industrial use. Determination of the flammability of solids.
Dodatek
Slika
Kalup in pripomočki za pripravo kupčka
(Vse dimenzije so v milimetrih}
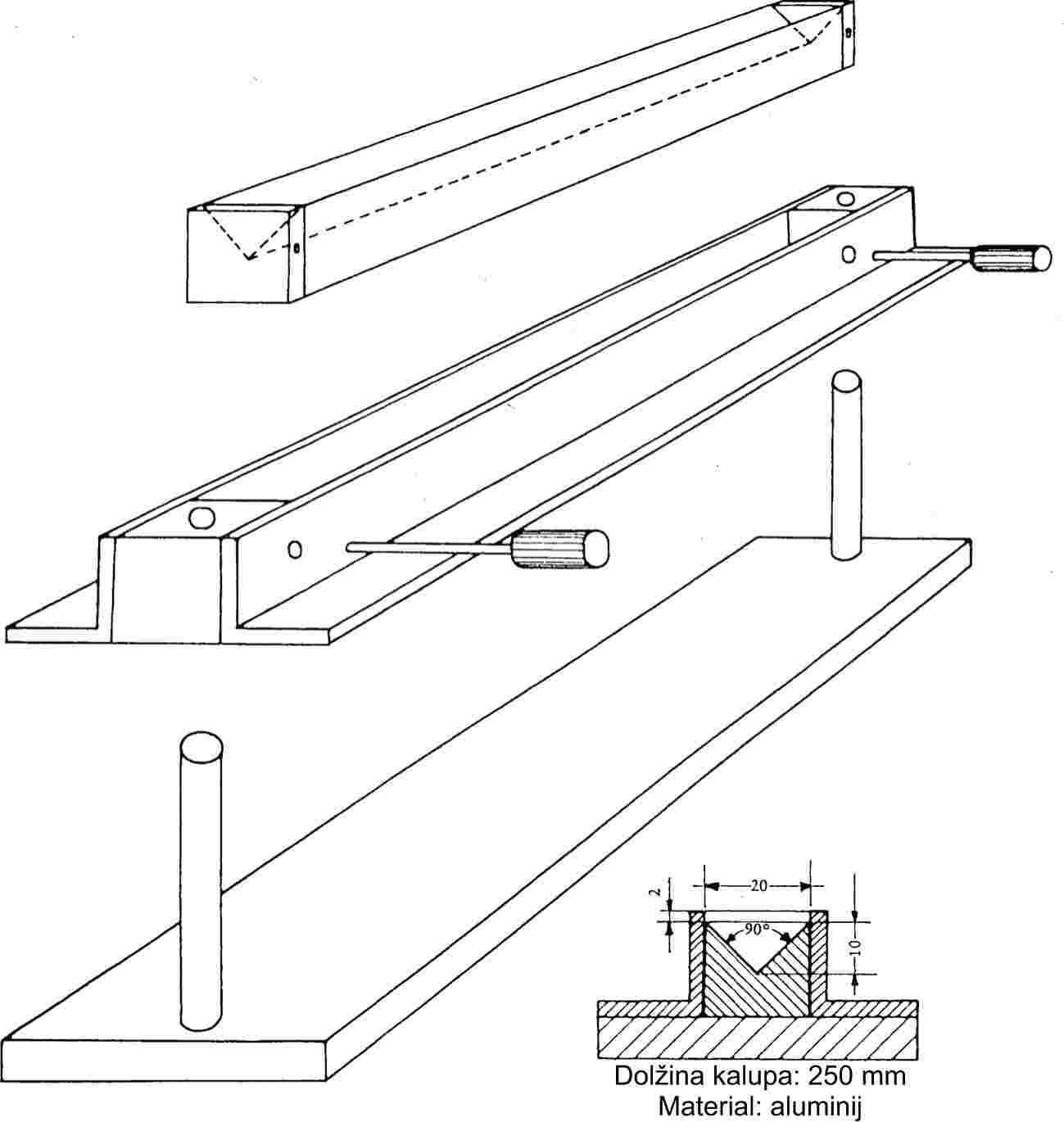
A.11 VNETLJIVOST (PLINI)
1. METODA
1.1 UVOD
Ta metoda omogoča ugotavljanje, ali so plini, zmešani z zrakom, pri sobni temperaturi (ca. 20 oC) in atmosferskem tlaku vnetljivi, in če so, v katerem območju koncentracij. Zmesi preskušanega plina z zrakom naraščajočih koncentracij se izpostavijo električni iskri, nato se opazuje, ali pride do vžiga.
1.2 OPREDELITVE IN ENOTE
Območje vnetljivosti je območje koncentracije med spodnjo in zgornjo mejo eksplozivnosti. Zgornja in spodnja meja eksplozivnosti sta tisti meji koncentracije vnetljivega plina v zmesi z zrakom, pri katerih se plamen ne širi.
1.3 REFERENČNE SNOVI
Niso določene.
1.4 PRINCIP METODE
Koncentracija plina v zraku se postopoma zvišuje in zmes se vsakokrat izpostavi električni iskri.
1.5. MERILA KAKOVOSTI
Niso navedena.
1.6 OPIS METODE
1.6.1 Aparatura
Preskusna posoda je pokončni stekleni valj z notranjim premerom najmanj 50 mm in višino najmanj 300 mm. Vžigalni elektrodi sta med seboj oddaljeni 3 do 5 mm in nameščeni 60 mm nad dnom valja. Valj je opremljen z odprtino za razbremenitev tlaka. Aparaturo je treba zaščiti z zaslonom, da se omeji morebitna škoda zaradi eksplozije.
Kot vir vžiga se uporabi indukcijska iskra, ki traja 0,5 s in jo proizvede visoko napetostni transformator z izhodno napetostjo od 10 do 15 kV (največja vhodna moč 300 W). Primer primerne aparature je opisan v viru (2).
1.6.2 Preskusni pogoji
Preskus je treba izvajati pri sobni temperaturi (ca. 20 oC).
1.6.3 Izvedba preskusa
Z uporabo dozirne črpalke se v stekleni valj potisne znana koncentracija plina v zraku. Skozi zmes se pošlje iskra, nato se opazuje, ali se plamen loči od vira vžiga in neodvisno širi ali ne. Postopoma se povečuje koncentracija plina, vsakokrat za 1 volumski %, do pojava vžiga, kakor je opisan zgoraj.
Če kemijska struktura plina kaže, da bi bil lahko nevnetljiv, in se lahko izračuna sestava stehiometrične zmesi z zrakom, je treba preskusiti le zmesi v območju od 10 % pod do 10 % nad stehiometrično sestavo, v intervalih po 1 %.
2. PODATKI
Pojav širjenja plamena je edini relevantni podatek za določitev te lastnosti.
3. POROČANJE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— natančna specifikacija snovi (identiteta in nečistote),
— opis uporabljene aparature skupaj z dimenzijami,
— temperatura, pri kateri je bil opravljen preskus,
— preskušene koncentracije in dobljeni rezultati,
— rezultat preskusa: nevnetljiv plin ali lahko vnetljiv plin,
— če se ugotovi, da je plin nevnetljiv, je treba navesti območje koncentracij, v katerem je bil preskušen v intervalih po 1 %,
— vse informacije in opombe, pomembne za razlago rezultatov.
4. VIRI
(1) NF T 20-041 (September 85). Chemical products for industrial use. Determination of the flammability of gases.
(2) W.Berthold, D.Conrad, T.Grewer, H.Grosse – einer Standard-Apparatur zur Messung von Explosionsgrenzen'. Chem.-Ing.-Tech. 1984, vol. 56, 2, 126–127. Wortmann, T. Redeker und H. Schacke. 'Entwicklung
A.12 VNETLJIVOST (STIK Z VODO)
1. METODA
1.1 UVOD
Ta preskusna metoda se lahko uporablja za ugotavljanje, ali se zaradi reakcije snovi ob stiku z vodo ali vlažnim zrakom razvije nevarna količina plina ali plinov, ki so morda lahko vnetljivi.
Preskusna metoda se lahko uporablja za trdne in tekoče snovi. Ta metoda ni primerna za snovi, ki se v stiku z zrakom spontano vnamejo.
1.2 OPREDELITVE IN ENOTE
Lahko vnetljivo: snovi, ki v stiku z vodo ali vlažnim zrakom razvijejo nevarne količine lahko vnetljivih plinov s hitrostjo najmanj 1 liter/kg na uro.
1.3 PRINCIP METODE
Snov se preskusi v skladu s spodaj opisanim zaporedjem faz; če pri kateri koli fazi pride do vžiga, nadaljnje preskušanje ni potrebno. Če je znano, da snov z vodo ne reagira burno, se preskušanje začne s fazo 4 (1.3.4).
1.3.1 Faza 1
Preskusna snov se da v kadičko z destilirano vodo pri 20 oC, nato se zapiše, ali se razviti plin vname ali ne.
1.3.2 Faza 2
Preskusna snov se da na filtrirni papir, ki plava na površini destilirane vode pri 20 oC v posodici, nato se zapiše, ali se razviti plin vname ali ne. Edini namen filtrirnega papirja je obdržati snov na enem mestu, da se poveča verjetnost vžiga.
1.3.3 Faza 3
Preskusna snov se oblikuje v približno 2 cm visok kupček s premerom približno 3 cm. Na kupček se kane nekaj kapljic vode, nato se zapiše, ali se razviti plin vname ali ne.
1.3.4 Faza 4
Preskusna snov se zmeša z destilirano vodo pri 20 oC, nato se sedem ur v enournih presledkih meri hitrost razvijanja plina. Če je hitrost razvijanja plina po sedmih urah neenakomerna ali naraščajoča, je treba čas merjenja podaljšati na največ pet dni. Preskus se lahko prekine, če hitrost ob katerem koli času preseže 1 liter/kg na uro.
1.4 REFERENČNE SNOVI
Niso določene.
1.5 MERILA KAKOVOSTI
Niso navedena.
1.6 OPIS METOD
1.6.1 Faza 1
1.6.1.1 Preskusni pogoji
Preskus se izvaja pri sobni temperaturi (ca. 20 oC).
1.6.1.2 Izvedba preskusa
Majhna količina (približno 2 mm v premeru) preskusne snovi se da v kadičko z destilirano vodo. Zapisati je treba, (i) ali se razvije kakršen koli plin in (ii) ali se ta plin vname. Če se plin vname, nadaljnje preskušanje snovi ni več potrebno, saj se snov obravnava kot nevarna.
1.6.2 Faza 2
1.6.2.1 Aparatura
Filtrirni papir se plosko položi na površino destilirane vode v kakršni koli ustrezni posodi, npr. izparilnici s premerom 100 mm.
1.6.2.2 Preskusni pogoji
Preskus se izvaja pri sobni temperaturi (ca. 20 oC).
1.6.2.3 Izvedba preskusa
Majhna količina preskusne snovi (približno 2 mm v premeru) se da na sredino filtrirnega papirja. Zapisati je treba, (i) ali se razvije kakršen koli plin in (ii) ali se ta plin vname. Če se plin vname, nadaljnje preskušanje snovi ni več potrebno, saj se snov obravnava kot nevarna.
1.6.3 Faza 3
1.6.3.1 Preskusni pogoji
Preskus se izvaja pri sobni temperaturi (ca. 20 oC).
1.6.3.2 Izvedba preskusa
Preskusna snov se oblikuje v približno 2 cm visok in 3 cm širok kupček z jamico na vrhu. V jamico se kane nekaj kapljic vode in zapiše, (i) ali se razvije kakršen koli plin in (ii) ali se ta plin vname. Če se plin vname, nadaljnje preskušanje snovi ni več potrebno, saj se snov obravnava kot nevarna.
1.6.4 Faza 4
1.6.4.1 Aparatura
Aparatura se sestavi, kakor je prikazano na sliki.
1.6.4.2 Preskusni pogoji
Preveri se ali posoda s preskusno snovjo vsebuje prah < 500 μm (velikost delcev). Če prah predstavlja več kot 1 % m/m celotne količine ali če je vzorec drobljiv, je treba celotno snov pred preskušanjem zmleti v prah, da se upošteva manjšanje velikosti delcev med shranjevanjem in uporabo; sicer se snov preskuša takšna, kakršna je bila prejeta. Preskus je treba izvajati pri sobni temperaturi (pribl. 20 oC) in atmosferskem tlaku.
1.6.4.3 Izvedba preskusa
V lij kapalnik aparature se da 10 do 20 ml vode in v erlenmajerico 10 g snovi. Volumen razvitega plina se lahko izmeri s kakršnimi koli primernimi pripomočki. Odpre se pipica lija, da voda steče v erlenmajerico, in sproži štoparica. V obdobju sedmih ur se vsako uro se izmeri razvijanje plina. Če je v tem obdobju razvijanje plina neenakomerno ali če ob koncu tega obdobja hitrost razvijanja plina narašča, se merjenje nadaljuje do največ petih dni. Če hitrost razvijanja plina kadar koli med merjenjem preseže 1 liter/kg na uro, se preskus lahko prekine. Ta preskus je treba izvesti trikrat.
Če kemijska identiteta plina ni znana, je treba plin analizirati. Če plin vsebuje lahko vnetljive sestavine in ni znano, ali je celotna zmes lahko vnetljiva, je treba pripraviti zmes z enako sestavo in jo preskusiti po metodi A.11.
2. PODATKI
Snov se šteje za nevarno, če:
— v kateri koli fazi preskusnega postopka pride do spontanega vžiga,
— ali
— se razvija vnetljiv plin s hitrostjo več kot 1 liter/kg snovi na uro.
3. POROČANJE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— natančna specifikacija snovi (identiteta in nečistote),
— podrobnosti o kakršni koli predpripravi preskusne snovi,
— rezultati preskusov (faze 1, 2, 3 in 4),
— kemijska identiteta razvitega plina,
— hitrost razvijanja plina, če se izvede faza 4 (1.6.4),
— kakršne koli dodatne opombe, pomembne za razlago rezultatov.
4. VIRI
(1) Recommendations on the transport of dangerous goods, test and criteria, 1990, United Nations, New York.
(2) NF T 20-040 (September 85). Chemical products for industrial use. Determination of the flammability of gases formed by the hydrolysis of solid and liquid products.
Dodatek
Slika
Aparatura
A.13 PIROFORNE LASTNOSTI TRDNIH SNOVI IN TEKOČIN
1. METODA
1.1 UVOD
Preskusni postopek se uporablja za trdne ali tekoče snovi, ki se že v majhnih količinah spontano vnamejo kmalu zatem, ko pridejo v stik z zrakom pri sobni temperaturi (ca. 20 oC).
V to metodo niso vključene snovi, ki morajo biti izpostavljene zraku več ur ali dni pri sobni temperaturi ali pri zvišani temperaturi, preden se vnamejo.
1.2 OPREDELITVE IN ENOTE
Šteje se, da so snovi piroforne, če se vnamejo ali povzročijo zoglenelost pri pogojih, opisanih v 1.6.
Morda bo treba preskusiti tudi samovnetljivost tekočin po metodi A.15 Temperatura samovžiga (tekočine in plini).
1.3 REFERENČNE SNOVI
Niso določene.
1.4 PRINCIP METODE
Snov, naj bo trdna ali tekoča, se da v inertno posodo in za pet minut izpostavi zraku pri sobni temperaturi. Če se tekoča snov ne vname, jo absorbiramo na filtrirni papir in za pet minut izpostavimo zraku pri sobni temperaturi (pribl. 20 oC). Če se trdna snov ali tekočina vname ali če tekočina vžge ali poogleni filtrirni papir, se šteje, da je snov piroforna.
1.5 MERILA KAKOVOSTI
Ponovljivost: zaradi varnosti zadostuje en sam pozitiven rezultat, da se snov šteje za piroforno.
1.6 OPIS PRESKUSNE METODE
1.6.1 Aparatura
V porcelanski lonček s premerom približno 10 cm se natrese približno 5 mm visok kupček diatomejske zemlje pri sobni temperaturi (ca. 20 oC).
Opomba:
Diatomejska zemlja ali katera koli druga primerljiva splošno dostopna inertna snov se šteje za reprezentativno prst, na katero bi se lahko v primeru nesreče razlila preskusna snov.
Za preskušanje tekočin, ki se ne vnamejo ob stiku z zrakom, če so v stiku z inertnim nosilcem, potrebujemo suh filtrirni papir.
1.6.2 Izvedba preskusa
(a) Prašnate trdne snovi
Z višine približno 1 m se na negorljivo površino strese 1 do 2 cm3 prašnate preskusne snovi in opazuje, ali se snov vname med padanjem ali v petih minutah posedanja.
Preskus se izvede šestkrat, razen če že prej pride do vžiga.
(b) Tekočine
Približno 5 cm3 preskusne tekočine se vlije v pripravljen porcelanski lonček in opazuje, ali se tekočina vname v petih minutah.
Če v šestih preskusih ne pride do vžiga, se opravijo naslednji preskusi:
Iz brizge se na prepognjen filtrirni papir nanese 0,5 ml preskusne snovi in opazuje, ali se filtrirni papir v petih minutah od nanosa tekočine vname ali zogleni. Preskus se izvede trikrat, razen če že prej pride do vžiga.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Preskus se lahko prekine, takoj ko se v katerem koli od preskusov dobi pozitiven rezultat.
2.2 VREDNOTENJE
Če se snov vname v petih minutah po dodatku v inertno posodo in izpostavitvi zraku ali če tekoča snov povzroči pooglenitev ali vžig filtrirnega papirja v petih minutah po dodatku in izpostavitvi zraku, se šteje, da je piroforna.
3. POROČANJE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— natančna specifikacija snovi (identiteta in nečistote),
— rezultati preskusov,
— kakršne koli dodatne opombe, pomembne za razlago rezultatov.
4. VIRI
(1) NF T 20-039 (September 85). Chemical products for industrial use. Determination of the spontaneous flammability of solids and liquids.
(2) Recommendations on the Transport of Dangerous Goods, Test and criteria, 1990, United Nations, New York.
A.14 EKSPLOZIVNE LASTNOSTI
1. METODA
1.1 UVOD
Metoda predstavlja preskusno shemo za ugotavljanje, ali trdna ali pastozna snov predstavlja nevarnost eksplozije, ko se izpostavi plamenu (toplotna občutljivost) ali udarcu ali trenju (občutljivost za mehanske dražljaje), in ali tekoča snov predstavlja nevarnost eksplozije, ko se izpostavi plamenu ali udarcu.
Metoda zajema tri dele:
(a) preskus toplotne občutljivosti (1);
(b) preskus mehanske občutljivosti za udarce (1);
(c) preskus mehanske občutljivosti za trenje (1).
Metoda daje podatke za oceno verjetnosti povzročitve eksplozije s pomočjo nekaterih običajnih dražljajev. Metoda ni namenjena ugotavljanju zmožnosti snovi, da eksplodira v kakršnih koli pogojih.
Metoda je primerna za ugotavljanje, ali bo snov predstavljala nevarnost eksplozije (toplotna in mehanska občutljivost), v pogojih, določenih v direktivi. Temelji na številnih vrstah aparatur, ki se splošno uporabljajo na mednarodni ravni (1) in običajno dajejo uporabne rezultate. Priznava se, da metoda ni dokončna. Lahko se uporabi aparatura, ki je drugačna od navedene, pod pogojem da je mednarodno priznana in se rezultati lahko zadovoljivo primerjajo z rezultati, dobljenimi z navedeno aparaturo.
Preskusov ni treba izvesti, kadar je iz razpoložljivih podatkov o termodinamiki (toplota proizvajanja, toplota razgrajevanja) in/ali odsotnosti nekaterih reaktivnih skupin (2) v strukturni formuli brez vsakršnega dvoma razvidno, da snov ni zmožna hitre razgradnje s proizvodnjo plinov ali sproščanjem toplote (tj. snov ne predstavlja nevarnosti eksplozije). Preskus mehanske občutljivosti za trenje pri tekočinah ni potreben.
1.2 OPREDELITVE IN ENOTE
Eksplozivno:
Snovi, ki lahko eksplodirajo ob izpostavitvi plamenu ali so občutljive za udarce ali trenje v posebni aparaturi (ali so bolj mehansko občutljive kakor 1,3-dinitrobenzen v nadomestni aparaturi).
1.3 REFERENČNE SNOVI
1,3-dinitrobenzen, tehnični, kristaliničen, presejan do velikosti delcev do 0,5 mm, za metode udarca in trenja.
Perhidro-1,3,5-trinitro-1,3,5-triazin (RDX, heksogen, ciklonit – CAS 121-82-4), rekristaliziran iz vodnega cikloheksanona, mokro presejan skozi sito z odprtinami 250 μm in zadržan na situ z odprtinami 150 μm ter posušen pri 103 ± 2 oC (4 ure) za drugi niz preskusov trenja in udarcev.
1.4 PRINCIP METODE
Za določitev varnih pogojev izvedbe treh preskusov občutljivosti so potrebni predhodni preskusi.
1.4.1 Preskusi varnosti pri ravnanju s snovjo (3)
Zaradi varnosti se pred izvedbo glavnih preskusov zelo majhni vzorci (ca. 10 mg) snovi segrevajo na odprtem s plamenom plinskega gorilnika ter izpostavijo udarcu v kakršni koli primerni aparaturi in trenju z uporabo kladiva in nakovala ali kakršne koli druge torne naprave. Namen preskusa je ugotoviti, ali je snov tako občutljiva in eksplozivna, da je treba predpisane preskuse občutljivosti, zlasti tiste za toplotno občutljivost, izvajati še posebej previdno, da se izvajalec preskusov ne poškoduje.
1.4.2 Toplotna občutljivost
Pri tej metodi se snov segreva v jekleni cevi, zaprti s šobnimi ploščami s spremenljivim premerom odprtine, da se določi, ali je verjetno, da bo snov eksplodirala pri intenzivni toploti in določeni zaprtosti.
1.4.3 Mehanska občutljivost (udarec)
Pri tej metodi se snov izpostavi udarcu določene mase, spuščene z določene višine.
1.4.4 Mehanska občutljivost (trenje)
Pri tej metodi se trdna ali pastozna snov izpostavi trenju med standardnimi površinami v določenih pogojih obremenitve in relativnega gibanja.
1.5 MERILA KAKOVOSTI
Niso navedena.
1.6 OPIS METODE
1.6.1 Toplotna občutljivost (učinek plamena)
1.6.1.1 Aparatura
Aparaturo sestavlja jeklena cev za enkratno uporabo s pripravo za zapiranje za večkratno uporabo (slika 1), nameščena v grelno in zaščitno napravo. Vsaka cev je izdelana z globokim vlečenjem iz jeklene pločevine (glej dodatek), njen notranji premer je 24 mm, dolžina 75 mm in debelina stene 0,5 mm. Na odprtem koncu cevi je prirobnica, ki omogoča zapiranje cevi s šobnim sklopom. Ta sklop sestavlja proti tlaku odporna šobna plošča z odprtino na sredini, ki je trdno pritrjena na cev z dvodelno vijačno zvezo (matica in navojni obroč). Matica in navojni obroč sta izdelana iz krom-manganovega jekla (glej dodatek), ki ne proizvaja isker do 800 oC. Šobne plošče so debele 6 mm, izdelane iz jekla, obstojnega na vročino (glej dodatek), in so na voljo z različnimi premeri odprtin.
1.6.1.2 Preskusni pogoji
Običajno se snov preskuša takšna, kakršna je bila prejeta, čeprav je v nekaterih primerih, npr. pri stisnjenih, litih ali kako drugače kondenziranih, morda treba snov pred preskušanjem zdrobiti.
Pri trdnih snoveh se masa snovi, ki se bo uporabila v vsakem preskusu, določi z dvostopenjskim predhodnim preskusom. Stehtana cev se napolni z 9 cm3 snovi, nato se snov potlači s pritiskom sile 80 N po celotnem prečnem prerezom cevi. Zaradi varnosti, ali kadar se stiskanjem lahko spremeni agregatno stanje snovi, se lahko uporabijo drugi postopki polnjenja; npr. če je snov zelo občutljiva za trenje, stiskanje ni primerno. Če je snov stisljiva, se dodajajo nove količine snovi z vsakokratnim stiskanjem, dokler ni cev napolnjena do višine 55 mm od roba. Določi se skupna masa, porabljena za napolnitev cevi do višine 55 mm od roba, nato se še dvakrat doda enaka količina snovi, ki se vsakokrat potlači s silo 80 N. Zatem se snov bodisi doda s stiskanjem bodisi odvzame, kar je potrebno, da se cev napolni do višine 15 mm od roba. Nato se izvede drugi predhodni preskus, ki se začne s stisnjeno količino, enako tretjini skupne mase, določene pri prvem predhodnem preskusu. Dodata se še dve taki količini in potlačita s silo 80 N, nato se z dodajanjem ali odvzemanjem snovi prilagodi njen nivo v cevi do višine 15 mm od roba. Pri vseh preskusih se uporabi količina trdne snovi, določena v drugem predhodnem preskusu; cev se polni v treh korakih, s tremi enako velikimi deli, pri čemer se vsak del s potrebno silo stisne do volumna 9 cm3. (To se lahko olajša z uporabo distančnih obročev.)
Tekočine in geli se nalijejo v cev do višine 60 mm, pri čemer je treba pri gelih posebej paziti, da vmes ni praznih prostorov. Na cev se od spodaj natakne navojni obroč, vstavi se ustrezna šobna plošča, nato se nanese nekaj maziva na osnovi molibdenovega disulfida in privije matica. Nujno se je treba prepričati, da nič snovi ni ujete med prirobnico in ploščo ali v navoju.
Kot gorivo se uporabi propan iz industrijske jeklenke, opremljene z regulatorjem tlaka (60 do 70 mbar), ki se dovaja skozi merilnik in preko razdelilnika enakomerno porazdeli (kar se določi z opazovanjem plamenov gorilnikov) med štiri gorilnike. Gorilniki so po preskusni komori razporejeni, kakor prikazuje slika 1. Skupna poraba vseh štirih gorilnikov je 3,2 litra propana na minuto. Lahko se uporabijo tudi drugi plini in gorilniki, vendar mora biti hitrost segrevanja taka, kot je določena na sliki 3. Pri vseh aparaturah je treba periodično preverjati hitrost segrevanja z uporabo cevi, napolnjenih z dibutilftalatom, kakor je navedeno na sliki 3.
1.6.1.3 Izvedba preskusov
V vsakem preskusu se cev segreva, dokler je ne raznese vendar ne dalj kot 5 minut. Preskus, pri katerem cev razpade na tri ali več delov, ki so v nekaterih primerih lahko med seboj povezani s tankimi trakovi kovine, kakor je prikazano na sliki 2, se ovrednoti kot preskus, pri katerem je prišlo do eksplozije. Preskus, pri katerem cev razpade na manj delov ali sploh ne razpade, se šteje kot preskus, ki ne povzroči eksplozije.
Najprej se opravi niz treh preskusov z odprtino premera 6,0 mm na šobni plošči, in če pri nobenem ni eksplozije, se izvede drugi niz treh preskusov z odprtino premera 2,0 mm na šobni plošči. Če pri nobenem nizu preskusov ne nastane eksplozija, nadaljnje preskušanje ni potrebno.
1.6.1.4 Vrednotenje
Rezultat preskusa je pozitiven, če pri katerem koli od zgoraj navedenih nizov preskusov nastane eksplozija.
1.6.2 Mehanska občutljivost (udarec)
1.6.2.1 Aparatura (slika 4)
Bistveni deli značilne aparature z udarnim kladivom so blok iz jeklene litine z osnovno ploščo, nakovalo, stebriček, vodila, udarne uteži, sprožilna naprava in priprava za vzorec. Jekleno nakovalo, 100 mm (premer) × 70 mm (višina), je privito na zgornji del jeklenega bloka, 230 mm (dolžina) × 250 mm (širina) × 200 mm (višina), z ulito osnovno ploščo, 450 mm (dolžina) × 450 mm (širina) × 60 mm (višina). Stebriček iz brezšivne vlečene jeklene cevi je nameščen v držalu, privitem na zadnjo stran jeklenega bloka. Aparatura je s štirimi vijaki pritrjena na masiven cementni blok 60 × 60 × 60 cm, tako da sta vodilni tirnici točno navpični in udarna utež prosto pade. Na voljo za uporabo sta dve uteži, 5 in 10 kg, iz masivnega jekla. Udarna glava vsake uteži je iz utrjenega jekla, 60 do 63 HRC, in ima premer najmanj 25 mm.
Vzorec se zapre v udarno pripravo, ki jo sestavljata dva valja iz masivnega jekla s skupno osjo, postavljena eden nad drugim, v votlem jeklenem valju, ki predstavlja vodilni obroč. Premer masivnih jeklenih valjev mora biti 10 (– 0,003, – 0,005) mm in višina 10 mm, njuna površina mora biti zloščena, robovi zaobljeni (polmer krivulje 0,5 mm), njuna trdota pa znašati 58 do 65 HRC. Zunanji premer votlega valja mora biti 16 mm, zloščene izvrtine 10 (+ 0,005, + 0,010) mm, višina pa 13 mm. Udarna priprava se sestavi na vmesnem nakovalu (premer 26 mm in višina 26 mm) iz jekla in centrira z obročem, ki ima odprtinice za odvajanje hlapov.
1.6.2.2 Preskusni pogoji
Volumen vzorca mora biti 40 mm3 ali ustrezen za kakršno koli nadomestno aparaturo. Trdne snovi se preskušajo v suhem stanju in pripravljene na naslednji način:
(a) prašnate snovi se presejejo (sito z odprtinami 0,5 mm); v preskusu se uporabi vsa snov, ki se preseje skozi sito;
(b) stisnjene, ulite ali kako drugače kondenzirane snovi se razbijejo na manjše delce in presejejo; v preskusu se uporabi presejana frakcija s premerom 0,5 do 1 mm, ki mora biti reprezentativna za izvirno snov.
Snovi, ki se običajno dobavljajo v pastozni obliki, se, kadar je mogoče, preskušajo v suhem stanju, v vsakem primeru pa po odstranitvi čim večje količine redčila. Pri preskušanju tekočih snovi se med zgornjim in spodnjim jeklenim valjem pusti razmik 1 mm.
1.6.2.3 Izvedba preskusov
Izvede se niz šestih preskusov s spuščanjem mase 10 kg z višine 0,40 m (40 J). Če pri teh šestih preskusih pri 40 J nastane eksplozija, je treba izvesti dodaten niz šestih preskusov s spuščanjem mase 5 kg z višine 0,15 m (7,5 J). V drugih napravah se vzorec primerja z izbrano referenčno snovjo po uveljavljenem postopku (npr. s tehniko dviganja in spuščanja itd.).
1.6.2.4 Vrednotenje
Šteje se, da je rezultat pozitiven, če eksplozija (vzplamenitev in/ali pokanje sta enakovredna eksploziji) nastane najmanj enkrat med katerim koli od preskusov s predpisano udarno aparaturo ali če je vzorec bolj občutljiv kot 1,3-dinitrobenzen ali RDX pri drugačnem preskusu z udarcem.
1.6.3 Mehanska občutljivost (trenje)
1.6.3.1 Aparatura (slika 5)
Torna aparatura je sestavljena iz osnovne plošče iz jeklene litine, na katero je postavljena torna naprava. To sestavljata nepremični porcelanast valjček in premična porcelanasta ploščica. Porcelanasta ploščica je pritrjena na drsnik, ki se premika po dveh vodilih. Drsnik je povezan z elektromotorjem preko pomikalnika, ekscentra in ustreznega menjalnika, tako da se porcelanasta ploščica enkrat samkrat premakne naprej in nazaj pod porcelanastim valjčkom za 10 mm. Porcelanast valjček se lahko obremeni z npr. 120 ali 360 newtoni.
Porcelanaste ploščice so izdelane iz belega tehničnega porcelana (hrapavost 9 do 32 mm) in imajo dimenzije 25 mm (dolžina) × 25 mm (širina) × 5 mm (višina). Porcelanast valjček, je prav tako narejen iz belega tehničnega porcelana ter je dolg 15 mm, ima premer 10 mm in hrapava zaokrožena konca s polmerom zaokroženega dela 10 mm.
1.6.3.2 Preskusni pogoji
Volumen vzorca mora biti 10 mm3 ali ustrezen za kakršno koli drugačno aparaturo.
Trdne snovi se preskušajo v suhem stanju in pripravljene na naslednji način:
(a) prašnate snovi se presejejo (sito z odprtinami 0,5 mm); v preskusu se uporabi vsa presejana snov;
(b) stisnjene, ulite ali kako drugače kondenzirane snovi se zdrobijo na manjše delce in presejejo; v preskusu se uporabi presejana frakcija s premerom < 0,5 mm.
Snovi, ki se običajno dobavljajo v pastozni obliki, se, kadar je mogoče, preskušajo v suhem stanju. Če se snovi ne da posušiti, se pasta (po odstranitvi največje možne količine redčila) preskusi kot 0,5 mm debel, 2 mm širok in 10 mm dolg film, pripravljen s šablono.
1.6.3.3 Izvedba preskusov
Porcelanast valjček se postavi na vzorec in obremeni. Med izvajanjem preskusa morajo zareze na porcelanasti ploščici ležati prečno na smer premikanja. Paziti je treba, da valjček stoji na vzorcu, da je pod valjčkom dovolj preskusne snovi in da se ploščica pravilno premika pod valjčkom. Pri pastoznih snoveh se za nanos snovi na ploščico uporabi 0,5 mm debela šablona z odprtino 2 × 10 mm. Porcelanasta ploščica se mora v 0,44 sekundah premakniti 10 mm naprej in nazaj pod porcelanastim valjčkom. Vsak del površine ploščice in valjčka se sme uporabiti le enkrat; oba konca vsakega valjčka se uporabita za dva preskusa in vsaka površina ploščice za tri preskuse.
Izvede se niz šestih preskusov z obremenitvijo 360 N. Če se v teh šestih preskusih dobi pozitiven rezultat, je treba izvesti dodaten niz šestih preskusov z obremenitvijo 120 N. V drugi aparaturi se vzorec primerja z izbrano referenčno snovjo po uveljavljenem postopku (npr. s tehniko dviganja in spuščanja itd.).
1.6.3.4 Vrednotenje
Šteje se, da je rezultat pozitiven, če eksplozija (prasketanje in/ali pokanje ali vzplamenitev so enakovredni eksploziji) nastane vsaj enkrat med katerim koli od preskusov s predpisano torno aparaturo ali če izpolnjuje enakovredna merila pri drugačnem tornem preskusu.
2. PODATKI
Načeloma se šteje, da snov predstavlja nevarnost eksplozije v smislu te direktive, če preskus toplotne, udarne ali torne občutljivosti da pozitiven rezultat.
3. POROČANJE
3.1 POROČILO O PRESKUSU
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— identiteta, sestava, čistost, vsebnost vlage itd., preskusne snovi,
— agregatno stanje vzorca in ali je bil zdrobljen, zdrobljen in/ali presejan,
— opažanja med preskusi toplotne občutljivosti (npr. masa vzorca, število delov itd.),
— opažanja med preskusi mehanske občutljivosti (npr. nastajanje velikih količin dima ali popoln razpad brez pokanja, plamena, isker, prasketanja itd.),
— rezultati vsake vrste preskusov,
— če je bila uporabljena drugačna aparatura, je treba navesti znanstveno utemeljitev ter dokaze o soodvisnosti med rezultati, pridobljenimi s predpisano aparaturo, in tistimi, pridobljenimi z enakovredno aparaturo,
— kakršne koli koristne opombe, na primer sklicevanja na preskuse s podobnimi proizvodi, ki so lahko pomembne za pravilno razlago rezultatov,
— vse dodatne opombe, pomembne za razlago rezultatov.
3.2 RAZLAGA IN VREDNOTENJE REZULTATOV
V poročilu o preskusu je treba navesti tudi kakršne koli rezultate, ki se štejejo za lažne, anomalne ali nereprezentativne. Če je treba katerega od rezultatov zavreči, je treba navesti obrazložitev in rezultate kakršnega koli nadomestnega ali dopolnilnega preskušanja. Če se anomalnega rezultata ne da obrazložiti, ga je treba sprejeti takšnega, kakršen je, in ga uporabiti za ustrezno razvrstitev snovi.
4. VIRI
(1) Recommendations on the Transport of Dangerous Goods: Tests and criteria, 1990, United Nations, New York.
(2) Bretherick, L., Handbook of Reactive Chemical Hazards, 4th edition, Butterworths, London, ISBN 0-750-60103-5, 1990.
(3) Koenen, H., Ide, K.H. and Swart, K.H., Explosivstoffe, 1961, vol. 3, 6-13 and 30–42.
(4) NF T 20-038 (September 85). Chemical products for industrial use – Determination of explosion risk.
Dodatek
Primer specifikacije materiala za preskus toplotne občutljivosti (glej DIN 1623)
(1) Cev: Specifikacija materiala št. 1.0336.505 g
(2) Šobna plošča: Specifikacija materiala št. 1.4873
(3) Navojni obroč in matica: Specifikacija materiala št. 1.3817
Slika 1
Aparatura za toplotno občutljivost
(vse dimenzije so v milimetrih)

Slika 2
Preskus toplotne občutljivosti
(primeri fragmentacije)

Slika 3
Umeritev hitrosti segrevanja pri preskusu toplotne občutljivosti

Krivulja temperatura/čas, dobljena s segrevanjem dibutilftalata (27 cm5) v zaprti (šobna plošča 1,5 mm) cevi ob pretoku propana 3,2 litra/minuto. Temperatura se meri s termočlenom nikelj-krom s premerom 1 mm v ovoju iz nerjavečega jekla, nameščenim centralno, 43 mm pod robom cevi. V območju med 135 in 285 °C mora biti hitrost segrevanja med 185 in 215 K/minuto.
Slika 4
Aparatura za udarni preskus
(vse dimenzije so v milimetrih)

Slika 4
Nadaljevanje

Slika 5
Aparatura za občutljivost za trenje

A.15 TEMPERATURA SAMOVŽIGA (TEKOČINE IN PLINI)
1. METODA
1.1 UVOD
Eksplozivne snovi in snovi, ki se spontano vnamejo v stiku z zrakom pri sobni temperaturi, se ne smejo preskušati s tem preskusom. Preskusni postopek se uporablja za pline, tekočine in pare, ki se ob prisotnosti zraka lahko vnamejo na vroči površini.
Temperaturo samovžiga lahko znatno zniža prisotnost katalitskih nečistot, material površine ali večji volumen preskusne posode.
1.2 OPREDELITVE IN ENOTE
Stopnja samovnetljivosti se izraža s temperaturo samovžiga. Temperatura samovžiga je najnižja temperatura, pri kateri se preskusna snov vname, če se pomeša z zrakom v pogojih, opredeljenih v preskusni metodi.
1.3 REFERENČNE SNOVI
Referenčne snovi so naštete v standardih (glej 1.6.3). Predvsem naj bi se uporabljale za občasno preverjanje učinkovitosti metode in za omogočanje primerjave z rezultati drugih metod.
1.4 PRINCIP METODE
S to metodo se določa najnižja temperatura notranje površine posode, pri kateri se plin, para ali tekočina, vbrizgana v posodo, vname.
1.5 MERILA KAKOVOSTI
Ponovljivost se spreminja v skladu z območjem temperatur samovžiga in uporabljeno preskusno metodo.
Občutljivost in specifičnost sta odvisni od uporabljene preskusne metode.
1.6 OPIS METODE
1.6.1 Aparatura
Aparatura je opisana v metodi iz 1.6.3.
1.6.2 Preskusni pogoji
Preskus na vzorcu preskusne snovi se izvede v skladu z metodo iz 1.6.3.
1.6.3 Izvedba preskusa
Glej IEC 79-4, DIN 51794, ASTM-E 659-78, BS 4056, NF T 20-037.
2. PODATKI
Zapišejo se temperatura preskusa, atmosferski tlak, uporabljena količina vzorca, čas, ki preteče do samovžiga.
3. POROČANJE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— natančna specifikacija snovi (identiteta in nečistote),
— uporabljena količina vzorca, atmosferski tlak,
— uporabljena aparatura,
— rezultati meritev (temperature preskusa, rezultati v zvezi z vžigom, ustrezni časovni zamik),
— vse dodatne opombe, pomembne za razlago rezultatov.
4. VIRI
Jih ni.
A.16 RELATIVNA TEMPERATURA SAMOVŽIGA ZA TRDNE SNOVI
1. METODA
1.1 UVOD
Eksplozivne snovi in snovi, ki se spontano vnamejo v stiku z zrakom pri sobni temperaturi, se ne smejo preskušati s tem preskusom.
Namen tega preskusa je zagotoviti predhodne podatke o samovnetljivosti trdnih snovi pri povišani temperaturi.
Če se vročina, ki se razvije ob reagiranju snovi s kisikom ali eksotermni razgradnji, ne porazgubi dovolj hitro po okolici, se bo snov samosegrevala in vnela. Samovžig se torej pojavi, kadar se toplota proizvaja hitreje, kot se izgublja.
Preskusni postopek je koristen kot predhodni presejalni preskus za trdne snovi. Zaradi zapletene narave vžiga in izgorevanja trdnih snovi je treba temperaturo samovžiga, določeno v skladu s to preskusno metodo, uporabljati le za primerjanje.
1.2 OPREDELITVE IN ENOTE
Temperatura samovžiga, dobljena s to metodo, je najnižja temperatura okolja, izražena v oC, pri kateri se določen volumen snovi v določenih pogojih vname.
1.3. REFERENČNE SNOVI
Jih ni.
1.4. PRINCIP METODE
Določen volumen preskusne snovi se da v peč pri sobni temperaturi; zapisuje se krivulja temperatura/čas, ki se nanaša na razmere v sredini vzorca, medtem ko se temperatura peči viša do 400 oC, ali do tališča, če je to nižje, s hitrostjo 0,5oC/min. Pri tem preskusu se temperatura peči, pri kateri temperatura vzorca doseže 400 oC s samosegrevanjem, imenuje temperatura samovžiga.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS METODE
1.6.1 Aparatura
1.6.1.1 Peč
Laboratorijska peč s temperaturnim programom (volumen približno 2 litra), opremljena s sistemom za naravno kroženje zraka in protieksplozijsko zaščito. Da se prepreči nastanek morebitne eksplozije, je treba kakršnim koli razgradnim plinom preprečiti stik z električnimi grelnimi elementi.
1.6.1.2 Kocka iz žičnate mreže
Kos žičnate mreže iz nerjavnega jekla z odprtinami 0,045 mm se razreže v skladu z vzorcem na sliki 1. Mreža se pregane in poveže z žico v kocko brez zgornje ploskve.
1.6.1.3 Termočlena
Primerna termočlena.
1.6.1.4 Zapisovalnik
Kakršen koli dvokanalni zapisovalnik, umerjen na 0 do 600 oC ali ustrezno napetost.
1.6.2 Preskusni pogoji
Snovi se preskušajo takšne, kakršne so bile prejete.
1.6.3 Izvedba preskusa
Kocka se napolni s preskusno snovjo, nato se narahlo stresa in polni s snovjo, dokler ni povsem polna. Kocka se nato obesi na sredino peči pri sobni temperaturi. En termočlen se namesti v sredino kocke, drugi pa med kocko in steno peči, da se beleži temperatura peči.
Temperatura se viša do 400 oC ali do tališča, če je to nižje, s hitrostjo 0,5oC/min in med tem se ves čas zapisujeta temperaturi peči in vzorca.
Ko se snov vname, termočlen v vzorcu pokaže izjemno skokovit porast temperature nad temperaturo peči.
2. PODATKI
Za vrednotenje je pomembna temperatura peči, pri kateri temperatura vzorca s samosegrevanjem doseže 400 oC (glej sliko 2).
3. POROČANJE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— opis preskusne snovi,
— rezultati merjenja, vključno s krivuljo temperatura/čas,
— vse dodatne opombe, pomembne za razlago rezultatov.
4. VIRI
NF T 20-036 (September 85). Chemical products for industrial use. Determination of the relative temperature of the spontaneous flammability of solids.
Slika 1
Vzorec za 20 mm-preskusno kocko

Slika 2
Značilna krivulja temperatura/čas
A.17 OKSIDACIJSKE LASTNOSTI (TRDNE SNOVI)
1. METODA
1.1 UVOD
Pred izvajanjem tega preskusa je koristno imeti predhodne informacije o vseh morebitnih eksplozivnih lastnostih snovi.
Ta preskus ni uporaben za tekočine, pline, eksplozivne ali lahko vnetljive snovi ali organske perokside.
Preskusa ni treba izvesti, če se na podlagi preučitve strukturne formule brez vsakršnega dvoma ugotovi, da snov ni zmožna eksotermno reagirati z gorljivo snovjo.
Treba je izvesti predhodni preskus, da se ugotovi, ali so pri izvedbi preskusa potrebni posebni varnostni ukrepi.
1.2 OPREDELITEV IN ENOTE
Čas gorenja: reakcijski čas v sekundah, v katerem reakcijsko območje prepotuje določeno razdaljo vzdolž kupčka, v skladu s postopkom iz 1.6.
Hitrost gorenja: izražena v milimetrih na sekundo.
Največja hitrost gorenja: največja vrednost izmed hitrosti gorenja, dobljenih z zmesmi, ki vsebujejo od 10 do 90 utežnih % oksidanta.
1.3 REFERENČNA SNOV
Pri preskusu in predhodnem preskusu se kot referenčna snov uporablja barijev nitrat (analitska čistost).
Referenčna zmes je zmes barijevega nitrata in uprašene celuloze, pripravljena v skladu z 1.6, ki ima največjo hitrost gorenja (običajno zmes s 60 utežnimi % barijevega nitrata).
1.4 PRINCIP METODE
Zaradi varnosti se izvede predhodni preskus. Kadar predhodni preskus jasno pokaže, da ima preskusna snov oksidacijske lastnosti, nadaljnje preskušanje ni potrebno. V nasprotnem primeru je treba s snovjo izvesti popoln preskus.
V popolnem preskusu se pripravijo zmesi iz preskusne snovi in določene gorljive snovi v različnih razmerjih. Vsaka zmes se nato oblikuje kupček, ki se na enem koncu prižge. Največja določena hitrost gorenja se primerja z največjo hitrostjo gorenja referenčne zmesi.
1.5 MERILA KAKOVOSTI
Če je treba snov drobiti in mešati, se za to lahko uporabi katera koli metoda, pod pogojem da razlika v največji hitrosti gorenja v šestih ločenih preskusih ne odstopa od aritmetične sredine za več kakor 10 %.
1.6 OPIS METODE
1.6.1 Priprava
1.6.1.1 Preskusna snov
Velikost delcev v vzorcu se zmanjša do < 0,125 mm po naslednjem postopku: preskusna snov se preseje, preostala frakcija se zmelje in postopek se ponavlja, dokler skozi sito ni presejana vsa preskusna snov.
Uporabi se lahko katera koli metoda za mletje in presejanje, ki ustreza merilom kakovosti.
Pred pripravo zmesi se snov posuši pri 105 oC do konstantne mase. Če je temperatura razgradnje preskusne snovi nižja od 105 oC, je treba snov posušiti pri ustrezni nižji temperaturi.
1.6.1.2 Gorljiva snov
Kot gorljiva snov se uporabi uprašena celuloza. Izbrati je treba vrsto celuloze, ki se uporablja za tenkoplastno kromatografijo ali kolonsko kromatografijo. Izkazalo se je, da je primerna celuloza z več kakor 85 % vlaken z dolžino med 0,020 in 0,075 mm. Celulozni prah se preseje skozi sito z odprtinami velikosti 0,125 mm. V celem preskusu je treba uporabiti celulozo iz iste serije.
Pred pripravo zmesi se uprašena celuloza posuši pri 105 oC do konstantne mase.
Če se v predhodnem preskusu uporabi žagovina, se pripravi žagovina mehkega lesa, tako da se zbere delež, presejan skozi sito z odprtinami velikosti 1,6 mm, se temeljito premeša in nato štiri ure suši pri 105 oC v plasti, debeli največ 25 mm. Žagovina se ohladi in hrani v čim bolj polni nepredušno zaprti posodi do uporabe, kar naj bo po možnosti v 24 urah po sušenju.
1.6.1.3 Vir vžiga
Kot vir vžiga se uporabi vroč plamen plinskega gorilnika (premer najmanj 5 mm). Če se uporabi kak drug vir vžiga (npr. pri preskušanju v inertni atmosferi), ga je treba opisati v poročilu in utemeljiti njegovo uporabo.
1.6.2 Izvedba preskusa
Opomba:
Zmesi oksidantov in celuloze ali žagovine je treba obravnavati kot morebitno eksplozivne in z njimi ravnati z ustrezno previdnostjo.
1.6.2.1 Predhodni preskus
Posušena snov se temeljito zmeša s posušeno celulozo ali žagovino v razmerju 2 utežna dela preskusne snovi in 1 utežni del celuloze ali žagovine, nato se zmes oblikuje v majhen stožčast kupček z dimenzijami 3,5 cm (premer osnovne ploskve) × 2,5 cm (višina), tako da se brez tlačenja napolni stožčast kalup (npr. laboratorijski stekleni lij z zamašeno odtočno cevko).
Kupček se da na hladno, negorljivo, neporozno in toplotno slabo prevodno osnovno ploščo. Preskus je treba izvesti v digestoriju, kakor v 1.6.2.2.
Z virom vžiga se dotaknemo kupčka. Opazujeta in zapišeta se silovitost in trajanje nastale reakcije.
Če je reakcija silovita, se šteje, da je snov oksidativna.
Kadar koli je rezultat dvomljiv, je treba izvesti spodaj opisani popolni preskusni postopek.
1.6.2.2 Popolni preskus
Pripravijo se zmesi oksidanta in celuloze, ki vsebujejo od 10 do 90 utežnih % oksidanta, vsaka za 10 % več. Pri mejnih primerih je treba uporabiti tudi vmesne koncentracije zmesi oksidanta in celuloze, da se največja hitrost gorenja določi natančneje.
S pomočjo kalupa se oblikuje kupček. Kalup je narejen iz kovine, dolg 250 mm ter ima trikotni prečni prerez z notranjo višino 10 mm in notranjo širino 20 mm. Na obe vzdolžni stranici kalupa je pritrjena kovinska plošča, kot stranska pregrada, ki sega 2 mm nad gornji rob trikotnega prečnega prereza (slika). Ta priprava se napolni z zmesjo v majhnem presežku. Kalup se enkrat spusti z višine 2 cm na trdno podlago, nato se presežek snovi postrga s ploščico v poševnem položaju. Snameta se stranski pregradi, preostali prah pa zgladi z valjčkom. Na vrh kalupa se položi osnovna plošča iz negorljivega, neporoznega in toplotno slabo prevodnega materiala, nato se cela priprava obrne za 180o in odstrani kalup.
Kupček se namesti v digestorij, prečno na tok zraka.
Hitrost odvajanja zraka mora biti zadostna, da dim ne uhaja v laboratorij, in se med preskusom ne sme spreminjati. Okrog aparature je treba namestiti zaslon, za zaščito pred prepihom.
Zaradi higroskopičnosti celuloze in nekaterih preskusnih snovi je treba preskus izvesti čim hitreje.
Prižgemo en konec kupčka, tako da se ga dotaknemo s plamenom.
Ko reakcijsko območje preide začetno razdaljo 30 mm se meri reakcijski čas prek razdalje 200 mm.
Preskus se izvede z referenčno snovjo in vsaj po enkrat z vsako od zmesi preskusne snovi in celuloze.
Če je največja hitrost gorenja znatno večja od hitrosti gorenja referenčne zmesi, se preskus lahko ustavi; sicer je treba preskus petkrat ponoviti z vsako od treh zmesi, pri katerih je bila hitrost gorenja največja.
Če se sumi, da je rezultat lažno pozitiven, je treba preskus ponoviti z inertno snovjo s podobno velikostjo delcev, kakršna je diatomejska zemlja, namesto celuloze. Druga možnost je, da se zmes preskusne snovi in celuloze z največjo hitrostjo gorenja ponovno preskusi v inertni atmosferi (vsebnost kisika < 2 % v/v).
2. PODATKI
Zaradi varnosti se za značilno oksidativno lastnost preskusne snovi šteje največja hitrost gorenja – ne srednja vrednost.
Za vrednotenje je pomembna največja vrednost hitrosti gorenja dane zmesi v nizu šestih preskusov.
Izdela se graf največje vrednosti hitrosti gorenja vsake zmesi v odvisnosti od koncentracije oksidanta. Iz grafa se določi največja hitrost gorenja.
Šest izmerjenih vrednosti hitrosti gorenja v enem nizu preskusov na zmesi z največjo hitrostjo gorenja se ne sme razlikovati od aritmetične sredine za več kot 10 %; sicer je treba izboljšati metodi mletja in mešanja.
Dobljena največja hitrost gorenja se primerja z največjo hitrostjo gorenja referenčne zmesi (glej 1.3).
Če se preskusi izvajajo v inertni atmosferi, se največja hitrost reakcije primerja s hitrostjo reakcije referenčne zmesi v inertni atmosferi.
3. POROČILO
3.1 POROČILO O PRESKUSU
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— identiteta, sestava, čistost, vsebnost vlage itd., preskusne snovi,
— kakršna koli obdelava vzorca (npr. mletje, sušenje …),
— v preskusih uporabljeni vir vžiga,
— rezultati meritev,
— način reagiranja (npr. hitro gorenje na površini, gorenje skozi celotno maso, kakršne koli informacije o produktih izgorevanja …),
— vse dodatne opombe, pomembne za razlago rezultatov, vključno z opisom silovitosti (plamenenje, iskrenje, dimljenje, počasno tlenje itd.) in približno trajanje, ugotovljeno v predhodnih varnostnih/presejalnih preskusih za preskusno in referenčno snov,
— rezultati preskusov z inertno snovjo, če so bili izvedeni,
— rezultati preskusov v inertni atmosferi, če so bili izvedeni.
3.2 RAZLAGA REZULTATA
Šteje se, da je snov oksidativna, kadar:
(a) je v predhodnem preskusu nastala silovita reakcija;
(b) je v popolnem preskusu največja hitrost gorenja preskušenih zmesi večja ali enaka največji hitrosti referenčne zmesi celuloze in barijevega nitrata.
Da se izognemo lažno pozitivnim rezultatom, je treba pri razlagi rezultatov upoštevati tudi rezultate, dobljene pri preskušanju snovi, zmešane z inertnim materialom, in/ali pri preskušanju v inertni atmosferi.
4. VIRI
NF T 20-035 (September 85). Chemical products for industrial use. Determination of the oxidizing properties of solids.
Dodatek
Slika
Kalup in pripomočki za pripravo kupčka
(Vse dimenzije so v milimetrih)

A.18 POVPREČNO ŠTEVILO MOLEKULSKE MASE IN PORAZDELITEV MOLEKULSKE MASE POLIMEROV
1. METODA
Ta metoda gelske permeacijske kromatografije je posnetek OECD smernice 118 (1996). Temeljna načela in nadaljnje tehnične informacije so navedene v literaturi 1.
1.1 UVOD
Ker so lastnosti polimerov tako raznolike, je nemogoče opisati eno samo metodo, s katero bi bili natančno določeni pogoji za separacijo in ocenjevanje, ki bi pokrivali vse možnosti in posebnosti, do katerih pride pri separaciji polimerov. Zlasti se gelni permeacijski kromatografiji (GPC) pogosto ne da podrediti kompleksnih sistemov polimerov. Kadar GPC metode ni mogoče uporabiti, lahko molekulsko maso določimo s pomočjo drugih metod (glej Prilogo). V takšnih primerih je treba uporabljeno metodo natančno obrazložiti in utemeljiti.
Opisana metoda temelji na DIN standardu 55672 (1). Ta DIN standard vsebuje podrobne informacije o načinu izvajanja poskusov in ocenjevanja podatkov. V primeru, da je treba pogoje poskusa spremeniti, je treba takšne spremembe utemeljiti. Lahko uporabimo tudi druge standarde, če so v celoti podprti z viri. Opisana metoda uporablja vzorce polistirena znane polidisperznosti za kalibriranje in jo bo mogoče treba spremeniti, da bo ustrezala določenim polimerom, npr. v vodi topnim polimerom in razvejanim polimerom z dolgimi verigami.
1.2 DEFINICIJE IN ENOTE
Povprečno število molekulske mase Mn in povprečno maso molekulske mase Mw določimo s pomočjo naslednjih enačb:
|
|
|
kjer je:
Hi stopnja signala detektorja od osnovne črte za retenzijski volumen Vi,
Mi molekulska masa frakcije polimera pri retenzijskem volumnu Vi in
n število podatkovnih točk.
Razpon porazdelitve molekulske mase, ki je mera za disperznost sistema, se kaže z razmerjem Mw/Mn.
1.3 REFERENČNE SNOVI
Ker je GPC relativna metoda, je treba opraviti kalibriranje. Običajno za to uporabimo ozko porazdeljene, linearno strukturirane vzorce polistirena z znanimi povprečnimi molekulskimi masami Mn in Mw in znano porazdelitvijo molekulske mase. Kalibracijsko krivuljo lahko uporabimo le pri določanju molekulske mase neznanega vzorca, če so pogoji za separacijo vzorca in standardov izbrani na povsem enak način.
Določeno razmerje med molekulsko maso in volumnom elucije je veljavno le pod specifičnimi pogoji posameznega poskusa. Ti pogoji vključujejo predvsem temperaturo, topilo (ali mešanico topila), kromatografske pogoje in separacijsko kolono ali sistem kolon.
Tako določene molekulske mase vzorca so relativne vrednosti in so opisane kot „ekvivalentne molekulske mase polistirena“. To pomeni, da se lahko glede na strukturalne in kemične razlike med vzorcem in standardi molekulske mase bolj ali manj oddaljijo od absolutnih vrednosti. Če uporabimo druge standarde, npr. polietilen glikol, polietilen oksid, polimetil metakrilat, poliakrilno kislino, je treba za to navesti razloge.
1.4 PRINCIP PRESKUSNE METODE
Porazdelitev molekulske mase vzorca in povprečno molekulsko maso (Mn, Mw) lahko določimo z uporabo GPC metode. GPC je poseben tip tekočinske kromatografije, kjer vzorec separiramo v skladu s hidrodinamičnimi volumni posameznih sestavin (2).
Separacija se izvede, ko vzorec preteče skozi kolono, napolnjeno s poroznim materialom, običajno z organskim gelom. Majhne molekule lahko predrejo skozi pore, večje molekule pa se izločijo. Pot večjih molekul je tako krajša in te so najprej eluirane. Srednje velike molekule predrejo skozi nekaj por in so eluirane pozneje. Najmanjše molekule, katerih povprečen hidrodinamični premer je manjši od por gela, lahko predrejo skozi vse pore. Te so eluirane zadnje.
V idealnih razmerah na separacijo v celoti vpliva velikost molekulskih vrst, vendar pa se v praksi težko izognemo vsaj nekaterim ovirajočim učinkom absorbcije. Neenakomerna napolnjenost kolon in mrtvi volumni lahko razmere poslabšajo (2).
Ugotavljanje izvedemo, na primer, na osnovi refrakcijskega indeksa ali UV absorpcije in dobimo preprosto distribucijsko krivuljo. Da pa bi na krivulji opredelili dejanske vrednosti molekulske mase, moramo kalibrirati kolono, tako da skoznjo pretečejo polimeri z znano molekulsko maso in, v idealnem primeru, v glavnem podobno strukturo, npr. različni standardi polistirena. Rezultat Gaussove krivulje, čeprav včasih popačen z majhnim repom na strani nizke molekulske mase, je običajno tak, da navpična os kaže količino, izraženo z maso, raznih eluiranih vrst molekulske mase, vodoravna os pa logaritem molekulske mase.
1.5 KRITERIJI KAKOVOSTI
Ponovljivost (Relativna standardna deviacija: RSD) volumna elucije bi morala preseči 0,3 %. Zahtevana ponovljivost analize mora biti zagotovljena s korekcijo prek internega standarda, če je kromatogram ocenjen v časovni odvisnosti in če ne ustreza zgoraj navedenem kriteriju (1). Polidisperznosti so odvisne od molekulskih mas standardov. V primeru standarda polistirena so tipične vrednosti naslednje:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw/Mn < 1,20 |
(Mp je mulekulska masa standarda pri maksimumu vrha)
1.6 OPIS PRESKUSNE METODE
1.6.1 Priprava standardnih raztopin polistirena
Standardi polistirena se raztopijo s previdnim mešanjem v izbranem eluatu. Pri pripravi raztopin je treba upoštevati navodila proizvajalca.
Koncentracije izbranih standardov so odvisne od različnih dejavnikov, npr. injekcijski volumen, viskoznost raztopine in občutljivost analitskega detektorja. Maksimalen injekcijski volumen mora biti prilagojen dolžini kolone, da bi se izognili preobremenitvi. Tipični injekcijski volumni za analitične separacije pri uporabi GPC metode s kolono 30 cm × 7,8 mm so navadno med 40 in 100 μl. Možni so višji volumni, vendar ne smejo presegati 250 μl. Optimalno razmerje med injekcijskim volumnom in koncentracijo je treba določiti pred dejanskim kalibriranjem kolone.
1.6.2 Priprava raztopine vzorca
Načeloma veljajo za pripravo raztopin vzorca enake zahteve. Vzorec se raztopi v ustreznem topilu, npr. tetrahidrofuranu (THF), če ga previdno pretresemo. V nobenem primeru ga ne smemo raztopiti z uporabo ultrazvočne kopeli. Kadar je potrebno, se raztopina vzorca očisti skozi membranski filter z velikostjo por med 0,2 in 2 μm.
Prisotnost neraztopljenih delcev je treba zabeležiti v zaključnem poročilu, saj do tega lahko pride zaradi vrst visoke molekulske mase. Uporabiti je treba ustrezno metodo za določitev odstotka razgrajenih delcev po masi. Raztopine je treba uporabiti v 24 urah.
1.6.3 Aparat
— zbiralnik za topilo,
— digestorij (kjer je primerno),
— črpalka,
— blažilec tresljajev (kjer je primerno),
— injekcijski sistem,
— kromatografske kolone,
— detektor,
— merilec pretoka (kjer je primerno),
— snemalnik in obdelovalec podatkov,
— posoda za odpadke.
Zagotoviti je treba da je sistem GPC inerten v zvezi z uporabljenimi topili (npr. z uporabo jeklenih kapilar za topilo THF).
1.6.4 Injekcijski sistem in sistem prenosa topila
Določen volumen raztopine vzorca nanesemo na kolono bodisi z avtomatičnim vzorčevalcem bodisi ročno na natančno določeno mesto. Če pri ročnem nanosu konico brizgalke prehitro umaknemo ali pritisnemo, lahko povzročimo spremembe v ugotovljeni porazdelitvi molekulske mase. Sistem prenosa topila mora biti, kolikor je mogoče, brez tresljajev, zato je najbolje, če uporabimo blažilec tresljajev. Red stopnje pretoka je 1 ml/min.
1.6.5 Kolona
Polimer je opredeljen z uporabo bodisi preproste kolone bodisi več zaporedno povezanih kolon, odvisno od vzorca. V prodaji so na voljo številni porozni materiali kolon z opredeljenimi lastnostmi (npr. velikost por, meje izločanja). Izbor separacijskega gela ali dolžine kolone je odvisen tako od lastnosti vzorca (hidrodinamični volumni, porazdelitev molekulske mase) in specifičnih pogojev za separacijo, kot so topilo, temperatura in pretok (1) (2) (3).
1.6.6 Teoretični platoji
Kolona ali kombinacija kolon, uporabljenih za separacijo, mora biti opredeljen s številom teoretičnih platojev. V primeru THF kot elucijskega topila to vsebuje nanos raztopine etil benzena ali drugega ustreznega nepolarnega vzorca na kolono znane dolžine. Število teoretičnih platojev dobimo z naslednjo enačbo:
|
|
ali |
|
kjer je
|
N |
= |
število teoretičnih platojev |
|
Ve |
= |
elucijski volumen na maksimumu vrha |
|
W |
= |
temelj širine vrha |
|
W1/2 |
= |
širina vrha na polovici višine |
1.6.7 Učinkovitost separacije
Poleg števila teoretičnih platojev, ki predstavlja količino, ki določa širino traku, svojo vlogo igra tudi učinkovitost separacije, ki jo določa nagib kalibracijske krivulje. Učinkovitost separacije kolone dobimo iz naslednjega razmerja:
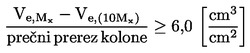
kjer je:
|
Ve, Mx |
= |
elucijski volumen za polistiren z molekulsko maso Mx |
|
Ve,(10.Mx) |
= |
elucijski volumen za polistiren z 10 krat večjo molekulsko maso |
Resolucijo sistema običajno opredelimo na naslednji način:

kjer sta:
|
Ve1, Ve2 |
= |
elucijska volumna dveh standardov polistirena na maksimumu vrha |
|
W1, W2 |
= |
širini vrha pri osnovni črti |
|
M1, M2 |
= |
molekulski masi pri maksimumu vrha (naj se razlikujeta s faktorjem 10). |
R-vrednost sistema kolone mora biti večja od 1, 7 (4).
1.6.8 Topila
Vsa topila morajo biti visoke čistosti (za THF se uporablja čistost 99,5 %). Zbiralnik za topilo (če je potreben v inertnem plinskem ozračju) mora biti dovolj velik za kalibriranje kolon in nekaj analiz vzorca. Topilo je treba razpliniti preden ga s črpalko prenesemo na kolono.
1.6.9 Nadzor temperature
Temperatura kritičnih internih sestavin (injekcijski zvitek, kolone, detektor in cevovod) mora biti konstantna in v skladu z izbranim topilom.
1.6.10 Detektor
Namen detektorja je količinsko beleženje koncentracije iz kolone eluiranega vzorca. Da bi se izognili nepotrebni širitvi vrhov, mora kivetni volumen detektorske celice ostati čim manjši. Razen v primeru disperzije svetlobe in detektorjev viskoznosti ne sme presegati 10 μl. Za detekcijo se navadno uporablja diferencialna refraktometrija. Vendar pa, če to zahtevajo specifične lastnosti vzorca ali elucijskega topila, je mogoče uporabiti tudi druge tipe detektorjev, npr. UV/VIS, IR, detektorje viskoznosti, itd.
2. PODATKI IN POROČANJE
2.1 PODATKI
Za podrobne ocenjevalne kriterije kot tudi za zahteve, ki se nanašajo na zbiranje in obdelavo podatkov, se je treba sklicevati na DIN standard (1).
Za vsak vzorec je treba opraviti dva samostojna poskusa. Analizirati je treba vsakega posebej.
Za vsako meritev je treba določiti Mn, Mw, Mw/Mn in Mp. Potrebno je eksplicitno označiti, da so merjene vrednosti relativne vrednosti, ekvivalentne molekulskim masam uporabljenega standarda.
Po določitvi retenzijskih volumnov ali retenzijskih časov (po možnosti popravljenih z uporabo internega standarda), se logaritem Mp vrednosti (kjer je Mp maskimum vrha kalibracijskega standarda) prikažejo ob eni izmed teh količin. Najmanj dve kalibracijski točki sta potrebni za dekado molekulske mase, najmanj pet meritvenih točk pa je zahtevanih za celotno krivuljo, ki bi morala pokrivati ocenjeno molekulsko maso vzorca. Končno točko nizke molekulske mase na kalibracijski krivulji določa n-heksil benzen ali katera drug ustrezen nepolaren vzorec. Povprečno število in povprečno maso molekulskih mas navadno določimo s pomočjo elektronske obdelave podatkov, ki temelji na enačbah iz oddelka 1.2. V primeru ročne digitalizacije, se lahko upošteva ASTM D 3536-91 (3).
Porazdelitvena krivulja mora biti posredovana v obliki tabele ali grafa (diferencialna frekvenca ali odstotek vsot proti logaritmu M). V grafičnem prikazu mora biti normalna širina ene dekade molekulske mase 4 cm, maksimum vrha pa naj sega približno 8 cm v višino. V primeru integralnih porazdelitvenih krivulj mora biti razlika na ordinati med 0 in 100 % približno 10 cm.
2.2 PRESKUSNO POROČILO
Preskusno poročilo mora vsebovati naslednje informacije:
2.2.1 Preskusna snov
— razpoložljive informacije o preskusni snovi (identiteta, aditivi, nečistote),
— opis obdelave vzorca, ugotovitve, problemi.
2.2.2 Inštrumenti
— zbiralnik za eluat, inertni plin, razplinjanje eluata, sestava eluata, nečistote,
— črpalka, blažilec tresljajev, injekcijski sistem,
— separacijske kolone (proizvajalec, vse informacije o značilnostih kolon, kot so velikost por, vrsta separacije, material, itd., število, dolžina in zaporedje uporabljenih kolon),
— število teoretičnih platojev kolone (ali kombinacije), učinkovitost separacije (resolucija sistema),
— informacije o simetriji vrhov,
— temperatura kolone, vrste nadzora temperature,
— detektor (principi merjenja, tip, volumen kivete),
— merilec pretoka, če je uporabljen (proizvajalec, principi merjenja),
— sistem zapisovanja in obdelovanja podatkov (strojna in programska oprema).
2.2.3 Kalibriranje sistema
— podroben opis metode, uporabljene za sestavo kalibracijske krivulje,
— informacije o kriterijih kakovosti za to metodo (npr. korelacijski koeficient, vsota kvadratov odstopanj, itd.),
— informacije o vseh ekstrapolacijah, domnevah in približevanjih, opravljenih med poskusnim postopkom in ocenitev ter obdelava podatkov,
— vse uporabljene meritve za ustvarjanje kalibracijske krivulje morajo biti dokumentirane na tabeli, ki vsebuje naslednje informacije za vsako kalibracijsko točko:
—— ime vzorca,
— proizvajalec vzorca,
— značilne vrednosti standardov Mp, Mn, Mw in Mw/Mn, kot jih posreduje proizvajalec, ali kot so izpeljane iz naknadnih meritev, skupaj s podrobnostmi o metodi določanja,
— injekcijski volumen in injekcijska koncentracija,
— Mp vrednost, uporabljena za kalibriranje,
— elucijski volumen ali popravljeni retenzijski čas, izmerjen pri maksimumih vrha,
— Mp, izračunan na maksimumu vrha,
— odstotek odstopanja od izračunanega Mpin kalibracijska vrednost.
2.2.4 Ocenjevanje
— ocena na časovni podlagi: metode, uporabljene za zagotovitev zahtevane obnovljivosti (metode popravljanja, interni standard, itd.),
— informacije o tem, ali je ocena izvedena na podlagi elucijskega volumna ali retenzijskega časa,
— informacije o mejah ocenjevanja, če vrh ni analiziran v celoti,
— opis blažilnih metod, če so uporabljene,
— postopki priprave in predobdelave vzorca,
— prisotnost morebitnih neraztopljenih delcev,
— injekcijski volumen (μl) in injekcijska koncentracija (mg/μl),
— ugotovitve, ki kažejo na učinke, ki peljejo k odklonom od idealnega GPC profila,
— podroben opis vseh sprememb v preskusnih postopkih,
— podrobnosti o stopnjah odstopanj,
— vse druge informacije in ugotovitve, ki so pomembne za razlago rezultatov.
3. VIRI
(1) DIN 55672 (1995) Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1.
(2) Yau, W.W., Kirkland, J.J., and Bly, D.D. eds, (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons.
(3) ASTM D 3536-91, (1991). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania.
(4) ASTM D 5296-92, (1992). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size – Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania.
Priloga
Primeri drugih metod za določanje povprečnega števila molekulske mase (Mn) za polimere
Gelska permeacijska kromatografija (GPC) je priljubljena metoda za določanje Mn, zlasti kadar je na razpolago niz standardov, katerih struktura je primerljiva s strukturo polimera. Vendar pa v primeru, kadar naletimo pri uporabi metode GPC na izvedbene težave ali kadar lahko pričakujemo, da snov ne bo izpolnila regularnega Mn kriterija (in ki ga je potrebno potrditi), so na razpolago druge metode, kot so:
1. Uporaba koligativnih lastnosti
1.1 Ebulioskopija/krioskopija
vključuje meritev zvišanja vrelišča (ebulioskopija) ali znižanja strdišča (krioskopija) topila ob dodajanju polimera. Metoda se zanaša na dejstvo, da je učinek raztopljenega polimera na točki vrelišča/strdišča tekočine odvisen od molekulske mase polimera (1) (2).
Nanos: Mn < 20 000.
1.2 Nižanje pritiska hlapov
vključuje meritev pritiska hlapov izbrane referenčne tekočine pred in po dodajanju znanih količin polimera (1) (2).
Nanos: Mn < 20 000 (teoretično; v praksi gre za mejno vrednost).
1.3 Membranska osmometrija
se zanaša na osmozo, t.j. naravno nagnjenost raztapljajočih se molekul, da predrejo skozi polprepustno membrano iz razredčila v koncentrirano raztopino, da bi se doseglo ravnovesje. V preskusu je razredčena raztopina na nični koncentraciji, medtem ko koncentrirana raztopina vsebuje polimer. Učinek prehajanja topila skozi membrano povzroča diferencial pritiska, ki je odvisen od koncentracije in molekulske mase polimera (1) (3) (4).
Nanos: Mn med 20 000–200 000.
1.4 Osmometrija v hlapni fazi
vključuje primerjavo stopnje hlapenja čistega raztopljenega aerosola na najmanj tri aerosole, ki vsebujejo polimer na različnih koncentracijah (1) (5) (6).
Nanos: Mn < 20 000.
2. Analiza končnih skupin
Da bi uporabili to metodo, sta potrebna tako celotna struktura polimera in narava verige, ki zaključuje končne skupine (ta se mora razlikovati od glavnega ogrodja po, na primer, NMR ali titriranju/derivatizaciji). Z določitvijo molekulske koncentracije končnih skupin, prisotnih na polimeru, lahko pridemo do vrednosti molekulske mase (7) (8) (9).
Nanos: Mn do 50 000 (z naraščajočo zanesljivostjo).
3. Literatura
(1) Billmeyer, F.W. Jr., (1984). Textbook of Polymer Science, 3rd Edn., John Wiley, New York.
(2) Glover, C.A., (1975). Absolute Colligative Property Methods. Chapter 4. In: Polymer Molecular Weights, Part I P.E. Slade, Jr. ed., Marcel Dekker, New York.
(3) ASTM D 3750-79, (1979). Standard Practice for Determination of Number-Average Molecular Weight of Polymers by Membrane Osmometry. American Society for Testing and Materials, Philadelphia, Pennsylvania.
(4) Coll, H. (1989). membrane Osmometry. In: Determination of Molecular Weight, A.R. Cooper ed., J. Wiley and Sons, pp. 25–52.
(5) ASTM 3592-77, (1977). Standard Recommended Practice for Determination of Molecular Weight by Vapour Pressure, American Society for Testing and Materials, Philadelphia, Pennsylvania.
(6) Morris, C.E.M., (1989). Vapour Pressure Osmometry. In: Determinationn of Molecular Weight, A.R. Cooper ed., John Wiley and Sons.
(7) Schröder, E., Müller, G., and Arndt, K-F., (1989). Polymer Characterisation, Carl Hanser Verlag, Munich.
(8) Garmon, R.G., (1975). End-Group Determinations, Chapter 3 In: Polymer Molecular Weights, Part I, P.E. Slade, Jr. ed., Marcel Dekker, New York.
(9) Amiya, S., et al. (1990). Pure and Applied Chemistry, 62, 2139–2146.
A.19 VSEBNOST POLIMEROV NIZKE MOLEKULSKE MASE
1. METODA
Ta gelska permeacijska kromatografija metoda je posnetek OECD smernice 119 (1996). Temeljna načela in nadaljnje tehnične informacije so navedene v literaturi 1.
1.1 UVOD
Ker so lastnosti polimerov tako raznolike, je nemogoče opisati eno samo metodo, s katero bi bili natančno določeni pogoji za separacijo in ocenjevanje, ki bi pokrivali vse možnosti in posebnosti, do katerih pride pri separaciji polimerov. Zlasti se gelski permeacijski kromatografiji (GPC) pogosto ne da podrediti kompleksnih sistemov polimerov. Kadar GPC metode ni mogoče uporabiti, lahko molekulsko maso določimo s pomočjo drugih metod (glej Prilogo). V takšnih primerih je treba uporabljeno metodo natančno obrazložiti in utemeljiti.
Opisana metoda temelji na DIN standardu 55672 (1). Ta DIN standard vsebuje podrobne informacije o načinu izvajanja poskusov in ocenjevanja podatkov. V primeru, da je treba pogoje poskusa spremeniti, je treba takšne spremembe utemeljiti. Lahko uporabimo tudi druge standarde, če so v celoti podprti z viri. Opisana metoda uporablja vzorce polistirena znane polidisperznosti za kalibriranje in jo bo mogoče treba spremeniti, da bo ustrezala določenim polimerom, npr. v vodi topnim polimerom in razvejanim polimerom z dolgimi verigami.
1.2 DEFINICIJE IN ENOTE
Nizka molekulska masa je arbitrarno opredeljena kot molekulska masa pod 1 000 daltoni.
Povprečno število molekulske mase Mn in povprečno maso molekulske mase Mw določimo s pomočjo naslednjih enačb:
|
|
|
kjer je
|
HI |
= |
stopnja signala detektorja od osnovne črte za retenzijski volumen Vi |
|
Mi |
= |
molekulska masa frakcije polimera pri retenzijskem volumnu Vi in n število podatkovnih točk. |
Razpon porazdelitve molekulske mase, ki je mera za disperznost sistema, se kaže z razmerjem Mw/Mn.
1.3 REFERENČNE SNOVI
Ker je GPC relativna metoda, je treba opraviti kalibriranje. Običajno za to uporabimo ozko porazdeljene, linearno strukturirane vzorce polistirena z znanimi povprečnimi molekulskimi masami Mn in Mw in znano porazdelitvijo molekulske mase. Kalibracijsko krivuljo lahko uporabimo le pri določanju molekulske mase neznanega vzorca, če so pogoji za separacijo vzorca in standardov izbrani na povsem enak način.
Določeno razmerje med molekulsko maso in volumnom elucije je veljavno le pod specifičnimi pogoji posameznega poskusa. Ti pogoji vključujejo predvsem temperaturo, topilo (ali mešanico topila), kromatografske pogoje in separacijsko kolono ali sistem kolon.
Tako določene molekulske mase vzorca so relativne vrednosti in so opisane kot „ekvivalentne molekulske mase polistirena“. To pomeni, da se lahko glede na strukturalne in kemične razlike med vzorcem in standardi molekulske mase bolj ali manj oddaljijo od absolutnih vrednosti. Če uporabimo druge standarde, npr. polietilen glikol, polietilen oksid, polimetil metakrilat, poliakrilno kislino, je treba za to navesti razloge.
1.4 PRINCIP PRESKUSNE METODE
Porazdelitev molekulske mase vzorca in povprečno molekulsko maso (Mn, Mw) lahko določimo z uporabo GPC metode. GPC je poseben tip tekočinske kromatografije, kjer vzorec separiramo v skladu s hidrodinamičnimi volumni posameznih sestavin (2).
Separacija se izvede, ko vzorec preteče skozi kolono, napolnjeno s poroznim materialom, običajno z organskim gelom. Majhne molekule lahko predrejo skozi pore, večje molekule pa se izločijo. Pot večjih molekul je tako krajša in te so najprej eluirane. Srednje velike molekule predrejo skozi nekaj por in so eluirane pozneje. Najmanjše molekule, katerih povprečen hidrodinamični premer je manjši od por gela, lahko predrejo skozi vse pore. Te so eluirane zadnje.
V idealnih razmerah na separacijo v celoti vpliva velikost molekulskih vrst, vendar pa se v praksi težko izognemo vsaj nekaterim oviraj očim učinkom absorbcije. Neenakomerna napolnjenost kolon in mrtvi volumni lahko razmere poslabšajo (2).
Ugotavljanje izvedemo, npr., na osnovi refrakcijskega indeksa ali UV absorpcije in dobimo preprosto distribucijsko krivuljo. Da pa bi na krivulji opredelili dejanske vrednosti molekulske mase, moramo kalibrirati kolono, tako da skoznjo pretečejo polimeri z znano molekulsko maso in, v idealnem primeru, v glavnem podobno strukturo, npr. različni standardi polistirena. Rezultat Gaussove krivulje, čeprav včasih popačen z majhnim repom na strani nizke molekulske mase, je običajno tak, da navpična os kaže količino, izraženo z maso, raznih eluiranih vrst molekulske mase, vodoravna os pa logaritem molekulske mase.
Vsebnost nizke molekulske mase izhaja iz te krivulje. Izračun je lahko točen le, če se vrste z nizko molekulsko maso ekvivalentno na osnovi mase odzivajo na polimer kot celota.
1.5 KRITERIJI KAKOVOSTI
Ponovljivost (Relativna standardna deviacija: RSD) volumna elucije bi morala preseči 0,3 %. Zahtevana ponovljivost analize mora biti zagotovljena s korekcijo prek internega standarda, če je kromatogram ocenjen v časovni odvisnosti in če ne ustreza zgoraj navedenem kriteriju (1). Polidisperznosti so odvisne od molekulskih mas standardov. V primeru standarda polistirena so tipične vrednosti naslednje:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw/Mn < 1,20 |
(Mp je molekulska masa standarda pri maksimumu vrha)
1.6 OPIS PRESKUSNE METODE
1.6.1 Priprava standardnih raztopin polistirena
Standardi polistirena se raztopijo s previdnim mešanjem v izbranem eluatu. Pri pripravi raztopin je treba upoštevati navodila proizvajalca.
Koncentracije izbranih standardov so odvisne od različnih dejavnikov, npr. injekcijski volumen, viskoznost raztopine in občutljivost analitskega detektorja. Maksimalen injekcijski volumen mora biti prilagojen dolžini kolone, da bi se izognili preobremenitvi. Tipični injekcijski volumni za analitične separacije pri uporabi GPC metode s kolono 30 cm × 7,8 mm so navadno med 40 in 100 μl. Možni so višji volumni, vendar ne smejo presegati 250 μl. Optimalno razmerje med injekcijskim volumnom in koncentracijo je treba določiti pred dejanskim kalibriranjem kolone.
1.6.2 Priprava raztopine vzorca
Načeloma veljajo za pripravo raztopin vzorca enake zahteve. Vzorec se raztopi v ustreznem topilu, npr. tetrahidrofuranu (THF), če ga previdno pretresemo. V nobenem primeru ga ne smemo raztopiti z uporabo ultrazvočne kopeli. Kadar je potrebno, se raztopina vzorca očisti skozi membranski filter z velikostjo por med 0,2 in 2 μm.
Prisotnost neraztopljenih delcev je treba zabeležiti v zaključnem poročilu, saj do tega lahko pride zaradi vrst visoke molekulske mase. Uporabiti je treba ustrezno metodo za določitev odstotka razgrajenih delcev po masi. Raztopine je treba uporabiti v 24 urah.
1.6.3 Korekcija vsebnosti nečistot in aditivov
Ponavadi je nujno opraviti korekcijo vsebnosti vrst z M < 1 000 za prispevek prisotnih nepolimerskih specifičnih sestavin (npr. nečistote in/ali aditivi), razen če je izmerjena vsebnost že < 1 %. To izvedemo z direktno analizo polimerske raztopine ali GPC eluata.
V primerih, kadar je eluat pri prehajanju skozi kolono preveč razredčen za nadaljnjo analizo, ga je treba koncentrirati. Mogoče bo potrebno izhlapeti eluat do suhega stanja in ga še enkrat raztopiti. Koncentriranje eluata se mora izvesti v pogojih, ki zagotavljajo, da na eluatu ne pride do nikakršnih sprememb. Tretiranje eluata po opravljeni GPC je odvisno od analitične metode, uporabljene za kvantitativno določitev.
1.6.4 Aparat
GPC aparat vsebuje naslednje komparente:
— zbiralnik za topilo,
— digestorij (kjer je primerno),
— črpalka,
— blažilec tresljajev (kjer je primerno),
— injekcijski sistem,
— kromatografske kolone,
— detektor,
— merilec pretoka (kjer je primerno),
— snemalnik in obdelovalec podatkov,
— posoda za odpadke.
Zagotoviti je treba da je sistem GPC inerten v zvezi z uporabljenimi topili (npr. z uporabo jeklenih kapilar za topilo THF).
1.6.5 Injekcijski sistem in sistem prenosa topila
Določen volumen raztopine vzorca nanesemo na kolono bodisi z avtomatičnim vzorčevalcem bodisi ročno na natančno določeno mesto. Če pri ročnem nanosu konico brizgalke prehitro umaknemo ali pritisnemo, lahko povzročimo spremembe v ugotovljeni porazdelitvi molekulske mase. Sistem prenosa topila mora biti, kolikor je mogoče, brez tresljajev, zato je najbolje, če uporabimo blažilec tresljajev. Red stopnje pretoka je 1 ml/min.
1.6.6 Kolona
Polimer je opredeljen z uporabo bodisi preproste kolone bodisi več zaporedno povezanih kolon, odvisno od vzorca. V prodaji so na voljo številni porozni materiali kolon z opredeljenimi lastnostmi (npr. velikost por, meje izločanja). Izbor separacijskega gela ali dolžine kolone je odvisen tako od lastnosti vzorca (hidrodinamični volumni, porazdelitev molekulske mase) in specifičnih pogojev za separacijo, kot so topilo, temperatura in pretok (1) (2) (3).
1.6.7 Teoretični platoji
Kolona ali kombinacija kolon, uporabljenih za separacijo, mora biti opredeljen s številom teoretičnih platojev. V primeru THF kot elucijskega topila to vsebuje nanos raztopine etil benzena ali drugega ustreznega nepolarnega vzorca na kolono znane dolžine. Število teoretičnih platojev dobimo z naslednjo enačbo:
|
|
ali |
|
kjer je
|
N |
= |
število teoretičnih platojev |
|
Ve |
= |
elucijski volumen na maksimumu vrha |
|
W |
= |
temelj širine vrha |
|
W1/2 |
= |
širina vrha na polovici višine |
1.6.8 Učinkovitost separacije
Poleg števila teoretičnih platojev, ki predstavlja količino, ki določa širino traku, svojo vlogo igra tudi učinkovitost separacije, ki jo določa nagib kalibracijske krivulje. Učinkovitost separacije kolone dobimo iz naslednjega razmerja:

kjer je:
|
Ve, Mx |
= |
elucijski volumen za polistiren z molekulsko maso Mx |
|
Ve,(10.Mx) |
= |
elucijski volumen za polistiren z 10 krat večjo molekulsko maso |
Resolucijo sistema običajno opredelimo na naslednji način:

kjer sta:
|
Ve1, Ve2 |
= |
elucijska volumna dveh standardov polistirena na maksimumu vrha |
|
W1, W2 |
= |
širini vrha pri osnovni črti |
|
M1, M2 |
= |
molekulski masi pri maksimumu vrha (naj se razlikujeta s faktorjem 10). |
R-vrednost sistema kolone mora biti večja od 1,7 (4).
1.6.9 Topila
Vsa topila morajo biti visoke čistosti (za THF se uporablja čistost 99,5 %). Zbiralnik za topilo (če je potreben v inertnem plinskem ozračju) mora biti dovolj velik za kalibriranje kolon in nekaj analiz vzorca. Topilo je treba razpliniti preden ga s črpalko prenesemo na kolono.
1.6.10 Nadzor temperature
Temperatura kritičnih internih sestavin (injekcijski zvitek, kolone, detektor in cevovod) mora biti konstantna in v skladu z izbranim topilom.
1.6.11 Detektor
Namen detektorja je količinsko beleženje koncentracije iz kolone eluiranega vzorca. Da bi se izognili nepotrebni širitvi vrhov, mora kivetni volumen detektorske celice ostati čim manjši. Razen v primeru disperzije svetlobe in detektorjev viskoznosti ne sme presegati 10 μ l. Za detekcijo se navadno uporablja diferencialna refraktometrija. Vendar pa, če to zahtevajo specifične lastnosti vzorca ali elucijskega topila, je mogoče uporabiti tudi druge tipe detektorjev, npr. UV/VIS, IR, detektorje viskoznosti, itd.
2. PODATKI IN POROČANJE
2.1 PODATKI
Za podrobne ocenjevalne kriterije kot tudi za zahteve, ki se nanašajo na zbiranje in obdelavo podatkov, se je treba sklicevati na DIN standard (1).
Za vsak vzorec je treba opraviti dva samostojna poskusa. Analizirati je treba vsakega posebej. V vseh primerih je bistveno, da določimo tudi podatke iz praznih polj, s katerimi smo ravnali v enakih pogojih kot vzorec.
Potrebno je eksplicitno označiti, da so merjene vrednosti relativne vrednosti, ekvivalentne molekulskim masam uporabljenega standarda.
Po določitvi retenzijskih volumnov ali retenzijskih časov (po možnosti popravljenih z uporabo internega standarda), se logaritem Mp vrednosti (kjer je Mp maskimum vrha kalibracijskega standarda) prikažejo ob eni izmed teh količin. Najmanj dve kalibracijski točki sta potrebni za dekado molekulske mase, najmanj pet meritvenih točk pa je zahtevanih za celotno krivuljo, ki bi morala pokrivati ocenjeno molekulsko maso vzorca. Končno točko nizke molekulske mase na kalibracijski krivulji določa n-heksil benzen ali kateri drug ustrezen nepolaren vzorec. Povprečno število in povprečno maso molekulskih mas navadno določimo s pomočjo elektronske obdelave podatkov, ki temelji na enačbah iz oddelka 1.2. V primeru ročne digitalizacije, se lahko upošteva ASTM D 3536-91 (3).
Če na koloni ostane kak netopen polimer, bo njegova molekulska masa verjetno višja od mase topne frakcije; v kolikor je ne bi upoštevali, bi to lahko pripeljalo do previsoke ocene vsebnosti nizke molekulske mase. Smernice za korekcijo vsebnosti nizke molekulske mase za netopen polimer se nahajajo v Prilogi.
Porazdelitvena krivulja mora biti posredovana v obliki tabele ali grafa (diferencialna frekvenca ali odstotek vsot proti logaritmu M). V grafičnem prikazu mora biti normalna širina ene dekade molekulske mase 4 cm, maksimum vrha pa naj sega približno 8 cm v višino. V primeru integralnih porazdelitvenih krivulj mora biti razlika na ordinati med 0 in 100 % približno 10 cm.
2.2 PRESKUSNO POROČILO
Preskusno poročilo mora vsebovati naslednje informacije:
2.2.1 Preskusna snov
— razpoložljive informacije o preskusni snovi (identiteta, aditivi, nečistote),
— opis obdelave vzorca, ugotovitve, problemi.
2.2.2 Inštrumenti
— zbiralnik za eluat, inertni plin, razplinjanje eluata, sestava eluata, nečistote,
— črpalka, blažilec tresljajev, injekcijski sistem,
— separacijske kolone (proizvajalec, vse informacije o značilnostih kolon, kot so velikost por, vrsta separacije, material, itd., število, dolžina in zaporedje uporabljenih kolon),
— število teoretičnih platojev kolone (ali kombinacije), učinkovitost separacije(resolucija sistema),
— informacije o simetriji vrhov,
— temperatura kolone, vrste nadzora temperature,
— detektor (principi merjenja, tip, volumen kivete),
— merilec pretoka, če je uporabljen (proizvajalec, principi merjenja),
— sistem zapisovanja in obdelovanja podatkov (strojna in programska oprema).
2.2.3 Kalibriranje sistema
— podroben opis metode, uporabljene za sestavo kalibracijske krivulje,
— informacije o kriterijih kakovosti za to metodo (npr. korelacijski koeficient, vsota kvadratov odstopanj, itd.),
— informacije o vseh ekstrapolacijah, domnevah in približevanjih, opravljenih med poskusnim postopkom in ocenitev ter obdelava podatkov,
— vse uporabljene meritve za ustvarjanje kalibracijske krivulje morajo biti dokumentirane na tabeli, ki vsebuje naslednje informacije za vsako kalibracijsko točko:
—— ime vzorca,
— proizvajalec vzorca,
— značilne vrednosti standardov Mp, Mn, Mw in Mw/Mn, kot jih posreduje proizvajalec, ali kot so izpeljane iz naknadnih meritev, skupaj s podrobnostmi o metodi določanja,
— injekcijski volumen in injekcijska koncentracija,
— Mp vrednost, uporabljena za kalibriranje,
— elucijski volumen ali popravljeni retenzijski čas, izmerjen pri maksimumih vrha,
— Mp, izračunan na maksimumu vrha,
— odstotek odstopanja od izračunanega Mpin kalibracijska vrednost.
2.2.4 Informacije o vsebnosti nizke molekulske mase
— opis uporabljenih metod pri analizi in način izvedbe poskusov,
— informacije o odstotkih vsebnosti vrst nizke molekulske mase (w/w), ki se nanaša na celotni vzorec,
— informacije o nečistotah, aditivih in drugih nepolimerskih vrstah v odstotkih po teži, ki se nanašajo na celoten vzorec.
2.2.5 Ocenjevanje
— ocena na časovni podlagi: metode, uporabljene za zagotovitev zahtevane obnovljivosti (metode popravljanja, interni standard, itd.),
— informacije o tem, ali je ocena izvedena na podlagi elucijskega volumna aliretenzijskega časa,
— informacije o mejah ocenjevanja, če vrh ni analiziran v celoti,
— opis blažilnih metod, če so uporabljene,
— postopki priprave in predobdelave vzorca,
— prisotnost morebitnih neraztopljenih delcev,
— injekcijski volumen (μl) in injekcijska koncentracija (mg/μl),
— ugotovitve, ki kažejo na učinke, ki peljejo k odklonom od idealnega GPC profila,
— podroben opis vseh sprememb v preskusnih postopkih,
— podrobnosti o stopnjah odstopanj,
— vse druge informacije in ugotovitve, ki so pomembne za interpretacijo rezultatov.
3. LITERATURA
(1) DIN 55672 (1995) Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1.
(2) Yau, W.W., Kirkland, J.J., and Bly, D.D. eds. (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons.
(3) ASTM D 3536-91, (1991). Standard Test method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania.
(4) ASTM D 5296-92, (1992). Standard Test method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania.
Priloga
Smernice za korekcijo vsebnosti nizke molekulske mase pri prisotnosti netopnega polimera
Kadar je v vzorcu prisoten netopen polimer, lahko to povzroči izgubo mase v teku GPC analize. Netopen polimer se lahko nepovratno ohrani na koloni ali filtru vzorca, medtem ko raztopni delež vzorca predre skozi kolono. V primeru, kadar je mogoče porast refrakcijskega indeksa (dn/dc) polimera oceniti ali izmeriti, lahko ocenimo maso vzorca, izgubljeno na koloni. V tem primeru, lahko opravimo korekcijo z uporabo zunanjega kalibriranja s standardnimi materiali znane koncentracije in dn/dc, da bi kalibrirali odziv refraktometra. V naslednjem primeru je uporabljen standard poli(metil metakrilat) (pMMA).
Pri zunanjem kalibriranju za analizo akrilnih polimerov, z GPC analiziramo pMMA standard znane koncentracije v tetrahidrofuranu, dobljene podatke pa uporabimo, da poiščemo konstanto na refraktometru, v skladu z enačbo:
K = R/(C × V × dn/dc)
kjer je
|
K |
= |
konstanta refraktometra (v mikrovoltsekundah/ml), |
|
R |
= |
odziv pMMA standarda (v mikrovoltsekundah), |
|
C |
= |
koncentracija pMMA standarda (v mg/ml), |
|
V |
= |
injekcijski volumen (v ml) in |
|
dn/dc |
= |
porast refrakcijskega indeksa za pMMA v tetrahidrofuranu (v ml/mg) |
Naslednji podatki so značilni za pMMA standard:
|
R |
= |
2 937 891 |
|
C |
= |
1,07 mg/ml |
|
V |
= |
0,1 ml |
|
dn/dc |
= |
= 9 × 10-5 ml/mg |
Dobljeno K vrednost 3,05 × 1011 nato uporabimo za izračun odziva teoretičnega detektorja, če je 100 % vbrizganega polimera eluirano skozi detektor.
A.20 OBNAŠANJE RAZTOPINE IZVLEČKA POLIMEROV V VODI
1. METODA
Opisana metoda je v skladu s revidirano različico OECD smernice 120 (1997). Nadaljnje tehnične informacije so navedene v literaturi (1).
1.1 UVOD
Za določene polimere, kot so emulzijski polimeri, bo mogoče potrebno opraviti začetno pripravo, preden se uporabi tukaj podana metoda. Metoda se ne uporablja pri tekočinskih polimerih in polimerih, ki v preskusnih pogojih reagirajo z vodo.
Kadar metoda ni izvedljiva ali mogoča, lahko obnašanje raztopine/izvlečka raziščemo s pomočjo drugih metod. V takšnih primerih je treba uporabljeno metodo natančno obrazložiti in utemeljiti.
1.2 REFERENČNE SNOVI
Jih ni.
1.3 PRINCIPI PRESKUSNE METODE
Obnašanje raztopine/izvlečka polimerov v vodnem gojišču določimo z uporabo metode z bučko (glej A.6 vodna topnost, metoda z bučko), upoštevajoč spodaj opisane spremembe.
1.4 KRITERIJI KAKOVOSTI
Jih ni.
1.5 OPIS PRESKUSNE METODE
1.5.1 Oprema
Za metodo je potrebna naslednja oprema:
— drobilna naprava, npr. mlinček za proizvajanje delcev znane velikosti,
— aparat za tresenje z možnostjo nadzora temperature,
— sistem membranskega filtra,
— ustrezna oprema za analizo,
— standardizirana sita.
1.5.2 Priprava vzorca
Reprezentativni vzorec je treba najprej z uporabo ustreznih sit zmanjšati na velikost delca med 0,125 in 0,25 mm. Mogoče bo potrebno hlajenje, da se doseže stabilnost vzorca ali zaradi procesa drobitve. Materiali gumijaste narave se lahko na temperaturi tekočega dušika zdrobijo (1).
Če zahtevane frakcije velikosti delca ni mogoče doseči, je treba velikost delca zmanjšati, kolikor je mogoče, in poročati o rezultatu. V poročilu je treba označiti, kako smo zdrobljen vzorec hranili pred preskusom.
1.5.3 Postopek
Tri vzorce po 10 g preskusne snovi odmerimo v vsako izmed treh posod, zaprtih s steklenimi zamaški, in v vsako posodo dodamo 1 000 ml vode. Če se izkaže, da je ravnanje s količino 10 g polimera neizvedljivo, je treba uporabiti naslednjo najvišjo količino, s katero je mogoče ravnati, in temu ustrezno prilagoditi količino vode.
Posode tesno zamašimo in jih pretresemo pri 20 oC. Uporabiti moramo napravo za tresenje ali mešanje, ki lahko deluje na stalni temperaturi. Po 24 urah vsebino vsake posamezne posode centrifugiramo ali prefiltriramo, koncentracijo polimera v čisti vodni fazi pa določimo z ustrezno analitično metodo. Če ustreznih analitičnih metod za vodno fazo ni na voljo, lahko skupno topljivost/izločljivost ocenimo iz suhe teže prefiltriranega ostanka ali centrifugirane oborine.
Ponavadi je treba po količini razločiti nečistote in aditive na eni strani in vrste z nizko molekulsko maso na drugi. V primeru gravimetrične določitve je prav tako pomembno opraviti prazni preskus brez uporabe vseh preskusnih snovi, da bi izračunali ostanke, do katerih pride med poskusnim postopkom.
Obnašanje raztopine/izvlečka polimerov v vodi pri 37 oC na pH 2 in pH 9 lahko določimo na enak način, kot je opisano za izvajanje eksperimenta pri 20 oC. pH vrednosti se lahko dosežejo z dodajanjem bodisi primernih puferjev ali ustreznih kislin ali baz, kot so hidrokloridna kislina, acetatna kislina, natrij analitične stopnje ali kalijev hidroksid ali NH3.
Glede na uporabljeno metodo analize moramo izpeljati enega ali dva preskusa. Kadar je za neposredno analizo vodne faze polimerskega delca na voljo dovolj specifičnih metod, bi moral zadostovati en sam preskus, kot je opisano zgoraj. Kadar pa takšne metode niso na voljo in je določitev obnašanja raztopine/izvlečka polimera omejena na posredno analizo z določanjem zgolj skupne vsebnosti organskega karbona (TOC) vodnega izvlečka, je treba opraviti dodaten preskus. Ta dodaten preskus je treba opraviti v treh izvedbah in uporabiti 10-krat manjše vzorce polimera in enake količine vode, kot je bila uporabljena v prvem preskusu.
1.5.4 Analiza
1.5.4.1 Preskus, opravljen z eno velikostjo vzorca
Metode so lahko na voljo za neposredno analizo sestavin polimera v vodni fazi. Po drugi strani je mogoče upoštevati tudi posredno analizo raztopljenih/izločenih sestavin polimera z določanjem skupne vsebnosti topnih delcev in korekcijo za sestavine, ki niso značilne za polimer.
Analiza vodne faze za vse polimerske vrste je mogoča:
bodisi z dovolj občutljivo metodo, npr.:
— TOC z uporabo persulfata ali digeriranjem dikromata za sprostitev CO2, ki mu sledi ocena z IR ali kemična analiza,
— atomska absorpcijska spektrometrija (AAS) ali njen emisijski ekvivalent induktivno sklopljene plazme (ICP) za polimere, ki vsebujejo silikon ali kovino,
— UV absorpcija ali spektrofluorometrija za akrilne polimere,
— LC-MS za vzorce z nizko molekulsko maso,
ali z vakuumskim izhlapevanjem do suhega stanja vodnega ekstrakta in spektroskopijo (IR, UV, itd.) ali AAS/ICP analizo ostanka.
Če analiza vodne faze kot takšne ni izvedljiva, je treba vodni izvleček izvleči z organskim topilom, ki ni združljiv z vodo, npr. s kloriranim hidrokarbonom. Topilo nato izhlapimo, ostanek pa analiziramo kot zgoraj, da bi ugotovili njegovo vsebnost v ustreznem polimeru. Vsako sestavino v tem ostanku, ki je prepoznana kot nečistota ali aditiv, je treba odšteti, da bi določili stopnjo raztopine/izvlečka samega polimera.
Kadar so prisotne relativno velike količine takšnih materialov, je mogoče ostanek potrebno analizirati, na primer, s tekočinsko kromatografijo visoke ločljivosti (HPLC) ali plinsko kromatografijo (GC), da bi razločili nečistote od prisotnega monomera in vrst, ki so iz monomera izpeljane, s čimer nato določimo pravo vsebnost teh vrst.
V nekaterih primerih lahko zadostuje preprosto izhlapevanje organskega topila do suhega stanja in tehtanje suhega ostanka.
1.5.4.2 Preskus, opravljen z dvema različnima velikostma vzorca
Vsi vodni izvlečki se analizirajo za TOC.
Gravimetrična določitev se izvede na neraztopljenem/neizvlečenem delu vzorca. Če po centrifugiranju ali filtriranju vsebnosti vsake posode ostanek polimera ostane pritrjen na stene posode, je treba posodo sprati s filtratom, dokler z nje ne odstranimo vseh vidnih ostankov. Temu sledi ponovno centrifugiranje ali filtriranje filtrata. Ostanke, ki ostanejo na filtru ali v centrifugini cevi posušimo pri 40 oC v vakuumu in jih stehtamo. S sušenjem nadaljujemo, dokler ne dosežemo konstantne teže.
2. PODATKI
2.1 PRESKUS, OPRAVLJEN Z ENO VELIKOSTJO VZORCA
Posamezni rezultati za vsako izmed treh bučk in povprečne vrednosti je treba podati in izraziti v enotah mase na volumen raztopine (značilno mg/l) ali mase na maso vzorca polimera (značilno mg/g). Poleg tega je treba podati tudi izgubo teže vzorca (izračunano kot teža vzorca, deljeno s težo začetnega vzorca). Izračunati je treba relativne standardne deviacije (RDS). Za celotno snov (polimer + bistveni aditivi, itd.) in samo za polimere (t.j. po odštetju prispevka takšnih aditivov) je treba podati posamezne številke.
2.2 PRESKUS, OPRAVLJEN Z DVEMA RAZLIČNIMA VELIKOSTIMA VZORCA
Posamezne TOC vrednosti vodnih izvlečkov dveh trojnih poskusov in povprečno vrednost za vsak poskus je treba podati izraženo v enotah mase na volumen raztopine (značilno mgC/l), kakor tudi v enotah mase na težo začetnega vzorca (značilno mgC/g).
Če med rezultatom na visokem in nizkem razmerju vzorec/voda ni razlike, lahko to pomeni, da so bile vse izločljive sestavine zares izvlečene. V tem primeru ponavadi direktna analiza ni potrebna.
Posamezne teže ostankov je treba podati izražene v odstotku začetnih tež vzorca. Povprečne vrednosti je treba izračunati za vsak poskus. Razlike med 100 % in dobljenimi odstotki predstavljajo odstotke topljivega in izločljivega materiala v izvirnem vzorcu.
3. POROČANJE
3.1 PRESKUSNO POROČILO
Preskusno poročilo mora vsebovati naslednje informacije:
3.1.1 Preskusna snov
— razpoložljive informacije o preskusni snovi (identiteta, aditivi, nečistote, vsebnost vrst z nizko molekulsko maso).
3.1.2 Poskusni pogoji
— opis uporabljenih postopkov in poskusnih pogojev,
— opis analitičnih in detekcijskih metod.
3.1.3 Rezultati
— rezultati o topnosti/izločljivosti v mg/l; posamezne in povprečne vrednosti za ekstrakcijske preskuse v različnih raztopinah, porazdeljenih v vsebnosti polimera in nečistotah, aditivih, itd.
— rezultati topnosti/izločljivosti v mg/g polimera,
— TOC vrednosti vodnega ekstrakta, masa vzorca in izračunani odstotki, če so merjeni,
— pH vsakega posameznega vzorca,
— informacije o praznih vrednostih,
— kjer je potrebno, napotki o kemični nestabilnosti preskusne snovi med preskusnim postopkom in analitičnim procesom,
— vse informacije, ki so pomembne za interpretacijo rezultatov.
4. LITERATURA
(1) DIN 53733 (1976) Zerkleinerung von Kunststofferzeugnissen für Prüfzwecke.
A.21 OKSIDATIVNE LASTNOSTI (TEKOČE SNOVI)
1. METODA
1.1 UVOD
Ta metoda preskušanja je namenjena merjenju potenciala tekoče snovi za povečanje stopnje gorenja ali intenzivnosti gorenja vnetljive snovi ali za tvorbo mešanice z vnetljivo snovjo, ki se sama vname, ko se obe temeljito premešata. Njena podlaga je preskus ZN za oksidativne tekoče snovi (1) in mu je enakovredna. Ker je metoda A.21 v prvi vrsti namenjena izpolnjevanju zahtev Uredbe 1907/2006, je potrebna primerjava le z eno referenčno snovjo. Če je pričakovati, da se bodo rezultati preskusov uporabljali za druge namene ( 3 ), bo morda potrebno preskušanje in primerjava z dodatnimi referenčnimi snovmi.
Ta preskus je treba opraviti, kadar preverjanje strukturne formule nedvomno pokaže, da snov ne more reagirati eksotermično z vnetljivim materialom.
Pred opravljanjem tega preskusa je koristno imeti predhodne informacije o možnih eksplozivnih lastnostih snovi.
Ta preskus se ne uporablja za trdne snovi, pline, eksplozivne ali zelo lahko vnetljive snovi, ali organske perokside.
Tega preskusa ni treba narediti, kadar so rezultati za preskusno snov iz preskusa ZN za oksidativne tekoče snovi (1) že na voljo.
1.2 DEFINICIJE IN ENOTE
Povprečni čas dvigovanja tlaka je povprečje izmerjenega časa za mešanico v preskusu, da bi se zagotovil dvig tlak s 695 kPa na 2 070 kPa nad zračnim tlakom.
1.3 REFERENČNA SNOV
Potrebna je 65 % (m/m) vodna dušikova kislina (analitske stopnje) kot referenčna snov ( 4 ).
Če izvajalec preskusa predvideva, da bi se rezultati tega preskusa lahko uporabili za druge namene (4) , je lahko ustrezno tudi preskušanje z dodatnimi referenčnimi snovmi ( 5 ).
1.4 PRINCIP PRESKUSNE METODE
Tekoča snov, ki jo je treba preskusiti, se zmeša v razmerju 1 proti 1 glede na maso, z vlaknato celulozo in vlije v tlačno posodo. Če med mešanjem ali polnjenjem pride do samovžiga, nadaljnje preskušanje ni potrebno.
Če samovžig ne nastane, se opravi preskus v celoti. Mešanica se segreje v tlačni posodi, določi se povprečni čas, potreben za dvig tlaka s 690 kPa na 2 070 kPa nad zračnim tlakom. To se primerja s povprečnim časom dviga tlaka za mešanico 1: 1 referenčne snovi/referenčnih snovi in celuloze.
1.5 KRITERIJI KAKOVOSTI
V seriji petih poskusov na eni snovi se rezultati ne smejo razlikovati za več kakor 30 % od aritmetične sredine. Rezultate, ki se razlikujejo za več kakor 30 % od aritmetične sredine, je treba zavreči, izboljšati postopek mešanja in polnjenja in ponoviti preskušanje.
1.6 OPIS METODE
1.6.1 Priprava
1.6.1.1 Vnetljiva snov
Posušena vlaknata celuloza z dolžino vlaken med 50 in 250 μm in povprečni premerom 25 μm ( 6 ) se uporablja kot vnetljivi material. Suši se 4 ure do konstantne teže v plasti, ki je debela največ 25 mm, pri 105 oC in se hrani v eksikatorju, s snovjo za sušenje, dokler se ne ohladi in dokler ni potrebna za uporabo. Vsebnost vode v posušeni celulozi mora biti manjša kakor 0,5 % na suho maso ( 7 ). Če je potrebno, se mora čas sušenja podaljšati, da bi se to doseglo ( 8 ). Med preskusom je treba ves čas uporabljati isto šaržo celuloze.
1.6.1.2 Naprava
1.6.1.2.1
Potrebna je tlačna posoda. Posoda je sestavljena iz cilindrične jeklene tlačne posode, dolžine 89 mm z zunanjim premerom 60 mm (glej sliko 1). Dve ravni držali se strojno pritrdita na nasprotnih straneh (zmanjšujeta prerez posode na 50 mm), da jo je lažje držati pri namestitvi sprožilnega mehanizma in oddušnega ventila. Posoda, ki ima izvrtino premera 20 mm, ima na obeh straneh do globine 19 mm vrezane navoje, ki ustrezajo 1' „britanske standardne cevi (BSP) ali metrično enakovredni cevi. Zračni ventil v obliki stranske ročice se privije v ukrivljeni sprednji del tlačne posode 35 mm od enega konca in pod kotom 90o glede na strojno obdelani ravnini. Za to je izvrtana 12 mm globoka izvrtina z navoji za privijanje 1/2“ BSP (ali metrično enakovrednega) navoja na koncu stranske ročice. Če je potrebno, pritrdimo za zatesnitev proti uhajanju plina inertno tesnilo. Stranska ročica sega 55 mm za ohišje tlačne posode in ima izvrtino 6 mm. Konec stranske ročice ima izrezane navoje za pritrditev naprave za spreminjanje pritiska z opno. Uporabimo lahko katero koli napravo za merjenje tlaka, pod pogojem, da nanjo ne vplivajo vroči plini ali razpadli produkti in da se lahko odziva na stopnje dviga tlaka 690–2 070 kPa v manj kakor 5 ms.
Konec tlačne posode, ki je najbolj oddaljen od stranske ročice, se zapre s sprožilnim mehanizmom, ki je opremljen z dvema elektrodama, od katerih je ena izolirana od ohišja mehanizma, druga pa ne. Drugi konec tlačne posode je zaprt z okroglo razpočno ploščo (tlak preboja približno 2 200 kPa), ki jo drži na mestu vijak z 20 mm izvrtino. Če je potrebno, pritrdimo za zatesnitev proti uhajanju plina inertno tesnilo. Podporno podnožje (slika 2) drži sklop v pravilnem položaju med uporabo. Ponavadi se sestoji iz osnovne plošče iz mehkega jekla velikosti 235 mm × 184 mm × 6 mm, na katero je pritrjen po dolžini 185 mm profil dimenzij kvadrata 70 mm × 70 mm × 4 mm.
Iz kvadratnega profila se izrežeta po dolžini dve nasprotni stranici, tako da nastane nad njima 86 mm dolg podest, ki ima dve nogi z ravnima stranicama. Konca teh ravnih stranic sta odrezana pod kotom 60 o na horizontalno ravnino in privarjena na osnovno ploščo. Utor, ki je 22 mm širok in 46 mm globok, je strojno vrezan v eno stran gornjega konca podlage, da se vanj uleže stranska ročica, kadar potisnemo sklop s tlačno posodo navzdol, najprej konec s sprožilnim mehanizmom, v podpornik podesta. Na spodnjo zunanjo prednjo stran kvadratnega profila je privarjen kos jekla, širine 30 mm in debeline 6 mm, ki deluje kakor distančnik. Dva 7 mm palčna vijaka, privita na nasprotni strani, pomagata držati tlačno posodo trdno na mestu. 12 mm široki trakovi iz 6 mm debelega jekla, privarjeni na stranske dele, ob robu podlage kvadratnega profila, podpirata tlačno posodo s spodnje strani.
1.6.1.2.2
Sistem vžiga je sestavljen iz 25 cm dolge žice iz niklja in kroma s premerom 0,6 mm in uporom 3,85 ohm/m. Žica se zvije s palico premera 5 mm v obliko tuljave in se pritrdi na elektrodo sprožilnega mehanizma. Tuljava mora imeti eno od oblik, prikazanih na sliki 3. Razdalja med dnom posode in spodnjim delom tuljave vžiga mora znašati 20 mm. Če elektrodi nista nastavljivi, je treba izolirati konca žice za vžig med tuljavo in dnom posode s keramičnim obročem. Žico segreva neprekinjeno tokovno napajanje, ki lahko zagotovi moč najmanj 10 amperov.
1.6.2 Potek preskušanja ( 9 )
Naprava, ki se sestoji iz zračnega ventila in sistema segrevanja, vendar brez nameščene okrogle razpočne plošče, je podprta s koncem s koncem, kjer je sprožilni mehanizem, obrnjenim navzdol. 2,5 g tekočine, ki jo je treba preskusiti, se zmeša z 2,5 g posušene celuloze v stekleni čaši in uporabimo stekleno paličico za mešanje ( 10 ). Zaradi varnosti je treba mešanje opraviti z varnostnim ščitom med izvajalcem preskusa in mešanico. Če se mešanica vname med mešanjem ali polnjenjem, nadaljnje preskušanje ni potrebno. Mešanica se dodaja v majhnih odmerkih po kapljicah v tlačno posodo, prepričati se je treba, da se mešanica nabira okoli tuljave vžiga in je z njo v dobrem stiku. Pomembno je, da se tuljava ne deformira med postopkom pakiranja, ker lahko to povzroči zmotne rezultate ( 11 ). Namesti se razpočna plošča in tesno privije vijak, ki jo drži na njenem mestu. Napolnjeno posodo prenesemo na sprožilno podporno podnožje, z okroglo razpočno ploščo obrnjeno navzgor, nameščena mora biti v ustrezni oklepni dimni omarici ali sprožilni celici. Tokovno napajanje se priključi na zunanje priključne letve sprožilnega mehanizma in uporabi moč 10 A. Čas med začetkom mešanje in vključitvijo močnostnega napajanja ne sme presegati 10 minut.
Signal, ki ga oddaja zračni ventil za tlak, se zabeleži z ustreznim sistemom, ki omogoča hkrati vrednotenje in oblikovanje stalnega zapisa dobljenega časovnega tlačnega profila (npr. začasen zapisovalnik skupaj z zapisovalnikom grafa). Mešanica se segreva, dokler se okrogla razpočna plošča ne razpoči ali dokler ne mine vsaj 60 s. Če razpočna plošča poči, je treba pustiti mešanico, da se ohladi, preden se naprava skrbno razstavi in pri tem upoštevati varnostne ukrepe zaradi podtlaka, ki lahko nastane. Izvede se 5 poskusov s preskusno snovjo in z referenčno snovjo/snovmi. Čas, potreben za dvig tlaka s 690 kPa na 2 070 kPa nad zračni tlak, se zabeleži. Izračuna se povprečni čas dviga tlaka.
V nekaterih primerih lahko snovi sprožijo dvig tlaka (previsok ali prenizek tlak) zaradi kemijskih reakcij, ki niso značilne za oksidativne lastnosti snovi. V takšnih primerih bo morda potrebno preskus ponoviti z inertno snovjo, npr. z diatomejsko zemljo (kieselguhr) namesto celuloze za pojasnitev vrste reakcije.
2. PODATKI
Časi dviga tlaka za preskusno snov in referenčno snov/snovi. Časi dviga tlaka za preskuse z inertno snovjo, če se opravljajo.
2.1 OBRAVNAVANJE REZULTATOV
Izračunajo se povprečni časi dviga tlaka za preskusno snov in referenčno snov/snovi.
Izračuna se povprečni čas dviga tlaka za preskuse z inertno snovjo (če se opravljajo).
Nekateri primeri rezultatov so prikazani v Tabeli 1.
Tabela 1
Primer rezultatov ()
|
Snov () |
Povprečni čas dviga tlaka za mešanico s celulozo 1:1 (ms) |
|
Amonijev dikromat, nasičena vodna raztopina |
20 800 |
|
Kalcijev nitrat, nasičena vodna raztopina |
6 700 |
|
Železov nitrat, nasičena vodna raztopina |
4 133 |
|
Litijev perklorat, nasičena vodna raztopina |
1 686 |
|
Magnezijev perklorat, nasičena vodna raztopina |
777 |
|
Nikljev nitrat, nasičena vodna raztopina |
6 250 |
|
Dušikova kislina, 65 % |
4 767 () |
|
Perklorova kislina, 50 % |
121 () |
|
Perklorova kislina, 55 % |
59 |
|
Kalijev nitrat, 30 % vodna raztopina |
26 690 |
|
Srebrov nitrat, nasičena vodna raztopina |
|
|
Natrijev klorat, 40 % vodna raztopina |
2 555 () |
|
Natrijev nitrat, 45 % vodna raztopina |
4 133 |
|
Inertna snov |
|
|
Vodna celuloza |
|
|
(1) Glej sklic (1) za razvrstitev v shemo prevoza ZN. (2) Nasičeno raztopino je treba pripraviti pri 20 oC. (3) Srednja vrednost pri poskusih iz primerjave med laboratoriji. (4) Maksimalni tlak 2 070 kPa ni dosežen. |
|
3. POROČILO
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje informacije:
— vrsto, sestavo, čistost, itd. preskušane snovi,
— koncentracijo preskusne snovi,
— postopek sušenja uporabljene celuloze,
— vsebnost vode uporabljene celuloze,
— rezultate meritev,
— rezultate preskusov z inertno snovjo, če so bili izvedeni,
— izračunane povprečne čase dviga tlaka,
— vsa odstopanja od te metode in razloge zanje,
— vse dodatne informacije ali pripombe, ki so pomembne za razlago rezultatov.
3.2 RAZLAGA REZULTATOV ( 12 )
Rezultati preskusa se ocenijo na podlagi tega;
(a) ali se mešanica preskušane snovi in celuloze spontano vname in
(b) primerjave povprečnega časa, ki je potreben, da tlak naraste s 690 kPa na 2 070 kPa s povprečnim časom za referenčno snov/snovi.
Tekočo snov je treba obravnavati, kot da je oksidant, kadar:
(a) se mešanica 1:1, glede na maso, snovi in celuloze spontano vname, ali
(b) ima mešanica 1:1, glede na maso, snovi in celuloze, manjši ali enak povprečni čas dviga tlaka, kot je povprečni čas dviga tlaka mešanice 1:1, glede na maso, 65 % (m/m) vodne dušikove kisline in celuloze.
Da bi se izognili napačnim pozitivnim rezultatom, je treba po potrebi pri razlagi rezultatov upoštevati tudi rezultate, dobljene pri preskušanju snovi z inertnim materialom.
4. VIRI
(1) Recommendations on the Transport of Dangerous Goods, Manual of Tests and Criteria. 3rd revised edition. UN Publication No: ST/SG/AC.10/11/Rev. 3, 1999, page 342. Test O.2: Test for oxidizing liquids.
Slika 1
Tlačna posoda

Slika 2
Podporni podest
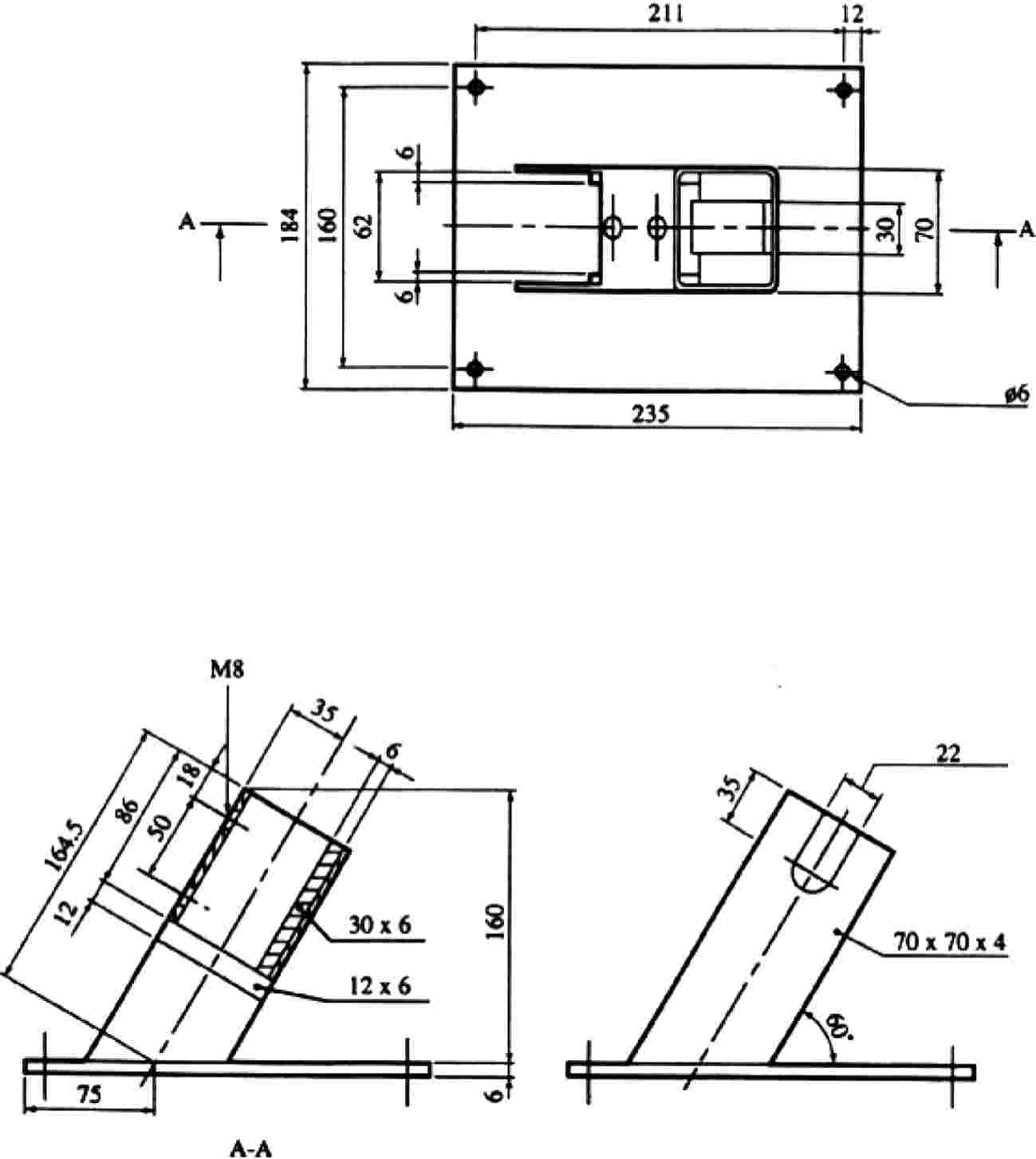
Slika 3
Sistem vžiga

Opomba: Uporabi se lahko kateri koli od obeh načrtov.
A.22. GEOMETRIJSKI SREDNJI PREMER GLEDE NA DOLŽINO VLAKEN
1. METODA
1.1 UVOD
Ta metoda opisuje postopek za merjenje geometrijskega srednjega premera glede na dolžino vlaken (LWGMD – Length Weighted Geometric Mean Diameter) velikih ročno izdelanih mineralnih vlaken (MMMF – Man Made Mineral Fibres). Ker ima LWGMD populacije 95 % verjetnosti, da leži med 95 odstotnimi stopnjami zaupanja (LWGMD ± dve standardni napaki) vzorca, bo dejanska vrednost (preskusna vrednost) nižja od 95 % meje zaupanja vzorca (tj. LWGMD ± dve standardni napaki). Metoda temelji na dopolnitvi (junij 1994) osnutka industrijskega postopka HSE, ki je bil usklajen na sestanku med ECFIA in HSE v Chestru dne 26.9.1993 in razvit za in iz drugega medlaboratorijskega poskusa (1, 2). To merilno metodo se lahko uporablja za označevanje premera vlaken velikih snovi ali proizvodov, ki vsebujejo MMMF, vključno z ognjeodpornimi keramičnimi vlakni (RFC), ročno izdelanimi steklenimi vlakni (MMVF), kristalnimi in polikristalnimi vlakni.
Določanje utežnostnega faktorja dolžine je sredstvo za izravnavo učinkov na porazdelitev premera, povzročenega zaradi preloma dolgih vlaken pri vzorčenju ali ravnanju z materialom. Geometrična statistika (geometrično povprečje) se uporablja za merjenje velikosti porazdelitve premera MMMF, ker imajo ti premeri običajno velikost porazdelitve, ki se približuje normalnemu logaritmu.
Merjenje dolžine kot tudi premera je obsežno in zahteva veliko časa, vendar, če se meritve izvedejo samo na tistih vlaknih, ki se dotikajo neskončno tanke črte v vidnem polju SEM, potem je verjetnost izbire danega vlakna sorazmerna njegovi dolžini. Ker to določa dolžino pri izračunih utežnostnega faktorja dolžine, je edina zahtevana meritev, meritev premera, tako da je možno LWGMD-2SE izračunati, kot je to opisano.
1.2 DEFINICIJE
Delec: Predmet z razmerjem dolžina/širina, ki je manjše od 3:1.
Vlakno: Predmet z razmerjem dolžina/širina, ki je manjše od 3:1.
1.3 OBSEG IN OMEJITVE
Ta metoda je zasnovana tako, da je možno pogledati porazdelitev premerov, ki imajo mediano premera od 0,5 μm do 6 μm. Večje premere je možno izmeriti, če se uporabijo manjše povečave SEM, vendar je metoda izredno omejena na natančno porazdelitev vlaken, tako da se priporoča uporaba meritev s TEM (prenosni elektronski mikroskop), če je mediana premera pod 0,5 μm.
1.4 NAČELA METODE PRESKUŠANJA
Število reprezentančnih vzorcev jeder se vzame iz krpe vlaken ali iz prostih velikih vlaken. Velika vlakna se z uporabo postopka drobljenja skrajšajo po dolžini, reprezentativni podvzorci pa se razpršijo v vodi. Alikvoti se izvlečejo in filtrirajo skozi 0,2 μm velike pore polikarbonskega filtra in se pripravijo za preskušanje s tehniko skeniranja z elektronskim mikroskopom (SEM). Premeri vlaken se merijo pri povečavi zaslona × 10 000 ali večji ( 13 ), pri tem pa se uporabi metoda sekanja črte, da je tako dosežena nevtralna ocena mediane premera. Izračuna se spodnjih 95 % intervala zaupanja (na osnovi enostranskega preskusa), tako da je možno dati oceno najnižje vrednosti srednjega geometrijskega premera glede na dolžino vlakna materiala.
1.5 OPIS METODE PRESKUŠANJA
1.5.1 Varnostni/previdnost
Do največje možne mere je treba zmanjšati izpostavljenost osebja pred vlakni, ki se uporabljajo v letalstvu, zato je za ravnanje s suhimi vlakni treba uporabljati dimno komoro ali komoro, v katero posegamo z rokavicami. Potrebno je spremljanje občasne izpostavljenosti osebja, da bi se določila učinkovitost kontrolne metode. Pri rokovanju z MMMF je treba nositi rokavice za enkratno uporabo, da se tako zmanjša draženje kože in prepreči navzkrižno onesnaženje.
1.5.2 Aparature/naprave
— Stiskalnica in barve (za tlak do 10 MPa),
— filtri s kapilarnimi karbonatnimi porami velikosti 0,2 μm (premera 25 mm),
— membranski filtri s 5 μm velikimi celuloznimi porami za uporabo pri podpornih filtrih,
— aparature za filtriranje stekla (ali sistem za filtriranje odpadkov), ki sprejmejo filtre s premorom 25 mm (npr. Millipore komplet za mikroanalizo stekla, tip št. XX10 025 00),
— sveže destilirana voda, ki je bila filtrirana skozi filter z velikostjo por 0,2 μm za odstranjevanje mikroorganizmov,
— naprava za pršenje nanosov na zlato ali zlate/paladijeve površine,
— skenirni elektronski mikroskop z ločitvijo do 10 nm in s povečavo ×100 000,
— razno: lopatice, rezilo skalpela tipa 24, pincete, cevi SEM, karbonsko lepilo ali karbonski lepilni trak, koloidno srebro,
— ultrazvočno tipalo ali namizna ultrazvočna kopel,
— naprava za jemanje vzorcev jedra ali vrtalnik za pluto za odvzem vzorcev iz MMMF krpe.
1.5.3 Postopek preskusa
1.5.3.1 Vzorčenje
Za odvzem vzorcev krp in plošč se uporablja 25 mm naprava za jemanje vzorcev jeder ali vrtalnik za pluto. Vzorce se odvzame enakomerno po vsej dolžini krajše strani krpe ali iz poljubne površine, če so na razpolago daljše strani krpe. Za odvzem naključnih vzorcev prostih vlaken se uporablja ista oprema. Če je le možno, naj se odvzame šest vzorcev, ki odražajo prostorske razlike velikega materiala.
Šest vzorcev jeder je treba z 10 MPa zdrobiti v 50 mm kalupu. Material se meša z lopatico in ponovno stisne z 10 MPa. Nato se material odstrani iz kalupa in shrani v zapečateno steklenico.
1.5.3.2 Priprava vzorca
Po potrebi se organska veziva lahko odstranijo tako, da se vlakna za ca. 1 uro vstavijo v peč pri 450 °C.
Napravite stožčasto obliko in jo razdelite na štiri dele (to je treba narediti v prašni komori).
Z lopatico dodajte majhno količino (< 0,5 g) vzorca v 100 ml sveže destilirane vode, ki ste jo predhodno filtrirali skozi membranski filter 0,2 μm (alternativno se lahko uporabijo izviri izjemno čiste vode, če se pokažejo kot zadovoljivi). Temeljito razpršite s pomočjo ultrazvočnega tipala, ki deluje z močjo 100 W in je uglašeno tako, da povzroča kavitacije. (Če tipalo ni na razpolago, uporabite naslednjo metodo: večkrat pretresite in obrnite za 30 s; za nekaj minut izpostavite ultrazvoku v namizni ultrazvočni napravi; nato ponovno pretresite in obrnite za nadaljnjih 30 s).
S široko pipeto (zmogljivosti 2–5 ml) takoj po razpršitvi vlakna odstranite večje število alikvotov (npr. tri alikvote po 3, 6 in 10 ml).
Vaakumsko filtrirajte vsak alikvot skozi polikarbonski filter 0,2 μm, ki mu pomaga podporni filter MEC s 5 μm porami, in uporablja 25 mm stekleni filtrski lijak z valjastim rezervoarjem. Približno 5 ml filtrirane destilirane vode je treba vliti v lijak in počasi s pipeto nakapati alikvot v vodo, pri tem pa držati vrh pipete pod meniskusom. Pipeto in rezervoar je po kapljanju treba temeljito splahniti, ker tanka vlakna težijo k površini.
Skrbno odstranite filter in ga ločite od podpornega filtra, preden ga vstavite v drugo posodo na sušenje.
S skalpelom tipa 24 odrežite četrtino ali polovico dela filtra z filtrskimi ostanki in pri tem uporabite sunkovite gibe. Previdno pritrdite odrezani del na trn SEM in pri tem uporabite vložke lepljivega ogljika ali ogljikovo lepilo. Koloidno srebro se nanese na najmanj tri mesta, da se izboljša električni stik na robovih filtra in trna. Ko se lepilo/koloidno srebro posuši, nabrizgajte sloj približno 50 nm zlata ali zlata/paladija na površino ostankov.
1.5.3.3 Umerjanje in delovanje SEM
1.5.3.3.1 Umerjanje
Umerjanje SEM je treba preveriti vsaj enkrat tedensko (idealno enkrat na dan) in pri tem uporabiti mrežo za umerjanje. Umerjanje je treba preveriti glede na potrjene standarde in če izmerjena vrednost (SEM) ni v območju ± 2 % od potrjene vrednosti, potem je treba umerjanje SEM prilagoditi in ponovno preveriti.
SEM mora biti sposoben ločiti vsaj najmanjši viden premer 0,2 μm pri uporabi prave matrike vzorčenja in pri povečavi × 2 000.
1.5.3.3.2 Delovanje
SEM naj obratuje pri povečavi 10 000 ( 14 ) pod pogoji, ki omogočajo dobro ločljivost s sprejemljivimi slikami pri počasnem skeniranju, npr. 5 s za sliko. Čeprav so delovne zahteve za različne SME lahko različne, je za doseganje najboljše vidljivosti in ločljivosti na splošno treba uporabiti nastavitev za majhno površino fokusa in kratko delovno razdaljo, z relativno nizko atomsko težo materialov in pospeševalnimi napetostmi 5–10 keV. Ker se izvaja linearni prehod, se priporoča uporaba naklona 0o za najmanjše potrebno ponovno fokusiranje ali, če je SEM v evcentričnem stanju, evcentrična delovna razdalja. Če material ne vsebuje vlaken majhnega premera in so premeri vlaken veliki (> 5 μm), se lahko uporabi manjša povečava.
1.5.3.4 Določanje velikosti
1.5.3.4.1 Pregled z nizko povečavo za oceno vzorca
Najprej naj se vzorec pregleda z nizko povečavo, da se ugotovi prisotnost kopičenja velikih vlaken in da se oceni gostota vlaken. V primeru prevelikega kopičenja se priporoča priprava novega vzorca.
Za statistično točnost je potrebno izmeriti najmanjše število vlaken, visoka gostota vlaken, ki je na videz primerna za pregled praznih polj, pa zahteva veliko časa in ne prispeva k analizi. Če je filter preobremenjen, je težko meriti vsa merljiva vlakna in ker velika vlakna lahko zakrivajo mala, ki potem niso vidna.
Nagnjenost k precenjevanju LWGMD je lahko rezultat gostote vlaken nad 150 vlaken/mm pri linearnem prehodu. Na drugi strani pa nizke koncentracije vlaken povečujejo čas analize in je pogosto stroškovno ugodno pripraviti vzorec gostote vlakna blizu najugodnejšega, kot vztrajati z oceno pri filtrih z nizko koncentracijo. Najugodnejša gostota vlaken naj bi dala povprečje o enem ali dveh ocenjevanih vlaknih v vidnih poljih pri povečavi 5 000. Najugodnejša gostota je odvisna od velikost (premera) vlaken, zato mora operater uporabiti nekatere strokovne presoje, da lahko odloči ali je gostota vlaken blizu najugodnejše ali ne.
1.5.3.4.2 Določanje utežnostnega faktorja dolžine za premere vlaken
Štejejo se samo vlakna, ki se dotaknejo (ali prečkajo) (neskončno) tanko črto na zaslonu SEM. Zato je na zaslonu narisana vodoravna (ali navpična) črta, ki poteka skozi sredino zaslona.
Alternativno je na sredini zaslona postavljena ena sama točka, v eni smeri pa poteka stalno skeniranje filtra. Premer se izmeri in zapiše za vsako vlakno z razmerjem dolžina/širina večjim od 3:1, ki se dotika ali prečka to točko.
1.5.3.4.3 Določanje velikosti vlakna
Priporoča se merjenje najmanj 300 vlaken. Vsako vlakno se meri le enkrat v sečišču s črto ali točko, narisano na sliki (ali blizu sečišča, če je rob vlakna nejasen). Pri vlaknih z neenakomernim presekom se uporabi meritev, ki predstavlja povprečje premera vlakna. Paziti je treba pri določanju robov in merjenju najkrajše razdalje med robovi vlakna. Določanje velikosti je možno on-line ali off-line na shranjenih slikah ali fotografijah. Priporoča se uporaba polavtomatskih sistemov za merjenje na slikah, ki nalagajo podatke neposredno v razpredelnice, ker se tako prihrani čas, zmanjša število napak pri prepisovanju, izračuni pa so lahko avtomatizirani.
Konci dolgih vlaken naj se preverijo pri majhnih povečavah, da se zagotovi, da se ne zvijajo nazaj v merilno ali vidno polje in so vlakna izmerjena le enkrat.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Premeri vlaken po navadi nimajo normalne porazdelitve. Če pa se izvede logaritmična transformacija, je možno dobiti porazdelitev, ki se približuje normalni.
Izračunajte aritmetično srednjo vrednost (srednji lnD) in standardno deviacijo (SDlnD) logaritma z osnovo e (lnD) za n premerov vlakna (D).
|
|
(1) |
|
|
(2) |
Standardna deviacija se deli s kvadratnim korenom števila meritev (n), da dobimo standardno napako (SElnD).
|
|
(3) |
Dvakrat odštejte standardno napako od srednje vrednosti in izračunajte njen eksponent (srednja vrednost minus dve standardni napaki) in tako dobite geometrijsko srednjo vrednost minus dve geometrijski standardni napaki.
|
|
(4) |
3. POROČANJE
POROČILO O PRESKUSU)
Poročilo o preskusu naj vsebuje vsaj naslednje informacije:
— vrednost LWGMD-2SE,
— kakršna koli odstopanja, še zlasti tista, ki vplivajo na natančnost in točnost rezultatov z ustreznimi obrazložitvami.
4. VIRI
(1) B. Tylee SOP MF 240. Health and Safety Executive. February 1999.
(2) G. Burdett in G. Revell. Development of a standard method to measure the length-weigthed geometric mean fibre diameter: Results of the Second inter-laboratory exchange. IR/L/MF/94/07. Project R42.75 HPD. Health and Safety Executive. Research and Laboratory Services Division. 1994.
DEL B: METODE ZA DOLOČANJE TOKSIČNOSTI IN DRUGIH UČINKOV NA ZDRAVJE
|
KAZALO |
|
|
SPLOŠNI UVOD |
|
|
B.1 bis. |
AKUTNA ORALNA TOKSIČNOST – POSTOPEK S TOČNO DOLOČENIM ODMERKOM |
|
B.1 tris. |
AKUTNA ORALNA TOKSIČNOST – METODA RAZREDOV AKUTNE TOKSIČNOSTI |
|
B.2 |
AKUTNA STRUPENOST (PRI VDIHAVANJU) |
|
B.3 |
AKUTNA STRUPENOST (V STIKU S KOŽO) |
|
B.4 |
AKUTNA TOKSIČNOST: DERMALNA DRAŽILNOST/JEDKOST |
|
B.5 |
AKUTNA TOKSIČNOST: OČESNA DRAŽILNOST/JEDKOST |
|
B.6 |
SENZIBILIZACIJA KOŽE |
|
B.7 |
TOKSIČNOST PRI PONAVLJAJOČIH SE ODMERKIH (28 DNI) PO ORALNI POTI |
|
B.8 |
STRUPENOST (PRI VDIHAVANJU) PRI PONAVLJAJOČEM SE ODMERKU (28 DNI) |
|
B.9 |
STRUPENOST (V STIKU S KOŽO) PRI PONAVLJAJOČEM SE ODMERKU (28 DNI) |
|
B.10 |
MUTAGENOST – PREIZKUS KROMOSOMSKIH ABERACIJ PRI SESALCIH IN VITRO |
|
B.11 |
MUTAGENOST – PRESKUS KROMOSOMSKIH ABERACIJ V KOSTNEM MOZGU SESALCEV IN VIVO |
|
B.12 |
MUTAGENOST – PREIZKUS MIKRONUKLEUSOV V ERITROCITIH SESALCEV IN VIVO |
|
B.13/14 |
MUTAGENOST: PREIZKUS POVRATNE MUTACIJE PRI BAKTERIJAH |
|
B.15 |
PRESKUS MUTAGENOSTI IN PRESEJALNA ŠTUDIJA RAKOTVORNOSTI GENSKA MUTACIJA – SACCHAROMYCES CEREVISIAE |
|
B.16 |
MITOTIČNA REKOMBINACIJA – SACCHAROMYCES CEREVISIAE |
|
B.17 |
MUTAGENOST – PREIZKUS GENSKIH MUTACIJ V CELICAH SESALCEV IN VITRO |
|
B.18 |
OKVARE IN POPRAVLJANJE DNK – NENAČRTNA SINTEZA DNK – SESALSKE CELICE IN VITRO |
|
B.19 |
PRESKUS IZMENJAVE SESTRSKIH KROMATID IN VITRO |
|
B.20 |
PRESKUS SPOLNO VEZANE RECESIVNE SMRTNOSTI NA DROSOPHILA MELANOGASTER |
|
B.21 |
PRESKUSI CELIČNE TRANSFORMACIJE SESALSKIH CELIC IN VITRO |
|
B.22 |
PRESKUS DOMINANTNE SMRTNOSTI NA GLODALCIH |
|
B.23 |
PREIZKUS KROMOSOMSKIH ABERACIJ V SPERMATOGONIJIH SESALCEV |
|
B.24 |
PRESKUS POJAVA MADEŽEV NA MIŠIH |
|
B.25 |
PRESKUS DEDNE TRANSLOKACIJE NA MIŠIH |
|
B.26 |
PRESKUS SUBKRONIČNE ORALNE TOKSIČNOSTI 90-DNEVNA ŠTUDIJA ORALNE TOKSIČNOSTI S PONAVLJAJOČIMI SE ODMERKI NA GLODALCIH |
|
B.27 |
PRESKUS SUBKRONIČNE ORALNE TOKSIČNOSTI 90-DNEVNA ŠTUDIJA ORALNE TOKSIČNOSTI S PONAVLJAJOČMI SE ODMERKI NA NEGLODALCIH |
|
B.28 |
ŠTUDIJA SUBKRONIČNE STRUPENOSTI V STIKU S KOŽO90-DNEVNA ŠTUDIJA S PONOVLJENIM DERMALNFM ODMERKOM NA GLODALCIH |
|
B.29 |
ŠTUDIJA SUBKRONIČNE INHALACIJSKE STRUPENOSTI 90-DNEVNA ŠTUDIJA S PONOVLJENIM INHALACIJSKIM ODMERKOM NA GLODALCIH . |
|
B.30 |
PRESKUS KRONIČNE STRUPENOSTI |
|
B.31 |
ŠTUDIJA STRUPENOSTI ZA PREDROJSTVENI RAZVOJ |
|
B.32 |
PRESKUS RAKOTVORNOSTI |
|
B.33 |
KOMBINIRAN PRESKUS KRONIČNE STRUPENOSTI/RAKOTVORNOSTI |
|
B.34 |
PRESKUS STRUPENOSTI ZA RAZMNOŽEVANJE NA ENI GENERACIJI |
|
B.35 |
ŠTUDIJA DVOGENERACIJSKE REPRODUKTIVNE STRUPENOSTI |
|
B.36 |
TOKSIKOKINETIKA |
|
B.37 |
ZAPOZNELA NEVROTOKSIČNOST ORGANOFOSFORNIH SNOVI PO AKUTNI IZPOSTAVLJENOSTI |
|
B.38 |
ZAPOZNELA NEVROTOKSIČNOST ORGANOFOSFORNIH SNOVI – 28-DNEVNA ŠTUDIJA S PONAVLJAJOČIMI SE ODMERKI |
|
B.39 |
PREIZKUS NENAČRTNE SINTEZE DNA (UDS) V JETRNIH CELICAH SESALCEV IN VIVO |
|
B.40 |
JEDKOST ZA KOŽO IN VITRO: PRESKUS TRANSKUTANE ELEKTRIČNE UPORNOSTI (TER) |
|
B.40 bis. |
JEDKOST ZA KOŽO IN VITRO: PRESKUS Z MODELOM ČLOVEŠKE KOŽE |
|
B.41 |
PRESKUS FOTOTOKSIČNOSTI 3T3 NRU IN VITRO |
|
B.42 |
PREOBČUTLJIVOST KOŽE: LOKALNA ANALIZA BEZGAVK |
|
B.43 |
ŠTUDIJA NEVROTOKSIČNOSTI NA GLODALCIH |
|
B.44 |
ABSORPCIJA SKOZI KOŽO: METODA IN VIVO |
|
B.45 |
ABSORPCIJA SKOZI KOŽO: METODA IN VITRO |
|
B.46. |
PRESKUS DRAŽENJA KOŽE IN VITRO: PRESKUSNA METODA REKONSTRUIRANE ČLOVEŠKE POKOŽNICE |
|
B.47. |
TESTNA METODA ZA DOLOČANJE MOTNJAVE IN PREPUSTNOSTI ROŽENICE GOVEDA ZA UGOTAVLJANJE JEDKIH IN ZELO DRAŽILNIH SNOVI ZA OČI (BCOP) |
|
B.48. |
TESTNA METODA NA IZOLIRANIH OČEH PIŠČANCEV ZA UGOTAVLJANJE JEDKIH IN ZELO DRAŽILNIH SNOVI ZA OČI (ICE) |
|
B.49. |
PRESKUS MIKRONUKLEUSOV IN VITRO PRI CELICAH SESALCEV |
|
B.50. |
PREOBČUTLJIVOST KOŽE: LOKALNA ANALIZA BEZGAVK: DA |
|
B.51. |
PREOBČUTLJIVOST KOŽE: LOKALNA ANALIZA BEZGAVK: BRDU-ELISA |
SPLOŠNI UVOD
A. OPREDELITEV PRESKUSNE SNOVI
Pred začetkom katere koli študije toksičnosti je treba poznati sestavo preskusne snovi, vključno z glavnimi nečistotami in ustreznimi fizikalno-kemijskimi lastnostmi, ki vključujejo tudi stabilnost.
Fizikalno-kemijske lastnosti preskusne snovi zagotavljajo pomembne informacije za izbiro načina vnosa, načrtovanje posamezne študije ter za rokovanje in skladiščenje preskusne snovi.
Pred začetkom študije je treba razviti analitično metodo za kvalitativno in kvantitativno določitev preskusne snovi (vključno z glavnimi nečistotami, kjer je mogoče) v sredstvu za odmerjanje in biološkem materialu.
Poročilo o preskusu naj vključuje vse informacije v zvezi z identifikacijo, fizikalno-kemijskimi lastnostmi, čistostjo in obnašanjem preskusne snovi.
B. VARSTVO ŽIVALI
Pri preskušanju toksičnosti sta bistvenega pomena izvajanje stroge kontrole nad okoljskimi razmerami in uporaba primernih tehnik za varstvo živali.
(i) Nastanitveni pogoji
Okoljske razmere v preskuševalnih živalskih prostorih ali ogradah morajo biti primerne za preskusno vrsto. Za podgane, miši in morske prašičke so primerne razmere sobna temperatura 22 oC ± 3 oC z relativno vlažnostjo od 30 % do 70 %; za kunce naj bi bila temperatura 20 ± 3 oC z relativno vlažnostjo od 30 do 70 %.
Nekatere preskusne tehnike so še posebno občutljive za temperaturne učinke in v takih primerih so podrobnosti o ustreznih razmerah vključene v opis preskusne metode. Pri vseh raziskavah toksičnih učinkov je treba temperaturo in vlažnost spremljati, zabeležiti in vključiti v končno poročilo o študiji.
Osvetlitev mora biti umetna, pri čemer je zaporedje 12 ur svetlobe in 12 ur teme. Podrobnosti o vzorcu osvetlitve je treba zabeležiti in vključiti v končno poročilo o študiji.
Razen, če metoda določa drugače, se lahko živali nastanijo v kletke posamično ali v majhnih skupinah istega spola; pri skupinski nastanitvi je v kletki lahko največ pet živali.
Pomembno je, da je v poročilih o poskusih na živalih navedena vrsta uporabljene nastanitve v kletkah in število nastanjenih živali v vsaki kletki med izpostavljenostjo kemikaliji in tudi v vsakem poznejšem obdobju opazovanja.
(ii) Prehranjevalni pogoji
Hrana naj izpolnjuje vse prehranjevalne zahteve preskusne živalske vrste. Če se preskusne snovi dajejo živalim z njihovo hrano, lahko interakcija med snovjo in sestavino hrane zmanjša hranilno vrednost. Možnost take reakcije je treba upoštevati pri razlagi rezultatov preskusa. Konvencionalna laboratorijska hrana se lahko uporablja z neomejenimi količinami pitne vode. Na izbiro hrane lahko vpliva potreba po zagotovitvi ustrezne primesi preskusne snovi, če se ta snov daje s hrano.
Kontaminanti v hrani, ki lahko vplivajo na toksičnost, ne smejo biti v koncentracijah, ki lahko povzročijo motnje.
C. ALTERNATIVNO PRESKUŠANJE
Evropska unija je zavezana k spodbujanju razvoja in preverjanja alternativnih tehnik, ki lahko zagotavljajo enako raven informacij kot trenutni živalski preskusi, vendar uporabljajo manjše število živali, povzročajo manj trpljenja ali se povsem izognejo uporabi živali.
Ko bodo takšne metode na razpolago, se bodo morale upoštevati, kjer je mogoče, za opredelitev nevarnosti ter posledično razvrstitev in označitev glede na njihovo dejansko nevarnost.
D. OCENJEVANJE IN INTERPRETACIJA
Ker je treba pri ocenjevanju in interpretaciji preskusov upoštevati omejitve, znotraj katerih se lahko rezultati živalskih študij in študij in vitro neposredno ekstrapolirajo na človeka, se lahko dokazi o škodljivih učinkih za človeka, če so na razpolago, uporabijo za potrditev rezultatov preskusa.
E. SKLICEVANJE NA LITERATURO
Večina teh metod je bila razvita v okviru programa OECD – smernice za preskušanje in jih je treba izvajati v skladu z načeli dobre laboratorijske prakse, da bi bilo kar najbolje zagotovljeno „medsebojno priznavanje podatkov“.
Dodatne informacije se lahko najdejo v napotilih, navedenih v smernicah za preskušanje OECD, in drugi ustrezni literaturi.
B.1 bis. AKUTNA ORALNA TOKSIČNOST – POSTOPEK S TOČNO DOLOČENIM ODMERKOM
1. METODA
Ta preskusna metoda ustreza OECD TV 420 (2001)
1.1 UVOD
Tradicionalne metode za ocenjevanje akutne toksičnosti upoštevajo pogin živali kot končno točko. Leta 1984 je Britansko društvo za toksikologijo predlagalo nov pristop k preskušanju akutne toksičnosti na podlagi dajanja serije točno določenih odmerkov (1). Ta pristop se je izognil uporabi pogina živali kot končne točke in se namesto tega oprl na opazovanje jasnih znakov toksičnosti na eni seriji velikosti točno določenih odmerkov. Po študijah v Združenem kraljestvu (2) in mednarodnih (3) validacijskih študijah in vivo se je sprejel postopek kot metoda za preskušanje v letu 1992. Kasneje so se statistične lastnosti Postopka s točnim odmerkom ovrednotile z uporabo matematičnih modelov v seriji študij (4)(5)(6). Tako študije in vivo kot študije na modelih so pokazale, da je postopek ponovljiv, da se zanj uporablja manj živali in da povzroča manj trpljenja kakor tradicionalne metode, ter da je z njim mogoče razvrstiti snovi na podoben način kot z drugimi metodami preskušanja akutne toksičnosti.
Navodila za izbiro najustreznejše metode preskušanja za dani namen se lahko poiščejo v Dokumentu s smernicami in navodili za preskušanje akutne oralne toksičnosti (7). Ta dokument z navodili vsebuje tudi dodatne informacije o izvajanju in razlagi metode preskušanja B.1 bis.
Princip metode je, da se v glavni študiji uporabljajo le zmerno toksični odmerki in se je treba izogibati dajanju odmerkov, za katere se pričakuje, da so smrtni. Prav tako se ne sme dajati odmerkov, za katere je znano, da povzročajo vidno bolečino in trpljenje živali zaradi jedkega ali močno dražečega delovanja. Umirajoče živali ali živali, ki očitno trpijo ali kažejo znake hudega in dolgotrajnega trpljenja, se usmrtijo na human način in se upoštevajo pri razlagi rezultatov preskusa na enak način kot živali, ki so poginile med preskusom. Kriterije za sprejem odločitve o usmrtitvi umirajočih živali ali živali, ki zelo trpijo, ter napotke za prepoznavanje napovedljive ali neizbežne smrti obravnava poseben Dokument s smernicami (8).
Z metodo pridobimo informacije o nevarnih lastnostih in nam omogoča uvrstitev in razvrstitev snovi v skladu z Globalno usklajenim sistemom (GHS) za razvrščanje kemikalij, ki povzročajo akutno toksičnost (9).
Laboratorij za preskušanje mora upoštevati vse razpoložljive informacije o preskusni snovi pred opravljanjem študije. Takšne informacije bodo vključevale vrsto in kemijsko sestavo snovi; njene fizikalno-kemijske lastnosti; rezultate katerih koli drugih preskusov toksičnosti na snovi, in vitro ali in vivo; toksikološke podatke o strukturno sorodnih snoveh ter pričakovano uporabo/uporabe snovi. Te informacije so potrebne, da vsem, ki jih to zadeva, zagotovijo, da je preskus pomemben za zaščito zdravja ljudi in da bo v pomoč pri izbiri ustreznega začetnega odmerka.
1.2 DEFINICIJE
Akutna oralna toksičnost: nanaša se na tiste škodljive učinke, ki sledijo dajanju enega odmerka snovi ali dajanju več odmerkov v 24 urah.
Kasnejša smrt: pomeni, da žival ne pogine ali da ne kaže znakov, da bo poginila, v 48 urah, vendar pogine kasneje med 14-dnevnim obdobjem opazovanja.
Odmerek: je količina dane preskusne snovi. Odmerek je izražen kot masa preskusne snovi na enoto teže preskusne živali (npr. mg/kg).
Očitna toksičnost: je splošen izraz, ki opisuje jasne znake toksičnosti po dajanju preskusne snovi (glej (3) na primer), takšne, da se pojavijo pri naslednjem najvišjem točno določenem odmerku hude bolečine in trajne znake hude stiske, stanje umiranja (kriteriji so navedeni v Dokumentu s smernicami za humane končne točke (8)), ali pa, če je mogoče pričakovati smrtnost pri večini živali.
GHS: Globalno usklajeni sistem razvrščanja kemijskih snovi in mešanic. Skupna aktivnost OECD (zdravje ljudi in okolje), Odbora ZN strokovnjakov za prevoz nevarnega blaga (fizikalno-kemijske lastnosti) in ILO (poročanje o nevarnih snovem) in koordinirana med organizacijami s Programom za pravilno ravnanje s kemikalijami (IOMC).
Neizbežna smrt: ko se pričakuje umirajoče stanje ali smrt pred naslednjim planiranim časom opazovanja. Značilni znaki tega stanja pri glodalcih lahko vključujejo krče, bočni položaj, poležavanje in tremor. (Glej Dokument s smernicami z navodili za humane končne točke (8) za podrobne podatke).
LD 50 (srednji smrtni odmerek): je statistično ugotovljen enkraten odmerek snovi, za katerega se lahko pričakuje, da bo povzročil smrt pri 50 odstotkih živali, kadar se jim da po oralni poti. Vrednost LD50 se izrazi z maso preskusne snovi na enoto teže preskusne živali (mg/kg).
Mejni odmerek: nanaša se na odmerek na zgornji omejitvi preskušanja (2 000 ali 5 000 mg/kg).
Umirajoče stanje: stanje umiranja ali nezmožnosti preživeti, kljub tretiranju. (Glej Dokument s smernicami humane končne točke (8) za več podrobnih podatkov).
Pričakovana smrt: prisotnost kliničnih znakov, ki kažejo na smrt ob znanem času v prihodnosti pred načrtovanim zaključkom eksperimenta, na primer: živali niso sposobne doseči vode ali hrane. (Glej Dokument s smernicami z navodili za humane končne točke (8) za več podrobnih podatkov).
1.3 PRINCIP PRESKUSNE METODE
Skupini živali istega spola se dajejo odmerki postopoma, z uporabo točno določenih odmerkov 5, 50, 300 in 2 000 mg/kg (izjemoma se lahko uporabi dodaten točno določen odmerek 5 000 mg/kg, glej oddelek 1.6.2). Začetna velikost odmerka se izbere na podlagi opazovalne študije kot odmerek, pri katerem se pričakuje, da se bodo pokazali nekateri znaki toksičnosti, ne da bi povzročil resne toksične posledice ali smrtnost. Klinični znaki in stanja, povezana z bolečino, trpljenjem in neizbežno smrtjo, so natančno napisana v posebnem OECD Dokument s smernicami (8). Nadaljnje skupine živali lahko dobivajo višje ali nižje točno določene odmerke, odvisno od prisotnosti ali odsotnosti znakov toksičnosti ali smrtnosti. Ta postopek se nadaljuje, dokler se ne ugotovi odmerka, ki povzroči očitno toksičnost ali več kot eno smrt, ali takrat, ko pri najvišjem odmerku ni videti nobenih učinkov, ali kadar nastopijo smrti pri najnižjem odmerku.
1.4 OPIS PRESKUSNE METODE
1.4.1 Izbira živalskih vrst
Najbolj cenjena vrsta glodalca je podgana, čeprav se lahko uporabijo tudi druge vrste glodalcev. Običajno se uporabljajo samice (7). To je zato, ker v literaturi poročila o običajnih LD50 preskusih kažejo, da je v občutljivosti med spoloma le malo razlik, vendar so v tistih primerih, kjer se razlike opažajo, samice na splošno neznatno bolj občutljive (10). Če pa iz poznavanja toksikoloških in toksikokinetičnih lastnosti strukturno sorodnih kemikalij izhaja, da je verjetno, da so samci bolj občutljivi, je treba uporabiti ta spol. Kadar se preskus opravlja na samcih, je treba imeti za to ustrezno obrazložitev.
Uporabiti je treba zdrave mlade odrasle živali običajno uporabljanih laboratorijskih sevov. Samice morajo biti nuliparne in ne smejo biti breje. Živali morajo biti na začetku odmerjanja stare od 8 do 12 tednov, njihova teža pa se mora gibati v intervalu ± 20 % povprečne teže katerih koli živali, ki so predhodno prejemale odmerek.
1.4.2 Pogoji bivanja in hranjenja
Temperatura eksperimentalnega prostora za živali mora znašati 22 oC (± 3 oC). Čeprav mora biti relativna vlažnost najmanj 30 % in po možnosti ne sme presegati 70 %, mora biti ciljna vlažnost, razen med čiščenjem prostora, 50 do 60 %. Osvetlitev mora biti umetna, v zaporedju 12 ur svetlobe in 12 ur teme. Za hranjenje se lahko uporabijo običajne predpisane laboratorijske vrste hranjenja z neomejeno količino pitne vode. Živali se lahko razporedijo v kletke po skupinah glede na odmerek, vendar število živali v vsaki kletki ne sme vplivati na neovirano opazovanje vsake živali.
1.4.3 Priprava živali
Živali se izberejo naključno, označijo se zato, da je možna individualna identifikacija in se zaprejo v kletke najmanj 5 dni pred začetkom odmerjanja, da se lahko prilagodijo laboratorijskim razmeram.
1.4.4 Priprava odmerkov
Na splošno je treba preskusne snovi dajati v konstantnem volumnu v območju odmerkov, ki jih je treba preskusiti s spreminjanjem koncentracije odmerjenega pripravka. Kadar je treba preskusiti tekoč končni produkt ali mešanico, pa je uporaba nerazredčene preskusne snovi, npr. pri konstantni koncentraciji, morda ustreznejša za naknadno oceno tveganja navedene snovi, in jo nekateri regulatorni organi zahtevajo. Maksimalni volumen odmerka se v nobenem primeru ne sme preseči. Maksimalni volumen tekočine, ki se jo lahko da naenkrat, je odvisen od velikosti preskusne živali. Pri glodalcih volumen običajno ne bi smel presegati 1 ml/100 g telesne teže, pri vodnih raztopinah pa se lahko upošteva 2 ml/100 g telesne teže. Glede na formulacijo pripravka za odmerjanje je priporočena, kadar koli je to mogoče, uporaba vodne raztopine/suspenzije/emulzije v olju (npr. v koruznem olju), sledi, po preferenčnem vrstnem redu, raztopina/suspenzija/emulzija v olju (npr. koruznem olju) in nato po možnosti raztopina v drugih nosilcih. Za nosilce, ki niso voda, je treba poznati toksikološke lastnosti nosilca. Odmerke je treba pripraviti tik pred dajanjem, razen kadar je znana stabilnost pripravka za obdobje, v katerem bo uporabljen, in je znano, da je sprejemljiva.
1.5 POSTOPEK
1.5.1 Dajanje odmerkov
Preskusna snov se daje v enem odmerku z gavažo z uporabo želodčne sonde ali primerne intubacijske kanile. V neobičajnih razmerah, ko enkraten odmerek ni mogoč, lahko odmerek dajemo v manjših frakcijah v obdobju, ki ne presega 24 ur.
Živali se morajo pred odmerjanjem postiti (npr. podgani je treba odtegniti hrano čez noč, vode pa ne; miš ne sme dobiti hrane 3 do 4 ure prej, vodo pa lahko). Po obdobju postenja je treba živali stehtati in jim dati preskusno snov. Po dajanju preskusne snovi se lahko odtegne hrana podganam za nadaljnje 3–4 ure ali mišim za 1–2 uri. Kadar se odmerek daje v frakcijah ves čas, je možno, da bo potrebno oskrbovati živali s hrano in vodo, odvisno od trajanja časovnega obdobja.
1.5.2 Opazovalna študija
Namen opazovalne študije je omogočanje izbire ustreznega začetnega odmerka za glavno študijo. Preskusna snov se daje posameznim živalim v zaporedju v skladu s tabelo poteka v Dodatku 1. Opazovalna študija se zaključi, ko se lahko sprejme odločitev o začetnem odmerku za glavno študijo (ali, če se opazi smrt pri najnižjem, točno določenem odmerku).
Začetni odmerek za opazovalno študijo se izbere izmed velikosti točno določenega odmerka 5, 50, 300 in 2 000 mg/kg kot odmerek, za katerega se pričakuje, da bo povzročil očitno toksičnost na podlagi, kadar je to mogoče, dokazov iz podatkov in vivo in in vitro za isto kemikalijo in za strukturno sorodne kemikalije. Če takšnih informacij ni, bo začetni odmerek 300 mg/kg.
Med odmerjanjem za vsako žival bo dovoljeno obdobje najmanj 24 ur. Vse živali je treba opazovati najmanj 14 dni.
Izjemoma in le tedaj, kadar je to upravičeno zaradi posebnih regulatornih potreb, se lahko upošteva dodatna večja velikost točno določenega odmerka 5 000 mg/kg (glej Dodatek 3). Zaradi skrbi za zaščito živali je preskušanje živali v območjih kategorije GHS 5 (2 000-5 000 mg/kg) nezaželeno in ga je treba upoštevati le, kadar obstaja velika verjetnost, da imajo rezultati takšnega preskušanja neposreden pomen za zaščito zdravja ljudi ali živali ali za okolje.
Kadar žival, preskušana v opazovalni študiji z najnižjo velikostjo točno določenega odmerka (5 mg/kg) pogine, je običajen postopek tak, da se študija zaključi in snov razvrsti v kategorijo GHS 1 (kot je prikazano v Dodatku 1). Če pa je potrebna nadaljnja potrditev razvrščanja, se lahko izvede neobvezen nadomestni postopek na naslednji način. Drugi živali se odmeri 5 mg/kg. Če druga žival pogine, se bo kategorija GHS 1 potrdila in študija se bo nemudoma zaključila. Če druga žival preživi, se bo dajal odmerek 5 mg/kg največ trem dodatnim živalim. Ker bo nevarnost smrtnosti velika, je treba tem živalim dajati odmerek na zaporeden način, da se zaščiti zdravje živali. Časovni interval med odmerjanjem vsaki živali bi moral biti dovolj dolg, da se ugotovi verjetnost, da bo predhodna žival preživela. Če se zgodi druga smrt, se bo zaporedje odmerjanja nemudoma končalo in odmerjanja za nadaljnje živali ne bo. Zaradi druge smrti (ne glede na število živali, preskušanih v času zaključka) se uvrsti v izid A (2 smrti ali več), upošteva se pravilo o razvrstitvi iz Dodatka 2 za 5 mg/kg točno določenega odmerka (kategorija 1, če sta smrti 2 ali če jih je več, ali kategorija 2, če je več kot 1 smrt). Dodatek 4 poleg tega daje napotke o razvrstitvi v sistem EU, dokler se ne začne izvajati novi GHS sistem.
1.5.3 Glavna študija
1.5.3.1 Število živali in velikosti odmerkov
Ukrepe, ki jih je treba izvesti po preskušanju z začetno velikostjo odmerka, prikazujejo tabele poteka v Dodatku 2. Potreben bo eden od treh ukrepov; ustavitev preskušanja in uvrstitev v ustrezen razred razvrstitve nevarnih snovi, preskus z večjim točno določenim odmerkom ali preskus z manjšim točno določenim odmerkom. Za zaščito živali pa se velikost odmerka, ki je povzročil smrt v opazovalni študiji, ne bo ponovila v glavni študiji (glej Dodatek 2). Izkušnje kažejo, da je najverjetnejši izid z začetno velikostjo odmerka tak, da se snov lahko razvrsti in nadaljnje preskušanje ne bo potrebno.
Običajno se uporabi skupina petih živali istega spola za vsako preiskovano velikost odmerka. Med petimi živalmi je ena iz opazovalne študije, ki prejema odmerke izbrane velikosti skupaj s štirimi dodatnimi živalmi (razen, kar ni običajno, če velikost odmerka, uporabljenega v glavni študiji, ni bila vključena v opazovalni študiji).
Časovni interval med odmerjanjem vsake velikosti je točno opredeljen z nastopom, trajanjem in resnostjo toksičnih znakov. Tretiranje živali z naslednjim odmerkom je treba prestaviti na kasneje, dokler ni gotovo, da so živali, ki so predhodno dobile odmerek, preživele. Priporočeno je po potrebi obdobje 3 do 4 dni med odmerjanjem vsake velikosti odmerka za upoštevanje opazovanja zapoznele toksičnosti. Časovni interval se lahko ustrezno prilagodi, npr. v primeru brezuspešnega odziva.
Kadar se upošteva zgornji točno določeni odmerek 5 000 mg/kg, je treba izpeljati postopek, opisan v Dodatku 3 (glej tudi oddelek 1.6.2).
1.5.3.2 Mejni preskus
Mejni preskus se uporablja predvsem v primerih, kadar ima izvajalec preskusa informacije, ki kažejo, da bo preskusni material verjetno netoksičen oziroma bo njegova toksičnost le nad regulatornimi mejnimi odmerki. Informacije o toksičnosti preskusnega materiala se lahko pridobi na podlagi znanja o podobnih preskusnih spojinah ali podobnih preskusnih mešanicah ali produktih, ob upoštevanju vrste in odstotka sestavin, za katere je znano, da so toksikološko pomembne. V tistih primerih, kjer je le malo ali nič informacij o njegovi toksičnosti, ali kadar se pričakuje, da bo preskusni material toksičen, je treba opraviti glavni preskus.
Uporaba običajnega postopka, začetni odmerek opazovalne študije 2 000 mg/kg (ali izjemoma 5 000 mg/kg), čemur sledi odmerjanje za naslednje 4 živali s to velikostjo odmerka, se upošteva kot mejni preskus za to navodilo.
1.6 OPAZOVANJA
Živali se opazujejo posamezno po odmerjanju najmanj enkrat v prvih 30 minutah, periodično v prvih 24 urah, s posebno pozornostjo v prvih 4 urah in nato 14 dni vsak dan, razen kadar jih je treba odstraniti iz študije in humano usmrtiti, če je njihovo zdravje ogroženo ali ko so najdene poginule. Trajanja opazovanja ni treba strogo določiti. Opredeliti ga je treba na podlagi toksičnih reakcij, časa nastopa in trajanja obdobja okrevanja ter ga je zato mogoče podaljšati, kadar je to potrebno. Obdobja, ko se pojavijo znaki toksičnosti in ko izginejo, so pomembna, zlasti če obstaja možnost, da bodo toksični znaki zapozneli (11). Vsa opazovanja se sistematsko zabeležijo, za vsako žival se vodijo posamezne kartoteke.
Dodatna opazovanja bodo potrebna, če živali še vedno kažejo znake toksičnosti. Opazovanja morajo vključevati spremembe na koži in kožuhu, očeh in sluznicah, in tudi na dihalih, v obtoku, na avtonomnih in centralnih živčnih sistemih ter pri somatomotoričnih aktivnostih in vzorcu vedenja. Pozornost je treba posvetiti opazovanjem trezorjev, krčem, slinjenju, driski, otrplosti, spanju in komi. Treba je upoštevati principe in kriterije, povzete v Dokumentu s smernicami za humane končne točke (8). Živali, najdene v umirajočem stanju, in živali, ki kažejo hudo bolečino in trajne znake resne stiske, je treba humano usmrtiti. Kadar se živali usmrtijo iz humanih razlogov ali so najdene poginule, je treba čas smrti zabeležiti kar se da natančno.
1.6.1 Telesna teža
Posamezne teže živali je treba ugotoviti tik pred dajanjem preskusne snovi in najmanj enkrat na teden po tem. Treba je izračunati in zabeležiti spremembe teže. Na koncu preskusa se preživele živali stehtajo in nato humano usmrtijo.
1.6.2 Patologija
Za vse preskusne živali (vključno s tistimi, ki poginejo med preskušanjem ali se odstranijo iz študije zaradi ogroženega zdravja živali) je treba opraviti popolno obdukcijo. Vse natančne patološke spremembe je treba zabeležiti za vsako žival. Mikroskopski pregled organov živali, ki so preživele 24 ali več ur po začetnem odmerjanju, se prav tako lahko upošteva, ker lahko da koristne informacije.
2. PODATKI
Zagotoviti je treba podatke za vsako posamezno žival. Nadalje je treba vse podatke prikazati v obliki preglednice, kjer je za vsako preskusno skupino prikazano število uporabljenih živali, število živali, ki kažejo znake toksičnosti, število živali, najdenih poginulih med preskusom ali usmrčenih iz humanih razlogov, čas smrti posameznih živali, opis in časovni potek toksičnih učinkov in reverzibilnost ter ugotovitve obdukcije.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje informacije, kot je primerno:
Preskusna snov:
— fizikalno stanje, čistost in, kjer je pomembno, fizikalno-kemijske lastnosti (vključno z izomernostjo),
— identifikacijske podatke, vključno s številko CAS.
Nosilec (če je primerno):
— utemeljitev izbire nosilca, če to ni voda.
Preskusne živali:
— uporabljena vrsta/sev,
— mikrobiološko stanje živali, kadar je znano,
— število, starost in spol živali (vključno, kjer je primerno, utemeljitev uporabe samcev namesto samic),
— vir, pogoji vzdrževanja, vrsta hrane, itd.
Pogoji preskusa:
— podatki o formulaciji preskusne snovi, vključno s podatki o fizikalni obliki snovi, ki jo dajemo,
— podatki o formulaciji preskusne snovi, vključno z volumni odmerjanja in časom odmerjanja,
— podatki o kakovosti hrane in vode (vključno z vrsto hrane/vir, vir vode),
— utemeljitev za izbiro začetnega odmerka.
Rezultati:
— preglednica odzivnih podatkov in velikost odmerka za vsako žival (npr. živali, ki kažejo znake toksičnosti, vključno s smrtnostjo, vrsto, resnostjo in trajanjem učinkov),
— preglednica telesne teže in sprememb telesne teže,
— teže posameznih živali na dan odmerjanja in v tedenskih intervalih po tem ter čas smrti ali usmrtitve,
— datum in čas smrti, če nastopi pred načrtovano usmrtitvijo,
— časovni potek nastopa znakov toksičnosti in ali so bili reverzibilni za vsako žival,
— ugotovitve obdukcije in histopatološke ugotovitve za vsako žival, če so na voljo.
Razprava in razlaga rezultatov.
Zaključki.
4. LITERATURA
(1) British Toxicology Society Working Party on Toxicity (1984). Special report: a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol., 3, 85–92.
(2) Van den Heuvel, M.J., Dayan, A.D. and Shillaker, R.O. (1987). Evaluation of the BTS approach to the testing of substances and preparations for their acute toxicity. Human Toxicol., 6, 279–291.
(3) Van den Heuvel, M.J., Clark, D.G., Fielder, R.J., Koundakjian, P.P., Oliver, G.J.A., Pelling, D., Tomlinson, N.J. and Walker, A.P. (1990). The international validation of a fixed-dose procedure as an alternative to the classical LD50 test. Fd. Chem. Toxicol. 28, 469–482.
(4) Whitehead, A. and Curnow, R.N. (1992). Statistical evaluation of the fixed-dose procedure. Fd. Chem. Toxicol., 30, 313-324.
(5) Stallard, N. and Whitehead, A. (1995). Reducing numbers in the fixed-dose procedure. Human Exptl. Toxicol. 14, 315–323. Human Exptl. Toxicol.
(6) Stallard, N., Whitehead, A. and Ridgeway, P. (2002). Statistical evaluation of the revised fixed dose procedure.-Hum. Exp. Toxicol., 21, 183–196.
(7) OECD (2001). Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris.
(8) OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assesment N. 19.
(9) OECD (1998). Harmonised Integrated Hazard Classification for Human Health and Environmental Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnetl.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html].
(10) Lipnick, R.L., Cotruvo, J.A., Hill, R.N., Bruce, R.D., Stitzel, K.A., Walker, A.P., Chu, I., Goddard, M., Segal, L., Springer, J. A. and Myers, R.C. (1995). Comparison of the Up-and-Down, Conventional LD50, and Fixed-Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33, 223–231.
(11) Chan P.K and A.W. Hayes (1994) Chapter 16 Acute Toxicity and Eye Irritation . In: Principles and Methods of Toxicology . 3rd Edition. A.W. Hayes, Editor. Raven Press, Ltd. New York, USA.
DODATEK 1
TABELA POTEKA ZA OPAZOVALNO ŠTUDIJO


DODATEK 2
TABELA POTEKA ZA GLAVNO ŠTUDIJO
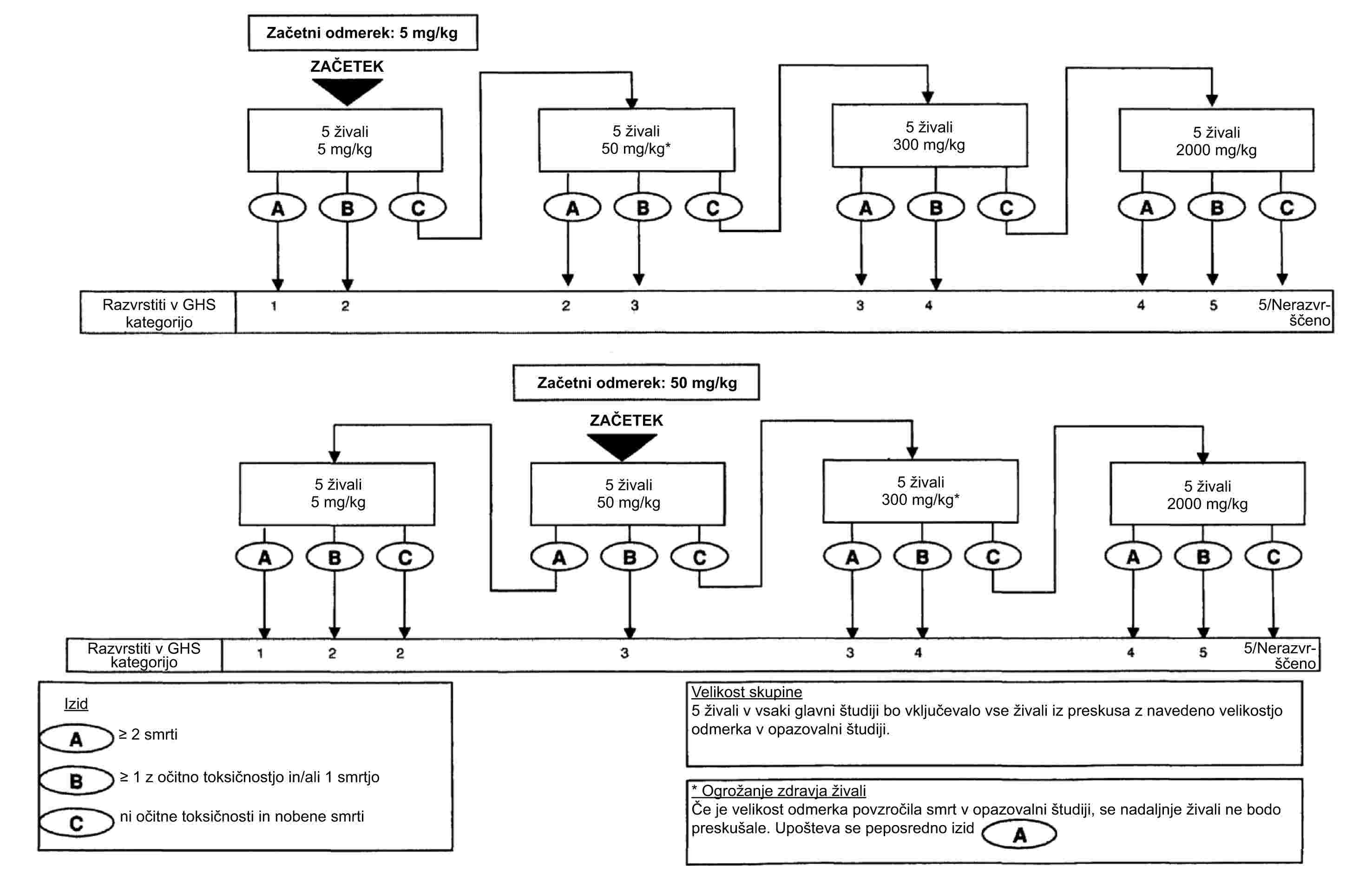

Dodatek 3
KRITERIJI ZA RAZVRSTITEV PRESKUSNIH SNOVI S PRIČAKOVANIMI VREDNOSTMI LD50, KI NE PRESEGAJO 2 000 mg/kg IN JIH NI POTREBNO PRESKUSITI
Kriteriji za kategorijo 5 nevarnih snovi so namenjeni omogočanju identifikacije preskusnih snovi, katerih nevarnost akutne toksičnosti je sorazmerno nizka, vendar lahko v nekaterih okoliščinah pomenijo nevarnost za ranljivo populacijo. Za te snovi se predvideva, da imajo oralni ali kožni LD50 v območju 2 000-5 000 mg/kg ali enakovrednih odmerkov za druge poti vnosa. Preskusne snovi bi se lahko uvrstile v kategorijo nevarnih snovi, opredeljeno z: 2 000 mg/kg < LD50 < 5 000 mg/kg (kategorijo 5 v GHS) v naslednjih primerih:
(a) če so uvrščene v to kategorijo po kateri koli shemi preskušanja Dodatka 2, na podlagi pogostnosti smrti;
(b) če so že na voljo dokazi, ki kažejo na to, da je LD50 v območju vrednosti kategorije 5; ali če druge študije na živalih ali študije toksičnih učinkov na ljudi kažejo na zaskrbljenost zaradi akutnosti za zdravje ljudi;
(c) z ekstrapolacijo, oceno ali meritvijo podatkov, če uvrstitev v višjo skupino nevarnih snovi ni zajamčena, in
— so na voljo zanesljive informacije, ki kažejo na toksične učinke na ljudeh, ali
— se opazi kakršna koli smrtnost pri preskušanju do vrednosti kategorije 4 po oralni poti, ali
— kadar strokovna presoja potrdi pomembne klinične znake toksičnosti pri preskušanju do vrednosti kategorije 4, z izjemo driske, piloerekcije ali nenormalnega videza, ali
— kadar se s strokovno presojo potrdi zanesljive informacije, ki kažejo na možnost pomembnih akutnih učinkov iz drugih študij na živalih.
PRESKUŠANJE Z ODMERKI NAD 2 000 mg/kg
Izjemoma, in le, kadar to opravičujejo posebne regulatorne zahteve, se lahko upošteva uporaba dodatne večje velikosti točno določenega odmerka 5 000 mg/kg. Zaradi skrbi za zaščito zdravja živali je preskušanje živali s 5 000 mg/kg nezaželeno in bi ga morali upoštevati le, kadar obstaja velika verjetnost, da bi rezultati takšnega preskusa imeli neposreden pomen za zaščito zdravja živali ali ljudi (9).
Opazovalna študija
Pravila o odločitvah, ki veljajo za zaporedni postopek, predstavljena v Dodatku 1, se razširijo za vključitev velikosti odmerka 5 000 mg/kg. Kadar se bo uporabil začetni odmerek opazovalne študije 5 000 mg/kg, bo zato izid A (smrt) zahteval še preskušanje druge živali pri 2 000 mg/kg; izida B in C (očitna toksičnost in nobene toksičnosti) bosta dopuščala izbiro 5 000 mg/kg kot začetnega odmerka za glavno študijo. Če se bo uporabil začetni odmerek, ki bo različen od 5 000 mg/kg, tedaj se bo preskušanje nadaljevalo do 5 000 mg/kg v primeru izidov B ali C pri 2 000 mg/kg; naslednji izid A pri 5 000 mg/kg bo narekoval začetni odmerek za glavno študijo 2 000 mg/kg in izida B in C bosta narekovala začetni odmerek za glavno študijo 5 000 mg/kg.
Glavna študija
Pravila o odločitvah, ki veljajo za zaporedni postopek, predstavljena v Dodatku 2, se razširijo na vključitev velikosti odmerka 5 000 mg/kg. Kadar se bo uporabil začetni odmerek glavne študije 5 000 mg/kg, bo zato izid A (> 2 smrt) zahteval še preskušanje druge skupine pri 2 000 mg/kg; iz izida B (očitna toksičnost in/ali ≤ 1 smrt) ali C (nobene toksičnosti) bo sledila neuvrščenost snovi v skladu z GHS. Podobno se bo, če bo odmerek različen od 5 000 mg/kg, preskušanje nadaljevalo do 5 000 mg/kg v primeru izida C pri 2 000 mg/kg, iz zaporednega izida A pri 5 000 mg/kg bo sledila uvrstitev snovi v kategorijo GHS 5, iz izidov B in C pa sledi, da bo snov neuvrščena.
DODATEK 4
PRESKUSNA METODA B.l bis
Napotki za razvrstitev v skladu s shemo EU za obdobje tranzicije do popolne uveljavitve Globalno usklajenega sistema razvrstitve (GHS) (iz sklica (8))

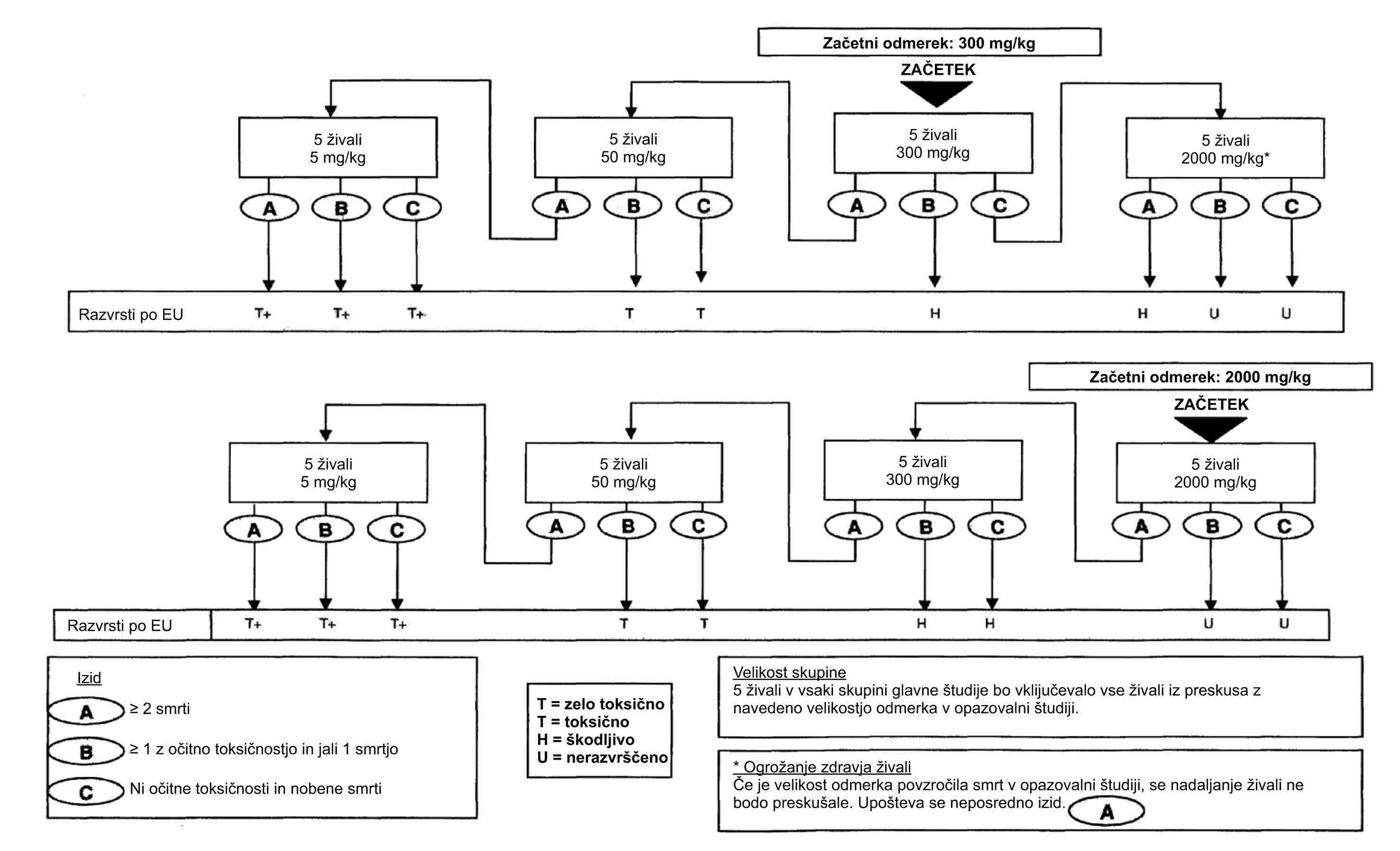
B.1 tris. AKUTNA ORALNA TOKSIČNOST – METODA RAZREDOV AKUTNE TOKSIČNOSTI
1. METODA
Ta preskusna metoda ustreza OECD TG 423 (2001)
1.1 UVOD
Metoda razredov akutne toksičnosti (1), prikazana v tem preskusu, je postopen postopek z uporabo treh živali enega spola za vsak korak. Odvisno od smrtnosti in/ali umirajočega stanja živali so lahko potrebni 2–4 koraki za omogočanje presoje o akutni toksičnosti preskusne snovi. Ta postopek je ponovljiv, zanj se uporablja zelo malo živali in omogoča razvrstitev snovi na podoben način kot z drugimi metodami preskušanja akutne toksičnosti. Metoda razredov akutne toksičnosti temelji na biometričnih vrednotenjih (2) (3) (4) (5) s točno določenimi odmerki, primerno ločenimi med seboj, da se omogoči uvrščanje snovi za razvrstitev in za ugotavljanje nevarnosti. Metoda, kakor je bila prejeta leta 1996, je bila obširno validirana in vivo v primerjavi s podatki za LD50, dobljenimi iz literature, tako nacionalne (6) kakor tudi mednarodne (7).
Navodila za izbiro najustreznejše preskusne metode za dani namen se lahko poiščejo v Dokumentu s smernicami za preskušanje akutne oralne toksičnosti (8). Ta dokument s smernicami vsebuje tudi dodatne informacije o postopku in razlagi metode preskušanja B.1 tris.
Preskusnih snovi, v odmerkih, za katere je znano, da povzročajo vidno bolečino in hude motnje pri živalih zaradi jedkega ali izrazito dražilnega delovanja, ni treba dajati. Umirajoče živali ali živali, ki očitno trpijo ali kažejo znake hudih in trajnih okvar, se usmrti na human način in se jih upošteva pri razlagi rezultatov preskusa na enak način, kot živali, ki so poginile med preskusom. Kriterije za sprejem odločitve o usmrtitvi umirajočih živali ali živali, ki zelo trpijo, ter napotke za prepoznavanje napovedljive ali neizbežne smrti obravnava poseben Dokument s smernicami (9).
Metoda uporablja predhodno določene odmerke, rezultati pa omogočajo razvrstitev snovi in uvrstitev v skladu z Globalno usklajenim sistemom za razvrščanje kemikalij, ki povzročajo akutno toksičnost (10).
V principu metoda ni namenjena omogočanju izračuna točnega LD50, vendar upošteva določitev opredeljenih razponov izpostavitve, kjer se pričakuje smrtnost, ker je smrt dela živali še vedno glavna končna točka tega preskusa. Ta metoda upošteva določitev vrednosti LD50 le, kadar iz najmanj 2 odmerkov sledi smrtnost, višja kakor 0 % in nižja kakor 100 %. Uporaba izbire predhodno določenih odmerkov, ne glede na preskusno snov, z razvrstitvijo, ki je izrecno povezana s številom živali, opazovanih v različnih stanjih, izboljšuje možnost za doslednost in ponovljivost poročanja med laboratoriji.
Laboratorij preskušanja mora upoštevati vse razpoložljive informacije o preskusni snovi pred začetkom opravljanja študije. Takšne informacije bodo vključevale vrsto in kemijsko sestavo snovi; njene fizikalno-kemijske lastnosti; rezultat katerih koli drugih preskusov toksičnosti na snovi, in vitro ali in vivo; toksikološke podatke o strukturno sorodnih ter pričakovano uporabo/uporabe snovi. Te informacije so potrebne, da vse, ki jih to zadeva, zagotovijo, da je preskus pomemben za zaščito zdravja ljudi in da bo v pomoč pri izbiri najustreznejšega začetnega odmerka.
1.2 DEFINICIJE
Akutna oralna toksičnost: nanaša se na tiste škodljive učinke, ki se pokažejo po dajanju enega odmerka snovi ali več odmerkov, danih v 24 urah.
Kasnejša smrt: pomeni, da žival ne pogine ali da ne kaže znakov, da bo poginila, v 48 urah, vendar pogine kasneje med 14 dnevnim obdobjem opazovanja.
Odmerek: je količina dane preskusne snovi. Odmerek je izražen kot masa preskusne snovi na enoto teže preskusne živali (npr. mg/kg).
GHS: Sistem globalno usklajene razvrstitve za kemijske snovi in mešanice. Skupna aktivnost OECD (zdravje ljudi in okolje), Odbor ZN strokovnjakov za prevoz nevarnega blaga (fizikalno-kemijske lastnosti) in ILO (sporočanje o nevarnosti) ter koordinirana med organizacijami s programom za pravilno ravnanje s kemikalijami (IOMC).
Neizbežna smrt: ko se pričakuje umirajoče stanje ali smrt pred naslednjim planiranim časom opazovanja. Značilni znaki tega stanja pri glodalcih lahko vključujejo krče, bočni položaj, poležavanje in tremor. (Glej Dokument s smernicami z napotki za humane mejne cilje (9) za več podrobnih podatkov).
LD50 (srednji smrtni odmerek): je statistično ugotovljen enkraten odmerek snovi, za katerega se lahko pričakuje, da bo povzročil smrt pri 50 odstotkih živali, kadar se jim da oralno. Vrednost LD50 je izražena z maso preskusne snovi na enoto teže preskusne živali (mg/kg).
Mejni odmerek: nanaša se na odmerek na zgornji omejitvi pri preskušanju (2 000 ali 5 000 mg/kg).
Umirajoče stanje: stanje umiranja ali nezmožnosti preživeti kljub tretiranju. (Glej Dokument s smernicami humane končne točke (9) za več podrobnih podatkov).
Pričakovana smrt: prisotnost kliničnih znakov, ki kažejo na smrt ob znanem času v prihodnosti pred načrtovanim zaključkom eksperimenta, na primer: nezmožnost živali, da bi dosegle vodo ali hrano. (Glej Priročnik napotki za humane končne točke (9) za več podrobnih podatkov).
1.3 PRINCIP PRESKUSNE METODE
Princip preskusa je tak, da temelji na postopnosti z uporabo minimalnega števila živali za vsak korak, za omogočanje uvrstitve se pridobi dovolj informacij o akutni toksičnosti preskusne snovi. Snov se daje oralno skupini eksperimentalnih v enem od predhodno opredeljenih odmerkov. Snov se testira z uporabo postopka po korakih, za vsak korak se uporabi tri živali istega spola, običajno ženskega. Prisotnost ali odsotnost smrtnosti živali, povezane s spojino, ki so prejemale odmerek na enem koraku, bo določila naslednji korak, npr.:
— nadaljnje preskušanje ni potrebno,
— odmerjanje za tri dodatne živali, z enakim odmerkom,
— odmerjanje za tri dodatne živali, z naslednjo večjo ali naslednjo manjšo velikostjo odmerka.
Podrobnosti preskusnega postopka so opisane v Dodatku 1. Metoda bo omogočila presojo glede uvrstitve preskusne snovi v enega v seriji razredov toksičnosti, opredeljenih s točno določenimi smrtnimi vrednostmi LD50.
1.4 OPIS METODE
1.4.1 Izbira živalskih vrst
Najbolj cenjena vrsta glodalca je podgana, čeprav se lahko uporabijo tudi druge vrste glodalcev. Običajno se uporabljajo samice (9), to pa zato, ker pregledi običajnih LD50 preskusov v literaturi kažejo, da je le malo razlik v občutljivosti med spoloma, vendar so v tistih primerih, kjer se opažajo razlike, samice v splošnem neznatno bolj občutljive (11). Če pa iz poznavanja toksikoloških in toksikokinetičnih lastnosti strukturno sorodnih kemikalij izhaja, da je verjetno, da bodo samci bolj občutljivi, tedaj je treba uporabiti ta spol. Kadar poteka preskušanje na samcih, je treba imeti za to ustrezno obrazložitev.
Uporabiti je treba zdrave mlade odrasle živali običajno uporabljanih laboratorijskih sevov. Samice morajo biti nuliparne in ne smejo biti breje. Živali morajo biti na začetku odmerjanja stare 8 do 12 tednov, njihova teža pa se mora gibati v intervalu ± 20 % povprečne teže katerih koli živali, ki so predhodno prejemale odmerek.
1.4.2 Pogoji bivanja in hranjenja
Temperatura prostora za preskuse z živalmi mora znašati 22 oC (± 3 oC). Čeprav mora biti relativna vlažnost najmanj 30 % in po možnosti ne sme presegati 70 %, mora biti ciljna vlažnost, razen med čiščenjem prostora, 50 do 60 %. Osvetlitev mora biti umetna v zaporedju 12 ur svetlobe in 12 ur teme. Za hranjenje se lahko uporabijo običajne predpisane laboratorijska vrste hranjenja z neomejeno količino pitne vode. Živali se lahko razporedijo v kletke po skupinah glede na odmerek, vendar število živali v vsaki kletki ne sme vplivati na neovirano opazovanje vsake živali.
1.4.3 Priprava živali
Živali se izberejo naključno, označijo se zato, da je možna individualna identifikacija in se zaprejo v kletke najmanj 5 dni pred začetkom odmerjanja, da se lahko prilagodijo laboratorijskim razmeram.
1.4.4 Priprava odmerkov
Na splošno je treba preskusne snovi dajati v konstantnem volumnu v razponu odmerkov, ki jih je treba preskusiti s spreminjanjem koncentracije pripravka odmerjanja. Kadar se namerava preskusiti tekoč končni produkt ali mešanico, je uporaba nerazredčene preskusne snovi, npr. pri konstantni koncentraciji, morda ustreznejša za naknadno oceno tveganja navedene snovi, in jo nekateri regulatorni organi zahtevajo. Maksimalni volumen odmerka se v nobenem primeru ne sme prekoračiti. Maksimalni volumen tekočine, ki se jo lahko da živali naenkrat, je odvisen od velikosti preskusne živali. Pri glodalcih volumen običajno ne sme presegati 1 ml/100g telesne teže, pri vodnih raztopinah pa lahko upoštevamo 2 ml/100 g telesne teže. Glede na formulacijo preparata odmerjanja je priporočena uporaba vodne raztopine/suspenzije/emulzije, kjer koli je to možno, sledi po preferenčnem vrstnem redu raztopina/suspenzija/emulzija v olju (npr. koruzno olje) in nato po možnosti raztopina v drugih nosilcih. Za nosilce, ki niso voda, je treba poznati toksikološke lastnosti nosilca. Odmerke je treba pripraviti tik pred dajanjem, razen kadar je znana stabilnost pripravka za obdobje, v katerem bo uporabljen, in je znano, da je sprejemljiva.
1.5 POSTOPEK
1.5.1 Dajanje odmerkov
Preskusna snov se daje v enem odmerku z gavažo z uporabo želodčne sonde ali primerne intubacijske kanile. V neobičajnih razmerah, ko enojni odmerek ni mogoč, lahko odmerek dajemo v manjših frakcijah v obdobju, ki ne presega 24 ur.
Živali se morajo pred odmerjanjem postiti (npr. podgani je treba odtegniti hrano čez noč, vode pa ne; miš ne sme dobiti hrane 3 do 4 ure prej, vodo pa lahko). Po obdobju postenja je treba živali stehtati in jim dati preskusno snov. Po dajanju preskusne snovi se lahko odtegne hrano podganam za nadaljnje 3–4 ure ali mišim za 1–2 uri. Kadar se odmerek daje v frakcijah ves čas, je možno, da bo potrebno oskrbovati živali s hrano in vodo, odvisno od trajanja časovnega obdobja.
1.5.2 Število živali in velikost odmerkov
Za vsak korak so potrebne 3 živali. Velikost odmerka, ki ga bo treba uporabiti kot začetni odmerek, se izbere izmed štirih stalnih velikosti, 5, 50, 300 in 2 000 mg/kg telesne teže. Začetna velikost odmerka bi morala biti tista, ki bo najverjetneje povzročila smrtnost nekaterih živali odmerjanja. Tabele poteka v Dodatku 1 opisujejo postopek, ki ga je treba izvesti za vsakega od začetnih odmerkov. Dodatek 4 daje poleg tega navodila za uvrstitev v sistem EU, dokler se ne bo izvajal novi GHS sistem.
Kadar je iz razpoložljivih informacije razvidno, da smrtnost pri največji velikosti (2 000 mg/kg telesne teže) ni verjetna, je treba opraviti mejni preskus. Kadar o snovi, ki jo je treba preskusiti, ni nobenih informacij, je priporočeno zaradi zdravja živali uporabiti začetni odmerek 30 mg/kg telesne teže.
Časovni interval med skupinami tretiranja je točno določen z nastopom, trajanjem in resnostjo toksičnih znakov. Tretiranje živali z naslednjim odmerkom je treba prestaviti na kasnejši čas, dokler ni gotovo, da bodo živali, ki so prej prejemale odmerek, preživele.
Izjemoma, in le kadar to opravičujejo posebne regulatorne zahteve, se lahko upošteva uporaba dodatne večje velikosti odmerka 5 000 mg/kg telesne teže (glej Dodatek 2). Zaradi skrbi za zaščito zdravja živali je preskušanje živali v območjih kategorije GHS 5 (2 000–5 000 mg/kg) nezaželeno in ga je treba upoštevati le, kadar obstaja velika verjetnost, da bi rezultati takšnega preskusa imeli neposreden pomen za zaščito zdravja ljudi ali živali ali za okolje.
1.5.3 Mejni preskus
Mejni preskus se uporablja predvsem v primerih, kadar ima izvajalec preskusa informacije, ki kažejo, da bo preskusni material verjetno netoksičen oziroma bo njegova toksičnost le nad regulatornimi mejnimi odmerki. Informacije o toksičnosti preskusnega materiala se lahko pridobijo na podlagi znanja o podobnih preskusnih spojinah ali podobnih preskusnih mešanicah ali produktih, ob upoštevanju vrste in odstotka sestavin, za katere je znano, da so toksikološko pomembne. V tistih primerih, kjer je le malo ali nič informacij o njegovi toksičnosti, ali kadar se pričakuje, da bo preskusni material toksičen, je treba opraviti glavni preskus.
Mejni preskus z eno velikostjo odmerka 2 000 mg/kg telesne teže se lahko opravi s šestimi živalmi (tri živali na en korak). Izjemoma se lahko opravi mejni preskus z eno velikostjo odmerka 5 000 mg/kg s tremi živalmi (glej Dodatek 2). Če nastane smrtnost, povezana s preskusno snovjo, bo morda potrebno izvesti nadaljnje preskušanje z naslednjo nižjo velikostjo.
1.6 OPAZOVANJA
Živali se opazujejo posamezno po odmerjanju najmanj enkrat v prvih 30 minutah, periodično v prvih 24 urah, s posebno pozornostjo v prvih 4 urah in nato 14 dni vsak dan, razen kadar jih je treba odstraniti iz študije in humano usmrtiti zaradi ogroženega zdravja ali ko so najdene poginule. Trajanja opazovanja ni treba strogo določiti. Opredeliti ga je treba na podlagi toksičnih reakcij, časa nastopa in trajanja okrevanja ter ga je zato mogoče podaljšati, kadar je to potrebno. Obdobja, ko se pojavijo znaki toksičnosti in ko izginejo, so pomembna, zlasti če obstaja težnja, da bodo toksični znaki zapozneli (12). Vsa opazovanja se sistematsko zabeležijo, za vsako žival se vodijo posamezne kartoteke.
Dodatna opazovanja bodo potrebna, če živali še vedno kažejo znake toksičnosti. Opazovanja morajo vključevati spremembe na koži in kožuhu, očeh in sluznicah, in tudi na dihalih, v obtoku, na avtonomnih in centralnih živčnih sistemih ter somatomotorični aktivnosti in vedenjskem vzorcu. Pozornost je treba posvetiti opazovanjem tremorjev, krčem, slinjenju, driski, otrplosti, spanju in komi. Treba je upoštevati principe in kriterije, povzete v Dokumentu s smernicami z napotki za humane končne točke (9). Živali, najdene v umirajočem stanju, in živali, ki kažejo hudo bolečino in trajne znake hudih okvar, je treba humano usmrtiti. Kadar živali usmrtimo zaradi humanih razlogov ali so najdene poginule, je treba čas smrti zabeležiti kar se da natančno.
1.6.1 Telesna teža
Posamezne teže živali je treba določiti tik pred dajanjem preskusne snovi in najmanj enkrat na teden po tem. Treba je izračunati in zabeležiti spremembe teže. Na koncu preskusa se preživele živali stehtajo in humano usmrtijo.
1.6.2 Patologija
Za vse preskusne živali (vključno s tistimi, ki poginejo med preskusom ali se odstranijo iz študije zaradi zaščite zdravja živali) je treba opraviti popolno obdukcijo. Vse natančne patološke spremembe je treba zabeležiti za vsako žival. Mikroskopski pregled organov, ki kažejo resne patološke znake, pri živalih, ki so preživele 24 ali več ur po začetnem odmerjanju se prav tako lahko upošteva, ker lahko da koristne informacije.
2. PODATKI
Zagotoviti je treba podatke za vsako posamezno žival. Nadalje je treba vse podatke prikazati v obliki preglednice, kjer je za vsako preskusno skupino prikazano število uporabljenih živali, število živali, ki kažejo znake toksičnosti, število živali, najdenih poginulih med preskusom ali usmrčenih iz humanih razlogov, čas smrti posameznih živali, opis in časovni potek toksičnih učinkov in reverzibilnosti ter ugotovitve obdukcije.
3. POROČANJE
3.1 Poročilo o preskusu
Poročilo o preskusu mora vsebovati naslednje informacije, kot je primerno:
Preskusna snov:
— fizikalno stanje, čistost in kjer je pomembno fizikalno-kemijske lastnosti (vključno z izomerizacijo),
— identifikacijski podatki, vključno s številko CAS.
Nosilec (če je primerno):
— utemeljitev izbire nosilca, če to ni voda.
Preskusne živali:
— uporabljena vrsta/sev,
— mikrobiološko stanje živali, kadar je znano,
— število, starost in spol živali (vključno, kjer je primerno, utemeljitev za uporabo samcev namesto samic),
— vir, pogoji vzdrževanja, vrsta hrane, itd.
Pogoji preskusa:
— podatki o formulaciji preskusne snovi, vključno s podatki o fizikalni obliki snovi, ki se daje,
— podatki o dajanju preskusne snovi, vključno z volumni odmerjanja in časom odmerjanja,
— podatki o kakovosti hrane in vode (vključno z vrsto prehranjevanja/vir, vir vode),
— utemeljitev za izbiro začetnega odmerka.
Rezultati:
— tabelarni prikaz odzivnih podatkov in velikost odmerka za vsako žival (npr. živali, ki kažejo znake toksičnosti, vključno s smrtnostjo; vrsto, resnost in trajanje učinkov),
— tabelarni prikaz telesne teže in sprememb telesne teže,
— teže posameznih živali na dan odmerjanja in v tedenskih intervalih po tem ter čas smrti ali usmrtitve,
— datum in čas smrti, če nastopi pred načrtovano usmrtitvijo,
— časovni potek nastopa znakov toksičnosti in ali so bili le–ti reverzibilni za vsako žival,
— ugotovitve obdukcije in histopatološke ugotovitve za vsako žival, če so na voljo.
Razprava in razlaga rezultatov.
Zaključki.
4. LITERATURA
(1) Roll R., Höfer-Bosse Th. And Kayser D. (1986). New Perspectives in Acute Toxicity Testing of Chemicals. Toxicol. Lett., Suppl. 31, 86
(2) Roll R., Riebschläger M., Mischke U. and Kayser D. (1989). Neue Wege zur Bestimmung der akuten Toxizität von Chemikalien. Bundesgesundheitsblatt 32, 336–341.
(3) Diener W., Sichha L., Mischke U., Kayser D. and Schlede E. (1994). The Biometric Evaluation of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 68, 559–610
(4) Diener W., Mischke U., Kayser D. and Schlede E. (1995). The Biometric Evaluation of the OECD Modified Version of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 729-734.
(5) Diener W., and Schlede E. (1999) Acute Toxicity Class Methods: Alterations to LD/LC50 Tests. ALTEX 16, 129–134
(6) Schlede E., Mischke U., Roll R. and Kayser D. (1992). A National Validation Study of the Acute-Toxic- Class Method – An Alternative to the LD50 Test. Arch. Toxicol. 66, 455–470.
(7) Schlede E., Mischke U., Diener W. and Kayser D. (1994). The International Validation Study of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 659–670.
(8) OECD (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris.
(9) OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N 19.
(10) OECD (1998) Harmonized Integrated Hazard Classification System For Human Health And Environmental Effects Of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html].
(11) Lipnick R L, Cotruvo, J A, Hill R N, Bruce R D, Stitzel K A, Walker A P, Chu I; Goddard M, Segal L, Springer J A and Myers R C (1995) Comparison of the Up-and Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol 33, 223–231.
(12) Chan P.K. and A.W. Hayes. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A.W. Hayes, Editor. Raven Press, Ltd., New York, USA.
Dodatek 1
POSTOPKI, PO KATERIH SE JE TREBA RAVNATI ZA VSAKEGA OD ZAČETNIH ODMERKOV
SPLOŠNE PRIPOMBE
Za vsak začetni odmerek prikazujejo ustrezne sheme preskušanja, kakor jih vključuje ta dodatek, po katerem se je treba ravnati.
— Dodatek 1 a: Začetni odmerek 5 mg/kg telesne teže
— Dodatek 1 b: Začetni odmerek 50 mg/kg telesne teže
— Dodatek 1 c: Začetni odmerek 300 mg/kg telesne teže
— Dodatek 1 d: Začetni odmerek 2 000 mg/kg telesne teže
Odvisno od števila humano usmrčenih živali ali poginulih živali sledi preskusni postopek navedenim puščicam.
Dodatek 1 A
POSTOPEK PRESKUSA Z ZAČETNIM ODMERKOM 5 MG/KG TELESNE TEŽE
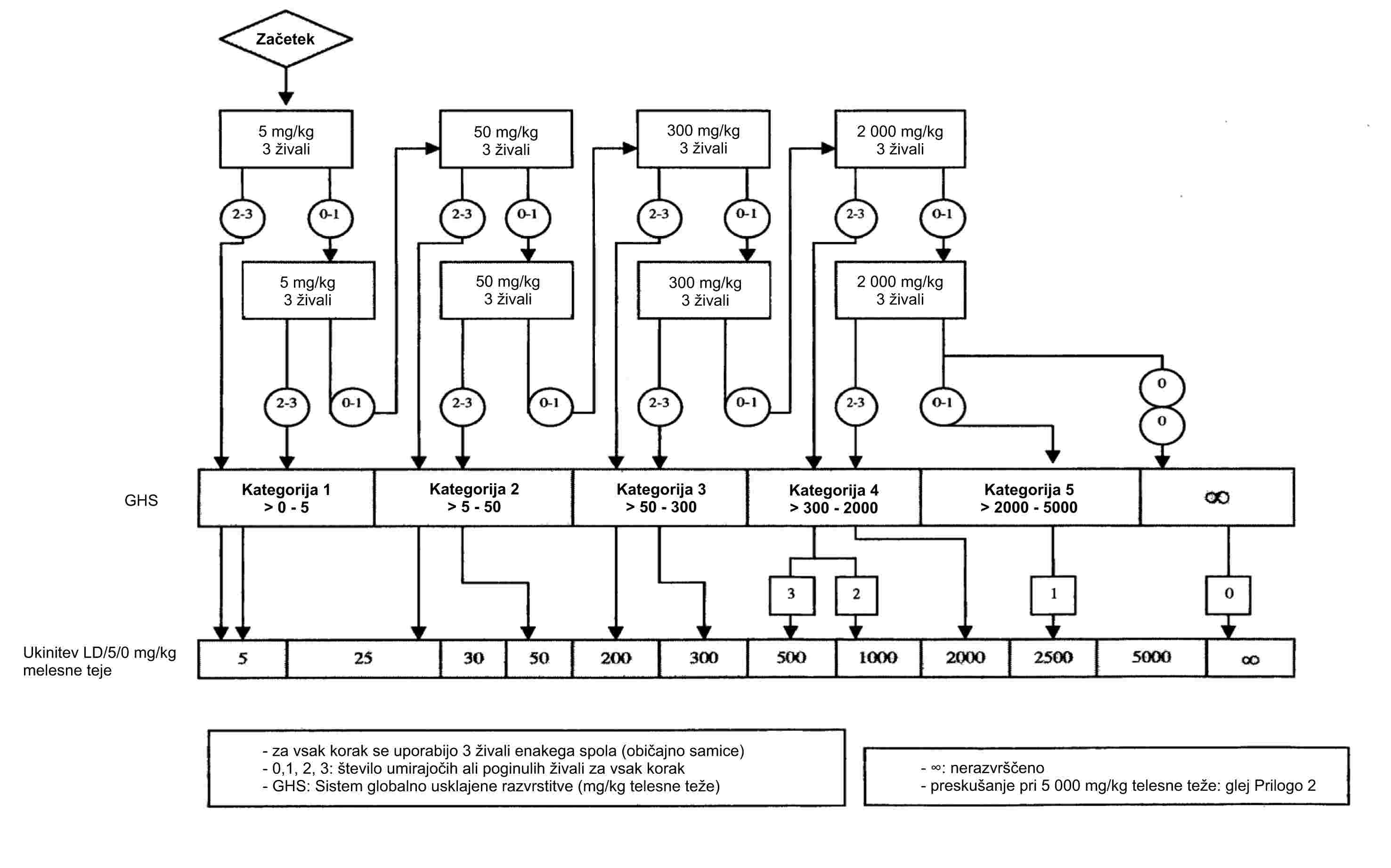
Dodatek 1 B
POSTOPEK PRESKUSA Z ZAČETNIM ODMERKOM 50 MG/KG TELESNE TEŽE

Dodatek 1 C
POSTOPEK PRESKUSA Z ZAČETNIM ODMERKOM 300 MG/KG TELESNE TEŽE

Dodatek 1 D
POSTOPEK PRESKUSA Z ZAČETNIM ODMERKOM 2 000 MG/KG TELESNE TEŽE
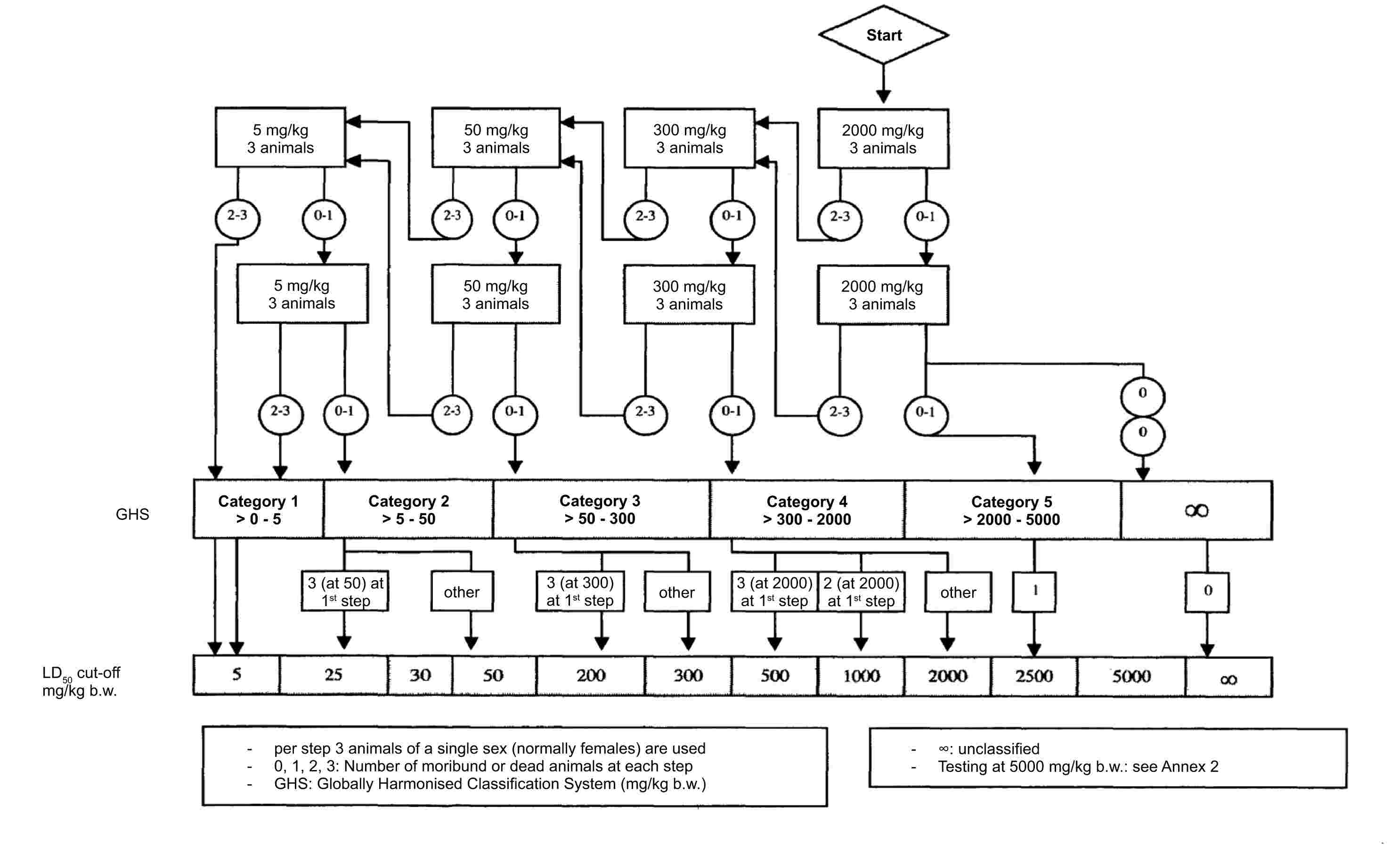
Dodatek 2
KRITERIJI ZA RAZVRSTITEV PRESKUSNIH SNOVI S PRIČAKOVANIMI VREDNOSTMI LD50, KI PRESEGAJO 2 000 MG/KG, NE DA BI BILO POTREBNO PRESKUŠANJE
Kriteriji za kategorijo nevarnih snovi 5 so namenjeni omogočanju identifikacije preskusnih snovi, katerih toksičnost je sorazmerno malo nevarna, vendar lahko v točno določenih okoliščinah predstavljajo nevarnost za ranljivo populacijo. Za te snovi se predvideva, da imajo oralni ali kožni LD50 v območju 2 000-5 000 mg/kg ali enakovrednih odmerkov za druge poti vnosa. Preskusne snovi se lahko uvrstijo v kategorijo nevarnih snovi, opredeljeno kot: 2 000 mg/kg < LD50 < 5 000 mg/kg (kategorija 5 v GHS) v naslednjih primerih:
(a) če so uvrščene v to kategorijo po kateri koli od shem preskušanja iz dodatkov l a–l d na podlagi pogostnosti smrti;
(b) če so že na voljo dokazi, ki kažejo na to, da je LD50 v razponu vrednosti kategorije 5; ali če druge študije na živalih ali toksičnih učinkih na ljudi kažejo zaskrbljenost zaradi njihove akutnosti;
(c) z ekstrapolacijo, ocenitvijo ali meritvijo podatkov, če dodelitev višjemu razredu nevarnih snovi ni zajamčena, in
— so na voljo zanesljive informacije, ki kažejo na toksične učinke pri ljudeh ali
— se opazi kakršna koli smrtnost pri preskušanju do vrednostmi kategorije 4 po oralni poti ali
— kadar strokovna presoja potrdi pomembne klinične znake toksičnosti pri preskušanju do vrednosti kategorije 4, z izjemo driske, piloerekcije ali nenormalnega videza, ali
— kadar strokovna presoja potrdi zanesljive informacije, ki kažejo na možnost pomembnih akutnih učinkov iz drugih študij na živalih.
PRESKUŠANJE Z ODMERKI NAD 2 000 MG/KG
Zaradi potrebe po zaščiti zdravja živali je preskušanje živali v razponih kategorije 5 (2 000 mg/kg) nezaželeno in bi ga morali upoštevati le, kadar obstaja velika verjetnost, da bi rezultati takšnega preskušanja imeli neposreden pomen za zaščito ljudi ali zdravje živali (10). Nadaljnje preskušanje se ne sme opravljati z večjimi velikostmi odmerkov.
Kadar je potrebno preskušanje odmerka 5 000 mg/kg, je potreben le en korak (to pomeni tri živali). Če prve žival odmerjanja pogine, se odmerjanje nadaljuje pri 2 000 mg/kg v skladu s tabelami poteka iz Dodatka 1. Če prva žival preživi, se preskušata nadaljnji dve živali. Če pogine le ena od treh živali, se za vrednost LD50, da bo presegla 5 000 mg/kg. Če pogineta obe živali, se odmerjanje nadaljuje z 2 000 mg/kg.
Dodatek 3
PRESKUSNA METODA B.1 bis. Napotki za razvrstitev v skladu s shemo EU za prehodno obdobje do popolne uveljavitve Globalno usklajenega sistema razvrstitve (GHS) (vzeto iz sklica (8))

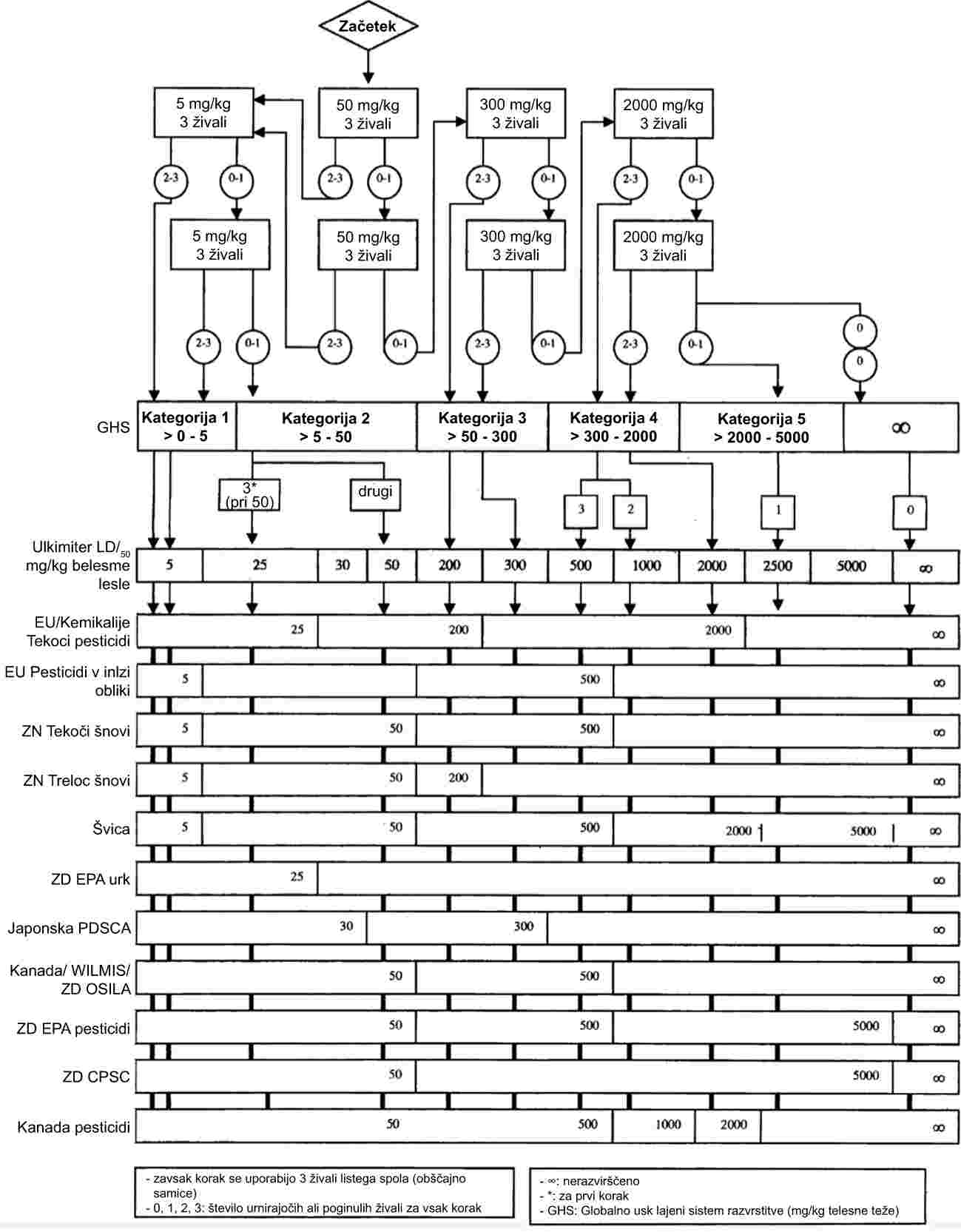
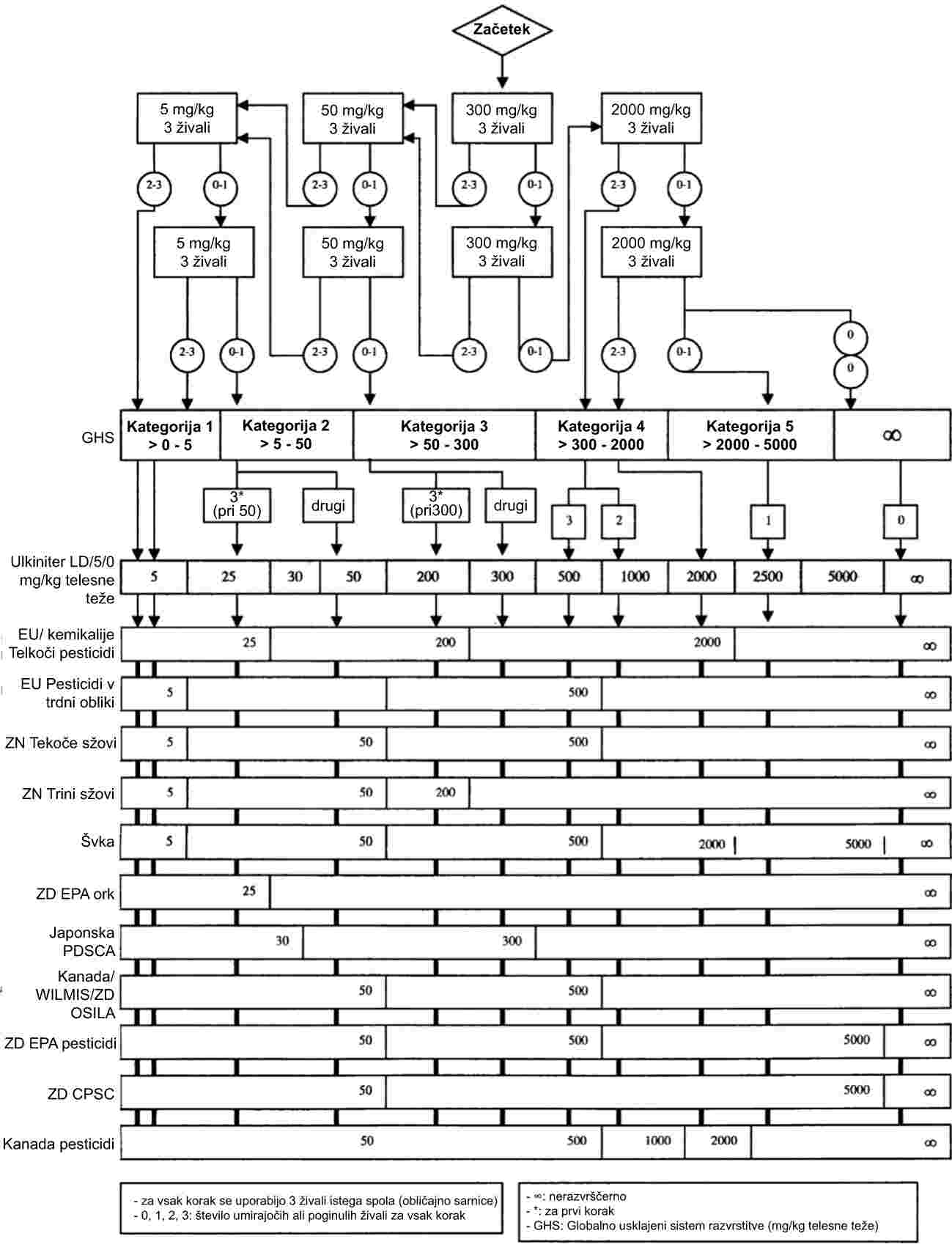
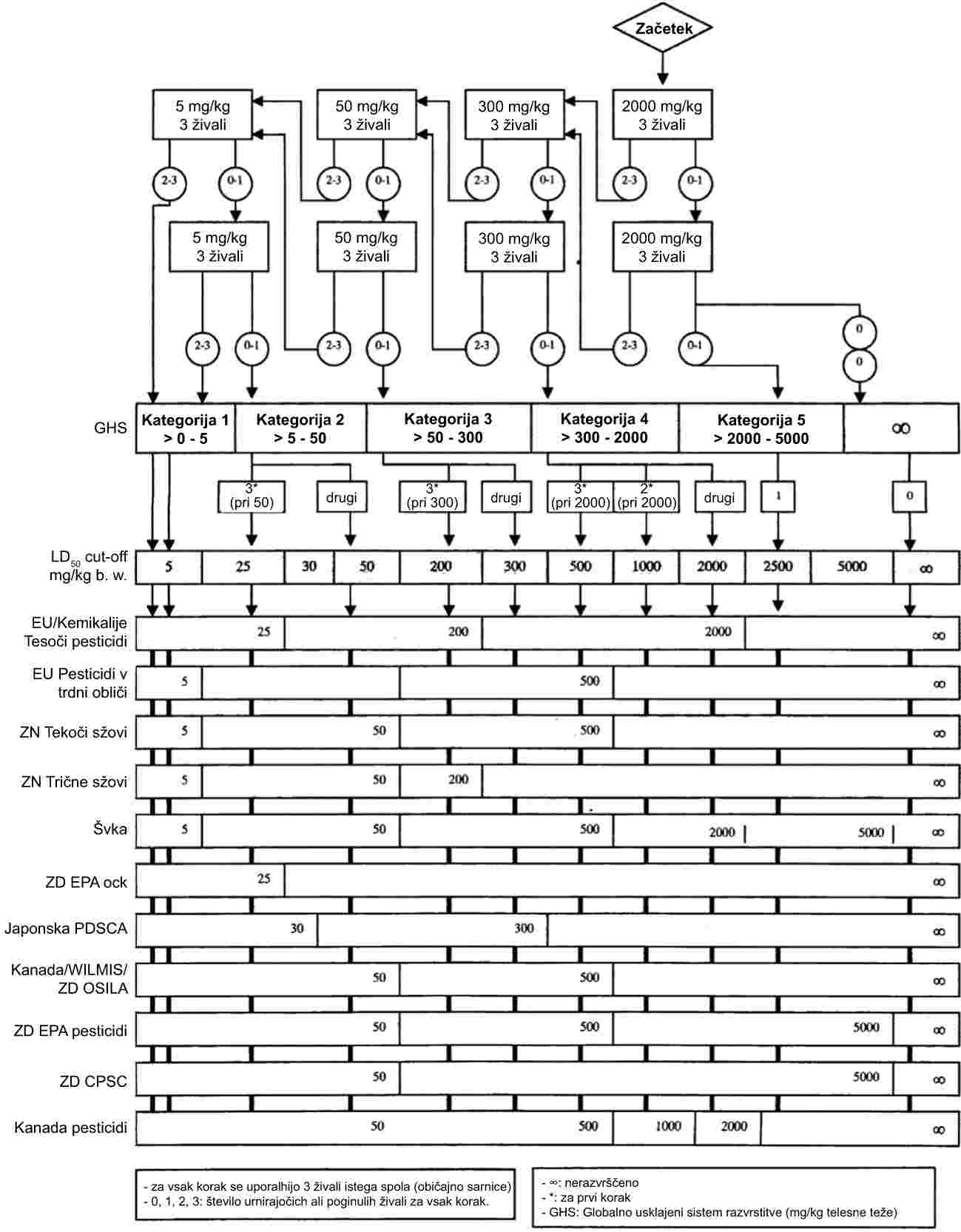
B.2 AKUTNA STRUPENOST (PRI VDIHAVANJU)
1. METODA
1.1 UVOD
Koristno je imeti predhodne informacije o porazdelitvi velikosti delcev, parnem tlaku, tališču, vrelišču, plamenišču in eksplozivnosti (če je primerno) snovi.
Glej tudi Splošni uvod, del B(A).
1.2 OPREDELITVE
Glej Splošni uvod dela B (B).
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Več skupin poskusnih živali se za določeno obdobje izpostavi preskusni snovi v stopnjevanih koncentracijah, pri čemer se uporabi ena koncentracija na skupino. Nato se opazujejo učinki in smrtnost. Na živalih, ki med preskusom poginejo, se opravi obdukcija, ob koncu preskusa pa tudi na preživelih živalih.
Živali, ki kažejo hude in dolgotrajne znake stresa in bolečine, bo morda treba humano usmrtiti. Odmerjanja preskusnih snovi na način, za katerega je znano, da povzroča izrazito bolečino in stres zaradi jedkih ali hudih dražilnih lastnosti, ni treba izvesti.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
1.6.1 Priprave
Najmanj pet dni pred začetkom preskusa se živali nastanijo v preskusnih pogojih nastanitve in hranjenja. Pred preskusom se zdrave mlade živali naključno izberejo in dodelijo potrebnemu številu skupin. Živali ni treba izpostaviti simulirani izpostavljenosti, razen če tako določa vrsta uporabljene aparature za izpostavljanje.
Trdne preskusne snovi bo morda treba mikronizirati, da bo velikost delcev ustrezna.
Po potrebi se preskusni snovi lahko doda ustrezni nosilec, da se lažje doseže primerna koncentracija preskusne snovi v zraku, vendar je treba nato uporabiti kontrolno skupino za ta nosilec. Če se za lažje odmerjanje uporabi nosilec ali drugi dodatki, mora biti dokazano, da ne povzročajo strupenih učinkov. Če je primerno, se lahko uporabijo podatki preteklih študij.
1.6.2 Preskusni pogoji
1.6.2.1 Poskusne živali
Razen v primeru kontraindikacij, je podgana najprimernejša vrsta. Uporabiti je treba splošno uporabljane laboratorijske seve. Ob začetku preskusa pri nobenem spolu območje nihanja mase uporabljenih živali ne sme presegati ± 20 % ustrezne srednje vrednosti.
1.6.2.2 Število in spol
Za vsako koncentracijo se uporabi najmanj 10 glodavcev (pet samic in pet samcev). Samice morajo biti nulipare in nebreje.
Opomba: Pri preskusih akutne strupenosti na živalih iz sistematskih skupin, višjih od glodavcev, je treba razmisliti o uporabi manjšega števila živali. Odmerke je treba skrbno izbrati in treba si je čim bolj prizadevati, da se ne presežejo zmerno strupeni odmerki. Pri takih preskusih se je treba izogibati dajanju smrtnih odmerkov preskusne snovi.
1.6.2.3 Koncentracije izpostavljenosti
Teh mora biti dovolj, najmanj tri, in biti morajo v primernih intervalih koncentracij, da pri preskusnih skupinah povzročijo niz različnih strupenih učinkov in stopenj umrljivosti. Podatki morajo zadoščati za izdelavo krivulje smrtnosti v odvisnosti od koncentracije in, kadar je mogoče, omogočiti sprejemljivo določitev LC50.
1.6.2.4 Mejni preskus
Če pri štiriurni izpostavitvi petih moških ali petih ženskih testnih živali 20 mg na liter plina ali 5 mg na liter aerosola ali delcev (ali če to ni mogoče zaradi fizičnih ali kemičnih lastnosti, vključno z eksplozivnimi lastnostmi testne snovi, maksimalne dosegljive koncentracije) v 14 dneh ne pride do smrtnosti zaradi sestavin, nadaljnje preskušanje ni potrebno.
1.6.2.5 Čas izpostavljenosti
Obdobje izpostavljenosti mora trajati štiri ure.
1.6.2.6 Oprema
Preskušanje na živalih se izvaja z opremo za vdihavanje, ki je zasnovana tako, da vzdržuje dinamični pretok zraka z najmanj 12 zamenjavami zraka na uro, da se zagotovita zadostna vsebnost kisika in enakomerna porazdelitev izpostavitvenega ozračja. Če se uporabi komora, mora biti zasnovana tako, da preskusne živali niso prenatrpane in so kar najbolj izpostavljene preskusni snovi z vdihavanjem. Splošno pravilo zagotavljanja stabilnosti ozračja v komori je, da skupni „volumen“ preskusnih živali ne sme presegati 5 % volumna preskusne komore. Lahko se uporabi nazooralno izpostavljanje, izpostavljanje samo glave ali izpostavljanje celega telesa v posamični komori; prva dva načina omogočata, da se sprejem preskusne snovi po drugih poteh čim bolj zmanjša.
1.6.2.7 Obdobje opazovanja
Obdobje opazovanja mora trajati najmanj 14 dni. Vendar trajanje obdobja opazovanja ne sme biti strogo določeno. Določeno mora biti na podlagi reakcij na strupenost, hitrosti njihovega pojavljanja in dolžine obdobja okrevanja; kadar se zdi potrebno, se lahko podaljša. Čas pojava in izginotja znakov strupenosti ter čas smrti sta pomembna, zlasti če se kaže težnja časovnega zamika smrti.
1.6.3 Postopek
Tik pred izpostavitvijo se živali stehtajo, nato se v za to določeni aparaturi izpostavijo preskusni koncentraciji za štiri ure, potem ko se je v komori vzpostavilo ravnovesje koncentracije. Čas uravnovešanja mora biti kratek. Med preskusom je treba vzdrževati temperaturo 22 ± 3 oC. V idealnih razmerah bi bilo treba relativno vlažnost vzdrževati med 30 in 70 %, vendar to v nekaterih primerih (npr. preskusi z nekaterimi aerosoli) ni izvedljivo. Vzdrževanje rahlega podtlaka v komori (< 5 mm vode) bo preprečilo uhajanje preskusne snovi v okolico. Med izpostavljenostjo se živalim ne dajeta ne hrana ne voda. Treba je uporabiti primerne sisteme za ustvarjanje in spremljanje preskusne atmosfere. Sistem mora zagotoviti, da se čim hitreje dosežejo stabilni pogoji izpostavljenosti. Komora mora biti zasnovana in upravljana tako, da se ohranja homogena porazdelitev preskusne atmosfere v njej.
Meriti ali spremljati je treba:
(a) pretok zraka (neprekinjeno);
(b) dejansko koncentracijo preskusne snovi, merjeno v območju dihanja najmanj trikrat med izpostavitvijo (pri nekaterih atmosferah, npr. aerosolih v velikih koncentracijah, bo morda potrebno polj pogosto spremljanje). V obdobju izpostavljenosti se koncentracija ne sme spreminjati za več kot ± 15 % srednje vrednosti. Vendar je lahko pri nekaterih aerosolih taka stopnja nadzora nedosegljiva in je zato sprejemljiv večji razpon. Pri aerosolih je treba izvajati analizo velikosti delcev, tako pogosto kot je potrebno (najmanj enkrat na preskusno skupino).
(c) temperaturo in vlažnost, če je mogoče neprekinjeno.
Med izpostavitvijo in po njej se izvaja sistematično opazovanje in zapisovanje opažanj; za vsako žival je treba voditi svojo evidenco. Prvi dan morajo biti opazovanja pogosta. Najmanj enkrat na vsak delavnik je treba izvesti temeljit klinični pregled, druga opazovanja pa se izvajajo vsak dan, z ustreznimi ukrepi za zmanjševanje izgube živali v študiji, npr. z obdukcijo ali ohladitvijo poginulih živali in osamitvijo ali žrtvovanjem šibkih ali umirajočih živali.
Opazovati je treba spremembe na koži in kožuhu, očeh, sluznici, dihalih, obtočilih, avtonomnem in osrednjem živčevju ter somatomotorični aktivnosti in vedenjskem vzorcu. S posebno pozornostjo je treba opazovati dihanje, tremor, krče, slinjenje, diarejo, letargijo, spanje in komo. Čas smrti je treba zapisati čim bolj natančno. Maso posameznih živali je treba določati vsak teden po izpostavljenosti in ob smrti.
Na živalih, ki poginejo med preskusom, in tistih, preživelih ob koncu preskusa, se opravi obdukcija, pri kateri se posebna pozornost posveti vsem spremembam v zgornjem in spodnjem predelu dihalne poti. Zapisati je treba vse makroskopske patološke spremembe. Kadar je tako navedeno, je treba vzeti vzorec tkiva za histopatološko preiskavo.
2. PODATKI
Podatke je treba povzeti v tabeli, ki za vsako preskusno skupino prikazuje število živali na začetku preskusa, čas smrti posameznih živali, število živali, ki kažejo druge znake strupenosti, opis strupenih učinkov in izsledke obdukcije. Spremembe v masi je treba izračunati in zapisati, kadar preskusna žival preživi več kakor en dan. Živali, ki se humano usmrtijo zaradi s snovjo povezanih stresa in bolečine, se zapišejo kot s snovjo povezane smrti. LC50 je treba določiti s pomočjo priznane metode. Vrednotenje podatkov mora vključevati morebitno razmerje, med izpostavljenostjo živali preskusni snovi ter incidenco in resnostjo vseh nepravilnosti, vključno z vedenjskimi in kliničnimi nepravilnostmi, hujšimi poškodbami, spremembami v telesni masi, smrtnostj in kakršnimi koli drugimi strupenimi učinki.
3. POROČANJE
3.1 POROČILO O PRESKUSU
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— vrsta, sev, vir, okoljski pogoji, prehrana itd.,
— preskusni pogoji: opis aparature za izpostavljanje vključno z načrtom, vrsto, merami, virom zraka, sistemom za proizvajanje aerosolov, metodo za klimatiziranje zraka in metodo namestitve živali v preskusni komori, če je bila uporabljena. Opisati je treba opremo za merjenje temperature, vlažnosti ter koncentracije in porazdelitve velikosti delcev aerosolov.
Podatki o izpostavitvi
Ti morajo biti zbrani v tabeli in prikazani s srednjimi vrednostmi in mero variabilnosti (npr. standardna deviacija) ter po možnosti vključevati:
(a) pretok zraka skozi opremo za vdihavanje;
(b) temperaturo in vlažnost zraka;
(c) nazivne koncentracije (količnik skupne količine preskusne snovi, vnesene v opremo za vdihavanje, in volumna zraka);
(d) vrsto nosilca, če je bil uporabljen;
(e) dejanske koncentracije v preskusnem območju dihanja;
(f) srednji aerodinamični masni premer (MMAD) in geometrijsko standardno deviacijo (GSD);
(g) čas uravnovešanja koncentracije;
(h) obdobje izpostavljenosti;
— tabelarni prikaz podatkov o odzivu po spolu in ravni izpostavljenosti (tj. število živali, ki so poginile ali bile usmrčene med preskusom; število živali, ki kažejo znake strupenosti; število izpostavljenih živali),
— čas smrti med izpostavitvijo ali po njej, razlogi in merila za humano usmrtitev živali,
— vsa opažanja,
— vrednost LC50 za vsak spol, določena ob koncu obdobja opazovanja (z navedeno metodo izračunavanja),
— 95 % interval zaupanja za LC50 (kadar je to mogoče),
— krivulja odmerek/smrtnost in naklon (kadar to omogoča metoda določanja),
— izsledki obdukcije,
— kakršni koli izsledki histopatoloških preiskav,
— razprava o rezultatih (posebno pozornost je treba posvetiti morebitnemu učinku humanih usmrtitev med preskusom na izračunano vrednost LC50),
— razlaga rezultatov.
3.2 VREDNOTENJE IN RAZLAGA
Glej Splošni uvod dela B (D).
4. VIRI
Glej Splošni uvod dela B (E).
B.3 AKUTNA STRUPENOST (V STIKU S KOŽO)
1. METODA
1.1 UVOD
Glej Splošni uvod dela B (A).
1.2 OPREDELITVE
Glej Splošni uvod dela B (B).
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Preskusna snov se nanese na kožo v stopnjevanih odmerkih več skupinam poskusnih živali, pri čemer se uporabi en odmerek na skupino. Nato se opazujejo učinki in smrtnost. Na živalih, ki med preskusom poginejo, se opravi obdukcija, ob koncu preskusa pa tudi na preživelih živalih.
Živali, ki kažejo hude in dolgotrajne znake stresa in bolečine, bo morda treba humano usmrtiti. Odmerjanja preskusnih snovi na način, za katerega je znano, da povzroča izrazito bolečino in stres zaradi jedkih ali dražilnih lastnosti, ni treba izvesti.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
1.6.1 Priprave
Najmanj pet dni pred začetkom preskusa se živali nastanijo v preskusnih kletkah v preskusnih pogojih nastanitve in hranjenja. Pred preskusom se zdrave mlade odrasle živali naključno izberejo in dodelijo tretiranim skupinam. Približno 24 ur pred preskusom je treba živalim s hrbtnega dela trupa s striženjem ali britjem odstraniti dlako. Med striženjem ali britjem dlake je treba paziti, da se koža ne odrgne, kar bi lahko spremenilo njeno prepustnost. Za nanos preskusne snovi je treba pripraviti najmanj 10 % telesne površine. Pri preskušanju trdnih snovi, ki se po potrebi lahko uprašijo, je treba preskusno snov dovolj navlažiti z vodo ali, kadar je potrebno, ustreznim nosilcem, da se zagotovi dober stik s kožo. Pri uporabi nosilca je treba upoštevati njegov vpliv na prodiranje preskusne snovi skozi kožo. Tekoče preskusne snovi se običajno uporabljajo nerazredčene.
1.6.2 Preskusni pogoji
1.6.2.1 Poskusne živali
Uporabi se lahko odrasla podgana ali kunec. Uporabijo se lahko tudi druge vrste, vendar je treba njihovo uporabo utemeljiti. Uporabiti je treba splošno uporabljane laboratorijske seve. Ob začetku preskusa pri nobenem spolu območje nihanja mase uporabljenih živali ne sme presegati ± 20 % ustrezne srednje vrednosti.
1.6.2.2 Število in spol
Na vsako velikost odmerka se uporabi najmanj 5 živali. Vse morajo biti istega spola. Če se uporabijo samice, morajo biti nulipare in nebreje. Kadar so na voljo informacije, da je eden od spolov izrazito občutljivejši, je treba snov odmeriti živalim tega spola.
Opomba: Pri preskusih akutne strupenosti na živalih iz sistematskih skupin, višjih od glodavcev, je treba razmisliti o uporabi manjšega števila živali. Odmerke je treba skrbno izbrati in treba si je čim bolj prizadevati, da se ne presežejo zmerno strupeni odmerki. Pri takih preskusih se je treba izogibati dajanju smrtnih odmerkov preskusne snovi.
1.6.2.3 Velikost odmerkov
Teh mora biti dovolj, najmanj tri, in biti morajo v primernih intervalih koncentracij, da pri preskusnih skupinah povzročijo niz različnih strupenih učinkov in stopenj umrljivosti. Pri določanju velikosti odmerkov je treba upoštevati vse dražilne ali jedke učinke. Podatki morajo zadoščati za izdelavo krivulje odmerek/odziv in, kadar je mogoče, omogočiti sprejemljivo določitev LD50.
1.6.2.4 Mejni preskus
Lahko se izvede mejni preskus pri eni velikosti odmerka najmanj 2 000 mg/kg telesne mase na skupini 5 samcev in 5 samic po spodaj opisanem postopku. Če se pojavi smrtnost, povezana s snovjo, bo morda potrebna popolna študija.
1.6.2.5 Obdobje opazovanja
Obdobje opazovanja mora trajati najmanj 14 dni. Vendar trajanje opazovanja ne sme biti strogo določeno. Določeno mora biti na podlagi reakcij na strupenost, hitrosti njihovega pojavljanja in dolžine obdobja okrevanja; kadar se zdi potrebno, se lahko podaljša. Čas pojava in izginotja znakov strupenosti, njihovo trajanje ter čas smrti so pomembni, zlasti če se kaže težnja časovnega zamika smrti.
1.6.3 Postopek
Vsaka žival mora biti v svoji kletki. Preskusno snov je treba enakomerno nanesti na območje, ki predstavlja približno 10 % skupne telesne površine. Pri zelo strupenih snoveh je lahko površina nanosa manjša, vendar mora biti čim več površine pokrite s čim tanjšo in enakomerno plastjo.
Snov mora ostati v stiku s kožo celo 24-urno obdobje izpostavljenosti, kar se zagotovi s poroznim gaznim povojem in nedražilnim obližem. Preskusna površina mora biti dodatno ustrezno pokrita, da gazni povoj in preskusna snov ostaneta na istem mestu in se živalim prepreči zaužitje preskusne snovi. Za preprečitev zaužitja se lahko uporabijo pripomočki za omejevanje gibanja, vendar popolna imobilizacija ni priporočena metoda.
Ob koncu obdobja izpostavljenosti se ostanek preskusne snovi odstrani, kadar je to izvedljivo, z vodo ali kako drugo ustrezno metodo čiščenja kože.
Opazovanja se beležijo sistematično in sproti. Za vsako žival je treba voditi svojo evidenco. Prvi dan morajo biti opazovanja pogosta. Najmanj enkrat na vsak delavnik je treba izvesti temeljit klinični pregled, druga opazovanja pa se izvajajo vsak dan, z ustreznimi ukrepi za zmanjševanje izgube živali v študiji, npr. z obdukcijo ali ohladitvijo poginulih živali in osamitvijo ali žrtvovanjem šibkih ali umirajočih živali.
Opazovati je treba spremembe na kožuhu, tretirani koži, očeh in sluznici ter tudi v dihalih, obtočilih, avtonomnem in osrednjem živčevju, somatomotorični aktivnosti in vedenjskem vzorcu. S posebno pozornostjo je treba opazovati tremor, krče, slinjenje, diarejo, letargijo, spanje in komo. Čas smrti je treba zapisati kolikor je mogoče natančno. Na živalih, ki poginejo med preskušanjem, in tistih, preživelih ob koncu preskusa, se opravi obdukcija. Zapisati je treba vse makroskopske patološke spremembe. Kadar je tako navedeno, je treba vzeti vzorec tkiva za histopatološko preiskavo.
Po zaključku študije na enem spolu, se snov odmeri najmanj eni skupini 5 živali drugega spola, da se ugotovi, ali so živali tega spola izrazito občutljivejše za preskusno snov. V posameznih primerih je upravičena uporaba manjšega števila živali. Kadar so na voljo zadovoljive informacije, ki kažejo, da so živali preskušenega spola izrazito občutljivejše, preskušanje živali drugega spola ni potrebno.
2. PODATKI
Podatke je treba povzeti v tabeli, ki za vsako preskusno skupino prikazuje število živali na začetku preskusa, čas smrti posameznih živali, število živali, ki kažejo druge znake strupenosti, opis strupenih učinkov in izsledke obdukcije. Maso posameznih živali je treba določiti in zapisati tik pred nanašanjem preskusne snovi, vsak teden po tem ter ob smrti; spremembe v masi je treba izračunati in zapisati, kadar preskusna žival preživi več kakor en dan. Živali, ki se humano usmrtijo zaradi s snovjo povezanih stresa in bolečine, se zapišejo kot s snovjo povezane smrti. LD50 je treba določiti s pomočjo priznane metode.
Vrednotenje podatkov mora vključevati vrednotenje morebitnih razmerij med izpostavljenostjo živali preskusni snovi ter incidenco in resnostjo vseh nepravilnosti, vključno z vedenjskimi in kliničnimi nepravilnostmi, hujšimi poškodbami, spremembami v telesni masi, smrtnostjo in kakršnimi koli drugimi strupenimi učinki.
3. POROČANJE
3.1 POROČILO O PRESKUSU
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— vrsta, sev, vir, okoljski pogoji, prehrana itd.,
— preskusni pogoji (vključno z metodo čiščenja kože in vrsto povoja: okluzivni ali neokluzivni),
— velikost odmerkov (z nosilcem, če se uporablja, in koncentracijami),
— spol živali, ki so prejele preskusno snov,
— tabelarni prikaz podatkov o odzivu po spolu in velikosti odmerka (tj. število živali, ki so poginile ali so bile usmrčene med preskusom; število živali, ki kažejo znake strupenosti; število izpostavljenih živali),
— čas smrti po odmerjanju, razlogi in merila za humano usmrtitev živali,
— vsa opažanja,
— vrednost LD50 za spol, na katerem je bila opravljena popolna študija, določena po 14 dneh z navedeno metodo določanja,
— 95 % interval zaupanja za LD50 (kadar je to mogoče),
— krivulja odmerek/smrtnost in naklon, kadar to omogoča metoda določanja,
— izsledki obdukcije,
— kakršni koli izsledki histopatoloških preiskav,
— rezultati kakršnih koli preskusov na drugem spolu,
— razprava o rezultatih (posebno pozornost je treba posvetiti morebitnemu učinku humanih usmrtitev živali med preskusom na izračunano vrednost LD50),
— razlaga rezultatov.
3.2 VREDNOTENJE IN RAZLAGA
Glej Splošni uvod dela B (D).
4. VIRI
Glej Splošni uvod dela B (E).
B.4 AKUTNA TOKSIČNOST: DERMALNA DRAŽILNOST/JEDKOST
1. METODA
Ta metoda ustreza OECD TG 404 (2002).
1.1 UVOD
Pri pripravi te dopolnjene metode je veljala posebna pozornost možnim izboljšavam v zvezi s skrbjo za zdravje živali in vrednotenje vseh obstoječih informacij o preskusni snovi, da bi se izognili nepotrebnemu preskušanju na laboratorijskih živalih. Ta metoda vključuje priporočilo, da je treba pred začetkom opravljanja preskusa za dražilnost/jedkost snovi in vivo opraviti analizo tehtnosti dokazov na podlagi pomembnih obstoječih podatkov. Kadar ni na voljo dovolj podatkov, se lahko pridobijo z uporabo zaporednega preskušanja (1). Strategija preskušanja vključuje opravljanje validiranih in sprejetih in vitro preskusov in je podana kot dodatek k tej metodi. Kjer je to ustrezno, je poleg tega priporočena zaporedna aplikacija treh preskusnih obližev na živali v začetnem preskusu in vivo namesto sočasne.
Za znanstveno zanesljivost in zdravje živali je koristno, da se preskušanje in vivo ne začne opravljati, dokler se niso ocenili vsi razpoložljivi podatki, pomembni za možno dermalno dražilnost/jedkost snovi z analizo tehtnosti dokazov. Takšni podatki bodo vključevali dokaze obstoječih študij na ljudeh in/ali laboratorijskih živalih, dokaze o dražilnosti/jedkosti ene ali več strukturno sorodnih snovi ali mešanic takšnih snovi, podatke, ki bodo dokazovali močno kislost ali alkalnost snovi (2)(3), in rezultate iz validiranih in sprejetih in vitro ali ex vivo preskusov (4)(5)(5a). Ta analiza bi morala zmanjšati potrebo po in vivo preskušanju dermalne jedkosti/dražilnosti snovi, za katere obstaja že dovolj dokazov iz drugih študij glede navedenih dveh končnih točk.
Bolj upoštevana strategija zaporednega preskušanja, ki vključuje opravljanje validiranih in sprejetih in vitro ali ex vivo preskusov za jedkost/dražilnost, je vključena kot dodatek k tej metodi. To strategijo so razvili in soglasno priporočili udeleženci OECD delavnice (6) in se je sprejela kot priporočena strategija preskušanja v Globalno usklajenem sistemu za razvrstitev kemijskih snovi (GHS) (7). Priporočeno se je ravnati po tej strategiji preskušanja pred opravljanjem preskušanja in vivo. Za nove snovi je priporočen postopen način preskušanja za pridobivanje znanstveno zanesljivih podatkov o jedkosti/dražilnosti snovi. Za obstoječe snovi, za katere ni dovolj podatkov, je treba uporabiti to strategijo za zapolnitev vrzeli manjkajočih podatkov. Uporabo drugačne strategije preskušanja ali postopka ali odločitev, da se ne bo uporabil način preskušanja po korakih, je treba upravičiti.
Če določitev jedkosti ali dražilnosti ni mogoča na podlagi analize tehtnosti dokazov, skladne s strategijo zaporednega preskušanja, je treba upoštevati preskus in vivo (glej Dodatek).
1.2 DEFINICIJE
Dermalna dražilnost: je nastanek reverzibilne poškodbe kože, ki sledi uporabi preskusne snovi, trajajoči do 4 ure.
Dermalna jedkost: je nastanek ireverzibilne poškodbe kože, in sicer vidne nekroze skozi epidermisa in v dermis, ki sledi uporabi preskusne snovi, trajajoči do 4 ure. Za jedke reakcije so značilni čiri, krvavitve, krvave kraste in na koncu štirinajstdnevnih opazovanj sprememba barve zaradi pobledele kože, celi predeli plešavosti in brazgotine. Treba je upoštevati histopatologijo za vrednotenje sumljivih lezij.
1.3 PRINCIP PRESKUSNE METODE
Snov, ki jo je treba preskusiti, se nanese na kožo preskusne živali v enkratnem odmerku; netretirane površine kože preskusne živali služijo za kontrolo. Stopnja dražilnosti/jedkosti se odčita in zabeleži v določenih intervalih in nadalje opiše, da se zagotovi celovito vrednotenje reverzibilnosti ali ireverzibilnosti opaženih učinkov.
Živali, ki kažejo trajne znake hudega trpljenja in/ali bolečine v kateri koli fazi preskusa je treba humano usmrtiti in snov skladno s tem oceniti. Kriterije za sprejem odločitve o humani usmrtitvi umirajočih in hudo trpečih živali je mogoče najti v sklicu (8).
1.4 OPIS PRESKUSNE METODE
1.4.1 Priprava za preskus in vivo
1.4.1.1 Izbira živalskih vrst
Kunec beličnik je najbolj zaželena laboratorijska žival in uporabljajo se zdravi mladi odrasli kunci. Za uporabo drugih vrst je potrebna obrazložitev.
1.4.1.2 Priprava živali
Približno 24 ur pred preskusom je treba odstraniti kožuh s skrbnim striženjem na hrbtnem delu trupa živali. Paziti je treba, da se ne odrgne koža in uporabiti le živali z zdravo, nepoškodovano kožo.
Nekateri kunčji sevi imajo goste zaplate dlak, ki so bolj izrazite v nekaterih obdobjih med letom. Takšni predeli goste rasti dlak se ne smejo uporabiti kot preskusni predeli.
1.4.1.3 Pogoji bivanja in hranjenja
Živali morajo imeti vsaka svoj prostor. Temperatura prostora za preskuse z živalmi mora znašati za kunce 20 oC (± 3 oC). Čeprav mora biti relativna vlažnost najmanj 30 % in po možnosti ne sme presegati 70 %, mora biti ciljna vlažnost, razen med čiščenjem prostora, 50 do 60 %. Osvetlitev mora biti umetna v zaporedju 12 ur svetlobe in 12 ur teme. Za hranjenje se lahko uporabijo običajne predpisane laboratorijske vrste hrane z neomejeno količino pitne vode.
1.4.2 Preskusni postopek
1.4.2.1 Aplikacija preskusne snovi
Preskusno snov je treba nanesti na del površine kože (približno 6 cm) in pokriti z obližem iz gaze, ki se pritrdi z nedražilnim trakom. Kadar neposredna aplikacija ni mogoče (npr. tekoče snovi ali nekatere kašnate zmesi), je treba preskusno snov najprej nanesti na obliž iz gaze, ki se nato uporabi na koži. Obliž mora biti v ohlapnem stiku s kožo, pritrjen z ustrezno napol zapiralno obvezo med trajanjem izpostavitve. Če se preskusna snov nanese na obliž, jo je treba pritrditi na kožo na takšen način, da je stik dober in snov enakomerno razporejena po koži. Treba je preprečiti živali dostop do obliža in zaužitje ali vdihavanje preskusne snovi.
Tekoče preskusne snovi se navadno uporabljajo nerazredčene. Kadar se preskušajo trdne snovi (ki se jih lahko zdrobi, če je to po presoji potrebno), je treba preskusno snov navlažiti z zelo majhno količino vode (ali, kadar je potrebno, z drugim ustreznim nosilcem), ki zadostuje za zagotavljanje dobrega stika s kožo. Kadar se uporabljajo drugi nosilci in ne voda, mora biti možen vpliv nosilca na dražilnost kože zaradi preskusne snovi minimalen, če sploh kateri.
Na koncu obdobja izpostavljenosti, ki traja običajno 4 ure, je treba odstraniti preostalo preskusno snov, kjer je to izvedljivo, z uporabo vode ali ustreznega topila, ne da bi se spremenil obstoječi odziv ali integriteta epidermisa.
1.4.2.2 Velikost odmerka
Odmerek 0,5 ml tekoče snovi ali 0,5 g trdne snovi ali kašnate zmesi se nanese na preskusni predel.
1.4.2.3 Začetni preskus (dermalni preskus dražilnosti/jedkosti in vivo z uporabo ene živali)
Močno je priporočeno, da se preskus in vivo na začetku izvede z uporabo ene živali, zlasti kadar se za snov domneva, da je potencialno jedka. To je v skladu s strategijo zaporednega preskušanja (glej Dodatek 1).
Kadar se za snov na podlagi analize tehtnosti dokazov presodi, da je jedka, ni potrebno nadaljnje preskušanje na živalih. Za večino snovi, za katere se domneva, da so jedke, nadaljnje preskušanje in vivo običajno ni potrebno. Kadar se kljub temu zdi potrebno zagotoviti dodatne podatke zaradi pomanjkljivih dokazov, se lahko izvede preskušanje na živalih z uporabo naslednjega pristopa: Na žival se zaporedoma nanesejo do trije preskusni obliži. Prvi obliž se odstrani po treh minutah. Če ni opazna nobena resna reakcija kože, se nanese drugi obliž in se odstrani po eni uri. Če kažejo opazovanja v tej fazi, da se na human način lahko dopusti podaljšanje izpostavljenosti na štiri ure, se nanese tretji obliž in se odstrani po štirih urah, odziv pa se razvrsti po stopnjah.
Če se opazi jedek učinek po kateri koli izmed teh treh zaporednih izpostavitev, se preskus nemudoma zaključi. Če se jedek učinek ne opazi po tem, ko se odstrani zadnji obliž, se žival opazuje 14 dni, razen kadar se jedkost razvije v zgodnejši časovni točki.
Kadar se ne pričakuje, da bo preskusna snov povzročila jedkost, a bi lahko bila dražilna, je treba nanesti le en obliž na eno žival za štiri ure.
1.4.2.4 Potrditveni preskus (dermalni preskus dražilnosti in vivo z dodatnimi živalmi)
Če se jedek učinek ne opazi v začetnem preskusu, je treba dražilni ali negativni odziv potrditi z uporabo do dveh dodatnih živali, s po enim obližem za vsako, v obdobju izpostavitve štirih ur. Če se v začetnem preskusu opazi dražilen učinek, se potrditveni preskus lahko naredi na zaporeden način ali s sočasno izpostavitvijo dveh dodatnih živali. Izjemoma, ko se začetni preskus ne izvaja, se lahko dve ali tri živali tretira le z enim obližem, ki se odstrani po štirih urah. Kadar se uporabljata dve živali, ni potrebno nadaljnje preskušanje, če obe kažeta enak odziv. V nasprotnem primeru se preskusi tudi tretja žival. Možno je, da bo treba oceniti dvomljive odzive z uporabo dodatnih živali.
1.4.2.5 Obdobje opazovanja
Obdobje opazovanja mora trajati dovolj dolgo, da se lahko v celoti ovrednoti reverzibilnost opaženih učinkov. Preskus je treba zaključiti ob katerem koli času, kadar kaže žival trajajoče znake hude bolečine ali okvar. Za določitev reverzibilnosti učinkov je treba živali opazovati 14 dni po odstranitvi obližev. Če se opazi reverzibilnost pred potekom 14 dni, je treba v tistem času preskus zaključiti.
1.4.2.6 Klinična opazovanja in razvrstitev reakcij kože v stopnje
Vse živali je treba pregledati, ali imajo znake rdečine in edemov, ter odzive zabeležiti po 60 minutah in nato po 24, 48 in 72 urah po odstranitvi obliža. Za začetne preskuse na eni živali se pregleda tudi preskusni predel takoj za tem, ko se obliž odstrani. Dermalne reakcije se razvrstijo v stopnje in zabeležijo v skladu s stopnjami iz tabele spodaj. Če nastane poškodba kože, ki je ni mogoče opredeliti kot dražilnost ali jedkost po 72 urah, bodo morda potrebna opazovanja do štirinajstega dne za opredelitev reverzibilnosti učinkov. Poleg opazovanja dražilnosti je treba v celoti zapisati in zabeležiti vse lokalne toksične učinke, kakor npr. tanjšanje kože in vse sistemske nasprotne učinke (npr. učinke na klinične znake toksičnosti in telesno težo). Za razjasnitev dvomljivih odzivov je treba opraviti histopatološki pregled.
Razvrščanje kožnih odzivov je nujno subjektivno. Da bi pospešili usklajevanje pri razvrščanju kožnih odzivov in nudili pomoč preskuševalnim laboratorijem ter vsem sodelujočim pri oblikovanju in razlagi rezultatov opazovanj, mora biti osebje, ki izvaja ta opazovanja, ustrezno usposobljeno, da obvlada uporabljeni sistem določanja stopnje (glej tabelo spodaj). Pri tem bi lahko bil v pomoč ilustriran priročnik za določanje stopnje dermalne dražilnosti in drugih poškodb (9).
2. PODATKI
2.1 OBDELAVA REZULTATOV
Rezultati študije se morajo povzeti v obliki preglednice v končnem poročilu o preskusu in morajo zajemati vse postavke s seznama v oddelku 3.1.
2.2 VREDNOTENJE REZULTATOV
Rezultate dermalne dražilnosti je treba vrednotiti v povezavi z vrsto in resnostjo lezij ter njihovo reverzibilnostjo ali pomanjkanjem reverzibilnosti. Posamezni rezultati ne predstavljajo absolutnega standarda za dražilne lastnosti materiala, ker se vrednotijo tudi drugi učinki preskusnega materiala. Namesto tega je treba razumeti posamezne rezultate kot referenčne vrednosti, ki jih je treba ovrednotiti v zvezi z vsemi drugimi opazovanji iz študije. Reverzibilnost dermalnih lezij je treba upoštevati pri oceni dražilnih odzivov.
Kadar so odzivi, kakor npr. plešavost, hiperkeratoza, hiperplazija in luščenje vidni do konca 14-dnevnega obdobja opazovanja, se preskusna snov obravnava kot dražilna.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje informacije, kot je primerno:
Obrazložitev za preskušanje in vivo: analiza tehtnosti dokazov iz prej obstoječih preskusnih podatkov, vključno z rezultati strategije zaporednega preskušanja:
— opis pomembnih podatkov, ki so na voljo pred preskušanjem,
— podatki, pridobljeni v vsaki fazi strategije preskušanja,
— opis opravljenih in vitro preskusov, vključno s podrobnimi podatki o postopkih, rezultati, dobljeni s preskusnimi/referenčnimi snovmi,
— analiza tehtnosti dokazov za opravljanje študije in vivo.
Preskusna snov:
— identifikacijski podatki (npr. številka CAS; vir, čistost, znane nečistoče, številka skupine),
— fizikalno stanje in fizikalno-kemijske lastnosti (npr.: pH hlapnost, topnost, stabilnost),
— če gre za mešanico, sestava in relativni odstotek sestavin.
Nosilec:
— identifikacija, koncentracija (kjer je ustrezno), uporabljeni volumen,
— obrazložitev upravičenosti izbire nosilca.
Preskusne živali:
— uporabljena vrsta/sev, obrazložitev uporabe živali, če to ni kunec beličnik,
— število živali istega spola,
— teže posameznih živali na začetku in na zaključku preskusa,
— starost na začetku študije,
— vir živali, pogoji bivanja, vrsta hranjenja, itd.
Pogoji preskusa:
— tehnika priprave predela za obliž,
— podrobni podatki o uporabljenih materialih za obliže in tehnika dela z obliži,
— podrobni podatki o pripravi preskusne snovi, aplikaciji in odstranitvi.
Rezultati:
— preglednica doseženih rezultatov odziva na dražilnost/jedkost za vsako žival na vseh izmerjenih časovnih točkah,
— opis vseh opaženih lezij,
— pripovedni opis vrste in stopnje opažene dražilnosti ali jedkosti in katere koli histopatološke ugotovitve,
— opis drugih nasprotnih, lokalnih (npr. tanjšanje kože) in sistemskih učinkov poleg derrmalne dražilnosti in jedkosti.
Razprava o rezultatih.
4. LITERATURA
(1) Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410–429.
(2) Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19–26.
(3) Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M. (1998) Evaluation of the proposed OECD Testing Strategy for skin corrosion. ATLA 26, 709–720.
(4) ECETOC (1990) Monograph No. 15, „Skin Irritation“, European Chemical Industry, Ecology and Toxicology Centre, Brussels.
(5) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp. 483–524.
(5a) Testing Method B.40 Skin Corrosion.
(6) OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22–24 January 1996 (http://www.oecd1.org/ehs/test/background.htm).
(7) OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd1.org/ehs/Class/HCL6.htm).
(8) OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://www.oecd1.org/ehs/test/monos.htm).
(9) EPA (1990). Atlas of Dermal Lesions, (20T-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, August 1990.
[Available from OECD Secretariat upon request].
Tabela I
UVRŠČANJE KOŽNIH REAKCIJ V STOPNJE
Nastanek rdečine in krast
|
Rdečine ni … |
0 |
|
Neznatna rdečina (komajda opazna) … |
1 |
|
Zelo razločna rdečina … |
2 |
|
Rdečina od zmerne do resne … |
3 |
|
Resna rdečina (goveja rdečina) in nastanek krast ovirata razvrstitev rdečine … |
4 |
Največ možnih: 4
Tvorba kožnih oteklin
|
Kožnih oteklin ni … |
0 |
|
Neznatna kožna oteklina (komajda opazna) … |
1 |
|
Rahla oteklina (robovi predela dobro vidni, ker so izbočeni) … |
2 |
|
Zmerna kožna oteklina (izbočena približno 1 mm) … |
3 |
|
Resna kožna oteklina (izbočena več kakor 1 mm in razširjena izven predela izpostavitve) … |
4 |
Največ možnih: 4
Za razjasnitev dvomljivih odzivov se lahko opravi histopatološki pregled.
Dodatek
Zaporedna strategija preskušanja za dermalno dražilnost in jedkost
SPLOŠNO
Za znanstveno zanesljivost in zdravje živali se je pomembno izogniti nepotrebni uporabi živali in zmanjšati kakršna koli preskušanja, za katera je verjetno, da bodo povzročila resne odzive pri živalih. Vse informacije o snovi, ki so nanašajo na možnost njene kožne jedkosti/dražilnosti, je treba oceniti pred odločitvijo o preskušanju in vivo. Mogoče že obstaja dovolj dokazov za razvrstitev preskusne snovi glede na njen potencial dermalne jedkosti ali dražilnosti, ne da bi bilo treba opraviti preskušanja na laboratorijskih živalih. Analiza tehtnosti dokazov in strategija zaporednega preskušanja bosta zato zmanjšali potrebo po preskušanju in vivo, zlasti če je verjetno, da bo snov povzročila resne reakcije.
Priporočeno je, da se analiza tehtnosti dokazov uporabi za ovrednotenje obstoječih informacij v zvezi s kožno dražilnostjo in jedkostjo snovi za odločitev, ali je treba opraviti poleg dermalnih študij in vivo dodatne študije, ki bi pomagale ugotoviti lastnosti takšnega potenciala. Kadar so potrebne nadaljnje študije, je priporočena uporaba strategije zaporednega preskušanja za pridobitev ustreznih eksperimentalnih podatkov. Za snovi, ki nimajo anamneze preskušanja, je treba uporabiti strategijo preskušanja, da se pridobi potrebni niz podatkov za ovrednotenje njenega potenciala dermalne jedkosti/dražilnosti. Strategija preskušanja, ki je opisana v tem dodatku, se je razvila v OECD delavnici (1) in se je kasneje uveljavila in razširila v Usklajeni integrirani sistem razvrstitve snovi, nevarnih za zdravje ljudi, in okoljskih učinkov kemijskih snovi, kakor je potrdilo 28. Skupno zasedanje Odbora za kemikalije in Delovna skupina za kemikalije novembra 1998 (2).
Čeprav zaporedno preskušanje ni bistven del metode preskušanja B.4, odraža priporočeni pristop za določanje značilnosti kožne dražilnosti/jedkosti. Ta pristop predstavlja hkrati najboljši običajen postopek in etično merilo uspešnosti za preskušanje in vivo za kožno dražilnost/jedkost. Metoda preskušanja vsebuje smernice za opravljanje preskusa in vivo in povzema dejavnike, ki jih je treba upoštevati pred začetkom takšnega poskusa. Strategija opredeljuje pristop za vrednotenje obstoječih podatkov o lastnostih preskusne snovi glede kožne dražilnosti/jedkosti in stopenjski pristop za pridobivanje ustreznih podatkov o snoveh, za katere se dodatne študije potrebujejo ali za katere se študije niso opravile. Priporoča tudi opravljanje validiranih in sprejetih preskusov in vitro ali ex vivo za kožno jedkost/dražilnost v posebnih okoliščinah.
OPIS VREDNOTENJA IN STRATEGIJE PRESKUŠANJA
Pred začetkom preskusov kot dela strategije zaporednega preskušanja (skica) je treba ovrednotiti vse informacije, ki so na voljo, da bi se odločili, ali je kožno preskušanje in vivo potrebno. Čeprav se pomembne informacije lahko pridobijo iz ocene posameznih parametrov (npr. najvišji pH), je treba upoštevati obstoječe informacije v celoti. Vse pomembne podatke o učinkih zadevne snovi ali analognih snovi je treba oceniti pri sprejemanju odločitve na podlagi tehtnosti dokazov in navesti obrazložitev za to odločitev. Glavni poudarek mora biti na obstoječih podatkih o snovi glede ljudi in živali, sledi izid preskušanja in vitro ali ex vivo. In vivo študij jedkih snovi se je treba izogibati, kadar koli je to možno. Dejavniki, upoštevani v strategiji preskušanja, vključujejo:
Vrednotenje obstoječih podatkov za ljudi in živali (korak 1). Najprej je treba upoštevati obstoječe podatke o ljudeh, npr. klinične ali poklicne študije in poročila o primerih, in/ali preskusne podatke za živali (npr. iz ene same ali iz ponavljajočih se študij toksičnosti z dermalno izpostavitvijo), ker dajejo informacije, ki so neposredno povezane z učinki na kožo. Snovi z znano dražilnostjo ali jedkostjo in snovi, za katere je nedvomno dokazano, da niso jedke ali dražilne, ni treba preskusiti s študijami in vivo.
Analiza odnosov med strukturo in aktivnostjo (SAR) (korak 2). Treba je upoštevati rezultate preskušanj strukturno sorodnih snovi, če so na voljo. Kadar so na razpolago zadostni podatki o ljudeh in/ali živalih za strukturno sorodne snovi ali mešanice takšnih snovi, ki kažejo, kakšen je njihov potencial kožne jedkosti/dražilnosti, se lahko domneva, da bo preskusna snov, ki se vrednosti, povzročila enake odzive. V navedenih primerih preskusne snovi morda ne bo treba preskusiti. Negativni podatki študij strukturno sorodnih snovi ali mešanic takšnih snovi v skladu s strategijo zaporednega preskušanja niso zadosten dokaz o nejedkosti/nedražilnosti snovi. Treba je uporabiti validirane in sprejete SAR pristope za identifikacijo dermalne jedkosti kakor tudi potenciala dražilnosti.
Fizikalno-kemijske lastnosti in kemijske reaktivnosti (korak 3). Snovi, ki kažejo najvišje stopnje pH, kakor npr. ≤ 2,0 in ≥ 11,5, imajo lahko močne lokalne učinke. Če je najvišja stopnja pH podlaga za identificiranje snovi kot jedke za kožo, tedaj se lahko upošteva tudi njena kisla/alkalna rezerva (ali blažilna sposobnost) (3) (4). Če blažilna sposobnost nakazuje, da snov morda ni jedka za kožo, tedaj je treba opraviti nadaljnje preskušanje za potrditev le-tega, najbolje z uporabo validiranega in sprejetega preskusa in vitro ali ex vivo (glej koraka 5 in 6).
Dermalna toksičnost (korak 4). Če se je kemikalija izkazala za zelo toksično po dermalni poti, je možno, da dermalna študija dražilnosti/jedkosti in vivo ne bo izvedljiva, ker bi lahko količina preskusne snovi, ki se jo običajno uporablja, lahko presegala zelo toksičen odmerek in bi sledil pogin ali hudo trpljenje živali. Poleg tega je mogoče, da tedaj, kadar so se že opravile študije dermalne toksičnosti z uporabo kuncev beličnikov do mejne velikosti odmerka 2 000 mg/kg telesne teže ali večje, in se ni opazila nikakršna dermalna dražilnost ali jedkost, dodatno preskušanje za kožno dražilnost/jedkost ne bo potrebno. Upoštevati je treba številne pomisleke, kadar se vrednoti akutna dermalna toksičnost v predhodno opravljenih študijah. Informacije o dermalnih lezijah so lahko nepopolne. Preskušanje in opazovanja so se morda opravila na vrsti živali, ki ni bila kunec, in vrste se lahko zelo razlikujejo glede občutljivosti odzivov. Tudi oblika preskusne snovi, aplicirana na živali, morda ni bila primerna za ocenitev kožne dražilnosti/jedkosti (npr. razredčitev snovi za preskušanje dermalne toksičnosti)(5). V tistih primerih, v katerih so se opravile skrbno načrtovane študije dermalne toksičnosti na kuncih, se negativne ugotovitve kljub temu lahko upoštevajo za zadosten dokaz, da snov ni jedka ali dražilna.
Rezultati in vitro ali ex vivo preskusov (koraka 5 in 6). Snovi, ki so pokazale jedke ali resne dražilne lastnosti v validiranem in sprejetem preskusu in vitro ali ex vivo (6) (7), načrtovanem za ocenitev teh posebnih učinkov, ni treba preskusiti na živalih. Lahko se domneva, da bodo takšne snovi povzročile podobne resne učinke in vivo.
Preskus in vivo na kuncih (koraka 7 in 8). Če se sprejme odločitev o opravljanju preskušanja in vivo na podlagi ocene tehtnosti dokazov, se mora začetni preskus začeti z uporabo ene živali. Če rezultati tega preskusa pokažejo, da je snov jedka za kožo, nadaljnjega preskušanja ni treba opraviti. Če se v začetnem preskusu jedki učinek ni opazil, je treba potrditi dražilni ali negativni odziv z uporabo do dveh dodatnih živali s 4-urnim trajanjem izpostavljenosti. Če se v začetnem preskusu opazi dražilen učinek, se lahko potrditveni preskus izvede na zaporeden način, ali pa z izpostavitvijo obeh dodatnih živali istočasno.
LITERATURA
(1) OECD (1996). Test Guidelines Programme: Final Report on the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held on Solna, Sweden, 22–24 January 1996 (http://www1.oecd.org/ehs/test/background.htm).
(2) OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm).
(3) Worth, A.P., Fentem J.H., Balls M., Botham P.A., Curren R.D., Earl L.K., Esdaile D.J., Liebsch M. (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, 709–720.
(4) Young, J.R., How, M.J., Walker, A.P., Worth, W.M.H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing on Animals. Toxic In Vitro, 2 (1) pp. 19–26.
(5) Patil, S.M., Patrick, E., Maibach, H.I. (1996) Animal, Human, and In Vitro Test Methods for Predicting Skin Irritation, in: Francis N. Marzulli and Howard I. Maibach (editors): Dermatotoxicology. Fifth Edition ISBN 1-56032-356-6, Chapter 31, 411–436.
(6) Testing Method B.40.
(7) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp. 483–524.
Skica
STRATEGIJA PRESKUŠANJA IN VREDNOTENJA ZA DERMALNO DRAŽILNOST/JEDKOST

B.5 AKUTNA TOKSIČNOST: OČESNA DRAŽILNOST/JEDKOST
1. METODA
Ta metoda ustreza OECD TG 405 (2002).
1.1 UVOD
Pri pripravi te dopolnjene metode je veljala posebna pozornost možnim izboljšavam z vrednotenjem vseh obstoječih informacij o preskusni snovi, da bi se izognili nepotrebnemu preskušanju na laboratorijskih živalih zaradi skrbi za zdravje živali. Ta metoda vključuje priporočilo, da je treba pred začetkom opravljanja opisanega preskusa in vivo za akutno očesno dražilnost/jedkost opraviti analizo tehtnosti dokazov (1) na podlagi ustreznih obstoječih podatkov. Kadar ni na voljo dovolj podatkov, je priporočeno, da se pridobijo z uporabo zaporednega preskušanja (2)(3). Strategija preskušanja vključuje opravljanje validiranih in sprejetih in vitro preskusov in je dana kot dodatek k tej metodi preskušanja. Poleg tega je priporočena uporaba in vivo preskusa dermalne dražilnosti/jedkosti, da se predvidi očesna jedkost pred upoštevanjem očesnega preskusa in vivo.
Za znanstveno zanesljivost in zdravje živali je koristno, da se preskušanje in vivo ne začne opravljati, dokler se niso ocenili vsi razpoložljivi podatki, pomembni za možno očesno dražilnost/jedkost snovi z analizo tehtnosti dokazov. Takšni podatki bodo vključevali dokaze iz obstoječih študij na ljudeh in/ali laboratorijskih živalih o dražilnosti/jedkosti ene ali več strukturno sorodnih snovi ali mešanic takšnih snovi, podatke, ki bodo dokazovali močno kislost ali alkalnost snovi (4)(5), in rezultate validiranih in sprejetih in vitro ali ex vivo preskusov za kožno jedkost in dražilnost (6)(6a). Mogoče je, da so se te študije opravile na podlagi analize tehtnosti dokazov ali pa iz nje sledile.
Za nekatere snovi lahko takšna analiza nakaže potrebo po in vivo študijah potenciala očesne jedkosti/dražilnosti snovi. V takšnih primerih bi bilo bolje pred upoštevanjem uporabe očesnega preskusa in vivo najprej opraviti in vivo študijo kožnih učinkih snovi in jih oceniti v skladu z metodo preskušanja B.4 (7). Uporaba analize tehtnostnih dokazov in strategija zaporednega preskušanja bi morali zmanjšati potrebo po in vivo preskušanju za očesno jedkost/dražilnost snovi, za katere obstaja že dovolj dokazov iz drugih študij. Če z uporabo strategije zaporednega preskušanja ni mogoče določiti potenciala očesne jedkosti ali dražilnosti niti po opravljeni in vivo študiji dermalne jedkosti in dražilnosti, se lahko opravi in vivo preskus očesne jedkosti/dražilnosti.
Bolj upoštevana strategija zaporednega preskušanja, ki vključuje opravljanje validiranih in vitro ali ex vivo preskusov za jedkost/dražilnost, je vključena v dodatku k tej metodi preskušanja. To strategijo so razvili in soglasno priporočili udeleženci OECD delavnice (8) in se je sprejela kot priporočena strategija preskušanja v Globalno usklajenem sistemu za razvrstitev kemijskih snovi (GHS) (9). Priporočeno se je ravnati po tej strategiji preskušanja pred opravljanjem preskušanja in vivo. Za nove snovi je priporočen postopen način preskušanja za pridobivanje znanstveno zanesljivih podatkov o jedkosti/dražilnosti snovi. Za obstoječe snovi, za katere ni dovolj podatkov o kožni in očesni jedkosti/dražilnosti, je treba uporabiti to strategijo za zapolnitev vrzeli manjkajočih podatkov. Uporabo drugačne strategije preskušanja ali postopka ali odločitev, da se ne bo uporabil način postopni preskušanja, je treba obrazložiti.
1.2 DEFINICIJE
Očesna dražilnost: je nastanek sprememb na očesu, ki sledijo aplikaciji preskusne snovi na sprednjo površino očesa in ki so v celoti reverzibilne v 21 dneh aplikacije.
Očesna jedkost: je nastanek poškodbe tkiva v očesu ali resnega fizičnega poslabšanja vida, ki sledi aplikaciji preskusne snovi na sprednjo površino očesa in ki ni v celoti reverzibilna v 21 dneh aplikacije.
1.3 PRINCIP PRESKUSNE METODE
Snov, ki jo je treba preskusiti, se nanese v enkratnem odmerku na eno od očes eksperimentalne živali; netretirano oko služi za kontrolo. Stopnja očesne dražilnosti/jedkosti se oceni s seštevanjem lezij na očesni veznici, roženici in šarenici, v točno določenih intervalih. Drugi učinki na oko in nasprotni sistemski učinki se prav tako opišejo, da se zagotovi celovito vrednotenje učinkov. Študija mora trajati dovolj dolgo, da se oceni reverzibilnost ali ireverzibilnost učinkov.
Živali, ki kažejo trajne znake hudega trpljenja in/ali bolečine v kateri koli fazi preskusa, je treba humano usmrtiti in snov skladno s tem oceniti. Kriterije za sprejem odločitve o humani usmrtitvi umirajočih in hudo trpečih živali je mogoče najti v sklicu (10).
1.4 OPIS PRESKUSNE METODE
1.4.1 Priprava za preskus in vivo
1.4.1.1 Izbira živalske vrste
Kunec beličnik je najbolj zaželena laboratorijska žival in uporabljajo se zdrave mlade odrasle živali. Za uporabo drugih sevov ali vrst je potrebna obrazložitev.
1.4.1.2 Priprava živali
Obe očesi vsake eksperimentalne živali, do nadaljnjega izbrane za preskušanje, je treba pregledati v 24 urah, preden se preskušanje začne. Živali, ki kažejo očesno dražilnost, očesne napake ali že prej nastalo poškodbo roženice, se ne smejo uporabiti.
1.4.1.3 Pogoji bivanja in hranjenja
Živali morajo imeti vsaka svoj prostor. Temperatura prostora za preskuse z živalmi mora znašati za kunce 20 oC (± 3 oC). Čeprav mora biti relativna vlažnost najmanj 30 % in po možnosti ne sme presegati 70 %, mora biti ciljna vlažnost, razen med čiščenjem prostora, 50 do 60 %. Osvetlitev mora biti umetna v zaporedju 12 ur svetlobe in 12 ur teme. Za hranjenje se lahko uporabijo običajne predpisane laboratorijske vrste hrane z neomejeno količino pitne vode.
1.4.2 Preskusni postopek
1.4.2.1 Aplikacija preskusne snovi
Preskusno snov je treba dati v mešiček veznice enega očesa vsake živali, potem ko se nežno potegne spodnja veka stran od zrkla. Veke se nato nežno držijo skupaj približno 1 sekundo, da se prepreči izguba materiala. Drugo oko, ki ostane netretirano, služi za kontrolo.
1.4.2.2 Izpiranje
Oči preskusnih živali se ne smejo umivati najmanj 24 ur po vkapanju preskusne snovi, z izjemo trdnih snovi (glej oddelek 1.4.2.3.2) in v primeru takojšnjih jedkih ali dražilnih učinkov. Po 24 urah se lahko uporabi izpiranje, če se meni, da je to ustrezno.
Uporaba satelitske skupine živali za raziskovanje vpliva izpiranja ni priporočena, razen če je znanstveno upravičena. Če je satelitska skupina potrebna, je treba uporabiti dva kunca. Pogoje izpiranja je treba skrbno dokumentirati, npr. čas izpiranja; sestavo in temperaturo raztopine za izpiranje; trajanje, volumen in hitrost aplikacije.
1.4.2.3 Velikost odmerka
1.4.2.3.1 Preskušanje tekočih snovi
Za preskušanje tekočih snovi se uporablja odmerek 0,1 ml. Razpršila pod pritiskom se ne smejo uporabljati za vkapanje snovi neposredno v oko. Tekoče razpršilo je treba iztisniti in zbrati v posodo pred vkapanjem 0,1 ml v oko.
1.4.2.3.2 Preskušanje trdnih snovi
Pri preskušanju trdnih snovi, kašnatih zmesi in zdrobljenih snovi, mora imeti uporabljena količina volumen 0,1 ml ali težo, ki ni večja kakor 100 mg. Preskusni material je treba zdrobiti v fin prah. Volumen trdnega materiala je treba izmeriti po rahlem zgoščevanju, npr. z rahlim potrkavanjem na merilno posodo. Če fiziološki mehanizmi niso odstranili iz očesa preskusne živali trdno preskusno snov na prvi časovni točki opazovanja eno uro po tretiranju, se lahko oko izplakne z raztopino vode in soli ali destilirano vodo.
1.4.2.3.3 Preskušanje razpršil
Priporočeno je, da se vsa utekočinjena razpršila in razpršila pod pritiskom zberejo v posodo pred vkapanjem v oko. Izjema so snovi v posodah za razpršila pod pritiskom, ki jih ni mogoče zbrati zaradi izhlapevanja. V takšnih primerih je treba držati oko odprto in nanesti preskusno snov v oko enostavnim z vbrizgom, ki traja približno eno sekundo, z razdalje 10 cm neposredno pred očesom. Ta razdalja se lahko spreminja v odvisnosti od pritiska razpršila in njegove vsebine. Paziti je treba, da se oko ne poškoduje zaradi pritiska razpršila. V ustreznih primerih bo mogoče potrebno oceniti potencial za nastanek „mehanske“ poškodbe očesa zaradi moči razpršila.
Oceno odmerka iz razpršila je mogoče dobiti z naslednjim preskusom: snov se razprši na tehtalni papir skozi odprtino velikosti kunčjega očesa, ki je nameščena neposredno pred papir. Porast teže papirja se uporabi za približno določitev količine, razpršene v oko. Za hlapljive snovi je mogoče odmerek oceniti s tehtanjem v zbirni posodi pred in po odstranitvi preskusnega material.
1.4.2.4 Začetni preskus (In vivo preskus očesne dražilnosti/jedkosti z uporabo ene živali)
Kot je opredeljeno v strategiji zaporednega preskušanja (glej Dodatek 1), je zelo priporočeno, da se preskus in vivo na začetku izvede z uporabo ene živali.
Če rezultati tega preskusa kažejo, da je snov jedka ali resno dražilna za oči z uporabo opisanega postopka, se nadaljnje preskušanje za očesno dražilnost ne opravi.
1.4.2.5 Lokalni anestetiki
Lokalni anestetiki se uporabljajo v odvisnosti od primera. Če analiza tehtnosti dokazov kaže, da snov lahko povzroči bolečino, ali če začetno preskušanje pokaže, da bo nastala boleča reakcija, se lokalni anestetik lahko uporabi pred vkapanjem preskusne snovi. Vrsto, koncentracijo in odmerek lokalnega anestetika je treba skrbno izbrati, da se zagotovi, da razlike pri reagiranju na preskusno snov ne bodo posledica njegove uporabe. Na podoben način je treba anestezirati kontrolno oko.
1.4.2.6 Potrditveni preskus (In vivo preskus dražilnosti z dodatnimi živalmi)
Če se jedek učinek ne opazi v začetnem preskusu, je treba dražilni ali negativni odziv potrditi z uporabo do dveh dodatnih živali. Če se v začetnem preskusu opazi resen dražilen učinek, ki kaže, da je možen močan (ireverzibilen) učinek pri potrditvenem preskušanju, je priporočeno, da se potrditveni preskus izvede na zaporeden način na eni živali namesto s sočasno izpostavitvijo dveh dodatnih živali. Če druga žival razkrije jedke ali resne dražilne učinke, se preskus ne nadaljuje. Mogoče bodo potrebne dodatne živali za potrditev šibkih ali zmernih dražilnih odzivov.
1.4.2.7 Obdobje opazovanja
Trajanje obdobja opazovanja mora biti dovolj dolgo, da se lahko v celoti ovrednoti obseg in reverzibilnost opaženih učinkov. Preskus je treba zaključiti ob katerem koli času, kadar kaže žival trajajoče znake hude bolečine ali trpljenja (9). Za določitev reverzibilnosti učinkov je običajno treba živali opazovati 21 dni po nanašanju preskusne snovi. Če se opazi reverzibilnost pred 21 dnem, je treba takrat preskus zaključiti.
1.4.2.7.1 Klinična opazovanja in uvrstitev očesnih reakcij v stopnje
Oči je treba pregledati po 1, 24, 48 in 72 urah po aplikaciji preskusne snovi. Živali se lahko preskušajo le toliko časa, kolikor je potrebno za pridobitev dokončnih informacij. Živali, ki trajno kažejo hude bolečine in trpljenje, je treba nemudoma humano usmrtiti in v skladu s tem oceniti snov. Usmrtiti je treba živali z naslednjimi očesnimi lezijami po vkapanju: perforacija roženice ali značilno gnojenje roženice vključno s stafilomom; kri v sprednjem delu očesa; stopnja 4 motnosti roženice, ki ne popusti 48 ur; odsotnost svetlobnega refleksa (odziv šarenice stopnje 2), ki traja 72 ur; gnojenje veznične vrečke; nekroza veznične membrane ali žmurke; ali odstopanje. To pa zaradi tega, ker te lezije na splošno niso reverzibilne.
Živali, pri katerih se ne razvijejo očesne lezije, se lahko usmrti ne prej kot 3 dni po instilaciji. Živali z blagimi do zmernimi lezijami je treba opazovati dokler lezije ne izginejo ali 21 dni, ko se raziskava zaključi. Opazovanja se izvajajo po 7, 14 in 21 dneh, da se določi stanje lezij ter njihova reverzibilnost ali ireverzibilnost.
Pri vsaki preiskavi je treba zabeležiti stopnjo očesne reakcije (veznice, roženice in šarenice) (tabela 1). Navesti je treba tudi katere koli druge poškodbe očesa (npr. površinski keratitis/panus, obarvanost) ali neželene sistemske učinke.
Za lažji pregled reakcij se lahko uporablja binokularna lupa, ročni oftalmoskop, biomikroskop ali drug ustrezen pripomoček. Po evidentiranju rezultatov opazovanja po 24 urah se lahko pregled oči nadaljuje s pomočjo fluoresceina.
Določanje stopnje očesnih odzivov/reakcij je nujno subjektivno. Da bi pospešili usklajevanje pri določanju stopnje očesnih odzivov in nudili pomoč preskuševalnim laboratorijem ter vsem sodelujočim pri oblikovanju in razlagi rezultatov opazovanj, mora biti osebje, ki izvaja ta opazovanja, ustrezno usposobljeno, da obvlada uporabljeni sistem določanja stopnje.
2. PODATKI
2.2 VREDNOTENJE REZULTATOV
Rezultate očesne dražilnosti je treba oceniti v zvezi z vrsto in resnostjo lezij ter njihovo reverzibilnostjo ali pomanjkljivostjo reverzibilnosti. Posamezni rezultati ne predstavljajo absolutnega standarda za dražilne lastnosti materiala, ker se ocenjujejo tudi drugi učinki preskusnega materiala. Namesto tega je treba obravnavati posamezne rezultate kot referenčne vrednosti in so pomembni le, če jih potrjuje popoln opis in vrednotenje vseh opazovanj.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje informacije:
Obrazložitev za preskušanje in vivo: analiza tehtnosti dokazov prej obstoječih podatkov, vključno z rezultati strategije zaporednega preskušanja:
— opis pomembnih podatkov, ki so na voljo pred preskušanjem,
— podatki, pridobljeni v vsaki fazi strategije preskušanja,
— opis opravljenih in vitro preskusov, vključno s podrobnimi podatki o postopkih, rezultati, dobljenimi s preskusnimi/referenčnimi snovmi,
— opis dražilnih kožnih reakcij in vivo/opravljena korozijska raziskava vključno z dobljenimi rezultati,
— analiza tehtnosti dokazov za opravljanje študije in vivo.
Preskusna snov:
— identifikacijski podatki (npr. številka CAS; vir, čistost, znane nečistoče, številka skupine),
— fizikalno stanje in fizikalno-kemijske lastnosti (npr.: pH hlapnost, topnost, stabilnost),
— če gre za mešanico, sestava in relativni odstotek sestavin,
— če se uporabi lokalni anestetik, identifikacija, čistost, vrsta, odmerek in možen medsebojni vpliv s preskusno snovjo.
Nosilec:
— identifikacija, koncentracija (kjer je ustrezno), uporabljeni volumen,
— obrazložitev upravičenosti izbire nosilca.
Preskusne živali:
— uporabljena vrsta/sev, obrazložitev za uporabo živali, če to ni kunec beličnik,
— starost vsake živali na začetku študije,
— število živali istega spola v preskusni in kontrolni skupini (če je potrebno),
— teže posameznih živali na začetku in na zaključku preskusa,
— vir, pogoji bivanja, vrsta hrana, itd.
Rezultati:
— opis metode, uporabljene za merjenje rezultatov dražilnosti na vsaki časovni točki opazovanja (npr. poševna ročna svetilka, biomikroskop, fluorescin),
— preglednica s podatki o dražilnem/jedkem odzivu za vsako žival na vsaki časovni točki opazovanja do odstranitve vsake živali iz preskusa,
— narativni opis stopnje in narave opisane dražilnosti ali korozije,
— pripovedni opis stopnje in vrste opaženih lezij v očesu (npr. vaskularizacije, tvorbe krp, zlepkov, madežev),
— opis neočesnih lokalnih in sistemskih nasprotnih učinkov in histopatoloških ugotovitev, če so.
Razprava o rezultatih.
3.2 RAZLAGA REZULTATOV
Sklepanje o veljavnosti rezultatov študij očesne dražilnosti na laboratorijskih živalih za ljudi je veljavno le v omejeni meri. V mnogih primerih je kunec beličnik bolj občutljiv na očesne dražilne snovi ali jedke snovi kakor ljudje.
Pri razlagi podatkov je treba paziti, da se izključi dražilnost, ki je posledica sekundarne infekcije.
4. LITERATURA
(1) Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410–429.
(2) de Silva, O., Cottin, M., Dami, N., Roguet, R., Catroux, P., Toufic, A., Sicard, C., Dossou, K.G., Gerner, I., Schlede, E., Spielmann, H., Gupta, K.C., Hill, R.N. (1997) Evaluation of Eye Irritation Potential: Statistical Analysis and Tier Testing Strategies. Food Chem. Toxicol 35, 159–164.
(3) Worth A.P. and Fentem J.H. (1999) A general approach for evaluating stepwise testing strategies ATLA 27, 161–177
(4) Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19–26.
(5) Neun, D.J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227–231.
(6) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp. 483–524.
(6a) Testing Method B.40 Skin Corrosion.
(7) Testing method B.4. Acute toxicity: dermal irritation/corrosion.
(8) OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd.org/ehs/test/background.htm).
(9) OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm).
(10) OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://www.oecd.org/ehs/test/monos.htm).
Tabela I
RAZVRŠČANJE OČESNIH LEZIJ V STOPNJE
Roženica
Motnost: stopnja gostote (odčitati jo je treba na najbolj gostem gostejšem predelu) ( 15 )
|
Ni gnojenja ali motnosti … |
0 |
|
Razpršene ali obširne površine motnosti (ki niso rahla motnost običajnega leska, delci šarenice jasno vidni) |
1 |
|
Prosojna površina razločna brez težav; delci šarenice rahlo zatemnjeni … |
2 |
|
Spodnja površina: delci šarenica se ne razločijo; velikost zenice se komajda razloči … |
3 |
|
Motna roženica: šarenica se ne razloči zaradi motnosti … |
4 |
Največ možnih: 4
OPOMBE
Šarenica
|
Normalna … |
0 |
|
Opazno poglobljene gube, naval krvi, otekanje, zmerna hiperemija okoli roženice; ali injekcija; šarenica reagira na svetlobo (počasna reakcija se upošteva kot učinek) … |
1 |
|
Krvavitev, resno propadanje ali odsotnost reakcije na svetlobo … |
2 |
Največ možnih: 2
Očesne veznice
Rdečina (nanaša se na veznice vek in nabrekle veznice, z izjemo roženice in šarenice)
|
normalna … |
0 |
|
Nekaj krvnih žil je hiperemičnih (injicirano) … |
1 |
|
Razpršena, škrlatna barva; posamezne žile niso zlahka razločne … |
2 |
|
Razširjena goveja rdečina … |
3 |
Največ možnih: 3
Kemoterapija
Otekanje (nanaša se na veke in/ali žmurke)
|
Normalno … |
0 |
|
Nekoliko otečeno nad normalnim … |
1 |
|
Očitno otečeno, z delnim zavihanjem vek navzven … |
2 |
|
Otečeno, z napol zaprtimi vekami … |
3 |
|
Otečeno, z več kakor napol zaprtimi vekami … |
4 |
Največ možnih: 4
Dodatek
Zaporedna strategija preskušanja za očesno dražilnost in jedkost
SPLOŠNO
Za znanstveno zanesljivost in zdravje živali se je pomembno izogniti nepotrebni uporabi živali in zmanjšati kakršna koli preskušanja, za katera je verjetno, da bodo povzročila resne odzive pri živalih. Vse informacije o snovi, ki so nanašajo na njeno možno jedkost/dražilnost, je treba oceniti pred odločitvijo o preskušanju in vivo. Mogoče že obstaja dovolj dokazov za razvrstitev preskusne snovi glede na njen potencial očesne jedkosti ali dražilnosti, ne da bi bilo treba opraviti preskušanja na laboratorijskih živalih. Analiza tehtnosti dokazov in strategija zaporednega preskušanja bosta zato zmanjšali potrebo po preskušanju in vivo, zlasti če je verjetno, da bo snov povzročila resne reakcije.
Priporočeno je, da se analiza tehtnosti dokazov uporabi za vrednotenje obstoječih informacij v zvezi z očesno dražilnostjo in jedkostjo snovi in za odločitev, ali je treba opraviti poleg očesnih študij in vivo dodatne študije, ki bi pomagale opredeliti takšen potencial. Kadar so potrebne nadaljnje študije, je priporočena uporaba strategije zaporednega preskušanja za pridobitev ustreznih eksperimentalnih podatkov. Za snovi, ki nimajo anamneze preskušanja, je treba uporabiti strategijo zaporednega preskušanja, da se pridobijo potrebni podatki za vrednotenje njihovega potenciala očesne jedkosti/dražilnosti. Strategija preskušanja, ki je opisana v tem dodatku, se je razvila v OECD delavnici (1). Kasneje se je uveljavila in razširila v Usklajeni integrirani sistem razvrstitve nevarnih snovi za zdravje ljudi, in okoljskih učinkov kemijskih snovi, kakor je potrdilo 28. Skupno zasedanje Odbora za kemikalije in Delovna skupina za kemikalije novembra 1998 (2).
Čeprav zaporedno preskušanje ni bistven del metode preskušanja B.4, prikazuje priporočeni pristop za določanje značilnosti očesne dražilnosti/jedkosti. Ta pristop predstavlja hkrati najboljši običajen postopek in etično merilo uspešnosti za preskušanje in vivo za kožno dražilnost/jedkost. Metoda preskušanja vsebuje smernice za opravljanje preskusa in vivo in povzema dejavnike, ki jih je treba upoštevati pred začetkom takšnega preskusa. Strategija zaporednega preskušanja opredeljuje pristop tehtnosti dokazov za vrednotenje obstoječih podatkov o lastnostih očesno dražilnih/jedkih snovi in stopenjski pristop za pridobivanje pomembnih podatkov o snoveh, za katere se dodatne študije potrebujejo ali za katere se študije niso opravile. Strategija vključuje opravljanje validiranih in sprejetih preskusov in vitro ali ex vivo in nato opravljanje študij kožne dražilnosti/jedkosti po metodi preskušanja B.4 v posebnih okoliščinah (3)(4).
OPIS STRATEGIJE POSTOPNEGA PRESKUŠANJA
Pred začetkom preskusov kot dela strategije zaporednega preskušanja (Skica) je treba ovrednotiti vse informacije, ki so na voljo, da bi se odločili, ali je očesno preskušanje in vivo potrebno. Čeprav se pomembne informacije lahko pridobijo iz ocene posameznih parametrov (npr. najvišjega pH), je treba upoštevati obstoječe informacije v celoti. Vse pomembne podatke o učinkih zadevne snovi ali analognih snovi je treba oceniti pri sprejemanju odločitve na podlagi tehtnosti dokazov in navesti obrazložitev za to odločitev. Glavni poudarek mora biti na obstoječih podatkih o snovi glede ljudi in živali, sledi izid preskušanja in vitro ali ex vivo. In vivo študij jedkih snovi se je treba izogibati, kadar koli je to možno. Dejavniki, upoštevani v strategiji preskušanja, vključujejo:
Vrednotenje obstoječih podatkov za ljudi in živali (korak 1). Najprej je treba upoštevati obstoječe podatke o ljudeh, npr. klinične ali poklicne študije in poročila o primerih, in/ali podatke preskusov na živalih, ker dajejo informacije, ki so neposredno povezane z učinki na oči. Snovi z znano jedkostjo ali resno dražilnostjo za oči, se ne smejo vkapati v oči živali, kakor tudi ne snovi, ki kažejo jedke ali dražilne učinke na koži; takšne snovi je treba prav tako obravnavati kot jedke in/ali dražilne za oči. Snovi, za katere je dovolj dokazov, da niso jedke in ne dražilne, iz predhodno opravljenih očesnih študij, prav tako ni treba preskusiti z očesnimi študijami in vivo.
Analiza odnosov med strukturo in aktivnostjo (SAR) (korak 2). Treba je upoštevati rezultate preskušanj strukturno sorodnih snovi, če so na voljo. Kadar so na razpolago zadostni podatki o ljudeh in/ali živalih za strukturno sorodne snovi ali mešanice takšnih snovi, ki kažejo, kakšen je njihov potencial očesne jedkosti/dražilnosti, se lahko domneva, da bo preskusna snov, ki se vrednoti, povzročila enake odzive. V navedenih primerih preskusne snovi morda ne bo treba preskusiti. Negativni podatki študij strukturno sorodnih snovi ali mešanic takšnih snovi v skladu s strategijo zaporednega preskušanja niso zadosten dokaz o nejedkosti/nedražilnosti snovi. Treba je uporabiti validirane in sprejete SAR pristope za identifikacijo dermalne jedkosti in potenciala dražilnosti za dermalne kakor tudi očesne učinke.
Fizikalno-kemijske lastnosti in kemijska reaktivnost (korak 3). Snovi, ki kažejo najvišje stopnje pH, kakor npr. < 2,0 in ≥ 11,5, imajo lahko močne lokalne učinke. Če je najvišja stopnja pH podlaga za identificiranje snovi kot jedke ali dražilne za oči, tedaj se lahko upošteva tudi njena kisla/alkalna rezerva (ali blažilna sposobnost) (3) (4). Če blažilna sposobnost nakazuje, da snov morda ni jedka za kožo, tedaj je treba opraviti nadaljnje preskušanje za potrditev le-tega, najbolje z uporabo validiranega in sprejetega preskusa in vitro ali ex vivo (glej oddelek koraka 5 in 6).
Upoštevanje drugih obstoječih informacij (korak 4). V tej fazi je treba oceniti vse razpoložljive informacije o sistemski toksičnosti po dermalni poti. Upoštevati je treba tudi akutno dermalno toksičnost preskusne snovi. Če se je pokazalo, da je snov zelo toksična po dermalni poti, je morda ne bo treba preskusiti v očesu. Čeprav ni nujno, da sta akutna dermalna toksičnost in očesna dražilnost/jedkost medsebojno povezani, se lahko domneva, da bo sredstvo, ki je zelo toksično po dermalni poti, pokazalo tudi visoko toksičnost, ko se bo vkapalo v oko. Takšne podatke je treba upoštevati tudi med korakoma 2 in 3.
Rezultatov in vitro ali ex vivo preskusov (koraka 5 in 6). Snovi, ki so pokazale jedke ali resne dražilne lastnosti v validiranem in sprejetem preskusu in vitro ali ex vivo (6)(7), ki se je validiral in sprejel izrecno za ocenitev jedkosti/dražilnosti za oči in kožo, ni treba preskusiti na živalih. Lahko se domneva, da bodo takšne snovi povzročile podobne resne učinke in vivo. Če niso na voljo validirani in sprejeti preskusi in vitrolex vivo, se lahko preskočita koraka 5 in 6 in se nadaljuje neposredno s korakom 7.
Ocena in vivo preskusa dermalne dražilnosti ali jedkosti snovi (korak 7). Če ni dovolj dokazov za pripravo zaključne analize tehtnosti dokazov za potencial očesne dražilnosti/jedkosti snovi na podlagi podatkov iz zgoraj navedenih študij, je treba naprej oceniti potencial kožne dražilnosti/jedkosti in vivo z uporabo metode preskušanja B.4 (4) in spremljajočega dodatka (9). Če se pokaže, da snov povzroča jedkost ali resno kožno dražilnost, jo je treba obravnavati kot jedko očesno dražilno snov, razen če informacije potrjujejo alternativen zaključek. Tedaj preskusa in vivo ne bi bilo potrebno opraviti. Če snov ni jedka ali resno dražilna za kožo, je treba opraviti in vivo očesni preskus.
Preskus in vivo na kuncih (koraka 8 in 9). Očesno preskušanje in vivo je treba pričeti z začetnim preskusom z uporabo ene živali. Če rezultati tega preskusa pokažejo, da je snov resno dražilna ali jedka za oči, nadaljnjega preskušanja ni treba opraviti. Če navedeni preskus ni odkril nobenih jedkih ali resno dražilnih učinkov, se opravi potrditveni preskus z dvema dodatnima živalma.
LITERATURA
(1) OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicol ogical Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www. oecd. org/ehs/test/background.htm).
(2) OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm).
(3) Worth, A.P. and Fentem J.H. (1999). A General Approach for Evaluating Stepwise Testing Strategies. ATLA 27, 161-177.
(4) Testing method B.4. Acute Toxicity: dermal irritation/corrosion.
(5) Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19–26.
(6) Neun, D.J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227–231.
(7) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp. 483–524.
(8) Testing Method B.40 Skin Corrosion.
(9) Annex to Testing method B.4: A Sequential Testing Strategy for Skin Irritation and Corrosion.
Skica
STRATEGIJA PRESKUŠANJA IN VREDNOTENJA ZA OČESNO DRAŽILNOST/JEDKOST

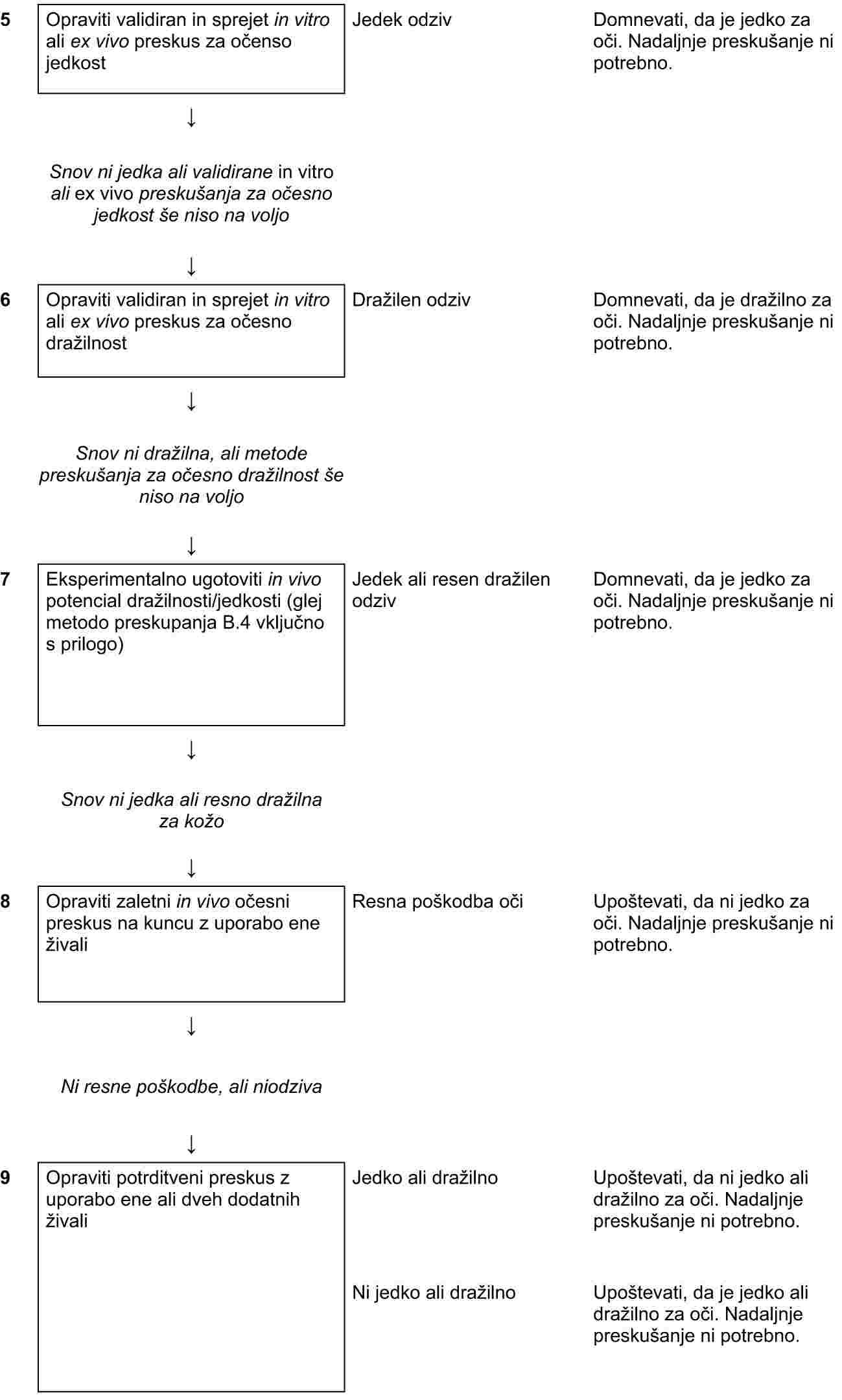
B.6 SENZIBILIZACIJA KOŽE
1. METODA
1.1 UVOD
Opombe:
Občutljivost preskusov in njihova sposobnost, da odkrijejo morebitne senzibilizatorje človeške kože, veljata za pomembni v sistemu razvrščanja toksičnosti v zvezi z javnim zdravjem.
Ni ene same preskusne metode, ki bi lahko ustrezno opredelila vse snovi s potencialom za senzibilizacijo človeške kože in bila hkrati uporabna za vse snovi.
Pri izbiri preskusa je treba upoštevati dejavnike, kakršne so fizikalne lastnosti snovi, vključno z njeno sposobnostjo penetracije v kožo.
Razviti sta bili dve vrsti preskusov na morskih prašičkih: pomožni preskusi, pri katerih se alergično stanje potencira z raztopitvijo ali suspendiranjem preskusne snovi v kompletnem Freundovem adjuvantu (KFA), in preskusi, pri katerih se adjuvant ne uporablja.
Pomožni preskusi so običajno natančnejši pri napovedovanju verjetnega senzibilizacijskega učinka neke snovi na človeško kožo od tistih metod, ki ne uporabljajo kompletnega Freundovega adjuvanta, in so zato primernejši.
Med pomožnimi preskusi se pogosto uporablja maksimizacijski preskus na morskih prašičkih (Gpmt). Čeprav se za odkrivanje potenciala snovi, da povzroči senzibilizacijo kože, lahko uporabijo mnoge druge metode, se Gpmt šteje za najboljši pomožni preskus.
Za mnoge razrede kemikalij se preskusi, ki ne uporabljajo adjuvanta (med katerimi se največ uporablja Buehlerjev preskus), štejejo za manj občutljive.
V nekaterih primerih lahko obstajajo utemeljeni razlogi za izbiro Buehlerjevega preskusa, ki namesto intradermalne injekcije, uporabljene v preskusu maksimizacije na morskih prašičkih, vključuje lokalno nanašanje. Če se uporabi Buehlerjev preskus, mora biti ta izbira znanstveno utemeljena.
V tej metodi sta opisana maksimizacij ski preskus na morskih prašičkih in Buehlerjev preskus. Uporabijo se lahko druge metode, če so dobro validirane in znanstveno utemeljene.
Če je rezultat priznanega predhodnega preskusa pozitiven, se lahko preskusna snov šteje za možnega povzročitelja senzibilizacij e in ni potrebna izvedba dodatnega preskusa na morskih prašičkih. Če pa je rezultat takšnega preskusa negativen, je treba izvesti preskus na morskih prašičkih v skladu s postopkom, opisanim v tej preskusni metodi.
Glej tudi del B splošnega uvoda.
1.2 OPREDELITVE POJMOV
Senzibilizacija kože: (alergijski kontaktni dermatitis) je imunološko pogojena kožna reakcija na neko snov. Pri človeku so značilne reakcije lahko srbenje, eritem, edem, papule, mehurji, gnojni mehurčki ali kombinacija teh reakcij. Pri drugih vrstah so reakcije lahko različne ter sta lahko vidna zgolj eritem in edem.
Indukcijska izpostavljenost: eksperimentalna izpostavljenost subjekta preskusni snovi za povzročitev hipersenzibilnega stanja.
Indukcijsko obdobje: najmanj enotedensko obdobje po indukcijski izpostavljenosti, v katerem se lahko razvije hipersenzibilno stanje.
Provokacij ska izpostavljenost: eksperimentalna izpostavljenost predhodno tretiranega subjekta preskusni snovi, izvedena po indukcijskem obdobju, da bi se ugotovilo, če subjekt reagira hipersenzibilno.
1.3 REFERENČNE SNOVI
Vsakih šest mesecev je treba oceniti senzibilnost in zanesljivost uporabljene eksperimentalne tehnike z uporabo snovi, za katere se ve, da povzročajo blago do zmerno senzibilizacijo kože.
Če je preskus pravilno izveden, se lahko v pomožnem preskusu za blage/zmerne senzibilizatorje pričakuje vsaj 30 % reakcija in vsaj 15 % v neadjuvantnem preskusu.
Prednostno se uporabljajo naslednje snovi.
|
Števila CAS |
Števila Einecs |
Imena Einecs |
Splošna imena |
|
101-86-0 |
202-983-3 |
α-heksilcinamaldehid |
α -heksilcinamaldehid |
|
149-30-4 |
205-736-8 |
benzotiazol-2-tiol (merkaptobenzotiazol) |
kaptaks |
|
94-09-7 |
202-303-5 |
benzokain |
nordkain |
Uporabijo se lahko druge kontrolne snovi, ki izpolnjujejo zgoraj navedena merila, če to upravičujejo okoliščine.
1.4 PRINCIP PRESKUSNE METODE
Na začetku so preskusne živali izpostavljene preskusni snovi z intradermalnimi injekcijami in/ali epidermalnim nanosom (indukcijska izpostavljenost). Po 10- do 14-dnevnem počivalnem obdobju (indukcijsko obdobje), v katerem se lahko razvije imunska reakcija, so živali izpostavljene provokacijskemu odmerku. Obseg in stopnja kožne reakcije na provokacijsko izpostavljenost pri preskusnih živalih se primerja z reakcijo, opaženo pri živalih kontrolne skupine, pri katerih med indukcijo posnemajo tretiranje in ki jih provokacij sko izpostavijo.
1.5 OPIS PRESKUSNIH METOD
Če je odstranitev preskusne snovi nujna, se to doseže z uporabo vode ali ustreznega topila, ne da bi se spremenila obstoječa reakcija ali okrnil epidermis.
1.5.1 Maksimizacijski preskus na morskih prašičkih (GPMT)
1.5.1.1
Zdravi mladi odrasli albino morski prašički so najmanj 5 dni pred preskusom aklimatizirani na razmere v laboratoriju. Pred preskusom so živali naključno razdeljene v skupine, ki bodo tretirane. Glede na preskusno metodo, ki je uporabljena, se dlaka lahko odvzame s striženjem, britjem ali kemično depilacijo. Pri tem je treba paziti, da koža ostane nepoškodovana. Živali je treba pred začetkom in na koncu preskusa stehtati.
1.5.1.2
1.5.1.2.1 Preskusne živali
Uporabljajo se albino morski prašički tistih sevov, ki se običajno uporabljajo v laboratorijih.
1.5.1.2.2 Število in spol
Uporabijo se lahko živali moškega in/ali ženskega spola. Samice morskih prašičkov morajo biti nuliparne in ne breje.
Skupina, ki bo tretirana, mora biti sestavljena iz najmanj 10, kontrolna skupina pa iz najmanj 5 živali. Če je prva skupina obsegala manj kakor 20 primerkov in druga manj kakor 10 ter ni mogoče sklepati, da je preskusna snov senzibilizator, se močno priporoča nadaljnje preskušanje na najmanj 20 preskusnih in 10 kontrolnih živali.
1.5.1.2.3 Velikost odmerkov
Koncentracija preskusne snovi, uporabljene za vsako indukcijsko izpostavljenost, naj bo sistemsko dobro tolerirana in naj ustreza najvišjemu odmerku, ki lahko povzroči blago do zmerno draženje kože. Koncentracija, ki se uporabi za provokacijsko izpostavljenost, naj ustreza najvišjemu odmerku, ki ne povzroči draženja. Če je potrebno, se lahko ustrezne koncentracije določijo s pilotno študijo, izvedeno na dveh ali treh živalih. V ta namen je priporočljiva uporaba živali, ki so bile tretirane s kompletnim Freundovim adjuvantom (KFA).
1.5.1.3
1.5.1.3.1 Indukcija
Dan 0 – tretirana skupina
V ramenske dele, s katerih so bile odstranjene dlake, se vbrizgajo trije pari intradermalnih injekcij volumna 0,1 ml, in sicer vsaka injekcija iz para na svoji strani sredinske črte.
Injekcija 1: zmes 1:1 (v/v) KFA/voda ali fiziološka raztopina
Injekcija 2: preskusna snov v ustreznem nosilcu pri izbrani koncentraciji
Injekcija 3: preskusna snov pri izbrani koncentraciji, formulirana v zmesi 1:1 (v/v) KFA/voda ali fiziološka raztopina
V injekciji 3 so v vodi topne snovi raztopljene v vodni fazi, preden se zmešajo s KFA. Lipotopne ali netopne snovi so suspendirane v KFA, preden so kombinirane z vodno fazo. Končna koncentracija preskusne snovi mora biti enaka tisti, ki je bila uporabljena v injekciji 2.
Injekciji 1 in 2 se vbrizgata ena poleg druge in čim bliže glavi, medtem ko se injekcija 3 vbrizga proti repnemu delu preskusnega območja.
Dan 0 – kontrolna skupina
Na ista območja kakor pri tretiranih živali se dajo tri serije dveh intradermalnih injekcij volumna 0,1 ml.
Injekcija 1: zmes 1:1 (v/v) KF A/voda ali fiziološka raztopina
Injekcija 2: nerazredčeno sredstvo
Injekcija 3: 50 % m/v formulacija nosilca v zmesi 1:1 (v/v) KF A/voda ali fiziološka raztopina.
Dan 5–7 – tretirana skupina in kontrolna skupina
Približno štiriindvajset ur pred lokalnim indukcijskim nanosom, če snov ni senzibilizator kože, je preskusno območje po striženju na kratko in/ali britju tretirano z 0,5 ml 10 % natrijevega lauril sulfata v vazelinu zato, da bi bilo povzročeno lokalno draženje.
Dan 6–8 – tretirana skupina
S preskusnega območja se spet odstranijo dlake. Filtrirni papir (2 × 4 cm), povsem impregniran s preskusno snovjo v ustreznem nosilcu, se nanese na preskusno območje in je z okluzivnim povojem v stiku s kožo 48 ur. Izbira nosilca mora biti utemeljena. Trde snovi so fino uprašene in inkorporirane v ustrezni nosilec. Če je primerno, se tekočine lahko nanesejo nerazredčene.
Dan 6–8 – kontrolna skupina
S preskusnega območja se spet odstranijo dlake. Na preskusno območje se podobno nanese zgolj nosilec, ki je z okluzivnim povojem v stiku s kožo 48 ur.
1.5.1.3.2 Provokacija
Dan 20–22 – tretirana skupina in kontrolna skupina
Z bokov tretiranih in kontrolnih živali se odstrani dlaka. Na en bok živali se nanese obliž ali gaza, impregnirana s preskusno snovjo in, če je primerno, se tudi na drugi bok lahko nanese obliž ali gaza, impregnirana zgolj z nosilcem. Obliži so 24 ur v stiku s kožo z okluzivnim povojem.
1.5.1.3.3 Opazovanje in ocenjevanje: tretirana skupina in kontrolna skupina
— približno 21 ur po odstranitvi obliža je treba provokacijsko območje očistiti ter ostriči na kratko in/ali obriti in depilirati, če je treba,
— približno 3 ure pozneje (približno 48 ur od začetka provokacijskega nanosa) se opazuje in zabeleži reakcija kože glede na ocene, prikazane v dodatku,
— približno 24 ur po tem opazovanju se opravi in spet zabeleži drugo opazovanje (72 ur).
Spodbuja se hitro čekiranje preskusnih in kontrolnih živali.
Če je treba pojasniti rezultate, pridobljene v prvi provokaciji, je treba preučiti možnost izvedbe druge provokacije (t. j. ponovne provokacije), če je to primerno z novo kontrolno skupino, približno teden dni po prvi provokaciji. Ponovna provokacij a se lahko izvede tudi s prvotno kontrolno skupino.
Vse kožne reakcije in kakršni koli nenavadni izsledki, vključno s sistemskimi reakcijami, ki so posledica indukcije in postopkov provokacij e, je treba opazovati in zabeležiti v skladu z ocenjevalno lestvico po Magnussonu/Kligmanu (glej dodatek). Za razjasnitev dvomljivih reakcij se lahko izvedejo drugi postopki, npr. histopatološka raziskava ali meritev debeline kožne gube.
1.5.2 Buehlerjev preskus
1.5.2.1
Zdravi mladi odrasli albino morski prašički se najmanj 5 dni pred preskusom aklimatizirajo na razmere v laboratoriju. Pred preskusom so živali naključno razdeljene v skupine, ki bodo tretirane. Glede na uporabljeno preskusno metodo se dlaka lahko odstrani s striženjem, britjem ali morda s kemično depilacijo. Pri tem je treba paziti, da koža ostane nepoškodovana. Živali je treba pred začetkom in na koncu preskusa stehtati.
1.5.2.2
1.5.2.2.1 Preskusne živali
Uporabljajo se albino morski prašički tistih sevov, ki se običajno uporabljajo v laboratorijih.
1.5.2.2.2 Število in spol
Uporabijo se lahko živali moškega in/ali ženskega spola. Samice morskih prašičkov morajo biti nuliparne in ne breje.
Skupina, ki bo tretirana, mora biti sestavljena iz najmanj 20, kontrolna skupina pa iz najmanj 10 živali.
1.5.2.2.3 Velikost odmerkov
Koncentracija preskusne snovi, uporabljene za vsako indukcijsko izpostavljenost, mora ustrezati najvišjemu odmerku, ki lahko povzroči blago, vendar ne čezmerno draženje kože. Koncentracija, ki se uporabi za provokacijsko izpostavljenost, mora ustrezati najvišjemu odmerku, ki še ne povzroči draženja.
Če je potrebno, se lahko ustrezne koncentracije določijo s pilotno študijo, ki se opravi na dveh ali treh živalih.Pri preskusnih vodotopnih snoveh je najprimernejše, da se kot nosilec uporabi voda ali razredčena nedražilna raztopina surfaktanta. Za druge preskusne snovi so primernejše mešanice 80 % etanola in vode za indukcijo, za provokacijo pa aceton.
1.5.2.3
1.5.2.3.1 Indukcija
Dan 0 – tretirana skupina
Z enega boka živali se odstrani dlaka (na kratko ostriže). Obliž, ki bo uporabljen v preskusu, je treba popolnoma impregnirati s preskusno snovjo v ustreznem nosilcu (izbira nosilca mora biti utemeljena; če je primerno, se tekočine lahko nanesejo nerazredčene).
Obliž je treba nanesti na preskusno območje in ga z okluzivnim obližem ali gazo ali ustreznim povojem držati v stiku s kožo 6 ur.
Obliž mora biti okluziven. Lahko se uporabi okrogla ali štirikotna vatna blazinica velikosti približno 4–6 cm2. Za zagotovitev okluzije je primerna imobilizacija z ustrezno napravo za imobilizacijo. Če se uporabi povoj, utegne biti potrebna dodatna izpostavljenost.
Dan 0 – kontrolna skupina
Z enega boka živali je odstranjena dlaka (na kratko ostrižena). Na preskusno območje se podobno kakor pri tretirani skupini nanese zgolj nosilec. Obliž se nanese na preskusno območje tako, da je okluzivni obliž ali gaza ali ustrezen povoj v stiku s kožo 6 ur. Če se lahko dokaže, da posnemajoča kontrolna skupina ni potrebna, se lahko uporabi netretirana kontrolna skupina.
Dan 6-8 in 13–15 – tretirana in kontrolna skupina
Na dan 6–8 in spet na dan 13–15 se na istem preskusnem območju (po potrebi obritem) opravi enak nanos kakor na dan 0.
1.5.2.3.2 Provokacija
Dan 27–29 – tretirana in kontrolna skupina
Z netretiranega boka tretiranih in kontrolnih živali se odstrani dlaka (na kratko ostrižena). Na zadnji del netretiranega boka tretiranih in kontrolnih živali se nanese okluzivni obliž ali gaza, vsebujoča ustrezno količino preskusne snovi pri najvišji koncentraciji, ki še ne povzroča draženj a.
Če je primerno, se okluzivni obliž ali gaza, ki vsebuje samo nosilec, nanese tudi na sprednji netretirani bok tretiranih in tudi kontrolnih živali. Obliže ali gaze je treba z ustreznim povojem držati v stiku s kožo 6 ur.
1.5.2.3.3 Opazovanje in ocenjevanje
— približno 21 ur po odstranitvi obliža je treba s provokacijskega območja odstraniti dlako,
— približno 3 ure pozneje (približno 30 ur po nanosu provokacij skega obliža) se opazujejo in zabeležijo reakcije kože glede na ocene, prikazane v dodatku,
— približno 24 ur po 30-urnem opazovanju (približno 54 ur po nanosu provokacijskega obliža) se kožne reakcije spet opazujejo in zabeležijo.
Spodbuja se hitro čekiranje preskusnih in kontrolnih živali.
Če je treba razjasniti rezultate, pridobljene v prvi provokaciji, je treba preučiti možnost za izvedbo druge provokacije (t. j. ponovne provokacije), kjer je primerno, z novo kontrolno skupino, približno teden dni po prvi provokaciji. Ponovna provokacij a se lahko izvede tudi na prvotni kontrolni skupini.
Vse kožne reakcije in kakršne koli nenavadne izsledke, vključno s sistemskimi reakcijami, ki so posledica indukcije in postopkov provokacij e, je treba opazovati in zabeležiti v skladu z ocenjevalno lestvico po Magnussonu/Kligmanu (glej dodatek). Za razjasnitev dvomljivih reakcij se lahko opravijo tudi drugi postopki, npr. histopatološka raziskava ali meritev debeline kožne gube.
2. PODATKI (GPMT in Buehlerjev preskus)
Vse podatke je treba povzeti v obliki tabele, ki za vsako posamezno žival prikazuje kožne reakcije pri posameznih opazovanjih.
3. POROČANJE (GPMT in Buehlerjev preskus)
Če je bila pred preskusom na morskem prašičku opravljena izločilna analiza, se mora predložiti opis ali napotitev k preskusu (npr. lokalna analiza limfnih vozlov (LLNA), preskus otekanja ušesa pri miših (MEST)), vključno s podrobnimi podatki o postopku, skupaj z rezultati, ki so bili pridobljeni s preskusnimi in referenčnimi snovmi.
Poročilo o preskusu (GPMT in Buehlerjev preskus)
Če je mogoče, poročilo o preskusu vključuje naslednje informacije:
Poskusne živali:
— sev uporabljenih morskih prašičkov,
— število, starost in spol živali,
— izvor, nastanitveni pogoji, hrana itd.,
— teža vsake živali na začetku preskusa.
Preskusni pogoji:
— tehnika priprave območja nanosa obliža,
— podrobnosti o uporabljenih materialih ter tehniki priprave in nanosa obliža,
— rezultat pilotne študije z izsledki o indukcijskih in provokacijskih koncentracijah, ki bodo uporabljene v preskusu,
— podrobnosti o pripravi preskusne snovi, nanosu in odstranitvi,
— utemeljitev izbire uporabljenega nosilca,
— koncentracije nosilca in preskusne snovi, uporabljene za indukcijsko in provokacijsko izpostavljenost, ter skupna količina snovi, ki je bila nanesena za indukcijo in provokacijo.
Rezultati:
— povzetek rezultatov zadnjega pregleda občutljivosti in zanesljivosti (glej 1.3), vključno z informacijami o snovi, koncentraciji in uporabljenem nosilcu,
— opazovanja, opravljena na posameznih živalih, vključno s sistemom ocenjevanja,
— podroben opis narave in stopnje opaženih učinkov,
— kakršni koli histopatološki izsledki.
Razprava o rezultatih.
Zaključki.
4. SKLICEVANJE
Ta metoda je skladna s smernicami za preskušanje OECD 406.
Dodatek
TABELA
Ocenjevalna lestvica po Magnussonu/Kligmanu za ocenjevanje reakcij pri provokacijskem preskusu z obliži
0 = ni vidnih znakov
1 = diskreten ali neenakomeren eritem
2 = zmeren in zlit eritem
3 = intenziven eritem in oteklina
B.7 TOKSIČNOST PRI PONAVLJAJOČIH SE ODMERKIH (28 DNI) PO ORALNI POTI
1. METODA
1.1 UVOD
Glej del B splošnega uvoda.
1.2 OPREDELITVE POJMOV
Glej del B splošnega uvoda.
1.3 PRINCIP PRESKUSNE METODE
Preskusna snov se daje v zaporednih dnevnih odmerkih oralno več skupinam poskusnih živali, in sicer ena velikost odmerka na skupino za obdobje 28 dni. V obdobju dajanja se živali vsak dan pozorno opazujejo zaradi znakov toksičnosti. Na živalih, ki med preskusom poginejo ali so usmrčene, se opravi nekropsija, ob koncu preskusa pa se tudi preživele živali usmrtijo in se opravi nekropsija.
Metoda daje večji poudarek nevrološkim učinkom kakor specifičnim ocenjevalnim parametrom in poudarja potrebo po pozornem kliničnem opazovanju živali za pridobitev čim več informacij. Cilj te metode je opredeliti kemikalije z nevrotoksičnim potencialom, kar lahko zahteva dodatno podrobno raziskavo. Poleg tega lahko metoda pokaže imunološke učinke in toksičnost razmnoževalnih organov.
1.4 OPIS PRESKUSNE METODE
1.4.1 Priprave
Zdrave mlade odrasle živali so naključno razdeljene v kontrolno skupino in skupino, ki bo tretirana. Kletke je treba razporediti tako, da se kar najbolj zmanjšajo morebitni učinki, ki nastanejo zaradi razporeditve kletk. Živali se jasno identificirajo in nastanijo v kletkah vsaj 5 dni pred začetkom študije, tako da se lahko prilagodijo razmeram v laboratoriju.
Preskusna snov se vnese z gastrično sondo ali s hrano ali pitno vodo. Metoda oralnega vnosa je odvisna od namena študije in fizikalnih/kemijskih lastnosti snovi.
Po potrebi se preskusna snov raztopi ali suspendira v ustreznem nosilcu. Priporoča se, da se, če je mogoče, najprej preuči možnost uporabe vodne raztopine/suspenzije, nato pa uporabe raztopine/emulzije v olju (npr. koruznem olju), kot tretja izbira pa uporaba možne raztopine v drugih nosilcih. Pri nevodnih nosilcih morajo biti toksične lastnosti nosilca znane. Treba je določiti stabilnost preskusne snovi v nosilcu.
1.4.2 Preskusni pogoji
1.4.2.1 Preskusne živali
Najprimernejša vrsta glodalcev so podgane, čeprav se lahko uporabijo tudi druge vrste glodalcev. Uporabiti je treba mlade, zdrave odrasle živali sevov, ki se običajno uporabljajo v laboratorijih. Samice morajo biti nuliparne in ne breje. Odmerke je treba začeti vnašati čim prej po zaključku laktacije in vsekakor preden živali dopolnijo devet tednov.
Na začetku študije mora biti sprememba teže živali minimalna in ne sme presegati ± 20 % povprečne teže za vsak spol.
Če je bila pred dolgoročno študijo izvedena predhodna študija s ponavljajočim se odmerkom po oralni poti, je po možnosti v obeh študijah treba uporabiti živali istega seva in istega izvora.
1.4.2.2 Število in spol
Za vsako stopnjo odmerka se mora uporabiti najmanj 10 živali (pet samic in pet samcev). Če se načrtujejo usmrtitve živali med študijo, je treba skupno število povečati za število živali, predvidenih za usmrtitev pred zaključkom študije.
Poleg tega se satelitska skupina 10 živali (pet živali na spol) lahko tretira z veliko količino odmerka 28 dni in se naslednjih 14 dni opazuje za ugotavljanje reverzibilnosti, trajanja učinka ali zapoznelega nastopa toksičnih učinkov. Prav tako se uporabi satelitska skupina 10 kontrolnih živali (pet živali na spol).
1.4.2.3 Velikost odmerkov
Običajno je treba uporabiti najmanj tri preskusne skupine in eno kontrolno skupino. Razen pri tretiranju s preskusno snovjo je treba z živalmi v kontrolni skupini ravnati enako kakor z živalmi preskusne skupine. Če je pri vnosu preskusne snovi uporabljen nosilec, naj enak nosilec v največji uporabljeni količini prejme tudi kontrolna skupina.
Če se na podlagi ocene drugih podatkov ne pričakujejo nobeni učinki pri odmerku 1 000 mg/kg telesne teže/dan, se lahko opravi mejni preskus. Če ne obstajajo ustrezni podatki, se lahko opravi študija ugotavljanja količinske meje, s katero se določijo odmerki za uporabo.
Pri izbiri velikosti odmerkov je treba upoštevati vse obstoječe podatke o toksičnosti in (toksiko-) kinetiki, ki so na razpolago za preskusno snov ali povezane snovi. Izbrati je treba največjo velikost odmerka, ki povzroči toksične učinke, vendar ne smrti ali hudega trpljenja. Nato je treba izbrati padajoče zaporedje velikosti odmerkov, da se določita vsak odziv, ki je pogojen z odmerkom, in koncentracija brez opaznih negativnih vplivov (NOAEL). Za določanje padajočih velikosti odmerkov je pogosto najbolje uporabiti dva- do štirikratne intervale, pogosto pa je primernejše, da se namesto zelo velikih intervalov (npr. več kakor faktor 10) med odmerki doda četrta preskusna skupina.
Če se snovi dajejo s hrano ali pitno vodo, je pomembno zagotoviti, da količine potrebne preskusne snovi ne spremenijo normalnega prehranjevalnega ali vodnega ravnotežja. Če se preskusna snov daje s hrano, se lahko uporabi bodisi stalna koncentracija v hrani (ppm) bodisi stalna velikost odmerka glede na telesno težo živali; opredeliti se mora uporabljena alternativa. Če je bila snov dana z gastrično sondo, mora biti odmerek vnesen vsak dan ob približno istem času in prilagojen tako, da se ohrani stalna velikost odmerka glede na telesno težo živali.
Če je bila pred dolgoročno študijo izvedena predhodna oralna študija s ponavljajočim se odmerkom, je treba v obeh študijah uporabiti podobno hrano.
1.4.2.4 Mejni preskus
Če preskus, izveden v skladu z opisanimi postopki za to študijo in pri velikosti odmerka, ki znaša najmanj 1 000 mg/kg telesne teže/dan, ali pri vnosu s hrano ali vodo pri enakovredni koncentraciji hrane ali pitne vode (na podlagi telesne teže), ne ustvari opaznih toksičnih učinkov in če se na podlagi podatkov o strukturno povezanih snoveh toksičnost ne pričakuje, se popolna študija z uporabo treh velikosti odmerkov morda ne šteje za potrebno. Mejni preskus se ne uporabi samo, če človeška izpostavljenost kaže na potrebo po uporabi večjega odmerka.
1.4.2.5 Obdobje opazovanja
Obdobje opazovanja naj traja 28 dni. Živali iz satelitske skupine, ki so bile izbrane za dodatna opazovanja, naj bodo nadzorovane najmanj nadaljnjih 14 dni brez kakršnega koli tretiranja, da bi odkrili zapozneli pojav, obstojnost ali izginotje toksičnih učinkov.
1.4.3 Postopek
Preskusna snov se živalim daje dnevno, sedem dni na teden za obdobje 28 dni; uporaba petdnevnega režima odmerjanja na teden mora biti ustrezno utemeljena. Če se preskusna snov živalim intubira, je to treba izvesti z enkratnim odmerkom z gastrično sondo ali ustrezno intubacijsko cevko. Največji volumen tekočine, ki se lahko vnese naenkrat, je odvisen od velikosti poskusne živali. Volumen ne sme presegati 1 ml/100 g telesne teže, razen pri vodnih raztopinah, pri katerih se lahko uporabi 2 ml/100 g telesne teže. Razen pri dražilnih ali korozivnih snoveh, ki pri višjih koncentracijah običajno povzročijo jasne poslabšane učinke, je treba spremenljivost preskusnih volumnov kar najbolj zmanjšati s prilagoditvijo koncentracije, da bi se tako ohranil stalni volumen pri vseh velikostih odmerkov.
1.4.3.1 Splošna opazovanja
Splošna klinična opazovanja je treba opraviti vsaj enkrat na dan, po možnosti vsak dan ob istem času in ob upoštevanju obdobja največje intenzivnosti pričakovanih učinkov po vnosu odmerka. Zabeležiti je treba podatke o zdravstvenem stanju živali. Živali je treba vsaj dvakrat na dan opazovati za določitev obolevnosti in smrtnosti. Umirajoče živali ali živali, ki kažejo znake hudega trpljenja ali bolečine, je treba nemudoma po ugotovitvi tega izključiti iz študije, jih humano usmrtiti in opraviti nekropsijo.
Enkrat pred prvo izpostavljenostjo (za omogočanje primerjav na istem subjektu) in nato najmanj enkrat na teden je treba opraviti podrobna klinična opazovanja vseh živali. V ta namen je treba živali vzeti iz kletk, v katerih bivajo, jih zbrati v standardnem ograjenem prostoru in po možnosti vsakokrat opazovati ob istem času. Opazovanja je treba pazljivo zabeležiti, po možnosti z uporabo sistemov točkovanja, ki jih jasno določi zadevni preskusni laboratorij. Storiti je treba vse potrebno za kar največje zmanjšanje spreminjanja preskusnih pogojev in za zagotovitev, da opazovanja po možnosti opravijo opazovalci, ki s tretiranjem niso seznanjeni. Pozornost je med drugim treba posvetiti vsem spremembam na koži, dlaki, očeh, na sluznici, pojavu sekrecije in ekskrecije in posamezne aktivnosti (npr. solzenje, piloerekcija, velikost zenice, nenavaden ritem dihanja). Prav tako je treba zabeležiti spremembe obnašanja, drže in odziva na tretiranje, pa tudi pojav kloničnih ali toničnih krčev, stereotipov (npr. čezmerno negovanje, nenehno vrtenje v krogih) ali nenavadnega obnašanja (npr. samopohaba, vzvratna hoja).
V četrtem tednu izpostavljenosti je treba nadaljevati ocenjevanje senzorične reaktivnosti na različne vrste dražljajev (npr. slušni, vizualni in proprioceptivni dražljaji), moči prijema in motorične aktivnosti. Dodatne podrobnosti o postopkih, ki se lahko uporabijo, so navedene v literaturi (glej del B splošnega uvoda).
Funkcionalna opazovanja, predvidena za četrti teden izpostavljenosti, se lahko izpustijo, če je študija izvedena kot predhodna za nadaljnjo študijo subkroničnosti (90 dni). V tem primeru je treba funkcionalna opazovanja vključiti v to dopolnilno študijo. Po drugi strani pa se lahko podatki o funkcionalnih opazovanjih, pridobljeni med študijo s ponavljajočimi se odmerki, izkažejo za koristne pri izbiranju velikosti odmerkov za nadaljnjo študijo subkroničnosti.
Izjemoma se lahko funkcionalna opazovanja opustijo tudi za skupine, ki sicer kažejo znake toksičnosti v takšnem obsegu, da bi to lahko močno oviralo izvedbo funkcionalnega preskusa.
1.4.3.2 Telesna teža in poraba hrane/vode
Vse živali je treba stehtati najmanj enkrat na teden. Vsaj enkrat na teden je treba izmeriti obseg porabe hrane in vode. Če se preskusna snov daje s pitno vodo, je treba najmanj enkrat na teden izmeriti količino porabe vode.
1.4.3.3 Hematologija
Na koncu preskusnega obdobja je treba opraviti naslednje hematološke preiskave: hematokrit, koncentracija hemoglobina, število eritrocitov, skupno število levkocitov in diferencialna slika levkocitov, število krvnih ploščic in čas/zmožnost koagulacije.
Vzorce krvi je treba odvzeti iz določenega območja neposredno pred ali med postopkom usmrtitve živali in jih pod ustreznimi pogoji shraniti.
1.4.3.4 Klinična biokemija
Klinične biokemične preiskave, katerih cilj je preučevanje glavnih toksičnih učinkov na tkiva ter zlasti ledvice in jetra, je treba opraviti na vzorcih krvi, ki so bili živalim odvzeti neposredno pred ali med postopkom njihove usmrtitve (razen živali, ki so bile najdene umirajoče in/ali usmrčene med preskusom). Priporoča se, da se živali pred odvzemom vzorcev krvi čez noč postijo ( 16 ). Preiskave plazme ali seruma morajo vključevati natrij, kalij, glukozo, skupni holesterol, ureo, kreatinin, skupne beljakovine in albumin, najmanj dva encima, ki sta kazalca hepatoceličnih učinkov (kot alanin-aminotransferaza, aspartat-aminotransferaza, alkalna fosfataza, gama-glutamil transpeptidaza in sorbitolna dehidrogenaza). Meritve dodatnih encimov (hepatskega ali drugega izvora) in žolčnih kislin včasih lahko dajo koristne informacije.
Po izbiri se lahko v zadnjem tednu študije izvedejo naslednje določene preiskave urina z uporabo časovno določenega zbiranja volumna urina: videz, volumen, ozmotsko neravnovesje ali specifična teža, pH, beljakovine, glukoza in kri/krvne celice.
Poleg tega se priporoča izvedba študij za preiskovanje serumskih znakov splošnih poškodb tkiva. Druge določitve, ki morajo biti izvedene, če obstaja možnost ali sum, da bodo znane lastnosti preskusne snovi vplivale na povezane metabolične profile, vključujejo kalcij, fosfat, trigliceride, posebne hormone, methemoglobin in holinesterazo. Le-ti morajo biti določeni za nekatere razrede snovi ali za posamezne primere.
Na splošno je najprimernejši fleksibilni prijem, ki je odvisen od vrste in opaženega in/ali pričakovanega učinka preskusne snovi.
Če so osnovni zgodovinski podatki neustrezni, je primerno, da se hematološki in klinični biokemični parametri določijo pred začetkom dajanja odmerkov.
1.4.3.5 Makroskopska nekropsija
Na vseh živalih iz študije se opravi kompletna makroskopska nekropsija, ki vključuje skrbno preiskavo zunanje telesne površine, vseh odprtin, lobanjske, torakalne in trebušne votline ter njihove vsebine. Jetra, ledvice, nadledvične žleze, moda, epididimide, priželjc, vranico, možgane in srce vseh živali je treba ustrezno odstraniti s sosednjih tkiv in čim prej stehtati, da se ognemo dehidraciji.
Naslednja tkiva je treba shraniti v fiksacijskem sredstvu, ki je najprimernejše za vrsto tkiva in predvideno poznejšo histopatološko preiskavo: vsa tkiva z makroskopskimi poškodbami, možgane (reprezentativne regije, ki vključujejo velike možgane, male možgane in most), hrbtenjačo, trebuh, tanko in debelo črevo (vključno s Peyerjevim skupkom limfnega tkiva), jetra, ledvice, nadledvične žleze, vranico, srce, priželjc, žlezo ščitnico, trahejo in pljuča (shranjeni z napihavanjem fiksativa in nato s potopitvijo), spolne žleze, dodatne spolne organe (npr. maternico, prostato), sečni mehur, limfne vozle (po možnosti en limfni vozel na poti vnosa in en limfni vozel, ki je oddaljen od poti vnosa in pokriva sistemske učinke), periferno živčevje (ishiatični ali tibialni živec), po možnosti v neposredni bližini mišice, in del kostnega mozga (ali kot alternativa, sveže prepariran aspirat kostnega mozga). Na podlagi kliničnih in drugih izsledkov se lahko pokaže potreba po preiskavah dodatnega tkiva. Poleg tega je treba shraniti vse organe, ki se štejejo za verjetne ciljne organe glede na znane lastnosti preskusne snovi.
1.4.3.6 Histopatološka preiskava
Celotno histopatološko preiskavo je treba opraviti na shranjenih organih in tkivih vseh živali v kontrolni skupini ter živalih v skupini, tretirani z visokim odmerkom. Te preiskave je treba razširiti na živali iz skupin, tretiranih z različnimi odmerki, če se v skupini, tretirani z visokim odmerkom, opazijo spremembe, ki jih je povzročilo tretiranje.
Preiščejo se vse makroskopske poškodbe.
Če se uporabi satelitska skupina, je treba izvesti histopatološko preiskavo na tkivih in organih, na katerih so bili v tretiranih skupinah opaženi učinki.
2. PODATKI
Priskrbeti je treba podatke za vsako posamezno žival. Poleg tega je treba vse podatke povzeti v obliki tabele, ki za vsako preskusno skupino prikazuje število živali na začetku preskusa, število živali, ki so bile med preskusom najdene mrtve ali so bile usmrčene iz humanih razlogov, in čas vsake smrti ali humane usmrtitve, število živali, ki kažejo znake toksičnosti, opis opaženih toksičnih učinkov, vključno s časom njihovega nastopa, trajanjem in resnostjo vseh toksičnih učinkov, število živali, ki kažejo poškodbe, vrsto poškodb in odstotek živali, ki kažejo posamezno vrsto poškodb.
Če je mogoče, je številčne rezultate treba ocenjevati na podlagi primerne in splošno priznane statistične metode. Statistične metode je treba izbrati med izdelavo študije.
3. POROČANJE
POROČILO O PRESKUSU
Če je mogoče, poročilo o preskusu vključuje naslednje informacije:
Poskusne živali:
— uporabljena vrsta/sev,
— število, starost in spol živali,
— vir, pogoji bivanja, prehrana itn.,
— teža vsake živali na začetku preskusa, v tedenskih intervalih v naslednjem obdobju in ob zaključku preskusa.
Preskusni pogoji:
— utemeljitev izbire uporabljenega nosilca, če to ni voda,
— utemeljitev izbire velikosti odmerka,
— podrobni podatki o sestavi preskusne snovi in pripravi hrane, doseženi koncentraciji, stabilnosti in homogenosti pripravka,
— podrobni podatki o dajanju preskusne snovi,
— če je primerno, sprememba koncentracije snovi, vnesene s hrano ali vodo (ppm), v dejanski odmerek (mg/kg telesne teže/dan),
— podrobni podatki o kvaliteti hrane in vode.
Rezultati:
— telesna teža/spremembe telesne teže,
— poraba hrane in, če je primerno, poraba vode,
— podatki o toksičnem odzivu po spolu in velikosti odmerka, vključno z znaki toksičnosti,
— narava, resnost in trajanje kliničnih opazovanj (reverzibilnih ali nereverzibilnih),
— ocena senzorične aktivnosti, moči prijema in motorične aktivnosti,
— hematološki preskusi z ustreznimi referenčnimi vrednostmi,
— klinični biokemični preskusi z ustreznimi referenčnimi vrednostmi,
— telesna teža ob usmrtitvi in podatki o teži organov,
— izsledki nekropsije,
— podroben opis vseh histopatoloških izsledkov,
— podatki o absorpciji, če so na razpolago,
— statistična obdelava rezultatov, kjer je to primerno.
Razprava o rezultatih.
Zaključki.
4. SKLICEVANJE
Ta metoda je skladna s smernicami za preskušanje OECD 407.
B.8 STRUPENOST (PRI VDIHAVANJU) PRI PONAVLJAJOČEM SE ODMERKU (28 DNI)
1. METODA
1.1 UVOD
Koristno je imeti predhodne informacije o porazdelitvi velikosti delcev, parnem tlaku, tališču, vrelišču, plamenišču in eksplozivnosti (če je primerno) snovi.
Glej tudi Splošni uvod, del B (A).
1.2 OPREDELITVE
Glej Splošni uvod dela B (B).
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Več skupin poskusnih živalih se 28 dni vsak dan za določeno obdobje izpostavi preskusni snovi v stopnjevanih koncentracijah, pri čemer se uporabi ena koncentracija na skupino. Če se za lažjo pripravo primerne koncentracije preskusne snovi v zraku uporabi nosilec, je treba uporabiti tudi kontrolno skupino za nosilec. V času dajanja odmerkov se živali vsakodnevno opazujejo zaradi odkrivanja znakov strupenosti. Na živalih, ki med preskusom poginejo, se opravi obdukcija, ob koncu preskusa pa tudi na preživelih živalih.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
1.6.1 Priprave
Najmanj pet dni pred začetkom preskusa se živali nastanijo v preskusnih pogojih nastanitve in hranjenja. Pred preskusom se zdrave mlade živali naključno izberejo in dodelijo potrebnemu številu skupin. Kadar je potrebno, se preskusni snovi lahko doda ustrezni nosilec za lažjo pripravo primerne koncentracije snovi v zraku. Če se za lažje odmerjanje uporabi nosilec ali drugi dodatki, mora biti dokazano, da ne povzročajo strupenih učinkov. Če je primerno, se lahko uporabijo podatki preteklih študij.
1.6.2 Preskusni pogoji
1.6.2.1 Poskusne živali
Razen v primeru kontraindikacij, je podgana najprimernejša vrsta. Uporabiti je treba splošno uporabljane laboratorijske seve mladih zdravih živali.
Ob začetku študije območje nihanja mase uporabljenih živali ne sme presegati ± 20 % ustrezne srednje vrednosti.
1.6.2.2 Število in spol
Za vsako preskusno skupino je treba uporabiti najmanj 10 živali (pet samic in pet samcev). Samice morajo biti nulipare in nebreje. Če se načrtujejo žrtvovanja med študijo, je treba število povečati za število živali, predvidenih za žrtvovanje pred zaključkom študije. Poleg tega se lahko satelitska skupina 10 živali (pet živali na spol) 28 dni tretira z odmerkom velike koncentracije in se naslednjih 14 dni opazuje za ugotavljanje povratnosti, obstojnosti ali zapoznelega pojava strupenih učinkov. Uporabi se tudi satelitska skupina 10 kontrolnih živali (pet živali na spol).
1.6.2.3 Koncentracija izpostavljenosti
Potrebne so najmanj tri koncentracije z eno kontrolo ali, če se uporabi nosilec, s kontrolo nosilca (ki ustreza koncentraciji nosilca pri največji velikosti odmerka). Razen tretiranja s preskusno snovjo, je treba z živalmi kontrolne skupine ravnati na enak način kakor z živalmi preskusnih skupin. Največja koncentracija naj povzroči strupene učinke, vendar nič ali malo smrtnih primerov. Najmanjša koncentracija ne sme povzročiti nobenih znakov strupenosti. Če obstaja uporabna ocena izpostavljenosti človeka, jo mora najmanjša koncentracija presegati. V idealnih razmerah bi vmesna koncentracija morala povzročiti minimalne opazne strupene učinke. Če se uporabi več kot ena vmesna koncentracija, morajo biti intervali med koncentracijami taki, da povzročijo stopnjevanje strupenih učinkov. V skupinah, tretiranih z majhno in srednjo koncentracijo, ter v kontrolnih skupinah naj bi bila pogostnost smrtnih primerov majhna, da se omogoči smiselno ovrednotenje rezultatov.
1.6.2.4 Čas izpostavljenosti
Dnevna izpostavljenost naj bi trajala šest ur, vendar bodo za izpolnitev posebnih zahtev morda potrebna drugačna obdobja.
1.6.2.5 Oprema
Preskušanje na živalih se izvaja z opremo za vdihavanje, ki je zasnovana tako, da vzdržuje dinamični pretok zraka z najmanj 12 zamenjavami zraka na uro, da se zagotovita zadostna vsebnost kisika in enakomerna porazdelitev izpostavitvenega ozračja. Če se uporabi komora, mora biti zasnovana tako, da preskusne živali niso prenatrpane in so kar najbolj izpostavljene preskusni snovi z vdihavanjem. Splošno pravilo zagotavljanja stabilnosti ozračja v komori je, da skupni „volumen“ preskusnih živali ne sme presegati 5 % volumna preskusne komore. Lahko se uporabi nazooralno izpostavljanje, izpostavljanje samo glave ali izpostavljanje celega telesa v posamični komori; prva dva načina kar se da zmanjšata sprejem preskusne snovi po drugih poteh.
1.6.2.6 Obdobje opazovanja
Poskusne živali je treba med celotnim obdobjem tretiranja in okrevanja dnevno opazovati, ali kažejo znake strupenosti. Zapisati je treba čas smrti in čas pojava ter izginotja znakov strupenosti.
1.6.3 Postopek
Živali se 28 dni, pet do sedem dni na teden dnevno izpostavljajo preskusni snovi. Živali katere koli satelitske skupine, predvidene za nadaljnja opazovanja, je treba pustiti nadaljnjih 14 dni brez tretiranja, da se ugotovi povratnost ali obstojnost strupenih učinkov. Med preskusom je treba vzdrževati temperaturo 22 ± 3 oC.
V idealnih razmerah bi bilo treba relativno vlažnost vzdrževati med 30 in 70 %, vendar to v nekaterih primerih (npr. preskusi z nekaterimi aerosoli) ni izvedljivo. Ohranjanje rahlega podtlaka v komori (< 5 mm vode) bo preprečilo uhajanje preskusne snovi v okolico. Med izpostavljenostjo se živalim ne dajeta ne hrana ne voda.
Uporabiti je treba dinamični inhalacijski sistem z ustreznim analitskim sistemom za nadzorovanje koncentracije. Za določitev primernih koncentracij izpostavljenosti se priporoča izvedba poskusnega preskusa. Pretok zraka je treba prilagoditi tako, da se zagotovijo homogeni pogoji v celi komori za izpostavljanje. Sistem mora zagotoviti, da se čim hitreje dosežejo stabilni izpostavitveni pogoji.
Meriti ali spremljati je treba:
(a) pretok zraka (neprekinjeno);
(b) dejansko koncentracijo preskusne snovi, merjeno v območju dihanja. V obdobju dnevne izpostavitve se koncentracija ne sme spreminjati za več kot ± 15 % srednje vrednosti. Vendar je lahko pri nekaterih aerosolih taka stopnja nadzora nedosegljiva in je zato sprejemljiv večji razpon. Ves čas študije morajo biti koncentracije od dneva do dneva kolikor je mogoče konstantne. Pri aerosolih je treba izvesti najmanj eno analizo velikosti delcev na preskusno skupino na teden;
(c) temperaturo in vlažnost, če je mogoče neprekinjeno.
Med izpostavitvijo in po njej se izvaja sistematično opazovanje in zapisovanje opažanj; za vsako žival je treba voditi svojo evidenco. Vse živali je treba dnevno opazovati in zapisati znake strupenosti, vključno s časom njihovega pojava, stopnjo in trajanjem. Opazovati je treba spremembe na koži in kožuhu, očeh, sluznici, dihalih, obtočilih, avtonomnem in osrednjem živčevju, somatomotorični aktivnosti in vedenjskem vzorcu. Tedensko je treba izmeriti maso živali. Priporoča se tudi tedenska meritev porabe hrane. Živali je treba redno opazovati, da se prepreči izguba živali zaradi kanibalizma, avtolize tkiv ali napak pri dajanju v kletke. Ob koncu študije se na vseh preživelih živalih nesatelitskih tretiranih skupin opravi obdukcija. Umirajoče živali in živali v hudem stresu ali s hudimi bolečinami se takoj ob odkritju odstranijo iz kletk ter humano usmrtijo in obducirajo.
Ob koncu preskusa se na vseh živalih, vključno z živalmi kontrolne skupine, opravijo naslednje preiskave:
(i) hematološke preiskave, ki vključujejo najmanj določitev hematokrita, koncentracije hemoglobina, števila eritrocitov, skupnega in diferencialnega števila levkocitov in zmožnosti koagulacije;
(ii) klinične biokemijske preiskave krvi, ki vključujejo določanje najmanj enega parametra delovanja jeter in ledvic: serumska alanin-aminotransferaza (prej poznana kot glutamat-piruvat-transaminaza), serumska aspartat-aminotransferaza (prej poznana kot glutamat-oksaloacetat-transaminaza), sečninski dušik, albumin, kreatinin v krvi, skupni bilirubin in skupne serumske beljakovine;
Druge določitve, ki so lahko potrebne za izdelavo ustrezne ocene strupenosti, vključujejo kalcij, fosfor, klorid, natrij, kalij, postno glukozo, lipide, hormone, ravnovesje kislina/baza, methemoglobin, aktivnost holinesteraze.
Kadar je potrebno, se za razširitev raziskave opaženih strupenih učinkov lahko uporabijo dodatne klinične biokemijske preiskave.
1.6.3.1 Makroskopska obdukcija
Na vseh živalih iz študije je treba izvesti popolno makroskopsko obdukcijo. Najmanj jetra, ledvice, nadledvične žleze, pljuča in moda je treba stehtati mokre čim prej po disekciji, da se prepreči njihova dehidracija. Organe in tkiva (dihala, jetra, ledvice, vranico, moda, nadledvične žleze, srce in vse organe, ki kažejo makroskopske poškodbe ali spremembe v velikosti) je treba shraniti v ustreznem mediju za morebitno histopatološko preiskavo v prihodnosti. Pljuča je treba odstraniti nepoškodovana, jih stehtati in tretirati z ustreznim fiksativom, da se ohrani njihova struktura.
1.6.3.2 Histopatološka preiskava
Pri skupini, tretirani z veliko koncentracijo, in kontrolni(-h) skupini(-ah) je treba histopatološko preiskavo opraviti na shranjenih organih in tkivih. Pri vseh skupinah, tretiranih z manjšimi odmerki, je treba preiskati organe in tkiva, ki v skupini z največjim odmerkom kažejo poškodbe, ki se lahko pripišejo preskusni snovi. Živali vseh satelitskih skupin je treba histološko preiskati s posebnim poudarkom na tistih organih in tkivih, pri katerih so bili pri drugih tretiranih skupinah ugotovljeni strupeni učinki.
2. PODATKI
Podatke je treba povzeti v tabeli, ki za vsako preskusno skupino prikazuje število živali na začetku preskusa in število živali, ki kažejo posamezno vrsto poškodbe.
Vse opažene rezultate je treba ovrednotiti z ustrezno statistično metodo. Uporabi se lahko katera koli priznana statistična metoda.
3. POROČANJE
3.1 POROČILO O PRESKUSU
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— vrsta, sev, vir, okoljski pogoji, prehrana itd.,
— preskusni pogoji:
— Opis aparature za izpostavljanje, vključno z načrtom, vrsto, merami, virom zraka, sistemom za proizvajanje aerosolov, metodo klimatiziranja zraka, obdelavo izpušnega zraka in metodo namestitve živali v preskusni komori, če je bila uporabljena. Opisati je treba opremo za merjenje temperature, vlažnosti in, kadar je primerno, stabilnosti koncentracije ali porazdelitve velikosti delcev aerosolov.
— Podatki o izpostavitvi:
— Ti morajo biti zbrani v tabeli in prikazani s srednjimi vrednostmi in mero variabilnosti (npr. standardna deviacija) ter po možnosti vključevati:
—(a) pretok zraka skozi opremo za vdihavanje;
(b) temperaturo in vlažnost zraka;
(c) nazivne koncentracije (količnik skupne količine preskusne snovi, vnesene v opremo za vdihavanje, in volumna zraka);
(d) vrsto nosilca, če je bil uporabljen;
(e) dejanske koncentracij e v preskusnem območju dihanja;
(f) srednji aerodinamični masni premer (MMAD) in geometrijska standardna deviacija (GSD);
— podatki o odzivu strupenosti po spolu in koncentraciji,
— čas smrti med študijo oziroma ali so živali preživele do zaključka,
— opis strupenih ali drugih učinkov; velikost odmerka brez učinkov,
— čas odkritja vsakega nenormalnega znaka in njegov nadaljnji razvoj,
— podatki o hrani in telesni masi,
— opravljeni hematološki preskusi in rezultati,
— opravljeni klinični biokemijski preskusi in rezultati,
— izsledki obdukcije,
— podroben opis vseh histopatoloških izsledkov,
— statistična obdelava rezultatov, kadar je možno,
— razprava o rezultatih,
— razlaga rezultatov.
3.2 VREDNOTENJE IN RAZLAGA
Glej Splošni uvod dela B (D).
4. VIRI
Glej Splošni uvod dela B (E).
B.9 STRUPENOST (V STIKU S KOŽO) PRI PONAVLJAJOČEM SE ODMERKU (28 DNI)
1. METODA
1.1 UVOD
Glej Splošni uvod dela B (A).
1.2 OPREDELITVE
Glej Splošni uvod dela B (B).
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Preskusna snov se 28 dni dnevno nanaša na kožo v stopnjevanih odmerkih več skupinam poskusnih živali, in sicer en odmerek na skupino. V obdobju dajanja odmerkov se živali vsakodnevno pozorno opazujejo zaradi odkrivanja znakov strupenosti. Na živalih, ki med preskusom poginejo, se opravi obdukcija, ob koncu preskusa pa tudi na preživelih živalih.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
1.6.1 Priprave
Najmanj pet dni pred začetkom preskusa se živali nastanijo v preskusnih pogojih nastanitve in hranjenja. Pred preskusom se zdrave mlade živali naključno izberejo in dodelijo tretiranim in kontrolnim skupinam. Tik pred začetkom preskusa se preskusnim živalim ostriže dlaka s hrbtnega dela trupa. Dlaka se lahko tudi obrije, vendar je treba to opraviti 24 ur pred preskusom. Striženje ali britje je običajno treba ponavljati približno v tedenskih intervalih. Med striženjem ali britjem je treba paziti, da se koža ne odrgne. Za nanos preskusne snovi je treba pripraviti najmanj 10 % telesne površine. Pri določanju površine pripravljenega dela in velikosti nanosa je treba upoštevati maso živali. Pri preskušanju trdnih snovi, ki se po potrebi lahko uprašijo, je treba preskusno snov dovolj navlažiti z vodo ali, kadar je potrebno, ustreznim nosilcem, da se zagotovi dober stik s kožo. Tekoče preskusne snovi se običajno uporabljajo nerazredčene. Nanosi se opravljajo dnevno, pet do sedem dni na teden.
1.6.2 Preskusni pogoji
1.6.2.1 Poskusne živali
Uporabijo se lahko odrasle podgane, kunci ali morski prašički. Uporabijo se lahko tudi druge vrste, vendar je treba njihovo uporabo utemeljiti.
Ob začetku študije območje nihanja mase uporabljenih živali ne sme presegati ± 20 % ustrezne srednje vrednosti.
1.6.2.2 Število in spol
Za vsako velikost odmerka je treba uporabiti najmanj 10 živali (pet samic in pet samcev) z zdravo kožo. Samice morajo biti nulipare in nebreje. Če se načrtujejo žrtvovanja med študijo, je treba število povečati za število živali, predvidenih za žrtvovanje pred zaključkom študije. Poleg tega se lahko satelitska skupina 10 živali (pet živali na spol) 28 dni tretira z velikim odmerkom in se naslednjih 14 dni opazuje za ugotavljanje reverzibilnosti, obstojnosti ali zapoznelega pojava strupenih učinkov. Uporabi se tudi satelitska skupina 10 kontrolnih živali (pet živali na spol).
1.6.2.3 Velikost odmerkov
Potrebne so najmanj tri velikosti odmerkov z eno kontrolo ali, če se uporabi nosilec, s kontrolo nosilca. Obdobje izpostavljenosti mora trajati najmanj šest ur dnevno. Preskusno snov je treba nanašati vsak dan ob istem času, nanose pa je treba v rednih časovnih presledkih (enkrat ali dvakrat tedensko) prilagoditi tako, da se vzdržuje konstantna velikost odmerka glede na telesno maso živali. Razen tretiranja s preskusno snovjo, je treba z živalmi kontrolne skupine ravnati na enak način kakor z živalmi preskusne skupine. Če se za lažje odmerjanje uporabi nosilec, se živalim skupine za kontrolo nosilca odmerki dajejo na enak način kakor živalim tretirane skupine in prejeti morajo enako količino, kakor živali skupine, tretirane z največjim odmerkom. Največji odmerek naj povzroči strupene učinke, vendar nič ali malo smrtnih primerov. Najmanjši odmerek ne sme povzročiti nobenih znakov strupenosti. Če obstaja uporabna ocena izpostavljenosti človeka, jo mora najmanjši odmerek presegati. V idealnih razmerah bi vmesna velikost odmerka morala povzročiti minimalne opazne strupene učinke. Če se uporabi več kot en vmesni odmerek, morajo biti intervali med velikostmi odmerkov taki, da povzročijo stopnjevanje strupenih učinkov. V skupinah, tretiranih z majhnimi in vmesnimi odmerki, ter v kontrolni skupini mora biti pogostnost smrtnih primerov majhna, da se omogoči smiselno ovrednotenje rezultatov.
Če nanos preskusne snovi povzroči hudo draženje kože, je treba koncentracije zmanjšati, zaradi česar se lahko zmanjšajo ali ne pokažejo drugi strupeni učinki pri velikih odmerkih. Če se poleg tega koža hudo poškoduje, je morda treba prekiniti študijo in začeti novo študijo z manjšimi koncentracijami.
1.6.2.4 Mejni preskus
Če pri predhodni študiji z odmerkom 1 000 mg/kg, ali z večjim odmerkom, ki ustreza možni izpostavljenosti človeka, kadar je ta znana, ni opaznih strupenih učinkov, nadaljnje preskušanje morda ne bo potrebno.
1.6.2.5 Obdobje opazovanja
Poskusne živali je treba dnevno opazovati, ali kažejo znake strupenosti. Zapisati je treba čas smrti in čas pojava ter izginotja znakov strupenosti.
1.6.3 Postopek
Vsaka žival mora biti v svoji kletki. Živali se 28 dni, v idealnih razmerah po sedem dni na teden, tretirajo s preskusno snovjo. Živali katere koli satelitske skupine, predvidene za nadaljnja opazovanja, je treba pustiti nadaljnjih 14 dni brez tretiranja, da se ugotovi povratnost ali obstojnost strupenih učinkov. Izpostavljanje mora trajati najmanj šest ur dnevno.
Preskusno snov je treba enakomerno nanesti na območje, ki predstavlja približno 10 % skupne telesne površine. Pri zelo strupenih snoveh je površina nanosa lahko manjša, vendar mora biti čim več površine pokrite s čim tanjšo in enakomerno plastjo.
Med izpostavljenostjo mora preskusna snov ostati v stiku s kožo, kar se zagotovi s poroznim gaznim povojem in nedražilnim obližem. Preskusna površina mora biti dodatno ustrezno pokrita, da gazni povoj in preskusna snov ostaneta na istem mestu in se živalim prepreči zaužitje preskusne snovi. Za preprečitev zaužitja se lahko uporabijo pripomočki za omejevanje gibanja, vendar popolna imobilizacija ni priporočena metoda. Lahko se uporabi tudi zaščitni ovratnik.
Ob koncu obdobja izpostavljenosti se ostanek preskusne snovi odstrani, kadar je to izvedljivo, z vodo ali kako drugo ustrezno metodo čiščenja kože.
Vse živali je treba dnevno opazovati in zapisati znake strupenosti, vključno s časom njihovega pojava, stopnjo in trajanjem. Opazovati je treba spremembe na koži in kožuhu, očeh in sluznici ter tudi v dihalih, obtočilih, avtonomnem in osrednjem živčevju, somatomotorični aktivnosti in vedenjskem vzorcu. Tedensko je treba izmeriti maso živali. Priporoča se tudi tedenska meritev porabe hrane. Živali je treba redno opazovati, da se prepreči izguba živali zaradi kanibalizma, avtolize tkiv ali napak pri dajanju v kletke. Ob koncu študije se na vseh preživelih živalih nesatelitskih tretiranih skupin opravi obdukcija. Umirajoče živali in živali v hudem stresu ali s hudimi bolečinami se takoj ob odkritju odstranijo iz kletk ter humano usmrtijo in obducirajo.
Ob koncu preskusa se na vseh živalih, vključno z živalmi kontrolne skupine, opravijo naslednje preiskave:
1. hematološke preiskave, ki vključujejo najmanj določitev hematokrita, koncentracije hemoglobina, števila eritrocitov, skupnega in diferencialnega števila levkocitov in zmožnosti koagulacije;
2. klinične biokemijske preiskave krvi, ki vključujejo določanje najmanj enega parametra delovanja jeter in ledvic: serumska alanin-aminotransferaza (prej poznana kot glutamat-piruvat-transaminaza), serumska aspartat-aminotransferaza (prej poznana kot glutamat-oksaloacetat-transaminaza), sečninski dušik, albumin, kreatinin v krvi, skupni bilirubin in skupne serumske beljakovine.
Druge določitve, ki so lahko potrebne za izdelavo ustrezne ocene strupenosti, vključujejo kalcij, fosfor, klorid, natrij, kalij, postno glukozo, lipide, hormone, ravnovesje kislina/baza, methemoglobin in aktivnost holinesteraze.
Kadar je potrebno, se za razširitev raziskave opaženih učinkov lahko uporabijo dodatne klinične biokemijske preiskave.
1.6.4 Makroskopska obdukcija
Na vseh živalih iz študije je treba izvesti popolno makroskopsko obdukcijo. Najmanj jetra, ledvica, nadledvične žleze in moda je treba stehtati mokre čim prej po disekciji, da se prepreči njihova dehidracija. Organe in tkiva, tj. normalno in tretirano kožo, jetra, ledvica, vranico, moda, nadledvične žleze, srce in tarčne organe (to je tiste organe, ki kažejo makroskopske poškodbe ali spremembe v velikosti), je treba shraniti v ustreznem mediju za morebitno histopatološko preiskavo v prihodnosti.
1.6.5 Histopatološka preiskava
Pri skupini, tretirani z velikim odmerkom, in kontrolni skupini je treba opraviti histološko preiskavo na shranjenih organih in tkivih. Pri vseh skupinah, tretiranih z manjšimi odmerki, je treba preiskati organe in tkiva, ki v skupini z največjim odmerkom kažejo poškodbe, ki se lahko pripišejo preskusni snovi. Živali satelitske skupine je treba histološko preiskati s posebnim poudarkom na tistih organih in tkivih, pri katerih so bili pri drugih tretiranih skupinah ugotovljeni strupeni učinki.
2. PODATKI
Podatke je treba povzeti v tabeli, ki za vsako preskusno skupino prikazuje število živali na začetku preskusa in število živali, ki kažejo posamezno vrsto poškodbe.
Vse opažene rezultate je treba ovrednotiti z ustrezno statistično metodo. Uporabi se lahko katera koli priznana statistična metoda.
3. POROČANJE
3.1 POROČILO O PRESKUSU
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— podatki o živalih (vrsta, sev, vir, okoljski pogoji, prehrana itd.),
— preskusni pogoji (vključno z vrsto povoja: okluzivni ali neokluzivni),
— velikost odmerkov (vključno z nosilcem, če je bil uporabljen) in koncentracije,
— velikost odmerka brez učinkov, kadar je možno,
— podatki o strupenem odzivu po spolu in odmerku,
— čas smrti med študijo oziroma ali so živali preživele do zaključka,
— strupeni ali drugi učinki,
— čas odkritja a vsakega nenormalnega znaka in njegov nadaljnji razvoj,
— podatki o hrani in telesni masi,
— opravljeni hematološki preskusi in rezultati,
— opravljeni klinični biokemijski preskusi in rezultati,
— izsledki obdukcije,
— podroben opis vseh histopatoloških izsledkov,
— statistična obdelava rezultatov, kadar je možno,
— razprava o rezultatih,
— razlaga rezultatov.
3.2 VREDNOTENJE IN RAZLAGA
Glej Splošni uvod dela B (D).
4. VIRI
Glej Splošni uvod dela B (E).
B.10 MUTAGENOST – PREIZKUS KROMOSOMSKIH ABERACIJ PRI SESALCIH IN VITRO
1. METODA
Ta metoda ustreza metodi OECD TG 473, In Vitro Mammalian Chromosome Aberration Test (1997).
1.1. UVOD
Namen preizkusa kromosomskih aberacij in vitro je določiti snovi, ki povzročijo strukturne kromosomske aberacije v kultiviranih sesalskih celicah (1) (2) (3). Ločimo dva tipa strukturnih aberacij, kromosomski tip in kromatidni tip. Večina kemičnih mutagenov povzroči aberacije kromatidnega tipa, nastopajo pa tudi aberacije kromosomskega tipa. Povečanje poliploidije lahko pomeni, da kemikalija lahko povzroči numerične aberacije. Vendar ta metoda ni namenjena določanju numeričnih aberacij in se navadno ne uporablja v ta namen. Kromosomske mutacije in podobni pojavi so vzrok številnih genskih bolezni pri človeku in obstajajo tehtni dokazi, da so kromosomske mutacije in podobni pojavi, ki povzročajo spremembe v onkogenih in genih, zaviralcih rasti tumorjev, somatskih celic, povezani z nastankom raka pri človeku in poskusnih živalih.
Pri preizkusu kromosomskih aberacij in vitro se lahko uporabijo kulture trajnih celičnih linij, celični sevi ali primarne celične kulture. Uporabljene celice se izberejo na podlagi zmožnosti rasti v kulturi, stabilnosti kariotipa, kromosomskega števila, raznolikosti kromosomov in pogostnosti spontanih kromosomskih aberacij.
Za preizkuse, opravljene in vitro, so navadno potrebni zunanji viri aktivacije presnove. Takšen sistem aktivacije presnove ne more povsem posnemati razmer in vivo pri sesalcih. Treba je paziti, da se prepreči nastanek razmer, ki bi vodile do pozitivnih rezultatov, ki ne kažejo prave mutagenosti in so lahko posledica sprememb pH, osmolarnosti ali visoke ravni citotoksičnosti (4) (5).
Ta preizkus se uporablja za iskanje možnih mutagenov in rakotvornih snovi za sesalce. Mnoge spojine, pri katerih je rezultat tega preizkusa pozitiven, so rakotvorne snovi za sesalce; vendar pa soodvisnost med tem preizkusom in rakotvornostjo ni popolna. Odvisna je od skupine nevarnosti kemikalije in vedno več je dokazov, da obstajajo rakotvorne snovi, ki jih ta preizkus ne zazna, ker je videti, da delujejo prek drugih mehanizmov in ne z neposrednim poškodovanjem DNA.
Glej tudi splošni uvod dela B.
1.2 DEFINICIJE
Aberacija kromatidnega tipa: strukturna poškodba kromosoma, izražena kot prelom posameznih kromatid ali prelom in združitev med kromatidama.
Aberacija kromosomskega tipa: strukturna poškodba kromosoma, izražena kot prelom ali prelom in združitev obeh kromatid na istem mestu.
Endoreduplikacija: proces, pri katerem se jedro po podvojitvi DNA v fazi S ne začne deliti, ampak takoj nastopi druga faza S. Nastanejo kromosomi s 4, 8, 16, ... kromatidami.
Presledek: akromatska lezija, manjša od širine ene kromatide, ob zelo majhni neporavnanosti kromatid.
Mitotični indeks: razmerje med številom celic v metafazi in skupnim številom celic v opazovani populaciji celic; kazalec stopnje množitve te populacije.
Numerična aberacija: število kromosomov, drugačno od normalnega števila, ki je značilno za uporabljene celice.
Poliploidija: večkratnik haploidnega števila kromosomov (n), razen diploidnega števila (tj. 3n, 4n in tako naprej).
Strukturna aberacija: sprememba v strukturi kromosoma, ki je vidna pri mikroskopskem pregledu metafaze celične delitve v obliki delecij in fragmentov, transpozicij ali recipročnih transi okacij.
1.3 PRINCIP PRESKUSNE METODE
Celične kulture se izpostavijo preizkušam snovi ob aktivaciji presnove in brez nje. Celične kulture se v poprej določenih intervalih po izpostavitvi preizkušam snovi obdelajo s snovjo za ustavitev metafaze (npr. Colcemidom® ali kolhicinom), se požanjejo in obarvajo, nato se metafazne celice mikroskopsko pregledajo, da se določi navzočnost kromosomskih aberacij.
1.4 OPIS PRESKUSNE METODE
1.4.1 Priprave
1.4.1.1 Celice
Lahko se uporabijo različne celične linije, celični sevi ali primarne celične kulture, vključno s človeškimi celicami (npr. fibroblasti kitajskega hrčka, limfociti periferne krvi človeka ali drugih sesalcev).
1.4.1.2 Gojišče in pogoji kultiviranja
Pri vzdrževanju kultur naj se uporabijo ustrezna gojišča za kulture in pogoji inkubacije (posode za kulture, koncentracija CO2, temperatura in vlažnost). Trajne celične linije in sevi se redno preverjajo, ali je v njih modalno kromosomsko število stabilno in ali niso okužene z mikoplazmo; okužene celične linije in sevi naj se ne uporabljajo. Poznati je treba normalni čas celičnega ciklusa in pogoje kultiviranja.
1.4.1.3 Priprava kultur
Trajne celične linije in sevi: celice se namnožijo iz založnih kultur, nasadijo v gojišče tako na gosto, da kultura ne bo dosegla konfluentne rasti, preden se požanjejo, in se inkubirajo pri 37 oC.
Limfociti: celotna kri, obdelana z antikoagulantom (npr. heparinom), ali ločeni limfociti, dobljeni iz zdravih osebkov, se dodajo v gojišče, ki vsebuje mitogen (npr. fitohemaglutinin), in se inkubirajo pri 37 oC.
1.4.1.4 Aktivacija presnove
Celice naj se izpostavijo preizkušam snovi ob navzočnosti in ob odsotnosti ustreznega sistema za aktivacijo presnove. Najpogosteje uporabljani sistem je postmitohondrijska frakcija (S9), pripravljena iz jeter glodavcev, ki so bila obdelana s sredstvi za encimsko indukcijo, kakor je Aroclorm 1254 (6) (7) (8) (9), ali z zmesjo fenobarbitona in β – naftoflavona, z dodanimi kofaktorji (10) (11) (12).
Postmitohondrijska frakcija se navadno uporablja v koncentracijah 1-10 % v/v v končnem preizkusnem gojišču. Pogoji sistema za aktivacijo presnove so lahko odvisni od skupine nevarnosti preizkušane kemikalije. Včasih je primerno uporabiti več kakor eno koncentracijo postmitohondrijske frakcije.
Vrsta razvojnih dosežkov, skupaj s pridobivanjem gensko spremenjenih celičnih linij, v katerih se izražajo geni za točno določene aktivirajoče encime, lahko daje možnosti za endogeno aktivacijo. Izbira uporabljenih celičnih linij naj bo znanstveno utemeljena (npr. s pomembnostjo izoencima citokrom P450 za presnovo preizkušane snovi).
1.4.1.5 Preizkušana snov/priprava
Trdne preizkušane snovi naj se pred obdelavo celic raztopijo ali suspendirajo v ustreznih topilih ali nosilcih, in če je to primerno, se razredčijo. Tekoče preizkušane snovi se lahko dodajo neposredno v preizkusni sistem in/ali pred obdelavo razredčijo. Uporabljajo naj se sveže pripravljene preizkušane snovi, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
1.4.2 Preizkusni pogoji
1.4.2.1 Topilo/nosilec
Topilo/nosilec naj ne vzbuja suma, da kemično reagira s preizkusno snovjo, in naj bo združljivo s preživetjem celic in delovanjem S9. Če se uporabijo manj poznana topila/nosilci, naj njihovo vključitev podpirajo podatki, ki kažejo na njihovo združljivost. Priporoča se, da se, kadar koli je to mogoče, kot prva možnost preuči uporaba vodnega topila/nosilca. Kadar se preizkušajo v vodi nestabilne snovi, naj se uporabijo brezvodna organska topila. Voda se lahko odstrani z molekulskim sitom.
1.4.2.2 Koncentracije izpostavljenosti
Med merili, ki jih je treba upoštevati pri določanju najvišje koncentracije, so citotoksičnost, topnost v preizkušanem sistemu in spremembe v pH ali osmolarnosti.
Citotoksičnost naj se določi ob aktivaciji presnove in brez nje v glavnem poskusu z uporabo ustreznega kazalca celične neokrnjenosti in rasti, kakor so stopnja konfluentne rasti, število živih celic ali mitotični indeks. Lahko je koristno, če se citotoksičnost in topnost določita v poprejšnjem poskusu.
Uporabijo naj se vsaj tri koncentracije, ki jih je mogoče analizirati. Ob nastopu citotoksičnosti naj te koncentracije zajamejo območje od največje toksičnosti do majhne toksičnosti ali netoksičnosti; to bo navadno pomenilo, da razlika med koncentracijami ne bo smela biti večja od faktorja med 2 in √10. V času odvzema naj bo pri najvišji koncentraciji znatno zmanjšana stopnja konfluentne rasti, število celic ali mitotični indeks (vsi za več kakor 50 %). Mitotični indeks je le posredno merilo citotoskičnih/citostatskih učinkov in je odvisen od časa, ki je pretekel od obdelave. Vendar je mitotični indeks sprejemljiv za suspenzijske kulture, pri katerih so druge meritve toksičnosti lahko težavne in nepraktične. Informacije o dinamiki celičnega ciklusa, kakor je povprečni generacijski čas (AGT), se lahko uporabijo kot dodatne informacije. Vendar je AGT le povprečna vrednost, iz katere ni vedno razviden obstoj zapoznelih podpopulacij, in celo zelo majhno povečanje povprečnega generacijskega časa lahko pomeni znatno zapoznelost optimalnega števila aberacij.
Za sorazmerno necitotoksične snovi naj bo največja preizkusna koncentracija 5μl/ml, 5 mg/ml oziroma 0,01 M, tista, ki je najnižja.
Za sorazmerno netopne snovi, ki pri koncentracijah, nižjih od netopnih koncentracij, niso toksične, naj bo največji uporabljeni odmerek koncentracija nad mejo topnosti v končnem gojišču kulture ob koncu obdelave. Pri nekaterih primerih (npr. kadar se toksičnost pokaže le pri koncentracijah, višjih od netopne koncentracije) je priporočljivo preizkusiti več kakor eno koncentracijo z vidno oborino. Lahko je koristno oceniti topnost na začetku in na koncu obdelave, saj se topnost med izpostavitvijo v preizkusnem sistemu lahko spremeni zaradi navzočnosti celic, seruma S9 itn. Netopnost se lahko zazna s prostim očesom. Oborina ne sme vplivati na štetje.
1.4.2.3 Negativni in pozitivni kontrolni vzorci
V vsak poskus naj se vključijo sočasni pozitivni in negativni (topilo ali nosilec) kontrolni vzorci, ob aktivaciji presnove in brez nje. Kadar se uporabi aktivacija presnove, mora biti kemikalija pozitivne kontrole tista, pri kateri je za mutageni odziv potrebna aktivacija.
V pozitivnih kontrolnih vzorcih naj se uporabi znani klastogen pri ravneh izpostavljenosti, pri katerih se pričakuje ponovljivo in zaznavno povečanje glede na ozadje, ki pokaže občutljivost preizkusnega sistema.
Koncentracije pozitivne kontrole naj se izberejo tako, da so učinki jasni, vendar ne razkrijejo takoj identitete kodiranih mikroskopskih preparatov. Primeri snovi pozitivne kontrole vključujejo:
|
Stanje aktivacije presnove |
Snov |
Št. CAS |
Št. Einecs |
|
Ni zunanje aktivacije presnove |
metil metansulfonat |
66-27-3 |
200-625-0 |
|
etil metansulfonat |
62-50-0 |
200-536-7 |
|
|
N-etil-N-nitrozosečnina |
759-73-9 |
212-072-2 |
|
|
mitomicin C |
50-07-7 |
200-008-6 |
|
|
4-nitrokinolin-N-oksid |
56-57-5 |
200-281-1 |
|
|
Zunanja aktivacija presnove |
benzo[a]piren |
50-32-8 |
200-028-5 |
|
ciklofosfamid ciklofosfamid monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
Lahko se uporabijo druge ustrezne snovi pozitivne kontrole. Uporabijo naj se kemikalije pozitivne kontrole, ki sodijo v isto skupino nevarnosti kakor preizkušana kemikalija, kadar so na voljo.
Za vsak odvzem naj se pripravijo negativni kontrolni vzorci, ki jih sestavlja le topilo ali nosilec v obdelovalnem gojišču, obdelani na enak način kakor obdelovalne kulture. Uporabijo se tudi neobdelani kontrolni vzorci, razen če pretekli kontrolni podatki dokazujejo, da izbrano topilo ne povzroča škodljivih ali mutagenih učinkov.
1.4.3 Postopek
1.4.3.1 Obdelava s preizkušano snovjo
Množeče se celice se obdelajo s preizkušano snovjo ob navzočnosti in ob odsotnosti sistema za aktivacijo presnove. Obdelava limfocitov naj se začne približno 48 ur po mitogeni stimulaciji.
1.4.3.2 Navadno se pri vsaki koncentraciji uporabita dve vzporedni kulturi; uporaba dveh vzporednih kultur se močno priporoča pri negativnih/s topilom kontrolnih kulturah. Kadar se na podlagi preteklih podatkov lahko dokaže, da so razlike med dvema vzporednima kulturama minimalne (13) (14), je sprejemljivo, da se uporabi ena kultura za vsako koncentracijo.
Plinaste ali hlapne snovi naj se preizkušajo z ustreznimi metodami, na primer v zatesnjenih posodah za kulture (15) (16).
1.4.3.3 Čas odvzema celic iz kulture
V prvem poskusu naj se celice za 3-6 ur izpostavijo preizkušam snovi, ob aktivaciji presnove in brez nje, in vzorčijo v času približno 1,5 dolžine normalnega celičnega ciklusa po začetku obdelave (12). Če so pri takšnem protokolu rezultati negativni ob aktivaciji, pa tudi brez nje, se opravi dodatni poskus brez aktivacije, pri katerem se kultura nenehno obdeluje do vzorčenja v času, enakem približno 1,5 dolžine normalnega celičnega ciklusa. Nekatere kemikalije se laže zaznajo pri časih obdelave/vzorčenja, ki so daljši od 1,5 dolžine ciklusa. Negativne rezultate ob aktivaciji presnove je treba potrditi za vsak primer posebej. Kadar se pojmuje, da potrditev negativnih rezultatov ni potrebna, naj se to utemelji.
1.4.3.4 Priprava kromosomov
Celične kulture se obdelajo s Colcemidom® ali kolhicinom, navadno 1-3 ure pred odvzemom celic. Celice se odvzamejo in obdelajo za pripravo kromosomov iz vsake kulture posebej. Priprava kromosomov vključuje hipotonično obdelavo celic, fiksiranje in barvanje.
1.4.3.5 Analiza
Vsi preparati, skupaj s pozitivnimi in negativnimi kontrolnimi vzorci, naj se pred mikroskopsko analizo neodvisno kodirajo. Ker fiksiranje pogosto povzroči pretrganje dela metafaznih celic in izgubo kromosomov, naj bo število centromer v štetih celicah pri vseh vrstah celic enako modalnemu številu ± 2. Če je to primerno, naj se na vsako koncentracijo in vsak kontrolni vzorec v štetje vključi vsaj 200 dobro vidnih metafaz, ki so enakomerno porazdeljene med vzporedne vzorce. To število se lahko zmanjša, kadar se opazi veliko število aberacij.
Čeprav je namen preizkusa zaznati strukturne kromosomske aberacije, je pomembno, da se evidentirata poliploidija in endoreduplikacija, kadar se pokažeta.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Poskusna enota je celica, zato naj se določi odstotek celic z eno ali več strukturnimi kromosomskimi aberacijami. Različni tipi strukturnih kromosomskih aberacij naj se navedejo skupaj s števili in pogostnostjo za poskusne in kontrolne kulture. Presledki se evidentirajo ločeno in navedejo v poročilu, vendar se na splošno ne vključijo v skupno pogostnost aberacij.
Evidentirajo naj se tudi sočasne meritve citotoksičnosti za vse obdelane in negativne kontrolne kulture v glavnih poskusih aberacij.
Navedejo se podatki za posamezne kulture. Vsi podatki naj bodo povzeti v tabelah.
Preverjanje jasnega pozitivnega odziva ni potrebno. Dvoumni rezultati naj se razjasnijo z dodatnimi preizkusi, po možnosti ob prilagojenih poskusnih pogojih. Potrebnost potrditve negativnih rezultatov je obravnavana pod 1.4.3.3. V nadaljnjih poskusih naj se preuči možnost prilagoditve preizkusnih parametrov, da se razširi območje pogojev analize. Preizkusni parametri, ki bi se lahko prilagodili, vključujejo intervale med koncentracijami in pogoje aktivacije presnove.
2.2 VREDNOTENJE IN INTERPRETACIJA REZULTATOV
Pozitivni rezultat se lahko določi na podlagi številnih meril, kakor je na primer s koncentracijo povezano povečanje ali ponovljivo povečanje števila celic s kromosomskimi aberacijami. Najprej naj se preuči biološka pomembnost rezultatov. Pri vrednotenju rezultatov preizkusa se kot pomoč lahko uporabijo statistične metode (3) (13). Statistična značilnost naj ne bo edini odločilni dejavnik za pozitivni odziv.
Povečano število poliploidnih celic lahko pomeni, da preizkušana snov lahko zavre mitozo in povzroči numerične kromosomske aberacije. Povečano število celic z endoredupliciranimi kromosomi lahko pomeni, da preizkušana snov lahko zavre potek celičnega ciklusa (17) (18).
Pojmuje se, da preizkušana snov, pri kateri rezultati ne izpolnjujejo navedenih meril, ni mutagena v tem sistemu.
Čeprav bo večina poskusov dala jasne pozitivne ali negativne rezultate, bodo v redkih primerih dobljeni podatki preprečili zanesljivo oceno o delovanju preizkušane snovi. Rezultati lahko ostanejo dvoumni ali dvomljivi ne glede na število ponovitev poskusa.
Pozitivni rezultati preizkusa kromosomskih aberacij in vitro pomenijo, da preizkušana snov povzroča strukturne kromosomske aberacij e v kultiviranih somatskih celicah sesalcev. Negativni rezultati pomenijo, da preizkušana snov pri preizkusnih pogojih ne povzroča kromosomskih aberacij v kultiviranih somatskih celicah sesalcev.
3. POROČANJE
POROČILO O PRESKUSU
Poročilo o preizkusu mora vsebovati naslednje informacije:
Topilo/nosilec:
— utemeljitev izbire nosilca,
— topnost in stabilnost preizkušane snovi v topilu/nosilcu, če sta znani.
Celice:
— vrsta in vir celic,
— značilnosti kari otipa in ustreznost uporabljene vrste celic,
— odsotnost mikoplazme, če je to primerno,
— podatki o dolžini celičnega ciklusa,
— spol donorjev krvi, celotna kri ali ločeni limfociti, uporabljeni mitogen,
— število pasaž, če je to primerno,
— metode vzdrževanj a celične kulture, če j e to primerno,
— modalno število kromosomov.
Preskusni pogoji:
— vrsta snovi za ustavitev metafaze, njena koncentracija in čas izpostavljenosti celic,
— razlogi za izbiro koncentracij in števila kultur, vključno z npr. podatki o citotoksičnosti in mejah topnosti, če so na voljo,
— sestava gojišč, koncentracija CO2, če je to primerno,
— koncentracija preizkušane snovi,
— volumen dodanega nosilca in preizkušane snovi,
— temperatura inkubacije,
— čas inkubacije,
— trajanje obdelave,
— gostota celic ob nasaditvi, če je to primerno,
— vrsta in sestava sistema za aktivacijo presnove, skupaj z merili sprejemljivosti,
— pozitivni in negativni kontrolni vzorci,
— metode priprave mikroskopskih preparatov,
— merila za štetje aberacij,
— število analiziranih metafaz,
— metode merjenja toksičnosti,
— merila za določitev, ali je študija pozitivna, negativna ali dvoumna.
Rezultati:
— znaki toksičnosti, npr. stopnja konfluentne rasti, podatki o celičnem ciklusu, število celic, mitotični indeks,
— znaki obarjanja,
— podatki o pH in osmolarnosti obdelovalnega gojišča, če sta bila določena,
— opredelitev aberacij, skupaj s presledki,
— število celic s kromosomskimi aberacijami in tip kromosomskih aberacij, ki se navedeta posebej za vsako obdelano in kontrolno kulturo,
— spremembe v ploidnosti, če so bile opažene,
— odvisnost med odmerkom in odzivom, kadar je to mogoče,
— statistične analize, če so bile opravljene,
— podatki o sočasni negativni (topilo/nosilec) in pozitivni kontroli,
— podatki o pretekli negativni (topilo/nosilec) in pozitivni kontroli, z območji, srednjimi vrednostmi in standardnimi odkloni.
Diskusija rezultatov.
Sklepi.
4. LITERATURA
(1) Evans, H.J. (1976). Cytological Methods for Detecting Chemical Mutagens. In: Chemical mutagens, Principles and Methods for their Detection, Vol. 4, Hollaender, A. (ed) Plenum Press, New York in London, str. 1–29.
(2) Ishidate, M. Jr. in Sofumi, T. (1985), The In Vitro Chromosomal Aberration Test Using Chinese Hamster Lung (CHL) Fibroblast Cells in Culture, v: Progress in Mutation Research, zv. 5, Ashby, J. idr., (izd.) Elsevier Science Publishers, Amsterdam-New York-Oxford, str. 427–432.
(3) Galloway, S. M., Armstrong, M. J., Reuben, C, Colman, S., Brown, B., Cannon, C, Bloom, A. D., Nakamura, F., Ahmed, M., Duk, S., Rimpo, J., Margolin, G. H., Resnick, M. A., Anderson, G., in Zeiger E. (1978), Chromosome aberration and sister chromatic exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals, Environs, Molec. Mutagen 10 (suppl. 10), str. 1–175.
(4) Scott, D., Galloway, S. M., Marshall, R. R., Ishidate, M. Jr., Brusick, D., Ashby, J., in Myhr, B. C. (1991), Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9, Mutation Res., 257, str. 147–204.
(5) Morita, T., Nagaki, T., Fukuda, I., in Okumura, K., (1992), Clastogenicity of low pH to Various Cultured Mammalian Cells, Mutation Res., 268, str. 297–305.
(6) Ames, B. N., McCann, J., in Yamasaki, E. (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test, Mutation Res., 31, str. 347–364.
(7) Maron, D. M., in Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation Res., 113, str. 173–215.
(8) Natarajan, A. T., Tates, A. D., van Buul, P. P. W., Meijers, M., in de Vogel, N. (1976), Cytogenetic Effects of Mutagen/Carcinogens after Activation in a Mircrosomal System In Vitro, I. Induction of Chromosome Aberrations and Sister Chromatid Exchange by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes, Mutation Res., 37, str. 83–90.
(9) Matsuoka, A., Hayashi, M., in Ishidate, M. Jr. (1979), Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In Vitro, Mutation Res., 66, str. 277–290.
(10) Elliot, B. M., Combes, R. D., Elcombe, C. R., Gatehouse, D. G., Gibson, G. G., Mackay, J. M., in Wolf, R. C. (1992), Report of UK Environmental Mutagen Society Working Party. Alternative to Aroclor 1254-induced S9 in In Vitro Genotoxicity Assays, Mutagenesis, 7, str. 175–177.
(11) Matsushima, T., Sawamura, M., Hara, K., in Sugimura, T. (1976), A. Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems, v: de Serres, F. J. Fouts, J. R. Bend, J. R., in Philpot, R. M. (izd.), In Vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, str. 85–88.
(12) Galloway, S. M., Aardema, M. J., Ishidate, M. Jr., Ivett, J. L., Kirkland, D. J. Morita, T., Mosesso, P., Sofumi, T. (1994), Report from Working Group on in In Vitro Tests for Chromosomal Aberrations, Mutation Res., 312, str. 241–261.
(13) Richardson, C, Williams, D. A., Allen, J. A., Amphlett, G, Chanter, D. O., in Phillips, B. (1989), Analysis of Data from In Vitro Cytogenetic Assays, v: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D. J., (cd) Cambridge University Press, Cambridge, str. 141–154.
(14) Soper, K. A., in Galloway, S. M. (1994), Replicate Flasks are not Necessary for In Vitro Chromosome Aberration Assays in CHO Cells, Mutation Res., 312, str. 139–149.
(15) Krahn, D. F., Barsky, F. C, in McCooey, K. T. (1982), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, v: Tice, R. R., Costa, D. L., Schaich, K. M. (izd.), Genotoxic Effects of Airborne Agents, New York, Plenum, str. 91–103.
(16) Zamora, P. O., Benson, J. M., Li, A. P., in Brooks, A. L. (1983), Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay, Environmental Mutagenesis, 5, str. 795–801.
(17) Locke-Huhle, C. (1983), Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest, Mutation Res., 119, str. 403–413.
(18) Huang, Y., Change, C, in Trosko, J. E. (1983), Aphidicolin-induced endoreduplication in Chinese hamster cells, Cancer Res., 43, str. 1362–1364.
B.11 MUTAGENOST – PRESKUS KROMOSOMSKIH ABERACIJ V KOSTNEM MOZGU SESALCEV IN VIVO
1. METODA
Ta metoda ustreza metodi OECD TG 475, Mammalian Bone Marrow Chromosome Aberration Test (1997).
1.1 UVOD
Preizkus kromosomskih aberacij in vivo pri sesalcih se uporablja za odkrivanje strukturnih kromosomskih aberacij, ki jih povzroči preizkušana snov v celicah kostnega mozga živali, navadno glodavcev (1) (2) (3) (4). Ločimo dva tipa strukturnih kromosomskih aberacij, kromosomski tip in kromatidni tip. Povečanje poliploidije lahko pomeni, da kemikalija lahko povzroči numerične aberacij e. Večina kemičnih mutagenov povzroči aberacij e kromatidnega tipa, nastopajo pa tudi aberacij e kromosomskega tipa. Kromosomske mutacije in podobni pojavi so vzrok genskih bolezni pri človeku in obstajajo tehtni dokazi, da so kromosomske mutacije in podobni pojavi, ki povzročajo spremembe v onkogenih in genih, zaviralcih rasti tumorjev, povezani z rakom pri človeku in v poskusnih sistemih.
Pri tem preizkusu se redno uporabljajo glodavci. Tarčno tkivo pri tem preizkusu je kostni mozeg, ker je zelo vaskularizirano tkivo in vsebuje populacijo celic s hitro menjavo ciklusa, ki se z lahkoto izolirajo in obdelajo. Druge vrste in tarčna tkiva niso predmet te metode.
Ta preizkus kromosomskih aberacij je posebno primeren za ocenjevanje nevarnosti mutagenosti, ker omogoča upoštevanje dejavnikov presnove in vivo, farmakokinetike in popravljanja DNA, čeprav so ti lahko različni pri različnih vrstah in tkivih. Preizkus in vivo je koristen tudi za nadaljnjo preiskavo mutagenih učinkov, odkritih pri preizkusu in vitro.
Če obstajajo dokazi, da preizkušana snov ali reaktivni metabolit ne bo dosegel tarčnega tkiva, ta preizkus ni primeren.
Glej tudi splošni uvod dela B.
1.2 DEFINICIJE
Aberacija kromatidnega tipa: strukturna poškodba kromosoma, izražena kot prelom posameznih kromatid ali prelom in združitev med kromatidama.
Aberacija kromosomskega tipa: strukturna poškodba kromosoma, izražena kot prelom ali prelom in združitev pri obeh kromatidah na istem mestu.
Endoreduplikacija: proces, pri katerem se jedro po podvojitvi DNA v fazi S ne začne deliti, ampak takoj nastopi druga faza S. Nastanejo kromosomi s 4, 8, 16, ... kromatidami.
Presledek: akromatska lezija, manjša od širine ene kromatide, ob zelo majhni neporavnanosti kromatid(-e).
Numerična aberacija: število kromosomov, drugačno od normalnega števila, ki je značilno za uporabljene celice.
Poliploidija: večkratnik haploidnega števila kromosomov (n), razen diploidnega števila (tj. 3n, 4n in tako naprej).
Strukturna aberacija: sprememba v strukturi kromosoma, ki je vidna pri mikroskopskem pregledu metafaze celične delitve v obliki delecij in fragmentov, transpozicij ali recipročnih transi okacij.
1.3 PRINCIP PRESKUSNE METODE
Živali se primerno izpostavijo preizkušam snovi in se v primernem času po tretiranju žrtvujejo. Pred žrtvovanjem se živali tretirajo s sredstvom za ustavitev metafaze (npr. kolhicinom ali Colcemidom®). Nato se pripravijo in obarvajo preparati kromosomov iz celic kostnega mozga in se določijo kromosomske aberacije v metafaznih celicah.
1.4 OPIS PRESKUSNE METODE
1.4.1 Priprave
1.4.1.1 Izbira živalskih vrst
Navadno se uporabljajo podgane, miši in kitajski hrčki, lahko pa se uporabi katera koli primerna vrsta sesalcev. Uporabijo naj se splošno uporabljani laboratorijski sevi mladih zdravih odraslih živali. Ob začetku študije naj bo nihanje teže živali čim manjše in naj ne presega ± 20 % srednje vrednosti teže vsakega spola.
1.4.1.2 Pogoji bivanja in hranjenja
Uporabljajo se splošni pogoji iz splošnega uvoda dela B, vendar naj bo ciljna vlažnost 50–60 %.
1.4.1.3 Priprava živali
Zdrave mlade odrasle živali se naključno dodelijo kontrolni in tretirani skupini. Kletke se razporedijo tako, da se čimbolj zmanjšajo možni učinki postavitve kletke. Živali se označijo z enkratnimi oznakami. Živali se vsaj pet dni aklimatizirajo na laboratorijske razmere.
1.4.1.4 Priprava odmerkov
Trdne preizkušane snovi naj se pred odmerjanjem živalim raztopijo ali suspendirajo v ustreznih topilih ali nosilcih, in če je to primerno, se razredčijo. Tekoče preizkušane snovi se lahko odmerijo neposredno ali pa se pred odmerjanjem razredčijo. Uporabljajo naj se sveže pripravljene preizkušane snovi, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
1.4.2 Preizkusni pogoji
1.4.2.1 Topilo/nosilec
Topilo/nosilec naj nima toksičnih učinkov pri uporabljenih odmerkih in naj se zanj ne sumi, da kemično reagira s preizkusno snovjo. Če se uporabijo manj poznana topila/nosilci, naj njihovo vključitev podpirajo podatki, ki kažejo na njihovo združljivost. Priporoča se, da se, kadar koli je to mogoče, kot prva možnost preuči uporaba vodnega topila/nosilca.
1.4.2.2 Kontrolni vzorci
V vsak preizkus naj se vključijo sočasni pozitivni in negativni (topilo/nosilec) kontrolni vzorci za vsak spol. Razen tretiranja s preizkusno snovjo naj se z živalmi v kontrolnih skupinah ravna enako kakor s tistimi v tretiranih skupinah.
Snovi pozitivne kontrole naj pri ravneh izpostavljenosti, pri katerih se pričakuje zaznavno povečanje glede na ozadje, povzročijo kromosomske aberacije in vivo. Odmerki pozitivne kontrole naj se izberejo tako, da so učinki jasni, vendar ne razkrijejo takoj identitete kodiranih mikroskopskih preparatov. Sprejemljivo je, da se snovi pozitivne kontrole dajejo živalim drugače kakor preizkušana snov in da se pri pozitivni kontroli vzorči le enkrat. Lahko se uporabijo kemikalije pozitivne kontrole, ki sodijo v isti razred kakor preizkušana kemikalija, kadar so na voljo:
|
Snov |
Št. CAS |
Št. Einecs |
|
Etil metansulfonat |
62-50-0 |
200-536-7 |
|
N-etil-N-nitrozosečnina |
759-73-9 |
212-072-2 |
|
Mitomicin C |
50-07-7 |
200-008-6 |
|
Ciklofosfamid Ciklofosfamid monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
|
Trietilenmelamin |
51-18-3 |
200-083-5 |
Negativni kontrolni vzorci, tretirani le s topilom ali nosilcem, drugače pa obravnavani enako kakor tretirane skupine, naj se vključijo v vsako vzorčenje, razen če pretekli kontrolni podatki kažejo na sprejemljivo spremenljivost med posameznimi živalmi in pogostnost celic s kromosomskimi aberacijami. Če se pri negativni kontroli opravi le eno vzorčenje, je čas prvega vzorčenja najprimernejši. Uporabijo naj se tudi netretirani kontrolni vzorci, razen če pretekli ali objavljeni kontrolni podatki dokazujejo, da izbrano topilo/nosilec ne povzroča škodljivih ali mutagenih učinkov.
1.5 POSTOPEK
1.5.1 Število in spol živali
Vsaka tretirana in kontrolna skupina mora vključevati vsaj pet živali vsakega spola, ki jih je mogoče analizirati. Če so v času študije na voljo podatki študij o isti vrsti in ob uporabi istega načina izpostavljanja, ki dokazujejo, da med spoloma ni znatnih razlik v toksičnosti, bo zadostovalo preizkušanje na enem spolu. Kadar bi bila izpostavljenost kemikaliji pri človeku lahko omejena na en spol, na primer pri nekaterih farmacevtskih učinkovinah, naj se preizkus opravi na živalih ustreznega spola.
1.5.2 Program tretiranja
Preizkušane snovi naj se po možnosti dajo z enkratnim vnosom. Preizkušane snovi se lahko dajejo tudi v razdeljenem odmerku, to pomeni dva vnosa v istem dnevu, ne več kakor nekaj ur narazen, da se olajša dajanje velikega volumna materiala. Drugačni režimi odmerjanja naj bodo znanstveno utemeljeni.
Vzorci naj se vzamejo dvakrat v enem dnevu ob različnih časih po tretiranju. Pri glodavcih je prvi čas vzorčenja 1,5 dolžine normalnega celičnega ciklusa (ki navadno traja 12–18 ur) po tretiranju. Ker čas, potreben za sprejem in presnovo preizkušane snovi ter njen učinek na dinamiko celičnega ciklusa, lahko vpliva na optimalni čas za zaznavo kromosomskih aberacij, se priporoča ponovni odvzem vzorcev 24 ur po prvem vzorčenju. Če se uporabijo režimi odmerjanja, daljši od enega dneva, naj se vzorči enkrat, 1,5 dolžine normalnega celičnega ciklusa po zadnjem vnosu.
Pred žrtvovanjem se živalim intraperitonealno injicira ustrezen odmerek sredstva za ustavitev metafaze (npr. Colcemida® ali kolhicina). Živali se vzorčijo v ustreznem časovnem intervalu po tem. Pri miših je ta interval približno 3–5 ur; pri kitajskih hrčkih je ta interval približno 4–5 ur. Celice se odvzamejo iz kostnega mozga in analizirajo, da se določijo kromosomske aberacij e.
1.5.3 Velikost odmerkov
Če se opravi študija za ugotavljanje območja, ker ni na voljo ustreznih podatkov, naj se opravi v istem laboratoriju, na isti vrsti, sevu in spolu ter ob enakem režimu tretiranja, kakor bo to uporabljeno v glavni študiji (5). Če toksičnost je, se za prvo vzorčenje uporabijo tri velikosti odmerkov. Te velikosti odmerkov naj zajamejo območje od največje toksičnosti do majhne toksičnosti ali netoksičnosti. Pri poznejšem vzorčenju se lahko uporabi le največji odmerek. Največji odmerek je opredeljen kot odmerek, ki povzroči takšne znake toksičnosti, na podlagi katerih je pričakovati, da bi večji odmerki pri istem režimu odmerjanja povzročili smrt. Snovi s specifičnim biološkim delovanjem pri majhnih netoksičnih odmerkih (na primer hormoni in mitogeni) so lahko izjeme pri merilih za določanje odmerka in naj se ovrednotijo za vsak primer posebej. Največji odmerek se lahko opredeli tudi kot odmerek, ki povzroči nekaj znakov toksičnosti v kostnem mozgu (npr. več kakor 50 % zmanjšanje mitotičnega indeksa).
1.5.4 Mejni preizkus
Če preizkus pri eni velikosti odmerka vsaj 2 000 mg/kg telesne teže, ki se da v enem vnosu ali v dveh vnosih v istem dnevu, ne povzroči nobenih opaznih toksičnih učinkov in če se na podlagi podatkov o strukturno sorodnih snoveh ne pričakuje, da bo snov genotksična, se lahko pojmuje, da popolna študija z uporabo treh velikosti odmerkov ni potrebna. Mejni odmerek za dolgotrajnejše študije je 2 000 mg/kg telesne teže/dan za tretiranje do 14 dni in 1 000 mg/kg telesne teže/dan za tretiranje, daljše od 14 dni. Pričakovana izpostavljenost človeka lahko nakaže potrebo po večjih odmerkih pri mejnem preizkusu.
1.5.5 Dajanje odmerkov
Navadno se preizkušana snov daje z gavažo po želodčni cevki ali ustrezni intubacijski kanili ali z intraperitonealno injekcijo. Sprejemljivi so tudi drugi načini izpostavljanja, kadar jih je mogoče utemeljiti. Največji volumen tekočine, ki se lahko naenkrat da z gavažo ali injekcijo, je odvisen od velikosti preizkušane živali. Volumen naj ne presega 2 ml/100 g telesne teže. Uporabo večjih volumnov je treba utemeljiti. Razen pri dražečih ali jedkih snoveh, ki bodo navadno povzročile dražilne učinke pri večjih koncentracijah, naj se s prilagoditvijo koncentracije čimbolj zmanjša spremenljivost preizkušanega volumna, tako da se zagotovi stalni volumen pri vseh velikostih odmerkov.
1.5.6 Priprava kromosomov
Takoj po žrtvovanju se kostni mozeg odvzame, izpostavi hipotonični raztopini in fiksira. Celice se nato nanesejo na objektna stekelca in obarvajo.
1.5.7 Analiza
Kot merilo citotoksičnosti naj se določi mitotični indeks v vsaj 1 000 celicah na žival pri vseh tretiranih živalih (skupaj s pozitivnimi kontrolnimi vzorci) in netretiranih živalih negativne kontrole.
Analizira naj se vsaj 100 celic za vsako žival. To število se lahko zmanjša, kadar se opazi veliko število aberacij. Vsi preparati, skupaj s pozitivnimi in negativnimi kontrolnimi vzorci, naj se pred mikroskopsko analizo neodvisno kodirajo. Ker postopki priprave mikroskopskih preparatov pogosto povzročijo pretrganje dela metafaz in izgubo kromosomov, naj bo število centromer v štetih celicah enako 2 n ± 2.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Podatki za posamezne živali naj bodo prikazani v tabelah. Poskusna enota je žival. Za vsako žival naj se določi število štetih celic, število aberacij na celico in odstotek celic z eno ali več strukturnimi kromosomskimi aberacij ami. Različni tipi strukturnih kromosomskih aberacij naj se navedejo skupaj s števili in pogostnostjo za tretirane in kontrolne skupine. Presledki se evidentirajo ločeno in navedejo v poročilu, vendar se na splošno ne vključijo v skupno pogostnost aberacij. Če ni dokaza za razliko v odzivu med spoloma, se pri statistični analizi lahko združijo podatki za oba spola.
2.2 VREDNOTENJE IN INTERPRETACIJA REZULTATOV
Pozitivni rezultat se lahko določi na podlagi številnih meril, kakor je na primer z odmerkom povezano povečanje relativnega števila celic s kromosomskimi aberacijami ali jasno povečanje števila celic z aberacijami v posamezni tretirani skupini ob posameznem vzorčenju. Najprej naj se preuči biološka pomembnost rezultatov. Pri vrednotenju rezultatov preizkusa se kot pomoč lahko uporabijo statistične metode (6). Statistična značilnost naj ne bo edini odločilni dejavnik za pozitivni odziv. Dvoumni rezultati naj se razjasnijo z dodatnimi preizkusi, po možnosti ob prilagojenih poskusnih pogojih.
Povečanje poliploidije lahko pomeni, da preizkušana snov lahko povzroči numerične kromosomske aberacije. Povečanje pogostnosti endoreduplikacije lahko pomeni, da preizkušana snov lahko zavre potek celičnega ciklusa (7) (8).
Pojmuje se, da preizkušana snov, pri kateri rezultati ne izpolnjujejo navedenih meril, ni mutagena v tem preizkusu.
Čeprav bo večina poskusov dala jasne pozitivne ali negativne rezultate, bodo v redkih primerih dobljeni podatki preprečili zanesljivo oceno o delovanju preizkušane snovi. Rezultati lahko ostanejo dvoumni ali dvomljivi ne glede na število opravljenih poskusov.
Pozitivni rezultati preizkusa kromosomskih aberacij in vivo pomenijo, da preizkušana snov povzroča kromosomske aberacije v kostnem mozgu preizkušane vrste. Negativni rezultati pomenijo, da preizkušana snov pri preizkusnih pogojih ne povzroča kromosomskih aberacij v kostnem mozgu preizkušane vrste.
Obravnava naj se verjetnost, da preizkušana snov ali njeni metaboliti dosežejo krvni obtok ali posebej tarčno tkivo (npr. sistemska toksičnost).
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preizkusu mora vsebovati naslednje informacije:
Topilo/nosilec:
— utemeljitev izbire nosilca,
— topnost in stabilnost preizkušane snovi v topilu/nosilcu, če sta znani.
Preizkusne živali:
— uporabljena vrsta/sev,
— število, starost in spol živali,
— vir, pogoji bivanja, prehrana itn.,
— teža posameznih živali na začetku preizkusa, skupaj z območjem telesne teže, srednjo vrednostjo in standardnim odklonom za vsako skupino.
Preizkusni pogoji:
— pozitivni in negativni (nosilec/topilo) kontrolni vzorci,
— podatki študije za ugotavljanje območja, če je bila opravljena,
— razlogi za izbiro velikosti odmerka,
— podrobnosti o pripravi preizkušane snovi,
— podrobnosti o dajanju preizkušane snovi,
— razlogi za način dajanja,
— metode za preverjanje, ali je preizkušana snov dosegla krvni obtok ali tarčno tkivo, če je to primerno,
— način preračunavanja koncentracije preizkušane snovi v hrani/pitni vodi (ppm) v dejanski odmerek (mg/kg telesne teže/dan), če je to primerno,
— podrobnosti o kakovosti hrane in vode,
— podroben opis programov tretiranja in vzorčenja,
— metode merjenja toksičnosti,
— vrsta snovi za ustavitev metafaze, njena koncentracija in čas tretiranja,
— metode priprave mikroskopskih preparatov,
— merila za štetje aberacij,
— število analiziranih celic na žival,
— merila za določitev, ali je študija pozitivna, negativna ali dvoumna.
Rezultati:
— znaki toksičnosti,
— mitotični indeks,
— tip in število aberacij, navedena za vsako žival posebej,
— skupno število aberacij na skupino, s srednjimi vrednostmi in standardnimi odkloni,
— število celic z aberacij ami na skupino, s srednjimi vrednostmi in standardnimi odkloni,
— spremembe v ploidnosti, če so bile opažene,
— odvisnost med odmerkom in odzivom, kadar je to mogoče,
— statistične analize, če so bile opravljene,
— podatki o sočasni negativni kontroli,
— podatki o pretekli negativni kontroli, z območji, srednjimi vrednostmi in standardnimi odkloni,
— podatki o sočasni pozitivni kontroli.
Diskusija rezultatov.
Sklepi.
4. LITERATURA
(1) Adler, I. D. (1984), Cytogenetic Tests in Mammals, v Mutagenicity Testing: a Practical Approach, S. Venitt and J. M. Parry (izd.), IRL Press, Oxford, Washington D. C, str. 275–306.
(2) Preston, R. J., Dean, B. J., Galloway, S., Holden, H., McFee, A. F., in Shelby, M. (1987), Mammalian In Vivo Cytogenetic Assays: Analysis of Chromosome Aberrations in Bone Marrow Cells, Mutation Res., 189, str. 157–165.
(3) Richold, M., Chandley, A., Ashby, J., Gatehouse, D. G., Bootman, J., in Henderson, L. (1990), In Vivo Cytogenetic Assays, v: D. J. Kirkland (ed.), Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Poročilo, del I, pregledan, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 115–141.
(4) Tice, R. R., Hayashi, M., MacGregaro, J. T., Anderson, D., Blakey, D. H., Holden, H. E., Kirsch-Volders, M., Oleson Jr., F. B., Pacchierotti, F., Preston, R. J., Romagna, F., Shimada, H., Sutou, S., in Vannier, B. (1994), Report from the Working Group on the in Vivo Mammalian Bone Marrow Chromosomal Aberration Test, Mutation Res., 312, str. 305–312.
(5) Fielder, R. J., Allen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G, Hodson-Walker, G, Morton, D. B., Kirkland, D. J., in Richold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, str. 313–319.
(6) Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson, R., Richold, M., Papworth, D. G., in Savage, J. R. K. (1989), Statistical Analysis of In Vivo Cytogenetic Assays, v: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, Poročilo, del III. Statistical Evaluation of Mutagenicity Test Data, D. J. Kirkland (izd.) Cambridge University Press, Cambridge, str. 184–232.
(7) Locke-Huhle, C. (1983), Endoreduplication in Chinese hamster cells during alpha-radiation-induced G2 arrest, Mutation Res., 119, str. 403–413.
(8) Huang, Y., Change, C, in Trosko, J. E. (1983), Aphidicolin-induced endoreduplication in Chinese hamster cells, Cancer Res., 43, str. 1362–1364.
B.12 MUTAGENOST – PREIZKUS MIKRONUKLEUSOV V ERITROCITIH SESALCEV IN VIVO
1. METODA
Ta metoda ustreza metodi OECD TG 474, Mammalian Erythrocyte Micronucleus Test (1997).
1.1 UVOD
Preizkus mikronukleusov in vivo pri sesalcih se uporablja za odkrivanje poškodb, ki jih preizkušana snov povzroči na kromosomih ali mitotičnem aparatu eritroblastov, z analizo eritrocitov, vzorčenih iz kostnega mozga in/ali celic periferne krvi živali, navadno glodavcev.
Namen preizkusa mikronukleusov je določiti snovi, povzročiteljice citogenetskih poškodb, zaradi katerih nastanejo mikronukleusi, ki vsebujejo zaostale fragmente kromosomov ali cele kromosome.
Ko se eritroblast iz kostnega mozga razvije v polikromatični eritrocit, se jedro izvrže; kakršen koli mikronukleus, kije nastal, lahko ostane v drugače brezjedrni citoplazmi. Vidnost mikronukleusov je v teh celicah olajšana, ker nimajo jedra. Povečanje pogostnosti polikromatičnih eritrocitov z mikronukleusi pri tretiranih živalih je znak induciranih poškodb kromosomov.
Pri tem preizkusu se redno uporablja kostni mozeg glodavcev, saj v tem tkivu nastajajo polikromatični eritrociti. Določanje nezrelih (polikromatičnih) eritrocitov z mikronukleusi v periferni krvi je enako sprejemljivo pri kateri koli vrsti, pri kateri je bilo dokazano, da vranica ni zmožna odstraniti eritrocitov z mikronukleusi, ali ki je pokazala dovoljšno občutljivost za zaznavanje snovi, povzročajočih strukturne ali numerične kromosomske aberacije. Mikronukleusi se lahko razločijo na podlagi številnih meril. Ta vključujejo določanje navzočnosti ali odsotnosti kinetohora ali centromerne DNA v mikronukleusih. Pogostnost nezrelih (polikromatičnih) eritrocitov z mikronukleusi je glavna končna točka. Število zrelih (normokromatičnih) eritrocitov, ki vsebujejo mikronukleuse, v periferni krvi med določenim številom zrelih eritrocitov se tudi lahko uporabi kot končna točka preizkusa, kadar se živali tretirajo štiri tedne ali več.
Ta preizkus mikronukleusov in vivo pri sesalcih je posebno primeren za ocenjevanje nevarnosti mutagenosti, ker omogoča upoštevanje dejavnikov presnove in vivo, farmakokinetike in popravljanja DNA, čeprav so ti lahko različni pri različnih vrstah, tkivih in genetskih končnih točkah. Preizkus in vivo je koristen tudi za nadaljnjo preiskavo mutagenih učinkov, odkritih v sistemu in vitro.
Če obstajajo dokazi, da preizkušana snov ali reaktivni metabolit ne bo dosegel tarčnega tkiva, ta preizkus ni primeren.
Glej tudi splošni uvod dela B.
1.2 DEFINICIJE
Centromera (kinetohor): del(-i) kromosoma, s katerim(-i) se med celično delitvijo povežejo niti delitvenega vretena, kar omogoči urejeno gibanje hčerinskih kromosomov proti poloma hčerinskih celic.
Mikronukleusi: majhna jedra, poleg glavnega jedra celic in ločena od njega, ki nastanejo med telofazo mitoze (mejoze) iz zaostalih fragmentov kromosomov ali celih kromosomov.
Normokromatični eritrocit: zreli eritrocit, ki nima ribosomov in ga lahko ločimo od nezrelih, polikromatičnih eritrocitov z barvanjem, selektivnim za ribosome.
Polikromatični eritrocit: nezreli eritrocit, v vmesnem stadiju razvoja, ki še vedno vsebuje ribosome in ga zato lahko ločimo od zrelih, normokromatičnih eritrocitov z barvanjem, selektivnim za ribosome.
1.3 PRINCIP PRESKUSNE METODE
Živali se primerno izpostavijo preizkušam snovi. Če se uporabi kostni mozeg, se živali žrtvujejo ob primernih časih po tretiranju, nato se odvzame kostni mozeg ter se pripravijo in obarvajo preparati (1) (2) (3) (4) (5) (6) (7). Kadar se uporabi periferna kri, se kri odvzame ob primernih časih po tretiranju, nato se pripravijo in obarvajo razmazi krvi (4) (8) (9) (10). Pri študijah s periferno krvjo naj med zadnjo izpostavitvijo in odvzemom celic preteče čimmanj časa. Preparati se analizirajo, da se določi navzočnost mikronukleusov.
1.4 OPIS PRESKUSNE METODE
1.4.1 Priprave
1.4.1.1 Izbira živalskih vrst
Če se uporabi kostni mozeg, se priporočajo miši ali podgane, lahko pa se uporabi katera koli primerna vrsta sesalcev. Kadar se uporabi periferna kri, se priporočajo miši. Lahko pa se uporabi katera koli primerna vrsta sesalcev, pri kateri vranica ne odstrani eritrocitov z mikronukleusi ali ki je pokazala dovoljšno občutljivost za zaznavanje snovi, povzročajočih strukturne ali numerične kromosomske aberacije. Uporabijo naj se splošno uporabljani laboratorijski sevi mladih zdravih živali. Ob začetku študije naj bo nihanje teže živali čim manjše in naj ne presega ± 20 % srednje vrednosti teže vsakega spola.
1.4.1.2 Pogoji bivanja in hranjenja
Uporabljajo se splošni pogoji iz splošnega uvoda dela B, vendar naj bo ciljna vlažnost 50–60 %.
1.4.1.3 Priprava živali
Zdrave mlade odrasle živali se naključno dodelijo kontrolni in tretirani skupini. Živali se označijo z enkratnimi oznakami. Živali se vsaj pet dni aklimatizirajo na laboratorijske razmere. Kletke se razporedijo tako, da se čimbolj zmanjšajo možni učinki postavitve kletke.
1.4.1.4 Priprava odmerkov
Trdne preizkušane snovi naj se pred odmerjanjem živalim raztopijo ali suspendirajo v ustreznih topilih ali nosilcih, in če je to primerno, se razredčijo. Tekoče preizkušane snovi se lahko odmerijo neposredno ali pa se pred odmerjanjem razredčijo. Uporabljajo naj se sveže pripravljene preizkušane snovi, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
1.4.2 Preizkusni pogoji
1.4.2.1 Topilo/nosilec
Topilo/nosilec naj nima toksičnih učinkov pri uporabljenih odmerkih in naj se zanj ne sumi, da kemično reagira s preizkušano snovjo. Če se uporabijo manj poznana topila/nosilci, naj njihovo vključitev podpirajo referenčni podatki, ki kažejo na njihovo združljivost. Priporoča se, da je, kadar koli je to mogoče, prva izbira vodno topilo/nosilec.
1.4.2.2 Kontrolni vzorci
V vsak preizkus naj se vključijo sočasni pozitivni in negativni (topilo/nosilec) kontrolni vzorci za vsak spol. Razen tretiranja s preizkušano snovjo naj se z živalmi v kontrolnih skupinah ravna enako kakor s tistimi v tretiranih skupinah.
Snovi pozitivne kontrole naj pri ravneh izpostavljenosti, pri katerih se pričakuje zaznavno povečanje glede na ozadje, povzročijo nastanek mikronukleusov in vivo. Odmerki pozitivne kontrole naj se izberejo tako, da so učinki jasni, vendar ne razkrijejo takoj identitete kodiranih mikroskopskih preparatov. Sprejemljivo je, da se snovi pozitivne kontrole dajejo živalim drugače kakor preizkušana snov in da se pri pozitivni kontroli vzorči le enkrat. Poleg tega se lahko uporabijo kemikalije pozitivne kontrole, ki sodijo v isto skupino nevarnosti kakor preizkušana kemikalija, kadar so na voljo. Primeri snovi pozitivne kontrole vključujejo:
|
Snov |
Št. CAS |
Št. Einecs |
|
Etil metansulfonat |
62-50-0 |
200-536-7 |
|
N-etil-N-nitrozosecnina |
759-73-9 |
212-072-2 |
|
Mitomicin C |
50-07-7 |
200-008-6 |
|
Ciklofosfamid Ciklofosfamid monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
|
Trietilenmelamin |
51-18-3 |
200-083-5 |
Negativni kontrolni vzorci, tretirani le s topilom ali nosilcem, drugače pa obravnavani enako kakor tretirane skupine, naj se vključijo v vsako vzorčenje, razen če pretekli kontrolni podatki dokazujejo sprejemljivo spremenljivost med posameznimi živalmi in pogostnost celic z mikronukleusi. Če se pri negativni kontroli opravi le eno vzorčenje, je čas prvega vzorčenja najprimernejši. Uporabijo naj se tudi netretirani kontrolni vzorci, razen če pretekli ali objavljeni kontrolni podatki dokazujejo, da izbrano topilo/nosilec ne povzroča škodljivih ali mutagenih učinkov.
Če se uporabi periferna kri, je kot negativni kontrolni vzorec lahko sprejemljiv tudi vzorec pred tretiranjem, vendar le pri kratkotrajnih študijah periferne krvi (npr. 1-3 tretiranje(-a)), kadar so dobljeni podatki v pričakovanem območju glede na preteklo kontrolo.
1.5 POSTOPEK
1.5.1 Število in spol živali
Vsaka tretirana in kontrolna skupina mora vključevati vsaj pet živali vsakega spola, ki jih je mogoče analizirati (11). Če so v času študije na voljo podatki študij o isti vrsti in ob uporabi istega načina izpostavljanja, ki dokazujejo, da med spoloma ni znatnih razlik v toksičnosti, bo zadostovalo preizkušanje na enem spolu. Kadar bi bila lahko izpostavljenost kemikaliji pri človeku omejena na en spol, na primer pri nekaterih farmacevtskih učinkovinah, naj se preizkus opravi na živalih ustreznega spola.
1.5.2 Program tretiranja
Ni mogoče priporočiti nobenega standardnega programa tretiranja (to je enega, dveh ali več vnosov v 24-urnih intervalih). Vzorci iz dolgotrajnih režimov odmerjanja so sprejemljivi, pod pogojem, daje bil dokazan pozitivni učinek pri tej študiji ali pri negativni študiji, če je bila dokazana toksičnost ali je bil uporabljen mejni odmerek in se je odmerjanje nadaljevalo do vzorčenja. Preizkušane snovi se lahko dajejo tudi v razdeljenem odmerku, to pomeni dva vnosa v istem dnevu, ne več kakor nekaj ur narazen, da se olajša dajanje velikega volumna materiala.
Preizkus se lahko izvede na dva načina:
(a) živali se s snovjo tretirajo enkrat. Vzorci kostnega mozga se odvzamejo vsaj dvakrat, vsaj 24 ur po tretiranju in najpozneje 48 ur po tretiranju, z ustreznimi intervali med vzorčenji. Vzorčenje manj kakor 24 ur po tretiranju naj se utemelji. Vzorci periferne krvi se odvzamejo vsaj dvakrat, vsaj 36 ur po tretiranju in najpozneje 72 ur po tretiranju, z ustreznimi intervali med vzorčenji. Ko se pri posameznem vzorčenju opazi pozitivni odziv, dodatno vzorčenje ni potrebno;
(b) če se opravita dva dnevna vnosa ali več (npr. dva vnosa ali več v 24-urnih intervalih), se vzorci odvzamejo enkrat med 18. in 24. uro po zadnjem vnosu pri kostnem mozgu in enkrat med 36. in 48. uro po zadnjem vnosu pri periferni krvi (12).
Lahko se vzamejo dodatni vzorci ob drugih časih, kadar je to primerno.
1.5.3 Velikost odmerkov
Če se opravi študija za ugotavljanje območja, ker ni na voljo ustreznih podatkov, naj se opravi v istem laboratoriju, na isti vrsti, sevu in spolu ob enakem režimu tretiranja, kakor bo to uporabljeno v glavni študiji (13). Če toksičnost je, se za prvo vzorčenje uporabijo tri velikosti odmerkov. Te velikosti odmerkov naj zajamejo območje od največje toksičnosti do majhne toksičnosti ali netoksičnosti. Pri poznejšem vzorčenju se lahko uporabi le največji odmerek. Največji odmerek je opredeljen kot odmerek, ki povzroči takšne znake toksičnosti, na podlagi katerih je pričakovati, da bi večji odmerki pri istem režimu odmerjanja povzročili smrt. Snovi s specifičnim biološkim delovanjem pri majhnih netoksičnih odmerkih (na primer hormoni in mitogeni) so lahko izjeme pri merilih za določanje odmerka in naj se ovrednotijo za vsak primer posebej. Največji odmerek se lahko opredeli tudi kot odmerek, ki povzroči nekaj znakov toksičnosti v kostnem mozgu (npr. zmanjšanje deleža nezrelih eritrocitov med vsemi eritrociti v kostnem mozgu ali periferni krvi).
1.5.4 Mejni preizkus
Če preizkus pri eni velikosti odmerka vsaj 2 000 mg/kg telesne teže, ki se da v enem vnosu ali dveh vnosih v istem dnevu, ne povzroči nobenih opaznih toksičnih učinkov in če se na podlagi podatkov o strukturno sorodnih snoveh ne pričakuje, da bo snov genotksična, se lahko pojmuje, da popolna študija z uporabo treh velikosti odmerkov ni potrebna. Mejni odmerek za dolgotrajnejše študije je 2 000 mg/kg telesne teže/dan za tretiranje do 14 dni in 1 000 mg/kg telesne teže/dan za tretiranje, daljše od 14 dni. Pričakovana izpostavljenost človeka lahko nakaže potrebo po večjih odmerkih pri mejnem preizkusu.
1.5.5 Dajanje odmerkov
Navadno se preizkušana snov daje z gavažo po želodčni cevki ali ustrezni intubacijski kanili ali z intraperitonealno injekcijo. Sprejemljivi so tudi drugi načini izpostavljanja, kadar se lahko utemeljijo. Največji volumen tekočine, ki se lahko naenkrat da z gavažo ali injekcijo, je odvisen od velikosti preizkusne živali. Volumen naj ne presega 2 ml/100 g telesne teže. Uporabo večjih volumnov je treba utemeljiti. Razen pri dražilnih ali jedkih snoveh, ki bodo pri večjih koncentracijah navadno povzročile dražilne učinke, naj se s prilagoditvijo koncentracije čimbolj zmanjša spremenljivost preizkusnega volumna, tako da se zagotovi stalni volumen pri vseh velikostih odmerkov.
1.5.6 Priprava kostnega mozga/krvi
Celice kostnega mozga se navadno odvzamejo iz stegnenic ali golenic takoj po žrtvovanju. Navadno se celice odstranijo iz stegnenic ali golenic, se preparirajo in obarvajo z uporabo uveljavljenih metod. Periferna kri se odvzame iz repne vene ali druge primerne krvne žile. Krvne celice se takoj supravitalno obarvajo (8) (9) (10) ali pa se pripravijo razmazi, ki se nato obarvajo. Uporaba DNA-specifičnega barvila (npr. akridin oranž (14) ali Hoechst 33258 plus pyronin-Y (15)) lahko prepreči nastanek nekaterih artefaktov, povezanih z uporabo barvila, ki ni specifično za DNA. Ta prednost ne preprečuje uporabe splošno uporabljenih barvil (npr. Giemsa). Lahko se uporabijo tudi dodatni sistemi (npr. celulozne kolone za odstranitev celic z jedri (16)), pod pogojem, daje bilo dokazano, da ti sistemi zadovoljivo delujejo pri pripravi mikronukleusov v laboratoriju.
1.5.7 Analiza
Za vsako žival se določi delež nezrelih med vsemi (nezrelimi + zrelimi) eritrociti, tako da se prešteje skupaj vsaj 200 eritrocitov pri kostnem mozgu in 1 000 eritrocitov pri periferni krvi (17). Vsi preparati, skupaj s pozitivnimi in negativnimi kontrolnimi vzorci, naj se pred mikroskopsko analizo neodvisno kodirajo. V določanje incidence nezrelih eritrocitov z mikronukleusi se vključi vsaj 2 000 nezrelih eritrocitov na žival. Dodatne informacije se lahko pridobijo s štetjem zrelih eritrocitov z mikronukleusi. Pri analizi mikroskopskih preparatov naj delež nezrelih eritrocitov med vsemi eritrociti ne bo manjši od 20 % kontrolne vrednosti. Kadar se živali tretirajo nepretrgano štiri tedne ali več, se lahko določi tudi incidenca mikronukleusov v vsaj 2 000 zrelih eritrocitih na žival. Sistemi za avtomatizirano analizo (slikovna analiza in pretočna citometrična analiza celičnih suspenzij) so sprejemljiva alternativa ročnemu določanju, če so ustrezno utemeljeni in validirani.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Podatki za posamezne živali naj bodo prikazani v tabelah. Poskusna enota je žival. Za vsako analizirano žival posebej naj se navedejo število štetih nezrelih eritrocitov, število nezrelih eritrocitov z mikronukleusi in število nezrelih med vsemi eritrociti. Kadar se živali tretirajo nepretrgano štiri tedne ali več, se navedejo tudi podatki o zrelih eritrocitih, če so bili zbrani. Za vsako žival se navede delež nezrelih med vsemi eritrociti, in če je to primerno, odstotek eritrocitov z mikronukleusi. Če ni dokaza za razliko v odzivu med spoloma, se pri statistični analizi lahko združijo podatki za oba spola.
2.2 VREDNOTENJE IN INTERPRETACIJA REZULTATOV
Pozitivni rezultat se lahko določi na podlagi številnih meril, kakor je na primer z odmerkom povezano povečanje števila celic z mikronukleusi ali jasno povečanje števila celic z mikronukleusi v posamezni tretirani skupini ob posameznem vzorčenju. Najprej naj se preuči biološka pomembnost rezultatov. Pri vrednotenju rezultatov preizkusa se kot pomoč lahko uporabijo statistične metode (18) (19). Statistična značilnost naj ne bo edini odločilni dejavnik za pozitivni odziv. Dvoumni rezultati naj se razjasnijo z dodatnimi preizkusi, po možnosti ob prilagojenih poskusnih pogojih.
Pojmuje se, da preizkušana snov, pri kateri rezultati ne izpolnjujejo navedenih meril, ni mutagena v tem preizkusu.
Čeprav bo večina poskusov dala jasne pozitivne ali negativne rezultate, bodo v redkih primerih dobljeni podatki preprečili zanesljivo oceno o delovanju preizkušane snovi. Rezultati lahko ostanejo dvoumni ali dvomljivi ne glede na število ponovitev poskusa.
Pozitivni rezultati preizkusa mikronukleusov pomenijo, da snov povzroča nastanek mikronukleusov, ki so posledica poškodb kromosomov ali mitotičnega aparata v eritroblastih preizkusne vrste. Negativni rezultati pomenijo, da preizkušana snov pri preizkusnih pogojih ne povzroča nastanka mikronukelusov v nezrelih eritrocitih preizkusne vrste.
Obravnava naj se verjetnost, da preizkušana snov ali njeni metaboliti dosežejo krvni obtok ali posebej tarčno tkivo (npr. sistemska toksičnost).
3. POROČANJE
POROČILO O PRESKUSU
Poročilo o preizkusu naj vsebuje naslednje informacije:
Topilo/nosilec:
— utemeljitev izbire nosilca,
— topnost in stabilnost preizkušane snovi v topilu/nosilcu, če sta znani,
Preizkusne živali:
— uporabljena vrsta/sev,
— število, starost in spol živali,
— vir, pogoji bivanja, prehrana itd.,
— teža posameznih živali na začetku preizkusa, skupaj z območjem telesne teže, srednjo vrednostjo in standardnim odklonom za vsako skupino.
Preizkusni pogoji:
— podatki o pozitivnih in negativnih (nosilec/topilo) kontrolnih vzorcih,
— podatki študij e za ugotavljanje območja, če je bila opravljena,
— razlogi za izbiro velikosti odmerka,
— podrobnosti o pripravi preizkušane snovi,
— podrobnosti o dajanju preizkušane snovi,
— razlogi za način dajanja,
— metode za preverjanje, ali je preizkušana snov dosegla krvni obtok ali tarčno tkivo, če je to primerno,
— način preračunavanja koncentracije preizkušane snovi v hrani/pitni vodi (ppm) v dejanski odmerek (mg/kg telesne teže/dan), če je to primerno,
— podrobnosti o kakovosti hrane in vode,
— podroben opis programov tretiranja in vzorčenja,
— metode priprave mikroskopskih preparatov,
— metode merjenja toksičnosti,
— merila za štetje nezrelih eritrocitov z mikronukleusi,
— število analiziranih celic na žival,
— merila za določitev, ali je študija pozitivna, negativna ali dvoumna.
Rezultati:
— znaki toksičnosti,
— delež nezrelih eritrocitov med vsemi eritrociti,
— število nezrelih eritrocitov z mikronukleusi, navedeno za vsako žival posebej,
— srednja vrednost ± standardni odklon nezrelih eritrocitov z mikronukleusi na skupino,
— odvisnost med odmerkom in odzivom, kadar je to mogoče,
— uporabljene statistične analize in metode,
— podatki o sočasni in pretekli negativni kontroli,
— podatki o sočasni pozitivni kontroli.
— Diskusija rezultatov.
— Sklepi.
4. LITERATURA
(1) Heddle, J. A. (1973), A Rapid In Vivo Test for Chromosomal Damage, Mutation Res., 18, str. 187–190.
(2) Schmid, W. (1975), The Micronucleus Test, Mutation Res., 31, str. 9–15.
(3) Heddle, J. A., Salamone, M. F., Hite, M., Kirkhart, B., Mavournin, K., MacGregor, J. G., in Newell, G. W. (1983), The Induction of Micronuclei as a Measure of Genotoxicity, Mutation Res. 123, str. 61–118.
(4) Mavournin, K. H., Blakey, D. H., Cimino, M. C, Salamone, M. F., in Heddle, J. A. (1990), The In Vivo Micronucleus Assay in Mammalian Bone Marrow and Peripheral Blood. A report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 239, str. 29–80.
(5) MacGregor, J. T., Schlegel, R., Choy, W. N., in Wehr, C. M. (1983), Micronuclei in Circulating Erythrocytes: A Rapid Screen for Chromosomal Damage During Routine Toxicity Testing in Mice, v: Developments in Science and Practice of Toxicology, izd. A. W. Hayes, R. C. Schnell and T. S. Miya. Elsevier, Amsterdam, str. 555–558.
(6) MacGregor, J. T., Heddle, J. A. Hite, M., Margolin, G. H., Ramel, C, Salamone, M. F., Tice, R. R., in Wild, D. (1987), Guidelines for the Conduct of Micronucleus Assays in Mammalian Bone Marrow Erythrocytes, Mutation Res., 189, str. 103–112.
(7) MacGregor, J. T., Wehr, C. M., Henika, P. R., in Shelby, M. E. (1990), The in Vivo Erythrocyte Micronucleus Test: Measurement at Steady State Increases Assay Efficiency and Permits Integration with Toxicity Studies, Fund. Appl. Toxicol. 14, str. 513–522.
(8) Hayashi, M., Morita, T., Kodama, Y., Sofumi, T., in Ishidate, M. Jr. (1990), The Micronucleus Assay with Mouse Peripheral Blood Reticulocytes Using Acridine Orange-Coated Slides, Mutation Res., 245, str. 245–249.
(9) The Collaborative Study Group for the Micronucleus Test (1992). Micronucleus Test with Mouse Peripheral Blood Erythrocytes by Acridime Orange Supravital Staining: The Summary Report of the 5th Collaborative Study by CSGMT/JEMMS, MMS, Mutation Res., 278, str. 83–98.
(10) The Collaborative Study Group for the Micronucleus Test (CSGMT/JEMMS, MMS: The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan) (1995), Protocol recommended for the short-term mouse peripheral blood micronucleus test, Mutagenesis, 10, str. 53–159.
(11) Hayashi, M., Tice, R. R., MacGregor, J. T., Anderson, D., Blackey, D. H., Kirsch-Volders, M., Oleson, Jr. F. B., Pacchicrotti, F., Romagna, F., Shimada, H. Sutou, S., in Vannier, B. (1994), in Vivo Rodent Erythrocyte Micronucleus Assay, Mutation Res., 312, str. 293–304.
(12) Higashikuni, N., in Sutou, S. (1995), An optimal, generalised sampling time of 30 ± 6 h after double dosing in the mouse peripheral micronucleus test, Mutagenesis, 10, str. 313–319.
(13) Fielder, R. J., Allen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G, Hodson-Walker, G, Morton, D. B., Kirkland, D. J., in Rochold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose Setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, str. 313–319.
(14) Hayashi, M., Sofumi, T., in Ishidate, M. Jr. (1983), An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test, Mutation Res., 120, str. 241–247.
(15) MacGregor, J. T., Wehr, C. M., in Langlois, R. G. (1983), A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyromin Y, Mutation Res., 120, str. 269–275.
(16) Romagna, F., in Staniforth, C. D. (1989), The automated bone marrow micronucleus test, Mutation Res., 213, str. 91–104.
(17) Gollapudi, B., in McFadden, L. G. (1995), Sample size for the estimation of polychromatic to normochromatic erythrocyte ratio in the bone marrow micronucleus test, Mutation Res., 347, str. 97–99.
(18) Richold, M., Ashby, J., Bootman, J., Chandley, A., Gatehouse, D. G., in Henderson, L. (1990), In Vivo Cytogenetics Assay, v: D. J. Kirkland (ed.), Basic Mutagenicity tests, UKEMS Recommended Procedures, UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Poročilo, del 1, pregledan, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 115–141.
(19) Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G E., Clare, G., Ferguson R., Richold, M., Papworth, D. G., in Savage, J. R. K. (1989), Staticical Analysis of In Vivo Cytogenetic Assays, in: D. J. Kirkland (izd.), Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Poročilo, del III, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 184–232.
B.13/14 MUTAGENOST: PREIZKUS POVRATNE MUTACIJE PRI BAKTERIJAH
1. METODA
Ta metoda ustreza metodi OECD TG 471, Bacterial Reverse Mutation Test (1997).
1.1 UVOD
Pri preizkusu bakterijskih povratnih mutacij se sevi vrst Salmonella typhimurium in Escherichia coli, ki potrebujejo aminokisline, uporabljajo za odkrivanje točkovnih mutacij, ki vključujejo substitucijo, adicijo ali delecijo enega ali nekaj baznih parov DNA (1) (2) (3). Princip tega preizkusa bakterijskih povratnih mutacij je, da zazna mutacije, ki obrnejo mutacije v preizkusnih sevih in obnovijo funkcionalno sposobnost bakterij za sintezo osnovne aminokisline. Povratno mutirane bakterije se zaznajo po sposobnosti rasti v odsotnosti aminokisline, ki jo starševski preizkusni sev potrebuje.
Točkovne mutacije so vzrok številnih genskih bolezni pri človeku in obstajajo tehtni dokazi, da so točkovne mutacije onkogenov in genov, zaviralcev rasti tumorjev somatskih celic, povezane z nastankom tumorjev pri človeku in poskusnih živalih. Preizkus bakterijskih povratnih mutacij je hiter, poceni in relativno lahko izvedljiv. Mnogi preizkusni sevi imajo več značilnosti, zaradi katerih so občutljivejši za zaznavanje mutacij, vključno z odzivnimi zaporedji DNA na mestih povratnih mutacij, povečano prepustnostjo celice za velike molekule in odstranitvijo DNA-popravljalnih mehanizmov ali okrepitvijo procesov popravljanja DNA, podvrženega napakam. Specifičnost preizkusnih sevov lahko da koristne informacije o vrstah mutacij, ki jih povzročijo genotoksične snovi. Na voljo je obsežna baza rezultatov za preizkuse bakterijskih povratnih mutacij za številne strukture in razvite so bile dobro uveljavljene metodologije za preizkušanje kemikalij z različnimi fizikalno-kemijskimi lastnostmi, vključno s hlapnimi spojinami.
Glej tudi splošni uvod dela B.
1.2 DEFINICIJE
Preizkus povratnih mutacij pri vrsti Salmonella typhimurium ali Escherichia coli zazna mutacijo pri sevu, ki potrebuje aminokislino (histidin oziroma triptofan), s katero nastane sev, neodvisen od zunanje oskrbe z aminokislino.
Mutageni substitucije baznih parov so snovi, ki povzročijo zamenjavo baz v DNA. Pri preizkusu povratne mutacije takšna zamenjava lahko nastane na mestu izvirne mutacije ali na drugem mestu bakterijskega genoma.
Mutageni premika bralnega okvira so snovi, ki povzročijo adicijo ali delecijo enega ali več baznih parov DNA in tako spremenijo bralni okvir RNA.
1.3 ZAČETNI PREUDARKI
Pri preizkusu bakterijskih povratnih mutacij se uporabljajo prokariontske celice, ki se od sesalskih razlikujejo v lastnostih, kakor so sprejemanje, presnova, kromsomska struktura in procesi popravljanja DNA. Za preizkuse, opravljene in vitro, so navadno potrebni zunanji viri aktivacije presnove. Sistemi aktivacije presnove in vitro ne morejo povsem posnemati razmer in vivo pri sesalcih. Preizkus torej ne daje neposrednih informacij o mutagenosti in rakotvornosti snovi pri sesalcih.
Preizkus bakterijskih povratnih mutacij se splošno uporablja kot začetno presejanje za odkrivanje genotoksičnega delovanja in zlasti delovanja, ki povzroči točkovne mutacije. Obsežna baza podatkov je pokazala, da mnoge kemikalije, ki pri tem preizkusu dajo pozitivni rezultat, kažejo mutageno delovanje tudi pri drugih preizkusih. Obstajajo primeri mutagenov, ki jih ta preizkus ne zazna; razlogi za te pomanjkljivosti se lahko pripišejo posebni naravi zaznane končne točke, razlikam v aktivaciji presnove ali razlikam v biološki razpoložljivosti. Po drugi strani pa lahko dejavniki, ki povečajo občutljivost preizkusa bakterijskih povratnih mutacij, privedejo do precenitve mutagenega delovanja.
Preizkus bakterijskih povratnih mutacij morda ne bo primeren za ocenjevanje nekaterih skupin nevarnih kemikalij, na primer močno baktericidnih spojin (npr. nekaterih antibiotikov) in tistih, za katere se domneva (ali ve), da motijo sistem podvojevanja prav v sesalskih celicah (npr. nekateri inhibitorji topoizomeraze in nekateri nukleozidni analogi). Pri takšnih primerih bi bili lahko bolj primerni preizkusi mutacij pri sesalcih.
Čeprav so mnoge spojine, pri katerih je rezultat tega preizkusa pozitiven, rakotvorne snovi za sesalce, soodvisnost ni absolutna. Odvisna je od skupine nevarnosti kemikalije in obstajajo rakotvorne snovi, ki jih ta preizkus ne zazna, ker delujejo prek drugih mehanizmov, ki niso genotoksični, ali mehanizmov, ki jih v bakterijskih celicah ni.
1.4 PRINCIP PREIZKUSNE METODE
Suspenzije bakterijskih celic se izpostavijo preizkušam snovi ob navzočnosti in ob odsotnosti zunanjega sistema za aktivacijo presnove. Pri metodi vključitve v ploščo se te suspenzije zmešajo s poltrdim gojiščem in takoj razlijejo po minimalnem gojišču. Pri metodi poprejšnje inkubacije se obdelovalna zmes inkubira in nato zmeša s poltrdim gojiščem pred nanosom na minimalno gojišče. Pri obeh tehnikah se po dveh ali treh dneh inkubacije preštejejo kolonije povratnih mutant in primerjajo s številom kolonij spontanih povratnih mutant na kontrolnih ploščah s topilom.
Opisanih je nekaj postopkov za izvedbo preizkusa bakterijskih povratnih mutacij. Med splošno uporabljanimi so metoda vključitve v ploščo (1) (2) (3) (4), metoda poprejšnje inkubacije (2) (3) (5) (6) (7) (8), fluktuacijska metoda (9) (10) in suspenzijska metoda (11). Opisane so tudi prilagoditve za preizkušanje plinov ali hlapov (12).
Postopki, opisani v metodi, veljajo predvsem za metodo vključitve v ploščo in metodo poprejšnje inkubacije. Obe sta sprejemljivi za izvajanje preizkusa ob aktivaciji presnove in brez nje. Nekatere snovi se lahko učinkoviteje zaznajo z metodo poprejšnje inkubacije. Te snovi sodijo v skupine nevarnih kemikalij, ki vključujejo kratkoverižne alifatske nitrozamine, dvovalentne kovine, aldehide, azo barvila in diazo spojine, pirolizidinske alkaloide ter alil in nitro spojine (3). Priznano je tudi, da se pri uporabi standardnih postopkov, kakor sta metoda vključitve v ploščo ali metoda poprejšnje inkubacije, nekatere skupine mutagenov ne zaznajo vedno. Ti naj se obravnavajo kot „posebni primeri“ in močno se priporoča, da se za njihovo zaznavanje uporabijo nadomestni postopki. Določijo se lahko naslednji „posebni primeri“ (skupaj s primeri postopkov, ki bi se lahko uporabili za njihovo zaznavanje): azo barvila in diazo spojine (3) (5) (6) (13), plini in hlapne kemikalije (12) (14) (15) (16) ter glikozidi (17) (18). Odstopanje od standardnega postopka je treba znanstveno utemeljiti.
1.5 OPIS PRESKUSNE METODE
1.5.1 Priprave
1.5.1.1. Bakterije
Sveže kulture bakterij se vzgojijo do pozne logaritemske faze ali zgodnje stacionarne faze rasti (približno 109 celic na ml). Kulture v pozni stacionarni fazi naj se ne uporabljajo. Kulture, ki se uporabijo v preizkusu, morajo obvezno imeti velik delež živih bakterij. Delež se lahko dokaže na podlagi podatkov o rastnih krivuljah iz preteklih kontrol ali pri vsakem preizkusu z določitvijo števila živih celic s štetjem na plošči.
Priporočena temperatura inkubacije je 37 oC.
Uporabi naj se vsaj pet sevov bakterij. Ti naj vključujejo štiri seve vrste S. typhimurium (TA 1535; TA 1537 ali TA97a ali TA97; TA98 in TA100), za katere je bilo dokazano, da so zanesljivi in dajejo ponovljive rezultate med laboratoriji. Ti štirje sevi vrste S. typhimurium imajo na primarnem mestu povratne mutacije bazne pare GC in znana je možnost, da ne zaznajo nekaterih oksidirajočih mutagenov, prečnih povezovalcev in hidrazinov. Takšne snovi lahko zaznajo sevi E. coli WP2 ali S. typhimurium TA102 (19), ki imajo na primarnem mestu povratne mutacije bazni par AT. Priporočena kombinacija sevov je torej:
— S. typhimurium TA1535 in
— S. typhimurium TA1537 ali TA97 ali TA97a in
— S. typhimurium TA98 in
— S. typhimurium TA100 in
— E. coli WP2 uvrA, ali E. coli WP2 uvrA (pKM101), ali S. typhimurium TA102.
Da bi se zaznali prečno povezovalni mutageni, bi bilo morda bolj primerno vključiti TA102 ali dodati sev E. coli, zmožen popravljanja DNA [npr. E. coli WP2 ali E. coli WP2 (pKM101)].
Uporabljajo naj se uveljavljeni postopki za pripravo založne kulture, preverjanje označevalcev in shranjevanje. Potreba po aminokislinah za rast naj se dokaže za vsak pripravek zamrznjene založne kulture (histidin za seve S. typhimurium in triptofan za seve E. coli). Podobno naj se preverijo druge fenotipske značilnosti, namreč: navzočnost ali odsotnost R-plazmidov, kadar je to primerno [tj. odpornost proti ampicilinu pri sevih TA98, TA100 in TA97a ali TA97, WP2 uvrA in WP2 uvrA (pKM101), in odpornost proti ampicilinu + tetraciklinu pri sevu TA 102G; navzočnost značilnih mutacij (tj. mutacije rfa pri S. typhimurium prek občutljivosti za kri stal vijolično in mutacije uvrA pri E. coli ali mutacije uvrB pri S. typhimurium prek občutljivosti za ultravijolično svetlobo) (2) (3). Število kolonij spontanih povratnih mutant pri sevih naj bo v območjih pogostnosti, pričakovanih glede na pretekle kontrolne podatke laboratorija, in po možnosti v območju, navedenem v literaturi.
1.5.1.2 Gojišče
Uporabljata se ustrezno minimalno gojišče (ki vsebuje npr. minimalno gojišče E po Vogel-Bonnerju in glukozo) in poltrdo gojišče, ki vsebuje histidin in biotin ali triptofan, da se omogoči nekaj delitev celic (1) (2) (9).
1.5.1.3 Aktivacija presnove
Bakterije naj se izpostavijo preizkušam snovi ob navzočnosti in ob odsotnosti ustreznega sistema za aktivacijo presnove. Najpogosteje uporabljani sistem je postmitohondrijska frakcija z dodanim kofaktorjem (S9), pripravljena iz jeter glodavcev, ki so bila obdelana s sredstvi za encimsko indukcijo, kakor je Aroclor 1254 (1) (2), ali z zmesjo fenobarbitona in β-naftoflavona (18) (20) (21). Postmitohondrij ska frakcija se navadno uporablja v koncentracijah od 5 do 30 % v/v v zmesi S9. Izbira in stanje sistema za aktivacijo presnove sta lahko odvisna od skupine nevarnosti preizkušane kemikalije. Včasih je primerno uporabiti več kakor eno koncentracijo postmitohondrijske frakcije. Pri azo barvilih in diazo spojinah bo morda bolj primerno uporabiti redukcijski sistem aktivacije presnove (6) (13).
1.5.1.4 Preizkušana snov/priprava
Trdne preizkušane snovi naj se pred obdelavo bakterij raztopijo ali suspendirajo v ustreznih topilih ali nosilcih, in če je to primerno, se razredčijo. Tekoče preizkušane snovi se lahko dodajo neposredno v preizkusni sistem in/ali se pred obdelavo razredčijo. Uporabljajo naj se sveže pripravljene preizkušane snovi, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
Topilo/nosilec naj ne vzbuja suma, da kemično reagira s preizkušano snovjo, in naj bo združljivo s preživetjem bakterij in delovanjem S9 (22). Če se uporabijo manj poznana topila/nosilci, naj njihovo vključitev podpirajo podatki, ki kažejo na njihovo združljivost. Priporoča se, da se, kadar koli je to mogoče, kot prva možnost preuči uporaba vodnega topila/nosilca. Kadar se preizkušajo v vodi nestabilne snovi, naj se uporabijo brezvodna organska topila.
1.5.2 Preizkusni pogoji
1.5.2.1 Preizkusni sevi (glej 1.5.1.1)
1.5.2.2 Koncentracije izpostavljenosti
Med merili, ki jih je treba upoštevati pri določanju največje uporabljene količine preizkušane snovi, so citotoksičnost in topnost v končni obdelovalni zmesi.
Lahko je koristno, če se toksičnost in netopnost določita v poprejšnjem poskusu. Citotoksičnost se lahko zazna prek zmanjšanja števila kolonij povratnih mutant, čistine na bakterijskem ozadju ali zmanjšanja bakterijskega ozadja ali stopnje preživetja obdelanih kultur. Citotoksičnost snovi se lahko spremeni ob navzočnosti sistemov za aktivacijo presnove. Netopnost naj se oceni kot oborina v končni zmesi pri dejanskih pogojih preizkusa in naj bo vidna s prostim očesom.
Priporočena največja preizkusna koncentracija za topne necitotoksične snovi je 5 mg/ploščo ali 5 μl/ploščo. Pri necitotoksičnih snoveh, ki niso topne pri koncentracijah 5 mg/ploščo ali 5 μl/ploščo, naj bo ena ali več preizkušenih koncentracij netopnih v končni obdelovalni zmesi. Preizkušane snovi, ki so citotoksične že pri koncentracijah, manjših od 5 mg/ploščo ali 5 ul/ploščo, naj se preizkušajo do citotoksične koncentracije. Oborina ne sme vplivati na štetje.
Uporabi naj se vsaj pet različnih koncentracij preizkušane snovi, ki jih je mogoče analizirati, z intervalom približno pol log (tj. √10) med preizkusnimi točkami pri začetnem poskusu. Primerni so lahko manjši intervali, kadar se raziskuje odvisnost med koncentracijo in odzivom. Lahko se izvedejo preizkusi s koncentracijami, večjimi od 5 mg/ploščo ali 5 μl/ploščo, kadar se ocenjujejo snovi, ki vsebujejo znatne količine potencialno mutagenih nečistot.
1.5.2.3 Negativni in pozitivni kontrolni vzorci
V vsak preizkus naj se vključijo sočasni pozitivni in negativni (topilo ali nosilec) kontrolni vzorci, specifični za sev, ob aktivaciji presnove in brez nje. Izberejo naj se koncentracije pozitivne kontrole, ki dokazujejo učinkovito izvedbo vsakega preizkusa.
Pri preizkusih, pri katerih se uporabi sistem aktivacije presnove, naj se referenčna(-e) snov(-i) pozitivne kontrole izbere(-jo) na podlagi vrste uporabljenih bakterijskih sevov.
Naslednje snovi so primeri ustreznih snovi pozitivne kontrole za preizkuse z aktivacijo presnove:
|
Št. CAS |
Št. Einecs |
Snovi |
|
781-43-1 |
212-308-4 |
9,10-dimetilantracen |
|
57-97-6 |
200-359-5 |
7,12-dimetilbenzo(a) antracen |
|
50-32-8 |
200-028-5 |
benzo[a]piren |
|
613-13-8 |
210-330-9 |
2-aminoantracen |
|
50-18-0 |
ciklofosfamid |
|
|
6055-19-2 |
200-015-4 |
ciklofosfamid monohidrat |
Naslednja snov je ustrezna snov pozitivne kontrole za metodo redukcijske aktivacije presnove:
|
Št. CAS |
Št. Einecs |
Snovi |
|
573-58-0 |
209-358-4 |
Kongo rdeče |
2-aminoantracen naj se ne uporablja kot edini kazalec učinkovitosti zmesi S9. Če se uporabi 2-aminoantracen, naj bo tudi za vsako serijo S9 značilen mutagen, ki potrebuje aktivacijo presnove z mikrosomskimi encimi, npr. benzo[a]piren, dimetilbenzo antracen.
Naslednje snovi so primeri snovi pozitivne kontrole za posamezne seve, za preizkuse, izvedene brez zunanjega sistema aktivacije presnove:
|
Št. CAS |
Št. Einecs |
Snovi |
Sev |
|
26628-22-8 |
247-852-1 |
natrijev azid |
TA 1535 in TA 100 |
|
607-57-8 |
210-138-5 |
2-nitrofluoren |
TA 98 |
|
90-45-9 |
201-995-6 |
9-aminoakridin |
TA 1537, TA 97 in TA 97a |
|
17070-45-0 |
241-129-4 |
ICR 191 |
TA 1537, TA 97 in TA 97a |
|
80-15-9 |
201-254-7 |
kumol hidroperoksid |
TA 102 |
|
50-07-7 |
200-008-6 |
mitomicin C |
WP2 uvrA in TAl 02 |
|
70-25-7 |
200-730-1 |
N-metil-N-nitro-N-nitrozogvanidin |
WP2, WP2uvrA in WP2uvrA(pK M101) |
|
56-57-5 |
200-281-1 |
4-nitrokinolin-1-oksid |
WP2, WP2uvrA in WP2uvrA(pK M101) |
|
3688-53-7 |
furilfuramid (AF2) |
sevi s plazmidi |
Lahko se uporabijo druge ustrezne referenčne snovi pozitivne kontrole. Uporabijo naj se kemikalije pozitivne kontrole, ki sodijo v isto skupino nevarnosti kakor preizkušana kemikalija, kadar so na voljo.
Vključijo naj se negativni kontrolni vzorci, ki jih sestavlja le topilo ali nosilec brez preizkušane snovi, obdelani na enak način kakor obdelovalne skupine. Uporabijo se tudi neobdelani kontrolni vzorci, razen če pretekli kontrolni podatki dokazujejo, da izbrano topilo ne povzroča škodljivih ali mutagenih učinkov.
1.5.3 Postopek
Pri metodi vključitve v ploščo (1) (2) (3) (4) brez aktivacije presnove se navadno 0,05 ml ali 0,1 ml preizkušane raztopine, 0,1 ml sveže bakterijske kulture (ki vsebuje približno 108 živih celic) in 0,5 ml sterilnega pufra zmeša z 2,0 ml poltrdega gojišča. Pri preizkusu z aktivacijo presnove se navadno 0,5 ml zmesi za aktivacijo presnove, ki vsebuje ustrezno količino postmitohondrijske frakcije (v območju od 5 do 30 % v/v v zmesi za aktivacijo presnove), zmeša s poltrdim gojiščem (2,0 ml) skupaj z bakterijami in preizkušano snovjo/raztopino. Vsebina vsake epruvete se premeša in razlije po površini plošče minimalnega gojišča. Pred inkubacijo naj se poltrdo gojišče strdi.
Pri metodi poprejšnje inkubacije (2) (3) (5) (6) se preizkušana snov/raztopina inkubira skupaj s preizkusnim sevom (ki vsebuje približno 108 živih celic) in sterilnim pufrom ali sistemom za aktivacijo presnove (0,5 ml), navadno 20 minut ali več pri 30–37 oC, preden se zmeša s poltrdim gojiščem in razlije na površino plošče minimalnega gojišča. Navadno se 0,05 ali 0,1 ml preizkušane snovi/raztopine, 0,1 ml bakterij in 0,5 ml zmesi S9 ali sterilnega pufra zmeša z 2,0 ml poltrdega gojišča. Epruvete se med inkubacijo prezračujejo s stresalnikom.
Za ustrezno oceno nihanja naj se za vsako velikost odmerka uporabijo tri plošče. Uporaba dveh plošč je sprejemljiva, kadar je znanstveno utemeljena. Občasna izguba plošče ne pomeni nujno neveljavnega preizkusa.
Plinaste ali hlapne snovi naj se preizkušajo z ustreznimi metodami, na primer v zatesnjenih posodah (12) (14) (15) (16).
1.5.4 Inkubacija
Vse plošče posameznega preizkusa naj se inkubirajo 48-72 ur pri 37 oC. Po inkubaciji se določi število kolonij povratnih mutant na ploščo.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Podatki se prikažejo kot število kolonij povratnih mutant na ploščo. Navede se tudi število kolonij povratnih mutant na ploščah negativne (kontrolni vzorec s topilom in neobdelani kontrolni vzorec, če se uporabi) in pozitivne kontrole. Navedejo se število na posameznih ploščah, srednja vrednost števila kolonij povratnih mutant na ploščo in standardni odklon za preizkušano snov ter pozitivne in negativne (neobdelane in/ali s topilom) vzorce.
Preverjanje jasnega pozitivnega odziva ni potrebno. Dvoumni rezultati naj se razjasnijo z dodatnimi preizkusi, po možnosti ob prilagojenih poskusnih pogojih. Negativne rezultate je treba potrditi za vsak primer posebej. Kadar se pojmuje, da potrditev negativnih rezultatov ni potrebna, naj se to utemelji. V nadaljnjih poskusih naj se preuči možnost prilagoditve preizkusnih parametrov, da se razširi območje analiziranih pogojev. Preizkusni parametri, ki bi se lahko prilagodili, vključujejo intervale med koncentracijami, metodo obdelave (vključitev v ploščo ali poprejšnja inkubacija v suspenziji) in pogoje aktivacije presnove.
2.2 VREDNOTENJE IN INTERPRETACIJA REZULTATOV
Pozitivni rezultat se lahko določi na podlagi številnih meril, kakor sta na primer s koncentracijo povezano povečanje v preizkušanem območju in/ali ponovljivo povečanje števila kolonij povratnih mutant na ploščo pri eni ali več koncentracijah pri vsaj enem sevu s sistemom za aktivacijo presnove ali brez njega (23). Najprej naj se preuči biološka pomembnost rezultatov. Pri vrednotenju rezultatov preizkusa se kot pomoč lahko uporabijo statistične metode (24). Vendar pa naj statistična značilnost ne bo edini odločilni dejavnik za pozitivni odziv.
Pojmuje se, da preizkušana snov, pri kateri rezultati ne izpolnjujejo navedenih meril, ni mutagena v tem preizkusu.
Čeprav bo večina poskusov dala jasne pozitivne ali negativne rezultate, bodo v redkih primerih dobljeni podatki preprečili zanesljivo oceno o delovanju preizkušane snovi. Rezultati lahko ostanejo dvoumni ali dvomljivi ne glede na število ponovitev poskusa.
Pozitivni rezultati preizkusa bakterijskih povratnih mutacij pomenijo, da snov povzroča točkovne mutacije z zamenjavo baz ali premikom bralnega okvira v genomu Salmonella typhimurium in/ali Escherichia coli. Negativni rezultati pomenijo, da preizkušana snov pri preizkusnih pogojih ni mutagena za preizkusno vrsto.
3. POROČANJE
POROČILO O PRESKUSU
Poročilo o preizkusu mora vsebovati naslednje informacije:
Topilo/nosilec:
— utemeljitev izbire topila/nosilca,
— topnost in stabilnost preizkušane snovi v topilu/nosilcu, če sta znani.
Sevi:
— uporabljeni sevi,
— število celic na kulturo,
— značilnosti seva.
Preizkusni pogoji:
— količina preizkušane snovi na ploščo (mg/ploščo ali μl/ploščo), skupaj z razlogi za izbiro odmerka in števila plošč na koncentracijo,
— uporabljena gojišča,
— vrsta in sestava sistema za aktivacijo presnove, skupaj z merili sprejemljivosti,
— postopki obdelave.
Rezultati:
— znaki toksičnosti,
— znaki obarjanja,
— število kolonij na posameznih ploščah,
— srednja vrednost števila kolonij povratnih mutant na ploščo in standardni odklon,
— odvisnost med odmerkom in odzivom, kadar je to mogoče,
— statistične analize, če so bile opravljene,
— podatki o sočasni negativni (topilo/nosilec) in pozitivni kontroli, z območji, srednjimi vrednostmi in standardnimi odkloni,
— podatki o pretekli negativni (topilo/nosilec) in pozitivni kontroli, z območji, srednjimi vrednostmi in standardnimi odkloni.
Diskusija rezultatov.
Sklepi.
4. LITERATURA
(1) Ames, B. N., McCann, J., in Yamasaki E. (1975), Methods of Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test, Mutation Res., 31, str. 347–364.
(2) Maron, D. M., in Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation Res., 113, str. 173–215.
(3) Gatehouse, D., Haworth, S., Cebula, T., Gocke, E., Kier, L., Matsushima, T., Melcion, C, Nohmi, T., Venitt, S., in Zeiger, E. (1994), Recommendations for the Performance of Bacterial Mutation Assays, Mutation Res., 312, str. 217–233.
(4) Kier, L. D., Brusick D. J., Auletta, A. E., Von Halle, E. S., Brown, M. M., Simmon, V. F., Dunkel, V., McCann, J., Mortelmans, K., Prival, M., Rao, T. K., in Ray V. (1986), The Salmonella typhimurium/Mammalian Microsomal Assay: A Report of the U. S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 168, str. 69–240.
(5) Yahagi, T., Degawa, M., Seino, Y. Y., Matsushima, T., Nagao, M., Sugimura, T., in Hashimoto, Y. (1975), Mutagenicity of Carcinogen Azo Dyes and their Derivatives, Cancer Letters, str. 91–96.
(6) Matsushima, M., Sugimura, T., Nagao, M., Yahagi, T., Shirai, A., in Sawamura, M. (1980), Factors Modulating Mutagenicity Microbial Tests, v: Short-term Test Systems for Detecting Carcinogens, izd. Norpoth K. H., in Garner, R. C, Springer, Berlin-Heidelberg-New York, str. 273–285.
(7) Gatehouse, D. G, Rowland, I. R., Wilcox, P., Callender, R. D., in Foster, R. (1980), Bacterial Mutation Assays, v: Basic Mutagenicity Tests: UKEMS, del 1, pregledan, izd. D. J. Kirkland, Cambridge University Press, str. 13–61.
(8) Aeschacher, H. U., Wolleb, U., in Porchet, L. (1987), Liquid Preincubation Mutagenicity Test for Foods, J. Food Safety, 8, str. 167–177.
(9) Green, M. H. L., Muriel, W. J., in Bridges, B. A. (1976), Use of a simplified fluctuation test to detect low levels of mutagens, Mutation Res., 38, str. 33–42.
(10) Hubbard, S. A., Green, M. H. L., Gatehouse, D., in Bridges, J. W. (1984), The Fluctuation Test in Bacteria, v: Handbook of Mutagenicity Test Procedures, 2. izdaja, izd. Kilbey, B. J., Legator, M., Nichols, W., in Ramel, C, Elsevier, Amsterdam-New York-Oxford, str. 141–161.
(11) Thompson, E. D., in Melampy, P. J. (1981), An Examination of the Quantitative Suspension Assay for Mutagenesis with Strains of Salmonella typhimurium, Environmental Mutagenesis, 3, str. 453–465.
(12) Araki, A., Noguchi, T., Kato, F., in Matsushima, T. (1994), Improved Method for Mutagenicity Testing of Gaseous Compounds by Using a Gas Sampling Bag, Mutation Res., 307, str. 335–344.
(13) Prival, M. J., Bell, S. J., Mitchell, V. D., Reipert, M. D., in Vaughan, V. L. (1984), Mutagenicity of Benzidine and Benzidine-Congener Dyes and Selected Monoazo Dyes in a Modified Salmonella Assay, Mutation Res., 136, str. 33–47.
(14) Zeiger, E., Anderson, B. E., Haworth, S., Lawlor, T., in Mortelmans, K. (1992), Salmonella Mutagenicity Tests. V. Results from the Testing of 311 Chemicals, Environ. Mol. Mutagen., 19, str. 2–141.
(15) Simmon, V., Kauhanen, K., in Tardiff, R. G. (1977), Mutagenic Activity of Chemicals Identified in Drinking Water, in Progress in Genetic Toxicology, D. Scott, B. Bridges in F., Sobels (izd.) Elsevier, Amsterdam, str. 249–258.
(16) Hughes, T. J., Simmons, D. M., Monteith, I. G., in Claxton, L. D. (1987), Vaporisation Technique to Measure Mutagenic Activity of Volatile Organic Chemicals in the Ames/Salmonella Assay, Environmental Mutagenesis, 9, str. 421–441.
(17) Matsushima, T., Matsumoto, A., Shirai, M., Sawamura, M., in Sugimura, T. (1979), Mutagenicity of the Naturally Occurring Carcinogen Cycasin and Synthetic Methylazoxy Methane Conjugates in Salmonella typhimurium, Cancer Res., 39, str. 3780–3782.
(18) Tamura, G., Gold, C, Ferro-Luzzi, A., in Ames, B. N. (1980), Fecalase: A Model for Activation of Dietary Glycosides to Mutagens by Intestinal Flora, Proc. Natl. Acad. Sci. USA, 77, str. 4961–4965.
(19) Wilcox, P., Naidoo, A., Wedd, D. J., in Gatehouse, D. G. (1990), Comparison of Salmonella typhimurium TA 102 with Escherichia coli WP2 Tester strains, Mutagenesis, 5, str. 285–291.
(20) Matsushima, T., Sawamura, M., Hara, K., in Sugimura, T. (1976), A Safe Substitute for Polychlorinated Biphenyls as an Inducer or Metabolic Activation Systems, v: In Vitro Metabolic Activation in Mutagenesis Testing, izd. F. J. de Serres idr. Elsevier, North Holland, str. 85–88.
(21) Elliot, B. M., Combes, R. D., Elcombe, C. R., Gatehouse, D. G., Gibson, G. G., Mackay, J. M., in Wolf, R. C. (1992), Alternatives to Aroclor 1254-induced S9 in in vitro Genotoxicity Assays, Mutagenesis, 7, str. 175–177.
(22) Maron, D., Katzenellenbogen, J., in Ames, B. N. (1981), Compatibility of Organic Solvents with the Salmonella/Microsome Test, Mutation Res., 88, str. 343–350.
(23) Claxton, L. D., Allen, J., Auletta, A., Mortelmans, K., Nestmann, E., in Zeiger, E. (1987), Guide for the Salmonella typhimurium/Mammalian Microsome Tests for Bacterial Mutagenicity, Mutation Res., 189, str. 83–91.
(24) Mahon, G. A. T., Green, M. H. L., Middleton, B., Mitchel, I., Robinson, W. D., in Tweats, D. J. (1989), Analysis of Data from Microbial Colony Assays, v: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, del II. Statistical Evaluation of Mutagenicity Test Data, izd. Kirkland, D. J., Cambridge University Press, str. 28–65.
B.15 PRESKUS MUTAGENOSTI IN PRESEJALNA ŠTUDIJA RAKOTVORNOSTI GENSKA MUTACIJA – SACCHAROMYCES CEREVISIAE
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Za merjenje nastanka genskih mutacij, ki jih inducirajo kemijski povzročitelji z ali brez metabolne aktivacije, je mogoče uporabiti niz haploidnih in diploidnih sevov kvasovke Saccharomyces cerevisiae.
Uporabljajo se sistemi napredne mutacije v haploidnih sevih, kot je merjenje mutacije rdečih mutant, ki potrebujejo adenin (ade-1, ade-2), v bele mutante, ki potrebujejo dvojni adenin, ter selektivni sistemi, kot je indukcija odpornosti proti kanavaninu in cikloheksimidu.
Najširše validirani sistem povratne mutacije vključuje uporabo haploidnega seva XV 185-14C, ki nosi ochre nesmiselne mutacije ade 2–1, org 4–17, lys 1–1 in trp 5–48, ki so povratne z mutageni, ki povzročajo zamenjave baz, in inducirajo usmerjene mutacije ali ochre supresorske mutacije. XV 185-14C nosi tudi označevalec his 1–7, ki je drugače pomenska mutacija, v glavnem povratna z mutacijami na drugem mestu, ter označevalec hom 3–10, ki je povraten z mutageni, ki inducirajo mutacije tipa premik bralnega okvira.
Pri diploidnih vrstah S. cerevisisae je edina široko uporabljana vrsta D7, ki je homozigotna za ilv 1–92.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Priprave
Raztopino preskusnih kemikalij in kontrolo je treba z uporabo ustreznega nosilca pripraviti tik pred preskusom. Če gre za v vodi netopne organske spojine, naj se ne uporabi več kot 2 % raztopina v/v organskih topil, kot so etanol, aceton ali dimetilsulfoksid (DMSO). Končna koncentracija nosilca ne sme bistveno vplivati na sposobnost preživetja celic in na značilnosti rasti.
Celice je treba izpostaviti preskusnim kemikalijam v prisotnosti in v odsotnosti ustreznega eksogenega metabolnega aktivacijskega sistema.
Najpogosteje uporabljeni sistem je s kofaktorjem dopolnjena post-mitohondrijalna frakcija iz jeter glodalcev, ki so bila prej tretirana s sredstvi, za encimsko indukcijo. Za metabolno aktivacijo je lahko ustrezna tudi uporaba drugih vrst, tkiv, post-mitohondrijalnih frakcij ali postopkov.
Preskusni pogoji
V študijah genske mutacije sta najbolj uporabljana haploidni sev XV 185-14C in diploidni sev D7. Ustrezni so lahko tudi drugi sevi.
Za določitev preživetja celic in števila mutant se uporabijo ustrezna gojišča.
Pozitivno kontrolo, netretirano kontrolo in kontrolo topila je treba opraviti hkrati. Za vsak specifičen mutacijski ciljni učinek je treba uporabiti ustrezne kemikalije pozitivne kontrole.
Uporabiti je treba najmanj pet ustrezno razporejenih koncentracij preskusne snovi. V primeru strupenih snovi pri najvišji koncentraciji preživetje ne sme pasti pod 5 do 10 %. Z relativno vodotopnimi snovmi je treba preskus opravljati do meje njihove topnosti z uporabo ustreznih postopkov. Za dobro vodotopne nestrupene snovi je treba zgornjo koncentracijo določiti od primera do primera.
Plošče se inkubirajo štiri do sedem dni pri 28 do 30 oC v temi.
Uporabljati je treba subkulture s frekvencami spontanih mutacij znotraj dovoljenega razpona.
Za analizo prototrofov, ki so nastali z gensko mutacijo, in sposobnosti preživetja celic je treba uporabiti najmanj tri ponovitvene plošče na koncentracijo. V primeru preskusov, pri katerih se uporabljajo označevalci, kot je hom 3-10 z nizko stopnjo mutacije, je treba za pridobitev statistično ustreznih podatkov število plošč povečati.
Postopek
Tretiranje sevov S. cerevisiae se običajno izvaja s preskusnim postopkom v tekoči suspenziji, ki zajema ali celice v stacionarni fazi ali rastoče celice. Začetne preskuse je treba opraviti na rastočih celicah: 1 - 5 × 10 celic/ml se izpostavi preskusni kemikaliji največ 18 ur pri 28 do 37 oC s tresenjem; če je primerno, se med tretiranjem doda ustrezna količina metabolnega aktivacij skega sistema. Na koncu tretiranja se celice centrifugirajo, sperejo in zasejejo na ustrezno gojišče. Po inkubaciji se plošče preštejejo za določitev preživetja in indukcije genske mutacije. Če je prvi preskus negativen, je treba drugi preskus opraviti z uporabo celic v stacionarni fazi. Če je prvi preskus pozitiven, se ga potrdi z ustreznim neodvisnim preskusom.
2. PODATKI
Podatki se povzamejo v obliki tabele, iz katere je razvidno število preštetih kolonij, število mutant, preživetje in frekvenco mutant. Vse rezultate je treba potrditi z neodvisnim preskusom. Podatke je treba oceniti z uporabo ustreznih statističnih metod.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu glede na tip izvajane študije vključijo naslednji podatki:
— uporabljeni sev,
— preskusni pogoji: celice v stacionarni fazi ali rastoče celice, sestava gojišč, inkubacijska temperatura in trajanje, metabolni aktivacijski sistem,
— pogoji tretiranja: stopnje izpostavljenosti, postopek in trajanje tretiranja, temperatura tretiranja, pozitivna in negativna kontrola,
— število preštetih kolonij, število mutant, preživetje in frekvenca mutantov, razmerje odmerek/odziv, če je primerno, statistična ocena podatkov,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.16 MITOTIČNA REKOMBINACIJA - SACCHAROMYCES CEREVISIAE
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Mitotično rekombinacijo v Saccharomyces cerevisiae je mogoče zaznati med geni (ali bolj splošno med genom in njegovo centromero) ali znotraj genov. Prvi primer se imenuje mitotični crossing-over in ustvarja recipročne produkte, medtem ko je drugi najpogosteje nerecipročen in se imenuje konverzija genov. Preskus crossing-over se običajno opravlja s proizvajanjem recesivnih homozigotnih kolonij ali sektorjev, ki nastanejo v heterozigotnem sevu, medtem ko se preskus konverzije genov opravlja s proizvodnjo prototrofnih revertant, ki nastanejo na avksotrofnem heteroalelnem sevu, ki nosi dva različna okvarjena alela istega gena. Najpogosteje uporabljani sevi za odkrivanje mitotične konverzije genov so D4 (heteroalelna na ade 2 in trp 5), D7 (heteroralelna na trp 5), BZ34 (heteroalelna na org 4) in JD1 (hetroalelna na his 4 in trp 5). Mitotični crossing-over, s katerim nastajajo rdeči in rožnati homozigotni sektorji, je mogoče določiti v D5 ali na D7 (ki meri tudi mitotično konverzijo genov in povratno mutacijo na ilv 1–92), pri čemer sta oba seva heteroalelna za komplementne alele ade 2.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Priprave
Raztopino preskusnih kemikalij ter kontrolo ali referenčne spojine je treba z uporabo ustreznega nosilca pripraviti tik pred preskusom. Če gre za v vodi netopne organske spojine, naj se ne uporabi več kot 2 % raztopina v/v organskih topil, kot so etanol, aceton ali dimetilsulfoksid (DMSO). Končna koncentracija nosilca ne sme bistveno vplivati na sposobnost preživetja celic in na značilnosti rasti.
Celice je treba izpostaviti preskusnim kemikalijam v prisotnosti in v odsotnosti ustreznega eksogenega metabolnega aktivacijskega sistema. Najpogosteje uporabljeni sistem je s kofaktorjem dopolnjena post-mitohondrijalna frakcija iz jeter glodalcev, ki so bila prej tretirana s sredstvi za indukcijo encimov. Za metabolno aktivacijo je lahko ustrezna tudi uporaba drugih vrst, tkiv, post-mitohondrijalnih frakcij ali postopkov.
Preskusni pogoji
Najpogosteje uporabljani sevi so diploidi D4, D5, D7 in JD1. Ustrezna je lahko tudi uporaba drugih sevov.
Za določitev preživetja celic in frekvence mitotične rekombinacije se uporabijo ustrezna gojišča.
Pozitivno kontrolo, netretirano kontrolo in kontrolo topila je treba opraviti hkrati. Za vsak specifični ciljni učinek rekombinacije je treba uporabiti ustrezne kemikalije pozitivne kontrole.
Uporabiti je treba najmanj pet ustrezno razporejenih koncentracij preskusne snovi. Med dejavniki, ki jih je treba upoštevati, so citotoksičnost in topnost. Najnižja koncentracija ne sme imeti nikakršnega učinka na sposobnost preživetja celic. V primeru strupenih kemikalij preživetje pri najvišji koncentraciji ne sme pasti pod 5 do 10 %. Z relativno vodotopnimi snovmi je treba preskus opravljati do meje njihove topnosti z uporabo ustreznih postopkov. Za dobro vodotopne nestrupene snovi je treba zgornjo koncentracijo določiti od primera do primera.
Celice se lahko izpostavijo preskusnim kemikalijam ali v njihovi stacionarni fazi ali v času rasti za obdobje največ 18 ur. Za dolga obdobja tretiranja pa je treba kulture mikroskopsko pregledati za nastanek spor, katerih prisotnost bi razveljavila preskus.
Plošče se inkubira v temi štiri do sedem dni pri 28 do 30 oC. Plošče, uporabljene za analizo rdečih in rožnatih homozigotnih sektorjev, ki nastanejo z mitotičnim crossing-over, je treba hraniti v hladilniku (približno 4 oC) za nadaljnji dan ali dva pred štetjem, da se omogoči razvoj ustreznih pigmentiranih kolonij.
Uporabiti je treba subkulture s frekvencami spontane mitotične rekombinacije znotraj dovoljenega normalnega razpona.
Uporabiti je treba najmanj tri ponovitvene plošče na koncentracijo za analizo prototrofov, ki so nastali z mitotično konverzijo genov, in sposobnosti preživetja celic. V primeru preskusov recesivne homozigotnosti, ki nastane z mitotičnim (crossing-over, je treba število plošč povečati, da bi se dobilo ustrezno število kolonij.
Postopki
Obdelava sevov S. cerevisiae se običajno izvaja s preskusnim postopkom v tekoči suspenziji, ki zajema ali celice v stacionarni fazi ali rastoče celice. Začetne preskuse je treba opraviti na rastočih celicah: 1 – 5 × 107 celic/ml se izpostavi preskusni kemikaliji največ 18 ur pri 28 do 37 oC s tresenjem; če je primerno, se med tretiranjem doda ustrezna količina metabolnega aktivacijskega sistema.
Na koncu tretiranja se celice centrifugirajo, sperejo in zasejejo na ustrezno gojišče. Po inkubaciji se plošče preštejejo za preživetje in indukcijo genske mutacije.
Če je prvi preskus negativen, je treba ob uporabi celic v stacionarni fazi opraviti drugi preskus. Če je prvi preskus pozitiven, se ga potrdi z ustreznim neodvisnim preskusom.
2. PODATKI
Podatki se povzamejo v obliki tabele, iz katere je razvidno število preštetih kolonij, število rekombinant, preživetje in frekvenca rekombinant.
Rezultate je treba potrditi z neodvisnim preskusom.
Podatke je treba oceniti z uporabo ustreznih statističnih metod.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu glede na tip izvajane študije vključijo naslednji podatki:
— uporabljeni sevi,
— preskusni pogoji: celice v stacionarni fazi in rastoče celice, sestava gojišč, inkubacijska temperatura in trajanje, metabolni aktivacijski sistem,
— pogoji tretiranja: stopnje izpostavljenosti, postopek in trajanje tretiranja, temperatura tretiranja, pozitivna in negativna kontrola,
— število preštetih kolonij, število rekombinant, preživetje in frekvenca rekombinacije, razmerje odmerek/odziv, če je primerno, statistična ocena podatkov,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.17 MUTAGENOST – PREIZKUS GENSKIH MUTACIJ V CELICAH SESALCEV IN VITRO
1. METODA
Ta metoda ustreza metodi OECD TG 476, In Vitro Mammalian Cell Gene Mutation Test (1997).
1.1 UVOD
Preizkus genskih mutacij v celicah sesalcev in vitro se lahko uporablja za odkrivanje genskih mutacij, ki jih povzročajo kemične snovi. Primerne celične linije vključujejo celice limfoma miši L5178Y, linije celic kitajskega hrčka CHO, CHO-AS52 in V79 in človeške limfoblaste TK6 (1). V teh celičnih linijah najpogosteje uporabljane genske končne točke izmerijo mutacijo na lokusih za timidin-kinazo (TK) in hipoksantin-gvanin-fosforibozil-transferazo (HPRT) in na transgenu za ksantin-gvanin-fosforibozil-transferazo (XPRT). Preizkusi mutacij TK, HPRT in XPRT zaznajo različne vrste genskih pojavov. Lokacija TK in XPRT na avtosomih lahko omogoči zaznavo genskih pojavov (npr. obsežnih delecij), ki se ne zaznajo na lokusu za HPRT na X kromosomih (2) (3) (4) (5) (6).
Pri preizkusu genskih mutacij v celicah sesalcev in vitro se lahko uporabijo kulture trajnih celičnih linij ali celičnih sevov. Uporabljene celice se izberejo na podlagi zmožnosti rasti v kulturi in stabilnosti pogostnosti spontanih mutacij.
Za preizkuse, opravljene in vitro, so navadno potrebni zunanji viri aktivacije presnove. Takšen sistem aktivacije presnove ne more povsem posnemati razmer in vivo pri sesalcih. Treba je paziti, da se prepreči nastanek razmer, ki bi vodile do rezultatov, ne izražajočih prave mutagenosti. Pozitivni rezultati, ki ne izražajo prave mutagenosti, so lahko posledica sprememb pH, osmolarnosti ali visoke ravni citotoksičnosti (7).
Ta preizkus se uporablja za iskanje možnih mutagenov in rakotvornih snovi za sesalce. Mnoge spojine, pri katerih je rezultat tega preizkusa pozitiven, so rakotvorne snovi za sesalce; vendar pa soodvisnost med tem preizkusom in rakotvornostjo ni popolna. Odvisna je od skupine nevarnosti kemikalije in vedno več je dokazov, da obstajajo rakotvorne snovi, ki jih ta preizkus ne zazna, ker, kakor kaže, delujejo prek drugih mehanizmov, ki niso genotoksični, ali mehanizmov, ki jih v sesalskih celicah ni (6).
Glej tudi splošni uvod dela B.
1.2 DEFINICIJE
Napredna mutacija: genska mutacija starševskega tipa mutirane oblike, ki povzroči spremembo ali izgubo encimskega delovanja kodirane beljakovine.
Mutageni substitucije baznih parov: snovi, ki povzročijo zamenjavo ene ali več baznih parov v DNA.
Mutageni premika bralnega okvira: snovi, ki povzročijo adicijo ali delecij o enega ali več baznih parov v molekuli DNA.
Čas izražanja fenotipa: obdobje, v katerem se nespremenjeni genski produkti odstranijo iz na novo mutiranih celic.
Pogostnost mutant: število opaženih mutiranih celic, deljeno s številom živih celic.
Relativna skupna rast: povečanje števila celic v časovnem obdobju v primerjavi s kontrolno populacijo celic; izračunano kot zmnožek rasti v suspenziji glede na negativno kontrolo in učinkovitosti kloniranja glede na negativno kontrolo.
Relativna rast v suspenziji: povečanje števila celic v obdobju izražanja glede na negativno kontrolo.
Sposobnost preživetja: učinkovitost tvorbe klonov obdelanih celic v času nasaditve v selektivnih pogojih po času izražanja.
Preživetje: učinkovitost tvorbe klonov obdelanih celic, ko se nasadijo na ploščo ob koncu obdelave; preživetje se navadno izraža v odvisnosti od preživetja kontrolne populacije celic.
1.3 PRINCIP PRESKUSNE METODE
Celice brez timidin-kinaze (TK) so zaradi mutacije TK+/- -> TK-/- odporne proti citotoksičnim učinkom pirimidinskega analoga trifluorotimidina (TFT). Celice s timidin-kinazo so občutljive za TFT, ki zavira celično presnovo in ustavi celično delitev. Mutirane celice so tako sposobne množitve v navzočnosti TFT, medtem ko normalne celice, ki vsebujejo timidin-kinazo, to niso. Podobno se celice brez HPRT ali XPRT selekcionirajo z odpornostjo proti 6-tiogvaninu (TG) ali 8-azogvaninu (AG). Lastnosti preizkušane snovi naj se skrbno preučijo, če se v katerem koli od preizkusov genskih mutacij v celicah sesalcev preizkuša bazni analog ali spojina, sorodna selektivni snovi. Preuči naj se na primer vsaka domnevna selektivna toksičnost preizkušane snovi za mutirane in nemutirane celice. Treba je potrditi učinkovitost selekcijskega sistema/snovi, kadar se preizkušajo kemikalije, ki so po strukturi sorodne selektivni snovi (8).
Celice v suspenziji ali enoplastni kulturi se za ustrezno časovno obdobje izpostavijo preizkušam snovi, ob aktivaciji presnove in brez nje, in se kultivirajo na novem gojišču, da se določi citotoksičnost in se omogoči izražanje fenotipa pred selekcijo mutant (9) (10) (11) (12) (13). Citotoksičnost se navadno določi z merjenjem relativne učinkovitosti tvorbe klonov (preživetje) ali relativne skupne rasti kultur po obdelovanju. Obdelovane kulture se vzdržujejo na rastnem gojišču dovolj dolgo obdobje, značilno za vsak izbran lokus in vrsto celic, ki omogoči skoraj optimalno izražanje fenotipa induciranih mutacij. Pogostnost mutant se določi z nasaditvijo znanega števila celic v gojišče s selektivno snovjo, da se zaznajo mutirane celice, in v gojišče brez selektivne snovi, da se določi učinkovitost tvorbe klonov (sposobnost preživetja). Po ustrezno dolgi inkubaciji se preštejejo kolonije. Pogostnost mutant se izračuna iz števila mutiranih kolonij v selektivnem gojišču in iz števila kolonij v neselektivnem gojišču.
1.4 OPIS PRESKUSNE METODE
1.4.1 Priprave
1.4.1.1 Celice
Na voljo je več vrst celic, ki se lahko uporabijo pri tem preizkusu, skupaj s subkloni celic L5171Y, CHO, CHO-AS52, V79 ali TK6. Za vrsto celic, uporabljeno pri tem preizkusu, naj bodo dokazane občutljivost za kemične mutagene, velika učinkovitost tvorbe klonov in stabilna pogostnost spontanih mutacij. Preveri naj se, ali celice niso okužene z mikoplazmo, in če so, naj se ne uporabijo.
Preizkus naj bo načrtovan tako, da bosta njegova občutljivost in moč vnaprej določeni. Število uporabljenih celic, kultur in koncentracij preizkušane snovi naj izraža te določene parametre (14). Najmanjše število živih celic, ki preživijo obdelovanje in se uporabijo v vsaki fazi preizkusa, naj temelji na pogostnosti spontanih mutacij. Splošno vodilo je, da se uporabi število celic, ki je vsaj 10-kratna recipročna vrednost pogostnosti spontanih mutacij. Vendar se priporoča, da se uporabi vsaj 106 celic. Na voljo naj bodo zadovoljivi pretekli podatki o uporabljenem celičnem sistemu, ki kažejo na dosledno učinkovitost preizkusa.
1.4.1.2 Gojišče in pogoji kultiviranja
Uporabijo naj se ustrezna gojišča za kulture in pogoji inkubacije (posode za kulture, temperatura, koncentracija CO2 in vlažnost). Gojišča naj se izberejo glede na selektivne sisteme in vrsto celic, ki se uporabijo v preizkusu. Posebej pomembno je, da se izberejo takšni pogoji kultiviranja, ki zagotavljajo optimalno rast celic v času izražanja in sposobnost tvorjenja kolonij mutiranih, pa tudi nemutiranih celic.
1.4.1.3 Priprava kultur
Celice se namnožijo iz založnih kultur, nasadijo v gojišče in inkubirajo pri 37 oC. Pred uporabo v tem preizkusu bo morda iz kultur treba odstraniti že obstoječe mutirane celice.
1.4.1.4 Aktivacija presnove
Celice naj se izpostavijo preizkušam snovi ob navzočnosti in ob odsotnosti ustreznega sistema za aktivacijo presnove. Najpogosteje uporabljani sistem je postmitohondrijska frakcija z dodanim kofaktorjem (S9), pripravljena iz jeter glodavcev, ki so bila obdelana s sredstvi za encimsko indukcijo, kakor je Aroclor 1254 (15) (16) (17) (18), ali z zmesjo fenobarbitona in β-naftoflavona (19) (20).
Postmitohondrijska frakcija se navadno uporablja v koncentracijah 1–10 % v/v v končnem preizkusnem gojišču. Izbira in stanje sistema za aktivacijo presnove sta lahko odvisna od skupine nevarnosti preizkušane kemikalije. Včasih je primerno uporabiti več kakor eno koncentracijo postmitohondrijske frakcije.
Vrsta razvojnih dosežkov lahko skupaj s pridobivanjem gensko spremenjenih celičnih linij, v katerih se izražajo geni za točno določene aktivirajoče encime, daje možnosti za endogeno aktivacijo. Izbira uporabljenih celičnih linij naj bo znanstveno utemeljena (npr. s pomembnostjo izoencima citokrom P450 za presnovo preizkušane snovi).
1.4.1.5 Priprava preizkušane snovi
Trdne preizkušane snovi naj se pred obdelavo celic raztopijo ali suspendirajo v ustreznih topilih ali nosilcih, in če je to primerno, se razredčijo. Tekoče preizkušane snovi se lahko dodajo neposredno v preizkusni sistem in/ali pred obdelavo razredčijo. Uporabljajo naj se sveže pripravljene preizkušane snovi, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
1.4.2 Preizkusni pogoji
1.4.2.1 Topilo/nosilec
Topilo/nosilec naj ne vzbuja suma, da kemično reagira s preizkušano snovjo, in naj bo združljivo s preživetjem celic in delovanjem S9. Če se uporabijo manj poznana topila/nosilci, naj njihovo vključitev podpirajo podatki, ki kažejo na njihovo združljivost. Priporoča se, da se, kadar koli je to mogoče, kot prva možnost preuči uporaba vodnega topila/nosilca. Kadar se preizkušajo v vodi nestabilne snovi, naj se uporabijo brezvodna organska topila. Voda se lahko odstrani z molekulskim sitom.
1.4.2.2 Koncentracije izpostavljenosti
Med merili, ki jih je treba upoštevati pri določanju najvišje koncentracije, so citotoksičnost, topnost v preizkusnem sistemu in spremembe v pH ali osmolarnosti.
Citotoksičnost naj se določi ob aktivaciji presnove in brez nje v glavnem poskusu z uporabo ustreznega kazalca celične neokrnjenosti in rasti, kakor sta relativna učinkovitost tvorbe klonov (preživetje) ali relativna skupna rast. Lahko je koristno, če se citotoksičnost in topnost določita v poprejšnjem poskusu.
Uporabijo naj se vsaj štiri koncentracije, ki jih je mogoče analizirati. Pri citotoksičnosti naj te koncentracije zajemajo območje od največje toksičnosti do majhne toksičnosti ali netoksičnosti; to bo navadno pomenilo, da razlika med koncentracijami ne bo smela biti večja od faktorja med 2 in √10. Če največja koncentracija temelji na citotoksičnosti, naj povzroči približno 10–20 % (vendar ne manj kakor 10 %) relativno preživetje (relativna učinkovitost tvorbe klonov) ali relativno skupno rast. Za sorazmerno necitotoksične snovi naj bo največja preizkušana koncentracija 5 mg/ml, 5μl/ml oziroma 0,01 M, tista, ki je najnižja.
Sorazmerno netopne snovi naj se preizkušajo do ali prek meje topnosti v pogojih kultiviranja. Netopnost naj se določi v končnem obdelovalnem gojišču, kateremu so izpostavljene celice. Lahko je koristno oceniti topnost na začetku in na koncu obdelave, saj se topnost med izpostavitvijo v preizkusnem sistemu lahko spremeni zaradi navzočnosti celic, S9, seruma itn. Netopnost se lahko zazna s prostim očesom. Oborina ne sme vplivati na štetje.
1.4.2.3 Kontrolni vzorci
V vsak poskus naj se vključijo sočasni pozitivni in negativni (topilo ali nosilec) kontrolni vzorci, ob aktivaciji presnove in brez nje. Kadar se uporabi aktivacija presnove, mora biti kemikalija pozitivne kontrole tista, pri kateri je za mutageni odziv potrebna aktivacija.
Primeri snovi pozitivne kontrole vključujejo:
|
Stanje aktivacije presnove |
Lokus |
Snov |
Št. CAS |
Št. Einecs |
|
Ni zunanje aktivacije presnove |
HPRT |
etil metansulfonat |
62-50-0 |
200-536-7 |
|
N-etil-N-nitrozosečnina |
759-73-9 |
212-072-2 |
||
|
TK (majhne in velike kolonije) |
metil metansulfonat |
66-27-3 |
200-625-0 |
|
|
XPRT |
etil metansulfonat |
62-50-0 |
200-536-7 |
|
|
N-etil-N-nitrozosečnina |
759-73-9 |
212-072-2 |
||
|
Zunanja aktivacija presnove |
HPRT |
3-metilholantren |
56-49-5 |
200-276-4 |
|
N-dimetil nitrozamin |
62-75-9 |
200-549-8 |
||
|
7,12-dimetilbenzoantracen |
57-97-6 |
200-359-5 |
||
|
TK (majhne in velike kolonije) |
ciklofosfamid |
50-18-0 |
200-015-4 |
|
|
ciklofosfamidmonohidrat |
6055-19-2 |
|||
|
Benzo[a]piren |
50-32-8 |
200-028-5 |
||
|
3-metilholantren |
56-49-5 |
200-276-5 |
||
|
XPRT |
N-dimetil nitrozamin(pri velikih koncentracijah S-9) |
62-75-9 |
200-549-8 |
|
|
Benzo[a]piren |
50-32-8 |
200-028-5 |
Lahko se uporabijo druge ustrezne referenčne snovi pozitivne kontrole, npr. če ima laboratorij bazo preteklih podatkov za 5-bromo 2'-dioksiuridin (št. CAS 59-14-3, št. Einecs 200-415-9), se lahko uporabi tudi ta referenčna snov. Uporabijo naj se kemikalije pozitivne kontrole, ki sodijo v isto skupino nevarnosti kakor preizkušana kemikalija, kadar so na voljo.
Vključijo naj se negativni kontrolni vzorci, ki jih sestavlja le topilo ali nosilec v obdelovalnem gojišču, obdelani enako kakor obdelovane skupine. Uporabijo se tudi neobdelani kontrolni vzorci, razen če pretekli kontrolni podatki dokazujejo, da izbrano topilo ne povzroča škodljivih ali mutagenih učinkov.
1.4.3 Postopek
1.4.3.1 Obdelava s preizkušano snovjo
Množeče se celice naj se izpostavijo preizkušam snovi ob aktivaciji presnove in brez nje. Čas izpostavljenosti naj bo ustrezno dolg (navadno zadostuje 3-6 ur). Čas izpostavljenosti lahko traja en celični ciklus ali več.
Pri vsaki preizkušeni koncentraciji se lahko obdelata dve vzporedni kulturi ali le ena. Kadar se uporabi le ena kultura, naj se poveča število koncentracij, da se zagotovi zadostno število kultur za analizo (npr. vsaj osem koncentracij, ki jih je mogoče analizirati). Uporabita naj se dve vzporedni kulturi negativne (topilo) kontrole.
Plinaste ali hlapne snovi naj se preizkušajo z ustreznimi metodami, na primer v zatesnjenih posodah za kulture (21) (22).
1.4.3.2 Merjenje preživetja, sposobnosti preživetja in pogostnosti mutant
Ob koncu izpostavljenosti se celice sperejo in kultivirajo, da se določi preživetje in omogoči izražanje fenotipa mutant. Merjenje citotoksičnosti z določanjem relativne učinkovitosti tvorbe klonov (preživetje) ali relativne skupne rasti kultur se navadno začne po obdelovanju.
Vsak lokus potrebuje določen najmanjši čas za skoraj optimalno izrazitev fenotipa na novo induciranih mutacij (HPRT in XPRT potrebujeta vsaj 6-8 dni, TK pa vsaj 2 dni). Celice naj se gojijo na gojišču s selektivno(-imi) snovjo(-mi) in na gojišču brez takšnih snovi, da se določita število mutant in učinkovitost tvorbe klonov. Merjenje sposobnosti preživetja (ki se uporabi za izračun pogostnosti mutant) se začne ob koncu časa izražanja z nasaditvijo v neselektivno gojišče.
Če da preizkušana snov pri preizkusu L5178Y TK+/- pozitiven rezultat, naj se pri vsaj eni od preizkusnih kultur (največja pozitivna koncentracija) ter pri negativnih in pozitivnih kontrolnih vzorcih kolonije razvrstijo po velikosti. Če da preizkušana snov pri preizkusu L5178Y TK+/- negativen rezultat, naj se kolonije razvrstijo po velikosti pri negativnih in pozitivnih kontrolnih vzorcih. Razvrstitev kolonij po velikosti se lahko izvede tudi pri študijah, pri katerih se uporabi TK6TK+/-.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Podatki naj vključujejo citotoksičnost in sposobnost preživetja, število kolonij in pogostnost mutant za obdelane in kontrolne kulture. Pri pozitivnem odzivu pri preizkusu L5178Y TK+/- se kolonije štejejo z upoštevanjem merila velikih in majhnih kolonij pri vsaj eni od koncentracij preizkušane snovi (največja pozitivna koncentracija) ter pri negativni in pozitivni kontroli. Molekularne in citogenetske lastnosti mutant z velikimi in majhnimi kolonijami so bile podrobno raziskane (23) (24). Pri preizkusu TK+/- se kolonije štejejo z upoštevanjem merila kolonij z normalno rastjo (velike) in počasno rastjo (majhne) (25). Mutirane celice z najobsežnejšimi genskimi poškodbami imajo daljši podvojitveni čas in zato sestavljajo majhne kolonije. Obseg poškodb se giblje od izgube celega gena do kromosomskih aberacij, vidnih pri kari otipu. Nastanek mutant z majhnimi kolonijami se povezuje s kemikalijami, ki povzročajo obsežne kromosomske aberacije (26). Manj resno prizadete mutirane celice rastejo s podobno hitrostjo kakor starševske celice in sestavljajo velike kolonije.
Navede naj se preživetje (relativna uspešnost tvorbe klonov) ali relativna skupna rast. Pogostnost mutant naj se izrazi kot število mutiranih celic na število preživelih celic.
Navedejo se podatki za posamezne kulture. Vsi podatki naj bodo povzeti v tabelah.
Preverjanje jasnega pozitivnega odziva ni potrebno. Dvoumni rezultati naj se razjasnijo z dodatnimi preizkusi, po možnosti ob prilagojenih poskusnih pogojih. Negativne rezultate je treba potrditi za vsak primer posebej. Kadar se pojmuje, da potrditev negativnih rezultatov ni potrebna, naj se to utemelji. Pri dvoumnih ali negativnih rezultatih naj se v nadaljnjih poskusih preuči možnost prilagoditve preizkusnih parametrov, da se razširi območje analiziranih pogojev. Preizkusni parametri, ki bi se lahko prilagodili, vključujejo intervale med koncentracijami in pogoje aktivacije presnove.
2.2 VREDNOTENJE IN INTERPRETACIJA REZULTATOV
Pozitivni rezultat se lahko določi na podlagi številnih meril, kakor je na primer s koncentracijo povezano povečanje ali ponovljivo povečanje pogostnosti mutant. Najprej naj se preuči biološka pomembnost rezultatov. Pri vrednotenju rezultatov preizkusa se kot pomoč lahko uporabijo statistične metode. Statistična značilnost naj ne bo edini odločilni dejavnik za pozitivni odziv.
Pojmuje se, da preizkušana snov, pri kateri rezultati ne izpolnjujejo navedenih meril, ni mutagena v tem sistemu.
Čeprav bo večina študij dala jasne pozitivne ali negativne rezultate, bodo v redkih primerih dobljeni podatki preprečili zanesljivo oceno o delovanju preizkušane snovi. Rezultati lahko ostanejo dvoumni ali dvomljivi ne glede na število ponovitev poskusa.
Pozitivni rezultati preizkusa genskih mutacij v celicah sesalcev in vitro pomenijo, da preizkušana snov povzroča genske mutacije v uporabljenih kultiviranih sesalskih celicah. Ponovljiv rezultat pri koncentraciji s pozitivnim odzivom je najbolj pomemben. Negativni rezultati pomenijo, da preizkušana snov pri preizkusnih pogojih ne povzroča genskih mutacij v uporabljenih kultiviranih sesalskih celicah.
3. POROČANJE
POROČILO O PRESKUSU
Poročilo o preizkusu mora vsebovati naslednje informacije:
Topilo/nosilec:
— utemeljitev izbire nosilca/topila;
— topnost in stabilnost preizkušane snovi v topilu/nosilcu, če sta znani.
Celice:
— vrsta in vir celic,
— število celičnih kultur,
— število pasaž celic, če je to primerno,
— metode vzdrževanja celične kulture, če je to primerno,
— odsotnost mikoplazme.
Preizkusni pogoji:
— razlogi za izbiro koncentracij in števila kultur, tudi npr. podatki o citotoksičnosti in mejah topnosti, če so na voljo,
— sestava gojišč, koncentracija CO2,
— koncentracija preizkušane snovi,
— volumen dodanega nosilca in preizkušane snovi,
— temperatura inkubacije,
— čas inkubacije,
— trajanje obdelave,
— gostota celic med obdelavo,
— vrsta in sestava sistema za aktivacijo presnove, skupaj z merili sprejemljivosti,
— pozitivni in negativni kontrolni vzorci,
— dolžina časa izražanja (skupaj s številom nasajenih celic ter programom kultiviranja na novem gojišču in dodajanja hranil, če je to primerno),
— selektivne snovi,
— merila za določitev, ali je preizkus pozitiven, negativen ali dvoumen,
— uporabljene metode za določanje števila živih in mutiranih celic,
— opredelitev, katera velikost in tip kolonij se upoštevata (vključno z merili za „majhne“ in „velike“ kolonije, če je to primerno).
Rezultati:
— znaki toksičnosti,
— znaki obarjanja,
— podatki o pH in osmolarnosti med izpostavljenostjo preizkusni snovi, če sta bila določena,
— velikost kolonij, če je določena, vsaj za negativne in pozitivne kontrolne vzorce,
— usposobljenost laboratorija za zaznavanje mutant z majhnimi kolonijami pri sistemu L5178Y TK+/-, kadar je to primerno,
— odvisnost med odmerkom in odzivom, kadar je to mogoče,
— statistične analize, če so bile opravljene,
— podatki o sočasni negativni (topilo/nosilec) in pozitivni kontroli,
— podatki o pretekli negativni (topilo/nosilec) in pozitivni kontroli, z območji, srednjimi vrednostmi in standardnimi odkloni,
— pogostnost mutant.
Diskusija rezultatov.
Sklepi.
4. LITERATURA
(1) Moore, M.M., DeMarini, D.M., DeSerres, F.J. and Tindall, K.R. (Eds.) (1987). Banbury Report 28: Mammalian Cell Mutagenesis, Cold Spring Harbor Laboratory, New York.
(2) Chu, E. H. Y., in Mailing H. V. (1968), Mammalian Cell Genetics. II. Chemical Induction of Specific Locus Mutations in Chinese Hamster Cells In Vitro, Proc. Natl. Acad. Sci. USA, 61, str. 1306–1312.
(3) Liber, H. L., in Thilly, W. G. (1982), Mutation Assay at the Thymidine Kinase Locus in Diploid Human Lymphoblasts, Mutation Res. 94, str. 467–485.
(4) Moore, M.M., Harington-Brock, K., Doerr, C.L. and Dearfield, K.L. (1989). Differential Mutant Quantitation at the Mouse Lymphoma TK and CHO HGPRT Loci. Mutagenesis, 4, str. 394–403.
(5) Aaron, C.S. and Stankowski, Jr.L.F. (1989). Comparison of the AS52/XPRT and the CHO/HPRT Assays: Evaluation of Six Drug Candidates. Mutation Res., 223, str. 121–128.
(6) Aaron, C.S., Bolcsfoldi, G., Glatt, H.R., Moore, M., Nishi, Y., Stankowski, Jr.L.F., Theiss, J. and Thompson, E. (1994). Mammalian Cell Gene Mutation Assays Working Group Report. Report of the International Workshop on Standardisation of Genotoxicity Test Procedures. Mutation Res., 312, str. 235–239.
(7) Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M., Brusick, D., Ashby, J. and Myhr, B.C. (1991). Genotoxicity Under Extreme Culture Conditions. A report from ICPEMC Task Group 9. Mutation Res., 257, str. 147–204.
(8) Clive, D., McCuen, R., Spector, J.F.S., Piper, C. and Mavournin, K.H. (1983). Specific Gene Mutations in L5178Y Cells in Culture. A Report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 115, str. 225–251.
(9) Li, A.P., Gupta, R.S., Heflich, R.H. and Wasson, J.S. (1988). A Review and Analysis of the Chinese Hamster Ovary/Hypoxanthine Guanine Phosphoribosyl Transferase System to Determine the Mutagenicity of Chemical Agents: A Report of Phase III of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 196, str. 17–36.
(10) Li, A.P., Carver, J.H., Choy, W.N., Hsie, A.W., Gupta, R.S., Loveday, K.S., O'Neill, J.P., Riddle, J.C., Stankowski, L.F. Jr. and Yang, L.L. (1987). A Guide for the Performance of the Chinese Hamster Ovary Cell/Hypoxanthine-Guanine Phosphoribosyl Transferase Gene Mutation Assay. Mutation Res., 189, str. 135–141.
(11) Liber, H.L., Yandell, D.W and Little, J.B. (1989). A Comparison of Mutation Induction at the TK and HPRT Loci in Human Lymphoblastoid Cells: Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK Locus. Mutation Res., 216, str. 9–17.
(12) Stankowski, L.F. Jr., Tindall, K.R. and Hsie, A.W. (1986). Quantitative and Molecular Analyses of Ethyl Methanosulphonate -and ICR 191- Induced Molecular Analyses of Ethyl Methanosulphonate -and ICR 191-Induced Mutation in AS52 Cells. Mutation Res., 160, str. 133–147.
(13) Turner, N.T., Batson, A.G. and Clive, D. (1984). Procedures for the L5178Y/TK+/- – TK+/- Mouse Lymphoma Cell Mutagenicity Assay. In: Kilbey, B.J. et al (eds.) Handbook of Mutagenicity Test Procedures, Elsevier Science Publishers, New York, str. 239–268.
(14) Arlett, C.F., Smith, D.M., Clarke, G.M., Green, M.H.L., Cole, J., McGregor, D.B. and Asquith, J.C. (1989). Mammalian Cell Gene Mutation Assays Based upon Colony Formation. In: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D.J., Ed., Cambridge University Press, str. 66–101.
(15) Abbondandolo, A., Bonatti, S., Corti, G., Fiorio, R., Loprieno, N. and Mazzaccaro, A. (1977). Induction of 6-Thioguanine-Resistant Mutants in V79 Chinese Hamster Cells by Mouse-Liver Microsome-Activated Dimethylnitrosamine. Mutation Res., 46, str. 365–373.
(16) Ames, B.N., McCann, J. and Yamasaki, E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test. Mutation Res., 31, str. 347–364.
(17) Clive, D., Johnson, K.O., Spector, J.F.S., Batson, A.G. and Brown M.M.M. (1979). Validation and Characterization of the L5178Y/TK+/- Mouse Lymphoma Mutagen Assay System. Mutat. Res., 59, str. 61–108.
(18) Maron, D.M. and Ames, B.N. (1983). Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, str. 173–215.
(19) Elliott, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992). Alternatives to Aroclor 1254 – Induced S9 in In Vitro Genotoxicity Assays. Mutagenesis, 7, str. 175–177.
(20) Matsushima, T., Sawamura, M., Clive, K. and Sugimura, T. (1976). A Safe Substitute Mavournin, Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. In: In Vitro Metabolic Activation in Mutagenesis Testing, de Serres, F.J., Fouts, J.R., Bend, J.R. 225-251. Philpot, R.M. (eds), Elsevier, North-Holland, str. 85–88.
(21) Krahn, D.F., Barsky, F.C. and McCooey, K.T. (1982). CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. In: Tiče, R.R., Costa, D.L., Schaich, K.M. (eds). Genotoxic Effects of Airborne Agents. New York, Plenum, str. 91–103.
(22) Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983). Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environmental Mutagenesis, 5, str. 795–801.
(23) Applegate, M.L., Cell/Hypoxanthine-Guanine M.M., Broder, C.B., Burrell, A. and Hozier, J.C. (1990). Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells. Proc. Natl. Acad. Sci. USA, 87, str. 51–55.
(24) Moore, M.M., Clive, D., Hozier, J.C, Howard, B.E., Batson, A.G., Turner, N.T. and Sawyer, J. (1985). Analysis of Trifluorothymidine-Resistant (TFT1) Mutants of L5178Y/TK+/- Mouse Lymphoma Cells. Mutation Res., 151, str. 161–174.
(25) Yandell, D.W., Dryja, T.P. and Little, J.B. (1990). ICR Genetic Analysis of Recessive Mutations at a Heterozygous Autosomal 191-Induced in Human Cells. Mutation Res., 229, str. 89–102.
(26) Moore, M.M. and Doerr, C.L. (1990). Comparison of Chromosome Aberration Frequency L5178Y/TK+/- Small-Colony TK+/- Mutant Frequency in L5178Y/TK+/--3.7.2C Mouse Lymphoma Cells. Mutagenesis, 5, str. 609–614.
B.18 OKVARE IN POPRAVLJANJE DNK – NENAČRTNA SINTEZA DNK – SESALSKE CELICE IN VITRO
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Preskus nenačrtne sinteze DNK meri repaturno sintezo DNK po izrezu in odstranitvi dela DNK, ki vsebuje mesto okvare, ki so jo inducirali kemijski in fizikalni povzročitelji. Preskus temelji na vključitvi timidina, označenega s tritijem (3H-TdR), v DNK sesalskih celic, ki niso v fazi S celičnega ciklusa. Sprejem H-TdR se lahko določi z avtoradiografijo ali tekočinskim scintilacijskim štetjem (LSC) DNK iz tretiranih celic. Sesalske celice v kulturi, razen če se ne uporabljeni primarnih podganjih hepatocitov, se tretirajo s preskusnim sredstvom z ali brez eksogenega metabolnega aktivacijskega sistema. Nenačrtno sintezo DNK je mogoče meriti tudi v in vivo sistemih.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Priprave
Preskusne kemikalije in kontrolne ali referenčne snovi je treba pripraviti na rastnem gojišču ali pa raztopiti ali suspendirati v ustreznih nosilcih ter nato še nadalje razredčiti v rastnem gojišču za uporabo v preskusu. Končna koncentracija nosilca naj ne vpliva na sposobnost preživetja celic.
V preskusu je mogoče uporabiti primarne kulture podganjih hepatocitov, človeške limfocite ali stabilizirane celične linije (npr. človeške diploidne fibroblaste).
Celice je treba izpostaviti preskusni kemikaliji v prisotnosti in v odsotnosti ustreznega metabolnega aktivacij skega sistema.
Preskusni pogoji
Za vsako preskusno točko sta potrebni najmanj dve celični kulturi za avtoradiografijo in šest kultur (ali manj, če je to znanstveno utemeljeno) za določitev nenačrtne sinteze DNK s tekočinskim scintilacijskim štetjem.
V vsak preskus je treba hkrati vključiti pozitivne in negativne (netretirane in/ali kontrole nosilca) kontrole z in brez metabolne aktivacije.
Primeri pozitivnih kontrol za preskus podganjih hepatocitov vključujejo 7,12- dimetil benzantracen (7,12-DMBA) ali 2-acetilaminofluoren (2-AAF). V primeru stabiliziranih celičnih linij je 4-nitrokinolin-N-oksid (4-NQO) primer pozitivne kontrole za avtoradiografski preskus in preskus tekočinskega scintilacijskega štetja, ki sta opravljena brez metabolne aktivacije; N-dimetil nitrosamin je primer spojine pozitivne kontrole kadar se uporabi metabolni aktivacijski sistem.
Uporabiti je treba več koncentracij preskusne snovi v območju, ustreznem za opredelitev odziva. Najvišja koncentracija mora sprožiti nekaj citotoksičnih učinkov. Snovi, relativno netopne v vodi, je treba preskušati do meje njihove topnosti. Za dobro vodotopne nestrupene snovi je treba zgornjo koncentracijo preskusne kemikalije določiti od primera do primera.
Za vzdrževanju kultur je treba uporabiti ustrezno rastno gojišče, CO2 koncentracijo, temperaturo in vlažnost. Stabilizirane celične linije je treba redno preverjati za okužbo z mikoplazmo.
Sistem metabolne aktivacij e se s kulturami primarnih hepatocitov ne uporablja. Stabilizirane celične linije in limfociti se izpostavijo preskusni snovi v prisotnosti in v odsotnosti ustreznega metabolnega aktivacij skega sistema.
Postopek
Stabilizirane celične linije se pridobijo iz založnih kultur (npr. s tripsinizacijo ali z otresanjem), nacepljenih v posodah za kulture v primerni gostoti in inkubiranih pri 37 oC.
Kratkotrajne kulture podganjih hepatocitov se določijo tako, da se sveže ločenim hepatocitom v ustreznem gojišču omogoči pritrditev na rastno podlago.
Kulture človeških limfocitov se pripravijo z uporabo ustreznih tehnik.
Sveže izolirane podganje hepatocite se primerno dolgo tretira s preskusno snovjo na gojišču, ki vsebuje 3H-TdR. Na koncu obdobja tretiranja je treba celice odstraniti z gojišča, in ji nato sprati, fiksirati in posušiti. Stekelca je treba potopiti v avtoradiografsko emulzijo (kot alternativo se lahko uporabi tudi odstranjevalni film), izpostaviti, razviti, obarvati in prešteti.
Avtoradiografske tehnike: celične kulture se ustrezno dolgo izpostavijo preskusni snovi, čemur sledi tretiranje s 3H-TdR. Čas določa narava snovi, aktivnost metabolnih sistemov in tip celic. Da bi odkrili vrhunec nenačrtne sinteze DNK, je treba 3H-TdR dodati bodisi istočasno s preskusno snovjo bodisi nekaj minut po izpostavljenosti preskusni snovi. Na izbiro med tema dvema postopkoma bodo vplivale možne interakcije med preskusno snovjo in 3H-TdR. Da bi ločili med nenačrtno sintezo DNK in semikonzervativnim podvajanjem DNK je mogoče slednje inhibirati, na primer, z uporabo gojišča brez arginina, nizke vsebnosti seruma ali hidroksiuree na gojišču.
Meritve nenačrtne sinteze DNK s tekočinskim scintilacijskim štetjem: Pred tretiranjem s preskusno snovjo je treba vstop celic v fazo S blokirati, kot je opisano zgoraj; celice je nato treba izpostaviti preskusni kemikaliji, kot je opisano v primeru avtoradiografije. Na koncu inkubacijskega obdobja je treba DNK ekstrahirati iz celic in določiti celotno vsebino DNK ter obseg vključitve 3H-TdR.
Treba je upoštevati, da je pri uporabi človeških limfocitov v zgoraj navedenih tehnikah preprečevanje semikonzervativega podvajanja DNK v nestimuliranih kulturah nepotrebno.
Analiza
Pri določanju nenačrtne sinteze DNK v celicah v kulturi se jedra faze S ne štejejo. Prešteti je treba najmanj 50 celic na koncentracijo. Stekelca je treba kodirati pred štetjem. Na vsakem stekelcu je treba prešteti več široko ločenih poljubnih polj. Količino vključenega 3H-TdR v citoplazmi je treba določiti s preštevanjem treh področij velikosti jedra v citoplazmi vsake preštete celice.
Pri določanju nenačrtne sinteze DNK s tekočinskim scintilacijskim štetjem je treba pri vsaki koncentraciji in v kontrolah uporabiti ustrezno število kultur.
Vse rezultate je treba potrditi v neodvisnem preskusu.
2. PODATKI
Podatki se povzamejo v obliki tabele.
2.1 AVTORADIOGRAFSKE DOLOČITVE
Obseg vključitve 3H-TdR v citoplazmi in število zrnc, najdenih na celičnem jedru, je treba zabeležiti posebej.
Za opis porazdelitve obsega vključitve 3H-TdR v citoplazmi in število zrnc na jedro se lahko uporabi sredina, mediana in modus.
2.2 DOLOČITVE S TEKOČINSKIM SCINTILACIJSKIM ŠTETJEM
Za namen določitev s tekočinskim scintilacijskim štetjem je treba vključitev 3H-TdR prikazati kot dpm/μg DNK. Srednja vrednost dpm/μg DNK s standardno deviacijo se lahko uporabi za opis porazdelitve vključitve.
Podatke je treba oceniti z uporabo ustreznih statističnih metod.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu glede na tip izvajane študije vključijo naslednji podatki:
— uporabljene celice, gostoto in število pasaž v času obdelave, število celičnih kultur,
— uporabljene metode za vzdrževanje celičnih kultur, vključno z gojiščem, temperaturo in koncentracijo CO2,
— preskusna snov, nosilec, koncentracije in utemeljitev izbora koncentracij, uporabljenih v preskusu,
— podrobnosti o metabolnem aktivacijskem sistemu,
— program tretiranja,
— pozitivne in negativne kontrole,
— uporabljena avtoradiografska tehnika,
— uporabljeni postopki za blokiranje vstopa celic v fazo S,
— uporabljeni postopki za ekstrakcijo DNK in določanje celotne vsebine DNK pri določitvah s tekočinskim scintilacijskim štetjem,
— razmerje odmerek/odziv, kadar je to mogoče,
— statistična ocena,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.19 PRESKUS IZMENJAVE SESTRSKIH KROMATID IN VITRO
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Preskus izmenjave sestrskih kromatid (SCE) je kratkotrajni preskus za odkrivanje recipročnih izmenjav DNK med sestrskima kromatidama kromosoma, ki se podvaja. Izmenjava sestrskih kromatid predstavlja izmenjavo produktov podvajanja DNK na na videz homolognih lokusih. Proces izmenjave predvidoma zajema razpad in ponovno združitev DNK, čeprav je malo poznanega o njegovi molekularni osnovi. Za odkrivanje izmenjav sestrskih kromatid je potrebnih nekaj načinov diferencialnega označevanja sestrskih kromatid, to pa se lahko doseže z vključitvijo bromdeoksiuridina (BrdU) v kromosomsko DNK za dva celična cikla.
Sesalske celice in vitro se izpostavijo preskusni kemikaliji z ali brez sesalskega eksogenega metabolnega aktivacijskega sistema, če je to primerno, in se jih goji skozi dva cikla podvajanja na gojišču, ki vsebuje BrdU. Po obdelavi z inhibitorjem delitvenega vretena (npr. s kolhicinom), da bi se celice akumulirale v metafazi mitoze (C-metafaza), se celice spravijo in opravijo kromosomske priprave.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Priprave
— V preskusu je mogoče uporabiti primarne kulture, (človeške limfocite) ali stabilizirane celične linije (npr. celice jajčnikov kitajskega hrčka). Celične linije je treba preveriti za okužbo z mikoplazmo.
— Uporabiti je treba ustrezno gojišče in inkubacijske pogoje (npr. temperatura, posode za gojitev, koncentracija CO2 in vlažnost).
— Preskusne snovi se lahko pripravijo na gojišču ali raztopijo ali suspendira v ustreznih nosilcih pred tretiranjem celic. Končna koncentracija nosilca v gojitvenem sistemu ne sme bistveno vplivati na sposobnost preživetja celic ali stopnjo rasti, vplive na frekvenco izmenjav sestrskih kromatid pa je treba spremljati z uporabo kontrole s topilom.
— Celice je treba izpostaviti preskusni snovi v prisotnosti in v odsotnosti sesalskega metabolnega aktivacijskega sistema. Kadar pa so uporabljeni tipi celic z endogeno metabolno aktivacijo, morata stopnja in narava aktivnosti ustrezati kemijskemu razredu, ki se preskuša.
Preskusni pogoji
Za vsako preskusno točko je potrebno uporabiti najmanj en dvojnik kultur.
V vsak preskus je treba vključiti pozitivne kontrole z uporabo neposredno delujoče spojine in spojine, ki zahteva aktivacijo presnove; uporabiti je treba tudi kontrolo nosilca.
Primeri snovi, ki jih je mogoče uporabiti kot pozitivne kontrole, so naslednji:
— neposredno delujoče spojine:
—— etilmetansulfonat,
— posredno delujoče spojine:
—— ciklofosfamid.
Kadar je primerno, se lahko vključi dodatna pozitivna kontrola enakega kemijskega razreda, kot je preskušana kemikalija.
Uporabiti je treba najmanj tri ustrezno razporejene koncentracije preskusne snovi. Najvišja koncentracija mora povzročiti opazne strupene učinke, vendar mora še vedno omogočati ustrezno podvajanje celic. Snovi, relativno netopne v vodi, je treba preskušati do meje njihove topnosti z uporabo ustreznih postopkov. Za dobro vodotopne nestrupene snovi je treba zgornjo koncentracijo preskusne snovi določiti od primera do primera.
Postopek
Stabilizirane celične linije se pridobijo iz založnih kultur (npr. s tripsinizacijo ali z otresanjem), nacepljenih v gojitvenih posodah v primerni gostoti in inkubiranih pri 37 oC. V primeru enoplastnih kultur je treba število celic na gojitveno posodo prilagoditi tako, da kulture v času spravila niso konfluentne za dosti več kot 50 %. Uporabijo pa se lahko tudi celice v suspenzijski kulturi. Kulture človeških limfocitov se z uporabo ustreznih tehnik pridobijo iz heparinizirane krvi in inkubirajo pri 37 oC.
Celice v eksponentni fazi rasti se ustrezno dolgo izpostavijo preskusni snovi; v večini primerov je učinkovito že ena do dve uri, vendar pa se lahko v nekaterih primerih čas obdelave podaljša do dveh zaključenih celičnih ciklov. Celice, ki nimajo zadostne endogene metabolne aktivacije, je treba izpostaviti preskusni snovi v prisotnosti in odsotnosti ustreznega sistema metabolne aktivacije. Na koncu obdobja izpostavljenosti se s celic spere preskusna snov in celice se gojijo skozi dva cikla podvajanja v prisotnosti BrdU. Lahko pa se uporabi tudi drugi postopek, v katerem se celice istočasno izpostavljajo preskusni kemikaliji in BrdU za celoten čas gojitve dveh celičnih ciklov.
Kulture človeških limfocitov se tretirajo v semisinhronih pogojih.
Celice se analizirajo v njihovi drugi delitvi po tretiranju, s čimer se zagotovi, da so bile najobčutljivejše faze celičnega ciklusa izpostavljene kemikaliji. Vse kulture, ki jim je dodan BrdU, se obdelajo v temi ali pri zasenčeni razbeljeni svetlobi žarnic do spravila celic, da bi se kolikor je mogoče zmanjšala fotoliza DNK, ki vsebuje BrdU.
Celične kulture se obdelajo z inhibitorjem delitvenega vretena (npr. s kolhicinom) eno do štiri ure pred spravilom. Vsaka kultura se za pripravo kromosomov spravi in predela posebej.
Pripravki kromosomov se pridobijo s standardnimi citogenetskimi tehnikami. Obarvanje stekelc, za prikaz izmenjav sestrskih kromatid, je mogoče opraviti z več tehnikami (npr. fluorescenca plus Giemsa metoda).
Število analiziranih celic naj temelji na spontani frekvenci izmenjave sestrskih kromatid v kontroli. Običajno se za izmenjavo sestrskih kromatid analizira najmanj 25 dobro razvitih metafaz na kulturo. Stekelca se kodirajo pred analizo. Pri človeških limfocitih se analizirajo le metafaze, ki vsebujejo 46 centromerov. Pri stabiliziranih celičnih linija se analizirajo le metafaze, ki vsebujejo ± 2 centromera modalnega števila. Navesti je treba ali je centrom erična zamenjava oznake zabeležena kot izmenjava sestrskih kromatid. Rezultate je treba potrditi z neodvisnim preskusom.
2. PODATKI
Podatki se povzamejo v obliki tabele. Za vsako obdelano in kontrolno kulturo posebej je treba navesti število izmenjav sestrskih kromatid za vsako metafazo in število sestrskih kromatid na kromosom za vsako metafazo.
Podatke je treba oceniti z uporabo ustreznih statističnih metod.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu glede na tip izvajane študije vključijo naslednji podatki:
— uporabljene celice, metode vzdrževanja celične kulture,
— preskusni pogoji: sestava gojišča, koncentracija CO2, koncentracija preskusne snovi, uporabljen nosilec, inkubacijska temperatura, čas tretiranja, uporabljen inhibitor delitvenega vretena, njegova koncentracija in trajanje tretiranja z njim, tip uporabljenega sesalskega aktivacijskega metabolnega sistema, pozitivne in negativne kontrole,
— število celičnih kultur na preskusno točko,
— podrobnosti uporabljene tehnike za pripravo stekelc,
— število analiziranih metafaz (podatki, podani za vsako kulturo posebej),
— srednje število izmenjave med sestrskimi kromatidami na celico in na kromosom (podatki, podani za vsako kulturo posebej),
— merila za štetje izmenjav sestrskih kromatid,
— utemeljitev izbora odmerka,
— razmerje odmerek-odziv, če je to primerno,
— statistična ocena,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.20 PRESKUS SPOLNO VEZANE RECESIVNE SMRTNOSTI NA DROSOPHILA MELANOGASTER
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Preskus spolno vezane recesivne smrtnosti (SLRL) z uporabo Drosophile melanogaster odkriva pojavnost mutacij, in sicer točkastih mutacij in majhnih delecij, v zarodni liniji žuželke. Ta preskus je preskus napredne mutacije, ki je sposoben odkriti mutacije na približno 800 lokusih kromosoma X; to predstavlja približno 80 % vseh lokusov kromosoma X. Kromosom X predstavlja približno eno petino celotnega haploidnega genoma.
Mutacije v kromosomu X Drosophile melanogaster se fenotipično izražajo na samcih, ki nosijo mutantni gen. Kadar je mutacija v hemizigotnih pogojih letalna, se na njeno prisotnost sklepa iz odsotnosti enega razreda zaroda samcev od dveh, ki jih običajno proizvede heterozigotna samica. Preskus spolno vezane recesivne smrtnosti izkorišča ta dejstva s pomočjo posebej označenih in razporejenih kromosomov.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Priprave
Uporabijo se lahko samci natančno opredeljenih zalog divjega tipa in samice zaloge seva Muller-5. Lahko pa se uporabijo tudi zaloge samic, ki so primerno označene z večkrat invertiranim kromosomom X.
Preskusne snovi je treba raztopiti v vodi. V vodi netopne snovi, se lahko raztopijo ali suspendirajo v ustreznih nosilcih (npr. mešanica etanola in Tween-60 ali 80), nato pa pred dajanjem razredčijo v vodi ali raztopini soli. Za nosilec naj se ne uporablja dimetilsulfoksid (DMSO).
Preskus je treba zasnovati z vnaprej določeno občutljivostjo in močjo. Frekvenca spontanih mutacij, opažena v ustrezni kontroli, bo vplivala na število tretiranih kromosomov, ki morajo biti analizirani.
Izpostavljenost je lahko oralna, z injekcijo ali pa se živali izpostavijo plinom ali hlapom. Hranjenje s preskusno snovjo se lahko opravi z raztopino sladkorja. Kadar je potrebno, se lahko snovi raztopijo v 0,7 % raztopini NaCl in vbrizgnejo v prsni koš ali trebuh.
Vključiti je treba negativne (nosilec) in pozitivne kontrole. Če pa so na razpolago ustrezni laboratorijski pretekli kontrolni podatki, sočasne kontrole niso potrebne.
Uporabiti je treba tri stopnje izpostavljenosti. Za predhodno oceno se lahko uporabi ena stopnja izpostavljenosti preskusni snovi, ki je bodisi maksimalna tolerirana koncentracija ali ki kaže nekaj znakov strupenosti. V primeru nestrupenih snovi je treba uporabiti izpostavljenost maksimalnim izvedljivim koncentracijam.
Samci divjega tipa (stari tri do pet dni) se tretirajo s preskusno snovjo in parijo posamezno s presežnim številom samic, ki se še niso parile, iz zaloge Muller-5 ali iz druge zaloge, ustrezno označene (z večkrat invertiranim kromosomom X). Samice se vsake dva do tri dni zamenjajo s takimi, ki se še niso parile, da se pokrije celoten cikel zarodnih celic. Na zarodu teh samic se zabeležijo letalni učinki, ki ustrezajo učinkom na zrelo spermo, spermatide srednje in zadnje faze, zgodnje spermatide, spermatocite in spermatogonije v času tretiranja.
Heterozigotnim samicam F1 iz zgoraj navedenih križanj se omogoči posamezno parjenje (tj. ena samica na fiolo) s svojimi brati. V generaciji F2 se pri vsaki kontroli zabeleži odsotnost samcev divjega tipa. Če se izkaže, da je kultura nastala iz samice F1, ki v starševskem kromosomu X nosi letalni gen (tj. ne opazi se samcev z tretiranim kromosomom), je treba potomke te samice z enakim genotipom preskušati, da bi se ugotovilo, ali se smrtnost ponovi v naslednji generaciji.
2. PODATKI
Podatki se povzamejo v obliki tabele, da se pokaže število preskušanih kromosomov X, število neplodnih samcev in število letalnih kromosomov pri vsaki koncentraciji izpostavljenosti in za vsako obdobje parjenja vsakega posameznega tretiranega samca. Navesti je treba število skupin različnih velikosti na vsakega samca. Navedene rezultate je treba potrditi v posebnem preskusu.
Pri oceni preskusov spolno vezane recesivne smrtnosti je treba uporabiti ustrezne statistične metode. Treba je upoštevati in z ustrezno statistično metodo oceniti kopičenje recesivnih letalnih genov, ki izhajajo od enega samca.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu glede na tip izvajane študije vključijo naslednji podatki:
— zaloga: zaloge Drosophila ali uporabljeni sevi, starost žuželk, število tretiranih samcev, število sterilnih samcev, število stabiliziranih F2 kultur, število F2 kultur brez potomcev, število kromosomov, ki nosijo letalni gen, opaženo v vsaki fazi zarodne celice,
— merila določanja velikosti tretiranih skupin,
— preskusni pogoji: podroben opis programa tretiranja in vzorčenja, stopnje izpostavljenosti, podatki o strupenosti, negativne (topilo) in pozitivne kontrole, če je to primerno,
— merila za štetje letalnih mutacij,,
— razmerje izpostavljenost/učinek, kjer je mogoče,
— ocena podatkov,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.21 PRESKUSI CELIČNE TRANSFORMACIJE SESALSKIH CELIC IN VITRO
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Za odkrivanje fenotipskih sprememb in vitro, ki jih inducirajo kemijske snovi, povezane z maligno transformacijo in vivo, se lahko uporabijo sistemi sesalskih celičnih kultur. Med splošno uporabljane celice spadajo C3H10T1/2, 3T3, SHE in podgane Fischer, preskusi pa temeljijo na spremembah v celični morfologiji, oblikovanju žarišč ali spremembah na izgubi pritrjevalne odvisnosti celic v poltrdnem agarju. Obstajajo tudi redkeje uporabljani sistemi, ki odkrivajo fiziološke ali morfološke spremembe v celicah po izpostavljenosti rakotvornim kemikalijam. Niti eden od ciljnih učinkov preskusa in vitro nima določene mehanistične povezave z rakom. Nekateri preskusni sistemi lahko odkrijejo promotorje tumorjev. Citotoksičnost se lahko določi z merjenjem učinka preskusnega materiala na sposobnosti tvorbe kolonij (učinkovitost kloniranja) ali na stopnje rasti kultur. Namen merjenja citotoksičosti je ugotoviti, ali je bila izpostavljenost preskusni kemikaliji toksikološko relevantna, ni pa mogoče z njim izračunati frekvenco transformacije v vseh preskusih, saj lahko nekateri vsebujejo podaljšano inkubacijo in/ali ponovni razmaz na plošče.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Priprave
Odvisno od uporabljanega preskusa transformacije je na voljo niz celičnih linij ali primarnih celic. Raziskovalec mora zagotoviti, da celice v opravljanem preskusu kažejo ustrezno fenotipsko spremembo po izpostavljenosti znanim rakotvornim snovem in da sta veljavnost in zanesljivost preskusa, ki se ga opravlja v raziskovalčevem laboratoriju, dokazljivi in dokumentirani.
Uporabiti je treba gojišča in preskusne pogoje, ki ustrezajo izvajanemu preskusu transformacije.
Preskusne snovi se lahko pripravijo v gojišču ali raztopijo ali suspendirajo v ustreznih nosilcih tik pred tretiranjem celic. Končna koncentracija nosilca v gojitvenem sistemu ne sme vplivati na sposobnost preživetja celic, stopnjo rasti ali pojav transformacije.
Celice je treba izpostaviti preskusni snovi v prisotnosti in v odsotnosti ustreznega metabolnega aktivacijskega sistema. Kadar pa so uporabljeni tipi celic z endogeno metabolno aktivacijo, se je treba prepričati, da narava aktivnosti ustreza kemijskemu razredu, ki se preskuša.
Preskusni pogoji
V vsak preskus je treba vključiti pozitivne kontrole z uporabo neposredno delujoče spojine ter spojine, ki zahteva metabolno aktivacijo; uporabiti je treba tudi negativno kontrolo (nosilec).
Primeri snovi, ki jih je mogoče uporabiti kot pozitivne kontrole, so naslednji:
— Neposredno delujoče kemikalije:
—— etilmetansulfonat,
— β-propiolakton.
— Spojine, ki zahtevajo aktivacijo presnove:
—— 2-acetilaminofluoren,
— 4-dimetil aminoazobenzen,
— 7,12-dimetilbenzantracen.
Kadar je primerno, je treba vključiti dodatno pozitivno kontrolno enakega kemijskega razreda, kot je preskušana spojina.
Uporabiti je treba nekaj koncentracij preskusne snovi. Te koncentracije morajo povzročiti s koncentracijo povezane učinke strupenosti, pri čemer najvišja koncentracija povzroča nizko stopnjo preživetja, preživetje v najnižji koncentraciji pa mora biti približno enako kot v negativni kontroli. Snovi, relativno netopne v vodi, je treba preskušati do meje njihove topnosti z uporabo ustreznih postopkov. Za dobro vodotopne nestrupene snovi je treba zgornjo koncentracijo preskusne snovi določiti od primera do primera.
Postopek
Celice je treba izpostaviti za ustrezno obdobje, odvisno od uporabljenega preskusnega sistema, to pa lahko pri podaljšani izpostavljenosti vključuje ponovno dajanje odmerka ob spremembi gojišča (in, če je potrebno, sveže mešanice za metabolno aktivacijo). Celice, ki nimajo zadostne endogene metabolne aktivacije, je treba izpostaviti preskusni snovi v prisotnosti in odsotnosti ustreznega metabolnega aktivacijskega sistema. Na koncu obdobja izpostavljenosti se s celic spere preskusna snov in celice se gojijo v pogojih, ki ustrezajo spremljanemu transformiranega fenotipa ter pojavnosti nekatere transformacije. Vsi rezultati se potrdijo v neodvisnem preskusu.
2. PODATKI
Podatki se povzamejo v obliki tabele, ti pa so lahko zelo različni, odvisno od uporabljenega preskusa, npr. število kolonij ali žarišč na ploščo, pozitivne plošče ali število transformiranih celic. Kadar je primerno, je treba preživetje izraziti kot odstotek kontrolne stopnje in frekvence transformacij izražene s številom transformantov na število preživelih celic. Podatke je treba oceniti z uporabo ustreznih statističnih metod.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu glede na tip izvajane študije vključijo naslednji podatki:
— uporabljen tip celic, število celičnih kultur, metode vzdrževanja celičnih kultur,
— preskusni pogoji: koncentracija preskusne snovi, uporabljen nosilec, inkubacijski čas, trajanje in frekvenca tretiranja, gostota celic v času tretiranja, tip uporabljenega eksogenega metabolnega aktivacijskega sistema, pozitivne in negativne kontrole, določitev spremljanega fenotipa, uporabljen selektivni sistem (če je primerno), utemeljitev izbora odmerka,
— metoda preštevanja živih in transformiranih celic,
— statistična ocena,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.22 PRESKUS DOMINANTNE SMRTNOSTI NA GLODALCIH
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Učinki dominantne smrtnosti povzročajo embrionalno ali fetalno smrt. Indukcija dominantno letalnih genov zaradi izpostavljenosti kemijski snovi kaže, da snov deluje na zarodno tkivo preskusnih vrst. Na splošno velja, da so dominantni letalni geni posledica kromosomske okvare (strukturne in numerične anomalije). Če gre za tretiranje samic, so lahko embrionalne smrti tudi posledica strupenih učinkov.
Na splošno se samci izpostavijo preskusni spojini in parijo z netretiranimi samicami, ki se še niso parile. Preskušajo se lahko različni stadiji zarodnih celic ločeno, z zaporednimi intervali parjenja. Porast števila mrtvih ugnezditev na samico v tretirani skupini nad številom mrtvih ugnezditev na samico v kontrolni skupini kaže na izgubo po ugnezditvi. Izguba pred ugnezditvijo se lahko oceni na podlagi števil corpora lutea ali s primerjavo skupnega števila ugnezditev na samico v preskusni in kontrolni skupini. Skupen dominantni letalni učinek je vsota izgub pred in po ugnezditvi. Izračun skupnega dominantnega smrtnega učinka temelji na primerjavi živih ugnezditev na samico v preskusni skupini z živimi ugnezditvami na samico v kontrolni skupini. Zmanjšanje števila ugnezditev v določenih presledkih je lahko rezultat uničenja celic (npr. spermatocit in/ali spermatogonijev).
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Priprave
Kadar je mogoče, je treba preskusne snovi raztopiti ali suspendirati v izotonični raztopini soli. Kemikalije, netopne v vodi, se lahko raztopijo ali suspendirajo v ustreznem nosilcu. Uporabljeni nosilec ne sme interferirati s preskusno kemikalijo niti povzročati strupenih učinkov. Uporabiti je treba sveže pripravljene preskusne kemikalije.
Preskusni pogoji
Preskusna spojina se na splošno da le enkrat. Na podlagi toksikoloških podatkov je mogoče uporabiti tudi ponavljajoči program tretiranja. Običajna načina dajanja sta oralna intubacija ali intraperitonealna injekcija. Ustrezni so tudi drugi načini dajanja.
Kot preskusne vrste se priporočajo podgane ali miši. Naključno se izberejo zdrave in spolno popolnoma zrele živali in se razporedijo v preskusne in kontrolne skupine.
Uporabiti je treba ustrezno število tretiranih samcev, da se lahko upošteva spontano spremembo ocenjevane biološke lastnosti. Izbrano število naj temelji na vnaprej določeni občutljivosti zaznavanja in vrednosti značilnosti. Na primer, v tipičnem preskusu bi moralo biti število samcev zadosti veliko, da omogoči od 30 do 50 brejih samic na interval parjenja.
Na splošno je treba v vsak preskus vključiti sočasne pozitivne in negativne (nosilec) kontrole. Kadar so na voljo sprejemljivi rezultati pozitivne kontrole iz preskusov, ki so bili pred kratkim izvajani v istem laboratoriju, jih je mogoče uporabiti namesto sočasne pozitivne kontrole. Snovi pozitivne kontrole je treba uporabiti v ustrezno nizkem odmerku (npr. MMS, intraperitonealno, pri 10 mg/kilogram), da bi se dokazala občutljivost preskusa.
Običajno se uporabijo tri velikosti odmerka. Odmerek visoke velikosti mora povzročiti znake strupenosti ali zmanjšano plodnost pri tretiranih živalih. V nekaterih primerih lahko zadostuje že en sam visok odmerek.
Nestrupene snovi je treba preskusiti s 5 g/kilogram pri enem samem odmerku ali z 1 g/kilogram/dan pri ponovljenih odmerkih.
Postopek
Na voljo je nekaj programov tretiranja. Preskusna snov se najpogosteje daje samo enkrat. Uporabijo se lahko tudi drugi programi tretiranja.
Posamezni samci se parijo zaporedno z eno ali dvema netretiranima samicama, ki se še nista parili, v ustreznih časovnih presledkih po tretiranju. Samice je treba pustiti s samci za čas najmanj enega pojatvenega cikla ali dokler se ne zgodi parjenje, kar se ugotovi ob prisotnosti semenčec v vagini ali ob prisotnosti vaginalnega zamaška.
Število parjenj po tretiranju je določeno s programom tretiranja, zagotoviti pa je treba, da se vse faze zarodnih celic po tretiranju vzorčijo.
Samice se žrtvujejo v drugi polovici brejosti, vsebina maternice pa se pregleda, da bi se določilo število mrtvih in živih ugnezditev. Lahko se pregledajo tudi jajčniki, da bi se določilo število corpora lutea.
2. PODATKI
Podatki se povzamejo v obliki tabele, da bi se prikazalo število samcev, število brejih samic in število nebrejih samic. Navesti je treba posamezne rezultate vsakega parjenja, vključno z identiteto vsakega samca in samice. Za vsako samico je treba zabeležiti teden parjenja, velikost odmerka, ki so ga sprejeli samci, pogostost živih ugnezditev in mrtve ugnezditve.
Izračun skupnega dominantnega smrtnega učinka temelji na primerjavi živih ugnezditev na samico v preskusni skupini z živimi ugnezditvami na samico v kontrolni skupini. Analizira se razmerje med mrtvimi in živimi ugnezditvami iz tretirane skupine v primerjavi z enakim razmerjem iz kontrolne skupine, da bi se prikazala izguba po ugnezditvi.
Iz tabel mora biti razvidno, ali podatki navedeni kot zgodnje in pozne smrti. Če je ocenjena izguba pred ugnezditvijo, je treba navesti tudi to. Izgubo pred ugnezditvijo je mogoče izračunati kot razliko med številom corpora lutea in številom ugnezditev ali kot zmanjšanje povprečnega števila ugnezditev na maternico v primerjavi s parjenji v kontrolah.
Podatki se ocenijo z ustreznimi statističnimi metodami.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— vrsta, sev, starost in masa uporabljenih živali, število živali vsakega spola v preskusni in kontrolni skupini,
— preskusna snov, nosilec, preskusne velikosti odmerka in utemeljitev izbora odmerka, negativne in pozitivne kontrole, podatki o strupenosti,
— program dajanja in tretiranja,
— program parjenja,
— uporabljena metoda za določitev, ali je prišlo do parjenja,
— čas žrtvovanja,
— merila za preštevanj e dominantnih letalnih genov,
— razmerje odmerek/odziv, če je primerno,
— statistična ocena,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.23 PREIZKUS KROMOSOMSKIH ABERACIJ V SPERMATOGONIJIH SESALCEV
1. METODA
Ta metoda ustreza metodi OECD TG 483, Mammalian Spermatogonial Chromosome Aberration Test (1997).
1.1 UVOD
Namen preizkusa kromosomskih aberacij v sesalskih spermatogonijih in vivo je določiti snovi, ki povzročijo strukturne kromosomske aberacije v spermatogonijih sesalcev (1) (2) (3) (4) (5). Ločimo dva tipa strukturnih aberacij, kromosomski tip in kromatidni tip. Večina kemičnih mutagenov povzroči aberacije kromatidnega tipa, nastopajo pa tudi aberacije kromosomskega tipa. Ta metoda ni namenjena določanju numeričnih aberacij in se navadno ne uporablja v ta namen. Kromosomske mutacije in podobni pojavi so vzrok številnih genskih bolezni pri človeku.
S tem preizkusom se določajo kromosomski pojavi v spermatogonijih in zato se pričakuje, da preizkus napove povzročitev dednih mutacij v kličnih celicah.
Pri tem preizkusu se redno uporabljajo glodavci. Ta citogenetski preizkus in vivo zazna kromosomske aberacije pri mitozi spermatogonijev. Druge tarčne celice niso predmet te metode.
Da se zaznajo aberacije kromatidnega tipa v spermatogonijih, naj se pregleda prva mitotska delitev celic po obdelavi, preden se lezije izgubijo v naslednjih celičnih delitvah. Dodatne informacije o obdelanih spermatogonijih se lahko pridobijo z analizo aberacij kromosomskega tipa pri mejotskih kromosomih v diakinezi-metafazi I, ko obdelane celice postanejo spermatociti.
Ta preizkus in vivo je namenjen ugotavljanju, ali so mutageni somatskih celic aktivni tudi v kličnih celicah. Poleg tega je ta preizkus na spermatogonijih primeren za ocenjevanje nevarnosti mutagenosti, ker omogoča upoštevanje dejavnikov presnove in vivo, farmakokinetike in popravljanja DNA.
V modu so številne generacije spermatogonijev, ki so različno občutljive za kemično obdelavo. Zaznane aberacije tako pomenijo skupni odziv obdelanih populacij spermatogonijev, pri čemer prevladujejo številnejši diferencirani spermatogoniji. Zaradi fizične in fiziološke prepreke Sertolijevih celic in prepreke med krvjo in modom so različne generacije spermatogonijev lahko izpostavljene krvnemu obtoku ali pa ne, odvisno od njihovega položaja v modu.
Če obstajajo dokazi, da preizkušana snov ali reaktivni metabolit ne bo dosegel tarčnega tkiva, ta preizkus ni primeren.
Glej tudi splošni uvod dela B.
1.2 DEFINICIJE
Aberacija kromatidnega tipa: strukturna poškodba kromosoma, izražena kot prelom posameznih kromatid ali prelom in združitev med kromatidama.
Aberacija kromosomskega tipa: strukturna poškodba kromosoma, izražena kot prelom ali prelom in združitev obeh kromatid na istem mestu.
Presledek: akromatska lezija, manjša od širine ene kromatide, ob zelo majhni neporavnanosti kromatid.
Numerična aberacija: število kromosomov, drugačno od normalnega števila, ki je značilno za uporabljene živali.
Poliploidija: večkratnik haploidnega števila kromosomov (n), razen diploidnega števila (tj. 3n, 4n in tako naprej).
Strukturna aberacija: sprememba v strukturi kromosoma, ki je vidna pri mikroskopskem pregledu metafaze celične delitve v obliki delecij, transpozicij ali recipročnih translokacij.
1.3 PRINCIP PRESKUSNE METODE
Živali se primerno izpostavijo preizkušam snovi in se v primernem času po tretiranju žrtvujejo. Pred žrtvovanjem se živali tretirajo s snovjo za ustavitev metafaze (npr. kolhicinom, Colcemidom®). Nato se pripravijo in obarvajo preparati kromosomov iz kličnih celic ter določijo kromosomske aberacije v metafaznih celicah.
1.4 OPIS PRESKUSNE METODE
1.4.1 Priprave
1.4.1.1 Izbira živalskih vrst
Navadno se uporabljajo samci kitajskega hrčka in miši. Lahko pa se uporabijo tudi samci drugih ustreznih vrst sesalcev. Uporabijo naj se splošno uporabljani laboratorijski sevi mladih zdravih odraslih živali. Ob začetku študije naj bo nihanje teže živali čim manjše in naj ne presega ± 20 % srednje vrednosti teže.
1.4.1.2 Pogoji bivanja in hranjenja
Uporabljajo se splošni pogoji iz splošnega uvoda dela B, vendar naj bo ciljna vlažnost 50–60 %.
1.4.1.3 Priprava živali
Zdravi mladi odrasli samci se naključno dodelijo kontrolni in tretirani skupini. Kletke se razporedijo tako, da se čimbolj zmanjšajo možni učinki postavitve kletke. Živali se označijo z enkratnimi oznakami. Živali se pred začetkom študije vsaj pet dni aklimatizirajo na laboratorijske razmere.
1.4.1.4 Priprava odmerkov
Trdne preizkušane snovi naj se pred odmerjanjem živalim raztopijo ali suspendirajo v ustreznih topilih ali nosilcih, in če je to primerno, se razredčijo. Tekoče preizkušane snovi se lahko odmerijo neposredno ali pa se pred odmerjanjem razredčijo. Uporabljajo naj se sveže pripravljene preizkušane snovi, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
1.4.2 Preizkusni pogoji
1.4.2.1 Topilo/nosilec
Topilo/nosilec naj nima toksičnih učinkov pri uporabljenih odmerkih in naj se zanj ne sumi, da kemično reagira s preizkušano snovjo. Če se uporabijo manj poznana topila/nosilci, naj njihovo vključitev podpirajo podatki, ki kažejo na njihovo združljivost. Priporoča se, da se, kadar koli je to mogoče, kot prva možnost preuči uporaba vodnega topila/nosilca.
1.4.2.2 Kontrolni vzorci
V vsak preizkus naj se vključijo sočasni pozitivni in negativni (topilo/nosilec) kontrolni vzorci. Razen tretiranja s preizkušano snovjo naj se z živalmi v kontrolnih skupinah ravna enako kakor s tistimi v tretiranih skupinah.
Snovi pozitivne kontrole naj pri ravneh izpostavljenosti, pri katerih se pričakuje zaznavno povečanje glede na ozadje, povzročijo strukturne kromosomske aberacije v spermatogonijih in vivo.
Odmerki pozitivne kontrole naj se izberejo tako, da so učinki jasni, vendar ne razkrijejo takoj identitete kodiranih mikroskopskih preparatov. Sprejemljivo je, da se snovi pozitivne kontrole dajejo živalim drugače kakor preizkušana snov in da se pri pozitivni kontroli vzorči le enkrat. Poleg tega se lahko uporabijo kemikalije pozitivne kontrole, ki sodijo v isto skupino nevarnosti kakor preizkušana kemikalija, kadar so na voljo. Primeri snovi pozitivne kontrole vključujejo:
|
Snov |
Št. CAS |
Št. Einecs |
|
Ciklofosfamid Ciklofosfamid monohidrat |
50-18-0 6055-19-2 |
200-015-4 |
|
Cikloheksilamin |
108-91-8 |
203-629-0 |
|
Mitomicin C |
50-07-7 |
200-008-6 |
|
Monomerni akrilamid |
79-06-1 |
201-173-7 |
|
Trietilenmelamin |
51-18-3 |
200-083-5 |
Negativni kontrolni vzorci, tretirani le s topilom ali nosilcem, drugače pa obravnavani enako kakor tretirane skupine, naj se vključijo v vsako vzorčenje, razen če pretekli kontrolni podatki dokazujejo sprejemljivo spremenljivost med posameznimi živalmi in pogostnost celic s kromosomskimi aberacijami. Uporabijo naj se tudi netretirani kontrolni vzorci, razen če pretekli ali objavljeni kontrolni podatki dokazujejo, da izbrano topilo/nosilec ne povzroča škodljivih ali mutagenih učinkov.
1.5 POSTOPEK
1.5.1 Število živali
Vsaka tretirana in kontrolna skupina mora vključevati vsaj pet samcev, ki jih je mogoče analizirati.
1.5.2 Program tretiranja
Preizkušane snovi se po možnosti dajo enkrat ali dvakrat (tj. kot en vnos ali kot dva vnosa). Preizkušane snovi se lahko dajo tudi v razdeljenem odmerku, tj. dva vnosa v istem dnevu, ne več kakor nekaj ur narazen, da se olajša dajanje velikega volumna materiala. Drugačni režimi odmerjanja naj bodo znanstveno utemeljeni.
Pri skupini z največjim odmerkom se vzorci vzamejo dvakrat po tretiranju. Ker preizkušana snov lahko vpliva na dinamiko celičnega ciklusa, se vzorci vzamejo enkrat zgodaj, približno 24 ur po tretiranju, in drugič pozno, približno 48 ur po tretiranju. Pri drugih odmerkih naj se vzorci vzamejo 24 ur ali 1,5 dolžine celičnega ciklusa po tretiranju, razen če je znano, da so drugi časi vzorčenja primernejši za zaznavanje učinkov (6).
Lahko se vzamejo dodatni vzorci ob drugih časih. Na primer pri kemikalijah, ki bi lahko povzročile zaostajanje kromosomov ali učinke, neodvisne od faze S, bi bilo lahko primerno vzorčiti bolj zgodaj (1).
Ustreznost programa ponovljenega tretiranja je treba določiti za vsak primer posebej. Po ponovljenem programu tretiranja naj se živali žrtvujejo 24 ur (1,5 dolžine celičnega ciklusa) po zadnjem vnosu. Lahko se vzamejo dodatni vzorci ob drugih časih, kadar je to primerno.
Pred žrtvovanjem se živalim intraperitonealno injicira ustrezen odmerek snovi za ustavitev metafaze (npr. Colcemida® ali kolhicina). Živali se vzorčijo v ustreznem časovnem intervalu po tem. Pri miših je ta interval približno 3–5 ur, pri kitajskih hrčkih pa približno 4–5 ur.
1.5.3 Velikost odmerkov
Če se opravi študija za ugotavljanje območja, ker ni na voljo ustreznih podatkov, naj se opravi v istem laboratoriju, na isti vrsti in sevu ter ob enakem režimu tretiranja, kakor bo to uporabljeno v glavni študiji (7). Pri toksičnosti se za prvo vzorčenje uporabijo tri velikosti odmerkov. Te velikosti odmerkov naj zajamejo območje od največje toksičnosti do majhne toksičnosti ali netoksičnosti. Pri poznejšem vzorčenju se lahko uporabi le največji odmerek. Največji odmerek je odmerek, ki povzroči takšne znake toksičnosti, da se pričakuje, da bi večji odmerki pri istem režimu odmerjanja povzročili smrt.
Snovi s specifičnim biološkim delovanjem pri majhnih netoksičnih odmerkih (kakor so hormoni in mitogeni) so lahko izjeme pri merilih za določanje odmerka in naj se ovrednotijo za vsak primer posebej. Največji odmerek se lahko opredeli tudi kot odmerek, ki povzroči nekaj znakov toksičnosti v spermatogonijih (npr. zmanjšanje razmerja med mitozami spermatogonijev v prvi in drugi mejotski metafazi; zmanjšanje naj ne bi preseglo 50 %).
1.5.4 Mejni preizkus
Če preizkus pri eni velikosti odmerka vsaj 2 000 mg/kg telesne teže/dan, ki se da v enem vnosu ali v dveh vnosih v istem dnevu, ne povzroči nobenih opaznih toksičnih učinkov in če se na podlagi podatkov o strukturno sorodnih snoveh ne pričakuje, da bo snov genotoksična, se lahko pojmuje, da popolna študija z uporabo treh velikosti odmerkov ni potrebna. Pričakovana izpostavljenost človeka lahko nakaže potrebo po večjih odmerkih pri mejnem preizkusu.
1.5.5 Dajanje odmerkov
Navadno se preizkušana snov daje z gavažo po želodčni cevki ali ustrezni intubacijski kanili ali z intraperitonealno injekcijo. Sprejemljivi so tudi drugi načini izpostavljanja, kadar se lahko utemeljijo. Največji volumen tekočine, ki se lahko naenkrat da z gavažo ali injekcijo, je odvisen od velikosti preizkusne živali. Volumen naj ne presega 2 ml/100 g telesne teže. Uporabo večjih volumnov je treba utemeljiti. Razen pri dražilnih ali jedkih snoveh, ki bodo navadno povzročile dražilne učinke pri večjih koncentracijah, naj se s prilagoditvijo koncentracije čimbolj zmanjša spremenljivost preizkusnega volumna, tako da se zagotovi stalni volumen pri vseh velikostih odmerkov.
1.5.6 Priprava kromosomov
Takoj po žrtvovanju se iz enega ali obeh mod pridobijo celične suspenzije, se izpostavijo hipotonični raztopini in fiksirajo. Celice se nato nanesejo na objektna stekelca in obarvajo.
1.5.7 Analiza
Pri vsaki živali naj se analizira vsaj 100 dobro vidnih metafaz (tj. najmanj 500 metafaz na skupino). To število se lahko zmanjša, kadar se opazi veliko število aberacij. Vsi preparati, skupaj s pozitivnimi in negativnimi kontrolnimi vzorci, naj se pred mikroskopsko analizo neodvisno kodirajo. Ker fiksiranje pogosto povzroči pretrganje dela metafaz in izgubo kromosomov, naj bo število centromer v štetih celicah enako 2n ± 2.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Podatki za posamezne živali naj bodo prikazani v tabeli. Poskusna enota je žival. Za vsako žival naj se določi število celic s strukturnimi kromosomskimi aberacij ami in število kromosomskih aberacij na celico. Različni tipi strukturnih kromosomskih aberacij naj se navedejo s svojimi števili in pogostnostjo za tretirane in kontrolne skupine. Presledki se evidentirajo ločeno in navedejo v poročilu, vendar se na splošno ne vključijo v skupno pogostnost aberacij.
Če se opazujeta mitoza, pa tudi mejoza, naj se določi razmerje med mitozami spermatogonijev v prvi in drugi mejotski metafazi kot merilo citotoksičnosti za vse tretirane živali in živali negativne kontrole v celem vzorcu 100 delečih se celic na žival, da se ugotovijo možni citotoksični učinki. Če se opazuje le mitoza, naj se določi mitotični indeks v vsaj 1 000 celicah za vsako žival.
2.2 VREDNOTENJE IN INTERPRETACIJA REZULTATOV
Pozitivni rezultat se lahko določi na podlagi številnih meril, kakor je na primer z odmerkom povezano povečanje relativnega števila celic s kromosomskimi aberacijami ali jasno povečanje števila celic z aberacijami v posamezni tretirani skupini ob posameznem vzorčenju. Najprej naj se preuči biološka pomembnost rezultatov. Pri vrednotenju rezultatov preizkusa se kot pomoč lahko uporabijo statistične metode (8). Statistična značilnost naj ne bo edini odločilni dejavnik za pozitivni odziv. Dvoumni rezultati naj se razjasnijo z dodatnimi preizkusi, po možnosti ob prilagojenih poskusnih pogojih.
Pojmuje se, da preizkušana snov, pri kateri rezultati ne izpolnjujejo navedenih meril, ni mutagena v tem preizkusu.
Čeprav bo večina poskusov dala jasne pozitivne ali negativne rezultate, bodo v redkih primerih dobljeni podatki preprečili zanesljivo oceno o delovanju preizkušane snovi. Rezultati lahko ostanejo dvoumni ali dvomljivi ne glede na število ponovitev poskusa.
Pozitivni rezultati preizkusa kromosomskih aberacij v spermatogonijih in vivo pomenijo, da preizkušana snov povzroča strukturne kromosomske aberacij e v kličnih celicah preizkusne vrste. Negativni rezultati pomenijo, da preizkušana snov pri preizkusnih pogojih ne povzroča kromosomskih aberacij v kličnih celicah preizkusne vrste.
Obravnava naj se verjetnost, da preizkušana snov ali njeni metaboliti dosežejo tarčno tkivo.
3. POROČANJE
POROČILO O PRESKUSU
Poročilo o preizkusu mora vsebovati naslednje informacije:
Topilo/nosilec:
— utemeljitev izbire nosilca,
— topnost in stabilnost preizkušane snovi v topilu/nosilcu, če sta znani.
Preizkusne živali:
— uporabljena vrsta/sev,
— število in spol živali,
— vir, pogoji bivanja, prehrana itn.,
— teža posameznih živali na začetku preizkusa, skupaj z območjem telesne teže, srednjo vrednostjo in standardnim odklonom za vsako skupino.
Preizkusni pogoji:
— podatki študije za ugotavljanje območja, če je bila opravljena,
— razlogi za izbiro velikosti odmerka,
— razlogi za način dajanja,
— podrobnosti o pripravi preizkušane snovi,
— podrobnosti o dajanju preizkušane snovi,
— razlogi za čas žrtvovanja,
— način preračunavanja koncentracije preizkušane snovi v hrani/pitni vodi (ppm) v dejanski odmerek (mg/kg telesne teže/dan), če je to primerno,
— podrobnosti o kakovosti hrane in vode,
— podroben opis programov tretiranja in vzorčenja,
— metode merjenja toksičnosti,
— vrsta snovi za ustavitev metafaze, njena koncentracija in čas tretiranja,
— metode priprave mikroskopskih preparatov,
— merila za štetje aberacij,
— število analiziranih celic na žival,
— merila za določitev, ali je študija pozitivna, negativna ali dvoumna.
Rezultati:
— znaki toksičnosti,
— mitotični indeks,
— razmerje med mitozami spermatogonijev v prvi in drugi mejotski metafazi,
— tip in število aberacij, navedena za vsako žival posebej,
— skupno število aberacij na skupino,
— število celic z aberacijami na skupino,
— odvisnost med odmerkom in odzivom, če je to mogoče,
— statistične analize, če so bile opravljene,
— podatki o sočasni negativni kontroli,
— podatki o pretekli negativni kontroli, z območji, srednjimi vrednostmi in standardnimi odkloni,
— podatki o sočasni pozitivni kontroli,
— spremembe v ploidnosti, če so bile opažene.
Diskusija rezultatov.
Sklepi.
4. LITERATURA
(1) Adler, I.D. (1986). Clastogenic Potential in Mouse Spermatogonia of Chemical Mutagens Related to their Cell-Cycle Specifications. In: Genetic Toxicology of Environmental Chemicals, Part B: Genetic Effects and Applied Mutagenesis, Ramel, C, Lambert, B. and Magnusson, J. (Eds.) Liss, New York, str. 477–484.
(2) Adler, ID., (1984). Cytogenetic tests in Mammals. In: Mutagenicity Testing: a Practical Approach. Ed. S. Venitt and J.M. Parry. IRL Press, Oxford, Washington DC, str. 275–306.
(3) Evans, E.P., Breckon, G. and Ford, C.E., (1964). An Air-Drying Method for Meiotic Preparations from Mammalian Testes. Cytogenetics and Cell Genetics, 3, str. 289–294.
(4) Richold, M., Ashby, J., Chandley, A., Gatehouse, D.G. and Henderson, L. (1990). In Vivo Cytogenetic Assays, In: D.J. Kirkland (Ed.) Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part I revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 115–141.
(5) Yamamoto, K. and Kikuchi, Y. (1978). A New Method for Preparation of Mammalian Spermatogonial Chromosomes. Mutation Res., 52, str. 207–209.
(6) Adler, ID., Shelby M.D., Bootman, J., Favor, J., Generoso, W., Pacchierotti, F., Shibuya, T. and Tanaka N. (1994). International Workshop on Standardisation of Genotoxicity Test Procedures. Summary Report of the Working Group on Mammalian Germ Cell Tests. Mutation Res., 312, str. 313–318.
(7) Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G, Morton, D.B., Kirkland, D.J. and Richold, M. (1992). Report of British Toxicology Society/UK Environmental Mutagen Society Working group: Dose setting in In Vivo Mutagenicity Assays. Mutagenesis, 7, str. 313–319.
(8) Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K. (1989). Statistical Analysis of In Vivo Cytogenetic Assays In: D.J. Kirkland (Ed.) Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, report, Part III. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 184–232.
B.24 PRESKUS POJAVA MADEŽEV NA MIŠIH
1. METODA
1.1 UVOD
Glej Splošni uvod dela E.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela E.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
To je preskus in vivo na miših, pri katerem se kemikalijam izpostavijo razvijajoči embrii. Ciljne celice v razvijajočih embriih so melanoblasti, ciljni geni pa so tisti, ki nadzorujejo pigmentacijo dlak krzna. Razvijajoči se embrii so heterozigotni za številne navedene gene za obarvanje krzna. Posledica mutacije v dominantnem alelu tega gena v melanoblastu ali izgube tega alela (zaradi različnih genetskih vzrokov) se odraža v izražanju recesivnega fenotipa v njegovih celicah potomkah, ki predstavlja madež spremenjene barve na krznu miši. Določi se število zaroda z navedenimi madeži, mutacijami, njihova pogostost pa se primerja s pogostostjo teh madežev med potomci, ki nastanejo iz embriov, tretiranih samo s topilom. Preskus pojava madežev pri miših odkriva predvidene somatske mutacije v fetalnih celicah.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Priprave
Preskusne snovi se, kadar je mogoče, raztopijo ali suspendirajo v izotonični raztopini soli. Kemikalije, netopne v vodi, se raztopijo ali suspendirajo v ustreznih nosilcih. Uporabljeni nosilec ne sme interferirati s preskusno kemikalijo niti povzročati strupenih učinkov. Uporabiti je treba sveže pripravljene preskusne kemikalije.
Miši seva T (nonagouti, a/a; chincilla, pink eye, cchp/cchp; brown, b/b; dilute, short ear, d se/d se; piebald spotting, s/s) se parijo ali s sevom HT (pallid, nonagouti, brachypody, pa a bp/pa a bp; leaden fuzzy, ln fz/ln fz; pearl pe/pe), ali s C57 BL (nonagouti, a/a). Lahko se izvajajo tudi druga ustrezna križanja, kot med NMRI (nonagouti, a/a; albino, c/c) in DBA (nonagouti, a/a; brown, b/b; dilute d/d), pod pogojem, da proizvedejo potomce nonagouti.
Tretira se zadostno število brejih samic, da bi se ustvarilo ustrezno število preživelega zaroda pri vsaki uporabljeni velikosti odmerka. Ustrezno velikost vzorca določa število madežev, opaženih na tretirani miši, in lestvica kontrolnih podatkov. Negativni rezultat je sprejemljiv le, če se doseže najmanj 300 potomcev samic, tretiranih z najvišjo velikostjo odmerka.
Na razpolago morajo biti sočasni kontrolni podatki za miši, ki so bile tretirane samo z nosilcem (negativne kontrole). Da bi se povečala občutljivost preskusa, se lahko uporabijo tudi pretekli kontrolni podatki iz istega laboratorija, pod pogojem da so le-ti homogeni. Če se ne odkrije mutagenosti preskusne kemikalije, naj bi bili na voljo podatki pozitivne kontrole, ki so bili pred kratkim pridobljeni v istem laboratoriju pri tretiranju s kemikalijo, za katero je poznano, da v tem preskusu pokaže mutagenost.
Običajna načina dajanja sta oralna intubacija ali intraperitonealna injekcija, ki se jo da brejim samicam. Kadar je ustrezno, se lahko uporabi tretiranje z inhalacijo ali kak drug način dajanja.
Uporabita se najmanj dve velikosti odmerka, vključno z eno, ki kaže znake strupenosti ali zmanjšano velikost zaroda. V primeru nestrupenih kemikalij je treba živali izpostaviti maksimalni izvedljivi velikosti odmerka.
Postopek
Običajno se živali tretirajo enkrat na osmi, deveti ali deseti dan brejosti, pri čemer je prvi dan tisti, ko se prvič opazi vaginalni zamašek. Ti dnevi se ujemajo s 7,25, 8,25 in 9,25 dneva po spočetju. V teh dneh se lahko živali tretirajo tudi zaporedno.
Med tretjim in četrtim tednom po skotitvi se potomci kodirajo in preštejejo se madeži. Ločimo tri razrede madežev:
(a) beli madeži v razmaku do 5 mm od srednje trebušne linije, ki so domnevno rezultat uničenja celic (WMVS);
(b) rumeni, agouti madeži okrog seskov, genitalij, vratu, pazdušnega in dimeljskega področja in sredi čela, ki so domnevno rezultat napačne diferenciacije (MDS); in
(c) pigmentirani in beli madeži, naključno razporejeni po krznu, ki so domnevno rezultat somatskih mutacij (RS).
Določijo se vsi trije razredi, vendar je le zadnji, RS, genetsko pomemben. Težave razločevanja med MDS in RS se lahko razrešijo s fluoroscentnim mikroskopiranjem vzorčnih dlak.
Upoštevati je treba očitne vidne morfološke abnormalnosti potomcev.
2. PODATKI
Podatki se predstavijo kot skupno število preštetih potomcev in število potomcev z enim ali več madeži, ki so domnevno rezultat somatskih mutacij. Podatki tretirane skupine in negativne kontrole se primerjajo z ustreznimi metodami. Podatki se navedejo tudi po posameznem zarodu.
3. POROČILO
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— sevi, uporabljeni pri križanju,
— število brejih samic v preskusnih in kontrolnih skupinah,
— povprečna velikost zaroda v preskusnih in kontrolnih skupinah ob skotitvi in pri odstavitvi od sesanja,
— velikost(i) odmerka preskusne kemikalije,
— uporabljeno topilo,
— dan brejosti, ko je bilo opravljeno tretiranje,
— način tretiranja,
— skupno število preštetih potomcev in število potomcev z WMVS, MDS in RS v preskusnih in kontrolnih skupinah,
— vidne morfološke abnormalnosti,
— razmerje odmerek/odziv pri RS, kadar je mogoče,
— statistična ocena,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.25 PRESKUS DEDNE TRANSLOKACIJE NA MIŠIH
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Preskus dedne translokacije na miših odkriva strukturalne in numerične kromosomske spremembe v zarodnih sesalskih celicah, pridobljenih pri potomcih prve generacije. Tipi odkritih kromosomskih sprememb so recipročne translokacije in, če so vključeni tudi potomci samic, izguba kromosoma X. Nosilci translokacij in samice tipa XO kažejo zmanjšano plodnost, kar se uporabi za izbor potomcev F1 za citogenetsko analizo. Popolno sterilnost povzročijo nekateri tipi translokacij (avtosom X in tip c-t). Translokacije se citogenetsko opazujejo v mejotičnih celicah v diakinezi-metafazi I posameznih samcev, bodisi samcev F1 ali zaroda samcev samic F1. Samice tipa XO se citogenetsko prepozna po prisotnosti samo 39 kromosomov v mitozi kostnega mozga.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Priprave
Preskusne kemikalije se raztopijo v izotonični raztopini soli. Če so netopne, se raztopijo ali suspendirajo v ustreznem nosilcu. Uporabljajo se sveže pripravljene raztopine preskusne spojine. Če je za lažje dajanje odmerkov uporabljen nosilec, le-ta ne sme vplivati na preskusno kemikalijo ali povzročati strupenih učinkov.
Načina dajanja sta običajno oralna intubacija in intraperitonealna injekcija. Ustrezni so lahko tudi drugi načini dajanja.
Zaradi lažjega vzrejnega in citološkega preverjanja se navedeni preskusi opravljajo na miših. Ne zahteva se nikakršen poseben mišji sev. Vendar pa mora biti povprečna velikost zaroda seva večja od osem in relativno konstantna.
Uporabijo se zdrave, spolno zrele živali.
Število potrebnih živali je odvisno od frekvence spontane translokacije in minimalne stopnje indukcije, ki je potrebna za pozitiven rezultat.
Preskus se običajno opravlja z analizami potomcev samcev F1. Preskus je treba opraviti na najmanj 500 potomcih samcih F1 na skupino odmerka. Če se vključijo potomci samice F1, je zahtevanih 300 samcev in 300 samic.
Na voljo naj bi bili ustrezni kontrolni podatki, izpeljani iz sočasnih in preteklih kontrol. Kadar so na voljo sprejemljivi rezultati pozitivne kontrole iz preskusov, ki so bili pred kratkim izvajani v istem laboratoriju, se ti rezultati lahko uporabijo namesto tekoče pozitivne kontrole.
Preskuša se ena velikost odmerka, ponavadi je to najvišji odmerek, povezan s povzročitvijo minimalnih strupenih učinkov, vendar brez vpliva na razmnoževalno vedenje ali preživetje. Da bi se določilo razmerje odmerek/odziv, sta zahtevana še dva dodatna nižja odmerka. V primeru nestrupenih kemikalij je treba živali izpostaviti maksimalni izvedljivi velikosti odmerka.
Postopek
Na voljo sta dva programa tretiranja. Najpogosteje se uporablja enkratno dajanje preskusne snovi. Preskusna snov se lahko daje tudi sedem dni na teden, in sicer 35 dni. Število parjenj po tretiranju je določeno s programom tretiranja, zagotoviti pa je treba, da se vzorčijo vse faze obdelanih zarodnih celic. Po obdobju parjenja se samice posamezno razvrstijo po kletkah. Ko samica skoti mladiče, se zabeleži datum, velikost zaroda in spol potomcev. Vsi moški potomci se odstavijo od sesanja, ženske potomke pa se izločijo, razen če se ne vključijo v preskus.
Uporabljata se ena od dveh možnih metod:
— preskus plodnosti potomcev F1 in nadaljnje preverjanje možnih nosilcev translokacij s citogenetsko analizo,
— citogenetska analiza vseh potomcev samcev F1 brez vnaprejšnje selekcije s preskusom plodnosti.
(a) Preskus plodnosti
Zmanjšano plodnost posameznih živali F1 je mogoče ugotoviti na podlagi opazovanja velikosti zaroda in/ali analize vsebine maternice samic.
Za uporabljeni mišji sev morajo biti določena merila določanja normalne in zmanjšane plodnosti.
Opazovanja velikosti zaroda: samci F1, ki bodo preskušani, so posamezno razporejeni po kletkah s samicami bodisi iz istega preskusa ali iz kolonije. Kletke se dnevno pregledujejo od 18. dne po parjenju. Ob skotitvi se zabeležita velikost zaroda in spol potomcev F2, nakar se zarodi izločijo. Če se opravlja preskus na potomcih samicah F1, se potomce F2 iz majhnih zarodov ohrani za nadaljnje preskuse. Samice, ki so nosilke translokacij, se preverijo s citogenetsko analizo translokacije pri katerem koli izmed njihovih moških mladičev. Samice tipa X0 se prepoznajo po tem, da se razmerje spolov samci-samice med njihovimi potomci spremeni iz 1:1 na 1:2. V naslednjem postopku se normalne živali F1 izločijo iz nadaljnjih preskusov, če prvi zarod F2 doseže ali preseže vnaprej določeno normalno vrednost, sicer se opazuje drugi ali tretji zarod F2.
Živali F1, ki jih po opazovanju najmanj treh zarodov F2 ni mogoče razvrstiti kot normalne, se nadaljnje preskušajo z analizo vsebine maternice samic, ki so se parile, ali pa se takoj podvržejo citogenetski analizi.
Analiza vsebine maternice: Zmanjšanje velikosti zaroda nosilcev translokacij je posledica embrionalne smrti, tako da visoko število mrtvih ugnezditev kaže na prisotnost translokacij e pri preskusni. Vsakega izmed samcev F1, na katerih se bo opravljal preskus, se pari z dvema do tremi samicami. Spočetje se ugotovi tako, da se vsak dan zjutraj samice pregledajo za vaginalne zamaške. 14 do 16 dni pozneje se samice žrtvujejo in zabeležijo se žive in mrtve ugnezditve v njihovih maternicah.
(b) Citogenetska analiza
Testisi se pripravijo s tehniko sušenja na zraku. Nosilci translokacij se prepoznajo po prisotnosti multivalentnih konfiguracij v diakinezi metafaze I v primarnih spermatocitah. Zahtevani dokaz, da je žival, na kateri se opravlja preskus, nosilec translokacij e, dobimo z opazovanjem najmanj dveh celic z multivalentno asociacijo.
Če ni bila opravljena nikakršna vzrejna selekcija, se na vseh samcih F1 opravi citogenetski pregled. Pod mikroskopom je treba prešteti najmanj 25 celic diakineze-metafaze I na samca. Pregled mitotičnih metafaz v spermatogonijih kostnega mozga je potreben pri samcih F1 z majhnimi testisi in mejotično členitvijo pred diakinezo ali na samicah za katere se sumi, da so tipa XO. Prisotnost nenavadno dolgega in/ali kratkega kromosoma v vsaki izmed 10 celic je dokaz posebne sterilne translokacij e pri samcih (c-t tip). Nekaj translokacij avtosoma X, ki povzročajo sterilnost samcev, se lahko prepozna le z analizo proganja mitotičnih kromosomov. Prisotnost 39 kromosomov v vseh 10 mitozah je dokaz stanja XO pri samici.
2. PODATKI
Podatki se povzamejo v obliki tabele.
Navede se srednja velikost zaroda in razmerje med spoloma iz parjenj staršev ob rojstvu in odstavitvi od sesanja za vsak interval parjenja.
Za oceno plodnosti živali F1 se prikaže srednja vrednost velikost zaroda vseh normalnih parjenj ter posamezne velikosti zarodov nosilcev translokacij F1. Za analizo vsebine maternice se navede povprečno število živih in mrtvih vsadkov pri normalnih parjenjih ter posamezna števila živih in mrtvih vsadkov za vsako parjenje nosilcev translokacij F1.
Za citogenetsko analizo diakineze-metafaze I se pri vsakem nosilcu translokacij navede število tipov multivalentne konfiguracije in skupno število celic.
V primeru posameznih sterilnih živali F1 se navede skupno število parjenj in trajanje obdobja parjenja. Podajo se teže testisov in podrobnosti citogenetske analize.
V primeru samic tipa X0 se navedena srednja velikost zaroda, razmerje po spolu med potomci F1 in rezultate citogenetske analize.
Kadar se možni nosilci translokacij vnaprej izberejo s preskusi plodnosti, je treba v tabele vključiti podatke o tem, od teh je bilo potrjenih za translokacij ske heterozigote.
Poročajo se podatki iz preskusov z negativno in pozitivno kontrolo.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— sev miši, starost živali, masa tretiranih živali,
— število starševskih živali vsakega spola v preskusni in kontrolni skupini,
— preskusni pogoji, podroben opis tretiranja, velikosti odmerka, topila, program parjenja,
— število in spol potomcev na samico, število in spol potomcev, vzrejenih za analizo translokacije,
— čas in merila analize translokacije,
— število in podroben opis nosilcev translokacij, vključno z vzrejnimi podatki in podatki o vsebini maternice, če je primerno;
— citogenetski postopki in podrobnosti mikroskopske analize, po možnosti s slikami,
— statistična ocena,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.26 PRESKUS SUBKRONIČNE ORALNE TOKSIČNOSTI 90-DNEVNA ŠTUDIJA ORALNE TOKSIČNOSTI S PONAVLJAJOČIMI SE ODMERKI NA GLODALCIH
1. METODA
Ta metoda za preskus subkronične oralne toksičnosti ustreza metodi OECD TG 408 (1998).
1.1 UVOD
Pri ocenjevanju in vrednotenju strupenih lastnosti kemikalije se lahko določi subkronična oralna toksičnost z uporabo ponavljajočega odmerjanja, potem ko so že bile pridobljene začetne informacije o toksičnosti s preskusi akutne toksičnosti ali 28-dnevnimi preskusi toksičnosti s ponavljajočimi se odmerki. Ta 90-dnevna študija daje informacije o možnih nevarnostih za zdravje, za katere je verjetno, da se pojavijo pri ponavljajoči se izpostavljenosti v daljšem časovnem obdobju, vključno z razvojem od odstavitve daleč v odraslo dobo. Študija daje informacije o glavnih toksičnih učinkih, nakaže ciljne organe in možnost kopičenja ter lahko omogoči oceno ravni izpostavljenosti brez opaznih škodljivih učinkov (NOAEL), ki ga je mogoče uporabiti za izbiro velikosti odmerkov pri študijah kronične toksičnosti in določanju varnostnih meril za izpostavljenost človeka.
Metoda namenja dodatno pozornost nevrološkim ciljnim učinkom ter pokaže možne učinke na imunski in reproduktivni sistem. Poudarjena je tudi potreba po skrbnem kliničnem opazovanju živali, da se pridobi kar največ informacij. Študija bi morala omogočiti identifikacijo kemikalij s potencialnimi nevrotoksičnimi in imunološkimi učinki ter učinki na reproduktivne organe, kar bi morebiti terjalo nadaljnje poglobljene raziskave.
Glej tudi Splošni uvod Del B.
1.2 OPREDELITEV POJMOV
Odmerek: je količina dane preskusne snovi. Odmerek je izražen kot masa (g, mg), kot masa preskusne snovi na enoto teže preskusne živali (npr. mg/kg) ali kot konstantna koncentracija v hrani (ppm).
Odmerjanje: je splošni izraz, ki obsega odmerek ter pogostnost in trajanje dajanja odmerka.
NOAEL: je kratica za odmerek brez opaznih škodljivih učinkov (No Observed Adverse Effect Level) in je največji odmerek, pri katerem ne opazimo nobenega škodljivega učinka, povezanega z tretiranjem.
1.3 PRINCIP PRESKUSNE METODE
Preskusna snov se 90 dni dnevo oralno daje v stopnjevanih odmerkih več skupinam poskusnih živali, in sicer ena velikost odmerka na skupino. V času dajanja odmerkov je treba živali pozorno opazovati ali kažejo znake toksičnosti. Na živalih, ki med preskusom poginejo ali so usmrčene, se izvede obdukcija, na koncu preskusa pa se usmrti tudi preživele živali in tudi na njih izvede obdukcija.
1.4 OPIS PRESKUSNE METODE
1.4.1 Priprava živali
Uporabiti je treba zdrave živali, ki so se najmanj pet dni prilagajale na laboratorijske razmere in ki predhodno niso bile uporabljene za poskuse. Poznati je treba vrsto, sev, vir, spol, težo in/ali starost poskusnih živali. Živali se naključno dodelijo kontrolni in tretirani skupini. Kletke je treba razporediti tako, da so možni učinki zaradi pozicije kletk čim manjši. Vsaki živali se dodeli posebna identifikacijska številka.
1.4.2 Priprava odmerkov
Preskusna snov se daje z gavažo, s hrano ali s pitno vodo. Metoda oralnega dajanja odmerkov je odvisna od namena študije in od fizikalnih/kemijskih lastnosti preskusnega materiala.
Po potrebi se preskusna snov raztopi ali suspendira v primernem nosilcu. Priporočljivo je, da se, kadar koli je mogoče, najprej razmisli o uporabi vodne raztopine/suspenzije, potem o raztopini/emulziji v olju (npr. koruzno olje), nato pa šele o možni raztopini v drugih nosilcih. V primeru nosilcev, ki niso voda, je treba poznati toksične lastnosti takega nosilca. Določiti je treba stabilnost preskusne snovi pri pogojih dajanja.
1.4.3 Preskusni pogoji
1.4.3.1 Poskusne živali
Priporočena vrsta je podgana, vendar se lahko uporabijo tudi druge vrste glodalcev, npr. miš. Uporabiti je treba laboratorijske seve mladih zdravih odraslih živali, ki se običajno uporabljajo. Samice morajo biti nuliparne in ne smejo biti breje. Z odmerjanjem je treba začeti čim prej po odstavitvi, v vsakem primeru pa preden živali dosežejo starost devetih tednov. Na začetku študije morajo biti razlike v teži posameznih živali čim manjše in ne smejo presegati ± 20 % povprečne teže za vsak spol. Če se študija izvaja kot predhodna študija za dolgotrajno študijo kronične toksičnosti, je treba v obeh študijah uporabiti živali istega seva in vira.
1.4.3.2 Število in spol
Za vsako velikost odmerka je treba uporabiti najmanj 20 živali (10 samic in 10 samcev). Če so načrtovane usmrtitve med potekom študije, je treba število povečati za število živali, predvidenih za usmrtitev pred zaključkom študije. Na podlagi že poznanih lastnosti kemikalije ali bližjih analogov je treba razmisliti o vključitvi satelitne skupine desetih živali (pet na spol) v kontrolno skupino in skupino z največjim odmerkom, za opazovanje reverzibilnosti ali obstojnosti morebitnih toksičnih učinkov po tretiranju. Trajanje tega opazovalnega obdobja po tretiranju se določi glede na opažene učinke.
1.4.3.3 Velikost odmerkov
Uporabiti je treba najmanj tri velikosti odmerkov in kontrolo, razen če se izvaja mejni preskus (glej 1.4.3.4). Velikosti odmerkov se lahko določijo na podlagi rezultatov študij s ponavljajočimi se odmerki ali študij za ugotavljanje območja odmerkov, pri tem pa morajo biti upoštevani vsi obstoječi toksikološki in toksikokinetični podatki, ki so na voljo v zvezi s preskusno snovjo ali sorodnimi materiali. Razen kadar zaradi fizikalno-kemijskih lastnosti ali bioloških učinkov preskusne snovi to ni mogoče, je treba najvišjo velikost odmerka izbrati z namenom, da se povzroči toksičnost, vendar pa ne smrt ali hudo trpljenje. Upadajoče zaporedje velikosti odmerkov je treba izbrati z namenom, da se pokažejo vse od odmerka odvisne reakcije, in je odmerek brez opaznih škodljivih učinkov (NOAEL) najnižji izbrani velikosti odmerka. Za upadajoče zaporedje velikosti odmerkov so pogosto optimalni dvakratni do štirikratni intervali, pogosto pa je bolje dodati še dodatno četrto preskusno skupino, kakor uporabiti zelo velike intervale (npr. več kot faktor okrog 6–10) med odmerki.
Kontrolna skupina je netretirana skupina ali kontrolna skupina, tretirana le z nosilcem, če je pri dajanju preskusne snovi ta uporabljen. Razen kar zadeva tretiranje s preskusno snovjo, morajo biti živali v kontrolni skupini obravnavane enako kakor živali v preskusni skupini. Če je uporabljen nosilec, mora kontrolna skupina prejeti volumen nosilca, enak največjemu uporabljenemu volumnu. Če se preskusna snov daje s hrano in se s tem povzroči zmanjšan vnos hrane, lahko uporabimo po parih hranjeno kontrolno skupino, da se razloči zmanjšan vnos hrane zaradi okusa ali toksikoloških sprememb v preskusnem modelu.
Ustrezno je treba upoštevati naslednje lastnosti nosilca in drugih aditivov: učinke na absorpcijo, distribucijo, presnovo ali retencijo preskusne snovi; učinke na kemijske lastnosti preskusne snovi, ki lahko spremenijo njene toksične lastnosti; ter učinke na porabo hrane ali vode ali prehranjenost živali.
1.4.3.4 Mejni preskus
Če preskus pri eni velikosti odmerka, enakovredni najmanj 1 000 mg/kg telesne teže/dan, pri katerem so uporabljeni postopki, opisani za to študijo, ne da opaznih škodljivih učinkov, in če toksičnost ni pričakovana glede na podatke o strukturno sorodnih snoveh, potem popolna študija z uporabo treh velikosti odmerkov morda ne bo potrebna. Mejni preskus se lahko uporabi za vse primere razen, kadar učinki izpostavljenosti pri človeku kažejo na potrebo po uporabi večje velikosti odmerka.
1.5 POSTOPEK
1.5.1 Dajanje odmerkov
Živali dobivajo preskusno snov dnevno sedem dni na teden v obdobju 90 dni. Vsako odstopanje od tega režima odmerjanja, npr. pet dni na teden, je treba utemeljiti. Če se preskusna snov daje z gavažo, jo je treba živali dati v enkratnem odmerku z uporabo želodčne sonde ali primerne intubacijske kanile. Maksimalni volumen tekočine, ki jo je mogoče dati naenkrat, je odvisen od velikosti poskusne živali. Volumen ne sme preseči 1 ml/100 g telesne teže, razen v primeru vodnih raztopin, kjer je dovoljeno uporabiti 2 ml/100 g telesne teže. Razen pri dražečih ali jedkih snoveh, ki bodo pri višjih koncentracijah običajno povzročile močnejše učinke, je treba variabilnost preskusnega volumna s prilagajanjem koncentracije obdržati na kar najnižji ravni, zato da bi zagotovili konstantni volumen pri vseh odmerkih.
Pri snoveh, ki se dajejo s hrano ali pitno vodo, je treba zagotoviti, da količine uporabljene preskusne snovi ne vplivajo na običajno raven vnosa hrane ali porabe vode. Kadar se preskusna snov daje s hrano, se lahko uporabi bodisi konstantna koncentracija v hrani (ppm) bodisi konstantna velikost odmerka glede na telesno težo živali; treba je navesti uporabljeni način. Če snov dajemo z gavažo, je treba odmerke dati vsak dan približno ob istem času in jih ustrezno prilagoditi, da se vzdržuje konstantna velikosti odmerka glede na telesno težo živali. Če se 90-dnevna študija izvaja kot predhodna študija za dolgotrajno študijo kronične toksičnosti, je treba v obeh študijah uporabiti podobno hrano.
1.5.2 Opazovanja
Obdobje opazovanja mora trajati najmanj 90 dni. Živali v satelitni skupini, ki so predvidene za naknadna opazovanja, morajo primerno časovno obdobje ostati netretirane, zato da bi lahko ugotovili, ali so toksični učinki obstojni ali reverzibilni.
Splošna klinična opazovanja je treba opraviti najmanj enkrat na dan, najbolje vsak dan ob istem času, pri čemer se upošteva vrhunec pričakovanih učinkov po odmerjanju. Klinično stanje živali je treba dokumentirati. Najmanj dvakrat dnevno, običajno na začetku in na koncu vsakega dne, je treba živali pregledati, da se odkrijejo znaki obolevnosti in smrtnosti.
Najmanj enkrat pred prvo izpostavljenostjo (zaradi primerjav na istem osebku) in enkrat na teden po tem je treba opraviti natančna klinična opazovanja vseh živali. Ta opazovanja je treba opraviti zunaj domače kletke, najbolje na standardnem mestu in vsakokrat ob podobnem času. Opažanja je treba skrbno dokumentirati, najbolje s pomočjo točkovanj, ki jih laboratorij, ki preskus opravlja, natančno definira. Prizadevati si je treba, da so variacije v pogojih opazovanja minimalne. Opaženi znaki morajo vključevati, vendar ne smejo biti omejeni le na, spremembe na koži, kožuhu, očeh, sluznicah, pojav sekrecije in ekskrecije ter delovanje avtonomnega živčevja (npr. lakrimacija, piloerekcija, velikost zenic, nenormalno dihanje). Dokumentirati je treba tudi spremembe v hoji, drži in reagiranju na ravnanje z živalmi, pa tudi prisotnost kloničnih in toničnih gibov, stereotipov (npr. prekomerno čiščenje, ponavljajoča se krožna premikanja) ali nenormalno vedenje (npr. samomaličenje, zadenjska hoja) (1).
Oftalmološko preiskavo z uporabo oftalmoskopa ali ustrezne enakovredne opreme je treba izvesti pred dajanjem preskusne snovi in na koncu študije, najbolje na vseh živalih, vendar vsaj v skupini z velikim odmerkom in v kontrolni skupini. Če se odkrijejo spremembe na očeh, je treba preiskati celo skupino.
Proti koncu obdobja izpostavljenosti, v nobenem primeru pa ne prej kot v11. tednu, je treba oceniti senzorične reakcije na razne dražljaje (1) (npr. akustične, vizualne in proprioceptivne dražljaje) (2), (3), (4), moč oprijema (5) in motorične aktivnosti (6). Nadaljnje podrobnosti glede možnih postopkov so podane v navedeni literaturi. Uporabiti je možno tudi druge postopke, ki so opisani drugod.
Opazovanja drugih funkcij proti koncu študije se lahko opustijo, če so podatki o funkcionalnih opazovanjih znani že iz drugih študij, v dnevnih kliničnih opazovanjih pa niso bile odkrite nobene funkcionalne pomanjkljivosti.
V izjemnih primerih se opazovanja drugih funkcij lahko opustijo tudi pri skupinah, v katerih so se znaki toksičnosti pokazali v tolikšnem obsegu, da bi znatno vplivali na rezultate funkcionalnega preskusa.
1.5.2.1 Telesna teža in poraba hrane/vode
Vse živali je treba stehtati najmanj enkrat na teden. Meritve porabe hrane je treba opraviti najmanj tedensko. Če se preskusna snov daje s pitno vodo, je treba najmanj tedensko izmeriti tudi porabo vode. Poraba vode se lahko upošteva tudi pri študijah odmerjanja s hrano ali z gavažo, pri katerih se vedenje glede pitja lahko spremeni.
1.5.2.2 Hematologija in klinična biokemija
Vzorce krvi je treba vzeti na imenovanem mestu in jih hraniti, če je to potrebno, v ustreznih pogojih. Na koncu preskusnega obdobja se vzorci odvzamejo tik pred usmrtitvijo ali med samim postopkom usmrtitve živali.
Na koncu preskusnega obdobja in pri morebitnih vmesnih odvzemih vzorcev krvi je treba izvesti naslednje hematološke teste: hematokrit, koncentracijo hemoglobina, število eritrocitov, skupna in diferencialna krvna slika, število trombocitov in meritev časa/potenciala koagulacije krvi.
Klinične biokemične določitve za ugotavljanje glavnih toksičnih učinkov v tkivih in zlasti učinkov na ledvica in jetra, je treba opraviti na vzorcih krvi, pridobljenih od vsake živali tik pred usmrtitvijo ali med samim postopkom usmrtitve (to ne velja za živali, ki so najdene poginjajoče in/ali poginule med postopkom). Podobno kot pri hematoloških preiskavah se vmesno vzorčenje lahko opravi tudi za klinične biokemične preskuse. Priporočeno je, da živali pred jemanjem vzorcev krvi čez noč postimo ( 17 ). Določitve v plazmi ali serumu morajo vključevati natrij, kalij, glukozo, skupni holesterol, sečnino, sečninski dušik v krvi, kreatinin, skupne beljakovine in albumin ter več kot dva encima, ki kažeta na hepatocelularne učinke (kot so alanin-aminotransferaza, aspartat-aminotransferaza, alkalna fosfataza, gamaglutamil-transpeptidaza, in sorbitol-dehidrogenaza). Vključiti je možno tudi meritve dodatnih encimov (jetrnih ali drugega izvora) in žolčnih kislin, ki lahko v nekaterih okoliščinah dajo koristne informacije.
Po izbiri se lahko v zadnjem tednu študije opravijo analize urina, dobljenega z zbiranjem v določenih časovnih obdobjih: videz, volumen, osmolalnost ali specifična teža, pH, beljakovine, glukoza in kri/krvne celice.
Poleg tega bi bilo treba razmisliti o preiskavi splošnih serumskih markerjev poškodb tkiva. Kadar znane lastnosti preskusne snovi lahko vplivajo na ustrezne sorodne presnovne profile ali kadar se pričakujejo takšni vplivi, je treba določiti kalcij, fosfor, vrednost trigliceridov na tešče, specifične hormone, methemoglobin in holinesterazo. Te parametre je treba določiti pri kemikalijah določenih razredov oziroma odvisno od primera.
V glavnem mora biti pristop fleksibilen, odvisno od vrste in od opaženega in/ali pričakovanega učinka dane snovi.
Če predhodni podatki o normalnih vrednostih niso primerni, je treba razmisliti o določitvi hematoloških in kliničnih biokemičnih parametrov pred odmerjanjem preskusne snovi; praviloma ni priporočeno, da se ti podatki določijo pred tretiranjem (7).
1.5.2.3 Obdukcija
Na vseh živalih iz študije je treba opraviti popolno in natančno obdukcijo, ki obsega natančno preiskavo zunanje površine telesa, vseh odprtin, lobanjske, prsne in trebušne votline ter njihove vsebine. Z jeter, ledvic, nadledvičnih žlez, mod, obmodka, maternice, jajčnikov, priželjca, vranice, možganov in srca vseh živali (to ne velja za živali, ki so najdene poginjajoče in/ali usmrčene med postopkom) je treba, kot je ustrezno, odstraniti vsa priraščena tkiva, nato pa, čim prej po disekciji, določiti njihovo mokro težo, zato da se prepreči sušenje.
Naslednja tkiva je treba shraniti v sredstvu, ki je najprimernejše za vrsto tkiva in za predvidene nadaljnje histopatološke preiskave: vse makroskopske lezije, možgane (reprezentativna področja, ki vključujejo velike možgane, male možgane in možgansko deblo/pons), hrbtenjačo (s treh predelov: vratnega, srednjega prsnega in ledvenega), hipofizo, ščitnico, obščitnico, priželjc, požiralnik, slinavke, želodec, tanko in debelo črevo (vključno s Peyerjivimi poloji), jetra, trebušno slinavko, ledvica, nadledvični žlezi, vranico, srce, sapnik in pljuča (vpihnjena s fiksativom, nato vstavljena v ustrezno raztopino), aorto, spolne žleze, maternico, akcesorne spolne organe, mlečne žleze samic, prostato, sečni mehur, žolčnik (miš), bezgavke (najbolje eno bezgavko, ki zajema predel poti odmerjanja, in drugo bezgavko oddaljeno od tega predela, zato da so vključeni tudi sistemski učinki), periferni živec (bedrni ali golenični) najbolje v neposredni bližini mišice, rezino kostnega mozga (in/ali sveži aspirat kostnega mozga), kožo in oči (če so bile med oftalmološkimi preiskavami ugotovljene spremembe). Klinične in druge ugotovitve lahko pokažejo, da bo treba pregledati dodatna tkiva. Shraniti je treba tudi vse organe, za katere je na podlagi znanih lastnosti preskusne snovi verjetno, da bi lahko bili ciljni organi.
1.5.2.4 Histopatologija
V celoti je treba opraviti histopatološke preiskave shranjenih organov in tkiv vseh živali iz kontrolne skupine in skupine z velikim odmerkom. Če so v skupini z velikim odmerkom opažene spremembe, povezane s tretiranjem, je treba te preiskave razširiti tudi na skupine vseh drugih odmerkov.
Preiskati je treba vse makroskopske lezije.
Če je uporabljena satelitna skupina, je treba histopatološke preiskave opraviti na tkivih in organih, na katerih so bili pri tretiranih skupinah vidni učinki.
2. PODATKI IN POROČANJE
2.1 PODATKI
Predložiti je treba podatke za vsako posamezno žival. Nadalje je treba vse podatke prikazati v obliki preglednice, iz katere so za vsako preskusno skupino razvidni naslednji podatki: število živali na začetku preskusa in število živali, med preskusom najdenih mrtvih ali usmrčenih iz humanih razlogov, nato čas smrti oziroma humane usmrtitve, število živali, ki kažejo znake toksičnosti, opis opaženih znakov toksičnosti, vključno s časom, ko so toksični učinki prvikrat nastopili, njihovim trajanjem in jakostjo, število živali s poškodbami, vrsto poškodb in odstotek živali z vsako posamezno vrsto poškodbe.
Če je mogoče, je treba numerične podatke ovrednotiti s primerno splošno sprejeto statistično metodo. Statistične metode in podatke, ki se analizirajo, je treba določiti pri načrtovanju študije.
2.2 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje informacije:
2.2.1 Preskusna snov:
— fizikalno stanje, čistost in fizikalno-kemijske lastnosti,
— identifikacijski podatki,
— nosilec (po potrebi): utemeljitev izbire nosilca, če to ni voda.
2.2.2 Vrsta poskusnih živali:
— uporabljena vrsta in sev,
— število, starost in spol živali,
— izvor, pogoji vzdrževanja, hrana ipd.,
— teža posameznih živali na začetku preskusa.
2.2.3 Preskusni pogoji:
— utemeljitev izbire velikosti odmerka,
— podatki o formulaciji preskusne snovi/priprave hrane, dosežena koncentracija, stabilnost in homogenost pripravka,
— podatki o dajanju preskusne snovi,
— dejanski odmerki (mg/kg telesne teže/dan) in po potrebi faktor za preračunavanje koncentracije preskusne snovi v hrani/pitni vodi (ppm) v dejanski odmerek,
— podatki o kakovosti hrane in vode.
2.2.4 Rezultati:
— telesna teža in spremembe v telesni teži,
— po potrebi podatki o porabi hrane in vode,
— podatki o toksičnem učinkovanju glede na spol in velikost odmerka, vključno z znaki toksičnosti,
— vrsta, resnost in trajanje kliničnih opažanj (ali so reverzibilna ali ne),
— rezultati oftalmoloških preiskav,
— ocena senzorične aktivnosti, moči oprijema in motorične aktivnosti (kadar so na voljo),
— hematološki testi z ustreznimi normalnimi vrednostmi,
— klinični biokemični preskusi z ustreznimi normalnimi vrednostmi,
— terminalna teža telesa, teže organov in razmerje teža organa/teža telesa,
— ugotovitve obdukcije,
— natančen opis vseh histopatoloških ugotovitev,
— podatki o absorpciji, če so na voljo,
— statistična obdelava rezultatov, po potrebi.
Razprava o rezultatih.
Zaključki.
3. LITERATURA
(1) IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document No. 60.
(2) Tupper, D.E., Wallace, R.B. (1980). Utility of the Neurologic Examination in Rats. Acta Neurobiol. Exp., 40, 999–1003.
(3) Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J.Toxicol. Environ. Health, 9, 691–704.
(4) Moser, V.C., Mc Daniel, K.M., Phillips, P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, 267–283.
(5) Meyer O.A., Tilson H.A., Byrd W.C., Riley M.T. (1979). A Method for the Routine Assesment of Fore- and Hind- limb grip Strength of Rats and Mice. Neurobehav. Toxivol., I, 233-236.
(6) Crofton K.M., Howard J.L., Moser V.C., Gill M.W., Reiter L.W., Tilson H.A., MacPhail R.C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, 599–609.
(7) Weingand K., Brown G., Hall R. et al. (1996). „Harmonisation of Animal Clinic Pathology Testing in Toxicity and Safety Studies“, Fundam. & Appl. Toxicol., 29, 198–201.
B.27 PRESKUS SUBKRONIČNE ORALNE TOKSIČNOSTI 90-DNEVNA ŠTUDIJA ORALNE TOKSIČNOSTI S PONAVLJAJOČMI SE ODMERKI NA NEGLODALCIH
1. METODA
Ta metoda za preskus subkronične oralne toksičnosti ustreza metodi OECD TG 409 (1998).
1.1 UVOD
Pri ocenjevanju in vrednotenju toksičnih lastnosti kemikalije se lahko določi subkronična toksičnost z uporabo ponavljajočega odmerjanja, potem ko so že bile pridobljene začetne informacije o toksičnosti s preskusi akutne toksičnosti ali 28-dnevnimi preskusi toksičnosti pri ponavljajočih se odmerkih. Ta 90-dnevna študija daje informacije o možnih nevarnostih za zdravje, za katere je verjetno, da se pojavijo pri ponavljani izpostavljenosti v obdobju naglega razvoja do mlade odrasle dobe. Študija daje informacije o glavnih toksičnih učinkih, pokaže ciljne organe in možnosti kopičenja ter lahko omogoči oceno ravni izpostavljenosti brez opaznih škodljivih učinkov, ki jo je mogoče uporabiti za izbiro velikosti odmerka pri preiskavah kronične toksičnosti in za določitev varnostnih meril za izpostavljenost človeka.
Preskusna metoda omogoča ugotavljanje škodljivih učinkov izpostavljenosti kemikalijam pri neglodalcih in se lahko uporablja le v naslednjih primerih:
— kadar učinki, ugotovljeni v drugih študijah, nakazujejo potrebo po razjasnitvi/karakterizaciji pri drugi, neglodalski vrsti, ali
— kadar toksikokinetične študije kažejo na to, da je uporaba določene vrste neglodalcev najbolj primerna izbira laboratorijske živali ali
— kadar drugi posebni razlogi upravičujejo uporabo neglodalske vrste.
Glej tudi Splošni uvod Del B.
1.2 OPREDELITEV POJMOV
Odmerek: je količina dajane preskusne snovi. Odmerek je izražen kot masa (g, mg), kot masa preskusne snovi na enoto teže poskusne živali (npr. mg/kg) ali kot konstantna koncentracija v hrani (ppm).
Odmerjanje: je splošni izraz, ki obsega odmerek, njegovo pogostnost in trajanje dajanja odmerka.
NOAEL: je kratica za odmerek brez opaznih škodljivih učinkov (No Observed Adverse Effect Level) in je največji odmerek, pri katerem ne opazimo nobenega škodljivega učinka, povezanega z tretiranjem.
1.3 PRINCIP PRESKUSNE METODE
Preskusna snov se v obdobju 90 dni dnevno oralno daje v stopnjevanih odmerkih več skupinam poskusnih živali, in sicer ena velikost odmerka na skupino. V času dajanja snovi natančno opazujemo, ali živali kažejo znake toksičnosti. Na živalih, ki med preskusom poginejo ali so usmrčene, se izvede obdukcija, na koncu preskusa pa se usmrtijo tudi preživele živali in tudi na njih se izvede obdukcija.
1.4 OPIS PRESKUSNE METODE
1.4.1 Izbira živalskih vrst
Neglodalska vrsta, ki se običajno uporablja, je pes, ki mora biti določene pasme; pogosto se uporablja angleški brak. Uporabijo se lahko tudi druge vrste, denimo svinja ali pritlikava svinja. Uporaba primatov se ne priporoča in njihovo uporabo je treba upravičiti. Uporabiti je treba mlade, zdrave živali, v primeru psa je najbolje, da se odmerjanje začne pri 4–6 mesecih, nikakor pa ne pozneje kot pri 9 mesecih starosti. Kadar se študija izvaja kot predhodna študija za dolgotrajno študijo kronične toksičnosti, je treba v obeh študijah uporabiti isto vrsto/pasmo.
1.4.2 Priprava živali
Uporabiti je treba zdrave mlade živali, ki so se prilagodile na laboratorijske razmere in ki predhodno niso bile uporabljene za poskuse. Trajanje aklimatizacije je odvisno od izbrane poskusne vrste in njenega vira. Priporoča se najmanj pet dni za pse ali svinje, gojene za ta namen v domačem laboratoriju, in najmanj dva tedna za iste živali, če so pridobljene iz zunanjega vira. Poznati je treba vrsto, sev, vir, spol, težo in/ali starost poskusnih živali. Živali je treba naključno dodeliti kontrolni in tretirani skupini. Kletke je treba razporediti tako, da so možni učinki zaradi pozicije kletk čim manjši. Vsaki živali je treba dodeliti enkratno identifikacijsko številko.
1.4.3 Priprava odmerkov
Preskusna snov se lahko daje s hrano, pitno vodo, gavažo ali kapsulami. Metoda oralnega dajanja je odvisna od namena študije in od fizikalno-kemijskih lastnosti preskusnega materiala.
Po potrebi se preskusna snov raztopi ali suspendira v primernem nosilcu. Priporočljivo je, da se, kadar koli je mogoče, najprej razmisli o uporabi vodne raztopine/suspenzije, potem o raztopini/emulziji v olju (npr. koruzno olje), nato pa šele o možni raztopini v drugih nosilcih. V primeru nosilcev, ki niso voda, je treba poznati toksične lastnosti takega nosilca. Določiti je treba stabilnost preskusne snovi v pogojih dajanja.
1.5 POSTOPEK
1.5.1 Število in spol živali
Za vsako velikost odmerka je treba uporabiti najmanj osem živali (štiri samice in štiri samce). Če so načrtovane usmrtitve med potekom študije, je treba število povečati za število živali, predvidenih za usmrtitev pred zaključkom študije. Število živali na koncu študije mora biti primerno za smiselno ovrednotenje toksičnih učinkov. Na podlagi že poznanih lastnosti snovi ali bližjih analogov je treba razmisliti o vključitvi satelitne skupine osmih živali (štiri na spol) v kontrolno skupino in skupino z največjim odmerkom, za opazovanje reverzibilnosti ali perzistence morebitnih toksičnih učinkov po tretiranju. Trajanje tega opazovalnega obdobja po tretiranju se določi glede na opažene učinke.
1.5.2 Odmerjanje
Uporabiti je treba najmanj tri velikosti odmerkov in istočasno kontrolo, razen če se izvaja mejni preskus (glej 1.5.3). Velikosti odmerkov se lahko določijo na podlagi rezultatov študij s ponavljajočim odmerjanjem ali študij za ugotavljanje območja odmerkov, pri tem pa morajo biti upoštevani vsi obstoječi toksikološki in toksikokinetični podatki, ki so na voljo v zvezi s preskusno snovjo ali sorodnimi materiali. Razen kadar zaradi fizikalno-kemijskih lastnosti ali bioloških učinkov preskusne snovi to ni mogoče, je treba najvišjo velikost odmerka izbrati z namenom, da se povzroči toksičnost, ne pa smrt ali hudo trpljenje. Upadajoče zaporedje velikosti odmerkov je treba izbrati z namenom, da se pokažejo vse od odmerka odvisne reakcije, in je velikost odmerka brez opaznih škodljivih učinkov (NOAEL) najnižja izbrana velikost odmerka. Za določanje upadajočega zaporedja velikosti odmerkov so pogosto najprimernejši dvakratni do štirikratni intervali, večinoma pa je bolje dodati dodatno, četrto preskusno skupino, kakor uporabiti zelo velike intervale (npr. več kot faktor okrog 6–10) med odmerki.
Kontrolna skupina je netretirana skupina ali skupina, tretirana z nosilcem, če je pri dajanju preskusne snovi ta uporabljen. Razen kar zadeva tretiranje s preskusno snovjo, morajo biti živali v kontrolni skupini obravnavane enako kakor živali v preskusni skupini. Če je uporabljen nosilec, mora kontrolna skupina prejeti volumen nosilca, enak največjemu uporabljenemu volumnu. Če se preskusna snov daje s hrano in se s tem povzroči zmanjšan vnos hrane, lahko uporabimo po parih hranjeno kontrolno skupino, da se razloči zmanjšan vnos hrane zaradi okusa ali toksikoloških sprememb v preskusnem modelu.
Ustrezno je treba upoštevati naslednje lastnosti nosilca in drugih dodatkov: učinke na absorpcijo, distribucijo, presnovo ali retencijo preskusne snovi; učinke na kemijske lastnosti preskusne snovi, ki lahko spremenijo njene toksične lastnosti; ter učinke na porabo hrane ali vode ali prehranjenost živali.
1.5.3 Mejni preskus
Če preskus pri eni velikosti odmerka, enakovredni najmanj 1 000 mg/kg telesne teže/dan, pri katerem so uporabljeni postopki, opisani za to študijo, ne da opaznih škodljivih učinkov in če toksičnost ni pričakovana glede na podatke o strukturno sorodnih snoveh, potem popolna študija z uporabo treh velikosti odmerkov morda ne bo potrebna. Mejni preskus se lahko uporabi v vseh primerih razen, kadar učinki izpostavljenosti pri človeku kažejo na potrebo po uporabi višje velikosti odmerka.
1.5.4 Dajanje odmerkov
Živali dobivajo preskusno snov dnevno sedem dni na teden v obdobju 90 dni. Vsako odstopanje od tega režima odmerjanja, npr. pet dni na teden, je treba utemeljiti. Če se preskusna snov daje z gavažo, jo je treba živali dati v enkratnem odmerku z uporabo želodčne sonde ali primerne intubacijske kanile. Največji volumen tekočine, ki jo je mogoče dati naenkrat, je odvisen od velikosti poskusne živali. Volumen naj bo čim manjši. Razen pri dražečih ali jedkih snoveh, ki bodo pri višjih koncentracijah običajno povzročile močnejše učinke, je treba variabilnost preskusnega volumna s prilagajanjem koncentracije obdržati na kar najnižji ravni, zato da bi zagotovili konstantni volumen pri vseh odmerkih.
Pri snoveh, ki se dajejo s hrano ali pitno vodo, je nujno zagotoviti, da količine uporabljene preskusne snovi ne vplivajo na običajno raven vnosa hrane ali porabe vode. Kadar se preskusna snov daje s hrano, se lahko uporabi bodisi konstantna koncentracija v hrani (ppm) bodisi konstantna velikost odmerka glede na telesno težo; treba je navesti uporabljeni način. Če snov dajemo z gavažo ali kapsulo, je treba odmerke dati vsak dan približno ob istem času in jih ustrezno prilagoditi, da se vzdržuje konstantna velikost odmerka glede na telesno težo živali. Če se 90-dnevna študija izvaja kot predhodna študija za dolgotrajno študijo kronične toksičnosti, je treba v obeh študijah uporabiti podobno hrano.
1.5.5 Opazovanja
Opazovano obdobje mora trajati najmanj 90 dni. Živali v satelitni skupini, ki so predvidene za naknadna opazovanja, se za primerno časovno obdobje ne tretira, zato da bi lahko ugotovili, ali so toksični učinki obstojni ali reverzibilni.
Splošna klinična opazovanja je treba opraviti najmanj enkrat na dan, najbolje vsak dan ob istem času, pri čemer se upošteva vrhunec pričakovanih učinkov po odmerjanju. Klinično stanje živali je treba dokumentirati. Najmanj dvakrat dnevno, običajno na začetku in na koncu vsakega dne, je treba živali pregledati, da se odkrijejo znaki obolevnosti in smrtnosti.
Najmanj enkrat pred prvo izpostavljenostjo (zaradi primerjav na istem osebku) in enkrat na teden po tem je treba opraviti natančna klinična opazovanja vseh živali. Ta opazovanja je treba, če je mogoče, opraviti zunaj domače kletke, na standardnem mestu in vsakokrat ob podobnem času. Prizadevati si je treba, da so variacije v pogojih opazovanja minimalne. Znake toksičnosti je treba skrbno dokumentirati, vključno s časom, ko so nastopili, njihovo jakostjo in trajanjem. Opazovanja morajo obsegati, vendar ne smejo biti omejena na, spremembe na koži, kožuhu, očeh, sluznicah, pojav sekrecije in ekskrecije ter delovanje avtonomnega živčevja (npr. lakrimacija, piloerekcija, velikost zenic, nenormalno dihanje). Dokumentirati je treba tudi spremembe v hoji, drži in odzivu na ravnanje z živalmi, pa tudi prisotnost zgibkov, stereotipnega vedenja (npr. prekomerno čiščenje, ponavljajoča se krožna premikanja) ali vsako nenormalno vedenje.
Oftalmološko preiskavo z uporabo oftalmoskopa ali ustrezne enakovredne opreme je treba izvesti pred dajanjem preskusne snovi in na koncu študije, najbolje na vseh živalih, vendar vsaj v skupini z velikim odmerkom in v kontrolni skupini. Če se odkrijejo spremembe na očeh, povezane z tretiranjem, je treba preiskati celo skupino.
1.5.5.1 Telesna teža in poraba hrane/vode
Vse živali je treba stehtati najmanj enkrat na teden. Meritve porabe hrane je treba opraviti vsaj tedensko. Če se preskusna snov daje s pitno vodo, je treba najmanj enkrat tedensko izmeriti tudi porabo vode. Poraba vode se lahko upošteva tudi pri študijah odmerjanja s hrano ali z gavažo, pri katerih se vedenje glede pitja lahko spremeni.
1.5.5.2 Hematologija in klinična biokemija
Vzorce krvi je treba vzeti na imenovanem mestu in hraniti, kadar je primerno, v ustreznih pogojih. Na koncu preskusnega obdobja se vzorci odvzamejo tik pred usmrtitvijo ali med samim postopkom usmrtitve živali.
Na začetku študije, nato bodisi v mesečnih intervalih bodisi na sredi preskusnega obdobja in na koncu preskusnega obdobja je treba opraviti hematološke preiskave, vključujoč krvno sliko levkocitov, število trombocitov in meritev časa/potenciala koagulacije krvi, protrombinski čas ali tromboplastinski čas.
Klinične biokemične določitve za ugotavljanje glavnih toksičnih učinkov v tkivih, zlasti učinkov na ledvica in jetra, je treba opraviti na vzorcih krvi, pridobljenih od vseh živali na začetku študije, nato bodisi v mesečnih intervalih bodisi na sredi preskusnega obdobja in na koncu preskusnega obdobja. Testna področja, o katerih je treba razmisliti, so elektrolitsko ravnotežje, presnova ogljikovodikov ter delovanje jeter in ledvic. Na izbor določenih testov bodo vplivala opažanja glede načina delovanja preskusne snovi. Pred odvzemom krvi je treba živali postiti za obdobje, primerno za posamezno vrsto. Predlagane določitve vključujejo kalcij, fosfor, klorid, natrij, kalij, glukozo na tešče, alanin-aminotransferazo, aspartat-aminotransferazo, ornitin-dekarboksilazo, gamaglutamil-transpeptidazo, sečninski dušik, albumin, kreatinin v krvi, skupni bilirubin in skupne serumske beljakovine.
Urinsko analizo je treba opraviti vsaj na začetku študije, nato na sredi preskusnega obdobja in še na koncu preskusnega obdobja, in sicer na urinu, ki je zbran v določenih časovnih obdobjih. Meritve pri urinski analizi naj vključujejo videz, volumen, osmolalnost ali specifično težo, pH, beljakovine, glukozo in kri/krvne celice. Če je treba preiskavo opaženih učinkov razširiti, se lahko uporabijo dodatni parametri.
Poleg tega bi bilo treba razmisliti o preiskavi splošnih markerjev poškodb tkiva. Za ustrezno toksikološko ovrednotenje bo morebiti treba določiti tudi lipide, hormone, razmerje kisline/baze, methemoglobin in inhibicijo holinesteraze. Če je treba opazovanje opaženih učinkov razširiti, se lahko opravijo dodatne klinične biokemijske analize. Te je treba določiti pri kemikalijah določenih razredov oziroma odvisno od primera.
V glavnem mora biti pristop fleksibilen, odvisno od vrste in od opaženega in/ali pričakovanega učinka dane snovi.
1.5.5.3 Obdukcija
Na vseh živalih iz študije je treba opraviti popolno in natančno obdukcijo, ki obsega skrbno preiskavo zunanje površine telesa, vseh odprtin, lobanjske, prsne in trebušne votline ter njihove vsebine. Z jeter z žolčnikom, ledvic, nadledvičnih žlez, mod, obmodka, jajčnikov, maternice, ščitnice (z obščitnicami), priželjca, vranice, možganov in srca vseh živali (to ne velja za živali, ki so najdene poginjajoče in/ali usmrčene med postopkom) je treba ustrezno očistiti vsa priraščena tkiva, nato pa določiti njihovo mokro težo, čim prej po disekciji, zato da se prepreči sušenje.
Naslednja tkiva je treba shraniti v sredstvu, ki je najprimernejše za vrsto tkiva in za predvidene nadaljnje histopatološke preiskave: vse makroskopske poškodbe, možgane (reprezentativna področja, ki vključujejo velike možgane, male možgane in možgansko deblo/pons), hrbtenjačo (s treh predelov: vratnega, srednjega prsnega in ledvenega), hipofizo, oči, ščitnico, obščitnico, priželjc, požiralnik, slinavke, želodec, tanko in debelo črevo (vključno s Peyerjivimi poloji), jetra, žolčnik, trebušno slinavko, ledvica, nadledvični žlezi, vranico, srce, sapnik in pljuča, aorto, spolne žleze, maternico, pomožne spolne organe, mlečne žleze samic, prostato, sečni mehur, bezgavke (priporočljivo, eno bezgavko, ki zajema predel poti odmerjanja preskusne snovi, in drugo bezgavko oddaljeno od tega predela, zato da so vključeni tudi sistemski učinki), periferni živec (ishiadični ali tibialni) najbolje v neposredni bližini mišice, rezino kostnega mozga (in/ali sveži aspirat kostnega mozga) in kožo. Klinične in druge ugotovitve lahko pokažejo, da bo treba pregledati dodatna tkiva. Shraniti je treba tudi vse organe, za katere je na podlagi znanih lastnosti preskusne snovi verjetno, da so ciljni organi.
1.5.5.4 Histopatologija
V celoti je treba opraviti histopatološke preiskave shranjenih organov in tkiv vsaj pri vseh živalih iz kontrolne skupine in skupine z velikim odmerkom. Če so v skupini z velikim odmerkom opažene spremembe, povezane s tretiranjem, je treba te preiskave razširiti tudi na skupine vseh drugih odmerkov.
Preiskati je treba vse makroskopske poškodbe.
Če je uporabljena satelitna skupina, je treba histopatološke preiskave opraviti na tkivih in organih, na katerih so bili vidni učinki v tretiranih skupinah.
2. PODATKI IN POROČANJE
2.1 PODATKI
Predložiti je treba podatke za vsako posamezno žival. Nadalje je treba vse podatke prikazati v obliki preglednice, iz katere so za vsako preskusno skupino razvidni naslednji podatki: število živali na začetku preskusa in število živali, med preskusom najdenih mrtvih ali usmrčenih iz humanih razlogov, čas smrti oziroma usmrtitve iz humanih razlogov, število živali, ki kažejo znake toksičnosti, opis opaženih znakov toksičnosti, vključno s časom, ko so toksični učinki prvikrat nastopili, njihovim trajanjem in jakostjo, število živali s poškodbami, vrsta poškodb in odstotek živali z vsako posamezno vrsto poškodbe.
Če je mogoče, je treba numerične podatke ovrednotiti s primerno splošno sprejeto statistično metodo. Statistične metode in podatke, ki se analizirajo, je treba določiti pri načrtovanju študije.
2.2 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje informacije:
2.2.1 Preskusna snov:
— fizikalno stanje, čistost in fizikalno-kemijske lastnosti,
— identifikacijski podatki,
— nosilec (po potrebi): utemeljitev izbire nosilca, če to ni voda.
2.2.2 Vrsta poskusnih živali:
— uporabljena vrsta in sev,
— število, starost in spol živali,
— vir, pogoji vzdrževanja, hrana ipd.,
— teža posameznih živali na začetku preskusa.
2.2.3 Pogoji preskusa:
— utemeljitev izbire velikosti odmerka,
— podatki o formulaciji preskusne snovi/priprave hrane, dosežena koncentracija, stabilnost in homogenost pripravka,
— podatki o dajanju preskusne snovi,
— dejanski odmerki (mg/kg telesne teže/dan) in po potrebi faktor za preračunavanje koncentracije preskusne snovi v hrani/pitni vodi (ppm) v dejanski odmerek,
— podatki o kakovosti hrane in vode.
2.2.4 Rezultati:
— telesna teža/spremembe v telesni teži,
— po potrebi podatki o porabi hrane in porabi vode,
— podatki o toksičnem učinkovanju glede na spol in velikost odmerka, vključno z znaki toksičnosti,
— vrsta, resnost in trajanje kliničnih opažanj (ali so reverzibilna ali ne),
— oftalmološka preiskava,
— hematološki testi z ustreznimi normalnimi vrednostmi,
— klinični biokemični preskusi z ustreznimi normalnimi vrednostmi,
— terminalna teža telesa, teže organov in razmerje med težo organa in telesno težo,
— ugotovitve obdukcije,
— natančen opis vseh histopatoloških ugotovitev,
— podatki o absorpciji, če so na voljo,
— statistična obdelava rezultatov, po potrebi.
Razprava o rezultatih.
Zaključki.
B.28 ŠTUDIJA SUBKRONIČNE STRUPENOSTI V STIKU S KOŽO 90-DNEVNA ŠTUDIJA S PONOVLJENIM DERMALNIM ODMERKOM NA GLODALCIH
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Preskusna snov se daje dnevno na kožo v graduiranih odmerkih nekaj skupinam preskusnih živali, po en odmerek na skupino v obdobju 90 dni. V obdobju dajanja se živali opazujejo dnevno, da bi se odkrilo znake strupenosti. Na živalih, ki med preskusom poginejo, se opravi nekropsija, po zaključku preskusa pa se nekropsija opravi tudi na preživelih živalih.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
1.6.1
Živali se vzdržujejo v preskusnih nastanitvenih in prehranjevalnih pogojih najmanj pet dni pred preskusom. Pred preskusom se naključno izberejo zdrave mlade živali in se razporedijo v preskusne ter kontrolne skupine. Pred samim preskusom se na hrbtnem predelu telesa preskusnih živali ostriže krzno. Lahko se ga obrije, vendar je treba to opraviti približno 24 ur pred preskusom. Živalim je običajno treba krzno ponovno ostriči ali obriti približno v tedenskih časovnih presledkih. Med striženjem ali britjem krzna je treba paziti, da se ne odrgne kožo. Za nanos preskusne snovi je treba očistiti najmanj 10 % telesne površine. Pri odločitvi o področju, ki ga je treba očistiti, in velikosti pokrivala, je treba upoštevati maso živali. Pri preskušanju trdnih snovi, ki jih je, kadar je primerno, mogoče uprašiti, je treba preskusno snov dovolj navlažiti z vodo ali, kadar je potrebno, ustreznim nosilcem, da se zagotovi dober stik s kožo. Tekoče preskusne snovi se ponavadi uporabljajo nerazredčene. Snovi se nanaša vsak dan pet do sedem dni na teden.
1.6.2 Preskusni pogoji
1.6.2.1
Uporabijo se odrasla podgana, kunec ali morski prašiček. Mogoče je uporabiti tudi druge vrste, vendar je njihovo uporabo treba utemeljiti. Na začetku preskusa nihanje v teži ne sme presegati ± 20 % srednje vrednosti. Kadar se subkronična dermalna študija izvaja kot predhodnica dolgodobne študije, je treba v obeh študijah uporabiti isto vrsto in sev.
1.6.2.2
Za vsako velikost odmerka je treba uporabiti najmanj 20 živali (10 samic in 10 samcev) z zdravo kožo. Samice naj bodo nuliparne in nebreje. Če so načrtovana vmesna žrtvovanja, je treba število povečati za število živali, ki naj bi bile žrtvovane še pred zaključkom študije. Poleg tega se lahko satelitsko skupino 20 živali (10 živali na spol) tretira z odmerkom visoke velikosti 90 dni in na njih v 28 dneh po tretiranju opazuje povratnost, obstojnost ali zapozneli pojav strupenih učinkov.
1.6.2.3
Zahtevane so najmanj tri velikosti odmerka s kontrolno skupino ali kontrolno skupino nosilca, v kolikor je uporabljen nosilec. Čas izpostavljenosti naj traja najmanj šest ur na dan. Preskusno snov je treba nanesti vsak dan približno ob enakem času, količino nanesene snovi pa prilagajati v časovnih presledkih (tedensko ali dvotedensko), da se ohrani konstantna velikost odmerka glede na telesno maso živali. Razen tretiranja s preskusno snovjo je treba z živalmi v kontrolni skupini ravnati na popolnoma enak način kot z živalmi iz preskusne skupine. Kadar se za lažje dajanje odmerkov uporabi nosilec, ga je treba na kontrolni skupini odmeriti na enak način kot na preskusnih skupinah, odmerek nosilca pa naj bo enak, kot pri preskusni skupini z najvišjo velikostjo odmerka. Najvišja velikost odmerka bi morala povzročiti strupene učinke, vendar sme povzročiti malo oziroma nobenega smrtnega primera. Najnižja velikost odmerka ne sme povzročiti nikakršnih znakov strupenosti. Kadar je na razpolago uporabna ocena izpostavljenost človeka, mora najnižja velikost to presegati. V najboljšem primeru mora srednja velikost odmerka povzročiti minimalne opazne strupene učinke. Če je uporabljena več kot ena srednja velikost odmerka, je treba te velikosti razporediti tako, da dobimo stopnjevanje strupenih učinkov. Za pomenljivo oceno rezultatov mora biti pojav smrtnih primerov v skupinah z nizkim in srednjim odmerkom ter v kontrolnih skupinah nizek.
Če nanos preskusne snovi povzroči hudo vnetje kože, je treba koncentracijo zmanjšati, kar ima lahko za posledico zmanjšanje ali odsotnost strupenih učinkov pri visoki velikosti odmerka. Če je koža hudo poškodovana, bo morda treba zaključiti študijo in začeti novo študijo z nižjimi koncentracijami.
1.6.3
Če predhodna študija pri velikosti odmerka 1 000 mg/kilogram, ali pri višji velikosti odmerka, povezani z možno izpostavljenostjo človeka, kadar je ta poznana, ne pokaže nikakršnih znakov strupenih učinkov, nadaljnji preskusi verjetno ne bodo potrebni.
1.6.4
Preskusne živali je treba dnevno opazovati, da bi se odkrili znaki strupenosti. Zabeležiti je treba čas smrti in čas, ko se znaki strupenosti pojavijo in izginejo.
1.6.5
Živali je treba hraniti v kletkah vsako posebej. Najprimerneje je, da se živalim odmerek preskusne snovi daje sedem dni na teden, v obdobju 90 dni.
Živali iz katere koli satelitske skupine, za katero so načrtovana nadaljnja opazovanja, je treba ohranjati še nadaljnjih 28 dni brez tretiranja, da bi se odkrilo okrevanje ali obstojnost strupenih učinkov. Čas izpostavljenosti naj bo šest ur na dan.
Preskusno snov je treba nanesti enakomerno na območje, ki znaša približno 10 % celotne telesne površine. V primeru zelo strupene snovi je lahko površina pokritosti manjša, vendar mora kljub temu biti v celoti pokrita s čim tanjšo in čim bolj enakomerno plastjo.
V času izpostavljenosti se preskusna snov ohranja v stiku s kožo s porozno obvezo iz gaze in lepilnim trakom, ki ne draži kože. Preskusno območje je treba še dodatno pokriti na primeren način, da se obvezo iz gaze in preskusno snov obdrži na mestu ter zagotovi, da živali ne morejo zaužiti preskusne snovi. Za preprečitev zaužitja preskusne snovi je mogoče uporabiti opremo, ki omejuje gibanje živali, vendar pa popolna imobilizacija ni priporočljiva metoda.
Na koncu obdobja izpostavljenosti se, kjer je mogoče, odstrani ostanke preskusne snovi z vodo ali s kakšno drugo ustrezno metodo čiščenja kože.
Vse živali je treba dnevno opazovati in beležiti znake strupenosti vključno s časom njihovega nastopa, stopnjo in trajanjem. Opazovanje v kletkah naj vključuje opazovanje sprememb na koži in krznu, v očeh in sluznicah ter v dihalnem in krvožilnem sistemu, avtonomnem in osrednjem živčnem sistemu, somatomotorični aktivnosti ter vedenjskem vzorcu. Tedensko je treba meriti porabo hrane in živali vsak teden stehtati. Redno opazovanje živali je potrebno, da se zagotovi, da med preskusom ne pride do izgube živali zaradi kanibalizma, avtolize tkiv ali napačne postavitve. Na koncu preskusnega obdobja se na vseh preživelih živalih iz nesatelitske preskusne skupine opravi nekropsija. Umirajoče živali je treba odstraniti in opraviti nekropsijo takoj, ko je to opaženo.
Naslednji pregledi se običajno opravijo na vseh živalih, vključno s kontrolnimi skupinami:
(a) Oftalmološki pregled z uporabo oftalmoskopa ali podobne ustrezne opreme je treba opraviti pred dajanjem preskusne snovi in ob zaključku študije, po možnosti na vseh živalih, najmanj pa na skupinah z visokim odmerkom in kontrolnih skupinah. Če se odkrijejo spremembe v očeh, je treba pregledati vse živali.
(b) Hematološko preiskavo, vključno s hematokritom, koncentracijo hemoglobina, številom eritrocitov, skupnim in diferencialnim številom levkocitov ter merjenjem zmožnosti koagulacije, kot je čas koagulacije, protrombinski čas, tromboplastinski čas ali število trombocitov, je treba opraviti na koncu preskusnega obdobja.
(c) Klinično biokemijsko določitev na krvi je treba izvesti na koncu preskusnega obdobja. Preskusna področja, ki štejejo za ustrezna vsem študijam, so ravnovesje elektrolitov, presnova ogljikovih hidratov, delovanje jeter in ledvic. Izbor določenih preskusov bo odvisen od opazovanj načina delovanja snovi. Predlagane določitve so meritve kalcija, fosforja, klora, natrija, kalija, glukoze na tešče (z obdobjem teščosti, ustreznim za posamezno vrsto), serumske glutaminske piruvične transaminaze ( 18 ), serumske glutaminske oksaloacetat transaminaze ( 19 ), ornitin-dekarboksilaze, gama-glutamil-transpeptidaze, sečnine, albumina, kreatinina v krvi, skupnega bilirubina in skupnih serumskih proteinov. Druge določitve, ki bi lahko bile potrebne za ustrezno oceno strupenosti vključujejo analize lipidov, hormonov, kislinsko-bazično ravnovesje, methemoglobina in aktivnost holinesteraze. Po potrebi je mogoče opraviti dodatne klinično biokemijske preiskave, da bi se razširilo raziskavo opaženih učinkov.
(d) Analize urina ni treba opravljati rutinsko, ampak samo takrat, kadar gre za indikacije, ki temeljijo na pričakovani ali opaženi strupenosti.
Če so predhodni podatki normalnih vrednosti neustrezni, je treba pozornost usmeriti na hematološke in klinično biokemijske parametre pred začetkom dajanja odmerkov.
1.6.6
Na vseh živalih je treba opraviti temeljito makroskopsko nekropsijo, ki vključujejo pregled zunanje površine telesa, vseh telesnih odprtin ter lobanjske, prsne in trebušne votline ter njihove vsebine. Jetra, ledvice, nadledvične žleze in moda je treba čim prej po seciranju, še vlažne, stehtati, da se izognemo izsušitvi. Naslednje organe in tkiva je treba shraniti v ustreznem mediju za morebitne nadaljnje histopatološke preiskave: vse vidne lezije, možgane – vključno z deli podaljšane hrbtenjače/mosta, skorjo malih možganov in možgansko skorjo, hipofizo, ščitnico/obščitnico in tkivo priželjca, (sapnik), pljuča, srce, aorto, žleze slinavke, jetra, vranico, ledvice, nadledvične žleze, trebušno slinavko, spolne žleze, maternico, pomožne spolne organe, žolčnik (če je prisoten), požiralnik, želodec, dvanajsternik, zgornje tanko črevo, spodnje tanko črevo, slepo črevo, debelo črevo, danko, sečni mehur, reprezentativni limfni vozel, (mlečno žlezo samic), (stegensko mišičevje), periferni živec, (oči), (prsnico s kostnim mozgom), (stegnenica, vključno s površino sklepa), (hrbtenjačo na treh ravneh – vratni, prsni in ledveni) in (eksorbitalne žlezne solznice). Tkiva, navedena v oklepajih, je treba pregledati le, če kažejo znake strupenosti ali če gre za indikacijo, da so to ciljni organi.
1.6.7
(a) Popolno histopatološko preiskavo je treba opraviti na normalni in tretirani koži ter organih in tkivih živali v kontrolni skupini in skupini z visokim odmerkom.
(b) Pregledati je treba vse vidne lezije.
(c) Pregledati je treba ciljne organe v skupinah z drugimi odmerki.
(d) Kadar so uporabljene podgane, je treba na pljučih živali iz skupin z nižjimi in srednje velikimi odmerki opraviti histopatološko preiskavo, da bi se odkrili znaki okužbe, saj se tako lahko ustrezno oceni zdravstveno stanje živali. Nadaljnje histopatološke preiskave na živalih v teh skupinah verjetno ne bodo potrebne na rutinski osnovi, vedno pa se morajo opraviti na organih, ki pokažejo znake lezij v skupini z visokim odmerkom.
(e) Kadar je uporabljena satelitska skupina, je treba opraviti histopatološko preiskavo na tkivih in organih, na katerih so v preskusnih skupinah opazni učinki.
2. PODATKI
Podatki se povzamejo v obliki tabele, iz katere je za vsako preskusno skupino razvidno število živali na začetku preskusa, število živali, pri katerih so opažene lezije, tipe lezij, in odstotek živali, ki kažejo določen tip lezije. Rezultate je treba oceniti z ustrezno statistično metodo. Uporabiti je mogoče katero koli priznano statistično metodo.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— vrsta, sev, vir, okoljski pogoji, hrana,
— preskusni pogoji,
— velikosti odmerka (vključno z nosilcem, če je ta uporabljen) in koncentracije,
— podatki o odzivu strupenosti po spolu in odmerku,
— če je možno, velikost odmerka, pri kateri ni opaženega učinka,
— čas smrti med študijo ali preživetje živali do zaključka,
— opis strupenih ali drugih učinkov,
— čas opazovanja vsakega znaka abnormalnosti in njegov nadaljnji potek,
— podatki o hrani in telesni masi,
— oftalmološke ugotovitve,
— opravljeni hematološki preskusi in vsi rezultati,
— opravljeni klinični biokemijski preskusi in vsi rezultati (vključno z rezultati vsake analize urina),
— ugotovitve nekropsije,
— podroben opis vseh histopatoloških ugotovitev,
— statistična obdelava rezultatov, kadar je to mogoče,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.29 ŠTUDIJA SUBKRONIČNE INHALACIJSKE STRUPENOSTI 90-DNEVNA ŠTUDIJA S PONOVLJENIM INHALACIJSKIM ODMERKOM NA GLODALCIH
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Več skupin preskusnih živali se za določeno obdobje dnevno izpostavi preskusni snovi v graduiranih koncentracijah, pri čemer se uporablja ena koncentracija na skupino v obdobju 90 dni. Kadar je uporabljen nosilec, ki pomaga sproščati ustrezno koncentracijo preskusne snovi v ozračje, je treba uporabiti kontrolno skupino za nosilec. V obdobju dajanja se živali opazujejo dnevno, da bi se odkrilo znake strupenosti. Na živalih, ki med preskusom poginejo, se opravi nekropsija, po zaključku preskusa pa se nekropsija opravi tudi na preživelih živalih.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
1.6.1
Živali se vzdržujejo v preskusnih nastanitvenih in prehranjevalnih pogojih najmanj pet dni pred preskusom. Pred preskusom se naključno izberejo zdrave mlade živali in se razporedijo v preskusne ter kontrolne skupine. Kadar je potrebno, se lahko preskusni snovi doda ustrezni nosilec, ki pomaga sproščati ustrezno koncentracijo snovi v ozračje. Če je za lažje odmerjanje uporabljen nosilec ali drugi dodatki, se je treba prepričati, da le-ti ne povzročajo strupenih učinkov. Če je ustrezno, se lahko uporabi pretekle podatke.
1.6.2
1.6.2.1
Če ni kontraindikacij, je priporočena vrsta podgana. Uporabiti je treba splošno uporabljene laboratorijske seve mladih zdravih živali. Na začetku študije nihanje v teži uporabljenih živali ne sme presegati ± 20 % ustrezne srednje vrednosti. Kadar se subkronična inhalacijska študija izvaja kot predhodnica dolgodobni študiji, je treba v obeh študijah uporabiti isto vrsto in sev.
1.6.2.2
Za vsako koncentracijo izpostavljenosti je treba uporabiti najmanj 20 živali (10 samic in 10 samcev). Samice naj bodo nuliparne in nebreje. Če so načrtovana vmesna žrtvovanja, je treba število povečati za število živali, ki naj bi bile žrtvovane še pred zaključkom študije. Poleg tega se lahko satelitsko skupino 20 živali (10 živali na spol) tretira z odmerkom visoke velikosti 90 dni in na njih v 28 dneh po tretiranju opazuje povratnost, obstojnost ali zapozneli pojav strupenih učinkov.
1.6.2.3
Zahtevane so najmanj tri koncentracije, s kontrolno skupino ali kontrolno skupino nosilca (ki ustreza koncentraciji nosilca pri najvišji koncentraciji), v kolikor je nosilec uporabljen. Razen tretiranja s preskusno snovjo je treba z živalmi v kontrolni skupini ravnati na popolnoma enak način kot z živalmi iz preskusne skupine. Najvišja koncentracija bi morala povzročiti strupene učinke, vendar malo oziroma nobenega smrtnega primera. Kadar je na voljo uporabna ocena izpostavljenosti človeka, mora najnižja velikost to presegati. V najboljšem primeru mora srednja koncentracija povzroči minimalne opazne strupene učinke. Če je uporabljena več kot ena srednja koncentracija, je treba te koncentracije razporediti tako, da dobimo stopnjevanje strupenih učinkov. Za pomenljivo oceno rezultatov mora biti pojav smrtnih primerov v skupinah z nizko in srednjo koncentracijo ter v kontrolnih skupinah nizek.
1.6.2.4
Dnevna izpostavljenost naj traja šest ur po uravnoteženju koncentracij v komorah. Za izpolnitev posebnih zahtev je mogoče čas izpostavljenosti podaljšati ali skrajšati.
1.6.2.5
Preskus se na živalih izvede v napravah za inhalacijo, ki so oblikovane tako, da ohranijo dinamičen pretok zraka z najmanj 12 spremembami zraka na uro, s čimer se zagotovi ustrezna vsebnost kisika in enakomerno porazdeljeno ozračje izpostavljenosti. Kadar je uporabljena komora, naj bo oblikovana tako, da bo natrpanost s preskusnimi živalmi minimalna, njihova izpostavljenost z inhalacijo preskusne snovi pa maksimalna. Na splošno velja, da naj za zagotovitev stabilnosti ozračja v komori skupna količina preskusnih živali ne presega 5 % prostornine preskusne komore. Uporabiti je mogoče komore, v katerih so živali izpostavljene samo z usti in nosom, z glavo ali s celotnim telesom; pri prvih dveh je vnos preskusne snovi po drugih poteh minimalno.
1.6.2.6
Preskusne živali je treba dnevno opazovati, da bi se odkrili znaki strupenosti, med celotnim obdobjem tretiranja in okrevanja. Zabeležiti je treba čas smrti in čas, ko se znaki strupenosti pojavijo in izginejo.
1.6.3
Živali se izpostavijo preskusni snovi dnevno, pet do sedem dni na teden, za obdobje 90 dni. Živali iz katere koli satelitske skupine, za katero so načrtovana nadaljnja opazovanja, je treba ohranjati še nadaljnjih 28 dni brez tretiranja, da bi se odkrilo okrevanje ali obstojnost strupenih učinkov. Temperaturo, pri kateri se preskus izvaja, je treba ohranjati na 22 ± 3 oC. Relativno vlažnost je najprimerneje ohranjati med 30 % in 70 %, toda v nekaterih primerih (npr. preskušanje aerosolov) to ni izvedljivo. Med izpostavljenostjo je treba odvzeti hrano in vodo.
Uporabiti je treba dinamični inhalacijski sistem z ustreznim analitskim kontrolnim sistemom koncentracije. Priporočljiv je poskusni preskus, da se določijo ustrezne koncentracije izpostavljenosti. Dotok zraka je treba prilagoditi, da bi se zagotovilo homogene pogoje po vsej komori. Sistem naj zagotovi kar najhitrejšo vzpostavitev stabilnih pogojev izpostavljenosti.
Meritve ali spremljanje naj zajema:
(a) stopnjo pretoka zraka (neprekinjeno);
(b) dejansko koncentracijo preskusne snovi, merjeno v dihalnem območju. Med vsakodnevno izpostavljenostjo naj koncentracija ne odstopa za več kot ± 15 % od srednje vrednosti. Vendar pa v primeru prahu in aerosolov ta raven kontrole ni nujno dosegljiva, zato je sprejemljiv širši razpon. V obdobju celotnega trajanja študije naj bodo vsakodnevne koncentracije, kolikor je to mogoče, konstantne. Med razvijanjem sistema sproščanja, je treba opraviti analizo velikosti delcev, da bi se določila stabilnost koncentracij aerosola. Med izpostavljenostjo se, kadar je to potrebno, izvede analiza za ugotovitev doslednosti porazdelitve velikosti delcev;
(c) temperaturo in vlažnost;
(d) med izpostavljenostjo in po njej potekajo opazovanja in se sistematično beležijo; podatke je treba beležiti za vsako posamezno žival posebej. Vse živali je treba dnevno opazovati in beležiti znake strupenosti vključno s časom njihovega nastopa, stopnjo in trajanjem. Opazovanja v kletkah naj vključujejo: spremembe na koži in krznu, v očeh, sluznicah, dihalnem in krvožilnem sistemu, avtonomnem in osrednjem živčnem sistemu, somatomotorični aktivnosti ter vedenjskem vzorcu. Tedensko je treba meriti porabo hrane in živali vsak teden stehtati. Redno opazovanje živali je potrebno da se zagotovi, da med študijo ne pride do izgube živali zaradi kanibalizma, avtolize tkiv ali napačne postavitve. Na koncu obdobja izpostavljenosti, se na vseh preživelih živalih opravi nekropsija. Umirajoče živali je treba odstraniti in opraviti nekropsijo takoj, ko je to opaženo.
Naslednji pregledi se običajno opravijo na vseh živalih, vključno s kontrolnimi skupinami:
(a) oftalmološki pregled z uporabo oftalmoskopa ali podobne ustrezne opreme je treba opraviti pred izpostavitvijo preskusni snovi in ob zaključku študije, po možnosti na vseh živalih, najmanj pa na skupinah z visokim odmerkom in kontrolnih skupinah. Če se odkrijejo spremembe v očeh, je treba pregledati vse živali;
(b) hematološko preiskavo, vključno s hematokritom, koncentracijo hemoglobina, številom eritrocitov, skupnim in diferencialnim številom levkocitov ter merjenjem zmožnosti koagulacije, kot je čas koagulacije, protrombinski čas, tromboplastinski čas ali število trombocitov, je treba opraviti na koncu preskusnega obdobja;
(c) klinično biokemijsko določitev na krvi je treba izvesti na koncu preskusnega obdobja. Preskusna področja, ki štejejo za ustrezna vsem študijam, so ravnovesje elektrolitov, presnova ogljikovih hidratov, delovanje jeter in ledvic. Izbor določenih preskusov bo odvisen od opazovanj načina delovanja snovi. Predlagane določitve so meritve kalcija, fosforja, klora, natrija, kalija, glukoze na tešče (z obdobjem teščosti, ustreznim za posamezno vrsto), serumske glutaminske piruvične transaminaze (19) , serumske glutaminske oksaloacetat transaminaze (19) , ornitin-dekarboksilaze, gama-glutamil-transpeptidaze, sečnine, albumina, kreatinina v krvi, skupnega bilirubina in skupnih serumskih proteinov. Druge določitve, ki bi lahko bile potrebne za ustrezno oceno strupenosti vključujejo analize lipidov, hormonov, ravnovesja kislinsko-bazično ravnovesje, methemoglobina in aktivnost holinesteraze. Po potrebi je mogoče opraviti dodatne klinično biokemijske preiskave, da bi se razširilo raziskavo opaženih učinkov;
(d) analize urina ni treba opravljati rutinsko, ampak samo takrat, kadar gre za indikacijo, ki temelji na pričakovani ali opaženi strupenosti.
Če so predhodni podatki normalnih vrednosti neustrezni, je treba pozornost usmeriti na hematološke in klinično biokemijske parametre pred začetkom dajanja odmerkov.
1.6.4
Na vseh živalih je treba opraviti popolno makroskopsko nekropsijo, ki vključuje pregled zunanje površine telesa, vseh telesnih odprtin ter lobanjske, prsne in trebušne votline ter njihove vsebine. Jetra, ledvice, nadledvične žleze, ščitnica (in obščitnice) in moda je treba čim prej po seciranju, še vlažne, stehtati, da se izognemo izsušitvi. Naslednje organe in tkiva je treba shraniti v ustreznem mediju za morebitne poznejše histopatološke preiskave: vse vidne lezije, pljuča – ki jih je treba odstraniti nepoškodovana, stehtati in obdelati z ustreznim fiksirjem, da se zagotovi ohranjenost pljučne strukture (oblivanje s fiksativom velja za učinkovit postopek), tkiva nosu in žrela, možgani – vključno z deli podaljšane hrbtenjače/mosta, skorjo malih možganov in možgansko skorjo, hipofizo, ščitnico/obščitnic in tkivo priželjca, sapnik, pljuča, srce, aorto, žleze slinavke, jetra, vranico, ledvice, nadledvične žleze, trebušno slinavko, maternico (pomožne spolne organe), (kožo), žolčnik (če je prisoten), požiralnik, želodec, dvanajsternik, zgornje tanko črevo, spodnje tanko črevo, slepo črevo, debelo črevo, danka, sečni mehur, reprezentativni limfni vozel, (mlečno žleza samic), (stegensko mišičevje), periferni živec, (oči), prsnico s kostnim mozgom, (stegnenico, vključno s površino sklepa) in (hrbtenjačo na treh ravneh – vratni, prsni in ledveni). Tkiva, navedena v oklepajih, je treba pregledati le, če kažejo znake strupenosti ali če gre za indikacijo, da so to ciljni organi.
1.6.5
(a) Popolno histopatološko preiskavo je treba opraviti na dihalih in drugih organih in tkivih vseh živali v kontrolni skupini in skupini z visokim odmerkom.
(b) Pregledati je treba vse vidne lezije.
(c) Pregledati je treba ciljne organe v skupinah z drugimi odmerki.
(d) Pljuča živali iz skupin z nižjimi in srednje velikimi odmerki je treba prav tako izpostaviti histopatološki preiskavi, saj se tako lahko ustrezno oceni zdravstveno stanje živali. Nadaljnje histopatološke preiskave na živalih v teh skupinah verjetno ne bodo potrebne na rutinski osnovi, vedno pa se morajo opraviti na organih, na katerih so v skupini z visokim odmerkom opazni znaki lezij.
(e) Kadar je uporabljena satelitska skupina, je treba opraviti histopatološko preiskavo na tkivih in organih, na katerih so v preskusnih skupinah opaženi učinki.
2. PODATKI
Podatki se povzamejo v obliki tabele, iz katere je za vsako preskusno skupino razvidno število živali na začetku preskusa, število živali, na katerih so opažene lezij e, tipe lezij, in odstotek živali, ki kažejo določen tip lezij e. Rezultate je treba oceniti z ustrezno statistično metodo. Uporabiti je mogoče katero koli priznano statistično metodo.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— vrsta, sev, vir, okoliški pogoji, hrana,
— preskusni pogoji:
— Opis aparature za izpostavljenost: vključno z obliko, tipom, dimenzijami, virom zraka, sistemom za sproščanje delcev in aerosolov, metodo klimatiziranja, obdelavo izpušnega zraka in metodo nastanitve živali v preskusne komore, kadar so te uporabljene. Opisati je treba opremo za merjenje temperature, vlažnosti in, kadar je to primerno, stabilnosti koncentracij aerosola ali velikosti delcev.
— Podatki o izpostavljenosti: zbrati jih je treba v tabeli in prikazati srednje vrednosti ter meritev nihanj (npr. standardno odstopanje), zajemati pa morajo:
—(a) stopnje pretoka zraka skozi naprave za inhalacijo;
(b) temperaturo in vlažnost zraka;
(c) nominalne koncentracije (skupna količina preskusne snovi, dane v napravo za inhalacijo in deljeno s prostornino zraka);
(d) vrsto nosilca, če je ta uporabljen;
(e) dejanske koncentracije na preskusnem dihalnem območju;
(f) mediano velikosti delcev (kjer je to primerno),
— podatki o odzivu strupenosti po spolu in koncentraciji,
— če je možno, velikost koncentracije, pri kateri ni opaženega učinka,
— čas smrti med študijo ali preživetje živali do zaključka,
— opis strupenih ali drugih učinkov,
— čas opazovanja vsakega znaka abnormalnosti in njegov nadaljnji potek,
— podatki o hrani in telesni masi,
— oftalmološke ugotovitve,
— opravljeni hematološki preskusi in rezultati,
— opravljeni klinično biokemijski poskusi in rezultati (vključno z rezultati vsake analize urina),
— ugotovitve nekropsije,
— podroben opis vseh histopatoloških ugotovitev,
— statistična obdelava rezultatov, kadar je to mogoče,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.30 PRESKUS KRONIČNE STRUPENOSTI
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Preskusna snov se običajno daje sedem dni na teden na ustrezen način nekaj skupinam preskusnih živali, in sicer po en odmerek na skupino večji del življenjske dobe živali. Med in po izpostavljenosti preskusni snovi se živali dnevno opazujejo, da bi se odkrilo znake strupenosti.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
1.6.1
Živali se vzdržujejo v preskusnih nastanitvenih in prehranjevalnih pogojih najmanj pet dni pred preskusom. Pred preskusom se naključno izberejo zdrave mlade živali in se razporedijo v preskusne ter kontrolne skupine.
1.6.2
Priporočena vrsta je podgana.
Na podlagi rezultatov predhodno opravljenih študij je mogoče uporabiti tudi druge vrste (glodalce ali neglodalce). Uporabiti je treba splošno uporabljene laboratorijske seve mladih zdravih živali, dajanje odmerkov pa naj se začne čim prej, potem ko se žival odstavi od sesanja.
Na začetku študije nihanje v teži uporabljenih živali ne sme presegati ± 20 % srednje vrednosti. Kadar se subkronična oralna študija izvaja kot predhodnica dolgodobni študiji, je treba v obeh študijah uporabiti isto vrsto/pasmo in sev.
Pri glodalcih je treba za vsako velikost odmerka in sočasno kontrolno skupino uporabiti najmanj 40 živali (20 samic in 20 samcev). Samice naj bodo nuliparne in nebreje. Če so načrtovana vmesna žrtvovanja, je treba število povečati za število živali, ki naj bi bile žrtvovane še pred zaključkom študije.
Pri neglodalcih zadostuje tudi manjše število živali, vendar najmanj štiri na spol na skupino.
Uporabiti je treba najmanj tri velikosti odmerka poleg sočasne kontrolne skupine. Najvišja velikost odmerka bi morala sprožiti očitne znake strupenosti, ne da bi povzročila preveliko smrtnost.
Najnižja velikost odmerka ne sme povzročiti nikakršnih znakov strupenosti.
Srednje velik odmerek ali odmerke je treba določiti na sredini med visokimi in nizkimi odmerki.
Pri izbiranju velikosti odmerka je treba upoštevati podatke iz predhodnih preskusov in študij strupenosti.
Pogostost izpostavljenosti je običajno dnevna. Če se kemikalija daje v pitni vodi ali vmeša v hrano, mora biti le-ta ves čas na voljo.
Uporabiti je treba sočasno kontrolno skupino, ki je v vseh pogledih identična preskusnim skupinam, razen glede izpostavljenosti preskusni snovi.
V posebnih okoliščinah, kot so inhalacijske študije z aerosoli ali uporaba emulgatorjev v oralnih študijah, katerih biološka aktivnost ni poznana, je treba uporabiti tudi sočasno negativno kontrolno skupino. Negativna kontrolna skupina se obravnava enako kot preskusne skupine, razen da živali niso izpostavljene preskusni snovi ali kateremu koli nosilcu.
Dva glavna načina dajanja sta oralno in inhalacijsko. Izbira načina dajanja je odvisna od fizikalnih in kemijskih lastnosti preskusne snovi in verjetnega načina izpostavljenosti pri ljudeh.
Pri uporabi dermalnega načina, se pojavljajo znatne praktične težave. Na kronično sistemsko strupenost, ki je rezultat absorpcije skozi kožo, je mogoče sklepati iz rezultatov kakšnega drugega oralnega preskusa, za ugotovitev obsežnosti absorpcije skozi kožo pa izhajati iz predhodnih preskusov strupenosti pri dajanju skozi kožo.
Kadar se preskusna snov absorbira iz prebavnega trakta in če je zaužitje eden od možnih načinov izpostavljenosti ljudi, ima, razen v primeru kontraindikacij, prednost oralni način dajanja. Živali lahko preskusno snov sprejmejo s hrano, raztopljeno v pitni vodi ali v kapsuli. Najprimerneje je dajati odmerke sedem dni na teden, saj se s petdnevnim dajanjem odmerkov na teden dopušča okrevanje ali odprava strupenosti v času, ko se odmerkov ne daje, to pa bi vplivalo na rezultat ter poznejšo oceno. Vendar pa na podlagi praktičnih ugotovitev velja, da je tudi petdnevno dajanje odmerkov na teden sprejemljivo.
Ker inhalacijske študije povzročajo bolj zapletene tehnične težave kot drugi načini dajanja, so na tem mestu podane podrobnejše smernice v zvezi s tem načinom dajanja. Upoštevati je treba tudi to, da je lahko v posebnih primerih veljavna alternativa intratrahealna instilacija.
Dolgotrajne izpostavljenosti se običajno zasnovane po vzorcu predvidene izpostavljenosti ljudi, pri čemer se živali izpostavlja ali šest ur na dan po izenačitvi koncentracij v komori, in sicer pet dni na teden (izpostavljenost s prekinitvami), ali, ustrezno možni izpostavljenosti preko okolja, 22 do 24 ur na dan sedem dni na teden (stalna izpostavljenost), pri čemer je približno ena ura na dan približno ob istem času namenjena hranjenju živali in vzdrževanju komore.
V obeh primerih so živali običajno izpostavljene nespremenljivim koncentracijam preskusne snovi. Bistvena razlika med izpostavljenostjo s prekinitvami in stalno izpostavljenostjo je v tem, da ima prva 17- do 18-urno obdobje, v katerem lahko živali okrevajo od učinkov vsakodnevne izpostavljenosti, s celo daljšimi obdobji okrevanja med vikendi.
Izbira med izpostavljenostjo s prekinitvami in stalno izpostavljenostjo je odvisna od ciljev študije in izpostavljenosti ljudi, ki na bi se jo simuliralo. Vendar je treba upoštevati tudi nekatere tehnične težave. Na primer, prednosti stalne izpostavljenosti pri simulaciji okoljskih pogojev lahko izniči potreba po napajanju in hranjenju med izpostavljenostjo in potreba po bolj zapletenih (in zanesljivih) tehnikah sproščanja aerosola in hlapov ter tehnikah spremljanja.
Živali je treba preskušati v komorah za inhalacijo, ki so oblikovane tako, da ohranijo dinamičen pretok zraka v količini najmanj 12 sprememb zraka na uro, da se zagotovi ustrezna vsebnost kisika in enakomerno porazdeljeno ozračje izpostavljenosti. Kontrolne komore in komore za izpostavljanje morajo biti po strukturi in obliki identične, da se zagotovijo primerljivi pogoji izpostavljenosti v vseh pogledih, razen glede izpostavljenosti preskusnim snovem. Na splošno se znotraj komore vzdržuje rahel negativen pritisk, da bi se preprečilo uhajanje preskusne snovi v okolico. Natrpanost s preskusnimi živalmi v komorah naj bo minimalna. Na splošno velja, da naj za zagotovitev stabilnosti ozračja v komori skupna količina preskusnih živali ne presega 5 % prostornine preskusne komore.
Meritve ali spremljanje naj zajema:
(i) Pretok zraka: stopnjo pretoka zraka skozi komoro je treba stalno spremljati.
(ii) Koncentracijo: med vsakodnevno izpostavljenostjo, naj preskusna snov ne odstopa za več kot ± 15 % od srednje vrednosti.
(iii) Temperatura in vlažnost: pri glodalcih je treba temperaturo ohranjati na 22 ± 2 oC, vlažnost v komori pa med 30 % in 70 %, razen kadar se uporabi voda za suspendiranje preskusne snovi v ozračju komore. Priporočljivo je oboje stalno spremljati.
(iv) Meritve velikosti delcev: v ozračjih komor s tekočimi ali trdnimi aerosoli je treba določiti porazdelitev velikosti delcev. Delci aerosolov morajo biti take velikosti, da jih uporabljena preskusna žival lahko vdihne. Vzorce ozračij komor je treba vzeti v območju dihanja živali. Vzorec zraka mora predstavljati porazdelitev delcev, katerim so živali izpostavljene, in mora na gravimetrični podlagi predstavljati ves suspendiran aerosol, tudi kadar večina aerosola ni vdihljiva. Analizo velikosti delcev je treba opraviti pogosto v času razvijanja sproščanja koncentracij, da bi se zagotovila stabilnost aerosola, po potrebi pa tudi pozneje med izpostavljenostjo, da bi se ustrezno določila doslednost porazdelitve delcev, ki so jim živali izpostavljene.
Obdobje dajanja naj traja najmanj 12 mesecev.
1.6.3
Najmanj enkrat na dan je treba opraviti natančen klinični pregled. Dodatna opazovanja je treba opraviti vsak dan z ustreznimi ukrepi, da se zagotovi minimalna izguba živali med študijo, na primer nekropsija ali zamrznitev mrtvih živali ter izolacija ali žrtvovanje slabotnih ali umirajočih živali. Opraviti je treba natančna opazovanja za ugotovitev nastopa in širjenja vseh strupenih učinkov, ter za zmanjšanje izgube zaradi bolezni, avtolize ali kanibalizma na minimum.
Klinične znake, vključno z nevrološkimi in očesnimi spremembami ter smrtnostjo, je treba zabeležiti za vse živali. Zabeležiti je treba čas nastopa in širjenja strupenih stanj, vključno s sumi na tumorje.
Telesno maso je treba za vsako žival posebej beležiti enkrat na teden v prvih 13-ih tednih preskusnega obdobja, pozneje pa najmanj enkrat na štiri tedne. Vnos hrane je treba določiti tedensko v prvih 13 tednih študije, potem pa v približno tri mesečnih časovnih presledkih, razen če zdravstveno stanje ali spremembe telesne mase ne zahtevajo drugače.
Hematološko preiskavo (npr. vsebnost hemoglobina, hematokrit, skupno število eritrocitov, skupno število levkocitov, trombocitov ali druga merjenja zmožnosti koagulacije) je treba opraviti pri treh mesecih, šestih mesecih, potem pa približno v šest mesečnih časovnih presledkih in ob zaključku na vzorcih krvi, odvzetih na vseh neglodalcih in na 10-ih podganah/spol iz vseh skupin. Če je mogoče, naj bodo krvni vzorci vsakokrat odvzeti na istih podganah. Poleg tega je treba na neglodalcih odvzeti en vzorec še pred preskusom.
Če klinična opažanja kažejo na poslabšanje zdravja živali med študijo, je treba na obolelih živalih opraviti pregled diferencialne krvne slike.
Pregled diferencialne krvne slike se opravi na vzorcih živali iz skupine z najvišjim odmerkom ter kontrolnih skupin. Na naslednji skupini ali skupinah z nizkim odmerkom se pregled diferencialne krvne slike opravi le, kadar gre za večjo neskladnost med skupino z najvišjim odmerkom in kontrolnimi skupinami, ali kadar pride do patoloških ugotovitev.
Za analizo je treba odvzeti vzorce urina na vseh neglodalcih in na 10-ih podganah/spol iz vseh skupin, če je mogoče, vsakokrat na istih podganah, tako kot pri hematološki preiskavi. Za vsako posamezno žival ali skupino vzorcev/spol/skupino pri glodalcih je treba določiti naslednje:
— videz: prostornina in gostota pri posameznih živalih,
— proteini, glukoza, ketoni, kri (polkvantitativno določanje),
— mikroskopija sedimenta (polkvantitativno določanje).
V približno šest mesečnih časovnih presledkih in ob zaključku se na vseh neglodalcih in na 10-ih podganah/spol iz vseh skupin, po možnosti vsakokrat na istih podganah, odvzamejo vzorci krvi za meritve na področju klinične kemije. Poleg tega naj se na neglodalcih odvzame en vzorec še pred preskusom. Iz navedenih vzorcev se pripravi plazma in se določi naslednje:
— skupna koncentracija proteinov,
— koncentracija albumina,
— preskus delovanja jeter (kot je aktivnost alkalne fosfataze, aktivnost glutamične piruvične transaminaze (19) in aktivnost glutamične oksaloacetat transaminaze (19) gama-glutamil-transpeptidaza, ornitin-dekarboksilaza,
— presnova ogljikovih hidratov, kot je krvna glukoza na tešče,
— preskusi delovanja ledvic, kot je sečnina v krvi.
Temeljito makroskopsko nekropsijo je treba opraviti na vseh živalih, vključno s tistimi, ki so umrle med preskusom ali so bile žrtvovane potem, ko se je odkrilo, da so v umirajočem stanju. Pred žrtvovanjem je treba vsem živalim odvzeti vzorce krvi za diferencialno krvno sliko. Vse makroskopsko vidne lezije, tumorje ali lezije, pri katerih gre za sum tumorja, je treba shraniti. Prizadevati si je treba za korelacijo makroskopskih opazovanj z mikroskopskimi ugotovitvami.
Vse organe in tkiva je treba shraniti za histopatološke preiskave. To ponavadi vključuje naslednje organe in tkiva: možgane ( 20 ) (podaljšano hrbtenjačo/most, skorjo malih možganov in možgansko skorj), hipofizo, ščitnico (vključno z obščitnicami), priželjc, pljuča (vključno s sapnikom), srce, aoro, žleze slinavke, jetra (20) , vranico, ledvice (20) , nadledvične žleze (20) , požiralnik, želodec, dvanajsternik, zgornje tanko črevo, spodnje tanko črevo, slepo črevo, debelo črevo, danko, maternico, sečni mehur, limfne vozle, trebušno slinavko, spolne žleze (20) , pomožne spolne organe, mlečno žlezo samic, kožo, mišičevje, periferni živec, hrbtenjača (vratni, prsni in ledveni del), prsnica s kostnim mozgom ter stegnenica (vključno s sklepom) in oči. Vpihovanje pljuč in sečnega mehurja s fiksativom je najboljši način za ohranitev teh tkiv; vpihovanje pljuč naslednje: inhalacijskih študijah je nujno za ustrezno histopatološko preiskavo. V posebnih študijah, kot so inhalacijske študije, je treba proučiti celotna dihala, vključno z nosom, žrelom in grlom.
Če so opravljeni drugi klinični pregledi, morajo biti podatki, pridobljeni v teh postopkih, na voljo pred mikroskopskim pregledom, saj lahko to daje patologu pomembne smernice.
Vse vidne spremembe, zlasti tumorje in kemije. Lezije, ki nastanejo na katerem koli organu, je treba mikroskopsko pregledati. Poleg tega so priporočeni še naslednji postopki:
(a) Mikroskopski pregled vseh ohranjenih organov in tkiv s popolnim opisom vseh lezij, odkritih pri:
1. vseh živalih, ki so umrle ali bile žrtvovane med študijo;
2. vseh skupinah z visokimi odmerki gama-glutamil-transpeptidaza, kontrolnih skupinah;
(b) Organi ali tkiva, ki kažejo abnormalnosti, ki je povzročila ali verjetno povzročila preskusna snov se pregledajo tudi pri skupini z nizkim odmerkom;
(c) Kadar rezultat preskusa kaže na znatno zmanjšanje normalne življenjske dobe živali ali na sprožitev učinkov, ki lahko vplivajo na odziv strupenosti, je treba pregledati naslednjo skupino z nizkim odmerkom, kot je opisano zgoraj;
(d) Podatki o pojavu lezij, ki so običajne pri sevu uporabljenih živali pod enakimi laboratorijskimi pogoji, npr. pretekli kontrolni podatki, so nepogrešljivi za pravilno oceno pomembnosti sprememb, opaženih na korelacijo živalih.
2. PODATKI
Podatki se povzamejo v obliki tabele, iz katere so razvidni število živali za vsako preskusno skupino na začetku preskusa, število živali, pri katerih so opažene lezije, in odstotek živali, ki kažejo določen tip lezije. Rezultate je treba oceniti z ustrezno statistično metodo. Uporabi se lahko katera koli priznana statistična metoda.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— vrsta, sev, vir, okoljski pogoji, hrana,
— preskusni pogoji:
— Opis opreme za izpostavljenost:
— vključno z obliko, tipom, dimenzijami, virom zraka, sistemom za sproščanje delcev in aerosolov, metodo klimatiziranja, obdelavo izpušnega zraka in metodo nastanitve živali v preskusne komore, kadar so te uporabljene. Opisati je treba opremo za merjenje temperature, vlažnosti in, kadar je ustrezno, stabilnosti koncentracij aerosola ali velikosti delcev.
— Podatki o izpostavljenosti:
— zbrati jih je treba v tabeli in prikazati s srednjimi vrednostmi ter meritvami nihanj (npr. standardno odstopanje), zajemati pa morajo:
—(a) stopnje pretoka zraka skozi naprave za inhalacijo;
(b) temperaturo in vlažnost zraka;
(c) nominalne koncentracije (skupna količina preskusne snovi, dane v naprave za inhalacijo deljeno s prostornino zraka);
(d) vrsto nosilca, če je ta uporabljen;
(e) dejanske koncentracije na preskuševalnem dihalnem območju;
(f) mediano velikosti delcev (kjer je to primerno),
— velikosti odmerkov (vključno z nosilcem, če je uporabljen) in koncentracije,
— podatki o odzivu strupenosti po spolu in koncentraciji,
— velikost odmerka, pri kateri ni opaženega učinka,
— čas smrti med študijo ali preživetje živali do zaključka,
— opis strupenih ali drugih učinkov,
— čas opazovanja vsakega znaka abnormalnosti in njegov nadaljnji potek,
— podatki o hrani in telesni masi,
— oftalmološke ugotovitve,
— opravljeni hematološki preskusi in vsi rezultati,
— opravljeni klinično biokemijski preskusi in vsi rezultati (vključno z rezultati vsake analize urina),
— ugotovitve nekropsije,
— podroben opis vseh histopatoloških ugotovitev,
— statistična obdelava rezultatov, kadar j e to ustrezno,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.31 ŠTUDIJA STRUPENOSTI ZA PREDROJSTVENI RAZVOJ
1. METODA
Ta metoda ustreza metodi OECD TG 414 (2001).
1.1 UVOD
Metoda za preskušanje strupenosti za razvoj je namenjena zagotavljanju splošnih informacij o učinkih predrojstvene izpostavljenosti breje preskusne živali in razvijajočih se organizmov v maternici; to lahko vključuje oceno vplivov matere, pa tudi smrti, strukturnih anomalij ali spremenjene rasti zarodka. Funkcionalne pomanjkljivosti, čeprav pomemben del razvoja, niso sestavni del te preskusne metode. Lahko se preizkusijo v posebni študiji ali kot dodatek k tej študiji z uporabo preskusne metode za razvojno nevrotoksičnost. Za informacije o preskušanju funkcionalnih pomanjkljivosti in drugih poporodnih učinkov preskusne metode se lahko na primeren način uporabi študija dvogeneracijske reproduktivne strupenosti ali študija razvojne nevrotoksičnosti.
Pri tej preskusni metodi je lahko v posameznih primerih potrebna posebna prilagoditev na podlagi posebnega poznavanja npr. fizikalno-kemijskih ali toksikoloških lastnosti preskusne snovi. Taka prilagoditev je sprejemljiva, kadar prepričljivi znanstveni podatki kažejo, da bo prilagoditev omogočila bolj informativen preskus. V takem primeru je treba znanstvene podatke natančno dokumentirati v poročilu o študiji.
1.2 DEFINICIJE
Razvojna toksikologija: preučevanje škodljivih učinkov na razvoj organizma, ki so lahko posledica izpostavljenosti pred spočetjem, med razvojem pred rojstvom ali po rojstvu do spolne zrelosti. Glavne pojavne oblike strupenosti za razvoj vključujejo 1. smrt organizma, 2. strukturno anomalijo, 3. spremenjeno rast in 4. funkcionalno pomanjkljivost. Razvojno toksikologijo so v preteklosti pogosto imenovali teratologija.
Škodljivi učinek: vsako odstopanje od normalnega, povezano s tretiranjem, ki zmanjšuje sposobnost organizma za preživetje, razmnoževanje ali prilagoditev okolju. V razvojni toksikologiji v njenem najširšem pomenu vključuje vsak učinek, ki moti normalen razvoj zarodka pred rojstvom in po njem.
Spremenjena rast: sprememba mase ali velikosti organa ali telesa potomca.
Spremembe (nepravilnosti): strukturne spremembe v razvoju, ki vključujejo deformnosti in odstopanja (28).
Deformnost/večja anomalija: strukturna sprememba, ki naj bi bila za žival škodljiva (lahko tudi smrtna) in je navadno redka.
Odstopanje/manjša anomalija: strukturna sprememba, ki naj bi imela malo ali nič škodljivega učinka na žival; lahko je prehodna in lahko se razmeroma pogosto pojavlja v kontrolni populaciji.
Zarodek: vsota izpeljank oplojenega jajčeca v kateri koli stopnji razvoja od oploditve do rojstva, vključno z embrionalnimi membranami ter embriom ali fetusom.
Vgnezditev (nidacija): pritrditev blastociste v epitelno maternično sluznico, vključno s prediranjem skozi maternični epitelij in vsaditvijo v endometrij.
Embrio: zgodnja ali razvojna stopnja katerega koli organizma, zlasti razvojni produkt oplojenega jajčeca od takrat, ko se pojavi vzdolžna os, do takrat, ko nastanejo vse glavne strukture.
Embriotoksičnost: škodljivo za normalno strukturo, razvoj, rast in/ali sposobnost za preživetje embria.
Fetus: nerojeni potomec v postembrionalnem obdobju.
Fetalna toksičnost: škodljivo za normalno strukturo, razvoj, rast in/ali preživetje fetusa.
Splav: predčasna izločitev produktov spočetja iz maternice: embria ali fetusa, nezmožnega preživetja.
Resorpcija: zarodek, ki naknadno po vgnezditvi v maternici odmre in se resorbira.
Zgodnja resorpcija: dokaz o vgnezditvi brez prepoznavnega embria/fetusa.
Pozna resorpcija: mrtvi embrio ali fetus z zunanjimi degenerativnimi spremembami.
NOAEL: kratica za vrednost brez opaznih škodljivih učinkov (No Observed Adverse Effect Level) in je največji odmerek ali stopnja izpostavljenosti, pri kateri ne opazimo nobenega škodljivega učinka, povezanega s tretiranjem.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Navadno se preskusna snov daje brejim živalim najmanj od vgnezditve do enega dne pred dnevom predvidene usmrtitve, ki naj bo čim bliže normalnemu dnevu kotitve brez tveganja izgube podatkov, ki izhajajo iz predčasne kotitve. Preskusna metoda ni namenjena samo preučevanju obdobja organogeneze (npr. od 5 do 15 dne pri glodalcu in od 6 do 18 dne pri kuncu), temveč tudi učinkov pred vgnezditvijo, kadar je primerno, v vsem obdobju brej osti do dneva pred carskim rezom. Malo pred carskim rezom se samice usmrtijo, preuči se maternična vsebina, fetusi pa se ocenijo glede na zunanje vidne nepravilnosti in spremembe mehkega tkiva in okostja.
1.5 OPIS PRESKUSNE METODE
1.5.1 Izbira živalskih vrst
Priporoča se, da se preskušanje izvaja na najustreznejših vrstah in da se uporabijo laboratorijske vrste in sevi, ki se navadno uporabljajo pri preskušanju strupenosti za predrojstveni razvoj. Priporočena glodalska vrsta je podgana in priporočena neglodalska vrsta je kunec. Če se uporabi druga vrsta, je treba to utemeljiti.
1.5.2 Nastanitvene in prehranjevalne razmere
Temperatura v prostoru s poskusnimi živalmi naj bo 22 oC (± 3o) za glodalce in 18 oC (± 3+) za kunce. Čeprav naj bi bila relativna vlažnost najmanj 30 % in je zaželeno, da ne presega 70 %, razen v času čiščenja prostora, je cilj 50–60 %. Osvetlitev naj bo umetna, zaporedje 12 ur svetlobe, 12 ur teme. Za hranjenje se lahko uporablja konvencionalna laboratorijska prehrana z neomejeno oskrbo s pitno vodo.
Parjenje naj se izvaja v kletkah, ki so primerne za ta namen. Čeprav je priporočljiva individualna namestitev živali, ki se parijo, je sprejemljiva tudi skupinska namestitev v manjšem številu.
1.5.3 Priprava živali
Uporabiti je treba zdrave živali, ki so se najmanj pet dni prilagajale na laboratorijske razmere in predhodno niso bile uporabljene za poskuse. Poznati je treba vrsto, sev, vir, spol, maso in/ali starost poskusnih živali. Živali v vseh preskusnih skupinah naj bodo čim enotnejše po masi in starosti. Za vsako velikost odmerka je treba uporabiti mlade odrasle samice, ki še niso kotile. Samice naj se parijo s samci iste vrste in seva, izogibati se je treba parjenju sorojencev. Pri glodalcih je dan brejosti 0 tisti dan, ko se opazi vaginalni čep in/ali seme; pri kuncih je dan 0 navadno dan koitusa ali umetne osemenitve, če se uporabi ta tehnika. Sparjene samice se na nepristranski način dodelijo v kontrolno in tretirano skupino. Kletke je treba razporediti tako, da so možni učinki zaradi pozicije kletk čim manjši. Vsaki živali se dodeli enotna identifikacijska številka. Sparjene samice se na nepristranski način dodelijo v kontrolno in tretirano skupino in če se samice parijo v serijah, se živali iz vsake serije enakomerno porazdelijo v skupini. Podobno se samice, ki jih osemeni isti samec, enakomerno porazdelijo v obe skupini.
1.6 POSTOPEK
1.6.1 Število in spol živali
Vsaka preskusna in kontrolna skupina naj vključuje zadostno število samic, tako da bo za obdukcijo približno 20 ženskih živali z vgnezditvijo. Skupine z manj kakor 16 živali z vgnezditvijo so lahko neustrezne. Ni nujno, da smrtnost mater ogrozi študijo, pod pogojem, da ni večja od približno 10 %.
1.6.2 Priprava odmerkov
Če se za olajšanje odmerjanja uporablja nosilec ali drug aditiv, je treba upoštevati naslednje lastnosti: učinke na absorpcijo, distribucijo, presnovo in retencijo ali ekskrecijo preskusne snovi; učinke na kemijske lastnosti preskusne snovi, ki lahko spremenijo njene toksične lastnosti; ter učinke na porabo hrane ali vode ali na prehranjenost živali. Nosilec ne sme biti toksičen za razvoj in ne sme učinkovati na reprodukcijo.
1.6.3 Odmerjanje
Normalno se preskusna snov daje vsak dan od vgnezditve (npr. od 5. dne po parjenju) do dneva pred predvidenim carskim rezom. Če predhodne študije, ki so na voljo, ne navajajo visoke možnosti za izgubo pred vgnezditvijo, se lahko tretiranje podaljša, tako da vključuje celotno obdobje brej osti, od parjenja do dneva pred predvideno usmrtitvijo. Dobro je znano, da se lahko neprimerno ravnanje ali stres med nosečnostjo končata s predrojstveno izgubo. Da bi zavarovali predrojstveno izgubo pred dejavniki, ki niso povezani s tretiranjem, se je treba izogibati nepotrebnemu pretovarjanju brejih živali, pa tudi stresu zaradi zunanjih dejavnikov, na primer hrupa.
Uporabiti je treba najmanj tri velikosti odmerkov in hkratno kontrolo. Zdrave živali se na nepristranski način dodelijo v kontrolno in tretirano skupino. Velikost odmerkov se razporedi tako, da se toksični učinki stopnjujejo. Razen kadar to zaradi fizikalno-kemijske narave ali bioloških lastnosti preskusne snovi ni mogoče, je treba najvišjo vrednost odmerka izbrati tako, da povzroči nekaj toksičnosti za razvoj in/ali pri materi (klinični znaki ali zmanjšanje telesne mase), vendar ne smrt ali hudo trpljenje. Najmanj ena vmesna velikost odmerka mora povzročiti minimalno opazne toksične učinke. Najmanjša velikost odmerka ne sme povzročiti nobenega dokaza toksičnosti niti za razvoj niti pri materi. Padajoče zaporedje velikosti odmerkov je treba izbrati tako, da se pokažejo vse reakcije, ki so odvisne od odmerka, in vrednost brez opaznih škodljivih učinkov (NOAEL). Za padajoče zaporedje velikosti odmerkov so pogosto optimalni dvakratni do štirikratni intervali, pogosto pa je bolje dodati še dodatno četrto preskusno skupino, kakor uporabiti zelo velike intervale med odmerki (npr. več kakor faktor 10). Čeprav je cilj ugotoviti vrednost brez opaznih škodljivih učinkov pri materi, so lahko sprejemljive tudi študije, ki ne dokažejo take vrednosti (1).
Vrednosti odmerkov je treba izbirati ob upoštevanju vseh obstoječih podatkov o strupenosti, pa tudi dodatnih informacij o presnovi in toksikokinetiki preskusne snovi ali sorodnih materialov. Te informacije pomagajo tudi pri dokazovanju ustreznosti režima odmerjanja.
Uporabiti je treba hkratno kontrolno skupino. Ta skupina je kontrolna skupina, tretirana z nepravim nadomestkom ali kontrolna skupina, tretirana le z nosilcem, če je ta uporabljen pri dajanju preskusne snovi. Vsem skupinam se daje enaka količina bodisi preskusne snovi ali nosilca. Živali v kontrolni (h) skupini(ah) se obravnavajo na enak način kakor živali v preskusni skupini. Kontrolne skupine, tretirane z nosilcem, morajo prejeti količino nosilca, enako največji uporabljeni količini (kakor v najnižji tretirani skupini).
1.6.4 Mejni preskus
Če preskus pri eni velikosti odmerka najmanj 1 000 mg/kg telesne mase/dan z oralnim dajanjem, pri katerem se uporabijo postopki, opisani za to študijo, ne povzroči opazne toksičnosti pri nobeni breji živali ali njenih potomcih in če se glede na obstoječe podatke (npr. o strukturno in/ali presnovno sorodnih zmeseh) ne pričakuje učinka, potem se šteje, da ni potrebna popolna študija z uporabo treh velikosti odmerkov. Pričakovana človekova izpostavljenost lahko narekuje potrebo, da se v mejnem preskusu uporabi večji oralni odmerek. Pri drugih vrstah dajanja, na primer pri vdihavanju ali dermalni aplikaciji, lahko fizikalno-kemijske lastnosti preskusne snovi pogosto določajo in omejujejo največjo dosegljivo raven izpostavljenosti (na primer dermalna aplikacija ne bi smela povzročati hude lokalne toksičnosti).
1.6.5 Dajanje odmerkov
Preskusna snov ali nosilec se navadno daje oralno z intubacijo. Če se uporabi drug način dajanja odmerkov, mora izvajalec preskusa zagotoviti utemeljitev in razlog za svojo izbiro, lahko pa so potrebne ustrezne spremembe (2)(3)(4). Preskusno snov je treba dati vsak dan približno ob istem času.
Odmerek za posamezno žival navadno temelji na zadnji posamični določitvi telesne mase. Vendar je potrebna previdnost pri prilagajanju odmerka v zadnjem trimestni brejosti. Pri izbiri odmerka je treba uporabiti obstoječe podatke, da bi preprečili čezmerno toksičnost pri materi. Če se pri tretiranih materah opazi čezmerna toksičnost, je treba te živali humano usmrtiti. Če več živali kaže znake čezmerne toksičnosti, je treba razmisliti o prekinitvi te skupine odmerka. Če se snov daje z gavažo, jo je treba dati živali po možnosti v enkratnem odmerku z uporabo želodčne sonde ali primerne intubacijske kanile. Maksimalna količina tekočine, ki jo je mogoče dati naenkrat, je odvisna od velikosti poskusne živali. Količina ne sme presegati 1 ml/100 g telesne mase, razen v primeru vodnih raztopin, kjer je dovoljeno uporabiti 2 ml/100 g telesne mase. Če se kot nosilec uporablja koruzno olje, količina ne sme presegati 0,4 ml/100 g telesne mase. Variabilnost preskusne količine je treba s prilagajanjem koncentracije obdržati na kar najnižji ravni, da se zagotovi konstantna količina pri vseh odmerkih.
1.6.6 Opazovanje mater
Klinična opazovanja je treba opraviti in dokumentirati najmanj enkrat na dan, najbolje vsak dan ob istem času, pri čemer se upošteva vrhunec pričakovanih učinkov po odmerjanju. Stanje živali je treba dokumentirati, vključno s smrtnostjo, odmiranjem, pomembnimi vedenjskimi spremembami in vsemi znaki očitne toksičnosti.
1.6.7 Telesna masa in poraba hrane
Živali je treba stehtati na dan brejosti 0 ali najpozneje tretji dan brejosti, če je živali, ki so se parile, dostavil zunanji rejec, nato na prvi dan odmerjanja, najmanj vsake 3 dni v obdobju odmerjanja in na dan predvidene usmrtitve.
Porabo hrane je treba zabeležiti vsake tri dni, na isti dan kot se določa telesna masa.
1.6.8 Postmortalni pregled
Samice je treba usmrtiti en dan pred pričakovano kotitvijo. Samice, ki kažejo znake splava ali predčasne kotitve pred predvideno usmrtitvijo, je treba usmrtiti in opraviti temeljit makroskopski pregled.
Ob koncu študije ali ob smrti med študijo se makroskopsko pregledajo kakršne koli strukturne anomalije ali patološke spremembe pri materi. Ocenitev matere med carskim rezom in poznejše analize fetusa naj se izvajajo po možnosti brez poznavanja tretirane skupine, da je pristranskost čim manjša.
1.6.9 Pregled maternične vsebine
Takoj po koncu študije ali čim prej po smrti se maternice odstranijo in ugotovi status nosečnosti živali. Maternice, ki niso videti gravidne, se še dodatno pregledajo (npr. z barvanjem z amonijevim sulfidom pri glodalcih in barvanjem po Salewskem ali ustrezno alternativno metodo pri kuncih), da se potrdi nenoseči status (5).
Gravidne maternice z materničnim vratom je treba stehtati. Masa gravidnih maternic se ne sme pridobiti od živali, za katere je ugotovljeno, da so med študijo poginile.
Pri brejih živalih se določi število rumenih telesc.
Maternično vsebino je treba pregledati glede na število embrionalnih ali fetalnih smrti in fetusov, ki so sposobni preživetja. Opisati je treba stopnjo resorpcije, da bi ocenili relativni čas smrti zarodka (glej oddelek 1.2).
1.6.10 Pregled fetusov
Za vsak fetus je treba določiti spol in telesno maso.
Pri vsakem fetusu je treba pregledati zunanje spremembe (6).
Pregledajo se spremembe skeleta in mehkega tkiva pri fetusih (npr. odstopanja in deformnosti ali nepravilnosti) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24). Kategorizacija fetalnih sprememb je zaželena, vendar ne nujna. Kadar se opravi kategorizacija, je treba jasno navesti merila za določitev vsake kategorije. Posebno pozornost je treba posvetiti reproduktivnemu traktu, ki ga je treba pregledati, če ima znake spremenjenega razvoja.
Pri glodalcih je treba pripraviti približno polovico vsakega zaroda in pregledati skeletne spremembe. Druga polovica se pripravi in pregleda glede sprememb mehkega tkiva s sprejetimi ali ustreznimi metodami serijskega razreza ali s tehnikami natančne osnovne raztelesbe.
Pri neglodalcih, npr. kuncih, se pri vseh fetusih pregledajo spremembe mehkega tkiva in skeleta. Pri telesih teh fetusov se spremembe mehkega tkiva ocenijo z natančno raztelesbo, ki lahko vključuje postopke za dodatno oceno notranje strukture srca (25). Glave polovice fetusov, ki so pregledani na ta način, se odstranijo in obdelajo za oceno sprememb mehkega tkiva (tudi oči, možganov, nosnih prehodov in jezika) z uporabo standardnih metod serijskega razreza (26) ali enako občutljivih metod. Telesa teh fetusov in preostalih nedotaknjenih fetusov se obdelajo in pregledajo glede skeletnih sprememb z enakimi metodami, kakor so opisane za glodalce.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Podatki se sporočajo posamično za matere in njihove potomce in se povzamejo v obliki tabele, ki prikazuje za vsako preskusno skupino in vsako generacijo število živali na začetku preskusa, število živali, najdenih mrtvih ali usmrčenih iz humanih razlogov med preskusom, čas katere koli smrti ali humane usmrtitve, število brejih samic, število živali, ki kažejo znake toksičnosti, opis znakov zaznane toksičnosti, vključno s časom začetka, trajanja in resnosti katerih koli toksičnih učinkov, vrsto embrionalnih/fetalnih opažanj o vseh ustreznih podatkih o zarodu.
Numerični rezultati se ocenijo z ustrezno statistično metodo z uporabo zaroda kot enote za podatkovno analizo. Uporabi se splošno sprejeta statistična metoda, statistične metode je treba določiti pri načrtovanju študije in jih utemeljiti. Sporočajo se tudi podatki o živalih, ki ne preživijo do predvidene usmrtitve. Ti podatki se lahko po potrebi vključijo v skupinske podatke. Ustreznost podatkov, dobljenih o teh živalih in vključitev ali izključitev iz katerih koli skupinskih podatkov, je treba utemeljiti ali presoditi na individualni podlagi.
2.2 VREDNOTENJE REZULTATOV
Ugotovitve študije strupenosti za predrojstveni razvoj je treba ovrednotiti glede na opažene učinke. Vrednotenje vsebuje naslednje informacije:
— rezultate preskusa pri materi in embriu/fetusu, vključno z ovrednotenjem razmerja ali njegove odsotnosti med izpostavljenostjo živali preskusni snovi in pojavom ter resnostjo vseh ugotovitev,
— merila, uporabljena za kategorizacijo zunanjih sprememb fetusa ter sprememb mehkega tkiva in skeleta, če je bila kategorizacija opravljena,
— kadar je primerno, pretekle kontrolne podatke za izboljšanje razlage rezultatov študije,
— številke, uporabljene pri izračunu vseh odstotkov ali kazalnikov,
— ustrezne statistične analize ugotovitev študije, če je to primerno, ki naj vključujejo dovolj informacij o metodi analize, tako da lahko neodvisni ocenjevalec/statistik ponovno ovrednoti in obnovi analizo,
Pri kateri koli študiji, ki dokaže odsotnost katerega koli toksičnega učinka, je treba razmisliti o nadaljnjih raziskavah za določitev absorpcije in biološke razpoložljivosti preskusne snovi.
2.3 RAZLAGA REZULTATOV
Študija strupenosti za predrojstveni razvoj zagotovi informacije o učinkih ponovne izpostavljenosti tej snovi med brej ostjo na matere in razvoj njihovih potomcev v maternici. Rezultate študije je treba razlagati skupaj z ugotovitvami subkroničnih, reprodukcijskih, toksikokinetičnih in drugih študij. Ker je poudarek tako na splošni toksičnosti v smislu toksičnosti pri materi kot na ciljnih učinkih strupenosti za razvoj, rezultati študije do določene mere omogočajo razlikovanje med razvojnimi učinki, ki se pojavijo v odsotnosti splošne toksičnosti in učinki, ki so doseženi samo na stopnjah, ki so strupene tudi za mater (27).
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje posebne informacije:
Preskusna snov:
— fizikalno stanje in, kjer je to ustrezno, fizikalno-kemijske lastnosti,
— identifikacijo, vključno s številko po CAS, če je znana/določena,
— čistost.
Nosilec (po potrebi):
— utemeljitev izbire nosilca, če to ni voda.
Preskusne živali:
— uporabljeno vrsto in sev,
— število in starost živali,
— izvor, nastanitvene razmere, hrano ipd.,
— maso posameznih živali na začetku preskusa.
Preskusni pogoji:
— utemeljitev izbire velikosti odmerka,
— podatke o sestavi preskusne snovi/pripravi hrane, doseženi koncentraciji, stabilnosti in homogenosti pripravka,
— podatke o dajanju preskusne snovi,
— preračunavanje koncentracije preskusne snovi v hrani/pitni vodi (ppm) v dejanski odmerek (mg/kg telesne mase/dan), če je primerno,
— okoljske razmere,
— podatke o kakovosti hrane in vode.
Rezultati:
Podatki o toksičnem učinkovanju pri materi po odmerku, ki vključujejo, vendar niso omejeni na:
— število živali na začetku preskusa, število preživelih živalih, število brejih in število živali, ki splavijo ali kotijo predčasno,
— dan smrti med študijo ali če živali preživijo do konca,
— podatki o živalih, ki ne preživijo do predvidene usmrtitve, se sporočijo, vendar se ne vključijo v medskupinske statistične primerjave,
— dan opazovanj a vsakega nenormalnega kliničnega znaka in poznejšega poteka,
— telesno maso, spremembo telesne mase in maso gravidne maternice, vključno, po izbiri, s spremembo telesne mase popravljeno za maso gravidne maternice,
— porabo hrane in porabo vode, če je izmerjena,
— ugotovitve obdukcije, vključno z maso maternice,
— treba je poročati o vrednostih brez opaznih škodljivih učinkov pri materi in o razvojnih učinkih.
Ciljni učinki za razvoj po odmerku na zarod z vsadki, ki vključujejo:
— število rumenih telesc,
— število vgnezditev, število in odstotek živih in mrtvih fetusov in resorpcij,
— število in odstotek izgub pred vgnezditvijo in po njej.
Ciljni učinki za razvoj po odmerku na zarod z živimi fetusi, ki vključujejo:
— število in odstotek živih potomcev,
— razmerje spolov,
— fetalna telesna masa, če je mogoče po spolu in skupno,
— zunanje deformnosti in deformnosti mehkega tkiva in skeleta ter druge ustrezne spremembe,
— merila za kategorizacijo, če je primerno,
— skupno število in odstotek fetusov in zaroda z zunanjo spremembo, spremembo mehkega tkiva ali skeleta, pa tudi vrste in pojavnost posameznih nepravilnosti in druge ustrezne spremembe.
Razprava o rezultatih.
Zaključki.
4. LITERATURA
(1) Kavlock R.J. et al. (1996) A Simulation Study of the Influence of Study Design on the Estimation of Benchmark Doses for Developmental Toxicity. Risk Analysis 16; 399–410.
(2) Kimmel, C.A. and Francis, E.Z. (1990) Proceedings of the Workshop on the Acceptability and Interpretation of Dermal Developmental Toxicity Studies. Fundamental and Applied Toxicology 14; 386-398.
(3) Wong, B.A., et al. (1997) Developing Specialized Inhalation Exposure Systems to Address Toxicological Problems. CIIT Activities 17; 1–8.
(4) US Environmental Protection Agency (1985) Subpart E-Specific Organ/Tissue Toxicity, 40 CFR 798.4350: Inhalation Developmental Toxicity Study.
(5) Salewski, E. (1964) Faerbermethode zum Makroskopischen Nachweis von Implantations Stellen am Uterusder Ratte. Naunyn-Schmeidebergs Archiv für Pharmakologie undExperimentelle Pathologie 247:367.
(6) Edwards, J. A. (1968) The external Development of the Rabbit and Rat Embryo. In Advances in Teratology. D.H.M. Woolam (ed.) Vol. 3. Academic Press, NY.
(7) Inouye, M. (1976) Differential Staining of Cartilage and Bone in Fetal Mouse Skeleton by Alcian Blue and Alizarin Red S. Congenital Anomalies 16, 171–173.
(8) Igarashi, E. et al. (1992) Frequency Of Spontaneous Axial Skeletal Variations Detected by the Double Staining Techniquefor Ossified and Cartilaginous Skeleton in Rat Foetuses. Congenital Anomalies 32, 381-391.
(9) Kimmel, C.A. et al. (1993) Skeletal Development Following Heat Exposure in the Rat. Teratology 47, 229-242.
(10) Marr, M.C. et al. (1988) Comparison of Single and Double Staining for Evaluation of Skeletal Development: The Effects of Ethylene Glycol (EG) in CD Rats. Teratology 37, 476.
(11) Barrow, M.V. and Taylor, W.J. (1969) A Rapid Method for Detecting Malformations in Rat Foetuses. Journal of Morphology 127:291-306.
(12) Fritz, H. (1974) Prenatal Ossification in Rabbits ss Indicative of Foetal Maturity. Teratology 11, 313–320.
(13) Gibson, J.P. et al. (1966) Use of the Rabbit in Teratogenicity Studies. Toxicology and Applied Pharmacology 9, 398–408.
(14) Kimmel, C.A. and Wilson, J.G. (1973) Skeletal Deviation in Rats: Malformations or Variations? Teratology 8, 309–316.
(15) Marr, M.C. et al. (1992) Developmental Stages of the CD (Sprague-Dawley) Rat Skeleton after Maternal Exposure to Ethylene Glycol. Teratology 46, 169–181.
(16) Monie, I.W. et al. (1965) Dissection Procedures for Rat Foetuses Permitting Alizarin Red Staining of Skeleton and Histological Study of Viscera. Supplement to Teratology Workshop Manual, pp. 163–173.
(17) Spark, C. and Dawson, A.B. (1928) The Order and Time of appearance of Centers of Ossification in the Fore and Hind Limbs of the Albino Rat, with Special Reference to the Possible Influence of the Sex Factor. American Journal of Anatomy 41, 411–445.
(18) Staples, R.E. and Schnell, V.L. (1964) Refinements in Rapid Clearing Technique in the KOH-Alizarin Red S Method for Fetal Bone. Stain Technology 39, 61–63.
(19) Strong, R.M. (1928) The Order Time and Rate of Ossification of the Albino Rat (Mus Norvegicus Albinus) Skeleton. American Journal of Anatomy 36, 313–355.
(20) Stuckhardt, J.L. and Poppe, S.M. (1984) Fresh Visceral Examination of Rat and Rabbit Foetuses Used in Teratogenicity Testing. Teratogenesis, Carcinogenesis, and Mutagenesis 4, 181–188.
(21) Walker, D.G. and Wirtschafter, Z.T. (1957) The Genesis of the Rat Skeleton. Thomas, Springfield, IL.
(22) Wilson, J.G. (1965) Embryological Considerations in Teratology. In Teratology: Principles and Techniques, Wilson J.G. and Warkany J. (eds). University of Chicago, Chicago, IL, pp 251–277.
(23) Wilson, J.G. and Fraser, F.C. (eds). (1977) Handbook of Teratology, Vol. 4. Plenum, NY.
(24) Varnagy, L. (1980) Use of Recent Fetal Bone Staining Techniques in the Evaluation of Pesticide Teratogenicity. Acta Vet. Acad. Sci. Hung. 28, 233–239.
(25) Staples, R.E. (1974) Detection of visceral Alterations in Mammalian Foetuses. Teratology 9, 37–38.
(26) Van Julsingha, E.B. and C.G. Bennett (1977) A Dissecting Procedure for the Detection of Anomalies in the Rabbit Foetal Head. In: Methods in Prenatal Toxicology Neubert, D., Merker, H.J. and Kwasigroch, T.E. (eds.). University of Chicago, Chicago, IL, pp. 126–144.
(27) US Environmental Protection Agency (1991) Guidelines for Developmental Toxicity Risk Assessment. Federal Register 56, 63798–63826.
(28) Wise, D.L. et al. (1997) Terminology of Developmental Abnormalities in Common Laboratory Mammals (Version 1) Teratology 55, 249–292.
B.32 PRESKUS RAKOTVORNOSTI
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Preskusna snov se običajno daje sedem dni na teden na ustrezen način nekaj skupinam preskusnih živali, in sicer po en odmerek na skupino večji del življenjske dobe živali. Med in po izpostavljenosti preskusni snovi se živali opazujejo dnevno, da bi se odkrilo znake strupenosti, zlasti razvoj tumorjev.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Živali se vzdržujejo v preskusnih nastanitvenih in prehranjevalnih pogojih najmanj pet dni pred preskusom. Pred preskusom se naključno izberejo zdrave mlade živali in se razporedijo v preskusne ter kontrolne skupine.
1.6.1
Na podlagi rezultatov predhodno opravljenih študij je mogoče uporabiti tudi druge vrste (glodalce ali neglodalce). Uporabiti je treba splošno uporabljene laboratorijske seve mladih zdravih živali, dajanje odmerkov pa naj se začne čim prej, potem ko se žival odstavi od sesanja.
Na začetku študije nihanje v teži uporabljenih živali ne sme presegati ± 20 % srednje vrednosti. Kadar se subkronična oralna študija izvaja kot predhodnica dolgodobni študiji, je treba v obeh študijah uporabiti isto vrsto/pasmo in sev.
1.6.2
Pri glodalcih je treba za vsako velikost odmerka in sočasno kontrolno skupino uporabiti najmanj 100 živali (50 samic in 50 samcev). Samice naj bodo nuliparne in nebreje. Če so načrtovana vmesna žrtvovanja, je treba število povečati za število živali, ki naj bi bile žrtvovane še pred zaključkom študije.
1.6.3
Uporabiti je treba najmanj tri velikosti odmerkov poleg sočasne kontrolne skupine. Najvišja velikost odmerka bi morala sprožiti znake minimalne strupenosti, kot je rahel zastoj pri pridobivanju telesne mase (manj kot 10 %), ne da bi se pri tem bistveno spremenila normalna življenjska doba zaradi drugih učinkov, razen tumorjev.
Najnižja velikost odmerka ne sme vplivati na normalno rast, razvoj in življenjsko dobo živali ali povzročiti kakršne koli znake strupenosti. Na splošno ta ne sme biti nižja od 10 % visokega odmerka.
Srednje velik odmerek ali odmerke je treba določiti na sredini med visokimi in nizkimi odmerki.
Pri izbiranju velikosti odmerka je treba upoštevati podatke iz predhodnih preskusov in študij strupenosti.
Pogostost izpostavljenosti je običajno dnevna.
Če se kemikalija daje v pitni vodi ali vmeša v hrano, mora biti ta ves čas na voljo.
1.6.4
Uporabiti je treba sočasno kontrolno skupino, ki je v vseh ozirih identična preskusnim skupinam, razen glede izpostavljenosti preskusni snovi.
V posebnih okoliščinah, kot so inhalacijske študije z aerosoli ali uporaba emulgatorjev v oralnih študijah, katerih biološka aktivnost ni znana, je treba uporabiti dodatno kontrolno skupino, ki ni izpostavljena nosilcu.
1.6.5
Trije glavni načini dajanja so oralni, dermalni in inhalacijski. Izbira načina dajanja je odvisna od fizikalnih in kemijskih lastnosti preskusne snovi in verjetnega načina izpostavljenosti pri ljudeh.
1.6.5.1 Oralne študije
Kadar se preskusna snov absorbira iz prebavnega trakta in če je zaužitje eden od možnih načinov izpostavljenosti ljudi, ima, razen v primeru kontraindikacij, prednost oralni način dajanja. Živali lahko preskusno snov sprejmejo s hrano, raztopljeno v pitni vodi ali v kapsuli.
Najprimerneje je dajati odmerke sedem dni na teden, saj se s petdnevnim dajanjem odmerkov na teden dopušča okrevanje ali odprava strupenosti v času, ko se odmerkov ne daje, to pa bi vplivalo na rezultat ter poznejšo oceno. Vendar pa na podlagi praktičnih ugotovitev velja, da je tudi petdnevno dajanje odmerkov na teden sprejemljivo.
1.6.5.2 Dermalne študije
Odločiti se je mogoče za izpostavljenost z barvanjem kože, s čimer se simulira glavni način izpostavljenosti človeka, kar služi kot modelni sistem za povzročitev kožnih lezij.
1.6.5.3 Inhalacijske študije
Ker inhalacijske študije povzročajo kompleksnejše tehnične težave kot drugi načini dajanja, so na tem mestu podane podrobnejše smernice v zvezi s tem načinom dajanja. Upoštevati je treba tudi to, da je lahko v posebnih primerih veljavna alternativa intratrahealna instilacija.
Dolgotrajne izpostavljenosti so običajno zasnovane po vzorcu predvidene izpostavljenosti ljudi, pri čemer se živali izpostavlja ali šest ur na dan po izenačitvi koncentracij v komori, in sicer pet dni na teden (izpostavljenost s prekinitvami), ali, ustrezno možni izpostavljenosti preko okolja, 22 do 24 ur na dan sedem dni na teden (stalna izpostavljenost), pri čemer je približno ena ura na dan približno ob istem času namenjena hranjenju živali in vzdrževanju komor. V obeh primerih so živali običajno izpostavljene nespremenljivim koncentracijam preskusne snovi. Velika razlika med izpostavljenostjo s prekinitvami in stalno izpostavljenostjo je v tem, da ima prva 17- do 18-urno obdobje, v katerem lahko živali okrevajo od učinkov vsakodnevne izpostavljenosti, s celo daljšimi obdobji okrevanja med vikendi.
Izbira med izpostavljenostjo s prekinitvami in stalno izpostavljenostjo je odvisna od ciljev študije in izpostavljenosti ljudi, ki na bi se jo simuliralo. Vendar je treba upoštevati tudi nekatere tehnične težave. Na primer prednosti stalne izpostavljenosti pri simulaciji okoljskih pogojev lahko izniči potreba po napajanju in hranjenju med izpostavljenostjo in potreba po bolj zapletenih (in zanesljivih) tehnikah sproščanja aerosola in hlapov ter tehnikah spremljanja.
1.6.6
Živali je treba preskušati v komorah za inhalacijo, ki so oblikovane tako, da ohranijo dinamičen pretok zraka v količini najmanj 12 sprememb zraka na uro, s čimer se zagotovi ustrezna vsebnost kisika in enakomerno porazdeljeno ozračje izpostavljenosti. Kontrolne komore in komore za izpostavljanje morajo biti po strukturi in obliki identične, da se zagotovijo primerljivi pogoji izpostavljenosti, v vseh ozirih, razen glede izpostavljenosti preskusnim snovem. Na splošno se znotraj komore vzdržuje rahel negativen pritisk, da bi se preprečilo uhajanje preskusne snovi v okolico. Natrpanost s preskusnimi živalmi v komorah naj bo minimalna. Na splošno velja, da naj za zagotovitev stabilnosti ozračja v komori skupna količina preskusnih živali ne presega 5 % prostornine preskusne komore.
Meritve ali spremljanje naj zajema:
(i) Pretok zraka: stopnjo pretoka zraka skozi komoro je treba stalno spremljati;
(ii) Koncentracijo: med vsakodnevno izpostavljenostjo, naj preskusna snov ne odstopa za več kot ± 15 % od srednje vrednosti. Med celotno študijo naj bodo vsakodnevne koncentracije kolikor je mogoče nespremenljive;
(iii) Temperatura in vlažnost: pri glodalcih je treba temperaturo ohranjati na 22 ± 2 oC, vlažnost v komori pa med 30 % in 70 %, razen kadar se uporabi voda za suspendiranje preskusne snovi v ozračju komore. Najprimerneje je oboje stalno spremljati;
(iv) Meritve velikosti delcev: v ozračjih komor s tekočimi ali trdnimi aerosoli je treba določiti porazdelitev velikosti delcev. Delci aerosolov morajo biti take velikosti, da jih uporabljena preskusna žival lahko vdihne. Vzorce ozračij komor je treba vzeti v območju dihanja živali. Vzorec zraka mora predstavljati porazdelitev delcev, katerim so živali izpostavljene, in mora na gravimetrični podlagi predstavljati ves suspendiran aerosol, tudi kadar večina aerosola ni vdihljiva. Analizo velikosti delcev je treba opraviti pogosto v času razvijanja sproščanja koncentracij, da bi se zagotovila stabilnost aerosola, po potrebi pa tudi pozneje med izpostavljenostjo, da bi se ustrezno določila doslednost porazdelitve delcev, ki so jim živali izpostavljene.
1.6.7
Trajanje preskusa rakotvornosti zajema večji del normalne življenjske dobe živali. Preskus na miših in hrčkih naj se zaključi pri 18. mesecih, na podganah pa pri 24. mesecih; v primeru nekaterih živalskih sevov z daljšo življenjsko dobo in/ali nižjo spontano stopnjo tumorjev, pa naj se preskus na miših in hrčkih zaključi pri 24. mesecih, na podganah pa pri 30. mesecih. Sprejemljivo je tudi, da se tako podaljšana študija zaključi, ko število preživelih živali v skupini z najnižjim odmerkom ali v kontrolni skupini doseže 25 %. Kadar se zaključi preskus, v katerem gre za očitno razliko v odzivu glede na spol, je treba vsak spol obravnavati posebej. Kadar zaradi očitnih znakov strupenosti pride do prezgodnje smrti samo v skupini z visokim odmerkom, to ne pomeni, da je treba preskus zaključiti, če pojav strupenosti v drugih skupinah ne povzroča težav. Da bi bil negativen rezultat sprejemljiv, v nobeni skupini ne sme priti do več kot 10 % izgube živali zaradi avtolize, kanibalizma ali težav z izvajanjem, in preživetje v vseh skupinah v 18. mesecu pri miših in hrčkih ter v 24. mesecu pri podganah ne sme biti manjše od 50 %.
1.6.8
1.6.8.1
Vsakodnevno opazovanje v kletkah naj vključuje spremembe na koži in krznu, v očeh in sluznicah, ter v dihalnem in krvožilnem sistemu, avtonomnem in osrednjem živčnem sistemu, somatomotorični aktivnosti ter vedenj skem vzorcu.
Redno opazovanje živali je potrebno za zagotovitev, da če je le mogoče med preskusom ne pride do izgube živali zaradi kanibalizma, avtolize tkiv ali napačne postavitve. Kadar se opazi umirajoče živali, jih je treba odstraniti in opraviti nekropsijo.
Za vse živali je treba zabeležiti klinične znake in smrtnost. Posebno pozornost je treba posvetiti razvoju tumorjev: zabeležiti je treba čas nastopa, mesto, velikosti, videz in napredovanje vseh makroskopsko vidnih ali otipljivih tumorjev.
Porabo hrane (in porabo vode, kadar se preskusna snov daje s pitno vodo) je treba v prvih 13-ih tednih študije meriti tedensko, potem pa približno v tri mesečnih časovnih presledkih, razen če spremembe zdravstvenega stanja ali telesne mase ne zahtevajo drugače.
Telesno maso vsake posamezne živali je treba v prvih 13-ih mesecih preskusnega obdobja zabeležiti enkrat tedensko, potem pa še najmanj enkrat na štiri tedne.
1.6.8.2
Če opazovanja v kletkah kažejo na poslabšanje zdravja živali med študijo, je treba na obolelih živalih opraviti pregled diferencialne krvne slike.
V 12. mesecu, 18. mesecu in tik pred žrtvovanjem se živalim odvzame vzorec krvi. Pregled diferencialne krvne slike se opravi na vzorcih živali iz skupine z najvišjim odmerkom ter kontrolnih skupin. Če se na podlagi teh podatkov, zlasti tistih, pridobljenih tik pred žrtvovanjem, ali podatkov, dobljenih po patološkem pregledu, pokaže potreba, je treba opraviti pregled diferencialne krvne slike tudi na naslednji skupini ali skupinah z nižjim odmerkom.
Popolno makroskopsko nekropsijo je treba opraviti na vseh živalih, vključno s tistimi, ki so umrle med preskusom ali so bile žrtvovane potem, ko se je odkrilo, da so v umirajočem stanju. Vse velike vidne lezije, tumorje ali lezije, pri katerih gre za sum tumorja, je treba shraniti.
Naslednje organe in tkiva je treba shraniti v ustreznem mediju za morebitne poznejše histopatološke preiskave: možgane (vključno z deli podaljšane hrbtenjače/mosta, skorjo malih možganov in možgansko skorjo), hipofizo, ščitnico/obščitnico in tkiva priželjca, sapnik in pljuča, srce, aorto, žleze slinavke, jetra, vranico, ledvice, nadledvične žleze, trebušno slinavko, spolne žleze, maternico, pomožne spolne organe, kožo, požiralnik, želodec, dvanajsternik, zgornje tanko črevo, spodnje tanko črevo, slepo črevo, debelo črevo, danko, sečni mehur, reprezentativni limfni vozel, mlečno žlezo samice, stegensko mišičevje, periferni živec, prsnica s kostnim mozgom, stegnenico (vključno s sklepom), hrbtenjačo na treh ravneh (vrtni, prsni in ledveni) in oči.
Vpihovanje pljuč in sečnega mehurja s fiksativom je najboljši način za ohranitev teh tkiv; vpihovanje pljuč pri inhalacijskih študijah je nujno za ustrezno histopatološko preiskavo. V posebnih študijah, kot so inhalacijske študije, je treba ohraniti celotna dihala, vključno z nosno votlino, žrelom in grlom.
(a) Temeljito histopatološko preiskavo je treba opraviti na organih in tkivih vseh živali, ki so umrle ali bile žrtvovane med preskusom in na živalih iz kontrolne skupine in skupine z visokim odmerkom.
(b) V vseh skupinah je treba mikroskopsko pregledati vse velike vidne tumorje ali lezije, pri katerih se sumi na tumor.
(c) Če gre za bistveno razliko pri pojavu neoplastičnih lezij v skupini z visokim odmerkom in kontrolni skupini, je treba opraviti histopatološko preiskavo na teh organih tudi v drugih skupinah.
(d) Če je preživelih živali v skupini z visokim odmerkom bistveno manj kot v kontrolni skupini, je treba v celoti pregledati naslednjo skupino z nižjim odmerkom.
(e) Če v skupini z visokim odmerkom obstajajo znaki o povzročitvi strupenih ali drugih učinkov, ki bi lahko vplivali na neoplastični odgovor, je treba v celoti pregledati naslednjo skupino z nižjim odmerkom.
2. PODATKI
Podatki se povzamejo v obliki tabele, iz katere je za vsako preskusno skupino razvidno število živali na začetku preskusa, število živali, pri katerih so opaženi tumorji, odkriti med preskusom, čas odkritja in število živali, na katerih so bili tumorji odkriti po žrtvovanju. Rezultate je treba oceniti z ustrezno statistično metodo. Uporabiti je mogoče katero koli priznano statistično metodo.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— vrsta, sev, vir, okoljski pogoji, hrana,
— preskusni pogoji:
—Opis opreme za izpostavljenost:
vključno z obliko, tipom, dimenzijami, virom zraka, sistemom za sproščanje delcev in aerosolov, metodo klimatiziranja, obdelavo izpušnega zraka in metodo nastanitve živali v preskusne komore, kadar so te uporabljene. Opisati je treba opremo za merjenje temperature, vlažnosti in, kadar je ustrezno, stabilnosti koncentracij aerosola ali velikosti delcev.
Podatki o izpostavljenosti:
Zbrati jih je treba v tabeli in prikazati s srednjimi vrednostmi ter meritvami nihanj (npr. standardno odstopanje), zajemati pa morajo:
(a) stopnje pretoka zraka skozi naprave za inhalacijo;
(b) temperaturo in vlažnost zraka;
(c) nominalne koncentracije (skupna količina preskusne snovi, dane v naprave za inhalacijo deljeno z prostornino zraka);
(d) vrsto nosilca, če je ta uporabljen;
(e) dejanske koncentracije na preskusnem dihalnem območju;
(f) mediano velikosti delcev (kjer je to primerno),
— velikosti odmerkov (vključno z nosilcem, če je uporabljen) in koncentracije,
— pojavnost tumorjev po spolu, odmerku in tipu tumorja,
— čas smrti med študijo ali preživetje živali do zaključka,
— podatki o odzivu strupenosti po spolu in koncentraciji,
— opis strupenih ali drugih učinkov,
— čas opazovanja vsakega znaka abnormalnosti in njegov nadaljnji potek,
— podatki o hrani in telesni masi,
— opravljeni hematološki preskusi in vsi rezultati,
— ugotovitve nekropsije,
— podroben opis vseh histopatoloških ugotovitev,
— statistična obdelava rezultatov z opisom uporabljene metode,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.33 KOMBINIRAN PRESKUS KRONIČNE STRUPENOSTI/RAKOTVORNOSTI
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Cilj kombiniranega preskusa strupenosti/rakotvornosti je opredeliti kronične in rakotvorne učinke snovi na vrstah sesalcev po dolgotrajni izpostavljenosti.
Zaradi tega se preskusu rakotvornosti doda najmanj ena preskusna satelitska skupina in kontrolna satelitska skupina. Odmerek v satelitski skupini z visokim odmerkom je lahko večji od odmerka za skupino z visokim odmerkom v preskusu rakotvornosti. Živali v preskusu rakotvornosti se pregledajo za splošno strupenost, ter za rakotvorni odziv. Živali iz preskusne satelitske skupine se pregledajo za splošno strupenost.
Preskusna snov se običajno daje sedem dni na teden na ustrezen način nekaj skupinam preskusnih živali, in sicer po en odmerek na skupino, večji del življenjske dobe živali. Med in po izpostavljenosti preskusni snovi se živali opazujejo dnevno, da bi se odkrilo znake strupenosti, zlasti razvoj tumorjev.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Živali se vzdržujejo v preskusnih nastanitvenih in prehranjevalnih pogojih najmanj pet dni pred preskusom. Pred preskusom se naključno izberejo zdrave mlade živali in se razporedijo v preskusne ter kontrolne skupine.
1.6.1
Priporočena vrsta je podgana. Na podlagi rezultatov predhodno opravljenih študij je mogoče uporabiti tudi druge vrste (glodalce ali neglodalce). Uporabiti je treba splošno uporabljene laboratorijske seve mladih zdravih živali, dajanje odmerkov pa naj se začne čim prej, potem ko se žival odstavi od sesanja.
Na začetku preskusa nihanje v teži uporabljenih živali ne sme presegati ± 20 % srednje vrednosti. Kadar se subkronična oralna študija izvaja kot predhodnica dolgodobni študiji, je treba v obeh študijah uporabiti isto vrsto in pasmo/sev.
1.6.2
Pri glodalcih je treba za vsako velikost odmerka in sočasno kontrolno skupino uporabiti najmanj 100 živali (50 samic in 50 samcev). Samice naj bodo nuliparne in nebreje. Če so načrtovana vmesna žrtvovanja, je treba število povečati za število živali, ki naj bi bile žrtvovane še pred zaključkom študije.
Preskusna satelitska skupina ali skupine za oceno drugih bolezni, razen tumorjev, naj vsebuje po 20 živali vsakega spola, medtem ko naj satelitska kontrolna skupina vsebuje po 10 živali vsakega spola.
1.6.3
Za namene preskusa rakotvornosti je treba uporabiti najmanj tri velikosti odmerka poleg sočasne kontrolne skupine. Najvišja velikost odmerka bi morala sprožiti znake minimalne strupenosti, kot je rahel zastoj pri pridobivanju telesne mase (manj kot 10 %), ne da bi se pri tem bistveno spremenila normalna življenjska doba zaradi drugih učinkov, razen tumorjev.
Najnižja velikost odmerka ne sme vplivati na normalno rast, razvoj in življenjsko dobo živali ali povzročiti kakršne koli znake strupenosti. Na splošno ta ne sme biti nižja od 10 % visokega odmerka.
Srednje velik odmerek ali odmerke je treba določiti na sredini med visokimi in nizkimi odmerki.
Pri izbiranju velikosti odmerka je treba upoštevati podatke iz predhodnih preskusov in študij strupenosti.
Za namene preskusa kronične strupenosti se v preskus vključijo dodatne preskusne skupine in sočasna kontrolna satelitska skupina. Visok odmerek mora na živalih iz preskusne satelitske skupine povzročiti jasne znake strupenosti.
Pogostost izpostavljenosti je običajno dnevna.
Če se kemikalija daje v pitni vodi ali vmeša v hrano, mora biti ta ves čas na voljo.
1.6.4
Uporabiti je treba sočasno kontrolno skupino, ki je v vseh ozirih identična preskusnim skupinam, razen glede izpostavljenosti preskusni snovi.
V posebnih okoliščinah, kot so inhalacijske študije z aerosoli ali uporaba emulgatorjev v oralnih študijah, katerih biološka aktivnost ni znana, je treba uporabiti dodatno kontrolno skupino, ki ni izpostavljena nosilcu.
1.6.5
Trije glavni načini dajanja so oralni, dermalni in inhalacijski. Izbira načina dajanja je odvisna od fizikalnih in kemijskih lastnosti preskusne snovi in verjetnega načina izpostavljenosti ljudi.
1.6.5.1 Oralni preskusi
Kadar se preskusna snov absorbira iz prebavnega trakta in če je zaužitje eden od načinov izpostavljenosti ljudi, ima prednost oralni način dajanja, razen v primeru kontraindikacij. Živali lahko preskusno snov sprejmejo s hrano, raztopljeno v pitni vodi ali v kapsuli.
Najprimerneje je dajati odmerke sedem dni na teden, saj se s petdnevnim dajanjem odmerkov na teden dopušča okrevanje ali odprava strupenosti v času, ko se odmerkov ne daje, to pa bi vplivalo na rezultat ter poznejšo oceno. Vendar pa na podlagi praktičnih ugotovitev velja, da je tudi petdnevno dajanje odmerkov na teden sprejemljivo.
1.6.5.2 Dermalni preskusi
Odločiti se je mogoče za izpostavljenost z barvanjem kože, s čimer se simulira glavni način izpostavljenosti človeka in kar služi kot modelni sistem za povzročitev kožnih lezij.
1.6.5.3 Inhalacijski preskusi
Ker inhalacijski preskusi povzročajo kompleksnejše tehnične težave kot drugi načini dajanja, so na tem mestu podane podrobnejše smernice v zvezi s tem načinom dajanja. Zapomniti si je treba tudi to, da je lahko v posebnih primerih veljavna alternativa intratrahealna instilacija.
Dolgotrajne izpostavljenosti so običajno zasnovane po vzorcu predvidene izpostavljenosti ljudi, pri čemer se živali izpostavlja ali šest ur na dan po izenačitvi koncentracij v komori, in sicer pet dni na teden (izpostavljenost s prekinitvami), ali, ustrezno možni izpostavljenosti preko okolja, 22 do 24 ur na dan sedem dni na teden (stalna izpostavljenost), pri čemer je približno ena ura na dan približno ob istem času namenjena hranjenju živali in vzdrževanju komor. V obeh primerih so živali običajno izpostavljene nespremenljivim koncentracijam preskusne snovi. Bistvena razlika med izpostavljenostjo s prekinitvami in stalno izpostavljenostjo je v tem, da ima prva 17- do 18-urno obdobje, v katerem lahko živali okrevajo od učinkov vsakodnevne izpostavljenosti, s celo daljšimi obdobji okrevanja med vikendi.
Izbira med izpostavljenostjo s prekinitvami in stalno izpostavljenostjo je odvisna od ciljev preskusa in izpostavljenosti ljudi, ki naj bi se jo simuliralo. Vendar je treba upoštevati tudi nekatere tehnične težave. Na primer, prednosti stalne izpostavljenosti pri simulaciji okoliških pogojev lahko izniči potreba po napajanju in hranjenju med izpostavljenostjo in potreba po bolj zapletenih (in zanesljivih) tehnikah sproščanja aerosola in hlapov ter tehnikah spremljanja.
1.6.6
Živali je treba preskušati v komorah za inhalacijo, ki so oblikovane tako, da ohranijo dinamičen pretok zraka v količini najmanj 12 sprememb zraka na uro, s čimer se zagotovi ustrezna vsebnost kisika in enakomerno porazdeljeno ozračje izpostavljenosti. Kontrolne komore in komore za izpostavljanje morajo biti po strukturi in obliki identične, da se zagotovijo primerljivi pogoji izpostavljenosti, v vseh ozirih, razen glede izpostavljenosti preskusnim snovem. Na splošno se znotraj komore vzdržuje rahel negativen pritisk, da bi se preprečilo uhajanje preskusne snovi v okolico. Natrpanost s preskusnimi živalmi v komorah naj bo minimalna. Na splošno velja, da naj za zagotovitev stabilnosti ozračja v komori skupna količina preskusnih živali ne presega 5 % prostornine preskusne komore.
Meritve ali spremljanje naj zajema:
(i) pretok zraka: stopnjo pretoka zraka skozi komoro je treba stalno spremljati;
(ii) koncentracijo: med vsakodnevno izpostavljenostjo, naj preskusna snov ne odstopa za več kot ± 15 % od srednje vrednosti. Med celotno študijo naj bodo vsakodnevne koncentracije kolikor je mogoče nespremenljive;
(iii) temperatura in vlažnost: pri glodalcih je treba temperaturo ohranjati na 22 ± 2 oC, vlažnost v komori pa med 30 % in 70 %, razen kadar se uporabi voda za suspendiranje preskusne snovi v ozračju komore. Najprimerneje je oboje stalno spremljati;
(iv) meritve velikosti delcev: v ozračjih komor s tekočimi ali trdnimi aerosoli je treba določiti porazdelitev velikosti delcev. Delci aerosolov morajo biti take velikosti, da jih uporabljena preskusna žival lahko vdihne. Vzorce ozračij komor je treba vzeti v območju dihanja živali. Vzorec zraka mora predstavljati porazdelitev delcev, katerim so izpostavljene živali, in mora na gravimetrični podlagi predstavljati ves suspendiran aerosol, tudi kadar večina aerosola ni vdihljiva. Analizo velikosti delcev je treba opraviti pogosto v času razvijanja sproščanja koncentracij, da bi se zagotovila stabilnost aerosola, po potrebi pa tudi pozneje med izpostavljenostjo, da bi se ustrezno določila doslednost porazdelitve delcev, ki so jim živali izpostavljene.
1.6.7
Trajanje dela preskusa, ki se tiče rakotvornosti, zajema večji del normalne življenjske dobe živali. Preskus naj se na miših in hrčkih zaključi pri 18. mesecih, na podganah pa pri 24. mesecih; kljub temu pa naj se v primeru nekaterih živalskih sevov z daljšo življenjsko dobo in/ali nižjo spontano stopnjo tumorjev, preskus na miših in hrčkih zaključi pri 24. mesecih, na podganah pa pri 30. mesecih. Sprejemljivo pa je tudi, da se tako podaljšana študija zaključi, ko število preživelih živali v skupini z najnižjim odmerkom ali v kontrolni skupini doseže 25 %. Kadar se zaključi preskus, v katerem gre za očitno razliko v odzivu glede na spol, je treba vsak spol obravnavati posebej. Kadar zaradi očitnih znakov strupenosti pride do prezgodnje smrti samo v skupini z visokim odmerkom, to ne pomeni, da je treba preskus zaključiti, če pojav strupenosti v drugih skupinah ne povzroča težav. Da bi bil negativen rezultat sprejemljiv, v nobeni skupini ne sme priti do več kot 10 % izgube živali zaradi avtolize, kanibalizma ali težav z izvajanjem, preživetje v 18. mesecu pri miših in hrčkih ter v 24. mesecu pri podganah pa ne sme biti v nobeni skupini manjše od 50 %.
Satelitske skupine 20 tretiranih živali vsakega spola ter 10 živali vsakega spola iz spremljajoče kontrolne skupine, uporabljene za preskus kronične strupenosti je treba ohraniti v preskusu najmanj 12 mesecev. Te živali je treba nameniti za žrtvovanje za pregled s preskusno snovjo povezane patologije, na katero ne vplivajo gerontološke spremembe.
1.6.8
1.6.8.1
Opraviti je treba vsakodnevna opazovanja v kletkah, ki naj vključujejo spremembe na koži in krznu, v očeh in sluznicah, ter v dihalnem in krvožilnem sistemu, avtonomnem in osrednjem živčnem sistemu, somatomotorični aktivnosti ter vedenj skem vzorcu.
Klinične preglede na živalih v tretirani satelitski skupini ali skupinah je treba opraviti v ustreznih časovnih presledkih.
Redno opazovanje živali je potrebno za zagotovitev, da med preskusom ne pride do izgube živali zaradi kanibalizma, avtolize tkiv ali napačne postavitve. Ko se opazi umirajoče živali, jih je treba odstraniti in opraviti nekropsijo.
Klinične znake vključno z nevrološkimi in očesnimi spremembami, ter smrtnostjo je treba zabeležiti pri vseh živalih. Posebno pozornost je treba nameniti razvoju tumorjev: zabeležiti je treba čas nastopa, mesto, velikosti, videz in napredovanje vseh makroskopsko vidnih ali otipljivih tumorjev; zabeležiti je treba tudi čas nastopa in napredovanje strupenih stanj.
Porabo hrane (in porabo vode, kadar se preskusna snov daje s pitno vodo) je treba v prvih 13 tednih študije meriti tedensko, potem pa približno v tri mesečnih časovnih presledkih, razen če spremembe zdravstvenega stanja ali telesne mase ne zahtevajo drugače.
Telesno maso vsake posamezne živali je treba enkrat v prvih 13. mesecih preskusnega obdobja zabeležiti tedensko, potem pa najmanj enkrat na štiri tedne.
1.6.8.2
Hematološka preiskava (npr. vsebnost hemoglobina, hematokrit, skupno število eritrocitov, skupno število levkocitov, trombocitov ali druga merjenja zmožnosti koagulacije) je treba opraviti pri treh mesecih, šestih mesecih, potem pa približno v šest mesečnih časovnih presledkih in ob zaključku na vzorcih krvi, odvzetih pri 10. podganah/spol iz vseh skupin. Če je mogoče, naj bodo krvni vzorci vsakokrat odvzeti istim podganam.
Če klinična opažanja kažejo na poslabšanje zdravja živali med študijo, je treba na obolelih živalih opraviti pregled diferencialne krvne slike. Pregled diferencialne krvne slike se opravi na vzorcih živali iz skupine z najvišjim odmerkom ter kontrolah. Na naslednji skupini ali skupinah z nizkim odmerkom se pregled diferencialne krvne slike opravi le, kadar gre za večjo neskladnost med skupino z najvišjim odmerkom in kontrolnimi skupinami, ali kadar pride do patoloških ugotovitev.
Za analizo je treba odvzeti vzorce urina pri 10. podganah/spol iz vseh skupin, če je mogoče, vsakokrat istim podganam, tako kot pri hematološki preiskavi. Za vsako posamezno žival ali skupino vzorcev/spol/skupino pri glodalcih je treba določiti naslednje:
— videz: prostornina in gostota pri posamezni živali,
— proteini, glukoza, ketoni, kri (polkvantitativno določanje),
— mikroskopija sedimenta (polkvantitativno določanje).
V približno šest mesečnih časovnih presledkih in ob zaključku se pri vseh neglodalcih in pri 10-ih podganah/spol iz vseh skupin, po možnosti vsakokrat istim podganam, odvzamejo vzorci krvi za meritve na področju klinične kemije. Poleg tega naj se na neglodalcih odvzame en vzorec še pred preskusom. Iz navedenih vzorcev se pripravi plazma in se določi naslednje:
— skupna koncentracija proteinov,
— koncentracija albumina,
— preskus delovanja jeter (kot je aktivnost alkalne fosfataze, aktivnost glutamične piruvične transaminaze (20) in aktivnost glutamične oksaloacetat transaminaze (20) gama-glutamil-transpeptidaza, ornitin-dekarboksilaza,
— presnova ogljikovih hidratov, kot je krvna glukoza na tešče,
— preskusi delovanja ledvic, kot je sečnina v krvi.
Popolno makroskopsko nekropsijo je treba opraviti na vseh živalih, vključno s tistimi, ki so umrle med preskusom ali so bile žrtvovane potem, ko se je odkrilo, da so v umirajočem stanju. Pred žrtvovanjem je treba vsem živalim odvzeti vzorce krvi za diferencialno krvno sliko. Vse velike vidne tumorje ali lezije, pri katerih gre za sum tumorja, je treba shraniti. Prizadevati si je treba za korelacijo makroskopskih opazovanj z mikroskopskimi ugotovitvami.
Vse organe in tkiva je treba shraniti za histopatološke preiskave. To po navadi zadeva naslednje organe in tkiva: možgane ( 21 ) (podaljšano hrbtenjačo/most, skorjo malih možganov in možgansko skorja), hipofizo, ščitnico (vključno z obščitnicami), priželjc, pljuča (vključno s sapnikom), srce, aorto, žleze slinavke, jetra (21) , vranico, ledvice (21) , nadledvične žleze (21) , požiralnik, želodec, dvanajsternik, zgornje tanko črevo, spodnje tanko črevo, slepo črevo, debelo črevo, danko, maternico, sečni mehur, limfne vozle, trebušno slinavko, spolne žleze (21) , pomožne spolne organe, mlečno žlezo samic, kožo, mišičevje, periferni živec, hrbtenjačo (vratni, prsni in ledveni del), prsnico s kostnim mozgom, stegnenico (vključno s sklepom) in oči.
Čeprav je vpihovanje pljuč in sečnega mehurja s fiksativom najboljši način za ohranitev teh tkiv, je vpihovanje pljuč v inhalacijskih študijah nujno zahtevano za ustrezno histopatološko preiskavo. V posebnih študijah, kot so inhalacijske študije, je treba proučiti celotna dihala, vključno z nosom, žrelom in grlom.
Če so opravljeni drugi klinični pregledi, morajo biti podatki, pridobljeni v teh postopkih, na voljo pred mikroskopskim pregledom, saj lahko to daje patologu pomembne smernice.
Za del, ki obsega preskus kronične strupenosti:
Opraviti je treba podroben pregled vseh ohranjenih organov vseh živali v satelitski skupini z visokim odmerkom in kontrolni skupini. Kadar se v satelitski skupini z visokim odmerkom odkrije s preskusno snovjo povezana patologija, je treba ob zaključku študije podrobni histopatološki preiskavi izpostaviti še ciljne organe vseh drugih živali iz vseh ostalih preskusnih satelitskih skupin, kot tudi tiste iz preskusnih skupin dela študije, ki obsega preskus rakotvornosti.
Za del, ki obsega preskus rakotvornosti:
(a) temeljito histopatološko preiskavo je treba opraviti na organih in tkivih vseh živali, ki so umrle ali bile žrtvovane med preskusom in na živalih iz kontrolne skupine in skupine z visokim odmerkom;
(b) v vseh skupinah je treba mikroskopsko pregledati vse makroskopsko vidne tumorje ali lezije, pri katerih se sumi na tumor;
(c) če gre za bistveno razliko pri pojavu neoplastičnih lezij v skupini z visokim odmerkom in kontrolni skupini, je treba opraviti histopatološko preiskavo na teh organih tudi v drugih skupinah;
(d) če je preživelih živali v skupini z visokim odmerkom bistveno manj kot v kontrolni skupini, je treba v celoti pregledati naslednjo skupino z nižjim odmerkom;
(e) če v skupini z visokim odmerkom obstajajo znaki o povzročitvi strupenih ali drugih učinkov, ki bi lahko vplivali na neoplastični odziv, je treba v celoti pregledati naslednjo skupino z nižjim odmerkom.
2. PODATKI
Podatki se povzamejo v obliki tabele, iz katere je za vsako preskusno skupino razvidno število živali na začetku preskusa, število živali, pri katerih so opaženi tumorji ali strupeni učinki, odkriti med preskusom, čas odkritja in število živali, na katerih so bili tumorji odkriti po žrtvovanju. Rezultate je treba oceniti z ustrezno statistično metodo. Uporabiti je mogoče katero koli priznano statistično metodo.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— vrsta, sev, vir, okoljski pogoji, hrana,
— preskusni pogoji:
—Opis opreme za izpostavljenost:
Vključno z obliko, tipom, dimenzijami, virom zraka, sistemom za sproščanje delcev in aerosolov, metodo klimatiziranja, obdelavo izpušnega zraka in metodo nastanitve živali v preskusne komore, kadar so te uporabljene. Opisati je treba opremo za merjenje temperature, vlažnosti in, kadar je ustrezno, stabilnosti koncentracij aerosola ali velikosti delcev.
Podatki o izpostavljenosti:
zbrati jih je treba v tabeli in prikazati s srednjimi vrednostmi ter meritvami nihanj (npr. standardno odstopanje), zajemati pa morajo:
(a) stopnje pretoka zraka skozi naprave za inhalacijo;
(b) temperaturo in vlažnost zraka;
(c) nominalne koncentracije (skupna količina preskusne snovi, dane v naprave za inhalacijo deljeno s prostornino zraka);
(d) vrsto nosilca, če je ta uporabljen;
(e) dejanske koncentracije v preskusnem dihalnem območju;
(f) mediano velikosti delcev (kjer je to primerno),
— velikosti odmerkov (vključno z nosilcem, če je uporabljen) in koncentracije,
— pojavnost tumorjev po spolu, odmerku in tipu tumorja;
— čas smrti med študijo ali preživetje živali do zaključka, vključno s satelitsko skupino,
— podatki o odzivu strupenosti po spolu in koncentraciji,
— opis strupenih ali drugih učinkov,
— čas opazovanja vsakega znaka abnormalnosti in njegov nadaljnji potek,
— oftalmološke ugotovitve,
— podatki o hrani in telesni masi,
— opravljeni hematološki preskusi in vsi rezultati,
— opravljeni klinično biokemijski preskusi in vsi rezultati (vključno z rezultati vsake analize urina),
— ugotovitve nekropsije,
— podroben opis vseh histopatoloških ugotovitev,
— statistična obdelava rezultatov z opisom uporabljene metode,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.34 PRESKUS STRUPENOSTI ZA RAZMNOŽEVANJE NA ENI GENERACIJI
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Preskusna snov se daje dnevno, v graduiranih odmerkih, nekaj skupinam samcev in samic. Samcem je treba dajati odmerke med rastjo in tekom najmanj enega zaključenega cikla spermatogeneze (približno 56 dni pri miših in 70 dni pri podganah), da bi preskusna snov lahko povzročila škodljive učinke na spermatogenezo.
Samicam iz starševske generacije (P) je treba odmerke dajati tekom najmanj dveh zaključenih pojatvenih ciklusov, da bi preskusna snov lahko povzročila škodljive učinke na pojatev. Živali se potem parijo. Preskusna snov se daje obema spoloma v času parjenja, pozneje pa samo še samicam v času brej osti in dokler traja dojenje. Za dajanje z inhalacijo je treba metodo prilagoditi.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
1.6.1
Pred preskusom se naključno izberejo zdrave mlade živali in se razporedijo v preskusne ter kontrolne skupine. Živali se vzdržujejo v preskusnih nastanitvenih in prehranjevalnih pogojih najmanj pet dni pred preskusom. Preskusno snov je priporočljivo dajati s hrano ali v pitni vodi. Sprejemljivi so tudi drugi načini dajanja. Vsem živalim je treba dajati odmerke z enako metodo v ustreznem preskusnem obdobju. Če se za lažje dajanje odmerkov uporabi nosilec ali drugi dodatki, se je treba prepričati, da le-ti ne povzročajo strupenih učinkov. Odmerke je treba dajati sedem dni na teden.
1.6.2
Priporočeni vrsti sta miš in podgana. Uporabiti je treba zdrave živali, ki niso bile izpostavljene predhodnim preskusnim postopkom. Sevi z nizko plodnostjo naj se ne uporabljajo. Preskusne živali je treba opredeliti po vrsti, sevu, spolu, teži in/ali starosti.
Za ustrezno oceno plodnosti je treba preučiti samce in samice. Vse preskusne in kontrolne živali je treba odstaviti od sesanja pred začetkom dajanja odmerkov.
Vsaka preskusna in kontrolna skupina naj ima zadostno število živali, da bo pri ali tik pred rokom skotitve vsebovala okrog 20 brejih samic.
Cilj je ustvariti zadosti primerov brej osti in mladičev, s čimer se zagotovi pomenljiva ocena zmožnosti učinkovanja snovi na plodnost, brej ost in materinsko vedenje v starševski P generaciji živali, ter na sesanje, rast in razvoj mladičev F1 od zaploditve do odstavitve od sesanja.
1.6.3
Hrano in vodo je treba priskrbeti ad libitum. Ko se bliža kotitev, je treba breje samice razvrstiti po materinskih kletkah ali kletkah za kotitev posamezno ter priskrbeti material za izdelavo gnezda.
1.6.3.1
Uporabiti je treba najmanj tri preskusne in eno kontrolno skupino. Če je pri dajanju preskusne snovi uporabljen nosilec, naj bi kontrolna skupina prejela nosilec v največji uporabljeni velikosti. Če preskusna snov povzroči manjši vnos ali izkoristek hrane, potem bi bila lahko potrebna uporaba paralelne kontrolne skupine za hrano. V najboljšem primeru najvišja velikost odmerka, razen če je ne omejujejo fizikalne/kemijske lastnosti ali biološki učinki preskusne snovi, povzroči strupenost, vendar ne smrtnosti, pri starševskih (P) živalih. Srednja velikost ali velikosti odmerka naj povzročijo minimalne strupene učinke, ki se jih lahko pripiše preskusni snovi, nizek odmerek pa ne bi sme povzročiti nikakršnih vidnih škodljivih učinkov na starših ali potomcih. Kadar se odmerek posameznim živalim daje z gavažo ali s kapsulo, ga je treba odmeriti na podlagi telesne mase posamezne živali in tedensko prilagajati spremembam telesne mase. Pri samicah v času brej osti lahko odmerki temeljijo na telesni masi na dan brej osti 0 ali 6, če je tako želeno.
1.6.3.2
V primeru snovi nizke strupenosti, kadar velikost odmerka najmanj 1 000 mg/kilogram ne povzroči nikakršnih znakov motenja razmnoževanja, študije pri drugih velikostih odmerka verjetno ne bodo potrebne. Če predhodna študija pri visoki velikosti odmerka z jasnimi znaki maternalne strupenosti ne pokaže nikakršnih škodljivih učinkov na plodnost, študije pri drugih velikosti odmerka verjetno ne bodo potrebne.
1.6.3.3 Izvajanje preskusa
Vsakodnevno dajanje odmerkov starševskim (P) samcem naj se začne pri starosti okrog pet do devet tednov, potem ko so že najmanj pet dni odstavljeni od sesanja in prilagojeni preskusnim pogojem. Pri podganah se dajanje odmerkov nadaljuje 10 tednov pred obdobjem parjenja (osem tednov pri miših). Samce je treba usmrtiti in pregledati ali na koncu obdobja parjenja ali pa se lahko ohranijo na preskusni hrani za morebitno produkcijo drugega zaroda in se usmrtijo in pregledajo enkrat pred koncem študije. Pri starševskih (P) samicah se dajanje odmerkov začne najmanj po petih dneh prilagajanja preskusnim pogojem in se nadaljuje najmanj dva tedna pred parjenjem. Vsakodnevno dajanje odmerkov starševskim samicam naj se nadaljuje še skozi tritedensko obdobje parjenja, brej osti in vse do odstavitve od sesanja mladičev F1. Upoštevati je treba spremembe časovnega razporeda dajanja odmerkov, utemeljenega na drugih razpoložljivih informacijah o preskusni snovi, kot je indukcija metabolizma ali bioakumulacije.
Pri preskusih strupenosti za razmnoževanje je mogoče uporabiti parjenje v razmerju ali 1:1 (en samec na eno samico) ali 1:2 (en samec na dve samici).
Pri parjenju 1:1 se samica nastani z istim samcem vse do spočetja ali dokler ne potečejo trije tedni. Vsako jutro se samice pregledajo za prisotnost semenčec ali vaginalnih zamaškov. Dan 0 brejosti je dan, ko se odkrije vaginalni zamašek ali semenčeca.
Tiste pare, ki se ne uspejo spariti, je treba preučiti, da bi se določil vzrok navidezne neplodnosti.
To lahko zajema postopke, kot so omogočanje dodatnih priložnosti za parjenje z drugimi dokazanimi očeti samci ali materami samicami, mikroskopski pregledi razmnoževalnih organov in pregled pojatvenega ciklusa ali spermatogeneze.
Živalim, ki jim je dan odmerek med študijo plodnosti, se omogoči, da skotijo na normalen način in vzredijo svoje mladiče do odstavitve od sesanja brez standardiziranja zarodov.
Kjer se opravi standardizirane zaroda, se predlaga naslednji postopek. V času od prvega do četrtega dne po skotitvi se lahko velikost vsakega zaroda prilagodi z izločitvijo odvečnih mladičev, da bi se dobilo, če je to mogoče, štiri samce in štiri samice na zarod.
Kadar število mladih samcev in samic ne omogoča, da bi jih v vsakem zarodu bilo po štiri na spol, je sprejemljiva tudi delna prilagoditev (na primer, pet samcev in tri samice). Prilagoditve se ne uporabljajo za primer zarodov z manj kot osmimi mladiči.
1.6.4
Tekom celotnega preskusnega obdobja je treba žival opazovati najmanj enkrat dnevno. Ustrezne vedenjske spremembe, znake težke ali podaljšane kotitve in vse znake strupenosti, vključno s smrtnostjo, je treba zabeležiti. V obdobju pred in med parjenjem je treba vsak dan meriti porabo hrane. Po kotitvi in v času dojenja je treba merjenje porabe hrane (hkrati z merjenjem porabe vode, kadar se preskusna snov daje s pitno vodo) meriti na isti dan, kot se tehta zarod. Starševske samce in samice je treba stehtati prvi dan dajanja odmerka, potem pa enkrat tedensko. O navedenih opazovanjih je treba poročati za vsako odraslo žival posebej.
Trajanje brej osti je treba računati od dneva 0 brej osti. Vsak zarod je treba pregledati čim prej po skotitvi, da bi se določilo število in spol mladičev, mrtvorojene in živorojene živali ter prisotnost vidnih anomalij.
Mrtve mladiče in mladiče, žrtvovane na četrti dan, je treba shraniti in preučiti glede možnih okvar. Žive mladiče je treba prešteti in zarode stehtati na jutro po skotitvi, četrti in sedmi dan ter potem še enkrat tedensko do zaključka študije, ko je treba živali stehtati posamezno.
Zabeležiti je treba fizične in vedenjske abnormalnosti, opažene na materah samicah ali mladičih.
1.6.5
1.6.5.1
Ob žrtvovanju ali smrti med študijo je treba na živalih iz starševske generacije opraviti makroskopski pregled, da bi se odkrile vse strukturalne abnormalnosti ali patološke spremembe, pri čemer se posebno pozornost posveti na razmnoževalnemu sistemu. Mrtve ali umirajoče mladiče je treba pregledati, da bi se odkrile okvare.
1.6.5.2
Jajčnike, maternico, maternični vrat, vagino, moda, obmodke, semenjake, prostato, sprednji reženj prostate, hipofizo in ciljne organe vseh starševskih živali je treba shraniti za mikroskopski pregled. V primeru, da ti organi niso bili pregledani v drugih študijah z večkratnimi odmerki, jih je treba, kadar je to izvedljivo, mikroskopsko pregledati na vseh živalih iz skupine z visokim odmerkom in kontrolne skupine ter na živalih, ki so umrle med študijo.
Organe, ki na navedenih živalih pokažejo abnormalnosti, je treba potem pregledati še na vseh ostalih starševskih živalih. V teh primerih je treba opraviti mikroskopski pregled vseh tkiv, ki kažejo vidne patološke spremembe. Kot je bilo predlagano v okviru postopkov parjenja, se mikroskopskemu pregledu lahko izpostavijo razmnoževalni organi živali, pri katerih se sumi neplodnost.
2. PODATKI
Podatki se povzamejo v obliki tabele, iz katere je za vsako preskusno skupino razvidno število živali na začetku preskusa, število plodnih samcev, število brejih samic, tipe sprememb in odstotek živali, ki kažejo določen tip spremembe.
Kadar je to mogoče, je treba numerične rezultate oceniti z ustrezno statistično metodo. Uporabiti je mogoče katero koli priznano statistično metodo.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— uporabljena vrsta/sev,
— podatki o odzivu strupenosti po spolu in odmerku, vključno z rodnostjo, brej ostjo in sposobnostjo preživetja,
— čas smrti med študijo ali preživetje živali do načrtovanega žrtvovanja ali do zaključka študije,
— tabela, na kateri so prikazane teže vsakega zaroda, povprečne teže mladičev ter posamezne teže mladičev na zaključku,
— strupeni ali drugi učinki na razmnoževanje, mladiče in poporodni rasti,
— dan opazovanja vsakega znaka abnormalnosti in njegov nadaljnji potek,
— podatki o telesni masi starševskih živali,
— ugotovitve nekropsije,
— podroben opis vseh mikroskopskih ugotovitev,
— statistična obdelava rezultatov, kadar je to mogoče,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.35 ŠTUDIJA DVOGENERACIJSKE REPRODUKTIVNE STRUPENOSTI
1. METODA
Ta metoda ustreza metodi OECD TG 416 (2001).
1.1 UVOD
Ta metoda za preskušanje dvogeneracijske reprodukcije je namenjena zagotavljanju splošnih informacij o učinkih preskusne snovi na celovitost in zmogljivost moških in ženskih reproduktivnih sistemov, vključno s funkcijo spolnih žlez, ciklom estrusa, obnašanjem pri parjenju, spočetjem, brej ostjo, kotitvijo, laktacijo in odstavljanjem, ter na rast in razvoj potomcev. Študija lahko zagotovi tudi informacije o učinkih preskusne snovi na neonatalno obolevnost, smrtnost in predhodne podatke o strupenosti za razvoj pred rojstvom in po njem ter služi kot vodnik za nadaljnje preskuse. Poleg preučevanja rasti in razvoja generacije F1 je ta preskusna metoda namenjena tudi ocenjevanju celovitosti in zmogljivosti moških in ženskih reproduktivnih sistemov ter rasti in razvoja generacije F2. Za nadaljnje informacije o strupenosti za razvoj in funkcionalnih pomanjkljivostih se lahko bodisi vključi dodatne študijske segmente v ta protokol s primerno uporabo metod za strupenost za razvoj in/ali razvojno nevrotoksičnost bodisi se te ciljne učinke preuči v posebnih študijah z uporabo ustreznih preskusnih metod.
1.2 PRINCIP PRESKUSNE METODE
Preskusna snov se daje v stopnjevanih odmerkih več skupinam samcev in samic. Samci generacije P morajo dobivati odmerek med rastjo in še najmanj en celotni spermatogenetski cikel (približno 56 dni pri miši in 70 dni pri podgani), da bi se pokazali kakršni koli škodljivi učinki na spermatogenezo. Učinki na seme se določijo s številnimi parametri semena (npr. morfologijo in gibljivostjo semena) in s pripravo tkiva in podrobno histopatologijo. Če so na voljo podatki o spermatogenezi iz prejšnjih študij s ponavljajočimi odmerki z dovolj dolgim trajanjem, npr. iz 90-dnevne študije, ni nujno, da se v vrednotenje vključijo samci generacije P. Vsekakor pa je priporočljivo, da se shranijo vzorci ali digitalni posnetki semena generacije P, da se omogoči poznejše vrednotenje. Samice generacije P morajo dobivati odmerek med rastjo in še nekaj celotnih ciklov estrusa, da bi odkrili kakršne koli škodljive učinke preskusne snovi na normalen cikel estrusa. Preskusna snov se daje staršem (P) med njihovim parjenjem, med posledično brej ostjo in med odstavljanjem njihovih potomcev F1. Med odstavljanjem se nadaljuje z dajanjem snovi potomcem F1 med njihovo rastjo do odraslosti, parjenja in ustvarjenja generacije F2, dokler se ne odstavi generacija F2.
Na vseh živalih se izvajajo klinična opazovanja in patološki pregledi glede znakov strupenosti s posebnim poudarkom na učinke na celovitost in zmogljivost moških in ženskih reproduktivnih sistemov in na rast in razvoj potomcev.
1.3 OPIS PRESKUSNE METODE
1.3.1 Izbira živalskih vrst
Priporočena vrsta za preskušanje je podgana. Če se uporabijo druge vrste, je treba to utemeljiti in potrebne so ustrezne spremembe. Sevi z nizko plodnostjo ali dobro znano visoko pojavnostjo razvojnih napak se ne smejo uporabljati. Na začetku študije morajo biti razlike v masi posameznih živali čim manjše in ne smejo presegati ± 20 % povprečne mase za vsak spol.
1.3.2 Nastanitvene in prehranjevalne razmere
Temperatura v prostoru s poskusnimi živalmi naj bo 22 oC (± 30 C). Čeprav naj bi bila relativna vlažnost najmanj 30 % in je zaželeno, da ne presega 70 %, razen v času čiščenja prostora, je cilj 50-60 %. Osvetlitev naj bo umetna, zaporedje 12 ur svetlobe, 12 ur teme. Za hranjenje se lahko uporablja konvencionalna laboratorijska prehrana z neomejeno oskrbo s pitno vodo. Na izbiro prehrane lahko vpliva potreba po zagotovitvi ustrezne primesi preskusne snovi, kadar se daje po tej metodi.
Živali se lahko namestijo posamično ali dajo v kletke v manjših skupinah istega spola. Parjenje naj se izvaja v kletkah, ki so primerne za ta namen. Po dokazu o kopulaciji se sparjene samice posamično naselijo v kletke za kotitev ali kletke za matere. Sparjene podgane so lahko tudi v manjših skupinah in se ločijo en dan ali dva pred kotitvijo. Ko je kotitev blizu, se sparjenim živalim zagotovi ustrezen in določen material za izdelavo gnezda.
1.3.3 Priprava živali
Uporabiti je treba zdrave mlade živali, ki so se najmanj pet dni prilagajale na laboratorijske razmere in predhodno niso bile uporabljene za poskuse. Poznati je treba vrsto, sev, vir, spol, maso in/ali starost poskusnih živali. Znana morajo biti sorodstvena razmerja med živalmi, tako da se je mogoče izogniti parjenju med sorojenci. Živali se naključno dodelijo v kontrolno in tretirano skupino (priporočljiva je plastitev po telesni masi). Kletke je treba razporediti tako, da so možni učinki zaradi pozicije kletk čim manjši. Vsaki živali se dodeli enotna identifikacijska številka. Pri generaciji P je to treba narediti, preden se začne odmerjanje. Pri generaciji F1 se to naredi ob odstavljanju živali, izbranih za parjenje. Za vse izbrane živali F1 je treba voditi evidenco z navedbo o poreklu zaroda. Poleg tega je priporočljiva posamična identifikacija mladičev čim prej po rojstvu, če se načrtuje posamično tehtanje mladičev ali kakršne koli funkcionalne preskuse.
Starši (P) so na začetku odmerjanja stari približno 5 do 9 tednov. Živali v vseh preskusnih skupinah naj bodo čim enotnejše po masi in starosti.
1.4 POSTOPEK
1.4.1 Število in spol živali
Vsaka preskusna in kontrolna skupina mora vsebovati zadostno število živali, da nastane po možnosti najmanj 20 brejih samic, ki kotijo ali so blizu kotitve. Pri snoveh, ki povzročajo nezaželene učinke, povezane s tretiranjem (npr. sterilnost, čezmerna toksičnost pri velikem odmerku), to ni mogoče. Cilj je dobiti dovolj brejih samic, da je zagotovljeno smiselno ovrednotenje potenciala snovi za vplivanje na plodnost, brej ost in materinsko obnašanje ter sesanje, rast in razvoj potomcev F1 od spočetja do zrelosti in razvoj njihovih potomcev (F2) do odstavitve. Če zaželeno število brejih živali (to je 20) ni doseženo, študija s tem torej ni nujno ovržena in je potrebno vrednotenje vsakega primera posebej.
1.4.2 Priprava odmerkov
Priporoča se, da se preskusna snov daje oralno (s hrano, pitno vodo ali gavažo), razen če se šteje drug način dajanja (npr. dermalno ali z vdihavanjem) za primernejšega.
Po potrebi se preskusna snov raztopi ali suspendira v primernem nosilcu. Priporočljivo je, da se, kadar koli je mogoče, najprej razmisli o uporabi vodne raztopine/suspenzije, potem o raztopini/emulziji v olju (npr. koruzno olje), šele nato o možni raztopini v drugih nosilcih. V primeru nosilcev, ki niso voda, je treba poznati toksične lastnosti takega nosilca. Določiti je treba stabilnost preskusne snovi v nosilcu.
1.4.3 Odmerjanje
Uporabijo se najmanj tri velikosti odmerkov in hkratna kontrola. Razen kadar zaradi fizikalno-kemijskih lastnosti ali bioloških učinkov preskusne snovi to ni mogoče, je treba najvišjo velikost odmerka izbrati z namenom, da se povzroči toksičnost, vendar ne smrt ali hudo trpljenje. V primeru nepričakovane smrtnosti, so študije s stopnjo smrtnosti, manjšo od približno 10 odstotkov pri starših (P), navadno še vedno sprejemljive. Padajoče zaporedje velikosti odmerkov je treba izbrati tako, da se pokažejo vse reakcije, ki so odvisne od odmerka, in vrednost brez opaznih škodljivih učinkov (NOAEL). Za padajoče zaporedje velikosti odmerkov so pogosto optimalni dvakratni do štirikratni intervali, pogosto pa je bolje dodati še dodatno četrto preskusno skupino, kakor uporabiti zelo velike intervale med odmerki (npr. več kot faktor 10). Pri študijah odmerjanja s hrano interval odmerka ne bi smel biti večji od trikratnega. Vrednosti odmerkov je treba izbirati ob upoštevanju vseh obstoječih podatkov o strupenosti, zlasti rezultate iz študij s ponavljajočimi odmerki. Upoštevajo se tudi vse razpoložljive informacije o presnovi in kinetiki preskusne zmesi ali sorodnih materialov. Te informacije poleg tega pomagajo tudi pri dokazovanju ustreznosti režima odmerjanja.
Kontrolna skupina je netretirana skupina ali kontrolna skupina, tretirana samo z nosilcem, če je ta uporabljen pri dajanju preskusne snovi. Razen pri tretiranju s preskusno snovjo, morajo biti živali v kontrolni skupini obravnavane enako kakor živali v preskusni skupini. Če je uporabljen nosilec, mora kontrolna skupina prejeti količino nosilca, enako največji uporabljeni količini. Če se preskusna snov daje s hrano in povzroča zmanjšan vnos ali izkoristek hrane, potem je morda potrebna uporaba po parih hranjene kontrolne skupine. Namesto hkratne po parih hranjene kontrolne skupine se lahko uporabijo podatki iz nadzorovanih študij, namenjenih ovrednotenju učinkov zmanjšane porabe hrane na reproduktivne parametre.
Upoštevati je treba naslednje lastnosti nosilca in drugih aditivov: učinke na absorpcijo, distribucijo, presnovo ali retencijo preskusne snovi; učinke na kemijske lastnosti preskusne snovi, ki lahko spremenijo njene toksične lastnosti; ter učinke na porabo hrane ali vode ali status prehranjenosti živali.
1.4.4 Mejni preskus
Če oralna študija pri eni velikosti odmerka najmanj 1 000 mg/kg telesne mase/dan ali enakovreden odstotek hrane ali pitne vode pri dajanju hrane ali pitne vode, pri kateri se uporabijo postopki, opisani za to študijo, ne povzroči opaznih toksičnih učinkov ne pri starših ne pri njihovih potomcih in se glede na podatke o strukturno in/ali presnovno sorodnih zmeseh ne pričakuje učinka, potem se šteje, da ni potrebna popolna študija z uporabo več velikosti odmerkov. Mejni preskus se lahko uporabi za vse primere, razen kadar človekova izpostavljenost kaže na potrebo po uporabi večje velikosti odmerka. Pri drugih vrstah dajanja, na primer pri vdihavanju ali dermalni aplikaciji, lahko fizikalno-kemijske lastnosti preskusne snovi, na primer topnost, pogosto določajo in omejujejo največjo dosegljivo raven izpostavljenosti.
1.4.5 Dajanje odmerkov
Živali naj dobivajo preskusno snov 7 dni na teden. Zaželena je oralna pot dajanja (prehrana, pitna voda ali gavaža). Če se uporabi drug način dajanja, je treba to utemeljiti in lahko so potrebne ustrezne spremembe. V ustreznem preskusnem obdobju vse živali dobivajo odmerke po enaki metodi. Kadar se preskusna snov daje z gavažo, je treba to storiti z uporabo želodčne sonde. Količina tekočine, ki se da naenkrat, ne sme presegati 1 ml/100 g telesne mase (pri koruznem olju največ 0,4 ml/100 g telesne mase), razen v primeru vodnih raztopin, kjer se sme uporabiti 2 ml/100 g telesne mase. Razen pri dražečih ali jedkih snoveh, ki pri višjih koncentracijah navadno povzročajo močnejše učinke, je treba variabilnost preskusne količine s prilagajanjem koncentracije obdržati na kar najnižji ravni, zato da bi zagotovili konstantno količino pri vseh odmerkih. Pri študijah z gavažo mladiči navadno dobivajo preskusno snov samo posredno skozi mleko, dokler se zanje po odstavitvi ne začne neposredno dajanje odmerkov. Pri študijah s prehrano ali pitno vodo dobijo mladiči dodatno preskusno snov neposredno, ko začnejo v zadnjem tednu laktacijskega obdobja sami jesti.
Pri snoveh, ki se dajejo s hrano ali pitno vodo, je treba zagotoviti, da količine uporabljene preskusne snovi ne vplivajo na običajno raven vnosa hrane ali porabe vode. Kadar se preskusna snov daje s hrano, se lahko uporabi bodisi konstantna koncentracija v hrani (ppm) bodisi konstantna velikost odmerka glede na telesno maso živali; treba je navesti uporabljeni način. Če dajemo snov z gavažo, je treba odmerke dati vsak dan približno ob istem času in jih najmanj enkrat tedensko prilagoditi, da se vzdržuje konstantna velikost odmerka glede na telesno maso živali. Pri prilagajanju odmerka gavaže, ki temelji na masi, je treba upoštevati informacije o porazdelitvi posteljice.
1.4.6 Načrti za poskuse
Dnevno dajanje odmerkov starševskim (P) samcem in samicam se začne, ko so stari 5 do 9 tednov. Dnevno dajanje odmerkov samcem in samicam F1 se začne ob odstavitvi; treba pa je upoštevati, da se lahko v primeru dajanja preskusne snovi s hrano ali pitno vodo začne neposredna izpostavljenost mladičev F1 preskusni snovi že v laktacijskem obdobju. Pri obeh spolih (P in F1) se odmerjanje nadaljuje najmanj 10 tednov pred obdobjem parjenja. Odmerjanje se nadaljuje pri obeh spolih še 2 tedna v obdobju parjenja. Samce je treba humano usmrtiti in preučiti, ko niso več potrebni za ocenjevanje reproduktivnih učinkov. Pri starševskih (P) samicah se mora odmerjanje nadaljevati skozi ves čas brej osti in do odstavljanja potomcev F1. Upoštevati je treba spremembe načrta odmerjanja, ki temeljijo na razpoložljivih informacijah o preskusni snovi, vključno z obstoječimi podatki o toksičnosti, nastajanju presnove ali bioakumulaciji. Odmerek za vsako žival navadno temelji na zadnji posamični določitvi telesne mase. Vendar je potrebna previdnost pri prilagajanju odmerka v zadnjem trimestni brej osti.
Tretiranje samcev in samic P in F1 se nadaljuje do konca. Vse odrasle samce in samice P in F1 je treba humano usmrtiti, ko niso več potrebni za ocenjevanje reproduktivnih učinkov. Potomci F1, ki niso izbrani za parjenje, in vsi potomci F2 se humano usmrtijo po odstavitvi.
1.4.7 Postopek parjenja
1.4.7.1 Parjenje staršev (P)
Pri vsakem parjenju se vsaka samica da skupaj z enim samcem z enako velikostjo odmerka (parjenje 1: 1), dokler ne pride do kopulacije ali dokler ne mineta 2 tedna. Samice se vsak dan pregledajo glede navzočnosti semena ali vaginalnega čepa. Dan brej osti 0 je opredeljen kot dan, ko je najden vaginalni čep ali seme. V primeru, da parjenje ni uspešno, se lahko razmisli o ponovnem parjenju samic z dokazanimi samci iste skupine. Sparjeni pari morajo biti jasno navedeni v podatkih. Parjenju sorojencev se je treba izogibati.
1.4.7.2 Parjenje F1
Pri parjenju potomcev F1, je treba iz vsakega zaroda po odstavitvi izbrati najmanj enega samca in eno samico za parjenje z drugimi mladiči z enako velikostjo odmerka, vendar iz drugega zaroda, za ustvarjenje generacije F2. Izbira mladičev iz vsakega zaroda mora biti naključna, brez značilnih opaznih razlik v telesni masi ali videzu med vrstniki iz zaroda. V primeru, da so opažene te razlike, je treba izbrati najboljše predstavnike iz vsakega zaroda. Praktično je to najbolje storiti glede na telesno maso, lahko pa je primernejše na podlagi videza. Potomci F1 se ne bi smeli pariti, dokler ne dosežejo polne spolne zrelosti.
Pari brez potomcev se morajo ovrednotiti, da se določi pravi vzrok neplodnosti. To lahko vključuje postopke, kot so dodatne možnosti za parjenje z drugimi dokazanimi očeti ali materami, mikroskopski pregled reproduktivnih organov in pregled ciklov estrusa ali spermatogeneze.
1.4.7.3 Drugo parjenje
V nekaterih primerih, na primer pri spremembah velikosti zaroda, povezanih s tretiranjem, ali pri opaženem dvoumnem učinku pri prvem parjenju, je priporočljivo, da se odrasli P ali F1 ponovno parijo, da bi ustvarili drugi zarod. Priporočeno je, da se ponovno parijo samice ali samci, ki niso ustvarili zaroda z dokazanimi plemenskimi živalmi nasprotnega spola. Če se zdi, da je pri kateri koli generaciji potrebno ustvariti drugi zarod, je treba živali ponovno pariti približno en teden po odstavitvi zadnjega zaroda.
1.4.7.4 Velikost zaroda
Živalim se dovoli, da normalno skotijo in redijo svoje potomce do odstavitve. Standardizacija velikosti zaroda ni obvezna. Kadar se standardizacija opravi, se metoda podrobno opiše.
1.5 OPAZOVANJA
1.5.1 Klinična opazovanja
Splošno klinično opazovanje je treba opraviti vsak dan in v primeru dajanja odmerkov z gavažo je treba upoštevati vrhunec pričakovanih učinkov po odmerjanju. Zabeležiti je treba vedenjske spremembe, znake težke ali podaljšane kotitve in vse znake toksičnosti. Dodatni, podrobnejši pregled vsake živali se izvede najmanj enkrat tedensko in se lahko primerno opravi takrat, ko se žival tehta. Dvakrat dnevno, ob koncu tedna pa enkrat dnevno, je treba vse živali opazovati glede obolevnosti in smrtnosti.
1.5.2 Telesna masa in poraba hrane/vode pri starših
Starši (P in F1) se stehtajo prvi dan dajanja odmerkov in potem najmanj enkrat tedensko. Starševske samice (P in F1) se med brejostjo stehtajo najmanj na 0., 7., 14. in 20. ali 21. dan ter med laktacijo na iste dneve, kot je tehtanje zaroda, in na dan, ko so živali usmrčene. O teh opazovanjih je treba poročati posamično za vsako odraslo žival. Med obdobjem pred parjenjem in med brejostjo se poraba hrane meri najmanj tedensko. Poraba vode se meri najmanj tedensko, če se preskusna snov daje z vodo.
1.5.3 Cikel estrusa
Dolžina in normalnost cikla estrusa se pri samicah P in F1 ovrednotita z vaginalnim brisom pred parjenjem in po izbiri med parjenjem, dokler ni najden dokaz o parjenju. Med jemanjem vaginalnih/vratnih celic je treba paziti, da ne pride do poškodb sluznice in pozneje do nastanka psevdogravidnosti (1).
1.5.4 Parametri semena
Pri vseh samcih P in F1 se na koncu zabeleži teža moda in obmodka in po en organ od vsakega shrani za histopatološki pregled (glej oddelek 1.5.7, 1.5.8.1). Za podskupino najmanj desetih samcev iz vsake skupine samcev P in F1 je treba preostala moda in obmodke uporabiti za štetje semenčic, odpornih na homogenizacijo, ali zalog semena v repu obmodka. Pri tej isti podskupini samcev je treba zbrati seme iz repov obmodkov ali semenovodov za ovrednotenje gibljivosti in morfologije semena. Če se opazujejo učinki, povezani s tretiranjem, ali kadar je v drugih študijah dokaz za možne učinke na spermatogenezo, se ovrednotenje semena izvede pri vseh samcih v vsaki skupini odmerka; drugače se lahko štetje omeji na kontrolne samce in samce P in F1 z velikim odmerkom.
Prešteti je treba tudi celotno število semenčic iz moda, ki so odporne na homogenizacijo, in seme iz repa obmodka (2) (3). Na zaloge semena v repu se lahko sklepa po koncentraciji in količini semena v suspenziji, ki se uporabi za dokončanje kakovostnih vrednotenj, in števila semena, dobljenega z naknadnim mletjem in/ali homogeniziranjem preostalega tkiva repa obmodka. Štetje je treba izvesti na izbrani podskupini samcev iz vseh skupin odmerkov takoj po usmrtitvi živali, razen če so narejeni video ali digitalni posnetki ali če se primerki zamrznejo in analizirajo pozneje. V teh primerih se lahko najprej analizirajo kontrole in skupina z velikim odmerkom. Če niso vidni nobeni učinki, povezani s tretiranjem (npr. učinki na število semenčic, gibljivost ali morfologijo), drugih skupin odmerkov ni treba analizirati. Kadar se učinki, povezani s tretiranjem, opazijo v skupini z velikim odmerkom, je treba ovrednotiti tudi skupine z manjšim odmerkom.
Gibljivost semena v obmodku (ali semenovodu) je treba ovrednotiti ali posneti na video takoj po usmrtitvi. Seme je treba ohraniti s čim manjšimi poškodbami in razredčiti za analizo gibljivosti s sprejemljivimi metodami (4). Odstotek progresivno gibljivega semena je treba določiti bodisi subjektivno ali objektivno. Kadar se opravi analiza gibanja s pomočjo računalnika (5) (6) (7) (8) (9) (10), izpeljava progresivne gibljivosti temelji na uporabniško določenih pragovih za povprečno hitrost ali na linearnem indeksu. Če se v času obdukcije vzorci posnamejo na videotrak (11) ali se drugače zabeležijo slike, se lahko pozneje analizirajo le samci P in F1 iz kontrolne skupine in skupine z velikim odmerkom, razen če so opazni učinki, povezani s tretiranjem, v tem primeru je treba ovrednotiti tudi skupine z manjšim odmerkom. Če ni video ali digitalne slike, se morajo ob obdukciji analizirati vsi vzorci iz vseh tretiranih skupin.
Treba je opraviti morfološko ovrednotenje semena iz obmodka (ali semenovoda). Seme (najmanj 200 na vzorec) je treba preučiti kot fiksirane, mokre preparate (12) in ga razvrstiti bodisi v normalno ali nenormalno. Primeri morfoloških anomalij semena vključujejo spojitev, ločene glavice ter glavice in/ali repke nepravilnih oblik. Ovrednotenje je treba izvesti na izbrani podskupini samcev v vseh skupinah odmerkov bodisi takoj po usmrtitvi živali ali pozneje na podlagi video ali digitalnih posnetkov. Tudi brisi se, potem ko so fiksirani, lahko preučujejo pozneje. V teh primerih se lahko najprej analizirajo kontrole in skupina z velikim odmerkom. Če niso vidni nobeni učinki (npr. učinki na morfologijo semena), drugih skupin odmerkov ni treba analizirati. Kadar se učinki, povezani s tretiranjem, opazijo v skupini z velikim odmerkom, je treba ovrednotiti tudi skupine z manjšim odmerkom.
Če so bili zgornji parametri za ovrednotenje semena že preučeni v študiji sistemske toksičnosti, ki je trajala vsaj 90 dni, jih ni treba ponoviti v dvogeneracijski študiji. Vsekakor pa je priporočljivo, da se shranijo vzorci ali digitalni posnetki semena generacije P, da se omogoči poznejše vrednotenje, če bi bilo potrebno.
1.5.5 Potomci
Vsak zarod je treba preučiti čim prej po skotitvi (laktacijski dan 0) in ugotoviti število in spol mladičev, mrtvorojenih, živorojenih, in navzočnost večjih nepravilnosti. Mladiče, ki so mrtvi na dan 0, je najbolje, če se ne macerirajo, preučiti glede možnih napak in vzroka smrti in konzervirati. Žive mladiče je treba prešteti in posamično stehtati ob skotitvi (laktacijski dan 0) ali na dan 1 in pozneje na dneve rednega tehtanja, npr. na 4., 7., 14. in 21. dan laktacije. Treba je evidentirati telesne ali vedenjske anomalije, ki se opazijo pri materah ali njihovih potomcih.
Telesni razvoj potomcev je treba zabeležiti v glavnem po prirastu telesne mase. Drugi telesni parametri (npr. očesne in ušesne odprtine, izbijanje zob, rast las) lahko dajo dodatne informacije, a ti podatki se raje ovrednotijo v kontekstu podatkov o spolni zrelosti (npr. starost in telesna masa ob vaginalni odprtini ali ločitvi prepucija na glavici penisa) (13). Funkcionalne preiskave (npr. motorične dejavnosti, senzorne funkcije, refleksna ontogenija) potomcev F1 pred in/ali po odstavitvi, zlasti tiste, ki se nanašajo na spolno zrelost, so priporočljive, če take preiskave niso vključene v posebne študije. Starost vaginalne odprtine in ločitve prepucija je treba določiti pri odstavljenih mladičih F1, izbranih za parjenje. Zadnjično-genitalno razdaljo pri mladičih F2 je treba izmeriti na poporodni dan 0, če jo sprožijo spremembe v razmerju spolov pri F1 ali časovna uskladitev spolne zrelosti.
Funkcionalna opazovanja se lahko opustijo pri skupinah, ki sicer jasno kažejo znake škodljivih učinkov (npr. znatno zmanjšanje pridobivanja telesne mase itd.). Če se opravljajo funkcionalne preiskave, naj se ne delajo na mladičih, ki so izbrani za parjenje.
1.5.6 Obdukcija
Na koncu študije ali ob smrti med študijo se makroskopsko pregledajo vsi starši (P in F1), vsi mladiči z zunanjimi anomalijami ali kliničnimi znaki, pa tudi po en naključno izbran mladič vsakega spola in zaroda iz obeh generacij F1 in F2 glede kakršnih koli strukturnih anomalij ali patoloških sprememb. Posebno pozornost je treba posvetiti organom reproduktivnega sistema. Mladiče, ki so humano usmrčeni v razmerah poginjanja, in mrtve mladiče je treba, če se ne macerirajo, preučiti glede možnih napak in/ali vzroka smrti in konzervirati.
Maternice vseh samic, ki so prvič kotile, se pregledajo na način, ki ne škoduje histopatološkemu ovrednotenju, glede navzočnosti in števila vgnezditev.
1.5.7 Masa organov
Na koncu se določi telesna masa in masa naslednjih organov vseh staršev P in F1 (parni organi se stehtajo posamično):
— maternice, jajčnikov,
— mod, obmodkov (v celoti in repa),
— prostate,
— semenskih mešičkov s koagulacijskimi žlezami in njihovimi tekočinami ter prostato (kot ena enota),
— možganov, jeter, ledvic, vranice, hipofize, ščitnice in nadledvičnih žlez ter znanih ciljnih organov.
Končno telesno maso je treba določiti za mladiče F1 in F2, ki so izbrani za obdukcijo. Stehtajo se naslednji organi po enega naključno izbranega mladiča vsakega spola in zaroda (glej oddelek 1.5.6): možgani, vranica in priželjc.
Rezultate obdukcije in tehtanja organov je treba oceniti v smislu ugotovitev iz drugih študij s ponavljajočimi odmerki, kadar je to izvedljivo.
1.5.8 Histopatologija
1.5.8.1 Starši
Naslednji organi in tkiva staršev (P in F1) ali njihovi reprezentativni vzorci se fiksirajo in shranijo v primernem mediju za histopatološki pregled.
— nožnica, maternica z vratom in jajčniki (shranjeni v ustreznem fiksativu),
— eno modo (konzervirano v Bouinovem ali primerljivem fiksativu), en obmodek, semenski mešički, prostata in koagulacijska žleza,
— predhodno določen(i) ciljni organ(i) vseh staršev P in F1, izbranih za parjenje.
Celotna histopatologija zgoraj naštetih konzerviranih organov in tkiv se izvede za vse živali z velikim odmerkom in za vse kontrolne živali P in F1, izbrane za parjenje. Pregled jajčnikov živali P ni obvezen. Organi, pri katerih je opaziti spremembe, povezane s tretiranjen, je treba pregledati tudi v skupinah z majhnim in srednjim odmerkom, da se lažje pojasni vrednost brez opaznih škodljivih učinkov. Poleg tega se histopatološko ovrednotijo reproduktivni organi živali z majhnim in srednjim odmerkom, za katere se domneva zmanjšana plodnost, npr. pri tistih, ki se niso mogli spariti, spočeti, zaploditi ali skotiti zdravih potomcev, ali pri katerih so prizadeti cikličnost estrusa ali število, gibljivost ali morfologija semena. Pregledajo se vse makroskopske lezije, na primer atrofija ali tumorji.
Treba je izvesti podroben histopatološki pregled mod (npr. z uporabo Bouinovega fiksativa, vstavljanja v parafin in prečnih prerezov debeline 4–5 um), da bi ugotovili učinke, povezane s tretiranjem, kot so zastale semenčice, manjkajoče plasti ali vrste kličnih celic, celice velikanke z več jedri ali uhajanje spermatogenih celic v svetlino (14). Pregled nepoškodovanega obmodka mora vključevati glavo, telo in rep, ki se lahko opravi z ocenjevanjem podolžnega prereza. Obmodek je treba oceniti glede prenikanja belih krvničk, spremembe prevladujoče vrste celic, vrst okvarjenih celic in fagocitoze semena. Za preučitev moških reproduktivnih organov se lahko uporabita PAS in barvanje s hematoksilinom.
Postlaktacijski jajčnik bi moral vsebovati začetne in rastoče folikle, pa tudi veliko rumenih telesc iz laktacije. Histopatološki pregled bi moral odkriti kakovostno izgubljanje populacije začetnih foliklov. Količinsko vrednotenje začetnih foliklov je treba izvesti za samice F1; število živali, izbira prereza jajčnika in velikost vzorca prereza morajo biti statistično ustrezni za uporabljeni postopek ocenjevanja. Pregled mora vključevati štetje števila začetnih foliklov, ki se lahko kombinirajo z majhnimi rastočimi folikli, za primerjavo tretiranih in kontrolnih jajčnikov (15) (16) (17) (18) (19).
1.5.8.2 Odstavljeni mladiči
Pretežno nenormalno tkivo in ciljni organi vseh mladičev z zunanjimi anomalijami ali kliničnimi znaki, pa tudi po en naključno izbran mladič vsakega spola in zaroda iz obeh generacij F1 in F2, ki niso bili izbrani za parjenje, se fiksirajo in shranijo v primernem mediju za histopatološki pregled. Izvede se celotni histopatološki opis značilnosti konzerviranih tkiv s posebnim poudarkom na organih reproduktivnega sistema.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Podatki se sporočajo posamično in se povzamejo v obliki tabele, ki prikazuje za vsako preskusno skupino in vsako generacijo število živali na začetku preskusa, število živali, najdenih mrtvih ali usmrčenih iz humanih razlogov med preskusom, čas katere koli smrti ali humane usmrtitve, število plodnih živali, število brejih samic, število živali, ki kažejo znake toksičnosti, opis znakov zaznane toksičnosti, vključno s časom začetka, trajanja in resnosti katerih koli toksičnih učinkov, vrsto opažanj o starših in potomcih, vrstah histopatoloških sprememb in vseh ustreznih podatkov o zarodu.
Številčni rezultati se morajo oceniti z ustrezno splošno sprejeto statistično metodo; statistične metode je treba določiti pri načrtovanju študije in jih utemeljiti. Za analiziranje podatkov so lahko koristni statistični modeli odziva v odvisnosti od odmerka. Poročilo mora vključevati dovolj informacij o metodi analize in uporabljenem računalniškem programu, tako da lahko neodvisni ocenjevalec/statistik ponovno ovrednoti in obnovi analizo.
2.2 VREDNOTENJE REZULTATOV
Ugotovitve te študije dvogeneracijske reproduktivne strupenosti je treba ovrednotiti glede na opažene učinke, vključno z obdukcijo in mikroskopskimi ugotovitvami. Vrednotenje vključuje razmerje ali njegovo odsotnost med odmerkom preskusne snovi in navzočnostjo ali odsotnostjo pojava in resnosti anomalij, vključno z makroskopskimi lezijami, ugotovljenimi ciljnimi organi, prizadeto plodnostjo, kliničnimi anomalijami, prizadeto zmogljivost reproduktivnosti in zaroda, spremembe telesne mase, učinke na smrtnost in druge strupene učinke. Pri vrednotenju rezultatov preskusa je treba upoštevati fizikalno-kemijske lastnosti preskusne snovi in toksikokinetične podatke, če so na voljo.
Pravilno izveden preskus reproduktivne strupenosti mora dati zadovoljivo oceno vrednosti brez učinka in razumevanje škodljivih učinkov na reprodukcijo, kotitev, laktacijo, poporodni razvoj vključno z rastjo in spolnim razvojem.
2.3 RAZLAGA REZULTATOV
Študija dvogeneracijske reproduktivne strupenosti zagotovi informacije o učinkih ponovne izpostavljenosti snovi v vseh fazah reproduktivnega cikla. Študija zagotovi zlasti informacije o reproduktivnih parametrih in o razvoju, rasti, dozorevanju in preživetju potomcev. Rezultate študije je treba razlagati skupaj z ugotovitvami sub kronične študije, študije predroj stvenega razvoja, toksikokinetične ter drugih razpoložljivih študij. Rezultati te študije se lahko uporabijo pri ocenjevanju potrebe po nadaljnjem preskušanju kemikalije. Ekstrapolacija rezultatov študije na človeka je veljavna le do omejene stopnje. Rezultati so najuporabnejši za zagotovitev informacij o vrednostih brez učinka in dovoljeni človekovi izpostavljenosti (20) (21) (22) (23).
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje informacije:
Preskusna snov:
— fizikalno stanje in ustrezne fizikalno-kemijske lastnosti,
— identifikacijske podatke,
— čistost.
Nosilec (po potrebi):
— utemeljitev izbire nosilca, če to ni voda.
Preskusne živali:
— uporabljeno vrsto/sev,
— število, starost in spol živali,
— izvor, nastanitvene razmere, hrano, material za izdelavo gnezda itd.,
— maso posameznih živali na začetku preskusa.
Preskusni pogoji:
— utemeljitev izbire velikosti odmerka,
— podatke o sestavi preskusne snovi/pripravi hrane, doseženi koncentraciji,
— stabilnost in homogenost pripravka,
— podatke o dajanju preskusne snovi,
— preračunavanje koncentracije preskusne snovi v hrani/pitni vodi (ppm) v dejanski odmerek (mg/kg telesne mase/dan), če je primerno,
— podatke o kakovosti hrane in vode.
Rezultati:
— porabo hrane in porabo vode, če je na voljo, izkoristek hrane (prirast telesne mase na gram porabljene hrane) in porabo preskusnega materiala za živali P in F1, razen za obdobje sobivanja in najmanj za zadnjo tretjino laktacije,
— podatke o absorpciji (če so na voljo),
— podatke o telesni masi za živali P in F1, ki so izbrane za parjenje,
— podatke o masi zaroda in mladičev,
— telesno maso ob usmrtitvi in podatke o absolutni in relativni telesni masi organov za starše,
— vrsto, resnost in trajanje kliničnih opažanj (ali so reverzibilna ali ne),
— čas smrti med študijo in, če živali preživijo, do konca,
— podatke o toksičnem učinkovanju glede na spol in odmerek, vključno z znaki parjenja, plodnostjo, brej ostjo, skotitvijo, sposobnostjo za preživetje in laktacijo; poročilo mora navajati številke, uporabljene pri izračunu teh kazalnikov,
— toksične ali druge učinke na reprodukcijo, potomce, poporodno rast itd.,
— ugotovitve obdukcije,
— natančen opis vseh histopatoloških ugotovitev,
— število samic P in F1 z normalnim ciklom in dolžino cikla,
— skupno število semena v repu obmodka, odstotek progresivno gibljivega semena, odstotek morfološko normalnega semena in odstotek semena z vsako ugotovljeno anomalijo,
— čas za parjenje, vključno s številom dni pred parjenjem,
— dolžino brejosti,
— število vgnezditev, rumenih telesc, velikost zaroda,
— število živorojenih in izgub po vgnezditvi,
— število mladičev z večjimi vidnimi anomalijami, če je treba poročati o številu spačkov,
— podatke o telesnih znakih pri mladičih in drugih poporodnih razvojnih podatkih; ovrednotene telesne znake je treba utemeljiti,
— podatke o opazovanju funkcij pri mladičih in odraslih, kot je primerno,
— statistično obdelavo rezultatov, po potrebi.
Razprava o rezultatih.
Zaključki, tudi vrednosti brez opaznih škodljivih učinkov pri materah in potomcih.
4. LITERATURA
(1) Sadleir, R.M.F.S. (1979). Cycles and Seasons, In: Reproduction in Mammals: I. Germ Cells and Fertilization, C.R. Auston and R.V. Short (eds.), Cambridge, New York.
(2) Gray, L.E. et al., (1989). A Dose-Response Analysis of Methoxychlor-Induced Alterations of Reproductive Development and Function in the Rat. Fundamental and Applied Toxicology 12: 92–108.
(3) Robb, G.W. et al., (1978). Daily Sperm Production and Epididymal Sperm Reserves of Pubertal and Adult Rats. Journal of Reproduction and Fertility 54: 103–107.
(4) Klinefelter, G.R. et al., (1991). The Method of Sperm Collection Significantly Influences Sperm Motion Parameters Following Ethane Dimethanesulfonate Administration in the Rat. Reproductive Toxicology 5: 39–44
(5) Seed, J. et al. (1996). Methods for Assessing Sperm Motility, Morphology, and Counts in the Rat, Rabbit, and Dog: a Consensus Report. Reproductive Toxicology 10(3): 237–244.
(6) Chapin, R.E. et al., (1992).Methods for Assessing Rat Sperm Motility. Reproductive Toxicology 6: 267-273
(7) Klinefelter, G.R. et al., (1992). Direct Effects of Ethane Dimethanesulphonate on Epididymal Function in Adult Rats: an In Vitro Demonstration. Journal of Andrology 13: 409–421.
(8) Slott, V.L. et al., (1991). Rat Sperm Motility Analysis: Methodologic Considerations. Reproductive Toxicology 5: 449–458.
(9) Slott, V.L. and Perreault, S.D., (1993). Computer-Assisted Sperm Analysis of Rodent Epididymal Sperm Motility Using the Hamilton-Thorn Motility Analyzer. In: Methods in Toxicology, Part A., Academic, Orlando, Florida. pp. 319–333.
(10) Toth, G.P. et al. (1989). The Automated Analysis of Rat Sperm Motility Following Subchronic Epichlorhydrin Administration: Methodologic and Statistical Considerations. Journal of Andrology 10: 401–415.
(11) Working, P.K. and M. Hurtt, (1987). Computerized Videomicrographic Analysis of Rat Sperm Motility. Journal of Andrology 8: 330–337.
(12) Linder, R.E. et al., (1992). Endpoints of Spermatoxicity in the Rat After Short Duration Exposures to Fourteen Reproductive Toxicants. Reproductive Toxicology 6: 491–505.
(13) Korenbrot, C.C. et al., (1977). Preputial Separation as an External Sign of Pubertal Development in the Male Rat. Biological Reproduction 17: 298–303.
(14) Russell, L.D. et al., (1990). Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, Florida.
(15) Heindel, J.J. and R.E. Chapin, (eds.) (1993). Part B. Female Reproductive Systems, Methods in Toxicology, Academic, Orlando, Florida.
(16) Heindel, J.J. et al., (1989) Histological Assessment of Ovarian Follicle Number in Mice As a Screen of Ovarian Toxicity. In: Growth Factors and the Ovary, A.N. Hirshfield (ed.), Plenum, New York, pp. 421–426.
(17) Manson, J.M. and Y.J. Kang, (1989). Test Methods for Assessing Female Reproductive and Developmental Toxicology. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven, New York.
(18) Smith, B.J. et al,. (1991). Comparison of Random and Serial Sections in Assessment of Ovarian Toxicity. Reproductive Toxicology 5: 379–383.
(19) Heindel, J.J. (1999). Oocyte Quantitation and Ovarian Histology. In: An Evaluation and Interpretation of Reproductive Endpoints for Human Health Risk Assessment, G. Daston,. and C.A. Kimmel, (eds.), ILSI Press, Washington, DC.
(20) Thomas, J. A. (1991). Toxic Responses of the Reproductive System. In: Casarett and Doull's Toxicology, M.O. Amdur, J. Doull, and CD. Klaassen (eds.), Pergamon, New York.
(21) Zenick, H. and E.D. Clegg, (1989). Assessment of Male Reproductive Toxicity: A Risk Assessment Approach. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven Press, New York.
(22) Palmer, A.K. (1981). In: Developmental Toxicology, Kimmel, C.A. and J. Buelke-Sam (eds.), Raven Press, New York.
(23) Palmer, A.K. (1978). In Handbook of Teratology, Vol. 4, J.G. Wilson and F.C. Fraser (eds.), Plenum Press, New York.
B.36 TOKSIKOKINETIKA
1. METODA
1.1 UVOD
Glej Splošni uvod dela B.
1.2 OPREDELITEV POJMOV
Glej Splošni uvod dela B.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Preskusna snov se daje na ustrezen način. Odvisno od namena študije se snov lahko daje v enkratnih ali ponovljenih odmerkih v določenih obdobjih eni ali več skupinam preskusnih živali. Nato se, glede na tip študije, določijo snov in/ali metaboliti v telesnih tekočinah, tkivih in/ali izločkih.
Študije se lahko opravljajo z „neoznačenimi“ ali „označenimi“ oblikami preskusne snovi. Kadar je uporabljen označevalec, mora le-ta biti nameščen na snov tako, da zagotavlja največ podatkov o vplivih spojine.
1.5 MERILA KAKOVOSTI
Jih ni.
1.6 OPIS PRESKUSNE METODE
Priprave
Zdrave mlade živali se prilagodijo laboratorijskim pogojem najmanj pet dni pred preskusom. Pred preskusom se naključno izberejo živali in se razporedijo v preskusne skupine. V posebnih razmerah se lahko uporabijo zelo mlade živali, breje živali in živali, ki so bile že tretirane.
Preskusni pogoji
Študije toksikokinetike se lahko izvajajo na eni ali več ustreznih vrstah živali, pri tem pa je treba upoštevati vrste, ki so uporabljene ali še bodo uporabljene v drugih toksikoloških študijah z isto preskusno snovjo. Kadar se za preskus uporabijo glodalci, nihanje v teži ne sme presegati ± 20 % srednje vrednosti.
V študijah absorpcije in izločanja je treba na začetku imeti po štiri živali za vsako velikost odmerka. Preferenca enega ali drugega spola ni obvezna, v nekaterih okoliščinah pa je treba opraviti študijo na obeh spolih. Če obstajajo razlike v odzivu med spoloma, je treba opraviti preskus na štirih živalih vsakega spola. V primeru študij na neglodalcih se lahko uporabi manj živali. študijah porazdelitve v tkivih je treba pri velikosti začetne skupine upoštevati število živali, ki jih je treba žrtvovati ob vsaki časovni točki, ter število časovnih točk, ki jih je treba preveriti.
V študijah metabolizma je velikost skupine odvisna od potreb študije. študijah z večkratnimi odmerki in večkratnimi časovnimi točkami je treba pri velikosti skupine upoštevati število časovnih točk in načrtovano(a) žrtvovanje(a), ki pa ne sme obsegati manj kot dve živali. Velikost skupine mora biti zadostna, da zagotovi sprejemljivo opredelitev sprejema, konstantnega nivoja in porabe (če je to primerno) preskusne snovi in/ali metabolitov.
V primeru dajanja enkratnega odmerka je treba uporabiti najmanj dve velikosti odmerka. Ti dve sta nizka velikost odmerka, pri kateri ni opaženih nikakršnih strupenih učinkov, in visoka velikost odmerka, pri kateri lahko pride do sprememb v toksikokinetičnih parametrih ali pri katerih se pojavijo strupeni učinki.
V primeru dajanja večkratnih odmerkov je nizka velikost odmerka običajno zadostna, vendar pa je v nekaterih okoliščinah visoka velikost odmerka prav tako potrebna.
Pri izvajanju študij toksikokinetike je treba uporabiti enak način in, če je to primerno, enak nosilec, kot je uporabljen ali bo uporabljen v drugih študijah strupenosti. Preskusna snov se v določenih obdobjih skupinam preskusnih živali običajno daje oralno z gavažo ali s hrano, z nanosom na kožo ali z inhalacijo. Intravenozno dajanje preskusne snovi lahko koristi pri določanju relativne absorpcije pri drugih načinih dajanja. Poleg tega je mogoče pridobiti uporabne podatke o vzorcu porazdelitve kmalu po intravenoznem dajanju snovi.
Upoštevati je treba možnost interference nosilca s preskusno snovjo. Pozornost je treba posvetiti razliki v absorpciji pri dajanju preskusne snovi z gavažo in s hrano ter potrebi po natančni opredelitvi odmerka, zlasti kadar se preskusna snov daje s hrano.
Vse živali je treba dnevno opazovati in beležiti znake strupenosti ter druge ustrezne klinične lastnosti, vključno s časom njihovega nastopa, stopnjo in trajanjem.
Postopek
Po tehtanju preskusnih živali se na ustrezen način daje preskusna snov. Če se zdi potrebno, se lahko živali pred dajanjem preskusne snovi postijo.
Stopnja in obseg absorpcije dane snovi se lahko ocenita z uporabo različnih metod, z referenčnimi skupinami ( 22 ) ali brez njih, na primer z:
— določitvijo količine preskusne snovi in/ali metabolitov v izločkih, kot so urin, žolč, fekalije, izdihani zrak in kar ostane v truplu,
— primerjavo biološkega odziva (npr. študije akutne strupenosti) v preskusni ter kontrolni in/ali referenčni skupini,
— primerjavo količine snovi, izločenih skozi ledvice, in/ali metabolitov v preskusni in referenčni skupini,
— določitvijo površine pod krivuljo plazma-nivo/čas preskusne snovi in/ali metabolitov ter primerjavo s podatki iz referenčne skupine.
Trenutno sta na voljo dva pristopa, izmed katerih je enega ali oba mogoče uporabiti za analizo porazdelitvenih vzorcev:
— uporabni kvalitativni podatki se pridobijo z uporabo tehnik avtoradiografije celega telesa,
— kvantitativni podatki se pridobijo z žrtvovanjem živali v različnih časovnih obdobjih po izpostavljenosti in z določanjem koncentracije in količine preskusne snovi in/ali metabolitov v tkivih in organih.
V študijah izločanja se zbirajo urin, fekalije in izdihani zrak ter, v nekaterih primerih, žolč. Količino preskusne snovi in/ali metabolitov v teh izločkih je treba meriti nekajkrat po izpostavljenosti, bodisi dokler ni izločenih 95 % danega odmerka bodisi sedem dni zapovrstjo, kar se zgodi prej.
V posebnih primerih je treba upoštevati izločanje preskusne snovi v mleku doječih preskusnih živali.
Da bi se določil obseg in vzorec metabolizma, je treba z ustreznimi tehnikami analizirati biološke vzorce. Obrazložiti je treba strukture metabolitov in predlagati ustrezne presnovne poti, kadar je treba odgovoriti na vprašanja, ki izhajajo iz predhodnih toksikoloških študij. V pomoč so lahko in vitro študije, s katerimi se pridobijo podatki o presnovnih poteh.
Dodatni podatki o odnosu med metabolizmom in strupenostjo se lahko pridobijo iz biokemijskih študij, kot je določitev učinkov presnovnih encimskih sistemov, poraba endogenih neproteinskih sulfidril spojin in vezanje snovi z makromolekulami.
2. PODATKI
Podatke je treba glede na tip izvajane študije povzeti v obliki tabele, podprti z grafičnim prikazom, kadar je to primerno. Za vsako preskusno skupino je treba, kadar je primerno, prikazati srednje in statistične spremembe meritev glede na čas, odmerek, tkiva in organe. Z ustreznimi metodami je treba določiti obseg absorpcije in količino ter stopnje izločanja. Pri izvajanju študij metabolizma je treba prikazati strukturo prepoznanih metabolitov in predstaviti možne presnovne poti.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu glede na tip izvajane študije vključijo naslednji podatki:
— vrsta, sev, vir, okoljski pogoji, hrana,
— opredelitev označenih materialov, kadar so le-ti uporabljeni,
— uporabljene velikosti odmerka in časovni razmiki,
— način(i) dajanja in vsi uporabljeni nosilci;
— opaženi strupeni in drugi učinki,
— metode določanja preskusne snovi in/ali metabolitov v bioloških vzorcih, vključno z izdihanim zrakom,
— tabelni prikaz meritev po spolu, odmerku, režimu, času, tkivih in organih,
— časovni prikaz obsega absorpcije in izločanja,
— metode opredeljevanja in prepoznavanja metabolitov v bioloških vzorcih,
— metode biokemijskih meritev, povezanih z metabolizmom,
— predlagane poti za metabolizem,
— obravnava rezultatov,
— razlaga rezultatov.
3.2 OCENA IN RAZLAGA
Glej Splošni uvod dela B.
4. VIRI
Glej Splošni uvod dela B.
B.37 ZAPOZNELA NEVROTOKSIČNOST ORGANOFOSFORNIH SNOVI PO AKUTNI IZPOSTAVLJENOSTI
1. METODA
1.1 UVOD
Pri ocenjevanju in vrednotenju toksičnih učinkov snovi je pomembno upoštevati potencial nekaterih razredov snovi, da povzročijo posebne vrste nevrotoksičnosti, ki se morda ne bi odkrile v drugih študijah toksičnosti. Nekatere organofosforne snovi, za katere je bilo ugotovljeno, da povzročajo zapoznelo nevrotoksičnost, bi morale biti predmet takšnega ocenjevanja.
Izločilne študije in vitro bi se lahko uporabile pri določanju tistih snovi, ki lahko povzročijo zapoznelo polinevropatijo; vendar negativni izsledki študij in vitro ne zagotavljajo dokazov, da preskusna snov ni nevrotoksikant.
Glej del B splošnega uvoda.
1.2 OPREDELITEV POJMOV
Organofosforne snovi vključujejo nenabite organofosforne estre, tioestre ali anhidride organofosfornih, organofosfoničnih ali organofosforamidnih kislin ali sorodnih fosforotiotskih, fosfonotiotskih ali fosforotioamidnih kislin ali druge snovi, ki lahko povzročijo zapoznelo nevrotoksičnost, ki je včasih opažena v tem razredu snovi.
Zapoznela nevrotoksičnost je sindrom, povezan z dolgotrajnim zapoznelim nastopom ataksije, distalnimi aksonopatijami hrbtenjače in perifernega živčevja ter z inhibicijo in staranjem nevropatske ciljne esteraze (NTE) v živčnem tkivu.
1.3 REFERENČNE SNOVI
Referenčna snov se lahko preskuša na pozitivni kontrolni skupini kot dokaz, da se tudi v preskusnih laboratorijskih okoliščinah odziv preskušane vrste ni bistveno spremenil.
Primer široko uporabljenega nevrotoksikanta je tri-o-tolil fosfat (CAS 78-30-8, Einecs 201-103-5, nomenklatura CAS: tris(2-metilfenil)ester fosforjeve kisline), znan tudi kot tris-o-krezilfosfat.
1.4 PRINCIP PRESKUSNE METODE
Preskusna snov se daje oralno in z enkratnim odmerkom domačim kokošim, ki so bile zaščitene pred akutnimi holinergičnimi učinki, če je to primerno. Živali se opazujejo 21 dni za morebitne vedenjske nepravilnosti, ataksijo in paralizo. Navadno se od 24 do 48 ur po vnosu odmerka izvedejo biokemične analize, zlasti inhibicija nevropatske ciljne erastaze (NTE), na naključno izbranih kokoših iz vsake skupine. Enaindvajset dni po izpostavljenosti se usmrtijo druge kokoši in se izvede histopatološka preiskava izbranega živčnega tkiva.
1.5 OPIS PRESKUSNE METODE
1.5.1 Priprave
Zdrave, mlade, odrasle kokoši, ki ne kažejo znakov virusnih obolenj, niso tretirane s snovmi, ki bi vplivala na rezultat preskusa, in ki ne kažejo znakov nenavadnega obnašanja, je treba naključno razvrstiti v skupino, ki bo tretirana, in v kontrolno skupino ter jih aklimatizirati na laboratorijske razmere najmanj 5 dni pred začetkom študije.
Treba je uporabiti kletke ali ograde, ki so dovolj velike, da omogočajo prosto gibanje kokoši in olajšajo opazovanje obnašanja živali.
Običajno se preskusna snov vnaša po oralni poti z gastrično sondo, želatinastimi kapsulami ali primerljivo metodo. Tekočine se lahko vnašajo nerazredčene ali raztopljene v ustreznem nosilcu, kakršno je na primer koruzno olje; če je mogoče, je treba trdne snovi raztopiti, ker se utegne zgoditi, da se veliki odmerki v želatinastih kapsulah ne absorbirajo učinkovito. Pri nevodnih nosilcih je treba poznati njihove toksične značilnosti ali jih v nasprotnem določiti pred začetkom preskusa.
1.5.2 Preskusni pogoji
1.5.2.1 Poskusne živali
Priporoča se uporaba mladih odraslih domačih kokoši nesnic {Gallus gallus domesticus), ki so stare od 8 do 12 mesecev. Uporabiti je treba kokoši pasem standardne velikosti in sevov, običajno vzrejene v okoliščinah, ki kokošim dovoljujejo svobodno gibanje.
1.5.2.2 Število in spol
Poleg skupine, ki bo tretirana, je treba uporabiti kontrolno skupino, ki ji je vnesen zgolj nosilec, in tudi pozitivno kontrolno skupino. Kontrolno skupino, ki ji je vnesen zgolj nosilec, je treba tretirati enako kakor skupino, ki bo tretirana, razen da se živalim ne da preskusna snov.
Vsaka skupina ptic mora biti sestavljena iz zadosti kokoši, tako da se lahko usmrti najmanj šest ptic za biokemične analize (tri na vsakega od obeh časovnih terminov opazovanja) in da lahko šest primerkov preživi 21-dnevno obdobje opazovanja za patološke preiskave.
Pozitivna kontrolna skupina se lahko preskuša hkrati, lahko pa je tudi nedavno preskušena kontrolna skupina. Sestavljena naj bo iz vsaj šestih kokoši, tretiranih z znanim zapoznelim nevrotoksikantom, od katerih so tri namenjene za biokemične analize in tri za patološke preiskave. Priporoča se redno dopolnjevanje predhodnih podatkov. Nove pozitivne kontrolne podatke je treba razviti vsakokrat, ko laboratorij, ki izvaja preskuse, spremeni katerega od bistvenih elementov preskusa (npr. sev, vrsta krme, nastanitvene razmere).
1.5.2.3 Velikosti odmerkov
Za določitev velikosti odmerka, ki se bo uporabil v glavni študiji, je treba izvesti predhodno študijo z ustreznim številom kokoši in skupin velikosti odmerkov. V tej predhodni študiji, namenjeni določitvi primernega odmerka za glavno študijo, se praviloma pričakuje nekaj smrtnosti. Da bi se izognili smrti zaradi akutnih holinergičnih učinkov, se lahko uporabi atropin ali kakšno drugo zaščitno sredstvo, za katero je znano, da ne moti zapoznelih nevrotoksičnih odzivov. Za določitev največjega nesmrtonosnega odmerka preskusne snovi so na voljo številne metode (glej metodo B.1 bis). Pri izbiri odmerka so lahko v veliko pomoč podatki iz predhodnih študij na kokoših ali druge toksikološke informacije.
Odmerek preskusne snovi v glavni študiji naj bo čim večji, pri čemer je treba upoštevati rezultate predhodne študije za izbiro odmerka in najvišji mejni odmerek 2 000 mg/kg telesne teže. Ne glede na število smrtnih primerov, ki se lahko pojavijo, pa naj bi preživelo zadosti živali za izvedbo biokemičnih analiz (šest) in histoloških preiskav (šest) do 21. dneva preskusa. Za preprečitev smrti zaradi akutnih holinergičnih učinkov je treba uporabiti atropin ali kakšno drugo zaščitno sredstvo, ki ne moti zapoznelih nevrotoksičnih odzivov.
1.5.2.4 Mejni preskus
Če preskus, izveden v skladu z opisanimi postopki za to študijo in pri stopnji odmerka, ki znaša najmanj 2 000 mg/kg telesne teže/dan, ne povzroči nobenih očitnih toksičnih učinkov in če podatki o strukturno sorodnih snoveh ne kažejo na pojav toksičnosti, študije z uporabo večjega odmerka ni treba izvesti. Mejni preskus se ne uporabi samo, če človeška izpostavljenost kaže na potrebo po uporabi večjega odmerka.
1.5.2.5 Obdobje opazovanja
Obdobje opazovanja traja 21 dni.
1.5.3 Postopek
Potem ko se živalim da zaščitno sredstvo za preprečevanje smrti zaradi akutnih holinergičnih učinkov, se preskusna snov vnese v enkratnem odmerku.
1.5.3.1 Splošno opazovanje
Opazovanje je treba začeti takoj po izpostavitvi. Vse kokoši je treba večkrat na dan natančno opazovati prva 2 dni preskusa in nato najmanj enkrat na dan v obdobju 21 dni ali do njihove predvidene usmrtitve. Zabeležiti je treba vse znake toksičnosti, vključno s časom nastopa, vrsto, resnostjo in trajanjem vedenjskih nepravilnosti. Za ataksijo je treba uporabiti stopenjsko ocenjevalno lestvico, sestavljeno iz najmanj štirih stopenj, zabeležiti pa je treba tudi primere paralize. Najmanj dvakrat na teden je treba kokoši, ki so bile izbrane za patološka opazovanja, izpustiti iz kletk in jih pripraviti k prisilni motorični dejavnosti, kakršno je denimo plezanje po lestvi, da bi bilo olajšano opazovanje minimalnih toksičnih učinkov. Umirajoče živali ali živali, ki kažejo znake hudega trpljenja in hude bolečine, je treba odstraniti, humano usmrtiti in opraviti nekropsijo.
1.5.3.2 Telesna teža
Vse živali je treba stehtati neposredno pred dajanjem preskusne snovi in nato najmanj enkrat na teden.
1.5.3.3 Biokemija
V nekaj dneh po vnosu odmerka je treba usmrtiti šest naključno izbranih kokoši iz vsake tretirane skupine in kontrolne skupine, ki ji je vnesen zgolj nosilec, ter tri kokoši iz pozitivne kontrolne skupine (če je ta skupina preskušena hkrati), možgane in ledveno hrbtenjačo pa je treba pripraviti in analizirati za določitev morebitne inhibicije nevropatske ciljne erastaze. Poleg tega je lahko za določitev inhibicije nevropatske ciljne erastaze koristno pripraviti in analizirati ishiatično živčno tkivo. Običajno se usmrtijo po tri ptice iz kontrolne skupine in vsake tretirane skupine po 24 urah in tri po 48 urah, medtem ko se tri kokoši iz pozitivnih kontrolnih skupin usmrtijo po 24 urah. Če opazovanja kliničnih znakov intoksikacije (ki se lahko oceni z opazovanjem časa nastopa holinergičnih znakov) kažejo, da bo odstranitev toksičnega sredstva potekala zelo počasi, utegne biti primernejše, da se odvzame tkivo pri treh pticah v obeh terminih v obdobju od 24 ur in do najpozneje 72 ur po vnosu odmerka.
Na teh vzorcih se po potrebi lahko opravijo analize acetilholinesteraze (AChE). Vendar se in vivo lahko AchE spontano reaktivira, kar lahko vodi k podcenjevanju zmožnosti neke snovi kot inhibitorja AChE.
1.5.3.4 Makroskopska nekropsija
Makroskopska nekropsija vseh živali (usmrčenih po načrtu in ubitih zaradi umiranja) naj vključuje opazovanje videza možganov in hrbtenjače.
1.5.3.5 Histopatološka preiskava
Živčno tkivo živali, preživelih obdobje opazovanja, in ki ni bilo uporabljeno za biokemične študije, se uporabi za mikroskopske preiskave. Tkivo je treba fiksirati in situ z uporabo tehnik škropitve. Opravi se odvzem tkiva na malih možganih (srednja longitudinalna stopnja), podaljšani hrbtenjači, hrbtenjači in perifernem živčevju. Vzorce hrbtenjače je treba odvzeti z zgornjega vratnega predela, srednjega prsnega in ledveno-križnega predela. Odvzamejo se tudi vzorci distalnega dela tibialnega živca in njegovih vej v smeri dvoglave mečne mišice in shiatičnega živca. Vzorce tkiva je treba obarvati z ustreznimi mielinskimi in specifičnimi aksonskimi barvili.
2. PODATKI
Če so rezultati na končnih točkah, izbranih v tej metodi (biokemija, histopatologija in opazovanje obnašanja), negativni, dodatno preskušanje zapoznele nevrotoksičnosti navadno ni potrebno. Dvoumni in nedokončni rezultati za te končne točke lahko zahtevajo dodatno ocenjevanje.
Priskrbeti je treba podatke za vsako posamezno žival. Poleg tega je treba vse podatke povzeti v obliki tabele, ki za vsako preskusno skupino prikazuje število živali na začetku preskusa, število živali, ki kažejo poškodbe, vedenjske spremembe in biokemične učinke, vrste in resnost teh poškodb ali učinkov in odstotek živali, ki jih je prizadela posamezna vrsta in resnost poškodbe ali učinka.
Izsledke te študije je treba ocenjevati glede na pojav, resnost in korelacije vedenjskih, biokemičnih in histopatoloških učinkov ter katerih koli drugih opaženih učinkov v tretiranih in kontrolnih skupinah.
Številčne rezultate je treba ocenjevati na podlagi primernih in splošno priznanih statističnih metod. Uporabljene statistične metode je treba izbrati pri izdelavi študije.
3. POROČANJE
POROČILO O PRESKUSU
Če je mogoče, poročilo o preskusu vključuje naslednje informacije:
Poskusne živali:
— uporabljen sev,
— število in starost živali,
— izvor, nastanitveni pogoji, itd.,
— teža vsake živali na začetku preskusa.
Preskusni pogoji:
— podrobni podatki o pripravi preskusne snovi, stabilnosti in homogenosti, kjer je primerno,
— utemeljitev izbire uporabljenega nosilca,
— podrobni podatki o dajanju preskusne snovi,
— podrobni podatki o kvaliteti hrane in vode,
— utemeljitev izbire odmerka,
— opis danih odmerkov, vključno s podrobnimi podatki o nosilcu in volumnu ter fizikalni obliki dane snovi,
— vrsta zaščitnega sredstva in podrobni podatki o njegovem vnosu.
Rezultati:
— podatki o telesni teži,
— podatki o toksičnem odzivu glede na skupino, vključno s smrtnostjo,
— narava, resnost in trajanje kliničnih opazovanj (reverzibilnih ali nereverzibilnih),
— natančen opis biokemičnih metod in njihovih izsledkov,
— izsledki nekropsije,
— podroben opis vseh histopatoloških izsledkov,
— statistična obdelava rezultatov, kjer je primerno.
Razprava o rezultatih.
Zaključki.
4. SKLICEVANJA
Ta metoda je skladna s smernicami za preskušanje OECD TG 418.
B.38 ZAPOZNELA NEVROTOKSIČNOST ORGANOFOSFORNIH SNOVI – 28-DNEVNA ŠTUDIJA S PONAVLJAJOČIMI SE ODMERKI
1. METODA
1.1 UVOD
Pri ocenjevanju in vrednotenju toksičnih učinkov snovi je pomembno upoštevati potencial določenih razredov snovi, da povzročijo posebne vrste nevrotoksičnosti, ki se morda ne odkrijejo v drugih študijah toksičnosti. Nekatere organofosforne snovi, za katere je bilo opaženo, da povzročajo zapoznelo nevrotoksičnost, bi morale biti predmet takšnega ocenjevanja.
Izločilne študije in vitro bi se lahko uporabile za določanje tistih snovi, ki lahko povzročijo zapoznelo polinevropatijo; vendar negativni izsledki študij in vitro ne zagotavljajo dokazov, da preskusna snov ni nevrotoksikant.
Ta 28-dnevni preskus zapoznele nevrotoksičnosti daje informacije o morebitnih nevarnostih za zdravje, ki jih lahko povzroči ponovna izpostavljenost v določenem obdobju. Prav tako bo zagotovil informacije o odzivu na odmerke in omogočil oceno stopnje koncentracije brez opaznih negativnih vplivov (NOAEL), ki se lahko uporablja za določitev meril o varnosti za izpostavljenost.
Glej del B splošnega uvoda.
1.2 OPREDELITEV POJMOV
Organofosforne snovi vključujejo nenabite organofosforne estre, tioestre ali anhidride organofosfornih, organofosfoničnih ali organofosforamidnih kislin ali sorodnih fosforotiotskih, fosfonotiotskih ali fosforotioamidskih kislin ali druge snovi, ki lahko povzročijo zapoznelo nevrotoksičnost, ki se včasih zasledi v tem razredu snovi.
Zapoznela nevrotoksičnost je sindrom, povezan z dolgotrajnim zapoznelim nastopom ataksije, distalnimi aksonopatijami hrbtenjače in perifernega živčevja ter z inhibicijo in staranjem nevropatske ciljne esteraze (NTE) v živčnem tkivu.
1.3 PRINCIP PRESKUSNE METODE
Dnevni odmerki preskusne snovi se domačim kokošim dajejo oralno 28 dni. Živali je treba najmanj enkrat na dan opazovati zaradi morebitnih vedenjskih nepravilnosti, ataksije in paralize do štirinajstega dneva po vnosu zadnjega odmerka. Navadno se od 24 do 48 ur po vnosu zadnjega odmerka opravijo biokemične analize, zlasti inhibicije nevropatske ciljne esteraze (NTE), na naključno izbranih kokoših iz vsake skupine. Dva tedna po vnosu zadnjega odmerka se usmrtijo druge kokoši in izvede se histopatološka preiskava izbranega živčnega tkiva.
1.4 OPIS PRESKUSNE METODE
1.4.1 Priprave
Zdrave, mlade, odrasle kokoši, ki ne kažejo znakov virusnih obolenj, niso tretirane s snovmi, ki bi vplivala na rezultat preskusa, in ki ne kažejo znakov nenavadnega obnašanja, je treba naključno razvrstiti v skupino, ki bo tretirana, in kontrolno skupino ter jih aklimatizirati na laboratorijske razmere najmanj 5 dni pred začetkom študije.
Uporabiti je treba kletke ali ograde, ki so dovolj velike, da omogočajo prosto gibanje kokoši in olajšajo opazovanje obnašanja živali.
Običajno je treba odmerek dajati oralno vsak dan in sedem dni na teden, po možnosti z gastrično sondo ali želatinastimi kapsulami. Tekočine se lahko vnašajo nerazredčene ali raztopljene v ustreznem nosilcu, kakršno je na primer koruzno olje; če je mogoče, je treba trdne snovi raztopiti, ker se utegne zgoditi, da se veliki odmerki v želatinastih kapsulah ne absorbirajo učinkovito. Pri nevodnih nosilcih je treba poznati njihove toksične značilnosti ali jih v nasprotnem določiti pred začetkom preskusa.
1.4.2 Preskusni pogoji
1.4.2.1 Poskusne živali
Priporoča se uporaba mladih odraslih domačih kokoši nesnic (Gallus gallus domesticus), ki so stare od 8 do 12 mesecev. Uporabiti je treba kokoši pasem standardne velikosti in sevov, običajno vzrejene v okoliščinah, ki kokošim dovoljujejo svobodno gibanje.
1.4.2.2 Število in spol
Običajno je treba uporabiti najmanj tri skupine za tretiranje in eno kontrolno skupino. Slednjo skupino je treba tretirati enako kakor skupino za tretiranje, razen da se živalim ne da preskusna snov.
Vsaka skupina ptic naj bo sestavljena iz zadosti kokoši, da se lahko najmanj šest ptic usmrti za biokemične analize (tri na vsakega od obeh časovnih terminov opazovanja) in da lahko šest ptic preživi 14-dnevno obdobje opazovanja za patološke preiskave.
1.4.2.3 Velikost odmerkov
Pri izbiri velikosti odmerkov je treba upoštevati tri rezultate preskusa zapoznele nevrotoksičnosti po akutni izpostavljenosti in vse druge obstoječe podatke o toksičnosti ali toksikokinetiki za preskusno zmes. Izbrati je treba največji odmerek, ki bi povzročil toksične učinke, po možnosti zapoznelo nevrotoksičnost, ne pa smrti ali hudega trpljenja. Nato je treba izbrati padajoče zaporedje velikosti odmerkov, da se dokažeta vsak odziv, ki je pogojen z odmerkom, in koncentracija brez opaznih negativnih vplivov pri najmanjšem odmerku.
1.4.2.4 Mejni preskus
Če preskus z velikostjo odmerka, ki znaša najmanj 1 000 mg/kg telesne teže/dan, z uporabo predpisanih postopkov za to študijo ne povzroči nobenih opaznih toksičnih učinkov in če podatki o strukturno sorodnih snoveh ne kažejo na pojav toksičnosti, študije z uporabo višjega odmerka ni treba izvesti. Mejni preskus se ne uporabi samo, če izpostavljenost človeka kaže na potrebo po uporabi večjega odmerka.
1.4.2.5 Obdobje opazovanja
Vse živali je treba med obdobjem izpostavljenosti in 14 dni po njem opazovati najmanj enkrat na dan, razen če je bila predvidena nekropsija.
1.4.3 Postopek
Živalim se dajejo odmerki preskusne snovi sedem dni na teden v obdobju 28 dni.
1.4.3.1 Splošna opazovanja
Opazovanja je treba začeti, takoj ko se lotimo tretiranja. Vse kokoši je treba najmanj enkrat na dan natančno opazovati vseh 28 dni tretiranja in naslednjih 14 dni ali do predvidene usmrtitve. Zabeležiti je treba vse znake toksičnosti, vključno s časom nastopa, vrsto, resnostjo in trajanjem. Opazovanja naj med drugim vključujejo vedenjske nepravilnosti. Ataksijo je treba meriti z vrstilno ocenjevalno lestvico, sestavljeno iz najmanj štirih stopenj, zabeležiti pa je treba tudi primere paralize. Najmanj dvakrat na teden je treba kokoši izpustiti iz kletk in jih pripraviti k prisilni motorični dejavnosti, kakršno je denimo plezanje po lestvi, da bi bilo olajšano opazovanje minimalnih toksičnih učinkov. Umirajoče živali ali živali, ki kažejo znake hudega trpljenja ali hude bolečine, je treba odstraniti, humano usmrtiti in opraviti nekropsijo.
1.4.3.2 Telesna teža
Vse kokoši je treba neposredno pred prvim dajanjem preskusne snovi in nato najmanj enkrat na teden stehtati.
1.4.3.3 Biokemija
V nekaj dneh po vnosu zadnjega odmerka je treba usmrtiti šest naključno izbranih kokoši iz tretirane in iz kontrolne skupine, možgane in ledveno hrbtenjačo pa je treba pripraviti in analizirati za določitev morebitne inhibicije nevropatske ciljne esteraze (NTE). Poleg tega je za določitev inhibicije nevropatske ciljne esteraze lahko koristno pripraviti in analizirati ishiatično živčno tkivo. Navadno se po 24 urah usmrtijo po tri ptice iz kontrolne in iz vsake tretirane skupine ter tri živali 48 ur po vnosu zadnjega odmerka. Če podatki iz študije akutne izpostavljenosti ali drugih študij (npr. toksikokinetika) kažejo, da je bolj priporočljiv drug čas usmrtitve po zadnjem vnosu odmerka, je treba uporabiti ta čas in razloge za tako ravnanje utemeljiti.
Na teh vzorcih se po potrebi lahko izvedejo analize acetilholinesteraze (AChE). Vendar se AChE in vivo lahko spontano reaktivira, kar lahko vodi k podcenjevanju učinkovitosti neke snovi kot inhibitorja AChE.
1.4.3.4 Makroskopska nekropsija
Makroskopska nekropsija vseh živali (tistih, ki so usmrčene po programu, in tistih, ki so usmrčene, ko že umirajo) naj vključuje opazovanje videza možganov in hrbtenjače.
1.4.3.5 Histopatološka preiskava
Živčno tkivo živali, preživelih obdobje opazovanja, ki ni bilo uporabljeno za biokemijske študije, je treba uporabiti za mikroskopske preiskave. Tkivo je treba fiksirati in situ z uporabo tehnik škropitve. Odvzem tkiva se opravi na malih možganih (srednja longitudinalna stopnja), podaljšani hrbtenjači, hrbtenjači in perifernem živčevju. Vzorce hrbtenjače je treba odvzeti z zgornjega vratnega predela, srednjega prsnega in ledveno-križnega predela. Odvzamejo se tudi vzorci distalnega dela tibialnega živca in njegovih vej v smeri dvoglave mečne mišice ter ishiatičnega živca. Vzorce tkiva je treba obarvati z ustreznimi mielinskimi in aksonskimi barvili. Mikroskopsko preiskavo je na začetku treba opraviti na shranjenem tkivu vseh živali kontrolne skupine in skupine, tretirane z velikim odmerkom. Če v slednji skupini obstajajo dokazi o učinkih, je treba izvesti tudi mikroskopsko preiskavo tkiv kokoši iz skupin s srednjim in nizkim odmerkom.
2. PODATKI
Če so rezultati na končnih točkah, izbranih v tej metodi (biokemija, histopatologija in opazovanje obnašanja), negativni, dodatno preskušanje zapoznele nevrotoksičnosti navadno ni potrebno. Dvoumni in nedokončni rezultati za te končne točke lahko zahtevajo nadaljnje ocenjevanje.
Priskrbeti je treba podatke za vsako posamezno žival. Poleg tega je treba vse podatke povzeti v obliki tabele, ki za vsako preskusno skupino prikazuje število živali na začetku preskusa, število živali, ki kažejo poškodbe, vedenjske spremembe in biokemične učinke, vrste in resnost teh poškodb ali učinkov ter odstotek živali, ki jih je prizadela posamezna vrsta in resnost poškodbe ali učinka.
Izsledke te študije je treba ocenjevati glede na pojav, resnost in korelacije vedenjskih, biokemičnih in histopatoloških učinkov ter katerih koli drugih opaženih učinkov v vsaki tretirani in kontrolni skupini.
Številčne rezultate je treba ocenjevati na podlagi primernih in splošno priznanih statističnih metod. Uporabljene statistične metode je treba izbrati pri izdelavi študije.
3. POROČANJE
POROČILO O PRESKUSU
Če je mogoče, poročilo o preskusu vključuje naslednje informacije:
Preskusne živali:
— uporabljeni sev,
— število in starost živali,
— izvor, nastanitvene razmere itd.,
— teža vsake živali na začetku preskusa.
Preskusni pogoji:
— podrobni podatki o pripravi preskusne snovi, stabilnosti in homogenosti, kjer je primerno,
— utemeljitev izbire uporabljenega nosilca,
— podrobni podatki o dajanju preskusne snovi,
— podrobni podatki o kvaliteti hrane in vode,
— utemeljitev izbire odmerka,
— opis danih odmerkov, vključno s podrobnimi podatki o nosilcu in volumnu ter fizikalni obliki dane snovi,
— če so biokemijske analize izvedene ob drugačnem času, kakršen je bil predviden (24 in 48 ur), utemeljitev takšne izbire.
Rezultati:
— podatki o telesni teži,
— podatki o toksičnem odzivu glede na velikost odmerka, vključno s smrtnostjo,
— stopnja koncentracije brez opaznih negativnih vplivov,
— narava, resnost in trajanje kliničnih opazovanj (reverzibilnih ali nereverzibilnih),
— natančen opis biokemičnih metod in njihovih izsledkov,
— izsledki nekropsije,
— podroben opis vseh histopatoloških izsledkov,
— statistična obdelava rezultatov, kjer je primerno.
Razprava o rezultatih.
Zaključki.
4. SKLICEVANJE
Ta metoda je skladna s smernicami za preskušanje OECD TG 419.
B.39 PREIZKUS NENAČRTNE SINTEZE DNA (UDS) V JETRNIH CELICAH SESALCEV IN VIVO
1. METODA
Ta metoda ustreza metodi OECD TG 486, Unscheduled DNA Synthesis (UDS) Test with Mammalian Liver Cells In Vivo (1997).
1.1 UVOD
Namen preizkusa nenačrtne sinteze DNA (UDS) v jetrnih celicah sesalcev in vivo je določiti preizkušane snovi, ki sprožijo popravljanje DNA v jetrnih celicah tretiranih živali (1), (2), (3), (4).
Ta preizkus in vivo je metoda za preiskovanje genotoksičnih učinkov kemikalij na jetra. Izmerjena končna točka kaže na poškodbe in posledično popravljanje DNA v jetrnih celicah. Jetra so navadno glavno področje presnove absorbiranih spojin. Zato so primerno mesto za merjenje poškodb DNA in vivo.
Če obstajajo dokazi, da preizkušana snov ne bo dosegla tarčnega tkiva, ta preizkus ni primeren.
Končna točka preizkusa nenačrtne sinteze DNA (UDS) se meri z določanjem sprejema označenih nukleozidov v celicah, v katerih ne poteka načrtna (faza S) sinteza DNA. Najpogosteje uporabljena tehnika je avtoradiografsko določanje sprejema timidina, označenega s tritijem (3H-TdR). Za preizkuse UDS in vivo se po možnosti uporabljajo jetra podgan. Namesto jeter se lahko uporabijo druga tkiva, vendar ta niso predmet te metode.
Zaznavanje odziva UDS je odvisno od števila baz DNA, ki se izrežejo in zamenjajo na mestu poškodbe. Zato je preizkus UDS posebej koristen za zaznavanje „popravljanja dolgih delov“ (20 do 30 baz), ki ga povzroči snov. „Popravljanje kratkih delov“ (ena do tri baze) se zazna z mnogo manjšo občutljivostjo. Poleg tega mutageni pojavi lahko nastanejo zaradi nepopravljanja, napačnega popravljanja ali napačnega podvojevanja lezij DNA. Velikost odziva UDS ne da nobenih podatkov o točnosti popravljanja. Možno je tudi, da mutagen reagira z DNA, a se poškodbe DNA ne popravijo s popravljanjem z izrezovanjem. Pomanjkanje specifičnih informacij o mutagenem delovanju pri preizkusu UDS se nadomesti s potencialno občutljivostjo te končne točke, ker se meri v celotnem genomu.
Glej tudi splošni uvod dela B.
1.2 DEFINICIJE
Celice v popravljanju: neto število jedrnih zrnc (NNG), večje od vnaprej določene vrednosti, utemeljene v laboratoriju, ki opravlja preizkus.
Neto število jedrnih zrnc (NNG): kvantitativno merilo za UDS aktivnost v celici pri avtoradiografskih preizkusih UDS, ki se izračuna tako, da se povprečno število citoplazemskih zrnc v jedru enakovrednih območjih citoplazme (CG) odšteje od števila jedrnih zrnc (NG): NNG = NG – CG. Število NNG se izračuna za posamezne celice in nato združi za celice v kulturi, v vzporednih kulturah itn.
Nenačrtna sinteza DNA (UDS): popravljalna sinteza DNA po izrezu in odstranitvi dela DNA, na katerem je poškodba, ki jo povzročijo kemične snovi ali fizikalni dejavniki.
1.3 PRINCIP PRESKUSNE METODE
Preizkus UDS v jetrnih celicah sesalcev in vivo kaže na popravljalno sintezo DNA po izrezu in odstranitvi dela DNA, na katerem je poškodba, ki jo povzročijo kemične snovi ali fizikalni dejavniki. Preizkus navadno temelji na vključitvi 3H-TdR v DNA jetrnih celic, v katerih je majhna pogostnost celic v fazi S celičnega ciklusa. Sprejem 3H-TdR se navadno določi z avtoradiografijo, ker ta tehnika ni tako dovzetna za motnje, ki jih povzročajo celice v fazi S, kakor je to na primer metoda tekočinske scintilacije.
1.4 OPIS METODE
1.4.1 Priprave
1.4.1.1 Izbira živalskih vrst
Navadno se uporabljajo podgane, lahko pa se uporabi katera koli primerna vrsta sesalcev. Uporabijo naj se splošno uporabljani laboratorijski sevi mladih zdravih odraslih živali. Ob začetku študije naj bo nihanje teže živali čim manjše in naj ne presega ± 20 % srednje vrednosti teže za vsak spol.
1.4.1.2 Pogoji bivanja in hranjenja
Uporabljajo se splošni pogoji iz splošnega uvoda dela B, vendar naj bo ciljna vlažnost 50 do 60 %.
1.4.1.3 Priprava živali
Zdrave mlade odrasle živali se naključno dodelijo kontrolni in tretirani skupini. Kletke se razporedijo tako, da se čimbolj zmanjšajo možni učinki postavitve kletke. Živali se označijo z enkratnimi oznakami in se pustijo v kletkah vsaj pet dni pred začetkom študije, da se aklimatizirajo na laboratorijske razmere.
1.4.1.4 Preizkušana snov/priprava
Trdne preizkušane snovi naj se pred odmerjanjem živalim raztopijo ali suspendirajo v ustreznih topilih ali nosilcih, in če je to primerno, se razredčijo. Tekoče preizkušane snovi se lahko odmerijo neposredno ali pa se pred odmerjanjem razredčijo. Uporabljajo naj se sveže pripravljene preizkušane snovi, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
1.4.2 Preizkusni pogoji
1.4.2.1 Topilo/nosilec
Topilo/nosilec naj nima toksičnih učinkov pri uporabljenih odmerkih in naj se zanj ne sumi, da kemično reagira s preizkušano snovjo. Če se uporabijo manj poznana topila/nosilci, naj njihovo vključitev podpirajo podatki, ki kažejo na njihovo združljivost. Priporoča se, da se, kadar koli je to mogoče, kot prva možnost preuči uporaba vodnega topila/nosilca.
1.4.2.2 Kontrolni vzorci
V vsak samostojno izveden del preizkusa naj se vključijo sočasni pozitivni in negativni (topilo/nosilec) kontrolni vzorci. Razen tretiranja s preizkušano snovjo naj se z živalmi v kontrolni skupini ravna enako kakor s tistimi v tretiranih skupinah.
Snovi pozitivne kontrole naj bodo snovi, za katere se ve, da povzročijo UDS, če se dajejo pri ravneh izpostavljenosti, pri katerih se pričakuje zaznavno povečanje glede na ozadje. Snovi pozitivne kontrole, pri katerih je potrebna aktivacija presnove, naj se uporabljajo v odmerkih, ki povzročijo zmeren odziv (4). Odmerki naj se izberejo tako, da so učinki jasni, vendar ne razkrijejo takoj identitete kodiranih mikroskopskih preparatov. Primeri snovi pozitivne kontrole vključujejo:
|
Čas vzorčenja |
Snov |
Št. CAS |
Št. Einecs |
|
Zgodnja vzorčenja (2 do 4 ure) |
N-dimetilnitrozamin |
62-75-9 |
200-249-8 |
|
Pozna vzorčenja (12 do 16 ur) |
N-2-fluorenilacetamid (2-AAF) |
53-96-3 |
200-188-6 |
Lahko se uporabijo druge ustrezne snovi pozitivne kontrole. Sprejemljivo je, da se snovi pozitivne kontrole dajejo živalim drugače kakor preizkušana snov.
1.5 POSTOPEK
1.5.1 Število in spol živali
Uporabi naj se zadostno število živali, da se upošteva naravno biološko nihanje odziva na preizkus. V vsaki skupini naj bodo vsaj tri živali, ki jih je mogoče analizirati. Če že obstaja obsežna baza preteklih podatkov, sta za sočasne negativne in pozitivne kontrolne skupine potrebni le ena ali dve živali.
Če so v času študije na voljo podatki študij o isti vrsti in ob uporabi istega načina izpostavljanja, ki dokazujejo, da med spoloma ni znatnih razlik v toksičnosti, bo zadostovalo preizkušanje na enem spolu, po možnosti na samcih. Kadar bi bila lahko izpostavljenost kemikaliji pri človeku omejena na en spol, na primer pri nekaterih farmacevtskih učinkovinah, naj se preizkus opravi na živalih ustreznega spola.
1.5.2 Program tretiranja
Preizkušane snovi se navadno dajejo z enkratnim vnosom.
1.5.3 Velikost odmerkov
Navadno se uporabljata vsaj dve velikosti odmerkov. Največji odmerek je odmerek, ki povzroči takšne znake toksičnosti, da se pričakuje, da bi večji odmerki pri istem režimu odmerjanja povzročili smrt. V splošnem naj bo manjši odmerek 50 do 25 % večjega odmerka.
Snovi s specifičnim biološkim delovanjem pri majhnih netoksičnih odmerkih (na primer hormoni in mitogeni) so lahko izjeme pri merilih za določanje odmerka in naj se ovrednotijo za vsak primer posebej. Če se opravi študija za ugotavljanje območja, ker ni na voljo ustreznih podatkov, naj se opravi v istem laboratoriju, na isti vrsti, sevu in spolu ter ob enakem režimu tretiranja, kakor bo to uporabljeno v glavni študiji.
Največji odmerek se lahko opredeli tudi kot odmerek, ki povzroči nekaj znakov toksičnosti v jetrih (npr. piknotična jedra).
1.5.4 Mejni preizkus
Če preizkus pri eni velikosti odmerka vsaj 2 000 mg/kg telesne teže, ki se da v enem vnosu ali v dveh vnosih v istem dnevu, ne povzroči nobenih opaznih toksičnih učinkov in če se na podlagi podatkov o strukturno sorodnih snoveh ne pričakuje, da bo snov genotoksična, popolna študija morda ne bo potrebna. Pričakovana izpostavljenost človeka lahko nakaže potrebo po večjih odmerkih pri mejnem preizkusu.
1.5.5 Dajanje odmerkov
Navadno se preizkušana snov da z gavažo po želodčni cevki ali ustrezni intubacijski kanili. Sprejemljivi so tudi drugi načini izpostavljanja, kadar se lahko utemeljijo. Vendar intraperitonealni način ni priporočljiv, ker jetra lahko izpostavi preizkušam snovi neposredno in ne prek krvožilnega sistema. Največji volumen tekočine, ki se lahko naenkrat da z gavažo ali injekcijo, je odvisen od velikosti preizkusne živali. Volumen naj ne presega 2 ml/100 g telesne teže. Uporabo večjih volumnov je treba utemeljiti. Razen pri dražilnih ali jedkih snoveh, ki bodo navadno povzročile dražilne učinke pri večjih koncentracijah, naj se s prilagoditvijo koncentracije čimbolj zmanjša spremenljivost preizkusnega volumna, tako da se zagotovi stalni volumen pri vseh velikostih odmerkov.
1.5.6 Priprava jetrnih celic
Jetrne celice tretiranih živali se navadno pripravijo 12 do 16 ur po odmerjanju. Navadno je potrebno dodatno, zgodnejše vzorčenje (ponavadi dve do štiri ure po tretiranju), razen če se po 12 do 16 urah pokaže jasen pozitivni odziv. Lahko se vzorči tudi ob drugih časih, kadar je to utemeljeno s podatki o toksikokinetiki.
Navadno se pripravijo kratkotrajne kulture jetrnih celic sesalcev, tako da se jetra perfundirajo in situ s kolagenazo in se sveže odcepljenim jetrnim celicam omogoči, da se pritrdijo na ustrezno podlago. Jetrne celice živali negativne kontrole naj imajo sposobnost preživetja (5) vsaj 50 %.
1.5.7 Določanje UDS
Sveže izolirane sesalske jetrne celice se primerno dolgo, na primer tri do osem ur, inkubirajo, navadno v gojišču, ki vsebuje 3H-TdR. Po končani inkubaciji se gojišče odstrani s celic, ki se nato lahko inkubirajo v gojišču s presežkom neoznačenega timidina, da se zmanjša nevgrajena radioaktivnost (cold chase). Celice se nato sperejo, fiksirajo in posušijo. Pri daljši inkubaciji „cold chase“ morda ne bo potreben. Mikroskopski preparati se pomočijo v avtoradiografsko emulzijo, se izpostavijo v temi (npr. hranijo se v hladilniku 7 do 14 dni), se razvijejo in pobarvajo, nato se preštejejo izpostavljena srebrna zrnca. Za vsako žival se pripravijo dva do trije preparati.
1.5.8 Analiza
Mikroskopski preparati naj vsebujejo dovolj celic z normalno morfologijo, da je omogočeno smiselno ocenjevanje UDS. Preparati se mikroskopsko pregledajo, da se poiščejo znaki očitne citotoksičnosti (npr. piknoza, zmanjšana raven radioaktivnih označevalcev).
Mikroskopski preparati naj se kodirajo pred štetjem zrnc. Navadno se v štetje vključi 100 celic za vsako žival z vsaj dveh preparatov; štetje manj kakor 100 celic/žival naj bo utemeljeno. Število zrnc se ne določa za jedra v fazi S, lahko pa se evidentira delež celic v fazi S.
Količina 3H-TdR, vgrajenega v jedra in citoplazmo morfološko normalnih celic, kar dokazuje nalaganje srebrnih zrnc, naj se določi z ustreznimi metodami.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Navedejo se podatki za posamezne mikroskopske preparate in živali. Poleg tega naj bodo vsi podatki povzeti v tabeli. Izračuna naj se neto število jedrnih zrnc (NNG) za vsako celico, vsako žival ter vsak odmerek in čas, tako da se od števila NG odšteje število CG. Če se preštevajo „celice v popravljanju“, naj bodo merila za določanje „celic v popravljanju“ utemeljena in zasnovana na podatkih pretekle ali sočasne negativne kontrole. Numerični rezultati se lahko ovrednotijo s statističnimi metodami. Če se uporabijo statistični testi, naj se izberejo in utemeljijo pred začetkom študije.
2.2 VREDNOTENJE IN INTERPRETACIJA REZULTATOV
Primeri meril za pozitivne/negativne odzive vključujejo:
|
pozitivne |
(i) |
vrednosti NNG, večje od poprej določenega praga, ki je utemeljen na podlagi preteklih podatkov laboratorija; |
|
ali |
(ii) |
vrednosti NNG, znatno večje kakor pri sočasni kontroli; |
|
negativne |
(i) |
vrednosti NNG, v območju preteklega kontrolnega praga ali pod njim; |
|
ali |
(ii) |
vrednosti NNG, ne znatno večje kakor pri sočasni kontroli. |
Prouči naj se biološka pomembnost rezultatov: to pomeni, naj se upoštevajo parametri, kakor so razlike med živalmi, odvisnost med odmerkom in odzivom ter citotoksičnost. Pri vrednotenju rezultatov preizkusa se kot pomoč lahko uporabijo statistične metode. Vendar pa naj statistična značilnost ne bo edini odločilni dejavnik za pozitivni odziv.
Čeprav bo večina poskusov dala jasne pozitivne ali negativne rezultate, bodo v redkih primerih dobljeni podatki preprečili zanesljivo oceno o delovanju preizkušane snovi. Rezultati lahko ostanejo dvoumni ali dvomljivi ne glede na število ponovitev poskusa.
Pozitivni rezultat preizkusa UDS z jetrnimi celicami sesalcev in vivo pomeni, da preizkušana snov povzroča poškodbe DNA v jetrnih celicah sesalcev in vivo, ki se lahko popravijo z nenačrtno sintezo DNA in vitro. Negativni rezultat pomeni, da preizkušana snov pri preizkusnih pogojih ne povzroča poškodb DNA, ki se lahko zaznajo s tem preizkusom.
Obravnava naj se verjetnost, da preizkušana snov doseže krvni obtok ali posebej tarčno tkivo (npr. sistemska toksičnost).
3. POROČANJE
POROČILO O PRESKUSU
Poročilo o preizkusu mora vsebovati naslednje informacije:
Topilo/nosilec:
— utemeljitev izbire nosilca,
— topnost in stabilnost preizkušane snovi v topilu/nosilcu, če sta znani.
Preskusne živali:
— uporabljena vrsta/sev,
— število, starost in spol živali,
— vir, pogoji bivanja, prehrana itn.,
— teža posameznih živali na začetku preizkusa, skupaj z območjem telesne teže, srednjo vrednostjo in standardnim odklonom za vsako skupino.
Preskusni pogoji:
— pozitivni in negativni (nosilec/topilo) kontrolni vzorci,
— podatki študije za ugotavljanje območja, če j e bila opravljena,
— razlogi za izbiro velikosti odmerka,
— podrobnosti o pripravi preizkušane snovi,
— podrobnosti o dajanju preizkušane snovi,
— razlogi za način dajanja,
— metode za preverjanje, ali je preizkušana snov dosegla krvni obtok ali tarčno tkivo, če je to primerno,
— način preračunavanja koncentracije preizkušane snovi v hrani/pitni vodi (ppm) v dejanski odmerek (mg/kg telesne teže/dan), če je to primerno,
— podrobnosti o kakovosti hrane in vode,
— podroben opis programov tretiranja in vzorčenja,
— metode merjenja toksičnosti,
— metoda priprave in kultiviranja jetrnih celic,
— uporabljena avtoradiografska tehnika,
— število pripravljenih mikroskopskih preparatov in število celic, upoštevanih pri štetju,
— merila vrednotenja,
— merila za določitev, ali je študija pozitivna, negativna ali dvoumna,
Rezultati:
— srednja vrednost števila jedrnih zrnc, števila citoplazemskih zrnc in neto števila jedrnih zrnc za posamezne mikroskopske preparate, živali in skupine,
— odvisnost med odmerkom in odzivom, če je na voljo,
— statistična ocena, če je na voljo,
— znaki toksičnosti,
— podatki o sočasni negativni (topilo/nosilec) in pozitivni kontroli,
— podatki o pretekli negativni (topilo/nosilec) in pozitivni kontroli, z območji, srednjimi vrednostmi in standardnimi odkloni,
— število „celic v popravljanju“, če je bilo določeno,
— število celic v fazi S, če je bilo določeno,
— sposobnost preživetja celic.
Diskusija rezultatov.
Sklepi.
4. LITERATURA
(1) Ashby, J., Lefevre, P.A., Burlinson, B. and Penman, M.G. (1985). An Assessment of the In Vivo Rat Hepatocyte DNA Repair Assay. Mutation Res., 156, str. 1–18.
(2) Butterworth, B.E., Ashby, J., Bermudez, E., Casciano, D., Mirsalis, J., Probst, G. and Williams, G. (1987). A Protocol and Guide for the In Vivo Rat Hepatocyte DNA-Repair Assay. Mutation Res. 189, str. 123–133.
(3) Kennelly, J.C., Waters, R., Ashby, J., Lefevre, P.A., Burlinson, B., Benford, D.J., Dean, S.W. and Mitchell, I. de G. (1993). In Vivo Rat Liver UDS Assay. In: Kirkland D.J. and Fox M., (Eds) Supplementary Mutagenicity Tests: UKEM Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part II revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, str. 52–77.
(4) Madle, S., Dean, S.W., Andrae, U., Brambilla, G., Burlinson, B., Doolittle, D.J., Furihata, C., Hertner, T., McQueen, C.A. and Mori, H. (1993). Recommendations for the Performance of UDS Tests In Vitro and In Vivo. Mutation Res., 312, str. 263–285.
(5) Fautz, R., Hussain, B., Efstathiou, E. and Hechenberger-Freudl, C. (1993). Assessment of the Relation Between the Initial Viability and the Attachment of Freshly Isolated Rat Hepatocytes Used for the In Vivo/In Vitro DNA Repair Assay (UDS). Mutation Res., 291, str. 21–27.
(6) Mirsalis, J.C., Tyson, C.K. and Butterworth, B.E. (1982). Detection of Genotoxic Carcinogens in the In Vivo/In Vitro Hepatocyte DNA Repair Assay. Environ. Mutagen, 4, str. 553–562.
B.40 JEDKOSTZAKOŽOIN VITRO: PRESKUS TRANSKUTANE ELEKTRIČNE UPORNOSTI (TER)
1. METODA
Ta preskusna metoda je enakovredna OECD TG 430 (2004).
1.1 UVOD
Jedkost za kožo pomeni nastanek nepovratnih poškodb kožnega tkiva po nanosu preskušanega materiala [po definiciji iz Globally Harmonised System for the Classification and Labelling of Chemical Substances and Mixtures (GHS)] (1). Ta metoda določa postopek, s katerim se ocena jedkosti ne opravlja na živih živalih.
Ocena jedkosti za kožo se je običajno opravljala na laboratorijskih živalih (2). Zadržki v zvezi z bolečinami in trpljenjem živali, ki je povezano s tem postopkom, je bilo upoštevano v reviziji preskusne metode B.4, ki omogoča določevanje jedkosti za kožo z alternativnimi metodami in vitro, pri čemer se preprečita bolečina in trpljenje.
Prvi korak k določitvi alternativnih preskusov, ki bi se lahko uporabili za preskušanje jedkosti za kožo v regulativne namene, so bile predvalidacijske študije (3). Za temi je bila opravljena uradna validacijska študija metod in vitro za oceno jedkosti za kožo (4) (5) (6) (7) (8). Na podlagi izidov teh študij in druge objavljene literature je bilo izdelano priporočilo, da se lahko naslednja preskusa uporabita za oceno jedkosti za kožo in vivo (9) (10) (11): preskus z modelom človeške kože (glej preskusno metodo B.40bis) in preskus transkutane električne upornosti (ta metoda).
V validacijski študiji in drugih objavljenih študijah so ugotovili, da lahko preskus transkutane električne upornosti (TER) pri podganah (12) (13) zanesljivo razlikuje med znanimi snovmi, ki so jedke za kožo, in znanimi snovmi, ki niso jedke (5) (9).
Preskus opisan v tej metodi omogoča identifikacijo jedkih kemijskih snovi in mešanic. Omogoča tudi identifikacijo nejedkih snovi in mešanic, če je podprta z dokazi in ob uporabi drugih obstoječih podatkov (npr. pH, razmerja struktura-aktivnost, podatki o ljudeh in/ali živalih) (1) (2) (11) (14). Ne daje pa podatkov o draženju kože niti ne omogoča nadaljnje kategorizacije jedkih snovi, kot je to dovoljeno v Globally Harmonised Classification System (GHS) (1).
Za popolno vrednotenje lokalnih učinkov na kožo po enkratni izpostavljenosti se priporoča upoštevanje načrtovanja zaporednega preskušanja, ki je priloženo Preskusni metodi B.4 (2) in na voljo v Globally Harmonised System (1). To načrtovanje preskušanja vključuje opravljanje preskusov jedkosti za kožo in vitro (kakor je opisano v tej metodi) in preskusov draženja kože in vitro pred preskušanjem na živih živalih.
1.2 OPREDELITEV POJMOV
Jedkost za kožo in vivo: je nastanek nepovratnih poškodb kože: zlasti, vidne nekroze skozi pokožnico in v usnjico v štirih urah po nanosu preskusne snovi. Reakcije na jedkost se razvrstijo na ulceracije, krvavitve, krvave kraste in po 14-dnevnem opazovanju, ko se zaradi luščenja kože izgubi obarvanost, na območja alopecije in brazgotine. Dvomljive lezije je treba preiskati histopatološko.
Transkutana električna upornost (TER): merilo električne impedance kože, ki je izražena kot upornost v kiloohmih. Preprosta in robustna metoda za ocenjevanje pregradne funkcije z beleženjem prehoda ionov preko kože z aparaturo z Wheatstonovim mostičem.
1.3 REFERENČNE SPOJINE
Tabela 1
Referenčne kemikalije
|
Ime |
Št. Einecs |
Št. CAS |
|
|
1,2-Diaminopropan |
201-155-9 |
78-90-0 |
Močno jedko |
|
Akrilna kislina |
201-177-9 |
79-10-7 |
Močno jedko |
|
2-terc-Butilfenol |
201-807-2 |
88-18-6 |
Jedko |
|
Kalijev hidroksid (10-odstoten) |
215-181-3 |
1310-58-3 |
Jedko |
|
Žveplova kislina (10-odstotna) |
231-639-5 |
7664-93-9 |
Jedko |
|
Oktanojska kislina (kaprilska kislina) |
204-677-5 |
124-07-02 |
Jedko |
|
4-Amino-1,2,4-triazol |
209-533-5 |
584-13-4 |
Ni jedko |
|
Evgenol |
202-589-1 |
97-53-0 |
Ni jedko |
|
Fenetil bromid |
203-130-8 |
103-63-9 |
Ni jedko |
|
Tetrakloroetilen |
204-825-9 |
27-18-4 |
Ni jedko |
|
Izostearinska kislina |
250-178-0 |
30399-84-9 |
Ni jedko |
|
4-(Metiltio)-benzaldehid |
222-365-7 |
3446-89-7 |
Ni jedko |
Večina navedenih kemikalij je vzetih s seznama kemikalij izbranih za mednarodno validacijsko študijo ECVAM (4). Izbira v tej študiji je temeljila na naslednjih kriterijih:
(i) enako število jedkih in nejedkih snovi;
(ii) komercialno dostopne snovi, ki pokrivajo večino pomembnih kemijskih skupin;
(iii) vključitev močno jedkih in manj jedkih snovi, da se omogoči razlikovanje na podlagi stopnje jedkosti;
(iv) izbira kemikalij, s katerimi je mogoče v laboratoriju ravnati, ne da bi nastopile druge hude nevarnosti z izjemo jedkosti.
1.4 PRINCIP PRESKUSNE METODE
Preskušani material se nanese za največ 24 ur na epidermalne površine kožnih ploščic v preskusnem sistemu z dvema komorama, v katerem kožne ploščice ločujejo komori. Kožne ploščice se odvzamejo s humano usmrčenih podgan, starih 28–30 dni. Jedki materiali se identificirajo glede na zmožnost zmanjšati celovitost in pregradno funkcijo rožene plasti pokožnice, ki se meri kot znižanje TER pod raven praga (12). Za TER pri podganah je bil na podlagi obsežnih podatkov za širok obseg kemikalij izbran prag 5 kΩ, kjer je bila velika večina vrednosti precej nad pragom (pogosto > 10 kΩ) ali precej pod njim (pogosto < 3 kΩ) (12). Na splošno materiali, ki niso jedki za živali, ampak so dražilni ali nedražilni, ne znižujejo TER pod ta prag. Prav tako lahko uporaba drugih kožnih pripravkov ali druge opreme spremeni vrednost praga, kar zahteva dodatne validacije.
V preskusni postopek je vključena stopnja vezave barvila za potrjevanje pozitivnih rezultatov preskusa TER, kadar so vrednosti okoli 5 kΩ. V stopnji vezave barvila se ugotovi, ali je povečanje ionske prepustnosti posledica fizičnega uničenja rožene plasti pokožnice. Metoda TER je na podganji koži pokazala, da lahko pri kuncih napove jedkost in vivo, določeno s preskusno metodo B.4 (2). Treba je pripomniti, da je preskus in vivo na kuncih v primerjavi s preskusom na koščku človeške kože zelo konzervativen glede jedkosti za kožo in draženja kože (15).
1.5 OPIS PRESKUSNE METODE
1.5.1 Živali
Podgane so bile izbrane, ker je bila občutljivost kože podgan za kemikalije v tem preskusu predhodno dokazana (10). Zagotoviti je treba, da so mešički dlak v dormantni fazi, preden se začne rast odraslih dlak, pri čemer sta zlasti pomembna starost (ob odvzemu kože) in linija podgane.
Dlaka na hrbtu in bokih mladih približno 22 dni starih samcev ali samic (Wistar ali podobne linije podgan) se previdno odstrani z majhnimi škarjami. Nato se živali s pazljivim brisanjem umijejo, ostrižena površina pa se potopi v antibiotično raztopino (ki denimo vsebuje streptomicin, penicilin, kloramfenikol in amfotericin v koncentracijah, ki učinkovito preprečujejo rast bakterij). Živali se z antibiotično raztopino ponovno umijejo tretji ali četrti dan po prvem umivanju, uporabijo pa se v 3 dneh po drugem umivanju, ko rožena plast okreva po odstranitvi dlak.
1.5.2 Priprava kožnih ploščic
Živali se humano usmrtijo, ko so stare 28-30 dni; ta starost je ključna. Z vsake posamezne živali se nato odstrani hrbtno bočna koža in z nje previdno odlušči vsa odvečna podkožna maščoba. Nato se izrežejo kožne ploščice v premeru približno 20 mm. Koža se lahko shrani pred uporabo ploščic, kadar se dokaže, da so podatki pozitivnih in negativnih kontrol enaki kot pri sveži koži.
Vsaka kožna ploščica se namesti čez konec cevi iz PTFE (politetrafluoroetilena), pri čemer se mora površina pokožnice dotikati cevi. Čez konec cevi se tesno namesti gumijast obroč, s katerim se koža pričvrsti, nato se obreže odvečno tkivo. Mere cevi in obroča so prikazane na sliki 2. Gumijasti obroč se nato z naravnim vazelinom pazljivo pri tesni na konec PTFE-cevi. Cev se z vzmetno sponko namesti v receptorsko komoro, ki vsebuje raztopino MgSO4 (154 mM) (slika 1). Kožne ploščice morajo biti popolnoma potopljene v raztopino MgSO4. Iz kože ene podgane je mogoče pridobiti od 10 do 15 kožnih ploščic.
Na dveh kožnih ploščicah iz kože vsake živali se pred začetkom preskušanja za namene kontrole kakovosti izmeri električna upornost. Ploščice se lahko uporabijo v preskusu, če je upornost obeh ploščic večja od 10 kΩ. Če je upornost manjša od 10 kΩ, je treba preostale ploščice, pripravljene iz iste kože, zavreči.
1.5.3 Nanos preskušanih in kontrolnih snovi
V vsaki študiji je treba uporabiti istočasne pozitivne in negativne kontrole, da se zagotovi ustreznost izvedbe modela poskusa. Uporabijo se lahko le kožne ploščice ene živali. Predlagana snov za pozitivno kontrolo je 10-molarna klorovodikova kislina, za negativno kontrolo pa destilirana voda.
Tekoče preskušane snovi (150 μL) se nanesejo enakomerno na površino pokožnice v cevi. Pri preskušanju trdnega materiala se na kožno ploščico enakomerno nanese dovolj trdne snovi, da se zagotovi, da je prekrita celotna površina pokožnice. Nato se na trdno snov doda deionizirana voda (150 μL), cevka pa se rahlo pretrese. Za največji stik s kožo bo morda treba trdno snov segrevati do 30 oC, da se preskušana snov stali ali zmehča, ali zmleti, da nastane granulat ali prašek.
Za vsako preskušano snov in kontrolno snov se uporabijo tri kožne ploščice. Preskušana snov se odstrani tako, da se toliko časa spira s curkom tekoče vode, ki ima do 30 oC, dokler ni več mogoče odstraniti materiala.
1.5.4 Meritve TER
Impedanca kože se izmeri kot TER z Wheatstonovim mostičem nizke napetosti in izmeničnega toka (13). Splošne specifikacije za mostič so: delovna napetost 1-3 volte, izmenični tok 50–1 000 Hz v obliki sinusa ali pravokotnika in merilno območje najmanj 0,1–30 kΩ. Merilni mostič v validacijski študiji je meril induktivnost do 2 000 H, kapacitivnost do 2 000 μF in upornost do 2 MΩ pri frekvencah 100 Hz ali 1 kHz v zaporednih ali vzporednih meritvah. V preskusu jedkosti TER se meritve beležijo v obliki upornosti pri frekvenci 100 Hz in z zaporednimi vrednostmi. Pred merjenjem električne upornosti se površinska napetost kože zmanjša, tako da se doda zadostna količina 70-odstotnega etanola, da prekrije pokožnico. Po nekaj sekundah se etanol odstrani iz cevi, tkivo pa se nato navlaži s 3 mL raztopine MgSO4 (154 mM). Za merjenje upornosti v kΩ/kožno ploščico se elektrode merilnega mostiča namestijo na vsako stran kožne ploščice (slika 1). Mere elektrod in dolžina elektrode pod krokodilsko sponko so navedene na sliki 2. Sponka notranje (debele) elektrode med merjenjem upornosti leži na vrhu PTFE-cevi, s čimer se zagotovi, da je v raztopino MgSO4 ves čas potopljena enaka dolžina elektrode. Zunanja elektroda je v receptorski komori, in sicer se dotika njenega dna. Razdalja med vzmetno sponko in dnom PTFE-cevi je konstantna (slika 2), saj ta razdalja vpliva na dobljeno vrednost upornosti. Zato mora biti razdalja med notranjo elektrodo in kožno ploščico konstantna in minimalna (1–2 mm).
Če je izmerjeni upor večji od 20 kΩ, je to morda posledica tega, da ostanki preskušane snovi prekrivajo površino pokožnice kožne ploščice. Za odstranitev te plasti se lahko na primer začepi PTFE-cev z orokavičenim palcem in jo stresa približno 10 sekund; raztopina MgSO4 se zavrže, merjenje upornosti pa se ponovi s svežim MgSO4.
Lastnosti in mere preskusne naprave in uporabljenega poskusnega postopka lahko vplivajo na pridobljene vrednosti TER. Prag za jedkost 5 kΩ je bil ugotovljen na podlagi podatkov, pridobljenih s posebnimi napravami in postopki, opisanimi v tej metodi. Če se preskusni pogoji bistveno spremenijo ali če se uporabi drugačna aparatura, lahko veljajo drugačni pragovi in kontrolne vrednosti. Zaradi tega je treba metodologijo in prag upornosti obvezno umerjati s preskušanjem vrste referenčnih standardov, ki se izberejo izmed kemikalij, uporabljenih v validacijski študiji (4) (5), ali iz skupin kemikalij, ki so podobne preskušani. Nabor primernih referenčnih kemikalij je prikazan v tabeli 1.
1.5.5 Metode vezave barvila
Izpostavljenost določenim nejedkim materialom lahko povzroči zmanjšanje upornosti pod prag 5 kΩ, pri čemer je omogočen prehod ionov skozi roženo plast in zmanjšanje električne upornosti (5). Npr. nevtralne organske snovi in kemikalije, ki so površinsko aktivne (med drugim detergenti, emulgatorji in druge površinsko aktivne snovi) lahko odstranjujejo kožne lipide in povzročijo večjo prepustnost ionov. Zato je treba pri vrednostih TER za preskušano snov pod ali okoli 5 kΩ in brez vidnih poškodb opraviti oceno penetracije barvila na kontrolnih in obdelovanih tkivih, da se ugotovi, ali so vrednosti TER posledica povečane prepustnosti kože ali jedkosti za kožo (3) (5). V slednjem primeru barvilo sulforodamin B poruši roženo plast, ki po nanosu na površino kože hitro penetrira in obarva pod njim ležeče tkivo. To specifično barvilo je odporno proti širokemu razponu kemikalij in nanj ne vpliva ekstrakcijski postopek, opisan spodaj.
1.5.5.1 Nanos in odstranitev barvila sulforodamin B
Po oceni TER se magnezijev sulfat odstrani iz cevi, kožo pa je treba natančno pregledati za vidne poškodbe. Če ni očitnih večjih poškodb, se na površino pokožnice vsake kožne ploščice za 2 uri nanese 150 μl 10-odstotne (m/V) raztopine barvila sulforodamin B (Acid Red 52; C.I. 45100; št. Einecs 222-529-8; št. CAS 3520-42-1) v destilirani vodi. Te kožne ploščice se nato približno 10 sekund spirajo s tekočo vodo pri največ sobni temperaturi, da se odstrani morebitno odvečno/nevezano barvilo. Vsaka kožna ploščica se pazljivo odstrani iz PTFE-cevi in se prenese v vialo (npr. 20-mililitrsko stekleničko za scintilacijsko tekočino), ki vsebuje deionizirano vodo (8 mL). Viale se 5 minut rahlo stresajo, da se odstrani preostalo odvečno nevezano barvilo. Postopek izpiranja se ponovi, nato pa se kožne ploščice odstranijo in prenesejo v viale, ki vsebujejo 5 mL 30-odstotnega (m/V) natrijevega dodecil sulfata (SDS) v destilirani vodi in se v inkubatorju čez noč shranijo pri 60 oC.
Po inkubaciji se vse kožne ploščice odstranijo in zavržejo, preostala raztopina pa se 8 minut centrifugira pri 21 oC (relativna centrifugalna sila ~ 175 × g). Vzorec supernatanta v količini 1 mL se nato razredči v razmerju 1 proti 5 (V/V) (tj. 1 mL + 4 mL) s 30-odstotnim SDS (m/V) v destilirani vodi. Optična gostota (OD) raztopine se meri pri 565 nm.
1.5.5.2 Izračun vsebnosti barvila
Vsebnost barvila sulforodamin B v ploščici se izračuna iz vrednosti OD (koeficient molarne ekstinkcije barvila sulforodamin B pri 565 nm = 8,7 × 10; molekulska masa = 580). Vsebnost barvila se določi za vsako kožno ploščico s pomočjo ustrezne umeritvene krivulje, nato pa se izračuna srednja vrednost vsebnosti barvila za ponovitve.
2. PODATKI
Vrednosti upornosti (kΩ) in, kadar je primerno, vrednosti vsebnosti barvila (μg/ploščico) za preskušano snov skupaj s podatki pozitivnih in negativnih kontrol, je treba prikazati v obliki razpredelnice (posamezni podatki preskušanja in srednje vrednosti ± standardni odklon), vključno s podatki ponovitev/ponovljenih poskusov, srednjimi vrednostmi in posameznimi vrednostmi.
2.1 RAZLAGA REZULTATOV
Povprečni rezultati TER se sprejmejo pod pogojem, da so vrednosti istočasne pozitivne in negativne kontrole v mejah sprejemljivosti za to metodo v preskusnem laboratoriju. Meje sprejemljivosti za metodologijo in aparaturo, opisani zgoraj, so prikazane v naslednji tabeli:
|
Kontrola |
Snov |
Mejni upor (kΩ) |
|
Pozitivna |
10M klorovodikova kislina |
0,5–1,0 |
|
Negativna |
Destilirana voda |
10–25 |
Povprečni rezultati vezanja barvila se sprejmejo pod pogojem, da so vrednosti istočasne kontrole v mejah sprejemljivosti za metodo. Predlagane sprejemljive meje vsebnosti barvila za kontrolne snovi za opisano metodologijo in napravo so naslednje:
|
Kontrola |
Snov |
Meje vsebnosti barvila (μg/košček) |
|
Pozitivna |
10 M klorovodikova kislina |
40–100 |
|
Negativna |
Destilirana voda |
15–35 |
Preskušana snov se šteje kot nejedka za kožo:
(i) če je srednja vrednost TER, dobljena za preskušano snov, večja od 5 kΩ ali
(ii) če je srednja vrednost TER manjša ali enaka kot 5 kΩ in
— na kožni ploščici ni vidnih poškodb in
— je srednja vrednost vsebnosti barvila v kožni ploščici veliko manjša od istočasno določene srednje vrednosti vsebnosti barvila v kožni ploščici iz pozitivne kontrol 10-molarno HCl.
Preskušana snov se šteje kot jedka za kožo:
(i) če je srednja vrednost TER manjša ali enaka kot 5 kΩ in je kožna plošč vidno poškodovana ali
(ii) če je srednja vrednost TER manjša ali enaka kot 5 kΩ in
— na kožni ploščici ni vidnih poškodb, vendar
— je srednja vrednost vsebnosti barvila v kožni ploščici večja ali enaka istočasno določeni srednji vrednosti vsebnosti barvila v kožni ploščici iz pozitivne kontrole z 10-molarno HCl.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje informacije:
Preskušane in kontrolne snovi:
— kemijsko(-a) ime(-na), npr. IUPAC, ime CAS in številko CAS, če je znana,
— čistost in sestavo snovi ali pripravka (v utežnih odstotnih vrednostih) in agregatno stanje,
— fizikalno-kemijske lastnosti pomembne za izvedbo študije, npr. agregatno stanje, pH, stabilnost, topnost v vodi,
— obdelava preskušanih/kontrolnih snovi pred preskušanjem, če je smiselno (npr. segrevanje, mletje),
— stabilnost, če je znana.
Preskusne živali:
— uporabljena linija in spol,
— starost živali, ko so bile uporabljene kot donorke,
— vir, pogoji nastanitve, prehrana itd.,
— podrobnosti o pripravi kože.
Preskusni pogoji:
— umeritvene krivulje za preskusne aparature,
— umeritvene krivulje za izvedbo preskusa vezave barvila,
— podrobni podatki o preskusnem postopku uporabljenem za meritve TER,
— podrobni podatki o preskusnem postopku uporabljenem za oceno vezave barvila; če je primerno,
— opis vseh sprememb preskusnih postopkov,
— opis uporabljenih kriterijev ocenjevanja.
Rezultati:
— podatki iz poskusa TER in vezave barvila (če je smiselno) za posamezno žival in posamezne vzorce kože v obliki razpredelnice,
— opis vseh opaženih učinkov.
Razprava o rezultatih.
Sklepi.
4. LITERATURA
(1) OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6.
(2) Preskusna metoda B.4. Akutna toksičnost: draženje kože/jedkost.
(3) Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report and recommendations of ECVAM Workshop 6. ATLA 23, 219–255.
(4) Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. in Vitro 12, 471-482.
(5) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhütter, H.-G., and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. in Vitro 12, 483–524.
(6) OECD (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62 pp.
(7) Balls, M., Blaauboer, B.J., Fentem. J.H., Bruner. L., Combes, R.D., Ekwall, B., Fielder. R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski. D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. The report and recommendations of ECVAM workshops. ATLA 23, 129–147.
(8) ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf
(9) ECVAM (1998). ECVAM News & Views. ATLA 26, 275-280.
(10) ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf .
(11) OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st –2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat
(12) Oliver, G.J.A., Pemberton, M.A., and Rhodes, C. (1986). An in vitro skin corrosivity test -modificationsand validation. Fd. Chem. Toxicol. 24, 507–512.
(13) Botham, P.A., Hall, T.J., Dennett, R., McCall, J.C., Basketter, D.A., Whittle, E., Cheeseman, M., Esdaile, D.J., and Gardner, J. (1992). The skin corrosivity test in vitro: results of an interlaboratory trial. Toxic. in Vitro 6, 191–194.
(14) Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709–720.
(15) Basketter, D.A., Chamberlain, M., Griffiths, H.A., Rowson, M., Whittle, E., York, M. (1997). The classification of skin irritants by human patch test. Fd. Chem. Toxicol. 35, 845–852.
(16) Oliver G.J.A, Pemberton M.A and Rhodes C. (1988). An In Vitro model for identifying skin-corrosive chemicals. I. Initial Validation. Toxic. in Vitro. 2, 7–17.
Slika 1
Aparatura za preskus TER s podganjo kožo

Slika 2
Mere uporabljenih cevi iz politetrafluoroetilena (PTFE), receptorskih cevi in elektrod

Ključni dejavniki zgoraj prikazane aparature:
— notranji premer PTFE-cevi,
— dolžina elektrod relativno na PTFE-cev in receptorsko cev, tako ta se kožna ploščica ne dotika elektrod in da je v stiku z raztopino MgSCO4 standardna dolžina elektrode,
— višina raztopine MgSCO4 v receptorski cevki mora biti relativna na gladino raztopine v PTFE-cevi, kakor je prikazano v sliki 1,
— kožna ploščica mora biti v PTFE-cev fiksirana zadostno, da je upor električnega toka resnično merilo lastnosti kože.
B.40 BIS. JEDKOST ZA KOŽO IN VITRO: PRESKUS Z MODELOM ČLOVEŠKE KOŽE
1. METODA
Ta preskusna metoda je enakovredna OECD TG 431 (2004).
1.1 UVOD
Jedkost za kožo pomeni nastanek nepovratnih poškodb kožnega tkiva po nanosu preskušanega materiala [po definiciji iz Globally Harmonised System for the Classification and Labelling of Chemical Substances and Mixtures (GHS)] (1). V tej preskusni metodi se ocena jedkosti ne opravlja na živih živalih ali živalskem tkivu.
Ocena jedkosti za kožo se je običajno opravljala na laboratorijskih živalih (2). Zadržki v zvezi z bolečinami in trpljenjem živali, ki je povezano s tem postopkom, je bila upoštevana v reviziji preskusne metode B.4, ki omogoča določevanje jedkosti za kožo z alternativnimi metodami in vitro, pri čemer se prepreči bolečina in trpljenje živali.
V tej preskusni metodi se ocena jedkosti ne opravlja na živih živalih ali živalskem tkivu. Za temi je bila opravljena uradna validacijska študija metod in vitro za oceno jedkosti za kožo (4) (5) (6) (7) (8). Na podlagi izidov teh študij in druge objavljene literature (9) je bilo izdano priporočilo, da se lahko naslednja preskusa uporabita za oceno jedkosti za kožo in vivo (10) (11) (12) (13): preskus z modelom človeške kože (glej metodo) in preskus transkutane električne upornosti (preskusna metoda B.40).
V validacijskih študijah so ugotovili, da lahko preskus z modelom človeške kože (3) (4) (5) (9) zanesljivo razlikuje med znanimi snovmi, ki so jedke za kožo, in znanimi snovmi, ki niso jedke. S protokolom preskusa je mogoče pridobiti podatke o tem, ali je preskusna snov močno ali šibko jedka za kožo.
Preskus, opisan v tej metodi, omogoča identifikacijo jedkih kemijskih snovi in mešanic. Omogoča tudi identifikacijo nejedkih snovi in mešanic, če je podprta z dokazi in ob uporabi drugih obstoječih podatkov (npr. pH, razmerja struktura-aktivnost, podatki o ljudeh in/ali živalih) (1) (2) (13) (14). Običajno pa ne daje zadostnih podatkov o draženju kože niti ne omogoča nadaljnje kategorizacije jedkih snovi, kakor je to dovoljeno v Globally Harmonised Classification System (GHS) (1).
Za popolno vrednotenje lokalnih učinkov na kožo po enkratni izpostavljenosti se priporoča upoštevanje načrtovanja zaporednega preskušanja, ki je priloženo preskusni metodi B.4 (2) in na voljo v Globally Harmonised System (GHS) (1). To načrtovanje preskušanja vključuje opravljanje preskusov jedkosti za kožo in vitro (kakor je opisano v tej metodi) in preskusov draženja kože pred preskušanjem na živih živalih.
1.2 OPREDELITEV POJMOV
Jedkost za kožo in vivo: je nastanek nepovratnih poškodb kože: zlasti, vidne nekroze skozi pokožnico in v usnjico v štirih urah po nanosu preskusne snovi. Reakcije na jedkost se razvrstijo na ulceracije, krvavitve, krvave kraste in po 14-dnevnem opazovanju, ko se zaradi luščenja kože izgubi obarvanost, na območja alopecije in brazgotine. Dvomljive lezije je treba preiskati histopatološko.
Viabilnost celic: parameter za merjenje celotne dejavnosti populacije celic (npr. zmožnost celičnih mitohondrijskih dehidrogenaz za redukcijo vitalnega barvila MTT), ki se glede na merjeni ciljni učinek in uporabljeni načrt preskusa ujema s skupnim številom in/ali vitalnostjo celic.
1.3 REFERENČNE SPOJINE
Tabela 1
Referenčne kemikalije
|
Ime |
Št. Einecs |
Št. CAS |
|
|
1,2-Diaminopropan |
201-155-9 |
78-90-0 |
Močno jedko |
|
Akrilna kislina |
201-177-9 |
79-10-7 |
Močno jedko |
|
2-terc-Butilfenol |
201-807-2 |
88-18-6 |
Jedko |
|
Kalijev hidroksid (10-odstoten) |
215-181-3 |
1310-58-3 |
Jedko |
|
Zveplova kislina (10-odstotna) |
231-639-5 |
7664-93-9 |
Jedko |
|
Oktanojska (kaprilska kislina) |
204-677-5 |
124-07-02 |
Jedko |
|
4-Amino-1,2,4-triazol |
209-533-5 |
584-13-4 |
Ni jedko |
|
Evgenol |
202-589-1 |
97-53-0 |
Ni jedko |
|
Fenetil bromid |
203-130-8 |
103-63-9 |
Ni jedko |
|
Tetrakloroetilen |
204-825-9 |
27-18-4 |
Ni jedko |
|
Izostearinska kislina |
250-178-0 |
30399-84-9 |
Ni jedko |
|
4-(Metiltio)-benzaldehid |
222-365-7 |
3446-89-7 |
Ni jedko |
Večina navedenih kemikalij je vzetih s seznama kemikalij izbranih za mednarodno validacijsko študijo ECVAM (4). Izbira v tej študiji je temeljila na naslednjih kriterijih:
(i) enako število jedkih in nejedkih snovi;
(ii) komercialno dostopne snovi, ki pokrivajo večino pomembnih kemijskih skupin;
(iii) vključitev močno jedkih in manj jedkih snovi, da se omogoči razlikovanje na podlagi stopnje jedkosti;
(iv) izbira kemikalij, s katerimi je mogoče v laboratoriju ravnati, ne da bi nastopile druge hude nevarnosti z izjemo jedkosti.
1.4 PRINCIP PRESKUSNE METODE
Preskušani material se površinsko nanese na tridimenzionalni model človeške kože, ki obsega najmanj rekonstruirano pokožnico s funkcionalno roženo plastjo. Jedki materiali se identificirajo glede na zmožnost, da se po določenem času izpostavljenosti zmanjšajo sposobnost celic [ki se določi npr. z uporabo preskusa redukcije MTT (15)] pod opredeljeno raven praga. Načelo preskusa modela človeške kože temelji na hipotezi, da jedke kemikalije lahko prodrejo v roženo plast z difuzijo ali erozijo in so citotoksične za spodaj ležeče sloje celic.
1.4.1 Postopek
1.4.1.1 Modeli človeške kože
Modeli človeške kože se lahko pripravijo ali pridobijo komercialno (npr. modela EpiDerm™ in EPISKIN™) (16) (17) (18) (19) ali pa jih razvije ali pripravi preskusni laboratorij (20) (21). Razumljivo je, da se pri uporabi človeške kože upoštevajo nacionalna in mednarodna etična načela in okoliščine. Vse nove modele je treba validirati (najmanj v obsegu, opisanem v 1.4.1.1.2). Modeli človeške kože za uporabo v tem preskusu morajo izpolnjevati naslednje zahteve:
1.4.1.1.1
Za pripravo epitelija se morajo uporabiti človeški keratinociti. Pod funkcionalno roženo plastjo je več slojev živih epitelijskih celic. Model kože ima lahko tudi sloj strome. Rožena plast mora biti večslojna z ustreznim profilom lipidov, da opravlja funkcijo pregrade z robustnostjo, da je odporna proti hitri penetraciji označevalcev citotoksičnosti. Zadrževalne lastnosti modela morajo preprečiti prehod materiala okoli rožene plasti v živo tkivo. Prehod preskušane kemikalije okoli rožene plasti povzroči slabo modeliranje izpostavljenosti kože. V modelu kože ne sme biti bakterij (vključno z mikoplazmami) ali plesni.
1.4.1.1.2
Obseg viabilnosti se ponavadi številčno vrednoti z uporabo MTT ali drugih s presnovo pretvorjenih vitalnih barvil. V teh primerih mora biti optična gostota (OD) barvila iz negativnega kontrolnega tkiva najmanj 20-krat večja od OD ekstrakcijskega topila [za pregled glej (22)]. Negativno kontrolno tkivo mora biti obstojno v kulturi (dajati podobne meritve viabilnosti) v času trajanja preskusa. Rožena plast mora biti dovolj robustna, da je odporna proti hitri penetraciji označevalcev citotoksičnosti (npr. l-odstotnega Tritona X-100). Ta lastnost se lahko oceni s časom izpostavljanja, ki je potreben, da se zmanjša viabilnost celic za 50 % (ET50) (npr. za modela EpiDerm™ in EPISKIN™ je to > 2 uri). Tkivo mora omogočati ponovljivost rezultatov tudi po določenem časovnem obdobju in po možnosti v različnih laboratorijih. Poleg tega mora biti tkivo primerno za uporabo v izbranem preskusnem protokolu za napovedovanje jedkosti referenčnih kemikalij (glej tabelo 1).
1.4.1.2 Nanos preskušanih in kontrolnih snovi
Za vsako obdelavo (čas izpostavljenosti), vključno s kontrolami, se izvedeta dve ponovitvi s tkivom. Pri tekočih materialih je treba nanesti dovolj preskušane snovi, da se enakomerno prekrije površina kože: uporabiti je treba najmanj 25 μL/cm2. Pri trdnih materialih je treba nanesti dovolj preskušane snovi, da je koža enakomerno prekrita, nato pa je treba snov navlažiti z deionizirano ali destilirano vodo, da se zagotovi dober stik s kožo. Kadar je primerno, je treba trdne snovi pred nanosom zmleti v prašek. Metoda nanosa mora biti primerna preskušani snovi (glej npr. referenco 5). Ob koncu časa izpostavljenosti je treba preskušani material skrbno sprati s površine kože z ustreznim pufrom ali 0,9-odstotno raztopino NaCl.
V vsaki študiji je treba uporabiti istočasne pozitivne in negativne kontrole, da se zagotovi ustreznost izvedbe modela poskusa. Predlagana snov za pozitivno kontrolo je ledocetna kislina ali 8-normalni KOH. Predlagana snov za negativno kontrolo je 0,9-odstotni NaCl ali voda.
1.4.1.3 Meritve viabilnosti celic
Za merjenje viabilnosti celic je možno uporabiti samo kvantitativne, validirane metode. Meritve viabilnosti morajo biti združljive z uporabo tridimenzionalne konstrukcije tkiva. Nespecifična vezava barvil ne sme vplivati na meritev viabilnosti. Zato niso primerna barvila, ki se vežejo na beljakovine, in barvila, ki se presnovno ne pretvarjajo (npr. nevtralno rdeče). Najpogosteje uporabljen preskus je redukcija MTT [3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijev bromid, Thiazolyl blue: št. Einecs 206-069-5, št. CAS 298-93-1)], za katerega je dokazano, da daje natančne in ponovljive rezultate (5), vendar se lahko uporabijo tudi druga barvila. Vzorec kože se za 3 ure potopi v raztopino MTT v ustrezni koncentraciji (npr. 0,3–1 mg/mL) pri ustrezni inkubacijski temperaturi. Oborina modrega formazana se nato ekstrahira s topilom (izopropanol), nato pa se koncentracija formazana izmeri z določitvijo OD pri valovni dolžini od 540 od 595 nm.
Kemična reakcija preskušanega materiala z vitalnim barvilom lahko posnema presnovo celice, kar povzroči lažne ocene viabilnosti. Ta pojav so ugotovili v primerih, ko preskusni material ni bil s spiranjem popolnoma odstranjen s kože (9). Če preskusni material neposredno deluje na vitalno barvilo, je treba uporabiti dodatne kontrole za odkrivanje in odpravljanje motenj preskusne snovi pri meritvah viabilnosti (9)(23).
2. PODATKI
Podatki o vrednosti OD in izračunanih odstotnih vrednostih viabilnosti celic za preskušano snov, pozitivne in negativne kontrole, vključno s podatki o ponovitvah/ponovljenih poskusih (kolikor je smiselno), srednjih vrednostih in posameznih vrednostih, je treba za vsako tkivo prikazati v obliki razpredelnice.
2.1 RAZLAGA REZULTATOV
Vrednosti OD, pridobljene za vsak preskušani vzorec, se lahko uporabijo za izračun odstotnega deleža viabilnosti celic v primerjavi z negativno kontrolo, katere viabilnost je arbitrarno postavljena na 100 %. Mejna vrednost odstotnega deleža viabilnosti celic, ki se uporablja za razlikovanje med jedkimi in nejedkimi preskušanimi materiali (ali za razlikovanje različnih razredov jedkosti), ali statistični postopki za vrednotenje rezultatov in identifikacijo jedkih materialov morajo biti natančno opredeljeni in zabeleženi, njihova ustreznost pa mora biti potrjena. Ponavadi se te vrednosti določijo med optimizacijo preskusa, preskusijo v predvalidacijski fazi in potrdijo v validacijski študiji. Primer je napovedovanje jedkosti v modelu EpiDerm™ je (9):
Preskušana snov se šteje kot jedka za kožo:
(i) če je viabilnost po 3 minutah izpostavljenosti manjša od 50 % ali
(ii) če je viabilnost po 3 minutah izpostavljenosti večja ali enaka kot 50 % in je viabilnost po 1 uri izpostavljenosti manjša od 15 %.
Preskušana snov se šteje kot nejedka za kožo:
(i) če je viabilnost po 3 minutah izpostavljenosti večja ali enaka 50 % in je viabilnost po 1 uri izpostavljenosti večja ali enaka 15 %.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje informacije:
Preskušana in kontrolna snov:
— kemijsko(-a) ime(-na), npr. IUPAC, ime CAS in številko CAS, če je znana,
— čistost in sestavo snovi ali pripravka (v utežnih odstotnih vrednostih),
— fizikalno-kemijske lastnosti pomembne za izvedbo študije, npr. agregatno stanje, pH, stabilnost, topnost v vodi,
— obdelava preskušanih/kontrolnih snovi pred preskušanjem, če je smiselno (npr. segrevanje, mletje),
— stabilnost, če je znana.
Utemeljitev modela kože in uporabljenega protokola.
Preskusni pogoji:
— uporabljeni celični sistem,
— podatki o umerjanju za merilno napravo, s katero se je merila viabilnost celic (npr. spektrofotometer),
— popolni podatki za podporo specifičnemu uporabljenemu modelu kože, vključno z njegovo veljavnostjo,
— podrobni podatki o preskusnem postopku,
— uporabljeni preskusni odmerki,
— opis vseh modifikacij preskusnih postopkov,
— sklicevanje na historične podatke o modelu,
— opis uporabljenih kriterijev ocenjevanja.
Rezultati:
— podatki iz posameznih preskusnih vzorcev v preglednici,
— opis drugih opaženih učinkov.
Razprava o rezultatih.
Sklep.
4. LITERATURA
(1) OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis. oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono (2001)6.
(2) Preskusna metoda B.4. Akutna toksičnost: draženje kože/jedkost.
(3) Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report recommendations of EC VAM Workshop 6 ATLA 23, 219–255.
(4) Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The EC VAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. In Vitro 12, 471–482.
(5) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. In Vitro 12, 483–524.
(6) OECD (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62 pp.
(7) Balls, M., Blaauboer, B.J., Fentem, J.H., Bruner, L., Combes, R.D., Ekwall, B., Fielder, R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski, D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. Test report and recommendations of ECVAM workshops. ATLA 23, 129–147.
(8) ICC VAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf
(9) Liebsch, M., Traue, D., Barrabas, C, Spielmann, H., Uphill, P., Wilkins, S., McPherson, J.P., Wiemann, C, Kaufmann, T., Remmele, M. and Holzhutter, H.G. (2000). The ECVAM prevalidation study on the use of EpiDerm for skin Corrosivity testing. ATLA 28, pp. 371–401.
(10) ECVAM (1998). ECVAM News & Views. ATLA 26, 275–280.
(11) ECVAM (2000). ECVAM News & Views. ATLA 28, 365–67.
(12) ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDerm™, EPISKIN™ (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf
(13) OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st - 2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat
(14) Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709–720.
(15) 15 Mosmann, T. (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity asssays. J.Immunol. Meth. 65, 55–63.
(16) Cannon, C.L., Neal, P.J., Southee, J.A., Kubilus, J., and Klausner, M., 1994. New epidermal model for dermal irritancy testing. Toxic. In Vitro 8, 889–891.
(17) Ponec, M., Boelsma, E., Weerheim, A., Mulder, A., Boutwstra, J., and Mommaas, M., 2000. Lipid and ultrastructural characterization of reconstructed skin models. International Journal of Pharmaceutics. 203, 211–225.
(18) Tinois E, Gaetani Q, Gayraud B, Dupont D, Rougier A, Pouradier DX (1994). The Episkin model: Successful reconstruction of human epidermis in vitro. In In vitro Skin Toxicology. Edited by A Rougier, AM Goldberg and HI Maibach: 133–140
(19) Tinois E, Tiollier J, Gaucherand M, Dumas H, Tardy M, Thivolet J (1991). In vitro and post -transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute. Experimental Cell Research 193: 310–319
(20) Parentau, N.L., Bilbo, P., Molte, C.J., Mason, V.S., and Rosenberg, H. (1992). The organotypic culture of human skin keratinocytes and fibroblasts to achieve form and function. Cytotechnology 9, 163–171.
(21) Wilkins, L.M., Watson, S.R., Prosky, S.J., Meunier, ST., Parentau, N.L. (1994). Development of a bilayered living skin construct for clinical applications. Biotechnology and Bioengineering 43/8, 747–756.
(22) Marshall, N.J., Goodwin, C.J., Holt, S.J. (1995). A critical assessment of the use of microculture tetrazolium assays to measure cell growth and function. Growth Regulation 5, 69–84.
(23) Fentem, J.H., Briggs, D., Chesne', C, Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Rouget, R., and van de Sandt, J.J.M., and Botham, P.A. (2001). A prevalidation study on in vitro tests for acute skin irritation: results and evaluation by the Management Team. Toxic. In Vitro 15, 57–93.
B.41 PRESKUS FOTOTOKSIČNOSTI 3T3 NRU IN VITRO
1. METODA
Ta preskusna metoda je enakovredna OECD TG 432 (2004).
1.1 UVOD
Fototoksičnost je opredeljena kot toksična reakcija snovi, nanesene na telo, ki se sproži ali bolj izrazi (razvidno pri manjših odmerkih) po naknadni izpostavljenosti svetlobi, ali se sproži z obsevanjem kože po sistemskem dajanju kemikalije.
S preskusom fototoksičnosti 3T3 NRU in vitro se ugotavlja fototoksični potencial preskušane snovi, ki ga izzove vzbujena kemikalija po izpostavljenosti svetlobi. V preskusu se določa fotocitotoksičnost na podlagi relativnega zmanjšanja viabilnosti celic izpostavljenih kemikaliji v prisotnosti in odsotnosti svetlobe. Snovi, ki jih določimo s tem preskusom, so najverjetneje fototoksične in vivo po sistemskem dajanju in porazdelitvi po koži ali po površinskem nanosu na kožo.
Za več vrst kemikalij je bilo ugotovljeno, da sprožajo fototoksične učinke (1) (2) (3) (4). Njihova edina skupna lastnost je sposobnost, da v območju sončne svetlobe absorbirajo svetlobno energijo. Po prvem zakonu fotokemije (Grotthaus-Draperjev zakon) zahteva fotoreakcija zadostno absorpcijo svetlobnih kvantov. Še preden se začne razmišljati o biološkem preskušanju je zato po Smernici za preskušanje OECD 101 pri preskušani kemikaliji treba določiti absorpcijski spekter UV/vidne svetlobe. Predlagano je bilo, da kemikalija zelo verjetno ni fotoreaktivna, če je koeficient molarne ekstinkcije/absorpcije manjši od 10 litrov × mol-1 × cm-1. Te kemikalije ni treba preskušati niti v preskusu fototoksičnosti 3T3 NRU in vitro niti v katerem koli drugem biološkem preskusu škodljivih fotokemijskih učinkov (1)(5). Glej tudi Dodatek 1.
Zanesljivost in pomen preskusa fototoksičnosti 3T3 NRU in vitro sta bila nedavno ovrednotena (6) (7) (8) (9). Dokazali so, da preskus fototoksičnosti 3T3 NRU in vitro napoveduje akutne fototoksične učinke pri živalih in ljudeh in vivo. Preskus ni namenjen napovedovanju drugih škodljivih učinkov, ki lahko nastanejo zaradi kombiniranega delovanja kemikalije in svetlobe, npr. ne obravnava fotogenotoksičnosti, fotoalergenosti ali fotorakotvornosti niti ne omogoča ocenjevanja fototoksičnega potenciala. Prav tako preskus ni bil zasnovan za obravnavanje posrednih mehanizmov fototoksičnosti, učinkov presnovkov preskušane snovi ali učinkov zmesi.
Medtem ko je uporaba presnovnih sistemov splošna zahteva za vse preskuse in vitro za napovedovanje genotoksičnega in karcinogenega potenciala, so se doslej v primeru fototoksikologije pojavili le redki primeri, kjer je potrebna presnovna transformacija, da bi kemikalija učinkovala kot fototoksin in vivo ali in vitro. Zaradi tega ni niti potrebno niti znanstveno upravičeno, da se pričujoči preskus opravi s sistemom za aktivacijo presnove.
1.2 OPREDELITEV POJMOV
Obsevanje: intenziteta ultravijolične (UV) ali vidne svetlobe, ki doseže površino, merjena v W/m ali mW/cm2.
Odmerek svetlobe: količina (= intenziteta x čas) ultravijoličnega (UV) ali vidnega sevanja, ki doseže površino, izražena v joulih (= W x s) na enoto površine, npr. J/m ali J/cm2.
Valovni pasovi UV-svetlobe: oznake, ki jih priporoča CIE (Commission Internationale de L'Eclairage), so: UVA (315–400 nm), UVB (280–315 nm) in UVC (100–280 nm). Uporabljajo se tudi druge oznake; ločnica med UVB in UVA je pogosto pri 320 nm, UVA pa se lahko razdeli v UV-A1 in UV-A2, pri čemer je ločnica pri približno 340 nm.
Viabilnost celic: parameter za merjenje celotne dejavnosti populacije celic (npr. sprejemanje vitalnega barvila nevtralno rdeče v celične lizosome), ki se glede na merjeni ciljni učinek in uporabljeni načrt preskusa ujema s skupnim številom in/ali vitalnostjo celic.
Relativna viabilnost celic: viabilnost celic, izražena glede na kontrole s topilom (negativne kontrole), ki potekajo ves čas preskusnega postopka (bodisi +Irr bodisi -Irr), vendar se ne obdelajo s preskušano kemikalijo.
PIF (faktor fotoiritacije): faktor, pridobljen s primerjanjem dveh enako učinkovitih citotoksičnih koncentracij (IC50) preskušane kemikalije, dobljenih v odsotnosti (- Irr) in v prisotnosti (+ Irr) necitotoksičnega obsevanja z UV A/vi dno svetlobo.
IC 50 : koncentracija preskušane kemikalije, pri kateri se viabilnost celic zmanjša za 50 %.
MPE (srednji fotoučinek): meritev, izpeljana iz matematične analize celotne oblike krivulj reakcije na dve koncentraciji, pridobljenih v odsotnosti (-Irr) in v prisotnosti (+Irr) necitotoksičnega obsevanja z U V A/vi dno svetlobo.
Fototoksičnost: akutna toksična reakcija, ki nastane po prvotni izpostavljenosti kože nekaterim kemikalijam in naknadni izpostavljenosti svetlobi, ali se podobno sproži z obsevanjem kože po sistemskem dajanju kemikalije.
1.3 PRINCIP PRESKUSNE METODE
Preskus fototoksičnosti 3T3 NRU in vitro temelji na primerjavi citotoksičnosti kemikalije, kadar se preskuša v prisotnosti in v odsotnosti izpostavljenosti necitotoksičnemu odmerku simulirane sončne svetlobe. Citotoksičnost se v tem preskusu izraža kot od koncentracije odvisno zmanjšanje sprejemanja vitalnega barvila nevtralno rdeče 24 ur po obdelovanju s preskušano kemikalijo in obsevanju (10). NR je šibko kationsko barvilo, ki zlahka prehaja celične membrane neodvisno od difuzije in se znotraj celično kopiči v lizosomih. Spremembe površine občutljive membrane lizosomov povzročijo krhkost lizosomov in druge spremembe, ki postopno postanejo nepovratne. Te spremembe izzovejo učinki ksenobiotikov in posledica je zmanjšano sprejemanje NR. Zato je mogoče razlikovati med viabilnimi, poškodovanimi in odmrlimi celicami, kar je osnova preskusa.
Celice Balb/c 3T3 se kultivirajo 24 ur, da se oblikujejo enoslojne celične plasti. Dve 96-kanalni plošči na eno preskušano kemikalijo se nato eno uro predinkubirata z osmimi različnimi koncentracijami preskušane snovi. Nato se ena od obeh plošč izpostavi največjemu necitotoksičnemu odmerku obsevanja, medtem ko druga plošča ostane v temi. Na obeh ploščah se nato gojišče za obdelovanje nadomesti z umetnim gojiščem, po nadaljnjih 24 urah inkubacije pa se viabilnost celic določa s sprejemanjem nevtralno rdečega. Viabilnost celic, izražena kot odstotek neobdelanih kontrol s topilom, se izračuna za vsako preskusno koncentracijo. Za napoved fototoksičnega potenciala se reakcije na koncentracije, pridobljene v prisotnosti in v odsotnosti obsevanja, med seboj primerjajo, običajno na ravni IC50, tj. pri koncentraciji, ki viabilnost celic v primerjavi z neobdelanimi kontrolami zmanjša za 50 %.
1.4 OPIS PRESKUSNE METODE
1.4.1 Priprave
1.4.1.1 Celice
V validacijski študiji je bila uporabljena stalna celična linija mišjih fibroblastov, Balb/c 3T3, klon 31, bodisi iz zbirke American Type Culture Collection (ATCC), Manassas, VA, ZDA, bodisi iz zbirke European Collection of Cell Cultures (ECACC), Salisbury, Wiltshire, Združeno Kraljestvo, zato je priporočljivo, da jo pridobite iz uveljavljene zbirke celic. Z istim preskusnim postopkom je mogoče uspešno uporabiti tudi druge celice ali celične linije, če so pogoji gojenja prilagojeni specifičnim potrebam celic, vendar pa je treba dokazati enakovrednost.
Celice je treba redno preverjati glede odsotnosti kontaminacije z mikoplazmami, uporabiti pa se smejo le, če jih v celicah ni (11).
Pomembno je, da se občutljivost celic za UV redno preverja v skladu s postopkom kontrole kakovosti, opisanim v tej metodi. Ker se občutljivost celic za UVA lahko poveča s številom pasaž, je treba uporabiti celice Balb/c 3T3 z najmanjšim možnim številom pasaž, po možnosti nižjim od 100. (Glej oddelek 1.4.2.2.2 in Dodatek 2).
1.4.1.2 Gojišča in pogoji gojenja
Tako za rutinske pasaže celic kot med samim preskusnim postopkom je treba uporabiti ustrezna gojišča kuture in ustrezne inkubacijske pogoje, npr. za celice Balb/c 3T3 so to DMEM (Eaglovo gojišče modificirano po Dulbeccu) z dodatkom 10-odstotnega seruma novorojenih telet, 4 mM glutamina, penicilina (100 R7) in streptomicina (100 μg/mL) ter odvisno od pufira inkubacija v vlažnem ozračju pri 37 oC v 5–7,5 % CO2 (glej oddelek 1.4.1.4, drugi odstavek). Pri tem je še zlasti pomembno, da pogoji ravnanja s celično kulturo zagotavljajo čas za celični cikel v okviru običajnih historičnih meja, ki veljajo za uporabljene celice ali celične linije.
1.4.1.3 Priprava kultur
Celice iz zamrznjenih založnih kultur se v umetno gojišče zasejejo v ustrezni gostoti in se ponovno kultivirajo vsaj enkrat, preden se uporabijo v preskusu fototoksičnosti 3T3 NRU in vitro.
Celice za preskus fototoksičnosti se v umetno gojišče zasejejo v takšni gostoti, da kulture do konca preskusa ne postanejo strnjene, tj. ko se 48 ur po zasejanju celic določa viabilnost celic. Za celice Balb/c 3T3, ki se kultivirajo v 96-kanalnih ploščah, se priporoča zasejanje z gostoto celic 1 × 104 celic na kanal.
Za vsako preskušano kemikalijo se celice enako zasejejo v dve ločeni 96-kanalni plošči, ki gresta nato hkrati čez celotni preskusni postopek pod enakimi pogoji gojenja, razen časovnega obdobja, v katerem se ena plošča obseva (+ Irr), druga pa ostane v temi (- Irr).
1.4.1.4 Priprava preskušane snovi
Preskušane snovi je treba sveže pripraviti tik pred uporabo, razen če podatki potrjujejo njihovo stabilnost med hranjenjem. Priporočljivo je, da se vsi postopki s kemikalijo in začetno obdelovanje celic izvajajo v pogojih svetlobe, ki preprečijo fotoaktivacijo ali razgradnjo preskušane snovi pred obsevanjem.
Preskušane kemikalije je treba raztopiti v pufrskih raztopinah soli, npr. Earlovi uravnoteženi raztopini soli (EBSS) ali drugi fiziološko uravnoteženi pufrski raztopini, v katerih zato, da med obsevanjem ne pride do interference, ne sme biti beljakovinskih sestavin in sestavin, ki absorbirajo svetlobo (npr. pH-indikatorskih barv in vitaminov). Ker so celice med obsevanjem približno 50 minut izven inkubatorja s CO2, je treba izvesti ustrezne ukrepe za preprečitev alkalinizacije. Če se uporabljajo šibki pufri, kot je EBSS, se lahko to doseže z inkubiranjem celic v 7,5 % CO2. Če se celice inkubirajo samo v 5 % CO2, je treba izbrati močnejši pufer.
Preskušane kemikalije z omejeno topnostjo v vodi je treba raztopiti v ustreznem topilu. Če se uporabi topilo, mora imeti stalni volumen v vseh kulturah, tj. v negativnih kontrolah (s topilom) in v vseh koncentracijah preskušane kemikalije, in mora biti v vseh koncentracijah necitotoksično. Koncentracije preskušane kemikalije je treba izbrati tako, da ne nastajajo oborine ali motne raztopine.
Priporočeni topili sta dimetilsulfoksid (DMSO) in etanol (EtOH). Primerna so lahko tudi druga topila z nizko citotoksičnostjo. Pred uporabo je treba pri vseh drugih topilih skrbno preveriti specifične lastnosti, npr. reagiranje s preskušano kemikalijo, izničenje fototoksičnega učinka, lovljenje radikalov in/ali stabilnost kemikalije v topilu.
Za boljšo topnost se lahko uporabi vrtinčno mešanje in/ali uporaba ultrazvoka in/ali segrevanje na ustrezno temperaturo, razen če to vpliva na stabilnost preskušane kemikalije.
1.4.1.5 Pogoji obsevanja
1.4.1.5.1
Izbira primernega vira svetlobe in ustreznega filtra je ključni dejavnik pri preskušanju fototoksičnosti. UVA in vidna območja so navadno povezana s pojavom fototoksičnih reakcij in vivo (3) (12), medtem ko je UVB na splošno manj pomemben in močno citotoksičen, saj svojo citotoksičnost med 313 in 280 nm poviša tisočkrat (13). Merila za izbiro ustreznega vira svetlobe morajo vključevati bistveno zahtevo, da vir svetlobe oddaja valovne dolžine, ki jih preskušana kemikalija absorbira (absorpcijski spekter), ter da mora odmerek svetlobe (ki ga je mogoče doseči v razumnem času izpostavljenosti) zadostovati za odkrivanje znanih fotocitotoksičnih kemikalij. Nadalje uporabljene valovne dolžine in odmerki ne smejo po nepotrebnem škodovati preskusnemu sistemu, npr. oddajanje toplote (infrardeče območje).
Simulacija sončne svetlobe s solarnimi simulatorji velja za optimalni umetni vir svetlobe. Porazdelitev obsevalne moči filtriranega solarnega simulatorja mora biti podobna sončni svetlobi na odprtem, ki je prikazana v (14). V solarnih simulatorjih se uporabljajo tako ksenonove obločne svetilke kakor (dopirane) živosrebrove kovinske halogenidne obločne svetilke (15). Slednje imajo prednost, da oddajajo manj toplote in da so cenejše, vendar je ujemanje s sončno svetlobo manj popolno kot pri ksenonovih obločnih svetilkah. Ker vsi solarni simulatorji oddajajo precejšnje količine UVB, jih je treba ustrezno filtrirati, da se oslabijo močno citotoksične valovne dolžine UVB. Ker vsi plastični materiali, iz katerih so izdelane posode za gojenje celic, vsebujejo UV stabilizatorje, je treba spekter meriti skozi pokrov enake vrste 96-kanalne plošče, kot se uporabi v preskusu. Ne glede na uporabljene ukrepe za oslabitev posameznih delov spektra s filtracijo ali z nenamernimi filtracij skimi učinki opreme spekter, zabeležen pod temi filtri, ne sme odstopati od standardizirane sončne svetlobe na odprtem (14). Primer spektralne razdelitve obsevanja filtriranega solarnega simulatorja, uporabljenega v validacijski študiji preskusa fototoksičnosti 3T3 NRU in vitro, je bil objavljen v (8) (16). Glej tudi sliko 1 v Dodatku 2.
1.4.1.5.2
Pred vsakim preskusom fototoksičnosti je treba redno preverjati intenzivnost svetlobe (obsevanja), in sicer z uporabo primernega širokospektralnega UV-metra. Intenzivnost je treba meriti skozi pokrov enake vrste 96-kanalne plošče, kot se uporabi v preskusu. UV-meter je treba predhodno kalibrirati za vir svetlobe. Preveriti je treba delovanje UV-metra in v ta namen se priporoča uporaba drugega, referenčnega UV-metra iste vrste in iste kalibracije. Idealno je treba pri večjih intervalih uporabiti spektroradiometer, da se meri spektralno sevanje filtriranega vira svetlobe in preveri kalibracija širokospektralnega UV-metra.
Ugotovljeno je bilo, da odmerek v višini 5 J/cm (izmerjen v območju UVA) ni citotoksičen za celice Balb/c 3T3 in da je dovolj močan, da vzbudi kemikalije, da povzročijo fototoksične reakcije, (6)(17); za 5 J/cm v časovnem obdobju 50 min, je bilo obsevanje prilagojeno na 1,7mW/cm2. Glej sliko 2 v Dodatku 2. Če se uporabi druga celična linija ali drugačen vir svetlobe, je morda potrebna kalibracija odmerka obsevanja, da se izbere odmerek, ki ni škodljiv za celice in zadosti močen za zaznavanje standardnih fototoksinov. Čas izpostavljenosti svetlobi se izračuna takole:
|
|
t(min) = (1J = 1 Ws) |
1.4.2 Preskusni pogoji
1.4.2.1 Koncentracije preskušane snovi
Razpon koncentracij kemikalije, ki se preskuša v prisotnosti (+ Irr) in v odsotnosti (- Irr) svetlobe, je treba ustrezno določiti v predhodnih poskusih za ugotavljanje razpona odmerka. Morda je uporabno določiti topnost na začetku in po 60 minutah (oziroma uporabljenem trajanju obdelovanja), saj se lahko topnost spreminja s časom in med izpostavljenostjo. Da se prepreči toksičnost zaradi nepravilnih pogojev gojenja ali zelo kislih oziroma alkalnih kemikalij, mora biti pH celičnih kultur z dodano preskušano kemikalijo v mejah 6,5–7,8.
Najvišja koncentracija preskušane snovi mora biti v fizioloških pogojih preskusa, npr. preprečiti je treba osmotske in pH strese. Odvisno od preskušane kemikalije je morda treba razmisliti o drugih fizikalno-kemij skih lastnostih, ki omejujejo najvišjo koncentracijo v preskusu. Pri relativno netopnih snoveh, ki niso toksične pri koncentracijah do nasičenja, je treba preskušati najvišjo dosegljivo koncentracijo. Na splošno je treba preprečiti obarjanje preskušane kemikalije v kateri koli preskusni koncentraciji. Maksimalna koncentracija preskušane snovi ne sme preseči 1 000 μg/mL; osmolarnost ne sme preseči 10 mmol. Uporabiti je treba geometrična zaporedja koncentracij po osem koncentracij preskušane snovi s konstantnim faktorjem razredčevanja (glej oddelek 2.1, drugi odstavek).
Če obstajajo podatki (iz poskusa za ugotavljanje razpona), da preskušana kemikalija ni citotoksična do mejne koncentracije v temnem poskusu (- Irr), vendar je zelo citotoksična pri obsevanju (+ Irr), se bodo razponi koncentracij, namenjeni preskus (+ Irr) morda morali razlikovati od koncentracij za preskus (- Irr), da bo izpolnjena zahteva glede ustrezne kakovosti podatkov.
1.4.2.2 Kontrole
1.4.2.2.1
Pri celicah je treba redno (približno vsako peto pasažo) preverjati občutljivost za vir svetlobe z ocenjevanjem njihove viabilnosti po izpostavitvi povečuj očim odmerkom obsevanja. V tej oceni je treba uporabiti več odmerkov obsevanja, vključno z ravnmi, ki so znatno večje od ravni, uporabljenih v preskusu fototoksičnosti 3T3 NRU. Te odmerke je najlažje številčno ovrednotiti z merjenjem UV-območja vira svetlobe. Celice se zasejejo z gostoto, ki se uporablja pri preskusu fototoksičnosti 3T3 NRU in vitro in so obsevane naslednji dan. Po enem dnevu se določi viabilnost celic na podlagi sprejemanja nevtralno rdečega. Nato je treba dokazati, da je bil ugotovljeni največji necitotoksični odmerek (npr. v validacijski študiji je bil 5 J/cm [UVA]) zadosten za pravilno razvrstitev referenčnih kemikalij (tabela 1).
1.4.2.2.2
Preskus izpolnjuje merila kakovosti, če je viabilnost obsevanih negativnih kontrol/kontrol s topilom večja od 80 % viabilnosti neobsevanih negativnih kontrol/kontrol s topilom.
1.4.2.2.3
Absolutna optična gostota (OD540 NRU), merjena v ekstraktu nevtralno rdečega iz kontrol s topilom, pokaže, ali je 1 × 104 celic, zasejanih v vsak posamezni kanal, v dveh dneh preskusa zraslo z običajno hitrostjo podvajanja. Preskus izpolnjuje merila sprejemljivosti, če je srednja vrednost OD540 NRU neobdelanih kontrol > 0,4 (tj. približno dvajsetkratnik odzadnje absorbance topila).
1.4.2.2.4
Skupaj z vsakim preskusom fototoksičnosti 3T3 NRU in vitro se obenem preskuša tudi znana fototoksična kemikalija. Priporoča se klorpromazin (CPZ). Za CPZ, ki se je preskušal s standardnim protokolom v preskusu fototoksičnosti 3T3 NRU in vitro, so bila opredeljena naslednja merila sprejemljivosti: obsevani CPZ (+ Irr): IC50 = 0,1 do 2,0 μg/mL, neobsevani CPZ (Irr): IC50 = 7,0 do 90,0 μg/mL. Faktor fotoiritacije (PIF) mora biti > 6. Spremljati je treba historične rezultate pozitivne kontrole.
Namesto klorpromazina se lahko kot hkratna pozitivna kontrola uporabijo tudi druge fototoksične kemikalije, ki ustrezajo vrsti kemikalije, ki se vrednoti, ali njenim značilnostim glede topnosti.
1.4.3 Preskusni postopek (6) (7) (8) (16) (17):
1.4.3.1 Prvi dan:
Odmeriti 100 μL umetnega gojišča v stranske kanale ene 96-kanalne mikrotitrske plošče (= slepi vzorci). V preostale kanale razdeliti 100 μL celične suspenzije z 1 × 105 celicami/mL (= 1 × 104 celic/kanal). Za vsako zaporedje koncentracij posamezne preskušane snovi in za kontrolo s topilom ter pozitivno kontrolo je treba pripraviti dve plošči.
Celice inkubirati 24 ur (glej oddelek 1.4.1.2), dokler ne oblikujejo na pol strnjene enoslojne plasti. S takšnim inkubacijskim časom se zagotovijo okrevanje celic, pritrjevanje in eksponentna rast.
1.4.3.2 Drugi dan:
Po inkubaciji odcediti umetno gojišče s celic in jih dvakrat previdno sprati s 150 μL pufrske raztopine, ki se je uporabila za inkubacijo. Dodati 100 μL pufra, ki vsebuje ustrezno koncentracijo preskušane kemikalije ali topila (kontrola s topilom). Uporabiti 8 različnih koncentracij preskušane kemikalije. Celice s preskušano kemikalijo v temi inkubirati 60 minut (glej oddelek 1.4.1.2 in 1.4.1.4, drugi odstavek).
Izmed obeh plošč, ki so bile pripravljene za vsako zaporedje koncentracije preskušane snovi in kontrole, se naključno izbere ena za določevanje citotoksičnosti (- Irr) (tj. kontrolna plošča) in ena za določevanje fotocitotoksičnosti (+ Irr) (tj. obdelovalna plošča).
Za izvedbo +Irr izpostavljanja celice pri sobni temperaturi obsevati 50 minut prek pokrova 96-kanalne plošče z največjim necitotoksičnim odmerkom sevanja (glej tudi Dodatek 2). Neobsevane plošče (- Irr) zadržati pri sobni temperaturi 50 minut v temni škatli (= trajanje izpostavljenosti svetlobi).
Odcediti preskusno raztopino in dvakrat previdno sprati s 150 μL pufrske raztopine, ki se je uporabila za inkubacijo in ki ne vsebuje preskušanega materiala. Zamenjati pufer z umetnim gojiščem in inkubirati (glej oddelek 1.4.1.2) čez noč (18–22 ur).
1.4.3.3 Tretji dan:
1.4.3.3.1
Celice je treba preučiti za rast, morfologijo in neokrnjenost enoslojne plasti pod fazno-kontrastnim mikroskopom. Zabeležiti je treba spremembe celične morfologije in učinke na rast celic.
1.4.3.3.2
Celice sprati s 150 μL predhodno segretega pufra. Raztopino za spiranje odstraniti z rahlim stresanjem. Dodati 100 μL nevtralno rdečega (NR) v koncentraciji 50 μg/mL (3-amino-7-dimetilamino-2-metilfenazin hidroklorid, številka Einecs 209-035-8; številka CAS 553-24-2; C.I. 50040) v gojišču brez seruma (16) in 3 ure inkubirati, kakor je opisano v odstavku 1.4.1.2. Po inkubaciji odstraniti gojišče z NR in celice sprati s 150 μL pufra. Odliti in odstraniti odvečni pufer s pivnanjem ali centrifugiranjem.
Dodati natančno 150 μL raztopine za desorpcijo NR (sveže pripravljeno zmes 49 delov vode + 50 delov etanola + 1 del ocetne kisline).
Deset minut nežno stresati mikrotitrsko ploščo na stresalniku za mikrotitrske plošče, dokler se NR ne ekstrahira iz celic in tvori homogeno raztopino.
Optično gostoto ekstrakta NR izmeriti pri 540 nm v spektrofotometru, slepe vzorce uporabiti kot referenco. Podatke shraniti v ustreznem elektronskem datotečnem formatu za naknadno analizo.
2. PODATKI
2.1 KAKOVOST IN KOLIČINA PODATKOV
Podatki iz preskusa naj omogočajo smiselno analizo povezave koncentracija-reakcija, pridobljene v prisotnosti in v odsotnosti obsevanja, in, če je možno, koncentracije preskušane kemikalije, pri kateri se je viabilnost celic zmanjšala za 50 % (IC50). Če se ugotovi citotoksičnost, je treba tako razpon koncentracij kakor razmak med posameznimi koncentracijami izbrati tako, da je poskusne podatke mogoče prikazati v obliki krivulje.
Pri jasno pozitivnih in jasno negativnih rezultatih (glej oddelek 2.3, prvi odstavek) je dovolj glavni poskus, podprt z enim ali več predhodnimi poskusi za ugotavljanje razpona.
Dvoumne, mejne ali nejasne rezultate je treba pojasniti z dodatnim preskušanjem (glej tudi oddelek 2.4, drugi odstavek). V teh primerih je treba preučiti spremembo pogojev preskusa. Pogoji preskusa, ki se lahko spremenijo, so med drugim območje ali razmak koncentracij, trajanje predinkubacije in trajanje izpostavljenosti obsevanju. Za kemikalije, ki so v vodi nestabilne, je lahko ustrezen krajši čas izpostavljanja.
2.2 OCENA REZULTATOV
Za vrednotenje podatkov se lahko izračunata faktor fotoiritacije (PIF) in srednji fotoučinek (MPE).
Za izračun mer fotocitotoksičnosti (glej spodaj) je treba določiti ustrezno neprekinjeno krivuljo koncentracija-reakcija (model), ki se približa naboru diskretnih vrednosti koncentracije-reakcije. Prirejanje krivulje podatkom se običajno opravi z metodo nelinearne regresije (18). Za vrednotenje vpliva variabilnosti podatkov na prirejeno krivuljo se priporoča postopek bootstrap.
Faktor fotoiritacije (PIF) se izračuna po naslednji enačbi:

Če IC50 v prisotnosti ali odsotnosti svetlobe ni mogoče izračunati, se PIF za preskušani material ne da določiti. Srednji fotoučinek (MPE) temelji na primerjavi celotnih krivulj koncentracija-reakcija (19). Opredeljen je kot tehtano povprečje preko reprezentativnega nabora vrednosti fotoučinka.
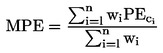
Fotoučinek PEc pri kateri koli koncentraciji C je definiran kot zmnožek učinka reakcije REc in učinka odmerka DEc, tj. PEc = REc × DEc. Učinek reakcije REc je razlika med reakcijama, zabeleženima v odsotnosti in prisotnosti svetlobe, tj. REc = Rc (- Irr) – Rc (+ Irr). Učinek odmerka se izračuna po naslednji enačbi:
pri čemer je C* enakovredna koncentracija, tj. koncentracija, pri kateri je reakcija + Irr enakovredna reakciji - Irr s koncentracijo C. Če C* ni možno določiti, ker so vrednosti reakcij krivulje +Irr sistematično višje ali nižje od Rc(- Irr), se učinek odmerka določi na 1. Utežni faktorji wi so določeni z najvišjo vrednostjo reakcije, tj. wi = MAX {Ri (+ Irr), Ri (- Irr)}. Koncentracijska mreža C; se izbere tako, da enako število točk pade v vsak koncentracijski interval, ki je definiran s koncentracijami, uporabljenimi v preskusu. Izračun MPE je omejen na najvišjo vrednost koncentracije, pri kateri vsaj ena od krivulj kaže vrednost reakcije najmanj 10 %. Če je ta najvišja koncentracija višja od najvišje koncentracije, uporabljene v poskusu + Irr, se preostanek krivulje + Irr določi na vrednost reakcije „0“. Kemikalija se uvrsti med fototoksične snovi, glede na to, ali je vrednost MPE večja od ustrezno izbrane vrednosti praga (MPEc = 0,15) ali ne.
Programska oprema za izračun PIF in MPE je na voljo na (20).
2.3 RAZLAGA REZULTATOV
Na podlagi validacijske študije (8) preskušana snov s PIF < 2 ali MPE < 0,1 napoveduje: „brez fototoksičnosti“. PIF > 2 in < 5 ali MPE > 0,1 in < 0,15 napoveduje: „verjetna fototoksičnost“; in PIF > 5 ali MPE > 0,15 napoveduje: „fototoksičnost“.
V vsakem laboratoriju, kjer se uvaja ta preskus, je treba pred preskušanjem preskušanih snovi za fototoksično vrednotenje preskusiti referenčne materiale, navedene v tabeli 1. Vrednosti PIF ali MPE morajo biti blizu vrednostim iz tabele 1.
Tabela 1
|
Kemijsko ime |
St Einecs |
St CAS |
PIF |
MPE |
Absorpcij ska konica |
Topilo (1) |
|
Amiodaron HCl |
243-293-2 |
[19774-82-4] |
> 3,25 |
0,27–0,54 |
242 nm 300 nm (plato) |
etanol |
|
Kloropromazin HCl |
200-701-3 |
[69-09-0] |
>14,4 |
0,33–0,63 |
309 nm |
etanol |
|
Norfloksacin |
274-614-4 |
[70458-96-7] |
> 71,6 |
0,34–0,90 |
316 nm |
acetonitril |
|
Antracen |
204-371-1 |
[120-12-7] |
> 18,5 |
0,19–0,81 |
356 nm |
acetonitril |
|
Protoporfirin IX, dinatrijev |
256-815-9 |
[50865-01-5] |
> 45,3 |
0,54–0,74 |
402 nm |
etanol |
|
L-Histidin |
[7006-35-1] |
brez PIF |
0,05–0,10 |
211 nm |
voda |
|
|
Heksaklorofen |
200-733-8 |
[70-30-4] |
1,1–1,7 |
0,00–0,05 |
299 nm 317 nm (plato) |
etanol |
|
Natrijev lavril sulfat |
205-788-1 |
[151-21-3] |
1,0–1,9 |
0,00–0,05 |
brez absorpcije |
voda |
|
(1) Topilo za merjenje absorpcije. |
||||||
2.4 RAZLAGA PODATKOV
Če so fototoksični učinki opaženi le pri najvišji preskusni koncentraciji (zlasti pri vodotopnih preskušanih kemikalijah), je morda potreben nadaljnji razmislek o oceni nevarnosti. Ta lahko zajema podatke o kožni absorpciji in akumulaciji kemikalije v koži in/ali podatke drugih preskusov, denimo pri preskusu kemikalije z modelom živalske ali človeške kože ali modeli kože in vitro.
Če pa toksičnost ni bila ugotovljena (+ Irr in - Irr) in če je topnost v vodi omejila preskusne koncentracije, je združljivost preskušane snovi s preskusom vprašljiva, tako da je treba razmisliti o potrjevalnem preskusu, npr. z drugim modelom.
3. POROČANJE
POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati vsaj naslednje informacije:
Preskusna snov:
— identifikacijski podatki, skupna generična imena in IUPAC ter št. CAS, če so znana,
— agregatno stanje in čistost,
— fizikalno-kemijske lastnosti, pomembne za izvedbo študije,
— absorpcijski spekter UV/vidna svetloba
— stabilnost in fotostabilnost, če sta znani.
Topilo:
— utemeljitev izbire topila,
— topnost preskušane kemikalije v topilu,
— odstotek topila v obdelovalnem gojišču.
Celice:
— vrsta in izvor celic,
— odsotnost mikoplazem,
— število celičnih pasaž, če je znano,
— občutljivost celic za sevanje, določena z obsevalno opremo, ki se uporablja pri preskusu fototoksičnosti 3T3 NRU in vitro.
Preskusni pogoji (1); inkubacijapred obdelavo in po njej:
— vrsta in sestava umetnega gojišča,
— pogoji inkubacije (koncentracija CO2; temperatura; vlažnost),
— trajanje inkubacije (predhodna obdelava, naknadna obdelava).
Preskusni pogoji (2); obdelava s kemikalijo:
— utemeljitev izbire koncentracij preskušane kemikalije, uporabljenih v prisotnosti in v odsotnosti obsevanja,
— pri omejeni topnosti preskušane kemikalije in odsotnosti citotoksičnosti: utemeljitev najvišje preskušane koncentracije,
— vrsta in sestava obdelovalnega gojišča (pufrska raztopina soli),
— trajanje kemičnega obdelovanja.
Preskusni pogoji (3); obsevanje:
— utemeljitev izbora uporabljenega vira svetlobe,
— izdelovalec in vrsta vira svetlobe ter radiometra,
— spektralne značilnosti sevanja vira svetlobe,
— značilnosti prepuščanja in absorpcije uporabljenega(-ih) filtra(-ov),
— značilnosti radio etra in podatki o njegovi kalibraciji,
— oddaljenost vira svetlobe od preskusnega sistema,
— UVA-obsevanje s te razdalje, izraženo v mW/cm2,
— trajanje izpostavljenosti UV/vidni svetlobi,
— odmerek UVA (obsevanje × čas), izražen v J/cm2,
— temperatura celičnih kultur med obsevanjem in celičnih kultur, ki so bile istočasno v temi.
Preskusni pogoji (4); Preskus viabilnosti z nevtralno rdečim:
— sestava gojišča za obdelovanje z nevtralno rdečim,
— trajanje inkubacij e nevtralno rdečega,
— pogoji inkubacije (koncentracija CO2; temperatura; vlažnost),
— pogoji ekstrakcije nevtralno rdečega (ekstrakcijsko sredstvo, trajanje),
— valovna dolžina, uporabljena za spektrofotometrično merjenje optične gostote nevtralno rdečega,
— druga valovna dolžina (referenca), če je bila uporabljena,
— vsebina spektrofotometričnega slepega vzorca, če je bil uporabljen.
Rezultati:
— viabilnost celic, pridobljena pri vsaki posamezni koncentraciji preskušane kemikalije, izražena kot odstotek viabilnosti povprečne vrednosti hkratnih kontrol s topilom,
— krivulje koncentracija-reakcija (koncentracija preskušane kemikalije proti relativni viabilnosti celic), pridobljene v hkratnih poskusih + Irr in - Irr,
— analiza krivulj koncentracij a-reakcij a: če je mogoče, navedba/izračun IC50 (+ Irr) in IC50 (- Irr),
— primerjava dveh krivulj koncentracij a-reakcij a, pridobljenih v prisotnosti in odsotnosti obsevanja, in sicer bodisi z izračunom faktorja fotoiritacije (PIF) ali z izračunom srednjega fotoučinka (MPE),
— merila za sprejemljivost preskusa; hkratna kontrola s topilom,
— absolutna viabilnost (optična gostota ekstrakta nevtralno rdečega) obsevanih in neobsevanih celic,
— historični podatki o negativnih kontrolah in kontrolah s topilom, srednje vrednosti in standardni odkloni,
— merila za sprejemljivost preskusa; hkratna pozitivna kontrola,
— IC50(+ Irr) in IC50(- Irr) ter PIF/MPE kemikalije za pozitivno kontrolo,
— historični podatki o kemikaliji za pozitivno kontrolo: IC50(+ Irr) and IC50(- Irr) ter PIF/MPE; srednje vrednosti in standardni odkloni.
Razprava o rezultatih.
Sklepi.
4. LITERATURA
1. Lovell W.W. (1993). A scheme for in vitro screening of substances for photoallergenic potential. Toxic. In Vitro 7: 95–102.
2. Santamaria, L. and Prino, G. (1972). List of the photodynamic substances. In „Research Progress in Organic, Biological and Medicinal Chemistry“ Vol. 3 part 1. North Holland Publishing Co. Amsterdam, p XI–XXXV.
3. Spielmann, H., Lovell, W.W., Holzle, E., Johnson, B.E., Maurer, T., Miranda, M.A., Pape, W.J.W., Sapora, O., and Sladowski, D. (1994). In vitro phototoxicity testing: The report and recommendations of ECVAM Workshop 2. ATLA, 22. 314–348.
4. Spikes, J.D. (1989). Photosensitization. In „The science of Photobiology“ Edited by K.C. Smith. Plenum Press, New York. 2nd edition, p 79–110.
5. OECD (1997) Environmental Health and Safety Publications, Series on Testing and Assessment No.7 „Guidance Document On Direct Phototransformation Of Chemicals In Water“ Environment Directorate, OECD, Paris.
6. Spielmann, H., Balls, M., Doring, B., Holzhiitter, H.G., Kalweit, S., Klecak, G., L'Eplattenier, H., Liebsch, M., Lovell, W.W., Maurer, T., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W., and Willshaw, A. (1994). EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay. Toxic. In Vitro 8, 793–796.
7. Anon (1998). Statement on the scientific validity of the 3T3 NRU PT test (an in vitro test for phototoxicity), European Commission, Joint Research Centre: ECVAM and DGXI/E/2, 3 November 1997, ATLA, 26, 7–8.
8. Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., Pechovitch, G De Silva, O., Holzhutter, H.G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W.W., Maurer, T., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W., and Brantom, P. (1998). The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test. Toxic. In Vitro 12, 305–327.
9. OECD (2002) Extended Expert Consultation Meeting on The In Vitro 3T3 NRU Phototoxicity Test Guideline Proposal, Berlin, 30th – 31th October 2001, Secretariat's Final Summary Report, 15th March 2002, OECD ENV/EHS, available upon request from the Secretariat.
10. Borenfreund, E., and Puerner, J.A. (1985). Toxicity determination in vitro by morphological alterations and neutral red absorption. Toxicology Lett., 24, 119–124.
11. Hay, R.J. (1988) The seed stock concept and quality control for cell lines. Analytical Biochemistry 171, 225–237.
12. Lambert L.A, Warner W.G., and Kornhauser A. (1996) Animal models for phototoxicity testing. In „Dermatotoxicology“, edited by F.N. Marzulli and H.I. Maibach. Taylor & Francis, Washington DC. 5th Edition, p 515–530.
13. Tyrrell R.M., Pidoux M (1987) Action spectra for human skin cells: estimates of the relative cytotoxicity of the middle ultraviolet, near ultraviolet and violet regions of sunlight on epidermal keratinocytes. Cancer Res., 47, 1825–1829.
14. ISO 10977. (1993). Photography – Processed photographic colour films and paper prints – Methods for measuring image stability.
15. Sunscreen Testing (UV.B) TECHNICALREPORT, CIE, International Commission on Illumnation, Publication No. 90, Vienna, 1993, ISBN 3 900 734 275
16. ZEBET/ECVAM/COLIPA – Standard Operating Procedure: In Vitro 3T3 NRU Phototoxicity Test. Final Version, 7 September, 1998. 18 pgs.
17. Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., De Silva, O., Holzhutter, H.G., Gerberick, F., Liebsch, M., Lovell, W.W., and Pfannenbecker, U. (1998) A study on UV filter chemicals from Annex VII of the European Union Directive 76/768/EEC, in the in vitro 3T3 NRU phototoxicity test. ATLA 26, 679-708.
18. Holzhutter, H.G., and Quedenau, J. (1995) Mathematical modeling of cellular responses to external signals. J. Biol. Systems 3, 127–138.
19. Holzhiitter, H.G. (1997). A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals. ATLA, 25, 445–462.
20. http://www.oecd.org/document/55/0,2340,en_2649_34377_2349687_l_l_l_l,00. html
Dodatek 1
Vloga 3T3 NRU PT v postopnem pristopu k preskušanju fototoksičnosti kemikalij
Dodatek 2
Slika 1
Spektralna porazdelitev moči pri filtriranem solarnem simulatorju

(glej oddelek 1.4.1.5, drugi odstavek)
V sliki 1 je prikazan primer sprejemljive spektralna porazdelitev obsevanja pri filtriranem solarnem simulatorju. Uporabljena je bila dopirana kovinska halogenidna svetilka, kakor v preskusu 3T3 NRU PT (6) (8) (17). Prikazan je učinek dveh različnih filtrov in učinka dodatnega filtriranja pokrova 96-kanalne plošče za celične kulture. Filter H2 se je uporabil le v preskusnih sistemih, ki lahko prenašajo večje količine UVB (preskus z modelom kože in preskus fotohemolize eritrocitov). Pri 3T3 NRU-PT je bil uporabljen filter H1. V sliki je prikazano, da se učinek dodatnega filtriranja pokrova plošče pojavlja predvsem v območju UVB, pri čemer v obsevalnem spektru ostaja dovolj UVB zavzbujanje kemikalij, ki se običajno absorbirajo v območje UVB, npr. amiodaron (glej tabelo 1).
Slika 2
Občutljivost celic Balb/c 3T3 za sevanje (izmerjeno v območju UVA)
Viabilnost celic ( % sprejemanja nevtralno rdečega pri kontrolah v temi)
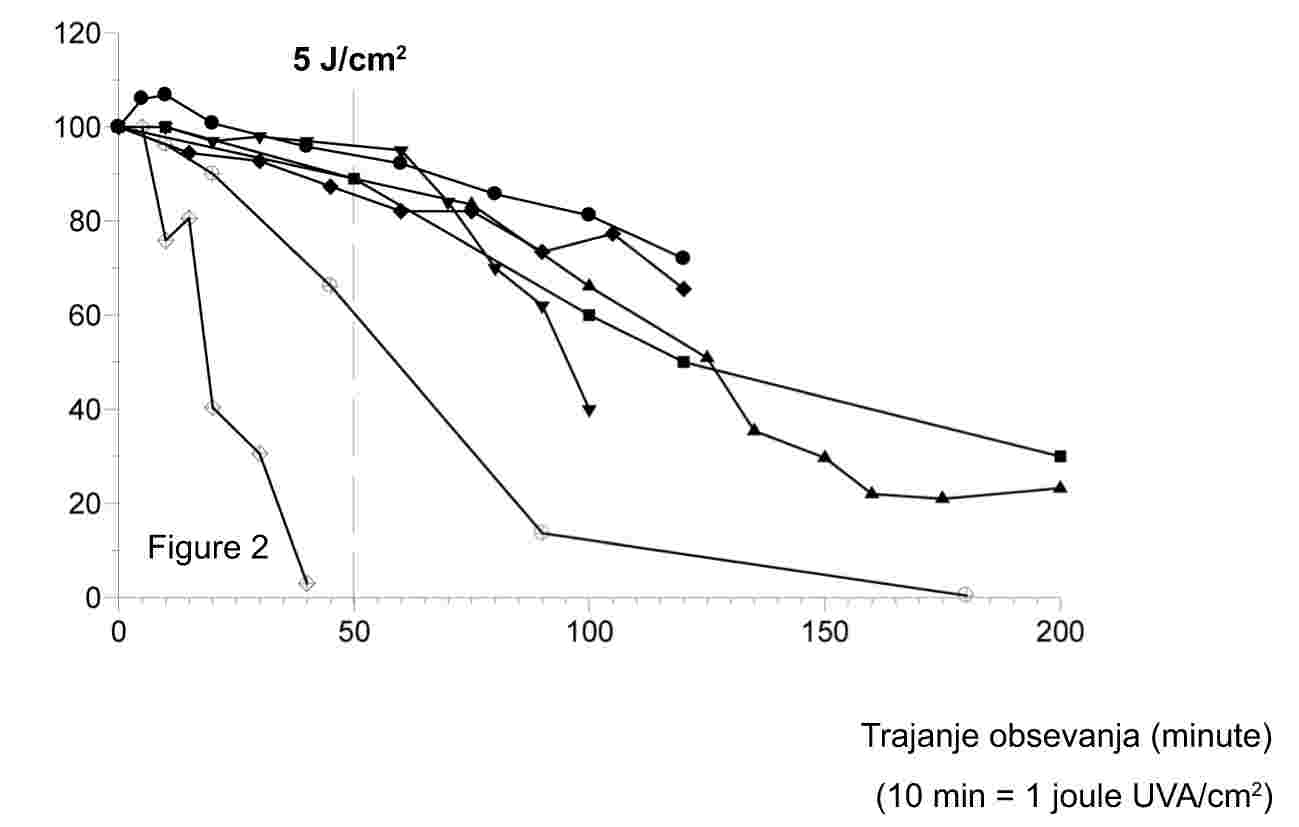
(glej oddelek 1.4.1.5.2, drugi odstavek; 1.4.2.2.1, 1.4.2.2.2)
Občutljivost celic Balb/c 3T3 za obsevanje z uporabljenim solarnim simulatorjem v validacijskem preskušanju preskusa fototoksičnosti 3T3 NRU, izmerjena v območju UVA. V sliki so prikazani rezultati sedmih različnih laboratorijev v predvalidacijski študiji (1). Krivulji z odprtimi točkami izvirajo iz starejših celic (večje število pasaž), ki so jih morale zamenjati nove zaloge celic, katerih rezultati so prikazane s krivuljami s krepkimi točkami, ki predstavljajo sprejemljivo toleranco na obsevanje.
Iz teh podatkov je pridobljen največji necitotoksični odmerek obsevanja 5 J/cm2 (navpična črtkana črta). Vodoravna črtkana črta prikazuje največji sprejemljiv učinek obsevanja, ki je opisan v odstavku 1.4.2.2.
B.42. PREOBČUTLJIVOST KOŽE: LOKALNA ANALIZA BEZGAVK
UVOD
1. Smernice OECD za preskušanje kemikalij in preskusne metode EU, ki temeljijo na teh smernicah, se redno preverjajo zaradi znanstvenega napredka, spreminjajočih se zakonodajnih potreb in vprašanj, povezanih z dobrim počutjem živali. Prvotna preskusna metoda za določanje preobčutljivosti kože pri miših, lokalna analiza bezgavk (LLNA; Smernica za preskušanje OECD 429; poglavje B.42 te priloge) je bila sprejeta že prej (1). Objavljene so podrobnosti o validaciji LLNA in pregled s tem povezanega dela (2) (3) (4) (5) (6) (7) (8) (9) (10) (11). Posodobljena LLNA temelji na oceni izkušenj in znanstvenih podatkih (12). To je druga preskusna metoda, zasnovana za ocenjevanje morebitne preobčutljivosti kože s kemikalijami (snovmi in zmesmi) pri živalih. Druga preskusna metoda (tj. Smernica za preskušanje OECD 406; poglavje B.6 te priloge) pa uporablja preskuse na morskih prašičkih, predvsem maksimizacijski in Buehlerjev preskus na morskih prašičkih (13). LLNA zagotavlja prednosti v primerjavi z metodo B.6 in Smernico za preskušanje OECD 406 (13) glede dobrega počutja živali. Ta posodobljena preskusna metoda za LLNA vključuje skupino standardov učinkovitosti (Dodatek 1), ki se lahko uporabijo za oceno statusa validacije novih in/ali spremenjenih preskusnih metod, ki so v fukcijskem in mehaničnem smislu podobne LLNA, v skladu z načeli smernic OECD št. 34 (14).
2. LLNA preučuje indukcijsko fazo preobčutljivosti kože in zagotavlja količinske podatke, ki so primerni za oceno odziva na odmerek. Treba je opozoriti, da so blagi/zmerni povzročitelji preobčutljivosti, ki se priporočajo kot ustrezne kemikalije pozitivne kontrole za preskusne metode z morskimi prašički (tj. B.6; Smernica za preskušanje OECD 406), (13) primerni tudi za uporabo pri LLNA (6) (8) (15). Pristop omejene LLNA (rLLNA), pri katerem bi se lahko uporabilo do 40 % manj živali, je prav tako opisan kot možnost v tej preskusni metodi (16) (17) (18). rLLNA se lahko uporabi, kadar obstaja zakonodajna potreba po potrditvi negativne napovedi o morebitni preobčutljivosti kože, če so izpolnjene vse druge specifikacije protokola LLNA, kot je opisano v tej preskusni metodi. Napoved negativnega rezultata bi morala temeljiti na vseh razpoložljivih informacijah, kot je opisano v odstavku 4. Pred uporabo rLLNA je treba zagotoviti jasne obrazložitve in znanstvene utemeljitve za njeno uporabo. Če je z rLLNA proti pričakovanjem pridobljen pozitiven ali dvoumen rezultat, je morda potrebno dodatno preskušanje za razlago ali pojasnitev izidov. rLLNA se ne sme uporabljati za ugotavljanje nevarnosti preskusnih snovi, ki povzročajo preobčutljivost kože, kadar so potrebne informacije o odzivu na odmerek, kot npr. podrazvrsititev za Uredbo (ES) št. 1272/2008 Evropskega parlamenta in Sveta o razvrščanju, označevanju in pakiranju snovi ter zmesi in Globalno usklajen sistem za razvrščanje in označevanje kemikalij Združenih narodov.
OPREDELITVE POJMOV
3. Uporabljene opredelitve pojmov so navedene v Dodatku 2.
IZHODIŠČA IN OMEJITVE
4. LLNA je nadomestna metoda za ugotavljanje morebitne preobčutljivosti kože s kemikalijami. To ne pomeni nujno, da je treba v vseh primerih namesto preskusov na morskih prašičkih uporabiti LLNA (tj. B.6; Smernica za preskušanje OECD 406) (13), temveč da je ta analiza enako dobra in se lahko uporabi kot druga možnost, pri kateri navadno niso več potrebne dodatne potrditve pozitivnih in negativnih rezultatov. Preskuševalni laboratorij mora pred začetkom študije preučiti vse razpoložljive informacije o preskusni snovi. Takšne informacije bodo vključevale vrsto in kemijsko sestavo preskusne snovi; njene fizikalno-kemijske lastnosti; rezultate katerih koli drugih preskusov toksičnosti na preskusni snovi, in vitro ali in vivo; in toksikološke podatke o strukturno sorodnih kemikalijah. Te informacije je treba preučiti, da se določi, ali je LLNA primerna za snov (glede na nezdružljivost omejenega števila vrst kemikalij pri LLNA – glej odstavek 5), in za lažjo izbiro odmerka.
5. LLNA je metoda in vivo in posledično ne odpravlja uporabe živali pri ocenjevanju delovanja, ki povzročajo alergijsko preobčutljivost ob stiku. Vendar ima možnost, da zmanjša število živali, potrebnih v ta namen. Še več, LLNA ponuja znatno izboljšanje (manj bolečine in trpljenja) načina, kako se živali uporabljajo za preskušanje alergijske preobčutljivosti ob stiku. LLNA temelji na upoštevanju imunoloških primerov, ki jih spodbudijo kemikalije med indukcijsko fazo preobčutljivosti. V nasprotju s preskusi na morskih prašičkih (tj. B.6; Smernica za preskušanje OECD (406) (13) LLNA ne zahteva, da se povzročijo izzvane reakcije prekomerne občutljivosti kože. Poleg tega LLNA ne zahteva uporabe pomožnega preskusa (13) kot pri maksimizacijskem preskusu na morskih prašičkih S tem LLNA zmanjšuje bolečino in trpljenje živali. Kljub prednostim LLNA v primerjavi z metodo B.6 in Smernico za preskušanje OECD 406 je treba upoštevati, da obstajajo nekatere omejitve, zaradi katerih je lahko nujna uporaba metode B.6 ali Smernice za preskušanje OECD 406 (13) (npr. lažni negativni izidi pri LLNA pri nekaterih kovinah, lažni pozitivni izidi pri nekaterih dražilnih snoveh za kožo [kot so nekatere vrste površinsko razgradljivih kemikalij] (19) (20), ali topnost preskusne snovi). Poleg tega je zaradi kemijskih razredov ali snovi s funkcionalnimi skupinami, za katere se je izkazalo, da lahko delujejo kot moteči dejavniki (21) lahko potrebna uporaba preskusov na morskih prašičkih (tj. B.6; Smernica za preskušanje OECD 406) (13). Na podlagi omejene podatkovne zbirke za validacijo, ki je obsegala zlasti pesticidne pripravke, je bolj verjetno, da bo za te vrste snovi pozitiven rezultat prinesla LLNA kot pa preskus na morskih prašičkih (22). Vendar pa bi se lahko pri preskušanju pripravkov preučila tudi možnost vključitve podobnih snovi z znanimi rezultati kot primerjalnih snovi, s čimer bi se dokazalo, da LLNA deluje pravilno (glej odstavek 16). Razen takšnih opredeljenih omejitev bi morala biti LLNA primerna za preskušanje katere koli snovi, razen če so s temi snovmi povezane lastnosti, ki lahko ovirajo natančnost LLNA.
NAČELO PRESKUSA
6. Osnovno načelo, na katerem temelji LLNA, je, da povzročitelji preobčutljivosti povzročijo množenje limfocitov v bezgavkah, ki drenirajo območje nanosa preskusne snovi. To množenje je sorazmerno z odmerkom in močjo uporabljenega alergena in je preprosto sredstvo za pridobitev količinske izmere preobčutljivosti. Množenje se izmeri s primerjavo povprečnega množenja v vsaki preskusni skupini in povprečnega množenja v kontrolni skupini, tretirani z nosilcem. Preden se utemelji razvrstitev preskusne snovi kot možnega povzročitelja preobčutljivosti kože, se določi razmerje med povprečnim množenjem v vsaki tretirani skupini in povprečnim množenjem v primerjalni kontrolni skupini z nosilcem, ki se imenuje stimulacijski indeks (SI) in mora biti ≥ 3. Tukaj opisani postopki temeljijo na uporabi in vivo radioaktivnih oznak za merjenje povečanega števila množečih se celic v ušesnih bezgavkah. Za oceno števila množečih se celic se lahko uporabijo tudi druge končne točke, če so zahteve standardov učinkovitosti v celoti izpolnjene (Dodatek 1).
OPIS ANALIZE
Izbira živalskih vrst
7. Izbrana vrsta za ta preskus je miš. Uporabijo se mlade odrasle mišje samice seva CBA/Ca ali CBA/J, ki še niso kotile in niso breje. Na začetku študije morajo biti živali stare 8–12 tednov, odstopanje mase živali pa mora biti čim manjše in ne sme presegati 20 % povprečne mase. Namesto tega se lahko uporabijo drugi sevi in samci, če je pridobljenih dovolj podatkov za dokaz, da ne obstajajo značilne razlike v odzivu pri LLNA glede na sev in/ali spol.
Bivalni in prehranjevalni pogoji
8. Miši morajo biti skupinsko nastanjene (23), razen če je zagotovljena ustrezna znanstvena utemeljitev za njihovo ločeno nastanitev. Temperatura v prostoru za poskusne živali mora biti 22 ± 3 °C. Čeprav mora biti relativna vlažnost najmanj 30 % in po možnosti ne sme, razen med čiščenjem prostora, presegati 70 %, mora biti ciljna vlažnost, 50–60 %. Osvetlitev mora biti umetna, in sicer 12 ur svetlobe, 12 ur teme. Za hranjenje se lahko uporablja običajna laboratorijska prehrana z neomejeno oskrbo s pitno vodo.
Priprava živali
9. Živali se naključno izberejo, označijo tako, da je omogočeno posamično prepoznavanje (vendar ne s katero od oblik ušesnih oznak), in zadržijo v kletkah najmanj pet dni pred začetkom dajanja odmerka, da se lahko prilagodijo laboratorijskim razmeram. Pred začetkom tretiranja se vse živali pregledajo, da se zagotovi, da nimajo opaznih kožnih lezij.
Priprava preskusnih raztopin
10. Trdne kemikalije se pred nanosom na uho miši raztopijo ali suspendirajo v ustreznih topilih ali nosilcih in po potrebi razredčijo. Tekoče kemikalije se lahko nanesejo nerazredčene ali pa se razredčijo pred dajanjem odmerka Pri netopnih kemikalijah, kot so tiste, ki se običajno uporabljajo v medicinskih pripomočkih, je treba uporabiti močno povečano ekstrakcijo v ustreznem topilu, da se odkrijejo vse ekstraktibilne sestavine za preskušanje pred nanosom na uho miši. Preskusne snovi je treba pripravljati dnevno, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
Preverjanje zanesljivosti
11. Za prikaz ustrezne učinkovitosti analize se uporabijo kemikalije pozitivne kontrole, ki se odzovejo z ustrezno in ponovljivo občutljivostjo kot preskusna snov, ki povzroča preobčutljivost, za katero je stopnja reakcije natančno opredeljena. Uporaba primerjalne pozitivne kontrole je priporočena, saj pokaže zmožnost laboratorija, da uspešno izvede vsako analizo, ter omogoča ocenjevanje ponovljivosti in primerljivosti v enem ali več laboratorijih. Tudi nekateri regulativni organi zahtevajo uporabo pozitivne kontrole pri vsaki raziskavi, zato se uporabnikom priporoča, da se pred izvedbo LLNA posvetujejo s pristojnimi organi. V skladu s tem se priporoča redna uporaba primerjalne pozitivne kontrole, saj tako ni potrebno dodatno preskušanje na živalih za izpolnitev zahtev, ki se lahko pojavijo zaradi uporabe redne pozitivne kontrole (glej odstavek 12). Pozitivna kontrola mora povzročiti pozitiven odziv LLNA na raven izpostavljenosti, za katero se pričakuje, da bo dala večji stimulacijski indeks (SI) > 3 kot negativna kontrolna skupina. Odmerek pozitivne kontrole je treba izbrati tako, da ne povzroči čezmernega draženja kože ali sistemske toksičnosti in da je indukcija ponovljiva, vendar ne čezmerna (tj. SI > 20 bi bil čezmeren) Priporočena pozitivna kontrola je 25-odstotni heksil cimetov aldehid (Služba za izmenjavo kemijskih izvlečkov [CAS] št. 101-86-0) v acetonu: olivno olje (4:1, v/v) in 5-odstotni merkaptobenzotiazol (št. CAS 149-30-4) v N,N-dimetilformamidu (glej Dodatek 1, preglednica 1). V nekaterih okoliščinah se lahko ob ustrezni utemeljitvi uporabijo druge pozitivne kontrole, ki izpolnjujejo zgornja merila.
12. Običajno je uporaba primerjalne pozitivne kontrolne skupine priporočena, lahko pa obstajajo okoliščine, v katerih redno preskušanje (tj. v razmikih ≤ 6 mesecev) pozitivne kontrole morda zadošča za laboratorije, ki redno izvajajo LLNA (tj. izvajajo LLNA vsaj enkrat mesečno) in imajo vzpostavljene zbirke podatkov o preteklih pozitivnih kontrolah, ki dokazujejo zmožnost laboratorija, da pridobi ponovljive in natančne rezultate s pozitivnimi kontrolami. Ustrezna strokovnost pri izvajanju LLNA se lahko uspešno dokaže z dobivanjem doslednih pozitivnih rezultatov pri pozitivni kontroli pri vsaj desetih neodvisnih preskusih, izvedenih v razumnem časovnem obdobju (tj. v manj kot enem letu).
13. Primerjalno pozitivno kontrolno skupino je treba vključiti vedno, kadar pride do postopkovne spremembe pri LLNA (tj. zamenjava usposobljenega osebja, zamenjava materiala za preskusno metodo in/ali reagentov, zamenjava opreme za preskusno metodo, zamenjava vira preskusnih živali), takšne spremembe pa je treba vedno zabeležiti v laboratorijskih poročilih. Pri odločanju o nujnosti vzpostavitve nove zbirke preteklih podatkov za beleženje doslednosti pri rezultatih pozitivne kontrole je treba upoštevati učinek, ki ga imajo te spremembe na ustreznost predhodno vzpostavljene zbirke preteklih podatkov.
14. Raziskovalci se morajo zavedati, da odločitev o izvajanju redne namesto primerjalne pozitivne kontrolne študije vpliva na ustreznost in sprejemljivost negativnih rezultatov študije, pridobljenih brez primerjalne pozitivne kontrole v razmiku med rednimi pozitivnimi kontrolnimi študijami. Na primer, če je rezultat, pridobljen z redno pozitivno kontrolno študijo, lažno negativen, so lahko vprašljivi negativni rezultati preskusne snovi, pridobljeni v času med zadnjo sprejemljivo redno pozitivno kontrolno študijo in nesprejemljivo redno pozitivno kontrolno študijo. Pri odločanju, ali vključiti primerjalne pozitivne kontrole ali izvajati samo redne pozitivne kontrole, je treba skrbno preučiti posledice teh rezultatov. Treba je razmisliti tudi o uporabi manjšega števila živali v primerjalni pozitivni kontrolni skupini, če je to znanstveno utemeljeno in če laboratorij na podlagi preteklih podatkov, značilnih za laboratorij, dokaže, da se lahko uporabi manjše število miši (12).
15. Čeprav je treba pozitivno kontrolo preskusiti v nosilcu, za katerega je znano, da povzroča dosleden odziv (npr. aceton: olivno olje; 4:1, v/v), lahko obstajajo nekatere zakonodajne okoliščine, ko je potrebno tudi preskušanje v nestandardnem nosilcu (klinično/kemično ustrezne sestave) (24). Če se primerjalna pozitivna kontrola preskuša v drugem nosilcu kot preskusna snov, je treba za primerjalno pozitivno kontrolo vključiti ločen kontrolni nosilec.
16. V primerih, kjer se ocenjujejo preskusne snovi za poseben kemijski razred ali razpon reakcij, so lahko primerjalne snovi uporabne tudi za dokaz, da preskusna metoda deluje pravilno za odkrivanje morebitne preobčutljivosti kože pri teh vrstah preskusnih snovi. Ustrezne primerjalne snovi morajo imeti naslednje lastnosti:
— strukturno in funkcijsko podobnost z razredom preskusne snovi, ki se preskuša,
— znane fizikalne/kemijske lastnosti,
— podporne podatke iz LLNA,
— podporne podatke od drugih živalskih modelov in/ali ljudi.
PRESKUSNI POSTOPEK
Število živali in velikost odmerkov
17. Na skupino odmerka se uporabijo najmanj štiri živali z najmanj tremi koncentracijami preskusne snovi, poleg tega pa še primerjalna negativna kontrolna skupina, tretirana zgolj z nosilcem za preskusno snov, in pozitivna kontrola (primerjalna ali izvedena pred kratkim, odvisno od politike laboratorija pri upoštevanju odstavkov 11–15). Treba je razmisliti o preskušanju več odmerkov pozitivne kontrole, zlasti če se pozitivna kontrola preskuša občasno. Živali v kontrolnih skupinah je treba, razen če se ne tretirajo s preskusno snovjo, obravnavati in tretirati na enak način kot živali v tretiranih skupinah.
18. Izbira odmerka in nosilca mora temeljiti na priporočilih iz sklica (3) in (5). Zaporedni odmerki se običajno izberejo iz ustrezne serije koncentracij, kot so 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 % itd. Izbira uporabljene serije koncentracij mora biti ustrezno znanstveno utemeljena. Kadar so na voljo, je treba pri izbiri treh zaporednih koncentracij upoštevati vse obstoječe toksikološke informacije (npr. akutno toksičnost in draženje kože) ter strukturne in fizikalno-kemijske informacije o želeni preskusni snovi (in/ali strukturno povezani snovi), tako da je pri največji koncentraciji izpostavljenost največja, hkrati pa ni sistemske toksičnosti in/ali čezmernega draženja kože (3) (25). Če takšne informacije niso na voljo, je morda najprej potreben predhodni presejalni preskus (glej odstavke 21–24).
19. Nosilec ne sme ovirati rezultatov preskusa ali vplivati nanje, izbere pa se na podlagi povečevanja topnosti, da se med pripravljanjem raztopine/suspenzije, ki je primerna za uporabo preskusne snov, pridobi največjo možno koncentracijo. Priporočljivi nosilci so aceton: olivno olje (4:1, v/v), N,N-dimetilformamid, metil etil keton, propilen glikol in dimetil sulfoksid (19), vendar se lahko uporabljajo tudi drugi, če je zagotovljena ustrezna znanstvena utemeljitev. V nekaterih okoliščinah je morda treba kot dodatno kontrolo uporabiti klinično ustrezno topilo ali trgovsko sestavo, v kateri se trži preskusna snov. Paziti je treba zlasti, da so v nosilni sistem vključene hidrofilne preskusne snovi, ki vlažijo kožo in se ne izsušijo takoj, z vključitvijo ustreznih pospeševalcev raztapljanja (npr. 1-odstotnim Pluronic® L92). Zato se je treba izogibati povsem vodnim nosilcem.
20. Obdelava bezgavk posamezne miši omogoča oceno spremenljivosti med posameznimi živalmi ter statistično primerjavo razlik med meritvami preskusne snovi in primerjalne kontrolne skupine z nosilcem (glej odstavek 35). Poleg tega je ocena možnosti zmanjšanja števila miši v pozitivni kontrolni skupini izvedljiva samo, če se zbirajo podatki o posameznih živalih (12) spodaj. Poleg tega nekateri regulativni organi zahtevajo zbiranje podatkov o posameznih živalih. Kljub temu lahko nekateri regulativni organi skupne podatke o živalih štejejo za sprejemljive; v takih primerih imajo lahko uporabniki možnost, da zbirajo podatke o posameznih živalih ali skupne podatke.
Predhodni presejalni preskus
21. Če informacije za določitev največjega odmerka za preskušanje niso na voljo (glej odstavek 18 zgoraj), je treba izvesti predhodni presejalni preskus, da se določi ustrezna velikost odmerka za preskušanje z LLNA. Namen predhodnega presejalnega preskusa je zagotoviti smernice za izbiro največje velikosti odmerka za uporabo v glavni študiji LLNA v primerih, ko niso na voljo informacije o koncentraciji, ki povzroči sistemsko toksičnost (glej odstavek 24) in/ali čezmerno draženje kože (glej odstavek 23). Največja velikost odmerka je 100-odstotna preskusna snov za tekočine ali najvišja možna koncentracija za trdne snovi ali suspenzije.
22. Predhodni presejalni preskus se izvede v pogojih, ki so enaki tistim v glavni študiji LLNA, s to razliko, da se ne izvede ocena množenja v bezgavkah in da se lahko uporabi manj živali na skupino odmerka. Predlaga se uporaba ene ali dveh živali na skupino odmerka. Vse miši se opazuje dnevno glede kliničnih znakov sistemske toksičnosti ali lokalnega draženja na mestu nanosa. Telesna masa se zabeleži pred preskusom in pred usmrtitvijo (6. dan). Obe ušesi vsake miši se opazuje glede rdečine in oceni s pomočjo preglednice 1 (25). Meritve debeline ušesa se izvedejo z napravo za merjenje debeline (npr. digitalnim mikrometrom ali merilnikom debeline s številčnico) 1. dan (pred odmerkom), 3. dan (približno 48 ur pred prvim odmerkom) in 6. dan. Poleg tega se lahko 6. dan debelino ušesa določi s preluknjanjem ušes za določitev mase, ki se izvede po humani usmrtitvi živali. Znak za čezmerno draženje kože je rdečina z oceno ≥ 3 in/ali povečana debelina ušesa za ≥ 25 % na kateri koli dan merjenja (26) (27). Največji odmerek, izbran za glavno študijo LLNA, je naslednji nižji odmerek v seriji koncentracij iz predhodnega presejalnega preskusa (glej odstavek 18), ki ne povzroči sistemske toksičnosti in/ali čezmernega draženja kože.
Preglednica 1
Ocena rdečine
|
Ugotovitev |
Ocena |
|
Rdečine ni |
0 |
|
Neznatna rdečina (komajda opazna) |
1 |
|
Zelo razločna rdečina |
2 |
|
Zmerna do močna rdečina |
3 |
|
Močna rdečina (rdečina rdeče pese) in nastanek krast ovirata razvrstitev rdečine |
4 |
23. Poleg 25-odstotnega povečanja debeline ušesa (26) (27) se za opredelitev dražilnih snovi pri LLNA uporablja tudi statistično značilno povečanje debeline ušesa tretirane miši v primerjavi s kontrolno mišjo (28) (29) (30) (31) (32) (33) (34). Ker pa se lahko statistično značilno povečanje pojavi tudi pri debelini ušesa, manjši od 25 %, ni izrecno povezano s čezmernim draženjem (30) (32) (33) (34).
24. Naslednje klinične ugotovitve lahko nakazujejo sistemsko toksičnost (35) (36), kadar se uporabljajo kot del celovite ocene, in zato lahko pokažejo največjo velikost odmerka za uporabo v glavni LLNA: spremembe v delovanju živčnega sistema (npr. piloerekcija, ataksija, tremorji in krči); vedenjske spremembe (npr. agresivnost, spremembe glede nege, opazna sprememba stopnje aktivnosti); spremembe dihanja (npr. spremembe frekvence in intenzivnosti dihanja, kot so dispneja, zasoplost in hropenje) ter spremembe glede uživanja hrane in vode. Poleg tega je treba pri oceni upoštevati znake letargije in/ali neodzivnosti ter morebitne klinične znake bolečine in trpljenja, ki niso samo blagi ali trenutni, ali zmanjšanje telesne mase za > 5 % od 1. do 6. dne ter smrtnost. Umirajoče živali ali živali, ki očitno trpijo ali kažejo znake hudega in dolgotrajnega trpljenja, se usmrtijo na human način (37).
Načrt za poskus glavne študije
25. Načrt za poskus analize je naslednji:
|
— |
1. dan : Posamično ugotovljena in zabeležena masa vsake živali in morebitne klinične ugotovitve. Nanos 25 μl ustrezno razredčene preskusne snovi, samega nosilca ali pozitivne kontrole (primerjalne ali izvedene pred kratkim, odvisno od politike laboratorija pri upoštevanju odstavkov 11–15). |
|
— |
2. in 3. dan : Ponovi se postopek nanosa, ki je bil izveden 1. dan. |
|
— |
4. in 5. dan : Brez tretiranja. |
|
— |
6. dan : Zabeleži se masa vsake živali. Vsem poskusnim in kontrolnim mišim se v repno žilo vbrizga 250 μl sterilnega fosfatnega pufra s soljo (PBS), ki vsebuje 20 μCi (7,4 × 105 Bq) tritiranega (3H)-metil timidina. Lahko pa se vsem mišim v repno veno vbrizga 250 μL PBS, ki vsebuje 2 μCi (7,4 × 104 Bq) 125I-jododeoksiuridina in 10–5 M fluorodeoksiuridina. Pet (5) ur kasneje so živali humano usmrčene. Ušesne bezgavke ob vsakem ušesu miši se izrežejo in shranijo v PBS za vsako žival (pristop po posamezni živali); lahko pa se bezgavke iz vsakega ušesa izrežejo in shranijo v PBS za vsako tretirano skupino (zbirni pristop za tretirane skupine). Podatki in diagrami o identifikaciji in izrezu bezgavk so na voljo v sklicu (12). Za nadaljnje spremljanje lokalnega odziva kože v glavni študiji se lahko v protokol študije vključijo dodatni parametri, kot so ocena rdečine ušesa ali meritve debeline ušesa (pridobljene z merilnikom debeline ali preluknjanjem ušes za določitev mase pri obdukciji). |
Priprava celičnih suspenzij
26. Enotna celična suspenzija iz celic izrezanih bezgavk, bodisi bilateralno iz posameznih živali bodisi zbirno iz tretiranih skupin, se pripravi z blago mehanično disagregacijo skozi žično mrežo iz nerjavnega jekla z velikostjo odprtin 200 mikronov ali drugo uveljavljeno tehniko za pripravo enotne celične suspenzije. Celice iz bezgavk se dvakrat izperejo s presežkom fosfatnega pufra s soljo in DNA se 18 ur obarja s 5-odstotno triklorocetno kislino pri 4 °C (3). Peleti se ponovno suspendirajo v 1 ml triklorocetne kisline in prenesejo v scintilacijske stekleničke, ki vsebujejo 10 ml scintilacijske tekočine, za štetje 3H, ali pa prenesejo neposredno v epruvete za gama štetje za 125I.
Določitev množenja celic (vključena radioaktivnost)
27. Vključitev 3H-metil timidina se izmeri z β-scintilacijskim štetjem razgradenj na minuto (DPM). Vključitev 125I-jododeoksiuridina se izmeri s štetjem 125I in se prav tako izrazi kot DPM. Odvisno od uporabljenega pristopa se vključitev izrazi kot DPM/miš (posamični pristop) ali DPM/tretirano skupino (zbirni pristop za tretirane skupine).
Omejena LLNA
28. V določenih primerih, ko obstaja zakonodajna potreba po potrditvi negativne napovedi preobčutljivosti kože, se lahko uporabi neobvezni protokol rLLNA (16) (17) (18) z manjšim številom živali, če so izpolnjene vse druge specifikacije protokola rLLNA v tej preskusni metodi. Pred uporabo rLLNA je treba zagotoviti jasne obrazložitve in znanstvene utemeljitve za njeno uporabo. Če je pridobljen pozitiven ali dvoumen rezultat, je morda potrebno dodatno preskušanje za razlago ali pojasnitev izida.
29. Edina razlika med protokoli preskusne metode LLNA in rLLNA je manjše število skupin odmerka, zaradi česar rLLNA ne zagotavlja informacij o odzivu na odmerek. Zato se, kadar so potrebne informacije o odzivu na odmerek, rLLNA ne uporablja. Tako kot pri LLNA z več odmerki mora biti koncentracija preskusne snovi, ki se ocenjuje pri rLLNA, najvišja koncentracija, ki pri miši ne povzroči očitne sistemske toksičnosti in/ali čezmernega draženja kože (glej odstavek 18).
OPAZOVANJA
Klinična opazovanja
30. Vsako miš je treba vsaj enkrat dnevno natančno opazovati glede kliničnih znakov, lokalnega draženja na mestu nanosa ali sistemske toksičnosti. Vsa opazovanja se sistematično zabeležijo v evidence, ki se vodijo za vsako miš. Načrti spremljanja morajo vključevati merila za hitro identifikacijo miši, ki izražajo sistemsko toksičnost, čezmerno draženje kože ali jedkost za kožo zaradi evtanazije (37).
Telesna masa
31. Kot je navedeno v odstavku 25, se telesna masa posameznih živali izmeri na začetku preskusa in ob predvideni humani usmrtitvi.
IZRAČUN REZULTATOV
32. Rezultati za vsako tretirano skupino so izraženi kot stimulacijski indeks (SI). Kadar se uporabi pristop po posamezni živali, se SI dobi tako, da se povprečno število razgradenj na minuto/miš v vsaki skupini preskusne snovi in v pozitivni kontrolni skupini deli s povprečnim številom razgradenj na minuto/miš za kontrolno skupino s topilom/nosilcem. Povprečni SI za kontrolne skupine z nosilcem je potem 1. Kadar se uporabi zbirni pristop za tretirane skupine, se SI dobi tako, da se zbirna radioaktivna vključitev za vsako tretirano skupino z vključitvijo zbirne kontrolne skupine deli z nosilcem, kar da povprečni SI.
33. Pri postopku odločanja se rezultat šteje za pozitivnega, ko je SI ≥ 3. Vendar se lahko pri odločanju, ali je mejni rezultat pozitiven, uporabijo tudi moč odziva na odmerek, statistični pomen ter doslednost odzivov v topilu/nosilcu in pozitivni kontroli (4) (5) (6).
34. Če je treba razjasniti dobljene rezultate, je treba upoštevati različne lastnosti preskusne snovi, tudi strukturno podobnost z znanimi povzročitelji preobčutljivosti, če povzroča čezmerno lokalno draženje kože pri miši, in naravo opaženega odnosa med odmerkom in odzivom. Ti in drugi razlogi so podrobno obravnavani drugje (7).
35. Zbiranje podatkov o radioaktivnosti na ravni posamezne miši bo omogočilo statistično analizo prisotnosti in stopnje odnosa med odmerkom in odzivom v podatkih. Morebitna statistična ocena lahko vključuje oceno odnosa med odmerkom in odzivom ter ustrezno prilagojene primerjave preskusnih skupin (npr. skupina, ki je prejela odmerek v parih, proti primerjavam primerjalnih kontrolnih skupin z nosilcem). Statistična analiza lahko obsega npr. linearno regresijo ali Williamsov preskus za oceno nihanj odziva na odmerek in Dunnettov preskus za primerjave po parih. Pri izbiri ustrezne metode statistične analize se mora raziskovalec zavedati možnih neenakosti varianc in drugih sorodnih problemov, zaradi katerih je lahko nujna pretvorba podatkov ali neparametrska statistična analiza. V vsakem primeru bo moral raziskovalec morda izvesti izračune SI ter statistične analize s podatkovnimi točkami (včasih imenovanimi „izločitve“) in brez njih.
PODATKI IN POROČANJE
Podatki
36. Podatki se povzamejo v obliki preglednice. Pri uporabi pristopa po posamezni živali se prikažejo vrednosti DPM za posamezno žival, skupinsko povprečje DPM/žival, s tem povezane napake (npr. SD, SEM) in povprečni SI za vsako skupino odmerka v primerjavi s primerjalno kontrolno skupino z nosilcem. Pri uporabi zbirnega pristopa za tretirane skupine se prikažeta povprečna/srednja DPM in povprečni SI za vsako skupino odmerka v primerjavi s primerjalno kontrolno skupino z nosilcem.
Poročilo o preskusu
37. Poročilo o preskusu vsebuje naslednje informacije:
preskušane in kontrolne snovi:
— identifikacijske podatke (npr. številko CAS in številko EC, če je na voljo; vir; čistost; znane nečistoče, številko serije),
— fizikalno stanje in fizikalno-kemijske lastnosti (npr. hlapnost, stabilnost, topnost),
— če je zmes, sestavo in relativne odstotke sestavin;
topilo/nosilec:
— identifikacijske podatke (čistost, po potrebi koncentracijo, uporabljeno količino),
— utemeljitev izbire uporabljenega nosilca;
preskusne živali:
— vir miši seva CBA,
— mikrobiološki status živali, če je znan,
— število in starost živali,
— vir živali, namestitvene pogoje, prehrano, itd.;
preskusni pogoji:
— podatke o pripravi in uporabi preskusne snovi,
— utemeljitev izbire odmerka (vključno z rezultati predhodnega presejalnega preskusa, če je bil izveden),
— uporabljene koncentracije nosilca in preskusne snovi ter skupno količino uporabljene preskusne snovi,
— podatke o kakovosti hrane in vode (vključno z vrsto/virom prehranjevanja, virom vode),
— podatke o programih tretiranja in vzorčenja,
— metode merjenja toksičnosti,
— merila za obravnavanje študij kot pozitivnih ali negativnih,
— podrobnosti o morebitnih odstopanjih protokola in pojasnilo, kako odstopanje vpliva na zasnovo študije in njene rezultate;
preverjanje zanesljivosti:
— povzetek rezultatov zadnjega preverjanja zanesljivosti, vključno z informacijami o uporabljeni preskusni snovi, koncentraciji in nosilcu,
— primerjalne in/ali pretekle pozitivne in primerjalne negativne (topilo/nosilec) kontrolne podatke za preskuševalni laboratorij,
— če primerjalna pozitivna kontrola ni bila vključena, datum in laboratorijsko poročilo nazadnje izvedene redne pozitivne kontrole in poročilo, ki navaja pretekle pozitivne kontrolne podatke za laboratorij, na podlagi katerih je upravičeno neizvajanje primerjalne pozitivne kontrole;
rezultati:
— posamezne mase živali na začetku odmerjanja in ob predvideni usmrtitvi; ter povprečno in povezano napako (npr. SD, SEM) za vsako tretirano skupino,
— časovni potek začetka toksičnosti in njenih znakov, vključno z morebitnim draženjem kože na mestu nanosa za vsako žival,
— preglednico z vrednostmi DPM za vsako posamezno miš (pristop po posamezni živali) ali povprečnimi/srednjimi (zbirni pristop za tretirane skupine) vrednostmi DPM in vrednostmi SI za vsako tretirano skupino,
— povprečno in povezano napako (npr. SD, SPM) za DPM/miš za vsako tretirano skupino in rezultate analize izločitev za vsako tretirano skupino pri uporabi pristopa po posamezni živali,
— izračunan SI in ustrezno merilo spremenljivosti, ki pri uporabi pristopa po posamezni živali upošteva spremenljivost med posameznimi živalmi tako v preskusni snovi kot kontrolnih skupinah,
— odnos med odmerkom in odzivom,
— po potrebi, statistične analize;
razprava o rezultatih:
— kratke pripombe o rezultatih, analizo odziva na odmerek in po potrebi statistične analize, s sklepom, ali naj se preskusna snov šteje za povzročitelja preobčutljivosti kože.
VIRI
1. OECD (2002), Skin Sensitisation: Local Lymph Node Assay. OECD Guideline for the Testing of Chemicals No 429, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
2. Kimber, I. and Basketter, D.A. (1992), The murine local lymph node assay; collaborative studies and new directions: A commentary, Food Chem. Toxicol., 30, 165–169.
3. Kimber, I., Dearman, R.J., Scholes, E.W. and Basketter, D.A. (1994), The local lymph node assay: developments and applications, Toxicol., 93, 13–31.
4. Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E. and Hastings, K.L. (1998), Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise, J. Toxicol. Environ. Health, 53 563–79.
5. Chamberlain, M. and Basketter, D.A. (1996), The local lymph node assay: status of validation, Food Chem. Toxicol., 34, 999–1002.
6. Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E. (1996), The local lymph node assay: A viable alternative to currently accepted skin sensitisation tests, Food Chem. Toxicol., 34, 985–997.
7. Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998), Strategies for identifying false positive responses in predictive sensitisation tests, Food Chem. Toxicol., 36, 327–33.
8. Van Och, F.M.M., Slob, W., De Jong, W.H., Vandebriel, R.J. and Van Loveren, H. (2000), A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employment of a regression method that includes determination of uncertainty margins, Toxicol., 146, 49–59.
9. Dean, J.H., Twerdok, L.E., Tice, R.R., Sailstad, D.M., Hattan, D.G., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: II. Conclusions and recommendations of an independent scientific peer review panel, Reg. Toxicol. Pharmacol, 34: 258–273.
10. Haneke, K.E., Tice, R.R., Carson, B.L., Margolin, B.H., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: III. Data analyses completed by the national toxicology program interagency center for the evaluation of alternative toxicological methods, Reg. Toxicol. Pharmacol, 34, 274–286.
11. Sailstad, D.M., Hattan, D., Hill, R.N., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: I. The ICCVAM review process, Reg. Toxicol. Pharmacol, 34: 249–257.
12. ICCVAM (2009), Recommended Performance Standards: Murine Local Lymph Node Assay, NIH Publication Number 09-7357, Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna-ps/LLNAPerfStds.pdf.
13. OECD (1992), Skin Sensitisation. OECD Guideline for Testing of Chemicals No 406, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
14. OECD (2005), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, Environment, Health and Safety Monograph, Series on Testing and Assessment No. 34, ENV/JM/MONO(2005)14, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
15. Dearman, R.J., Hilton, J., Evans, P., Harvey, P., Basketter, D.A. and Kimber, I. (1998), Temporal stability of local lymph node assay responses to hexyl cinnamic aldehyde, J. Appl. Toxicol., 18, 281–284.
16. Kimber, I., Dearman, R.J., Betts, C.J., Gerberick, G.F., Ryan, C.A., Kern, P.S., Patlewicz, G.Y. and Basketter, D.A. (2006), The local lymph node assay and skin sensitisation: a cut-down screen to reduce animal requirements? Contact Dermatitis, 54, 181–185.
17. ESAC (2007), Statement on the Reduced Local Lymph Node Assay (rLLNA), European Commission Directorate General, Joint Research Centre, Institute for Health and Consumer Protection, European Centre for the Validation of Alternative Methods, April 2007. Na voljo na spletni strani: http://ecvam.jrc.it/ft_doc/ESAC26_statement_rLLNA_20070525-1.pdf.
18. ICCVAM (2009), The Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) Test Method Evaluation Report. The Reduced Murine Local Lymph Node Assay: An Alternative Test Method Using Fewer Animals to Assess the Allergic Contact Dermatitis Potential of Chemicals and Products, NIH Publication Number 09-6439, Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/.
19. ICCVAM (1999), The Murine Local Lymph Node Assay: A Test Method for Assessing the Allergic Contact Dermatitis Potential of Chemicals/Compounds, The Results of an Independent Peer Review Evaluation Coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM), NIH Publication No. 99-4494, Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna/llnarep.pdf.
20. Kreiling, R., Hollnagel, H.M., Hareng, L., Eigler, L., Lee, M.S., Griem, P., Dreessen, B., Kleber, M., Albrecht, A., Garcia, C. and Wendel, A. (2008), Comparison of the skin sensitising potential of unsaturated compounds as assessed by the murine local lymph node assay (LLNA) and the guinea pig maximization test (GPMT), Food Chem. Toxicol., 46, 1896–1904.
21. Basketter, D., Ball, N., Cagen, S., Carrilo, J.C., Certa, H., Eigler, D., Garcia, C., Esch, H., Graham, C., Haux, C., Kreiling, R. and Mehling, A. (2009), Application of a weight of evidence approach to assessing discordant sensitisation datasets: implications for REACH, Reg. Toxicol. Pharmacol., 55, 90–96.
22. ICCVAM (2009), ICCVAM Test Method Evaluation Report. Assessment of the Validity of the LLNA for Testing Pesticide Formulations and Other Products, Metals, and Substances in Aqueous Solutions, NIH Publication Number 10-7512, Research Triangle Park, NC: National Institute of Environmental Health Sciences, na voljo na spletni strani: http://iccvam.niehs.nih.gov/.
23. ILAR (1996), Institute of Laboratory Animal Research (ILAR) Guide for the Care and Use of Laboratory Animals, 7th ed. Washington, DC: National Academies Press.
24. McGarry, H.F. (2007), The murine local lymph node assay: regulatory and potency considerations under REACH, Toxicol., 238, 71–89.
25. OECD (2002), Acute Dermal Irritation/Corrosion. OECD Guideline for Testing of Chemicals No. 404, Paris, France. Na voljo na spletni strani: http://www.oecd.org/document/40/0,3343,en_2649_34377_37051368_1_1_1_1,00.html.
26. Reeder, M.K., Broomhead, Y.L., DiDonato, L. and DeGeorge, G.L. (2007), Use of an enhanced local lymph node assay to correctly classify irritants and false positive substances, Toxicologist, 96, 235.
27. ICCVAM (2009), Non-radioactive Murine Local Lymph Node Assay: Flow Cytometry Test Method Protocol (LLNA: BrdU-FC) Revised Draft Background Review Document, Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/methods/immunotox/fcLLNA/BRDcomplete.pdf.
28. Hayes, B.B., Gerber, P.C., Griffey, S.S. and Meade, B.J. (1998), Contact hypersensitivity to dicyclohexylcarbodiimide and diisopropylcarbodiimide in female B6C3F1 mice, Drug. Chem. Toxicol., 21, 195–206.
29. Homey, B., von Schilling, C., Blumel, J., Schuppe, H.C., Ruzicka, T., Ahr, H.J., Lehmann, P. and Vohr, V.W. (1998), An integrated model for the differentiation of chemical-induced allergic and irritant skin reactions, Toxicol. Appl. Pharmacol., 153, 83–94.
30. Woolhiser, M.R., Hayes, B.B. and Meade, B.J. (1998), A combined murine local lymph node and irritancy assay to predict sensitisation and irritancy potential of chemicals, Toxicol. Meth., 8, 245–256.
31. Hayes, B.B. and Meade, B.J. (1999), Contact sensitivity to selected acrylate compounds in B6C3F1 mice: relative potency, cross reactivity, and comparison of test methods, Drug. Chem. Toxicol., 22, 491–506.
32. Ehling, G., Hecht, M., Heusener, A., Huesler, J., Gamer, A.O., van Loveren, H., Maurer, T., Riecke, K., Ullmann, L., Ulrich, P., Vandebriel, R. and Vohr, H.W. (2005), A European inter-laboratory validation of alternative endpoints of the murine local lymph node assay: first round. Toxicol., 212, 60–68.
33. Vohr, H.W. and Ahr, H.J. (2005), The local lymph node assay being too sensitive? Arch. Toxicol., 79, 721-728.
34. Patterson, R.M., Noga, E. and Germolec, D. (2007), Lack of evidence for contact sensitisation by Pfiesteria extract, Environ. Health Perspect., 115, 1023-1028.
35. OECD (1987), Acute Dermal Toxicity, OECD Guideline for Testing of Chemicals No 402, Paris, France. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
36. ICCVAM (2009), Report on the ICCVAM-NICEATM/ECVAM/JaCVAM Scientific Workshop on Acute Chemical Safety Testing: Advancing In Vitro Approaches and Humane Endpoints for Systemic Toxicity Evaluations. Research Triangle Park, NC: National Institute of Environmental Health Sciences, na voljo na spletni strani: http://iccvam.niehs.nih.gov/methods/acutetox/Tox_workshop.htm.
37. OECD (2000), Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation, Environmental Health and Safety Monograph, Series on Testing and Assessment No. 19, ENV/JM/MONO(2000)7, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
Dodatek 1
Standardi učinkovitosti za ocenjevanje predlaganih podobnih ali prilagojenih preskusnih metod LLNA za preobčutljivost kože
UVOD
1. Namen standardov učinkovitosti je posredovati podlago, na kateri se lahko za nove preskusne metode, lastniške (tj. avtorske, zaščitene z blagovno znamko, registrirane) in nelastniške, ugotovi, da so ustrezno natančne in zanesljive za določene namene preskušanja. Ti standardi učinkovitosti, ki temeljijo na validiranih in uveljavljenih preskusnih metodah, se lahko uporabijo za oceno zanesljivosti in natančnosti drugih podobnih metod (ki se pogovorno imenujejo „podobni“ preskusi), ki temeljijo na podobnih znanstvenih načelih in merijo ali napovedujejo isti biološki ali toksični učinek (14).
2. Spremenjene metode (tj. predlagane morebitne izboljšave odobrene preskusne metode) je treba pred sprejetjem oceniti, da se ugotovita učinek predlaganih sprememb na učinkovitost preskusa in obseg, v katerem takšne spremembe vplivajo na informacije, ki so na voljo za druge elemente postopka validacije. Odvisno od števila in narave predlaganih sprememb, dobljenih podatkov in podporne dokumentacije za te spremembe se zanje izvede enak postopek validacije, kot je predpisan za nov preskus ali, po potrebi, omejena ocena zanesljivosti in ustreznosti z uveljavljenimi standardi učinkovitosti (14).
3. Podobne ali spremenjene metode, ki so predlagane za uporabo v okviru te preskusne metode, je treba oceniti ter določiti njihovo zanesljivost in natančnost z uporabo kemikalij, ki predstavljajo celoten razpon ocen LLNA. Da bi se izognili neupravičeni uporabi živali, se priporoča, da se razvijalci modelov pred začetkom izvajanja validacijskih študij v skladu s standardi učinkovitosti in smernicami iz te preskusne metode posvetujejo z ustreznimi organi.
4. Ti standardi učinkovitosti temeljijo na ameriških ICCVAM, evropskih ECVAM in japonskih JaCVAM usklajenih standardih učinkovitosti (12) za ocenjevanje veljavnosti podobnih ali spremenjenih različic LLNA. Standardi učinkovitosti obsegajo bistvene elemente preskusne metode, priporočene referenčne kemikalije ter standarde za natančnost in zanesljivost, ki jih mora predlagana metoda doseči ali preseči.
I. Bistveni elementi preskusne metode
5. Za zagotovitev, da je podobna ali spremenjena metoda LLNA v funkcijskem in mehaničnem smislu podobna LLNA in meri isti biološki učinek, morajo biti v protokol preskusne metode vključeni naslednji elementi:
— preskusna snov se površinsko nanese na obe ušesi miši,
— množenje limfocitov se izmeri v bezgavkah, ki drenirajo območje nanosa preskusne snovi,
— množenje limfocitov se izmeri med indukcijsko fazo preobčutljivosti kože,
— pri preskusnih snoveh je največji izbran odmerek najvišja koncentracija, ki pri miši ne povzroči sistemske toksičnosti in/ali čezmernega draženja kože; pri pozitivnih referenčnih kemikalijah je največji odmerek vsaj tako velik kot vrednosti ocenjene koncentracije, potrebne za stimulacijski indeks 3 (vrednosti EC3) ustreznih referenčnih kemikalij (glej preglednico 1) pri LLNA, ne da bi pri miši povzročil sistemsko toksičnost in/ali čezmerno draženje kože,
— v vsako študijo je treba vključiti primerjalno kontrolno skupino z nosilcem, po potrebi pa se uporabi tudi primerjalna pozitivna kontrola,
— na skupino odmerka se uporabijo najmanj štiri živali,
— zberejo se podatki o posamezni živali ali skupni podatki o živalih.
Če katero od teh meril ni izpolnjeno, standardov učinkovitosti ni mogoče uporabiti za validacijo podobne ali spremenjene metode.
II. Najkrajši možni seznam referenčnih kemikalij
6. Usklajeni ameriški ICCVAM, evropski ECVAM in japonski JaCVAM standardi učinkovitosti (12) določajo najkrajši možni seznam 18 referenčnih kemikalij, ki jih je treba uporabiti, in štiri druge referenčne kemikalije (tj. snovi, ki so pri LLNA dale lažne pozitivne ali lažne negativne rezultate v primerjavi z rezultati pri človeku in morskih prašičkih (B.6, ali Smernica za preskušanje OECD 406) (13) in so zato lahko enako ali bolj učinkovite od LLNA), vključene v standarde učinkovitosti za LLNA. Merila za izbor za opredelitev teh kemikalij so bila:
— seznam referenčnih kemikalij predstavlja vrste snovi, ki se običajno preskušajo glede morebitnega povzročanja preobčutljivosti kože, in razpon odzivov, ki jih LLNA lahko meri ali napove;
— kemična struktura snovi je natančno opredeljena;
— za vsako snov so na voljo podatki LLNA iz preskusov na morskih prašičkih (tj. B.6; Smernica za preskušanje OECD 406) (13) in (kadar je mogoče) ljudeh; in
— snovi so dostopne pri tržnih virih.
Priporočene referenčne kemikalije so navedene v preglednici 1. Študije, ki uporabljajo predlagane referenčne kemikalije, morajo biti ocenjene v nosilcu, s katerim so navedene v preglednici 1. V primerih, ko navedena snov ni na voljo, se lahko z ustrezno utemeljitvijo uporabijo druge snovi, ki izpolnjujejo navedena merila za izbor.
Preglednica 1
Priporočene referenčne kemikalije za standarde učinkovitosti za LLNA
|
Številka |
Kemikalije (3) |
Št. CAS |
Oblika |
Nos (4) |
EC3 % (5) |
N (6) |
0,5 x–2,0 x EC3 |
Dejanski razpon EC3 |
LLNA v primerjavi z MP |
LLNA v primerjavi s človekom |
|
1 |
5-kloro-2-metil-4-izotiazolin-3-on (CMI) in 2-metil-4-izotiazolin-3-on (MI) (7) |
26172-55-4/2682-20-4 |
tek. |
DMF |
0,009 |
1 |
0,0045–0,018 |
NI |
+/+ |
+/+ |
|
2 |
DNCB |
97-00-7 |
trd. |
AOO |
0,049 |
15 |
0,025–0,099 |
0,02–0,094 |
+/+ |
+/+ |
|
3 |
4-fenilendiamin |
106-50-3 |
trd. |
AOO |
0,11 |
6 |
0,055–0,22 |
0,07–0,16 |
+/+ |
+/+ |
|
4 |
kobaltov klorid |
7646-79-9 |
trd. |
DMSO |
0,6 |
2 |
0,3–1,2 |
0,4–0,8 |
+/+ |
+/+ |
|
5 |
izoevgenol |
97-54-1 |
tek. |
AOO |
1,5 |
47 |
0,77–3,1 |
0,5–3,3 |
+/+ |
+/+ |
|
6 |
2-merkaptobenzotiazol |
149-30-4 |
trd. |
DMF |
1,7 |
1 |
0,85–3,4 |
NI |
+/+ |
+/+ |
|
7 |
citral |
5392-40-5 |
tek. |
AOO |
9,2 |
6 |
4,6–18,3 |
5,1–13 |
+/+ |
+/+ |
|
8 |
HCA |
101-86-0 |
tek. |
AOO |
9,7 |
21 |
4,8–19,5 |
4,4–14,7 |
+/+ |
+/+ |
|
9 |
evgenol |
97-53-0 |
tek. |
AOO |
10,1 |
11 |
5,05–20,2 |
4,9–15 |
+/+ |
+/+ |
|
10 |
fenil benzoat |
93-99-2 |
trd. |
AOO |
13,6 |
3 |
6,8–27,2 |
1,2–20 |
+/+ |
+/+ |
|
11 |
cimetov alkohol |
104-54-1 |
trd. |
AOO |
21 |
1 |
10,5–42 |
NI |
+/+ |
+/+ |
|
12 |
imidazolidinil urea |
39236-46-9 |
trd. |
DMF |
24 |
1 |
12–48 |
NI |
+/+ |
+/+ |
|
13 |
metil metakrilat |
80-62-6 |
tek. |
AOO |
90 |
1 |
45–100 |
NI |
+/+ |
+/+ |
|
14 |
klorobenzen |
108-90-7 |
tek. |
AOO |
25 |
1 |
n.r. |
n.r. |
–/– |
–/ (1) |
|
15 |
izopropanol |
67-63-0 |
tek. |
AOO |
50 |
1 |
n.r. |
n.r. |
–/– |
–/+ |
|
16 |
mlečna kislina |
50-21-5 |
tek. |
DMSO |
25 |
1 |
n.r. |
n.r. |
–/– |
–/ (1) |
|
17 |
metil salicilat |
119-36-8 |
tek. |
AOO |
20 |
9 |
n.r. |
n.r. |
–/– |
–/– |
|
18 |
salicilna kislina |
69-72-7 |
trd. |
AOO |
25 |
1 |
n.r. |
n.r. |
–/– |
–/– |
|
Druge snovi za prikaz izboljšane učinkovitosti glede na LLNA |
||||||||||
|
19 |
natrijev lavrilsulfat |
151-21-3 |
trd. |
DMF |
8,1 |
5 |
4,05–16,2 |
1,5–17,1 |
+/– |
+/– |
|
20 |
etilen glikol dimetakrilat |
97-90-5 |
tek. |
MEK |
28 |
1 |
14–56 |
NI |
+/– |
+/+ |
|
21 |
ksilen |
1330-20-7 |
tek. |
AOO |
95,8 |
1 |
47,9–100 |
NI |
+/ (2) |
+/– |
|
22 |
nikljev diklorid |
7718-54-9 |
trd. |
DMSO |
5 |
2 |
n.r. |
n.r. |
–/+ |
–/+ |
|
(1) Predvideva se, da pri ljudeh ni povzročitelj preobčutljivosti, ker niso bili najdeni nobeni rezultati kliničnih epikutanih testov, zato ni vključen v komplet za epikutano testiranje kot alergen, in najdenega ni bilo nobenega poročila o primeru preobčutljivosti pri človeku. (2) Podatki o MP niso na voljo. (3) Kemikalije je treba pripravljati dnevno, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo. (4) Zaradi morebitnega vpliva različnih nosilcev na učinkovitost LLNA je treba uporabljati priporočen nosilec za vsako referenčno kemikalijo (24) (32). (5) Povprečna vrednost v primerih, ko je bila na voljo več kot ena vrednost EC3. Pri negativnih snoveh (tj. s stimulacijskim indeksom < 3) je navedena najvišja preskušena koncentracija. (6) Število študij LLNA, s katerimi so bili pridobljeni podatki. (7) Na tržišču na voljo pod imenom Kathon CG (št. CAS 55965-84-9), ki je zmes CMI in MI v razmerju 3:1. Relativne koncentracije vsake sestavine so od 1,1 % do 1,25 % (CMI) in od 0,3 % do 0,45 % (MI). Neaktivne sestavine so magnezijeve soli (21,5 % do 24 %) in bakrov nitrat (0,15 % do 0,17 %), s preostalo sestavo 74 % do 77 % vode. Kathon CG je dostopen preko podjetij Sigma-Aldrich in Rohm and Haas (zdaj Dow Chemical Corporation). Kratice: AOO = aceton olivno olje (4:1, v/v); št. CAS = številka Službe za izmenjavo kemijskih izvlečkov; DMF = N,N-dimetilformamid; DMSO = dimetil sulfoksid; DNCB = 2,4-dinitroklorobenzen; EC3 = ocenjena koncentracija, potrebna za stimulacijski indeks 3; MP = rezultat preskusa na morskih prašičkih (tj. B. 6 ali Smernica za preskušanje OECD 406) (13); HCA = heksil cimetov aldehid; LLNA = rezultat lokalne analize bezgavk pri glodavcih (tj. B. 42 ali Smernica za preskušanje OECD 429) (1); MEK = metil etil keton; NI = ni izračunano, ker so bili podatki pridobljeni z eno samo študijo; n.r = ni relevantno, ker je stimulacijski indeks < 3; trd. = trdna snov; Nos = nosilec preskusa. |
||||||||||
III. Opredeljeni standardi zanesljivosti in natančnosti
7. Natančnost podobne ali spremenjene metode LLNA mora pri ocenjevanju z uporabo 18 referenčnih kemikalij, ki jih je treba uporabiti, dosegati ali presegati natančnost standardov učinkovitosti za LLNA. Rezultat nove ali spremenjene metode mora biti pravilna razvrstitev na podlagi odločitve „da/ne“. Vendar pa nova ali spremenjena metoda morda ne bo pravilno razvrstila vseh 18 referenčnih kemikalij, ki jih je treba uporabiti. Če je, na primer, eden od šibkih povzročiteljev preobčutljivosti napačno razvrščen, se lahko za dokaz enake učinkovitosti upoštevajo utemeljitev za napačno razvrstitev in ustrezni podatki (npr. rezultati preskusa, ki zagotavljajo pravilno razvrstitev drugih snovi s fizikalnimi in kemijskimi lastnostmi ter lastnostmi, ki povzročajo preobčutljivost, podobnimi lastnostim napačno razvrščene referenčne kemikalije). V takih okoliščinah se status validacije novih in spremenjenih preskusnih metod za LLNA oceni za vsak primer posebej.
8. Za ugotavljanje ponovljivosti v laboratoriju se nova ali prilagojena metoda LLNA oceni z uporabo snovi, ki povzroča preobčutljivost in je natančno opredeljena v LLNA. Zato standardi učinkovitosti za LLNA temeljijo na spremenljivosti rezultatov ponovljenih preskusov s heksil cimetovim aldehidom (HCA). Za oceno zanesljivosti v laboratoriju je treba vrednosti ocenjenega praga koncentracije (ECt) za HCA pridobiti ob štirih različnih priložnostih, med preskusi pa mora biti vsaj en teden razmaka. Sprejemljivo ponovljivost v laboratoriju kaže zmožnost laboratorija, da pri vsakem preskusu s HCA pridobi vrednosti ECt med 5 % in 20 %, kar predstavlja razpon od 0,5 do 2,0-krat povprečne ocenjene koncentracije, potrebne za stimulacijski indeks 3 (EC3), določene za HCA (10 %) pri LLNA (glej preglednico 1).
9. Ponovljivost nove ali prilagojene metode LLNA v laboratorijih se oceni z uporabo dveh snovi, ki povzročata preobčutljivost in sta natančno opredeljeni v LLNA. Standardi učinkovitosti za LLNA temeljijo na spremenljivosti rezultatov preskusov s HCA in 2,4-dinitroklorobenzenom (DNCB) v različnih laboratorijih. Vrednosti ECt je treba pridobiti neodvisno in z eno samo študijo, izvedeno v vsaj treh ločenih laboratorijih. Za prikaz sprejemljive ponovljivosti v laboratorijih mora vsak laboratorij pridobiti vrednosti ECt od 5 % do 20 % za HCA in od 0,025 % do 0,1 % za DNCB, kar predstavlja razpon od 0,5 do 2,0-krat povprečne koncentracije EC3, določene za HCA (10 %) oziroma DNCB (0,05 %), pri LLNA (glej preglednico 1).
Dodatek 2
Opredelitve pojmov
Natančnost : stopnja ujemanja rezultatov preskusne metode z uveljavljenimi referenčnimi vrednostmi. To je merilo učinkovitosti preskusne metode in eden od vidikov ustreznosti. Ta izraz in izraz „skladnost“ se pogosto izmenično uporabljata za pomen deleža ustreznih rezultatov preskusne metode (14).
Primerjalna snov : snov, ki povzroča preobčutljivost ali je ne povzroča in se uporablja kot standard za primerjavo s preskusno snovjo. Primerjalna snov mora imeti naslednje lastnosti: (i) trajen in zanesljiv vir; (ii) strukturno in funkcijsko podobnost z razredom preskušanih snovi; (iii) znane fizikalno-kemijske lastnosti; (iv) podporne podatke o znanih učinkih in (v) znano učinkovitost v razponu želene reakcije.
Ocenjen prag koncentracije (ECt) : ocenjena koncentracija preskusne snovi, potrebne za stimulacijski indeks, ki kaže na pozitiven rezultat.
Ocenjena koncentracija tri (EC3) : ocenjena koncentracija preskusne snovi, potrebne za stimulacijski indeks tri.
Lažno negativna snov : preskusna snov, ki je s preskusno metodo nepravilno opredeljena kot negativna ali neaktivna, čeprav je dejansko pozitivna ali aktivna.
Lažno pozitivna snov : preskusna snov, ki je s preskusom nepravilno opredeljena kot pozitivna ali aktivna, čeprav je dejansko negativna ali neaktivna.
Nevarnost : možnost škodljivega učinka na zdravje ali okolje. Do škodljivega učinka pride, če je raven izpostavljenosti dovolj visoka.
Ponovljivost v laboratorijih : merjenje obsega, v katerem lahko različni kvalificirani laboratoriji, ki uporabljajo isti protokol in preskušajo iste preskusne snovi, pridejo do kvalitativno in kvantitativno podobnih rezultatov. Ponovljivost v laboratorijih se ugotovi med postopki pred validacijo in med validacijo ter kaže, v kakšnem obsegu se lahko preskus uspešno uporablja v več laboratorijih; imenuje se tudi ponovljivost v različnih laboratorijih (14).
Ponovljivost v laboratoriju : določitev, obsega, v katerem lahko kvalificirane osebe v istem laboratoriju uspešno ponovijo rezultate z uporabo določenega protokola v različnem času. Imenuje se tudi ponovljivost znotraj laboratorija (14).
Podobni preskus : pogovorni izraz za preskusno metodo, ki je strukturno in funkcijsko podobna potrjeni in uveljavljeni referenčni preskusni metodi. Takšna preskusna metoda je primerna za naknadno validacijo. Uporablja se izmenično s podobno preskusno metodo (14).
Izločitev : izločitev je ugotovitev, ki se izrazito razlikuje od drugih vrednosti v naključnem vzorcu populacije.
Standardi učinkovitosti : standardi, ki temeljijo na validirani preskusni metodi, na podlagi katere se lahko ocenjuje primerljivost predlagane preskusne metode, ki je v mehaničnem in funkcijskem smislu podobna. Obsegajo: i) nujne elemente preskusne metode, ii) najkrajši možni seznam referenčnih kemikalij, izbranih iz skupine kemikalij, ki se uporabljajo za dokazovanje sprejemljive učinkovitosti validirane preskusne metode, in iii) podobne stopnje natančnosti in zanesljivosti, ki temeljijo na rezultatu uporabe validirane preskusne metode, kar mora pri ocenjevanju dokazati predlagana preskusna metoda ob uporabi najkrajšega možnega seznama referenčnih kemikalij (14).
Lastniška preskusna metoda : preskusna metoda, pri kateri sta proizvodnja in distribucija omejeni s patenti, avtorskimi pravicami, blagovnimi znamkami itd.
Zagotavljanje kakovosti : postopek upravljanja, pri katerem posamezniki, neodvisni od oseb, ki so izvajale preskuse, ocenijo izpolnjevanje laboratorijskih standardov za preskušanje, zahtev in postopkov vodenja evidenc ter natančnosti prenosa podatkov.
Referenčne kemikalije : kemikalije, izbrane za uporabo v postopku validacije, za katere so odzivi referenčnega preskusnega sistema ali želenih vrst in vitro ali in vivo že znani. Te kemikalije morajo biti reprezentativne za razrede kemikalij, za katere naj bi se uporabila preskusna metoda, predstavljati pa morajo celoten razpon odzivov, ki se jih lahko pričakuje od kemikalij, za katere bo morda uporabljena, od močnega, do šibkega, do negativnega. Za različne faze validacije in različne preskusne metode ter preskusne uporabe so lahko potrebne različne skupine referenčnih kemikalij (14).
Ustreznost : opis odnosa med preskusom in želenim učinkom ter njegovim pomenom in uporabnostjo za določen namen. Pomeni stopnjo, do katere preskus pravilno izmeri ali napove želeni biološki učinek. Ustreznost vključuje upoštevanje natančnosti (skladnosti) preskusne metode (14).
Zanesljivost : stopnja ponovljivosti preskusne metode v laboratorijih in med njimi v določenem časovnem obdobju pri uporabi istega protokola. Oceni se z izračunom ponovljivosti v enem ali več laboratorijih (14).
Preobčutljivost kože : imunološki proces, ki se pojavi, ko je občutljiv posameznik lokalno izpostavljen kemičnemu alergenu, ki na koži sproži imunski odziv in lahko povzroči razvoj preobčutljivosti ob stiku.
Stimulacijski indeks (SI) : vrednost, izračunana za oceno morebitne preobčutljivosti kože, ki jo lahko povzroči preskusna snov; je razmerje med množenjem v tretiranih skupinah in množenjem v primerjalni kontrolni skupini z nosilcem.
Preskusna snov (imenovana tudi preskusna kemikalija) : katera koli snov ali zmes, preskušana z uporabo te preskusne metode.
Validirana preskusna metoda : preskusna metoda, za katero sta bili na podlagi validacijskih študij določeni ustreznost (vključno z natančnostjo) in zanesljivost za določen namen. Treba je opozoriti, da natančnost in zanesljivost validirane preskusne metode nista nujno zadostni, da bi bili sprejemljivi za predlagani namen (14).
B.43 ŠTUDIJA NEVROTOKSIČNOSTI NA GLODALCIH
1. METODA
Ta metoda ustreza metodi OECD TG 424 (1997).
Ta preskusna metoda je namenjena pridobivanju informacij, ki so potrebne za potrditev ali nadaljnjo opredelitev potencialne nevrotoksičnosti kemikalij na odraslih živalih. Lahko se jo kombinira z obstoječimi preskusnimi metodami za študije strupenosti s ponavljajočimi odmerki ali pa se jo izvaja kot posebno študijo. Priporočljivo je, da se v pomoč pri načrtovanju študij, ki temeljijo na tej preskusni metodi, uporabijo napotki OECD o strategijah in metodah preskušanja nevrotoksičnosti (1). To je še posebej pomembno, kadar se razmišlja o spremembah postopkov opazovanja in preskušanja, ki se priporočajo za rutinsko uporabo te metode. Napotki so bili pripravljeni za olajšanje izbire drugih preskusnih postopkov za uporabo v posebnih okoliščinah.
Vrednotenje razvojne nevrotoksičnosti ni predmet te metode.
1.1 UVOD
Pri ocenjevanju in vrednotenju strupenih lastnosti kemikalij je pomembno, da se upošteva potencial za nevrotoksične učinke. Že preskusna metoda za sistemsko toksičnost s ponavljajočimi odmerki vključuje opazovanja, ki iščejo potencialno nevrotoksičnost. Ta preskusna metoda se lahko uporabi za načrtovanje študije za pridobitev nadaljnjih informacij ali potrditev informacij o nevrotoksičnih učinkih, ki jih pokažejo študije sistemske toksičnosti s ponavljajočimi odmerki. Vendar lahko upoštevanje potencialne nevrotoksičnosti nekaterih razredov kemikalij pokaže, da bi jih lahko primerneje ocenili z uporabo te metode brez predhodnih navedb o potencialni nevrotoksičnosti iz študij sistemske toksičnosti s ponavljajočimi odmerki. Taki razlogi vključujejo na primer:
— opazovanje nevroloških znakov ali nevropatoloških lezij v študijah toksičnosti, ki niso študije sistemske toksičnosti s ponavljajočimi odmerki, ali
— strukturno podobnost ali druge informacije o povezavah z znanimi nevrotoksikanti.
Poleg tega lahko obstajajo še drugi primeri, ko je primerna uporaba te preskusne metode; za nadaljnje podrobnosti glej (1).
Ta metoda je oblikovana tako, da se lahko prilagodi in v primeru posebnih potreb potrdi posebna histopatološka in vedenjska nevrotoksičnost kemikalij, pa tudi da se zagotovi označitev in količinska opredelitev nevrotoksičnih odzivov.
V preteklosti je bila nevrotoksičnost izenačena z nevropatijo, ki vključuje nevropatološke lezije ali nevrološke motnje, kot so božjast, paraliza ali tremor. Čeprav je nevropatija pomembna pojavna oblika nevrotoksičnosti, je danes jasno, da obstajajo številni drugi znaki toksičnosti živčnega sistema (npr. izguba motorične koordinacije, senzorične pomanjkljivosti, učne in spominske motnje), ki se ne odražajo v nevropatiji ali drugih vrstah študij.
Ta preskusna metoda za nevrotoksičnost je namenjena odkrivanju glavnih nevrovedenj skih in nevropatoloških učinkov na odraslih glodalcih. Čeprav lahko vedenjski učinki tudi v odsotnosti morfoloških sprememb odražajo škodljiv vpliv na organizem, niso vse vedenjske spremembe značilne za živčni sistem. Zato je treba vse opažene spremembe ovrednotiti skupaj s soodvisnimi histopatološkimi, hematološkimi ali biokemičnimi podatki, pa tudi s podatki o drugih vrstah sistemske toksičnosti. Preskušanje, ki se v tej metodi zahteva za zagotavljanje označitve in količinske opredelitve nevrotoksičnih odzivov, vključuje posebne histopatološke in vedenjske postopke, ki se lahko nadalje podprejo z elektrofiziološkimi in/ali biokemičnimi raziskavami (1) (2) (3) (4).
Nevrotoksikanti lahko delujejo na številne cilje v živčnem sistemu in z različnimi mehanizmi. Ker ni ene same vrste preskusov, s katerimi bi se lahko temeljito ovrednotilo nevrotoksičen potencial vseh snovi, je lahko potrebno izkoristiti druge in vivo ali in vitro preskuse, značilne za vrsto opazovane ali pričakovane nevrotoksičnosti.
Ta preskusna metoda se lahko uporablja tudi skupaj z navodili v napotkih OECD o strategijah in metodah preskušanja nevrotoksičnosti (1) za načrtovanje študij, ki so namenjene nadaljnji označitvi ali povečanju občutljivosti količinske opredelitve odziva na odmerek po vrstnem redu ali boljši oceni vrednosti brez opaznih škodljivih učinkov ali utemeljitvi znanih ali domnevnih nevarnosti kemikalije. Na primer, študije se lahko namenijo ugotavljanju in vrednotenju nevrotoksičnega(-ih) mehanizma(-ov) ali dopolnitvi podatkov, ki so že na voljo iz uporabe osnovnih nevrovedenj skih in nevropatoloških postopkov opazovanja. Takim študijam ni treba ponoviti podatkov, ki bi jih dobili z uporabo standardnih postopkov, ki jih priporoča ta metoda, če so taki podatki že na voljo in ne štejejo za potrebne pri razlagi rezultatov študije.
Ta študija nevrotoksičnosti, če se uporablja samostojno ali v kombinaciji, zagotavlja informacije, s katerimi se lahko:
— ugotovi, ali je živčni sistem trajno ali reverzibilno prizadet zaradi preskušane kemikalije,
— prispeva k označitvi sprememb živčnega sistema, povezanih z izpostavljenostjo kemikaliji, in razumevanjem osnovnega mehanizma,
— določi odnose med odzivom na odmerek in časovnim odzivom, da bi ocenili vrednost brez opaznih škodljivih učinkov (ki se lahko uporablja za ugotavljanje varnostnih meril za kemikalijo).
Ta preskusna metoda uporablja oralno dajanje preskusne snovi. Drugi načini dajanja (npr. dermalno ali z vdihavanjem) so lahko primernejši in lahko zahtevajo spremembo priporočenih postopkov. Razlogi za izbiro načina dajanja so odvisni od profila človekove izpostavljenosti in razpoložljivih toksikoloških ali kinetičnih informacij.
1.2 OPREDELITVE POJMOV
Škodljivi učinek: je odstopanje od normalnega, povezano s tretiranjem, ki zmanjšuje sposobnost organizma za preživetje, razmnoževanje ali prilagoditev okolju.
Odmerek: je količina dane preskusne snovi. Odmerek je izražen kot masa (g, mg), kot masa preskusne snovi na enoto mase preskusne živali (npr. mg/kg) ali kot konstanta koncentracije v hrani (ppm).
Odmerjanje: je splošen izraz, ki vključuje odmerek ter pogostost in trajanje dajanja odmerka.
Nevrotoksičnost: je škodljiva sprememba strukture ali funkcije živčnega sistema, ki je posledica izpostavljenosti kemičnemu, biološkemu ali fizičnemu sredstvu.
Nevrotoksikant: je vsako kemično, biološko ali fizično sredstvo, ki ima potencial, da povzroča nevrotoksičnost.
NOAEL: je kratica za vrednost brez opaznih škodljivih učinkov (No Observed Adverse Effect Level) in je največji odmerek, pri katerem ne opazimo nobenega škodljivega učinka, povezanega s tretiranjem.
1.3 PRINCIP PRESKUSNE METODE
Preskusna kemikalija se daje oralno v vrsti odmerkov več skupinam laboratorijskih glodalcev. Navadno se zahtevajo ponavljajoči odmerki in režim odmerjanja je lahko 28 dni, subkroničen (90 dni) ali kroničen (1 leto ali dlje). Postopki, navedeni v tej preskusni metodi, se lahko uporabljajo tudi za študijo akutne nevrotoksičnosti. Živali se preskušajo, da bi omogočili odkrivanje ali označitev vedenjskih in/ali nevroloških anomalij. V vsakem obdobju opazovanja se ocenjuje vrsta vedenjskih oblik, ki jih lahko prizadenejo nevrotoksikanti. Na koncu preskusa se podskupina živali vsakega spola iz vsake skupine perfundira in situ in pripravijo ter preučijo se prerezi možganov, hrbtenjače in perifernih živcev.
Kadar se študija opravi kot samostojna študija za ugotavljanje nevrotoksičnosti ali za označitev nevrotoksičnih učinkov, se lahko živali iz vsake skupine, ki niso uporabljene za perfuzijo in naknadno histopatologijo (glej Tabelo 1), uporabijo za posebne nevrovedenj ske, nevropatološke, nevrokemične ali elektrofiziološke postopke, ki lahko dopolnijo podatke, dobljene s standardnimi preiskavami, ki se zahtevajo po tej metodi (1). Ti dopolnilni postopki so lahko še posebno koristni, kadar empirična opazovanja ali pričakovani učinki kažejo posebno vrsto ali cilj nevrotoksičnosti kemikalije. Preostale živali pa se lahko uporabijo za vrednotenja, kakor so tista, ki se zahtevajo v preskusnih metodah za študije toksičnosti s ponavljajočimi odmerki na glodalcih.
Kadar se postopki te preskusne metode kombinirajo s postopki drugih preskusnih metod, je potrebno zadostno število živali, da se izpolnijo zahteve obeh študij glede opazovanja.
1.4 OPIS PRESKUSNE METODE
1.4.1 Izbira živalskih vrst
Priporočena glodalska vrsta je podgana, čeprav se lahko ob utemeljitvi uporabi druga glodalska vrsta. Uporabijo se laboratorijski sevi mladih odraslih živali, ki se splošno uporabljajo. Samice morajo biti nuliparne in ne smejo biti breje. Dajanje odmerkov se mora normalno začeti čim prej po odstavitvi, po možnosti najpozneje takrat, ko so živali stare šest tednov in v vsakem primeru preden so živali stare devet tednov. Kadar pa se ta študija kombinira z drugimi študijami, je morda treba to starost prilagoditi. Razlike v masi posameznih živali na začetku študije ne smejo presegati ± 20 % povprečne mase za vsak spol. Če se kratkotrajna študija s ponavljajočimi odmerki izvaja kot predhodna študija za dolgotrajno študijo, je treba v obeh študijah uporabiti živali istega seva in vira.
1.4.2 Nastanitvene in prehranjevalne razmere
Temperatura v prostoru s poskusnimi živalmi naj bo 22 oC (± 3 oC). Čeprav naj bi bila relativna vlažnost najmanj 30 % in je zaželeno, da ne presega 70 %, razen v času čiščenja prostora, je cilj 50–60 %. Osvetlitev naj bo umetna, zaporedje 12 ur svetlobe, 12 ur teme. Glasnega ponavljajočega hrupa naj bo čim manj. Za hranjenje se lahko uporablja konvencionalna laboratorijska prehrana z neomejeno oskrbo s pitno vodo. Na izbiro prehrane lahko vpliva potreba po zagotovitvi ustrezne primesi preskusne snovi, kadar se daje po tej metodi. Živali se lahko namestijo posamično ali dajo v kletke v manjših skupinah istega spola.
1.4.3 Priprava živali
Zdrave mlade živali se naključno dodelijo v tretirano in kontrolno skupino. Kletke je treba razporediti tako, da so možni učinki zaradi pozicije kletk čim manjši. Živali se na enoten način identificirajo in zadržijo v kletkah (5) dni pred začetkom študije, da se prilagodijo na laboratorijske razmere.
1.4.4 Način dajanja in priprava odmerkov
Ta preskusna metoda se posebej ukvarja z oralnim dajanjem preskusne snovi. Oralno dajanje je lahko z gavažo, hrano, pitno vodo ali kapsulami. Drugi načini dajanja (npr. dermalno ali z vdihavanjem) so lahko primernejši in lahko zahtevajo spremembo priporočenih postopkov. Razlogi za izbiro načina dajanja so odvisni od profila človekove izpostavljenosti in razpoložljivih toksikoloških ali kinetičnih informacij. Treba je navesti utemeljitev za izbiro načina dajanja, pa tudi posledične spremembe postopkov te preskusne metode.
Po potrebi se lahko preskusna snov raztopi ali suspendira v primernem nosilcu. Priporočljivo je, da se najprej razmisli o uporabi vodne raztopine/suspenzije, potem o raztopini/suspenziji v olju (npr. koruznem olju) in šele nato o možni raztopini/suspenziji v drugih nosilcih. Strupene lastnosti nosilca morajo biti znane. Poleg tega je treba upoštevati naslednje lastnosti nosilca: učinke nosilca na absorpcijo, distribucijo, presnovo ali retencijo preskusne snovi, ki lahko spremenijo njene toksične lastnosti; ter učinke na porabo hrane ali vode ali status prehranjenosti živali.
1.5 POSTOPKI
1.5.1 Število in spol živali
Kadar se študija opravi kot posebna študija, je treba uporabiti najmanj 20 živali (10 samic in 10 samcev) v vsaki skupini odmerka in v kontrolni skupini za vrednotenje podrobnih kliničnih in funkcionalnih opazovanj. Najmanj pet samcev in pet samic, izbranih izmed teh 10 samcev in 10 samic, je treba perfundirati in situ in uporabiti za podrobno nevrohistopatologijo na koncu študije. V primerih, ko se glede nevrotoksičnih učinkov opazuje le omejeno število živali v dani skupini odmerka, je treba upoštevati vključitev teh živali med živali, izbrane za perfuzijo. Kadar se študija izvede v kombinaciji s študijo toksičnosti s ponavljajočimi odmerki, je treba uporabiti zadostno število živali, da so izpolnjeni cilji obeh študij. Najmanjše število živali na skupino za različne kombinacije študij je podano v Tabeli 1. Če se načrtujejo vmesne usmrtitve ali obnovitvene skupine za opazovanje reverzibilnosti, obstojnosti ali zapoznelega nastopa toksičnih učinkov po tretiranju ali če se razmišlja o dopolnilnih opazovanjih, je treba število živali povečati, da se zagotovi, da je na voljo število živali, ki je potrebno za opazovanje in histopatologijo.
1.5.2 Tretirane in kontrolne skupine
Na splošno se uporabijo najmanj tri skupine odmerkov in kontrolna skupina, a če se po oceni drugih podatkov ne pričakuje nobenih učinkov pri ponavljajočem odmerku 1 000 mg/kg telesne mase/dan, se lahko izvede mejni preskus. Če ni na voljo primernih podatkov, se lahko izvede študija za ugotavljanje območja odmerkov, da pomaga določiti odmerke, ki se naj uporabijo. Razen pri tretiranju s preskusno snovjo, morajo biti živali v kontrolni skupini obravnavane enako kakor živali v preskusni skupini. Če je pri dajanju preskusne snovi uporabljen nosilec, mora kontrolna skupina prejeti količino nosilca, enako največji uporabljeni količini.
1.5.3 Preverjanje zanesljivosti
Laboratorij, ki izvaja študijo, mora predložiti podatke, ki dokazujejo njegovo sposobnost za izvedbo študije in občutljivost uporabljenih postopkov. Ti podatki morajo zagotoviti dokaz o sposobnosti odkrivanja in po potrebi količinske opredelitve sprememb različnih ciljnih učinkov, ki se priporočajo za opazovanje, na primer avtonomnih znakov, senzoričnih reakcij, moči nožnega oprijema in motorične aktivnosti. Informacije o kemikalijah, ki povzročajo različne vrste nevrotoksičnih odzivov in bi se lahko uporabljaje kot snovi pozitivne kontrole, so v sklicih od 2 do 9. Pretekli podatki se lahko uporabijo, če ostanejo bistveni vidiki poskusnih postopkov enaki. Priporoča se občasno posodabljanje preteklih podatkov. Kadar izvajalski laboratorij spremeni kak bistven element pri izvajanju preskusa ali postopkov, je treba razviti nove podatke, ki izkazujejo nadaljnjo občutljivost postopkov.
1.5.4 Izbira odmerkov
Velikosti odmerkov se izberejo ob upoštevanju vsake predhodno opažene toksičnosti in kinetičnih podatkov, ki so na voljo za preskusne zmesi ali sorodne materiale. Največjo velikost odmerka je treba izbrati s ciljem povzročitve nevrotoksičnih učinkov ali jasnih sistemskih toksičnih učinkov. Padajoče zaporedje velikosti odmerkov je treba potem izbrati tako, da se pokažejo vse reakcije, ki so odvisne od odmerka, in vrednost brez opaznih škodljivih učinkov (NOAEL) pri najnižji velikosti odmerka. Načeloma je treba velikosti odmerkov določiti tako, da se lahko primarni toksični učinki na živčni sistem ločijo od učinkov, ki so povezani s sistemsko toksičnostjo. Dvakratni do trikratni intervali so pogosto najprimernejši, večinoma pa je bolje dodati dodatno, četrto preskusno skupino, kakor uporabiti zelo velike intervale med odmerki (npr. več kakor faktor 10). Kadar obstaja primerna ocena človekove izpostavljenosti, je treba upoštevati tudi to.
1.5.5 Mejni preskus
Če študija pri eni velikosti odmerka najmanj 1 000 mg/kg telesne mase/dan, pri katerem so uporabljeni postopki, opisani za to študijo, ne da opaznih nevrotoksičnih učinkov, in če toksičnost ni pričakovana glede na podatke o strukturno sorodnih zmeseh, potem popolna študija z uporabo treh velikosti odmerkov morda ne bo potrebna. Pričakovana človekova izpostavljenost lahko narekuje potrebo, da se v mejnem preskusu uporabi večji oralni odmerek. Pri drugih vrstah dajanja, na primer pri vdihavanju ali dermalni aplikaciji, lahko fizikalno-kemijske lastnosti preskusne snovi pogosto določajo največjo dosegljivo raven izpostavljenosti. Za izvedbo akutne oralne študije mora biti odmerek za mejni preskus najmanj 2 000 mg/kg.
1.5.6 Dajanje odmerkov
Živali dobivajo odmerek preskusne snovi dnevno, sedem dni v tednu, najmanj 28 dni; uporabo petdnevnega režima odmerjanja ali krajše obdobje izpostavljenosti je treba utemeljiti. Če se preskusna snov daje z gavažo, jo je treba dati v enkratnem odmerku z uporabo želodčne sonde ali primerne intubacijske kanile. Maksimalna količina tekočine, ki jo je mogoče dati naenkrat, je odvisna od velikosti poskusnih živali. Količina ne sme presegati 1 ml/100 g telesne mase. Vendar se lahko v primeru vodnih raztopin upošteva uporaba do 2 ml/100 g telesne mase. Razen pri dražečih ali jedkih snoveh, ki pri višjih koncentracijah navadno povzročajo močnejše učinke, je treba variabilnost preskusnega volumna s prilagajanjem koncentracije obdržati na kar najnižji ravni, zato da bi zagotovili konstantno količino pri vseh odmerkih.
Pri snoveh, ki se dajejo s hrano ali pitno vodo, je treba zagotoviti, da količine uporabljene preskusne snovi ne vplivajo na običajno raven vnosa hrane ali porabe vode. Kadar se preskusna snov daje s hrano, se lahko uporabi bodisi konstantna koncentracija v hrani (ppm) bodisi konstantna velikost odmerka glede na telesno maso živali; treba je navesti uporabljeni način. Če snov dajemo z gavažo, je treba odmerke dati vsak dan približno ob istem času in jih ustrezno prilagoditi, da se vzdržuje konstantna velikost odmerka glede na telesno maso živali. Če se študija s ponavljajočimi odmerki izvaja kot predhodna študija za dolgotrajno študijo, je treba v obeh študijah uporabiti podobno hrano. Pri akutnih študijah se lahko odmerek, če posamezni odmerek ni mogoč, daje v manjših delih v obdobju, ki ne presega 24 ur.
1.6 OPAZOVANJE
1.6.1 Pogostost opazovanj in preskusov
Pri študijah s ponavljajočimi odmerki se obdobje opazovanja prekriva z obdobjem dajanja odmerka. Pri akutnih študijah je treba opazovati 14-dnevno obdobje po tretiranju. Pri živalih v satelitskih skupinah, ki ostanejo v obdobju po tretiranju neizpostavljene, opazovanja zajemajo tudi to obdobje.
Opazovanja se opravijo dovolj pogosto, da je čim večja možnost za odkritje vedenjskih in/ali nevroloških anomalij. Opazovanja je najbolje opraviti vsak dan ob istem času, pri čemer se upošteva vrhunec pričakovanih učinkov po odmerjanju. Pogostost kliničnih opazovanj in funkcionalnih preskusov je povzeta v Tabeli 2. Če kinetični ali drugi podatki, ki so dobljeni iz prejšnjih študij, kažejo na potrebo po uporabi drugih časov za opazovanja, preskuse ali obdobja po opazovanju, je treba sprejeti drugačen razpored, da bi dobili čim več informacij. Spremembe programa je treba utemeljiti.
1.6.1.1 Opazovanja splošnega zdravstvenega stanja in smrtnosti/obolevnosti
Vse živali je treba najmanj enkrat dnevno natančno opazovati glede zdravstvenega stanja, najmanj dvakrat dnevno pa tudi glede obolevnosti in smrtnosti.
1.6.1.2 Podrobna klinična opazovanja
Podrobna klinična opazovanja se na vseh živalih, ki so izbrane v ta namen (glej Tabelo 1), opravijo enkrat pred prvo izpostavljenostjo (zaradi primerjav na istem osebku) in potem v različnih presledkih, odvisno od trajanja študije (glej Tabelo 2). Podrobna klinična opazovanja satelitskih obnovitvenih skupin je treba opraviti na koncu obnovitvenega obdobja. Podrobna klinična opazovanja je treba opraviti zunaj domače kletke na standardnem mestu. Opažanja je treba skrbno dokumentirati s pomočjo meril in točkovanj za vsako meritev pri opazovanju. Laboratorij, ki opravlja preskus, mora jasno opredeliti merila ali lestvice. Prizadevati si je treba, da so odstopanja od pogojev preskušanja čim manjša (ne sistematično povezana s tretiranjem) in da opazovanja izvajajo usposobljeni opazovalci, ki ne poznajo dejanskega tretiranja.
Priporočljivo je, da se opazovanja izvajajo na strukturiran način, kjer se dobro opredeljena merila (vključno z opredelitvijo normalnega „območja“) uporabljajo sistematično za vsako žival v vsakem opazovalnem času. „Normalno območje“ mora biti ustrezno dokumentirano. Vse opažene znake je treba zabeležiti. Vedno, kadar je to izvedljivo, se zabeleži tudi velikost opaženih znakov. Klinična opazovanja morajo obsegati tudi, vendar ne samo, spremembe na koži, kožuhu, očeh, sluznicah, pojav sekrecije in ekskrecije ter delovanje avtonomnega živčevja (npr. lakrimacija, piloerekcija, velikost zenic, nenormalen vzorec dihanja in/ali dihanje skozi usta, vsi nenavadni znaki uriniranja in izločanja blata ali razbarvan urin).
Zapisati je treba tudi vse nenavadne odzive v zvezi s položajem telesa, stopnjo aktivnosti (npr. zmanjšanje ali povečanje raziskovanja standardnega mesta) in koordinacijo gibov. Zabeležiti je treba spremembe v hoji (npr. zibanje, ataksija), drži (npr. grbast hrbet) in reagiranju na ravnanje, nameščanje ali druge okoljske dražljaje, pa tudi navzočnost kloničnih ali toničnih gibov, krčev ali tremorja, stereotipe (npr. prekomernega čiščenja, nenavadnih gibov z glavo, ponavljajočega se krožnega premikanja) ali nenormalno vedenje (npr. grizenje ali čezmerno lizanje, samomaličenje, zadenjsko hojo, oddajanje zvokov) ali agresivnost.
1.6.1.3 Funkcionalni preskusi
Podobno kakor podrobna klinična opazovanja je treba tudi funkcionalne preskuse izvesti enkrat pred izpostavljenostjo in potem pogosto pri vseh živalih, izbranih v ta namen (glej Tabelo 1). Tudi pogostost funkcionalnega preskušanja je odvisna od trajanje študije (glej Tabelo 2). Poleg obdobij opazovanja iz Tabele 2 je treba tudi funkcionalna opazovanja o satelitskih obnovitvenih skupinah opraviti čim bliže končni usmrtitvi. Funkcionalni preskusi vključujejo senzorične reakcije na različne dražljaje [npr. akustične, vizualne in proprioceptivne dražljaje (5) (6) (7)], oceno moči nožnega oprijema (8) in oceno motorične aktivnosti (9). Motorično aktivnost je treba izmeriti z avtomatiziranim sredstvom, ki lahko odkrije oboje, zmanjšanje in povečanje aktivnosti. Če se uporabi drug opredeljen sistem, mora biti količinski in z dokazano občutljivostjo in zanesljivostjo. Vsako sredstvo mora biti preskušeno, da je zagotovljena zanesljivost v času in skladnost med sredstvi. Nadaljnje podrobnosti glede možnih postopkov so podane v navedeni literaturi. Če ni podatkov (npr. o strukturni aktivnosti, epidemioloških podatkov, drugih toksikoloških študij) za navedbo potencialnih nevrotoksičnih učinkov, je treba razmisliti o vključitvi bolj specializiranih preskusov za podrobnejšo preučitev možnih učinkov senzorične in motorične funkcije ali učenja in spominjanja. Več informacij o bolj specializiranih preskusih in njihovi uporabi je navedenih v (1).
Izjemoma se lahko živali, ki kažejo znake toksičnosti v takem obsegu, da bi znatno vplivali na funkcionalni preskus, izpustijo pri tem preskusu. Izločitev živali iz funkcionalnega preskusa je treba utemeljiti.
1.6.2 Telesna masa in poraba hrane/vode
Pri študijah, ki trajajo do 90 dni, je treba vse živali stehtati najmanj enkrat na teden in meriti porabo hrane (porabo vode, kadar se preskusna snov daje v tem mediju) najmanj tedensko. Pri dolgotrajnih študijah je treba prvih 13 tednov vse živali stehtati najmanj enkrat na teden in potem najmanj enkrat na 4 tedne. Meritve porabe hrane (porabe vode, kadar se preskusna snov daje v tem mediju) je treba v prvih 13 tednih opravljati najmanj tedensko in potem v približno trimesečnih presledkih, razen če zdravstveno stanje ali spremembe telesne mase narekujejo drugače.
1.6.3 Oftalmologija
Pri študijah, ki trajajo dlje kakor 28 dni, je treba oftalmološko preiskavo z uporabo oftalmoskopa ali ustreznega enakovrednega instrumenta izvesti pred dajanjem preskusne snovi in na koncu študije, najbolje na vseh živalih, vendar vsaj v skupini živali z velikim odmerkom in v kontrolni skupini. Če se odkrijejo spremembe na očeh ali če klinični znaki narekujejo tako potrebo, je treba preiskati vse živali. Pri dolgotrajnih študijah je treba oftalmološko preiskavo izvesti tudi po 13 tednih. Oftalmoloških preiskav ni treba izvajati, če so ti podatki že na voljo iz drugih študij s podobnim trajanjem in podobno velikostjo odmerkov.
1.6.4 Hematologija in klinična biokemija
Kadar se študija nevrotoksičnosti izvaja v kombinaciji s študijo sistemske toksičnosti s ponavljajočimi odmerki, je treba opraviti hematološke preiskave in klinične biokemične določitve, kakor je določeno v metodi za študije sistemske toksičnosti. Zbiranje vzorcev je treba izvajati na tak način, da so potencialni učinki na nevrovedenje čim manjši.
1.6.5 Histopatologija
Nevropatološke preglede je treba načrtovati tako, da dopolnjujejo in razširijo opazovanja, opravljena med fazo študije in vivo. Tkiva najmanj 5 živali na spol in skupino (glej Tabelo 1 in naslednji odstavek) se fiksirajo in situ z uporabo splošno priznanih tehnik perfuzije in fiksacije (glej sklic 3, poglavje 5 in sklic 4, poglavje 50). Zabeležijo se vse večje opazne spremembe. Kadar se študija opravlja kot samostojna študija presejanja nevrotoksičnosti ali za označitev nevrotoksičnih učinkov, se lahko preostale živali uporabijo za posebne nevrovedenjske (10) (11), nevropatološke (10) (11) (12) (13), nevrokemične (10) (11) (14) (15) ali elektrofiziološke (10) (11) (16) (17) postopke, ki lahko dopolnijo tukaj opisane postopke in preiskave ali povečajo število histopatološko preučevanih osebkov. Ti dopolnilni postopki so lahko še posebno koristni, kadar empirična opazovanja ali pričakovani učinki kažejo posebno vrsto ali cilj nevrotoksičnosti (2) (3). Preostale živali pa se lahko uporabijo tudi za rutinska patološka vrednotenja, opisana v metodi za študije s ponavljajočimi odmerki.
Vse vzorce tkiva, vstavljene v parafin, je treba barvati po splošnem postopku, na primer s hematoksilinom in eozinom (H&E), in izvesti mikroskopski pregled. Če se opazijo ali domnevajo znaki periferne nevropatije, je treba preiskati v plastiko vstavljene vzorce perifernega živčnega tkiva. Klinični znaki lahko nakazujejo tudi dodatna mesta za preiskavo ali uporabo posebnih postopkov barvanja. Napotki o dodatnih mestih za preiskavo so v (3) (4). V pomoč pri dokazovanju posebnih vrst patoloških sprememb so lahko tudi ustrezne posebne barve (18).
Reprezentativne prereze osrednjega in perifernega živčnega sistema je treba histološko pregledati (glej sklic 3, poglavje 5 in sklic 4, poglavje 50). Pregledana območja navadno vključujejo: velike možgane, osrednji del možganov (limbični sistem), skupaj s prerezom hipokampusa, medmožgane, male možgane, pons, medulo oblongato, oko z vidnim živcem in mrežnico, hrbtenjačo ob vratnem in ledvenem delu, spinalne ganglije, dorzalna in ventralna vlakna, proksimalni bedrni živec, proksimalni golenični živec (pri kolenu) in veje goleničnega živca v mečni mišici. Rezine hrbtenjače in perifernih živcev vključujejo prečne ali diagonalne in vzdolžne prereze. Pozornost je treba posvetiti ožilju živčnega sistema. Pregledati je treba tudi vzorec skeletne mišice, zlasti mečne mišice. Posebno pozornost je treba posvetiti mestom s celično in vlaknasto strukturo in vzorcu v osrednjem in perifernem živčnem sistemu, za katere je znano, da jih nevrotoksikanti posebno prizadenejo.
Napotki o nevropatoloških spremembah, ki so tipična posledica izpostavljenosti toksičnim snovem, so v sklicih (3)(4). Priporoča se postopna preučitev vzorcev, pri kateri se s kontrolno skupino najprej primerjajo prerezi iz skupine z velikim odmerkom. Če se v vzorcih iz teh skupin ne opazi nobene nevropatološke spremembe, nadaljnja analiza ni potrebna. Če se v skupini z velikim odmerkom opazijo nevropatološke spremembe, je treba potem zaporedno preučiti in označiti vzorce iz vseh potencialno prizadetih tkiv iz skupin s srednjim in majhnim odmerkom.
Če se pri pregledu kakovosti najde kakršen koli dokaz o nevropatoloških spremembah, potem je treba drugi pregled opraviti na vseh območjih živčnega sistema, ki kaže te spremembe. Prereze iz vseh skupin odmerkov iz vsakega potencialno prizadetega območja je treba označiti in preučiti naključno, brez poznavanja oznake. Pogostost in resnost vsake lezije je treba zabeležiti. Ko so ocenjena vsa območja iz vseh skupin odmerkov, se lahko oznaka razčleni in opravi statistična analiza za ovrednotenje odnosov med odmerkom in odzivom. Opisati je treba primere različnih stopenj resnosti za vsako lezijo.
Nevropatološke ugotovitve je treba ovrednotiti v smislu vedenjskih opazovanj in meritev, pa tudi drugih podatkov iz prejšnjih in sočasnih študij sistemske toksičnosti preskusne snovi.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Predložiti je treba podatke za vsako posamezno žival. Nadalje je treba vse podatke prikazati v obliki tabele, iz katere so za vsako preskusno ali kontrolno skupino razvidni naslednji podatki: število živali na začetku preskusa in število živali, med preskusom najdenih mrtvih ali usmrčenih iz humanih razlogov, nato čas smrti oziroma humane usmrtitve, število živali, ki kažejo znake toksičnosti, opis opaženih znakov toksičnosti, vključno s časom, ko so toksični učinki prvikrat nastopili, njihovim trajanjem, vrsto in jakostjo, število živali s poškodbami, vključno z vrsto in resnostjo poškodb.
2.2 VREDNOTENJE IN RAZLAGA REZULTATOV
Ugotovitve študije je treba ovrednotiti glede na pojavnost, resnost in soodvisnost nevrovedenj skih in nevropatoloških učinkov (vključeni so nevrokemij ski ali elektrofiziološki učinki, pa tudi dopolnilne preiskave) ter drugih opaženih škodljivih učinkov. Če je mogoče, je treba numerične podatke ovrednotiti s primerno splošno sprejeto statistično metodo. Statistične metode se izberejo med načrtovanjem študije.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje informacije:
Preskusna snov:
— fizikalno stanje (vključno z izomerizmom, čistostjo in fizikalno-kemijskimi lastnostmi),
— identifikacijske podatke.
Nosilec (po potrebi):
— utemeljitev izbire nosilca.
Preskusne živali:
— uporabljeno vrsto/sev,
— število, starost in spol živali,
— izvor, nastanitvene razmere, prilagoditev, hrano ipd.,
— maso posameznih živali na začetku preskusa.
Preskusni pogoji:
— podatke o sestavi preskusne snovi/pripravi hrane, doseženi koncentraciji, stabilnosti in homogenosti pripravka:
— specifikacijo uporabljenih odmerkov, vključno s podatki o nosilcu, količini in fizični obliki danega materiala,
— podatke o dajanju preskusne snovi,
— utemeljitev izbire velikosti odmerkov,
— utemeljitev načina in trajanja izpostavljenosti,
— preračunavanje koncentracije preskusne snovi v hrani/pitni vodi (ppm) v dejanski odmerek (mg/kg telesne mase/dan), če je primerno,
— podatke o kakovosti hrane in vode.
Opazovanje in preskusni postopki:
— podatke o dodelitvi živali iz vsake skupine v perfuzij ske podskupine,
— podatke o sistemih točkovanja, vključno z merili in točkovalnimi lestvicami za vsako meritev v podrobnih kliničnih opazovanjih,
— podatke o funkcionalnih preskusih za sensorične reakcije na različne dražljaje (npr. akustične, vizualne in proprioceptivne); za ocenjevanje moči nožnega oprijema; za ocenjevanje motorične aktivnosti (vključno s podatki o avtomatiziranih sredstvih za odkrivanje aktivnosti); in drugih uporabljenih postopkih,
— podatke o oftalmoloških preiskavah in, če je primerno, hematoloških preiskavah in kliničnih biokemijskih preskusih z ustreznimi normalnimi vrednostmi,
— podatke za posebne nevrovedenjske, nevropatološke, nevrokemične ali elektrofiziološke postopke.
Rezultati:
— telesno maso/spremembe telesne mase, vključno s telesno maso ob usmrtitvi,
— porabo hrane in porabo vode, kar je primerno,
— podatke o toksičnem učinkovanju glede na spol in velikost odmerka, vključno z znaki toksičnosti,
— vrsto, resnost in trajanje (čas začetka in poznejši potek) podrobnih kliničnih opazovanj (ali so reverzibilna ali ne),
— natančen opis vseh rezultatov funkcionalnega preskusa,
— ugotovitve obdukcije,
— podroben opis vseh nevrovedenjskih, nevropatoloških in nevrokemijskih ali elektrofizioloških ugotovitev, če so na voljo,
— podatke o absorpciji in presnovi, če so na voljo,
— statistično obdelavo rezultatov, po potrebi.
Razprava o rezultatih:
— informacije o odzivu na odmerek,
— odnos katerih koli drugih toksičnih učinkov do zaključka o nevrotoksičnem potencialu preskusne kemikalije,
— vrednost brez opaznih škodljivih učinkov.
Zaključki:
— zaželena je posebna izjava o celotni nevrotoksičnosti preskusne kemikalije.
4. LITERATURA
(1) OECD Giudance Document on Neurotoxicity Testing Strategies and Test Methods. OECD, Paris. V pripravi.
(2) Test Guideline for a Developmental Neurotoxicity Study, OECD Guidelines for the Testing of Chemicals. V pripravi.
(3) World Health Organization (WHO) (1986). Environmental Health Criteria document 60: Principles and Methods for the Assessment of Neurotoxicity associated with Exposure to Chemicals.
(4) Spencer, P.S. and Schaumburg, H.H. (1980). Experimental and Clinical Neurotoxicology. Eds. Spencer, P.S. and Schaumburg, H.H. eds. Williams and Wilkins, Baltimore/London.
(5) Tupper, D.E. and Wallace, R.B. (1980). Utility of the Neurological Examination in Rats. Acta Neurobiol. Exp., 40, 999–1003.
(6) Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, 691–704.
(7) Moser, V.C., McDaniel, K.M. and Phillips, P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of amitraz. Toxic. Appl. Pharmacol., 108, 267–283.
(8) Meyer, O.A., Tilson, H.A., Byrd, W.C. and Riley, M.T. (1979). A Method for the Routine Assessment of Fore- and Hind- limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., I, 233–236.
(9) Crofton, K.M., Haward, J.L., Moser, V.C., Gill, M.W., Reirer, L.W., Tilson, H.A. and MacPhail, R.C. (1991) Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, 599–609.
(10) Tilson, H.A., and Mitchell, C.L. eds. (1992). Neurotoxicology Target Organ Toxicology Series. Raven Press, New York.
(11) Chang, L.W., ed. (1995). Principles of Neurotoxicology. Marcel Dekker, New York.
(12) Broxup, B. (1991). Neuopathology as a screen for Neurotoxicity Assessment. J. Amer. Coll. Toxicol., 10, 689–695.
(13) Moser, V.C., Anthony, D.C., Sette, W.F. and MacPhail, R.C. (1992). Comparison of Subchronic Neurotoxicity of 2-Hydroxyethyl Acrylate and Acrylamide in Rats. Fund. Appl.Toxicol., 18, 343–352.
(14) O'Callaghan, J.P. (1988). Neurotypic and Gliotypic Proteins as Biochemical Markers of Neurotoxicity. Eurotoxicol. Teratol., 10, 445–452.
(15) O'Callaghan J.P. and Miller, D.B. (1988). Acute Exposure of the Neonatal Rat to Triethyltin Results in Persistent Changes in Neurotypic and Gliotypic Proteins. J. Pharmacol. Exp. Then, 244, 368–378.
(16) Fox. D.A., Lowndes, H.E. and Birkamper, G.G. (1982). Electrophysiological Techniques in Neurotoxicology. In: Nervous System Toxicology. Mitchell, C.L. ed. Raven Press, New York, pp 299–335.
(17) Johnson, B.L. (1980). Electrophysiological Methods in neurotoxicity Testing. In: Experimental and Clinical Neurotoxicology. Spencer, P.S. and Schaumburg, H.H. eds., Williams and Wilkins Co.,. Baltimore/London, pp. 726–742.
(18) Bancroft, J.D. and Steven A. (1990). Theory and Pratice of Histological Techniques. Chapter 17, Neuropathological Techniques. Lowe, James and Cox, Gordon eds. Churchill Livingstone.
Tabela 1
Najmanjše število živali, ki so potrebne na skupino, kadar se študija nevrotoksičnosti izvaja posebej ali v kombinaciji s študijami
|
ŠTUDIJA NEVROTOKSIČNOSTI, IZVEDENA KOT: |
||||
|
Posebna študija |
Kombinirana študija z 28-dnevno študijo |
Kombinirana študija z 90-dnevno študijo |
Kombinirana študija s študijo kronične toksičnosti |
|
|
Skupno število živali na skupino |
10 samcev in 10 samic |
10 samcev in 10 samic |
15 samcev in 15 samic |
25 samcev in 25 samic |
|
Število živali, izbranih za funkcionalno preskušanje, vključno s podrobnimi kliničnimi opazovanji |
10 samcev in 10 samic |
10 samcev in 10 samic |
10 samcev in 10 samic |
10 samcev in 10 samic |
|
Število živali, izbranih za perfuzijo in situ in nevrohistopatologijo |
5 samcev in 5 samic |
5 samcev in 5 samic |
5 samcev in 5 samic |
5 samcev in 5 samic |
|
Število živali, izbranih za opazovanja toksičnosti s ponavljajočimi odmerki/subkronično/kronično, hematologijo, klinično biokemijo, histopatologijo itd., kakor je navedeno v zadevnih Smernicah |
5 samcev in 5 samic |
|||
|
Po potrebi dopolnilna opazovanja |
5 samcev in 5 samic |
|||
|
† Vključuje pet živali, izbranih za funkcionalno preskušanje in podrobna klinična opazovanja kot del študije nevrotoksičnosti. |
||||
Tabela 2
Pogostost kliničnih opazovanj in funkcionalnih preskusov
|
Vrsta opazovanja |
Trajanje študije |
||||
|
Akutno |
28 dni |
90 dni |
Kronično |
||
|
Pri vseh živalih |
Splošno zdravstveno stanje |
dnevno |
dnevno |
dnevno |
dnevno |
|
Smrtnost/obolevnost |
dvakrat dnevno |
dvakrat dnevno |
dvakrat dnevno |
dvakrat dnevno |
|
|
Pri živalih, izbranih za funkcionalna opaz ovanja |
Podrobna klinična opazovanja |
— pred prvo izpostavljenostjo — v 8 urah po odmerjanju v pričakovanem času vrhunca učinka — 7. in 14. dan po odmerjanju |
— pred prvo izpostavljenostjo — potem enkrat tedensko |
— pred prvo izpostavljenostjo — enkrat v prvem ali drugem tednu izpostavljenosti — potem mesečno |
— pred prvo izpostavljenostjo — enkrat na koncu prvega meseca izpostavljenosti — potem vsake tri mesece |
|
Funkcionalni preskusi |
— pred prvo izpostavljenostjo — v 8 urah po odmerjanju v pričakovanem času vrhunca učinka — 7. in 14. dan po odmerjanju |
— pred prvo izpostavljenostjo — v četrtem tednu tretiranja čim bliže koncu obdobja izpostavljenosti |
— pred prvo izpostavljenostjo — enkrat v prvem ali drugem tednu izpostavljenosti — potem mesečno |
— pred prvo izpostavljenostjo — enkrat na koncu prvega meseca izpostavljenosti — potem vsake tri mesece |
|
B.44 ABSORPCIJA SKOZI KOŽO: METODA IN VIVO
1. METODA
Ta preskusna metoda je enakovredna OECD TG 427 (2004).
1.1 UVOD
Izpostavljenost številnim kemikalijam se v glavnem dogaja skozi kožo, medtem ko se pri večini toksikoloških študij, opravljenih na živalih v laboratoriju kemikalije dajejo oralno. Študija perkutane absorpcije in vivo, določena v teh smernicah vzpostavlja povezavo, potrebno za ekstrapoliranje iz oralnih študij, pri ocenah varnosti po izpostavljenosti kože.
Snov mora preiti veliko celičnih plasti kože, preden lahko pride do obtoka. Plast, ki določa stopnjo za večino snovi, je stratum corneum (rožena plast), sestavljena iz mrtvih celic. Prepustnost skozi kožo je odvisna tako od lipofilnosti kemikalije in debeline zunanje plasti epidermisa, kakor tudi od dejavnikov, kot je molekulska masa in koncentracija snovi. V splošnem je koža podgan in kuncev bolj prepustna od človeške kože, prepustnost kože morskih prašičkov in opic pa je bolj podobna prepustnosti človeške kože.
Metode za merjenje absorpcije skozi kožo so razdeljene v dve kategoriji: in vivo ter in vitro. Po metodi in vivo lahko pridobimo dobre informacije o absorpciji skozi kožo za različne laboratorijske vrste. V zadnjem času so se bolj razvile metode in vitro. Pri le-teh se uporablja prenos čez celotno ali delno debelino živalske ali človeške kože v posodo s tekočino. Metoda in vitro je opisana posebej v ločeni preskusni metodi (1). Priporočljivo je, da se preverijo Napotki OECD za izvajanje študij o absorpciji skozi kožo (2) kot pomoč pri izbiri najbolj ustrezne metode v dani situaciji, saj vsebujejo več podrobnosti o ustreznosti tako in vivo, kakor tudi in vitro metode.
Metoda in vivo, ki je tu opisana, omogoča določanje penetracije preskusne snovi skozi kožo v sistemski prostor. Ta tehnika se uporablja že mnogo let (3) (4) (5) (6) (7). Čeprav so študije perkutane absorpcije in vitro v številnih primerih lahko ustrezne, pa v določenih situacijah le študija in vivo lahko da potrebne podatke.
Prednosti metode in vivo so, da uporablja fiziološko in presnovno nedotaknjen sistem, uporablja vrste, ki so skupne številnim toksikološkim študijam in se lahko spreminja za uporabo pri drugih vrstah. Slabo stran pa predstavljajo uporaba živih živali, potreba po materialu, označenem z radioaktivnim izotopom za omogočanje zanesljivih rezultatov, težave pri določanju faze zgodnje absorpcije ter razlike v prepustnosti kože zaželenih vrst (podgane) in človeške kože. Živalska koža je v splošnem bolj prepustna in zato se lahko prekutana absorpcija pri človeku preceni (6) (8) (9). Kavstične/korozivne snovi se na živih živalih ne preskušajo.
1.2 OPREDELITEV POJMOV
Neabsorbirani odmerek: pomeni odmerek, izpran s površine kože po izpostavljenosti in vsak odmerek, prisoten na neokluzivni ovojnici, vključno z vsakim odmerkom, ki bo izhlapel iz kože med izpostavljenostjo.
Absorbirani odmerek (in vivo): je odmerek, prisoten v urinu, ostankih izpiranja kletke, iztrebkih, izdihanem zraku (če se meri), krvi, tkivih (če se odvzemajo) in preostalem trupu po odstranitvi mesta kože za nanos.
Absorpcijski odmerek: pomeni odmerek, prisoten na ali v koži po izpiranju.
1.3 PRINCIP PRESKUSNE METODE
Preskusna snov, ki naj bo označena z radioaktivnim izotopom, se nanese na pobrito kožo živali v eni ali več ustreznih velikostih odmerka v obliki reprezentančnega pripravka v uporabi. Preskusni pripravek se pusti v stiku s kožo določeno časovno obdobje pod ustrezno ovojnico (neokluzivno, polokluzivno ali okluzivno) zaradi preprečitve zaužitja preskusnega pripravka. Ob koncu obdobja izpostavljenosti se ovojnica odstrani in koža se očisti z ustreznim čistilnim sredstvom, ovojnica ter čistilna sredstva se shranijo za analizo, uporabi pa se sveža ovojnica. Živali so nastanjene v posameznih presnovnih kletkah pred, med in po obdobju izpostavljenosti, iztrebki in izdihani zrak v tem obdobju pa se zberejo za analizo. Zbiranje izdihanega zraka se lahko opusti, če je dovolj podatkov, da se ustvarja malo ali nič hlapnih radioaktivnih metabolitov. V vsako študijo je običajno vključenih več skupin živali, ki bodo izpostavljene preskusnemu pripravku. Na koncu obdobja izpostavljenosti se eno skupino usmrti. Druge skupine se zatem usmrtijo v rednih časovni razmikih (2). Ob koncu obdobja vzorčenja se preostale živali usmrtijo, odvzame se kri za analizo, prostor nanosa se odstrani za analizo, trupi pa se analizirajo zaradi morebitnih neiztrebljenih snovi. Vzorci se preskusijo z ustreznimi sredstvi in oceni se stopnja prekutane absorpcije (6) (8) (9).
1.4 OPIS METODE
1.4.1 Izbira živalskih vrst
Najbolj pogosto uporabljene vrste so podgane, lahko pa se uporabljajo tudi linije brez dlak in vrste, katerih stopnje absorpcije skozi kožo so bolj podobne človeškim (3) (6) (7) (8) (9). Uporabljajo se mlade, odrasle, zdrave živali enega spola (privzet je moški spol) in linij, ki se običajno uporabljajo v laboratorijih. Ob začetku študije teža uporabljenih živali ne sme odstopati za več kot ± 20 % od povprečne teže. Primerne so, na primer, podgane moškega spola s težo 200 g–250 g, zlasti v zgornji polovici tega obsega.
1.4.2 Število in spol živali
Skupina vsaj štirih živali enega spola se uporabi za vsak preskusni pripravek in vsak načrtovan čas usmrtitve. Skupine živali se usmrtijo v različnih časovnih razmikih, najprej na primer ob koncu obdobja izpostavljenosti (tipično 6 ali 24 ur) in nato naslednje (npr. po 48 in 72 urah). Če obstajajo podatki, ki kažejo na bistvene razlike v dermalni toksičnosti med moškim in ženskim spolom, se izbere bolj občutljiv spol. Če takih podatkov ni, se lahko uporablja kateri koli spol.
1.4.3 Pogoji nastanitve in hranjenja
Temperatura v prostoru za poskuse na živalih naj bo 22 oC(± 3 oC). Čeprav naj bi bila relativna vlažnost vsaj 30 % in naj po možnosti ne bi presegala 70 %, razen med čiščenjem prostora, bi cilj moral biti 50–60 %. Osvetlitev naj bo umetna, in sicer 12 ur svetlobe, 12 ur teme. Za hranjenje se lahko uporablja običajna laboratorijska hrana, ki naj bo prosto na voljo, skupaj z neomejeno količino pitne vode. Med študijo in po možnosti tudi med aklimatizacijo so živali nameščene v presnovnih kletkah posamično. Ker bi razlitje hrane in vode ogrozilo rezultate, je treba verjetnost takih dogodkov čim bolj zmanjšati.
1.4.4 Priprava živali
Živali se označijo zaradi posamezne identifikacije in zadržujejo v kletkah vsaj pet dni pred začetkom študije zaradi aklimatizacije na laboratorijske pogoje.
Po preteku obdobja aklimatizacije in približno 24 ur pred odmerjanjem se vsaka žival obrije na ramenskem predelu in hrbtu. Prepustnost je pri poškodovani drugačna kot pri nedotaknjeni, zato je treba paziti, da se koža ne odrgne. Po opravljenem britju in približno 24 ur pred nanosom preskusne snovi na kožo (glej oddelek 1.4.7) je treba površino kože očistiti z acetonom, da se odstrani maščoba. Dodatno umivanje z milom in vodo ni priporočljivo, saj lahko vsak ostanek mila pospeši absorpcijo preskusne snovi. Površina mora biti dovolj velika, da omogoči zanesljive izračune absorbirane količine preskusne kemikalije na cm kože, po možnosti vsaj 10 cm . Taka površina je možna pri podganah s telesno težo 200-250 g. Po pripravi se živali vrnejo v presnovne kletke.
1.4.5 Preskusna snov
Preskusna snov je snov, katere penetracijske značilnosti se preučujejo. V idealnem primeru naj bi bila preskusna snov označena z radioaktivnim izotopom.
1.4.6 Preskusni pripravek
Pripravek preskusne snovi (npr. čist, razredčen ali sestavljen material, ki vsebuje preskusno kemikalijo, ki se nanese na kožo) naj bo enak (ali realističen nadomestek) tistemu, kateremu so izpostavljeni ljudje ali druge možne ciljne vrste. Vsako odstopanje od pripravka, ki se uporablja v praksi, mora biti utemeljeno. Po potrebi se preskusna snov raztopi ali razredči v primernem nosilcu. Če je nosilec kaj drugega kot voda, morajo biti znane absorpcijske lastnosti in možno medsebojno vplivanje s preskusno snovjo.
1.4.7 Nanos na kožo
Na površini kože se določi mesto nanosa določene površine. Znana količina preskusnega pripravka se nato enakomerno nanese na površino. Ta količina mora običajno oponašati možno človeško izpostavljenost, tipično 1–5 mg/cm2 za trdne snovi ali do 10 μl/cm za tekočine. Vse druge količine morajo biti utemeljene s pričakovanimi pogoji uporabe, cilji preučevanja ali fizičnimi lastnostmi preskusnega pripravka. Po nanosu je treba živali preprečiti negovanje tretiranega mesta. Primer tipične naprave je prikazan na Sliki 1. Običajno se mesto nanosa zaščiti z neokluzivno ovojnico (npr. prepustno najlonsko gazo). Pri neprekinjenem nanašanju pa je potrebna okluzija na mestu nanosa. V primeru, da izhlapevanje polhlapnih preskusnih snovi zmanjša stopnjo izkoristka preskusne snovi do nesprejemljive mere (glej tudi oddelek 1.4.10, prvi odstavek), je treba ujeti izhlapelo snov v ogleni filter, ki pokriva napravo za nanos (glej Sliko 1). Pomembno je, da naprava ne poškoduje kože ali absorbira preskusnega pripravka ali reagira z njim. Živali se vrnejo v posamezne presnovne kletke, da se zberejo iztrebki.
1.4.8 Trajanje izpostavljenosti in jemanje vzorcev
Trajanje izpostavljenosti je časovni razmik med nanosom in odstranitvijo preskusnega pripravka z izpiranjem kože. Uporablja naj se ustrezno obdobje izpostavljenosti (tipično 6 ali 24 ur) na podlagi pričakovanega trajanja izpostavljenosti človeka. Po preteku obdobja izpostavljenosti se živali zadržijo v presnovnih kletkah do načrtovane usmrtitve. Živali je treba opazovati zaradi znakov toksičnosti/nenormalnih reakcij v rednih časovnih razmikih med celotnim trajanjem študije. Ob koncu obdobja izpostavljenosti je treba pregledati obdelano kožo zaradi vidnih znakov razdraženosti.
Presnovne kletke morajo omogočati ločeno zbiranje urina in iztrebkov med celo študijo. Omogočati morajo tudi zbiranje 14C-ogljikovega dioksida in hlapnih 14C-ogljikovih spojin, ki se analizirajo, če so prisotne v večji količini (> 5 %). Urin, iztrebke in ujete tekočine (npr. 14C-ogljikov dioksid in hlapne 14C-spojine) je treba zbirati ločeno za vsako skupino ob vsakem času vzorčenja. Če obstaja dovolj podatkov, da se ustvarja malo ali nič hlapnih radioaktivnih metabolitov, se lahko uporabljajo odprte kletke.
Iztrebki se zbirajo med obdobjem izpostavljenosti, do 24 ur po prvem stiku s kožo in nato dnevno do konca poskusa. Medtem ko so trije časovni razmiki za zbiranje iztrebkov običajno dovolj, pa lahko, glede na predviden namen preskusnega pripravka ali obstoječe kinetične podatke, pridejo v poštev tudi bolj ustrezni ali dodatni trenutki za študijo.
Ob koncu obdobja izpostavljenosti se z vsake živali odstrani zaščitna naprava in ločeno shrani za analizo. Obdelano kožo vseh živali je treba vsaj trikrat izprati s čistilnim sredstvom z ustreznimi brisi. Paziti je treba, da se ne okužijo drugi deli telesa. Uporabi naj se čistilno sredstvo, ki je tipično za običajno telesno higieno, npr. milnica. Na koncu se kožo osuši. Vse brise in kar se izpere je treba shraniti za analizo. Za zaščito obdelanega mesta tistih živali, ki sestavljajo skupine za kasnejše časovne točke, je treba pred njihovo vrnitvijo v posamezne kletke uporabiti svežo ovojnico.
1.4.9 Zaključni postopki
Za vsako skupino je treba posamezne živali usmrtiti ob določenem času in zbrati kri za analizo. Zaščitno napravo ali ovojnico je treba odstraniti za analizo. Kožo z mesta nanosa in podobne površine, na katero ni bil nanesen odmerek, vendar je bila pobrita, je treba odstraniti z vsake živali za ločeno analizo. Mesto nanosa se lahko frakcionira, da se loči stratum corneum od podležečega epidermisa zaradi zagotavljanja več podatkov o stanju preskusne kemikalije. Ugotavljanje tega stanja v času po obdobju izpostavljenosti bi moralo pokazati usodo vseh preskusnih kemikalij v stratum corneum. Zaradi omogočanja frakcioniranja kože (po končnem izpiranju kože in usmrtitvi živali) se odstrani vsaka zaščitna ovojnica. Mesto nanosa na kožo in še krožni predel okoli njega se izreže s podgane in pripne na desko. Kos lepilnega traku se rahlo pritisne na površino kože in odstrani skupaj z delom stratum corneum. To se nadaljuje, dokler se trak več ne prilepi na površino kože, ko je odstranjen ves stratum corneum. Za vsako žival se trakovi lahko kombinirajo v eni posodi, v katero se doda sredstvo za razgradnjo tkiv, da raztopi stratum corneum. Vsa morebitna ciljna tkiva se lahko odstranijo za ločeno merjenje, preden se opravi analiza absorbiranega odmerka v preostanku trupa. Trupe posameznih živali je treba shraniti za analizo. Ponavadi zadostuje analiza celotne vsebine. Ciljni organi se lahko odstranijo za ločeno analizo (če to nakazujejo druge študije). Urin v mehurju ob določeni usmrtitvi se doda prejšnji količini urina. Po odvzemu iztrebkov iz presnovnih kletk ob času, določenem za usmrtitev, je treba kletke in lovilne posode izprati z ustreznim topilom. Prav tako je treba analizirati drugo morebitno kontaminirano opremo.
1.4.10 Analiza
Pri vseh študijah je treba doseči zadosten izkoristek (tj. povprečje 100 ± 10 % > radioaktivnosti). Izkoristke izven tega obsega je treba utemeljiti. Količino uporabljenega odmerka v vsakem vzorcu je treba analizirati po ustrezno potrjenih postopkih.
Statistični podatki morajo vključevati določeno mero odstopanj za ponovitve vsakega nanosa.
2. PODATKI
Za vsako žival je treba ob vsakem času vzorčenja za preskusno kemikalijo in/ali metabolite opraviti naslednje meritve. Poleg posameznih podatkov je treba poročati o povprečju podatkov, urejenih v skupine po času vzorčenja.
— količina, povezana z zaščitnimi napravami,
— količina, ki se odstrani s kože,
— količina v/na koži, ki je ni mogoče izprati s kože,
— količina v vzorcu krvi,
— količina v iztrebkih in izdihanem zraku (če je ustrezno),
— količina, ki ostane v trupu in organih, odstranjenih za ločeno analizo.
Količina preskusne snovi in/ali metabolitov v iztrebkih, izdihanem zraku, krvi in v trupu omogoča določanje celotne absorbirane količine v vsaki časovni točki. Izračuna se lahko tudi količina preskusne kemikalije, absorbirane na cm kože, izpostavljene preskusni snovi v obdobju izpostavljenosti.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati zahteve, določene v protokolu, vključno z utemeljitvijo uporabljenega sistema preskusa, ter tudi naslednje:
Preskusna snov:
— identifikacijski podatki [npr. številka CAS, če je na voljo; vir; čistost (radiokemijska čistost); znane nečistoče; serijska številka]
— agregatno stanje, fizikalno-kemijske lastnosti (npr. pH, hlapnost, topnost, stabilnost, molekulska masa in log Pow).
Preskusni pripravek:
— pripravek in utemeljenost uporabe,
— podrobnosti preskusnega pripravka, količina nanosa, dosežena koncentracija, nosilec, stabilnost in homogenost.
Preskusna žival:
— uporabljena vrsta/linija,
— število, starost in spol živali,
— vir živali, namestitveni pogoji, prehrana, itd.,
— teže posameznih živali ob začetku preskusa.
Preskusni pogoji:
— podrobnosti uporabe preskusnega pripravka (mesto nanosa, preskusne metode, zaprtost/nezaprtost, prostornina, ekstrakcija, zaznavnost),
— podrobnosti kakovosti hrane in vode.
Rezultati:
— kakršni koli znaki toksičnosti,
— tabelirani absorpcijski podatki (izraženi kot hitrost, količina in odstotek),
— celotni izkoristek poskusa,
— razlaga rezultatov, primerjava z razpoložljivimi podatki o absorpciji skozi kožo preskusne spojine.
Razprava o rezultatih.
Sklepi.
4. LITERATURA
(1) Preskusna metoda B.45. Absorpcija skozi kožo: Metoda in vitro.
(2) OECD (2002). Napotki za izvajanje študij o absorpciji skozi kožo. OECD, Pariz.
(3) ECETOC (1993) Perkutana absorpcija. Evropski center za ekotoksikologijo in toksikologijo kemikalij, Monografija št. 20.
(4) Zendzian RP (1989) Skin Penetration Method suggested for Environmental Protection Agency Requirements. J. Am. Coll. Toxicol. 8(5), 829–835.
(5) Kemppainen BW, Reifenrath WG (1990) Methods for skin absorption. CRC Press Boca Raton, FL, USA.
(6) EPA (1992) Dermal Exposure Assessment: Principles and Applications. Exposure Assessment Group, Office of Health and Environmental Assessment.
(7) EPA (1998) Health Effects Test Guidelines, OPPTS 870-7600, Dermal Penetration. Office of Prevention, Pedsticides and Toxic Substances.
(8) Bronaugh RL, Wester RC, Bucks D, Maibach HI and Sarason R (1990) In vivo percutaneous absorption of fragrance ingredients in reshus monkeys and humans. Fd. Chem. Toxic. 28, 369–373.
(9) Feldman RJ and Maibach HI (1970) Absorption of some organic compounds through the skin in man. J. Invest Dermatol. 54, 399-404.
Slika 1
Primer oblike značilne naprave, ki se uporablja za določanje in zaščito dermalnega mesta nanosa med in vivo študijami perkutane absorpcije
B.45 ABSORPCIJA SKOZI KOŽO: METODA IN VITRO
1. METODA
Ta preskusna metoda je enakovredna OECD TG 428 (2004).
1.1 UVOD
Ta metoda je bila oblikovana za zagotavljanje informacij o absorpciji preskusne snovi, nanesene na izrezano kožo. Lahko se kombinira z metodo za absorpcijo skozi kožo: metodo in vivo (1), ali pa se opravi ločeno. Priporočljivo je, da se preverijo Napotki OECD za izvajanje študij o absorpciji skozi kožo (2), kot pomoč pri oblikovanju študij, ki temeljijo na tej metodi. Napotki so bili pripravljeni, da bi omogočili izbiro ustreznih in vitro postopkov za uporabo v posebnih okoliščinah, zaradi zagotavljanja zanesljivosti rezultatov, pridobljenih s to metodo.
Metode za merjenje absorpcije skozi kožo in dermalne dostave so razdeljene v dve kategoriji: in vivo ter in vitro. Metode absorpcije skozi kožo in vivo so zelo uveljavljene in zagotavljajo farmakokinetične informacije pri številnih živalskih vrstah. Metoda in vivo je opisana posebej v drugi preskusni metodi (1). Metode in vitro se tudi že dolgo uporabljajo za merjenje absorpcije skozi kožo. Čeprav formalne validacijske študije metod in vitro, ki so zajete v to preskusno metodo, niso bile opravljene, so se strokovnjaki OECD leta 1999 dogovorili, da je v podporo metodi in vitro (3) ovrednotenih dovolj podatkov. Dodatni podrobni podatki, ki krepijo to podporo, vključno s pomembnim številom neposrednih primerjav med metodama in vitro ter in vivo, so zagotovljeni v Napotkih (2). Ta tema je obravnavana v številnih monografijah, ki tudi navajajo podrobno ozadje uporabe metode in vitro (4) (5) (6) (7) (8) (9) (10) (11) (12). Z metodami in vitro se meri difuzija kemikalij v kožo in po koži v posodo s tekočino, uporablja pa se lahko neaktivna koža za merjenje samo difuzije, ali sveža, presnovno aktivna koža za istočasno merjenje difuzije in kožne presnove. Take metode so postale posebno uporabne kot sito za primerjanje dostave kemikalij iz različnih pripravkov v in skozi kožo, lahko pa so tudi uporabni modeli za ocenjevanje absorpcije skozi kožo pri človeku.
Metode in vitro ni mogoče uporabljati za vsa stanja in razrede kemikalij. Preskusno metodo in vitro je mogoče uporabljati za začetno kakovostno presojo penetracije skozi kožo. V določenih primerih je treba to metodo dopolniti s podatki iz metode in vivo. Za nadaljnjo razčlenitev stanj, v katerih bi bila metoda in vitro ustrezna, je treba preveriti napotke (2). Dodatne podrobne informacije v podporo odločitvi so na voljo v (3).
Ta metoda predstavlja splošna načela merjenja dermalne absorpcije in dostave preskusne snovi pri uporabi izrezane kože. Uporablja se lahko koža več vrst sesalcev, vključno s človekom. Značilnosti prepustnosti kože se po odstranitvi s teles ohranjajo, ker je glavna difuzij ska pregrada neaktivna stratum corneum; aktivni prenos kemikalij skozi kožo ni identificiran. Pokazalo se je, da ima koža zmožnost presnavljanja nekaterih kemikalij med perkutano absorpcijo (6), vendar ta postopek ne omejuje hitrosti dejansko absorbiranega odmerka, čeprav lahko vpliva na naravo snovi, ki vstopa v krvni obtok.
1.2 OPREDELITEV POJMOV
Neabsorbirani odmerek: pomeni odmerek, izpran s površine kože po izpostavljenosti in vsak odmerek, prisoten na neokluzivni ovojnici, vključno z vsakim odmerkom, ki bo izhlapel iz kože med izpostavljenostjo.
Absorbirani odmerek (in vitro): masa preskusne snovi, ki pride do receptorske tekočine ali obtoka v sistemu v določenem časovnem obdobju.
Absorpcijski odmerek (in vitro): pomeni odmerek, prisoten na ali v koži po izpiranju.
1.3 PRINCIP PRESKUSNE METODE
Preskusno snov, ki je lahko označena z radioaktivnim izotopom, se nanese na površino vzorca kože, ki ločuje dve komori difuzijske celice. Kemikalija določen čas in pod določenimi pogoji ostane na koži, preden se odstrani po ustreznem postopku čiščenja. Receptorska tekočina se v časovnih točkah vzorči med celotnim poskusom in analizirajo se preskusne kemikalije in/ali metaboliti.
Če se uporabljajo presnovno aktivni sistemi, se z ustreznimi metodami lahko analizirajo metaboliti preskusnih kemikalij. Na koncu poskusa se v celoti oceni razdelitev preskusnih kemikalij in njihovih metabolitov, kadar je ustrezno.
Absorpcija preskusne snovi se meri v določenem časovnem obdobju pri ustreznih pogojih, ki so opisani v tej metodi in v napotkih (2), z analizo receptorske tekočine in obdelane kože. Za preskusno snov, ki ostane v koži, se šteje, da je absorbirana, razen če je mogoče pokazati, da se absorpcija lahko določi le iz vrednosti receptorske tekočine. Analiza drugih elementov (snovi, izprane s kože, ki ostane v plasteh kože) omogoča dodatno ovrednotenje podatkov, vključno s celotno razpoložljivostjo preskusne snovi in odstotkom izkoristka.
Za prikaz uspešnosti in zanesljivosti preskusnega sistema v izvajalnem laboratoriju, bi morali biti rezultati za ustrezne referenčne kemikalije na voljo in v skladu z objavljeno literaturo za uporabljeno metodo. To zahtevo je mogoče izpolniti s testiranjem ustrezne referenčne snovi (po možnosti z lipofilnostjo, ki je blizu preskusni snovi) hkrati s preskusno snovjo ali z zagotavljanjem dovolj preteklih podatkov za številne referenčne snovi z različno lipofilnostjo (npr. kofein, benzojska kislina in testosteron).
1.4 OPIS PRESKUSNE METODE
1.4.1 Difuzijska celica
Difuzijska celica je sestavljena iz donorske in receptorske komore, med katere se namesti koža (tipični primer je prikazan na Sliki 1). Celica mora zagotoviti dobro zaščito okoli kože, omogočiti enostavno vzorčenje in dobro mešanje receptorske raztopine v stiku s spodnjo stranjo kože ter dober temperaturni nadzor celice in njene vsebine. Sprejemljive so statične in pretočne difuzijske celice. Običajno na donorskih komorah med izpostavljenostjo končnemu odmerku preskusnega pripravka ni okluzije. Pri neprekinjenem nanašanju in pri določenih potekih pri končnih odmerkih pa je okluzija na na donorskih komorah lahko potrebna.
1.4.2 Receptorska tekočina
Uporaba fiziološko prevodne receptorske tekočine je bolj zaželena, čeprav se lahko uporabljajo tudi druge, če so utemeljene. Dana mora biti natančna sestava receptorske tekočine. Zagotovljena mora biti zadostna topnost preskusne kemikalije v receptorski tekočini, tako da ne deluje kot pregrada za absorpcijo. Poleg tega receptorska tekočina ne sme vplivati na neoporečnost kožnega pripravka. V pretočnem sistemu hitrost pretoka ne sme ovirati difuzije preskusne snovi v receptorsko tekočino. V sistemu statične celice je treba tekočino neprestano mešati in redno jemati vzorce. Če se preučuje presnova, mora receptorska tekočina podpirati aktivnost kože med celotnim poskusom.
1.4.3 Kožni pripravki
Uporablja se lahko človeška ali živalska koža. Razumljivo je, da se pri uporabi človeške kože upoštevajo nacionalna in mednarodna etična načela in okoliščine. Čeprav je bolj zaželena aktivna koža, se lahko uporablja tudi neaktivna koža, če je mogoče dokazati njeno neoporečnost. Sprejemljive so bodisi epidermalne membrane (encimsko, toplotno ali kemijsko ločene) ali koža z razcepljeno debelino (tipično debela 200-400 μm), pripravljena z dermatomom. Lahko se uporablja koža s celotno debelino, vendar se je treba izogibati prekomerni debelini (ca. > 1 mm), razen če je izrecno potrebna za določanje preskusnih kemikalij v plasteh kože. Izbira vrst, anatomsko mesto in tehnika pripravljanja morajo biti utemeljeni. Potrebni so sprejemljivi podatki iz najmanj štirih ponovitev na preskusni pripravek.
1.4.4 Neoporečnost kožnega pripravka
Bistveno je, da je koža pravilno pripravljena. Neustrezno ravnanje lahko poškoduje stratum corneum, zato je treba preveriti neoporečnost pripravljene kože. Kadar se preiskuje presnova kože, je treba sveže izrezano kožo uporabiti čim hitreje in pod pogoji, ki podpirajo presnovno dejavnost. Na splošno naj bo sveže izrezana koža uporabljena v 24 urah, sprejemljivo obdobje skladiščenja pa je lahko različno glede na encimski sistem presnavljanja in temperature skladiščenja (13). Če so kožni pripravki pred uporabo skladiščeni, je treba podati dokaze, ki izkazujejo ohranjanje pregradne funkcije.
1.4.5 Preskusna snov
Preskusna snov je snov, katere penetracijske značilnosti se preučujejo. V idealnem primeru naj bi bila preskusna snov označena z radioaktivnim izotopom.
1.4.6 Preskusni pripravek
Pripravek preskusne snovi (npr. čist, razredčen ali sestavljen material, ki vsebuje preskusno snov, ki se nanese na kožo) naj bo enak (ali realističen nadomestek) tistemu, kateremu so izpostavljeni ljudje ali druge možne ciljne vrste. Vsako odstopanje od pripravka, ki se uporablja v praksi, mora biti utemeljeno.
1.4.7 Koncentracije in izdelave pripravkov preskusnih snovi
Običajno se uporablja več kot ena koncentracija preskusne snovi, da zajema zgornjo možno izpostavljenost človeka. Enako je treba upoštevati razpon preskušanja značilnih pripravkov.
1.4.8 Nanos na kožo
Pod normalnimi pogoji izpostavljenosti človeka kemikalijam gre ponavadi za končne odmerke. Zato je treba uporabiti nanos, ki oponaša izpostavljenost človeka, običajno 1-5 mg/cm2 kože za trdne snovi in do 10 μl/cm2 za tekočine. Količina mora biti utemeljena s pričakovanimi pogoji uporabe, cilji preučevanja ali fizičnimi lastnostmi preskusnega pripravka. Nanosi na površino kože so lahko, na primer, neprekinjeni, če se nanašajo veliki volumni na enoto površine.
1.4.9 Temperatura
Na pasivno difuzijo kemikalij (in zato njihovo absorpcijo skozi kožo) vpliva temperatura. Difuzijsko komoro in kožo je treba ohranjati pri konstantni temperaturi, ki je blizu normalni temperature kože, to je 32 – 1 oC. Različne oblike celic zahtevajo različne temperature vodne kopeli ali toplotnih blokov, da se zagotavlja fiziološka norma receptorja/kože. Vlažnost naj bo po možnosti od 30 do 70 %.
1.4.10 Trajanje izpostavljenosti in jemanje vzorcev
Koža je lahko izpostavljena preskusnemu pripravku med celotnim poskusom ali krajši čas (tj., zaradi oponašanja določene vrste izpostavljenosti človeka). S kože je treba z ustreznim čistilnim sredstvom izprati odvečni preskusni pripravek in preostanek zbrati za analizo. Postopek odstranjevanja preskusnega pripravka je odvisen od pogoja pričakovane uporabe in ga je treba utemeljiti. Običajno se zahteva obdobje vzorčenja 24 ur za omogočanje zadostne karakterizacije absorpcijskega profila. Ker se neoporečnost kože lahko začne slabšati po 24 urah, čas vzorčenja običajno ne sme presegati 24 ur. Za preskusne snovi, ki hitro prodrejo v kožo, to ni potrebno, za preskusne snovi, ki prodirajo počasi, pa je lahko potreben daljši čas. Pogostost vzorčenja receptorske tekočine mora omogočati grafično predstavitev absorpcijskega profila preskusne snovi.
1.4.11 Zaključni postopki
Vse elemente sistema preskusa je treba analizirati in določiti izkoristek. To obsega donorsko komoro, izpiranje površine kože, kožni pripravek in receptorsko komoro/komoro s tekočino. V nekaterih primerih se koža lahko frakcionira na izpostavljeno površino kože in površino kože pod celičnim robom ter na stratum corneum, epidermis in dermis fractions za ločeno analizo.
1.4.12 Analiza
Pri vseh študijah je treba doseči zadosten izkoristek (cilj bi moral biti povprečje 100 – +/-10 % radioaktivnosti in vsaka odstopanja morajo biti utemeljena). Količino preskusne snovi v receptorski tekočini, kožni pripravek, izpiranja s površine kože in kar se izpere z aparature je treba z ustrezno tehniko analizirati.
2. PODATKI
Predstaviti je treba analizo receptorske tekočine, distribucijo kemikalij preskusne snovi v sistemu preskusa in absorpcijski profil glede na čas. Kadar se uporabljajo pogoji izpostavljenosti končnemu odmerku, je treba izračunati količino, izprano s kože, količino, povezano s kožo (in v različnih plasteh kože, če se analizira) in količino, prisotno v receptorski tekočini (stopnjo in količino ali odstotek nanesenega odmerka). Včasih je absorpcija skozi kožo lahko izražena le s podatki o receptorski tekočini. Če pa preskusna snov ostane v koži ob koncu študije, jo je treba vključiti v skupno absorbirano količino (glej odstavek 66 glede na (3)). V pogojih neprekinjene izpostavljenosti odmerku lahko podatki omogočajo izračun prepustnostne konstante (Kp). V teh pogojih delež absorpcije ni pomemben.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati zahteve, določene v protokolu, vključno z utemeljitvijo uporabljenega sistema preskusa, ter tudi naslednje:
Preskusna snov:
— agregatno stanje, fizikalno-kemijske lastnosti (vsaj molekulska masa in log Pow), čistost (radiokemijska čistost),
— identifikacijski podatki (npr. serijska številka),
— topnost v receptorski tekočini.
Preskusni pripravek:
— pripravek in utemeljenost uporabe,
— homogenost.
Preskusni pogoji:
— viri in mesto kože, metoda priprave, pogoji shranjevanja pred uporabo, vsa predhodna obdelava (čiščenje, zdravljenje z antibiotiki, itd.), merjenja neoporečnosti kože, presnovni status, utemeljitev uporabe,
— oblika celice, sestava receptorske tekočine, pretok receptorske tekočine, ali časi in postopki vzorčenja,
— podrobnosti nanosa preskusnega pripravka in količinska opredelitev nanesenega odmerka,
— trajanje izpostavljenosti,
— podrobnosti odstranitve preskusnega pripravka s kože, npr. izpiranje kože,
— podrobnosti analize kože in vse tehnike frakcioniranja, uporabljene za prikaz porazdelitve kože,
— postopki čiščenja celice in opreme,
— preskusna metoda, tehnike ekstrakcije, meje zaznavnosti in validacija analitične metode.
Rezultati:
— celotni izkoristek poskusa (naneseni odmerek = izpiranja s kože + koža + receptorska tekočina + izpiranja s celice),
— tabeliranje posameznih celičnih izkoristkov v vsakem prostoru,
— absorpcijski profil,
— tabelirani absorpcijski podatki (izraženi kot hitrost, količina in odstotek).
Razprava o rezultatih.
Sklepi.
4. LITERATURA
(1) Preskusna metoda B.44. Absorpcija skozi kožo: Metoda in vivo.
(2) OECD (2002). Napotki za izvajanje študij o absorpciji skozi kožo. OECD, Pariz.
(3) OECD (2000). Poročilo s sestanka Razširjenega pripravljalnega odbora OECD za preskušanje perkutane absorpcije, Priloga 1 k ENV/JM/TG(2000)5. OECD, Pariz.
(4) Kemppainen BW and Reifenrath WG. (1990). Methods for skin absorption. CRC Press, Boca Raton.
(5) Bronaugh RL and Collier, SW. (1991). Protocol for In vitro Percutaneous Absorption Studies, in In vitro Percutaneous Absorption: Principles, Fundamentals and Applications, RL Bronaugh and HI Maibach, Eds., CRC Press, Boca Raton, pp. 237-241.
(6) Bronaugh RL and Maibach HI. (1991). In vitro Percutaneous Absorption: Principles, Fundamentals and Applications. CRC Press, Boca Raton.
(7) Evropski center za ekotoksikologijo in toksikologijo kemikalij (1993). Monografija št.. 20, Perkutana absorpcija, ECETOC, Brussels.
(8) Diembeck W, Beck H, Benech-Kieffer F, Courtellemont P, Dupuis J, Lovell W, Paye M, Spengler J, Steiling W (1999). Test Guidelines for In Vitro Assessment of Dermal Absorption and Percutaneous Penetration of Cosmetic Ingredients, Fd Chem Tox, 37, 191-205.
(9) Recommended Protocol for In vitro Percutaneous Absorption Rate Studies (1996). US Federal Register, Vol. 61, No. 65.
(10) Howes D, Guy R, Hadgraft J, Heylings JR et a\. (1996). Methods for assessing Percutaneous absorption. ECVAM Workshop Report ATLA 24, 81 R10.
(11) Schaefer H and Redelmeier TE. (1996). Skin barrier: principles of percutaneous absorption. Karger, Basel.
(12) Roberts MS and Walters KA. (1998). Dermal absorption and toxicity assessment. Marcel Dekker, New York.
(13) Jewell, C, Heylings, JR., Clowes, HM. And Williams, FM. (2000). Percutaneous absorption and metabolism of dinitrochlorobenzene in vitro. Arch Toxicol 74: 356-365.
Slika 1
Primer značilne oblike statične difuzijske celice za študije perkutane absorpcije in vitro
B.46. PRESKUS DRAŽENJA KOŽE IN VITRO: PRESKUSNA METODA REKONSTRUIRANE ČLOVEŠKE POKOŽNICE
UVOD
1. Draženje kože pomeni nastanek popravljive poškodbe kože po nanosu preskusne snovi za največ 4 ure [kot je določeno v Globalnem usklajenem sistemu za razvrščanje in označevanje kemikalij (GHS) Združenih narodov (ZN) ter Uredbi (ES) št. 1272/2008 Evropskega parlamenta in Sveta z dne 16. decembra 2008 o razvrščanju, označevanju in pakiranju snovi in zmesi (1) (3)]. Ta preskusna metoda zajema postopek in vitro, ki se lahko uporablja za ugotavljanje nevarnosti dražilnih kemikalij (snovi in zmesi) v skladu s kategorijo 2 standardov po GHS ZN in uredbo CLP EU (1) (2) (3). V EU in drugih regijah, ki niso sprejele neobvezne kategorije 3 po GHS ZN (blage dražilne snovi), se lahko ta preskusna metoda uporabi tudi za opredelitev nerazvrščenih kemikalij, tj. „Brez kategorije“ po GHS ZN in CLP EU (1) (3). Ta preskusna metoda se lahko uporabi za določitev razdraženosti kože zaradi kemikalije kot samostojni nadomestni preskus za preskušanje draženja kože in vivo v okviru strategije stopenjskega preskušanja (4 in poglavje B.4 te priloge).
2. Ocenjevanje razdraženosti kože se običajno izvaja na laboratorijskih živalih [Smernica za preskušanje OECD 404; poglavje B.4 v tej prilogi] (4). V skladu s prizadevanji za dobro počutje živali je bila metoda B.4 leta 2004 pregledana in omogoča določitev jedkosti za kožo/draženja kože z uporabo strategije stopenjskega preskušanja, pri čemer se uporabljata validirani metodi in vitro ali ex vivo, da se tako preprečijo bolečine in trpljenje živali. Tri validirane preskusne metode in vitro so bile sprejete kot smernice za preskušanje OECD 430, 431 in 435 (5) (6) (7) in dve od njih kot poglavji B.40 in B.40a te priloge, ki se uporabljajo za del strategije stopenjskega preskušanja B.4 ali Smernice za preskušanje OECD 404 (4), ki se nanaša na jedkost.
3. Ta preskusna metoda obravnava končni učinek draženja kože na zdravje ljudi. Temelji na rekonstruirani človeški pokožnici, ki je v svoji zasnovi (uporaba netransformiranih človeških keratinocitov pokožnice kot vira celic, vzorčnega tkiva in citoarhitekture) zelo podobna biološkim in fiziološkim značilnostim zgornjih delov človeške kože, tj. pokožnice. Ta preskusna metoda vključuje tudi skupino standardov učinkovitosti (Dodatek 2) za ocenjevanje podobnih in spremenjenih preskusnih metod za rekonstruirano človeško pokožnico, ki jih je razvil evropski ECVAM (8), v skladu z načeli smernice OECD št. 34 (9).
4. Ta preskusna metoda se upošteva pri treh validiranih metodah. Predvalidacijske, optimizacijske in validacijske študije so dopolnjene s preskusno metodo in vitro (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20), pri kateri se uporabljajo modeli rekonstruirane človeške pokožnice, na tržišču pa je na voljo pod imenom EpiSkinTM (validirana referenčna metoda – VRM). Dve drugi metodi in vitro za preskušanje draženja kože na rekonstruirani človeški pokožnici, ki sta na voljo na tržišču, sta v skladu z validacijo na podlagi standardov učinkovitosti pokazali podobne rezultate kot validirana referenčna metoda (21). To sta metodi EpiDermTM SIT (EPI-200) in SkinEthicTM RHE (22).
5. Preden se lahko predlagana podobna ali spremenjena in vitro metoda rekonstruirane človeške pokožnice, razen validirane referenčne metode, metode EpiDermTM SIT (EPI-200) ali metode SkinEthicTM RHE, uporabi v zakonodajne namene, je treba ugotoviti njeno zanesljivost, ustreznost (natančnost) in omejitve glede njene namenjene uporabe ter tako zagotoviti, da se jo lahko šteje za podobno validirani referenčni metodi v skladu s standardi učinkovitosti iz te preskusne metode (Dodatek 2). Poleg tega se priporoča, da se pred razvojem in validiranjem podobne ali spremenjene metode rekonstruirane človeške pokožnice in vitro ter njeno predložitvijo za sprejetje v zakonodajo preuči obrazložitveni referenčni dokument OECD o preskušanju draženja kože in vitro (23)
OPREDELITVE POJMOV
6. Uporabljene opredelitve pojmov so navedene v Dodatku 1.
ZAČETNI POMISLEKI IN OMEJITVE
7. Omejitev preskusne metode, kot je pokazala validacijska študija (16), je, da ne omogoča uvrstitve kemikalij v neobvezno kategorijo 3 po GHS ZN (blage dražilne snovi) (1). Kadar se uporablja kot delni nadomestni preskus, se morda zahteva nadaljnje preskušanje in vivo za nadaljnjo karakterizacijo dražilnosti (4 in poglavje B.4 te priloge). Upošteva se, da se pri uporabi človeške kože upoštevajo nacionalna in mednarodna etična načela in okoliščine.
8. Ta preskusna metoda obravnava element draženja kože in vitro strategije stopenjskega preskušanja metode B.4 (Smernica za preskušanje OECD 404) o jedkosti/draženju za kožo (4). Ta preskusna metoda sicer ne zagotavlja ustreznih informacij o jedkosti za kožo, vendar je treba spomniti, da metoda B.40a (Smernica za preskušanje OECD 431) o jedkosti za kožo temelji na istem sistemu rekonstruirane človeške pokožnice, uporablja pa drug protokol (poglavje B.40a). Ta metoda temelji na modelih rekonstruirane človeške pokožnice, ki uporabljajo človeške keratinocite in tako predstavljajo in vitro ciljni organ želene vrste. Poleg tega neposredno vključuje prvo stopnjo kaskadne reakcije vnetja/mehanizma delovanja (poškodba celic in poškodba tkiva, posledica pa je lokalizirana poškodba), do katere pride med draženjem in vivo. V postopku validacije, na katerem temelji ta preskusna metoda, so bile preskušene številne kemikalije, empirična zbirka podatkov validacijske študije pa skupno obsega 58 kemikalij (16)(18)(23). To velja za trdne snovi, tekoče snovi, poltrdne snovi in voske. Tekoče snovi so lahko vodne raztopine ali ne, trdne snovi so lahko topne ali netopne v vodi. Če je mogoče, je treba trdne snovi pred uporabo zmleti v fin prah; druga predhodna obdelava vzorca ni potrebna. Plini in aerosoli še niso bili ocenjeni v validacijski študiji (24). Čeprav se lahko preskusijo z uporabo tehnologije rekonstruirane človeške pokožnice, veljavna preskusna metoda ne dovoljuje preskušanje plinov in aerosolov. Opozoriti je treba tudi, da lahko močno obarvane kemikalije vplivajo na merjenje sposobnosti preživetja celic, zato je treba za popravke uporabiti prilagojene kontrole (glej odstavke 24–26).
9. Kadar je razvrstitev nedvoumna, bi moralo za preskusno kemikalijo zadoščati eno samo preskušanje, sestavljeno iz treh dvojnikov tkiv. V primeru mejnih rezultatov, kot so neskladne ponovne meritve in/ali povprečni odstotek sposobnosti preživetja, enak 50 ± 5 %, je treba preučiti možnost izvedbe drugega preskušanja in nato še tretjega, če so rezultati prvih dveh preskušanj neskladni.
NAČELO PRESKUSNE METODE
10. Preskusna kemikalija se površinsko nanese na tridimenzionalni model rekonstruirane človeške pokožnice, ki vključuje netransformirane keratinocite človeške pokožnice, gojene za večplastni, zelo raznolik model človeške pokožnice. Sestavljajo ga organizirane bazalne, spinalne in zrnate plasti ter večplastna rožena plast, ki vključuje medcelične lamelarne maščobne plasti, ki predstavljajo glavne razrede maščob in so podobni strukturi in vivo.
11. S kemikalijami izzvano draženje kože, ki se pokaže v obliki rdečine in otekline, je rezultat kaskadnih reakcij, ki se začnejo s prodiranjem v roženo plast in poškodbo spodaj ležečih plasti keratinocitov. Odmirajoči keratinociti sprostijo posrednike, ti pa sprožijo kaskadne reakcije vnetja, ki deluje na celice v usnjici, zlasti na celice strome in endotelne celice. Zaradi razširitve in povečane prepustnosti endotelnih celic nastaneta opazna rdečina in oteklina (24). Metode na podlagi rekonstruirane človeške pokožnice merijo začetne dogodke v kaskadni reakciji.
12. Sposobnost preživetja celic v modelih rekonstruirane človeške pokožnice se meri z encimsko pretvorbo vitalnega barvila MTT [3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijev bromid, Thiazolyl blue; številka CAS 298–93-1] v soli modrega formazana, katere količina se izmeri po ekstrakciji iz tkiv (25). Dražilne kemikalije se prepozna zaradi zmožnosti zmanjšanja sposobnosti preživetja celic pod opredeljene vrednosti praga (tj. ≤ 50 %, za kategorijo 2 po GHS ZN/CLP EU). Odvisno od zakonodajnega okvira, v katerem se uporabljajo rezultati te preskusne metode, se lahko kemikalije, ki vplivajo na sposobnost preživetja celic nad opredeljeno vrednostjo praga, štejejo za nedražilne snovi (tj. > 50 %, brez kategorije).
DOKAZOVANJE STROKOVNOSTI
13. Pred redno uporabo katere koli od treh validiranih metod, pri kateri se upošteva ta preskusna metoda, morajo laboratoriji dokazati tehnično strokovnost z uporabo desetih referenčnih kemikalij, navedenih v preglednici 1. Za podobne metode, ki so razvite v okviru te preskusne metode, ali za spremembe katere od treh validiranih metod morajo biti pred začetkom uporabe metode kot predpisanega preskušanja izpolnjene zahteve glede standardov učinkovitosti, opisanih v Dodatku 2 te preskusne metode.
14. V okviru dokazovanja strokovnosti se priporoča, da uporabnik po prejetju preveri pregrado tkiv, kakor to določa proizvajalec modela rekonstruirane človeške pokožnice. To je zlasti pomembno, če tkiva potujejo na dolge razdalje/dalj časa. Potem ko je metoda uspešno vzpostavljena in je dokazana strokovnost glede njene uporabe, redno preverjanje tkiv ni več potrebno. Vendar se priporoča, da se ob redni uporabi metode še naprej ocenjujejo značilnosti pregrade tkiv v rednih časovnih razmikih.
Preglednica 1
Referenčne kemikalije (1)
|
Kemikalija |
Št. CAS |
Rezultat preskusa in vivo (2) |
Agregatno stanje |
Kategorija po GHS ZN/CLP EU |
|
Naftalen ocetna kislina |
86-87-3 |
0 |
trdno |
brez kategorije |
|
Izopropanol |
67-63-0 |
0,3 |
tekoče |
brez kategorije |
|
Metil stearat |
112-61-8 |
1 |
trdno |
brez kategorije |
|
Heptil butirat |
5870-93-9 |
1,7 |
tekoče |
brez kategorije |
|
Heksil salicilat |
6259-76-3 |
2 |
tekoče |
brez kategorije |
|
Ciklamen aldehid |
103-95-7 |
2,3 |
tekoče |
kat. 2 |
|
1-bromoheksan |
111-25-1 |
2,7 |
tekoče |
kat. 2 |
|
Kalijev hidroksid (5-odstotni vodni) |
1310-58-3 |
3 |
tekoče |
kat. 2 |
|
1-metil-3-fenil-1-piperazin |
5271-27-2 |
3,3 |
trdno |
kat. 2 |
|
Heptanal |
111-71-7 |
3,4 |
tekoče |
kat. 2 |
|
(1) Te referenčne kemikalije so podmnožica referenčnih kemikalj, uporabljenih v validacijski študiji. (2) Rezultat in vivo v skladu z metodo B.4 in Smernico za preskušanje OECD 404 (4). (3) V okviru te preskusne metode se neobvezna kategorija 3 po GHS ZN (blage dražilne snovi) (1) šteje kot „Brez kategorije“. (4) Neobvezna kategorija 3 po UN GHS se v okviru CLP EU ne uporablja. |
||||
POSTOPEK
15. V nadaljevanju so opisani elementi in postopki za ocenjevanje razdraženosti kože z metodo rekonstruirane človeške pokožnice. Model rekonstruirane človeške pokožnice mora biti rekonstruiran in je lahko pripravljen v podjetju ali kupljen na tržišču. Za EpiSkinTM, EpiDermTM SIT (EPI-200) in SkinEthicTM RHE so na voljo standardni operativni postopki (SOP) (26)(27)(28). Preskušanje se mora izvajati v skladu z naslednjimi zahtevami:
Elementi preskusne metode rekonstruirane človeške pokožnice
Splošni pogoji
16. Za rekonstrukcijo epitelija se uporabijo netransformirani človeški keratinociti. Pod funkcionalno roženo plastjo je več slojev živih epitelijskih celic (bazalna plast, trnasta plast, zrnata plast). Rožena plast mora biti razdeljena na več plasti in vsebovati lipidni profil za močno funkcionalno pregrado za zaustavitev hitre penetracije označevalcev citotoksičnosti, npr. natrijevega dodecil sulfata (SDS) ali Tritona X-100. Funkcija pregrade mora biti dokazana in se lahko oceni z določitvijo koncentracije, pri kateri označevalec po določenem času izpostavljenosti zmanjša sposobnost preživetja tkiv za 50 % (IC50), ali z določitvijo časa izpostavljenosti, ki je potreben za zmanjšanje sposobnosti preživetja celic za 50 % (ET50) po nanosu določene stalne koncentracije označevalca. Zadrževalne značilnosti modela rekonstruirane človeške pokožnice morajo preprečiti prehod materiala okoli rožene plasti v živo tkivo, kar bi preprečilo učinkovitost modelov za raziskovanje v zvezi z izpostavljenostjo kože. V modelu rekonstruirane človeške pokožnice ne sme biti bakterij, virusov, mikoplazme ali plesni.
Pogoji za funkcionalnost
17. Analiza, uporabljena za določanje stopnje sposobnosti preživetja celic je analiza z MTT (25). Uporabniki modela rekonstruirane človeške pokožnice morajo zagotoviti, da vsaka serija modela rekonstruirane človeške pokožnice izpolnjuje merila, določena za negativno kontrolo. Optična gostota (OD) izvlečka ekstrakcijskega topila mora biti dovolj majhna, tj. OD < 0,1. Razpon sprejemljivosti (zgornjo in spodnjo mejo) za negativne kontrolne vrednosti optične gostote (v pogojih za preskusno metodo draženja kože) določi razvijalec/dobavitelj modela rekonstruirane človeške pokožnice, razponi sprejemljivosti za tri validirane metode pa so podani v preglednici 2. Zabeležiti je treba, da je negativno kontrolno tkivo, kar zadeva celične kulture, med preskušanjem stabilno (meritve sposobnosti preživetja celic so podobne).
Preglednica 2
Razpon sprejemljivosti za negativne kontrolne vrednosti optične gostote
|
Spodnja meja sprejemljivosti |
Zgornja meja sprejemljivosti |
|
|
EpiSkinTM (SM) |
≥ 0,6 |
≤ 1,5 |
|
EpiDermTM SIT (EPI-200) |
≥ 1,0 |
≤ 2,5 |
|
SkinEthicTM RHE |
≥ 1,2 |
≤ 2,5 |
18. Rožena plast in njena maščobna sestava morata zadostovati za zaustavitev hitre penetracije citotoksičnih označevalcev, npr. SDS ali Triton X-100, kot se ocenjuje z IC50 ali ET50 (preglednica 3).
19. Opravljen mora biti histološki pregled modela rekonstruirane človeške pokožnice za prikaz strukture, podobne človeški pokožnici (vključno z večplastno roženo plastjo).
20. Rezultati kemikalije pozitivne kontrole in negativnih kontrol preskusne metode morajo dokazati ponovljivost.
21. Razvijalec/dobavitelj modela rekonstruirane človeške pokožnice mora zagotoviti in dokazati, da vsaka serija modela rekonstruirane človeške pokožnice izpolnjuje opredeljena merila za sprostitev proizvodnje, med katerimi so najpomembnejša merila za sposobnost preživetja (odstavek 17), pregradno funkcijo (odstavek 18) in morfologijo (odstavek 19). Te podatke je treba zagotoviti uporabnikom metode, da lahko te informacije vključijo v poročilo. Razpon sprejemljivosti (zgornja in spodnja meja) za IC50 ali ET50 mora določiti dobavitelj modela rekonstruirane človeške pokožnice (ali raziskovalec ob uporabi lastnega modela). Le rezultati, doseženi z ustreznimi tkivi, se štejejo kot zanesljivi za napovedi v zvezi z razvrstitvijo draženja kože. Kot primer so v preglednici 3 navedeni razponi sprejemljivosti za tri validirane metode.
Preglednica 3
Primeri meril za nadzor kakovosti serije
|
Spodnja meja sprejemljivosti |
Zgornja meja sprejemljivosti |
|
|
EpiSkinTM (SM) (18-urno preskušanje s SDS) (26) |
IC50 = 1,0 mg/ml |
IC50 = 3,0 mg/ml |
|
EpiDermTM SIT (EPI-200) (1-odstotni Triton X-100) (27) |
ET50 = 4,8 h |
ET50 = 8,7 h |
|
SkinEthicTM RHE (1-odstotni Triton X-100) (28) |
ET50 = 4,0 h |
ET50 = 9,0 h |
Nanos preskusnih in kontrolnih kemikalij
22. Za vsako preskusno kemikalijo in kontrole v vsaki ponovitvi je treba uporabiti vsaj tri dvojnike. Za tekoče in trdne snovi je treba uporabiti zadostno količino preskusne kemikalije, da se enakomerno prekrije površina pokožnice, pri čemer mora biti odmerek natančno določen, tj. najmanj 25 μL/cm2 ali 25 mg/cm2. Za boljši stik med preskusno kemikalijo in površino pokožnice je treba v primeru trdnih snovi površino pokožnice pred nanosom navlažiti z deionizirano ali destilirano vodo. Če je mogoče, je treba trdne snovi preskušati v obliki finega prahu. Ob koncu časa izpostavljenosti je treba preskusno kemikalijo skrbno sprati s površine pokožnice z vodnim pufrom ali 0,9-odstotnim NaCl. Glede na uporabljeni model rekonstruirane človeške pokožnice lahko čas izpostavljenosti traja od 15 do 60 minut, inkubacijska temperatura pa je od 20 do 37 °C. Ta obdobja izpostavljenosti in temperature se optimizirajo za vsako metodo rekonstruirane človeške pokožnice in predstavljajo različne vsebovane lastnosti metod; za podrobnosti glej Standardne operativne postopke za te metode (26) (27) (28).
23. Negativno kontrolo (NC) in pozitivno kontrolo (PC) je treba uporabiti istočasno za vsako ponovitev, da se dokaže, da so sposobnost preživetja celic (z negativno kontrolo), pregradna funkcija in posledična občutljivost tkiva (s pozitivno kontrolo) v okviru v preteklosti opredeljenega razpona sprejemljivosti. Predlagana snov za pozitivno kontrolo je 5-odstotni vodni SDS. Predlagani kemikaliji za negativno kontrolo sta voda ali fosfatni pufer s soljo (PBS).
Meritve sposobnosti preživetja celic
24. Pri postopku preskušanja je zelo pomembno, da se meritve sposobnosti preživetja celic ne opravljajo takoj po izpostavljenosti preskusnim kemikalijam, ampak v svežih gojiščih po dovolj dolgi inkubacijski dobi po preskušanju izpranih tkiv. Ta čas omogoča izboljšanje stanja, kar zadeva šibke citotoksične vplive, in pojav jasnih citotoksičnih vplivov. V fazi optimizacije preskusa (11) (12) (13) (14) (15) se je za optimalno izkazala 42-urna inkubacijska doba po preskušanju.
25. Analiza MTT je validirana kvantitativna metoda, ki jo je treba v okviru te preskusne metode uporabljati za merjenje sposobnosti preživetja celic. Ustreza uporabi tridimenzionalne konstrukcije tkiva. Vzorec tkiva se za 3 ure potopi v ustrezno koncentracijo raztopine MTT (npr. 0,3 -1 mg/ml). S topilom (npr. izopropanolom, kislim izopropanolom) se izvleče oborina modrega formazana, potem pa se koncentracija formazana izmeri tako, da se določi OD pri valovni dolžini 570 nm ± 30 nm.
26. Optične značilnosti preskusne kemikalije ali njenega kemijskega delovanja na MTT lahko zato ovirajo analizo, zaradi česar je lahko ocena sposobnosti preživetja celic lažna (ker lahko preskusna kemikalija prepreči obarvanje ali povzroči, da se razlikuje od običajnega). To se lahko zgodi, če se določena preskusna kemikalija s splakovanjem ne odstrani s kože v celoti ali če prodre v pokožnico. Če preskusna kemikalija deluje neposredno na MTT (snov, ki neposredno zmanjša MTT), je običajne barve ali se obarva med testiranjem tkiva, je treba izvesti dodatne kontrole, da se ugotovi in odpravi interference preskusne kemikalije s tehniko za merjenje sposobnosti preživetja. Za podrobnejši opis načina glede popravka neposrednega zmanjšanja MTT in vpliva obarvanih snovi glej Standardne operativne postopke za te tri validirane referenčne metode (26) (27) (28).
Merila za sprejemljivost
27. Za vsako metodo, pri kateri se uporabljajo veljavne serije rekonstruirane človeške pokožnice (glej odstavek 21), morajo negativna kontrolna tkiva izražati optično gostoto, iz katere je razvidna kakovost tkiv, pri katerih so se upoštevale zahtevane stopnje in vsi postopki protokola. Vrednosti kontrol optične gostote ne smejo biti nižje od v preteklosti postavljenih mej. Podobno morajo tkiva s pozitivno kontrolo, tj. 5-odstotnim vodnim SDS, kazati sposobnost tkiv, da se odzovejo na dražilne snovi v pogojih preskusne metode (26) (27) (28). S tem povezane in ustrezne meritve spremenljivosti med dvojniki tkiv je treba opredeliti (npr. v primeru uporabe standardnih odmikov mora biti njihova vrednost v okviru enostranskega 95-odstotnega intervala tolerance, izračunanega na podlagi preteklih podatkov; pri validirani referenčni metodi je standardni odmik < 18 %).
Razlaga rezultatov in napovedni model
28. Vrednosti optične gostote, pridobljene z vsako preskusno kemikalijo, se lahko uporabijo za izračun deleža za preživetje sposobnih celic negativne kontrole, ki mora biti 100 %. Mejna vrednost deleža za preživetje sposobnih celic, ki dražilne preskusne kemikalije loči od nerazvrščenih, in statistični postopki, ki se uporabljajo za ocenjevanje rezultatov ter določanje dražilnih kemikalij, morajo biti natančno opredeljeni in zabeleženi ter dokazani kot ustrezni. Mejne vrednosti za napoved draženja so podane v nadaljevanju:
— Preskusna kemikalija se v skladu s kategorijo 2 po GHS ZN/CLP EU šteje kot dražilna za kožo, če je sposobnost preživetja tkiva po izpostavljenosti in inkubaciji po preskušanju manjša od ali enaka (≤) 50 %.
— Odvisno od zakonodajnega okvira, v katerem se uporabljajo rezultati te preskusne metode, se preskusna kemikalija v skladu z oznako „brez kategorije“ po GHS ZN/CLP EU šteje kot snov, ki ne draži kože, če je sposobnost preživetja tkiva po izpostavljenosti in inkubaciji večja (>) od 50 %.
PODATKI IN POROČANJE
Podatki
29. Za vsako preskušanje je treba podatke o posameznih dvojnikih tkiv (npr. vrednosti optične gostote in podatke o izračunanem deležu za preživetje sposobnih celic za vsako preskusno kemikalijo, vključno z razvrščanjem) sporočiti v obliki preglednice, po potrebi vključno s podatki o ponovljenih preskusih. To pomeni, da je treba sporočiti standardni odmik ± za vsako preskušanje. Za vsako preskušano kemikalijo je treba sporočiti opaženo medsebojno vplivanje z reagentom MTT in obarvanimi preskusnimi kemikalijami.
Poročilo o preskusu
30. Poročilo o preskusu vsebuje naslednje informacije:
Preskušane in kontrolne kemikalije:
— kemijska imena, kot so ime in številka CAS, ime in številka EC, če je znana,
— čistost in sestava kemikalije (v odstotkih mase),
— fizikalno-kemijske značilnosti, ki so pomembne za izvedbo študije (npr. agregatno stanje, obstojnost, hlapnost, pH, topnost v vodi, če so znane),
— obdelava preskušanih/kontrolnih snovi pred preskušanjem, če je smiselno (npr. segrevanje, mletje),
— pogoji skladiščenja;
Utemeljitev uporabljenega modela rekonstruirane človeške pokožnice in protokola
Preskusni pogoji:
— uporabljeni sistem celic,
— popolne informacije za podporo specifičnemu uporabljenemu modelu rekonstruirane človeške pokožnice, vključno z njegovo učinkovitostjo. To lahko vključuje, vendar ni omejeno na:
—(i) sposobnost preživetja;
(ii) pregradno funkcijo;
(iii) morfologijo;
(iv) ponovljivost in napovedljivost;
(v) nadzor kakovosti modela,
— podrobni podatki o preskusnem postopku,
— uporabljeni preskusni odmerki, čas izpostavljenosti in inkubacijska doba po preskušanju,
— opis vseh sprememb postopka preskušanja,
— sklicevanje na podatke o modelu, pridobljene v preteklosti. To lahko vključuje, vendar ni omejeno na:
—(i) sprejemljivost podatkov o nadzoru kakovosti s sklicevanjem na podatke o seriji, pridobljene v preteklosti;
(ii) sprejemljivost vrednosti pozitivne in negativne kontrole s sklicevanjem na sredstva in razpone pozitivne in negativne kontrole,
— opis uporabljenih meril za ocenjevanje, vključno z zagovorom izbire mejnih vrednosti za napovedni model,
— sklicevanje na podatke, pridobljene v preteklosti;
Rezultati:
— evidentiranje podatkov posameznih preskusnih kemikalij za vsak preskus in vsako ponovljeno meritev,
— navedba kontrol, uporabljenih za snovi, ki neposredno zmanjšajo MTT, in/ali obarvane preskusne kemikalije,
— opis drugih opaženih učinkov;
Razprava o rezultatih
Sklep
VIRI
1. UN (2009), United Nations Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Third revised edition, UN New York and Geneva. Na voljo na spletni strani: http://www.unece.org/trans/danger/publi/ghs/ghs_rev03/03files_e.html.
2. EC-ECVAM (2009), Statement on the „Performance under UN GHS of three in vitro assays for skin irritation testing and the adaptation of the Reference Chemicals and Defined Accuracy Values of the ECVAM skin irritation Performance Standards“, issued by the ECVAM Scientific Advisory Committee (ESAC30), 9 April 2009. Na voljo na spletni strani: http://ecvam.jrc.ec.europa.eu.
3. Uredba (ES) št. 1272/2008 Evropskega parlamenta in Sveta z dne 16. decembra 2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi, o spremembi in razveljavitvi direktiv 67/548/EGS in 1999/45/ES ter spremembi Uredbe (ES) št. 1907/2006. UL L 353, 31. 12. 2008, str. 1.
4. OECD (2004), Acute Dermal Irritation/Corrosion, OECD Guideline for the Testing of Chemicals No. 404, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
5. OECD (2004), In Vitro Skin Corrosion: Transcutaneous Electrical Resistance (TER), OECD Guideline for the Testing of Chemicals No. 430, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
6. OECD (2004), In Vitro Skin Corrosion: Human Skin Model Test, OECD Guideline for the Testing of Chemicals No. 431, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
7. OECD (2006), In Vitro Membrane Barrier Test Method for Skin Corrosion, OECD Guideline for the Testing of Chemicals No. 435, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
8. EC-ECVAM (2009), Performance Standards for in vitro skin irritation test methods based on Reconstructed human Epidermis (RhE)? Na voljo na spletni strani: http://ecvam.jrc.ec.europa.eu.
9. OECD (2005), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, OECD Series on Testing and Assessment No. 34, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
10. Fentem, J.H., Briggs, D., Chesné, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Roguet, R., van de Sandt, J.J. M. and Botham, P. (2001), A prevalidation study on in vitro tests for acute skin irritation, Results and evaluation by the Management Team, Toxicol. in Vitro 15, 57–93.
11. Portes, P., Grandidier, M.-H., Cohen, C. and Roguet, R. (2002), Refinement of the EPISKIN protocol for the assessment of acute skin irritation of chemicals: follow-up to the ECVAM prevalidation study, Toxicol. in Vitro 16, 765–770.
12. Kandárová, H., Liebsch, M., Genschow, E., Gerner, I., Traue, D., Slawik, B. and Spielmann, H. (2004), Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests, ALTEX 21, 107–114.
13. Kandárová, H., Liebsch, M., Gerner, I., Schmidt, E., Genschow, E., Traue, D. and Spielmann, H. (2005), The EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests – An assessment of the performance of the optimised test, ATLA 33, 351–367.
14. Cotovio, J., Grandidier, M.-H., Portes, P., Roguet, R. and Rubinsteen, G. (2005), The in vitro acute skin irritation of chemicals: optimisation of the EPISKIN prediction model within the framework of the ECVAM validation process, ATLA 33, 329–349.
15. Zuang, V., Balls, M., Botham, P.A., Coquette, A., Corsini, E., Curren, R.D., Elliot, G.R., Fentem, J.H., Heylings, J.R., Liebsch, M., Medina, J., Roguet, R., van De Sandt, J.J.M., Wiemann, C. and Worth, A. (2002), Follow-up to the ECVAM prevalidation study on in vitro tests for acute skin irritation, The European Centre for the Validation of Alternative Methods Skin Irritation Task Force report 2, ATLA 30, 109–129.
16. Spielmann, H., mailto:Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovio, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., mailto:Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007), The ECVAM international validation study on in vitro tests for acute skin irritation: Report on the validity of the EPISKIN and EpiDerm assays and on the skin integrity function test, ATLA 35, 559–601.
17. Hoffmann, S. (2006), ECVAM skin irritation validation study phase II: Analysis of the primary endpoint MTT and the secondary endpoint IL1-α. Na voljo na spletni strani: http://ecvam.jrc.ec.europa.eu.
18. Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. and Zuang, V. (2007), The ECVAM international validation study on in vitro tests for acute skin irritation: selection of test chemicals, ATLA 35, 603–619.
19. Cotovio, J., Grandidier, M.-H., Lelièvre, D., Roguet, R., Tinois-Tessonneaud, E. and Leclaire, J. (2007), In vitro acute skin irritancy of chemicals using the validated EPISKIN model in a tiered strategy - Results and performances with 184 cosmetic ingredients, AATEX, 14, 351–358.
20. EC-ECVAM (2007), Statement on the validity of in vitro tests for skin irritation, issued by the ECVAM Scientific Advisory Committee (ESAC26), 27 April 2007. Na voljo na spletni strani: http://ecvam.jrc.ec.europa.eu.
21. EC-ECVAM (2007), Performance Standards for applying human skin models to in vitro skin irritation testing. Na voljo na spletni strani: http://ecvam.jrc.ec.europa.eu.
22. EC-ECVAM (2008), Statement on the scientific validity of in vitro tests for skin irritation testing, issued by the ECVAM Scientific Advisory Committee (ESAC29), 5 November 2008. Na voljo na spletni strani: http://ecvam.jrc.ec.europa.eu.
23. OECD (2010), Explanatory background document to the OECD draft Test Guideline on in vitro skin irritation testing. OECD Series on Testing and Assessment, No. 137, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/document/24/0,3746,en_2649_34377_47858904_1_1_1_1,00.html.
24. Welss, T., Basketter, D.A. and Schröder, K.R. (2004), In vitro skin irritation: fact and future. State of the art review of mechanisms and models, Toxicol. in Vitro 18, 231–243.
25. Mosmann, T. (1983), Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays, J. Immunol. Methods 65, 55–63.
26. EpiSkinTM SOP, Version 1.8 (February 2009), ECVAM Skin Irritation Validation Study: Validation of the EpiSkinTM test method 15 min - 42 hours for the prediction of acute skin irritation of chemicals. Na voljo na spletni strani: http://ecvam.jrc.ec.europa.eu.
27. EpiDermTM SOP, Version 7.0 (Revised March 2009), Protocol for: In vitro EpiDermTM skin irritation test (EPI-200-SIT), For use with MatTek Corporation’s reconstructed human epidermal model EpiDerm (EPI-200). Na voljo na spletni strani: http://ecvam.jrc.ec.europa.eu.
28. SkinEthicTM RHE SOP, Version 2.0 (February 2009), SkinEthic skin irritation test-42bis test method for the prediction of acute skin irritation of chemicals: 42 minutes application + 42 hours post-incubation. Na voljo na spletni strani: http://ecvam.jrc.ec.europa.eu.
29. Harvell, J.D., Lamminstausta, K., and Maibach, H.I. (1995), Irritant contact dermatitis, In: Practical Contact Dermatitis, str. 7–18, (Ed. Guin J. D.). Mc Graw-Hill, New York.
30. Direktiva Komisije 2001/59/ES z dne 6. avgusta 2001 o 28. prilagoditvi tehničnemu napredku Direktive Sveta 67/548/EGS o približevanju zakonov in drugih predpisov v zvezi z razvrščanjem, pakiranjem in označevanjem nevarnih snovi (UL L 225, 21.8.2001, str. 1).
31. Basketter, D.A., York, M., McFadden, J.P. and Robinson, M.K. (2004), Determination of skin irritation potential in the human 4-h patch test. Contact Dermatitis 51, 1–4.
32. Jirova, D., Liebsch, M., Basketter, D., Spiller, E., Kejlova, K., Bendova, H., Marriott, M. and Kandarova, H. (2007), Comparison of human skin irritation and photo-irritation patch test data with cellular in vitro assays and animal in vivo data, ALTEX, 14, 359–365.
33. Jírová, D., Basketter, D., Liebsch, M., Bendová, H., Kejlová, K., Marriott, M. and Kandárová, H. (2010), Comparison of human skin irritation patch test data with in vitro skin irritation assays and animal data, Contact Dermatitis, 62, 109–116.
Dodatek 1
Opredelitve pojmov
Natančnost : stopnja ujemanja rezultatov preskusne metode z uveljavljenimi referenčnimi vrednostmi. To je merilo učinkovitosti preskusne metode in eden od vidikov ustreznosti. Ta izraz in izraz „skladnost“ se pogosto izmenično uporabljata za poimenovanje deleža ustreznih rezultatov preskusne metode (9).
Sposobnost preživetja celic : parameter za merjenje celotne dejavnosti celične populacije, npr. zmožnosti celičnih mitohondrijskih dehidrogenaz za redukcijo vitalnega barvila MTT ([3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijev bromid], Thiazolyl blue), ki se glede na izmerjeni končni učinek in uporabljeni načrt preskusa ujema s skupnim številom in/ali sposobnostjo preživetja živih celic.
Skladnost : je merjenje učinkovitosti preskusne metode pri preskusnih metodah, s katerimi se dosežejo kategorični rezultati, in eden od vidikov ustreznosti. Izraz se izmenično uporablja z natančnostjo in je opredeljen kot delež vseh preskušanih kemikalij, ki so pravilno razvrščene kot pozitivne ali negativne. (9).
ET50 : lahko se oceni z določanjem časa izpostavljenosti, ki je potreben za zmanjšanje sposobnosti preživetja celic za 50 % po nanosu določene stalne koncentracije označevalca, glej tudi IC50.
EU CLP (Uredba (ES) št. 1272/2008 Evropskega parlamenta in Sveta z dne 16. decembra 2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi) : v Evropski uniji izvaja globalno usklajen sistem za razvrščanje in označevanje kemikalij (snovi in zmesi) Združenih narodov (3).
GHS (globalno usklajen sistem za razvrščanje in označevanje kemikalij) Združenih narodov (ZN)) : sistem za razvrščanje kemikalij (snovi in zmesi) s pomočjo standardiziranih vrst in stopenj fizikalnih, zdravstvenih in okoljskih nevarnosti ter za označevanje z npr. piktogrami, opozorilnimi besedami, izjavami o nevarnosti, varnostnimi izjavami in varnostnimi listi z namenom razširjanja informacij o škodljivih učinkih kemikalij ter s tem zaščite ljudi (vključno z delodajalci, delavci, prevozniki, potrošniki in reševalci) in okolja (1).
IC50 : lahko se oceni z določanjem koncentracije, pri kateri označevalec po določenem času izpostavljenosti zmanjša sposobnosti preživetja tkiva za 50 % (IC50), glej tudi ET50.
Prevelik odmerek : količina na pokožnico nanesene preskusne kemikalije, ki je večja od količine, potrebne za celotno in enakomerno prekrivanje površine pokožnice.
Podobni preskus : pogovorni izraz za preskusno metodo, ki je strukturno in funkcijsko podobna potrjeni in uveljavljeni referenčni preskusni metodi. Takšna preskusna metoda je primerna za naknadno validacijo. Uporablja se izmenično s podobno preskusno metodo (9).
Standardi učinkovitosti : standardi, ki temeljijo na validirani referenčni metodi, na podlagi katere se lahko ocenjuje primerljivost predlagane preskusne metode, ki je v funkcijskem in mehaničnem smislu podobna referenčni. Obsegajo: i) nujne elemente preskusne metode, ii) najkrajši možni seznam referenčnih kemikalij, izbranih iz skupine kemikalij, ki se uporabljajo za dokazovanje sprejemljive učinkovitosti validirane preskusne metode, ter iii) podobne stopnje natančnosti in zanesljivosti, ki temeljijo na rezultatih validirane preskusne metode, kar mora dokazati predlagana preskusna metoda pri ocenjevanju ob uporabi najkrajšega možnega seznama referenčnih kemikalij (9).
Referenčne kemikalije : kemikalije, izbrane za uporabo v postopku validacije, za katere so odzivi referenčnega preskusnega sistema ali želenih vrst in vitro ali in vivo že znani. Te kemikalije morajo biti reprezentativne za razrede kemikalij, za katere naj bi se uporabila preskusna metoda, predstavljati pa morajo celoten razpon odzivov, ki se jih lahko pričakuje od kemikalij, za katere bo morda uporabljena, od močnega, do šibkega, do negativnega. Za različne faze validacije in različne preskusne metode ter preskusne uporabe so lahko potrebne različne skupine referenčnih kemikalij (9).
Ustreznost : opis odnosa med preskusom in želenim učinkom ter njegovim pomenom in uporabnostjo za določen namen. Pomeni stopnjo, do katere preskus pravilno izmeri ali napove želeni biološki učinek. Ustreznost vključuje upoštevanje natančnosti (skladnosti) preskusne metode (9).
Zanesljivost : stopnja reproduktivnosti preskusne metode v laboratorijih in med njimi v določenem časovnem obdobju pri uporabi istega protokola. Oceni se z izračunom ponovljivosti v enem ali več laboratorijih (9).
Nadomestni preskus : preskus, ki bo nadomestil preskus v redni uporabi in ki je uveljavljen za ugotavljanje nevarnosti in/ali oceno tveganja ter za katerega je bilo ugotovljeno, da v primerjavi z uveljavljenim preskusom v vseh mogočih okoliščinah preskušanja in za vse mogoče preskusne kemikalije zagotavlja enakovredno ali izboljšano varstvo zdravja ljudi ali živali ali okolja, kot se uporablja (9).
Občutljivost : delež vseh pozitivnih/aktivnih preskusnih kemikalij, ki se s preskusom pravilno razvrstijo. To je merilo natančnosti za preskusno metodo, s katero se dosežejo kategorični rezultati, in je pomemben dejavnik pri ocenjevanju ustreznosti preskusne metode (9).
Draženje kože : draženje kože je nastanek popravljive poškodbe kože po nanosu preskusne snovi za največ 4 ure. Razdraženost kože je reakcija, ki je prisotna na posameznih mestih, ni imunogena in se pojavi kmalu po izpostavitvi kože draženju (29). Njena glavna lastnost je popravljiva narava, ki vključuje vnetne reakcije in večino značilnih kliničnih znakov razdraženosti (rdečino, oteklino, srbenje in bolečino), povezanih z vnetnim procesom.
Specifičnost : delež vseh negativnih/neaktivnih preskusnih kemikalij, ki se s preskusom pravilno razvrstijo. To je merilo natančnosti za preskusno metodo, s katero se dosežejo kategorični rezultati, in je pomemben dejavnik pri ocenjevanju ustreznosti preskusne metode. (9).
Strategija stopenjskega preskušanja : preskušanje, pri katerem se preskusne metode uporabljajo v zaporedju; o preskusnih metodah, izbranih v vsaki naslednji stopnji, se odloča na podlagi rezultatov na prejšnji stopnji preskušanja (9).
Preskusna kemikalija (imenovana tudi preskusna snov) : katera koli snov ali zmes, preskušana z uporabo te preskusne metode.
Dodatek 2
Standardi učinkovitosti za oceno predlaganih podobnih ali spremenjenih metod rekonstruirane človeške pokožnice in vitro za draženje kože
UVOD
1. Namen standardov učinkovitosti je posredovati podlago, na kateri se lahko za nove metode, lastniške (tj. avtorske, zaščitene z blagovno znamko, registrirane) in nelastniške, ugotovi, da so ustrezno natančne in zanesljive za določene namene preskušanja. Ti standardi učinkovitosti, ki temeljijo na validiranih in uveljavljenih preskusnih metodah, se lahko uporabijo za oceno zanesljivosti in natančnosti drugih podobnih metod (ki se pogovorno imenujejo „podobni“ preskusi), ki temeljijo na podobnih znanstvenih načelih in merijo ali napovedujejo isti biološki ali toksični učinek (9).
2. Spremenjene metode (tj. predlagane morebitne izboljšave odobrene preskusne metode) je treba pred sprejetjem oceniti, da se ugotovita učinek predlaganih sprememb na učinkovitost preskusa in obseg, v katerem takšne spremembe vplivajo na informacije, ki so na voljo za druge elemente postopka validacije. Odvisno od števila in narave predlaganih sprememb, dobljenih podatkov in podporne dokumentacije za te spremembe se zanje izvede enak postopek validacije, kot je predpisan za nov preskus ali, po potrebi, omejena ocena zanesljivosti in ustreznosti z uveljavljenimi standardi učinkovitosti (9).
3. Podobne ali spremenjene metode katere koli od treh validiranih metod [EpiSkin™ (validirana referenčna metoda – VRM), EpiDerm™ SIT (EPI-200) in SkinEthic™ RHE], ki so predlagane za uporabo v okviru te preskusne metode, je treba oceniti ter določiti njihovo zanesljivost in natančnost z uporabo kemikalij, ki predstavljajo celoten razpon rezultatov preskusa Draize za draženje kože. Pri ocenjevanju z uporabo 20 priporočenih referenčnih kemikalij standardov učinkovitosti (preglednica 1) morajo biti predlagane podobne ali spremenjene metode tako zanesljive in natančne kot validirana referenčna metoda (preglednica 2) (2) (16). Vrednosti natančnosti in zanesljivosti, ki morajo biti dosežene, so navedene v odstavkih 8 do 12 tega dodatka. Vključene so nerazvrščene (brez kategorije po GHS ZN/CLP EU) in razvrščene (kategorija 2 po GHS ZN/CLP EU) (1) kemikalije, ki predstavljajo različne kemijske razrede, da se lahko zanesljivost in natančnost (občutljivost, specifičnost in splošna natančnost) predlagane metode primerjata z zanesljivostjo in natančnostjo validirane referenčne metode. Pred uporabo metode za preskušanje novih preskusnih kemikalij je treba določiti zanesljivost metode, njeno zmožnost, da pravilno opredeli dražilne kemikalije kategorije 2 po GHS ZN/CLP EU, in, odvisno od zakonodajnega okvira, za katerega se pridobivajo podatki, tudi njeno zmožnost, da pravilno opredeli kemikalije brez kategorije po GHS ZN/CLP EU.
4. Ti standardi učinkovitosti temeljijo na standardih učinkovitosti evropskega ECVAM (8) in so posodobljeni v skladu s sistemi po GHS ZN/CLP EU za razvrščanje in označevanje (1) (3). Prvotni standardi učinkovitosti so bili opredeljeni po končani validacijski študiji (21) in so temeljili na sistemu razvrščanja EU, kot ga določa Direktiva Komisije 2001/59/ES z dne 6. avgusta 2001 o 28. prilagoditvi tehničnemu napredku Direktive Sveta 67/548/EGS o približevanju zakonov in drugih predpisov v zvezi z razvrščanjem, pakiranjem in označevanjem nevarnih snovi ( 23 ). Zaradi sprejetja sistema po GHS ZN za razvrščanje in označevanje v EU (CLP EU) (3), do katerega je prišlo med zaključkom validacijske študije in dokončanjem te preskusne metode, so bili standardi učinkovitosti posodobljeni (8). Posodobitev se nanaša v glavnem na spremembe (i) sklopa referenčnih kemikalij standardov učinkovitosti ter (ii) opredeljenih vrednosti zanesljivosti in natančnosti (2) (23).
STANDARDI UČINKOVITOSTI ZA PRESKUSNE METODE REKONSTRUIRANE ČLOVEŠKE POKOŽNICE IN VITRO ZA DRAŽENJE KOŽE
5. Standardi učinkovitosti zajemajo naslednje tri elemente (9):
I. Nujne elemente preskusne metode
II. Najkrajši možni seznam referenčnih kemikalij
III. Opredeljene vrednosti natančnosti in zanesljivosti
I. Nujni elementi preskusne metode
6. Vključujejo bistvene strukturne, funkcionalne in postopkovne elemente validirane metode, ki morajo biti vključeni v protokol predlagane, v funkcijskem in mehaničnem smislu podobne ali spremenjene metode. Ti elementi vključujejo edinstvene značilnosti metode, pomembne podrobnosti o postopku in ukrepe za nadzor kakovosti. Izpolnjevanje teh bistvenih elementov preskusne metode pomaga pri zagotavljanju, da podobna ali spremenjena metoda temelji na enakih konceptih kot ustrezna validirana referenčna metoda (9). Bistveni elementi preskusne metode so podrobneje opisani v odstavkih 16 do 21 preskusne metode, pri preskušanju pa je treba upoštevati naslednje:
— splošne pogoje (odstavek 16) in
— funkcionalne pogoje, ki obsegajo:
—— sposobnost preživetja (odstavek 17),
— pregradno funkcijo (odstavek 18),
— morfologijo (odstavek 19),
— ponovljivost (odstavek 20), in
— nadzor kakovosti (odstavek 21).
II. Najkrajši možni seznam referenčnih kemikalij
7. Referenčne kemikalije se uporabljajo za ugotavljanje, ali sta zanesljivost in natančnost predlagane podobne ali spremenjene metode, ki se je izkazala za strukturno in funkcionalno dovolj podobno validirani referenčni metodi ali ki predstavlja manjšo spremembo ene od validiranih referenčnih metod, primerljivi z učinkovitostjo validirane referenčne metode 1 ali boljši kot VRM (2) (8) (16) (23). Med 20 priporočenimi referenčnimi kemikalijami, navedenimi v preglednici 1, so kemikalije, ki predstavljajo različne kemijske razrede (tj. kategorije kemikalij na podlagi funkcionalnih skupin) in so reprezentativne za celoten razpon rezultatov preskusa Draize za draženje kože (od nerazdražene do zelo razdražene kože). Kemikalije, vključene v seznam, obsegajo 10 kemikalij kategorije 2 po GHS ZN/CLP EU in 10 nerazvrščenih kemikalij, od katerih so 3 kemikalije iz neobvezne kategorije 3 po GHS ZN. V okviru te preskusne metode se neobvezna kategorija 3 šteje kot „Brez kategorije“. Kemikalije iz preglednice 1 so glede na kemijsko delovanje in agregatno stanje izbrane iz kemikalij, uporabljenih v fazi optimizacije, ki je sledila predvalidaciji, in v validacijski študiji validirane referenčne metode (14) (18). Te referenčne kemikalije predstavljajo najmanjše možno število snovi, ki jih je treba uporabiti pri ocenjevanju natančnosti in zanesljivosti predlagane podobne ali spremenjene metode, vendar se ne smejo uporabljati za razvoj novih metod. Če navedena snov ni na voljo, se lahko uporabijo druge snovi, za katere so na voljo ustrezni referenčni podatki in vivo, zlasti iz kemikalij, uporabljenih v fazi optimizacije, ki je sledila predvalidaciji, in v validacijski študiji validirane referenčne metode. Po želji se lahko na najkrajši možni seznam referenčnih kemikalij dodajo druge kemikalije, ki predstavljajo druge kemijske razrede in za katere so na voljo ustrezni referenčni podatki in vivo, da se dodatno oceni natančnost predlagane metode.
Preglednica 1
Najkrajši možni seznam referenčnih kemikalij za določitev vrednosti natančnosti in zanesljivosti za metode rekonstruirane človeške pokožnice za razdraženost kože (1)
|
Kemikalija |
Številka CAS |
Agregatno stanje |
Rezultat preskusa in vivo |
VRM in vitro kat. |
GHS ZN/CLP EU in vivo kat. |
|
1-bromo-4-kloropropan |
6940-78-9 |
tekoče |
0 |
kat. 2 |
brez kategorije |
|
Dietil ftalat |
84-66-2 |
tekoče |
0 |
brez kategorije |
brez kategorije |
|
Naftalen ocetna kislina |
86-87-3 |
trdno |
0 |
brez kategorije |
brez kategorije |
|
Alil fenoksiacetat |
7493-74-5 |
tekoče |
0,3 |
brez kategorije |
brez kategorije |
|
Izopropanol |
67-63-0 |
tekoče |
0,3 |
brez kategorije |
brez kategorije |
|
4-metiltio-benzaldehid |
3446-89-7 |
tekoče |
1 |
kat. 2 |
brez kategorije |
|
Metil stearat |
112-61-8 |
trdno |
1 |
brez kategorije |
brez kategorije |
|
Heptil butirat |
5870-93-9 |
tekoče |
1,7 |
brez kategorije |
brez kategorije |
|
Heksil salicilat |
6259-76-3 |
tekoče |
2 |
brez kategorije |
brez kategorije |
|
Cinnamaldehid |
104-55-2 |
tekoče |
2 |
kat. 2 |
brez kategorije (neobvezna kat.3) (3) |
|
1-dekanol (2) |
112-30-1 |
tekoče |
2,3 |
kat. 2 |
kat. 2 |
|
Ciklamen aldehid |
103-95-7 |
tekoče |
2,3 |
kat. 2 |
kat. 2 |
|
1-bromoheksan |
111-25-1 |
tekoče |
2,7 |
kat. 2 |
kat. 2 |
|
2-klorometil-3,5-dimetil-4-metoksipiridinhidroklorid |
86604-75-3 |
trdno |
2,7 |
kat. 2 |
kat. 2 |
|
Di-n-propildisulfid (2) |
629-19-6 |
tekoče |
3 |
brez kategorije |
kat. 2 |
|
Kalijev hidroksid (5-odstotni vodni) |
1310-58-3 |
tekoče |
3 |
kat. 2 |
kat. 2 |
|
Benzenetiol, 5–(1,1-dimetiletil)-2-metil |
7340-90-1 |
tekoče |
3,3 |
kat. 2 |
kat. 2 |
|
1-metil-3-fenil-1-piperazin |
5271-27-2 |
trdno |
3,3 |
kat. 2 |
kat. 2 |
|
Heptanal |
111-71-7 |
tekoče |
3,4 |
kat. 2 |
kat. 2 |
|
Tetrakloroetilen |
127-18-4 |
tekoče |
4 |
kat. 2 |
kat. 2 |
|
(1) Izbor kemikalij temelji na naslednjih merilih: (i) kemikalije so na voljo na tržišču, (ii), predstavljajo celoten niz rezultatov preskusa Draize za draženje kože (od nerazdražene do zelo razdražene kože), (iii) njihova kemična struktura je natančno opredeljena, (iv) predstavljajo kemijsko delovanje, ki je uporabljeno v validacijskem postopku, in (v), niso povezane z zelo strupenim profilom (npr. rakotvornim ali strupenim za reprodukcijski sistem) ali stroški zaradi prepovedane izpostavljenosti tem kemikalijam. (2) Kemikalije, ki so dražilne za kunce, vendar obstajajo zanesljivi dokazi, da niso dražilne za ljudi (31) (32) (33). (3) Po GHS ZN, ne po CLP EU. |
|||||
III. Opredeljene vrednosti natančnosti in zanesljivosti
8. Za namene določanja zanesljivosti in ustreznosti predlaganih podobnih ali spremenjenih metod, ki se bodo uporabljale v več laboratorijih, je treba vseh 20 referenčnih kemikalij iz preglednice 1 preskusiti v vsaj treh laboratorijih. Če se bo predlagana metoda uporabljala v samo enem laboratoriju, preskušanje v več laboratorij za validacijo ne bo potrebno. Vendar pa je bistveno, da takšne validacijske študije v skladu z mednarodnimi smernicami neodvisno ocenijo mednarodno priznani organi za validacijo (9). V vsakem laboratoriju mora biti preskušanih vseh 20 kemikalij v treh neodvisnih ponovitvah, izvedenih z različnimi serijami tkiv in v intervalih, med katerimi je preteklo dovolj časa. Vsako ponovitev morajo sestavljati vsaj trije sočasno preskušani dvojniki tkiv za vsako vključeno preskusno kemikalijo, negativno kontrolo in pozitivno kontrolo.
9. Vrednosti zanesljivosti in natančnosti predlagane metode je treba izračunati ob upoštevanju vseh štirih meril, navedenih v nadaljevanju, s čimer se zagotovi, da so vrednosti zanesljivosti in ustreznosti izračunane na vnaprej določen in dosleden način:
1. za izračun spremenljivosti in napovedljivosti (natančnosti) metode v laboratoriju in med laboratoriji se upoštevajo samo podatki ponovitev v celoti izvedenih zaporedij ponovitev;
2. vsak sodelujoč laboratorij mora pri dokončnem razvrščanju vsake referenčne kemikalije upoštevati povprečno vrednost sposobnosti preživetja iz različnih izvedenih ponovitev preskusa v celoti izvedenega zaporedja ponovitev;
3. pri izračunu spremenljivosti metode med laboratoriji se upoštevajo samo podatki, pridobljeni za kemikalije, za katere so bila zaporedja ponovitev v celoti izvedena v vseh sodelujočih laboratorijih;
4. izračun vrednosti natančnosti se izvede na podlagi napovedi posameznega laboratorija, ki so jih različni sodelujoči laboratoriji pridobili za 20 referenčnih kemikalij.
V skladu s tem zaporedje ponovitev sestavljajo tri neodvisne ponovitve, ki jih izvede en laboratorij za eno preskusno kemikalijo. V celoti izvedeno zaporedje ponovitev je zaporedje ponovitev, ki jih izvede en laboratorij za eno preskusno kemikalijo, pri čemer so veljavne vse tri ponovitve. To pomeni, da ena sama neveljavna ponovitev razveljavi celotno zaporedje ponovitev, sestavljeno iz treh ponovitev.
10. Ocena ponovljivosti v laboratoriju mora kazati skladnost razvrstitev (v kategorijo 2/brez kategorije po GHS ZN/CLP EU), ki se doseže z različnimi neodvisnimi ponovitvami preskusa z 20 referenčnimi kemikalijami v enem laboratoriju in je enaka ali večja (≥) od 90 %.
11. Ocena ponovljivosti v različnih laboratorijih ni potrebna, če se bo predlagana preskusna metoda uporabljala le v enem laboratoriju. Za metode, ki se bodo uporabljale v več laboratorijih, mora biti skladnost razvrstitev (v kategorijo 2/brez kategorije po GHS ZN/CLP EU), ki se dosežejo z različnimi neodvisnimi ponovitvami preskusa z 20 referenčnimi kemikalijami, najbolje v najmanj treh laboratorijih, enaka ali večja (≥) od 80 %.
12. Natančnost (občutljivost, specifičnost in splošna natančnost) predlagane podobne ali spremenjene metode mora biti primerljiva z natančnostjo validirane referenčne metode, ob upoštevanju dodatnih informacij, povezanih z ustreznostjo pri želenih vrstah (preglednica 2). Občutljivost mora biti enaka ali večja (≥) od 80 % (2) (8) (23). Nadaljnja posebna omejitev se nanaša na občutljivost predlagane metode in vitro, saj lahko samo dve kemikaliji kategorije 2 in vivo, 1-dekanol in di-n-propildisulfid, več kot en sodelujoči laboratorij napačno razvrsti kot brez kategorije. Specifičnost mora biti enaka ali večja (≥) od 70 % (2) (8) (23). Glede specifičnosti predlaganih metod in vitro ni nobenih drugih omejitev, tj. kateri koli sodelujoči laboratorij lahko napačno razvrsti katero koli kemikalijo brez kategorije in vivo, če je končna specifičnost preskusne metode v sprejemljivem razponu. Splošna natančnost mora biti enaka ali večja (≥) od 75 % (2) (8) (23). Čeprav je občutljivost validirane referenčne metode, izračunane za 20 referenčnih kemikalij iz preglednice 1, enaka 90 %, je opredeljena najnižja možna vrednost občutljivosti za katero koli podobno ali spremenjeno metodo, ki se šteje za veljavno, določena na 80 %, saj je za obe kemikaliji, 1-dekanol (mejna kemikalija) in di-n-propildisulfid (lažna negativna validirane referenčne metode), znano, da pri ljudeh ne povzročata draženja (31) (32) (33), čeprav sta bili pri preskusu s kunci opredeljeni kot dražilni snovi. Ker modeli rekonstruirane človeške pokožnice temeljijo na celicah človeškega izvora, lahko te kemikalije napovedo kot snovi, ki ne dražijo (brez kategorije po GHS ZN/CLP EU).
Preglednica 2
Zahtevane vrednosti napovedljivosti za občutljivost, specifičnost in splošno natančnost katere koli podobne ali spremenjene metode, ki se šteje za veljavno
|
Občutljivost |
Specifičnost |
Splošna natančnost |
|
≥ 80 % |
≥ 70 % |
≥ 75 % |
13. Lahko se zgodi, da eden ali več preskusov v zvezi z eno preskusno kemikalijo ali več preskusnimi kemikalijami ne izpolnjuje meril za sprejemljivost preskusa za preskusne in kontrolne kemikalije ali pa ni sprejemljiv zaradi drugih razlogov. Za dopolnitev manjkajočih podatkov je za vsako preskusno kemikalijo dopustna izvedba največ dveh dodatnih preskusov („ponovno preskušanje“). Natančneje, ker je treba v primeru ponovnega preskušanja primerjalno preskusiti tudi pozitivno in negativno kontrolo, sta lahko za vsako preskusno kemikalijo izvedeni največ dve dodatni ponovitvi.
14. Obstaja verjetnost, da vsak sodelujoči laboratorij za vsako referenčno kemikalijo tudi po ponovnem preskušanju ne bo dobil vsaj treh veljavnih ponovitev, zahtevanih za vsako preskušano kemikalijo, zaradi česar bo podatkovna matrika nepopolna. Da se zbirka podatkov štela za popolno, je treba v takih primerih izpolniti naslednja tri merila:
1. pri vseh 20 referenčnih kemikalijah mora biti vsaj eno zaporedje ponovitev izvedeno v celoti;
2. v vsakem od vsaj treh sodelujočih laboratorijev mora biti v celoti izvedenih vsaj 85 % zaporedij ponovitev (za 20 kemikalij; tj. v enem laboratoriju so dovoljena 3 neveljavna zaporedja ponovitev);
3. v celoti izvedenih mora biti vsaj 90 % vseh zaporedij ponovitev iz vsaj treh laboratorijev (za 20 kemikalij, preskušanih v treh laboratorijih, tj. skupno je dovoljenih 6 neveljavnih zaporedij ponovitev).
B. 47 TESTNA METODA ZA DOLOČANJE MOTNJAVE IN PREPUSTNOSTI ROŽENICE GOVEDA ZA UGOTAVLJANJE JEDKIH IN ZELO DRAŽILNIH SNOVI ZA OČI (BCOP)
UVOD
1. Testna metoda za določanje motnjave in prepustnosti roženice goveda (BCOP) je testna metoda in vitro, ki se pod določenimi pogoji in z določenimi omejitvami uporablja za razvrščanje snovi in zmesi med „jedke in zelo dražilne za oči“ (1) (2) (3). Pri tej testni metodi so zelo dražilne snovi tiste snovi, ki povzročajo poškodbe oči, ki se pri zajcu ohranijo najmanj 21 dni po aplikaciji. Čeprav testa in vivo na očeh zajcev ne more nadomestiti popolnoma, se test BCOP priporoča kot del stopenjske testne strategije za regulativno razvrščanje in označevanje za posebna področja uporabe (4)(5). Testne snovi in zmesi (6) se lahko razvrstijo med jedke ali zelo dražilne snovi za oči, ne da bi bilo potrebno opraviti dodatno testiranje na zajcih. Snov z negativnim testnim rezultatom bi bilo treba testirati na zajcih s pomočjo sekvenčne testne strategije, ki je določena v testni smernici OECD 405 (7) (poglavje B. 5 te priloge).
2. V tej testni metodi so opisani postopki za oceno potencialne jedkosti in močne dražilnosti testne snovi za oči glede na njeno sposobnost, da v izolirani roženici goveda povzroča motnjavo in povečano prepustnost. Toksični učinki na roženico se merijo z: (i) zmanjšanim prenosom svetlobe (motnjava) in (ii) povečanim prehajanjem barvila natrijevega fluoresceina (prepustnost). Oceni motnjave in prepustnosti roženice po aplikaciji testne snovi skupaj pomenita dražilnost in vitro (IVIS), ki se uporablja za razvrstitev testne snovi v različne stopnje draženja.
3. S testno metodo BCOP so bile testirane tudi dražilne snovi, ki povzročajo poškodbe oči, ki izginejo v manj kot 21 dnevih, in nedražilne snovi. Vendar natančnost in zanesljivost testne metode BCOP pri snoveh iz teh dveh kategorij nista bili ocenjeni formalno.
4. Opredelitve so navedene v dodatku I.
ZAČETNI POMISLEKI IN OMEJITVE
5. Ta testna metoda temelji na protokolu testne metode BCOP Medagencijskega usklajevalnega odbora za validacijo alternativnih metod (ICCVAM)(8), ki je bil pripravljen po mednarodni študiji o validaciji (4)(5)(9), pri kateri sta sodelovala Evropski center za validacijo alternativnih metod (ECVAM) in Japonski center za validacijo alternativnih metod (JaCVAM). Protokol temelji na informacijah, ki jih je prispeval Inštitut za raziskave in vitro (IIVS), in protokolu INVITTOX 124 (10), ki se je uporabil pri predvalidacijski študiji o preskusu BCOP, ki je bila opravljena med leti 1997–1998 in ki jo je sponzorirala Evropska skupnost. Oba protokola temeljita na testni metodologiji BCOP, o kateri je prvi poročal Gautheron et al. (11).
6. Opredeljene omejitve za to testno metodo temeljijo na visokem številu lažno pozitivnih rezultatov za alkohole in ketone ter visokem številu lažno negativnih rezultatov za trdne snovi, zbranih v podatkovni zbirki za validacijo (glej točko 44) (5). Če se snovi iz teh kemijskih in fizikalnih razredov izključijo iz podatkovne zbirke, se natančnost BCOP v sistemih za razvrščanje snovi EU, EPA in GHS bistveno izboljša (5). Pri tem preskusu (tj. za ugotavljanje izključno jedkih in zelo dražilnih snovi za oči) lažno negativni rezultati niso kritični, saj bi se take snovi nato preskušale na zajcih ali, odvisno od regulativnih zahtev, z drugimi ustrezno potrjenimi testi in vitro, pri katerih se uporablja sekvenčna testna strategija, ki temelji na teži dokazov. Poleg tega nekaterih kemijskih ali proizvodnih razredov (npr. zmesi) s trenutno validacijsko podatkovno zbirko ni bilo mogoče ustrezno oceniti. Vendar pa bi lahko preskuševalci to testno metodo uporabili pri vseh vrstah testnega materiala (tudi pri zmeseh), pri čemer bi bil pozitiven rezultat sprejemljiv kot indikator za jedko ali zelo dražilno snov za oči. Pozitivne rezultate, pridobljene z uporabo alkoholov ali ketonov, je treba razlagati previdno, saj obstaja tveganje, da so vanje vključeni tudi lažno pozitivni rezultati.
7. Pri vseh postopkih na očesih in roženicah goveda je treba upoštevati veljavna pravila in postopke testnega urada o ravnanju z živalskim materialom, kamor spadajo med drugim tudi tkiva in tkivne tekočine. Priporočajo se splošni previdnostni ukrepi za laboratorije (12).
8. Čeprav testna metoda upošteva nekatere učinke, ocenjene s testno metodo za ugotavljanje dražilnih snovi na očeh zajcev, in do določene mere tudi njihovo resnost, je kljub temu omejena, saj ne upošteva poškodb veznice in šarenice. Čeprav tudi same reverzibilnosti poškodb roženice s preskusom BCOP ni mogoče oceniti, je bilo na podlagi študij na očeh zajcev kljub temu predlagano, da se oceni prvotna globina poškodbe roženice ter tako razlikuje med ireverzibilnimi in reverzibilnimi učinki (13). Treba je tudi opozoriti, da s testno metodo BCOP ni mogoče oceniti potencialne sistemske toksičnosti, povezane z izpostavljenostjo oči.
9. Trenutno potekajo prizadevanja za nadaljnjo karakterizacijo uporabnosti in omejitev preskusa BCOP za ugotavljanje lažje dražilnih in nedražilnih snovi (glej tudi točko 45). Uporabnikom se priporoča, da organizacijam za validacijo zagotovijo vzorce in/ali podatke za uradno oceno morebitnih prihodnjih uporab testne metode BCOP, vključno za ugotavljanje lažje dražilnih in nedražilnih snovi.
10. Laboratoriji, ki ta preskus opravljajo prvič, morajo uporabiti kemikalije za preverjanje usposobljenosti iz dodatka 2. Te kemikalije uporabijo, da dokažejo, da so tehnično sposobni izvajati testno metodo BCOP, preden podatke o testu BCOP predložijo za regulativno razvrstitev nevarnosti.
NAČELO TESTA
11. Testna metoda BCOP je organotipski model, ki zagotavlja kratkoročno ohranjanje običajne fiziološke in biokemijske funkcije roženice goveda in vitro. Pri tej testni metodi se poškodba, ki jo povzroči testna snov, oceni tako, da se spremembe motnjave in prepustnosti roženice merijo kvantitativno z opacitometrom oziroma spektrofotometrom vidne svetlobe. Obe meritvi se uporabita za izračun IVIS, na podlagi katerega se dodeli kategorija nevarnosti dražilnosti in vitro, s pomočjo katere se predvidi potencialni dražilni učinek testne snovi in vivo (glej merila za odločanje).
12. Pri testni metodi BCOP se uporabljajo izolirane roženice oči sveže zaklanega goveda. Motnjava roženice se meri kvantitativno in ustreza količini svetlobe, ki prodre skozi roženico. Prepustnost se meri kvantitativno in ustreza količini barvila natrijevega fluoresceina, ki prodre skozi celotno debelino roženice in ga zazna medij v zadnjem delu držala. Testne snovi se dodajo v sprednji del držala za roženico in se tako aplicirajo na epitelno površino roženice. Dodatek 3 vsebuje opis in sliko držala, ki se uporablja za BCOP. Držala za roženico ponujajo na trgu različna podjetja, laboratoriji pa jih lahko izdelajo tudi sami.
Izvor in starost oči goveda ter izbor živalskih vrst
13. Govedo, ki se zakolje v klavnicah, je običajno namenjeno za človeško prehrano ali druge komercialne uporabe. Pri testih BCOP se kot vir roženic uporabljajo samo zdrave živali, primerne za vstop v prehransko verigo. Ker so goveda glede na pasmo, starost in spol različno težka, ni priporočene teže za zakol.
14. Velikost roženice se lahko pri očeh različno starih živali razlikuje. Roženice z vodoravnim premerom > 30,5 mm in centralno debelino roženice (CCT) ≥ 1 100 μm ima običajno govedo, starejše od osem let, roženice z navpičnim premerom < 28,5 mm in CCT < 900 μm pa običajno govedo, mlajše od pet let (14). Zato se oči goveda, starejšega od 60 mesecev, običajno ne uporabljajo. Oči goveda, mlajšega od 12 mesecev, se običajno prav tako ne uporabljajo, saj še niso popolnoma razvite, debelina in premer roženice pa sta bistveno manjša kot pri očeh starejšega goveda. Kljub temu se lahko uporabljajo roženice mladih živali (tj. starih od šest do 12 mesecev), saj ima njihova uporaba nekatere prednosti, npr. večja razpoložljivost, manjši starostni razpon in manjša nevarnost izpostavljenosti goveji spongiformni encefalopatiji za osebje klavnice (15). Ker bi bilo nadaljnje ocenjevanje učinka, ki ga imata velikost in debelina roženice na odzivnost jedkih in zelo dražilnih snovi za oči, koristno, se uporabnike spodbuja, da sporočijo približno starost in/ali težo živali, katerih roženice so uporabili v študiji.
Odvzem in prevoz oči v laboratorij
15. Oči odvzame osebje klavnice. Da bi čim bolj zmanjšali mehanske in druge vrste poškodb oči, jih morajo odvzeti takoj po zakolu. Da oči ne bi bile izpostavljene potencialno dražilnim snovem, osebje klavnice pri spiranju glav živali ne sme uporabljati detergentov.
16. Oči je treba dati v dovolj veliko posodo, jih preliti s Hanksovo uravnoteženo raztopino soli (HBSS) in prepeljati v laboratorij tako, da se njihovo stanje čim manj poslabša in/ali da ne pride do bakterijske okužbe. Ker se oči odvzamejo med zakolom, lahko pridejo v stik s krvjo in drugimi biološkimi snovmi, vključno z bakterijami in drugimi mikroorganizmi. Zato mora biti tveganost okužbe čim manjša (tj. posoda, v kateri so oči, se mora hraniti na mokrem ledu, HBSS, ki se uporablja za hrambo oči med prevozom, pa je treba dodati antibiotike [tj. 100 IU/mL penicilina in 100 μg/mL streptomicina]).
17. Čas med odvzemom oči in uporabo roženic mora biti pri BCOP čim krajši (običajno se odvzamejo in uporabijo isti dan) in ne sme vplivati na zanesljivost testnih rezultatov. Ti temeljijo na merilih za izbor oči ter pozitivnih in negativnih kontrolnih reakcijah. Vsa očesa, uporabljena v preskusu, morajo pripadati isti skupini oči, odvzeti na določen dan.
Merila za izbor oči za uporabo pri testu BCOP
18. Po prihodu v laboratorij se oči skrbno pregledajo, ali so poškodovane, vključno s povečano motnjavo, praskami in neovaskularizacijo. Uporabljajo se lahko samo roženice nepoškodovanih oči.
19. Kakovost vsake roženice se oceni tudi v poznejši fazi preskusa. Roženice z motnjavo več kot sedem enot motnjave (OPOMBA: opacitometer je treba kalibrirati v skladu s standardi za določevanje enot motnjave, glej dodatek 3) je treba po enournem kalibriranju izločiti.
20. Vsaka testna skupina (testna snov, primerjalne negativne in pozitivne kontrole) je sestavljena iz najmanj treh oči. Pri preskusu BCOP je treba za negativno kontrolo uporabiti tri roženice. Ker se roženice odstranijo s celotnega zrkla in pritrdijo v držala za roženice, se lahko zaradi artefaktov, ki nastanejo zaradi prijemanja, vrednosti motnjave in prepustnosti v posameznih primerih spremenijo (tudi pri negativni kontroli). Poleg tega se vrednosti motnjave in prepustnosti roženic z negativno kontrolno reakcijo uporabljajo za korigiranje vrednosti motnjave in preglednosti predmeta testiranja in pozitivnih kontrolnih vzorcev pri izračunih IVIS.
POSTOPEK
Priprava oči
21. Nepoškodovane roženice se secirajo tako, da se ohrani 2 do 3 mm širok rob beločnice, kar olajša nadaljnje ravnanje, pri čemer je treba paziti, da se epitelij in endotelij roženice ne poškodujeta. Izolirane roženice se pritrdijo v posebej za to izdelana držala, sestavljena iz sprednjega in zadnjega dela držala, na katera je roženica pripeta z epitelno oziroma endotelno stranjo. Oba dela držala se do roba napolnita z ogretim Eaglovim minimalnim osnovnim medijem EMEM (najprej zadnji del držala), pri čemer je treba zagotoviti, da se ne tvorijo mehurčki. Naprava se nato ekvilibrira pri 32 ± 1 °C najmanj eno uro, da se roženice ekvilibrirajo z medijem in da se doseže čim bolj normalna presnova (približna temperatura na površini roženice znaša in vivo 32 °C).
22. Po ekvilibriranju se v oba dela držala doda svež, ogret medij EMEM, za vsako roženico pa se zabeležijo izhodiščne vrednosti motnjave. Roženice z makroskopskimi poškodbami tkiva (npr. praskami, pigmentacijo, neovaskularizacijo) ali motnjavo, večjo od sedem enot, se zavržejo. Nato se izračuna povprečna motnjava vseh ekvilibriranih roženic. Za negativno kontrolo (ali kontrolo s topilom) se izberejo najmanj tri roženice, katerih motnjava je blizu povprečni motnjavi vseh roženic. Preostale roženice se nato razdelijo na skupino za nadaljnje testiranje in skupino za pozitivne kontrole.
23. Ker je toplotna kapaciteta vode večja od zraka, zagotavlja voda stabilnejše temperaturne pogoje za inkubacijo. Zato se priporoča, da se držalo za roženico in njegova vsebina hranita v vodni kopeli pri 32 ± 1 °C. Lahko se uporabljajo tudi inkubatorji za vzdrževanje temperature zraka, če zagotavljajo stabilno temperaturo (tj. s predčasnim segrevanjem držal in medijev).
Uporaba testne snovi
24. Vodita se dva različna testna protokola - eden za tekočine in površinsko aktivne snovi (trdne snovi ali tekočine) ter eden za površinsko neaktivne snovi (trdne snovi).
25. Tekočine se testirajo nerazredčene, medtem ko se površinsko aktivne snovi testirajo v 10-odstotni koncentraciji w/v in 0,9-odstotni raztopini natrijevega klorida, destilirani vodi ali drugem topilu, za katerega je dokazano, da nima škodljivih učinkov na testni sistem. Poltrdne snovi, kreme in voski se navadno testirajo kot tekočine. Če se uporabljajo druge koncentracije raztopin, jih je treba ustrezno utemeljiti. Roženice so izpostavljene tekočinam in površinsko aktivnim snovem 10 minut. Če je čas izpostavljenosti drugačen, ga je treba ustrezno znanstveno utemeljiti.
26. Površinsko neaktivne trdne snovi se navadno testirajo kot 20-odstotne raztopine ali suspenzije v 0,9-odstotni raztopini natrijevega klorida, destilirani vodi ali drugem topilu, za katerega je dokazano, da nima škodljivih učinkov na testni sistem. V določenih okoliščinah in če je znanstveno utemeljeno, se lahko trdne snovi testirajo tudi nerazredčene z neposredno aplikacijo na površino roženice, pri čemer se uporablja odprta metoda (glej točko 29). Roženice so izpostavljene trdnim snovem štiri ure; če je znanstveno utemeljeno, se lahko tako kot pri tekočinah in površinsko aktivnih snoveh čas izpostavljenosti spremeni.
27. Uporabljajo se lahko različne testne metode, odvisno od fizikalnih in kemijskih lastnosti testne snovi (tj. trdna, tekoča, viskozna ali neviskozna tekočina). Najpomembnejše je zagotoviti, da testna snov dovolj dobro pokriva epitelno površino in da se med spiranjem ustrezno odstrani. Zaprta metoda se navadno uporablja za neviskozne do nekoliko viskozne testne snovi, medtem ko se odprta metoda navadno uporablja za polviskozne in viskozne tekoče testne tekočine in nerazredčene trdne snovi.
28. Pri zaprti metodi se prek dozirnih odprtin na zgornji površini v sprednji del držala doda toliko testne snovi (750 μL), da ta prekrije epitelno stran roženice, odprtine pa se nato za čas izpostavljenosti zatesnijo s tesnilnimi čepki. Treba je zagotoviti, da je vsaka roženica testni snovi izpostavljena dovolj dolgo.
29. Pri odprti metodi se pred testiranjem s sprednjega dela držala odstranita obroček za zapiranje okenca in stekleno okence. Kontrolna ali testna snov (750 μL ali dovolj testne snovi, da je prekrita celotna roženica) se aplicira neposredno na epitelno površino roženice z mikropipeto. Če se testna snov težko pipetira, se lahko za lažje doziranje testno snov nanese s pipeto za neposredno izpodrivanje tlaka. Konica pipete za neposredno izpodrivanje tlaka se vstavi v dozirno konico brizgalke, da se material napolni v konico za izpodrivanje pod tlakom. Če se potisni bat počasi sprošča, se vlečni bat pipete pomakne navzgor. Če se v konici pipete začnejo tvoriti zračni mehurčki, se predmet testiranja odstrani (izvrže) in postopek ponovi, dokler konica ni polna in v njej ni zračnih mehurčkov. Po potrebi se lahko uporabi običajna brizgalka (brez igle), saj omogoča merjenje natančne količine testne snovi in lažjo aplikacijo na epitelno površino roženice. Po doziranju se na sprednji del držala ponovno namesti stekleno okence in tako ponovno ustvari zaprt sistem.
Inkubacija po izpostavljenosti
30. Po izpostavljenosti se testna snov, snov za negativno kontrolo ali snov za pozitivno kontrolo odstrani iz sprednjega dela držala, epitelij pa se najmanj trikrat (oziroma dokler testna snov ni več vidna) spere z EMEM (ki vsebuje fenol rdeče). Za spiranje se uporablja medij, ki vsebuje fenol rdeče, saj se lahko s spreminjanjem barv v fenol rdečem nadzoruje, ali je bilo spiranje kislih ali alkalnih materialov učinkovito. Če je fenol rdeče še vedno obarvano (rumeno ali vijoličasto) ali če je testna snov še vedno vidna, se roženice sperejo več kot trikrat. Ko v mediju ni več testne snovi, se roženice še zadnjič sperejo z EMEM (brez fenol rdečega). EMEM (brez fenol rdečega) se uporabi pri zadnjem spiranju, da se zagotovi, da je bilo fenol rdeče odstranjeno iz sprednjega dela držala pred merjenjem motnjave. Nato se sprednji del držala ponovno napolni s svežim EMEM brez fenol rdečega.
31. Pri tekočinah ali površinsko aktivnih snoveh se roženice po spiranju dajo v inkubator še za dve dodatni uri pri 32 ± 1 °C. V določenih okoliščinah je po izpostavljenosti koristna tudi daljša inkubacija, vendar je to odvisno od vsakega posameznega primera. Roženice, ki se testirajo s trdnimi snovmi, se po štirih urah izpostavljenosti temeljito sperejo, vendar pri njih nadaljnja inkubacija ni potrebna.
32. Po končani inkubaciji, ki sledi izpostavljenosti (pri tekočinah in površinsko aktivnih snoveh), oziroma po koncu štiriurne izpostavljenosti (pri površinsko neaktivnih trdnih snoveh) se zabeležita motnjava in prepustnost vsake roženice. Poleg tega se vsaka roženica pregleda vizualno in zabeležijo vsa pomembnejša opažanja (npr. lupljenje tkiva, prisotnost preostale testne snovi, neenotni vzorci motnjave). Ta opažanja so lahko pomembna, saj se lahko odražajo v odklonih, ki jih izmeri opacitometer.
Kontrolne snovi
33. Vsak poskus vključuje primerjalno negativno kontrolo ali kontrolo s topilom/vehiklom ter pozitivno kontrolo.
34. Pri testiranju 100-odstotne tekoče snovi se v testno metodo BCOP vključi primerjalna negativna kontrola (npr. 0,9-odstotna raztopina natrijevega klorida ali destilirane vode), da se ugotovijo nespecifične spremembe testnega sistema in zagotovijo izhodiščne vrednosti za končne točke preskusa. Ta kontrola tudi zagotavlja, da preskusni pogoji ne povzročajo dražilnih reakcij.
35. Pri testiranju razredčene tekočine, površinsko aktivne ali trdne snovi se v testno metodo BCOP vključi primerjalna kontrolna skupina s topilom/vehiklom, da se ugotovijo nespecifične spremembe testnega sistema in zagotovijo izhodiščne vrednosti za končne točke preskusa. Uporablja se lahko samo topilo/vehikel, za katerega je dokazano, da nima škodljivih učinkov na testni sistem.
36. Pri vsakem poskusu se kot primerjalna pozitivna kontrola vključi tudi znana dražilna snov za oči, da se zagotovi, da se sproži želena reakcija. Ker se pri tej testni metodi preskus BCOP uporablja za ugotavljanje jedkih ali zelo dražilnih snovi za oči, mora biti referenčna snov pri pozitivni kontroli snov, ki pri tej testni metodi povzroči močno reakcijo. Da se zagotovi, da se odkloni pri reakcijah pozitivne kontrole ocenjujejo v daljšem obdobju, stopnja dražilnega učinka ne sme biti prevelika.
37. Primera pozitivnih kontrol za tekoče testne snovi sta dimetilformamid ali 1-odstoten natrijev hidroksid. Primer pozitivne kontrole za trdno testno snov je 20-odstoten w/v imidazol v 0,9-odstotni raztopini natrijevega klorida.
38. Primerjalne snovi so primerne za ocenjevanje potencialnih dražilnih učinkov, ki jih imajo neznane kemikalije določenega kemijskega ali proizvodnega razreda na oči, ali za ocenjevanje relativnega potencialnega draženja dražilne snovi za oko v določenem razponu dražilnih reakcij.
Merjene končne točke
39. Motnjava je odvisna od količine svetlobe, ki prodre skozi roženico. Motnjava roženice se meri kvantitativno s pomočjo opacitometra, pri čemer se meri neprekinjeno.
40. Prepustnost je odvisna od količine barvila natrijevega fluoresceina, ki prodre skozi vse celične sloje roženice (tj. od epitelija na zunanji površini roženice do endotelija na notranji površini roženice). V sprednji del držala za roženico, na katerega je pripeta epitelna stran roženice, se doda 1 mL raztopine natrijevega fluoresceina (4 ali 5 mg/mL pri testiranju tekočin in površinsko aktivnih snovi oziroma površinsko neaktivnih snovi), medtem ko se zadnji del držala, na katerega je pripeta endotelna stran roženice, napolni s svežim EMEM. Držalo se nato da v inkubator v vodoravnem položaju za 90 ± 5 minut pri 32 ± 1 °C. Količina natrijevega fluoresceina, ki prodre v zadnji del držala, se meri kvantitativno s pomočjo spektrofotometrije UV/VIS. Spektrofotometrične meritve pri 490 nm se beležijo kot neprekinjeno merjene vrednosti optične gostote (OD490) ali absorbance. Prepustnost fluorosceina se določa z vrednostmi OD490, ki so bile izmerjene s spektrofotometrom vidne svetlobe pri standardni dolžini poti 1 cm.
41. Namesto spektrofotometra se lahko uporablja tudi čitalec 96-mestnih mikrotiterskih plošč, pod pogojem, da: (i) se lahko določi linearno merilno območje čitalca za določevanje vrednosti fluroesceina OD490 in (ii) če se v 96-mestni mikrotiterski plošči uporablja dovolj veliko vzorcev fluoresceina, da se zagotovijo vrednosti OD490, ki ustrezajo standardni dolžini poti 1 cm (za to so lahko potrebne popolnoma napolnjene posode [navadno 360 μL]).
PODATKI IN POROČANJE
Ocenjevanje podatkov
42. Po korigiranju vrednosti motnjave in povprečne prepustnosti (OD490) za vrednosti ozadja za motnjavo in vrednosti prepustnosti negativne kontrole OD490 se vrednosti povprečne motnjave in prepustnosti OD490 za vsako testno skupino združijo v empirično izpeljani formuli, s katero se izračuna vrednost draženja in vitro (IVIS) za vsako testno skupino, kot sledi:
IVIS = povprečna vrednost motnjave + (15 × povprečna vrednost prepustnosti OD490)
Po Sini et al. (16) je bila ta formula izpeljana na podlagi laboratorijskih in medlaboratorijskih študij. Podatki, zbrani med multilaboratorijsko študijo za 36 spojin, so bili ocenjeni z multivariantno analizo, s katero se je določila najustreznejša enačba za primerjanje podatkov in vivo ter in vitro. Analizo so opravili znanstveniki dveh različnih podjetij in izpeljali skoraj identični enačbi.
43. Vrednosti motnjave in prepustnosti je treba oceniti tudi neodvisno, da se ugotovi, ali testna snov skozi eno od dveh končnih točk učinkuje jedko ali zelo dražilno (glej merila za odločanje).
Merila za odločanje
44. Snov z IVIS ≥ 55,1 velja za jedko ali zelo dražilno snov. Kot je navedeno pod točko 1, je treba testno snov, ki ni opredeljena kot jedka ali zelo dražilna za oči, zaradi razvrščanja in označevanja dodatno testirati. V primerjavi s podatki testne metode in vivo na očeh zajcev, razvrščenih po sistemih za razvrščanje EPA (1), EU (2) ali GHS (3), je splošna natančnost testne metode BCOP 79-odstotna (113/143) do 81-odstotna (119/147), delež lažno pozitivnih rezultatov 19-odstoten (20/103) do 21-odstoten (22/103) ter delež lažno negativnih rezultatov 16-odstoten (7/43) do 25-odstoten (10/40). Če se iz podatkovne zbirke izključijo snovi določenega kemijskega (npr. alkoholi, ketoni) ali fizikalnega razreda, je natančnost testa BCOP po sistemih za razvrščanje EU, EPA in GHS 87-odstotna (72/83) do 92-odstotna (78/85), delež lažno pozitivnih rezultatov 12-odstoten (7/58) do 16-odstoten (9/56) ter delež lažno negativnih rezultatov 0-odstoten (0/27) do 12-odstoten (3/26).
45. Tudi če jedke ali zelo dražilne testne snovi za oči ni mogoče razvrstiti, so lahko podatki, pridobljeni z BCOP in testom in vivo na očeh zajcev ali primerno validiranim testom in vitro, koristni za nadaljnje ocenjevanje primernosti in omejitev testne metode BCOP za določanje nejedkih in ne zelo dražilnih snovi (trenutno se pripravljajo smernice za uporabo testnih metod in vitro za ugotavljanje toksičnosti za oči).
Merila za sprejemljivost študije
46. Test se šteje za sprejemljivega, če je pri pozitivni kontroli vrednost IVIS znotraj dveh standardnih odklonov veljavne povprečne vrednosti iz preteklih testov, ki jo je treba posodobiti najmanj vsake tri mesece oziroma vedno, kadar opravljajo test laboratoriji, ki redko opravljajo teste (tj. manj kot enkrat mesečno). Reakcije negativne kontrole s topilom/vehiklom morajo dati vrednosti motnjave in prepustnosti, ki so manjše od veljavnih zgornjih omejitev vrednosti ozadja za motnjavo in prepustnosti roženic goveda, testiranih z zadevnimi negativnimi kontrolami ali kontrolami s topilom/vehiklom.
Poročilo o testu
47. V poročilu o testu je treba navesti naslednje informacije (če so pomembne za izvedbo študije):
testne in kontrolne snovi
kemijska imena in strukturno ime Službe za izmenjavo kemijskih izvlečkov (CAS), ki jim sledijo druga imena, če so znana;
registrska številka CAS (RN), če je znana;
čistost in sestava snovi ali zmesi (v težnostnih odstotkih), če so te informacije na voljo;
fizikalno-kemijske lastnosti, pomembne za izvedbo študije, npr. fizikalno stanje, hlapnost, pH vrednost, stabilnost, kemijski razred, topnost v vodi;
obdelava testnih/kontrolnih snovi pred testiranjem, če je pomembna (npr. segrevanje, mletje);
stabilnost, če je znana.
podatki o naročniku in testnem laboratoriju
ime in naslov naročnika, testnega laboratorija in vodje študije;
podatki o viru oči (tj. obrat, v katerem so bili odvzeti);
pogoji za hrambo in prevoz oči (tj. dan in čas odvzema oči, čas pred prvim testiranjem, prevozna sredstva in temperaturni pogoji, morebitno uporabljeni antibiotiki);
posebne lastnosti živali, katerim so bili odvzete oči, če so znane (tj. starost, spol, teža živali donatorke).
utemeljitev testne metode in uporabljenega protokola
celovitost testne metode
postopek za zagotavljanje celovitosti (tj. natančnosti in zanesljivosti) testne metode v daljšem časovnem obdobju (npr. redno testiranje snovi za preverjanje sposobnosti, uporaba podatkov o negativni in pozitivni kontroli iz preteklih testov).
merila za sprejemljivost testa
sprejemljiva primerjalna pozitivna in negativna kontrola na podlagi podatkov iz preteklih testov;
sprejemljiva primerjalna pozitivna in negativna kontrola na podlagi podatkov iz preteklih testov.
testni pogoji
opis uporabljenega testnega sistema;
vrsta uporabljenega držala za roženico;
podatki o kalibriranju naprav za merjenje motnjave in prepustnosti (npr. opacitometer in spektrofotometer);
podatki o uporabljenih roženicah goveda, vključno z izjavami o njihovi kakovosti;
podrobnosti o uporabljenem testnem postopku;
uporabljene koncentracije testne snovi;
opis vseh sprememb testnega postopka;
sklic na modelne podatke iz preteklih testov (tj. negativna in pozitivna kontrola, snovi za preverjanje sposobnosti, primerjalne snovi);
opis uporabljenih meril za ocenjevanje.
rezultati
tabele s podatki iz posameznih testnih vzorcev (npr. vrednosti motnjave in OD490 ter izračunane vrednosti IVIS za testno snov ter pozitivne, negativne in primerjalne kontrole [če so bile upoštevane], vključno s podatki iz ponovitev poskusa v dvojniku, če so bile opravljene, ter povprečne vrednosti ± standardni odklon pri vsakem poskusu);
opis drugih opaženih učinkov;
razprava o rezultatih
sklepne ugotovitve.
LITERATURA
(1) U.S. EPA (1996). Label Review Manual: 2nd Edition. EPA737-B-96-001. Washington, DC: U.S. Environmental Protection Agency.
(2) Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directive 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No. 1907/2006. OJ L 353, 31.12.2008, p. 1.
(3) UN (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Second revised edition, New York & Geneva: United Nations Publications, 2007.Available:
[http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html]
(4) ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Available:
[http://ecvam.jrc.it/index.htm]
(5) ICCVAM (2007). Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Available:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(6) Regulation (EC) No 1907/2006 of the European Parliament and of the Council of 18 December 2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC. OJ L 396, 30.12.2006, p. 1.
(7) OECD (2002). Test Guideline 405. OECD Guideline for Testing of Chemicals. Acute eye irritation/corrosion. Available:
[http://www.oecd.org/document/40/0,2340,en_2649_34377_37051368_1_1_1_1,00.html]
(8) ICCVAM (2007). ICCVAM Recommended BCOP Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Available:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(9) ICCVAM. (2006). Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability Test Method. NIH Publication No.: 06-4512. Research Triangle Park: National Toxicology Program. Available:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_ice.htm]
(10) INVITTOX (1999). Protocol 124: Bovine Corneal Opacity and Permeability Assay – SOP of Microbiological Associates Ltd. Ispra, Italy: European Centre for the Validation of Alternative Methods (ECVAM).
(11) Gautheron, P., Dukic, M., Alix, D. and Sina, J.F. (1992). Bovine corneal opacity and permeability test: An in vitro assay of ocular irritancy. Fundam. Appl. Toxicol. 18:442-449.
(12) Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Available:
[http://www.cdc.gov/ncidod/dhqp/pdf].
(13) Maurer, J.K., Parker, R.D. and Jester, J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
(14) Doughty, M.J., Petrou, S. and Macmillan, H. (1995). Anatomy and morphology of the cornea of bovine eyes from a slaughterhouse. Can. J. Zool. 73:2159-2165.
(15) Collee, J. and Bradley, R. (1997). BSE: A decade on - Part I. The Lancet 349: 636-641.
(16) Sina, J.F., Galer, D.M., Sussman, R.S., Gautheron, P.D., Sargent, E.V., Leong, B., Shah, P.V., Curren, R.D., and Miller, K. (1995). A collaborative evaluation of seven alternatives to the Draize eye irritation test using pharmaceutical intermediates. Fundam Appl Toxicol 26:20-31.
(17) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Available:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
(18) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye (ICE) Test Method. Na voljo:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
Dodatek 1
OPREDELITVE
Natančnost : stopnja ujemanja testnih rezultatov s priznanimi referenčnimi vrednostmi. Je merilo učinkovitosti testne metode in eden od vidikov „ustreznosti“. Ta izraz in izraz „skladnost“ se pogosto izmenično uporabljata in pomenita delež pravilnih rezultatov testne metode.
Primerjalna snov : snov, ki se uporablja kot standard za primerjavo s testno snovjo. Primerjalna snov mora imeti naslednje lastnosti: (i) trajen in zanesljiv vir; (ii) strukturno in funkcijsko podobnost z razredom testiranih snovi; (ii) znane fizikalne/kemijske lastnosti; (iv) spremni podatki o znanih učinkih in (v) znana potenca v razponu želene reakcije.
Roženica : prozoren sprednji del zrkla, ki pokriva šarenico in zenico ter skozi katerega vstopa svetloba.
Motnjava roženice : merjenje stopnje motnjave roženice po izpostavljenosti testni snovi. Povečana motnjava roženice pomeni, da je roženica poškodovana. Motnjava se lahko ocenjuje subjektivno kot pri Dreizovem testu na očeh zajcev ali objektivno z inštrumentom, kot je „opacitometer“.
Prepustnost roženice : kvantitativna vrednost poškodovanega epitelija roženice, izmerjena z določanjem količine barvila natrijevega fluoresceina, ki prodre skozi vse celične plasti roženice.
EPA kategorija 1 : jedka snov (ireverzibilno uničenje očesnega tkiva), ki poškoduje ali draži roženico več kot 21 dni (1).
EU kategorija R41 : poškodba očesnega tkiva ali resno fizično poslabšanje vida po aplikaciji testne snovi na sprednjo površino očesa, ki po 21 dneh aplikacije ni popolnoma reverzibilna (2).
Delež lažno negativnih rezultatov : delež vseh pozitivnih snovi, ki jih testna metoda prikaže kot lažno negativne. To je eden od kazalnikov učinkovitosti testne metode.
Delež lažno pozitivnih rezultatov : delež vseh negativnih snovi, ki jih testna metoda prikaže kot lažno negativne. To je eden od kazalnikov učinkovitosti testne metode.
GHS (Globalno usklajeni sistem za razvrščanje in označevanje kemikalij) : sistem za razvrščanje kemikalij (snovi in zmesi) s pomočjo standardiziranih vrst in stopenj fizikalnih, zdravstvenih in okoljskih nevarnosti ter za označevanje z npr. piktogrami, opozorilnimi besedami, izjavami o nevarnosti, varnostnimi izjavami in varnostnimi listi z namenom razširjanja informacij o škodljivih učinkih kemikalij ter s tem zaščite ljudi (vključno z delodajalci, delavci, prevozniki, potrošniki in reševalci) in okolja (3).
GHS kategorija 1 : poškodba očesnega tkiva ali resno fizično poslabšanje vida po aplikaciji testne snovi na sprednjo površino očesa, ki po 21 dneh aplikacije ni popolnoma reverzibilna (3).
Nevarnost : neločljiva lastnost snovi ali stanja, ki lahko ob izpostavljenosti tej snovi škodljivo učinkuje na organizem, sistem ali (pod)populacijo.
Vrednost draženja in vitro (IVIS) : empirično izpeljana formula, ki se uporablja pri testu BCOP, pri kateri se povprečne vrednosti motnjave in prepustnosti za vsako testno skupino združijo v eno samo vrednost in vitro za vsako testno skupino. IVIS = povprečna vrednost motnjave + (15 x povprečna vrednost prepustnosti).
Negativna kontrola : netestirani dvojnik, ki vsebuje vse komponente testnega sistema. Ta vzorec se obdela z vzorci, testiranimi s testno snovjo, in drugimi kontrolnimi vzorci, da se ugotovi, ali topilo reagira s testnim sistemom.
Nedražilna snov : snovi, ki niso razvrščene v EPA kategorije I, II ali III; EU kategoriji R41 ali R36 ali GHS kategorije 1, 2A ali 2B dražilnih snovi za oči.
Jedka snovi za oči : (a) snov, ki povzroča ireverzibilno poškodbo očesnega tkiva; (b) snovi, ki so razvrščene v GHS kategorijo 1, EPA kategorijo I ali EU kategorijo R41 dražilnih snovi za oči (1) (2) (3).
Dražilna snov za oči : (a) snov, ki po aplikaciji na sprednjo površino očesa povzroči reverzibilno poškodbo očesa; (b) snovi, ki so razvrščene v EPA kategoriji II ali III, EU kategorijo R36 ali GHS kategoriji 2A ali 2B dražilnih snovi za oči (1) (2) (3).
Zelo dražilna snov za oči : (a) snov, ki po aplikaciji na sprednjo površino očesa povzroči poškodbo tkiva, ki po 21 dneh po aplikaciji ne izgine oziroma resno fizično poslabša vid; (b) snovi, ki so razvrščene v GHS kategorijo 1, EPA kategorijo I ali EU kategorijo R41 dražilnih snovi za oči (1) (2) (3).
Opacitometer : inštrument za merjenje motnjave roženice, ki kvantitativno ocenjuje prenos svetlobe skozi roženico. Navadno ima dva dela, ki imata vsak svoj vir svetlobe in fotocelico. En del se uporablja za testirano roženico, drugi za kalibriranje in nastavitev inštrumenta na vrednost nič. Svetloba halogene svetilke se skozi kontrolni del (prazen del brez okenc ali tekočine) usmeri v fotocelico in primerja s svetlobo, usmerjeno v fotocelico skozi testni del, v katerem je del z roženico. Primerja se razlika v preneseni svetlobi iz fotocelic, na digitalnem ekranu pa se prikaže numerična vrednost motnjave.
Pozitivna kontrola : dvojnik, ki vsebuje vse komponente testnega sistema in se testira s snovjo, za katero je znano, da sproži pozitivno reakcijo. Da se zagotovi, da se odkloni pri reakciji pozitivne kontrole ocenjujejo v daljšem časovnem obdobju, stopnja reakcije ne sme biti prevelika.
Zanesljivost : stopnja reproduktivnosti testne metode v laboratorijih in med njimi v določenem časovnem obdobju pri uporabi istega protokola. Oceni se z izračunom laboratorijske in medlaboratorijske reproduktivnosti in ponovljivosti.
Kontrola s topilom/vehiklom : netestirani vzorec, ki vsebuje vse komponente testnega sistema, vključno s topilom ali vehiklom, ki se obdela z vzorci, testiranimi s testno snovjo, in drugimi kontrolnimi vzorci, da se določi izhodiščna reakcija za vzorce, testirane s testno snovjo in raztopljene v istem topilu ali vehiklu. Pri testiranju s primerjalno negativno kontrolo ta vzorec tudi pokaže, ali topilo oziroma vehikel reagira s testnim sistemom.
Stopenjsko testiranje : stopenjska testna strategija, pri kateri se v posebnem vrstnem redu pregledajo vse informacije o testni snovi, pri čemer se na vsaki stopnji uporabi teža dokazov, da se določi, ali je na voljo dovolj informacij za razvrstitev snovi med nevarne snovi, preden se preide na naslednjo stopnjo. Če se lahko na podlagi razpoložljivih informacij določi potencialno draženje snovi, dodatno testiranje ni potrebno. Če na podlagi razpoložljivih informacij potencialnega draženja testne snovi ni mogoče določiti, se opravi postopno sekvenčno testiranje na živalih, dokler ni mogoča jasna razvrstitev.
Validirana testna metoda : testna metoda, za katero sta bili na podlagi validacijskih študij določeni primernost (vključno z natančnostjo) in zanesljivost za določen namen. Treba je opozoriti, da natančnost in zanesljivost validirane testne metode nista nujno zadostni, da bi bili sprejemljivi za predlagani namen.
Teža dokazov : proces preučevanja prednosti in slabosti različnih informacij z namenom sprejetja zaključka o potencialni nevarnosti snovi in njegovi utemeljitvi.
Dodatek 2
Snovi za preverjanje usposobljenosti za testno metodo BCOP
Preden lahko začnejo laboratoriji redno uporabljati testno metodo, ki izpolnjuje zahteve te testne metode, morajo dokazati tehnično usposobljenost tako, da deset priporočenih snovi iz tabele 1 pravilno razvrstijo glede na njihov dražilni učinek na oči. Te snovi so bile izbrane, ker predstavljajo razpon reakcij lokalnega draženja/razjedanja očesa, ki temelji na rezultatih testa in vivo na očeh zajcev (TG 405) (tj. kategorije 1, 2A, 2B ali snovi, ki niso razvrščene in označene v skladu z UN GHS (3) (7)). Vendar se lahko zaradi validirane primernosti teh preskusov (tj. izključno za določevanje jedkih in zelo dražilnih snovi za oči) usposobljenost dokaže samo z dvema testnima rezultatoma, na podlagi katerih je mogoča razvrstitev (jedka/zelo dražilna snov ali nejedka/nedražilna snov). Druga merila za izbor snovi so bila, da so te dostopne na trgu, da so na voljo visokokakovostni referenčni podatki in vivo in visokokakovostni podatki, pridobljeni z dvema metodama in vitro, za kateri se pripravljajo smernice. Zaradi tega so bile dražilne snovi izbrane iz priporočenega seznama ICCVAM, ki vsebuje 122 referenčnih snovi za validacijo testnih metod in vitro za ugotavljanje toksičnosti za oči (glej dodatek H: ICCVAM - Priporočene referenčne snovi) (5). Referenčni podatki so zbrani v dokumentih ICCVAM o pregledu ozadja testne metode BCOP in testne metode ICE na izoliranih očeh piščancev (17) (18).
Tabela 1
Priporočene snovi za ugotavljanje tehnične usposobljenosti za BCOP
|
Snov |
Št. CAS |
Kemijski (1) razred |
Fizikalna oblika |
Razvrstitev in vivo (2) |
Razvrstitev in vitro (3) |
|
benzalkonijev klorid (5 %) |
8001-54-5 |
onijska spojina |
tekoča |
kategorija 1 |
jedka/zelo dražilna snov |
|
klorheksidin |
55-56-1 |
amin, amidin |
trdna |
kategorija 1 |
jedka/zelo dražilna snov |
|
dibenzoil-L-vinska kislina |
2743-38-6 |
karboksilna kislina, ester |
trdna |
kategorija 1 |
jedka/zelo dražilna snov |
|
imidazol |
288-32-4 |
heterociklična spojina |
trdna |
kategorija 1 |
jedka/zelo dražilna snov |
|
trikloroocetna kislina (30 %) |
76-03-9 |
karboksilna kislina |
tekoča |
kategorija 1 |
jedka/zelo dražilna snov |
|
2,6-diklorobenzoil klorid |
4659-45-4 |
kislinski halid |
tekoča |
kategorija 2A |
nejedka/lažje dražilna snov |
|
etil-2-metil acetoacetat |
609-14-3 |
keton, ester |
tekoča |
kategorija 2B |
nejedka/lažje dražilna snov |
|
amonijev nitrat |
6484-52-2 |
anorganska sol |
trdna |
kategorija 2A |
nejedka/lažje dražilna snov |
|
glicerol |
56-81-5 |
alkohol |
tekoča |
ni oznake |
nejedka/lažje dražilna snov |
|
n-heksan |
110-54-3 |
ogljikovodik (acikličen) |
tekoča |
ni oznake |
nejedka/lažje dražilna snov |
|
(1) Kemijski razredi so bili dodeljeni za vsako testno snov s standardnim sistemom za razvrščanje, ki temelji na sistemu MeSH (na voljo na http//www.nlm.nih.gov/mesh). (2) Na podlagi rezultatov, pridobljenih s testom in vivo na očeh zajcev (OECD TG 405), in ob upoštevanju UN GHS (3)(7). (3) Na podlagi rezultatov BCOP in ICE. Kratice: št. CAS = registrska številka Službe za izmenjavo kemijskih izvlečkov (CAS) |
|||||
Dodatek 3
DRŽALO ZA ROŽENICO ZA DOLOČANJE BCOP
1. Držala za roženico za BCOP so narejena iz intertnega materiala (npr. polipropilena). Sestavljena so iz dveh polovic (sprednjega in zadnjega dela) in dveh podobnih cilindričnih notranjih posodic. Prostornina vsake posodice je 5 mL in se konča s steklenim okencem, skozi katerega se beležijo vrednosti motnjave. Premer notranjih posodic je 1,7 cm, globina pa 2,2 cm ( 24 ). Tesnilni obroček na zadnjem delu držala preprečuje uhajanje. Roženice se z endotelno stranjo navzdol položijo na tesnilni obroček zadnjega dela držala, sprednji del držala pa se položi na epitelno stran roženice. Oba dela držala sta pritrjena s tremi vijaki iz nerjavečega materiala na zunanjih robovih vsakega dela. Na koncu vsakega dela držala je stekleno okence, ki se lahko odstrani za lažji dostop do roženice. Med steklenim okencem in delom držala je tesnilni obroček, ki preprečuje uhajanje. Skozi luknjici na vrhu vsakega dela držala se vnašajo in odstranjujejo medij in testne snovi. Med testiranjem in inkubacijo sta oba dela držala zaprta z gumijastimi čepki.
Glosar
Glass disc : steklena ploščica
PTFE-O-ring : tesnilni obroček PTFE
Refill : odprtina za polnjenje
Hanger : povezovalni element
Cap : čepek
Nut : varovalni obroček
O-ring : tesnilni obroček
Posterior compartment : zadnji del držala
Anterior compartment : sprednji del držala
Fixing screws : pritrdilni vijaki
OPACITOMETER
2. Opacitometer je naprava, ki meri prenos svetlobe. Svetloba halogene svetilke se skozi kontrolni del (prazen del brez okenc ali tekočine) usmeri v fotocelico in primerja s svetlobo, usmerjeno v fotocelico skozi testni del, v katerem je del z roženico. Nato se primerja razlika v svetlobi, ki se prenese iz fotocelic, na digitalnem ekranu pa se prikaže numerična vrednost motnjave. Enote motnjave so že določene.
3. Opacitometer naj bi prek izmerjenih vrednosti motnjave zagotovil linearno reakcijo, ki ustreza mejnim vrednostim, ki se uporabljajo v različnih sistemih za razvrščanje, opisanih v modelu za prognosticiranje (tj. do mejne vrednosti, ki določa jedkost/močno dražilnost). Da bodo izmerjene vrednosti do 75–80 enot motnjave linearne in natančne, je treba opacitometer kalibrirati s kalibratorji. Kalibratorji (neprepustne poliesterske folije) se namestijo v kalibracijski del (del za roženico, zasnovan posebej za kalibratorje) in beležijo na opacitometru. Kalibracijski del je zasnovan tako, da je oddaljenost kalibratorjev med svetlobo in fotocelico približno enaka kot oddaljenost roženic med merjenjem prepustnosti. Opacitometer se najprej kalibrira na 0 enot motnjave, pri čemer se uporablja kalibracijski del brez kalibratorja. Nato se tri različni kalibratorji en za drugim namestijo v kalibracijski del ter se meri prepustnost. Kalibratorji 1, 2 in 3 naj bi zagotovili vrednosti prepustnosti, ki ustrezajo vnaprej določenim vrednostim 75, 150 oziroma 225 enot motnjave ± 5 %.
B. 48 TESTNA METODA NA IZOLIRANIH OČEH PIŠČANCEV ZA UGOTAVLJANJE JEDKIH IN ZELO DRAŽILNIH SNOVI ZA OČI (ICE)
UVOD
1. Testna metoda na izoliranih očeh piščancev (ICE) je testna metoda in vitro, ki se pod določenimi pogoji in z določenimi omejitvami uporablja za razvrščanje snovi in zmesi med „jedke in zelo dražilne za oči“ (1) (2) (3). V tej testni metodi so zelo dražilne snovi tiste snovi, ki povzročajo poškodbe oči, ki se pri zajcu ohranijo najmanj 21 dni po aplikaciji. Čeprav testa in vivo na očeh zajcev ne more nadomestiti popolnoma, se test ICE priporoča kot del stopenjske testne strategije za regulativno razvrščanje in označevanje za posebna področja uporabe (4) (5). Testne snovi in zmesi (6), ki v tem preskusu dajo pozitiven rezultat, se lahko razvrstijo med jedke ali zelo dražilne snovi za oči, ne da bi bilo potrebno opraviti dodatno testiranje na zajcih. Snov z negativnim rezultatom testa bi bilo treba testirati na zajcih s pomočjo sekvenčne testne strategije, ki je določena v preskusni smernici OECD 405 (7) (poglavje B. 5 te priloge).
2. V tej testni metodi so opisani postopki za oceno potencialne jedkosti in močne dražilnosti testne snovi za oči glede na njeno sposobnost, da v izoliranem očesu piščanca povzroča toksičnost. Toksični učinki na roženico se merijo z: (i) kvalitativnim ocenjevanjem motnjave, (ii) kvalitativnim ocenjevanjem poškodbe epitelija po aplikaciji fluoresceina (zadrževanje fluoresceina), (iii) kvantitativnim ocenjevanjem povečane debeline (nabreklosti) in (iv) kvantitativnim ocenjevanjem makroskopske morfološke poškodbe na površini. Motnjava roženice, nabreklost in ocenjevanje poškodb po izpostavljenosti testni snovi se najprej ocenijo posamično in nato združijo, da se lahko določi stopnja dražilnosti očesa.
3. S testno metodo ICE so bile testirane tudi dražilne snovi, ki povzročajo poškodbe oči, ki izginejo v manj kot 21 dneh, in nedražilne snovi. Vendar natančnost in zanesljivost testne metode ICE pri snoveh iz teh dveh kategorij nista bili ocenjeni formalno.
4. Opredelitve so navedene v dodatku 1.
ZAČETNI POMISLEKI IN OMEJITVE
5. Ta testna metoda temelji na protokolu (8) testne metode ICE Medagencijskega usklajevalnega odbora za validacijo alternativnih metod (ICCVAM), ki je bil pripravljen po mednarodni študiji o validaciji (4)(5)(9), pri kateri so sodelovali Evropski center za validacijo alternativnih metod (ECVAM), Japonski center za validacijo alternativnih metod (JaCVAM) ter Oddelek za toksikologijo in uporabno farmakologijo nizozemskega Inštituta za raziskave TNO. Protokol temelji na informacijah iz objavljenih protokolov ter protokolu, ki ga uporablja TNO (10) (11) (12) (13) (14).
6. Opredeljene omejitve za to testno metodo temeljijo na visokem številu lažno pozitivnih rezultatov za alkohole ter visokem številu lažno negativnih rezultatov za trdne in površinsko aktivne snovi (glej točko 47) (4). Če se snovi iz teh kemijskih in fizikalnih razredov izključijo iz podatkovne zbirke, se natančnost ICE v sistemih za razvrščanje EU, EPA in GHS bistveno izboljša (4). Pri tem preskusu (tj. za ugotavljanje izključno jedkih in zelo dražilnih snovi za oči) lažno negativni rezultati niso kritični, saj bi se take snovi nato preskušale na zajcih ali, odvisno od regulativnih zahtev, z drugimi ustrezno potrjenimi testi in vitro, pri katerih se uporablja sekvenčna testna strategija, ki temelji na teži dokazov. Poleg tega nekaterih kemijskih ali proizvodnih razredov (npr. zmesi) s trenutno validacijsko podatkovno zbirko ni bilo mogoče ustrezno oceniti. Vendar pa bi lahko preskuševalci to testno metodo uporabili pri vseh vrstah testnega materiala (tudi pri zmeseh), pri čemer bi bil pozitiven rezultat sprejemljiv kot indikator za jedko ali zelo dražilno snov za oči. Pozitivne rezultate, pridobljene z uporabo alkoholov, je treba razlagati previdno, saj obstaja tveganje, da so vanje vključeni tudi lažno pozitivni rezultati
7. Pri vseh postopkih na očesih piščancev je treba upoštevati veljavna pravila in postopke testnega urada o ravnanju s človeškim ali živalskim materialom, kamor spadajo med drugim tudi tkiva in tkivne tekočine. Priporočajo se splošni previdnostni ukrepi za laboratorije (15).
8. Čeprav testna metoda upošteva nekatere učinke na očesa, ocenjene s testno metodo za ugotavljanje dražilnih snovi na očeh zajcev, in do določene mere tudi njihovo resnost, je kljub temu omejena, saj ne upošteva poškodb veznice in šarenice. Čeprav tudi same reverzibilnosti poškodb roženice s testom ICE ni mogoče oceniti, je bilo na podlagi študij na očeh zajcev kljub temu predlagano, da se oceni prvotna globina poškodbe roženice ter tako razlikuje med ireverzibilnimi in reverzibilnimi učinki (16). Treba je tudi opozoriti, da s testno metodo ICE ni mogoče oceniti potencialne sistemske toksičnosti, povezane z izpostavljenostjo oči.
9. Trenutno potekajo prizadevanja za nadaljnjo karakterizacijo uporabnosti in omejitev testne metode ICE za ugotavljanje lažje dražilnih in nedražilnih snovi (glej tudi točko 48). Uporabnikom se priporoča, da organizacijam za validacijo zagotovijo vzorce in/ali podatke za uradno oceno morebitnih prihodnjih uporab testne metode ICE, vključno za ugotavljanje lažje dražilnih ali nedražilnih snovi za oči.
10. Laboratoriji, ki ta preskus opravljajo prvič, morajo uporabiti kemikalije za preverjanje usposobljenosti iz dodatka 2. Te kemikalije uporabijo, da dokažejo, da so tehnično sposobni izvajati testno metodo ICE, preden podatke o testu ICE predložijo za regulativno razvrstitev nevarnosti.
NAČELO TESTA
11. Testna metoda ICE je organotipski model, ki zagotavlja kratkoročno ohranjanje piščančjega očesa v in vitro. Pri tej testni metodi se poškodba, ki jo povzroči testna snov, oceni tako, da se določijo nabreklost roženice, njena prepustnost in zadrževanje fluorosceina. Medtem ko se zadnja parametra ocenjujeta kvalitativno, je treba nabreklost roženice oceniti kvantitativno. Vsaka meritev se pretvori v kvantitativen rezultat, ki se uporabi za izračun splošnega indeksa dražilnosti, ali pa se ji dodeli kvalitativna kategorija, ki se uporablja za razred jedkosti in močne dražilnosti za oči in vitro. Oba rezultata se lahko nato uporabita za predvidevanje jedkosti in močne dražilnosti testne snovi za oči in vivo (glej merila za odločanje).
Izvor in starost oči piščancev
12. Za ta preskus se običajno uporabljajo oči piščancev, ki so bili zaklani v klavnicah in namenjeni za človeško prehrano, kar pomeni, da poskusne živali niso potrebne. Uporabljajo se samo oči zdravih živali, primernih za vstop v prehransko verigo
13. Čeprav kontrolirana študija za ocenjevanje najprimernejše starosti piščancev ni bila opravljena, se pri tej testni metodi uporabljajo mladi piščanci, ki so bili zaklani v klavnicah (tj. piščanci, stari približno sedem tednov in težki od 1,5–2,5 kg).
Odvzem in prevoz oči v laboratorij
14. Glave se odstranijo neposredno po omamljanju piščancev, običajno z električnim šokom, in po izkrvavitvi zaradi prereza vratu. Piščanci se morajo nahajati v bližini laboratorija, tako da se njihove glave iz klavnice v laboratorij pripeljejo dovolj hitro, da se njihovo stanje čim manj poslabša in/ali da ne pride do bakterijske okužbe. Čas med odvzemom oči in uporabo glav piščancev mora biti pri testni metodi ICE čim krajši (navadno dve uri) in ne sme vplivati na zanesljivost rezultatov preskusa. Ti temeljijo na merilih za izbor oči ter pozitivnih in negativnih kontrolnih reakcijah. Vsa očesa, uporabljena v preskusu, morajo pripadati isti skupini oči, odvzeti na določen dan.
15. Ker se očesa secirajo v laboratoriju, se intaktne glave iz klavnice v laboratorij prepeljejo na sobni temperaturi v plastičnih posodah in navlažene s krpami, napojenimi z izotonično fiziološko raztopino.
Merila za izbor oči za test ICE
16. Oči z močno izhodiščno obarvanostjo s fluoresceinom (tj. > 0,5) ali motno roženico (tj. > 0,5) po izolaciji se zavržejo.
17. Vsaka testna skupina in primerjalna pozitivna kontrola sta sestavljeni iz najmanj treh oči. Za negativno kontrolo ali kontrolo s topilom (če se namesto fiziološke raztopine uporablja drugo topilo) se uporabi najmanj eno oko.
POSTOPEK
Priprava oči
18. Skrbno se odstranijo veke, pri čemer je treba paziti, da se roženica ne poškoduje. Celovitost roženice se hitro oceni tako, da se na njeno površino za nekaj sekund aplicira kapljica 2-odstotnega (w/v) natrijevega fluoresceina, površina pa se nato spere z izotonično fiziološko raztopino. Oči, ki jim je bil dodan fluorescein, se nato osvetlijo s špranjsko svetilko, da se roženica ne bi poškodovala (tj. zadrževanje fluoresceina in motnjava roženice ≤ 0,5).
19. Če je oko nepoškodovano, se izreže iz lobanje, pri čemer je treba paziti, da se roženica ne poškoduje. Zrklo se potegne iz očesne votline potegne tako, da se žmurka zagrabi s kirurškimi prijemalkami, očesne mišice pa se prerežejo z ukrivljenimi škarjami s topo konico. Tako se prepreči, da bi se roženica zaradi prevelikega tlaka poškodovala (tj. artefakti zaradi stisnjenja).
20. Ko se oko odstrani iz očesne votline, se ga mora še vedno držati viden del vidnega živca. Po odstranitvi iz očesne votline se oko položi na vpojno podlago, nato pa se odrežeta žmurka in preostalo vezno tkivo.
21. Izolirano oko se pritrdi v prijemalko iz nerjavečega materiala, pri čemer mora biti roženica v vodoravnem položaju. Prijemalka se nato prenese v komoro naprave za superfuzijo (16). Prijemalke je treba v napravi za superfuzijo namestiti tako, da je celotna roženica pokrita z izotonično fiziološko raztopino. Temperatura v komorah naprave za superfuzijo mora znašati 32 ± 1,5 °C. Dodatek 3 vsebuje diagram običajne naprave za superfuzijo z očesnimi prijemalkami, ki je na voljo na trgu, laboratoriji pa jo lahko izdelajo tudi sami. Naprava se lahko prilagodi potrebam posameznega laboratorija (tj. za sprejem različnega števila oči).
22. V napravi za superfuzijo se oči še enkrat pregledajo s špranjsko svetilko, da se zagotovi, da se med seciranjem niso poškodovale. Pri tem se z nastavkom za merjenje globine na špranjski svetilki na apeksu roženice izmeri tudi debelina roženice. Oči z (i) vrednostjo zadržanega fluoresceina > 0,5; (ii) motnjavo roženice > 0,5; ali (iii) dodatnimi znaki poškodb je treba zamenjati. Za oči, ki se na podlagi teh meril ne zavržejo, velja, da se kljub temu zavržejo, če debelina roženice za več kot 10 % odstopa od povprečne vrednosti vseh oči. Uporabniki morajo upoštevati, da lahko špranjske svetilke pri različnih širinah špranje za debelino roženice dajo različne merilne vrednosti. Širino špranje je treba nastaviti na 0,095 mm.
23. Po pregledu in izločitvi se oči dajo v inkubator za približno 45 do 60 minut, da se pred doziranjem ekvilibrirajo s testnim sistemom. Po ekvilibriranju se kot izhodiščna vrednost za debelino in motnjavo roženice zabeleži nična vrednost (tj. čas = 0). Vrednost fluoresceina, določena pri seciranju, se uporabi kot izhodiščna vrednost za končno točko.
Uporaba testne snovi
24. Po meritvi z ničnimi referenčnimi vrednostmi se oko (in držalo) odvzame iz naprave za superfuzijo in da v vodoravni položaj, nato pa se na roženico aplicira testna snov.
25. Tekoče testne snovi se običajno testirajo nerazredčene, lahko pa se po potrebi tudi razredčijo (tj. kot del koncepta študije). Najpogosteje se kot topilo pri razredčenih snoveh uporablja fiziološka raztopina. Pod kontrolnimi pogoji se lahko uporabljajo tudi druga topila, vendar je treba dokazati, da so primerna.
26. Tekoče testne snovi se aplicirajo na roženico tako, da je s testno snovjo enakomerno pokrita celotna površina roženice; standardna prostornina je 0,03 mL.
27. Če je mogoče, je treba trdne testne snovi čim bolj zdrobiti v terilnici s pestilom ali primerljivim orodjem za trenje. Prašek se aplicira na roženico tako, da je njena površina enakomerno pokrita s testno snovjo; standardna količina je 0,03 g.
28. Testna snov (tekoča ali trdna) se pusti učinkovati 10 sekund, nato pa se spere z očesa s fiziološko raztopino (približno 20 mL) pri sobni temperaturi. Oko (in držalo) se nato ponovno da v napravo za superfuzijo v prvotnem pokončnem položaju.
Kontrolne snovi
29. Vsak poskus vključuje primerjalno negativno kontrolo ali kontrolo s topilom/vehiklom ter pozitivne kontrole.
30. Pri testiranju 100-odstotnih tekočin ali trdnih snovi se kot primerjalna negativna kontrola pri testni metodi ICE uporablja fiziološka raztopina, da se ugotovijo nespecifične spremembe testnega sistema in da preskusni pogoji ne povzročajo neustreznih dražilnih reakcij.
31. Pri testiranju razredčenih tekočin se v testno metodo vključi primerjalna kontrolna skupina s topilom/vehiklom, da se ugotovijo nespecifične spremembe testnega sistema in da preskusni pogoji ne povzročajo dražilnih reakcij. Kot je navedeno v točki 25, se lahko uporablja samo topilo/vehikel, za katerega je dokazano, da nima škodljivih učinkov na testni sistem.
32. Pri vsakem poskusu se kot primerjalna pozitivna kontrola vključi tudi znana dražilna snov za oči, da se zagotovi, da se sproži želena reakcija. Ker se pri tej testni metodi preskus ICE uporablja za ugotavljanje jedkih ali zelo dražilnih snovi, mora biti referenčna snov pri pozitivni kontroli snov, ki pri tej testni metodi povzroči močno reakcijo. Da se zagotovi, da se odkloni pri reakciji pozitivne kontrole ocenjujejo v daljšem časovnem obdobju, stopnja močne reakcije ne sme biti prevelika. Za pozitivno kontrolo je treba zbrati dovolj podatkov o in vitro, da se lahko izračuna statistično določen sprejemljiv razpon pozitivne kontrole. Če za določeno pozitivno kontrolo ni na voljo ustreznih podatkov o testni metodi ICE iz preteklosti, je treba opraviti študije, v katerih se bodo ti podatki zbrali.
33. Primera pozitivnih kontrol za tekoče testne snovi sta 10-odstotna ocetna kislina ali 5-odstoten benzalkonijev klorid, primera pozitivnih kontrol za trdne testne snovi pa natrijev hidroksid in imidazol.
34. Primerjalne snovi so primerne za ocenjevanje potencialnih dražilnih učinkov, ki jih imajo neznane kemikalije določenega kemijskega ali proizvodnega razreda na oči, ali za ocenjevanje relativnega potencialnega draženja dražilne snovi za oko v določenem razponu dražilnih učinkov.
Merjene končne točke
35. Testirane roženice se ocenijo pred testiranjem in nato 30, 75, 120, 180 in 240 minut (± 5 minut) po spiranju, ki se opravi po testiranju. Ti časovni intervali omogočajo ustrezno število meritev med štiriurnim testiranjem in zagotavljajo dovolj časa, da se oči med posameznimi meritvami ustrezno pregledajo.
36. Končne točke, ki se ocenijo, so motnjava roženice, nabreklost, zadrževanje fluoresceina in morfološki učinki (tj. luknjičast ali odstopljen epitelij). Vse končne točke razen zadrževanja fluoresceina (ki se določi pred testiranjem in 30 minut po izpostavljenosti testni snovi) se določijo pri vsakem navedenem časovnem intervalu.
37. Priporoča se, da se motnjava roženice, zadrževanje fluoresceina, morfološki učinki in morebitni histopatološki izvidi fotografirajo.
38. Po štiriurnem pregledu je treba oči hraniti v ustrezni fiksirni raztopini (tj. v nevtralnem formalinskem pufru), da se lahko po potrebi opravi histopatološki pregled.
39. Nabreklost roženice se določi na podlagi debelin roženice, izmerjenih z optičnim pahimetrom na špranjski svetilki. Izrazi se v odstotkih in izračuna na podlagi izmerjenih debelin roženic s pomočjo naslednje formule:
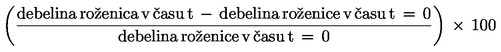
40. Povprečna nabreklost roženice vseh testnih oči, izražena v odstotkih, se izračuna v vseh časovnih intervalih. Na podlagi najvišje povprečne vrednosti nabreklosti roženice, ki je bila zabeležena v vseh časovnih intervalih, se za vsako testno snov določi skupna vrednost posamezne kategorije.
41. Pri izračunu motnjave roženice se upošteva površina najbolj motne roženice. Povprečna motnjava roženice vseh testnih oči se izračuna v vseh časovnih intervalih. Na podlagi najvišje povprečne vrednosti motnjave roženice, ki je bila zabeležena v vseh časovnih obdobjih, se za vsako testno snov določi skupna vrednost za posamezno kategorijo (tabela 1).
Tabela 1
Motnjava roženice
|
Vrednost |
Opažanja |
|
0 |
roženica ni motna |
|
0,5 |
roženica zelo malo motna |
|
1 |
neostra in razpršena območja, deli šarenice dobro vidni |
|
2 |
območje, ki prepušča svetlobo, dobro razpoznavno deli šarenice slabše vidni |
|
3 |
zelo motna roženica; deli šarenice niso vidni; velikost zenice komaj razpoznavna |
|
4 |
popolnoma motna roženica; šarenica ni vidna |
42. Povprečna vrednost zadržanega fluoresceina se pri vseh testnih očeh izračuna samo za 30-minutno časovno obdobje in se za vsako testno snov dodeli kot skupna vrednost za posamezno kategorijo (tabela 2).
Tabela 2
Zadrževanje fluoresceina
|
Vrednost |
Opažanja |
|
0 |
brez zadržanega fluoresceina |
|
0,5 |
zelo malo zadržanega fluoresceina v posameznih celicah |
|
1 |
posamezne celice z nekaj fluoresceina, razdrobljene na testiranem področju roženice |
|
2 |
točkaste ali zlite celice z veliko fluoresceina |
|
3 |
velika zlita področja roženice, v katerih se zadržuje fluorescein |
43. Morfološki učinki vključujejo „luknjičaste“ epitelne celice roženice, „odstopljeni“ epitelij, „kosmato“ roženično površino in „prilepljeno“ testno snov na roženico. Ta opažanja so lahko različno resna in se lahko pojavijo istočasno. Uvrščanje teh opažanj poteka subjektivno glede na razlago raziskovalca.
PODATKI IN POROČANJE
Ocenjevanje podatkov
44. Rezultate za motnjavo in nabreklost roženice ter zadrževanje fluoresceina je treba oceniti ločeno, da se ustvari razred ICE za vsako končno točko. Razredi ICE za vsako končno točko se nato združijo, da se vsaka testna snov lahko razvrsti v razred dražilnosti.
Merila za odločanje
45. Po oceni vsake končne točke se na podlagi vnaprej določenega razpona dodelijo razredi ICE. Debelina roženice (tabela 3), motnjava roženice (tabela 4) in zadrževanje fluoresceina (tabela 5) se razlagajo s pomočjo štirih razredov ICE po naslednjih lestvicah:
Tabela 3
Merila ICE za razvrstitev glede na debelino roženice
|
Povprečna nabreklost roženice (%) (1) |
Razred ICE |
|
0 do 5 |
I |
|
> 5 do 12 |
II |
|
> 12 do 18 (> 75 min po aplikaciji) |
II |
|
> 12 do 18 (≤ 75 min po aplikaciji) |
III |
|
> 18 do 26 |
III |
|
> 26 do 32 (> 75 min po aplikaciji) |
III |
|
> 26 to 32 (≤ 75 min po aplikaciji) |
IV |
|
> 32 |
IV |
|
(1) Vrednosti za nabreklost roženice so veljavne samo, če se merijo s špranjsko svetilko tipa Haag-Streit BP900 z napravo za merjenje globine št. I in nastavljeno širino špranje 9½, tj. 0,095 mm. Uporabniki morajo upoštevati, da lahko špranjske svetilke pri različnih širinah špranje dajo različne merilne vrednosti za debelino roženice. |
|
Tabela 4
Merila ICE za razvrstitev motnjave roženice
|
Povprečna najvišja vrednost motnjave (1) |
Razred ICE |
|
0,0–0,5 |
I |
|
0,6–1,5 |
II |
|
1,6–2,5 |
III |
|
2,6–4,0 |
IV |
|
(1) Glej tabelo 1. |
|
46. Splošni razred testne snovi za dražilnost in vitro se določi tako, da se za razrede dražilnosti, ki ustrezajo ugotovljenim kategorijam za nabreklost in motnjavo roženice ter zadrževanje fluoresceina, uporabi formula iz tabele 6.
Tabela 6
Splošna razvrstitev za dražilnost in vitro
|
Razvrstitev |
Kombinacije treh končnih točk |
|
jedka/zelo dražilna snov |
3 × IV 2 × IV, 1 × III 2 × IV, 1 × II (1) 2 × IV, 1 × I (1) motnjava roženice ≥ 3 pri 30 min (pri najmanj 2 očeh) motnjava roženice 4 pri vsakem časovnem intervalu (pri najmanj 2 očeh) močno odstopljen epitelij (pri najmanj enem očesu) |
|
(1) manj pogoste kombinacije |
|
47. Kot je navedeno v prvem odstavku, je treba testno snov, ki ni opredeljena kot jedka ali zelo dražilna za oči, zaradi razvrščanja in označevanja dodatno testirati. V primerjavi s podatki testne metode in vivo na očeh zajcev za določanje jedkih ali zelo dražilnih snovi za oči, razvrščenih po EPA (1), EU (2) ali GHS (3), je splošna natančnost testne metode ICE 83-odstotna (120/144) do 87-odstotna (134/154), delež lažno pozitivnih rezultatov 6-odstoten (7/122) do 8-odstoten (9/116) ter delež lažno negativnih rezultatov 41-odstoten (13/32) do 50-odstoten (15/30). Če se iz podatkovne zbirke izključijo snovi nekaterih kemijskih (npr. alkoholi, ketoni) ali fizikalnih razredov (npr. trdne snovi), je natančnost testa ICE po sistemih za razvrščanje EU, EPA in GHS 91-odstotna (75/82) do 92-odstotna (69/75), delež lažno pozitivnih rezultatov 5-odstoten (4/73) do 6-odstoten (4/70) ter delež lažno negativnih rezultatov 29-odstoten (2/7) do 33-odstoten (3/9) (4).
48. Tudi če jedke ali zelo dražilne testne snovi za oči ni mogoče razvrstiti, so lahko podatki, pridobljeni s ICE in testom in vivo na očeh zajcev ali primerno validiranim testom in vitro, koristni za nadaljnje ocenjevanje primernosti in omejitev testne metode ICE za določanje nejedkih in ne zelo dražilnih snovi (smernice za uporabo testnih metod in vitro za ugotavljanje toksičnosti za oči se pripravljajo).
Merila za sprejemljivost študije
49. Test se šteje za sprejemljivega, če dajo primerjalne negativne kontrole s vehiklom/topilom in primerjalne pozitivne kontrole za dražilnost vrednosti, ki spadajo v razrede nedražilnih snovi oziroma razrede zelo dražilnih/jedkih snovi.
Poročilo o testu
50. V poročilu o testu je treba navesti naslednje informacije (če so pomembne za izvedbo študije):
testne in kontrolne snovi
kemijska imena in strukturno ime Službe za izmenjavo kemijskih izvlečkov (CAS), ki jim sledijo druga imena, če so znana;
registrska številka CAS (RN), če je znana;
čistost in sestava snovi ali zmesi (v težnostnih odstotkih), če so te informacije na voljo;
fizikalno-kemijske lastnosti, pomembne za izvedbo študije, npr. fizikalno stanje, pH vrednost, stabilnost, kemijski razred, topnost v vodi;
obdelava testnih/kontrolnih snovi pred testiranjem, če je pomembna (npr. segrevanje, mletje);
stabilnost, če je znana.
podatki o naročniku in testnem laboratoriju
ime in naslov naročnika, testnega laboratorija in vodje študije;
podatki o viru oči (tj. obrat, v katerem so bili odvzeti);
pogoji za hrambo in prevoz oči (tj. dan in čas odvzema oči, čas pred prvim testiranjem, prevozna sredstva in temperaturni pogoji, morebitno uporabljeni antibiotiki);
posebne lastnosti živali, katerim so bili odvzete oči, če so znane (tj. starost, spol, teža živali donatorke).
utemeljitev testne metode in uporabljenega protokola
celovitost testne metode
postopek za zagotavljanje celovitosti (tj. natančnosti in zanesljivosti) testne metode v daljšem časovnem obdobju (npr. redno testiranje snovi za ugotavljanje sposobnosti, uporaba podatkov o negativni in pozitivni kontroli iz preteklih testov).
merila za sprejemljivost testa
sprejemljiva primerjalna pozitivna in negativna kontrola na podlagi podatkov iz preteklih testov.
testni pogoji
opis uporabljenega testnega sistema;
vrsta uporabljene špranjske svetilke (tj. model);
nastavitve inštrumentov za uporabljeno špranjsko svetilko;
podatki o uporabljenih očeh piščancev, vključno z izjavami o njihovi kakovosti;
podrobnosti o uporabljenem testnem postopku;
uporabljene koncentracije testne snovi;
opis vseh sprememb testnega postopka;
sklic na podatke o modelu iz preteklih testov (tj. negativna in pozitivna kontrola, snovi za preverjanje sposobnosti; ugotavljanje sposobnosti, primerjalne snovi);
opis uporabljenih meril za ocenjevanje.
rezultati
opis drugih opaženih učinkov;
po potrebi slike oči;
razprava o rezultatih
sklepne ugotovitve
LITERATURA
(1) U.S. EPA (1996). Label Review Manual: 2nd Edition. EPA737-B-96-001. Washington, DC: U.S. Environmental Protection Agency.
(2) Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directive 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No. 1907/2006. OJ L 353, 31.12.2008, 1.
(3) United nations (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Second revised edition, UN New York and Geneva, 2007. Available at:
[http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html]
(4) ICCVAM (2007). Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Available:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(5) ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Available:
[http://ecvam.jrc.it/index.htm].
(6) Regulation (EC) No 1907/2006 of the European Parliament and of the Council of 18 December 2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC. OJ L 396, 30.12.2006, p.1.
(7) OECD (2002). Test Guideline 405. OECD Guideline for Testing of Chemicals. Acute eye irritation/corrosion. Available:
[http://www.oecd.org/document/40/0, 2340, en_2649_34377_37051368_1_1_1_1,00.html]
(8) ICCVAM (2007). ICCVAM Recommended ICE Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Available:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(9) ICCVAM. (2006). Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye Test Method. NIH Publication No.: 06-4513. Research Triangle Park: National Toxicology Program. Available:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_ice.htm]
(10) Prinsen, M.K. and Koëter, B.W.M. (1993). Justification of the enucleated eye test with eyes of slaughterhouse animals as an alternative to the Draize eye irritation test with rabbits. Fd. Chem. Toxicol. 31:69-76.
(11) INVITTOX (1994). Protocol 80: Chicken enucleated eye test (CEET). Available:
[http://ecvam.jrc.it/index.htm].
(12) Balls, M., Botham, P.A., Bruner, L.H. and Spielmann H. (1995). The EC/HO international validation study on alternatives to the Draize eye irritation test. Toxicol. In Vitro 9:871-929.
(13) Prinsen, M.K. (1996). The chicken enucleated eye test (CEET): A practical (pre)screen for the assessment of eye irritation/corrosion potential of test materials. Food Chem. Toxicol. 34:291-296.
(14) Chamberlain, M., Gad, S.C., Gautheron, P. and Prinsen, M.K. (1997). IRAG Working Group I: Organotypic models for the assessment/prediction of ocular irritation. Food Chem. Toxicol. 35:23-37.
(15) Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Available:
[http://www.cdc.gov/ncidod/dhqp/pdf/isolation2007.pdf].
(16) Maurer, J.K., Parker, R.D. and Jester J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
(17) Burton, A.B.G., M. York and R.S. Lawrence (1981). The in vitro assessment of severe irritants. Fd. Cosmet.- Toxicol.- 19, 471-480.
(18) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Available:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
(19) ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe IrritantsIsolated Chicken Eye (ICE) Test Method. Na voljo:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
Dodatek 1
OPREDELITVE
Natančnost : stopnja ujemanja rezultatov testne metode s sprejetimi referenčnimi vrednostmi. Je merilo učinkovitosti testne metode in eden od vidikov „ustreznosti“. Ta izraz in izraz „skladnost“ se pogosto izmenično uporabljata in pomenita delež ustreznih rezultatov testne metode.
Primerjalna snov : snov, ki se uporablja kot standard za primerjavo s testno snovjo. Primerjalna snov mora imeti naslednje lastnosti: (i) trajen in zanesljiv vir; (ii) strukturno in funkcijsko podobnost z razredom testiranih snovi; (ii) znane fizikalne/kemijske lastnosti; (iv) spremni podatki o znanih učinkih in (v) znana potenca v razponu želene reakcije.
Roženica : prozoren sprednji del zrkla, ki pokriva šarenico in zenico ter skozi katerega vstopa svetloba.
Motnjava roženice : merjenje stopnje motnjave roženice po izpostavljenosti testni snovi. Povečana motnjava roženice pomeni, da je roženica poškodovana.
Nabreklost roženice : objektivno merjenje pri testu ICE, da se določi občutljivost roženice po aplikaciji testne snovi. Izrazi se v odstotkih in izračuna na podlagi izhodiščnih (vrednosti pred aplikacijo) izmerjenih vrednosti debelin roženice in debelin, zabeleženih v testu ICE v rednih časovnih intervalih po aplikaciji testnega materiala. Stopnja nabreklosti roženice je indikator za poškodbo roženice.
EPA kategorija 1 : jedka snov (ireverzibilno uničenje očesnega tkiva), ki prizadene ali draži roženico več kot 21 dni (1).
EU kategorija R41 : poškodba očesnega tkiva ali resno fizično poslabšanje vida po aplikaciji testne snovi na sprednjo površino očesa, ki po 21 dneh aplikacije ni popolnoma reverzibilna (2).
Delež lažno negativnih rezultatov : delež vseh pozitivnih snovi, ki jih testna metoda prikaže kot lažno negativne. To je eden od kazalnikov učinkovitosti testne metode.
Delež lažno pozitivnih rezultatov : delež vseh negativnih snovi, ki jih testna metoda prikaže kot lažno pozitivne. To je eden od kazalnikov učinkovitosti testne metode.
Zadrževanje fluoresceina : subjektivno merjenje pri testu ICE, s katerim se določi obseg zadržanega natrijevega fluoresceina v celicah epitelija po aplikaciji testne snovi. Obseg zadržanega fluoresceina je indikator za poškodbo roženičnega epitelija.
GHS (Globalno usklajeni sistem za razvrščanje in označevanje kemikalij) : sistem za razvrščanje kemikalij (snovi in zmesi) s pomočjo standardiziranih vrst in stopenj fizikalnih, zdravstvenih in okoljskih nevarnosti ter za označevanje z npr. piktogrami, opozorilnimi besedami, izjavami o nevarnosti, varnostnimi izjavami in varnostnimi listi z namenom razširjanja informacij o škodljivih učinkih kemikalij ter s tem zaščite ljudi (vključno z delodajalci, delavci, prevozniki, potrošniki in reševalci) in okolja (3).
GHS kategorija 1 : poškodba očesnega tkiva ali resno fizično poslabšanje vida po aplikaciji testne snovi na sprednjo površino očesa, ki po 21 dneh aplikacije ni popolnoma reverzibilna (3).
Nevarnost : neločljiva lastnost snovi ali stanja, ki lahko ob izpostavljenosti tej snovi škodljivo učinkuje na organizem, sistem ali (pod)populacijo.
Negativna kontrola : netestirani dvojnik, ki vsebuje vse komponente testnega sistema. Ta vzorec se obdela z vzorci, testiranimi s testno snovjo, ali drugimi kontrolnimi vzorci, da se ugotovi, ali topilo reagira s testnim sistemom.
Nedražilna snov : snovi, ki niso razvrščene v EPA kategorije I, II ali III; EU kategoriji R41 ali R36; ali GHS kategorije 1, 2A ali 2B dražilnih snovi za oči.
Jedka snovi za oči : (a) snov, ki povzroča ireverzibilno poškodbo očesnega tkiva; (b) snovi, ki so razvrščene v GHS kategorijo 1, EPA kategorijo I ali EU kategorijo R41 dražilnih snovi za oči (1) (2) (3).
Dražilna snov za oči : (a) snov, ki po aplikaciji na sprednjo površino očesa povzroča reverzibilno poškodbo očesa; (b) snovi, ki niso razvrščene v EPA kategorije I, II ali III; EU kategorija R36: ali GHS kategorijo 1, 2A ali 2B dražilnih snovi za oči.
Zelo dražilna snov za oči : (a) snov, ki po aplikaciji na sprednjo površino očesa povzroči poškodbo tkiva, ki po 21 dneh po aplikaciji ne izgine oziroma resno fizično poslabša vid; (b) snovi, ki so razvrščene v GHS kategorijo 1, EPA kategorijo I ali EU kategorijo R41 dražilnih snovi za oči (1) (2) (3).
Pozitivna kontrola : dvojnik, ki vsebuje vse komponente testnega sistema in se testira s snovjo, za katero je znano, da reagira pozitivno. Da se zagotovi, da se odkloni pri reakciji pozitivne kontrole ocenjujejo v daljšem časovnem obdobju, stopnja močne reakcije ne sme biti prevelika.
Zanesljivost : stopnja reproduktivnosti testne metode v laboratorijih in med njimi v določenem časovnem obdobju pri uporabi istega protokola. Oceni se z izračunom laboratorijske in medlaboratorijske reproduktivnosti in ponovljivosti.
Špranjska svetilka : inštrument, ki se uporablja za direktno preiskavo očesa in ki skupaj z binokularnim mikroskopom tvori stereomikroskop s pokončno sliko. Pri testni metodi ICE se ta inštrument uporablja za vpogled v sprednje strukture očesa piščanca ter za objektivno merjenje debeline roženice z nastavkom za merjenje globine.
Kontrola s topilom/vehiklom : netestirani vzorec, ki vsebuje vse komponente testnega sistema, vključno s topilom ali vehiklom, ki se obdela s kontrolnimi vzorci, testiranimi s testno snovjo, in drugimi kontrolnimi vzorci, da se določi izhodiščna reakcija za vzorce, testirane s testno snovjo in raztopljene v istem topilu ali vehiklu. Pri testiranju s primerjalno negativno kontrolo ta vzorec tudi pokaže, ali topilo oziroma vehikel reagira s testnim sistemom.
Stopenjsko testiranje : stopenjska testna strategija, pri kateri se v posebnem vrstnem redu pregledajo vse informacije o testni snovi, pri čemer se na vsaki stopnji uporabi teža dokazov, da se določi, ali je na voljo dovolj informacij za razvrstitev snovi med nevarne snovi, preden se preide na naslednjo stopnjo. Če se lahko na podlagi razpoložljivih informacij določi potencialno draženje snovi, dodatno testiranje ni potrebno. Če na podlagi razpoložljivih informacij potencialnega draženja testne snovi ni mogoče določiti, se opravi postopno sekvenčno testiranje na živalih, dokler ni mogoča jasna razvrstitev.
Validirana testna metoda : testna metoda, za katero sta bili na podlagi validacijskih študij določeni primernost (vključno z natančnostjo) in zanesljivost za določen namen. Treba je opozoriti, da natančnost in zanesljivost validirane testne metode nista nujno zadostni, da bi bili sprejemljivi za predlagani namen.
Teža dokazov : proces preučevanja prednosti in slabosti različnih informacij z namenom sprejetja zaključka o potencialni nevarnosti snovi in njegovi utemeljitvi.
Dodatek 2
KEMIKALIJE ZA PREVERJANJE SPOSOBNOSTI PRI TESTNI METODI ICE
Preden lahko začnejo laboratoriji redno uporabljati testno metodo, ki izpolnjuje zahteve te testne metode, morajo dokazati tehnično usposobljenost tako, da deset priporočenih snovi iz tabele 1 pravilno razvrstijo glede na njihov dražilni učinek na oči. Te snovi so bile izbrane, ker predstavljajo razpon reakcij lokalnega draženja/razjedanja očesa, ki temelji na rezultatih testa in vivo na očeh zajcev (TG 405) (kategorije 1, 2A, 2B ali snovi, ki niso razvrščene in označene v skladu z UN GHS (3) (7). Vendar se lahko zaradi validirane primernosti teh poskusov (tj. izključno za določevanje jedkih in zelo dražilnih snovi za oči) usposobljenost dokaže samo z dvema testnima rezultatoma, na podlagi katerih je mogoča razvrstitev (jedka/zelo dražilna snov ali nejedka/nedražilna snov). Druga merila za izbor snovi so bila, da so te dostopne na trgu, da so na voljo visokokakovostni referenčni podatki in vivo in visokokakovostni podatki, pridobljeni z dvema metodama in vitro, za kateri se pripravljajo smernice. Zaradi tega so bile dražilne snovi izbrane iz priporočenega seznama ICCVAM, ki vsebuje 122 referenčnih snovi za validacijo testnih metod in vitro za ugotavljanje toksičnosti za oči (glej dodatek H: Referenčni podatki so zbrani v dokumentih ICCVAM o pregledu ozadja testne metode BCOP in testne metode ICE na izoliranih očeh piščancev (18) (19).
Tabela 1
Priporočene snovi za ugotavljanje tehnične usposobljenosti za ICE
|
Kemikalija |
Št. CAS |
Kemijski razred (1) |
Fizikalna oblika |
Razvrstitev in vivo (2) |
Razvrstitev in vitro (3) |
|
benzalkonijev klorid (5 %) |
8001-54-5 |
onijska spojina |
tekoča |
kategorija 1 |
jedka/zelo dražilna snov |
|
klorheksidin |
55-56-1 |
amin, amidin |
trdna |
kategorija 1 |
jedka/zelo dražilna snov |
|
dibenzoil-L-vinska kislina |
2743-38-6 |
karboksilna kislina, ester |
trdna |
kategorija 1 |
jedka/zelo dražilna snov |
|
imidazol |
288-32-4 |
heterociklična spojina |
trdna |
kategorija 1 |
jedka/zelo dražilna snov |
|
trikloroocetna kislina (30 %) |
76-03-9 |
karboksilna kislina |
tekoča |
kategorija 1 |
jedka/zelo dražilna snov |
|
2,6-diklorobenzoil klorid |
4659-45-4 |
kislinski halid |
tekoča |
kategorija 2A |
nejedka/lažje dražilna snov |
|
etil-2-metil acetoacetat |
609-14-3 |
keton, ester |
tekoča |
kategorija 2B |
nejedka/lažje dražilna snov |
|
amonijev nitrat |
6484-52-2 |
anorganska sol |
trdna |
kategorija 2A |
nejedka/lažje dražilna snov |
|
glicerol |
56-81-5 |
alkohol |
tekoča |
ni oznake |
nejedka/lažje dražilna snov |
|
n-heksan |
110-54-3 |
ogljikovodik (acikličen) |
tekoča |
ni oznake |
nejedka/lažje dražilna snov |
|
(1) Kemijski razredi so bili dodeljeni za vsako testno snov s standardnim sistemom za razvrščanje, ki temelji na sistemu MeSH (na voljo na http//www.nlm.nih.gov/mesh). (2) Na podlagi rezultatov, pridobljenih s testom in vivo na očeh zajcev (OECD TG 405), in ob upoštevanju UN GHS (3)(7). (3) Na podlagi rezultatov BCOP in ICE. Kratice: št. CAS = registrska številka Službe za izmenjavo kemijskih izvlečkov (CAS). |
|||||
Dodatek 3
Diagrami naprave za superfuzijo in prijemalk za oči pri ICE
(za dodaten generičen opis naprave za superfuzijo in prijemalke za oči glej Burton et al. (17))

B.49. PRESKUS MIKRONUKLEUSOV IN VITRO PRI CELICAH SESALCEV
UVOD
1. Analiza mikronukleusov in vitro je preskus genotoksičnosti za odkrivanje mikronukleusov v citoplazmi interfaznih celic. Mikronukleusi lahko izvirajo iz acentričnih kromosomskih delcev (tj. brez centromere) ali celih kromosomov, ki med anafazo celične delitve ne morejo potovati na pole. Analiza odkriva delovanje kemikalij, ki povzročajo strukturne in številčne poškodbe kromosomov (klastogene in anevgene snovi in zmesi) (1) (2) v celicah, pri katerih je med izpostavljenostjo preskusni snovi ali po njej prišlo do delitve celic. Ta preskusna metoda omogoča uporabo protokolov z inhibitorjem polimerizacije aktina citohalazina B (citoB). Dodatek citohalazina B pred načrtovano mitozo omogoča določitev in selektivno analizo frekvence mikronukleusov v celicah, v katerih se je zaključila ena mitoza, ker imajo takšne celice dve jedri (3) (4). Ta preskusna metoda omogoča uporabo protokolov brez citokinetskega bloka, če obstajajo dokazi, da je pri analizirani celični populaciji prišlo do mitoze.
2. Ob uporabi analize mikronukleusov in vitro za opredelitev kemikalij (snovi in zmesi), ki spodbujajo nastanek mikronukleusov, se lahko z uporabo citokinetskega bloka, imunokemijskega označevanja kinetohor ali hibridizacije s centromerno/telomerno sondo (fluorescenčna in situ hibridizacija (FISH)) prav tako pridobijo informacije o mehanizmih poškodb kromosomov in nastanka mikronukleusov (5) (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16). Postopek označevanja in hibridizacije se lahko uporabi v primeru povečanega nastajanja mikronukleusov, ko želi raziskovalec ugotoviti, ali je povečanje nastalo zaradi dogodkov, ki povzročajo strukturne in številčne poškodbe kromosomov (klastogenih in/ali anevgenih dogodkov).
3. Mikronukleusi predstavljajo poškodbo, ki je bila prenesena na hčerinske celice, pri čemer se kromosomske aberacije v metafaznih celicah ne morejo prenesti. Ker se lahko mikronukleusi v interfaznih celicah ocenijo razmeroma objektivno, mora laboratorijsko osebje ugotoviti samo, ali so se celice delile in koliko celic vsebuje mikronukleus. Zato se lahko pripravke določi razmeroma hitro, analiza pa je lahko avtomatizirana. Zaradi tega se lahko pri vsakem tretiranju oceni na tisoče namesto na stotine celic, s čimer se poveča moč analize. Ker lahko mikronukleusi nastanejo zaradi zaostalih kromosomov, obstaja možnost odkritja snovi, ki povzročajo anevploidijo in se pri klasičnih preskusih kromosomskih aberacij, glej npr. Smernico za preskušanje OECD 473 (poglavje B.10 te priloge), težko preučujejo (17). Vendar analiza mikronukleusov in vitro ne omogoča razlikovanja kemikalij, ki povzročajo poliploidijo, od tistih, ki povzročajo klastogenost, brez posebnih tehnik, kot je fluorescenčna in situ hibridizacija (FISH), opisana v odstavku 2.
4. Analiza mikronukleusov in vitro je metoda, pri kateri se običajno uporabljajo gojene človeške celice ali celice glodavcev. Zagotavlja celovito podlago za preiskovanje morebitnih poškodb kromosomov in vitro, saj lahko odkriva snovi, ki povzročajo strukturne in številčne poškodbe kromosomov (anevgene in klastogene).
5. Analiza mikronukleusov in vitro je zanesljiva in učinkovita pri različnih vrstah celic ter ob prisotnosti ali odsotnosti citohalazina B. Na voljo so obširni podatki, ki podpirajo veljavnost analize mikronukleusov in vitro pri različnih celičnih linijah glodavcev (CHO, V79, CHL/IU, in L5178Y) in človeških limfocitih (18) (19) (20) (21) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31). Ti vključujejo zlasti mednarodne validacijske študije, ki jih usklajuje Société Française de Toxicologie Génétique (SFTG) (18) (19) (20) (21) (22), in poročila International Workshop on Genotoxicity Testing (4) (16). Razpoložljivi podatki so bili tudi ponovno ocenjeni v retrospektivni validacijski študiji glede zanesljivosti dokazov, ki jo je izvedel Evropski center za validacijo alternativnih metod (ECVAM) Evropske komisije, Znanstveni svetovalni odbor ECVAM (ESAC) pa je preskusno metodo potrdil kot znanstveno veljavno (32) (33) (34). Opisana je bila uporaba celičnih linij človeških limfoblastov TK6 (35), celic HepG2 (36) (37) in primarnih embrionalnih celic sirijskega hrčka (38), čeprav v validacijskih študijah niso bile uporabljene.
OPREDELITVE POJMOV
6. Uporabljene opredelitve pojmov so navedene v Dodatku 1.
ZAČETNI PREUDARKI
7. Pri preskusih, izvedenih in vitro, je treba običajno uporabiti zunanji vir aktivacije presnove, razen če so celice glede na snovi, ki se preskušajo, sposobne presnavljanja. Zunanji sistem aktivacije presnove ne posnema pogojev in vivo v celoti. Treba je tudi paziti, da se prepreči nastanek razmer, ki bi vodile do nepravilnih pozitivnih rezultatov, ki ne kažejo prave mutagenosti in so lahko posledica dejavnikov, kot je opazna sprememba pH ali osmolarnosti ali visoka raven citotoksičnosti (39) (40) (41). Če preskusna kemikalija v času dodajanja v medij vpliva na spremembo pH, je treba pH prilagoditi, po možnosti z dodajanjem pufra v založno raztopino, tako da vsi volumni pri vseh preskusnih koncentracijah in za vse kontrole ostanejo enaki.
8. Za analizo nastanka mikronukleusov je bistvenega pomena, da je do mitoze prišlo v tretiranih in netretiranih kulturah. Glede štetja mikronukleusov se največ podatkov pridobi s pomočjo celic, v katerih se je med tretiranjem s preskusno snovjo ali po njej zaključila ena mitoza.
NAČELO PRESKUSNE METODE
9. Človeške celične kulture ali celične kulture sesalcev so izpostavljene preskusni snovi z zunanjim virom aktivacije presnove ali brez nje, razen če so uporabljene celice z ustrezno sposobnostjo presnavljanja. V vsak preskus so vključene primerjalne (topilo/nosilec) kemikalije in kemikalije pozitivne kontrole.
10. Med izpostavljenostjo preskusni snovi ali po njej se celice gojijo tako dolgo, dokler zaradi poškodbe kromosoma ali vretena v interfaznih celicah ne pride do nastanka mikronukleusov. Za nastanek anevploidije mora biti med mitozo navadno prisotna preskusna snov. Odvzete in obarvane interfazne celice se analizirajo glede prisotnosti mikronukleusov. Po možnosti se mikronukleuse šteje samo v tistih celicah, v katerih je med izpostavljenostjo preskusni snovi ali v obdobju po izpostavljenosti, če se uporabi, prišlo do mitoze. V kulturah, ki so bile tretirane s citokinetskim blokom, se to doseže s štetjem samo celic z dvema jedroma. Če citokinetski blok ni bil uporabljen, je treba dokazati, da bi pri analiziranih celicah verjetno prišlo do deljenja celic med izpostavljenostjo preskusni snovi ali po njej. Pri vseh protokolih je treba dokazati, da je do množenja celic prišlo v kontrolnih in tretiranih kulturah, v kulturah (ali vzporednih kulturah), pri katerih se štejejo mikronukleusi, pa je treba oceniti obseg citotoksičnosti ali citostaze, ki je nastala zaradi preskusne snovi.
OPIS ANALIZE
Pripravki
11. Lahko se uporabijo gojeni primarni človeški limfociti periferne krvi (5) (19) (42) (43) in številne celične linije glodavcev, kot so celice CHO, V79, CHL/IU, in L5178Y (18) (19) (20) (21) (22) (25) (26) (27) (28) (30). Uporabo drugih celičnih linij in vrst je treba utemeljiti na podlagi njihove dokazane učinkovitosti v analizi, kot je opisano v oddelku Merila za sprejemljivost. Ker pogostost mikronukleusov v ozadju vpliva na občutljivost analize, se priporoča uporaba celičnih vrst z nizko, stabilno pogostostjo nastajanja mikronukleusov v ozadju.
12. Človeški limfociti periferne krvi se pridobijo od mladih (starih približno 18–35 let), zdravih posameznikov, ki ne kadijo in ki v zadnjem času niso bili izpostavljeni genotoksičnim kemikalijam ali sevanju. Če so za uporabo zbrane celice od več kot enega donatorja, je treba določiti število donatorjev. Pogostost mikronukleusov se povečuje z leti, ta trend pa je bolj opazen pri ženskah kot pri moških (44), kar je treba pri upoštevati pri izbiri donorskih celic.
Gojišča in pogoji gojenja
13. Pri vzdrževanju kultur se uporabijo ustrezna gojišča za kulture in pogoji inkubacije (posode za kulture, koncentracija CO2, temperatura in vlažnost). Trajne celične linije in sevi se redno preverjajo, ali je v njih modalno kromosomsko število stabilno in ali niso okužene z mikoplazmo; okužene celične linije in sevi naj se ne uporabljajo. Poznati je treba običajni čas celičnega ciklusa za pogoje gojenja, ki se uporabljajo v preskuševalnem laboratoriju. Če se uporablja metoda citokinetskega bloka, mora biti koncentracija citokinetskega inhibitorja prilagojena določeni vrsti celic in dokazano mora biti, da zagotavlja dober izkoristek celic z dvema jedroma za štetje.
Priprava kultur
14. Trajne celične linije in sevi: celice se namnožijo iz založnih kultur, nasadijo v gojišče tako na gosto, da kultura ne bo dosegla konfluentne rasti v enojnih plasteh in kulture suspenzije ne bodo dosegle prevelike gostote preden se požanjejo, in se inkubirajo pri 37 °C.
15. Limfociti: celotna kri, tretirana z antikoagulantom (npr. heparinom), ali ločeni limfociti, so gojeni ob prisotnosti mitogena, npr. fitohemaglutinina (PHA) pred izpostavljenostjo preskusni snovi in citohalazinu B.
Aktivacija presnove
16. Pri uporabi celic z neustrezno notranjo sposobnostjo presnavljanja je treba uporabiti zunanje presnovne sisteme. Najpogosteje uporabljani sistem je postmitohondrijska frakcija z dodanim kofaktorjem (S9), pripravljena iz jeter glodavcev, ki so bila tretirana s sredstvi za encimsko indukcijo, kot je Aroclor 1254 (45) (46), ali z zmesjo fenobarbitona in β-naftoflavona (46) (47) (48) (49). Slednja kombinacija ni v nasprotju s Stockholmsko konvencijo o obstojnih organskih onesnaževalih (50) in Uredbo (ES) št. 850/2004 o obstojnih organskih onesnaževalih (66), za nastanek oksidaz z mešano funkcijo pa se je v primerjavi s sredstvom Aroclor 1254 izkazala kot enako učinkovita (46) (47) (48) (49). Postmitohondrijska frakcija se običajno uporablja v koncentracijah 1–10 % (v/v) v končnem preskusnem gojišču. Pogoji sistema za aktivacijo presnove so lahko odvisni od skupine preskušane kemikalije in včasih je primerno uporabiti več kot eno koncentracijo S9.
17. Gensko spremenjene celične linije, v katerih se izražajo geni za točno določene aktivirajoče človeške encime ali encime glodavcev, lahko odpravijo potrebo po zunanjem sistemu aktivacije presnove in se lahko uporabijo kot preskusne celice. V takih primerih mora biti izbira uporabljenih celičnih linij znanstveno utemeljena, npr. s pomembnostjo oksidaze z mešano funkcijo za presnovo preskusne snovi (51) in njihovo odzivnostjo na znane snovi, ki povzročajo strukturne in številčne poškodbe kromosomov (anevgene in klastogene) (glej oddelek Merila za sprejemljivost). Priznati je treba, da izražene oksidaze z mešano funkcijo morda ne bodo presnavljale snovi, ki se preskuša; v takem primeru negativni rezultati ne bi pomenili, da preskusna snov ne more spodbuditi nastanka mikronukleusov.
Priprava preskusne snovi
18. Trdne kemikalije se pred obdelavo celic raztopijo v ustreznih topilih ali nosilcih, in po potrebi razredčijo. Tekoče kemikalije se lahko dodajo neposredno v preskusni sistem in/ali se pred obdelavo razredčijo. Plinaste ali hlapne kemikalije je treba preskušati z ustrezno spremenjenimi običajnimi protokoli, kot je obdelava v zatesnjenem nosilcu (52) (53). Uporabljajo se sveže pripravljene preskusne snovi, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
Preskusni pogoji
Topilo/nosilec
19. Topilo/nosilec ne sme reagirati v stiku s preskusno snovjo, prav tako pa mora biti pri uporabljeni koncentraciji združljivo s preživetjem celic ali ohranjanjem delovanja S9. Če se uporabijo manj znana topila/nosilci (npr. voda, gojišče celic, dimetil sulfoksid), morajo njihovo uporabo podpirati podatki, ki kažejo na njihovo združljivost s preskusno snovjo in njihovo pomanjkanje genotoksičnosti. Priporoča se, da je, kadar koli je to mogoče, prva izbira vodno topilo/nosilec.
Uporaba citohalazina B kot citokinetskega bloka
20. Eden od najpomembnejših dejavnikov pri učinkovitosti analize mikronukleusov in vitro je zagotavljanje, da je v celicah, ki se bodo štele, med izpostavljenostjo preskusni snovi ali v obdobju inkubacije po izpostavljenosti, če se uporabi, prišlo do mitoze. Citohalazin B je snov, ki se najbolj pogosto uporablja za blokado citokineze, ker povzroča sestavljanje aktina in tako preprečuje ločevanje hčerinskih celic po mitozi, zaradi česar nastanejo celice z dvema jedroma (5) (54) (55). Štetje mikronukleusov je tako lahko omejeno na celice, pri katerih je med obdelavo ali po njej prišlo do mitoze. Učinek preskusne snovi na kinetiko množenja celic se lahko meri istočasno. Citohalazin B se kot citokinetski blok uporablja takrat, kadar se uporabljajo človeški limfociti, ker se trajanje celičnih ciklov razlikuje od kulture do kulture in od donatorja do donatorja, vsi limfociti pa se ne odzivajo na fitohemaglutinin (PHA). Pri preskušanju celičnih linij so bile uporabljene tudi druge metode za ugotavljanje, ali so se štete celice delile; te metode so obravnavane v nadaljevanju (glej odstavek 26).
21. Laboratorij za vsako vrsto celic določi ustrezno koncentracijo citohalazina B, da doseže optimalno pogostost celic z dvema jedroma v kontrolnih kulturah s topilom/nosilcem. Ustrezna koncentracija citohalazina B je običajno med 3 in 6 μg/ml.
Merjenje množenja celic in citotoksičnosti ter izbira koncentracij izpostavljenosti
22. Pri določanju najvišje koncentracije preskusne snovi, ki se bo preskušala, se je treba izogibati koncentracijam, pri katerih se lahko pojavijo nepravilni pozitivni odzivi, na primer koncentracijam, pri katerih se pojavijo čezmerna citotoksičnost, obarjanje v gojiščih in opazne spremembe pH ali osmolarnosti (39) (40) (41).
23. Izvedejo se meritve množenja celic, s čimer se zagotovi, da je v tretiranih celicah med analizo prišlo do mitoze in da je obdelava izvedena na ustreznih ravneh citotoksičnosti (glej odstavek 29). Citotoksičnost se določa z aktivacijo presnove in brez nje v celicah, pri katerih je aktivacija presnove potrebna, in sicer z uporabo relativnega povečanja števila celic (relative increase in cell counts, RICC) ali relativne podvojitve populacije (relative population doubling, RPD) (glej Dodatek 2 za formule), razen če se uporabi citohalazin B. Če se uporabi citohalazin B, se lahko citotoksičnost določi z indeksom pomnoževanja (RI) (glej Dodatek 2 za formulo).
24. Obdelava kultur s citohalazinom B in merjenje relativne pogostosti celic z enim, dvema ali več jedri v kulturi zagotavljata natančno metodo za količinsko opredelitev učinka na množenje celic in citotoksično ali citostatično delovanje obdelave (5) ter zagotavljata, da so preštete samo celice, pri katerih je prišlo do delitve med obdelavo ali po njej.
25. V študijah s citohalazinom B se lahko citostaza/citotoksičnost količinsko opredeli s pomočjo indeksa množenja citokinetskega bloka (cytokinesis-block proliferation index, CBPI) (5) (26) (56) ali določi s pomočjo indeksa pomnoževanja iz vsaj 500 celic na kulturo (glej Dodatek 2 za formule). Kadar se za oceno množenja celic uporablja citohalazin B, je treba CBPI ali RI določiti na podlagi vsaj 500 celic na kulturo. Te meritve se lahko poleg drugih uporabijo za oceno citotoksičnosti tako, da se primerjajo vrednosti v tretiranih in kontrolnih kulturah. Z oceno drugih označevalcev citotoksičnosti (npr. konfluentnost, število celic, apoptoza, nekroza, štetje v metafazi) se lahko pridobijo koristne informacije.
26. V študijah brez citohalazina B je treba dokazati, da so se celice, preštete v kulturi, delile med obdelavo s preskusno snovjo ali po njej; v nasprotnem primeru lahko pride do lažnih negativnih odzivov. Metode, ki so bile uporabljene za zagotavljanje, da so deljene celice štete, obsegajo vključitev in naknadno odkrivanje bromdeoksiuridina (BrdU) za določitev celic, ki so se podvojile (57), tvorbo klonov, kadar so celice iz stalnih celičnih linij tretirane in štetein situ na stekelcu mikroskopa (indeks množenja (PI)) (25) (26) (27) (28), oziroma merjenje relativne podvojitve populacije (RPD) ali relativnega povečanja števila celic (RICC) ali druge preverjene metode (16) (56) (58) (59) (glej Dodatek 2 za formule). Z oceno drugih označevalcev citotoksičnosti ali citostaze (npr. konfluentnost, število celic, apoptoza, nekroza, štetje v metafazi) se lahko pridobijo koristne informacije.
27. Ocenijo se vsaj tri koncentracije, ki jih je mogoče analizirati. Da bi to dosegli, bo morda treba poskus izvesti z uporabo večjega števila koncentracij, ki so tesno skupaj, in analizirati tvorbo mikronukleusov v teh koncentracijah, ki zagotavljajo ustrezen razpon citotoksičnosti. Druga strategija je izvedba predhodnega preskusa citotoksičnosti, da se zoži razpon za končni preskus.
28. Najvišja koncentracija naj proizvede 55 ± 5 % citotoksičnost. Višje ravni lahko povzročijo poškodbo kromosomov kot drugotni učinek citotoksičnosti (60). Ko se citotoksičnost pojavi, naj izbrane preskusne koncentracije obsegajo razpon od tiste, ki povzroči 55 ± 5 % citotoksičnost, do tistih, ki povzročijo majhno citotoksičnost ali je sploh ne povzročijo.
29. Če toksičnost ali oborina nista opaženi, mora najvišja preskusna koncentracija ustrezati 0,01 M, 5 mg/ml ali 5 μl/ml, pri čemer se upošteva nižja od obeh vrednosti. Koncentracije, izbrane za analizo, se lahko na splošno razlikujejo za največ 10. Pri preskusnih snoveh, ki kažejo strmo krivuljo odziva na koncentracijo, je morda potrebna manjša razlika med koncentracijami, tako da se štejejo tudi kulture v zmernem in nizkem razponu toksičnosti.
30. Kadar je topnost omejitveni dejavnik, mora biti najvišja koncentracija, če ni omejena s citotoksičnostjo, najnižja koncentracija, pri kateri je v kulturah vidna najmanjša možna oborina, če pri štetju ni nobenih interferenc. Ocena oborine se izvede z metodami, kot je pregled s svetlobnim mikroskopom, s katerim se opazi oborino, ki ostaja ali se pojavi med gojenjem (do konca obdelave).
Kontrolni vzorci
31. V vsak poskus se vključijo primerjalni pozitivni kontrolni vzorci in kontrolni vzorci s topilom/nosilcem, ob aktivaciji presnove in brez nje.
32. Pozitivni kontrolni vzorci so potrebni za dokaz sposobnosti uporabljenih celic, protokol preskusa pa za opredelitev snovi, ki povzročajo strukturne in številčne poškodbe kromosomov (anevgene in klastogene) ter potrditev sposobnosti presnavljanja pripravka S9. Pozitivni kontrolni vzorci morajo uporabiti znane povzročitelje tvorbe mikronukleusov pri koncentracijah, pri katerih se pričakuje majhno, vendar ponovljivo povečanje glede na ozadje, ki pokaže občutljivost preskusnega sistema. Koncentracije pozitivne kontrole naj se izberejo tako, da so učinki jasni, vendar ne razkrijejo takoj identitete kodiranih mikroskopskih preparatov.
33. Za prikaz sposobnosti presnavljanja in zmožnosti sistema, da odkriva klastogene, je treba uporabiti klastogen, pri katerem je potrebna aktivacija presnove (npr. ciklofosfamid; benzo[a]piren). Uporabijo se lahko tudi druge ustrezne snovi pozitivne kontrole, če je to utemeljeno. Ker so lahko nekateri pozitivni kontrolni vzorci, ki potrebujejo aktivacijo presnove, v določenih pogojih obdelave ali določenih celičnih linijah aktivni brez zunanje aktivacije presnove, je treba potrebo po aktivaciji presnove in delovanje pripravka S9 preskusiti na izbrani celični liniji in z izbranimi koncentracijami.
34. Trenutno niso znani nobeni anevgeni, ki bi za svojo genotoksično delovanje potrebovali aktivacijo presnove (16). Trenutno uveljavljeni pozitivni kontroli za anevgeno delovanje sta, na primer, kolhicin in vinblastin. Druge kemikalije se lahko uporabijo, če vplivajo na nastanek mikronukleusov izključno ali v glavnem preko anevgenega delovanja. Da bi se izognili uporabi dveh pozitivnih kontrolnih vzorcev (za klastogenost in anevgenost) brez aktivacije presnove, je lahko kontrola anevgenosti pozitivna kontrola brez S9, kontrola klastogenosti pa se lahko uporablja za preskus ustreznosti uporabljenega sistema za aktivacijo presnove. Pozitivno kontrolo za klastogenost in anevgenost je treba uporabiti pri celicah, pri katerih uporaba S9 ni potrebna. Priporočeni pozitivni kontrolni vzorci so navedeni v Dodatku 3.
35. Če so na voljo ustrezne kemikalije, se lahko preuči možnost uporabe pozitivnih kontrol, ki sodijo v isto skupino kemikalij. Vsi uporabljeni pozitivni kontrolni vzorci morajo ustrezati vrsti celic in pogojem aktivacije.
36. Za vsak odvzem se pripravijo kontrolni vzorci, ki jih sestavlja le topilo ali nosilec. Uporabijo se tudi netretirani kontrolni vzorci, razen če objavljeni ali laboratorijski pretekli kontrolni podatki dokazujejo, da izbrano topilo pri uporabljenih koncentracijah ne povzroča genotoksičnih ali škodljivih učinkov.
PRESKUSNI POSTOPEK
Program tretiranja
37. Da bi bila verjetnost odkritja snovi, ki povzročajo številčne in strukturne poškodbe kromosomov (anevgene in klastogene snovi) ter delujejo v določeni fazi celičnega cikla, čim večja, mora biti s preskusno snovjo tretirano zadostno število celic v vseh fazah njihovih celičnih ciklov. Program tretiranja celičnih linij in primarnih celičnih kultur se lahko zato nekoliko razlikuje od tistega za limfocite, pri katerih je za začetek celičnega cikla potrebna stimulacija z mitogenom, kar je obravnavano v odstavkih 41–43 (16).
38. Teoretični premisleki skupaj z objavljenimi podatki (18) kažejo, da je večina snovi, ki povzročajo številčne in strukturne poškodbe kromosomov (anevgene in klastogene snovi) odkritih s kratkoročnim obdobjem tretiranja, ki traja 3 do 6 ur z dodanim pripravkom S9 ali brez, ki mu sledita odvzem preskusne snovi in obdobje rasti 1,5–2,0 celičnih ciklov (6). Celice se vzorčijo v času, ki je enak približno 1,5–2,0 dolžinama običajnega (tj. netretiranega) celičnega cikla po začetku ali ob koncu tretiranja (glej preglednico 1). Čas vzorčenja ali obnavljanja se lahko podaljša, če je znano ali se sumi, da preskusna snov vpliva na dolžino celičnega cikla (npr. pri preskušanju nukleozidnih analogov).
39. Zaradi morebitne citotoksičnosti pripravkov S9 za kultivirane celice sesalcev se podaljšana izpostavljenost v dolžini 1,5–2,0 običajnih celičnih ciklov uporablja samo, če S9 ni dodan. Pri podaljšanem tretiranju so na voljo možnosti, ki omogočajo tretiranje celic s preskusno kemikalijo z dodanim citohalazinom B ali brez njega. Te možnosti so namenjene primerom, kjer se lahko pojavi zaskrbljenost glede morebitnih interakcij med preskusno snovjo in citohalazinom B.
40. Priporočeni programi tretiranja celic so predstavljeni v preglednici 1. Ti splošni programi tretiranja se lahko prilagodijo glede na stabilnost ali reaktivnost preskusne snovi ali določenih značilnosti rasti uporabljenih celic. Vsa tretiranja se morajo začeti in končati med eksponentno rastjo celic. Ti programi so podrobneje predstavljeni v odstavkih 41–47, ki sledijo.
Preglednica 1
Obdobja tretiranja in odvzema celic za analizo mikronukleusov in vitro
|
Limfociti, primarne celice in celične linije, tretirane s citohalazinom B |
+ S9 |
Obdelava traja 3–6 ur z dodanim S9; odstranita se S9 in obdelovalno gojišče; dodata se sveže gojišče in citohalazin B; celice se odvzamejo po 1,5–2,0 običajnih celičnih ciklih. |
|
– S9 kratka izpostavljenost |
Obdelava traja 3–6 ur; odstrani se obdelovalno gojišče; dodata se sveže gojišče in citohalazin B; celice se odvzamejo po 1,5–2,0 običajnih celičnih ciklih. |
|
|
– S9 daljša izpostavljenost |
Možnost A: obdelava traja 1,5–2 dolžini običajnega celičnega cikla z dodanim citohalazinom B; celice se odvzamejo ob koncu obdobja izpostavljenosti. Možnost B: obdelava traja 1,5–2,0 običajna celična cikla; odstrani se preskusna snov; dodata se sveže gojišče in citohalazin B; celice se odvzamejo po 1,5–2,0 običajnih celičnih ciklih. |
|
|
Celične linije, tretirane brez citohalazina B (enako kot opisani programi tretiranja, vendar brez dodajanja citohalazina B) |
||
Limfociti, primarne celice in celične linije, tretirane s citohalazinom B
41. Pri limfocitih je najučinkovitejši pristop z začetekom izpostavljenosti preskusni snovi 44–48 ur po stimulaciji fitohemaglutinina (PHA), ko ni več sinhronizacije ciklov (5). V prvotni analizi se celice obdelujejo 3 do 6 ur s preskusno snovjo z dodanim S9 ali brez njega. Obdelovalno gojišče se odstrani in nadomesti s svežim gojiščem, ki vsebuje citohalazin B, celice pa se odvzamejo čez 1,5–2,0 dolžini običajnega celičnega cikla.
42. Če sta oba prvotna preskusa pri kratki obdelavi (3–6 ur) negativna ali dvoumna, se izvede nadaljnja obdelava z daljšo izpostavljenostjo brez S9. Na voljo sta dve možnosti obdelave, ki sta enako sprejemljivi. Vendar je za stimuliranje limfocitov, pri katerih se lahko eksponentna rast po 96 urah po stimulaciji zmanjšuje, morda primernejša možnost A. Pri možnosti B celične kulture do končnega časa vzorčenja ne smejo postati strjene.
— Možnost A: celice se s preskusno snovjo obdelujejo 1,5–2,0 dolžini običajnih celičnih ciklov in odvzamejo ob koncu obdelave.
— Možnost B: celice se s preskusno snovjo obdelujejo 1,5–2,0 dolžini običajnega celičnega cikla. Obdelovalno gojišče se odstrani in nadomesti s svežim gojiščem, celice pa se odvzamejo po dodatnih 1,5–2,0 dolžinah običajnega celičnega cikla.
43. Primarne celice in celične linije se obdelajo na podoben način kot limfociti, vendar stimulacija s PHA 44–48 ur ni potrebna. Celice, ki niso limfociti, morajo biti izpostavljene tako, da so ob končani študiji še vedno v logaritemski fazi rasti.
Celične linije, tretirane brez citohalazina B
44. Celice se obdelujejo 3–6 ur z dodanim S9 in brez njega. Obdelovalno gojišče se odstrani in nadomesti s svežim gojiščem, celice pa se odvzamejo čez 1,5–2,0 dolžini običajnega celičnega cikla.
45. Če sta oba prvotna preskusa pri kratki obdelavi (3–6 ur) negativna ali dvoumna, se izvede nadaljnja obdelava z daljšo izpostavljenostjo (brez S9). Na voljo sta dve možnosti obdelave, ki sta enako sprejemljivi:
— Možnost A: celice se s preskusno snovjo obdelujejo 1,5–2,0 dolžini običajnega celičnega cikla in odvzamejo ob koncu obdelave.
— Možnost B: celice se s preskusno snovjo obdelujejo 1,5–2,0 dolžini običajnega celičnega cikla. Obdelovalno gojišče se odstrani in nadomesti s svežim gojiščem, celice pa se odvzamejo po dodatnih 1,5–2,0 dolžinah običajnega celičnega cikla.
46. V enojnih plasteh so lahko po zaključku 3–6 ur trajajoče obdelave prisotne mitotične celice (so okrogle in se ločujejo od površine). Ker se te mitotične celice zlahka ločijo, se jih lahko ob odstranitvi gojišča s preskusno snovjo izgubi. Pri spiranju kultur se jih odvzame, nato pa vrne v kulture, pri čemer je treba paziti, da se v času odvzema ne izgubijo celice, pri katerih poteka mitoza in pri katerih obstaja tveganje nastanka mikronukleusa.
Število kultur
47. Za vsako koncentracijo preskusne snovi ter kulture z nosilcem/topilom in kulture negativne kontrole se uporabita dve vzporedni kulturi. Kadar se na podlagi preteklih podatkov laboratorija lahko dokaže, da so razlike med dvema vzporednima kulturama minimalne, je sprejemljivo, da se uporabi ena kultura. Če se uporabi ena kultura, se priporoča, da se analizira večje število koncentracij.
Odvzem celic in priprava mikroskopskih preparatov
48. Vsaka kultura se odvzame in obdela ločeno. Priprava celic lahko vključuje hipotonično obdelavo, vendar to ni potrebno, če se ustrezno širjenje celic doseže tudi drugače. Pri pripravi mikroskopskih preparatov se lahko uporabijo različne tehnike, če se za štetje pridobi pripravke s celicami visoke kakovosti. Zadržati je treba citoplazmo celic, kar omogoči odkrivanje mikronukleusov in (pri metodi s citokinetskim blokom) zanesljivo identifikacijo celic z dvema jedroma.
49. Mikroskopske preparate se lahko obarva z različnimi metodami, kot so Giemsa ali DNA-specifična flourescentna barvila (59). Uporaba DNA-specifičnega barvila (npr. akridin oranž (61) ali Hoechst 33258 plus pyronin-Y (62)) lahko prepreči nastanek nekaterih artefaktov, povezanih z uporabo barvila, ki ni specifično za DNA. Za opredelitev vsebine (kromosom/kromosomski delec) mikronukleusov, če so potrebne mehanske informacije o njihovi tvorbi, se lahko uporabi kinetohorno protitelo, fluorescentna in situ hibridizacija (FISH) s sondami DNA za centromere ali primarno označevanje in situ s premazi, specifičnimi za centromere, skupaj z ustreznim nasprotnim barvanjem DNA (15) (16). Za razlikovanje med snovmi, ki povzročajo strukturne in številčne poškodbe kromosomov (anevgeni in klastogeni), se lahko uporabijo druge metode, če so se izkazale za učinkovite.
Analiza
50. Vse preparate se, skupaj z vzorci s topilom/nosilcem in kontrolnimi vzorci, pred mikroskopsko analizo neodvisno kodira. Namesto tega se lahko kodirane vzorce analizira s pomočjo validiranega, avtomatiziranega sistema za pretočno citometrično analizo ali slikovno analizo.
51. Pri kulturah, tretiranih s citohalazinom B, je treba pogostost mikronukleusov analizirati v vsaj 2 000 celicah z dvema jedroma na koncentracijo (vsaj 1 000 celic z dvema jedroma na kulturo; dve kulturi na koncentracijo). Če se uporabi ena kultura, je treba iz te kulture oceniti vsaj 2 000 celic z dvema jedroma na koncentracijo. Če je za štetje pri vsaki koncentraciji uporabljenih precej manj kot 1 000 celic z dvema jedroma na kulturo ali 2 000 celic z dvema jedroma v primeru ene kulture in če ni ugotovljeno znatno povečanje števila mikronukleusov, je treba preskus ponoviti z več celicami ali z manj toksičnimi koncentracijami, kar je primerneje. Paziti je treba, da se ne šteje celic z dvema jedroma, ki so nepravilne oblike ali pri katerih se velikost dveh jeder precej razlikuje; prav tako se celic z dvema jedroma ne sme zamenjevati s slabo razširjenimi celicami z več jedri. Celice, ki imajo več kot dve glavni jedri, se ne analizirajo glede mikronukleusov, saj je lahko izhodiščna pogostost mikronukleusov v teh celicah višja (63) (64). Štetje celic z enim jedrom je sprejemljivo, če je za preskusno snov znano, da vpliva na delovanje citohalazina B.
52. V celičnih linijah, analiziranih brez tretiranja s citohalazinom B, se mikronukleuse šteje v vsaj 2 000 celicah na koncentracijo (vsaj 1 000 celic na kulturo; dve kulturi na koncentracijo). Če se uporabi samo eno kulturo na koncentracijo, se pri tej kulturi oceni vsaj 2 000 celic.
53. Ko je uporabljen citohalazin B, je treba za oceno množenja celic določiti CBPI ali RI (glej Dodatek 2) na podlagi vsaj 500 celic na kulturo. Kadar se tretiranje izvaja brez dodanega citohalazina B, je treba zagotoviti dokaz, da so se štete celice množile, kot je obravnavano v odstavkih 24–27.
Merila za sprejemljivost
54. Laboratorij, ki predlaga uporabo analize mikronukleusov in vitro, opisano v tej preskusni metodi, mora z uporabo referenčnih kemikalij iz Dodatka 3 dokazati svojo sposobnost, da zanesljivo in natančno odkrije kemikalije, za katere je znano, da povzročajo številčne in strukturne poškodbe kromosomov (anevgeno in klastogeno delovanje), z aktivacijo presnove in brez nje, pa tudi znane negativne kemikalije. Kot dokaz za zmožnost laboratorija, da pravilno izvede to preskusno metodo, mora laboratorij zagotoviti dokaze, da se je pri celicah, ki se jih šteje glede tvorbe mikronukleusov, zaključila ena delitev jedra, če se preskus izvaja brez uporabe citohalazina B.
55. Kemikalije iz Dodatka 3 se priporoča kot referenčne kemikalije. Lahko se vključi nadomestne ali dodatne kemikalije, če je njihovo delovanje znano, če spodbujajo tvorbo mikronukleusov z enakimi mehanizmi delovanja in če se zanje izkaže, da so pomembne v zvezi s kemikalijami, ki se bodo preskušale z uporabo postopka analize mikronukleusov in vitro. Utemeljitev bi lahko vključevala validacijsko študijo, pri kateri so uporabljene številne različne snovi, oziroma študijo, osredotočeno na ožji spekter, ki temelji na kemijskem razredu preskusne snovi ali mehanizmu škode, ki se preučuje.
56. Kontrolne kulture s topilom/nosilcem in netretirane kulture naj bi dale ponovljivo nizko in dosledno pogostost mikronukleusov (običajno 5–25 mikronukleusov/1 000 celic za vrste celic, opredeljene v odstavku 11). Druge vrste celic imajo lahko različne razpone odzivov, ki jih je treba določiti pri validaciji za uporabo pri analizi mikronukleusov in vitro. Za določitev preteklih kontrolnih razponov je treba uporabiti podatke, pridobljene z negativno kontrolo, kontrolo s topilom in pozitivno kontrolo. Te vrednosti se uporabijo pri odločanju o ustreznosti primerjalne negativne/pozitivne kontrole za poskus.
57. Če so za analizo predlagane manjše spremembe protokola (npr. avtomatizirano štetje namesto ročnih tehnik štetja; uporaba nove vrste celic), se pred sprejetjem spremenjenega protokola za uporabo najprej dokaže učinkovitost spremembe. Dokaz učinkovitosti vključuje dokaz, da se lahko odkrije glavne mehanizme preloma kromosomov in pridobitev ali izgubo ter da se lahko za razred posamezne snovi ali številnih različnih snovi, ki se bodo preskušale, pridobi ustrezne pozitivne in negativne rezultate.
PODATKI IN POROČANJE
Obdelava rezultatov
58. Če se uporabi tehnika citokinetskega bloka, se pri ocenjevanju nastajanja mikronukleusov uporabi samo pogostost celic z dvema jedroma z mikronukleusi (ne glede na število mikronukleusov na celico). Štetje celic z enim, dvema ali več mikronukleusi bi lahko zagotovilo koristne informacije, vendar ni obvezno.
59. Določiti je treba sočasne meritve citotoksičnosti in/ali citostaze za vse tretirane kulture in kontrolne kulture s topilom/nosilcem (58). Pri uporabi metode citokinetskega bloka je treba za vse tretirane in kontrolne kulture izračunati CBPI ali RI kot merili zakasnitve celičnega cikla. Če citohalazin B ni dodan, se uporabi relativna podvojitev populacije (RPD) ali relativno povečanje števila celic (RICC) ali indeks množenja (glej Dodatek 2).
60. Navedejo se podatki za posamezne kulture. Poleg tega se podatki povzamejo v obliki preglednice.
61. Kemikalije lahko pri analizi mikronukleusov in vitro povzročijo nastanek mikronukleusov zato, ker povzročajo prelom kromosomov, izgubo kromosomov ali pa oboje hkrati. Za ugotovitev, ali je mehanizem za nastajanje mikronukleusov posledica delovanja, ki povzroča strukturne in številčne poškodbe kromosomov (klastogenega in/ali anevgenega delovanja), se lahko izvede nadaljnja analiza z uporabo antikinetohornih protiteles, in situ sond, specifičnih za centromere, ali drugih metod.
Vrednotenje in razlaga rezultatov
62. Ni zahteve po potrjevanju jasnega pozitivnega ali negativnega odziva z dodatnimi preskusi. Dvoumni rezultati se lahko pojasnijo z analizo dodatnih 1 000 celic iz vseh kultur, zaradi česar ne pride do izgube slepih vzorcev. Če ta pristop ne pomaga pri spremembi rezultata, je treba izvesti nadaljnje preskušanje. V nadaljnjih poskusih naj se preuči možnost prilagoditve razširjenega ali zožanega razpona preskusnih parametrov, kot je primerno. Preskusni parametri, ki se lahko spremenijo, vključujejo razmik med preskusnimi koncentracijami, časovno razporeditev obdelave in odvzema celic in/ali pogoje za aktivacijo presnove.
63. Pozitivni rezultat se lahko določi na podlagi številnih meril, kot je na primer s koncentracijo povezano povečanje ali statistično značilno povečanje števila celic z mikronukleusi. Najprej naj se preuči biološka pomembnost rezultatov. Upoštevanje tega, ali so dobljene vrednosti v razponu preteklih kontrol ali zunaj njega, lahko zagotovi smernice pri ocenjevanju biološke pomembnosti odziva. Pri vrednotenju rezultatov preskusa se kot pomoč lahko uporabijo ustrezne statistične metode (65). Vendar je treba rezultate statističnega preskušanja oceniti z upoštevanjem odnosa med odmerkom in odzivom. Upoštevati je treba tudi ponovljivost in pretekle podatke.
64. Čeprav bo večina poskusov dala jasne pozitivne ali negativne rezultate, bodo v nekaterih primerih dobljeni podatki preprečili zanesljivo oceno o delovanju preskusne snovi. Ti dvoumni ali dvomljivi odzivi se lahko pojavijo ne glede na število ponovitev poskusa.
65. Pozitivni rezultati analize mikronukleusov in vitro pomenijo, da v kultiviranih celicah sesalcev preskusna snov povzroča prelome ali izgubo kromosomov. Negativni rezultati pomenijo, da preskusna snov pri uporabljenih preskusnih pogojih ne povzroča preloma kromosomov in/ali pridobitve ali izgube v uporabljenih kultiviranih sesalskih celicah.
Poročilo o preskusu
66. Poročilu o preskusu vsebuje vsaj naslednje informacije (če so pomembne za izvedbo študije):
Preskusna kemikalija:
— identifikacijske podatke in registrsko številko Službe za izmenjavo kemijskih izvlečkov ter številko EC,
— agregatno stanje in čistost,
— fizikalno-kemijske lastnosti, pomembne za izvedbo študije,
— reagiranje preskusne kemikalije s topilom/nosilcem ali gojiščem celic;
Topilo/nosilec:
— utemeljitev izbire topila/nosilca,
— topnost in stabilnost preskusne snovi v topilu/nosilcu;
Celice:
— vrsto in izvor uporabljenih celic,
— ustreznost uporabljene vrste celic,
— odsotnost mikoplazme, če je to primerno,
— informacije o trajanju celičnega cikla, podvojitvenem času ali indeksu množenja,
— kadar so uporabljeni limfociti, spol, starost in število donatorjev krvi, če je primerno,
— kadar so uporabljeni limfociti, ali je izpostavljena kri v celoti ali ločeni limfociti,
— število pasaž, če je primerno,
— metode vzdrževanja celičnih kultur, če je primerno,
— modalno število kromosomov,
— običajno (negativna kontrola) trajanje celičnega cikla;
Preskusni pogoji:
— identiteto citogenetskega bloka (npr. cytoB), če je uporabljen, njegovo koncentracijo in trajanje izpostavljenosti celic,
— razloge za izbiro koncentracij in števila kultur, vključno s podatki o citotoksičnosti in mejah topnosti, če so na voljo,
— sestavo gojišč, koncentracijo CO2, če je primerno,
— koncentracije preskusne snovi,
— koncentracije (in/ali volumen) nosilca in dodane preskusne snovi,
— inkubacijsko temperaturo in čas trajanja inkubacije,
— trajanje obdelave,
— odvzem po obdelavi,
— gostoto celic ob nasaditvi, če je primerno,
— vrsto in sestavo sistema za aktivacijo presnove, skupaj z merili za sprejemljivost,
— kemikalije pozitivne kontrole in negativne kontrole,
— metode priprave mikroskopskih preparatov in uporabljene tehnike barvanja,
— merila za identifikacijo mikronukleusov,
— števila analiziranih celic,
— metode merjenja citotoksičnosti,
— morebitne dodatne informacije v zvezi s citotoksičnostjo,
— merila za določanje študij kot pozitivnih, negativnih ali dvoumnih,
— uporabljene metode statistične analize,
— metode, kot je uporaba kinetohornega protitelesa, za ugotavljanje, ali mikronukleusi vsebujejo cele kromosome ali le delce kromosomov, če je primerno;
Rezultati:
— meritev uporabljene citotoksičnosti, npr CBPI ali RI v primeru metode citokinetskega bloka; RICC, RPD ali PI v primerih, ko metode citokinetskega bloka niso uporabljene; druge ugotovitve, če je primerno, npr. konfluentnost celic, apoptozo, nekrozo, štetje v metafazi, pogostost celic z dvema jedroma,
— znake obarjanja,
— podatke o pH in osmolarnosti obdelovalnega gojišča, če sta bila določena,
— opredelitev sprejemljivih celic za analizo,
— porazdelitev celic z enim, dvema ali več jedri v primeru uporabe metode citokinetskega bloka,
— število celic z mikronukleusum, podanih ločeno za vsako tretirano in kontrolno kulturo, ter po potrebi opredelitev, ali so iz celic z dvema ali enim jedrom,
— odvisnost med koncentracijo in odzivom, kadar je mogoče,
— kemijske podatke o primerjalni negativni (topilo/nosilec) in pozitivni kontroli (koncentracije in topila),
— pretekle kemijske podatke o negativni (topilo/nosilec) in pozitivni kontroli, skupaj z razponi, povprečji in standardnim odstopanjem ter intervalom zaupanja (npr. 95 %),
— statistično analizo; p-vrednosti, če obstajajo;
Razprava o rezultatih
Sklepi
VIRI
1. Kirsch-Volders, M. (1997), Towards a validation of the micronucleus test. Mutation Res., 392, 1–4.
2. Parry, J.M. and Sors, A. (1993), The detection and assessment of the aneugenic potential of environmental chemicals: the European Community aneuploidy project, Mutation Res., 287, 3–15.
3. Fenech, M. and Morley, A.A. (1985), Solutions to the kinetic problem in the micronucleus assay, Cytobios., 43, 233–246.
4. Kirsch-Volders, M., Sofuni, T., Aardema, M., Albertini, S., Eastmond, D., Fenech, M., Ishidate, M. Jr, Lorge, E., Norppa, H., Surralles, J., von der Hude, W. and Wakata, A. (2000), Report from the In Vitro Micronucleus Assay Working Group, Environ. Mol. Mutagen., 35, 167–172.
5. Fenech, M. (2007), Cytokinesis-block micronucleus cytome assay, Nature Protocols, 2(5), 1084–1104.
6. Fenech, M. and Morley, A.A. (1986), Cytokinesis-block micronucleus method in human lymphocytes: effect of in-vivo ageing and low dose X-irradiation, Mutation Res., 161, 193–198.
7. Eastmond, D.A. and Tucker, J.D. (1989), Identification of aneuploidy-inducing agents using cytokinesis-blocked human lymphocytes and an antikinetochore antibody, Environ. Mol. Mutagen., 13, 34–43.
8. Eastmond, D.A. and Pinkel, D. (1990), Detection of aneuploidy and aneuploidy-inducing agents in human lymphocytes using fluorescence in-situ hybridisation with chromosome-specific DNA probes, Mutation Res., 234, 9–20.
9. Miller, B.M., Zitzelsberger, H.F., Weier, H.U. and Adler, I.D. (1991), Classification of micronuclei in murine erythrocytes: immunofluorescent staining using CREST antibodies compared to in situ hybridization with biotinylated gamma satellite DNA, Mutagenesis, 6, 297–302.
10. Farooqi, Z., Darroudi, F. and Natarajan, A.T. (1993), The use of fluorescence in-situ hybridisation for the detection of aneugens in cytokinesis-blocked mouse splenocytes, Mutagenesis, 8, 329–334.
11. Migliore, L., Bocciardi, R., Macri, C. and Lo Jacono, F. (1993), Cytogenetic damage induced in human lymphocytes by four vanadium compounds and micronucleus analysis by fluorescence in situ hybridization with a centromeric probe, Mutation Res., 319, 205–213.
12. Norppa, H., Renzi, L. and Lindholm, C. (1993), Detection of whole chromosomes in micronuclei of cytokinesis-blocked human lymphocytes by antikinetochore staining and in situ hybridization, Mutagenesis, 8, 519–525.
13. Eastmond, D.A, Rupa, D.S. and Hasegawa, L.S. (1994), Detection of hyperdiploidy and chromosome breakage in interphase human lymphocytes following exposure to the benzene metabolite hydroquinone using multicolor fluorescence in situ hybridization with DNA probes, Mutation Res., 322, 9–20.
14. Marshall, R.R., Murphy, M., Kirkland, D.J. and Bentley, K.S. (1996), Fluorescence in situ hybridisation (FISH) with chromosome-specific centromeric probes: a sensitive method to detect aneuploidy, Mutation Res., 372, 233–245.
15. Zijno, P., Leopardi, F., Marcon, R. and Crebelli, R. (1996), Analysis of chromosome segregation by means of fluorescence in situ hybridization: application to cytokinesis-blocked human lymphocytes, Mutation Res., 372, 211–219.
16. Kirsch-Volders, M., Sofuni, T., Aardema, M., Albertini, S., Eastmond, D., Fenech, M., Ishidate Jr., M., Lorge, E., Norppa, H., Surrallés, J., von der Hude, W. and Wakata, A. (2003), Report from the in vitro micronucleus assay working group. Mutation Res., 540, 153–163.
17. OECD (1997), In Vitro Mammalian Chromosome Aberration Test, Test Guideline No. 473, OECD Guidelines for Testing of Chemicals, OECD, Paris. Na voljo na spletni strani: www.oecd.org/env/testguidelines.
18. Lorge, E., Thybaud, V., Aardema, M.J., Oliver, J., Wakata, A., Lorenzon G. and Marzin, D. (2006), SFTG International collaborative Study on in vitro micronucleus test. I. General conditions and overall conclusions of the study, Mutation Res., 607, 13–36.
19. Clare, G., Lorenzon, G., Akhurst, L.C., Marzin, D., van Delft, J., Montero, R., Botta, A., Bertens, A., Cinelli, S., Thybaud, V. and Lorge, E. (2006), SFTG International collaborative study on the in vitro micronucleus test. II. Using human lymphocytes, Mutation Res., 607, 37–60.
20. Aardema, M.J., Snyder, R.D., Spicer, C., Divi, K., Morita, T., Mauthe, R.J., Gibson, D.P., Soelter, S., Curry, P.T., Thybaud, V., Lorenzon, G., Marzin, D. and Lorge, E. (2006), SFTG International collaborative study on the in vitro micronucleus test, III. Using CHO cells, Mutation Res., 607, 61–87.
21. Wakata, A., Matsuoka, A., Yamakage, K., Yoshida, J., Kubo, K., Kobayashi, K., Senjyu, N., Itoh, S., Miyajima, H., Hamada, S., Nishida, S., Araki, H., Yamamura, E., Matsui, A., Thybaud, V., Lorenzon, G., Marzin, D. and Lorge, E. (2006), SFTG International collaborative study on the in vitro micronucleus test, IV. Using CHO/IU cells, Mutation Res., 607, 88–124.
22. Oliver, J., Meunier, J.-R., Awogi, T., Elhajouji, A., Ouldelhkim, M.-C., Bichet, N., Thybaud, V., Lorenzon, G., Marzin, D. and Lorge, E. (2006), SFTG International collaborative study on the in vitro micronucleus test, V. Using L5178Y cells, Mutation Res., 607, 125–152.
23. Albertini, S., Miller, B., Chetelat, A.A. and Locher, F. (1997), Detailed data on in vitro MNT and in vitro CA: industrial experience, Mutation Res., 392, 187–208.
24. Miller, B., Albertini, S., Locher, F., Thybaud, V. and Lorge, E. (1997), Comparative evaluation of the in vitro micronucleus test and the in vitro chromosome aberration test: industrial experience, Mutation Res., 392, 45–59.
25. Miller, B., Potter-Locher, F., Seelbach, A., Stopper, H., Utesch, D. and Madle, S. (1998), Evaluation of the in vitro micronucleus test as an alternative to the in vitro chromosomal aberration assay: position of the GUM Working Group on the in vitro micronucleus test. Gesellschaft fur Umwelt-Mutations-forschung, Mutation Res., 410, 81–116.
26. Kalweit, S., Utesch, U., von der Hude, W. and Madle, S. (1999), Chemically induced micronucleus formation in V79 cells – comparison of three different test approaches, Mutation Res. 439, 183–190.
27. Kersten, B., Zhang, J., Brendler Schwaab, S.Y., Kasper, P. and Müller, L. (1999), The application of the micronucleus test in Chinese hamster V79 cells to detect drug-induced photogenotoxicity, Mutation Res. 445, 55–71.
28. von der Hude, W., Kalweit, S., Engelhardt, G., McKiernan, S., Kasper, P., Slacik-Erben, R., Miltenburger, H.G., Honarvar, N., Fahrig, R., Gorlitz, B., Albertini, S., Kirchner, S., Utesch, D., Potter-Locher, F., Stopper, H. and Madle, S. (2000), In vitro micronucleus assay with Chinese hamster V79 cells - results of a collaborative study with in situ exposure to 26 chemical substances, Mutation Res., 468, 137–163.
29. Garriott, M.L., Phelps, J.B. and Hoffman, W.P. (2002), A protocol for the in vitro micronucleus test, I. Contributions to the development of a protocol suitable for regulatory submissions from an examination of 16 chemicals with different mechanisms of action and different levels of activity, Mutation Res., 517, 123–134.
30. Matsushima, T., Hayashi, M., Matsuoka, A., Ishidate, M. Jr., Miura, K.F., Shimizu, H., Suzuki, Y., Morimoto, K., Ogura, H., Mure, K., Koshi, K. and Sofuni, T. (1999), Validation study of the in vitro micronucleus test in a Chinese hamster lung cell line (CHL/IU), Mutagenesis, 14, 569–580.
31. Elhajouji, A., and Lorge, E. (2006), Special Issue: SFTG International collaborative study on in vitro micronucleus test, Mutation Res., 607, 1–152.
32. ECVAM (2006), Statement by the European Centre for the Validation of Alternative Methods (ECVAM) Scientific Advisory Committee (ESAC) on the scientific validity of the in vitro micronucleus test as an alternative to the in vitro chromosome aberration assay for genotoxicity testing. ESAC 25th meeting, 16-17 November, 2006, na voljo na spletni strani: http://ecvam.jrc.it/index.htm.
33. ESAC (2006), ECVAM Scientific Advisory Committee (ESAC) Peer Review, Retrospective Validation of the In Vitro Micronucleus Test, Summary and Conclusions of the Peer Review Panel, na voljo na spletni strani: http://ecvam.jrc.it/index.htm.
34. Corvi, R., Albertini, S., Hartung, T., Hoffmann, S., Maurici, D., Pfuhler, S, van Benthem, J., Vanparys P. (2008), ECVAM Retrospective Validation of in vitro Micronucleus Test (MNT), Mutagenesis, 23, 271–283.
35. Zhang, L.S., Honma, M., Hayashi, M., Suzuki, T., Matsuoka, A. and Sofuni, T. (1995), A comparative study of TK6 human lymphoblastoid and L5178Y mouse lymphoma cell lines in the in vitro micronucleus test, Mutation Res., 347, 105–115.
36. Ehrlich, V., Darroudi, F., Uhl, M., Steinkellner, S., Zsivkovits, M. and Knasmeuller, S. (2002), Fumonisin B1 is genotoxic in human derived hepatoma (HepG2) cells, Mutagenesis, 17, 257–260.
37. Knasmüller, S., Mersch-Sundermann, V., Kevekordes, S., Darroudi, F., Huber, W.W., Hoelzl, C., Bichler, J. and Majer, B.J. (2004), Use of human-derived liver cell lines for the detection of environmental and dietary genotoxicants; current state of knowledge, Toxicol., 198, 315–328.
38. Gibson, D.P., Brauninger, R., Shaffi, H.S., Kerckaert, G.A., LeBoeuf, R.A., Isfort, R.J. and Aardema, M.J. (1997), Induction of micronuclei in Syrian hamster embryo cells: comparison to results in the SHE cell transformation assay for National Toxicology Program test chemicals, Mutation Res., 392, 61–70.
39. Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M. Jr., Brusick, D., Ashby, J. and Myhr, B.C. (1991), International Commission for Protection Against Environmental Mutagens and Carcinogens, Genotoxicity under extreme culture conditions. A report from ICPEMC Task Group 9, Mutation Res., 257, 147–205.
40. Morita, T., Nagaki, T., Fukuda, I. and Okumura, K. (1992), Clastogenicity of low pH to various cultured mammalian cells, Mutation Res., 268, 297–305.
41. Brusick, D. (1986), Genotoxic effects in cultured mammalian cells produced by low pH treatment conditions and increased ion concentrations, Environ. Mutagen., 8, 789–886.
42. Fenech, M. and Morley, A.A. (1985), Measurement of micronuclei in lymphocytes, Mutation Res., 147, 29–36.
43. Fenech, M. (1997), The advantages and disadvantages of cytokinesis-blood micronucleus method, Mutation Res., 392, 11–18.
44. Bonassi, S., Fenech, M., Lando, C., Lin, Y.P., Ceppi, M., Chang, W.P., Holland, N., Kirsch-Volders, M., Zeiger, E., Ban, S., Barale, R., Bigatti, M.P., Bolognesi, C., Jia, C., Di Giorgio, M., Ferguson, L.R., Fucic, A., Lima, O.G., Hrelia, P., Krishnaja, A.P., Lee, T.K., Migliore, L., Mikhalevich, L., Mirkova, E., Mosesso, P., Muller, W.U., Odagiri, Y., Scarffi, M.R., Szabova, E., Vorobtsova, I., Vral, A. and Zijno, A. (2001), HUman MicroNucleus Project: international database comparison for results with the cytokinesis-block micronucleus assay in human lymphocytes, I. Effect of laboratory protocol, scoring criteria and host factors on the frequency of micronuclei, Environ. Mol. Mutagen. 37, 31–45.
45. Maron, D.M. and Ames, B.N. (1983), Revised methods for the Salmonella mutagenicity test, Mutation Res., 113, 173–215.
46. Ong, T.-m., Mukhtar, M., Wolf, C.R. and Zeiger, E. (1980), Differential effects of cytochrome P450-inducers on promutagen activation capabilities and enzymatic activities of S-9 from rat liver, J. Environ. Pathol. Toxicol., 4, 55–65.
47. Elliott, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992), Alternatives to Aroclor 1254-induced S9 in in-vitro genotoxicity assays. Mutagenesis, 7, 175–177.
48. Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A safe substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems, In: de Serres, F.J., Fouts, J. R., Bend, J.R. and Philpot, R.M. (eds), In Vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, str. 85–88.
49. Johnson, T.E., Umbenhauer, D.R. and Galloway, S.M. (1996), Human liver S-9 metabolic activation: proficiency in cytogenetic assays and comparison with phenobarbital/beta-naphthoflavone or Aroclor 1254 induced rat S-9, Environ. Mol. Mutagen., 28, 51–59.
50. UNEP (2001), Stockholm Convention on Persistent Organic Pollutants, United Nations Environment Programme (UNEP). Na voljo na spletni strani: http://www.pops.int/.
51. Doherty, A.T., Ellard, S., Parry, E.M. and Parry, J.M. (1996), An investigation into the activation and deactivation of chlorinated hydrocarbons to genotoxins in metabolically competent human cells, Mutagenesis, 11, 247–274.
52. Krahn, D.F., Barsky, F.C. and McCooey, K.T. (1982), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, v: Tice, R.R., Costa, D.L. and Schaich, K.M. (eds), Genotoxic Effects of Airborne Agents. New York, Plenum, str. 91–103.
53. Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983), Evaluation of an exposure system using cells grown on collagen gels for detecting highly volatile mutagens in the CHO/HGPRT mutation assay, Environ. Mutagenesis 5, 795–801.
54. Fenech, M. (1993), The cytokinesis-block micronucleus technique: a detailed description of the method and its application to genotoxicity studies in human populations, Mutation Res., 285, 35–44.
55. Phelps, J.B., Garriott, M.L., and Hoffman, W.P. (2002), A protocol for the in vitro micronucleus test. II. Contributions to the validation of a protocol suitable for regulatory submissions from an examination of 10 chemicals with different mechanisms of action and different levels of activity, Mutation Res., 521, 103–112.
56. Kirsch-Volders, M., Sofuni, T., Aardema, M., Albertini, S., Eastmond, D., Fenech, M., Ishidate, M. Jr., Kirchner, S., Lorge, E., Morita, T., Norppa, H., Surralles, J., Vanhauwaert, A. and Wakata, A. (2004), Corrigendum to,Report from the in vitro micronucleus assay working group, Mutation Res., 564, 97–100.
57. Pincu, M., Bass, D. and Norman, A. (1984), An improved micronuclear assay in lymphocytes, Mutation Res., 139, 61–65.
58. Lorge, E., Hayashi, M., Albertini, S. and Kirkland, D. (2008), Comparison of different methods for an accurate assessment of cytotoxicity in the in vitro micronucleus test. I. Theoretical aspects, Mutation Res., 655, 1–3.
59. Surralles, J., Xamena, N., Creus, A., Catalan, J., Norppa, H. and Marcos, R. (1995), Induction of micronuclei by five pyrethroid insecticides in whole-blood and isolated human lymphocyte cultures, Mutation Res., 341, 169–184.
60. Galloway, S. (2000), Cytotoxicity and chromosome aberrations in vitro: Experience in industry and the case for an upper limit on toxicity in the aberration assay, Environ. Molec. Mutagenesis 35, 191–201.
61. Hayashi, M., Sofuni, T., and Ishidate, M. Jr. (1983), An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test, Mutation Res., 120, 241–247.
62. MacGregor, J. T., Wehr, C. M., and Langlois, R. G. (1983), A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyronin Y, Mutation Res., 120, 269–275.
63. Hayashi, M., Sofuni, T. and Ishidate, M. Jr. (1983), An application of acridine orange fluorescent staining to the micronucleus test, Mutation Res., 120, 241–247.
64. Fenech, M., Chang, W.P., Kirsch-Volders, M., Holland, N., Bonassi, S. and Zeiger, E. (2003), HUMN project: detailed description of the scoring criteria for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures, Mutation Res., 534, 65–75.
65. Hoffman, W.P., Garriott, M.L. and Lee, C. (2003), In vitro micronucleus test, v: Encyclopedia of Biopharmaceutical Statistics, Second edition. S. Chow (ed.), Marcel Dekker, Inc. New York, NY, str. 463–467.
66. Uredba (ES) št. 850/2004 Evropskega parlamenta in Sveta z dne 29. aprila 2004 o obstojnih organskih onesnaževalih in spremembi Direktive 79/117/EGS (UL L 229, 30.4.2004, str. 5).
Dodatek 1
Opredelitve pojmov
Anevgen : snov ali proces, na podlagi katerega pride do anevploidije v celicah ali organizmih zaradi reagiranja z elementi mitotičnega in meotičnega cikla delitve celic (angl. „aneugen“, op. prev.).
Anevploidija : odstopanje od normalnega diploidnega (ali haploidnega) števila kromosomov z enim kromosomom ali več kot enim kromosomov, vendar ne s celotno skupino ali skupinami kromosomov (poliploidija).
Apoptoza : programirana celična smrt, za katero je značilna vrsta korakov, ki vodijo k razgradnji celic v delce, vezane na membrano, ki se nato odstranijo s fagocitozo ali osipanjem.
Množenje celic : povečanje števila celic zaradi mitotične delitve celic.
Centromera : mesto na kromosomu, kjer sta spojeni obe kromatidi in na katerem sta na obeh straneh pritrjeni obe kinetohori.
Klastogen : snov ali proces, ki v populacijah celic ali organizmih povzroča strukturne poškodbe kromosomov (angl. „clastogen“, op. prev.).
Citokineza : proces delitve celic, ki sledi takoj po mitozi in vpliva na oblikovanje dveh hčerinskih celic, ki imata vsaka eno samo jedro.
Indeks množenja citokinetskega bloka (CBPI) : delež celic, pri katerih se je izvedla druga delitev, v tretirani populaciji glede na netretirano kontrolo (glej Dodatek 2 za formulo).
Citostaza : zaviranje rasti celic (glej Dodatek 2 za formulo).
Citotoksičnost : škodljivi učinki na celično strukturo ali delovanje, ki na koncu povzročijo smrt celice.
Genotoksično : splošni izraz, ki zajema vse poškodbe DNA ali kromosomov, vključno s prelomi, prerazporeditvijo aduktov, mutacijami, aberacijami kromosomov in anevploidijo. Vsi genotoksični učinki ne vplivajo na nastanek mutacij ali trajno poškodbo kromosomov.
Interfazne celice : celice, ki niso v fazi mitoze.
Kinetohora : struktura s proteinom, ki nastane na centromeri kromosoma in na katero se pripnejo niti delitvenega vretena med delitvijo celice, kar omogoča pravilno gibanje hčerinskih kromosomov proti poloma hčerinskih celic.
Mikronukleusi : majhna jedra, poleg glavnega jedra celic in ločena od njega, ki nastanejo med telofazo mitoze ali mejoze iz zaostalih fragmentov kromosomov ali celih kromosomov.
Mitoza : delitev celičnega jedra, ki je običajno razdeljena na profazo, prometafazo, metafazo, anafazo in telofazo.
Mitotični indeks : razmerje med številom celic v metafazi in skupnim številom celic v opazovani populaciji celic; pokazatelj stopnje množenja celic te populacije.
Mutageno : povzroči dedno spremembo zaporedij baznih parov DNA v genih ali strukturi kromosomov (kromosomske aberacije).
Nerazdvajanje : par kromatid se ne razdvoji in ustrezno loči v razvijajoče se hčerinske celice, zaradi česar imata hčerinski celici nenormalno število kromosomov.
Poliploidija : številčne kromosomske aberacije v celicah ali organizmih, ki ne vplivajo na posamezen kromosom ali kromosome (anevploidija), ampak na vse kromosome.
Indeks množenja (PI) : metoda za merjenje citotoksičnosti v primerih, ko citohalazin B ni dodan (glej Dodatek 2 za formulo).
Relativno povečanje števila celic (RICC) : metoda za merjenje citotoksičnosti v primerih, ko citohalazin B ni dodan (glej Dodatek 2 za formulo).
Relativna podvojitev populacije (RPD) : metoda za merjenje citotoksičnosti v primerih, ko citohalazin B ni dodan (glej Dodatek 2 za formulo).
Indeks pomnoževanja (RI) : razmerje ciklov celične delitve v tretirani kulturi glede na netretirano kulturo, med obdobjem izpostavljenosti in obnavljanja (glej Dodatek 2 za formulo).
Preskusna kemikalija (imenovana tudi preskusna snov) : katera koli snov ali zmes, preskušana z uporabo te preskusne metode.
Dodatek 2
Formule za ocenjevanje citotoksičnosti
1. Ko je uporabljen citohalazin B, ocena citotoksičnosti temelji na indeksu množenja citokinetskega bloka (CBPI) ali indeksu pomnoževanja (RI) (16) (58). CBPI kaže povprečno število celičnih ciklov na celico med obdobjem izpostavljenosti citohalazinu B in se lahko uporabi za izračun množenja celic. RI kaže relativno število jeder v tretiranih kulturah v primerjavi s kontrolnimi kulturami in se lahko uporabi za izračun % citostaze:
% citostaze = 100 – 100{(CBPIT – 1) ÷ (CBPIC – 1)}
in:
|
T |
= |
kultura, tretirana s preskusno kemikalijo |
|
C |
= |
kontrolna kultura z nosilcem |
pri čemer je:

Tako je CPBI z vrednostjo 1 (vse celice imajo eno jedro) enak 100-odstotni citostazi.
Citostaza = 100 – RI

|
T |
= |
tretirane kulture |
|
C |
= |
kontrolne kulture |
2. Zato RI s 53 % pomeni, da se je v primerjavi s številom celic, ki so se delile v kontrolni kulturi in oblikovale celice z dvema jedroma in več jedri, v tretirani kulturi delilo samo 53 % tega števila celic, tj. 47-odstotna citostaza.
3. Ko citohalazin B ni uporabljen, se priporoča ocena cititoksičnosti na podlagi relativnega povečanja števila celic (RICC) ali relativne podvojitve populacije (RPD) (58), saj obe metodi upoštevata delež celične populacije, ki se je delil.


pri čemer je:
podvajanje populacije = [log (število celic po obdelavi ÷ prvotno število celic)] ÷ log 2
4. Zato RICC ali RPD s 53 % kaže na 47-odstotno citotoksičnost/citostazo.
5. Z uporabo indeksa množenja (PI) se lahko citotoksičnost oceni s pomočjo štetja števila klonov, ki jih sestavljajo 1 celica (cl1), 2 celici (cl2), 3 do 4 celice (cl4) in 5 do 8 celic (cl8).

6. PI se kot koristen in zanesljiv parameter citotoksičnosti uporablja tudi za celične linije, kultivirane in situ brez dodanega citohalazina B (25) (26) (27) (28).
Dodatek 3
Referenčne kemikalije, priporočene za ocenjevanje učinkovitosti (1)
|
Kategorija |
Kemikalija |
št. CAS |
Št. EC |
|
1. Klastogeni, aktivni brez aktivacije presnove |
|||
|
Citozin-arabinozid |
147-94-4 |
205-705-9 |
|
|
Mitomicin C |
50-07-7 |
200-008-6 |
|
|
2. Klastogeni, ki zahtevajo aktivacijo presnove |
|||
|
Benzo(a)piren |
50-32-8 |
200-028-5 |
|
|
Ciklofosfamid |
50-18-0 |
200-015-4 |
|
|
3. Anevgeni |
|||
|
Kolhicin |
64-86-8 |
200-598-5 |
|
|
Vinblastin |
143-67-9 |
205-606-0 |
|
|
4. Negativne snovi |
|||
|
Di(2-etilheksil)ftalat |
117-81-7 |
204-211-0 |
|
|
Nalidinska kislina |
389-08-2 |
206-864-7 |
|
|
Piren |
129-00-0 |
204-927-3 |
|
|
Natrijev klorid |
7647-14-5 |
231-598-3 |
|
|
(1) Referenčne kemikalije so kemikalije, priporočene za uporabo. Nadomestne ali dodatne kemikalije se lahko dodajo na seznam referenčnih kemikalij, če je njihovo delovanje znano, če spodbujajo tvorbo mikronukleusov z enakimi mehanizmi delovanja in če se zanje izkaže, da so pomembne v zvezi s kemikalijami, ki se bodo preskušale z uporabo postopka analize mikronukleusov in vitro. Odvisno od namena bi lahko utemeljitev obsegala validacijsko študijo, pri kateri so uporabljene številne različne snovi, oziroma študijo, osredotočeno na ožji spekter, ki temelji na kemijskem razredu preskusne snovi ali mehanizmu škode, ki se ga preučuje. |
|||
B.50. PREOBČUTLJIVOST KOŽE: LOKALNA ANALIZA BEZGAVK: DA
UVOD
1. Smernice OECD za preskušanje kemikalij in preskusne metode EU se redno preverjajo zaradi znanstvenega napredka, spreminjajočih se zakonodajnih potreb in vprašanj, povezanih z dobrim počutjem živali. Prva preskusna metoda (B.42) za določanje preobčutljivosti kože pri miši, lokalna analiza bezgavk (LLNA; Smernica za preskušanje OECD 429) je bila že preverjena (1). Objavljene so podrobnosti o validaciji LLNA in pregled s tem povezanega dela (2) (3) (4) (5) (6) (7) (8) (9). Pri LLNA se za merjenje množenja limfocitov uporablja radioizotopni timidin ali jod, zato je lahko uporaba analize omejena v primerih, kjer je pridobitev, uporaba ali odstranitev radioaktivnosti težavna. LLNA, DA (razvil jo je Daicel Chemical Industries, Ltd) je neradioaktivna različica LLNA, ki količinsko opredeljuje vsebnost adenozin-trifosfata (ATP) s pomočjo bioluminescence kot pokazatelja množenja limfocitov. Preskusno metodo LNNA: DA je validirala in pregledala mednarodna strokovna skupina za ocenjevanje ter jo priporočila kot koristno za opredelitev kemikalij, ki povzročajo preobčutljivost, in kemikalij, ki je ne povzročajo, z nekaterimi omejitvami (10) (11) (12) (13). Ta preskusna metoda je zasnovana za ocenjevanje morebitne preobčutljivosti kože s kemikalijami (snovmi in zmesmi) pri živalih. Poglavje B.6 te priloge in Smernica za preskušanje OECD 406 uporabljata preskuse na morskih prašičkih, predvsem maksimizacijski in Buehlerjev preskus na morskih prašičkih (14). LLNA (poglavje B.42 te priloge; Smernica za preskušanje OECD 429) in dve spremembi, pri katerih se radioaktivnost ne uporablja, analiza LLNA: DA (poglavje B.50 te priloge; Smernica za preskušanje OECD 442 A) in LLNA: BrdU-ELISA (poglavje B.51 te priloge; Smernica za preskušanje OECD 442 B) zaradi manj pogoste in izpopolnjene uporabe živali zagotavljajo prednost v primerjavi s preskusi na morskih prašičkih iz metode B.6 in Smernica za preskušanje OECD 406 (14).
2. Podobno kot LLNA tudi LLNA: DA preučuje indukcijsko fazo preobčutljivosti kože in zagotavlja količinske podatke, ki so primerni za oceno odziva na odmerek. Ker odkriva povzročitelje preobčutljivosti, ne da bi bilo pri tem treba uporabiti radioaktivni označevalec za DNA, se ne pojavljajo vprašanja glede poklicne izpostavljenosti radioaktivnosti in odstranjevanja odpadkov. Zaradi tega bo za odkrivanje povzročiteljev preobčutljivosti morda mogoča pogostejša uporaba miši, zaradi česar bi se lahko še bolj zmanjšala uporaba morskih prašičkov za preskušanje morebitne preobčutljivosti kože (tj. B.6; Smernica za preskušanje OECD 406) (14).
OPREDELITVE POJMOV
3. Uporabljene opredelitve pojmov so navedene v Dodatku 1.
ZAČETNI POMISLEKI IN OMEJITVE
4. Analiza LLNA: DA je spremenjena metoda LLNA za ugotavljanje morebitne preobčutljivosti kože s kemikalijami, s posebnimi omejitvami. Ni nujno, da to pomeni, da je treba v vseh primerih namesto preskusov na morskih prašičkih in LLNA (tj. B.6; Smernica za preskušanje OECD 406) (14), uporabiti analizo LLNA: DA, temveč da je ta analiza enakovredna in se lahko uporabi kot druga možnost, pri kateri običajno niso več potrebne dodatne potrditve pozitivnih in negativnih rezultatov (10) (11). Preskuševalni laboratorij mora pred začetkom opravljanja študije upoštevati vse razpoložljive informacije o preskusni snovi. Takšne informacije bodo vključevale vrsto in kemijsko sestavo preskusne snovi; njene fizikalno-kemijske lastnosti; rezultate katerih koli drugih preskusov toksičnosti na preskusni snovi, in vitro ali in vivo; in toksikološke podatke o strukturno sorodnih kemikalijah. Te informacije je treba upoštevati, da se določi, ali je metoda LLNA: DA primerna za preskusno snov (glede na nezdružljivost omejenega števila vrst kemikalij z analizo LLNA: DA [glej odstavek 5] in za lažjo izbiro odmerka.
5. Analiza LLNA: DA je metoda in vivo in posledično ne odpravlja uporabe živali pri ocenjevanju delovanj, ki povzročajo alergijsko preobčutljivost ob stiku. Vendar ima možnost, da v primerjavi s preskusi na morskih prašičkih (B.6; Smernica za preskušanje OECD 406) (14) zmanjša število živali, potrebnih v ta namen. Poleg tega nudi analiza LLNA: DA znatno izboljšanje (manj bolečine in trpljenja) načina, kako se živali uporabljajo za preskušanje alergijske preobčutljivosti ob stiku, saj v nasprotju z metodo B.6 in Smernico za preskušanje 406 ne zahteva, da se povzročijo izzvane reakcije prekomerne občutljivosti kože. Kljub prednostim analize LLNA: DA v primerjavi z metodo B.6 in Smernico za preskušanje OECD 406 (14), obstajajo nekatere omejitve, zaradi katerih je lahko nujna uporaba metode B.6 ali Smernice za preskušanje OECD 406 (npr. preskušanje določenih kovin, lažni pozitivni rezultati pri nekaterih dražilnih snoveh za kožo [kot so nekatere vrste površinsko razgradljivih kemikalij] (6) (1 in poglavje B.42 te priloge), topnost preskusne snovi). Poleg tega je zaradi kemijskih razredov ali snovi s funkcionalnimi skupinami, za katere se je izkazalo, da lahko delujejo kot moteči dejavniki (16), lahko potrebna uporaba preskusov na morskih prašičkih (tj. B.6; Smernica za preskušanje OECD 406 (14)). Za omejitve, določene za LLNA (1 in poglavje B.42 te priloge), je bilo priporočeno, da se uporabljajo tudi za analizo LLNA: DA (10). Poleg tega uporaba analize LLNA: DA morda ni primerna za uporabo snovi, ki vplivajo na ravni adenozin-trifosfata (ATP) (npr. snovi, ki delujejo kot inhibitorji ATP), ali snovi, ki vplivajo na natančno merjenje ATP v celicah (npr. prisotnost encimov, ki razgrajujejo ATP, prisotnost zunajcelične ATP v bezgavki). Razen takšnih določenih omejitev bi morala biti analiza LLNA: DA primerna za preskušanje katere koli snovi, razen če so s temi snovmi povezane lastnosti, ki lahko ovirajo natančnost analize LLNA: DA. Poleg tega je treba razmisliti o možnosti mejnih pozitivnih rezultatov v primerih, ko so dobljene vrednosti stimulacijskega indeksa (SI) med 1,8 in 2,5 (glej odstavke 31–32). To temelji na podatkovni zbirki za validacijo s 44 snovmi s stimulacijskim indeksom ≥ 1,8 (glej odstavek 6), pri kateri je analiza LLNA: DA pravilno opredelila vseh 32 povzročiteljev preobčutljivosti pri LLNA, vendar je nepravilno opredelila tri od 12 snovi, ki pri LLNA ne povzročajo preobčutljivosti z vrednostmi stimulacijskega indeksa med 1,8 in 2,5 (tj. mejno pozitivna vrednost) (10). Ker pa je bil za določanje vrednosti stimulacijskega indeksa in izračun predvidljivih lastnosti preskusa uporabljen isti nabor podatkov, so lahko navedeni rezultati pretirana ocena dejanskih predvidljivih lastnosti.
NAČELA METODE PRESKUŠANJA
6. Osnovno načelo, na katerem temelji analiza LLNA: DA, je, da povzročitelji preobčutljivosti povzročijo množenje limfocitov v bezgavkah, ki drenirajo območje nanosa preskusne snovi. To množenje je sorazmerno z odmerkom in močjo uporabljenega alergena in je preprosto sredstvo za doseganje količinske izmere preobčutljivosti. Množenje se izmeri s primerjavo povprečnega množenja v vsaki preskusni skupini in povprečnega množenja v kontrolni skupini, tretirani z nosilcem. Določi se razmerje med povprečnim množenjem v vsaki tretirani skupini in povprečnim množenjem v primerjalni kontrolni skupini z nosilcem, ki se imenuje stimulacijski indeks (SI) in mora biti ≥ 1,8, preden je nadaljnje ocenjevanje preskusne snovi kot možnega povzročitelja preobčutljivosti kože utemeljeno. Opisani postopki temeljijo na merjenju vsebnosti ATP z bioluminiscenco (za katero je znano, da se ujema s številom živih celic) (17), ki pokaže povečano število množečih se celic v ušesnih bezgavkah (18) (19). Metoda z bioluminiscenco izkorišča encim luciferaze za kataliziranje nastanka svetlobe iz ATP in luciferin v skladu z naslednjo reakcijo:
ATP + Luciferin + O
2
![]() Oxyluciferin + AMP + PPi
+ CO
2 + Light
Oxyluciferin + AMP + PPi
+ CO
2 + Light
Oddana osvetljenost je linearno povezana s koncentracijo ATP in se meri z luminometrom. Analiza reakcije med luciferinom in luciferazo je občutljiva metoda za količinsko opredelitev ATP, ki se uporablja na številne načine (20).
OPIS ANALIZE
Izbira živalskih vrst
7. Izbrana vrsta za ta preskus je miš. Validacijske študije za analizo LLNA: DA so bile izvedene samo s sevom CBA/J, ki je zato priporočeni sev (12) (13). Uporabijo se mlade odrasle mišje samice, ki še niso kotile in niso breje. Na začetku študije morajo biti živali stare 8–12 tednov, odstopanje mase živali pa mora biti čim manjše in ne sme presegati 20 % povprečne mase. Namesto tega se lahko uporabi druge seve in samce, ko je dobljenih dovolj podatkov za prikaz, da ne obstajajo značilne razlike v odzivu pri analizi LLNA: DA glede na sev in/ali spol.
Bivalni in prehranjevalni pogoji
8. Miši morajo biti skupinsko nastanjene (21), razen če je zagotovljena ustrezna znanstvena utemeljitev za njihovo ločeno nastanitev. Temperatura v prostoru za poskusne živali mora biti 22 ± 3 °C. Čeprav mora biti relativna vlažnost najmanj 30 % in po možnosti ne sme presegati 70 %, mora biti ciljna vlažnost, razen med čiščenjem prostora, 50 do 60 %. Osvetlitev naj bo umetna, in sicer 12 ur svetlobe, 12 ur teme. Za hranjenje se lahko uporablja konvencionalna laboratorijska prehrana z neomejeno oskrbo s pitno vodo.
Priprava živali
9. Živali se naključno izberejo, označijo tako, da je omogočeno posamično prepoznavanje (vendar ne s katero od oblik ušesnih oznak), in zadržijo v kletkah najmanj pet dni pred začetkom dajanja odmerka, da se lahko prilagodijo laboratorijskim razmeram. Pred začetkom tretiranja se vse živali pregledajo, da se zagotovi, da nimajo opaznih kožnih lezij.
Priprava preskusnih raztopin
10. Trdne kemikalije se pred nanosom na uho miši raztopijo ali suspendirajo v ustreznih topilih ali nosilcih in po potrebi razredčijo. Tekoče kemikalije se lahko nanesejo nerazredčene ali pa se razredčijo pred dajanjem odmerka. Pri netopnih kemikalijah, kot so tiste, ki se običajno uporabljajo v medicinskih pripomočkih, je treba uporabiti močno povečano ekstrakcijo v ustreznem topilu, da se odkrije vse ekstraktibilne sestavine za preskušanje pred nanosom na uho miši. Preskusne snovi je treba pripravljati dnevno, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
Preverjanje zanesljivosti
11. Za prikaz ustrezne učinkovitosti analize se uporabijo kemikalije pozitivne kontrole, ki se odzovejo z ustrezno in ponovljivo občutljivostjo kot preskusna snov, ki povzroča preobčutljivost, za katero je stopnja reakcije natančno opredeljena. Uporaba primerjalne pozitivne kontrole je priporočena, saj pokaže zmožnost laboratorija, da uspešno izvede vsako analizo, ter omogoča ocenjevanje ponovljivosti in primerljivosti v enem ali več laboratorijih. Tudi nekateri regulativni organi zahtevajo uporabo pozitivne kontrole pri vsaki raziskavi, zato se uporabnikom priporoča, da se pred izvedbo analize LLNA: DA posvetujejo s pristojnimi organi. V skladu s tem se priporoča redna uporaba primerjalne pozitivne kontrole, saj tako ni potrebno dodatno preskušanje na živalih za izpolnitev zahtev, ki se lahko pojavijo zaradi uporabe redne pozitivne kontrole (glej odstavek 12). Pozitivna kontrola mora povzročiti pozitiven odziv analize LLNA: DA na raven izpostavljenosti, za katero se pričakuje, da bo dala večji stimulacijski indeks (SI) > 1,8 kot negativna kontrolna skupina. Odmerek pozitivne kontrole je treba izbrati tako, da ne povzroči čezmernega draženja kože ali sistemske toksičnosti in da je indukcija ponovljiva, vendar ne čezmerna (tj. SI > 10 bi se štel za čezmernega) Priporočena pozitivna kontrola je 25-odstotni heksil cimetov aldehid (Služba za izmenjavo kemijskih izvlečkov [CAS] št. 101-86-0) in 25-odstotni evgenol (št. CAS 97-53-0) v acetonu: olivnem olju (4:1, v/v). V nekaterih okoliščinah se lahko ob ustrezni utemeljitvi uporabijo druge pozitivne kontrole, ki izpolnjujejo zgornja merila.
12. Običajno je uporaba pozitivne kontrolne skupine priporočena, lahko pa obstajajo okoliščine, v katerih redno preskušanje (tj. v razmikih ≤ 6 mesecev) pozitivne kontrole morda zadošča za laboratorije, ki redno izvajajo analizo LLNA: DA (tj. izvajajo analizo LLNA: DA vsaj enkrat mesečno) in imajo vzpostavljeno zbirko podatkov o preteklih pozitivnih kontrolah, ki dokazujejo zmožnost laboratorija, da pridobi ponovljive in natančne rezultate s pozitivnimi kontrolami. Ustrezna strokovnost pri izvajanju analize LLNA: DA se lahko uspešno dokaže z dobivanjem doslednih pozitivnih rezultatov s pozitivno kontrolo pri vsaj desetih neodvisnih preskusih, izvedenih v razumnem časovnem obdobju (tj. v manj kot enem letu).
13. Primerjalno pozitivno kontrolno skupino je treba vključiti vedno, kadar pride do postopkovne spremembe pri analizi LLNA: DA (tj. zamenjava usposobljenega osebja, zamenjava materiala za preskusno metodo in/ali reagentov, zamenjava opreme za preskusno metodo, zamenjava vira preskusnih živali), takšne spremembe pa je treba vedno zabeležiti v laboratorijskih poročilih. Pri odločanju o nujnosti vzpostavitve nove zbirke preteklih podatkov za beleženje doslednosti pri rezultatih pozitivne kontrole je treba upoštevati učinek, ki ga imajo te spremembe na ustreznost predhodno vzpostavljene zbirke preteklih podatkov.
14. Raziskovalci se morajo zavedati, da odločitev o izvajanju redne namesto primerjalne pozitivne kontrolne študije vpliva na ustreznost in sprejemljivost negativnih rezultatov študije, pridobljenih brez primerjalne pozitivne kontrole v razmiku med rednimi pozitivnimi kontrolnimi študijami. Na primer, če je rezultat, pridobljen z redno pozitivno kontrolno študijo, lažno negativen, so lahko vprašljivi negativni rezultati preskusne snovi, pridobljeni v času med zadnjo sprejemljivo redno pozitivno kontrolno študijo in nesprejemljivo redno pozitivno kontrolno študijo. Pri odločanju, ali vključiti primerjalne pozitivne kontrole ali izvajati samo redne pozitivne kontrole, je treba skrbno preučiti posledice teh rezultatov. Treba je razmisliti tudi o uporabi manjšega števila živali v primerjalni pozitivni kontrolni skupini, če je to znanstveno utemeljeno in če laboratorij na podlagi preteklih podatkov, značilnih za laboratorij, dokaže, da se lahko uporabi manjše število miši (22).
15. Čeprav je treba pozitivno kontrolo preskusiti v nosilcu, za katerega je znano, da povzroča dosleden odziv (npr. aceton: olivno olje; 4:1, v/v), lahko obstajajo nekatere zakonodajne okoliščine, ko je potrebno tudi preskušanje v nestandardnem nosilcu (klinično/kemično ustrezne sestave) (23). Če se primerjalna pozitivna kontrola preskuša v drugem nosilcu kot preskusna snov, je treba za primerjalno pozitivno kontrolo vključiti ločen kontrolni nosilec.
16. V primerih, kjer se ocenjujejo snovi za poseben kemijski razred ali razpon reakcij, so lahko primerjalne snovi uporabne tudi za dokaz, da preskusna metoda deluje pravilno za odkrivanje morebitne preobčutljivosti kože pri teh vrstah snovi. Ustrezne primerjalne snovi morajo imeti naslednje lastnosti:
— strukturno in funkcijsko podobnost z razredom preskusne snovi, ki se preskuša,
— znane fizikalno-kemijske lastnosti;
— podporne podatke iz analiz LLNA: DA;
— podporne podatke od drugih živalskih modelov in/ali ljudi.
PRESKUSNI POSTOPEK
Število živali in velikost odmerkov
17. Na skupino odmerka se uporabijo najmanj štiri živali z najmanj tremi koncentracijami preskusne snovi, poleg tega pa še primerjalna negativna kontrolna skupina, tretirana zgolj z nosilcem za preskusno snov, in pozitivna kontrola (primerjalna ali izvedena pred kratkim, odvisno od politike laboratorija pri upoštevanju odstavkov 11–15). Treba je razmisliti o preskušanju več odmerkov pozitivne kontrole, zlasti če se pozitivna kontrola preskuša občasno. Živali v kontrolnih skupinah je treba, razen če se ne tretirajo s preskusno snovjo, obravnavati in tretirati na enak način kot živali v tretiranih skupinah.
18. Izbira odmerka in nosilca mora temeljiti na priporočilih iz sklicev (2) in (24). Zaporedni odmerki se običajno izberejo iz ustrezne serije koncentracij, kot so 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 % itd. Izbira uporabljene serije koncentracij mora biti ustrezno znanstveno utemeljena. Kadar so na voljo, je treba pri izbiri treh zaporednih koncentracij upoštevati vse obstoječe toksikološke informacije (npr. akutno toksičnost in draženje kože) ter strukturne in fizikalno-kemijske informacije o želeni preskusni snovi (in/ali strukturno povezani snovi), tako da je pri največji koncentraciji izpostavljenost največja, hkrati pa ni sistemske toksičnosti in/ali čezmernega draženja kože (24) (25). Če takšne informacije niso na voljo, je morda najprej potreben predhodni presejalni preskus (glej odstavke 21–24).
19. Nosilec ne sme ovirati rezultatov preskusa ali vplivati nanje, izbere pa se na podlagi povečevanja topnosti, da se med pripravljanjem raztopine/suspenzije, ki je primerna za uporabo preskusne snov, pridobi največjo možno koncentracijo. Priporočljivi nosilci so aceton: olivno olje (4:1, v/v), N,N-dimetilformamid, metil etil keton, propilen glikol in dimetil sulfoksid (6), vendar se lahko uporabljajo tudi drugi, če je zagotovljena ustrezna znanstvena utemeljitev. V nekaterih okoliščinah je morda treba kot dodatno kontrolo uporabiti klinično ustrezno topilo ali trgovsko sestavo, v kateri se trži preskusna snov. Paziti je treba zlasti, da so v nosilni sistem vključene hidrofilne snovi, ki vlažijo kožo in se ne izsušijo takoj, z vključitvijo ustreznih pospeševalcev raztapljanja (npr. 1-odstotnim Pluronic® L92). Zato se je treba izogibati povsem vodenim nosilcem.
20. Obdelava bezgavk posamezne miši omogoča oceno spremenljivosti med posameznimi živalmi ter statistično primerjavo razlik med meritvami preskusne snovi in primerjalne kontrolne skupine z nosilcem (glej odstavek 33). Poleg tega je ocena možnosti zmanjšanja števila miši v pozitivni kontrolni skupini izvedljiva samo, če se zbirajo podatki o posameznih živalih (22). Poleg tega nekateri regulativni organi zahtevajo zbiranje podatkov o posameznih živalih. Redno zbiranje podatkov o posameznih živalih zagotavlja prednosti glede dobrega počutja živali, saj se s tem prepreči dvojno preskušanje, ki bi bilo potrebno, če bi bilo treba rezultate, prvotno zbrane na en način (npr. preko združenih podatkov o živalih) zaradi drugih zahtev regulativnih organov (npr. glede podatkov o posameznih živalih) kasneje ponovno preučiti.
Predhodni presejalni preskus
21. Če informacije za določitev največjega odmerka za preskušanje niso na voljo (glej odstavek 18), je treba izvesti predhodni presejalni preskus, da se določi ustrezna velikost odmerka za preskušanje z analizo LLNA: DA. Namen predhodnega presejalnega preskusa je zagotoviti smernice za izbiro največje velikosti odmerka za uporabo v glavni študiji analize LLNA: DA v primerih, ko ni na voljo informacij o koncentraciji, ki povzroči sistemsko toksičnost (glej odstavek 24) in/ali čezmerno draženje kože (glej odstavek 23). Največja velikost odmerka je 100-odstotna preskusna snov za tekočine ali najvišja možna koncentracija za trdne snovi ali suspenzije.
22. Predhodni presejalni preskus se izvede v pogojih, ki so enaki tistim v glavni študiji analize LLNA: DA, s to razliko, da se ne izvede ocena množenja v bezgavkah in da se lahko uporabi manj živali na skupino odmerka. Predlaga se uporaba ene ali dveh živali na skupino odmerka. Vse miši se opazuje dnevno glede kliničnih znakov sistemske toksičnosti ali lokalnega draženja na mestu nanosa. Telesna masa se zabeleži pred preskusom in pred usmrtitvijo (8. dan). Obe ušesi vsake miši se opazuje glede rdečine in oceni s pomočjo preglednice 1 (25). Meritve debeline ušesa se izvedejo z napravo za merjenje debeline (npr. digitalnim mikrometrom ali merilnikom debeline s številčnico) 1. dan (pred odmerkom), 3. dan (približno 48 ur pred prvim odmerkom), 7. dan (24 ur pred usmrtitvijo) in 8. dan. Poleg tega se lahko 8. dan debelino ušesa določi s preluknjanjem ušes za določitev mase, ki se izvede po humani usmrtitvi živali. Znak za čezmerno draženje je rdečina z oceno ≥ 3 in/ali povečana debelina ušesa za ≥ 25 % na kateri koli dan merjenja (26) in (27). Največji odmerek, izbran za glavno študijo analize LLNA: DA, je naslednji nižji odmerek v seriji koncentracij iz predhodnega presejalnega preskusa (glej odstavek 18), ki ne povzroči sistemske toksičnosti in/ali čezmernega draženja kože.
Preglednica 1
Ocena rdečine
|
Ugotovitev |
Ocena |
|
Rdečine ni |
0 |
|
Neznatna rdečina (komajda opazna) |
1 |
|
Zelo razločna rdečina |
2 |
|
Zmerna do močna rdečina |
3 |
|
Močna rdečina (rdečina rdeče pese) in nastanek krast ovirata razvrstitev rdečine |
4 |
23. Poleg 25-odstotnega povečanja debeline ušesa (26) (27), se za opredelitev dražilnih snovi pri LLNA uporablja tudi statistično značilno povečanje debeline ušesa tretirane miši v primerjavi s kontrolno mišjo tako uporablja za opredelitev dražilnih snovi pri lokalni analizi bezgavk (28) (29) (30) (31) (32) (33) (34). Ker pa se lahko statistično značilno povečanje pojavi tudi pri debelini ušesa, manjši od 25 %, ni izrecno povezano s čezmernim draženjem (30) (31) (32) (33) (34).
24. Naslednje klinične ugotovitve lahko nakazujejo sistemsko toksičnost (35), kadar se uporabljajo kot del celovite ocene, in zato lahko pokažejo največjo velikost odmerka za uporabo v glavni analizi LLNA: DA: spremembe v delovanju živčnega sistema (npr. piloerekcija, ataksija, tremorji in krči); vedenjske spremembe (npr. agresivnost, spremembe glede nege, opazna sprememba ravni dejavnosti); spremembe dihanja (npr. spremembe frekvence in intenzivnosti dihanja kot so dispneja, zasoplost in hropenje) ter spremembe glede uživanja hrane in vode. Poleg tega je treba pri oceni upoštevati znake letargije in/ali neodzivnosti ter morebitne klinične znake bolečine in trpljenja, ki niso samo blagi ali trenutni, ali zmanjšanje telesne mase za > 5 % od 1. do 8. dne ter smrtnost. Umirajoče živali ali živali, ki kažejo znake hudega in dolgotrajnega trpljenja, se usmrtijo na human način (36).
Načrt za poskus glavne študije
25. Načrt za poskus analize je naslednji:
|
— |
1. dan : Posamično ugotovljena in zabeležena masa vsake živali in morebitne klinične ugotovitve. Nanos 1-odstotne vodne raztopine natrijevega laurel sulfata (SLS) na vsak uhelj, s pomočjo čopiča, namočenega v raztopino SLS, in premaz celotnega uhlja v štirih do petih potezah. Uro po obdelavi s SLS sledi nanos 25 μl ustrezno razredčene preskusne snovi, samega nosilca ali pozitivne kontrole (primerjalne ali izvedene pred kratkim, odvisno od politike laboratorija pri upoštevanju odstavkov 11–15 na vsak uhelj. |
|
— |
2., 3. in 7. dan : Ponovi se postopek predhodne obdelave z 1-odstotno vodno raztopino SLS in nanosa preskusne snovi, ki je bil izveden 1. dan. |
|
— |
4., 5. in 6. dan : Brez tretiranja. |
|
— |
8. dan : Zabeleži se masa vsake živali in morebitne klinične ugotovitve. Približno 24 do 30 ur po začetku nanašanja 7. dne se živali humano usmrti. Ušesne bezgavke ob vsakem ušesu miši se izrežejo in shranijo v fosfatni pufer s soljo (PBS) za vsako žival Podatki in diagrami o identifikaciji in izrezu bezgavk so na voljo v sklicu (22). Za nadaljnje spremljanje odziva kože v glavni študiji se lahko v študijski protokol vključijo dodatni parametri, kot so ocena rdečine ušesa ali meritve debeline ušesa (pridobljene z merilnikom debeline ali preluknjanjem ušes za določitev mase pri obdukciji). |
Priprava celičnih suspenzij
26. Enotna celična suspenzija iz celic bilateralno izrezanih bezgavk vsake miši se pripravi tako, da se bezgavke namesti med dve objektni stekelci, ki se ju nežno stisne in tako zdrobi bezgavke. Po potrditvi, da se je tkivo na tanko razširilo, se stekelci povlečeta narazen. Tkivo na obeh stekelcih se suspendira s fosfatnim pufrom s soljo tako, da se vsako stekelce drži pod kotom nad petrijevko in spira s PBS ter istočasno strga tkivo s stekelca. Bezgavke živali v negativni kontroli so majhne, zato je treba biti pazljiv, da ne pride do umetnega vpliva na vrednosti SI. Za spiranje obeh stekelc se uporabi skupno 1 ml PBS. Suspenzija iz celic bezgavk v petrijevki se narahlo zmeša s strgalom za celice. Nato se s mikropipeto zbere 20 μL alikvota suspenzije iz celic bezgavk, pri čemer je treba paziti, da se ne pobere membrana, vidna z očesom, in zmeša z 1,98 ml PBS, s čimer dobimo 2 ml vzorec. Z enakim postopkom se nato pripravi drugi 2 ml vzorec, tako da sta za vsako žival pripravljena dva vzorca.
Določitev množenja celic (merjenje vsebnosti adenozin-trifosfata (ATP) pri limfocitih)
27. Povečanje vsebnosti ATP v bezgavkah se meri z metodo luciferina/luciferaze z uporabo kompleta za merjenje ATP, ki meri bioluminiscenco v relativnih luminiscenčnih enotah (RLU). Čas analize od časa usmrtitve živali do merjenja vsebnosti ATP za vsako posamezno žival mora biti enak, in sicer približno 30 minut, ker se vsebnost ATP po usmrtitvi živali postopoma zmanjšuje (12). Zato mora biti serija postopkov od izreza ušesnih bezgavk do merjenja ATP izvedena v 20 minutah z vnaprej določenim časovnim razporedom, ki je enak za vsako žival. Luminiscenca ATP se izmeri v vsakem 2 ml vzorcu, tako da se za vsako žival pridobi dve meritvi ATP. Nato se določi povprečna luminiscenca ATP, ki se uporabi pri nadaljnjih izračunih (glej odstavek 30).
OPAZOVANJA
Klinična opazovanja
28. Vsako miš je treba vsaj enkrat dnevno natančno opazovati glede kliničnih znakov, lokalnega draženja na mestu nanosa ali sistemske toksičnosti. Vsa opazovanja se sistematično zabeležijo v evidence, ki se vodijo za vsako miš. Načrt spremljanja vključuje merila za hitro identifikacijo miši, ki izražajo sistemsko toksičnost, čezmerno draženje kože ali jedkost za kožo zaradi evtanazije (36).
Telesna masa
29. Kot je navedeno v odstavku 25 se telesna masa posameznih živali izmeri na začetku preskusa in ob predvideni humani usmrtitvi.
IZRAČUN REZULTATOV
30. Rezultati za vsako tretirano skupino so izraženi kot povprečni stimulacijski indeks (SI). SI se dobi tako, da se povprečno število relativne luminiscenčne enote/miš v vsaki skupini preskusne snovi in v pozitivni kontrolni skupini deli s povprečnim številom relativne luminiscenčne enote/miš za kontrolno skupino s topilom/nosilcem. Povprečni stimulacijski indeks za kontrolne skupine z nosilcem je potem 1.
31. Rezultat se šteje za pozitivnega, če je SI ≥ 1,8 (10). Vendar se lahko pri odločanju, ali je mejni rezultat pozitiven (tj. vrednost SI med 1,8 in 2,5), uporabijo tudi moč odziva na odmerek, statistični pomen ter doslednost odzivov v topilu/nosilcu in pozitivni kontroli (2) (3) (37).
32. Pri mejnem pozitivnem odzivu s SI med 1,8 in 2,5 bodo uporabniki morda za potrditev, da so takšni rezultati pozitivni, poleg vrednostih SI upoštevali tudi moč odziva na odmerek, dokaze o sistemski toksičnosti ali statistični pomen (10). Upoštevati je treba tudi različne lastnosti preskusne snovi, vključno s strukturno podobnostjo z znanimi povzročitelji preobčutljivosti, povzročanjem čezmernega lokalnega draženja kože pri miši ter naravo opaženega odnosa med odmerkom in odzivom. Ti in drugi razlogi so podrobno obdelani drugje (4).
33. Zbiranje podatkov na ravni posamezne miši bo omogočilo statistično analizo prisotnosti in stopnje odnosa med odmerkom in odzivom v podatkih. Morebitna statistična ocena lahko vključuje oceno odnosa med odmerkom in odzivom ter ustrezno prilagojene primerjave preskusnih skupin (npr. skupina, ki je prejela odmerek v parih, proti primerjavam primerjalnih kontrolnih skupin s topilom/nosilcem). Statistična analiza lahko obsega npr. linearno regresijo ali Williamsov preskus za oceno nihanj odziva na odmerek in Dunnettov preskus za primerjave po parih. Pri izbiri ustrezne metode statistične analize se mora raziskovalec zavedati možnih neenakosti varianc in drugih sorodnih problemov, zaradi katerih je lahko nujna pretvorba podatkov ali neparametrska statistična analiza. V vsakem primeru bo moral raziskovalec morda izvesti izračune stimulacijskega indeksa in statistične analize s podatkovnimi točkami (včasih imenovanimi „izločitve“) in brez njih.
PODATKI IN POROČANJE
Podatki
34. Podatki se povzamejo v obliki preglednice, ki prikazuje vrednosti relativne luminiscenčne enote za posamezno žival, skupinsko povprečje relativne luminiscenčne enote/žival, s tem povezane napake (npr. SD, SEM) in povprečni SI za vsako skupino odmerka v primerjavi s primerjalno kontrolno skupino s topilom/nosilcem.
Poročilo o preskusu
35. Poročilo o preskusu vsebuje naslednje informacije:
preskusne in kontrolne kemikalije:
— identifikacijske podatke (npr. številko CAS in številko EC, če je na voljo; vir; čistost; znane nečistoče, številko serije),
— fizikalno stanje in fizikalno-kemijske lastnosti (npr. hlapnost, stabilnost, topnost),
— če je zmes, sestavo in relativne odstotke sestavin;
topilo/nosilec:
— identifikacijske podatke (čistost, po potrebi koncentracijo, uporabljeno količino),
— utemeljitev izbire uporabljenega nosilca;
preskusne živali:
— vir miši seva CBA,
— mikrobiološki status živali, če je znan,
— število in starost živali,
— vir živali, namestitvene pogoje, prehrano, itd.;
preskusni pogoji:
— vir, številko serije in podatke proizvajalca glede zagotavljanja kakovosti/nadzora kakovosti kompleta za ATP,
— podatke o pripravi in uporabi preskusne snovi,
— utemeljitev izbire odmerka (vključno z rezultati predhodnega presejalnega preskusa, če je bil izveden),
— uporabljene koncentracije nosilca in preskusne snovi in skupno količino uporabljene preskusne snovi,
— podatke o kakovosti hrane in vode (vključno z vrsto/virom prehranjevanja, virom vode),
— podatke o programih tretiranja in vzorčenja,
— metode merjenja toksičnosti,
— merila za obravnavanje študij kot pozitivnih ali negativnih,
— podrobnosti o morebitnih odstopanjih protokola in pojasnilo, kako odstopanje vpliva na zasnovo študije in njene rezultate;
preverjanje zanesljivosti:
— povzetek rezultatov zadnjega preverjanja zanesljivosti, vključno z informacijami o uporabljeni preskusni snovi, koncentraciji in nosilcu,
— primerjalne in/ali pretekle pozitivne in primerjalne negativne (topilo/nosilec) kontrolne podatke za preskuševalni laboratorij,
— če primerjalna pozitivna kontrola ni bila vključena, datum in laboratorijsko poročilo nazadnje izvedene redne pozitivne kontrole in poročilo, ki navaja pretekle pozitivne kontrolne podatke za laboratorij, na podlagi katerih je upravičeno neizvajanje primerjalne pozitivne kontrole;
rezultati:
— posamezne mase živali na začetku odmerjanja in ob predvideni usmrtitvi; ter povprečno in povezano napako (npr. SD, SEM) za vsako tretirano skupino,
— časovni potek začetka toksičnosti in njenih znakov, vključno z morebitnim draženjem kože na mestu dajanja za vsako žival,
— čas usmrtitve živali in čas merjenja ATP za vsako žival,
— preglednico z vrednostmi relativne luminiscenčne enote in vrednostmi stimulacijskega indeksa za vsako tretirano skupino odmerka,
— povprečno in povezano napako (npr. SD, SPM) za relativno luminiscenčno enoto/miš za vsako tretirano skupino,
— izračunan SI in ustrezno merilo spremenljivosti, ki upošteva spremenljivost med posameznimi živalmi tako v preskusni snovi kot kontrolnih skupinah,
— odnos med odmerkom in odzivom,
— po potrebi, statistične analize;
razprava o rezultatih:
— kratke pripombe o rezultatih, analizo odziva na odmerek in po potrebi statistične analize, s sklepom, ali naj se preskusna snov šteje za povzročitelja preobčutljivosti kože.
VIRI
1. OECD (2010), Skin Sensitisation: Local Lymph Node Assay, Test Guideline No. 429, Guidelines for the Testing of Chemicals, OECD, Paris. Available at: http://www.oecd.org/env/testguidelines
2. Chamberlain, M. and Basketter, D.A. (1996), The local lymph node assay: status of validation. Food Chem, Toxicol., 34, 999-1002.
3. Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E. (1996), The local lymph node assay: A viable alternative to currently accepted skin sensitisation tests. Food Chem, Toxicol., 34, 985–997.
4. Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998), Strategies for identifying false positive responses in predictive sensitisation tests. Food Chem. Toxicol., 36, 327–333.
5. Van Och, F.M.M., Slob, W., De Jong, W.H., Vandebriel, R.J. and Van Loveren, H. (2000), A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employement of a regression method that includes determination of uncertainty margins. Toxicol., 146, 49–59.
6. ICCVAM (1999), The murine local lymph node Assay: A test method for assessing the allergic contact dermatitis potential of chemicals/compounds: The results of an independent peer review evaluation coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494. Research Triangle Park, N.C. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna/llnarep.pdf.
7. Dean, J.H., Twerdok, L.E., Tice, R.R., Sailstad, D.M., Hattan, D.G., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: II. Conclusions and recommendations of an independent scientific peer review panel. Reg. Toxicol. Pharmacol. 34, 258–273.
8. Haneke, K.E., Tice, R.R., Carson, B.L., Margolin, B.H., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: III. Data analyses completed by the national toxicology program interagency center for the evaluation of alternative toxicological methods. Reg. Toxicol. Pharmacol. 34, 274–286.
9. Sailstad, D.M., Hattan, D., Hill, R.N., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: I. The ICCVAM review process.Reg. Toxicol. Pharmacol. 34, 249–257.
10. ICCVAM (2010), ICCVAM Test Method Evaluation Report. Nonradioactive local lymph node assay: modified by Daicel Chemical Industries, Ltd., based on ATP content test method protocol (LLNA: DA). NIH Publication No. 10-7551A/B. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/methods/immunotox/llna-DA/TMER.htm.
11. ICCVAM (2009), Independent Scientific Peer Review Panel Report: Updated validation status of new versions and applications of the murine local lymph node assay: a test method for assessing the allergic contact dermatitis potential of chemicals and products. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/docs/immunotox_docs/LLNAPRPRept2009.pdf.
12. Idehara, K., Yamagishi, G., Yamashita, K. and Ito, M. (2008), Characterization and evaluation of a modified local lymph node assay using ATP content as a non-radio isotopic endpoint.J. Pharmacol. Toxicol. Meth., 58, 1–10.
13. Omori, T., Idehara, K., Kojima, H., Sozu, T., Arima, K., Goto, H., Hanada, T., Ikarashi, Y., Inoda, T., Kanazawa, Y., Kosaka, T., Maki, E., Morimoto, T., Shinoda, S., Shinoda, N., Takeyoshi, M., Tanaka, M., Uratani, M., Usami, M., Yamanaka, A., Yoneda, T., Yoshimura, I. and Yuasa, A. (2008), Interlaboratory validation of the modified murine local lymph node assay based on adenosine triphosphate measurement. J. Pharmacol. Toxicol. Meth., 58, 11–26.
14. OECD (1992), Skin Sensitisation, Test Guideline No. 406, Guidelines for Testing of Chemicals, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
15. Kreiling, R., Hollnagel, H.M., Hareng, L., Eigler, L., Lee, M.S., Griem, P., Dreessen, B., Kleber, M., Albrecht, A., Garcia, C. and Wendel, A. (2008), Comparison of the skin sensitising potential of unsaturated compounds as assessed by the murine local lymph node assay (LLNA) and the guinea pig maximization test (GPMT). Food Chem. Toxicol., 46, 1896–1904.
16. Basketter, D., Ball, N., Cagen, S., Carrillo, J.C., Certa, H., Eigler, D., Garcia, C., Esch, H., Graham, C., Haux, C., Kreiling, R. and Mehling, A. (2009), Application of a weight of evidence approach to assessing discordant sensitisation datasets: implications for REACH. Reg. Toxicol. Pharmacol., 55, 90–96.
17. Crouch, S.P., Kozlowski, R., Slater, K.J. and Fletcher J. (1993), The use of ATP bioluminescence as a measure of cell proliferation and cytotoxicity. J. Immunol. Meth., 160, 81–88.
18. Ishizaka, A., Tono-oka, T. and Matsumoto, S. (1984), Evaluation of the proliferative response of lymphocytes by measurement of intracellular ATP. J. Immunol. Meth., 72, 127–132.
19. Dexter, S.J., Cámara, M., Davies, M. and Shakesheff, K.M. (2003), Development of a bioluminescent ATP assay to quantify mammalian and bacterial cell number from a mixed population. Biomat., 24, 27–34.
20. Lundin A. (2000), Use of firefly luciferase in ATP-related assays of biomass, enzymes, and metabolites. Meth. Enzymol., 305, 346–370.
21. ILAR (1996), Institute of Laboratory Animal Research (ILAR) Guide for the Care and Use of Laboratory Animals. 7th ed. Washington, DC: National Academies Press.
22. ICCVAM (2009), Recommended Performance Standards: Murine Local Lymph Node Assay, NIH Publication Number 09-7357, Research Triangle Park, NC: National Institute of Environmental Health Science. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna-ps/LLNAPerfStds.pdf.
23. McGarry, H.F. (2007), The murine local lymph node assay: regulatory and potency considerations under REACH. Toxicol., 238, 71–89.
24. Kimber, I., Dearman, R.J., Scholes E.W. and Basketter, D.A. (1994), The local lymph node assay: developments and applications. Toxicol., 93, 13–31.
25. OECD (2002), Acute Dermal Irritation/Corrosion, Test Guideline No. 404, Guidelines for Testing of Chemicals, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
26. Reeder, M.K., Broomhead, Y.L., DiDonato, L. and DeGeorge, G.L. (2007), Use of an enhanced local lymph node assay to correctly classify irritants and false positive substances. Toxicologist, 96, 235.
27. ICCVAM (2009), Nonradioactive Murine Local Lymph Node Assay: Flow Cytometry Test Method Protocol (LLNA: BrdU-FC) Revised Draft Background Review Document. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/methods/immunotox/fcLLNA/BRDcomplete.pdf.
28. Hayes, B.B., Gerber, P.C., Griffey, S.S. and Meade, B.J. (1998), Contact hypersensitivity to dicyclohexylcarbodiimide and diisopropylcarbodiimide in female B6C3F1 mice. Drug. Chem. Toxicol., 21, 195–206.
29. Homey, B., von Schilling, C., Blumel, J., Schuppe, H.C., Ruzicka, T., Ahr, H.J., Lehmann, P. and Vohr, V.W. (1998), An integrated model for the differentiation of chemical-induced allergic and irritant skin reactions. Toxicol. Appl. Pharmacol., 153, 83–94.
30. Woolhiser, M.R., Hayes, B.B. and Meade, B.J. (1998), A combined murine local lymph node and irritancy assay to predict sensitisation and irritancy potential of chemicals. Toxicol. Meth., 8, 245–256.
31. Hayes, B.B. and Meade, B.J. (1999), Contact sensitivity to selected acrylate compounds in B6C3F1 mice: relative potency, cross reactivity, and comparison of test methods. Drug Chem. Toxicol., 22, 491–506.
32. Ehling, G., Hecht, M., Heusener, A., Huesler, J., Gamer, A.O., van Loveren, H., Maurer, T., Riecke, K., Ullmann, L., Ulrich, P., Vandebriel, R. and Vohr, H.W. (2005), A European inter-laboratory validation of alternative endpoints of the murine local lymph node assay: first round. Toxicol., 212, 60–68.
33. Vohr, H.W. and Ahr, H.J. (2005), The local lymph node assay being too sensitive? Arch. Toxicol., 79, 721–728.
34. Patterson, R.M., Noga, E. and Germolec, D. (2007), Lack of evidence for contact sensitisation by Pfiesteria extract. Environ. Health Perspect., 115, 1023–1028.
35. ICCVAM (2009), Report on the ICCVAM-NICEATM/ECVAM/JaCVAM Scientific Workshop on Acute Chemical Safety Testing: Advancing In Vitro Approaches and Humane Endpoints for Systemic Toxicity Evaluations. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/methods/acutetox/Tox_workshop.htm.
36. OECD (2000), Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation, Environmental Health and Safety Monograph Series on Testing and Assessment No. 19, ENV/JM/MONO(2000)7, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
37. Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E. and Hastings, K.L. (1998), Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. J. Toxicol. Environ. Health, 53563–79.
38. OECD (2005), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, Environment, Health and Safety Monograph Series on Testing and Assessment No. 34, ENV/JM/MONO(2005)14, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
Dodatek 1
OPREDELITVE POJMOV
Natančnost : stopnja ujemanja rezultatov preskusne metode z uveljavljenimi referenčnimi vrednostmi. To je merilo učinkovitosti preskusne metode in eden od vidikov ustreznosti. Ta izraz in izraz „skladnost“ se pogosto izmenično uporabljata za pomen deleža ustreznih rezultatov preskusne metode (38).
Primerjalna snov : snov, ki povzroča preobčutljivost ali je ne povzroča in se uporablja kot standard za primerjavo s preskusno snovjo. Primerjalna snov mora imeti naslednje lastnosti: (i) trajen in zanesljiv vir; (ii) strukturno in funkcijsko podobnost z razredom preskušanih snovi; (iii) znane fizikalno-kemijske lastnosti; (iv) podporne podatke o znanih učinkih in (v) znano učinkovitost v razponu želene reakcije.
Lažno negativna snov : snov, ki je s preskusno metodo nepravilno opredeljena kot negativna ali neaktivna, čeprav je dejansko pozitivna ali aktivna.
Lažno pozitivna snov : snov, ki je s preskusom nepravilno opredeljena kot pozitivna ali aktivna, čeprav je dejansko negativna ali neaktivna.
Nevarnost : možnost škodljivega učinka na zdravje ali okolje. Do škodljivega učinka pride, če je raven izpostavljenosti dovolj velika.
Ponovljivost v laboratorijih : merjenje obsega, v katerem lahko različni kvalificirani laboratoriji, ki uporabljajo isti protokol in preskušajo iste preskusne snovi, pridejo do kvalitativno in kvantitativno podobnih rezultatov. Ponovljivost v laboratorijih se ugotovi med postopki pred validacijo in med validacijo ter kaže, v kakšnem obsegu se lahko preskus uspešno uporablja v več laboratorijih; imenuje se tudi ponovljivost v različnih laboratorijih (38).
Ponovljivost v laboratoriju : določitev obsega, v katerem lahko kvalificirane osebe v istem laboratoriju uspešno ponovijo rezultate z uporabo določenega protokola v različnem času. Imenuje se tudi ponovljivost znotraj laboratorija (38).
Izločitev : izločitev je ugotovitev, ki se izrazito razlikuje od drugih vrednosti v naključnem vzorcu populacije.
Zagotavljanje kakovosti : postopek upravljanja, pri katerem posamezniki, neodvisni od oseb, ki so izvajale preskuse, ocenijo izpolnjevanje laboratorijskih standardov za preskušanje, zahtev in postopkov vodenja evidenc ter natančnosti prenosa podatkov.
Zanesljivost : stopnja ponovljivosti preskusne metode v laboratorijih in med njimi v določenem časovnem obdobju pri uporabi istega protokola. Oceni se z izračunom ponovljivosti v enem ali več laboratorijih (38).
Preobčutljivost kože : imunološki proces, ki se pojavi, ko je občutljiv posameznik lokalno izpostavljen kemičnemu alergenu, ki na koži sproži imunski odziv in lahko povzroči razvoj preobčutljivosti ob stiku.
Stimulacijski indeks (SI) : vrednost, izračunana za oceno morebitne preobčutljivosti kože, ki jo lahko povzroči preskusna snov; je razmerje med množenjem v tretiranih skupinah in množenjem v primerjalni kontrolni skupini z nosilcem.
Preskusna snov (imenovana tudi preskusna kemikalija) : katera koli snov ali zmes, preskušana z uporabo te preskusne metode.
B.51. PREOBČUTLJIVOST KOŽE: LOKALNA ANALIZA BEZGAVK: BRDU-ELISA
UVOD
1. Smernice OECD za preskušanje kemikalij in preskusne metode EU se redno preverjajo zaradi znanstvenega napredka, spreminjajočih se zakonodajnih potreb in vprašanj, povezanih z dobrim počutjem živali. Prva preskusna metoda (B.42) za določanje preobčutljivosti kože pri miši, lokalna analiza bezgavk (LLNA; Smernica za preskušanje OECD 429) je bila že preverjena (1 in poglavje B.42 te Priloge). Objavljene so podrobnosti o validaciji LLNA in pregled s tem povezanega dela (2) (3) (4) (5) (6) (7) (8) (9). Pri LLNA se za merjenje množenja limfocitov uporablja radioizotopni timidin ali jod, zato je lahko uporaba analize omejena v primerih, kjer je pridobitev, uporaba ali odstranitev radioaktivnosti težavna. LLNA: BrdU-ELISA [encimsko-imunski test, v nadaljnjem besedilu: analiza LLNA: BrdU-ELISA] je neradioaktivna različica LLNA, pri kateri se uporablja radioaktivno neoznačen 5-bromo 2-deoksiuridin (BrdU) (Služba za izmenjavo kemijskih izvlečkov [CAS] št. 59-14-3) v preskusnem sistemu, ki temelji na encimsko-imunskem testu za merjenje množenja limfocitov. Analizo LLNA: BrdU-ELISA je validirala in pregledala mednarodna neodvisna strokovna skupina za ocenjevanje ter jo priporočila kot koristno za opredelitev kemikalij, ki povzročajo preobčutljivost, in kemikalij, ki je ne povzročajo, z nekaterimi omejitvami (10) (11) (12). Ta preskusna metoda je zasnovana za ocenjevanje morebitne preobčutljivosti kože s kemikalijami (snovmi in zmesmi) pri živalih. Poglavje B.6 te priloge in Smernica za preskušanje OECD 406 uporabljata preskuse na morskih prašičkih, predvsem maksimizacijski in Buehlerjev preskus na morskih prašičkih (13). LLNA (poglavje B.42 te priloge; Smernica za preskušanje OECD 429) in dve spremembi, pri katerih se radioaktivnost ne uporablja, analiza LLNA: BrdU-ELISA (poglavje B.51 te priloge; Smernica za preskušanje OECD 442 B) in analiza LLNA: DA (poglavje B.50 te priloge; Smernica za preskušanje OECD 442 A) zaradi manj pogoste in izpopolnjene uporabe živali zagotavljajo prednost v primerjavi s preskusi na morskih prašičkih iz metode B.6 in Smernice za preskušanje OECD 406 (13).
2. Podobno kot LLNA tudi analiza LLNA: BrdU-ELISA preučuje indukcijsko fazo preobčutljivosti kože in zagotavlja količinske podatke, ki so primerni za oceno odziva na odmerek. Ker odkriva povzročitelje preobčutljivosti, ne da bi bilo pri tem treba uporabiti radioaktivni označevalec za DNA, se ne pojavljajo vprašanja glede poklicne izpostavljenosti radioaktivnosti in odstranjevanja odpadkov. Zaradi tega bo za odkrivanje povzročiteljev preobčutljivosti morda mogoča pogostejša uporaba miši, zaradi česar bi se lahko še bolj zmanjšala uporaba morskih prašičkov za preskušanje morebitne preobčutljivosti kože (tj. B.6; Smernica za preskušanje OECD 406) (13).
OPREDELITVE POJMOV
3. Uporabljene opredelitve pojmov so navedene v Dodatku 1.
ZAČETNI POMISLEKI IN OMEJITVE
4. Analiza LLNA: BrdU-ELISA je spremenjena metoda LLNA za ugotavljanje morebitne preobčutljivosti kože s kemikalijami, s posebnimi omejitvami. Ni nujno, da to pomeni, da je treba v vseh primerih namesto preskusov na morskih prašičkih ali LLNA (tj. B.6; Smernica za preskušanje OECD 406) (13) uporabiti analizo LLNA: BrdU-ELISA, temveč da je ta analiza enakovredna in se lahko uporabi kot druga možnost, pri kateri običajno niso več potrebne dodatne potrditve pozitivnih in negativnih rezultatov (10) (11). Preskuševalni laboratorij mora pred začetkom opravljanja študije upoštevati vse razpoložljive informacije o preskusni snovi. Takšne informacije bodo vključevale vrsto in kemijsko sestavo preskusne snovi; njene fizikalno-kemijske lastnosti; rezultate katerih koli drugih preskusov toksičnosti na preskusni snovi, in vitro ali in vivo; in toksikološke podatke o strukturno sorodnih kemikalijah. Te informacije je treba upoštevati, da se določi, ali je metoda LLNA: BrdU-ELISA primerna za preskusno snov (glede na nezdružljivost omejenega števila vrst kemikalij z analizo LLNA: BrdU-ELISA [glej odstavek 5]) in za lažjo izbiro odmerka.
5. Analiza LLNA: BrdU-ELISA je metoda in vivo in posledično ne odpravlja uporabe živali pri ocenjevanju delovanj, ki povzročajo alergijsko preobčutljivost ob stiku. Vendar ima možnost, da v primerjavi s preskusi na morskih prašičkih (B.6; Smernica za preskušanje OECD 406) (13), zmanjša število živali, potrebnih v ta namen. Poleg tega nudi analiza LLNA: BrdU-ELISA znatno izboljšanje načina, kako se živali uporabljajo za preskušanje alergijske preobčutljivosti ob stiku, saj v nasprotju z metodo B.6 in Smernico za preskušanje OECD 406 ne zahteva, da se povzročijo izzvane reakcije prekomerne občutljivosti kože. Poleg tega analiza LLNA: BrdU-ELISA za razliko od maksimizacijskega preskusa na morskih prašičkih ne zahteva uporabe pomožnega preskusa (poglavje B.6 te priloge, 13). S tem analiza LLNA: BrdU-ELISA zmanjšuje trpljenje živali. Kljub prednostim analize LLNA: BrdU-ELISA v primerjavi z metodo B.6 in Smernico za preskušanje OECD 406 (13) obstajajo nekatere omejitve, zaradi katerih je lahko nujna uporaba metode B.6 ali Smernice za preskušanje OECD 406 (npr. preskušanje določenih kovin, lažni pozitivni izidi pri nekaterih dražilnih snoveh za kožo [kot so nekatere vrste površinsko razgradljivih kemikalij] (6) (1 in poglavje B.42 te priloge), topnost preskusne snovi). Poleg tega je zaradi kemijskih razredov ali snovi s funkcionalnimi skupinami, za katere se je izkazalo, da lahko delujejo kot moteči dejavniki (15), lahko potrebna uporaba preskusov na morskih prašičkih (tj. B.6; Smernica za preskušanje OECD 406 (13)). Za omejitve, določene za LLNA (1 in poglavje B.42 te priloge), je bilo priporočeno, da se uporabljajo tudi za analizo LLNA: BrdU-ELISA (10). Razen takšnih določenih omejitev bi morala biti analiza LLNA: BrdU-ELISA primerna za preskušanje katerih koli kemikalij, razen če so s temi kemikalijami povezane lastnosti, ki lahko ovirajo natančnost analize LLNA: BrdU-ELISA. Poleg tega je treba razmisliti o možnosti mejnih pozitivnih rezultatov v primerih, ko so dobljene vrednosti stimulacijskega indeksa (SI) med 1,6 in 1,9 (glej odstavke 31–32). To temelji na podatkovni zbirki za validacijo s 43 snovmi s stimulacijskim indeksom ≥ 1,6 (glej odstavek 6), pri kateri je analiza LLNA: BrdU-ELISA pravilno opredelila vseh 32 povzročiteljev preobčutljivosti pri LLNA, vendar je nepravilno opredelila dve od 11 snovi, ki pri LLNA ne povzročajo preobčutljivosti z vrednostmi stimulacijskega indeksa med 1,6 in 1,9 (tj. mejno pozitivna vrednost) (10). Ker pa je bil za določanje vrednosti stimulacijskega indeksa in izračun predvidljivih lastnosti preskusa uporabljen isti nabor podatkov, so lahko navedeni rezultati pretirana ocena dejanskih predvidljivih lastnosti.
NAČELA METODE PRESKUŠANJA
6. Osnovno načelo, na katerem temelji analiza LLNA: BrdU-ELISA, je, da povzročitelji preobčutljivosti povzročijo množenje limfocitov v bezgavkah, ki drenirajo območje nanosa preskusne snovi. To množenje je sorazmerno z odmerkom in močjo uporabljenega alergena in je preprosto sredstvo za doseganje količinske izmere preobčutljivosti. Množenje se izmeri s primerjavo povprečnega množenja v vsaki preskusni skupini in povprečnega množenja v kontrolni skupini, tretirani z nosilcem. Določi se razmerje med povprečnim množenjem v vsaki tretirani skupini in povprečnim množenjem v primerjalni kontrolni skupini z nosilcem, ki se imenuje stimulacijski indeks (SI) in mora biti ≥ 1,6, preden je nadaljnje ocenjevanje preskusne snovi kot možnega povzročitelja preobčutljivosti kože utemeljeno. Opisani postopki temeljijo na merjenju vsebnosti BrdU, ki kaže povečano število množečih se celic v ušesnih bezgavkah. BrdU je analog timidina in se v množeče se celice DNA vključi na podoben način. Vključitev BrdU se meri z encimsko-imunskim testom, ki uporablja protitelo, specifično za BrdU, ki je označeno tudi s peroksidazo. Ko se doda substrat, peroksidaza reagira s substratom in nastane obarvan produkt, ki je količinsko opredeljen pri določeni absorbanci z uporabo čitalca mikrotiterskih plošč.
OPIS ANALIZE
Izbira živalskih vrst
7. Izbrana vrsta za ta preskus je miš. Validacijske študije za analizo LLNA: BrdU-ELISA so bile izvedene samo s sevom CBA/JN, ki je zato priporočeni sev (10) (12). Uporabijo se mlade odrasle mišje samice, ki še niso kotile in niso breje. Na začetku študije morajo biti živali stare 8–12 tednov, odstopanje mase živali pa mora biti čim manjše in ne sme presegati 20 % povprečne mase. Namesto tega se lahko uporabi druge seve in samce, ko je dobljenih dovolj podatkov za prikaz, da ne obstajajo značilne razlike v odzivu pri analizi LLNA: BrdU-ELISA.
Bivalni in prehranjevalni pogoji
8. Miši morajo biti skupinsko nastanjene (16), razen če je zagotovljena ustrezna znanstvena utemeljitev za njihovo ločeno nastanitev. Temperatura v prostoru za poskusne živali mora biti 22 ± 3 °C. Čeprav mora biti relativna vlažnost najmanj 30 % in po možnosti ne sme presegati 70 %, mora biti ciljna vlažnost, razen med čiščenjem prostora, 50 do 60 %. Osvetlitev naj bo umetna, in sicer 12 ur svetlobe, 12 ur teme. Za hranjenje se lahko uporablja konvencionalna laboratorijska prehrana z neomejeno oskrbo s pitno vodo.
Priprava živali
9. Živali se naključno izberejo, označijo tako, da je omogočeno posamično prepoznavanje (vendar ne s katero od oblik ušesnih oznak), in zadržijo v kletkah najmanj pet dni pred začetkom dajanja odmerka, da se lahko prilagodijo laboratorijskim razmeram. Pred začetkom tretiranja se vse živali pregledajo, da se zagotovi, da nimajo opaznih kožnih lezij.
Priprava preskusnih raztopin
10. Trdne kemikalije se pred nanosom na uho miši raztopijo ali suspendirajo v ustreznih topilih ali nosilcih in po potrebi razredčijo. Tekoče kemikalije se lahko nanesejo nerazredčene ali pa se razredčijo pred dajanjem odmerka. Pri netopnih kemikalijah, kot so tiste, ki se običajno uporabljajo v medicinskih pripomočkih, je treba uporabiti močno povečano ekstrakcijo v ustreznem topilu, da se odkrije vse ekstraktibilne sestavine za preskušanje pred nanosom na uho miši. Preskusne snovi je treba pripravljati dnevno, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
Preverjanje zanesljivosti
11. Za prikaz ustrezne učinkovitosti analize se uporabijo kemikalije pozitivne kontrole, ki se odzovejo z ustrezno in ponovljivo občutljivostjo kot preskusna snov, ki povzroča preobčutljivost, za katero je stopnja reakcije natančno opredeljena. Uporaba primerjalne pozitivne kontrole je priporočena, saj pokaže zmožnost laboratorija, da uspešno izvede vsako analizo, ter omogoča ocenjevanje ponovljivosti in primerljivosti v enem ali več laboratorijih. Tudi nekateri regulativni organi zahtevajo uporabo pozitivne kontrole pri vsaki raziskavi, zato se uporabnikom priporoča, da se pred izvedbo analize LLNA: BrdU-ELISA posvetujejo s pristojnimi organi. V skladu s tem se priporoča redna uporaba primerjalne pozitivne kontrole, saj tako ni potrebno dodatno preskušanje na živalih za izpolnitev zahtev, ki se lahko pojavijo zaradi uporabe redne pozitivne kontrole (glej odstavek 12). Pozitivna kontrola mora povzročiti pozitiven odziv analize LLNA: BrdU-ELISA na raven izpostavljenosti, za katero se pričakuje, da bo dala večji stimulacijski indeks SI ≥ 1,6 kot negativna kontrolna skupina. Odmerek pozitivne kontrole je treba izbrati tako, da ne povzroči čezmernega draženja kože ali sistemske toksičnosti in da je indukcija ponovljiva, vendar ne čezmerna (tj. SI > 14 bi se štel za čezmernega). Priporočena pozitivna kontrola je 25-odstotni heksil cimetov aldehid (CAS št. 101-86-0) in 25-odstotni evgenol (št. CAS 97-53-0) v acetonu: olivnem olju (4:1, v/v). V nekaterih okoliščinah se lahko ob ustrezni utemeljitvi uporabijo druge pozitivne kontrole, ki izpolnjujejo zgornja merila.
12. Običajno je uporaba pozitivne kontrolne skupine priporočena, lahko pa obstajajo okoliščine, v katerih redno preskušanje (tj. v razmikih ≤ 6 mesecev) pozitivne kontrole morda zadošča za laboratorije, ki redno izvajajo analizo LLNA: BrdU-ELISA (tj. izvajajo analizo LLNA: BrdU-ELISA vsaj enkrat mesečno) in imajo vzpostavljeno zbirko preteklih podatkov o pozitivnih kontrolah, ki dokazuje zmožnost laboratorija, da pridobi ponovljive in natančne rezultate s pozitivnimi kontrolami. Ustrezna strokovnost pri izvajanju analize LLNA: BrdU-ELISA se lahko uspešno dokaže z dobivanjem doslednih pozitivnih rezultatov s pozitivno kontrolo pri vsaj desetih neodvisnih preskusih, izvedenih v razumnem časovnem obdobju (tj. v manj kot enem letu).
13. Primerjalno pozitivno kontrolno skupino je treba vključiti vedno, kadar pride do postopkovne spremembe pri analizi LLNA: BrdU-ELISA (npr. zamenjava usposobljenega osebja, zamenjava materiala za preskusno metodo in/ali reagentov, zamenjava opreme za preskusno metodo, zamenjava vira preskusnih živali), takšne spremembe pa je treba vedno zabeležiti v laboratorijskih poročilih. Pri odločanju o nujnosti vzpostavitve nove zbirke preteklih podatkov za beleženje doslednosti pri rezultatih pozitivne kontrole je treba upoštevati učinek, ki ga imajo te spremembe na ustreznost predhodno vzpostavljene zbirke preteklih podatkov.
14. Raziskovalci se morajo zavedati, da odločitev o izvajanju redne namesto primerjalne pozitivne kontrolne študije vpliva na ustreznost in sprejemljivost negativnih rezultatov študije, pridobljenih brez primerjalne pozitivne kontrole v razmiku med rednimi pozitivnimi kontrolnimi študijami. Na primer, če je rezultat, pridobljen z redno pozitivno kontrolno študijo, lažno negativen, so lahko vprašljivi negativni rezultati preskusne snovi, pridobljeni v času med zadnjo sprejemljivo redno pozitivno kontrolno študijo in nesprejemljivo redno pozitivno kontrolno študijo. Pri odločanju, ali vključiti primerjalne pozitivne kontrole ali izvajati samo redne pozitivne kontrole, je treba skrbno preučiti posledice teh rezultatov. Treba je razmisliti tudi o uporabi manjšega števila živali v primerjalni pozitivni kontrolni skupini, če je to znanstveno utemeljeno in če laboratorij na podlagi preteklih podatkov, značilnih za laboratorij, dokaže, da se lahko uporabi manjše število miši (17).
15. Čeprav je treba pozitivno kontrolo preskusiti v nosilcu, za katerega je znano, da povzroča dosleden odziv (npr. aceton: olivno olje; 4:1, v/v), lahko obstajajo nekatere zakonodajne okoliščine, ko je potrebno tudi preskušanje v nestandardnem nosilcu (klinično/kemično ustrezne sestave) (18). Če se primerjalna pozitivna kontrola preskuša v drugem nosilcu kot preskusna snov, je treba za primerjalno pozitivno kontrolo vključiti ločen kontrolni nosilec.
16. V primerih, kjer se ocenjujejo preskusne snovi za poseben kemijski razred ali razpon reakcij, so lahko primerjalne snovi uporabne tudi za dokaz, da preskusna metoda deluje pravilno za odkrivanje morebitne preobčutljivosti kože pri teh vrstah preskusnih snovi. Ustrezne primerjalne snovi morajo imeti naslednje lastnosti:
— strukturno in funkcijsko podobnost z razredom preskusne snovi, ki se preskuša,
— znane fizikalno-kemijske lastnosti,
— podporne podatke iz analiz LLNA: BrdU-ELISA,
— podporne podatke od drugih živalskih modelov in/ali ljudi.
PRESKUSNI POSTOPEK
Število živali in velikost odmerkov
17. Na skupino odmerka se uporabijo najmanj štiri živali z najmanj tremi koncentracijami preskusne snovi, poleg tega pa še primerjalna negativna kontrolna skupina, tretirana zgolj z nosilcem za preskusno snov, in pozitivna kontrolna skupina (primerjalna ali izvedena pred kratkim, odvisno od politike laboratorija pri upoštevanju odstavkov 11–15). Treba je razmisliti o preskušanju več odmerkov pozitivne kontrole, zlasti če se pozitivna kontrola preskuša občasno. Živali v kontrolnih skupinah je treba, razen če se ne tretirajo s preskusno snovjo, obravnavati in tretirati na enak način kot živali v tretiranih skupinah.
18. Izbira odmerka in nosilca mora temeljiti na priporočilih iz sklicev (2) in (19). Zaporedni odmerki se običajno izberejo iz ustrezne serije koncentracij, kot so 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 % itd. Izbira uporabljene serije koncentracij mora biti ustrezno znanstveno utemeljena. Kadar so na voljo, je treba pri izbiri treh zaporednih koncentracij upoštevati vse obstoječe toksikološke informacije (npr. akutno toksičnost in draženje kože) ter strukturne in fizikalno-kemijske informacije o želeni preskusni snovi (in/ali strukturno povezani snovi), tako da je pri največji koncentraciji izpostavljenost največja, hkrati pa ni sistemske toksičnosti in/ali čezmernega draženja kože (19) (20 in poglavje B.4 te Priloge). Če takšne informacije niso na voljo, je morda najprej potreben predhodni presejalni preskus (glej odstavke 21–24).
19. Nosilec ne sme ovirati rezultatov preskusa ali vplivati nanje, izbere pa se na podlagi povečevanja topnosti, da se med pripravljanjem raztopine/suspenzije, ki je primerna za uporabo preskusne snov, pridobi največjo možno koncentracijo. Priporočljivi nosilci so aceton: olivno olje (4:1, v/v), N,N-dimetilformamid, metil etil keton, propilen glikol in dimetil sulfoksid (6), vendar se lahko uporabljajo tudi drugi, če je zagotovljena ustrezna znanstvena utemeljitev. V nekaterih okoliščinah je morda treba kot dodatno kontrolo uporabiti klinično ustrezno topilo ali trgovsko sestavo, v kateri se trži preskusna snov. Paziti je treba zlasti, da so v nosilni sistem vključene hidrofilne preskusne snovi, ki vlažijo kožo in se ne izsušijo takoj, z vključitvijo ustreznih pospeševalcev raztapljanja (npr. 1-odstotnim Pluronic® L92). Zato se je treba izogibati povsem vodenim nosilcem.
20. Obdelava bezgavk posamezne miši omogoča oceno spremenljivosti med posameznimi živalmi in statistično primerjavo razlik med meritvami preskusne snovi in primerjalne kontrolne skupine z nosilcem (glej odstavek 33). Poleg tega je ocena možnosti glede zmanjšanja števila miši v pozitivni kontrolni skupini izvedljiva samo, če se zbira podatke o posameznih živalih (17). Poleg tega nekateri regulativni organi zahtevajo zbiranje podatkov o posameznih živalih. Redno zbiranje podatkov o posameznih živalih zagotavlja prednosti glede dobrega počutja živali, saj se s tem prepreči dvojno preskušanje, ki bi bilo potrebno, če bi bilo treba rezultate, prvotno zbrane na en način (npr. preko združenih podatkov o živalih) zaradi drugih zahtev regulativnih organov (npr. glede podatkov o posameznih živalih) kasneje ponovno preučiti.
Predhodni presejalni preskus
21. Če informacije za določitev največjega odmerka za preskušanje niso na voljo (glej odstavek 18), je treba izvesti predhodni presejalni preskus, da se določi ustrezna velikost odmerka za preskušanje z analizo LLNA: BrdU-ELISA. Namen predhodnega presejalnega preskusa je zagotoviti smernice za izbiro največje velikosti odmerka za uporabo v glavni študiji analize LLNA: BrdU-ELISA v primerih, ko ni na voljo informacij o koncentraciji, ki povzroči sistemsko toksičnost (glej odstavek 24) in/ali čezmerno draženje kože (glej odstavek 23). Največja velikost odmerka je 100-odstotna koncentracija preskusne snovi za tekočine ali najvišja možna koncentracija za trdne snovi ali suspenzije.
22. Predhodni presejalni preskus se izvede v pogojih, ki so enaki tistim v glavni študiji analize LLNA: BrdU-ELISA, s to razliko, da se ne izvede ocena množenja v bezgavkah in da se lahko uporabi manj živali na skupino odmerka. Predlaga se uporaba ene ali dveh živali na skupino odmerka. Vse miši se opazuje dnevno glede kliničnih znakov sistemske toksičnosti ali lokalnega draženja na mestu nanosa. Telesna masa se zabeleži pred preskusom in pred usmrtitvijo (6. dan). Obe ušesi vsake miši se opazuje glede rdečine in oceni s pomočjo preglednice 1 (20 in poglavje B.4 te priloge). Meritve debeline ušesa se izvedejo z napravo za merjenje debeline (npr. digitalnim mikrometrom ali merilnikom debeline s številčnico) 1. dan (pred odmerkom), 3. dan (približno 48 ur pred prvim odmerkom) in 6. dan. Poleg tega se lahko 6. dan debelino ušesa določi s preluknjanjem ušes za določitev mase, ki se izvede po humani usmrtitvi živali. Znak za čezmerno draženje je rdečina z oceno ≥ 3 in/ali povečana debelina ušesa za ≥ 25 % na kateri koli dan merjenja (21) (22). Največji odmerek, izbran za glavno študijo analize LLNA: BrdU-ELISA, je naslednji nižji odmerek v seriji koncentracij iz predhodnega presejalnega preskusa (glej odstavek 18), ki ne povzroči sistemske toksičnosti in/ali čezmernega draženja kože.
Preglednica 1
Ocena rdečine
|
Ugotovitev |
Ocena |
|
Rdečine ni |
0 |
|
Neznatna rdečina (komajda opazna) |
1 |
|
Zelo razločna rdečina |
2 |
|
Zmerna do močna rdečina |
3 |
|
Močna rdečina (rdečina rdeče pese) in nastanek krast ovirata razvrstitev rdečine |
4 |
23. Poleg 25-odstotnega povečanja debeline ušesa (21) (22) se za opredelitev dražilnih snovi pri LLNA uporablja tudi statistično značilno povečanje debeline ušesa tretirane miši v primerjavi s kontrolno mišjo (22) (23) (24) (25) (26) (27) (28). Ker pa se lahko statistično značilno povečanje pojavi tudi pri debelini ušesa, manjši od 25 %, ni izrecno povezano s čezmernim draženjem (25) (26) (27) (28) (29).
24. Naslednje klinične ugotovitve lahko nakazujejo sistemsko toksičnost (30), kadar se uporabljajo kot del celovite ocene, in zato lahko pokažejo največjo velikost odmerka za uporabo v glavni analizi LLNA: BrdU-ELISA: spremembe v delovanju živčnega sistema (npr. piloerekcija, ataksija, tremorji in krči); vedenjske spremembe (npr. agresivnost, spremembe glede nege, opazna sprememba stopnje aktivnosti); spremembe dihanja (npr. spremembe frekvence in intenzivnosti dihanja, kot so dispneja, zasoplost in hropenje) in spremembe glede uživanja hrane in vode. Poleg tega je treba pri oceni upoštevati znake letargije in/ali neodzivnosti ter morebitne klinične znake bolečine in trpljenja, ki niso samo blagi ali trenutni, ali zmanjšanje telesne mase za > 5 % od 1. do 6. dne ter smrtnost. Umirajoče živali ali živali, ki kažejo znake hudega in dolgotrajnega trpljenja, se usmrtijo na human način (31).
Načrt za poskus glavne študije
25. Načrt za poskus analize je naslednji:
|
— |
1. dan : Posamično ugotovljena in zabeležena masa vsake živali in morebitne klinične ugotovitve. Nanos 25 μl ustrezno razredčene preskusne snovi, samega nosilca ali pozitivne kontrole (primerjalne ali izvedena pred kratkim, odvisno od politike laboratorija pri upoštevanju odstavkov 11–15) na vsak uhelj. |
|
— |
2. in 3. dan : Ponovi se postopek nanosa, ki je bil izveden 1. dan. |
|
— |
4. dan : Brez tretiranja. |
|
— |
5. dan : Intraperitonealno vbrizganje 0,5 ml (5 mg/miš) raztopine BrdU (10 mg/ml). |
|
— |
6. dan : Zabeleži se masa vsake živali in morebitne klinične ugotovitve. Približno 24 ur po vbrizgani BrdU se živali humano usmrti. Ušesne bezgavke ob vsakem ušesu miši se izrežejo in shranijo v fosfatni pufer s soljo (PBS) za vsako žival Podatki in diagrami o identifikaciji in izrezu bezgavk so na voljo v sklicu (17). Za nadaljnje spremljanje odziva kože v glavni študiji se lahko v študijski protokol vključijo dodatni parametri, kot so ocena rdečine ušesa ali meritve debeline ušesa (pridobljene z merilnikom debeline ali preluknjanjem ušes za določitev mase pri obdukciji). |
Priprava celičnih suspenzij
26. Enotna celična suspenzija iz celic bilateralno izrezanih bezgavk vsake miši se pripravi z blago mehanično disagregacijo skozi žično mrežo iz nerjavnega jekla z velikostjo odprtin 200 mikronov ali drugo uveljavljeno tehniko za pripravo enotne celične suspenzije (npr. uporabo plastičnega pestila za enkratno uporabo za drobljenje bezgavk, ki mu sledi prehajanje skozi mrežo iz najlona z velikostjo odprtin 70 mikronov). Postopek priprave suspenzije iz celic bezgavk je pri tej analizi bistvenega pomena, zato mora vsak izvajalec predhodno pridobiti te spretnosti. Bezgavke živali v negativni kontroli so majhne, zato je treba biti pazljiv, da ne pride do umetnega vpliva na vrednosti SI. V vsakem primeru je treba ciljni volumen suspenzije iz celic bezgavk prilagoditi določenemu optimiziranemu volumnu (približno 15 ml). Optimiziran volumen temelji na doseganju povprečne absorbance negativne kontrolne skupine v razponu 0,1–0,2.
Določitev množenja celic (merjenje vsebnosti bromdeoksiuridina (BrdU) v DNA limfocitov)
27. BrdU se meri z encimsko-imunskim testom z uporabo tržnega kompleta (npr. Roche Applied Science, Mannheim, Nemčija, št. v katalogu 11 647 229 001). Na kratko, v vdolbinice treh mikroplošč z ravnim dnom se doda 100 μL suspenzije iz celic bezgavk. Po fiksaciji in denaturaciji celic iz bezgavk se v vsako vdolbinico doda anti-BrdU protitelo in omogoči, da pride do reakcije. Nato se anti-BrdU protitelo odstrani s spiranjem, doda se raztopina substrata in omogoči se, da nastane kromogen. Nato se izmeri absorbanca pri 370 nm z referenčno valovno dolžino 492 nm. V vseh primerih morajo biti preskusni pogoji analize optimizirani (glej odstavek 26).
OPAZOVANJA
Klinična opazovanja
28. Vsako miš je treba vsaj enkrat dnevno natančno opazovati glede kliničnih znakov, lokalnega draženja na mestu nanosa ali sistemske toksičnosti. Vsa opazovanja se sistematično zabeležijo v evidence, ki se vodijo za vsako miš. Načrt spremljanja vključuje merila za hitro identifikacijo miši, ki izražajo sistemsko toksičnost, čezmerno draženje kože ali jedkost za kožo zaradi evtanazije (31).
Telesna masa
29. Kot je navedeno v odstavku 25, se telesna masa posameznih živali izmeri na začetku preskusa in ob predvideni humani usmrtitvi.
IZRAČUN REZULTATOV
30. Rezultati za vsako tretirano skupino so izraženi kot povprečni stimulacijski indeks (SI). SI se dobi tako, da se povprečni indeks označevanja za BrdU/miš v vsaki skupini preskusne snovi in v pozitivni kontrolni skupini deli s povprečnim indeksom označevanja za BrdU za kontrolno skupino s topilom/nosilcem. Povprečni stimulacijski indeks za kontrolne skupine z nosilcem je potem 1.
Indeks označevanja za BrdU je opredeljen kot:
indeks označevanja za BrdU = (ABSem – ABS blankem) – (ABSref – ABS blankref)
pri čemer je em = valovna dolžina emisije in ref = referenčna valovna dolžina.
31. Rezultat se šteje za pozitivnega, če je SI ≥ 1,6 (10). Vendar se lahko pri odločanju, ali je mejni rezultat pozitiven (tj. vrednost SI med 1,6 in 1,9), uporabijo tudi moč odziva na odmerek, statistični pomen ter doslednost odzivov v topilu/nosilcu in pozitivni kontroli (3) (6) (32).
32. Pri mejnem pozitivnem odzivu s SI med 1,6 in 1,9 bodo uporabniki morda za potrditev, da so takšni rezultati pozitivni, poleg vrednosti SI upoštevali tudi moč odziva na odmerek, dokaze o sistemski toksičnosti ali statistični pomen (10). Upoštevati je treba tudi različne lastnosti preskusne snovi, vključno s strukturno podobnostjo z znanimi povzročitelji preobčutljivosti, povzročanjem čezmernega lokalnega draženja kože pri miši ter naravo opaženega odnosa med odmerkom in odzivom. Ti in drugi razlogi so podrobno obdelani drugje (4).
33. Zbiranje podatkov na ravni posamezne miši bo omogočilo statistično analizo prisotnosti in stopnje odnosa med odmerkom in odzivom v podatkih. Morebitna statistična ocena lahko vključuje oceno odnosa med odmerkom in odzivom ter ustrezno prilagojene primerjave preskusnih skupin (npr. skupina, ki je prejela odmerek v parih, proti primerjavam primerjalnih kontrolnih skupin s topilom/nosilcem). Statistična analiza lahko obsega npr. linearno regresijo ali Williamsov preskus za oceno nihanj odziva na odmerek in Dunnettov preskus za primerjave po parih. Pri izbiri ustrezne metode statistične analize se mora raziskovalec zavedati možnih neenakosti varianc in drugih sorodnih problemov, zaradi katerih je lahko nujna pretvorba podatkov ali neparametrska statistična analiza. V vsakem primeru bo moral raziskovalec morda izvesti izračune stimulacijskega indeksa in statistične analize s podatkovnimi točkami (včasih imenovanimi „izločitve“) in brez njih.
PODATKI IN POROČANJE
Podatki
34. Podatki se povzamejo v obliki preglednice, ki prikazuje vrednosti indeksa označevanja za BrdU, skupinsko povprečje indeksa označevanja za BrdU/žival, s tem povezane napake (npr. SD, SEM) in povprečni SI za vsako skupino odmerka v primerjavi s primerjalno kontrolno skupino s topilom/nosilcem.
Poročilo o preskusu
35. Poročilo o preskusu vsebuje naslednje informacije:
preskusne in kontrolne kemikalije:
— identifikacijske podatke (npr. številko CAS in številko EC, če je na voljo; vir; čistost; znane nečistoče, številko serije),
— fizikalno stanje in fizikalno-kemijske lastnosti (npr. hlapnost, stabilnost, topnost),
— če je zmes, sestavo in relativne odstotke sestavin;
topilo/nosilec:
— identifikacijske podatke (čistost, po potrebi koncentracijo, uporabljeno količino),
— utemeljitev izbire uporabljenega nosilca;
preskusne živali:
— vir miši seva CBA,
— mikrobiološki status živali, če je znan,
— število in starost živali,
— število, starost in spol živali;
preskusni pogoji:
— vir, številko serije in podatke proizvajalca glede zagotavljanja kakovosti/nadzora kakovosti (občutljivost na protitelesa in specifičnost ter mejo zaznavnosti) kompleta za encimsko-imunski test,
— podatke o pripravi in uporabi preskusne snovi,
— utemeljitev izbire odmerka (vključno z rezultati predhodnega presejalnega preskusa, če je bil izveden),
— uporabljene koncentracije nosilca in preskusne snovi in skupno količino uporabljene preskusne snovi,
— podatke o kakovosti hrane in vode (vključno z vrsto/virom prehranjevanja, virom vode),
— podatke o programih tretiranja in vzorčenja,
— metode merjenja toksičnosti,
— merila za obravnavanje študij kot pozitivnih ali negativnih,
— podrobnosti o morebitnih odstopanjih protokola in pojasnilo, kako odstopanje vpliva na zasnovo študije in njene rezultate;
preverjanje zanesljivosti:
— povzetek rezultatov zadnjega preverjanja zanesljivosti, vključno z informacijami o uporabljeni preskusni snovi, koncentraciji in nosilcu,
— primerjalne in/ali pretekle pozitivne in primerjalne negativne (topilo/nosilec) kontrolne podatke za preskuševalni laboratorij,
— če primerjalna pozitivna kontrola ni bila vključena, datum in laboratorijsko poročilo nazadnje izvedene redne pozitivne kontrole in poročilo, ki navaja pretekle pozitivne kontrolne podatke za laboratorij, na podlagi katerih je upravičeno neizvajanje primerjalne pozitivne kontrole;
rezultati:
— posamezne mase živali na začetku odmerjanja in ob predvideni humani usmrtitvi; ter povprečno in povezano napako (npr. SD, SEM) za vsako tretirano skupino,
— časovni potek začetka toksičnosti in njenih znakov, vključno z morebitnim draženjem kože na mestu dajanja za vsako žival,
— preglednico s kazalniki označevanja za BrdU za vsako posamezno miš in vrednosti SI za vsako tretirano skupino,
— povprečno in povezano napako (npr. SD, SPM) za indeks označevanja za BrdU/miš za vsako tretirano skupino,
— izračunan SI in ustrezno merilo spremenljivosti, ki upošteva spremenljivost med posameznimi živalmi tako v preskusni snovi kot kontrolnih skupinah,
— odnos med odmerkom in odzivom,
— po potrebi, statistične analize;
razprava o rezultatih:
— kratke pripombe o rezultatih, analizo odziva na odmerek in po potrebi statistične analize, s sklepom, ali naj se preskusna snov šteje za povzročitelja preobčutljivosti kože.
VIRI
1. OECD (2010), Skin Sensitisation: Local Lymph Node Assay, Test Guideline No. 429, Guidelines for the Testing of Chemicals, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
2. Chamberlain, M. and Basketter, D.A. (1996), The local lymph node assay: status of validation. Food Chem. Toxicol., 34, 999–1002.
3. Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E. (1996), The local lymph node assay: A viable alternative to currently accepted skin sensitisation tests. Food Chem. Toxicol., 34, 985–997.
4. Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998), Strategies for identifying false positive responses in predictive sensitisation tests. Food Chem. Toxicol., 36, 327–33.
5. Van Och, F.M.M., Slob, W., De Jong, W.H., Vandebriel, R.J. and Van Loveren, H. (2000), A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employement of a regression method that includes determination of uncertainty margins. Toxicol., 146, 49–59.
6. ICCVAM (1999), The murine local lymph node Assay: A test method for assessing the allergic contact dermatitis potential of chemicals/compounds: The results of an independent peer review evaluation coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494. Research Triangle Park, N.C. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna/llnarep.pdf.
7. Dean, J.H., Twerdok, L.E., Tice, R.R., Sailstad, D.M., Hattan, D.G., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: II. Conclusions and recommendations of an independent scientific peer review panel. Reg. Toxicol. Pharmacol., 34(3), 258–273.
8. Haneke, K.E., Tice, R.R., Carson, B.L., Margolin, B.H., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: III. Data analyses completed by the national toxicology program interagency center for the evaluation of alternative toxicological methods. Reg. Toxicol. Pharmacol., 34(3), 274–286.
9. Sailstad, D.M., Hattan, D., Hill, R.N., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: I. The ICCVAM review process. Reg. Toxicol. Pharmacol., 34(3), 249–257.
10. ICCVAM (2010), ICCVAM Test Method Evaluation Report. Nonradioactive local lymph node assay: BrdU-ELISA Test Method Protocol (LLNA: BrdU-ELISA). NIH Publication No. 10-7552A/B. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/methods/immunotox/llna-ELISA/TMER.htm.
11. (11) ICCVAM (2009), Independent Scientific Peer Review Panel Report: Updated validation status of new versions and applications of the murine local lymph node assay: a test method for assessing the allergic contact dermatitis potential of chemicals and products. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/docs/immunotox_docs/LLNAPRPRept2009.pdf.
12. Takeyoshi, M., Iida, K., Shiraishi, K. and Hoshuyama, S. (2005), Novel approach for classifying chemicals according to skin sensitising potency by non-radioisotopic modification of the local lymph node assay. J. Appl. Toxicol., 25, 129–134.
13. OECD (1992), Skin Sensitisation, Test Guideline No. 406, Guidelines for Testing of Chemicals, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
14. Kreiling, R., Hollnagel, H.M., Hareng, L., Eigler, L., Lee, M.S., Griem, P., Dreessen, B., Kleber, M., Albrecht, A., Garcia, C. and Wendel, A. (2008), Comparison of the skin sensitising potential of unsaturated compounds as assessed by the murine local lymph node assay (LLNA) and the guinea pig maximization test (GPMT). Food Chem. Toxicol., 46, 1896–1904.
15. Basketter, D., Ball, N., Cagen, S., Carrilo, J.C., Certa, H., Eigler, D., Garcia, C., Esch, H., Graham, C., Haux, C., Kreiling, R. and Mehling, A. (2009), Application of a weight of evidence approach to assessing discordant sensitisation datasets: implications for REACH. Reg. Toxicol. Pharmacol., 55, 90–96.
16. ILAR (1996), Institute of Laboratory Animal Research (ILAR) Guide for the Care and Use of Laboratory Animals. 7th ed. Washington, DC: National Academies Press.
17. ICCVAM (2009), Recommended Performance Standards: Murine Local Lymph Node Assay. NIH Publication Number 09-7357. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna-ps/LLNAPerfStds.pdf.
18. McGarry, H.F. (2007), The murine local lymph node assay: regulatory and potency considerations under REACH. Toxicol., 238, 71–89.
19. Kimber, I., Dearman, R.J., Scholes E.W. and Basketter, D.A. (1994), The local lymph node assay: developments and applications. Toxicol., 93, 13–31.
20. OECD (2002), Acute Dermal Irritation/Corrosion, Test Guideline No. 404, Guidelines for Testing of Chemicals, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
21. Reeder, M.K., Broomhead, Y.L., DiDonato, L. and DeGeorge, G.L. (2007), Use of an enhanced local lymph node assay to correctly classify irritants and false positive substances. Toxicologist, 96, 235.
22. ICCVAM (2009), Nonradioactive Murine Local Lymph Node Assay: Flow Cytometry Test Method Protocol (LLNA: BrdU-FC) Revised Draft Background Review Document. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/methods/immunotox/fcLLNA/BRDcomplete.pdf.
23. Hayes, B.B., Gerber, P.C., Griffey, S.S. and Meade, B.J. (1998), Contact hypersensitivity to dicyclohexylcarbodiimide and diisopropylcarbodiimide in female B6C3F1 mice. Drug Chem. Toxicol., 21, 195–206.
24. Homey, B., von Schilling, C., Blumel, J., Schuppe, H.C., Ruzicka, T., Ahr, H.J., Lehmann, P. and Vohr, V.W. (1998), An integrated model for the differentiation of chemical-induced allergic and irritant skin reactions. Toxicol. Appl. Pharmacol., 153, 83–94.
25. Woolhiser, M.R., Hayes, B.B. and Meade, B.J. (1998), A combined murine local lymph node and irritancy assay to predict sensitisation and irritancy potential of chemicals. Toxicol. Meth., 8, 245–256.
26. Hayes, B.B. and Meade, B.J. (1999), Contact sensitivity to selected acrylate compounds in B6C3F1 mice: relative potency, cross reactivity, and comparison of test methods. Drug. Chem. Toxicol., 22, 491–506.
27. Ehling, G., Hecht, M., Heusener, A., Huesler, J., Gamer, A.O., van Loveren, H., Maurer, T., Riecke, K., Ullmann, L., Ulrich, P., Vandebriel, R. and Vohr, H.W. (2005), A European inter- laboratory validation of alternative endpoints of the murine local lymph node assay: first round. Toxicol., 212, 60–68.
28. Vohr, H.W. and Ahr, H.J. (2005), The local lymph node assay being too sensitive? Arch. Toxicol., 79, 721–728.
29. Patterson, R.M., Noga, E. and Germolec D. (2007), Lack of evidence for contact sensitisation by Pfiesteria extract. Environ. Health Perspect., 115, 1023–1028.
30. ICCVAM (2009), Report on the ICCVAM-NICEATM/ECVAM/JaCVAM Scientific Workshop on Acute Chemical Safety Testing: Advancing In Vitro Approaches and Humane Endpoints for Systemic Toxicity Evaluations. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Na voljo na spletni strani: http://iccvam.niehs.nih.gov/methods/acutetox/Tox_workshop.htm.
31. OECD (2000), Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation, Environmental Health and Safety Monograph Series on Testing and Assessment No. 19, ENV/JM/MONO(2000)7, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
32. Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E. and Hastings, K.L. (1998), Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. J. Toxicol. Environ.l Health, 53, 563–79.
33. OECD (2005), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, Environment, Health and Safety Monograph Series on Testing and Assessment No. 34, ENV/JM/MONO(2005)14, OECD, Paris. Na voljo na spletni strani: http://www.oecd.org/env/testguidelines.
Dodatek 1
OPREDELITVE POJMOV
Natančnost : stopnja ujemanja rezultatov preskusne metode z uveljavljenimi referenčnimi vrednostmi. To je merilo učinkovitosti preskusne metode in eden od vidikov ustreznosti. Ta izraz in izraz „skladnost“ se pogosto izmenično uporabljata za pomen deleža ustreznih rezultatov preskusne metode (33).
Primerjalna snov : snov, ki povzroča preobčutljivost ali je ne povzroča in se uporablja kot standard za primerjavo s preskusno snovjo. Primerjalna snov mora imeti naslednje lastnosti: (i) trajen in zanesljiv vir; (ii) strukturno in funkcijsko podobnost z razredom preskušanih snovi; (iii) znane fizikalno-kemijske lastnosti; (iv) podporne podatke o znanih učinkih in (v) znano učinkovitost v razponu želene reakcije.
Lažno negativna snov : preskusna snov, ki je s preskusno metodo nepravilno opredeljena kot negativna ali neaktivna, čeprav je dejansko pozitivna ali aktivna (33).
Lažno pozitivna snov : preskusna snov, ki je s preskusom nepravilno opredeljena kot pozitivna ali aktivna, čeprav je dejansko negativna ali neaktivna (33).
Nevarnost : možnost škodljivega učinka na zdravje ali okolje. Do škodljivega učinka pride, če je raven izpostavljenosti dovolj visoka.
Ponovljivost v laboratorijih : merjenje obsega, v katerem lahko različni kvalificirani laboratoriji, ki uporabljajo isti protokol in preskušajo iste preskusne snovi, pridejo do kvalitativno in kvantitativno podobnih rezultatov. Ponovljivost v laboratorijih se ugotovi med postopki pred validacijo in med validacijo ter kaže, v kakšnem obsegu se lahko preskus uspešno uporablja v več laboratorijih; imenuje se tudi ponovljivost v različnih laboratorijih (33).
Ponovljivost v laboratoriju : določitev, obsega, v katerem lahko kvalificirane osebe v istem laboratoriju uspešno ponovijo rezultate z uporabo določenega protokola v različnem času. Imenuje se tudi ponovljivost znotraj laboratorija (33).
Izločitev : izločitev je ugotovitev, ki se izrazito razlikuje od drugih vrednosti v naključnem vzorcu populacije.
Zagotavljanje kakovosti : postopek upravljanja, pri katerem posamezniki, neodvisni od oseb, ki so izvajale preskuse, ocenijo izpolnjevanje laboratorijskih standardov za preskušanje, zahtev in postopkov vodenja evidenc ter natančnosti prenosa podatkov.
Zanesljivost : stopnja ponovljivosti preskusne metode v laboratorijih in med njimi v določenem časovnem obdobju pri uporabi istega protokola. Oceni se z izračunom ponovljivosti v enem ali več laboratorijih (33).
Preobčutljivost kože : imunološki proces, ki se pojavi, ko je občutljiv posameznik lokalno izpostavljen kemičnemu alergenu, ki na koži sproži imunski odziv in lahko povzroči razvoj preobčutljivosti ob stiku.
Stimulacijski indeks (SI) : vrednost, izračunana za oceno morebitne preobčutljivosti kože, ki jo lahko povzroči preskusna snov; je razmerje med množenjem v tretiranih skupinah in množenjem v primerjalni kontrolni skupini z nosilcem.
Preskusna snov (imenovana tudi preskusna kemikalija) : katera koli snov ali zmes, preskušana z uporabo te preskusne metode.
DEL C: METODE ZA DOLOČANJE STRUPENOSTI ZA OKOLJE
|
KAZALO |
|
|
C.1 |
AKUTNA STRUPENOST ZA RIBE |
|
C.2 |
PRESKUS AKUTNE IMOBILIZACIJE VODNIH BOLH (DAPHNIA SP.) |
|
C.3 |
SLADKOVODNE ALGE IN CIANOBAKTERIJE, PRESKUS ZAVIRANJA RASTI |
|
C.4 |
DOLOČANJE „DOBRE“ BIORAZGRADLJIVOSTI |
|
DEL I |
SPLOŠNO |
|
DEL II |
PRESKUS UPADANJA DOC (METODA C.4-A) |
|
DEL III |
PRILAGOJENI PRESEJALNI PRESKUS OECD (METODA C.4-B) |
|
DEL IV |
PRESKUS RAZVIJANJA CO2 (METODA C.4-C) |
|
DEL V |
PRESKUS MANOMETRIČNE RESPIROMETRIJE (METODA C.4-D) |
|
DEL VI |
PRESKUS Z ZAPRTO STEKLENICO (METODA C.4-E) |
|
DEL VII |
PRESKUS M.I.T.I. (METODA C.4-F) |
|
C.5 |
RAZGRADNJA – BIOKEMIJSKA POTREBA PO KISIKU |
|
C.6 |
RAZGRADNJA – KEMIJSKA POTREBA PO KISIKU |
|
C.7 |
RAZGRADNJA – ABIOTSKA RAZGRADNJA: HIDROLIZA KOT FUNKCIJA pH |
|
C.8 |
STRUPENOST ZA DEŽEVNIKE |
|
C.9 |
BIORAZGRADNJA – ZAHN-WELLENSEV PRESKUS |
|
C.1O |
BIORAZGRADNJA – SIMULACIJSKI PRESKUSI Z AKTIVNIM BLATOM |
|
C.11 |
BIORAZGRADNJA– PRESKUS ZAVIRANJA DIHANJA AKTIVNEGA BLATA |
|
C.12 |
BIORAZGRADNJA – SPREMENJENI SCAS PRESKUS |
|
C.13 |
BIOKONCENTRACIJA: PRETOČNI PRESKUS NA RIBAH |
|
C.14 |
PRESKUS RASTI RIBJIH MLADIC |
|
C.15 |
RIBE, PRESKUS KRATKOTRAJNE TOKSIČNOSTI NA EMBRIIH IN MLADICAH S HRANILNIM MEŠIČKOM |
|
C.16 |
ČEBELE DELAVKE – PRESKUS AKUTNE ORALNE TOKSIČNOSTI |
|
C.17 |
ČEBELE DELAVKE – PRESKUS AKUTNE KONTAKTNE TOKSIČNOSTI |
|
C.18 |
ADSORPCIJA/DESORPCIJA Z UPORABO METODE ŠARŽNIH PRESKUSOV RAVNOTEŽJA |
|
C.19 |
OCENJEVANJE ADSORPCIJSKEGA KOEFICIENTA (KOC ) TAL IN ODPADNEGA BLATA (BLATA IZ ČISTILNIH NAPRAV) S TEKOČINSKO KROMATOGRAFIJO VISOKE LOČLJIVOSTI (HPLC) |
|
C.20 |
PRESKUS RAZMNOŽEVANJA VRSTE DAPHNIA MAGNA |
|
C.21 |
TALNI MIKROORGANIZMI: PRESKUS TRANSFORMACIJE DUŠIKA |
|
C.22 |
TALNI MIKROORGANIZMI: PRESKUS TRANSFORMACIJE OGLJIKA |
|
C.23 |
AEROBNA IN ANAEROBNA TRANSFORMACIJA V TLEH |
|
C.24 |
AEROBNA IN ANAEROBNA TRANSFORMACIJA V SISTEMIH VODNIH USEDLIN |
|
C.25. |
AEROBNA MINERALIZACIJA V POVRŠINSKI VODI – SIMULACIJSKI PRESKUS BIORAZGRADNJE |
|
C.26. |
LEMNA SP. GROWTH INHIBITION TEST |
C.1 AKUTNA STRUPENOST ZA RIBE
1. METODA
1.1 UVOD
Namen tega preskusa je določiti akutno smrtno strupenost snovi za ribe v sladki vodi. Za pomoč pri izbiranju najbolj primerne preskusne metode (statična, polstatična ali pretočna), da se zagotovijo zadovoljivo konstantne koncentracije preskusne snovi v času preskusa, je zaželeno, da je na voljo čim več informacij o topnosti v vodi, parnem tlaku, kemični stabilnosti, disociacijski konstanti in biorazgradljivosti snovi.
Pri načrtovanju preskusa in pri razlagi rezultatov je treba upoštevati tudi dodatne informacije (na primer strukturno formulo, stopnjo čistosti, vrsto in odstotek bistvenih nečistot, prisotnost in količino dodatkov ter porazdelitveni koeficient n-oktanol/voda).
1.2 OPREDELITVE IN ENOTE
Akutna strupenost je zaznaven škodljiv učinek, ki ga v kratkem času (nekaj dneh) v organizmu povzroči izpostavljenost snovi. V tem preskusu je akutna strupenost izražena kot srednja smrtna koncentracija (LC50), to je koncentracija v vodi, ki povzroči pogin 50 % rib v preskusni skupini med neprekinjeno izpostavljenostjo, katere trajanje mora biti navedeno.
Vse koncentracije preskusne snovi so navedene v masi na volumen (miligramih na liter). Lahko se izrazijo tudi v masi na maso (mg· kg-1).
1.3 REFERENČNE SNOVI
Za dokazovanje, da se odziv preskusne vrste v laboratorijskih preskusnih pogojih ni bistveno spremenil, se lahko preskusi referenčna snov.
Za ta preskus ni določena nobena referenčna snov.
1.4 PRINCIP PRESKUSNE METODE
Lahko se izvede mejni preskus s 100 mg na liter, v dokaz, da je LC50 večji od te koncentracije.
Ribe se za 96 ur izpostavijo preskusni snovi, dodani vodi, v nizu koncentracij. Smrtni primeri se zapišejo v najmanj 24-urnih intervalih, in kadar je mogoče, se za vsak čas opazovanja izračunajo koncentracije, pri katerih pogine 50 % rib (LC50).
1.5 MERILA KAKOVOSTI
Merila kakovosti se uporabljajo za mejni preskus in za popolni preskus.
Ob koncu preskusa smrtnost v kontrolnih vzorcih ne sme biti večja od 10 % (oziroma ene ribe, če se uporabi manj kot deset rib).
Ves čas preskusa mora biti koncentracija raztopljenega kisika več kot 60 % nasičenosti zraka.
Ves čas preskusa se koncentracije preskusne snovi vzdržujejo v območju 80 % začetnih koncentracij.
Pri snoveh, ki se lahko topijo v preskusnem mediju in dajejo stabilne raztopine, t.j. snovi, ki ne bodo znatno hlapele, se razgradile, hidrolizirale ali adsorbirale, se šteje, da je začetna koncentracija enakovredna nazivni koncentraciji. Priložijo se dokazi, da so se koncentracije vzdrževale ves čas preskusa in so bila izpolnjena merila kakovosti.
Pri snoveh, ki:
(i) so slabo topne v preskusnem mediju ali
(ii) so zmožne tvoriti stabilne emulzije ali disperzije ali
(iii) v vodnih raztopinah niso stabilne,
se šteje, da je začetna koncentracija koncentracija, izmerjena v raztopini (ali, če to tehnično ni izvedljivo, v vodnem stolpcu) na začetku preskusa. Koncentracija se določi po vzpostavitvi ravnotežja, vendar pred vnosom preskusnih rib.
V vsakem od teh primerov, je treba opraviti dodatne meritve med preskusom, da se potrdijo dejanske koncentracije izpostavljenosti ali izpolnitev meril kakovosti.
Vrednost pH se ne sme spreminjati za več kot 1 enoto.
1.6 OPIS PRESKUSNE METODE
Uporabijo se lahko tri vrste postopkov:
Statični preskus:
Preskus strupenosti, pri katerem ni pretoka preskusne raztopine. (Raztopine ostanejo nespremenjene ves čas preskusa.)
Polstatični preskus:
Preskus, pri katerem ni pretoka preskusne raztopine, se pa preskusna raztopina v rednih časovnih presledkih (npr. 24 ur) v celoti obnovi.
Pretočni preskus:
Preskus strupenosti, pri katerem se voda v preskusnih komorah neprestano obnavlja, pri čemer se preskusna snov prenaša z vodo, uporabljeno za obnavljanje preskusnega medija.
1.6.1 Reagenti
1.6.1.1 Raztopine preskusnih snovi
Osnovne raztopine potrebnih koncentracij se pripravijo z raztopitvijo snovi v deionizirani vodi ali vodi v skladu s točko 1.6.1.2.
Izbrane preskusne koncentracije se pripravijo z redčenjem osnovne raztopine. Če se preskušajo velike koncentracije, se snov lahko raztopi neposredno v vodi za redčenje.
Običajno je treba snovi preskusiti le do meje topnosti. Pri nekaterih snoveh (npr. snoveh, ki so slabo topne v vodi ali imajo visok Pow, ali tistih, ki v vodi tvorijo stabilne disperzije in ne pravih raztopin) je sprejemljivo izvesti preskus pri koncentraciji nad mejo topnosti, da se zagotovi doseganje največje topne/stabilne koncentracije. Pomembno pa je, da ta koncentracija ne bo motila preskusnega sistema (npr. tvorba filma na vodni površini, ki prepreči obnavljanje kisika v vodi itd.).
Pri pripravi osnovnih raztopin snovi, ki so slabo topne v vodi, ali za lažje dispergiranje teh snovi v preskusnem mediju se lahko uporabi ultrazvočno dispergiranje, organska topila, emulgatorji ali disperzijska sredstva. Kadar se uporabijo take pomožne snovi, morajo preskusne raztopine vseh koncentracij vsebovati enako količino pomožne snovi in dodatno kontrolno skupino rib je treba izpostaviti enaki koncentraciji pomožne snovi, kakor je uporabljena v preskusnih skupinah. Koncentracija takih pomožnih snovi mora biti čim manjša in v nobenem primeru ne sme preseči 100 mg na liter preskusnega medija.
Preskus je treba opraviti brez uravnavanja pH. Če obstajajo dokazi o izraziti spremembi pH, se priporoča, da se preskus ponovi z uravnanim pH in rezultati vključijo v poročilo. V tem primeru je treba pH vrednost osnovne raztopine uravnati na pH vrednost vode za redčenje, razen če obstajajo posebni razlogi, da se to ne stori. V ta namen je najbolje uporabiti HCl in NaOH. To uravnavanje pH je treba opraviti tako, da se koncentracija preskusne snovi v osnovni raztopini bistveno ne spremeni. Če uravnava povzroči kemijsko reakcijo ali obarjanje preskusne snovi, je treba o tem poročati.
1.6.1.2 Voda za vzdrževanje in razredčenje
Uporabi se lahko pitna voda (ki ni onesnažena s potencialno zdravju škodljivimi koncentracijami klora, težkih kovin ali drugih snovi), kakovostna naravna voda ali obdelana voda (glej Dodatek 1). Priporoča se uporaba vode s skupno trdoto med 50 in 250 mg na liter (kot CaCO3) in pH vrednostjo 6,0 do 8,5.
1.6.2 Aparatura
Vse aparature morajo biti izdelane iz kemijsko inertnih materialov.
— sistem za avtomatsko redčenje (za pretočni preskus),
— oksimeter,
— oprema za določanje trdote vode,
— ustrezna aparatura za uravnavanje temperature,
— pH-meter.
1.6.3 Preskusne ribe
Ribe morajo biti zdrave in brez očitnih nepravilnosti.
Uporabljeno vrsto je treba izbrati na podlagi praktičnih meril, kot so njihova razpoložljivost celo leto, lahko vzdrževanje, pripravnost za preskušanje, relativna občutljivost za kemikalije in kakršni koli ekonomski, biološki ali ekološki dejavniki, ki so lahko pomembni. Pri izbiri vrste rib je treba upoštevati tudi potrebo po primerljivosti dobljenih podatkov in obstoječe mednarodne uskladitve (vir 1).
Seznam ribjih vrst, ki se priporočajo za ta preskus, je v Dodatku 2; najbolj primerni vrsti sta cebrica in šarenka.
1.6.3.1 Vzdrževanje
Ribe naj po možnosti izvirajo iz ene same jate rib s podobno dolžino in starostjo. Ribe je treba vzdrževati najmanj 12 dni v naslednjih pogojih:
obremenitev:
ustrezna sistemu (kroženje ali pretok) in vrsti rib,
voda:
glej 1.6.1.2,
svetloba:
12 do 16 ur osvetljevanja dnevno,
koncentracija raztopljenega kisika:
najmanj 80 % nasičenosti zraka,
hranjenje:
trikrat tedensko ali vsak dan, 24 ur pred začetkom preskusa pa se hranjenje ustavi.
1.6.3.2 Smrtnost
Po 48-urnem obdobju prilagajanja se zapišejo smrtni primeri in uporabijo naslednja merila:
— več kot 10 % populacije v sedmih dneh:
— celotna serija se zavrne,
— med 5 in 10 % populacije:
— obdobje vzdrževanja se podaljša za sedem dni.
— Če ne pride do novih smrtnih primerov, je serija sprejemljiva, v nasprotnem primeru jo je treba zavrniti,
— manj kot 5 % populacije:
— serija se sprejme.
1.6.4 Prilagajanje
Najmanj sedem dni pred uporabo morajo biti vse ribe izpostavljene vodi z enako kakovostjo in temperaturo, kakor se bo uporabila v preskusu.
1.6.5 Preskusni postopek
Pred dokončnim preskusom se lahko opravi preskus za ugotavljanje območja, namenjen pridobivanju informacij o območju koncentracij, ki se bodo uporabile v glavnem preskusu.
Poleg preskusnega niza se izvede ena kontrola brez preskusne snovi in, če je potrebno, tudi ena kontrola s pomožno snovjo.
Glede na fizikalne in kemijske lastnosti preskusne snovi je treba izbrati ustrezno metodo preskusa, statično, polstatično ali pretočno, tako da so izpolnjena merila kakovosti.
Ribe se izpostavijo snovi na spodaj opisani način:
— trajanje: 96 ur,
— število živali: najmanj 7 na koncentracijo,
— bazeni: s primernim volumnom glede na priporočeno obremenitev,
— obremenitev: za statične in polstatične preskuse je največja priporočena obremenitev 1 g na liter; pri pretočnih sistemih je sprejemljiva tudi večja obremenitev,
— preskusna koncentracija: najmanj 5 koncentracij, ki se med seboj razlikujejo za konstantni faktor največ 2,2 in so kolikor je mogoče porazdeljene prek območja od 0 do 100-odstotne smrtnosti,
— voda: glej 1.6.1.2,
— svetloba: 12 do 16 ur osvetljevanja dnevno,
— temperatura: primerna za vrsto (Dodatek 2), vendar v mejah ± 1 oC pri vsakem preskusu,
— koncentracija raztopljenega kisika: najmanj 60 % nasičenosti zraka pri izbrani temperaturi,
— hranjenje: ga ni.
Ribe se pregledajo po prvih 2 do 4 urah in nato v najmanj 24-urnih intervalih. Ribe se štejejo za mrtve, če dotik dela med predrepno in repno plavutjo ne povzroči nobene reakcije in niso opazni dihalni gibi. Mrtve ribe se odstranijo takoj, ko so opažene, in zapišejo se smrtni primeri. Zapišejo se vse opazne nepravilnosti (npr. izguba ravnotežja, spremembe v načinu plavanja, dihanju, pigmentaciji itd.).
Dnevno je treba meriti pH, raztopljeni kisik in temperaturo.
Z uporabo postopkov, opisanih v tej preskusni metodi, se lahko izvede mejni preskus pri 100 mg na liter, v dokaz, da je LC50 večji od te koncentracije.
Če ima snov take lastnosti, da koncentracije 100 mg na liter ni mogoče doseči, se mejni preskus izvede s koncentracijo, enako topnosti snovi (ali največji koncentraciji, pri kateri še nastane stabilna disperzija) v uporabljenem mediju (glej tudi točko 1.6.1.1).
Mejni preskus je treba izvesti s 7 do 10 ribami, z enakim številom v kontrolni(-h) skupini(-ah). (Po binomski teoriji velja, da je pri 10 uporabljenih ribah in smrtnosti 0 verjetnost, da je LC50 večji od koncentracije, uporabljene v mejnem preskusu, enaka 99,9 %. Pri 7, 8, ali 9 ribah odsotnost smrtnosti pomeni najmanj 99-odstotno verjetnost, da je LC50 večji od uporabljene koncentracije.)
Če se pojavijo smrtni primeri, je treba izvesti popolno študijo. Če se opazijo subletalni učinki, jih je treba navesti v poročilu.
2. PODATKI IN OCENA
Za vsako obdobje, ko so bila zapisana opažanja (24, 48, 72 in 96 ur), se na logaritemsko-verjetnostnem papirju izdela graf odstotka smrtnosti za vsako priporočeno obdobje izpostavljanja v odvisnosti od koncentracije.
Kadar je mogoče in za vsak čas opazovanja, je treba po standardnih postopkih oceniti LC50 in meje zaupanja (p = 0,05); te vrednosti je treba zaokrožiti na eno ali največ dve značilni mesti (primeri zaokrožitve na dve mesti: 170 za 173,5; 0,13 za 0,127; 1,2 za 1,21).
Kadar je naklon krivulje koncentracija/odstotek odziva preveč strm za izračun LC50, zadostuje grafična ocena te vrednosti.
Kadar dve zaporedni koncentraciji pri faktorju 2,2 povzročita samo 0 in 100 % smrtnost, ti dve vrednosti zadostujeta za prikaz območja, v katerem je LC50.
Če se opazi, da ni mogoče ohraniti stabilnosti ali homogenosti preskusne snovi, je treba to navesti v poročilu in upoštevati pri razlagi rezultatov.
3. POROČANJE
V poročilo o preskusu se, če je možno, vključijo naslednje informacije:
— informacije o preskusnih ribah (znanstveno ime, sev, dobavitelj, vse predhodne obdelave, velikost in število, uporabljena za vsako preskusno koncentracijo),
— vir in glavne kemijske lastnosti vode za redčenje (pH, trdota, temperatura),
— v primeru snovi, slabo topnih v vodi, metoda priprave osnovne in preskusnih raztopin,
— koncentracija vseh pomožnih snovi,
— seznam uporabljenih koncentracij in vse razpoložljive informacije o stabilnosti preskusne snovi v preskusni raztopini pri uporabljenih koncentracijah,
— če se opravijo kemijske analize, uporabljene metode in dobljeni rezultati,
— rezultati mejnega preskusa, če je bil opravljen,
— razlogi za izbiro uporabljenega preskusnega postopka in podatki o njem (npr. statičen, polstatičen, stopnja odmerjanja, pretok, morebitno prezračevanje, obremenitev z ribami itd.),
— opis preskusne opreme,
— režim osvetljevanja,
— koncentracija raztopljenega kisika, pH vrednost in temperatura preskusnih raztopin vsakih 24 ur,
— dokazi, da so bila izpolnjena merila kakovosti,
— tabela, ki prikazuje skupno smrtnost pri vsaki koncentraciji in pri kontroli (ali kontroli s pomožno snovjo, če je potrebno) ob vsakem priporočenem času opazovanja,
— graf koncentracija/odstotek odziva ob koncu preskusa,
— če je mogoče, vrednosti LC50 za vsak priporočeni čas opazovanja (s 95-odstotnimi mejami zaupanja),
— uporabljeni statistični postopki za določanje vrednosti LC50,
— dobljeni rezultati, če se uporabi referenčna snov,
— največja preskusna koncentracija, ki v času preskusa ne povzroči smrti,
— najmanjša preskusna koncentracija, ki v času preskusa povzroči 100-odstotno smrtnost.
4. VIRI
(1) OECD, Paris, 1981, Test Guideline 203, Decision of the Council C(81) 30 final and updates.
(2) AFNOR – Determination of the acute toxicity of a substance to Brachydanio rerio – Static and Flow Through methods – NFT 90-303 June 1985.
(3) AFNOR – Determination of the acute toxicity of a substance to Salmo gairdneri – Static and Flow – Through methods – NFT 90-305 June 1985.
(4) ISO 7346/1,/2 and/3 -Water Quality -Determination of the acute lethal toxicity of substances to a fresh water fish (Brachydanio rerio Hamilton-Buchanan -Teleostei, Cyprinidae). Part 1: Static method. Part 2: Semi-static method. Part 3: Flow-through method.
(5) Eidgenossisches Department des Innern, Schweiz: Richtlinien fur Probenahme und Normung von Wasseruntersuchungsmethoden – Part II 1974.
(6) DIN Testverfahren mit Wasserorganismen, 38 412 (11) und 1 (15).
(7) JIS K 0102, Acute toxicity test for fish.
(8) NEN 6506- Water -Bepaling van de akute toxiciteit met behulp van Poecilia reticulata, 1980.
(9) Environmental Protection Agency, Methods for the acute toxicity tests with fish, macroinvertebrates and amphibians. The Committee on Methods for Toxicity Tests with Aquatic Organisms, Ecological Research Series EPA-660-75-009, 1975.
(10) Environmental Protection Agency, Environmental monitoring and support laboratory, Office of Research and Development, EPA-600/4-78-012, January 1978.
(11) Environmental Protection Agency, Toxic Substance Control, Part IV, 16 March 1979.
(12) Standard methods for the examination of water and wastewater, fourteen edition, APHA-AWW A-WPCF, 1975.
(13) Commission of the European Communities, Inter-laboratory test programme concerning the study of the ecotoxicityof a chemical substance with respect to the fish. EEC Study D.8368, 22 March 1979.
(14) Verfahrensvorschlag des Umweltbundesamtes zum akuten Fisch-Test. Rudolph, P. und Boje, R. Okotoxikologie, Grundlagen fur die okotoxikologische Bewertung von Umweltchemikalien nach dem Chemikaliengesetz, ecomed 1986.
(15) Litchfield, J. T. and Wilcoxon, F., A simplified method for evaluating dose effects experiments, J. Pharm, tExp. Therap., 1949, vol. 96, 99.
(16) Finney, D.J. Statistical Methods in Biological Assay. Griffin, Weycombe, U.K., 1978.
(17) Sprague, J. B. Measurement of pollutant toxicity to fish. Bioassay methods for acute toxicity. Water Res., 1969, vol. 3, 793-821.
(18) Sprague, J.B. Measurement of pollutant toxicity to fish. II Utilising and applying bioassay results. Water Res. 1970, vol. 4, 3-32.
(19) Stephan, C.E. Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). American Society for Testing and Materials, ASTM STP 634, 1977, 65-84.
(20) Stephan, C.E., Busch, K.A., Smith, R., Burke, J. and Andrews, R.W. A computer program for calculating an LC50. US EPA.
Dodatek 1
Obdelana voda
Primer ustrezne vode za redčenje
Vse kemikalije morajo biti analitsko čiste.
Voda mora biti destilirana voda dobre kakovosti ali deionizirana voda s prevodnostjo pod 5 μScm-1.
Aparatura za destilacijo vode ne sme vsebovati bakrenih delov.
Osnovne raztopine
|
CaCl2. 2H2O (kalcijev klorid dihidrat): Raztopimo v vodi in dopolnimo do 1 litra. |
11,76 g |
|
MgSO4. 7H2O (magnezijev sulfat heptahidrat): Raztopimo v vodi in dopolnimo do 1 litra. |
4,93 g |
|
NaHCO3 (natrijev hydrogen karbonat): Raztopimo v vodi in dopolnimo do 1 litra. |
2,59 g |
|
KCI (kalijev klorid): Raztopimo v vodi in dopolnimo do 1 litra. |
0,23 g |
Obdelana voda za redčenje
Zmešamo po 25 ml vsake od štirih osnovnih raztopin in dopolnimo z vodo do 1 litra.
Prezračujemo, dokler koncentracija raztopljenega kisika ni enaka nasičenosti zraka.
Vrednost pH mora biti 7,8 ± 0,2.
Če je potrebno, pH uravnavamo z NaOH (natrijevem hidroksidu) ali HCl (klorovodikovo kislino).
Tako pripravljeno vodo za redčenje pustimo približno 12 ur in je ne smemo več zračiti.
Vsota ionov Ca in Mg v tej raztopini je 2,5 mmol na liter. Razmerje ionov Ca in Mg je 4:1 ter Na in K 10:1. Skupna alkalnost te raztopine je 0,8 mmol na liter.
Nobeno odstopanje v pripravi vode za redčenje ne sme spremeniti sestave ali lastnosti vode.
Dodatek 2
Priporočene ribje vrste za preskušanje
|
Priporočena vrsta |
Priporočeno območje temperature preskusa ( oC) |
Priporočena skupna dolžina preskusne živali (cm) |
|
Brachydanio rerio (Teleostei, Cyprinidae) (Hamilton–Buchanan), navadna cebrica |
20 do 24 |
3,0 ± 0,5 |
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque), črnoglavi pisanec |
20 do 24 |
5,0 ± 2,5 |
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linneaus 1758), krap |
20 do 24 |
6,0 ± 2,0 |
|
Oryzias latipes (Teleostei, Poeciliidae) Cyprinodontidae (Tomminck and Schlege 1850), medaka |
20 do 24 |
3,0 ± 1,0 |
|
Poecilia reticulata (Teleostei, Poeciliidae) (Peters 1859), gupi |
20 do 24 |
3,0 ± 1,0 |
|
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque Linneaus 1758), sončni ostriž |
20 do 24 |
5,0 ± 2,0 |
|
Onchorhynchus mykiss (Teleostei, Salmonidae) (Walbaum 1988), amerikanka |
12 do 17 |
6,0 ± 2,0 |
|
Leuciscus idus (Teleostei, Cyprinidae) (Linneaus 1758), jez |
20 do 24 |
6,0 ± 2,0 |
Zbiranje
Zgoraj navedene ribe se z lahkoto gojijo in/ali so obče na voljo celo leto. Lahko se razmnožujejo in gojijo bodisi v ribogojnicah bodisi v laboratoriju v pogojih, kjer se nadzorujejo bolezni in zajedavci, tako da bodo preskusne živali zdrave in znanega porekla. Te ribe so na voljo v številnih delih sveta.
Dodatek 3
Primer krivulje smrtnosti v odvisnosti od koncentracije
Primer določanja LC50 z uporabo logaritemskega-verjetnostnega papirja

C.2 PRESKUS AKUTNE IMOBILIZACIJE VODNIH BOLH (DAPHNIA SP.)
1. METODA
Ta preskusna metoda akutne imobilizacije je enakovredna OECD TG 202 (2004).
1.1 UVOD
Ta metoda opisuje preskus akutne toksičnosti za določanje učinkov kemikalij na vodne bolhe. Kolikor je možno, so bile uporabljene obstoječe preskusne metode (1) (2) (3).
1.2 OPREDELITVE POJMOV
V zvezi s to metodo se uporabljajo naslednje opredelitve:
EC 50 : je koncentracija, za katero se oceni, da imobilizira 50 % vodnih bolh v navedenem obdobju izpostavljenosti. Če se uporabi druga opredelitev pojma, je treba to navesti skupaj z virom.
Imobilizacija: Živali, ki niso zmožne plavati v 15 sekundah po rahlem stresanju preskusne posode, se štejejo za imobilne (čeprav lahko še vedno premikajo svoje tipalke).
1.3 PRINCIP PRESKUSNE METODE
Mlade vodne bolhe, ki niso starejše od 24 ur ob začetku preskusa, se za 48 ur izpostavijo preskusni snovi v nizu koncentracij. Imobilizacija se ugotavlja po 24 urah in 48 urah ter primerja s kontrolnimi vrednostmi. Rezultati se analizirajo, da se izračuna EC50 po 48 h (glej oddelek 1.2 za opredelitve). Določevanje EC50 po 24 h je izbirno.
1.4 PODATKI O PRESKUSNI SNOVI
Treba je poznati topnost v vodi in parni tlak. na voljo mora biti zanesljiva analitska metoda za številčno vrednotenje snovi v preskusni raztopini z znanim analitskim izkoristkom in mejo zaznavnosti (LOD). Uporabni podatki so strukturna formula, čistost snovi, stabilnost v vodi ali na svetlobi, Pow in rezultati preskusa za dobro biorazgradljivost (glej metodo C.4).
Opomba: Navodila za preskušanje snovi, ki jih je težko preskušati zaradi fizikalno-kemijskih lastnosti, so na voljo v (4).
1.5 REFERENČNE SNOVI
S preskušanjem referenčne snovi za EC50 se zagotavlja zanesljivost preskusnih pogojev. Za ta namen se priporočajo strupene snovi, ki se uporabljajo v mednarodnih preskusih primerljivosti (1) (5) ( 25 ). Preskus(-e) z referenčno snovjo je najboljše opraviti vsak mesec in najmanj dvakrat letno.
1.6 MERILA KAKOVOSTI
Za veljavnost preskusa veljajo naslednja merila izvedbe:
— v kontrolah, vključno s kontrolo, ki vsebuje sredstvo za raztapljanje, ne sme biti imobiliziranih več kot 10 % vodnih bolh,
— koncentracija raztopljenega kisika na koncu preskusa mora biti > 3 mg/l v kontrolni in preskusni posodi.
Opomba: V zvezi s prvim merilom ne sme več kot 10 % kontrolnih vodnih bolh kazati znakov imobilizacije ali drugih znakov bolezni ali stresa, npr. razbarvanja, neobičajnega vedenja, kot je ujetost na površini vode.
1.7 OPIS PRESKUSNE METODE
1.7.1 Oprema
Preskusne posode in druge aparature, ki bodo prišle v stik s preskusnimi raztopinami, so v celoti steklene ali iz drugega kemijsko inertnega materiala: Preskusne posode so običajno steklene epruvete ali čaše; pred vsako uporabo jih je treba očistiti s standardnimi laboratorijskimi postopki. Preskusne posode so narahlo pokrite, da se preprečita izguba vode zaradi izhlapevanja in vnos prahu v raztopine. Hlapne snovi je treba preskušati v zaprtih do vrha napolnjenih posodah, ki so dovolj velike, da kisik ne postane omejujoč dejavnik ali da ga je premalo (glej oddelek 1.6 in prvi odstavek oddelka 1.8.3)
Poleg navedenega je potrebna naslednja oprema ali samo del: oksimeter (z mikroelektrodo ali drugo ustrezno opremo za merjenje raztopljenega kisika v majhnih vzorcih); pH-meter; ustrezna aparatura za uravnavanje temperature; oprema za določanje koncentracije skupnega organskega ogljika (TOC); oprema za določanje kemijske potrebe po kisiku (KPK); oprema za določanje trdote vode itn.
1.7.2 Preskusni organizem
Prednost ima vrsta Daphnia magna Straus, lahko pa se v tem preskusu uporabi tudi druga vrsta (npr. Daphniapulex). Preskusne živali morajo biti na začetku preskusa stare manj kot 24 ur; za zmanjšanje variabilnosti se močno priporoča, da niso potomci iz prvega legla. Izvirati morajo iz zdrave populacije (t.j. ne kažejo znakov stresa, kot so visoka smrtnost, navzočnost samcev in ephipije, zakasnitev prvega legla, razbarvane živali itn.). Vsi organizmi, uporabljeni v posameznem preskusu, morajo izvirati iz kultur iz iste populacije vodnih bolh. Zarodne živali je treba držati v razmerah (svetloba, temperatura, medij), ki so podobni tistim iz preskusa. Če se medij za vodne bolhe v preskusu razlikuje od medija za rutinsko gojenje vodnih bolh, je pred preskusom dobro opraviti aklimatizacijo. V tem primeru je treba mladiče vodnih bolh pustiti v vodi za redčenje pri preskusni temperaturi najmanj 48 ur pred začetkom preskusa.
1.7.3 Gojiščna voda in voda za redčenje
Za gojiščno vodo in vodo za redčenje je sprejemljiva naravna voda (površinska ali podzemna voda), obdelana voda ali deklorirana vodovodna voda, če vodne bolhe v njej preživijo trajanje gojitve, aklimatizacije in preskušanja brez znakov stresa. Vsaka voda, ki ustreza kemijskim značilnostim sprejemljive vode za redčenje, ki so navedene v Dodatku 1, je primerna za preskusno vodo. Voda mora biti ves čas trajanja preskusa konstantne kakovosti. Obdelana voda se lahko pripravi z dodajanjem specifičnih količin reagentov priznane analitske čistosti deionizirani ali destilirani vodi. Primeri obdelane vode so prikazani v (1) (6) in Dodatku 2. Upoštevati je treba, da se pri preskušanju snovi, ki vsebujejo kovine, izogibamo medijem, ki vsebujejo znana kelatorska sredstva, kot sta medija M4 in M7 iz Dodatka 2. Vrednost pH mora biti v območju 6 do 9. Za Daphnia Magna se priporoča uporaba vode s trdoto med 140 in 250 mg/l (kot CaCO3), za druge vrste vodnih bolh pa so primernejše vode z manjšo trdoto. Vodo za redčenje lahko pred uporabo v preskusu prezračujemo, da koncentracija raztopljenega kisika doseže nasičenost.
Če uporabimo naravno vodo, moramo parametre kakovosti izmeriti najmanj dvakrat letno ali ko posumimo, da so se te značilnosti bistveno spremenile (glej prejšnji odstavek in Dodatek 1). Opraviti je treba tudi meritve težkih kovin (npr. Cu, Pb, Zn, Hg, Cd, Ni). Če uporabimo deklorirano vodovodno vodo, je zaželeno dnevno analiziranje vsebnosti klora. Če je voda za redčenje površinskega ali podzemnega izvora, moramo izmeriti prevodnost in skupni organski ogljik (TOC) ali kemijsko potrebo po kisiku (KPK).
1.7.4 Preskusne raztopine
Preskusne raztopine izbranih koncentracij se ponavadi pripravijo z redčenjem osnovne raztopine. Osnovne raztopine se po možnosti pripravijo z raztapljanjem preskusne snovi v vodi za redčenje. Kolikor je možno, se je treba izogniti uporabi topil, emulgatorjev ali disperzijskih sredstev. Vendar je uporaba teh spojin v nekaterih primerih neizogibna, da pripravimo ustrezno koncentrirano osnovno raztopino. Navodila za primerna topila, emulgatorje in disperzij ska sredstva so v (4). V vsakem primeru preskusna snov v preskusni raztopini ne sme preseči meje topnosti v vodi za redčenje.
Preskus je treba opraviti brez uravnavanja pH. Če pH ne ostane v območju 6–9, se lahko opravi drugi preskus z uravnanjem pH osnovne raztopine na pH vode za redčenje pred dodatkom preskusne snovi. To uravnavanje pH je treba opraviti tako, da se koncentracija v osnovni raztopini ne spremeni bistveno in da se ne povzroči nobena kemijska reakcija ali obarjanje preskusne snovi. Najboljše je uporabiti HCl in NaOH.
1.8 POSTOPEK
1.8.1 Pogoji izpostavitve
1.8.1.1 Preskusne in kontrolne skupine
Preskusne posode napolnimo z ustreznimi količinami vode za redčenje in raztopinami preskusne snovi. Razmerje zrak/voda v posodi mora biti enako v preskusni in kontrolni skupini. Vodne bolhe nato vnesemo v preskusne posode. Za vsako preskusno koncentracijo in za kontrole je treba uporabiti najmanj 20 živali, po možnosti razdeljene na štiri skupine po pet živali. Uporabiti je treba najmanj 2 ml preskusne raztopine na žival (t.j. količino 10 ml za pet vodnih bolh v preskusni posodi). Če koncentracija preskusa ni stabilna, se preskus lahko opravi s polstatičnim obnavljanjem ali pretočnim sistemom.
Poleg tretiranega niza se izvede kontrolni niz z vodo za redčenje in če je ustrezno tudi kontrolni niz, ki vsebuje sredstvo za raztapljanje.
1.8.1.2 Preskusne koncentracije
Razen če so na voljo podatki o toksičnosti preskusne snovi, se lahko opravi preskus za ugotavljanje območja, namenjen določanju območja koncentracij za dokončni preskus. V ta namen se vodne bolhe izpostavijo nizu s širokimi intervali koncentracij preskusne snovi. Pet vodnih bolh je treba izpostaviti vsaki preskusni koncentraciji 48 ur ali manj. Ponovitve niso obvezne. Obdobje izpostavitve se lahko skrajša (npr. 24 ur ali manj), če je možno pridobiti v krajšem času podatke, primerne namenu preskusa za ugotavljanje območja.
Uporabiti je treba najmanj pet preskusnih koncentracij. Urediti jih je treba v geometrijski vrsti z geometrijskim razmerjem, ki po možnosti ne presega 2,2. Če se uporabi manj kot pet koncentracij, je treba to utemeljiti. Najvišja preskušena koncentracija po možnosti povzroči 100-odstotno imobilizacijo, najnižja preskušena koncentracija pa nobenih opaznih učinkov.
1.8.1.3 Pogoji inkubacije
Temperatura mora biti v območju od 18 oC do 22 oC, vendar konstantna v mejah ± 1 oC pri vsakem preskusu. Priporočljiv je ciklus 16 ur svetlobe in 8 ur teme. Popolna tema je tudi sprejemljiva, zlasti če so preskusne snovi na svetlobi nestabilne.
Preskusne posode se ne smejo prezračevati med preskusom. Preskus se opravi brez uravnavanja pH. Med preskusom se vodne bolhe ne smejo hraniti.
1.8.1.4 Trajanje
Preskus traja 48 ur.
1.8.2 Pripombe
V vsaki preskusni posodi se ugotovijo imobilizirane vodne bolhe 24 in 48 ur po začetku preskusa, (glej oddelek 1.2 za opredelitve). Poleg imobiliziranosti se navede tudi vsako neobičajno vedenje ali neobičajni videz.
1.8.3 Analitske meritve
Raztopljeni kisik in pH se izmerita na začetku in koncu preskusa v kontroli(ah) in najvišji koncentraciji preskusne snovi. Koncentracija raztopljenega kisika v kontrolah mora biti skladna s merilom veljavnosti (glej oddelek 1.6). Vrednost pH v posameznem preskusu običajno ne sme variirati za več kot 1,5 enote. Temperatura se običajno meri v kontrolnih posodah ali v zraku prostora in se po možnosti neprekinjeno zapisuje med preskusom ali vsaj na začetku in koncu preskusa.
Koncentracije preskusne snovi je treba izmeriti najmanj v najvišji in najnižji preskusni koncentraciji na začetku in koncu preskusa (4). Priporoča se, da rezultati temeljijo na izmerjenih koncentracijah. Če pa so na voljo dokazi, da so se koncentracije preskusne snovi zadovoljivo zadrževale v območju ± 20 % nominalne ali izmerjene začetne koncentracije ves čas preskusa, lahko rezultati temeljijo na nominalnih ali izmerjenih začetnih vrednostih.
1.9 MEJNI PRESKUS
Z uporabo postopkov, opisanih v tej metodi, se lahko izvede mejni preskus s 100 mg/l preskusne snovi ali do meje topnosti v preskusnem mediju (pri čemer se uporabi nižja od obeh vrednosti) za dokaz, da je EC50 večji od te koncentracije. Mejni preskus je treba izvesti z 20 vodnimi bolhami (po možnosti razdeljenimi v štiri skupine po pet) in enakim številom v kontrolni(-h) skupini(-ah). Če se pojavi imobilizacija, je treba izvesti popolno študijo. Zapisati je treba vsako ugotovljeno neobičajno vedenje.
2. PODATKI
Podatke je treba povzeti v preglednici, ki za vsako tretirano skupino in kontrolo prikazuje število uporabljenih vodnih bolh in imobilizacijo pri vsakem opazovanju. Prikaže se odstotek imobiliziranih vodnih bolh po 24 urah in 48 urah glede na preskusne koncentracije. Podatki se analizirajo z ustreznimi statističnimi metodami (npr. verjetnostna analiza itn.), da se izračunajo naklon krivulj in EC50 z 9-odstotnimi mejami zaupanja (p = 0,05) (7) (8).
Kadar standardne metode izračuna EC50 niso primerne za pridobljene podatke, se za približek EC50 uporabita najvišja koncentracija, ki ni povzročila imobilizacije, in najnižja koncentracija, ki je povzročila 100-odstotno imobilizacijo (pri čemer je EC50 geometrijska sredina teh dveh koncentracij).
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje podatke:
Preskusna snov:
— fizikalno stanje in pomembne fizikalno-kemijske lastnosti,
— kemijski identifikacijski podatki, vključno s čistostjo.
Preskusna vrsta:
— izvor in vrsta vodnih bolh (Daphnia), izvorni dobavitelj (če je znan) in uporabljeni pogoji gojenja (vključno z izvorom, vrsto in količino hrane, pogostnostjo hranjenja).
Preskusni pogoji:
— opis preskusnih posod: vrsta posod, količina raztopine, število vodnih bolh na preskusno posodo, število preskusnih posod (ponovitev) na koncentracijo,
— metode priprave osnovnih in preskusnih raztopin, vključno z uporabo kakršnih koli topil ali disperzivnih sredstev, uporabljene koncentracije,
— podrobnosti o vodi za redčenje: izvor in kakovostne značilnosti vode (pH, trdota, razmerje Ca/Mg, razmerje Na/K, alkalnost, prevodnost itn); sestava obdelane vode, če je bila uporabljena,
— pogoji inkubacije: temperatura, intenzivnost in periodičnost svetlobe, raztopljeni kisik, pH itn.
Rezultati:
— število in odstotek vodnih bolh, ki so bile imobilizirane ali so kazale kakršne koli škodljive učinke (vključno z neobičajnim vedenjem) v kontrolnih skupinah in vsaki tretirani skupini v vsakem obdobju opazovanja in opis narave opaženih učinkov,
— rezultat in datum opravljenega preskusa z referenčno snovjo, če sta na voljo,
— nominalne preskusne koncentracije in rezultati vseh analiz za določevanje koncentracije preskusne snovi v preskusnih posodah; navesti je treba tudi analitski izkoristek metode in mejo zaznavnosti,
— vse fizikalno-kemijske meritve temperature, pH in koncentracije raztopljenega kisika med preskusom,
— EC50 po 48 h za imobilizacijo z intervali zaupanja in grafi prirejenih modelov, ki so bili uporabljeni pri izračunu teh vrednosti, nakloni krivulj odmerek-odziv in njihova standardna napaka; statistični postopki, uporabljeni za določevanje EC50 (te podatke je treba navesti tudi za imobilizacijo po 24 h, če je bila izmerjena),
— obrazložitev vsakega odstopanja od preskusne metode in morebitni vpliv odstopanja na rezultate preskusa.
4. VIRI
(1) ISO 6341. (1996). Water quality – Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) – Acute toxicity test. Third edition, 1996.
(2) EPA OPPTS 850.1010. (1996). Ecological Effects Test Guidelines – Aquatic Invertebrate Acute Toxicity Test, Freshwater Daphnids.
(3) Environment Canada. (1996) Biological test method. Acute Lethality Test Using Daphnia spp. EPS 1/RM/11. Environment Canada, Ottawa, Ontario, Canada.
(4) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publication. Series on Testing and Assessment. No. 23. Paris 2000.
(5) Commission of the European Communities. Study D8369. (1979). Inter-laboratory Test Programme concerning the study of the ecotoxicity of a chemical substance with respect to Daphnia.
(6) OECD Guidelines for the Testing of Chemicals. Guideline 211: Daphnia magna Reproduction Test, adopted September 1998.
(7) Stephan C.E. (1977). Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). ASTM STP 634 – American Society for Testing and Materials. Str. 65-84
(8) Finney D.J. (1978). Statistical Methods in Biological Assay. 3rd ed. London. Griffin, Weycombe, UK.
DODATEK 1
NEKATERE KEMIJSKE LASTNOSTI SPREJEMLJIVE VODE ZA REDČENJE
|
Snov |
Koncentracija |
|
Snov v delcih |
< 20 mg/l |
|
Skupni organski ogljik |
< 2 mg/l |
|
Neionizirani amoniak |
< 1 μg/l |
|
Rezidualni klor |
< 10 μg/l |
|
Skupni organofosforni pesticidi |
< 50 ng/l |
|
Skupni organoklorovi pesticidi s polikloriranimi bifenili |
< 50 ng/l |
|
Skupni organski klor |
< 25 ng/l |
DODATEK 2
PRIMERI PRIMERNE OBDELANE PRESKUSNE VODE
Preskusna voda ISO (1)
|
Osnovne raztopine (ena snov) |
Za pripravo obdelane vode se doda naslednje količine osnovnih raztopin v 1 litru vode (1) |
|
|
Snov |
Količina dodana v 1 liter vode (1) |
|
|
Kalcijev klorid CaCl2, 2H2O |
11,76 g |
25 ml |
|
Magnezijev sulfat MgSO4, 7H2O |
4,93 g |
25 ml |
|
Natrijev hidrogenkarbonat NaHCO3 |
2,59 g |
25 ml |
|
Kalijev klorid KCl |
0,23 g |
25 ml |
|
(1) Voda primerne čistosti, npr. deionizirana, destilirana ali pridobljena z vzvratno osmozo, ki ne presega 10 μS.cm-1. |
||
Medija Elendt M7 in M4
Aklimatizacija na medija Elendt M4 in M7
Nekateri laboratoriji so imeli težave pri neposrednem prenosu vodnih bolh v medija M4 in M7. Vendar so težavo z določenim uspehom rešili s postopno aklimatizacijo, t.j. prenašanjem iz lastnega medija v 30-odsotni medij Elendt, nato v 60-odstotni in nato v 100-odstotni medij Elendt. Aklimatizacijsko obdobje lahko traja do enega meseca.
Priprava
Ločene osnovne raztopine (I) posameznih elementov v sledeh se najprej pripravijo z vodo primerne čistosti, npr. deionizirano, destilirano ali pridobljeno z vzvratno osmozo. Iz teh različnih osnovnih raztopin (I) se pripravi druga osnovna raztopina (II), ki vsebuje vse elemente v sledeh (kombinirana raztopina), t.j.:
|
Osnovna(-e) raztopina(-e) I (ena snov) |
Količina, dodana vodi (mg/l) |
Koncentracija (glede na medij M4) |
Za pripravo kombinirane osnovne raztopine II se doda naslednje količine osnovne raztopine I vodi (ml/l) |
|
|
M4 |
M7 |
|||
|
H3 BO3 |
57 190 |
20 000-kratna |
1,0 |
0,25 |
|
MnCl2.4H2O |
7 210 |
20 000-kratna |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000-kratna |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000-kratna |
1,0 |
0,25 |
|
SrCl2.6H2O |
3 040 |
20 000-kratna |
1,0 |
0,25 |
|
NaBr |
320 |
20 000-kratna |
1,0 |
0,25 |
|
Na2 MoO4.2H2O |
1 230 |
20 000-kratna |
1,0 |
0,25 |
|
CuCl2.2H2O |
335 |
20 000-kratna |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000-kratna |
1,0 |
1,0 |
|
CoCl2.6H2O |
200 |
20 000-kratna |
1,0 |
1,0 |
|
KI |
65 |
20 000-kratna |
1,0 |
1,0 |
|
Na2 SeO3 |
43,8 |
20 000-kratna |
1,0 |
1,0 |
|
NH4 VO3 |
11,5 |
20 000-kratna |
1,0 |
1,0 |
|
Na2 EDTA.2H2O |
5 000 |
2 000-kratna |
— |
— |
|
FeSO4.7H2O |
1 991 |
2 000-kratna |
— |
— |
|
Raztopini Na2EDTA in FeSO4 se pripravita ločeno, zlijeta skupaj in nato nemudoma avtoklavirata. |
||||
|
Pri tem nastane: |
||||
|
Raztopina 2 l Fe-EDTA |
1 000-kratna |
20,0 |
5,0 |
|
Medija M4 in M7 se pripravita iz osnovne raztopine II, makrohranil in vitaminov po naslednjem postopku:
|
Količina, dodana vodi (mg/l) |
Koncentracija (glede na medij M4) |
Količina osnovne raztopine II, dodana za prip ravo medija (ml/l) |
||
|
M4 |
M7 |
|||
|
Osnovna raztopina II (kombinirani elementi v sledeh) |
20-kratna |
50 |
50 |
|
|
Osnovne raztopine makrohranil (ena snov) |
||||
|
CaCl2 · 2H20 |
293 800 |
1 000-kratna |
1,0 |
1,0 |
|
MgSO4 · 7H2O |
246 600 |
2 000-kratna |
0,5 |
0,5 |
|
KCl |
58 000 |
10 000-kratna |
0,1 |
0,1 |
|
NaHCO3 |
64 800 |
1 000-kratna |
1,0 |
1,0 |
|
Na2 SiO3 · 9H2O |
50 000 |
5 000-kratna |
0,2 |
0,2 |
|
NaNO3 |
2 740 |
10 000-kratna |
0,1 |
0,1 |
|
KH2 PO4 |
1 430 |
10 000-kratna |
0,1 |
0,1 |
|
K2HPO4 |
1 840 |
10 000-kratna |
0,1 |
0,1 |
|
Kombinirana osnova vitaminov |
— |
10 000-kratna |
0,1 |
0,1 |
|
Kombinirano osnovno raztopino vitaminov pripravimo z dodatkom treh vitaminov v 1 liter vode, kakor je prikazano spodaj: |
||||
|
Tiamin hidroklorid |
750 |
10 000-kratna |
||
|
Cianokobalamin (B12) |
10 |
10 000-kratna |
||
|
Biotin |
7,5 |
10 000-kratna |
||
Kombinirano osnovno raztopino vitaminov hranimo zamrznjeno v majhnih alikvotih. Vitamini se dodajo medijem neposredno pred uporabo.
|
Opomba |
: |
Da preprečimo obarjanje soli pri pripravi popolnega medija, dodajamo alikvote osnovnih raztopin v približno 500–800 ml deionizirane vode, ki jo dopolnimo do 1 litra. |
|
Opomba |
: |
Prvi opis medija M4 je objavljen v Elendt, B. P. (1990). Selenium deficiency in Crustacea; an ultrastructual approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25-33. |
C.3 SLADKOVODNE ALGE IN CIANOBAKTERIJE, PRESKUS ZAVIRANJA RASTI
1. METODA
Ta metoda je enakovredna OECD TG 201 (2006)(1).
1.1 UVOD
Preskusne metode se ob upoštevanju znanstvenega napredka redno spreminjajo in posodabljajo. Preskusno metodo C.3 je bilo treba spremeniti zaradi vključitve dodatnih vrst in izpolnitve zahtev za oceno nevarnosti in razvrstitev kemikalij. Spremembe so bile izvedene na podlagi izčrpnih praktičnih izkušenj, znanstvenega napredka na področju študij toksičnosti za alge in ob široki uporabi ustreznih predpisov od njenega prvotnega sprejetja.
1.2 POMEN IZRAZOV
Za namene preskusnih metod se uporabljajo naslednje opredelitve in okrajšave:
Biomasa: je suha teža žive snovi prisotne v populaciji, izražena v dani prostornini; npr. mg alg/liter preskusne raztopine. „Biomasa“ je običajno opredeljena kot masa, vendar se v tem preskusu ta beseda uporablja za označevanje mase na prostornino. V tem preskusu se običajno merijo tudi nadomestki za biomaso, kot so npr. število celic, fluorescenca itd., zato se izraz „biomasa“ uporablja tudi za meritve teh nadomestkov.
Koeficient variacije: je merilo variabilnosti parametra brez merila, opredeljeno kot razmerje med standardnim odstopanjem in povprečjem. Izraziti ga je mogoče tudi kot odstotno vrednost. Srednji koeficient variacije povprečne specifične stopnje rasti v ponovitvenih kontrolnih kulturah se računa tako, kot sledi:
1. Izračuna se KV v odstotkih povprečne specifične stopnje rasti na dan/po posamičnih delih za vsakokratno ponovitev.
2. Izračuna se srednja vrednost vseh izračunanih vrednosti v točki 1, da se pridobi srednji koeficient variacije specifične stopnje rasti na dan/po posamičnih delih v ponovitvenih kontrolnih kulturah.
ECx : je koncentracija preskusne snovi, raztopljene v preskusnem mediju, katere rezultat je x % (npr. 50 %) zmanjšanje rasti preskusnega organizma v ustreznem obdobju izpostavljenosti (navesti v primeru odstopanja od polnega ali običajnega trajanja preskusa). Za nedvoumno označitev vrednosti EC, pridobljene iz stopnje rasti ali prirasta, se uporabljata simbola „ErC“ ali „EyC“.
Rastno gojišče: je povsem sintetično gojišče, v katerem rastejo preskusne alge med izpostavljenostjo preskusni snovi. Preskusne snovi se običajno raztopijo v preskusnem mediju.
Stopnja rasti (povprečna specifična stopnja rasti): je logaritemsko povečanje biomase v času izpostavljenosti.
Koncentracija z najnižjim opaznim učinkom (LOEC): je najnižja preskušena koncentracija, pri kateri se ugotovi statistično pomemben učinek snovi na zmanjšanje rasti (pri p < 0,05) v primerjavi s kontrolnim vzorcem v ustreznem času izpostavljenosti. Vendar pa morajo imeti vse preskusne koncentracije nad LOEC škodljiv učinek, ki je enak ali večji od učinka, opazovanega pri LOEC. Če teh dveh pogojev ni mogoče izpolniti, je treba izčrpno razložiti, na kak način je bila izbrana LOEC (in ne NOEC).
Koncentracija brez opaznega učinka (NOEC): je preskusna koncentracija tik pod LOEC.
Odvisna spremenljivka: je spremenljivka za ocenitev toksičnosti, izpeljana iz katerih koli izmerjenih parametrov, ki opisujejo biomaso z drugačno računsko metodo. Za to metodo sta stopnja rasti in prirasta odvisni spremenljivki, neposredno izpeljani iz izmerjene biomase ali katerega koli omenjenega nadomestka.
Specifična stopnja rasti: je odvisna spremenljivka, opredeljena kot količnik razlike naravnih logaritmov opazovanega parametra (v tej preskusni metodi je to biomasa) in upoštevanega časovnega obdobja.
Prirast: je vrednost izmerjene spremenljivke ob koncu obdobja izpostavljenosti manj vrednost izmerjene spremenljivke ob začetku obdobja izpostavljenosti, s katero se izrazi povečanje biomase med preskusom.
1.3 UPORABA PRESKUSA
Ta preskusna metoda se najlažje uporabi pri vodotopnih snoveh, za katere je verjetno, da bodo v pogojih preskusa ostale v vodi. Za preskušanje snovi, ki so hlapne, močno adsorptivne, obarvane in slabo topne v vodi, ali snovi, ki lahko vplivajo na razpoložljivost hranilnih snovi ali mineralov v preskusnem mediju, so morda potrebne nekatere prilagoditve opisanega postopka (npr. zaprt sistem ali hlajenje preskusnih posod). Navodila za nekaj primernih prilagoditev so navedena v (2), (3) in (4).
1.4 PRINCIP PRESKUSA
Namen tega preskusa je določiti učinke snovi na rast sladkovodnih mikroalg in/ali cianobakterij. Preskusni organizmi v eksponentni fazi rasti se v šaržnih kulturah izpostavijo preskusni snovi ponavadi za 72 ur. Kljub relativno kratkemu trajanju preskusa je mogoče oceniti učinke na več generacijah.
Odziv sistema je zmanjšanje rasti pri vrsti kultur alg (preskusnih enot), ki so izpostavljene različnim koncentracijam preskusne snovi. Odziv je ocenjen v odvisnosti od koncentracije izpostavljenosti v primerjavi s povprečno rastjo ponovitvenih, neizpostavljenih kontrolnih kultur. Za popolno izražanje odziva sistema na toksične učinke (optimalna občutljivost) se kulturam za merjenje zmanjšanja specifične stopnje rasti omogoči neomejena eksponentna rast pod zadostnimi prehranskimi pogoji ter stalno svetlobo v zadostnem časovnem obdobju.
Rast in zaviranje rasti sta določena z meritvami biomase alg v odvisnosti od časa. Biomasa alg je opredeljena kot suha teža na prostornino, npr. mg alg/liter preskusne raztopine. Vendar je suho težo težko meriti, zato se uporabljajo nadomestni parametri. Od teh nadomestkov se najpogosteje uporablja število celic. Drugi nadomestni parametri vključujejo prostornino celic, fluorescenco, optično gostoto itn. Pretvorni faktor med izmerjenim nadomestnim parametrom in biomaso mora biti znan.
Končna točka preskusa je zaviranje rasti, izraženo kot logaritmično povečanje biomase (povprečne specifične stopnje rasti) med obdobjem izpostavljenosti. Iz povprečnih specifičnih stopenj rasti, zabeleženih v vrsti preskusnih raztopin, je koncentracija, ki doseže določeno zaviranje rasti x % (npr. 50 %), določena in izražena kot ErCx (npr. ErC50).
Za rabo te metode v zakonodajnem okviru EU bi morali za izračun rezultatov uporabiti povprečno specifično hitrost rasti iz razlogov, opisanih v oddelku 2.2 spodaj. Dodatna odvisna spremenljivka, ki se uporablja za to preskusno metodo, je prirastek, ki je lahko potreben za izpolnitev zakonodajnih zahtev v nekaterih državah. Opredeljen je kot biomasa na koncu obdobja izpostavljenosti manj biomasa na začetku obdobja izpostavljenosti. Iz prirastka, zabeleženega v vrsti preskusnih raztopin, se koncentracija, ki doseže določeno zaviranje prirastka x % (npr. 50 %), izračuna in izrazi kot EyCx (npr. EyC50).
Zraven tega je mogoče statistično določiti koncentracijo z najnižjim opaznim učinkom (LOEC) in koncentracijo brez opaznega učinka (NOEC).
1.5 PODATKI O PRESKUSNI SNOVI
Podatki o preskusni snovi, ki so lahko uporabni pri vzpostavitvi preskusnih pogojev, vključujejo strukturno formulo, stopnjo čistosti, stabilnost na svetlobi, stabilnost pod pogoji preskusa, lastnosti absorpcije svetlobe, pKa in rezultate raziskav o preoblikovanju, vključno z biološko razgradljivostjo v vodi.
Topnost v vodi, porazdelitveni koeficient oktanol/voda (Pov) in parni tlak preskusne snovi morajo biti znani, razpoložljiva pa mora biti tudi validirana metoda za količinsko opredelitev snovi v preskusnih raztopinah skupaj z navedeno rekuperacijo in mejo zaznavnosti.
1.6 REFERENČNA SNOV
Referenčna snov/referenčne snovi, kot je na primer 3,5-diklorofenol, ki se uporablja za mednarodni prstanasti preskus (4), se lahko preskusi kot sredstvo preskušanja preskusnega postopka. Kot referenčna snov za zelene alge se prav tako lahko uporabi kalijev dikromat. Referenčno snov je zaželeno preskusiti vsaj dvakrat letno.
1.7 VELJAVNOST PRESKUSA
Za veljavnost preskusa morajo biti izpolnjena naslednja izvedbena merila:
— Biomasa v kontrolnih kulturah se mora v 72 urah preskusnega obdobja eksponentno povečati za faktor najmanj 16. To ustreza specifični stopnji rasti v 0,92 dneva1. Za najpogosteje uporabljene vrste je stopnja rasti ponavadi bistveno višja (glej Dodatek 1). Merilo ni izpolnjeno, kadar se uporabijo vrste, ki rastejo počasneje od tistih, ki so navedene v Dodatku 1. V tem primeru se mora preskusno obdobje podaljšati, da se zagotovi 16-kratna rast v kontrolnih kulturah, medtem ko mora biti rast eksponentna skozi celotno preskusno obdobje. Preskusno obdobje se lahko skrajša za najmanj 48 ur za ohranitev neomejene eksponentne rasti med preskusom, dokler je dosežen minimalni množitelj 16.
— Povprečni koeficient variacije za posamične specifične stopnje rasti (dnevi 0–1, 1–2 in 2–3, za 72-urne preskuse) v kontrolnih kulturah (glej poglavje 1.2 v „koeficient variacije“) ne sme prekoračiti 35 %. Za računanje posamičnih specifičnih stopenj rasti glej drugi odstavek v poglavju 2.2.1. Merilo se uporablja za povprečno vrednost koeficientov variacije, izračunanih za ponovitvene kontrolne kulture.
— Koeficient variacije za povprečne specifične stopnje rasti med celotnim preskusnim obdobjem v ponovitvenih kontrolnih kulturah ne sme prekoračiti 7 % v preskusih z zelenimi algami Pseudokirchneriella subcapitata in Desmodesmus subspicatus. Za druge manj pogosto preskušene vrste vrednost ne sme prekoračiti 10 %.
1.8 OPIS METODE
1.8.1 Aparatura
Preskusne posode in drugi aparature, ki pridejo v stik s preskusnimi raztopinami, morajo biti v celoti iz stekla ali drugega kemijsko inertnega materiala. Predmete je treba temeljito umiti, da organski ali anorganski onesnaževalci ne ovirajo rasti alg ali sestave preskusnih raztopin.
Preskusne posode so ponavadi steklene bučke z dimenzijami, ki dopuščajo zadostno prostornino kulture za meritve med preskusom in zadosten prenos mase CO2 iz ozračja (glej drugi odstavek v poglavju 1.8.9). Količina tekočine mora biti zadostna za analitsko določanje (glej peti odstavek v poglavju 1.8.11).
Potrebna je tudi nekatera ali vsa oprema v nadaljevanju:
— Inkubator za kultiviranje: priporoča se omara ali soba, v kateri se lahko izbrana temperatura inkubacije vzdržuje na ± 2 °C.
— Naprave za merjenje svetlobe: treba je poudariti, da bo metoda za merjenje jakosti svetlobe in še zlasti vrsta sprejemnika (odjemnika) vplivala na izmerjeno vrednost. Meritve naj se po možnosti izvajajo z uporabo okroglega (4 π) sprejemnika (ki reagira na neposredno in odbito svetlobo iz vseh kotov nad in pod ravnino meritve) ali sprejemnika 2 π (ki reagira na svetlobo iz vseh kotov nad ravnino meritve).
— Aparatura za določanje biomase alg: število celic, ki je najpogosteje uporabljen nadomestni parameter za biomaso alg, se lahko izvede z uporabo elektronskega števca delcev, mikroskopa s števno komoro ali pretočnega citometra. Za merjenje drugih nadomestkov biomase se lahko uporabljajo pretočni citometer, fluorimeter, spektrofotometer ali kolorimeter. Pretvorni faktor, ki povezuje število celic s suho težo, je koristen za preračunavanje. Zaradi zagotovitve uporabnih meritev pri nizkih koncentracijah biomase, ko se uporablja spektrofotometer, je morda treba uporabiti kivete s svetlobno potjo vsaj 4 cm.
1.8.2 Preskusni organizmi
Uporabi se lahko nekaj vrst nepritrjenih mikroalg in cianobakterij. Sevi, navedeni v Dodatku 1, so se izkazali kot primerni za uporabo preskusnega postopka, določenega v tej preskusni metodi.
Pri uporabi drugih vrst je treba poročati o sevu in/ali izvoru. Treba je potrditi, da se lahko eksponentna rast izbrane preskusne alge ohrani skozi celotno preskusno obdobje pod prevladujočimi pogoji.
1.8.3 Rastno gojišče
Priporočata se dve alternativni rastni gojišči; gojišče OECD in gojišče AAP. Sestave teh gojišč so prikazane v Dodatku 2. Začetna pH vrednost ter kapaciteta pufrov (ki ureja porast pH) sta v teh dveh gojiščih različni. Zato so rezultati preskusov lahko različni, odvisno od uporabljenega gojišča, še posebno pri preskušanju ionizirajočih snovi.
Morda bo za nekatere namene, npr. pri preskušanju kovin in kelatnih reagentov ali pri preskušanju pri različnih pH vrednostih, treba prilagoditi rastno gojišče. Uporaba prilagojenega gojišča mora biti podrobno opisana in utemeljena (3)(4).
1.8.4 Začetna koncentracija biomase
Začetna biomasa v preskusnih kulturah mora biti enaka v vseh preskusnih kulturah in zadostno nizka, da dopušča eksponentno rast skozi celotno inkubacijsko obdobje brez tveganja izčrpanja hranilnih snovi. Začetna biomasa kot suha snov ne sme prekoračiti 0,5 mg/l. Priporočene so naslednje začetne koncentracije celic:
|
Pseudokirchneriella subcapitata: |
5 × 103–104 |
celic/ml |
|
Desmodesmus subspicatus |
2–5 × 103 |
celic/ml |
|
Navicula pelliculosa |
104 |
celic/ml |
|
Anabaena flos-aquae |
104 |
celic/ml |
|
Synechococcus leopoliensis |
5 × 104–105 |
celic/ml |
1.8.5 Koncentracija preskusne snovi
Območje koncentracije, v katerem se lahko pojavijo učinki, je lahko določeno na osnovi rezultatov iz preskusov za ugotavljanje območja. Za zadnji dokončni preskus naj se izbere najmanj pet koncentracij, razvrščenih v geometrijskih vrstah s faktorjem, ki ne presega 3,2. Za preskusno snov, ki kaže ravno krivuljo odziva koncentracije, je lahko določen višji faktor. Serije koncentracij naj po možnosti pokrivajo območje, ki povzroča 5–75-odstotno zaviranje stopnje rasti alg.
1.8.6 Ponovitve in kontrolni vzorci
Načrt preskusa mora vključevati tri ponovitve za vsako preskusno koncentracijo. Če ni zahtevana določitev NOEC, se lahko načrt preskusa prilagodi, da se poveča število koncentracij in zmanjša število ponovitev na koncentracijo. Izvedejo se najmanj tri kontrolne ponovitve, v idealnih razmerah pa naj se uporabi dvakratno število ponovitev za vsako preskusno koncentracijo.
Za analitsko določanje koncentracij preskusne snovi se lahko pripravi ločena serija preskusnih raztopin (glej četrti in šesti odstavek v poglavju 1.8.11).
Kadar se za raztapljanje preskusne snovi uporabi topilo, morajo biti v preskusni načrt vključene dodatne kontrolne kulture, ki vsebujejo topilo pri enaki koncentraciji, kot je bila uporabljena pri preskusnih kulturah.
1.8.7 Priprava kulture inokuluma
Kultura inokuluma se pripravi v preskusnem mediju 2–4 dni pred začetkom preskusa zaradi prilagoditve preskusnih alg preskusnim pogojem in zagotovitve, da so alge v eksponentni fazi rasti, ko se uporabijo za inokulacijo preskusnih raztopin. Algalno biomaso je treba prilagoditi, da lahko eksponentna rast do začetka preskusa prevlada v kulturi inokuluma. Kultura inokuluma se inkubira pod enakimi pogoji kot preskusne kulture. V kulturi inokuluma se meri porast biomase, da se zagotovi rast znotraj normalnega obsega za preskusni sev pod pogoji kultiviranja. Primer postopka za kultiviranje alg je opisan v Dodatku 3. Da ne pride do sinhrone delitve celic med preskusom, se lahko zahteva še drugi ukrep razmnoževanja kulture inokuluma.
1.8.8 Priprava preskusne raztopine
Vse preskusne raztopine morajo vsebovati enake koncentracije rastnih gojišč in začetno biomaso preskusnih alg. Preskusne raztopine izbranih koncentracij se ponavadi pripravijo z mešanjem osnovne raztopine preskusne snovi z rastnim gojiščem in kulturo inokuluma. Osnovne raztopine se ponavadi pripravijo tako, da se snov raztopi v preskusnem mediju.
Topila, npr. aceton, t-butil alkohol in dimetilformamid, se lahko uporabljajo kot nosilci za dodajanje snovi z nizko topnostjo v vodi preskusnemu mediju (2)(3). Koncentracija topila naj ne prekorači 100 μl/l in enaka koncentracija topila naj bo dodana vsem kulturam (tudi kontrolnim) v seriji preskusov.
1.8.9 Inkubacija
Preskusne posode se zaprejo z zamaški, ki prepuščajo zrak. Posode se pretresejo in postavijo v inkubator za kultiviranje. Med preskusom je potrebno imeti alge v suspenziji in omogočiti prenos CO2. V ta namen je potrebno nenehno tresenje ali mešanje. Kulture naj se ohranjajo pri temperaturi obsega 21 do 24 °C, kontrolirani pri ± 2 °C. Za vrste, razen naštetih v Dodatku 1, npr. tropske vrste, so lahko primerne višje temperature, pod pogojem, da so lahko izpolnjena merila za veljavnost. Priporočeno je, da se bučke v inkubatorju naključno razporedi in dnevno prestavlja.
Vrednost pH kontrolnega medija naj se med preskusom ne poveča za več kot 1,5. Za kovine in spojine, ki delno ionizirajo pri pH okrog preskusne pH, je morda treba omejiti premik (drift) pH, da se zagotovijo ponovljivi in natančni rezultati. Premik za < 0,5 pH enot je tehnično izvedljiv in se lahko doseže tako, da se v preskusni raztopini zagotovi primerna stopnja prenosa mase CO2 iz okoliškega zraka, npr. s povečanjem stopnje tresenja. Druga možnost je zmanjšanje potrebe po CO2 z zmanjšanjem začetne biomase ali skrajšanjem trajanja preskusa.
Površina, na kateri so kulture inkubirane, naj prejema stalno, enotno fluorescentno osvetljenost, npr. „hladno belo“ svetlobo ali „dnevno svetlobo“. Sevi alg in cianobakterij se razlikujejo glede svojih zahtev po svetlobi. Izbrana jakost svetlobe naj ustreza uporabljenemu preskusnemu organizmu. Za priporočene vrst zelenih alg se na stopnji preskusnih raztopin izbere jakost svetlobe od 60 do 120 μE·m–2·s–1, kadar se meri v fotosintetično učinkovitem obsegu valovne dolžine 400–700 nm z uporabo primernega sprejemnika. Nekatere vrste, zlasti Anabaena flos-aquae, dobro rastejo pri nižjih jakostih svetlobe in se pri visokih jakostih lahko poškodujejo. Za takšne vrste naj bo izbrana povprečna jakost svetlobe v obsegu 40–60 μE·m–2·s–1. (Pri merilnikih svetlobe, umerjenih v luksih, enakovredno območje 4 440–8 880 lux za hladno belo svetlobo približno ustreza priporočeni jakosti svetlobe 60–120μE·m–2·s–1.) Jakost svetlobe v inkubacijskem območju ne odstopa od povprečne jakosti svetlobe za več kot ± 15 %.
1.8.10 Trajanje preskusa
Preskus ponavadi traja 72 ur. Preskus lahko traja tudi več ali manj časa, pod pogojem da so izpolnjena vsa merila za veljavnost, navedena v poglavju 1.7.
1.8.11 Merjenje in analitsko določanje
Biomasa alg v vsaki bučki se med preskusnim obdobjem določa najmanj enkrat dnevno. Če se merjenje izvaja na majhnih količinah, vzetih iz preskusne raztopine s pipeto, je treba te ohranjati nespremenjene.
Merjenje biomase se izvaja z ročnim štetjem celic s pomočjo mikroskopa ali z elektronskim števcem delcev (s štetjem celic in/ali biovolumnom). Alternativne tehnike, npr. pretočna citometrija, klorofilna fluorescenca in vitro ali in vivo (6)(7) ali optična gostota, se lahko uporabljajo pod pogojem, da je mogoče v območju biomase v preskusu ugotoviti zadovoljivo povezavo z biomaso.
Vrednost pH raztopin se izmeri na začetku in koncu preskusa.
Če je na voljo analitski postopek za določanje preskusne snovi v uporabljenem območju koncentracije, je treba preskusne raztopine analizirati, da se preverijo začetne koncentracije in vzdrževanje koncentracij izpostavljenosti med preskusom.
Analiza koncentracije preskusne snovi na začetku in koncu preskusa nizke in visoke preskusne koncentracije in koncentracija okrog pričakovane EC50 sta lahko zadostni, kadar je verjetno, da se bodo koncentracije izpostavljenosti med preskusom razlikovale za manj kot 20 % od nominalnih vrednosti. Analiza vseh preskusnih koncentracij na začetku in koncu preskusa se priporoča, kadar je malo verjetno, da bodo koncentracije ostale znotraj 80–120 % nominalne vrednosti. Za hlapne, neobstojne ali močno adsorptivne preskusne snovi se priporoča dodatno vzorčenje za analizo v 24-urnih intervalih med obdobjem izpostavljenosti, da se bolje določijo izgube preskusne snovi. Za te snovi so potrebne posebne ponovitve. V vseh primerih je treba izvesti določanje koncentracije preskusne snovi samo na eni ponovitveni posodi pri vsaki preskusni koncentraciji (ali na vsebnostih posod, zbranih s ponovitvijo).
Preskusni medij, pripravljen posebej za analizo koncentracij izpostavljenosti med preskusom, naj se obravnavajo enako kot tisti, uporabljeni za preskušanje; npr. naj se inokulirajo z algami in inkubirajo pod enakimi pogoji. Če se zahteva analiza raztopljene koncentracije preskusne snovi, je morda treba ločiti alge od medija. Najboljše je, da se ločitev izvede s centrifugiranjem z nizkim pospeškom g, ki zadošča, da se alge usedejo.
Če obstajajo dokazi, da se je koncentracija preskušane snovi zadovoljivo ohranila znotraj ± 20 % nominalne ali izmerjene začetne koncentracije skozi celoten preskus, se analiza rezultatov lahko utemelji na nominalnih ali izmerjenih začetnih vrednostih. Če je odstopanje od nominalne ali izmerjene začetne koncentracije večje od ± 20 %, se analiza rezultatov utemelji na geometrijski povprečni koncentraciji med izpostavljenostjo ali na modelih, ki opisujejo upad koncentracije preskusne snovi (3)(8).
Preskus zaviranja rasti alge je bolj dinamičen preskusni sistem od večine drugih kratkoročnih preskusov toksičnosti za vodno okolje. Posledično je morda težko določiti dejanske koncentracije izpostavljenosti, še posebno za adsorptivne snovi, preskušene pri nizkih koncentracijah. Izginevanje snovi iz raztopine z adsorpcijo v naraščajočo biomaso alg v takih primerih ne pomeni, da se je snov izgubila iz preskusnega sistema. Ko je rezultat preskusa analiziran, je treba preveriti preveriti, ali upadanje v koncentraciji preskusne snovi med preskusom spremlja upadanje v zaviranju rasti. Če je tako, se lahko preuči uporaba primernega modela, ki opisuje upadanje koncentracije v preskusni snovi (8). Če ne, je morda primerno utemeljiti analizo rezultatov na začetnih (nominalnih ali izmerjenih) koncentracijah.
1.8.12 Druga opazovanja
Izvesti je treba mikroskopsko opazovanje, da se preveri normalna in zdrava navzočnost kulture inokuluma in opazuje vsako nenormalno pojavljanje alg (ki ga lahko povzroči izpostavljenost preskusni snovi) na koncu preskusa.
1.8.13 Mejni preskus
V nekaterih okoliščinah, npr. kadar predhodni preskus pokaže, da preskusna snov nima toksičnih učinkov pri koncentracijah do 100 mg·l–1 ali do svoje meje topnosti v preskusnem mediju (karkoli je nižje), se lahko izvede mejni preskus, ki vključuje primerjavo odzivov v kontrolni skupini in eni tretirani skupini (100 mg·l–1 ali koncentracija, ki je enaka meji topnosti). Zelo se priporoča, da je mejni preskus podprt z analizo koncentracije izpostavljenosti. Za mejni preskus se uporabljajo vsi prej opisani preskusni pogoji in merila za veljavnost, razen da je število tretiranih ponovitev najmanj šest. Odvisne spremenljivke v kontrolni in tretirani skupini se lahko analizirajo z uporabo statističnega testa za primerjavo načinov, npr. s študentskim t-preskusom. Če so variance obeh skupin neenake, je treba izvesti t-preskus, prilagojen za neenake variance.
1.8.14 Sprememba za močno barvane snovi
Obsevanje (jakost svetlobe) bi moralo biti na zgornjem koncu območja predvidenega s to preskusno metodo: 120μE m-2 s-1 ali več.
Svetlobna pot bi morala biti zmanjšana z zmanjšanjem količine preskusnih raztopin (v območje od 5 do 25 ml).
Primerno mešanje (na primer z zmernim stresanjem) bi moralo biti zagotovljeno za večjo pogostost izpostavitve alge večjim obsevanjem na površini kulture.
2. PODATKI
2.1 IZRIS RASTNIH KRIVULJ
Biomasa v preskusnih posodah je lahko izražena v enotah nadomestnega parametra, uporabljenega za merjenje (npr. število celic, fluorescenca).
V tabeli se predstavi ocenjena koncentracijo biomase v preskusnih kulturah in kontrolnih skupinah skupaj s koncentracijami preskusnega materiala in časom meritev, zabeleženim z ločljivostjo vsaj celih ur, da se izdela izris rastnih krivulj. Na tej stopnji so lahko uporabne tako logaritmične kot linearne lestvice, vendar so logaritmične lestvice obvezne in na splošno podajo boljšo predstavitev variacij od rastnega vzorca med preskusnim obdobjem. Eksponentna rast pri izrisu na logaritmični lestvici kaže ravno črto in naklonjenost črte (nagib) prikazuje specifično stopnjo rasti.
Z uporabo izrisov se preveri, ali kontrolne kulture skozi celotni preskus rastejo eksponentno glede na pričakovano stopnjo. Zaradi možnih napak se preverijo vse podatkovne točke in videz grafov ter neobdelani podatki in postopki. Zlasti se preverijo vse podatkovne točke, za katere se zdi, da odstopajo zaradi sistematične napake. Če je mogoče postopkovne napake očitno prepoznati in/ali so zelo verjetne, se specifična podatkovna točka označi kot izločena in se ne vključi v kasnejšo statistično analizo. (Koncentracija alg nič v eni od dveh ali treh ponovitvenih posod lahko pokaže, da posoda ni bila pravilno inokulirana ali da je bila neprimerno očiščena.) Razlogi za zavrnitev podatkovnih točk kot izločenih morajo biti jasno navedeni v poročilu o preskusu. Veljavni razlogi so samo (redko) postopkovne napake in ne le slaba natančnost. Statistični postopki za prepoznavanje izločitve imajo za to vrsto problema omejeno uporabnost in ne morejo nadomestiti strokovne presoje. Izločitve (označene kot take) naj se po možnosti ohranijo med podatkovnimi točkami, ki so prikazane v katerikoli grafični ali tabelarni predstavitvi podatkov.
2.2 ODVISNA SPREMENLJIVKA
Namen preskusa je določiti učinke preskusne snovi na rast alg. Ta preskusna metoda opisuje dve odvisni spremenljivki, ker imajo države članice različne preference in zakonodajne potrebe. Da bi bili preskusni rezultati sprejemljivi v vseh državah članicah, se morajo rezultati ovrednotiti z uporabo obeh odvisnih spremenljivk (a) in (b), ki sta:
(a) povprečna specifična stopnja rasti: ta odvisna spremenljivka se preračuna na osnovi logaritmičnega naraščanja biomase med preskusnim obdobjem, ki je dnevno izražen;
(b) prirast: ta odvisna spremenljivka je biomasa na koncu preskusa manj začetna biomasa.
Za rabo te metode v zakonodajnem okviru EU bi morali za izračun rezultatov uporabiti povprečno specifično hitrost rasti iz razlogov, ki so opisani spodaj. Treba je opozoriti, da toksične vrednosti, preračunane z uporabo teh dveh odvisnih spremenljivk, niso primerljive, in ta razlika mora biti priznana pri uporabi rezultatov preskusa. Vrednosti ECx, ki temeljijo na povprečni specifični stopnji rasti (ErCx), bodo na splošno višje kot rezultati, ki temeljijo na prirastu (EyCx), če se zaradi matematične osnove zadevnih pristopov upoštevajo preskusni pogoji te preskusne metode. To se ne razlaga kot razlika v občutljivosti med obema odvisnima spremenljivkama, preprosto zato ker so vrednosti matematično različne. Koncept povprečne specifične stopnje rasti temelji na splošnem eksponentnem rastnem vzorcu alg v neomejenih kulturah, kjer je toksičnost ocenjena na osnovi učinkov na stopnjo rasti in ni odvisna od absolutne vrednosti specifične kontrolne stopnje rasti, naklona krivulje koncentracija-odziv ali trajanja preskusa. Nasprotno so rezultati, ki temeljijo na odvisni spremenljivki prirasta, odvisni od vseh teh drugih spremenljivk. EyCx je odvisna od specifične stopnje rasti vrst alg, uporabljenih v vsakem preskusu, in od maksimalne specifične stopnje rasti, ki je lahko različna glede na vrsto in celo glede na seve alg. Ta odvisna spremenljivka se ne uporablja za primerjanje občutljivosti na toksične snovi med vrstami alg ali celo različnimi sevi. Medtem ko ima uporaba povprečne specifične stopnje rasti v znanosti prednost pri ocenjevanju toksičnosti, pa so v to preskusno metodo vključene tudi ocene toksičnosti, ki temeljijo na prirastu, da se zadovolji trenutnim pravnim predpisom v nekaterih državah.
2.2.1 Povprečna stopnja rasti
Povprečna specifična stopnja rasti za določeno obdobje se izračuna kot logaritmično povečanje biomase za vsako posamezno posodo kontrolnih in tretiranih skupin iz enačbe:

kjer je:
|
μ i–j : |
povprečna specifična stopnja rasti od časa i do j; |
|
X i : |
biomasa v času i; |
|
X j : |
biomasa v času j. |
Srednja vrednost stopnje rasti skupaj z ocenami razhajanj se izračuna za vsako tretirano skupino in kontrolno skupino.
Povprečna specifična stopnja rasti se izračuna za celotno preskusno obdobje (ponavadi dnevi 0–3) z uporabo nominalno inokulirane biomase kot začetne vrednosti raje kot izmerjene začetne vrednosti, saj je v tem primeru dosežena večja natančnost. Če oprema za merjenje biomase dopušča zadovoljivo natančno določanje nizke biomase inokuluma (npr. pretočni citometer), potem se lahko uporabi začetna izmerjena koncentracija biomase. Prav tako se ocenijo posamične stopnje rasti, izračunane kot specifične stopnje rasti za vsak dan med potekom preskusa (dnevi 0–1, 1–2 in 2–3) in pregleda se, ali kontrolna stopnja rasti ostaja konstantna (glej merila za veljavnost, poglavje 1.7). Znatno nižja specifična stopnja rasti prvega dne od celotne povprečne specifične stopnje rasti lahko nakazuje fazo prilagajanja. Medtem ko je lahko faza prilagajanja v kontrolnih skupinah s pravilnim razmnoževanjem predkultur zmanjšana in praktično izničena, lahko faza prilagajanja v izpostavljenih kulturah nakazuje obnovitev po začetnem toksičnem stresu ali zmanjšani izpostavljenosti zaradi izgube preskusne snovi (vključno s sorpcijo na biomaso alg) po začetni izpostavljenosti. Zaradi tega se lahko oceni posamična stopnja rasti, da se ocenijo učinki preskusne snovi, ki se pojavi med obdobjem izpostavljenosti. Bistvene razlike med posamično stopnjo rasti in povprečno stopnjo rasti nakazujejo odklon od konstantne eksponentne rasti in da je zagotovljena natančna preiskava rastnih krivulj.
Odstotek zaviranja stopnje rasti za vsako tretirano ponovitev se izračuna po enačbi:
![]()
kjer je:
|
% Ir: |
odstotek zaviranja v povprečni specifični stopnji rasti |
|
μC: |
srednja vrednost za povprečno specifično stopnjo rasti (μ) v kontrolni skupini; |
|
μT: |
povprečna specifična stopnja rasti za tretirano ponovitev. |
Če se za pripravo preskusnih raztopin uporabijo topila, naj se pri izračunu odstotka zaviranja raje kot kontrole brez topil uporabi kontrole topil.
2.2.2 Prirast
Prirast se računa kot biomasa ob koncu preskusa manj začetna biomasa za vsako posodo kontrolnega in tretiranega vzorca. Za vsako preskusno koncentracijo in kontrolni vzorec se izračuna srednja vrednost prirasta z ocenjeno varianco. Odstotek zaviranja v prirastu (% Iy) se lahko izračuna za vsako tretirano ponovitev po enačbi:
![]()
kjer je:
|
% Iy: |
odstotek zaviranja prirasta |
|
YC: |
srednja vrednost prirasta v kontrolni skupini |
|
YT: |
vrednost prirasta za tretirano ponovitev. |
2.3 IZRIS KRIVULJE ODZIVA KONCENTRACIJE
Izriše se odstotek zaviranja glede na logaritem koncentracije preskusne snovi in se natančno pregleda izris, pri čemer se ne upošteva vsaka takšna podatkovna točka, ki je bila izločena v prvi fazi. Skozi podatkovne točke se potegne ravna črta, in sicer ročno ali z računalniško interpolacijo, da se dobi prvi vtis o razmerju odziv-koncentracija, nato se nadaljuje z bolj podrobno metodo, po možnosti z računalniško statistično metodo. Odvisno od predvidene uporabe podatkov, kvalitete (natančnosti) in količine podatkov, kot tudi razpoložljivosti orodij za analizo podatkov, se lahko odloči (in včasih povsem upravičeno), da se ustavi analiza podatkov na tej stopnji in se preprosto prebere ključne vrednosti EC50 in EC10 (in/ali EC20) iz ročno narisane krivulje (glej tudi spodnje poglavje o spodbujevalnih učinkih). Utemeljeni razlogi za neuporabo statistične metode lahko vključujejo:
— Podatki niso primerni za računalniške metode, saj le-te ne izdelajo nobenih bolj zanesljivih rezultatov, kot jih lahko pridobi strokovna presoja – nekateri računalniški programi v takšnih situacijah celo ne morejo izdelati zanesljive rešitve (ponovitve se ne združujejo itd.).
— Spodbujevalni odzivi rasti se z uporabo razpoložljivih računalniških programov ne morejo ustrezno obravnavati (glej spodaj).
2.4 STATISTIČNI POSTOPKI
Cilj je pridobiti kvantitativno razmerje koncentracija-odziv z uporabo regresijske analize. Lahko se uporabi tehtana linearna regresija, po tem ko se izvede linearizacijska pretvorba podatkov o odzivu – na primer v verjetnostnih ali logaritmičnih ali Weibullovih enotah (9), vendar so nelinearni regresijski postopki prednostne metode, ki bolje obravnavajo neizogibne podatkovne nepravilnosti in odklone od enakomerne porazdelitve. Če se te nepravilnosti približujejo ničelnemu ali popolnemu zaviranju, se lahko povečajo s pretvorbo in ovirajo analizo (9). Upoštevati je treba, da so standardne metode za analizo, ki uporabljajo verjetnostne, logaritmične ali Weibullove pretvorbe, namenjene za uporabo na kvantiziranih podatkih (npr. umrljivost ali preživetje), in morajo biti ustrezno prirejene zaradi upoštevanja podatkov o rasti ali o biomasi. Posebni postopki za določanje vrednosti ECx iz stalnih podatkov so navedeni v (10), (11) in (12). Uporaba nelinearne regresijske analize je podrobneje opisana v Dodatku 4.
Za vsako odvisno spremenljivko, ki se analizira, se za izračun ocenjenih vrednosti pri vrednostih ECx uporabi razmerje koncentracija-odziv. Kadar je to mogoče, se določijo 95 % meje zaupanja za vsako oceno. Ujemanje podatkov o odzivu z regresijskim modelom naj se oceni grafično ali statistično. Regresijska analiza se izvede z uporabo posamičnih ponovitvenih odzivov in ne srednjih vrednosti tretiranih skupin. Če pa je nelinearno prilagajanje krivulj težko ali zaradi preveč razpršenih podatkov ne uspe, se težava lahko prepreči z izvedbo regresije na skupinskih srednjih vrednostih kot praktični način zmanjševanja vpliva pričakovanih izločitev. Uporaba te možnosti naj se navede v poročilu kot odklon od normalnega postopka, ker ujemanje krivulje s posamičnimi ponovitvami ni dalo dobrih rezultatov.
Ocene EC50 in meje zaupanja se prav tako lahko pridobi z uporabo linearne interpolacije z metodo vezanja (13), če so razpoložljivi regresijski modeli/metode za podatke neustrezni.
Za ocenjevanje LOEC in zato tudi NOEC ter za učinke preskusne snovi na stopnjo rasti je potrebno primerjati srednje vrednosti tretiranih skupin z uporabo tehnik analize variance (ANOVA). Srednja vrednost vsake koncentracije se nato primerja s srednjo vrednostjo kontrolnih skupin z uporabo primerne multiple primerjave ali preskusne metode trenda. Uporabna sta lahko Dunnettov ali Williamsov preskus (14)(15)(16)(17)(18). Potrebno je oceniti, ali predpostavka o homogenosti variance ANOVA drži. Ta ocena se lahko izvede grafično ali s formalnim preskusom (18). Primerna preskusa sta Levenejev in Bartlettov. Neizpolnjevanje predpostavke o homogenosti varianc se lahko včasih popravi z logaritmično pretvorbo podatkov. Če je heterogenost variance velika in je s pretvorbo ni mogoče popraviti, se obravnava analiza z metodami kot so Jonckheerevi step-down preskusi trenda. Dodatna navodila o določanju NOEC so navedena v (12).
Nedavni znanstveni razvoj je privedel do priporočila o opustitvi koncepta NOEC in nadomestitve le-tega z regresijo, ki temelji na ocenjenih vrednostih ECx. Za ta preskus alg ni bila določena primerna vrednost x. Primerno je območje 10 do 20 % (odvisno od izbrane odvisne spremenljivke) in po možnosti naj se poroča tako o EC10 kot tudi o EC20.
2.5 SPODBUJANJE RASTI
Pri nizkih koncentracijah je včasih opaženo spodbujanje rasti (negativno zaviranje). To je lahko posledica hormeze („spodbujanje toksičnosti“) ali dodajanja spodbujevalnih rastnih faktorjev s preskusnim materialom minimalnemu uporabljenemu mediju. Upoštevati je treba, da dodajanje anorganskih hranil naj ne bi imelo nobenih neposrednih učinkov, saj naj bi preskusni medij ohranjal presežek hranil skozi celoten preskus. Nizek odmerek spodbujanja se ponavadi ne upošteva pri računanju EC50, razen če je zelo velik. Če pa je zelo velik ali če se izračuna vrednost ECx za nizek x, so potrebni posebni postopki. Brisanju spodbujevalnih odzivov iz analize podatkov se je treba izogibati, če je mogoče, in če razpoložljiva programska oprema za prilagajanje krivulje ne more sprejeti manjših spodbujanj, se lahko uporabi linearna interpolacija z metodo vezanja. Če je spodbujanje zelo veliko, naj se obravnava model hormeze (19).
2.6 NETOKSIČNO ZAVIRANJE RASTI
Preskusni materiali, ki absorbirajo svetlobo, lahko povzročijo zmanjšanje stopnje rasti, ker senčenje zmanjša količino razpoložljive svetlobe. Takšne fizikalne učinke je treba s prilagoditvijo preskusnih pogojev ločiti od toksičnih učinkov in o njih ločeno poročati. Navodila so navedena v (2) in (3).
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati:
Preskusno snov:
— fizične značilnosti in fizikalno kemijske lastnosti, vključno z mejo topnosti v vodi,
— kemijske identifikacijske podatke, vključno s čistostjo.
Preskusne vrste:
— sev, dobavitelja ali vir in uporabljene pogoje gojenja.
Preskusne pogoje:
— podatke o začetku preskusa in njegovo trajanje,
— opis načrta preskusa: preskusne posode, volumne kultur, gostoto biomase na začetku preskusa,
— sestavo medija,
— preskusne koncentracije in ponovitve (npr. število ponovitev, število uporabljenih preskusnih koncentracij in geometrijskih naraščanj),
— opis priprave preskusnih raztopin, vključno z uporabo topil itd.,
— inkubator za kultiviranje,
— jakost in kvaliteto svetlobe (vir, homogenost),
— temperaturo,
— preskušene koncentracije: nominalne preskusne koncentracije in vsake rezultate analiz, da se določi koncentracija preskusne snovi v preskusnih posodah Poroča naj se o rekuperaciji metode in meji količinske določitve v preskusni matrici,
— vse odklone od te preskusne metode,
— metodo za določanje biomase in dokaze o korelaciji med izmerjenim parametrom in suho težo.
Rezultate:
— pH vrednosti na začetku in koncu preskusa za vsa tretiranja,
— biomaso za vsako bučko pri vsaki točki meritve in metodo za merjenje biomase,
— rastne krivulje (izris biomase glede na čas),
— izračunane odvisne spremenljivke za vsako tretirano ponovitev, s srednjimi vrednostmi in koeficienti variacij za ponovitve,
— grafično predstavitev razmerja koncentracija/učinek,
— ocene toksičnosti za odvisne spremenljivke, npr. EC50, EC10, EC20 in pripadajoče intervale zaupanja. Če sta izračunani, LOEC in NOEC in statistične metode, uporabljene za njuno določitev,
— če je bila uporabljena ANOVA, velikost učinka, ki je bil opažen (npr. najmanj pomembna razlika),
— vsako spodbujanje rasti, ki se je pokazalo pri katerem koli tretiranju,
— vse druge opažene učinke, npr. morfološke spremembe alg,
— razpravo o rezultatih, vključno z vsakim vplivom na izid preskusa, ki izhaja iz odklonov od preskusne metode.
4. VIRI
(1) OECD TG 201 (2006). Freshwater Alga and Cyanobacteria, Growth Inhibition Test.
(2) ISO 1998: Water quality – Guidance for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waster water. ISO/DIS 14442.
(3) OECD 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, št. 23.
(4) ISO 1998: Water quality – Sampling – Part 16: General Guidance for Biotesting. ISO 5667–16.
(5) ISO 1993: Water quality – Algal growth inhibition test. ISO 8692.
(6) Mayer, P., Cuhel, R. in Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525–2531.
(7) Slovacey, R.E. in Hanna, P.J. In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22,5 (1977), str. 919–925.
(8) Simpson, S.L., Roland, M.G.E., Stauber, J.L. in Batley, G.E. (2003) Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem 22, 2073–2079.
(9) Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718.
(10) Nyholm, N. Sørensen, P.S., Kusk, K.O. in Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167.
(11) Bruce, R.D. in Versteeg, D.J. (1992). A statistical procedure for modelling continuous toxicity data. Env. Toxicol. Chem. 11:1485–1494.
(12) OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
(13) Norberg-King T.J. (1988). An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN.
(14) Dunnett, C.W. (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096–1121.
(15) Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20: 482–491.
(16) Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103–117.
(17) Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 510–531.
(18) Draper, N.R. in Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York.
(19) Brain P. in Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93–96.
Dodatek 1
Sevi, dokazano primerni za preskušanje
Zelene alge
— Pseudokirchneriella subcapitata, (prej poznana kot Selenastrum capricornutum), ATCC 22662, CCAP 278/4, 61.81 SAG
— Desmodesmus subspicatus (prej poznana kot Scenedesmus subspicatus) 86.81 SAG
Kremenaste alge
— Navicula pelliculosa, UTEX 664
Cianobakterije
— Anabaena flos-aquae, UTEX 1444, ATCC 29413, CCAP 1403/13A
— Synechococcus leopoliensis, UTEX 625, CCAP 1405/1
Viri sevov
Priporočeni sevi so na voljo v kulturah z eno samo vrsto alg v naslednjih zbirkah (po abecednem vrstnem redu):
ATCC: American Type Culture Collection
10801 University Boulevard
Manassas, Virginia 20110–2209
USA
CCAP, Culture Collection of Algae and Protozoa
Institute of Freshwater Ecology,
Windermere Laboratory
Far Sawrey, Amblerside
Cumbria
LA22 0LP
UK
SAG: Sammlung von Algenkulturen
Albrecht-von-Haller-Institut
Universität Göttingen
Nikolausberger Weg 18
37073 Göttingen
GERMANY
UTEX Culture Collection of Algae
Section of Molecular, Cellular and Developmental Biology
School of Biological Sciences
the University of Texas at Austin
Austin, Texas 78712
USA
Videz in značilnosti priporočenih vrst
|
P. subcapitata |
D. subspicatus |
N. pelliculosa |
A. flos-aquae |
S. leopoliensis |
|
|
Videz |
upognjene, zvite posamezne celice |
ovalne, v glavnem posamezne celice |
paličice |
verige ovalnih celic |
paličice |
|
Velikost (Lș × șW) μm |
8–14 × 2–3 |
7–15 × 3–12 |
7,1 × 3,7 |
4,5 × 3 |
6 × 1 |
|
Volumen celice (μm3/celico) |
40–60 (1) |
60–80 (1) |
40–50 (1) |
30–40 (1) |
2,5 (2) |
|
Suha teža celice (mg/celico) |
2–3 × 10–8 |
3–4 × 10–8 |
3–4 × 10–8 |
1–2 × 10–8 |
2–3 × 10–9 |
|
Stopnja rasti (3) (dan–1) |
1,5–1,7 |
1,2–1,5 |
1,4 |
1,1–1,4 |
2,0–2,4 |
|
(1) Izmerjeno z elektronskim števcem delcev (2) Izračunano iz velikosti (3) Najpogosteje opazovana stopnja rasti v gojišču OECD pri jakosti svetlobe približno μE·m–2·s–1 in 21 °C |
|||||
Posebna priporočila o kultiviranju in ravnanju s priporočenimi preskusnimi vrstami
Pseudokirchneriella subcapitata in Desmodesmus subspicatus
Te zelene alge se na splošno lahko vzdržuje v različnih gojiščih kultur. Podatki o primernih gojiščih so na voljo v zbirkah kultur. Celice so ponavadi samotarske, meritve celične gostote pa se lahko izvedejo na enostaven način z uporabo elektronskega merilca delcev ali mikroskopa.
Anabaena flos-aquae
Za gojenje osnovne kulture se lahko uporabijo različna rastna gojišča. Zelo pomembno je, da se šaržni kulturi ne dopusti, da gre preko logaritemske faze rasti, kadar se obnavlja, saj je na tej stopnji obnova težka.
Anabaena flos-aquae razvije skupke ugnezdenih verig celic. Velikost teh skupkov je glede na pogoje kultiviranja lahko različna. Te skupke je pri štetju s pomočjo mikroskopa ali ob uporabi elektronskega števca delcev za določanje biomase morda treba ločiti.
Za ločevanje verig se lahko uporabi ultrazvočno razbijanje podvzorcev, da se zmanjša variabilnost štetja. Daljše ultrazvočno razbijanje od priporočenega za ločevanje verig v krajše dolžine lahko uniči celice. Jakost in trajanje ultrazvočnega razbijanja morata biti enaka za vse tretirane skupine.
Na hemocitometru se prešteje dovolj polj (najmanj 400 celic), da se nadomesti variabilnost. To bo izboljšalo zanesljivost mikroskopskega določanja gostote.
Elektronski števec delcev se lahko uporabi za določanje celotnega volumna celic alg Anabaena po ločevanju celičnih verig z natančnim ultrazvočnim razbijanjem. Energijo ultrazvočnega razbijanja je treba prilagoditi, da se prepreči razkroj celic.
Da se zagotovi dobro premešano in homogeno suspenzijo alg, ki se uporabi za inokulacijo preskusnih posod, se uporabi mešalnik vortex ali podobna primerna metoda.
Preskusne posode naj se postavijo na krožno in recipročno stresalno mizo pri približno 150 obratih na minuto. Alternativno se lahko uporabi prekinjeno tresenje za zmanjšanje težnje Anabaene po oblikovanju grud. Če se grude pojavijo, je treba paziti, da se doseže reprezentativne vzorce za merjenje biomase. Za razdrobitev grud je lahko pred vzorčenjem potrebno močno tresenje.
Synechococcus leopoliensis
Za gojenje osnovne kulture se lahko uporabijo različna rastna gojišča. Podatki o primernih gojiščih so na voljo v zbirkah kultur.
Synechococcus leopoliensis raste kot samotarske celice v obliki paličic. Celice so zelo majhne, kar otežuje uporabo mikroskopskega štetja za merjenje biomase. Uporabni so elektronski števci delcev, opremljeni za štetje delcev do najmanjše velikosti približno 1 μm. Primerne so tudi in vitro fluorometrične meritve.
Navicula pelliculosa
Za gojenje osnovne kulture se lahko uporabijo različna rastna gojišča. Podatki o primernih gojiščih so na voljo v zbirkah kultur. Pomembno si je zapomniti, da je v gojišču zahtevan silikat.
Navicula pelliculosa lahko pod določenimi rastnimi pogoji oblikuje skupke. Celice alg se zaradi proizvajanja lipidov včasih kopičijo na površinski prevleki. V teh okoliščinah je potrebno zagotoviti posebne ukrepe, ko se vzame podvzorce za določanje biomase, da se pridobi reprezentativne vzorce. Morda je lahko potrebno močno stresanje, npr. z uporabo mešalnika vortex.
Dodatek 2
Rastno gojišče
Uporabiti se sme eno od naslednjih dveh rastnih gojišč:
Gojišče OECD: Originalno gojišče OECD TG 201, tudi v skladu z ISO 8692
US. EPA gojišče AAP tudi v skladu z ASTM.
Pri pripravi teh gojišč naj se uporabi reagentne ali analitsko čiste kemikalije in deionizirana voda.
Sestava gojišča AAP (US. EPA) in gojišča OECD TG 201
|
Sestavina |
EPA |
OECD |
||
|
mg/l |
mM |
mg/l |
mM |
|
|
NaHCO3 |
15,0 |
0,179 |
50,0 |
0,595 |
|
NaNO3 |
25,5 |
0,300 |
||
|
NH4Cl |
15,0 |
0,280 |
||
|
MgCl2·6(H2O) |
12,16 |
0,0598 |
12,0 |
0,0590 |
|
CaCl2·2(H2O) |
4,41 |
0,0300 |
18,0 |
0,122 |
|
MgSO4·7(H2O) |
14,6 |
0,0592 |
15,0 |
0,0609 |
|
K2HPO4 |
1,044 |
0,00599 |
||
|
KH2PO4 |
1,60 |
0,00919 |
||
|
FeCl3·6(H2O) |
0,160 |
0,000591 |
0,0640 |
0,000237 |
|
Na2EDTA·2(H2O) |
0,300 |
0,000806 |
0,100 |
0,000269 (1) |
|
H3BO3 |
0,186 |
0,00300 |
0,185 |
0,00299 |
|
MnCl2·4(H2O) |
0,415 |
0,00201 |
0,415 |
0,00210 |
|
ZnCl2 |
0,00327 |
0,000024 |
0,00300 |
0,0000220 |
|
CoCl2·6(H2O) |
0,00143 |
0,000006 |
0,00150 |
0,00000630 |
|
Na2MoO4·2(H2O) |
0,00726 |
0,000030 |
0,00700 |
0,0000289 |
|
CuCl2.2(H2O) |
0,000012 |
0,00000007 |
0,00001 |
0,00000006 |
|
pH |
7,5 |
8,1 |
||
|
(1) Molarno razmerje EDTA in železa neznatno presega enoto. To preprečuje usedline železa in istočasno zmanjšuje kelacijo ionov težkih kovin. |
||||
V preskusu s kremenasto algo Navicula pelliculosa morata biti obe gojišči dopolnjeni z Na2SiO3·9H20, da se pridobi koncentracija 1,4 mg Si/l.
PH gojišča se pridobi z ravnovesjem med karbonatnim sistemom gojišča in parcialnim tlakom CO2 v atmosferskem zraku. Približno razmerje med pH pri 25 °C in koncentracijo molarnega bikarbonata je:
pHeq = 11,30 + log [HCO3]
S 15 mg NaHCO3/l, pHeq = 7,5 (gojišče U.S. EPA in s 50 mg NaHCO3/l, pHeq = 8,1 (gojišče OECD).
Elementna sestava v preskusnih gojiščih
|
Element |
EPA |
OECD |
|
mg/l |
mg/l |
|
|
C |
2,144 |
7,148 |
|
N |
4,202 |
3,927 |
|
P |
0,186 |
0,285 |
|
K |
0,469 |
0,459 |
|
Na |
11,044 |
13,704 |
|
Ca |
1,202 |
4,905 |
|
Mg |
2,909 |
2,913 |
|
Fe |
0,033 |
0,017 |
|
Mn |
0,115 |
0,115 |
Priprava gojišča OECD
|
Hranilo |
Koncentracija v osnovni raztopini |
|
Osnovna raztopina 1: makrohranilne snovi |
|
|
NH4Cl MgCl2·6H2O CaCl2·2H2O MgSO4·7H2O KH2PO4 |
1,5 g·l–1 1,2 g·l–1 1,8 g·l–1 1,5 g·l–1 0,16 g·l–1 |
|
Osnovna raztopina 2: železo |
|
|
FeCl3·6H2O Na2EDTA·2H2O |
64 mg·l–1 100 mg·l–1 |
|
Osnovna raztopina 3: elementi v sledovih |
|
|
H3BO3 MnCl2·4H2O ZnCl2 CoCl2·6H2O CuCl2·2H2O Na2MoO4·2H2O |
185 mg·l–1 415 mg·l–1 3 mg·l–1 1,5 mg·l–1 0,01 mg·l–1 7 mg·l–1 |
|
Osnovna raztopina 4: bikarbonat |
|
|
NaHCO3 |
50 g·l–1 |
|
Na2SiO3·9H20 |
|
Osnovne raztopine se sterilizira z membransko filtracijo (s povprečnim premerom por 0,2 μm) ali avtoklaviranjem (120 °C, 15 min). Raztopine se shrani v temnem prostoru pri 4 °C.
Raztopin 2 in 4 se ne avtoklavira, temveč le sterilizira z membransko filtracijo.
Rastno gojišče se pripravi z dodajanjem primerne količine raztopin 1–4 vodi.
K 500 ml sterilizirane vode se doda:.
— 10 ml osnovne raztopine 1
— 1 ml osnovne raztopine 2
— 1 ml osnovne raztopine 3
— 1 ml osnovne raztopine 4
Do 1 000 ml se dopolni s sterilizirano vodo.
Za vzpostavljanje ravnovesja gojišča z atmosferskim CO2 se dopusti dovolj časa; če je potrebno, s pomočjo prepihovanja sterilnega filtriranega zraka za nekaj ur.
Priprava gojišča AAP
A1.1 Po 1 ml vsake osnovne raztopine A1.2.1–A1.2.7 se dolije v približno 900 ml deionizirane ali destilirane vode, nato se raztopina razredči na 1 liter.
A1.2 Makrohranilne osnovne raztopine se pridobijo z raztapljanjem spodaj navedenih snovi v 500 ml deionizirane ali destilirane vode. Reagenti A1.2.1, A1.2.2, A1.2.3, in A1.2.4 se lahko združijo v eno osnovno raztopino.
A1.2.1 NaNO3 – 12,750 g.
A1.2.2 MgCl2 ·6H2O – 6,082 g.
A1.2.3 CaCl2 ·2H2O – 2,205 g.
A1.2.4 Mikrohranilna osnovna raztopina – (glej A1.3).
A1.2.5 MgSO4·7H2O – 7,350 g.
A1.2.6 K2HPO4 – 0,522 g.
A1.2.7 NaHCO3 – 7,500 g.
A1.2.8 Na2SiO3·9H2O – glej opombo A1.1.
Opomba A1.1 – Uporablja se samo za preskusne vrste kremenastih alg. Doda se lahko neposredno (202,4 mg) ali z dodajanjem osnovne raztopine do končne koncentracije 20 mg/l Si v gojišču.
A1.3 Mikrohranilna osnovna raztopina se pridobi z raztapljanjem spodaj navedenih snovi v 500 ml deionozirane ali destilirane vode.
A1.3.1 H3BO3 – 92,760 mg.
A1.3.2 MnCl2·4H2O – 207,690 mg.
A1.3.3 ZnCl2 – 1,635 mg.
A1.3.4 FeCl3·6H2O – 79,880 mg.
A1.3.5 CoCl2·6H2O – 0,714 mg.
A1.3.6 Na2MoO4·2H2O – 3,630 mg.
A1.3.7 CuCl2·2H2O – 0,006 mg.
A1.3.8 Na2EDTA·2H2O – 150,000 mg.
[dinatrijev (etilendinitrilo) tetraacetat].
A1.3.9 Na2SeO4·5H2O – 0,005 mg. Glej opombo A1.2.
Opomba A1.2 – Uporablja se samo za gojišča za osnovne raztopine vrst kremenastih alg.
A1.4 pH se uravna na 7,5 ± 0,1 z 0,1 N ali 1,0 N NaOH ali HCl.
A1.5 Gojišče se filtrira v sterilni vsebnik skozi 0,22-μm membranski filter, če se uporabi števec delcev, ali skozi 0,45-μm filter, če se števec delcev ne uporabi.
A1.6 Gojišče se do uporabe shrani v temnem prostoru pri temperaturi približno 4 °C.
Dodatek 3
Primer postopka kultiviranja alg
Splošne opombe
Namen kultiviranja po naslednjem postopku je pridobiti kulture alg za preskuse toksičnosti.
Uporabiti je treba primerne metode, s katerimi se zagotovi, da se kulture alg ne okužijo z bakterijami. Lahko so zaželene aksenične kulture, vsekakor pa se morajo uvesti in uporabiti kulture z eno samo vrsto alg.
Vse postopke je treba izvesti v sterilnih pogojih, da se prepreči okužba z bakterijami in drugimi algami.
Oprema in materiali
Glej v Preskusni metodi: Aparatura.
Postopki za pridobivanje kultur alg
Priprava hranilnih raztopin (gojišče):
Vse hranilne soli gojišča se pripravi kot koncentrirane osnovne raztopine ter hrani v temnem in hladnem prostoru. Te raztopine se sterilizirajo s filtracijo ali avtoklaviranjem.
Gojišče se pripravi z dodajanjem pravilne količine osnovne raztopine sterilni destilirani vodi, pri čemer se pazi, da ne pride do okužbe. Za trdno gojišče se doda 0,8 % agarja.
Osnovna kultura:
Osnovne kulture so majhne kulture alg, ki se redno prenašajo v sveža gojišča in se uporabljajo kot začetni preskusni material. Če se kulture ne uporabljajo redno, se nanesejo na poševna agarska gojišča v epruvetah. Nato se najmanj enkrat na dva meseca prenesejo na sveže gojišče.
Osnovne kulture se gojijo v erlenmajericah z ustreznim gojiščem (volumen približno 100 ml). Kadar se alge inkubirajo pri 20 °C ob stalni osvetlitvi, jih je treba na sveže gojišče prenesti enkrat na teden.
Med prenosom se del „stare“ kulture s sterilno pipeto prenese v erlenmajerico s svežim gojiščem, tako da je pri hitro rastoči vrsti začetna koncentracija približno 100-krat manjša, kakor v stari kulturi.
Stopnja rasti vrste se lahko določi iz rastne krivulje. Če je ta znana, se lahko oceni gostota, pri kateri je treba kulturo prenesti v novo gojišče. To je treba storiti, preden kultura doseže fazo odmiranja.
Predkultura:
Predkultura je namenjena pridobivanju količine alg, primerne za inokulacijo preskusnih kultur. Predkultura se inkubira v pogojih preskusa in uporabi, ko je še v eksponentni fazi rasti, običajno po 2–4 dneh inkubacije. Kulture alg, ki vsebujejo deformirane ali nenormalne celice, je treba zavreči.
Dodatek 4
Analiza podatkov pri nelinearni regresiji
Splošni premisleki
Odziv v preskusih alg in drugih mikrobioloških rastnih preskusih – rast biomase je po naravi stalna ali metrična spremenljivka – stopnja postopka, če se uporabi stopnja rasti, in njen integral v času, če je izbrana biomasa. Obe sta v povezavi z ustreznim povprečnim odzivom ponovitvenih neizpostavljenih kontrolnih skupin in kažeta največji odziv pri uvedenih pogojih – s svetlobo in temperaturo kot osnovnima določevalnima dejavnikoma v preskusu alg. Sistem je porazdeljen ali homogen in biomasa se lahko šteje za kontinuum brez ozira na posamezne celice. Porazdelitev variance vrste odziva za takšen sistem se nanaša izključno na eksperimentalne dejavnike (opisane značilno z logaritmično normalno ali normalno porazdelitvijo napake). To je v nasprotju s tipičnimi biološkimi odzivi s kvantiziranimi podatki, pri katerih se pogosto pričakuje, da bo toleranca (tipično binominalno porazdeljena) posameznih organizmov prevladujoča komponenta variance. Odzivi kontrole so nič ali raven naravnega ozadja.
V enostavnih razmerah se normiran ali relativni odziv, r, monotono zmanjša od 1 (ničelno zaviranje) do 0 (100-odstotno zaviranje). Zapomniti si je treba, da vse odzive spremlja napaka, tako da se lahko navidezno negativna zaviranja izračuna samo kot rezultat naključne napake.
Regresijska analiza
Modeli
Regresijska analiza je namenjena kvantitativnemu opisovanju krivulje koncentracija-odziv v obliki matematične regresijske funkcije Y = f (C) ali bolj pogoste F (Z), kjer je Z = log C. Če se jo uporabi inverzno, potem C = f–1 (Y) dopušča izračun številk ECx, vključno z EC50, EC10 in EC20, in njihovimi 95 % mejami zaupanja. Za več preprostih matematičnih funkcijskih oblik se je izkazalo, da uspešno opisujejo razmerja koncentracija-odziv, ki nastanejo v preskusih zaviranja rasti alg. Funkcije na primer vključujejo logistično enačbo, nesimetrično Weibullovo enačbo in funkcijo logaritemsko normalne porazdelitve, ki so vse sigmoidne krivulje, ki se asimptotično približujejo ena za C → 0 in nič za C → neskončno.
Uporaba stalnih funkcijskih modelov praga (npr. Kooijmanov model za „zaviranje rasti populacije“ Kooijman et al. 1996) je nedavno predlagana ali alternativna asimptotičnim modelom. Ta model ne pričakuje učinkov pri koncentracijah pod določenim pragom, EC0+, ki je ocenjen z ekstrapolacijo razmerja odziv-koncentracija pri preseku osi koncentracije z uporabo enostavne zvezne funkcije, ki je v začetni točki nediferenciabilna.
Zapomniti si je treba, da je analiza lahko enostavno zmanjšanje vsot preostalih kvadratov (pričakovana konstantna varianca) ali ovrednotenih kvadratov, če se heterogenost variance izravna.
Postopek
Ta postopek se izvede takole: izberemo ustrezno funkcijsko enačbo, Y = f (C), in jo z nelinearno regresijo prilagodimo podatkom. Raje kot srednje vrednosti ponovitev uporabimo meritve iz vsake posamezne bučke, da zberemo toliko podatkov, kot je le mogoče. Če je na drugi strani varianca visoka, praktične izkušnje kažejo, da lahko srednje vrednosti ponovitev zagotavljajo bolj robustno matematično oceno, na katero manj vplivajo naključne napake v podatkih, kot pa pri vsaki ohranjeni posamezni podatkovni točki.
Izrišemo prilagojeno krivuljo in izmerjene podatke ter raziščemo, ali je krivulja ustrezno prilagojena. Analiza ostankov je lahko za ta namen še posebej koristno orodje. Če izbrano funkcijsko razmerje, ki naj ustreza odzivu pri posameznih koncentracijah, ne odraža celotne krivulje ali njenega pomembnega dela, na primer odziva pri nizkih koncentracijah, izberemo drugo možnost prilagajanja krivulje – npr. nesimetrično krivuljo, kot je Weibullova funkcija, namesto simetrične. Negativna zaviranja rasti lahko povzročajo težave, na primer pri logaritmično normalni porazdelitveni funkciji, ki prav tako zahteva alternativno regresijsko funkcijo. Takšnim negativnim vrednostim ni priporočeno dodeliti ničelne ali majhne pozitivne vrednosti, ker to izkrivi porazdelitve napak. Lahko je primerno narediti ločene prilagoditve krivulj na delih krivulje, kot je nizki delež zaviranja rasti, da se oceni številke EClow x. Iz prilagojene enačbe (z „inverzno oceno“, C = f–1 (Y), izračunamo karakteristične ocenjene vrednosti ECx, in poročamo najmanj o ocenah EC50 in eni ali dveh ocenah EClow x. Izkušnje praktičnega preskušanja so pokazale, da natančnost preskusov alg ponavadi dopušča sprejemljivo natančno ovrednotenje pri 10 % stopnji zaviranja rasti, če so podatkovne točke zadovoljive – razen če se pri nizkih koncentracijah kot moteč dejavnik pojavi spodbujanje rasti. Natančnost ocene EC20 je pogosto znatno boljša kot ocena EC10, ker je EC20 ponavadi na približno linearnem delu osrednje krivulje odziva koncentracije. Včasih je EC10 težko razložiti zaradi spodbujanja rasti. Zato je, medtem ko je EC10 ponavadi dosežena z zadostno natančnostjo, priporočeno tudi stalno poročanje o EC20.
Utežni dejavniki
Eksperimentalna varianca pogosto ni konstantna in značilno vsebuje sorazmerno komponento, zato je bolj primerna rutinsko izvedena tehtana regresija. Utežni dejavniki za takšno analizo se ponavadi predpostavljajo kot obratno sorazmerni varianci.
Wi = 1/Var(ri)
Veliko regresijskih programov dopušča možnost analize tehtane regresije z utežnimi dejavniki, ki so navedeni v tabeli. Ustrezno naj se utežni dejavniki normalizirajo tako, da se jih pomnoži z n/Σ wi (n je število podatkovnih točk), tako da je njihova vsota enaka ena.
Normalizacijski odzivi
Normaliziranje s povprečnim odzivom kontrole povzroča nekatere temeljne probleme in prinaša precej zapleteno strukturo variance. Z deljenjem odzivov s povprečnim odzivom kontrole za pridobitev deleža zaviranja rasti predstavimo dodatno napako, ki jo povzroči napaka pri srednji vrednosti kontrole. Razen če je napaka zanemarljivo majhna, morajo biti utežni dejavniki v regresiji in meje zaupanja popravljeni za kovarianco s kontrolo (17). Treba si je zapomniti, da je velika natančnost pri ocenjenem povprečnem odzivu kontrole pomembna, da se lahko zmanjša celotna varianca za relativni odziv. Ta varianca je:
(spodnji indeks i se nanaša na stopnjo koncentracije i in spodnji indeks 0 na kontrole)
Yi = relativni odziv = ri/r0 = 1 – I = f (Ci)
z varianco:
Var (Yi) = Var (ri/r0) ≅ (∂Yi / ∂ ri)2·Var(ri) + (∂ Yi/ ∂ r0)2·Var (r0)
in ker je
(∂ Yi/ ∂ ri) = 1/r0 in (∂ Yi / ∂ r0) = ri/r0 2
z normalno porazdeljenimi podatki ter mi in m0 ponovitvami:
Var(ri) = σ2/mi
celotna varianca relativnega odziva, Yi postane:
Var(Yi) = σ2/(r0 2 mi) + ri 2·σ2/r0 4 m0
Napaka srednje vrednosti kontrole je obratno sorazmerna s kvadratnim korenom števila povprečnih kontrolnih ponovitev, in se včasih lahko določi, da se vključi podatke preteklih študij in tako zelo zmanjša napake. Alternativni postopek ni normaliziranje podatkov in prilagajanje absolutnih odzivov, vključno s podatki odziva kontrole, temveč predstavitev vrednosti odziva kontrole kot dodatnega parametra, ki ga je treba prilagoditi z nelinearno regresijo. Ta metoda potrebuje z običajno 2-parametrsko regresijsko enačbo prilagajanje 3 parametrov in zato zahteva več podatkovnih točk kot nelinearna regresija na podatkih, ki so normalizirani z uporabo vnaprej določenega odziva kontrole.
Obratni intervali zaupanja
Izračun intervalov zaupanja nelinearne regresije z obratno oceno je bolj zapleten in v navadnih statističnih računalniških programskih paketih ni razpoložljiva standardna možnost. Približne meje zaupanja se lahko pridobijo s standardnimi programi nelinearne regresije s ponovno parameterizacijo (Bruce in Versteeg, 1992), ki vključuje predelavo matematične enačbe z želenimi ocenjenimi vrednostmi, npr. EC10 in EC50 kot parametri, ki se jih mora oceniti. Naj bo funkcija I = f (α, β, koncentracija) in izkoristimo razmerja definicij f (α, β, EC10) = 0,1 in f (α, β, EC50) = 0,5, da nadomestimo f (α, β, koncentracija) z enakovredno funkcijo g (EC10, EC50, koncentracija.
Bolj neposredni izračun (Andersen et al, 1998) se izvede tako, da obdržimo izvirno enačbo in uporabimo Taylorjev raztezek pri srednjih vrednostih za ri in r0
Nedavno so postale priljubljene metode vezanja. Take metode uporabljajo izmerjene podatke in naključno število pogostnega ponovnega vzorčenja, ki ga usmerja generator, da se oceni empirična porazdelitev variance.
Viri
Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): No-effect concentrations in algal growth inhibition tests. Water Research, 30, 1625–1632.
Bruce, R.D. in Versteeg, D.J.(1992) A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Env. Toxicol. Chem.11, 1485–1494.
Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A. & Nyholm, N. (1998): Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405–420.
C.4 DOLOČANJE „DOBRE“ BIORAZGRADLJIVOSTI
Del I SPLOŠNO
I.1 UVOD
Opisanih je šest preskusnih metod, ki omogočajo presejalno preskušanje snovi glede lahke biorazgradljivosti v aerobnem vodnem mediju:
(a) Upadanje raztopljenega organskega ogljika (DOC) (Metoda C.4-A)
(b) Prilagojeno presejanje OECD – upadanje DOC (Metoda C.4-B)
(c) Razvijanje ogljikovega dioksida (CO2) (prilagojeni Sturmov preskus) (Metoda C.4-C)
(d) Manometrična respirometrija (Metoda C.4-D)
(e) Zaprta steklenica (Metoda C.4-E)
(f) MITI (Ministry of International Trade and Industry – Japonska) (Metoda C.4-F)
Splošne in skupne opombe za vseh šest preskusov so navedene v delu I metode. Posebnosti za posamezne metode so navedene v delih II do VII. Dodatki vsebujejo opredelitve, enačbe in navodila.
Medlaboratorijska primerjava, ki jo je OECD izvedel leta 1988, je pokazala, da metode dajejo dosledne rezultate. Vendar je glede na fizikalne lastnosti preskusne snovi lahko bolj primerna ena ali druga od metod.
I.2 IZBIRA USTREZNE METODE
Za izbiro najprimernejše metode so potrebne informacije o topnosti, parnem tlaku in adsorpcijskih lastnostih snovi. Za izračun teoretičnih vrednosti in/ali preverjanje izmerjenih vrednosti parametrov, npr. TPK, TCO2, DOC, TOC, KPK (glej dodatka 1 in 2) je treba poznati kemično strukturo ali formulo.
Preskusne snovi, topne v vodi do najmanj 100 mg/l, se lahko preskusijo z vsemi metodami, pod pogojem da so nehlapne in neadsorptivne. Za tiste snovi, ki so slabo topne v vodi, hlapne ali adsorptivne, so primerne metode navedene v tabeli 1. Načini ravnanja s snovmi, ki so slabo topne v vodi, in hlapnimi snovmi so opisani v Dodatku 3. Zmerno hlapne snovi se lahko preskušajo po metodi upadanja DOC, če je v preskusnih posodah (ki morajo biti ustrezno zaprte) dovolj prostora za plin. V tem primeru je treba izvesti abiotsko kontrolo, da se upoštevajo vse fizikalne izgube.
Tabela 1
Uporabnost preskusnih metod
|
Preskus |
Analitska metoda |
Primernost za snovi, ki so: |
||
|
slabo topne |
hlapne |
adsorptivne |
||
|
Upadanje DOC |
Raztopljeni organski ogljik |
— |
— |
+/- |
|
Prilagoj. metoda OECD upadanja DOC |
Raztopljeni organski ogljik |
— |
— |
+/- |
|
Razvijanje CO2 |
Respirometrija: razvijanje CO2 |
+ |
— |
+ |
|
Manometrična respirometrija |
Manometrična respirometrija: poraba kisika |
+ |
+/- |
+ |
|
Zaprta steklenica |
Respirometrija: raztopljeni kisik |
+/- |
+ |
+ |
|
MITI |
Respirometrija: poraba kisika |
+ |
+/- |
+ |
Za razlago dobljenih rezultatov so potrebne informacije o čistoti ali relativnih deležih glavnih sestavin preskusne snovi, zlasti kadar so rezultati nizki ali mejni.
Informacije o strupenosti preskusne snovi za bakterije (Dodatek 5) so lahko uporabne za izbiro primernih preskusnih koncentracij in so lahko bistvene za pravilno razlago nizkih vrednosti biorazgradljivosti.
I.3 REFERENČNE SNOVI
Za preverjanje postopka se preskusijo referenčne snovi, ki izpolnjujejo merila za dobro biorazgradljivost, s postavitvijo primerne steklenice vzporedno z navadnimi preskusnimi vzorci.
Primerne snovi so anilin (sveže destiliran), natrijev acetat in natrijev benzoat. Te referenčne snovi se pri teh metodah vse razgradijo, tudi kadar se namerno ne doda noben inokulum.
Predlagano je bilo, da se poišče taka referenčna snov, ki je dobro biorazgradljiva, vendar potrebuje dodan inokulum. Predlagan je bil kalijev hidorgen fosfat, vendar je treba pridobiti več podatkov za to snov, preden se lahko sprejme kot referenčna snov.
Pri respirometričnih preskusih lahko snovi, ki vsebujejo dušik, vplivajo na sprejem kisika zaradi nitrifikacije (glej dodatka 2 in 5).
I.4 PRINCIP PRESKUSNIH METOD
Raztopina ali suspenzija preskusne snovi v mineralnem mediju se inokulira in inkubira v aerobnih pogojih v temi ali razpršeni svetlobi. Količina DOC v preskusni raztopini, ki izvira iz inokuluma, mora biti čim manjša glede na količino DOC, ki izvira iz preskusne snovi. Endogena aktivnost inokuluma se preverja z vzporednim slepim preskusom z inokulumom in brez preskusne snovi, čeprav se endogena aktivnost celic v prisotnosti snovi ne bo povsem skladala s tisto v kontrolnem vzorcu. Za preverjanje postopkov pa se vzporedno izvede preskus samo z referenčno snovjo.
Na splošno se razgradnja spremlja z določanjem parametrov, kot so DOC, CO2, proizvodnja in sprejem kisika, meritve pa se izvajajo dovolj pogosto, da je omogočena določitev začetka in konca biorazgradnje. Pri avtomatskih respirometrih je merjenje neprekinjeno. DOC se včasih meri poleg še enega parametra, vendar navadno le na začetku in na koncu preskusa. Specifične kemijske analize se lahko uporabijo za določanje primarne razgradnje preskusne snovi in koncentracije kakršnega koli vmesnega proizvoda (obvezno pri preskusu MITI).
Navadno preskus traja 28 dni. Lahko pa se zaključi pred 28. dnem, t.j. takoj, ko krivulja biorazgradnje doseže konstantno vrednost pri najmanj treh določitvah. Preskus se lahko tudi podaljša preko 28 dni, kadar krivulja kaže, da se je biorazgradnja začela, vendar 28. dan še ni dosegla konstantne vrednosti.
I.5 MERILA KAKOVOSTI
I.5.1 Obnovljivosti
Zaradi narave biorazgradnje in mešanih populacij bakterij, ki se uporabijo kot inokulum, je treba izvesti najmanj dve vzporedni določitvi.
Splošna izkušnja je, da večja kot je koncentracija mikroorganizmov, dodanih preskusnemu mediju, manjše bodo razlike med ponovitvami. Testi primerljivosti so tudi pokazali, da so razlike med rezultati različnih laboratorijev lahko velike, vendar so pri dobro biorazgradljivih snoveh rezultati običajno kar skladni.
I.5.2 Veljavnost preskusa
Preskus se šteje za veljavnega, če je razlika med skrajnimi ponovitvenimi vrednostmi odstranitve preskusne snovi bodisi ob konstantni vrednosti bodisi na koncu preskusa bodisi ob koncu 10-dnevnega okna manj kot 20 % in če je odstotek razgradnje referenčne snovi dosegel raven za dobro biorazgradljivost v 14 dneh. Če kateri koli od teh pogojev ni izpolnjen, je treba preskus ponoviti. Zaradi strogosti teh metod, nizke vrednosti ne pomenijo nujno, da preskusna snov ni biorazgradljiva v okoljskih pogojih, temveč kažejo na to, da bodo za določitev biorazgradljivosti potrebne dodatne raziskave.
Če je bila v preskusu strupenosti, ki je vseboval preskusno in referenčno snov, razgradnja v 14 dneh manj kot 35 % (glede na DOC) ali manj kot 25 % (glede na TPK ali TCO2), se lahko predpostavlja, da je preskusna snov inhibitorna (glej tudi Dodatek 4). Preskusni niz je treba ponoviti, če je mogoče z manjšo koncentracijo preskusne snovi in/ali večjo koncentracijo inokuluma, vendar ne nad 30 mg trdnih delcev/liter.
I.6 SPLOŠNI POSTOPKI IN PRIPRAVE
Splošni pogoji za preskuse so povzeti v tabeli 2. Aparatura in drugi preskusni pogoji, ki se nanašajo posebej na posamezne preskuse so opisani pod naslovi posameznih preskusov.
Tabela 2
Preskusni pogoji
|
Preskus |
Upadanje DOC |
Razvijanje CO2 |
Manometrična respirometrija |
Prilagojen presejalni preskus OECD |
Zaprta steklenica |
MITI (I) |
|
Koncentracija preskusne snovi kot |
||||||
|
mg/l |
100 |
2–10 |
100 |
|||
|
mg DOC/l |
10–40 |
10–20 |
10–40 |
|||
|
mg ThOD/l |
50–100 |
5–10 |
||||
|
Koncentracija inokuluma (v celicah/ln pribiližno) |
≤ 30 mg/l SS ali ≤ 100 ml odtoka/l (107–108) |
0,5 ml sekundarnega odtoka (105) |
≤ 5 ml odtoka/l (104–106) |
30 mg/l SS (107–108) |
||
|
Koncentracija elementov v mineralnem mediju (v mg/l) |
||||||
|
P |
116 |
11,6 |
29 |
|||
|
N |
1,3 |
0,13 |
1,3 |
|||
|
Na |
86 |
8,6 |
17,2 |
|||
|
K |
122 |
12,2 |
36,5 |
|||
|
Mg |
2,2 |
2,2 |
6,6 |
|||
|
Ca |
9,9 |
9,9 |
29,7 |
|||
|
Fe |
0,05–0,1 |
0,05–0,1 |
0,15 |
|||
|
pH |
7,4± 0,2 po možnosti 7,0 |
Po možnosti7,0 |
||||
|
Temperatuura |
22 ± 2 oC |
25 ± 1 oC |
||||
|
DOC = raztopljeni organski ogljik |
ThoD = teoretična poraba kisika |
SS = neraztopljene trdne snovi |
||||
I.6.1 Voda za redčenje
Uporabi se deionizirana ali destilirana voda brez inhibitornih koncentracij strupenih snovi (npr. ionov Cu++). Ne sme vsebovati več kot 10 % organskega ogljika, vnesenega s preskusno snovjo. Velika čistost preskusne vode je nujna za odpravo visokih vrednosti slepih vzorcev. Okužba lahko nastane zaradi vsebovanih nečistot in tudi zaradi ionsko-izmenjevalnih smol in liziranega materiala iz bakterij in alg. Za vsak niz preskusov je treba uporabiti eno samo serijo vode, predhodno preverjeno z analizo DOC. Tako preverjanje ni potrebno pri preskusu z zaprto steklenico, vendar mora biti poraba kisika vode majhna.
I.6.2 Osnovne raztopine mineralnih sestavin
Za pripravo preskusnih raztopin se pripravijo osnovne raztopine mineralnih sestavin ustreznih koncentracij. Za metodo upadanja DOC, prilagojeni sejalni preskus OECD, preskus razvijanja CO2, manometrično respirometrijo in preskus z zaprto steklenico se lahko uporabijo naslednje osnovne raztopine (z različnimi faktorji redčenja).
Faktorji redčenja in, za preskus MITI, posebna priprava mineralnega medija so navedeni pod naslovi posameznih preskusov.
Pripravimo naslednje osnovne raztopine iz analitsko čistih reagentov.
|
(a) |
Monokalijev dihidrogen ortofosfat, KH2PO4 |
8,50 g |
|
Dikalijev monohidrogen ortofosfat, K2HPO4 |
21,75 g |
|
|
Dinatrijev monohidrogen ortofosfat dihidrat, Na2HPO4. 2 H2O |
33,40 g |
|
|
Amonijev klorid, NH4Cl |
0,50 g |
|
|
Raztopimo v vodi in dopolnimo do 1 litra. pH raztopine mora biti 7,4. |
||
|
(b) |
Kalcijev klorid, brezvodni, CaCl2 |
27,50 g |
|
ali kalcijev klorid dihidrat, CaCl2, 2 H2O |
36,40 g |
|
|
Raztopimo v vodi in dopolnimo do 1 litra. |
||
|
(c) |
Magnezijev sulfat heptahidrat, MgSO4. 7 H2O |
22,50 g |
|
Raztopimo v vodi in dopolnimo do 1 litra |
||
|
(d) |
Železov(III) klorid heksahidrat, FeCl3 . 6 H2O |
0,25 g |
|
Raztopimo v vodi in dopolnimo do 1 litra. |
Opomba: Da nam te raztopine ne bo treba pripraviti tik pred uporabo, ji dodamo kapljico koncentrirane HCl ali 0,4 g natrijeve soli etilendiamintetraocetne kisline (EDTA) na liter.
I.6.3 Osnovne raztopine snovi
Kadar topnost presega 1 g/l, raztopimo 1–10 g, kakor je primerno, preskusne ali referenčne snovi v deionizirani vodi in dopolnimo do 1 litra. V nasprotnem primeru pripravimo osnovne raztopine v mineralnem mediju ali snov dodamo neposredno v mineralni medij. Ravnanje z manj topnimi snovmi je opisano v Dodatku 3, vendar se za preskus MITI (metoda C.4-F) ne smejo uporabiti ne topila ne emulgatorji.
I.6.4 Inokulumi
Inokulum se lahko pridobi iz različnih virov: aktivno blato, komunalne odplake (neklorirane), površinske vode in prsti ali njihove zmesi. Kadar se za preskuse upadanja DOC, razvijanja CO2 in manometrične respirometrije uporabi aktivno blato, mora biti odvzeto iz čistilne naprave ali laboratorijske enote, ki prejema predvsem gospodinjske odplake. Ugotovljeno je bilo, da inokulumi iz drugih virov dajo bolj razpršene rezultate. Za prilagojeni presejalni preskus OECD in preskus z zaprto steklenico je potreben bolj razredčen inokulum brez kosmov in najprimernejši vir je sekundarni odtok iz čistilne naprave za gospodinjske odplake ali laboratorijske enote. Inokulum za preskus MITI se pridobi iz zmesi virov in je opisan pod naslovom za ta preskus.
I.6.4.1 Inokulum iz aktivnega blata
Zberemo svež vzorec aktivnega blata iz prezračevalnega bazena čistilne naprave ali laboratorijske enote, ki čisti predvsem gospodinjske odplake. Odstranimo grobe delce, če je potrebno s filtriranjem skozi fino sito, in nato vzdržujemo blato aerobno.
Druga možnost je, da ga po odstranitvi grobih delcev pustimo, da se posede ali ga centrifugiramo (npr. 10 min pri 1 100 g). Supernatant zavržemo. Blato lahko speremo v mineralnem mediju. Koncentrirano blato suspendiramo v mineralnem mediju, tako da bo koncentracija neraztopljenih trdnih snovi 3–5 g/l, in prezračujemo do uporabe.
Blato je treba odvzeti iz pravilno delujoče konvencionalne čistilne naprave. Če je bilo blato odvzeto iz čistilne naprave z visoko stopnjo čiščenja ali če se domneva da vsebuje inhibitorje, ga je treba sprati. Resuspendirano blato po temeljitem mešanju pustimo, da se posede, ali ga centrifugiramo, zavržemo supernatant in sprano blato ponovno suspendiramo v dodatnem volumnu mineralnega medija. Postopek ponavljamo, dokler ne menimo, da je blato brez presežnega substrata ali inhibitorjev.
Tik pred uporabo popolnoma resuspendiranega blata ali neobdelanega blata odvzamemo vzorec za določitev suhe mase neraztopljenih trdnih snovi.
Dodatna možnost je, da aktivno blato homogeniziramo (3–5 g neraztopljenih trdnih snovi/l). Blato obdelujemo z mehanskim mešalnikom 2 minuti pri srednji hitrosti. Zmešano blato naj se poseda 30 minut, če je potrebno tudi dlje, nato odlijemo tekočino, ki jo uporabimo kot inokulum v koncentraciji 10 ml/l mineralnega medija.
I.6.4.2 Drugi viri inokuluma
Lahko se pridobi iz sekundarnega odtoka iz čistilne naprave ali laboratorijske enote, ki prejema predvsem gospodinjske odplake. Zberemo svež vzorec in ga med prevozom vzdržujemo v aerobnem stanju. Pustimo, da se poseda 1 uro, ali ga filtriramo skozi grobi filtrirni papir in supernatant oziroma filtrat vzdržujemo v aerobnem stanju do uporabe. Na liter medija se lahko uporabi do 100 ml takega inokuluma.
Še en vir inokuluma je površinska voda. V tem primeru odvzamemo vzorec ustrezne površinske vode, npr. reke, jezera, in ga vzdržujemo v aerobnem stanju do uporabe. Če je potrebno inokulum koncentriramo s filtriranjem ali centrifugiranjem.
I.6.5 Aklimatizacija inokulumov
Inokulumi se lahko predhodno aklimatizirajo na preskusne pogoje, ne smejo pa se prilagoditi na preskusno snov. Aklimatizacija vključuje prezračevanje aktivnega blata v mineralnem mediju ali sekundarnega odtoka 5–7 dni pri temperaturi preskusa. Aklimatizacija včasih izboljša natančnost preskusnih metod, tako da zniža vrednosti slepih vzorcev. Pri MITI aklimatizacija inokuluma ni potrebna.
I.6.6 Abiotski kontrolni vzorci
Kadar je potrebno, preverimo ali pride do abiotske razgradnje preskusne snovi, tako da določimo odstranitev DOC, sprejem kisika ali razvijanje ogljikovega dioksida v sterilnih kontrolnih vzorcih brez inokuluma. Steriliziramo s filtriranjem skozi membranski filter (0,2–0,45 mikrometrov) ali z dodatkom ustrezne strupene snovi v ustrezni koncentraciji. Če uporabimo membranski filter, vzorce odvzamemo aseptično, da ohranimo sterilnost. Če adsorpcija preskusne snovi ni bila izključena že prej, morajo preskusi, ki merijo biorazgradnjo kot odstranitev DOC, zlasti tisti z inokulumom iz aktivnega blata, vključevati abiotski kontrolni vzorec, ki je inokuliran in zastrupljen.
I.6.7 Število steklenic
Število steklenic v značilnem preskusu je navedeno pod naslovom za posamezni preskus.
Lahko se uporabijo naslednje vrste vzorcev:
— Preskusna suspenzija: vsebuje preskusno snov in inokulum
— Slepi vzorec z inokulumom: vsebuje le inokulum
— Vzorec za kontrolo postopka: vsebuje referenčno snov in inokulum
— Abiotski sterilni kontrolni vzorec: sterilen, vsebuje preskusno snov (glej I.6.6)
— Vzorec za kontrolo adsorpcije: vsebuje preskusno snov, inokulum in sterilizacijsko sredstvo
— Vzorec za kontrolo strupenosti: vsebuje preskusno snov, referenčno snov in inokulum
Določanje v preskusni suspenziji in slepem vzorcu z inokulumom mora obvezno potekati vzporedno. Priporočljivo je, da se tudi določanje v drugih vzorcih izvaja vzporedno.
To sicer ni vedno možno. Zagotovimo, da je dovolj vzorcev ali odčitkov za oceno odstotka odstranitve v 10-dnevnem oknu.
I.7 PODATKI IN OCENA
Pri izračunavanju odstotka razgradnje, Dt, se uporabijo srednje vrednosti podvojenih meritev parametra v preskusnih posodah in slepem vzorcu z inokulumom. Enačbe so navedene v spodnjih oddelkih za posamezne preskuse. Grafično se prikaže potek razgradnje in označi 10-dnevno okno. Izračunata se odstotek odstranitve ob koncu 10-dnevnega okna in vrednost ob konstantni koncentraciji ali ob koncu preskusa, kar je primerno, in navedeta v poročilu.
Pri respirometričnih preskusih lahko snovi, ki vsebujejo dušik, vplivajo na sprejem kisika zaradi nitrifikacije (glej dodatka 2 in 5).
I.7.1 Razgradnja merjena z določanjem DOC
Odstotek razgradnje, Dt, ob vsakem vzorčenju se izračuna posebej za steklenice, ki vsebujejo preskusno snov, z uporabo srednjih vrednosti ponovljenih meritev DOC, da se lahko oceni veljavnost preskusa (glej I.5.2). Izračuna se po naslednji enačbi:

pri čemer je:
|
Dt |
= |
% razgradnje ob času t, |
|
C0 |
= |
srednja začetna koncentracija DOC v inokuliranem mediju, ki vsebuje preskusno snov (mg DOC/l), |
|
Ct |
= |
srednja koncentracija DOC v inokuliranem mediju, ki vsebuje preskusno snov, ob času t (mg DOC/l), |
|
Cb0 |
= |
srednja začetna koncentracija DOC v slepem inokuliranem mineralnem mediju (mg DOC/l), |
|
Cbt |
= |
srednja koncentracija DOC v slepem inokuliranem mineralnem mediju ob času t (mg DOC/l). |
Vse koncentracije se izmerijo s preskusi.
I.7.2 Razgradnja, merjena s specifično analizo
Kadar so na voljo specifični analitski podatki, se primarna biorazgradnja izračuna po:
![]()
pri čemer je:
|
Dt |
= |
% razgradnje ob času t, običajno 28 dni, |
|
Sa |
= |
količina ostanka preskusne snovi v inokuliranem mediju ob koncu preskusa (mg), |
|
Sb |
= |
količina ostanka preskusne snovi v slepem vzorcu z vodo/medijem, kateremu je bila dodana le preskusna snov (mg). |
I.7.3 Abiotska razgradnja
Kadar se uporabi abiotski sterilni kontrolni vzorec, se izračuna odstotek abiotske razgradnje po enačbi:

pri čemer je:
|
CS(o) |
= |
koncentracija DOC v sterilnem kontrolnem vzorcu ob dnevu 0 |
|
Cs(t) |
= |
koncentracija DOC v sterilnem kontrolnem vzorcu ob dnevu t |
I.8 POROČANJE
Poročilo o preskusu, če je možno, vsebuje naslednje podatke:
— preskusna in referenčna snov ter njuna čistota,
— preskusni pogoji,
— inokulum: vrsta in mesto(-a) vzorčenja, koncentracija in kakršna koli aklimatizacija,
— delež in vrsta industrijskih odpadkov, prisotnih v odplaki, če sta znana,
— trajanje preskusa in temperatura,
— pri slabo topnih preskusnih snoveh, uporabljena obdelava,
— uporabljena preskusna metoda; treba je navesti znanstvene razloge in obrazložitev za vsako spremembo v postopku,
— podatkovni list,
— vsi opaženi pojavi zaviranja,
— vsaka opažena abiotska razgradnja,
— specifični kemijski analitski podatki, če so na voljo,
— analitski podatki o vmesnih proizvodih, če so na voljo,
— graf odstotka razgradnje v odvisnosti od časa za preskusno in referenčno snov; jasno je treba označiti fazo prilagajanja, fazo razgradnje, 10-dnevno okno in naklon (Dodatek 1). Če preskus izpolnjuje merila za veljavnost, se lahko za graf uporabijo srednje vrednosti odstotka razgradnje v steklenicah s preskusno snovjo.
— odstotek odstranitve po 10-dnevnem oknu in ob doseženi konstantni koncentraciji ali ob koncu preskusa.
Del II PRESKUS UPADANJA DOC (Metoda C.4-A)
II. PRINCIP METODE
Izmerjeni volumen inokuliranega mineralnega medija, ki vsebuje znano koncentracijo preskusne snovi (10–40 mg DOC/l) kot edinega vira organskega ogljika, se prezračuje v temi ali na razpršeni svetlobi pri 22 ± 2 oC.
Razgradnja se spremlja 28 dni prek analize DOC v pogostih presledkih. Stopnja biorazgradnje se izračuna tako, da se koncentracija odstranjenega DOC (popravljena glede na slepi vzorec z inokulumom) izrazi kot odstotek koncentracije na začetku preskusa. Stopnja primarne biorazgradnje se lahko izračuna tudi iz dopolnilne kemijske analize, izvedene na začetku in na koncu inkubacije.
II.2 OPIS METODE
II.2.1 Aparatura
(a) erlenmajerice, npr. 250 ml do 2 l, odvisno od volumna, potrebnega za analizo DOC;
(b) stresalnik, primeren za erlenmajerice, bodisi z avtomatskim uravnavanjem temperature bodisi v prostoru s konstantno temperaturo in dovolj močan, da vzdržuje aerobne pogoje v vseh erlenmajericah;
(c) filtrirna naprava z ustreznimi membranskimi filtri;
(d) analizator DOC;
(e) aparatura za določanje raztopljenega kisika;
(f) centrifuga.
II.2.2 Priprava mineralnega medija
Pripravo osnovnih raztopin glej v I.6.2.
Zmešamo 10 ml raztopine (a) in 800 ml vode za redčenje, dodamo po 1 ml raztopin (b) do (d) in dopolnimo z vodo za redčenje do 11.
II.2.3 Priprava in aklimatizacija inokuluma
Inokulum se lahko pridobi iz različnih virov: aktivnega blata, komunalnih odplak, površinskih vod, prsti ali zmesi teh virov.
Glej I.6.4, I.6.4.1, I.6.4.2 in I.6.5.
II.2.4 Priprava steklenic
Kot primer, v 2l erlenmajerice damo po 800 ml mineralnega medija in v posamezne erlenmajerice dodamo ustrezno količino osnovne raztopine preskusne ali referenčne snovi, da bo koncentracija snovi enakovredna 10–40 mg DOC/l. Preverimo pH vrednost in jo po potrebi uravnamo na 7,4. Erlenmajerice inokuliramo z aktivnim blatom ali inokulumom iz kakega drugega vira (glej I.6.4), tako da bo končna koncentracija neraztopljenih trdnih snovi največ 30 mg/l. Pripravimo tudi kontrolne vzorce z inokulumom v mineralnem mediju brez preskusne ali referenčne snovi.
Če je potrebno, uporabimo eno posodo za preverjanje morebitnega inhibitornega učinka preskusne snovi, tako da inokuliramo raztopino, ki vsebuje primerljivi koncentraciji preskusne in referenčne snovi v mineralnem mediju.
Če je potrebno pripravimo tudi sterilni vzorec za preverjanje, ali se preskusna snov razgrajuje abiotsko, tako da uporabimo neinokulirano raztopino snovi (glej I.6.6).
Če sumimo, da se preskusna snov znatno adsorbira na steklo, blato itd., s predhodnim preskusom določimo verjetno stopnjo adsorpcije in s tem primernost preskusa za snov (glej tabelo 1). Pripravimo erlenmajerico s preskusno snovjo, inokulumom in sterilizacijskim sredstvom.
Vse erlenmajerice dopolnimo z mineralnim medijem do 1 l, premešamo in iz vsake erlenmajerice vzamemo vzorec za določitev začetne koncentracije DOC (glej Dodatek 2.4). Odprtine erlenmajeric pokrijemo, npr. z aluminijasto folijo, tako da je omogočena prosta izmenjava zraka med erlenmajerico in ozračjem. Erlenmajerice postavimo v stresalnik in tako začnemo preskus.
II.2.5 Število steklenic v značilnem preskusu
Steklenici 1 in 2: Preskusna suspenzija
Steklenici 3 in 4: Slepi vzorec z inokulumom
Steklenica 5: Vzorec za kontrolo postopka
po možnosti in kadar je potrebno:
Steklenica 6: Abiotski sterilni kontrolni vzorec
Steklenica 7: Vzorec za kontrolo adsorpcije
Steklenica 8: Vzorec za kontrolo strupenosti
Glej tudi I.6.7.
II.2.6 Izvedba preskusa
Ves čas preskusa v znanih časovnih intervalih določamo koncentracijo DOC v vsaki steklenici v podvojenih meritvah, in sicer dovolj pogosto, da lahko določimo začetek 10-dnevnega okna in odstotek odstranitve na koncu 10-dnevnega okna. Odvzamemo le najmanjši volumen preskusne suspenzije, potreben za vsako določitev.
Če je potrebno, pred vzorčenjem nadomestimo izgube zaradi izhlapevanja, tako da dodamo ustrezno količino vode za redčenje (I.6.1). Pred odvzemom vzorca medij temeljito premešamo in zagotovimo, da se material, prilepljen na steno posode, raztopi ali suspendira. Vzorce takoj po odvzemu membransko filtriramo ali centrifugiramo (glej Dodatek 2.4). Filtrirane ali centrifugirane vzorce analiziramo isti dan ali pa jih shranimo pri temperaturi 2–4 oC za največ 48 ur ali pod –18 oC za daljše obdobje.
II.3 PODATKI IN POROČANJE
II.3.1 Obdelava rezultatov
Izračunamo odstotek razgradnje ob času t iz I.7.1 (Določanje DOC) in, neobvezno, iz I.7.2 (specifična analiza).
Vse rezultate zapišemo na predvidene podatkovne liste.
II.3.2 Veljavnost rezultatov
Glej I.5.2.
II.3.3 Poročanje
Glej I.8.
II.4 PODATKOVNI LIST
V nadaljevanju je predstavljen primer podatkovnega lista.
PRESKUS UPADANJA DOC
1. LABORATORIJ
2. DATUM ZAČETKA PRESKUSA
3. PRESKUSNA SNOV
Ime:
Koncentracija osnovne raztopine: ... mg/l kot snov
Začetna koncentracija v mediju, to: ... mg/l kot snov
4. INOKULUM
Vir:
Obdelava:
Aklimatizacija, če je bila opravljena:
Koncentracija neraztopljenih trdnih snovi v reakcijski zmesi: ... mg/l
5. DOLOČITVE OGLJIKA
Analizator ogljika:
|
Št. steklenice |
DOC po n dneh (mg/l) |
||||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Preskusna snov in inokulum |
1 |
a1 |
|||||
|
A2 |
|||||||
|
a, srednja vrednost Ca(t) |
|||||||
|
2 |
b1 |
||||||
|
b2 |
|||||||
|
b, srednja vrednost Cb(t) |
|||||||
|
Slepi vzorec z inokulumom in brez preskusne snovi |
3 |
C1 |
|||||
|
C2 |
|||||||
|
c, srednja vrednost Cc(t) |
|||||||
|
4 |
d1 |
||||||
|
d2 |
|||||||
|
d, srednja vrednost Cd(t) |
|||||||
|
|
|||||||
6. VREDNOTENJE NEOBDELANIH PODATKOV
|
Št. steklenice |
% razgradnje po n dneh |
|||||
|
0 |
n1 |
n2 |
n3 |
nx |
||
|
1 |
|
0 |
||||
|
2 |
|
0 |
||||
|
Srednja vrednost (1) |
|
0 |
||||
|
(1) Če je med D1 in D2 velika razlika, se srednja vrednost ne izračuna. |
||||||
Opomba: za referenčno snov in vzorce za kontrolo strupenosti se lahko uporabi podobna oblika
7. ABIOTSKA KONTROLA (neobvezno)
|
Čas (dnevi) |
||
|
0 |
t |
|
|
Konc. DOC (mg/l) v sterilnih kontrolnih vzorcih |
Cs(o) |
Cs(t) |

8. SPECIFIČNA KEMIČNA ANALIZA (neobvezno)
|
Količina ostanka preskusne snovi ob koncu preskusa (mg/l) |
% primarne razgradnje |
|
|
Sterilni kontrolni vzorec |
Sb |
|
|
Inokulirani preskusni medij |
Sa |
|
Del III PRILAGOJENI PRESEJALNI PRESKUS OECD (Metoda C.4-B)
III.1 PRINCIP METODE
Izmerjeni volumen mineralnega medija, ki vsebuje znano koncentracijo preskusne snovi (10–40 mg DOC/l) kot edinega vira organskega ogljika, se inokulira z 0,5 ml odtoka na liter medija. Zmes se prezračuje v temi ali na razpršeni svetlobi pri 22 ± 2 oC.
Razgradnja se spremlja 28 dni prek analize DOC v pogostih presledkih. Stopnja biorazgradnje se izračuna tako, da se koncentracija odstranjenega DOC (popravljena glede na slepi vzorec z inokulumom) izrazi kot odstotek koncentracije na začetku preskusa. Stopnja primarne biorazgradnje se lahko izračuna tudi iz dopolnilne kemijske analize, izvedene na začetku in na koncu inkubacije.
III.2 OPIS METODE
III.2.1 Aparatura
(a) Erlenmajerice, npr. 250 ml do 2 l, odvisno od volumna, potrebnega za analizo DOC;
(b) stresalnik – primeren za erlenmajerice, bodisi z avtomatskim uravnavanjem temperature bodisi v prostoru s konstantno temperaturo in dovolj močan, da vzdržuje aerobne pogoje v vseh erlenmajericah;
(c) filtrirna naprava z ustreznimi membranskimi filtri;
(d) analizator DOC;
(e) aparatura za določanje raztopljenega kisika;
(f) centrifuga.
III.2.2 Priprava mineralnega medija
Pripravo osnovnih raztopin glej v I.6.2.
Zmešamo 10 ml raztopine (a) in 800 ml vode za redčenje, dodamo po 1 ml raztopin (b) do (d) in dopolnimo z vodo za redčenje do 1 litra.
Pri tej metodi se za inokulum uporabi le 0,5 ml odtoka/liter, zato bo medij morda treba okrepiti z elementi v sledeh in rastnimi faktorji. To se stori tako, da se na liter končnega medija doda po 1 ml vsake od naslednjih raztopin:
Raztopine elementov v sledeh:
|
Manganov sulfat tetrahidrat, MnSO4.4H2O |
39,9 mg |
|
Borova kislina, H3BO3 |
57,2 mg |
|
Cinkov sulfat heptahidrat, ZnSO4.7H2O |
42,8 mg |
|
Amonijev heptamolibdat (NH4)6 Mo7O24 |
34,7 mg |
|
Fe-helat (FeCl3 etilendiamin-tetra-ocetna kislina) |
100,0 mg |
|
Raztopimo v vodi za redčenje in dopolnimo z vodo za redčenje do 1 000 ml. |
|
|
Raztopina vitaminov |
|
|
Kvasni ekstrakt |
15,0 mg |
Kvasni ekstrakt raztopimo v 100 vode. Steriliziramo s filtriranjem skozi 0,2-mikronsko membrano ali pripravimo sveže.
III.2.3 Priprava in aklimatizacija inokuluma
Inokulum se lahko pridobi iz sekundarnega odtoka iz čistilne naprave ali laboratorijske enote, ki prejema predvsem gospodinjske odplake. Glej I.6.4.2 in I.6.5.
Uporabi se 0,5 ml na liter mineralnega medija.
III.2.4 Priprava steklenic
Kot primer, v 2-litrske erlenmajerice damo po 800 ml mineralnega medija in v posamezne erlenmajerice dodamo ustrezno količino osnovne raztopine preskusne ali referenčne snovi, da bo koncentracija snovi enakovredna 10–40 mg DOC/liter. Preverimo pH vrednost in jo po potrebi uravnamo na 7,4. Erlenmajerice inokuliramo s komunalno odplako v koncentraciji 0,5 ml/liter (glej I.6.4.2). Pripravimo tudi kontrolne vzorce z inokulumom v mineralnem mediju brez preskusne ali referenčne snovi.
Če je potrebno, uporabimo eno posodo za preverjanje morebitnega inhibitornega učinka preskusne snovi, tako da inokuliramo raztopino, ki vsebuje primerljivi koncentraciji preskusne in referenčne snovi v mineralnem mediju.
Če je potrebno pripravimo tudi sterilni vzorec za preverjanje, ali se preskusna snov razgrajuje abiotsko, tako da uporabimo neinokulirano raztopino snovi (glej I.6.6).
Če sumimo, da se preskusna snov znatno adsorbira na steklo, blato itd., s predhodnim preskusom določimo verjetno stopnjo adsorpcije in s tem primernost preskusa za snov (glej tabelo 1). Pripravimo erlenmajerico s preskusno snovjo, inokulumom in sterilizacijskim sredstvom.
Vse erlenmajerice dopolnimo z mineralnim medijem do 1 litra, premešamo in iz vsake erlenmajerice vzamemo vzorec za določitev začetne koncentracije DOC (glej Dodatek 2.4). Odprtine erlenmajeric pokrijemo, npr. z aluminijasto folijo, tako da je omogočena prosta izmenjava zraka med erlenmajerico in ozračjem. Erlenmajerice postavimo v stresalnik in tako začnemo preskus.
III.2.5 Število steklenic v značilnem preskusu
Steklenici 1 in 2: Preskusna suspenzija
Steklenici 3 in 4: Slepi vzorec z inokulumom
Steklenica 5: Vzorec za kontrolo postopka ter
po možnosti in kadar je potrebno:
Steklenica 6: Abiotski sterilni kontrolni vzorec
Steklenica 7: Vzorec za kontrolo adsorpcije
Steklenica 8: Vzorec za kontrolo strupenosti
Glej tudi 1.6.7.
III.2.6 Izvedba preskusa
Ves čas preskusa v znanih časovnih intervalih določamo koncentracijo DOC v vsaki steklenici v podvojenih meritvah, in sicer dovolj pogosto, da lahko določimo začetek 10-dnevnega okna in odstotek odstranitve na koncu 10-dnevnega okna. Odvzamemo le najmanjši volumen preskusne suspenzije, potreben za vsako določitev.
Če je potrebno, pred vzorčenjem nadomestimo izgube zaradi izhlapevanja, tako da dodamo ustrezno količino vode za redčenje (I.6.1). Pred odvzemom vzorca medij temeljito premešamo in zagotovimo, da se material, prilepljen na steno posode, raztopi ali suspendira. Vzorce takoj po odvzemu membransko filtriramo ali centrifugiramo (glej Dodatek 2.4). Filtrirane ali centrifugirane vzorce analiziramo isti dan ali pa jih shranimo pri temperaturi 2–4 oC za največ 48 ur ali pod –18 oC za daljše obdobje.
III.3 PODATKI IN POROČANJE
III.3.1 Obdelava rezultatov
Izračunamo odstotek razgradnje ob času t iz I.7.1 (Določanje DOC) in, neobvezno, iz I.7.2 (specifična analiza).
Vse rezultate zapišemo na predvidene podatkovne liste.
III.3.2 Veljavnost rezultatov
Glej I.5.2.
III.3.3 Poročanje
Glej I.8.
III.4 PODATKOVNI LIST
V nadaljevanju je predstavljen primer podatkovnega lista.
PRILAGOJENI PRESEJALNI PRESKUS OECD
1. LABORATORIJ
2. DATUM ZAČETKA PRESKUSA
3. PRESKUSNA SNOV
Ime:
Koncentracija osnovne raztopine: ... mg/l kot snov
Začetna koncentracija v mediju, to: ... mg/l kot snov
4. INOKULUM
Vir:
Obdelava:
Aklimatizacija, če je bila opravljena:
Koncentracija neraztopljenih trdnih snovi v reakcijski zmesi: ... mg/l
5. DOLOČITVE OGLJIKA
Analizator ogljika:
|
Št. steklenice |
DOC po n dneh (mg/l) |
||||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Preskusna snov in inokulum |
1 |
a1 |
|||||
|
a2 |
|||||||
|
a, srednja vrednost Ca(t) |
|||||||
|
2 |
b1 |
||||||
|
b2 |
|||||||
|
b, srednja vrednost Cb(t) |
|||||||
|
Slepi vzorec z inokulumom in brez preskusne snovi |
3 |
C1 |
|||||
|
C2 |
|||||||
|
c, srednja vrednost Cc(t) |
|||||||
|
4 |
d1 |
||||||
|
d2 |
|||||||
|
d, srednja vrednost Cd(t) |
|||||||
|
|
|||||||
6. VREDNOTENJE NEOBDELANIH PODATKOV
|
Št. steklenice |
% razgradnje po n dneh |
|||||
|
0 |
n1 |
n2 |
n3 |
nx |
||
|
1 |
|
0 |
||||
|
2 |
|
0 |
||||
|
Srednja vrednost (1) |
|
0 |
||||
|
(1) Če je med D1 in D2 velika razlika, se srednja vrednost ne izračuna. |
||||||
Opomba: za referenčno snov in vzorce za kontrolo strupensosti se lahko uporabi podobna oblika.
7. ABIOTSKA KONTROLA (neobvezno)
|
Čas (dnevi) |
||
|
0 |
t |
|
|
Konc. DOC (mg/l) v sterilnih kontrolnih vzorcih |
CS(o) |
Cs(t) |

8. SPECIFIČNA KEMIJSKA ANALIZA (neobvezno)
|
Kakiāna ostarika preskusne snovi ob koncu preskusa |
% primarne razgradnje |
|
|
Sterilni kontrolni vzorec |
Sb |
|
|
Inokulirani preskusni modij |
Sa |
|
Del IV PRESKUS RAZVIJANJA CO2 (Metoda C.4-C)
IV.1 PRINCIP METODE
Izmerjeni volumen inokuliranega mineralnega medija, ki vsebuje znano koncentracijo preskusne snovi (10–20 mg DOC ali TOC/l) kot edinega vira organskega ogljika, se prezračuje z uvajanjem zraka brez ogljikovega dioksida z nadzorovano hitrostjo v temi ali na razpršeni svetlobi. Razgradnja se spremlja 28 dni z določanjem proizvedenega ogljikovega dioksida, ki se ujame v barijev ali natrijev hidroksid in izmeri s titracijo preostalega hidroksida ali kot anorganski ogljik. Količina ogljikovega dioksida, proizvedenega iz preskusne snovi (popravljena glede na slepi vzorec z inokulumom), se izrazi kot odstotek TCO2. Stopnja biorazgradnje se lahko izračuna tudi iz dopolnilne analize DOC, izvedene na začetku in na koncu inkubacije.
IV.2 OPIS METODE
IV.2.1 Aparatura
(a) Buče, 2–5 litrov, vsaka opremljena s prezračevalno cevjo, ki sega skoraj do dna bučke, in odvodno odprtino;
(b) magnetna mešala, kadar se preskušajo slabo topne snovi;
(c) steklenice za absorpcijo plina;
(d) naprava za uravnavanje in merjenje zračnega pretoka;
(e) aparatura za izpiranje ogljikovega dioksida, za pripravo zraka brez ogljikovega dioksida; lahko pa se uporabi zmes kisika brez CO2 in dušika brez CO2 iz plinskih jeklenk v pravem razmerju (20 % O2 in 80 % N2);
(f) naprava za določanje ogljikovega dioksida, bodisi titrimetrično ali s kako obliko analizatorja anorganskega ogljika;
(g) naprava za membransko filtracijo (neobvezno);
(h) analizator DOC (neobvezno).
IV.2.2 Priprava mineralnega medija
Pripravo osnovnih raztopin glej v I.6.2.
Zmešamo 10 ml raztopine (a) in 800 ml vode za redčenje, dodamo po 1 ml raztopin (b) do (d) in dopolnimo z vodo za redčenje do 1 l.
IV.2.3 Priprava in aklimatizacija inokuluma
Inokulum se lahko pridobi iz različnih virov: aktivnega blata, komunalnih odplak, površinskih vod, prsti ali zmesi teh virov.
Glej I.6.4, I.6.4.1, I.6.4.2 in I.6.5.
IV.2.4 Priprava steklenic
Naslednji volumni in mase se na primer nanašajo na 5-litrske steklenice, ki vsebujejo 3 l suspenzije. Če se uporabijo manjši volumni, je treba vrednosti ustrezno spremeniti, vendar hkrati zagotoviti točno merjenje nastalega ogljikovega dioksida.
V vsako 5-litrsko steklenico damo 2 400 ml mineralnega medija. Dodamo ustrezen volumen pripravljenega aktivnega blata (glej I.6.4.1 in I.6.5), da bo v končnih 3 l inokulirane zmesi koncentracija neraztopljenih trdnih snovi največ 30 mg/l. Druga možnost je, da pripravljeno blato najprej razredčimo z mineralnim medijem, da dobimo suspenzijo 500–1 000 mg/l, nato dodamo ustrezen alikvot vsebini 5-litrske steklenice, da dobimo koncentracijo 30 mg/l; ta način zagotavlja večjo natančnost. Lahko se uporabijo drugi viri inokuluma (glej I.6.4.2).
Te inokulirane zmesi čez noč prezračujemo z zrakom brez CO2, da iz sistema izperemo ogljikov dioksid.
V vzporedne steklenice dodamo ločeno preskusno snov in referenčno snov, kot znani volumen osnovnih raztopin, tako da bo dobljena koncentracija DOC ali TOC, ki ga prispeva dodana snov, 10 do 20 mg/l; za kontrolo inokuluma v nekaj steklenic ne dodamo snovi. Slabo topne preskusne snovi dodamo neposredno v steklenice, na podlagi mase ali volumna, ali ravnamo z njimi, kakor je opisano v Dodatku 3.
Če je potrebno, uporabimo eno steklenico za preverjanje morebitnega inhibitornega učinka preskusne snovi, tako da vanjo damo preskusno in referenčno snov v koncentracijah, enakih koncentracijam v drugih steklenicah.
Če je potrebno pripravimo tudi sterilni vzorec za preverjanje, ali se preskusna snov razgrajuje abiotsko, tako da uporabimo neinokulirano raztopino snovi (glej I.6.6). Steriliziramo z dodatkom strupene snovi v primerni koncentraciji.
Suspenzije v vseh erlenmajericah dopolnimo do 3 l z mineralnim medijem, predhodno prezračevanim z zrakom brez CO2. Po izbiri lahko vzamemo vzorce za analizo DOC (glej Dodatek 2.4) in/ali specifično analizo. Na odvodne odprtine erlenmajeric priključimo absorpcijske steklenice.
Če uporabimo barijev hidroksid, na vsako 5-litrsko erlenmajerico zaporedno priključimo po tri absorpcijske steklenice s po 100 ml 0,0125 M raztopine barijevega hidroksida. V raztopini ne sme biti oborjenega sulfata in karbonata in tik pred uporabo je treba določiti njeno koncentracijo. Če uporabimo natrijev hidroksid, priključimo dva lovilnika, drugega za potrditev, da se je v prvem absorbiral ves ogljikov dioksid. Primerne so absorpcijske steklenice, opremljene z zapirali za serumske steklenice. V vsako steklenico dodamo 200 ml 0,05 M natrijevega hidroksida, kar je dovolj za absorpcijo celotne količine ogljikovega dioksida, ki se razvije pri popolni razgradnji preskusne snovi. Raztopina natrijevega hidroksida vsebuje sledi karbonatov, tudi ko je sveže pripravljena; to se popravi z odštetjem količine ogljika v slepem vzorcu.
IV.2.5 Število steklenic v značilnem preskusu
Steklenici 1 in 2: Preskusna suspenzija
Steklenici 3 in 4: Slepi vzorec z inokulumom
Steklenica 5: Vzorec za kontrolo postopka
ter po možnosti in kadar je potrebno:
Steklenica 6: Abiotski sterilni kontrolni vzorec
Steklenica 7: Vzorec za kontrolo strupenosti
Glej tudi I.6.7.
IV.2.6 Izvedba preskusa
Preskus pričnemo s črpanjem zraka brez CO2 skozi suspenzije s hitrostjo 30–100 ml/min. Periodično odvzamemo vzorce absorbenta ogljikovega dioksida za analizo vsebnosti CO2. Prvih deset dni je priporočljivo analize izvesti vsak drugi ali tretji dan, nato pa vsak peti dan do 28. dne, da se lahko določi 10-dnevno okno.
Osemindvajseti dan odvzamemo vzorce (neobvezno) za DOC in/ali specifično analizo, izmerimo pH suspenzij in dodamo po 1 ml koncentrirane klorovodikove kisline v vsako steklenico; steklenice čez noč prezračujemo, da iz preskusnih suspenzij izženemo ves ogljikov dioksid. Devetindvajseti dan izvedemo zadnjo analizo razvitega ogljikovega dioksida.
Ob dnevih, ko merimo CO2, odklopimo steklenici najbližji absorber z barijevim hidroksidom in raztopino hidroksida titriramo z 0,05 M HCl ob fenolftaleinu kot indikatorju. Preostale absorberje prestavimo za eno mesto bliže steklenici, na konec verige pa priključimo nov absorber s 100 ml svežega 0,0125 M barijevega hidroksida. Titriramo po potrebi, na primer, ko opazimo znatno obarjanje v prvem lovilniku in preden se obarjanje začne v drugem, ali najmanj enkrat na teden. Kadar kot absorbent uporabimo natrijev hidroksid, z brizgo odvzamemo majhen vzorec (odvisno od lastnosti uporabljenega analizatorja ogljika) raztopine natrijevega hidroksida iz absorberja, ki je najbliže steklenici. Vzorec injiciramo v IC-del analizatorja ogljika za neposredno analizo razvitega ogljikovega dioksida.
Vsebino drugega lovilnika analiziramo šele ob koncu preskusa, da upoštevamo popravke zaradi morebitnega prehajanja ogljikovega dioksida naprej.
IV.3 PODATKI IN POROČANJE
IV.3.1 Obdelava rezultatov
Količina v absorberju ujetega CO2, določena s titracijo, se izračuna po:
mgCO2 = (100 × CB – 0,5 × V x CA) × 44
pri čemer je:
|
V |
= |
volumen HCl, porabljen za titracijo 100 ml absorbenta (ml), |
|
CB |
= |
koncentracija raztopine barijevega hidroksida (M), |
|
CA |
= |
koncentracija raztopina klorovodikove kisline (M), |
če je CB enak 0,0125 M in CA enak 0,05 M, se za titracijo 100 ml barijevega hidroksida porabi 50 ml, je masa CO2:
![]()
V tem primeru je torej faktor za pretvorbo pri titraciji porabljene HCl v mg CO2 enak 1,1.
Iz ustreznih vrednosti, dobljenih pri titraciji, izračunamo maso CO2, proizvedenega samo iz inokuluma ter iz inokuluma in preskusne snovi; razlika je masa CO2, proizvedenega iz preskusne snovi.
Če na primer pri vzorcu z inokulumom porabimo za titracijo 48 ml ter pri vzorcu z inokulumom in preskusno snovjo 45 ml,
CO2 iz inokuluma = 1,1 × (50 - 48) = 2,2 mg
CO2 iz inokuluma in preskusne snovi skupaj = 1,1 × (50 - 45) = 5,5 mg
torej je masa CO2, proizvedenega iz preskusne snovi, enaka 3,3 mg.
Odstotek biorazgradnje se izračuna po enačbi:

ali

pri čemer je 3,67 faktor pretvorbe (44/12) ogljika v ogljikov dioksid.
Odstotek razgradnje po vsakem časovnem intervalu določimo tako, da seštejemo odstotke TCO2, izračunane za vsak dan do dneva meritve.
Pri absorberjih z natrijevim hidroksidom, količino proizvedenega ogljikovega dioksida, izraženega kot anorganski ogljik IC (mg), izračunamo tako, da koncentracijo IC v absorbentu pomnožimo z volumnom absorbenta.
Odstotek razgradnje izračunamo po enačbi:
![]()
Odstranitev DOC (neobvezno) izračunamo, kakor je opisano v I.7. Te in vse druge rezultate zapišemo na predvidene podatkovne liste.
IV.3.2 Veljavnost rezultatov
Vsebnost IC v suspenziji preskusne snovi v mineralnem mediju mora biti na začetku preskusa manj kot 5 % TC in skupni CO2, razvit v slepem vzorcu z inokulumom, na koncu preskusa ne sme preseči 40 mg/l medija. Če dobljene vrednosti presežejo 70 mg CO2/liter, je treba kritično preveriti podatke in tehniko preskušanja.
Glej tudi I.5.2.
IV.3.3 Poročanje
Glej I.8.
IV.4 PODATKOVNI LIST
V nadaljevanju je predstavljen primer podatkovnega lista.
PRESKUS RAZVIJANJA OGLJIKOVEGA DIOKSIDA
1. LABORATORIJ
2. DATUM ZAČETKA PRESKUSA
3. PRESKUSNA SNOV
Ime:
Koncentracija osnovne raztopine: ... mg/l kot snov
Začetna konc. v mediju: ... mg/l kot snov
Skupni C, dodan v steklenico: ... mg C
TCO2: ... mg CO2
4. INOKULUM
Vir:
Obdelava:
Aklimatizacija, če je bila opravljena:
Koncentracija neraztopljenih trdnih snovi v reakcijski zmesi: mg/liter
5. PROIZVODNJA OGLJIKOVEGA DIOKSIDA IN RAZGRADLJIVOST
Metoda Ba(OH)/NaOH/drugo
|
Čas (dan) |
Nastali CO2 preskusni vzorec (mg) |
Nastali CO2 slepi vzorec (mg) |
Nastali CO2 kumulativni (mg) (preskusni minus slepi vzorec, srednja vrednost) |
TCO2 cumulative
|
|||||
|
1 2 |
srednja vrednost |
3 4 |
srednja vrednost |
1 |
2 |
1 |
2 |
srednja vrednost |
|
|
0 |
|||||||||
|
n1 |
|||||||||
|
n2 |
|||||||||
|
n3 |
|||||||||
|
28 |
|||||||||
Opomba: za referenčno snov in vzorce za kontrolo strupenosti se lahko uporabi podobna oblika.
6. ANALIZA OGLIJIKA (neobvezno)
Analizator ogljika:
|
Čas (dan) |
Slepi vzorec mg/l |
Preskusna snov mg/l |
|
0 |
Cb(o) |
Co |
|
28 (1) |
Cb(t) |
Ct |
|
(1) ali ob koncu inkubacije. |
||

7. ABIOTSKA RAZGRADNJA (neobvezno)

Del V PRESKUS MANOMETRIČNE RESPIROMETRIJE (Metoda C.4-D)
V.1 PRINCIP METODE
Izmerjeni volumen inokuliranega mineralnega medija, ki vsebuje znano koncentracijo preskusne snovi (100 mg preskusne snovi/l, da dobimo najmanj 50–100 mg TPK/l) kot edinega vira organskega ogljika, se do 28 dni meša v zaprti steklenici pri konstantni temperaturi (± 1 oC ali manj). Poraba kisika se določi bodisi z merjenjem količine kisika (elektrolitsko proizvedenega), potrebne za ohranjanje konstantnega volumna plina v respirometrski steklenici, bodisi iz spremembe volumna ali tlaka (ali kombinacije obeh) v aparaturi. Razviti ogljikov dioksid se absorbira v raztopini kalijevega hidroksida ali drugega ustreznega absorbenta. Količina kisika, ki jo porabi preskusna snov (popravljena glede na sprejem pri slepem vzorcu z inokulumom, preskušenem vzporedno) se izrazi kot odstotek TPK ali KPK. Po izbiri se lahko izračunata primarna biorazgradnja iz dopolnilne specifične analize, opravljene na začetku in na koncu inkubacije, ter popolna biorazgradnja z analizo DOC.
V.2 OPIS METODE
V.2.1 Aparatura
(a) ustrezni respirometer;
(b) termostat, ki vzdržuje konstantno temperaturo do ± 1 oC ali bolj natančno;
(c) naprava za membransko filtracijo (neobvezno);
(d) analizator ogljika (neobvezno).
V.2.2 Priprava mineralnega medija
Pripravo osnovnih raztopin glej v I.6.2.
Zmešamo 10 ml raztopine (a) in 800 ml vode za redčenje, dodamo po 1 ml raztopin (b) do (d) in dopolnimo z vodo za redčenje do 1 litra.
V.2.3 Priprava in aklimatizacija inokuluma
Inokulum se lahko pridobi iz različnih virov: aktivnega blata, komunalnih odplak, površinskih vod in prsti ali zmesi teh virov.
Glej I.6.4, I.6.4.1, I.6.4.2 in I.6.5.
V.2.4 Priprava steklenic
Iz osnovnih raztopin pripravimo ločene serije raztopin preskusne in referenčne snovi v mineralnem mediju, ki ustrezajo koncentraciji 100 mg snovi/l (da dobimo najmanj 50–100 mg TPK/l).
TPK izračunamo na podlagi tvorbe amonijevih soli, razen če pričakujemo nitrifikacijo, takrat mora izračun temeljiti na tvorbi nitrata (glej Dodatek 2.2).
Določimo pH vrednost in jo po potrebi uravnamo na 7,4± 0,2.
Slabo topne snovi se dodajo pozneje (glej spodaj).
Če bomo določali strupenost preskusne snovi, pripravimo dodatno raztopino v mineralnem mediju, ki vsebuje preskusno in referenčno snov v istih koncentracijah, kakor posamezne raztopine.
Če potrebujemo meritev fizikalno-kemijskega sprejema kisika, pripravimo raztopino preskusne snovi, navadno v koncentraciji 100 mg TPK/l, ki jo steriliziramo z dodatkom ustrezne strupene snovi (glej I.6.6).
V steklenice, najmanj po dve za vsako vrsto vzorca, damo potrebne volumne raztopin preskusne in referenčne snovi. Pripravimo dodatne steklenice z le mineralnim medijem (za kontrolo inokuluma) ter, če je potrebno, z zmesjo raztopin preskusne in referenčne snovi in s sterilno raztopino.
Če je preskusna snov slabo topna, jo dodamo v tej fazi, neposredno v steklenico, na podlagi mase ali volumna, ali ravnamo z njo, kakor je opisano v Dodatku 3. V razdelke CO2-absorberja damo kalijev hidroksid, tablete zmesi natrijevega ali kalijevega hidroksida in kalcijevega oksida ali kak drug absorbent.
V.2.5 Število steklenic v značilnem preskusu
Steklenici 1 in 2: Preskusna suspenzija
Steklenici 3 in 4: Slepi vzorec z inokulumom
Steklenica 5: Vzorec za kontrolo postopka
po možnosti in kadar je potrebno:
Steklenica 6: Sterilni kontrolni vzorec
Steklenica 7: Vzorec za kontrolo strupenosti
Glej tudi I.6.7.
V.2.6 Izvedba preskusa
Počakamo, da steklenice dosežejo želeno temperaturo, in ustrezne steklenice inokuliramo s pripravljenim aktivnim blatom ali inokulumom iz drugega vira, tako da bo koncentracija neraztopljenih trdnih snovi največ 30 mg/l. Sestavimo aparaturo, vklopimo mešalnik, preverimo nepredušnost in začnemo meriti sprejem kisika. Običajno nam ni treba storiti nič drugega, kot opraviti potrebne odčitke in dnevno preverjati, ali se vzdržujeta prava temperatura in ustrezno mešanje.
Sprejem kisika izračunamo iz vrednosti, odčitanih v rednih in pogostih intervalih po metodah, ki jih navaja proizvajalec opreme. Ob koncu inkubacije, navadno po 28 dneh, izmerimo pH vsebine steklenic, zlasti če je sprejem kisika manjši ali večji od ThODNH4 (za snovi, ki vsebujejo dušik).
Če je potrebno, iz respirometrskih steklenic na začetku in na koncu odvzamemo vzorce za analizo DOC ali specifično kemijsko analizo (glej Dodatek 2.4). Ob prvem odvzemu zagotovimo, da je volumen preostale preskusne suspenzije v steklenici znan. Kadar kisik sprejema preskusna snov, ki vsebuje dušik, določimo povečanje koncentracije nitrita in nitrata v 28 dneh ter izračunamo popravek za kisik, porabljen pri nitrifikaciji (Dodatek 5).
V.3 PODATKI IN POROČANJE
V.3.1 Obdelava rezultatov
Količino kisika (mg), ki ga sprejme preskusna snov po določenem času (popravljeno glede na sprejem v slepem vzorcu za kontrolo inokuluma v istem času), delimo z uporabljeno maso preskusne snovi. Tako dobimo BPK, izražen v mg kisika/mg preskusne snovi, to je

= mg O2 na mg preskusne snovi.
odstotek razgradnje izračunamo po enačbi:

ali po enačbi
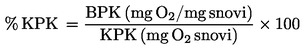
Opozoriti je treba, da ti dve metodi ne dasta nujno enakega rezultata; priporočena je uporaba prve metode.
Pri snoveh, ki vsebujejo dušik, uporabimo ustrezni TPK (NH4 ali N03), glede na to kaj vemo ali pričakujemo glede nitrifikacije (Dodatek 2.2). Če pride do nitrifikacije, ki pa je nepopolna, izračunamo popravek za kisik, porabljen pri nitrifikaciji, iz sprememb v koncentraciji nitrita in nitrata (Dodatek 5).
Kadar določimo organski ogljik in/ali izvedemo specifično kemično analizo, odstotek razgradnje izračunamo, kakor je opisano v I.7.
Vse rezultate zapišemo na priložene podatkovne liste.
V.3.2 Veljavnost rezultatov
Sprejem kisika v slepem vzorcu z inokulumom je navadno 20–30 mg O2/l in ne sme biti večji od 60 mg/l v 28 dneh. Pri vrednostih nad 60 mg/l je treba kritično preveriti podatke in tehniko preskušanja. Če je pH vrednost izven območja 6–8,5 in poraba kisika pri preskusni snovi pod 60 %, je treba preskus ponoviti z manjšo koncentracijo preskusne snovi.
Glej tudi I.5.2.
V.3.3 Poročanje
Glej I.8.
V.4 PODATKOVNI LIST
V nadaljevanju je predstavljen primer podatkovnega lista.
PRESKUS MANOMETRIČNE RESPIROMETRIJE
1. LABORATORIJ
2. DATUM ZAČETKA PRESKUSA
3. PRESKUSNA SNOV
Ime:
Koncentracija osnovne raztopine: ... mg/liter
Začetna koncentracija v mediju, Co: ... mg/liter
Volumen v preskusni steklenici (V): ... ml
TPK ali KPK: ... mg O2/mg preskusne snovi (NH4 or NO3)
4. INOKULUM
Vir:
Obdelava:
Aklimatizacija, če je bila opravljena:
Koncentracija neraztopljenih trdnih snovi v reakcijski zmesi: ... mg/l
5. SPREJEM KISIKA: BIORAZGRADLJIVOST
|
Čas (dan) |
|||||||||||||
|
0 |
7 |
14 |
21 |
28 |
|||||||||
|
Spr. O2 (mg) preskusna snov |
1 |
||||||||||||
|
2 |
|||||||||||||
|
a, srednja vrednost |
|||||||||||||
|
Spr. O2 (mg) slepi vzorec |
3 |
||||||||||||
|
4 |
|||||||||||||
|
b, srednja vrednost |
|||||||||||||
|
Popravljeni BPK (mg) |
(a1 – bm) |
||||||||||||
|
(a2 – bm) |
|||||||||||||
|
BPK na mg preskusne snovi |
|
||||||||||||
|
|
|||||||||||||
|
% razgradnje
|
D1 (a1) |
||||||||||||
|
D2 (a2) |
|||||||||||||
|
srednja vrednost (1) |
|||||||||||||
|
(1) Če je med D1 in D2 velika razlika, se srednja vrednost ne izračuna. V = volumen medija v preskusni steklenici. |
|||||||||||||
Opomba: za referenčno snov in vzorce za kontrolo strapenosti se lahko uporabi podobna oblika.
6. POPRAVEK ZA NITRIFIKACIJO (glej Prilogo V)
|
Päev |
0 |
28 |
Erinevus |
|
(i) Koncentracija nitrata (mg N/l), |
(N) |
||
|
(ii) Ekvivalent kisika (4,57 × N × V) (mg) |
— |
— |
|
|
(iii) Koncentracija nitrita (mg N/l) |
(N) |
||
|
(iv) Ekvivalent kisika (3,43 × N × V) (mg) |
— |
— |
|
|
(ii + iv) Skupni ekvivalent kisika |
— |
— |
7. ANALIZA OGLJIKA (neobvezno)
Analizator ogljika:
|
Čas (dan) |
Slepi vzorec (mg/l) |
Preskusna snov mg/l |
|
0 |
(Cblo) |
(Co) |
|
28 (1) |
(Cblt) |
(Ct) |
|
(1) ali ob koncu inkubacije. |
||

8. SPECIFIČNA ANALIZA (neobvezno)
|
Sb |
= |
Koncentracija v fizikalno-kemijskem (sterilnem) kontrolnem vzorcu po 28 dneh |
|
Sa |
= |
Koncentracija v inokulirani steklenici po 28 dneh, |
![]()
9. ABIOTSKA RAZGRADNJA (neobvezno)
|
a |
= |
poraba kisika v sterilnih steklenicah po 28 dneh, |
![]()
(glej oddelka 1 in 3)
![]()
Del VI PRESKUS Z ZAPRTO STEKLENICO (METODA C.4-E)
VI.1 PRINCIP PRESKUSNE METODE
Raztopina preskusne snovi v mineralnem mediju, običajno 2–5 mg/l, se inokulira z relativno majhnim številom mikroorganizmov iz mešane populacije in hrani v do vrha napolnjenih zaprtih steklenicah v temi pri konstantni temperaturi. Razgradnja se spremlja 28 dni prek analize raztopljenega kisika. Količina kisika, ki jo porabi preskusna snov (popravljena glede na sprejem pri slepem vzorcu z inokulumom, preskušenem vzporedno), se izrazi kot odstotek TPK ali KPK.
VI.2 OPIS METODE
VI.2.1 Aparatura
(a) BPK-steklenice s steklenimi zamaški, npr. 250–300 ml;
(b) vodna kopel ali inkubator, za hranjenje steklenic pri konstantni temperaturi (± 1 oC ali bolj natančno) in brez svetlobe;
(c) velike steklenice (2–5 litrov) za pripravo medijev in polnjenje BPK-steklenic;
(d) kisikova elektroda in merilnik ali oprema in reagenti za titracijo po Winklerju.
VI.2.2 Priprava mineralnega medija
Pripravo osnovnih raztopin glej v I.6.2.
Zmešamo po 1 ml raztopin (a) do (d) in dopolnimo do 1 litra z vodo za redčenje.
VI.2.3 Priprava inokuluma
Inokulum se navadno pridobi iz sekundarnega odtoka iz čistilne naprave ali laboratorijske enote, ki prejema predvsem gospodinjske odplake. Drugi vir inokuluma je površinska voda. Navadno uporabimo od ene kapljice (0,05 ml) do 5 ml filtrata na liter medija; morda bo treba s poskusi ugotoviti najprimernejši volumen za določen odtok (glej I.6.4.2 in I.6.5).
VI.2.4 Priprava steklenic
Mineralni medij močno prezračujemo najmanj 20 minut. Vsak niz preskusov izvedemo z mineralnim medijem iz iste serije. Na splošno je medij pripravljen za uporabo po 20 h pri temperaturi preskusa. Za namene kontrole določimo koncentracijo raztopljenega kisika; vrednost mora biti približno 9 mg/l pri 20 oC. Vse postopke prenašanja in polnjenja z medijem, nasičenim z zrakom, opravimo tako, da v njem ne nastajajo mehurčki, na primer z uporabo sifonov.
Pripravimo vzporedne skupine BPK-steklenic za določanje preskusne in referenčne snovi v sočasnih preskusnih nizih. Pripravimo zadostno število BPK-steklenic, vključno s slepimi vzorci z inokulumom, da omogočimo podvojene meritve porabe kisika v želenih časovnih intervalih, npr. po 0, 7, 14, 21 in 28 dneh. Lahko bo potrebnih več steklenic, da se omogoči določitev 10-dnevnega okna.
V velike steklenice damo popolnoma prezračen mineralni medij, tako da so napolnjene do približno ene tretjine. Nato v posamezne steklenice dodamo dovolj osnovne raztopine preskusne snovi ali referenčne snovi, da je končna koncentracija snovi največ 10 mg/l. V dodatno steklenico za slepi vzorec z medijem ne dodamo nobene snovi.
Da je zagotovljeno, da aktivnost inokuluma ni omejena, koncentracija raztopljenega kisika v BPK-steklenicah ne sme pasti pod 0,5 mg/l. To omejuje koncentracijo preskusne snovi na približno 2 mg/l. Pri slabo razgradljivih snoveh in tistih z majhnim TPK, lahko uporabimo tudi 5–10 mg/l. V nekaterih primerih je priporočljivo izvesti vzporedna niza z dvema različnima koncentracijama preskusne snovi, na primer z 2 in s 5 mg/l. Navadno TPK izračunamo na podlagi tvorbe amonijevih soli, če pa pričakujemo ali vemo, da bo potekala nitrifikacija, ga izračunamo na podlagi tvorbe nitrata (ThODNO3: glej Dodatek 2.2). Če je nitrifikacija nepopolna, vendar se pojavi, izračunamo popravke glede na spremembe v koncentraciji nitrita in nitrata, določene z analizo (glej Dodatek 5).
Če bomo preučevali strupenost preskusne snovi (na primer, kadar je bila predhodno določena nizka vrednost biorazgradljivosti), potrebujemo dodaten niz steklenic.
Pripravimo še eno veliko steklenico, ki vsebuje prezračen mineralni medij (do približno ene tretjine volumna) ter preskusno in referenčno snov v končnih koncentracijah, enakih tistim v drugih velikih steklenicah.
Raztopine v velikih steklenicah inokuliramo s sekundarnim odtokom (ena kapljica ali približno 0,05 ml do 5 ml na liter) ali drugim virom, kot je rečna voda (glej I.6.4.2). Nato raztopine dopolnimo do volumna s prezračenim mineralnim medijem, preko cevi, ki sega do dna steklenice, da dosežemo ustrezno mešanje.
VI.2.5 Število steklenic v značilnem preskusu
V značilnem preskusu se uporabijo naslednje steklenice:
— najmanj 10 steklenic, ki vsebujejo preskusno snov in inokulum (preskusna suspenzija),
— najmanj 10 steklenic, ki vsebujejo le inokulum (slepi vzorec z inokulumom),
— najmanj 10 steklenic, ki vsebujejo referenčno snov in inokulum (kontrola postopka),
— in, kadar je potrebno, 6 steklenic, ki vsebujejo preskusno snov, referenčno snov in inokulum (kontrola strupenosti). Da pa bi zagotovo omogočili določitev 10-dnevnega okna, bi potrebovali še enkrat toliko steklenic.
VI.2.6 Izvedba preskusa
Vsako pripravljeno raztopino s cevjo, ki sega v spodnjo četrtino velike steklenice (ne do dna), takoj prenesemo v BPK-steklenice ustrezne skupine, tako da so vse BPK-steklenice napolnjene do vrha. Rahlo potrkamo po steklenici, da odstranimo vse zračne mehurčke. V steklenicah za čas nič takoj določimo raztopljeni kisik z metodo po Winklerju ali z elektrodo. Vsebina steklenic se lahko shrani za poznejšo analizo po Winklerju, tako da se ji doda manganov(II) sulfat in natrijev hidroksid (prvi reagent po Winklerju). Steklenice, ki vsebujejo kisik, fiksiran kot rjavi manganov(III) hidroksid, previdno zapremo in shranimo v temi pri 10–20 oC za največ 24 ur, preden nadaljujemo s postopkom po Winklerju. Preostale steklenice zamašimo, pri čemer zagotovimo, da v njih ni zračnih mehurčkov, in jih inkubiramo pri 20 oC v temi. Vsak niz mora spremljati popoln vzporedni niz za določanje slepega inokuliranega medija. V ustreznih časovnih intervalih (najmanj tedensko) 28 dnevne inkubacije odvzamemo vzorce iz najmanj po dveh vzporednih steklenic na niz za določitev raztopljenega kisika.
Tedenski vzorci bi morali omogočiti oceno odstotka odstranitve v 14-dnevnem oknu, vzorčenje na 3–4 dni pa bi moralo omogočiti določitev 10-dnevnega okna, za kar je potrebnih približno dvakrat toliko steklenic.
Pri snoveh, ki vsebujejo dušik, je treba izračunati popravke za porabo kisika pri nitrifikaciji. V ta namen za določitev koncentracije raztopljenega kisika uporabimo metodo s kisikovo elektrodo in nato iz BPK-steklenice odvzamemo vzorec za določitev nitrita in nitrata. Iz povečanja koncentracije nitrita in nitrata izračunamo porabljeni kisik (glej Dodatek 5).
VI.3 PODATKI IN POROČANJE
VI.3.1 Obdelava rezultatov
Najprej izračunamo BPK po vsakem časovnem intervalu, tako da porabo kisika (mg O2/l) v slepem vzorcu z inokulumom odštejemo od tiste v vzorcu s preskusno snovjo. Tako popravljeno porabo delimo s koncentracijo (mg/l) preskusne snovi, da dobimo specifični BPK, izražen kot mg kisika na mg preskusne snovi. Izračunamo odstotek biorazgradljivosti, tako da specifični BPK delimo s specifičnim TPK (izračunanim v skladu z Dodatkom 2.2) ali KPK (določenim z analizo, glej Dodatek 2.3), tako je:

= mg O2 na mg preskusne snovi

ali

Opozoriti je treba, da ti dve metodi ne dasta nujno enakega rezultata; priporočena je uporaba prve metode.
Pri snoveh, ki vsebujejo dušik, uporabimo ustrezni TPK (NH4 ali NO3), glede na to kaj vemo ali pričakujemo glede nitrifikacije (Dodatek 2.2). Če pride do nitrifikacije, ki pa je nepopolna, izračunamo popravek za kisik, porabljen pri nitrifikaciji, iz sprememb v koncentraciji nitrita in nitrata (Dodatek 5).
VI.3.2 Veljavnost rezultatov
Poraba kisika v slepem vzorcu z inokulumom po 28 dneh ne sme preseči 1,5 mg raztopljenega kisika/l. Pri višjih vrednostih je treba preveriti preskusne tehnike. Koncentracija preostalega kisika v preskusnih steklenicah nikoli ne sme pasti pod 0,5 mg/l. Tako nizka raven kisika je primerna le, če se taka raven lahko točno določi z uporabljeno metodo za določanje raztopljenega kisika.
Glej tudi I.5.2.
VI.3.3 Poročanje
Glej I.8.
VI.4 PODATKOVNI LIST
V nadaljevanju je predstavljen primer podatkovnega lista.
PRESKUS Z ZAPRTO STEKLENICO
1. LABORATORIJ
2. DATUM ZAČETKA PRESKUSA
3. PRESKUSNA SNOV
Ime:
Koncentracija osnovne raztopine: ... mg/liter
Začetna koncentracija v steklenici: ... mg/liter
TPK ali KPK: ... mg O2/mg preskusne snovi
4. INOKULUM
Vir:
Obdelava:
Aklimatizacija, če je bila opravljena:
Koncentracija v reakcijski zmesi: ... mg/liter
5. DOLOČANJE DO
Metoda: Winkler/elektroda
Analize steklenic
|
Čas inkubacije (d) |
DO (mg/l) |
|||||
|
0 |
n1 |
n2 |
||||
|
Slepi vzorec (brez snovi) |
1 |
C1 |
||||
|
2 |
C2 |
|||||
|
Srednja vrednost |
|
|||||
|
Preskusna snov |
1 |
a1 |
||||
|
2 |
a2 |
|||||
|
Srednja vrednost |
|
|||||
Opomba: Za referenčno snov in vzarec za kontrolo strapenosti se lahko uporabi podobna oblika.
6. POPRAVEK ZA NITRIFIKACIJO (glej Prilogo V)
|
Čas inkubacije (d) |
0 |
n1 |
n2 |
n3 |
|
(i) Koncentracija nitrata (mg N/l) |
||||
|
(ii) Sprememba Koncentracije nitrata (mg N/l) |
— |
|||
|
(iii) Ekvivalent kisika (mg/l) |
— |
|||
|
(iv) Koncentracija nitrita (mg N/l) |
||||
|
(v) Sprememba koncentracije nitrita (mg N/l) |
— |
|||
|
(vi) Ekvivalent kisika (mg/l) |
— |
|||
|
(iii + vi) Skupni ekvivlent kisika (mg/l) |
— |
7. PORABA DO: % RAZGRADNJE
|
Poraba po n dneh (mg/l) |
||||
|
n1 |
n2 |
n3 |
||
|
STEKLENICA 1: (mto – mtx) – (mbo – mbx) |
||||
|
STEKLENICA 2: (mto – mtx) – (mbo – mbx) |
||||
|
STEKLENICA 1:
|
||||
|
STEKLENICA 2:
|
||||
|
strednja vrednost % D (1) =
|
||||
|
(1) Srednje vrednosti ne računamo, če je razlika med ponovitvama zelo velika. |
||||
|
mt0 |
= |
vrednost v preskusni steklenici ob času 0 |
|
mtx |
= |
vrednost v preskusni steklenici ob času x |
|
mbo |
= |
srednja vrednost slepega vzorca ob času 0 |
|
mbx |
= |
srednja vrednost slepega vzorca ob času x |
Upoštevamo tudi popravek za nitrifikacijo iz (iii) + (vi) v oddelku 6.
8. PORABA DO V SLEPEM VZORCU
Poraba kisika v slepem vzorcu: (mb0 – mb28) mg/l. Ta poraba je pomembna za veljavnost preskusa. Mora biti manj kot 1,5 mg/l.
DEL VII PRESKUS M.I.T.I. (MetodA C.4-F)
VII.1 PRINCIP METODE
V obdobju 28 dni se avtomatsko meri sprejem kisika v raztopini ali suspenziji preskusne snovi v mineralnem mediju, inokulirani s posebej gojenimi, neprilagojenimi mikroorganizmi, med stalnim mešanjem v zatemnjenem, zaprtem respirometru pri 25 ± 1 oC. Razviti ogljikov dioksid se absorbira v zmesi natrijevega in kalcijevega hidroksida. Biorazgradljivost se izrazi kot odstotek sprejema kisika (popravljenega glede na sprejem v slepem vzorcu) glede na teoretični sprejem (TPK). Lahko se izračuna tudi odstotek primarne biorazgradnje iz dopolnilne specifične kemične analize, opravljene na začetku in na koncu inkubacije, ter, neobvezno, z analizo DOC.
VII.2 OPIS METODE
VII.2.1 Aparatura
(a) avtomatski elektrolitski BPK-meter ali respirometer, navadno opremljen s šestimi 300 ml-steklenicami s posodicami za CO2-absorbent;
(b) prostor s konstantno temperaturo in/ali vodna kopel s temperaturo 25 oC ± 1 oC ali bolj natančno;
(c) naprava za membransko filtracijo (neobvezno);
(d) analizator ogljika (neobvezno).
VII.2.2 Priprava mineralnega medija
Pripravimo naslednje osnovne raztopine iz analitsko čistih reagentov in vode (I.6.1):
|
(a) |
Monokalijev dihidrogen ortofosfat, KH2PO4 |
8,50 g |
|
Dikalijev monohidrogen ortofosfat, K2HPO4 |
21,75 g |
|
|
Dinatrijev monohidrogen ortofosfat dodekahidrat Na2HPO4 12 H2O |
44,60 g |
|
|
Amonijev klorid, NH4Cl |
1,70 g |
|
|
Raztopimo v vodi in dopolnimo do 1 litra. |
||
|
pH vrednost raztopine mora biti 7,2. |
||
|
(b) |
Magnezijev sulfat heptahidrat, MgSO4 7 H2O |
22,50 g |
|
Raztopimo v vodi in dopolnimo do 1 litra. |
||
|
(c) |
Kalcijev klorid, brezvodni, CaCl2 |
27,50 g |
|
Raztopimo v vodi in dopolnimo do 1 litra. |
||
|
(d) |
Železov (III) klorid heksahidrat, FeCl3 6 H2O |
0,25 g |
|
Raztopimo v vodi in dopolnimo do 1 litra. |
Zmešamo po 3 ml raztopine (a), (b), (c) in (d) in dopolnimo do 1 litra.
VII.2.3 Priprava inokuluma
Zberemo sveže vzorce na najmanj desetih mestih, v glavnem na območjih, kjer se uporabljajo in odvajajo različne kemikalije. Na mestih kot so čistilne naprave za komunalno ali industrijsko odpadno vodo, reke, jezera, morja, zberemo 1-litrske vzorce blata, površinske prsti, vode itd. in jih dobro zmešamo skupaj. Odstranimo plavajoče delce in pustimo nekaj časa stati, nato uravnamo pH supernatanta na 7 ± 1 z natrijevim hidroksidom ali fosforno kislino.
Z ustreznim volumnom filtriranega supernatanta napolnimo posode za obdelavo aktivnega blata po sistemu polni-prazni in tekočino prezračujemo približno 23 1/2 h. Trideset minut po ustavitvi prezračevanja zavržemo približno eno tretjino celotnega volumna supernatanta ter preostanku dodamo enak volumen raztopine (pH 7), ki vsebuje po 0,1 % glukoze, peptona in monokalijevega ortofosfata, in nadaljujemo s prezračevanjem. Postopek ponovimo enkrat na dan. Enoto za blato je treba upravljati v skladu z dobro prakso: tekočina mora biti bistra, vzdrževati je treba konstantno temperaturo 25 ± 2 oC, pH mora biti 7 ± 1, blato se mora dobro posedati, prezračevanje mora biti zadostno, da je zmes ves čas aerobna, prisotne morajo biti praživali in najmanj vsake tri mesece je treba z referenčno snovjo preveriti aktivnost blata. Blata ne smemo uporabiti dokler ne preteče najmanj en mesec obdelave in ne po več kot štirih mesecih. Nato v rednih časovnih presledkih, enkrat na tri mesece, zbiramo vzorce na najmanj 10 mestih.
Za vzdrževanje enake aktivnosti svežega in starega blata zmešamo filtrirani supernatant obdelovanega aktivnega blata z enakim volumnom filtriranega supernatanta sveže zbrane mešanice iz desetih virov ter nastalo zmes kultiviramo po zgornjem postopku. Blato za inokulum odvzamemo 18–24 h po polnjenju enote.
VII.2.4 Priprava steklenic
Pripravimo naslednjih šest steklenic:
Št. 1: 100 mg/l preskusne snovi v vodi za redčenje
Št. 2, 3 in 4: 100 mg/l preskusne snovi v mineralnem mediju
Št. 5: 100 mg/l referenčne snovi (npr. anilin) v mineralnem mediju
Št. 6: samo mineralni medij
Slabo topne snovi dodamo neposredno na podlagi mase ali volumna ali z njimi ravnamo, kakor je opisano v Dodatku 3, ne smemo pa uporabiti ne topil ne emulgatorjev. V vse steklenice damo CO2-absorbent v za to namenjene posodice. V steklenicah št. 2, 3 in 4 uravnamo pH na 7,0.
VII.2.5 Izvedba preskusa
Steklenice št. 2, 3 in 4 (preskusne suspenzije), št. 5 (kontrola aktivnosti) in št. 6 (slepi vzorec z inokulumom) inokuliramo z majhno količino inokuluma, tako da bo koncentracija neraztopljenih trdnih snovi 30 mg/l. V steklenico št. 1, ki je namenjena abiotski kontroli, ne damo inokuluma. Sestavimo aparaturo, preverimo nepredušnost, vklopimo mešalnike in začnemo meriti sprejem kisika v temi. Dnevno preverjamo temperaturo, mešalnik in kulometrični zapisovalnik sprejema kisika ter zapišemo vse spremembe barve vsebine steklenic. Z ustrezno metodo, na primer s šestmestnim grafičnim zapisovalnikom, ki izriše krivuljo BPK, neposredno odčitavamo sprejem kisika v šestih steklenicah. Ob koncu inkubacije, navadno 28 dni, izmerimo pH vsebine steklenic ter določimo koncentracijo ostanka preskusne snovi in kakršnega koli vmesnega produkta in, pri vodotopnih snoveh, koncentracijo DOC (Dodatek 2.4). Pri hlapnih snoveh moramo biti posebej previdni. Če pričakujemo nitrifikacijo, po možnosti določimo koncentracijo nitrata in nitrita.
VII.3 PODATKI IN POROČANJE
VII.3.1 Obdelava rezultatov
Količino kisika (mg), ki ga sprejme preskusna snov po določenem času, popravljeno glede na sprejem v slepem vzorcu za kontrolo inokuluma v istem času, delimo z uporabljeno maso preskusne snovi. Tako dobimo BPK, izražen v mg kisika/mg preskusne snovi, to je:

= mg O2 na mg preskusne snovi
Odstotek biorazgradnje se izračuna po enačbi:

Pri zmeseh izračunamo TPK iz elementarne analize, kakor pri enostavnih spojinah. Uporabimo ustrezni TPK (TPKNH4 ali TPKNO3), glede na to ali nitrifikacije ni ali je popolna (Dodatek 2.2). Če pa pride do nitrifikacije, vendar je nepopolna, izračunamo popravek za kisik, porabljen pri nitrifikaciji, iz sprememb v koncentraciji nitrita in nitrata (Dodatek 5).
Odstotek primarne biorazgradnje izračunamo iz izgube specifične (izhodne) snovi (glej 1.7.2).
![]()
Če je v steklenici št. 1, namenjeni merjenju fizikalno-kemijske odstranitve, prišlo do izgube preskusne snovi, to navedemo v poročilu in uporabimo koncentracijo preskusne snovi (Sb) po 28 dneh v tej steklenici za izračun odstotka biorazgradnje.
Kadar določamo DOC (neobvezno), izračunamo odstotek popolne biorazgradnje po enačbi:

kakor je opisano v točki I.7.1. Če je v steklenici št. 1, namenjeni merjenju fizikalno-kemijske odstranitve, prišlo do izgube DOC, uporabimo koncentracijo DOC v tej steklenici za izračun odstotka biorazgradnje.
Vse rezultate zapišemo na priložene podatkovne liste.
VII.3.2 Veljavnost rezultatov
Sprejem kisika v slepem vzorcu z inokulumom je navadno 20–30 mg O2/l in ne sme biti večji od 60 mg/l v 28 dneh. Pri vrednostih nad 60 mg/l je treba kritično preveriti podatke in tehniko preskušanja. Če je pH vrednost izven območja 6–8,5 in poraba kisika pri preskusni snovi pod 60 %, je treba preskus ponoviti z manjšo koncentracijo preskusne snovi.
Glej tudi 1.5.2.
Če odstotek razgradnje anilina, izračunan iz porabe kisika, ne preseže 40 % po 7 dneh in 65 % po 14 dneh, se preskus šteje za neveljavnega.
VII.3.3 Poročanje
Glej 1.8.
VII.4 PODATKOVNI LIST
V nadaljevanju je predstavljen primer podatkovnega lista.
PRESKUS M.I.T.I. (I)
1. LABORATORIJ
2. DATUM ZAČETKA PRESKUSA
3. PRESKUSNA SNOV
Ime:
Koncentracija osnovne raztopine: ... mg/l kot snov
Začetna koncentracija v mediju, Co: ... mg/l kot snov
Volumen reakcijske zmesi, V: .. ml
TPK: ... mg O2/l
4. INOKULUM
Mesta vzorčenja blata:
|
1) … |
6) … |
|
2) … |
7) … |
|
3) … |
8) … |
|
4) … |
9) … |
|
5) … |
10) … |
Koncentracija neraztopljenih trdnih snovi v aktivnem blatu po aklimatizaciji s sintetičnim blatom = ... mg/l
Volumen aktivnega blata na liter končnega medija = ... ml
Koncentracija blata v končnem mediju = ... mg/l
5. SPREJEM KISIKA: BIORAZGRADLJIVOST
Vrsta uporabljenega respirometra:
|
Čas (dan) |
|||||||
|
0 |
7 |
14 |
21 |
28 |
|||
|
Spr. O2 (mg) preskusna snov |
a1 |
||||||
|
a2 |
|||||||
|
a3 |
|||||||
|
Spr. O2 (mg) slepi vzorec |
b |
||||||
|
Popravljeni spr. O2 (mg) |
(a1 – b) (a2 – b1) (a3 – b1) |
||||||
|
BPK na mg preskusne snovi |
|
Steklenica 1 |
|||||
|
Steklenica 2 |
|||||||
|
Steklenica 3 |
|||||||
|
% razgradnje
|
1 |
||||||
|
2 |
|||||||
|
3 |
|||||||
|
srednja vrednost (1) |
|||||||
|
(1) Srednje vrednosti ne računamo, če je razlika med panovitvanna zelo velika. |
|||||||
Opomba: Za referenčno, snov se lahko uporabi padobna oblika.
6. ANALIZA OGLIJIKA (neobvezno):
Analizator ogljika:
|
Steklenica |
DOC |
% odstranjenega DOC |
Srednja vrednost |
|||
|
Izmerjeni |
Popravljeni |
|||||
|
Voda + preskusna snov |
a |
— |
— |
|||
|
Blato + preskusna snov |
b1 |
b1 – c |
||||
|
Blato + preskusna snov |
b2 |
b2 – c |
||||
|
Blato + preskusna snov |
b3 |
b3 – c |
||||
|
Slepi kontrolni vzorec |
c |
— |
— |
— |
||
![]()
7. PODATKI SPECIFIČNE KEMIČNE ANALIZE
|
Kabčina ostamka preskusne snovi ob koncu preskusa |
% razgradnje |
|
|
Slepi preskus z vodo |
Sb |
|
|
Inokulirani medij |
Sa1 |
|
|
Sa2 |
||
|
Sa3 |
![]()
Izračunamo % razgradnje za steklenice a1, a2, a3.
8. OPOMBE
Priložiti je treba krivuljo BPK v odvisnosti od časa, če je na voljo.
DODATEK 1
OKRAJŠAVE IN OPREDELITEV POJMOV
|
DO |
: |
Raztopljeni kisik (mg/l) je koncentracija kisika, raztopljenega v vodnem vzorcu (dissolved oxygen). |
|
BPK |
: |
Biokemijska potreba po kisiku (g) je količina kisika, ki ga porabijo mikroorganizmi pri presnavljanju preskusne snovi; izražena tudi v g sprejetega kisika na g preskusne snovi. (Glej metodo C.5). |
|
KPK |
: |
Kemijska potreba po kisiku (g) je količina kisika, porabljenega pri oksidaciji preskusne snovi z vročim, kislim dikromatom; predstavlja mero količine prisotne oksidirajoče snovi; izražena tudi v g porabljenega kisika na g preskusne snovi. (Glej metodo C.6). |
|
DOC |
: |
Raztopljeni organski ogljik (dissolved organic carbon) je organski ogljik, ki je prisoten v raztopini ali gre skozi 0,45-mikrometrski filter ali ostane v supernatantu po 15-minutnem centrifugiranju pri 40 000 m.s-2 (± 4 000 g). |
|
TPK |
: |
Teoretična potreba po kisiku (mg) je skupna količina kisika, potrebna za popolno oksidacijo snovi; izračuna se iz molekulske formule (glej Dodatek 2.2) in se izrazi tudi v mg kisika, potrebnega za mg preskusne snovi. |
|
TCO2 |
: |
Teoretični ogljikov dioksid (mg) je količina ogljikovega dioksida, izračunana iz znane ali izmerjene vsebnosti ogljika v preskusni snovi, ki se proizvede ob popolni mineralizaciji snovi; izražena tudi v mg ogljikovega dioksida, razvitega na mg preskusne snovi. |
|
TOC |
: |
Skupni organski ogljik vzorca je vsota organskega ogljika v raztopini in suspenziji (total organic carbon). |
|
IC |
: |
Anorganski ogljik (inorganic carbon). |
|
TC |
: |
Skupni ogljik je vsota organskega in anorganskega ogljika v vzorcu (total carbon). |
Primarna biorazgradnja:
je sprememba kemične strukture snovi, ki jo povzroči biološko delovanje, zaradi česar snov zgubi posebne lastnosti.
Popolna biorazgradnja (aerobna):
je raven biorazgradnje, ki se doseže, ko mikroorganizmi povsem porabijo preskusno snov, pri čemer nastane ogljikov dioksid, voda, mineralne soli in nove mikrobne celične sestavine (biomasa).
Dobro biorazgradljivo:
je arbitrarna razvrstitev snovi, ki so prestale nekatere specifične presejalne preskuse za popolno biorazgradljivost; ker so ti preskusi dovolj strogi, se predpostavlja, da se bodo take snovi v vodnem okolju in aerobnih pogojih hitro in povsem biorazgradile.
Inherentno biorazgradljivo:
razvrstitev snovi, za katere obstajajo nedvoumni dokazi o biorazgradljivosti (primarni ali popolni) iz katerega koli priznanega preskusa biorazgradljivosti.
Možnost čiščenja:
je voljnost snovi za odstranitev med biološkim čiščenjem odpadnih vod, ne da bi to škodovalo normalnemu delovanju čistilnih procesov. Na splošno se dobro biorazgradljive snovi lahko čistijo, ne pa tudi vse inherentno biorazgradljive snovi. Lahko delujejo tudi abiotski procesi.
Čas prilagajanja (lag faza):
je pri preskusu upadanja čas, ki preteče od inokulacije do razgradnje najmanj 10 %. Čas prilagajanja je pogosto zelo spremenljiv in slabo obnovljiv.
Čas razgradnje:
je čas od konca časa prilagajanja do trenutka, ko se doseže 90 % največje ravni razgradnje.
10-dnevno okno:
je obdobje 10 dni, ki se začne takoj, ko se doseže 10-odstotna razgradnja.
DODATEK 2
IZRAČUN IN DOLOČITEV PRIMERNIH ZBIRNIH PARAMETROV
Odvisno od izbrane metode bodo potrebni nekateri zbirni parametri. V naslednjem oddelku je opisana izpeljava teh vrednosti. Uporaba teh parametrov je opisana v posameznih metodah.
1. Vsebnost ogljika
Vsebnost ogljika se izračuna iz znane ali z elementarno analizo določene elementarne sestave preskusne snovi.
2. Teoretična potreba po kisiku (TPK)
Teoretična potreba po kisiku (TPK) se lahko izračuna, če je znana ali je bila z elementarno analizo določena elementarna sestava. Za spojino:
CcHhClclNnNanaOoPpSs
brez nitrifikacije je
![]()
mg/mg
ali z nitrifikacijo
![]()
mg/mg
3. Kemijska potreba po kisiku (KPK)
Kemijska potreba po kisiku (KPK) se določi po metodi C.6.
4. Raztopljeni organski ogljik (DOC)
Raztopljeni organski ogljik (DOC) je po opredelitvi organski ogljik katere koli snovi ali zmesi v vodi, ki gre skozi 0,45-mikrometrski filter.
Iz preskusnih posod vzamemo vzorce in jih takoj filtriramo v filtrirni napravi z uporabo ustreznega membranskega filtra. Prvih 20 ml (kadar uporabimo majhen filter, se ta količina lahko zmanjša) filtrata zavržemo. Za analizo ogljika obdržimo 10–20 ml, kadar injiciramo, lahko tudi manj (volumen odvisen od količine, potrebne za analizator ogljika). Koncentracija DOC se določi z analizatorjem organskega ogljika, ki lahko točno izmeri koncentracijo ogljika, enakovredno ali manjšo od 10 % začetne koncentracije DOC v preskusu.
Filtrirane vzorce, ki jih ne moremo analizirati isti dan, lahko konzerviramo tako, da jih shranimo v hladilniku pri temperaturi 2–4 oC za 48 h ali pod –18 oC za dlje časa.
Opombe:
Membranski filtri so pogosto impregnirani s površinsko aktivnimi snovmi, da postanejo hidrofilni. Tak filter lahko vsebuje več mg topnega organskega ogljika, ki moti določanje biorazgradljivosti. Površinsko aktivne snovi in druge topne organske spojine se s filtrov odstranijo tako, da se filtri trikrat po eno uro kuhajo v vreli deionizirani vodi. Filtri se nato lahko shranijo v vodi za en teden. Če se uporabijo filtrirni vložki za enkratno uporabo, je treba vsako serijo preveriti, ali ne sprošča topnega organskega ogljika.
Odvisno od vrste membranskega filtra se lahko nanj adsorbira preskusna snov. Zato je priporočljivo zagotoviti, da se preskusna snov ne zadrži na filtru.
Namesto filtracije se za določanje razlike med TOC in DOC uporabi 15-minutno centrifugiranje pri 40 000 m sec-2 (4 000 g). Metoda ni zanesljiva pri začetni koncentraciji < 10 mg DOC/l, saj se bodisi ne odstranijo vse bakterije bodisi se ogljik kot del bakterijske plazme ponovno raztopi.
LITERATURA
— (1) Standard Methods for the Examination of Water and Wastewater, 12th ed, Am. Pub. Hlth. Ass., Am. Wat. Poll. Control Fed., Oxygen Demand, 1965, str. 65.
— (2) Wagner, R., Von Wasser, 1976, vol. 46,139.
— (3) DIN-Entwurf 38409 Teil 41 Deutsche Einheitsverfahren zur Wasser-, Abwasser- und Schlammuntersuchung, Summarische Wirkungs- und Stoffkenngröβen (Gruppe H). Bestimmung des Chemischen Sauerstoffbedarfs (CSB) (H 41), Normenausschuβ Wasserwesen (NAW) in DIN Deutsches Institut für Normung e. V.
— (4) Gerike, P., The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol 13 (1), 169.
DODATEK 3
VREDNOTENJE BIORAZGRADLJIVOSTI SLABO TOPNIH SNOVI
Pri preskusih biorazgradljivosti s slabo topnimi snovmi, je treba posebno pozornost posvetiti naslednjim vidikom.
Homogene tekočine bodo redko povzročale težave pri vzorčenju, trdne materiale pa je priporočljivo homogenizirati z ustreznimi sredstvi, da se preprečijo napake zaradi nehomogenosti. Posebej previdni moramo biti, kadar potrebujemo reprezentativne vzorce nekaj miligramov zmesi snovi ali snovi z veliko vsebnostjo nečistot.
Lahko se uporabijo različni načini mešanja med preskusom. Biti moramo previdni, da mešanje ravno zadostuje za dispergiranje snovi, ne povzroči pa pregrevanja, prekomernega penjenja in prekomernih strižnih sil.
Lahko se uporabi emulgator, ki daje stabilne disperzije snovi. Ne sme biti strupen za bakterije in ne sme se biorazgraditi ali povzročiti penjenja v pogojih preskusa.
Za topila veljajo enaka merila, kakor za emulgatorje.
Ni priporočljivo uporabljati trdnih nosilcev za trdne preskusne snovi, so pa lahko primerni za oljaste snovi.
Kadar se uporabijo pomožne snovi, kot so emulgatorji, topila in nosilci, je treba izvesti preskus na slepem vzorcu, ki vsebuje pomožno snov.
Za preučevanje biorazgradljivosti slabo topnih snovi se lahko uporabi kateri koli od treh respirometričnih preskusov: CO2, BPK, MITI.
LITERATURA
— de Morsier, A. et al., Biodegradation tests for poorly soluble compounds. Chemosphere, 1987, vol. 16, 833.
— Gerike, P., The Biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13, 169.
DODATEK 4
VREDNOTENJE BIORAZGRADLJIVOSTI SNOVI, ZA KATERE SE SUMI, DA SO STRUPENE ZA INOKULUM
Kadar se na snovi opravi preskus dobre biorazgradljivosti in je videti, da snov ni biorazgradljiva, se priporoča naslednji postopek, če je treba razlikovati med inhibicijo in inertnostjo (Reynolds et al., 1987).
Za preskuse strupenosti in biorazgradljivosti je treba uporabiti podobne ali enake inokulume.
Za oceno strupenosti snovi, preučevanih v preskusih biorazgradljivosti, se zdi primerno uporabiti eno od metod inhibicije stopnje respiracije blata (preskus inhibicije respiracije aktivnega blata – Direktiva 88/302/EGS), BPK in/ali metod inhibicije rasti oziroma kombinacijo teh metod.
Če je treba preprečiti inhibicijo zaradi strupenosti, je priporočljivo pri preskušanju dobre biorazgradljivosti uporabiti koncentracije preskusne snovi, ki so manjše od 1/10 vrednosti EC50 (ali manjše od vrednosti EC20), dobljenih pri preskušanju strupenosti. Snovi z vrednostjo EC50 nad 300 mg/l, verjetno ne bodo imele strupenega učinka pri preskušanju dobre biorazgradljivosti.
Vrednosti EC50, manjše od 20 mg/l, bodo verjetno predstavljale resen problem pri nadaljnjem preskušanju. Treba je uporabiti majhne koncentracije preskusne snovi ter posledično uporabiti strog in občutljiv preskus z zaprto steklenico ali material, označen s 14C. Po drugi strani lahko aklimatiziran inokulum omogoči uporabo večjih koncentracij preskusne snovi. Vendar se v tem drugem primeru izgubi specifično merilo preskusa dobre biorazgradljivosti.
LITERATURA
(1) Reynolds, L. et al., Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 1987, vol. 16, 2259.
DODATEK 5
POPRAVEK SPREJEMA KISIKA ZARADI VPLIVA NITRIFIKACIJE
Napake zaradi neupoštevanja nitrifikacije pri določanju biorazgradljivosti z merjenjem sprejema kisika so pri preskusnih snoveh, ki ne vsebujejo N, zanemarljive (največ 5 %), tudi če se oksidacija amonijskega dušika kdaj pa kdaj pojavlja v preskusnih posodah in tistih s slepim vzorcem. Lahko pa nastanejo resne napake, kadar preskusna snov vsebuje N.
Če je prišlo do nitrifikacije, ki pa ni popolna, se opaženi sprejem kisika v reakcijski zmesi lahko popravi za količino kisika, porabljenega za oksidacijo amoniaka do nitrita in nitrata, če se določijo spremembe koncentracije nitrita in nitrata med inkubacijo, z upoštevanjem naslednjih enačb:
|
2 NH4Cl + 3O2 = 2 HN O2 + 2 HCI + 2 H2O |
(1) |
|
2 HNO2 + O2 = 2 HNO3 |
(2) |
|
Torej: |
|
|
2 NH4Cl + 4 O2 = 2 HNO3 + 2 HCl + 2 H2O |
(3) |
Po enačbi (1) je količina kisika, ki jo 28 g dušika v amonijevem kloridu (NH4Cl) porabi pri oksidaciji do nitrita, enaka 96 g, faktor je torej 3,43 (96/28). Po enačbi (3) pa je količina kisika, ki jo porabi 28 g dušika pri oksidaciji do nitrata, enaka 128 g, kar pomeni faktor 4,57 (128/28).
Ker sta reakciji zaporedni, saj potekata v ločenih in različnih bakterijskih vrstah, se koncentracija nitrita lahko poveča ali zmanjša; v drugem primeru se bo proizvedla ekvivalentna koncentracija nitrata. Količina kisika, porabljenega pri tvorbi nitrata, je torej 4,57 pomnoženo s povečanjem koncentracije nitrata, medtem ko je količina kisika, povezana z nastajanjem nitrita, enaka 3,43 pomnoženo s povečanjem koncentracije nitrita oziroma pri zmanjšanju koncentracije nitrita je izguba kisika enaka - 3,43 pomnoženo s zmanjšanjem koncentracije.
To je:
|
O2, porabljen pri tvorbi nitrata = 4,57 × povečanje koncentracije nitrata |
(4) |
|
in |
|
|
O2, porabljen pri tvorbi nitrita = 3,43 × povečanje koncentracije nitrita |
(5) |
|
in |
|
|
O2, izgubljen pri izginjanju nitrita = - 3,43 × zmanjšanje koncentracije nitrata |
(6) |
|
Tako da je |
|
|
sprejem O2 zaradi nitrifikacije = ± 3,43 × sprememba konc. nitrita + 4,57 × povečanje (7) konc. nitrata |
(7) |
|
in |
|
|
O2 sprejem zaradi oksidacije C = celotni opaženi sprejem – sprejem zaradi nitrifikacije |
(8) |
Če se določi le skupni oksidirani N, se lahko za prvi približek šteje, da je sprejem kisika zaradi nitrifikacije enak 4,57 × povečanje oksidiranega N.
Popravljena vrednost porabe kisika zaradi oksidacije C se primerja s TPK NH3, kakor se izračuna v Dodatku 2.
C.5 RAZGRADNJA – BIOKEMIJSKA POTREBA PO KISIKU
1. METODA
1.1 UVOD
Namen te metode je izmeriti biokemijsko potrebo po kisiku (BPK) trdnih ali tekočih organskih snovi.
Podatki, pridobljeni s tem preskusom, se nanašajo na vodotopne snovi; lahko pa se, vsaj načeloma, preskušajo tudi hlapne snovi in tiste, slabo topne v vodi.
Ta metoda se uporablja samo za tiste organske preskusne snovi, ki ne zavirajo bakterij pri koncentraciji, uporabljeni pri preskusu. Če preskusna snov ni topna pri preskusni koncentraciji, bodo morda potrebni posebni ukrepi, kot je uporaba ultrazvočnega dispergiranja, da se doseže dobra disperzija preskusne snovi.
Podatki o strupenosti snovi so lahko uporabni za razlago nizkih rezultatov in za izbiro primernih preskusnih koncentracij.
1.2 OPREDELITVE IN ENOTE
BPK je opredeljen kot masa raztopljenega kisika, potrebna za biokemijsko oksidacijo določenega volumna raztopine snovi pod predpisanimi pogoji.
Rezultati se izrazijo v gramih BPK na gram preskusne snovi.
1.3 REFERENČNE SNOVI
Zaželena je uporaba ustrezne referenčne snovi za preverjanje aktivnosti inokuluma.
1.4 PRINCIP PRESKUSNE METODE
Vnaprej določena količina snovi, raztopljene ali dispergirane v dobro prezračenem primernem mediju, se inokulira z mikroorganizmi in inkubira v temi pri konstantni določeni temperaturi okolja.
BPK se določi iz razlike v vsebnosti raztopljenega kisika na začetku in na koncu preskusa. Preskus mora trajati najmanj pet dni in največ 28 dni.
Vzporedno je treba opraviti slepi preskus z vzorcem brez preskusne snovi.
1.5 MERILA KAKOVOSTI
Določitev BPK se ne šteje za veljavno določitev biorazgradljivosti snovi. Ta preskus se lahko upošteva le kot presejalni preskus.
1.6 OPIS POSKUSNE METODE
Pripravi se predhodna raztopina ali disperzija snovi, tako da se dobi koncentracija BPK, ki je združljiva z uporabljeno metodo. Nato se določi BPK po kateri koli ustrezni nacionalni ali mednarodni standardizirani metodi.
2. PODATKI IN OCENA
BPK v predhodni raztopini se izračuna po izbrani normirani metodi in pretvori v grame BPK na gram preskusne snovi.
3. POROČANJE
Navede se uporabljena metoda.
Biokemijska potreba po kisiku mora biti srednja vrednost najmanj treh veljavnih meritev.
Poročati je treba o vseh informacijah in opombah, pomembnih za razlago rezultatov, zlasti glede nečistot, agregatnega stanja, strupenih učinkov in notranje sestave snovi, ki bi lahko vplivale na rezultate.
Poročati je treba o uporabi dodatka za zaviranje biološke nitrifikacije.
4. VIRI
Seznam standardiziranih metod, na primer:
(1) NF T 90 – 103: Determination of the biochemical oxygen demand.
(2) NBN 407: Biochemical oxygen demand.
(3) NEN 3235 5.4: Bepaling van het biochemish zuurstofverbruik (BZV).
(4) The determination of biochemical oxygen demand, Methods for the examination of water and associated materials, HMSO, London.
(5) ISO 5815: Determination of biochemical oxygen demand after n days.
C.6 RAZGRADNJA – KEMIJSKA POTREBA PO KISIKU
1. METODA
1.1 UVOD
Namen te metode je izmeriti kemijsko potrebo po kisiku (KPK) trdnih ali tekočih organskih snovi na standardni način, pod določenimi laboratorijskimi pogoji.
Za izvedbo tega preskusa in razlago dobljenih rezultatov bodo uporabne informacije o formuli snovi (npr. halogenidi, železove soli organskih spojin, organoklorove spojine).
1.2 OPREDELITVE IN ENOTE
Kemijska potreba po kisiku je mera oksidacije snovi, izražena kot količina kisika ekvivalentna količini oksidacijskega reagenta, ki jo porabi snov pod določenimi laboratorijskimi pogoji.
Rezultat se izrazi v gramih KPK na gram preskusne snovi.
1.3 REFERENČNE SNOVI
Referenčnih snovi ni treba uporabiti vsakokrat, ko se preučuje nova snov. Predvsem naj bi se uporabljale za občasno umerjanje metode in za omogočanje primerjave rezultatov pri uporabi druge metode.
1.4 PRINCIP PRESKUSNE METODE
Vnaprej določena količina snovi, raztopljene ali dispergirane v vodi, se dve uri oksidira s kalijevim dikromatom v mediju s koncentrirano žveplovo kislino in s srebrovim sulfatom kot katalizatorjem pod povratnim hladilnikom. Ostanek dikromata se določi s titracijo s standardiziranim železo-amonijevim sulfatom.
Pri snoveh, ki vsebujejo klor, se doda živosrebrov sulfat ( 26 ) da se zmanjšanja motnja zaradi klorida.
1.5 MERILA KAKOVOSTI
Zaradi arbitrarnega načina določanja je KPK „indikator oksidacije“ in se kot tak uporablja kot praktični način merjenja organskih snovi.
Klorid lahko moti ta preskus; določanje KPK lahko motijo tudi anorganski reducenti ali oksidanti.
Nekatere ciklične spojine in mnoge hlapne spojine (npr. nižje maščobne kisline) se pri tem preskusu ne oksidirajo popolnoma.
1.6 OPIS PRESKUSNE METODE
Pripravi se predhodna raztopina ali disperzija snovi, tako da se dobi KPK med 250 in 600 mg na liter.
Opombe:
Pri snoveh, ki so slabo topne ali se jih ne da dispergirati, se lahko zatehta količina fino uprašene snovi ali tekoče snovi, ki ustreza približno 5 mg KPK, in se da v preskusno aparaturo z vodo.
Pogosto, zlasti pri slabo topnih snoveh, je kemijsko potrebo po kisiku (KPK) bolj primerno določiti po različici metode, t.j. v zaprtem sistemu z napravo za izravnavo tlaka (H. Kelkenberg, 1975). S to prilagojeno metodo se pogosto lahko uspešno kvantitativno določijo snovi, ki se s konvencionalno metodo le stežka določijo – npr. ocetna kislina. Vendar je v primeru piridina tudi ta metoda neuspešna. Če se koncentracija kalijevega dikromata, predpisana v viru (1), poveča na 0,25 N (0,0416 M), se lažje neposredno zatehta 5–10 mg snovi, kar je bistveno za določanje KPK slabo topnih snovi (vir (2)).
V drugih primerih se nato določi KPK po kateri koli ustrezni nacionalni ali mednarodni standardizirani metodi.
2. PODATKI IN OCENA
KPK v preskusni bučki se izračuna po izbrani normirani metodi in pretvori v grame KPK na gram preskusne snovi.
3. POROČANJE
Treba je navesti uporabljeno referenčno metodo.
Kemijska potreba po kisiku mora biti srednja vrednost najmanj treh meritev. Poročati je treba o vseh informacijah in opombah, pomembnih za razlago rezultatov, zlasti glede nečistot, agregatnega stanja in notranjih lastnosti snovi (če so znane), ki bi lahko vplivale na rezultate.
Treba je poročati o uporabi živosrebrovega sulfata za zmanjšanje motnje zaradi klorida.
4. VIRI
(1) Kelkenberg, H.,Z. von Wasser und Abwasserforschung, 1975, vol. 8, 146.
(2) Gerike, P. The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13, 169.
Seznam standardiziranih metod, na primer:
NBN T 91–201 Determination of the chemical oxygen demand.
ISBN O 11 7512494 Chemical oxygen demand (dichromate value) of polluted and waste waters.
NF T 90–101 Determination of the chemical oxygen demand.
DS 217 = water analysis Determination of the chemical oxygen demand.
DIN 38409-H-41 Determination of the chemical oxygen demand (COD) within the range above 15 mg per litre.
NEN 3235 5.3 Bepaling van het chemisch zuurstofverbruik.
ISO 6060 Water quality: chemical oxygen demand dichromate methods.
C.7 RAZGRADNJA – ABIOTSKA RAZGRADNJA: HIDROLIZA KOT FUNKCIJA pH
1. METODA
Ta preskusna metoda je enakovredna OECD TG 111 (2004).
1.1 UVOD
Kemikalije lahko vstopijo v površinske vode z neposrednim vnosom, razpršenjem, razlitjem, odtekanjem, odlaganjem odpadkov, odpadnimi vodami iz industrije, gospodinjstev in kmetijstva ter odlaganjem iz atmosfere. V teh vodah se lahko pretvorijo s kemijskimi (npr. hidrolizo, oksidacijo), fotokemijskimi in/ali mikrobnimi procesi. V tej smernici je opisana laboratorijska preskusna metoda za določevanje abiotskih hidrolitskih pretvorb kemikalij v vodnih sistemih pri vrednostih pH, ki so v tem okolju običajne (pH 4–9). Ta smernica temelji na obstoječih smernicah (1) (2) (3) (4) (5) (6) (7).
S poskusi se določi (i) hitrost hidrolize preskusne snovi kot funkcijo pH ter (ii) identiteta ali narava in stopnje nastajanja ali razpada produktov hidrolize, ki so jim lahko izpostavljeni organizmi. Te študije so lahko potrebne za kemikalije, ki se neposredno vnašajo v vode, ali kemikalije, za katere je verjetno, da lahko vstopijo v okolje po drugih poteh, ki so opisane zgoraj.
1.2 OPREDELITVE IN ENOTE
Glej Dodatek 2.
1.3 UPORABA METODE
Metoda je splošno uporabna za kemijske snovi (označene ali neoznačene), za katere je na voljo analitska metoda z zadostno natančnostjo in občutljivostjo. Uporabna je za rahlo hlapne in nehlapne spojine, ki so zadostno topne v vodi. Preskus se ne uporablja za kemikalije, ki so zelo hlapne iz vode (npr. fumigante, organska topila) in jih ni mogoče zadržati v raztopini v poskusnih pogojih tega preskusa. Preskus je težko izvesti s snovmi, ki so slabo topne v vodi (8).
1.4 PRINCIP PRESKUSNE METODE
Sterilne vodne pufrske raztopine z različnimi vrednostmi pH (pH 4, 7 in 9) se obdelajo s preskusno snovjo in inkubirajo v temi v nadzorovanih laboratorijskih pogojih (pri konstantnih temperaturah). Po ustreznih časovnih intervalih se na pufrskih raztopinah izvede analiza za preskusno snov in produkte hidrolize. Če je preskusna snov označena (npr. s 14C), je lažje določiti masno ravnovesje.
Ta preskusna metoda je zasnovana kot stopenjski pristop, ki je prikazan in razložen v Dodatku 1. Rezultat vsake stopnje sproži naslednjo stopnjo.
1.5 PODATKI O PRESKUSNI SNOVI
Za določevanje hitrosti hidrolize se lahko uporabijo neoznačena ali označena preskusna snov. Označene snovi je na splošno bolje uporabiti za preučevanje poti hidrolize in za določevanje ravnovesja mase, vendar v posebnih primerih označevanje ni absolutno potrebno. Priporočljivo je označevanje s 14C, vendar se lahko uporabljajo tudi drugi izotopi, npr. 13C, 15N, 3H. Če je možno, se označi(-jo) najbolj stabilen(-lni) del(-i) molekule. Če npr. preskusna snov vsebuje en obroč, je treba označiti ta obroč; če preskusna snov vsebuje dva ali več obročev, pa se lahko opravijo ločene študije za ugotavljanje usode vsakega označenega obroča in za pridobivanje ustreznih podatkov o tvorbi produktov hidrolize. Čistost preskusne snovi mora biti najmanj 95 %.
Pred izvedbo preskusa hidrolize morajo biti na voljo naslednji podatki o preskusni snovi:
(a) topnost v vodi [Preskusna metoda A.6];
(b) topnost v organskih topilih;
(c) parni tlak [Preskusna metoda A.4] in/ali konstanta Henryjevega zakona;
(d) porazdelitveni koeficient n-oktanol/voda [Preskusna metoda A.8];
(e) konstanta disociacije (pKa) [Smernica OECD 112] (9);
(f) hitrost neposredne in posredne fototransformacij e v vodi, kadar j e primerno.
Na voljo morajo biti analitske metode za številčno vrednotenje preskusne snovi ter če je ustrezno za identifikacijo in številčno vrednotenje produktov hidrolize v vodnih raztopinah (glej tudi oddelek 1.7.2).
1.6 REFERENČNE SNOVI
Po možnosti je treba uporabiti referenčne snovi za identifikacijo in številčno vrednotenje produktov hidrolize s spektroskopskimi in kromatografskimi metodami ali drugimi ustrezno občutljivimi metodami.
1.7 MERILA KAKOVOSTI
1.7.1 Analitski izkoristek
Analiza najmanj dvojnika pufrskih raztopin ali njihovih ekstraktov neposredno po dodatku preskusne snovi ponuja prve kazalce ponovljivosti analitske metode in enakomernosti uporabe postopka za preskusno snov. Izračun analitskih izkoristkov v kasnejših stopnjah poskusov omogočajo ustrezna masna ravnovesja (če se uporabi označena snov). Analitski izkoristki morajo biti v območju 90 % do 110 % za označene in neoznačene kemikalije (7). Če je doseganje tega območja tehnično zahtevno, je sprejemljiv analitski izkoristek 70 % za neoznačene kemikalije, vendar je za to potrebna utemeljitev.
1.7.2 Ponovljivost in občutljivost analitske metode
Ponovljivost analitskih metod, uporabljenih za številčno vrednotenje preskusne snovi in produktov hidrolize, je v kasnejših stopnjah možno preveriti z analizo istih pufrskih raztopin (ali njihovih ekstraktov) v dvojniku potem, ko je količina produktov hidrolize dovolj velika za številčno vrednotenje.
Analitska metoda mora biti zadostno občutljiva za številčno vrednotenje koncentracij preskusne snovi do 10 % ali manj začetne koncentracije. Če je ustrezno, morajo biti analitske metode tudi zadostno občutljive za številčno vrednotenje produktov hidrolize v 10 % ali več uporabljene koncentracije (kadar koli v študiji) vse do 25 % ali manj najvišje koncentracije.
1.7.3 Intervali zaupanja za podatke kinetike hidrolize
Intervale zaupanja je treba izračunati in predstaviti za vse regresijske koeficiente, konstante hitrosti, razpolovne dobe in druge parametre kinetike (npr. DT50).
1.8 OPIS PRESKUSNE METODE
1.8.1 Oprema in aparatura
Studijo je treba izvesti v steklenih posodah (npr. epruvetah ali majhnih bučkah) v temi in sterilnih pogojih, če je potrebno, razen če predhodni podatki (npr. porazdelitveni koeficient n-oktanol/voda) pokažejo, da se preskusna snov lahko veže na steklo. V teh primerih je morda treba preučiti uporabo alternativnih materialov (npr. teflon). Problem vezave na steklo je možno zmanjšati na enega ali več naslednjih načinov:
— določitev mase preskusne snovi in produktov hidrolize, vezanih na preskusno posodo,
— uporaba ultrazvočne kopeli,
— spiranje vse steklovine s topili ob vsakem vzorčenju,
— uporaba formuliranih proizvodov,
— uporaba večjih količin sotopil pri dodajanju preskusne snovi v sistem; če se uporablja sotopilo, mora biti takšno, da ne povzroči hidrolize preskusne snovi.
Običajno so za inkubacijo različnih preskusnih raztopin potrebne temperaturno nadzorovane stresalne vodne kopeli ali termostatsko nadzorovani inkubatorji.
Potrebna je običajna laboratorijska oprema, zlasti naslednja oprema
— pH-meter,
— analitski instrumenti, kot so oprema za GC, HPLC in TLC, vključno z ustreznimi sistemi detekcije za analizo radioaktivno označenih in neoznačenih snovi ali metodo obratnega redčenja izotopov,
— instrumenti za identifikacijo (npr. MS, GC-MS, HPLC-MS, NMR itn.),
— tekočinski scintilacijski števec,
— separacijski liji za tekočinsko-tekočinsko ekstrakcijo,
— instrumenti za koncentracijo raztopin in ekstraktov (npr. rotacijski evaporator),
— naprava za nadzorovanje temperature (npr. vodna kopel).
Kemijski reagenti so med drugim npr:
— organska topila analitske čistosti, npr. heksan, diklorometan itn.,
— scintilacijska tekočina,
— pufrske raztopine (glej oddelek 1.8.3 za podrobnosti).
Vso steklovino, analitsko čisto vodo in pufrske raztopine, uporabljene v preskusu hidrolize, je treba sterilizirati.
1.8.2 Uporaba preskusne snovi
Preskusna snov se vnese v obliki vodne raztopine v različne pufrske raztopine (glej Dodatek 3). Če je potrebno za zadostno raztapljanje, je za uporabo in porazdelitev preskusne snovi dovoljena uporaba majhnih količin topil, ki se mešajo z vodo (npr. acetonitril, aceton, etanol), vendar ne smejo presegati 1 % v/v. Če je treba uporabiti višje koncentracije (npr. pri slabo topnih preskusnih snoveh), se to dovoli le, kadar je mogoče dokazati, da topilo ne vpliva na hidrolizo preskusnih snovi.
Rutinska uporaba formuliranih proizvodov ni priporočljiva, saj ni možno izključiti vpliva sestavin formule na hidrolizo. Vendar je uporaba formuliranih snovi ustrezna alternativa pri slabo vodotopnih preskusnih snoveh ali snoveh, ki se vežejo na steklo (glej oddelek 1.8.1).
Uporabiti se sme ena koncentracija preskusne snovi; pri čemer njena koncentracija ne sme preseči 0,01 M ali polovice koncentracije nasičenosti (glej Dodatek 1).
1.8.3 Pufrske raztopine
Preskus hidrolize je treba opraviti pri vrednostih pH 4, 7 in 9. Za ta namen je treba pripraviti pufrske raztopine iz kemikalij in vode analitske čistosti. Nekaj uporabnih pufrskih sistemov je navedenih v Dodatku 3. Upoštevati je treba, da lahko uporabljeni pufrski sistem vpliva na hitrost hidrolize, zato je v teh primerih treba uporabiti drug pufrski sistem ( 27 ).
Vrednost pH vsake pufrske raztopine je treba preveriti s kalibriranim pH-metrom z natančnostjo najmanj 0,1 pri zahtevani temperaturi.
1.8.4 Preskusni pogoji
1.8.4.1 Preskusna temperatura
Poskuse hidrolize je treba izvajati pri konstantnih temperaturah. Zaradi ekstrapolacije je pomembno, da se temperatura vzdržuje v mejah vsaj ± 0,5oC.
Če hidrolitsko obnašanje preskusne snovi ni znano, je treba opraviti predhodni poskus (Stopnja 1) pri temperaturi 50 oC. Preskusi kinetike v višjih stopnjah se izvajajo pri najmanj treh temperaturah (vključno s preskusom pri 50 oC), razen če je bila v preskusih Stopnje 1 ugotovljena odpornost preskusne snovi proti hidrolizi. Predlagano temperaturno območje je 10–70 oC (po možnosti z najmanj eno temperaturo pod 25 oC), kar zajema poročevalno temperaturo 25 oC in večino temperatur, ki jih srečamo na terenu.
1.8.4.2 Svetloba in kisik
Vse preskuse hidrolize je treba izvesti z ustrezno metodo, da se preprečijo fotolitski učinki. Izvesti je treba vse ustrezne ukrepe, da se prepreči dostop kisika (npr. 5-minutno vpihavanje mehurčkov helija, dušika ali argona pred pripravo raztopine).
1.8.4.3 Trajanje preskusa
Predhodni poskus mora trajati 5 dni, preskusi višjih stopenj pa se izvajajo, dokler se ne hidrolizira 90 % preskusne snovi ali 30 dni (do česar pride prej).
1.8.5 Izvedba preskusa
1.8.5.1 Predhodni preskus (Stopnja 1)
Predhodni poskus se izvede pri 50 ± 0,5oC in vrednostih pH 4,0, 7,0 in 9,0. Če je hidroliza določena po 5 dneh (t0,5 25 oC > 1 leto) manj kot 10-odstotna, se šteje, da je preskusna snov hidrolitsko stabilna in običajno ni potrebno dodatno preskušanje. Če je znano, da je snov nestabilna pri za okolje ustreznih temperaturah ( 28 ), ni potreben predhodni preskus. Analitska metoda mora biti dovolj natančna in občutljiva za ugotavljanje 10-odstotnega zmanjšanja začetne koncentracije preskusne snovi.
1.8.5.2 Hidroliza nestabilnih snovi (Stopnja 2)
Preskus višje stopnje (napredni preskus) je treba opraviti pri vrednostih pH, pri katerih je bilo v predhodnem poskusu ugotovljeno, da je preskusna snov nestabilna. Pufrske raztopine preskusne snovi je treba termostatirati pri izbranih temperaturah. Za preskušanje obnašanja prvega reda, je treba vsako reakcijsko raztopino analizirati v časovnih intervalih, ki dajo najmanj šest podatkov meritev v ustreznih razmikih med 10- in 90-odstotno hidrolizo preskusne snovi. Posamezne ponovitve preskusnih vzorcev (najmanj duplikatni vzorci v ločenih reakcijskih posodah) je treba odstraniti in vsebino analizirati ob vsakem od najmanj šestih vzorčenj (za najmanj dvanajst podatkovnih točk s ponovitvami). Uporaba enega skupnega vzorca, iz katerega se jemljejo posamezni alikvoti preskusne raztopine v vsakem intervalu vzorčenja, se šteje kot nezadostna, saj ne dopušča analize variabilnosti podatkov in lahko povzroči težave zaradi kontaminacije preskusne raztopine. Ob koncu preskusa višjih stopenj je treba opraviti preskuse potrditve sterilnosti (t.j. po 90-odstotni hidrolizi ali po 30 dneh). Če pa ni ugotovljena razgradnja (t.j. pretvorba), se šteje, da preskusi sterilnosti niso potrebni.
1.8.5.3 Identifikacija produktov hidrolize (Stopnja 3)
Z ustreznimi analitskimi metodami je treba identificirati vse poglavitne produkte hidrolize, vsaj tiste ki znašajo > 10 % uporabljenega odmerka.
1.8.5.4 Izbirni preskusi
Pri hidrolitsko nestabilni preskusni snovi je morda treba opraviti dodatne preskuse pri pH vrednostih, ki so različne od 4, 7 in 9. Npr. za fiziološke namene je morda treba opraviti preskus v bolj kislih pogojih (npr. pH 1,2) in pri eni sami fiziološko ustrezni temperaturi (37 oC).
2. PODATKI
Če je ustrezno, je treba količino preskusne snovi in produktov hidrolize navajati v % uporabljene začetne koncentracije in, kadar je primerno, v mg/L za vsako vzorčenje in vsako vrednost pH in preskusno temperaturo. Če je bila uporabljena označena preskusna snov, je treba navesti tudi masno ravnovesje v odstotkih uporabljene začetne koncentracije.
Narisati je treba grafično predstavitev logaritemsko pretvorjenih koncentracij preskusne snovi v odvisnosti od časa. Opredeliti je treba vse večje produkte hidrolize, vsaj tiste, ki so > 10 % uporabljenega odmerka, in izrisati logaritemsko pretvorjene koncentracije teh snovi na enak način kot za izhodiščno snov, da so prikazane njihove hitrosti nastajanja in izginjanja.
2.1 OBDELAVA REZULTATOV
Z uporabo ustreznega kinetičnega modela je treba natančneje določiti razpolovne dobe ali vrednosti DT50. Razpolovno dobo in/ali vrednosti DT50 (vključno z intervali zaupanja) je treba navesti za vsak pH in temperaturo skupaj z opisom uporabljenega modela, redom kinetike in koeficientom določitve (r2). Kadar je to primerno, je treba izračune opraviti tudi za produkte hidrolize.
V primeru študij hitrosti, opravljenih pri različnih temperaturah, je treba konstante psevdoprvega reda (kobs) opisati kot funkcije temperature. Izračun mora temeljiti tako na ločitvi kobs v konstanti hitrosti za kislinsko katalizirano (kH), nevtralno (kneutral) in bazično katalizirano hidrolizo (KOH) kot na Arrheniusovi enačbi:
![]()
pri čemer je Ai oziroma Bi regresijska konstanta iz preseka oziroma naklona najbolje prirejenih premic, ki nastanejo pri linearni regresiji ln ki v odvisnosti od obratne vrednosti absolutne temperature v kelvinih (T). Z Arrheniusovimi odvisnostmi za kislinsko, nevtralno in bazično katalizirano hidrolizo se lahko izračunajo konstante hitrosti psevdoprvega reda in s tem razpolovne dobe za druge temperature, pri katerih neposrednega določevanja konstante hitrosti v poskusu ni možno izvesti (10).
2.2 VREDNOTENJE IN RAZLAGA REZULTATOV
Večina hidrolitskih reakcij navidezno sledi konstantam prvega reda in so zato razpolovne dobe neodvisne od koncentracije (glej enačbo 4 v Dodatku 2). To običajno dovoljuje uporabo laboratorijskih rezultatov določenih pri 10-2 do 10-3 M na okoljske pogoje (< 10-6 M) (10). Mabey in Mill (11) sta navedla več primerov dobrega ujemanja med hitrostmi hidrolize, izmerjenimi v čistih in naravnih vodah za različne kemikalije, pod pogojem, da sta bila izmerjena pH in temperatura.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati najmanj naslednje podatke:
Preskusna snov:
— splošno ime, kemijsko ime, številka CAS, strukturna formula (v kateri je naveden položaj označevalca, če je bila uporabljena radioaktivno označena snov) in zadevne fizikalno-kemijske lastnosti (glej točko 1.5),
— čistost (nečistoče) preskušene snovi,
— čistost označevalca označene kemikalije in molarna aktivnost (kadar je primerno).
— Pufrske raztopine:
— datum in podrobnosti priprave,
— uporabljeni pufri in vode,
— molarnost in pH pufrskih raztopin.
Preskusni pogoji:
— datumi izvedbe študij,
— količina uporabljene preskusne snovi,
— metode in topila (vrsta in količina), uporabljene pri uporabi preskusne snovi,
— inkubirani volumen puferirane preskusne snovi,
— opis uporabljenega inkubacij skega sistema,
— pH in temperatura med študijo,
— časi vzorčenja,
— metoda(-e) ekstrakcije,
— metode za številčno vrednotenje in identifikacijo preskusne snovi ter njenih produktov hidrolize v pufrskih raztopinah,
— število ponovitev.
Rezultati:
— ponovljivost in občutljivost uporabljene analitske metode,
— analitski izkoristki (odstotne vrednosti za veljavnost raziskave so navedene v točki 1.7.1),
— podatki za ponovitve in povprečne vrednosti v tabeli,
— masno ravnotežje med študijo in pri koncu študije (če je bila uporabljena označena preskusna snov),
— rezultati predhodnega preskusa,
— razprava o rezultatih in interpretacija rezultatov,
— vsi izvirni podatki in slike.
Naslednji podatki so potrebni le pri določevanju hitrosti hidrolize:
— grafi koncentracij v odvisnosti od časa za preskusne snovi in, kadar je primerno, za produkte hidrolize pri vsaki vrednosti pH in temperaturi,
— tabele rezultatov Arrheniusove enačbe za temperaturo 20 oC/25 oC s pH, hitrostno konstanto [h-1 ali dan-1], razpolovno dobo ali DT50, temperaturami [ oC] in intervali zaupanja ter koeficienti korelacije (r2) ali primerljivimi podatki,
— predlagane poti hidrolize.
4. LITERATURA
(1) OECD (1981). Hydrolysis as a Function of pH. OECD Guideline for Testing of ChemicalsNr. 111, adopted 12 May 1981.
(2) US-Environmental Protection Agency (1982). 40 CFR 796.3500, Hydrolysis as a Function of pH at 25 oC. Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
(3) Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
(4) European Union (EU) (1995). Commission Directive 95/36/EC amending Council Directive 91/414/EEC concerning the placing of plant protection products on the market. Annex V: Fate and Behaviour in the Environment.
(5) Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
(6) BBA (1980). Merkblatt Nr. 55, Teil I und II: Prüfung des Verhaltens von Pflanzenbehandlungsmitteln im Wasser (October 1980).
(7) SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
(8) OECD (2000). Guidance document on aquatic toxicity testing of difficult substances and mixtures, OECD Environmental Health and Safety Publications Series on Testing and Assessment Nr. 23.
(9) OECD (1993). Guidelines for the Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6–11 to Guidelines for the Testing of Chemicals.
(10) Nelson, H, Laskowski D, Thermes S, and Hendley P. (1997) Recommended changes in pesticide fate study guidelines for improving input to computer models. (Text version of oral presentation at the 14th Annual Meeting of the Society of Environmental Toxicology and Chemistry, Dallas TX, November 1993).
(11) Mabey, W. and Mill, T. (1978). Critical review of hydrolysis of organic compounds in water under environmental conditions. J. Phys. Chem. Ref. Data 7, 383–415.
DODATEK 1
Stopenjski preskus hidrolize

DODATEK 2
Opredelitve in enote
V vseh primerih je treba uporabiti standardne mednarodne enote (SI).
Preskusna snov: vsaka snov, ki je lahko izhodiščna spojina ali ustrezen produkt pretvorbe.
Produkt pretvorbe: vse snovi, ki nastanejo zaradi biotskih ali abiotskih pretvorbenih reakcij preskusne snovi.
Produkti hidrolize: vse snovi, ki nastanejo zaradi hidrolitskih pretvorbenih reakcij preskusne snovi.
Hidroliza je reakcija preskusne snovi RX z vodo, pri kateri je v reakcijskem središču prišlo do neto zamenjave skupine X z OH:
|
RX + HOH → ROH + HX |
[1] |
Hitrost manjšanja koncentracije RX v tem poenostavljenem postopku opisuje
|
hitrost = k [H2O] [RX] |
reakcija drugega reda |
|
ali |
|
|
hitrost = k [RX] |
reakcija drugega reda |
odvisno od stopnje, ki omejuje hitrost. Ker količina vode znatno presega količino preskusne snovi, se ta vrsta reakcije običajno opiše kot reakcija psevdoprvega reda, pri kateri konstanto opazovane hitrosti določa razmerje
|
kobs = k [H2O] |
[2] |
in se lahko določi po enačbi ( 29 )
|
|
[3] |
pri čemer je
t = čas
in C0, Ct = koncentraciji snovi (RX) ob času 0 in t.
Enota te konstante je (čas)-1 in razpolovna doba (čas, potreben za reagiranje 50 % preskusne snovi) je
|
|
[4] |
Razpolovna doba: (t0,5) je čas, potreben za 50-odstotno nidrolizo preskusne snovi, ce lahko reakcijo opišemo s kinetiko prvega reda: ni odvisna od koncentracije.
DT 50 (Čas razpada 50): je čas, v katerem se koncentracija preskusne snovi zniža za 50 %; se razlikuje od razpolovne dobe t0,5, če reakcija ne sledi kinetiki prvega reda.
Ocena k pri različnih temperaturah
Kadar je konstanta hitrosti znana za dve temperaturi, lahko konstante hitrosti pri drugih hitrostih izračunamo z Arrheniusovo enačbo:
![]()
ali
![]()
Graf ln k v odvisnosti od l/T je ravna črta z naklonom –E/R
pri čemer je:
|
k |
= |
konstanta hitrosti, izmerjena pri različnih temperaturah |
|
E |
= |
aktivacijska energija [kJ/mol] |
|
T |
= |
absolutna temperatura [K] |
|
R |
= |
plinska konstanta [8,314 J/mol.K] |
Aktivacijska energija je bila izračunana z regresijsko analizo ali naslednjo enačbo:

pri čemer je: T2 > T1.
DODATEK 3
Pufrski sistemi
A. CLARK IN LUBS:
Pufrske zmesi po CLARKU in LUBSU ( 30 )
|
Sestava |
pH |
|
0,2 N HCl IN 0,2 N KCl PRI 20 oC |
|
|
47,5 ml HCl + 25 ml KCl razredč. do 100 ml |
1,0 |
|
32,25 ml HCl + 25 ml KCl razredč. do 100 ml |
1,2 |
|
20,75 ml HCl + 25 ml KCl razredč. do 100 ml |
1,4 |
|
13,15 ml HCl + 25 ml KCl razredč. do 100 ml |
1,6 |
|
8,3 ml HCl + 25 ml KCl razredč. do 100 ml |
1,8 |
|
5,3 ml HCl + 25 ml KCl razredč. do 100 ml |
2,0 |
|
3,35 ml HCl + 25 ml KCl razredč. do 100 ml |
2,2 |
|
0,1 M kalijevega biftalata + 0,1 N HCl pri 20 oC |
|
|
46,70 ml 0,1 N HCl + 50 ml biftalata do 100 ml |
2,2 |
|
39,60 ml 0,1 N HCl + 50 ml biftalata do 100 ml |
2,4 |
|
32,95 ml 0,1 N HCl + 50 ml biftalata do 100 ml |
2,6 |
|
26,42 ml 0,1 N HCl + 50 ml biftalata do 100 ml |
2,8 |
|
20,32 ml 0,1 N HCl + 50 ml biftalata do 100 ml |
3,0 |
|
14,70 ml 0,1 N HCl + 50 ml biftalata do 100 ml |
3,2 |
|
9,90 ml 0,1 N HCl + 50 ml biftalata do 100 ml |
3,4 |
|
5,97 ml 0,1 N HCl + 50 ml biftalata do 100 ml |
3,6 |
|
2,63 ml 0,1 N HCl + 50 ml biftalata do 100 ml |
3,8 |
|
0,1 M kalijev biftalat + 0,1 N NaOH pri 20 oC |
|
|
0,40 ml 0,1 N NaOH + 50 ml biftalata do 100 ml |
4,0 |
|
3,70 ml 0,1 N NaOH + 50 ml biftalata do 100 ml |
4,2 |
|
7,50 ml 0,1 N NaOH + 50 ml biftalata do 100 ml |
4,4 |
|
12,15 ml 0,1 N NaOH + 50 ml biftalata do 100 ml |
4,6 |
|
17,70 ml 0,1 N NaOH + 50 ml biftalata do 100 ml |
4,8 |
|
23,85 ml 0,1 N NaOH + 50 ml biftalata do 100 ml |
5,0 |
|
29,95 ml 0,1 N NaOH + 50 ml biftalata do 100 ml |
5,2 |
|
35,45 ml 0,1 N NaOH + 50 ml biftalata do 100 ml |
5,4 |
|
39,85 ml 0,1 N NaOH + 50 ml biftalata do 100 ml |
5,6 |
|
43,00 ml 0,1 N NaOH + 50 ml biftalata do 100 ml |
5,8 |
|
45,45 ml 0,1 N NaOH + 50 ml biftalata do 100 ml |
6,0 |
Pufrske zmesi po CLARKU in LUBSU (nadaljevanje)
|
0,1 M monokalijev fosfat + 0,1 N NaOH pri 20 oC |
|
|
5,70 ml 0,1 N NaOH + 50 ml fosfata do 100 ml |
6,0 |
|
8,60 ml 0,1 N NaOH + 50 ml fosfata do 100 ml |
6,2 |
|
12,60 ml 0,1 N NaOH + 50 ml fosfata do 100 ml |
6,4 |
|
17,80 ml 0,1 N NaOH + 50 ml fosfata do 100 ml |
6,6 |
|
23,45 ml 0,1 N NaOH + 50 ml fosfata do 100 ml |
6,8 |
|
29,63 ml 0,1 N NaOH + 50 ml fosfata do 100 ml |
7,0 |
|
35,00 ml 0,1 N NaOH + 50 ml fosfata do 100 ml |
7,2 |
|
39,50 ml 0,1 N NaOH + 50 ml fosfata do 100 ml |
7,4 |
|
42,80 ml 0,1 N NaOH + 50 ml fosfata do 100 ml |
7,6 |
|
45,20 ml 0,1 N NaOH + 50 ml fosfata do 100 ml |
7,8 |
|
46,80 ml 0,1 N NaOH + 50 ml fosfata do 100 ml |
8,0 |
|
0,1 M H3BO3 v 0,1 M KCl + 0,1 N NaOH pri 20 oC |
|
|
2,61 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
7,8 |
|
3,97 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
8,0 |
|
5,90 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
8,2 |
|
8,50 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
8,4 |
|
12,00 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
8,6 |
|
16,30 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
8,8 |
|
21,30 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
9,0 |
|
26,70 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
9,2 |
|
32,00 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
9,4 |
|
36,85 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
9,6 |
|
40,80 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
9,8 |
|
43,90 ml 0,1 N NaOH + 50 ml borove kisline do 100 ml |
10,0 |
B. KOLTHOFF IN VLEESCHHOUWER:
Citratni pufri po KOLTHOFFU in VLEESCHHOUWERJU
|
Sestava |
pH |
|
0,1 M monokalijev citrat in 0,1 N HCl pri 18 oC (1) |
|
|
49,7 ml 0,1 N HCl + 50 ml citrata do 100 ml |
2,2 |
|
43,4 ml 0,1 N HCl + 50 ml citrata do 100 ml |
2,4 |
|
36,8 ml 0,1 N HCl + 50 ml citrata do 100 ml |
2,6 |
|
30,2 ml 0,1 N HCl + 50 ml citrata do 100 ml |
2,8 |
|
23,6 ml 0,1 N HCl + 50 ml citrata do 100 ml |
3,0 |
|
17,2 ml 0,1 N HCl + 50 ml citrata do 100 ml |
3,2 |
|
10,7 ml 0,1 N HCl + 50 ml citrata do 100 ml |
3,4 |
|
4,2 ml 0,1 N HCl + 50 ml citrata do 100 ml |
3,6 |
|
0,1 M monokalijev citrat in 0,1 N NaOH pri 18 oC (1) |
|
|
2,0 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
3,8 |
|
9,0 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
4,0 |
|
16,3 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
4,2 |
|
23,7 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
4,4 |
|
31,5 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
4,6 |
|
39,2 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
4,8 |
|
46,7 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
5,0 |
|
54,2 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
5,2 |
|
61,0 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
5,4 |
|
68,0 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
5,6 |
|
74,4 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
5,8 |
|
81,2 ml 0,1 N NaOH + 50 ml citrata do 100 ml |
6,0 |
|
(1) Dodati droben kristal timola ali podobne snovi, da se prepreči rast plesni. |
|
C. SÖRENSEN:
Zmesi borata po SÖRENSENU
|
Sestava |
Sörensen 18 oC |
Walbum, pH pri |
|||
|
ml boraksa |
ml HCl/NaOH |
10 oC |
40 oC |
70 oC |
|
|
0,05 M boraks + 0,1 N HCl |
|||||
|
5,25 |
4,75 |
7,62 |
7,64 |
7,55 |
7,47 |
|
5,50 |
4,50 |
7,94 |
7,98 |
7,86 |
7,76 |
|
5,75 |
4,25 |
8,14 |
8,17 |
8,06 |
7,95 |
|
6,00 |
4,00 |
8,29 |
8,32 |
8,19 |
8,08 |
|
6,50 |
3,50 |
8,51 |
8,54 |
8,40 |
8,28 |
|
7,00 |
3,00 |
8,08 |
8,72 |
8,56 |
8,40 |
|
7,50 |
2,50 |
8,80 |
8,84 |
8,67 |
8,50 |
|
8,00 |
2,00 |
8,91 |
8,96 |
8,77 |
8,59 |
|
8,50 |
1,50 |
9,01 |
9,06 |
8,86 |
8,67 |
|
9,00 |
1,00 |
9,09 |
9,14 |
8,94 |
8,74 |
|
9,50 |
0,50 |
9,17 |
9,22 |
9,01 |
8,80 |
|
10,00 |
0,00 |
9,24 |
9,30 |
9,08 |
8,86 |
|
0,05 M boraks + 0,1 N NaOH |
|||||
|
10,0 |
0,0 |
9,24 |
9,30 |
9,08 |
8,86 |
|
9,0 |
1,0 |
9,36 |
9,42 |
9,18 |
8,94 |
|
8,0 |
2,0 |
9,50 |
9,57 |
9,30 |
9,02 |
|
7,0 |
3,0 |
9,68 |
9,76 |
9,44 |
9,12 |
|
6,0 |
4,0 |
9,97 |
10,06 |
9,67 |
9,28 |
Zmesi fosfata po SÖRENSEN-u
|
Sestava |
pH |
|
0,0667 M monokalijev fosfat + 0,0667 M dinatrijev fosfat pri 20 oC |
|
|
99,2 ml. KH2PO4 + 0,8 ml Na2HPO4 |
5,0 |
|
98,4 ml. KH2PO4 + 1,6 ml Na2HPO4 |
5,2 |
|
97,3 ml. KH2PO4 + 2,7 ml Na2HPO4 |
5,4 |
|
95,5 ml. KH2PO4 + 4,5 ml Na2HPO4 |
5,6 |
|
92,8 ml. KH2PO4 + 7,2 ml Na2HPO4 |
5,8 |
|
88,9 ml. KH2PO4 + 11,1 ml Na2HPO4 |
6,0 |
|
83,0 ml. KH2PO4 + 17,0 ml Na2HPO4 |
6,2 |
|
75,4 ml. KH2PO4 + 24,6 ml Na2HPO4 |
6,4 |
|
65,3 ml. KH2PO4 + 34,7 ml Na2HPO4 |
6,6 |
|
53,4 ml. KH2PO4 + 46,6 ml Na2HPO4 |
6,8 |
|
41,3 ml. KH2PO4 + 58,7 ml Na2HPO4 |
7,0 |
|
29,6 ml. KH2PO4 + 70,4 ml Na2HPO4 |
7,2 |
|
19,7 ml. KH2PO4 + 80,3 ml Na2HPO4 |
7,4 |
|
12,8 ml. KH2PO4 + 87,2 ml Na2HPO4 |
7,6 |
|
7,4 ml. KH2PO4 + 92,6 ml Na2HPO4 |
7,8 |
|
3,7 ml. KH2PO4 + 96,3 ml Na2HPO4 |
8,0 |
C.8 STRUPENOST ZA DEŽEVNIKE
PRESKUS NA UMETNIH TLEH
1. METODA
1.1 UVOD
Pri tem laboratorijskem preskusu se preskusna snov doda umetnim tlem, v katera se dajo deževniki za 14 dni. Po tem obdobju (in poljubno po sedmih dneh), se pregleda smrtni učinek snovi na deževnike. Preskus ponuja metodo za relativno kratkotrajen pregled učinkov kemikalij na deževnike, po vnosu preko kože ali hrane.
1.2 OPREDELITEV POJMOV IN ENOTA
LC50: Koncentracija snovi, za katero se ocenjuje, da v preskusnem obdobju ubije 50 % preskusnih živali.
1.3 REFERENČNA SNOV
Referenčna snov se uporablja v rednih časovnih presledkih da se prikaže, da se občutljivost preskusnega sistema ni bistveno spremenila.
Kot referenčna snov se priporoča analitsko čisti kloroacetamid.
1.4 PRINCIP PRESKUSA
Tla so spremenljiv medij, zato je treba za ta preskus uporabiti natančno opredeljena umetna ilovnata tla. Odrasli deževniki vrste Eisenia foetida (glej opozorilo v Dodatku) se hranijo v opredeljenih umetnih tleh tretiranih z različnimi koncentracijami preskusne snovi. Vsebina posod se raztrese na pladenj 14 dni (ali sedem dni) po začetku preskusa ter se preštejejo preživeli deževniki pri vsaki koncentraciji.
1.5 MERILA KAKOVOSTI
Preskus je zasnovan tako, da je kolikor je mogoče, ponovljiv glede na preskusni substrat in organizem. Smrtnost v kontrolah na koncu preskusa ne sme presegati 10 %, sicer je preskus neveljaven.
1.6 OPIS PRESKUSNE METODE
1.6.1 Materiali
1.6.1.1
Kot osnovni preskusni substrat se uporabljajo opredeljena umetna tla.
(a) Osnovni substrat (odstotki veljajo za suho maso)
— 10 % šotnega maha (čim bližje pH 5,5 do 6,0 brez kakršnih koli vidnih ostankov rastlin in fino zmlet),
— 20 % gline kaolinit, po možnosti z več kot 50 % kaolinita,
— Približno 69 % industrijskega kremenovega peska (prevladujoči fini pesek z več kot 50 % delcev velikosti 0,05 do 0,2 mm). Če se snov v vodi ne dovolj dispergira, je treba imeti na voljo 10 g tega peska na preskusno posodo za poznejše mešanje s preskusno snovjo,
— Približno 1 % kalcijevega karbonata (CaCO3), zdrobljenega v prah, kemijsko čistega, ki se ga doda, za zvišanje pH na 6,0± 0,5.
(b) Preskusni substrat
Preskusni substrat vsebuje osnovni substrat, preskusno snov in deionizirano vodo.
Vsebnost vode je od 25 do 42 % suhe teže osnovnega substrata. Vsebnost vode v substratu se določi z izsušitvijo vzorca do konstantne teže pri 105 oC. Glavno merilo je, da se umetna tla vlaži do točke, dokler ni stoječe vode. Paziti je treba, da se z mešanjem ustvari enakomerna porazdelitev preskusne snovi in substrata. Poročati je treba o načinu vnosa preskusne snovi v substrat.
(c) Kontrolni substrat
Kontrolni substrat vsebuje osnovni substrat in vodo. Če je uporabljeno dodatno sredstvo, mora dodatna kontrola vsebovati enako količino tega dodatnega sredstva.
1.6.1.2
Steklene posode prostornine približno enega litra (ustrezno pokrite s plastičnimi pokrovi, posodami ali plastičnim filmom z luknjami za prezračevanje), napolnjeni s količino vlažnega preskusnega ali kontrolnega substrata, ki ustreza 500 g substrata suhe teže.
1.6.2 Preskusni pogoji
Posode je treba hraniti v klimatskih komorah pri temperaturi 20 ± 2 oC in pod stalno svetlobo. Jakost svetlobe naj bo 400 do 800 luksov.
Preskusno obdobje traja 14 dni, smrtnost pa je mogoče oceniti tudi sedem dni po začetku preskusa.
1.6.3 Preskusni postopek
Koncentracije preskusne snovi se izrazijo kot masa snovi na suho maso osnovnega substrata (mg/kg).
Razpon koncentracij, ki povzročajo smrtnost od 0 do 100 % se lahko določi s preskusom za ugotavljanje območja, da bi dobili podatke o razponu koncentracij, ki naj bi se jih uporabilo v končnem preskusu.
Snovi je treba preskusiti pri naslednjih koncentracijah: 1 000; 100; 10; 1; 0,1 mg snovi/kilogram preskusnega substrata (suha masa).
Če naj se opravi popoln končni preskus, lahko za preskus za ugotavljanje območja zadostuje že ena preskusna serija na koncentracijo in ena za netretirano kontrolo, pri čemer vsebuje vsaka 10 deževnikov.
Rezultati preskusa za ugotavljanje območja se uporabijo, za izbor najmanj petih koncentracij v geometrijskem zaporedju, ki povzročijo smrtnost od 0 do 100 % in se ločijo med sabo za konstanten faktor, ki ni večji od 1,8.
Preskusi, pri katerih se uporablja navedena zaporedja koncentracij, naj bi omogočili čimbolj natančno določitev vrednost LC50 in njenih mej zaupanja.
V končnem preskusu se uporabijo najmanj štiri preskusne serije na koncentracijo in štiri netretirane kontrole, pri čemer ima vsaka po 10 deževnikov. Rezultati teh ponovitvenih serij se kažejo kot povprečje in standardna deviacija.
Kadar dve zaporedni koncentraciji v razmerju 1,8 povzročita le 0 % in 100 % smrtnost, ti dve vrednosti zadostujeta za določitev razpona, znotraj katerega leži LC50.
Preskusni substrat naj bo, kadar je mogoče, pripravljen brez dodajanja dodatnih sredstev, razen vode. Tik pred začetkom preskusa se emulzija ali disperzija preskusne snovi v deionizirani vodi ali drugem topilu zmeša z osnovnim preskusnim substratom ali pa se enakomerno razprši s finim kromatografskim ali drugim podobnim razpršilom.
Če preskusna snov v vodi ni topna, se lahko raztopi v čim manjši količini ustreznega organskega topila (npr. heksan, aceton ali kloroform).
Za raztapljanje, razpršitev ali emulgiranje preskusne snovi se lahko uporabijo samo tista sredstva, ki hitro izhlapijo. Preskusni substrat je treba pred uporabo prezračiti. Količino izparele vode je treba nadoknaditi. Kontrola mora vsebovati enako količino vsakega dodatnega sredstva.
Če preskusne snovi ni mogoče raztopiti, razpršiti ali emulgirati v organskih topilih, se 10 g mešanice fino zdrobljenega kremenovega peska in količine preskusne snovi, ki je potrebna za tretiranje 500 g suhe teže umetnih tal, zmeša s 490 g suhe teže preskusnega substrata.
Za vsako preskusno serijo se količina vlažnega preskusnega substrata, ki ustreza 500 g suhe teže, postavi v steklene posode, na preskusni substrat pa se položi 10 deževnikov, ki so bili 24 ur kondicionirani v podobnem vlažnem osnovnem substratu, nato pa hitro oprani in posušeni s pomočjo v filtrirnega papirja.
Posode se pokrijejo s preluknjanimi plastičnimi pokrovi, posodami ali filmom, da se prepreči izsuševanje substrata, nakar se jih za 14 dni izpostavi preskusnim pogojem.
Ocene je treba opraviti 14 dni (ali sedem dni) po začetku preskusa. Substrat se raztrese na ploščo iz stekla ali nerjavečega jekla. Pregledajo se deževniki in določi se število preživelih deževnikov. Deževniki veljajo za mrtve, če se ne odzivajo na nežni mehanični stimulus na sprednjem koncu.
Kadar se pregled opravi po sedmih dneh, se posode ponovno napolnijo s substratom, preživeli deževniki pa se ponovno položijo na isti preskusni substrat.
1.6.4 Preskusni organizmi
Preskusni organizmi naj bodo odrasli osebki vrste Eisenia foetida (glej opozorilo v Dodatku) (stari najmanj dva meseca in s klitelumom) 300 do 600 mg mokre teže. (Za metodo razmnoževanja glej Dodatek).
2. PODATKI
2.1 OBDELAVA IN OCENA REZULTATOV
Koncentracije snovi se poročajo z navedbo ustreznih odstotkov mrtvih deževnikov.
Kadar so podatki ustrezni, je treba vrednost LC50 vain meje zaupanja (p = 0,05) določiti z uporabo standardnih metod (Litchfield in Wilcoxon, 1949, za ustrezno metodo). LC50 je treba podati kot mg preskusne snovi na kilogram preskusnega substrata (suha masa).
V tistih primerih, kjer je nagib krivulje koncentracij prestrm, da bi omogočal izračun LC50, zadostuje že grafična določitev te vrednosti.
Kadar dve zaporedni koncentraciji v razmerju 1,8 povzročita le 0 % in 100 % smrtnost, ti dve vrednosti zadostujeta za določitev razpona, znotraj katerega leži LC50.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— izjava, da je bil preskus opravljen v skladu z zgoraj navedenimi merili kakovosti,
— opravljeni preskus (preskus za ugotavljanje območja in/ali končni preskus),
— natančen opis preskusnih pogojev ali izjava, da je bil preskus opravljen v skladu z metodo; poročati je treba o vseh morebitnih odstopanj,
— natančen opis, kako se je preskusno snov vmešalo v osnovni preskusni substrat,
— podatki o preskusnih organizmih (vrsta, starost, srednja vrednost in razpon v teži, pogoji vzdrževanja in razmnoževanja, dobavitelj),
— uporabljena metoda za določitev LC50,
— rezultati preskusa vključno z vsemi uporabljenimi podatki,
— opis opaženih simptomov ali vedenjskih sprememb pri preskusnih organizmih,
— smrtnost v kontrolah,
— LC50 ali najvišja preskusna koncentracija brez smrtnosti in najnižja preskusna koncentracija s 100 % smrtnostjo, 14 dni (ali sedem dni) po začetku preskusa,
— prikaz krivulje koncentracija/odziv,
— rezultati, dobljeni s preskusno snovjo, bodisi v povezavi s dotičnim preskusom bodisi iz predhodnih preskusov kontrole kakovosti.
4. VIRI
(1) OECD, Paris, 1981, Test Guideline 207, Decision of the Council C(81) 30 final.
(2) Edwards, C. A. in Lofty, J. R., 1977, Biology of Earthworms, Chapman and Hall, London, str. 331.
(3) Bouche, M. B., 1972, Lombriciens de France, Ecologie et Systématique, Institut National de la Recherche Agronomique, str. 671.
(4) Litchfield, J. T. in Wilcoxon, F. A simplified method of evaluation dose effect experiments. J. Pharm. Exp. Therap., zv. 96, 1949, str. 99.
(5) Commission of the European Communities, Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms, Report EUR 8714 EN, 1983.
(6) Umweltbunden/Biologische Bundesanstalt fur Land- un Forstwirtschaft, Berlin, 1984, Verfahrensvorschlag „Toxizitatstest am Regenwurm Eisenia foetida in kiinstlichem Boden“, v: Rudolph/Boje, Okotoxologie, ecomed, Landsberg, 1986.
Dodatek
Razmnoževanje in vzdrževanje deževnikov pred preskusom
Za namen razmnoževanja se 30 do 50 odraslih deževnikov postavi v škatlo za razmnoževanje s svežim substratom in se odstrani po 14. dneh. Te živali se lahko uporabijo za nadaljnje razmnoževalne serije. Deževniki, ki se izležejo iz kokonov se, ko so zreli, uporabijo za preskušanje (pod predpisanimi pogoji po dveh ali treh mesecih).
Pogoji vzdrževanja in razmnoževanja
|
Klimatska komora |
: |
temperatura 20 ± 2 oC, po možnosti pod stalno svetlobo (jakost svetlobe 400 do 800 luksov). |
|
Škatle za razmnoževanje |
: |
ustrezne plitve posode prostornine 10 do 20 l. |
|
Substrat |
: |
Vrsta Eisenia foetida se lahko razmnožuje v različnih živalskih iztrebkih. Kot razmnoževalni medij je priporočljiva uporaba mešanice, ki jo do 50 % po prostornini sestavlja šota, 50 % pa kravji ali konjski gnoj. pH vrednost medija mora biti 6 do 7 (uravnavano s kalcijevim karbonatom) in z nizko ionsko prevodnostjo (manj kot 6 mmho ali 0,5 % koncentracije soli). Substrat mora biti vlažen, vendar ne preveč moker. Poleg zgoraj navedene metode je mogoče uporabiti tudi druge uspešne postopke. |
Opomba: Eisenia foetida obstaja v dveh rasah, ki so ju nekateri taksonomi ločili v vrste (Bouche, 1972). Te so morfološko podobne, vendar so za vrsto Eisenia foetida foetida značilne prečne črte ali obroči na nekaterih predelih, medtem ko druga, Eisenia foetida andrei, tega nima in je bolj pisane rdečkaste barve. Kadar je mogoče, je treba uporabiti vrsto Eisenia foetida andrei. Drugo vrsto je mogoče uporabiti, če je na voljo potrebna metodologija.
C.9 BIORAZGRADNJA
ZAHN-WELLENSOV PRESKUS
1. METODA
1.1 UVOD
Namen te metode je ocena možne končne biorazgradljivosti vodotopnih, nehlapljivih organskih snovi, ko so v statičnem preskusu izpostavljene relativno visokim koncentracijam mikroorganizmom.
Pri tem lahko pride do fizikalno-kemijske adsorbcije na suspendiranih trdnih delcih, kar je treba upoštevati pri razlagi rezultatov (glej 3.2).
Snovi, ki se bodo preučevale, se uporabijo v koncentracijah, ki ustrezajo vrednostim DOC v razponu od 50 do 400 mg/liter, ali vrednostim KPK v razponu od 100 do 1 000 mg/liter (DOC = raztopljeni organski ogljik; KPK = kemijska potreba po kisiku). Prednost teh relativno visokih koncentracij je analitska zanesljivost. Spojine s strupenimi lastnostmi lahko odložijo ali zavrejo proces razgradnje.
Pri tej metodi se merjenje koncentracije raztopljenega organskega ogljika ali kemijske potrebe po kisiku uporablja za oceno končne biorazgradljivosti preskusne snovi.
Istočasna uporaba specifične analitske metode lahko omogoči oceno primarne biorazgradnje snovi (izginotje matične kemijske strukture).
Metoda se uporablja le za tiste organske preskusne snovi, ki pri koncentraciji, uporabljeni v preskusu:
— so topne v vodi pod preskusnimi pogoji,
— imajo zanemarljiv parni tlak pod preskusnimi pogoji,
— ne zavirajo bakterij,
— se v preskusnem sistemu adsorbirajo le v omejenih razsežnostih,
— se ne izgubijo iz preskusne raztopine s penjenjem.
Podatki o relativnih deležih glavnih sestavin preskusnega materiala bodo uporabni pri razlagi dobljenih rezultatov, zlasti v primerih, kadar so ti rezultati nizki ali zanemarljivi.
Podatki o strupenosti snovi za mikroorganizme so zaželeni pri razlagi nizkih rezultatov in pri izbiranju ustreznih preskusnih koncentracij.
1.2 OPREDELITVE POJMOV IN ENOTE
Obseg razgradljivosti, dosežen na koncu preskusa, se navede kot „Biorazgradljivost v Zahn-Wellensovem preskusu“:

pri čemer je:
|
DT |
= |
biorazgradnja (%) v času T, |
|
CA |
= |
vrednosti DOC (ali KPK) v preskusni mešanici, izmerjene tri ure po začetku preskusa (mg/l) (DOC = raztopljeni organski ogljik, KPK = kemijska potreba po kisiku), |
|
CT |
= |
vrednosti DOC ali KPK v preskusni mešanici v času vzorčenja (mg/l), |
|
CB |
= |
vrednosti DOC ali KPK negativne kontrole v času vzorčenja (mg/l), |
|
CBA |
= |
vrednosti DOC ali KPK negativne kontrole, izmerjene tri ure po začetku preskusa (mg/l). |
Obseg razgradljivosti se zaokroži na najbližji celi odstotek.
Odstotek razgradnje se navede kot odstotek odstranitve DOC (ali KPK) preskusne snovi.
Razlika med izmerjeno vrednostjo po treh urah in izračunano ali, po možnosti, izmerjeno začetno vrednostjo lahko da uporabne podatke o odstranitvi snovi (glej 3.2, Razlaga rezultatov).
1.3 REFERENČNE SNOVI
V nekaterih primerih, kadar se preiskujejo nove snovi, so referenčne snovi lahko uporabne; vendar pa posebej določene referenčne snovi še ni mogoče priporočiti.
1.4 PRINCIP PRESKUSNE METODE
V eno do štiri litrsko stekleno posodo opremljeno s mešalom in prezračevalom se skupaj vnese aktivno blato, mineralne hranilne snovi in preskusni material kot edini vir ogljika v vodni raztopini. Zmes se meša in prezračuje pri 20 do 25 oC pod razpršeno svetlobo ali v temnem prostoru do 28 dni. Potek razgradnje se spremlja z določanjem vrednosti DOC (ali KPK) v filtrirani raztopini dnevno ali v drugih ustreznih rednih časovnih presledkih. Razmerje med izločenim DOC (ali KPK) po vsakem časovnem presledku in vrednostjo tri ure po začetku, se prikaže kot odstotek biorazgradnje in služi kot merilo obsega razgradnje v tem času. Rezultat se prikaže v odvisnosti od časa, da se dobi krivulja biorazgradnje.
Kadar je uporabljena specifična analitska metoda, se lahko izmerijo spremembe v koncentraciji matične molekule, ki so posledica biorazgradnje (primarna biorazgradljivost).
1.5 MERILA KAKOVOSTI
Ponovljivost tega preskusa je bila dokazana v krožnem preskusu.
Občutljivost metode se na splošno določi s spremenljivostjo negativne kontrole in, v manjši meri, z natančnostjo s katero je mogoče določiti raztopljen organski ogljik in količino preskusne spojine v raztopini.
1.6 OPIS PRESKUSNEGA POSTOPKA
1.6.1 Priprave
1.6.1.1
Preskusna voda: pitna voda z vsebnostjo organskega ogljika < 5 mg/liter. Skupna koncentracija ionov kalcija in magnezija ne sme presegati 2,7 mmol/liter, sicer je potrebno ustrezno razredčenje z deionizirano ali destilirano vodo.
|
Žveplena kislina, analitski reagent (A.R.): |
50 g/l |
|
Raztopina natrijevega hidroksida A.R.: |
40 g/l |
|
Mineralna hranilna raztopina: raztopiti v enem litru deionizirane vode: |
|
|
amonijev klorid, NH4Cl, A.R.: |
38,5 g |
|
natrijev dihidrogenfosfat, NaH2PO4.2H2O, A.R.: |
33,4 g |
|
kalijev dihidrogenfosfat, KH2PO4, A.R.: |
8,5 g |
|
dikalijev monohidrogenfosfat, K2HPO4, A.R.: |
21,75 g |
Zmes služi kot hranilni in pufrski sistem.
1.6.1.2
Steklene posode s prostornino od enega do štirih litrov (npr. cilindrične posode).
Mešalec s steklenim ali kovinskim mešalom na primerni ročici (mešalec naj rotira približno 5 do 10 cm nad dnom posode). Namesto tega se lahko uporabi magnetno mešalo s 7 do 10 cm dolgim telesom.
Steklena cev notranjega premera 2 do 4 mm za dotok zraka. Odprtina cevi naj bo približno 1 cm nad dnom posode.
Centrifuga (približno 3 550 g).
Merilec pH vrednosti.
Merilec raztopljenega kisika.
Papirni filtri.
Naprave za membransko filtracijo.
Filtrirne membrane z velikostjo por 0,45 μm. Filtrirne membrane so primerne, če je zagotovljeno, da ne izpuščajo ogljika in ne absorbirajo snovi med filtriranjem.
Analitska oprema za določanje vsebnosti organskega ogljika in kemijske potrebe po kisiku.
1.6.1.3
Aktivno blato iz biološke čistilne naprave se spere s (ponavljajočim) centrifugiranjem ali usedanjem v preskusni vodi (zgoraj).
Aktivno blato mora biti v ustreznem stanju. Takšno blato je na voljo v primerno delujoči čistilni napravi odpadnih vod. Da bi dobili čim več različnih vrst ali sevov bakterij, je priporočljivo zmešati inokulume iz različnih virov (npr. različne čistilne naprave, ekstrakti tal, rečnih vod, itd.). Mešanico je treba tretirati, kot je opisano zgoraj.
Za preverjanje aktivnosti aktivnega blata glej točko „Funkcionalni nadzor“ spodaj.
1.6.1.4
V preskusno posodo dodajte 500 ml preskusne vode, 2,5 ml/liter mineralne hranilne raztopine in aktivno blato v količini, ki ustreza od 0,2 do 1,0 g/liter suhe snovi v končni mešanici. Dodajte zadostno količino osnovne raztopine preskusne snovi, da bo v končni mešanici koncentracija DOC od 50 do 400 mg/liter. Ustrezne vrednosti KPK so 100 do 1 000 mg/liter. Dopolnite s preskusno vodo do skupne prostornine od enega do štirih litrov. Skupna prostornina, ki jo je treba izbrati, je odvisna od števila vzorcev, ki jih je treba vzeti za določitev DOC ali KPK, ter prostornin, potrebnih za analitski postopek.
Običajno je zadovoljiva prostornina dveh litrov. Sestavi se najmanj ena kontrolna posoda (negativna kontrola), vzporedno z vsako preskusno serijo; ta vsebuje samo aktivno blato in mineralno hranilno raztopino v preskusni vodi enake skupne prostornine kot v preskusnih posodah.
1.6.2 Izvajanje preskusa
Preskusne posode se premešajo z magnetnimi mešali ali propelerji pod razpršeno svetlobo ali v temnem prostoru pri 20 do 25 oC. Prezračevanje se doseže s stisnjenim zrakom, po potrebi prečiščenim skozi bombažni filter in, če je potrebno steklenico za pranje. Zagotoviti je treba, da se blato ne usede, in da koncentracija kisika ne pade pod 2 mg/liter.
pH vrednost je treba preverjati v rednih časovnih presledkih (npr. vsak dan) in po potrebi prilagoditi na pH 7 do 8.
Izgube zaradi izhlapevanja se nadomesti tik pred vsakim vzorčenjem z deionizirano ali destilirano vodo v zahtevanih količinah. Dober postopek je označevanje nivoja tekočine na posodi pred začetkom preskusa. Nove oznake se naredijo po vsakem vzorčenju (brez zračenja in mešanja). Prvi vzorci se vedno vzamejo tri ure po začetku preskusa, da bi se odkrilo adsorpcijo preskusnega materiala v aktivnem blatu.
Odstranitvi preskusnega materiala se sledi z določitvami DOC in KPK, ki se jih opravi vsak dan ali v kakšnem drugem rednem časovnem presledku. Vzorci iz preskusne posode ali negativne kontrole se prefiltrirajo skozi previdno opran papirni filter. Prvih 5 ml filtrata preskusne snovi se zavrže. Blato, ki ga je težko filtrirati, se lahko predhodno odstrani z 10 minutnim centrifugiranjem. Določitve DOC in KPK se opravijo najmanj v dvojniku. Preskus poteka do 28 dni.
Opomba: Vzorci, ki ostanejo motni, se prefiltrirajo skozi membranske filtre. Membranski filtri ne smejo prepuščati ali adsorbirati nikakršnega organskega materiala.
Posoda, ki vsebuje znano snov, se uporabi vzporedno z vsako preskusno serijo, da se preveri funkcionalno zmogljivost aktivnega blata. V ta namen velja za uporabnega dietilenglikol.
Če se analize opravijo v relativno kratkih časovnih presledkih (npr. vsak dan), je prilagoditev mogoče jasno prepoznati na krivulji razgradnje (glej Sliko 2). Preskus naj se zato ne prične tik pred koncem tedna.
Če do prilagoditve pride ob koncu tega obdobja, je preskus mogoče podaljšati do zaključka razgradnje.
Opomba: Če je potrebno širše poznavanje vedenja prilagojenega blata, se isto aktivno blato še enkrat izpostavi istemu preskusnemu materialu v skladu z naslednjim postopkom:
Izklopite mešalo in prezračevalo ter pustite, da se aktivno blato usede. Odlijte tekočino supernatanta, napolnite do dveh litrov s preskusno vodo, mešajte 15 minut in ponovno pustite, da se usede. Ko ponovno odlijete tekočino supernatanta, uporabite preostalo blato za ponovitev preskusa z enakim materialom v skladu z 1.6.1.4 in 1.6.2 zgoraj. Aktivno blato je namesto s usedanjem mogoče izolirati tudi s centrifugiranjem.
Prilagojeno blato se lahko zmeša s svežim do koncentracije 0,2 do 1 g suhe teže/liter.
Vzorci se običajno filtrirajo skozi previdno opran papirni filter (za pranje uporabite deionizirano vodo).
Vzorci, ki ostanejo motni, se filtrirajo skozi membranske filtre (0,45 μm).
Koncentracija DOC se določi v dvojniku v filtratih vzorcev (prvih 5 ml se zavrže) s pomočjo instrumenta za določanje TOC. Če filtrata ni mogoče analizirati še isti dan, se ga mora do naslednjega dne shraniti v hladilniku. Daljše shranjevanje ni priporočljivo.
Koncentracijo KPK se določi v filtratih vzorcev z analitskim postopkom, opisanim v viru (2) spodaj.
2. PODATKI IN OCENA
Koncentracije DOC in/ali KPK se določijo najmanj v dvojniku na vzorcih, v skladu s 1.6.2 zgoraj. Razgradnja v času T se izračuna v skladu s formulo (z opredelitvami pojmov), podano v točki 1.2 zgoraj.
Obseg razgradnje se zaokroži na najbližji celi odstotek. Obseg razgradnje, dosežene na koncu preskusa, se opiše kot „Biorazgradljivost v Zahn-Wellensovem preskusu“.
Opomba: Če je do popolne razgradnje prišlo pred zaključkom preskusa in je ta rezultat potrjen z drugo analizo, opravljeno naslednji dan, se preskus lahko zaključi.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— začetna koncentracija snovi,
— vsi drugi podatki in rezultati preskusa v zvezi s preskusno snovjo, referenčno snovjo, če je uporabljena, in negativno kontrola,
— koncentracija po treh urah,
— krivulja biorazgradnje z opisom,
— datum in mesto vzorčenja preskusnih organizmov, status prilagoditve, uporabljena koncentracija, itd.,
— znanstveni razlogi za vsako spremembo preskusnega postopka.
3.2 RAZLAGA REZULTATOV
Odstranitev DOC (KPK), ki poteka postopoma nekaj dni ali tednov, pomeni, da se preskusna snov biološko razgrajuje.
Svojo vlogo pa lahko v nekaterih primerih odigra tudi fizikalno-kemijska adsorpcija, to pa se pokaže, kadar gre za celotno ali delno odstranitev na samem začetku, v prvih treh urah, razlika med kontrolo in preskusnimi supernatantnimi raztopinami pa ostaja na nepričakovano nizki ravni.
Za razlikovanje med biološko razgrajenostjo (ali delno biološko razgrajenostjo) in adsorpcijo je treba opraviti dodatne preskuse,
To je mogoče opraviti na številne načine, najprepričljivejša pa je uporaba supernatanta ali blata kot inokuluma v preskusu osnovne zbirke (po možnosti respirometrični preskus).
Preskusne snovi, ki v tem preskusu dajo visoko, neadsorptivno odstranitev DOC (KPK) je treba šteti za potencialno biorazgradljive. Delna, neadsorptivna odstranitev pomeni, da je kemikalija do neke mere podvržena nekakšni biorazgradnji. Nizka ali nična odstranitev DOC (KPK) lahko pomeni, da preskusna snov zavira mikroorganizme, to pa je mogoče ugotoviti tudi z lizo in izgubo blata, kar povzroča motne supernatante. Preskus je treba ponoviti z uporabo nižje koncentracije preskusne snovi.
Uporaba za spojino značilne analitske metode ali preskusne snovi s 14C označeno preskusno snovjo lahko omogoči večjo občutljivost. V primeru 14C preskusne spojine bo obnovitev 14 CO2 potrdila, da je prišlo do biorazgradnje.
Kadar so rezultati podani za primarno biorazgradnjo, je treba, če je mogoče, razložiti spremembo kemijske strukture, ki povzroča zmanjšanje odziva matične preskusne snovi.
Validacija analitske metode mora biti podana skupaj z opaženim odzivom, v preskusnem mediju negativne kontrole.
4. VIRI
(1) OECD, Pariz, 1981, Test Guideline 302 B, Decision of the Council C(81) 30 final.
(2) Annex V C.9 Degradation: Chemical Oxygen Demand, Commission Directive 84/449/EEC (OJ L 251, 19.9.1984, str. 1).
Dodatek
PRIMER OCENE
|
Organska spojina: |
4-etoksibenzenska kislina |
|
Teoretična preskusna koncentracija: |
600 mg/l |
|
Teoretični DOC: |
390 mg/l |
|
Inokulum |
čistilna naprava odplak |
|
Koncentracija: |
1 gram suhega materiala/liter |
|
Status prilagoditve: |
neprilagojen |
|
Analiza: |
določitev DOC |
|
Količina vzorca: |
3 ml |
|
Kontrolna snov: |
dietilenglikol |
|
Strupenost spojine: |
ni strupenih učinkov pod 1 000 mg/l uporabljen preskus: preskus s fermentacijskimi cevmi |
|
Trajanje preskusa |
Kontrolna snov |
Preskusna snov |
|||||
|
negatίvna kontrola ROO (1) mg/l |
DOC (1) mg/l |
KPK neto mg/l |
Razgradnja % |
DOC (1) mg/l |
KPK neto mg/l |
Razgradnja % |
|
|
0 |
— |
— |
300,0 |
— |
— |
390,0 |
— |
|
3 ure |
4,0 |
298,0 |
294,0 |
2 |
371,6 |
367,6 |
6 |
|
1 dan |
6,1 |
288,3 |
282,2 |
6 |
373,3 |
367,2 |
6 |
|
2 dneva |
5,0 |
281,2 |
276,2 |
8 |
360,0 |
355,0 |
9 |
|
5 dni |
6,3 |
270,5 |
264,2 |
12 |
193,8 |
187,5 |
52 |
|
6 dni |
7,4 |
253,3 |
245,9 |
18 |
143,9 |
136,5 |
65 |
|
7 dni |
11,3 |
212,5 |
201,2 |
33 |
104,5 |
93,2 |
76 |
|
8 dni |
7,8 |
142,5 |
134,7 |
55 |
58,9 |
51,1 |
87 |
|
9 dni |
7,0 |
35,0 |
28,0 |
91 |
18,1 |
11,1 |
97 |
|
10 dni |
18,0 |
37,0 |
19,0 |
94 |
20,0 |
2,0 |
99 |
|
(1) Srednje vrednosti treh določitev. |
|||||||
Slika 1
Primeri krivulj biorazgradnje
Slika 2
Primeri prilagoditve blata

C.10 BIORAZGRADNJA
SIMULACIJSKI PRESKUSI Z AKTIVNIM BLATOM
1. METODA
1.1 UVOD
1.1.1 Splošne opombe
Ta metoda se uporablja le za tiste organske snovi, ki pri koncentraciji, uporabljeni v preskusu:
— so topne v vodi v obsegu, potrebnem za pripravo preskusne raztopine,
— imajo zanemarljiv parni tlak v preskusnih pogojih,
— ne zavirajo bakterij.
Podatki o relativnih deležih glavnih sestavin preskusnega materiala bodo uporabni pri razlagi dobljenih rezultatov, zlasti v primerih, kadar so ti rezultati nizki ali zanemarljivi.
Podatki o strupenosti snovi za mikroorganizme so zaželeni za razlago nizkih rezultatov in za izbiro ustreznih preskusnih koncentracij.
1.1.2 Določitev končne biorazgradljivosti (analiza DOC/KPK)
Namen te metode je določitev končne biorazgradljivosti z merjenjem odstranitve snovi in vseh metabolitov iz modela čistilne naprave z aktivnim blatom pri koncentraciji, ki ustreza > 12 mg DOC/liter (ali približno 40 mg KPK/liter); za optimalno velja 20 mg DOC/liter. (DOC = raztopljeni organski ogljik; KPK = kemijska potreba po kisiku).
Ugotoviti je treba vsebnost organskega ogljika (ali kemijske potrebe po kisiku) v preskusnem materialu.
1.1.3 Določitev primarne biorazgradljivosti (specifična analiza)
Namen te metode je določitev primarne biorazgradljivosti snovi v modelu čistilne naprave z aktivnim blatom pri koncentraciji približno 20 mg/liter z uporabospecifične analitske metode (če analitska metoda in upoštevanje strupenosti tako dovoljujeta, je mogoče uporabiti nižje ali višje koncentracije). S tem je omogočena ocena primarne biorazgradljivosti snovi (izginotje matične kemijske strukture).
Namen te metode ni določitev mineralizacije preskusne snovi.
Na voljo mora biti ustrezna analitska metoda za določitev preskusne snovi.
1.2 OPREDELITEV POJMOV IN ENOTE
1.2.1 Analiza DOC/KPK
Stopnja odstranitve snovi se poda z:
|
|
[1(a)] |
pri čemer je:
|
DR |
= |
stopnja odstranitve DOC (ali KPK) v odstotkih znotraj danega srednjega retencij skega časa glede na preskusni material, |
|
T |
= |
koncentracija preskusnega materiala v pritoku v mg DOC/liter (ali mg KPK/liter), |
|
E |
= |
koncentracija DOC (ali KPK) v iztoku preskusne enote v mg DOC/liter (ali mg KPK/liter), |
|
EO |
= |
koncentracija DOC (ali KPK) v iztoku negativne kontrole v mg DOC/liter (ali mg KPK/liter). |
Razgradnja se navede kot odstotek odstranitve DOC (ali KPK) v danem retencijskem času glede na preskusni material.
1.2.2 Specifična analiza
Odstotek odstranitve preskusne snovi iz vodne faze (Rw) v danem srednjem retencijskem času se poda z:
|
|
[1(b)] |
pri čemer je:
|
CI |
= |
koncentracija snovi v pritoku preskusne enote (mg snovi/liter, določeno s specifično analizo), |
|
CO |
= |
koncentracija snovi v iztoku preskusne enote (mg snovi/liter, določeno s specifično analizo). |
1.3 REFERENČNE SNOVI
V nekaterih primerih, kadar se preiskujejo nove snovi, so referenčne snovi lahko uporabne; vendar pa še ni mogoče priporočiti specifične referenčne snovi.
1.4 PRINCIP PRESKUSNIH METOD
Za določitev končne biorazgradljivosti potekata vzporedno dve pilotski enoti aktivnega blata (OECD potrditveni preskus ali preskus z enotami poroznih posod). Preskusna snov se doda pritoku (sintetične ali gospodinjske odplake) ene izmed enot, medtem ko druga prejme samo odplake. Za določitev primarne biorazgradnje s specifično analizo v pritoku in iztoku se uporabi le ena enota.
Koncentracije DOC (ali KPK) se merijo v iztokih ali pa se koncentracije snovi določijo s specifično analizo.
DOC preskusnega materiala se ne meri, ampak se le navede.
Kadar se opravljajo meritve DOC (ali KPK), se smatra, da je razlika v povprečnih koncentracijah med preskusnimi in kontrolnimi iztoki posledica nerazgraj enega preskusnega materiala.
Pri izvajanju specifičnih analiz, je mogoče izmeriti spremembo v koncentraciji matične molekule (primarna biorazgradnja).
Z enotami se lahko upravlja po „sistemu spojenih enot“, s postopkom transinokulacije.
1.5 MERILA KAKOVOSTI
Začetna koncentracija snovi je odvisna od tipa izvedene analize in njenih omejitev.
1.6 OPIS PRESKUSNE METODE
1.6.1. Priprava
1.6.1.1
Potreben je par enot istega tipa, razen kadar se izvaja specifična analiza. Uporabita se lahko dva tipa naprav:
OECD potrditveni preskus
Oprema (Dodatek 1) vsebuje posodo za shranjevanje (A) sintetičnih odplak, dozirno črpalko (B), prezračevalno posodo(C), usedalnik (D), „air-lift“ črpalko (E) za recikliranje aktivnega blata in posodo (F) za zbiranje tretiranega iztoka.
Posodi (A) in (F) morata biti iz stekla ali ustrezne plastike in držati najmanj 24 litrov. Črpalka (B) mora omogočati neprekinjen pretok sintetičnih odplak do prezračevalne posode; uporabiti je mogoče kakršen koli ustrezen sistem, pod pogojem, da sta zagotovljena tako dotok kot koncentracija. Pri normalnem delovanju je višina usedalnika (D) nastavljena tako, da prostornina v prezračevalni posodi za znaša tri litre suspenzije aktivnega blata. Prezračevalo iz sintranega stekla (G) se potopi v posodo (C) pri vrhu stožca. Količina zraka, izpihnjenega skozi prezračevalo, se lahko spremlja s pomočjo merilnika pretoka.
„Air-lift“ črpalka (E) se postavi tako, da se aktivno blato iz usedalnika neprekinjeno in redno reciklira v prezračevalno (C).
„Porozna posoda“
Porozna posoda je sestavljena iz plošč s poroznega polietilena (debeline 2 mm, največja velikost por 95 μm), ki so oblikovani v cilindre premera 14 cm, s stožčastim dnom 45o (Sliki 1 in 2 Dodatka 2). Porozna posoda stoji v neprepustni posodi iz ustrezne plastike premera 15 cm z odtokom na višini 17,2 cm na cilindričnem delu, ki določa prostornino (3 litri) v porozni posodi. Vrh notranje posode obdaja togi podporni obroč iz ustrezne plastike, tako da je med notranjo in zunanjo posodo prostor za iztok 0,5 cm.
Porozne posode se lahko namestijo na dno vodne kopeli s termostatom. Do dna notranje posode, na katero so nameščeni ustrezni difuzorji, vodi dovod zraka.
Posodi (A) in (E) morata biti iz stekla ali ustrezne plastike in držati najmanj 24 litrov. Črpalka (B) mora omogočati neprekinjen pretok sintetičnih odplak do prezračevalne posode; uporabiti je mogoče kakršen koli ustrezen sistem, pod pogojem, da sta zagotovljena dotok in koncentracija.
Zahtevane so dodatne notranje porozne posode, za zamenjavo tistih, ki bi se lahko med uporabo zamašile; zamašene posode se očistijo tako, da se za 24 ur potopijo v raztopino hipoklorita, čemur sledi temeljito pranje v vodi iz pipe.
1.6.1.2
Naprave za membransko filtracijo in membranski filtri z velikostjo por 0,45 μm. Membranski filtri so primerni le, če je zagotovljeno, da med filtriranjem ne izpuščaj o ogljika in ne adsorbirajo snovi.
1.6.1.3
Uporabi se lahko bodisi ustrezna sintetiče substrate bodisi gospodinjske odplake.
Primer sintetičnih substratov
Raztopiti v vsakem litru vode iz pipe:
|
Pepton: |
160 mg |
|
Mesni ekstrakt: |
10 mg |
|
Sečnina: |
30 mg |
|
NaCl: |
7 mg |
|
CaCl2·2H2O: |
4 mg |
|
MgSO4·7H2O: |
2 mg |
|
K2HPO4: |
28 mg |
Gospodinjske odplake
Te je treba zbirati sveže vsak dan iz zbirališča v primarnem usedalniku čistilne naprave, ki predvsem obdeluje gospodinjske odplake.
1.6.1.4
Pripraviti je treba npr. 1 % raztopino preskusnega materiala, da se doda preskusni enoti. Ugotoviti je treba koncentracijo materiala, da se odplakam ali neposredno enoti preko druge črpalke doda ustrezna količina, s čimer se doseže zahtevana preskusna koncentracija.
1.6.1.5
Opomba: Pri uporabi gospodinjskih odplak bi bilo nesmiselno uporabljati inokulum z nizko koncentracijo bakterij, zato se namesto njega lahko uporabi aktivno blato.
Uporabi se lahko različne inokulume.
Podani so trije primeri ustreznih inokulumov:
(a) Inokulum iz sekundarnega iztoka
Inokulum je treba pridobiti iz sekundarnega iztoka dobre kakovosti, zbranega iz čistilne naprave, ki pretežno obdeluje gospodinjske odplake. Iztok se mora obdobju med vzorčenjem in uporabo hraniti v aerobnih pogojih. Za pripravo inokuluma se vzorec prefiltrira skozi grob filter, prvih 200 ml se zavrže. Filtrat se do uporabe ohranja v aerobnem stanju. Inokulum se mora uporabiti na dan, ko je bil zbran. Za inokulacijo je treba uporabiti najmanj 3 ml inokuluma.
(b) Sestavljeni inokulum
Inokulum iz sekundarnega iztoka:
Glej opis zgoraj.
Inokulum iz prsti:
100 g vrtne prsti (plodne, ne sterilne) se suspendira v 1 000 ml pitne vode, ki ne vsebuje klora. (Prsti z zelo velikim deležem gline, peska ali humusa niso ustrezne.) Po mešanju se suspenzija pusti 30 minut, da se usede. Supernatant se prefiltrira skozi grob filtrirni papir, prvih 200 ml se zavrže. Filtrat se prezrači takoj in se ga prezračuje do uporabe. Inokulum se mora uporabiti na dan, ko je bil zbran.
Inokulum iz površinske vode:
Dodatni delni inokulum se pridobi iz mezosaprobne površinske vode. Vzorec se prefiltrira skozi grobi papir, prvih 200 ml se zavrže. Filtrat se do uporabe ohranja v aerobnem stanju. Inokulum se mora uporabiti na dan, ko je bil zbran.
Enake prostornine treh delnih vzorcev inokuluma se združijo, dobro premešajo, končni inokulum pa se pridobi iz dobljene mešanice. Za inokulacijo je treba uporabiti najmanj 3 ml inokuluma.
(c) Inokulum iz aktivega blata
Za inokulum se lahko uporabi prostornina (ne več kot 3 litri) aktivnega blata (vsebnost suspendiranih trdnih snovi do 2,5 g/liter), vzetega iz prezračevalnega bazena čistilne naprave, ki pretežno obdeluje gospodinjske odplake.
1.6.2 Postopek
Preskus se opravlja pri sobni temperaturi; ta naj se vzdržuje med 18 in 25 oC.
Če je primerno, se preskus lahko opravi pri nižji temperaturi (do 10 oC); če se snov razgradi, se običajno ne zahtevajo dodatni postopki. Če pa se snov ne razgradi, je treba preskus opraviti pri stalni temperaturi med 18 in 25 oC.
1.6.2.1
Rast blata/obdobje stabilizacije je obdobje, v katerem koncentracija suspendiranih trdnih snovi aktivnega blata in delovanje enot preide v konstantno stanje v uporabljenih pogojih delovanja.
Pripravljalno obdobje je obdobje, ki traja od trenutka, ko se prvič doda preskusna snov, do trenutka, ko njeno odstranjevanje doseže konstanten nivo (relativno konstantna vrednost). To obdobje ne sme presegati šestih tednov.
Obdobje ocenjevanja je tritedensko obdobje po tem, ko odstranjevanje preskusne snovi doseže relativno konstantno, in ponavadi visoko, vrednost. Za tiste snovi, ki v prvih šestih tednih kažejo nizko razgradljivost ali pa se sploh ne razgrajujejo, se za obdobje ocenjevanja vzamejo naslednji trije tedni.
Na začetku napolnite enoto(-e), potrebno(-e) za en preskus, z mešanico inokuluma in pritoka.
Nato se v delovanje spravi prezračevalo (in „air-lift“ (E) v primeru enot OECD potrditvenega preskusa) ter dozirna naprava.
Pritok, v katerem ni preskusne snovi, mora iti skozi prezračevalno posodo (C) bodisi v pretoku enega litra na uro ali pol litra na uro; s tem dobimo srednji retencijski čas treh ali šestih ur.
Stopnjo prezračevanja je treba uravnavati, tako da vsebina posode (C) ves čas ostaja v suspenziji, medtem ko je vsebnost raztopljenega kisika najmanj 2 mg/liter.
Penjenje je treba preprečiti z ustreznimi sredstvi. Ne smejo se uporabiti sredstva proti penjenju, ki zavirajo aktivno blato.
Blato, ki se je nakopičilo na vrhu prezračevalne (C) (in, v primeru enot OECD potrditvenega preskusa, na dnu usedalnika (D) in v krožnem toku) se mora s krtačenjem ali na kak drug način vrniti nazaj v suspenzijo aktivnega blata najmanj enkrat na dan.
Kadar se blato ne usede, se lahko njegovo gostoto poveča z dodatkom 2 ml delov 5 % raztopine železovega klorida, kar se po potrebi ponovi.
Iztok se zbira v posodi (E ali F) 20 do 24 ur, vzorec pa se vzame po temeljitem mešanju. Posodo (E ali F) je treba temeljito očistiti.
Da bi spremljali in nadzorovali učinkovitost procesa, se kemijska potreba po kisiku (KPK) ali raztopljeni organski ogljik (DOC) filtrata nakopičenega izpusta meri najmanj dvakrat tedensko, prav tako tudi KPK in DOC filtriranega pritoka (z uporabo membrane z velikostjo por 0,45 μm, prvih 20 ml (približno) filtrata se zavrže).
Upad DOC ali KPK bi se moral stabilizirati, ko se doseže približno stalno dnevno razgradnjo.
Vsebnost suhe snovi aktivnega blata v prezračevalnem bazenu je treba določiti dvakrat tedensko (v g/liter). Enote je mogoče upravljati na dva načina: ali se vsebnost suhe snovi aktivnega blata določa dvakrat tedensko, in če gre za več kot 2,5 g/liter, se mora presežek aktivnega blata zavreči, ali pa se vsak dan odvrže iz vsake posode 500 ml suspenzije aktivnega blata, s čimer dobimo srednji retencijski čas blata šest dni.
Kadar so izmerjeni in ocenjeni parametri (učinkovitost procesa (pri odstranitvi KPK ali DOC), koncentracija blata, usedanje blata, motnost iztokov, itd.) dveh enot dovolj ustaljeni, se lahko preskusna snov daje v pritok ene izmed enot, ob upoštevanju 1.6.2.2.
Preskusna snov pa se lahko doda že na začetku obdobja rasti blata (1.6.2.1), še zlasti kadar se blato doda kot inokulum.
1.6.2.2
Ohranjajo se delovni pogoji pripravljalnega obdobja, zadostna količina osnovne raztopine (približno 1 %) preskusnega materiala pa se doda pritoku preskusne enote, da bi se dobila zaželena koncentracija preskusnega materiala (približno 10 do 20 mg DOC/liter ali 40 mg KPK/liter) v odplakah. To se lahko naredi z vsakodnevnim vmešanjem osnovne raztopine k odplakam ali s pomočjo ločenega črpalnega sistema. Navedena koncentracija se lahko doseže postopoma. Če preskusna snov na aktivnem blatu ne povzroča nobenih strupenih učinkov, je mogoče preskušati višje koncentracije.
Enoti negativne kontrole se doda le pritok brez dodanih snovi. Ustrezne prostornine iztokov se vzamejo za analizo in prefiltrirajo skozi membranske filtre (0,45 μm), prvih 20 ml (približno) filtrata pa se zavrže.
Prefiltrirane vzorce je treba analizirati še isti dan, sicer se morajo shraniti s pomočjo katere koli ustrezne metode, na primer z uporabo 0,05 ml 1 % raztopine živosrebrovega klorida (HgCl2) za vsakih 10 ml filtrata ali tako, da se jih do 24 ur hrani pri 2 do 4 oC ali za daljše obdobje pod – 18 oC.
Čas pripravljanja vključno z dodajanjem preskusne snovi ne sme preseči šest tednov, obdobje ocenjevanja pa ne sme biti krajše od treh tednov, za izračun končnega rezultata mora biti na voljo 14 do 20 določitev.
Način spojenih enot
Spajanje enot se doseže z izmenjavanjem 1,5 litra suspenzije aktivnega blata (vključno z blatom) iz prezračevalnih posod aktivnega blata med dvema enotama enkrat dnevno. V primeru močno absorptivnih preskusnih materialov se iz usedalnikov vzame le 1,5 litra supernatantne tekočine in se jo izlije v posodo z aktivnim blatom druge enote.
1.6.2.3
Da bi spremljali obnašanje snovi, je mogoče opraviti dve vrsti analize:
DOC in KPK
Koncentracije DOC se določijo v dvojniku z analizatorjem ogljika in/ali KPK vrednostmi, v skladu z virom (2).
Specifična analiza
Koncentracije preskusne snovi se določijo z ustrezno analitsko metodo. Kadar je to mogoče, se opravi določitev snovi, absorbirane na blatu.
2. PODATKI IN OCENA
2.1 NAČIN SPOJENIH ENOT
Pri uporabi „načina spojenih enot“ se dnevne stopnje odstranitve (SO) izračunajo v skladu z 1.2.1.
Navedene dnevne stopnje odstranitve (SO) se popravijo v SOc za prenos materiala zaradi procesa transinokulacije z enačbo [2] za triurni ali z enačbo [3] za šesturni srednji retencijski čas.
|
|
[2] |
|
|
[3] |
Izračuna se srednja vrednost nizov vrednosti SOc, z enačbo [4] pa še standardna deviacija
|
|
[4] |
pri čemer je:
|
s DRc |
= |
standardna deviacija niza vrednosti SOc, |
|
|
= |
srednja vrednost SOc, |
|
n |
= |
število določitev. |
Napačne vrednosti (outliers) niza SOc se izločijo v skladu z ustreznim statističnim postopkom, npr. Nalimov (6), pri 95 % stopnji verjetnosti, ponovno pa se izračuna še srednjo vrednost in standardno deviacijo podatka o SOc brez napačnih vrednosti.
Končni rezultat se na to izračuna z enačbo [5]
|
|
[5] |
pri čemer je:
|
tn-1; α |
= |
tabelarna vrednost t za n vrednostnih parov E in Eo in statistično zaupanje P (P = 1 – α), pri čemer je P določen na 95 % (1). |
Rezultat se prikaže kot povprečje z mejami tolerance pri 95 % stopnji verjetnosti, ustrezni standardni deviaciji in število podatkov podatkovnega niza o SOc brez napačnih vrednosti ter število napačnih vrednosti (outliers), npr.
|
DRc |
= |
98,6± 2,3 % odstranitve DOC, |
|
s |
= |
4,65 % odstranitve DOC, |
|
n |
= |
18, |
|
x |
= |
število napačnih vrednosti (outliers). |
2.2 NAČIN NESPOJENIH ENOT
Delovanje enot se lahko preveri z:
![]()
Navedene dnevne odstranitve se lahko grafično prikažejo, da se odkrijejo kakršni koli trendi npr. pri prilagoditvah.
2.2.1 Uporaba določitev KPK/DOC
Dnevna stopnja odstranitve (SO) se izračuna v skladu z 1.2.1.
Izračuna se srednjo vrednost podatkov SO; poleg tega se standardna deviacija izračuna v skladu z:
|
|
[6] |
pri čemer je:
|
sSO |
= |
standardna deviacija niza vrednosti SOi, |
|
|
= |
srednja vrednost SOi, |
|
n |
= |
število določitev. |
Napačne vrednosti (outliers) niza SOc se izločijo v skladu z ustreznim statističnim postopkom, npr. Nalimov (6), pri 95 % stopnji verjetnosti, ponovno pa se izračuna še srednjo vrednost in standardno deviacijo podatka o SOc brez napačnih vrednosti.
Končni rezultat se nato izračuna z enačbo [7] kot:
|
|
[7] |
pri čemer je:
|
tn-1;α |
= |
tabelarna vrednost t za n vrednostnih parov E in EO in statistično zaupanje P (P = 1 – α), pri čemer je P določen na 95 % (1). |
Rezultat se prikaže kot povprečje z mejami tolerance pri 95 % stopnji verjetnosti, ustrezno standardno deviacijo in število podatkov podatkovnega niza o SOc brez napačnih vrednosti ter število napačnih vrednosti, npr.
|
SOc |
= |
(98,6± 2,3) % odstranitve DOC, |
|
s |
= |
(4,65) % odstranitve DOC, |
|
n |
= |
18, |
|
x |
= |
število napačnih vrednosti. |
2.2.2 Uporaba specifične analize
Odstotek odstranitve preskusne snovi iz vodne faze (Rw) se izračuna v skladu z 1.2.2.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— obrazec, podan v Dodatku 3, ki prikazuje pogoje delovanja za preskus,
— izbrana naprava (potrditveni preskus OECD ali preskus s poroznimi posodami),
— izbrani delovni način: način spojenih metod ali ne,
— izbrane odplake: sintetične ali gospodinjske – v primeru gospodinjskih odplak datum in lokacija vzorca,
— izbrani inokulum z datumom in lokacijo vzorca,
— izjava z opisom analitske metode, če so bile opravljene specifične analize,
— prikaz odstranitve KPK ali DOC ob času, vključno s pripravljalnim in obdobjem ocenjevanja,
— analitska rekuperacija preskusne snovi kot KPK ali DOC v osnovni raztopini,
— prikaz odstotka odstranitve preskusne snovi iz vodne faze v odvisnosti od časa (pripravljalno obdobje in obdobje ocenjevanja), če so bile opravljene specifične analize,
— povprečna odstranitev DOC ali KPK preskusne snovi in standardno deviacijo se izračuna iz rezultatov v obdobju ocenjevanja, t.j. kadar gre za ustaljeno odstranitev preskusnega materiala ali obdobje ustaljenega delovanja,
— prikaz koncentracije aktivnega blata v odvisnosti od časa,
— vse opombe v zvezi z aktivnim blatom (izločitev presežnega blata, kopičenje, FeCl3, itd.),
— koncentracija snovi, uporabljene v preskusu,
— vsi rezultati v zvezi z analizo, opravljeno na blatu,
— vsi podatki in rezultati preskusa v zvezi s preskusno snovjo in referenčno snovjo, če je uporabljena,
— znanstveni razlogi za vse spremembe postopka.
3.2 RAZLAGA REZULTATOV
Nizka odstranitev preskusne snovi iz vodne faze je lahko posledica zaviranja mikroorganizmov s preskusno snovjo. To je mogoče odkriti tudi z lizo in izgubo blata, kar povzroča motne supernatante, ter s povečanjem učinkovitosti odstranitve KPK (ali DOC) pilotske naprave.
Svojo vlogo lahko včasih odigra tudi fizikalno-kemijska adsorpcija. Razlike med biološkim delovanjem na molekulo in fizikalno-kemijsko adsorpcijo je mogoče prikazati z analizo, opravljeno na blatu po ustrezni desorpciji.
Dodatni preskusi so potrebni, če je treba ločiti med biorazgradnjo (ali delno biorazgradnjo) in adsorpcijo.
To je mogoče opraviti na številne načine, naj prepričljivejša pa je uporaba supernatanta kot inokuluma v preskusu iz osnovne zbirke (po možnosti v respirometričnem preskusu).
Če je opažena visoka odstranitev DOC ali KPK, je le-ta posledica biorazgradnje, medtem ko se pri nizkih odstranitvah biorazgradnja ne da razločiti od izločitve. Na primer, če topna spojina kaže visoko adsorpcijsko konstanto v višini 98 %, stopnja izgube odvečnega blata pa je dnevno 10 %, je možna do 40 % izločitev; pri 30 % stopnji izgube odvečnega blata lahko izločitev zaradi adsorpcije in odstranitve odvečnega blata doseže 65 % (4).
Pri uporabi specifične analize je treba pozornost posvetiti razmerju med strukturo snovi in uporabljeno specifično analizo. V tem primeru opaženega pojava ni mogoče interpretirati kot mineralizacijo snovi.
4. VIRI
(1) OECD, Pariz, 1981, Test Guideline 303 A, Decision of the Council C(81) 30 final.
(2) Annex V C.9 Degradation: Chemical Oxygen Demand, Commission Directive 84/449/EEC (UL L 251, 19.9.1984, str. 1).
(3) Painter, H. A., King, E. F., WRC Porous-Pot method for assessing biodegradability, Technical Report TR70, June 1978, Water Research Centre, Združeno kraljestvo.
(4) Wierich, P., Gerike, P., The fate of soluble, recalcitrant, and adsorbing compounds in activated sludge plants, Ecotoxicology and Environmental Safety, zv. 5, junij 1981, str. 161 do 171.
(5) Council Directive 82/242/EEC and 82/243/EEC (UL L 109, 22.4.1982, str. 1) amending Council Directive 73/404/EEC in 73/405/EEC on biodegradability of detergents (UL L 347, 17.12.1973, str. 51).
(6) Streuli, H., Fehlerhafte Interpretation und Anwendung von Ausreiβertests, insbesondere bei Ringversuchen zur Uberpriifung analytisch-chemischer Untersuchungsmethoden, Fresenius-Zeitscrift fur Analytische Chemie, 303(1980), str. 406 do 408.
Dodatek 1
Slika 1

Slika 2
Dodatek 2
Slika 1
Oprema za ocenjevanje biorazgradljivosti

Silka 2
Podrobnosti o tri litrski porozni prezračevalni posodi
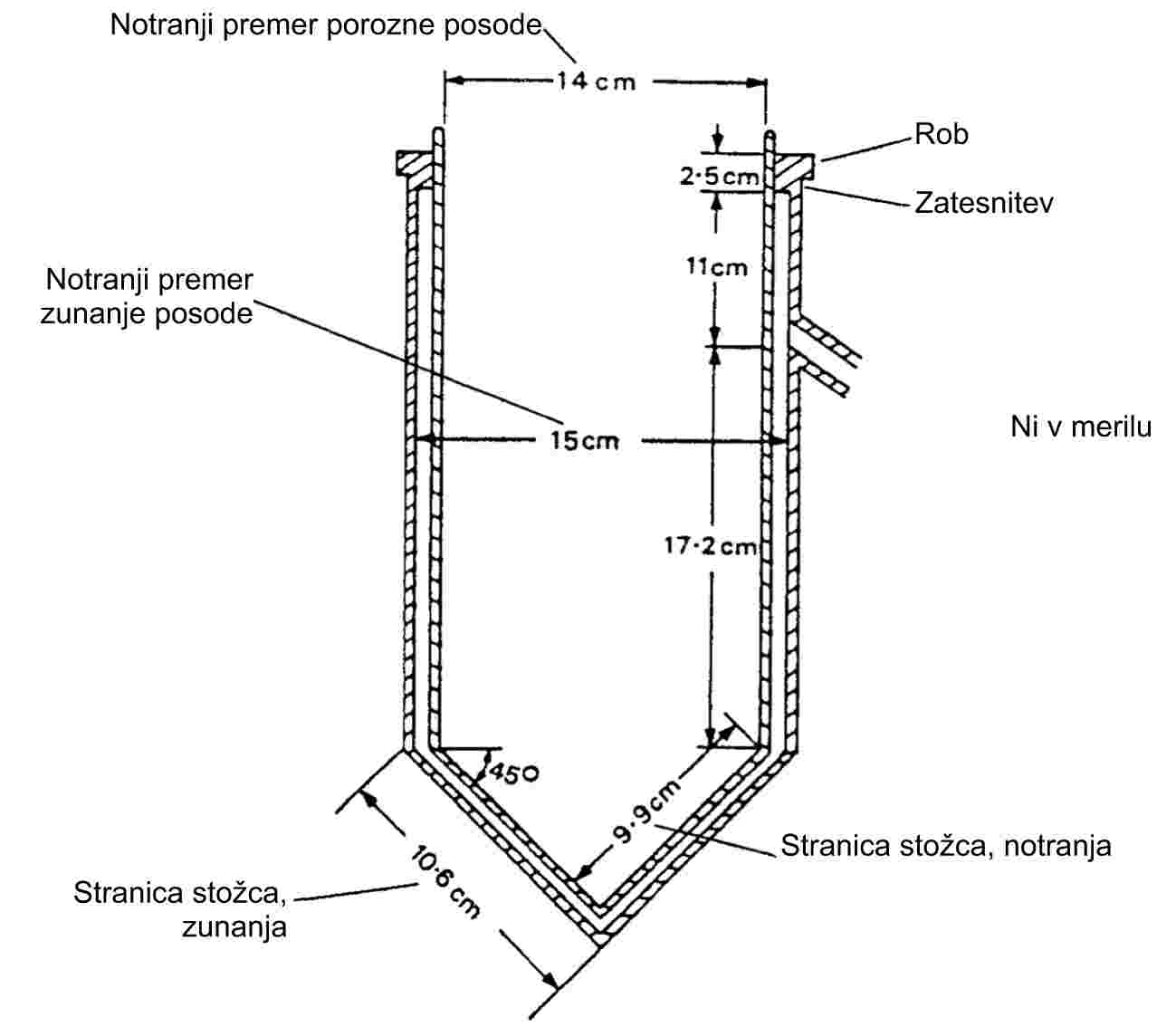
Dodatek 3
Delovni pogoji za simulacijski preskus z aktivnim blatom
Pregled vsake skupine
Naprave
|
OECD potrditev |
|
|
Porozna posoda |
Način delovanja
|
Samostojna enota |
|
|
Spojene enote |
|
|
Nespojene enote |
Transinokulacija
|
Je ni |
|
|
Aktivirano blato |
|
|
Supernatant |
Srednji retenzijski čas
|
Tri ure |
|
|
Šest ur |
Osnovno hranilo
|
Gospodinjske odplake |
|
|
Sintetične odplake |
Inokulum
|
Sekundarni odtok |
|
|
Sestavljeno blato |
|
|
Aktivno blato |
Dodatni preskusni material
|
Od začetka |
|
|
Postopno naraščanje |
|
|
Po nastanku blata |
Analiza
|
Specifična |
|
|
COD |
|
|
DOC |
C.11 BIORAZGRADNJA
PRESKUS ZAVIRANJA DIHANJA AKTIVNEGA BLATA
1. METODA
1.1 UVOD
Opisana metoda ocenjuje učinek preskusne snovi na mikroorganizme z merjenjem stopnje respiracije pod določenimi pogoji pri različnih koncentracijah preskusne snovi.
Namen te metode je omogočiti hitro presejalno metodo, s katero je mogoče prepoznati snovi, ki bi lahko negativno vplivale na aerobne mikrobiološke čistilne naprave, ter prikazati ustrezne koncentracije preskusnih snovi, ki niso zaviralne, za uporabo v preskusih biorazgradljivosti.
Preskus za ugotavljanje območja se lahko opravi pred končnim preskusom. Z njim se pridobijo podatki o razponu koncentracij, ki se uporabijo pri glavnem preskusu.
V načrt preskusa sta vključeni dve kontroli brez preskusne snovi, ena na začetku in druga na koncu preskusnega niza. Vsako serijo aktivnega blata je treba preveriti z uporabo referenčne snovi.
To metodo se najlažje uporabi za snovi, za katere je zaradi njihove topnosti v vodi in nizke hlapljivosti verjetno, da bodo ostale v vodi.
Pri snoveh z omejeno topnostjo v preskusnem mediju verjetno ne bo mogoče določiti EC50.
Rezultati, ki temeljijo na sprejemu kisika, lahko pripeljejo do napačnih zaključkov, kadar je preskusna snov nagnjena razdvojitvi oksidativne fosforilacije.
Za izvajanje preskusa je koristno razpolagati z naslednjimi podatki:
— topnost v vodi,
— parni tlak,
— strukturalna formula,
— čistost preskusne snovi.
Priporočilo
Aktivno blato lahko vsebuje potencialno patogene organizme, zato je treba z njim ravnati previdno.
1.2 OPREDELITEV POJMOV IN ENOTE
Stopnja respiracije je poraba kisika mikroorganizmov odpadnih voda v aerobnem blatu, ki se na splošno izrazi kot mg O2 na mg blata na uro.
Da se izračuna zaviralni učinek preskusne snovi pri določeni koncentraciji, se stopnja respiracije izrazi kot odstotek srednje vrednosti stopenj respiracije v dveh kontrolah:

pri čemer je:
|
Rs |
= |
stopnja porabe kisika pri preskusni koncentraciji preskusne snovi, |
|
Rc1 |
= |
stopnja porabe kisika, kontrola 1, |
|
Rc2 |
= |
stopnja porabe kisika, kontrola 2. |
EC50 je pri tej metodi koncentracija preskusne snovi, pri kateri je stopnja respiracije 50 % tiste, prikazane v kontroli pod pogoji, opisanimi v tej metodi.
1.3 REFERENČNE SNOVI
Priporoča se, da se kot poznan zaviralec respiracije za referenčno snov uporabi 3,5-diklorofenol in se ga preskusi za EC50 na vsaki seriji aktivnega blata, s čimer se preveri, da občutljivost blata ni nenormalna.
1.4 PRINCIP PRESKUSNE METODE
Stopnja respiracije aktivnega blata, hranjenega s standardno količino hranil iz sintetičnih odplak, se izmeri po kontaktnem času 30 minut ali treh ur ali obeh. Prav tako se izmeri stopnja respiracije istega aktivnega blata pri različnih koncentracijah preskusne snovi v sicer identičnih pogojih. Zaviralni učinek preskusne snovi pri določeni koncentraciji se izrazi kot odstotek srednjih vrednosti stopenj respiracije v dveh kontrolah. Vrednost EC50 se izračuna na podlagi določitev pri različnih koncentracijah.
1.5 MERILA KAKOVOSTI
Preskusni rezultati so veljavni, če:
— stopnji respiracije v dveh kontrolah ne razlikujeta druga od druge za več kot 15 %,
— je EC50 (30 minut in/ali tri ure) 3,5-diklorofenola v sprejemljivem razponu 5 do 30 mg/liter.
1.6 OPIS PRESKUSNE METODE
1.6.1 Reagenti
1.6.1.1
Raztopine preskusne snovi se pripravijo sveže na začetku študije z uporabo osnovne raztopine. Koncentracija osnovne raztopine 0,5 g/l je primerna, če se upošteva spodaj priporočen postopek.
1.6.1.2
Raztopino 3,5-diklorofenola je na primer mogoče pripraviti z raztopitvijo 0,5 g 3,5-diklorofenola v 10 ml 1M NaOH, redčenjem na približno 30 ml z destilirano vodo, z dodajanjem (med mešanjem) 0,5M H2SO4 do točke začetne precipitacije – potrebne bo približno 8 ml 0,5M H2SO4 – končno z redčenjem mešanice do enega litra z destilirano vodo. Vrednost pH mora takrat biti med 7 in 8.
1.6.1.3
Hranila iz sintetičnih odplak se naredijo z raztapljanjem naslednjih količin snovi v enem litru vode:
— 16 g peptona,
— 11 g mesnega ekstrakta,
— 3 g sečnine,
— 0,7 g NaCl,
— 0,4 g CaCl2.2H2O,
— 0,2 g MgSO4.7H2O,
— 2,8 g K2HPO4.
Opomba 1: Te sintetične odplake so 100-kratni koncentrat odplak, opisanih v Tehničnem poročilu OECD: „Predlagana metoda za določitev biorazgradljivosti površinsko aktivnih snovi, uporabljenih v sintetičnih detergentih“ (11. junij 1976), z dodatkom dikalijevega hidrogen fosfata.
Opomba 2: Če se pripravljeno gojišče ne uporabi takoj, ga je potrebno najdlje en teden hraniti v temi pri 0 do 4 oC v pogojih, ki ne povzročajo nikakršnih sprememb v njegovi sestavi. Gojišče se pred shranitvijo lahko tudi sterilizira, ali pa se dodata pepton in mesni ekstrakt tik pred izvajanjem preskusa. Pred uporabo se ga dobro premeša in prilagodi pH.
1.6.2 Naprave
Merilne naprave: natančna oblika ni ključnega pomena. Vendar pa mora biti posoda za merjenje popolnoma polna, sonda pa se mora tesno prilegati na vrat merilne posode.
Potrebna je običajna laboratorijska oprema in zlasti naslednje:
— merilna naprava,
— naprava za prezračevanje,
— pH elektroda in oprema za merj enje,
— O2-elektroda.
1.6.3 Priprava inokuluma
Za preskus se kot mikrobiološki inokulum uporabi aktivno blato iz čistilnih naprav, ki v obdelujejo predvsem gospodinjske odplake.
Če je potrebno se lahko ob prihodu v laboratorij grobi delci odstranijo s kratkotrajnim usedanjem, npr. 15 minut, in odlivanjem zgornjih plasti drobnejših trdih delcev za uporabo. Lahko pa se blato tudi nekaj sekund meša z mešalom.
Poleg tega, če se zdi, da je prisoten zaviralni material, je treba blato oprati pod vodo iz pipe ali z izotonično raztopino. Po centrifugiranju se supernatant odlije (ta postopek se trikrat ponovi).
Majhna količina blata se stehta in posuši. Na podlagi tega je mogoče izračunati količino mokrega blata, ki ga je treba suspendirati v vodi, da bi dobili aktivno blato z razponom suspendiranih trdnih snovi v suspenziji aktivnega blata od 2 do 4 g/liter. Če se upošteva spodaj priporočeni postopek, ta količina v preskusnem gojišču ustvari koncentracijo med 0,8 in 1,6 g/liter.
Če blata ni mogoče uporabiti na dan zbiranja, se 50 ml sintetičnih odplak doda vsakemu litru aktivnega blata, pripravljenega, kot je opisano zgoraj; ta se nato čez noč zrači pri 20 ± 2 oC. Zrači se še naprej za uporabo v teku dneva. Pred uporabo se po potrebi preveri in prilagodi pH na 6 do 8. V suspenziji aktivnega blata suspendirane trdne snovi je treba določiti, kot je opisano v prejšnjem odstavku.
Če je treba v naslednjih dneh uporabiti isto serijo blata (maksimalno štiri dni), se na koncu vsakega delovnega dne v liter blata doda 50 ml hranil iz sintetičnih odplak.
1.6.4 Izvajanje preskusa
|
Trajanje/kontaktni čas: |
30 minut in/ali tri ure, medtem ko poteka zračenje |
|
Voda: |
Pitna voda (po potrebi brez klora) |
|
Oskrba z zrakom: |
Čisti zrak, brez olja. Pretok zraka 0,5 do 1 liter/minuto |
|
Merilne naprave: |
Bučka z ravnim dnom, kot je BPK bučka |
|
Merilnik kisika: |
Ustrezna kisikova elektroda z rekorderjem |
|
Hranilna raztopina: |
Sintetične odplake (glej zgoraj) |
|
Preskusna snov: |
Sveže pripravljena preskusna snov na začetku preskusa |
|
Referenčna snov: |
Npr. 3,5-diklorofenol (najmanj tri koncentracije) |
|
Kontrole: |
Inokulirani vzorec brez preskusne snovi |
|
Temperatura: |
20 ± 2 oC. |
Predlagani preskusni postopek, ki ga je v triurnem kontaktnem obdobju mogoče upoštevati v primeru preskusne in referenčne snovi, je opisan spodaj:
Uporabi se več posod (npr. čaše s prostornino 1 litra).
Uporabiti je treba najmanj pet koncentracij, ki se med seboj razlikujejo za stalen faktor, ki po možnosti ne presega 3,2.
V času „0“ se iz 16 ml hranil iz sintetičnih odplak z vodo naredi 300 ml mešanice. Doda se 200 ml mikrobnega inokuluma, celotna mešanica (500 ml) se nato zlije v prvo posodo (prva kontrola C1).
Preskusne posode je treba stalno prezračevati da se zagotovi, da raztopljeni O2 ne pade pod 2,5 mg/liter in da tik pred merjenjem stopnje respiracije koncentracija O2 znaša približno 6,5 mg/liter.
V času „15 minut“ (gre za poljuben, vendar primeren 15 minutni časovni presledek) se zgornji postopek ponovi, razen da se 100 ml osnovne raztopine preskusne snovi doda 16 ml sintetičnih odplak, še preden se doda vodo, da se dobi količina 300 ml, in mikrobni inokulum, da se dobi količina 500 ml. Ta mešanica se nato izlije v drugo posodo in zrači, kot je opisano zgoraj. Ta proces se ponovi v 15 minutnih intervalih z različnimi količinami osnovne raztopine preskusne snovi, da se dobi niz posod, ki vsebujejo različne koncentracije preskusne snovi. Na koncu se pripravi še druga kontrola (C2).
Po treh urah se zabeleži pH, dobro premešani vzorec vsebine prve posode pa se pretoči v merilno napravo ter se v naslednjih 10 minutah meri stopnjo respiracije.
Ta določitev se opravi na vsebini vsake posode v 15 minutnih časovnih presledkih, tako da je kontaktni čas v vsaki posodi tri ure.
Referenčna snov se preskuša na enak način na vsaki seriji mikrobnega inokuluma.
Kadar je treba meritve opraviti po 30 minutah kontakta, je potreben drugačen pristop (npr. več kot en merilec kisika).
Če se zahteva merjenje kemijske porabe kisika, se pripravijo dodatne posode s preskusno snovjo, hranili iz sintetičnih odplak in vodo, vendar brez aktivnega blata. Poraba kisika se izmeri in zabeleži po 30 minutnem času prezračevanja in/ali treh urah (kontaktni čas).
2. PODATKI IN OCENA
Stopnja respiracije se izračuna na podlagi izsledkov rekorderja med približno 6,5 mg O2/liter in 2,5 mg O2/liter, ali v obdobju 10 minut v primeru nizke stopnje respiracije. Predel respiracijske krivulje, na kateri se meri stopnja respiracije, mora biti linearen.
Če se stopnji respiracije v dveh kontrolah razlikujeta za več kot 15 %, ali pa EC50 (30 minut in/ali tri ure) referenčne snovi ni v sprejemljivem razponu (5 do 30 mg/liter za 3,5-diklorofenol), je preskus neveljaven in se mora ponoviti.
Odstotek zaviranja se izračuna pri vsaki preskusni koncentraciji (glej 1.2). Odstotek zaviranja se prikaže v odvisnosti od koncentracije na log-normalnem (ali log-verjetnost) grafu, in izpelje se vrednost EC50.
Z uporabo standardnih postopkov je mogoče določiti 95 % meje zaupanja za vrednosti EC50.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— preskusna snov: kemijski identifikacijski podatki,
— preskusni sistem: vir, koncentracija in vsako predhodno obdelovanje aktivnega blata,
— preskusni pogoji:
—— pH reakcijske mešanice pred merjenjem respiracije,
— temperatura med preskusom,
— trajanje preskusa,
— referenčna snov in nj ena izmerj ena vrednost EC50,
— abiotski sprejem kisika (če obstaja).
— rezultati:
—— vsi izmerjeni podatki,
— krivulj a zaviranj a in metoda za izračun EC50,
— EC50 in če je možno, 95 % meje zaupanja, EC20 in EC80,
— vsa opažanja in vse deviacije od te preskusne metode, ki bi lahko vplivali na rezultat.
3.2 RAZLAGA PODATKOV
EC50 vrednost je treba upoštevati le kot smernico za možno strupenost preskusne snovi za aktivno blato, ki se uporablja za obdelovanje odplak ali mikroorganizme v odpadnih vodah, saj zapletenih interakcij, ki se pojavljajo v okolju, ni mogoče natančno simulirati z laboratorijskim preskusom. Poleg tega lahko preskusne snovi, ki lahko zaviralno učinkujejo na oksidacijo amoniaka, povzročijo atipične krivulje zaviranja. Glede na to je s tem je pri razlagi takšnih krivulj potrebna previdnost.
4. VIRI
(1) International Standard ISO 8192-1986.
(2) Broecker, B., Zahn, R., Water Research 11, 1977, str. 165.
(3) Brown, D., Hitz, H. R., Schaefer, L., Chemosphere 10, 1981, str. 245.
(4) ETAD (Ecological and Toxicological Association of Dreyfuss Manufacturing Industries), Recommended Method No. 103, prav tako opisano v:
(5) Robra, B., Wasserl Abwasser 117, 1976, str. 80.
(6) Schefer, W., Textilveredlung 6, 1977, str. 247.
(7) OECD, Pariz, 1981, Test Guideline 209, Decision of the Council C(84) 30 final.
C.12 BIORAZGRADNJA
SPREMENJENI SCAS PRESKUS
1. METODA
1.1 UVOD
Namen te metode je ocena potencialne skrajne biorazgradljivosti vodotopnih, nehlapnih organskih snovi, ki so za daljši čas izpostavljene relativno visokim koncentracijam mikroorganizmov. Sposobnost preživetja mikroorganizmov se v tem obdobju ohranja z dnevnim dodajanjem hranil iz posedenih odplak. (Med vikendi je treba odplake shraniti na 4 oC. Lahko pa se uporabi sintetične odplake potrditvenega preskusa OECD.)
Lahko pride do fizikalno-kemijske adsorpcije na suspediranih trdnih snoveh, kar je treba upoštevati pri razlagi rezultatov (glej 3.2).
Zaradi dolgega obdobja zadrževanja tekoče faze (36 ur) in vmesnega dodajanja hranil, preskus ne simulira pogojev, ki so prisotni v čistilnih napravah. Pridobljeni rezultati z različnimi preskusnimi snovmi kažejo, da ima preskus visok potencial biorazgradnje.
Preskusni pogoji, so zelo ugodni za izbor in/ali prilagoditev mikroorganizmov, ki lahko razgradijo preskusno spojino. (Ta postopek je mogoče uporabiti tudi za pridobitev aklimatiziranih inokulumov za uporabo v drugih preskusih.)
Pri tej metodi se merilo koncentracije raztopljenega organskega ogljika uporablja za oceno skrajne biorazgradljivosti preskusnih snovi. Zaželena je določitev DOC po zakisanju in čiščenju, in ne kot razliko med Cskupni – Canorganski.
Istočasna uporaba specifične analitske metode lahko omogoči oceno primarne razgradnje snovi (izginotje matične kemijske strukture).
Metoda se uporablja le za tiste organske preskusne snovi, ki so pri koncentracijah, uporabljenih v preskusu:
— topne v vodi (najmanj 20 mg raztopljenega organskega ogljika/liter),
— imajo zanemarljiv parni tlak,
— ne zaviraj o bakterij,
— se bistveno ne adsorbirajo v preskusnem sistemu,
— se ne izgubijo iz preskusne raztopine s penjenjem.
Določiti je treba vsebnost organskega ogljika v preskusnem materialu.
Podatki o relativnih deležih glavnih sestavin preskusnega materiala bodo uporabni pri razlagi dobljenih rezultatov, zlasti v primerih, kadar so ti rezultati nizki ali obrobni.
Podatki o strupenosti snovi za mikroorganizme so lahko uporabni pri razlagi nizkih rezultatov in pri izbiri ustreznih preskusnih koncentracij.
1.2 OPREDELITEV POJMOV IN ENOTE
|
CT |
= |
koncentracija preskusne spojine v obliki organskega ogljika, kot je prisotna ali dodana usedenim odplakam na začetku obdobja prezračevanja (mg/liter), |
|
Ct |
= |
koncentracija raztopljenega organskega ogljika, ugotovljenega v supernatantu v preskusni tekočini na koncu obdobja prezračevanja (mg/liter), |
|
Cc |
= |
koncentracija raztopljenega organskega ogljika, odkritega v supernatantu kontrole na koncu obdobja prezračevanja (mg/liter). |
Biorazgradnja je v tej metodi opredeljena kot izginotje organskega ogljika. Biorazgradnja se lahko prikaže z:
1. Odstotkom odstranitve Dda količine dnevno dodane snovi:
|
|
[1] |
pri čemer je
|
Dda |
= |
razgradnja/dnevno dodajanje. |
2. Odstotek odstranitve Dssd količine snovi, prisotne na začetku vsakega dne:
|
|
[2(a)] |
|
|
[2(b)] |
pri čemer je
|
Dssd |
= |
razgradnja/snov na začetku dneva, |
indeksa i in (i + 1) veljata za dan meritve.
Enačba 2(a) je priporočljiva, če se DOC iztoka razlikuje iz dneva v dan, medtem ko se enačbo 2(b) lahko uporabi, kadar iztok DOC ostaja iz dneva v dan relativno konstanten.
1.3 REFERENČNE SNOVI
V nekaterih primerih, kadar se preiskuje nova snov, so referenčne snovi lahko uporabne; vendar pa specifične referenčne snovi tukaj niso priporočene.
Zagotovljeni so podatki o nekaj spojinah, ocenjenih s krožnimi testi (glej Dodatek 1), predvsem zaradi tega, da se lahko od časa do časa izvede umerjanje metode in da se omogoči primerjava rezultatov pri uporabi kakšne druge metode.
1.4 PRINCIP PRESKUSNE METODE
Aktivno blato iz čistilne naprave se prenese v polkontinuirano enoto aktivnega blata („semi-continuous activated sludge“ – SCAS). Doda se preskusna spojina in usedene gospodinjske odplake, mešanica pa se nato prezračuje 23 ur. Nato se prezračevanje ustavi, blato se pusti, da se usede, supernatanta se odstrani.
Blato, ki ostane v prezračevalnih komorah, se potem premeša z dodatnim alikvotom preskusne spojine in odplak in cikel se ponovi.
Biorazgradnja se ugotovi z določitvijo vsebnosti raztopljenega organskega ogljika v supernatantu. Ta vrednost se primerja z vrednostjo, dobljeno v supernatantu, dobljenem iz kontrole, dozirane samo s usedenimi odplakami.
Pri uporabi specifične analitske metode, se lahko izmerijo spremembe v koncentraciji matične molekule kot posledica biorazgradnje (primarna biorazgradljivost).
1.5 MERILA KAKOVOSTI
Ponovljivost te metode, utemeljena na podlagi odstranitve raztopljenega organskega ogljika, še ni bilo določena. (Kadar naj bi šlo za primarno biorazgradnja, se zelo natančni podatki dobijo iz materialov, ki so znatno razgrajeni.)
Občutljivost metode se na splošno določi s spremenljivostjo negativne kontrole in, v manjši meri, z natančnostjo določitve raztopljenega organskega ogljika in stopnjo preskusne spojine v raztopini na začetku vsakega cikla.
1.6 OPIS PRESKUSNEGA POSTOPKA
1.6.1 Priprave
Uporabi se lahko zadostno število čistih prezračevalnih enot ali pa originalna 1,5 litrska preskusna enota SCAS s cevmi za dovod zraka (Slika 1) za vsako preskusno snov in kontrole. Stisnjeni zrak, ki se dovaja v preskusne enote prečiščen skozi bombažni filter, ne sme vsebovati organskega ogljika ali biti predhodno nasičen z vodo, da bi se zmanjšale izgube zaradi izhlapevanja.
Vzorec premešane suspenzije aktivnega blata, ki vsebuje 1 do 4 g suspendiranih trdnih snovi/liter, se dobi iz čistilni napravi z aktivnim blatom, ki pretežno čistijo gospodinjske odplake. Za vsako prezračevalno enoto se zahteva približno 150 ml suspenzije aktivnega blata.
Osnovne raztopine preskusne snovi se pripravijo v destilirani vodi; običajno zahtevana koncentracija je 400 mg/liter organskega ogljika, s čimer dobimo koncentracijo preskusne spojine v višini 20 mg/liter ogljika na začetku vsakega prezračevalnega cikla, v kolikor ne pride do biorazgradnje.
Višje koncentracije so dovoljene, če to strupenost za mikroorganizmov omogoča.
Izmeri se vsebnost organskega ogljika v osnovnih raztopinah.
1.6.2 Preskusnu pogoji
Preskus je treba opraviti pri 20 do 25 oC.
Uporabi se visoka koncentracija aerobnih mikroorganizmov (od 1 do 4 g/liter suspendiranih trdnih snovi), učinkovito obdobje zadrževanja pa traja 36 ur. Karbonatni material v hranilih odplak se močno oksidira, običajno v osmih urah po začetku vsakega prezračevalnega cikla. Potem blato endogeno diha v preostalem obdobju prezračevanja, v katerem je edini razpoložljivi substrat preskusna spojina, razen če tudi ta ni že metabolizirana. Te lastnosti skupaj z vsakodnevno ponovno inokulacijo preskusa, kadar se kot gojišče uporablja gospodinjske odplake, ustvarjajo izredno ugodne pogoje tako za prilagoditev kot tudi visoke stopnje biorazgradnje.
1.6.3 Izvajanje preskusa
Vzame se vzorec suspenzije aktivnega blata iz čistilne naprave z aktivnim blatom za gospodinjske odplake ali pa se zame laboratorijske enote in se jih ohranja v aerobnem stanju, dokler se jih ne uporabi v laboratoriju. Vsaka prezračevalna enota, kakor tudi kontrolna enota, se napolni s 150 ml suspenzije aktivnega blata (če se uporablja originalna preskusna enota SCAS, se dana količina pomnoži z 10) in prične se prezračevanje. Po 23 urah se prezračevanje ustavi in blato se pusti, da se 45 minut useda. V tem času se odpre zamašek na vsaki posodi in se odvzame 100 ml supernatanta. Tik pred uporabo se vzame vzorec usedenih gospodinjskih odplak, 100 ml pa se doda blatu, ki ostane v vsaki prezračevalni enoti. Še enkrat se prične prezračevanje. V tej fazi se ne dodajajo nikakršni preskusni materiali, enote pa se vsak dan napolnijo z gospodinjskimi odplakami, dokler se pri usedanju ne dobi čisti supernatant. To ponavadi traja do dva tedna, v tem času pa se raztopljeni organski ogljik v supernatantu na koncu vsakega prezračevalnega cikla približa konstantni vrednosti.
Na koncu tega obdobja se premešajo posamezna usedena blata in v vsako enoto se doda 50 ml dobljenega sestavljenega blata.
Kontrolnim enotam se doda 95 ml usedenih odplak in 5 ml vode, preskusnim enotam pa 95 ml usedenih odplak plus 5 ml ustrezne preskusne spojine osnovne raztopine (400 mg/liter). Ponovno se začne prezračevanje, ki traja 23 ur. Blato se potem pusti, da se 45 minut useda, in odvzame se supernatant, ki se ga analizira za raztopljeni organski ogljik.
Zgoraj opisani postopek dodajanja in odvzemanja se ponavlja dnevno ves čas preskusa.
Pred usedanjem bo lahko treba očistiti stene enot, da bi se preprečilo kopičenje trdnih snovi nad nivojem tekočine. Za vsako enoto se uporabi drugo strgalo ali krtača, da bi se preprečile navzkrižne okužbe.
Najbolje je, da se raztopljeni organski ogljik v supernatantu določa dnevno, čeprav so dopustne tudi manj pogoste analize. Pred analizo se raztopine prefiltrirajo skozi čiste 0,45 μm membranske filtre ali pa se centrifugirajo. Membranski filtri so ustrezni, če se zagotovi, da ne prepuščajo ogljika niti absorbirajo snovi med filtracijo. Temperatura snovi ne sme presegati 40 oC, medtem ko je v centrifugi.
Trajanje preskusa v primeru spojin, ki kažejo malo ali sploh nikakršne biorazgradnje, je neomejeno, vendar je na podlagi izkušenj priporočeno, da naj na splošno preskus traja najmanj 12 in ne dlje kot 26 tednov.
2. PODATKI IN OCENA
Vrednosti raztopljenega organskega ogljika v supernatantih preskusnih in kontrolnih enot se prikažejo v odvisnosti od časa.
Ko se doseže biorazgradnja, se bo stopnja, ugotovljena v preskusu, približala stopnji, ugotovljeni v kontroli. Ko se ugotovi, da je razlika med dvema stopnjama po treh zaporednih meritvah konstantna, se določi število nadaljnjih meritev, potrebnih za omogočanje statistične obdelave podatkov, in izračuna se odstotek biorazgradnje preskusne spojine (Dda ali Dssd, glej 1.2).
3. POROČANJE
3.1 POROČILO O PRESKUSU
Če je mogoče, se v poročilo o preskusu vključijo naslednji podatki:
— vse podatke o vrsti odplak, tipu uporabljene enote in rezultatih preskusa v zvezi s preskusno snovjo, referenčna snov, če je uporabljena, in negativna kontrola,
— temperatur,
— krivulja odstranitve z opisom, način izračunavanja (glej 1.2),
— datum in mesto vzorčenja aktivnega blata in odplak, status prilagoditve, koncentracija, itd.,
— znanstveni razlogi za vsako spremembo preskusnega postopka,
— podpis in datum.
3.2 RAZLAGA REZULTATOV
Ker snov, ki se preskuša s to metodo, še ne bo hitro biorazgradljiva, se bo vsaka odstranitev DOC, ki je izključno posledica biorazgradljivosti, običajno odvijala postopoma nekaj dni ali tednov, razen v tistih primerih, kjer je prilagoditev trenutna, kar se kaže z nenadnim izginotjem, ki se zgodi po nekaj tednih.
Pomembno vlogo pa lahko v nekaterih primerih odigra tudi fizikalno-kemijska adsorpcija; to se pokaže, kadar gre za celotno ali delno odstranitev dodanega DOC na samem začetku. Kaj se zgodi potem, je odvisno od dejavnikov, kot so stopnje adsorpcije in koncentracija suspendiranih trdnih snovi v zavrženem iztoku. Ponavadi razlika med koncentracijo DOC v kontrolnih in preskusnih supernatantih postopoma narašča od začetne nizke vrednosti, ta razlika pa se potem ohranja pri novi vrednosti preostali del preskusa, razen če ne pride do prilagoditve.
Če je treba določiti razliko med biorazgradnjo (ali delno biorazgradnjo) in adsorpcijo, so potrebni dodatni preskusi. To je mogoče opraviti na številne načine, naj prepričljivejša pa je uporaba supernatanta ali blata kot inokuluma v preskusu iz osnovne zbirke (po možnosti v respirometričnem preskusu).
Preskusne snovi, ki v tem preskusu povzročajo visoko, neadsorptivno odstranitev DOC, je treba šteti za potencialno biorazgradljive. Delna, neadsorptivna odstranitev pomeni, da je kemikalija le izpostavljena nekakšni biorazgradnji.
Nizke ali nične odstranitve DOC lahko pomenijo, da preskusna snov zavira mikroorganizme, to pa je mogoče odkriti tudi z lizo in izgubo blata, kar povzroča motne supernatante. Preskus je treba ponoviti z uporabo nižje koncentracije preskusne snovi.
Uporaba specifične analitske metode ali preskusne snovi z oznako 14C lahko omogoči večjo občutljivost. V primeru 14C preskusne spojine bo predelava 14CO2 potrdila, da je prišlo do biorazgradnje.
Kadar podani podatki veljajo za primarno biorazgradnjo, je treba, če je mogoče, razložiti spremembo kemijske strukture, ki povzroča izgubo odziva matične preskusne snovi.
Validacija analitske metode mora biti podana skupaj z odzivom, odkritim na preskusnem gojišču negativne kontrole.
4. VIRI
(1) OECD, Pariz, 1981, Test Guideline 302 A, Decision of the Council C(81) 30 final.
Dodatek 1
SCAS preskus: primeri rezultatov
|
Snov |
Ct (mg/l) |
Ct-Cc (mg/l) |
Odstotek biorazgradnje Dda |
Trajanje preskusa (dni) |
|
4-acetil aminobenzensulfonat |
17,2 |
2,0 |
85 |
40 |
|
Tetrapropilen benzensulfonat |
17,3 |
8,4 |
51,4 |
40 |
|
4-nitrofenol |
16,9 |
0,8 |
95,3 |
40 |
|
Dietilen glikol |
16,5 |
0,2 |
98,8 |
40 |
|
Anilin |
16,9 |
1,7 |
95,9 |
40 |
|
Ciklopentan tetra karboksilat |
17,9 |
3,2 |
81,1 |
120 |
Dodatek 2
Primer preskusne naprave

C.13 BIOKONCENTRACIJA: PRETOČNI PRESKUS NA RIBAH
1. METODA
Ta biokoncentracijska metoda je v skladu s OECD smernico 305 (1996).
1.1 UVOD
Ta metoda opisuje postopek za določanje biokoncentracijskega potenciala snovi v ribah pod pretočnimi pogoji. Čeprav so pretočni preskusni režimi veliko bolj zaželeni, so dopustni tudi polstatični režimi, vendar pod pogojem, da so izpolnjena merila veljavnosti (validacije).
Navedena metoda nudi dovolj podatkov za izvedbo preskusa, hkrati pa dopušča dovolj svobode za prilagoditev načrta preskusa pogojem v posameznih laboratorijih in spreminjajočim lastnostim preskusnih snovi. Najbolj ustrezna je za stabilne organske kemikalije z vrednostmi log Pow med 1,5 in 6,0 (1), kljub temu pa se lahko uporablja tudi pri superlipofilnih snoveh (ki imajo log Pow > 6,0). Predocena biokoncentracijskega faktorja (BKF), včasih označena s KB, bo za take superlipofilne snovi predvidoma višja od vrednosti biokoncentracijskega faktorja stabilnega stanja (BKFSS), ki naj bi se določila na osnovi laboratorijskih poskusov. Predocene biokoncentracijskega faktorja za organske kemikalije z log Pow vrednostmi do približno 9,0 se lahko pridobijo tako, da se uporabi enačba iz literature Bintein et al (2). Parametri, ki določajo biokoncentracijski potencial, vsebujejo konstanto stopnje absorpcije (k1), konstanto stopnje očiščenja (k2) in BKFSS.
Radioaktivno označene preskusne snovi lahko pospešijo analizo vodnih in ribjih vzorcev ter se lahko uporabijo pri odločitvi, ali je treba ugotoviti in količinsko opredeliti nepravilnosti. Če se merijo skupni radioaktivni ostanki (na primer z izgorevanjem ali topnostjo v tkivu), BKF temelji na izvorni spojini, vseh zadržanih metabolitih in tudi asimiliranem ogljiku. Biokoncentracijski faktorji, ki temeljijo na skupnih radioaktivnih ostankih, tako ne morejo biti neposredno primerljivi z biokoncentracijskimi faktorji, izpeljanim zgolj s specifično kemično analizo izvorne spojine.
Postopki čiščenja se lahko uporabijo v študijah o radioaktivnosti, da se določi BKF, temelječ na izvorni spojini, če je treba, pa se določijo tudi glavni metaboliti. Študija metabolizma rib se lahko s pomočjo analize in ugotavljanja ostankov v tkivih združi tudi s študijo biokoncentracije.
1.2 DEFINICIJE IN ENOTE
Biokoncentracija/bioakumulacija je povečana koncentracija preskusne snovi v ali na organizmu (določenih tkivih le-tega), ki je odvisna od koncentracije preskusne snovi v okoliškem gojišču.
Biokoncentracijski faktor (BKF ali Kβ) je koncentracija preskusne snovi v/na ribah ali določenih tkivih le-teh (Cf kot μg/g (ppm)) kadar koli med fazo absorpcije v tega akumulacijskega preskusa, deljena s koncentracijo kemikalije v okoliškem gojišču (Cw kot μg/ml (ppm)).
Biokoncentracijski faktor stabilnega stanja (BCFSS ali Kβ) se v daljšem časovnem obdobju znatno ne spreminja, pri čemer koncentracija preskusne snovi v okoliškem gojišču v tem obdobju ostaja konstantna.
Plato ali stabilno stanje je doseženo v krivulji preskusne snovi v ribah (Cf) proti času, ko krivulja postane vzporedna s časovno osjo in so tri zaporedne analize Cf na vzorcih, vzetih najmanj v razmaku dveh dni, v obsegu ± 20 % druga od druge, in ni znatnih razlik med tremi obdobji vzorčenja. Pri analiziranju združenih vzorcev so potrebne najmanj štiri zaporedne analize. Za preskusne snovi, ki se absorbirajo počasi, so bolj primerni sedemdnevni presledki.
Biokoncentracijski faktorji, izračunani neposredno iz konstant kinetične stopnje (k1/k2), se imenujejo kinetični faktor koncentracije, BFKK.
Koeficient porazdelitve oktanol/voda (Pow) je uravnoteženo razmerje topnosti kemikalije v n-oktanolu in vodi (metoda A.8), izraženo tudi kot Kow. Logaritem Pow se uporablja kot pokazatelj potenciala kemikalije za biokoncentracijo glede na vodne organizme.
Faza izpostavitve ali absorpcije je čas, ko so ribe izpostavljene preskusni kemikaliji.
Konstanta stopnje absorpcije (k1) je številčna vrednost, ki določa stopnjo povečanja koncentracije preskusne snovi v/na preskusnih ribah (ali določenih tkivih le-teh), ko so ribe izpostavljene navedeni kemikaliji (k1 se izrazi v dan-1).
Faza po izpostavitvi ali faza očiščenja (izgube) je čas po prenosu preskusnih rib iz gojišča, ki vsebuje preskusno snov, v gojišče, ki te snovi ne vsebuje, ko se preuči očiščenje (ali čista izguba) snovi iz preskusnih rib (ali določenih tkiv le-teh).
Konstanta stopnje očiščenja (izgube) (k2) je številčna vrednost, ki določa stopnjo zmanjšanja koncentracije preskusne snovi v preskusnih ribah (ali določenih tkivih le-teh) po prenosu preskusnih rib iz gojišča, ki vsebuje preskusno snov, v gojišče, ki te snovi ne vsebuje (k2 se izrazi v dan-1).
1.3 PRINCIP PRESKUSNE METODE
Preskus sestavljata dve fazi: faza izpostavitve (absorpcije) in faza po izpostavitvi (očiščenja). Med fazo absorpcije so ločene skupine rib ene vrste izpostavljene najmanj dvema koncentracijama preskusne snovi. Ribe se nato za fazo očiščenja prestavijo v gojišče, ki ne vsebuje preskusne snovi. Faza očiščenja je vedno potrebna, razen če je bila absorpcija snovi v fazi absorpcije zanemarljiva (npr. BKF je manjši od 10). Koncentracija preskusne snovi v/na ribah (ali določenih tkivih le-teh) se spremlja v obeh fazah preskusa. Poleg dveh preskusnih koncentracij, se kontrolna skupina rib goji pod enakimi pogoji, le da ti ne vključujejo preskusne snovi, s čimer se morebitni škodljivi učinki, opaženi med biokoncetracijskim preskusom, primerjajo z ustrezno kontrolno skupino, pridobijo pa se tudi osnovne koncentracije preskusne snovi.
Faza absorpcije se izvaja 28 dni, razen če se izkaže, da je bilo ravnovesje doseženo že prej. Trajanje faze absorpcije in čas, potreben za dosego stabilnega stanja, se lahko predvidi na osnovi enačbe iz Dodatka 3. Faza očiščenja se takrat prične tako, da se ribe prestavijo v enako gojišče v drugi čisti posodi, ki pa ne vsebuje preskusne snovi. Kjer je možno, se biokoncentracijski faktor izračuna tako kot razmerje (BKFSS) koncentracije v ribah (Cf) in v vodi (Cw) med očitnim stabilnim stanjem ter kot kinetični biokoncentracijski faktor (BKFk) kot razmerje konstant stopenj absorpcije (k1) in očiščenja (k2), ob predpostavljanju kinetike prvega reda. Če kinetika prvega reda očitno ni upoštevana, je treba uporabiti bolj zapletene modele (Dodatek 5).
Če do stabilnega stanja ne pride v 28 dneh, se faza absorpcije podaljša, dokler se ne doseže stabilno stanje ali največ za 60 dni; takrat se začne faza očiščenja.
Konstanta stopnje absorpcije, konstanta stopnje očiščenja (izgube) (ali konstante, kadar so vključeni bolj zapleteni modeli), biokoncentracijski faktor in, kjer je možno, meje zaupanja vsakega izmed teh parametrov, se izračunajo na osnovi modela, ki najbolje opisuje izmerjene koncentracije preskusne snovi v ribah in vodi.
BKF se izrazi kot funkcija skupne mokre teže rib. Vendar pa se, če so ribe dovolj velike, določena tkiva ali organi (npr. mišice, jetra) lahko uporabijo za posebne namene ali pa se lahko razdelijo na užitne (fileji) in neužitne (drobovje) dele. Ker je pri mnogih organskih snoveh jasno razmerje med potencialom za biokoncentracijo in lipofilijo, obstaja tudi ustrezno razmerje med vsebnostjo lipida preskusnih rib in zabeleženo biokoncentracijo takšnih snovi. Da bi tako zmanjšali ta vir spremenljivosti v rezultatih preskusa za navedene snovi z visoko lipofilijo (t.j. z log Pow > 3), mora biti biokoncentracija dodatno izražena v odnosu do vsebnosti lipida in ne samo glede na telesno težo.
Vsebnost lipida naj se določi na enakem biološkem materialu, kot se uporablja za določanje koncentracije preskusne snovi, kadar je to izvedljivo.
1.4 PODATKI O PRESKUSNI SNOVI
Pred izvedbo preskusa biokoncentracije je o preskusni snovi potrebno pridobiti naslednje podatke:
— topnost v vodi,
— koeficient porazdelitve oktanol/voda Pow (označen tudi kot Kow, ki se določa z metodo HPLC v A.8),
— hidroliza,
— fototransformacija v vodi, določena pod sončnim ali simuliranim sončnim obsevanjem in pod pogoji obsevanja preskusa biokoncentracije (3),
— površinska napetost (t.j. za snovi, pri katerih se log Pow ne more določiti),
— parni tlak,
— hitra biorazgradljivost (kadar je to primerno).
Drug potreben podatek je strupenost za vrste rib, ki naj se uporabijo v preskusu, po možnosti asimptotični LC50 (t.j. neodvisen od časa). Dostopna mora biti ustrezna analitična metoda znane točnosti, natančnosti in občutljivosti, saj mora biti omogočena količinska opredelitev preskusne snovi v preskusnih raztopinah in biološkem materialu, prav tako pa podrobnosti o pripravi in shranjevanju vzorca. Ravno tako mora biti znana analitična meja zaznavnosti preskusne snovi v vodi in v ribjih tkivih. Ko je uporabljena preskusna snov z oznako 14C, mora biti znan odstotek radioaktivnosti, povezan z nečistotami.
1.5 VELJAVNOST PRESKUSA
Če naj bo preskus veljaven, morajo veljati naslednji pogoji:
— temperatura niha za manj kot ± 2 oC,
— koncentracija raztopljenega kisika ne pade pod 60 % nasičenosti,
— koncentracija preskusne snovi v posodah se vzdržuje v obsegu ± 20 % povprečja merjenih vrednosti med fazo absorpcije,
— smrtnost ali drugi škodljivi učinki/bolezni v kontrolnih in opazovanih ribah na koncu preskusa znašajo manj kot 10 %; kadar preskus traja več tednov ali mesecev, morajo smrtnost ali drugi škodljivi učinki v obeh skupinah rib znašati manj kot 5 % na mesec in skupno ne smejo presegati 30 %.
1.6 REFERENČNE SPOJINE
Uporaba referenčnih spojin znanega biokoncentracijskega potenciala bi koristila pri preverjanju preskusnega postopka, kadar je to potrebno. Vendar pa se določenih snovi še ne more priporočiti.
1.7 OPIS PRESKUSNE METODE
1.7.1 Oprema
Pri vseh delih opreme se je treba izogniti uporabi materialov za vse dele naprav, ki se lahko raztopijo, absorbirajo ali izlužijo in škodljivo učinkujejo na ribe. Uporabijo se lahko standardne pravokotne ali valjaste akvarije iz kemično neaktivnega materiala in ustrezne prostornine, ki je v skladu s stopnjo obremenitve. Uporabo cevnega materiala iz mehke plastike je treba čim bolj zmanjšati. Zaželena je raba cevnega materiala iz teflona®, nerjavečega jekla in/ali stekla. Izkušnje kažejo, da je priporočljivo uporabljati snovi z visokim koeficientom absorpcije, na primer sintetične piretroide in silanizirano steklo. V teh primerih je treba opremo po uporabi zavreči.
1.7.2 Voda
Za preskus se običajno uporablja naravna voda, pridobljena iz neonesnaženega vira, ki omogoča enotno kakovost. Kakovost vode za pripravo raztopine mora biti taka, da izbrani vrsti rib omogoča preživetje ves čas trajanja prilagajanja in preskusnih obdobij, ne da bi ribe pokazale kakršen koli neobičajen videz ali obnašanje. Najbolje bi bilo dokazati, da preskusne vrste v vodi za pripravo raztopine lahko preživijo, rastejo in se razmnožujejo (npr. v laboratorijski kulturi ali preskusu strupenosti v življenjskem ciklu). Vodi je treba določiti najmanj pH-vrednost, trdoto, skupne trdne snovi, skupni organski ogljik in po možnosti tudi amonij, nitrit, alkalnost ter, za morske vrste, slanost. Parametri, ki so pomembni za najugodnejše počutje rib, so dobro znani, vendar Dodatek 1 priporoča najvišje koncentracije številnih parametrov za sladko in morsko preskusno vodo.
Voda mora biti ves čas preskusa enake kakovosti. Vrednost pH naj se nahaja v območju 6,0 do 8,5, vendar mora biti v času danega preskusa v območju ± 0,5 pH enot. Da bi preprečili vpliv vode za pripravo raztopine na rezultate preskusa (na primer s kompleksacijo preskusne snovi) ali njeno škodljivo učinkovanje na skupino rib, je treba v časovnih presledkih vzeti vzorce za analizo. Določanje težkih kovin (npr. Cu, Pb, Zn, Hg, Cd, Ni), glavnih anionov in kationov (npr. Ca, Mg, Na, K, Cl, SO4), pesticidov (npr. skupni organofosforni in skupni organoklorni pesticidi), skupnega organskega ogljika in suspendiranih suhih snovi je treba izvesti, na primer, vsake tri mesece, kadar je voda za pripravo raztopine po svoji kakovosti relativno konstantna. Če je dokazano, da se kakovost vode ni spremenila najmanj eno leto, so določanja lahko manj pogosta, razmiki pa daljši (npr. šest mesecev).
Vsebnost naravnih delcev in skupni organski ogljik (TOC) vode za pripravo raztopine morata biti čim nižja, s čimer preprečimo, da bi organska snov absorbirala preskusne snovi, saj to lahko zmanjša njeno biološko dostopnost (4). Najvišja sprejemljiva vrednost je 5 mg/l za delce (suha snov, ki jo zadrži 0,45 μm filter) in 2 mg/l za skupni organski ogljik (glej Dodatek 1). Če je treba, naj se voda pred uporabo filtrira. Prispevek k vsebnosti organskega ogljika v vodi zaradi preskusnih rib (izločki) in iz ostankov hrane mora biti čim nižji. Koncentracija organskega ogljika v preskusni posodi v času preskusa ne sme presegati koncentracije organskega ogljika, ki izvira iz preskusne snovi in iz dodatka za topnost (če se ga uporabi), za več kot 10 mg/l (± 20 %).
1.7.3 Preskusne raztopine
Založna raztopina preskusne snovi se pripravi v ustrezni koncentraciji. Zaželeno je, da se založna raztopina pripravi preprosto z mešanjem ali tresenjem preskusne snovi v vodi za pripravo raztopine. Uporaba topil ali sredstev za disperzijo (dodatkov za topnost) se odsvetuje; kljub temu pa se jih lahko uporabi v nekaterih primerih, da se pridobi ustrezno koncentrirana založna raztopina. Uporabljajo se lahko topila, kot so etanol, metanol, etilen glikol monometil eter, etilen glikol dimetil eter, dimetilformamid in trietilen glikol. Sredstva za disperzijo, ki se lahko uporabijo, so Cremaphor RH40, Tween 80, metilceluloza 0,01 % in HCO-40. Ob uporabi hitro biorazgradljivih dodatkov za topnost je treba biti previden, saj lahko le-ti povzročijo težave z rastjo bakterij v pretočnih preskusih. Preskusna snov je lahko radioaktivno označena in mora biti visoke čistosti (npr. po možnosti > 98 %).
Za pretočne preskuse je potreben sistem, ki neprestano razdeljuje in redči založno raztopino preskusne snovi (npr. merska črpalka, proporcionalno razredčilo, saturator), da lahko preskusne koncentracije dovaja v preskusne posode. Na dan naj bi se vsebina vsake preskusne posode zamenjala najmanj petkrat. Zaželena je pretočna metoda, kadar pa to ni mogoče (npr. kadar na preskusne organizme delujejo škodljivi učinki), se lahko uporabi polstatična tehnika, pod pogojem, da je zadovoljeno merilom veljavnosti. Stopnje pretoka založnih raztopin in vode za pripravo raztopine je treba preveriti 48 ur pred preskusom in nato v času preskusa najmanj vsak dan. Ta pregled vključuje določanje stopnje pretoka skozi vsako preskusno posodo, pri čemer se zagotovi, da se le-ta znotraj posode ali med njimi ne spreminja za več kot 20 %.
1.7.4 Izbira vrst
Pomembni pogoji za izbiro vrst so, da so lahko dostopne, da so na razpolago v primernih velikostih in da se lahko ustrezno gojijo v laboratoriju. Drugi pogoji za izbiro vrste rib vključujejo rekreacijsko, tržno, ekološko pomembnost, pa tudi primerljivo občutljivost, dosedanjo uspešno rabo, itd.
Priporočene preskusne vrste so navedene v Dodatku 2. Uporabijo se lahko tudi druge vrste, vendar je morda treba prilagoditi preskusni postopek, da se zagotovijo ustrezni preskusni pogoji. V tem primeru se princip izbora vrst in preskusne metode zabeleži.
1.7.5 Gojenje rib
Založna populacija rib naj se najmanj dva tedna aklimatizira v vodi pri preskusni temperaturi in se ves čas prehranjuje tako pogosto in s tako hrano kot med preskusom.
Po 48 urah od naselitve se zabeleži smrtnost, pri čemer se uporabijo naslednja merila:
— smrtnost, ki v sedmih dneh preseže 10 % populacije; treba je zavrniti celotno serijo;
— smrtnost, ki v sedmih dneh znaša 5 do 10 % populacije; aklimatizirati jih je treba še sedem dni,
— smrtnost, ki je v sedmih dneh manjša od 5 % populacije: serija se sprejme – če je smrtnost v naslednjih sedmih dneh višja od 5 %, se celotna serija zavrne.
Poskrbeti je treba, da ribe, ki se uporabljajo v preskusu, nimajo opaznih bolezni in nepravilnosti. Vse bolne ribe je treba zavreči. Rib se dva tedna pred preskusom ali v času trajanja preskusa ne sme zdraviti.
1.8 IZVEDBA PRESKUSA
1.8.1 Predhodni preskus
Da se izboljšajo preskusni pogoji končno veljavnega preskusa, npr. izbira koncentracij(e) preskusnih snovi, trajanje faze absorpcije in očiščenja, bi bilo koristno izvesti predhodni preskus.
1.8.2 Pogoji izpostavitve
1.8.2.1
Trajanje faze absorpcije se lahko predvidi na podlagi praktičnih izkušenj (npr. na podlagi predhodne študije ali podatkov o biokoncentraciji sorodne kemikalije) ali določenih empiričnih razmerij, pri čemer se uporabijo podatki o topnosti v vodi ali koeficientu porazdelitve oktanol/voda preskusne snovi (glej Dodatek 3).
Fazo absorpcije je treba izvajati 28 dni, razen če se lahko dokaže, da je bilo ravnovesje doseženo že prej. Če stabilno stanje ni bilo doseženo v 28 dneh, je treba fazo absorpcije podaljšati in izvesti nadaljnje meritve, dokler se ne doseže stabilno stanje ali največ za 60 dni.
1.8.2.2
Obdobje, ki traja polovico trajanja faze absorpcije, ponavadi zadostuje, da se pojavi ustrezno (npr. 95 %) zmanjšanje v obremenitvi telesa s snovjo (glej Dodatek 3 za razlago ocene). Če je čas, potreben za dosego 95 % izgube, predolg in na primer dvakrat presega normalno dolžino faze absorpcije (t.j. več kot 56 dni), se lahko uporabi krajše obdobje (t.j. dokler koncentracija preskusne snovi ne znaša manj kot 10 % koncentracije stabilnega stanja). Vendar pa se za snovi, ki imajo bolj zapletene vzorce absorpcije in očiščenja, kot je predstavljeno v enodelnem modelu, ki zajame kinetiko prvega reda, dovoli daljša faza očiščenja za določanje konstant stopnje izgube. Na to obdobje pa lahko vendarle vpliva obdobje, v katerem koncentracija preskusne snovi v ribah ostaja nad analitično mejo zaznavnosti.
1.8.2.3
Število rib na preskusno koncentracijo je treba izbrati tako, da so za vsako vzorčenje na voljo najmanj štiri ribe na vzorec. Če se zahteva večja statistična značilnost, je potrebnih več rib na vzorec.
Če se uporabljajo odrasle ribe, je treba zabeležiti, ali so v preskusu uporabljeni samice, samci ali oba spola. Če sta uporabljena oba spola, je treba še pred izpostavitvijo dokazati, da so razlike v vsebnosti lipidov med spoloma zanemarljive; morda je potrebna združitev vseh samcev in samic.
Za kateri koli preskus se izberejo ribe podobne teže, tako da najmanjše niso manjše od dveh tretjin teže največjih. Vse morajo biti vzgojene v istem letu in prihajati iz istega vira. Ker teža in starost rib včasih odločilno vplivata na BKF vrednosti (1), je treba te podatke točno beležiti. Priporoča se, da se podvzorci rib pred preskusom stehtajo, da se tako oceni povprečna teža.
1.8.2.4
Visoka razmerja voda-ribe se uporabijo, da bi se čim bolj zmanjšala redukcija v Cw, ki jo povzroča dodajanje rib na začetku preskusa, in da bi se izognili upadu koncentracije raztopljenega kisika. Pomembno je, da stopnja obremenitve ustreza uporabljenim preskusnim vrstam. V vsakem primeru se ponavadi priporoča stopnja obremenitve akvarija, ki znaša 0,1 do 1,0 g rib (mokra teža) na liter vode na dan. Visoke stopnje obremenitve se lahko uporabijo, če se pokaže, da se zahtevana koncentracija preskusne snovi lahko vzdržuje v območju ± 20 % mejnih vrednosti, in da koncentracija raztopljenega kisika ni manjša od 60 % nasičenosti.
Pri izbiri ustreznih režimov obremenitve je treba upoštevati naravni habitat ribjih vrst. Ribe, ki živijo pri dnu, na primer, lahko zahtevajo več prostora na dnu akvarija pri enaki prostornini vode kot vrste pelagičnih rib.
1.8.2.5
V času prilagajanja in preskusa se ribe hranijo s primerno prehrano znane vsebnosti lipida in skupnega proteina, v ustreznih količinah, ki zagotavljajo zdrav razvoj in vzdržujejo telesno težo. Ribe se hranijo vsak dan ves čas prilagajanja in preskusa s hrano, ki znaša približno 1 do 2 % telesne teže na dan; tako ostaja koncentracija lipida v času preskusa pri večini vrst rib na relativno stalni ravni. Količino hrane je treba preračunati, na primer, enkrat na teden, da se vzdržuje stalna telesna teža in vsebnost lipida. Za ta izračun se lahko teža rib v vsaki preskusni posodi oceni iz teže ribe, ki je bila nazadnje vzorčena iz navedene posode. Ribe, ki ostanejo v posodi, se ne tehtajo.
Ostanki hrane in iztrebki se iz preskusnih snovi izčrpajo vsak dan kmalu po hranjenju (v roku 30 minut do ene ure). Posode so ves čas preskusa čim čistejše, tako da ostaja koncentracija organske snovi čim nižja, saj lahko prisotnost organskega ogljika omeji biološko dostopnost preskusne snovi (1).
Ker veliko hrane izvira iz ribje moke, je treba hrano analizirati, da se ugotovi prisotnost preskusnih snovi. Zaželeno je tudi, da se v hrani analizira prisotnost pesticidov in težkih kovin.
1.8.2.6
Obdobje osvetljenosti ponavadi traja 12 do 16 ur, temperatura (nihanje ± 2 oC) pa mora ustrezati preskusnim vrstam (glej Dodatek 2). Vrsta in lastnosti svetlobe morajo biti znane. Paziti je treba na morebitno fototransformacijo preskusne snovi pod obsevalnimi pogoji študije. Uporabiti je treba ustrezno svetlobo, da ribe niso izpostavljene nenaravnim fotoproizvodom. V nekaterih primerih je ustrezno uporabiti filter, da se prestreže UV obsevanje pod 290 nm.
1.8.2.7
Ribe so pod pretočnimi pogoji izpostavljene najmanj dvema koncentracijama preskusnih snovi v vodi. Višja (ali najvišja) koncentracija preskusne snovi ponavadi znaša okoli 1 % njenega akutnega asimptotičnega LC50 in je ob uporabi analitične metode najmanj desetkrat višja od njene meje zaznavnosti v vodi.
Najvišja preskusna koncentracija se lahko določi tudi tako, da se akutni 96h LC50 deli z ustreznim akutno/kroničnim razmerjem (pri nekaterih kemikalijah so ustrezna razmerja lahko okoli tri do sto). Če je možno, se izbere druga koncentracija, ki se razlikuje od zgoraj navedene za faktor 10. Če zaradi 1 % kriterija LC50 in analitične mejne vrednosti to ni možno, se lahko uporabi faktor, ki je nižji od 10, ali pa je treba razmisliti o uporabi preskusne snovi, označene s 14C. Nobena uporabljena koncentracija ne sme presegati topnosti preskusne snovi.
Če se uporabi dodatek za topnost, njegova koncentracija ne sme presegati 0,1 ml/l in mora biti enaka v vseh prekusnih posodah. Poznati je treba njegov prispevek, skupaj s preskusno snovjo, k skupni vsebnosti organskega ogljika v preskusni vodi. Vendar pa se je treba uporabi takšnih materialov na vsak način poskusiti izogniti.
1.8.2.8
Poleg preskusne serije je treba imeti še eno kontrolo z vodo za pripravo raztopine ali eno z dodatkom za topnost, če je ta v preskusu uporabljen, pod pogojem, da je bilo ugotovljeno, da navedeni dodatek ne vpliva na ribe. Če temu ni tako, je treba imeti obe kontroli.
1.8.3 Pogostost meritev kakovosti vode
Med preskusom je treba raztopljeni kisik, TOC, pH in temperaturo meriti v vseh posodah. Skupna trdota in slanost, če je to primerno, se morata meriti v kontrolah in v eni posodi z višjo (ali najvišjo) koncentracijo. Raztopljeni kisik in slanost, če je to primerno, naj se izmerita najmanj trikrat – na začetku, približno na sredini in na koncu faze absorpcije – in enkrat tedensko v fazi očiščenja. TOC je treba izmeriti na začetku preskusa (24 ur in 48 ur pred začetkom faze absorpcije), preden se dodajo ribe, in najmanj enkrat tedensko med fazo absorpcije in fazo očiščenja. Temperaturo je treba meriti vsak dan, pH na začetku in koncu vsake faze, trdota pa enkrat na preskus. Temperatura naj se po možnosti nadzira neprekinjeno v najmanj eni posodi.
1.8.4 Vzorčenje in analiza rib in vode
1.8.4.1
Vzorec vode iz preskusnih posod se za določanje koncentracije preskusne snovi vzame preden se dodajo ribe, med fazo absorpcije in fazo očiščenja. Voda se vzorči istočasno kot ribe in pred hranjenjem, lahko pa tudi večkrat. Med fazo absorbcije se določijo koncentracije preskusnih snovi, da se preveri skladnost z merili veljavnosti.
Ribe se vzorčijo najmanj petkrat med fazo absorpcije in najmanj štirikrat med fazo očiščenja. Ker je v nekaterih primerih na osnovi takega števila vzorcev težko izračunati razmeroma natančno oceno BKF vrednosti, zlasti če ne gre za preprosto kinetiko očiščenja prvega reda, je priporočljivo v obeh fazah vzorce vzeti bolj pogosto (glej Dodatek 4). Dodatni vzorci se shranijo in analizirajo samo, če se rezultati prvega kroga analiz izkažejo kot neustrezni za izračun biokoncentracijskega faktorja z želeno natančnostjo.
Primer sprejemljivega razporeda vzorčenja je podan v Dodatku 4. Druge razporeditve se izračunajo preprosto tako, da se za izračun časa izpostavitve uporabijo druge vrednosti Pow, predvidene za 95 % absorpcijo.
Vzorčenje se nadaljuje med fazo absorpcije, dokler ne pride do stabilnega stanja ali največ 28 dni. Če do stabilnega stanja ne pride v 28 dneh, se vzorčenje nadaljuje, dokler ne pride do stabilnega stanja ali še največ 60 dni. Pred začetkom faze očiščenja se ribe premestijo v čiste akvarije.
1.8.4.2
Vzorci vode za analizo se pridobijo na primer tako, da se voda prek inertnega cevnega materiala izčrpa s središčne točke preskusne posode. Glede na to, da ne filtriranje ne centrifugiranje vedno ne ločita delcev preskusne snovi, ki niso biološko dostopni, od tistih, ki so biouporabni (zlasti za superlipofilne kemikalije, t.j. kemikalije z log Pow > 5) (1) (5), vzorci ne smejo biti izpostavljeni takemu ravnanju.
Namesto tega je treba poskrbeti, da so akvariji čim bolj čisti in da se vsebnost skupnega organskega ogljika nadzira tako med fazo absorpcije kot med fazo očiščenja.
Ob vsakem vzorčenju se iz preskusnih posod odstrani ustrezno število rib (ponavadi najmanj štiri). Vzorčene ribe se hitro izperejo z vodo, osušijo, usmrtijo v hipu z najbolj ustrezno in humano metodo ter nato stehtajo.
Zaželeno je, da se ribe in voda analizirajo takoj po vzorčenju, da se prepreči razgradnja ali druge izgube ter da se v teku preskusa izračunata približni stopnji absorpcije in očiščenja. S takojšnjo analizo se izognemo tudi zamudam pri ugotavljanju kdaj je bil plato dosežen.
Če takojšnja analiza ni izvedena, se vzorci shranijo z ustrezno metodo. Pred začetkom študije se pridobijo podatki o ustrezni metodi shranjevanja za določeno preskusno snov – na primer globoko zmrzovanje, shranjevanje pri 4 oC, trajanja shranjevanja, ekstrakcija, itd.
1.8.4.3
Ker je za celoten postopek pomembna točnost, natančnost in občutljivost analitične metode, uporabljene za preskusno snov, je treba praktično preveriti, da sta natančnost in reproduktivnost kemične analize, kakor tudi ponovna pridobitev preskusne snovi tako iz vode kot iz rib, zadovoljivi za določeno metodo. Preveriti je treba tudi, da se preskusne snovi v vodi, ki se uporablja za pripravo raztopine, ne zazna.
Če je treba, se vrednosti Cw in Cf, pridobljeni s preskusom, popravita glede na prispevek oziroma na vrednosti ozadja kontrol. Z vzorci rib in vode se ves čas ravna tako, da se čim bolj zmanjša onesnaženje in izguba (npr. ki je posledica adsorpcije na vzorčevalno napravo).
1.8.4.4
Če se v preskusu uporabljajo radioaktivno označeni materiali, se lahko analizira količina skupnega radioaktivnega označevala (t.j. izvornega in metabolitov) ali pa se vzorci očistijo, tako da se izvorna spojina lahko analizira ločeno. Glavni metaboliti se lahko določijo tudi na koncu faze absorpcije ali najkasneje med stabilnim stanjem. Če je BKF glede na skupne radioaktivno označene ostanke > 1 000 %, je priporočljivo in za določene kategorije kemikalij, kot so na primer pesticidi, zelo priporočljivo, da se ugotovijo in količinsko opredelijo razkroj ki, ki predstavljajo > 10 % skupnih ostankov v ribjem tkivu v stabilnem stanju. Če so razkrojki, ki predstavljajo > 10 % skupnih radioaktivno označenih ostankov v ribjem tkivu, ugotovljeni in količinsko določeni, potem je priporočljivo tudi, da se ugotovijo in količinsko opredelijo tudi razkrojki v preskusni vodi.
Koncentracija preskusne snovi se običajno določi za vsako posamezno stehtano ribo. Če to ni mogoče, je združevanje vzorcev pri vsakem vzorčenju dovoljeno, vendar združevanje omejuje statistične postopke, ki se lahko uporabljajo za tako pridobljene podatke. Če sta določen statistični postopek in stopnja značilnosti pomembna faktorja, se mora v preskus vključiti ustrezno število rib, da se prilagodi zaželenemu postopku združevanja vzorcev in statistične značilnosti (6) (7).
BKF je treba izraziti tako kot funkcijo mokre teže in, za visoko lipofilne snovi, kot funkcijo vsebnosti lipida. Vsebnost lipida rib se določi pri vsakem vzorčenju, če je to mogoče. Za določanje vsebnosti lipida se morajo uporabiti ustrezne metode (Literatura 8 in 2 Dodatek 3). Kot standardna metoda se lahko priporoči tehnika z ekstrakcijo kloroforma/metanola (9). Različne metode ne dajo enakih vrednosti (10), zato je pomembno, da so znane podrobnosti o uporabljeni metodi. Če je mogoče, naj se analiza lipida izvede na istem ekstraktu, kot je bil pripravljen za analizo preskusne snovi, saj morajo biti nemalokrat lipidi odstranjeni iz ekstrakta, preden se ga lahko analizira s kromatografom. Vsebnost lipida v ribah (kot mg/kg mokre teže) se na koncu preskusa ne sme razlikovati od začetne vrednosti za več kot ± 25 %. Ravno tako je treba zabeležiti odstotek suhe snovi v tkivu, da se omogoči pretvorba koncentracije lipida od mokre do suhe osnove.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Krivulja absorpcije preskusne snovi se dobi tako, da se njena koncentracija v/na ribi (ali določenih tkivih) v fazi absorpcije grafično prikaže kot funkcija časa na aritmetični lestvici. Če krivulja doseže plato, torej če postane približno asimptotična na časovno premico, se BKFSS stabilnega stanja izračuna na podlagi enačbe:

Če stabilno stanje ni doseženo, se za oceno nevarnosti BKFSS lahko dovolj natančno izračuna na podlagi „stabilnega stanja“ pri 80 % (1,6/k2) ali 95 % (3,0/k2) glede na ravnovesje.
Določi se tudi koncentracijski faktor (BKFk) kot razmerje k1/k2, dveh konstant kinetike prvega reda. Konstanta stopnje očiščenja (k2) se ponavadi določi na osnovi krivulje očiščenja (t.j. grafični prikaz upadanja koncentracije preskusne snovi v ribi s časom). Konstanta stopnje absorpcije (k1) se nato izračuna na podlagi danega k2 in vrednosti Cf, ki se pridobi iz krivulje absorpcije (gl. tudi Dodatek 5). Za izračun faktorja BKFk in konstant stopenj k1 in k2 je zaželena uporaba računalniških metod za izračun nelinearnih parametrskih ocen (11). Sicer se za izračun k1 in k2 lahko uporabijo grafične metode. Če krivulja očiščenja očitno ni krivulja prvega reda, je treba uporabiti bolj zapletene modele (glej literaturo v Dodatku 3) in poiskati nasvet biostatistika.
2.3 RAZLAGA REZULTATOV
Rezultate je treba razlagati previdno, kadar se izmerjene koncentracije preskusnih raztopin pojavljajo na ravneh blizu meje zaznavnosti analitične metode.
Jasno določeni krivulji absorpcije in očiščenja sta pokazateljici kakovostnih podatkov o biokoncentraciji. Odstopanja v konstantah absorpcije/očiščenja med dvema preskusnima koncentracijama morajo znašati manj kot 20 %. Večje opažene razlike v stopnjah absorpcije/očiščenja med obema uporabljenima preskusnima koncentracijama je treba zabeležiti in navesti možne razloge. Ponavadi se meja zaupanja pri biokoncentracijskih faktorjih iz dobro zasnovanih študij približa ± 20 %.
3. POROČANJE
Poročilo o preskusu mora vsebovati naslednje podatke:
3.1 PRESKUSNA SNOV:
— fizikalna narava in, kadar je to primerno, fizikalno-kemijske lastnosti,
— podatki o kemični identifikaciji (vključno z vsebnostjo organskega ogljika, če je to primerno),
— če gre za radioaktivno označeno snov, točen položaj radioaktivnih atoma/atomov in odstotek radioaktivnosti, združene z nečistotami.
3.2 PRESKUSNE VRSTE
— znanstveno ime, sev, vir, kakršna koli predobdelava, aklimatizacija, starost, red velikosti, itd.
3.3 PRESKUSNI POGOJI:
— uporabljeni preskusni postopek (npr. pretočni ali polstatični),
— tip in lastnosti uporabljene svetlobe in obdobje(a) osvetljenosti,
— načrt preskusa (npr. število in velikost preskusnih posod, stopnja nadomeščene vodne prostornine, število ponovitev, število rib na ponovitev, število preskusnih koncentracij, dolžina faze absorpcije in faze očiščenja, pogostost vzorčenja ribjih in vodnih vzorcev),
— metoda priprave založnih raztopin in pogostost obnovitev (dodatek za topnost, njegova koncentracija in njegov prispevek k vsebnosti organskega ogljika v preskusni vodi morajo biti podani, kadar so uporabljeni),
— nominalne preskusne koncentracije, povprečje izmerjenih vrednosti in njihovih normalnih odklonov v preskusnih posodah ter metoda, s pomočjo katere so bili izmerjeni,
— vir vode za pripravo raztopine, opis kakršnih koli predobdelav, rezultati katerih koli predstavitev sposobnosti preskusnih rib, da živijo v tej vodi, in značilnosti vode: pH, trdota, temperatura, koncentracija raztopljenega kisika, stopnje ostanka klora (če so izmerjene), skupni organski ogljik, suspendirane suhe snovi, slanost preskusnega gojišča (če je to primerno) in katere koli druge opravljene meritve,
— kakovost vode v preskusnih posodah, pH, trdota, TOC, temperatura in koncentracija raztopljenega kisika,
— podrobni podatki o hranjenju (na primer vrsta hrane, vir, sestava – najmanj vsebnost lipida in proteina, če je možno, količina dane hrane in pogostost),
— podatki o ravnanju z ribjimi in vodnimi vzorci, vključno s podrobnostmi o pripravi, shranjevanju, ekstrakciji in analitičnih postopkih (in natančnost) za preskusno snov in vsebnost lipida (če je izmerjena).
3.4 REZULTATI:
— rezultati vseh poprej izvedenih študij,
— smrtnost kontrolnih rib in rib v vsaki posodi s preskusno snovjo ter kakršno koli zabeleženo nenavadno obnašanje,
— vsebnost lipida v ribah (če je določena med preskusom),
— krivulje (vključno z vsemi izmerjenimi podatki) iz katerih je razvidna absorpcija in očiščenje preskusne kemikalije v ribi ter čas, potreben za dosego stabilnega stanja,
— Cf in Cw (s standardno deviacijo in razponom, če je to primerno) za vsa vzorčenja (pri čemer je Cf izražen v μg/g mokre teže (ppm) celotnega telesa ali določenega tkiva le-tega, npr. lipid, in Cw v μg/ml (ppm)). Cw vrednosti za kontrolno serijo (zabeležiti je treba tudi ozadje),
— biokoncentracijski faktor stabilnega stanja (BKFSS) in/ali kinetični koncentracijski faktor (BKFk) ter, če je to primerno, 95 % meje zaupanja za konstante stopenj absorpcije in očiščenja (izgube) (vse izraženo v odnosu do celega telesa in skupne vsebnosti lipida v živali ali določenih tkiv le-te, če je izmerjena), meje zaupanja in standardna deviacija (če je na razpolago) in metode analize računavanja/analize podatkov za vsako koncentracijo uporabljene preskusne snovi,
— kadar so uporabljene radioaktivno označene snovi, in če je to potrebno, naj se predloži kopičenje vseh zaznanih metabolitov,
— kar koli nenavadnega v zvezi s preskusom, kakršno koli odstopanje od teh postopkov in kateri koli drugi pomembni podatki,
z razvojem metode pred preskusom in s preskusnim načrtom je treba zmanjšati rezultate v smislu „neopaženo znotraj mej zaznavnosti“, saj se takšni rezultati ne morejo uporabiti za izračun konstante.
4. LITERATURA
(1) Connell D. W. (1988). Bioaccumulation behaviour of persistent chemicals with aquatic organisms. Rev. Environ. Contam. Toxicol. 102, str. 117-156.
(2) Bintein S., Devillers J. and Karcher W. (1993). Non-linear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR and QSAR in Environmental Research, 1, str. 29–390.
(3) OECD, Pariz (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals. No. 3.
(4) Kristensen P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Danska.
(5) US EPA 822-R-94-002 (1994) Great Lake Water Quality Initiative Technical Support Document for the Procedure to Determine Bioaccumulation Factors. Juli 1994.
(6) US FDA (Food and Drug Administration) Revision. Pesticide analytical manual, 1, 5600 Fisher's Lane, Rockville, MD 20852, Juli 1975.
(7) US EPA (1974). Section 5, A(l). Analysis of Human or animal Adipose Tissue, in Analysis of Pesticide Residues in Human and Environmental Samples, Thompson J. F. (ur.) Research Triangle Park, N. C. 27711.
(8) Compaan H. (1980) v „The determination of the possible effects of chemicals and wastes on the aquatic environment: degradation, toxicity, bioaccumulation“, poglavje 2.3, del II. Government Publishing Office, Hag, Nizozemska.
(9) Gardner et al, (1995). Limn. & Oceanogr. 30, str. 1099–1105.
(10) Randall R. C, Lee H., Ozretich R. J., Lake J. L. and Pruell R. J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Toxicol. Chem. 10, str. 1431–1436.
(11) CEC, Bioconcentration of chemical substances in fish: the flow-through method- Ring Test Programme, 1984 to 1985. Final report March 1987. Avtorja: P. Kristensen in N. Nyholm.
(12) ASTM E-1022-84 (Reapproved 1988). Standard Practice for conducting Bioconcentration Tests with Fishes and Saltwater Bivalve Molluscs.
DODATEK 1
Kemične lastnosti sprejemljive razredčene vode
|
SNOV |
MEJNA KONCENTRACIJA |
|
|
1 |
Delci |
5 mg/l |
|
2 |
Skupni organski ogljik |
2 mg/l |
|
3 |
Neionizirani amoniak |
1 μg/l |
|
4 |
Ostanki klora |
10 μg/l |
|
5 |
Skupni organofosforni pesticidi |
50 ng/l |
|
6 |
Skupni organoklorni pesticidi plus poliklorirani bifenili |
50 ng/l |
|
7 |
Skupni organski klor |
25 ng/l |
|
8 |
Aluminij |
1 μg/l |
|
9 |
Arzen |
1 μg/l |
|
10 |
Krom |
1 μg/l |
|
11 |
Kobalt |
1 μg/l |
|
12 |
Baker |
1 μg/l |
|
13 |
Železo |
1μg/l |
|
14 |
Svinec |
1μg/l |
|
15 |
Nikelj |
1μg/l |
|
16 |
Cink |
1μg/l |
|
17 |
Kadmij |
100 ng/1 |
|
18 |
Živo srebro |
100 ng/1 |
|
19 |
Srebro |
100 ng/1 |
DODATEK 2
Priporočene vrste rib za preskušanje
|
Priporocene vrste |
Priporočen razpon preskusnih temperatur( oC) |
Priporočena skupna dolžina preskusnih živali (cm) |
|
|
1 |
Danio rerio (1) (Teleostei, Cyprinidae) (Hamilton-Buchanan) navadna cebrica |
20–25 |
3,0± 0,5 |
|
2 |
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) črnoglavi pisanec |
20–25 |
5,0± 2,0 |
|
3 |
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) Navadni krap |
20–25 |
5,0± 3,0 |
|
4 |
Oryzias latipes (Teleostei, Poeciliidae) (Temminck and Schlegel) medaka |
20–25 |
4,0± 1,0 |
|
5 |
Poecilia reticulata (Teleostei, Poeciliidae) (Peters) gupi |
20–25 |
3,0± 1,0 |
|
6 |
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque) Bluegill |
20–25 |
5,0± 2,0 |
|
7 |
Oncorhynchus mykiss (Teleostei, Salmonidae) (Walbaum) šarenka |
13–17 |
8,0± 4,0 |
|
8 |
Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) zet |
18–20 |
3,0± 1,0 |
|
(1) Meyer A., Orti G. (1993) Proc. Royal Society of London, Series B., zv. 252, str. 231 |
|||
Različne estuarske in morske vrste se uporabljajo v različnih državah, na primer:
|
zebrasta grba |
Leiostomus xanthurus |
|
ovčjeglavi zobati krapovec |
Cyprinodon variegatus |
|
bibavični gavun |
Menidia beryllina |
|
svetlikavi ostriž |
Cymatogaster aggregata |
|
angleška iverka |
Parophrys vetulus |
|
tihomorski jelenjerogi kapelj |
Leptocottus armatus |
|
zet |
Gasterosteus aculeatus |
|
brancin |
Dicentracus labrax |
|
zelenika |
Alburnus alburnus |
Zbirka
Sladkovodne ribe, navedene v tabeli, se gojijo brez posebnosti in/ali so zlahka na voljo vse leto, razpoložljivost morskih in estuarskih vrst pa je deloma omejena na posamezne države. Vzgojijo in gojijo se lahko ali v ribogojnicah ali laboratoriju, pod pogoji, ki nadzirajo bolezni in parazite, tako da je preskusna žival zdrava in znanega porekla. Te ribe so na voljo marsikje po svetu.
DODATEK 3
Napoved trajanja faz absorpcije in očiščenja
1. Napoved trajanje faze absorpcije
Pred izvedbo preskusa se lahko ocena k2 in posledično nekaj odstotkov časa, potrebnega za dosego stabilnega stanja, pridobi na osnovi empiričnih razmerij med k2 in koeficientom porazdelitve n-oktanol/voda (Pow) ali k2 in topnostjo v vodi (s).
Ocena k2 (dan-1) se lahko pridobi, na primer, na podlagi naslednjega empiričnega razmerja (1):
|
log10 k2 = 0,414 log10(Pow) + 1,47(r2 = 0,95) |
[enačba 1] |
Za druga razmerja glej literaturo (2).
Če koeficient porazdelitve (Pow) ni znan, se ocena lahko pridobi (3) na podlagi poznavanja topnosti snovi v vodi (s):
|
log10 (Pow) = 0,862 log10(s) + 0,710 (r2 = 0,994) |
[enačba 2] |
kjer je
s = topnost (mol/l) : (n=36)
Ta razmerja veljajo samo za kemikalije z log Pow vrednostmi med 2 in 6,5 (4).
Čas, potreben za dosego določenega odstotka stabilnega stanja, se lahko izračuna s pomočjo ocene k2 na podlagi splošne kinetične enačbe, ki opisuje absorpcijo in očiščenje (kinetika prvega reda):
![]()
ali če je Cw konstanta:
|
|
[enačba 3] |
Kadar se približamo stabilnemu stanju (t→∞), se enačba 3 lahko okrajša (5) (6):
![]()
Potem je k1/k2 .Cw približek koncentraciji v ribi pri „stabilnem stanju“ (Cf, s).
Enačba 3 se lahko zapiše kot:
|
|
[enačba 4] |
Z uporabo enačbe 4 se čas za dosego določenega odstotka stabilnega stanja lahko predvidi, kadar je k2 predhodno ocenjen z uporabo enačb 1 ali 2.
Kot napotek: statistično najugodnejše trajanje faze absorpcije za pridobitev statistično sprejemljivih podatkov (BKFk) je tisto obdobje, ki se zahteva za krivuljo logaritma koncentracije preskusne snovi v ribah, načrtano proti linearnemu času, da doseže razpolovišče, ali 1,6/k2, ali 80 % stabilnega stanja, ne pa več kot 3,0/k2 ali 95 % stabilnega stanja (7).
Čas, potreben za dosego 80 % stabilnega stanja je (enačba 4):
|
|
[enačba 5] |
Podobno je 95 % stabilnega stanja:
|
|
[enačba 6] |
Na primer, trajanje faze absorpcije (up) za preskusno snov z log Pow = 4 bi bilo (ob uporabi enačb 1, 5 in 6):
|
log10k2 = - 0,414.(4) + 1,47 |
k2 = 0,652 dni-1 |
fa (80 %) = 1,6/0,652, t.y. tj. 2,45 dni (59 ur)
ali fa (95 %) = 3,0/0,652, t.y. tj. 4,60 dni (110 ur)
Prav tako bi faza absorpcije za preskusno snov, ki ima s = 10-5 mol/l (log(s) = - 5,0), trajala (ob uporabi enačb 1, 2, 5 in 6):
log10 (Pow) = 0,862 (- 5,0) + 0,710 = 5,02
log10 K2 =0,414 (5,02) + 1,47
k2 = 0,246 dni -1
fa (80 %) = 1,6/0,246, tj. 6,5 dni (156 ur)
ali fa (95 %) = 3,0/0,246, tj. 12,2 dni (293 ur)
Uporabi se lahko tudi izraz:
teq = 6,54 × 103 Pow + 55,31 (ur)
za izračun časa, potrebnega za dosego efektivnega stabilnega stanja (4).
2. Napoved trajanja faze očiščenja
Napoved časa, potrebnega za zmanjšanje obremenitve telesna na nekaj odstotkov začetne koncentracije, se lahko prav tako izračuna iz splošne enačbe, ki opisuje absorpcijo in očiščenje (kinetika prvega reda) (1) (8).
Za fazo očiščenja se predvideva, da je Cw enak nič. Enačba se lahko okrajša na:
![]()
ali
![]()
kjer je Cf,0 koncentracija na začetku faze očiščenja. 50 % očiščenja bo tako opravljenega v času (t50):

ali
![]()
Podobno se bo 95 % očiščenja doseglo pri:
![]()
Če se 80 % absorpcije uporabi za prvo obdobje 1,6/k 2) in 95 % izgube v fazi očiščenja (3,0/k 2), potem je faza očiščenja približno dvakrat daljša od faze absorpcije.
Pomembno pa je opozoriti, da ocene temeljijo na predvidevanju, da fazi absorpcije in očiščenja sledita kinetiki prvega reda. Če kinetika prvega reda očitno ne ustreza, je treba uporabiti bolj zapletene modele (npr. literatura (1)).
Literatura (Dodatek 3)
(1) Spacie A. and Hamelink J.L. (1982) Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. and Chem. 1, str. 309–320.
(2) Kristensen P. (1991) Bioconcentration in fish: comparison of BCF's derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute.
(3) Chiou C.T. and Schmedding D.W. (1982) Partitioning of organic compounds in octanol-water systems. Environ. Sci. Technol. 16 (1), str. 4–10.
(4) Hawker D.W. and Connell D.W. (1988) Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22 (6), str. 701–707.
(5) Branson D.R., Blau G.E., Alexander H.C. and Neely W.B. (1975) Transactions of the American Fisheries Society, 104 (4). str. 785–792.
(6) Ernst W. (1985) Accumulation in Aquatic organisms. In: Appraisal of tests to predict the environmental behaviour of chemicals. Ed. by Sheehman P., Korte F., Klein W. and Bourdeau P.H. Part 4.4 str. 243–255. SCOPE, 1985, John Wiley & Sons Ltd. N.Y.
(7) Reilly P.M., Bajramovic R., Blau G.E., Branson D.R. and Sauerhoff M.W. (1977) Guidelines for the optimal design of experiments to estimate parameters in first order kinetic models, Can. J. Chem. Eng. 55, str. 614–622.
(8) Konemann H. and Van Leeuwen K. (1980) Toxicokinetics in fish: Accumulation and Elimination of six Chlorobenzenes by Guppies. Chemosphere, 9, str. 3–19.
DODATEK 4
Teoretični primer vzorčne razporeditve biokoncentracijskih preskusov snovi z log Pow = 4
|
Vzročenje rib |
Časovni razpored vzorčenja |
Število vodnih vzorcev |
Število rib na vzorec |
|
|
Minimalna zahtevana pogostnost (v dnevih) |
Dodatno vzorčenje |
|||
|
Faza absorpcije |
-1 0 |
2 (1) 2 |
dodati 45–80 rib |
|
|
1. |
0,3 |
0,4 |
2 (2) |
4 (4) |
|
2. |
0,6 |
0,9 |
2 (2) |
4 (4) |
|
3. |
1,2 |
1,7 |
2 (2) |
4 (4) |
|
4. |
2,4 |
3,3 |
2 (2) |
4 (4) |
|
5. |
4,7 |
2 |
6 |
|
|
Faza očiščenja |
Prenesti ribe v vodo brez preskusnih kemikalij |
|||
|
6. |
5,0 |
5,3 |
4 (4) |
|
|
7. |
5,9 |
7,0 |
4 (4) |
|
|
8. |
9,3 |
11,2 |
4 (4) |
|
|
9. |
14,0 |
17,5 |
6 (4) |
|
|
(1) Vzorčna voda po najmanj treh zamenjanih vsebinah vode. Vrednosti v oklepajih so števila vzorcev (vode, rib), ki naj se upoštevajo, če se izvede dodatno vzorčenje. Opomba: Predhodna ocena k2 za log Pow = 4,0 je 0,652 dni-1. Skupno trajanje preskusa znaša 3 × up = 3 × 4,6 dni, t.j. 14 dni. Za oceno „up“ glej Dodatek 3. |
||||
DODATEK 5
Razlikovanje modelov
Za večino biokoncentracijskih podatkov se predvideva, da se „razmeroma“ dobro opišejo s preprostim dvodelnim/dvoparametrskim modelom, kot je nakazano s premočrtno krivuljo, ki se približuje točkam za koncentracijo v ribah med fazo očiščenja, kadar so le-te grafično prikazane na pollogaritemskem papirju. (Kadar te točke ne morejo biti načrtane s premočrtno krivuljo, je treba uporabiti bolj zapletene modele, glej na primer Spacie in Hamelink, literatura 1 v Dodatku 3).
Grafična metoda za določanje konstante stopnje očiščenja (izgube) k2
Koncentracija preskusne snovi, ki se nahaja v vsakem vzorcu rib, naj se načrta proti času vzorčenja na pollogaritemskem papirju. Nagib te linije je k2.
![]()

Odstopanje od ravne linije lahko kaže na bolj zapleten vzorec očiščenja kot je kinetika prvega reda. Grafična metoda se lahko uporabi za ugotavljanje tipov očiščenja, ki odstopajo od kinetike prvega reda.
Grafična metoda za določanje konstante stopnje absorpcije k1
Če je k2 podan, se k1 izračuna po naslednji enačbi:
|
|
[enačba 1] |
Vrednost Cf se razbere iz razpolovišča enakomerno padajoče krivulje absorpcije na podlagi podatkov, ko je logaritemska koncentracija načrtana proti času (na aritmetični lestvici).
Računalniška metoda za izračun konstant absorpcije in očiščenja (izgube)
Zaželeno je, da se za izračun biokoncentracij skega faktorja ter konstant stopenj k1 in k2 uporabijo računalniške nelinearne parametrične metode ocenjevanja. Ti programi najdejo vrednosti za k1 in k2, če imajo dovolj podatkov o koncentraciji zaporednega časa in model:
|
|
[enačba 2] |
|
|
[enačba 3] |
kjer je tc = čas na koncu faze absorpcije.
Ta pristop omogoča ocene standardne deviacije k1 in k2.
Ker se k2 v večini primerov lahko oceni na podlagi krivulje očiščenja z relativno visoko natančnostjo in ker med parametroma k1 in k2 obstaja močna soodvisnost, če ju določamo sočasno, je priporočljivo, da se najprej izračuna k2 zgolj na podlagi podatkov očiščenja in šele nato k1 na osnovi podatkov absorpcije, pri čemer se uporabi nelinearna regresija.
C.14 PRESKUS RASTI RIBJIH MLADIC
1. METODA
Ta metoda preskušanja toksičnosti za rast ustreza metodi OECD TG 215 (2000).
1.1 UVOD
Ta preskus je namenjen ocenjevanju vplivov daljše izpostavljenosti kemikalijam na rast ribjih mladic. Temelji na metodi, ki je bila razvita in krožno preskušena (1) (2) v Evropski uniji, za ocenjevanje vplivov kemikalij na rast mladic šarenke (Oncorhynchus mykiss) v pretočnih pogojih. Lahko se uporabljajo tudi druge dobro dokumentirane vrste. Veliko izkušenj je bilo na primer pridobljenih s preskusi rasti na cebrici (Danio rerio) ( 31 ) (3) (4) in medaki (medaka, Oryzias latipes) (6) (7) (8).
Glej tudi Splošni uvod Del C.
1.2 OPREDELITEV POJMOV
Najnižja koncentracija z opaznim učinkom (Lowest observed effect concentration – LOEC): je najnižja preskušena koncentracija preskusne snovi, pri kateri je bilo opaženo, da ima snov pomemben učinek (pri p < 0,05) v primerjavi s kontrolo. Vendar pa morajo imeti vse preskusne koncentracije nad LOEC škodljiv učinek, ki je enak ali večji kot učinek, opažen pri LOEC.
Koncentracija brez opaznih učinkov (No observed effect concentration – NOEC): je preskusna koncentracija tik pod LOEC.
EC x : v tej preskusni metodi je to koncentracija preskusne snovi, ki povzroča x % variacije v stopnji rasti rib, kadar jo primerjamo s kontrolo.
Stopnja obremenitve: je mokra teža rib na prostornino vode.
Gostota rib: je število rib na prostornino vode.
Specifična stopnja rasti posameznih rib: izraža stopnjo rasti posamezne ribe na osnovi njene začetne teže.
Povprečna specifična stopnja rasti v bazenu: izraža srednjo stopnjo rasti populacije bazena pri eni koncentraciji.
Psevdo-specifična stopnja rasti: izraža stopnjo rasti posamezne ribe v primerjavi s srednjo začetno težo populacije bazena.
1.3 PRINCIP PRESKUSNE METODE
Mladice v fazi eksponentne rasti se po tehtanju dajo v preskusne komore in izpostavijo nizu subletalnih koncentracij preskusne snovi, ki je raztopljena v vodi, po možnosti s pretokom, ali, če to ni mogoče, pod ustreznimi polstatičnimi pogoji (statični pogoji s periodičnim obnavljanjem). Preskus traja 28 dni. Ribe se hranijo vsak dan. Obrok hrane temelji na začetni teži rib in se lahko ponovno preračuna po 14 dneh. Na koncu preskusa se ribe ponovno stehtajo. Učinki na stopnjo rasti se analizirajo z uporabo regresijskega modela, da se oceni koncentracija, ki povzroči x % variacijo v stopnji rasti, t.j. ECX (npr. EC10, EC20, ali EC30). Druga možnost pa je, da se podatki primerjajo s kontrolnimi vrednostmi, da bi določili najnižjo koncentracijo z opaznim učinkom (LOEC) ter tudi koncentracijo brez opaznih učinkov (NOEC).
1.4 PODATKI O PRESKUSNI SNOVI
Na voljo bi morali biti rezultati preskusa akutne toksičnosti (glej preskusno metodo C.1), ki je bil po možnosti izveden na vrsti, izbrani za ta preskus. To pomeni, da sta znana topnost preskusne snovi v vodi in parni tlak preskusne snovi ter da je na voljo zanesljiva analitska metoda za določitev količine snovi v preskusnih raztopinah z znano in izpričano točnostjo in mejo detekcije.
Koristni podatki zajemajo tudi strukturno formulo, čistost snovi, stabilnost v vodi in na svetlobi, pKa, Pow in rezultate preskusov za lahko biorazgradljivost (glej preskusno metodo C.4).
1.5 VELJAVNOST PRESKUSA
Za veljavnost preskusa morajo biti izpolnjeni naslednji pogoji:
— smrtnost v kontroli (kontrolah) na koncu preskusa ne sme presegati 10 %,
— srednja teža rib v kontroli (kontrolah) se mora dovolj povečati, da omogoča odkrivanje minimalnih variacij stopenj rasti, ki veljajo za pomembne. Krožni preskus (3) je pokazal, da se mora pri šarenki srednja teža rib v kontroli povečati vsaj za polovico (t.j. 50 %) njihove srednje začetne teže v 28 dneh; npr. začetna teža: 1 g/ribo (= 100 %), končna teža po 28 dneh: > 1,5 g/ribo (> 150 %),
— koncentracija raztopljenega kisika mora ves čas preskusa znašati vsaj 60 % nasičenosti zraka (air saturation value – ASV),
— razlika v temperaturi vode v različnih preskusnih komorah med preskusom nikoli ne sme biti večja od ± 1 oC in jo je treba ohranjati v razponu 2 oC znotraj temperaturnih razponov, ki so določeni za preskusno vrsto (Dodatek 1).
1.6 OPIS PRESKUSNE METODE
1.6.1 Naprave
Običajna laboratorijska oprema in zlasti naslednje:
— oksimetri in pH-metri,
— oprema za ugotavljanje trdote in alkalnosti vode,
— ustrezne naprave za nadzor temperature in, po možnosti, stalno spremljanje,
— bazeni, izdelani iz kemijsko inertnih materialov, in primernega volumna glede na priporočeno obremenitev in gostoto rib (glej poglavje 1.8.5 in Dodatek 1),
— primerna točna tehtnica (t.j. točna do ± 0,5 %).
1.6.2 Voda
Za preskusno vodo se lahko uporabi katera koli voda, v kateri kaže preskusna vrsta primerno dolgotrajno preživetje in rast. V času preskusa mora biti voda konstantne kakovosti. pH-vrednost vode mora biti med 6,5 in 8,5, v enem preskusu pa mora biti v območju ± 0,5 pH enote. Priporoča se trdota vode nad 140 mg/l (kot CaCO3). Da bi zagotovili, da voda za redčenje ne bo preveč vplivala na rezultate preskusa (na primer s kompleksacijo preskusne snovi), je treba v ustreznih časovnih razmakih vzeti vzorce za analizo. Izvajati je treba meritve težkih kovin (npr. Cu, Pb, Zn, Hg, Cd in Ni), glavnih anionov in kationov (npr. Ca, Mg, Na, K, Cl in SO4), pesticidov (npr. skupnih organofosforjevih in skupnih organoklorovih pesticidov), skupnega organskega ogljika in suspendiranih trdnih delcev, na primer vsake tri mesece, kadar se ve, da je voda za redčenje relativno konstantne kakovosti. Če je dokazano, da je kakovost vode konstantna vsaj eno leto, se lahko meritve izvajajo manj pogosto, časovni razmaki pa se lahko podaljšajo (npr. na vsakih šest mesecev). Nekatere kemijske lastnosti sprejemljive vode za redčenje so navedene v Dodatku 2.
1.6.3 Preskusne raztopine
Preskusne raztopine izbranih koncentracij se pripravijo z redčenjem osnovne raztopine.
Osnovno raztopino je treba po možnosti pripraviti preprosto z mešanjem ali stresanjem preskusne snovi v vodi za redčenje z uporabo mehanskih sredstev (npr. z mešanjem ali ultrazvokom). Za to, da se dobi primerno koncentrirana osnovna raztopina se lahko uporabijo kolone za nasičevanje raztopine.
V nekaterih primerih je lahko potrebna uporaba topil ali disperzijskih sredstev (topila), da se pripravi primerno koncentrirana osnovna raztopina. Med primernimi topili so aceton, etanol, metanol, dimetilsulfoksid, dimetilformamid in trietilenglikol. Med primernimi disperzij skimi sredstvi so Cremophor RH40, Tween 80, metilceluloza 0,01 % in HCO-40. Pri uporabi lahko biorazgradljivih sredstev (npr.aceton) in/ali lahko hlapnih spojinah je treba paziti, saj lahko povzročijo težave zaradi namnožitve bakterij pri pretočnih preskusih. Kadar se uporabi topila, to ne sme imeti pomembnega vpliva na rast rib niti vidnih škodljivih učinkov na mladice, kar se pokaže s kontrolo, v kateri je le topilo.
Pri pretočnih preskusih je potreben sistem, ki stalno odmerja in redči osnovno raztopino preskusne snovi (npr. merilna črpalka, proporcionalni razredčevalnik, sistem naprav za nasičenje), da v preskusne komore dovaja serije koncentracij. Pretok osnovnih raztopin in vode za redčenje je treba preverjati v ustreznih časovnih razmakih, po možnosti vsak dan, med preskusom in se ne sme razlikovati za več kot 10 % med celotnim preskusom. Krožni preskus (3) je pokazal, da je pri šarenki sprejemljiva pogostost odstranjevanja vode med preskusom 6 litrov/g ribe/dan (glej poglavje 1.8.2.2).
Za semi-statične (obnavljajoče) preskuse, bo pogostost obnavljanja medija odvisna od stabilnosti preskusne snovi, vendar se priporoča dnevno obnavljanje vode. Če iz predhodnih preskusov stabilnosti (glej poglavje 1.4) izhaja, da koncentracija preskusne snovi ni stabilna (t.j. izven območja 80–120 % nominalne ali pod 80 % izmerjene začetne koncentracije) v času obnavljanja, je treba razmisliti o izvedbi pretočnega preskusa.
1.6.4 Izbira vrst
Priporočena vrsta za ta preskus je šarenka (Oncorhynchus mykiss), ker je bila večina izkušenj pridobljenih s krožnimi preskusi s to vrsto rib (1) (2). Uporabi pa se lahko tudi druge dobro dokumentirane vrste, za katere obstajajo dobri zapisi, vendar bo pri tem morda treba preskusni postopek prilagoditi, da se zagotovijo primerni preskusni pogoji. Izkušnje so na primer na voljo tudi za cebrico (Danio rerio) (3) (4) in medako (Oryzias latipes) (5) (6) (7). V tem primeru je treba izbor vrste in eksperimentalne metode utemeljiti v poročilu.
1.6.5 Vzdrževanje rib
Preskusne ribe se izberejo iz populacije enega staleža, po možnosti iz istega drsta, ki so bile vsaj dva tedna pred preskusom kar zadeva kakovost vode in svetlobo v pogojih, podobnih tistim, ki se uporabijo v preskusu. Ves čas vzdrževanja rib in med preskusom je treba ribe hraniti z minimalnim obrokom 2 % telesne teže na dan in po možnosti 4 % telesne teže na dan.
Po 48-urnem času prilagoditve, se evidentira smrtnost in uporabijo se naslednja merila:
— smrtnost v sedmih dneh je večja od 10 % populacije: celotna serija se zavrne,
— smrtnost med 5 in 10 % populacije: prilagoditev naj traja dodatnih sedem dni; če je v drugih sedmih dneh smrtnost večja od 5 %, se zavrne celotna serija,
— smrtnost v sedmih dneh manjša od 5 % populacije: serija se sprejme.
Ribe v dveh tednih pred preskusom ali med poskusom ne smejo biti zdravljene zaradi bolezni.
1.7 NAČRT PRESKUSA
Izraz „načrt preskusa“ se nanaša na izbiro števila in razmakov med preskusnimi koncentracijami, število bazenov za vsako koncentracijo ter število rib na bazen. V idealnem primeru bi bil načrt preskusa izbran ob upoštevanju:
— cilja študije,
— metode statistične analize, ki bo uporabljena,
— razpoložljivosti in stroškov eksperimantalnih virov.
Če je mogoče, bi morala izjava o cilju določati statistično moč, pri kateri se zahteva zaznava dane velikosti razlike (npr. v stopnji rasti), ali – druga možnost – določati točnost, s katero mora biti ocenjen ECX (npr. z x = 10, 20 ali 30 in po možnosti ne manj kot 10). Brez tega ne more biti zagotovo predpisana obsežnost študije.
Pomembno je vedeti, da lahko načrt preskusa, ki je optimalen (najbolje izkoristi vire) za uporabo ene metode statistične analize, ni nujno optimalen za drugo. Priporočeni načrt za oceno LOEC/NOEC torej ne bi bil enak kot načrt, priporočen za regresijsko analizo.
V večini primerov je regresijska analiza bolj zaželena kot analiza variance iz razlogov, ki jih obravnavata Stephan in Rogers (8). Kadar pa se ne najde noben primeren regresijski model (r2 < 0,9), je treba uporabiti metodo LOEC/NOEC.
1.7.1 Načrt preskusa za regresijsko analizo
Pri načrtu preskusa, ki naj bi ga analizirali z regresijo, je pomembno razmisliti o naslednjem:
— Koncentracija z učinkom (npr. EC10,20,30) in razpon koncentracije, v katerem je vpliv preskusne snovi zanimiv, bi morala biti zajeta s koncentracijami, vključenimi v preskus. Natančnost, s katero se ocenijo koncentracije z učinkom, bo največja, ko je koncentracija z učinkom na sredini razpona preskušanih koncentracij. V pomoč pri izbiri ustreznih preskusnih koncentracij je lahko predhodni preskus za ugotavljanje območja.
— Za zagotovitev zadovoljivega statističnega modeliranja mora preskus vključevati vsaj en kontrolni bazen in pet dodatnih bazenov z različnimi koncentracijami. Kjer je to ustrezno, je treba pri uporabi topila poleg preskusne serije izvesti eno kontrolo, ki vsebuje topilo pri najvišji preskušani koncentraciji (glej poglavja 1.8.3 in 1.8.4).
— Uporabi se lahko ustrezno geometrijsko zaporedje ali logaritemsko zaporedje (9) (glej Dodatek 3). Zaželeno je logaritemsko določanje razmakov med preskusnimi koncentracijami.
— Če je na voljo več kot šest bazenov, se dodatni bazeni bodisi uporabijo za zagotovitev ponovitve preskusa bodisi razporedijo preko razpona koncentracij, da se omogočijo manjši razmaki med koncentracijami. Kateri koli od teh dveh ukrepov je enako zaželen.
1.7.2 Načrt za oceno NOEC/LOEC z uporabo analize variance (ANOVA)
Po možnosti bi morale biti na voljo ponovitveni bazeni za vsako koncentracijo, statistična analiza pa bi morala biti izvedena na ravni bazenov (10). Brez ponovitvenih bazenov ne moremo ugotavljati variabilnosti med bazeni, razen variabilnosti zaradi posameznih rib. Vendar pa izkušnje kažejo (11), da je bila med-bazenska variabilnost zelo majhna v primerjavi z variabilnostjo znotraj enega bazena (t.j. med ribami) v preučenem primeru. Zato je relativno sprejemljiva možnost, da se izvede statistična analiza na ravni posameznih rib.
Običajno se uporablja vsaj pet preskusnih koncentracij v geometričnem zaporedju s faktorjem, ki po možnosti ne presega 3,2.
V splošnem, kadar so preskusi izvedeni s ponovitvenimi bazeni, bi moralo biti število ponovitvenih kontrolnih bazenov in zato število rib dvakrat tolikšno kot število pri vsaki od preskusnih koncentracij, ki bi morale biti enake velikosti (12) (13) (14). V nasprotnem primeru, ko ni na voljo ponovitvenih bazenov, bi moralo biti število rib v kontrolni skupini enako številu rib pri vsaki preskusni koncentraciji.
Če naj ANOVA temelji na bazenih in ne na posameznih ribah (kar bi vključevalo ali posamično označevanje rib ali uporabo psevdo-specifičnih stopenj rasti (glej poglavje 2.1.2), je potrebno dovolj veliko število ponovitvenih bazenov, da se omogoči določitev standardnega odklona „bazenov ene koncentracije“. To pomeni, da bi morale biti stopinje prostosti napake v analizi variance vsaj 5 (10). Če so ponovljene le kontrole, obstaja nevarnost, da bo variabilnost napak pristranska, ker se lahko poveča s srednjo vrednostjo zadevne stopnje rasti. Ker je verjetno, da se bo s povečevanjem koncentracije stopnja rasti manjšala, to lahko vodi k precenjevanju variabilnosti.
1.8 POSTOPEK
1.8.1 Izbira in tehtanje preskusnih rib
Pomembno je, da se že na začetku preskusa čim bolj zmanjša variacija teže rib. Primerni razponi velikosti za različne vrste, priporočene za uporabo v tem preskusu, so navedeni v Dodatku 1. Za celo serijo rib, ki so uporabljene v preskusu se v idealnem primeru razpon posameznih tež na začetku preskusa vzdržuje znotraj ± 10 % aritmetične sredine teže in v nobenem primeru ne sme presegati 25 %. Priporočljivo je, da se pred preskusom stehta podvzorec rib, da bi ocenili srednjo težo.
Osnovne populacije rib se ne sme hraniti 24 ur pred začetkom preskusa. Ribe se nato izberejo naključno. Z uporabo splošnega anestetika (npr. vodna raztopina 100 mg/l trikain metan sulfonata (MS 222), nevtralizirana z dodatkom dveh delov natrijevega bikarbonata na del MS 222), se določi mokra teža posameznih rib (osušenih s pivnikom) z natančnostjo, navedeno v Dodatku 1. Ribe s težo znotraj zaželenega razpona se zadržijo in naključno porazdelijo po preskusnih posodah. Zapiše se skupna mokra teža rib v vsaki preskusni posodi. Uporaba anestetika in rokovanje z ribami (vključno s sušenjem in tehtanjem) lahko pri mladicah povzroči stres in poškodbe, zlasti pri majhnih vrstah. Zato je treba z mladicami ravnati izredno pazljivo, da se izognemo povzročanju stresa in poškodb preskusnih živali.
Ribe se ponovno stehtajo na 28. dan preskusa (glej poglavje 1.8.6). Če pa se zdi potrebno, da bi ponovno preračunali obroke hrane, se lahko ribe ponovno stehtajo na 14. dan preskusa (glej poglavje 1.8.2.3). Lahko se uporabi tudi kakšna druga metoda, kot je fotografska metoda, da se ugotovi spremembe v velikosti rib, na osnovi katerih se lahko prilagodijo obroki hrane.
1.8.2 Pogoji izpostavljenosti
1.8.2.1 Trajanje
Preskus traja ≥ 28 dni.
1.8.2.2 Stopnje obremenitve in gostota populacij
Pomembno je, da sta stopnja obremenitve in gostota rib ustrezni za uporabljeno preskusno vrsto (glej Dodatek 1). Če je gostota rib prevelika, bo prišlo do stresa zaradi gneče, kar bo povzročilo zmanjšano stopnjo rasti in mogoče bolezen. Če je gostota premajhna, lahko to povzroči teritorialno vedenje, ki bi tudi lahko vplivalo na rast. V vsakem primeru bi morala biti stopnja obremenitve dovolj nizka, da se lahko ohranja koncentracija raztopljenega kisika vsaj 60 % nasičenosti zraka brez prezračevanja. Krožni preskus (3) je pokazal, da je sprejemljiva stopnja obremenitve za šarenko 16 rib, težkih 3-5 g, na 40 litrov. Priporočena pogostost odstranjevanja vode med preskusom je 6 litrov/g ribe/dan.
1.8.2.3 Hranjenje
Ribe je treba hraniti z ustrezno hrano (Dodatek 1) z zadostno stopnjo, da se omogoči sprejemljiva stopnja rasti. Paziti je treba, da ne pride do rasti mikrobov in kalnosti vode. Pri šarenki je verjetno, da bo stopnja 4 % njihove teže na dan tem pogojem zadostila (2) (15) (16) (17). Dnevni obrok se lahko razdeli na dva enaka dela, ki se dasta ribam v dveh obrokih na dan v razmaku vsaj petih ur. Obrok temelji na začetni skupni teži vseh rib za vsako preskusno posodo. Če se ribe ponovno stehtajo na 14. dan, se obrok ponovno preračuna. Pred tehtanjem se rib 24 ur ne sme hraniti.
Hrano, ki je ribe ne pojedo, in fekalije je treba odstraniti iz posod vsak dan tako, da se s sesalko previdno očisti dno vsakega bazena.
1.8.2.4 Svetloba in temperatura
Fotoperioda in temperatura vode bi morali biti ustrezni za preskusno vrsto (Dodatek 1).
1.8.3 Preskusne koncentracije
Običajno je potrebnih pet koncentracij preskusne snovi, ne glede na načrt preskusa (glej poglavje 1.7.2). V pomoč pri izbiri ustreznih preskusnih koncentracij je predhodno znanje o toksičnosti preskusne snovi (npr. iz akutnega preskusa in/ali iz študij za ugotavljanje območja). Če se uporabi manj kot pet koncentracij, je treba to utemeljiti. Najvišja preskušana koncentracija ne sme preseči meje topnosti snovi v vodi.
Kadar se za pomoč pri pripravi osnovne raztopine uporabi topilo, njegova končna koncentracija ne sme biti večja od 0,1 ml/l in je po možnosti enaka v vseh preskusnih posodah (glej poglavje 1.6.3). Vendar pa si je treba prizadevati, da se uporabi takih materialov izognemo.
1.8.4 Kontrole
Število kontrol z vodo za redčenje je odvisno od načrta preskusa (glej poglavja 1.7–1.7.2). Če se uporabi topilo, je treba vključiti tudi enako število kontrol s topilom kot kontrol z vodo za redčenje.
1.8.5 Pogostost analitskih določitev in meritev
Med preskusom se v rednih časovnih razmakih ugotavljajo koncentracije preskusne snovi (glej spodaj).
V pretočnih preskusih je treba pretok raztopin za redčenje in osnovne raztopine preskusne snovi preverjati v časovnih razmakih, po možnosti dnevno, in ta se med preskusom ne sme spreminjati za več kot 10 %. Kadar se pričakuje, da bo koncentracija preskusne snovi znotraj ± 20 % nominalne vrednosti (t.j. v razponu 80–120 %; glej poglavji 1.6.2 in 1.6.3), se priporoča, da se analizirajo vsaj najvišje in najnižje preskusne koncentracije na začetku preskusa in nato v tedenskih presledkih. Pri preskusih, kjer se pričakuje, da koncentracija preskusne snovi ne bo ostala znotraj ± 20 % nominalne koncentracije (na osnovi podatkov o stabilnosti preskusne snovi), je treba na enak način analizirati vse preskusne koncentracije.
Pri semi-statičnih (obnavljajočih) preskusih, kjer se pričakuje, da bo koncentracija preskusne snovi ostala znotraj ± 20 % nominalne vrednosti, se priporoča, da se analizirajo vsaj najvišje in najnižje sveže pripravljene preskusne koncentracije, tik pred obnovitvijo na začetku študije in kasneje vsak teden. Pri preskusih, kjer se pričakuje, da koncentracija preskusne snovi ne bo ostala znotraj ± 20 % nominalne koncentracije, je treba analizirati vse preskusne koncentracije na enak način kot pri stabilnejših snoveh.
Priporoča se, da rezultati temeljijo na merjenih koncentracijah. Če pa so na voljo dokazi, ki kažejo na to, da se je koncentracija preskusne snovi v raztopini zadovoljivo ohranjala znotraj ± 20 % nominalne ali izmerjene začetne koncentracije ves čas preskusa, lahko rezultati temeljijo na nominalnih ali merjenih vrednostih.
Vzorce bo morda treba filtrirati (npr. z uporabo filtra z velikostjo por 0,45 μm) ali centrifugirati. Priporočen postopek je centrifugiranje. Če pa se preskusni material ne adsorbira na filtre, je lahko sprejemljivo tudi filtriranje.
Med preskusom je treba meriti raztopljeni kisik, pH-vrednost in temperaturo v vseh preskusnih posodah. Skupna trdota, alkalnost in slanost (če je primerno) se merijo v kontrolah in eni posodi z najvišjo koncentracijo. Raztopljeni kisik in slanost (če je primerno) je treba izmeriti vsaj trikrat (na začetku, sredini in koncu preskusa). Pri semi-statičnih preskusih je priporočljivo, da se raztopljeni kisik meri pogosteje, po možnosti pred in po vsakokratni obnovitvi vode ali vsaj enkrat tedensko. pH-vrednost je treba meriti na začetku in na koncu vsakokratne obnove vode pri statičnih obnovitvenih preskusih in vsaj tedensko pri pretočnih preskusih. Trdota in alkalnost se merita enkrat na vsak preskus. Temperatura se po možnosti stalno spremlja v vsaj eni preskusni posodi.
1.8.6 Opazovanja
Teža: na koncu preskusa je treba stehtati vse preživele ribe kot mokro težo (ribe posušene s pivnikom) bodisi v skupinah po preskusnih posodah bodisi posamično. Tehtanje živali po preskusnih posodah je bolj zaželeno kot posamezno tehtanje, pri katerem je treba posamezne ribe označiti. V primeru merjenja posameznih tež rib za ugotavljanje specifične stopnje rasti posameznih rib, je treba tehniko označevanja izbrati tako, da se ne povzroči stres pri živalih (ustrezne so lahko alternativne možnosti drugačne od zamrzovalnega označevanja („freeze marking“), npr. uporaba tanke obarvane ribiške vrvice).
Ribe je treba pregledovati vsak dan v času trajanja preskusa, vse zunanje nepravilnosti (kot so krvavitve, razbarvanje) ter neobičajno vedenje je treba zapisati. Zapisati je treba vse smrtne primere, mrtve ribe pa čim prej odstraniti. Mrtve ribe se ne nadomeščajo, stopnja obremenitve in gostota rib pa sta zadovoljivi, da se preprečijo vplivi na rast zaradi sprememb v številu rib na bazen. Vendar pa bo treba prilagoditi stopnjo hranjenja.
2. PODATKI IN POROČANJE
2.1 OBDELAVA REZULTATOV
Priporoča se, da naj bo tako v načrt kot analizo preskusa vključen tudi statistik, ker so pri tej preskusni metodi mogoče precejšnje variacije načrta eksperimenta, kot na primer v številu preskusnih komor, številu preskusnih koncentracij, številu rib itd. Glede na možnosti, ki so na voljo pri načrtu preskusa, tu niso podana specifična vodila za statistični postopek.
Stopnja rasti se ne izračuna za preskusne posode, v katerih smrtnost presega 10 %. Stopnja smrtnosti pa se navede za vse preskusne koncentracije.
Ne glede na to, katera metoda se uporabi za analizo podatkov, je osrednji koncept specifična stopnja rasti r med časom t1 in časom t2. To se lahko opredeli na različne načine, odvisno od tega, ali so ribe posamično označene ali ne, oziroma ali je potrebno povprečje bazena.
![]()
![]()
![]()
pri čemer je:
|
r1 |
= |
specifična stopnja rasti posamezne ribe |
|
r2 |
= |
povprečna specifična stopnja rasti v bazenu |
|
r3 |
= |
„psevdo“-specifična stopnja rasti |
|
W1, W2 |
= |
teži posamezne ribe ob času t1 in času t2 |
|
loge w1 |
= |
logaritem teže posamezne ribe ob začetku študije |
|
loge w2 |
= |
logaritem teže posamezne ribe ob koncu študije |
|
logeW1 |
= |
povprečje logaritmov vrednosti w1 za ribe v bazenu ob začetku študije |
|
logeW2 |
= |
povprečje logaritmov vrednosti w2 za ribe v bazenu ob koncu študije |
|
t1, t2 |
= |
čas (dnevi) na začetku in na koncu študije |
r1, r2, r3 se lahko izračunajo za obdobje od 0–28 dni in, kjer je to ustrezno (npr. ko je bila izvedena meritev na 14. dan), za obdobje od 0–14 dni in 14–28 dni.
2.1.1 Regresijska analiza rezultatov (model koncentracija-odziv)
Ta metoda poišče primerno matematično razmerje med specifično stopnjo rasti in koncentracijo in tako omogoča oceno „ECX“, t.j. katero koli potrebno vrednost EC. Z uporabo te metode izračun vrednosti r za posamezne ribe (r1) ni nujen in namesto tega lahko analiza temelji na povprečni vrednosti r za bazen (r2). Zaželena je slednja metoda. Prav tako pa je ta ustreznejša v primeru uporabe najmanjših vrst.
Povprečne specifične stopnje rasti v bazenih (r2) je treba grafično prikazati v odvisnosti od koncentracije, da se preveri razmerje med koncentracijo in odzivom.
Za izražanje razmerja med r2 in koncentracijo je treba izbrati ustrezen model in izbira modela mora biti ustrezno utemeljena.
Če je število preživelih rib v vsakem bazenu različno, je treba pretehtati proces prilagoditve modela („model fitting“), pa naj bo ta enostaven ali nelinearen, da se upoštevajo neenake velikosti skupin.
Metoda prilagoditve modela („fitting of model“) mora omogočati oceno, na primer, EC20 in njene porazdelitve (bodisi standardna napaka ali interval zaupanja). Graf prilagojenega modela je treba prikazati v odvisnosti od podatkov, da se lahko razbere ustreznost prilagoditve modela („fit of the model“) (8) (18) (19) (20).
2.1.2 Analiza rezultatov za oceno LOEC
Če je preskus vključeval ponovitvene bazene pri vseh koncentracijah, lahko ocena LOEC temelji na analizi variance (ANOVA) povprečne specifične stopnje rasti v posameznih bazenih (glej poglavje 2.1), ki ji sledi ustrezna metoda (npr. Dunnettov ali Williamsov test (12) (13) (14) (21)) primerjave povprečja r za vsako koncentracijo s povprečjem r za kontrole, z namenom, da se identificira najnižja koncentracija, za katero je ta razlika pomembna pri stopnji verjetnosti 0,05. Če niso izpolnjene zahtevane domneve za parametrske metode – nenormalna porazdelitev (npr. Shapiro-Wilov test) ali heterogena varianca (Bartlettov test), je potreben razmislek o preoblikovanju podatkov, da se poenotijo variance pred izvedbo ANOVA, ali pred izvedbo tehtane ANOVA.
Če preskus ni vključeval ponovitvenih bazenov za vsako koncentracijo, bo ANOVA, ki temelji na bazenih, neobčutljiva ali nemogoča. V takem primeru je sprejemljiv kompromis, da ANOVA temelji na „psevdo“-specifični stopnji rasti r3 za posamezne ribe.
Povprečje r3 za vsako preskusno koncentracijo se potem lahko primerja s povprečnim r3 za kontrole. LOEC se lahko določi kot prej. Zavedati se je treba, da ta metoda niti ne upošteva niti ne zagotavlja zaščite pred variabilnostjo med bazeni, razen tiste, ki je utemeljena z variabilnostjo med posameznimi ribami. Izkušnje pa so pokazale (8), da je bila variabilnost med bazeni zelo majhna v primerjavi z variabilnostjo znotraj bazena (t.j. med ribami). Če posamezne ribe niso vključene v analizo, mora biti zagotovljena metoda določitve osamelcev in treba je utemeljiti njeno uporabo.
2.2 RAZLAGA REZULTATOV
Rezultati morajo biti previdno obrazloženi, kadar so merjene koncentracije snovi v preskusnih raztopinah blizu meje detekcije analitske metode ali, pri semi-statičnih preskusih, kadar se koncentracija preskusne snovi zmanjša med sveže pripravljeno raztopino in pred obnovo.
2.3 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje podatke:
2.3.1 Preskusna snov:
— fizikalno stanje in ustrezne fizikalno-kemijske lastnosti,
— identifikacijski podatki o kemikaliji, vključno s čistostjo in analitsko metodo za količinsko določanje preskusne snovi, kjer je to ustrezno.
2.3.2 Preskusna vrsta:
— znanstveno ime, če je mogoče,
— ev, velikost, dobavitelj, kakršno koli predhodno tretiranje itd.
2.3.3 Preskusni pogoji:
— uporabljeni preskusni postopek (npr. semi-statični/obnavljajoči, pretočni, obremenitev, gostota rib itd.),
— načrt preskusa (npr. število preskusnih posod, preskusnih koncentracij in ponovitev, število rib na posodo),
— metoda priprave osnovnih raztopin in pogostost obnavljanja (navedena morata biti topilo in njegova koncentracija, kadar se uporabi),
— nominalna preskusna koncentracija, srednje vrednosti izmerjenih vrednosti in njihovi standardni odkloni v preskusnih posodah in metoda, s katero so bile te dobljene, ter dokazi, da se meritve nanašajo na koncentracije preskusne snovi v pravi raztopini,
— značilnosti vode za redčenje: pH-vrednost, trdota, alkalnost, temperatura, koncentracija raztopljenega kisika, koncentracija sledi klora (če so bile merjene), skupni organski ogljik, suspendirani trdni delci, slanost preskusnega medija (če je bila merjena) in katere koli druge izvedene meritve,
— kakovost vode v preskusnih posodah: pH-vrednost, trdota, temperatura in koncentracija raztopljenega kisika,
— podrobni podatki o hranjenju (npr. vrsta hrane, vir, dana količina in pogostost).
2.3.4 Rezultati:
— dokazi, da so kontrole izpolnjevale merilo preživetja za veljavnost, in podatki o smrtnosti v kateri koli od preskusnih koncentracij,
— uporabljene statistične analitske tehnike, statistika, ki temelji na ponovitvah ali ribah, obdelava podatkov in upravičenost uporabljenih tehnik,
— tabelaričen prikaz podatkov o posameznih in srednjih težah rib v dnevih 0, 14 (če so bile merjene) in 28, vrednosti povprečne stopnje rasti v bazenu ali psevdo-specifične stopnje rasti (kakor je ustrezno) za obdobje od 0–28 dni ali po možnosti od 0–14 dni in od 14–28 dni,
— rezultati statistične analize (t.j. regresijske analize ali ANOVA), po možnosti v tabelarični in grafični obliki in LOEC (p = 0,05) in NOEC ali ECX, če je mogoče s standardnimi napakami,
— pojav kakršnih koli neobičajnih reakcij rib in kakršnih koli vidnih učinkov, ki jih povzroči preskusna snov.
3. LITERATURA
(1) Solbe J.F. de LG (1987). Environmental Effects of Chemicals (CFM 9350 SLD). Report on a UK Ring Test of a Method for Studying the Effects of Chemicals on the Growth rate of Fish. WRc Report No. PRD 1388-M/2.
(2) Ashley S., Mallett M.J. and Grandy N.J. (1990). EEC Ring Test of a Method for Determining the Effects of Chemicals on the Growth Rate of Fish. Final Report to the Commission of the European Communities. WRc Report No EEC 2600-M.
(3) Crossland N.O. (1985). A method to evaluate effects of toxic chemicals on fish growth. Chemosphere, 14, str. 1855–1870.
(4) Nagel R., Bresh H., Caspers N., Hansen P.D., Market M., Munk R., Scholz N. and Hofte B.B. (1991). Effect of 3,4-dichloroaniline on the early life stages of the Zebrafish (Brachydanio rerio): results of a comparative laboratory study. Ecotox. Environ. Safety, 21, str. 157–164.
(5) Yamamoto, Tokio. (1975). Series of stock cultures in biological field. Medaka (killifish) biology and strains. Keigaku Publish. Tokio, Japan.
(6) Holcombe, G.W., Benoit D.A., Hammermeister, D.E., Leonard, E.N. and Johnson, R.D. (1995). Acute and long-term effects of nine chemicals on the Japanese medaka (Oryzias latipes).Arch. Environ. Conta. Toxicol. 28, str. 287–297.
(7) Benoit, D.A., Holcombe, G.W. and Spehar, R.L. (1991). Guidelines for conducting early life toxicity tests with Japanese medaka {Oryzias latipes). Ecological Research Series EPA-600/3-91-063. U. S. Environmental Protection Agency, Duluth, Minesota.
(8) Stephan C.E. and Rogers J.W. (1985). Advantages of using regression analysis to calculate results of chronic toxicity tests. Aquatic Toxicology and Hazard Assessment: Eighth Symposium, ASTM STP 891, R C Bahner and D J Hansen, Eds., American Society for Testing and Materials, Philadelphia, str. 328–338.
(9) Environment Canada (1992). Biological test method: toxicity tests using early life stages of salmonid fish (rainbow trout, coho salmon, or atlantic salmon). Conservation and Protection, Ontario, Report EPS 1/RM/28, str. 81.
(10) Cox D.R. (1958). Planning of experiments. Wiley Edt.
(11) Pack S. (1991). Statistical issues concerning the design of tests for determining the effects of chemicals on the growth rate of fish. Room Document 4, OECD Ad Hoc Meeting of Experts on Aquatic Toxicology, WRc Medmenham, UK, 10-12 December 1991.
(12) Dunnett C.W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control, J. Amer. Statist. Assoc, 50, str. 1096–1121.
(13) Dunnett C.W. (1964). New tables for multiple comparisons with a control. Biometrics, 20, str. 482–491.
(14) Williams D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, str. 103–117.
(15) Johnston, W.L., Atkinson, J.L., Glanville N.T. (1994). A technique using sequential feedings of different coloured food to determine food intake by individual rainbow trout, Oncorhynchus mykiss: effect of feeding level. Aquaculture 120, str. 123–133.
(16) Quinton, J. C. and Blake, R.W. (1990). The effect of feed cycling and ration level on the compensatory growth response in rainbow trout, Oncorhynchus mykiss. Journal of Fish Biology, 37, str. 33–41.
(17) Post, G. (1987). Nutrition and Nutritional Diseases of Fish. Chapter IX in Testbook of Fish Health. T.F.H. Publications, Inc. Neptune City, New Jersey, USA. 288 P.
(18) Bruce, R.D. and Versteeg D.J. (1992). A statistical procedure for modelling continuous toxicity data . Environ. Toxicol. Chem. 11, 1485–1494.
(19) DeGraeve, G.M., Cooney, J.M., Pollock, T.L., Reichenbach, J.H., Dean, Marcus, M.D. and Mclntyre, D.O. (1989). Precision of EPA seven-day fathead minnow larval survival and growth test; intra and interlaboratory study, report EA-6189 (American Petroleum Institute Publication, n. 4468). Electric Power Research Institute, Palo alto, CA.
(20) Norbert-King T.J. (1988). An interpolation estimate for chronic toxicity: the ICp approach. US Environmental Protection Agency. Environmental Research Lab., Duluth, Minesota. Tech. Rep. No 05–88 of National Effluent Toxicity Assesment Center. Sept. 1988. Str. 12.
(21) Williams D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, str. 510–531.
DODATEK 1
PRIPOROČENE VRSTE RIB ZA PRESKUŠANJE IN USTREZNI POGOJI PRESKUŠANJA
|
Vrsta |
Priporočen razpon preskusne temperature (o C) |
Fotoperioda (v urah) |
Priporočen razpon začetne teže rib (g) |
Zahtevana natančnost merjenja |
Stopnja obremenitve (g/l) |
Gostota rib (na liter) |
Hrana |
Dolžina preskusa (v dnevih) |
|
Priporočena vrsta: |
||||||||
|
Oncorhynchus mykiss šarenka |
12,5–16,0 |
12–16 |
1–5 |
Zaokrožanje na najbližjih 100 mg |
1,2–2,0 |
4 |
Suha hrana zaščitene znamke za salmonidne mladice |
≥ 28 |
|
Druge dobro dokumentirane vrste: |
||||||||
|
Danio rerio cebrica |
21–25 |
12–16 |
0,050–0,100 |
Zaokrožanje na najbližji 1 mg |
0,2– - 1,0 |
5–10 |
Živa hrana (Brachionus Artemia) |
≥ 28 |
|
Oryzias latipes medaka |
21–25 |
12–16 |
0,050–0,100 |
Zaokrožanje na najbližji 1 mg |
0,2–1,0 |
5– 20 |
Živa hrana (Brachionus Artemid) |
≥ 28 |
DODATEK 2
NEKATERE KEMIJSKE ZNAČILNOSTI SPREJEMLJIVE VODE ZA REDČENJE
|
SNOV |
KONCENTRACIJA |
|
Trdni delci |
< 20 mg/l |
|
Skupni organski ogljik |
< 2 mg/l |
|
Neionizirani amoniak |
< 1 μg/l |
|
Ostanek klora |
< 10 μg/l |
|
Skupni organofosfomi pesticide |
< 50 ng/l |
|
Skupni organoklorni pesticidi in poliklorirani bifenili |
< 50 ng/1 |
|
Skupni organski klor |
< 25 ng/1 |
DODATEK 3
Logaritmične serije koncentracij, primerne za preskus toksičnosti (9)
|
Stolpec (število koncentracij med 100 in 10, ali med 10 in 1) (1) |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
32 |
46 |
56 |
63 |
68 |
72 |
75 |
|
10 |
22 |
32 |
40 |
46 |
52 |
56 |
|
3,2 |
10 |
18 |
25 |
32 |
37 |
42 |
|
1,0 |
4,6 |
10 |
16 |
22 |
27 |
32 |
|
2,2 |
5,6 |
10 |
15 |
19 |
24 |
|
|
1,0 |
3,2 |
6,3 |
10 |
14 |
18 |
|
|
1,8 |
4,0 |
6,8 |
10 |
13 |
||
|
1,0 |
2,5 |
4,6 |
7,2 |
10 |
||
|
1,6 |
3,2 |
5,2 |
7,5 |
|||
|
1,0 |
2,2 |
3,7 |
5,6 |
|||
|
1,5 |
2,7 |
4,2 |
||||
|
1,0 |
1,9 |
3,2 |
||||
|
1,4 |
2,4 |
|||||
|
1,0 |
1,8 |
|||||
|
1,3 |
||||||
|
1,0 |
||||||
|
(1) Iz stolpca se lahko izbere serija petih (ali več) zaporednih koncentracij. Vmesne vrednosti med koncentracijami v stolpcu (x) so v stolpcu (2x + 1). Navedene vrednosti lahko predstavljajo koncentracije, izražene v odstotkih na prostornino ali težo (mg/l ali μg/l). Vrednosti se lahko množijo ali delijo s katero koli potenco števila 10, kot je ustrezno. Stolpec 1 se lahko uporabi, če je ugotovljena znatna negotovost stopnje toksičnosti. |
||||||
C.15 RIBE, PRESKUS KRATKOTRAJNE TOKSIČNOSTI NA EMBRIIH IN MLADICAH S HRANILNIM MEŠIČKOM
1. METODA
Ta metoda preskušanja kratkotrajne toksičnosti ustreza metodi OECD TG 212 (1998).
1.1 UVOD
Ta preskus kratkotrajne toksičnosti na ribjih embriih in mladicah s hranilnim mešičkom je kratkotrajni preskus, pri katerem se izpostavijo življenjski stadiji od novo oplojene ikre do konca stadija mladice z rumenjakovo vrečko. Pri preskusu na embriih in mladicah z rumenjakovo vrečko ni predvideno hranjenje, zato se mora preskus končati, ko se mladica še hrani iz hranilnega mešička.
Preskus je namenjen za določanje smrtnih in, delno, subletalnih učinkov kemikalij na posamezni preskušani stadij in vrsto. S tem preskusom se lahko pridobi koristne informacije, ker lahko (a) vzpostavi most med letalnimi in subletalnimi preskusi, (b) se uporabi kot presejalni preskus bodisi za popolni preskus zgodnjega razvojnega stadija ali za preskuse kronične toksičnosti in (c) se uporabi za preskušanje vrst, kjer tehnike gojitve rib niso dovolj razvite, da bi pokrile obdobje prehoda od endogenega do eksogenega hranjenja.
Ne smemo pozabiti, da na splošno lahko dajo točno oceno kronične toksičnosti kemikalij za ribe le preskusi, ki vključujejo vse razvojne stadije rib, in da lahko vsaka omejitev izpostavljenosti, glede življenskih stadijev, zmanjša občutljivost in tako podceni kronično toksičnost. Zato se lahko pričakuje, da bo preskus na embriiih in mladicah s hranilnim mešičkom manj občutljiv kot popolni preskus na zgodnjem razvojnem stadiju, zlasti kar zadeva kemikalije z visoko lipofilnostjo (log Pow > 4) in kemikalije s posebnim načinom toksičnega delovanja. Pričakovali pa bi manjše razlike v občutljivosti med obema preskusoma za kemikalije z nespecifičnim, narkotičnim načinom delovanja (1).
Pred objavo tega preskusa, je bilo največ izkušenj s tem preskusom na embriih in mladicah s hranilnim mešičkom pri sladkovodni ribi Danio rerio, Hamilton-Buchanan (Teleostei, Cyprinidae – cebrica). Zato so v Dodatku 1 podrobnejši napotki za izvedbo preskusa na tej vrsti. To ne izključuje uporabe drugih vrst, s katerimi imamo tudi že izkušnje (Tabela 1).
1.2 OPREDELITEV POJMOV
Najnižja koncentracija z opaznim učinkom (lowest observed effect concentration – LOEC): je najnižja preskušena koncentracija preskusne snovi, pri kateri je bilo opaženo, da ima snov pomemben učinek (pri p < 0,05) v primerjavi s kontrolo. Vendar pa morajo imeti vse preskusne koncentracije nad LOEC škodljiv učinek, ki je enak ali večji kot učinek, opažen pri LOEC.
Koncentracija brez opaznih učinkov (no observed effect concentration – NOEC): je preskusna koncentracija tik pod LOEC.
1.3 PRINCIP PRESKUSA
Embrionalni stadij in stadij mladice s hranilnim mešičkom se izpostavita nizu koncentracij preskusne snovi, raztopljene v vodi. V okviru protokola je možna izbira med semi-statičnim in pretočnim postopkom. Izbira je odvisna od narave preskusne snovi. Preskus se začne tako, da se oplojene ikre položijo v preskusne komore, in se konča tik preden je hranilni mešiček katere koli ličinke v kateri koli preskusni komori povsem absorbiran ali preden začnejo osebki kontrole umirati od lakote. Smrtni in subletalni učinki se ocenjujejo in primerjajo s kontrolnimi vrednostmi, da se določi najnižja koncentracija z opaznim učinkom in iz tega koncentracija brez opaznih učinkov. Druga možnost je, da se jih analizira z uporabo regresijskega modela, da se oceni koncentracija, ki povzroči dani odstotek učinka (t.j. LC/ECX, kjer je x določen % učinka).
1.4 PODATKI O PRESKUSNI SNOVI
Na voljo bi morali biti rezultati preskusa akutne toksičnosti (glej preskusno metodo C.1), ki je bil po možnosti izveden na vrsti, izbrani za ta preskus. Rezultati so lahko uporabni pri izbiri ustreznega obsega preskusnih koncentracij pri preskusu na zgodnjih razvojnih stadijih. Znana morata biti topnost v vodi (vključno s topnostjo v preskusni vodi) in parni tlak preskusne snovi. Na voljo mora biti zanesljiva analitska metoda za določitev količine snovi v preskusnih raztopinah z znano in izpričano točnostjo in mejo detekcije.
Podatki o preskusni snovi, uporabni pri določanju preskusnih pogojev, vključujejo strukturno formulo, čistost snovi, stabilnost na svetlobi, stabilnost v preskusnih pogojih, pKa, Pow in rezultate preskusov za lahko biorazgradljivost (glej preskusno metodo C.4).
1.5 VELJAVNOST PRESKUSA
Za veljavnost preskusa morajo biti izpolnjeni naslednji pogoji:
— celotno število preživelih oplojenih iker v kontrolah in kadar je primerno, v posodah, kjer je samo topilo, mora biti večje ali enako mejnim vrednostim, določenih v Dodatkih 2 in 3, ali njim enako,
— koncentracija raztopljenega kisika mora biti ves čas preskusa med 60 in 100 % nasičenostjo zraka (ASV),
— razlika v temperaturi vode v različnih preskusnih komorah ali v zaporednih dneh med preskusom nikoli ne sme biti večja od ± 1,5oC in jo je treba ohranjati znotraj temperaturnih razponov, ki so določeni za preskusno vrsto (Dodatka 2 in 3).
1.6 OPIS PRESKUSNE METODE
1.6.1 Preskusne komore
Uporabijo se lahko kakršne koli steklene ali druge kemijsko inertne posode. Posode morajo biti dovolj velike, da omogočajo skladnost s stopnjo obremenitve (glej poglavje 1.7.1.2). Priporočljivo je, da se preskusne komore naključno postavijo v območje, kjer poteka preskus. Kadar so v laboratoriju sistematični učinki, ki se jih lahko kontrolira z uporabo razdelitve v bloke, se bolj kot povsem naključni načrt priporoča uporaba načrta naključnih blokov, pri čemer se v vsakem bloku izvajajo vsa tretiranja. Če se uporablja razdelitev v bloke, je to treba upoštevati pri poznejši analizi podatkov. Preskusne komore morajo biti zaščitene pred neželenimi motnjami.
1.6.2 Izbira vrst
Priporočljive ribje vrste so navedene v Tabeli 1A. To ne izključuje uporabe drugih vrst (primeri so navedeni v Tabeli 1B), vendar bo morda treba temu prilagoditi preskusni postopek, da se zagotovijo primerni preskusni pogoji. V tem primeru je treba izbiro vrste in eksperimentalne metode utemeljiti v poročilu.
1.6.3 Vzdrževanje plemenskih rib
Podrobnosti o vzdrževanju plemenskih rib v zadovoljivih pogojih lahko najdemo v OECD TG 210 ( 32 ) in v literaturi (2) (3) (4) (5) (6).
1.6.4 Ravnanje z embrii in ličinkami
Embrii in ličinke se lahko izpostavijo v glavni posodi, v manjših posodah, ki imajo mrežaste stranice ali konce, da se lahko skozi posodo pretaka preskusna raztopina. Neturbulentni tok skozi te majhne posode se lahko doseže tako, da se posode obesijo na držalo, nameščeno tako, da premika posodo gor in dol, vendar tako, da so organizmi ves čas potopljeni; uporabi se lahko tudi sistem s sifonskim splakovanjem. Oplojene ikre salmonidnih rib lahko ležijo na podstavkih ali mrežah z dovolj velikimi luknjicami, da lahko ličinke, ko se izležejo, padejo skoznje. Za odstranjevanje embriev in ličink pri semi-statičnih preskusih s popolno vsakodnevno obnovo je primerna uporaba pasterjevih pipet (glej odstavek 1.6.6).
Kadar se za zadrževanje iker v glavni preskusni posodi uporabljajo posodice, rešetke ali mreže za ikre, je treba te priprave odstraniti, ko se ličinke izležejo (32) , obdržijo se le mreže, da ribe ne pobegnejo. Če je treba ličinke prenesti, se te ne smejo izpostaviti zraku in pri spuščanju rib iz posod za ikre se ne smejo uporabljati lovilne mrežice (taka previdnost morda ni potrebna pri nekaterih manj nežnih vrstah, npr. pri krapu). Čas prenosa je različen, odvisno od vrste in tudi ni vselej potreben. Za semi-statično tehniko se lahko uporabijo čaše ali plitve posode, po potrebi opremljene z mrežastim zaslonom, ki je nekoliko dvignjen od dna posode. Če je prostornina teh posod zadostna glede na zahteve obremenitve (glej 1.7.1.2), prenos embriev ali ličink morda ni potreben.
1.6.5 Voda
Vsaka voda z ustreznimi kemičnimi lastnostmi sprejemljive vode za redčenje, naštetimi v Dodatku 4, v kateri preskušana vrsta kaže vsaj tolikšno preživetje v kontrolah, kot je opisano v Dodatkih 2 in 3, je primerna za preskusno vodo. V času preskusa mora voda ohranjati konstantno kakovost. pH-vrednost mora ostati v območju ± 0,5 pH enote. Za zagotovitev, da voda za redčenje ne bi neprimerno vplivala na preskusni rezultat (na primer s kompleksacijo preskusne snovi) ali škodljivo učinkovala na produktivnost plemenskih rib, je treba v časovnih razmakih jemati vzorce za analizo. Izvajati je treba meritve težkih kovin (npr. Cu, Pb, Zn, Hg, Cd in Ni), glavnih anionov in kationov (npr. Ca, Mg, Na, K, Cl in SO4), pesticidov (npr. skupnih organofosfornih in skupnih organoklornih pesticidov), skupnega organskega ogljika in suspendiranih trdnih delcev, na primer vsake tri mesece, kadar se ve, da je voda za redčenje relativno konstantne kakovosti. Če se dokaže, da je bila kakovost vode konstantna vsaj eno leto, se lahko meritve izvajajo manj pogosto, časovni razmaki pa se lahko podaljšajo (npr. na vsakih šest mesecev).
1.6.6 Preskusne raztopine
Preskusne raztopine izbranih koncentracij se pripravijo z redčenjem osnovne raztopine.
Osnovno raztopino je treba po možnosti pripraviti preprosto z mešanjem ali stresanjem preskusne snovi v vodi za redčenje z uporabo mehanskih sredstev (npr. z mešanjem ali ultrazvokom). Za to, da se dobi primerno koncentrirana osnovna raztopina se lahko uporabijo kolone za nasičevanje raztopine. Kolikor je mogoče, se je treba izogibati uporabi topil ali disperzij skih sredstev (topil); vendar so take zmesi lahko potrebne v nekaterih primerih, da se pripravi primerno koncentrirana osnovna raztopina. Primeri ustreznih topil so aceton, etanol, metanol, dimetil formamid in trietilen glikol. Primeri primernih disperzij skih sredstev Cremophor RH40, Tween 80, metilceluloza 0,01 % in HCO-40. Pri uporabi lahko biorazgradljivih sredstev (npr. acetonu) in/ali lahko hlapnih spojin je treba paziti, saj lahko povzročijo težave zaradi namnožitve bakteriji pri pretočnih preskusih. Kadar se uporabi topil, to ne sme imeti pomembnega vpliva na preživetje niti opaznih škodljivih vplivov na zgodnje razvojne stadije, kar se pokaže pri kontroli, v kateri je le topilo. V vsakem primeru si je treba prizadevati, da se izognemo rabi takih materialov.
Za sem-statično tehniko se lahko uporabita dva različna postopka obnove; bodisi (i) se pripravijo nove preskusne raztopine v čistih posodah in se preživele ikre in ličinke nežno prenesejo v nove posode v majhni količini stare raztopine, ne da bi se izpostavile zraku, bodisi (ii) preskusni organizmi ostanejo v posodah, medtem ko se zamenja del (vsaj tri četrtine) preskusne vode. Pogostost obnove medija je odvisna od stabilnosti preskusne snovi, vendar se priporoča dnevna obnova vode. Če predhodni preskusi stabilnosti (glej poglavje 1.4) pokažejo, da koncentracija preskusne snovi med obnavljanji vode ni stabilna (t.j. izven razpona 80–120 % nominalne ali pod 80 % izmerjene začetne koncentracije), je treba razmisliti o izvedbi pretočnega preskusa. V vsakem primeru je treba poskrbeti, da se ličink ne izpostavlja stresu med postopkom obnavljanja vode.
Za pretočne preskuse je priporočljiv sistem, ki stalno odmerja in redči osnovno raztopino preskusne snovi (npr. merilna črpalka, proporcionalni razredčevalnik, sistem naprav za nasičenje), da dovaja niz koncentracij v preskusne komore. Pretok osnovnih raztopin in vode za redčenje je treba preverjati v ustreznih časovnih razmakih, po možnosti vsak dan, in se ne sme razlikovati za več kot 10 % med celotnim preskusom. Ugotovljeno je bilo, da je primeren pretok enak prostornini vsaj petih preskusnih komor na 24 ur (2).
1.7 POSTOPEK
Koristne informacije o opravljanju preskusov strupenosti na ribjih embriih in mladicah s hranilnim mešičkom so na voljo v literaturi, nekateri primeri so vključeni v poglavju o literaturi v tem besedilu (7) (8) (9).
1.7.1 Pogoji izpostavljenosti
1.7.1.1 Trajanje
Preskus naj se po možnosti začne v 30 minutah po oploditvi iker. Embrii se potopijo v preskusno raztopino pred začetkom brazdanja blastodiska ali takoj po njem in v vsakem primeru pred stadijem gastrule. Pri ikrah, ki se jih dobi od komercialnega dobavitelja, preskusa morda ne bo mogoče začeti takoj po oploditvi. Ker lahko odlašanje z začetkom preskusa resno vpliva na občutljivost preskusa, je treba s preskusom začeti v osmih urah po oploditvi. Ker se ličinke v času izpostavitve ne hranijo, je treba preskus zaključiti, tik preden katera koli ličinka v kateri koli izmed preskusnih komor povsem absorbira hranilni mešiček ali preden se v kontroli začne umiranje zaradi lakote. Trajanje bo odvisno od uporabljene vrste. Nekatera priporočena trajanja so navedena v Dodatkih 2 in 3.
1.7.1.2 Obremenitev
Število oplojenih iker mora biti na začetku preskusa dovolj veliko, da izpolnjuje statistične zahteve. Ikre morajo biti naključno razporejene po tretiranjih in na koncentracijo je treba uporabiti vsaj 30 oplojenih iker, enakomerno porazdeljenih (ali vsaj kolikor je mogoče, ker je pri uporabi nekaterih vrst težko dobiti enake serije) med vsaj tri ponovitvene preskusne komore. Obremenitev (biomasa na prostornino preskusne raztopine) mora biti dovolj nizka za vzdrževanje koncentracije raztopljenega kisika na vsaj 60 % nasičenosti zraka brez prezračitve. Za pretočne preskuse je priporočena obremenitev, ki nikoli ne presega 0,5 g/l na 24 ur in ne presega 5 g/l raztopine (2).
1.7.1.3 Svetloba in temperatura
Fotoperioda in temperatura vode morata biti primerni za preskusne vrste (Dodatka 2 in 3). Za spremljanje temperature, je morda primerno uporabiti dodatno preskusno posodo.
1.7.2 Preskusne koncentracije
Običajno je potrebnih pet koncentracij preskusne snovi v razmakih, določenih s konstantnim faktorjem, ki ne presega 3,2. Pri izbiri obsega preskusnih koncentracij je treba upoštevati krivuljo odvisnosti LC50 od časa izpostavljenosti pri akutnem preskusu. V nekaterih okoliščinah bo morda primerno uporabiti manj kot pet koncentracij, na primer v mejnih preskusih, in manjši razmak med koncentracijami. Če se uporabi manj kot pet koncentracij, je treba to utemeljiti. Koncentracij snovi, ki so višje od LC50 po 96 urah ali 100 mg/l, katera koli je nižja, ni treba preskušati. Snovi se ne sme preskušati nad njihovo mejo topnosti v preskusni vodi.
Kadar se pri pripravi osnovne raztopine uporabi topilo (glej poglavje 1.6.6), njegova končna koncentracija v preskusnih posodah ne sme biti večja od 0,1 ml/l in mora biti enaka v vseh preskusnih posodah.
1.7.3 Kontrole
Poleg preskusnega niza je treba imeti eno kontrolo z vodo za redčenje (z ustreznimi ponovitvami) ter, če je primerno, eno kontrolo s topilom (z ustreznimi ponovitvami).
1.7.4 Pogostost analitskih določitev in meritev
Med preskusom se v rednih intervalih ugotavljajo koncentracije preskusnih snovi.
Pri semi-statičnih preskusih, kjer se pričakuje, da bo koncentracija preskusne snovi ostala znotraj ± 20 % nominalne (t.j. v obsegu 80–120 %; glej oddelek 1.4 in 1.6.6), je priporočljivo, da se analizirata vsaj najvišja in najnižja preskusna koncentracija, ko sta sveže pripravljeni in takoj pred obnovitvijo ob vsaj treh priložnostih, ki so enakomerno razporejene skozi ves preskus (t.j. treba je analizirati vzorec iste raztopine – ko je sveže pripravljena in ob obnavljanju).
Za preskuse, kjer se ne pričakuje, da bo koncentracija preskusne snovi ostala znotraj ± 20 % nominalne (na podlagi podatkov o stabilnosti snovi), je treba analizirati vse preskusne koncentracije, ko so sveže pripravljene in ob obnavljanju, vendar po enakem režimu (t.j. ob vsaj treh priložnostih, ki so enakomerno razporejene skozi preskus). Določanje koncentracij preskusne snovi pred obnavljanjem je treba izvesti le pri eni ponovitveni posodi pri vsaki preskusni koncentraciji. Določitve je treba izvajati v ne več kot sedemdnevnih razmikih. Priporoča se, da rezultati temeljijo na merjenih koncentracijah. Če pa so na voljo dokazi, ki dokazujejo, da se koncentracija preskusne snovi v raztopini zadovoljivo ohranja znotraj ± 20 % nominalne ali izmerjene začetne koncentracije ves čas preskusa, lahko rezultati temeljijo na nominalnih ali merjenih začetnih vrednostih.
Za pretočne preskuse je primeren podoben režim vzorčenja, kot je opisan za polstatične preskuse (vendar se v tem primeru ne merijo „stare“ raztopine). Če pa preskus traja več kot sedem dni, je priporočljivo povečati število vzorčenj v prvem tednu (npr. trije nizi meritev), da se zagotovi stabilnost preskusne koncentracije.
Vzorce je morda treba centrifugirati ali filtrirati (npr. z uporabo filtra s porami velikosti 0,45 μm). Ker pa ne centrifugiranje ne filtriranje ne ločita vselej tiste frakcije preskusne snovi, ki ni biorazpoložljiv, od biorazpoložljive frakcije, ni nujno, da se vzorci tako tretirajo.
Med preskusom je treba meriti raztopljeni kisik, pH in temperaturo v vseh preskusnih posodah. V kontrolah in v eni posodi z najvišjo koncentracijo je treba meriti skupno trdoto in slanost (če je primerno). Raztopljeni kisik in slanost (če je primerno) je treba izmeriti vsaj trikrat (na začetku, na sredi in na koncu preskusa). Pri polstatičnih preskusih je priporočljivo, da se raztopljeni kisik meri pogosteje, po možnosti pred in po vsaki obnovitvi vode in po njej ali vsaj enkrat na teden. Pri semi-statičnih preskusih je treba pH izmeriti na začetku in na koncu vsake obnovitve vode, pri pretočnih preskusih pa vsaj enkrat tedensko. Trdoto je treba izmeriti enkrat na vsak preskus. Temperaturo je treba meriti vsak dan in jo je najbolje nenehno spremljati v vsaj eni preskusni posodi.
1.7.5 Opazovanja
1.7.5.1 Stadiji razvoja embria
Embrionalni stadij (t.j. stadij gastrule) je treba na začetku izpostavljenosti preskusni snovi kolikor je mogoče natančno preveriti. To se lahko naredi z uporabo reprezentativnega vzorca iker, ki so primerno konzervirane in očiščene. Opis in prikaz embrionalnega stadija lahko najdemo tudi v literaturi (2) (5) (10) (11).
1.7.5.2 Izvolitev in preživetje
Vsaj enkrat na dan je treba opazovati izvalitev in preživetje in to zapisati. Zaželeno je, da so opazovanja pogostejša na začetku preskusa (npr. vsakih 30 minut v prvih treh urah), ker je v nekaterih primerih čas preživetja bolj pomemben kot le število smrti (npr. pri akutnih toksičnih učinkih). Mrtve embrie in ličinke je treba odstraniti, takoj ko jih opazimo, ker se lahko zelo hitro razkrojijo. Izjemna pazljivost je potrebna, pri odstranjevanju posameznih mrtvih osebkov, da ne udarimo ali fizično poškodujemo sosednjih iker/ličink, saj so te izjemno nežne in občutljive. Merila za smrt so različna glede na razvojni stadij:
— za ikre: zlasti v zgodnjih stadijih opazna izguba prosojnosti in sprememba barve, ki jo povzroči koagulacija in/ali obarjanje beljakovin, ki povzročajo bel moten videz,
— za embrie: odsotnost gibanja telesa in/ali odstonost srčnega utripa in/ali motna razbarvanost pri vrstah, katerih embrii so sicer prosojni,
— za ličinke: negibnost in/ali odsotnost dihalnega gibanja in/ali odsotnost srčnega utripa in/ali bela motna obarvanost osrednjega živčnega sistema in/ali pomanjkanje odzivanja na mehanske dražljaje.
1.7.5.3 Nenormalen videz
Število ličink, ki kažejo nenormalne telesne oblike in/ali nenormalno obarvanost, in stadij absorbcije hranilnega mešička, je treba zapisovati v primernih intervalih, odvisno od trajanja preskusa in narave opisane anomalije. Opozoriti je treba, da so nenormalni embrii in ličinke lahko naraven pojav, in jih je v kontrolah pri nekaterih vrstah lahko več odstotkov. nenormalne živali se odstranijo iz posode šele, ko poginejo.
1.7.5.4 Nenormalno vedenje
Nenormalnosti, npr. hiperventilacija, nekoordinirano plavanje, netipično mirovanje je treba zapisovati v primernih časovnih razmakih odvisno od trajanja preskusa. Te učinke je sicer težko količinsko opredeliti, vendar lahko, kadar jih opazimo, pripomorejo k interpretaciji podatkov o smrtnosti, t.j. pridobijo podatke o načinu toksičnega delovanja snovi.
1.7.5.5 Dolžina
Na koncu preskusa je priporočljivo merjenje dolžine posameznih osebkov; uporabimo lahko standardno dolžino (dolžino do razcepa repne plavuti) ali celotno dolžino. Če pa pride do razpada ali erozije repne plavuti, je treba uporabiti standardno dolžino. Nasplošno mora biti pri preskusih, ki dobro potekajo, koeficient variacije dolžine med ponovitvami v kontrolah < 20 %.
1.7.5.6 Teža
Na koncu preskusa se lahko izmerijo posamezne teže; bolje je izmeriti suho težo (24 ur pri 60 oC) kot mokro težo (po sušitvi s pivnikom). Nasplošno bi moral biti pri preskusu, ki dobro poteka, koeficient variacije teže med ponovitvami v kontrolah ≤ 20 %.
Na podlagi teh opažanj bodo za statistično analizo na razpolago vsi oziroma nekateri spodaj navedeni podatki:
— kumulativna umrljivost,
— število zdravih ličink na koncu preskusa,
— čas začetka in konca izvalitve iker (t.j. 90 % izvaljenih ličink pri vsaki ponovitvi),
— število ličink, ki se izležejo vsak dan,
— dolžina (in teža) preživelih živali na koncu preskusa,
— število ličink, ki so deformirane ali nenormalnega videza,
— število ličink, ki kažejo nenormalno vedenje.
2. PODATKI IN POROČANJE
2.1 OBDELAVA REZULTATOV
Priporoča se, da naj bo tako v načrt kot analizo preskusa vključen tudi statistik, ker ta preskusna metoda omogoča precejšnje variacije načrta eksperimenta, kot na primer v številu preskusnih komor, številu preskusnih koncentracij, v začetnem številu oplojenih iker in v izmerjenih parametrih. Glede na možnosti, ki so na voljo pri načrtu preskusa, tu niso podana specifična navodila za statistični postopek.
Da bi ocenili LOEC/NOEC, bi bilo treba analizirati variance v vsakem nizu ponovitev z uporabo analize variance (ANOVA) ali kontingenčne tabele. Da bi naredili večkratno primerjavo med rezultati posameznih koncentracij in rezultaih v kontrolah, je lahko uporabna Dunnettova metoda (12) (13). Na voljo so tudi drugi uporabni primeri (14) (15). Izračunati je treba velikost učinka, ki ga zaznamo z uporabo ANOVA ali drugih postopkov (t.j. moč preskusa) in poročati o njem. Opozoriti je treba, da vsa opazovanja, našteta v poglavju 1.7.5.6, niso primerna za statistično analizo z ANOVA. Na primer, kumulativna smrtnost in število zdravih ličink na koncu preskusa se lahko analizirata s probit metodami.
Da bi ocenili LC/ECxs, je treba (a) ustrezno krivuljo, kot je logistična krivulja, prilagoditi podatkom, ki nas zanimajo, z uporabo statistične metode, kot je metoda najmanjših kvadratov ali metoda nelinearnih najmanjših kvadratov. Krivuljo je treba parametrizirati, tako da se lahko neposredno oceni LC/ECX, ki nas zanima, in njegova standardna napaka. To bo zelo olajšalo izračun mej zaupanja okoli LC/ECX. Če ni dobrih razlogov za uporabo drugačne ravni zaupanja, je treba navesti dvostransko 95 % zaupanje. Postopek prilagoditve naj po možnosti zagotavlja sredstva za oceno pomembnosti neprilagojenosti („lack of fit“). Uporabijo se lahko grafične metode za prilagajanje krivulj. Za vsa opazovanja, našteta v poglavju 1.7.5.6, je primerna regresijska analiza.
2.2 RAZLAGA REZULTATOV
Rezultate je treba razlagati previdno, kadar so merjene koncentracije toksičnih snovi v preskusnih raztopinah blizu meje detekcije analitske metode. Prav tako pazljivo je treba razložiti rezultate za koncentracije nad topnostjo snovi v vodi.
2.3 POROČILO O PRESKUSU
Poročilo o preskusu mora vključevati naslednje podatke:
2.3.1 Preskusna snov:
— fizikalno stanje in ustrezne fizikalno-kemijske lastnosti,
— identifikacijski podatki o kemikaliji, vključno s čistostjo in analitsko metodo za količinsko določanje preskusne snovi, kjer je to ustrezno.
2.3.2 Preskusna vrsta:
— znanstveno ime, sev, število starševskih rib (t.j. koliko samic je bilo uporabljenih za zagotovitev potrebnega števila iker v preskusu), vir in metoda zbiranja oplojenih iker in nadaljnje ravnanje z njimi.
2.3.3 Preskusni pogoji:
— uporabljeni preskusni postopek (npr. semi-statični ali pretočni, časovno obdobje od oploditve do začetka preskusa, obremenitev itn.),
— fotoperioda,
— načrt preskusa (npr. število preskusnih komor in ponovitev, število embriev na ponovitev),
— metoda priprave osnovnih raztopin in pogostost obnove (navesti je treba topilo in njegovo koncentracijo, če je to uporabljeno),
— nominalne preskusne koncentracije, izmerjene vrednosti, njihove srednje vrednosti in standardni odkloni v preskusnih posodah in metoda določitve, ter če je preskusna snov topna v vodi v koncentracijah pod preskušenimi, je treba priskrbeti dokaze, da se meritve nanašajo na koncentracije preskusne snovi v raztopini,
— značilnosti vode za redčenje: pH, trdota, temperatura, koncentracija raztopljenega kisika, koncentracija sledi klora (če so bile merjene), skupni organski ogljik, suspendirani trdni delci, slanost preskusnega medija (če je bila merjena) in katere koli druge izvedene meritve,
— kakovost vode v preskusnih posodah: pH, trdota, temperatura in koncentracija raztopljenega kisika.
2.3.4 Rezultati:
— rezultati kakršnih koli uvodnih študij stabilnosti preskusne snovi,
— dokazi, da kontrole ustrezajo standardom sprejemljivega preživetja za to preskusno vrsto (Dodatka 2 in 3),
— podatki o smrtnosti/preživetju v embrionalnem stadiju in stadiju ličink ter skupna smrtnost/preživetje,
— dnevi do izvalitve in število izvaljenih ličink,
— podatki o dolžini (in teži),
— pojav in opis morebitnih morfoloških nepravilnosti,
— pojav in opis morebitnih učinkov na vedenje,
— statistična analiza in obdelava podatkov,
— za preskuse, analizirane z metodo ANOVA, ocena najnižje koncentracije z opaznim učinkom (LOEC) pri p = 0,05 in koncentracije brez opaznih učinkov (NOEC) za vsak obravnavan odziv, vključno z opisom uporabljenih statističnih postopkov in obseg opaženega učinka,
— za preskuse, analizirane z regresijskimi tehnikami, LC/ECx in intervali zaupanja ter graf prilagojenega modela („graf of fitted model“), uporabljenega za izračun,
— pojasnilo morebitnih odstopanj od te preskusne metode.
3. LITERATURA
(1) Kristensen P. (1990) Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, str 60. Junij 1990.
(2) ASTM (1988). Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. Str. 26.
(3) Brauhn J.L. and Schoettger R.A. (1975). Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. p.54, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota.
(4) Brungs W.A. and Jones B.R. (1977) Temperature Criteria for Freshwater Fish: Protocol and Procedures p. 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota.
(5) Laale H.W. (1977) The Biology and Use of the Zebrafish {Brachydanio rerio) in Fisheries Research. A Literature Review. J. Biol. 10, 121–173.
(6) Legault R. (1958) A Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, str. 328–330.
(7) Dave G., Damgaard B., Grande M., Martelin J.E., Rosander B. and Viktor T. (1987). Ring Test of an Embryo-larval Toxicity Test with Zebrafish {Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, str. 61–71.
(8) Birge J.W., Black J.A. and Westerman A.G. (1985). Short-term Fish and Amphibian Embryo-larval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, str. 807–821.
(9) Van Leeuwen C.J., Espeldoorn A. and Mol F. (1986) Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. III. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, 129–145.
(10) Kirchen R.V. and W. R. West (1969). Teleostean Development. Carolina Tips 32(4): 1–4. Carolina Biological Supply Company.
(11) Kirchen R.V. and W. R. West (1976). The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina. Str. 36.
(12) Dunnett C.W. (1955) A Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc, 50, str. 1096–1121.
(13) Dunnett C.W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, 482–491.
(14) Mc Clave J.T., Sullivan J.H. and Pearson J.G. (1980). Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia.
(15) Van Leeuwen C.J., Adema D.M.M. and Hermes J. (1990). Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, str. 321–334.
(16) Environment Canada. (1992). Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS l/RM/28, December 1992, str. 81.
(17) Dave G. and Xiu R. (1991). Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio rerio. Arch. of Environmental Contamination and Toxicology, 21, 126–134.
(18) Meyer A., Bierman C.H. and Orti G. (1993). The phylogenetic position of the Zebrafish (Danio rerio), a model system in developmental biology – an invitation to the comperative methods. Proc. Royal Society of London, Series B, 252: 231–236.
(19) Ghillebaert F., Chaillou C, Deschamps F. and Roubaud P. (1995). Toxic Effects, at Three pH Levels, of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, 19–28.
(20) US EPA, (1991). Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPA report EPA/600/3-91/064, Dec. 1991, EPA, Duluth.
(21) US EPA, (1991). Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Oryzias latipes). EPA report EPA/600/3-91/063, Dec. 1991, EPA, Duluth.
(22) De Graeve G.M., Cooney J.D., Mclntyre DO., Poccocic T.L., Reichenbach N.G., Dean J.H. and Marcus M.D. (1991). Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, 1189–1203.
(23) Calow P. (1993). Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish.
(24) Balon E.K. (1985). Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, str. 280.
(25) Blaxter J.H.S. (1988). Pattern and variety in development, In: W.S. Hoar and D.J. Randall Eds., Fish Physiology, vol. XIA, Academic press, str. 1–58.
Tabela 1A
Ribje vrste, priporočene za preskušanje
|
SLADKOVODNE |
|
Oncorhvnchus mykiss Šarenka (9) (16) |
|
Danio rerio Cebrica (7) (17) (18) |
|
Cyprinus caprio Krap (8) (19) |
|
Oryzias latipes Medaka (20) (21) |
|
Pimephales promelas Črnoglavi pisanec (8) (22) |
Tabela 1B
Primeri drugih dobro dokumentiranih vrst, ki so bile tudi uporabljene
|
SLADKOVODNE |
MORSKE |
|
Carassius auratus Zlata ribica (8) |
Menidia peninsulae Bibavični glavun (23) (24) (25) |
|
Lepomis macrochirus Vrsta ostriža (8) |
Clupea harengus Atlantska sled (24) (25) |
|
Gadus morhua Trska (24) (25) |
|
|
Cyprinodon variegatus Bisernasti krapič (23) (24) (25) |
DODATEK 1
SMERNICE ZA IZVEDBO PRESKUSA TOKSIČNOSTI NA EMBRIIH IN MLADICAH S HRANILNIM MEŠIČKOM CEBRICE (Brachydanio rerio)
UVOD
Cebrica izvira iz Koromandijske obale Indije, kjer naseljuje hitro tekoče vode. To je pogosta akvarijska riba iz družine krapov, tako da lahko podatke o njeni negi in gojenju dobimo v standardni referenčni literaturi o tropskih ribah. Njeno biologijo in uporabo v ribogojniških raziskavah, je podal Laale (1).
Ta riba redko doseže dolžino več kot 45 mm. Njeno telo je cilindrične oblike s 7–9 temno modrimi vodoravnimi srebrnkastimi progami. Proge se stekajo v repno in predrepno plavut. Hrbet je olivnozelen. Samci so vitkejši od samic. Samice so bolj srebrnkaste in njihov trebuh je napihnjen, zlasti pred drstenjem.
Odrasle ribe lahko prenesejo velika nihanja v temperaturi, pH in trdoti vode. Vendar je treba zagotoviti optimalne pogoje, da bi dobili zdrave ribe, ki proizvajajo kvalitetne ikre.
Med drstenjem samec zasleduje samico in se zaletava vanjo, in ko samica izloča ikre, jih samec oplaja. Ikre, ki so prozorne in nelepljive, padejo na dno, kjer jih starši včasih pojedo. Na drstenje vpliva svetloba. Če je jutranja svetloba primerna, se ribe navadno drstijo v zgodnjih jutranjih urah takoj po zori.
Samica lahko proizvede serije več sto iker v tedenskih razmikih.
POGOJI ZA STARŠEVSKE RIBE. REPRODUKCIJO IN ZGODNJE RAZVOJNE STADIJE
Izberite primerno število zdravih rib in jih vsaj dva tedna pred nameravanim drstenjem hranite v ustrezni vodi (npr. Dodatek 4). Skupini rib je treba omogočiti, da se razmnožujejo vsaj enkrat, preden naredijo serijo iker, ki bo uporabljena v preskusu. Gostota rib v tem času ne sme preseči 1 gram rib na liter. Redno menjavanje vode ali uporaba prečiščevalnih sistemov bosta omogočila večjo gostoto. V bazenih je treba ohranjati temperaturo 25 ± 2 oC. Ribe morajo imeti raznoliko prehrano, ki je lahko na primer sestavljena iz ustrezne komercialne suhe hrane, živih, komaj izleglih rakocov rodu Artemia, trzač, vodnih bolh, belih črvov (Enchytracheidae).
Spodaj sta opisana dva postopka, ki sta v praksi pripeljala do dovolj velike serije zdravih, oplojenih iker za izvedbo preskusa:
(i) Osem samic in 16 samcev se da v bazen s 50 litri vode za redčenje, zaščiti pred neposredno svetlobo in pusti čim bolj pri miru vsaj 48 ur. Popoldan, en dan pred začetkom preskusa se na dno akvarija položi drstitveni pladenj. Drstitveni pladenj je sestavljen iz 5–7 cm visokega okvirja (iz pleksi stekla ali drugega primernega materiala), na zgornjo stran je pritrjena 2–5 milimetrska groba mreža, na dno pa 10–30 mikrometrska fina mreža. Na grobo mrežo na okvirju pritrdimo več „drstnih debel“, ki so iz ravne najlonske vrvice. Potem ko so bile ribe 12 ur v temi, prižgemo šibko svetilko, ki bo sprožila drstenje. Dve do štiri ure po drstenju odstranimo drstitveni pladenj in poberemo ikre. Drstitveni pladenj bo ribam onemogočil, da bi pojedle ikre, hkrati pa omogočil, da se jih brez težav pobere. Skupina rib se mora drstiti vsaj enkrat pred tistim drstenjem, katerega ikre so uporabljene za preskušanje.
(ii) Pet do deset ribjih samcev in samic nastanimo posamič vsaj dva tedna pred načrtovanim drstenjem. Po 5–10 dneh se trebuhi samic napihnejo in njihove genitalne papile postanejo vidne. Samci nimajo papil. Drstenje se opravi v drstitvenih bazenih, opremljenih z lažnim prežastim dnom (kot zgoraj). Bazen je napoljnen z vodo za redčenje, tako da je gladina vode 5–10 cm nad mrežico. Dan pred načrtovanim drstenjem damo v bazen eno samico in dva samca. Postopno povečujemo temperaturo vode do ene stopinje nad prilagoditveno temperaturo. Ugasnemo svetilko in pustimo bazen čim bolj pri miru. Zjutraj prižgemo šibko svetilko, ki sproži drstenje. Po 2–4 urah odstranimo ribe in poberemo ikre. Če potrebujemo večje skupke iker, kot jih lahko dobimo od ene samice, lahko hkrati postavimo dovolj veliko število drstnih bazenov. Če si zapisujemo produktivnost posameznih samic pred preskusom (velikost in kakovost skupka), lahko izberemo tiste, ki so najbolj uspešne pri reprodukciji.
Ikre moramo prenesti v preskusne posode s steklenimi cevkami (z notranjim premerom, ki ni manjši od 4 mm), ki imajo namestljivo sesalno bučo. Količina vode pri prenosu iker mora biti čim manjša. Ikre so težje od vode in se odtočijo iz cevke. Paziti moramo, da ikre (in ličinke) ne bi prišle v stik z zrakom. Narediti je treba mikroskopski pregled vzorcev serij, da se zagotovi, da ni nepravilnosti v prvih razvojnih stadijih. Dezinfekcija iker ni dovoljena.
Stopnja smrtnosti iker je najvišja v prvih 24 urah po oploditvi. V tem obdobju je opažena smrtnost pogosto 5–40 %. Ikre degenerirajo zaradi neuspešne oploditve ali napak v razvoju. Kakovost serije iker je verjetno odvisna od samice, ker nekatere samice dosledno proizvajajo kakovostne ikre, druge pa nikoli. Serije se razlikujejo tudi v hitrosti razvoja in stopnja izvalitve. Preživetje uspešno oplojenih iker in ličink s hranilnim mešičkom je dobro, večinoma 90 %. Pri 25 oC se ličinke izležejo 3–5 dni po oploditvi in absorbirajo hranilni mešiček približno 13 dni po oploditvi.
Embrionalni razvoj sta dobro opisala Hisaoka in Battle (2). Zaradi prosojnosti iker in ličink po izvalitvi lahko sledimo razvoju ribe in opazimo prisotnost deformnosti. Približno štiri ure po drstenju lahko ločimo neoplojene ikre od oplojenih (3). Za ta pregled položimo ikre v preskusne posode majhne prostornine in jih proučujemo pod mikroskopom.
Preskusni pogoji, ki se nanašajo na zgodnje razvojne stadije, so našteti v Dodatku 2. Optimalna vrednost za pH je 7,8 in za trdoto vode pa 250 mg CaCO3/l.
IZRAČUNI IN STATISTIČNI PODATKI
Priporočen je dvofazni pristop. Najprej se statistično analizirajo podatki o smrtnosti, nenormalnem razvoju in času izvalitve. Nato se statistično ovrednoti dolžina telesa pri tistih koncentracijah, pri katerih ne opazimo škodljivih učinkov na katerega koli od teh parametrov. Ta pristop je priporočljiv, ker lahko toksična snov selektivno ubija manjše ribe, odloži čas izvalitve in povzroča velike deformnosti in so zato meritve dolžine lahko pristranske. Poleg je treba pri vsakem tretiranju izmeriti približno enako število rib, da zagotovimo veljavnost preskusne statistike.
DOLOČANJE LC50 IN EC50
Izračuna se odstotek preživelih iker in ličink ter korigira glede na smrtnost v kontrolah po Abbottovi enačbi (4):

kjer je,
|
P |
= |
korigiran % preživelih |
|
P' |
= |
% preživelih, opaženih v preskusni koncentraciji |
|
C |
= |
preživetje v kontroli |
Če je mogoče, se LC50 določa po primerni metodi na koncu preskusa.
Če želimo v statistiko EC50 vključiti morfološke nepravilnosti, najdemo ustrezna navodila v Stephan (5).
OCENA LOEC IN NOEC
Cilj preskusa na ikrah in mladicah s hranilnim mešičkom je primerjati koncentracije različne od nič s kontrolami, t.j. določiti LOEC. Zato moramo uporabiti postopke multiple primerjave (6) (7) (8) (9) (10).
LITERATURA
(1) Laale H.W. (1977) The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Fish Biol. 10, 121–173.
(2) Hisaoka K.K. and Battle H.I. (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio (Hamilton-Buchanan) J. Morph., 102, str. 311.
(3) Nagel R. (1986). Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachydanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, str. 173–181.
(4) Finney D.J. (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, str. 1–333.
(5) Stephan C.E. (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment: Fifth Conference, ASTM STP 766, J.G. Pearson, R.B. Foster and W.E. Bishop, Eds., American Society for Testing and Materials, str. 69–81.
(6) Dunnett C.W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc, 50, str. 1096–1121.
(7) Dunnett C.W. (1964) New Tables for Multiple Comparisons with a Control. Biometrics, 20, 482–491.
(8) Williams D.A. (1971). A Test for Differences Between Treatment Means when Several Dose Levels are Compared with a Zero Dose Control. Biometrics, 27, str. 103–117.
(9) Williams D.A. (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, str. 519–531.
(10) Sokal R.R. and Rohlf F.J. (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W.H. Freeman and Co., San Francisco.
DODATEK 2
PRESKUSNI POGOJI, TRAJANJE IN MERILA PREŽIVETJA ZA PRIPOROČENE VRSTE
|
VRSTA |
TEMP (0C) |
SLANOST (0/00) |
FOTO-PERIODA (ure) |
TRAJANJE STADIJEV (dnevi) |
TIPIČNO TRAJANJE PRESKUSA |
PREŽIVETJE V KONTROLAH, (NAJMANJŠI %) |
||
|
EmbrIo |
mladica s hranilni m mešičko m |
uspeh izvalitve |
po izvalitvi |
|||||
|
SLADKOVODNE |
||||||||
|
Brachydanio rerio cebrica |
25 ± 1 |
— |
12–16 |
3–5 |
8–10 |
Čim prej po oploditvi (zgodnji stadij gastrule) do 5 dni po izvalitvi (8–10 dni) |
80 |
90 |
|
Oncorhynchus mykiss šarenka |
10 ± 1 (1) 12 ± 1 (2) |
— |
0 () |
30–35 |
25–30 |
Čim prej po oploditvi (zgodnji stadij gastrule) do 20 dni po izvalitvi (50–55 dni) |
66 |
70 |
|
Cyprinus carpio |
21 – 25 |
— |
12–16 |
5 |
> 4 |
Čim prej po oploditvi (zgodnji stadij gastrule) do 4 dni po izvalitvi (8–9 dni) |
80 |
75 |
|
Oryzias latipes Medaka |
24 ± 1 (1) 23 ± 1 (2) |
— |
12–16 |
8–11 |
4–8 |
Čim prej po oploditvi (zgodnji stadij gastrule) do 5 dni po izvalitvi (13–16 dni) |
80 |
80 |
|
Pimephales promelas črnoglavi pisanec |
25 ± 2 |
— |
16 |
4–5 |
5 |
Čim prej po oploditvi (zgodnji stadij gastrule) do 4 dni po izvalitvi (8–9 dni) |
60 |
70 |
|
(1) Za embrie. (2) Za ličinke. (3) Tema ze embrie in ličinke, dokler ne mine en teden po izvalitvi, razen kadar se jih pregleduje. Nato blaga svetloba skozi celoten preskus |
||||||||
DODATEK 3
Preskusni pogoji, trajanje in merila preživetja za druge dobro dokumentirane vrste
|
VRSTA |
TEMP ( oC) |
SLANOST (0/00) |
FOTOPERIODA (ure) |
TRAJANJE STADIJEV (dnevi) |
TIPIČNO TRAJANJE PRESKUSA |
PREŽIVETJE V KONTROLAH, (NAJMANJŠI %) |
||
|
EMBRI |
MLADICA S HRANILNIM MEŠIČKOM |
uspeh izvalitve |
po izvalitvi |
|||||
|
SLADKOVODNE |
||||||||
|
Carassius auratus zlata ribica |
24 ± 1 |
— |
— |
3–4 |
> 4 |
Čim prej po oploditvi (zgodnji stadij gastrule) do 4 dni po izvalitvi (7 dni) |
— |
80 |
|
Leopomis macrochirus vrsta ostriža |
21 ± 1 |
— |
16 |
3 |
> 4 |
Čim prej po oploditvi (zgodnji stadij gastrule) do 4 dni po izvalitvi (7 dni) |
— |
75 |
|
MORSKE |
||||||||
|
Menidia peninsulae bibavični glavun |
22–25 |
15–22 |
12 |
1,5 |
10 |
Čim prej po oploditvi (zgodnji stadij gastrule) do 5 dni po izvalitvi (6–7 dni) |
80 |
60 |
|
Clupea harengus atlantski sled |
10 ± 1 |
8–15 |
12 |
20–25 |
3–5 |
Čim prej po oploditvi (zgodnji stadij gastrule) do 3 dni po izvalitvi (23–27 dni) |
60 |
80 |
|
Gadus morhua trska |
5 ± 1 |
5–30 |
12 |
14–16 |
3–5 |
Čim prej po oploditvi (zgodnji stadij gastrule) do 3 dni po izvalitvi (18 dni) |
60 |
80 |
|
Cyprinodon variegatus biserjasti krapič |
25 ± 1 |
15–30 |
12 |
— |
— |
Čim prej po oploditvi (zgodnji stadij gastrule) do 4/7 dni po izvalitvi (28 dni) |
> 75 |
80 |
DODATEK 4
NEKATERE KEMIČNE ZNAČILNOSTI SPREJEMLJIVE VODE ZA REDČENJE
|
Snov |
Koncentracije |
|
Trdni delci |
< 20 mg/l |
|
Skupni organski ogljik |
< 2 mg/l |
|
Neionizirani amoniak |
< 1 μg/l |
|
Klor v sledeh |
< 10 μg/l |
|
Skupni organofosforni pesticidi |
< 50 ng/l |
|
Skupni organoklorni pesticidi in poliklorirani bifenili |
< 50 ng/l |
|
Skupna količina organskega klora |
< 25 ng/l |
C.16 ČEBELE DELAVKE – PRESKUS AKUTNE ORALNE TOKSIČNOSTI
1. METODA
Ta preskusna metoda akutne toksičnosti ustreza metodi OECD TG 213 (1998).
1.1 UVOD
Ta preskus toksičnosti je laboratorijska metoda, namenjena oceni akutne oralne toksičnosti fitofarmacevtskih sredstev in drugih kemikalij za odrasle čebele delavke.
Pri ocenjevanju in vrednotenju toksičnih značilnosti snovi je lahko potrebna določitev akutne oralne toksičnosti pri čebelah, npr. kadar je verjetna izpostavljenost čebel dani kemikaliji. Preskus akutne oralne toksičnosti se izvede za določitev inherentne toksičnosti pesticidov in drugih kemikalij za čebele. Rezultate tega preskusa je treba uporabiti za določane potrebe po nadaljnjem vrednotenju. Ta metoda se lahko uporablja zlasti v programih z več koraki za ocenjevanje nevarnosti pesticidov za čebele, ki temelji na zaporednem napredovanju preskusov toksičnosti v laboratorijih do pol-poljskih in poljskih poskusih (1). Pesticidi se lahko preskušajo kot aktivne snovi (a.s.) ali kot formulirani pripravki.
Za preverjanje občutljivosti čebel in natančnosti preskusnega postopka se uporabljajo toksični standardi.
1.2 OPREDELITEV POJMOV
Akutna oralna toksičnost: so škodljivi učinki, ki se pojavijo v največ 96 urah (h) oralnega dajanja enkratnega odmerka preskusne snovi.
Odmerek: je količina zaužite preskusne snovi. Odmerek se izraža kot masa (ug) preskusne snovi na preskusno žival (μg/čebelo). dejanskega odmerka na vsako čebelo ni mogoče izračunati, ker se čebele hranijo skupinsko, lahko pa se oceni povprečni odmerek (v celoti zaužita preskusna snov/število preskusnih čebel v eni kletki).
LD 50 (srednji smrtni odmerek) oralno: je statistično izpeljan enkratni odmerek snovi, ki lahko povzroči smrt pri 50 % živali, če ga dajemo po oralni poti. Vrednost LD50 se izraža v (ug) preskusne snovi na čebelo. Za pesticide je preskusna snov lahko bodisi aktivna snov (a.s.) ali formuliran pripravek, ki vsebuje eno ali več aktivnih snovi.
Smrtnost: žival zapišemo kot mrtvo, ko je povsem negibna.
1.3 PRINCIP PRESKUSNE METODE
Odrasle čebele delavke (opis mellifera) se izpostavijo nizu odmerkov preskusne snovi, dispregirane v raztopini saharoze. Čebele nato dobivajo enako hrano, v kateri ni preskusne snovi. Vsaj 48 ur se dnevno zapisuje smrtnost in se primerja s kontrolnimi vrednostmi. Če se stopnja smrtnosti povečuje v času med 24. in 48. uro, smrtnost kontrol pa ostaja na sprejemljivi ravni, t.j. < 10 %, je primerno, da se preskus podaljša na največ 96 ur. Rezultati se analizirajo, da se izračuna LD50 pri 24 in 48 urah in, če se preskus podaljša, pri 72 in 96 urah.
1.4 VELJAVNOST PRESKUSA
Za veljavnost preskusa veljajo naslednji pogoji:
— povprečna smrtnost za skupno število kontrol ne sme presegati 10 % na koncu preskusa,
— LD50 toksičnega standarda ustreza določenemu območju.
1.5 OPIS PRESKUSNE METODE
1.5.1 Zbiranje čebel
Uporabiti moramo mlade odrasle čebele delavke iste pasme, t.j. čebele iste starosti, prehranjevalnega statusa itn. Dobiti jih moramo iz kolonij z matico, ki so primerno hranjene, so zdrave, kolikor je mogoče brez bolezni, z znano zgodovino in fiziološkim stanjem. Zberemo jih lahko v zjutraj na dan preskusa ali večer pred preskusom in jih imamo pod preskusnimi pogoji do naslednjega dne.Primerne so čebele, ki jih zberemo s satnic brez zaroda. Izogibati se je treba zbiranju zgodaj spomladi in pozno jeseni, ker je v tem času fiziološko stanje čebel spremenjeno. Če je treba preskuse opraviti zgodaj spomladi ali pozno jeseni, se čebele lahko dajo v inkubator in en teden hranijo s „čebeljo pogačo“ (pelodom, nabranim iz sata) in raztopino saharoze. Čebele, ki se zdravijo s kemičnimi snovmi, kot so antibiotiki, pripravki proti varoozi itn., se ne smejo uporabljati za preskus toksičnosti štiri tedne od časa, ko se je prenehalo z zadnjim zdravljenjem.
1.5.2 Bivalni in prehranjevalni pogoji
Uporabljajo se kletke, ki jih je lahko čistiti in so zračne. Uporabi se lahko kateri koli primeren material, npr. nerjaveče jeklo, žična mreža, plastika ali lesene kletke za enkratno uporabo itn. Po možnosti naj bo v vsaki kletki 10 čebel. Velikost preskusnih kletk mora biti primerna za število čebel, t.j. da zagotavlja dovolj prostora.
Čebele je treba imeti v temi v prostoru, kjer se preskus izvaja pri temperaturi 25 ± 2 oC. Ves čas preskusa je treba zapisovati relativno vlažnost, ki je navadno okoli 50-70 %. Postopki ravnanja, vključno z tretiranji in opazovanji, se lahko izvajajo na (dnevni) svetlobi. Kot hrana se uporablja raztopina saharoze v vodi s končno koncentracijo 500 g/l (50 % m/V). Po danih preskusnih odmerkih, je treba zagotoviti hrano ad libitum. Sistem hranjenja mora dopuščati zapisovanje zaužite hrane za vsako kletko (glej poglavje 1.6.3.1). Uporablja se lahko steklena cevka (približno 50 mm dolga in 10 mm široka z odprtim koncem zoženim na približno 2 mm v premeru).
1.5.3 Priprava čebel
Zbrane čebele naključno porazdelimo v preskusne kletke, ki jih naključno postavimo v prostor, kjer se izvaja preskus.
Čebele se pred začetkom preskusa lahko stradajo do 2 uri. Priporočljivo je, da se čebel pred tretiranjem ne hrani, tako da so na začetku preskusa vse čebele v enakem stanju, glede vsebine prebavil. Umirajoče čebele moramo pred začetkom preskusa zavreči in jih nadomestiti z zdravimi.
1.5.4 Priprava odmerkov
Kadar je preskusna snov zmes, ki se meša z vodo, se lahko dispergira neposredno v 50-odstotni raztopini saharoze. Za tehnične proizvode in snovi, težko topne v vodi, lahko uporabimo nosilce, kot so organska topila, emulgatorji ali disperzna sredstva nizke toksičnosti za čebele (npr. aceton, dimetil formamid, dimetil sulfoksid). Koncentracija nosilca je odvisna od topnosti preskusne snovi in mora biti enaka za vse preskusne koncentracije. Vendar je splošno primerna koncentracija topila 1 %, ki se ne sme preseči.
Pripraviti je treba primerne kontrolne raztopine, t.j. kadar se za raztapljanje preskusne snovi uporabi topilo ali disperzijsko sredstvo, je treba uporabiti dve ločeni kontrolni skupini: raztopino v vodi in raztopino saharoze s topilom/nosilcem v koncentraciji, uporabljeni pri preskusnih raztopinah.
1.6 POSTOPEK
1.6.1 Preskusne in kontrolne skupine
Število preskušenih odmerkov in ponovitev mora zadoščati statističnim potrebam za določanje LD50 z intervalom zaupanja 95 %. Navadno je za preskus potrebnih pet odmerkov v geometrijskem zaporedju s faktorjem, ki ne presega 2,2 in pokriva območje LD50. Vendar je treba faktor redčenja in število koncentracij za odmerjanje določiti glede na nagib krivulje toksičnosti (odmerek/smrtnost) in z upoštevanjem statistične metode, izbrane za analizo rezultatov. Preskus za določitev območja omogoča izbiro primernih koncentracij za odmerjanje.
Vsako preskusno koncentracijo je treba odmeriti najmanj trem ponovitvenim preskusnim skupinam, v vsaki naj bo 10 čebel. Poleg preskusnega niza je treba pripraviti še najmanj tri kontrolne serije po 10 čebel. Vključiti je treba tudi kontrolne serije za uporabljena topila/nosilce (glej poglavje 1.5.4).
1.6.2 Toksični standard
V preskusni niz je treba vključiti tudi toksični standard. Za zajetje pričakovane vrednosti LD50, je treba izbrati vsaj tri odmerke. Pri vsakem preskusnem odmerku je treba uporabiti najmanj tri ponovitvene kletke, v vsaki mora biti po 10 čebel. Zaželen toksični standard je dimetoat, za katerega je znana vrednost LD50-24 h oralno v območju 0,10–0,35 μg a.s./čebelo (2). Kadar se lahko priskrbi dovolj podatkov za potrditev pričakovanega odziva na odmerek (npr. parati on), se lahko uporabijo drugi toksični standardi.
1.6.3 Izpostavljenost
1.6.3.1 Dajanje odmerkov
Vsaka preskusna skupina čebel mora dobiti 100–200 μl 50-odstotne vodne raztopine saharoze, ki vsebuje preskusno snov v ustrezni koncentraciji. Za proizvode z nizko topnostjo, nizko toksičnostjo ali nizko koncentracijo v formulaciji, je potrebna večja količina, ker je treba uporabiti večje deleže raztopine saharoze. Treba je spremljati količino tretirane hrane, ki jo zaužije posamezna skupina. Ko je hrana porabljena (navadno v 3–4 urah), je treba krmilnik odstraniti iz kletke in ga nadomestiti s tistim, ki vsebuje samo raztopino saharoze. Raztopina saharoze se nato dodaja ad libitum. Za nekatere spojine pri višjih koncentracijah je lahko posledica zavrnitve preskusnega odmerka ta, da je zaužite malo ali nič hrane. Po največ 6 urah je treba nezaužito tretirano hrano nadomestiti s čisto raztopino saharoze. Treba je oceniti količino zaužite tretirane hrane (npr. meritve prostornine/teže preostale tretirane hrane).
1.6.3.2 Trajanje
Najbolje je, da preskus traja 48 ur po tem, ko se preskusna raztopina zamenja s čisto raztopino saharoze. Če se smrtnost še naprej povečuje za več kot 10 % po prvih 24 urah, je treba podaljšati preskus na največ 96 ur, pod pogojem, da smrtnost kontrolnih skupin ne presega 10 %.
1.6.4 Opazovanja
Smrtnost se zapiše 4 ure po začetku preskusa in odtlej po 24 urah in 48 urah (t.j. po tem ko se da odmerek). Če je treba podaljšati opazovalni čas, je treba izvesti dodatna opazovanja v 24-urnih intervalih do največ 96 ur, pod pogojem da kontrolna smrtnost ne preseže 10 %.
Oceniti je treba količino zaužite hrane na skupino. Primerjava stopnje zaužitja tretirane in netretirane hrane v danih 6 urah lahko zagotovi informacije o okusnosti tretirane hrane.
Zapisati je treba vse nenormalne vedenjske učinke, opažene v preskusnem obdobju.
1.6.5 Mejni preskus
V nekaterih primerih (npr. kadar se pričakuje, da je preskusna snov nizke toksičnosti) se lahko naredi mejni preskus, tako da uporabimo 100 μg a.s./čebelo, da bi prikazali, da je LD50 večji od te vrednosti. Uporabiti je treba isti postopek, vključno s tremi ponovitvenimi preskusnimi skupinami za preskusni odmerek, ustreznimi kontrolami, oceno količine zaužite tretirane hrane in uporabo toksičnega standarda. Če se opazi umiranje, je treba izvesti popolno študijo. Če se opazijo subletalni učinki (glej poglavje 1.6.4), jih je treba zapisati.
2. PODATKI IN POROČANJE
2.1 PODATKI
Podatke je treba povzeti v obliki tabele, ki za vsako tretirano Skupino ter za kontrolne skupine in za skupine toksičnega standarda prikazujejo število uporabljenih čebel, smrtnost ob vsakem času opazovanja in število čebel, ki se nenormalno vedejo. Podatki o smrtnosti se analizirajo z ustreznimi statističnimi metodami (npr. probit analizo, drsečo sredino, binomsko verjetnostjo) (3) (4). Grafično se prikaže krivulje odziva v odvisnosti od odmerka ob vsakem priporočenem opazovalnem času in izračunajo nagib krivulj in srednji smrtni odmerki (LD50) z 95 % intervalom zaupanja. Popravki glede na smrtnost kontrolnih skupin se lahko naredijo z uporabo Abbottovega popravka (4) (5). Kadar tretirana hrana ni v celoti porabljena, je treba določiti odmerek preskusne snovi, ki jo zaužije posamezna skupina. LD50 je treba izraziti v μg preskusne snovi na čebelo.
2.2 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje podatke:
2.2.1 Preskusna snov:
— fizikalno stanje in ustrezne fizikalno-kemijske lastnosti (npr. stabilnost v vodi, parni tlak),
— identifikacijski podatki o kemikaliji, vključno s strukturno formulo, čistostjo (t.j. za pesticide, identiteta in koncentracija aktivne snovi/aktivnih snovi).
2.2.2 Preskusna vrsta:
— znanstveno ime, pasma, približna starost (v tednih), metoda in datum zbiranja,
— informacije o kolonijah, ki so bile uporabljene za zbiranje preskusnih čebel, vključno z zdravjem, morebitno boleznijo v odraslosti, morebitnim predhodnim zdravljenjem itn.
2.2.3 Preskusni pogoji:
— temperatura in relativna vlažnost prostora, kjer se izvaja preskus,
— bivalni pogoji vključno z vrsto, velikostjo in materialom kletk,
— metode priprave osnovnih in preskusnih raztopin (navesti je treba topilo, če je uporabljeno, in njegovo koncentracijo),
— načrt preskusa, se pravi število in koncentracije preskusnih odmerkov, število kontrol; za vsako preskusno koncentracijo in kontrolo, število ponovitvenih kletk in število čebel na kletko,
— datum preskusa.
2.2.4 Rezultati:
— rezultati morebitne predhodne študije za določitev območja,
— grobi podatki: smrtnost pri vsakem preskušenem odmerku v vsakem opazovalnem času,
— graf odziva v odvisnosti od odmerka na koncu preskusa,
— vrednosti LD50 z 95 % intervalom zaupanja ob vsakem od priporočenih opazovalnih časov za preskusno snov in toksični standard,
— statistični postopki, uporabljeni za določitev LD50,
— smrtnost pri kontrolah,
— drugi opaženi ali izmerjeni biološki učinki, npr. nenormalno vedenje čebel (vključno z zavračanjem preskusnih odmerkov), stopnja zaužitja hrane v tretiranih in netretiranih skupinah,
— kakršno koli odstopanje od tu opisanega preskusnega postopka in kakršni koli drugi relevantni podatki.
3. LITERATURA
(1) EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products – Honeybees. EPPO bulletin, vol. 23, N.1, 151–165. March 1993.
(2) Gough, H. J., McIndoe, E.C., Lewis, G.B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.) 1981-1992. Journal of Apicultural Research, 22, 119–125.
(3) Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99–113.
(4) Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
(5) Abbott, W.S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol.,18, 265–267.
C.17 ČEBELE – PRESKUS AKUTNE KONTAKTNE TOKSIČNOSTI
1. METODA
Ta metoda preskušanja akutne toksičnosti ustreza metodi OECD TG 214 (1998).
1.1 UVOD
Ta preskus toksičnosti je laboratorijska metoda, namenjena oceni akutne kontaktne toksičnosti fitofarmacevtskih sredstev in drugih kemikalij za odrasle čebele delavke.
Pri ocenjevanju in ovrednotenju toksičnih lastnosti snovi, je lahko potrebna določitev akutne kontaktne toksičnosti pri čebelah, npr. kadar je verjetna izpostavljenost čebel dani kemikaliji. Preskus akutne kontaktne toksičnosti se izvede, da se ugotovi inherentna toksičnost pesticidov in drugih kemikalij za čebele. Rezultate teh preskusov je treba uporabiti za opredelitev potrebe po nadaljnjem ocenjevanju. Ta metoda se lahko uporablja zlasti v programih z več koraki za vrednotenje nevarnosti pesticidov za čebele, ki temeljijo na zaporednem napredovanju od preskusov toksičnosti v laboratorijih do pol-poljskih in poljskih preskusov (1). Pesticidi se lahko preskušajo kot aktivne snovi (a.s.) ali kot formulirani pripravki.
Za potrditev občutljivosti čebel in natančnosti preskusnega postopka je treba uporabiti toksični standard.
1.2 OPREDELITEV POJMOV
Akutna kontaktna toksičnost: so škodljivi učinki, ki se pojavijo v največ 96 urah topične aplikacije enkratnega odmerka snovi.
Odmerek: je količina uporabljene preskusne snovi. Odmerek je izražen kot masa (μg) preskusne snovi na testno žival (μg/čebelo).
LD 50 (srednji smrtni odmerek) pri kontaktu: je statistično dobljen enkratni odmerek snovi, ki lahko povzroči smrt pri 50 % živalih, ki se aplicira s kontaktom. Vrednost LD50 se navede v μg preskusne snovi na čebelo. Za pesticide je preskusna snov lahko bodisi aktivna snov (a.s.) ali formuliran proizvod, ki vsebuje eno aktivno snov ali več.
Smrtnost: žival zapišemo kot mrtvo, ko je povsem negibna.
1.3 PRINCIP PRESKUSNE METODE
Odrasle čebele delavke (Apis mellifera) se izpostavijo nizu odmerkov preskusne snovi, raztopljene v ustreznem nosilcu, z neposredno aplikacijo na toraks (kapljice). Trajanje preskusa je 48 ur. Če se stopnja smrtnosti povečuje v času med 24. in 48. uro, medtem ko smrtnost kontrolne skupine ostaja na sprejemljivi ravni, t.j. ± 10 %, je primerno podaljšati preskus na največ 96 ur. Smrtnost se dnevno zapisuje in primerja s kontrolnimi vrednostmi. Rezultati se analizirajo, da se izračuna LD50 po 24-ih urah in 48 urah, in če se preskus podaljša, po 72 urah in 96 urah.
1.4 VELJAVNOST PRESKUSA
Za veljavnost preskusa veljajo naslednji pogoji:
— povprečna smrtnost za celotno število kontrol ne sme preseči 10 % na koncu preskusa,
— LD50 toksičnega standarda ustreza določenemu območju.
1.5 OPIS PRESKUSNE METODE
1.5.1 Zbiranje čebel
Uporabiti moramo mlade odrasle čebele delavke, t.j. čebele iste starosti, prehranjevalnega statusa, pasme itn. Dobiti jih moramo iz kolonij z matico, ki dobivajo primerno hrano, so zdrave, kolikor je mogoče brez bolezni, z znano zgodovino in fiziološkim stanjem. Zberemo jih lahko zjutraj na dan poskusa ali večer pred preskusom in jih imamo pod preskusnimi pogoji do naslednjega dne. Primerne so čebele, ki jih zberemo s satnic brez zaroda. Izogibati se je treba zbiranju zgodaj spomladi in pozno jeseni, ker je v tem času fiziološko stanje čebel spremenjeno. Če je treba preskuse opraviti zgodaj spomladi ali pozno jeseni, se čebele lahko dajo v inkubator in en teden hranijo s „čebeljo pogačo“ (pelodom, nabranim iz sata) in raztopino saharoze. Čebele, ki se zdravijo s kemičnimi snovmi, kot so antibiotiki, proizvodi proti varoozi itn., se ne smejo uporabiti za preskus toksičnosti štiri tedne od časa, ko se je prenehalo z zadnjim zdravljenjem.
1.5.2 Bivalni in prehranjevalni pogoji
Uporabljajo se kletke, ki jih je lahko čistiti in so zračne. Uporabi se lahko kateri koli primeren material, npr. nerjavno jeklo, žična mreža, plastika ali lesene kletke za enkratno uporabo itn. Velikost preskusnih kletk mora biti primerna za število čebel, t.j. da zagotavlja dovolj prostora. Po možnosti naj bo v vsaki kletki 10 čebel.
Čebele je treba imeti v temi v prostoru, kjer se izvaja preskus pri temperaturi 25 ± 2 oC. Ves čas preskusa je treba zapisovati relativno vlažnost, ki je navadno okoli 50-70 %. Postopki ravnanja, vključno z tretiranjem in opazovanji, se lahko izvajajo na (dnevni) svetlobi. Kot hrana se uporablja raztopina saharoze v vodi s končno koncentracijo 500 g/l (50 % m/v), ki jo je treba zagotavljati ad libitum v preskusnem času z uporabo krmilnika čebele. To je lahko steklena cevka (približno 50 mm dolga in 10 mm široka z odprtim koncem, zožanim na približno 2 mm v premeru).
1.5.3 Priprava čebel
Zbrane čebele se lahko za nanos preskusne snovi anestezirajo z ogljikovim dioksidom ali dušikom. Uporabljena količina anestetika in čas izpostavljenosti morata biti čim manjša. Umirajoče čebele moramo pred začetkom preskusa zavreči in jih nadomestiti z zdravimi.
1.5.4 Priprava odmerkov
Preskusno snov je treba nanesti kot raztopino v nosilcu, t.j. v organskem topilu ali v vodni raztopini z vlažilnim sredstvom. Organsko topilo naj bo po možnosti aceton, vendar se lahko uporabijo tudi druga organska topila nizke toksičnosti za čebele (npr. dimetil formamid, dimetil sulfoksid). Za formulirane pripravke dispergirane v vodi in zelo polarne organske snovi, ki niso topne v organskih topilih, je raztopine lažje nanašati, če so pripravljene v šibki raztopini komercialnega vlažilnega sredstva (npr. Agral, Cittowett, Lubrol, Triton, Tween).
Pripraviti je treba primerne kontrolne raztopine, t.j. kadar se za raztapljanje preskusne snovi uporabi topilo ali disperzijsko sredstvo, je treba uporabiti dve ločeni kontrolni skupini: eno, tretirano z vodo, in eno, tretirano z topilom/disperzij skim sredstvom.
1.6 POSTOPEK
1.6.1 Preskusne in kontrolne skupine
Število preskušanih odmerkov in ponovitev mora zadoščati statističnim zahtevam za določitev LD50 z 95 % intervalom zaupanja. Navadno je za preskus potrebnih pet odmerkov v geometrijskemem zaporedju s faktorjem, ki ne presega 2,2 in pokriva območje LD50. Vendar je treba število odmerkov določiti glede na nagib krivulje toksičnosti (odmerek/smrtnost) in z upoštevanjem statistične metode, ki smo jo zbrali za analizo rezultatov. Preskus za določitev območja omogoča izbiro primernih odmerkov.
Z v preskusno koncentracijo je treba izvesti vsaj tri ponovitve, v vsaki mora biti 10 čebel.
Poleg preskusnega niza je treba pripraviti še najmanj tri kontrolne serije, v vsaki mora biti po 10 čebel. Če se uporabi organsko topilo ali vlažilno sredstvo, je treba vključiti tri dodatne kontrolne skupine po 10 čebel za topilo ali vlažilno sredstvo.
1.6.2 Toksični standard
V preskusni niz je treba vključiti toksični standard. Da se zajame pričakovana vrednost LD50, je treba izbrati vsaj tri odmerke. Pri vsakem preskusnem odmerku je treba uporabiti najmanj tri ponovitvene kletke, v vsaki mora biti po 10 čebel. Priporočljiv toksičen standard je dimetoat, za katerega je znana vrednost (kontaktna) LD50-24 h v območju 0,10–0,30 μg a.s./čebelo (2). Kadar se lahko priskrbi dovolj podatkov za potrditev pričakovanega odziva na odmerek, se lahko uporabijo drugi toksični standardi (npr. paration).
1.6.3 Izpostavljenost
1.6.3.1 Dajanje odmerkov
Čebele se pod anestezijo individualno tretirajo s topično aplikacijo. Čebele se naključno dodelijo skupinam z različnim preskusnim odmerkom in kontrolam. Na hrbtno stran toraksa vsake čebele se z mikroaplikatorjem nanese 1 μl raztopine, ki vsebuje preskusno snov v primerni koncentraciji. Uporabijo se lahko tudi drugačne količine, če je to utemeljeno. Po nanosu odmerka, se čebele dajo v preskusne kletke in oskrbijo z raztopino saharoze.
1.6.3.2 Trajanje
Preskus naj po možnosti traja 48 ur. Če se smrtnost poveča za več kot 10 % med 24. in 48. uro, je treba podaljšati preskus na največ 96 ur, pod pogojem da smrtnost kontrolnih skupin ne presega 10 %.
1.6.4 Opazovanja
Smrtnost se zapiše 4 ure po odmerjanju in nato po 24 urah in 48 urah. Če je potreben podaljšan opazovalni čas, je treba izvesti dodatna opazovanja v 24 urnih časovnih razmikih, največ 96 ur, pod pogojem da smrtnost kontrolnih skupin ne presega 10 %.
Zapisati je treba vse nenormalne vedenjske učinke, opažene v času preskusa.
1.6.5 Mejni preskus
V nekaterih primerih (npr. kadar se pričakuje, da je preskusna snov nizke toksičnosti) se lahko naredi mejni preskus, tako da se uporabi 100 μg a.s./čebelo, da se prikaže, da je LD50 večji od te vrednosti. Uporabiti je treba isti postopek, vključno s tremi ponovitvenimi preskusnimi skupinami za preskusni odmerek, ustreznimi kontrolnimi skupinami in uporabo toksičnega standarda. Če se opazi umiranje, je treba izvesti popolno študijo. Če se opazijo subletalni učinki (glej poglavje 1.6.4), jih je treba zapisati.
2. PODATKI IN POROČANJE
2.1 PODATKI
Podatke je treba povzeti v obliki tabele, ki za vsako tretirano Skupino in za kontrolne skupine in za skupine toksičnega standarda prikazujejo število uporabljenih čebel, smrtnost ob vsakem času opazovanja in število čebel, ki se nenormalno vedejo. Podatki o smrtnosti se analizirajo z ustreznimi statističnimi metodami (npr. probit analizo, drsečo sredino, binomsko verjetnostjo) (3) (4). Grafično se prikaže krivulja odziva v odvisnosti od odmerka ob vsakem priporočenem opazovalnem času (t.j. 24 ur, 48 ur in, če pride v poštev, 72 ur in 96 ur) in izračunajo nagib krivulj in srednji smrtni odmerki (LD50) z 95 % intervalom zaupanja. Popravki glede na smrtnost kontrolnih skupin se lahko izvedejo z uporabo Abbottovega popravka (4) (5). LD50 je treba izraziti v μg preskusne snovi na čebelo.
2.2 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje podatke:
2.2.1 Preskusna snov:
— fizikalno stanje in fizikalno-kemijske lastnosti (npr. obstojnost v vodi, parni tlak),
— identifikacijski podatki o kemikaliji, vključno s strukturno formulo, čistostjo (t.j. za pesticide, identiteta in koncentracija aktivne snovi/aktivnih snovi).
2.2.2 Preskusna vrsta:
— znanstveno ime, pasma, približna starost (v tednih), metoda in datum zbiranja,
— informacije o kolonijah, ki so bile uporabljene za zbiranje preskusnih čebel, vključno z zdravjem, morebitno boleznijo v odraslosti, morebitnim predhodnim zdravljenjem itn.
2.2.3 Preskusni pogoji:
— temperatura in relativna vlažnost eksperimentalnega prostora,
— bivalni pogoji vključno z vrsto, velikostjo in materialom kletk,
— metode nanosa preskusne snovi, npr. uporabljeno topilo, prostornina nanešene preskusne raztopine, uporabljeni anestetiki,
— načrt preskusa, npr. število in koncentracije preskusnih odmerkov, število kontrol; za vsak preskusni odmerek in kontrolo, število ponovitvenih kletk in število čebel na kletko,
— datum preskusa.
2.2.4 Rezultati:
— rezultati morebitne predhodne študije za določitev območja,
— grobi podatki: smrtnost pri vsaki preskušani koncentraciji ob vsakem opazovalnem času,
— graf odziva v odvisnosti od odmerka na koncu preskusa,
— vrednosti LD50 z 95 % intervalom zaupanja ob vsakem od priporočenih opazovalnih časov za preskusno snov in toksični standard,
— statistični postopki, uporabljeni za določitev LD50,
— smrtnost pri kontrolah,
— drugi opaženi ali izmerjeni biološki učinki, npr. nenormalni odzivi čebel,
— kakršno koli odstopanje od preskusnega postopka, ki je tu opisan, in kakršen koli drug relevanten podatek.
3. LITERATURA
(1) EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products – Honeybees. EPPO bulletin, vol. 23, N.1, 151–165. March, 1993.
(2) Gough, H. J., McIndoe, E.C., Lewis, G.B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.), 1981–1992. Journal of Apicultural Research 22, 119–125.
(3) Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99–113.
(4) Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
(5) Abbott, W.S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol. 18, 265–267.
C.18 ADSORPCIJA/DESORPCIJA Z UPORABO METODE ŠARŽNIH PRESKUSOV RAVNOTEŽJA
1. METODA
Ta metoda ustreza metodi OECD tg 106 za določanje adsorpcije/desorpcije s pomočjo metode šaržnega ravnotežja (2000).
1.1 UVOD
Metoda upošteva krožni preskus in delavnico o izbiranju tal za razvoj preskusa adsorpcije (1) (2) (3) (4) ter tudi obstoječe smernice na nacionalni ravni (5) (6) (7) (8) (9) (10) (11).
Študije adsorpcije/desorpcije so koristne za pridobivanje bistvenih informacij o mobilnosti kemikalij in njihovi porazdelitvi v tleh, vodi in zraku znotraj biosfere (12) (13) (14) (15) (16) (17) (18) (19) (20) (21). Informacije se lahko uporabijo za napovedovanje ali ocenjevanje, na primer, razpoložljivosti kemikalije za razgradnjo (22) (23), transformacijo ali vnos v organizme (24); izluževanja skozi talni profil (16) (18) (19) (21) (25) (26) (27) (28); izhlapevanja iz tal (21) (29) (30); odtekanja s površin v naravne vode (18) (31) (32). Podatki o adsorpciji se lahko uporabijo za namene primerjave in modeliranja (19) (33) (34) (35).
Porazdelitev kemikalije med talno in vodno fazo je kompleksen proces, odvisen od številnih različnih dejavnikov: kemične narave snovi (12) (36) (37) (38) (39) (40), lastnosti tal (4) (12) (13) (14) (41) (42) (43) (44) (45) (46) (47) (48) (49) in podnebnih dejavnikov, kot so padavine, temperatura, sončna svetloba in veter. Zato številnih pojavov in mehanizmov, vpletenih v proces adsorpcije kemikalije v tleh, ni mogoče popolnoma opredeliti s poenostavljenim laboratorijskim modelom, kot je ta metoda. Vendar, čeprav ne more zajeti vseh primerov, možnih v okolju, daje dragocene informacije o pomembnosti adsorpcije kemikalije za okolje.
Glej tudi Splošni uvod.
1.2 PODROČJE UPORABE
Metoda je namenjena ocenjevanju adsorpcijskega/desorpcijskega obnašanja snovi v tleh. Cilj je ugotoviti sorptivno vrednost, ki se lahko uporabi za napovedovanje porazdelitve v vrsti različnih okoljskih pogojev; s tem namenom se določijo ravnotežni adsorpcijski koeficienti za kemikalijo v različnih tleh kot funkcija lastnosti tal (npr. vsebnost organskega ogljika, vsebnost gline in tekstura tal ter pH). Uporabiti je treba različne tipe tal, da bi čim širše zajeli interakcije dane snovi s tlemi, ki jih najdemo v naravi.
Pri tej metodi adsorpcija predstavlja proces vezave kemikalije na površino tal; ne razlikuje med različnimi adsorpcijskimi procesi (fizikalna in kemijska adsorpcija) in procesi, kot so katalizirana razgradnja na površini, masovna adsorpcija ali kemična reakcija. Adsorpcija na koloidnih delcih (premer < 0,2 μm), ki jih tvorijo tla, se ne upošteva.
Parametri tal, ki veljajo za najpomembnejše pri adsorpciji so: vsebnost organskega ogljika (3) (4) (12) (13) (14) (41) (43) (44) (45) (46) (47) (48); vsebnost gline in tekstura tal (3) (4) (41) (42) (43) (44) (45) (46) (47) (48) ter pH za spojine, ki lahko ionizirajo (3) (4) (42). Drugi parametri tal, ki lahko vplivajo na adsorpcijo/desorpcijo neke snovi so efektivna kationska izmenjalna kapaciteta (ECEC), vsebnost amorfnega železa in aluminijevih oksidov, zlasti pri vulkanskih in tropskih tleh (4), ter specifična površina (49).
Preskus je namenjen ovrednotenju adsorpcije kemikalije na različne tipe tal z različno vsebnostjo organskega ogljika, vsebnostjo gline in teksturo ter pH-vrednostjo. Zajema tri stopnje:
Stopnja 1: Predhodna študija za določitev:
— razmerja tla/raztopina,
— časa potrebnega za vzpostavitev ravnotežja adsorpcije in količine preskusne snovi, adsorbirane ob ravnotežju,
— adsorpcija preskusne snovi na površine preskusnih posod in stabilnosti preskusne snovi med preskusnim obdobjem.
Stopnja 2: Presejalni preskus: adsorpcija se proučuje na petih različnih tipih tal s pomočjo kinetike adsorpcije pri eni koncentraciji in določanja porazdelitvenega koeficienta Kd in Koc.
Stopnja 3: Določitev Freundlichovih adsorpcijskih izoterm za določitev vpliva koncentracije na obseg adsorpcije na tla.
Proučevanje desorpcije s pomočjo kinetike desorpcije/Freundlichovih desorpcijskih izoterm (Dodatek 1).
1.3 OPREDELITEV POJMOV IN ENOTE
|
Simbol |
Opredelitev |
Enota |
|
|
odstotek adsorpcije ob č času ti |
% |
|
Aeq |
odstotek adsorpcije ravnotežju ob adsorpcijskem |
% |
|
|
masa preskusne snovi, času ti adsorbirane na tla ob |
μg |
|
|
masa preskusne snovi, časovnem intervalu Δti adsorbirane na tla v |
μg |
|
|
masa preskusne snovi, adsorbirane na tla ob adsorpcijskem ravnotežju |
μg |
|
m0 |
masa preskusne snovi v epruveti na začetku preskusa adsorpcije |
μg |
|
|
masa preskusne snovi, izmerjena v alikvotu (
|
μg |
|
|
masa snovi v raztopini ob adsorpcijskem ravnotežju |
μg |
|
msoil |
količina talne faze, izražena v suhi masi tal |
g |
|
Cst |
masna koncentracija osnovne raztopine snovi |
μg cm-3 |
|
C0 |
začetna masna koncentracija preskusne raztopine v stiku s tlemi |
μg cm-3 |
|
|
masna koncentracija snovi v vodni fazi ob času ti, ko se izvaja analiza |
μg cm-3 |
|
|
vsebnost snovi, adsorbirane na tla ob adsorpcijskem ravnotežju |
μg cm-1 |
|
|
masna koncentracija snovi v vodni fazi ob adsorpcijskem ravnotežju |
μg cm-3 |
|
V0 |
začetna prostornina vodne faze v stiku s tlemi med preskusom adsorpcije |
cm3 |
|
|
prostornina alikvota, v katerem se meri preskusna snov |
cm3 |
|
Kd |
porazdelitveni koeficient za adsorpcijo |
cm3 g-1 |
|
Koc |
adsorpcijski koeficient, normiran na organski ogljik |
cm3 g-1 |
|
Kom |
porazdelitveni koeficient, normiran na organsko snov |
cm3 g-1 |
|
|
Freundlichov adsorpcijski koeficient |
μg 1-1/n (cm3) 1/n g-1 |
|
1/n |
Freundlichov eksponent |
|
|
|
odstotek desorpcije ob času ti |
% |
|
|
odstotek desorpcije, ki ustreza časovnemu intervalu Δti |
% |
|
Kdes |
navidezni desorpscijski koeficient |
cm3 g–1 |
|
|
Freundlichov desorpscijski koeficient |
μg 1-1/n (cm3) 1/n g-1 |
|
|
masa preskusne snovi, desorbirane s tal ob času Δti |
μg |
|
|
masa preskusne snovi, desorbirane s tal v časovnem intervalu Δti |
μg |
|
|
masa snovi, določena analitsko v vodni fazi ob desorpcijskem ravnotežju |
μg |
|
|
skupna masa preskusne snovi, desorbirane ob desorpcijskem ravnotežju |
μg |
|
|
masa snovi, ki ostane adsorbirana na tleh po časovnem intervalu Δti |
μg |
|
|
masa snovi, ki ostane od adsorpcijskega ravnotežja zaradi nepopolne nadomestitve prostornine |
μg |
|
|
vsebnost preskusne snovi, ki ostane adsorbirana na tleh ob desorpcijskem ravnotežju |
μg g–1 |
|
|
masna koncentracija preskusne snovi v vodni fazi ob desorpcijskem ravnotežju |
μg cm-3 |
|
VT |
skupna prostornina vodne faze v stiku s tlemi med poskusom kinetike desorpcije, izvedenem s serijalno metodo |
cm3 |
|
VR |
prostornina supernatanta, odstranjenega iz epruvete po vzpostavitvi adsorpcijskega ravnotežja in nadomeščenega z enako prostornino 0,01 M raztopine CaCl2 |
cm3 |
|
|
prostornina alikvota, odvzetega iz epruvete za namen analize (i) med preskusom kinetike desorpcije, izvedenim s serijalnoo metodo |
cm3 |
|
|
prostornina raztopine, odvzete iz epruvete (i) za meritev preskusne snovi med poskusom kinetike desorpcije (paralelna metoda) |
cm3 |
|
|
prostornina raztopine, odvzete iz epruvete za meritev preskusne snovi ob desorpcijskem ravnotežju |
cm3 |
|
MB |
masna bilanca |
% |
|
mE |
skupna masa preskusne snovi, ekstrahirane iz tal in sten preskusne posode v dveh fazah |
μg |
|
Vrec |
prostornina supernatanta, rekuperiranega po adsorpcijskem ravnotežju |
cm3 |
|
Pow |
porazdelitveni koeficient oktanol/voda |
|
|
pKa |
disociacijska konstanta |
|
|
Sw |
topnost v vodi |
g l-1 |
1.4 PRINCIP PRESKUSNE METODE
Znane prostornine raztopin preskusne snovi, neoznačene ali radioaktivno označene, pri znanih koncentracijah v 0,01 M CaCl2 se dodajo vzorcem tal znane suhe teže, pri katerih je bilo predhodno doseženo ravnotežje v 0,01 M CaCl2. Zmes se ustrezno dolgo stresa. Suspenzije tal se nato ločijo s centrifugiranjem in po želji s filtracijo, nato se vodna faza analizira. Količina preskusne snovi, adsorbirane na vzorcu tal, se izračuna kot razlika med količino preskusne snovi v raztopini na začetku in količino, ki ostane na koncu poskusa (posredna metoda).
Kot druga možnost se lahko količina adsorbirane preskusne snovi določi tudi neposredno z analizo tal (neposredna metoda). Ta postopek, ki zajema postopno ekstrakcijo tal z ustreznim topilom, je priporočljiv v primerih, ko razlike v koncentraciji raztopine snovi ni mogoče točno določiti. Taki primeri so na primer: adsorpcija preskusne snovi na površino preskusnih posod, nestabilnost preskusne snovi v času trajanja preskusa, šibka adsorpcija, ki povzroči samo majhno spremembo koncentracije v raztopini, ter močna adsorpcija, ki povzroči nizke koncentracije, ki jih ni mogoče točno določiti. Če se uporabi radioaktivno označena snov, se je mogoče izogniti ekstrakciji tal z analizo talne faze s sežigom in tekočinskim scintilacijskim štetjem. Vendar je tekočinsko scintilacijsko štetje nespecifična tehnika, ki ne more razlikovati med izhodiščno snovjo in produkti transformacije; zato se uporabi samo, če je preskusna kemikalija stabilna v času trajanja študije.
1.5 INFORMACIJE O PRESKUSNI SNOVI
Kemični reagenti morajo biti analitsko čisti. priporočena je uporaba neoznačenih preskusnih snovi z znano sestavo in najbolje najmanj 95-odstotno čistostjo ali radioaktivno označenih snovi z znano sestavo in radioaktivno čistostjo. V primeru sledil kratke razpolovne dobe, je treba uporabiti korekcije za upoštevanje razpadanja.
Pred izvajanjem preskusa adsorpcije/desorpcije morajo biti na voljo naslednje informacije o preskusni snovi:
(a) topnost v void (A.6);
(b) parni tlak (A.4) in/ali Henryjeva konstanta;
(c) abiotska razgradnja: hidroliza kot funkcija pH (C.7);
(d) porazdelitveni koeficient (A.8);
(e) lahka biorazgradljivost (C.4) ali aerobna in anaerobna transformacija v tleh;
(f) pKa snovi, ki lahko ionizirajo;
(g) neposredna fotoliza v vodi (t.j. absorpcijski spekter UV-VIS v vodi, kvantni izkoristek) in fotorazgradnja na tleh.
1.6 UPORABNOST PRESKUSA
Preskus se uporablja za kemične snovi, za katere je na voljo analitska metoda z zadostno točnostjo. Pomemben parameter, ki lahko vpliva na zanesljivost rezultatov, zlasti pri posredni metodi, je stabilnost preskusne snovi v času trajanja preskusa. Zato je predpogoj preverjanje stabilnosti v predhodni študiji; če se ugotovi, da pride do transformacije snovi v času, kolikor bi trajal preskus, je priporočljivo, da se glavna študija izvede z analiziranjem tako talne kot vodne faze.
Težave lahko nastanejo pri izvajanju tega preskusa na preskusnih snoveh, ki so slabo topne v vodi (Sw < 10-4 g l-1) ter pri visoko nabitih snoveh, ker koncentracije v vodni fazi ni mogoče analitično izmeriti z zadostno točnostjo. V teh primerih so potrebni dodatni koraki. Smernice za reševanje teh težav so dane v ustreznih poglavjih te metode.
Pri preskušanju hlapnih snovi je treba paziti, da med študijo ne pride do izgub.
1.7 OPIS METODE
1.7.1 Naprave in reagenti
Standardna laboratorijska oprema, zlasti naslednje:
(a) Epruvete ali posode za izvedbo poskusov. Pomembno je, da:
— se te epruvete ali posode neposredno prilegajo prostoru v centrifugi za preprečevanje napak pri rokovanju in prenašanju,
— so te epruvete ali posode iz inertnega materiala, ki omogoča čim manjšo adsorpcijo preskusne snovi na njihovo površino.
(b) Naprava za stresanje: stresalnik ali enakovredna naprava; naprava za stresanje mora delovati tako, da so tla med tresenjem ves čas v suspenziji.
(c) Centrifuga: najbolje z visoko hitrostjo, npr. centrifugalna sila > 3 000 g, z uravnavano temperaturo, ki iz vodne raztopine lahko odstrani delce s premerom nad 0,2 μm. Posode je treba med stresanjem in centrifugiranjem zapreti s pokrovom, da se prepreči izhlapevanje in izguba vode; za čim manjšo adsorpcijo na pokrove je treba uporabiti deaktivirane pokrove, kot so s teflonom prevlečeni pokrovi z navojem.
(d) Neobvezno: naprava za filtriranje; filtri s porami 0,2 μm, sterilni, za enkratno uporabo. Posebna pozornost je potrebna pri izbiri materiala filtra, da ne bi na njem ostajala preskusna snov; za slabo topne preskusne snovi se ne priporočajo filtri iz organskih materialov.
(e) Analitski inštrumenti, primerni za merjenje koncentracije preskusne kemikalije.
(f) Laboratorijski sušilnik, v katerem je mogoče vzdrževati temperaturo 103 oC do 110 oC.
1.7.2 Opredelitev in izbira tal
Tla je treba opredeliti s tremi parametri, ki veljajo za prvenstveno odgovorne za adsorptivno sposobnost: organski ogljik, vsebnost gline in tekstura tal ter pH. Kot je bilo že omenjeno (glej Področje uporabe), lahko tudi druge fizikalno-kemijske lastnosti tal vplivajo na adsorpcijo/desorpcijo neke snovi in jih je treba v takih primerih upoštevati.
Metode, uporabljene za opredelitev tal, so zelo pomembne in imajo lahko precejšen vpliv na rezultate. Zato je priporočljivo pH tal meriti v raztopini 0,01 M CaCl2 (raztopini, ki se uporablja pri preskušanju adsorpcije/desorpcije) po ustrezni metodi ISO (ISO-10390-1). Priporočljivo je tudi, da se druge ustrezne lastnosti tal določijo po standardnih metodah (na primer ISO „Handbook of Soil Analysis“); s tem se omogoči, da analiza sorpcijskih podatkov temelji na globalno standardiziranih parametrih za tla. Nekaj smernic za obstoječe standardne metode analize in opredeljevanja tal je na voljo v literaturi (50–52). Za umerjanje preskusnih metod za tla je priporočljiva uporaba referenčnih tal.
Smernice za izbiranje tal za poskuse adsorpcije/desorpcije so v tabeli 1. Sedem izbranih tal zajema tipe iz zmernih geografskih območij. Pri preskusnih snoveh, ki lahko ionizirajo, naj izbrana tla zajemajo širok razpon pH, da bi lahko ovrednotili adsorpcijo snovi v njeni ionizirani in neionizirani obliki. Navodila o tem, koliko različnih tipov tal uporabiti v različnih fazah preskusa, so navedena pod 1.9 „Izvedba preskusa“.
Če se da prednost drugim vrstam tal, jih je treba opredeliti z istimi parametri in morajo imeti podobne razlike v lastnostih kot tiste, opisane v tabeli 1, četudi niso popolnoma skladne z merili.
Tabela 1
Smernice za izbiranje vzorcev tal za adsorpcijo/desorpcijo
|
Tip tal |
Razpon pH (v 0,01 M CaCl2) |
Vsebnost organskega ogljika (%) |
Vsebnost gline (%) |
Tekstura tal (1) |
|
1 |
4,5–5,5 |
1,0–2,0 |
65–80 |
glina |
|
2 |
> 7,5 |
3,5–5,0 |
20–40 |
glinasta ilovica |
|
3 |
5,5–7,0 |
1,5–3,0 |
15–25 |
meljasta ilovica |
|
4 |
4,0–5,5 |
3,0–4,0 |
15–30 |
ilovica |
|
5 |
< 4,0–6,0 (2) |
< 10–15 (2) |
ilovnat pesek |
|
|
6 |
> 7,0 |
40–65 |
glinasta ilovica/glina |
|
|
7 |
< 4,5 |
> 10 |
< 10 |
pesek/ilovnat pesek |
|
(1) Po FAO in ameriškem sistemu (85). (2) Najbolje je, da imajo ustrezne spremenljivke vrednosti znotraj razpona. Če se pojavijo težave pri iskanju ustreznega talnega materiala, so sprejemljive tudi vrednosti pod navedenim minimumom. (3) Tla z manj kot 0,3 % organskega ogljika lahko povzročijo motnje v korelaciji med vsebnostjo organskih snovi in adsorpcijo. Zato je priporočljivo uporabiti tla z vsebnostjo organskega ogljika najmanj 0,3 %. |
||||
1.7.3 Zbiranje in shranjevanje vzorcev tal
1.7.3.1 Zbiranje
Ne priporoča se nobena posebna tehnika vzorčenja ali orodja; tehnika vzorčenja je odvisna od namena študije (53) (54) (55) (56) (57) (58).
Treba je upoštevati naslednje:
(a) potrebne so podrobne informacije o preteklosti mesta vzorčenja; to vključuje lokacijo, pokritost z vegetacijo, uporabo pesticidov in/ali gnojil, biološke dodatke ali naključno kontaminacijo. Treba je upoštevati priporočila standarda ISO o vzorčenju tal (ISO 10381-6) glede opisa mesta vzorčenja;
(b) mesto vzorčenja je treba definirati z UTM (Universal Transversal Mercator-Projection/European Horizontal Datum) ali zemljepisnimi koordinatami; s tem je v prihodnosti omogočen ponoven odvzem vzorca teh tal ali pa to lahko pomaga pri definiranju tal po različnih sistemih klasifikacije, uporabljenih v različnih državah. Poleg tega je treba odvzeti vzorec samo iz horizonta A do največje globine 20 cm. Zlasti, če je pri tipu tal št. 7 horizont Oh prisoten kot del tal, ga je treba pri vzorčenju vključiti.
Vzorce tal je treba prenašati v posodah in v temperaturnih razmerah, ki zagotavljajo, da se prvotne lastnosti tal bistveno ne spremenijo.
1.7.3.2 Shranjevanje
Najbolje je uporabiti tla, na sveže odvzeta na terenu. Samo če to ni mogoče, se lahko vzorec tal shrani pri temperaturi prostora, posušen na zraku. Nobena omejitev časa shranjevanja ni priporočena, vendar je treba tla, hranjena več kot tri leta, pred uporabo ponovno analizirati glede na njihovo vsebnost organskega ogljika, pH in CEC.
1.7.3.3 Rokovanje z vzorci tal in njihova priprava na preskus
Tla se posušijo na zraku pri temperaturi prostora (najbolje med 20 in 25 oC). Desagregacija (razdruževanje) naj se izvede s čim manjšo silo, tako da se prvotna tekstura tal čim manj spremeni. Tla se presejejo tako, da je velikost delcev < 2 mm; glede postopka presejanja se upoštevajo priporočila standarda ISO o vzorčenju tal (ISO 10381-6). Priporočena je previdna homogenizacija, saj se s tem poveča ponovljivost rezultatov. Vsebnost vlage v posameznem vzorcu tal se določi na treh alikvotnih delih s segrevanjem pri 105 oC dokler ni več pomembnih sprememb mase (sušenje do konstantne mase, približno 12 h). Pri vseh izračunih se masa tal nanaša na maso po sušenju, t.j. maso tal, brez vsebnosti vlage.
1.7.4 Priprava preskusne snovi za aplikacijo na tla
Preskusna snov se raztopi v 0,01 M raztopini CaCl2 v destilirani ali deionizirani vodi, pri čemer se raztopina CaCl2 uporabi kot vodna topilna faza za izboljšanje centrifugiranja in doseganje čim manjše kationske izmenjave. Najbolje je, da je koncentracija osnovne raztopine tri velikostne rede večja od meje detekcije uporabljene analitske metode. S tem pragom se zavaruje točnost meritev glede na metodologijo, ki jo ta metoda upošteva; poleg tega mora biti koncentracija osnovne raztopine pod topnostjo preskusne snovi v vodi.
Osnovno raztopino je najbolje pripraviti tik pred apliciranjem na vzorce tal, hraniti pa jo je treba zaprto v temi pri 4 oC. Čas hranjenja je odvisen od stabilnosti preskusne snovi in njene koncentracije v raztopini.
Samo pri slabo topnih snoveh (Sw < 10-4 g l-1) je lahko potrebno uporabiti ustrezno topilo, če je preskusno snov težko raztopiti. To topilo: (a) naj bo tako, ki se meša z vodo, kot sta metanol ali acetonitril; (b) njegova koncentracija naj ne presega 1 % skupne prostornine osnovne raztopine in naj bo manjša od te koncentracije v raztopini preskusne snovi, ki bo prišla v stik s tlemi (najbolje manj kot 0,1 %); in (c) naj ne bo površinsko aktivna snov in naj ne bo podvrženo solvoliznim reakcijam s preskusno kemikalijo. Uporabo topila je treba navesti in utemeljiti pri poročanju o podatkih.
Druga možnost za slabo topne snovi je dodajanje preskusne snovi v preskusni sistem s primešanjem: preskusna snov se raztopi v organskem topilu, katerega alikvot se doda sistemu tal in 0,01 M raztopine CaCl2 v destilirani ali deionizirani vodi. Vsebnost organskega topila v vodni fazi naj bo čim manjša in naj normalno ne presega 0,1 %. Težava pri primešanju iz organske raztopine je lahko neponovljivost glede prostornine. Tako lahko pride do dodatne napake, ker koncentracije preskusne snovi in pomožnega topila ne bodo enake pri vseh preskusih.
1.8 PREDPOGOJI ZA IZVEDBO PRESKUSA ADSORPCIJE/DESORPCIJE
1.8.1 Analitska metoda
Ključni parametri, ki lahko vplivajo na točnost meritev sorpcije, zajemajo točnost analitske metode pri analiziranju faze raztopine in adsorbirane faze, stabilnost in čistost preskusne snovi, doseganje sorpcijskega ravnotežja, velikost spremembe koncentracije raztopine, razmerje tla/raztopina in spremembe strukture tal med procesom uravnoteženja (35) (59–62). Nekaj primerov v zvezi z vprašanjem točnosti je navedenih v Dodatku 2.
Zanesljivost uporabljene analitske metode je treba preveriti pri območju koncentracij, ki se bodo verjetno pojavile v preskusu. Izvajalec poskusa naj svobodno razvije ustrezno metodo z ustrezno točnostjo, natančnostjo, ponovljivostjo, mejami detekcije in rekuperacijo. Smernice za izvedbo takega preskusa so dane s spodnjim poskusom.
Ustrezna prostornina 0,01 M CaCl2, npr. 100 cm3, se stresa 4 h z določeno količino, npr. 20 g, tal z visoko adsorptivnostjo t.j. tal z veliko vsebnostjo organskega ogljika in gline; te teže in prostornine so lahko različne glede na analitske potrebe, vendar je primerno izhodišče razmerje tla/raztopina 1:5. Zmes se centrifugira in vodna faza se lahko filtrira. Določena prostornina osnovne raztopine preskusne snovi se doda vodni fazi, da se doseže nominalna koncentracija v območju koncentracij, ki se bodo verjetno pojavile v preskusu. Ta prostornina naj ne presega 10 % končne prostornine vodne faze, da se narava raztopine pred uravnoteženjem čim manj spremeni. Raztopina se analizira.
Vključiti je treba slepi vzorec, ki ga sestavlja sistem tal in raztopine CaCl2 (brez preskusne snovi) za preverjanje artefaktov pri analitski metodi in vplivov matriksa, ki jih povzročijo tla.
Analitske metode, ki se lahko uporabijo za merjenje sorpcije, zajemajo plinsko-tekočinsko kromatografijo (GLC), tekočinsko kromatografijo visoke ločljivosti (HPLC), spektrometrijo (npr. GC/masna spektrometrija, HPLC/masna spektromertrija) in tekočinsko scintilacijsko štetje (za radioaktivno označene snovi). Ne glede na uporabljeno analitsko metodo, velja za primerno, če je rekuperacija med 90 % in 110 %) nominalne vrednosti. Da bi bila po porazdelitvi mogoča detekcija in ovrednotenje, naj bodo meje detekcije analitske metode vsaj dva velikostna reda pod nominalno koncentracijo.
Lastnosti in meje detekcije analitske metode za izvajanje študij adsorpcije imajo pomembno vlogo pri določanju preskusnih pogojev in celotne eksperimentalne izvedbe preskusa. Ta metoda sledi splošni eksperimentalni poti ter daje priporočila in smernice za alternativne rešitve, kadar analitska metoda ali zmožnosti laboratorija omejujejo izvedbo.
1.8.2 Izbira optimalnih razmerij tla/raztopina
Izbira ustreznih razmerij tla/raztopino za študije sorptivnosti je odvisna od porazdelitvenega koeficienta Kd in želene relativne stopnje adsorpcije. Sprememba koncentracije snovi v raztopini določa statistično točnost meritve na osnovi oblike adsorpcijske enačbe in meje analitske metodologije pri zaznavanju koncentracije kemikalije v raztopini. Zato je v splošni praksi koristno določiti nekaj fiksnih razmerij, pri katerih je adsorbirani odstotek nad 20 % in najbolje nad 50 % (62), pri tem pa je treba paziti, da je koncentracija preskusne snovi v vodni fazi ves čas dovolj velika, da omogoča točne meritve. To je zlasti pomembno v primeru visokih adsorpcijskih odstotkov.
Primeren pristop k izbiranju ustreznih razmerij tla/raztopina temelji na oceni vrednosti Kd s predhodnimi študijami ali po uveljavljenih tehnikah ocenjevanja (Dodatek 3). Ustrezno razmerje se nato lahko izbere na podlagi grafičnega prikaza razmerja tla/raztopina v odvisnosti od Kd za fiksne odstotke adsorpcije (slika 1). V tem grafičnem prikazu se predpostavlja, da je adsorpcijska enačba linearna ( 33 ). Uporabna odvisnost se dobi s preureditvijo enačbe (4) za Kd v obliko enačbe (1):
|
|
(1) |
ali v njeni logaritemski obliki, ob predpostavki, da R = msoil/V0 and Aeq %/100 =

|
|
(2) |

Slika 1: Odvisnost med razmerji tla/raztopina in Kd pri različnih odstotkih adsorbirane preskusne snovi
Slika 1 prikazuje potrebna razmerja tla/raztopina kot funkcija Kd za različne stopnje adsorpcije. Na primer, pri razmerju tla/raztopina 1:5 in Kd 20 bi prišlo do približno 80-odstotne adsorpcije. Da bi pri enakem Kd dobili 50-odstotno adsorpcijo, je treba uporabiti razmerje 1:25. Ta pristop k izbiranju ustreznih razmerij tla/raztopina omogoča preiskovalcu fleksibilnost, da lahko zadovolji potrebe preskusa.
Težavnejši primeri so tisti, kjer se kemikalija zelo dobro ali zelo slabo adsorbira. Kadar je adsorpcija nizka, je priporočeno razmerje tla/raztopina 1:1, vendar so pri nekaterih zelo organskih tipih tal lahko potrebna manjša razmerja, da dobimo blato. Pri analitski metodologiji je potrebna previdnost, da se izmerijo majhne spremembe v koncentraciji raztopine; drugače bo meritev adsorpcije netočna. Po drugi strani lahko pri zelo visokih porazdelitvenihih koeficientih Kd uporabimo lahko razmerje tla/raztopina do 1:100, da bi v raztopini ostala pomembna količina kemikalije. Vendar je treba paziti, da zagotovimo dobro mešanje, in omogočimo dovolj časa za vzpostavitev ravnotežja v sistemu. Druga možnost za obvladovanje teh ekstremnih primerov, ko ni primerne analitske metodologije, je napovedovanje vrednosti Kd z uporabo tehnik ocenjevanja, na primer na osnovi vrednosti Pow (Dodatek 3). To je lahko uporabno zlasti pri slabo adsorbiranih/polarnih kemikalijah s Pow < 20 in lipofilnih/zelo sorptivnih kemikalijah s Pow > 104.
1.9 IZVEDBA PRESKUSA
1.9.1 Preskusni pogoji
Vsi preskusi se izvedejo pri normalni temperaturi in, če je mogoče, pri stalni temperaturi med 20 in 25 oC.
Pogoji centrifugiranja morajo omogočati odstranitev delcev iz raztopine, ki so večji od 0,2 μm. Ta velikost ustreza najmanjšemu delcu, ki še velja za trden delec, in je meja med trdnimi in koloidnimi delci. Smernice za določitev pogojev centrifugiranja so navedena v Dodatku 4.
Če centrifuga ne more zagotoviti odstranitve delcev, večjih od 0,2 μm, se lahko uporabi kombinacija centrifugiranja in filtriranja z 0,2 μm filtri. Ti filtri naj bodo iz primernega inertnega materiala, da se na njih ne bi izgubljala preskusna snov. V vsakem primeru je treba dokazati, da med filtracijo ne prihaja do izgub preskusne snovi.
1.9.2 Stopnja 1 – Predhodna študija
Namen predhodne študije je bil že naveden v poglavju Področje uporabe. Smernice za postavitev takega preskusa pa so dane s spodaj predlaganim preskusom.
1.9.2.1 Izbira optimalnih razmerij tla/raztopina
Uporabita se dva tipa tal in tri razmerja tla/raztopina (šest poskusov). En tip tal naj ima visoko vsebnost organskega ogljika in nizko vsebnost gline, drugi pa nizko vsebnost organskega ogljika in visoko vsebnost gline. Predlagana so naslednja razmerja tla/raztopina:
— 50 g tal in 50 cm3 vodne raztopine preskusne snovi (razmerje 1/1),
— 10 g tal in 50 cm3 vodne raztopine preskusne snovi (razmerje 1/5),
— 2 g tal in 50 cm3 vodne raztopine preskusne snovi (razmerje 1/25).
Minimalna količina tal, s katero se lahko izvede poskus, je odvisna od laboratorijskih zmožnosti in učinkovitosti uporabljenih analitskih metod. Vendar je priporočljivo uporabiti vsaj 1 g, najbolje pa 2 g, da bi bili rezultati preskusa zanesljivi.
Kontrolni vzorec samo s preskusno snovjo v 0,01 M raztopini CaCl2 (brez tal) se tretira po natančno enakem postopku kot preskusni sistem, da se preveri stabilnost preskusne snovi v raztopini CaCl2 in njeno morebitno adsorpcijo na površine preskusnih posod.
Po en slepi vzorec na tip tal z enako količino tal in skupno prostornino 50 cm30,01 M raztopine CaCl2 (brez preskusne snovi) se tretirajo po enakem preskusnem postopku. To je namenjeno kontroli ozadja med analizo, da se zaznajo moteče snovi ali kontaminirana tla.
Vse poskuse, vključno s kontrolami in slepimi vzorci, je treba izvajati vsaj v dveh ponovitvah. Skupno število vzorcev, ki jih je treba pripraviti za študijo, se lahko izračuna glede na metodologijo, ki bo uporabljena.
Metode za predhodno študijo in glavno študijo so na splošno enake, kjer je ustrezno, so navedene izjeme.
Na zraku posušeni vzorci tal se uravnotežijo s stresanjem s prostornino vsaj 45 cm30,01 M CaCl2 čez noč (12 h) pred dnem preskusa. Nato se doda določena količina osnovne raztopine preskusne snovi, da se končna prostornina dopolni do 50 cm3. Ta količina dodane osnovne raztopine: (a) naj ne presega 10 % končne prostornine vodne faze 50 cm3, da se narava raztopine pred uravnoteženjem čim manj spremeni; in (b) naj bo taka, da bo začetna koncentracija preskusne snovi v stiku s tlemi (Co) vsaj dva velikostna reda večja od meje detekcije analitske metode; ta prag omogoča izvajanje točnih meritev, tudi če pride do močne adsorpcije (> 90 %), in kasnejšo določitev adsorpcijskih izoterm. Priporočljivo je tudi, da začetna koncentracija snovi (Co), če je to mogoče, ne presega polovice njene meje topnosti.
Primer za izračun koncentracije osnovne raztopine (Cst) je naveden spodaj. Predpostavlja se meja detekcije pri 0,01 ug cm-3 in 90-odstotna adsorpcija; tako, da je najbolje, da je začetna koncentracija preskusne snovi v stiku s tlemi 1 ug cm-3 (dva velikostna reda nad mejo detekcije). Če predpostavljamo, da se doda največja priporočena prostornina osnovne raztopine, t.j. 5 cm3 k 45 cm30,01 M CaCl2 raztopine za uravnoteženje (= 10 % osnovne raztopine v 50 cm3 skupne prostornine vodne faze), bi morala biti koncentracija osnovne raztopine 10 μg cm-3; to je tri velikostne rede nad mejo detekcije analitske metode.
pH vodne faze se meri pred in po stiku s tlemi, saj ima pomembno vlogo v adsorpcij skem procesu, zlasti pri snoveh, ki lahko ionizirajo.
Zmes se stresa, dokler ni vzpostavljeno adsorpcijsko ravnotežje. Čas potreben za vzpostavitev ravnotežja v tleh je zelo različen glede na kemikalijo in tip tal; navadno zadostuje 24 h (77). V predhodni študiji se vzorci lahko zbirajo zaporedno v času 48 h mešanja (na primer po 4, 8, 24, 48 h). Vendar naj bodo časi analize fleksibilni ob upoštevanju delovnega razporeda v laboratoriju.
Za analiziranje preskusne snovi v vodni raztopini obstajata dve možnosti: (a) paralelna metoda in (b) serialna metoda. Poudariti je treba, da je pri paralelni metodi matematična obdelava rezultatov enostavnejša (Dodatek 5), čeprav je metoda eksperimentalno bolj zahtevna. Vendar je izbira metodologije prepuščena izvajalcu, ki mora pretehtati zmožnosti in sredstva laboratorija.
(a) Paralelna metoda: pripravijo se vzorci z enakim razmerjem tla/raztopina, toliko vzorcev, kot je časovnih intervalov, pri katerih se želi proučevati kinetiko adsorpcije. Po centrifugiranju in po želji po filtriranju se vodna faza prve epruvete v čim večji meri rekuperira in se izmeri po na primer 4 h, vodna faza druge epruvete po 8 h, tista iz tretje po 24 h itd.
(b) Serialna metoda: za vsako razmerje tla/raztopina se pripravita samo dva vzorca. V opredeljenih časovnih intervalih se zmes centrifugira, da se ločijo faze. V majhnem alikvotu vodne faze se takoj določi preskusna snov; nato se poskus nadaljuje s prvotno zmesjo. Če se po centrifugiranju izvede filtracija, mora imeti laboratorij možnost filtriranja majhnih vodnih alikvotov. Priporočeno je, da skupna prostornina odvzetih alikvotov ne presega 1 % skupne prostornine raztopine tako, da se razmerje tla/raztopina ne spremeni bistveno in da se ne zmanjša masa topljenca, ki je med preskusom na voljo za adsorpcijo.
Odstotek adsorpcije
![]()
![]()
1.9.2.2 Določanje časa adsorpcijskega ravnotežja in količine preskusne snovi, adsorbirane ob ravnotežju
Kot je bilo že omenjeno, grafični prikazi
![]()
ali
![]()
v odvisnosti od časa omogočajo ocenitev vzpostavitve adsorpcijskega ravnotežja in količine preskusne snovi, adsorbirane ob ravnotežju. Sliki 1 in 2 v Dodatku 5 sta primera takih grafičnih prikazov. Čas, potreben za vzpostavitev ravnotežja pove, koliko časa sistem potrebuje, da doseže konstanten nivo.
Če se za neka tla ne ugotovi konstantnega nivoja, temveč gre za stalno naraščanje, so za to lahko krivi dejavniki, kot sta biorazgradnja ali počasna difuzija. Biorazgradnja se lahko ugotovi s ponovitvijo poskusa s steriliziranim vzorcem tal. Če tudi v tem primeru ni dosežen konstanten nivo, mora izvajalec poiskati druge pojave, ki bi lahko bili vpleteni v njegovi študiji; to se lahko naredi z ustreznimi spremembami eksperimentalnih pogojev (temperatura, čas stresanja, razmerja tla/raztopina). Izvajalcu je prepuščeno, da odloči, ali nadaljevati s preskusnim postopkom, čeprav se ravnotežje morda ne bo vzpostavilo.
1.9.2.3 Adsorpcija na površino preskusne posode in stabilnost preskusne snovi
Nekatere informacije o adsorpciji preskusne snovi na površino preskusnih posod in o njeni stabilnosti se lahko pridobijo z analiziranjem kontrolnih vzorcev. Če se ugotovi izčrpanje snovi za več kot za standardno napako analitske metode, sta lahko vzrok abiotska razgradnja in/ali adsorpcija na površino preskusne posode. Ta dva pojava se lahko razločita s temeljitim izpiranjem sten posode z znano prostornino ustreznega topila in analiziranjem vsebnosti preskusne snovi v izpiralni raztopini za izpiranje. Če ni ugotovljena adsorpcija na površino posode, je izgubljanje dokaz za abiotsko nestabilnost preskusne snovi. Če je adsorpcija ugotovljena, je treba zamenjati material preskusne posode. Vendar podatkov o adsorpciji na površino preskusnih posod, dobljenih s tem poskusom, ni mogoče neposredno ekstrapolirati na preskus tla/raztopina. Prisotnost vzorca tal bo vplivala na to adsorpcijo.
Dodatne informacije o stabilnosti preskusne snovi je mogoče dobiti z določitvijo masne bilance izhodiščne snovi v odvisnosti od časa. To pomeni, da se analizira vsebnost preskusne snovi v vodni fazi, ekstraktu tal in na stenah preskusne posode. Razlika med maso dodane preskusne kemikalije in vsoto mas preskusne kemikalije v vodni fazi, ekstraktih tal in na stenah preskusne posode je enaka razgrajeni in/ali izhlapeli in/ali neekstrahirani masi. Za določitev masne bilance bi moralo biti adsorpcijsko ravnotežje vzpostavljeno v času trajanja poskusa.
Masna bilanca se določi za oba tipa tal in za eno razmerje tla/raztopina, pri katerem v ravnotežju pride do izgubljanja nad 20 % in najbolje nad 50 %>. Ko je poskus za določitev razmerja končan z analiziranjem zadnjega vzorca vodne faze po 48 h, se faze ločijo s centrifugiranjem in, po želji, s filtracijo. Vodna faza se v čim večji meri rekuperira, tlom pa se za ekstrakcijo preskusne snovi doda primerno ekstrakcijsko topilo (z ekstrakcijskim koeficientom najmanj 95 %). Priporočeni sta vsaj dve zaporedni ekstrakcij i. Določi se količina preskusne snovi v ekstraktih tal in ekstraktih preskusnih posod in izračuna se masna bilanca (enačba 10, Podatki in poročanje). Če je manjša od 90 %>, preskusna snov velja za nestabilno v času trajanja preskusa. Vendar se lahko študija nadaljuje ob upoštevanju neobstojnosti preskusne snovi; v tem primeru je priporočljivo analizirati obe fazi v glavni študiji.
1.9.2.4 Stopnja 2 – Kinetika adsorpcije pri eni koncentraciji preskusne snovi
Uporabi se pet tipov tal, izbranih iz tabele 1. Med teh pet tipov je, če je primerno, koristno vključiti nekatere ali vse tipe tal, uporabljene v predhodni študiji. V tem primeru stopnje 2 ni treba ponoviti za tipe tal, uporabljene v predhodni študiji.
Čas potreben za vzpostavitev ravnotežja, razmerje tla/raztopina, teža vzorca tal, prostornina vodne faze v stiku s tlemi in koncentracija preskusne snovi v raztopini se izberejo na podlagi izsledkov predhodne študije. Analizo je najbolje opraviti približno po 2, 4, 6, 8 (po možnosti tudi 10) in 24 urah stika; čas stresanja se lahko podaljša na največ 48 h, če kemikalija zahteva daljši čas za vzpostavitev ravnotežja glede na rezultate določanja razmerja. Vendar se časi analize lahko pretehtajo s fleksibilnostjo.
Vsak poskus (en tip tal in ena raztopina) se izvede vsaj v dveh ponovitvah, da se omogoči oceno variance rezultatov. V vsakem poskusu je en slepi vzorec. Sestavljen je iz vzorca tal in 0,01 M raztopine CaCl2 brez preskusne snovi ter ima tako težo in prostornino, kot sta uporabljeni v preskusu. Kontrolni vzorec, ki vsebuje samo preskusno snov v 0,01 M raztopini CaCl2 (brez tal), se tretira po enakem preskusnem postopku in služi kot zaščita pred nepričakovanim.
Odstotek adsorpcije se izračuna za vsak čas
![]()
![]()
Rezultati preskusa kinetike adsorpcije
Linearna vrednost Kd navadno točno opiše obnašanje pri sorpciji v tleh (35) (78) in izraža inherentno mobilnost kemikalij v tleh. Na primer, na splošno kemikalije s Kd ≤ 1 cm3 g-1 veljajo za kvalitativno mobilne. Podobno so MacCall et al. (16) razvili sistem razvrščanja po mobilnosti na osnovi vrednosti Koc. Poleg tega obstajajo sistemi razvrščanja glede na izluževanje, ki temeljijo na odnosu med Koc DT-50 ( 35 ) (32) (79).
Glede na študije analize napake (61) se vrednosti Kd pod 0,3 cm3 g-1 ne dajo točno oceniti iz zmanjšanja koncentracije v vodni fazi, četudi se uporabi najugodnejše (z vidika točnosti) razmerje tla/raztopina, t.j. 1:1. Vtem primeru je priporočljiva analiza obeh faz, tal in raztopine.
Glede na zgornje opombe je priporočljivo, da se študija adsorptivnega obnašanja kemikalije v tleh in njene potencialne mobilnosti nadaljuje z določitvijo Freundlichovih adsorpcijskih izoterm za te sisteme, za katere je mogoča točna določitev Kd po eksperimentalnem protokolu iz te preskusne metode. Točna določitev je mogoča, če je rezultat pomnožitve Kd z razmerjem tla/raztopina > 0,3, kadar meritve temeljijo na zmanjševanju koncentracije v vodni fazi (posredna metoda), oziroma > 0,1, kadar se analizirata obe fazi (neposredna metoda) (61).
1.9.2.5 Stopnja 3 – Adsorpcijske izoterme in kinetika desorpcije/desorpcijske izoterme
1.9.2.5.1
Uporabi se pet koncentracij preskusne snovi, ki najbolje da zajemajo dva velikostna reda; pri izbiri teh koncentracij se upoštevajo topnost v vodi in posledične koncentracije vodnega ravnotežja. Med študijo je potrebno ohranjati isto razmerje tla/raztopina za posamezni tip tal. Preskus adsorpcije se izvede, kakor je opisano zgoraj, z edino razliko, da se vodna faza analizira samo enkrat ob času, potrebnem za vzpostavitev ravnotežja, kakor je že bilo določeno v stopnji 2. Določijo se ravnotežne koncentracije v raztopini, adsorbirana količina pa se izračuna iz izgubljanja preskusne snovi v raztopini ali z neposredno metodo. Adsorbirana masa na enoto mase tal se prikaže grafično kot funkcija ravnotežne koncentracije preskusne snovi (glej poglavje „Podatki in poročanje“).
Rezultati poskusa adsorpcijskih izoterm
Med doslej predlaganimi matematičnimi modeli adsorpcije se za opisovanje adsorpcijskih procesov najpogosteje uporablja Freundlichova izoterma. Bolj podrobne informacije o razlagi in pomenu adsorpcij skih modelov so na voljo v literaturi (41) (45) (80) (81) (82).
Opomba: Treba je omeniti, da je primerjava vrednosti KF (Freundlichov adsorpcijski koeficient) za različne snovi mogoča samo, če so te vrednosti KF izražene v enakih enotah (83).
1.9.2.5.2
Namen tega preskusa je proučiti, ali se kemikalija reverzibilno ali ireverzibilno adsorbira na tla. Ta podatek je pomemben, saj ima tudi desorpcijski proces pomembno vlogo pri obnašanju kemikalije v tleh. Poleg tega so podatki o desorpciji koristni vhodni podatki pri računalniškem modeliranju izluževanja in odtekanja raztopljenih snovi. Če se želi opraviti študija desorpcije, je priporočljivo, da se spodaj opisana študija izvede za vsak sistem, za katerega je bila v prejšnjem preskusu kinetike desorpcije mogoča točna določitev Kd.
Kot pri študiji kinetike desorpcije, obstajata dve možnosti izvajanja poskusa kinetike desorpcije: (a) paralelna metoda in (b) serialna metoda. Izbira metodologije je prepuščena izvajalcu, ki mora pretehtati zmožnosti in sredstva laboratorija.
(a) Paralelna metoda: za vsak tip tal, ki se izbere za študijo desorpcije, se pripravijo vzorci z enakim razmerjem tla/raztopina, in sicer toliko vzorcev, kolikor je časovnih intervalov, v katerih se želi proučevati kinetika desorpcije. Najbolje je uporabiti enake časovne intervale kot pri poskusu kinetike adsorpcije; vendar se lahko skupni čas ustrezno podaljša, da se lahko v sistemu vzpostavi desorpcijsko ravnotežje. Za vsak preskus (en tip tal, ena raztopina) se pripravi en slepi vzorec. Sestavljen je iz vzorca tal in 0,01 M raztopine CaCl2 brez preskusne snovi ter ima težo in prostornino, enaki tistima v preskusu. Kot kontrolni vzorec se po enakem preskusnem postopku tretira preskusna snov v 0,01 M raztopini CaCl2 (brez tal). Vse zmesi tal z raztopino se stresajo, dokler se ne vzpostavi adsorpcijsko ravnotežje (kot je bilo določeno zgoraj v stopnji 2). Nato se faze ločijo s centrifugiranjem in vodne faze se v čim večji meri odstranijo. Prostornina odstranjene raztopine se nadomesti z enako prostornino 0,01 M CaCl2 brez preskusne snovi in nove zmesi se zopet stresajo. Vodna faza v prvi epruveti se v čim večji meri rekuperira in se izmeri po na primer 2 h, tista v drugi epruveti po 4 h, tista v tretji po 6 h itd., dokler se ne vzpostavi desorpcijsko ravnotežje.
(b) Serijska metoda: po preskusu kinetike adsorpcije se zmes centrifugira in vodna faza v čim večji meri odstrani. Prostornina odstranjene raztopine se nadomesti z enako prostornino 0,01 M CaCl2 brez preskusne snovi. Nova zmes se stresa, dokler ni vzpostavljeno desorpcijsko ravnotežje. V tem času se v določenih časovnih intervalih zmes centrifugira, da se ločijo faze. V majhnem alikvotu vodne faze se takoj analizira vsebnost preskusne snovi; nato se preskus nadaljuje s prvotno zmesjo. Prostornina posameznega alikvota naj bo manjša od 1 % skupne prostornine. Enaka količina sveže raztopine 0,01 M CaCl2 se doda zmesi, da se ohrani razmerje tla/raztopina, stresanje pa se nadaljuje do naslednjega časovnega intervala.
Odstotek desorbcije se izračuna za vsak čas
![]()
![]()
Rezultati preskusa kinetike desorpcije
Skupni grafični prikazi odstotkov desorpcije (
![]()
) in adsorpcije (
![]()
) v odvisnosti od časa omogočajo ocenitev reverzibilnosti adsorpcijskega procesa. Če se desorpcijsko ravnotežje vzpostavi tudi v dvakrat daljšem času od adsorpcij skega ravnotežja in če je skupna desorpcija večja od 75 % adsorbirane količine, velja adsorpcij a za reverzibilno.
1.9.2.5.3
Freundlichove desorpcij ske izoterme se določajo na tleh, uporabljenih pri preskusu adsorpcij skih izoterm. Preskus desorpcije se izvede, kakor je opisano v poglavju „Kinetika desorpcije“, z edino razliko, da se vodna faza analizira samo enkrat, ob desorpcij skem ravnotežju. Izračuna se količina desorbirane preskusne snovi. Vsebnost preskusne snovi, ki ostane adsorbirana na tleh ob desorpcij skem ravnotežju, se grafično prikaže kot funkcija ravnotežne koncentracije preskusne snovi v raztopini (glej poglavje Podatki in poročanje ter Dodatek 5).
2. PODATKI IN POROČANJE
Analitski podatki se prikažejo v obliki tabel (glej Dodatek 6). Navedejo se posamezne meritve in izračunana povprečja. Dodajo se grafični prikazi adsorpcij skih izoterm. Izračuni se opravijo, kot je opisano spodaj.
Za namen preskusa velja, da je teža 1 cm3 vodne raztopine 1 g. Razmerje tla/raztopina se lahko z isto številko izrazi v enotah m/m ali m/V.
2.1 ADSORPCIJA
Adsorpcija
![]()
![]()
|
|
(3) |
pri čemer je:
|
|
= |
odstotek adsorpcije ob času ti (%); |
|
|
= |
masa preskusne snovi, adsorbirane na tla ob času ti (μg); |
|
m0 |
= |
masa preskusne snovi v epruveti na začetku preskusa (μg). |
Podrobne informacije o izračunavanju odstotka
![]()
pri paralelni in serijski metodi so navedene v Dodatku 5.
Porazdelitvenii koeficient Kd je razmerje med vsebnostjo snovi v fazi tal in masno koncentracijo snovi v vodni raztopini v preskusnih pogojih, ko je doseženo adsorpcijsko ravnotežje.
|
|
(4) |
pri čemer je:
|
|
= |
vsebnost snovi, adsorbirane na tla ob adsorpcijskem ravnotežju (μg g-1); |
|
|
= |
masna koncentracija snovi v vodni fazi ob adsorpcijskem ravnotežju (μg cm-3). Ta koncentracija se določi analitsko ob upoštevanju vrednosti, dobljenih pri slepem vzorcu; |
|
|
= |
masa snovi, adsorbirane na tla ob adsorpcijskem ravnotežju (μg); |
|
|
= |
masa snovi v raztopini ob adsorpcijskem ravnotežju (μg); |
|
msoil |
= |
količina talne faze, izražena v suhi masi tal (g) |
|
V0 |
= |
začetna prostornina vodne faze v stiku s tlemi (cm3). |
Odnos med Aeq in Kd se navede z:
|
|
(5) |
pri čemer je:
|
Aeq |
= |
odstotek adsorpcije ob adsorpcijskem ravnotežju, %. |
Adsorpcijski koeficient normiran na organski ogljik Koc; povezuje porazdelitveni koeficient Kd z vsebnostijo organskega ogljika v vzorcu tal:
|
|
(6) |
pri čemer je:
|
%OC |
= |
odstotek organskega ogljika v vzorcu tal (g g-1). |
Koeficient Koc predstavlja eno samo vrednost, ki označuje porazdelitev večinoma nepolarnih organskih kemikalij med organski ogljik v tleh ali usedlinah in vodi. Adsorpcija teh kemikalij je v korelaciji z organsko vsebnostjo sorptivnih trdnih snovi (7); tako so vrednosti Koc odvisne od specifičnih lastnosti huminskih frakcij, ki se precej razlikujejo po zmožnosti sorpcije zaradi razlik v izvoru, genezi itd.
2.1.1 Adsorpcijske izoterme
Enačba Freundlichovih adsorpcij skih izoterm predstavlja odvisnost med količino adsorbirane preskusne snovi in koncentracijo preskusne snovi v raztopini ob ravnotežju (enačba 8).
Podatki se obdelajo kot pri „Adsorpciji“ in za vsako epruveto se izračuna vsebnost preskusne snovi, adsorbirane na tla po preskusu adsorpcije (
![]()
, drugje navedeno kot x/m). Predpostavlja se, da je bilo ravnotežje vzpostavljeno in da
![]()
predstavlja ravnotežno vrednost:
|
|
(7) |
Freundlichova adsorpcijska enačba je (8):
|
|
(8) |
ali v linearni obliki:
|
|
(9) |
pri čemer je:
|
|
= |
Freundlichov adsorpcijski koeficient; njegova dimenzija je cm3 g-1 samo pri 1/n = 1; v vseh drugih primerih se nagib 1/n vpelje v dimenziji
|
|
n |
= |
regresijska konstanta; 1/n ima navadno vrednost med 0,7 in 1,0 in kaže na to, da so podatki o sorpciji pogosto rahlo nelinearni. |
Enačbi (8) in (9) se grafično prikažeta in vrednosti
![]()

Slika 2: Freundlichova adsorpcijska krivulja, normalna in linearizirana
2.1.2 Masna bilanca
Masna bilanca („Mass balance MB“) je opredeljena kot odstotek snovi, ki jo je mogoče analitično rekuperirati po preskusu adsorpcije, glede na nominalno količino snovi na začetku preskusa.
Obdelava podatkov je drugačna, če se topilo popolnoma meša z vodo. V primeru topila, ki se meša z vodo, se lahko za določitev količine snovi, rekuperirane z ekstrakcijo s topilom, uporabi obdelava podatkov, opisana pod „Desorpcija“. Če se topilo manj meša z vodo, je treba določiti rekuperirano količino.
Masna bilanca (MB) za adsorpcijo se izračuna, kakor sledi; predpostavlja se, da izraz (mE) ustreza vsoti mas preskusnih kemikalij, ekstrahiranih iz tal in površin preskusne posode z organskim topilom:
|
|
(10) |
pri čemer je:
|
MB |
= |
masna bilanca (%), |
|
mE |
= |
skupna masa preskusne snovi, ekstrahirane iz tal in sten preskusne posode v dveh fazah (μg), |
|
C0 |
= |
začetna masna koncentracija preskusne raztopine v stiku s tlemi (μg cm-3), |
|
Vrec |
= |
prostornina supernatanta, rekuperiranega po adsorpcijskem ravnotežju (cm-3). |
2.2 DESORPCIJA
Desorpcija (D) je opredeljena kot odstotek desorbirane preskusne snovi glede na količino prej adsorbirane snovi v preskusnih pogojih:
|
|
(11) |
pri čemer je:
|
|
= |
odstotek desorpcije ob času ti(%); |
|
|
= |
masa preskusne snovi, desorbirane s tal ob času ti (μg); |
|
|
= |
masa preskusne snovi, adsorbirane na tla ob adsorpcijskem ravnotežju (μg) |
Podrobne informacije o izračunavanju odstotka desorpcije
![]()
pri paralelni in serijski metodi so navedene v Dodatku 5.
Navidezni desorpscijski koeficient (Kdes) je v preskusnih pogojih razmerje med vsebnostjo snovi, ki ostane v talni fazi, in masno koncentracijo desorbirane snovi v vodni raztopini, ko je doseženo desorpcijsko ravnotežje:
|
|
(12) |
pri čemer je:
|
Kdes |
= |
desorpscijski koeficient (cm3 g-1); |
|
|
= |
skupna masa preskusne snovi, desorbirane ob desorpcijskem ravnotežju (μg); |
|
VT |
= |
skupna prostornina vodne faze v stiku s tlemi med preskusom kinetike desorpcije (cm3). |
Navodila za izračun
![]()
so v dodatku 5 pod naslovom „Desorpcija“.
Opomba
Če je bil že opravljeni preskus adsorpcije izveden po paralelni metodi, velja, da je prostornina VT v enačbi 12 enaka Vo.
2.2.1 Desorpcijske izoterme
Enačba Freundlichovih desorpcijskih izoterm odvisnost med vsebnostjo preskusne snovi, ki ostane adsorbirana na tleh, in koncentracijo preskusne snovi v raztopini ob desorpcij skem ravnotežju (enačba 16).
Za vsako epruveto se vsebnost snovi, ki ostane adsorbirana na tleh ob desorpcij skem ravnotežju, izračuna, kakor sledi:
|
|
(13) |
![]()
je opredeljen kot:
|
|
(14) |
pri čemer je:
|
|
= |
vsebnost preskusne snovi, ki ostane adsorbirana na tla ob desorpcijskem ravnotežju (μg g-1); |
|
|
= |
masa snovi, določena analitsko v vodni fazi ob desorpcijskem ravnotežju (μg); |
|
|
= |
masa preskusne snovi, ki ostane od adsorpcijskega ravnotežja zaradi nepopolne nadomestitve prostornine (μg); |
|
|
= |
masa snovi v raztopini ob adsorpcijskem ravnotežju (μg); |
|
|
(15) |
|
|
= |
prostornina raztopine, vzete iz epruvete za meritev preskusne snovi ob desorpcijskem ravnotežju (cm3); |
|
VR |
= |
prostornina supernatanta, odstranjenega iz epruvete po vzpostavitvi adsorpcijskega ravnotežja in nadomeščenega z enako prostornino 0,01 M raztopine CaCl2 (cm3); |
Freundlichova desorpcijska enačba je (16):
|
|
(16) |
ali v linearni obliki:
|
|
(17) |
pri čemer je:
|
|
= |
Freundlichov desorpcijski koeficient; |
|
n |
= |
regresijska konstanta; |
|
|
= |
masna koncentracija snovi v vodni fazi ob desorpcijskem ravnotežju (μg cm-3). |
Enačbi 16 in 17 se lahko prikažeta grafično in vrednosti
![]()
in 1/n se izračunata z regresijsko analizo po enačbi 17.
Opomba:
Če je Freundlichov adsorpcijski ali desorpcijski eksponent 1/n enak 1, bo Freundlichova ravnotežna konstanta adsorpcije ali desorpcije (vezalna konstanta) (
![]()
![]()
2.2.2 Poročilo o preskusu
Poročilo o preskusu mora vsebovati naslednje informacije:
— popolno identifikacijo uporabljenih vzorcev tal, vključno z:
— geografsko oznako mesta (zemljepisna širina, zemljepisna dolžina),
— datumom vzorčenja,
— vrsto rabe (npr. kmetijsko zemljišče, gozd itd.),
— globino vzorčenja,
— vsebnostjo peska/mulja/gline, pH-vrednostmi (v 0,01 M CaCl2),
— vsebnostjo organskega ogljika,
— vsebnostjo organskih snovi,
— vsebnostjo dušika,
— razmerjem C/N,
— kationsko izmenjalno kapaciteto (mmol/kg),
— vsemi informacijami v zvezi z zbiranjem in shranjevanjem vzorcev tal,
— kadar je primerno, vsemi relevantnimi informacijami za razlago adsorpcije/desorpcije preskusne snovi,
— sklici na metode, uporabljene za določanje posameznih parametrov,
— informacije o preskusni snovi, kakor je primerno,
— temperaturo preskusov,
— pogoje centrifugiranja,
— analitski postopek, uporabljen za analiziranje preskusne snovi,
— utemeljitev morebitne uporabe topila za pripravo osnovne raztopine preskusne snovi,
— razlage popravkov izračunov, če je ustrezno,
— podatke v skladu z obrazcem (Dodatek 6) in grafične prikaze,
— vse informacije in opažanja, koristne za razlago rezultatov preskusa.
4. LITERATURA
(1) Kukowski H. and Brümmer G., (1987). Investigations on the Adsorption and Desorption of Selected Chemicals in Soils. UBA Report 106 02045, Part II.
(2) Fränzle O., Kuhnt G. and Vetter L., (1987). Selection of Representative Soils in the EC-Territory. UBA Report 106 02045, Part I.
(3) Kuhnt G. and Muntau H. (Eds.) EURO-Soils: Identification, Collection, Treatment, Characterisation. Special Publication no. 1.94.60, Joint Research Centre. European Commission, ISPRA, December 1994.
(4) OECD Test Guidelines Programme, Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18–20 January 1995 (June 1995).
(5) US-Environment Protection Agency: Pesticide Assessment Guidelines, Subdivision N, Chemistry: Environmental Fate, Series 163-1, Leaching and Adsorption/Desorption Studies, Addendum 6 on Data Reporting, 540/09-88-096, Date: 1/1988.
(6) US-Environment Protection Agency: Prevention, Pesticides and Toxic Substances, OPPTS Harmonized Test Guidelines, Series 835-Fate, Transport and Transformation Test Guidelines, 0PPTS No: 835.1220 Sediment and Soil Adsorption/Desorption Isotherm. EPA No: 712-C-96-048, April 1996.
(7) ASTM Standards, E 1195-85, Standard Test Method for Determining a Sorption Constant (Koc) for an Organic Chemical in Soil and Sediments.
(8) Agriculture Canada: Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada, 15 July 1987.
(9) Netherlands Commission Registration Pesticides (1995): Application for registration of a pesticide. Section G. Behaviour of the product and its metabolites in soil, water and air.
(10) Danish National Agency of Environmental Protection (October 1988): Criteria for registration of pesticides as especially dangerous to health or especially harmful to the environment.
(11) BBA (1990), Guidelines for the Official Testing of Plant Protection Products, Biological Research Centre for Agriculture and Forestry, Braunschweig, Germany.
(12) Calvet R., (1989), „Evaluation of adsorption coefficients and the prediction of the mobilities of pesticides in soils“, in Methodological Aspects of the Study of Pesticide Behaviour in Soil (ed. P. Jamet), INRA, Paris, (Review).
(13) Calvet R., (1980) „Adsorption-Desorption Phenomena“ in Interactions between herbicides and the soil. (R.J. Hance ed.), Academic Press, London, str. 83–122.
(14) Hasset J.J., and Banwart W.L., (1989), „The sorption of nonpolar organics by soils and sediments“ in Reactions and Movement of Organic Chemicals in Soils. Soil Science Society of America (S.S.S.A), Special Publication no. 22, str. 31–44.
(15) van Genuchten M. Th., Davidson J.M., and Wierenga P.J., (1974), „An evaluation of kinetic and equilibrium equations for the prediction of pesticide movement through porous media“. Soil Sci. Soc. Am. Proc., Vol. 38(1), 29–35.
(16) McCall P.J., Laskowski D.A., Swann R.L., and Dishburger H.J., (1981), „Measurement of sorption coefficients of organic chemicals and their use, in environmental fate analysis“, in Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington DC.
(17) Lambert S.M., Porter P.E., and Schieferrstein R.H., (1965), „Movement and sorption of chemicals applied to the soil“. Weeds, 13, 185–190.
(18) Rhodes R.C., Belasco I.J., and Pease H.L., (1970) „Determination of mobility and adsorption of agrochemicals in soils“. J.Agric.Food Chem., 18, 524–528.
(19) Russell M.H., (1995), „Recommended approaches to assess pesticide mobility in soil“ in Environmental Behavior of Agrochemicals (ed. T.R. Roberts and P.C. Kearney). John Wiley & Sons Ltd.
(20) Esser H.O., Hemingway R.J., Klein W., Sharp D.B., Vonk J.W. and Holland P.T., (1988), „Recommended approach to the evaluation of the environmental behavior of pesticides“, IUPAC Reports on Pesticides (24). Pure Appl. Chem., 60, 901–932.
(21) Guth J.A., Burkhard N., and D.O. Eberle, (1976), „Experimental models for studying the persistence of pesticides in soils“. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, pp 137–157, BCPC, Surrey, UK.
(22) Furminge C.G.L., and Osgerby J.M., (1967), „Persistence of herbicides in soil“. J. Sci. Fd Agric., 18, 269–273.
(23) Burkhard N., and Guth J.A., (1981), „Chemical hydrolysis of 2-Chloro-4,6-bis(alkylamino)-1,3,5-triazine herbicides and their breakdown in soil under the influence of adsorption“. Pestic. Sci. 12, 45–52.
(24) Guth J.A., Gerber H.R., and Schlaepfer T., (1977). „Effect of adsorption, movement and persistence on the biological availability of soil-applied pesticides“. Proc. Br. Crop Prot. Conf., 3, 961–971.
(25) Osgerby J.M., (1973), „Process affecting herbicide action in soil“. Pestic. Sci., 4, 247–258.
(26) Guth J.A., (1972), „Adsorptions- und Einwascheverhalten von Pflanzenschutzmitteln in Böden“. Schr. Reihe Ver. Wass. -Boden-Lufthyg. Berlin-Dahlem, Heft 37, 143–154.
(27) Hamaker J.W., (1975), „The interpretation of soil leaching experiments“, in Environmental Dynamics of Pesticides (eds R. Haque and V.H. freed), pp. 135–172, Plenum Press, NY.
(28) Helling C.S., (1971), „Pesticide mobility in soils“. Soil Sci. Soc. Amer. Proc., 35, 732–210.
(29) Hamaker J.W., (1972), „Diffusion and volatilization“ in Organic chemicals in the soil environment (C.A.I. Goring and J.W. Hamaker eds), Vol. I, 49–143.
(30) Burkhard N. and Guth J.A., (1981), „Rate of volatilisation of pesticides from soil surfaces; Comparison of calculated results with those determined in a laboratory model system“. Pestic. Sci. 12, 37–44.
(31) Cohen S.Z., Creeger S.M., Carsel R.F., and Enfield C.G., (1984), „Potential pesticide contamination of groundwater from agricultural uses“, in Treatment and Disposal of Pesticide Wastes, pp. 297–325, Acs Symp. Ser. 259, American Chemical Society, Washington, DC.
(32) Gustafson D.I., (1989), „Groundwater ubiquity score: a simple method for assessing pesticide leachability“. J. Environ. Toxic. Chem., 8(4), 339–357.
(33) Leistra M., and Dekkers W.A., (1976). „Computed effects of adsorption kinetics on pesticide movement in soils“. J. of Soil Sci., 28, 340–350.
(34) Bromilov R.H., and Leistra M., (1980), „Measured and simulated behavior of aldicarb and its oxydation products in fallow soils“. Pest. Sci., 11, 389–395.
(35) Green R.E., and Karickoff S.W., (1990), „Sorption estimates for modeling“, in Pesticides in the Soil Environment: Process, Impacts and Modeling (ed. H.H. Cheng). Soil Sci. Soc. Am., Book Series no. 2, pp.80–101,
(36) Lambert S.M., (1967), „Functional relationship between sorption in soil and chemical structure“. J. Agri. Food Chem., 15, 572–576.
(37) Hance R.J., (1969), „An empirical relationship between chemical structure and the sorption of some herbicides by soils“. J. Agri. Food Chem., 17, 667–668.
(38) Briggs G.G. (1969), „Molecular structure of herbicides and their sorption by soils“. Nature, 223, 1288.
(39) Briggs G.G. (1981). „Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor“. J. Agric. Food Chem., 29, 1050–1059.
(40) Sabljic A., (1984), „Predictions of the nature and strength of soil sorption of organic polutance by molecular topology“. J. Agric. Food Chem., 32, 243–246.
(41) Bailey G.W., and White J.L., (1970), „Factors influencing the adsorption, desorption, and movement of pesticides in soil“. Residue Rev., 32, 29–92.
(42) Bailey G.W., J.L. White and Y. Rothberg., (1968), „Adsorption of organic herbicides by montomorillonite: Role of pH and chemical character of adsorbate“. Soil Sci. Soc. Amer. Proc. 32:222–234.
(43) Karickhoff S.W., (1981) „Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils“. Chemosphere 10, 833–846.
(44) Paya-Perez A., Riaz M. and Larsen B., (1989), „Soil Sorption of 6 Chlorobenzenes and 20 PCB Congeners“. Environ. Toxicol. Safety 21, 1–17.
(45) Hamaker J.W., and Thompson J.M., (1972). „Adsorption in organic chemicals“ in Organic Chemicals in the Soil Environment (Goring C.A.I. and Hamaker J.W., eds), Vol I and II, Marcel Dekker, Inc., New York, NY, 1972, str. 49–143.
(46) Deli J., and Warren G.F., 1971, „Adsorption, desorption and leaching of diphenamid in soils“. Weed Sci. 19:67–69.
(47) Chu-Huang Wu, Buehring N., Davinson J.M. and Santelmann, (1975), „Napropamide Adsorption, desorption and Movement in soils“. Weed Science, Vol. 23, 454–457.
(48) Haues M.H.B., Stacey M., and Thompson J.M., (1968) „Adsorption of s-triazine herbicides by soil organic preparations“ in Isotopes and Radiation in Soil Organic Studies, p.75, International. Atomic Energy Agency, Vienna.
(49) Pionke H.B., and Deangelis R.J., (1980), „Methods for distributing pesticide loss in field run-off between the solution and adsorbed phase“, CREAMS, in A Field Scale Model for Chemicals, Run-off and Erosion from Agricultural Management Systems, Chapter 19, Vol. III: Supporting Documentation, USDA Conservation Research report.
(50) ISO Standard Compendium Environment: Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition (1994).
(51) Scheffer F., and Schachtschabel, Lehrbuch der Bodenkunde, F. Enke Verlag, Stuttgart (1982), 11th edition.
(52) Black, Evans D.D., White J.L., Ensminger L.E., and Clark F.E., eds. „Methods of Soil Analysis“, Vol 1 and 2, American Society of Agronomy, Madison, WI, 1982.
(53) ISO/DIS 10381-1 Soil Quality – Sampling – Part 1: Guidance on the design of sampling programmes.
(54) ISO/DIS 10381-2 Soil Quality – Sampling – Part 2: Guidance on sampling techniques.
(55) ISO/DIS 10381-3 Soil Quality – Sampling – Part 3: Guidance on safety of sampling.
(56) ISO/DIS 10381-4 Soil Quality – Sampling – Part 4: Guidance on the investigation of natural and cultivated soils.
(57) ISO/DIS 10381-5 Soil Quality – Sampling – Part 5: Guidance on the investigation of soil contamination of urban and industrial sites.
(58) ISO 10381-6, 1993: Soil Quality – Sampling – Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
(59) Green R.E., and Yamane V.K., (1970) „Precision in pesticide adsorption measurements“. Soil Sci. Am. Proc., 34, 353–354.
(60) Grover R., and Hance R.J. (1970), „Effect of ratio of soil to water on adsorption of linuron and atrazine“. Soil Sci., 109–138.
(61) Boesten, J.J.T.I, „Influence of soil/liquid ratio on the experimental error of sorption coefficients in pesticide/soil system“. Pest. Sci. 1990, 30, 31–41.
(62) Boesten, J.J.T.I. „Influence of soil/liquid ratio on the experimental error of sorption coefficients in relation to OECD guideline 106“ Proceedings of 5th international workshop on environmental behaviour of pesticides and regulatory aspects, Brussels, 26–29 April 1994.
(63) Bastide J., Cantier J.M., et Coste C., (1980), „Comportement de substances herbicides dans le sol en fonction de leur structure chimique“. Weed Res. 21, 227–231.
(64) Brown D.S., and Flagg E.W., (1981), „Empirical prediction of organic pollutants sorption in natural sediments“. J. Environ.Qual., 10(3), 382–386.
(65) Chiou C.T., Porter P.E., and Schmedding D.W., (1983), „Partition equilibria of non-ionic organic compounds between soil organic matter and water“. Environ. Sci. Technol., 17(4), 227–231.
(66) Gerstl Z., and Mingelgrin U., (1984), „Sorption of organic substances by soils and sediments“. J. Environm. Sci. Health, B19 (3), 297–312.
(67) Vowles P.D., and Mantoura R.F.C., (1987), „Sediment-water partition coefficient and HPLC retention factors of aromatic hydrocarbons“. Chemosphere, 16(1), 109–116.
(68) Lyman W.J., Reehl W.F.and Rosenblatt D.H. (1990). Handbook of Chemical Property Estimation Methods. Environmental Behaviour of Organic Compounds. American Chemical Society, Washington DC.
(69) Keniga E.E., and Goring, C.A.I. (1980). „Relationship between water solubility, soil sorption, octanol-water partitioning and concentration of chemicals in the biota“ in Aquatic Toxicology (eds J.G. Eaton, et al.), pp.78–115, ASTM STP 707, Philadelphia.
(70) Chiou C.T., Peters L.J., and Freed V.H., (1979), „A physical concept of soil-water equilibria for non-ionic organic compounds“. Science, Vol. 206, 831–832.
(71) Hassett J.J., Banwart W.I., Wood S.G., and Means J.C., (1981), „Sorption of/-Naphtol: implications concerning the limits of hydrophobic sorption“. Soil Sci. Soc. Am. J. 45, 38–42.
(72) Karickhoff S.W., (1981), „Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils“. Chemosphere, Vol. 10(8), 833–846.
(73) Moreale A., van Bladel R., (1981), „Adsorption de 13 herbicides et insecticides par le sol. Relation solubilité – reactivité“. Revue de l'Agric., 34 (4), 319–322.
(74) Müller M., Kördel W. (1996), „Comparison of screening methods for the determination/estimation of adsorption coefficients on soil“. Chemosphere, 32(12), 2493–2504.
(75) Kördel W., Kotthoff G., Müller M. (1995), „HPLC – screening method for the determination of the adsorption coefficient on soil – results of a ring test“. Chemosphere 30 (7), 1373–1384.
(76) Kördel W., Stutte J., Kotthoff G. (1993), „HPLC – screening method for the determination of the adsorption coefficient on soil – comparison of different stationary phases“. Chemosphere 27 (12), 2341–2352.
(77) Hance, R.J., (1967), „The speed of Attainment of Sorption Equilibria in Some Systems Involving Herbicides“. Weed Research, Vol. 7, str. 29–36.
(78) Koskinen W.C., and Harper S.S., (1990), „The retention processes: mechanisms“ in Pesticides in the Soil Environment: Processes, Impacts and Modelling (ed. H.H. Cheng). Soil Sci. Soc. Am. Book Series, No. 2, Madison, Wisconsin.
(79) Cohen S.Z., Creeger S.M., Carsel R.F., and Enfield C.G. (1984), „Potential pesticide contamination of groundwater from agricultural uses“, in Treatment and Disposal of Pesticide Wastes, pp. 297–325, ACS Symp. Ser. 259, American Chemical Society, Washington, DC.
(80) Giles C.H., (1970), „Interpretation and use of sorption isotherms“ in Sorption and Transport Processes in Soils. S.C.I. Monograph No. 37, 14–32.
(81) Giles, C.H.; McEwan J.H.; Nakhwa, S.N. and Smith, D, (1960), „Studies in adsorption: XI. A system of classification of solution adsorption isotherms and its use in the diagnosis of adsorption mechanisms and in measurements of pesticides surface areas of soils“. J. Chem. Soc., 3973–93.
(82) Calvet R., Tercé M., and Arvien J.C., (1980), „Adsorption des pesticides par les sols et leurs constituants: 3. Caractéristiques générales de l'adsorption“. Ann. Agron. 31: 239–251.
(83) Bedbur E., (1996), „Anomalies in the Freundlich equation“, Proc. COST 66 Workshop, Pesticides in soil and the environment, 13–15 May 1996, Stratford-upon-Avon, U.K.
(84) Guth, J.A., (1985), „Adsorption/desorption“, in Joint International Symposium, Physicochemical Properties and their Role in Environmental Hazard Assessment, July 1–3, Canterbury, UK.
(85) Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962).
DODATEK 1
Shema preskusa

DODATEK 2
VPLIV TOČNOSTI ANALITSKE METODE IN SPREMEMBE KONCENTRACIJE NA TOČNOST REZULTATOV ADSORPCIJE
Iz nasleduje tabele (84) je očitno, da pri zelo majhni razhki med začetno maso (mo = 110 μg) in ravnotežno maso (
![]()
![]()
|
Količina tal msoil |
msoil |
= 10 g |
|
Prostornina raztopine |
V0 |
= 100 cm3 |
|
(μg) |
(μg cm-3) |
R |
(μg) |
(μg g-1) |
R‡ |
Kd* |
R‡ |
|
|
ZA A = 9 % |
||||||||
|
m0 = 110 μg or C0= 1,100 μg/cm3 |
100 |
1,000 |
Dejanska vrednost |
10 |
1,00 |
Dejanska vrednost |
1 |
|
|
101 |
1,010 |
1 % |
9 |
0,90 |
10 % |
0,891 |
10,9 % |
|
|
105 |
1,050 |
5 % |
5 |
0,50 |
50 % |
0,476 |
52,4 % |
|
|
109 |
1,090 |
9 % |
1 |
0,10 |
90 % |
0,092 |
90,8 % |
|
|
ZA A = 55 % |
||||||||
|
m0= 110 μg or C0= 1,100 μg/cm3 |
50,0 |
0,500 |
Dejanska vrednost |
60,0 |
6,00 |
Dejanska vrednost |
12,00 |
|
|
50,5 |
0,505 |
1 % |
59,5 |
5,95 |
0,8 % |
11,78 |
1,8 % |
|
|
52,5 |
0,525 |
5 % |
57,5 |
5,75 |
4,0 % |
10,95 |
8,8 % |
|
|
55,0 |
0,550 |
10 % |
55,0 |
5,50 |
8,3 % |
10,00 |
16,7 % |
|
|
ZA A = 99 % |
||||||||
|
m0 = 110 μg or C0= 1,100 μg/cm3 |
1,100 |
0,011 |
Dejanska vrednost |
108,9 |
10,89 |
Dejanska vrednost |
990 |
|
|
1,111 |
0,01111 |
1 % |
108,889 |
10,8889 |
0,01 % |
980 |
1,0 % |
|
|
1,155 |
0,01155 |
5 % |
108,845 |
10,8845 |
0,05 % |
942 |
4,8 % |
|
|
1,21 |
0,0121 |
10 % |
108,790 |
10,8790 |
0,10 % |
899 |
9,2 % |
|
|
|
= |
|
|
|
= |
masa preskusne snovi v talni fazi ob ravnotežju, μg; |
|
|
= |
masa preskusne snoví vodni fazi ob ravnotežju, μg; |
|
|
= |
vsebnost preskisne snovi v talni fazi ob ravnotežju, μg g-1; |
|
|
= |
masna konceutracija preskusne snovi v vodili fazi ob ravnotežju. μg cm-3; |
|
R |
= |
analitska napaka pri dolocanju
|
|
R‡ |
= |
izračunana napaka zaradi analitske napake R. |
DODATEK 3
TEHNIKE OCENJEVANJA Kd
1. Tehnike ocenjevanja omogočajo napovedovanje Kd na podlagi korelacij z, na primer, vrednostmi Pow (12) (39) (63–68), podatki o topnosti v vodi (12) (19) (21) (39) (68–73) ali podatki o polarnosti, dobljenimi z uporabo HPLC z obrnjeno fazo (74–76). Kakor je prikazano v tabelah 1 in 2, se iz teh enačb izračuna Koc ali Kom in nato, posredno, Kd iz enačb:
|
|
|
2. Koncept teh korelacij temelji na dveh predpostavkah: (1) na adsorpcijo snovi v največji meri vplivajo organske snovi v tleh; in (2) vpletene interakcije so večinoma nepolarne. Zaradi tega te korelacije: (1) niso uporabne za polarne snovi ali so zanje uporabne samo do neke mere, in (2) niso uporabne v primerih, ko je vsebnost organskih snovi v tleh zelo majhna (12). Poleg tega, čeprav so bile med Pow in adsorpcijo sicer ugotovljene zadovoljive korelacije, tega ni mogoče trditi za odnos med topnostjo v vodi in obsegom adsorpcije (19) (21); dosedanje študije si zelo nasprotujejo.
3. Nekaj primerov korelacije med adsorpcijskim koeficientom in porazdelitvenim koeficientom oktanol/voda ter topnostjo v vodi je navedenih v tabeli 1 oziroma 2.
Tabela 1
Primeri korelacij med adsorpcij skim porazdelitvenimim koeficientom in porazdelitvenim koeficientom oktanol/voda; za dodatne primere glej (12) (68)
|
Snovi |
Korelacije |
Avtorji |
|
Substituirane sečnine |
log Kom = 0,69 + 0,52 log Pow |
Briggs (1981) (39) |
|
Aromatske klorirane |
log Koc = - 0,779 + 0,904 log Pow |
Chiou et al. (1983) (65) |
|
Razni pesticidi |
log Kom = 4,4 + 0,72 log Pow |
Gerstl in Mingelgrin (1984) (66) |
|
Aromatski ogljikovodiki |
log Koc = - 2,53 + 1,15 log Pow |
Vowles in Mantoura (1987) (67) |
Tabela 2
Primeri korelacij med adsorpcijskim porazdelitvenim koeficientom in topnostjo v vodi; za dodatne primere glej (68) (69)
|
Spojine |
Korelacije |
Avtorji |
|
Razni pesticidi |
log Kom = 3,8 – 0,561 log Sw |
Gerstl in Mingelgrin (1984) (66) |
|
Alifatske, aromatske klorirane snovi |
log Kom = (4,040 +/– 0,038) – (0,557 +/– 0,012) log Sw |
Chiou et al. (1979) (70) |
|
α-naftol |
logKoc = 4,273 – 0,686 log Sw |
Hasset et al. (1981) (71) |
|
Ciklične, alifatske aromatske snovi |
logKoc = - 1,405 – 0,921 log Sw - 0,00953 (mp-25) |
Karickhoff (1981) (72) |
|
Razne spojine |
log Kom = 2,75 – 0,45 log Sw |
Moreale van Blade (1982) (73) |
DODATEK 4
IZRAČUNI ZA DOLOČITEV POGOJEV CENTRIFUGIRANJA
1. Čas centrifugiranja se izračuna po naslednji enačbi ob predpostavki kroglastih delcev:
|
|
(1) |
Za poenostavitev so vsi parametri opisani z enotami, ki niso enote SI (g, cm).
pri čemer je:
|
ω |
= |
hitrost vrtenja (=2 π rpm/60), rad s-1; |
|
rpm |
= |
vrtljaji na minuto; |
|
η |
= |
viskoznost raztopine, g s-1 cm-1; |
|
rp |
= |
polmer delcev, cm; |
|
ρs |
= |
gostota tal, g cm-3; |
|
ρaq |
= |
gostota raztopine, g cm-3; |
|
Rt |
= |
razdalja od središča rotorja centrifuge do gladine raztopine v centrifugirki, cm; |
|
Rb |
= |
razdalja od središča rotorja centrifuge do dna centrifugirke, cm; |
|
Rb-Rt |
= |
dolžina zmesi tla/raztopina v centrifugirki, cm. |
V splošni praksi se uporabljajo dvakratni izračunani časi za zagotovitev popolne ločitve.
2. Enačbo (1) je mogoče še bolj poenostaviti, če predpostavimo, da sta viskoznost (η) in gostota (ρaq) raztopine enaki viskoznosti in gostoti vode pri 25 oC; torej, η = 8,95 × 10-3g s-1cm-1 IN ρaq = 1,0 g.cm-3.
Nato se izračuna čas centrifugiranja po enačbi (2):
|
|
(2) |
3. Iz enačbe 2 postane očitno, da sta pri določanju pogojev centrifugiranja, t.j. časa (t) in hitrosti (rpm) pomembna dva parametra, za ločitev delcev specifične velikosti (v našem primeru s polmerom 0,1 μm): (1) gostota tal in (2) dolžina zmesi v centrifugirki (Rb-Rt), oz. razdalja, ki jo prepotuje delec od gladine raztopine do dna centrifugirke; seveda je pri fiksni prostornini dolžina zmesi v centrifugirki odvisna od kvadrata polmera centrifugirke.
4. Slika 1 prikazuje spreminjanje časa centrifugiranja (t) v odvisnosti od hitrosti centrifugiranja (rpm) pri različnih gostotah tal (ps) (slika 1a) in različnih dolžinah zmesi v centrifugirkah (slika 1b). Iz slike 1a je vpliv gostote tal očiten; na primer, pri klasičnem centrifugiranju s 3 000 rpm je čas centrifugiranja približno 240 minut za gostoto tal 1,2 g cm3, za gostoto 20 g cm3 pa je samo 50 minut. Podobno slika lb kaže, da je pri klasičnem centrifugiranju s 3 000 rpm čas centrifugiranja približno 50 minut, če je dolžina zmesi 10 cm, in samo 7 minut pri dolžini 1 cm. Vendar je pomembno najti optimalen odnos med centrifugiranjem, ki zahteva najmanjšo možno dolžino, in čim lažjim ločevanjem faz po centrifugiranju.
5. Poleg tega je pri določanju eksperimentalnih pogojev za ločevanje faz tla/raztopina pomembno upoštevati morebiten obstoj tretje „psevdofaze“ – koloidov. Ti delci, manjši od 0,2 μm, lahko pomembno vplivajo na celoten mehanizem adsorpcije snovi v suspenziji tal. Kadar se centrifugiranje izvaja po zgornjem opisu, koloidi ostanejo v vodni fazi in se analizirajo skupaj z vodno fazo. Tako se informacije o njihovem vplivu izgubijo.
Če ima zadevni laboratorij možnost ultracentrifugiranja ali ultrafiltracije, je mogoče adsorpcijo/desorpcijo snovi v tleh proučiti bolj podrobno ter tako pridobiti tudi informacije o adsorpciji snovi na koloide. V tem primeru se izvede ultracentrifugiranje pri 60 000 rpm/min ali ultrafiltracija s poroznostjo filtra 100 000 Daltonov za ločitev treh faz – tal, koloidov in raztopine. Tudi preskusni protokol se ustrezno prilagodi, da bodo vse tri faze analizirane.
Slika 1a
Spreminjanje časa centrifugiranja (t) v odvisnosti od hitrosti centrifugiranja (rpm) za različne gostote tal (ρs). Rt = 10 cm, Rb -Rt = 10 cm, η = 8,95 × 10-3g s-1cm-1 and ρaq = 1,0 g.cm-3 at 25 oC.
Slika 1b.

Spreminjanje časa centrifugiranja (t) v odvisnosti od hitrosti centrifugiranja (rpm) za različne dolžine zmesi v centrifugirki (Rb -Rt) = L; Rt = 10 cm, η = 8,95 x 10-3g s-1cm-1, ρaq = 1,0 g.cm-3 pri 25 oC in ρs = 2,0 g cm-3.
DODATEK 5
IZRAČUN ADSORPCIJE A ( %) IN DESORPCIJE D ( %)
Časovna shema postopka je:
Pri vseh izračunih se predpostavlja, da je preskusna snov stabilna in da se bistveno ne adsorbira na stene posode.
ADSORPCIJA A (A %)
(a) Paralelna metoda
Odstotek adsorpcije se izračuna za vsako epruveto (i) za vsak čas (ti) po enačbi:
|
|
(1) |
Elementi te enačbe se lahko izračunajo na naslednji način:
|
m0 = C0 · V0 (μg) |
(2) |
|
|
(3) |
pri čemer je:
|
|
= |
odstotek adsorpcije ( %) ob času ti; |
|
|
= |
masa preskusne snovi na tleh ob času ti, ko se opravi analiza (μg); |
|
m0 |
= |
masa preskusne snovi v epruveti na začetku preskusa (μg); |
|
C0 |
= |
začetna masna koncentracija preskusne raztopine v stiku s tlemi (μg cm-3); |
|
|
= |
masna koncentracija snovi v vodni fazi ob času ti, ko se izvaja analiza (μg cm-3); ta koncentracija se določi analitsko ob upoštevanju vrednosti, dobljenih s slepimi vzorci. |
|
V0 |
= |
začetna prostornina preskusne raztopine v stiku s tlemi (cm3). |
Vrednosti odstotka adsorpcije
![]()
ali
![]()
se prikažejo grafično v odvisnosti od časa in določi se čas, potreben za vzpostavitev sorpcijskega ravnotežja. Primera takih grafov sta sliki 1 in 2.
Slika 1
Graf adsorpcijskega ravnotežja

Slika 2
Masna koncentracija preskusne snovi v vodni fazi (Caq) v odvisnosti od časa
(b) Serialna metoda
Naslednje enačbe upoštevajo, da se adsorpcij ski postopek izvaja z merjenjem preskusne snovi v majhnih alikvotnih delih vodne faze v točno določenih časovnih intervalih.
— Za vsak časovni interval se količina snovi, adsorbirane na tla, izračuna po naslednjih enačbah:
—— za prvi časovni interval Δti = t1– t0
—
|
|
(4) |
— za drugi časovni interval Δt2 = t2 – t1
—
|
|
(5) |
— za tretji časovni interval Δt3 = t3 – t2
—
|
|
(6) |
— za n-ti časovni interval Δtn = tn – tn – 1
—
|
|
(7) |
— Odstotek adsorpcije za vsak časovni interval,
![]()
|
|
(8) |
— odstotek adsorpcije
![]()
|
|
(9) |
— Vrednosti adsorpcije
![]()
![]()
— Ob času uravnoteženja teq:
—— je masa preskusne snovi, adsorbirane na tla:
—
|
|
(10) |
— je masa preskusne snovi v raztopini:
—
|
|
(11) |
— odstotek adsorpcije ob ravnotežju pa je:
—
|
|
(12) |
Zgoraj uporabljeni parametri so:
|
|
= |
masa snovi, adsorbirane na tla v časovnih intervalih Δt1, Δt2,..., Δtn (μg); |
|
|
= |
masa snovi, izmerjena v alikvotu
|
|
|
= |
masa snovi, adsorbirane na tla ob adsorpcijskem ravnotežju (μg); |
|
|
= |
masa snovi v raztopini ob adsorpcijskem ravnotežju (μg); |
|
|
= |
prostornina alikvota, v katerem se meri preskusna snov (cm3); |
|
|
= |
odstotek adsorpcije, ki ustreza časovnemu intervalu Δti ( %); |
|
|
= |
odstotek adsorpcije ob adsorpcijskem ravnotežju ( %). |
DESORPCIJA D ( %)
Za čas t0, ko se začne poskus kinetike desorpcije, velja trenutek, ko se največja rekuperirana prostornina raztopine preskusne snovi (potem, ko je adsorpcijsko ravnotežje vzpostavljeno) nadomesti z enako prostornino 0,01 M raztopine CaCl2.
(a) Paralelna metoda
Ob času ti se masa preskusne snovi izmeri v vodni fazi, vzeti iz epruvete i (
![]()
|
|
(13) |
Ob desorpcijskem ravnotežju je ti = teq in zato je
![]()
![]()
Masa preskusne snovi, desorbirane v nekem časovnem intervalu (Δti) se izračuna po enačbi:
|
|
(14) |
Odstotek desorpcije se izračuna:
b času ti po enačbi:
|
|
(15) |
in za časovni interval (Δti) po enačbi:
|
|
(16) |
pri čemer je:
|
|
= |
odstotek desorpcije ob času ti ( %); |
|
|
= |
odstotek desorpcije, ki ustreza časovnemu intervalu Δti ( %); |
|
|
= |
masa preskusne snovi, desorbirane ob času ti, (μg); |
|
|
= |
masa preskusne snovi, desorbirane v časovnem intervalu Δti (μg); |
|
|
= |
masa preskusne snovi, analitsko izmerjena ob času ti v prostornini raztopine
|
|
|
= |
masa preskusne snovi, ki ostane od adsorpcijskega ravnotežja zaradi nepopolne nadomestitve prostornine (μg); |
|
|
(17) |
|
|
= |
masa preskusne snovi v raztopini ob adsorpcijskem ravnotežju (μg); |
|
VR |
= |
prostornina supernatanta, odstranjenega iz epruvete po vzpostavitvi adsorpcijskega ravnotežja in nadomeščenega z enako prostornino 0,01 M raztopine CaCl2 (cm3); |
|
|
= |
prostornina raztopine, vzete iz epruvete (i) za meritev preskusne snovi pri poskusu kinetike desorpcije (cm3). |
Vrednosti desorpcije
![]()
ali
![]()
(glede na potrebe študije) se prikažejo grafično v odvisnosti od časa in določi se čas, potreben za vzpostavitev desorpcijskega ravnotežja.
b) Serialna metoda
Naslednje enačbe upoštevajo, da je bil predhodni adsorpcijski postopek izveden z merjenjem preskusne snovi v majhnih alikvotnih delih
![]()
|
|
(18) |
Ob času ti:
— se masa preskusne snovi izmeri v majhnem alikvotnem delu
![]()
|
|
(19) |
— Ob desorpcijskem ravnotežju je ti = teq in zato je
![]()
![]()
— Odstotek desorpcije
![]()
|
|
(20) |
Ob časovnem intervalu (Δti):
Za vsak časovni interval se količina desorbirane snovi izračuna:
— za prvi časovni interval Δt1 = t1 - t0
—
|
|
(21) |
— za drugi časovni interval Δt2 = t2-t1
—
|
|
(22) |
— za n-ti časovni interval Δtn = tn-tn-1
—
|
|
(23) |
Nazadnje se izračuna odstotek desorpcije za vsak časovni interval
![]()
po naslednji enačbi:
|
|
(24) |
odstotek desorpcije
![]()
|
|
(25) |
pri čemer so zgoraj uporabljeni parametri:
|
|
= |
masa snovi, ki ostane adsorbirana v tleh po časovnih intervalih Δt1, Δt2,..., Δtn (μg); |
|
|
= |
masa preskusne snovi, desorbirane v časovnih intervalih Δt1, Δt2,..., Δtn (μg); |
|
|
= |
masa snovi, izmerjene v alikvotu
|
|
VT |
= |
skupna prostornina vodne faze v stiku s tlemi med poskusom kinetike desorpcije, izvedenem s serijsko metodo (cm3); |
|
|
= |
masa snovi, ki ostane od adsorpcijskega ravnotežja zaradi nepopolne nadomestitve prostornine (μg);
|
|
VR |
= |
prostornina supernatanta, odstranjenega iz epruvete po vzpostavitvi adsorpcijskega ravnotežja in nadomeščenega z enako prostornino 0,01 M raztopine CaCl2 (cm3); |
|
|
= |
prostornina alikvota, odvzetega iz epruvete (i) za namen analize med poskusom kinetke desorpcije, izvedenim s serijsko metodo (cm3);
|
DODATEK 6
ADSORPCIJA/DESORPCIJA V TLEH: LISTI ZA POROČANJE PODATKOV
Preskušana snov:
Preskušan tip tal:
Vsebnost suhe mase v tleh (105 oC, 12 h): … %
Temperatura: … oC
Primernost analitske metode
|
Teža tal |
g |
|
|
Tla: suha masa |
g |
|
|
Prostornina raztopine CaCl2 |
cm3 |
|
|
Nominalna koncentracija končne razopine |
μg cm-3 |
|
|
Analitska koncentracija končne razopine |
μg cm-3 |
Princip uporabljene analitske metode:
Umerjanje analitske metode:
Preskušana snov:
Preskušan tip tal:
Vsebnost suhe mase v tleh (105 oC, 12 h): … %
Temperatura: … oC
|
Uporabljena analitska metodologija: |
Posredna |
|
Paralelna |
|
Serialna |
|
|
Neposredna |
|
Preskus adsorpcije: preskusni vzorci
|
Simbol |
Enota |
Čas uravnoteženja |
Čas uravnoteženja |
Čas uravnoteženja |
Čas uravnotežen |
|||||
|
Št. epruvete |
||||||||||
|
Masa tal |
— |
g |
||||||||
|
Tla: suha masa |
msoil |
g |
||||||||
|
Prostornina vode v zatehtanih tleh (izračunana) |
VWS |
cm3 |
||||||||
|
Prostornina 0,01 M raztopine CaCl2 za vzpostavitev ravnotežja v tleh |
cm3 |
|||||||||
|
Prostornina osnovne raztopine |
cm3 |
|||||||||
|
Skupna prostornina vodne faze v stiku s tlemi |
V0 |
cm3 |
||||||||
|
Začetna koncentracija preskusne raztopine |
C0 |
μgcm-3 |
||||||||
|
Masa preskusne snovi na začetku preskusa |
m0 |
μg |
||||||||
|
Po stresanju in centrifugiranju |
||||||||||
|
NEPOSREDNA METODA |
||||||||||
|
Paralelna metoda |
||||||||||
|
Koncentracija preskusne snovi v vodni fazi, vključno s korekcijo za vrednost slepega vzorca |
|
μg cm-3 |
||||||||
|
Serialna metoda |
||||||||||
|
Masa preskusne snovi, izmerjena v alikvotu VA a |
|
μg |
||||||||
|
NEPOSREDNA METODA |
||||||||||
|
Masa preskusne snovi adsorbirane v tleh |
|
μg |
||||||||
|
Izračun adsorpcije |
||||||||||
|
Adsorpcija |
|
% |
||||||||
|
|
% |
|||||||||
|
Srednje velikosti |
||||||||||
|
Adsorpcijski koeficient |
Kd |
cm3 g-1 |
||||||||
|
Srednje velikosti |
||||||||||
|
Adsorpcijski koeficient |
Kd |
cm3 g-1 |
||||||||
|
Srednje velikosti |
||||||||||
Preskušana snov:
Preskušan tip tal:
Vsebnost suhe mase v tleh (105 oC, 12 h): … %
Temperatura: … oC
Preskus adsorpcije: slepi vzorci in kontrola
|
Simb ol |
Enota |
Slepi vzorec |
Slepi vzorec |
Kontrola |
||||
|
Št. epruvete |
||||||||
|
Masa tal |
g |
0 |
0 |
|||||
|
Prostornina vode v zatehtanih tleh (izračunana) |
cm3 |
— |
— |
|||||
|
Prostornina 0,01 M raztopine CaCl2 za vzpostavitev ravnotežja v tleh |
cm3 |
|||||||
|
Prostornina osnovne raztopine |
cm3 |
0 |
0 |
|||||
|
Skupna prostornina vodne faze v stiku s tlemi |
cm3 |
— |
— |
|||||
|
Začetna koncentracija preskusne snovi v vodni fazi |
μg cm-3 |
|||||||
|
Po stresanju in centrifugiranju |
||||||||
|
Koncentracija v vodni fazi |
μg cm-3 |
|||||||
Opomba: Po potrebi dodajte stolpce
Preskušana snov:
Preskušan tip tal:
V sebnost suhe mase v tleh (105 oC 12 h): … %
Temperatura: … oC
Masna bilanca
|
Simbol |
Enota |
|||||
|
Št. epruvete |
||||||
|
Masa tal |
— |
g |
||||
|
Tla: suha masa |
msoil |
g |
||||
|
Prostornina vode v zatehtanih tleh (izračunana) |
VWS |
ml |
||||
|
Prostornina 0,01 M raztopine CaCl2 za vzpostavitev ravnotežja v tleh |
ml |
|||||
|
Prostornina osnovne raztopine |
cm3 |
|||||
|
Skupna prostornina vodne faze v stiku s tlemi |
V0 |
cm3 |
||||
|
Začetna koncentracija preskusne raztopine |
C0 |
μg cm-3 |
||||
|
Čas potreben za vzpostavitev ravnotežja |
— |
h |
||||
|
Po stresanju in centrifugiranju |
||||||
|
Koncentracija preskusne snovi v vodni fazi ob adsorpcijskem ravnotežju, vključno s korekcijo za vrednost slepega vzorca |
|
μg cm-3 |
||||
|
Čas uravnoteženja |
teq |
h |
||||
|
Prvo redčenje s topilom |
||||||
|
Odstranjena prostornina vodne faze |
Vrec |
cm3 |
||||
|
Dodana prostornina topila |
ΔV |
cm3 |
||||
|
Prva ekstrakcija s topilom |
||||||
|
Signal, analiziran v topilu |
SE1 |
var. |
||||
|
Koncentracija preskusne snovi v topilu |
CE1 |
μg cm-3 |
||||
|
Masa snovi, ekstrahirane iz tal in sten posode |
mE1 |
μg |
||||
|
Drugo redčenje s topilom |
||||||
|
Odstranjena prostornina topila |
_Vs |
cm3 |
||||
|
Dodana prostornina topila |
V |
cm3 |
||||
|
Druga ekstrakcija s topilom |
||||||
|
Signal, analiziran v fazi topila |
SE2 |
var. |
||||
|
Koncentracija preskusne snovi v topilu |
CE2 |
μg cm-3 |
||||
|
Masa snovi, ekstrahirane iz tal in sten posode |
mE2 |
μg |
||||
|
Skupna masa preskusne snovi, ekstrahirana v dveh kroakih |
mE |
μg |
||||
|
Masna bilanca |
MB |
% |
||||
Preskušana snov:
Preskušan tip tal:
Vsebnost suhe mase v tleh (105 oC, 12 h): … %
Temperatura: … oC
Adsorpcijske izoterme
|
Simbol |
Enota |
|||||||||
|
Št. epruvete |
||||||||||
|
Masa tal |
— |
g |
||||||||
|
Tla: suha masa |
E |
g |
||||||||
|
Prostornina vode v zatehtanih tleh (izračunana) |
VWS |
cm3 |
||||||||
|
Prostornina 0,01 M raztopine CaCl2 za vzpostavitev ravnotežja vtleh |
cm3 |
|||||||||
|
Prostornina dodane osnovne raztopine |
cm3 |
|||||||||
|
Skupna prostornina vodne faze v stiku s tlemi (izračunana) |
V0 |
cm3 |
||||||||
|
Koncentracija raztopine |
C0 |
μg cm-3 |
||||||||
|
Čas potreben za vzpostavitev ravnotežja |
— |
h |
||||||||
|
Po stresanju in centrifugiranju |
||||||||||
|
Koncentracija snovi v vodni fazi, vkljulno s korekcijo za vrednost slepega vzorca |
|
μg cm-3 |
||||||||
|
Temperatura |
oC |
|||||||||
|
Adsorbirana masa na enoto tal |
|
μg g-1 |
||||||||
Regresijska analiza:
vrednost Kads F:
vrednost l/n:
regresijski koeficient r2:
Preskušana snov:
Preskušan tip tal:
Vsebnost suhe mase v tleh (105 oC, 12 h): … %
Temperatura: … oC
|
Uporabljena metodologija: |
analitska Posredna |
|
Paralelna |
|
Serialna |
|
Preskus desorpcije
|
Simbol |
Enota |
Časovni interval |
Časovni interval |
Časovni interval |
Časovni interval |
||
|
Št. epruvete iz faze adsorpcije |
|||||||
|
Masa snovi, adsorbirane na tla v adsorpcijskem ravnotežju |
|
μg |
|||||
|
Odstranjena prostornina vodne faze, nadomeščena z 0,01 M CaCl2 |
VR |
cm3 |
|||||
|
Skupna prostornina vodne faze v stiku s tlemi |
PM |
V0 |
cm3 |
||||
|
SM |
VT |
cm3 |
|||||
|
Masa preskusne snovi, ki ostane od adsorpcijskega ravnotežja zaradi nepopolne nadomestitve prostornine |
|
μg |
|||||
|
Kinetika desorpcije |
|||||||
|
Izmerjena masa snovi, desorbirane s tal ob času ti |
|
μg |
|||||
|
Prostornina raztopine, vzete iz epruvete (i) za meritev preskusne snovi |
PM |
Vi r |
cm3 |
||||
|
SM |
vD a |
cm3 |
|||||
|
Masa snovi, desorbirane s tal ob času ti (izračunana) |
|
μg |
|||||
|
Masa snovi, desorbirane s tal v časovnem intervalu Δti (izračunana) |
|
μg |
|||||
|
Odstotek desorpcije |
|||||||
|
Desorpcija ob časuti |
Dti % |
% |
|||||
|
Desorpcija v časovnem intervalu Δti |
|
% |
|||||
|
Desorpcijski koeficient |
Kdes |
||||||
PM: Paralelna metoda
SM: Serialna metoda
C.19 OCENJEVANJE ADSORPCIJSKEGA KOEFICIENTA (KOC ) TAL IN ODPADNEGA BLATA (BLATA IZ ČISTILNIH NAPRAV) S TEKOČINSKO KROMATOGRAFIJO VISOKE LOČLJIVOSTI (HPLC)
1. METODA
Ta metoda ustreza metodi OECD TG121 (2001).
1.1 UVOD
Sorptivno obnašanje snovi v tleh ali odpadnem blatu iz čistilnih naprav lahko opišemo s parametri, ki se eksperimentalno ugotovijo s preskusno metodo C.18. Eden od pomembnih parametrov je adsorpcijski koeficient, ki je opredeljen kot razmerje med koncentracijo snovi v tleh/blatu in koncentracijo snovi v vodni fazi ob adsorpcijskem ravnotežju. Adsorpcijski koeficient, normiran na vsebnost organskega ogljika v tleh (Koc), je koristen pokazatelj sposobnosti vezave kemikalije na organske snovi v tleh in odpadnem blatu ter omogoča primerjavo med različnimi kemikalijami. Ta parameter je mogoče oceniti prek korelacije s topnostjo v vodi in porazdelitvenim koeficientom n-oktanol/voda (1) (2) (3) (4) (5) (6) (7).
Eksperimentalna metoda, opisana v tem preskusu, uporablja HPLC za ocenitev adsorpcijskega koeficienta Koc v tleh in odpadnem blatu (8). Dobljene vrednosti so bolj zanesljive kot tiste, izračunane z metodo QSAR (9). Kot ocenjevalna metoda ne more popolnoma nadomestiti šaržnih preskusov ravnotežja, ki se uporabljajo v preskusni metodi C.18. Kljub temu je lahko ocenjeni Koc koristen pri izbiranju ustreznih preskusnih parametrov za proučevanje adsorpcije/desorpcije po preskusni metodi C.18 z računanjem Kd (porazdelitveni koeficient) ali Kf (Freundlichov adsorpcijski koeficient) po enačbi 3 (glej poglavje 1.2).
1.2 OPREDELITEV POJMOV
K d : Porazdelitveni koeficient je opredeljen kot razmerje med ravnotežnimi koncentracijami C raztopljene preskusne snovi v dvofaznem sistemu iz sorbenta (tla ali odpadno blato) in vodne faze; to je vrednost brez enote, kadar sta koncentraciji v obeh fazah izraženi kot teža/težo. Če je koncentracija v vodni fazi podana kot teža/prostornino, je enota ml· g-1. Kd se lahko spreminja glede na sorptivne lastnosti in je lahko odvisen od koncentracije.
|
|
(1) |
pri čemer je:
|
Csoil |
= |
koncentracija preskusne snovi v tleh ob ravnotežju (μg· g-1) |
|
Csludge |
= |
koncentracija preskusne snovi v blatu ob ravnotežju (μg· g-1) |
|
Caq |
= |
koncentracija preskusne snovi v vodni fazi ob ravnotežju (μg· g-1, μg· ml-1). |
K f : Freundlichov adsorpcijski koeficient je opredeljen kot koncentracija preskusne snovi v tleh ali odpadnem blatu (x/m), ko je ravnotežna koncentracija Caq v vodni fazi enaka ena; enota je μg· g-1 sorbenta. Vrednost se lahko spreminja glede na sorptivne lastnosti.
|
|
(2) |
pri čemer je:
|
x/m |
= |
količina preskusne snovi x (μg), adsorbirane na količino sorbenta m (g) ob ravnotežju |
|
1/n |
= |
nagib Freundlichove adsorpcijske izoterme |
|
Caq |
= |
koncentracija preskusne snovi v vodni fazi ob ravnotežju (μg· ml-1) |
At
![]()
K oc : Porazdelitveni koeficient (Kd) ali Freundlichov adsorpcijski koeficient (Kf), normiran na vsebnost organskega ogljika (foc) v sorbentu; zlasti za neionizirane kemikalije je približni pokazatelj obsega adsorpcije med snovjo in sorbentom in omogoča primerjavo med različnimi kemikalijami. Glede na enote Kd in Kf je Koc lahko brez enote ali ima enoto ml· g-1 ali μg· g-1 organske snovi.
|
|
(3) |
Razmerje med Koc in Kd ni vedno lineareno, tako da so lahko vrednosti Koc različne pri različnih tipih tal, vendar je njihova variabilnost močno zmanjšana v primerjavi z vrednostmi Kd ali Kf .
Adsorpcijski koeficient (Koc) se izpelje iz kapacitivnega faktorja (k') s pomočjo umeritvenega grafa log k' v odvisnosti od log Koc izbranih referenčnih spojin.
|
|
(4) |
pri čemer je:
|
tR |
= |
retencijski čas preskusne in referenčne snovi pri HPLC (minute) |
|
t0 |
= |
mrtvi čas pri HPLC (minute) (glej poglavje 1.8.2). |
POW : Porazdelitveni koeficient oktanol/voda je opredeljen kot razmerje med koncentracijama raztopljene snovi v n-oktanolu in vodi; to je vrednost brez enote.
|
|
(5) |
1.3 REFERENČNE SNOVI
Pred uporabo metode naj bodo znane strukturna formula, čistost In disociacijska konstanta (če je ustrezno). Koristne so informacije o topnosti v vodi in organskih topilih, porazdelitvenem koeficientu oktanol/voda in hidroliznih lastnostih.
Za korelacijo izmerjenih podatkov o retenciji pri FIPLC za preskusno snov z njenim adsorpcijskim koeficientom Koc je treba izdelati umeritveni graf log Koc v odvisnosti od k'. Uporabiti je treba vsaj šest referenčnih točk, pri čemer je vsaj ena nad in ena pod pričakovano vrednostjo za preskusno snov. Točnost metode se znatno izboljša, če se uporabijo referenčne snovi, ki so strukturno sorodne preskusni snovi. Če ti podatki niso na razpolago, uporabnik sam izbere ustrezne umeritvene snovi. V tem primeru se izbere bolj splošna skupina strukturno heterogenih snovi. Snovi in vrednosti Koc, ki se lahko uporabijo, so naštete v Dodatku in sicer v tabeli 1 za odpadno blato in v tabeli 3 za tla. Izbira drugih umeritvenih snovi mora biti utemeljena.
1.4 PRINCIP PRESKUSNE METODE
HPLC se izvaja s analiznimi kolonami, polnjenimi s cianopropilno trdno fazo (cianopropilnimi trdnimi delci), ki je na voljo na tržišču in ki vsebuje lipofilne in polarne dele. Uporablja se zmerno polarna stacionarna faza na osnovi matrice iz silicijevega oksida:
|
— O — Si |
— CH2 — CH2 — CH2 |
— CN |
|
silicijev oksid |
nepolarni vmesnik |
polami del |
Princip preskusne metode je podoben kot pri preskusni metodi A.8 (porazdelitveni koeficient, metoda HPLC). Pri potovanju skozi kolono skupaj z mobilno fazo pride do interakcije med preskusno snovjo in stacionarno fazo. Porazdeljevanje med mobilno in stacionarno fazo zadrži preskusno snov. Dvojna sestava stacionarne faze, ki ima polarna in nepolarna mesta, omogoča interakcijo med polarnimi in nepolarnimi skupinami molekule na podoben način kot pri organskih snoveh v matriksu tal ali odpadnega blata. To omogoča določitev odnosa med retencijskim časom v koloni in adsorpcijskim koeficientom na organski snovi.
pH ima pomemben vpliv na obnašanje pri sorpcij zlasti pri polarnih snoveh. Pri kmetijskih tleh in v bazenih komunalnih čistilnih naprav je pH navadno med 5,5 in 7,5. Za snovi, ki lahko ionizirajo, je treba izvesti dva preskusa, za ionizirano in neionizirano obliko, v ustreznih pufrih, vendar samo če najmanj 10 % preskusne spojine disociira v območju pH 5,5 do 7,5.
Ker se pri ocenjevanju uporabi samo razmerje med retencijo na koloni HPLC in adsorpcijskim koeficientom, kvantitativna analitska metoda ni potrebna, potrebna je samo določitev retencijskega časa. Če je na voljo primerna skupina referenčnih snovi in se lahko uporabijo standardni eksperimentalni pogoji, ta metoda predstavlja hiter in učinkovit način ocenjevanja adsorpcijskega koeficienta Koc.
1.5 UPORABNOST PRESKUSA
Metoda HPLC je uporabna za kemične snovi (označene ali neoznačene), za katere je na razpolago ustrezen sistem za detekcijo (npr. spektrofotometer, detektor radioaktivnosti) in ki so v času trajanja poskusa dovolj stabilne. Zlasti koristna je lahko za kemikalije, ki jih je z drugimi eksperimentalnimi sistemi težko proučevati (t.j. hlapne snovi; snovi, ki v vodi niso topne pri koncentraciji, ki jo je mogoče analitsko izmeriti; snovi z visoko afiniteto do površine inkubacijskih sistemov). Metoda se lahko uporabi za zmesi, pri katerih ostanejo neločljivi elucijski trakovi. V tem primeru je treba navesti zgornje in spodnje mejne vrednosti log Koc spojin preskusne zmesi.
Nečistote lahko včasih povzročijo težave pri razlagi rezultatov HPLC, vendar so majhnega pomena, če je mogoče preskusno snov analitsko jasno določiti in ločiti od nečistot.
Metoda je validirana za snovi iz tabele 1 v Dodatku in je bila uporabljena tudi za razne druge kemikalije iz naslednjih razredov:
— aromatski amini (npr. trifluralin, 4-kloroanilin, 3,5-dinitroanilin, 4-metilanilin, N-metilanilin, 1-naftilamin),
— aromatski estri karboksilne kisline (npr. metilester benzojske kisline, etilester 3,5-dinitrobenzojske kisline),
— aromatski ogljikovodiki (npr. toluen, ksilen, etilbenzen, nitrobenzen),
— estri ariloksifenoksipropionske kisline (npr. diklofop-metil, fenoksaprop-etil, fenoksaprop-P-etil),
— benzimidazolijevi in imidazolijevi fungi cidi (npr. karbendazim, fuberidazol, triazokside),
— amidi karboksilne kisline (npr. 2-klorobenzamid, N,N-dimetilbenzamid, 3,5-dinitrobenzamid, N-metilbenzamid, 2-nitrobenzamid, 3-nitrobenzamid),
— klorirani ogljikovodiki (npr. endosulfan, DDT, heksaklorobenzen, kvintozen, 1,2,3-triklorobenzen),
— organofosforjevi insekticidi (npr. azinfos-metil, disulfoton, fenamifos, izofenfos, pirazofos, sulprofos, triazofos),
— fenoli (npr. fenol, 2-nitrofenol, 4-nitrofenol, pentaklorofenol, 2,4,6-triklorofenol, 1-naftol),
— derivati feniluree (npr. izoproturon, monolinuron, pencikuron),
— pigmentna barvila (npr. Acid Yellow 219, Basic Blue 41, Direct Red 81),
— poliaromatski ogljikovodiki (npr. acenaften, naftalen),
— 1,3,5-triazin herbicidi (npr. prometrin, propazin, simazin, terbutrin),
— derivati triazola (npr. tebukonazol, triadimefon, tradimenol, triapentenol).
Metoda ni uporabna za snovi, ki reagirajo bodisi z eluentom ali stacionarno fazo. Prav tako ni uporabna za snovi, ki na specifičen način interagirajo z anorganskimi komponentami (npr. tvorba gručastih kompleksov z minerali gline). Metoda morda ne bo delovala pri površinsko aktivnih snoveh, anorganskih spojinah in zmernih ali močnih organskih kislinah ali bazah. Določiti je mogoče vrednosti log Koc v razponu od 1,5 to 5,0. Snovi, ki lahko ionizirajo, je treba meriti s pomočjo pufrske mobilne faze, vendar je treba paziti, da se prepreči obarjanje pufrskih komponent ali preskusne snovi.
1.6 MERILA KAKOVOSTI
1.6.1 Točnost
Navadno je adsorpcijski koeficient preskusne snovi mogoče oceniti do ± 0,5 logaritemske enote vrednosti, določene z metodo šaržnih preskusov ravnotežja (glej tabelo 1 v Dodatku). Boljša točnost se lahko doseže, če so referenčne snovi strukturno sorodne preskusni snovi.
1.6.2 Ponovljivost
Določanje je treba izvesti vsaj v dveh ponovitvah. Vrednosti log Koc dobljene pri posameznih merjenjih naj bodo znotraj obsega 0,25 logaritemske enote.
1.6.3 Obnovljivost
Dosedanje izkušnje z uporabo te metode potrjujejo njeno veljavnost. Pri preiskavi metode HPLC s pomočjo 48 snovi (večinoma pesticidov), za katere so bili na razpolago zanesljivi podatki o Koc tal, je bil ugotovljen korekcijski koeficient R = 0,95 (10) (11).
Za izboljšanje in validacijo metode je bil izveden preskus s primerjavo med laboratoriji, v katerem je sodelovalo 11 laboratorijev (12). Izsledki so navedeni v tabeli 2 v Dodatku.
1.7 OPIS PRESKUSNE METODE
1.7.1 Predhodna ocenitev adsorpcijskega koeficienta
Porazdelitveni koeficient oktanol/voda Pow (= Kow) in, do neke mere, topnost v vodi se lahko uporabita kot pokazatelja obsega adsorpcije, zlasti za neionizirane snovi, in se tako lahko uporabita za predhodno določanje območja. Objavljena je bila že vrsta koristnih korelacij za več skupin kemikalij (1) (2) (3) (4) (5) (6) (7).
1.7.2 Naprave
Potreben je tekočinski kromatograf, opremljen s črpalko brez pulzov in primernim detektorjem. Priporočljiva je uporaba injekcijskega ventila z injekcijsko zanko. Uporabi se komercialni cianopropil vezan na silikagel (npr. Hypersil in Zorbax CN). Med injekcijski sistem in analizno kolono se lahko namesti varovalna kolona iz enakega materiala. Kolone različnih dobaviteljev se lahko znatno razlikujejo glede na učinkovitost ločevanja. Kot vodilo je treba doseči naslednje faktorje zmogljivosti k': log k' > 0,0 za log Koc = 3,0 in log k' > – 0,4 za log Koc = 2,0 pri uporabi mobilne faze metanol/voda 55/45 %.
1.7.3 Mobilne faze
Preskušenih je bilo več mobilnih faz, priporočljivi pa sta naslednji dve:
— metanol/voda (55/45 % v/v)
— metanol/0,01 M citratni pufer pH 6,0 (55/45 % V/V)
Metanol čistosti za HPLC in destilirana voda ali citratni pufer se uporabita za pripravo elucijskega topila. Zmes se pred uporabo razplini. Uporabiti je treba izokratsko elucijo. Če zmes metanol/voda ni ustrezna, se lahko poskusi z drugimi zmesmi organskih topil in vode, npr. etanol/voda ali acetonitril/voda. Pri spojinah, ki lahko ionizirajo, je priporočljiva uporaba pufra za stabilizacijo pH. Poskrbeti je treba, da ne pride do obarjanja soli in uničenja kolone, kar se lahko zgodi pri nekaterih zmeseh: organska faza/pufer.
Ne smejo se uporabljati dodatki, kot so reagenti z ionskim parom, ker lahko vplivajo na sorptivne lastnosti stacionarne faze. Take spremembe stacionarne faze so lahko ireverzibilne. Zaradi tega je treba poskuse z dodatki obvezno izvajati na ločenih kolonah.
1.7.4 Topljenci
Preskusne in referenčne snovi je treba raztopiti v mobilni fazi.
1.8 IZVEDBA PRESKUSA
1.8.1 Preskusni pogoji
Treba je beležiti temperaturo med meritvami. Uporaba termostatirane peči s kromatografsko kolono je zelo priporočljiva za zagotavljanje konstantnih pogojev med umerjanjem in ocenjevanjem ter merjenjem preskusne snovi.
1.8.2 Določanje mrtvega časa t0
Za določanje mrtvega časa t0 se lahko uporabita dve različni metodi (glej tudi poglavje 1.2).
1.8.2.1 Določanje mrtvega časa to s pomočjo homologne serije
Ta postopek dokazano daje zanesljive in standardizirane vrednosti t0. Za podrobnosti glej preskusno metodo A.8: porazdelitveni koeficient (n-oktanol/voda), metoda HPLC.
1.8.2.2 Določanje mrtvega časa to s pomočjo inertnih snovi, ki jih kolona ne zadrži
Ta tehnika temelji na injiciranju raztopin formamida, sečnine ali natrijevega nitrata. Meritve je treba opraviti vsaj v dveh ponovitvah.
1.8.3 Določanje retencijskega časa tR
Referenčne snovi se izberejo kakor je opisano v poglavju 1.3. Lahko se injicirajo kot mešani standard za določitev njihovih retencijskih časov, pod pogojem da je bilo potrjeno, da prisotnost drugih referenčnih standardov ne vpliva na retencijski čas posameznega referenčnega standarda. Umerjanje se opravlja v rednih presledkih vsaj dvakrat dnevno, da se lahko upoštevajo nepričakovane spremembe v delovanju kolone. Najbolje je umeritveno injiciranje izvesti pred in po injiciranju preskusne snovi za potrditev, da se retencijski časi niso spremenili. Preskusne snovi se injicirajo ločeno v čim manjših količinah (da ne bi prišlo do preobremenitve kolone) in določijo se njihovi retencijski časi.
Za večjo zanesljivost meritev je treba določitev opraviti vsaj dvakrat. Vrednosti log Koc v posameznih meritvah morajo biti v območju 0,25 logaritemske enote.
1.8.4 Vrednotenje
Kapacitivni faktorji k' se izračunajo iz mrtvega časa t0 in retencijskih časov tR izbranih referenčnih snovi po enačbi 4 (glej poglavje 1.2). Podatke log k' za referenčne snovi se nato vnese v graf odvisnosti od njihovih vrednosti Koc iz poskusov s šaržnim ravnotežjem iz tabel 1 in 3 v Dodatku. S pomočjo tega grafičnega prikaza se nato vrednost log k' preskusne snovi uporabi za določitev njene vrednosti log Koc. Če dejanski rezultati pokažejo, da je log Koc preskusne snovi izven umeritvenega območja, je treba preskus ponoviti in uporabiti druge, bolj ustrezne referenčne snovi.
2. PODATKI IN POROČANJE
Poročilo mora vsebovati naslednje informacije:
— identiteto preskusnih in referenčnih snovi in njihovo čistost ter vrednosti pKa, če je ustrezno,
— opis opreme in delovnih pogojev, npr. vrsta in dimenzije analizne (in varovalne) kolone, detekcijsko sredstvo, mobilna faza (razmerje komponent in pH), temperaturni razpon med meritvami,
— mrtvi čas in metodo za njegovo določanje,
— količine preskusnih in referenčnih snovi v koloni,
— retencijske čase referenčnih spojin, uporabljenih za umerjanje,
— podrobnosti o prilagojeni regresijski premici (log k' v odvisnosti od log Koc) in graf regresijske premice,
— podatke o povprečni retenciji in ocenjeno vrednost log Koc za preskusno spojino,
— kromatograme.
3. LITERATURA
(1) W.J. Lyman, W.F. Reehl, D.H. Rosenblatt (ed). (1990). Handbook of chemical property estimation methods, chapt. 4, McGraw-Hill, New York.
(2) J. Hodson, N.A. Williams (1988). The estimation of the adsorption coefficient (Koc) for soils by HPLC. Chemosphere, 17, 1 67.
(3) G.G. Briggs (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem., 29, 1050–1059.
(4) C.T. Chiou, P.E. Porter, D.W. Schmedding (1983). Partition equilibria of nonionic organic compounds between soil organic matter and water. Environ. Sci. Technol., 17, 227–231.
(5) Z. Gerstl, U. Mingelgrin (1984). Sorption of organic substances by soils and sediment. J. Environm. Sci. Health, B19, 297–312.
(6) C.T. Chiou, L.J. Peters, V. H. Freed (1979). A physical concept of soil water equilibria for nonionic organic compounds, Science, 106, 831–832.
(7) S.W. Karickhoff (1981). Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils. Chemosphere, 10, 833–846.
(8) W. Kordel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2). 121–128.
(9) M. Mueller, W. Kordel (1996). Comparison of screening methods for the estimation of adsorption coefficients on soil. Chemosphere, 32(12), 2493–2504.
(10) W. Kordel, J. Stutte, G. Kotthoff (1993). HPLC-screening method for the determination of the adsorption coefficient in soil-comparison of different stationary phases, Chemosphere, 27(12). 2341–2352.
(11) B. von Oepen, W. Kordel, W. Klein (1991). Sorption of nonpolar and polar compounds to soils: Processes, measurements and experience with the applicability of the modified OECD Guideline 106, Chemosphere, 22, 285–304.
(12) W. Kordel, G. Kotthoff, J. Muller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), 1373–1384.
DODATEK
Tabela 1
Primerjava vrednosti Koc za tla in blato iz čistilnih naprav ter vrednosti, izračunane po presejalni metodi HPLC (1), (2)
|
Snov |
Št. CAS |
log Koc za odpadno blato |
log Koc pri HPLC |
Δ |
log Koc za tla |
log Koc pri HPLC |
Δ |
|
Atrazin |
1912-24-9 |
1,66 |
2,14 |
0,48 |
1,81 |
2,20 |
0,39 |
|
Linuron |
330-55-2 |
2,43 |
2,96 |
0,53 |
2,59 |
2,89 |
0,30 |
|
Fention |
55-38-9 |
3,75 |
3,58 |
0,17 |
3,31 |
3,40 |
0,09 |
|
Monuron |
150-68-5 |
1,46 |
2,21 |
0,75 |
1,99 |
2,26 |
0,27 |
|
Fenantren |
85-01-8 |
4,35 |
3,72 |
0,63 |
4,09 |
3,52 |
0,57 |
|
Fenil benzoat |
93-99-2 |
3,26 |
3,03 |
0,23 |
2,87 |
2,94 |
0,07 |
|
Benzamid |
55-21-0 |
1,60 |
1,00 |
0,60 |
1,26 |
1,25 |
0,01 |
|
4-Nitrobenzamid |
619-80-7 |
1,52 |
1,49 |
0,03 |
1,93 |
1,66 |
0,27 |
|
Acetanilid |
103-84-4 |
1,52 |
1,53 |
0,01 |
1,26 |
1,69 |
0,08 |
|
Anilin |
62-53-3 |
1,74 |
1,47 |
0,27 |
2,07 |
1,64 |
0,43 |
|
2,5-Dikloroanilin |
95-82-9 |
2,45 |
2,59 |
0,14 |
2,55 |
2,58 |
0,03 |
|
(1) W. Kordel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2). 121–128. (2) W. Kordel, D. Hennecke, C. Franke (1997). Determination of the adsorption-coefficients of organic substances on sewage sludges. Chemosphere, 35 (1/2), 107–119. |
|||||||
Tabela 2
Izsledki preskusa s primerjavo med laboratoriji (11 sodelujočih laboratorijev), izvedenega za izboljšanje in validacijo metode HPLC (1)
|
Snov |
Št. CAS |
log Koc |
Koc |
log Koc |
|
[OECD 106] |
[metoda HPLC] |
|||
|
Atrazin |
1912-24-9 |
1,81 |
78 + 16 |
1,89 |
|
Monuron |
150-68-5 |
1,99 |
100 + 8 |
2,00 |
|
Triapentenol |
77608-88-3 |
2,37 |
292 + 58 |
2,47 |
|
Linuron |
330-55-2 |
2,59 |
465 + 62 |
2,67 |
|
Fention |
55-38-9 |
3,31 |
2062 + 648 |
3,31 |
|
(1) W. Kordel, G. Kotthoff, J. Muller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), 1373–1384 |
||||
Tabela 3
Priporočene referenčne snovi za presejalno metodo HPLC na osnovi adsorpcijskih podatkov za tla
|
Referenčna snov |
Št. CAS |
Povprečne vrednosti log Koc iz šaržnega preskusa ravnotežja |
Število podatkov Koc |
log S.D. |
Vir |
|
Acetanilid |
103-84-4 |
1,25 |
4 |
0,48 |
|
|
Fenol |
108-95-2 |
1,32 |
4 |
0,70 |
|
|
2-Nitrobenzamid |
610-15-1 |
1,45 |
3 |
0,90 |
|
|
N.N-dimetilbenzamid |
611-74-5 |
1,52 |
2 |
0,45 |
|
|
4-Metilbenzamid |
619-55-6 |
1,78 |
3 |
1,76 |
|
|
Metil benzoat |
93-58-3 |
1,80 |
4 |
1,08 |
|
|
Atrazin |
1912-24-9 |
1,81 |
3 |
1,08 |
|
|
Isoproturon |
34123-59-6 |
1,86 |
5 |
1,53 |
|
|
3 -Nitrob enzami d |
645-09-0 |
1,95 |
3 |
1,31 |
|
|
Anilin |
62-53-3 |
2,07 |
4 |
1,73 |
|
|
3,5-Dinitrobenzamid |
121-81-3 |
2,31 |
3 |
1,27 |
|
|
Karbendazim |
10605-21- 7 |
2,35 |
3 |
1,37 |
|
|
Triadimenol |
55219-65-3 |
2,40 |
3 |
1,85 |
|
|
Triazoksid |
72459-58-6 |
2,44 |
3 |
1,66 |
|
|
Triazofos |
24017-47-8 |
2,55 |
3 |
1,78 |
|
|
Linuron |
330-55-2 |
2,59 |
3 |
1,97 |
|
|
Naftalen |
91-20-3 |
2,75 |
4 |
2,20 |
|
|
Endosulfandiol |
2157-19-9 |
3,02 |
5 |
2,29 |
|
|
Metiokarb |
2032-65-7 |
3,10 |
4 |
2,39 |
|
|
Acid Yellow 219 |
63405-85-6 |
3,16 |
4 |
2,83 |
|
|
1,2,3 -Triklorobenzen |
87-61-6 |
3,16 |
4 |
1,40 |
|
|
y-HCH |
58-89-9 |
3,23 |
5 |
2,94 |
|
|
Fention |
55-38-9 |
3,31 |
3 |
2,49 |
|
|
Direct Red 81 |
2610-11-9 |
3,43 |
4 |
2,68 |
|
|
Pirazofos |
13457-18-6 |
3,65 |
3 |
2,70 |
|
|
α-Endosulfan |
959-98-8 |
4,09 |
5 |
3,74 |
|
|
Diklofop-metil |
51338-27-3 |
4,20 |
3 |
3,77 |
|
|
Fenantrene |
85-01-8 |
4,09 |
4 |
3,83 |
|
|
Basic Blue 41 (zmes) |
26850-47- 5 12270-13-2 |
4,89 |
4 |
4,46 |
|
|
DDT |
50-29-3 |
5,63 |
1 |
— |
|
|
(1) W. Kordel, J. Miiller (1994). Bestimmung des Adsorptionskoeffizienten organischer Chemikalien mit der HPLC. UBA R&D Report No. 106 01 044 (1994). (2) B.V. Oepen, W. Kordel, W. Klein. (1991). Chemosphere, 22, 285–304 (3) Podatki iz industrije |
|||||
C.20 PRESKUS RAZMNOŽEVANJA VRSTE DAPHNIA MAGNA
1. METODA
Ta metoda preskušanja toksičnosti za razmnoževanje ustreza metodi OECD TG 211 (1998).
1.1 UVOD
Glavni cilj preskusa je oceniti vpliv kemikalij na sposobnost razmnoževanja vrste Daphnia magna.
1.2 OPREDELITEV POJMOV IN ENOTE
Starši: so samice vodne bolhe (iz rodu Daphnia), ki so prisotne na začetku preskusa in katerih sposobnost razmnoževanja je predmet te študije.
Potomci: so mladiči vodne bolhe, ki jih starši producirajov času preskusa.
Najnižja koncentracija z opaznim učinkom (LOEC): je najnižja preskušena koncentracija, pri kateri je ugotovljeno, da ima snov v danem obdobju izpostavljenosti statistično značilen učinek na razmnoževanje in smrtnost staršev (pri p < 0,05) ob primerjavi s kontrolo. Vendar morajo imeti vse preskusne koncentracije nad LOEC škodljiv učinek, ki je enak ali večji kot učinek, opažen pri LOEC. Če teh dveh pogojev ni mogoče izpolniti, je treba podrobno razložiti, kako je bil izbran LOEC (in s tem NOEC).
Koncentracija brez opaznih učinkov (NOEC): je preskusna koncentracija neposredno pod LOEC, ki v primerjavi s kontrolo nima statistično značilnega učinka (p < 0,05) v danem obdobju izpostavljenosti.
ECx: je koncentracija preskusne snovi, raztopljene v vodi, ki povzroči x- % zmanjšanje v razmnoževanju vrste Daphnia magna v danem obdobju izpostavljenosti.
Za populacijo značilna stopnja rasti: je merilo rasti populacije, ki združuje sposobnost razmnoževanja in smrtnost v določeni starosti (20) (21) (22). Pri populacijah v dinamičnem ravnotežju je enaka nič. Pri rastočih populacijah je pozitivna, pri upadajočih pa negativna. Slednja seveda ni samovzdržna in na koncu vodi k izumrtju.
Meja detekcije: je najnižja koncentracija, ki jo je mogoče zaznati, ne pa tudi količinsko ovrednotiti.
Meja določanja: je najnižja koncentracija, ki jo je mogoče količinsko izmeriti.
Smrtnost: žival se zabeleži kot mrtva, če je nepremična, t.j. če ne more plavati ali če v 15 sekundah po rahlem tresenju preskusne posode ni opaziti premikanja okončin ali postabdomna. (Če se uporabi druga opredelitev pojmov, je treba o tem poročati, skupaj z navedbo literature.)
1.3 PRINCIP PRESKUSNE METODE
Mlade samice vodne bolhe iz rodu daphnia (starši), na začetku preskusa mlajše od 24 ur, se izpostavijo preskusni snovi, dodani vodi v različnih koncentracijah. Preskus traja 21 dni. Na koncu preskusa se oceni celotno število živih potomcev na starša, ki je ob koncu poskusa živ. To pomeni, da se mladiči odraslih živali, ki med preskusom poginejo, pri računanju ne upoštevajo. Sposobnost razmnoževanja staršev je mogoče izraziti tudi na druge načine (npr. število živih potomcev, ki jih ima žival na dan od prvega dne, ko so opaženi potomci), vendar je treba o tem poročati poleg celotnega števila mladičev na starša, ki je ob koncu preskusa še živ. Sposobnost razmnoževanja živali, izpostavljenih preskusni snovi, se primerja z živalmi kontrol, da se določita najnižja koncentracija z opaznim učinkom (LOEC) in s tem koncentracija brez opaznih učinkov (NOEC). Poleg tega se, kolikor je mogoče, podatki analizirajo s pomočjo regresijskega modela, da se oceni koncentracija, ki bi povzročila x-odstotno znižanje sposobnosti razmnoževanja (t.j. EC50, EC20 ali EC10).
Poročati je treba tudi o preživetju staršev in času do produkcije prvega zaroda. Proučijo se lahko tudi drugi od snovi odvisni učinki na parametre, kot sta rast (npr. dolžina) in po možnosti za populacijo značilna stopnja rasti.
1.4 PODATKI O PRESKUSNI SNOVI
Na razpolago naj bodo izsledki preskusa akutne toksičnosti (glej metodo C.2, del I) za vrsto Daphnia magna. Ti izsledki so lahko koristni pri izbiranju ustreznega razpona preskusnih koncentracij za preskuse razmnoževanja. Znana morata biti topnost v vodi in parni tlak preskusne snovi, na razpolago pa mora biti zanesljiva analitska metoda za določanje količine snovi v preskusnih raztopinah, za katero obstajajo poročila o uspešnosti rekuperacije in meji določanja.
Informacije o preskusni snovi, ki so lahko koristne pri določanju preskusnih pogojev, vključujejo strukturno formulo, čistost snovi, stabilnost na svetlobi, stabilnost pri preskusnih pogojih, pKa, Pow in izsledke preskusa lahke biorazgradljivosti (glej metodo C.4).
1.5 VELJAVNOST PRESKUSA
Da bi bil preskus veljaven, morajo kontrole izpolnjevati naslednja merila:
— smrtnost staršev (samic vodnih bolh) ob koncu preskusa ne presega 20 %,
— povprečno število živih potomcev na starša, ki preživi do konca poskusa, je ≥ 60.
1.6 OPIS PRESKUSNE METODE
1.6.1 Naprave
Preskusne posode in druge priprave, ki pridejo v stik s preskusno snovjo, morajo biti v celoti iz stekla ali drugega kemično inertnega materiala. Preskusne posode so navadno steklene čaše.
Poleg tega bo lahko potrebna naslednja oprema:
— oksimeter (z mikroelektrodo ali drugo primerno opremo za merjenje raztopljenega kisika v vzorcih z majhno prostornino),
— primerna naprava za uravnavanje temperature,
— pH meter,
— oprema za določanje trdote vode,
— oprema za določanje koncentracije skupnega organskega ogljika (TOC) v vodi ali oprema za določanje kemijske potrebe po kisiku (KPK),
— primerna naprava za nadzorovanje režima osvetlitve in merjenje jakosti svetlobe.
1.6.2 Preskusni organizem
V preskusu se uporabi vrsta Daphnia magna, Straus. Lahko se uporabijo druge vrste iz rodu Daphnia, pod pogojem, da ustrezno izpolnjujejo merila za veljavnost (merilo za veljavnost v zvezi s sposobnostjo razmnoževanja kontrole mora biti ustrezno za vrsto vodne bolhe). Če se uporabijo druge vrste vodnih bolh, morajo biti jasno identificirane, njihova uporaba pa utemeljena.
Najbolje je, če je klon identificiran z genotipizacijo. Raziskave (1) so pokazale, da sposobnost razmnoževanja klona A (ki izvira iz IRCHA v Franciji) (3) dosledno izpolnjuje merilo za veljavnost, ki zahteva, da je povprečno število preživelih potomcev na preživelega starša ≥ 60, če so gojeni v razmerah, opisanih v tej metodi. Vendar so sprejemljivi tudi drugi kloni, pod pogojem da kultura vodnih bolh dokazano izpolnjuje merila za veljavnost preskusa.
Na začetku preskusa morajo biti živali mlajše od 24 ur in ne smejo biti prva generacija potomcev. Izvirati morajo iz zdravega staleža (t.j. ne smejo kazati znakov stresa, kot je visoka smrtnost, prisotnost samcev in efipijev, zamuda pri produkciji prvega zaroda, razbarvane živali itd.). Živali v staležu morajo biti gojene v razmerah (svetloba, temperatura, medij, hranjenje in živali na enoto prostornine), podobnih tistim, ki se uporabijo v preskusu. Če se v preskusu uporabi gojitveni medij vodnih bolh, ki je različen od tistega, ki se ga uporablja za rutinsko gojenje vodnih bolh, je dobro vključiti prilagoditveno obdobje pred preskusom, ki navadno traja okoli tri tedne (t.j. eno generacijo), da starši ne bi bili pod stresom.
1.6.3 Preskusni medij
Za ta preskus je priporočljivo uporabiti popolnoma definiran medij. S tem se je mogoče izogniti uporabi dodatkov (npr. morske alge, ekstrakt tal itd.), ki jih je težko opredeliti, s čimer se izboljšajo možnosti za standardizacijo med laboratoriji. Ugotovljeno je bilo, da sta medija Elendt M4 (4) in M7 (glej Dodatek 1) primerna za ta namen. Sprejemljivi pa so tudi drugi mediji (npr. (5) (6)), pod pogojem da sposobnost kulture vodnih bolh dokazano izpolnjuje merila za veljavnost preskusa.
Če se uporabijo mediji, ki vsebujejo nedefinirane dodatke, je treba te dodatke jasno navesti, poročilo o preskusu pa naj vsebuje informacije o sestavi, zlasti v zvezi z vsebnostjo ogljika, ker to lahko vpliva na prehrano. Priporočljivo je določiti skupni organski ogljik (TOC) in/ali kemijsko potrebo po kisiku (KPK) osnovnega pripravka organskega dodatka in oceniti posledični prispevek k TOC/KPK preskusnega medija. Priporočljivo je, da je raven TOC v mediju (t.j. pred dodatkom alg) pod 2 mg/l (7).
Pri preskušanju snovi, ki vsebujejo kovine, se je pomembno zavedati, da lahko lastnosti preskusnega medija (npr. trdota, sposobnost tvorbe kelatov) vplivajo na toksičnost preskusne snovi. Zato je zaželen popolnoma definiran medij. Vendar sta trenutno edina popolnoma definirana medija, ki sta dokazano primerna za dolgotrajno gojenje vrste Daphnia magna, Elendt M4 in M7. Oba medija vsebujeta kelatni reagent EDTA. Pri delu se je izkazalo (2), da je „navidezna toksičnost“ kadmija na splošno manjša, če se preskus z razmnoževanjem izvede v medijih M4 in M7, kot če se izvede v medijih, ki ne vsebujejo EDTA. M4 in M7 zato nista priporočljiva za preskusne snovi, ki vsebujejo kovine, izogibati pa se je treba tudi drugim medijem, ki vsebujejo znane kelatne reagente. Za snovi, ki vsebujejo kovine, je morda primerno uporabiti alternativni medij, kot je na primer trda sladka voda, rekonstituirana po ASTM (7), ki ne vsebuje EDTA, z dodanim izvlečkom morskih alg (8). Ta kombinacija trde sladke vode, rekonstituirane po ASTM, in izvlečka morskih alg je primerna tudi za dolgoročno gojenje in preskušanje vrste Daphnia magna (2), čeprav še vedno kaže rahlo kelatno delovanje zaradi organske sestavine v dodanem izvlečku morskih alg.
Na začetku preskusa in med njim mora biti koncentracija raztopljenega kisika nad 3 mg/l. pH mora biti med 6 in 9 in se navadno v času enega preskusa ne sme spreminjati za več kot 1,5 enote. Priporočljiva je trdota nad 140 mg/l (kot CaCO3). Pri preskusih na tej ravni in nad njo je bila ugotovljena sposobnost razmnoževanja, ki je v skladu z merili za veljavnost (9) (10).
1.6.4 Preskusne raztopine
Preskusne raztopine izbranih koncentracij se navadno pripravijo z redčenjem osnovne raztopine. Osnovne raztopine je najbolje pripraviti z raztapljanjem snovi v preskusnem mediju.
V nekaterih primerih je lahko potrebno uporabiti organsko topilo ali disperzijsko sredstvo za pripravo primerne koncentracije osnovne raztopine, vendar se je treba čim bolj izogibati uporabi takih materialov. Primeri primernih topil so aceton, etanol, metanol, dimetilformamid in trietilen glikol. Primeri primernih disperzijskih sredstev so Cremophor RH40, metilceluloza 0,01 % in HCO-40. V nobenem primeru preskusna snov v preskusni raztopini ne sme preseči meje topnosti v preskusnem mediju.
Topila se uporabijo za pripravo osnovne raztopine, ki jo je mogoče natančno dozirati v vodo. Pri priporočeni koncentraciji topila v končnem preskusnem mediju (t.j. ≤ 0,1 ml/l) zgoraj našteta topila niso toksična in ne povečajo topnosti snovi v vodi.
Disperzijska sredstva lahko pomagajo pri natančnem doziranju in disperziji. Pri priporočeni koncentraciji v končnem preskusnem mediju (t.j. ≤ 0,1 ml/l) zgoraj našteta disperzijska sredstva niso toksična in ne povečajo topnosti snovi v vodi.
1.7 NAČRT PRESKUSA
Dodelitev preskusnih posod v tretiranje in vse nadaljnje ravnanje s preskusnimi posodami naj bo naključno. Če ni, lahko pride do pristranskosti, ki bi jo lahko razumeli kot učinek koncentracije. Zlasti če se poskusne enote tretirajo po vrstnem redu tretiranj ali koncentracij, lahko učinek, odvisen od časa, kot je utrujenost izvajalca ali druge napake, vodi do večjega učinka pri višjih koncentracijah. Nadalje, če je verjetno, da bodo na rezultate preskusa vplivale začetne ali okoljske razmere preskusa, kot je položaj v laboratoriju, je treba razmisliti o razdelitvi v bloke.
1.8 POSTOPEK
1.8.1 Pogoji izpostavitve
1.8.1.1 Trajanje
Preskus traja 21 dni.
1.8.1.2 Obremenitev
Starši se razporedijo posamič, po en na preskusno posodo s po 50–100 ml medija.
Včasih so lahko potrebne večje prostornine za zadovoljitev potreb analitskega postopka, uporabljenega za določanje koncentracije preskusne snovi, čeprav je dopustno tudi združevanje ponovitev za kemijsko analizo. Če se uporabijo prostornine, večje od 100 ml, je včasih treba povečati obroke vodnim bolham, za zagotovitev zadostne dostopnosti hrane in skladnosti z merili za veljavnost. Za pretočne preskuse se lahko zaradi tehničnih razlogov pretehtajo alternativni načrti (npr. štiri skupine po 10 živali v večji preskusni prostornini), vendar je treba o vseh spremembah načrta preskusa poročati.
1.8.1.3 Število živali
Pri semi-statičnih preskusih najmanj 10 živali, razporejenih posamič, za vsako preskusno koncentracijo in najmanj 10 živali, razporejenih posamič, v kontrolni seriji.
Pri pretočnih preskusih se je izkazalo, da je primerno število 40 živali, razdeljenih v štiri skupine po 10 živali za vsako preskusno koncentracijo (1). Uporabi se lahko manjše število preskusnih organizmov, priporočeno pa je najmanj 20 živali na koncentracijo, razdeljenih v dve ali več ponovitev z enakim številom živali (npr. štiri ponovitve, vsaka s petimi vodnimi bolhami). Zavedati se je treba, da pri preskusih, v katerih so živali v skupinah, sposobnosti razmnoževanja ni mogoče izraziti kot skupno število živih potomcev, ki jih imajo ob koncu preskusa živi starši, če starši poginejo. V tem primeru je treba sposobnost razmnoževanja izraziti kot „skupno število živih potomcev, ki jih imajo starši, prisotni na začetku preskusa“.
1.8.1.4 Hranjenje
Pri semi-statičnih preskusih je živali najbolje hraniti dnevno vsekakor pa vsaj trikrat na teden (t.j. v skladu s spremembami medija). O odstopanjih od tega (npr. pri pretočnih preskusih) je treba poročati.
Najbolje je, da je med preskusom prehrana staršev sestavljena iz živih celic alg ene ali več naslednjih vrst: Chlorella sp., Selenastrum capricornutum (zdaj Pseudokirchneriella subcapitata (11) in Scenedesmus subspicatus. Prehrana naj temelji na količini organskega ogljika (C), zagotovljenega posamezni starševski živali. Raziskave (12) so pokazale, da za vrsto Daphnia magna obroki med 0,1 in 0,2 mg C/vodno bolho/dan zadostujejo za doseganje zahtevanega števila potomcev za izpolnitev meril za veljavnost preskusa. Obroki se lahko zagotavljajo v enakih količinah ves čas trajanja preskusa ali pa, po želji, se lahko na začetku uporabijo manjše količine in se nato povečujejo ob upoštevanju rasti staršev. Vendar naj tudi v tem primeru obroki ves čas ostanejo v priporočenem razponu 0,1–0,2 mg C/vodno bolho/dan.
Če se za ugotavljanje potrebnega obroka hrane uporabijo nadomestne meritve, kot sta število celic alg ali absorpcija svetlobe (t.j. zaradi večje pripravnosti, ker je merjenje vsebnosti ogljika zamudno), mora vsak laboratorij pripraviti svoj nomogram povezanosti nadomestnih meritev z vsebnostjo ogljika v kulturi alg (glej Dodatek 2 za nasvet o pripravi nomogramov). Nomograme je treba preveriti vsaj enkrat letno in bolj pogosto, če se spremenijo pogoji kulture alg. Ugotovljeno je bilo, da je absorpcija svetlobe boljše nadomestilo za vsebnost ogljika kot število celic (13).
Vodne bolhe je treba hraniti s koncentrirano suspenzijo alg, da je prostornina gojitvenega medija kulture alg, prenesenega v preskusne posode, čim manjša. Koncentrirane alge se lahko pripravi s centrifugiranjem, ki mu sledi resuspendiranje v destilirani vodi, deionizirani vodi ali v gojitvenem mediju za gojenje vodnih bolh.
1.8.1.5 Svetloba
16 ur svetlobe z jakostjo, ki ne presega 15-20 μE· m-2·s-1.
1.8.1.6 Temperatura
Temperatura preskusnega medija naj bo med 18 in 22 oC. Vendar naj se pri posameznem preskusu temperatura, če je mogoče, ne spreminja za več kot za 2 oC znotraj teh meja (npr. 18–20, 19–21 ali 20–22 oC). Včasih je za spremljanje temperature ustrezno uporabiti dodatno preskusno posodo.
1.8.1.7 Prezračevanje
Preskusne posode se med preskusom ne smejo prezračevati.
1.8.2 Preskusna koncentracija
Navadno bi moralo biti vsaj pet preskusnih koncentracij, urejenih po geometrijskem zaporedju s faktorjem separacije, za katerega je najbolje, da ne presega 3,2, uporabiti pa je treba tudi ustrezno število ponovitev za vsako preskusno koncentracijo (glej poglavje 1.8.1.3). Pri uporabi manj od petih koncentracij je treba to utemeljiti. Snovi se ne preskušajo nad njihovo mejo topnosti v preskusnem mediju.
Pri določanju razpona koncentracij se upošteva naslednje:
(i) Če je cilj ugotoviti LOEC/NOEC, mora biti najnižja preskusna koncentracija dovolj nizka, da plodnost pri tej koncentraciji ni značilno nižja od kontrolne. Če ni tako, je treba preskus ponoviti z manjšo najnižjo koncentracijo.
(ii) Če je cilj ugotoviti LOEC/NOEC, mora biti najvišja preskusna koncentracija dovolj visoka, da je plodnost pri tej koncentraciji značilno nižja od kontrolne. Če ni tako, je treba preskus ponoviti z večjo najvišjo koncentracijo.
(iii) Če se ocenjuje ECx za vplive na razmnoževanje, je priporočljivo uporabiti zadostne koncentracije, da se ECx lahko določi z ustrezno stopnjo zaupanja. Če se ocenjuje EC50 za vpliv na razmnoževanje, je priporočljivo, da je najvišja preskusna koncentracija večja od te EC50. Drugače bo sicer še vedno mogoče oceniti EC50, vendar bo interval zaupanja za ta EC50 zelo širok in morda ne bo mogoče zadovoljivo oceniti primernosti prilagojenega modela.
(iv) Najbolje je, da razpon preskusnih koncentracij ne zajema koncentracij, ki imajo statistično značilen vpliv na preživetje odraslih, saj bi se s tem spremenila vrsta preskusa iz preprostega preskusa razmnoževanja v sestavljen preskus razmnoževanja in smrtnosti, za katerega je potrebna veliko bolj zapletena statistična analiza.
Predhodno poznavanje toksičnosti preskusne snovi (npr. iz akutnega preskusa in/ali študij za določanje območja) bi moralo biti v pomoč pri izbiranju ustreznih preskusnih koncentracij.
Če se za lažjo pripravo preskusnih raztopin uporabi topilo ali disperzijsko sredstvo (glej poglavje 1.6.4), njegova končna koncentracija v preskusni posodi ne sme presegati 0,1 ml/l in mora biti enaka v vseh preskusnih posodah.
1.8.3 Kontrole
Poleg preskusne serije je treba izvesti kontrolno serijo s preskusnim medijem in, če je ustrezno, kontrolno serijo s topilom ali disperzij skim sredstvom. Če se uporabi topilo ali disperzij sko sredstvo, mora biti njegova koncentracija enaka tisti v posodah s preskusno snovjo. Uporabiti je treba ustrezno število ponovitev (glej poglavje 1.8.1.3).
Na splošno bi moral biti pri pravilno izvedenem preskusu koeficient variacije okoli srednjega števila živih potomcev na starša v kontrolah ≤ 25 % in o tem je treba poročati pri načrtih preskusa, pri katerih se uporabljajo posamično razporejene živali.
1.8.4 Obnavljanje preskusnega medija
Pogostost obnavljanja medija je odvisna od stabilnosti preskusne snovi, vendar mora biti vsaj trikrat na teden. Če je iz predhodnih preskusov stabilnosti (glej poglavje 1.4) razvidno, da koncentracija preskusne snovi ni stabilna (t.j. da je izven območja 80–120 % nominalne ali pod 80 % izmerjene začetne koncentracije) v najdaljšem obdobju obnovitve (t.j. tri dni), je treba razmisliti o bolj pogostem obnavljanju medija ali o uporabi pretočnega preskusa.
Ko se medij obnavlja pri semi-statičnem preskusu, se pripravi druga serija preskusnih posod, vanje pa se prenese starše, na primer s stekleno pipeto primernega premera. Prostornina medija, prenesenega z vodnimi bolhami, mora biti čim manjša.
1.8.5 Opazovanja
Rezultati opazovanj med preskusom naj se navedejo na podatkovnem listu (glej primere v dodatkih 3 in 4). Če so potrebne druge meritve (glej 1.3 in 1.8.8), so lahko potrebna dodatna opazovanja.
1.8.6 Potomci
Najbolje je, da se potomci posameznega starša odstranijo in preštejejo vsakodnevno od pojava prvega zaroda, da ne bi jedli hrane, namenjene odraslim. Za namen te metode je treba prešteti samo število živih potomcev, vendar je treba zabeležiti prisotnost nedozorelih jajčec ali mrtvih potomcev.
1.8.7 Smrtnost
Smrtnost med starši je najbolje beležiti dnevno, vsaj ob časih, ko se štejejo potomci.
1.8.8 Drugi parametri
Čeprav je ta metoda namenjena predvsem ocenjevanju učinkov na razmnoževanje, so lahko tudi drugi vplivi v zadostni meri kvantificirani za statistično analizo. Meritve rasti so zelo zaželene, saj dajejo informacije o morebitnih subletalnih učinkih, ki so lahko bolj koristne od samih meritev razmnoževanja; priporočeno je merjenje dolžine staršev (t.j. dolžine telesa, razen analne osti) na koncu preskusa. Drugi parametri, ki se lahko izmerijo ali izračunajo, so čas do pojava prvega zaroda (in naslednjih zarodov), število in velikost zarodov na žival, število nedozorelih zarodov, prisotnost samcev ali efipijev in za populacijo značilna stopnja rasti.
1.8.9 Pogostost analitskih določitev in meritev
Koncentracijo kisika, temperaturo, trdoto in vrednosti pH je treba meriti vsaj enkrat tedensko v svežih in starih medijih, kontrolah in najvišjih koncentracijah preskusne snovi.
Med preskusom se v rednih časovnih presledkih določajo koncentracije preskusne snovi.
Pri semi-statičnih preskusih, pri katerih se pričakuje, da bo koncentracija preskusne snovi ostala znotraj ± 20 % nominalne vrednosti (t.j. znotraj območja 80–120 % – glej 1.4 in 1.8.4), je priporočeno, da se analizirajo vsaj najvišje in najnižje preskusne koncentracije, ko so sveže pripravljene, in ob eni od obnovitev v prvem tednu preskusa (t.j. analize je treba opraviti na vzorcu iste raztopine – ko je sveže pripravljena in ob obnovitvi). Te določitve naj se potem ponavljajo najmanj tedensko.
Pri preskusih, pri katerih se ne pričakuje, da bo koncentracija preskusne snovi ostala znotraj ± 20 % nominalne vrednosti, je treba analizirati vse preskusne koncentracije, ko so sveže pripravljene in ob obnovitvi. Vendar se lahko pri preskusih, pri katerih izmerjena začetna koncentracija preskusne snovi ni znotraj ± 20 % nominalne vrednosti, a se lahko zagotovijo zadostni dokazi, da so začetne koncentracije ponovljive in stabilne (t.j. znotraj območja 80–120 % začetnih koncentracij), se kemijske določitve v drugem in tretjem tednu preskusa lahko skrčijo na najvišje in najnižje preskusne koncentracije. V vseh primerih je treba določitev koncentracij preskusne snovi pred obnovitvijo izvesti samo za eno ponovitveno posodo pri vsaki preskusni koncentraciji.
Za pretočni preskus je ustrezen podoben režim vzorčenja kot je opisan za semi-statične preskuse (vendar v tem primeru ni merjenja „starih“ raztopin). Vseeno je priporočljivo povečati pogostost jemanja vzorcev v prvem tednu (npr. trije nizi meritev) za zagotovitev, da so preskusne koncentracije ostale stabilne. Pri tej vrsti preskusa se dnevno preverja pretok razredčila in preskusne snovi.
Če obstajajo dokazi, da je bila koncentracija preskusne snovi ves čas trajanja preskusa zadovoljivo znotraj ± 20 % nominalne ali izmerjene začetne koncentracije, lahko rezultati temeljijo na nominalni ali izmerjeni začetni vrednosti. Če je odmik od nominalne ali izmerjene začetne koncentracije večji od ± 20 %, je treba rezultate izraziti kot časovno tehtano sredino (glej Dodatek 5).
2. PODATKI IN POROČANJE
2.1 OBDELAVA REZULTATOV
Namen tega preskusa je določiti vpliv preskusne snovi na skupno število živih potomcev na starša, ki je ob koncu preskusa živ. Skupno število potomcev na starša se izračuna za vsako preskusno posodo (t.j. ponovitev). Če v kateri koli ponovitvi starš med preskusom pogine ali se zanj izkaže, da je samec, se ponovitev izključi iz analize. Analiza potem temelji na zmanjšanem številu ponovitev.
Za ocenitev LOEC in s tem NOEC za učinke kemikalije na sposobnost razmnoževanja je treba izračunati srednjo sposobnost razmnoževanja za ponovitve za vsako koncentracijo in standardni odklon ostanka združenih podatkov („pooled“), kar se lahko naredi s pomočjo analize variance (ANOVA). Srednjo vrednost za vsako koncentracijo je treba nato primerjati s srednjo vrednostjo kontrole s pomočjo ustrezne metode multiple primerjave. Koristna sta lahko Dunnettov in Williamsov test (14) (15) (16) (17). Treba je preveriti, ali drži predpostavka ANOVA o homogenosti variance. Priporočeno je, da se to naredi grafično, kot pa s formalnim preskusom značilnosti (18); primerna alternativa je izvedba Bartlettovega testa. Če ta predpostavka ne drži, je treba razmisliti o preoblikovanju podatkov za homogenizacijo varianc pred izvedbo ANOVA ali pa se izvede tehtana ANOVA. Treba je izračunati velikost učinka, zaznavnega z ANOVA (t.j. najmanjša značilna razlika), in o tem poročati.
Za ocenitev koncentracije, ki bi povzročila 50-odstotno zmanjšanje razmnoževalne sposobnosti (t.j. EC50), je treba primerno krivuljo, kot je logistična krivulja, prilagoditi podatkom s pomočjo statistične metode, kot je metoda najmanjših kvadratov. Krivulja je lahko parametrizirana, tako da je mogoče EC50 in njeno standardno napako oceniti neposredno. To zelo olajša izračun mej zaupanja za EC50. Razen če obstajajo dobri razlogi, da so boljše drugačne stopnje zaupanja, je treba navesti dvostranske 95-odstotne meje zaupanja. Najbolje je, če se postopek prilagajanja uporabi za ocenjevanje značilnosti neprilagojenosti. To se lahko naredi grafično ali z delitvijo vsote ostanka kvadratov na „komponente neprilagojenosti“ in „čiste napake“ ter izvedbo preskusa značilnosti za neprilagojenost. Ker imajo tretiranja, pri katerih je plodnost visoka, verjetno večjo varianco števila mladičev kot tretiranja, pri katerih je plodnost nizka, je treba razmisliti o tehtanju opaženih vrednosti, da bi se pokazale različne variance za različne tretirane skupine (za informacije o ozadju glej literaturo (18).
Pri analiziranju podatkov iz končnega krožnega preskusa (2) je bila logistična krivulja prilagojena s pomočjo naslednjega modela, čeprav je mogoče uporabiti tudi druge primerne modele:

pri čemer je:
|
Y |
= |
skupno število mladičev na starša, živega ob koncu preskusa (izračunano za vsako posodo) |
|
x |
= |
koncentracija snovi |
|
c |
= |
pričakovano število mladičev pri x = 0 |
|
x0 |
= |
EC50 populacije |
|
b |
= |
parameter nagiba |
Ta model bo verjetno primeren v mnogih primerih, vendar obstajajo preskusi, za katere ni ustrezen. Preveriti je treba veljavnost modela, kot je nakazano zgoraj. V nekaterih primerih je lahko ustrezen model hormeze, pri katerem nizke koncentracije povzročajo povečane učinke (19).
Oceniti je mogoče tudi druge koncentracije z učinkom, kot sta EC10 ali EC20, čeprav je morda bolje uporabiti drugačno parametrizacijo modela od tiste, uporabljene za ocenitev EC50.
2.2 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje:
2.2.1 Preskusna snov:
— fizikalno stanje in ustrezne fizikalno-kemijske lastnosti,
— identifikacijski podatki o kemikaliji, vključno s čistostjo.
2.2.2 Preskusne vrste:
— klon (ali je bil genetsko tipiziran), dobavitelj ali vir (če je znano) in uporabljeni pogoji gojenja. Če se ne uporabi vrsta Daphnia magna, je treba o tem poročati in to utemeljiti.
2.2.3 Preskusni pogoji:
— uporabljen preskusni postopek (npr. semi-statični ali pretočni, prostornina, obremenitev s številom vodnih bolh na liter),
— fotoperioda in jakost svetlobe,
— načrt preskusa (npr. število ponovitev, število staršev na ponovitev),
— podrobnosti o uporabljenem gojitvenem mediju,
— dodatki organskega materiala, če so uporabljeni, vključno s sestavo, virom, metodo priprave, TOC/KPK osnovnih pripravkov, oceno posledičnega TOC/KPK v preskusnem mediju,
— podrobne informacije o hranjenju, vključno s količino (v mg C/vodno bolho/dan) in razporedom (npr. vrsta hrane, pri algah vključno z imenom vrste in, če je znano, sevom, pogoji gojenja kulture),
— metoda priprave osnovne raztopine in pogostost obnavljanja (če je uporabljeno topilo ali disperzijsko sredstvo, ga je treba navesti, prav tako njegovo koncentracijo).
2.2.4 Rezultati
— rezultati kakršnih koli predhodnih študij obstojnosti preskusne snovi,
— nominalne preskusne koncentracije in rezultati vseh analiz za določanje koncentracije preskusne snovi v preskusnih posodah (glej primer podatkovnega lista v Dodatku 4); poročati je treba tudi o uspešnosti rekuperacije metode in o meji določanja,
— kakovost vode v preskusnih posodah (t.j. pH, temperatura in koncentracija raztopljenega kisika ter TOC in/ali KPK in trdota, kjer je ustrezno) (glej primer podatkovnega lista v Dodatku 3),
— popolna evidenca živih potomcev na vsakega starša (glej primer podatkovnega lista v Dodatku 3),
— število smrti pri starših in dan posameznih smrti (glej primer podatkovnega lista v Dodatku 3),
— koeficient variacije za plodnost kontrol (na osnovi skupnega števila živih potomcev na živega starša ob koncu preskusa),
— graf skupnega števila živih potomcev na ob koncu preskusa živega starša (za vsako ponovitev) v odvisnosti od koncentracije preskusne snovi,
— najnižja koncentracija z opaznim učinkom (LOEC) na razmnoževanje, vključno z opisom uporabljenega statističnega postopka in navedbo, velikosti učinka, ki je bil zaznan, ter koncentracija brez opaznega učinka (NOEC) na razmnoževanje; kjer je ustrezno, je treba poročati tudi o LOEC/NOEC za smrtnost staršev,
— kjer je ustrezno, ECx za razmnoževanje ter intervali zaupanja in graf prilagojenega modela („fitted model“), uporabljenega za njen izračun, nagib krivulje odmerek/odziv in njena standardna napaka,
— drugi opaženi biološki učinki ali meritve: poročajte o vseh drugih bioloških učinkih, ki so bili opaženi ali izmerjeni (npr. rast staršev), vključno z morebitno ustrezno utemeljitvijo,
— razlaga kakršnega koli odstopanja od preskusne metode.
3. LITERATURA
(1) OECD Test Guideline Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20–21 March 1993.
(2) OECD Environmental Health and Safety Publications. Series on Testing and Assessment No.6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997.
(3) Baird D.J., Barber J., Bradley M.C., Soares A.M.V.M. and Calow P. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, 257–265.
(4) Elendt B.P., (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25–33.
(5) EPA (1993). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohio.
(6) Vigano L., (1991) Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol.,47, 775–782.
(7) ASTM (1988). Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P.A., str. 20.
(8) Baird D.J., Soares A.M.V.M., Girling A., Barber J., Bradley M.C. and Calow P. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H.Lokke, H. Tyle & F. Bro-Rasmussen. Eds.), str. 144–148.
(9) Parkhurst B.R., Forte J.L. and Wright G.P. (1981). Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, 1–8.
(10) Cowgill U.M. and Milazzo D.P. (1990) The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), 185–196.
(11) Korshikov (1990). Pseudokirchneriella subcapitata Hindak, F-1990. Biologice Prace, 36, 209.
(12) Sims I.R., Watson S. and Holmes D. (1993). Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, 2053–2058.
(13) Sims I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, 459–466.
(14) Dunnett C.W., (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc, 50, 1096–1121.
(15) Dunnett C.W., (1964). New tables for multiple comparisons with a control. Biometrics, 20, 482–491.
(16) Williams D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103–117.
(17) Williams D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, 510–531.
(18) Draper N.R. and Smith H. (1981). Applied Regression Analysis, second edition, Wiley, N.Y.
(19) Brain P. and Cousens R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, 93–96.
(20) Wilson E.O. and Bossert, W.H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers.
(21) Poole R.W. (1974). An Introduction to quantitative Ecology. Mc Graw Hill Series in Population Biology, New York, str. 532.
(22) Meyer J.S., Ingersoll C.G., McDonald L.L. and Boyce M.S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, 1156–1166.
DODATEK 1
PRIPRAVA POPOLNOMA DEFINIRANIH MEDIJEV ELENDT M7 IN M4
Aklimatizacija na medija Elendt M7 in M4
Nekateri laboratoriji so imeli težave pri neposrednem prenosu vodnih bolh v medija M4 (1) in M7. Vendar je bilo doseženega nekaj uspeha s postopno prilagoditvijo, tj. selitvijo iz lastnega medija v 30-odstotni Elendt, nato v 60-odstotni Elendt in potem v 100-odstotnega. Za prilagoditev je lahko potreben do en mesec časa.
PRIPRAVA
Elementi v sledeh
Najprej se pripravijo ločene osnovne raztopine (I) posameznih elementov v sledeh v primerno čisti vodi, npr. deionizirani, destilirani ali izpostavljeni obratni osmozi. Iz teh različnih osnovnih raztopin (I) se pripravi druga enotna osnovna raztopina (II), ki vsebuje vse elemente v sledeh (sestavljena raztopina), tj.:
|
Osnovne raztopine I (posamezne snovi) |
Količina, dodana vodi mg/l |
Koncentr acija (glede na medij M4) (kratna) |
Za pripravo sestavljene osnovne raztopine II se vodi dodajo naslednje količine osnovne raztopine I ml/l |
|
|
M4 |
M7 |
|||
|
H3BO3 |
57 190 |
20 000 |
1,0 |
0,25 |
|
MnCl2 * 4 H2O |
7 210 |
20 000 |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000 |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000 |
1,0 |
0,25 |
|
SrCl2 * 6 H2O |
3 040 |
20 000 |
1,0 |
0,25 |
|
NaBr |
320 |
20 000 |
1,0 |
0,25 |
|
Na2MoO4 * 2 H2O |
1 260 |
20 000 |
1,0 |
0,25 |
|
CuCl2 * 2 H2O |
335 |
20 000 |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000 |
1,0 |
1,0 |
|
CoCl2 * 6 H2O |
200 |
20 000 |
1,0 |
1,0 |
|
KI |
65 |
20 000 |
1,0 |
1,0 |
|
Na2SeO3 |
43,8 |
20 000 |
1,0 |
1,0 |
|
NH4VO3 |
11,5 |
20 000 |
1,0 |
1,0 |
|
Na2EDTA * 2 H2O |
5 000 |
2 000 |
— |
— |
|
FeSO4 * 7 H2O |
1 991 |
2 000 |
— |
— |
|
Raztopini Na2EDTA in FeSO4 se pripravita ločeno, zlijeta se skupaj in takoj avtoklavirata. S tem nastane: |
||||
|
Raztopina 21 Fe-EDTA |
1 000-kratna |
20,0 |
5,0 |
|
Medija M4 in M7
Medija M4 in M7 se pripravita iz osnovne raztopine II, makronutrientov in vitaminov na naslednji način:
|
Količina, dodana vodi mg/l |
Koncentra cija (glede na medij M4) (kratna) |
Količina osnovne raztopine, dodane za pripravo medija ml/l |
||
|
M4 |
M7 |
|||
|
Osnovna raztopina II s kombiniranimi elementi v sledeh |
20 |
50 |
50 |
|
|
Osnovne raztopine makronutrientov (posamezna snov) |
||||
|
CaCl2 * 2 H2O |
293 800 |
1 000 |
1,0 |
1,0 |
|
MgSO4 * 7 H2O |
246 600 |
2 000 |
0,5 |
0,5 |
|
KCl |
58 000 |
10 000 |
0,1 |
0,1 |
|
NaHCO3 |
64 800 |
1 000 |
1,0 |
1,0 |
|
Na2SiO3 * 9 H2O |
50 000 |
5 000 |
0,2 |
0,2 |
|
NaNO3 |
2 740 |
10 000 |
0,1 |
0,1 |
|
KH2PO4 |
1 430 |
10 000 |
0,1 |
0,1 |
|
K2HPO4 |
1 840 |
10 000 |
0,1 |
0,1 |
|
Sestavljena osnovna raztopina vitaminov |
— |
10 000 |
0,1 |
0,1 |
|
Sestavljena osnovna raztopina vitaminov se pripravi z dodatkom 3 vitaminov v 1 liter vode, kot je prikazano spodaj: |
||||
|
Tiamin hidroklorid |
750 |
10 000 |
— |
— |
|
Cianokobalamin (B12) |
10 |
10 000 |
— |
— |
|
Biotin |
7,5 |
10 000 |
— |
— |
|
Sestavljena osnovna raztopina vitaminov se hrani zamrznjena v majhnih alikvotih. Vitamini se dodajo medijem tik pred uporabo. Opombe Da se pri pripravi celotnih medijev ne bi obarjale soli, se okoli 500–800 ml deionizirane vode dodajo alikvoti osnovnih raztopin in nato se razopina dopolni do 1 litra. Prva objava medija M4 je Elendt, B.P. (1990). Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25–33. |
||||
DODATEK 2
ANALIZA SKUPNEGA ORGANSKEGA OGLJIKA (TOC) IN IZDELAVA NOMOGRAMA ZA VSEBNOST TOC V HRANI IZ ALG
Priznano je, da se vsebnost ogljika v hrani iz alg navadno ne meri neposredno, temveč iz korelacij (t.j. nomogramov) z nadomestnimi meritvami, kot sta število celic alg ali absorpcija svetlobe.
TOC je bolje meriti z visokotemperaturno oksidacijo kot z UV ali persulfatno metodo (glej The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB).
Za izdelavo nomograma je treba alge ločiti od gojitvenega medija s centrifugiranjem, ki mu sledi resuspendiranje v destilirani vodi. Nadomestni parameter in koncentracija TOC za vsak vzorec se izmerita trikrat. Analizirati je treba negativne kontrole z destilirano vodo in izpeljati koncentracijo TOC iz koncentracije TOC v vzorcu alg.
Nomogram mora biti linearen v zahtevanem razponu koncentracij ogljika. Primeri so navedeni spodaj.
Opomba: Ti primeri se ne smejo uporabiti za pretvorbo; bistvenega pomena je, da laboratoriji pripravijo svoje lastne nomograme.


DODATEK 3
PRIMER PODATKOVNEGA LISTA ZA EVIDENTIRANJE OBNAVLJANJA MEDIJEV, PODATKOV FIZIKALNEGA/KEMIJSKEGA SPREMLJANJA, HRANJENJA, RAZMNOŽEVANJA VODNIH BOLH IN SMRTNOSTI PRI ODRASLIH
|
Poskus št.: |
Začetni podatki |
Klon: |
Medij: |
Vrstahrane: |
Preskusna snov: |
Nominalna koncentracija: |
||||||||||||||||||
|
Dan |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
||
|
Obnovitev medija (odkljukaj) |
||||||||||||||||||||||||
|
pH (1) |
nov |
|||||||||||||||||||||||
|
star |
||||||||||||||||||||||||
|
O2 mg/l (1) |
nov |
|||||||||||||||||||||||
|
star |
||||||||||||||||||||||||
|
Temperatura ( oC) (1) |
nov |
|||||||||||||||||||||||
|
star |
||||||||||||||||||||||||
|
Hranjenje (odkljukaj) |
||||||||||||||||||||||||
|
Št. živih potomcev (2) |
Skupaj |
|||||||||||||||||||||||
|
Posoda1 |
||||||||||||||||||||||||
|
2 |
||||||||||||||||||||||||
|
3 |
||||||||||||||||||||||||
|
4 |
||||||||||||||||||||||||
|
5 |
||||||||||||||||||||||||
|
6 |
||||||||||||||||||||||||
|
7 |
||||||||||||||||||||||||
|
8 |
||||||||||||||||||||||||
|
9 |
||||||||||||||||||||||||
|
10 |
||||||||||||||||||||||||
|
Skupaj |
||||||||||||||||||||||||
|
Kumulativna smtnost pri odraslih (3) |
||||||||||||||||||||||||
|
(1) Navedite, katera posoda je bila uporabljena za poskus. (2) Zabeležite smrt katere koli odrasle živali kot „M“ v ustreznem okvirčku. (3) Zabeležite abortiran zarod kot „AB“ v ustreznem okvirčku.u. |
||||||||||||||||||||||||
DODATEK 4
PRIMER PODATKOVNEGA LISTA ZA EVIDENTIRANJE REZULTATOV KEMIJSKE ANALIZE
(a) Izmerjene koncentracije
|
Nominalna konc. |
Vzorec 1. tedna |
Vzorec 2. tedna |
Vzorec 3. tedna |
|||
|
Svež |
Star |
Svež |
Star |
Svež |
Star |
|
(b) Izmerjene koncentracije kot odstotek nominalne vrednosti
|
Nominalna konc. |
Vzorec 1. tedna |
Vzorec 2. tedna |
Vzorec 3. tedna |
|||
|
Svež |
Star |
Svež |
Star |
Svež |
Star |
|
DODATEK 5
IZRAČUN ČASOVNO TEHTANE SREDINE
Časovno tehtana sredina
Ker se lahko koncentracija preskusne snovi v času med obnovitvami medija zniža, je treba razmisliti o tem, kakšne koncentracije izbrati kot reprezentativne za razpon koncentracij, ki so jim izpostavljene starševske vodne bolhe. Izbor mora temeljiti tako na bioloških kot statističnih vidikih. Če naj bi, na primer, na razmnoževanje najbolj vplivala najvišja koncentracija, ki so ji živali izpostavljene, je treba uporabiti najvišjo koncentracijo. Če pa velja, da je bolj pomemben akumuliran ali dolgodobni učinek toksične snovi, je bolj ustrezna povprečna koncentracija. V tem primeru je ustrezno uporabiti povprečje, ki je časovno tehtana srednja koncentracija, saj ta upošteva spreminjanje trenutne koncentracije v odvisnosti od časa.
Slika 1
Primer časovno tehtane sredine

Slika 1 prikazuje primer (poenostavljenega) preskusa, ki je trajal sedem dni, z obnovitvijo medija na dneve 0, 2 in 4.
Tanka cikcakasta črta predstavlja koncentracijo v odvisnosti od časa. Padec koncentracije naj bi sledil eksponentnemu procesu razpadanja.
Šest označenih točk predstavlja ugotovljene koncentracije, izmerjene na začetku in na koncu posameznega obdobja obnovitve.
Ravna debela črta kaže položaj časovno tehtane sredine.
Časovno tehtana sredina se izračuna tako, da je površina pod časovno tehtano sredino enaka površini pod krivuljo koncentracije. Izračun za zgornji primer je naveden v tabeli 1.
Tabela 1
Izračun časovno tehtane sredine
|
Obnovitev št. |
Dnevi |
Konc0 |
Konc1 |
Ln(Konc0) |
Ln(Konc1) |
Površina |
|
1 |
2 |
10,000 |
4,493 |
2,303 |
1,503 |
13,767 |
|
2 |
2 |
11,000 |
6,037 |
2,398 |
1,798 |
16,544 |
|
3 |
3 |
10,000 |
4,066 |
2,303 |
1,403 |
19,781 |
|
Skupaj dnevi: 7 |
Skupna površina |
50,091 |
||||
|
Časovno tehtana sredina |
7,156 |
|||||
|
Dnevi je število dni v obdobju obnovitve Konc0 je koncentracija, izmerjena na začetku posameznega obdobna obnovitve Konc1 je koncentracija, izmerjena na koncu posameznega obdobna obnovitve Ln(Konc0) je naravni logaritem Konc0 Ln(Koncl) je naravni logaritem Konc1 Površina je površina pod eksponentno krivuljo za posamezno obdobje obnovitve. Izračuna se po enačbi:
|
||||||
Časovno tehtana sredina je Skupna površina deljena s Skupaj dnevi.
Seveda je treba za preskus z razmnoževanjem vodnih bolh tabelo razširiti na 21 dni.
Jasno je, da pri beleženju opažanj samo na začetku in na koncu posameznega obdobja obnovitve ni mogoče potrditi, ali je proces razpadanja dejansko eksponenten. Pri drugačni krivulji bi prišlo do drugačnega izračuna za Površino. Vendar eksponenten proces razpadanja ni neverjeten in je verjetno najboljša krivulja, ki se jo da uporabiti v odsotnosti drugih informacij.
Potrebna pa je previdnost, če na koncu obdobja obnovitve kemijska analiza ne pokaže obstoja snovi. Če ni mogoče oceniti, kako hitro snov izgine iz raztopine, je nemogoče dobiti realistično površino pod krivuljo in tako je torej nemogoče dobiti sprejemljivo časovno tehtano sredino.
C.21 TALNI MIKROORGANIZMI: PRESKUS TRANSFORMACIJE DUŠIKA
1. METODA
Ta preskusna metoda ustreza metodi OECD TG 216 (2000).
1.1 UVOD
Ta preskusna metoda opisuje laboratorijsko metodo, namenjeno raziskovanju dolgoročnih učinkov kemikalij po enkratni izpostavljenosti na dejavnost talnih mikroorganizmov pri transformaciji dušika. Preskus načeloma temelji na priporočilih Evropske in sredozemske organizacije za varstvo rastlin (1). Vendar so bile upoštevane tudi druge smernice, na primer smernice Nemškega zveznega zavoda za biologijo (2), Ameriške agencije za varstvo okolja (3) SET AC (4) in Mednarodne organizacije za standardizacijo (5). Na delavnici OECD o izbiri tal/usedline, ki je bila leta 1995 v Belgiratu v Italiji (6), je bil dosežen dogovor o številu in vrstah tal za uporabo v tem preskusu. Priporočila za odvzemanje, obravnavanje in shranjevanje vzorcev tal temeljijo na napotkih ISO (7) in priporočilih delavnice iz Belgirata. Pri ocenjevanju in vrednotenju toksičnih lastnosti preskusnih snovi, je lahko potrebno določanje učinkov na mikrobno dejavnost v tleh, npr. kadar so potrebni podatki o potencialnih stranskih učinkih izdelkov za zaščito pridelka na talno mikrofloro ali kadar se pričakuje izpostavljenost mikroorganizmov kemikalijam, ki niso izdelki za zaščito pridelka. Preskus transformacije dušika se izvaja za določitev učinkov teh kemikalij na talno mikrofloro. Če se preskušajo agrokemikalije (npr. izdelki za zaščito pridelka, gnojila, gozdarske kemikalije), se izvedejo preskusi transformacije dušika in transformacije ogljika. Če se preskušajo kemikalije, ki niso agrokemikalije, zadošča preskus transformacije dušika. Če pa spadajo vrednosti preskusa transformacije dušika E50 za take kemikalije v izbor nitrifikacijskih inhibitorjev, ki so na voljo na tržišču (npr. nitrapirin), se lahko za pridobitev dodatnih informacij izvede preskus transformacije ogljika.
Tla so sestavljena iz živih in neživih sestavin, ki obstajajo v sestavljenih in heterogenih zmeseh. Mikroorganizmi imajo pomembno vlogo pri razgradnji in transformaciji organskih snovi v rodovitnih tleh in številne vrste prispevajo k različnim vidikom rodovitnosti tal. Vsaka dolgoročna motnja teh biokemičnih procesov lahko potencialno vpliva na kroženje hranilnih snovi, to pa lahko spremeni rodovitnost tal. Transformacija ogljika in dušika se pojavlja v vseh rodovitnih vrstah tal. Čeprav se mikrobne združbe, ki so odgovorne za te procese, razlikujejo od ene do druge vrste tal, so poti transformacije v bistvu enake.
Ta opisana preskusna metoda je namenjena odkrivanju dolgoročnih škodljivih učinkov snovi na proces transformacije dušika v aerobnih površinskih vrstah tal. Preskusna metoda omogoča tudi oceno učinkov snovi na transformacijo ogljika s talno mikrofloro. Nastajanje nitrata sledi razgradnji vezi med ogljikom in dušikom. Zato je, če so v tretiranih in kontrolnih tleh ugotovljene enake stopnje nastajanja nitrata, velika verjetnost, da so glavne poti razgradnje ogljika nedotaknjene in delujejo. Substrat, izbran za preskušanje (zdrob iz lucerne v prahu), ima ugodno razmerje ogljik-dušik (navadno med 12/1 in 16/1). Zato se pomanjkanje ogljika med preskusom zmanjša in če so mikrobne združbe zaradi kemikalije poškodovane, se lahko obnovijo v 100 dneh.
Preskusi, na katerih je bila razvita ta preskusna metoda, so bili prvenstveno namenjeni za snovi, pri katerih je mogoče predvideti količino, ki bo prišla v tla. Tak primer so izdelki za zaščito pridelka, pri katerih je stopnja uporabe na področju znana. Pri agrokemikalijah zadošča preskušanje dveh odmerkov, ki ustrezata pričakovani ali napovedani stopnji uporabe. Agrokemikalije se lahko preskušajo kot aktivne sestavine (a.i.) ali kot formulirani pripravki. Vendar preskus ni omejen na agrokemikalije. S spreminjanjem obojega, količine preskusne snovi, ki se uporabi v tleh, in načina vrednotenja podatkov, se lahko preskus uporabi tudi za kemikalije, pri katerih ni znana količina, ki naj bi prišla v tla. Tako se s kemikalijami, ki niso agrokemikalije, določijo učinki serije koncentracij pri transformaciji dušika. Podatki iz teh preskusov se uporabijo za pripravo krivulje odziva na odmerek in izračun vrednosti ECx, kjer je x opredeljen % učinka.
1.2 OPREDELITVE POJMOV
Transformacija dušika: je dokončna razgradnja organske snovi, ki vsebuje dušik, z mikroorganizmi preko procesa amonifikacije in nitrifikacije do anorganskega končnega produkta nitrata.
EC x (efektivna koncentracija): je koncentracija preskusne snovi v tleh, ki daje x-odstotno inhibicijo transformacije dušika v nitrat.
EC 50 (srednja efektivna koncentracija): je koncentracija preskusne snovi v tleh, ki daje 50-odstotno (50 %) inhibicijo transformacije dušika v nitrat.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Presejana tla se dopolnijo z rastlinskim zdrobom v prahu in bodisi tretirajo s preskusno snovjo ali pustijo netretirana (kontrolna). Če se preskušajo agrokemikalije, se priporoča najmanj dve preskusni koncentraciji, izbereta pa se glede na največjo pričakovano koncentracijo na področju. Po 0, 7, 14 dnevih in 28 dnevih inkubacije se z ustreznim topilom ekstrahira vzorce tretiranih in kontrolnih tal in določi količina nitrata v ekstraktih. Stopnja nastajanja nitrata v tretiranih vzorcih se primerja s stopnjo v kontrolnih vzorcih in izračuna odstotek odklona tretiranih od kontrolnih. Vsi preskusi trajajo najmanj 28 dni. Če so 28. dan razlike med tretiranimi in netretiranimi tlemi enake ali večje od 25 %, se merjenje nadaljuje do največ 100 dni. Če se preskušajo kemikalije, ki niso agrokemikalije, se v vzorce tal doda serija koncentracij preskusne snovi in po 28 dnevih inkubacije se izmerijo količine nitrata, ki nastane v tretiranih in kontrolnih vzorcih. Z regresijskim modelom se analizirajo rezultati preskusov z več koncentracijami in izračunajo vrednosti ECx (to je EC50, EC25 in/ali EC10). Glej opredelitve pojmov.
1.5 VELJAVNOST PRESKUSA
Vrednotenje rezultatov preskusa z agrokemikalijami temelji na razmeroma majhnih razlikah (povprečna vrednost ± 25 %) med koncentracijami nitrata v kontrolnih in tretiranih vzorcih tal, tako da lahko velike razlike v kontrolah vodijo v napačne rezultate. Zato morajo biti razlike med ponovljenimi kontrolnimi vzorci manjše od ± 15 %.
1.6 OPIS PRESKUSNE METODE
1.6.1 Naprave
Za preskuse se uporabljajo posode iz kemijsko inertnega materiala. Imeti morajo ustrezno prostornino v skladu s postopkom, ki se uporablja za inkubacijo tal, se pravi za inkubacijo v razsutem stanju ali kot serija posameznih vzorcev tal (glej oddelek 1.7.1.2). Paziti je treba, da je med preskusom izguba vode čim manjša in da se omogoči izmenjava plinov (npr. posode za preskus so lahko pokrite s perforirano polietilensko folijo). Kadar se preskušajo hlapne snovi, je treba uporabiti zatesnjene, nepredušno zaprte posode. Te naj bodo take velikosti, da je približno ena četrtina prostornine napolnjena z vzorcem tal.
Uporablja se standardna laboratorijska oprema, ki vključuje:
— napravo za stresanje: mehanski mešalnik ali enakovredno opremo,
— centrifugo (3 000 g) ali napravo za filtriranje (z uporabo filtrirnega papirja, ki ne vsebuje nitrata),
— instrument za analizo nitrata z ustrezno občutljivostjo in ponovljivostjo.
1.6.2 Izbira in število tal
Uporabljajo se samo ena tla. Priporočene lastnosti tal so:
— vsebnost peska: ne manj kakor 50 % in ne več kakor 75 %,
— pH: 5,5–7,5,
— vsebnost organskega ogljika: 0,5–1,5 %,
— mikrobno biomaso je treba izmeriti (8) (9) in njena vsebnost ogljika naj bo vsaj 1 % skupnega organskega ogljika tal.
V večini primerov predstavljajo tla s temi lastnostmi najslabše možno stanje, ker je adsorpcija preskusne kemikalije najmanjša in razpoložljivost za mikrofloro največja. Zato navadno niso potrebni preskusi z drugimi vrstami tal. Kljub temu je lahko v nekaterih primerih, npr. kadar je glavni del pričakovane uporabe preskusne snovi v posebnih tleh, na primer kislih gozdnih, ali pri elektrostatično nabitih kemikalijah, potrebna uporaba dodatnih tal.
1.6.3 Odvzemanje in shranjevanje vzorcev tal
1.6.3.1 Odvzemanje
Na voljo morajo biti podrobne informacije o preteklosti mesta vzorčenja, kjer se odvzemajo tla za preskus. Podrobnosti vključujejo točno lokacijo, pokritost z vegetacijo, datume uporabe izdelkov za zaščito pridelka, uporabo organskih in anorganskih gnojil, dodatke bioloških materialov ali naključno kontaminacijo. Mesto, izbrano za odvzemanje tal, naj omogoča dolgotrajno uporabo. Primerni so trajni pašniki, polja z letnimi posevki žit (razen koruze) ali gosto posejanim zelenim gnojilom. Izbrano mesto vzorčenja najmanj eno leto pred jemanjem vzorcev ne sme biti tretirano z izdelki za zaščito pridelka. Tudi organska gnojila se ne smejo uporabljati najmanj šest mesecev. Sprejemljiva je samo uporaba mineralnega gnojila, kadar je v skladu z zahtevami posevka, vzorcev tal pa se ne sme vzeti še najmanj tri mesece po uporabi gnojila. Uporabi tal, tretiranih z gnojili, ki imajo znane biocidne učinke (npr. kalcijev cianamid), se je treba izogibati.
Vzorčenju se je treba izogibati med dolgimi obdobji (daljšimi od 30 dni) suše ali poplave in takoj po njih. Pri zoranih tleh se vzorci jemljejo iz globine od 0 do 20 cm globine. Pri traviščih (pašnikih) ali drugih tleh, ki dolgo niso preorana (najmanj eno sezono), je največja globina vzorčenja lahko malo več kakor 20 cm (npr. do 25 cm).
Vzorce tal je treba prenašati v posodah in v temperaturnih razmerah, ki zagotavljajo, da se prvotne lastnosti tal bistveno ne spremenijo.
1.6.3.2 Shranjevanje
Najbolje je uporabiti tla, na sveže odvzeta na terenu. Če se shranjevanju v laboratoriju ne da izogniti, se lahko vzorci tal shranjujejo največ tri mesece v temi pri 4 ± 2 oC. Med shranjevanjem tal morajo biti zagotovljeni aerobni pogoji. Če se tla odvzemajo na območjih, ki so zamrznjena najmanj tri mesece na leto, je treba razmisliti o shranitvi za šest mesecev pri –18 oC do –22 oC. Mikrobna biomasa shranjenih tal se izmeri pred vsakim poskusom in ogljika v biomasi mora biti najmanj 1 % skupne vsebnosti organskega ogljika v tleh (glej oddelek 1.6.2).
1.6.4 Ravnanje s tlemi in priprava na preskus
1.6.4.1 Predhodna inkubacija
Če so bila tla shranjena (glej oddelek 1.6.3.2), se priporoča predhodna inkubacija za čas od 2 do 28 dni. Temperatura in vsebnost vlage tal med predhodno inkubacijo naj bosta podobni kakor med preskusom (glej oddelka 1.6.4.2 in 1.7.1.3).
1.6.4.2 Fizikalno-kemijske lastnosti
Iz tal se ročno odstranijo večji objekti (npr. kamni, deli rastlin itd.), nato se vlažno presejejo brez odvečnega sušenja na velikost delcev, ki so manjši ali enaki 2 mm. Vsebnost vlage v vzorcu tal je treba prilagoditi z destilirano ali deionizirano vodo na vrednost med 40 % in 60 % največje zmogljivosti zadrževanja vode.
1.6.4.3 Dopolnitev z organskim substratom
Tla je treba dopolniti z ustreznim organskim substratom, npr. zdrobom iz travnato zelene lucerne v prahu (glavna sestavina: Medicago sativa) v razmerju C/N med 12/1 in 16/1. Priporočeno razmerje lucerna/tla je 5 g lucerne na kilogram tal (suha teža).
1.6.5 Priprava preskusne snovi za aplikacijo na tla
Preskusna snov se normalno uporablja z nosilcem. Nosilec je lahko voda (za snovi, topne v vodi) ali inertna trdna snov, kot je droben kremenov pesek (velikost delcev: 0,1–0,5 mm). Tekočih nosilcev, ki niso voda (npr. organska topila, kot sta aceton, kloroform), se je treba izogibati, ker lahko škodijo mikroflori. Če se kot nosilec uporablja pesek, se lahko prelije s preskusno snovjo, raztopljeno ali suspendirano v ustreznem topilu. V takih primerih je treba topilo pred mešanjem s tlemi odstraniti z izhlapevanjem. Za optimalno razporeditev preskusne snovi v tleh, se priporoča razmerje 10 g peska na kilogram tal (suhe teže). Kontrolni vzorci se tretirajo z enakovredno količino vode in/ali samo s kremenovim peskom.
Pri preskušanju hlapnih kemikalij se je treba, kolikor je mogoče, izogniti izgubam in poskusiti zagotoviti homogeno porazdelitev v tleh (npr. preskusno snov je treba vbrizgati v tla na več mestih).
1.6.6 Preskusne koncentracije
Če se preskušajo agrokemikalije, je treba uporabiti najmanj dve koncentraciji. Nižja koncentracija mora odražati najmanj največjo količino, za katero se pričakuje, da bi jo tla dosegla v praktičnih razmerah, višja koncentracija pa naj bo mnogokratnik nižje. Koncentracije preskusne snovi, dodane v tla, se izračunajo ob predpostavki enotne vključitve v globino 5 cm in gostote tal v razsutem stanju 1,5. Za agrokemikalije, ki se aplicirajo neposredno na tla ali za kemikalije, pri katerih je mogoče napovedati količino, ki pride v tla, so priporočene preskusne koncentracije največje predvidene koncentracije v okolju (PKO) in petkratniki te koncentracije. Snovi, za katere se pričakuje, da bodo v eni sezoni večkrat aplicirane na tla, je treba preskusiti pri koncentracijah, dobljenih z množenjem PKO z največjim pričakovanim številom aplikacij. Vendar zgornja preskušena koncentracija ne sme presegati desetkratnika največje posamične stopnje aplikacije. Če se preskušajo kemikalije, ki niso agrokemikalije, se uporabi geometrična serija najmanj petih koncentracij. Preskušene koncentracije naj zajemajo razpon, ki je potreben za določitev vrednosti ECx.
1.7 IZVEDBA PRESKUSA
1.7.1 Pogoji izpostavljenosti
1.7.1.1 Tretiranje in kontrola
Če se preskušajo agrokemikalije, se tla razdelijo v tri dele enake teže. Dva dela se zmešata z nosilcem, ki vsebuje proizvod, tretji pa se zmeša z nosilcem brez proizvoda (kontrola). Priporočajo se najmanj tri ponovitve s tretiranimi in netretiranimi tlemi. Če se preskušajo kemikalije, ki niso agrokemikalije, se tla razdelijo v šest delov enake teže. Pet vzorcev se zmeša z nosilcem, ki vsebuje preskusno snov, in šesti vzorec se zmeša z nosilcem brez kemikalije. Priporočajo se po tri ponovitve za tretirane vzorce in kontrolo. Paziti je treba, da se zagotovi homogeno razporeditev preskusne snovi v tretiranih vzorcih tal. Med mešanjem se je treba izogibati stiskanju tal in nastajanju kep.
1.7.1.2 Inkubacija vzorcev tal
Inkubacija vzorcev tal se lahko izvede na dva načina: kot vzorci tretiranih in netretiranih tal v razsutem stanju ali kot serija posameznih podvzorcev vsakih tretiranih in netretiranih tal enake velikosti. Vendar pa se lahko, kadar se preskušajo hlapne snovi, preskus izvede samo s serijo posameznih podvzorcev tal. Kadar se tla inkubirajo v razsutem stanju, se pripravijo velike količine tretiranih in netretiranih tal, podvzorci za analizo pa se jemljejo po potrebi med preskusom. Količina, ki se na začetku pripravi za vsako tretiranje in kontrolo, je odvisna od velikosti podvzorcev, števila za analizo uporabljenih ponovitev in pričakovanega največjega števila ponovitev vzorčenja. Tla, inkubirana v razsutem stanju, je treba pred podvzorčenjem temeljito premešati. Kadar se tla inkubirajo kot serija posameznih vzorcev tal, se vsak vzorec tretiranih in netretiranih tal v razsutem stanju razdeli na zahtevano število podvzorcev in ti se uporabljajo po potrebi. Pri preskusih, kjer se lahko pričakuje več kakor dve vzorčenji, je treba pripraviti dovolj vzorcev, ob upoštevanju vseh ponovitev in vseh vzorčenj. Najmanj tri ponovitve vzorcev tal za preskus je treba inkubirati v aerobnih pogojih (glej oddelek 1.7.1.1). Pri vseh preskusih je treba uporabljati ustrezne posode z dovolj velikim volumnom nad vzorcem, da se prepreči razvoj anaerobnih pogojev. Vendar pa se lahko, kadar se preskušajo hlapne snovi, preskus izvede samo s serijo posameznih podvzorcev tal.
1.7.1.3 Preskusni pogoji in trajanje
Preskus se izvaja v temi pri sobni temperaturi 20 ± 2 oC. Vsebnost vlage v vzorcih tal se med preskusom vzdržuje med 40 % in 60 % največje zmogljivosti zadrževanja vode v tleh (glej oddelek 1.6.4.2) v razponu ± 5 %. Po potrebi se lahko doda destilirana, deionizirana voda.
Najkrajše trajanje preskusov je 28 dni. Če se preskušajo agrokemikalije, se primerjajo stopnje nastajanja nitrata v tretiranih in kontrolnih vzorcih. Če se te na 28. dan razlikujejo za več kakor 25 %, se preskus nadaljuje, dokler ni dosežena razlika, ki je enaka ali manjša od 25 % ali do največ 100 dni, kar je prej. Pri kemikalijah, ki niso agrokemikalije, se preskus prekine po 28 dneh. Na 28. dan se določijo količine nitrata v vzorcih tretiranih in kontrolnih tal in izračunajo vrednosti ECx.
1.7.2 Vzorčenje in analiza tal
1.7.2.1 Načrt za vzorčenje tal
Če se preskušajo agrokemikalije, se vzorci tal 0., 7., 14. in 28. dan analizirajo na nitrat. Če se zahteva podaljšan preskus, je treba nadaljnje meritve opraviti v 14-dnevnih presledkih po 28. dnevu.
Če se preskušajo kemikalije, ki niso agrokemikalije, se uporabi najmanj pet preskusnih koncentracij, vzorci tal pa se analizirajo na nitrat na začetku (dan 0) in na koncu obdobja izpostavljenosti (28 dni). Če se zdi potrebno, se lahko doda še vmesno merjenje, npr. 7. dan. Podatki, dobljeni na 28. dan, se uporabljajo za določitev vrednosti ECx za kemikalijo. Po želji se lahko podatki o kontrolnih vzorcih iz dneva 0 uporabijo za poročanje o začetni količini nitrata v tleh.
1.7.2.2 Analiza vzorcev tal
Količina nitrata, ki nastane v vsaki tretirani in kontrolni ponovitvi, se določi ob vsakem vzorčenju. Nitrat se ekstrahira iz tal s stresanjem vzorcev z ustreznim ekstrakcijskim topilom, npr. z 0,1 M raztopino kalijevega klorida. Priporoča se razmerje 5 ml raztopine KCl na gram suhe teže tal. Da bi optimizirali ekstrakcijo, posode, v katerih so vzorci tal in ekstrakcijska raztopina, ne smejo biti več kakor do polovice polne. Mešanice se 60 minut stresajo s 150 obrati na minuto. Zmesi se centrifugirajo ali filtrirajo in tekoče faze se analizirajo na nitrat. Tekoči ekstrakti brez delcev se lahko pred analizo shranijo pri minus 20 ± 5 oC za čas do šest mesecev.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Če so preskusi izvedeni z agrokemikalijami, je treba zabeležiti količino nitrata, nastalega v vsaki ponovitvi vzorca tal, in podati povprečne vrednosti vseh ponovitev v tabelarični obliki. Stopnje transformacije dušika se ovrednotijo z ustreznimi in splošno sprejetimi statističnimi metodami (npr. F-preskus, 5 % raven pomembnosti). Količine nastalega nitrata so izražene v mg nitrata/kg suhe teže tal/dan. Stopnja nastajanja nitrata pri vsakem tretiranju se primerja s kontrolo in izračuna odstotek odstopanja od kontrole.
Če so preskusi izvedeni s kemikalijami, ki niso agrokemikalije, se določi količina nitrata, ki nastane v vsaki ponovitvi in pripravi krivulja odziva na odmerek za oceno vrednosti ECx. Količine nitrata (to je mg nitrata/kg suhe teže tal), ugotovljene v tretiranih vzorcih po 28 dneh se primerjajo s količinami, ugotovljenimi v kontroli. Iz teh podatkov se izračuna % vrednosti inhibicije za vsak preskus koncentracije. Ti odstotki se potem glede na koncentracijo in statistične postopke uporabijo za izračun vrednosti ECx. Intervali zaupanja (p = 0,95) za izračunane ECx so določeni tudi z uporabo standardnih postopkov (10) (11) (12).
Preskusne snovi, ki vsebujejo velike količine dušika, lahko prispevajo h količinam nitrata, ki nastanejo med preskusom. Če se te snovi preskusijo pri visoki koncentraciji (npr. kemikalije, za katere se pričakuje, da bodo uporabljene v ponovljenih aplikacijah), je v preskus treba vključiti ustrezne kontrole (to je tla plus preskusno snov, vendar brez rastlinskega zdroba). Podatki iz teh kontrol se morajo upoštevati pri izračunih ECx.
2.2 RAZLAGA REZULTATOV
Kadar se ocenjujejo rezultati iz preskusov z agrokemikalijami in je razlika med stopnjami nastalih nitratov med nižjim tretiranjem (to je največjo predvideno koncentracijo) in kontrolo pri katerem koli vzorčenju po 28. dnevu enaka ali manjša od 25 %, se lahko oceni, da proizvod nima dolgoročnega vpliva na transformacijo dušika v tleh. Kadar se vrednotijo rezultati iz preskusov s kemikalijami, ki niso agrokemikalije, se uporabijo vrednosti EC50, EC25 in/ali EC10.
3 POROČANJE
Poročilo o preskusu mora vsebovati naslednje informacije:
Popolna identifikacija uporabljenih tal, vključno z:
— geografsko oznako mesta (zemljepisno širino, zemljepisno dolžino),
— informacijami o preteklosti mesta preskusa (pokritost z vegetacijo, uporaba izdelkov za zaščito pridelkov, uporaba gnojil, naključna kontaminacija itd.),
— vrsto rabe (npr. kmetijsko zemljišče, gozd itd.),
— globino vzorčenja (cm),
— vsebnostjo peska/mulja/gline ( % suhe teže),
— pH (v vodi),
— organsko vsebnostjo ogljika ( % suhe teže),
— vsebnostjo dušika ( % suhe teže),
— začetno koncentracijo nitrata (mg nitrata/kg suhe teže),
— kationsko izmenjalno kapaciteto (mmol/kg),
— mikrobno biomaso glede na odstotke skupnega organskega ogljika,
— sklici na metode, uporabljene za določanje posameznih parametrov,
— vsemi informacijami v zvezi z odvzemanjem in shranjevanjem vzorcev tal,
— podrobnostmi o predhodni inkubaciji tal, če je bila.
Preskusna snov:
— fizikalno stanje in ustrezne fizikalno-kemijske lastnosti,
— kemijske identifikacijske podatke, kadar je ustrezno, vključno s strukturno formulo, čistostjo (odstotek aktivne sestavine v izdelkih za zaščito pridelka), vsebnostjo dušika.
Substrat:
— vir substrata,
— sestavo (zdrob iz lucerne, zdrob iz travnato zelene lucerne),
— vsebnost ogljika, dušika ( % suhe teže),
— velikost presejanih delcev (mm).
Preskusni pogoji:
— podatke o dopolnitvi tal z organskim substratom,
— število koncentracij uporabljene preskusne kemikalije in, kadar je primerno, utemeljitev izbranih koncentracij,
— podatke o aplikaciji preskusne snovi na tla,
— inkubacijsko temperaturo,
— vsebnost vlage v tleh na začetku preskusa in med njim,
— uporabljeno metodo inkubacije tal (v razsutem stanju ali kot serija posameznih podvzorcev),
— število ponovitev,
— število vzorčenj,
— uporabljeno metodo za ekstrakcijo nitrata iz tal.
Rezultati:
— analitični postopek in opremo, uporabljeno za analizo nitrata,
— tabelarične podatke, vključno s posameznimi in srednjimi vrednostmi meritev nitrata,
— razliko med ponovitvami s tretiranimi in kontrolnimi vzorci,
— razlage popravkov izračunov, če je ustrezno,
— odstotek razlik v stopnjah nastajanja nitrata pri vsakem vzorčenju ali, če je primerno, vrednost EC50 s 95-odstotno mejo zaupanja, drugo ECx (EC25 ali EC10) z intervalom zaupanja in graf krivulje odziva na odmerek,
— statistično obdelavo rezultatov,
— vse informacije in opažanja, koristne za razlago rezultatov preskusa.
4. LITERATURA
(1) EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1–16, 1994.
(2) BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1–1 (2nd eds., 1990).
(3) EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
(4) SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SET AC-Europe, Brussels.
(5) ISO/DIS 14238 (1995). Soil Quality – Determination of Nitrogen Mineralisation and Nitrification in Soils and the Influence of Chemicals on these Processes. Technical Committee ISO/TC 190/SC 4: Soil Quality – Biological Methods.
(6) OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18–20 January 1995.
(7) ISO 10381-6 (1993). Soil quality – Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
(8) ISO 14240-1 (1997). Soil quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method.
(9) ISO 14240-2 (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method.
(10) Litchfield, J.T. and Wilcoxon F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99–113.
(11) Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
(12) Finney, D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK.
C.22 TALNI MIKROORGANIZMI: PRESKUS TRANSFORMACIJE OGLJIKA
1. METODA
Ta metoda ustreza metodi OECD TG 217 (2000).
1.1 UVOD
Ta preskusna metoda opisuje laboratorijsko metodo, namenjeno raziskovanju potencialnih dolgoročnih učinkov enkratne izpostavljenosti izdelkov za zaščito pridelka in morebitnih drugih kemikalij na dejavnost talnih mikroorganizmov pri transformaciji ogljika. Preskus načeloma temelji na priporočilih Evropske in sredozemske organizacije za varstvo rastlin (1). Vendar so bile upoštevane tudi druge smernice, na primer smernice Nemškega zveznega zavoda za biologijo (2), Ameriške agencije za varstvo okolja (3) in SET AC (4). Na delavnici OECD o izbiri tal/usedline, ki je bila leta 1995 v Belgiratu v Italiji (5), je bil dosežen dogovor o številu in vrstah tal za uporabo v tem preskusu. Priporočila za odvzemanje, obravnavanje in shranjevanje vzorcev tal temeljijo na napotkih ISO (6) in priporočilih delavnice iz Belgirata.
Pri ocenjevanju in vrednotenju toksičnih lastnosti preskusnih snovi, je lahko potrebno določanje učinkov na mikrobno dejavnost v tleh, npr. kadar so potrebni podatki o potencialnih stranskih učinkih izdelkov za zaščito pridelka na talno mikrofloro ali kadar se pričakuje izpostavljenost mikroorganizmov kemikalijam, ki niso izdelki za zaščito pridelka. Preskus transformacije ogljika se izvaja za določitev učinkov teh kemikalij na talno mikrofloro. Če se preskušajo agrokemikalije (npr. izdelki za zaščito pridelka, gnojila, gozdarske kemikalije), se izvedejo preskusi transformacije ogljika in transformacije dušika. Če se preskušajo kemikalije, ki niso agrokemikalije, zadošča preskus transformacije dušika. Če pa spadajo vrednosti preskusa transformacije dušika E50 za take kemikalije v izbor nitrifikacijskih inhibitorjev, ki so na voljo na tržišču (npr. nitrapirin), se lahko preskus transformacije ogljika izvede za pridobitev dodatnih informacij.
Tla so sestavljena iz živih in neživih sestavin, ki obstajajo v sestavljenih in heterogenih zmeseh. Mikroorganizmi imajo pomembno vlogo pri razgradnji in transformaciji organskih snovi v rodovitnih tleh in številne vrste prispevajo k različnim vidikom rodovitnosti tal. Vsaka dolgoročna motnja teh biokemičnih procesov lahko potencialno vpliva na kroženje hranilnih snovi, to pa lahko spremeni rodovitnost tal. Transformacija ogljika in dušika se pojavlja v vseh rodovitnih vrstah tal. Čeprav se mikrobne združbe, ki so odgovorne za te procese, razlikujejo od ene do druge vrste tal, so poti transformacije v bistvu enake.
Ta preskusna metoda je namenjena odkrivanju dolgoročnih škodljivih učinkov snovi na proces transformacije ogljika v aerobnih površinskih vrstah tal. Preskus je občutljiv na spremembe velikosti in dejavnosti mikrobnih združb, ki so odgovorne za transformacijo ogljika, ker so te združbe odvisne od poudarjene kemikalije in pomanjkanja ogljika. Uporabijo se peščena tla z malo organskih snovi. Ta tla se tretirajo s preskusno snovjo in inkubirajo v pogojih, ki omogočajo hitro mikrobiološko presnovo. V teh pogojih se viri razpoložljivega ogljika v tleh hitro praznijo. To povzroča pomanjkanje ogljika, ki ubija mikrobne celice in povzroča mrtvilo in/ali spomlacijo. Če teče preskus več kakor 28 dni, se lahko vsota teh reakcij izmeri v kontrolah (netretiranih tleh) kot progresivna izguba presnovno aktivne mikrobne biomase (7). Če je biomasa v tleh s poudarjenim ogljikom v teh pogojih preskusa prizadeta zaradi navzočnosti kemikalije, se morda ne vrne na enako raven kot kontrola. Zato motnje, ki jih povzroči preskusna snov kadar koli med preskusom, pogosto trajajo do konca preskusa.
Preskusi, na katerih je bila razvita ta preskusna metoda, so bili prvenstveno namenjeni za snovi, pri katerih je mogoče predvideti količino, ki bo prišla v tla. Tak primer so izdelki za zaščito pridelka, pri katerih je stopnja uporabe na področju znana. Pri agrokemikalijah zadošča preskušanje dveh odmerkov, ki ustrezata pričakovani ali napovedani stopnji uporabe. Agrokemikalije se lahko preskušajo kot aktivne sestavine (a.i.) ali kot formulirani pripravki. Vendar preskus ni omejen na kemikalije s predvidenimi koncentracijami v okolju. S spreminjanjem obojega, količine preskusne snovi, ki se uporabi v tleh, in načina vrednotenja podatkov, se lahko preskus uporabi tudi za kemikalije, pri katerih ni znana količina, ki naj bi prišla v tla. Tako se s kemikalijami, ki niso agrokemikalije, določijo učinki serije koncentracij pri transformaciji ogljika. Podatki iz teh preskusov se uporabijo za pripravo krivulje odziva na odmerek in izračun vrednosti ECx, kjer je x opredeljen % učinka.
1.2 OPREDELITVE POJMOV
Transformacija ogljika: je razgradnja organske snovi z mikroorganizmi, pri kateri nastane anorganski končni produkt ogljikov dioksid.
EC x (efektivna koncentracija): je koncentracija preskusne snovi v tleh, ki daje x-odstotno inhibicijo transformacije ogljika v ogljikov dioksid.
EC 50 (srednja efektivna koncentracija): je koncentracija preskusne snovi v tleh, ki daje 50-odstotno inhibicijo transformacije ogljika v ogljikov dioksid.
1.3 REFERENČNE SNOVI
Jih ni.
1.4 PRINCIP PRESKUSNE METODE
Presejana tla se bodisi tretirajo s preskusno snovjo ali pustijo netretirana (kontrolna). Če se preskušajo agrokemikalije, se priporoča najmanj dve preskusni koncentraciji, izbereta pa se glede na največjo pričakovano koncentracijo na področju. Po 0, 7, 14 dnevih in 28 dnevih inkubacije se tretirane in kontrolne vzorce tal pomeša z glukozo, stopnje respiracije, ki jo povzroči glukoza, pa se merijo 12 zaporednih ur. Stopnje respiracije so izražene kot sproščeni ogljikov dioksid (mg ogljikovega dioksida/kg suhih tal/uro) ali kot porabljeni kisik (mg kisika/kg tal/uro). Povprečna stopnja respiracije v vzorcih tretiranih tal se primerja s stopnjo v kontrolni in se izračuna odstotek odstopanja tretiranih tal od kontrolnih. Vsi preskusi trajajo najmanj 28 dni. Če so 28. dan razlike med tretiranimi in netretiranimi tlemi enake ali večje od 25 %, se merjenje v 14-dnevnih presledkih nadaljuje do največ 100 dni. Če se preskušajo kemikalije, ki niso agrokemikalije, se v vzorce tal doda serija koncentracij preskusne snovi in po 28 dnevih se izmerijo stopnje respiracije, ki jih povzroči glukoza (to je povprečna količina nastalega ogljikovega dioksida ali porabljenega kisika). Z regresijskim modelom se analizirajo rezultati preskusov s serijo koncentracij in izračunajo vrednosti ECx (to je EC50, EC25 in/ali EC10). Glej opredelitve pojmov.
1.5 VELJAVNOST PRESKUSA
Vrednotenje rezultatov preskusa z agrokemikalijami temelji na razmeroma majhnih razlikah (povprečna vrednost ± 25 %) med sproščenim ogljikovim dioksidom in porabljenim kisikom v kontrolnih in tretiranih vzorcih tal, tako da lahko velike razlike v kontrolah vodijo v napačne rezultate. Zato morajo biti razlike med ponovljenimi kontrolnimi vzorci manjše od ± 15 %.
1.6 OPIS PRESKUSNE METODE
1.6.1 Naprave
Za preskuse se uporabljajo posode iz kemijsko inertnega materiala. Imeti morajo ustrezno prostornino v skladu s postopkom, ki se uporablja za inkubacijo tal, se pravi za inkubacijo v razsutem stanju ali kot serija posameznih vzorcev tal (glej oddelek 1.7.1.2). Paziti je treba, da je med preskusom izguba vode čim manjša in da se omogoči izmenjava plinov (npr. posode za preskus so lahko pokrite s perforirano polietilensko folijo). Kadar se preskušajo hlapne snovi, je treba uporabiti zatesnjene, nepredušno zaprte posode. Te naj bodo take velikosti, da je približno ena četrtina prostornine napolnjena z vzorcem tal.
Za določitev respiracije, ki jo povzroči glukoza, so potrebni inkubacijski sistemi in instrumenti za merjenje produkcije ogljikovega dioksida ali porabe kisika. Primeri takih sistemov in instrumentov so v literaturi (8) (9) (10) (11).
1.6.2 Izbira in število tal
Uporabljajo se samo ena tla. Priporočene lastnosti tal so:
— vsebnost peska: ne manj kakor 50 % in ne več kakor 75 %,
— pH: 5,5–7,5,
— vsebnost organskega ogljika: 0,5–1,5 %,
— mikrobno biomaso je treba izmeriti (12) (13) in njena vsebnost ogljika naj bo vsaj 1 % skupnega organskega ogljika tal.
V večini primerov predstavljajo tla s temi lastnostmi najslabše možno stanje, ker je adsorpcija preskusne kemikalije najmanjša in razpoložljivost za mikrofloro največja. Zato navadno niso potrebni preskusi z drugimi vrstami tal. Kljub temu je lahko v nekaterih primerih, npr. kadar je glavni del pričakovane uporabe preskusne snovi v posebnih tleh, na primer kislih gozdnih tleh, ali pri elektrostatično nabitih kemikalijah, treba nadomestiti dodatna tla.
1.6.3 Odvzemanje in shranjevanje vzorcev tal
1.6.3.1 Odvzemanje
Na voljo morajo biti podrobne informacije o preteklosti mesta vzorčenja, kjer se odvzemajo tla za preskus. Podrobnosti vključujejo točno lokacijo, pokritost z vegetacijo, datume uporabe izdelkov za zaščito pridelka, uporabo organskih in anorganskih gnojil, dodatke bioloških materialov ali naključno kontaminacijo. Mesto, izbrano za odvzemanje tal, naj omogoča dolgotrajno uporabo. Primerni so trajni pašniki, polja z letnimi posevki žit (razen koruze) ali gosto posejanim zelenim gnojilom. Izbrano mesto vzorčenja ne sme biti tretirano z izdelki za zaščito pridelka najmanj eno leto pred jemanjem vzorcev. Tudi organska gnojila se ne smejo uporabljati najmanj šest mesecev. Sprejemljiva je samo uporaba mineralnega gnojila, kadar je v skladu z zahtevami posevka, vzorcev tal pa se ne sme vzeti še najmanj tri mesece po uporabi gnojila. Uporabi tal, tretiranih z gnojili, ki imajo znane biocidne učinke (npr. kalcijev cianamid), se je treba izogibati.
Vzorčenju se je treba izogibati med dolgimi obdobji (daljšimi od 30 dni) suše ali poplave in takoj po njih. Pri zoranih tleh se vzorci jemljejo iz globine od 0 do 20 cm globine. Pri traviščih (pašnikih) ali drugih tleh, ki dolgo niso preorana (najmanj eno sezono), je največja globina vzorčenja lahko malo več kakor 20 cm (npr. do 25 cm). Vzorce tal je treba prenašati v posodah in v temperaturnih razmerah, ki zagotavljajo, da se prvotne lastnosti tal bistveno ne spremenijo.
1.6.3.2 Shranjevanje
Najbolje je uporabiti tla, na sveže odvzeta na terenu. Če se shranjevanju v laboratoriju ne da izogniti, se lahko vzorec tal shranjuje največ tri mesece v temi pri 4 ± 2 oC. Med shranjevanjem tal morajo biti zagotovljeni aerobni pogoji. Če se tla odvzamejo na območjih, ki so zamrznjena najmanj tri mesece na leto, je treba razmisliti o shranitvi za šest mesecev pri –18 oC do –22 oC. Mikrobna biomasa shranjenih tal se izmeri pred vsakim poskusom in ogljika v biomasi mora biti najmanj 1 % skupne vsebnosti organskega ogljika v tleh (glej oddelek 1.6.2).
1.6.4 Ravnanje s tlemi in priprava na preskus
1.6.4.1 Predhodna inkubacija
Če so bila tla shranjena (glej oddelka 1.6.4.2 in 1.7.1.3), se priporoča predhodna inkubacija za čas od 2 do 28 dni. Temperatura in vsebnost vlage tal med predhodno inkubacijo naj bosta podobni kakor med preskusom (glej oddelka 1.6.4.2 and 1.7.1.3).
1.6.4.2 Fizikalno-kemijske lastnosti
Iz tal se ročno odstranijo večji objekti (npr. kamni, deli rastlin itd.), nato se vlažno presejejo brez odvečnega sušenja na velikost delcev, ki so manjši ali enaki 2 mm. Vsebnost vlage v vzorcu tal je treba prilagoditi z destilirano ali deionizirano vodo na vrednost med 40 % in 60 % največje zmogljivosti zadrževanja vode.
1.6.5 Priprava preskusne snovi za aplikacijo na tla
Preskusna snov se normalno uporablja z nosilcem. Nosilec je lahko voda (za snovi, topne v vodi) ali inertna trdna snov, kot je droben kremenov pesek (velikost delcev: 0,1–0,5 mm). Tekočih nosilcev, ki niso voda (npr. organska topila, kot sta aceton, kloroform), se je treba izogibati, ker lahko škodijo mikroflori. Če se kot nosilec uporablja pesek, se lahko prelije s preskusno snovjo, raztopljeno ali suspendirano v ustreznem topilu. V takih primerih je treba topilo pred mešanjem s tlemi odstraniti z izhlapevanjem. Za optimalno razporeditev preskusne snovi v tleh, se priporoča razmerje 10 g peska na kilogram tal (suhe teže). Kontrolni vzorci se tretirajo z enakovredno količino vode in/ali samo s kremenovim peskom.
Pri preskušanju hlapnih kemikalij se je treba izogibati izgubam in poskusiti zagotoviti homogeno porazdelitev v tleh (npr. preskusno snov je treba vbrizgati v tla na več mestih).
1.6.6 Preskusne koncentracije
Če se preskušajo izdelki za zaščito pridelka ali druge kemikalije s predvidenimi koncentracijami v okolju, je treba uporabiti najmanj dve koncentraciji. Nižja koncentracija mora odražati najmanj največjo količino, za katero se pričakuje, da bi jo tla dosegla v praktičnih razmerah, višja koncentracija pa naj bo mnogokratnik nižje. Koncentracije preskusne snovi, dodane v tla, se izračunajo ob predpostavki enotne vključitve v globino 5 cm in gostote tal v razsutem stanju 1,5. Za agrokemikalije, ki se aplicirajo neposredno na tla ali za kemikalije, pri katerih je mogoče napovedati količino, ki pride v tla, so priporočene najvišje preskusne koncentracije predvidenih koncentracij v okolju (PKO) in petkratniki te koncentracije. Snovi, za katere se pričakuje, da bodo v eni sezoni večkrat aplicirane na tla, je treba preskusiti pri koncentracijah, dobljenih z množenjem PKO z največjim pričakovanim številom aplikacij. Vendar zgornja preskušena koncentracija ne sme presegati desetkratnika največje posamične stopnje aplikacije.
Če se preskušajo kemikalije, ki niso agrokemikalije, se uporabi geometrična serija najmanj petih koncentracij. Preskušene koncentracije naj zajemajo razpon, ki je potreben za določitev vrednosti ECx.
1.7 IZVEDBA PRESKUSA
1.7.1 Pogoji izpostavljenosti
1.7.1.1 Tretiranje in kontrola
Če se preskušajo agrokemikalije, se tla razdelijo v tri dele enake teže. Dva dela se zmešata z nosilcem, ki vsebuje proizvod, tretji pa se zmeša z nosilcem brez proizvoda (kontrola). Priporočajo se najmanj tri ponovitve s tretiranimi in netretiranimi tlemi. Če se preskušajo kemikalije, ki niso agrokemikalije, se tla razdelijo v šest delov enake teže. Pet vzorcev se zmeša z nosilcem, ki vsebuje preskusno snov, in šesti vzorec se zmeša z nosilcem brez kemikalije. Priporočajo se po tri ponovitve za tretirane vzorce in kontrolo. Paziti je treba, da se zagotovi homogeno razporeditev preskusne snovi v tretiranih vzorcih tal. Med mešanjem se je treba izogibati stiskanju tal in nastajanju kep.
1.7.1.2 Inkubacija vzorcev tal
Inkubacija vzorcev tal se lahko izvede na dva načina: kot vzorci tretiranih in netretiranih tal v razsutem stanju ali kot serija posameznih podvzorcev vsakih tretiranih in netretiranih tal enake velikosti. Vendar pa se lahko, kadar se preskušajo hlapne snovi, preskus izvede samo s serijo posameznih podvzorcev tal. Kadar se tla inkubirajo v razsutem stanju, se pripravijo velike količine tretiranih in netretiranih tal, podvzorci za analizo pa se jemljejo po potrebi med preskusom. Količina, ki se na začetku pripravi za vsako tretiranje in kontrolo, je odvisna od velikosti podvzorcev, števila za analizo uporabljenih ponovitev in pričakovanega največjega števila ponovitev vzorčenja. Tla, inkubirana v razsutem stanju, je treba pred podvzorčenjem temeljito premešati. Kadar se tla inkubirajo kot serija posameznih vzorcev tal, se vsak vzorec tretiranih in netretiranih tal v razsutem stanju razdeli na zahtevano število podvzorcev in ti se izkoriščajo po potrebi. Pri preskusih, kjer se lahko pričakuje več kakor dve vzorčenji, je treba pripraviti dovolj vzorcev, ob upoštevanju vseh ponovitev in vseh vzorčenj. Najmanj tri ponovitve vzorcev tal za preskus je treba inkubirati v aerobnih pogojih (glej oddelek 1.7.1.1). Pri vseh preskusih je treba uporabljati ustrezne posode z dovolj velikim volumnom nad vzorcem, da se prepreči razvoj anaerobnih pogojev. Vendar pa se lahko, kadar se preskušajo hlapne snovi, preskus izvede samo s serijo posameznih podvzorcev tal.
1.7.1.3 Preskusni pogoji in trajanje
Preskus se izvaja v temi pri sobni temperaturi 20 ± 2 oC. Vsebnost vlage v vzorcih tal se med preskusom vzdržuje med 40 % in 60 % največje zmogljivosti zadrževanja vode v tleh (glej oddelek 1.6.4.2) v razponu ± 5 %. Po potrebi se lahko doda destilirana, deionizirana voda.
Najkrajše trajanje preskusov je 28 dni. Če se preskušajo agrokemikalije, se primerjajo količine sproščenega ogljikovega dioksida ali porabljenega kisika v tretiranih in kontrolnih vzorcih. Če se te na 28. dan razlikujejo za več kakor 25 %, se preskus nadaljuje, dokler ni dosežena razlika, ki je enaka ali manjša od 25 % ali do največ 100 dni, kar je prej. Če se preskušajo kemikalije, ki niso agrokemikalije, se preskus prekine po 28 dneh. Na 28. dan se določijo količine sproščenega ogljikovega dioksida ali porabljenega kisika v vzorcih tretiranih in kontrolnih tal in izračunajo vrednosti ECx.
1.7.2 Vzorčenje in analiza tal
1.7.2.1 Načrt za vzorčenje tal
Če se preskušajo agrokemikalije, se vzorci tal na 0., 7., 14. in 28. dan analizirajo glede stopnje respiracije, ki jo povzroča glukoza. Če je potreben podaljšan preskus, se nadaljnje meritve opravijo v 14-dnevnih presledkih po 28. dnevu.
Če se preskušajo kemijalije, ki niso agrokemikalije, se uporabi in analizira vsaj pet preskusnih koncentracij in vzorcev tal glede respiracije, ki jo povzroči glukoza, na začetku (dan 0) in na koncu obdobja izpostavljenosti (28 dni). Če se zdi potrebno, se lahko doda še vmesno merjenje, npr. 7. dan. Podatki, dobljeni na 28. dan, se uporabljajo za določitev vrednosti ECx za kemikalijo. Po potrebi se lahko podatki o kontrolnih vzorcih iz dneva 0 uporabijo za oceno začetnih količin presnovno dejavne mikrobne biomase v tleh (12).
1.7.2.2 Merjenje stopenj respiracije, ki jo povzroči glukoza
Stopnja respiracije, ki jo povzroči glukoza v vsaki tretirani in kontrolni ponovitvi, se določi ob vsakem vzorčenju. Vzorci tal se pomešajo z zadostno količino glukoze, da izzove takojšnji največji odziv respiracije. Količina glukoze, ki je potrebna za sprožanje največjega respiratornega odziva iz danih tal, se lahko določi s predhodnim preskusom s serijo koncentracij glukoze (14). Vendar za peščena tla z 0,5–1,5 % organskega ogljika navadno zadošča 2 000 mg do 4 000 mg glukoze na kg suhe teže tal. Glukoza se lahko zmelje v prah s čistim kremenovim peskom (10 g peska/kg suhe teže tal) in homogeno pomeša s tlemi.
Vzorci tal, dopolnjeni z glukozo, se inkubirajo v primerni napravi za merjenje stopenj respiracije, bodisi neprekinjeno, vsako uro ali vsaki dve uri (glej oddelek 1.6.1) pri 20 ± 2 oC. Sproščeni ogljikov dioksid ali porabljeni kisik se meri 12 zaporednih ur in meritve se morajo začeti čim prej, to je 1 ali 2 uri po dopolnitvi z glukozo. Izmeri se skupna količina sproščenega ogljikovega dioksida ali porabljenega kisika v 12 urah in določi srednja stopnja respiracije.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Če se preskušajo agrokemikalije, je treba zabeležiti sproščeni ogljikov dioksid ali porabljeni kisik v vsakem ponovljenem vzorcu tal in v tabelarični obliki podati povprečne vrednosti vseh ponovitev. Rezultati se ovrednotijo z ustreznimi in splošno sprejetimi statističnimi metodami (npr. F-preskus, 5 % raven pomembnosti). Stopnje respiracije, ki jo povzroči glukoza, so izražene v mg ogljikovega dioksida/kg suhe teže tal/uro ali mg kisika/suho težo tal/uro. Povprečna stopnja nastajanja ogljikovega dioksida ali povprečna stopnja porabe kisika v vsakem tretiranem vzorcu se primerja s stopnjo porabe v kontroli in izračuna odstotek odstopanja od kontrole.
Če so preskusi izvedeni s kemikalijami, ki niso agrokemikalije, se določi količina sproščenega ogljikovega dioksida ali porabljenega kisika v vsaki ponovitvi in pripravi krivulja odziva na odmerek za oceno vrednosti ECx. Stopnje respiracije, ki jih povzroči glukoza (to je mg ogljikovega dioksida/kg suhe teže tal/uro ali mg kisika/suho težo tal/uro), ugotovljene v tretiranih vzorcih po 28 dnevih, se primerjajo s tistimi, ki so ugotovljene v kontroli. Iz teh podatkov se izračuna % vrednosti inhibicije za vsak preskus koncentracije. Ti odstotki se glede na koncentracijo in statistične postopke uporabijo za izračun vrednosti ECx. Intervali zaupanja (p = 0,95) za izračunane ECx so določeni tudi z uporabo standardnih postopkov (15) (16) (17).
2.2 RAZLAGA REZULTATOV
Kadar se ocenjujejo rezultati iz preskusov z agrokemikalijami in je razlika med stopnjami respiracije med nižjim tretiranjem (to je največjo predvideno koncentracijo) in kontrolo pri katerem koli vzorčenju po 28. dnevu enaka ali manjša od 25 %, se lahko oceni, da proizvod nima dolgoročnega vpliva na transformacijo ogljika v tleh. Kadar se vrednotijo rezultati iz preskusov s kemikalijami, ki niso agrokemikalije, se uporabijo vrednosti EC50, EC25 in/ali EC10.
3 POROČANJE
POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje informacije:
Popolna identifikacija uporabljenih tal, vključno z:
— geografsko oznako mesta (zemljepisno širino, zemljepisno dolžino),
— informacijami o preteklosti mesta preskusa (pokritost z vegetacijo, uporaba izdelkov za zaščito pridelkov, uporaba gnojil, naključna kontaminacija itd.),
— vrsto rabe (npr. kmetijsko zemljišče, gozd itd.),
— globino vzorčenja (cm),
— vsebnostjo peska/mulja/gline ( % suhe teže),
— pH (v vodi),
— organsko vsebnostjo ogljika ( % suhe teže),
— vsebnostjo dušika ( % suhe teže),
— kationsko izmenjalno kapaciteto (mmol/kg),
— začetno mikrobno biomaso glede na odstotke skupnega organskega ogljika,
— sklici na metode, uporabljene za določanje posameznih parametrov,
— vsemi informacijami v zvezi z odvzemanjem in shranjevanjem vzorcev tal,
— podrobnostmi o predhodni inkubaciji tal, če je bila.
Preskusna snov:
— fizikalno stanje in ustrezne fizikalno-kemijske lastnosti,
— kemijske identifikacijske podatke, kadar je ustrezno, vključno s strukturno formulo, čistostjo (odstotek aktivne sestavine v izdelkih za zaščito pridelka), vsebnostjo dušika.
Preskusni pogoji:
— podatke o dopolnitvi tal z organskim substratom,
— število koncentracij uporabljene preskusne kemikalije in, kadar je primerno, utemeljitev izbranih koncentracij,
— podatke o aplikaciji preskusne snovi na tla,
— inkubacijsko temperaturo,
— vsebnost vlage v tleh na začetku preskusa in med njim,
— uporabljeno metodo inkubacije tal (v razsutem stanju ali kot serija posameznih podvzorcev),
— število ponovitev,
— število vzorčenj.
Rezultati:
— metodo in opremo, uporabljeno za merjenje stopenj respiracije,
— tabelarične podatke, vključno s posameznimi in srednjimi vrednostmi količin ogljikovega dioksida ali kisika,
— razliko med ponovitvami s tretiranimi in kontrolnimi vzorci,
— razlage popravkov izračunov, če je ustrezno,
— odstotek razlik v stopnjah respiracije, povzročene z glukozo, pri vsakem vzorčenju ali, če je primerno, vrednost EC50 s 95 odstotno mejo zaupanja, drugo ECx (EC25 ali EC10) z intervalom zaupanja in graf krivulje odziva na odmerek,
— statistično obdelavo rezultatov, po potrebi,
— vse informacije in opažanja, koristne za razlago rezultatov preskusa.
4. LITERATURA
(1) EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1–16, 1994.
(2) BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Pl ant Protection Products, VI, 1–1 (2nd eds., 1990).
(3) EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
(4) SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brussels.
(5) OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18–20 January 1995.
(6) ISO 10381-6 (1993). Soil quality – Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
(7) Anderson, J.P.E. (1987). Handling and Storage of Soils for Pesticide Experiments, in „Pesticide Effects on Soil Microflora“. Eds. L. Somerville and M.P. Greaves, Chap. 3: 45–60.
(8) Anderson, J.P.E. (1982). Soil Respiration, in „Methods of Soil Analysis – Part 2: Chemical and Microbiological Properties“. Agronomy Monograph No 9. Eds. A.L. Page, R.H. Miller and D.R. Keeney. 41: 831–871.
(9) ISO 11266-1. (1993). Soil Quality – Guidance on Laboratory Tests for Biodegradation in Soil: Part 1. Aerobic Conditions.
(10) ISO 14239 (1997E). Soil Quality – Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions.
(11) Heinemeye, r O., Insam, H., Kaiser, E.A, and Walenzik, G. (1989). Soil microbial biomass and respiration measurements; an automated technique based on infrared gas analyses. Plant and Soil, 116: 77–81.
(12) ISO 14240-1 (1997). Soil quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method.
(13) ISO 14240-2 (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method.
(14) Malkomes, H.-P. (1986). Einfluß von Glukosemenge auf die Reaktion der Kurzzeit-Atmung im Boden Gegeniiber Pflanzenschutzmitteln, Dargestellt am Beispiel eines Herbizide. (Influence of the Amount of Glucose Added to the Soil on the Effect of Pesticides in Short-Term Respiration, using a Herbicide as an Example). Nachrichtenbl. Deut. Pflanzenschutzd., Braunschweig, 38: 113–120.
(15) Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99–113.
(16) Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
(17) Finney D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK.
C.23 AEROBNA IN ANAEROBNA TRANSFORMACIJA V TLEH
1. METODA
Ta preskusna metoda ustreza metodi OECD TG 307 (2002).
1.1 UVOD
Ta preskusna metoda temelji na obstoječih smernicah (1) (2) (3) (4) (5) (6) (7) (8) (9). Metoda, opisana v tej preskusni metodi, je namenjena ovrednotenju aerobne in anaerobne transformacije kemikalij v tleh. Izvajajo se poskusi za določitev (i) stopnje transformacije preskusne snovi in (ii) narave in stopenj nastajanja in zmanjševanja produktov transformacije, ki so jim lahko izpostavljene rastline in talni organizmi. Take študije so potrebne za kemikalije, ki se nanašajo neposredno na tla ali za katere je verjetno, da bodo prišle v talno okolje. Rezultati teh laboratorijskih študij se lahko uporabijo tudi za razvoj protokolov vzorčenja in analiz za študije na sorodnih področjih.
Aerobne in anaerobne študije z eno vrsto tal navadno zadoščajo za ovrednotenje poti transformacije (8) (10) (11). Stopnje transformacije je treba določiti še v najmanj treh dodatnih vzorcih tal (8) (10).
Na delavnici OECD o izbiri tal/usedline, ki je bila leta 1995 v Belgiratu v Italiji (10), je bil dosežen dogovor predvsem o številu in vrstah tal za uporabo v tem preskusu. Vrste preskušanih tal morajo biti reprezentativne za okoljske razmere, kjer se bo pojavila uporaba ali sproščanje. Na primer kemikalije, ki se lahko sproščajo v subtropskih do tropskih podnebjih, se morajo preskušati na ferasolih ali nitosolih (sistem FAO). Na delavnici so bila dana tudi priporočila v zvezi z odvzemanjem, obravnavanjem in shranjevanjem vzorcev tal, ki temeljijo na napotkih ISO (15). Ta metoda obravnava tudi uporabo riževih (namakalnih, poplavljenih) tal.
1.2 OPREDELITVE POJMOV
Preskusna snov: katera koli snov, bodisi osnovna zmes ali ustrezni produkti transformacije.
Produkti transformacije: vse snovi, ki so posledica biotskih ali abiotskih transformacijskih reakcij preskusne snovi, vključno s CO2 in produkti, ki so v vezanih ostankih.
Vezani ostanki: „vezani ostanki“ predstavljajo spojine v tleh, rastlinske ali živalske, ki vztrajajo v matrici v obliki osnovne snovi ali njenega(ih) metabolita(ov)/produktov transformacije po ekstrakciji. Ekstrakcijska metoda ne sme bistveno spremeniti samih spojin ali strukture matrice. Narava vezi se lahko delno pojasni z ekstrakcijskimi metodami, ki spreminjajo matrico, in z visoko razvitimi analitskimi tehnikami. Do sedaj so bile, na primer, na ta način odkrite kovalentne ionske in sorptivne vezi. Na splošno nastajanje vezanih ostankov znatno zmanjša biološko dostopnost in biološko razpoložljivost (12) (prikrojeno po IUPAC-u 1984 (13)).
Aerobna transformacija: reakcije, ki se pojavljajo v navzočnosti molekularnega kisika (14).
Anaerobna transformacija: reakcije, ki se pojavljajo v odsotnosti molekularnega kisika (14).
Tla: so mešanica mineralnih in organskih kemičnih sestavin, slednje vsebujejo spojine z visoko vsebnostjo ogljika in dušika in z veliko molsko maso, ki jih poživljajo majhni (večinoma mikro-) organizmi. Tla se lahko obdelujejo v dveh stanjih:
(a) v neoviranem, kakor so se razvila s časom, z značilnimi plastmi različnih vrst tal;
(b) oviranem, kakor jih navadno najdemo na ornih zemljiščih ali kakor se pojavljajo, kadar se vzorci jemljejo s kopanjem in se uporablja ta preskusna metoda (14).
Mineralizacija: je popolna razgradnja organske spojine v CO2 in H2O v aerobnih razmerah in CH4, CO2 in H2O v anaerobnih razmerah. V smislu te preskusne metode, kjer se uporablja spojina z oznako 14C, mineralizacija pomeni obsežno razgradnjo, v kateri se označen ogljikov atom oksidira s sproščanjem ustrezne količine 14CO2 (14).
Razpolovna doba: t0,5 je čas, potreben za 50 %-no transformacijo preskusne snovi, kadar lahko transformacijo opišemo kot kinetiko prvega reda; razpolovna doba ni odvisna od koncentracije.
Čas razgradnje DT 50 : je čas, v katerem se koncentracija preskusne snovi zmanjša za 50 %; je drugačen od razpolovne dobe t0,5, ko transformacija ne sledi kinetiki prvega reda.
Čas razgradnje DT 75 : je čas, v katerem se koncentracija preskusne snovi zmanjša za 75 %.
Čas razgradnje DT 90 : je čas, v katerem se koncentracija preskusne snovi zmanjša za 90 %.
1.3 REFERENČNE SNOVI
Referenčne snovi se uporabljajo za opis in/ali določitev produktov transformacije s spektroskopsko in kromatografsko metodo.
1.4 UPORABNOST PRESKUSA
Metoda se uporablja za vse kemijske snovi (brez oznake ali z radioaktivno oznako), za katere je na voljo dovolj natančna in občutljiva analitska metoda. Uporablja se za rahlo hlapne, nehlapne, vodotopne ali v vodi netopne spojine. Preskus naj se ne uporablja za kemikalije v tleh, ki so lahko hlapne (npr. fumiganti, organska topila) in se tako ne morejo zadrževati v tleh za poskusne pogoje tega preskusa.
1.5 PODATKI O PRESKUSNI SNOVI
Za merjenje stopnje transformacije se lahko uporabi neoznačena ali označena preskusna snov. Označeni material je potreben za preučevanje poti transformacije in za vzpostavitev masne bilance. Priporoča se oznaka 14C, vendar je lahko koristna tudi uporaba drugih izotopov, na primer C, N, H, P. Če je to mogoče, naj se oznaka namesti na najstabilnejši del(e) molekule ( 36 ). Čistost preskusne snovi naj bo vsaj 95 %.
Pred izvajanjem preskusa o aerobni in anaerobni transformaciji v tleh, naj bodo na voljo naslednje informacije o preskusni snovi:
(a) topnost v vodi (metoda A.6);
(b) topnost v organskih topilih;
(c) tlak pare (metoda A.4) in Henryjeva konstanta;
(d) porazdelitveni koeficient n-oktanol/voda (metoda A.8);
(e) kemijska stabilnost v temi (hidroliza) (metoda C.7);
(f) pKa, če je molekula nagnjena k dodajanju ali odvzemanju protonov [Smernica OECD 112] (16).
Druge uporabne informacije lahko vključujejo podatke o toksičnosti preskusne snovi na talne mikroorganizme [metodi preskušanja C.21 in C.22] (16).
Na voljo morajo biti analitske metode (vključno z metodami ekstrakcije in očiščenja) za količinsko opredelitev in določitev preskusne snovi in njenih produktov transformacije.
1.6 PRINCIP PRESKUSNE METODE
Vzorci tal se tretirajo s preskusno snovjo in inkubirajo v temi v bučkah biometričnega tipa ali v pretočnih sistemih v nadzorovanih laboratorijskih razmerah (pri stalni temperaturi in vlažnosti tal). Po ustreznih časovnih presledkih se vzorci tal ekstrahirajo in analizirajo se osnovna snov in produkti transformacije. Tudi hlapni produkti se zberejo za analizo z ustreznimi absorpcijskimi pripomočki. Z uporabo materiala z oznako 14C se lahko izmerijo različne stopnje mineralizacije preskusne snovi z zajemanjem sproščenega 14CO2 in ugotovi se masna bilanca, vključno z nastajanjem talnih vezanih ostankov.
1.7 MERILA KAKOVOSTI
1.7.1 Izkoristek
Ekstrakcija in analiza najmanj dvojnih vzorcev tal takoj po dodajanju preskusne snovi da prvi prikaz ponovljivosti analitske metode in izenačenosti postopka uporabe za preskusno snov. Izkoristki poznejših stopenj poskusov so podani z ustreznimi masnimi bilancami. Izkoristki so v razponu od 90 % do 110 % pri označenih kemikalijah (8) in od 70 % do 110 % pri neoznačenih kemikalijah (3).
1.7.2 Ponovljivost in občutljivost analitske metode
Ponovljivost analitske metode (brez začetne učinkovitosti ekstrakcije) za količinsko določitev preskusne snovi in proizvodov transformacije se lahko preveri z dvojno analizo istega ekstrakta tal, ki je inkubiran dovolj dolgo, da nastajajo proizvodi transformacije.
Meja detekcije analitske metode za preskusno snov in za proizvode transformacije mora biti najmanj 0,01 mg· kg-1 tal (kot preskusne snovi) ali 1 % uporabljenega odmerka, kar je manj. Opredeliti je treba tudi mejo količinske opredelitve.
1.7.3 Točnost podatkov transformacije
Regresijska analiza koncentracij preskusne snovi v funkciji časa daje ustrezne informacije o zanesljivosti krivulje transformacije in omogoča izračun intervala zaupanja za razpolovne dobe (v primeru psevdo kinetike prvega reda) ali vrednosti DT50 in, če je primerno, vrednosti DT75 in DT90.
1.8 OPIS PRESKUSNE METODE
1.8.1 Oprema in kemijski reagenti
Inkubacijski sistemi so sestavljeni iz statičnih zaprtih sistemov ali ustreznih pretočnih sistemov (7) (17). Primera ustrezne pretočne naprave za inkubacijo tal in bučke biometričnega tipa sta prikazana na slikah 1 in 2. Obe vrsti inkubacijskih sistemov imata prednosti in omejitve (7) (17).
Potrebna je standardna laboratorijska oprema in zlasti naslednje:
— instrumenti za analizo, na primer oprema GLC, HPLC, TLC, vključno z ustreznimi sistemi detekcije za analiziranje radioaktivno označenih ali neoznačenih snovi ali inverzno metodo izotopskega redčenja,
— instrumenti za prepoznavanje (npr. MS, GC-MS, HPLC-MS, NMR itd.),
— tekočinski scintilacijski števec,
— oksidacijsko sredstvo za izgorevanje radioaktivnega materiala,
— centrifuga,
— naprave za ekstrakcijo (na primer centrifugirne epruvete za hladno ekstrakcijo in naprava Soxhlet za kontinuirano ekstrakcijo pod refluksom),
— instrumenti za koncentriranje raztopin in ekstraktov (npr. rotacijski evaporator),
— vodna kopel,
— mehanska naprava za mešanje (npr. stroj za gnetenje, rotacijski mešalnik).
Uporabljeni kemični reagenti vključujejo na primer:
— NaOH, analitsko čist, 2 mol· dm-3 ali drugo ustrezno bazo (npr. KOH, etanolamin),
— H2SO4, analitsko čisto, 0,05 mol· dm-3,
— etilen glikol, analitsko čist,
— trdne absorpcijske materiale, na primer natrijevo sol in poliuretanske čepe,
— organska topila, analitsko čista, na primer aceton, metanol itd.,
— scintilacijsko tekočino.
1.8.2 Aplikacija preskusne snovi
Za dodajanje in porazdelitev v tla se lahko preskusna snov raztopi v vodi (deionizirani ali destilirani) ali po potrebi v manjši količini acetona ali drugega organskega topila (6), v katerem je preskusna snov dovolj topna in stabilna. Vendar količina izbranega topila ne sme znatno vlivati na mikrobno dejavnost v tleh (glej oddelke 1.5 in 1.9.2–1.9.3.) Uporabi topil, ki zavirajo mikrobno dejavnost, na primer kloroformu, diklorometanu in drugim halogeniranim topilom, se je treba izogibati.
Preskusna snov se lahko doda tudi kot trdna, npr. pomešana v kremenov pesek (6) ali v majhen podvzorec preskusnih tal, ki je bil posušen na zraku in steriliziran. Če se preskusna snov doda z uporabo topila, je treba topilu omogočiti, da izhlapi, preden se v originalni nesterilni vzorec tal doda primešan podvzorec.
Pri splošnih kemikalijah, katerih glavna pot vstopa v tla je preko odpadnega blata/kmetijskega nanosa, je treba preskusno snov najprej dodati v blato, ki se potem uvede v vzorec tal (glej oddelka 1.9.2 in 1.9.3).
Ne priporoča se rutinska uporaba formuliranih pripravkov. Vendar je uporaba formuliranega materiala lahko ustrezna rešitev npr. pri slabo topnih preskusnih snoveh.
1.8.3 Tla
1.8.3.1 Izbira tal
Za določitev poti transformacije se lahko uporabijo reprezentativna tla; priporoča se peščena ilovica ali muljasta ilovica ali ilovica ali ilovnati pesek [v skladu s klasifikacijo FAO in USDA (18)] s pH 5,5–8,0, vsebnostjo organskega ogljika 0,5–2,5 % in mikrobno biomaso najmanj 1 % skupnega organskega ogljika (10).
Za preučevanje stopnje transformacije je treba uporabiti najmanj tri dodatne vzorce tal, ki predstavljajo izbor ustreznih tal. Tla se morajo razlikovati po vsebnosti organskega ogljika, pH, vsebnosti gline in mikrobne biomase (10).
Vse vrste tal je treba opredeliti vsaj glede teksture ( % peska, % mulja, % gline) [v skladu s klasifikacijo FAO in USDA (18)], pH, kationske izmenjalne kapacitete, organskega ogljika, gostote v razsutem stanju, značilnosti zadrževanja vode ( 37 ) in mikrobne biomase (le za aerobne študije). Dodatne informacije o lastnostih tal so lahko koristne pri razlagi rezultatov. Za določitev lastnosti tal se lahko uporabijo metode, priporočene v sklicih (19) (20) (21) (22) (23). Mikrobno biomaso je treba določiti z uporabo metode respiracije, ki jo povzroči substrat (25) (26), ali z alternativnimi metodami (20).
1.8.3.2 Odvzemanje, obravnavanje in shranjevanje tal
Na voljo morajo biti podrobne informacije o preteklosti mesta vzorčenja, kjer se odvzemajo tla za preskus. Podrobnosti vključujejo točno lokacijo, pokritost z vegetacijo, uporabo kemikalij, uporabo organskih in anorganskih gnojil, dodatke bioloških materialov ali drugo kontaminacijo. Če so bila tla tretirana s preskusno snovjo ali analognimi strukturami, se ne uporabljajo v študijah transformacije (10) (15).
Tla je treba na sveže odvzeti na terenu (iz horizonta A ali zgornjega 20 cm sloja) z vsebnostjo vode, ki omogoča presejanje. Pri tleh, ki niso iz riževih polj, se je treba izogibati vzorčenju med ali takoj po dolgih obdobjih (> 30 dni) suše, zmrzali ali poplave (14). Vzorce je treba prepeljati na način, ki čim bolj zmanjša spremembe v vsebnosti vode v tleh in jih čim bolj zadrževati v temi, brez dostopa do zraka. V ta namen je na splošno primerna ohlapno zavezana polietilenska vreča.
Tla se obdelajo čimprej po vzorčenju. Vegetacijo, večje živalske vrste in kamne v tleh je treba odstraniti, preden se tla presujejo skozi 2 mm sito, ki odstrani manjše kamne, živalske vrste in rastlinske odpadke. Obsežnemu sušenju in drobljenju tal pred sejanjem se je treba izogibati (15).
Kadar je pozimi jemanje vzorcev na terenu težko (tla zamrznjena ali prekrita s plastmi snega), se smejo vzeti iz serije tal, shranjenih v topli gredi pod rastlinsko prevleko (npr. travo ali mešanico trave in detelje). Močno se priporočajo študije s tlemi, ki so na sveže odvzeta na terenu, če pa je treba odvzeta in obdelana tla pred začetkom študije shraniti, je potrebno skladiščenje v ustreznih razmerah in samo za omejen čas (4 ± 2 oC za največ tri mesece), da se ohrani mikrobna dejavnost ( 38 ). Podrobna navodila o odvzemanju, obravnavanju in shranjevanju tal, ki se uporabljajo za biotransformacijske poskuse, so v (8) (10) (15) (26) (27).
Preden se obdelana tla uporabijo za ta preskus, jih je treba predhodno inkubirati, da se omogoči kaljenje in odstranitev semen in ponovna vzpostavitev ravnovesja mikrobne presnove po spremembi razmer med vzorčenjem ali shranjevanjem na inkubacijske razmere. Na splošno zadošča obdobje predhodne inkubacije od 2 do 28 dni, ki približa pogoje temperature in vlage dejanskemu preskusu (15). Skupen čas shranjevanja in predhodne inkubacije ne sme presegati treh mesecev.
1.9 IZVEDBA PRESKUSA
1.9.1 Preskusni pogoji
1.9.1.1 Preskusna temperatura
V celotnem obdobju preskusa morajo biti tla inkubirana v temi pri stalni temperaturi, ki je reprezentativna za podnebne razmere, kjer bo potekala uporaba ali sproščanje. Temperatura 20 ± 2 oC se priporoča za vse preskusne snovi, ki lahko pridejo v tla v zmernih podnebjih. Temperaturo je treba spremljati.
Za kemikalije, ki se uporabljajo ali sproščajo v hladnejših podnebjih (npr. v severnih državah v jesenskih/zimskih obdobjih), je treba inkubirati dodatne vzorce tal, vendar pri nižji temperaturi (npr. 10 ± 2 oC).
1.9.1.2 Vsebnost vlage
Za preskuse transformacije v aerobnih razmerah je treba prilagoditi vsebnost vlage[4] in jo vzdrževati pri pF med 2,0 in 2,5 (3). Vsebnost vlage v tleh je izražena kot masa vode na maso suhih tal in se mora redno nadzorovati (npr. v 2-tedenskih razmikih) s tehtanjem inkubacijskih bučk in izgubo vode nadomestiti z dodajanjem vode (najbolje s sterilno filtrirano vodo iz pipe). Paziti je treba, da se preprečijo ali čim bolj zmanjšajo izgube preskusne snovi in/ali produktov transformacije z izhlapevanjem in/ali fotorazgradnjo (če obstaja) med dodajanjem vlage.
Za preskuse transformacije v razmerah anaerobnih in riževih tal se tla prepojijo z vodo s poplavljanjem.
1.9.1.3 Aerobne inkubacijske razmere
V pretočnih sistemih se aerobne razmere ohranjajo s prekinjenim splakovanjem ali z neprekinjenim prezračevanjem z navlaženim zrakom. V biometričnih bučkah se izmenjava zraka ohranja z difuzijo.
1.9.1.4 Sterilne aerobne razmere
Da bi dobili informacije o ustreznosti abiotske transformacije preskusne snovi, se lahko vzorci tal sterilizirajo (glede sterilizacijskih metod glej sklica 16 in 29), tretirajo s sterilno preskusno snovjo (npr. dodatek raztopine skozi sterilni filter) in prezračijo z navlaženim sterilnim zrakom, kot je opisano v oddelku 1.9.1.3. Pri riževih tleh je treba tla in vodo sterilizirati in izvesti inkubacijo, kot je opisano v oddelku 1.9.1.6.
1.9.1.5 Anaerobne inkubacijske razmere
Za vzpostavitev in ohranjanje anaerobnih razmer se tla, ki so tretirana s preskusno snovjo in inkubirana v aerobnih razmerah za 30 dni ali eno razpolovno dobo ali DT50 (kar je krajše), potem namočijo z vodo (1–3 cm plast vode), inkubacijski sistem pa se spere z inertnim plinom (npr. dušikom ali argonom) ( 39 ). Preskusni sistem mora omogočati meritve, kot na primer pH, koncentracijo kisika in redoks potenciala, ter vključevati naprave za zajemanje hlapnih produktov. Biometrični tip sistema mora biti zaprt, da se izogne vstopu zraka z difuzijo.
1.9.1.6 Razmere inkubacije na riževih poljih
Za preučevanje transformacije na riževih tleh se tla poplavijo s približno 1–5 centimetrsko plastjo vode, preskusna snov pa se nanese na vodno fazo (9). Priporočena globina tal je najmanj 5 cm. Sistem se prezračuje z zrakom, kakor v aerobnih razmerah, spremljati in poročati pa je treba o pH, koncentraciji kisika in redoks potencialu vodne plasti. Pred začetkom študij transformacije je potrebno najmanj dvotedensko obdobje predhodne inkubacije (glej oddelek 1.8.3.2).
1.9.1.7 Trajanje preskusa
Stopnja in pot študije normalno ne sme presegati 120 dni ( 40 ) (6) (8), ker se po tem pričakuje postopno upadanje mikrobne dejavnosti v tleh v umetnem laboratorijskem sistemu, izoliranem od naravnega dopolnjevanja. Kadar je treba opredeliti zmanjševanje preskusne snovi in nastajanje ali zmanjševanje glavnih produktov transformacije, se lahko študije nadaljujejo v daljših obdobjih (npr. 6 ali 12 mesecev) (8). Daljša inkubacijska obdobja je treba utemeljiti v poročilu o preskusu in priložiti meritve biomase na koncu teh obdobij in med njimi.
1.9.2 Izvajanje preskusa
V vsako inkubacijsko bučko (glej sliki 1 in 2 v Dodatku 3) se vloži približno 50 do 200 g tal (na osnovi suhe teže) in tla, tretirana s preskusno snovjo po eni od metod, opisanih v oddelku 1.8.2. Če se za aplikacijo preskusne snovi uporabijo organska topila, jih je treba odstraniti iz tal z izhlapevanjem. Potem se tla temeljito premešajo z lopatico in/ali stresanjem bučk. Če se študija izvaja v razmerah riževega polja, je treba tla in vodo po aplikaciji preskusne snovi temeljito premešati. Majhne alikvote (npr. 1 g) tretiranih tal je treba analizirati glede preskusne snovi, da se preveri enotna porazdelitev. Za alternativne metode glej spodaj.
Stopnja tretiranja naj ustreza največji stopnji aplikacije izdelka za zaščito pridelka, priporočeni v navodilih za uporabo in enotni vključitvi v ustrezno globino polja (npr. 10 cm vrhnje plasti tal ( 41 ). Na primer za kemikalije, uporabljene na listju ali tleh brez vključitve, je ustrezna globina za izračun, koliko kemikalije bi bilo treba dodati v vsako bučko, 2,5 cm. Za kemikalije, vključene v tla, je ustrezna globina vključitve opredeljena v navodilih za uporabo. Za splošne kemikalije se stopnja uporabe oceni na podlagi najustreznejše poti vstopa, na primer, če je glavna pot vstopa v tla preko odpadnega blata, se kemikalija dozira v blato s koncentracijo, ki odraža pričakovano koncentracijo blata in mora količina blata, dodanega v tla, odražati normalno nalaganje blata na kmetijska tla. Če ta koncentracija ni dovolj visoka za ugotavljanje produktov transformacije, lahko pomagajo ločeni vzorci tal, ki vsebujejo višje stopnje, vendar se je treba izogibati pretiranim stopnjam, ki vplivajo na mikrobne funkcije tal (glej oddelka 1.5 in 1.8.2).
Namesto tega se večja serija (npr. 1 do 2 kg) tal lahko tretira s preskusno snovjo, pazljivo primešano v ustreznem mešalnem stroju in potem v manjših 50 do 200 gramskih delih prenešeno v inkubacijske bučke (na primer z uporabo razdeljenih vzorcev). Manjše alikvote (npr. 1 g) tretirane serije tal je treba analizirati glede preskusne snovi, da se preveri enotna porazdelitev. Tak postopek se priporoča, ker omogoča enotnejšo porazdelitev preskusne snovi v tla.
Tudi netretirani vzorci tal se inkubirajo v enakih razmerah (aerobnih) kot vzorci, tretirani s preskusno snovjo. Ti vzorci se uporabijo za meritve biomase na koncu študij in med njimi.
Kadar se preskusna snov uporabi na tleh, raztopljenih z organskim topilom ali topili, se vzorci tal, tretirani z enako količino topil(a), inkubirajo v enakih razmerah (aerobnih) kakor vzorci, tretirani s preskusno snovjo. Ti vzorci se uporabljajo za začetne meritve biomase na koncu študij in med njimi za preverjanje učinkov topil(a) na mikrobno biomaso.
Bučke, ki vsebujejo tretirana tla, so bodisi priložene pretočnemu sistemu, opisanemu v sliki 1, ali zaprte z absorpcijsko kolono, prikazano v sliki 2 (glej Dodatek 3).
1.9.3 Vzorčenje in meritve
Dvojne inkubacijske bučke se odstranijo v ustreznih časovnih razmikih in vzorci tal se ekstrahirajo z ustreznimi topili različne polarnosti in analizirajo glede preskusne snovi in/ali produktov transformacije. Dobro načrtovana študija vključuje dovolj bučk, tako da se pri vsakem vzorčenju žrtvujeta dve bučki. Tudi absorpijske raztopine ali trdni absorpcijski materiali se odstranijo v različnih časovnih razmikih (v prvem mesecu v 7-dnevnih razmikih in po prvem mesecu 17-dnevnih razmikih) med in na koncu inkubacije vsakega vzorca tal in analizirajo glede hlapnih produktov. Poleg vzorca tal, vzetega neposredno po uporabi (vzorec dneva 0), se vključi najmanj 5 dodatnih vzorčnih točk. Časovne razmike je treba izbrati na tak način, da je mogoče vzpostaviti vzorec zmanjševanja preskusne snovi in vzorce nastajanja in zmanjševanja produktov transformacije (npr. 0, 1, 3, 7 dni; 2, 3 tedne; 1, 2, 3 mesece itd.).
Pri uporabi preskusne snovi z oznako 14C, se količinsko določi neizločljiva radioaktivnost z izgorevanjem in izračuna masna bilanca za vsak vzorčni interval.
V primeru anaerobne in riževe inkubacije se talna in vodna faza skupaj analizirata glede preskusne snovi in produktov transformacije ali ločeno s filtracijo ali centrifugitanjem pred ekstrakcijo in analizo.
1.9.4 Neobvezni preskusi
Aerobne, nesterilne študije pri dodatnih temperaturah in vlagi tal so lahko koristne pri oceni vpliva temperature in vlage tal na stopnje transformacije preskusne snovi in/ali produktov njene transformacije v tleh.
Nadaljnja opredelitev neizločljive radioaktivnosti se lahko poskuša recimo z uporabo izjemno kritične ekstrakcije tekočin.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Količine preskusne snovi, produktov transformacije, hlapnih (samo v %) in neizločljivih snovi se podajo kot % uporabljenih začetnih koncentracij in, kadar je primerno, kot mg· kg-1 tal (na podlagi suhe teže tal) za vsak interval vzorčenja. Masno bilanco je treba podati v odstotku uporabljene začetne koncentracije za vsak interval vzorčenja. Grafična predstavitev koncentracij preskusne snovi glede na čas omogoča oceno njene razpolovne dobe transformacije ali DT50. Treba je prepoznati glavne produkte transformacije in zarisati tudi njihove koncentracije glede na čas, da se prikažejo stopnje njihovega nastajanja in zmanjševanja. Glavni produkt transformacije je vsak produkt, ki predstavlja > 10 % uporabljenega odmerka v katerem koli času med študijo.
Zajeti hlapni produkti dajejo neko navedbo hlapnega potenciala preskusne snovi in njenih produktov transformacije iz tal.
Natančnejše določitve razpolovnih dob ali vrednosti DT50 in po potrebi DT75 in vrednosti DT90 je treba pridobiti z uporabo ustreznih izračunov kinetičnih modelov. Razpolovna doba in vrednosti DT50 se sporočajo skupaj z opisom uporabljenega modela, vrstnega reda kinetike in določitve koeficienta (r2). Kinetika prvega reda ima prednost, razen če je r2 < 0,7. Po potrebi se izračuni uporabijo tudi za glavne produkte transformacije. Primeri ustreznih modelov so opisani v sklicih od 31 do 35.
V primeru stopenjske študije, izvedene pri različnih temperaturah, so transformacijske stopnje opisane kot funkcija temperature v temperaturnem razponu pri poskusu z uporabo Arrheniusovega zakona v formuli:
![]()
or
![]()
,
kjer sta In A in B regresijski konstanti iz preseka in nagiba najboljše linije, nastale iz linearno padajoče 1n k do l/T, kjer je k konstantna stopnja pri temperaturi T in je T temperatura v Kelvinu. Paziti je treba na omejeni razpon temperature, v katerem je Arreheniusov zakon veljaven v primeru, če transformacijo ureja mikrobna dejavnost.
2.2 VREDNOTENJE IN RAZLAGA REZULTATOV
Čeprav se študije izvajajo v umetnem laboratorijskem sistemu, rezulati omogočajo ocene stopnje transformacije preskusne snovi in tudi stopnje nastajanja in zmanjševanja produktov transformacije v terenskih razmerah (36) (37).
Študija poti transformacije preskusne snovi zagotavlja informacije o poteh, po katerih se uporabljena snov strukturno spremeni v tleh s kemičnimi in mikrobnimi reakcijami.
3. POROČANJE
POROČILO O PRESKUSU
Poročilo o preskusu mora vključevati:
Preskusna snov:
— splošno ime, kemijsko ime, številko po CAS, strukturno formulo (z navedbo položaja oznak(e), kadar se uporabi radioaktivno označeni material) in ustrezne fizikalno-kemijske lastnosti (glej oddelek 1.5),
— čistost (nečistoče) preskusne snovi,
— radiokemijsko čistost označene kemikalije in specifično dejavnost (kjer je primerno).
Referenčne snovi:
— kemijsko ime in strukturo referenčnih snovi, uporabljenih za opredelitev in/ali določitev produktov transformacije.
Preskusna tla:
— podrobnosti o mestu odvzema,
— datum in postopek vzorčenja tal,
— lastnosti tal, kot so pH, vsebnost organskega ogljika, teksturo ( % peska, % mulja, % gline), kationsko izmenjalno kapaciteto, gostoto v razsutem stanju, značilnost zadrževanja vode in mikrobno biomaso,
— dolžino shranjevanja tal in razmere shranjevanja (če se shranjuje).
Preskusni pogoji:
— datume izvajanja študij,
— količino uporabljene preskusne snovi,
— uporabljena topila in metodo aplikacije preskusne snovi,
— začetno težo tretiranih tal in vzorcev, odvzetih za analizo v vsakem časovnem obdobju,
— opis uporabljenega sistema inkubacije,
— stopnje pretoka zraka (le za pretočne sisteme),
— temperaturo poskusnega okolja,
— vsebnost vlage v tleh med inkubacijo,
— mikrobno biomaso na začetku, med potekom in na koncu aerobnih študij,
— pH, koncentracijo kisika in redoks potenciala na začetku, med potekom in na koncu študij anaerobnih in riževih tal,
— metodo(-e) ekstrakcije,
— metode za količinsko opredelitev in določitev preskusne snovi in glavnih produktov transformacije v tleh in absorpcijskih materialih,
— število ponovitev in število kontrol.
Rezultati:
— rezultat določitve mikrobne dejavnosti,
— ponovljivost in občutljivost uporabljenih analitskih metod,
— stopnje izkoristka (vrednosti v % za veljavno študijo so podane v oddelku 1.7.1),
— tabele rezultatov, izraženih kot % apliciranega začetnega odmerka in, kadar je primerno, kot mg· kg-1 tal (na osnovi suhe teže),
— masno bilanco med potekom in na koncu študij,
— opredelitev neizločljive (vezane) radioaktivnosti ali ostankov v tleh,
— količinsko opredelitev sproščenega CO2 in drugih hlapnih spojin,
— prikaze koncentracij tal glede na čas za preskusno snov in, kadar je primerno, za glavne produkte transformacije,
— razpolovno dobo ali DT50, DT75 in DT90 za preskusno snov in, kadar je primerno, za glavne produkte transformacije vključno z intervalom zaupanja,
— oceno stopnje abiotske razgradnje v sterilnih razmerah,
— oceno kinetike transformacije za preskusno snov in, kadar je primerno, za glavne produkte transformacije,
— predlagane poti transformacije, kadar je primerno,
— razpravo in razlago rezultatov,
— surove podatke (to je vzorčne kromatograme, vzorčne izračune stopenj transformacije in sredstev, uporabljenih za določitev produktov transformacije).
4. LITERATURA
(1) US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
(2) Agriculture Canada (1987). Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada.
(3) Evropska Unija (EU) (1995). Direktiva Komisije 95/36/ES z dne 14. julija 1995 o spremembi Direktive Sveta 91/414/EGS o dajanju fitofarmacevtskih sredstev v promet. Priloga II, Del A in Priloga III, Del A: Vpliv in porazdelitev v okolju.
(4) Dutch Commission for Registration of Pesticides (1995). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
(5) BBA (1986). Richtlinie fur die amtliche Priifung von Pflanzenschutzmitteln, Teil IV, 4–1. Verbleib von Pflanzenschutzmitteln im Boden – Abbau, Umwandlung und Metabolismus.
(6) ISO/DIS 11266-1 (1994). Soil Quality – Guidance on laboratory tests for biodegradation of organic chemicals in soil – Part 1: Aerobic conditions.
(7) ISO 14239 (1997). Soil Quality – Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions.
(8) SET AC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
(9) MAFF – Japan 2000 – Draft Guidelines for transformation studies of pesticides in soil – Aerobic metabolism study in soil under paddy field conditions (flooded).
(10) OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18–20 January 1995.
(11) Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123–157.
(12) DFG: Pesticide Bound Residues in Soil. Wiley – VCH (1998).
(13) T.R. Roberts: Non-extractable pesticide residue in soils and plants. Pure Appl. Chem. 56, 945–956 (IUPAC 1984)
(14) OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981)
(15) ISO 10381-6 (1993). Soil Quality – Sampling – Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
(16) Priloga V k Dir. 67/548/EGS
(17) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85–114.
(18) Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962).
(19) Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods. A. Klute, Ed.) Agronomy Series No 9, 2nd Edition.
(20) Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties. AL. Page, R.H. Miller and D.R. Kelney, Eds. Agronomy Series No 9, 2nd Edition.
(21) ISO Standard Compendium Environment (1994). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
(22) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
(23) Scheffer, F., Schachtschabel, P. (1975). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
(24) Anderson, J.P.E., Domsch, K.H. (1978) A physiological method for the quantitative measurement of microbial biomass in soils. Soil Biol. Biochem. 10, 215–221.
(25) ISO 14240-1 and 2 (1997). Soil Quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method. Part 2: fumigation-extraction method.
(26) Anderson, J.P.E. (1987). Handling and storage of soils for pesticide experiments. In Pesticide Effects on Soil Microflora. L. Somerville, M.P. Greaves, Eds. Taylor & Francis, 45–60.
(27) Kato, Yasuhiro. (1998). Mechanism of pesticide transformation in the environment: Aerobic and bio-transformation of pesticides in aqueous environment. Proceedings of the 16th Symposium on Environmental Science of Pesticide, 105–120.
(28) Keuken O., Anderson J.P.E. (1996). Influence of storage on biochemical processes in soil. In Pesticides, Soil Microbiology and Soil Quality, 59–63 (SETAC-Europe).
(29) Stenberg B., Johansson M., Pell M., Sjödahl-Svensson K., Stenstrom J., Torstensson L. (1996). Effect of freeze and cold storage of soil on microbial activities and biomass. In Pesticides, Soil Microbiology and Soil Quality, 68–69 (SETAC-Europe).
(30) Gennari, M., Negre, M., Ambrosoli, R. (1987). Effects of ethylene oxide on soil microbial content and some chemical characteristics. Plant and Soil 102, 197–200.
(31) Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141–146.
(32) Hamaker, J.W. (1976). The application of mathematical modelling to the soil persistence and accumulation of pesticides. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, 181–199.
(33) Goring, C.A.I., Laskowski, D.A., Hamaker, J.W., Meikle, R.W. (1975). Principles of pesticide degradation in soil. In „Environmental Dynamics of Pesticides“. R. Haque and V.H. Freed, Eds., 135–172.
(34) Timme, G., Frehse, H., Laska, V. (1986). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. II. Pflanzenschutz -Nachrichten Bayer 39, 188–204.
(35) Timme, G., Frehse, H. (1980). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. I. Pflanzenschutz – Nachrichten Bayer 33, 47–60.
(36) Gustafson D.I., Holden L.R. (1990). Non-linear pesticide dissipation in soil; a new model based on spatial variability. Environm. Sci. Technol. 24, 1032–1041.
(37) Hurle K., Walker A. (1980). Persistence and its prediction. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 83–122.
DODATEK 1
PRITISK VODE, POLJSKA KAPACITETA TAL ZA VODO (FC) IN ZMOGLJIVOST ZADRŽEVANJA VODE (WHC) ( 42 )
|
Visina vodne kolone [cm] |
pF () |
bar () |
Pripombe |
||
|
107 |
7 |
104 |
suha tla |
||
|
1,6 · 104 |
4,2 |
16 |
tocka izsusenosti |
||
|
104 |
4 |
10 |
|||
|
103 |
3 |
1 |
|||
|
6· 102 |
2,8 |
0,6 |
|||
|
3,3 · 102 |
2,5 |
0,33 () |
|
||
|
102 |
2 |
0,1 |
|||
|
60 |
1,8 |
0,06 |
|||
|
33 |
1,5 |
0,033 |
|||
|
10 |
1 |
0,01 |
WHC (približek) |
||
|
1 |
0 |
0,001 |
tla, nasičena z vodo |
||
|
(1) pF = logaritem cm vodne kolone. (2) 1 bar =105 Pa. (3) Približno ustreza vsebnosti vode 10 % v pesku, 35 % v ilovici in 45 % v glini. (4) Poljska kapaciteta tal za vodo ni stalna, ampak se spreminja z vrsto tal med pF 1,5 in 2,5. |
|||||
Pritisk vode se meri v cm vodne kolone ali v barih. Zaradi velikega razpona vleka je pritisk izražen preprosto kot vrednost pF, ki je enaka logaritmu cm vodne kolone.
Poljska kapaciteta tal za vodo je opredeljena kot količina vode glede na maso, ki jo lahko naravna tla shranijo 2 dni po dolgem deževnem obdobju ali po zadostnem namakanju. Določi se v neoviranih tleh in situ na terenu. Merjenje se zato ne uporablja na oviranih laboratorijskih vzorcih tal. Vrednosti poljske kapacitete tal za vodo, določene v oviranih tleh lahko kažejo velika sistematična odstopanja.
Zmogljivost zadrževanja vode (WHC) je opredeljena v laboratoriju z neoviranimi in oviranimi tlemi z nasičenjem talne kolone z vodo s kapilarnim prenosom. Posebno uporabna je pri oviranih tleh in je lahko do 30 % večja kakor poljska kapaciteta tal za vodo (1). Eksperimentalno jo je tudi lažje določiti kakor zanesljive vrednosti poljske kapacitete.
Opombe
DODATEK 2
VSEBNOST VLAGE V TLEH (g vode na 100 g suhih tal) V RAZLIČNIH VRSTAH TAL V RAZLIČNIH DRŽAVAH
|
Vsebnost vlage v tleh pri |
||||
|
Vrsta tal |
Država |
|||
|
WHC (1) |
pF = 1,8 |
pF = 2,5 |
||
|
Pesek |
Nemčija |
28,7 |
8,8 |
3,9 |
|
Ilovnati pesek |
Nemčija |
50,4 |
17,9 |
12,1 |
|
Ilovnati pesek |
Švica |
44,0 |
35,3 |
9,2 |
|
Muljasta ilovica |
Švica |
72,8 |
56,6 |
28,4 |
|
Glinasta ilovica |
Brazilija |
69,7 |
38,4 |
27,3 |
|
Glinasta ilovica |
Japonska |
74,4 |
57,8 |
31,4 |
|
Peščena ilovica |
Japonska |
82,4 |
59,2 |
36,0 |
|
Muljasta ilovica |
ZDA |
47,2 |
33,2 |
18,8 |
|
Peščena ilovica |
ZDA |
40,4 |
25,2 |
13,3 |
|
(1) Zmogljivost zadrževanja vode. |
||||
DODATEK 3
Slika 1
Primer pretočne naprave za preučevanje transformacije kemikalij v tleh ( 43 ) ( 44 )
Slika 2
Primer bučke biometričnega tipa za preučevanje transformacije kemikalij v tleh ( 45 )

C.24 AEROBNA IN ANAEROBNA TRANSFORMACIJA V SISTEMIH VODNIH USEDLIN
1. METODA
Ta preskusna metoda ustreza metodi OECD TG 308 (2002).
1.1 UVOD
Kemikalije lahko vstopijo v plitve ali globoke površinske vode po poteh, kot so neposredni vnos, pronicanje pršenja, površinsko odtekanje, drenaža, odlaganje odpadkov, industrijske, domače ali kmetijske odplake in usedline iz zraka. Ta preskusna metoda opisuje laboratorijsko metodo za ocenjevanje aerobne in anaerobne transformacije organskih kemikalij v sistemih vodnih usedlin. Temelji na obstoječih smernicah (1) (2) (3) (4) (5) (6). Na delavnici OECD o izbiri tal/usedline, ki je bila leta 1995 v Belgiratu v Italiji (7), je bil dosežen dogovor predvsem o številu in vrstah tal za uporabo v tem preskusu. Dana so bila tudi priporočila v zvezi z odvzemanjem, obravnavanjem in shranjevanjem vzorcev usedlin, ki temeljijo na napotkih ISO (8). Take študije so potrebne za kemikalije, ki se vnašajo neposredno v vodo ali za katere je verjetno, da bodo prišle v vodno okolje po zgoraj opisanih poteh.
Razmere v naravnih sistemih vodnih usedlin so v zgornji vodni fazi pogosto aerobne. Površinska plast usedline je lahko bodisi aerobna ali anaerobna, globlje usedline pa so navadno anaerobne. Da bi zajeli vse te možnosti, so v tem dokumentu opisani tako aerobni kot anaerobni preskusi. Aerobni preskus simulira aerobno vodno kolono nad plastjo aerobne usedline, pod katero je anaerobno pobočje. Anaerobni preskus simulira povsem anaerobni sistem vode in usedline. Če okoliščine kažejo, da je treba znatno odstopati od teh priporočil, na primer z uporabo nedotaknjenih jeder usedlin ali usedlin, ki so bile morda izpostavljene preskusni snovi, so v ta namen na volji druge metode (9).
1.2 OPREDELITVE POJMOV
V vsakem primeru se uporabljajo standardne mednarodne enote (SI).
Preskusna snov: katera koli snov, bodisi osnovna ali ustrezni produkti transformacije.
Produkti transformacije: vse snovi, ki so posledica biotskih in abiotskih transformacijskih reakcij preskusne snovi, vključno s CO2 in vezanimi ostanki.
Vezani ostanki:„vezani ostanki“ predstavljajo spojine v tleh, rastlinske ali živalske, ki vztrajajo v matrici v obliki osnovne snovi ali njenega metabolita ali njenih metabolitov/produktov po ekstrakciji. Ekstrakcijska metoda ne sme bistveno spremeniti samih spojin ali strukture matrice. Narava vezi se lahko delno pojasni z ekstrakcijskimi metodami, ki spreminjajo matrico, in z visoko razvitimi analitskimi tehnikami. Do sedaj so bile, na primer, na ta način odkrite kovalentne ionske in sorptivne vezi. Na splošno nastajanje vezanih ostankov znatno zmanjša biološko dostopnost in biološko razpoložljivost (10) [prikrojeno po IUPAC-u (11)].
Aerobna transformacija (oksidacija): reakcije, ki se pojavljajo v navzočnosti molekularnega kisika (12).
Anaerobna transformacija (redukcija): reakcije, ki se pojavljajo v odsotnosti molekularnega kisika (12).
Naravne vode: so površinske vode, dobljene iz ribnikov, rek, potokov itd.
Usedlina: je mešanica mineralnih in organskih kemičnih sestavin, slednje vsebujejo spojine z visoko vsebnostjo ogljika in dušika in z veliko molsko maso. Odlaga jo naravna voda in tvori povezavo z vodo.
Mineralizacija: je popolna razgradnja organske spojine v CO2, H2O v aerobnih razmerah in CH4, CO2 in H2O v anaerobnih razmerah. V smislu te preskusne metode, kjer se uporablja spojina z radioaktivno oznako, mineralizacija pomeni obsežno razgradnjo molekule, v kateri se označeni ogljikov atom oksidira ali količinsko reducira s sproščanjem ustrezne količine 14CO2 oziroma 14CH4.
Razpolovna doba, t0,5, je čas, potreben za 50 %-no transformacijo preskusne snovi, kadar lahko transformacijo opišemo kot kinetiko prvega reda; razpolovna doba ni odvisna od začetne koncentracije.
Čas razgradnje DT 50 : je čas, v katerem se začetna koncentracija preskusne snovi zmanjša za 50 %.
Čas razgradnje DT 75 : je čas, v katerem se začetna koncentracija preskusne snovi zmanjša za 75 %.
Čas razgradnje DT 90 : je čas, v katerem se začetna koncentracija preskusne snovi zmanjša za 90 %.
1.3 REFERENČNE SNOVI
Referenčne snovi se uporabljajo za določitev in količinsko opredelitev produktov transformacije s spektroskopsko in kromatografsko metodo.
1.4 PODATKI O PRESKUSNI SNOVI
Za merjenje stopnje transformacije se lahko uporabi neoznačena ali izotopno označena preskusna snov, čeprav se priporoča označeni material. Označeni material je potreben za preučevanje poti transformacije in za vzpostavitev masne bilance. Priporoča se oznaka 14C, vendar je lahko koristna tudi uporaba drugih izotopov, na primer C, N, H, P. Ce je to mogoče, naj se oznaka namesti na najstabilnejši del(e) molekule ( 46 ). Kemijska in/ali radiokemij ska čistost preskusne snovi naj bo vsaj 95 %.
Pred izvajanjem preskusa morajo biti na voljo naslednje informacije o preskusni snovi:
(a) topnost v vodi (metoda A.6);
(b) topnost v organskih topilih;
(c) tlak pare (metoda A.4) in Henryjeva konstanta;
(d) porazdelitveni koeficient n-oktanol/voda (metoda A. 8);
(e) adsorpcijski koeficient (Kd, Kf or Koc, kjer je primerno) (metoda C.18);
(f) hidroliza (metoda C.7);
(g) disociacijska konstanta (pKa) [Smernica OECD 112] (13);
(h) kemijska struktura preskusne snovi in po potrebi položaj oznak(e) izotopa.
Opomba: Poročati je treba o temperaturi, pri kateri so bile opravljene te meritve.
Druge uporabne informacije lahko vključujejo podatke o toksičnosti preskusne snovi za talne mikroorganizme, podatke o lahki in/ali inherentni biorazgradljivosti in podatke o aerobni in anaerobni transformaciji v tleh.
Na voljo morajo biti analitske metode (vključno z metodami ekstrakcije in očiščenja) za določitev in količinsko opredelitev preskusne snovi in njenih produktov transformacije v vodi in usedlini (glej oddelek 1.7.2).
1.5 PRINCIP PRESKUSNE METODE
Metoda, opisana v tem preskusu, uporablja sistem aerobnih in anaerobnih vodnih usedlin (glej Dodatek 1), ki omogoča:
— merjenje stopnje transformacije preskusne snovi v sistemu vode in usedline,
— merjenje stopnje transformacije preskusne snovi v usedlini,
— merjenje stopnje mineralizacije preskusne snovi in/ali njenih produktov transformacije (če se uporablja preskusna snov z oznako 14C),
— določitev in količinsko opredelitev produktov transformacije v vodni fazi in fazi usedline, vključno z masno bilanco (če se uporablja označena preskusna snov),
— merjenje porazdelitve preskusne snovi in njenih produktov transformacije med dve fazi v času inkubacije v temi (na primer, da bi se izognili cvetenju alg) pri stalni temperaturi. Razpolovne dobe in vrednosti DT50, DT75 in DT90 se določijo, kadar so podatki zanesljivi, vendar se ne smejo ekstrapolirati še dolgo po koncu poskusnega obdobja (glej oddelek 1.2).
Tako za aerobne kot za anaerobne študije sta potrebni najmanj dve usedlini in z njimi povezana voda (7). Seveda pa lahko obstajajo primeri, ko je treba uporabiti več kakor dve vodni usedlini, na primer, pri kemikaliji, ki je lahko navzoča v sveži vodi in/ali morskem okolju.
1.6 UPORABNOST PRESKUSA
Metoda se navadno uporablja za kemične snovi (brez oznake ali z radioaktivno oznako), za katere je na voljo dovolj natančna in občutljiva analitska metoda. Uporablja se za rahlo hlapne, nehlapne, vodotopne ali v vodi slabo topne spojine. Preskus naj se ne uporablja za kemikalije v vodi, ki so lahko hlapne (npr. fumiganti, organska topila) in se tako ne morejo zadrževati v vodi in/ali usedlini za poskusne pogoje tega preskusa.
Metoda se je do zdaj uporabljala za študije transformacije kemikalij v sveži vodi in usedlinah, vendar bi se načeloma lahko uporabljala tudi za morske rokave in priobalne sisteme. Ni pa primerna za simuliranje razmer v tekoči vodi (npr. rekah) ali na odprtem morju.
1.7 MERILA KAKOVOSTI
1.7.1 Izkoristek
Ekstrakcija in analiza najmanj dvojnih vzorcev vode in usedline takoj po dodajanju preskusne snovi da prvi prikaz ponovljivosti analitske metode in izenačenosti postopka uporabe za preskusno snov. Izkoristki poznejših stopenj poskusov so podani z ustreznimi masnimi bilancami (kadar se uporabi označeni material). Izkoristki so v razponu od 90 % do 110 % pri označenih kemikalijah (6) in od 70 % do 110 % pri neoznačenih kemikalijah.
1.7.2 Ponovljivost in občutljivost analitske metode
Ponovljivost analitske metode (brez začetne učinkovitosti ekstrakcije) za količinsko določitev preskusne snovi in proizvodov transformacije se lahko preveri z dvojno analizo istega ekstrakta vode ali vzorcev usedline, ki so bili inkubirani dovolj dolgo, da nastajajo proizvodi transformacije.
Meja detekcije analitske metode za preskusno snov in za proizvode transformacije mora biti najmanj 0,01 mg· kg-1 vode ali usedline (kot preskusne snovi) ali 1 % začetne količine, uporabljene v preskusnem sistemu, kar je manj. Opredeliti je treba tudi mejo količinske opredelitve.
1.7.3 Točnost podatkov transformacije
Regresijska analiza koncentracij preskusne snovi v funkciji časa daje ustrezne informacije o točnosti krivulje transformacije in omogoča izračun intervala zaupanja za razpolovne dobe (če se uporablja psevdo kinetika prvega reda) ali vrednosti DT50 in, če je primerno, vrednosti DT75 in DT90.
1.8 OPIS METODE
1.8.1 Preskusni sistem in naprave
Studijo je treba opraviti v steklenih posodah (npr. steklenicah, epruvetah za centrifugiranje), razen če predhodne informacije (na primer porazdelitveni koeficient n-oktanol/voda, sorpcijski podatki itd.) kažejo, da se lahko preskusna snov lepi na steklo in je treba v tem primeru razmisliti o drugem materialu (na primer o teflonu). Če je znano, da se preskusna snov oprijema stekla, je ta problem mogoče odpraviti z eno ali več od naslednjih metod:
— določimo maso preskusne snovi in produktov transformacije, ki so se oprijeli stekla,
— zagotovimo, da se na koncu preskusa vsa steklena oprema izpere z raztopino,
— uporabimo formulirane produkte (glej tudi oddelek 1.9.2),
— uporabimo povečano količino pomožnega topila za dodajanje preskusne snovi v sistem; če se uporablja pomožno topilo, naj bo to pomožno topilo, ki ne raztaplja preskusne snovi.
Primera tipičnih preskusnih naprav, to je plinske pretočne naprave in sistema biometričnega tipa, sta prikazana v dodatkih 2 in 3 (14). Drugi uporabni inkubacijski sistemi so opisani v sklicu 15. Načrt poskusne naprave mora omogočati izmenjavo zraka ali dušika in zajemanje hlapnih produktov. Mere naprave morajo izpolnjevati zahteve preskusa (glej oddelek 1.9.1). Prezračevanje se lahko zagotovi bodisi z blagim vpihavanjem mehurčkov ali spuščanjem zraka ali dušika preko vodne površine. V slednjem primeru je priporočljivo rahlo mešanje vode od zgoraj zaradi boljše porazdelitve kisika ali dušika v vodi. Zrak brez CO2 se ne sme uporabljati, ker lahko povzroči povečanje pH vode. V obeh primerih je nezaželeno motenje usedline in se je treba temu čim bolj izogibati. Rahlo hlapne kemikalije je treba preskusiti v sistemu biometričnega tipa z blagim mešanjem vodne površine. Lahko se uporabljajo tudi zaprte posode z volumnom nad vzorcem bodisi z atmosferskim zrakom ali dušikom in notranjimi stekleničkami za zajemanje hlapnih produktov (16). Pri aerobnem preskusu je potrebna redna izmenjava plina v volumnu nad vzorcem, da se nadomesti kisik, ki ga porabi biomasa.
Primerni lovilniki za zbiranje hlapnih produktov transformacije med drugim zajemajo 1 mol·dm-3 raztopine kalijevega hidroksida ali natrijevega hidroksida za ogljikov dioksid [9] in etilen glikol, etanolamin ali 2 % parafin v ksilenu za organske spojine. Hlapne snovi, ki nastanejo v anaerobnih razmerah, kot na primer metan, se lahko zberejo recimo z molekulskimi siti. Take hlapne snovi se lahko sežgejo, na primer v CO2, tako da se plin spusti skozi kremenovo epruveto, napolnjeno s CuO, pri temperaturi 900 oC in se nastali CO2 zajame v absorpcijsko posodo z alkalijskimi snovmi (17).
Potrebni so laboratorijski instrumenti za kemijsko analizo preskusne snovi in produktov transformacije (npr. plinsko tekočinsko kromatografijo (GLC), tekočinsko kromatografijo visoke ločljivosti (HPLC), tankoplastno kromatografijo (TLC), masno spektroskopijo (MS), plinsko kromatografijo-masno spektroskopijo (GC-MS), tekočinsko kromatografijo-masno spektroskopijo (LC-MS), jedrsko magnetno resonanco (NMR) itd.), vključno s sistemi detekcije radioaktivno označenih ali neoznačenih kemikalij, kot je primerno. Kadar se uporablja radioaktivno označeni material, sta potrebna tudi tekočinski scintilacijski števec in oksidacijsko sredstvo za izgorevanje (za sežig vzorcev usedline pred analizo radioaktivnosti).
Po potrebi se zahteva še druga standardna laboratorijska oprema za fizikalno-kemijske in biološke določitve (glej oddelek tabele 1, oddelek 1.8.2.2), steklena posoda, kemikalije in reagenti.
1.8.2 Izbira in število vodnih usedlin
Mesta vzorčenja je treba izbrati v skladu z namenom preskusa v dani situaciji. Pri izbiranju mesta vzorčenja je treba upoštevati preteklost morebitnih kmetijskih, industrijskih ali domačih vnosov v zajetje in vode v zgornjem toku. Usedline se ne smejo uporabiti, če so bile v predhodnih 4 letih kontaminirane s preskusno snovjo ali analognimi strukturami.
1.8.2.1 Izbira usedine
Za aerobne študije se navadno uporabita dve usedlini (7). Izbrani usedlini se morata razlikovati glede vsebnosti organskega ogljika in teksture. Ena usedlina naj ima visoko vsebnost organskega ogljika (2,5–7,5 %) in fino teksturo, druga usedlina naj ima nizko vsebnost organskega ogljika (0,5–2,5 %) in grobo teksturo. Razlika med vsebnostjo organskega ogljika naj bo normalno vsaj 2 %. „Fina tekstura“ je opredeljena kot vsebnost [gline + mulja] [10] > 50 % in „groba tekstura“ je opredeljena kot vsebnost [gline + mulja] < 50 %. Razlika v vsebnosti [gline + mulja] obeh usedlin naj bo normalno vsaj 20 %. V primerih, ko lahko pride kemikalija tudi v morsko vodo, naj bo vsaj en sistem vode in usedline morskega izvora.
Pri povsem anaerobnih študijah, je treba vzorce za dve usedlini (vključno z njunimi povezanimi vodami) vzeti iz anaerobnih con teles površinskih vod (7). Z obema fazama, fazo usedline in vodno fazo, je treba ravnati previdno in ju prenesti brez navzočnosti kisika.
Pri izbiri usedlin so lahko pomembni še drugi parametri in jih je treba upoštevati za vsak primer posebej. Na primer razpon pH usedlin bi bil pomemben za preskušanje kemikalij, pri katerih je transformacija in/ali sorpcija lahko odvisna od pH. Odvisnost sorpcije od pH se lahko odraža v pKa preskusne snovi.
1.8.2.2 Opis značilnosti vzorcev vode in usedline
Ključni parametri, ki se morajo izmeriti in je treba o njih poročati (s sklicevanjem na uporabljeno metodo) tako za vodo kot usedlino, in stopnja preskusa, pri kateri je treba te parametre določiti, so povzeti v tukajšnji tabeli. Metode za določanje teh parametrov so v vednost podane v sklicih (18) (19) (20) (21).
Poleg tega utegne biti glede na posamezen primer potrebno izmeriti in poročati o drugih parametrih (npr. za svežo vodo: o delcih, alkalnosti, trdoti, prevodnosti, NO3/PO4 (razmerje in posamezne vrednosti); za usedline: o kationski izmenjalni kapaciteti, zmogljivosti zadrževanja vode, karbonatu, skupnem dušiku in fosforju in za morske sisteme: o slanosti). Analiza nitrata, sulfata, biološko razpoložljivega železa in drugih možnih sprejemnikov elektronov v usedlinah in vodah je lahko koristna tudi pri ocenjevanju redoks pogojev, zlasti v zvezi z anaerobno transformacijo.
Meritve parametrov za opredelitev vzorcev vode in usedline (7) (22) (23)
|
Parameter |
Stopnja preskusnega postopka |
|||||
|
Terensko vzorčenje |
Poznejše ravnanje |
Začetek prilagoditve |
Začete k preskusa |
Med preskusom |
Konec preskusa |
|
|
Voda |
||||||
|
Izvor/vir |
X |
|||||
|
Temperatura |
X |
|||||
|
pH |
X |
X |
X |
X |
X |
|
|
Skupni organski ogljik |
X |
X |
X |
|||
|
Koncentracija O2 (1) |
X |
X |
X |
X |
X |
|
|
Redoks potencial (1) |
X |
X |
X |
X |
||
|
Usedlina |
||||||
|
Izvor/vir |
X |
|||||
|
Globina plasti |
X |
|||||
|
pH |
X |
X |
X |
X |
X |
|
|
Porazdelitev velikosti delcev |
X |
|||||
|
Skupni organski ogljik |
X |
X |
X |
X |
||
|
Microbna biomasa (1) |
X |
X |
X |
|||
|
Redoks potencial (2) |
Opazovanje (barva/vonj) |
X |
X |
X |
X |
|
|
(1) Metoda stopnje mikrobne respiracije (26), metoda zaplinjanja (27) ali meritve s štetjem (npr. bakterij, aktinomicet, gliv in skupnih kolonij) pri aerobnih študijah; stopnja metanogeneze pri anaerobnih študijah. (2) Rezultati novejših raziskav kažejo, da meritve koncentracij kisika v vodi in redoks potencialov nimajo niti mehanistične niti napovedovalne vrednosti glede rasti in razvoja mikrobnih populacij na površini teh vod (24) (25). Boljša orodja za razlago in vrednotenje stopenj in poti aerobne biotransformacije so lahko določitev potrebe po biokemijskem kisiku (BOD pri terenskem vzorčenju, na začetku in na koncu preskusa) in koncentracij mikro/makro hranilnih snovi Ca, Mg in Mn (na začetku in na koncu preskusa) v vodi in meritve skupnega N in skupnega P v usedlinah (pri terenskem vzorčenju in na koncu preskusa). |
||||||
1.8.3 Odvzemanje, obravnavanje in shranjevanje
1.8.3.1 Odvzemanje
Pri vzorčenju usedlin je treba upoštevati osnutek smernice ISO o vzorčenju usedlin z dna (8). Vzorce usedlin je treba jemati s celotnih 5 do 10 cm zgornje plasti usedline. Z usedlino povezano vodo je treba odvzeti z istega mesta ali lokacije in v istem času kakor usedlino. Pri anaerobnih študijah je treba usedline in z njimi povezano vodo vzorčiti in prevažati brez navzočnosti kisika (28) (glej oddelek 1.8.2.1). Nekaj pripomočkov za vzorčenje je opisanih v literaturi (8) (23).
1.8.3.2 Ravnanje
Usedlina se loči od vode s filtriranjem in se mokro preseje skozi 2 mm sito z uporabo odvečne vode z lokacije, ki se nato zavrže. Nato se znane količine usedlin in vode zmešajo v želenem razmerju (glej oddelek 1.9.1) v inkubacijskih bučkah in pripravijo za prilagoditveno obdobje (glej oddelek 1.8.4). Pri anaerobnih študijah je treba vse stopnje ravnanja opraviti brez navzočnosti kisika (29) (30) (31) (32) (33).
1.8.3.3 Shranjevanje
Močno se priporoča uporaba sveže odvzetih vzorcev usedlin in vode, če pa je nujno shranjevanje, je treba usedlino in vodo presejati, kakor je opisano zgoraj, in shraniti skupaj, namočeno v vodi (6–10 cm plast vode) v temi pri 4 ± 2 oC4 za največ 4 tedne (7) (8) (23). Vzorce, ki se uporabijo za aerobne študije, je treba shraniti s prostim dostopom do zraka (npr. v odprtih posodah), tiste za anaerobne študije pa brez navzočnosti kisika. Med prevozom in shranjevanjem ne sme priti do zamrznitve usedlin in vode in izsuševanja usedline.
1.8.4 Priprava vzorcev usedline/vode za preskus
Obdobje prilagoditve naj poteka pred dodajanjem preskusne snovi, vsak vzorec usedline/vode se položi v inkubacijsko posodo za uporabo pri glavnem preskusu, prilagoditev pa naj se izvaja v povsem enakih razmerah kakor preskusna inkubacija (glej oddelek 1.9.1). Prilagoditveno obdobje je čas, potreben, da se doseže razumna stabilnost sistema, kot jo odražajo pH, koncentracija kisika v vodi, redoks potencial usedline in vode in makroskopska ločitev faz. Obdobje prilagoditve naj normalno traja od enega tedna do dveh tednov in ne sme presegati štirih tednov. Poročati je treba o rezultatih določitev, ki se izvedejo v tem obdobju.
1.9 IZVEDBA PRESKUSA
1.9.1 Preskusni pogoji
Preskus je treba izvesti v inkubacijski napravi (glej oddelek 1.8.1) z vodno usedlino v volumenskem razmerju med 3: 1 in 4: 1 in plastjo usedline 2,5 cm (± 0,5 cm) ( 47 ). Priporočena najmanjša količina na inkubacijsko posodo je 50 g usedline (na osnovi suhe teže).
Preskus je treba opraviti v temi pri stalni temperaturi v razponu od 10 do 30 oC. Primerna je temperatura (20 ± 2) oC. Po potrebi se lahko v posameznih primerih, odvisno od informacij, ki se zahtevajo od preskusa, razmisli o dodatni nižji temperaturi (npr. 10 oC). Inkubacijsko temperaturo je treba spremljati in o njej poročati.
1.9.2 Ravnanje s preskusno snovjo in njena uporaba
Uporabi se ena preskusna koncentracija kemikalije ( 48 ). Pri kemikalijah za zaščito pridelka, ki se vnašajo neposredno v vodna telesa, se največji odmerek na nalepki jemlje kot največja stopnja aplikacije, računano na osnovi površinskega območja vode v preskusni posodi. V vseh drugih primerih naj se uporabijo koncentracije, ki temeljijo na napovedih iz emisij v okolje. Treba je paziti, da se zagotovi vnos zadostne koncentracije preskusne snovi za opredelitev poti transformacije ter nastajanje in zmanjševanje produktov transformacije. V primerih, ko so koncentracije preskusne snovi blizu mejam detekcije na začetku študije in/ali kadar glavni produkti transformacije niso zlahka zaznavni ob navzočnosti 10 % stopnje aplikacije preskusne snovi, je morda treba uporabiti večje odmerke (npr. 10-krat). A če se uporabijo višje preskusne koncentracije, ne smejo imeti opaznega škodljivega učinka na mikrobno dejavnost sistema vode in usedline. Da bi dosegli stalno koncentracijo preskusne snovi v posodah različnih velikosti, je morda primerno razmisliti o prilagoditvi količine uporabljenega materiala na podlagi globine vodne kolone v posodi glede na globino vode na terenu (za katero se predvideva, da je 100 cm, vendar se lahko uporabijo druge globine). Glej Dodatek 4 za primer izračuna.
V idealnem primeru se preskusna snov uporabi kot vodna raztopina v vodni fazi preskusnega sistema. Če se temu ne da izogniti, je dovoljena uporaba manjših količin topil, ki se mešajo z vodo (npr. aceton, etanol), za nanos in porazdelitev preskusne snovi, vendar ne sme presegati 1 % v/v in ne sme imeti škodljivih učinkov na mikrobno dejavnost preskusnega sistema. Pri izdelavi vodne raztopine preskusne snovi je potrebna pazljivost, za zagotavljanje popolne homogenosti je morda primerna uporaba generatorskih kolon in predhodno mešanje. Po dodajanju vodne raztopine v preskusni sistem se priporoča nežno mešanje vodne faze, tako da se čim manj moti usedlina.
Ne priporoča se rutinska uporaba formuliranih pripravkov, ker lahko formulirane sestavine škodujejo porazdelitvi preskusne snovi in/ali produktov transformacije med vodno fazo in fazo usedline. Vendar je lahko uporaba formuliranega materiala ustrezna rešitev pri slabo topnih preskusnih snoveh.
Število inkubacijskih posod je odvisno od števila vzorčenj (glej oddelek 1.9.3). Treba je vključiti zadostno število preskusnih sistemov, tako da se lahko pri vsakem vzorčenju žrtvujeta dva sistema. Če se pri vsaki vodni usedlini uporabijo kontrolne enote, se ne smejo tretirati s preskusno snovjo. Kontrolne enote se lahko uporabljajo za določanje mikrobne biomase usedline in skupnega organskega ogljika v vodi in usedlini na koncu študije. Dve kontrolni enoti (to je po ena kontrolna enota iz vsake vodne usedline) se lahko uporabi za spremljanje potrebnih parametrov v usedlini in vodi med prilagoditvenim obdobjem (glej tabelo v oddelku 1.8.2.2). Dve dodatni kontrolni enoti je treba vključiti v primeru, če se preskusna snov nanese s pomočjo topila, da se izmeri škodljive učinke na mikrobno dejavnost preskusnega sistema.
1.9.3 Trajanje preskusa in vzorčenje
Trajanje poskusa normalno ne presega 100 dni (6) in naj se nadaljuje, dokler se ne vzpostavijo pot razgradnje in vzorec razporeditve vode/usedline ali dokler se 90 % preskusne snovi ne porabi s transformacijo in/ali izhlapevanjem. Število vzorčenj naj bo vsaj šest (vključno z ničelnim), z neobvezno predhodno študijo (glej oddelek 1.9.4), ki se uporabi za vzpostavitev ustreznega režima vzorčenja in trajanja preskusa, razen če je iz prejšnjih študij na voljo dovolj podatkov o preskusni snovi. Za hidrofobne preskusne snovi so lahko v začetnem obdobju študije potrebne dodatne točke vzorčenja zaradi določitve stopnje razporeditve med vodno fazo in fazo usedline.
Po ustreznem številu vzorčenj se vse inkubacijske posode (v ponovitvah) odstranijo za analizo. Usedlina in nad njo ležeča voda se analizirata posebej[15]. Površinska voda se previdno odstrani s čim manjšim motenjem usedline. Pri ekstrakciji in opredelitvi preskusne snovi in produktov transformacije je treba upoštevati ustrezne analitske postopke. Paziti je treba, da se odstrani material, ki se je morda adsorbiral na inkubacijsko posodo ali na povezovalne cevi, ki se uporabljajo za zajemanje hlapnih snovi.
1.9.4 Neobvezni predhodni preskus
Če se trajanje in režim vzorčenja ne moreta oceniti po drugih ustreznih študijah preskusne snovi, je lahko primeren neobvezni predhodni preskus, ki ga je treba izvesti z uporabo enakih preskusnih razmer, kakor so predlagane za dejansko študijo. O ustreznih poskusnih razmerah in rezultatih predhodnega preskusa, če se izvede, je treba na kratko poročati.
1.9.5 Meritve in analiza
Koncentracijo preskusne snovi in produktov transformacije je treba pri vsaki ponovitvi vzorčenja izmeriti in o njej poročati (o koncentraciji in o uporabljenem odstotku). Na splošno je treba ugotoviti produkte transformacije, ki se pri katerem koli vzorčenju zaznajo pri > 10 % uporabljene radioaktivnosti v skupnem sistemu voda-usedlina, razen če ni upravičeno utemeljeno drugače. Tudi produkte transformacije, pri katerih se koncentracije med študijo nenehno povečujejo, je treba upoštevati pri ugotavljanju, tudi če njihove koncentracije ne presegajo zgornjih omejitev, ker lahko označujejo obstojnost. Slednje je treba upoštevati glede na vsak primer posebej in v poročilu podati utemeljitev.
O rezultatih iz sistemov zajemanja plinov/hlapnih snovi (CO2 in drugih, to je hlapnih organskih spojin) je treba poročati za vsako ponovitev vzorčenja. Poročati je treba o stopnjah mineralizacije. O neizločljivih (vezanih) ostankih v usedlini je treba poročati za vsako točko vzorčenja.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Skupno masno bilanco ali izkoristek (glej oddelek 1.7.1) dodane radioaktivnosti je treba izračunati za vsako ponovitev vzorčenja. O rezultatih se poroča v obliki odstotka dodane radioaktivnosti. O porazdelitvi radioaktivnosti med vodo in usedlino se poroča v obliki koncentracij in odstotkov za vsako ponovitev vzorčenja.
Razpolovna doba, DT50 in po potrebi DT75 in DT90 preskusne snovi se izračunajo skupaj z njihovim intervalom zaupanja (glej oddelek 1.7.3). Informacije o stopnji razpršitve preskusne snovi v vodi in usedlini se lahko dobijo z uporabo ustreznih ocenjevalnih orodij. Te so lahko vse od uporabe psevdo kinetike prvega reda, empiričnih tehnik prilagajanja krivulje, pri katerih se uporabljajo grafične ali številčne rešitve do bolj zapletenega ocenjevanja, na primer z uporabo eno- ali večprekatnih modelov. Nadaljnji podatki so na voljo v ustrezni objavljeni literaturi (35) (36) (37).
Vsi pristopi imajo svoje prednosti in slabosti in se znatno razlikujejo po sestavljenosti. Predpostavka kinetike prvega reda je lahko prevelika poenostavitev procesov razgradnje in porazdelitve, a kadar je mogoče, daje pojem (stopnjo konstante ali razpolovno dobo), ki je lahko razumljiv in ima vrednost pri simulacij skem modeliranju in izračunavanju predvidenih okoljskih koncentracij. Empirčni pristopi ali linearne transformacije se lahko bolje ujemajo s krivuljami podatkov in zato omogočajo boljše ocene razpolovnih dob, vrednosti DT50 in po potrebi DT75 in DT90. Uporaba izpeljanih konstant pa je omejena. Modeli s prekati lahko dajo številne uporabne konstante vrednosti pri ocenjevanju tveganja, ki opisujejo stopnjo razgradnje v različnih prekatih in porazdelitev kemikalije. Uporabljajo se lahko tudi za ocenjevanje stopnje konstant pri oblikovanju in razgradnji glavnih produktov transformacije. V vseh primerih mora biti izbrana metoda utemeljena in mora izvajalec poskusa grafično in/ali statistično prikazati, zakaj je izbira dobra.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo mora vsebovati naslednje informacije:
Preskusna snov:
— splošno ime, kemijsko ime, številko po CAS, strukturno formulo (z navedbo položaja oznak(e), kadar se uporabi radioaktivno označeni material) in ustrezne fizikalno-kemijske lastnosti,
— čistost (nečistoče) preskusne snovi,
— radiokemijsko čistost označene kemikalije in molarno dejavnost (kjer je primerno).
Referenčne snovi:
— kemijsko ime in strukturo referenčnih snovi, uporabljenih za opredelitev in/ali določitev produktov transformacije.
Preskusne usedline in vode:
— lokacijo in opis mest(a) vzorčenja vodnih usedlin, vključno, če je mogoče, s preteklo kontaminacijo,
— vse informacije v zvezi z odvzemanjem, shranjevanjem (če se izvaja) in prilagoditvijo sistemov vode in usedlin,
— značilnosti vzorcev vode in usedlin, ki so naštete v tabeli v oddelku 1.8.2.2.
Preskusni pogoji:
— uporabljeni preskusni sistem (npr. pretočni, biometrični, način prezračevanja, metodo mešanja, količino vode, maso usedline, gostoto obeh plasti, vode in usedline, mere preskusnih posod itd.),
— uporabo preskusne snovi v preskusnem sistemu: uporabljeno preskusno koncentracijo, število ponovitev in način uporabe kontrol preskusne snovi (npr. morebitno uporabo topila) itd.,
— inkubacijsko temperaturo,
— število vzorčenj,
— metode ekstrakcije in učinkovitost, pa tudi analitske metode in meje detekcije,
— metode opredelitve/določitve produktov transformacije,
— odstopanja od preskusnega protokola ali preskusnih razmer med študijo.
Rezultati:
— vrednosti surovih podatkov reprezentativnih analiz (vsi surovi podatki se morajo shraniti v GLP arhivu),
— ponovljivost in občutljivost uporabljenih analitskih metod,
— stopnje izkoristka (vrednosti v % za veljavno študijo so podane v oddelku 1.7.1),
— tabele rezultatov, izražene v % uporabljenega odmerka in v mg· kg-1 v vodi, usedlini in skupnem sistemu (samo %) za preskusno snov in, če je primerno, za produkte transformacije in neizločljivo radioaktivnost,
— masno bilanco med potekom in na koncu študij,
— grafično predstavitev transformacije v vodi in frakcijah usedlin ter v skupnem sistemu (vključno z mineralizacijo),
— stopnje mineralizacije,
— razpolovno dobo, vrednosti DT50 in po potrebi DT75 in DT90 za preskusno snov in, kadar je primerno, za glavne produkte transformacije, vključno z intervalom zaupanja v vodi, usedlini in skupnem sistemu,
— oceno kinetike transformacije za preskusno snov in, kadar je primerno, za glavne produkte transformacije,
— predlagane poti transformacije, kadar je primerno,
— razpravo o rezultatih.
4 LITERATURA
(1) BBA-Guidelines for the examination of plant protectors in the registration process. (1990). Part IV, Section 5–1: Degradability and fate of plant protectors in the water/sediment system. Nemčija.
(2) Commission for registration of pesticides: Application for registration of a pesticide. (1991). Part G. Behaviour of the product and its metabolites in soil, water and air, Section G.2.1 (a). Nizozemska.
(3) MAFF Pesticides Safety Directorate. (1992). Preliminary guideline for the conduct of biodegradability tests on pesticides in natural sediment/water systems. Ref No SC 9046. Združeno kraljestvo.
(4) Agriculture Canada: Environmental chemistry and fate. (1987). Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) – Anaerobic and aerobic. Kanada. Str. 35–37.
(5) US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982). Section 162-3, Anaerobic aquatic metabolism.
(6) SETAC-Europe publication. (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides. Ed. Dr Mark R. Lynch. SETAC-Europe, Brussels.
(7) OECD Test Guidelines Programme. (1995). Final Report of the OECD Workshop on Selection of Soils/sediments, Belgirate, Italy, 18–20 January 1995.
(8) ISO/DIS 5667-12. (1994). Water quality – Sampling – Part 12: Guidance on sampling of bottom sediments.
(9) US-EPA (1998a). Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPA 712-C-98-080.
(10) DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998).
(11) T.R. Roberts: Non-extractable pesticide residues in soils and plants. Pure Appl. Chem. 56, 945–956 (IUPAC 1984).
(12) OECD Test Guideline 304A: Inherent Biodegradability in Soil (adopted 12 May 1981).
(13) OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6–11 to Guidelines for the Testing of Chemicals.
(14) Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic model ecosystem. BCPC – Pests and Diseases, 3B-4, 149–158.
(15) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D.H. Hutson, T.R. Roberts, Eds.), Vol. 1, 85-114. J. Wiley & Sons.
(16) Madsen, T., Kristensen, P. (1997). Effects of bacterial inoculation and non-ionic surfactants on degradation of poly cyclic aromatic hydrocarbons in soil. Environ. Toxicol. Chem. 16, 631–637.
(17) Steber, J., Wierich, P. (1987). The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with 14C-labelled model surfactants. Water Research 21, 661–667.
(18) Black, C.A. (1965). Methods of Soil Analysis. Agronomy Monograph No. 9. American Society of Agronomy, Madison.
(19) APHA (1989). Standard Methods for Examination of Water and Wastewater (17th edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C.
(20) Rowell, D.L. (1994). Soil Science Methods and Applications. Longman.
(21) Light, T.S. (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, 1038–1039.
(22) SETAC-Europe publication (1991). Guidance document on testing procedures for pesticides in freshwater mesocosms. From the Workshop „A Meeting of Experts on Guidelines for Static Field Mesocosms Tests“, 3–4 July 1991.
(23) SETAC-Europe publication. (1993). Guidance document on sediment toxicity tests and bioassays for freshwater and marine environments. From the Workshop On Sediment Toxicity Assessment (WOSTA), 8-10 November 1993. Eds.: I.R. Hill, P. Matthiessen and F. Heimbach.
(24) Vink, J.P.M., van der Zee, S.E.A.T.M. (1997). Pesticide biotransformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, 2858–2868.
(25) Vink, J.P.M., Schraa, G, van der Zee, S.E.A.T.M. (1999). Nutrient effects on microbial transformation of pesticides in nitrifying waters. Environ. Toxicol, 329–338.
(26) Anderson, T.H., Domsch, K.H. (1985). Maintenance carbon requirements of actively-metabolising microbial populations under in-situ conditions. Soil Biol. Biochem. 17, 197–203.
(27) ISO-14240-2. (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method.
(28) Beelen, P. Van and F. Van Keulen. (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), 13–21.
(29) Shelton, D.R. and Tiedje, J.M. (1984). General method for determining anaerobic biodegradation potential. App. Environ. Microbiol. 47, 850–857.
(30) Birch, R.R., Biver, C, Campagna, R., Gledhill, W.E., Pagga, U., Steber, J., Reust, H. and Bontinck, W.J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527–1550.
(31) Pagga, U. and Beimborn, D.B. (1993). Anaerobic biodegradation tests for organic compounds. Chemoshpere 27, 1499–1509.
(32) Nuck, B.A. and Federle, T.W. (1986). A batch test for assessing the mineralisation of 14C-radiolabelled compounds under realistic anaerobic conditions. Environ. Sci. Technol. 30, 3597–3603.
(33) US-EPA (1998b). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPA 712-C-98-090.
(34) Sijm, Haller and Schrap (1997). Influence of storage on sediment characteristics and drying sediment on sorption coefficients of organic contaminants. Bulletin Environ. Contam. Toxicol. 58, 961–968.
(35) Timme, G., Frehse H. and Laska V. (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues II. Pflanzenschutz-Nachrichten Bayer, 39, 187–203.
(36) Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues I. Pflanzenschutz – Nachrichten Bayer, 33, 47–60.
(37) Carlton, R.R. and Allen, R. (1994). The use of a compartment model for evaluating the fate of pesticides in sediment/water systems. Brighton Crop Protection Conference – Pest and Diseases, str. 1349–1354.
DODATEK 1
NAPOTKI ZA AEROBNE IN ANAEROBNE PRESKUSNE SISTEME
Aerobni preskusni sistem
Aerobni preskusni sistem, opisan v tej preskusni metodi, je sestavljen iz aerobne vodne plasti (tipične koncentracije kisika so v razponu od 7 do 10 mg· 1-l) in plasti usedline, aerobne na površini in anaerobne pod površino (tipični povprečni redoks potenciali (Eh) v anaerobni coni usedline so v razponu od –80 do –190 mV). V vsaki inkubacijski enoti se vlažen zrak spusti preko površine vode, da se ohrani dovolj kisika v volumnu nad vzorcem.
Anaerobni preskusni sistem
Pri anaerobnem preskusnem sistemu je preskusni postopek v bistvu enak kakor je opisan za aerobni sistem, le da se preko površine vode v vsaki inkubacijski enoti spusti dušik za ohranjanje dušika v volumnu nad vzorcem. Usedlina in voda se štejeta za anaerobna, dokler je redoks potencial (Eh) nižji od –100 mV.
Pri anaerobnem preskusu ocenjevanje mineralizacije vključuje meritve vsebovanega ogljikovega dioksida in metana.
DODATEK 2
PRIMER PLINSKE PRETOČNE NAPRAVE

DODATEK 3
PRIMER BIOMETRIČNE NAPRAVE

DODATEK 4
PRIMER IZRAČUNA ZA DOLOČANJE KONCENTRACIJE PRESKUSNE SNOVI V PRESKUSNIH POSODAH
|
Notranji premer cilindra: |
= 8 cm |
|
Globina vodne kolone brez usedline: |
= 12 cm |
|
Površina: 3,142 × 42 |
= 50,3 cm2 |
|
Stopnja aplikacije: 500 g preskusne snovi/ha ustreza 5 μg/cm2 |
|
|
Skupno μg: 5 × 50,3 |
= 251,5 μg |
|
Prilagojena količina glede na globino 100 cm: 12 × 251,5 ÷100 |
= 30,18 μg |
|
Volumen vodne kolone: 50,3 × 12 |
= 603 ml |
|
Koncentracija v vodi: 30,18 ÷ 603 |
= 0,050 μg/ml ali 50 μg/l |
C.25. AEROBNA MINERALIZACIJA V POVRŠINSKI VODI – SIMULACIJSKI PRESKUS BIORAZGRADNJE
1 METODA
Ta preskusna metoda je enakovredna OECD TG 309 (2004) (1).
1.1 UVOD
Namen tega preskusa je izmeriti časovni potek biorazgradnje preskusne snovi z nizko koncentracijo v aerobni naravni vodi in opažanja količinsko opredeliti v obliki enačbe kinetike. Ta simulacijski preskus je laboratorijski preskus serije stresanih bučk za določitev hitrosti aerobne biorazgradnje organskih snovi v vzorcih naravne površinske vode (sladke, brakične ali morske). Temelji na ISO/DIS 14592–1 (2) in vključuje tudi elemente iz preskusnih metod C.23 in C.24 (3)(4). Pri preskušanjih, ki trajajo dolgo, lahko neobvezno polkontinuirano delovanje zamenja serije, da se prepreči razpad mikrokozma. Glavni cilj simulacijskega preskusa je določitev mineralizacije preskusne snovi v površinski vodi in mineralizacija predstavlja osnovo za izražanje kinetike razgradnje. Vendar je neobvezni sekundarni cilj preskusa pridobiti podatke o primarni razgradnji in o tvorbi poglavitnih produktov transformacije. Določitev produktov transformacije in po možnosti količinska opredelitev njihovih koncentracij, sta zlasti pomembna za snovi, ki se zelo počasi mineralizirajo (npr. ko razpolovna doba skupnega ostanka 14C presega 60 dni). Običajno se za določitev in količinsko opredelitev produktov transformacije uporabijo višje koncentracije preskusne snovi (npr, > 100 μg/l) zaradi analitičnih omejitev.
Nizka koncentracija v tem preskusu pomeni koncentracijo (npr. manj kot 1 μg/l do 100 μg/l), ki je dovolj nizka, da se v preskusu zagotovi biorazgradna kinetika, ki odraža biorazgradno kinetiko, kakršna se pričakuje v okolju. V primerjavi s skupno maso biorazgradljivih substratov iz ogljika, ki so na voljo v naravni vodi, uporabljeni v preskusu, bo preskusna snov v nizki koncentraciji služila kot sekundarni substrat. Ta pomeni, da je pričakovana biorazgradna kinetika prvega reda (kinetika „brez rasti“) in da se lahko preskusna snov razgradi s „sopresnovo“. Kinetika prvega reda pomeni, da je hitrost razgradnje (mg/l/dan) sorazmerna s koncentracijo substrata, ki se s časom znižuje. Pri kinetiki pravega prvega reda je konstanta specifične hitrosti razgradnje k neodvisna od časa in koncentracije. To pomeni, da se k znatno ne spreminja med potekom poskusa in se ne spremeni, če se med poskusi koncentracija doda. Po opredelitvi je konstanta specifične hitrosti razgradnje enaka relativni spremembi koncentracije s časom: k = (1/C) · (dC/dt). Čeprav v predpisanih pogojih običajno pričakujemo kinetiko prvega reda, so določenih okoliščinah bolj primerne druge kinetike. Odstopanja od kinetike prvega reda lahko npr. opazimo, če hitrost biopretvorbe namesto hitrosti biološke reakcije omejuje pojav prenosa mase, kot je hitrost difuzije. Vendar lahko podatke skoraj vedno opišemo s psevdo kinetiko prvega reda s sprejeto konstanto odvisno od koncentracije.
Pred preskušanjem morajo biti na voljo podatki od biorazgradljivosti preskusne snovi v višjih koncentracijah (npr. v standardnih presejalnih preskusih) kot tudi podatki o abiotski razgradljivosti, produktih transformacije in pomembnih fizikalno-kemijskih lastnostih, da se omogoči načrtovanje poskusa in interpretacija rezultatov. Določitev popolne biorazgradljivosti omogočajo preskusne snovi, označene s 14C, in določevanje fazne porazdelitve 14C na koncu preskusa. Če se uporablja neoznačena preskusna snov, se lahko popolna biorazgradnja oceni le, če se preskuša višja koncentracija in če so znani vsi poglavitni produkti transformacije.
1.2 OPREDELITVE
Primarna biorazgradnja: Strukturna sprememba (transformacija) kemijske snovi z mikroorganizmi, pri čemer izgine kemijska identiteta.
Funkcionalna biorazgradnja: Strukturna sprememba (transformacija) kemijske snovi z mikroorganizmi, pri čemer izgine specifična lastnost.
Popolna aerobna biorazgradnja: Razgradnja kemijske snovi z mikroorganizmi v prisotnosti kisika v ogljikov dioksid in mineralne soli katerih koli drugih elementov, ki so prisotni, (mineralizacija) ter nastanek nove biomase in organskih produktov mikrobne biosinteze.
Mineralizacija: Razgradnja kemijske ali organske snovi z mikroorganizmi v prisotnosti kisika v ogljikov dioksid, vodo in mineralne soli katerih koli drugih elementov, ki so prisotni.
Faza prilagajanja: Čas, ki preteče od začetka preskusa, dokler se razgradni mikroorganizmi ne prilagodijo in dokler se stopnja biorazgradnje kemijske ali organske snovi ne poveča do zaznavne ravni (npr. 10 % največje teoretične biorazgradnje ali manj, odvisno od točnosti merilne tehnike).
Največja stopnja biorazgradnje: Stopnja biorazgradnje kemijske ali organske snovi v preskusu v odstotkih, nad katero v preskusu ni bilo dodatne biorazgradnje.
Primarni substrat: Zbirka naravnih virov ogljika in energije, ki omogočajo rast in ohranjanje mikrobne biomase.
Sekundarni substrat: Sestavina substrata, ki je prisotna v tako nizki koncentraciji, da pri svoji razgradnji mikroorganizmom, zmožnim razgradnje te snovi, prinese le nepomembno količino ogljika in energije v primerjavi s količino ogljika in energije, ki jo prinese razgradnja sestavin glavnenega substrata (primarnih substratov).
Konstanta hitrosti razgradnje: Konstanta kinetike prvega reda ali psevdo kinetike prvega reda k (d–1), ki kaže hitrost razgradnje v procesu. V serijskem poskusu se k oceni iz začetnega dela krivulje razgradnje, ki se izdela po koncu faze prilagajanja.
Razpolovna doba, t1/2 (d): Izraz, ki opisuje hitrost reakcije prvega reda. Razpolovna doba je čas, ki ustreza znižanju koncentracije za faktor 2. Razpolovna doba in konstanta hitrosti razgradnje sta v zvezi v enačbi t1/2 = ln2/k.
Razpolovna doba razgradnje, DT50 (d): Izraz, s katerim se količinsko opredeli izid preskusov biorazgradnje. Razpolovna doba razgradnje je čas, vključno s fazo prilagajanja, ki je potreben za doseganje 50-odstotne biorazgradnje.
Meja zaznavnosti (LOD) in meja količinske opredelitve (LOQ): Meja zaznavnosti (LOD) je koncentracija snovi, pod katero identitete snovi ni možno razlikovati od analitičnih artefaktov. Meja količinske opredelitve (LOQ) je koncentracija snovi, pod katero koncentracije ni možno določiti s sprejemljivo natančnostjo.
Raztopljeni organski ogljik (DOC): Tisti del organskega ogljika v vzorcu vode, ki ga ni mogoče odstraniti z navedeno separacijo faz, npr. s centrifugiranjem pri 40 000 ms–2 za 15 min ali z membransko filtracijo z membranami, ki imajo pore s premerom od 0,2 μm do 0,45 μm.
Skupna aktivnost organskega 14C (TOA): Skupna aktivnost 14C, odvisna od organskega ogljika.
Aktivnost raztopljenega organskega 14C (DOA): Skupna aktivnost 14C, odvisna od raztopljenega organskega ogljika.
Aktivnost organskega 14C v delcih (POA): Skupna aktivnost 14C, odvisna od organskega ogljika v delcih.
1.3 UPORABNOST PRESKUSA
Ta simulacijski preskus se uporablja za nehlapne ali rahlo hlapne organske spojine, ki se preskušajo v nizkih koncentracijah. Če se uporabljajo bučke odprte proti atmosferi (npr. zamašene z vato) se snovi s konstantami Henryevega zakona manj od približno 1 Pa·m3/mol (približno 10–5 atm·m3/mol) lahko štejejo za praktično nehlapne. Z uporabo zaprtih bučk z nadprostorom je možno preskušati rahlo hlapne snovi (s konstantami Henryevega zakona < 100 Pa·m3/mol ali < 10–3 atm·m3/mol) brez izgub iz preskusnega sistema. Če se pri odstranjevanju CO2 ne upoštevajo ustrezni previdnostni ukrepi, lahko to povzroči izgubo snovi, označenih s 14C. V takšnih primerih bo morda treba zajeti CO2 v notranjo absorpcijsko posodo z alkalijskimi snovmi ali uporabiti zunanji absorpcijski sistem za CO2 (neposredno določevanje 14CO2; glejte Prilogo 3). Za določevanje kinetike biorazgradnje morajo biti koncentracije preskusne snovi pod lastno topnostjo v vodi. Kljub temu je treba opozoriti, da so lahko vrednosti topnosti v vodi iz literature znatno višje od topnosti preskusne snovi v naravnih vodah. Neobvezno se lahko določi topnost še zlasti slabo vodotopnih preskusnih snovi z uporabo preskušanih naravnih vod.
Ta metoda se lahko uporabi za simuliranje biorazgradnje v površinskih vodah brez grobih delcev (pelagični preskus) ali v motnih površinskih vodah, ki so blizu mejne ploskve med vodo in sedimentom (preskus suspendiranega sedimenta).
1.4 PRINCIP PRESKUSNE METODE
Preskus se opravi v seriji z inkubacijo preskusne snovi bodisi s samo površinsko vodo (pelagični preskus) bodisi s površinsko vodo z dodanimi suspendiranimi trdnimi snovmi/sedimentom v koncenctraciji 0,01 do 1 g/l suhe mase (preskus suspendiranega sedimenta), da se simulira vodno telo s suspendiranim ali resuspendiranim sedimentom. Za večino površinskih vod je značilna koncentracija suspendiranih trdnih snovi/sedimenta na spodnji meji navedenega razpona. Preskusne bučke se inkubirajo v temi pri temperaturi okolja v aerobnih pogojih in ob agitaciji. Za določitev kinetike biorazgradnje je treba uporabiti najmanj dve različni koncentraciji preskusne snovi. Koncentraciji se morata med seboj razlikovati za faktor od 5 do 10. Koncentraciji morata predstavljati pričakovano območje koncentracij v okolju. Najvišja koncentracija preskusne snovi ne sme preseči 100 μg/l, vendar imajo kot najvišje koncentracije prednost preskusne koncentracije pod 10 μg/l ali manj, s čimer se zagotovi, da biorazgradnja sledi kinetiki prvega reda. Najnižja koncentracija ne sme preseči 10 μg/l, vendar imajo kot najnižje koncentracije prednost preskusne koncentracije od 1 do 2 μg/l ali manj kot 1 μg/l. Običajno je mogoče zadostno analizo tako nizkih koncentracij doseči s komercialno dostopnimi snovmi, označenimi s 14C. Če se preskusna snov vnese v koncentraciji ≤ 100 μg/l, je zaradi analitskih omejitev pogosto nemogoče izmeriti koncentracijo preskusne snovi z zahtevano točnostjo (glejte drugi odstavek oddelka 1.7.2). Za določitev in količinsko opredelitev poglavitnih produktov transformacije ali kadar ni na voljo specifična analitska metoda z nizko mejo zaznavnosti, se lahko uporabijo višje koncentracije preskusne snovi (> 100 μg/l ali včasih > 1 mg/l). Če se preskušajo visoke koncentracije preskusne snovi, morda ne ni možno uporabiti rezultatov za oceno konstante razgradnje prvega reda in razpolovne dobe, saj razgradnja ne bo sledila kinetiki prvega reda.
Razgradnjo je treba spremljati v ustreznih časovnih razmikih z merjenjem bodisi preostalega 14C bodisi preostale koncentracije preskusne snovi, če se uporabi specifična kemijska analiza. Označevanje najbolj obstojnega dela molekule s 14C omogoča določevanje skupne mineralizacije. Označevanje manj obstojnega dela molekule s 14C in specifična analiza pa omogočata vrednotenje le primarne biorazgradnje. Vendar ni nujno, da najbolj obstojen del molekule obsega relevantno funkcionalno področje molekule (področje, ki je odvisno od specifične lastnosti, npr. strupenosti, bioakumulacije itn.). V tem primeru je morda treba uporabiti preskusno snov, ki je označena s 14C v funkcionalnem delu, da je mogoče slediti odstranjevanju specifične lastnosti.
1.5 PODATKI O PRESKUSNI SNOVI
V tem preskusu je mogoče uporabiti radioaktivno označene in neoznačene preskusne snovi. Priporočljiva je tehnika označevanja s 14C, pri čemer se običajno označi(-jo) najobstojnejši del(-i) molekule (glejte tudi oddelek 1.4). Za snovi, ki vsebujejo več kot en aromatski obroč, enega ali več ogljikovih atomov v vsakem obroču, je označevanje s 14C prednostno. Poleg tega ima prednost označevanje enega ali več ogljikovih atomov s 14C na obeh straneh lahko cepljivih vezi. Kemijska in/ali radiokemijska čistota preskusne snovi mora biti > 95 %. Pri radioaktivno označenih snoveh ima prednost specifična aktivnost približno 50 μCi/mg (1,85 MBq) ali več, kar omogoči merjenje 14C v preskusih, ki vsebujejo nizke začetne koncentracije. Na voljo morajo biti naslednji podatki o preskusni snovi:
— topnost v vodi [metoda A.6],
— topnost v organskem topilu ali organskih topilih (za snovi, ki se vnesejo s topilom ali imajo majhno topnost v vodi),
— disociacijska konstanta (pKa), če je snov nagnjena k protonaciji ali deprotonaciji [OECD TG 112] (5),
— parni tlak [metoda A.4] in konstanta Henryevega zakona,
— kemijska obstojnost v vodi v temi (hidroliza) [metoda C.7].
V primeru preskušanja slabo vodotopnih snovi v morski vodi je morda uporabno poznati konstanto izsoljevanja (ali „Setschenowovo konstanto“) Ks, ki je določena z enačbo: log (S/S’) = Ks Cm, kjer pomeni: S – topnost snovi v sladki vodi, S’ – topnost snovi v morski vodi in Cm – molarnost soli.
Če se preskus opravlja kot „preskus suspendiranega sedimenta“, morajo biti na voljo tudi naslednji podatki:
— porazdelitveni koeficient n-oktanol/voda [metoda A.8],
— adsorpcijski koeficient [metoda C.18].
Drugi uporabni podatki so med drugim:
— koncentracija v okolju, če je znana ali ocenjena,
— strupenost preskusne snovi za mikroorganizme [metoda C.11],
— lahka in/ali inherentna biorazgradljivost [metode C.4 A–F, C.12, C.9, OECD TG 302 (5)],
— aerobna ali anaerobna biorazgradljivost v raziskavah transformacije v prsti in sedimentu/vodi [metode C.23, C.24].
1.6 REFERENČNA SNOV
Kot referenčno snov je treba uporabiti snov, ki se običajno lahko razkraja v aerobnih pogojih (npr. anilin ali natrijev benzoat). Pričakovani časovni interval razgradnje anilina in natrijevega benzoata je ponavadi manj kot 2 tedna. Namen referenčnih snovi je zagotoviti, da je mikrobna aktivnost v preskusni vodi v določenih mejah, tj. da voda vsebuje aktivno mikrobno populacijo.
1.7 MERILA KAKOVOSTI
1.7.1 Izkoristek
Neposredno po dodatku preskusne snovi je treba vsako začetno preskusno koncentracijo najmanj v dveh vzorcih preveriti z meritvami aktivnosti 14C ali s kemijskimi analizami v primeru neoznačenih snovi. S tem se pridobijo podatki o uporabnosti in ponovljivosti analitske metode in podatki o homogenosti porazdelitve preskusne snovi. Običajno se v naknadnih analizah podatkov namesto nazivne koncentracije uporablja izmerjena začetna aktivnost 14C ali koncentracija preskusne snovi, saj se s tem upoštevajo izgube zaradi sorpcije in napak pri odmerjanju. Za snovi, označene s 14C, izkoristek na koncu preskusa daje masna bilanca (glejte zadnji odstavek oddelka 1.8.9.4). V idealnem primeru bi morala biti bilanca radioaktivne mase v območju od 90 % do 110 %, vendar za neoznačene preskusne snovi analitska točnost privede do začetnega izkoristka med 70 % in 110 %. Ta območja se morajo šteti za ciljna in ne kot kriteriji za sprejemljivost preskusa. Neobvezno se lahko za preskusno snov določi analitska točnost pri nižji koncentraciji kot je začetna koncentracija in tudi za poglavitne produkte transformacije.
1.7.2 Ponovljivost in občutljivost analitske metode
Ponovljivost analitske metode (vključno z učinkovitostjo začetne ekstrakcije) za količinsko opredelitev preskusne snovi in proizvodov transformacije, če je smiselno, je treba preveriti s petimi ponovitvami analiz posameznih ekstraktov površinske vode.
Meja zaznavnosti (LOD) analitske metode za preskusno snov in za produkte transformacije mora biti, če je možno, vsaj 1 % začetne vnesene količine v preskusnem sistem. Meja količinske opredelitve (LOQ) mora biti enaka ali manj od 10 % vnesene koncentracije. Kemijske analize številnih organskih snovi in njihovih produktov transformacije pogosto zahtevajo vnos relativno visoke koncentracije preskusne snovi, tj. > 100 μg/l.
1.8 OPIS PRESKUSNE METODE
1.8.1 Oprema
Preskus se lahko opravlja v stožčastih ali valjastih bučkah ustrezne prostornine (npr. 0,5 ali 1,0 litra), ki so zamašene z zamaški iz silikona ali kavčuka. Preskus se lahko opravlja tudi v serumskih bučkah z zaporkami, ki tesnijo CO2 (npr. septumi z butilnega kavčuka). Druga možnost je izvedba preskusa z uporabo več bučk, pri čemer se v vzorčnih časovnih razmikih odvzameta najmanj dve celi bučki (glejte zadnji odstavek oddelka 1.8.9.1). Za nehlapne preskusne snovi, ki niso radioaktivno označene, plinotesni zamaški ali zaporke niso potrebne; primerni so vatirani čepi, ki preprečujejo onesnaženje iz zraka (glejte drugi odstavek oddelka 1.8.9.1). Rahlo hlapne snovi je treba preskusiti v sistemu biometričnega tipa z blagim mešanjem vodne gladine. Zagotoviti je treba, da ne pride do bakterijskega onesnaženja. Neobvezno se lahko posode pred uporabo sterilizirajo s segrevanjem ali avtoklaviranjem. Poleg naštetega, je potrebna naslednja standardna laboratorijska oprema:
— stresalna miza ali magnetni mešalniki za neprekinjeno agitacijo preskusnih bučk,
— centrifuga,
— pH-meter,
— turbidimeter za nefelometrične meritve motnosti,
— pečica ali mikrovalovna pečica za določitev suhe mase,
— oprema za membransko filtracijo,
— avtoklav ali pečica za toplotno sterilizacijo steklovine,
— oprema za ravnanje s snovmi, označenimi s 14C,
— oprema za količinsko opredelitev aktivnosti 14C v vzorcih iz raztopin za lovljenje CO2 in, če je treba, iz vzorcev sedimenta,
— analitska oprema za določevanje preskusne (in referenčne) snovi, če se uporablja kemijska analiza (npr. plinski kromatograf, visokotlačni tekočinski kromatograf).
1.8.2 Založne raztopine preskusne snovi
Za pripravo založnih raztopin preskusne in referenčne snovi je treba uporabiti deionizirano vodo (glejte prvi odstavek oddelka 1.8.7). Deionizirana voda mora biti brez snovi, ki so lahko strupene za mikroorganizme. Ne sme vsebovati več kot 1 mg/l raztopljenega organskega ogljika (DOC) (6).
1.8.3 Odvzem in prevoz površinske vode
Mesto vzorčenja površinske vode je treba izbrati v skladu z namenom preskusa v dani situaciji. Pri izbiranju mesta vzorčenja je treba upoštevati preteklost morebitnih kmetijskih, industrijskih ali domačih vnosov. Če je bilo vodno okolje v zadnjih štirih letih onesnaženo s preskusno snovjo ali njenimi strukturnimi analogi, se ne sme uporabiti za odvzem preskusne vode, razen če je raziskovanje hitrosti razgrajevanja na predhodno izpostavljenih mestih izrecen namen raziskovalca. Na mestu vzorčenja je treba izmeriti pH in temperaturo vode. Zabeležiti je treba tudi globino vzorčenja in izgled vzorca vode (npr. barva in motnost) (glejte oddelek 3). Izmeriti je treba koncentracijo kisika in/ali redoks potencial v vodi ter v površinskem sloju sedimenta, da se dokažejo aerobni pogoji, razen če je to očitno na podlagi izgleda in preteklih izkušenj na mestu vzorčenja. Površinsko vodo je treba prenesti v temeljito očiščeni posodi. Med prevozom temperatura vzorca ne sme bistveno preseči temperature, ki se uporablja med preskusom. Če trajanje prevoza preseže 2 do 3 ure, je priporočljivo ohlajanje na 4 °C med prevozom. Vzorec vode ne sme zamrzniti.
1.8.4 Shranjevanje in priprava površinske vode
Preskus je treba po možnosti začeti v enem dnevu po odvzemu vzorca. Trajanje shranjevanja vode, kadar je potrebno, je treba čimbolj skrajšati. V nobenem primeru pa ne sme preseči 4 tednov. Do uporabe je treba vzorec vode hraniti pri 4 °C z aeracijo. Pred uporabo je treba odstraniti grobe delce, npr. s filtracijsko skozi najlonski filter z velikostjo mreže približno 100 μm ali skozi grobi filter papir oz. s sedimentacijo.
1.8.5 Priprava vode z dodanim sedimentom (neobvezno)
Za preskus suspendiranega sedimenta je treba v bučke, ki vsebujejo naravno vodo (filtrirano za odstranitev grobih delcev, kakor je opisano v razdelku 1.8.4), dodati površinski sediment, da nastane suspenzija. Koncentracija suspendiranih trdnih snovi mora biti med 0,01 in 1 g/l. Površinski sediment mora izvirati iz istega mesta vzorčenja kot vzorec vode. Odvisno od posameznega vodnega okolja je možno opredeliti površinski sediment kot sediment z visoko vsebnostjo organskega ogljika (2,5–7,5 %) in fino teksturo ali kot sediment z nizko vsebnostjo organskega ogljika (0,5–2,5 %) in grobo teksturo (3). Površinski sediment se lahko pripravi po naslednjem postopku: neposredno po vzorčenju se s cevko iz prosojne plastične mase izvleče več sredic sedimenta, odreže zgornje aerobne plasti (od površine do globine največ 5 mm), nato pa se sredice združijo. Dobljeni vzorec sedimenta je treba prenesti v posodi z dovolj velikim zračnim nadprostorom, da je sediment v aerobnih pogojih (če trajanje prevoza preseže 2 do 3 ure, je potrebno ohlajanje na 4 °C). Vzorec sedimenta je treba suspendirati v preskusni vodi v razmerju 1:10 in do uporabe hraniti pri 4 °C z aeracijo. Trajanje shranjevanja sedimenta, kadar je potrebno, je treba čimbolj skrajšati. V nobenem primeru pa ne sme preseči 4 tednov.
1.8.6 Polkontinuiran postopek (neobvezen)
Če je potrebno dlje časa trajajoče prilagajanje preden je mogoče izmeriti znatno razgradnjo preskusne snovi, bo morda potrebna daljša inkubacija (več mesecev). Če je to znano iz predhodnega preskušanja snovi, se lahko preskus začne s polkontinuiranim postopkom, ki omogoča obdobno obnavljanje dela preskusne vode ali suspenzije (glejte Prilogo 2). Namesto tega se lahko običajni serijski preskus spremeni v polkontinuirani postopek, če v približno 60 dneh ne pride do razgradnje preskusne snovi v serijskem postopku (glejte drugi odstavek oddelka 1.8.8.3).
1.8.7 Dodajanje preskusne (ali referenčne) snovi
Za snovi z veliko topnostjo v vodi (> 1 mg/l) in majhno hlapnostjo (konstante Henryevega zakona < 1 Pa·m3/mol ali < 10–5 atm·m3/mol) se lahko pripravi založna raztopina v deionizirani vodi (glejte oddelek 1.8.2). Ustrezni volumni založne raztopine se lahko dolivajo v preskusne posode, da se doseže želena koncentracija. Volumen kakršne koli dodane založne raztopine mora biti najmanjši praktični volumen (< 10 % končnega volumna tekočine, če je možno). Drugačen postopek je raztapljanje preskusne snovi v večjem volumnu preskusne vode, kar je morda lahko alternativni postopek namesto uporabe organskih topil.
Če se temu ne da izogniti, je treba založne raztopine nehlapnih snovi s slabo topnostjo v vodi pripraviti s hlapnim organskim topilom, vendar količina topila, dodanega v preskusni sistem, ne sme presegati 1 % v/v in ne sme imeti škodljivih učinkov na mikrobno dejavnost. Topilo ne sme vplivati na obstojnost preskusne snovi v vodi. Topilo je treba zmanjšati na izjemno majhno količino, tako da bistveno ne poveča koncentracije DOC v preskusni vodi ali suspenziji. To je treba preveriti z analizo, specifično za snov, ali, če je možno, analizo DOC (6). Zelo veliko pozornosti je treba posvetiti omejevanju količine prenesenega topila na zares potrebno količino. Ravno tako natančno pa je treba preveriti, da se količina preskusne snovi lahko raztopi v končnem volumnu preskusne vode. Uporabijo se lahko druge tehnike za vnos preskusne snovi v preskusne posode, kot so opisane v (7) in (8). Kadar se za vnos preskusne snovi uporablja organsko topilo, je treba kontrolne vzorce s topilom, ki vsebujejo preskusno vodo (brez dodatkov), in preskusno vodo z dodatkom referenčne snovi obdelati podobno kot aktivne preskusne posode z dodatno preskusno snovjo v topilu kot nosilcu. Namen kontrolnih vzorcev s topilom je preveriti možne neželene učinke topila na mikrobno populacijo, kar se pokaže z razgradnjo referenčne snovi.
1.8.8 Preskusni pogoji
1.8.8.1 Preskusna temperatura
Inkubacijo je treba izvajati v temi (prednostno) ali v difuzni svetlobi pri kontrolirani (± 2 °C) temperaturi. Temperatura je lahko temperatura na terenu ali standardna temperatura 20–25 °C. Temperatura na terenu je lahko bodisi dejanska temperatura na mestu vzorčenja v času vzorčenja ali povprečna terenska temperatura na mestu vzorčenja.
1.8.8.2 Agitacija
Zagotoviti je treba agitacijo z neprekinjenim stresanjem ali mešanjem, da se delci in mikroorganizmi ohranjajo v suspenziji. Agitacija tudi olajša prenos kisika iz nadprostora v tekočino, da se lahko zadostno ohranjajo aerobni pogoji. Bučke se postavijo na stresalno mizo (stresanje s hitrostjo približno 100 o/min) ali pa se uporabi magnetno mešanje. Agitacija mora biti neprekinjena. Kljub temu, mora biti stresanje ali mešanje čimbolj nežno, da se še ohranja homogena suspenzija.
1.8.8.3 Trajanje preskusa
Trajanje preskusa običajno ne sme preseči 60 dni, razen če se uporabi polkontinuiran postopek z obdobnim obnavljanjem preskusne suspenzije (glejte oddelek 1.8.6 in Prilogo 2). Če pa se razgradnja preskusne snovi začne v prvih 60 dneh, je možno serijski preskus podaljšati do največ 90 dni. Razgradnjo je treba spremljati v ustreznih časovnih razmikih z določevanje bodisi preostalega 14C bodisi sproščenega 14CO2 (glejte oddelek 1.8.9.4) in/ali s specifično kemijsko analizo (glejte 1.8.9.5). Trajanje inkubacije mora biti dovolj dolgo, da se ovrednoti postopek razgradnje. Obseg razgradnje mora prednostno preseči 50 %; za počasi razgradljive snovi mora biti obseg razgradnje zadosten (običajno večji od 20 %), da se lahko oceni kinetična konstanta hitrosti razgradnje.
V preskusnem sistemu je treba opraviti obdobne meritve pH in koncentracije kisika, razen če so takšne meritve nepotrebne zaradi predhodnih izkušenj iz podobnih preskusov z vodo in sedimenti iz istega mesta vzorčenja. V nekaterih pogojih lahko presnova primarnih substratov v veliko višjih koncentracijah v vodi ali sedimentu povzroči dovolj sproščenega CO2 in izrabo kisika, da se bistveno spremenijo pogoji poskusa.
1.8.9 Postopek
1.8.9.1 Priprava bučk za pelagični preskus
Primeren volumen preskusne vode se prenese v preskusne bučke, ki se napolnijo do približno ene tretjine volumna bučke, vendar ne manj kot približno 100 ml. Če se uporabi več bučk (da je omogočen odvzem celotnih bučk za vsako vzorčenje) je primeren volumen preskusne vode tudi približno 100 ml, saj lahko majhni volumni vzorca vplivajo na dolžino faze prilagajanja. Preskusna snov se doda iz založne raztopine, kakor je opisano v oddelkih 1.8.2 in 1.8.7. Uporabiti je treba najmanj dve različni koncentraciji preskusne snovi, ki se razlikujeta za faktor od 5 do 10, da se določi kinetika razgradnje in izračuna kinetična konstanta hitrosti razgradnje. Obe izbrani koncentraciji morata biti nižji od 100 μg/l in prednostno v območju < 1–10 μg/l.
Bučke se zaprejo z zamaški ali zaporkami, ki ne prepuščajo zraka in CO2. Za nehlapne preskusne kemikalije, ki niso označene s 14C, so primerni razrahljani vatirani čepi, ki preprečujejo onesnaženje iz zraka (glejte oddelek 1.8.1), pod pogojem, da je za poglavitne produkte razgradnje znano, da so nehlapni in da se uporablja posredno določevanje CO2 (glejte Dodatek 3).
Bučke inkubirajte pri izbrani temperaturi (glejte oddelek 1.8.8.1). Vzorci za kemijsko analizo ali meritve 14C se odvzamejo na začetku preskusa (tj. preden se začne biorazgradnja; glejte oddelek 1.7.1) in v primernih časovnih razmikih med preskusom. Vzorčenje se opravi z odvzemom podvzorcev (npr. 5-ml alikvotov) iz vsake ponovitve ali z odvzemom celotnih bučk pri vsakem času vzorčenja. Mineralizacija preskusne snovi se lahko določi posredno ali neposredno (glejte Dodatek 3). Običajno je med fazo razgradnje (tj. po zaključeni fazi prilagajanja) potrebnih najmanj pet vzorčnih točk, da se zanesljivo oceni konstanta hitrosti, razen če se za hitro razgradljive snovi utemelji, da so dovolj tri vzorčne točke. Za snovi, ki se ne razkrajajo hitro, je med fazo razgradnje enostavno opraviti več meritev in zato je treba v oceno k vključiti več podatkovnih točk. Ni mogoče določiti fiksnega časovnega razporeda vzorčenja, saj hitrost biorazgradnje variira. Vendar pa je priporočljivo vzorčiti enkrat tedensko, če je razgradnja počasna. Če se preskusna snov hitro razkraja, je treba vzorčenje opraviti enkrat dnevno v prvih treh dneh in nato vsak drug ali tretji dan. V določenih pogojih, kot so zelo hitro hidrolizirajoče snovi, je morda treba vzorčiti v urnih razmikih. Priporočljivo je, da se pred preskusom opravi predhodna raziskava, v kateri se določijo ustrezni razmiki vzorčenja. Če je treba vzorce ohraniti za dodatne specifične analize, je priporočljivo, da se odvzame več vzorcev in izberejo tisti, ki jih je treba analizirati na koncu poskusa z vzvratno strategijo, tj. zadnji vzorci se analizirajo prvi (glejte drugi odstavek v oddelku 1.8.9.5 za smernice o obstojnosti vzorcem med shranjevanjem).
1.8.9.2 Število bučk in vzorcev
Pripraviti je treba dovolj veliko število preskusnih bučk, da so na voljo:
— preskusne bučke; najmanj dvojnik za vsako koncentracijo preskusne snovi (prednostno najmanj 3) ali več preskusnih bučk za vsako koncentracijo, če se ob vsakem vzorčenju odvzamejo cele bučke (označene z FT),
— preskusne bučke za izračun masne bilance; najmanj dvojnik za vsako preskusno koncentracijo (označeno z FM),
— slepi kontrolni vzorec brez preskusne snovi; najmanj ena slepa kontrolna preskusna bučka, ki vsebuje le preskusno vodo (označeno z FB),
— referenčni kontrolni vzorec; dvojnik z referenčno snovjo (npr. anilin ali natrijev benzoat, koncentracija 10 μg/l) (označeno z FC). Namen referenčnega kontrolnega vzorca je potrditev najmanjše mikrobne aktivnosti. Če je ustrezno, se lahko uporabi radioaktivno označena snov, tudi če se razgradnja preskusne snovi spremlja s kemijskimi analizami,
— sterilni kontrolni vzorec; ena ali dve bučki, ki vsebujeta sterilizirano preskusno vodo, za preučevanje možne abiotske razgradnje ali drugačnega nebiološkega izginevanja preskusne snovi (označeno z FS). Biološko aktivnost je možno ustaviti z avtoklaviranjem (121 °C; 20 min) preskusne vode ali z dodajanjem strupene snovi (npr. natrijevega azida (NaN3) v koncentraciji 10–20 g/l, živosrebrnega klorida (HgCl2) v koncentraciji 100 mg/l ali formalina v koncentraciji 100 mg/l) ali s sevanjem gama. Če se uporabi HgCl2, ga je treba odstraniti kot strupen odpadek. Če se vodi doda sediment v veliki količini, sterilnosti ni enostavno doseči. V tem primeru je priporočljivo zaporedno avtoklaviranje (npr. trikrat). Preučiti je treba, ali avtoklaviranje morda spremeni sorpcijske lastnosti sedimenta,
— kontrolni vzorci s topilom, vsebujejo preskusno vodo in preskusno vodo z referenčno snovjo; dvojniki bučk, obdelani z enako količino topila in enakim postopkom, kakor se uporablja za vnos preskusne snovi. Namen je preveriti možne neželene učinke topila z določitvijo razgradnje referenčne snovi.
V zasnovi preskusa mora raziskovalec preučiti relativni pomen povečanja števila ponovitev proti povečanju števila vzorčenj. Natančno število potrebnih bučk bo odvisno od metode za merjenje razgradnje (glejte tretji odstavek v oddelku 1.8.9.1; oddelek 1.8.9.4 in Dodatek 3).
V vsakem vzorčenju je treba iz vsake preskusne bučke odvzeti dva podvzorca (npr. 5-ml alikvota). Če se uporablja več bučk, da je omogočen odvzem celotnih bučk, je treba pri vsakem vzorčenju žrtvovati najmanj dve bučki (glejte prvi odstavek v oddelku 1.8.9.1).
1.8.9.3 Priprava bučk za preskus s suspendiranim sedimentom [neobvezen]
V preskusne posode se doda potrebni volumen preskusne vode in sedimenta, če je treba (glejte oddelek 1.8.5). Priprava bučk za preskus suspendiranega sedimenta je enaka kot za pelagični preskus (glejte oddelka 1.8.9.1. in 1.8.9.2). Prednostno je treba uporabljati serumske steklenice ali podobno oblikovane bučke. Zaprte bučke se položijo na stresalnik. Seveda je treba odprte bučke za nehlapne snovi, ki niso označene s 14C, postaviti pokonci. V tem primeru je priporočljiva uporaba magnetnega mešanja in magnetnih palčk, ki so prevlečene s steklom. Po potrebi se steklenice aerirajo, da se ohranjajo ustrezni aerobni pogoji.
1.8.9.4 Radiokemijske določitve
Sproščeni 14CO2 se meri posredno ali neposredno (glejte Dodatek 3). 14CO2 se določa posredno z razliko med začetno aktivnostjo 14C v preskusni vodi ali suspenziji in skupno preostalo aktivnostjo v času vzorčenja, ki se izmeri po zakisanju vzorca na pH 2–3 in odstranitvi CO2. S tem se odstrani anorganski ogljik in izmerjena preostala aktivnost izvira iz organskega materiala. Če se med transformacijo preskusne snovi tvorijo poglavitni hlapni produkti transformacije, se posredno določevanje 14CO2 ne sme uporabiti (glejte Dodatek 3). Če je možno, je treba sproščanje 14CO2 meriti neposredno (glejte Dodatek 3) v vsakem času vzorčenja in v najmanj eni preskusni bučki. Ta postopek omogoča preverjanje tako masne bilance in postopka biorazgradnje, vendar je omejen na preskuse, ki se opravljajo v zaprtih bučkah.
Če se sproščeni 14CO2 med preskusom meri neposredno, je treba v ta namen na začetku preskusa pripraviti več bučk. Če se med transformacijo preskusne snovi tvorijo poglavitni hlapni produkti transformacije, je priporočljivo neposredno določevanje 14CO2. V vsaki točki merjenja se dodatne preskusne bučke zakisajo na pH 2–3, nato pa se 14CO2 zbere v notranji ali zunanji absorpcijski posodi (glejte Dodatek 3).
Neobvezno se lahko koncentracije s 14C označene preskusne snovi in poglavitnih produktov transformacije določijo z radiokromatografijo (npr. tankoplastno kromatografijo, RAD-TLC) ali HPLC z radiokemijskim zaznavanjem.
Neobvezno se lahko določi fazna porazdelitev preostale radioaktivnosti (glejte Dodatek 1) ter preostala preskusna snov in produkti transformacije.
Na koncu preskusa je treba določiti masno bilanco z neposrednim merjenjem 14CO2 v ločeni poskusni bučki, iz katere med poskusom ni bil odvzet noben vzorec (glejte Dodatek 3).
1.8.9.5 Specifična kemijska analiza
Če je na voljo specifična analitska metoda, se lahko primarna biorazgradnja določi z merjenjem preostale koncentracije preskusne snovi namesto uporabe tehnik radioaktivnega označevanja. Če se uporabi radioaktivno označena preskusna snov (za merjenje skupne mineralizacije), se lahko vzporedno opravijo specifične kemijske analize, ki dajo uporabne dodatne podatke in s katerimi se preverja postopek. Specifične kemijske analize se lahko tudi uporabijo za merjenje produktov transformacije, ki nastanejo med razgradnjo preskusne snovi. Ta pristop je priporočljiv za snovi, ki se mineralizirajo z razpolovno dobo, daljšo od 60 dni. Koncentracijo preskusne snovi in produktov transformacije je treba pri vsaki ponovitvi vzorčenja izmeriti in o njej poročati (o koncentraciji in o uporabljenem odstotku). Na splošno je treba ugotoviti produkte transformacije, ki se pri katerem koli vzorčenju zaznajo pri ≥ 10 % uporabljene koncentracije, razen če ni upravičeno utemeljeno drugače. Tudi produkte transformacije, pri katerih se koncentracije med raziskavo nenehno povečujejo, je treba upoštevati pri ugotavljanju, tudi če njihove koncentracije ne presegajo zgornje omejitve, ker lahko označujejo obstojnost. Če je možno, da se preskusna snov hitro abiotsko pretvarja (npr. s hidrolizo), je treba preučiti izvedbo analiz produktov transformacije v sterilnih kontrolnih vzorcih. Potrebo po količinski opredelitvi in določevanju produktov transformacije je treba upoštevati glede na vsak primer posebej in v poročilu podati utemeljitev. Tehnike ekstrakcije z organskim topilom je treba uporabiti po navodilih v ustreznem analitičnem postopku.
Če se analiza opravi v 24 urah (prednostno), je treba vse vzorce shranjevati pri 2 do 4 °C in zrakotesno. Če je shranjevanje daljše, je treba vzorce zamrzniti pod – 18 °C ali kemijsko konzervirati. Zakisanje ni priporočljiva metoda konzerviranja vzorcev saj so lahko zakisani vzorci neobstojni. Če se vzorci ne analizirajo v 24 urah in so shranjevani dlje, je treba opraviti raziskavo obstojnosti med shranjevanjem, da se dokaže obstojnost želenih kemikalij med shranjevanjem pri – 18 °C ali v pogojih konzerviranja. Če analitična metoda vključuje bodisi ekstrakcijo s topili ali ekstrakcijo trdne faze (SPE), je treba ekstrakcijo opraviti nemudoma po vzorčenju ali po ohlajenem shranjevanju za največ 24 ur.
Morda bodo potrebni volumni vzorcev, večji od prikazanih v oddelku 1.8.1, odvisno od občutljivosti analitične metode. Preskus se enostavno izvede s preskusnim volumnom 1 liter v bučkah s prostornino 2–3 litra, ko je možno jemati vzorce približno 100 ml.
2. PODATKI IN POROČANJE
2.1 OBDELAVA REZULTATOV
2.1.1 Prikaz podatkov
Čase vzorčenja je treba zaokrožiti na celo število ur (razen, če se snov bistveno razkraja v minutah do urah), ne pa na celo število dni. Prikazati je treba ocene preostale aktivnosti preskusne snovi (za snovi označene s 14C) ali preostale koncentracije (za neoznačene snovi) v odvisnosti od časa v linearnem in pollogaritemskem prikazu (glejte sliki 1a in 1b). Če je prišlo do razgradnje, se primerjajo rezultati iz bučk FT in bučk FS. Če se povprečne vrednosti rezultatov iz bučk s preskusno snovjo (FT) in sterilnih bučk (FS) razlikujejo za manj kot 10 %, se lahko predpostavi, da je opažena razgradnja pretežno abiotska. Če je razgradnja v bučkah FS manjša, se lahko s temi številkami popravi številke bučk FT (z odštevanjem), da se oceni obseg biorazgradnje. Kadar se opravljajo neobvezne analize za poglavitne produkte transformacije, je treba prikazati njihovo nastajanje ali upad poleg prikaza upada preskusne snovi.
V krivulji razgradnje (pollogaritemski prikaz) se z ekstrapolacijo krivulje do odsotnosti razgradnje oceni dolžina faze prilagajanja. Namesto tega se lahko dolžina faze prilagajanja oceni z določitvijo časa, potrebnega za približno 10 % razgradnje (glejte sliki 1a in 1b). Iz pollogaritemskega prikaza se z linearno regresijo odvisnosti ln (preostale aktivnosti 14C ali koncentracije preskusne snovi) od časa oceni konstanto hitrosti prvega reda, k, in njeno standardno napako. Zlasti pri meritvah 14C se uporabijo le podatki iz začetnega linearnega dela krivulje po zaključku faze prilagajanja, pri čemer se prednostno izbere nekaj reprezentativnih podatkov pred izborov večjega števila bolj negotovih podatkov. Tu negotovost vključuje napake, ki so vezane na priporočljivo neposredno uporabo izmerjenih preostalih aktivnosti 14C (glejte spodaj). V določenih primerih je pomembno izračunati dve različni konstanti hitrosti, če razgradnja sledi bifaznemu vzorcu. Za ta namen se določijo dve različni fazi krivulje razgradnje. Konstanto hitrosti, k, in razpolovno dobo t1 = ln2/k je treba izračunati za vsako posamezno vzporedno bučko, če se iz iste bučke jemlje več podvzorcev, ali s pomočjo povprečnih vrednosti, če se ob vzorčenju jemljejo celotne bučke (glejte zadnji odstavek oddelka 1.8.9.2). Če se uporabi prvi omenjeni postopek, je treba konstanto hitrosti razgradnje in razpolovno dobo navesti za vsako posamezno vzporedno bučko in kot povprečno vrednost s standardno napako. Če se uporabijo visoke koncentracije preskusne snovi, lahko krivulja razgradnje znatno odstopa od premice (pollogaritemski prikaz) in kinetika prvega reda morda ne velja. Določitev razpolovne dobe zato nima smisla. Vendar je mogoče za omejen niz podatkov uporabiti psevdo kinetiko prvega reda in oceni razpolovno dobo DT50 (čas za 50 % razgradnje). Vendar je treba upoštevati, da časovnega poteka razgradnje po izbranem nizu podatkov ni mogoče napovedati z DT50, ki opisuje le dani nabor podatkov. Analitična orodja za statistične izračune in prilagajanje krivulj so enostavno dostopna in uporaba tovrstne programske opreme je priporočljiva.
Če se opravljajo specifične kemijske analize, se ocenijo konstante hitrosti in razpolovne dobe za primarno razgradnjo, kakor je opisano zgoraj za skupno mineralizacijo. Če je primarna razgradnja omejen proces, se lahko v nekaterih primerih uporabijo podatkovne točke iz celotnega poteka razgradnje. To je zato, ker so meritve neposredne, nasprotno kot pri meritvah aktivnosti 14C.
Če so se uporabile s 14C označene snovi, je treba masno ravnovesje izraziti v odstotkih vnesene začetne koncentracije, najmanj na koncu preskusa.
2.1.2 Preostala aktivnost
Ko se biorazkraja s 14C označen del organske snovi, se večji del 14C pretvori v 14CO2, drugi del pa se uporabi za rast biomase in/ali sintezo izvenceličnih presnovkov. Zato dokončna „popolna“ biorazgradnja snovi ne pomeni 100-odstotne pretvorbe ogljika iz te snovi v 14CO2. 14C, ki se vgradi v produkte, nastale v biosintezi, se naknadno počasi sprosti kot 14CO2 zaradi „sekundarne mineralizacije“. Zaradi tega prikazi preostale aktivnosti organskega 14C (izmerjeni po odstranitvi CO2) ali nastalega 14CO2 v odvisnosti od časa kažejo „rep“ po zaključku razgradnje. To zaplete kinetično interpretacijo podatkov in za ta namen je treba za oceno konstante hitrosti razgradnje običajno uporabiti le začetni del krivulje (po zaključku faze prilagajanje in pred 50-odstotno razgradnjo). Če se preskusna snov razkraja, je skupna preostala aktivnost organskega 14C vedno večja od aktivnosti 14C, povezane s preostalo nerazgrajeno preskusno snovjo. Če poteka razgradnja preskusne snovi z reakcijo prvega reda in se v CO2 mineralizira konstantni delež α, je začetni naklon krivulje izginevanja 14C (skupni organski 14C v odvisnosti od časa) α-krat naklon ustrezne krivulje koncentracije preskusne snovi (oz. natančno rečeno, dela preskusne snovi, ki je označen s 14C). Konstanta hitrosti razgradnje, izračunana iz nepopravljenih meritev aktivnosti skupnega organskega 14C, bo zato konzervativna. Postopki za ocenjevanje koncentracij preskusne snovi iz izmerjenih radiokemijskih aktivnosti, ki temeljijo na raznih poenostavitvenih predpostavkah, so opisani v virih (2)(9)(10)(11). Takšne postopke je najenostavneje uporabiti za hitro razgradljive snovi.
2.2 RAZLAGA REZULTATOV
Če se ugotovi, da je k neodvisen od dodane koncentracije (tj. če je izračunani k približno enak pri različnih koncentracijah preskusne snovi), se lahko predpostavi, da je konstanta hitrosti prvega reda reprezentativna za uporabljene pogoje preskušanja, tj. preskusno snov, vzorec vode in preskusno koncentracijo. Do kakšne mere se lahko rezultati generalizirajo ali ekstrapolirajo na druge sisteme, pa je treba ovrednotiti s strokovno presojo. Če se uporabijo visoke koncentracije preskusne snovi in razgradnja zato ne sledi kinetiki prvega reda, podatkov ni mogoče uporabiti za neposredno oceno konstante hitrosti prvega reda ali ustrezne razpolovne dobe. Vendar so podatki, pridobljeni iz preskusa z visokimi koncentracijami preskusne snovi, lahko še vedno uporabni za ocenjevanje stopnje skupne mineralizacije in/ali zaznavanje in količinsko produktov transformacije.
Če so znane hitrosti drugih postopkov izginevanja poleg biorazgradnje (npr. hidrolize ali izhlapevanja), se lahko odštejejo od neto hitrosti izginevanja med preskusom, da se dobi približna ocena hitrosti biorazgradnje. Podatki za hidrolizo se lahko npr. pridobijo iz sterilnega kontrolnega vzorca ali iz vzporednega preskušanja z višjo koncentracijo preskusne snovi.
Posredno in neposredno določevanje 14CO2 (oddelek 1.8.9.4 in Dodatek 3) se lahko uporabita le za merjenje obsega mineralizacije preskusne snovi v CO2. Za analizo koncentracij s 14C označene preskusne snovi in tvorbe poglavitnih produktov transformacije (tretji odstavek oddelka 1.8.9.4) se lahko uporabita radiokromatografija (RAD-TLC) ali HPLC. Da se omogoči neposredno ocenjevanje razpolovne dobe, je nujno, da ni prisotnih drugih poglavitnih produktov transformacije (opredeljeno kot ≥ 10 % vnesene količine preskusne snovi). Če so prisotni poglavitni produkti transformacije, kakor so opredeljeni tu, je potrebno podrobno vrednotenje podatkov. To lahko vključuje ponovitve preskušanja in/ali določitev produktov transformacije (glejte prvi odstavek oddelka 1.8.9.5), razen če lahko usodo produktov transformacije upravičeno ovrednotimo na podlagi izkušenj (npr. podatki o poteh razgradnje). Ker se delež preskusne snovi, ki se pretvori v CO2, razlikuje (odvisno v večji meri od koncentracije preskusne snovi in drugih dostopnih substratov, preskusnih pogojev in mikrobne skupnosti), ta preskus ne omogoča enostavne ocene popolne biorazgradnje kakor v preskusu upadanja DOC, vendar je rezultat podoben kakor pri respirometričnem preskusu. Stopnja mineralizacije bo tako manjša ali enaka najnižji ravni popolne biorazgradnje. Da se določi popolnejša slika popolne biorazgradnje (mineralizacija in vgradnja v biomaso), je treba na koncu preskusa opraviti analizo fazne porazdelitve 14C (glejte Dodatek 1). 14C v delcih bo sestavljen iz 14C, ki je vgrajen v bakterijsko biomaso, in 14C, ki je sorbiran na organske delce.
2.3 VELJAVNOST PRESKUSA
Če se referenčna snov ne razgradi v pričakovanem časovnem obdobju (za anilin in natrijev benzoat običajno prej kot v dveh tednih), obstaja dvom o veljavnosti preskusa, zato je treba veljavnost dodatno preveriti ali pa se preskus ponovi z novim vzorcem vode. V ISO preskusu primerljivosti metode je sedem laboratorijev, izbranih iz cele Evrope, ugotovilo konstante hitrosti razgradnje za anilin, ki so variirale od 0,3 do 1,7 dan–1 s povprečno vrednostjo 0,8 d–1 pri 20 oC in standardno napako ± 0,4 d–1 (t½ = 0,9 dni). Tipični časi prilagoditve so bili od 1 do 7 dni. Preiskane vode so imele po navedbah bakterijsko maso, ki je ustrezala 103–104 kolonije tvorečim delcem (CFU) na ml. Hitrosti razgradnje v srednjeevropskih vodah, bogatih s hranili, so bile višje od hitrosti v nordijskih oligotrofnih vodah. Razlike so lahko nastale zaradi različnega trofičnega statusa ali zaradi predhodne izpostavitve kemijskim snovem.
Skupni izkoristek (masna bilanca) na koncu poskusa bi morala biti med 90 % in 110 % za radioaktivno označene snovi, začetni izkoristek na začetku poskusa bi moral biti med 70 % in 110 % za neoznačene snovi. Vendar se morajo nakazana območja šteti le za ciljna in se ne smejo uporabiti kot kriteriji za sprejemljivost preskusa.
3. POROČILO O PRESKUSU
Na poročilu o preskusu je treba jasno navesti vrsto raziskave, tj. pelagični preskus ali preskus suspendiranega sedimenta. Poročilo o preskusu mora vsebovati tudi najmanj naslednje podatke:
Preskusna snov in referenčna snov/referenčne snovi:
— splošna imena, kemijska imena (priporočeno poimenovanje po IUPAC in/ali CAS), številke po CAS, strukturne formule (z navedbo položaja 14C, če se uporabi radioaktivno označena snov) in ustrezne fizikalno-kemijske lastnosti preskusne in referenčne snovi (glej oddelka 1.5 in 1.6),
— kemijska imena, številke po CAS, strukturne formule (z navedbo položaja 14C, če se uporabi radioaktivno označena snov) in ustrezne fizikalno-kemijske lastnosti snovi, ki se uporabijo kot standardi za določitev in količinsko opredelitev produktov transformacije,
— čistoto (nečistote) preskusne snovi in referenčnih snovi,
— radiokemijsko čistoto označene kemikalije in specifično aktivnost (kadar je primerno).
Površinska voda:
Navesti je treba najmanj naslednje podatke o odvzetem vzorcu vode:
— lokacijo in opis mesta vzorčenja, vključno, če je mogoče, s preteklim onesnaženjem,
— datum in uro vzorčenja,
— hranila (skupni N, amoniak, nitrit, nitrat, skupni P, raztopljeni ortofosfat),
— globina odvzema,
— izgled vzorca (npr. barva in motnost),
— vrednosti DOC in TOC,
— vrednost BOD,
— temperaturo in pH na mestu vzorčenja v času vzorčenja,
— kisikov in redoks potencial (obvezno, če aerobni pogoji niso očitni),
— slanost ali prevodnost (v primeru morske vode in brakične vode),
— suspendirane trdne snovi (v primeru motnega vzorca),
— po možnosti druge pomembne podatke o mestu vzorčenja v času vzorčenja (npr. dejanski ali zgodovinski podatki o pretoku rek ali morskih tokov, bližnji poglavitni iztoki in vrsta iztokov, vremenski pogoji pred časom vzorčenja),
in neobvezno:
— mikrobno biomaso (npr. neposredno štetje z akridinskim oranžnim ali določitev delcev, ki tvorijo kolonije),
— anorganski ogljik,
— koncentracijo klorofila kot specifično oceno biomase alg.
Poleg opisanega je treba navesti naslednje podatke o sedimentu, če se opravlja preskus suspendiranega sedimenta:
— globina odvzema sedimenta,
— izgled sedimenta (npr. obarvan, blaten, muljast ali peščen),
— tekstura (npr. delež grobega peska, drobnega peska, mulja in gline),
— suha masa v g/l suspendiranih trdnih snovi, koncentracija TOC ali zmanjšanje mase po sežigu kot merilo vsebnosti organske snovi,
— pH,
— kisikov in redoks potencial (obvezno, če aerobni pogoji niso očitni).
Preskusni pogoji:
— zakasnitev med odvzemom in uporabo v laboratorijskem preskus, shranjevanje vzorca in predobdelava vzorca, datum izvedbe raziskav,
— količina uporabljene preskusne snovi, preskusne koncentracije in referenčne snovi,
— metoda vnosa preskusne snov, vključno z uporabo topil,
— uporabljeni volumen površinske vode in sedimenta (če se je uporabil) in volumen vzorcev, odvzetih za analizo v vsakem časovnem obdobju,
— opis uporabljenega preskusnega sistema.
Če se ne uporabi tema, podatki o pogojih „difuzne svetlobe“;
— podatke o metodi/metodah uporabljenih za vzpostavitev sterilnih kontrol (npr. temperatura, trajanje in število ciklov avtoklaviranja),
— inkubacijsko temperaturo,
— podatke o analitskih tehnika in metodi/metodah, uporabljenih za radiokemijske meritve in za preverjanje masne bilance ter meritve fazne porazdelitve (če so bile opravljene),
— število ponovitev.
Rezultati:
— odsotki izkoristka (glejte oddelek 1.7.1),
— ponovljivost in občutljivost uporabljenih analitskih metod, vključno z mejo zaznavnosti (LOD) in mejo količinske opredelitve (LOQ) (glejte oddelek 1.7.2),
— vse izmerjene podatke (vključno s časom vzorčenja) in izračunane vrednosti v preglednici ter krivulje razgradnje; za vsako preskusno koncentracijo in za vsako vzporedno bučko je treba navesti koeficient linearne korelacije za naklon logaritemske krivulje, ocenjeno fazo prilagajanja in konstanto hitrosti prvega reda ali psevdo prvega reda (če je možno) ter ustrezno razpolovno dobo razgradnje (ali trajanje razpolovne dobe t50),
— navesti pomembne vrednosti, kot so povprečja rezultatov, opaženih v posameznih ponovitvah, npr. dolžina faze prilagajanja, konstanto hitrosti razgradnje in razpolovno dobo razgradnje (ali t50),
— uvrstiti sistem kot neprilagojen ali prilagojen na osnovi izgleda krivulje razgradnje in iz možnih vplivov na preskusno koncentracijo,
— rezultate končnega preverjanja masne bilance in rezultate meritev fazne porazdelitve (če so bile opravljene),
— delež mineraliziranega 14C in končna raven primarne razgradnje, če se uporabijo specifične analize,
— določitev, molska koncentracija in odstotek vnesenih in poglavitnih produktov transformacije (glejte prvi odstavek oddelka 1.8.9.5), kadar je primerno,
— predlagane poti transformacije, kadar je primerno,
— razpravo o rezultatih.
4. VIRI
(1) OECD TG 309 (2004) Aerobic Mineralisation in surface water – Simulation Biodegradation Test.
(2) ISO/DIS 14592–1 (1999) Water quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations – Part 1: Shake flask batch test with surface water or surface water/sediment suspensions.
(3) Testing Method C.23. Aerobic and anaerobic transformation in soil.
(4) Testing Method C.24. Aerobic and anaerobic transformation in aquatic sediments.
(5) OECD (1993). Guidelines for the Testing of Chemicals. OECD, Paris.
(6) ISO 8245 (1999). Water quality – Guidelines on the determination of total organic carbon (TOC) and dissolved organic carbon (DOC).
(7) ISO 10634 (1995). Water quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
(8) OECD draft (2000). Guidance Document on aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 22 (to be published summer 2000).
(9) Simkins, S. in Alexander, M. (1984). Models for mineralization kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol.47, 394–401.
(10) Ingerslev, F. in N. Nyholm. (2000). Shake-flask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, 274–283.
(11) ISO/CD 14592–1 (1999). Ring test report: Water Quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1 – report of 1998/1999 ring-test. Shake flask batch test with surface water or surface water/sediment suspensions.
Dodatek 1
Fazna porazdelitev 14C
Zaradi preverjanja postopka je treba rutinske meritve preostale skupne aktivnosti organskega 14C (TOA) dopolniti z meritvami masne bilance, ki vključujejo neposredno določevanje sproščenega 14CO2 po zajetju v absorpcijsko posodo (glejte Dodatek 3). Pozitiven rezultat tvorbe 14CO2 je sam po sebi neposreden dokaz biorazgradnje in je v nasprotju z abiotsko razgradnjo ali drugačnim izginevanjem, npr. izhlapevanjem in sorpcijo. Dodatne uporabne podatke, ki opisujejo obnašanje biorazgradnje, je možno dobiti iz meritev porazdelitve TOA med raztopljenim stanjem (raztopljena aktivnost organskega 14C, DOA) in delci (aktivnost organskega 14C v delcih, POA) po ločevanju delcev z membransko filtracijo ali centrifugiranjem. POA obsega preskusno snov, ki je sorbirana na mikrobno biomaso in na druge delce, ter ogljik preskusne snovi, ki je bil uporabljen za sintezo novega celičnega materiala in s tem vgrajen v frakcijo biomase, ki jo predstavljajo delci. Kot oceno nastajanja raztopljenega organskega materiala s 14C lahko uporabimo DOA na koncu biorazgradnje (izravnanje krivulje odvisnosti razgradnje od časa).
Fazna porazdelitev preostalega 14C v izbranih vzorcih se oceni s filtracijo vzorcev skozi 0,22-μm ali 0,45-μm membranski filter iz materiala, ki ne adsorbira znatnih količin preskusne snovi (primerni so lahko polikarbonatni filtri). Če je sorpcija preskusne snovi na filter preobsežna, da bi jo lahko zanemarili (kar je treba preverite pred poskusom), se lahko namesto filtracije uporabi centrifugiranje (2 000 g; 10 min).
S filtratom oziroma centrifugatom ravnajte, kakor je opisano v Dodatku 3 za nefiltrirane vzorce. Membranske filtre je treba raztopiti v primerni scintilacijski tekočini in prešteti, kakor ponavadi. Običajno se uporabi le metoda razmerja zunanjega standarda za korekcijo pojenjanja ali oksidant za vzorec. Če se je uporabilo centrifugiranje, se sediment resuspendira, da nastane frakcija z delci v 1–2 ml destilirane vode, ki se jo prenese v scintilacijsko vialo. Centrifugirano posodo dvakrat speremo z 1 ml destilirane vode in izpirek prenesemo v scintilacijsko vialo. Če je treba, se lahko suspenzijo vklopi v gel za tekočinsko scintilacijsko štetje.
Dodatek 2
Polkontinuiran postopek
Da se doseže zadostna razgradnja odpornih snovi je lahko potrebna podaljšana inkubacija do več mesecev. Trajanje preskusa običajno ne sme preseči 60 dni, razen če se lastnosti prvotnega vzorca vode ohranjajo z obnavljanjem preskusne suspenzije. Vendar je možno preskusno obdobje podaljšati do največ 90 dni brez obnavljanja preskusne suspenzije, če se razgradnja preskusne snovi po prvih 60 dneh še ni začela.
Med inkubacijo za dolga obdobja se lahko raznolikost mikrobne združbe zmanjša zaradi različnih mehanizmov izginjanja in zaradi možnega osiromašenja vzorca vode esencialnih hranil in primarnih substratov ogljika. Zato je priporočljivo, da se uporabi polkontinuiran preskus, s katerim se zadostno določi hitrost razgradnje počasi razgradljivih snovi. Preskus je treba začeti s polkontinuiranim postopkom, če se za 20-odstotno razgradnjo snovi lahko na podlagi predhodnih izkušenj pričakuje trajanje inkubacije tri mesece. V nasprotnem primeru se lahko običajni serijski preskus spremeni v polkontinuiran preskus, če v približno 60 dneh preskušanja v serijskem preskusu ni dosežena nikakršna razgradnja preskusne snovi. Če se opazi znatna razgradnja (npr. > 20 %) se lahko polkontinuiran postopek ustavi in preskus nadaljuje kot serijski poskus.
V polkontinuiranem preskusu se vsake dva tedna približno ena tretjina volumna preskusne suspenzije zamenja s sveže odvzeto vodo, kateri je dodana preskusna snov v začetni koncentraciji. Nadomestni vodi podobno dodamo sediment v začetni koncentraciji (med 0,01 in 1 g/l), če se opravlja preskus suspendiranega sedimenta. Če se opravlja preskus suspendirane trdne snovi iz sedimenta, je pomembno, da popolnoma suspendiran sistem ohranjamo tudi med obnavljanjem vode in da je zadrževalni čas identičen za trdne snovi in vodo, saj lahko v nasprotnem primeru izgubimo nameravano podobnost s homogenim vodnim sistemom brez fiksiranih faz. Iz teh razlogov ima pri uporabi polkontinuiranega postopka prednost začetna koncentracija suspendiranih sedimentov na spodnji meji navedenega intervala.
Predpisano dodajanje preskusne snovi kaže, da se začetne koncentracije preskusne snovi pri delnem obnavljanju preskusne suspenzije ne presežejo, zato ne pride do prilagajanja, ki se sicer pogosto pojavi pri visokih koncentracijah. Ker postopek obsega tako ponovno inokulacijo in nadomestilo osiromašenih hranil in primarnih substratov, se izvirna mikrobna raznolikost obnovi in trajanja preskusa se lahko podaljša v principu do neskončnosti. Kadar se uporabi polkontinuiran postopek, je pomembno upoštevati, da se preostala koncentracija preskusne snovi popravi za količino preskusne snovi, ki se doda in odvzame pri vsakem postopku obnove. Pri spojinah, ki se sorbirajo v majhnem obsegu, se lahko pojma skupna in raztopljena koncentracija preskusne snovi uporabljata enakovredno. V navedenih pogojih (0,1–1 g trdnih snovi/l) je sorpcija nepomembna (< 5 %) za snovi z log Kow < 3 (velja za nevtralne, lipofilne spojine). To ponazarja naslednji primer izračuna. 0,1 g/l trdnih snovi grobo ustreza 10 mg ogljika na liter (delež ogljika, fC = 0,01). Ob predpostavki, da:
Log Kow (preskusne snovi) = 3
Koc = 0,42 × Kow
Porazdelitveni koeficient, Kd = fC × Koc
velja, da raztopljena frakcija skupne koncentracije (C-voda (Cw)/C-skupno (Ct) je:
Cw/Ct = 1/(1 + Kd × SS) = 1(1 + Koc × fC × SS) = 1/(1 + 0,42 × 103 × 0,01 × 0,1 × 10–3) = 0,999
Dodatek 3
Določitev 14CO2
Posredna določitev 14CO2
Za rutinske meritve je posredna metoda ponavadi najhitrejša in najbolj natančna, če je preskusna metoda nehlapna in se ne pretvarja v hlapne produkte transformacije. Nefiltrirane vzorce, npr. 5 ml, se preprosto prenese v scintilacijske viale. Primerna začetna aktivnost v vzorcih je 5 000 dpm–10 000 dpm (80–170 Bq), najmanjša začetna aktivnost pa je približno 1 000 dpm. Po zakisanju na pH 2–3 z 1–2 kapljicama koncentrirane H3PO4 ali HCl je treba CO2 odstraniti. Odstranjevanje CO2 se lahko opravi z uvajanjem zraka za približno ½–1 ure. Namesto tega se lahko viale močno stresa za 1–2 uri (npr. za stresalniku za mikroplošče) ali pusti preko noči pri nežnejšem stresanju. Učinkovitost odstranjevanja CO2 je treba preveriti (s podaljševanjem trajanja aeracije ali stresanja). Nato se doda scintilacijska tekočina, ki je primerna za štetje vodnih vzorcev. Vzorec se homogenizira na vrtinčastem mešalu, nato pa se s tekočinskim scintilacijskim štetjem določi radioaktivnost, pri čemer se odšteje aktivnost ozadja, določena v slepih vzorcih (FB). Če preskusna voda ni zelo obarvana in ne vsebuje visoko koncentracijo delcev, bodo vzorci običajno kazali enakomerno pojenjanje, kar bo dovolj za izvedbo korekcije pojenjanja z zunanjim standardom. Če je preskusna voda zelo obarvana, bo potrebna korekcija pojenjanja z dodatkom notranjega standarda. Če je koncentracija delcev visoka, morda ne bo možno doseči homogene raztopine ali gela ali pa bo variacija pojenjanja med vzorci velika. V tem primeru se lahko uporabi metoda štetja, ki je opisana spodaj za preskusne suspenzije. Če se preskus opravlja kot preskus suspendiranega sedimenta, se lahko meritve 14CO2 opravijo posredno z odvzemom 10 ml homogenega vzorca preskusne vode/suspenzije in ločitvijo faz s centrifugiranjem pri primerni hitrosti (npr. pri 40 000 m/s2 za 15 min). Vodno fazo se nato obdela, kakor je opisano zgoraj. Aktivnost 14C v fazi z delci (POA) je treba določiti z resuspendiranjem sedimenta v majhnem volumnu destilirane vode, prenosom v scintilacijske viale in dodatkom scintilacijske tekočine, da nastane gel (za ta namen so na voljo posebne scintilacijske tekočine). Odvisno od narave delcev (npr. njihove vsebnosti organskega ogljika) je morda možno pred dodatkom scintilacijske tekočine vzorec razkrojiti preko noči v topilniku tkiv in ga nato homogenizirati na vrtinčastem mešalu. Namesto tega se lahko POA določi s sežigom v prebitku kisika v oksidantu vzorca. Pri štetju je treba vedno vključiti notranje standarde. Morda bo treba opraviti korekcijo pojenjanja z dodatkom notranjega standarda v vsak posamezni vzorec.
Neposredna določitev 14CO2
Če se sproščeni 14CO2 meri neposredno, je treba na začetku poskusa začeti z več bučkami, odvzemom preskusnih bučk v vsaki merilni časovni točki z zakisanjem vsebine na pH 2–3 in zajemom 14CO2 v notranji (vstavljenem v vsako preskusno bučko na začetku preskusa) ali zunanji absorpcijski posodi. Kot absorpcijsko sredstvo se lahko uporabi bodisi alkalijska snov (npr. 1-normalna raztopina NaOH ali zrno NaOH) bodisi etanolamin ali absorbent na osnovi etanolamina bodisi komercialno dostopni absorbent. Pri neposrednem merjenju 14CO2 je treba bučke zapreti z npr. septumom iz butilnega kavčuka.
Slika 1a
Primer aritmetičnega prikaza podatkov (preostala aktivnost v odvisnosti od časa)

Slika 1b
Primer pologaritemskega prikaza podatkov (ln preostale aktivnosti v odvisnosti od časa).

C.26. PRESKUS ZAVIRANJA RASTI LEMNA SP.
1. METODA
Ta preskusna metoda je enakovredna OECD TG 221 (2006) (1). Pristojni organi EU so dosegli širše soglasje o primernosti preskusov z vodno lečo kot druge možnosti za preskuse na algah za močno obarvane snovi (2)(3).
1.1 UVOD
Ta preskusna metoda je zasnovana za določanje strupenosti snovi za sladkovodne rastline iz rodu Lemna (vodolečevke). Temelji na obstoječih smernicah (4)(5)(6)(7)(8)(9), vendar zaradi upoštevanja nedavnih raziskav in posvetovanj o številnih ključnih vprašanjih vključuje spremembe navedenih metod. Predlagana metoda je bila validirana v mednarodnem preskusu primerljivosti (10).
Ta preskusna metoda opisuje preskušanje strupenosti z organizmoma Lemna gibba in Lemna minor. Oba organizma sta bila obsežno proučena in sta predmet zgoraj navedenih standardov. Taksonomija rodu Lemna je težka zaradi prisotnosti velike množice fenotipov. Čeprav lahko pride do genetske variabilnosti kot odziv na strupene snovi, trenutno ni dovolj podatkov o tej vrsti variabilnosti, na podlagi katerih bi bilo za to preskusno metodo mogoče priporočiti uporabo specifičnega klona. Opozoriti je treba, da se preskus ne opravlja aksenično, ampak se med preskusom uporabljajo postopki, da se čimbolj zmanjša onesnaženje z drugimi organizmi.
Podrobno je opisano preskušanje z obnavljanjem preskusne raztopine (polstatično ali pretočno) ali brez obnavljanja le-te (statično). Glede na cilje preskusa in zakonske zahteve je priporočljivo proučiti možnosti uporabe polstatičnih ali pretočnih metod, npr. za snovi, ki hitro izginjajo iz raztopine zaradi izhlapevanja, svetlobne razgradnje, obarjanja ali biorazgradnje. Več smernic je na voljo v (11).
1.2 OPREDELITVE
Za namene te preskusne metode se uporabljajo naslednje opredelitve in okrajšave:
Biomasa: masa suhe snovi živih organizmov, ki so prisotni v populaciji. V tem preskusu se kot nadomestek za biomaso običajno meri število listov oziroma površina listov. Ravno tako se izraz „biomasa“ nanaša na te nadomestne meritve.
Kloroza: porumenelost listnega tkiva.
Klon: je organizem ali celica, ki se z nespolnim razmnoževanjem razvije iz enega organizma. Zato so osebki iz istega klona genetsko identični.
Kolonija: pomeni skupek materinskih in hčerinskih listov (ponavadi 2 do 4), ki so pritrjeni eden na drugega. V nekaterih primeri to pomeni rastlino.
ECx : je koncentracija preskusne snovi, raztopljene v preskusnem mediju, ki povzroči x-odstotno (npr. 50-odstotno) zmanjšanje rasti vodne leče v navedenem obdobju izpostavljanja (v primeru, da je trajanje poskusa odstopalo od popolne ali običajne dolžine, ga je treba navesti nedvoumno). Da se nedvoumno označi, da vrednost EC izhaja iz hitrosti rasti ali izplena, se uporabi simbol „ErC“ za hitrost rasti in „EyC“ za izplen, sledi pa merjena spremenljivka, npr. ErC (število listov).
Pretočen: preskus, v katerem se preskusna raztopina neprekinjeno menja.
List: posamezna/ena „listu podobna“ struktura rastline vodne leče. Je najmanjša enota, tj. osebek, ki je zmnožen razmnoževanja.
Grbavost: pomeni liste, ki so grbasti ali otekli.
Rast: je povečanje merjene spremenljivke, npr. števila listov, suhe mase, mokre mase ali površine listov, v času preskusa.
Hitrost rasti (povprečna specifična hitrost rasti): je logaritemsko povečanje biomase v obdobju izpostavljanja.
Najnižja koncentracija z opaznim učinkom (LOEC): je najnižja preskušena koncentracija snovi, pri kateri je opaziti statistično značilen učinek zmanjšanja rasti (pri p < 0,05) v primerjavi s kontrolnim vzorcem v navedenem obdobju izpostavljanja. Vendar morajo imeti vse koncentracije nad LOEC škodljiv učinek, ki je enak ali večji od škodljivega učinka, opaženega pri LOEC. Če ta dva pogoja ni možno izpolniti, je treba navesti popolno razlago izbire LOEC (in posledično NOEC).
Merjene spremenljivke: so vse vrste spremenljivk, ki se merijo, da se izrazi izid preskusa z eno ali več različnimi spremenljivkami odziva. V tej metodi so merjene spremenljivke število listov, površina listov, sveža masa in suha masa.
Monokultura: je kultura z eno rastlinsko vrsto.
Nekroza: je odmrlo (tj. belo ali z vodo prepojeno) listno tkivo.
Koncentracija brez opaznega učinka (NOEC): je preskušena koncentracija neposredno pod LOEC.
Fenotip: so opazne lastnosti organizma, ki jih določajo njegovi geni v interakciji z okoljem.
Spremenljivke odziva: so spremenljivke za oceno strupenosti, ki so izpeljane iz katere koli merjene spremenljivke za opis biomase z različnimi postopki izračuna. V tej metodi sta hitrost rasti in izplen spremenljivki odziva, ki sta izpeljani iz merjenih spremenljivk, kot so število listov, površina listov, sveža masa in suha masa.
Polstatični (obnavljajoči) preskus: je preskus, v katerem se preskusna raztopina v danih časovnih presledkih med preskusom redno menja.
Statični preskus: je preskusna metoda, v kateri preskusna raztopina med preskusom ne obnavlja.
Kazalec izida preskusa: opisuje splošen dejavnik, ki ga preskušana snov spremeni glede na kontrolni vzorec in je cilj preskusa. V tej metodi je kazalec izida zaviranje rasti, ki ga lahko izrazimo z različnimi spremenljivkami odziva, katere temeljijo na eni ali več merjenih spremenljivk.
Preskusni medij: je popolnoma sintetično gojišče, na katerem preskusne rastline rastejo ob izpostavitvi preskusni snovi. Običajno se preskusna snov raztopi v preskusnem mediju.
Izplen: je vrednost merjene spremenljivke za izražanje biomase na koncu obdobja izpostavljanja minus vrednost merjene spremenljivke na začetku obdobja izpostavljanja.
1.3 PRINCIP PRESKUSNE METODE
Kulturam rastlin iz rodu Lemna v eksponentni fazi rasti se omogoči, da sedem dni rastejo kot monokultura v prisotnosti različnih koncentracij preskusne snovi. Cilj preskusa je količinsko opredeliti učinke snovi na vegetativno rast v tem obdobju, na osnovi izbranih merjenih spremenljivk. Primarna merjena spremenljivka je število listov. Poleg nje se meri vsaj še ena merjena spremenljivka (skupna površina listov, suha teža ali sveža teža), saj lahko nekatere snovi bolj vplivajo na druge merjene spremenljivke kot na število listov. Učinki, ki so odvisni od snovi, se količinsko opredelijo tako, da se rast v preskusni raztopini primerja z rastjo kontrolnih vzorcev, nato pa se določi koncentracija, ki je povzročila navedeno x-odstotno zaviranje rasti (npr. 50-odstotno). Ta koncentracija se izrazi kot ECx (npr. EC50).
Kazalec izida je zaviranje rasti, ki je izraženo kot logaritemsko povečanje merjene spremenljivke (povprečne specifične hitrosti rasti) v obdobju izpostavljanja. Iz povprečne specifične hitrosti rasti niza preskusnih raztopin se določi koncentracija, ki je povzročila navedeno x-odstotno zaviranje hitrosti rasti (npr. 50-odstotno). Ta koncentracija se izrazi kot ErCx (npr. ErC50).
Dodatna spremenljivka odziva, ki se uporablja v tej preskusni metodi, je izplen, ki ga je morda treba določiti, da se izpolnijo specifične zakonske zahteve nekaterih držav. Izplen se določi kot vrednost merjenih spremenljivk na koncu obdobja izpostavljanja minus vrednost merjenih spremenljivk na začetku obdobja izpostavljanja. Iz izplena niza preskusnih raztopin se določi koncentracija, ki je povzročila navedeno x-odstotno zaviranje izplena (npr. 50-odstotono). Ta koncentracija se izrazi kot EyCx (npr. EyC50).
Poleg navedenega se lahko statistično določita tudi najnižja koncentracija z opaznim učinkom (LOEC) in koncentracija brez opaznega učinka (NOEC).
1.4 PODATKI O PRESKUSNI SNOVI
Na voljo mora biti analitska metoda z zadostno občutljivostjo za količinsko opredelitev snovi v preskusnem mediju.
Podatki o preskusni snovi, ki so morda uporabni za določevanje pogojev preskusa, so med drugim strukturna formula, čistota, topnost v vodi, obstojnost v vodi in na svetlobi, pKa, Kow, parni tlak in biorazgradljivost. Topnost v vodi in parni tlak se lahko uporabita za izračun konstante Henryevega zakona, ki pokaže, ali so v časovnem obdobju poskusa verjetne bistvene izgube preskusne snovi. To pripomore k odločitvi o uvedbi posameznih postopkov za nadzorovanje takšnih izgub. Če so podatki o topnosti in obstojnosti preskusne snovi negotovi, je priporočljivo, da se te vrednosti določijo v pogojih preskusa, tj. v gojišču, pri temperaturi in režimu osvetljevanja, ki se uporabijo v preskusu.
Kadar je zlasti pomembno nadzorovanje pH preskusnega medija (npr. pri preskušanju kovin ali snovi, ki so hidrolitično neobstojne), je priporočljivo dodajanje pufra v gojišče (glejte prvi odstavek oddelka 1.7.4). Več smernic za preskusne snovi z fizikalno-kemijskimi lastnostmi, zaradi katerih je preskušanje oteženo, je navedenih v (11).
1.5 REFERENČNE SNOVI
Za preverjanje preskusnega postopka, se lahko uporabi referenčna snov oz. referenčne snovi, kot je 3,5-diklorofenol, ki je bil uporabljen v mednarodnem preskusu primerljivosti (10). Priporočljivo je referenčno snov preskusiti najmanj dvakrat letno oz. vzporedno z določevanjem strupenosti preskusne snovi, kadar se preskušanja opravljajo redkeje.
1.6 VELJAVNOST PRESKUSA
Za veljavnost preskusa mora biti podvojitveni čas števila listov v kontrolnem vzorcu krajši od 2,5 dni (60 h), kar ustreza približno sedemkratnemu povečanju v sedmih dneh in povprečni specifični hitrosti 0,275 dan–1. Ta kriterij je mogoče doseči z mediji in pogoji preskusa, ki so opisani v tej preskusni metodi, ter statičnim preskusnim režimom (8). Pričakovati je tudi, da je ta kriterij dosegljiv tudi v polstatičnih in pretočnih pogojih preskusa. Izračun podvojitvenega časa je prikazan v oddelku 2.1
1.7 OPIS METODE
1.7.1 Aparatura
Vsa oprema v stiku s preskusnimi mediji mora biti izdelana iz stekla ali druge kemijsko inertne snovi. Steklovino za gojenje in preskušanje je treba očistiti kemijskih onesnaževalcev, ki se lahko spirajo v preskusni medij. Ta steklovina mora biti sterilna. Preskusne posode morajo biti dovolj široke, da listi posameznih kolonij v posodah kontrolnih vzorcev rastejo brez prekrivanja do konca preskusa. Ni pomembno, ali se korenine dotikajo dna preskusnih posod, vendar je najmanjša priporočljiva globina vsake preskusne posode 20 mm, najmanjša priporočljiva prostornina vsake preskusne posode pa 100 ml. Če se izpolnijo te zahteve, izbira preskusnih posod ni ključna. Kot primerne so se izkazale steklene čaše, kristalizacijske posodice in steklene petrijevke ustreznih mer. Preskusne posode morajo biti pokrite, da se čimbolj zmanjša izhlapevanje in nenamerno onesnaženje, hkrati pa je omogočena potrebna izmenjava zraka. Primerne poskusne posode in zlasti pokrovi ne smejo senčiti ali spremeniti spektralnih značilnosti svetlobe.
Kulture in preskusne posode se ne smejo hraniti skupaj. To je najbolje doseči z ločenimi okoljskimi gojitvenimi komorami, inkubatorji ali prostori. Mora biti omogočeno nadzorovanje osvetlitve in temperature ter ohranjanje teh parametrov na konstantni ravni (glejte oddelek 1.7.8).
1.7.2 Preskusni organizem
V tem preskusu se uporabi bodisi Lemna gibba bodisi Lemna minor. Kratki opisi vrst vodne leče, ki so bile uporabljene v preskušanjih strupenosti, so navedeni v Dodatku 1. Rastlinski material je možno dobiti iz zbirke kultur, drugega laboratorija ali na terenu. Če se rastlinski material odvzame na terenu, je treba rastline ohranjati v kulturi v istem mediju, kakor se uporablja za preskus, najmanj osem tednov pred uporabo. Terenska mesta, kjer se jemljejo začetne kulture, morajo biti brez očitnih virov onesnaženja. Če se kulture pridobijo iz drugega laboratorija ali zbirke kultur, jih je treba na podoben način ohranjati najmanj tri tedne. V poročilu je treba vedno navesti v preskusu uporabljen vir rastlinskega materiala ter vrsta in klon (če sta znana).
Monokulture, za katere se s prostim očesom oceni, da niso onesnažene z drugimi organizmi, npr. algami in praživalmi. Zdrave rastline vrste L. minor bodo sestavljale kolonije, ki imajo od dva do pet listov. Zdrave kolonije vrste L. gibba pa lahko imajo do sedem listov.
Kakovost in enakomernost rastlin, ki se uporabijo v preskusu, bosta pomembno vplivali na izid preskusa, zato je treba rastline natančno izbrati. Uporabiti je treba mlade, hitrorastoče rastline brez vidnih lezij ali sprememb barve (kloroza). Kulture dobre kakovosti nakazuje visoka pojavnost kolonij, ki imajo najmanj dva lista. Veliko število posameznih listov kaže na okoljski stres, npr. omejitev hranil, in rastlinski material, katerega kulture se ne smejo uporabiti za preskušanje.
1.7.3 Gojenje
Kulture se lahko hranijo pri zmanjšani osvetlitvi in znižani temperaturi (4–10 °C), da se zmanjša pogostnost vzdrževanja kultur (npr. kadar se za neko obdobje ne načrtuje preskusov z vodno lečo). Podrobnosti gojenja so navedene v Dodatku 2. Kadar se pojavijo očitni znaki onesnaženja z algami ali drugimi organizmi, je treba podvzorec listov vodne leče površinsko sterilizirati ter nato prenesti v sveži medij (glejte Dodatek 2). V tem primeru je treba preostalo onesnaženo kulturo zavreči.
Najmanj sedem dni pred preskušanjem je treba zadostno število kolonij aseptično prenesti v sveži sterilni medij in gojiti 7–10 dni v pogojih preskusa.
1.7.4 Preskusni medij
Kakor je opisano spodaj, so za Lemna gibba in Lemna minor priporočeni različni mediji. Natančno je treba proučiti vključitev pufra v preskusni medij (MOPS (4-morfolinpropan sulfonska kislina, CAS št.: 1132–61–2; EINECS št.: 214–478–5) v medij za L. minor in NaHCO3 v medij za L. gibba), kadar sumimo, da lahko reagira s preskusno snovjo in vpliva na izražanje strupenosti. Če se izpolnijo zahteve veljavnosti, je sprejemljiv tudi medij po Steinbergu (12).
Za gojenje L. minor in preskušanje z L. minor je priporočljiva modifikacija gojišča za vodno lečo iz švedskega standarda (SIS). Sestava tega medija je navedena v Dodatku 3.
Za gojenje L. gibba in preskušanje z L. gibba je priporočljivo gojišče 20X – AAP, kakor je opisano v Dodatku 3.
Za L. minor je primeren tudi medij po Steinbergu, kakor je opisan v Dodatku 3, vendar se lahko uporabi tudi za L. gibba pod pogojem, da se izpolnijo zahteve veljavnosti.
1.7.5 Preskusne raztopine
Preskusne raztopine se ponavadi pripravijo z razredčitvijo založnih raztopin. Založne raztopine preskusne snovi se običajno pripravijo z raztopitvijo snovi v gojišču.
Najvišja preskušena koncentracija preskusne snovi običajno ne sme preseči topnosti te snovi v vodi v pogojih preskusa. Vendar je treba opozoriti, da Lemna spp. plavajo na gladini in so lahko izpostavljene snovem, ki se zbirajo na mejni ploskvi med vodo in zrakom (npr. slabo vodotopne snovi ali hidrofobne snovi ali površinsko aktivne snovi). V takšnih pogojih izpostavitev ne bo posledica snovi iz raztopine in preskusne koncentracije lahko, odvisno od značilnosti preskusne snovi, presežejo topnost v vodi. Za preskusne snovi z majhno topnostjo v vodi bo morda treba pripraviti koncentrirano založno raztopino ali dispergirati snov s pomočjo organskega topila ali disperzijskega sredstva, da se omogoči dodajanje točnih količin preskusne snovi v preskusni medij ter da se olajša njeno razprševanje in raztapljanje. Čim bolj si je treba prizadevati, da se izognemo uporabi takšnih snovi. Uporaba pomožnih topil ali disperzijskih sredstev ne sme povzročiti fitotoksičnosti. Npr. pogosto uporabljeni topili, ki ne povzročata fitotoksičnosti pri koncentracijah do 100 μl·l–1, sta med drugim aceton in dimetilformamid. Če se uporabi topilo ali disperzijsko sredstvo, je treba končno koncentracijo te snovi navesti v poročilu in jo ohranjati na najnižji ravni (≤ 100 μl·l–1). Ravno tako morajo vsi postopki obdelave in kontrolni vzorci vsebovati enako koncentracijo topila ali disperzijskega sredstva. Več smernic o uporabi disperzijskih sredstev je na voljo v (11).
1.7.6 Preskusne in kontrolne skupine
Pri izbiri primernih preskusnih koncentracij pripomore predhodno poznavanje strupenosti preskusne snovi za vodno lečo, npr. podatki iz preskusa za ugotavljanje območja. V dokončnem preskusu strupenosti mora biti običajno najmanj pet preskusnih koncentracij, ki so urejene v geometrijskem zaporedju. Po možnosti ločilni faktor med preskusnimi koncentracijami ne sme presegati 3,2, vendar se lahko uporabijo večje vrednosti, če je krivulja odziva na koncentracijo ravna. Če se uporabi manj kot pet koncentracij, je treba to utemeljiti. Za vsako preskusno koncentracijo je treba uporabiti najmanj tri ponovitve.
Pri določevanju območja preskusnih koncentracij (pri ugotavljanju območja in/ali v dokončnem preskusu strupenosti) je treba proučiti naslednje možnosti:
— Za določitev ECx z ustrezno ravnijo zaupanja morajo preskusne koncentracije oklepati vrednost ECx. Npr. če ocenjujemo EC50, mora biti najvišja preskusna koncentracija višja od vrednosti EC50. Če vrednost EC50 leži izven območja preskusnih koncentracij, bodo povezani intervali zaupanja veliki in pravilna ocena statističnega ujemanja modela morda ne bo možna.
— Če je cilj določitev LOEC/NOEC, mora biti najnižja preskusna koncentracija dovolj nizka, da rast ni bistveno manjša od kontrole. Poleg tega mora biti najvišja preskusna koncentracija dovolj visoka, da je rast bistveno manjša od kontrole. V nasprotnem primeru bo treba preskus ponoviti z drugačnim območjem koncentracij (razen če je najvišja koncentracija na meji topnosti ali najvišji zahtevani mejni koncentraciji, npr. 100 mg·l–1).
Vsak preskus mora vključevati kontrole, ki so sestavljene iz enakega hranilnega medija, števila listov in kolonij, okoljskih pogojev in postopkov, kakor se uporabljajo za preskusne posode, vendar brez preskusne snovi. Če se uporablja pomožno topilo ali disperzijsko sredstvo, je treba vključiti dodatno kontrolno obdelavo s topilom/disperzijskim sredstvom, ki je prisotno v enaki koncentraciji kot v posodah s preskusno snovjo. Število ponovitev kontrolnih posod (in posod s topilom, če je smiselno) mora biti najmanj enako, idealno dvakrat večje, številu posod za vsako preskusno koncentracijo.
Če določevanje NOEC ni zahtevano, se načrt preskusa lahko spremeni, tako da se poveča število koncentracij in zmanjša število ponovitev na koncentracijo. Kljub temu morajo imeti kontrolni vzorci najmanj tri ponovitve.
1.7.7 Izpostavitev
Iz inokulacijske kulture se prenesejo kolonije, ki obsegajo od 2 do 4 vidne liste, in naključno določijo preskusnim posodam v aseptičnih pogojih. Vsaka preskusna posoda mora vsebovati skupno od 9 do 12 listov. Število listov in kolonij mora biti v vsaki preskusni posodi enako. Izkušnje, pridobljene s to metodo in v preskusih primerljivosti, kažejo, da tri ponovitve na postopek obdelave, pri čemer vsaka ponovitev na začetku vsebuje 9 do 12 listov, zadostujejo za odkritje razlike v rasti, ki znaša od 4 do 7 % zaviranja med obdelavami, izračunanega s hitrostjo rasti (od 10 do 15 % zaviranja, izračunanega z izplenom) (10).
Za inkubator je treba pripraviti naključno porazdelitev položajev testnih posod, da se čimbolj zmanjša vpliv prostorskih razlik v temperaturi in jakosti svetlobe. Pri beleženju opažanj se tudi zahteva blokovska zasnova oz. naključna razporeditev posod (ali pogostejše premeščanje).
Če predhodni preskus obstojnosti kaže, da koncentracije preskusne snovi ni možno ohranjati (tj. izmerjena koncentracija pade pod 80 % začetno izmerjene koncentracije) v obdobju trajanja poskusa (7 dni), je priporočljiv polstatični režim preskusa. V tem primeru je treba kolonije izpostaviti sveže pripravljenim preskusnim in kontrolnim raztopinam najmanj dvakrat med poskusom (npr. 3. in 5. dan). Pogostost izpostavitve svežemu mediju mora biti odvisna od obstojnosti preskusne snovi: večja pogostnost bo potrebna za ohranjanje približno konstantnih koncentracij zelo neobstojnih ali hlapnih snovi. V določenih okoliščinah bo morda treba uporabiti pretočni postopek (11)(13).
Izpostavitev s foliarnim nanosom (pršenjem) ni obravnavana v tej preskusni metodi. Glejte (14).
1.7.8 Pogoji inkubacije
Uporabiti je treba neprekinjeno toplo ali hladno belo fluorescentno osvetlitev, da je jakost svetlobe v območju od 85 do 135 μE·m–2·s–1, če se meri v fotosintetsko aktivnem sevanju (400–700 nm) v točkah, ki so enako oddaljene od vira svetlobe kot listi vodne leče (enakovredno 6 500–10 000 lux). Razlike v izbrani jakosti svetlobe preko preskusnega območja ne smejo preseči ± 15 %. Metoda zaznavanja in merjenja svetlobe, zlasti vrsta tipala, vpliva na izmerjeno vrednost. Sferična tipala (ki se odzivajo na svetlobo iz vseh kotov nad in pod ravnino merjenja) in „kosinusnih“ tipal (ki se odzivajo na svetlobo iz vseh kotov nad ravnino merjenja) so bolj primerna od enosmernih tipal in dajejo višje odčitke v primeru več točkovnih virov svetlobe, ki so takšne vrste, kot je opisano tu.
Temperatura preskusnih posod mora biti 24 ± 2 °C. Vrednost pH kontrolnega medija se med preskusom ne bi smela povečati za več kot 1,5 enote. Vendar odstopanje za več kot 1,5 enote ne razveljavi preskusa, če se dokaže, da preskus ustreza kriterijem veljavnosti. Posebno pozornost je treba posvetiti lezenju vrednosti pH v posebnih primerih, ko se preskušajo neobstojne snovi ali kovine. Glejte (11) za dodatne smernice.
1.7.9 Trajanje
Preskus se prekine 7 dni po prenosu rastlin v preskusne posode.
1.7.10 Meritve in analitske določitve
Ob začetku preskusa se prešteje in zabeleži število listov v preskusnih posodah, pri čemer je treba zajeti štrleče, razločno vidne liste. Število listov, ki izgledajo normalni ali nenormalni, je treba določiti na začetku preskusa, najmanj vsake 3 dni v obdobju izpostavljanja (tj. najmanj dvakrat v 7-dnevnem obdobju) in ob prekinitvi preskusa. Zabeležiti je treba spremembe v razvoju rastline, npr. v velikosti in izgledu listov, indikacije nekroze, kloroze ali grbavosti, razpadanje kolonij ali izgubo zmožnosti plavanja na gladini ter spremembe dolžine korenin in izgleda. Zabeležiti je treba tudi bistvene značilnosti preskusnega medija (npr. prisotnost neraztopljenih snovi, rast alge v preskusni posodi).
Poleg določitev števila listov med preskusom je treba določiti tudi učinke preskusne snovi na eno (ali več) od naslednjih merjenih spremenljivk:
(i) skupna površina listov;
(ii) suha masa;
(iii) sveža masa.
Skupna površina listov ima prednost v tem, da jo je mogoče določiti za vsako preskusno in kontrolno posodo na začetku preskusa, med preskusom in na koncu preskusa. Suho ali svežo maso je treba določiti na začetku preskusa iz vzorca inokulacijske kulture, ki je reprezentativen za material, s katerim se preskus začne, in na koncu preskusa z rastlinskim materialom iz vsake preskusne in kontrolne posode. Če se površina listov ne izmeri, ima suha masa prednost pred svežo maso.
Skupna površina listov, suha masa in sveža masa se lahko izračunajo po naslednjih postopkih:
(i) Skupna površina listov: Skupna površina listov vseh kolonij se lahko določi s slikovno analizo. Obris preskusne posode in rastlin se lahko zajame z videokamero (npr. z osvetlitvijo posode od spodaj) in nastala slika nato digitalizira. S kalibracijo s ploskimi oblikami znane površine se lahko določi skupna površina listov v preskusni posodi. Paziti je treba, da se izključijo motnje, ki jih povzroča rob preskusne posode. Druga možnost, ki je delovno zahtevnejša, pa je fotografiranje preskusnih posod in rastlin, izrezovanje nastalih obrisov kolonij in določevanje njihove površine z analizatorjem površine listov ali milimetrskim papirjem. Druge tehnike (npr. razmerje teže papirja s površino obrisa kolonij in površine merske enote) so lahko tudi primerne.
(ii) Suha masa: Zbere se vse kolonije iz vsake preskusne posode in jih spere z destilirano ali deionizirano vodo. Kolonije se popivna, da se odstrani odvečno vodo. Nato se posušijo pri 60 °C do konstantne mase. Vključiti je treba vse fragmente korenin. Suho maso je treba izraziti z natančnostjo najmanj 0,1 mg.
(iii) Sveža masa: Vse kolonije se prenese v zatehtane polistirenske epruvete (ali iz druge inertne snovi) z majhnimi (1 mm) odprtinami v zaobljenem dnu. Epruvete se nato centrifugirajo pri 3 000 o/min za 10 minut pri sobni temperaturi. Epruvete, ki vsebujejo sedaj posušene kolonije, se ponovno stehtajo. Sveža masa se izračuna z odštevanjem mase prazne epruvete.
1.7.10.1 Pogostost meritev in analitskih določitev
Če se uporabi statično zasnovo preskusa, je treba pH vsake obdelave izmeriti na začetku in na koncu preskusa. Če se uporabi polstatično zasnovo preskusa, je treba pH izmeriti za vsako šaržo „sveže“ preskusne raztopine pred obnovitvijo in za ustrezno „iztrošeno“ raztopino.
Jakost svetlobe je treba meriti v rastni komori, inkubatorju ali prostoru v točkah, ki so enako oddaljene od vira svetlobe kot listi vodne leče. Jakost svetlobe je treba izmeriti najmanj enkrat med preskusom. Najmanj dnevno je treba beležiti temperaturo medija v nadomestni posodi, ki je v enakih pogojih v rastni komoro, inkubatorju ali sobi.
Med preskusom se v primernih časovnih presledkih določajo koncentracije preskusne snovi. V statičnih preskusih je treba določiti koncentracije najmanj na začetku in na koncu preskusa.
V polstatičnih preskusih se ne pričakuje da bo koncentracija preskusne snovi ostala v območju ± 20 % nazivne koncentracije, zato je treba analizirati vse sveže pripravljene preskusne raztopine in enake raztopine pri vsaki obnovitvi (glejte tretji odstavek v oddelku 1.7.7). Pri tistih preskusih, v katerih izmerjena začetna koncentracije preskusne snovi ni v ± 20 % nazivne koncentracije, vendar obstajajo zadostni dokazi, da so začetne koncentracije ponovljive in obstojne (tj. v območju 80–120 % začetne koncentracije), se lahko kemijske določitve opravijo le na najvišji in najnižji koncentraciji. V vseh primerih je treba določitev koncentracije preskusne snovi pred obnovitvijo opraviti le za eno ponovitev vsake preskusne koncentracije (ali združene vsebine posod posameznih ponovitev).
Če se uporabi pretočni preskus, je treba izvajati podoben režim vzorčenja, kakor je opisan za polstatične preskuse, vključno za analizo na začetku, na sredini in na koncu preskusa, če je smiselno. Vendar meritve „iztrošenih“ raztopin niso primerne v tem primeru. V preskusu te vrste je treba pretok redčila in preskusne snovi ali založne raztopine preskusne snovi preverjati dnevno.
Če so na voljo dokazi, da so se koncentracije preskusne snovi zadovoljivo vzdrževale v območju ± 20 % nazivne ali izmerjene začetne koncentracije ves čas preskusa, lahko analiza rezultatov temelji na nazivnih ali izmerjenih začetnih vrednostih. Če je odklon od nazivne ali izmerjene začetne koncentracije več kot ± 20 %, mora analiza rezultatov temeljiti na geometrijskem povprečju koncentracije med izpostavljanjem ali modelih, ki opisujejo zmanjševanje koncentracije preskusne snovi (11).
1.7.11 Mejni preskus
V določenih okoliščinah, npr. ko predhodni preskus kaže, da preskusna snov nima strupenih učinkov pri koncentracijah do 100 mg·l–1 ali do meje topnosti v preskusnem mediju (katera koli vrednost je nižja), je treba opraviti mejni preskus, ki vključuje primerjavo odzivov kontrolne skupine in obdelane skupine (100 mg·l–1 ali koncentracija, ki je enaka meji topnosti). Zelo se priporoča, da se ta poskus podpre z analizo koncentracije izpostavljanja. Vsi predhodni pogoji preskusa in kriteriji veljavnosti veljajo za mejni preskus, le število ponovitev v obdelani skupini je treba podvojiti. Rast v kontrolni in obdelani skupini se lahko analizira s statističnim preskusom za primerjavo sredin, npr. Studentov t-test.
2. PODATKI IN POROČANJE
2.1 PODVOJITVENI ČAS
Podvojitveni čas (Td) števila listov in izpolnjevanje tega kriterija veljavnosti raziskave (oddelek 1.6) se določi po naslednji enačbi skupaj s podatki iz kontrolnih posod:
Td = ln 2/μ
kjer je μ povprečna specifična hitrost, določena, kakor je opisano v prvem in drugem odstavku oddelka 2.2.1.
2.2 SPREMENLJIVKE ODZIVA
Namen tega preskusa je določiti učinke preskusne snovi na vegetativno rast vrst rodu Lemna. Ta preskusna metoda opisuje dve spremenljivki odziva, saj imajo države članice različne prednosti in zakonske zahteve. Rezultati preskusa bodo sprejemljivi v vseh državah članicah, če se učinki ovrednotijo z obema spremenljivkama odziva, (a) in (b), ki sta opisani spodaj.
(a) Povprečna specifična hitrost rasti: ta spremenljivka odziva se izračuna na osnovi spremembe logaritmov števila listov in na osnovi spremembe logaritmov drugega merjenega parametra (skupne površine listov, suhe mase ali sveže mase) skozi čas (izražen v dnevih) v kontrolni in vsaki obdelani skupini. Včasih se to imenuje relativna hitrost rasti (15).
(b) Izplen: ta spremenljivka odziva se izračuna na osnovi spremembe števila listov in na osnovi spremembe drugega merjenega parametra (skupne površine listov, suhe mase ali sveže mase) v kontrolni in vsaki obdelani skupini.
Opozoriti je treba, da vrednosti strupenosti, ki se izračunajo iz teh dveh spremenljivk odziva niso primerljive. To razliko je treba upoštevati pri uporabi rezultatov preskusa. Če se upoštevajo pogoji preskusa iz te preskusne metode, bodo vrednosti ECx, ki temeljijo na povprečni specifični hitrosti rasti (ErCx), ponavadi višje od rezultatov, ki temeljijo na izplenu (EyCx), zaradi matematične osnove teh dveh pristopov. To se ne sme razlagati kot razlika v občutljivosti obeh spremenljivk odziva. Razlika enostavno izvira iz različne matematične narave vrednosti. Pojem povprečne specifične hitrosti rasti temelji na splošnem vzorcu eksponentne rasti vodne leče v nelimitiranih kulturah, ko se strupenost ocenjuje na osnovi učinkov na hitrost rasti brez odvisnosti od absolutne ravni specifične hitrosti rasti v kontrolnem vzorcu, naklona krivulje odziva na koncentracijo ali od trajanja preskusa. Nasprotno pa so rezultati, ki temeljijo na odzivni spremenljivki izplen odvisni od vseh teh drugih spremenljivk. Vrednost EyCx je odvisna od specifične hitrosti rasti v posameznem preskusu uporabljene vrste vodne leče in od največje specifične hitrosti rasti, ki se lahko med vrstami razlikuje ali celo med kloni. Ta spremenljivka odziva se ne sme uporabiti za primerjanje občutljivosti za strupene snovi med vrstami vodne leče ali celo med kloni. Iz znanstvenega vidika ima uporaba povprečne specifične hitrosti rasti prednost pri ocenjevanju strupenosti. Ocene strupenosti na osnovi izplena pa so vključene v to preskusno metodo, da se izpolnijo trenutne zakonske zahteve nekaterih držav.
Ocene strupenosti morajo temeljiti na številu listov in še eni dodatni merjeni spremenljivki (skupna površina listov, suha teža ali sveža teža), saj lahko nekatere snovi bolj vplivajo na druge merjene spremenljivke kot na število listov. V primeru izračunavanja le števila listov te razlike ne bi zaznali.
Pri vsaki meritvi se število listov in vse druge zabeležene merjene spremenljivke, tj. skupna površina listov, suha teža ali sveža, predstavi v tabeli skupaj s koncentracijami preskusne snovi. Naknadna analiza podatkov, npr. za oceno LOEC, NOEC ali ECx, mora temeljiti na vrednostih posameznih ponovitev in ne na izračunanih povprečnih vrednostih vsake obdelane skupine.
2.2.1 Povprečna specifična hitrost rasti
Povprečna specifična hitrost rasti se za določeno obdobje za vsako ponovitev v kontrolni in vsaki obdelani skupini izračuna kot logaritemsko povečanje spremenljivk rasti – števila listov in še ene druge merjene spremenljivke (skupna površina listov, suha masa ali sveža masa) – po spodnji enačbi:
![]()
pri čemer je:
|
μi–j: |
povprečna specifična hitrost rasti od časa i do časa j |
|
Ni: |
merjena spremenljivka v preskusni posodi ali kontrolni posodi v času i |
|
Nj: |
merjena spremenljivka v preskusni posodi ali kontrolni posodi v času j |
|
t: |
časovno obdobje od i do j. |
Za vsako obdelano skupino in kontrolno skupino se izračuna povprečna vrednost hitrosti rasti in oceni varianca.
Povprečna specifična hitrost rasti se izračuna za celotno preskusno obdobje (čas „i“ v zgornji enačbi pomeni začetek preskusa, čas „j“ pa konec preskusa). Za vsako preskusno koncentracijo in kontrolno skupino se izračuna povprečna vrednost povprečne specifične hitrosti rasti in oceni varianca. Ovrednoti se tudi presečna hitrost rasti, da se ocenijo učinki preskusne snovi, ki se pojavljajo med obdobjem izpostavljanja (npr. pregledovanje logaritemsko pretvorjenih rastnih krivulj). Znatne razlike med presečno hitrostjo rasti in povprečno hitrostjo rasti kažejo odstopanje od konstantne eksponentne rasti. Tedaj je utemeljeno natančno preverjanje rastnih krivulj. Konzervativni pristop v tem primeru je primerjanje specifičnih rastnih krivulj obdelanih kultur v času največjega zaviranja s specifičnimi rastnimi krivuljami kontrolnih kultur v istem času.
Nato se lahko za vsako koncentracijo preskusne snovi (obdelana skupina) izračuna odstotek zaviranja hitrosti rasti (Ir) po naslednji enačbi:

pri čemer je:
|
% Ir: |
odstotek zaviranja povprečne specifične hitrosti rasti |
|
μC: |
povprečna vrednost μ v kontrolnem vzorcu |
|
μT: |
povprečna vrednost μ v obdelanem vzorcu. |
2.2.2 Izplen
Učinki na izplen se določijo na osnovi dveh merjenih spremenljivk, števila listov in še ene druge merjene spremenljivke (skupna površina listov, suha teža ali sveža teža), ki jo je mogoče določiti v vsaki preskusni posodi na začetku in na koncu preskusa. V primeru suhe mase ali sveže mase se določi začetna biomasa na osnovi vzorca listov, odvzetih iz iste šarže, kakor se uporabi za inokulacijo preskusnih posod (glejte drugi odstavek v oddelku 1.7.3). Za vsako preskusno koncentracijo in kontrolno skupino se izračuna povprečna vrednost izplena in oceni varianca. Za vsako obdelano skupino se lahko izračuna odstotek zaviranja v izplenu (% Iy) po naslednji enačbi:
![]()
pri čemer je:
|
% Iy: |
odstotek zmanjšanja izplena |
|
bC: |
končna biomasa minus začetna biomasa v kontrolni skupini |
|
bT: |
končna biomasa minus začetna biomasa v obdelani skupini. |
2.2.3 Izdelava krivulj odziva na koncentracijo
Izrisati je treba krivulje odziva na koncentracijo, ki posredujejo povprečno odstotno zaviranje spremenljivke odziva (Ir, ki se izračuna, kakor je prikazano v zadnjem odstavku oddelka 2.2.1, ali Iy, ki se izračuna, kakor je prikazano v zadnjem odstavku oddelka 2.2.2) in logaritemsko pretvorjeno koncentracijo preskusne snovi.
2.2.4 Ocena ECx
Ocene vrednosti ECx (npr. EC50) morajo temeljiti na povprečni specifični hitrosti rasti (ErCx) in izkoristku (EyCx). Vsaka od teh vrednosti pa temelji na številu listov in še eni dodatni merjeni spremenljivki (skupna površina listov, suha masa ali sveža masa). Postopek je takšen, ker obstajajo preskusne snovi, ki različno vplivajo na število listov in druge merjene spremenljivke. Želeni parametri strupenosti so torej štiri vrednosti ECx za vsako izračunano raven zaviranja x: ErCx (število listov), ErCx (skupna površina listov, suha masa ali sveža masa), EyCx (število listov) in EyCx (skupna površina listov, suha masa ali sveža masa).
2.3 STATISTIČNI POSTOPKI
Cilj je količinsko ovrednotiti odziv na koncentracijo z regresijsko analizo. Možno je uporabiti uteženo linearno regresijo po opravljeni linearizacijski transformaciji podatkov odziva – npr. v probit, logit ali Weibullove enote (16), vendar imajo prednost nelinearni regresijski postopki, saj bolje obravnavajo neizogibne nepreavilnosti v podatkih ter odklone od enakomernih porazdelitev. Takšne nepravilnosti se lahko ob približevanju ničli ali popolni inhibiciji s transformacijo povečajo, kar moti analizo (16). Opozoriti je treba, da so standardne metode analize s probit, logit ali Weibullovo transformacijo namenjene uporabi na kvantnih podatkih (npr. smrtnosti ali preživetju), zato jih je treba prilagoditi za uporabo na podatkih o hitrosti rasti ali izplenu. Specifični postopki za določevanje vrednosti ECx iz kontinuiranih podatkov so na voljo v (17), (18) in (19).
Za vsako analizirano spremenljivko odziva se izračuna točkasta ocena vrednosti ECx, pri čemer se uporabi zveza med odzivom in koncentracijo. Če je možno, se za vsako oceno določi 95-odstotni interval zaupanja. Grafično ali statistično je treba določiti ustreznost prileganja podatkov odzivan na regresijski model. Regresijska analiza se mora opraviti na odzivih posameznih ponovitev in ne na povprečnih vrednostih obdelanih skupin.
Če dostopni regresijski modeli/metode niso primerni za podatke, se lahko ocene EC50 in intervali zaupanja določijo tudi z linearno interpolacijo s postopkom bootstrapping (20).
Za oceno LOEC in posledično NOEC je nujno primerjati povprečne vrednosti obdelanih skupin s tehnikami analize variance (ANOVA). Povprečna vrednost za vsako koncentracijo se primerja s povprečno vrednostjo kontrole z ustrezno metodo večkratne primerjave ali preskusa trenda. Uporabna sta lahko preskus po Dunnettu ali preskus Williamsu (21)(22)(23)(24). Po potrebi se ugotovi, ali velja domneva homogenosti variance v ANOVA. To vrednotenje se lahko opravi grafično ali s formalnim preskusom (25). Primerna preskusa sta preskus po Levenu ali preskus po Bartlettu. Če domneva homogenosti variance ni izpolnjena, lahko to odpravimo z logaritemsko transformacijo podatkov. Če je heterogenost variance skrajna in je ni mogoče odpraviti s transformacijo, je treba proučiti možnosti analize z metodami, kot so večstopenjski preskusi Jonkheere. Več smernic o določevanju vrednosti NOEC je na voljo v (19).
Nedavni razvoj znanosti je privedel do priporočila o opuščanju pojma NOEC in njegovi zamenjavi z regresijsko določenimi točkovnimi ocenami ECx. Za ta preskus z vodno lečo ustrezna vrednost x še ni določena. Vendar izgleda, da je primeren razpon od 10 do 20 % (odvisno od izbrane spremenljivke odziva), zato je treba v poročilih prednostno navajati vrednosti EC10 in EC20.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje podatke:
Preskušana snov:
— agregatno stanje in fizikalno-kemijske lastnosti, vključno z mejo topnosti v vodi,
— kemijski identifikacijski podatki (npr. CAS številka), vključno s čistoto.
Preskusna vrsta:
— znanstveno ime, klon (če je znan) in vir.
Preskusni pogoji:
— uporabljeni preskusni postopek (statični, polstatični ali pretočni),
— datum začetka preskusa in trajanje preskusa,
— preskusni medij,
— opis zasnove poskusa: preskusne posode in pokrovi, volumni raztopin, število kolonij in listov na preskusno posodo na začetku preskusa,
— preskusne koncentracije (nazivne in izmerjene, kakor je smiselno) in število ponovitev na posamezno koncentracijo,
— metode priprave založnih in preskusnih raztopin, vključno z uporabo kakršnihkoli topil ali disperzivnih sredstev,
— temperatura med preskusom,
— vir svetlobe, jakost in homogenost svetlobe,
— vrednosti pH preskusnega in kontrolnega medija,
— koncentracije preskusne snovi in analizna metoda z ustreznimi podatki za vrednotenje kakovosti (validacijske raziskave, standardni odkloni in intervali zaupanja analiz),
— metode za določevanje števila listov in drugih merjenih spremenljivk, npr. suha masa, sveža masa ali površina listov,
— vsa odstopanja od te preskusne metode.
Rezultati:
— neobdelani podatki: število listov in druge merjene spremenljivke v vsaki preskusni in kontrolni posodi za vsa opazovanja in analize,
— povprečne vrednosti in standardni odkloni za vsako merjeno spremenljivko,
— rastne krivulje za vsako koncentracijo (priporočljivo z logaritemsko pretvorjeno merjeno spremenljivko, glejte drugi odstavek oddelka 2.2.1),
— podvojitveni čas/hitrost rasti v kontroli na podlagi števila listov,
— izračunane spremenljivke odziva za vsako ponovitev obdelave s povprečnimi vrednostmi in koeficientom variacije za ponovitve,
— grafična predstavitev razmerja med koncentracijo in učinkom,
— ocene strupenih končnih točk spremenljivk odziva, npr. EC50, EC10, EC20 in povezane intervale zaupanja. LOEC in/ali NOEC, če sta izračunani, in statistične metode za njuno določitev,
— če se uporablja ANOVA, obseg učinka, ki se lahko zazna (npr. najmanjša statistično značilna razlika),
— kakršni koli stimulacijski učinki na rast v kateri koli obdelani skupini,
— kakršni koli vidni znaki fitotoksičnosti ter opažanja preskusne raztopine,
— razprava o rezultatih, ki vključuje vse vplive na izid preskusa, ki so izvirali iz odstopanj od te preskusne metode.
4. VIRI
(1) OECD TG 221 (2006). Lemna Sp. Growth Inhibition Test.
(2) Uporaba raziskave o vodni leči za obarvane snovi je razložena v odstavku 13.5.3 Priročnika o odločitvah EU, julij 2006, na naslovu http://ecb.jrc.ec.europa.eu/new-chemicals
(3) Guidance on information requirements and chemical safety assessment – Poglavje R.7b: Endpoint specific guidance; Preglednica 7.8.3 Summary of difficult substance testing issues, na naslovu
http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1234958685#A
(4) ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742. In, Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA.
(5) USEPA – United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96–156. 8pp.
(6) AFNOR – Association Française de Normalisation. (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
(7) SSI – Swedish Standards Institute. (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (v švedščini).
(8) Environment Canada. (1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37–120 pp.
(9) Environment Canada. (1993). Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Canadian Wildlife Service, Technical Report Series No. 145.
(10) Sims I., Whitehouse P., in Lacey R. (1999). The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency.
(11) OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No.23.
(12) ISO DIS 20079. Water Quality – Determination of the Toxic Effect of Water Constituents and Waste Water to Duckweed (Lemna minor) – Duckweed Growth Inhibition Test.
(13) Walbridge C. T. (1977). A flow-through testing procedure with duckweed (Lemna minor L.). Environmental Research Laboratory – Duluth, Minnesota 55804. US EPA Report No. EPA-600/3–77 108. September 1977.
(14) Lockhart W. L., Billeck B. N. in Baron C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353–359.
(15) Huebert, D.B. in Shay J.M. (1993). Considerations in the assessment of toxicity using duckweeds. Environmental Toxicology and Chemistry, 12, 481–483.
(16) Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718.
(17) Nyholm, N. Sørensen, P.S., Kusk, K.O. in Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167.
(18) Bruce R.D. in Versteeg D.J. (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485–1494.
(19) OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
(20) Norberg-King T.J. (1988). An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN.
(21) Dunnett, C.W. (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096–1121.
(22) Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics, 20, 482–491.
(23) Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103–117.
(24) Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28: 510–531.
(25) Brain P. in Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93–96.
Dodatek 1
Opis Lemna spp.
Vodne rastline Lemna spp., ki jih navadno imenujemo vodna leča, spadajo v družino Lemnaceae, ki ima v štirih rodovih številne vrste, ki rastejo po vsem svetu. Njihov raznolik izgled in raznolika taksonomija sta obsežno opisana (1)(2). Vrsti Lemna gibba in L. minor sta predstavnici iz zmernega podnebja. Pogosto se uporabljata za preskuse strupenosti. Obe vrsti imata plavajoče ali potopljeno diskoidno steblo (list) in zelo tanko korenino, ki izhaja iz središča spodnje površine vsakega lista. Predstavnice rodu Lemna spp. redko cvetijo. Rastline se razmnožujejo vegetativno z nastajanjem novih listov (3). Mlajše rastline so v primerjavi s starejšimi rastlinami svetlejše, imajo krajše korenine in dva do tri liste različnih velikosti. Vodna leča je zaradi majhnosti, preproste strukture, nespolnega razmnoževanja in kratkega generacijskega časa zelo primerna za laboratorijsko preskušanje (4)(5).
Zaradi verjetne medvrstne variacije v občutljivosti so veljavne le primerjave znotraj iste vrste.
Primeri vrst vodne leče, ki so bile uporabljene za preskušanje: referenca vrst
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2. Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys. Chem., 29: 935–941.
Lemna minor: United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96–156. 8pp.
Association Française de Normalisation (AFNOR). (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
Swedish Standards Institute (SIS). (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (v švedščini).
Lemna gibba: ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742.
United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96–156. 8pp.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch. Environ. Contam. Toxicol., 10:1959–1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol. Environ. Saf., 5:87–96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481–483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds. Verh.-Int. Ver. Limnol., 19:2102–2111.
Viri vrst vodne leče
University of Toronto Culture Collection of Algae and Cyanobacteria
Department of Botany, University of Toronto
Toronto, Ontario, Canada, M5S 3 B2
Tel. +1 416 9783641
Faks +1 416 9785878
e-naslov: jacreman@botany.utoronto.ca
http://www.botany.utoronto.ca/utcc
North Carolina State University
Forestry Dept
Duckweed Culture Collection
Campus Box 8002
Raleigh, NC 27695–8002
United States
Tel. 001 (919) 515–7572
astomp@unity.ncsu.edu
Institute of Applied Environmental Research (ITM) Stockholm University
SE-106 91 Stockholm
Sweden
Tel. +46 86747240
Faks +46 86747636
Federal Environmental Agency (UBA)
FG III 3.4
Schichauweg 58
12307 Berlin
Germany
e-naslov: lemna@uba.de
http://www.umweltbundesamt.de/contact.htm
Literatura
(1) Hillman, W.S. (1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221–287.
(2) Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanischen Inst. ETH, Stiftung Rubel, Zürich, Switzerland.
(3) Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82–991150–0–0. The Agricultural Research Council of Norway, University of Oslo.
(4) Wang, W. (1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1–14.
(5) Wang, W. (1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7–22.
Dodatek 2
Vzdrževanje založne kulture
Založne kulture se lahko vzdržujejo pri nizkih temperaturi (4–10 °C) dlje časa brez potrebe po obnovitvi. Gojišče za vodno lečo je lahko enako, kakor se uporablja za preskušanje, vendar se lahko za založne kulture uporabijo tudi drugi mediji, bogati s hranili.
Obdobno se z aseptičnimi tehnikami določeno število mladih, svetlozelenih rastlin prenese v novo gojitveno posodo, ki vsebuje sveži medij. V ohlajenih pogojih, kakor so priporočeni tukaj, se lahko presajanje opravlja v časovnih presledkih, dolgih do tri mesece.
Uporabljati je treba kemijsko čiste (kislinsko oprane) in sterilne steklene gojitvene posode ter aseptične tehnike. V primeru kontaminacije založne kulture, npr. z algami ali glivami, je treba uporabiti postopke, s katerimi odpravimo kontaminirajoče organizme. V primeru alg in večine drugih kontaminirajočih organizmov lahko uporabimo površinsko sterilizacijo. Odvzame se vzorec onesnaženega rastlinskega materiala in odrežejo se korenine. Material se nato močno stresa v čisti vodi, čemur sledi potapljanje v 0,5-odstotno (v/v) raztopino natrijevega hipoklorita za 30 sekund do 5 minut. Rastlinski material nato speremo s sterilno vodo in prenesemo v več šaržah v gojitvene posode, ki vsebujejo sveže gojišče. Veliko listov bo zaradi obdelave odmrlo, zlasti če se uporabijo daljši časi izpostavitve, vendar nekaj preživelih bo ponavadi nekontaminiranih. S temi se lahko inokulirajo nove kulture.
Dodatek 3
Mediji
Za L. minor in L. gibba so priporočena različna gojišča. Za L. minor je priporočljiva modifikacija medija iz švedskega standarda (SIS), za L. gibba pa je priporočljiva modifikacija medija 20X AAP. Sestavi obeh medijev sta navedeni spodaj. Pri pripravi teh medijev je treba uporabiti reagente analitske čistote in deionizirano vodo.
Gojišče za vodno lečo iz švedskega standarda (SIS)
— Založne raztopine I–V steriliziramo z avtoklaviranjem (120 °C, 15 minut) ali membransko filtracijo (velikost por približno 0,2 μm).
— Založno raztopino VI (in neobvezno raztopino VII) steriliziramo le z membransko filtracijo; ti dve raztopini se ne smeta avtoklavirati.
— Sterilne založne raztopine je treba shranjevati v hladnih in temnih pogojih. Založne raztopine I–V je treba zavreči po šestih mesecih, založna raztopina VI (in neobvezno raztopina VII) pa imajo rok uporabnosti en mesec.
—
|
Št. založne raztopine |
Snov |
Koncentracija v založni raztopini (g·l–1) |
Koncentracija v pripravljenem mediju (mg·l–1) |
Pripravljen medij |
|
|
Element |
Koncentracija (mg·l–1) |
||||
|
I |
NaNO3 KH2PO4 |
8,50 1,34 |
85 13,4 |
Na; N K; P |
32; 14 6,0; 2,4 |
|
II |
MgSO4 · 7H2O |
15 |
75 |
Mg; S |
7,4; 9,8 |
|
III |
CaCl2 · 2H2O |
7,2 |
36 |
Ca; Cl |
9,8; 17,5 |
|
IV |
Na2CO3 |
4,0 |
20 |
C |
2,3 |
|
V |
H3BO3 MnCl2 · 4H2O Na2MoO4 · 2H2O ZnSO4 · 7H2O CuSO4 · 5H2O Co(NO3)2 · 6H2O |
1,0 0,20 0,010 0,050 0,0050 0,010 |
1,00 0,20 0,010 0,050 0,0050 0,010 |
B Mn Mo Zn Cu Co |
0,17 0,056 0,0040 0,011 0,0013 0,0020 |
|
VI |
FeCl3 · 6H2O Na2-EDTA·2H2O |
0,17 0,28 |
0,84 1,4 |
Fe — |
0,17 — |
|
VII |
MOPS (pufer) |
490 |
490 |
— |
— |
— Za pripravo enega litra medija SIS se naslednje sestavine dodajo v 900 ml deionizirane vode:
—— 10 ml založne raztopine I,
— 5 ml založne raztopine II,
— 5 ml založne raztopine III,
— 5 ml založne raztopine IV,
— 1 ml založne raztopine V,
— 5 ml založne raztopine VI,
— 1 ml založne raztopine VII (neobvezno),
—
Opomba: Za preskušanje določenih preskusnih snovi bo morda potrebna dodatna količina založne raztopine VII (MOPS pufer) (glejte zadnji odstavek v oddelku 1.4).
— Vrednost pH se uravna na 6,5 ± 0,2 z 0,1 ali 1 molom HCl oziroma NaOH. Volumen se dopolni na en liter z deionizirano vodo.
Gojišče 20X AAP
Pripravijo se založne raztopine v sterilni destilirani ali deionizirani vodi.
Sterilne založne raztopine je treba shranjevati v hladnih in temnih pogojih. V teh pogojih imajo založne raztopine rok uporabnosti najmanj 6–8 tednov.
Za medij 20X-AAP se pripravi pet hranilnih založnih raztopin (A1, A2, A3, B in C) iz kemikalij reagentne čistote. Za pripravo gojišča se doda 20 ml vsake hranilne založne raztopine v približno 850 ml deionizrane vode. Vrednost pH se uravna na 7,5 ± 0,1 z bodisi 0,1 bodisi 1 mol HCl oziroma NaOH. Volumen se uravna na en liter z deionizirano vodo. Gojišče se nato filtrira skozi 0,2-μm (približno) membranski filter v sterilno posodo.
Gojišče, namenjeno za preskušanje, je treba pripraviti 1–2 dni pred uporabo, da se pH stabilizira. Pred uporabo je treba preveriti vrednost pH gojišča. Po potrebi se znova uravna z dodajanjem 0,1 ali 1 molom NaOH oziroma HCl, kakor je opisano zgoraj.
|
Št. Založne raztopine |
Snov |
Koncentracija v založni raztopini (g·l–1) (1) |
Koncentracija v pripravljenem mediju (mg·l–1) (1) |
Pripravljen medij |
|
|
Element |
Koncentracija (mg·l–1) (1) |
||||
|
A1 |
NaNO3 MgCl2·6H2O CaCl2·2H2O |
26 12 4,4 |
510 240 90 |
Na; N Mg Ca |
190; 84 58,08 24,04 |
|
A2 |
MgSO4·7H2O |
15 |
290 |
S |
38,22 |
|
A3 |
K2HPO4·3H2O |
1,4 |
30 |
K; P |
9,4;3,7 |
|
B |
H3BO3 MnCl2·4H2O FeCl3·6H2O Na2EDTA·2H2O ZnCl2 CoCl2·6H2O Na2MoO4·2H2O CuCl2·2H2O |
0,19 0,42 0,16 0,30 3,3 mg·l–1 1,4 mg·l–1 7,3 mg·l–1 0,012 mg·l–1 |
3,7 8,3 3,2 6,0 66 μg·l–1 29 μg·l–1 145 μg·l–1 0,24 μg·l–1 |
B Mn Fe — Zn Co Mo Cu |
0,65 2,3 0,66 — 31 μg·l–1 7,1 μg·l–1 58 μg·l–1 0,080 μg·l–1 |
|
C |
NaHCO3 |
15 |
300 |
Na; C |
220; 43 |
|
(1) Razen če ni drugačne opombe |
|||||
Končna opomba: Teoretično primerna končna koncentracija bikarbonata (pri kateri ni treba znatno uravnavati vrednosti pH) je 15 mg/l, ne 300 mg/l. Vendar zgodovinska uporaba medija 20X-AAP, vključno z uporabo v preskusu primerljivosti, temelji na 300 mg/l. (I. Sims, P. Whitehouse in R. Lacey. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency.)
Medij po STEINBERGU (po ISO 20079)
Koncentracije in založne raztopine:
— Modificiran medij po Steinbergu se v ISO 20079 uporablja le za Lemna minor (saj je v tem standardu dovoljena le Lemna minor), vendar so preskusi pokazali, da se lahko dobri rezultati dosežejo tudi z Lemna gibba.
— Pri pripravi medija je treba uporabiti kemikalije reagentne ali analitske čistote in deionizirano vodo.
— Gojišče se pripravi iz založnih raztopin ali 10-kratno koncentriranega medija, ki omogoča najvišjo koncentracijo medija brez obarjanja.
Tabela 1
pH-stabiliziran medij po STEINBERGU (modificiran po Altenburgerju)
|
Snov |
Gojišče |
||
|
Makroelementi |
mol. masa |
mg/l |
mmol/l |
|
KNO3 |
101,12 |
350,00 |
3,46 |
|
Ca(NO3)2 · 4H2O |
236,15 |
295,00 |
1,25 |
|
KH2PO4 |
136,09 |
90,00 |
0,66 |
|
K2HPO4 |
174,18 |
12,60 |
0,072 |
|
MgSO4 · 7H2O |
246,37 |
100,00 |
0,41 |
|
Mikroelementi |
mol. masa |
μg/l |
μmol/l |
|
H3BO3 |
61,83 |
120,00 |
1,94 |
|
ZnSO4 · 7H2O |
287,43 |
180,00 |
0,63 |
|
Na2MoO4 · 2H2O |
241,92 |
44,00 |
0,18 |
|
MnCl2 · 4H2O |
197,84 |
180,00 |
0,91 |
|
FeCl3 · 6H2O |
270,21 |
760,00 |
2,81 |
|
EDTA dinatrijev dihidrat |
372,24 |
1 500,00 |
4,03 |
Tabela 2
Založne raztopine (makroelementi)
|
1. Makroelementi (50-kratno koncentrirani) |
g/l |
|
Založna raztopina 1: |
|
|
KNO3 |
17,50 |
|
KH2PO4 |
4,5 |
|
K2HPO4 |
0,63 |
|
Založna raztopina 2: |
|
|
MgSO4 · 7H2O |
5,00 |
|
Založna raztopina 3: |
|
|
Ca(NO3)2 · 4H2O |
14,75 |
Tabela 3
Založne raztopine (mikroelementi)
|
2. Mikroelementi (1 000-kratno koncentrirani) |
mg/l |
|
Založna raztopina 4: |
|
|
H3BO3 |
120,0 |
|
Založna raztopina 5: |
|
|
ZnSO4 · 7H2O |
180,0 |
|
Založna raztopina 6: |
|
|
Na2MoO4 · 2H2O |
44,0 |
|
Založna raztopina 7: |
|
|
MnCl2 · 4H2O |
180,0 |
|
Založna raztopina 8: |
|
|
FeCl3 · 6H2O |
760,00 |
|
EDTA dinatrijev dihidrat |
1 500,00 |
— Založni raztopini 2 in 3 je možno združiti (ob upoštevanju zahtevanih koncentracij). Ravno tako založne raztopine 4 do 7.
— Za daljši rok uporabnosti se lahko založne raztopine obdelajo v avtoklavu pri 121 °C za 20 min. Druga možnost pa je sterilna filtracija (0,2 μm). Za založno raztopino 8 je močno priporočljiva sterilna filtracija (0,2 μm).
Priprava končne koncentracije (modificiranega) medija po STEINBERGU
— V približno 900 ml deionizrane vode se doda 20 ml založnih raztopin 1, 2 in 3 (glejte tabelo 2), da se prepreči obarjanje.
— Doda se 1,0 ml založnih raztopin 4, 5, 6 in 7 (glejte tabelo 3).
— Vrednost pH mora biti 5,5 ± 0,2 (uravnava se z dodajanjem minimalnega volumna raztopine NaOH ali HCl).
— Z vodo se dopolni do 1 000 ml.
— Če so založne raztopine sterilizirane in se uporabi ustrezna voda, dodatna sterilizacija ni potrebna. Če se sterilizira končni medij, je treba založno raztopino 8 dodati po avtoklaviranju (pri 121 °C za 20 min).
Priprava 10-kratno koncentriranega (modificiranega) medija po STEINBERGU za začasno hranjenje
— V približno 30 ml vode se doda 20 ml založnih raztopin 1, 2 in 3 (glejte tabelo 2), da se prepreči obarjanje.
— Doda se 1,0 ml založnih raztopin 4, 5, 6 in 7 (glejte tabelo 3). Z vodo se dopolni do 100 ml.
— Če so založne raztopine sterilizirane in se uporabi ustrezna voda, dodatna sterilizacija ni potrebna. Če se sterilizira končni medij, je treba založno raztopino 8 dodati po avtoklaviranju (pri 121 °C za 20 min).
— Vrednost pH medija (končne koncentracije) mora biti 5,5 ± 0,2.
( 1 ) UL L 396, 30.12.2006, str. 1. Popravljena različica v UL L 136, 29.5.2007, str. 3.
( 2 ) UL P 196, 16.8.1967, str. 1. Direktiva, kakor je bila nazadnje spremenjena z Direktivo 2006/121/ES Evropskega parlamenta in Sveta (UL L 396, 30.12.2006, str. 850). Popravljena različica v UL L 136, 29.5.2007, str. 281.
( 3 ) Kot na primer v uredbah ZN o prevozu.
( 4 ) Kislino je treba titrirati pred preskušanjem za potrditev njene koncentracije.
( 5 ) Npr.: 50 % (m/v) perklorne kisline in 40 % (m/m) natrijevega klorata se uporabi kot referenca 1.
( 6 ) Npr.: Whatmanov stolpec za kromatografski celulozni prah CF 11, kataložna številka 4021 050.
( 7 ) Potrjeno (npr.) s Karl-Fisherjevo titracijo.
( 8 ) Druga možnost je, da se doseže ta vsebnost vode lahko tudi z (npr.) 24-urnim segrevanjem pri 105 oC v brezzračnem prostoru.
( 9 ) Mešanice oksidantov s celulozo je treba obravnavati kot potencialno eksplozivne in z njimi ustrezno pravilno ravnati.
( 10 ) V praksi se to lahko to doseže tako, da se pripravi mešanica 1: 1 tekoče snovi, ki jo je treba preskusiti, in celuloze v večji količini, kot je potrebno za poskus, in prenesti 5 ± 0,1 g v tlačno posodo. Mešanico je treba za vsak poskus sveže pripraviti.
( 11 ) Zlasti se je treba izogibati stiku med sosednjimi zavoji tuljave.
( 12 ) Glej sklic 1 za razlago rezultatov v skladu z zakonodajo ZN o prevozu z uporabo različnih referenčnih snovi.
( 13 ) Ta vrednost povečave je določena za vlakna s premerom 3 μm, za vlakna s premerom 6 μm pa je primernejša povečava ×5 000.
( 14 ) Za vlakna s premerom 3 μm glej prejšnjo opombo.
( 15 ) Predel motnosti roženice je treba navesti.
( 16 ) Za določeno število preiskav seruma in plazme, zlasti za določanje glukoze, se priporoča, da se živali čez noč postijo. Glavni razlog za to je, da bi povečana variabilnost, ki bi se pojavila, če se žival ne bi postila, lahko pripeljala do prikritja manj opaznih učinkov in do težav pri razlagi. Po drugi strani pa lahko post čez noč spremeni splošni metabolizem živali in zlasti pri študijah prehranjevanja ovira dnevno izpostavljenost preskusni snovi. Če je bil izbran post, je treba klinične biokemične preiskave izvesti po zaključku funkcionalnih opazovanj v četrtem tednu študije.
( 17 ) Za več meritev v serumu in plazmi, zlasti pa za glukozo, je priporočeno, da se živali čez noč postijo. Glavni razlog za to je, da bi povečana variabilnost, ki bi bila neizogibno posledica nepoštenja, prikrila šibkejše učinke in otežila interpretacijo. Po drugi strani pa poštenje čez noč lahko vpliva na splošno presnovo živali in zlasti v študijah prehranjevanja zmoti dnevno izpostavljenost preskusni snovi. Če se uporabi poštenje čez noč, je treba klinične biokemične analize izvesti po opravljenih funkcionalnih opazovanjih v okviru študije.
( 18 ) Danes poznana kot serumska alanin aminotransferaza.
( 19 ) Danes poznana kot serumska aspartat aminotransferaza
( 20 ) Navedene organe, odvzete na desetih živalih po spolu na skupino v primeru glodalcev ter na vseh neglodalcih, skupaj s ščitnico (in obščitnicami), je treba stehtati.
( 21 ) Navedene organe, odvzete na 10 živalih po spolu na skupino, je treba stehtati.
( 22 ) V tej metodi je referenčna skupina tista, pri kateri se preskusna snov daje na drug način, kar zagotavlja popolno biorazpoložljivost odmerka.
( 23 ) UL L 225, 21.8.2001, str. 1.
( 24 ) Navedene dimenzije se nanašajo na držala za roženico, ki se uporabljajo pri kravah, starih od 12 do 60 mesecev. Za uporabo pri živalih, starih od šest do 12 mesecev, bi moralo biti držalo zasnovano tako, da bi bila prostornina vsakega dela 4 mL, premer obeh notranjih delov 1,5 cm in njuna globina 2,2 cm. Pri vsakem novo zasnovanem držalu za roženico je pomembno, da je razmerje med izpostavljeno površino roženice in prostornino zadnjega dela enako razmerju pri običajnih držalih za roženico. Tako se zagotovi, da se pravilno določijo vrednosti prepustnosti za izračun IVIS s predlagano formulo.
( 25 ) Rezultati teh medlaboratorijskih preskusov in Tehnični popravek ISO 6341 so za kalijev dikromat (K2Cr2O7) pokazali EC50 – 24 h v območju 0,6 mg/l do 1,7 mg/l.
( 26 ) Po uporabi je treba raztopine, ki vsebujejo živosrebrove soli, primerno obdelati, da se prepreči sproščanje živega srebra v okolje.
( 27 ) Mabey in Mill priporočata boratne ali acetatne pufre namesto fosfatnih (11).
( 28 ) Ti podatki lahko izvirajo iz drugih virov, kot so podatki o hidrolizi strukturno podobnih spojin iz literature ali drugih predhodnih polkvantitativnih preskusov hidrolize s preskusno snovjo z zgodnejše stopnje razvoja.
( 29 ) Če grafična predstavitev logaritemsko pretvorjenih podatkov v odvisnosti od časa ne kaže linearne funkcije (izenačene s stopnjo reakcije prvega reda), uporaba enačbe [3] ni ustrezna za določanje konstante hitrosti hidrolize preskusne snovi.
( 30 ) Vrednosti pH v teh tabelah so bile izračunane iz potencialnih meritev s Sorensenovimi standardnimi enačbami (1909). Ustrezne vrednosti pH so 0,04 enote višje od vrednosti iz preglednice.
( 31 ) Meyer, A., Bierman, C. H. and Orti, G. (1993). The phylogenetic position of the zebrafish (Danio rerio), a model system in developmental biology: an invitation to the comparative method. Proc. R. Soc. Lond. B. 252, str. 231–236.
( 32 ) OECD, Pariz, 1992, Preskusna navodila 210, Ribe, Preskus strupenosti v zgodnjih razvojnih stadijih.
( 33 )
![]()
( 34 ) Za ocenjevanje vzpostavitve ravnotežnega konstantnega nivoja se lahko uporabijo tudi grafi koncentracije preskusne snovi v vodni fazi
![]()
( 35 ) DT-50: čas razgradnje 50 % preskusne snovi.
( 36 ) Na primer, če preskusna snov vsebuje en obroč, je potrebna oznaka tega obroča; če preskusna snov vsebuje dva ali več obročev, so lahko potrebne študije za ovrednotenje usode vsakega označenega obroča in pridobitev ustreznih informacij o oblikovanju produktov transformacije.
( 37 ) Sposobnost tal glede zadrževanja vode se lahko izmeri kot poljska kapaciteta tal za vodo, kot zmogljivost zadrževanja vode ali kot pritisk črpanja vode (pF). Za razlago glej Dodatek 1. V poročilu o preskusu je treba navesti, ali sta bili sposobnost zadrževanja vode in gostota v razsutem stanju določeni v neoviranih vzorcih zemljišča ali v oviranih (predelanih) vzorcih.
( 38 ) Rezultati novejših raziskav kažejo, da se lahko tudi tla iz zmernih pasov shranijo pri –20 oC za več kakor tri mesece (28) (29) brez večjih izgub mikrobne dejavnosti.
( 39 ) Aerobne razmere prevladujejo v površinskih tleh in celo v podpovršinskih tleh, kot je prikazano v raziskovalnem projektu, ki ga je sponzorirala EU (K. Takagi et al. (1992). Microbial diversity and activity in subsoils: Methods, field site, seasonal variation in subsoil temperatures and oxygen contents. Proc. Internat. Symp. Environm. Aspects Pesticides Microbiol., 270–277, 17.–21. avgust 1992, Sigtuna, Švedska). Anaerobne razmere se lahko samo občasno pojavijo med poplavami tal po hudem deževju ali kadar so vzpostavljene namakalne razmere na riževih poljih.
( 40 ) Aerobne študije se lahko prekinejo precej pred 120 dnevi, pod pogojem, da je do takrat jasno dosežena pot transformacije in dokončna mineralizacija. Prekinitev preskusa je mogoča po 120 dneh ali ko je transformiranih najmanj 90 % preskusne snovi, vendar le, če je oblikovanih najmanj 5 % CO2.
( 41 ) Izračun začetne koncentracije na področni osnovi z uporabo naslednje enačbe:

|
Csoil |
= |
začetna koncentracija v tleh [mg·kg-1] |
|
A |
= |
stopnja aplikacije [kg· ha-1]; 1 = gostota plasti tal na polju[m]; d = gostota suhih tal v razsutem stanju [m]; d = gostota sunih tal v razsutem stanju [kg· m-3]. |
Praviloma daje stopnja uporabe 1 kg-ha-1 v tleh koncentracijo približno 1 mg· kg-1 v 10-centimetrski plasti (ob predpostavki gostote v razsutem stanju 1 g· cm-3).
( 42 ) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
( 43 ) Guth, J. A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123–157.
( 44 ) Guth, J. A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85–114.
( 45 ) Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141–146.
( 46 ) Na primer, če snov vsebuje en obroč, je potrebna oznaka tega obroča; če preskusna snov vsebuje dva ali več obročev, so lahko potrebne študije za ovrednotenje usode vsakega označenega obroča in pridobitev ustreznih informacij o oblikovanju produktov transformacije.
( 47 ) Novejše študije so pokazale, da lahko shranjevanje pri 4 oC vodi v zmanjšanje vsebnosti organskega ogljika v usedlini, kar lahko povzroči tudi zmanjšanje mikrobne dejavnosti (34).
( 48 ) Preskus z drugo koncentracijo je lahko koristen pri kemikalijah, ki pridejo v površinske vode po drugih vstopnih poteh in povzročijo znatno drugačne koncentracije, če se lahko manjša koncentracija dovolj natančno analizira.