EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32014R0900
Commission Regulation (EU) No 900/2014 of 15 July 2014 amending, for the purpose of its adaptation to technical progress, Regulation (EC) No 440/2008 laying down test methods pursuant to Regulation (EC) No 1907/2006 of the European Parliament and of the Council on the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) Text with EEA relevance
Uredba Komisije (EU) št. 900/2014 z dne 15. julija 2014 o spremembi Uredbe (ES) št. 440/2008 o določitvi testnih metod v skladu z Uredbo (ES) št. 1907/2006 Evropskega parlamenta in Sveta o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) z namenom njene prilagoditve tehničnemu napredku Besedilo velja za EGP
Uredba Komisije (EU) št. 900/2014 z dne 15. julija 2014 o spremembi Uredbe (ES) št. 440/2008 o določitvi testnih metod v skladu z Uredbo (ES) št. 1907/2006 Evropskega parlamenta in Sveta o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) z namenom njene prilagoditve tehničnemu napredku Besedilo velja za EGP
OJ L 247, 21.8.2014, p. 1–111
(BG, ES, CS, DA, DE, ET, EL, EN, FR, HR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 In force
In force
|
21.8.2014 |
SL |
Uradni list Evropske unije |
L 247/1 |
UREDBA KOMISIJE (EU) št. 900/2014
z dne 15. julija 2014
o spremembi Uredbe (ES) št. 440/2008 o določitvi testnih metod v skladu z Uredbo (ES) št. 1907/2006 Evropskega parlamenta in Sveta o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) z namenom njene prilagoditve tehničnemu napredku
(Besedilo velja za EGP)
EVROPSKA KOMISIJA JE –
ob upoštevanju Pogodbe o delovanju Evropske unije,
ob upoštevanju Uredbe (ES) št. 1907/2006 Evropskega parlamenta in Sveta z dne 18. decembra 2006 o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) ter o ustanovitvi Evropske agencije za kemikalije in o spremembi Direktive 1999/45/ES ter o razveljavitvi Uredbe Sveta (EGS) št. 793/93 in Uredbe Komisije (ES) št. 1488/94 ter Direktive Sveta 76/769/EGS in direktiv Komisije 91/155/EGS, 93/67/EGS, 93/105/ES in 2000/21/ES (1), ter zlasti člena 13(2) Uredbe,
ob upoštevanju naslednjega:
|
(1) |
Uredba Komisije (ES) št. 440/2008 (2) vsebuje preskusne metode za namene ugotavljanje fizikalno-kemijskih lastnosti, toksičnosti in ekotoksičnosti kemikalij, ki jih je treba uporabiti za namene Uredbe (ES) št. 1907/2006. |
|
(2) |
Uredbo (ES) št. 440/2008 je treba posodobiti tako, da se vanjo prednostno vključijo nove in posodobljene preskusne metode, ki jih je pred kratkim sprejel OECD, in da se v skladu z Direktivo 2010/63/EU Evropskega parlamenta in Sveta (3) zagotovi zmanjšanje števila živali za poskusne namene. Opravljena so bila posvetovanja z deležniki o tem osnutku. |
|
(3) |
Ta prilagoditev tehničnemu napredku vsebuje šest novih preskusnih metod za ugotavljanje toksičnosti in drugih učinkov na zdravje, vključno s študijo razvojne nevrotoksičnosti, razširjeno enogeneracijsko študijo strupenosti za razmnoževanje, preskusom genskih mutacij in vivo pri gensko spremenjenih glodavcih, preskusom in vitro za preiskovanje učinkov na sintezo steroidnih hormonov ter dvema metodama in vivo za preiskovanje estrogenih in (anti)androgenih učinkov. |
|
(4) |
Uredbo (ES) št. 440/2008 bi bilo zato treba ustrezno spremeniti. |
|
(5) |
Ukrepi iz te uredbe so v skladu z mnenjem odbora, ustanovljenega na podlagi člena 133 Uredbe (ES) št. 1907/2006 – |
SPREJELA NASLEDNJO UREDBO:
Člen 1
Priloga k Uredbi (ES) št. 440/2008 se spremeni v skladu s Prilogo k tej Uredbi.
Člen 2
Ta uredba začne veljati tretji dan po objavi v Uradnem listu Evropske unije.
Ta uredba je v celoti zavezujoča in se neposredno uporablja v vseh državah članicah.
V Bruslju, 15. julija 2014
Za Komisijo
Predsednik
José Manuel BARROSO
(1) UL L 396, 30.12.2006, str. 1.
(2) Uredba Komisije (ES) št. 440/2008 z dne 30. maja 2008 o določitvi testnih metod v skladu z Uredbo (ES) št. 1907/2006 Evropskega parlamenta in Sveta o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) (UL L 142, 31.5.2008, str. 1).
(3) Direktiva 2010/63/EU Evropskega parlamenta in Sveta z dne 22. septembra 2010 o zaščiti živali, ki se uporabljajo v znanstvene namene (UL L 276, 20.10.2010, str. 33).
PRILOGA
Priloga k Uredbi (ES) št. 440/2008 se spremeni:
vstavijo se poglavja B.53, B.54, B.55, B.56, B.57 in B.58:
„B.53 ŠTUDIJA RAZVOJNE NEVROTOKSIČNOSTI
UVOD
1. Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) št. 426 (2007). Delovna skupina OECD za strupenost za razmnoževanje in razvoj je junija 1995 v Københavnu obravnavala potrebo po posodobitvi obstoječih smernic za preskušanje OECD za strupenost za razmnoževanje in razvoj ter pripravo novih smernic za končne točke, ki še niso zajete (1). Delovna skupina je priporočila, da bi bilo treba smernico za preskušanje v zvezi z razvojno nevrotoksičnostjo pripraviti na podlagi smernice ameriške agencije EPA, ki je bila tudi že revidirana (2). Junija 1996 je v Københavnu potekalo drugo posvetovalno zasedanje, da bi se sekretariatu predložili napotki za pripravo nove smernice za preskušanje v zvezi s strupenostjo za razvoj, vključno s pomembnimi dejavniki, npr. podrobnostmi o izbiri živalskih vrst, obdobjem odmerjanja, preskusnim obdobjem, končnimi točkami, ki jih je treba oceniti, in merili za vrednotenje rezultatov. Leta 1998 je bila objavljena ameriška smernica za oceno tveganja nevrotoksičnosti (3). Oktobra 2000 sta drug za drugim potekala strokovno posvetovalno zasedanje OECD in delavnica Inštituta za tvegano znanost ILSI, leta 2005 pa je bilo v Tokiu organizirano strokovno posvetovalno zasedanje. Namen teh srečanj je bila obravnava znanstvenih in tehničnih vprašanj, povezanih z obstoječo smernico za preskušanje, priporočila z zasedanj (4) (5) (6) (7) pa so se upoštevala pri pripravi te testne metode. Dodatne informacije o izvedbi, interpretaciji in terminologiji, uporabljeni za to preskusno metodo, so navedene v smernicah OECD št. 43 ‚Reproductive Toxicity Testing and Assessment‘ (8) in št. 20 ‚Neurotoxicity Testing‘ (9).
ZAČETNI PREUDARKI
2. Znano je, da številne kemikalije povzročajo razvojne nevrotoksične učinke pri človeku in drugih vrstah (10) (11) (12) (13). Za oceno in vrednotenje strupenih lastnosti kemikalije je lahko potrebna določitev možnosti za razvojno nevrotoksičnost. Študije razvojne nevrotoksičnosti so namenjene zagotavljanju podatkov o možnih funkcionalnih in morfoloških učinkih na razvijajoči se živčni sistem potomca, ki lahko nastanejo zaradi izpostavljenosti v maternici in zgodnjem življenjskem obdobju, vključno z opredelitvami odziva na odmerek.
3. Študija razvojne nevrotoksičnosti se lahko izvede kot ločena študija, lahko je vključena v študijo strupenosti za razmnoževanje in/ali nevrotoksičnosti pri odraslih (npr. preskusne metode B.34 (14), B.35 (15) in B.43 (16)) ali dodana študiji strupenosti za predrojstveni razvoj (npr. preskusna metoda B.31 (17)). Če je študija razvojne nevrotoksičnosti vključena v drugo študijo ali ji je dodana, je treba ohraniti celovitost obeh vrst študij. Vsi preskusi morajo biti v skladu z veljavno zakonodajo ali vladnimi in institucionalnimi smernicami za uporabo laboratorijskih živali v raziskavi (npr. 18).
4. Preskuševalni laboratorij mora pred začetkom izvajanja študije preučiti vse razpoložljive informacije o preskusni kemikaliji. Takšne informacije vključujejo vrsto in strukturo kemikalije, njene fizikalno-kemijske lastnosti, rezultate katerih koli drugih preskusov strupenosti kemikalije in vitro ali in vivo, toksikološke podatke o strukturno sorodnih kemikalijah in pričakovane uporabe kemikalije. Te informacije so potrebne, da se vsem, ki jih to zadeva, zagotovi, da je preskus pomemben za zaščito zdravja ljudi in da bo v pomoč pri izbiri ustreznega začetnega odmerka.
NAČELO PRESKUSA
5. Preskusna kemikalija se živalim daje med brejostjo in laktacijo. Matere se preskušajo za oceno učinkov na breje in doječe samice, pri čemer se lahko zagotovijo tudi primerjalne informacije (matere v primerjavi s potomci). Potomci se za vrednotenje nevrotoksičnosti naključno izberejo iz legel. Vrednotenje zajema opazovanje makroskopskih nevroloških in vedenjskih sprememb, vključno z oceno telesnega razvoja, vedenjske ontogenije, motorične aktivnosti, motorične in senzorične funkcije, učenja in spominjanja ter vrednotenjem teže možganov in nevropatologije med poporodnim razvojem in odraslo dobo.
6. Če je preskusna metoda izvedena kot ločena študija, se lahko dodatne razpoložljive živali iz vsake skupine uporabijo za posebne nevrovedenjske, nevropatološke, nevrokemične ali elektrofiziološke postopke, ki lahko dopolnijo podatke, dobljene s preiskavami, ki se priporočajo po tej metodi (16) (19) (20) (21). Dopolnilni postopki so lahko posebno koristni, kadar empirična opazovanja, pričakovani učinki ali mehanizem/način delovanja kaže posebno vrsto nevrotoksičnosti. Ti dopolnilni postopki se lahko uporabijo pri materah in mladičih. Uporabijo se lahko tudi postopki ex vivo ali in vitro, če ne spremenijo celovitosti postopkov in vivo.
PRIPRAVE ZA PRESKUS
Izbira živalskih vrst
7. Priporočena preskusna vrsta je podgana; druge vrste se lahko uporabijo, če je primerno. Vendar je treba opozoriti, da so dnevi brejosti in dnevi po rojstvu, navedeni v tej preskusni metodi, značilni za običajno uporabljene seve podgan, pri čemer je treba izbrati primerljive dneve, če se uporabijo druge vrste ali neobičajni sev. Uporabo drugih vrst je treba utemeljiti na podlagi podatkov o strupenosti, farmakokinetičnih podatkov in/ali drugih podatkov. Utemeljitev mora vključevati razpoložljivost poporodnih nevrovedenjskih in nevropatoloških ocen za posamezne vrste. Če že obstaja preskus, ki je povzročil zaskrbljenost, bi bilo treba razmisliti o uporabi vrste/seva, ki je povzročil zaskrbljenost. Zaradi različne učinkovitosti različnih sevov podgan je treba dokazati, da je sev, ki je bil izbran za uporabo, ustrezno ploden in odziven. Dokumentirati je treba zanesljivost in občutljivost drugih vrst za zaznavanje razvojne nevrotoksičnosti.
Nastanitveni in prehranjevalni pogoji
8. Temperatura v prostoru za preskusne živali mora biti 22 ± 3 °C. Čeprav mora biti relativna vlažnost vsaj 30 % in po možnosti ne presega 70 %, razen med čiščenjem prostora, mora biti cilj 50–60 %. Osvetlitev mora biti umetna, pri čemer je zaporedje 12 ur svetlobe in 12 ur teme. Ciklus osvetlitve se lahko pred parjenjem in med izvajanjem študije tudi obrne, da se izvede ocena funkcionalnih in vedenjskih končnih točk v obdobju teme (pri rdeči svetlobi), tj. ko so živali običajno aktivne (22). Vse spremembe ciklusa svetlobe in teme morajo vključevati ustrezno aklimatizacijo, da se živalim omogoči prilagoditev na novi ciklus. Za hranjenje se lahko uporablja običajna laboratorijska hrana z neomejeno količino pitne vode. Navedeta se vrsta hrane in vode, obe pa se analizirata za kontaminante.
9. Živali se lahko nastanijo posamično ali dajo v kletke v manjših skupinah istega spola. Parjenje se mora izvajati v kletkah, ki so primerne za ta namen. Po dokazu o kopulaciji ali najpozneje 15. dan brejosti se sparjene živali naselijo v kletke za kotitev ali kletke za matere. Kletke je treba razporediti tako, da so morebitni učinki zaradi njihovega položaja čim manjši. Ko je kotitev blizu, je treba sparjenim samicam zagotoviti ustrezen in določen material za izdelavo gnezda. Dobro znano je, da ima lahko neustrezno ravnanje ali stres med brejostjo neugodne posledice, vključno izgubo zarodka ter spremenjenim razvojem pred rojstvom in po njem. Da bi preprečili predrojstveno izgubo zaradi dejavnikov, ki niso povezani s tretiranjem, je treba z živalmi med brejostjo ravnati previdno ter se izogibati stresu zaradi zunanjih dejavnikov, na primer čezmernega zunanjega hrupa.
Priprava živali
10. Uporabiti je treba zdrave živali, ki so prilagojene na laboratorijske razmere in predhodno niso bile uporabljene za poskuse, razen če je študija vključena v drugo študijo (glej odstavek 3). Opredeliti je treba vrsto, sev, vir, spol, težo in starost preskusnih živali. Vsaki živali se dodeli edinstvena identifikacijska številka, s katero se označi. Živali iz vseh preskusnih skupin morajo imeti čim bolj enako težo in starost ter biti v običajnem razponu vrst in seva iz študije. Za vsako velikost odmerka je treba uporabiti mlade odrasle samice, ki še niso kotile. Sorojenci se ne smejo pariti, kar je treba skrbno zagotoviti. Dan brejosti (DB) 0 je dan, ko se opazi vaginalni čep in/ali seme. Pri nakupu brejih živali pri dobavitelju je treba omogočiti ustrezen čas aklimatizacije (npr. 2–3 dni). Sparjene samice je treba na nepristranski način razdeliti v kontrolne in tretirane skupine ter jih med skupinami čim bolj enakomerno porazdeliti (npr. za zagotovitev enakomerne porazdelitve med skupinami, kot je razdelitev na podlagi telesne teže, se priporoča stratificiran naključni postopek). Samice, ki jih osemeni isti samec, je treba enakomerno razdeliti med skupine.
POSTOPEK
Število in spol živali
11. Vsaka preskusna in kontrolna skupina mora vključevati zadostno število brejih samic, ki bodo izpostavljene preskusni kemikaliji, za zagotovitev, da se skoti ustrezno število potomcev za vrednotenje nevrotoksičnosti. Za vsak odmerek je priporočenih 20 zarodov. Zasnove za odmerjanje v ponovitveni in postopni skupini so dovoljene, če je doseženo skupno število zarodov na skupino in se za ponovitve upoštevajo ustrezni statistični modeli.
12. Na poporodni dan (PPD) 4 ali pred njim (dan kotitve je PPD 0) je treba velikost posameznega zaroda prilagoditi z naključno izločitvijo odvečnih mladičev, da so vsi zarodi enako veliki (23). Velikost zaroda ne sme presegati povprečne velikosti zaroda za uporabljeni sev glodavcev (8–12). V zarodu mora biti čim bolj uravnoteženo število mladih samcev in samic. Selektivno izločanje mladičev, npr. na podlagi telesne teže, ni ustrezno. Po standardizaciji zarodov (izločevanju) in pred nadaljnjim preskušanjem funkcionalnih končnih točk je treba posamezne mladiče, ki so predvideni za preskušanje pred odstranitvijo od sesanja in po njej, označiti z edinstvenimi oznakami s pomočjo katere koli primerne humane metode označevanja mladičev (npr. 24).
Dodelitev živali za funkcionalne in vedenjske preskuse, tehtanje možganov ter nevropatološka vrednotenja
13. Preskusna metoda omogoča različne pristope glede na dodelitev živali, ki so bile izpostavljene in utero in v obdobju laktacije, za funkcionalne in vedenjske preskuse, spolno zrelost, določanje teže možganov ter nevropatološko vrednotenje (25). Drugi preskusi nevrovedenjske funkcije (npr. socialno vedenje), nevrokemije ali nevropatologije se lahko dodajo glede na posamezni primer, če se ne ogrozi celovitost izvirnega preskusa.
14. Iz vsake tretirane skupine se izberejo mladiči, ki se nato dodelijo za oceno končnih točk na PPD 4. Mladiče je treba izbrati tako, da sta oba spola iz vsakega zaroda v vsaki tretirani skupini čim bolj enakomerno zastopana v vseh preskusih. Za preskušanje motorične aktivnosti je treba preskusiti isti par mladega samca in samice pri vseh starostih pred odstranitvijo od sesanja (glej odstavek 35). Pri vseh drugih preskusih se lahko za različne vedenjske preskuse dodelijo isti ali ločeni pari samcev in samic. Za primerjalne preskuse kognitivne funkcije med odstavljenci in odraslimi živalmi bo morda treba dodeliti različne mladiče, da se preprečijo zavajajoči učinki starosti in predhodnega usposabljanja na te meritve (26) (27). Pri odstranitvi od sesanja (PPD 21) se lahko mladiči, ki niso bili izbrani za preskušanje, humano odstranijo. Navesti je treba vsako spremembo razdelitve mladičev. Statistična enota meritve mora biti zarod (ali mati) in ne mladič.
15. Obstaja več načinov za dodelitev mladičev za preglede pred odstranitvijo od sesanja in po njej, kognitivne preskuse, patološke preglede itd. (glej sliko 1 za splošni načrt in Dodatek 1 za primere dodelitve). Priporočena najmanjša števila živali v posamezni tretirani skupini za preglede pred odstranitvijo od sesanja in po njej so naslednja:
|
Klinična opazovanja in telesna teža |
Vse živali |
|
Podrobna klinična opazovanja |
20/spol (1/spol/zarod) |
|
Teža možganov (po fiksaciji), PPD 11–22 |
10/spol (1/zarod) |
|
Teža možganov (nefiksirani), ~ PPD 70 |
10/spol (1/zarod) |
|
Nevropatologija (fiksacija s potopitvijo ali perfuzijo), PPD 11–22 |
10/spol (1/zarod) |
|
Nevropatologija (fiksacija s perfuzijo), PPD ~ 70 |
10/spol (1/zarod) |
|
Spolna zrelost |
20/spol (1/spol/zarod) |
|
Drugi razvojni znaki (neobvezno) |
Vse živali |
|
Vedenjska ontogenija |
20/spol (1/spol/zarod) |
|
Motorična aktivnost |
20/spol (1/spol/zarod) |
|
Motorična in senzorična funkcija |
20/spol (1/spol/zarod) |
|
Učenje in spominjanje |
10/spol (1) (1/zarod) |
Odmerjanje
16. Uporabiti je treba najmanj tri velikosti odmerkov in hkratni kontrolni vzorec. Velikost odmerkov se razporedi tako, da se učinki strupenosti stopnjujejo. Če največji odmerek ni omejen s fizikalno-kemijskimi ali biološkimi lastnostmi kemikalije, ga je treba izbrati tako, da izzove določene strupene učinke pri materi (npr. klinični znaki, manjše pridobivanje telesne teže (ne več kot 10 %) in/ali dokaz za toksičnost, pri kateri se omeji odmerek, v tarčnem organu). Velik odmerek je z nekaterimi izjemami lahko omejen na 1 000 mg/kg/dan telesne teže. Pričakovana izpostavljenost pri ljudeh lahko na primer kaže na potrebo po uporabi večjega odmerka. Namesto tega se lahko izvedejo pilotne študije ali predhodne študije za ugotavljanje območja, da se določi največji odmerek, ki ga je treba uporabiti in bi moral povzročiti minimalno stopnjo strupenih učinkov pri materi. Če se s standardno študijo strupenosti za razvoj ali pilotno študijo dokaže, da je preskusna kemikalija strupena za razvoj, mora biti največja velikost odmerka največji odmerek, ki ne bo povzročil čezmernih strupenih učinkov pri potomcih ali smrti in utero ali pred rojstvom ali deformnosti, ki lahko prepreči smiselno vrednotenje nevrotoksičnosti. Najmanjša velikost odmerka naj ne bi povzročila dokazov o strupenih učinkih pri materi ali razvoju, vključno z nevrotoksičnostjo. Izbere se padajoče zaporedje velikosti odmerkov, da se pokažejo vsi z odmerkom povezani odzivi in velikost odmerka, pri kateri ni opaženih škodljivih učinkov (NOAEL) ali odmerki blizu meje zaznavnosti, ki omogoča določitev standardnega odmerka. Za padajoče zaporedje velikosti odmerkov so pogosto optimalni dvakratni do štirikratni intervali, pogosto pa je bolje dodati še dodatno četrto skupino odmerkov, kot uporabiti zelo velike intervale (npr. več kot faktor 10) med odmerki.
17. Pri izbiri velikosti odmerkov je treba upoštevati vse obstoječe podatke o strupenosti ter dodatne informacije o presnovi in toksikokinetiki preskusne kemikalije ali sorodnih snovi. Te informacije lahko pomagajo tudi pri dokazovanju ustreznosti režima odmerjanja. Na podlagi izpostavljenosti in farmakokinetičnih informacij (28) (29) je treba pri mladičih razmisliti o uporabi neposrednega odmerjanja. Pred izvajanjem študije neposrednega odmerjanja je treba skrbno obravnavati prednosti in slabosti (30).
18. Skupina za hkratno kontrolo mora biti kontrolna skupina, tretirana z nepravim nadomestkom, ali kontrolna skupina, tretirana z nosilcem, če je ta uporabljen pri dajanju preskusne kemikalije. Vsem živalim je treba običajno dati enako količino preskusne kemikalije ali nosilca na podlagi telesne teže. Če se za lažje odmerjanje uporablja nosilec ali drug aditiv, je treba upoštevati naslednje lastnosti: učinke na absorpcijo, distribucijo, presnovo ali retencijo preskusne kemikalije, učinke na kemijske lastnosti preskusne kemikalije, ki lahko spremenijo njene strupene lastnosti, ter učinke na porabo hrane ali vode ali status prehranjenosti živali. Nosilec ne sme povzročati učinkov, ki bi lahko vplivali na razlago študije, ne sme biti nevrovedenjsko strupen ali imeti učinkov na razmnoževanje ali razvoj. V zvezi z novimi nosilci je treba poleg kontrolne skupine, tretirane z nosilcem, vključiti tudi kontrolno skupino, tretirano z nepravim nadomestkom. Z živalmi v kontrolni(-h) skupini(-ah) se ravna na enak način kot z živalmi v preskusni skupini.
Dajanje odmerkov
19. Preskusno kemikalijo ali nosilec je treba dajati na način, ki je najprimernejši za možno izpostavljenost pri ljudeh, ter na podlagi razpoložljivih podatkov o presnovi in distribuciji pri preskusnih živalih. Način dajanja odmerka je običajno oralen (npr.z gavažo, hrano ali pitno vodo), vendar se lahko glede na lastnosti in pričakovane ali znane načine izpostavljenosti pri ljudeh uporabijo tudi drugi načini (npr. prek kože, z vdihavanjem); dodatna navodila so navedena v Smernici št. 43 (8). Izbrani način dajanja je treba utemeljiti. Preskusno kemikalijo je treba dati vsak dan približno ob istem času.
20. Odmerek za vsako žival mora običajno temeljiti na zadnji posamični določitvi telesne teže. Vendar je potrebna previdnost pri prilagajanju odmerkov v zadnji tretjini brejosti. Če se pri tretiranih materah opazijo čezmerni strupeni učinki, je treba te živali humano usmrtiti.
21. Preskusno kemikalijo ali nosilec je treba sparjenim samicam dajati vsaj vsak dan od dneva ugnezditve (DB 6) do konca laktacije (PPD 21), da so mladiči izpostavljeni preskusni kemikaliji med nevrološkim razvojem pred rojstvom in po njem. Starost, pri kateri se začne odmerjanje, ter trajanje in pogostost odmerjanja se lahko prilagodijo, če dokazi podpirajo zasnovo poskusa, ki je primernejši za izpostavljenost pri ljudeh. Trajanje odmerjanja je treba prilagoditi za druge vrste, da se zagotovi izpostavljenost v vseh zgodnjih fazah razvoja možganov (npr. enakovredno rasti možganov človeka pred rojstvom in takoj po rojstvu). Odmerjanje se lahko začne ob začetku brejosti (DB 0), čeprav je treba upoštevati, da lahko preskusne kemikalije povzročijo izgubo pred ugnezditvijo. Z dajanjem odmerka na DB 6 se prepreči to tveganje, vendar razvojne faze med DB 0 in 6 niso tretirane. Če laboratorij kupi breje živali, začetek odmerjanja na DB 0 ni mogoč, zato je DB 6 primeren čas za začetek. Laboratorij za preskušanje mora režim odmerjanja določiti v skladu z zadevnimi informacijami o učinkih preskusne kemikalije, predhodnimi izkušnjami in logističnimi težavami, kar lahko vključuje podaljšanje odmerjanja tudi na obdobje po odstavitvi od sesanja. Pri živalih, ki niso skotile vseh potomcev, se odmerjanje na dan kotitve ne izvede. Na splošno se pričakuje, da bodo mladiči izpostavljeni prek materinega mleka, vendar je treba v primerih, kjer ni dovolj dokazov za nadaljnjo izpostavljenost potomcev, razmisliti o neposrednem odmerjanju. Dokaz o stalni izpostavljenosti se lahko pridobi npr. na podlagi farmakokinetičnih informacij, strupenosti za potomce ali spremembami biomarkerjev (28).
OPAZOVANJA
Opazovanja pri materah
22. Pri vseh materah je treba vsaj enkrat na dan skrbno opazovati njihovo zdravstveno stanje, vključno z obolevnostjo in smrtnostjo.
23. V obdobjih tretiranja in opazovanja je treba redno izvajati več podrobnih kliničnih opazovanj (vsaj dve v obdobju odmerjanja med brejostjo in dve v obdobju odmerjanja med laktacijo) z vsaj desetimi materami na velikost odmerka. Živali morajo zunaj njihove domače kletke opazovati usposobljeni tehniki, ki niso seznanjeni s tretiranjem živali, in sicer po standardiziranih postopkih, da se čim bolj zmanjšata stres za živali in pristranskost opazovalca ter zagotovi čim bolj konstantna zanesljivost med opazovalci. Kadar je mogoče, je priporočljivo, da opazovanja v okviru posamezne študije opravi isti tehnik.
24. Prisotnost opaženih znakov je treba zabeležiti. Vedno, kadar je to izvedljivo, je treba zabeležiti tudi stopnjo opaženih znakov. Klinična opazovanja morajo obsegati tudi, vendar ne samo, spremembe na koži, kožuhu, očeh, sluznicah, pojav sekrecije ter delovanje avtonomnega živčevja (npr. solzenje, piloerekcija, velikost zenic, nenormalen vzorec dihanja in/ali dihanje skozi usta ter vsi nenavadni znaki pri uriniranju ali izločanju blata).
25. Zapisati je treba tudi vse nenavadne odzive v zvezi s položajem telesa, stopnjo aktivnosti (npr. zmanjšanje ali povečanje raziskovanja standardnega mesta) in koordinacijo gibov. Zabeležiti je treba spremembe v hoji (npr. zibanje, ataksija), drži (npr. grbast hrbet) in reagiranju na ravnanje, nameščanje ali druge okoljske dražljaje, pa tudi navzočnost kloničnih ali toničnih gibov, krčev ali tremorja, stereotipije (npr. čezmerno čiščenje, nenavadni gibi z glavo, ponavljajoče se krožno premikanje), nenormalno vedenje (npr. grizenje ali čezmerno lizanje, samopohaba, zadenjska hoja, oddajanje glasov) ali agresivnost.
26. Zabeležiti je treba znake strupenosti, vključno z dnevom nastopa, časom dneva, stopnjo in trajanjem.
27. Živali je treba v času odmerjanja med študijo stehtati vsaj enkrat na teden, blizu dneva kotitve ali na dan kotitve in na PPD 21 (odstavitev od sesanja). Pri študijah z gavažo je treba matere stehtati vsaj dvakrat na teden. Odmerke je treba ustrezno prilagoditi ob posameznem določanju telesne teže. Porabo hrane je treba meriti vsaj vsak teden med brejostjo in laktacijo. Porabo vode je treba meriti vsaj enkrat na teden, če izpostavljenost poteka prek oskrbe z vodo.
Opazovanja pri potomcih
28. Pri vseh potomcih je treba vsaj enkrat na dan opazovati znake strupenosti ter obolevnost in smrtnost.
29. V obdobjih tretiranja in opazovanja je treba izvesti podrobnejša klinična opazovanja potomcev. Potomce (vsaj enega mladiča/spol/zarod) morajo opazovati usposobljeni tehniki, ki niso seznanjeni s tretiranjem živali, in sicer po standardiziranih postopkih, da se čim bolj zmanjša pristranskost in čim bolj poveča zanesljivost opazovalcev. Kadar je mogoče, je priporočljivo, da opazovanja opravi isti tehnik. V opazovani fazi razvoja je treba ustrezno spremljati vsaj končne točke, opisane v odstavkih 24 in 25.
30. Zabeležiti je treba vse znake strupenosti pri potomcu, vključno z dnevom nastopa, časom dneva, stopnjo in trajanjem.
Telesni in razvojni znaki
31. Spremembe znakov razvoja pred odstavitvijo od sesanja (npr. znotrajmaternično oblikovanje uhlja, odpiranje oči, izraščanje sekalcev) so tesno povezane s telesno težo (30) (31). Telesna teža je lahko najboljši pokazatelj telesnega razvoja. Merjenje razvojnih znakov je zato priporočljivo le, če obstajajo predhodni dokazi, da bodo te končne točke zagotovile dodatne informacije. Časovna razporeditev ocene teh parametrov je navedena v tabeli 1. Glede na pričakovane učinke in rezultate začetnih meritev se lahko priporoča dodajanje časovnih točk ali opravljanje meritev v drugih razvojnih fazah.
32. Pri oceni telesnega razvoja je priporočljivo uporabiti postkoitalno starost namesto postnatalne starosti (33). Če se preskus pri mladičih izvede na dan odstavitve od sesanja, je priporočljivo, da se ta preskus izvede pred dejansko odstavitvijo od sesanja, da se prepreči zavajajoči učinek stresa, povezanega z odstavitvijo od sesanja. Poleg tega se preskusov na mladičih po odstavitvi od sesanja ne sme izvajati dva dni po odstavitvi od sesanja.
Tabela 1
Časovna razporeditev ocene telesnih in razvojnih znakov ter funkcionalnih/vedenjskih končnih točk (2)
|
Starostna obdobja Končne točke |
Pred odstavitvijo od sesanja (3) |
Adolescenca (3) |
Mladi odrasli (3) |
|
Telesni in razvojni znaki |
|||
|
Telesna teža in klinična opazovanja |
vsak teden (4) |
vsaj vsaka dva tedna |
vsaj vsaka dva tedna |
|
Teža možganov |
PPD 22 (5) |
ob koncu |
|
|
Nevropatologija |
PPD 22 (5) |
ob koncu |
|
|
Spolna zrelost |
— |
kot je ustrezno |
— |
|
Drugi razvojni znaki (6) |
kot je ustrezno |
— |
— |
|
Funkcionalne/vedenjske končne točke |
|||
|
Vedenjska ontogenija |
vsaj dve meritvi |
|
|
|
Motorična aktivnost (vključno s privajanjem) |
1–3-krat (7) |
— |
enkrat |
|
Motorična in senzorična funkcija |
— |
enkrat |
enkrat |
|
Učenje in spominjanje |
— |
enkrat |
enkrat |
33. Žive mladiče je treba prešteti in določiti njihov spol, npr. z vizualnim pregledom ali meritvijo zadnjično-genitalne razdalje (34) (35), vsakega mladiča iz zaroda pa je treba stehtati pri rojstvu ali kmalu po tem, vsaj enkrat na teden med laktacijo ter vsaj enkrat vsaka dva tedna po njej. Ko se ovrednoti spolna zrelost, je treba ob pojavu odprtja nožnice (36) ali ločitvi prepucija (37) določiti starost in telesno težo vsaj enega samca in ene samice iz zaroda.
Vedenjska ontogenija
34. Ontogenijo izbranih vedenj je treba izmeriti pri vsaj enem mladiču/spol/zarod v ustreznem starostnem obdobju, pri čemer se ob vseh dnevih preskušanja za vsa ocenjena vedenja uporabijo isti mladiči. Dnevi meritve morajo biti v tem obdobju enakomerno razporejeni, da se opredelijo običajne spremembe v ontogeniji tega vedenja ali spremembe v ontogeniji tega vedenja, povezane s tretiranjem (38). Nekateri primeri vedenj, katerih ontogenija se lahko oceni, so: posturalni refleks, negativna geotaksija in motorična aktivnost (38) (39) (40).
Motorična aktivnost
35. Motorično aktivnost je treba spremljati (41) (42) (43) (44) (45) v obdobju pred odstavitvijo od sesanja in v obdobju odraslosti. Za preskušanje v času odstavljanja od sesanja glej odstavek 32. Preskušanje mora biti dovolj dolgo, da se dokaže privajanje netretiranih kontrolnih vzorcev na preskušanje. Za oceno vedenjske ontogenije se zelo priporoča uporaba motorične aktivnosti. Če se preskušanje uporabi kot preskus vedenjske ontogenije, je za vsa preskušanja pred odstavitvijo od sesanja treba uporabiti iste živali. Preskušanje mora biti dovolj pogosto, da se oceni ontogenija privajanja med preskušanjem (44). To lahko pomeni trikrat ali pogosteje pred dnem odstavitve od sesanja in vključno z njim (npr. PPD 13, 17 in 21). Preskušanje istih živali ali živali iz istega zaroda mora potekati tudi v obdobju odraslosti proti koncu študije (npr. PPD 60–70). Po potrebi se lahko opravi preskušanje ob dodatnih dneh. Motorično aktivnost je treba spremljati z aparaturo za avtomatizirano beleženje aktivnosti, ki mora biti zmožna zaznati povečanje in zmanjšanje aktivnosti (npr. osnovna aktivnost, kot jo izmeri naprava, ne sme biti tako nizka, da bi preprečila zaznavanje zmanjšanja, in ne tako visoka, da bi preprečila zaznavanje povečanja aktivnosti). Vsako napravo je treba preskusiti v skladu s standardnimi postopki, da se zagotovi čim bolj zanesljivo delovanje naprav vse dni. Tretirane skupine morajo biti čim bolj uravnoteženo razporejene med napravami. Vsako žival je treba preskusiti ločeno. Tretirane skupine morajo biti uravnoteženo razporejene med čase preskušanja, da se prepreči zavajajoči učinek cirkadianega ritma aktivnosti. Prizadevati si je treba, da so variacije v preskusnih pogojih minimalne in niso sistematično povezane s tretiranjem. Med spremenljivkami, ki lahko vplivajo na različna merila vedenja, vključno z motorično aktivnostjo, so jakost zvoka, velikost in oblika preskusne kletke, temperatura, relativna vlažnost, svetlobni pogoji, vonji, uporaba domače kletke ali nove preskusne kletke in motnje iz okolja.
Motorična in senzorična funkcija
36. Motorično in senzorično funkcijo je treba natančno pregledati vsaj enkrat v obdobju adolescence in enkrat v obdobju odraslosti (npr. PPD 60–70). Za preskušanje v času odstavljanja od sesanja glej odstavek 32. Treba je izvesti ustrezno preskušanje za zagotovitev ustreznega kvantitativnega vzorčenja senzoričnih dražljajev (npr. somatosenzoričnih, vestibularnih) in motoričnih funkcij (npr. moč, koordinacija). Primeri preskusov motorične in senzorične funkcije so refleks zravnave (46), posturalni refleks (47) (48), reakcija na slušni dražljaj (40) (49) (50) (51) (52) (53) (54) in izzvani potenciali (55).
Preskusi učenja in spominjanja
37. Preskus asociativnega učenja in spominjanja je treba izvesti po odstavitvi od sesanja (npr. 25 ± 2 dni) in pri mladih odraslih (PPD 60 in starejših). Za preskušanje v času odstavljanja od sesanja glej odstavek 32. V teh dveh fazah razvoja se lahko uporabijo isti ali ločeni preskusi. Pri izbiri preskusov učenja in spominjanja pri mladičih, ki so prenehali sesati, in odraslih podganah je dovoljena določena prožnost. Vendar morajo biti preskusi načrtovani tako, da izpolnjujejo dve merili. Prvič, učenje je treba oceniti kot spremembo v več ponovitvenih preskušanjih ali sejah učenja ali s preskusi, ki vključujejo eno preskušanje, ob upoštevanju pogoja, ki kontrolira neasociativne učinke izkušenj. Drugič, preskusi morajo poleg izvirnega učenja (priučitev) vključevati določeno mero (kratkoročnega ali dolgoročnega) spomina, vendar te mere spomina ni mogoče sporočiti brez mere priučitve, ki se pridobi z istim preskusom. Če preskusi učenja in spominjanja kažejo učinek preskusne kemikalije, je morda treba razmisliti o dodatnih preskusih, da se ovržejo druge razlage na podlagi sprememb senzoričnih, motivacijskih in/ali motoričnih zmogljivosti. Poleg zgoraj navedenih meril se priporoča, da se preskus učenja in spominjanja izbere na podlagi dokazane občutljivosti na razred preiskovane kemikalije, če so takšne informacije na voljo v virih. Če takšnih informacij ni, primeri preskusov, ki bi lahko izpolnjevali navedeni merili, vključujejo: pasivno izogibanje (43) (56) (57), zapoznelo uskladitev s položajem pri odraslih podganah (58) in mladičih (59), pogojevanje z vonjem (43) (60), Morrisov vodni labirint (61) (62) (63), Bielov ali Cincinnatijev labirint (64) (65), zvezdasti labirint (66), T-labirint (43) ter priučitev in retencijo vedenja, kontroliranega s planiranim potekom (26) (67) (68). Dodatni preskusi so opisani v virih v zvezi z mladiči, ki so prenehali sesati (26) (27), in odraslimi podganami (19) (20).
Posmrtni pregled
38. Matere se lahko evtanazirajo po odstavitvi potomca od sesanja.
39. Nevropatološko vrednotenje potomca se izvede z uporabo tkiv živali, ki so bile humano usmrčene na PPD 22 ali med PPD 11 in PPD 22 ali ob koncu študije. Pri potomcih, usmrčenih na PPD 22, je treba pregledati možganska tkiva, pri živalih, usmrčenih ob koncu, pa je treba pregledati tkiva centralnega živčnega sistema in perifernega živčnega sistema. Živali, usmrčene na PPD 22 ali prej, se lahko fiksirajo s potopitvijo ali perfuzijo. Živali, usmrčene ob koncu študije, se fiksirajo s perfuzijo. Vsi vidiki priprave vzorcev tkiva od perfuzije živali do seciranja vzorcev tkiv, obdelave tkiv in barvanja preparatov morajo upoštevati uravnoteženo zasnovo, tako da vse serije vsebujejo reprezentativne vzorce posamezne skupine odmerka. Dodatne smernice v zvezi z nevropatologijo so navedene v Smernici OECD št. 20 (9), glej tudi (103).
Obdelava vzorcev tkiv
40. Zabeležiti je treba vse makroskopske anomalije, ki so vidne v času obdukcije. Vzorci tkiv morajo predstavljati vse pomembnejše regije živčnega sistema. Vzorce tkiv je treba hraniti v ustreznem fiksativu in jih obdelati v skladu s standardiziranimi objavljenimi histološkimi protokoli (69) (70) (71) (103). Vstavljanje v parafin je sprejemljivo za tkiva centralnega živčnega sistema in perifernega živčnega sistema, uporaba osmija po fiksaciji, skupaj z vstavljanjem v epoksi, pa je lahko ustrezna, če je potrebna večja stopnja ločljivosti (npr. za periferno živčevje, če obstaja sum na periferno nevropatijo, in/ali za morfometrično analizo perifernega živčevja). Možgansko tkivo, zbrano za morfometrično analizo, je treba vstaviti v ustrezen medij pri vseh velikostih odmerka hkrati, da se preprečijo artefakti zaradi krčenja, ki bi lahko bili povezani s podaljšano hrambo v fiksativu (6).
Nevropatološka preiskava
41. Nameni kvalitativnega pregleda so:
|
(i) |
opredeliti regije v živčnem sistemu, ki kažejo dokaze nevropatoloških sprememb; |
|
(ii) |
opredeliti vrste nevropatoloških sprememb, ki so posledica izpostavljenosti preskusni kemikaliji, in |
|
(iii) |
določiti stopnjo resnosti nevropatoloških sprememb. |
Reprezentativne histološke rezine vzorcev tkiv mora mikroskopsko pregledati ustrezno usposobljen patolog, ki poišče dokaze nevropatoloških sprememb. Vsem nevropatološkim spremembam je treba dodeliti subjektivno oceno resnosti. Hematoksilinska in eozinska barvila so lahko ustrezna za oceno rezin možganov živali, ki so bile humano usmrčene na PPD 22 ali prej. Za rezine tkiv centralnega in perifernega živčnega sistema živali, usmrčenih ob koncu študije, pa se priporoča barvanje z mielinskimi barvili (npr. luksol obstojna modra/krezil vijolična) in barvilom na osnovi srebra (npr. Bielschowskyjevo ali Bodianovo barvilo). Glede na strokovno presojo patologa in vrsto opaženih sprememb se lahko tudi druga barvila štejejo kot ustrezna za ugotavljanje in opis posebnih vrst sprememb (npr. glialni fibrilarni kisli protein (GFAP) ali lektinska histokemija za oceno glialnih in mikroglialnih sprememb (72), fluoro-žad za zaznavanje nekroze (73) (74) ali barvila na osnovi srebra za ugotavljanje degeneracij živčevja (75)).
42. Opraviti je treba morfometrično (kvantitativno) vrednotenje, ker lahko ti podatki prispevajo k zaznavanju učinka, povezanega s tretiranjem, in so dragoceni za razlago razlik v teži možganov ali morfologiji, povezanih s tretiranjem (76) (77). Za morfometrično vrednotenje je treba odvzeti in pripraviti vzorec živčnega tkiva. Morfometrična vrednotenja lahko zajemajo npr. linearne ali površinske meritve posebnih možganskih regij (78). Pri linearnih ali površinskih meritvah je treba uporabiti homologne rezine, ki so skrbno izbrane na podlagi zanesljivih mikroskopskih znakov (6). Stereologija se lahko uporabi za opredelitev učinkov, povezanih s tretiranjem, na spremenljivke, kot so volumen ali število celic za posamezne nevroanatomske regije (79) (80) (81) (82) (83) (84).
43. Pregledati je treba, ali so v možganih dokazi za nevropatološke spremembe, povezane s tretiranjem, pri čemer je treba ustrezne vzorce odvzeti iz vseh pomembnih možganskih regij (npr. vohalni bulbus, možganska skorja, hipokamus, bazalni gangliji, talamus, hipotalamus, srednjimi možgani (tektum, tegmentum in možganski pedunkli), most, podaljšana hrbtenjača in mali možgani), da se zagotovi natančen pregled. Pomembno je, da so vse rezine odvzete iz iste ravnine. Pri odraslih živalih, ki so bile humano usmrčene ob koncu študije, je treba odvzeti reprezentativne rezine hrbtenjače in perifernega živčnega sistema. Območja, ki se pregledujejo, morajo vključevati oko z vidnim živcem in mrežnico, hrbtenjačo ob vratnem in ledvenem delu, dorzalna in ventralna vlakna, proksimalni bedrni živec, proksimalni golenični živec (pri kolenu) in veje goleničnega živca v mečni mišici. Rezine hrbtenjače in perifernih živcev morajo vključevati prečne ali diagonalne in vzdolžne rezine.
44. V okviru nevropatološkega vrednotenja je treba poleg celičnih sprememb (npr. vakuolacija, degeneracija in nekroza nevronov) in sprememb tkiva (npr. glioza, infiltracija levkocitov in tvorjenje cist) poiskati morebitne znake razvojnih poškodb živčnega sistema (6) (85) (86) (87) (88) (89). V zvezi s tem je pomembno, da se učinki, povezani s tretiranjem, ločijo od običajnih razvojnih dogodkov, za katere je znano, da se pojavijo v razvojni fazi, ki ustreza času usmrtitve (90). Primeri pomembnih sprememb, ki kažejo na razvojne poškodbe, med drugim vključujejo:
|
— |
makroskopske spremembe velikosti ali oblike vohalnega bulbusa, velikih možganov ali malih možganov, |
|
— |
spremembe relativne velikosti različnih možganskih regij, vključno z zmanjšanjem ali povečanjem velikosti regij zaradi izgube ali obstojnosti običajno prehodnih populacij celic ali projekcij aksonov (npr. zunanja zarodna plast malih možganov, corpus callosum), |
|
— |
spremembe v množitvi, migraciji in diferenciaciji, kot kažejo območja čezmerne apoptoze ali nekroze, skupin ali razpršenih populacij ektopičnih, dezorientiranih ali deformiranih nevronov, ali spremembe relativne velikosti različnih plasti kortikalnih struktur, |
|
— |
spremembe vzorcev mielinizacije, vključno s splošnim zmanjšanjem mieliniziranih struktur ali njihovim spremenjenim barvanjem, |
|
— |
dokaz za hidrocefalus, zlasti povečanje prekatov, stenozo možganskega akvedukta in tanjšanje možganskih polobel. |
Analiza odvisnosti med odmerkom in odzivom pri nevropatoloških spremembah
45. Za kvalitativno in kvantitativno nevropatološko analizo se priporoča naslednji postopek s posameznimi koraki. Najprej se rezine iz skupine z velikim odmerkom primerjajo z rezinami iz kontrolne skupine. Če pri živalih iz skupine z velikim odmerkom ni dokazov o nevropatoloških spremembah, nadaljnja analiza ni potrebna. Če v skupini z velikim odmerkom obstajajo dokazi o nevropatoloških spremembah, se pregledajo živali iz skupin s srednjim in nizkim odmerkom. Če se skupina z velikim odmerkom konča zaradi smrti ali druge zavajajoče strupenosti, se za analizo nevropatoloških sprememb uporabijo skupine z velikim in srednjim odmerkom. Če obstajajo znaki nevrotoksičnosti v skupinah z manjšim odmerkom, je treba v teh skupinah opraviti nevropatološko analizo. Če se pri kvalitativnem ali kvantitativnem pregledu ugotovijo nevropatološke spremembe, povezane s tretiranjem, je treba na podlagi vrednotenja vseh živali iz skupin z vsemi odmerki določiti odvisnost pojavnosti od odmerka, pogostost in stopnjo resnosti poškodb ali morfometričnih sprememb. V to vrednotenje je treba vključiti vse regije možganov, v katerih so vidni dokazi nevropatoloških sprememb. Za vsako vrsto poškodbe je treba opisati značilnosti, ki so uporabljene za opredelitev posamezne stopnje resnosti in kažejo lastnosti, na podlagi katerih se stopnje razlikujejo med sabo. Zabeležiti je treba pogostost posamezne vrste poškodb in njihovo stopnjo resnosti ter opraviti statistično analizo, da se ovrednoti vrsta odvisnosti med odmerkom in odzivom. Priporočena je uporaba kodiranih mikroskopskih preparatov (91).
PODATKI IN POROČANJE
Podatki
46. Podatke je treba sporočati ločeno in jih povzeti v obliki tabele, kjer so za vsako preskusno skupino prikazane vrste sprememb ter število mater in potomcev po spolu in zarodu, ki prikazuje posamezno vrsto spremembe. Če je bila izvedena neposredna izpostavljenost potomca po rojstvu, je treba sporočiti način, trajanje in obdobje izpostavljenosti.
Vrednotenje in razlaga rezultatov
47. Študija razvojne nevrtoksičnosti bo zagotovila informacije o učinkih ponavljajoče se izpostavljenosti kemikaliji in utero in v zgodnjem razvoju po rojstvu. Ker je poudarek tako na splošni strupenosti kot na razvojni nevrotoksičnosti končnih točk, rezultati študije omogočajo razlikovanje med učinki na razvoj živčevja, ki se pojavijo v odsotnosti splošne strupenosti pri materi, in učinki, ki so izraženi samo na stopnjah, ki so strupene tudi za mater. Zaradi zapletenih medsebojnih odvisnosti med zasnovo študije, statistično analizo in biološko pomembnostjo podatkov bo ustrezna interpretacija podatkov o razvojni nevrotoksičnosti vključevala strokovno presojo (107) (109). Razlaga rezultatov preskusa mora temeljiti na pristopu tehtnosti dokazov (20) (92) (93) (94). Obravnavati je treba vzorce vedenjskih ali morfoloških ugotovitev, če obstajajo, in dokaze o odzivu na odmerek. V to opredelitev je treba vključiti podatke iz vseh študij, ki zadevajo vrednotenje razvojne nevrotoksičnosti, vključno z epidemiološkimi študijami na ljudeh ali poročili o primerih in eksperimentalnimi študijami na živalih (npr. podatki o toksikonetiki, informacije o aktivnosti strukture in podatke iz drugih študij strupenosti). To vključuje odvisnost med odmerki preskusne kemikalije in prisotnostjo ali odsotnostjo, pojavnostjo in obsegom katerega koli nevrotoksičnega učinka za posamezni spol (20) (95).
48. Vrednotenje podatkov mora vključevati razpravo o biološki pomembnosti in statistični značilnosti. Statistične analize je treba obravnavati kot orodje, ki usmerja razlago podatkov, vendar je ne določa. Odsotnost statistične značilnosti ne sme biti edini razlog za sklep o odsotnosti učinkov, povezanih s tretiranjem, tako kot statistična značilnost ne sme biti edina utemeljitev za sklepno ugotovitev o učinku, povezanem s tretiranjem. Da bi preprečili morebitne lažno negativne ugotovitve in neločljive težave pri ‚dokazovanju negativnega rezultata‘, je treba obravnavati razpoložljive pozitivne podatke in pretekle kontrolne podatke, zlasti če ni učinkov, povezanih s tretiranjem (102) (106). Verjetnost lažno pozitivnih rezultatov je treba obravnavati ob upoštevanju statističnega vrednotenja vseh podatkov (96). Vrednotenje mora vključevati odnos med ugotovljenimi nevropatološkimi in vedenjskimi spremembami, če obstaja.
49. Vse rezultate je treba analizirati z uporabo statističnih modelov, ki ustrezajo zasnovi preskusa (108). Izbiro parametrske ali neparametrske analize je treba utemeljiti z upoštevanjem dejavnikov, kot so vrsta podatkov (pretvorjeni ali ne) in njihova porazdelitev ter relativna zanesljivost izbrane statistične analize. Statistične analize morajo biti izbrane ob upoštevanju namena in zasnove študije, da se čim bolj zmanjšajo napake tipa I (lažno pozitivni rezultati) in tipa II (lažno negativni rezultati) (96) (97) (104) (105). Razvojne študije, v katerih se uporabljajo multiparne vrste in preskuša več mladičev na zarod, morajo v statistični model vključiti zarod, da se preprečijo povečane stopnje napak tipa I (98) (99) (100) (101). Statistična enota meritve mora biti zarod in ne mladič. Preskuse je treba zasnovati tako, da se živali iz istega zaroda ne obravnavajo kot neodvisna opazovanja. Vse končne točke, ki se vedno znova izmerijo pri istem subjektu, je treba analizirati z uporabo statističnih modelov, ki upoštevajo odvisnost navedenih meritev.
Poročilo o preskusu
50. Poročilo o preskusu mora vključevati naslednje informacije:
Preskusna kemikalija:
|
— |
agregatno stanje in, če je to ustrezno, fizikalno-kemijske lastnosti, |
|
— |
identifikacijske podatke, vključno z virom, |
|
— |
čistost pripravka ter znane in/ali pričakovane nečistote. |
Nosilec (po potrebi):
|
— |
utemeljitev izbire nosilca, če to ni voda ali fiziološka raztopina. |
Preskusne živali:
|
— |
uporabljene vrste in seve ter utemeljitev, če to ni podgana, |
|
— |
dobavitelja preskusnih živali, |
|
— |
število, začetno starost in spol živali, |
|
— |
izvor, nastanitvene pogoje, hrano, vodo itd., |
|
— |
težo posamezne živali na začetku preskusa. |
Preskusni pogoji:
|
— |
utemeljitev izbire velikosti odmerkov, |
|
— |
utemeljitev načina in trajanja odmerjanja, |
|
— |
specifikacije uporabljenih odmerkov, vključno s podatki o nosilcu, količini in fizični obliki danega materiala, |
|
— |
podrobne podatke o formulaciji preskusne kemikalije in pripravi hrane, doseženi koncentraciji, stabilnosti in homogenosti pripravka, |
|
— |
metodo, uporabljeno za edinstveno identifikacijo mater in potomcev, |
|
— |
podroben opis postopkov randomizacije, uporabljenih za razdelitev mater v tretirane skupine, izbiro mladičev za izločitev in razdelitev mladičev v preskusne skupine, |
|
— |
podrobne podatke o dajanju preskusne kemikalije, |
|
— |
če je primerno, pretvorbo koncentracije preskusne kemikalije, vnesene s hrano ali vodo ali vdihavanjem (ppm), v dejanski odmerek (mg/kg telesne teže/dan), |
|
— |
okoljske pogoje, |
|
— |
podrobne podatke o kakovosti hrane in vode (npr. voda iz pipe, destilirana voda), |
|
— |
datum začetka študije in datum konca študije. |
Opazovanje in preskusni postopki:
|
— |
podroben opis postopkov, uporabljenih za standardizacijo opazovanj in postopkov ter operativne opredelitve za vrednotenje opazovanj, |
|
— |
seznam vseh uporabljenih preskusnih postopkov in utemeljitev njihove uporabe, |
|
— |
podrobnosti o uporabljenih vedenjskih/funkcionalnih, patoloških, nevrokemijskih in elektrofizioloških postopkih, vključno z informacijami in podrobnostmi o avtomatiziranih napravah, |
|
— |
postopke za umerjanje in zagotavljanje enakovrednosti naprav ter uravnoteženje tretiranih skupin v preskusnih postopkih, |
|
— |
kratko utemeljitev, s katero se pojasnijo odločitve na podlagi strokovne presoje. |
Rezultati (posamezni rezultati in povzetek, vključno s srednjo vrednostjo in varianco, če je ustrezno):
|
— |
število živali na začetku študije in število na koncu študije, |
|
— |
število živali in zarodov, uporabljenih za posamezno preskusno metodo, |
|
— |
identifikacijsko številko posamezne živali in zarod, iz katerega prihaja, |
|
— |
velikost zaroda in povprečno težo pri rojstvu po spolu, |
|
— |
telesno težo in podatke o spremembi telesne teže, vključno s terminalno telesno težo matere in potomcev, |
|
— |
podatke o porabi hrane in, če je ustrezno, podatke o porabi vode (npr. če se preskusna kemikalija daje prek vode), |
|
— |
podatke o odzivu na strupenost po spolu in velikost odmerka, vključno z znaki strupenost ali smrtnosti, vključno s časom in vzrokom smrti, če je ustrezno, |
|
— |
vrsto, resnost, trajanje, dan nastopa, čas dneva in nadaljnji potek podrobnih kliničnih opazovanj, |
|
— |
vrednotenje posameznih razvojnih znakov (teža, spolna zrelost in vedenjska ontogenija) pri posamezni časovni točki opazovanja, |
|
— |
podroben opis vseh vedenjskih, funkcionalnih, nevropatoloških, nevrokemijskih in elektrofizioloških ugotovitev po spolu, vključno s povečanjem in zmanjšanjem iz kontrolnih skupin, |
|
— |
izsledke obdukcije, |
|
— |
teže možganov, |
|
— |
diagnoze, ki izhajajo iz nevroloških znakov in poškodb, vključno z naravno nastalimi boleznimi ali stanji, |
|
— |
slike vzorčnih ugotovitev, |
|
— |
slike majhne povečave za oceno homologije rezin, uporabljenih za morfometrijo, |
|
— |
podatke o absorpciji in presnovi, vključno z dopolnilnimi podatki iz ločene študije toksikokinetike, če so na voljo, |
|
— |
statistično obdelavo rezultatov, vključno s statističnimi modeli, uporabljenimi za analizo podatkov, in rezultate, ne glede na to, ali so bili značilni ali ne, |
|
— |
seznam osebja, ki je sodelovalo pri študiji, vključno s strokovno usposobljenostjo. |
Razprava o rezultatih:
|
— |
informacije o odzivu na odmerek po spolu in skupini, |
|
— |
povezanost katerih koli drugih strupenih učinkov s sklepno ugotovitvijo o nevrotoksičnem potencialu preskusne kemikalije po spolu in skupini, |
|
— |
vpliv katerih koli informacij o toksikokinetiki na sklepne ugotovitve, |
|
— |
podobnost učinkov na kateri koli znan nevrotoksikant, |
|
— |
podatke, ki dokazujejo zanesljivost in občutljivost preskusne metode (tj. pozitivne podatke in pretekle kontrolne podatke), |
|
— |
odvisnosti, če obstajajo, med nevropatološkimi in funkcionalnimi učinki, |
|
— |
vrednosti brez opaznih škodljivih učinkov (NOAEL) ali standardni odmerek za matere in potomce po spolu in skupini. |
Sklepne ugotovitve:
|
— |
razprava o celotni razlagi podatkov na podlagi rezultatov, vključno s sklepno ugotovitvijo o tem, ali je preskusna kemikalija povzročila razvojno nevrotoksičnost, in vrednostih brez opaznih škodljivih učinkov. |
VIRI
|
(1) |
OECD (1995). Draft Report of the OECD Ad Hoc Working Group on Reproduction and Developmental Toxicity. Copenhagen, Denmark, 13–14 June 1995. |
|
(2) |
US EPA (1998). U.S. Environmental Protection Agency Health Effects Test Guidelines. OPPTS 870.6300. Developmental Neurotoxicity Study. US EPA 712-C-98-239. Na voljo na: [http://www.epa.gov/opptsfrs/OPPTS_Harmonized/870_Health_Effects_Test_Guidelines/Series/]. |
|
(3) |
US EPA (1998). Guidelines for Neurotoxicity Risk Assessment. US EPA 630/R-95/001F. Na voljo na: [http://cfpub.epa.gov/ncea/cfm/recordisplay.cfm?PrintVersion=True&deid=12479]. |
|
(4) |
Cory-Slechta, D.A., Crofton, K.M., Foran, J.A., Ross, J.F., Sheets, L.P., Weiss, B., Mileson, B. (2001). Methods to identify and characterize developmental neurotoxicity for human health risk assessment: I. Behavioral effects. Environ. Health Perspect., 109:79–91. |
|
(5) |
Dorman, D.C., Allen, S.L., Byczkowski, J.Z., Claudio, L., Fisher, J.E. Jr., Fisher, J.W., Harry, G.J., Li, A.A., Makris, S.L., Padilla, S., Sultatos, L.G., Mileson, B.E. (2001). Methods to identify and characterize developmental neurotoxicity for human health risk assessment: III. Pharmacokinetic and pharmacodynamic considerations. Environ. Health Perspect., 109:101–111. |
|
(6) |
Garman, R.H., Fix,A.S., Jortner, B.S., Jensen, K.F., Hardisty, J.F., Claudio, L., Ferenc, S. (2001). Methods to identify and characterize developmental neurotoxicity for human health risk assessment: II. Neuropathology. Environ. Health Perspect., 109:93–100. |
|
(7) |
OECD (2003). Report of the OECD Expert Consultation Meeting on Developmental Neurotoxicity Testing. Washington D.C., US, 23–25 October 2000. |
|
(8) |
OECD (2008). OECD Environment, Health and Safety Publications Series on Testing and Assessment No. 43. Guidance Document on Mammalian Reproductive Toxicity Testing and Assessment. Environment Directorate, OECD, Paris. July 2008. Na voljo na: [http://search.oecd.org/officialdocuments/displaydocumentpdf/?cote=env/jm/mono(2008)16&doclanguage=en]. |
|
(9) |
OECD (2003). OECD Environment, Health and Safety Publications Series on Testing and Assessment No. 20. Guidance Document for Neurotoxicity Testing. Environment Directorate, OECD, Paris, September 2003. Na voljo na: [http://www.oecd.org/document/22/0,2340,en_2649_34377_1916054_1_1_1_1,00.html]. |
|
(10) |
Kimmel, C.A., Rees, D.C., Francis, E.Z. (1990) Qualitative and quantitative comparability of human and animal developmental neurotoxicity. Neurotoxicol. Teratol., 12: 173–292. |
|
(11) |
Spencer, P.S., Schaumburg, H.H., Ludolph, A.C. (2000) Experimental and Clinical Neurotoxicology, 2nd Edition, ISBN 0195084772, Oxford University Press, New York. |
|
(12) |
Mendola, P., Selevan, S.G., Gutter, S., Rice, D. (2002) Environmental factors associated with a spectrum of neurodevelopmental deficits. Ment. Retard. Dev. Disabil. Res. Rev. 8:188–197. |
|
(13) |
Slikker, W.B., Chang, L.W. (1998) Handbook of Developmental Neurotoxicology, 1 st Edition, ISBN 0126488606, Academic Press, New York. |
|
(14) |
Poglavje B.34 te priloge, Preskus strupenosti za razmnoževanje na eni generaciji. |
|
(15) |
Poglavje B.35 te priloge, Študija dvogeneracijske reproduktivne strupenosti. |
|
(16) |
Poglavje B.43 te priloge, Študija nevrotoksičnosti na glodalcih. |
|
(17) |
Poglavje B.31 te priloge, Študija strupenosti za predrojstveni razvoj. |
|
(18) |
Direktiva 2010/63/EU Evropskega parlamenta in Sveta z dne 22. septembra 2010 o zaščiti živali, ki se uporabljajo v znanstvene namene (UL L 276, 20.10.2010, str. 33). |
|
(19) |
WHO (1986) Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals (Environmental Health Criteria 60), Albany, New York: World Health Organization Publications Center, USA. Na voljo na: [http://www.inchem.org/documents/ehc/ehc/ehc060.htm]. |
|
(20) |
WHO (2001) Neurotoxicity Risk Assessment for Human Health: Principles and Approaches (Environmental Health Criteria 223), World Health Organization Publications, Geneva. Na voljo na: [http://www.intox.org/databank/documents/supplem/supp/ehc223.htm]. |
|
(21) |
Chang, L.W., Slikker, W. (1995) Neurotoxicology: Approaches and Methods, 1 st Edition, ISBN 012168055X, Academic Press, New York. |
|
(22) |
De Cabo, C., Viveros, M.P. (1997) Effects of neonatal naltrexone on neurological and somatic development in rats of both genders. Neurotoxicol. Teratol., 19:499–509. |
|
(23) |
Agnish, N.D., Keller, K.A. (1997) The rationale for culling of rodent litters. Fundam. Appl. Toxicol., 38:2–6. |
|
(24) |
Avery, D.L., Spyker, J.M. (1977) Foot tattoo of neonatal mice. Lab. Animal Sci., 27:110–112. |
|
(25) |
Wier, P.J., Guerriero, F.J., Walker, R.F. (1989) Implementation of a primary screen for developmental neurotoxicity. Fundam. Appl. Toxicol., 13:118–136. |
|
(26) |
Spear, N.E., Campbell, B.A. (1979) Ontogeny of Learning and Memory. ISBN 0470268492, Erlbaum Associates, New Jersey. |
|
(27) |
Krasnegor, N.A., Blass, E.M., Hofer, M.A., Smotherman, W. (1987) Perinatal Development: A Psychobiological Perspective. Academic Press, Orlando. |
|
(28) |
Zoetis, T., Walls, I. (2003) Principles and Practices for Direct Dosing of Pre-Weaning Mammals in Toxicity Testing and Research. ILSI Press, Washington, DC. |
|
(29) |
Moser, V., Walls, I., Zoetis, T. (2005) Direct dosing of preweaning rodents in toxicity testing and research: Deliberations of an ILSI RSI expert working group. Int. J. Toxicol., 24:87–94. |
|
(30) |
Conolly, R.B., Beck, B.D., Goodman, J.I. (1999) Stimulating research to improve the scientific basis of risk assessment. Toxicol. Sci., 49: 1–4. |
|
(31) |
ICH (1993) ICH Harmonised Tripartite Guideline: Detection of Toxicity to Reproduction for Medical Products (S5A). International Conference on Harmonisation of Technical Requirements for Registration of Phamaceuticals for Human Use. |
|
(32) |
Lochry, E.A. (1987) Concurrent use of behavioral/functional testing in existing reproductive and developmental toxicity screens: Practical considerations. J. Am. Coll. Toxicol., 6:433–439. |
|
(33) |
Tachibana, T., Narita, H., Ogawa, T., Tanimura, T. (1998) Using postnatal age to determine test dates leads to misinterpretation when treatments alter gestation length, results from a collaborative behavioral teratology study in Japan. Neurotoxicol. Teratol., 20:449–457. |
|
(34) |
Gallavan, R.H. Jr., Holson, J.F., Stump, D.G., Knapp, J.F., Reynolds, V.L. (1999) Interpreting the toxicologic significance of alterations in anogenital distance: potential for confounding effects of progeny body weights. Reprod. Toxicol., 13:383–390. |
|
(35) |
Gray, L.E. Jr., Ostby, J., Furr, J., Price, M., Veeramachaneni, D.N., Parks, L. (2000) Perinatal exposure to the phthalates DEHP, BBP, and DINP, but not DEP, DMP, or DOTP, alters sexual differentiation of the male rat. Toxicol. Sci., 58:350–365. |
|
(36) |
Adams, J., Buelke-Sam, J., Kimmel, C.A., Nelson, C.J., Reiter, L.W., Sobotka, T.J., Tilson, H.A., Nelson, B.K. (1985) Collaborative behavioral teratology study: Protocol design and testing procedure. Neurobehav. Toxicol. Teratol., 7:579–586. |
|
(37) |
Korenbrot, C.C., Huhtaniemi, I.T., Weiner, R.W. (1977) Preputial separation as an external sign of pubertal development in the male rat. Biol. Reprod., 17:298–303. |
|
(38) |
Spear, L.P. (1990) Neurobehavioral assessment during the early postnatal period. Neurotoxicol. Teratol., 12:489–95. |
|
(39) |
Altman, J., Sudarshan, K. (1975) Postnatal development of locomotion in the laboratory rat. Anim. Behav., 23:896–920. |
|
(40) |
Adams, J. (1986) Methods in Behavioral Teratology. In: Handbook of Behavioral Teratology. Riley, E.P., Vorhees, C.V. (eds.) Plenum Press, New York, str. 67–100. |
|
(41) |
Reiter, L.W., MacPhail, R.C. (1979) Motor activity: A survey of methods with potential use in toxicity testing. Neurobehav. Toxicol., 1:53–66. |
|
(42) |
Robbins, T.W. (1977) A critique of the methods available for the measurement of spontaneous motor activity, Handbook of Psychopharmacology, Vol. 7, Iverson, L.L., Iverson, D.S., Snyder, S.H., (eds.) Plenum Press, New York, str. 37–82. |
|
(43) |
Crofton, K.M., Peele, D.B., Stanton, M.E. (1993) Developmental neurotoxicity following neonatal exposure to 3,3'-iminodipropionitrile in the rat. Neurotoxicol. Teratol., 15:117–129. |
|
(44) |
Ruppert, P.H., Dean, K.F., Reiter, L.W. (1985) Development of locomotor activity of rat pups in figure-eight mazes. Dev. Psychobiol., 18:247–260. |
|
(45) |
Crofton, K.M., Howard, J.L., Moser, V.C., Gill, M.W., Reiter, L.W., Tilson, H.A., MacPhail, R.C. (1991) Interlaboratory comparison of motor activity experiments: Implications for neurotoxicological assessments. Neurotoxicol. Teratol., 13:599–609. |
|
(46) |
Ross, J. F., Handley, D. E., Fix, A. S., Lawhorn, G. T., Carr, G. J. (1997) Quantification of the hind-limb extensor thrust response in rats. Neurotoxicol. Teratol., 19:1997. 405–411. |
|
(47) |
Handley, D.E., Ross, J.F., Carr, G.J. (1998) A force plate system for measuring low-magnitude reaction forces in small laboratory animals. Physiol. Behav., 64:661–669. |
|
(48) |
Edwards, P.M., Parker, V.H. (1977) A simple, sensitive, and objective method for early assessment of acrylamide neuropathy in rats. Toxicol. Appl. Pharmacol., 40:589–591. |
|
(49) |
Davis, M. (1984) The mammalian startle response. In: Neural Mechanisms of Startle Behavior, Eaton, R.C. (ed), Plenum Press, New York, str. 287–351. |
|
(50) |
Koch, M. (1999) The neurobiology of startle. Prog. Neurobiol., 59:107–128. |
|
(51) |
Crofton, K.M. (1992) Reflex modification and the assessment of sensory dysfunction. In Target Organ Toxicology Series: Neurotoxicology, Tilson, H., Mitchell, C. (eds). Raven Press, New York, str. 181–211. |
|
(52) |
Crofton, K.M., Sheets, L.P. (1989) Evaluation of sensory system function using reflex modification of the startle response. J. Am. Coll. Toxicol., 8:199–211. |
|
(53) |
Crofton, K.M, Lassiter, T.L, Rebert, C.S. (1994) Solvent-induced ototoxicity in rats: An atypical selective mid-frequency hearing deficit. Hear. Res., 80:25–30. |
|
(54) |
Ison, J.R. (1984) Reflex modification as an objective test for sensory processing following toxicant exposure. Neurobehav. Toxicol. Teratol., 6:437–445. |
|
(55) |
Mattsson, J.L., Boyes, W.K., Ross, J.F. (1992) Incorporating evoked potentials into neurotoxicity test schemes. In: Target Organ Toxicology Series: Neurotoxicity, Tilson, H., Mitchell, C., (eds.), Raven Press, New York. str. 125–145. |
|
(56) |
Peele, D.B., Allison, S.D., Crofton, K.M. (1990) Learning and memory deficits in rats following exposure to 3,3'-iminopropionitrile. Toxicol. Appl. Pharmacol., 105:321–332. |
|
(57) |
Bammer, G. (1982) Pharmacological investigations of neurotransmitter involvement in passive avoidance responding: A review and some new results. Neurosci. Behav. Rev., 6:247–296. |
|
(58) |
Bushnell, P.J. (1988) Effects of delay, intertrial interval, delay behavior and trimethyltin on spatial delayed response in rats. Neurotoxicol. Teratol., 10:237–244. |
|
(59) |
Green, R.J., Stanton, M.E. (1989) Differential ontogeny of working memory and reference memory in the rat. Behav. Neurosci., 103:98–105. |
|
(60) |
Kucharski, D., Spear, N.E. (1984) Conditioning of aversion to an odor paired with peripheral shock in the developing rat. Develop. Psychobiol., 17:465–479. |
|
(61) |
Morris, R. (1984) Developments of a water-maze procedure for studying spatial learning in the rat. J. Neurosci. Methods, 11:47–60. |
|
(62) |
Brandeis, R., Brandys, Y., Yehuda, S. (1989) The use of the Morris water maze in the study of memory and learning. Int. J. Neurosci., 48:29–69. |
|
(63) |
D'Hooge, R., De Deyn, P.P. (2001) Applications of the Morris water maze in the study of learning and memory. Brain Res. Rev, 36:60–90. |
|
(64) |
Vorhees, C.V. (1987) Maze learning in rats: A comparison of performance in two water mazes in progeny prenatally exposed to different doses of phenytoin. Neurotoxicol. Teratol., 9:235–241. |
|
(65) |
Vorhees, C.V. (1997) Methods for detecting long-term CNS dysfunction after prenatal exposure to neurotoxins. Drug Chem. Toxicol., 20:387–399. |
|
(66) |
Akaike, M., Tanaka, K., Goto, M., Sakaguchi, T. (1988) Impaired Biel and Radial arm maze learning in rats with methyl-nitrosurea induced microcephaly. Neurotoxicol. Teratol., 10:327–332. |
|
(67) |
Cory-Slechta, D.A., Weiss, B., Cox, C. (1983) Delayed behavioral toxicity of lead with increasing exposure concentration. Toxicol. Appl. Pharmacol., 71:342–352. |
|
(68) |
Campbell, B.A., Haroutunian, V. (1981) Effects of age on long-term memory: Retention of fixed interval responding. J. Gerontol., 36:338–341. |
|
(69) |
Fix, A.S, Garman, R.H. (2000) Practical aspects of neuropathology: A technical guide for working with the nervous system. Toxicol. Pathol., 28: 122–131. |
|
(70) |
Prophet, E.B., Mills, B., Arrington, J.B., Sobin, L.H. (1994) Laboratory Methods in Histotechnology, American Registry of Pathology, Washington, DC, str. 84–107. |
|
(71) |
Bancroft, J.D., Gamble, M. (2002) Theory and Practice of Histological Techniques, 5th edition, Churchill Livingstone, London. |
|
(72) |
Fix, A.S., Ross, J.F., Stitzel, S.R., Switzer, R.C. (1996) Integrated evaluation of central nervous system lesions: stains for neurons, astrocytes, and microglia reveal the spatial and temporal features of MK-801-induced neuronal necrosis in the rat cerebral cortex. Toxicol. Pathol., 24: 291–304. |
|
(73) |
Schmued, L.C., Hopkins, K.J. (2000) Fluoro-Jade B: A high affinity tracer for the localization of neuronal degeneration. Brain Res., 874:123–130. |
|
(74) |
Krinke, G.J., Classen, W., Vidotto, N., Suter, E., Wurmlin, C.H. (2001) Detecting necrotic neurons with fluoro-jade stain. Exp. Toxic. Pathol., 53:365–372. |
|
(75) |
De Olmos, I.S., Beltramino, C.A., and de Olmos de Lorenzo, S. (1994) Use of an amino-cupric-silver technique for the detection of early and semiacute neuronal degeneration caused by neurotoxicants, hypoxia and physical trauma. Neurotoxicol. Teratol., 16, 545–561. |
|
(76) |
De Groot, D.M.G., Bos-Kuijpers, M.H.M., Kaufmann, W.S.H., Lammers, J.H.C.M., O'Callaghan, J.P., Pakkenberg, B., Pelgrim, M.T.M., Waalkens-Berendsen, I.D.H., Waanders, M.M., Gundersen, H.J. (2005a) Regulatory developmental neurotoxicity testing: A model study focusing on conventional neuropathology endpoints and other perspectives. Environ. Toxicol. Pharmacol., 19:745–755. |
|
(77) |
De Groot, D.M.G., Hartgring, S., van de Horst, L., Moerkens, M., Otto, M., Bos-Kuijpers, M.H.M., Kaufmann, W.S.H., Lammers, J.H.C.M., O'Callaghan, J.P., Waalkens-Berendsen, I.D.H., Pakkenberg, B., Gundersen, H.J. (2005b) 2D and 3D assessment of neuropathology in rat brain after prenatal exposure to methylazoxymethanol, a model for developmental neurotoxicity. Reprod. Toxicol., 20:417–432. |
|
(78) |
Rodier, P.M., Gramann, W.J. (1979) Morphologic effects of interference with cell proliferation in the early fetal period. Neurobehav. Toxicol., 1:129–135. |
|
(79) |
Howard, C.V., Reed, M.G. (1998) Unbiased Stereology: Three-Dimensional Measurement in Microscopy, Springer-Verlag, New York. |
|
(80) |
Hyman, B.T., Gomez-Isla, T., Irizarry, M.C. (1998) Stereology: A practical primer for neuropathology. J. Neuropathol. Exp. Neurol., 57: 305–310. |
|
(81) |
Korbo, L., Andersen, B.B., Ladefoged, O., Møller, A. (1993) Total numbers of various cell types in rat cerebellar cortex estimated using an unbiased stereological method. Brain Res., 609: 262–268. |
|
(82) |
Schmitz, C. (1997) Towards more readily comprehensible procedures in disector stereology. J. Neurocytol., 26:707–710. |
|
(83) |
West, M.J. (1999) Stereological methods for estimating the total number of neurons and synapses: Issues of precision and bias. Trends Neurosci., 22:51–61. |
|
(84) |
Schmitz, C., Hof, P.R. (2005) Design-based stereology in neuroscience. Neuroscience, 130: 813–831. |
|
(85) |
Gavin, C.E., Kates, B., Gerken, L.A., Rodier, P.M. (1994) Patterns of growth deficiency in rats exposed in utero to undernutrition, ethanol, or the neuroteratogen methylazoxymethanol (MAM). Teratology, 49:113–121. |
|
(86) |
Ohno, M., Aotani, H., Shimada, M. (1995) Glial responses to hypoxic/ischemic encephalopathy in neonatal rat cerebrum. Develop. Brain Res., 84:294–298. |
|
(87) |
Jensen KF, Catalano SM. (1998) Brain morphogenesis and developmental neurotoxicology. In: Handbook of Developmental Neurotoxicology, Slikker, Jr. W., Chang, L.W. (eds) Academic Press, New York, str. 3–41. |
|
(88) |
Ikonomidou, C., Bosch, F., Miksa, M., Bittigau, P., Vöckler, J., Dikranian, K., Tenkova, T.I., Stefovska, V., Turski, L., Olney, J.W. (1999) Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain. Science, 283:70–74. |
|
(89) |
Ikonomidou, C., Bittigau, P., Ishimaru, M.J., Wozniak, D.F., Koch, C., Genz, K., Price, M.T., Sefovska, V., Hörster, F., Tenkova, T., Dikranian, K., Olney, J.W. (2000) Ethanol-induced apoptotic degeneration and fetal alcohol syndrome. Science, 287:1056–1060. |
|
(90) |
Friede, R. L. (1989) Developmental Neuropathology. Second edition. Springer-Verlag, Berlin. |
|
(91) |
House, D.E., Berman, E., Seeley, J.C., Simmons, J.E. (1992) Comparison of open and blind histopathologic evaluation of hepatic lesions. Toxicol. Let., 63:127–133. |
|
(92) |
Tilson, H.A., MacPhail, R.C., Crofton, K.M. (1996) Setting exposure standards: a decision process. Environ. Health Perspect., 104:401–405. |
|
(93) |
US EPA (2005) Guidelines for Carcinogen Risk Assessment. US EPA NCEA-F-0644A. |
|
(94) |
US EPA (1996) Guidelines for Reproductive Toxicity Risk Assessment, Federal Register 61(212): 56274–56322. |
|
(95) |
Danish Environmental Protection Agency (1995) Neurotoxicology. Review of Definitions, Methodology, and Criteria. Miljøprojekt nr. 282. Ladefoged, O., Lam, H.R., Østergaard, G., Nielsen, E., Arlien-Søborg, P. |
|
(96) |
Muller, K.E., Barton, C.N., Benignus, V.A. (1984). Recommendations for appropriate statistical practice in toxicologic experiments. Neurotoxicology, 5:113–126. |
|
(97) |
Gad, S.C. (1989) Principles of screening in toxicology with special emphasis on applications to Neurotoxicology. J. Am. Coll. Toxicol., 8:21–27. |
|
(98) |
Abby, H., Howard, E. (1973) Statistical procedures in developmental studies on a species with multiple offspring. Dev. Psychobiol., 6:329–335. |
|
(99) |
Haseman, J.K., Hogan, M.D. (1975) Selection of the experimental unit in teratology studies. Teratology, 12:165–172. |
|
(100) |
Holson, R.R., Pearce, B. (1992) Principles and pitfalls in the analysis of prenatal treatment effects in multiparous species. Neurotoxicol. Teratol., 14: 221–228. |
|
(101) |
Nelson, C.J., Felton, R.P., Kimmel, C.A., Buelke-Sam, J., Adams, J. (1985) Collaborative Behavioral Teratology Study: Statistical approach. Neurobehav. Toxicol. Teratol., 7:587–90. |
|
(102) |
Crofton, K.M., Makris, S.L., Sette, W.F., Mendez, E., Raffaele, K.C. (2004) A qualitative retrospective analysis of positive control data in developmental neurotoxicity studies. Neurotoxicol. Teratol., 26:345–352. |
|
(103) |
Bolon, B., Garman, R., Jensen, K., Krinke, G., Stuart, B., and an ad hoc working group of the STP Scientific and Regulatory Policy Committee. (2006) A ‚best practices‘ approach to neuropathological assessment in developmental neurotoxicity testing – for today. Toxicol. Pathol. 34:296–313. |
|
(104) |
Tamura, R.N., Buelke-Sam, J. (1992) The use of repeated measures analysis in developmental toxicology studies. Neurotoxicol. Teratol., 14(3):205–210. |
|
(105) |
Tukey, J.W., Ciminera, J.L., Heyse, J.F. (1985) Testing the statistical certainty of a response to increasing doses of a drug. Biometrics, 41:295–301. |
|
(106) |
Crofton, K.M., Foss, J.A., Haas, U., Jensen, K., Levin, E.D., and Parker, S.P. (2008) Undertaking positive control studies as part of developmental neurotoxicity testing: report from the ILSI Research Foundation/Risk Science Institute expert working group on neurodevelopmental endpoints. Neurotoxicology and Teratology, 30(4):266–287. |
|
(107) |
Raffaele, K.C., Fisher, E., Hancock, S., Hazelden, K., and Sobrian, S.K. (2008) Determining normal variability in a developmental neurotoxicity test: report from the ILSI Research Foundation/Risk Science Institute expert working group on neurodevelopmental endpoints. Neurotoxicology and Teratology, 30(4):288–325. |
|
(108) |
Holson, R.R., Freshwater, L., Maurissen, J.P.J., Moser, V.C., and Phang, W. (2008) Statistical issues and techniques appropriate for developmental neurotoxicity testing: a report from the ILSI Research Foundation/Risk Science Institute expert working group on neurodevelopmental endpoints. Neurotoxicology and Teratology, 30(4):326–348. |
|
(109) |
Tyl, R.W., Crofton, K.M., Moretto, A., Moser, V.C., Sheets, L.P., and Sobotka, T.J. (2008) Identification and interpretation of developmental neurotoxicity effects: a report from the ILSI Research Foundation/Risk Science Institute expert working group on neurodevelopmental endpoints Neurotoxicology and Teratology, 30(4):349–381. |
Slika 1
Splošni načrt preskušanja za funkcionalne/vedenjske preskuse, vrednotenje nevropatologije in težo možganov. Ta diagram temelji na opisu iz odstavkov 13–15 (PPD = poporodni dan). Primeri dodelitev živali so navedeni v Dodatku 1.

Dodatek 1
|
1. |
Primeri možnih dodelitev so opisani in prikazani v obliki tabele spodaj. Ti primeri so namenjeni prikazu, da je mogoče živali v študiji razdeliti v različne vzorce preskušanja na več različnih načinov. |
Primer 1
|
2. |
Za preskušanje vedenjske ontogenije pred odstavitvijo od sesanja se uporabi ena skupina 20 mladičev/spol/velikost odmerka (tj. 1 samec in 1 samica na zarod). Od teh živali je 10 mladičev/spol/velikost odmerka (tj. 1 samec ali 1 samica na zarod) humano usmrčenih na PPD 22. Možgani se odstranijo, stehtajo in obdelajo za histopatološko vrednotenje. Poleg tega se zberejo podatki o teži možganov z uporabo nefiksiranih možganov preostalih 10 samcev in 10 samic na velikost odmerka. |
|
3. |
Druga skupina 20 živali/spol/velikost odmerka (tj. 1 samec in 1 samica na zarod) se uporabi za funkcionalne/vedenjske preskuse po odstavitvi od sesanja (podrobna klinična opazovanja, preskušanja motorične aktivnosti, slušnih dražljajev in kognitivne funkcije pri adolescentih) in ocenjevanje starosti ob nastopu spolne zrelosti. Od teh živali se 10 živali/spol/velikost odmerka (tj. 1 samec ali 1 samica na zarod) anestezira in fiksira s perfuzijo ob koncu študije (približno PPD 70). Po dodatni fiksaciji in situ se možgani odstranijo in obdelajo za nevropatološko vrednotenje. |
|
4. |
Za preskušanje kognitivne funkcije pri mladih odraslih (npr. PPD 60–70) se uporabi tretja skupina 20 mladičev/spol/velikost odmerka (tj. 1 samec in 1 samica na zarod). Od tega je 10 živali/spol/skupino (1 samec ali 1 samica na zarod) usmrčenih ob koncu študije, pri čemer se možgani odstranijo in stehtajo. |
|
5. |
Preostalih 20 živali/spol/skupino se shrani za morebitne dodatne preskuse. Tabela 1
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Primer 2
|
6. |
Za preskušanje vedenjske ontogenije pred odstavitvijo od sesanja se uporabi ena skupina 20 mladičev/spol/velikost odmerka (tj. 1 samec in 1 samica na zarod). Od teh živali je 10 mladičev/spol/velikost odmerka (tj. 1 samec ali 1 samica na zarod) humano usmrčenih na PPD 11. Možgani se odstranijo, stehtajo in obdelajo za histopatološko vrednotenje. |
|
7. |
Druga skupina 20 živali/spol/velikost odmerka (tj. 1 samec in 1 samica na zarod) se uporabi za preglede po odstavitvi od sesanja (podrobna klinična opazovanja, motorična aktivnost, ocena starosti ob nastopu spolne zrelosti ter motorična in senzorična funkcija). Od teh živali se 10 živali/spol/velikost odmerka (tj. 1 samec ali 1 samica na zarod) anestezira in fiksira s perfuzijo ob koncu študije (približno PPD 70) Po dodatni fiksaciji in situ se možgani odstranijo, stehtajo in obdelajo za nevropatološko vrednotenje. |
|
8. |
Za preskušanje kognitivne funkcije pri adolescentih in mladih odraslih se uporabi 10 mladičev/spol/velikost odmerka (tj. 1 samec ali 1 samica na zarod). Za preskuse kognitivne funkcije na PPD 23 in pri mladih odraslih se uporabijo različne živali. Ob koncu se 10 živali/spol/skupino, ki se preskusijo kot odrasli, usmrti, možgani pa se odstranijo in stehtajo. |
|
9. |
Preostalih 20 živali/spol/skupino, ki niso bile izbrane za preskušanje, se usmrti in izloči ob odstavitvi od sesanja. Tabela 2
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Primer 3
|
10. |
Za oceno teže možganov in nevropatološko oceno na PPD 11 se uporabi ena skupina 20 mladičev/spol/velikost odmerka (tj. 1 samec in 1 samica na zarod). Od teh živali je 10 mladičev/spol/velikost odmerka (tj. 1 samec ali 1 samica na zarod) humano usmrčenih na PPD 11, pri čemer se možgani odstranijo, stehtajo in obdelajo za histopatološko vrednotenje. Poleg tega se zberejo podatki o teži možganov z uporabo nefiksiranih možganov preostalih 10 samcev in 10 samic na velikost odmerka. |
|
11. |
Druga skupina 20 živali/spol/velikost odmerka (tj. 1 samec in 1 samica na zarod) se uporabi za vedenjsko ontogenijo (motorična aktivnost), preglede po odstavitvi od sesanja (motorična aktivnost in ocena starosti ob nastopu spolne zrelosti) in preskušanje kognitivne funkcije pri adolescentih. |
|
12. |
Druga skupina 20 živali/spol/velikost odmerka (tj. 1 samec in 1 samica na zarod) se uporabi za preskuse motorične in senzorične funkcije (slušni dražljaji) ter podrobna klinična opazovanja. Od teh živali se 10 živali/spol/velikost odmerka (tj. 1 samec ali 1 samica na zarod) anestezira in fiksira s perfuzijo ob koncu študije (približno PPD 70) Po dodatni fiksaciji in situ se možgani odstranijo, stehtajo in obdelajo za nevropatološko vrednotenje. |
|
13. |
Druga skupina 20 mladičev/spol/velikost odmerka se uporabi za preskušanje kognitivne funkcije pri mladih odraslih (tj. 1 samec in 1 samica na zarod). Od tega je 10 živali/spol/skupino (tj. 1 samec ali 1 samica na zarod) ob koncu usmrčenih, pri čemer se možgani odstranijo in stehtajo. Tabela 3
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dodatek 2
Opredelitve
Kemikalija: snov ali zmes.
Preskusna kemikalija: katera koli snov ali zmes, ki se preskuša s to preskusno metodo.
B.54 UTEROTROPNI BIOLOŠKI PRESKUS NA GLODAVCIH: KRATKOTRAJNI PRESEJALNI PRESKUS ZA ESTROGENE LASTNOSTI
UVOD
1. Ta preskusna metoda ustreza Smernici za preskušanje OECD št. 440 (2007). OECD je leta 1998 začela z izvajanjem prednostne dejavnosti, da bi pregledala obstoječe in razvila nove smernice za odkrivanje in preskušanje potencialnih povzročiteljev endokrinih motenj (1). Ta dejavnost je med drugim zajemala razvoj smernice za preskušanje za uterotropni biološki preskus na glodavcih. Za uterotropni biološki preskus na glodavcih je bil opravljen obsežen program validacije, med drugim priprava podrobnega referenčnega dokumenta (2) (3) in izvajanje obsežnih študij znotraj laboratorija in med laboratoriji, da bi dokazali ustreznost in ponovljivost biološkega preskusa z močnim referenčnim estrogenom, šibkimi agonisti estrogenskih receptorjev, močnim antagonistom estrogenskih receptorjev in negativno referenčno kemikalijo (4) (5) (6) (7) (8) (9). Ta preskusna metoda B.54 je bila razvita na podlagi izkušenj, pridobljenih med programom validacije preskusa in dobljenih rezultatov z agonisti estrogenov.
2. Uterotropni biološki preskus je kratkotrajni presejalni preskus, ki izvira iz 30. let prejšnjega stoletja (27) (28) in ga je prvi standardiziral strokovni odbor leta 1962 (32) (35). Temelji na povečanju teže maternice ali uterotropnem odzivu (za pregled glej (29)). Vrednoti sposobnost kemikalije, da sproži biološko delovanje, ki je v skladu z agonisti ali antagonisti naravnih estrogenov (npr. 17ß-estradiol), se pa za odkrivanje antagonistov uporablja precej redkeje kot za odkrivanje agonistov. Maternica se na estrogene odziva na dva načina. Prvotni odziv je povečanje teže zaradi prepojenosti z vodo. Temu odzivu sledi povečanje teže zaradi rasti tkiva (30). Odziv maternice pri podganah in miših je kvalitativno primerljiv.
3. Ta biološki preskus služi kot presejalna študija in vivo, njegovo uporabo pa je treba obravnavati v okviru temeljnega okvira za preskušanje in oceno kemikalij, ki povzročajo endokrine motnje, 'OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals' (Dodatek 2). V tem temeljnem okviru je uterotropni biološki preskus na ravni 3 kot preskus in vivo, ki zagotavlja podatke o enem samem endokrinem mehanizmu, tj. estrogenosti.
4. Uterotropni biološki preskus naj bi bil vključen v sistem preskusov in vitro in in vivo, s katerimi bi opredelili kemikalije, ki bi lahko vplivale na endokrini sistem, na podlagi tega pa bi bile opravljene ocene tveganja za zdravje ljudi in okolje. V programu OECD za validacijo so bili za oceno učinkovitosti preskusa za opredelitev estrogenih kemikalij uporabljeni močni in šibki agonisti estrogenov (4) (5) (6) (7) (8). Tako sta bila uspešno dokazana občutljivost postopka preskušanja za agoniste estrogenov in zagotovljena dobra ponovljivost znotraj laboratorija in med laboratoriji.
5. V zvezi z negativnimi kemikalijami je bila v program validacije vključena samo ena 'negativna' referenčna kemikalija, ki je bila kot negativna že potrjena z uterotropnim preskusom ter in vitro preskusi vezave na receptorje in receptorjev, ocenjeni pa so bili tudi dodatni podatki študij, ki niso bili povezani s programom OECD za validacijo in so dodatno podprli specifičnost uterotropnega biološkega preskusa za odkrivanje agonistov estrogenov (16).
ZAČETNI PREUDARKI IN OMEJITVE
6. Agonisti in antagonisti estrogenov delujejo kot ligandi estrogenskih receptorjev α in β in lahko pri receptorjih aktivirajo oziroma zavirajo dejavnost prepisovanja. Zato bi lahko prišlo do škodljivih učinkov za zdravje, vključno z učinki na razmnoževanje in razvoj. Zato je potrebna hitra ocena in vrednotenje kemikalije kot možnega agonista ali antagonista estrogenov. Afiniteta liganda do estrogenskega receptorja ali aktivacije prepisovanja in vitro je samo eden od kazalnikov morebitne nevarnosti. Drugi kazalniki so lahko aktivacija presnove in njena deaktivacija po vstopu v telo, razporeditev v tarčna tkiva in odstranitev iz telesa, vsaj delno pa so odvisni od načina vnosa in preskusne kemikalije. Zato je treba morebitno dejavnost kemikalije pod ustreznimi pogoji proučiti in vivo, razen če so potrebne informacije razvidne že iz lastnosti kemikalije glede absorpcije, porazdelitve, presnove in izločanja. Maternična tkiva se na stimulacijo z estrogeni odzovejo s hitro in bujno rastjo, zlasti pri laboratorijskih glodavcih, pri katerih pojatveni cikel traja približno 4 dni. Glodavci, zlasti podgane, se pogosto uporabljajo tudi v študijah strupenosti za opredelitev nevarnosti. Zato je maternica pri glodavcih ustrezen tarčni organ za presejanje agonistov in antagonistov estrogenov in vivo.
7. Ta preskusna metoda temelji na protokolih iz validacijske študije OECD, ki so se izkazali za zanesljive in ponovljive v študijah znotraj laboratorija in med laboratoriji (5) (7). Trenutno sta na voljo dve metodi, in sicer metoda s sterilizirano odraslo samico in metoda z nezrelo nesterilizirano samico. V programu OECD za validacijo preskusa se je izkazalo, da sta obe metodi primerljivo občutljivi in ponovljivi. Metoda z nezrelo samico je nekoliko manj specifična, ker je os hipotalamus – hipofiza – spolne žleze (os HPG) nedotaknjena, vendar pokriva širše področje preiskave kot metoda s sterilizirano samico, saj se lahko pri prvi metodi žival odzove na kemikalije, ki vplivajo na os HPG in ne samo na estrogenski receptor. Delovanje osi HPG pri podgani se prične pri približno 15 dneh starosti. Pred tem pubertete ni mogoče spodbuditi s tretiranjem, na primer z GnRH. Ko samice prihajajo v puberteto, imajo pred odpiranjem nožnice več tihih ciklov, zaradi katerih sicer ne pride do odpiranja nožnice ali ovulacije, so pa prisotna hormonska nihanja. Če kemikalija os HPG neposredno ali posredno stimulira pred puberteto, pride do zgodnje ovulacije in pospešenega odpiranja nožnice. Do tega ne pride samo zaradi kemikalij, ki delujejo na os HPG; tudi nekatere vrste hrane, ki imajo višje ravni presnovljive energije kot druge, bodo stimulirale rast in spodbudile odpiranje nožnice, čeprav niso estrogenske. Takšne kemikalije ne bi povzročile uterotropnega odziva pri sterilizirani odrasli samici, saj njihova os HPG ne deluje.
8. Zaradi dobrobiti živali je zaželena uporaba metode z nezrelimi podganami, saj tako ni potrebna kirurška predpriprava živali, izogniti pa se je mogoče tudi neuporabi tistih živali, ki kažejo morebitne znake pojatvenega cikla (glej odstavek 30).
9. Do uterotropnega odziva ne pride samo zaradi estrogenosti, tj. do odziva lahko pride tudi zaradi drugih kemikalij, ne samo agonistov ali antagonistov estrogenov. Do stimulativnega odziva lahko na primer pride tudi zaradi relativno velikih odmerkov progesterona, testosterona ali različnih sintetičnih progestinov (30). Vsak odziv je mogoče histološko analizirati za keratinizacijo in kornifikacijo nožnice (30). Ne glede na morebiten izvor odziva naj bi bili na podlagi pozitivnega rezultata uterotropnega biološkega preskusa običajno začeti postopki za nadaljnja pojasnila. Dodatni dokazi o estrogenosti bi bili lahko pridobljeni na podlagi preskusov in vitro, kot so preskusi vezave na estrogenske receptorje in preskusi aktivacije prepisovanja, ali na podlagi drugih preskusov in vivo, kot je preskus na podgani ženskega spola v puberteti.
10. Ob upoštevanju, da uterotropni biološki preskus služi kot presejalna študija in vivo, je bil pristop validacije koristen tako za vprašanja, povezana z dobrobitjo živali, kot za večstopenjsko strategijo preskušanja. Zato je bilo prizadevanje usmerjeno v strogo validacijo ponovljivosti in občutljivosti za estrogenost, kar je najpomembnejše vprašanje pri številnih kemikalijah, medtem ko v razsežnost antiestrogenosti v preskusu ni bilo vloženega veliko truda. Preskušen je bil samo en antiestrogen z močnim delovanjem, saj je število kemikalij z jasnim antiestrogenim profilom (ki ga ne prikrije kakšno estrogeno delovanje) zelo majhno. Zato je ta preskusna metoda namenjena estrogenemu protokolu, protokol, ki v preskusu opisuje antagonistično delovanje, pa je vključen v smernici (37). Ponovljivost in občutljivost preskusa za kemikalije z izključno antiestrogenim delovanjem bo jasneje opredeljena v prihodnosti, ko bo preskusni postopek že nekaj časa v uporabi in bo opredeljenih več kemikalij s tem načinom delovanja.
11. Priznava se, da morajo biti vsi postopki, pri katerih se uporabljajo živali, v skladu z lokalnimi standardi za varstvo živali; opisi oskrbe in ravnanja z živalmi v nadaljevanju so minimalni standardi, nadomestili pa jih bodo lokalni predpisi, kot je Direktiva 2010/63/EU Evropskega parlamenta in Sveta z dne 22. septembra 2010 o zaščiti živali, ki se uporabljajo v znanstvene namene (38). Nadaljnje smernice o humanem ravnanju z živalmi je predložila OECD (25).
12. Kot pri vseh preskusih, pri katerih se uporabljajo žive živali, se je treba pred pričetkom izvajanja preskusa prepričati, da so podatki resnično potrebni. Na primer, dva pogoja, pri katerih so podatki potrebni, sta:
|
— |
visok potencial za izpostavljenost (raven 1 temeljnega okvira, Dodatek 2) ali pokazatelji estrogenosti (raven 2), zaradi katerih je potrebno preveriti, ali se lahko takšni učinki pojavijo in vivo, |
|
— |
učinki, ki kažejo na estrogenost v preskusih in vivo na ravni 4 ali 5, da bi ugotovili, ali so bili učinki povezani z estrogenimi mehanizmi, ki jih ni mogoče pojasniti s preskusom in vitro. |
13. Opredelitve, uporabljene v tej preskusni metodi, so navedene v Dodatku 1.
NAČELO PRESKUSA
14. Občutljivost uterotropnega biološkega preskusa je odvisna od sistema preskušanja na živalih, pri katerem os hipotalamus – hipofiza – jajčniki ne deluje, zaradi česar so prisotne nizke endogene koncentracije cirkulirajočega estrogena. Tako se zagotovi nizka osnovna teža maternice in največji možni razpon odziva na prejete estrogene. To zahtevo izpolnjujeta dve na estrogen občutljivi stanji pri glodavcih ženskega spola:
|
(i) |
nezrele samice po odstavitvi in pred puberteto ter |
|
(ii) |
mlade odrasle samice po sterilizaciji, ko je dovolj časa, da se maternična tkiva zmanjšajo. |
15. Preskusna kemikalija se vnese dnevno, in sicer oralno z gavažo ali s podkožnim injiciranjem. Stopnjevani odmerki preskusne kemikalije se dajejo vsaj dvema tretiranima skupinama (za navodila glej odstavek 33) preskusnih živali, pri čemer se za vsako skupino uporabi ena velikost odmerka, in sicer v obdobju treh zaporednih dni pri metodi z nesterilizirano nezrelo samico in obdobju najmanj treh zaporednih dni pri metodi s sterilizirano odraslo samico. Približno 24 ur po prejetju zadnjega odmerka se na živalih opravi obdukcija. Pri agonistih estrogenov se na podlagi srednje teže maternice živali v tretiranih skupinah glede na nosilec oceni, ali je prišlo do statistično značilnega povečanja. Statistično značilno povečanje srednje teže maternice živali v preskusni skupini v tem biološkem preskusu pomeni pozitiven odziv.
OPIS METODE
Izbira živalskih vrst
16. Lahko se uporabijo laboratorijski sevi glodavcev, ki se običajno uporabljajo. Med validacijo so bili na primer uporabljeni sevi podgan Sprague-Dawley in Wistar. Sevi z maternicami, za katere je znano ali pa se sumi, da so manj odzivne, se ne smejo uporabiti. Laboratorij bi moral dokazati občutljivost uporabljenega seva v skladu z odstavkoma 26 in 27.
17. V uterotropnem biološkem preskusu se od 30-ih let prejšnjega stoletja običajno uporabljajo podgane in miši. Validacijske študije OECD so bile izvedene samo s podganami na podlagi prepričanja, da sta obe vrsti enakovredni, zato bi morala biti ena vrsta dovolj za globalno validacijo, da bi prihranili sredstva in živali. Podgane so prva izbira pri večini študij strupenosti za razmnoževanje in razvoj. Ker za miši obstaja obsežna zbirka preteklih podatkov, in bi tako razširili področje uporabe uterotropnega biološkega preskusa na glodavcih na uporabo miši kot preskusne vrste, je bila na miših opravljena omejena nadaljevalna validacijska študija (16). V skladu s prvotnim namenom ohranjanja sredstev in živali je bil izbran premostitveni pristop z omejenim številom preskusnih kemikalij in sodelujočih laboratorijev ter brez preskušanja kodiranih vzorcev. Ta premostitvena validacijska študija za uterotropni biološki preskus na steriliziranih mladih odraslih miših dokazuje, da se podatki, pridobljeni s podganami in mišmi, kvalitativno in kvantitativno dobro dopolnjujejo. Če bo po uterotropnem biološkem preskusu morda izvedena dolgotrajna študija, bo tako mogoče v obeh študijah uporabiti živali iste vrste, seva in izvora. Premostitveni pristop je bil uporabljen samo za sterilizirane odrasle miši, poročilo pa ne zagotavlja zanesljivih podatkov za validacijo modela z nezrelimi samicami, zato model z nezrelimi mišmi ne sodi na področje uporabe obstoječe preskusne metode.
18. Zato se lahko v nekaterih primerih namesto podgan uporabijo miši. Uporabo te vrste je treba utemeljiti na podlagi toksikoloških, farmakokinetičnih in/ali drugih meril. Za miši bodo morda potrebne spremembe protokola. Na primer, poraba hrane pri miših glede na telesno težo je večja kot pri podganah, zato mora biti vsebnost fitoestrogena v hrani za miši manjša kot v hrani za podgane (9) (20) (22).
Nastanitveni in prehranjevalni pogoji
19. Vsi postopki morajo biti skladni z vsemi lokalnimi standardi za varstvo živali v laboratorijih. Ti opisi oskrbe in ravnanja z živalmi so minimalni standardi, ki jih bodo nadomestili lokalni predpisi, kot je Direktiva 2010/63/EU Evropskega parlamenta in Sveta z dne 22. septembra 2010 o zaščiti živali, ki se uporabljajo v znanstvene namene (38). Temperatura v prostoru s preskusnimi živalmi naj bo 22 °C (z odstopanjem približno ± 3 °C). Relativna vlažnost naj bo najmanj 30 % in po možnosti naj ne presega 70 %, razen med čiščenjem prostora. Cilj je 50–60-odstotna relativna vlažnost. Osvetlitev naj bo umetna. Dnevno zaporedje osvetlitve naj bo 12 ur svetlobe, 12 ur teme.
20. Laboratorijsko prehrano in pitno vodo je treba priskrbeti ad libitum. Mlade odrasle živali so lahko nastanjene posamično ali pa so v kletke razvrščene v skupine po največ tri živali. Zaradi mladosti nezrelih živali je priporočljiva družabna skupinska nastanitev.
21. Znano je, da visoka vsebnost fitoestrogenov v laboratorijski prehrani povzroči tolikšno povečanje teže maternice pri glodavcih, da to vpliva na uterotropni biološki preskus (13) (14) (15). Pri nezrelih živalih lahko visoka vsebnost fitoestrogenov in presnovljiva energija v laboratorijski prehrani vplivata tudi na pojav zgodnje pubertete. Fitoestrogeni so prisotni v glavnem zaradi vsebnosti izdelkov iz soje in lucerne v laboratorijski prehrani, koncentracija fitoestrogenov v standardni laboratorijski prehrani pa se razlikuje od serije do serije (23). Telesna teža je pomembna spremenljivka, ker je z njo povezana količina zaužite hrane. Zato se lahko dejanski odmerek fitoestrogenov, zaužitih z enako prehrano, razlikuje glede na vrsto in starost (9). Pri nezrelih podganah ženskega spola je lahko poraba hrane glede na telesno težo približno dvakrat večja od porabe hrane pri steriliziranih mladih odraslih samicah. Pri mladih odraslih miših je lahko poraba hrane glede na telesno težo približno štirikrat večja od porabe hrane pri steriliziranih mladih odraslih podganah ženskega spola.
22. Rezultati uterotropnega biološkega preskusa (9) (17) (18) (19) kažejo, da je določena količina fitoestrogenov v prehrani sprejemljiva in ne zmanjša občutljivosti biološkega preskusa. Praviloma naj raven fitoestrogenov v prehrani nezrelih podganah ženskega spola sevov Sprague Dawley in Wistar (6) (9) ne bi presegla 350 μg ekvivalentov genisteina/gram laboratorijske prehrane. Takšna prehrana bi morala biti primerna tudi pri preskušanju na mladih odraslih steriliziranih podganah, ker je poraba hrane glede na telesno težo pri mladih odraslih živalih manjša v primerjavi s porabo hrane pri nezrelih živalih. Če se uporabijo odrasle sterilizirane miši ali podgane, ki so bolj občutljive na fitoestrogen, je treba upoštevati sorazmerno zmanjšanje ravni fitoestrogenov v prehrani (20). Poleg tega lahko zaradi razlik v razpoložljivi presnovni energiji iz različne prehrane pride do časovnega zamika začetka pubertete (21) (22).
23. Pred začetkom študije je treba skrbno izbrati prehrano brez povečane vrednosti fitoestrogenov (za navodila glej (6) (9)) ali presnovljive energije, ki lahko vplivajo na rezultate (15) (17) (19) (22) (36). Zagotavljanje ustreznega delovanja sistema preskušanja, ki ga uporablja laboratorij in je določen v odstavkih 26 in 27, je pomembno za preverjanje obeh dejavnikov. Kot varovalo v skladu z dobro laboratorijsko prakso je treba za vsako serijo prehrane, uporabljene med študijo, opraviti reprezentativno vzorčenje zaradi morebitne analize vsebnosti fitoestrogenov (npr. v primeru visoke kontrolne teže maternice v primerjavi s preteklimi kontrolnimi vzorci ali nezadostnega odziva na referenčni estrogen, 17-alfa-etinilestradiol). Alikvote je treba analizirati v okviru študije ali pa jih zamrzniti pri –20 °C oziroma tako, da se vzorec pred analizo ne razgradi.
24. Nekatere vrste stelje lahko vsebujejo naravno prisotne estrogene ali antiestrogene kemikalije (na primer, znano je, da koruzni storž vpliva na cikličnost pri podganah in očitno deluje antiestrogeno). Izbrana stelja naj bi vsebovala najmanjšo možno koncentracijo fitoestrogenov.
Priprava živali
25. Preskusne živali, ki ne kažejo nobenih znakov bolezni ali fizičnih nepravilnosti, se naključno dodelijo v kontrolne in tretirane skupine. Kletke je treba razporediti tako, da so možni učinki zaradi njihovega položaja čim manjši. Živali je treba označiti z edinstvenimi oznakami. Najbolje je, da so nezrele živali med prilagajanjem do odstavitve v kletkah skupaj z materami ali nadomestnimi materami. Obdobje prilagajanja pred začetkom študije naj bi pri mladih odraslih živalih in nezrelih živalih, ki so prispele skupaj z materami ali nadomestnimi materami, trajalo približno 5 dni. Če so prispele nezrele živali, odstavljene in brez mater, bo morda potrebno krajše obdobje prilagajanja, saj naj bi se dajanje odmerkov pričelo takoj po odstavitvi (glej odstavek 29).
POSTOPEK
Preverjanje strokovnosti laboratorija
26. Za preverjanje strokovnosti laboratorija sta na voljo dve različni možnosti:
|
— |
redno preverjanje na podlagi prvotne študije osnovne pozitivne kontrole (glej odstavek 27). Vsaj vsakih 6 mesecev in vedno, ko pride do spremembe, ki bi lahko vplivala na uspešnost preskusa (npr. nova sestava prehrane, menjava osebja, ki opravlja obdukcije, menjava seva živali ali dobavitelja itd.), je treba odzivnost sistema preskušanja (živalski model) preveriti s primernim odmerkom (na podlagi študije osnovne pozitivne kontrole iz poglavja 27) referenčnega estrogena: 17α-etinilestradiol (št. CAS 57-63-6) (EE), |
|
— |
uporaba sočasnih kontrolnih vzorcev z vključitvijo skupine, ki je prejela ustrezni odmerek referenčnega estrogena, v vsak preskus. |
Če se sistem ne odzove v skladu s pričakovanji, je treba pogoje preskusa preveriti in ustrezno spremeniti. Priporoča se, da je odmerek referenčnega estrogena, ki bo uporabljen v obeh primerih, približno ED70 do 80.
27. Študija osnovne pozitivne kontrole – Preden laboratorij prvič izvede študijo v okviru te preskusne metode, je treba dokazati strokovnost laboratorija s preskusom odzivnosti živalskega modela z določitvijo odziva na odmerek referenčnega estrogena: 17α-etinilestradiola (št. CAS 57-63-6) (EE) z najmanj štirimi odmerki. Odziv teže maternice se nato primerja z dobljenimi preteklimi podatki (glej vir (5)). Če študija osnovne pozitivne kontrole ne prinese pričakovanih rezultatov, je treba pogoje preskusa preveriti in spremeniti.
Število in stanje živali
28. Vsaka tretirana in kontrolna skupina mora vključevati vsaj 6 živali (za protokola obeh metod, tj. z nezrelo in sterilizirano odraslo samico).
Starost nezrelih živali
29. Pri uterotropnem biološkem preskusu z nezrelimi živalmi je treba opredeliti dan skotitve. Dajanje odmerkov se mora začeti dovolj zgodaj, da se ob koncu dajanja preskusne kemikalije še ne prične fiziološko naraščanje endogenih estrogenov, povezanih s puberteto. Po drugi strani pa obstajajo dokazi, da so zelo mlade živali morda manj občutljive. Pri opredelitvi optimalne starosti mora vsak laboratorij upoštevati lastne osnovne podatke o zorenju.
Na splošno se lahko dajanje odmerkov podganam prične takoj po zgodnji odstavitvi na 18. poporodni dan (dan skotitve je poporodni dan 0). Dajanje odmerkov podganam naj bi bilo končano 21. poporodni dan, vsekakor pa pred 25. poporodnim dnem, saj se po tej starosti začne delovanje osi hipotalamus – hipofiza – jajčniki, ravni endogenih estrogenov pa lahko začnejo naraščati hkrati s povprečji osnovne teže maternice in povečanjem standardnih odklonov v skupini (2) (3) (10) (11) (12).
Postopek sterilizacije
30. Pri steriliziranih podganah in miših ženskega spola (tretirane in kontrolne skupine) se sterilizacija opravi med 6. in 8. tednom starosti. Pri podganah naj bi od sterilizacije do prvega odmerka preteklo vsaj 14 dni, da se lahko maternica zmanjša na najmanjšo, stabilno osnovno težo. Pri miših naj bi od sterilizacije do prvega odmerka preteklo vsaj 7 dni. Ker za proizvodnjo velike koncentracije cirkulirajočih estrogenov (3) zadošča majhna količina materničnega tkiva, je treba pred uporabo na živalih opraviti preskus z opazovanjem epitelijskih celic, vzetih z brisom nožnice vsaj pet zaporednih dni (npr. pri podganah na 10.–14. dan po sterilizaciji). Če živali kažejo morebitne znake pojatvenega cikla, se jih ne sme uporabiti. Pri obdukciji je treba ostanke jajčnikov pregledati zaradi morebitne prisotnosti tkiva jajčnikov. Če je tkivo prisotno, se živali ne smejo uporabiti pri izračunih (3).
31. Postopek sterilizacije se prične tako, da pravilno anestezirana žival leži na trebuhu. Rez, s katerim se odpre dorzolateralno trebušno steno, naj meri približno 1 cm v dolžino na sredini med zunanjim robom reber in črevničnim grebenom ter nekaj milimetrov lateralno od lateralnega roba ledvene mišice. Jajčnik je treba iz trebušne votline prestaviti na aseptično polje. Jajčnik je treba ločiti pri stiku jajcevoda in maternice. Po potrditvi, da ni prišlo do večje krvavitve, je treba trebušno steno zapreti s šivom, kožo pa speti s sponkami ali zapreti z ustreznim šivom. Mesto ligacije je prikazano na sliki 1. Uporabiti je treba primerne pooperativne analgetike v skladu s priporočili veterinarja, ki ima izkušnje z nego glodavcev.
Telesna teža
32. Pri metodi s sterilizirano odraslo samico telesna teža in teža maternice nista povezani, ker na težo maternice vplivajo hormoni, kot je estrogen, ne pa tudi rastni faktorji, ki vplivajo na velikost telesa. Ravno nasprotno je telesna teža povezana s težo maternice pri modelu z nezrelo samico v času dozorevanja (34). Zato naj bi bilo na začetku študije pri modelu z nezrelo samico nihanje teže uporabljenih živali čim manjše in naj ne bi preseglo ± 20 % srednje teže. To pomeni, da mora rejec standardizirati velikost zaroda in tako zagotoviti, da so potomci različnih mater približno enako hranjeni. Živali je treba razdeliti v skupine (kontrolne in tretirane) v naključnem razponu teže, tako da se povprečna telesna teža vsake skupine statistično ne razlikuje od drugih skupin. Če je mogoče, je treba paziti, da živali iz istega legla niso razporejene v isto tretirano skupino, ne da bi se zaradi tega povečalo število legel, uporabljenih v raziskavi.
Odmerjanje
33. Za ugotavljanje, ali lahko preskusna kemikalija in vivo deluje estrogeno, običajno zadoščajo dve skupini z odmerki in kontrola, zato je zaradi dobrobiti živali zaželen takšen način preskušanja. Če je cilj pridobiti krivuljo odziva na odmerek ali ekstrapolacija na manjše odmerke, so potrebne vsaj 3 skupine odmerkov. Če ni potrebna samo opredelitev estrogenega delovanja, ampak so potrebne tudi druge informacije (na primer ocena moči delovanja), je treba razmisliti o drugačnem režimu odmerjanja. Razen tretiranja s preskusno kemikalijo je treba živali v kontrolni skupini obravnavati enako kot živali v preskusni skupini. Če je pri dajanju preskusne kemikalije uporabljen nosilec, mora kontrolna skupina prejeti enako količino nosilca kot tretirane skupine (ali največjo uporabljeno količino pri preskusnih skupinah, če so količine, ki jih skupine prejmejo, različne).
34. Cilj pri uterotropnem biološkem preskusu je izbrati odmerke, ki zagotavljajo preživetje živali in zanje niso preveč strupeni oziroma jim ne povzročajo prevelike stiske po treh zaporednih dneh dajanja kemikalije, do največjega odmerka 1 000 mg/kg/d. Pri predlaganju in izbiri velikosti vseh odmerkov je treba upoštevati vse obstoječe podatke o strupenosti in (toksiko-)kinetiki, ki so na razpolago za preskusno kemikalijo ali sorodne snovi. Pri največjem odmerku je treba najprej upoštevati informacije o LD50 in/ali akutni strupenosti, da bi se izognili smrti, hudemu trpljenju ali stiski živali (24) (25) (26). Največji odmerek bi moral biti največji tolerančni odmerek (MTD); študija, opravljena z velikostjo odmerka, ki je povzročil pozitiven uterotropni odziv, bi bila prav tako sprejeta. Kot sito so na splošno sprejemljivi veliki intervali med odmerki (npr. polovica logaritemske enote, kar ustreza večanju odmerka za faktor 3,2, ali celo do ene logaritemske enote). Če ustrezni podatki niso na voljo, se lahko opravi študija ugotavljanja območja, s pomočjo katere se določijo odmerki za uporabo.
35. Namesto tega se lahko v primeru, ko je moč estrogenega delovanja agonista mogoče oceniti s podatki in vitro (ali in silico), pri izbiri odmerka upoštevajo ti podatki. Količina preskusne kemikalije, ki bi povzročila uterotropne odzive, enakovredne referenčnemu agonistu (etinilestradiolu), se na primer oceni z njeno relativno in vitro stopnjo učinkovanja glede na etinilestradiol. Največji preskusni odmerek se dobi tako, da se ta enakovredni odmerek pomnoži z ustreznim faktorjem, npr. 10 ali 100.
Preudarki glede ugotavljanja območja
36. Po potrebi se lahko z nekaj živalmi izvede predhodna študija za ugotavljanje območja. S tem v zvezi se lahko uporabi smernica OECD št. 19 (25), ki opredeljuje klinične znake strupenosti ali stiske pri živalih. Če je to v okviru te študije za ugotavljanje območja po treh dneh dajanja odmerkov izvedljivo, se lahko maternice izreže in stehta približno 24 ur po zadnjem odmerku. Ti podatki so nato lahko v pomoč pri zasnovi glavne študije (izbira sprejemljivih največjih in manjših odmerkov ter priporočilo glede števila skupin z odmerki).
Dajanje odmerkov
37. Preskusna kemikalija se daje oralno z gavažo ali s podkožnim injiciranjem. Pri izbiri načina dajanja je treba upoštevati vprašanja, povezana z dobrobitjo živali in toksikološke vidike, kot so relevantnost za način izpostavljenosti kemikaliji pri ljudeh (npr. na podlagi dajanja oralno z gavažo se modelira izpostavljenost prek zaužitja, na podlagi podkožnega injiciranja se modelira izpostavljenost prek vdihavanja ali adsorpcije skozi kožo), fizikalne/kemijske lastnosti preskusne kemikalije in zlasti obstoječi toksikološki podatki ter podatki o presnovi in kinetiki (npr. potreba po izogibanju presnovi prvega prehoda, boljša učinkovitost določenega načina izpostavljenosti).
38. Priporoča se, da se, kadar koli je to mogoče, najprej prouči uporaba vodne raztopine/suspenzije. Ker je večina estrogenih ligandov ali njihovih metaboličnih prekurzorjev hidrofobnih, se običajno uporablja raztopina/suspenzija v olju (npr. koruznem, arašidovem, sezamovem ali oljčnem olju). Ker imajo ta olja različno vsebnost kalorij in maščob, lahko nosilec vpliva na skupni vnos presnovljive energije, zaradi česar bi morda lahko spremenil izmerjene končne točke, kot je teža maternice, zlasti pri metodi z nezrelo samico (33). Zato je treba pred začetkom študije za vsak nosilec, ki bo uporabljen, za primerjavo uporabiti kontrolne vzorce brez nosilcev. Preskusne kemikalije se lahko raztopijo v najmanjši količini 95-odstotnega etanola ali drugega primernega topila, na končno delovno koncentracijo pa razredčijo v preskusnem nosilcu. Strupene lastnosti topila morajo biti znane in preskušene v ločeni kontrolni skupini, pri kateri je uporabljeno samo topilo. Če je preskusna kemikalija stabilna, se lahko raztapljanje preskusne kemikalije pospeši s previdnim segrevanjem in močnim mehanskim delovanjem. Določiti je treba stabilnost preskusne kemikalije v nosilcu. Če je preskusna kemikalija ves čas trajanja študije stabilna, se lahko pripravi samo začetni alikvot preskusne kemikalije, nato pa se dnevno pripravljajo določene razredčine odmerkov.
39. Čas odmerjanja je odvisen od uporabljenega modela (glej odstavek 29 za model z nezrelo samico in odstavek 30 za sterilizirano odraslo samico). Nezrele podgane ženskega spola prejemajo preskusno kemikalijo dnevno tri zaporedne dni. Pri steriliziranih podganah ženskega spola se prav tako priporoča tridnevno odmerjanje, vendar je sprejemljiva tudi daljša izpostavljenost, ki lahko izboljša odkrivanje kemikalij s šibko aktivnostjo. Pri sterilizirani miši ženskega spola bi moralo pri močnih agonistih estrogenov zadoščati tridnevno dajanje odmerka, saj podaljšanje na največ sedem dni ne prinaša nobenih prednosti, vendar pa v validacijski študiji (16) ta povezava za šibke estrogene ni bila preverjena, zato bi bilo treba pri sterilizirani odrasli samici odmerjanje podaljšati na največ 7 zaporednih dni.Odmerek je treba dati vsak dan približno ob istem času. Po potrebi jih je treba prilagoditi, da bi ohranili konstantno velikost odmerka glede na telesno težo živali (npr. mg preskusne kemikalije na kg telesne teže na dan). Variabilnost preskusnega volumna na podlagi telesne teže je treba s prilagajanjem koncentracije raztopine za odmerjanje obdržati na kar najnižji ravni, da bi zagotovili konstantno količino na podlagi telesne teže pri vseh odmerkih in vseh načinih dajanja.
40. Če se preskusna kemikalija daje z gavažo, jo je treba živali dati v enkratnem dnevnem odmerku z uporabo želodčne sonde ali primerne intubacijske kanile. Največja količina tekočine, ki se lahko da naenkrat, je odvisna od velikosti preskusne živali. Upoštevati je treba lokalne standarde za varstvo živali, količina pa ne sme preseči 5 ml/kg telesne teže, razen pri vodnih raztopinah, pri katerih se lahko uporabi 10 ml/kg telesne teže.
41. Če se preskusna kemikalija daje s podkožnim injiciranjem, se daje v enkratnem dnevnem odmerku. Odmerki se dajejo na dorzoskapularnem in/ali ledvenem delu s sterilno iglo (npr. velikosti 23 ali 25) in brizgo tuberkulinko. Mesto injiciranja se lahko obrije. Morebitne izgube, uhajanje snovi na mestu injiciranja ali nepopoln vnos odmerka je treba zabeležiti. Skupna količina odmerka na podgano na dan ne sme preseči 5 ml/kg telesne teže, razdeljenih na dve mesti injiciranja, razen pri vodnih raztopinah, pri katerih se lahko uporabi 10 ml/kg telesne teže.
Opazovanja
Splošna in klinična opazovanja
42. Splošna klinična opazovanja je treba opraviti vsaj enkrat dnevno in pogosteje, če se kažejo znaki strupenosti. Opazovanja je najbolje opraviti vsak dan ob istih časih ob upoštevanju vrhunca pričakovanih učinkov po odmerjanju. Vse živali je treba opazovati za določitev smrtnosti, obolevnosti in splošnih kliničnih znakov, kot so spremembe vedenja, spremembe na koži, dlaki, očeh in sluznicah, pojav sekrecije in ekskrecije ter delovanje avtonomnega živčevja (npr. solzenje, piloerekcija, velikost zenic, nenavaden vzorec dihanja).
Telesna teža in poraba hrane
43. Vse živali je treba stehtati dnevno na 0,1 g natančno, in sicer tik pred začetkom tretiranja, tj. ko se živali dodeli v skupine. Izmeri se lahko tudi količina hrane, ki jo živali porabijo med obdobjem tretiranja, in sicer za vsako posamezno kletko s tehtanjem hranilnic. Rezultati glede porabe hrane se izrazijo v gramih na podgano na dan.
Seciranje in merjenje teže maternice
44. Podgane so humano usmrčene 24 ur po prejetem zadnjem odmerku. Zaželen je naključni vrstni red obdukcije po skupinah, da ne bi prišlo do napredovanja neposredno po skupinah odmerkov, kar bi lahko v manjši meri vplivalo na podatke. Cilj biološkega preskusa je merjenje teže mokre in osušene maternice. V mokri teži je zajeta maternica s tekočinami v lumnu. Osušena teža se izmeri po odstranitvi tekočin v lumnu maternice.
45. Pred seciranjem je treba pri nezrelih živalih preveriti odpiranje nožnice. Postopek seciranja se začne s prerezom trebušne stene pri sramnični zrasti. Nato je treba rog maternice in jajčnike, če so prisotni, ločiti od dorzalne trebušne stene. Sečni mehur in uretri je treba odstraniti z ventralne in lateralne strani maternice in nožnice. Brazgotinasto zarastlino med rektumom in nožnico je treba ločiti tako, da je viden stik nožničnega ustja in presredka. Maternico in nožnico se od telesa loči s prerezom nožnične stene tik nad stikom s presredkom, kot je prikazano na sliki 2. Maternico je treba od telesne stene ločiti s previdnim prerezom mezenterija maternice od točke pritrditve po celotni dorzolateralni dolžini vsakega roga maternice. Po odstranitvi maternice iz telesa je treba biti dovolj hiter, da ne pride do izsušitve tkiv. Izguba teže zaradi izsušitve je pomembnejša pri majhnih tkivih, kot je maternica (23). Če so jajčniki prisotni, jih je treba ločiti pri jajcevodu in paziti, da ne pride do izgube tekočine iz lumna roga maternice. Če je bila žival sterilizirana, je treba ostanke jajčnikov pregledati zaradi morebitne prisotnosti tkiva jajčnikov. Odstraniti je treba odvečno maščobo in vezno tkivo. Nožnico je treba od maternice ločiti tik pod materničnim vratom, tako da vrat ostane pritrjen na maternico, kot je prikazano na sliki 2.
46. Maternice je treba posamično prenesti v edinstveno označeno in stehtano posodo (npr. petrijevko ali plastično posodo za tehtanje), pri čemer je treba še vedno paziti, da pred tehtanjem ne pride do izsušitve (npr. v posodo se lahko na primer odloži filtrirni papir, rahlo navlažen z raztopino vode in soli). Maternico s tekočino v lumnu se stehta na 0,1 mg natančno (mokra teža maternice).
47. Vsako posamezno maternico je treba nato posamično obdelati in odstraniti tekočino iz lumna. Oba roga maternice se vzdolžno prebodeta ali prerežeta. Maternica se odloži na rahlo navlažen filtrirni papir (npr. Whatman št. 3) in nežno stisne z drugim kosom rahlo navlaženega filtrirnega papirja, da se popolnoma odstrani tekočina iz lumna. Maternica brez tekočine iz lumna se stehta na 0,1 mg natančno (osušena teža maternice).
48. S podatki o teži maternice ob usmrtitvi se je mogoče prepričati, da primerna starost nezrele nesterilizirane podgane ni bila presežena, vendar so glede tega odločilni pretekli podatki o sevu podgan, ki ga je uporabil laboratorij (glej odstavek 56 za razlago rezultatov).
Neobvezne preiskave
49. Po tehtanju se lahko maternica fiksira v 10-odstotnem nevtralnem formalinskem pufru in se po barvanju s hematoksilinom in eozinom histopatološko pregleda. Skladno s tem se lahko pregleda tudi nožnica (glej odstavek 9). Poleg tega se lahko za kvantitativno primerjavo opravi tudi morfometrično merjenje povrhnjice endometrija.
PODATKI IN POROČANJE
Podatki
50. Podatki študije morajo obsegati:
|
— |
število posameznih živali na začetku preskusa, |
|
— |
število in identiteto živali, najdenih poginulih med preskusom ali usmrčenih iz humanih razlogov ter datum in čas pogina ali humane usmrtitve, |
|
— |
število in identiteto živali, ki kažejo znake strupenosti in opis znakov zaznane strupenosti, vključno s časom začetka, trajanja in resnosti morebitnih strupenih učinkov, in |
|
— |
število in identiteto živali, pri katerih so vidne poškodbe, ter opis vrste poškodb. |
51. Zabeležiti je treba podatke za posamezne živali, in sicer njihovo telesno težo, mokro težo maternice ter osušeno težo maternice. Za ugotavljanje, ali se je zaradi odmerjanja preskusne kemikalije teža maternice statistično značilno povečala (p < 0,05), je treba uporabiti enostranske statistične analize za agoniste. Izvesti je treba ustrezne statistične analize za ugotavljanje sprememb v osušeni in mokri teži maternice zaradi prejemanja odmerkov. Podatki se lahko na primer ovrednotijo z analizo kovariance (ANCOVA), pri čemer je telesna teža pri obdukciji kovariat. Pred analizo podatkov se lahko za podatke o maternici izvede logaritemska pretvorba podatkov za stabilizacijo varianc. Dunnettov in Hsujev preskus sta primerna za primerjave po parih vsake skupine, ki je prejela odmerek, s kontrolnimi vzorci, ki so prejemali le nosilec, in izračun intervalov zaupanja. Grafi studentiziranih ostankov se lahko uporabijo za odkrivanje morebitnih osamelcev in oceno homogenosti varianc. Ti postopki so bili uporabljeni v programu OECD za validacijo z metodo PROC GLM v sistemu za statistično analizo (SAS Institute, Cary, Severna Karolina, ZDA), različica 8 (6) (7).
52. Končno poročilo mora vključevati naslednje podatke:
Preskuševalni laboratorij:
|
— |
pristojno osebje in njihove pristojnosti v zvezi s študijo, |
|
— |
podatke preskusa osnovne pozitivne kontrole in periodične podatke o pozitivni kontroli (glej odstavka 26 in 27). |
Preskusna kemikalija:
|
— |
opredelitev preskusnih kemikalij, |
|
— |
agregatno stanje in, če je to ustrezno, fizikalno-kemijske lastnosti, |
|
— |
metodo in pogostost priprave razredčin, |
|
— |
morebitne podatke o stabilnosti, |
|
— |
morebitne analize raztopin za odmerjanje. |
Nosilec:
|
— |
opredelitev nosilca (stanje, dobavitelj in št. serije), |
|
— |
utemeljitev izbire nosilca (če ta ni voda). |
Preskusne živali:
|
— |
vrsto in sev ter utemeljitev izbire, |
|
— |
dobavitelja in določeni objekt dobavitelja, |
|
— |
starost ob dobavi z datumom kotitve, |
|
— |
pri nezrelih živalih podatek, ali so prispele skupaj z materami ali nadomestnimi materami, in datum odstavitve, |
|
— |
podrobnosti postopka prilagajanja živali, |
|
— |
število živali na posamezno kletko, |
|
— |
podrobnosti in metodo edinstvenih oznak živali in skupin. |
Preskusni pogoji:
|
— |
podrobnosti postopka randomizacije (tj. uporabljenega postopka), |
|
— |
utemeljitev izbire odmerka, |
|
— |
podrobne podatke o formulaciji preskusne kemikalije, njeni doseženi koncentraciji, stabilnosti in homogenosti, |
|
— |
podrobne podatke o dajanju preskusne kemikalije in utemeljitev izbire načina izpostavljenosti, |
|
— |
prehrano (ime, vrsto, dobavitelja, vsebino in, če so znane, ravni fitoestrogenov), |
|
— |
izvor vode (npr. voda iz pipe ali filtrirana voda) in njena dobava (pretakanje iz velike posode, v steklenicah itd.), |
|
— |
steljo (ime, vrsto, dobavitelja, vsebino), |
|
— |
evidenco o pogojih v kletkah, intervalih osvetlitve, sobni temperaturi in vlažnosti, čiščenju prostora, |
|
— |
podroben opis postopka obdukcije in tehtanja maternice, |
|
— |
opis statističnih podatkov. |
Rezultati:
Za posamezne živali:
|
— |
vse dnevne telesne teže posameznih živali (od dodelitve v skupine do obdukcije) (na 0,1 g natančno), |
|
— |
starost vsake posamezne živali (v dneh, pri čemer je dan skotitve dan 0) ob pričetku dajanja preskusne kemikalije, |
|
— |
datum in čas dajanja vsakega odmerka, |
|
— |
izračunani volumen in dan odmerek ter opažanja glede morebitne izgube odmerka med dajanjem odmerka ali po njem, |
|
— |
dnevno evidenco stanja živali, vključno z zadevnimi simptomi in opažanji, |
|
— |
domnevni vzrok pogina (če je žival med študijo najdena umirajoča ali poginula), |
|
— |
datum in čas humane usmrtitve z navedbo časa, preteklega od zadnjega odmerka, |
|
— |
mokro težo maternice (na 0,1 mg natančno) ter morebitna opažanja glede izgube tekočine iz lumna med seciranjem in pripravo na tehtanje, |
|
— |
osušeno težo maternice (na 0,1 mg natančno). |
Za vsako skupino živali:
|
— |
srednje dnevne telesne teže (na 0,1 g natančno) in standardne odklone (od dodelitve v skupine do obdukcije), |
|
— |
srednje mokre teže maternic in povprečne osušene teže maternic (na 0,1 mg natančno) in standardne odklone, |
|
— |
če je izmerjena, dnevno porabo hrane (izračunano kot grami porabljene hrane na žival), |
|
— |
rezultate statističnih analiz, ki primerjajo mokre in osušene teže maternic tretiranih skupin glede na enake meritve v kontrolnih skupinah z nosilcem, |
|
— |
rezultate statističnih analiz, ki primerjajo skupno telesno težo in pridobljeno težo tretiranih skupin glede na enake meritve v kontrolnih skupinah z nosilcem. |
53. Povzetek pomembnih smernic preskusne metode
|
|
Podgana |
Miš |
|
Živali |
||
|
Sev |
Običajno uporabljeni laboratorijski sevi glodavcev |
|
|
Število živali |
Najmanj 6 živali na skupino odmerka |
|
|
Število skupin |
Najmanj 2 preskusni skupini (za navodila glej odstavek 33) in negativna kontrolna skupina Za navodila glede pozitivnih kontrolnih skupin glej odstavka 26 in 27 |
|
|
Nastanitveni in prehranjevalni pogoji |
||
|
T° v prostoru z živalmi |
22 °C ± 3 °C |
|
|
Relativna vlažnost |
50–60 % in ne manj kot 30 % ali več kot 70 % |
|
|
Dnevno zaporedje osvetlitve |
12 ur svetlobe, 12 ur teme |
|
|
Prehrana in pitna voda |
Ad libitum |
|
|
Nastanitev |
Posamično ali v skupinah po največ tri živali (pri nezrelih živalih se priporoča družabna skupinska nastanitev) |
|
|
Prehrana in stelja |
Za prehrano in steljo priporočena nizka raven fitoestrogenov |
|
|
Protokol |
||
|
Metoda |
Metoda z nezrelo nesterilizirano samico (zaželena) Metoda s sterilizirano odraslo samico |
Metoda s sterilizirano odraslo samico |
|
Starost nezrelih živali ob odmerjanju |
Ne prej kot 18. poporodni dan. Dajanje odmerkov je treba zaključiti pred 25. poporodnim dnem. |
V okviru področja uporabe obstoječe preskusne metode ni relevantna. |
|
Starost ob sterilizaciji |
Med 6. in 8. tednom starosti |
|
|
Starost steriliziranih živali ob odmerjanju |
Od sterilizacije do prvega dne dajanja odmerka bi moralo preteči vsaj 14 dni. |
Od sterilizacije do prvega dne dajanja odmerka bi moralo preteči vsaj 7 dni. |
|
Telesna teža |
Nihanje telesne teže naj bo čim manjše in naj ne preseže ± 20 % srednje teže. |
|
|
Odmerjanje |
||
|
Način dajanja |
Oralno z gavažo ali s podkožnim injiciranjem |
|
|
Pogostost dajanja |
Enkratni dnevni odmerek |
|
|
Prostorninski delež za gavažo in injiciranje |
≤ 5 ml/kg telesne teže (ali do največ 10 ml/kg telesne teže pri vodnih raztopinah) (na dveh mestih injiciranja pri dajanju podkožno) |
|
|
Trajanje odmerjanja |
3 zaporedne dni pri modelu z nezrelo samico Najmanj 3 zaporedne dni pri modelu s sterilizirano odraslo samico |
7 zaporednih dni pri modelu s sterilizirano odraslo samico |
|
Čas obdukcije |
Približno 24 ur po zadnjem odmerku |
|
|
Rezultati |
||
|
Pozitiven odziv |
Statistično značilno povečanje povprečne teže maternice (mokre in/ali osušene) |
|
|
Referenčni estrogen |
17α-etinilestradiol |
|
SMERNICE ZA RAZLAGO IN PRIZNAVANJE REZULTATOV
54. Na splošno se lahko preskus za estrogenost šteje za pozitivnega, če vsaj pri največjem odmerku pride do statistično značilnega povečanja teže maternice (p < 0,05) v primerjavi s kontrolno skupino, pri kateri je uporabljeno le topilo. Pozitiven rezultat je nadalje podprt s prikazom biološko verjetnega razmerja med odmerkom in stopnjo odziva ob upoštevanju, da lahko estrogene in antiestrogene dejavnosti preskusne kemikalije, ki se prekrivajo, vplivajo na obliko krivulje odziva na odmerek.
55. Da bi bila mogoča smiselna razlaga podatkov, je treba paziti, da se ne preseže največji tolerančni odmerek. Zmanjšanje telesne teže, klinične znake in druge ugotovitve je treba temeljito ovrednotiti.
56. Pomemben dejavnik za priznavanje podatkov, zbranih z uterotropnim biološkim preskusom, so teže maternic živali v kontrolni skupini z nosilcem. Visoke kontrolne vrednosti lahko ogrozijo odzivnost biološkega preskusa in zmožnost odkrivanja zelo šibkih agonistov estrogenov. Na podlagi pregleda literature in podatkov, zbranih med validacijo uterotropnega biološkega preskusa, je mogoče ugotoviti, da se visoke povprečne kontrolne vrednosti lahko pojavijo tudi spontano, zlasti pri nezrelih živalih (2) (3) (6) (9). Ker je teža maternice pri nezrelih podganah odvisna od številnih spremenljivk, kot so sev ali telesna teža, zgornje meje za težo maternice ni mogoče določiti. Načeloma velja, da je treba rezultate obravnavati kot sumljive, če so teže osušenih maternic pri nezrelih podganah iz kontrolne skupine med 40 in 45 mg, zaradi tež maternic nad 45 mg pa bo morda treba ponoviti preskus. Vendar je treba takšne primere obravnavati posamično (3) (6) (8). Pri preskušanju na odraslih podganah po nepopolni sterilizaciji ostane prisotno tkivo jajčnikov, ki lahko proizvaja endogeni estrogen in zavira zmanjševanje teže maternice.
57. Da bi bili rezultati sprejemljivi, mora osušena kontrolna teža maternice tehtati manj kot 0,09 % telesne teže pri nezrelih podganah ženskega spola in manj kot 0,04 % pri steriliziranih mladih odraslih samicah (glej tabelo 31 (2)). Če so kontrolne teže maternic večje, je treba proučiti različne dejavnike, tudi starost živali, fitoestrogene v prehrani in druge, negativen rezultat preskusa (ni pokazateljev estrogenega delovanja) pa je treba uporabljati previdno.
58. Pretekli podatki kontrolnih skupin z nosilcem naj bodo shranjeni v laboratoriju. Pretekli podatki za odzive na pozitivne referenčne estrogene, kot je 17α-etinilestradiol, naj bodo prav tako shranjeni v laboratoriju. Laboratoriji lahko preskušajo tudi odziv na znane šibke agoniste estrogenov. Zaradi zagotavljanja, da se z metodami laboratorija pridobi zadostna občutljivost, se lahko vsi ti podatki primerjajo z razpoložljivimi podatki (2) (3) (4) (5) (6) (7) (8).
59. V validacijski študiji OECD se je pri mokrih težah maternic pojavljala večja variabilnost kot pri osušenih težah maternic (6) (7). Vendar pa bi značilen odziv v kateri koli od obeh meritev pomenil, da je preskusna kemikalija pozitivna za estrogeno delovanje.
60. Do uterotropnega odziva ne pride samo zaradi estrogenov, vendar je treba pozitiven rezultat uterotropnega biološkega preskusa na splošno razlagati kot dokaz za estrogeni potencial in vivo in na njegovi podlagi običajno začeti postopke za nadaljnja pojasnila (glej odstavek 9 in temeljni okvir ‚OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals‘, Priloga 2).
Slika 1
Shema s prikazom kirurške odstranitve jajčnikov

Postopek se prične s prerezom dorzolateralne trebušne stene na sredini med zunanjim robom reber in črevničnim grebenom ter nekaj milimetrov lateralno od lateralnega roba ledvene mišice. V trebušni votlini je treba poiskati jajčnike. Jajčnike je nato treba na aseptičnem polju fizično odstraniti iz trebušne votline, za omejitev krvavitve namestiti ligaturo med jajčnik in maternico ter jajčnik odstraniti z rezom pri stiku jajcevoda in obeh rogov maternice. Po potrditvi, da ni prišlo do večje krvavitve, je treba trebušno steno zapreti s šivom, kožo pa speti s sponkami ali zapreti s šivom. Pred uporabo je treba živalim dati vsaj 14 dni, da si opomorejo in da se teža maternice zmanjša.
Slika 2
Odstranitev in priprava materničnih tkiv za merjenje teže
Postopek se začne s prerezom trebušne stene pri sramnični zrasti. Nato je treba oba jajčnika, če sta prisotna, in rog maternice ločiti od dorzalne trebušne stene. Sečni mehur in uretri je treba odstraniti z ventralne in lateralne strani maternice in nožnice. Brazgotinasto zarastlino med rektumom in nožnico je treba ločiti tako, da je viden stik nožničnega ustja in presredka. Maternico in nožnico se od telesa loči s prerezom nožnične stene tik nad stikom s presredkom, kot je prikazano na sliki. Maternico je treba od telesne stene ločiti s previdnim prerezom mezenterija maternice od točke pritrditve po celotni dorzolateralni dolžini vsakega roga maternice. Po odstranitvi iz telesa je treba odstraniti odvečno maščobo in vezno tkivo. Če so jajčniki prisotni, jih je treba ločiti pri jajcevodu in paziti, da ne pride do izgube tekočine iz lumna roga maternice. Če je bila žival sterilizirana, je treba ostanke jajčnikov pregledati zaradi morebitne prisotnosti tkiva jajčnikov. Nožnico je treba od maternice ločiti tik pod materničnim vratom, tako da vrat ostane pritrjen na maternico, kot je prikazano na sliki. Maternica se nato lahko stehta.
Dodatek 1
OPREDELITEV POJMOV:
|
|
Antiestrogenost je zmožnost kemikalije, da v organizmu sesalca zavre delovanje estradiola 17ß. |
|
|
Kemikalija je snov ali zmes. |
|
|
Datum skotitve je poporodni dan 0. |
|
|
Odmerjanje je splošen izraz, ki vključuje odmerek ter pogostost in trajanje dajanja odmerka. |
|
|
Odmerek je količina dane preskusne kemikalije. Pri uterotropnem biološkem preskusu je odmerek izražen kot teža preskusne kemikalije na enoto telesne teže preskusne živali na dan (npr. mg/kg telesne teže/dan). |
|
|
Največji tolerančni odmerek (MTD) je največja količina kemikalije, ki po vstopu v telo ne ubije preskusnih živali (označen z LD0) (IUPAC, 1993). |
|
|
Estrogenost je zmožnost kemikalije, da v organizmu sesalca deluje kot estradiol 17ß. |
|
|
Poporodni dan N je N-ti dan življenja po dnevu skotitve. |
|
|
Občutljivost je delež vseh pozitivnih/aktivnih preskusnih kemikalij, ki se s preskusom pravilno razvrstijo. To je merilo natančnosti za preskusno metodo, s katero se dosežejo kategorični rezultati, in je pomemben dejavnik pri ocenjevanju ustreznosti preskusne metode. |
|
|
Specifičnost je delež vseh negativnih/neaktivnih preskusnih kemikalij, ki se s preskusom pravilno razvrstijo. To je merilo natančnosti za preskusno metodo, s katero se dosežejo kategorični rezultati, in je pomemben dejavnik pri ocenjevanju ustreznosti preskusne metode. |
|
|
Preskusna kemikalija pomeni vsako snov ali zmes, preskušeno s to preskusno metodo. |
|
|
Uterotropni je izraz, ki se uporablja za opis pozitivnega vpliva na rast materničnih tkiv. |
|
|
Validacija je znanstveni postopek, oblikovan za določanje zahtev glede delovanja in omejitev preskusne metode ter za prikaz njene zanesljivosti in ustreznosti za določen namen. |
Dodatek 2

OPOMBE K OKVIRU:
|
Opomba 1: |
Vstop na vseh ravneh in izstop z vseh ravni je mogoč in odvisen od obstoječih potreb po informacijah za namene ocene nevarnosti in tveganja. |
|
Opomba 2: |
Na ravni 5 bi moral ekotoksikološki vidik vključevati končne točke, ki kažejo na mehanizme škodljivih učinkov in morebitno škodo za populacijo. |
|
Opomba 3: |
Če večmodalni model zajema več preskusov ene končne točke, ta model zamenja uporabo teh preskusov ene končne točke. |
|
Opomba 4: |
Kemikalije je treba ocenjevati vsako posebej in pri tem upoštevati razpoložljive informacije ter funkcijo ravni okvira. |
|
Opomba 5: |
V času nastanka tega dokumenta okvir še ni izpopolnjen. Na ravneh 3, 4 in 5 vključuje preskuse, ki so na voljo ali pa še v postopku validacije. Slednji so vključeni začasno. Ko bodo razviti in validirani, bodo uradno dodani v okvir. |
|
Opomba 6: |
Za raven 5 se ne sme šteti, da vključuje samo končne preskuse. Preskusi, vključeni na tej ravni, prispevajo k splošni oceni nevarnosti in tveganja. |
VIRI
|
(1) |
OECD (1998). Report of the First Meeting of the OECD Endocrine Disrupter Testing and Assessment (EDTA) Task Force, 10th–11th March 1998, ENV/MC/CHEM/RA(98)5. |
|
(2) |
OECD (2003). Detailed Background Review of the Uterotrophic Bioassay: Summary of the Available Literature in Support of the Project of the OECD Task Force on Endocrine Disrupters Testing and Assessment (EDTA) to Standardise and Validate the Uterotrophic Bioassay. OECD Environmental Health and Safety Publication Series on Testing and Assessment No. 38. ENV/JM/MONO(2003)1. |
|
(3) |
Owens J.W., Ashby J. (2002). Critical Review and Evaluation of the Uterotrophic Bioassay for the Identification of Possible Estrogen Agonists and Antagonists: In Support of the Validation of the OECD Uterotrophic Protocols for the Laboratory Rodent. Crit. Rev. Toxicol. 32:445–520. |
|
(4) |
OECD (2006). OECD Report of the Initial Work Towards the Validation of the Rodent Uterotrophic Assay – Phase 1. OECD Environmental Health and Safety Publication Series on Testing and Assessment No. 65. ENV/JM/MONO(2006)33. |
|
(5) |
Kanno, J., Onyon L., Haseman J., Fenner-Crisp P., Ashby J., Owens W. (2001). The OECD program to validate the rat uterotrophic bioassay to screen compounds for in vivo estrogenic responses: Phase 1. Environ Health Perspect. 109:785–94. |
|
(6) |
OECD (2006). OECD Report of the Validation of the Rodent Uterotrophic Bioassay: Phase 2 – Testing of Potent and Weak Oestrogen Agonists by Multiple Laboratories. OECD Environmental Health and Safety Publication Series on Testing and Assessment No. 66. ENV/JM/MONO(2006)34. |
|
(7) |
Kanno J., Onyon L., Peddada S., Ashby J., Jacob E., Owens W. (2003). The OECD program to validate the rat uterotrophic bioassay: Phase Two – Dose Response Studies. Environ. Health Persp. 111:1530–1549 |
|
(8) |
Kanno J., Onyon L., Peddada S., Ashby J., Jacob E., Owens W. (2003). The OECD program to validate the rat uterotrophic bioassay: Phase Two – Coded Single Dose Studies. Environ. Health Persp. 111:1550–1558. |
|
(9) |
Owens W., Ashby J., Odum J., Onyon L. (2003). The OECD program to validate the rat uterotrophic bioassay: Phase Two – Dietary phytoestrogen analyses. Environ. Health Persp. 111:1559–1567. |
|
(10) |
Ogasawara Y., Okamoto S., Kitamura Y., Matsumoto K. (1983). Proliferative pattern of uterine cells from birth to adulthood in intact, neonatally castrated, and/or adrenalectomized mice assayed by incorporation of [I125]iododeoxyuridine. Endocrinology 113:582–587. |
|
(11) |
Branham W.S., Sheehan D.M., Zehr D.R., Ridlon E., Nelson C.J. (1985). The postnatal ontogeny of rat uterine glands and age-related effects of 17β-estradiol. Endocrinology 117:2229–2237. |
|
(12) |
Schlumpf M., Berger L., Cotton B., Conscience-Egli M., Durrer S., Fleischmann I., Haller V., Maerkel K., Lichtensteiger W. (2001). Estrogen active UV screens. SÖFW-J. 127:10–15. |
|
(13) |
Zarrow M.X., Lazo-Wasem E.A., Shoger R.L. (1953). Estrogenic activity in a commercial animal ration. Science 118:650–651. |
|
(14) |
Drane H.M., Patterson D.S.P., Roberts B.A., Saba N. (1975). The chance discovery of oestrogenic activity in laboratory rat cake. Fd. Cosmet. Toxicol. 13:425–427. |
|
(15) |
Boettger-Tong H, Murphy L, Chiappetta C, Kirkland JL, Goodwin B, Adlercreutz H, Stancel GM, Makela S. (1998). A case of a laboratory animal feed with high estrogenic activity and its impact on in vivo responses to exogenously administered estrogens. Environ. Health Perspec. 106:369–373. |
|
(16) |
OECD (2007). Additional data supporting the Test Guideline on the Uterotrophic Bioassay in rodents. OECD Environmental Health and Safety Publication Series on Testing and Assessment No. 67. |
|
(17) |
Degen G.H., Janning P., Diel P., Bolt H.M. (2002). Estrogenic isoflavones in rodent diets. Toxicol. Lett. 128:145–157. |
|
(18) |
Wade M.G., Lee A., McMahon A., Cooke G., Curran I. (2003). The influence of dietary isoflavone on the uterotrophic response in juvenile rats. Food Chem. Toxicol. 41:1517–1525. |
|
(19) |
Yamasaki K., Sawaki M., Noda S., Wada T., Hara T., Takatsuki M. (2002). Immature uterotrophic assay of estrogenic compounds in rats given different phytoestrogen content diets and the ovarian changes in the immature rat uterotrophic of estrogenic compounds with ICI 182,780 or antide. Arch. Toxicol. 76:613–620. |
|
(20) |
Thigpen J.E., Haseman J.K., Saunders H.E., Setchell K.D.R., Grant M.F., Forsythe D. (2003). Dietary phytoestrogens accelerate the time of vaginal opening in immature CD-1 mice. Comp. Med. 53:477–485. |
|
(21) |
Ashby J., Tinwell H., Odum J., Kimber I., Brooks A.N., Pate I., Boyle C.C. (2000). Diet and the aetiology of temporal advances in human and rodent sexual development. J. Appl. Toxicol. 20:343–347. |
|
(22) |
Thigpen J.E., Lockear J., Haseman J., Saunders H.E., Caviness G, Grant M.F., Forsythe D.B. (2002). Dietary factors affecting uterine weights of immature CD-1 mice used in uterotrophic bioassays. Cancer Detect. Prev. 26:381–393. |
|
(23) |
Thigpen J.E., Li L.-A., Richter C.B., Lebetkin E.H., Jameson C.W. (1987). The mouse bioassay for the detection of estrogenic activity in rodent diets: I. A standardized method for conducting the mouse bioassay. Lab. Anim. Sci. 37:596–601. |
|
(24) |
OECD (2008). Acute oral toxicity – up-and-down procedure. OECD Guideline for the testing of chemicals No 425. |
|
(25) |
OECD (2000). Guidance document on the recognition, assessment and use of clinical signs as humane endpoints for experimental animals used in safety evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment No 19. ENV/JM/MONO(2000)7. |
|
(26) |
OECD (2001). Guidance document on acute oral toxicity. Environmental Health and Safety Monograph Series on Testing and Assessment No 24. ENV/JM/MONO(2001)4. |
|
(27) |
Bulbring, E., and Burn, J.H. (1935). The estimation of oestrin and of male hormone in oily solution. J. Physiol. 85: 320–333. |
|
(28) |
Dorfman, R.I., Gallagher, T.F. and Koch, F.C (1936). The nature of the estrogenic substance in human male urine and bull testis. Endocrinology 19: 33–41. |
|
(29) |
Reel, J.R., Lamb IV, J.C. and Neal, B.H. (1996). Survey and assessment of mammalian estrogen biological assays for hazard characterization. Fundam. Appl. Toxicol. 34: 288–305. |
|
(30) |
Jones, R.C. and Edgren, R.A. (1973). The effects of various steroid on the vaginal histology in the rat. Fertil. Steril. 24: 284–291. |
|
(31) |
OECD (1982). Organization for Economic Co-operation and Development – Principles of Good Laboratory Practice, ISBN 92-64-12367-9, Paris. |
|
(32) |
Dorfman R.I. (1962). Methods in Hormone Research, Vol. II, Part IV: Standard Methods Adopted by Official Organization. New York, Academic Press. |
|
(33) |
Thigpen J. E. et al. (2004). Selecting the appropriate rodent diet for endocrine disruptor research and testing studies. ILAR J 45(4): 401–416. |
|
(34) |
Gray L.E. and Ostby J. (1998). Effects of pesticides and toxic substances on behavioral and morphological reproductive development: endocrine versus non-endocrine mechanism. Toxicol Ind Health. 14 (1–2): 159–184. |
|
(35) |
Booth A.N., Bickoff E.M. and Kohler G.O. (1960). Estrogen-like activity in vegetable oils and mill by-products. Science 131:1807–1808. |
|
(36) |
Kato H, Iwata T, Katsu Y, Watanabe H, Ohta Y, Iguchi T (2004). Evaluation of estrogenic activity in diets for experimental animals using in vitro assay. J. Agric Food Chem. 52, 1410–1414. |
|
(37) |
OECD (2007). Guidance Document on the Uterotrophic Bioassay Procedure to Test for Antioestrogenicity. Series on Testing and Assessment. No. 71. |
|
(38) |
Direktiva 2010/63/EU Evropskega parlamenta in Sveta z dne 22. septembra 2010 o zaščiti živali, ki se uporabljajo v znanstvene namene (UL L 276, 20.10.2010, str. 33). |
B.55 HERSHBERGERJEV BIOLOŠKI PRESKUS NA PODGANAH: KRATKOTRAJNI PRESEJALNI PRESKUS ZA (ANTI)ANDROGENE LASTNOSTI
UVOD
1. Ta preskusna metoda ustreza Smernici za preskušanje OECD št. 441 (2009). OECD je leta 1998 začela z izvajanjem prednostne dejavnosti, da bi pregledala obstoječe in razvila nove smernice za odkrivanje in preskušanje potencialnih povzročiteljev endokrinih motenj (1). Ta dejavnost je med drugim zajemala razvoj smernic za preskušanje za Hershbergerjev biološki preskus na podganah. Farmacevtska industrija je ta preskus uporabljala več desetletij, prvič pa ga je leta 1962 standardiziral uradni strokovni odbor kot presejalni preskus za androgene kemikalije (2). V obdobju 2001–2007 je bil za Hershbergerjev biološki preskus na podganah opravljen obsežen program validacije, med drugim priprava dokumenta o pregledu ozadja metode (23) in dokumenta z zbirko podrobnih metod (3), razvoj priročnika za seciranje (21) in izvajanje obsežnih študij znotraj laboratorija in med laboratoriji, da bi dokazali zanesljivost in ponovljivost biološkega preskusa. V teh validacijskih študijah so bili uporabljeni močan referenčni androgen (testosteron propionat (TP)), dva močna sintetična androgena (trenbolon acetat in metil testosteron), močan antiandrogen farmacevtski proizvod (flutamid), močan zaviralec sinteze (finasterid) naravnega androgena (dihidrotestosteron – DHT), več šibko antiandrogenih pesticidov (linuron, vinklozolin, procimidon, p,p' DDE), močan zaviralec 5α-reduktaze (finasterid) in dve znani negativni kemikaliji (dinitrofenol in nonilfenol) (4) (5) (6) (7) (8). Ta preskusna metoda je bila razvita na podlagi dolgoletnih izkušenj z biološkim preskusom ter izkušenj, pridobljenih med validacijo programa preskusa in dobljenih rezultatov.
2. Hershbergerjev biološki preskus je kratkotrajna presejalna študija in vivo, pri kateri se uporabljajo pomožna tkiva moškega reproduktivnega trakta. Izvajanje preskusa se je začelo v 30. letih prejšnjega stoletja, v 40. letih prejšnjega stoletja pa so bile vanj vključene tudi mišice v moškem reproduktivnem traktu, ki so odzivne na androgene (2) (9–15). V 60. letih prejšnjega stoletja je bilo s standardizirano različico protokola (2) (14) ocenjenih več kot 700 možnih androgenov in v tem obdobju je uporaba preskusa za androgene in antiandrogene veljala za standardno metodo (2) (15). Ta biološki preskus temelji na spremembi teže petih od androgenov odvisnih tkiv pri kastrirani podgani moškega spola v obdobju okrog pubertete. Ocenjuje sposobnost kemikalije, da sproži biološko delovanje, ki je tipično povezano z agonisti ali antagonisti androgenov oziroma zaviralci 5α-reduktaze. Pet od androgenov odvisnih tarčnih tkiv, ki so vključena v to preskusno metodo, je: ventralna prostata (VP), semenski mešiček (SM) (skupaj s tekočinami in koagulacijskimi žlezami), mišica levator ani z bulbokavernozno mišico (LABC), Cowperjevi žlezi (COW) in glavica penisa (GP). Pri kastrirani podgani moškega spola v obdobju okrog pubertete se teh pet tkiv na androgene odzove s povečanjem absolutne teže. Ko so ta tkiva stimulirana k povečanju teže z dajanjem močnega referenčnega androgena, se vseh pet tkiv na antiandrogene odzove z zmanjšanjem absolutne teže. Primarni model za Hershbergerjev biološki preskus je kirurško kastriran samec v obdobju okrog pubertete, kar je bilo validirano v fazi 1, 2 in 3 programa validacije Hershbergerjevega preskusa.
3. Hershbergerjev biološki preskus služi kot mehanistična presejalna študija in vivo za agoniste androgenov, antagoniste androgenov in zaviralce 5α-reduktaze, njegovo uporabo pa je treba obravnavati v okviru temeljnega okvira OECD za preskušanje in oceno povzročiteljev endokrinih motenj, 'OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals' (Dodatek 2). V tem temeljnem okviru je Hershbergerjev biološki preskus na ravni 3 kot preskus in vivo, ki zagotavlja podatke o enem samem endokrinem mehanizmu, tj. (anti)androgenosti. Vključen naj bi bil v sistem preskusov in vitro in in vivo, s katerimi bi opredelili kemikalije, ki bi lahko vplivale na endokrini sistem, na podlagi tega pa bi bile opravljene ocene nevarnosti in tveganja za zdravje ljudi in okolje.
4. Zaradi prizadevanj za dobrobit živali v zvezi s postopkom kastracije je bil kot alternativni model za Hershbergerjev biološki preskus uporabljen nekastriran stimuliran odstavljen samec, da bi se izognili kastraciji. Preskusna metoda s stimuliranim odstavljenim mladičem je bila validirana (24), v validacijskih študijah pa Hershbergerjev biološki test z odstavljenim mladičem pri preskušenih odmerkih ni dosledno odkrival učinkov šibkih antiandrogenov na težo organov, odvisnih od androgenov. Zato v to preskusno metodo ni bil vključen. Ker pa lahko uporaba te metode pripomore k dobrobiti živali in zagotovi informacije o drugih načinih delovanja, je vključena v Smernico OECD št. 115 (25).
ZAČETNI PREUDARKI IN OMEJITVE
5. Agonisti in antagonisti androgenov delujejo kot ligandi androgenskega receptorja in lahko aktivirajo oziroma zavirajo gensko prepisovanje, ki ga receptor nadzira. Poleg tega nekatere kemikalije zavirajo pretvorbo testosterona v močnejši naravni androgen dihidrotestosteron v nekaterih tarčnih tkivih androgenov (zaviralci 5α-reduktaze). Zaradi takšnih kemikalij bi lahko prišlo do škodljivih učinkov za zdravje, vključno z učinki na razmnoževanje in razvoj. Zato obstaja regulativna potreba po hitri oceni in vrednotenju kemikalije kot možnega agonista ali antagonista androgenov ali zaviralca 5α-reduktaze. Afiniteta liganda do androgenskega receptorja, ki jo izmeri vezavni receptor ali aktivacije prepisovanja markerskih genov in vitro, ni edini kazalnik morebitne nevarnosti. Drugi kazalniki vključujejo aktivacijo presnove in njeno deaktivacijo po vstopu v telo, razporeditev kemikalij v tarčna tkiva in odstranitev iz telesa. Zato je treba morebitno dejavnost kemikalije pregledati in vivo pod ustreznimi pogoji in izpostavljenostjo. Vrednotenje in vivo je manj kritično, če so znane lastnosti kemikalije glede absorpcije, porazdelitve, presnove in izločanja. Od androgenov odvisna tkiva se na stimulacijo z androgeni odzovejo s hitro in bujno rastjo, zlasti pri kastriranih podganah moškega spola v obdobju okrog pubertete. Glodavci, zlasti podgane, se pogosto uporabljajo tudi v študijah strupenosti za opredelitev nevarnosti. Zato je različica preskusa s kastrirano podgano moškega spola v obdobju okrog pubertete, pri kateri se uporabi pet tarčnih tkiv, primerna za iskanje agonistov androgenov, antagonistov androgenov in zaviralcev 5α-reduktaze in vivo.
6. Ta preskusna metoda temelji na protokolih iz validacijske študije OECD, ki so se izkazali za zanesljive in ponovljive v študijah znotraj laboratorija in med laboratoriji (4) (5) (6) (7) (8). V tej preskusni metodi sta predstavljena postopka z androgenom in antiandrogenom.
7. Čeprav je bilo nekaj razlik v odmerku testosteron propionata, ki so ga različni laboratoriji v programu OECD za validacijo Hershbergerjevega biološkega preskusa uporabili za odkrivanje antiandrogenov (0,2 proti 0,4 mg/kg/d, podkožno injiciranje), med tema dvema različicama protokola ni bilo velike razlike glede zmožnosti zaznavanja šibkega ali močnega antiandrogenega delovanja. Jasno je, da odmerek testosteron propionata ne sme biti tako velik, da bi blokiral učinke šibkih antagonistov androgenskega receptorja (AR) ali tako majhen, da bi se androgena tkiva odzvala z majhno rastjo tudi brez sočasne uporabe antiandrogena.
8. Posamezna od androgenov odvisna tkiva ne rastejo samo zaradi androgenov, tj. na težo nekaterih tkiv lahko vplivajo tudi druge kemikalije, ne samo agonisti androgenov. Vendar rast več tkiv hkrati dokazuje mehanizem, bolj značilen za androgene. Veliki odmerki močnih estrogenov lahko na primer vplivajo na povečanje teže semenskih mešičkov, druga od androgenov odvisna tkiva v preskusu pa se ne odzovejo na podoben način. Antiandrogene kemikalije lahko delujejo kot antagonisti androgenskega receptorja ali zaviralci 5α-reduktaze. Zaviralci 5α-reduktaze imajo različne učinke, ker je pretvorba v močnejši dihidrotestosteron različna od tkiva do tkiva. Antiandrogeni, ki zavirajo 5α-reduktazo, na primer finasterid, imajo v primerjavi z močnim antagonistom AR, kot je flutamid, izrazitejše učinke na ventralno prostato kot na druga tkiva. Ta razlika med odzivi tkiv se lahko uporabi za razlikovanje med načinom delovanja, pogojenim z androgenskim receptorjem, in načinom delovanja, pogojenim s 5α-reduktazo. Poleg tega je androgenski receptor evolucijsko povezan z receptorjem za druge steroidne hormone, nekateri drugi hormoni pa lahko pri velikih, suprafizioloških odmerkih vežejo in zavirajo učinke testosteron propionata, ki pospešujejo rast (13). Verjetno je tudi, da bi lahko povečana presnova steroidov in posledično znižanje serumskega testosterona vplivalo na manjšo rast od androgenov odvisnih tkiv. Zato je treba pozitiven rezultat Hershbergerjevega biološkega preskusa običajno oceniti na podlagi analize, ki temelji na pristopu tehtnosti dokazov, vključno s preskusi in vitro, kot so preskusi vezave na androgenske in estrogenske receptorje (AR in ER) ter ustreznimi preskusi aktivacije prepisovanja, ali na podlagi drugih preskusov in vivo, ki proučujejo podobna tarčna tkiva androgenov, kot so preskus na samcu v puberteti, 15-dnevni preskus na nekastriranem odraslem samcu ali 28-dnevne oziroma 90-dnevne študije s ponavljajočimi se odmerki.
9. Izkušnje kažejo, da so ksenobiotični antiandrogeni pogostejši od ksenobiotičnih androgenov. Zato se pričakuje, da se bo Hershbergerjev biološki preskus najpogosteje uporabljal za odkrivanje antiandrogenov. Postopek preskušanja za androgene pa bi bilo mogoče priporočiti za steroidne ali steroidom podobne kemikalije oziroma kemikalije, pri katerih pokazatelj morebitnih androgenih učinkov izhaja iz metod na ravni 1 ali 2 temeljnega okvira (Dodatek 2). Podobno lahko pri preskusih na ravni 5 opazimo prisotnost škodljivih učinkov, povezanih z (anti)androgenimi profili, zaradi česar je treba oceniti, ali kemikalija deluje z endokrinim načinom delovanja.
10. Priznava se, da morajo biti vsi postopki, pri katerih se uporabljajo živali, v skladu z lokalnimi standardi za varstvo živali; opisi oskrbe in ravnanja z živalmi v nadaljevanju so minimalni standardi, nadomestili pa jih bodo lokalni predpisi, kot je Direktiva 2010/63/EU Evropskega parlamenta in Sveta z dne 22. septembra 2010 o zaščiti živali, ki se uporabljajo v znanstvene namene (26). Nadaljnje smernice o humanem ravnanju z živalmi je predložila OECD (17).
11. Kot pri vsakem biološkem preskusu, pri katerem se uporabljajo preskusne živali, je treba skrbno pretehtati nujnost izvedbe te študije. Razloga za takšno odločitev sta lahko dva:
|
— |
visok potencial za izpostavljenost (raven 1 temeljnega okvira) ali pokazatelji (anti)androgenosti v preskusih in vitro (raven 2), ki utemeljujejo preiskave glede tega, ali se lahko takšni učinki pojavijo in vivo, |
|
— |
učinki, tipično povezani z (anti)androgenostjo v preskusih in vivo na ravni 4 ali 5, ki utemeljujejo preiskave določenega načina delovanja, npr. za ugotavljanje, ali so se učinki pojavili zaradi (anti)androgenega mehanizma. |
12. Opredelitve, uporabljene v tej preskusni metodi, so navedene v Dodatku 1.
NAČELO PRESKUSA
13. Hershbergerjev biološki preskus svojo občutljivost doseže z uporabo samcev z minimalno endogeno tvorbo androgenov. Uporabijo se kastrirani samci, če je po kastraciji dovoljenega dovolj časa, da se tarčna tkiva zmanjšajo na minimalno in enotno osnovno težo. Pri odkrivanju morebitne androgene dejavnosti so zato prisotne nizke endogene koncentracije cirkulirajočih androgenov, os hipotalamus – hipofiza – spolne žleze tega učinka ne more izravnati prek povratnih mehanizmov, zmožnost odziva tkiva se poveča na največjo možno raven, začetna variabilnost teže tkiva pa se zmanjša na kar najnižjo raven. Pri odkrivanju morebitne antiandrogene dejavnosti je enakomernejše pridobivanje teže tkiva mogoče s stimulacijo tkiv z referenčnim androgenom. Zato je za izvajanje Hershbergerjevega biološkega preskusa potrebnih samo 6 živali na vsako skupino odmerka, pri drugih preskusih z nekastriranimi samci v puberteti ali odraslimi samci pa se priporoča uporaba 15 samcev na vsako skupino odmerka.
14. Kastracijo podgan moškega spola v obdobju okrog pubertete je treba opraviti na primeren način z uporabo odobrenih anestetikov in aseptično tehniko. Prvih nekaj dni po operaciji je treba dajati analgetike, da bi odpravili nelagodje po operaciji. Kastracija poveča natančnost preskusa pri odkrivanju šibkih androgenov in antiandrogenov, saj odstrani kompenzacijske endokrine povratne mehanizme, ki so prisotni pri nekastrirani živali in lahko oslabijo učinke danih androgenov in antiandrogenov, pa tudi veliko variabilnost koncentracij serumskega testosterona med osebki. Zato je zaradi kastracije potrebno manjše število živali za iskanje teh endokrinih dejavnosti.
15. Pri odkrivanju morebitne androgene dejavnosti se preskusna kemikalija 10 zaporednih dni dnevno daje oralno z gavažo ali s podkožno injekcijo. Preskusne kemikalije se dajejo vsaj dvema tretiranima skupinama preskusnih živali, pri čemer se za vsako skupino uporabi ena velikost odmerka. Približno 24 ur po prejetju zadnjega odmerka se na živalih opravi obdukcija. Če se je v primerjavi s kontrolno skupino z nosilcem teža dveh ali več tarčnih organov živali v skupinah, ki so prejele preskusno kemikalijo, statistično značilno povečala, to pomeni, da je preskusna kemikalija pozitivna na morebitno androgeno dejavnost (glej odstavek 60). Androgeni, kot je trenbolon, ki jih ni mogoče 5α-reducirati, imajo izrazitejše učinke na LABC in GP kot testosteron propionat, vendar bi se morala povečati teža vseh tkiv.
16. Pri odkrivanju morebitne antiandrogene dejavnosti se preskusna kemikalija 10 zaporednih dni dnevno daje oralno z gavažo ali s podkožno injekcijo skupaj z dnevnimi odmerki testosteron propionata (0,2 ali 0,4 mg/kg/d) s podkožno injekcijo. V programu validacije je bilo ugotovljeno, da se lahko uporabi 0,2 ali 0,4 mg/kg/d testosteron propionata, saj sta oba odmerka učinkovita pri zaznavanju antiandrogenov, zato je treba za uporabo v preskusu izbrati le enega od odmerkov. Stopnjevani odmerki preskusne kemikalije se dajejo vsaj trem tretiranim skupinam preskusnih živali, pri čemer se za vsako skupino uporabi ena velikost odmerka. Približno 24 ur po prejetju zadnjega odmerka se na živalih opravi obdukcija. Če se je v primerjavi s kontrolno skupino, ki je prejela samo testosteron propionat, teža dveh ali več tarčnih organov živali v skupinah, ki so prejele preskusno kemikalijo in testosteron propionat, statistično značilno zmanjšala, to pomeni, da je preskusna kemikalija pozitivna na morebitno antiandrogeno dejavnost (glej odstavek 61).
OPIS METODE
Izbira vrste in seva
17. V Hershbergerjevem biološkem preskusu se od 30. let prejšnjega stoletja običajno uporabljajo podgane. Čeprav je biološko možno, da bi bil odziv pri podganah in miših podoben, so na podlagi 70-letnih izkušenj s podganami za Hershbergerjev biološki preskus primernejše podgane. Če bo po Hershbergerjevem biološkem preskusu morda izvedena dolgotrajna večgeneracijska študija, bo tako mogoče v obeh študijah uporabiti živali iste vrste, seva in izvora.
18. Ta protokol laboratorijem omogoča, da izberejo sev podgane za uporabo v preskusu; na splošno naj bi bil isti, kot ga je sodelujoči laboratorij že uporabljal. Lahko se uporabijo običajno uporabljeni laboratorijski sevi podgan; ne sme se uporabiti sevov, ki dozorijo precej pozneje kot pri starosti 42 dni, ker zaradi kastracije teh samcev pri starosti 42 dni morda ne bi bilo mogoče merjenje teže glavice penisa, kar se lahko opravi šele, ko se kožica loči od spolnega uda. Zato se sevi podgan Fisher 344 ne bi smeli uporabiti, razen izjemoma. Spolni razvoj seva podgan Fisher 344 poteka drugače kot pri drugih, običajno uporabljenih sevih, kot sta seva Sprague Dawley ali Wistar (16). Če bi bil uporabljen takšen sev, bi moral laboratorij podgane kastrirati, ko bi bile malo starejše, in dokazati občutljivost uporabljenega seva. Laboratorij mora jasno utemeljiti izbiro seva podgan. Če bo po presejalni študiji izvedena študija s ponavljajočim se odmerkom po oralni poti, študija razmnoževanja in razvoja ali dolgoročna študija, je najbolje, da se v vseh študijah uporabijo živali istega seva in istega izvora.
Nastanitveni in prehranjevalni pogoji
19. Vsi postopki morajo biti skladni z vsemi lokalnimi standardi za varstvo živali v laboratorijih. Ti opisi oskrbe in ravnanja z živalmi so minimalni standardi, ki jih bodo nadomestili strožji lokalni predpisi, kot je Direktiva 2010/63/EU Evropskega parlamenta in Sveta z dne 22. septembra 2010 o zaščiti živali, ki se uporabljajo v znanstvene namene (26). Temperatura v prostoru s preskusnimi živalmi naj bo 22 °C (z odstopanjem približno ± 3 °C). Relativna vlažnost naj bo najmanj 30 % in po možnosti naj ne presega 70 %, razen med čiščenjem prostora. Cilj je 50–60-odstotna relativna vlažnost. Osvetlitev naj bo umetna. Dnevno zaporedje osvetlitve naj bo 12 ur svetlobe, 12 ur teme.
20. Ker so živali mlade in so podgane družabne živali, je zaželeno, da so nastanjene skupinsko in ne posamično. Z nastanitvijo dveh ali treh živali v vsako kletko živali ne bodo prenatrpane in pod s tem povezanim stresom, ki bi lahko vplival na hormonsko uravnavanje razvoja tkiv pomožnih spolnih organov. Kletke je treba temeljito očistiti, da se odstranijo morebitni kontaminanti, in jih razporediti tako, da so možni učinki zaradi njihovega položaja čim manjši. Kletke primerne velikosti (~ 2 000 kvadratnih centimetrov) bodo preprečile prenatrpanost.
21. Živali je treba s humano metodo edinstveno označiti (npr. z ušesno znamko ali oznako). Metodo identifikacije je treba zabeležiti.
22. Laboratorijsko prehrano in pitno vodo je treba priskrbeti ad libitum. Laboratoriji, ki izvajajo Hershbergerjev biološki preskus, bi morali uporabljati laboratorijsko prehrano, ki jo običajno uporabljajo pri preskušanju kemikalij. V validacijski študiji biološkega preskusa niso bili opaženi nobeni učinki ali variabilnost, ki bi jih lahko pripisali prehrani. Prehrano, ki se uporablja, je treba zabeležiti, vzorec laboratorijske prehrane pa shraniti za morebitno prihodnjo analizo.
Merila uspešnosti za težo od androgenov odvisnih organov
23. Med validacijsko študijo ni bilo nobenih dokazov, da zmanjšanje telesne teže vpliva na povečanje ali zmanjšanje teže tkiva pri tarčnih tkivih (tj. tistih, ki jih je treba v tej študiji stehtati).
24. Med različnimi sevi podgan, uspešno uporabljenimi v programu validacije, je teža od androgenov odvisnih organov večja pri težjih sevih podgan kot pri lažjih sevih. Zato merila uspešnosti Hershbergerjevega biološkega preskusa ne vključujejo absolutne pričakovane teže organov za pozitivne in negativne kontrolne vzorce.
25. Ker je koeficient variacije za tkivo obratno sorazmeren s statistično značilnostjo, merila uspešnosti za Hershbergerjev biološki preskus temeljijo na najvišjih vrednostih koeficienta variacije za vsako tkivo (tabela 1). Koeficienti variacije se izpeljejo iz validacijskih študij OECD. Če so rezultati negativni, morajo laboratoriji preveriti koeficiente variacije iz kontrolne skupine in skupine, tretirane z velikim odmerkom, da bi ugotovili, ali so bila presežena merila uspešnosti za največji koeficient variacije.
26. Študijo je treba ponoviti, ko: 1) trije ali več od desetih možnih posameznih koeficientov variacije v kontrolni skupini in skupini, tretirani z velikim odmerkom, presežejo najvišje vrednosti, ki so za študije agonistov in antagonistov določene v tabeli 1, in 2) sta bili vsaj dve tarčni tkivi mejno zanemarljivi, tj. so bile vrednosti ρ med 0,05 in 0,10.
Tabela 1
Najvišji dovoljeni koeficienti variacij, določeni za tarčna tkiva pomožnih spolnih organov za kastriran model v validacijski študiji OECD (12)
|
Tkivo |
Antiandrogeni učinki |
Androgeni učinki |
|
Semenska mešička |
40 % |
40 % |
|
Ventralna prostata |
40 % |
45 % |
|
LABC |
20 % |
30 % |
|
Cowperjevi žlezi |
35 % |
55 % |
|
Glavica penisa |
17 % |
22 % |
POSTOPEK
Skladnost z zakonodajo in verifikacija laboratorija
27. V nasprotju z uterotropnim preskusom (poglavje B.54 te priloge) dokazovanje usposobljenosti laboratorija pred začetkom študije pri Hershbergerjevem biološkem preskusu ni potrebno, ker so pri tem preskusu hkratni pozitivni (testosteron propionat in flutamid) in negativni kontrolni vzorci sestavni del preskusa.
Število in stanje živali
28. Vsaka tretirana in kontrolna skupina mora vključevati vsaj 6 živali. To velja tako za androgeni kot tudi za antiandrogeni protokol.
Kastracija
29. Več dni po prejemu živali naj bi potekalo začetno obdobje prilagajanja, s čemer se zagotovi, da so živali zdrave in se razvijajo. Ker pri živalih, ki so bile kastrirane pred 42. dnem starosti ali 42. poporodnim dnem, morda ne bo prišlo do ločevanja prepucija, bi morale biti živali kastrirane na 42. poporodni dan ali pozneje, ne pa prej. Živali se kastrirajo pod anestezijo tako, da se zareže v modnik in odstranijo obe modi ter obmodki z ligacijo žil in semenovoda. Po potrditvi, da ni nobene krvavitve, je treba modnik zapreti s šivom ali sponkami. V prvih nekaj dneh po operaciji naj bi živali prejemale analgetike, da bi ublažili nelagodje po operaciji. Če se pri dobavitelju nabavijo kastrirane živali, mora dobavitelj zagotoviti starost živali in stopnjo spolne zrelosti.
Prilagajanje po kastraciji
30. Prilagajanje živali na laboratorijske pogoje mora potekati še vsaj 7 dni po kastraciji, da se zmanjša teža tarčnih tkiv. Živali je treba opazovati dnevno, vsako žival, ki kaže znake bolezni ali telesne anomalije, pa je treba odstraniti. Tretiranje z začetkom dajanja odmerkov (v študiji) se lahko prične že 49. poporodni dan, vendar ne pozneje kot 60. poporodni dan. Starost ob obdukciji ne bi smela preseči 70. poporodnega dneva. Ta prožnost laboratoriju omogoča, da učinkovito sestavi razpored preskusov.
Telesna teža in randomizacija skupine
31. Zaradi različne telesne teže posameznih živali se znotraj skupine in med skupinami živali teža organov razlikuje. S povečanjem variabilnosti teže tkiv se poveča koeficient variacij in zmanjša statistična vrednost preskusa (včasih imenovana tudi občutljivost preskusa). Zato je treba nihanja telesne teže eksperimentalno in statistično uravnavati.
32. V eksperimentalno uravnavanje sodi zagotavljanje majhnih nihanj v telesni teži znotraj skupin študije in med njimi. Treba se je izogniti uporabi nenavadno majhnih ali velikih živali ter se jih ne sme uvrstiti v kohorto študije. Na začetku študije naj nihanje teže uporabljenih živali ne preseže ± 20 % srednje teže (npr. 175 g ± 35 g za kastrirane podgane v obdobju okrog pubertete). Živali je treba dodeliti v skupine (kontrolne in tretirane) v naključnem razponu teže, tako da se povprečna telesna teža vsake skupine statistično ne razlikuje od drugih skupin. Uporabljeni postopek randomizacije sklopov je treba zabeležiti.
33. Ker lahko strupenost zmanjša telesno težo tretiranih skupin v primerjavi s telesno težo kontrolne skupine, se lahko kot sočasna spremenljivka uporabi telesna teža na prvi dan prejemanja kemikalije in ne telesna teža ob obdukciji.
Odmerjanje
34. Da bi ugotovili, ali lahko preskusna kemikalija in vivo deluje androgeno, običajno zadoščajo dve skupini odmerkov preskusne kemikalije ter pozitivna kontrolna skupina in skupina z nosilcem (negativna kontrolna skupina) (glej odstavek 43), zato je takšen način preskušanja zaželen zaradi dobrobiti živali. Če je cilj pridobiti krivuljo odziva na odmerek ali ekstrapolacija na manjše odmerke, so potrebne vsaj 3 skupine odmerkov. Če ni potrebna samo opredelitev androgenega delovanja, ampak so potrebne tudi druge informacije (na primer ocena moči delovanja), je treba razmisliti o drugačnem režimu odmerjanja. Za preskušanje za antiandrogene se preskusna kemikalija daje skupaj z referenčnim agonistom androgenov. Uporabijo se vsaj 3 preskusne skupine z različnimi odmerki preskusne kemikalije ter pozitivna in negativna kontrolna skupina (glej odstavek 44). Razen tretiranja s preskusno kemikalijo je treba živali v kontrolni skupini obravnavati enako kot živali v preskusni skupini. Če je pri dajanju preskusne kemikalije uporabljen nosilec, mora kontrolna skupina prejeti količino nosilca, enako največji uporabljeni količini pri preskusnih skupinah.
35. Pri predlaganju in izbiri velikosti vseh odmerkov je treba upoštevati vse obstoječe podatke o strupenosti in (toksiko-)kinetiki, ki so na razpolago za preskusno kemikalijo ali sorodne snovi. Pri največjem odmerku je treba najprej upoštevati informacije o LD50 in/ali akutni strupenosti, da bi se izognili smrti, hudemu trpljenju ali stiski živali (17) (18) (19) (20), pa tudi informacije, ki so na voljo o odmerkih, uporabljenih v študijah kroničnosti in subkroničnosti. Na splošno se zaradi največjega odmerka končna telesna teža živali ne sme zmanjšati za več kot 10 % kontrolne teže. Največji odmerek je lahko 1) največji odmerek, ki zagotavlja preživetje živali in za živali ni preveč strupen oziroma jim ne povzroča velike stiske po 10 zaporednih dneh dajanja odmerka do največjega odmerka 1 000 mg/kg/dan (glej odstavek 36), ali 2) odmerek, ki povzroči (anti)androgene učinke, pri čemer se izbere manjši izmed njiju. Kot sito so sprejemljivi veliki intervali med odmerki, npr. polovica logaritemske enote (kar ustreza večanju odmerka za faktor 3,2) ali celo ena logaritemska enota. Če ustrezni podatki niso na voljo, se lahko opravi študija ugotavljanja območja (glej odstavek 37), s pomočjo katere se določijo odmerki za uporabo.
Mejna velikost odmerka
36. Če preskus, izveden v skladu z opisanimi postopki za to študijo in pri mejnem odmerku 1 000 mg/kg telesne teže/dan in manjšim odmerkom, ne doseže statistično značilne spremembe v teži razmnoževalnih organov, se dodatne velikosti odmerkov morda ne štejejo za potrebne. Mejni odmerek se ne uporabi samo, če podatki o izpostavljenosti pri ljudeh kažejo na potrebo po uporabi večjega odmerka.
Preudarki glede ugotavljanja območja
37. Po potrebi se lahko z nekaj živalmi izvede predhodna študija za ugotavljanje območja za izbiro primernih skupin odmerkov (z uporabo metod za preskušanje akutne strupenosti (poglavji B.1 bis in B.1 tris te priloge (27), Smernica za preskušanje OECD št. 425 (19))). Cilj pri Hershbergerjevem biološkem preskusu je izbrati odmerke, ki zagotavljajo preživetje živali in zanje niso preveč strupeni oziroma jim ne povzročajo prevelike stiske po desetih zaporednih dneh dajanja kemikalije do mejnega odmerka 1 000 mg/kg/dan, kot je navedeno v odstavkih 35 in 36. S tem v zvezi se lahko uporabijo smernice OECD (17), v katerih so opredeljeni klinični znaki, ki kažejo na strupenost za živali ali njihovo stisko. Če je to v okviru te študije za ugotavljanje območja po desetih dneh dajanja odmerkov izvedljivo, se lahko tarčna tkiva izreže in stehta približno 24 ur po zadnjem danem odmerku. Ti podatki se nato lahko uporabijo kot pomoč pri izbiri odmerkov v glavni študiji.
Referenčne kemikalije in nosilec
38. Referenčni agonist androgenov naj bi bil testosteron propionat (TP), št. CAS 57-82-5. Referenčni odmerek TP je lahko 0,2 mg/kg telesne teže/dan ali 0,4 mg/kg telesne teže/dan. Referenčni antagonist androgenov naj bi bil flutamid (FT), št. CAS 1311-84-7. Referenčni odmerek FT naj bi bil 3 mg/kg telesne teže/dan, FT pa je treba dati skupaj z referenčnim odmerkom TP.
39. Priporoča se, da se, kadar koli je to mogoče, najprej prouči uporaba vodne raztopine/suspenzije. Ker so številni ligandi androgenov ali njihovi metabolični prekurzorji hidrofobni, se običajno uporablja raztopina/suspenzija v olju (npr. koruznem, arašidovem, sezamovem ali oljčnem olju). Preskusne kemikalije se lahko raztopijo v najmanjši količini 95-odstotnega etanola ali drugega primernega topila, na končno delovno koncentracijo pa razredčijo v preskusnem nosilcu. Strupene lastnosti topila bi morale biti znane in preskušene v ločeni kontrolni skupini, pri kateri je uporabljeno samo topilo. Če je preskusna kemikalija stabilna, se lahko raztapljanje preskusne kemikalije pospeši s previdnim segrevanjem in močnim mehanskim delovanjem. Določiti je treba stabilnost preskusne kemikalije v nosilcu. Če je preskusna kemikalija ves čas trajanja študije stabilna, se lahko pripravi samo začetni alikvot preskusne kemikalije, nato pa se dnevno pripravljajo določene razredčine odmerkov, pri čemer je treba paziti, da ne pride do kontaminacije in kvarjenja vzorcev.
Dajanje odmerkov
40. TP je treba dati s podkožnim injiciranjem, FT pa oralno z gavažo.
41. Preskusno kemikalijo se daje oralno z gavažo ali s podkožnim injiciranjem. Pri izbiri načina dajanja je treba upoštevati vprašanja, povezana z dobrobitjo živali in fizikalne/kemijske lastnosti preskusne kemikalije. Poleg tega je treba upoštevati toksikološke vidike, kot je način izpostavljenosti kemikaliji pri ljudeh (npr. na podlagi dajanja oralno z gavažo se modelira izpostavljenost prek zaužitja, na podlagi podkožnega injiciranja se modelira izpostavljenost prek vdihavanja ali adsorpcije skozi kožo) in obstoječe toksikološke podatke ter o presnovi in kinetiki (npr. potreba po izogibanju presnovi prvega prehoda, boljša učinkovitost določenega načina izpostavljenosti) pred začetkom obsežnega, dolgotrajnega preskušanja, če se pozitivni rezultati dobijo z injiciranjem.
42. Živali naj bi odmerek prejemale na enak način in v enakem časovnem zaporedju deset zaporednih dni v približno 24-urnih intervalih. Velikost odmerka je treba dnevno prilagajati glede na hkratno dnevno merjenje telesne teže. Količina odmerka in čas vnosa naj se zabeležita vsak dan izpostavljenosti. Da bi bila mogoča smiselna razlaga podatkov, je treba paziti, da se ne preseže največji odmerek iz odstavka 35. Zmanjšanje telesne teže, klinične znake in druge ugotovitve je treba temeljito ovrednotiti. Pri dajanju oralno z gavažo se uporabi želodčna sonda ali primerna intubacijska kanila. Največja količina tekočine, ki se jo lahko da naenkrat, je odvisna od velikosti preskusne živali. Upoštevati je treba lokalne standarde za varstvo živali, količina pa ne sme preseči 5 ml/kg telesne teže, razen pri vodnih raztopinah, pri katerih se lahko uporabi 10 ml/kg telesne teže. Pri podkožnem injiciranju se odmerki dajejo na dorzoskapularnem in/ali ledvenem delu s sterilno iglo (npr. velikosti 23 ali 25) in brizgo tuberkulinko. Mesto injiciranja se lahko obrije. Morebitne izgube, uhajanje snovi na mestu injiciranja ali nepopoln vnos odmerka je treba zabeležiti. Skupna količina odmerka na podgano na dan ne sme preseči 0,5 ml/kg telesne teže.
Posebni postopki za agoniste androgenov
43. Za preskus za agoniste androgenov je nosilec negativna kontrola, skupina, ki prejema TP, pa pozitivna kontrola. Biološka dejavnost, ki je skladna z agonisti androgenov, se preskuša z dajanjem izbranih odmerkov preskusne kemikalije tretiranim skupinam 10 dni zapored. Teža tkiv petih pomožnih spolnih organov živali v skupinah, ki so prejele preskusno kemikalijo, se primerja s skupino za nosilec, da bi se ugotovila statistično značilna povečanja teže.
Posebni postopki za antagoniste androgenov in zaviralce 5α-reduktaze
44. Za preskus za antagoniste androgenov in zaviralce 5α-reduktaze je skupina, ki prejema TP, negativna kontrola, skupina, ki hkrati prejema referenčna odmerka TP in FT, pa pozitivna kontrola. Biološka dejavnost, ki je skladna z antagonisti androgenov in zaviralci 5α-reduktaze, se preskuša z dajanjem referenčnega odmerka TP in dajanjem preskusne kemikalije 10 dni zapored. Teža tkiv petih pomožnih spolnih organov živali v skupinah, ki so prejele preskusno kemikalijo in TP, se primerja z referenčno skupino, ki je prejela samo TP, da bi se ugotovila statistično značilna zmanjšanja teže.
OPAZOVANJA
Klinična opazovanja
45. Splošna klinična opazovanja je treba opraviti vsaj enkrat dnevno in pogosteje, če se kažejo znaki strupenosti. Opazovanja je najbolje opraviti vsak dan ob istih časih ob upoštevanju vrhunca pričakovanih učinkov po odmerjanju. Vse živali je treba opazovati za določitev smrtnosti, obolevnosti in splošnih kliničnih znakov, kot so spremembe vedenja, spremembe na koži, dlaki, očeh in sluznicah, pojav sekrecije in ekskrecije ter delovanje avtonomnega živčevja (npr. solzenje, piloerekcija, velikost zenic, nenavaden vzorec dihanja).
46. Živali, ki so najdene poginule, je treba odstraniti in uničiti brez nadaljnje analize podatkov. Smrtnost živali pred obdukcijo in morebitne očitne razloge za smrtnost je treba vključiti v evidenco študije. Umirajoče živali je treba humano usmrtiti. Umirajoče in posledično usmrčene živali ter očitne razloge za obolevnost je treba vključiti v evidenco študije.
Telesna teža in poraba hrane
47. Vse živali je treba stehtati dnevno na 0,1 g natančno, in sicer tik pred začetkom tretiranja, tj. ko so živali razdeljene v skupine. Izmeri se lahko tudi količina hrane, ki jo živali porabijo med obdobjem tretiranja, in sicer za vsako posamezno kletko s tehtanjem hranilnic. Rezultati glede porabe hrane se izrazijo v gramih na podgano na dan.
Seciranje in merjenje teže tkiv in organov
48. Približno 24 ur po zadnjem odmerku preskusne kemikalije je treba podgane usmrtiti in opraviti izkrvavitev v skladu z običajnimi postopki zadevnega laboratorija ter opraviti obdukcijo. Metodo humane usmrtitve je treba zabeležiti v laboratorijskem poročilu.
49. Zaželen je naključni vrstni red obdukcije po skupinah, da ne bi prišlo do napredovanja neposredno po skupinah odmerkov, kar bi lahko vplivalo na podatke. Vse ugotovitve pri obdukciji, tj. patološke spremembe/vidne poškodbe, je treba zabeležiti in o njih poročati.
50. Pet od androgenov odvisnih tkiv (VP, SV, LABC, COW, GP) je treba stehtati. Ta tkiva je treba izrezati, previdno odstraniti priraščena tkiva in maščobo ter določiti njihovo svežo (nefiksirano) težo. Z vsakim tkivom je treba ravnati zelo skrbno, da ne bi prišlo do izgube tekočin in izsušitve, zaradi česar bi lahko prišlo do precejšnjih napak in variabilnosti, saj bi se zabeležene teže zmanjšale. Več tkiv je lahko zelo majhnih ali jih je težko secirati, zaradi česar bo prišlo do variabilnosti. Zato je pomembno, da osebe, ki secirajo tkiva pomožnih spolnih organov, poznajo standardne postopke seciranja za ta tkiva. Priročnik s standardnim operativnim postopkom za seciranje je na voljo na spletni strani OECD (21). S skrbnim usposabljanjem v skladu s priročnikom s standardnim operativnim postopkom se bo zmanjšal morebitni vir variacij v študiji. Zaželeno je, da je za seciranje zadevnega tkiva zadolžen isti obducent, saj tako ne pride do razlik med posamezniki pri obdelavi tkiva. Če to ni mogoče, bi morala biti obdukcija zasnovana tako, da vsak obducent secira zadevno tkivo iz vseh tretiranih skupin, namesto da en posameznik secira vsa tkiva kontrolne skupine, nekdo drug pa je zadolžen za tretirane skupine. Vsako tkivo pomožnega spolnega organa je treba stehtati brez pivnanja na 0,1 mg natančno in zabeležiti težo za vsako žival.
51. Več tkiv je lahko zelo majhnih ali pa jih je težko secirati, zaradi česar bo prišlo do variabilnosti. Iz preteklega dela je razvidna vrsta koeficientov variacij, za katere se zdi, da se razlikujejo glede na strokovnost laboratorija. V nekaj primerih so bile v določenem laboratoriju ugotovljene velike razlike v absolutni teži tkiv, kot sta ventralna prostata in Cowperjevi žlezi.
52. Lahko se opravijo tudi meritve jeter, obeh ledvic in obeh nadledvičnih žlez. S teh tkiv je prav tako treba odstraniti odvečno priraščeno vezivno tkivo in maščobo. Jetra je treba stehtati in težo zabeležiti na 0,1 g natančno, prav tako je treba stehtati obe ledvici in nadledvični žlezi ter težo zabeležiti na 0,1 mg natančno. Jetra, ledvici in nadledvični žlezi so organi, na katere vplivajo androgeni, in dobri pokazatelji sistemske strupenosti.
53. Lahko se opravijo tudi meritve serumskega luteinizirajočega hormona (LH), hormona, ki spodbuja rast foliklov (FSH), in testosterona (T). Koncentracije serumskega testosterona so koristne pri ugotavljanju, ali preskusna kemikalija povzroča presnovo testosterona v jetrih in tako znižuje koncentracije v serumu. Brez podatkov o testosteronu bi se lahko zdelo, da je do tega učinka prišlo zaradi antiandrogenega mehanizma. Koncentracije LH zagotavljajo informacije glede zmožnosti antiandrogena, da zmanjša težo organov in vpliva na funkcijo hipotalamusa in hipofize, ki lahko v dolgotrajnih študijah povzroči tumorje na modih. Hormon FSH je pomemben hormon za spermatogenezo. Lahko se opravijo tudi meritve T4 in T3 v serumu, ki bi zagotovile koristne dodatne informacije o zmožnosti za porušenje hormonskega ravnovesja ščitnice. Če se bodo opravile meritve hormonov, je treba pred obdukcijo podgane omamiti in vzeti kri s punkcijo srca, metodo anestezije pa je treba skrbno izbrati, da ne bi vplivala na meritve hormonov. Metodo priprave seruma, vir radioimunskega preskusa ali druge komplete za merjenje, analitične postopke in rezultate je treba zabeležiti. Koncentracije LH je treba zabeležiti kot ng na ml seruma in testosteron je treba prav tako zabeležiti kot ng na ml seruma.
54. Seciranje tkiv je opisano v nadaljevanju s podrobnim priročnikom za seciranje s fotografijami, ki so bile kot dodatno gradivo objavljene v okviru programa validacije (21). Na spletni strani korejske uprave za hrano in zdravila je na voljo tudi posnetek seciranja (22).
|
— |
Žival je obrnjena z ventralno površino navzgor; preveriti je treba, ali se je kožica penisa ločila od glavice. Če sta ločeni, je treba umakniti kožico in odstraniti glavico penisa, jo stehtati (na 0,1 mg natančno) in težo zabeležiti. |
|
— |
Kožo na trebuhu in trebušno steno je treba prerezati, s čemer se razkrijejo notranji organi. Če se bodo opravile meritve neobveznih organov, je treba odstraniti jetra in jih stehtati na 0,1 g natančno, odstraniti želodec in črevesje, odstraniti obe ledvici in nadledvični žlezi ter jih stehtati na 0,1 mg natančno. S tem postopkom se razkrije mehur in začne seciranje tarčnih moških pomožnih organov. |
|
— |
Za seciranje ventralne prostate (VP) je treba mehur s prerezom veznega tkiva po sredini ločiti od plasti ventralnih mišic. Mehur je treba premakniti anteriorno proti semenskim mešičkom, da se razkrijeta levi in desni reženj ventralne prostate (prekrita s plastjo maščobe). Z desnega in levega režnja VP je treba previdno odstraniti maščobo. Desni reženj VP je treba previdno odmakniti od sečnice ter ločiti reženj in sečnico. Med držanjem desnega režnja VP je treba nežno odmakniti levi reženj VP in ga izrezati; režnja je treba stehtati na 0,1 mg natančno in težo zabeležiti. |
|
— |
Za seciranje semenskih mešičkov in koagulacijskih žlez je treba kavdalno premakniti mehur, s čemer se razkrijejo semenovod, desni in levi reženj semenskih mešičkov in koagulacijske žleze (SVCG). Treba je preprečiti uhajanje tekočine, in sicer tako, da se s sponko spne spodnji del SVCG, kjer se stikata semenovod in sečnica. SVCG je treba previdno izrezati, s sponko še vedno na mestu odstraniti maščobo in priraščena tkiva, nato pa ju položiti v tarirano posodo za tehtanje, odstraniti sponko, stehtati organe na 0,1 mg natančno in težo zabeležiti. |
|
— |
Za seciranje mišice levator ani z bulbokavernozno mišico (LABC) je treba razkriti mišice in koren penisa. Mišice LA so ovite okrog debelega črevesa, sprednje mišice LA in BC pa so pritrjene na čebulček penisa. Odstraniti je treba kožo in adneks s perianalnega območja, ki potekata od korena penisa do sprednjega dela anusa. Postopoma je treba odstraniti mišice BC od čebulčka in tkiv. Debelo črevo je treba prerezati na pol, nato pa se lahko v celoti izrežejo mišice LABC in odstranijo. Z mišic LABC je treba odstraniti maščobo in priraščena tkiva, nato pa mišice stehtati na 0,1 mg natančno in težo zabeležiti. |
|
— |
Ko so mišice LABC odstranjene, sta vidni okrogli Cowperjevi ali bulbouretralni žlezi (COW) pri spodnjem delu in nekoliko dorzalno od čebulčka. Pri izrezu je potrebna previdnost, da se ne poškoduje tanka kapsula, zaradi česar bi iztekala tekočina. Cowperjevi žlezi je treba stehtati na 0,1 mg natančno in težo zabeležiti. |
|
— |
Zabeležiti je treba tudi izgubo tekočine iz katere koli žleze med obdukcijo in seciranjem. |
55. Če je za oceno vsake kemikalije potrebna obdukcija večjega števila živali, kot je smiselno za en dan, se lahko začetek študije razporedi na dva zaporedna dneva, kar pomeni, da bo obdukcija in s tem povezano delo razporejeno na dva dneva. V tem primeru je treba uporabiti polovico živali vsake od tretiranih skupin na dan.
56. Po obdukciji je treba trupla uničiti na primeren način.
POROČANJE
Podatki
57. Podatki se sporočajo posamično (tj. telesna teža, teža tkiva pomožnih spolnih organov, neobvezne meritve ter drugi odzivi in opažanja) in za vsako skupino živali (srednji in standardni odkloni vseh meritev). Podatki se povzamejo v obliki tabele. Podatki prikazujejo število živali na začetku preskusa, število živali, najdenih poginulih ali najdenih, ko kažejo znake strupenosti med preskusom, opis znakov zaznane strupenosti, vključno s časom njenega začetka, trajanja in resnosti.
58. Končno poročilo mora vključevati naslednje podatke:
Preskuševalni laboratorij:
|
— |
naziv laboratorija, kraj, |
|
— |
vodjo študije in drugo osebje ter njegove pristojnosti v zvezi s študijo, |
|
— |
datume začetka in konca študije, tj. prvi dan dajanja preskusne kemikalije oziroma zadnji dan obdukcije. |
Preskusna kemikalija:
|
— |
izvor, številko serije, vrsto, čistoto, polni naslov dobavitelja in opredelitev preskusnih kemikalij, |
|
— |
agregatno stanje in, če je to ustrezno, fizikalno-kemijske lastnosti, |
|
— |
pogoje shranjevanja, metodo in pogostost priprave razredčin, |
|
— |
morebitne podatke o stabilnosti, |
|
— |
morebitne analize raztopin/suspenzij za odmerjanje. |
Nosilec:
|
— |
opredelitev nosilca (vrsta, dobavitelj in št. serije), |
|
— |
utemeljitev izbire nosilca (če ta ni voda). |
Preskusne živali in postopki reje živali:
|
— |
uporabljeno vrsto/sev in utemeljitev izbire, |
|
— |
izvor ali dobavitelja živali, vključno s polnim naslovom, |
|
— |
število in starost dobavljenih živali, |
|
— |
pogoje nastanitve (temperaturo, osvetlitev itd.), |
|
— |
prehrano (ime, vrsto, dobavitelja, št. serije, vsebino in, če so znane, ravni fitoestrogenov), |
|
— |
steljo (ime, vrsto, dobavitelja, vsebino), |
|
— |
pogoje v kletkah in število živali na posamezno kletko. |
Preskusni pogoji:
|
— |
starost ob kastraciji in trajanje prilagajanja po kastraciji, |
|
— |
teže posameznih živali ob začetku študije (na 0,1 g natančno), |
|
— |
postopek randomizacije in evidenco dodelitve v skupine z nosilcem, referenčne skupine, skupine, ki so prejele preskusno kemikalijo, in kletke, |
|
— |
srednji in standardni odklon telesne teže za vsako skupino za vsak dan tehtanja v času trajanja študije, |
|
— |
utemeljitev izbire odmerka, |
|
— |
način dajanja preskusne kemikalije in utemeljitev izbire načina izpostavljenosti, |
|
— |
če je bil opravljen preskus za antiandrogenost, tretiranje s TP (odmerek in količino), |
|
— |
tretiranje s preskusno kemikalijo (odmerek in količina), |
|
— |
čas odmerjanja, |
|
— |
postopke obdukcije, vključno z načini izkrvavitve in morebitne anestezije, |
|
— |
če so bile opravljene analize seruma, podrobnosti metode. Če je bil na primer uporabljen radioimunski preskus (RIA), je treba sporočiti izvor kompletov za izvedbo preskusa, datum poteka kompleta, postopek scintilacijskega štetja in standardiziranje. |
Rezultati:
|
— |
dnevna opazovanja za vsako žival med dajanjem odmerkov, vključno s: |
|
— |
telesno težo (na 0,1 g natančno), |
|
— |
kliničnimi znaki (če se pojavijo), |
|
— |
morebitnimi meritvami ali opombami o porabi hrane, |
|
— |
opazovanja pri obdukciji za vsako žival, vključno z: |
|
— |
datumom obdukcije, |
|
— |
skupino tretiranja živali, |
|
— |
identifikacijsko oznako živali, |
|
— |
obducentom, |
|
— |
časom dneva, ko sta bili opravljeni obdukcija in seciranje, |
|
— |
starostjo živali, |
|
— |
končno telesno težo pri obdukciji in zabeleženo morebitno statistično značilno povečanje ali zmanjšanje, |
|
— |
vrstnim redom izkrvavitve živali in seciranja pri obdukciji, |
|
— |
težo petih tarčnih od androgenov odvisnih tkiv: |
|
— |
ventralne prostate (na 0,1 mg natančno), |
|
— |
semenskih mešičkov in koagulacijskih žlez, skupaj s tekočino (obeh, na 0,1 mg natančno), |
|
— |
sistema mišice levator ani z bulbokavernozno mišico (na 0,1 mg natančno), |
|
— |
Cowperjevih žlez (sveža teža – obeh, na 0,1 mg natančno), |
|
— |
glavice penisa (sveža teža, na 0,1 mg natančno), |
|
— |
morebitno težo neobveznih tkiv: |
|
— |
jeter (na 0,1 g natančno), |
|
— |
ledvic (obeh, na 0,1 mg natančno), |
|
— |
nadledvičnih žlez (obeh, na 0,1 mg natančno), |
|
— |
splošne pripombe in komentarje, |
|
— |
morebitne analize serumskih hormonov:
|
|
— |
splošne pripombe in komentarje. |
Povzetek podatkov
Podatke je treba prikazati v obliki tabele, v kateri so navedeni podatki o velikosti vzorca za vsako skupino, srednje vrednosti in standardna napaka povprečnega ali standardnega odklona. Tabele bi morale vsebovati telesno težo živali pri obdukciji, spremembe telesne teže od začetka odmerjanja do obdukcije, težo tkiv tarčnih pomožnih spolnih organov in težo neobveznih tkiv.
Razprava o rezultatih
Analiza rezultatov
59. Telesno težo in težo organov ob obdukciji je treba statistično analizirati za lastnosti, kot je homogenost varianc, za analizo pa po potrebi ustrezno pretvoriti podatke. Tretirane skupine je treba primerjati s kontrolno skupino s tehnikami, kot je ANOVA, ki ji sledi primerjava po parih (npr. Dunnettov enostranski preskus) in merilo za statistično razliko, npr. p ≤ 0,05. Skupine s statistično značilnostjo je treba identificirati. Vendar se je treba 'relativni teži' organov izogibati zaradi neveljavnih statističnih predpostavk, na katerih temelji ta obdelava podatkov.
60. Za agonizem androgenov mora biti kontrola preskusna skupina, tretirana samo z nosilcem. Zaradi značilnosti delovanja preskusne kemikalije se lahko tkiva različno relativno odzivajo; na primer trenbolon, ki ga ni mogoče 5 alfa-reducirati, ima izrazitejše učinke na LABC in GP kot testosteron propionat. Statistično značilno povečanje (p ≤ 0,05) teže dveh ali več tarčnih od androgenov odvisnih tkiv (VP, LABC, GP, CG in SVCG) se šteje za pozitiven rezultat na agoniste androgenov, določena stopnja povečane rasti pa bi se morala pojaviti pri vseh tarčnih tkivih. Skupna ocena odzivov vseh tkiv pomožnih spolnih organov je mogoča z uporabo ustrezne multivariantne analize podatkov. Tako bi se lahko analiza izboljšala, zlasti v primerih, ko se statistično značilen odziv pojavi samo pri enem tkivu.
61. Za agonizem androgenov mora biti kontrola preskusna skupina, tretirana z referenčnim androgenom (samo s testosteron propionatom). Zaradi značilnosti delovanja preskusne kemikalije se lahko tkiva različno relativno odzivajo; na primer zaviralci 5α-reduktaze imajo v primerjavi z močnimi antagonisti AR, kot je flutamid, izrazitejše učinke na ventralno prostato kot na druga tkiva. Statistično značilno zmanjšanje (p ≤ 0,05) teže dveh ali več tarčnih od androgenov odvisnih tkiv (VP, LABC, GP, CG in SVCG) v primerjavi s tretiranjem samo s testosteron propionatom se šteje za pozitiven rezultat na antagoniste androgenov, določena stopnja zmanjšanja rasti pa bi se morala pojaviti pri vseh tarčnih tkivih. Skupna ocena odzivov vseh tkiv pomožnih spolnih organov je mogoča z uporabo ustrezne multivariantne analize podatkov. Tako bi se lahko analiza izboljšala, zlasti v primerih, ko se statistično značilen odziv pojavi samo pri enem tkivu.
62. Podatke je treba prikazati v obliki tabele, v kateri so navedeni srednja vrednost, standardna napaka srednje vrednosti (sprejemljiv bi bil tudi standardni odklon) in podatki o velikosti vzorca za vsako skupino. Vključene bi morale biti tudi tabele s podatki za posamezne živali. Preveriti je treba posamične vrednosti, srednjo vrednost, standardno napako (standardni odklon) in vrednosti koeficienta variacij za kontrolne podatke, da bi ugotovili, ali izpolnjujejo sprejemljiva merila za skladnost s pričakovanimi preteklimi vrednostmi. S pomočjo koeficientov variacij, ki presegajo vrednosti koeficientov variacij iz tabele 1 (glej odstavka 25 in 26) za težo vsakega organa, je treba ugotoviti, ali je prišlo do napake pri beleženju ali vnašanju podatkov oziroma ali laboratorij še ne obvlada popolnoma natančnega seciranja od androgenov odvisnih tkiv in je potrebno nadaljnje usposabljanje/praksa. Na splošno so koeficienti variacij (standardni odklon deljen s povprečno težo organa) ponovljivi med laboratoriji in študijami. Predstavljeni morajo biti vsaj podatki za ventralno prostato, semenski mešiček, mišico levator ani z bulbokavernozno mišico, Cowperjevi žlezi, glavico penisa in jetra ter podatki o teži organov in spremembi telesne teže od začetka odmerjanja do obdukcije. Podatki so lahko predstavljeni tudi po prilagoditvi kovariance za telesno težo, vendar ne namesto predstavitve neprilagojenih podatkov. Poleg tega je treba v primeru, da do ločitve prepucija ne pride v nobeni od skupin, pojavnost ločitve prepucija zabeležiti in s Fisherjevim natančnim preskusom statistično primerjati s kontrolno skupino.
63. Ko se s pomočjo originalnih obrazcev preverja točnost podatkov, vnesenih v računalnik, je treba vrednosti teže organov, ki niso biološko verjetne ali pa se od povprečij te tretirane skupine razlikujejo za več kot tri standardne odklone, natančno preveriti in po potrebi zavreči kot napake pri beleženju.
64. Primerjava rezultatov študije z vrednostmi koeficientov variacije OECD (v tabeli 1) je pogosto pomemben korak pri razlagi glede veljavnosti rezultatov študije. Pretekli podatki kontrolnih skupin z nosilcem naj bodo shranjeni v laboratoriju. Pretekli podatki o odzivih na pozitivne referenčne kemikalije, kot sta testosteron propionat in flutamid, naj bodo prav tako shranjeni v laboratoriju. Laboratoriji lahko tudi redno preskušajo odziv na znane šibke agoniste in antagoniste androgenov ter te podatke hranijo. Zaradi zagotavljanja, da se z metodami laboratorija dobi ustrezno statistično natančnost in moč, se lahko ti podatki primerjajo z razpoložljivimi podatki OECD.
Dodatek 1
OPREDELITEV POJMOV:
|
|
Androgen je izraz, ki se uporablja za opis pozitivnega vpliva na rast od androgenov odvisnih tkiv. |
|
|
Antiandrogen je zmožnost kemikalije, da v organizmu sesalca zavre delovanje testosteron propionata. |
|
|
Kemikalija je snov ali zmes. |
|
|
Datum skotitve je poporodni dan 0. |
|
|
Odmerek je količina dane preskusne kemikalije. Pri Hershbergerjevem biološkem preskusu je odmerek izražen kot teža preskusne kemikalije na enoto telesne teže preskusne živali na dan (npr. mg/kg telesne teže/dan). |
|
|
Odmerjanje je splošen izraz, ki vključuje odmerek ter pogostost in trajanje dajanja odmerka. |
|
|
Umirajoč je izraz, ki se uporablja za opis umirajoče živali, tj. živali, ki je blizu smrti. |
|
|
Poporodni dan N je N-ti dan življenja po dnevu skotitve. |
|
|
Občutljivost je zmožnost preskusne metode, da pravilno identificira kemikalije, ki imajo lastnost, zaradi katere so preskušane. |
|
|
Specifičnost je zmožnost preskusne metode, da pravilno identificira kemikalije, ki nimajo lastnosti, zaradi katere so preskušane. |
|
|
Preskusna kemikalija pomeni vsako snov ali zmes, preskušeno s to preskusno metodo. |
|
|
Validacija je znanstven postopek, oblikovan za določanje zahtev glede delovanja in omejitev preskusne metode ter za prikaz njene zanesljivosti in ustreznosti za določen namen. |
Dodatek 2

OPOMBE K OKVIRU:
|
Opomba 1: |
Vstop na vseh ravneh in izstop z vseh ravni je mogoč in odvisen od obstoječih potreb po informacijah zaradi ocene nevarnosti in tveganja. |
|
Opomba 2: |
Na ravni 5 bi moral ekotoksikološki vidik vključevati končne točke, ki kažejo na mehanizme škodljivih učinkov in morebitno škodo za populacijo. |
|
Opomba 3: |
Če večmodalni model zajema več preskusov ene končne točke, ta model zamenja uporabo teh preskusov ene končne točke. |
|
Opomba 4: |
Kemikalije je treba ocenjevati vsako posebej in pri tem upoštevati razpoložljive informacije ter funkcijo ravni okvira. |
|
Opomba 5: |
V času nastanka tega dokumenta okvir še ni izpopolnjen. Na ravneh 3, 4 in 5 vključuje preskuse, ki so na voljo ali pa še v postopku validacije. Slednji so vključeni začasno. Ko bodo razviti in validirani, bodo uradno dodani v okvir. |
|
Opomba 6: |
Za raven 5 se ne sme šteti, da vključuje samo končne preskuse. Preskusi, vključeni na tej ravni, prispevajo k splošni oceni nevarnosti in tveganja. |
VIRI
|
(1) |
OECD (1998). Report of the First Meeting of the OECD Endocrine Disrupter Testing and Assessment (EDTA) Task Force, 10th–11th March 1998, ENV/MC/CHEM/RA(98)5. |
|
(2) |
Dorfman R.I. (1962). Standard methods adopted by official organization. Academic Press, NY. |
|
(3) |
Gray L.E. Jr., Furr J. and Ostby J.S. (2005). Hershberger assay to investigate the effects of endocrine disrupting compounds with androgenic and antiandrogenic activity in castrate-immature male rats. In: Current Protocols in Toxicology 16.9.1–16.9.15. J Wiley and Sons Inc. |
|
(4) |
OECD (2006). Final OECD report of the initial work towards the validation of the rat Hershberger assay. Phase 1. Androgenic response to testosterone propionate and anti-androgenic effects of flutamide. Environmental Health and Safety, Monograph Series on Testing and Assessment No 62. ENV/JM/MONO(2006)30. |
|
(5) |
OECD (2008). Report of the OECD Validation of the Rat Hershberger Bioassay: Phase 2: Testing of Androgen Agonists, Androgen Antagonists and a 5α-Reductase Inhibitor in Dose Response Studies by Multiple Laboratories. Environmental Health and Safety, Monograph Series on Testing and Assessment No 86. ENV/JM/MONO(2008)3. |
|
(6) |
OECD (2007). Report of the Validation of the Rat Hershberger Assay: Phase 3: Coded Testing of Androgen Agonists, Androgen Antagonists and Negative Reference Chemicals by Multiple Laboratories. Surgical Castrate Model Protocol. Environmental Health and Safety, Monograph Series on Testing and Assessment No 73. ENV/JM/MONO(2007)20. |
|
(7) |
Owens, W., Zeiger E., Walker M., Ashby J., Onyon L., Gray, Jr., L.E. (2006). The OECD programme to validate the rat Hershberger bioassay to screen compounds for in vivo androgen and antiandrogen responses. Phase 1: Use of a potent agonist and a potent antagonist to test the standardized protocol. Env. Health Persp. 114:1265–1269. |
|
(8) |
Owens W., Gray L.E., Zeiger E., Walker M., Yamasaki K., Ashby J., Jacob E. (2007). The OECD program to validate the rat Hershberger bioassay to screen compounds for in vivo androgen and antiandrogen responses: phase 2 dose-response studies. Environ Health Perspect. 115(5):671–8. |
|
(9) |
Korenchevsky V. (1932). The assay of testicular hormone preparations. Biochem J 26:413–422. |
|
(10) |
Korenchevsky V., Dennison M., Schalit R. (1932). The response of castrated male rats to the injection of the testicular hormone. Biochem J 26:1306–1314. |
|
(11) |
Eisenberg E., Gordan G.S. (1950). The levator ani muscle of the rat as an index of myotrophic activity of steroidal hormones. J Pharmacol Exp Therap 99:38–44. |
|
(12) |
Eisenberg E., Gordan G.S., Elliott H.W. (1949). Testosterone and tissue respiration of the castrate male rat with a possible test for mytrophic activity. Endocrinology 45:113–119. |
|
(13) |
Hershberger L., Shipley E., Meyer R. (1953). Myotrophic activity of 19-nortestosterone and other steroids determined by modified levator ani muscle method. Proc Soc Exp Biol Med 83:175–180. |
|
(14) |
Hilgar A.G., Vollmer E.P. (1964). Endocrine bioassay data: Androgenic and myogenic. Washington DC: United States Public Health Service. |
|
(15) |
Dorfman R.I. (1969). Androgens and anabolic agents. In: Methods in Hormone Research, volume IIA. (Dorfman RI, ed.) New York:Academic Press, 151–220. |
|
(16) |
Massaro E.J. (2002). Handbook of Neurotoxicology, volume I. New York: Humana Press, p. 38. |
|
(17) |
OECD (2000). Guidance document on the recognition, assessment and use of clinical signs as humane endpoints for experimental animals used in safety evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment No 19. ENV/JM/MONO(2000)7. |
|
(18) |
OECD (1982). Organization for Economic Co-operation and Development – Principles of Good Laboratory Practice, ISBN 92-64-12367-9, Paris. |
|
(19) |
OECD (2008). Acute oral toxicity – up-and-down procedure. OECD Guideline for the testing of chemicals No 425. |
|
(20) |
OECD (2001). Guidance document on acute oral toxicity. Environmental Health and Safety Monograph Series on Testing and Assessment No 24. ENV/JM/MONO(2001)4. |
|
(21) |
Supplemental materials for Owens et al. (2006). The OECD programme to validate the rat Hershberger bioassay to screen compounds for in vivo androgen and antiandrogen responses. Phase 1: Use of a potent agonist and a potent antagonist to test the standardized protocol. Env. Health Persp. 114:1265-1269. See, section II, The dissection guidance provided to the laboratories: http://www.ehponline.org/docs/2006/8751/suppl.pdf. |
|
(22) |
Korea Food and Drug Administration. Visual reference guide on Hershberger assay procedure, including a dissection video. http://rndmoa.kfda.go.kr/endocrine/reference/education_fr.html. |
|
(23) |
OECD (2008). Background Review Document on the Rodent Hershberger Bioassay. Environmental Health and Safety Monograph Series on Testing and Assessment No 90. ENV/JM/MONO(2008)17. |
|
(24) |
OECD (2008). Draft Validation report of the Intact, Stimulated, Weanling Male Rat Version of the Hershberger Bioassay. |
|
(25) |
OECD (2009). Guidance Document on the Weanling Hershberger Bioassay in rats: A shortterm screening assay for (anti)androgenic properties. Series on Testing and Assessment, Number 115. |
|
(26) |
Direktiva 2010/63/EU Evropskega parlamenta in Sveta z dne 22. Septembra 2010 o zaščiti živali, ki se uporabljajo v znanstvene namene (UL L 276, 20.10.2010, str. 33). |
|
(27) |
Naslednja poglavja te priloge:
|
B.56 RAZŠIRJENA ENOGENERACIJSKA ŠTUDIJA STRUPENOSTI ZA RAZMNOŽEVANJE
UVOD
1. Ta preskusna metoda ustreza Smernici za preskušanje OECD št. 443 (2012). Temelji na predlogu tehničnega odbora za oceno varnosti kemikalij v kmetijstvu (ACSA) Inštituta za zdravstvene in okoljske vede (HESI) Mednarodnega inštituta za znanost o življenju (ILSI) za razširjeno enogeneracijsko študijo strupenosti za razmnoževanje v življenjskem obdobju potomcev prve generacije (F1), kakor je objavljen v Cooper et al., 2006 (1). Narejene so bile številne izboljšave načrta študije in dodana so bila pojasnila, da bi zagotovili prožnost in poudarili pomen izhajanja iz obstoječega znanja in ugotovitev ob opazovanju živih živali, ki se uporabijo za usmerjanje in prilagajanje preskušanja. Ta preskusna metoda obsega podroben opis izvajanja razširjene enogeneracijske študije strupenosti za razmnoževanje. Preskusna metoda opisuje tri kohorte živali F1:
Kohorta 1: oceni končne točke razmnoževanja/razvoja; ta kohorta bo morda razširjena na generacijo F2.
Kohorta 2: oceni morebiten učinek izpostavljenosti kemikaliji na živčni sistem v razvoju.
Kohorta 3: oceni morebiten učinek izpostavljenosti kemikaliji na imunski sistem v razvoju.
2. Odločitev glede ocenjevanja druge generacije in opustitve kohorte za razvojno nevrotoksičnost in/ali kohorte za razvojno imunotoksičnost bi morala temeljiti na obstoječem znanju o kemikaliji, ki se vrednoti, in potrebah različnih regulativnih organov. Namen te preskusne metode je zagotoviti podrobnosti o izvajanju študije in načinih vrednotenja vsake od kohort.
3. Postopek za odločitev o notranjih sprožilcih za produkcijo druge generacije je opisan v Smernici OECD št. 117 (39) za regulativne organe, ki uporabljajo notranje sprožilce.
ZAČETNI PREUDARKI IN CILJI
4. Glavni cilj razširjene enogeneracijske študije o strupenosti za razmnoževanje je vrednotenje določenih življenjskih obdobij, ki niso zajeta v drugih vrstah študij strupenosti in preskušanje za učinke, ki bi lahko bili posledica izpostavljenosti kemikalijam v pred- in poporodnem obdobju. Pri končnih točkah razmnoževanja se priporoča, da se najprej, in ko je to mogoče, za odkrivanje učinkov na ženske in moške razmnoževalne organe uporabijo informacije iz študij s ponavljajočimi se odmerki (vključno s presejalnimi študijami za strupenost za razmnoževanje, npr. Smernica za preskušanje OECD št. 422 (32)), ali kratkotrajnih presejalnih študij za povzročitelje endokrinih motenj (npr. uterotropni preskus – preskusna metoda B.54 (36), in Hershbergerjev preskus – preskusna metoda B.55 (37)). Mednje lahko sodijo spermatogeneza (histopatologija mod) pri samcih ter pojatveni cikli, štetje foliklov/zorenje oocitov in celovitost jajčnikov (histopatologija) pri samicah. Razširjena enogeneracijska študija strupenosti za razmnoževanje služi kot preskus za končne točke razmnoževanja, pri katerih so potrebni interakcija samcev in samic, samice z zarodkom in samice s potomci ter generacija F1 do obdobja po spolni zrelosti (glej Smernico OECD št. 151, ki podpira to preskusno metodo (40)).
5. Preskusna metoda je zasnovana tako, da zagotavlja vrednotenje pred- in poporodnih učinkov kemikalij na razvoj, pa tudi temeljito vrednotenje sistemske strupenosti pri brejih in doječih samicah ter mladih in odraslih potomcih. S podrobnim proučevanjem ključnih končnih točk razvoja, kot so sposobnost potomcev za preživetje, zdravje in razvojni status ob rojstvu ter fizični in funkcionalni razvoj do odraslosti, naj bi se opredelili določeni tarčni organi pri potomcih. Poleg tega bo študija zagotovila in/ali potrdila informacije o učinkih preskusne kemikalije na celovitost in zmogljivost moških in ženskih razmnoževalnih sistemov. Še posebej, vendar ne izključno, so obravnavani naslednji parametri: funkcija spolnih žlez, pojatveni cikel, zorenje semena v obmodku, vedenje pri parjenju, spočetje, brejost, kotitev in laktacija. Poleg tega bodo informacije, pridobljene na podlagi ocen razvojne nevrotoksičnosti in/ali razvojne imunotoksičnosti, opredelile morebitne učinke v teh sistemih. Podatki, pridobljeni s temi preskusi, bi morali omogočiti določanje vrednosti brez opaznih škodljivih učinkov (NOAEL), najnižjih vrednosti z opaženim škodljivim učinkom (LOAEL) in/ali primerjalnih odmerkov za različne končne točke in/ali biti uporabljeni za opredelitev učinkov, ugotovljenih v prejšnjih študijah s ponavljajočim se odmerkom, in/ali služiti kot smernica za nadaljnje preskušanje.
6. Shema protokola je predstavljena na sliki 1. Preskusna kemikalija se daje neprekinjeno v stopnjevanih odmerkih več skupinam spolno zrelih samcev in samic. Ta generacija staršev (P) prejema odmerke v določenem obdobju pred parjenjem (obdobje je določeno na podlagi razpoložljivih informacij za preskusno kemikalijo, vendar mora trajati vsaj dva tedna) in v dvotedenskem obdobju parjenja. Starševski (P) samci nadalje prejemajo odmerke vsaj do odstavitve potomcev F1. Odmerke naj bi prejemali vsaj 10 tednov. Če je treba pojasniti učinke na razmnoževanje, lahko odmerke prejemajo tudi dalj časa. Tretiranje starševskih (P) samic se nadaljuje med brejostjo in laktacijo do usmrtitve po odstavitvi njihovih potomcev (tj. 8–10 tednov tretiranja). Potomci F1 so s preskusno kemikalijo nadalje tretirani od odstavitve do odraslosti. Če se ocenjuje druga generacija (glej Smernico OECD št. 117 (39)), se potomce F1 še naprej tretira do odstavitve potomcev F2 ali zaključka študije.
7. Na vseh živalih se izvajajo klinična opazovanja in patološki pregledi za znake strupenosti s posebnim poudarkom na celovitosti in zmogljivosti moških in ženskih razmnoževalnih sistemov ter na zdravju, rasti, razvoju in delovanju potomcev. Ob odstavitvi so izbrani potomci razdeljeni v določene podskupine (kohorte 1–3, glej odstavka 33 in 34 ter sliko 1) zaradi nadaljnjih preiskav, vključno s spolno zrelostjo, celovitostjo in delovanjem razmnoževalnega organa, vedenjskimi in nevrološkimi končnimi točkami ter delovanjem imunskega sistema.
8. Pri izvajanju študije je treba upoštevati vodilna načela in premisleke iz smernice OECD št. 19 o prepoznavanju, oceni in uporabi kliničnih znakov kot humanih končnih točk za preskusne živali, ki se uporabljajo pri ocenah varnosti (34).
9. Ko bo na voljo dovolj študij za ugotavljanje učinka tega novega načrta študije, bo opravljen pregled preskusne metode, ki bo ob upoštevanju pridobljenih izkušenj po potrebi spremenjena.
Slika 1
Shema razširjene enogeneracijske študije strupenosti za razmnoževanje
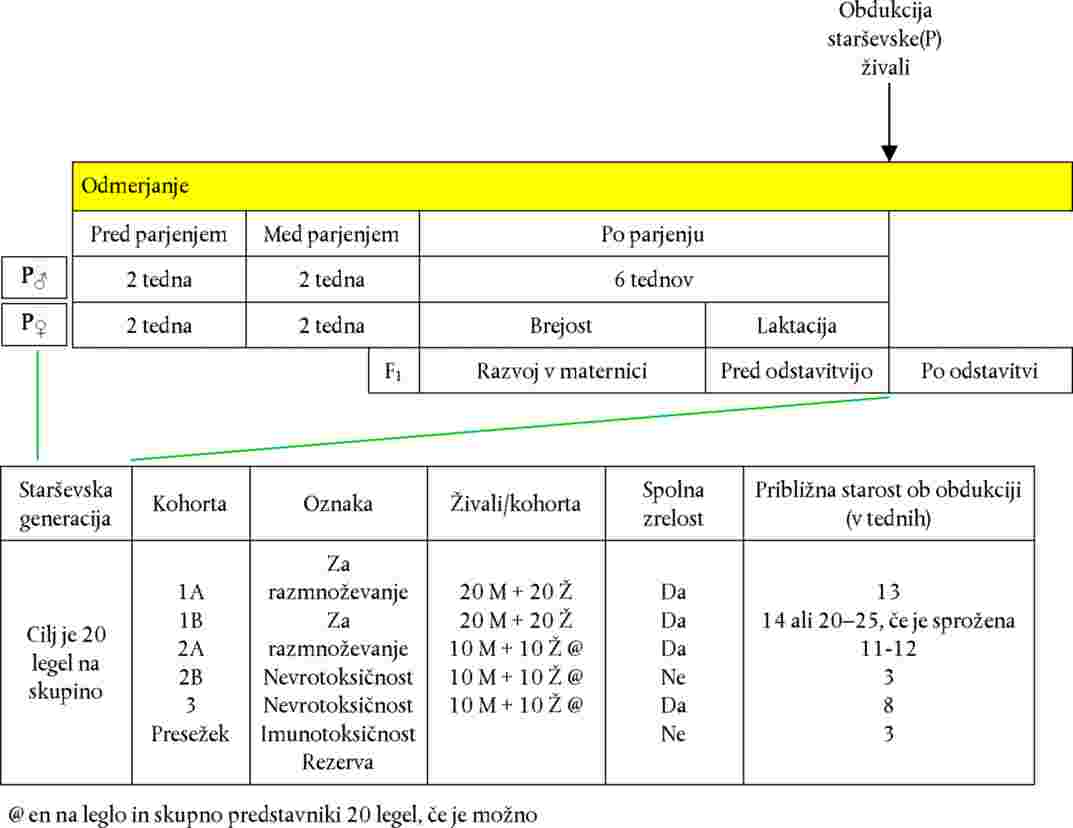
OPIS METODE/PRIPRAVE NA PRESKUS
Živali
Izbira živalske vrste in seva
10. Vrsto za preskus strupenosti za razmnoževanje je treba skrbno izbrati ob upoštevanju vseh razpoložljivih informacij. Zaradi obsega osnovnih podatkov in primerljivosti s splošnimi preskusi strupenosti je priporočena vrsta običajno podgana; merila in priporočila v tej preskusni metodi se nanašajo na to vrsto. Če se uporabi druga vrsta, je treba izbiro utemeljiti in ustrezno spremeniti protokol. Sevi z nizko plodnostjo ali dobro znano visoko pojavnostjo spontanih razvojnih napak se ne smejo uporabljati.
Starost, telesna teža in merila za vključitev
11. Uporabijo se zdravi starši, na katerih se še niso izvajali preskusni postopki. Proučiti je treba samce in samice; uporabijo se samice, ki še niso kotile in ki niso breje. Starši (P) naj bodo spolno zreli, ob začetku odmerjanja naj imajo podobno težo (v okviru spola), ob parjenju naj bodo približno enako stari (približno 90 dni) in naj bodo reprezentativni za vrsto in sev, uporabljena v študiji. Živali naj se prilagajajo vsaj 5 dni po prihodu. Živali se naključno dodelijo v kontrolne in tretirane skupine tako, da bodo povprečne telesne teže med skupinami primerljive (tj. ± 20 % srednje vrednosti).
Nastanitveni in prehranjevalni pogoji
12. Temperatura v prostoru s preskusnimi živalmi naj bo 22 °C (± 3 °C). Relativna vlažnost naj bo med 30 in 70 %, pri čemer je najprimernejše območje med 50 in 60 %. Umetna osvetlitev naj bo nastavljena na 12 ur svetlobe, 12 ur teme. Uporablja se lahko običajna laboratorijska prehrana z neomejeno količino pitne vode. Posebno pozornost je treba nameniti vsebnosti fitoestrogenov v prehrani, saj lahko njihova visoka raven vpliva na nekatere končne točke razmnoževanja. Priporoča se uporaba standardizirane prehrane z odprto formulo, v kateri so bile v skladu s priporočili zmanjšane količine estrogenih kemikalij (2) (30). Na izbiro prehrane lahko vpliva potreba po zagotovitvi ustrezne primesi preskusne kemikalije, kadar se daje po tej metodi. Preveriti je treba vsebnost, homogenost in stabilnost preskusne kemikalije v prehrani. Hrano in pitno vodo je treba redno analizirati za kontaminante. Vzorce vsake serije prehrane, uporabljene med študijo, je treba shraniti pod ustreznimi pogoji (npr. zamrznjene pri – 20 °C) do zaključka poročila, če bi bilo treba na podlagi rezultatov opraviti nadaljnjo analizo sestavin prehrane.
13. Živali je treba v kletke namestiti v manjših skupinah istega spola in iz iste tretirane skupine. Zaradi izogibanja poškodbam (npr. samcev po obdobju parjenja) se lahko namestijo tudi posamično. Parjenje naj se izvaja v kletkah, ki so primerne za ta namen. Po dokazu o kopulaciji se domnevno breje samice namestijo ločeno v kletke za kotitev ali kletke za matere, kjer imajo na voljo ustrezen in določen material za izdelavo gnezda. Legla so nastanjena s svojimi materami do odstavitve. Živali F1 naj bi bile od odstavitve do usmrtitve nameščene v majhnih skupinah istega spola in tretirane skupine. Če je to znanstveno upravičeno, so lahko živali nameščene posamično. Raven fitoestrogenov v izbrani stelji naj bo kar najmanjša.
Število in identifikacija živali
14. Običajno naj bi bilo v vsaki preskusni in kontrolni skupini zadostno število sparjenih parov, da je za vsako skupino odmerka brejih vsaj 20 samic. Cilj je dovolj brejih samic, da je zagotovljeno smiselno ovrednotenje potenciala snovi za vplivanje na plodnost, brejost in materinsko obnašanje starševske (P) generacije ter rast in razvoj potomcev F1 od spočetja do zrelosti. Če zaželeno število brejih živali ni doseženo, študija s tem torej ni nujno ovržena in je potrebno vrednotenje vsakega primera posebej ob upoštevanju morebitne vzročne povezave s preskusno kemikalijo.
15. Pred začetkom odmerjanja se vsaki starševski (P) živali dodeli edinstvena identifikacijska številka. Če je iz preteklih podatkov laboratorija razvidno, da velik delež samic morda ne bo imel rednih (4- ali 5-dnevnih) pojatvenih ciklov, se priporoča ocena pojatvenih ciklov pred pričetkom tretiranja. Skupina se lahko tudi poveča in se tako zagotovi, da bo imelo ob začetku tretiranja v vsaki skupini vsaj 20 samic redne (4- ali 5-dnevne) pojatvene cikle. Vsi potomci F1 se označijo z edinstvenimi oznakami, ko so novorojene živali prvič pregledane na poporodni dan 0 ali 1. poporodni dan. Ves čas trajanja študije je treba voditi evidenco z navedbo o poreklu zaroda za vse živali F1 in, kadar je primerno, živali F2.
Preskusna kemikalija
Razpoložljive informacije o preskusni kemikaliji
16. Pregled obstoječih informacij je pomemben zaradi odločitev o načinu dajanja, izbiri nosilca, izbiri vrste živali, izbiri odmerkov in morebitnih spremembah urnika odmerjanja. Zato je treba pri načrtovanju razširjene enogeneracijske študije strupenosti za razmnoževanje upoštevati vse ustrezne razpoložljive informacije o preskusni kemikaliji, tj. fizikalno-kemijske lastnosti, toksikokinetiko (vključno s presnovo, značilno za vrsto), toksikodinamične lastnosti, razmerja med strukturo in aktivnostjo, presnovne procese in vitro, rezultate predhodnih študij strupenosti in zadevne informacije o strukturnih analogih. Predhodne informacije o absorpciji, porazdelitvi, presnovi in izločanju ter bioakumulaciji je mogoče pridobiti na podlagi kemijske sestave, fizikalno-kemijskih podatkov, obsega študij vezave na plazemske beljakovine ali toksikokinetičnih študij, rezultati študij strupenosti pa zagotavljajo dodatne informacije, npr. o vrednosti brez opaznih škodljivih učinkov (NOAEL), presnovi ali nastajanju presnove.
Upoštevanje podatkov o toksikokinetiki
17. Čeprav niso zahtevani, so podatki o toksikokinetiki iz predhodno izvedenih študij za ugotavljanje območja ali drugih študij izredno koristni pri načrtovanju študije, izbiri velikosti odmerkov in razlagi rezultatov. Zlasti koristni so podatki, ki: 1) preverjajo izpostavljenost razvijajočih se zarodkov in mladičev preskusni kemikaliji (ali ustreznim metabolitom), 2) zagotavljajo oceno notranje dozimetrije in 3) ocenijo možnost nasičenosti kinetičnega procesa, odvisne od odmerka. Če so na voljo, je treba upoštevati tudi dodatne podatke o toksikokinetiki, kot so profili presnovkov, časovni poteki koncentracije itd. Dodatne podatke o toksikokinetiki je mogoče zbrati tudi med glavno študijo, če to ne moti zbiranja in razlage končnih točk glavne študije.
Na splošno je pri načrtovanju razširjene enogeneracijske študije strupenosti za razmnoževanje koristen naslednji podatkovni niz o toksikokinetiki:
|
— |
pozna brejost (npr. 20. dan brejosti) – kri matere in kri zarodka, |
|
— |
sredina obdobja laktacije (10. poporodni dan) – kri matere, kri mladiča in/ali mleko, |
|
— |
zgodnje obdobje po odstavitvi (npr. 28. poporodni dan) – vzorci krvi odstavljenih živali. |
Pri določanju določenih analitov (npr. matične kemikalije in/ali metabolitov) in sheme vzorčenja je potrebna prožnost. Število in čas odvzema vzorcev na določeni dan vzorčenja sta na primer odvisna od načina izpostavljenosti in predhodnega poznavanja toksikokinetičnih lastnosti pri nebrejih živalih. Pri študijah o prehrani zadošča vzorčenje ob enem samem doslednem času vsak dan vzorčenja, pri odmerjanju z gavažo pa bo morda potrebno vzorčenje tudi ob drugih časih, da bi dobili boljšo oceno območja notranjih odmerkov. Ni pa potrebno pripraviti celotnega časovnega poteka koncentracije na kateri koli dan vzorčenja. Po potrebi se lahko za analizo zarodkov in novorojenih živali podatke o krvi združi po spolu znotraj legel.
Način dajanja kemikalije
18. Pri izbiri načina dajanja je treba upoštevati načine, ki so najpomembnejši za izpostavljenost pri ljudeh. Čeprav je protokol zasnovan za dajanje preskusne kemikalije s hrano, ga je mogoče spremeniti za dajanje na druge načine (pitna voda, gavaža, vdihavanje, skozi kožo), odvisno od lastnosti kemikalije in potrebnih informacij.
Izbira nosilca
19. Po potrebi se preskusna kemikalija raztopi ali suspendira v ustreznem nosilcu. Priporoča se, da se, kadar koli je to mogoče, najprej razmisli o uporabi vodne raztopine/suspenzije, nato pa raztopine/suspenzije v olju (npr. koruznem). V primeru nosilcev, ki niso voda, je treba poznati toksične lastnosti takega nosilca. Uporabi nosilcev z morebitno intrinzično strupenostjo se je treba izogibati (npr. acetonu, dimetilsulfoksidu). Določiti je treba stabilnost preskusne kemikalije v nosilcu. Če se za lažje odmerjanje uporabi nosilec ali drug dodatek, je treba upoštevati naslednje lastnosti: učinke na absorpcijo, porazdelitev, presnovo ali zadrževanje preskusne kemikalije; učinke na kemijske lastnosti preskusne kemikalije, ki bi lahko spremenili njene strupene lastnosti; in učinke na porabo vode ali hrane oziroma prehranjenost živali.
Izbira odmerka
20. Običajno naj bi študija obsegala vsaj tri velikosti odmerkov in hkratno kontrolo. Pri izbiri ustreznih velikosti odmerkov bi moral raziskovalec upoštevati vse razpoložljive informacije, vključno z informacijami o odmerjanju iz prejšnjih študij, podatke o toksikokinetiki pri brejih in nebrejih samicah, obseg prenosa z dojenjem ter ocene izpostavljenosti pri ljudeh. Če so na voljo podatki o toksikokinetiki, ki kažejo na od odmerka odvisno nasičenost toksikokinetičnih procesov, se je treba izogniti velikim odmerkom, ki očitno kažejo nasičenost, seveda če naj bi bila izpostavljenost pri ljudeh precej pod točko nasičenosti. V takih primerih naj bi bil največji odmerek na prevojni točki za prehod na nelinearne toksikokinetične lastnosti ali tik nad njo.
21. Če ustreznih podatkov o toksikokinetiki ni na voljo, naj bi velikosti odmerkov temeljile na učinkih strupenosti, razen kadar zaradi fizikalne/kemijske narave preskusne kemikalije to ni mogoče. Če velikosti odmerkov temeljijo na strupenosti, je treba največji odmerek izbrati z namenom, da se povzroči določena stopnja sistemske strupenosti, vendar ne smrti ali hudega trpljenja živali.
22. Padajoče zaporedje velikosti odmerkov je treba izbrati tako, da se pokažejo vse od odmerka odvisne reakcije in določi vrednost brez opaženih škodljivih učinkov (NOAEL) ali odmerke blizu meje zaznavnosti, na podlagi katerih bi bilo mogoče določiti primerjalni odmerek za najobčutljivejše končne točke. Da ne bi bilo prevelikega razpona med NOAEL in LOAEL, so pogosto optimalni dvakratni do štirikratni intervali. Pogosto je bolje dodati četrto preskusno skupino, kot uporabiti zelo velike intervale med odmerki (npr. več kot faktor 10).
23. Razen tretiranja s preskusno kemikalijo se z živalmi v kontrolni skupini ravna enako kot z živalmi v preskusni skupini. Ta skupina je kontrolna skupina, ki ni tretirana ali je tretirana z nepravim nadomestkom, ali kontrolna skupina, tretirana le z nosilcem, če je ta uporabljen pri dajanju preskusne kemikalije. Če je uporabljen nosilec, mora kontrolna skupina prejeti količino nosilca, enako največji uporabljeni količini.
Mejni preskus
24. Če pri odmerku najmanj 1 000 mg/kg telesne teže/dan ni dokazov o strupenosti pri študijah s ponavljajočimi se odmerki ali se ne pričakuje strupenosti glede na podatke o strukturno in/ali presnovno sorodnih kemikalijah, ki kažejo na podobnost presnovnih lastnosti in vivo/in vitro, se šteje, da študija z uporabo več različnih velikosti odmerkov ni potrebna. V takih primerih se lahko razširjena enogeneracijska študija strupenosti za razmnoževanje izvede s kontrolno skupino in enim odmerkom najmanj 1 000 mg/kg telesne teže/dan. Če se pri tej velikosti odmerka pojavijo dokazi o strupenosti za razmnoževanje in razvoj, bodo potrebne nadaljnje študije z manjšimi odmerki za opredelitev NOAEL. Ti preudarki o mejnem preskusu veljajo samo v primeru, ko na podlagi izpostavljenosti pri ljudeh ni razvidna potreba po večjem odmerku.
POSTOPKI
Izpostavljenost potomcev
25. Priporočen način dajanja je izpostavljenost s prehrano. Če se izvajajo študije dajanja z gavažo, je treba opozoriti, da mladiči preskusno kemikalijo običajno prejemajo posredno prek mleka, dokler se po odstavitvi ne prične neposredno odmerjanje. Pri študijah s prehrano ali pitno vodo dobijo mladiči preskusno kemikalijo tudi neposredno, ko se začnejo v zadnjem tednu obdobja dojenja samostojno prehranjevati. Če se v mleko izloča premalo preskusne kemikalije in če ni dokazov o neprekinjeni izpostavljenosti potomcev, je treba razmisliti o spremembi načrta študije. V tem primeru je treba proučiti možnost neposrednega odmerjanja mladičem med dojenjem na podlagi razpoložljivih informacij o toksikokinetiki, strupenosti za potomce ali spremembi biomarkerjev (3) (4). Pred pričetkom neposrednega odmerjanja doječim se mladičem je treba skrbno pretehtati prednosti in slabosti (5).
Urnik odmerjanja in dajanje odmerkov
26. Informacije o pojatvenem ciklu, histopatoloških preiskavah ženskega in moškega reproduktivnega trakta in/ali analizi semena iz mod/obmodka so morda na voljo iz prejšnjih ustrezno dolgih študij strupenosti s ponavljajočim se odmerkom. Trajanje tretiranja pred parjenjem v razširjeni enogeneracijski študiji strupenosti za razmnoževanje je torej usmerjeno v odkrivanje učinkov na spremembe delovanja, ki bi lahko motile vedenje pri parjenju in oploditev. Tretiranje pred parjenjem mora trajati dovolj dolgo, da se dosežejo stabilni pogoji izpostavljenosti pri starševskih (P) samcih in samicah. V večini primerov za oba spola zadošča dvotedensko tretiranje pred parjenjem. Pri samicah so v tem času zajeti 3–4 popolni pojatveni cikli, kar bi moralo zadoščati za odkrivanje morebitnih škodljivih učinkov na cikličnost. Pri samcih je to obdobje enakovredno obdobju, potrebnemu za prehod zorečih semenčic v obmodkih, in bi moralo zadoščati za odkrivanje učinkov na seme po fazi proizvodnje v modih (med zadnjimi fazami sprostitve spermatidov v obmodek in zorenjem semena v obmodku) pri parjenju. Ob usmrtitvi, ko sta načrtovani histopatologija mod in obmodka ter analiza parametrov semena, so starševski (P) samci in samci F1 izpostavljeni vsaj en celotni proces spermatogeneze ((6) (7) (8) (9) in Smernica OECD št. 151 (40)).
27. Scenarije izpostavljenosti samcev pred parjenjem je mogoče spremeniti, če so bili v prejšnjih študijah jasno ugotovljeni strupenost za moda (oslabitev spermatogeneze) ali učinki na celovitost in delovanje semena. Podobno je lahko pri samicah zaradi znanih učinkov preskusne kemikalije na pojatveni cikel in s tem na spolno dojemljivost utemeljena uporaba drugačnih scenarijev izpostavljenosti pred parjenjem. V posebnih primerih je lahko sprejemljivo, da se tretiranje starševskih (P) samic prične šele po brisu, pozitivnem na seme (glej Smernico OECD št. 151 (40)).
28. Po pričetku obdobja odmerjanja pred parjenjem je treba živali s preskusno kemikalijo tretirati neprekinjeno 7 dni na teden do obdukcije. Vse živali dobivajo odmerke po enaki metodi. Odmerjanje naj se nadaljuje med dvotedenskim obdobjem parjenja in pri starševskih (P) samicah med brejostjo in laktacijo do dneva usmrtitve po odstavitvi. Samce je treba tretirati enako do usmrtitve ob odstavitvi živali F1. Pri obdukciji je treba dati prednost samicam, na katerih je treba opraviti obdukcijo na isti/podoben dan laktacije. Obdukcija samcev lahko poteka več dni, odvisno od zmogljivosti laboratorija. Če se neposredno odmerjanje ni pričelo že med dojenjem, se mora neposredno odmerjanje samcem in samicam F1 pričeti ob odstavitvi in nadaljevati do načrtovane obdukcije, odvisno od kohorte.
29. Pri kemikalijah, ki se dajejo s hrano ali pitno vodo, je nujno zagotoviti, da količine uporabljene preskusne kemikalije ne vplivajo na običajno raven vnosa hrane ali porabe vode. Kadar se preskusna kemikalija daje s hrano, se lahko uporabi konstantna koncentracija v hrani (ppm) ali pa konstantna velikost odmerka glede na telesno težo živali; uporabljeno metodo je treba določiti.
30. Pri kemikalijah, ki se dajejo z gavažo, naj količina enega danega odmerka tekočine običajno ne bi presegla 1 ml/100 g telesne teže (0,4 ml/100 g telesne teže je največja dovoljena količina za olje, npr. koruzno olje). Razen pri dražečih ali jedkih kemikalijah, ki pri višjih koncentracijah navadno povzročajo močnejše učinke, je treba variabilnost preskusne količine s prilagajanjem koncentracije obdržati na kar najnižji ravni, da bi zagotovili konstantno količino pri vseh odmerkih. Odmerek je treba dati vsak dan približno ob istem času. Odmerek za posamezno žival je navadno izbran na podlagi nazadnje določene telesne teže živali, prilagodi pa se ga vsaj enkrat tedensko za odrasle samce in odrasle nebreje samice ter vsaka dva dni za breje samice in živali F1 pred odstavitvijo in dva tedna po odstavitvi. Če podatki o toksikokinetiki kažejo na prenos preskusne kemikalije prek posteljice v majhnih količinah, bo morda treba v zadnjem tednu brejosti prilagoditi odmerek z gavažo, da mati ne bi prejela preveč strupenega odmerka. Na dan kotitve se samice ne smejo tretirati z gavažo ali na kakšen drugi način odmerjanja, pri katerem je treba ravnati z živaljo; bolje je, da samice na ta dan ne prejmejo preskusne kemikalije, kot da se zmoti postopek kotitve.
Parjenje
31. Vsaka starševska (P) samica se namesti skupaj z naključno izbranim, nepovezanim samcem, ki prejema enako velikost odmerka (parjenje 1:1), dokler ne pride do kopulacije ali dokler ne mineta 2 tedna. Če ni dovolj samcev, na primer zaradi pogina samcev pred parjenjem, se lahko samci, ki so se že parili, sparijo (1:1) z drugimi samicami, tako da so vse samice sparjene. Dan 0 brejosti je opredeljen kot dan, na katerega so potrjeni dokazi o parjenju (je opažen vaginalni čep ali seme). Živali je treba ločiti takoj, ko so najdeni dokazi o kopulaciji. Če po dveh tednih ni prišlo do parjenja, je treba živali ločiti brez nadaljnje priložnosti za parjenje. Sparjeni pari morajo biti jasno označeni v podatkih.
Velikost legla
32. Četrti dan po skotitvi se lahko velikost vsakega legla prilagodi z naključno izločitvijo odvečnih mladičev, da bi se dobilo, če je to mogoče, pet samcev in pet samic na leglo. Selektivna izločitev mladičev, npr. na podlagi telesne teže, ni primerna. Kadar zaradi števila mladih samcev in samic ni mogoče, da bi jih bilo v vsakem zarodu po pet na spol, je sprejemljiva tudi delna prilagoditev (na primer, šest samcev in štiri samice).
Izbor mladičev za študije po odstavitvi (glej sliko 1)
33. Ob odstavitvi (okrog 21. poporodnega dne) se iz vseh razpoložljivih legel do 20 mladičev na vsako skupino odmerka in kontrolno skupino izbere za nadaljnje preiskave in vzdržuje do spolne zrelosti (razen če je preskušanje potrebno prej). Mladiči se izberejo naključno, vključiti pa se ne smejo očitni spački (živali s telesno težo, ki je več kot dva standardna odklona manjša od povprečne telesne teže mladičev iz zadevnega legla), saj najverjetneje ne bodo reprezentativni za tretirano skupino.
21. poporodni dan so izbrani mladiči F1 naključno razporejeni v eno od treh kohort živali, kot sledi:
Kohorta 1 (1A in 1B)= Preskušanje strupenosti za razmnoževanje/razvoj
Kohorta 2 (2A in 2B)= Preskušanje razvojne nevrotoksičnosti
Kohorta 3= Preskušanje razvojne imunotoksičnosti
Kohorta 1A: En samec in ena samica/leglo/skupino (20/spol/skupino): prednostni izbor za prvotno oceno učinkov na razmnoževalne sisteme in učinkov splošne strupenosti.
Kohorta 1B: En samec in ena samica/leglo/skupino (20/spol/skupino): prednostni izbor za nadaljnjo oceno sposobnosti razmnoževanja s parjenjem živali F1, ko se ocenjuje (glej Smernico OECD št. 117 (39)), in za pridobivanje dodatnih histopatoloških podatkov v primeru domnevno strupenih snovi za razmnoževanje ali domnevnih povzročiteljev endokrinih motenj oziroma v primeru, ko so rezultati iz kohorte 1A dvoumni.
Kohorta 2A: skupno 20 mladičev na skupino (10 samcev in 10 samic na skupino; en samec ali ena samica na leglo), dodeljenih za preskušanje za nevrološko-vedenjske motnje, ki mu sledi nevrohistopatološka ocena kot odraslih.
Kohorta 2B: skupno 20 mladičev na skupino (10 samcev in 10 samic na skupino; en samec ali ena samica na leglo), dodeljenih za nevrohistopatološko oceno ob odstavitvi (21. ali 22. poporodni dan). Če živali ni dovolj, je treba dati prednost dodelitvi živali kohorti 2A.
Kohorta 3: skupno 20 mladičev na skupino (10 samcev in 10 samic na skupino; en na leglo, če je mogoče). Morda bodo potrebni dodatni mladiči iz kontrolne skupine, ki bodo živali pozitivne kontrole v preskusu protitelesnega odziva na osnovi T-celic (TDAR) na 56. poporodni dan ± 3 dnevi.
34. Če v leglu ni dovolj mladičev za vse kohorte, ima prednost kohorta 1, saj jo je mogoče razširiti na produkcijo generacije F2. V primeru posebnih okoliščin, npr. če je kemikalija domnevno strupena za živčevje, imunski sistem ali razmnoževanje, se lahko kateri koli kohorti dodelijo dodatni mladiči. Ti mladiči se lahko uporabijo za preiskave ob različnih časovnih točkah ali za ocenjevanje dodatnih končnih točk. Na mladičih, ki niso dodeljeni v kohorte, se bodo opravile klinične biokemijske preiskave (odstavek 55) in opravljena bo makroskopska obdukcija (odstavek 68).
Drugo parjenje starševskih (P) živali
35. Za starševske (P) živali drugo parjenje običajno ni priporočeno, saj se zaradi tega izgubijo pomembne informacije o številu vgnezditev (in s tem podatki o izgubah po vgnezditvi in ob kotitvi) za prvo leglo. Potreba po preverjanju ali pojasnjevanju učinka pri izpostavljenih samicah bi bila bolje izpolnjena z razširitvijo študije na parjenje generacije F1. Vendar pa drugo parjenje starševskih (P) samcev z netretiranimi samicami vedno predstavlja možnost, da se razjasnijo dvoumni rezultati ali nadalje opredelijo učinki na plodnost, ugotovljeni pri prvem parjenju.
OPAZOVANJA ŽIVIH ŽIVALI
Klinična opazovanja
36. Pri starševskih (P) živalih in izbranih živalih F1 se splošno klinično opazovanje opravi enkrat dnevno. V primeru odmerjanja z gavažo je treba klinična opazovanja izvesti pred odmerjanjem in po njem (za morebitne znake strupenosti, povezane z najvišjo koncentracijo plazme). Zabeležijo se bistvene vedenjske spremembe, znaki težke ali podaljšane kotitve in vsi znaki strupenosti. Dvakrat dnevno, ob koncu tedna pa enkrat dnevno, je treba vse živali opazovati za ugotavljanje hude strupenosti, obolevnosti in smrtnosti.
37. Poleg tega se podrobnejši pregled vseh starševskih (P) živali in živali F1 (po odstavitvi) izvede enkrat tedensko in se lahko primerno opravi takrat, ko se žival tehta, zaradi česar se zmanjša stres ob ravnanju z njo. Opazovanja je treba skrbno izvajati in beležiti z uporabo sistemov ocenjevanja, ki jih določi preskuševalni laboratorij. Prizadevati si je treba, da so variacije v preskusnih pogojih čim manjše. Pozornost je med drugim treba posvetiti vsem spremembam na koži, dlaki, očeh in sluznicah, pojavu sekrecije in ekskrecije ter delovanju avtonomnega živčevja (npr. solzenje, piloerekcija, velikost zenic, nenormalen vzorec dihanja). Prav tako je treba zabeležiti spremembe vedenja, drže in odzivanja na ravnanje, pa tudi navzočnost kloničnih ali toničnih gibov, stereotipije (npr. čezmerno čiščenje, nenehno vrtenje v krogih) ali nenormalnega vedenja (npr. samopohaba, zadenjska hoja).
Telesna teža in poraba hrane/vode
38. Starševske (P) živali se stehtajo prvi dan dajanja odmerkov in potem najmanj enkrat tedensko. Poleg tega se starševske (P) samice med laktacijo tehtajo na iste dneve, kot poteka tehtanje mladičev iz njihovega zaroda (glej odstavek 44). Vse živali F1 se stehtajo posamično ob odstavitvi (21. poporodni dan) in potem najmanj enkrat tedensko. Telesna teža se zabeleži tudi na dan nastopa pubertete (končano ločevanje prepucija ali pojav odprtja nožnice). Vse živali se stehtajo ob usmrtitvi.
39. Med študijo se poraba hrane in vode (v primeru dajanja preskusne kemikalije z vodo) beleži vsaj enkrat tedensko na iste dneve kot telesna teža živali (razen med obdobjem sobivanja). Poraba hrane vsake kletke živali F1 se beleži tedensko, začne pa se z dodelitvijo zadevni kohorti.
Pojatveni cikli
40. Predhodne informacije o učinkih na pojatveni cikel, povezanih s preskusno kemikalijo, so morda na voljo že iz prejšnjih študij strupenosti s ponavljajočim se odmerkom in se lahko uporabijo pri načrtovanju protokola za določeno preskusno kemikalijo za razširjeno enogeneracijsko študijo strupenosti za razmnoževanje. Običajno se ocenjevanje pojatvene cikličnosti (s citologijo nožnice) začne hkrati s tretiranjem in nadaljuje do potrditve o parjenju ali konca dvotedenskega obdobja parjenja. Če so bili pri samicah opravljeni presejalni preskusi glede normalnosti pojatvenih ciklov pred tretiranjem, je nadaljevanje jemanja brisa nožnice koristno tudi po začetku tretiranja; če pa obstajajo pomisleki glede splošnih učinkov ob začetku tretiranja (na primer izrazito zmanjšana poraba hrane na začetku), se lahko živalim omogoči največ dvotedensko obdobje prilagajanja na tretiranje pred začetkom dvotedenskega obdobja jemanja brisov, ki mu sledi parjenje. Če se s tem obdobje tretiranja samic podaljša (tj. na štiritedensko tretiranje pred parjenjem), bi bilo morda treba nabaviti mlajše živali in podaljšati obdobje tretiranja samcev pred parjenjem. Med jemanjem celic nožnice/materničnega vratu je treba paziti, da ne pride do poškodb sluznice in posledično do namišljene brejosti (10) (11).
41. Za vse samice F1 v kohorti 1A je brise nožnice treba pregledovati dnevno, po pojavu odprtja nožnice do prvega brisa s poroženelimi celicami, da bi določili časovni interval med tema dvema dogodkoma. Pojatvene cikle vseh samic F1 v kohorti 1A je prav tako treba spremljati dva tedna, s pričetkom okoli 75. poporodnega dne. Če bo potrebno parjenje generacije F1, je treba citologijo nožnice v kohorti 1B spremljati od časa parjenja do odkritja dokazov o parjenju.
Parjenje in brejost
42. Poleg standardnih končnih točk (npr. telesna teža, poraba hrane, klinična opazovanja vključno s preverjanjem smrtnosti/obolevnosti) je treba zabeležiti datume parjenja, datum oploditve in datum kotitve ter izračunati predkoitalni interval (od parjenja do oploditve) in trajanje brejosti (od oploditve do kotitve). V času pričakovane kotitve je treba starševske (P) samice skrbno pregledati za morebitne znake distocije. Morebitne nepravilnosti pri gnezdenju ali dojenju je treba zabeležiti.
43. Dan kotitve je dan laktacije 0 za mater in poporodni dan 0 za potomce. Namesto tega lahko vse primerjave temeljijo tudi na postkoitalnem obdobju, da ne bi prišlo do zamenjave podatkov o poporodnem razvoju zaradi razlik v času trajanja brejosti; treba pa je zabeležiti tudi čas kotitve. To je pomembno zlasti, kadar preskusna kemikalija vpliva na trajanje brejosti.
Parametri pri potomcih
44. Vsak zarod je treba proučiti čim prej po skotitvi (poporodni dan 0 ali 1. poporodni dan) ter ugotoviti število in spol mladičev, število mrtvorojenih in živorojenih živali ter navzočnost večjih nepravilnosti (navzven vidne nepravilnosti, vključno z razcepljenim nebom, podkožne krvavitve, neobičajna barva ali struktura kože, prisotnost popkovine, pomanjkanje mleka v želodcu, prisotnost suhih izločkov). Poleg tega mora biti v okviru prve klinične preiskave novorojenih živali opravljena kvalitativna ocena telesne temperature, aktivnosti in odzivanja na ravnanje. Mladiče, ki so najdeni mrtvi na poporodni dan 0 ali pozneje, je treba proučiti glede možnih okvar in vzroka smrti. Žive mladiče je treba prešteti in posamično stehtati na poporodni dan 0 ali 1. poporodni dan ter redno tehtati pozneje, npr. vsaj na 4., 7., 14. in 21. poporodni dan. Primerno starosti živali je treba klinične preglede ponoviti ob tehtanju potomcev oziroma pogosteje, če so bile ob kotitvi podane ugotovitve v zvezi s posameznimi primeri. Opaženi znaki lahko vključujejo, niso pa omejeni na zunanje nepravilnosti, spremembe na koži, dlaki, očeh in sluznicah, pojav sekrecije in ekskrecije ter delovanje avtonomnega živčevja. Prav tako je treba zabeležiti spremembe vedenja, drže in odzivanja na ravnanje, pa tudi pojav kloničnih ali toničnih gibov, stereotipije ali nenormalnega vedenja.
45. Zadnjično-genitalno razdaljo vsakega mladiča je treba izmeriti vsaj enkrat med poporodnim dnem 0 in 4. poporodnim dnem. Podatke o telesni teži mladičev je treba zbrati na dan, ko se meri zadnjično-genitalna razdalja, slednjo pa je treba normirati na mero velikosti mladiča, po možnosti kubični koren telesne teže (12). Mladiče moškega spola je treba za prisotnost bradavic in bradavičnih kolobarjev pregledati na 12. ali 13. poporodni dan.
46. Vsi izbrani mladiči F1 se dnevno pregledajo za ločitev prepucija od glavice penisa pri samcih oziroma pojav odprtja nožnice pri samicah, in sicer pred pričakovanim dnem teh končnih točk, da se ugotovi, ali do spolne zrelosti prihaja zgodaj. Morebitne nepravilnosti genitalnih organov, kot so trajni vaginalni filament, hipospadija ali razcepljen penis, je treba zabeležiti. Spolna zrelost živali F1 se primerja s fizičnim razvojem z določitvijo starosti in telesne teže ob ločitvi prepucija od glavice spolnega uda pri samcih oziroma pojavu vaginalne odprtine pri samicah (13).
Ocena morebitne razvojne nevrotoksičnosti (kohorti 2A in 2B)
47. Za oceno nevrotoksičnosti je treba uporabiti deset samcev in deset samic kohorte 2A ter deset samcev in deset samic kohorte 2B (za vsako kohorto: 1 samec ali 1 samica na leglo; iz vsakega legla je naključno izbran vsaj 1 mladič). Pri vsaki živali kohorte 2A se opravi ocena slušnega dražljaja, sklop funkcionalnih opazovanj, ocena motorične aktivnosti (glej odstavke 48–50) in nevropatološka ocena (glej odstavka 74–75). Prizadevati si je treba, da so variacije pri vseh preskusnih pogojih čim manjše in niso sistematično povezane s tretiranjem. Med spremenljivkami, ki lahko vplivajo na vedenje, so jakost zvoka (npr. občasni hrup), temperatura, vlaga, osvetlitev, vonji, čas dneva in motnje iz okolja. Rezultate preskusov nevrotoksičnosti je treba razlagati v povezavi z ustreznimi referenčnimi razponi preteklih kontrol. Živali kohorte 2B je treba uporabiti za nevropatološko oceno 21. ali 22. poporodni dan (glej odstavka 74–75).
48. Preskus slušnega dražljaja se opravi 24. poporodni dan (± 1 dan) z živalmi v kohorti 2A. Izvajanje preskušanja na dan preskušanja mora biti uravnoteženo po tretiranih in kontrolnih skupinah. Vsako preskušanje je sestavljeno iz 50 preskusov. Pri izvajanju preskusa slušnih dražljajev je treba določiti srednjo amplitudo odziva pri vsakem sklopu po 10 preskusov (5 sklopov po 10 preskusov), pri čemer morajo biti preskusni pogoji optimizirani za habituacijo znotraj preskušanja. Ti postopki morajo biti v skladu s preskusno metodo B.53 (35).
49. Ob primernem času med 63. in 75. poporodnim dnem se pri živalih iz kohorte 2A opravi sklop funkcionalnih opazovanj in avtomatizirani preskus motorične aktivnosti. Ti postopki morajo biti v skladu s preskusnima metodama B.43 (33) in B.53 (35). Sklop funkcionalnih opazovanj vključuje temeljit opis videza, vedenja in funkcionalne neokrnjenosti subjekta. To se oceni z opazovanjem v domači kletki, po prenosu na standardno mesto (na terenu), kjer se žival prosto giblje, in z gibalnimi preskusi. Preskušanje naj se izvaja od najmanj do najbolj interaktivnega. Seznam meril je naveden v Dodatku 1. Vse živali morajo skrbno opazovati usposobljeni opazovalci, ki niso seznanjeni s tretiranjem živali, in sicer po standardiziranih postopkih, s katerimi se zmanjša variabilnost opazovalca. Če je to mogoče, naj živali v zadevnem preskusu vrednoti isti opazovalec. Če to ni mogoče, je potreben dokaz o enaki zanesljivosti opazovalcev. Za vsak parameter v sklopu vedenjskega preskušanja je treba uporabiti izrecne operativno opredeljene lestvice in merila za točkovanje. Če je mogoče, je treba razviti objektivna kvantitativna merila za opazovane končne točke, ki vključujejo subjektivno razvrščanje. Za motorično aktivnost se vsaka žival preskuša posamično. Preskušanje mora biti dovolj dolgo, da se za kontrolne vzorce dokaže habituacija znotraj preskušanja. Motorično aktivnost je treba spremljati z avtomatizirano napravo za beleženje aktivnosti, ki lahko odkrije tako zmanjšanje kot tudi povečanje aktivnosti, (tj. osnovna aktivnost, kot jo izmeri naprava, ne sme biti tako nizka, da ni mogoče zaznati zmanjšanja, in ne tako visoka, da ni mogoče zaznati povečanja aktivnosti). Vsako napravo je treba preskusiti s standardnimi postopki, da je zagotovljeno čim bolj zanesljivo delovanje naprav vse dni. Preskušanje tretiranih skupin mora biti v največji možni meri uravnoteženo med napravami. Tretirane skupine morajo biti uravnoteženo razporejene po časih preskušanja, da se prepreči zavajajoči učinek cirkadianega ritma aktivnosti.
50. Če so v skladu z obstoječimi informacijami potrebni drugi funkcionalni preskusi (npr. senzorični, socialni, kognitivni), jih je treba vključiti, ne da bi bila pri tem ogrožena celovitost drugih vrednotenj v okviru študije. Če se ti preskusi izvajajo na istih živalih kot standardno preskušanje slušnega dražljaja, sklop funkcionalnih opazovanj in preskušanje motorične aktivnosti, je treba pripraviti časovni razpored različnih preskusov, da bi bila celovitost teh preskusov čim manj ogrožena. Dopolnilni postopki so lahko posebno koristni, kadar empirična opazovanja, pričakovani učinki ali mehanizem/način delovanja kažejo posebno vrsto nevrotoksičnosti.
Ocena morebitne razvojne nevrotoksičnosti (kohorta 3)
51. Na 56. poporodni dan (± 3 dni) je treba 10 samcev in 10 samic iz kohorte 3 iz vsake tretirane skupine (1 samec ali 1 samica na leglo; iz vsakega legla je naključno izbran vsaj 1 mladič) uporabiti v preskusu protitelesnega odziva na osnovi T-celic (TDAR), tj. primarni odziv protitelesa razreda IgM na antigen na osnovi T-celic, kot so SRBC (ovčje rdeče krvničke) ali KLH (hemocianin iz morskega polža), v skladu z veljavnimi postopki preskušanja imunotoksičnosti (14) (15). Odziv je mogoče ovrednotiti s štetjem celic, ki delajo plake (celice PFC), v vranici, ali določanjem titra protitelesa IgM, značilnega za SRBC ali KLH, v serumu s preskusom ELISA ob vrhuncu odziva. Vrhunec odziva je običajno štiri (odziv celic PFC) ali pet (preskus ELISA) dni po intravenozni imunizaciji. Če se primarni odziv protiteles preskuša s štetjem celic, ki delajo plake, ni treba vseh podskupin živali vrednotiti na isti dan, pod pogojem, da: so imunizacija in usmrtitev podskupin načrtovani tako, da se celice PFC prešteje ob vrhuncu odziva; je v podskupinah enako število potomcev moškega in ženskega spola iz vseh skupin z odmerkom, vključno s kontrolnimi skupinami; in so podskupine vrednotene približno ob isti poporodni starosti. Izpostavljenost preskusni kemikaliji se nadaljuje do dneva pred odvzemom vranic za preskus odziva celic PFC ali seruma za preskus ELISA.
Nadaljnja ocena morebitne strupenosti za razmnoževanje (kohorta 1B)
52. Živali iz kohorte 1B se lahko po potrebi tretirajo še po 90. poporodnem dnevu in parijo za produkcijo generacije F2. Samce in samice iz iste skupine z odmerkom je treba namestiti skupaj (pri tem se je treba izogibati parjenju med sorojenci) do največ dva tedna, ki se začneta na 90. poporodni dan ali pozneje, vendar ne pozneje od 120. poporodnega dne. Postopki morajo biti podobni kot pri starševskih (P) živalih. Glede na tehtnost dokazov pa se legla morda lahko usmrtijo na 4. poporodni dan, namesto da bi se jih spremljalo do odstavitve ali še dlje.
OPAZOVANJA OB USMRTITVI
Klinična biokemija/hematologija
53. Pri starševskih (P) živalih je treba spremljati sistemske učinke. Ob usmrtitvi se desetim naključno izbranim starševskim (P) samcem in samicam na skupino z odmerkom, ki so se postili, vzamejo vzorci krvi z določenega mesta, ki se nato shranijo pod ustreznimi pogoji in na katerih se opravijo delne ali popolne hematološke preiskave, klinične biokemijske preiskave, preskusa za T4 in TSH ali drugi pregledi na podlagi profila znanih učinkov preskusne kemikalije (glej Smernico OECD št. 151 (40)). Pregledati je treba naslednje hematološke parametre: hematokrit, koncentracijo hemoglobina, število eritrocitov, skupno število levkocitov in diferencialno sliko levkocitov, število trombocitov in čas/potencial koagulacije krvi. Preiskave plazme ali seruma morajo vključevati: glukozo, skupni holesterol, sečnino, kreatinin, skupne beljakovine, albumin in najmanj dva encima, ki sta kazalnika hepatoceličnih učinkov (kot so alanin-aminotransferaza, aspartat-aminotransferaza, alkalna fosfataza, gamaglutamil transpeptidaza in sorbitol dehidrogenaza). Meritve dodatnih encimov in žolčnih kislin lahko včasih dajo koristne informacije. Poleg tega se lahko vsem živalim tudi odvzame kri in se shrani za morebitno poznejšo analizo, da se razjasnijo dvoumni učinki ali zberejo podatki o notranji izpostavljenosti. Če drugo parjenje starševskih (P) živali ni načrtovano, se vzorci krvi zberejo tik pred postopkom ob načrtovani usmrtitvi ali v sklopu le-tega. Če se živali ne usmrtijo, se vzorce krvi odvzame nekaj dni pred drugim parjenjem živali. Razen če je na podlagi obstoječih podatkov iz študij s ponavljajočim se odmerkom razvidno, da preskusna kemikalija ne vpliva na parameter, je treba pred usmrtitvijo opraviti analizo urina in ovrednotiti naslednje parametre: videz, količino, osmolalnost ali specifično težo, pH, beljakovine, glukozo, kri in krvne celice ter celični drobir. Odvzame se lahko tudi urin za spremljanje ekskrecije preskusne kemikalije in/ali metabolitov.
54. Pri živalih F1 je treba spremljati tudi sistemske učinke. Ob usmrtitvi se desetim naključno izbranim samcem in samicam iz kohorte 1A na skupino z odmerkom, ki so se postili, vzamejo vzorci krvi z določenega mesta, ki se nato shranijo pod ustreznimi pogoji in na katerih se opravijo standardne klinične biokemijske preiskave, vključno z oceno serumske koncentracije hormonov ščitnice (T4 in TSH), hematološke preiskave (skupno število in diferencialna slika levkocitov ter število eritrocitov) in analiza urina.
55. Na 4. poporodni dan se odvečne mladiče makroskopsko obducira in upoštevajo se meritve serumske koncentracije hormona ščitnice (T4). Po potrebi se zarodu odvzame kri novorojenih mladičev (4. poporodni dan) za biokemično analizo/analizo hormonov ščitnice. Za analizo T4 in TSH se kri odvzame tudi odstavljenim mladičem, ki se jih makroskopsko obducira na 22. poporodni dan (mladiči F1, ki niso izbrani za kohorte).
Parametri semena
56. Parametre semena se meri pri vseh samcih generacije P, razen če obstajajo podatki, ki dokazujejo, da so v 90-dnevni študiji parametri semena nespremenjeni. Pregled parametrov semena se opravi pri vseh samcih iz kohorte 1A.
57. Ob usmrtitvi se pri vseh starševskih (P) samcih in samcih F1 (kohorta 1A) zabeleži teža moda in obmodka. Vsaj eno modo in en obmodek se shrani za histopatološki pregled. Drugi obmodek se uporabi za štetje zalog semena v repu obmodka (16) (17). Poleg tega se odvzame seme iz repov obmodkov (ali semenovodov) z metodami, pri katerih so poškodbe za ovrednotenje gibljivosti in morfologije semena kar najmanjše (18).
58. Gibljivost semena je treba ovrednotiti takoj po usmrtitvi ali zabeležiti za poznejšo analizo. Odstotek progresivno gibljivega semena je treba subjektivno ali objektivno določiti z analizo gibanja s pomočjo računalnika (19) (20) (21) (22) (23) (24). Za morfološko ovrednotenje semena je treba vzorce semena iz obmodka (ali semenovoda) proučiti kot fiksirane ali mokre preparate (25) in najmanj 200 semenčic na vzorec razvrstiti kot normalne (glavica in srednji del/repek so videti normalno) ali nenormalne. Primeri morfoloških anomalij semena vključujejo spojitev, ločene glavice ter glavice in/ali repke nepravilnih oblik (26). Glavice nepravilne oblike ali velike glavice lahko kažejo na okvare pri sprostitvi spermatidov v obmodek.
59. Če se ob obdukciji zamrznejo vzorci semena, fiksirajo brisi in posnamejo posnetki za analizo gibljivosti semena (27), se lahko naknadno analizirajo le samci iz kontrolne skupine in skupin z velikim odmerkom. Če so opazni učinki, povezani s tretiranjem, je treba ovrednotiti tudi skupine z manjšim odmerkom.
Makroskopska obdukcija
60. Ob usmrtitvi ali prezgodnji smrti se vse starševske (P) živali in živali F1 makroskopsko obducirajo in makroskopsko pregledajo za odkrivanje kakršnih koli strukturnih anomalij ali patoloških sprememb. Posebno pozornost je treba posvetiti organom razmnoževalnega sistema. Mladiče, ki so humano usmrčeni med poginjanjem, in mrtve mladiče je treba zabeležiti in, če se ne macerirajo, proučiti glede možnih okvar in/ali vzroka smrti ter konzervirati.
61. Pri odraslih starševskih (P) samicah in samicah F1 se na dan obdukcije pregleda bris nožnice, da se ugotovi faza pojatvenega cikla in omogoči korelacija s histopatološkimi preiskavami razmnoževalnih organov. Maternice vseh starševskih (P) samic (in po potrebi samic F1) se pregledajo glede navzočnosti in števila vgnezditev na način, ki nima negativnega vpliva na histopatološko ovrednotenje.
Teža organov in shranjevanje tkiv – odrasle starševske (P) živali in odrasle živali F1
62. Po usmrtitvi se čim prej po seciranju, da ne pride do izsušitve, določita telesna teža in mokra teža v nadaljevanju navedenih organov vseh starševskih (P) živali in odraslih živali F1 iz zadevnih kohort (kakor je navedeno v nadaljevanju). Ti organi se nato shranijo pod ustreznimi pogoji. Če ni navedeno drugače, se lahko parni organi stehtajo posamično ali skupaj, v skladu z običajno prakso zadevnega laboratorija.
|
— |
Maternica (z jajcevodoma in materničnim vratom), jajčniki. |
|
— |
Moda, obmodki (v celoti in repi za vzorce za štetje semena). |
|
— |
Prostata (dorzolateralni in ventralni del skupaj). Pri odstranitvi sklopa prostate je treba paziti, da se ne predreta semenska mešička, ki sta polna tekočine. V primeru učinka na skupno težo prostate, povezanega s tretiranjem, je treba po fiksaciji previdno secirati dorzolateralni in ventralni segment in ju ločeno stehtati. |
|
— |
Semenska mešička s koagulacijskimi žlezami in njihovimi tekočinami (kot ena enota). |
|
— |
Možgani, jetra, ledvice, srce, vranica, priželjc, hipofiza, ščitnica (po fiksaciji), nadledvični žlezi in znani tarčni organi ali tkiva. |
63. Poleg navedenih organov je treba pod ustreznimi pogoji shraniti vzorce perifernega živca, mišice, hrbtenjače, očesa z vidnim živcem, prebavnega trakta, sečnega mehurja, pljuč, sapnika (s pritrjeno ščitnico in obščitnicami), kostnega mozga, semenovoda (pri samcih), mlečnih žlez (pri samcih in samicah) in nožnice.
64. Pri živalih kohorte 1A se vsi organi stehtajo in shranijo za histopatološke preiskave.
65. Pri preiskavi pred- in poporodno povzročenih imunotoksičnih učinkov se pri 10 samcih in 10 samicah iz kohorte 1A iz vsake tretirane skupine (1 samec ali 1 samica na leglo; iz vsakega legla je naključno izbran vsaj 1 mladič) ob usmrtitvi opravi naslednje:
|
— |
tehtanje bezgavk, ki so blizu predela poti izpostavljenosti, in tistih, ki so od njega oddaljene (poleg tehtanja nadledvičnih žlez, priželjca in vranice, ki je bilo pri vseh živalih iz kohorte 1A že opravljeno), |
|
— |
analiza podskupin limfocitov v vranici (limfocitov T s površinskim označevalcem CD4+ in CD8+, limfocitov B in naravnih celic ubijalk) v eni polovici vranice, druga polovica se shrani za histopatološko ovrednotenje. |
Z analizo podskupin limfocitov v vranici pri neimuniziranih živalih (kohorta 1A) se bo ugotovilo, ali je izpostavljenost povezana s spremembo imunološke razporeditve celic 'pomagalk' (CD4+), citotoksičnih (CD8+) limfocitov iz priželjca ali naravnih celic ubijalk (hiter odziv na neoplastične celice in patogene).
66. Pri živalih iz kohorte 1B se stehtajo in do vklapljanja v blok obdelajo naslednji organi in tkiva:
|
— |
nožnica (nestehtana), |
|
— |
maternica z materničnim vratom, |
|
— |
jajčniki, |
|
— |
moda (vsaj eno), |
|
— |
obmodki, |
|
— |
semenski mešički in koagulacijske žleze, |
|
— |
prostata, |
|
— |
hipofiza, |
|
— |
opredeljeni tarčni organi. |
Histopatološke preiskave pri kohorti 1B se izvedejo, če so rezultati iz kohorte 1A dvoumni, ali v primeru domnevnih strupenih snovi za razmnoževanje ali domnevnih povzročiteljev endokrinih motenj.
67. Kohorti 2A in 2B: Preskušanje razvojne nevrotoksičnosti (21. ali 22. poporodni dan in odrasli potomci). Živali iz kohorte 2A je treba po vedenjskem preskušanju usmrtiti, zabeležiti težo možganov in izvesti popolne nevrohistopatološke preiskave zaradi ocene nevrotoksičnosti. Živali iz kohorte 2B se usmrtijo 21. ali 22. poporodni dan, zabeleži se teža možganov in izvede mikroskopski pregled možganov za oceno nevrotoksičnosti. Fiksiranje s perfuzijo je zahtevano pri živalih iz kohorte 2A in neobvezno pri živalih iz kohorte 2B, kot to določa preskusna metoda B.53 (35).
Teža organov in shranjevanje tkiv – odstavljeni mladiči F1
68. Mladiči, ki niso izbrani za kohorte, vključno s spački, so po odstavitvi, na 22. poporodni dan, usmrčeni, razen če so na podlagi rezultatov potrebne nadaljnje preiskave živih živali. Na usmrčenih mladičih se izvede makroskopska obdukcija in ocenijo razmnoževalni organi, kakor je opisano v odstavkih 62 in 63. Pri največ 10 mladičih na spol na skupino iz čim več zarodov je treba stehtati možgane, vranico in priželjc ter jih shraniti pod ustreznimi pogoji. Poleg tega se lahko tkiva mlečnih žlez teh mladičev moškega in ženskega spola shranijo za nadaljnjo mikroskopsko analizo (13) (glej Smernico OECD št. 151 (40)). Večje nepravilnosti in tarčna tkiva je treba shraniti za morebiten histološki pregled.
Histopatologija – starševske (P) živali
69. Popolni histopatološki pregled iz odstavkov 62 in 63 se opravi za vse starševske (P) živali iz skupin z velikim odmerkom in kontrolnih skupin. Organe, pri katerih so vidne spremembe zaradi tretiranja, je prav tako treba pregledati pri vseh živalih iz skupin z manjšimi odmerki za pomoč pri določanju NOAEL. Poleg tega se histopatološko ovrednotijo razmnoževalni organi vseh živali, za katere se domneva zmanjšana plodnost, npr. pri tistih, ki se niso mogli spariti, spočeti, zaploditi ali skotiti zdravih potomcev, ali pri katerih so bili prizadeti cikličnost pojatev ali število, gibljivost ali morfologija semena, in vse makroskopske poškodbe.
Histopatologija – živali F1
Živali iz kohorte 1
70. Popolni histopatološki pregled iz odstavkov 62 in 63 se opravi za vse odrasle živali iz skupin z velikim odmerkom in kontrolnih skupin iz kohorte 1A. Iz vsakega legla se uporabi vsaj 1 mladič vsakega spola. Vse makroskopske poškodbe ter organe in tkiva, pri katerih so vidne spremembe zaradi tretiranja, je treba pregledati tudi pri vseh živalih iz skupin z manjšimi odmerki za pomoč pri določanju NOAEL. Za vrednotenje pred- in poporodno povzročenih učinkov na limfoidne organe je treba poleg histopatološkega vrednotenja priželjca, vranice in nadledvičnih žlez, ki se opravi pri vseh živalih iz kohorte 1A, pri 10 samcih in 10 samicah iz kohorte 1A opraviti tudi histopatološko vrednotenje na odvzetih bezgavkah in kostnem mozgu.
71. Pri razmnoževalnih in endokrinih tkivih vseh živali iz kohorte 1B, obdelanih do vklapljanja v blok v skladu z odstavkom 66, je treba v primeru domnevnih strupenih snovi za razmnoževanje ali domnevnih povzročiteljev endokrinih motenj opraviti histopatološke preglede. Živali iz kohorte 1B se histološko pregledajo tudi v primeru, da so rezultati iz kohorte 1A dvoumni.
72. Jajčniki odraslih samic bi morali vsebovati začetne in rastoče folikle, pa tudi rumena telesca; histopatološki pregled bi zato moral biti namenjen količinskemu vrednotenju začetnih in majhnih rastočih foliklov ter rumenih telesc pri samicah F1; število živali, izbira rezine jajčnika in velikost vzorca rezine morajo biti statistično ustrezni za uporabljeni postopek vrednotenja. Štetje foliklov se lahko najprej izvede na živalih iz kontrolnih skupin in skupin z velikim odmerkom, v primeru škodljivih učinkov pri slednjih pa je treba proučiti tudi nižje odmerke. Pregled mora vključevati štetje števila začetnih foliklov, ki se lahko kombinirajo z majhnimi rastočimi folikli, za primerjavo tretiranih in kontrolnih jajčnikov (glej Smernico OECD št. 151) (40)). Oceno rumenih telesc je treba izvesti vzporedno s preskušanjem cikličnosti pojatev, tako da se lahko faza cikla upošteva pri vrednotenju. Preveriti je treba, ali so se jajcevod, maternica in nožnica ustrezno razvili.
73. Pri samcih F1 se izvedejo podrobni histopatološki pregledi mod, da bi se ugotovili učinki na diferenciacijo in razvoj mod ter na spermatogenezo, povezani s tretiranjem (38). Če je mogoče, je treba pregledati rezine mrežja mod. Preveriti je treba, ali so se glava, telo in rep obmodkov in semenovod ustrezno razvili, pa tudi parametre za te organe, zahtevane za starševske (P) samce.
Živali iz kohorte 2
74. Za vse skupine z velikimi odmerki in kontrolne skupine živali iz kohorte 2A se po končanem preskušanju za nevrološko-vedenjske motnje (po 75. poporodnem dnevu, vendar ne po 90. poporodnem dnevu) opravijo nevrohistopatološki pregledi pri obeh spolih. Histopatološki pregled možganov se pri vseh skupinah z velikimi odmerki in kontrolnih skupinah živali kohorte 2B pri obeh spolih opravi na 21. ali 22. poporodni dan. Organe ali tkiva, pri katerih so vidne spremembe zaradi tretiranja, je prav tako treba pregledati pri vseh živalih iz skupin z manjšimi odmerki za pomoč pri določanju NOAEL. Pri živalih iz kohort 2A in 2B se pregleda več rezin možganov, pri čemer se pregledajo vohalni bulbus, možganska skorja, hipokampus, bazalni gangliji, talamus, hipotalamus, srednji možgani (tectum, tegmentum in možganski pedunkli), možgansko deblo in mali možgani. Samo pri živalih iz kohorte 2A se pregledajo oči (mrežnica in vidni živec) ter vzorci perifernega živca, mišice in hrbtenjače. Vsi nevrohistološki postopki morajo biti v skladu s preskusno metodo B.53 (35).
75. Morfometrična (kvantitativna) vrednotenja je treba opraviti na reprezentativnih območjih možganov (homolognih rezinah, skrbno izbranih na podlagi zanesljivih mikroskopskih znakov) in lahko vključujejo linearne in/ali površinske meritve določenih predelov možganov. Da bi se izbrala najbolj homologna in reprezentativna rezina za določen predel možganov, ki se bo vrednotil, je treba vzeti vsaj tri zaporedne rezine pri vsakem znaku (ravni). Nevropatolog bi moral ustrezno presoditi, ali so rezine, pripravljene za meritev, homologne z drugimi v vzorcu in torej primerne za uporabo, ker se lahko zlasti linearne meritve spreminjajo na relativno kratki razdalji (28). Nehomologne rezine se ne smejo uporabiti. Cilj je vzorčenje vseh živali, ki so za to namenjene (10/spol/velikost odmerka), vendar lahko zadošča tudi manjše število živali. Vzorci, manjši od 6 živali/spol/velikost odmerka, na splošno ne zadoščajo za namene te preskusne metode. S stereologijo se lahko opredelijo s tretiranjem povezani učinki na parametre, kot je količina ali število celic za določene nevroanatomske predele. Vsi vidiki priprave vzorcev tkiva, od fiksacije tkiva do seciranja vzorcev tkiva, obdelave tkiva in barvanja preparatov, bi morali biti načrtovani uravnoteženo, tako da vsaka serija vsebuje reprezentativne vzorce vsake skupine z odmerkom. Pri uporabi morfometrične ali stereološke analize je treba možgansko tkivo vstaviti v ustrezen medij pri vseh velikostih odmerka hkrati, da se ne bi pojavili artefakti zaradi skrčenja, povezani z dolgotrajno hrambo v fiksativu.
POROČANJE
Podatki
76. Podatki se sporočajo posamično in se povzamejo v obliki tabele. Kadar je to mogoče, se za vsako skupino in vsako generacijo sporočijo naslednji podatki: število živali na začetku preskusa, število živali, najdenih poginulih ali usmrčenih iz humanih razlogov med preskusom, čas katere koli smrti ali humane usmrtitve, število plodnih živali, število brejih samic, število samic, ki so skotile zarod, in število živali, ki kažejo znake strupenosti. Sporočiti je treba opis strupenosti, vključno s časom njenega začetka, trajanja in resnosti.
77. Številčni rezultati se morajo oceniti z ustrezno in sprejeto statistično metodo. Statistične metode je treba določiti pri načrtovanju študije; ustrezno morajo obravnavati nenormalne podatke (npr. podatke štetja), okrnjene podatke (npr. omejen čas opazovanja), odvisnost (npr. učinki na zarod in ponovljeni ukrepi) in neenake variance. Posplošeni linearni mešani modeli in modeli odziva na odmerek obsegajo obsežen sklop analitičnih orodij, ki so morda primerni za podatke, pridobljene na podlagi te preskusne metode. Poročilo mora vključevati dovolj informacij o metodi analize in uporabljenem računalniškem programu, tako da lahko neodvisni ocenjevalec/statistik ovrednoti/ponovno ovrednoti analizo.
Vrednotenje rezultatov
78. Ugotovitve je treba ovrednotiti glede na opažene učinke, vključno z obdukcijo in mikroskopskimi ugotovitvami. Vrednotenje vključuje razmerje ali odsotnost razmerja med odmerkom ter navzočnostjo, pojavom in resnostjo anomalij, vključno z makroskopskimi poškodbami. Oceniti je treba tudi tarčne organe, plodnost, klinične anomalije, zmogljivost razmnoževanja in produkcije zaroda, spremembe telesne teže, učinke na smrtnost ter druge strupene učinke in učinke na razvoj. Posebno pozornost je treba nameniti spremembam, omejenim na en spol. Pri vrednotenju rezultatov je treba upoštevati fizikalno-kemijske lastnosti preskusne kemikalije in, če so na voljo, podatke o toksikokinetiki, vključno s prenosom prek posteljice in izločanjem mleka.
Poročilo o preskusu
79. Poročilo o preskusu naj vsebuje naslednje informacije, pridobljene s to študijo s pomočjo starševskih (P) živali, živali F1 in živali F2 (kot je ustrezno):
Preskusna kemikalija:
|
— |
vse zadevne razpoložljive informacije o kemikaliji, toksikokinetičnih in toksikodinamičnih lastnostih preskusne kemikalije, |
|
— |
identifikacijske podatke, |
|
— |
čistoto. |
Nosilec (po potrebi):
|
— |
utemeljitev izbire nosilca, če ta ni voda. |
Preskusne živali:
|
— |
uporabljeno vrsto/sev, |
|
— |
število, starost in spol živali, |
|
— |
izvor, pogoje nastanitve, hrano, material za izdelavo gnezda itd., |
|
— |
težo posameznih živali na začetku preskusa, |
|
— |
podatke o vaginalnem brisu za starševske (P) samice pred pričetkom tretiranja (če so bili podatki takrat zbrani), |
|
— |
evidenco parjenja starševske (P) generacije z navedbo samca in samice, ki sta se parila, in uspešnost parjenja, |
|
— |
evidenco o leglu izvora za odrasle živali generacije F1. |
Preskusni pogoji:
|
— |
utemeljitev izbire velikosti odmerka, |
|
— |
podatke o sestavi preskusne kemikalije/pripravi hrane, doseženih koncentracijah, |
|
— |
stabilnost in homogenost pripravka v nosilcu (npr. prehrani, pitni vodi), v krvi in/ali mleku pod pogoji uporabe in hrambe med uporabami, |
|
— |
podrobne podatke o dajanju preskusne kemikalije, |
|
— |
pretvorbo koncentracije preskusne kemikalije v hrani/pitni vodi (ppm) v dejanski odmerek (mg/kg telesne teže/dan), če je primerno, |
|
— |
podrobne podatke o kakovosti hrane in vode (vključno s podatki o sestavi prehrane, če so na voljo), |
|
— |
podroben opis postopkov randomizacije za izbiro mladičev za izločitev in dodelitev mladičev v preskusne skupine, |
|
— |
okoljske pogoje, |
|
— |
seznam osebja, ki je sodelovalo v študiji, vključno s strokovno usposobljenostjo. |
Rezultati (povzetek in posamični podatki po spolu in odmerku):
|
— |
porabo hrane in porabo vode, če je na voljo, izkoristek hrane (prirast telesne teže na gram zaužite hrane, razen za obdobje sobivanja in med laktacijo) in porabo preskusne kemikalije (za dajanje s hrano/pitno vodo) za starševske (P) živali in živali F1, |
|
— |
podatke o absorpciji (če so na voljo), |
|
— |
podatke o telesni teži za starševske (P) živali, |
|
— |
podatke o telesni teži za izbrane živali F1 po odstavitvi, |
|
— |
čas smrti med študijo oziroma ali podatek o tem, da so živali preživele do zaključka, |
|
— |
vrsto, resnost in trajanje kliničnih opažanj (s podatki o reverzibilnosti), |
|
— |
podatke hematoloških preskusov, analize urina in podatke meritev na področju klinične kemije, vključno s TSH in T4, |
|
— |
fenotipsko analizo vraničnih celic (celic T, B, NK), |
|
— |
celularnosti kostnega mozga, |
|
— |
podatke o odzivu na strupenost, |
|
— |
število starševskih (P) samic in samic F1 z normalnim ali nenormalnim pojatvenim ciklom in trajanje cikla, |
|
— |
čas do parjenja (predkoitalni interval, število dni med parjenjem in oploditvijo), |
|
— |
strupene ali druge učinke na razmnoževanje, vključno s številom in odstotkom živali, ki so se sparile, bile breje, so skotile in dosegle laktacijo, odstotkom samcev, ki so oplodili samico, in samic z znaki distocije/podaljšano ali zahtevno kotitvijo, |
|
— |
trajanje brejosti in, če so podatki na voljo, kotitve, |
|
— |
število vgnezditev, velikost zaroda in odstotek mladičev moškega spola, |
|
— |
število in odstotek izgub po vgnezditvi, živorojenih in mrtvorojenih živali, |
|
— |
podatke o teži zaroda in posameznih mladičev (samcev, samic in obeh spolov), število spačkov, če je ugotovljeno, |
|
— |
število mladičev z večjimi vidnimi anomalijami, |
|
— |
strupene ali druge učinke na potomce, poporodno rast, sposobnost preživetja itd., |
|
— |
podatke o fizičnih znakih pri mladičih in druge podatke o poporodnem razvoju, |
|
— |
podatke o spolnem zorenju živali F1, |
|
— |
podatke o opazovanju funkcij pri mladičih in odraslih, kot je primerno, |
|
— |
telesno težo ob usmrtitvi in podatke o absolutni in relativni teži organov za starševske (P) živali in odrasle živali F1, |
|
— |
ugotovitve obdukcije, |
|
— |
natančen opis vseh histopatoloških ugotovitev, |
|
— |
skupno število semena v repu obmodka, odstotek progresivno gibljivega semena, odstotek morfološko normalnega semena in odstotek semena z ugotovljeno posamezno anomalijo za starševske (P) samce in odrasle samce F1, |
|
— |
število in faze zrelosti foliklov v jajčnikih starševskih (P) samic in samic F1, če je primerno, |
|
— |
število rumenih telesc v jajčnikih samic F1, |
|
— |
statistično obdelavo rezultatov, če je to primerno. |
Parametri kohorte 2:
|
— |
podroben opis postopkov za standardiziranje opažanj in postopkov ter operativne opredelitve za ocenjevanje opažanj, |
|
— |
seznam vseh uporabljenih preskusnih postopkov in utemeljitev njihove uporabe, |
|
— |
podrobnosti o uporabljenih vedenjskih/funkcionalnih, nevropatoloških in morfometričnih postopkih, vključno z informacijami in podrobnostmi o avtomatiziranih napravah, |
|
— |
postopke za umerjanje in zagotavljanje enakovrednosti naprav ter uravnoteženje tretiranih skupin v preskusnih postopkih, |
|
— |
kratko utemeljitev, s katero se pojasnijo odločitve na podlagi strokovne presoje, |
|
— |
podrobnosti o vseh vedenjskih/funkcionalnih, nevropatoloških in morfometričnih ugotovitvah po spolu in skupini z odmerkom, vključno s povečanji in zmanjšanji iz kontrolnih skupin, |
|
— |
težo možganov, |
|
— |
morebitne diagnoze na podlagi nevroloških znakov in poškodb, vključno z naravnimi pojavi bolezni ali stanj, |
|
— |
slike vzorčnih ugotovitev, |
|
— |
slike majhne povečave za ocenjevanje homologije rezin, uporabljenih za morfologijo, |
|
— |
statistično obdelavo rezultatov, vključno s statističnimi modeli, uporabljenimi za analizo podatkov, in rezultate, ne glede na to, ali so bili značilni ali ne, |
|
— |
odnos katerih koli drugih strupenih učinkov do sklepne ugotovitve o nevrotoksičnem potencialu preskusne kemikalije, po spolu in skupini z odmerkom, |
|
— |
vpliv katerih koli informacij o toksikokinetiki na sklepne ugotovitve, |
|
— |
podatke, ki podpirajo zanesljivost in občutljivost preskusne metode (tj. podatke o pozitivni kontroli in pretekle kontrolne podatke), |
|
— |
odnose, če obstajajo, med nevropatološkimi in funkcionalnimi učinki, |
|
— |
NOAEL ali primerjalni odmerek za matere in potomce, po spolu in skupini z odmerkom, |
|
— |
razpravo o celotni razlagi podatkov na podlagi rezultatov, vključno s sklepno ugotovitvijo o tem, ali je kemikalija povzročila razvojno nevrotoksičnost, in NOAEL. |
Parametri kohorte 3:
|
— |
titre serumskih protiteles IgM (senzibilizacija na SRBC ali KHL) ali vraničnih enot IgM PFC (senzibilizacija na SRBC), |
|
— |
izvajanje metode TDAR morajo v okviru procesa optimizacije potrditi laboratorij, ki prvič izvaja preskus, in redno (npr. letno) vsi laboratoriji, |
|
— |
razpravo o celotni razlagi podatkov na podlagi rezultatov, vključno s sklepno ugotovitvijo o tem, ali je kemikalija povzročila razvojno imunotoksičnost, in NOAEL. |
Razprava o rezultatih
Sklepne ugotovitve, tudi vrednosti brez opaznih škodljivih učinkov pri starših in potomcih
Zagotoviti je treba tudi vse informacije, ki niso bile pridobljene med študijo, ampak so uporabne za razlago rezultatov (npr. podobnost učinkov z učinki znanih nevrotoksinov).
Razlaga rezultatov
80. Razširjena enogeneracijska študija strupenosti za razmnoževanje po potrebi zagotavlja informacije o učinkih ponovne izpostavljenosti kemikaliji med vsemi fazami reprodukcijskega cikla. Študija zlasti zagotavlja informacije o razmnoževalnem sistemu ter o končnih točkah razvoja, rasti, preživetja in delovanja potomcev do 90. poporodnega dne.
81. Pri razlagi rezultatov je treba upoštevati vse razpoložljive informacije o kemikaliji, vključno s fizikalno-kemijskimi, toksikokinetičnimi in toksikodinamičnimi lastnostmi, razpoložljive zadevne informacije o strukturnih analogih in rezultate iz predhodno izvedenih študij strupenosti s preskusno kemikalijo (npr. akutno strupenost, strupenost po ponovnih aplikacijah, mehanistične študije ter študije za ocenjevanje znatnih kvalitativnih in kvantitativnih razlik med vrstami med presnovnimi lastnostmi in vivo/in vitro). Rezultate makroskopske obdukcije in tehtanja organov je treba oceniti v smislu ugotovitev iz drugih študij s ponavljajočimi se odmerki, kadar je to izvedljivo. Zmanjšano rast potomcev je mogoče obravnavati v zvezi z učinkom preskusne kemikalije na sestavo mleka (29).
Kohorta 2 (razvojna nevrotoksičnost)
82. Rezultate nevrovedenjske in nevropatološke analize je treba razlagati v okviru vseh ugotovitev z analizo, ki temelji na tehtnosti dokazov, in strokovno presojo. Potrebna je razprava o vzorcih vedenjskih ali morfoloških ugotovitev, če so prisotni, in dokazih odziva na odmerek. V to opredelitev je treba vključiti vrednotenje razvojne nevrotoksičnosti, vključno z epidemiološkimi študijami na ljudeh ali poročili o primerih, in eksperimentalne študije na živalih (npr. podatki o toksikokinetiki, informacije o razmerju med strukturo in aktivnostjo, podatki iz drugih študij strupenosti). V vrednotenje podatkov je treba vključiti razpravo o biološki in statistični značilnosti. Vrednotenje naj vključuje odnos med ugotovljenimi nevropatološkimi in vedenjskimi spremembami, če obstaja. Za navodila o razlagi rezultatov o razvojni nevrotoksičnosti glej preskusno metodo B.53 (35) in Tyl et al., 2008 (31).
Kohorta 3 (razvojna imunotoksičnost)
83. V okviru vseh ugotovitev je treba ovrednotiti zaviranje ali krepitev imunskega sistema, kakor je ocenjena s TDAR (protitelesni odziv na osnovi T-celic). Pomembnost rezultata odziva protiteles, odvisnega od celic T, lahko podprejo drugi učinki na imunološko povezane kazalnike (npr. celularnost kostnega mozga, teža in histopatološke preiskave limfoidnih tkiv, razporeditev podskupin limfocitov). Učinki, ugotovljeni na podlagi odziva protiteles, odvisnega od celic T, morda ne bodo tako pomembni v primeru drugih ugotovljenih strupenosti pri nizkih koncentracijah izpostavljenosti.
84. Za pomoč pri razlagi rezultatov o razmnoževanju in nevrotoksičnosti glej Smernico OECD št. 43 (26).
VIRI
|
(1) |
Cooper, R.L., J.C. Lamb, S.M. Barlow, K. Bentley, A.M. Brady, N. Doerr, D.L. Eisenbrandt, P.A. Fenner-Crisp, R.N. Hines, L.F.H. Irvine, C.A. Kimmel, H. Koeter, A.A. Li, S.L. Makris, L.P. Sheets, G.J.A. Speijers and K.E. Whitby (2006), 'A Tiered Approach to Life Stages Testing for Agricultural Chemical Safety Assessment', Critical Reviews in Toxicology, 36, 69–98. |
|
(2) |
Thigpen, J.E., K.D.R. Setchell, K.B. Ahlmark, J. Locklear, T. Spahr, G.F. Leviness, M.F. Goelz, J.K. Haseman, R.R. Newbold, and D.B. Forsythe (1999), ‚Phytoestrogen Content of Purified Open and Closed Formula Laboratory Animal Diets‘, Lab. Anim. Sci., 49, 530–536. |
|
(3) |
Zoetis, T. and I. Walls (2003), Principles and Practices for Direct Dosing of Pre-Weaning Mammals in Toxicity Testing and Research, ILSI Press, Washington, DC. |
|
(4) |
Moser, V.C., I. Walls and T. Zoetis (2005), ‚Direct Dosing of Preweaning Rodents in Toxicity Testing and Research: Deliberations of an ILSI RSI Expert Working Group‘, International Journal of Toxicology, 24, 87–94. |
|
(5) |
Conolly, R.B., B.D. Beck, and J.I. Goodman (1999), ‚Stimulating Research to Improve the Scientific Basis of Risk Assessment‘, Toxicological Sciences, 49, 1–4. |
|
(6) |
Ulbrich, B. and A.K. Palmer (1995), ‚Detection of Effects on Male Reproduction – a Literature Survey‘, Journal of the American College of Toxicologists, 14, 293–327. |
|
(7) |
Mangelsdorf, I., J. Buschmann and B. Orthen (2003), ‚Some Aspects Relating to the Evaluation of the Effects of Chemicals on Male Fertility‘, Regulatory Toxicology and Pharmacology, 37, 356–369. |
|
(8) |
Sakai, T., M. Takahashi, K. Mitsumori, K. Yasuhara, K. Kawashima, H. Mayahara and Y. Ohno (2000). ‚Collaborative work to evaluate toxicity on male reproductive organs by repeated dose studies in rats – overview of the studies‘, Journal of Toxicological Sciences, 25, 1–21. |
|
(9) |
Creasy, D.M. (2003), ‚Evaluation of Testicular Toxicology: A Synopsis and Discussion of the Recommendations Proposed by the Society of Toxicologic Pathology‘, Birth Defects Research, Part B, 68, 408–415. |
|
(10) |
Goldman, J.M., A.S. Murr, A.R. Buckalew, J.M. Ferrell and R.L. Cooper (2007), ‚The Rodent Estrous Cycle: Characterization of Vaginal Cytology and its Utility in Toxicological Studies‘, Birth Defects Research, Part B, 80 (2), 84–97. |
|
(11) |
Sadleir, R.M.F.S. (1979), ‚Cycles and Seasons‘, in C.R. Auston and R.V. Short (eds.), Reproduction in Mammals: I. Germ Cells and Fertilization, Cambridge, New York. |
|
(12) |
Gallavan, R.H. Jr, J.F. Holson, D.G. Stump, J.F. Knapp and V.L. Reynolds (1999), ‚Interpreting the Toxicologic Significance of Alterations in Anogenital Distance: Potential for Confounding Effects of Progeny Body Weights‘, Reproductive Toxicology, 13: 383–390. |
|
(13) |
Korenbrot, C.C., I.T. Huhtaniemi and R.I. Weiner (1977), ‚Preputial Separation as an External Sign of Pubertal Development in the Male Rat‘, Biological Reproduction, 17, 298–303. |
|
(14) |
Ladics, G.S. (2007), ‚Use of SRBC Antibody Responses for Immunotoxicity Testing‘, Methods, 41, 9–19. |
|
(15) |
Gore, E.R., J. Gower, E. Kurali, J.L. Sui, J. Bynum, D. Ennulat and D.J. Herzyk (2004), ‚Primary Antibody Response to Keyhole Limpet Hemocyanin in Rat as a Model for Immunotoxicity Evaluation‘, Toxicology, 197, 23–35. |
|
(16) |
Gray, L.E., J. Ostby, J. Ferrell, G. Rehnberg, R. Linder, R. Cooper, J. Goldman, V. Slott and J. Laskey (1989), ‚A Dose-Response Analysis of Methoxychlor-Induced Alterations of Reproductive Development and Function in the Rat‘, Fundamental and Applied Toxicology, 12, 92–108. |
|
(17) |
Robb, G.W., R.P. Amann and G.J. Killian (1978), ‚Daily Sperm Production and Epididymal Sperm Reserves of Pubertal and Adult Rats‘, Journal of Reproduction and Fertility,54, 103–107. |
|
(18) |
Klinefelter, G.R., L.E. Jr Gray and J.D. Suarez (1991), 'The Method of Sperm Collection Significantly Influences Sperm Motion Parameters Following Ethane Dimethanesulfonate Administration in the Rat'. Reproductive Toxicology,5, 39–44. |
|
(19) |
Seed, J., R.E. Chapin, E.D. Clegg., L.A. Dostal, R.H. Foote, M.E. Hurtt, G.R. Klinefelter, S.L. Makris, S.D. Perreault, S. Schrader, D. Seyler, R. Sprando, K.A. Treinen, D.N. Veeramachaneni and L.D. Wise (1996), ‚Methods for Assessing Sperm Motility, Morphology, and Counts in the Rat, Rabbit, and Dog: a Consensus Report‘, Reproductive Toxicology, 10, 237–244. |
|
(20) |
Chapin, R.E., R.S. Filler, D. Gulati, J.J. Heindel, D.F. Katz, C.A. Mebus, F. Obasaju, S.D. Perreault, S.R. Russell and S. Schrader (1992), ‚Methods for Assessing Rat Sperm Motility‘, Reproductive Toxicology, 6, 267–273. |
|
(21) |
Klinefelter, G.R., N.L. Roberts and J.D. Suarez (1992), ‚Direct Effects of Ethane Dimethanesulphonate on Epididymal Function in Adult Rats: an In Vitro Demonstration‘, Journal of Andrology, 13, 409–421. |
|
(22) |
Slott, V.L., J.D. Suarez and S.D. Perreault (1991), ‚Rat Sperm Motility Analysis: Methodologic Considerations‘, Reproductive Toxicology, 5, 449–458. |
|
(23) |
Slott, V.L., and S.D. Perreault (1993), ‚Computer-Assisted Sperm Analysis of Rodent Epididymal Sperm Motility Using the Hamilton-Thorn Motility Analyzer‘, Methods in Toxicology, Part A, Academic, Orlando, Florida, str. 319–333. |
|
(24) |
Toth, G.P., J.A. Stober, E.J. Read, H. Zenick and M.K. Smith (1989), ‚The Automated Analysis of Rat Sperm Motility Following Subchronic Epichlorhydrin Administration: Methodologic and Statistical Considerations‘, Journal of Andrology, 10, 401–415. |
|
(25) |
Linder, R.E., L.F. Strader, V.L. Slott and J.D. Suarez (1992), ‚Endpoints of Spermatoxicity in the Rat After Short Duration Exposures to Fourteen Reproductive Toxicants‘, Reproductive Toxicology, 6, 491–505. |
|
(26) |
OECD (2008), Guidance Document on Mammalian Reproductive Toxicity Testing and Assessment, Series on Testing and Assessment, No. 43, ENV/JM/MONO(2008)16, OECD, Paris. |
|
(27) |
Working, P.K., M. Hurtt (1987), ‚Computerized Videomicrographic Analysis of Rat Sperm Motility‘, Journal of Andrology, 8, 330–337. |
|
(28) |
Bolin, B., R. Garman, K. Jensen, G. Krinke, B. Stuart, and an ad Hoc Working Group of the STP Scientific and Regulatory Policy Committee (2006), ‚A ‚Best Practices‘ Approach to Neuropathologic Assessment in Developmental Neurotoxicity Testing – for Today‘, Toxicological Pathology, 34, 296–313. |
|
(29) |
Stütz, N., B. Bongiovanni, M. Rassetto, A. Ferri, A.M. Evangelista de Duffard, and R. Duffard (2006), ‚Detection of 2,4-dichlorophenoxyacetic Acid in Rat Milk of Dams Exposed During Lactation and Milk Analysis of their Major Components‘, Food Chemicals Toxicology, 44, 8–16. |
|
(30) |
Thigpen, J.E., K.D.R. Setchell, J.K. Haseman, H.E. Saunders, G.F. Caviness, G.E. Kissling, M.G. Grant and D.B. Forsythe (2007), ‚Variations in Phytoestrogen Content between Different Mill Dates of the Same Diet Produces Significant Differences in the Time of Vaginal Opening in CD-1 Mice and F344 Rats but not in CD Sprague Dawley Rats‘, Environmental health perspectives, 115(12), 1717–1726. |
|
(31) |
Tyl, R.W., K. Crofton, A. Moretto, V. Moser, L.P. Sheets and T.J. Sobotka (2008), ‚Identification and Interpretation of Developmental Neurotoxicity Effects: a Report from the ILSI Research Foundation/Risk Science Institute Expert Working Group on Neurodevelopmental Endpoints‘, Neurotoxicology and Teratology, 30: 349–381. |
|
(32) |
OECD (1996), Combined Repeated Dose Toxicity Study with the Reproduction/Developmental Toxicity Screening Test, OECD Guideline for Testing of Chemicals, No. 422, OECD, Paris. |
|
(33) |
Poglavje B.43 te priloge, Študija nevrotoksičnosti na glodalcih. |
|
(34) |
OECD (2000), Guidance Document on the recognition, assessment, and use of clinical signs as humane endpoints for experimental animals used in safety evaluations, Series on Testing and Assessment, No. 19, ENV/JM/MONO(2000)7, OECD, Paris. |
|
(35) |
Poglavje B.53 te priloge, Študija razvojne nevrotoksičnosti. |
|
(36) |
Poglavje B.54 te priloge, Uterotropni biološki preskus na glodavcih: kratkotrajni presejalni preskus za estrogene lastnosti. |
|
(37) |
Poglavje B.55 te priloge, Hershbergerjev biološki preskus na podganah: kratkotrajni presejalni preskus za (anti)androgene lastnosti. |
|
(38) |
OECD (2009), Guidance Document for Histologic Evalution of Endocrine and Reproductive Test in Rodents, Series on Testing and Assessment, No. 106, OECD, Paris. |
|
(39) |
OECD (2011), Guidance Document on the Current Implementation of Internal Triggers in the Extended One Generation Reproductive Toxicity Study in the United States and Canada, Series on Testing and Assessment, No. 117, ENV/JM/MONO(2011)21, OECD, Paris. |
|
(40) |
OECD (2013), Guidance Document supporting TG 443: Extended One Generation Reproductive Toxicity Study, Series on Testing and Assessment, No. 151, OECD, Paris. |
Dodatek 1
Meritve in opazovanja, vključena v sklop funkcionalnih opazovanj (kohorta 2A)
|
Domača kletka in na terenu |
Gibalne |
Fiziološke |
|
Drža |
Enostaven prenos |
Temperatura |
|
Neprostovoljni klonični in tonični |
Enostavno ravnanje |
Telesna teža |
|
Zaprtost očesne veke |
Tonus mišic |
Odziv zenic |
|
Piloerekcija |
Odziv na pristop |
Velikost zenic |
|
Slinjenje |
Odziv na dotik |
|
|
Solzenje |
Odziv na slušni dražljaj |
|
|
Oddajanje glasov |
Odziv na stiskanje repa |
|
|
Dvigovanje |
Posturalni odziv |
|
|
Anomalije pri hoji |
Razširjenost prstov pri pristanku |
|
|
Vzburjenost |
Moč oprijema s prednjimi okončinami |
|
|
Stereotipije |
Moč oprijema z zadnjimi okončinami |
|
|
Nenormalno vedenje |
|
|
|
Madeži |
|
|
|
Anomalije pri dihanju |
|
|
Dodatek 2
OPREDELITVE:
Kemikalija : snov ali zmes.
Preskusna kemikalija : vsaka snov ali zmes, ki se preskuša s to preskusno metodo.
B.57 PRESKUS STEROIDOGENEZE CELIC H295R
UVOD
1. Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) št. 456 (2011). OECD je leta 1998 začela z izvajanjem prednostne dejavnosti, da bi pregledala obstoječe in razvila nove smernice za odkrivanje in preskušanje kemikalij, ki bi lahko povzročale endokrine motnje. Temeljni okvir OECD iz leta 2002 za preskušanje in oceno povzročiteljev endokrinih motenj (OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupting Chemicals), zajema pet ravni, pri čemer vsaka raven ustreza posamezni stopnji biološke kompleksnosti (1). Za preskus steroidogeneze celic H295R in vitro (H295R), opisan v okviru te preskusne metode, se uporablja adenokarcinomska celična linija človeka (celice NCI-H295R), pri čemer preskus predstavlja raven 2 'preskusa in vitro za zagotavljanje mehanističnih podatkov', ki se uporablja za namene presejanja in prednostnega razvrščanja. Priprava in standardizacija preskusa kot presejalnega preskusa za odkrivanje kemičnih učinkov na steroidogenezo, zlasti proizvajanje 17β-estradiola (E2) in testosterona (T), sta bili izvedeni v postopku, ki ga sestavlja več korakov. Preskus celic H295R je bil optimiziran in validiran (2) (3) (4) (5).
2. Cilj preskusa steroidogeneze celic H295R je zaznati kemikalije, ki vplivajo na proizvajanje E2 in T. Namen preskusa celic H295R je identificirati ksenobiotike, katerih ciljna območja so endogene komponente, ki zajemajo znotrajcelične biokemijske poti, ki se začnejo z zaporedjem reakcij od holesterola do proizvajanja E2 in/ali T. Preskus celic H295R ni namenjen identifikaciji kemikalij, ki vplivajo na steroidogenezo zaradi učinkov na os hipotalamus – hipofiza – spolne žleze (HPG). Cilj preskusa je zagotoviti odgovor DA/NE na vprašanje o možnosti, da bi kemikalija povzročila ali zavirala proizvodnjo T in E2, vendar je mogoče v nekaterih primerih dobiti tudi kvantitativne rezultate (glej odstavka 53 in 54). Rezultati preskusa so izraženi kot relativne spremembe v proizvodnji hormonov v primerjavi s kontrolnimi vzorci s topilom (KVT). Namen preskusa ni zagotoviti posebnih mehanističnih informacij glede interakcije preskusne kemikalije z endokrinim sistemom. V raziskavi je bila uporabljena celična linija za opredelitev učinkov na posebne encime in vmesne hormone, kot je progesteron (2).
3. Opredelitve in kratice, uporabljene v okviru te preskusne metode, so opisane v Dodatku. Podroben protokol, vključno z navodili za pripravo raztopin, gojenje celic in izvajanje različnih vidikov preskusa, je na voljo v dodatkih I–III k dokumentu OECD 'Multi-Laboratory Validation of the H295R Steroidogenesis Assay to Identify Modulators of Testosterone and Estradiol Production' (4).
ZAČETNI PREUDARKI IN OMEJITVE
4. V biosintezo spolnih steroidnih hormonov je vključenih pet različnih encimov, ki katalizirajo šest različnih reakcij. Encimska pretvorba holesterola v pregnenolon z encimom za cepitev stranske verige holesterola (CYP11A) iz družine citokromov P450 (CYP) predstavlja prvi korak v zaporedju biokemijskih reakcij, ki se končajo s sintezo steroidnih končnih proizvodov. Glede na vrstni red naslednjih dveh reakcij se steroidogenska pot razdeli na dve poti, in sicer Δ5-hidroksisteroidno pot in Δ4-ketosteroidno pot, ki se končata s proizvodnjo androstendiona (slika 1).
5. Androstendion se pretvori v testosteron (T) s pomočjo 17β-hidroksisteroidne dehidrogenaze (17β-HSD). Testosteron je tako vmesni kot končni hormonski produkt. Pri moškem se lahko T pretvori v dihidrotestosteron (DHT) s 5α-reduktazo, ki se nahaja v celičnih membranah, jedrni ovojnici in endoplazmatskem retikulumu tarčnih tkiv androgenega delovanja, kot so prostata in semenski mešički. DHT je kot androgen znatno močnejši kot T in se prav tako šteje za končni hormon. Pri preskusu celic H295R se DHT ne meri (glej odstavek 10).
6. Encim na steroidogenski poti, ki pretvori androgene kemikalije v estrogene kemikalije, je aromataza (CYP19). CYP19 pretvori T v 17β-estradiol (E2) in androstendion v estron. E2 in T se štejeta za končna hormona steroidogenske poti.
7. Specifičnost aktivnosti liaze CYP17 se med vrstami razlikuje pri vmesnih substratih. Pri človeku daje encim prednost substratom Δ5-hidroksisteroidne poti (pregnenolon), pri podgani pa imajo prednost substrati Δ4-ketosteroidne poti (progesteron) (19). S takšno razliko aktivnosti liaze CYP17 se lahko razložijo nekatere razlike v odzivu na kemikalije, ki spreminjajo steroidogenezo in vivo in so odvisne od vrst (6). Dokazano je, da celice H295 najbolj točno odražajo izražanje adrenalnih encimov in vzorec proizvajanja steroidov pri odraslem človeku (20), vendar je znano, da izražajo encime tako za Δ5-hidroksisteroidne kot tudi za Δ4-ketosteroidne poti za sintezo androgenov (7) (11) (13) (15).
Slika 1
Steroidogenska pot v celicah H295R

Opomba:
Encimi so v ležečem tisku, hormoni so v odebeljenem tisku, puščice pa označujejo smer sinteze. Sivo ozadje označuje kortikosteroidne poti/produkte. Poti spolnih steroidov/produktov so obkroženi. CYP = citokrom P450; HSD = hidroksisteroidna dehidrogenaza; DHEA = dehidroepiandrosteron.
8. Človeška adenokarcinomska celična linija H295R je uporaben model in vitro za preiskovanje učinkov na sintezo steroidnih hormonov (2) (7) (8) (9) (10). V celični liniji H295R se izražajo geni, ki kodirajo vse ključne encime za zgoraj navedeno steroidogenezo (11) (15) (slika 1). To je edinstvena lastnost, ker je izražanje teh genov in vivo specifično za tkiva in razvojno fazo, pri čemer se običajno v enem tkivu ali eni razvojni fazi ne izražajo vsi geni, ki sodelujejo pri steroidogenezi (2). Celice H295R imajo fiziološke značilnosti consko nediferenciranih človeških fetalnih celic nadledvičnice (11). Celice predstavljajo edinstven sistem in vitro, ker so sposobne proizvesti vse steroidne hormone, ki se nahajajo v skorji nadledvične žleze in spolnih žlezah, kar omogoča preskušanje učinkov na sintezo kortikosteroidov in proizvajanje spolnih steroidnih hormonov, kot so androgeni in estrogeni, čeprav je bil preskus validiran le za zaznavanje T in E2. Spremembe, ki jih preskusni sistem zabeleži v obliki spremembe proizvodnje T in E2, so lahko rezultat številnih različnih interakcij preskusnih kemikalij s steroidogenimi funkcijami, ki se izražajo s celicami H295R. Vključujejo modulacijo izražanja, sintezo ali funkcijo encimov, ki sodelujejo pri proizvajanju, pretvorbi ali odstranitvi steroidnih hormonov (12) (13) (14). Zaviranje proizvajanja hormonov je lahko posledica neposredne konkurenčne vezave z encimom na poti, vpliva na kofaktorje, kot sta NADPH (nikotinamid adenin dinukleotid fosfat) in cAMP (ciklični adenozin monofosfat), in/ali povečanja steroidne presnove ali supresije izražanja genov nekaterih encimov na poti steroidogeneze. Medtem ko je lahko zaviranje funkcija neposrednih ali posrednih postopkov pri proizvajanju hormonov, je indukcija običajno posredna, na primer z vplivanjem na kofaktorja, kot sta NADPH in cAMP (kot v primeru forskolina), zmanjšanjem steroidne presnove (13) in/ali povečanjem izražanja genov za sintezo steroidov.
9. Preskus celic H295R ima več prednosti:
|
— |
omogoča zaznavanje tako povečanja kot tudi zmanjšanja proizvajanja T in E2, |
|
— |
omogoča neposredno oceno možnih učinkov kemikalije na sposobnost preživetja celic/citotoksičnost. To je pomembna lastnost, saj omogoča razlikovanje med učinki, ki so posledica citotoksičnosti, in učinki, ki so posledica neposredne interakcije kemikalij s steroidogenimi potmi, kar pri sistemih izsečkov tkiv, ki zajemajo več vrst celic različnih občutljivosti in funkcionalnosti, ni mogoče, |
|
— |
ne zahteva se uporaba živali, |
|
— |
celična linija H295R je na voljo na tržišču. |
10. Glavne omejitve preskusa so naslednje:
|
— |
njegova presnovna zmogljivost ni znana, vendar je verjetno zelo omejena, zato bodo kemikalije, ki morajo biti presnovno aktivirane, v tem preskusu verjetno spregledane, |
|
— |
ker celice H295R izhajajo iz tkiva nadledvične žleze, vsebujejo encime, ki so sposobni proizvodnje glukokortikoidov in mineralokortikoidov ter spolnih hormonov, zato bi lahko učinki na proizvajanje glukokortikoidov in mineralokortikoidov vplivali na ravni T in E2, opažene v preskusu, |
|
— |
ker se v njem ne meri DHT, se ne pričakuje zaznavanje kemikalij, ki zavirajo 5α-reduktazo, pri čemer se lahko v tem primeru uporabi Hershbergerjev preskus (16), |
|
— |
preskus celic H295R ne bo zaznal kemikalij, ki vplivajo na steroidogenezo prek vpliva na os hipotalamus – hipofiza – spolne žleze (HPG), ker se to lahko proučuje le pri nepoškodovanih živalih. |
NAČELO PRESKUSA
11. Cilj tega preskusa je zaznavanje kemikalij, ki vplivajo na proizvajanje E2 in T. T je tudi posrednik na poti proizvajanja E2. V preskusu se lahko zaznajo kemikalije, ki običajno zavirajo ali sprožijo encime poti steroidogeneze.
12. Preskus se običajno opravi pod standardnimi pogoji za celične kulture na plošči s 24 jamicami za gojenje kulture. Za izvajanje preskusa se lahko uporabijo tudi plošče drugih velikosti, vendar je treba nasaditvene in preskusne pogoje ustrezno prilagoditi, da se ohrani upoštevanje meril uspešnosti.
13. Po 24-urni aklimatizaciji na ploščah z več jamicami so celice 48 ur izpostavljene sedmim koncentracijam preskusne kemikalije v vsaj treh ponovitvah. Topilo ter znan zaviralec in povzročitelj proizvajanja hormonov se v nespremenljivi koncentraciji preskusita kot negativni in pozitivni kontrolni vzorec. Ob koncu obdobja izpostavljenosti se iz vseh jamic odstrani gojišče. Sposobnost preživetja celic v posamezni jamici se analizira takoj po odstranitvi gojišča. Koncentracije hormonov v gojišču se lahko izmerijo z uporabo različnih metod, vključno s kompleti za hormonske meritve, ki so na voljo na tržišču, in/ali instrumentalnimi tehnikami, kot je tekočinska kromatografija z masno spektrometrijo (LC-MS). Podatki so izraženi kot razmerje spremembe glede na kontrolni vzorec s topilom in najnižjo koncentracijo z opaženim učinkom (LOEC). Če je preskus negativen, se največja preskušena koncentracija sporoči kot koncentracija brez opaznega učinka (NOEC). Sklepne ugotovitve glede sposobnosti kemikalije, da vpliva na steroidogenezo, morajo temeljiti na vsaj dveh neodvisnih ponovitvah preskusa. Prvi potek preskusa lahko deluje kot ponovitev za ugotavljanje območja, pri čemer se koncentracije za drugo ali tretjo ponovitev po potrebi naknadno prilagodijo, če nastanejo težave v zvezi s topnostjo ali citotoksičnostjo ali če se zdi, da je kemikalija aktivna na robu območja preskušane koncentracije.
POSTOPEK V ZVEZI S KULTURAMI
Celična linija
14. Celice NCI-H295R na tržišču zagotavlja American Type Culture Collections (ATCC) po podpisu sporazuma o prenosu materiala (14).
Uvod
15. Zaradi sprememb zmogljivosti celic za proizvajanje E2 s staranjem/večanjem pasaž (2) je treba celice pred uporabo gojiti v skladu s posebnim protokolom, pri čemer je treba zabeležiti število pasaž od odtajanja celic ter število pasaž, pri katerem so bile celice zamrznjene in shranjene v tekoči dušik. Prvo število označuje dejansko število pasaž celic, drugo število pa število pasaž, pri katerem so bile celice zamrznjene in shranjene. Celice, ki so bile zamrznjene po peti pasaži in odtajane ter so se nato trikrat delile (4 pasaže, pri čemer se sveže odtajane celice štejejo kot pasaža 1) po ponovnem gojenju, bi bile na primer označene s pasažo 4,5. Primer označevanja s številkami je naveden v Dodatku 1 k validacijskemu poročilu (4).
16. Založno gojišče se uporablja kot osnova za obogatena gojišča ali gojišča za zamrzovanje. Obogateno gojišče je potreben sestavni del gojenja celic. Gojišče za zamrzovanje je posebej zasnovano tako, da omogoča zamrzovanje celic za dolgoročno shranjevanje brez posledic. V Nu-serumu (ali primerljivem serumu z enakimi lastnostmi, ki dokazano zagotavlja podatke, ki izpolnjujejo zahteve glede izvedbe preskusa in kontrole kakovosti), ki je sestavina obogatenega gojišča, je treba analizirati za osnovne koncentracije T in E2. Priprava teh raztopin je opisana v Dodatku II k validacijskemu poročilu (4).
17. Po iniciaciji celične kulture H295R iz izvirne serije ATCC morajo celice rasti pet pasaž (tj. se celice delijo štirikrat). Celice pete pasaže se nato zamrznejo v tekočem dušiku za shranjevanje. Pred zamrzovanjem celic se vzorec prejšnjih celic četrte pasaže preskusi na plošči za kontrolo kakovosti (glej odstavka 36 in 37), da se preveri, ali osnovno proizvajanje hormonov in odziv na pozitivne kontrolne kemikalije izpolnjujeta merila za kontrolo kakovosti preskusa iz tabele 5.
18. Celice H295R je treba gojiti, zamrzniti in shraniti v tekočem dušiku, da se zagotovi stalna razpoložljivost celic ustrezne pasaže/starosti za gojenje in uporabo. Največje število pasaž po dodajanju nove (15) ali zamrznjene (16) serije celic v kulturo, ki je sprejemljiva za uporabo v preskusu celic H295R, ne sme biti večje od 10. Sprejemljive pasaže za kulture celic iz serije, ki je bila zamrznjena pri pasaži 5, so na primer med 4,5 in 10,5. Za celice, ki se gojijo iz teh zamrznjenih serij, je treba upoštevati postopek iz odstavka 19. Te celice je treba gojiti vsaj štiri (4) dodatne pasaže (pasaža 4,5), preden se uporabijo pri preskušanju.
Začetne celice iz zamrznjene zaloge
19. Postopek za začetek gojenja celic iz zamrznjene zaloge je treba uporabiti, če se nova serija celic odstrani iz hrambe v tekočem dušiku za namen gojenja in preskušanja. Podrobnosti o tem postopku so navedene v Dodatku III k validacijskemu poročilu (4). Celice se odstranijo iz hrambe v tekočem dušiku, hitro odtajajo, vstavijo v obogateno gojišče v centrifugirki, centrifugirajo pri sobni temperaturi, ponovno suspendirajo v obogatenem gojišču in prestavijo v bučke. Gojišče je treba naslednji dan zamenjati. Celice H295R se gojijo v inkubatorju pri 37 °C s 5 % CO2 v atmosferi z zrakom, pri čemer se gojišče obnovi dvakrat do trikrat na teden. Ko so celice približno 85–90-odstotno konfluentne, jih je treba deliti. Delitev celic je potrebna, da se zagotovijo zdrave celice, ki rastejo in se ohranijo za opravljanje bioloških preskusov. Celice se trikrat sperejo s fosfatnim pufrom s soljo (PBS, brez Ca2+ Mg2+) in odstranijo iz bučk z dodajanjem ustreznega encima za ločevanje, npr. tripsina, v PBS (brez Ca2+ Mg2+). Takoj ko se celice ločijo od bučke, je treba delovanje encima ustaviti z dodajanjem obogatenega gojišča v razmerju trikratnika volumna, uporabljenega za tretiranje z encimom. Celice se prestavijo v centrifugirko, centrifugirajo pri sobni temperaturi, supernatant se odstrani, peleti celic pa se ponovno suspendirajo v obogatenem gojišču. Ustrezna količina raztopine s celicami se da v novo bučko. Količino raztopine s celicami je treba prilagoditi tako, da so celice konfluentne v 5–7 dneh. Priporočeno razmerje subkultivacije je od 1:3 do 1:4. Ploščo je treba skrbno označiti. Celice so zdaj pripravljene za uporabo v preskusu, odvečne celice pa je treba zamrzniti v tekočem dušiku, kot je opisano v odstavku 20.
Zamrzovanje celic H295R (priprava celic za shranjevanje v tekočem dušiku)
20. Pri pripravi celic H295R za zamrzovanje je treba upoštevati zgoraj opisani postopek delitve celic do faze ponovnega suspendiranja peletov celic na dnu centrifugirke. V tem primeru se peleti celic ponovno suspendirajo v gojišču za zamrzovanje. Raztopina se prenese v ustrezno označeno kriovialo, ki se zamrzne pri – 80 oC za 24 ur in se nato prestavi v tekoči dušik za shranjevanje. Podrobnosti o tem postopku so navedene v Dodatku III k validacijskemu poročilu (4).
Nasaditev in predhodna inkubacija celic za preskušanje
21. Število plošč s 24 jamicami, pripravljenih, kot je opisano v odstavku 19, ki bo potrebno, je odvisno od števila kemikalij, ki jih je treba preskusiti, in konfluentnosti celic v posodah za gojenje. Ena bučka (75 cm2) s celicami, ki so 80–90-odstotno konfluentne, bo na splošno zagotovila dovolj celic za 1–1,5 plošče (s 24 jamicami) s ciljno gostoto od 200 000 do 300 000 celic na mililiter gojišča, zaradi česar bo konfluentnost v jamicah po 24 urah 50–60-odstotna (slika 2). To je tipična optimalna gostota celic za proizvajanje hormonov v preskusu. Pri večjih gostotah se vzorci proizvajanja T in E2 spremenijo. Priporočljivo je, da se pred prvim izvajanjem preskusa preskusijo različne gostote zasejanja med 200 000 in 300 000 celicami na ml, za nadaljnje preskuse pa izbere gostota, ki po 24 urah povzroči 50–60-odstotno konfluentnost v jamicah.
Slika 2
Mikrofotografija celic H295R pri gostoti zasejanja 50 % v plošči s 24 jamicami za gojenje kulture po 24 urah, posneta na robu jamice (A) in sredi jamice (B)

22. Gojišče se s pipeto nakapa iz bučke, celice pa se trikrat sperejo s sterilnim PBS (brez Ca2+ Mg2+). Za ločitev celic od bučke se doda raztopina z encimi (v PBS). Po ustrezno dolgem ločevanju celic je treba delovanje encima ustaviti z dodajanjem obogatenega gojišča v razmerju trikratnika volumna, uporabljenega za tretiranje z encimom. Celice se prestavijo v centrifugirko, centrifugirajo pri sobni temperaturi, supernatant se odstrani, peleti celic pa se ponovno suspendirajo v obogatenem gojišču. Gostota celic se izračuna na primer s hemocitometrom ali števcem celic. Raztopino s celicami je treba razredčiti do želene gostote za nasaditev in skrbno premešati, da se zagotovi homogena gostota celic. Celice je treba nasaditi z 1 ml raztopine s celicami na jamico, plošče in jamice pa označiti. Zasejane plošče se 24 ur inkubirajo pri 37 °C in 5 % CO2 v atmosferi z zrakom, da se omogoči pritrditev celic na jamice.
ZAHTEVE GLEDE KONTROLE KAKOVOSTI
23. Ključno je, da se med odmerjanjem v jamice dajo natančne količine raztopin in vzorcev, ker te količine določajo koncentracije, uporabljene v izračunih rezultatov preskusov.
24. Pred iniciacijo celične kulture in nadaljnjimi preskušanji mora vsak laboratorij dokazati občutljivost svojega sistema za merjenje hormonov (odstavki 29–31).
25. Če je treba uporabiti preskuse meritev hormonov na podlagi protiteles, je treba pred začetkom preskušanja analizirati možen vpliv kemikalij, ki se bodo preskušale, na sistem za merjenje, ki se uporablja za količinsko opredelitev T in E2, kot je opisano v odstavku 32.
26. Priporočeno topilo za preskus je DMSO. Če se uporabi drugo topilo, je treba določiti naslednje:
|
— |
topnost preskusne kemikalije, forskolina in prokloraza v topilu ter |
|
— |
citotoksičnost kot funkcijo koncentracije topila. |
Priporoča se, da največja dovoljena koncentracija topila ne presega desetkratnika razredčine najmanj citotoksične koncentracije topila.
27. Pred prvim izvajanjem preskušanja mora laboratorij opraviti zahtevani preskus, kot je opisan v odstavkih 33–35, s katerim dokaže, da je sposoben ohraniti in doseči ustrezno celično kulturo ter preskusne pogoje, ki so potrebni za preskušanja kemikalij.
28. Ob začetku preskušanja z novo serijo je treba pred uporabo nove serije celic opraviti preskus s kontrolno ploščo, da se ovrednoti delovanje celic, kot je opisano v odstavkih 36 in 37.
Učinkovitost sistema za merjenje hormonov
Občutljivost metode, točnost, natančnost in navzkrižna reaktivnost z matriko vzorčenja
29. Vsak laboratorij lahko za analizo proizvajanja T in E2 v celicah H295R uporabi sistem za merjenje hormonov po svoji izbiri, pod pogojem, da izpolnjuje merila uspešnosti, vključno z mejo določljivosti. Meji sta običajno 100 pg/ml za T in 10 pg/ml za E2 ter temeljita na osnovnih ravneh hormonov, opaženih v validacijskih študijah. Vendar so lahko glede na osnovne ravni hormonov, dosežene v zadevnem laboratoriju, ustrezne višje ali nižje ravni. Pred začetkom plošče za kontrolo kakovosti in potekov preskusov mora laboratorij dokazati, da je s preskusom hormonov, ki se bo uporabil, koncentracije hormonov v obogatenem gojišču mogoče izmeriti z ustrezno točnostjo in natančnostjo, da so izpolnjena merila za kontrolo kakovosti iz tabel 1 in 5, in sicer z analizo obogatenega gojišča s primešanim hormonom kot interno kontrolo. Obogatenemu gojišču se dodajo vsaj tri koncentracije vsakega hormona (npr. 100, 500 in 2 500 pg/ml T, 10, 50 in 250 pg/ml E2 ali pa se lahko za najmanjše primešane koncentracije za T in E2 uporabijo in analizirajo najmanjše možne koncentracije na podlagi mej zaznavnosti za izbrani sistem za merjene hormonov). Izmerjene koncentracije hormonov neekstrahiranih vzorcev morajo biti znotraj 30 % nominalnih koncentracij, razlika med ponovnimi meritvami istega vzorca pa ne sme presegati 25 % (glej tudi tabelo 8 za dodatna merila kontrole kakovosti). Če so ta merila kontrole kakovosti izpolnjena, se šteje, da je izbrani preskus meritve hormonov dovolj točen in natančen ter ne reagira navzkrižno s sestavinami v gojišču (matrika vzorca) tako, da bi se lahko pričakoval znaten vpliv na rezultat preskusa. V tem primeru ekstrakcija vzorcev pred merjenjem hormonov ni potrebna.
30. Če merila kakovosti iz tabel 1 in 8 niso izpolnjena, lahko pride do znatnih vplivov matrike in je treba izvesti preskus z ekstrahiranim primešanim gojiščem. Primer postopka ekstrakcije je opisan v Dodatku II k validacijskemu poročilu (4). Meritve koncentracij hormonov v ekstrahiranih vzorcih je treba trikrat ponoviti (17). Če je mogoče dokazati, da sestavine gojišča po ekstrakciji ne vplivajo na metodo zaznavanja hormonov, kot je opredeljeno z merili kontrole kakovosti, je treba vse nadaljnje preskuse izvesti z uporabo ekstrahiranih vzorcev. Če po ekstrakciji meril kontrole kakovosti ni mogoče izpolniti, uporabljeni sistem za merjenje hormonov ni primeren za namen preskusa steroidogeneze celic H295R in je treba uporabiti drugo metodo za zaznavanje hormonov.
Umeritvena krivulja
31. Koncentracije hormonov v kontrolnih vzorcih s topilom (KVT) morajo biti znotraj linearnega dela umeritvene krivulje. Najbolje je, da so vrednosti kontrolnih vzorcev s topilom blizu sredine linearnega dela, da se omogoči merjenje povzročanja in zaviranja sinteze hormonov. Ustrezno se izberejo razredčine gojišča (ali ekstraktov), ki jih je treba izmeriti. Linearno povezavo je treba določiti z ustreznim statističnim pristopom.
Preskus vpliva kemikalij
32. Če se bodo za merjenje hormonov uporabljali preskusi na podlagi protiteles, kot so encimskoimunski preskusi (ELISA) in radioimunski preskusi (RIA), je treba za vsako kemikalijo preskusiti možen vpliv na sistem za merjenje hormonov, ki se bo uporabil, preden se začne dejansko preskušanje kemikalij (Dodatek III k validacijskemu poročilu (4)), ker lahko nekatere kemikalije vplivajo na te preskuse (17). Če se z analizo hormonov ugotovi prisotnost vpliva, ki je enak ali večji od 20 % osnovne proizvodnje hormonov T in/ali E2, je treba opraviti preskus vpliva kemikalij na preskus hormonov (kot je opisan v oddelku 5.0 Dodatka III k validacijskemu poročilu (4)) pri vseh razredčinah kemijskih založnih raztopin, da se opredeli odmerek, pri katerem se pojavi znaten (≥ 20 %) vpliv. Če je vpliv manjši od 30 %, se rezultati lahko popravijo za vpliv. Če vpliv preseže 30 %, so podatki neveljavni, pri čemer je treba podatke pri teh koncentracijah zavreči. Če se znaten vpliv preskusne kemikalije na sistem za merjenje hormonov pojavi pri več kot eni necitotoksični koncentraciji, je treba uporabiti drug sistem za merjenje hormonov. Da se prepreči vpliv zaradi kontaminacije s kemikalijami, se priporoča, da se hormoni iz gojišča ekstrahirajo z ustreznim topilom, pri čemer so možne metode navedene v validacijskem poročilu (4).
Tabela 1
Merila uspešnosti za sisteme za merjenje hormonov
|
Parameter |
Merilo |
|
Občutljivost metode merjenja |
Meja določljivosti (LOQ) T: 100 pg/ml; E2: 10 pg/ml (18) |
|
Učinkovitost ekstrakcije hormonov (samo, kadar je ekstrakcija potrebna) |
Povprečne stopnje izkoristka (na podlagi treh ponovitev meritev) primešanih količin hormonov od dodane količine ne smejo odstopati za več kot 30 %. |
|
Vpliv kemikalij (samo za sisteme na podlagi protiteles) |
Znatna (≥ 30 % osnovne proizvodnje zadevnega hormona) navzkrižna reaktivnost s hormoni, ki jih proizvedejo celice, se ne sme pojaviti (19) (20). |
Preskus usposobljenosti laboratorija
33. Pred preskušanjem neznanih kemikalij je treba s preskusom usposobljenosti laboratorija dokazati, da je laboratorij usposobljen za doseganje in ohranitev ustrezne celične kulture ter preskusnih pogojev, ki so potrebni za uspešno izvedbo preskusa. Ker je uspešnost preskusa neposredno povezana z osebjem laboratorija, ki opravlja preskus, je treba te postopke delno ponoviti, če se osebje v laboratoriju zamenja.
34. Ta preskus usposobljenosti bo izveden pod enakimi pogoji, kot so navedeni v odstavkih 38 do 40, z izpostavitvijo celic 7 naraščajočim koncentracijam močnih, zmernih in šibkih povzročiteljev in zaviralcev ter negativni kemikaliji (glej tabelo 2). Kemikalije, ki jih je treba preskusiti, vključujejo zlasti močnega povzročitelja forskolin (št. CAS 66575-29-9), močnega zaviralca prokloraz (št. CAS 67747-09-5), zmernega povzročitelja atrazin (št. CAS 1912-24-9), zmernega zaviralca aminoglutetimid (št. CAS 125-84-8), šibkega povzročitelja (proizvajanje E2) in šibkega zaviralca (proizvajanje T) bisfenol A (št. CAS 80-05-7) ter negativno kemikalijo humani horionski gonadotropin (HCG) (št. CAS 9002-61-3), kot je navedeno v tabeli 2. Za vse kemikalije se vodijo ločene plošče, kot je prikazano v tabeli 6. Vsak dnevni preskus s kemikalijami za preskušanje usposobljenosti mora vključevati eno ploščo za kontrolo kakovosti (tabela 4, odstavka 36–37).
Tabela 2
Kemikalije za preverjanje usposobljenosti in koncentracije izpostavljenosti
|
Kemikalija za preskušanje usposobljenosti |
Preskusne koncentracije (μM) |
|
Prokloraz |
0 (21), 0,01, 0,03, 0,1, 0,3, 1, 3, 10 |
|
Forskolin |
0 (21), 0,03, 0,1, 0,3, 1, 3, 10, 30 |
|
Atrazin |
0 (21), 0,03, 0,1, 1, 3, 10, 30, 100 |
|
Aminoglutetimid |
0 (21), 0,03, 0,1, 1, 3, 10, 30, 100 |
|
Bisfenol A |
0 (21), 0,03, 0,1, 1, 3, 10, 30, 100 |
|
HCG |
0 (21), 0,03, 0,1, 1, 3, 10, 30, 100 |
Izpostavljenost celic H295R kemikalijam za preskus usposobljenosti se izvede v ploščah s 24 jamicami med preskusom usposobljenosti laboratorija. Vsi odmerki preskusne kemikalije se odmerjajo v μM. Odmerki se dajejo v DMSO pri 0,1 % m/m na jamico. Vse preskusne koncentracije je treba preskusiti v treh ponovitvah (tabela 6). Za vsako kemikalijo se vodijo ločene plošče. Vsak dnevni preskus vključuje eno ploščo za kontrolo kakovosti.
35. Analize sposobnosti preživetja celic in hormonov je treba izvesti, kot je določeno v odstavkih 42 do 46. Mejno vrednost (najnižja koncentracija z opaženim učinkom, LOEC) in odločitev o razvrstitvi je treba sporočiti in primerjati z vrednostmi v tabeli 3. Podatki se štejejo za sprejemljive, če izpolnjujejo najnižjo koncentracijo z opaženim učinkom in odločitev o razvrstitvi iz tabele 3.
Tabela 3
Mejne vrednosti (LOEC) in odločitev o razvrstitvi kemikalij za preskušanje usposobljenosti
|
|
Št. CAS |
LOEC (μM) |
Odločitev o razvrstitvi |
||
|
T |
E2 |
T |
E2 |
||
|
Prokloraz |
67747-09-5 |
≤ 0,1 |
≤ 1,0 |
+ (22) (zaviranje) |
+ (zaviranje) |
|
Forskolin |
66575-29-9 |
≤ 10 |
≤ 0,1 |
+ (povzročanje) |
+ (povzročanje) |
|
Atrazin |
1912-24-9 |
≤ 100 |
≤ 10 |
+ (povzročanje) |
+ (povzročanje) |
|
Aminoglutetimid |
125-84-8 |
≤ 100 |
≤ 100 |
+ (zaviranje) |
+ (zaviranje) |
|
Bisfenol A |
80-05-7 |
≤ 10 |
≤ 10 |
+ (zaviranje) |
+ (povzročanje) |
|
HCG |
9002-61-3 |
n. r. |
n. r. |
Negativno |
Negativno |
Plošča za kontrolo kakovosti
36. Plošča za kontrolo kakovosti se uporablja za preverjanje delovanja celic H295R pod normalnimi pogoji za kulture ter za vzpostavitev zbirke preteklih podatkov za koncentracije hormonov v kontrolnih vzorcih s topilom, pozitivnih in negativnih kontrolnih vzorcih ter za druge meritve kontrole kakovosti v daljšem obdobju.
|
— |
Delovanje celic H295R je treba oceniti s ploščo za preverjanje kakovosti za vsako novo serijo ATCC ali po prvi uporabi predhodno zamrznjene zaloge celic, razen če je bil preskus usposobljenosti laboratorija (odstavki 32–34) opravljen s to serijo celic. |
|
— |
Plošča za kontrolo kakovosti zagotavlja popolno oceno preskusnih pogojev (npr. sposobnost preživetja celic, kontrolni vzorci s topilom, negativnih in pozitivnih kontrolnih vzorcev ter spremenljivost v preskusih in med njimi) pri preskušanju kemikalij in bi morala biti del vsake ponovitve preskusa. |
37. Preskus kontrole kakovosti se izvede na plošči s 24 jamicami, pri čemer se upoštevajo enaki postopki inkubacije, odmerjanja, sposobnosti preživetja celice/citotoksičnosti, ekstrakcije hormonov in analize hormonov, kot so opisani v odstavkih 38 do 46 za preskušanje kemikalij. Plošča za kontrolo kakovosti zajema slepe vzorce, kontrolne vzorce s topili ter dve koncentraciji znanega povzročitelja (forskolin, 1, 10 μM) in zaviralca (prokloraz, 0,1, 1 μM) sinteze E2 in T. Poleg tega se v izbranih jamicah uporabi MeOH kot pozitivni kontrolni vzorec za preskus sposobnosti preživetja/citotoksičnost. Podroben opis razporeditve plošče je naveden v tabeli 4. Merila, ki jih mora plošča za kontrolo kakovosti izpolnjevati, so navedena v tabeli 5. Najmanjša osnovna proizvodnja hormonov za T in E2 mora biti izpolnjena tako v kontrolnem vzorcu s topilom kot v praznih jamicah.
Tabela 4
Razporeditev plošče za kontrolo kakovosti za preskušanje delovanja neizpostavljenih celic H295R ter celic, izpostavljenih znanim zaviralcem (PRO = prokloraz) in spodbujevalcem (FOR = forskolin) proizvajanja E2 in T. Po koncu preskusa izpostavljenosti in odstranitvi gojišča se vsem jamicam z MeOH doda 70-odstotna raztopina metanola, ki deluje kot pozitivni kontrolni vzorec za citotoksičnost (glej preskus citotoksičnosti v Dodatku III k validacijskemu poročilu (4))
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
A |
Prazno (23) |
Prazno (23) |
Prazno (23) |
Prazno (23) (+ MeOH) (24) |
Prazno (23) (+ MeOH) (24) |
Prazno (23) (+ MeOH) (24) |
|
B |
DMSO (25) 1 μl |
DMSO (25) 1 μl |
DMSO (25) 1 μl |
DMSO (25) 1 μl (+ MeOH) (24) |
DMSO (25) 1 μl (+ MeOH) (24) |
DMSO (25) 1 μl (+ MeOH) (24) |
|
C |
FOR 1 μM |
FOR 1 μM |
FOR 1 μM |
PRO 0,1 μM |
PRO 0,1 μM |
PRO 0,1 μM |
|
D |
FOR 10 μM |
FOR 10 μM |
FOR 10 μM |
PRO 1 μM |
PRO 1 μM |
PRO 1 μM |
Tabela 5
Merila uspešnosti za ploščo za kontrolo kakovosti
|
|
T |
E2 |
|
Osnovna proizvodnja hormona v kontrolnem vzorcu s topilom (KVT) |
≥ 5-kratnik meje določljivosti |
≥ 2,5-kratnik meje določljivosti |
|
Povzročanje (10 μM forskolina) |
≥ 1,5-kratnik KVT |
≥ 7,5-kratnik KVT |
|
Zaviranje (1 μM prokloraza) |
≤ 0,5-kratnik KVT |
≤ 0,5-kratnik KVT |
POSTOPEK KEMIČNE IZPOSTAVLJENOSTI
38. Predhodno inkubirane celice se odstranijo iz inkubatorja (odstavek 21) in preverijo pod mikroskopom, da se zagotovi, da so pred odmerjanjem v dobrem stanju (pritrditev, morfologija).
39. Celice se postavijo v biološko varno omaro, obogateno gojišče pa se odstrani in nadomesti z novim obogatenim gojiščem (1 ml/jamico). Priporočeno topilo za to metodo je DMSO. Če obstajajo razlogi za uporabo drugega topila, se to znanstveno utemelji. Celice so izpostavljene preskusni kemikaliji z dodajanjem 1 μl ustrezne založne raztopine v DMSO (glej Dodatek II k validacijskemu poročilu (4)) na 1 ml obogatenega gojišča (prostornina jamice). Tako je končna koncentracija v jamicah 0,1 % DMSO. Za zagotovitev ustreznega mešanja se na splošno priporoča, da se ustrezna založna raztopina preskusne kemikalije v DMSO zmeša z obogatenim gojiščem za pridobitev želene končne koncentracije posameznega odmerka, zmesi pa doda posamezni jamici takoj po odstranitvi starega gojišča. Če se uporabi ta možnost, mora koncentracija DMSO (0,1 %) ostati enaka v vseh jamicah. V jamicah, ki vsebujejo najvišji koncentraciji, se s stereomikroskopom vizualno oceni nastajanje oborine ali motnosti, ki kaže nepopolno topnost preskusne kemikalije. Če se opazita taki stanji (motnost, nastajanje oborine), se pregledajo tudi jamice, ki vsebujejo naslednje nižje koncentracije (in tako naprej), pri čemer se jamice, ki se niso v celoti spremenile v raztopino, izključijo iz nadaljnjega vrednotenja in analize. Plošča se za 48 ur vrne v inkubator pri 37 °C in 5 % CO2 v atmosferi z zrakom. Razporeditev plošče s preskusno kemikalijo je prikazana v tabeli 6. Zaloge 1–7 kažejo razporeditev naraščajočih odmerkov preskusne kemikalije.
Tabela 6
Shema odmerjanja za izpostavljenost celic H295R preskusnim kemikalijam v plošči s 24 jamicami
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
A |
DMSO |
DMSO |
DMSO |
Zaloga 4 |
Zaloga 4 |
Zaloga 4 |
|
B |
Zaloga 1 |
Zaloga 1 |
Zaloga 1 |
Zaloga 5 |
Zaloga 5 |
Zaloga 5 |
|
C |
Zaloga 2 |
Zaloga 2 |
Zaloga 2 |
Zaloga 6 |
Zaloga 6 |
Zaloga 6 |
|
D |
Zaloga 3 |
Zaloga 3 |
Zaloga 3 |
Zaloga 7 |
Zaloga 7 |
Zaloga 7 |
40. Po 48 urah se izpostavljene plošče odstranijo iz inkubatorja, pri čemer se v vsaki jamici pod mikroskopom preverijo stanje celic (pritrditev, morfologija, stopnja konfluence) in znaki citotoksičnosti. Gojišče iz vsake jamice se razdeli na dva enaka dela (po približno 490 μl) ter prenese v dve ločeni in ustrezno označeni viali (tj. en alikvot za zagotovitev rezervnega vzorca za vsako jamico). Da se prepreči izsušitev celic, se gojišče odstrani iz ene vrstice ali stolpca naenkrat in nadomesti z gojiščem za preskus sposobnosti preživetja/citotoksičnosti celice. Če se sposobnost preživetja/citotoksičnost celice ne izmeri takoj, se v vsako jamico doda 200 μl PBS s Ca2+ in Mg2+. Gojišča se zamrznejo pri – 80 °C do nadaljnje obdelave za analizo koncentracij hormonov (glej odstavke 44–46). Čeprav sta T in E2 v gojišču pri – 80 °C na splošno stabilna vsaj 3 mesece, je treba v vsakem laboratoriju dokumentirati stabilnost hormonov med shranjevanjem.
41. Takoj po odstranitvi gojišča se za vsako izpostavljeno ploščo določi sposobnost preživetja/citotoksičnost celic.
Določanje sposobnosti preživetja celice
42. Za določanje možnega vpliva preskusne kemikalije na sposobnost preživetja celice se lahko uporabi preskus sposobnosti preživetja/citotoksičnosti celice po izbiri. Preskus mora zagotoviti dejansko meritev odstotka celic, sposobnih preživetja, v jamici, ali dokazati, da je neposredno primerljiva s preskusom Live/Dead® (njegovo linearno funkcijo) (glej Dodatek III k validacijskemu poročilu (4)). Drugi preskus, ki dokazano deluje enako dobro, je preskus MTT [3-(4,5-dimetiltiazol-2-il)-2,5-difenil tetrazolijev bromid] (18). Ocena sposobnosti preživetja celic z uporabo zgornje metode je relativna meritev, ki ne kaže nujno linearnih povezav z absolutnim številom celic v jamici. Zato mora analitik izvesti vzporedno subjektivno vizualno oceno vsake jamice, pri čemer je treba posneti digitalne fotografije kontrolnih vzorcev s topilom ter vzeti dve največji necitotoksični koncentraciji in ju arhivirati, da se omogoči poznejša ocena dejanske gostote celic, če je to potrebno. Če se na podlagi vizualnega pregleda ali preskusa sposobnosti preživetja/citotoksičnosti zdi, da se je število celic povečalo, je treba to domnevno povečanje preveriti. Če se povečanje števila celic potrdi, je treba to navesti v poročilu o preskusu. Sposobnost preživetja celic bo izražena glede na povprečni odziv v kontrolnih vzorcih s topilom, ki se šteje kot 100-odstotna sposobnost preživetja celic, in se izračuna, kot je ustrezno za uporabljeni preskus sposobnosti preživetja/citotoksičnosti celic. Za preskus MTT se lahko uporabi naslednja formula:
% celic, sposobnih preživetja = (odziv v jamici – povprečni odziv v jamicah, obdelanih z MeOH [= 100-odstotna smrtnost]) ÷ (povprečni odziv v jamicah preskusnih vzorcev s topilom – povprečni odziv v jamicah, obdelanih z MeOH [= 100-odstotna smrtnost]).
43. Jamice s sposobnostjo preživetja, manjšo od 80 % glede na povprečno sposobnost preživetja v kontrolnih vzorcih s topilom (= 100-odstotno preživetje), se ne smejo vključiti v analizo končnih podatkov. Zaviranje steroidogeneze, ki se pojavi ob prisotnosti skoraj 20-odstotne citotoksičnosti, je treba skrbno ovrednotiti za zagotovitev, da citotoksičnost ni vzrok za zaviranje.
Analiza hormonov
44. Vsak laboratorij lahko za analizo T in E2 uporabi sistem za merjenje hormonov po izbiri. Za pripravo razredčin se lahko uporabijo rezervni alikvoti gojišča iz posamezne tretirane skupine, da se koncentracija uskladi z linearnim delom umeritvene krivulje. Kot je navedeno v odstavku 29, mora vsak laboratorij dokazati skladnost svojega sistema za merjenje hormonov (npr. ELISA, RIA, LC-MS, LC-MS/MS) z merili kontrole kakovosti, tako da pred izvedbo kontrole kakovosti ali preskušanja kemikalij analizira gojišče s primešanim hormonom interne kontrole. Za zagotovitev, da deli preskusnega sistema ne vplivajo na meritev hormonov, bo hormone morda treba pred njihovim merjenjem ekstrahirati iz gojišča (glej odstavek 30 za pogoje, pod katerimi se ekstrakcija zahteva, in pogoje, pod katerimi se ne zahteva). Priporoča se izvedba ekstrakcije na podlagi postopkov iz Dodatka III k validacijskemu poročilu (4).
45. Če se za meritev proizvajanja hormonov uporablja komplet za preskušanje, ki je na voljo na tržišču, je treba analizo hormonov izvesti, kot je določeno v navodilih, ki jih je kompletu za preskušanje priložil proizvajalec. Večina proizvajalcev uporablja edinstven postopek za izvedbo analize hormonov. Razredčine vzorcev je treba prilagoditi tako, da bodo pričakovane koncentracije hormonov v kontrolnih vzorcih s topilom na sredini linearnega razpona umeritvene krivulje posameznega preskusa (Dodatek III k validacijskemu poročilu (4)). Vrednosti zunaj linearnega dela umeritvene krivulje je treba zavreči.
46. Končne koncentracije hormonov se izračunajo, kot sledi:
Primer:
|
Ekstrahirano: |
450 μl gojišča |
|
Obdelano v: |
250 μl pufra za preskus |
|
Razredčina pri preskusu: |
1:10 (za uskladitev vzorca z linearnim razponom umeritvene krivulje) |
|
Koncentracija hormonov pri preskusu: |
150 pg/ml (že prilagojeno koncentraciji na ml preskušenega vzorca) |
|
Izkoristek: |
89 % |
|
Končna koncentracija hormonov = |
(Koncentracija hormonov (na ml) ÷ izkoristek) (faktor razredčenja) |
|
Končna koncentracija hormonov = |
(150 pg/ml) ÷ (0,89) × (250 μl/450 μl) × 10 = 936,3 pg/ml |
Izbira preskusnih koncentracij
47. Izvesti je treba vsaj dva neodvisna poteka preskusa. Če predhodne informacije, kot so informacije o mejah topnosti ali citotoksičnosti, ne zagotavljajo podlage za izbiro preskusnih koncentracij, se priporoča, da se preskusne koncentracije za prvi potek preskusa razporedijo v intervalih log10, pri čemer je največja koncentracija 10-3 M. Če je kemikalija topna in ni citotoksična pri nobeni preskušeni koncentraciji ter je bil prvi potek preskusa negativen pri vseh koncentracijah, je treba to potrditi še z enim potekom preskusa z uporabo enakih pogojev kot pri prvem poteku preskusa (tabela 7). Če so rezultati prvega poteka preskusa dvoumni (tj. je faktor spremembe statistično značilen pri kontrolnem vzorcu z raztopino pri samo eni koncentraciji) ali pozitivni (tj. je faktor spremembe pri dveh ali več sosednjih koncentracijah statistično značilen), je treba preskus ponoviti, kot je navedeno v tabeli 7, z izboljšanjem izbranih preskusnih koncentracij. Preskusne koncentracije v drugem in tretjem poteku preskusa (če je primerno) je treba prilagoditi na podlagi rezultatov oklepajočih koncentracij iz prvega poteka preskusa, ki so sprožile učinek, z uporabo razporejanja koncentracij na podlagi 1/2-logaritma (npr. če so koncentracije 0,001, 0,01, 0,1, 1, 10, 100 in 1 000 μM iz prvega poteka preskusa povzročile sproženje pri 1 in 10 μM, morajo biti koncentracije, preskušene v drugem poteku preskusa, 0,1, 0,3, 1, 3, 10, 30 in 100 μM), razen če je treba za doseganje najnižje koncentracije z opaženim učinkom uporabiti nižje koncentracije. V slednjem primeru je treba v drugem poteku preskusa z 1/2-logaritemsko skalo preskusiti vsaj pet koncentracij pod najnižjo koncentracijo, preskušeno pri prvem poteku preskusa. Če drugi potek preskusa ne potrdi prvega poteka (tj. se statistična značilnost ne pojavi pri predhodno pozitivno preskušeni koncentraciji ± 1 povečanje koncentracije), je treba izvesti tretji preskus z uporabo izvirnih preskusnih pogojev. Dvoumni rezultati prvega poteka preskusa se štejejo za negativne, če opaženega učinka ni mogoče potrditi v nobenem od naslednjih dveh potekov preskusa. Dvoumni rezultati se štejejo za pozitiven odziv (učinek), če je mogoče odziv potrditi pri vsaj še enem poteku preskusa v okviru povečanja koncentracije za ± 1 (glej oddelek 55 za postopek razlage podatkov).
Tabela 7
Matrika odločanja za možne scenarije rezultatov
|
Potek preskusa 1 |
Potek preskusa 2 |
Potek preskusa 3 |
Odločitev |
|||
|
Scenarij |
Odločitev |
Scenarij |
Odločitev |
Scenarij |
Pozitivno |
Negativno |
|
Negativno |
Potrditev (26) |
Negativno |
Konec |
|
|
X |
|
Negativno |
Potrditev (26) |
Pozitivno |
Izboljšanje (27) |
Negativno |
|
X |
|
Dvoumno (28) |
Izboljšanje (27) |
Negativno |
Potrditev (26) |
Negativno |
|
X |
|
Dvoumno (28) |
Izboljšanje (27) |
Negativno |
Potrditev (26) |
Pozitivno |
X |
|
|
Dvoumno (28) |
Izboljšanje (27) |
Pozitivno |
|
|
X |
|
|
Pozitivno |
Izboljšanje (27) |
Negativno |
Potrditev (26) |
Pozitivno |
X |
|
|
Negativno |
Potrditev (26) |
Pozitivno |
Izboljšanje (27) |
Pozitivno |
X |
|
|
Pozitivno |
Izboljšanje (27) |
Pozitivno |
Konec |
|
X |
|
Kontrola kakovosti preskusne plošče
48. Poleg izpolnjevanja meril kontrole kakovosti plošč je treba izpolniti tudi druga merila kakovosti iz tabele 8, ki se nanašajo na sprejemljive variacije med podvojenimi jamicami, podvojenimi preskusi, linearnostjo in občutljivostjo sistemov za merjenje hormonov, variabilnost med podvojenimi meritvami hormonov istega vzorca in odstotkom izkoristka hormonskih dodatkov po ekstrakciji gojišča (če je primerno; glej odstavek 30 o zahtevah glede ekstrakcije). Podatki morajo biti razvrščeni v sprejemljiva območja, opredeljena za posamezne parametre, da se upoštevajo pri nadaljnjem vrednotenju. Če ta merila niso izpolnjenja, mora biti v razpredelnici navedeno, da zadevni vzorec ni izpolnjeval meril kontrole kakovosti in da ga je treba ponovno analizirati ali izločiti iz sklopa podatkov.
Tabela 8
Sprejemljiva območja in/ali variacije (%) za parametre preskusne plošče za preskus celic H295R
(LOQ: meja določljivosti sistema za meritev hormonov. KV: Koeficient variacije; KVT: kontrolni vzorec s topilom; DPM: razgradnje na minuto)
|
|
Primerjava med |
T |
E2 |
|
Osnovna proizvodnja hormonov v KVT |
Razmerje spremembe, večje od LOQ |
≥ 5-kratna |
≥ 2,5-kratna |
|
Preskusi izpostavljenosti – v okviru KV plošče za KVT (podvojene jamice) |
Absolutne koncentracije |
≤ 30 % |
≤ 30 % |
|
Preskusi izpostavljenosti – med KV plošče za KVT (podvojeni preskusi) |
Faktor spremembe |
≤ 30 % |
≤ 30 % |
|
Sistem merjenja hormonov – občutljivost |
Zaznavno razmerje zmanjšanja glede na KVT |
≥ 5-kratno |
≥ 2,5-kratno |
|
Sistem merjenja hormonov – KV podvojene meritve za KVT (29) |
Absolutne koncentracije |
≤ 25 % |
≤ 25 % |
|
Ekstrakcija iz gojišča – izkoristek notranjega standarda 3H (če je primerno) |
DPM |
≥ 65 % nominalno |
|
ANALIZA PODATKOV IN POROČANJE
Analiza podatkov
49. Za vrednotenje relativnega povečanja/zmanjšanja kemijsko spremenjenega proizvajanja hormonov je treba rezultate normalizirati na srednjo vrednost kontrolnega vzorca s topilom vseh preskusnih plošč in rezultate izraziti kot spremembe glede na kontrolne vzorce s topilom na posamezni preskusni plošči. Vse podatke je treba izraziti kot srednjo vrednost ± 1 standardni odklon.
50. V analizo podatkov je treba vključiti le podatke o hormonih iz jamic, kjer je bila citotoksičnost manjša od 20 %. Relativne spremembe je treba izračunati, kot sledi:
relativna sprememba = (koncentracija hormonov v posamezni jamici) ÷ (srednja koncentracija hormonov v vseh jamicah s kontrolnim vzorcem s topilom).
51. Če se na podlagi vizualnega pregleda jamice ali preskusa sposobnosti preživetja/citotoksičnosti iz odstavka 42 zdi, da se je število celic povečalo, je treba to domnevno povečanje preveriti. Če se povečanje števila celic potrdi, je treba to navesti v poročilu o preskusu.
52. Pred izvedbo statistične analize je treba opraviti vrednotenje predpostavke normalnosti in homogenosti variance. Normalnost je treba ovrednotiti z uporabo standardnih verjetnostnih grafikonov ali drugih ustreznih statističnih metod (npr. Shapiro-Wilkov preskus). Če podatki (razmerja sprememb) niso normalno porazdeljeni, jih je treba poskusiti približati normalni porazdelitvi s pretvorbo. Če so podatki normalno porazdeljeni ali so blizu normalne porazdelitve, je treba razlike med skupinami koncentracij kemikalije in kontrolnim vzorcem s topilom analizirati z uporabo parametričnega preskusa (npr. Dunnettov preskus), pri čemer je koncentracija neodvisna, odziv (faktor spremembe) pa odvisna spremenljivka. Če so podatki normalno porazdeljeni, je treba uporabiti neparametrični preskus (npr. Kruskal-Wallisov preskus, Steelov preskus). Razlike se štejejo za značilne, kadar je p ≤ 0,05. Statistična vrednotenja se opravijo na podlagi povprečnih vrednosti posamezne jamice, ki predstavlja neodvisne podatkovne točke s podvojitvami. Pričakuje se, da zaradi velikega razmika med odmerki v prvem poteku preskusa (skala log10) v veliko primerih ne bo mogoče opisati jasne odvisnosti med koncentracijo in odzivom, kjer bosta dva največja odmerka na linearnem delu sigmoidne krivulje. Zato se za prvi potek preskusa ali kateri koli drug sklop podatkov, pri katerem se pojavi to stanje (npr. kadar ni mogoče oceniti največje učinkovitosti), uporabi statistika s stalno spremenljivko tipa I, opisana zgoraj.
53. Če na linearnem delu krivulje ležita več kot dve podatkovni točki in kadar je mogoče izračunati največje učinkovitosti, kot je predvideno za nekatere od drugih potekov preskusa, ki se izvedejo z uporabo pollogaritemske razporeditve koncentracij izpostavljenosti, je treba za izračun učinkovitih koncentracij (npr. EC50 in EC20) uporabiti verjetnostni, logaritemski ali drug ustrezen regresijski model.
54. Rezultate je treba predstaviti v grafični (palični grafikon, ki predstavlja srednjo vrednost +/– 1 standardni odklon) in tabelarni (najnižja koncentracija z opaženim učinkom/koncentracija brez opaznega učinka, smer učinka in moč največjega odziva, ki je del dela podatkov o odvisnosti med odmerkom in odzivom) obliki (za primer glej sliko 3). Ocena podatkov se šteje za veljavno le, če je temeljila na vsaj dveh neodvisno izvedenih potekih preskusa. Preskus ali potek preskusa se šteje za neodvisen, če je bil izveden na drug dan z uporabo novega kompleta raztopin in kontrolnih vzorcev. Obseg koncentracij, uporabljen v drugem in tretjem poteku preskusa (če je potrebno), se lahko prilagodi na podlagi rezultatov prvega poteka preskusa, da se bolje opredeli območje odziva na odmerek, ki vsebuje najnižjo koncentracijo z opaženim učinkom (glej odstavek 47).
Slika 3
Primer predstavitve in vrednotenja podatkov, pridobljenih med izvajanjem preskusa celic H295R, v grafični in tabelarni obliki
(Zvezdice označujejo statistično značilne razlike kontrolnega vzorca s topilom (p < 0,05). LOEC: najnižja koncentracija z opaženim učinkom; največja sprememba: največja moč odziva, opažena pri kateri koli koncentraciji, v primerjavi s povprečnim odzivom kontrolnega vzorca s topilom (= 1))

|
Kemikalija |
LOEC |
Največja sprememba |
|
Forskolin |
0,01 |
0,15-kratna |
|
Letrozol |
0,001 |
29-kratna |
Postopek razlage podatkov
55. Preskusna kemikalija se oceni za pozitivno, če se razmerje indukcije statistično razlikuje (p ≤ 0,05) od kontrolnega vzorca s topilom v dveh sosednjih koncentracijah v vsaj dveh neposredno opravljenih potekih preskusa (tabela 7). Preskusa kemikalija se oceni za negativno na podlagi dveh neodvisnih negativnih potekov preskusa ali v treh potekih preskusa, ki zajemata dva negativna poteka preskusa in en dvoumen ali pozitiven potek preskusa. Če podatki, pridobljeni v treh neodvisnih preskusih, ne izpolnjujejo meril za odločitev iz tabele 7, rezultatov preskusa ni mogoče interpretirati. Rezultati pri koncentracijah, ki presegajo meje topnosti, ali pri citotoksičnih koncentracijah ne smejo biti vključeni v razlago rezultatov.
Poročilo o preskusu
56. Poročilo o preskusu mora vključevati naslednje informacije:
Preskuševalni laboratorij:
|
— |
ime in kraj laboratorija, |
|
— |
vodjo študije ter drugo osebje in njihove pristojnosti v zvezi s študijo, |
|
— |
datum začetka študije in datum konca študije. |
Preskusna kemikalija, reagenti in kontrolni vzorci:
|
— |
identiteto (ime, št. CAS, kot je ustrezno), vir, številko lota/serije, čistoto, dobavitelja ter opredelitev preskusne kemikalije, reagentov in kontrolnih vzorcev, |
|
— |
agregatno stanje in ustrezne fizikalno-kemijske lastnosti preskusne kemikalije, |
|
— |
pogoje shranjevanja ter metodo in pogostost priprave preskusnih kemikalij, reagentov in kontrolnih vzorcev, |
|
— |
stabilnost preskusne kemikalije. |
Celice:
|
— |
vir in vrsto celic, |
|
— |
število celičnih pasaž (identifikator celične pasaže) celic, uporabljenih v preskusu, |
|
— |
opis postopkov za ohranitev celičnih kultur. |
Zahteve pred preskušanjem (če je ustrezno):
|
— |
opis in rezultate preskusa vpliva kemikalij na preskus hormonov, |
|
— |
opis in rezultate meritev učinkovitosti ekstrakcije hormonov, |
|
— |
umeritvene in umeritvene krivulje za vse analitične preskuse, ki jih je treba izvesti, |
|
— |
meje zaznavnosti za izbrane analitične preskuse. |
Preskusni pogoji:
|
— |
sestavo gojišča, |
|
— |
koncentracijo preskusne kemikalije, |
|
— |
gostoto celic (ocenjena ali izmerjena koncentracija celic po 24 urah in 48 urah), |
|
— |
topnost preskusne kemikalije (meja topnosti, če je določena), |
|
— |
čas in pogoje inkubacije. |
Rezultati preskusa:
|
— |
neobdelane podatke za vse jamice za kontrolne vzorce in preskusne kemikalije – vsako podvojeno meritev v obliki izvirnih podatkov, pridobljenih z instrumentom, uporabljenim za meritev proizvajanja hormonov (npr. optična gostota, enote fluorescence, razgradnja na minuto itd.), |
|
— |
validacijo normalnosti ali razlago pretvorbe podatkov, |
|
— |
srednjo vrednost odzivov ± 1 standardni odklon za vsako izmerjeno jamico, |
|
— |
podatke o citotoksičnosti (preskusne koncentracije, ki so povzročile citotoksičnost), |
|
— |
potrditev, da so bile zahteve glede kontrole kakovosti izpolnjene, |
|
— |
relativno spremembo v primerjavi s kontrolnim vzorcem s topilom, s popravkom za citotoksičnost, |
|
— |
palični grafikon, ki kaže relativno spremembo (razmerje spremembe) pri posamezni koncentraciji, standardni odklon in statistično značilnost, kot je navedeno v odstavkih 49–54. |
Razlaga podatkov:
|
— |
uporabo postopka za razlago podatkov za rezultate in razpravo o ugotovitvah. |
Razprava:
|
— |
ali v študiji obstajajo znaki za možnost, da bi lahko na podatke o T/E2 vplivali posredni učinki na glukokortikoidne in mineralokortikoidne poti? |
Sklepne ugotovitve
VIRI
|
(1) |
OECD (2002), OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals, v Dodatku 2 k poglavju B.54 te priloge. |
|
(2) |
Hecker, M., Newsted, J.L., Murphy, M.B., Higley, E.B., Jones, P.D., Wu, R. and Giesy, J.P. (2006), Human adrenocarcinoma (H295R) cells for rapid in vitro determination of effects on steroidogenesis: Hormone production, Toxicol. Appl. Pharmacol., 217, 114–124. |
|
(3) |
Hecker, M., Hollert, H., Cooper, R., Vinggaard, A.-M., Akahori, Y., Murphy, M., Nellemann, C., Higley, E., Newsted, J., Wu, R., Lam, P., Laskey, J., Buckalew, A., Grund, S., Nakai, M., Timm, G., and Giesy, J. P. (2007), The OECD validation program of the H295R steroidgenesis assay for the identification of in vitro inhibitors or inducers of testosterone and estradiol production, Phase 2: inter laboratory pre-validation studies. Env. Sci. Pollut. Res., 14, 23–30. |
|
(4) |
OECD (2010), Multi-Laboratory Validation of the H295R Steroidogenesis Assay to Identify Modulators of Testosterone and Estradiol Production, OECD Series of Testing and Assessment No. 132, ENV/JM/MONO(2010)31, Paris. Na voljo na [http://www.oecd.org/document/30/0,3746,en_2649_34377_1916638_1_1_1_1,00.html]. |
|
(5) |
OECD (2010), Peer Review Report of the H295R Cell-Based Assay for Steroidogenesis, OECD Series of Testing and Assessment No. 133, ENV/JM/MONO(2010)32, Paris. Na voljo na: [http://www.oecd.org/document/30/0,3746,en_2649_34377_1916638_1_1_1_1,00.html]. |
|
(6) |
Battelle (2005), Detailed Review Paper on Steroidogenesis. Na voljo na: [http://www.epa.gov/endo/pubs/edmvs/steroidogenesis_drp_final_3_29_05.pdf]. |
|
(7) |
Hilscherova, K., Jones, P. D., Gracia, T., Newsted, J. L., Zhang, X., Sanderson, J. T., Yu, R. M. K., Wu, R. S. S. and Giesy, J. P. (2004), Assessment of the Effects of Chemicals on the Expression of Ten Steroidogenic Genes in the H295R Cell Line Using Real-Time PCR, Toxicol. Sci., 81, 78–89. |
|
(8) |
Sanderson, J. T., Boerma, J., Lansbergen, G. and Van den Berg, M. (2002), Induction and inhibition of aromatase (CYP19) activity by various classes of pesticides in H295R human adrenocortical carcinoma cells, Toxicol. Appl. Pharmacol., 182, 44–54. |
|
(9) |
Breen, M.S., Breen, M., Terasaki, N., Yamazaki, M. and Conolly, R.B. (2010), Computational model of steroidogenesis in human H295R cells to predict biochemical response to endocrine-active chemicals: Model development for metyrapone, Environ. Health Perspect., 118: 265–272. |
|
(10) |
Higley, E.B., Newsted, J.L., Zhang, X., Giesy, J.P. and Hecker, M. (2010), Assessment of chemical effects on aromatase activity using the H295R cell line, Environ. Sci. Poll. Res., 17:1137–1148. |
|
(11) |
Gazdar, A. F., Oie, H. K., Shackleton, C. H., Chen, T. R., Triche, T. J., Myers, C. E., Chrousos, G. P., Brennan, M. F., Stein, C. A. and La Rocca, R. V. (1990), Establishment and characterization of a human adrenocortical carcinoma cell line that expresses Multiple pathways of steroid biosynthesis, Cancer Res., 50, 5488–5496. |
|
(12) |
He, Y.H., Wiseman, S.B., Zhang, X.W., Hecker, M., Jones, P.D., El-Din, M.G., Martin, J.W. and Giesy, J.P. (2010), Ozonation attenuates the steroidogenic disruptive effects of sediment free oil sands process water in the H295R cell line, Chemosphere, 80:578–584. |
|
(13) |
Zhang, X.W., Yu, R.M.K., Jones, P.D., Lam, G.K.W., Newsted, J.L., Gracia, T., Hecker, M., Hilscherova, K., Sanderson, J.T., Wu, R.S.S. and Giesy, J.P. (2005), Quantitative RT-PCR methods for evaluating toxicant-induced effects on steroidogenesis using the H295R cell line, Environ. Sci. Technol., 39:2777–2785. |
|
(14) |
Higley, E.B., Newsted, J.L., Zhang, X., Giesy, J.P. and Hecker, M. (2010), Differential assessment of chemical effects on aromatase activity, and E2 and T production using the H295R cell line, Environ. Sci. Pol. Res., 17:1137–1148. |
|
(15) |
Rainey, W. E., Bird, I. M., Sawetawan, C., Hanley, N. A., Mccarthy, J. L., Mcgee, E. A., Wester, R. and Mason, J. I. (1993), Regulation of human adrenal carcinoma cell (NCI-H295) production of C19 steroids, J. Clin. Endocrinol. Metab., 77, 731–737. |
|
(16) |
Poglavje B.55 te priloge: Hershbergerjev biološki preskus na podganah: kratkotrajni presejalni preskus za (anti)androgene lastnosti. |
|
(17) |
Shapiro, R., and Page, L.B. (1976), Interference by 2,3-dimercapto-1-propanol (BAL) in angiotensin I radioimmunoassay, J. Lab. Clin. Med., 2, 222–231. |
|
(18) |
Mosmann, T. (1983), Rapid colorimetric assay for growth and survival: application to proliferation and cytotoxicity assays, J. Immunol. Methods., 65, 55–63. |
|
(19) |
Brock, B.J., Waterman, M.R. (1999). Biochemical differences between rat and human cytochrome P450c17 support the different steroidogenic needs of these two species, Biochemistry. 38:1598–1606. |
|
(20) |
Oskarsson, A., Ulleras, E., Plant, K., Hinson, J. Goldfarb, P.S., (2006), Steroidogenic gene expression in H295R cells and the human adrenal gland: adrenotoxic effects of lindane in vitro, J. Appl. Toxicol., 26:484–492. |
Dodatek
OPREDELITEV POJMOV:
|
|
Konfluentnost se nanaša na pokritje ali množitev, ki je celicam dovoljena v gojišču kulture ali čez njega. |
|
|
Kemikalija pomeni snov ali zmes. |
|
|
KV pomeni koeficient variacije in je opredeljen kot razmerje med standardnim odklonom porazdelitve in njegovo aritmetično sredino. |
|
|
CYP pomeni citokrom P450 mono-oksigenaze, družino genov in encimov, ki jih proizvajajo, ki sodelujejo pri katalizi različnih biokemijskih reakcij, vključno s sintezo in presnovo steroidnih hormonov. |
|
|
DPM pomeni število razgradenj na minuto. To je število atomov v dani količini radioaktivne snovi, za katero se zazna, da razpade v eni minuti. |
|
|
E2 je 17β-estradiol, tj. najpomembnejši estrogen v sistemih sesalcev. |
|
|
Celice H295R so človeške adenokarcinomske celice, ki imajo fiziološke lastnosti consko nediferenciranih človeških fetalnih celic nadledvičnice in izražajo vse encime steroidogenezne poti. Zagotavlja jih ATCC. |
|
|
Gojišče za zamrzovanje se uporablja za zamrzovanje in shranjevanje zamrznjenih celic. Zajema založno gojišče ter BD Nu-Serum in dimetilsulfoksid. |
|
|
Linearni razpon je razpon v okviru umeritvene krivulje za sistem meritve hormonov, kjer so rezultati sorazmerni s koncentracijo analita, prisotnega v vzorcu. |
|
|
LOQ je kratica za 'mejo določljivosti' in je najmanjša količina kemikalije, ki jo je mogoče razločiti od odsotnosti kemikalije (slepa vrednost) v dani meji zaupanja. Za namen te metode mejo določljivosti običajno opredeli proizvajalec preskusnih sistemov, če ni določeno drugače. |
|
|
LOEC je najnižja koncentracija z opaženim učinkom, tj. najmanjša raven koncentracije, pri kateri se odziv pri preskusu statistično razlikuje od odziva kontrolnega vzorca s topilom. |
|
|
NOEC je koncentracija brez opaznega učinka, ki je najvišja preskušena koncentracija, če pri preskusu ni pozitivnega odziva. |
|
|
Pasaža je število delitev celic po iniciaciji kulture iz zamrznjene zaloge. Začetna pasaža, ki se je začela iz zamrznjene zaloge, ima številko ena (1). Celice, ki so se delile enkrat, so označene kot pasaža 2 itd. |
|
|
PBS je Dulbeccov fosfatni pufer s soljo. |
|
|
Kontrola kakovosti, okrajšano QC, pomeni ukrepe, ki so potrebni za zagotovitev veljavnih podatkov. |
|
|
Plošča za kontrolo kakovosti je plošča s 24 jamicami, ki vsebuje dve koncentraciji pozitivnih in negativnih kontrolnih vzorcev za spremljanje uspešnosti nove serije celic ali zagotavljanje pozitivnih kontrolnih vzorcev za preskušanje kemikalij. |
|
|
Ponovitev je neodvisen preskus z novim kompletom raztopin in kontrolnih vzorcev. |
|
|
Založno gojišče je osnova za pripravo drugih reagentov. Sestavljen je iz zmesi Dulbeccovega gojišča Modified Eagle in Hamove zmesi hranil F-12 (DMEM/F12) v razmerju 1:1 v 15 mM pufra HEPES brez fenol rdečega ali natrijevega bikarbonata. Natrijev bikarbonat se doda kot pufer; glej Dodatek II k validacijskemu poročilu (4). |
|
|
Obogateno gojišče zajema založno gojišče ter BD Nu-Serum in visokokakovostno zmes ITS+; glej Dodatek II k validacijskemu poročilu (4). |
|
|
Steroidogeneza je pot sinteze, ki vodi od holesterola do različnih steroidnih hormonov. Več vmesnih produktov na poti sinteze steroidov, kot sta progesteron in testosteron, je pomembnih hormonov samih po sebi, vendar delujejo tudi kot predhodne sestavine za hormone nižje na poti sinteze. |
|
|
T pomeni testosteron, enega od dveh najpomembnejših androgenov v sistemu sesalcev. |
|
|
Preskusna kemikalija je katera koli snov ali zmes, ki se preskuša s to preskusno metodo. |
|
|
Preskusna plošča je plošča, na kateri so celice H295R izpostavljene preskusnim kemikalijam. Preskusne plošče vsebujejo kontrolni vzorec s topilom in preskusno kemikalijo v sedmih stopnjah koncentracije v treh ponovitvah. |
|
|
Tripsin 1X je razredčena raztopina encima tripsina, tj. serinska proteaza trebušne slinavke, ki se uporablja za odstopitev celic s plošče za gojenje; glej Dodatek III k validacijskemu poročilu (4). |
B.58 PRESKUS GENSKIH MUTACIJ NA SOMATSKIH IN KLIČNIH CELICAH GENSKO SPREMENJENIH GLODAVCEV
UVOD
1. Ta preskusna metoda ustreza Smernici za preskušanje OECD št. 488 (2013). Na voljo so preskusne metode EU za številne preskuse mutacij in vitro, ki lahko odkrijejo kromosomske in/ali genske mutacije. Obstajajo tudi preskusne metode za končne točke in vivo (tj. kromosomske aberacije in nenačrtna sinteza DNA); vendar pa te metode ne merijo genskih mutacij. Preskusi mutacij pri gensko spremenjenih glodavcih (TGR) izpolnjujejo potrebo po praktičnih in splošno razširjenih preskusih genskih mutacij in vivo.
2. Preskusi mutacij pri gensko spremenjenih glodavcih so bili obsežno pregledani (24) (33). Uporabljajo se gensko spremenjene podgane in miši z večkratnimi kopijami v kromosome vključenih prenosljivih vektorjev na osnovi plazmida ali faga. Transgeni vsebujejo poročevalske gene za odkrivanje različnih vrst mutacij, ki so jih preskusne kemikalije povzročile in vivo.
3. Mutacije pri glodavcih se ocenijo s pridobitvijo transgena in analizo fenotipa poročevalskega gena v bakterijskem gostitelju, ki nima poročevalskega gena. Preskusi genskih mutacij pri gensko spremenjenih glodavcih merijo mutacije, povzročene pri genetsko nevtralnih genih, pridobljenih iz praktično katerega koli tkiva glodavca. Ti preskusi zato zaobidejo številne omejitve, povezane s proučevanjem genskih mutacij v endogenih genih in vivo (npr. omejeno število tkiv, primernih za analizo, negativna/pozitivna selekcija za mutacije).
4. Iz dokazov je razvidno, da se transgeni na mutagene odzivajo podobno kot endogeni geni, zlasti glede substitucije baznih parov, premikov bralnega okvira ter majhnih delecij in insercij (24).
5. Pri International Workshops on Genotoxicity Testing (mednarodna delavnica o preskušanju genotoksičnosti, IWGT) so odobrili vključitev preskusov genskih mutacij pri gensko spremenjenih glodavcih za odkrivanje genskih mutacij in vivo in priporočili protokol za njihovo izvajanje (15) (29). Ta preskusna metoda temelji na teh priporočilih. Za nadaljnjo analizo, ki podpira uporabo tega protokola, glej (16).
6. Pričakuje se, da bo v prihodnosti preskus genskih mutacij pri gensko spremenjenih glodavcih mogoče združiti s študijo strupenosti s ponavljajočim se odmerkom (poglavje B.7 te priloge). Potrebni so podatki, ki bi zagotovili, da krajše, enodnevno obdobje med koncem obdobja odmerjanja in vzorčenjem iz študije strupenosti s ponavljajočim se odmerkom, ki pri preskusih genskih mutacij pri gensko spremenjenih glodavcih traja 3 dni, ne vpliva na občutljivost preskusa genskih mutacij pri gensko spremenjenih glodavcih. Potrebni so tudi podatki, ki kažejo, da uporaba seva gensko spremenjenih glodavcev namesto običajnih sevov glodavcev ne vpliva na uspešnost preskusa s ponavljajočim se odmerkom. Ko bodo ti podatki na voljo, bo ta preskusna metoda posodobljena.
7. Opredelitve ključnih pojmov so navedene v Dodatku.
ZAČETNI PREUDARKI
8. Preskusi genskih mutacij pri gensko spremenjenih glodavcih, za katere je na voljo dovolj podatkov, ki podpirajo njihovo uporabo v tej preskusni metodi, so: miš z bakteriofagom z genom lacZ (Muta™Mouse); miš s plazmidom z genom lacZ; miš in podgana, ki sta gpt in Spi– negativni; miš in podgana z genom lacI (Big Blue®) pod standardnimi pogoji. Poleg tega se lahko preskus pozitivne selekcije gena cII uporabi za vrednotenje mutacij v modelih Big Blue® in Muta™Mouse. Mutageneza pri modelih TGR se običajno oceni kot pogostnost mutantov; če je potrebno, pa se lahko dodatne informacije pridobi z molekularno analizo mutacij (glej odstavek 24).
9. Ti preskusi genskih mutacij in vivo pri glodavcih so posebno primerni za ocenjevanje nevarnosti mutagenosti, ker so odzivi preskusov odvisni od presnove in vivo, farmakokinetike in popravljanja DNA, čeprav so ti lahko različni pri različnih vrstah, tkivih in vrstah poškodb DNA. Preskus in vivo za genske mutacije je koristen tudi za nadaljnjo preiskavo mutagenih učinkov, odkritih pri sistemu in vitro, in za spremljanje rezultatov preskusov z uporabo drugih končnih točk in vivo (24). Poleg tega, da je vzročno povezana z nastankom raka, je genska mutacija pomembna končna točka za napoved nerakastih bolezni na podlagi mutacij pri somatskih tkivih (12) (13) in bolezni, ki se prenašajo prek zarodne linije.
10. Če obstajajo dokazi, da preskusna kemikalija ali zadevni metabolit ne bosta dosegla interesnih tkiv, izvajanje preskusa genskih mutacij pri gensko spremenjenih glodavcih ni primerno.
NAČELO PRESKUSNE METODE
11. V preskusih, opisanih v odstavku 8, je tarčni gen po izvoru bakterijski ali bakteriofag, iz genomske DNA glodavcev pa se pridobi z vključitvijo transgena v prenosljivi vektor na osnovi bakteriofaga λ ali plazmida. Pri postopku je potrebna ekstrakcija genomske DNA iz interesnega tkiva glodavcev, obdelava genomske DNA in vitro (tj. pakiranje vektorjev λ ali ligacija in elektroporacija plazmidov za pridobitev prenosljivega vektorja), in posledično odkritje mutacij v bakterijskih gostiteljih pod ustreznimi pogoji. V preskusih se uporabljajo nevtralni transgeni, ki se zlahka pridobijo iz večine tkiv.
12. Osnovni preskus genskih mutacij pri gensko spremenjenih glodavcih obsega tretiranje glodavca v določenem obdobju. Kemikalije se lahko dajejo na kateri koli primerni način, vključno z vsaditvijo (npr. preskušanje medicinskih pripomočkov). Celotno obdobje, v katerem žival prejema odmerek, se imenuje obdobje odmerjanja. Odmerjanju običajno sledi obdobje pred usmrtitvijo, med katerim žival ne prejema kemikalije in med katerim se nepopravljene poškodbe DNA ustalijo kot stabilne mutacije. V virih se to obdobje različno imenuje sprememba, ustalitev ali izražanje; ob koncu tega obdobja sledi vzorčenje (15) (29). Po usmrtitvi živali se genomski DNA izolira iz interesnih tkiv in prečisti.
13. Podatki za eno samo tkivo na žival iz več pakiranj/ligacij se ponavadi združijo in pogostnost mutantov se običajno ovrednoti z uporabo skupno med 105 in 107 enot, ki delajo plake ali kolonije. Pri uporabi metod s pozitivno selekcijo se skupno število enot, ki tvorijo plake, določi z ločenim sklopom neselektivnih plošč.
14. Metode s pozitivno selekcijo so se razvile zaradi poenostavitve odkrivanja mutacij pri genu gpt (gpt delta miš in podgana, gpt – fenotip (20) (22) (28)) in genu lacZ (Muta™Mouse ali miš s plazmidom z genom lacZ (3) (10) (11) (30)); genske mutacije lacI v živalih Big Blue® se odkrivajo z neselektivno metodo, ki mutante opredeli s proizvajanjem obarvanih (modrih) plakov. Metodologija pozitivne selekcije je v uporabi tudi za odkrivanje točkovnih mutacij v genu cII prenosljivega vektorja na osnovi bakteriofaga λ [miš ali podgana Big Blue® in miš Muta™Mouse (17)] in delecijske mutacije v λ rdečih in gam genih (selekcija Spi– v miši in podgani z genom gpt (21) (22) (28)). Pogostnost mutantovse izračuna tako, da se število plakov/plazmidov z mutacijami v transgenu deli s skupnim številom plakov/plazmidov, pridobljenih iz istega vzorca DNA. Sporočeni parameter pri preskusih genskih mutacij pri gensko spremenjenih glodavcih je pogostnost mutantov. Poleg tega je pogostnost mutantov mogoče določiti kot del celic, ki prenašajo neodvisne mutacije; pri tem izračunu je potreben popravek za klonalno ekspanzijoz določanjem zaporedja pridobljenih mutantov (24).
15. Mutacije v preskusih točkovnih mutacij v genih lacI, lacZ, cII in gpt so v glavnem sestavljene iz mutacij substitucij baznih parov, premikov bralnega okvira ter majhnih insercij/delecij. Sorazmerni delež teh vrst mutacij med spontanimi mutacijami je podoben kot pri tistem v endogenem genu Hprt. Obsežne delecije je mogoče zaznati samo v preskusih s selekcijo Spi– in plazmidom lacZ (24). Interesne mutacije so mutacije in vivo v miši ali podgani. Mutacije in vitro in ex vivo, ki se lahko pojavijo med pridobivanjem, podvajanjem ali popravilom fagov/plazmidov, so relativno redke, v nekaterih sistemih pa jih lahko bakterijski gostitelj/sistem pozitivne selekcije posebej identificira ali izključi.
OPIS PRESKUSNE METODE
Priprava
Izbira živalskih vrst
16. Na voljo so številni modeli za odkrivanje genskih mutacij v gensko spremenjeni miši, njihova uporaba pa je bolj razširjena od modelov z gensko spremenjeno podgano. Če je podgana očitno primernejši model od miši (npr. pri preiskovanju mehanizma karcinogeneze za tumor, ki se pojavi samo pri podganah, za povezavo s študijami strupenosti pri podganah, ali če je presnova podgane bolj reprezentativna za človeško presnovo), je treba razmisliti o uporabi modelov z gensko spremenjeno podgano.
Nastanitveni in prehranjevalni pogoji
17. Temperatura v prostoru s preskusnimi živalmi naj bo 22 °C (± 3 °C). Čeprav naj bi bila relativna vlažnost vsaj 30 % in naj po možnosti ne bi presegala 70 %, razen v času čiščenja prostora, bi cilj moral biti ohranjanje 50–60-odstotne relativne vlažnosti. Osvetlitev naj bo umetna, pri čemer je zaporedje 12 ur svetlobe in 12 ur teme. Za hranjenje se lahko uporablja konvencionalna laboratorijska prehrana z neomejeno oskrbo s pitno vodo. Na izbiro prehrane lahko vpliva potreba po zagotovitvi ustrezne primesi preskusne kemikalije, kadar se daje na ta način. Če agresivno vedenje ni pričakovano, je treba živali namestiti v majhnih skupinah (po največ pet živali) istega spola. Če je to znanstveno upravičeno, so lahko živali nameščene posamično.
Priprava živali
18. Zdrave mlade spolno zrele odrasle živali (ob začetku tretiranja stare 8–12 tednov) se naključno razdelijo v kontrolne in tretirane skupine. Živali se označijo z edinstvenimi oznakami. Živali se vsaj pet dni prilagajajo na laboratorijske razmere. Kletke je treba razporediti tako, da so možni učinki zaradi njihovega položaja čim manjši. Ob začetku študije naj bo razlika med težami živali čim manjša in naj ne presega ± 20 % srednje vrednosti teže vsakega spola.
Priprava odmerkov
19. Trdne preskusne kemikalije naj se pred odmerjanjem živalim raztopijo ali suspendirajo v ustreznih topilih ali nosilcih ali primešajo prehrani ali pitni vodi. Tekoče preskusne kemikalije se lahko odmerijo neposredno ali pa se pred odmerjanjem razredčijo. Pri izpostavljenosti z vdihavanjem se lahko preskusne kemikalije dajejo v obliki plina, pare ali trdnega/tekočega aerosola, odvisno od njihovih fizikalno-kemijskih lastnosti. Uporabljajo naj se sveže pripravljene preskusne kemikalije, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo.
Preskusni pogoji
Topilo/nosilec
20. Topilo/nosilec pri uporabljenih količinah odmerkov naj nima strupenih učinkov in naj se zanj ne sumi, da kemično reagira s preskusno kemikalijo. Če se uporabijo manj poznana topila/nosilci, naj bo njihova uporaba podprta z referenčni podatki, ki kažejo na njihovo združljivost. Priporoča se, da se, kadar koli je to mogoče, najprej razmisli o uporabi vodnega topila/nosilca.
Pozitivni kontrolni vzorci
21. Običajno je treba hkrati uporabiti živali pozitivne kontrole. Laboratoriji, ki so dokazali usposobljenost (glej odstavek 23) in redno izvajajo te preskuse, lahko za potrditev uspešnosti metode v vsako študijo vključijo DNA tretiranih živali iz prejšnjih pozitivnih kontrol. DNA iz prejšnjih preskusov je treba pridobiti iz istih vrst in interesnih tkiv ter primerno shraniti (glej odstavek 36). Pri uporabi hkratnih pozitivnih kontrolnih vzorcev ni treba, da se odmerjajo na enak način kot preskusna kemikalija, vendar pa mora zanje biti znano, da povzročajo mutacije v vsaj enem interesnem tkivu za preskusno kemikalijo. Odmerke kemikalije pozitivne kontrole je treba izbrati tako, da bodo sprožili blage ali zmerne učinke, na podlagi katerih bo mogoče kritično oceniti uspešnost in občutljivost preskusa. Primeri kemikalij pozitivne kontrole in nekatera njihova tarčna tkiva so navedeni v tabeli 1.
Tabela 1
Primeri kemikalij pozitivne kontrole in nekatera njihova tarčna tkiva
|
Kemikalije pozitivne kontrole in njihove št. CAS |
Ime EINECS in št. EINECS |
Značilnosti |
Tarčno tkivo mutacije |
|
|
Podgana |
Miš |
|||
|
N-etil-N-nitrozosečnina [št. CAS 759-73-9] |
N-etil-N-nitrozosečnina [212-072-2] |
Neposredno delujoč mutagen |
Jetra, pljuča |
Kostni mozeg, debelo črevo, epitelij debelega črevesa, črevesje, jetra, pljuča, vranica, ledvice, granulozne celice v jajčnikih, moške klične celice |
|
Etil karbamat (uretan) [št. CAS 51-79-6] |
Uretan [200-123-1] |
Mutagen, potrebna je presnova, a ima samo blage učinke |
|
Kostni mozeg, predželodec, tanko črevo, jetra, pljuča, vranica |
|
2,4-diaminotoluen [št. CAS 95-80-7] |
4-metil-m-fenilendiamin [202-453-1] |
Mutagen, potrebna je presnova, pozitiven je tudi v preskusu s Spi– |
Jetra |
Jetra |
|
Benzo[a]piren [št. CAS 50-32-8] |
Benzo[def]krizen [200-028-5] |
Mutagen, potrebna je presnova |
Jetra, omentum |
Kostni mozeg, prsi, debelo črevo, predželodec, žlezni želodec, srce, jetra, pljuča, moške klične celice |
Negativni kontrolni vzorci
22. Negativne kontrolne vzorce, tretirane samo s topilom ali nosilcem, drugače pa tretirane enako kot tretirane skupine, je treba vključiti v vsako vzorčenje. Če pretekli ali objavljeni podatki ne dokazujejo, da izbrano topilo/nosilec ne povzroča nobenih škodljivih ali mutagenih učinkov, se v vsako vzorčenje vključijo neobdelani kontrolni vzorci, da se dokaže sprejemljivost kontrole nosilca.
Preverjanje strokovnosti laboratorija
23. Usposobljenost za izvajanje teh preskusov se dokaže s prikazom zmožnosti ponovitve pričakovanih rezultatov iz objavljenih podatkov (24) za: 1) pogostnost mutacij s kemikalijami pozitivne kontrole (vključno z blagimi odzivi), kot so kemikalije iz tabele 1, nemutageni in kontrole nosilca, in 2) pridobivanje transgena iz genomskega DNA (npr. učinkovitost pakiranja).
Določanje zaporedja mutantov
24. Za regulativno uporabo določanje zaporedja DNA mutantov ni potrebno, zlasti če je dobljen jasen pozitiven ali negativen rezultat. Podatki o določanju zaporedja pa so lahko koristni pri pojavu visoke interindividualne variacije. V teh primerih se lahko določanje zaporedja uporabi za izključitev pojava velikega števila mutantov (t. i. jackpots) ali klonov z opredelitvijo edinstvenih mutantov v določenem tkivu. Določanje zaporedja približno 10 mutantov na tkivo na žival bi moralo zadoščati za preprosto ugotavljanje, ali klonski mutanti prispevajo k pogostnosti mutantov; za matematično popravo pogostnosti mutantov za klonskost bo morda potrebnih tudi do 25 mutantov. Določanje zaporedja mutantov bo morda potrebno tudi pri manjšem povečanju pogostnosti mutantov (tj. ki komaj presežejo vrednosti v neobdelanih kontrolnih vzorcih). Razlike v spektru mutantov med kolonijami mutantov v tretiranih in netretiranih živalih bodo morda podprle mutageni učinek (29). Spektri mutantov so lahko koristni tudi za razvoj mehanističnih hipotez. Ko naj bi bilo določanje zaporedja vključeno v protokol študije, je treba biti posebej pazljiv pri načrtovanju takšnih študij, zlasti glede števila mutantov z določenim zaporedjem na vzorec, da se doseže ustrezna moč glede na uporabljen statistični model (glej odstavek 43).
POSTOPEK
Število in spol živali
25. Vnaprej določeno število živali na skupino mora biti tolikšno, da se zagotovi statistična moč, potrebna za odkrivanje vsaj podvajanja pogostnosti mutantov. Skupine naj bodo sestavljene iz vsaj pet živali; če je statistična moč premajhna, je treba povečati število živali po potrebi. Običajno se uporabijo živali moškega spola. V nekaterih primerih bi bilo morda preskušanje samo samic upravičeno; na primer pri preskušanju zdravil, ki jih tipično uporabljajo ženske, ali raziskovanju presnove, značilne za ženske. Če so med spoloma glede strupenosti ali presnove velike razlike, bo potrebno preskušanje na samcih in samicah.
Obdobje odmerjanja
26. Na podlagi ugotovitev, da se mutacije kopičijo z vsakim tretiranjem, je potreben režim s ponavljajočimi se odmerki, in sicer dnevnim tretiranjem prek 28 dni. Na splošno naj bi bilo to dovolj časa, da šibki mutageni nakopičijo dovolj mutacij, izpostavljenost pa dovolj dolga, da je mogoče odkriti mutacije v počasi množečih se organih. Za nekatera vrednotenja so morda primerni tudi drugi režimi tretiranja, te druge razporede dajanja odmerkov pa je treba znanstveno upravičiti v protokolu. Tretiranje mora trajati vsaj toliko časa, kolikor je potrebnega za popolno indukcijo vseh zadevnih presnovnih encimov, pri krajših tretiranjih pa bo morda potrebno večkratno vzorčenje, ki je primerno za organe z različnimi stopnjami namnoževanja. V vsakem primeru je treba pri utemeljitvi protokola uporabiti vse razpoložljive informacije (npr. o splošni strupenosti ali presnovi in farmakokinetiki), zlasti pri odstopanju od navedenih standardnih priporočil. Sicer lahko tretiranje, daljše od 8 tednov poveča občutljivost, vendar ga je treba jasno razložiti in utemeljiti, saj lahko dolgo tretiranje povzroči navidezno povečanje pogostnosti mutantov zaradi klonalne ekspanzije (29).
Velikost odmerkov
27. Velikosti odmerkov naj temeljijo na rezultatih študije za ugotavljanje območja za merjenje splošne strupenosti, ki je bila opravljena z enakim načinom izpostavljenosti, ali pa na rezultatih že obstoječih študij subakutne strupenosti. Za določanje območij odmerkov se lahko uporabijo gensko nespremenjene živali istega seva glodavcev. Da bi se dobile informacije o odzivu na odmerek, je treba v glavnem preskusu v celotno študijo vključiti negativno kontrolno skupino (glej odstavek 22) in najmanj tri ustrezno razporejene velikosti odmerka, razen če se uporabi mejni odmerek (glej odstavek 28). Največji odmerek bi moral biti največji tolerančni odmerek (MTD). Največji tolerančni odmerek je odmerek, ki povzroči takšne znake strupenosti, da se pričakuje, da bi večji odmerki pri istem režimu odmerjanja povzročili smrt. Snovi s specifičnim biološkim delovanjem pri majhnih, nestrupenih odmerkih (kakor so hormoni in mitogeni) in kemikalije, ki kažejo nasičenost toksokinetičnih lastnosti, so lahko izjeme pri merilih za določanje odmerka in naj se ovrednotijo za vsak primer posebej. Uporabljene velikosti odmerkov naj zajemajo območje od največje strupenosti do majhne strupenosti ali nestrupenosti.
Mejni preskus
28. Če preskusi za ugotavljanje območja odmerkov ali obstoječi podatki povezanih sevov glodavcev kažejo, da režim tretiranja z najmanj mejnim odmerkom (glej v nadaljevanju) ne povzroči nobenih opaznih učinkov strupenosti in če se na podlagi podatkov o strukturno sorodnih snoveh ne pričakuje, da bo snov genotoksična, se lahko pojmuje, da popolna študija z uporabo treh velikosti odmerkov ni potrebna Pri 28-dnevnem obdobju odmerjanja (tj. 28 dnevnih tretiranj) je mejni odmerek 1 000/mg/kg telesne teže/dan. Pri največ 14-dnevnem obdobju odmerjanja je mejni odmerek 2 000 mg/kg telesne teže/dan (razporede odmerjanja, ki se razlikujejo od 28 dnevnih tretiranj, je treba znanstveno utemeljiti v protokolu; glej odstavek 26).
Dajanje odmerkov
29. Navadno se preskusna kemikalija daje z gavažo po želodčni cevki ali ustrezni intubacijski kanili. Na splošno je treba pri načrtovanju študije upoštevati predviden način izpostavljenosti pri ljudeh. Zato so sprejemljivi tudi drugi načini izpostavljanja (pitna voda, podkožno, intravenozno, lokalno, vdihavanje, intratrahealno, s prehrano ali vsadkom), kadar se lahko utemeljijo. Dajanje z intraperitonealno injekcijo ni priporočeno, saj ni fiziološko pomemben način izpostavljenosti pri ljudeh. Največja količina tekočine, ki se lahko naenkrat da z gavažo ali injekcijo, je odvisna od velikosti preskusne živali. Količina ne sme presegati 2 ml/100 g telesne teže. Uporabo večjih količin je treba utemeljiti. Razen pri dražečih ali jedkih kemikalijah, ki pri višjih koncentracijah navadno povzročajo močnejše učinke, je treba variabilnost preskusne količine s prilagajanjem koncentracije obdržati na kar najnižji ravni, da bi zagotovili konstantno količino pri vseh odmerkih.
Vzorčenje
Somatske celice
30. Vzorčenje je pomembna spremenljivka, ker je določeno z obdobjem, potrebnim za ustalitev mutacije. To obdobje je odvisno od tkiva in je očitno povezano z obnavljanjem populacije celic, pri čemer se kostni mozeg in črevesje hitro odzivata, jetra pa precej počasneje. Ustrezen kompromis za merjenje pogostnosti mutantov v hitro in počasi se množečih tkivih je 28 zaporednih dni tretiranja (kot je navedeno v odstavku 26) in vzorčenje tri dni po zadnjem tretiranju; mogoče pa je, da v takih pogojih v počasi se množečih tkivih ne bo prišlo do največje pogostnosti mutantov. Če so počasi množeča se tkiva še posebej pomembna, bo morda primernejše poznejše obdobje vzorčenja 28 dni po 28 dneh dajanja odmerkov (16) (29). V takih primerih bi poznejše vzorčenje zamenjalo tridnevno vzorčenje, za kar bi bila potrebna znanstvena utemeljitev.
Klične celice
31. Preskusi pri gensko spremenjenih glodavcih so primerni za študijo povzročanja mutacije genov v moških kličnih celicah (7) (8) (27), pri kateri sta čas in kinetika spermatogeneze dobro opredeljeni (27). Ker je število jajčnih celic, ki so na voljo za analizo, nizko celo po superovulaciji in zaradi dejstva, da v oocitih sinteza DNA ne poteka, za določanje mutacij v ženskih kličnih celicah ni mogoče uporabiti transgenskih preskusov (31).
32. Časi vzorčenja moških kličnih celic morajo biti izbrani tako, da so vzorčene različne vrste izpostavljenih celic v različnih fazah razvoja klične celice in da je bila tarčna faza vzorčenja dovolj izpostavljena. Obdobje, v katerem klične celice napredujejo od zarodnih celic iz spermatogonijev do zrele sperme, ki doseže semenovode/repe obmodkov, traja ~ 49 dni pri miši (36) in ~ 70 dni pri podgani (34) (35). Po 28-dnevnem izpostavljanju, ki mu sledi tridnevno vzorčenje, bo seme, odvzeto iz semenovodov/repov obmodkov (7) (8), predstavljalo populacijo celic, izpostavljenih med približno zadnjo polovico spermatogeneze, ki obsega mejotično in postmejotično obdobje, ne pa tudi obdobja spermatogonijev ali zarodnih celic. Da bi bile celice v semenovodih/repih obmodkov, ki so bile zarodne celice spermatogonijev v obdobju izpostavljenosti, ustrezno vzorčene, je po končanem tretiranju potrebno dodatno vzorčenje vsaj 7 tednov (pri miši) ali 10 tednov (pri podgani).
33. Celice, pridobljene iz semenskih cevk po režimu 28 dni + 3 dnevi, predstavljajo mešano populacijo, obogateno za vse faze kličnih celic v razvoju (7) (8). Ocena faz, v katerih so povzročene mutacije klične celice, z vzorčenjem teh celic za odkrivanje genske mutacije ni tako natančna kot z vzorčenjem semenčic iz semenovodov/repov obmodkov (ker se iz cevk odvzamejo vzorci številnih različnih celic in bo nekaj somatskih celic to populacijo celic kontaminiralo). Vendar pa so z vzorčenjem iz semenskih cevk in semenčic iz semenovodov/repov obmodkov po režimu vzorčenja samo 28 dni + 3 dnevi v določeni meri zajete celice, izpostavljene v večini razvojnih faz klične celice, kar je lahko koristno za odkrivanje nekaterih mutagenov kličnih celic.
Opazovanja
34. Splošna klinična opazovanja je treba opraviti vsaj enkrat na dan, po možnosti vsak dan ob istem času in ob upoštevanju obdobja največje intenzivnosti pričakovanih učinkov po vnosu odmerka. Zabeležiti je treba podatke o zdravstvenem stanju živali. Živali je treba vsaj dvakrat na dan opazovati za določitev obolevnosti in smrtnosti. Vse živali je treba stehtati vsaj enkrat tedensko in ob usmrtitvi. Meritve porabe hrane je treba opraviti vsaj tedensko. Če se preskusna kemikalija daje s pitno vodo, je treba izmeriti porabo vode pri vsaki menjavi vode in vsaj tedensko. Živali, ki kažejo nesmrtonosne znake čezmerne strupenosti, je treba usmrtiti pred koncem preskusnega obdobja (23).
Odvzem tkiv
35. Odvzem tkiv je treba jasno utemeljiti. Ker je povzročanje mutacij mogoče proučevati v skoraj vsakem tkivu, je treba tkiva, ki bodo odvzeta, izbrati na podlagi razlogov za izvajanje študije in obstoječih podatkih o mutagenosti, rakotvornosti ali strupenosti za preskuševano kemikalijo. Pomembni dejavniki, ki jih je treba upoštevati, so način dajanja (na podlagi verjetnih načinov izpostavljenosti pri ljudeh), predvidena razporeditev tkiv in možni mehanizem delovanja. Če ni nobenih osnovnih informacij, je treba odvzeti več morebitnih interesnih somatskih tkiv. Ta tkiva naj bi predstavljala hitro množeča se in počasi množeča se tkiva ter tkiva, ki so mesto kontakta. Poleg tega je treba odvzeti semenčice iz semenovodov/repov obmodkov in klične celice v razvoju iz semenskih cevk (kakor je opisano v odstavkih 32 in 33) ter jih shraniti za primer, če bo v prihodnosti potrebna analiza mutagenosti kličnih celic. Pridobiti je treba podatke o teži organov, pri večjih organih pa je treba odvzeti isto območje pri vseh živalih.
Shranjevanje tkiv in DNA
36. Tkiva (ali homogenate tkiv) je treba shraniti pri najmanj – 70 °C, za izolacijo DNA pa jih je treba uporabiti v 5 letih. Izolirano DNA, shranjeno v hladilniku v primernem pufru pri 4 °C, je treba za analizo mutacij uporabiti v 1 letu.
Izbor tkiv za analizo mutantov
37. Izbira tkiva mora temeljiti na preudarkih, kot so: 1) način dajanja ali mesto prvega kontakta (npr. žlezni želodec pri dajanju oralno, pljuča pri dajanju z vdihavanjem ali koža pri lokalnem nanašanju); in 2) farmakokinetični parametri iz študij splošne strupenosti, ki kažejo na razporeditev, zadrževanje ali kopičenje v tkivih, ali tarčnih organih za strupenost. Če se izvajajo študije za nadaljnje spremljanje študij rakotvornosti, je treba upoštevati tarčna tkiva rakotvornosti. Izbira tkiv za analizo naj bi kar najbolj pripomogla k odkrivanju kemikalij, ki so neposredno delujoči mutageni in vitro, hitro metabolizirane, zelo reaktivne ali pa se slabo absorbirajo, ali pa kemikalij, pri katerih se tarčno tkivo določi z načinom dajanja (6).
38. Če ni nobenih osnovnih informacij, je treba ob upoštevanju mesta kontakta zaradi načina dajanja za mutagenost ovrednotiti jetra in vsaj eno hitro se množeče tkivo (npr. žlezni želodec, kostni mozeg). V večini primerov je mogoče navedene zahteve izpolniti z analizo dveh skrbno izbranih tkiv, v nekaterih primerih pa bodo potrebna vsaj tri tkiva. Če obstajajo razlogi za posebno zaskrbljenost glede učinkov kličnih celic, vključno s pozitivnimi odzivi v somatskih celicah, je treba tkiva kličnih celic ovrednotiti za mutacije.
Merilne metode
39. Za priporočene gensko spremenjene modele so na voljo standardne laboratorijske ali objavljene metode za odkrivanje mutantov: lambda bakteriofag in plazmid lacZ (30); miš lacI (2) (18); miš delta gpt (22); podgana delta gpt (28); cII (17). Prilagoditve je treba utemeljiti in ustrezno dokumentirati. Podatki iz več poskusov pakiranja se lahko združijo in uporabijo za doseganje zadostnega števila plakov ali kolonij. Če je za dosego ustreznega števila plakov potrebnih veliko reakcij pakiranja, to lahko kaže na slabo kakovost DNA. V takih primerih je treba podatke obravnavati previdno, saj so morda niso zanesljivi. Optimalno skupno število plakov ali kolonij na vzorec DNA določa statistična verjetnost odkrivanja zadostnega števila mutantov pri določeni spontani pogostnosti mutantov. Na splošno je potrebnih najmanj 125 000 do 300 000 plakov, če je spontana pogostnost mutantov v višini 3 × 10-5 (15). Pri preskusu Big Blue® lacI je treba dokazati, da je mogoče z vključitvijo ustreznih barvnih kontrol hkrati z vsakim nanosom odkriti celotno območje barvnih fenotipov mutantov. Tkiva in vzorce (elemente) slednjih je treba obdelati in analizirati z razdelitvijo v bloke, pri čemer se elementi iz kontrolne skupine z nosilcem/topilom, pozitivne kontrolne skupine (če se uporablja) ali DNA pozitivnega kontrolnega vzorca (če je primerno) in vsake tretirane skupine obdelajo skupaj.
PODATKI IN POROČANJE
Obdelava rezultatov
40. Podatki za posamezne živali naj bodo prikazani v tabelah. Preskusna enota je žival. Poročilo naj vsebuje skupno število enot, ki delajo plake ali kolonije, število mutantov in pogostnost mutantov za vsako tkivo vsake živali. Če izvedemo več reakcij pakiranja/sproščanja fagov, je treba sporočiti število reakcij na posamezni vzorec DNA. Sicer je treba shraniti podatke za vsako posamezno reakcijo, vendar je treba sporočiti samo skupno število enot, ki delajo plake ali kolonije. Sporočiti je treba podatke o strupenosti in kliničnih znakih v skladu z odstavkom 34. Morebitne rezultate določanja zaporedja je treba predstaviti za vsak analizirani mutant in izračune pogostnosti mutantov prikazati za vsako žival in tkivo.
Statistično vrednotenje in razlaga rezultatov
41. Za določitev pozitivnega rezultata obstaja več meril, na primer povečanje pogostnosti mutantov, povezano z odmerkom, ali očitno povečanje pogostnosti mutantov v skupini z enim odmerkom v primerjavi s kontrolno skupino s topilom/nosilcem. Da bi dobili dovolj podatkov za analizo odziva na odmerek, je treba analizirati vsaj tri tretirane skupine. Najprej naj se prouči biološka pomembnost rezultatov, pri vrednotenju rezultatov preskusa pa se kot pomoč lahko uporabijo ustrezne statistične metode (4) (14) (15) (25) (26). V uporabljenih statističnih preskusih naj bo preskusna enota žival.
42. Preskusno kemikalijo, pri kateri rezultati ne izpolnjujejo navedenih meril v katerem od tkiv, je treba v tem preskusu šteti za nemutageno. Za biološko pomembnost negativnega rezultata je treba potrditi izpostavljenost tkiva.
43. Za analize določanja zaporedja DNA so za pomoč pri razlagi rezultatov na voljo številni statistični pristopi (1) (5) (9) (19).
44. Upoštevanje tega, ali so dobljene vrednosti v razponu preteklih kontrol ali zunaj njega, lahko zagotovi smernice pri ocenjevanju biološke pomembnosti odziva (32).
Poročilo o preskusu
45. Poročilo o preskusu mora vključevati naslednje podatke:
Preskusna kemikalija:
|
— |
identifikacijske podatke in št. CAS, če je znana, |
|
— |
izvor, številko serije, če je na voljo, |
|
— |
agregatno stanje in čistoto, |
|
— |
fizikalno-kemijske lastnosti, pomembne za izvedbo študije, |
|
— |
stabilnost preskusne kemikalije, če je znana. |
Topilo/nosilec:
|
— |
utemeljitev izbire uporabljenega nosilca, |
|
— |
topnost in stabilnost preskusne kemikalije v topilu/nosilcu, če sta znani, |
|
— |
pripravo pripravkov hrane in pitne vode ali pripravkov za vdihavanje, |
|
— |
analitične ugotovitve o pripravkih (npr. stabilnost, homogenost, nominalne koncentracije). |
Preskusne živali:
|
— |
uporabljeno vrsto/sev in utemeljitev izbire, |
|
— |
število, starost in spol živali, |
|
— |
izvor, nastanitvene razmere, hrano itd., |
|
— |
težo posameznih živali na začetku preizkusa, skupaj z območjem, srednjo vrednostjo in standardnim odklonom telesne teže za vsako skupino. |
Preskusni pogoji:
|
— |
podatke o pozitivnih in negativnih (nosilec/topilo) kontrolnih vzorcih, |
|
— |
podatke iz študije za ugotavljanje območja, |
|
— |
utemeljitev izbire velikosti odmerka, |
|
— |
podrobnosti o pripravi preskusne kemikalije, |
|
— |
podrobne podatke o dajanju preskusne kemikalije, |
|
— |
utemeljitev načina dajanja, |
|
— |
metode za merjenje strupenosti za živali, vključno s histopatološko ali hematološko analizo, če sta bili uporabljeni, ter pogostost opazovanja živali in tehtanja, |
|
— |
v primeru negativnih rezultatov metode za preverjanje, ali je preskusna kemikalija dosegla tarčno tkivo ali krvni obtok, |
|
— |
dejanski odmerek (mg/kg telesne teže/dan), preračunan na podlagi koncentracije preskusne kemikalije v hrani/pitni vodi (ppm) in porabe, če je primerno, |
|
— |
podrobne podatke o kakovosti hrane in vode, |
|
— |
podroben opis razporedov tretiranj in vzorčenj ter utemeljitev izbir, |
|
— |
metode usmrtitve, |
|
— |
postopke za izolacijo in hrambo tkiv, |
|
— |
metode za izolacijo genomske DNA pri glodavcih, reševanje transgena iz genomske DNA in prenos transgene DNA v bakterijskega gostitelja, |
|
— |
izvor in številko serij za vse celice, komplete in reagente (kjer je primerno), |
|
— |
metode za štetje mutantov, |
|
— |
metode za molekularno analizo mutantov in uporabo pri popravi za klonskost in/ali izračun pogostnosti mutantov, če je primerno. |
Rezultati:
|
— |
stanje živali pred preskusnim obdobjem in med njim, vključno z znaki strupenosti, |
|
— |
telesno težo in težo organov ob usmrtitvi, |
|
— |
za vsako tkivo/žival število mutantov, število ovrednotenih plakov ali kolonij, pogostnost mutantov, |
|
— |
za vsako skupino tkiv/živali število reakcij v obliki pakiranj na posamezni vzorec DNA, skupno število mutantov, povprečno pogostnost mutantov, standardni odklon, |
|
— |
odvisnost med odmerkom in odzivom, kadar je to mogoče, |
|
— |
za vsako tkivo/žival število neodvisnih mutantov in povprečno pogostnost mutantov, če je bila izvedena molekularna analiza mutantov, |
|
— |
podatke o hkratni in pretekli negativni kontroli z območji, povprečji in standardnimi odkloni, |
|
— |
podatke o hkratni pozitivni kontroli (ali nehkratni pozitivni kontroli za DNA), |
|
— |
analitične ugotovitve, če so na voljo (npr. koncentracija DNA pri pakiranju, podatki o določanju zaporedja DNA), |
|
— |
uporabljene statistične analize in metode. |
Razprava o rezultatih
Sklepna ugotovitev
VIRI
|
(1) |
Adams, W.T. and T.R. Skopek (1987), ‚Statistical Test for the Comparison of Samples from Mutational Spectra‘, J. Mol. Biol., 194: 391–396. |
|
(2) |
Bielas, J.H. (2002), ‚A more Efficient Big Blue® Protocol Improves Transgene Rescue and Accuracy in an Adduct and Mutation Measurement‘, Mutation Res., 518: 107–112. |
|
(3) |
Boerrigter, M.E., M.E. Dollé, H.-J. Martus, J.A. Gossen and J. Vijg (1995), ‚Plasmid-based Transgenic Mouse Model for Studying in vivo Mutations‘Nature, 377(6550): 657–659. |
|
(4) |
Carr, G.J. and N.J. Gorelick (1995), ‚Statistical Design and Analysis of Mutation Studies in Transgenic Mice‘, Environ. Mol. Mutagen, 25(3): 246–255. |
|
(5) |
Carr, G.J. and N.J. Gorelick (1996), ‚Mutational Spectra in Transgenic Animal Research: Data Analysis and Study Design Based upon the Mutant or Mutation Frequency‘, Environ. Mol. Mutagen, 28: 405–413. |
|
(6) |
Dean, S.W., T.M. Brooks, B. Burlinson, J. Mirsalis, B. Myhr, L. Recio and V. Thybaud (1999), ‚Transgenic Mouse Mutation Assay Systems can Play an important Role in Regulatory Mutagenicity Testing in vivo for the Detection of Site-of-contact Mutagens‘, Mutagenesis, 14(1): 141–151. |
|
(7) |
Douglas, G.R., J. Jiao, J.D. Gingerich, J.A. Gossen and L.M. Soper(1995), ‚Temporal and Molecular Characteristics of Mutations Induced by Ethylnitrosourea in Germ Cells Isolated from Seminiferous Tubules and in Spermatozoa of lacZ Transgenic Mice‘, Proc. Natl. Acad. Sci. USA, 92: 7485–7489. |
|
(8) |
Douglas, G.R., J.D. Gingerich, L.M. Soper and J. Jiao (1997), ‚Toward an Understanding of the Use of Transgenic Mice for the Detection of Gene Mutations in Germ Cells‘, Mutation Res., 388(2-3): 197–212. |
|
(9) |
Dunson, D.B. and K.R. Tindall (2000), ‚Bayesian Analysis of Mutational Spectra‘, Genetics, 156: 1411–1418. |
|
(10) |
Gossen, J.A., W.J. de Leeuw, C.H. Tan, E.C. Zwarthoff, F. Berends, P.H. Lohman, D.L. Knook and J. Vijg (1989), ‚Efficient Rescue of Integrated Shuttle Vectors from Transgenic Mice: a Model for Studying Mutations in vivo‘, Proc. Natl. Acad. Sci. USA, 86(20): 7971–7975. |
|
(11) |
Gossen, J.A. and J. Vijg (1993), ‚A Selective System for lacZ-Phage using a Galactose-sensitive E. coli Host‘, Biotechniques, 14(3): 326, 330. |
|
(12) |
Erikson, R.P. (2003), ‚Somatic Gene Mutation and Human Disease other than Cancer‘, Mutation Res., 543: 125–136. |
|
(13) |
Erikson, R.P. (2010), ‚Somatic Gene Mutation and Human Disease other than Cancer: an Update‘, Mutation Res., 705: 96–106. |
|
(14) |
Fung, K.Y., G.R. Douglas and D. Krewski (1998), ‚Statistical Analysis of lacZ Mutant Frequency Data from Muta™Mouse Mutagenicity Assays‘, Mutagenesis, 13(3): 249–255. |
|
(15) |
Heddle, J.A., S. Dean, T. Nohmi, M. Boerrigter, D. Casciano, G.R. Douglas, B.W. Glickman, N.J. Gorelick, J.C. Mirsalis, H.-J Martus, T.R. Skopek, V. Thybaud, K.R.Tindall and N. Yajima (2000), ‚In vivo Transgenic Mutation Assays‘, Environ. Mol. Mutagen., 35: 253–259. |
|
(16) |
Heddle, J.A., H.-J. Martus and G.R. Douglas (2003), ‚Treatment and Sampling Protocols for Transgenic Mutation Assays‘, Environ. Mol. Mutagen., 41: 1–6. |
|
(17) |
Jakubczak, J.L., G. Merlino, J.E. French, W.J. Muller, B. Paul, S. Adhya and S. Garges (1996), ‚Analysis of Genetic Instability during Mammary Tumor Progression using a novel Selection-based Assay for in vivo Mutations in a Bacteriophage λ Transgene Target‘, Proc. Natl. Acad. Sci. USA, 93(17): 9073–9078. |
|
(18) |
Kohler, S.W., G.S. Provost, P.L. Kretz, A. Fieck, J.A. Sorge and J.M. Short (1990), ‚The Use of Transgenic Mice for Short-term, in vivo Mutagenicity Testing‘, Genet. Anal. Tech. Appl., 7(8): 212–218. |
|
(19) |
Lewis P.D., B. Manshian, M.N. Routledge, G.B. Scott and P.A. Burns (2008), ‚Comparison of Induced and Cancer-associated Mutational Spectra using Multivariate Data Analysis‘, Carcinogenesis, 29(4): 772–778. |
|
(20) |
Nohmi, T., M. Katoh, H. Suzuki, M. Matsui, M. Yamada, M. Watanabe, M. Suzuki, N. Horiya, O. Ueda, T. Shibuya, H. Ikeda and T. Sofuni (1996), ‚A new Transgenic Mouse Mutagenesis Test System using Spi– and 6-thioguanine Selections‘, Environ. Mol. Mutagen., 28(4): 465–470. |
|
(21) |
Nohmi, T., M. Suzuki, K. Masumura, M. Yamada, K. Matsui, O. Ueda, H. Suzuki, M. Katoh, H. Ikeda and T. Sofuni (1999), ‚Spi– Selection: an Efficient Method to Detect γ-ray-induced Deletions in Transgenic Mice‘, Environ. Mol. Mutagen., 34(1): 9–15. |
|
(22) |
Nohmi, T., T. Suzuki and K.I. Masumura (2000), 'Recent Advances in the Protocols of Transgenic Mouse Mutation Assays', Mutation Res., 455(1–2): 191–215. |
|
(23) |
OECD (2000), Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation, Series on Testing and Assessment, No 19, ENV/JM/MONO(2000)7, OECD, Paris. |
|
(24) |
OECD (2009), Detailed Review Paper on Transgenic Rodent Mutation Assays, Series on Testing and Assessment, No 103, ENV/JM/MONO(2009)7, OECD, Paris. |
|
(25) |
Piegorsch, W.W., B.H. Margolin, M.D. Shelby, A. Johnson, J.E. French, R.W. Tennant and K.R. Tindall (1995), 'Study Design and Sample Sizes for a lacI Transgenic Mouse Mutation Assay', Environ. Mol. Mutagen., 25(3): 231–245. |
|
(26) |
Piegorsch, W.W., A.C. Lockhart, G.J. Carr, B.H. Margolin, T. Brooks, ... G.R. Douglas, U.M. Liegibel, T. Suzuki, V. Thybaud, J.H. van Delft and N.J. Gorelick (1997), ‚Sources of Variability in Data from a Positive Selection lacZ Transgenic Mouse Mutation Assay: an Interlaboratory Study‘, Mutation. Res., 388(2–3): 249–289. |
|
(27) |
Singer, T.M., I.B. Lambert, A. Williams, G.R. Douglas and C.L. Yauk (2006), ‚Detection of Induced Male Germline Mutation: Correlations and Comparisons between Traditional Germline Mutation Assays, Transgenic Rodent Assays and Expanded Simple Tandem Repeat Instability Assays‘, Mutation. Res., 598: 164–193. |
|
(28) |
Toyoda-Hokaiwado, N., T. Inoue, K. Masumura, H. Hayashi, Y. Kawamura, Y. Kurata, M. Takamune, M. Yamada, H. Sanada, T. Umemura, A. Nishikawa and T. Nohmi (2010), 'Integration of in vivo Genotoxicity and Short-term Carcinogenicity Assays using F344 gpt delta Transgenic Rats: in vivo Mutagenicity of 2,4-diaminotoluene and 2,6-diaminotoluene Structural Isomers', Toxicol. Sci., 114(1): 71–78. |
|
(29) |
Thybaud, V., S. Dean, T. Nohmi, J. de Boer, G.R. Douglas, B.W. Glickman, N.J. Gorelick, J.A. Heddle, R.H. Heflich, I. Lambert, H.-J. Martus, J.C. Mirsalis, T. Suzuki and N. Yajima (2003), ‚In vivo Transgenic Mutation Assays‘, Mutation Res., 540: 141–151. |
|
(30) |
Vijg, J. and G.R. Douglas (1996), 'Bacteriophage λ and Plasmid lacZ Transgenic Mice for studying Mutations in vivo' in: G. Pfeifer (ed.), Technologies for Detection of DNA Damage and Mutations, Part II, Plenum Press, New York, NY, USA, str. 391–410. |
|
(31) |
Yauk, C.L., J.D. Gingerich, L. Soper, A. MacMahon, W.G. Foster and G.R. Douglas (2005), ‚A lacZ Transgenic Mouse Assay for the Detection of Mutations in Follicular Granulosa Cells‘, Mutation Res., 578(1–2): 117–123. |
|
(32) |
Hayashi, M., K. Dearfield, P. Kasper, D. Lovell, H.-J. Martus, V. Thybaud (2011), ‚Compilation and Use of Genetic Toxicity Historical Control Data‘, Mutation Res., doi:10.1016/j.mrgentox.2010.09.007. |
|
(33) |
OECD (2011), Retrospective Performance Assessment of OECD Test Guideline on Transgenic Rodent Somatic and Germ Cell Gene Mutation Assays, Series on Testing and Assessment, No 145, ENV/JM/MONO(2011)20, OECD, Paris. |
|
(34) |
Clermont, Y. (1972), ‚Kinetics of spermatogenesis in mammals seminiferous epithelium cycle and spermatogonial renewal‘. Physiol. Rev. 52: 198–236. |
|
(35) |
Robaire, B., Hinton, B.T., and Oregbin-Crist, M.-C. (2006), ‚The Epididymis‘, in Neil, J.D., Pfaff, D.W., Chalis, J.R.G., de Kretser, D.M., Richards, J.S., and P. M, Wassarman (eds.), Physiology of Reproduction, Elsevier, the Netherlands, str. 1071–1148. |
|
(36) |
Russell, L.B. (2004), ‚Effects of male germ-cell stage on the frequency, nature, and spectrum of induced specific-locus mutations in the mouse‘, Genetica, 122: 25–36. |
Dodatek
OPREDELITEV POJMOV:
Obdobje odmerjanja : celotno obdobje, v katerem žival prejema odmerek.
Substitucija baznih parov : vrsta mutacije, ki povzroči zamenjavo enega samega nukleotidnega baznega para v DNA z drugim nukleotidnim baznim parom DNA.
Kapsida : proteinski plašč, ki ovija virusni delec.
Kemikalija : snov ali zmes.
Klonalna ekspanzija : nastanek številnih celic iz ene same (mutirane) celice.
Enote, ki delajo kolonije : merilo števila bakterij, sposobnih za razmnoževanje.
Konkatemer : dolga neprekinjena biomolekula, ki jo sestavlja več enakih kopij, povezanih v serijo.
Kohezivni konec : odsek enoverižne DNA z 12 nukleotidi, ki je na obeh koncih dvovijačnega genoma bakteriofaga lambda.
Delecija : mutacija, pri kateri genom izgubi enega ali več (zaporednih) nukleotidov.
Elektroporacija : uporaba električnih impulzov za povečanje prepustnosti celičnih membran.
Endogeni gen : gen, ki izvira iz genoma.
Povečana binomska porazdelitev : večja variabilnost pri ponovitvi ocene deleža populacije, kot bi bila pričakovana, če bi imela populacija binomsko porazdelitev.
Premik bralnega okvira : genetska mutacija, ki jo povzročijo insercije ali delecije števila nukleotidov, ki ni enakomerno deljivo s tri v zaporedju DNA, ki kodira za proteine/peptide.
Insercija : v zaporedje DNA je dodan najmanj en nukleotidni bazni par.
Jackpot : veliko število mutantov, ki s klonalno ekspanzijo nastanejo iz ene same mutacije.
Obsežne delecije : delecije v DNA, ki obsegajo več kot nekaj kilobaz (učinkovito se jih odkriva v preskusih s selekcijo Spi– in plazmidom lacZ).
Ligacija : kovalentno povezovanje dveh koncev molekul DNA z ligazo DNA.
Mitogen : kemikalija, ki celico spodbudi k celični delitvi, sproži mitozo (tj. celično delitev).
Nevtralni gen : gen, na katerega ne vplivajo pozitivni ali negativni selektivni pritiski.
Pakiranje : sinteza infektivnih bakteriofagnih delcev od priprave kapside bakteriofaga in proteinov repa in konkatemer molekul DNA bakteriofaga. Običajno se uporablja za pakiranje DNA, klonirano na vektor lambda (ločeno s kohezivnimi konci) v infekciozne delce lambde.
Učinkovitost pakiranja : učinkovitost, s katero so pakirani bakteriofagi integrirani v bakteriji gostiteljici.
Enote, ki delajo plake : merilo števila bakteriofagov, sposobnih za razmnoževanje.
Točkovna mutacija : splošni izraz za mutacijo, ki vpliva le na majhno zaporedje DNA, vključno z majhnimi insercijami, delecijami in zamenjavami baznih parov.
Pozitivna selekcija : metoda, ki preživetje omogoči samo mutantom.
Poročevalski gen : gen, pri katerem se hitro odkrije mutirani genski produkt.
Vzorčenje : konec obdobja, pred usmrtitvijo, med katerim žival ne prejema kemikalije in med katerim se nepopravljene poškodbe DNA fiksirajo v stabilne mutacije.
Vektor za prenos : vektor, ki je zgrajen tako, da se lahko razširi v dveh različnih vrstah gostiteljev; zato je mogoče DNA, vstavljeno v prenosljivi vektor, preskušati ali jo obravnavati v dveh različnih vrstah celic ali dveh različnih organizmih.
Preskusna kemikalija : vsaka snov ali zmes, preskušana s to preskusno metodo.
Transgensko : iz, se nanaša na ali pa je organizem, pri katerem je prišlo do spremembe genoma zaradi prenosa gena ali genov iz druge vrste.
(1) Glede na občutljivost preskusov kognitivne funkcije je treba razmisliti o preiskavi večjega števila živali, npr. največ 1 samca in 1 samice na zarod (za dodelitev živali glej Dodatek 1) (nadaljnja navodila glede velikosti vzorca so navedena v Smernici OECD št. 43 (8)).
(2) V tej tabeli je predstavljeno najmanjše število meritev, ki jih je treba izvesti. Glede na pričakovane učinke in rezultate začetnih meritev se lahko priporoča dodajanje dodatnih časovnih točk (npr. stare živali) ali opravljanje meritev v drugih razvojnih fazah.
(3) Priporoča se, da se preskusi na mladičih ne izvajajo dva dni po odstavitvi od sesanja (glej odstavek 32). Priporočeni starosti za preskuse v adolescenci sta: učenje in spominjanje = PPD 25 ± 2; motorična in senzorična funkcija = PPD 25 ± 2. Priporočena starost za preskuse na mladih odraslih je PPD 60–70.
(4) Telesno težo je treba v primeru neposrednega odmerjanja izmeriti vsaj dvakrat na teden, da se odmerki prilagodijo v času hitrega pridobivanja telesne teže.
(5) Teža možganov in nevropatologija se lahko ocenita prej (npr. na PPD 11), če je primerno (glej odstavek 39).
(6) Druge razvojne znake, poleg telesne teže (npr. odpiranje oči), je treba zabeležiti, kadar je primerno (glej odstavek 31).
(7) Glej odstavek 35.
(8) V tem primeru se zarodi zmanjšajo na 4 samce in 4 samice, pri čemer se mladi samci označijo s številkami od 1 do 4, mlade samice pa s številkami od 5 do 8.
(9) V tem primeru se zarodi zmanjšajo na 4 samce in 4 samice, pri čemer se mladi samci označijo s številkami od 1 do 4, mlade samice pa s številkami od 5 do 8.
(10) Za kognitivne preskuse na PPD 23 in pri mladih odraslih se uporabijo različne živali (npr. sodi/lihi zarodi od skupaj 20).
(11) V tem primeru se zarodi zmanjšajo na 4 samce in 4 samice, pri čemer se mladi samci označijo s številkami od 1 do 4, mlade samice pa s številkami od 5 do 8.
(12) Mejni koeficient variacij za zadevno tkivo je bil določen s pomočjo grafa vrednosti koeficienta variacij – zaporedno podanih od najnižje do najvišje – za vse srednje vrednosti iz vseh preskusov v validaciji z določenim modelom (z agonistom ali antagonistom). Mejna vrednost koeficienta variacij je bila odčitana s točke, pri kateri so vmesna povečanja do naslednjega najvišjega koeficienta variacij v seriji precej večja kot prejšnjih nekaj koeficientov variacij – 'točka preloma'. Opozoriti je treba, da so bile s to analizo sicer opredeljene relativno zanesljive 'točke preloma' za preskus z antagonistom, vendar so krivulje koeficienta variacij za preskus z agonistom pokazale bolj enakomerno povečanje, zaradi česar je opredelitev mejne vrednosti koeficienta variacij s to metodo do neke mere arbitrarna.
(13) Raziskave so pokazale, da je mlečna žleza, zlasti v zgodnji fazi svojega razvoja, občutljiva končna točka za estrogensko delovanje. Priporoča se, da se pri validaciji v to metodo vključijo končne točke v zvezi z mlečnimi žlezami obeh spolov.
(14) ATCC CRL-2128; ATCC, Manassas, VA, ZDA [http://www.lgcstandards-atcc.org/].
(15) ‚Nova serija‘ pomeni svežo serijo celic, prejetih od dobavitelja ATCC.
(16) ‚Zamrznjena serija‘ pomeni celice, ki so že bile gojene in nato zamrznjene v laboratoriju, ki ni laboratorij dobavitelja ATCC.
Opomba: Če je potrebna ekstrakcija, se za posamezen ekstrakt opravijo tri ponovne meritve. Vsak vzorec se ekstrahira samo enkrat.
Opomba: Meje meritve metode temeljijo na vrednostih osnovne proizvodnje hormonov iz tabele 5 in učinkovitosti. Če se lahko doseže večje osnovno proizvajanje hormonov, je lahko meja višja.
(19) Nekatera protitelesa za T in E2 so lahko pri večjih deležih navzkrižno reaktivna z androstendionom in estronom. V takih primerih ni mogoče točno določiti učinkov na 17β-HSD. Vendar lahko podatki kljub temu zagotavljajo uporabne informacije o učinkih na proizvajanje estrogena ali androgena na splošno. V takih primerih je treba podatke izraziti kot odzive androgena/estrogena in ne kot E2 in T.
(20) Ti vključujejo: holesterol, pregnenolon, progesteron, 11-deoksikortikosteron, kortikosteron, aldosteron, 17α-pregnenolon,17α-progesteron, deoksikortizol, kortizol, DHEA, androstendion, estron.
(21) Kontrolni vzorec (0) s topilom (DMSO), 1 μl DMSO/jamico.
(22) + : pozitivno.
N. r.: ni relevantno, ker ne sme biti sprememb po izpostavljenosti necitotoksičnim koncentracijam negativnega kontrolnega vzorca.
(23) Celice v praznih jamicah prejmejo le gojišče (tj. nič topila).
(24) Metanol (MeOH) se doda po koncu izpostavljenosti in ko je gojišče odstranjeno iz teh jamic.
(25) Kontrolni vzorec s topilom DMSO (1 μl/jamico).
(26) Potrditev prejšnjega poteka preskusa z uporabo enake zasnove preskusa.
(27) Ponovitev preskusa pri razporeditvi koncentracij z 1/2-logaritmom (omejitev koncentracij, ki so se v predhodnem preskusu izkazale za znatno različne).
(28) Razmerje spremembe pri eni koncentraciji se statistično znatno razlikuje od kontrolnega vzorca z raztopino.
(29) Nanaša se na ponovljene meritve istega vzorca.

