EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 01992L0065-20141229
Council Directive 92/65/EEC of 13 July 1992 laying down animal health requirements governing trade in and imports into the Community of animals, semen, ova and embryos not subject to animal health requirements laid down in specific Community rules referred to in Annex A (I) to Directive 90/425/EEC
Consolidated text: Direktiva Sveta 92/65/EGS z dne 13. julija 1992 o zahtevah zdravstvenega varstva živali za trgovino in za uvoz v Skupnost živali, semena, jajčnih celic in zarodkov, za katere ne veljajo zahteve zdravstvenega varstva živali, določene v posebnih pravilih Skupnosti iz Priloge A(I) k Direktivi 90/425/EGS
Direktiva Sveta 92/65/EGS z dne 13. julija 1992 o zahtevah zdravstvenega varstva živali za trgovino in za uvoz v Skupnost živali, semena, jajčnih celic in zarodkov, za katere ne veljajo zahteve zdravstvenega varstva živali, določene v posebnih pravilih Skupnosti iz Priloge A(I) k Direktivi 90/425/EGS
1992L0065 — SL — 29.12.2014 — 014.001
Ta dokument je mišljen zgolj kot dokumentacijsko orodje in institucije za njegovo vsebino ne prevzemajo nobene odgovornosti
|
DIREKTIVA SVETA 92/65/EGS z dne 13. julija 1992 (UL L 268, 14.9.1992, p.54) |
spremenjena z:
|
|
|
Uradni list |
||
|
No |
page |
date |
||
|
L 117 |
23 |
24.5.1995 |
||
|
L 102 |
63 |
12.4.2001 |
||
|
L 187 |
3 |
16.7.2002 |
||
|
UREDBA EVROPSKEGA PARLAMENTA IN SVETA (ES) št. 998/2003 z dne 26. maja 2003 |
L 146 |
1 |
13.6.2003 |
|
|
L 198 |
3 |
6.8.2003 |
||
|
DIREKTIVA SVETA 2004/68/ES Besedilo velja za EGP z dne 26. aprila 2004 |
L 139 |
320 |
30.4.2004 |
|
|
L 114 |
17 |
1.5.2007 |
||
|
DIREKTIVA SVETA 2008/73/ES Besedilo velja za EGP z dne 15. julija 2008 |
L 219 |
40 |
14.8.2008 |
|
|
L 52 |
14 |
3.3.2010 |
||
|
L 118 |
56 |
12.5.2010 |
||
|
L 293 |
62 |
11.11.2010 |
||
|
L 50 |
51 |
23.2.2012 |
||
|
DIREKTIVA 2013/31/EU EVROPSKEGA PARLAMENTA IN SVETA Besedilo velja za EGP z dne 12. junija 2013 |
L 178 |
107 |
28.6.2013 |
|
|
L 281 |
14 |
23.10.2013 |
||
|
IZVEDBENA UREDBA KOMISIJE (EU) št. 846/2014 z dne 4. avgusta 2014 |
L 232 |
5 |
5.8.2014 |
|
spremenjena z:
|
C 241 |
21 |
29.8.1994 |
||
|
L 236 |
33 |
23.9.2003 |
popravljena z:
DIREKTIVA SVETA 92/65/EGS
z dne 13. julija 1992
o zahtevah zdravstvenega varstva živali za trgovino in za uvoz v Skupnost živali, semena, jajčnih celic in zarodkov, za katere ne veljajo zahteve zdravstvenega varstva živali, določene v posebnih pravilih Skupnosti iz Priloge A(I) k Direktivi 90/425/EGS
SVET EVROPSKIH SKUPNOSTI JE
ob upoštevanju Pogodbe o ustanovitvi Evropske gospodarske skupnosti in zlasti člena 43 Pogodbe,
ob upoštevanju predlogov Komisije ( 1 ),
ob upoštevanju mnenja Evropskega parlamenta ( 2 ),
ob upoštevanju mnenja Ekonomsko–socialnega odbora ( 3 ),
ker so žive živali in proizvodi živalskega izvora vključeni v seznam proizvodov v Prilogi II k Pogodbi; ker dajanje takih živali in proizvodov na trg predstavlja vir dohodka za del kmečke populacije;
ker je za zagotavljanje racionalnega razvoja sektorja in povečanja produktivnosti treba na ravni Skupnosti določiti predpise v zvezi z zdravstvenim varstvom živali in proizvodov;
ker mora Skupnost do 31. decembra 1992 sprejemati ukrepe, namenjene postopnemu oblikovanju notranjega trga;
ker je z ozirom na zgoraj navedene cilje Svet sprejel predpise v zvezi z zdravstvenim varstvom živali, ki se uporabljajo za govedo, prašiče, ovce in koze, kopitarje, perutnino in valilna jajca, ribe in ribje proizvode, školjke, seme bikov in merjascev, ovčje zarodke, sveže meso, perutninsko meso, mesne proizvode, meso divjadi in kunčje ter zajčje meso;
ker bi bilo treba sprejeti predpise v zvezi z zdravstvenim varstvom živali za dajanje na trg živali in proizvodov živalskega izvora, ki še niso zajeti v zgoraj navedenih predpisih;
ker bi bilo treba predvideti uporabo te direktive brez poseganja v Uredbo Sveta (EGS) št. 3626/82 z dne 3. decembra 1982 o izvajanju Konvencije o mednarodni trgovini z ogroženimi divjimi živalskimi in rastlinskimi vrstami v Skupnosti ( 4 );
ker se je pri nekaterih tehničnih vidikih treba sklicevati na Direktivo Sveta 64/432/EGS z dne 26. junija 1964 o problemih v zvezi z zdravstvenim varstvom živali, ki vplivajo na trgovino z govedom in prašiči med državami članicami Evropske skupnosti ( 5 ) ter na Direktivo 85/511/EGS z dne 18. novembra 1985 o uvedbi ukrepov Skupnosti za obvladovanje slinavke in parkljevke ( 6 );
ker se je v zvezi z organizacijo in nadaljevanjem pregledov ter v zvezi z zaščitnimi ukrepi, ki naj se izvajajo, treba sklicevati na splošne predpise, določene v Direktivi Sveta 90/425/EGS z dne 26. junija o veterinarskih in zootehničnih pregledih, ki se zaradi vzpostavitve notranjega trga izvajajo v trgovini znotraj Skupnosti z nekaterimi živimi živalmi in proizvodi ( 7 );
ker je treba, razen če je to drugače predpisano, trgovino z živalmi in proizvodi živalskega izvora liberalizirati brez poseganja v izvedbo možnih zaščitnih ukrepov;
ker bi bilo treba ob znatnem tveganju razširjanja bolezni, ki so jim živali izpostavljene, za nekatere živali in proizvode živalskega izvora določiti posebne zahteve, ki se uporabijo pri dajanju na trg za namen trgovanja, zlasti če so živali in proizvodi namenjeni regijam z visokim zdravstvenim statusom;
ker poseben položaj Združenega kraljestva Velike Britanije in Severne Irske ter Irske zaradi otoške lege teh držav in dejstva, da tam že dolgo ni bilo stekline, utemeljuje posebne določbe, s katerimi se zagotovi, da dajanje psov in mačk na trg v Združenem kraljestvu in na Irskem, ki po poreklu niso iz teh držav, ne vključuje tveganja za vnos stekline v navedeni državi, ne da bi to vplivalo na odpravo veterinarskih pregledov na mejah med državami članicami;
ker je zdravstveno spričevalo najustreznejše sredstvo za jamčenje in spremljanje skladnosti s temi zahtevami;
ker je za ohranjanje zdravstvene situacije v Skupnosti pri dajanju živali in proizvodov živalskega izvora iz te direktive na trg, treba zanje zagotoviti uporabo minimalnih zahtev, določenih za trgovino ter skladnost z njimi nadzorovati v skladu z načeli in predpisi, določenimi v Direktivi Sveta 90/675/EGS z dne 10. decembra 1990 o določitvi načel, ki urejajo organizacijo veterinarskih pregledov na proizvodih, ki vstopajo v Skupnost iz tretjih držav ( 8 );
ker je treba predvideti postopek, ki uvaja tesno sodelovanje med državami članicami in Komisijo znotraj Stalnega veterinarskega odbora;
ker skrajni rok za prenos v nacionalno zakonodajo, 1. januar 1994, določen v členu 29, ne bi smel vplivati na odpravo veterinarskih pregledov na mejah 1. januarja 1993,
SPREJEL NASLEDNJO DIREKTIVO:
POGLAVJE I
Splošne določbe
Člen 1
Ta direktiva določa zahteve v zvezi z zdravstvenim varstvom živali, s katerimi se urejata trgovina in uvoz v Skupnost živali, semena, jajčnih celic in zarodkov, za katere se ne uporabljajo zahteve v zvezi z zdravstvenim stanjem živali, predpisane v posebnih pravilih Skupnosti, navedenih v Prilogi F.
Ta direktiva se uporablja brez poseganja v predpise, sprejete v skladu z Uredbo (EGS) 3626/82.
Ta direktiva ne vpliva na nacionalne predpise, ki se uporabljajo za hišne živali, četudi njihova ohranitev ne sme ogroziti odprave veterinarskih pregledov na mejah med državami članicami.
Člen 2
1. V tej direktivi pomeni:
(a) „trgovina“ je trgovina, kakor je opredeljena v členu 2(3) Direktive 90/425/EGS;
(b) „živali“ so primerki živalskih vrst, ki niso navedene v Direktivah 64/432/EGS ( 9 ), 90/426/EGS ( 10 ), 90/539/EGS, 91/67/EGS ( 11 ), 91/68/EGS ( 12 ), 91/492/EGS ( 13 ) in 91/493/EGS ( 14 );
(c) „uradno odobrena ustanova, inštitut ali središče“ je vsaka stalna, geografsko omejena ustanova, ki je bila odobrena v skladu z določbami člena 13 in v kateri se drži ali vzreja ena ali več vrst živali, za komercialne ali nekomercialne namene, in izključno za enega ali več naslednjih namenov:
— razkazovanje živali in izobraževanje javnosti,
— ohranitev vrste,
— bazične ali aplikativne znanstvene raziskave ali rejo živali za namen takih raziskav;
(d) „bolezni, ki jih je treba obvezno prijaviti“ so bolezni, navedene v Prilogi A.
2. Poleg tega se smiselno uporabljajo opredelitve pojmov iz člena 2 direktiv 64/432/EGS, 91/67/EGS in 90/539/EGS, razen tistih za uradno odobrena središča in ustanove.
POGLAVJE II
Predpisi, ki se uporabljajo za trgovino
Člen 3
Države članice zagotovijo, da je trgovina iz odstavka 1 člena 1 prepovedana ali omejena samo zaradi razlogov v zvezi z zdravstvenim varstvom živali, ki izhajajo iz uporabe te direktive ali zakonodaje Skupnosti, in zlasti iz uporabe sprejetih zaščitnih ukrepov.
Švedska lahko do sprejetja določb Skupnosti na tem področju ohrani svoje nacionalne predpise v zvezi s kačami in plazilci, poslanimi na Švedsko.
Člen 4
Države članice sprejmejo vse potrebne ukrepe, s katerimi se zagotovi, da se za namen uporabe člena 4(1)(a) Direktive 90/425/EGS z živalmi iz členov 5 do 10 te direktive, brez poseganja v člen 13 in posebne določbe, ki se sprejmejo v skladu z izvajanjem člena 24, sme trgovati le, če izpolnjujejo pogoje, določene v členih 5 do 10, in če prihajajo z gospodarstev ali podjetij iz člena 12(1) in (3) te direktive, ki so registrirani pri pristojnem organu in ki se obvežejo:
— da bodo redno pregledovala živali v skladu s členom 3(3) Direktive 90/425/EGS,
— da bodo obvestila pristojni organ ne le o izbruhu bolezni, ki jih je treba obvezno prijaviti, temveč tudi o izbruhu bolezni iz Priloge B, za katere je zadevna država članica sestavila program za nadzor ali spremljanje bolezni,
— da se bodo ravnala v skladu s posebnimi nacionalnimi ukrepi za nadzor nad boleznijo, ki je posebnega pomena za dano državo članico in ki je zajeta v programu, sestavljenem v skladu s členom 14 ali v skladu s sklepom na podlagi člena 15(2),
— da bodo dajala na trg za namen trgovanja le živali, ki nimajo nobenih znakov bolezni in ki prihajajo z gospodarstev ali območij, za katere ne veljajo nobene prepovedi zaradi razlogov v zvezi z zdravstvenim varstvom živali, in glede živali, ki jih ne spremlja zdravstveno spričevalo ali trgovinski dokument, predviden v členih 5 do 11, da bodo dajala na trg le živali, za katere je operater sam potrdil, da v času odpreme niso imele nobenih očitnih znakov bolezni in da za njegovo gospodarstvo ne veljajo nobeni ukrepi v zvezi z zdravstvenim varstvom živali,
— da se bodo ravnala v skladu z zahtevami, ki zagotavljajo dobro počutje živali.
Člen 5
1. Države članice zagotovijo, da je trgovina z opicami (simiae in prosimiae) omejena le na živali, ki jih odpošilja ali prejema ustanova, inštitut ali središče, ki so ga odobrili pristojni organi držav članic v skladu s členom 13, in da take živali spremlja veterinarsko spričevalo, ki ustreza vzorcu iz Priloge E, v katerem mora potrdilo, s katerim se jamči, da so živali zdrave, izpolniti uradni veterinar ustanove, inštituta ali središča porekla.
2. Pristojni organ države članice sme z odstopanjem od odstavka 1 dovoliti, da odobrena ustanova, inštitut ali središče pridobi opice, ki so last posameznika.
Člen 6
A. Brez poseganja v člen 14 in 15 morajo države članice zagotoviti, da se sme s kopitarji, razen tistih vrst iz direktiv 64/432/EGS, 90/426/EGS in 91/68/EGS, trgovati le, če izpolnjujejo naslednje zahteve:
1) Na splošno:
(a) morajo biti identificirani v skladu s členom 3(1)(c) Direktive 90/425/EGS;
(b) ne smejo biti namenjeni za zakol v skladu s programom za izkoreninjenje nalezljive bolezni;
(c) niso smeli biti cepljeni proti slinavki in parkljevki in morajo izpolnjevati ustrezne zahteve Direktive 85/511/EGS in člena 4(a) Direktive 64/432/EGS;
(d) morajo prihajati z gospodarstva iz člena 3(2)(b) in (c) Direktive 64/432/EGS, za katero ne veljajo ukrepi v zvezi z zdravstvenim varstvom živali, zlasti tisti, sprejeti v skladu z direktivami 85/511/EGS, 80/217/EGS ( 15 ) in 91/68/EGS, in so morali biti na gospodarstvu stalno od rojstva ali najmanj zadnjih trideset dni pred odpremo;
(e) jih mora spremljati spričevalo, ki ustreza vzorcu iz Priloge E del 1, v katerem je naslednje potrdilo:

▼M7 —————
2) Prežvekovalci:
(a) morajo prihajati iz črede, uradno proste tuberkuloze in bruceloze v skladu z Direktivo 64/432/EGS ali Direktivo 91/68/EGS, in morajo glede določb v zvezi z zdravstvenim varstvom živali izpolnjevati ustrezne zahteve, določene za govedo v členu 3(2)(c), (d), (f), (g) in (h) Direktive 64/432/EGS ali v členu 3 Direktive 91/68/EGS;
(b) če ne izvirajo iz črede, ki izpolnjuje pogoje iz (a), morajo izvirati z gospodarstva, na katerem ni bil evidentiran noben primer bruceloze ali tuberkuloze v 42 dneh pred natovarjanjem živali in na katerem so bili prežvekovalci v 30 dneh pred pošiljanjem pregledani, z negativnim rezultatom, s testom za dokaz prisotnosti bruceloze ter tuberkuloze;
(c) skladno s postopkom iz člena 26, se lahko sprejmejo določbe v zvezi z enzootsko govejo levkozo;
3) Prašiči:
(a) ne smejo prihajati s področja, za katero veljajo ukrepi prepovedi povezani s prisotnostjo afriške prašičje kuge v skladu s členom 9(a) Direktive 64/432/EGS;
(b) morajo biti s gospodarstva, za katero ne veljajo nobene omejitve, določene v Direktivi 80/217/EGS zaradi klasične prašičje kuge;
(c) morajo biti z bruceloze prostega gospodarstva v skladu z določbami Direktive 64/432/EGS in morajo izpolnjevati ustrezne zahteve v zvezi z zdravstvenim varstvom živali, določene v Direktivi 64/432/EGS za prašiče;
(d) če ne prihajajo iz črede, ki izpolnjuje pogoje, določene v (c), morajo 30 dni pred odpremo z negativnimi rezultati opraviti test, s katerim se dokaže odsotnost protiteles proti brucelozi;
▼M7 —————
4) Zahteve za preiskave iz tega člena se lahko določijo v skladu s postopkom iz člena 26. Pri tem je treba upoštevati prežvekovalce, gojene v arktičnih regijah Skupnosti.
Do sprejetja odločitev iz prejšnjega odstavka se uporabljajo nacionalni predpisi.
B. Direktiva 64/432/EGS se spremeni:
1) V členu 2(b) in (c) se namesto „govedo(-a)“ uporabi izraz „žival(-i), vrste goveda (vključno z Bubalus bubalus)“;
2) Vstavi se člen:
„Člen 10a
Po postopku, določenem v členu 12, se lahko zdravstvena spričevala, za katere je dan vzorec v Prilogi F, spremenijo ali dopolnijo, zlasti da bi upoštevali zahteve člena 6 Direktive 92/65/EGS.“
Člen 7
A. Države članice morajo zagotoviti, da se s pticami, razen tistimi iz Direktive 90/539/EGS, trguje le, če izpolnjujejo naslednje zahteve:
1) Na splošno:
(a) morajo biti z gospodarstva, na katerem v 30 dneh pred odpremo ni bila diagnosticirana aviarna influenca;
(b) morajo biti z gospodarstva ali področja, za katera ne veljajo omejitve v okviru ukrepov za zatiranje atipične kokošje kuge.
Dokler se ne začnejo izvajati ukrepi Skupnosti iz člena 19 Direktive 90/539/EGS, se še naprej uporabljajo nacionalne zahteve za zatiranje atipične kokošje kuge, v skladu s splošnimi določbami Pogodbe;
(c) so morale biti v skladu s tretjo alineo člena 10(1) Direktive 91/496/EGS v karanteni, če so bile uvožene iz tretje države, in sicer v karanteni na gospodarstvu, kamor so bile odpeljane po vstopu na ozemlje Skupnosti;
2) Poleg tega papige:
(a) ne smejo prihajati z gospodarstva niti niso smele biti v stiku z živalmi z gospodarstva, na katerem je bila diagnosticirana psitakoza (Chlamydia psittaci).
Obdobje prepovedi od zadnjega zabeleženega primera in obdobje zdravljenja pod veterinarskim nadzorstvom, ki je priznano po postopku, predvidenim v členu 26, mora biti najmanj dva meseca;
(b) morajo biti identificirane v skladu s členom 3(1)(c) Direktive 90/425/EGS.
Metode za identificiranje papig in zlasti bolnih papig se uvedejo po postopku, predvidenem v členu 26;
(c) mora jih spremljati trgovinski dokument, ki ga je podpisal uradni veterinar ali veterinar, odgovoren za gospodarstvo oz. podjetje porekla in ki ga je v ta namen pooblastil pristojni organ.
B. V pododstavku 2 člena 2(2) Direktive Sveta 91/495/EGS z dne 27. novembra 1990 o javno zdravstvenih problemih in problemih zdravstvenega varstva živali, ki vplivajo na proizvodnjo in dajanje na trg mesa kuncev in mesa gojene divjadi ( 16 ), se vstavita besedi „in tekači (Ratitae)“ v tretjo vrstico za besedilom „Direktiva 90/539/EGS“.
V točki 1 člena 2(2) Direktive Sveta 90/539/EGS z dne 15. oktobra 1990 o pogojih zdravstvenega varstva živali, ki urejajo trgovino med državami članicami Evropske skupnosti in uvoz perutnine in valilnih jajc iz tretjih držav ( 17 ), se vstavita besedi „ter tekači (Ratitae)“ za besedi „in jerebice“.
Člen 8
Države članice zagotovijo, da se s čebelami (Apis melifera) trguje le, če izpolnjujejo naslednje zahteve:
(a) prihajajo s področja, za katero ne velja prepoved zaradi pojava hude gnilobe čebelje zalege (American foulbrood).
Obdobje prepovedi mora trajati najmanj 30 dni od zadnjega zabeleženega primera in od datuma, ko je pristojni organ pregledal vse panje v polmeru treh kilometrov in so bili vsi okuženi panji zažgani ali tretirani ter pregledani na zadovoljstvo navedenega pristojnega organa.
V skladu s postopkom, določenim v členu 26, in po posvetovanju s Stalnim veterinarskim odborom, se lahko zahteve, ki se uporabljajo za čebele (Apis melifera), ali enakovredne zahteve uporabijo za čmrlje;
(b) jih spremlja zdravstveno spričevalo, ki ustreza vzorcu v Prilogi E, v katerem potrdilo izpolni pristojni organ, s čimer potrdi, da so izpolnjene zahteve, določene v (a).
Člen 9
1. Države članice zagotovijo, da se z zajci in kunci trguje le, če izpolnjujejo naslednje zahteve:
(a) ne prihajajo z gospodarstva ali niso bili v stiku z živalmi z gospodarstva, na katerem je steklina ali za katerega se sumi, da je bila v preteklem mesecu prisotna steklina;
(b) prihajajo z gospodarstva, na katerem nobena žival nima kliničnih znakov miksomatoze.
2. Države članice, ki zahtevajo zdravstveno spričevalo za premik zajcev in kuncev na svojem ozemlju, lahko zahtevajo, da so k njim poslane živali opremljene z zdravstvenim spričevalom, ki ustreza vzorcu v Prilogi E, in ki ga dopolnjuje naslednje potrdilo:
„Podpisani… potrjujem, da zgoraj navedena pošiljka izpolnjuje zahteve člena 9 Direktive 92/65/EGS in da živali pri pregledu ne kažejo nobenih kliničnih znakov bolezni.“
To spričevalo mora izdati uradni veterinar ali veterinar, pristojen za gospodarstvo porekla in ki ga je v ta namen pooblastil pristojni organ; pri industrijski reji spričevalo izda uradni veterinar. Države članice, ki želijo uporabiti to možnost, obvestijo Komisijo, ki zagotovi, da je izpolnjena zahteva, določena v odstavku 1.
3. Irska in Združeno kraljestvo lahko zahtevata predložitev zdravstvenega spričevala, ki zagotavlja, da je izpolnjena zahteva, določena v odstavku 1(a).
Člen 10
1. Države članice zagotovijo, da je prepovedana trgovina z ►M5 ————— ◄ kunami in lisicami, ki prihajajo z gospodarstva ali so bili v stiku z živalmi z gospodarstva, na katerem je steklina ali za katerega se sumi, da je bila v preteklih šestih mesecih prisotna steklina, v kolikor se tam ne uporablja sistematičen program cepljenja.
2. S psi, mačkami in belimi dihurji se lahko trguje, če:
(a) izpolnjujejo pogoje iz člena 6 in, kjer je to ustrezno, člena 7 Uredbe (EU) št. 576/2013 Evropskega parlamenta in Sveta z dne 12. junija 2013 o netrgovskih premikih hišnih živali ( 18 );
(b) jih v 48 urah pred odpremo klinično pregleda veterinar, ki ga je pooblastil pristojni organ, ter
(c) jih med prevozom na namembni kraj spremlja zdravstveno spričevalo, ki:
(i) ustreza vzorcu iz dela 1 Priloge E ter
(ii) ga podpiše uradni veterinar, ki potrjuje, da je veterinar, ki ga je pooblastil pristojni organ, v ustreznem oddelku identifikacijskega dokumenta v formatu, določenem v členu 21(1) Uredbe (EU) št. 576/2013, dokumentiral, da je bil klinični pregled opravljen v skladu s točko (b), iz katerega je razvidno, da so živali v času kliničnega pregleda sposobne za načrtovani prevoz v skladu z Uredbo Sveta (ES) št. 1/2005 z dne 22. decembra 2004 o zaščiti živali med prevozom in postopki, povezanimi z njim ( 19 ).
▼M14 —————
4. Irska, Ciper, Malta in Združeno kraljestvo lahko brez poseganja v odstavka 2 in 3 ohranita svoje nacionalne predpise o karanteni za vse mesojede ►M5 razen vrst iz odstavkov 2 in 3; ◄ živali, primate, netopirje in druge živali, dovzetne za steklino, ki jih zajema ta direktiva, in za katere ni mogoče dokazati, da so se skotili na posestvu in bili tam vse od rojstva, kar pa ne sme ogroziti odprave veterinarskih pregledov na mejah med državami članicami.
5. Odločba 90/638/EGS se spremeni:
1) členu 1 se doda alinea:
— „za programe za nadzor nad steklino: merila, določena v Prilogi III.“
2) doda se Priloga:
„PRILOGA III
Merila za programe za nadzor nad steklino
Programi za nadzor nad steklino morajo vsebovati najmanj:
(a) merila iz točk 1 do 7 Priloge I;
(b) podrobne podatke o regiji ali regijah, v katerih se opravlja oralna imunizacija lisic, ter o njihovih naravnih mejah. Regija ali regije morajo zajemati najmanj 6 000 km2 ali celotno območje države članice in lahko vključujejo sosednje predele tretje države;
(c) podrobne podatke o cepivih, ki se bodo uporabljala, o sistemu polaganja, gostoti in pogostnosti polaganja vab;
(d) če je ustrezno, vse podrobnosti in stroške ter namen ukrepov za ohranitev ali varstvo flore in favne, ki jih sprejmejo prostovoljne organizacije na ozemlju, zajetem s temi projekti.“
6. Svet s kvalificirano večino na predlog Komisije imenuje poseben inštitut, ki določi merila, potrebna za standardizacijo seroloških testov in odloči o njegovih obveznostih.
7. Države članice zagotovijo, da stroške uporabe seroloških testov nosijo uvozniki.
▼M5 —————
Člen 10a
V zvezi s steklino in v skladu s postopkom iz člena 26, po predstavitvi ustreznih utemeljitev, se člen 9 in 10 spremenita tako, da se upošteva položaj na Finskem in Švedskem, tako da bodo za te države veljale enake določbe, kot veljajo za države članice v enakovrednem položaju.
Člen 11
1. Države članice zagotovijo, da se brez poseganja v odločitve, ki se sprejmejo pri izvajanju členov 21 in 23, trguje le s semenom, jajčnimi celicami in zarodki, ki izpolnjujejo pogoje, določene v odstavkih 2, 3, 4 in 5.
2. Seme ovnov, kozlov in kopitarjev brez poseganja v kakršna koli merila, ki jih je treba izpolnjevati za vstop kopitarjev v rodovniške knjige za nekatere posebne pasme:
— mora biti odvzeto, predelano in skladiščeno za uporabo pri umetnem osemenjevanju v središču, ki je bilo z zdravstvenega stališča odobreno v skladu s Prilogo D(I), ali pri ovnih in kozlih, z odstopanjem od zgoraj navedenega, na gospodarstvu, ki izpolnjuje zahteve Direktive 91/68/EGS,
— mora biti odvzeto živalim, ki izpolnjujejo pogoje, določene v Prilogi D(II),
— mora biti odvzeto, predelano, shranjeno, skladiščeno in transportirano v skladu s Prilogo D(III),
— med prevozom v drugo državo članico spremlja zdravstveno spričevalo, ki ustreza vzorcu, ki se določi v skladu s postopkom iz člena 26.
3. Jajčne celice in zarodke ovc, koz, kopitarjev in prašičev:
— donork, ki izpolnjujejo pogoje, določene v Prilogi D(IV), je odvzela skupina za zbiranje zarodkov ali pa jih je pridobila skupina za pridobivanje zarodkov, ki jo je odobril pristojni organ države članice, in izpolnjujejo pogoje, ki se v skladu s postopkom iz člena 26 določijo v Prilogi D(I),
— morajo biti odvzeti, predelani in shranjeni v ustreznem laboratoriju, ter skladiščeni in transportirani v skladu s Prilogo D(III),
— med prevozom v drugo državo članico spremlja zdravstveno spričevalo, ki ustreza vzorcu, ki se določi v skladu s postopkom iz člena 26.
Seme za osemenjevanje donork mora biti pri ovcah, kozah in kopitarjih v skladu z določbami odstavka 2, pri prašičih pa v skladu z določbami Direktive 90/429/EGS.
Vsa dodatna jamstva se lahko določijo v skladu s postopkom iz člena 26.
4. Pristojni organ zadevne države članice registrira odobrena središča iz prve alinee odstavka 2 in odobrene skupine iz prve alinee odstavka 3 ter jim dodeli veterinarsko registrsko številko.
Vsaka država članica pripravi in posodablja seznam odobrenih središč in odobrenih skupin ter njihovih veterinarskih registrskih številk ter ga da na voljo drugim državam članicam in javnosti.
Podrobna pravila za enotno uporabo tega odstavka se lahko sprejmejo v skladu s postopkom iz člena 26.
5. Zahteve zdravstvenega varstva živali in vzorci zdravstvenih spričeval, ki se uporabljajo za to seme, jajčne celice in zarodke vrst, ki niso naštete v odstavkih 2 in 3, se določijo v skladu s postopkom iz člena 26.
Dokler se ne določijo zahteve zdravstvenega varstva živali in vzorci zdravstvenih spričeval, ki se uporabljajo pri prometu s tovrstnim semenom, jajčnimi celicami in zarodki, se še naprej uporabljajo nacionalna pravila.
Člen 12
1. Predpisi za preglede, uvedene z Direktivo 90/425/EGS, se uporabljajo, zlasti glede organizacije in nadaljevanja pregledov, za živali, semena, jajčne celice in zarodke, zajete s to direktivo in ki jih spremlja zdravstveno spričevalo. Druge živali morajo prihajati z gospodarstev, za katera veljajo načela navedene direktive glede pregledov porekla in namembnega kraja.
2. Za živali, seme, jajčne celice in zarodke, zajete s to direktivo, se uporablja člen 10 Direktive 90/425/EGS.
3. Za namen trgovanja, se člen 12 Direktive 90/425/EGS razširi na trgovce, pri katerih so živali iz členov 7, 9 in 10 stalno ali začasno.
4. Obveščanje o namembnem kraju, kakor je predvideno v členu 4(2) Direktive 90/425/EGS, se za živali, seme, jajčne celice ali zarodke, ki jih v skladu s to direktivo spremlja zdravstveno spričevalo, opravlja preko sistema Animo.
5. Brez poseganja v posebne določbe te direktive mora pristojni organ pri sumu, da se ne ravna v skladu s to direktivo, ali pri dvomu o zdravju živali ali o kakovosti semena, jajčnih celic in zarodkov iz člena 1 opraviti vse potrebne preglede.
6. Države članice sprejmejo ustrezne upravne ali kazenske ukrepe za kaznovanje katere koli kršitve te direktive, zlasti če se ugotovi, da spričevala ali dokumenti ne ustrezajo dejanskemu stanju živali iz člena 1, da identifikacija živali ali oznake semena, jajčnih celic in zarodkov niso v skladu s to direktivo ali da živali ali proizvodi niso opravili pregledov, predvidenih s to direktivo.
Člen 13
1. Pri trgovanju z živalmi vrste, ki je dovzetna za bolezni, navedene v Prilogi A, ali za bolezni, navedene v Prilogi B, kadar namembna država članica uporabi jamstva, predvidena v členih 14 in 15, ter pri trgovanju s semenom, jajčnimi celicami in zarodki takih živali med ustanovami, inštituti ali središči, odobrenimi v skladu s Prilogo C, je obvezno predložiti prevozno listino, ki ustreza vzorcu v Prilogi E. Ta listina, ki jo izpolni veterinar, pristojen za ustanove, inštitute ali središča porekla, mora natančno navajati, da živali, seme, jajčne celice ali zarodki prihajajo iz ustanove, inštituta ali središča, odobrenega v skladu s Prilogo C, in jih mora spremljati med prevozom.
2.
(a) Glede bolezni, ki jih je treba obvezno prijaviti, ustanove, inštituti ali središča za pridobitev odobritve predložijo pristojnemu organu države članice vsa potrebna dokazila v zvezi z zahtevami iz Priloge C.
(b) Po prejemu dokumentacije z zahtevo za odobritev ali za obnovitev odobritve jo mora pristojni organ preučiti z vidika podatkov, ki jih vsebuje in, če je to ustrezno, z vidika rezultatov pregledov, opravljenih na kraju samem.
(c) Pristojni organ umakne odobritev v skladu s točko 3 Priloge C.
(d) Pristojni organ registrira vse odobrene ustanove, inštitute in središča ter jim dodeli številko odobritve.
Vsaka država članica pripravi in posodablja seznam odobrenih ustanov, inštitutov in središč ter njihovih številk odobritve ter ga da na voljo drugim državam članicam in javnosti.
Podrobna pravila za enotno uporabo te točke se lahko sprejmejo v skladu s postopkom iz člena 26.
(e) Švedska ima po začetku veljavnosti Pogodbe o pristopu dve leti časa, da začne izvajati ukrepe, določene za ustanove, zavode in centre.
Člen 14
1. Če država članica sestavi ali je sestavila, neposredno ali preko rejcev, program prostovoljnega ali obveznega nadzora ali spremljanja ene od bolezni iz Priloge B, lahko program predstavi Komisiji in pri tem posebej poudari:
— razširjenost bolezni na njenem ozemlju,
— ali gre za bolezen, ki jo je treba obvezno prijaviti,
— razloge za program ob upoštevanju stroškovne učinkovitosti in pomena bolezni,
— geografsko območje, na katerem se program izvaja,
— statusne kategorije, ki se uporabljajo za gospodarstva, zahteve za vsako vrsto pri vnosu živali na gospodarstvo in postopke testov,
— postopke za nadzor nad programom, vključno z obsegom sodelovanja rejcev pri izvajanju programa za spremljanje in nadzor,
— ukrepe, ki se sprejmejo, če gospodarstvo iz kakršnega koli razloga izgubi svoj status,
— ukrepe, ki se sprejmejo, če so rezultati testov, ki se opravijo v okviru programa, pozitivni,
— nediskriminatorno naravo trgovine na ozemlju zadevne države članice glede na trgovino znotraj Skupnosti.
2. Komisija preuči programe, ki jih predložijo države članice. Programi se lahko odobrijo po postopku, predvidenem v členu 26, v skladu z merili, določenimi v odstavku 1. Po istem postopku se opredelijo dodatna splošna ali omejena jamstva, ki se lahko zahtevajo pri trgovanju, in sicer hkrati s programi ali najpozneje tri mesece po predložitvi programov. Takšna jamstva ne smejo presegati tistih, ki jih država članica izvaja na nacionalni ravni.
3. Programi, ki jih predložijo države članice, se lahko spremenijo ali dopolnijo po postopku, določenem v členu 26. Po istem postopku se lahko spremenijo jamstva iz odstavka 2.
Člen 15
1. Če država članica meni, da je njeno ozemlje ali na del ozemlja prost ene od bolezni, navedenih v Prilogi B, za katere so dovzetne živali, zajete v tej direktivi, predloži Komisiji ustrezna dokazila in pri tem posebej poudari:
— naravo bolezni in zgodovino pojavljanja bolezni na ozemlju države,
— rezultate nadzornega testiranja, ki temeljijo na seroloških, mikrobioloških, patoloških ali epidemioloških preiskavah,
— obdobje, v katerem je bilo treba to bolezen prijaviti pristojnim organom,
— obdobje izvajanja nadzora,
— če je ustrezno, obdobje, v katerem je bilo prepovedano cepljenje zoper bolezen, ter geografsko območje, kjer je veljala prepoved,
— ukrepe za preverjanje odsotnosti bolezni.
2. Komisija preuči dokazila, predvidena v odstavku 1 in Stalnemu veterinarskemu odboru predloži odločitev, s katero odobri ali zavrne načrt, ki ga je predložila država članica. Če je načrt sprejet, se dodatna jamstva, splošna ali omejena, ki se lahko zahtevajo pri trgovanju, opredelijo po postopku, določenem v členu 26. Jamstva ne smejo presegati tistih, ki jih država članica izvaja na nacionalni ravni.
Dokler se ne sprejme odločitev, lahko zadevna država članica pri svojem trgovskem poslovanju ohrani ustrezne zahteve, potrebne za ohranjanje njenega statusa.
3. Zadevna država članica uradno obvesti Komisijo o vsaki spremembi podatkov, določenih v odstavku 1. Opredeljena jamstva, kakor so določena v odstavku 2, se z vidika takega obvestila lahko spremenijo ali umaknejo po postopku, določenem v členu 26.
POGLAVJE III
Predpisi, ki se uporabljajo za uvoz v Skupnost
Člen 16
Pogoji, ki se uporabljajo pri uvozu živali, semena, jajčnih celic in zarodkov, zajetih s to direktivo, morajo biti najmanj enakovredni pogojem, določenim v poglavju II.
Za mačke, pse in bele dihurje morajo biti uvozni pogoji vsaj enaki pogojem iz točk (a) do (d) člena 10(1) in točke (a) člena 12 Uredbe (EU) št. 576/2013.
Poleg pogojev iz drugega pododstavka pse, mačke in bele dihurje med prevozom na namembni kraj spremlja veterinarsko spričevalo, ki ga izpolni in podpiše uradni veterinar, ki potrjuje, da je veterinar, ki ga je pooblastil pristojni organ, v 48 urah pred odpremo živali klinično pregledal in je potrdil, da so živali v času kliničnega pregleda sposobne za načrtovani prevoz.
Člen 17
1. Za enotno izvajanje člena 16 se uporabljajo določbe naslednjih odstavkov.
2. V Skupnost je dovoljeno uvažati le živali, seme, jajčne celice in zarodke iz člena 11, ki izpolnjujejo naslednje zahteve:
(a) morajo prihajati iz tretje države, ki je na seznamu, sestavljenem v skladu z odstavkom 3(a);
(b) mora jih spremljati zdravstveno spričevalo, ki ustreza vzorcu, sestavljenem v skladu s postopkom iz člena 26, in ki ga je podpisal pristojni organ države izvoznice ter v katerem je potrjeno, da
(i) živali
— izpolnjujejo dodatne pogoje ali nudijo enakovredna jamstva iz odstavka 4 in
— prihajajo iz odobrenih središč, ustanov, inštitutov, z jamstvi, ki so vsaj enakovredna jamstvom iz Priloge C;
(ii) seme, jajčne celice in zarodki prihajajo iz odobrenih središč za pridobivanje in skladiščenje semena ali skupin za zbiranje in pridobivanje zarodkov, z jamstvi, ki so vsaj enakovredna jamstvom, ki se v skladu s postopkom iz člena 26 določijo v Prilogi D(I).
Dokler se ne oblikujejo seznami tretjih držav ter odobrijo organizacije iz točke (b), zahteve zdravstvenega varstva živali in vzorci zdravstvenih spričeval iz odstavkov (a) in (b), se še naprej uporabljajo nacionalna pravila pod pogojem, da niso ugodnejša od tistih, določenih v Poglavju II.
3. Določi se naslednje:
(a) v skladu s postopkom iz člena 26 seznam tretjih držav ali delov tretjih držav, ki lahko državam članicam in Komisiji zagotavljajo jamstva, enakovredna tistim iz Poglavja II, za živali, seme, jajčne celice in zarodke;
(b) v skladu s to točko seznam odobrenih središč ali skupin iz prve alinee odstavka 2 člena 11 in prve alinee odstavka 3 navedenega člena, ki se nahajajo v eni od tretjih držav s seznama iz točke (a) tega odstavka in za katere lahko pristojni organ zagotavlja jamstva iz člena 11(2) in (3).
Komisiji se sporoči seznam odobrenih središč in skupin iz prvega pododstavka ter njihovih veterinarskih registrskih številk.
Pristojni organ tretje države mora nemudoma začasno prekiniti veljavnost odobritve ali preklicati odobritev središč ali skupin, če ta ne izpolnjuje več pogojev iz člena 11(2) in (3), in o tem nemudoma obvestiti Komisijo.
Komisija pošlje državam članicam kakršne koli nove in posodobljene sezname, ki jih prejme od pristojnega organa tretje države v skladu z drugim in tretjim pododstavkom, ter jih da na voljo javnosti za namene obveščanja.
Podrobna pravila za enotno uporabo te točke se lahko sprejmejo v skladu s postopkom iz člena 26.
(c) v skladu s postopkom iz člena 26 posebne zahteve za zdravstveno varstvo živali, zlasti za zaščito Skupnosti pred nekaterimi eksotičnimi boleznimi, ali jamstva, enakovredna tistim iz te direktive.
Posebne zahteve in enakovredna jamstva, določena za tretje države, ne smejo biti ugodnejša od tistih iz Poglavja II.
4. Seznam, predviden v odstavku 3, sme zajemati le tretje države ali dele tretjih držav:
(a) iz katerih ni prepovedan uvoz:
— zaradi obstoja ene od bolezni iz Priloge A, ali katere koli druge v Skupnosti eksotične bolezni,
— v skladu s členi 6, 7 in 14 Direktive 72/462/EGS in s členom 17 Direktive 91/495/EGS ter Direktive 71/118/EGS ( 20 ) ali pri drugih živalih, zajetih s to direktivo, po odločitvi, sprejeti v skladu s postopkom, določenim v členu 26, zaradi zdravstvenega stanja v teh tretjih državah ali njihovih delih;
(b) ki jim je bilo priznano v skladu s členom 3(2) Direktive 72/463/EGS, da zaradi njihove zakonodaje in organizacije veterinarskih in inšpekcijskih služb, pooblastil teh služb in nadzora nad njimi, so sposobne jamčiti izvajanje svoje veljavne zakonodaje;
(c) katerih veterinarske službe so sposobne jamčiti, da so v skladu z zdravstvenimi zahtevami, ki so najmanj enakovredne tistim, določenim v poglavju II.
5. Izvedenci Komisije in držav članic opravljajo preglede na kraju samem, za preverjanje, ali je mogoče jamstva tretje države o pogojih proizvodnje in dajanja na trg šteti za enakovredna tistim, ki se uporabljajo v Skupnosti.
Izvedence držav članic, pooblaščene za te preglede, imenuje Komisija na predlog držav članic.
Pregledi se opravljajo v imenu Skupnosti, ki nosi vse stroške v tej zvezi.
6. Dokler se ne organizirajo pregledi iz odstavka 5, se še naprej uporabljajo nacionalne določbe za preglede v tretjih državah. Vse primere neskladnosti z jamstvi, ki so dana v skladu z odstavkom 3 in ki se ugotovijo med pregledi, je treba sporočiti Stalnemu veterinarskemu odboru.
Člen 18
1. Države članice zagotovijo, da se živali, seme, jajčne celice in zarodki, zajete s to direktivo, uvažajo v Skupnost le:
— če jih spremlja spričevalo, ki ga sestavi uradni veterinar.
— Vzorec spričevala se glede na vrsto živali sestavi po postopku, določenem v členu 26.
— če so uspešno opravili preglede, zahtevane z direktivama 90/675/EGS in 91/496/EGS ( 21 ),
— če je pred odpremo pošiljk na ozemlje Skupnosti uradni veterinar opravil pregled, s katerim se zagotovi, da so izpolnjeni transportni pogoji, določeni v Direktivi 91/628/EGS ( 22 ), zlasti kar zadeva hranjenje in napajanje,
— če so živali iz členov 5 do 10 pred prihodom na trg bile v karanteni, v skladu s podrobnimi pravili, določenimi po postopku iz člena 26.
2. Dokler se ne uvedejo posebne določbe za ta člen, se še naprej uporabljajo nacionalni predpisi za uvoz iz tretjih držav, za katere na ravni Skupnosti niso bile sprejete take zahteve, pod pogojem, da nacionalni predpisi niso ugodnejša od tistih, določenih v poglavju II.
Člen 19
Po postopku, določenem v členu 26, se sprejmejo:
(a) posebne zahteve v zvezi z zdravstvenim varstvom živali za uvoz v Skupnost, ter narava in vsebina spremljevalnih dokumentov za živali, namenjene živalskim vrtovom, cirkusom, zabaviščnim parkom ali poskusnim laboratorijem, glede na vrsto živali;
(b) za zaščito zadevne vrste živali v Skupnosti, dodatna jamstva poleg tistih, predvidenih za razne živalske vrste, zajete v tej direktivi.
Člen 20
Pravila iz Direktive 97/78/ES se uporabljajo zlasti za organizacijo pregledov in nadaljnje ukrepe v zvezi z njimi, ki jih morajo izvajati države članice, ter za zaščitne ukrepe, ki jih je treba uporabljati v skladu s postopkom iz člena 22 navedene direktive.
►C2 Do izvedbe sklepov, predvidenih v točki B člena 8 in v členu 30 Direktive 91/496/EGS, ◄ se še naprej uporabljajo ustrezne nacionalne določbe za uporabo člena 8(1) in (2) navedene direktive, brez poseganja v skladnost z načeli in določbami iz odstavka 1 tega člena.
POGLAVJE IV
Skupne končne določbe
Člen 21
Po postopku, določenem v členu 26, se po potrebi določijo vsi vzorci spričeval, ki se uporabljajo v trgovini ter pogoji v zvezi z zdravstvenim varstvom živali, ki morajo biti izpolnjeni za trgovino z živalmi, semenom, jajčnimi celicami in zarodki, ki niso zajeti v členih 5 do 11.
Člen 22
Po postopku, določenem v členu 26, se po potrebi spremenijo Priloge k tej direktivi.
Priloga B se pred uveljavitvijo Pogodbe o pristopu ponovno preuči, zlasti z namenom, da se seznam bolezni prilagodi tako, da zajema tudi bolezni, za katere so dovzetni prežvekovalci in prašiči in tiste bolezni, ki se prenašajo z ovčjim semenom, jajčnimi celicami in zarodki.
Člen 23
Po postopku, določenem v členu 26, se lahko, če je ustrezno, z odstopanjem ►M7 ————— ◄ poglavja II določijo posebne zahteve za gibanje cirkuških živali in živali v zabaviščnih parkih ter zahteve za trgovino z živalmi, semenom, jajčnimi celicami in zarodki, namenjenimi živalskim vrtovom.
Člen 24
1. Državam članicam je dovoljeno, da za živali (vključno s pticami v kletkah), seme, jajčne celice in zarodke iz te direktive, ki vstopajo na njihovo ozemlje in ki so prišle skozi ozemlje tretje države, zahtevajo predložitev zdravstvenega spričevala, s katerim se dokaže skladnost z zahtevami te direktive.
2. Države članice, ki izkoristijo možnost, določeno v odstavku 1, o tem obvestijo Komisijo in druge države članice v Stalnem veterinarskem odboru.
Člen 25
Prilogi A k Direktivi 90/425/EGS se doda:
„Direktiva Sveta 92/65/EGS z dne 13. julija 1992 o zahtevah zdravstvenega varstva živali za trgovino in za uvoz v Skupnost živali, semena, jajčnih celic in zarodkov, za katere ne veljajo zahteve zdravstvenega varstva živali, določene v posebnih pravilih Skupnosti iz Priloge A(I) k Direktivi 90/425/EGS (UL L 268, 14.9.1992, str. 54).“
Člen 26
1. Komisiji pomaga Stalni odbor za prehranjevalno verigo in zdravje živali, ustanovljen s členom 58 Uredbe (ES) št. 178/2002 Evropskega parlamenta in Sveta ( 23 ).
2. Kadar je navedeno sklicevanje na ta odstavek, se uporabljata člena 5 in 7 Sklepa 1999/468/ES.
Obdobje, določeno v členu 5(6) Sklepa 1999/468/ES ( 24 ), je tri mesece.
3. Odbor sprejme svoj poslovnik.
Člen 27
Države članice, ki izvajajo alternativni sistem nadzora, ki nudi dodatna jamstva, enakovredna tistim, določenim v tej direktivi, glede gibanja znotraj njihovega ozemlja živali, semena, jajčnih celic in zarodkov, zajetih s to direktivo, lahko druga drugi na podlagi vzajemnosti odobrijo odstopanja od člena 6(A)(1)(f), člena 8(b) in člena 11(1)(d).
Člen 28
Po postopku, določenem v členu 26, se lahko sprejmejo prehodni ukrepi za obdobje treh let, namenjeni olajšanemu prehodu v novo ureditev, ki jo uvaja ta direktiva.
Člen 29
1. Države članice sprejmejo zakone in druge predpise, potrebne za uskladitev s to direktivo, najpozneje do 1. januarja 1994. O tem takoj obvestijo Komisijo.
Države članice se v sprejetih ukrepih sklicujejo na to direktivo ali pa sklic nanjo navedejo ob njihovi uradni objavi. Način sklicevanja določijo države članice.
2. Države članice sporočijo Komisiji besedila glavnih predpisov nacionalne zakonodaje, ki jih sprejmejo na področju, ki ga ureja ta direktiva.
3. Določitev roka za prenos v nacionalno zakonodajo s 1. januarjem 1994 ne posega v odpravo veterinarskih pregledov na mejah, predvideno v Direktivi 89/662/EGS in 90/425/EGS.
Člen 30
Ta direktiva je naslovljena na države članice.
PRILOGA A
BOLEZNI, KI JIH JE OBVEZNO TREBA PRIJAVITI V OKVIRU TE DIREKTIVE
|
Bolezen |
Rod/družina/vrste, primarno zadevne |
|
Konjska kuga |
Equidae |
|
Afriška prašičja kuga |
Suidae in Tayassuidae |
|
Aviarna influenca |
Aves |
|
Huda gniloba čebelje zalege |
Apis |
|
Vranični prisad |
Bovidae, Camelidae, Cervidae, Elephantidae, Equidae in Hippopotamidae |
|
Bolezen modrikastega jezika |
Antilocapridae, Bavidae, Cervidae, Giraffidae, in Rhinocerotidae |
|
Brucella abortus |
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae in Tragulidae |
|
Brucella melitensis |
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae in Tragulidae |
|
Brucella ovis |
Camelidae, Tragulidae, Cervidae, Giraffidae, Bovidae in Antilocaprida, |
|
Brucella suis |
Cervidae, Leporidae, Ovibos moschatus, Suidae in Tayassuidae |
|
Klasična prašičja kuga |
Suidae in Tayassuidae |
|
Pljučna kuga govedi |
Govedo (vključno z govedom zebu, bivolom, bizonom in jakom) |
|
Ebola |
Primati, razen človeka |
|
Slinavka in parkljevka |
Artiodactyla in azijski sloni |
|
Infekciozna hematopoetska nekroza |
Salmonidae |
|
Vozličasti dermatitis |
Bovidae in Giraffidae |
|
Osepnice opic |
Rodentia in primati, razen človeka |
|
Mycobacterium bovis |
Mammalia, zlasti Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, in Tragulidae |
|
Atipična kokošja kuga |
Aves |
|
Kuga drobnice |
Bovidae in Suidae |
|
Nalezljiva ohromelost prašičev |
Suidae |
|
Psitakoza |
Psittaciformes |
|
Steklina |
Carnivora in Chiroptera |
|
Mrzlica doline Rift |
Bovidae, vrste Camelus in Rhinocerotidae |
|
Goveja kuga |
Artiodactyla |
|
Mali panjski hrošč (Aethina tumida) |
Apis in Bombus |
|
Osepnice ovac in koz |
Bovidae |
|
vezikularna bolezen prašičev |
Suidae in Tayassuidae |
|
Pršica Tropilaelaps (Tropilaelaps spp). |
Apis |
|
Vezikularni stomatitis |
Artiodactyla in Equidae |
|
TSE |
Bovidae, Cervidae, Felidae in Mustelidae |
PRILOGA B
SEZNAM BOLEZNI, ZA KATERE SE PO TEJ DIREKTIVI LAHKO PRIZNAJO NACIONALNI PROGRAMI
|
kuna |
virusni enteritis aleutijska bolezen |
|
čebele |
pohlevna gniloba čebelje zalege varoza in pršičavost (acariasis) |
|
opice in mačke |
tuberkuloza |
|
prežvekovalci |
tuberkuloza |
|
lagomorfi (zajci in kunci) |
miksomatoza virusna hemoragična bolezen kuncev tularemija |
PRILOGA C
POGOJI, KI UREJAJO ODOBRITEV USTANOV, INŠTITUTOV ALI SREDIŠČ
1. Da bi bil uradno odobren po členu 13(2) te direktive, mora ustanova, inštitut ali središče, kakor so opredeljeni v členu 2(1)(c):
(a) biti jasno razmejen in ločen od okolice ali zaprtih živali in nameščen tako, da ne predstavlja zdravstvenega tveganja za kmetijska gospodarstva, katerih zdravstveni status bi lahko bil ogrožen;
(b) imeti ustrezna sredstva za lovljenje, zaprtje in izolacijo živali ter imeti na razpolago ustrezne karantenske objekte in odobrene postopke za živali, ki prihajajo iz neodobrenih virov;
(c) biti prost bolezni, navedenih v Prilogi A, in bolezni, navedenih v Prilogi B, če ima zadevna država program na podlagi člena 14. Da je ustanova, inštitut ali središče proglašeno za proste teh bolezni, pristojni organ oceni evidenco o zdravstvenem stanju živali, ki so jo vodili najmanj predhodna tri leta ter rezultate kliničnih in laboratorijskih testov, opravljenih na živalih v ustanovi, inštitutu ali središču. Vendar se z odstopanjem od te zahteve odobrijo novi obrati, če v njih nahajajoče se živali, izhajajo iz odobrenih obratov;
(d) voditi posodobljene evidence, ki navajajo:
(i) število in identiteto (starost, spol, vrsto in posamezno identifikacijo, kjer je to praktično) živali vsake vrste, prisotne v ustanovi;
(ii) število in identiteto (starost, spol, vrsto in posamezno identifikacijo, kjer je to praktično) živali, ki prihajajo v ustanovo ali jo zapuščajo, skupaj s podatki o njihovem poreklu ali namembnosti, prevozu iz ali v ustanovo ter o zdravstvenem statusu živali;
(iii) rezultate krvnih preiskav ali drugih diagnostičnih postopkov;
(iv) primere bolezni in, če je to ustrezno, uporabljeno zdravljenje;
(v) patomorfološke rezultate pregledov živali, ki so poginile v obratu, vključno z mrtvorojenimi živalmi;
(vi) opažanja v obdobju izolacije ali karantene;
(e) imeti dogovor s pristojnim laboratorijem za opravljanje patomorfoloških preiskav ali pa imeti enega ali več ustreznih prostorov, kjer te preglede lahko opravlja pristojna oseba pod nadzorom uradno odobrenega veterinarja;
(f) imeti ustrezen dogovor ali objekte, postavljene na kraju obratovanja za ustrezno uničenje trupov živali, ki so poginile zaradi bolezni ali so bile usmrčene;
(g) zagotoviti, s pogodbo ali drugim pravno zavezujočim instrumentom, storitve veterinarja, ki ga je odobril pristojni organ in je pod nadzorom le-tega, in ki:
(i) smiselno v skladu z zahtevami, navedenimi v členu 14(3)(B) Direktive 64/432/EGS,
(ii) zagotavlja, da so ustrezni ukrepi za preprečevanje in nadzorovanje bolezni v zvezi s stanjem bolezni v zadevni državi, odobreni s strani pristojnih organov in se uporabljajo v ustanovi, inštitutu ali središču. Taki ukrepi vključujejo:
— letni načrt nadzorovanja živalskih bolezni, vključno z ustrezno kontrolo zoonoz,
— klinično, laboratorijsko in patomorfološko testiranje živali, za katere se sumi, da so okužene z nalezljivo boleznijo,
— cepljenje dovzetnih živali proti nalezljivim boleznim, kakor je ustrezno, vendar v skladu z zakonodajo Skupnosti;
(iii) zagotavlja, da se vsi sumljivi primeri poginov ali prisotnost kakršnih koli drugih znakov ki nakazujejo, da so živali obolele za eno ali več boleznimi iz prilog A in B, nemudoma uradno sporočijo pristojnemu organu, če je posamezna bolezen taka, da jo je treba obvezno prijaviti v zadevni državi članici;
(iv) zagotavlja, da so prihajajoče živali izolirane, kakor je potrebno, ter v skladu z zahtevami te direktive in navodili, če obstajajo, izdanimi s strani pristojnih organov;
(v) je odgovoren za dnevno skladnost z zahtevami v zvezi z zdravstvenim varstvom živali te direktive in zakonodaje Skupnosti o dobrem počutju živali med prevozom in odstranjevanju živalskih odpadkov;
(h) biti v skladu z določbami člena 5 Direktive 86/609/EGS, če ima živali, namenjene za laboratorije, ki opravljajo poskuse.
2. Odobritev se ohrani, kadar so izpolnjene naslednje zahteve:
(a) prostori so pod nadzorom uradnega veterinarja iz pristojnega organa, ki:
(i) najmanj enkrat letno obišče prostore ustanove, inštituta ali središča;
(ii) pregleda dejavnost odobrenega veterinarja in izvajanje letnega programa za nadzor bolezni;
(iii) zagotavlja, da so izpolnjene določbe te direktive;
(b) le živali, ki prihajajo iz druge odobrene ustanove, inštituta ali središča se sprejmejo v ustanovo, v skladu z določbami te direktive;
(c) uradni veterinar preveri, da:
— so izpolnjene določbe te direktive,
— rezultati kliničnih, patomorfoloških in laboratorijskih testov na živalih niso dokazali pojava bolezni iz prilog A in B;
(d) ustanova, inštitut ali središče vodi evidenco iz točki 1(d) po odobritvi najmanj deset let.
3. Z odstopanjem od člena 5(1) te direktive in točke 2(b) te priloge, živali, vključno z opicami (simiae in prosimiae), ki ne izvirajo iz odobrene ustanove, inštituta ali središča, lahko pridejo v odobreno ustanovo, inštitut ali središče pod pogojem, da se za te živali uporabi karantena pod uradnim nadzorom in v skladu z navodili, ki jih je izdal pristojni organ pred vključitvijo v zbirko.
Za opice (simiae in prosimiae) se upošteva zahteve karantene, določene v OIE Mednarodnem zdravstvenem kodeksu (poglavje 2.10.1 in Dodatek 3.5.1).
Za druge živali, ki so v karanteni v skladu s točko 2(b) te priloge, mora biti obdobje karantene najmanj 30 dni za bolezni, navedene v Prilogi A.
4. Živali, ki so v odobreni ustanovi, inštitutu ali središču, le-tega zapustijo le, če so namenjene v drugo odobreno ustanovo, inštitut ali središče v tej državi članici ali drugi državi članici; vendar če niso namenjene za odobreno ustanovo, inštitut ali središče, odidejo le v skladu z zahtevami pristojnega organa, da se zagotovi, da ni tveganja za morebitno širjenje bolezni.
5. Če ima država članica ugodnosti dodatnih jamstev po zakonodaji Skupnosti, lahko zahteva ustrezne dodatne zahteve in potrdila za dovzetne vrste, da se dodajo odobreni ustanovi, inštitutu ali središču.
6. Postopki za delni ali popolni začasni preklic, umik ali obnovitev odobritve so naslednji:
(a) če pristojni organ ugotovi, da zahteve točke 2 niso bile izpolnjene, ali da je spremenjena uporaba, ki ni več zajeta s členom 2 te direktive, se odobritev začasno prekliče ali umakne;
(b) če se vloži uradno obvestilo o sumu na bolezen, navedeno v Prilogi A ali B, pristojni organ začasno prekliče odobritev ustanove, inštituta ali središča, dokler se sum uradno ne izključi. Odvisno od zadevne bolezni in tveganja za prenos bolezni, se začasni preklic lahko nanaša na ustanovo kot celoto ali le na nekatere kategorije živali, dovzetne za zadevno bolezen. Pristojni organi zagotovijo, da se sprejmejo ukrepi, potrebni za potrditev ali izključitev suma ter za omejitev širjenja bolezni, v skladu z zakonodajo Skupnosti, ki ureja ukrepe, ki jih je treba sprejeti proti zadevni bolezni in o trgovini z živalmi;
(c) če se sum bolezni potrdi, se ustanova, inštitut ali središče ponovno odobri šele, ko so po izkoreninjenju bolezni in vira okužbe v prostorih, vključno z ustreznim čiščenjem in razkuževanjem, pogoji, določeni v točki 1 te priloge, razen tistih iz točke 1(c), ponovno izpolnjeni;
(d) pristojni organ obvesti Komisijo o začasnem preklicu, umiku ali obnovitvi odobritve ustanove, inštituta ali središča.
PRILOGA D
POGLAVJE I
Pogoji za osemenjevalna središča za pridobivanje semena, osemenjevalna središča za skladiščenje semena, skupine za zbiranje zarodkov in skupine za pridobivanje zarodkov
I. Pogoji za odobritev osemenjevalnih središč za pridobivanje in skladiščenje semena
|
1. |
Za pridobitev odobritve in veterinarske registrske številke iz člena 11(4) vsako osemenjevalno središče za pridobivanje semena: 1.1 nadzoruje veterinar osemenjevalnega središča, ki ga pooblasti pristojni organ; 1.2 ima najmanj: (a) prostor za nastanitev živali, ki ga je mogoče zakleniti, in če se tako zahteva, tudi prostor za gibanje konjev, oba fizično ločena od prostorov za zbiranje, pripravo in skladiščenje semena; (b) objekte za karanteno, ki niso neposredno povezani s prostori za običajno nastanitev živali; (c) brez poseganja v točko 1.4 objekte za zbiranje semena na mestu zbiranja semena in okrog, ki imajo nezazidane površine zaščitene pred hudimi vremenskimi razmerami in protizdrsna tla, ki ščitijo pred hudimi poškodbami zaradi padcev; (d) ločen prostor za čiščenje in razkuževanje ali sterilizacijo opreme; (e) prostor za pripravo semena, ločen od objektov za zbiranje, in prostor za čiščenje opreme iz točke (d), za katere pa ni nujno, da so na isti lokaciji; (f) prostor za skladiščenje semena, za katerega ni nujno, da je na isti lokaciji; 1.3 je zgrajeno ali izolirano tako, da se preprečuje stik z živino iz okolice; 1.4 je zgrajeno tako, da je mogoče celotno osemenjevalno središče za pridobivanje semena, razen pisarniških prostorov in pri kopitarjih prostora za gibanje, brez težav očistiti in razkužiti. |
|
2. |
Za pridobitev odobritve osemenjevalno središče za pridobivanje semena: (a) ima dodeljeno posebno veterinarsko registrsko številko iz člena 11(4) za vsako vrsto semena, ki je skladiščeno v osemenjevalnem središču, če se v osemenjevalnih središčih, odobrenih v skladu s to direktivo, skladišči več različnih vrst zbranega semena ali če se v središču zarodki shranjujejo v skladu s to direktivo; (b) stalno nadzoruje veterinar osemenjevalnega središča, ki ga pooblasti pristojni organ; (c) ima prostor za skladiščenje semena, ki je opremljen z ustrezno opremo za skladiščenje semena in/ali shranjevanje zarodkov ter je zgrajen tako, da so navedeni pripravki in oprema zaščiteni pred hudimi vremenskimi in okoljskimi razmerami; (d) je zgrajeno tako, da se preprečuje stik z živino ali drugimi živalmi iz okolice; (e) je zgrajeno tako, da je mogoče celotno središče, razen pisarniških prostorov in pri kopitarjih prostora za gibanje, brez težav očistiti in razkužiti; (f) je zgrajeno tako, da se učinkovito preprečuje vstop nepooblaščenim osebam. |
II. Pogoji za nadzor osemenjevalnih središč za pridobivanje in skladiščenje semena
|
1. |
Osemenjevalna središča za pridobivanje semena: 1.1 se nadzorujejo tako, da se zagotovi: (a) da vsebujejo le živali vrst, katerih seme je treba zbrati. Lahko pa so dovoljene tudi druge domače živali, če ne pomenijo tveganja za okužbo tistih vrst, katerih seme je treba zbrati, in če izpolnjujejo pogoje, ki jih določi veterinar osemenjevalnega središča. Če je osemenjevalno središče za pridobivanje semena kopitarjev na isti lokaciji kot osemenjevalno središče za umetno osemenjevanje ali osemenjevalno središče za naravni pripust, so dovoljeni samice kopitarjev („kobile“) ter nekastrirani samci kopitarjev („žrebci“) za preskušanje in naravni pripust, če izpolnjujejo zahteve iz točk 1.1, 1.2, 1.3 in 1.4 oddelka I poglavja II; (b) da se preprečuje vstop nepooblaščenim osebam in da morajo pooblaščeni obiskovalci izpolnjevati pogoje, ki jih določi veterinar osemenjevalnega središča; (c) da je zaposleno le kvalificirano osebje, ki je bilo ustrezno usposobljeno za dezinfekcijske in higienske metode za preprečevanje širjenja bolezni; 1.2 se spremljajo tako, da se zagotovi: (a) da so vodene evidence o: (i) vrsti, pasmi, datumu rojstva in identifikaciji vsake živali v osemenjevalnem središču; (ii) kakršnem koli premiku živali, ki vstopajo v osemenjevalno središče ali ga zapuščajo; (iii) anamnezi in vseh diagnostičnih preiskavah in njihovih izvidih ter o zdravljenju in opravljenem cepljenju rejenih živali; (iv) datumu zbiranja in priprave semena; (v) namembnosti semena; (vi) skladiščenju semena; (b) da nobena žival v osemenjevalnem središču ni v naravnem pripustu najmanj 30 dni pred dnem prvega zbiranja semena in med obdobjem zbiranja semena; (c) da se zbiranje, priprava in skladiščenje semena izvajajo samo v prostorih, predvidenih za ta namen; (d) da so vsi instrumenti, ki so v stiku s semenom ali donorjem med zbiranjem in pripravo, primerno razkuženi ali sterilizirani pred uporabo, razen instrumentov, ki so novi in za enkratno uporabo ter se po uporabi zavržejo („instrumenti za enkratno uporabo“). Če je za kopitarje osemenjevalno središče za pridobivanje semena na isti lokaciji kakor osemenjevalno središče za umetno osemenjevanje ali osemenjevalno središče za naravni pripust, so instrumenti in oprema za umetno osemenjevanje ali naravni pripust strogo ločeni od instrumentov in opreme, ki prihajajo v stik z donorji ali drugimi živalmi v osemenjevalnem središču za pridobivanje semena, in od semena; (e) da so proizvodi živalskega izvora, ki se uporabljajo pri pripravi semena – vključno z razredčili, dodatki ali polnila – pridobljeni iz virov, ki ne pomenijo tveganja za zdravje živali ali pa so pred uporabo obdelani tako, da se takšno tveganje prepreči; (f) da sredstva za zamrzovanje, uporabljena za ohranjevanje ali skladiščenje semena, niso bila predhodno uporabljena za druge proizvode živalskega izvora; (g) da so posode za skladiščenje in prevoz semena ustrezno razkužene ali sterilizirane pred vsakim polnjenjem, razen posod, ki so nove in za enkratno uporabo ter se po uporabi zavržejo („posode za enkratno uporabo“); (h) da je vsak posamezen odmerek semena ali vsak ejakulat svežega semena, namenjen za nadaljnjo pripravo, jasno označen tako, da je mogoče brez težav ugotoviti datum zbiranja semena, vrsto, pasmo in identifikacijo donorja ter številko odobritve osemenjevalnega središča za pridobivanje semena; 1.3 redno pregleduje uradni veterinar najmanj enkrat na koledarsko leto v pripustni sezoni za sezonske živali in dvakrat na koledarsko leto za živali s celoletno reprodukcijo, da se preučijo in preverijo, po potrebi na podlagi evidenc, standardni postopki delovanja in notranji nadzor ter vse zadeve v zvezi s pogoji za odobritev, nadzor in spremljanje. |
|
2. |
Osemenjevalna središča za skladiščenje semena: 2.1 se nadzorujejo, da se zagotovi: (a) da status donorjev, katerih seme se shranjuje v središču, izpolnjuje pogoje iz te direktive; (b) da so izpolnjene zahteve iz točk 1.1(b) in (c); (c) da se vodijo evidence o vsakem premiku semena v osemenjevalno središče za skladiščenje semena ali iz njega; 2.2 se spremljajo tako: (a) da v odobreno osemenjevalno središče za skladiščenje semena vstopi le seme, ki je bilo zbrano v odobrenem osemenjevalnem središču za pridobivanje ali skladiščenje semena in prihaja iz njega ter je bilo prepeljano pod pogoji, ki zagotavljajo vsa mogoča zdravstvena jamstva, in pri tem ni bilo v stiku z nobenim drugim semenom; (b) da poteka skladiščenje semena le v prostorih, ki so posebej določeni za ta namen in za katere veljajo strogi higienski pogoji; (c) da so vsi instrumenti, ki so v stiku s semenom, primerno razkuženi ali sterilizirani pred uporabo, razen instrumentov za enkratno uporabo; (d) da so posode za skladiščenje in prevoz semena ustrezno razkužene ali sterilizirane pred vsakim polnjenjem, razen posod za enkratno uporabo; (e) da sredstva za zamrzovanje, uporabljena za ohranjevanje ali skladiščenje semena, niso bila predhodno uporabljena za druge proizvode živalskega izvora; (f) da je vsak posamezen odmerek semena jasno označen tako, da je mogoče brez težav ugotoviti datum zbiranja semena, vrsto, pasmo in identifikacijo donorja ter številko odobritve osemenjevalnega središča za pridobivanje semena; vsaka država članica Komisiji in drugim državam članicam sporoči značilnosti in obliko oznak, uporabljenih na svojem ozemlju; 2.3 brez poseganja v točko 2.2(a) shranjujejo zarodke v odobrenem osemenjevalnem središču za skladiščenje semena, če ti izpolnjujejo zahteve iz te direktive, in sicer v ločenih posodah za skladiščenje; 2.4 redno pregleduje uradni veterinar najmanj dvakrat na koledarsko leto, da se preučijo in preverijo, po potrebi na podlagi evidenc, standardni postopki delovanja in notranji nadzor ter vse zadeve v zvezi s pogoji za odobritev, nadzor in spremljanje. |
III. Pogoji za odobritev in nadzor skupin za zbiranje zarodkov in skupin za pridobivanje zarodkov
|
1. |
Za pridobitev odobritve skupina za zbiranje zarodkov izpolnjuje naslednje zahteve: 1.1 Zbiranje, pripravo in shranjevanje zarodkov opravi veterinar skupine ali eden ali več tehnikov, za katere je odgovoren veterinar in so usposobljeni ter jih je veterinar skupine poučil o osnovnih higienskih tehnikah in metodah ter s tehnikami in načeli nadzora nad boleznijo. 1.2 Veterinar skupine je odgovoren za vse postopke, ki jih izvede skupina, vključno s: (a) potrditvijo identitete in zdravstvenega statusa donorke; (b) sanitarnim ravnanjem in kirurškimi postopki na donorkah; (c) razkuževanjem in higienskimi postopki; (d) vodenjem evidenc o: (i) vrsti, pasmi, datumu rojstva in identifikaciji vsake donorke; (ii) anamnezi in vseh diagnostičnih preiskavah in njihovih izvidih ter o zdravljenju in opravljenem cepljenju donork; (iii) kraju in datumu zbiranja, priprave in shranjevanja oocitov, jajčnih celic in zarodkov; (iv) označevanju zarodkov in podrobnostih o njihovi namembnosti, če je znana. 1.3 Skupina je pod splošnim nadzorom uradnega veterinarja, ki jo redno pregleda najmanj enkrat na koledarsko leto za zagotovitev, po potrebi na podlagi evidenc, da se uporabljajo standardni postopki delovanja in notranjega nadzora, da se izpolnjujejo sanitarni pogoji glede zbiranja, priprave in shranjevanja zarodkov in da se preverijo vse zadeve v zvezi s pogoji za odobritev in nadzor. 1.4 Skupini je na voljo stalni laboratorij ali mobilni laboratorij, v katerem se lahko zarodki pregledajo, pripravijo in zapakirajo ter ki ima vsaj delovno površino, optični ali stereo mikroskop in po potrebi opremo za zamrzovanje. 1.5 Stalni laboratorij ima: (a) prostor za pripravo zarodkov, ki je fizično ločen od prostora, v katerem se zbirajo zarodki; (b) prostor za čiščenje in sterilizacijo instrumentov, razen v primeru uporabe instrumentov za enkratno uporabo; (c) prostor za shranjevanje zarodkov. 1.6 Mobilni laboratorij: (a) ima posebej opremljen del vozila z ločenima oddelkoma za: (i) pregled in pripravo zarodkov, ki je čisti del, in (ii) odlaganje opreme in materialov, ki so bili v stiku z donorkami; (b) uporablja le opremo za enkratno uporabo, razen če poskrbi za sterilizacijo opreme in nabavo tekočin in drugih potrebnih proizvodov za zbiranje in pripravo zarodkov s sodelovanjem s stalnim laboratorijem. 1.7 Pri načrtovanju in ureditvi objektov in laboratorijev ter vseh postopkih, ki jih izvaja skupina, je treba zagotoviti, da ne pride do navzkrižnega onesnaženja. 1.8 Skupini so na voljo prostori za shranjevanje, ki: (a) vsebujejo najmanj en prostor, ki ga je mogoče zakleniti, za shranjevanje jajčnih celic in zarodkov; (b) se zlahka očistijo in razkužijo; (c) imajo evidence vseh premikov jajčnih celic in zarodkov; (d) imajo posode za shranjevanje jajčnih celic in zarodkov v prostoru, ki je pod nadzorom veterinarja skupine in ga redno pregleduje uradni veterinar. 1.9 Pristojni organ lahko odobri skladiščenje semena v prostorih za skladiščenje iz točke 1.8, če: (a) seme izpolnjuje zahteve iz te direktive za ovce in koze ali kopitarje ali zahteve iz Direktive Sveta 90/429/EGS z dne 26. junija 1990 o zahtevah za zdravstveno varstvo živali, ki veljajo za promet znotraj Skupnosti in za uvoz semena domačih prašičev ( 25 ) za prašiče, (b) je seme shranjeno v ločenih posodah za skladiščenje v prostorih za shranjevanje odobrenih zarodkov za nadaljnje delo skupine. |
|
2. |
Za pridobitev odobritve skupina za pridobivanje zarodkov izpolnjuje tudi naslednje zahteve: 2.1 Člani skupine so ustrezno poučeni o metodah nadzora nad boleznijo in laboratorijskih preiskavah, zlasti postopkih za delo v sterilnih razmerah. 2.2 Skupini je na voljo stalni laboratorij, ki: (a) ima ustrezno opremo in objekte, vključno z ločenimi prostori za: — odvzem oocitov iz jajčnikov, — pripravo oocitov, jajčnih celic in zarodkov, — shranjevanje zarodkov; (b) ima prostore z laminarnim tokom ali druge primerne objekte, v katerih se izvajajo vsi tehnični postopki v zvezi s posebnimi sterilnimi razmerami (priprava jajčnih celic, zarodkov in semena). Vendar se lahko centrifugiranje semena izvaja zunaj prostora z laminarnim tokom ali drugega prostora, če se izvajajo vsi higienski varnostni ukrepi. 2.3 Kadar se jajčne celice in druga tkiva zbirajo v klavnici, ji je na voljo primerna oprema za zbiranje in prevoz jajčnikov in drugih tkiv v predelovalni laboratorij na higieničen in varen način. |
POGLAVJE II
Pogoji za živali donorje
I. Pogoji za žrebce donorje
|
1. |
Za zbiranje semena se lahko uporablja žrebec donor, ki po mnenju veterinarja osemenjevalnega središča izpolnjuje naslednje zahteve: 1.1 Ob sprejemu ali na dan zbiranja semena ne kaže nobenih znakov infekcijske ali kužne bolezni. 1.2 Izvira z ozemlja ali pri regionalizaciji iz dela ozemlja države članice ali tretje države in z gospodarstva pod veterinarskim nadzorom, ki izpolnjuje zahteve iz Direktive Sveta 90/426/EGS. 1.3 30 dni pred dnem zbiranja semena je bival na gospodarstvih, na katerih v tem obdobju noben kopitar ni kazal kliničnih znakov konjskega virusnega arteritisa ali infekcioznega ekvinega metritisa. 1.4 30 dni pred prvim zbiranjem semena in med obdobjem zbiranja semena ni v naravnem pripustu. 1.5 Na njem se opravijo naslednji testi, izvedeni in potrjeni v laboratoriju, ki ga priznava pristojni organ in ki ima teste, navedene v nadaljevanju, vključene v svojo akreditacijo v skladu s členom 12 Uredbe (ES) št. 882/2004 Evropskega parlamenta in Sveta ( 26 ), po programu iz točke 1.6: (a) agar gel imunodifuzijski test (Cogginsov test) ali test ELISA na infekciozno anemijo enoprstih kopitarjev z negativnim rezultatom; (b) test za izolacijo virusa kužnega arteritisa enoprstih kopitarjev ali odkrivanje njegovega genoma z verižno reakcijo s polimerazo (PCR) ali PCR v realnem času, izveden z negativnim rezultatom na alikvotu celotnega semena žrebca donorja, razen če je bil na žrebcu donorju opravljen test nevtralizacije seruma na kužni arteritis enoprstih kopitarjev, rezultat pa je negativen pri razredčini seruma 1: 4; (c) test za določanje povzročitelja nalezljivega metritisa kobil, ki mora biti v vsakem primeru negativen na treh vzorcih (brisih), odvzetih žrebcu donorju dvakrat v razmiku vsaj 7 dni, v nobenem primeru pa ne prej kot 7 dni (sistemsko zdravljenje) ali 21 dni (lokalno zdravljenje) po morebitnem zdravljenju žrebca donorja s protimikrobnimi sredstvi, vsaj z naslednjih območij: — penilne ovojnice (prepucija), — sečnice, — jamice (fossa glandis). Pred pošiljanjem v laboratorij se vzorci vstavijo v transportno gojišče z aktivnim ogljem, kot je gojišče Amies. Na vzorcih mora biti opravljen vsaj eden od naslednjih testov: (i) kultura pod mikroaerofilnimi pogoji vsaj 7 dni za izolacijo bakterije Taylorella equigenitalis; izvedeno v 24 urah po odvzemu vzorcev donorju ali v 48 urah, če se vzorci med prevozom hranijo na hladnem, ali (ii) verižna reakcija s polimerazo (PCR) ali PCR v realnem času za odkrivanje genoma bakterije Taylorella equigenitalis, ki se opravi v 48 urah po odvzemu vzorcev donorju. 1.6 Na njem je bil opravljen eden od naslednjih programov testiranja: (a) če je žrebec donor nepretrgoma nastanjen v osemenjevalnem središču za pridobivanje semena najmanj 30 dni pred dnem prvega zbiranja in med obdobjem zbiranja semena ter noben enoprsti kopitar v osemenjevalnem središču za pridobivanje semena ne pride v neposredni stik z enoprstim kopitarjem, katerega zdravstveni status je nižji od zdravstvenega statusa žrebca donorja, se opravijo testi iz točke 1.5 na vzorcih, odvzetih žrebcu donorju vsaj enkrat letno na začetku pripustne sezone ali pred prvim zbiranjem semena, namenjenega za trgovino s svežim, ohlajenim ali zamrznjenim semenom, in najmanj 14 dni od začetka vsaj 30-dnevnega obdobja nastanitve pred prvim zbiranjem semena; (b) če je žrebec donor nastanjen v osemenjevalnem središču za pridobivanje semena najmanj 30 dni pred dnem prvega zbiranja in med obdobjem zbiranja semena, vendar mora občasno zapustiti osemenjevalno središče pod nadzorom veterinarja osemenjevalnega središča za nepretrgano obdobje, krajše od 14 dni, in/ali drugi enoprsti kopitarji v osemenjevalnem središču za pridobivanje semena pridejo v neposredni stik z enoprstim kopitarjem, katerega zdravstveni status je nižji od zdravstvenega statusa žrebca donorja, se opravijo testi iz točke 1.5 po naslednjem razporedu: (i) vsaj enkrat letno na vzorcih, odvzetih žrebcu donorju, na začetku pripustne sezone ali pred prvim zbiranjem semena, namenjenega za trgovino s svežim, ohlajenim ali zamrznjenim semenom, in najmanj 14 dni od začetka vsaj 30-dnevnega obdobja nastanitve pred prvim zbiranjem semena, ter (ii) v obdobju zbiranja semena, namenjenega za trgovanje s svežim, ohlajenim ali zamrznjenim semenom, kot sledi: — test iz točke 1.5(a) na vzorcih, odvzetih ne več kot 90 dni pred zbiranjem semena za trgovino, — test iz točke 1.5(b) na vzorcih, odvzetih ne več kot 30 dni pred zbiranjem semena za trgovino, razen če je bilo s testom izolacije virusa, testom PCR ali PCR v realnem času na alikvotu celotnega semena, ki je bil živali odvzet največ 6 mesecev pred zbiranjem semena za trgovino, potrjeno, da žrebec donor ni prenašalec in je test nevtralizacije seruma za kužni arteritis enoprstih kopitarjev pokazal pozitiven rezultat v razredčini seruma vsaj 1: 4, — test iz točke 1.5(c) na vzorcih, odvzetih ne več kot 60 dni pred zbiranjem semena za trgovino, ki se lahko v primeru testa PCR ali PCR v realnem času izvede na treh vzorcih (brisih), odvzetih naenkrat; (c) če žrebec donor ne izpolnjuje pogojev iz točk (a) in (b) in če je seme, zbrano za trgovino, zamrznjeno, se testi iz točke 1.5 na vzorcih, odvzetih žrebcu donorju, opravijo po naslednjem razporedu: (i) najmanj enkrat letno na začetku pripustne sezone; (ii) med obdobjem skladiščenja iz točke 1.3(b) oddelka I poglavja III in preden se seme odstrani iz osemenjevalnega središča ali uporabi na vzorcih, odvzetih ne prej kot 14 dni in ne pozneje kot 90 dni po datumu zbiranja semena. Z odstopanjem od točke (ii) prvega pododstavka se vzorčenje po zbiranju in testiranje na kužni arteritis enoprstih kopitarjev iz točke 1.5(b) ne zahtevata, če je test izolacije virusa potrdil, da seropozitiven žrebec ni prenašalec kužnega arteritisa enoprstih kopitarjev, test PCR ali PCR v realnem času je pokazal negativen rezultat na vzorcih alikvota celotnega semena žrebca donorja, odvzetih dvakrat letno v presledku najmanj štirih mesecev, test nevtralizacije seruma za kužni arteritis enoprstih koipitarjev pa je pokazal pozitiven rezultat v razredčini seruma vsaj 1: 4. 1.7 Če je kateri koli od testov iz točke 1.5 pozitiven, se žrebec donor izolira, s semenom, zbranim pri njem po dnevu zadnjega negativnega testa, pa se ne trguje z izjemo semena vsakega ejakulata, pri katerem je bil test na konjski virusni arteritis negativen. Seme, zbrano pri drugih žrebcih v osemenjevalnem središču za pridobivanje semena od dneva zadnjega zbiranja vzorca, ki je bil negativen po enem od testov iz točke 1.5, se skladišči ločeno in z njim se ne trguje, dokler se zdravstveni status osemenjevalnega središča za pridobivanje semena ne obnovi in dokler se shranjeno seme uradno ne pregleda na povzročitelje bolezni iz točke 1.5. 1.8 Seme, zbrano pri žrebcih v osemenjevalnem središču za pridobivanje semena, za katerega velja prepoved v skladu s členom 4 ali 5 Direktive 90/426/EGS, se skladišči ločeno in z njim se ne trguje, dokler uradni veterinar ne obnovi zdravstvenega statusa osemenjevalnega središča za pridobivanje semena v skladu z Direktivo 90/426/EGS in dokler se shranjeno seme uradno ne pregleda na povzročitelje bolezni iz točke Priloge A k Direktivi 90/426/EGS. |
II. Pogoji za ovne donorje in kozle donorje
|
1. |
Za vse ovce in koze, ki se sprejmejo v osemenjevalno središče za pridobivanje semena, veljajo naslednje zahteve: 1.1 najmanj 28 dni so bile v karanteni v nastanitvenih prostorih, ki jih posebej za ta namen odobrijo pristojni organi in v katerih so le živali z najmanj enakim zdravstvenim statusom („karantenska nastanitev“); 1.2 pred bivanjem v karantenski nastanitvi so bile uradno proste bruceloze v skladu s členom 2 Direktive Sveta 91/68/EGS, in pred tem niso bivale na gospodarstvu z nižjim zdravstvenim statusom glede bruceloze; 1.3 prihajajo z gospodarstva, kjer je bil na njih 60 dni pred bivanjem v karantenski nastanitvi opravljen serološki test na nalezljivi epididimitis (B. ovis) v skladu s Prilogo D k Direktivi 91/68/EGS ali kateri koli drugi test z dokumentirano enakovredno občutljivostjo in specifičnostjo; 1.4 na vzorcih krvi, odvzetih med 28-dnevnim obdobjem pred začetkom obdobja karantene iz točke 1.1, so bili opravljeni naslednji testi, ki so bili vedno negativni, razen testa na bordersko bolezen iz točke (c)(ii): (a) serološki test na brucelozo (B. melitensis) v skladu s Prilogo C k Direktivi 91/68/EGS; (b) serološki test na nalezljivi epididimitis (B. ovis) v skladu s Prilogo D k Direktivi 91/68/EGS ali kateri koli drugi test z dokumentirano enakovredno občutljivostjo in specifičnostjo; (c) za bordersko bolezen: (i) test izolacije virusa ali test na antigen virusa in (ii) serološki test za ugotavljanje prisotnosti ali odsotnosti protiteles („test na protitelesa“). Pristojni organ lahko dovoli, da se testi iz te točke izvedejo na vzorcih, odvzetih v karantenski nastanitvi. V tem primeru se obdobje karantene iz točke 1.1 ne začne pred dnevom vzorčenja. Če je kateri koli test iz te točke pozitiven, je treba zadevno žival takoj odstraniti iz karantenske nastanitve. Če so živali v skupinski izolaciji, se obdobje karantene iz točke 1.1 za preostale živali ne začne, dokler ni odstranjena žival s pozitivnim testom; 1.5 na vzorcih, odvzetih med obdobjem karantene iz točke 1.1 najmanj 21 dni po sprejemu v karantensko nastanitev, so bili opravljeni naslednji testi z negativnim rezultatom: (a) serološki test na brucelozo (B. melitensis) v skladu s Prilogo C k Direktivi 91/68/EGS; (b) serološki test na nalezljivi epididimitis (B. ovis) v skladu s Prilogo D k Direktivi 91/68/EGS ali kateri koli drugi test z dokumentirano enakovredno občutljivostjo in specifičnostjo; 1.6 na vzorcih krvi, odvzetih med obdobjem karantene iz točke 1.1 in najmanj 21 dni po sprejemu v karantensko nastanitev, so bili opravljeni testi na bordersko bolezen iz točke 1.4(c)(i) in (ii). Za vsako žival (seronegativno ali seropozitivno) se dovoli vstop v osemenjevalno središče za pridobivanje semena le, če ne pride do serokonverzije pri živalih, pri katerih je bil test pred vstopom v karantensko nastanitev negativen. Če pride do serokonverzije, se vse živali, ki ostanejo seronegativne, še naprej zadržijo v karanteni, dokler v obdobju treh tednov po pojavu serokonverzije v skupini ne pride več do serokonverzije. Za seropozitivne živali se dovoli vstop v osemenjevalno središče za pridobivanje semena, če je bil test iz točke 1.4(c)(i) negativen. |
|
2. |
Živali je dovoljeno sprejeti v osemenjevalno središče za pridobivanje semena le z izrecnim dovoljenjem veterinarja osemenjevalnega središča. Vsak vstop ali izstop iz osemenjevalnega središča za pridobivanje semena se evidentira. |
|
3. |
Nobena žival, ki se sprejme v osemenjevalno središče za pridobivanje semena, ne kaže nobenih kliničnih znakov bolezni na dan vstopa. Vse živali brez poseganja v točko 4 prihajajo iz karantenske nastanitve, ki na dan odpošiljanja živali v osemenjevalno središče za pridobivanje semena izpolnjuje naslednje pogoje: (a) leži na območju s polmerom 10 kilometrov, v katerem v zadnjih 30 dneh ni bilo nobenega primera slinavke in parkljevke; (b) zadnje tri mesece je prosto slinavke in parkljevke in bruceloze; (c) zadnjih 30 dni je prosto obvezno prijavljivih bolezni, kot so opredeljene v členu 2(b)(6) Direktive 91/68/EGS. |
|
4. |
Če so izpolnjeni pogoji iz odstavka 3 in če so bili v 12 mesecih pred premikom živali opravljeni rutinski testi iz točke 5, je živali dovoljeno preseliti iz enega odobrenega osemenjevalnega središča za pridobivanje semena v drugega z enakim zdravstvenim statusom brez izolacije ali testov, če je preselitev neposredna. Taka žival ne sme priti v neposredni ali posredni stik s parkljarji z nižjim zdravstvenim statusom, prevozno sredstvo za ta namen pa se pred uporabo razkuži. Če se žival seli iz enega osemenjevalnega središča za pridobivanje semena v drugega v drugi državi članici, se preselitev izvede v skladu z Direktivo 91/68/EGS. |
|
5. |
Na vse ovcah in kozah v osemenjevalnem središču za pridobivanje semena se najmanj enkrat na koledarsko leto opravijo naslednji testi z negativnimi rezultati: (a) serološki test na brucelozo (B. melitensis) v skladu s Prilogo C k Direktivi 91/68/EGS; (b) serološki test na nalezljivi epididimitis (B. ovis) v skladu s Prilogo D k Direktivi 91/68/EGS ali kateri koli drugi test z dokumentirano enakovredno občutljivostjo in specifičnostjo; (c) test na protitelesa iz točke 1.4(c)(ii) na bordersko bolezen samo za seronegativne živali. |
|
6. |
Vse teste iz tega oddelka izvaja odobren laboratorij. |
|
7. |
Če je kateri koli test iz točke 5 pozitiven, se žival izolira, s semenom, zbranim od te živali od dneva zadnjega negativnega testa, pa se ne trguje. Žival iz prvega odstavka se odstrani iz osemenjevalnega središča, razen v primeru borderske bolezni, ko se na njej opravi test iz točke 1.4(c)(i) z negativnim rezultatom. Seme, zbrano od drugih živali v osemenjevalnem središču za pridobivanje semena od dneva zadnjega zbiranja vzorca, ki je bil negativen po enem od testov iz točke 5, se skladišči ločeno in z njim se ne trguje, dokler se zdravstveni status osemenjevalnega središča za pridobivanje semena ne obnovi in dokler se shranjeno seme uradno ne pregleda na povzročitelje bolezni iz točke 5. |
|
8. |
Seme je pridobljeno od živali, ki: (a) ne kažejo nobenih kliničnih znakov bolezni na dan zbiranja semena; (b) v 12 mesecih pred dnem zbiranja semena: (i) niso bile cepljene proti slinavki in parkljevki ali (ii) so bile cepljene proti slinavki in parkljevki najmanj 30 dni pred zbiranjem, pri čemer se na 5 % (najmanj pet slamic) od vsakega zbiranja semena opravi test izolacije virusa slinavke in parkljevke z negativnimi rezultati; (c) so v primeru zbiranja svežega semena bivale v odobrenem osemenjevalnem središču za pridobivanje semena v neprekinjenem obdobju najmanj 30 dni pred dnem zbiranja semena; (d) izpolnjujejo zahteve iz členov 4, 5 in 6 Direktive 91/68/EGS; (e) če so bivale na gospodarstvih iz prve alinee člena 11(2), je bil v 30 dneh pred dnem zbiranja semena opravljen naslednji test z negativnim rezultatom: (i) serološki test na brucelozo (B. melitensis) v skladu s Prilogo C k Direktivi 91/68/EGS; (ii) serološki test na nalezljivi epididimitis (B. ovis) v skladu s Prilogo D k Direktivi 91/68/EGS ali kateri koli drugi test z dokumentirano enakovredno občutljivostjo in specifičnostjo; (iii) test na virus borderske bolezni; (f) ki ni bila uporabljena za naravni pripust najmanj 30 dni pred dnem prvega zbiranja semena in med dnem prvega vzorca iz točk 1.5 in 1.6 ali točke (e) in do konca obdobja zbiranja. |
|
9. |
Seme, zbrano od ovnov in kozlov v osemenjevalnem središču za pridobivanje semena ali gospodarstvu iz prve alinee člena 11(2), za katerega velja prepoved zaradi zdravstvenega stanja živali v skladu s členom 4 Direktive 91/68/EGS, se skladišči ločeno in z njim se ne trguje, dokler uradni veterinar ne obnovi zdravstvenega statusa osemenjevalnega središča za pridobivanje semena ali gospodarstva v skladu z Direktivo 91/68/EGS in dokler se shranjeno seme uradno ne pregleda na povzročitelje bolezni iz Priloge B(I) k Direktivi 91/68/EGS. |
POGLAVJE III
Zahteve za seme, jajčne celice in zarodke
I. Pogoji za zbiranje, pripravo, ohranjevanje, skladiščenje in prevoz semena
1.1 Kadar so brez poseganja v Direktivo 2001/82/ES Evropskega parlamenta in Sveta ( 27 ) v vsakem ml semena dodani antibiotiki ali mešanica antibiotikov s protibakterijsko aktivnostjo, ki je najmanj enakovredna naslednjim mešanicam: gentamicin (250 μg), tilozin (50 μg), linkomicin-spektinomicin (150/300 μg); penicillin (500 IU), streptomicin (500 μg), linkomicin-spektinomicin (150/300 μg); ali amikacin (75 μg), divekacin (25 μg), se imena dodanih antibiotikov in njihove koncentracije navedejo v veterinarskem spričevalu iz četrte alinee člena 11(2).
1.2 Vsi instrumenti, uporabljeni pri zbiranju, pripravi, ohranjevanju ali zamrzovanju semena, se pred uporabo ustrezno razkužijo ali sterilizirajo, razen instrumentov za enkratno uporabo.
1.3 Zamrznjeno seme se:
(a) skladišči v posodah za skladiščenje:
(i) ki so bile pred uporabo očiščene in razkužene ali sterilizirane ali so za enkratno uporabo;
(ii) s sredstvom za zamrzovanje, ki ni bilo predhodno uporabljeno za druge proizvode živalskega izvora;
(b) pred odpošiljanjem ali uporabo skladišči pri odobrenih pogojih najmanj 30 dni od dneva zbiranja.
1.4 Seme za trgovino se:
(a) prevaža v namembno državo članico v posodah za prevoz, ki so bile pred uporabo očiščene in razkužene ali sterilizirane ali so za enkratno uporabo ter so zapečatene in oštevilčene še pred odpošiljanjem iz odobrenega osemenjevalnega središča za pridobivanje ali skladiščenje semena;
(b) označi tako, da se številka na slamicah ali drugi embalaži ujema s številko na veterinarskem spričevalu iz četrte alinee člena 11(2) in s posodo, v kateri je shranjeno in se prevaža.
II. Pogoji za jajčne celice in zarodke
1. Zbiranje in priprava zarodkov, pridobljenih in vivo
Zarodki, pridobljeni in vivo, so spočeti z umetno oploditvijo s semenom, ki izpolnjuje zahteve iz te direktive, in je zbrano, pripravljeno in ohranjeno na naslednji način:
1.1 Zarodke zbere in pripravi pooblaščena skupina za zbiranje zarodkov, tako da ne pridejo v stik z drugo serijo zarodkov, ki ne izpolnjuje zahtev iz te direktive.
1.2 Zarodki se zberejo na mestu, ki je ločeno od drugih prostorov ali delov gospodarstva in je dobro vzdrževano, zgrajeno iz materialov, ki omogočajo učinkovito in preprosto čiščenje in razkuževanje.
1.3 Zarodki se pripravijo (pregledajo, sperejo, obdelajo in shranijo v označenih in sterilnih slamicah, ampulah ali drugi embalaži) v stalnem laboratoriju ali mobilnem laboratoriju, ki za občutljive vrste leži na območju, na katerem v zadnjih 30 dneh v 10-kilometrskem premeru ni bilo izbruha slinavke in parkljevke.
1.4 Vsa oprema, ki se uporabi za zbiranje, obravnavo, spiranje, zamrzovanje in shranjevanje zarodkov, je pred uporabo sterilizirana ali ustrezno očiščena in razkužena v skladu s Priročnikom IETS ( 28 ) ali je za enkratno uporabo.
1.5 Kakršen koli biološki proizvod živalskega izvora, ki se uporabi v mediju in raztopinah za zbiranje, pripravo, spiranje ali shranjevanje zarodkov, je prost patogenih mikroorganizmov. Mediji in raztopine, ki se uporabijo pri zbiranju, zamrzovanju in shranjevanju zarodkov, se sterilizirajo z odobreno metodo po Priročniku IETS, z njim pa se ravna tako, da se zagotovi sterilnost. Antibiotiki se lahko po potrebi dodajo mediju za zbiranje, pripravo, spiranje in shranjevanje v skladu s Priročnikom IETS.
1.6 Sredstva za zamrzovanje, ki se uporabijo za ohranjevanje ali shranjevanje zarodkov, niso bila predhodno uporabljena za druge proizvode živalskega izvora.
1.7 Vsaka slamica, ampula ali druga embalaža, v kateri so shranjeni zarodki, je jasno označena z označbami v skladu s standardiziranim sistemom po Priročniku IETS.
1.8 Zarodki se sperejo in imajo pred spiranjem in neposredno po njem nepoškodovano ovojnico (zona pellucida) ali embrionalno ovojnico v primeru zarodkov enoprstih kopitarjev. Standardni postopek spiranja se spremeni v skladu s Priročnikom IETS, tako da vključuje dodatna spiranja z encimom tripsinom, kadar je to priporočeno za inaktivacijo ali odstranitev nekaterih patogenov.
1.9 Zarodki različnih živali donork se ne sperejo skupaj.
1.10 Celotna površina ovojnice (zona pellucida) vsakega zarodka ali embrionalna ovojnica v primeru zarodkov enoprstih kopitarjev se pregleda z najmanj 50-kratno povečavo, da se potrdi, da je nepoškodovana in brez sprijete snovi.
1.11 Zarodki serije, pri kateri je bil pregled iz točke 1.10 pozitiven, se shranijo v sterilno slamico, ampulo ali drugo embalažo, označeno v skladu s točko 1.7, in tako zapečatijo.
1.12 Vsak zarodek se, kadar je mogoče, čim prej zamrzne in shrani v prostor, ki je pod nadzorom veterinarja skupine.
1.13 Vsaka skupina za zbiranje zarodkov predloži v uradni pregled za bakterijsko in virusno onesnaženje rutinske vzorce neživih zarodkov ali jajčnih celic ter tekočin za splakovanje ali spiranje, ki nastanejo pri opravljanju njihovih dejavnosti v skladu s Priročnikom IETS.
1.14 Vsaka skupina za zbiranje zarodkov vodi evidenco svojih dejavnosti glede zbiranja zarodkov dve leti po tem, ko so zarodki dani v promet ali uvoženi, vključno s:
(a) pasmami, starostjo in individualnimi identifikacijskimi številkami zadevnih živali donork;
(b) mestom zbiranja, priprave in shranjevanja zarodkov;
(c) označbami zarodkov, skupaj s podrobnostmi o naslovniku pošiljke.
2. Zbiranje in priprava jajčnih celic, jajčnikov in drugih tkiv za pridobitev zarodkov, pridobljenih in vitro
Pogoji iz točk 1.1 do 1.14 se smiselno uporabljajo za zbiranje in pripravo jajčnih celic, jajčnikov in drugih tkiv za uporabo pri oploditvi in vitro in/ali za kulturo in vitro. Poleg tega se uporablja še naslednje:
2.1 Pristojni organ pozna in nadzoruje gospodarstva, s katerih izvirajo živali donorke.
2.2 Kadar se jajčniki in druga tkiva zbirajo v klavnicah pri posameznih živalih ali serijah donork („serija zbiranja“), so klavnice uradno odobrene v skladu z Uredbo (ES) št. 854/2004 Evropskega parlamenta in Sveta z dne 29. aprila 2004 o določitvi posebnih predpisov za organizacijo uradnega nadzora proizvodov živalskega izvora, namenjenih za prehrano ljudi ( 29 ) in so pod nadzorom veterinarja, ki je odgovoren, da se izvajajo inšpekcijski pregledi ante mortem in post mortem morebitnih živalih donork, in ki potrdi, da pri teh živalih ni znakov ustreznih kužnih bolezni, ki se lahko prenašajo med živalmi. Klavnica za občutljive vrste leži na območju s polmerom 10 kilometrov, v katerem v zadnjih 30 dneh ni bilo nobenega primera slinavke in parkljevke.
2.3 Serije jajčnikov se ne pripeljejo v laboratorij za pripravo, dokler niso dokončani inšpekcijski pregledi post mortem živali donork.
2.4 Oprema za odvzem in prevoz jajčnikov in drugih tkiv se pred uporabo očisti in razkuži ali sterilizira ter se uporablja samo za ta namen.
3. Priprava zarodkov, pridobljenih in vitro
Pogoji iz točk 1.1 do 1.14 se smiselno uporabljajo za pripravo zarodkov, pridobljenih in vitro. Poleg tega se uporablja še naslednje:
3.1 Zarodki, pridobljeni in vitro, so spočeti z oploditvijo in vitro s semenom, ki izpolnjuje zahteve iz te direktive.
3.2 Zarodki se po koncu obdobja kulture in vitro in pred zamrzovanjem, shranjevanjem in prevozom sperejo in obdelajo v skladu s točkami 1.8, 1.10 in 1.11.
3.3 Zarodki različnih živali donork, v primeru odvzema pri posamezni živali, ali različnih serij zbiranja se ne sperejo skupaj.
3.4 Zarodki različnih živali donork, v primeru odvzema pri posamezni živali, ali različnih serij zbiranja se ne shranijo v isti slamici, ampuli ali drugi embalaži.
4. Priprava mikromanipuliranih zarodkov
Pred kakšno koli mikromanipulacijo, ki lahko poškoduje ovojnico, se vsi zarodki ali jajčne celice zberejo in pripravijo v skladu s sanitarnimi pogoji iz točk 1, 2 in 3. Poleg tega se uporabljajo še naslednji pogoji:
4.1 Mikromanipulacija, ki vključuje penetracijo ovojnice, se izvede v primernih laboratorijskih prostorih pod nadzorom veterinarja odobrene skupine.
4.2 Vsaka skupina za zbiranje zarodkov vodi evidenco o svojih dejavnosti v skladu s točko 1.14, vključno s podrobnostmi o tehnikah mikromanipulacije, ki vključujejo penetracijo ovojnice in so bile izvedene na zarodkih. Pri zarodkih, pridobljenih z oploditvijo in vitro, se lahko identifikacija zarodkov opravi na podlagi serije, vendar vključuje podrobnosti o datumu in kraju zbiranja jajčnikov in/ali jajčnih celic. Prav tako je mogoča identifikacija gospodarstva izvora živali donork.
5. Shranjevanje zarodkov
5.1 Vsaka skupina za zbiranje in pridobivanje zarodkov zagotovi, da so zarodki shranjeni pri primerni temperaturi v prostorih za shranjevanje iz točke 1.8 oddelka III poglavja I.
5.2 Zamrznjeni zarodki se pred odpošiljanjem shranijo v odobrenih razmerah najmanj 30 dni od dneva zbiranja ali pridobivanja.
6. Prevoz zarodkov
6.1 Zarodki, s katerimi se trguje, se prevažajo v namembno državo članico v posodah, ki so bile pred uporabo očiščene in razkužene ali sterilizirane ali so za enkratno uporabo ter so zapečatene in oštevilčene še pred odpošiljanjem iz odobrenih prostorov za shranjevanje.
6.2 Slamice, ampule ali druga embalaža se označijo tako, da se številka na slamicah, ampulah ali drugi embalaži ujema s številko na veterinarskem spričevalu iz tretje alinee člena 11(3) in s posodo, v kateri so shranjene in se prevažajo.
POGLAVJE IV
Zahteve za donorke
|
1. |
Donorke se lahko uporabljajo za zbiranje zarodkov ali jajčnih celic le, če same in gospodarstva, iz katerih izvirajo, po mnenju uradnega veterinarja izpolnjujejo zahteve ustreznih direktiv o trgovini znotraj Unije z živimi živalmi za rejo in proizvodnjo zadevne vrste. |
|
2. |
Poleg zahtev iz Direktive 64/432/EGS prašičje donorke izpolnjujejo pogoje glede Aujeszkyjeve bolezni iz členov 9 ali 10 navedene direktive, razen za zarodke, pridobljene in vivo in obdelane s tripsinom. |
|
3. |
Zahteve iz Direktive 91/68/EGS se uporabljajo za ovčje in kozje donorke. |
|
4. |
Poleg zahtev iz Direktive 90/426/EGS se: 4.1 donorke ne uporabijo za naravni pripust najmanj 30 dni pred dnem zbiranja jajčnih celic ali zarodkov ter med dnem prvega vzorca iz točk 4.2 in 4.3 in dnem zbiranja jajčnih celic in zarodkov; 4.2 na donorkah opravi agar gel imunodifuzijski test (Cogginsov test) ali test ELISA z negativnim rezultatom za infekciozno anemijo enoprstih kopitarjev na vzorcu krvi, odvzetem najmanj 14 dni po datumu začetka vsaj 30-dnevnega obdobja iz točke 4.1 in ne več kot 90 dni pred zbiranjem jajčnih celic ali zarodkov za trgovino; 4.3 na donorkah opravi test za določanje povzročitelja nalezljivega metritisa kobil z negativnim rezultatom v vsakem primeru v laboratoriju iz točke 1.5 poglavja (II)(I) na vsaj dveh vzorcih (brisih), odvzetih donorki v nobenem primeru ne prej kot 7 dni (sistemsko zdravljenje) ali 21 dni (lokalno zdravljenje) po morebitnem zdravljenju donorke s protimikrobnimi sredstvi, vsaj z naslednjih območij: — sluzničnih površin fosse clitoralis, — klitoralnih sinusov. Vzorci se odvzamejo med obdobjem iz točke 4.1, in sicer dvakrat v razmiku najmanj 7 dni v primeru testa iz točke (i) ali enkrat v primeru testa iz točke (ii). Pred pošiljanjem v laboratorij se vzorci vstavijo v transportno gojišče z aktivnim ogljem, kot je gojišče Amies. Na vzorcih mora biti opravljen vsaj eden od naslednjih testov: (i) kultura pod mikroaerofilnimi pogoji vsaj 7 dni za izolacijo bakterije Taylorella equigenitalis; izvedeno v 24 urah po odvzemu vzorcev donorki ali v 48 urah, če se vzorci med prevozom hranijo na hladnem, ali (ii) verižna reakcija s polimerazo (PCR) ali PCR v realnem času za odkrivanje genoma bakterije Taylorella equigenitalis, ki se opravi v 48 urah po odvzemu vzorcev donorki. |
PRILOGA E
Del 1 – Veterinarsko spričevalo za trgovino z živalmi z gospodarstev (kopitarji, ptice, cepljene proti aviarni influenci, lagomorfi, psi, mačke in beli dihurji) 92/65 EI




Del 2 – Zdravstveno spričevalo za trgovanje s čebelami in čmrlji
92/65 EII


Del 3 – Veterinarsko spričevalo za trgovino z živalmi, semenom, jajčnimi celicami in zarodki iz odobrenih organov, inštitutov ali središč 92/65 EIII
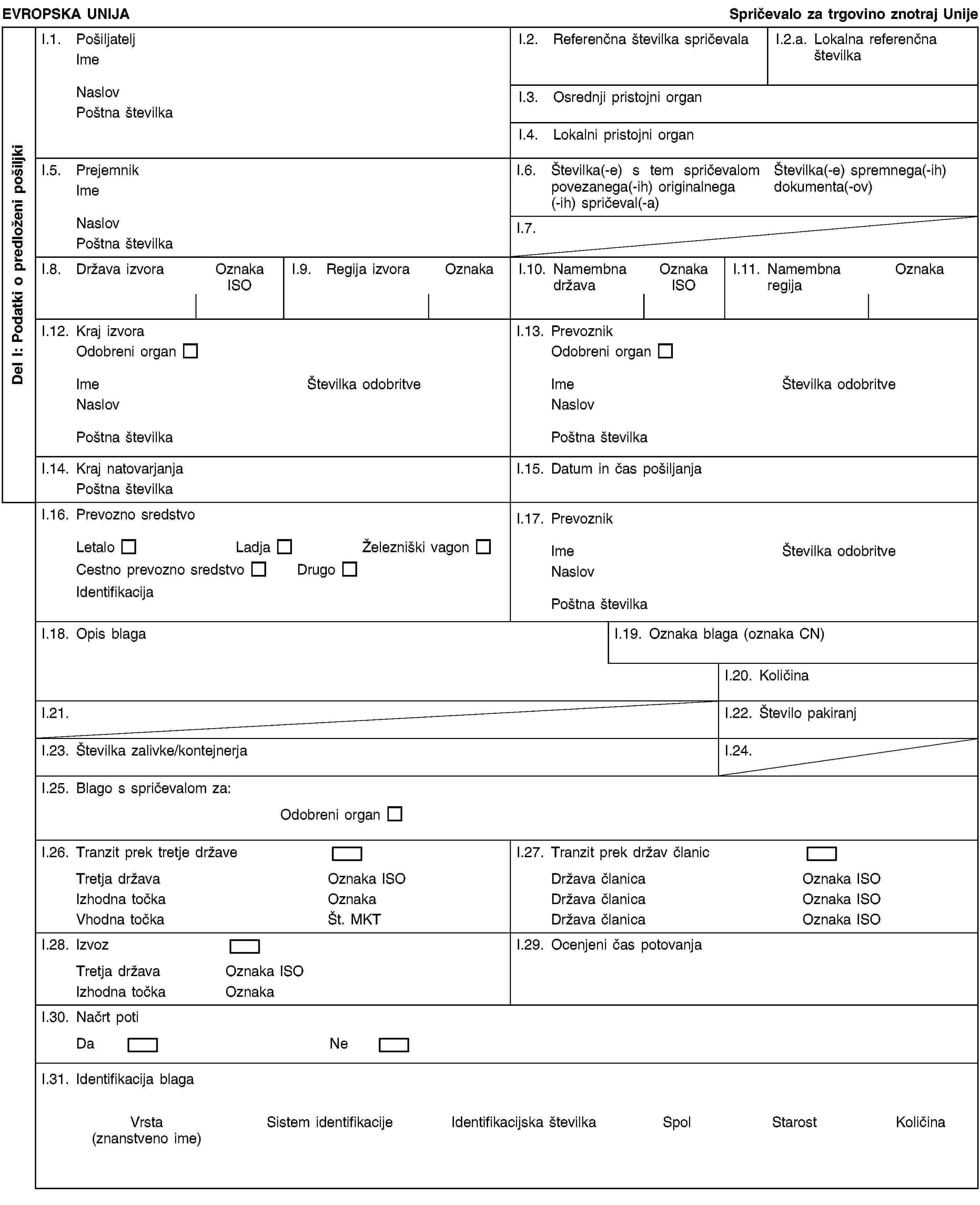

PRILOGA F
Uredba Sveta 64/432/EGS z dne 26. junija 1964 o problemih v zvezi z zdravstvenim varstvom živali, ki vplivajo na trgovino z govedom in prašiči znotraj Skupnosti
Direktiva Sveta 88/407/EGS z dne 14. junija 1988 o zahtevah za zdravstveno varstvo živali, ki veljajo za promet med državami članicami Evropske skupnosti in za uvoz globoko zamrznjenega semena domačih živali iz vrst govedi
Direktiva Sveta 89/556/EGS z dne 25. septembra 1989 o pogojih za zdravstveno varstvo živali, ki urejajo trgovanje znotraj Skupnosti in uvoz iz tretjih držav za zarodke domačih živali vrste goveda
Direktiva Sveta 90/426/EGS z dne 26. junija 1990 o pogojih v zvezi z zdravstvenim varstvom živali, ki ureja premike in uvoz kopitarjev iz tretjih držav
Direktiva Sveta 90/429/EGS z dne 26. junija 1990 o zahtevah za zdravstveno varstvo živali, ki veljajo za promet znotraj Skupnosti in za uvoz semena domačih prašičev
Direktiva Sveta 90/539/EGS z dne 15. oktobra 1990 o pogojih zdravstvenega stanja živali, ki veljajo znotraj Skupnosti za trgovanje s perutnino in valilnimi jajci ter za njihov uvoz iz tretjih držav
Direktiva Sveta 91/6/EGS z dne 28. januarja 1991 o pogojih v zvezi z zdravjem živali, ki urejajo dajanje živali in proizvodov iz ribogojstva na trg
Direktiva Sveta 91/68/EGS z dne 28. januarja 1991 o pogojih v zvezi z zdravstvenim varstvom živali, ki urejajo trgovanje znotraj Skupnosti z ovcami in kozami
Direktiva Sveta 2004/68/ES z dne 24. aprila 2004 o določitvi pravil o zdravstvenem stanju živali za uvoz v Skupnost nekaterih živih kopitarjev, o spremembi direktiv 90/426/ES in 92/65/EGS in o razveljavitvi Direktive 72/462/EGS.
( 1 ) UL C 327, 30.12.1989, str. 57 in UL C 84, 2.4.1990, str. 102.
( 2 ) UL C 38, 19.2.1990, str. 134 in UL C 149, 18.6.1990, str. 263.
( 3 ) UL C 62, 12.3.1990, str. 47 in UL C 182, 23.7.1990, str. 25.
( 4 ) UL L 384, 31.12.1982, str. 1. Uredba, kakor je bila nazadnje spremenjena z Uredbo (EGS) št. 197/90 (UL L 29, 31.1.1990, str. 1).
( 5 ) UL 121, 29.7.1964, str. 1977/64. Direktiva, kakor je bila nazadnje spremenjena z Direktivo 91/499/EGS (UL L 268, 24.9.1991, str. 107).
( 6 ) UL L 315, 26.11.1985, str. 11. Direktiva, kakor je bila spremenjena z Direktivo 90/423/EGS (UL L 224, 18.8.1990, str. 13).
( 7 ) UL L 224, 18.8.1990, str. 29. Direktiva, kakor je bila nazadnje spremenjena z Direktivo 91/496/EGS (UL L 268, 24.9.1991, str. 56).
( 8 ) UL L 373, 31.12.1990, str. 1. Direktiva, kakor je bila spremenjena z Direktivo 91/496/EGS (UL L 268, 24.9.1991, str. 56).
( 9 ) Direktiva Sveta 60/426/EGS z dne 26. junija 1990 o pogojih zdravstvenega varstva živali za premike in uvoz kopitarjev iz tretjih držav (UL L 224, 18.8.1990, str. 42). Direktiva, kakor je bila spremenjena z Direktivo 91/496/EGS (UL L 268, 24.9.1991, str. 56).
( 10 ) Direktiva Sveta 90/539/EGS z dne 15. oktobra 1990 o pogojih zdravstvenega varstva živali, ki urejajo trgovino med državami članicami Evropske skupnosti in uvoz perutnine in valilnih jajc iz tretjih držav (UL L 303, 31.10.1990, str. 6). Direktiva, kakor je bila nazadnje spremenjena z Direktivo 91/496/EGS (UL L 268, 24.9.1991, str. 56).
( 11 ) Direktiva Sveta 91/67/EGS z dne 28. januarja 1991 o pogojih v zvezi z zdravjem živali, ki urejajo dajanje živali in proizvodov iz ribogojstva na trg (UL L 46, 19.2.1991, str. 1).
( 12 ) Direktiva Sveta 91/68/EGS z dne 28. januarja 1991 o pogojih v zvezi z zdravstvenim varstvom živali, ki urejajo trgovanje znotraj Skupnosti z ovcami in kozami (UL L 46, 19.2.1991, str. 1).
( 13 ) Direktiva Sveta 91/492/EGS z dne 15. julija 1991 o zdravstvenih pogojih za proizvodnjo in dajanje na trg živih školjk (UL L 268, 24.9.1991, str. 1).
( 14 ) Direktiva Sveta 91/493/EGS z dne 22. julija 1991 o zdravstvenih pogojih za proizvodnjo in dajanje na trg ribiških proizvodov (UL L 268, 24.9.1991, str. 15).
( 15 ) Direktiva Sveta 80/217/EGS z dne 22. januarja 1980 o ukrepih Skupnosti za nadzor nad klasično prašičjo kugo (UL L 47, 21.2.1980, str. 11). Direktiva, kakor je bila nazadnje spremenjena z Direktivo 87/486/EGS (UL L 280, 3.10.1987, str. 21).
( 16 ) UL L 268, 24.9.1991, str. 41.
( 17 ) UL L 303, 31.10.1990, str. 6.
( 18 ) UL L 178, 28.6.2013, str. 1.
( 19 ) UL L 3, 5.1.2005, str. 1.
( 20 ) Direktiva Sveta 71/118/EGS z dne 15. februarja 1971 o zdravstvenih problemih, ki vplivajo na trgovino s svežim perutninskim mesom (UL L 55, 8.3.1971, str. 23.) Direktiva, kakor je bila nazadnje spremenjena z Direktivo 90/654/EGS (UL L 353, 17.12.1990, str. 48).
( 21 ) Direktiva Sveta 91/496/EGS z dne 15. julija 1991 o določitvi načel o organizaciji veterinarskih pregledov živali, ki vstopajo v Skupnost iz tretjih držav, in o sprememebi direktiv 89/662/EGS, 90/425/EGS ter 90/675/EGS (UL L 268, 24.9.1991, str. 56).
( 22 ) Direktiva Sveta 91/628/EGS z dne 19. novembra 1991 o zaščiti živali med prevozom in o spremembi direktiv 90/425/EGS in 91/496/EGS (UL L 340, 11.12.1991, str. 17).
( 23 ) UL L 31, 1.2.2002, str. 1.
( 24 ) UL L 184, 17.7.1999, str. 23.
( 25 ) UL L 224, 18.8.1990, str. 62.
( 26 ) Uredba (ES) št. 882/2004 Evropskega parlamenta in Sveta z dne 29. aprila 2004 o izvajanju uradnega nadzora, da se zagotovi preverjanje skladnosti z zakonodajo o krmi in živilih ter s pravili o zdravstvenem varstvu živali in zaščiti živali (UL L 165, 30.4.2004, str. 1).
( 27 ) UL L 311, 28.11.2001, str. 1.
( 28 ) Priročnik Mednarodnega združenja za prenos zarodkov – Smernice za izvajanje postopkov in splošne informacije o uporabi tehnologije za prenos zarodkov s poudarkom na sanitarnih postopkih, ki ga izdaja Mednarodno združenje za prenos zarodkov, 1111 North Dunlap Avenue, Savoy, Illinois 61874 USA (http://www.iets.org/).
( 29 ) UL L 139, 30.4.2004, str. 206.


