EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32007R0829
Commission Regulation (EC) No 829/2007 of 28 June 2007 amending Annexes I, II, VII, VIII, X and XI to Regulation (EC) No 1774/2002 of the European Parliament and of the Council as regards the placing on the market of certain animal by-products (Text with EEA relevance)
Uredba Komisije (ES) št. 829/2007 z dne 28. junija 2007 o spremembi prilog I, II, VII, VIII, X in XI k Uredbi (ES) št. 1774/2002 Evropskega parlamenta in Sveta glede dajanja na trg določenih živalskih stranskih proizvodov (Besedilo velja za EGP)
Uredba Komisije (ES) št. 829/2007 z dne 28. junija 2007 o spremembi prilog I, II, VII, VIII, X in XI k Uredbi (ES) št. 1774/2002 Evropskega parlamenta in Sveta glede dajanja na trg določenih živalskih stranskih proizvodov (Besedilo velja za EGP)
OJ L 191, 21.7.2007, p. 1–99
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 No longer in force, Date of end of validity: 03/03/2011; implicitno zavrnjeno 32009R1069
No longer in force, Date of end of validity: 03/03/2011; implicitno zavrnjeno 32009R1069
- Date of document:
- 28/06/2007
- Date of effect:
- 24/07/2007; začetek veljavnosti datum objave + 3 glej člen 3
- Date of end of validity:
- 03/03/2011; implicitno zavrnjeno 32009R1069
- Author:
- Evropska komisija
- Form:
- Uredba
- Additional information:
- velja za EGP
- Treaty:
- Pogodba o ustanovitvi Evropske skupnosti
- Legal basis:
-
- 32002R1774 - A28 32002R1774 - A29P3L1 32002R1774 - A32P1
- Link
- Link
- Link
- Select all documents mentioning this document No data available in the table
- Modifies:
-
Relation Act Comment Subdivision concerned From To Modifies 32002R1774 sprememba priloga 1 24/07/2007 Modifies 32002R1774 sprememba priloga 8 24/07/2007 Modifies 32002R1774 sprememba priloga 7 24/07/2007 Modifies 32002R1774 sprememba priloga 10 24/07/2007 Modifies 32002R1774 sprememba priloga 11 24/07/2007 Modifies 32002R1774 sprememba priloga 2 24/07/2007
No data available in the table
- Modified by:
-
Relation Act Comment Subdivision concerned From To Modified by 32007R1256 zamenjava člen 2 29/10/2007 Implicitly repealed by 32009R1069 04/03/2011 - Instruments cited:
- Link
- EUROVOC descriptor:
- Subject matter:
- Directory code:
|
21.7.2007 |
SL |
Uradni list Evropske unije |
L 191/1 |
UREDBA KOMISIJE (ES) št. 829/2007
z dne 28. junija 2007
o spremembi prilog I, II, VII, VIII, X in XI k Uredbi (ES) št. 1774/2002 Evropskega parlamenta in Sveta glede dajanja na trg določenih živalskih stranskih proizvodov
(Besedilo velja za EGP)
KOMISIJA EVROPSKIH SKUPNOSTI JE –
ob upoštevanju Pogodbe o ustanovitvi Evropske skupnosti,
ob upoštevanju Uredbe (ES) št. 1774/2002 Evropskega parlamenta in Sveta z dne 3. oktobra 2002 o določitvi zdravstvenih pravil za živalske stranske proizvode, ki niso namenjeni prehrani ljudi (1), in zlasti drugega odstavka člena 28, prvega pododstavka člena 29(3) in člena 32(1) Uredbe,
ob upoštevanju naslednjega:
|
(1) |
Uredba (ES) št. 1774/2002 določa zahteve za zdravstveno varstvo živali in javno zdravje pri uvozu določenih živalskih stranskih proizvodov in proizvodov, pridobljenih iz njih, v Skupnost in pri njihovem tranzitu skozi Skupnost. Navedena uredba določa splošne higienske zahteve za predelavo snovi kategorij 1, 2 in 3 ter prav tako določa zahteve za dajanje na trg navedenih živalskih stranskih proizvodov in proizvodov, pridobljenih iz njih, vključno z vzorčnimi zdravstvenimi spričevali za njihov uvoz v Skupnost. |
|
(2) |
Zaradi nevarnosti vnosa malega panjskega hrošča v Skupnost, kjer ta parazit trenutno ni prisoten, je treba določiti zahteve za uvoz čebeljega voska, namenjenega za tehnične namene, in prav tako spremeniti opredelitev proizvodov čebelarstva v Prilogi I k Uredbi (ES) št. 1774/2002. Zato je treba ustrezno spremeniti ustrezno opredelitev v Prilogi I k navedeni uredbi, uvozne zahteve, določene v poglavju IX Priloge VIII, in vzorčno zdravstveno spričevalo, navedeno v poglavju 13 Priloge X k navedeni uredbi. |
|
(3) |
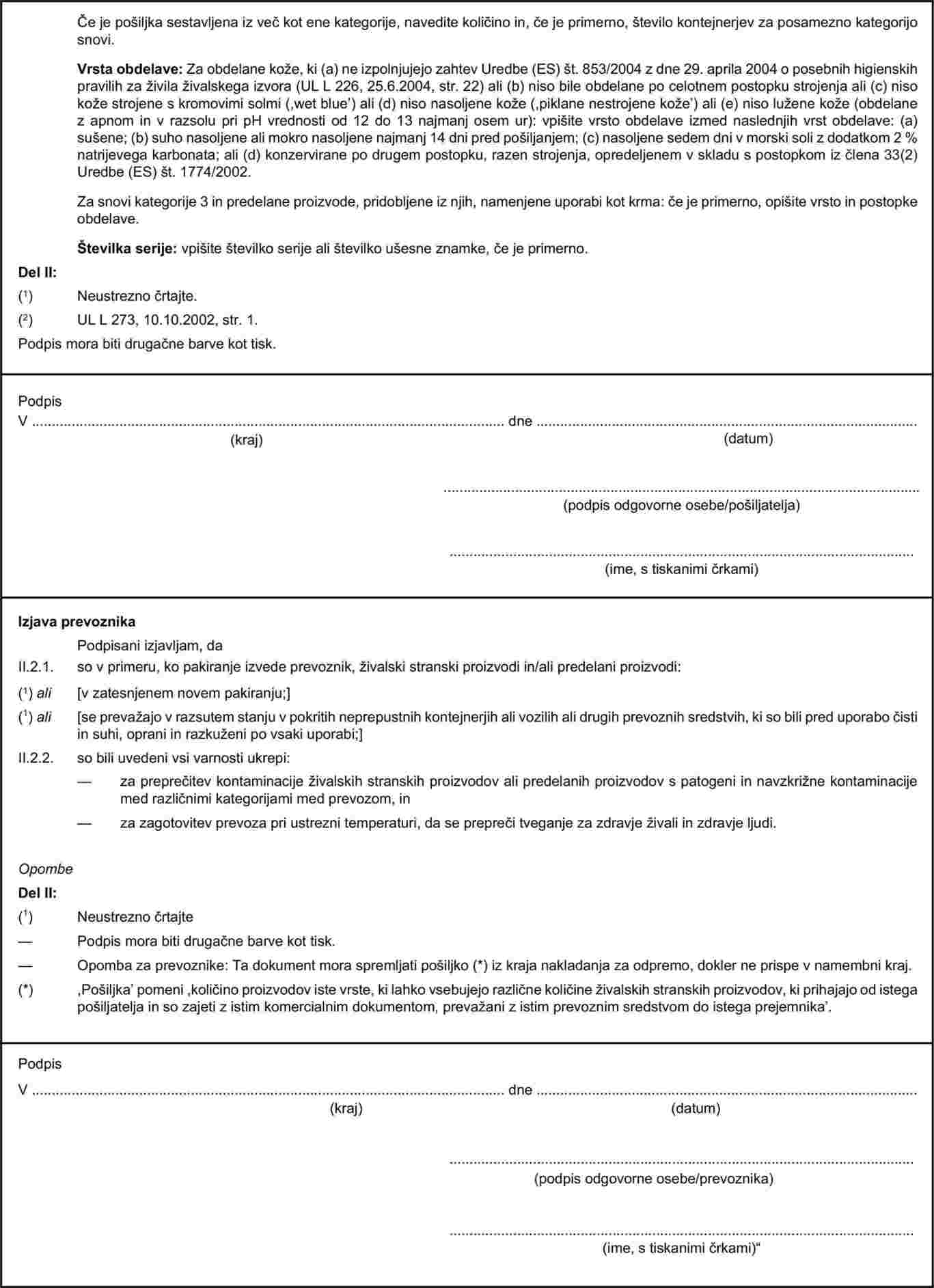
Poglavje X Priloge II k Uredbi (ES) št. 1774/2002 določa vzorčni komercialni dokument, ki med prevozom spremlja živalske stranske proizvode in predelane proizvode. Zaradi izboljšanja sledljivosti živalskih kož med prevozom je treba navedeni vzorčni dokument spremeniti. Zato je treba Prilogo II k navedeni uredbi ustrezno spremeniti. |
|
(4) |
Uredba (ES) št. 999/2001 Evropskega parlamenta in Sveta z dne 22. maja 2001 o določitvi predpisov za preprečevanje, nadzor in izkoreninjenje nekaterih transmisivnih spongiformnih encefalopatij (2) se uporablja za proizvodnjo in dajanje na trg živih živali in proizvodov živalskega izvora. Prepoveduje krmljenje rejnih živali, ki se gojijo, pitajo ali vzrejajo za proizvodnjo hrane, s predelanimi živalskimi beljakovinami. |
|
(5) |
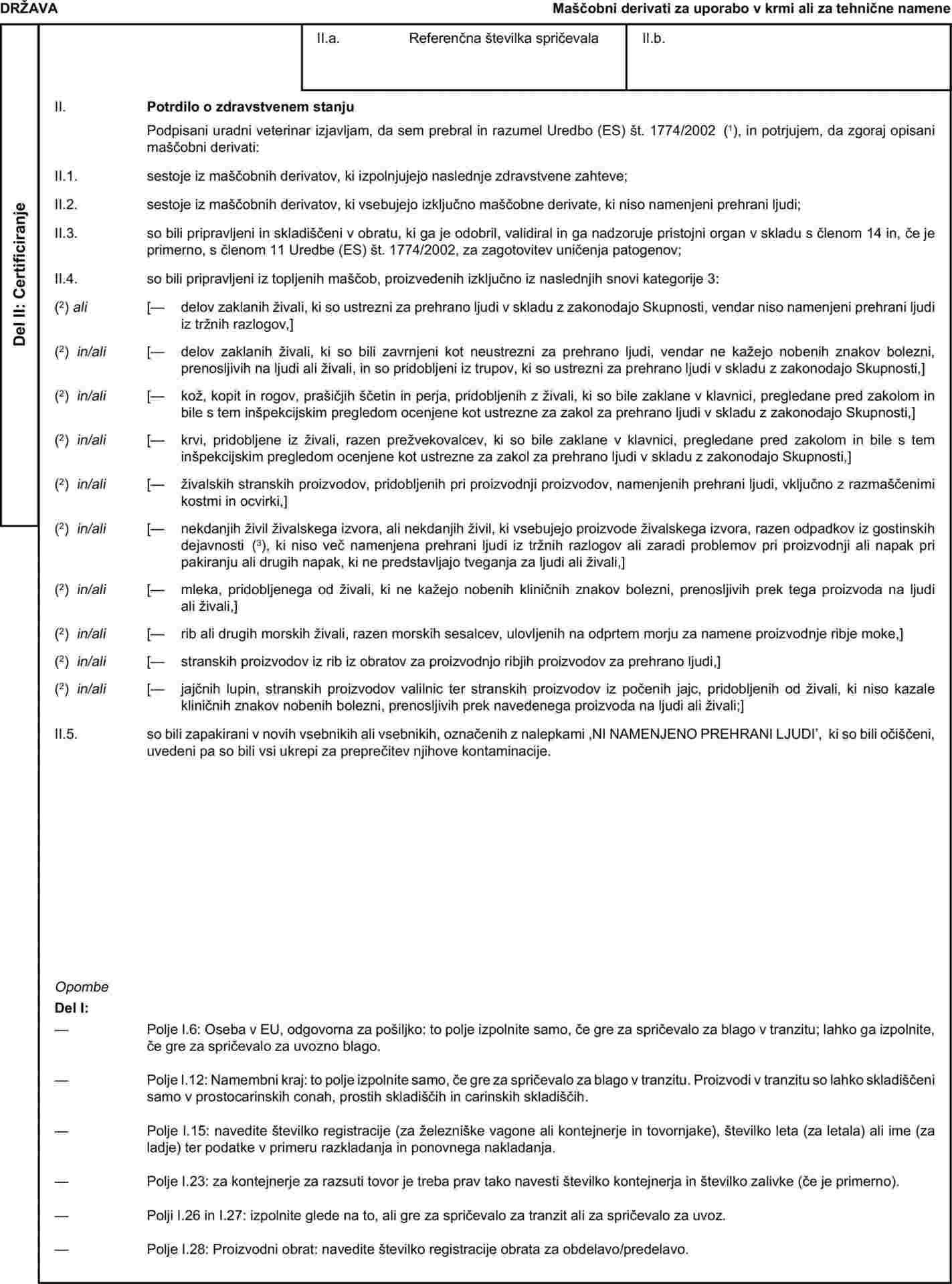
Ker navedena prepoved v Uredbi (ES) št. 999/2001 ostaja veljavna, se morajo za predelane živalske beljakovine, pridobljene iz krvi prašičev, uporabljati manj stroge zahteve predelave, kakor so določene v poglavju II Priloge VII k Uredbi (ES) št. 1774/2002, od sedanje metode predelave 1, saj ni znanstvenih dokazov o nevarnosti prenosa TSE s prašičev. Vendar je treba zaradi zdravstvenega varstva ljudi in živali uvesti zahtevo o minimalni temperaturi za predelavo prašičje krvi. Poglavje II Priloge VII k Uredbi (ES) št. 1774/2002 je zato treba ustrezno spremeniti. |
|
(6) |
Poglavje II A(1) Priloge VIII k Uredbi (ES) št. 1774/2002 dovoljuje uporabo delov zaklanih živali, ki so ustrezni za prehrano ljudi, vendar niso namenjeni prehrani ljudi iz tržnih razlogov, pri proizvodnji surove hrane za hišne živali v Skupnosti. Zdi se, da se lahko deli takih živali, ki so zavrnjeni kot neustrezni za prehrano ljudi, vendar ne kažejo nobenih znakov bolezni, prenosljivih na ljudi ali živali, prav tako varno uporabijo v hrani za hišne živali. Poglavje II A(1) in poglavje XI Priloge VIII k navedeni uredbi, ki predpisuje ustrezne določbe za uvoz v Skupnost, je zato treba ustrezno spremeniti. |
|
(7) |
Obstoječa vzorčna zdravstvena spričevala za uvoz živalskih kož v Skupnost je treba spremeniti zaradi uvedbe nekaterih tehničnih sprememb. Zaradi jasnosti je torej treba posebne zahteve za proizvode, ki so navedeni v poglavju VI Priloge VIII, in vzorčna zdravstvena spričevala, navedena v poglavjih 5(A), 5(B) in 5(C) Priloge X k Uredbi (ES) št. 1774/2002, ustrezno spremeniti. |
|
(8) |
Evropska agencija za varnost hrane (EFSA) je v svojem Znanstvenem mnenju o vidikih zdravstvenega varstva in zaščite živali ob pojavu aviarne influence, sprejetem 13. in 14. septembra 2005, sklenila, da je treba perje pred dajanjem na trg obdelati, da se zmanjša tveganje za širjenje aviarne influence. Poglavje VIII Priloge VIII k Uredbi (ES) št. 1774/2002 določa stalne ukrepe Skupnosti za dajanje na trg in uvoz perja. Glede na to mnenje in sedanje globalne epidemiološke razmere v zvezi z aviarno influenco je primerno spremeniti ustrezne ukrepe Skupnosti za uvoz in obdelavo perja pred uvozom. Prilogo VIII k navedeni uredbi je zato treba ustrezno spremeniti. |
|
(9) |
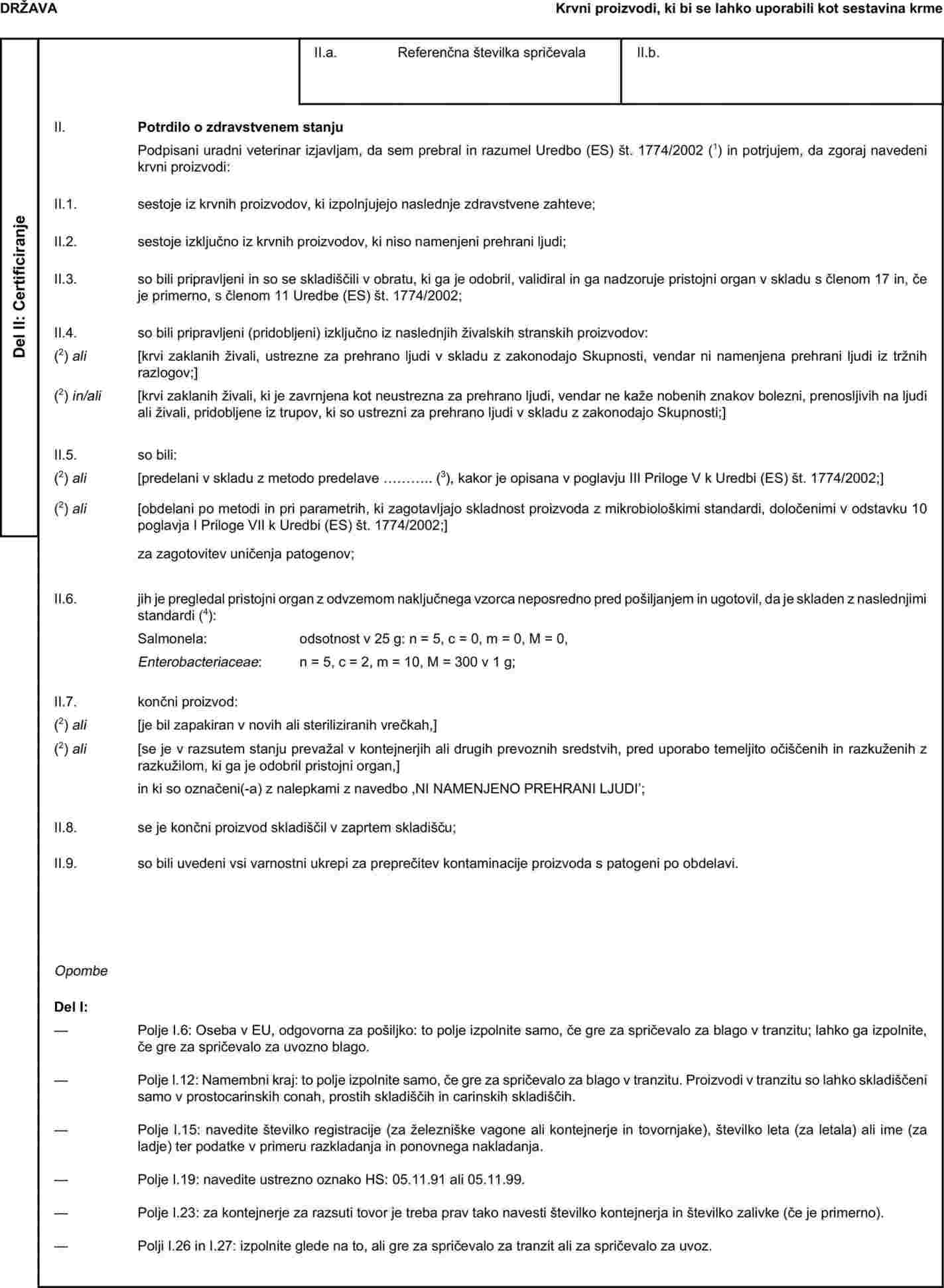
Ustrezno zdravstveno spričevalo, navedeno v poglavju I Priloge X k Uredbi (ES) št. 1774/2002 za uvoz predelanih živalskih beljakovin, ki niso namenjene prehrani ljudi, in proizvodov, ki vsebujejo take beljakovine, razen hrane za hišne živali, je treba ustrezno spremeniti, da se zagotovijo enake možnosti predelave za tretje države kot za Skupnost. Poglavje 1 Priloge X k Uredbi (ES) št. 1774/2002 je zato treba ustrezno spremeniti. |
|
(10) |
Poglavje 3(B) Priloge X k Uredbi (ES) št. 1774/2002 določa vzorčno zdravstveno spričevalo za uvoz predelane hrane za hišne živali, razen konzervirane hrane za hišne živali, v Skupnost. Zdi se, da se predelana hrana za hišne živali v tretjih državah vse pogosteje proizvaja z mešanjem že predelanih sestavin, ki so bile posamično obdelane v skladu z zahtevami navedene uredbe. Toplotna obdelava takih sestavin bi lahko škodljivo vplivala na njihove hranilne lastnosti. Zato je treba dovoliti uvoz predelane hrane za hišne živali, ki je sestavljena iz takih varnih sestavin, v Skupnost in ustrezno spremeniti vzorčno zdravstveno spričevalo, navedeno v poglavju 3(B) Priloge X k Uredbi (ES) št. 1774/2002. |
|
(11) |
Uredba (ES) št. 1774/2002 določa, da se nekateri živalski stranski proizvodi za proizvodnjo hrane za hišne živali lahko uvozijo v Skupnost, čeprav vsebujejo snovi, pridobljene iz živali, ki so bile tretirane z določenimi prepovedanimi substancami. Vendar zaenkrat še ni dovoljen uvoz predelane hrane za hišne živali, pasjih žvečilk in aromatične drobovine, ki vsebujejo take snovi. Ker se zdi, da pri uvozu takih snovi za proizvodnjo hrane za hišne živali znotraj Skupnosti tveganje za zdravje ni večje kot v primeru, kadar so take snovi sestavina uvožene predelane hrane za hišne živali, pasjih žvečilk in aromatične drobovine, je treba prav tako dovoliti uvoz teh predelanih proizvodov, ki vsebujejo take snovi. Zato je treba vzorčna zdravstvena spričevala, navedena v poglavjih 3(A), 3(B), 3(C) in 3(E) Priloge X k Uredbi (ES) št. 1774/2002, ustrezno spremeniti. |
|
(12) |
Poglavje 3(B) Priloge X k Uredbi (ES) št. 1774/2002 določa, da mora zdravstveno spričevalo za predelano hrano za hišne živali, razen za konzervirano hrano za hišne živali, vsebovati potrdilo, v katerem je navedeno, da je bila hrana za hišne živali pakirana v novo embalažo, označeno z nalepkami z navedbo „ni namenjeno prehrani ljudi“. Direktiva Sveta 79/373/EGS z dne 2. aprila 1979 o trženju krmnih mešanic (3) že predpisuje enakovredne zahteve za označevanje, ki preprečujejo nenamerno ali malomarno napačno uporabo takih proizvodov za prehrano ljudi. Zahteve glede vzorčnega zdravstvenega spričevala v poglavju 3(B) Priloge X k Uredbi (ES) št. 1774/2002 morajo upoštevati navedeno zakonodajo in jih je zato treba ustrezno spremeniti. |
|
(13) |
Priloga VIII k Uredbi (ES) št. 1774/2002 določa zahteve za dajanje na trg in uvoz hrane za hišne živali, pasjih žvečilk in tehničnih proizvodov v Skupnost. Poglavje II B(4) navedene priloge določa, da je treba pasje žvečilke med predelavo obdelati po postopku toplotne obdelave, ki zagotavlja uničenje patogenih organizmov. Več držav članic je zaprosilo za odobritev drugih postopkov obdelave med predelavo pasjih žvečilk, ki zagotavljajo enakovredna varnostna jamstva. Zato je treba poglavje II B(4) Priloge VIII k Uredbi (ES) št. 1774/2002 ustrezno spremeniti. |
|
(14) |
Poglavje 3(C) Priloge X k Uredbi (ES) št. 1774/2002 določa vzorčno zdravstveno spričevalo za uvoz pasjih žvečilk v Skupnost. Ker se za predelavo pasjih žvečilk v Skupnosti dovolijo poleg toplotne obdelave tudi drugi postopki obdelave, je treba te druge postopke obdelave prav tako dovoliti za uvožene pasje žvečilke. Nekatere pasje žvečilke se proizvajajo po tradicionalnih metodah iz rib. Skrb za zdravstveno varstvo živali v takem primeru ne zahteva toplotne obdelave. Zato je treba vzorčno zdravstveno spričevalo v poglavju 3(C) Priloge X k navedeni uredbi ustrezno spremeniti. |
|
(15) |
Poglavje II B(6) Priloge VIII k Uredbi (ES) št. 1774/2002 določa mikrobiološke standarde, ki se uporabljajo za surovo hrano za hišne živali, proizvedeno v Skupnosti. Navedene standarde je treba predpisati tudi za uvoz surove hrane za hišne živali za neposredno prodajo v Skupnosti in za živalske stranske proizvode za krmo farmsko gojenih kožuharjev, namenjene pošiljanju v Skupnost. Poglavje 3(D) Priloge X k navedeni uredbi je zato treba ustrezno spremeniti. |
|
(16) |
Priloga XI k Uredbi (ES) št. 1774/2002 navaja sezname tretjih držav, iz katerih lahko države članice dovolijo uvoz živalskih stranskih proizvodov, ki niso namenjeni prehrani ljudi. Del XIII navedene priloge določa seznam tretjih držav, iz katerih lahko države članice dovolijo uvoz seruma kopitarjev. V skladu z navedenim delom XIII vključuje ta seznam tretje države iz Priloge I k Odločbi Komisije 2004/211/ES z dne 6. januarja 2004 o uvedbi seznama tretjih držav in delov njihovega ozemlja, s katerih države članice dovolijo uvoz živih kopitarjev in semena, jajčnih celic in zarodkov vrste kopitarji, ter o spremembi odločb 93/195/EGS in 94/63/ES (4), iz katerih je dovoljen uvoz kopitarjev za zakol. |
|
(17) |
Serum kopitarjev pa se lahko pridobi od živih živali. Zato bi moralo zdravstveno stanje živali, ki omogoča vključitev tretje države v navedeni seznam tretjih držav, iz katerih je dovoljen uvoz kopitarjev za vzrejo in prirejo, zadoščati za odločitev o tem, ali se serum kopitarjev lahko uvozi iz te tretje države. To bi zlasti omogočilo uvoz seruma kopitarjev iz Mehike. Del XIII Priloge XI k Uredbi (ES) št. 1774/2002 je zato treba ustrezno spremeniti. |
|
(18) |
Veterinarska spričevala se predpišejo v obliki, določeni v Odločbi Komisije 2007/240/ES (5) o sprejetju usklajenih vzorcev za veterinarska spričevala za uvoz živih živali in proizvodov živalskega izvora v Evropsko skupnost. Komercialni dokument iz poglavja X Priloge II k Uredbi (ES) št. 1774/2002 in vzorčna zdravstvena spričevala iz Priloge X k navedeni uredbi je treba ustrezno spremeniti. |
|
(19) |
Po začetku veljavnosti te uredbe je treba zagotoviti prehodno obdobje, da se omogoči neprekinjen uvoz živalskih stranskih proizvodov in proizvodov pridobljenih iz njih, ki so zajeti z Uredbo (ES) št. 1774/2002 in jih spremljajo zdravstvena spričevala v skladu z navedeno uredbo, v Skupnost. |
|
(20) |
Ukrepi, predvideni s to uredbo, so v skladu z mnenjem Stalnega odbora za prehranjevalno verigo in zdravje živali - |
SPREJELA NASLEDNJO UREDBO:
Člen 1
Priloge I, II, VII, VIII, X in XI k Uredbi (ES) št. 1774/2002 se spremenijo v skladu s Prilogo k tej uredbi.
Člen 2
V prehodnem obdobju šestih mesecev od datuma začetka veljavnosti te uredbe lahko komercialni dokument iz Priloge II k Uredbi (ES) št. 1774/2002 in vzorčna zdravstvena spričevala iz Priloge X k navedeni uredbi, izpolnjena v skladu z določbami, ki so veljale pred datumom začetka veljavnosti te uredbe, še naprej spremljajo proizvode, zajete s takimi dokumenti ali spričevali.
Člen 3
Ta uredba začne veljati in se uporabljati tretji dan po objavi v Uradnem listu Evropske unije.
Ta uredba je v celoti zavezujoča in se neposredno uporablja v vseh državah članicah.
V Bruslju, 28. junija 2007
Za Komisijo
Markos KYPRIANOU
Član Komisije
(1) UL L 273, 10.10.2002, str. 1. Uredba, kakor je bila nazadnje spremenjena z Uredbo Komisije (ES) št. 2007/2006 (UL L 379, 28.12.2006, str. 98).
(2) UL L 147, 31.5.2001, str. 1. Uredba, kakor je bila nazadnje spremenjena z Uredbo Komisije (ES) št. 1923/2006 (UL L 404, 30.12.2006, str. 1).
(3) UL L 86, 6.4.1979, str. 30. Direktiva, kakor je bila nazadnje spremenjena z Uredbo (ES) št. 807/2003 (UL L 122, 16.5.2003, str. 36).
(4) UL L 73, 11.3.2004, str. 1. Odločba, kakor je bila spremenjena z Uredbo (ES) št. 1792/2006 (UL L 362, 20.12.2006, str. 1).
(5) UL L 104, 21.4.2007, str. 37.
PRILOGA
Priloge k Uredbi (ES) št. 1774/2002 se spremenijo:
|
1. |
Priloga I se spremeni:
|
|
2. |
V Prilogi II se poglavje X nadomesti z naslednjim: „POGLAVJE X Komercialni dokument
VZORČNI KOMERCIALNI DOKUMENT ZA PREVOZ ŽIVALSKIH STRANSKIH PROIZVODOV IN PREDELANIH PROIZVODOV V EVROPSKI SKUPNOSTI Opombe
|
|
3. |
V Prilogi VII, poglavje II, odstavek A(1), se prvi pododstavek nadomesti z naslednjim: „Predelane živalske beljakovine, pridobljene iz živali vrst sesalcev, je treba najprej predelati po postopku predelave 1. Vendar se lahko kri prašičev obdela po katerem koli od postopkov predelave od 1 do 5 ali po postopku predelave 7 pod pogojem, da se pri postopku predelave 7 uporabi toplotna obdelava pri temperaturi najmanj 80 °C po vsej snovi.“ |
|
4. |
Priloga VIII se spremeni:
|
|
5. |
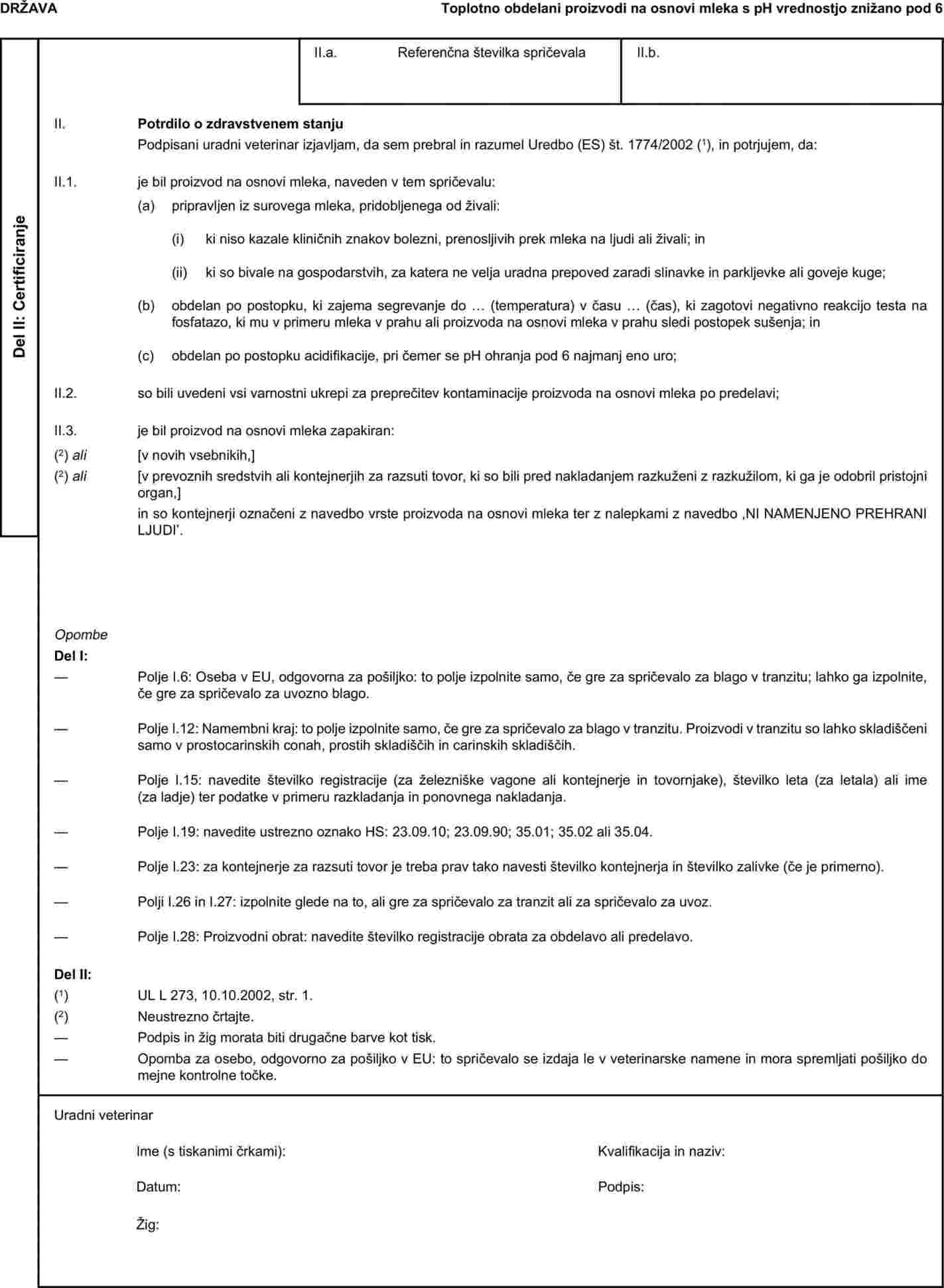
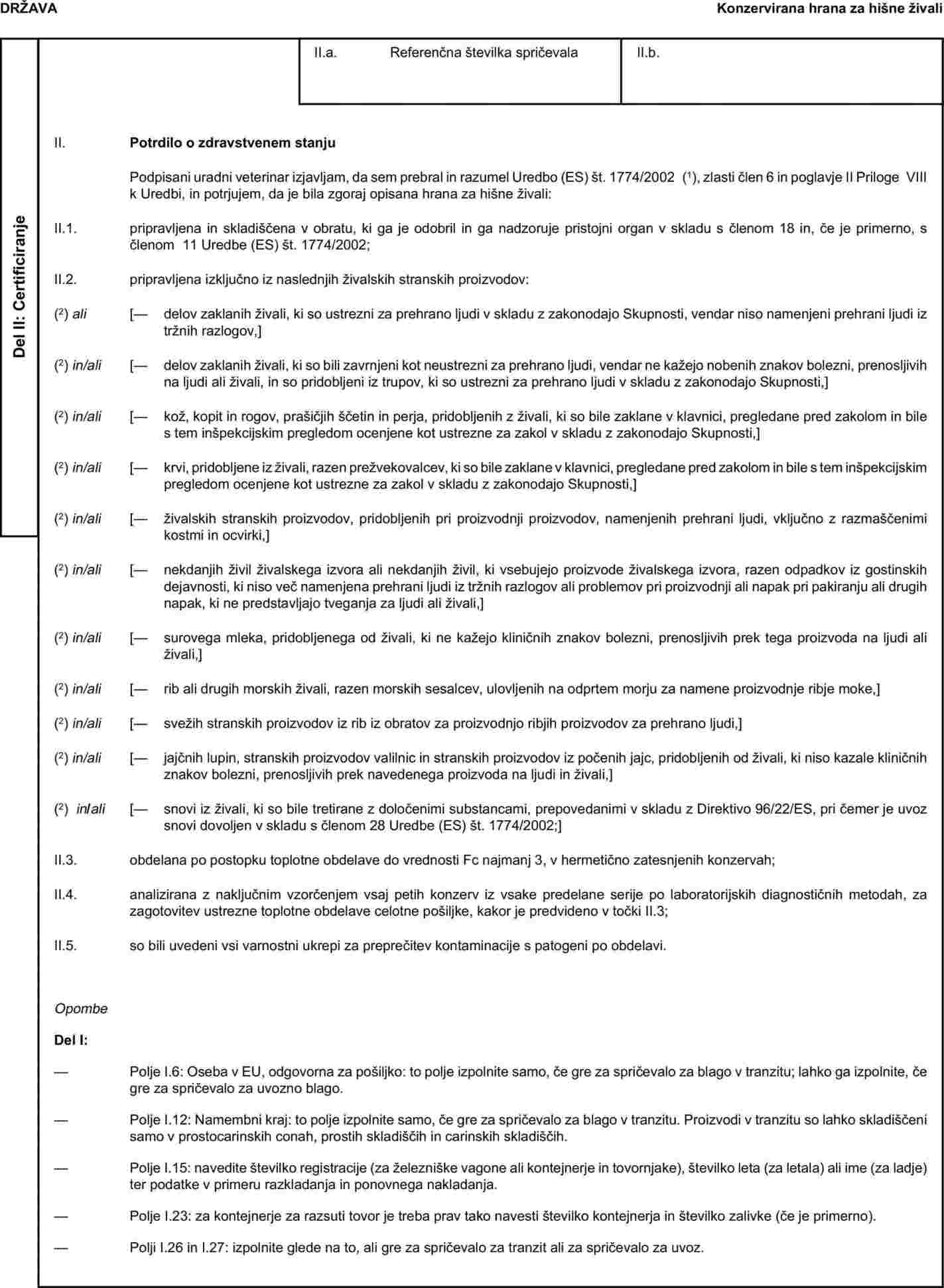
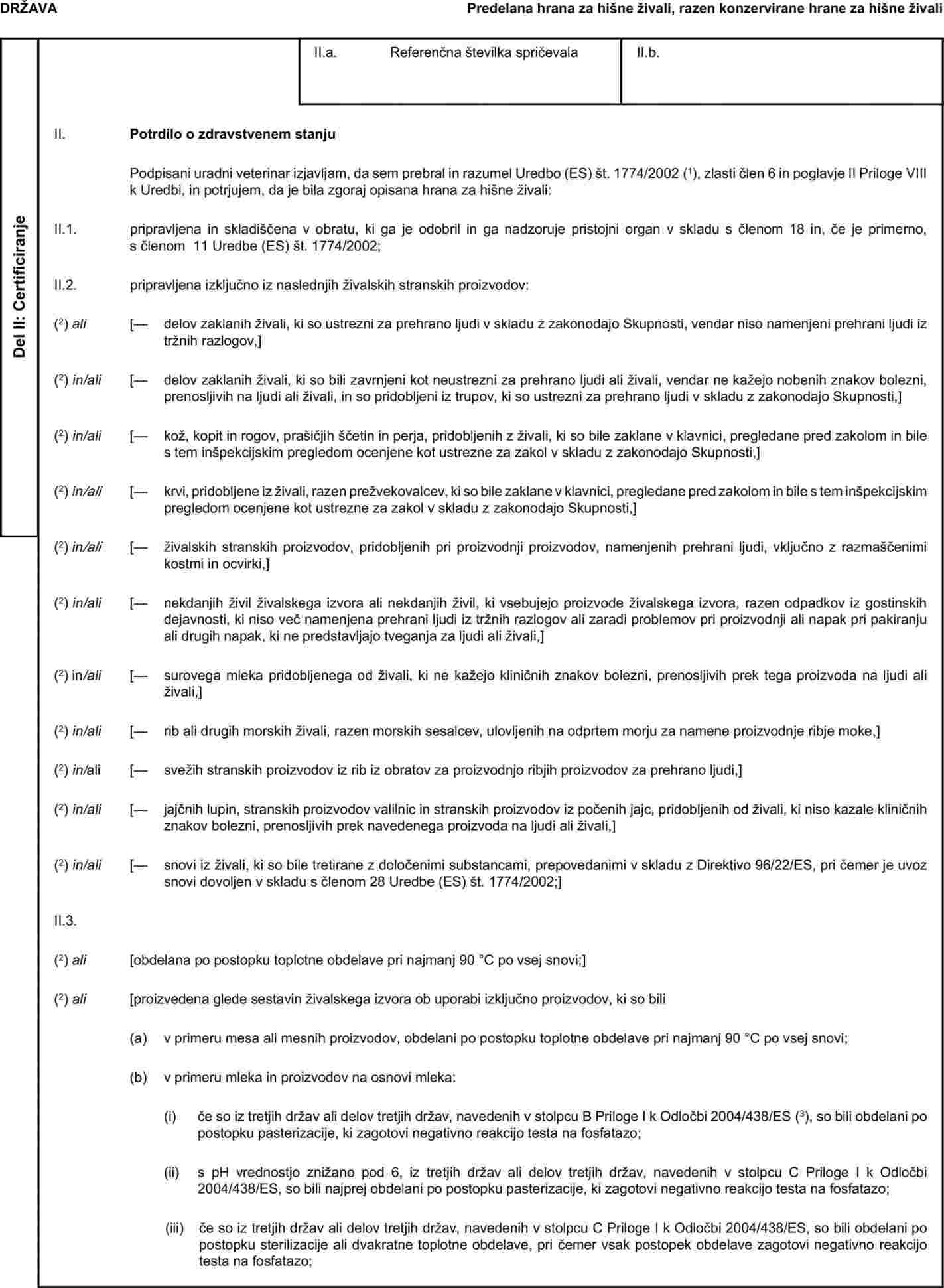
Priloga X se nadomesti: „PRILOGA X VZORČNA ZDRAVSTVENA SPRIČEVALA ZA DOLOČENE ŽIVALSKE STRANSKE PROIZVODE TER IZ NJIH PRIDOBLJENE PROIZVODE ZA UVOZ IZ TRETJIH DRŽAV IN ZA TRANZIT SKOZI EVROPSKO SKUPNOST Opombe
|
|
6. |
Priloga XI se spremeni:
|