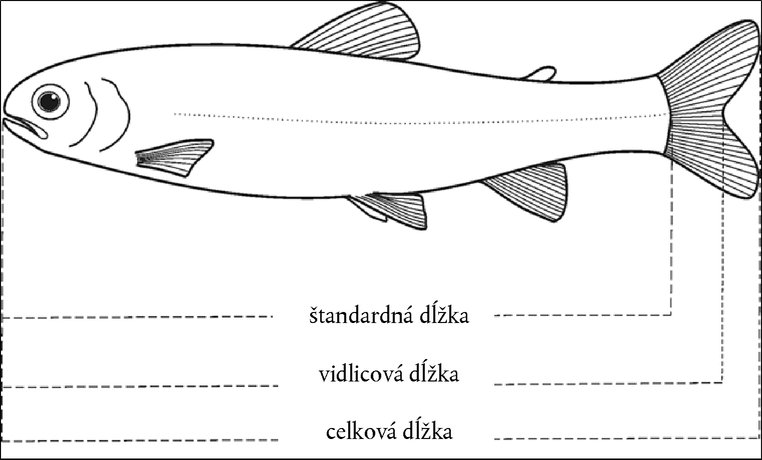
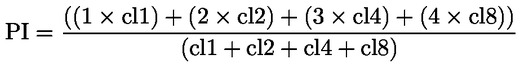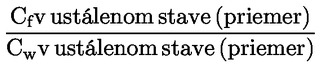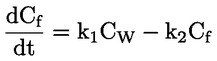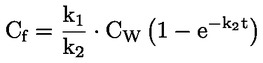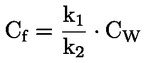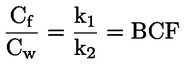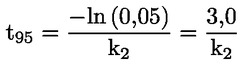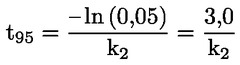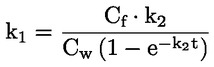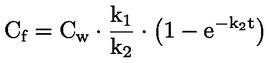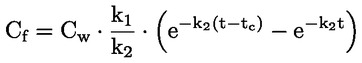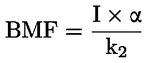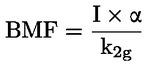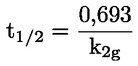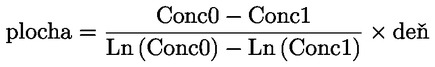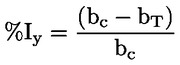PRÍLOHA
Príloha k nariadeniu (ES) č. 440/2008 sa mení takto:
|
1. |
Do časti A sa dopĺňa táto kapitola: „A.25 DISOCIAČNÉ KONŠTANTY VO VODE (TITRAČNÁ METÓDA – SPEKTROFOTOMETRICKÁ METÓDA – KONDUKTOMETRICKÁ METÓDA) ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov 112 (1981). Základné požiadavky
Usmerňujúce informácie
Všeobecné informácie o metóde
Štandardné dokumenty Táto testovacia metóda je založená na metódach uvedených v odkazoch v oddiele „Literatúra“ a v publikácii Preliminary Draft Guidance for Premanufacture Notification EPA, August 18, 1978. METÓDA – ÚVOD, ÚČEL, ROZSAH, RELEVANTNOSŤ, POUŽITIE A OBMEDZENIA TESTU Disociácia látky vo vode je dôležitá pri posudzovaní jej vplyvu na životné prostredie. Riadi formu látky, ktorá zas určuje jej správanie a prenos. Môže ovplyvniť adsorpciu chemikálií na pôdach a sedimentoch a absorpciu do biologických buniek. Definície a jednotky Disociácia je reverzibilné štiepenie na dve alebo viaceré chemické podoby, ktoré môžu byť iónmi. Tento proces sa vo všeobecnosti vyjadruje ako RX ⇌ R ++ X – a konštanta definovaná rovnovážnymi koncentráciami (rovnovážna konštanta), ktorou sa reakcia riadi je
Napríklad v konkrétnom prípade, kde R je vodík (látka je kyselina), konštanta je
alebo
Referenčné látky Tieto referenčné látky sa nemusia použiť vo všetkých prípadoch, keď sa skúma nová látka. Uvádzajú sa predovšetkým preto, aby sa z času na čas mohla vykonať kalibrácia metódy a aby sa umožnilo porovnanie výsledkov, ak sa použije iná metóda.
Bolo by užitočné mať látku s niekoľkými pK, ako sa uvádza v princípe metódy uvedenom ďalej. Takýmito látkami by mohli byť:
Princíp testovacej metódy Chemický proces opísaný vo všeobecnosti len mierne závisí od teploty v teplotnom rozsahu relevantnom pre dané prostredie. Určenie disociačnej konštanty si vyžaduje meranie koncentrácií disociovaných a nedisociovaných foriem chemickej látky. So znalosťou stechiometrie disociačnej reakcie uvedenej v časti Definície a jednotky možno určiť príslušnú konštantu. V tomto konkrétnom prípade opísanom v tejto testovacej metóde sa látky správajú ako kyseliny alebo zásady a ich stanovenie možno najľahšie uskutočniť stanovením relatívnej koncentrácie ionizovanej a neionizovanej formy látky a pH roztoku. Vzťah medzi uvedenými pojmami je daný rovnicou pre pKa v časti Definície a jednotky. Niektoré látky vykazujú viac ako jednu disociačnú konštantu. V takom prípade možno rozvinúť podobné rovnice. Niektoré z metód uvedených v tomto dokumente sú vhodné aj pri iných ako acidobázických disociáciách. Kritériá kvality Opakovateľnosť Disociačná konštanta by sa mala dať zopakovať (pri minimálne troch stanoveniach) s presnosťou na ± 0,1 log jednotiek. OPIS TESTOVACEJ METÓDY K stanoveniu pKa existujú dva základné prístupy. V rámci jedného sa známe množstvo látky titruje podľa potreby kyselinou alebo zásadou, druhý zahŕňa určenie relatívnej koncentrácie ionizovanej a neionizovanej formy látky a jej závislosti od pH. Príprava Metódy založené na uvedených zásadách možno rozdeliť na titráciu, spektrofotometriu a konduktometriu. Testovacie roztoky Pri titračnej a konduktometrickej metóde by sa chemická látka mala rozpustiť v destilovanej vode. Pri spektrofotometrickej alebo inej metóde sa použijú tlmivé roztoky. Koncentrácia testovanej látky by nemala presiahnuť 0,01 M alebo polovicu koncentrácie látky v nasýtenom roztoku, podľa toho, ktorá z uvedených koncentrácií je nižšia, pričom by sa na prípravu roztokov mala použiť najčistejšia dostupná forma látky. Ak je látka len čiastočne rozpustná, možno ju pred prípravou roztokov s uvedenými koncentráciami rozpustiť v malom množstve vodou miešateľného rozpúšťadla. Roztoky by sa mali skontrolovať na prítomnosť emulzií s využitím Tyndallovho javu, najmä ak bol na zvýšenie rozpustnosti použitý kosolvent. Ak sa použijú tlmivé roztoky, ich koncentrácia by nemala presiahnuť 0,05 M. Podmienky testu Teplota Teplota by sa mala udržiavať s presnosťou najmenej ± 1 °C. Stanovenie by sa podľa možnosti malo uskutočniť pri 20 °C. Ak existuje podozrenie, že látka je významne závislá od teploty, stanovenie by sa malo vykonať aspoň pri dvoch ďalších teplotách. V takom prípade by intervaly medzi teplotami mali byť 10 °C a teplota by sa mala udržiavať v rozmedzí ± 0,1 °C. Analýzy Konkrétna analytická metóda sa určí na základe charakteristických vlastností testovanej látky. Musí byť dostatočne citlivá, aby ňou bolo možné stanoviť rôzne druhy chemikálií pri každej koncentrácii testovaného roztoku. Vykonanie testu Titračná metóda Testovaný roztok sa stanovuje titráciou štandardným roztokom kyseliny alebo zásady (podľa vhodnosti), pričom po každom pridaní titračného činidla sa odmeria pH. Pred dosiahnutím bodu ekvivalencie by sa malo pridať aspoň 10 čiastkových množstiev. Ak sa rovnováha dosiahne dostatočne rýchlo, možno použiť potenciometer so zapisovaním. Pri tejto metóde musí byť presne známe celkové množstvo látky a jej koncentrácia. Musia sa prijať preventívne opatrenia na vylúčenie oxidu uhličitého. Podrobnosti postupu, preventívnych opatrení a výpočtu sú uvedené v štandardných testoch, napr. odkazy (1), (2), (3), (4). Spektrofotometrická metóda Zistí sa vlnová dĺžka, pri ktorej má ionizovaná a neionizovaná forma látky výrazne odlišné mólové absorpčné (extinkčné) koeficienty. Absorpčné spektrum UV/VIS sa získa z roztokov konštantnej koncentrácie pri pH, pri ktorom je príslušná látka v podstate neionizovaná, pri ktorom je plne ionizovaná a pri niekoľkých pH nachádzajúcich sa medzi nimi. Dosiahnuť to možno buď pridaním koncentrovanej kyseliny (zásady) k pomerne veľkému objemu roztoku látky vo viaczložkovom tlmivom roztoku, a to spočiatku pri vysokom (nízkom) pH (odkaz 5), alebo pridaním rovnakých objemov zásobného roztoku látky, napr. vo vode, v metanole, do konštantných objemov rôznych tlmivých roztokov pokrývajúcich požadovaný rozsah pH. Z hodnôt pH a absorbancie pri zvolenej vlnovej dĺžke sa vypočíta dostatočný počet hodnôt pKa, pričom sa použije aspoň 5 hodnôt pH, pri ktorých je látka ionizovaná najmenej na 10 percent a zároveň menej ako na 90 percent. Ďalšie podrobnosti experimentu a metóda výpočtu sú uvedené v odkaze (1). Konduktometrická metóda Odmeria sa vodivosť približne 0,1 M elektricky vodivého vodného roztoku látky, pričom sa použije vodivostný článok so známou malou konštantou vodivostného článku. Odmeria sa aj vodivosť niekoľkých presných zriedení daného roztoku. Koncentrácia sa pri každom riedení zníži na polovicu, pričom celá séria by mala pokrývať aspoň koncentrácie v rozmedzí jedného rádu. Medzná (limitná) vodivosť pri nekonečnom riedení sa zistí vykonaním podobného experimentu so sodíkovou soľou a následnou extrapoláciou. Stupeň disociácie možno potom vypočítať z vodivosti každého roztoku pomocou Onsagerovej rovnice, a teda pomocou Ostwaldovho zrieďovacieho zákona možno disociačnú konštantu vypočítať ako K = α2C/(1 – α), kde C je koncentrácia v mol/l a α je (disociačný stupeň) disociovaná frakcia. Musia sa prijať preventívne opatrenia na vylúčenie CO2. Ďalšie podrobnosti experimentu a metóda výpočtu sú uvedené v štandardných textoch a v odkazoch (1), (6) a (7). ÚDAJE A PREZENTOVANIE VÝSLEDKOV Spracovanie výsledkov Titračná metóda Hodnota pKa sa vypočíta z 10 nameraných bodov na titračnej krivke. Vypočíta sa priemer a štandardná odchýlka týchto hodnôt pKa. Spolu s tabuľkou výsledkov by sa mal predložiť aj graf závislosti pH od objemu štandardnej zásady alebo kyseliny. Spektrofotometrické metódy Z hodnôt absorbancie a pH z každého spektra sa zostaví tabuľka. Z medziľahlých údajov spektier sa vypočíta aspoň päť hodnôt pKa a takisto priemer a štandardná odchýlka týchto výsledkov. Konduktometrická metóda Pre každú koncentráciu kyseliny a pre každú koncentráciu zmesi jedného ekvivalentu kyseliny a 0,98 ekvivalentu bezuhličitanového hydroxidu sodného sa vypočíta ekvivalent vodivosti Λ. Kyselina má byť v prebytku, aby sa predišlo prebytku OH– iónov v dôsledku hydrolýzy. Hodnoty 1/Λ sa zobrazia v grafe v závislosti od √C a Λo soli možno zistiť extrapoláciou pri nulovej koncentrácii. Hodnotu Λo kyseliny možno vypočítať z hodnôt pre H+ a Na+ uvádzaných v literatúre. Hodnotu pKa možno vypočítať zo vzorca α = Λi/Λo a Ka = α2C/(1 – α) pre každú koncentráciu. Presnejšie hodnoty Ka možno získať vykonaním korekcií na mobilitu a aktivitu. Mal by sa vypočítať priemer a štandardná odchýlka hodnôt pKa. Skúšobný protokol Predložiť by sa mali všetky nespracované údaje a vypočítané hodnoty pKa spolu s metódou výpočtu (najlepšie v tabuľkovej forme, napr. podľa návrhu v odkaze 1), ako aj štatistické parametre opísané v predchádzajúcej časti. V prípade titračných metód by sa mali uviesť podrobnosti o štandardizácii štandardných roztokov. V prípade spektrofotometrickej metódy by sa mali uviesť všetky spektrá. V prípade konduktometrickej metódy by sa mali uviesť podrobnosti o stanovení konštanty vodivostného článku. Mali by sa uviesť informácie o použitej technike, analytických metódach a povahe všetkých použitých tlmivých roztokov. Mala by sa uviesť skúšobná teplota(-y). LITERATÚRA
|
|
2. |
V časti B sa kapitola B.5 nahrádza takto: „B.5 AKÚTNE PODRÁŽDENIE/POLEPTANIE OKA ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 405 (2012). Usmernenia OECD na testovanie chemikálií sa pravidelne preskúmavajú, aby sa zabezpečilo, že odzrkadľujú najaktuálnejšie vedecké poznatky. Pri predchádzajúcich preskúmaniach tohto usmernenia na vykonávanie testov sa osobitná pozornosť venovala možným zlepšeniam na základe vyhodnotenia všetkých existujúcich informácií o testovanej chemikálii, aby sa zabránilo zbytočnému testovaniu na pokusných zvieratách a aby sa tým zohľadnili dobré životné podmienky zvierat. Metóda TG 405 (prijatá v roku 1981 a aktualizovaná v rokoch 1987, 2002 a 2012) zahŕňa odporúčanie, podľa ktorého by sa pred uskutočnením opísaného testu akútneho podráždenia/poleptani oka in vivo mala uskutočniť analýza váhy dôkazov (1) na základe existujúcich relevantných údajov. Ak nie sú k dispozícii dostačujúce údaje, podľa odporúčania by sa mali získať na základe postupného testovania (2) (3). Stratégia testovania zahŕňa vykonanie validovaných a uznaných testov in vitro a je uvedená ako doplnok k tejto testovacej metóde. Na účely nariadenia (ES) č. 1907/2006 o registrácii, hodnotení, autorizácii a obmedzovaní chemikálií (REACH) (2) je do príslušných usmernení ECHA takisto zahrnutá integrovaná stratégia testovania (21). Testovanie na zvieratách by sa malo vykonať len vtedy, ak sa po zvážení dostupných alternatívnych metód stanoví, že je to nevyhnutné a že jeho použitie je v týchto stanovených prípadoch vhodné. V čase prípravy tejto aktualizovanej testovacej metódy existujú prípady, keď je použitie tejto testovacej metódy stále potrebné alebo vyžadované podľa niektorých regulačných rámcov. Najnovšia aktualizácia sa zameriava najmä na použitie analgetík a anestetík bez toho, aby bola ovplyvnená základná koncepcia a štruktúra usmernenia na vykonávanie testov. ICCVAM (3) a nezávislý medzinárodný vedecký panel pre partnerské preskúmanie preskúmali užitočnosť a obmedzenia bežného používania lokálnych anestetík, systémových analgetík a parametrov pre humánne ukončenie postupu v priebehu bezpečnostnej štúdie očnej dráždivosti in vivo (12). V rámci preskúmania sa dospelo k záveru, že využívaním lokálnych anestetík a systémových analgetík by sa dalo zabrániť väčšine bolesti a ťažkostí alebo ich úplne odstrániť bez toho, aby to malo vplyv na výsledky testu, a vyslovilo sa odporúčanie, že takéto látky by sa mali vždy používať. V tejto testovacej metóde sa prihliada na uvedené preskúmanie. V priebehu in vivo testovania akútneho podráždenia a poleptania oka by sa mali bežne používať lokálne anestetiká, systémové analgetiká a parametre pre humánne ukončenie postupu. Výnimky z ich použitia by sa mali odôvodniť. Jemnejšie prístupy uvedené v tejto metóde výrazne zmiernia bolesť a ťažkosti zvierat alebo im zabránia vo väčšine situácií, keď je štúdia bezpečnosti prostredníctvom očného testovania in vivo stále potrebná. Súčasťou vyváženého preventívneho tíšenia bolesti by malo byť i) bežné predbežné ošetrenie lokálnym anestetikom (napr. proparakaínom alebo tetrakaínom) a systémovým analgetikom (napr. buprenorfínom), ii) bežné pravidelné dávkovanie systémových analgetík (napr. buprenorfínu a meloxikamu) po ošetrení, iii) naplánované pozorovanie, monitorovanie a zaznamenávanie klinických príznakov bolesti a/alebo ťažkostí u zvierat a iv) naplánované pozorovanie, monitorovanie a zaznamenávanie charakteru, závažnosti a priebehu všetkých poranení oka. Ďalšie podrobnosti sú uvedené v aktualizovaných postupoch opísaných ďalej. Po podaní testovanej chemikálie by sa nemali podávať žiadne ďalšie lokálne anestetiká ani analgetiká, aby sa zabránilo interferencii so štúdiou. Analgetiká s protizápalovým účinkom (napr. meloxikam) by sa nemali aplikovať lokálne a dávky používané systémovo by nemali interferovať s účinkami na oko. Definície sú uvedené v dodatku k testovacej metóde. ÚVODNÉ ÚVAHY V záujme vedeckej spoľahlivosti, ako aj dobrých životných podmienok zvierat by sa o testovaní in vivo nemalo uvažovať, pokiaľ analýzou váhy dôkazov neboli vyhodnotené všetky dostupné údaje súvisiace s potenciálom chemikálie vyvolať poleptanie/podráždenie oka. Medzi takéto údaje patria dôkazy z existujúcich štúdií na ľuďoch a/alebo laboratórnych zvieratách, dôkazy o schopnosti jednej alebo viacerých štrukturálne príbuzných látok alebo zmesí takýchto látok vyvolať poleptanie/podráždenie oka, informácie svedčiace o silnej kyslosti alebo zásaditosti chemikálie (4) (5) a výsledky z validovaných a uznaných testov na poleptanie kože a poleptanie/podráždenie oka in vitro alebo ex vivo (6) (13) (14) (15) (16) (17). Štúdie sa mohli uskutočniť pred analýzou váhy dôkazov alebo ako jej dôsledok. V prípade určitých chemikálií môže takáto analýza poukazovať na potrebu in vivo štúdií potenciálu chemikálie vyvolať poleptanie/podráždenie oka. Vo všetkých takýchto prípadoch by sa pred uvažovaním o použití očného testu in vivo mala pokiaľ možno najskôr uskutočniť štúdia žieravých účinkov chemikálie na kožu in vitro a/alebo in vivo, a potom vyhodnotiť v súlade so stratégiou postupného testovania testovacou metódou B.4 (7) alebo s integrovanou stratégiou testovania uvedenou v usmernení ECHA (21). Stratégia postupného testovania, ktorej súčasťou je vykonanie validovaných testov poleptania/podráždenia oka in vitro alebo ex vivo, je zahrnutá ako doplnok k tejto testovacej metóde, a na účely nariadenia REACH v usmernení ECHA (21). Odporúča sa, aby sa pred vykonaním testovania in vivo uplatnila takáto stratégia testovania. V prípade nových chemikálií sa na získanie vedecky spoľahlivých údajov o schopnosti chemikálie vyvolať poleptanie/podráždenie odporúča stratégia postupného testovania. V prípade existujúcich chemikálií s nedostatkom údajov o schopnosti chemikálie vyvolať poleptanie/podráždenie kože a oka možno uvedenú stratégiu použiť na získanie chýbajúcich údajov. Použitie odlišnej stratégie testovania alebo testovacej metódy alebo rozhodnutie nepoužiť stratégiu postupného testovania treba zdôvodniť. PRINCÍP TESTU IN VIVO Po predbežnom ošetrení systémovým analgetikom a indukcii vhodnej lokálnej anestézie sa chemikália, ktorá sa má testovať, aplikuje v jednorazovej dávke do jedného oka pokusného zvieraťa; chemikáliou neovplyvňované oko slúži ako kontrola. Stupeň podráždenia/poleptania oka sa vyhodnotí na základe hodnotenia lézií spojovky, rohovky a dúhovky, a to v špecifických intervaloch. V záujme úplného vyhodnotenia účinkov sa opíšu aj iné účinky na oko a nepriaznivé systémové účinky. Trvanie štúdie by malo byť dostatočné na posúdenie vratnosti alebo nevratnosti účinkov. Zvieratá vykazujúce príznaky závažných ťažkostí a/alebo bolesti v ktoromkoľvek štádiu testu alebo lézie, ktoré sú zhodné s parametrami pre humánne ukončenie postupu opísanými v tejto testovacej metóde (pozri bod 26), by sa mali humánnym spôsobom usmrtiť a daná chemikália by sa mala príslušným spôsobom vyhodnotiť. Kritéria pre rozhodnutie o humánnom usmrtení moribundných a silne trpiacich zvierat sú predmetom usmerňovacieho dokumentu OECD (8). PRÍPRAVA NA TEST IN VIVO Výber druhov Podľa možnosti sa ako laboratórne zviera použije králik – albín a použijú sa zdravé mladé dospelé zvieratá. Použitie iných kmeňov alebo druhov by sa malo zdôvodniť. Príprava zvierat Obe oči každého pokusného zvieraťa predbežne vybratého na testovanie by sa mali vyšetriť počas 24 hodín pred začatím testovania. Zvieratá vykazujúce podráždenie oka, očné poruchy alebo predchádzajúce poranenie rohovky by sa nemali použiť. Podmienky umiestnenia a kŕmenia Zvieratá by sa mali umiestniť jednotlivo. V prípade králikov by teplota experimentálnej miestnosti mala byť 20 °C (± 3 °C). Aj keď relatívna vlhkosť by mala byť aspoň 30 % a pokiaľ možno, okrem obdobia počas čistenia miestnosti, by nemala prevyšovať 70 %, cieľová relatívna vlhkosť by mala byť 50 – 60 %. Osvetlenie by malo byť umelé so striedaním 12 hodín svetla a 12 hodín tmy. Malo by sa zabrániť nadmernej intenzite svetla. Na kŕmenie možno používať bežné laboratórne krmivo s neobmedzenou dodávkou pitnej vody. POSTUP TESTOVANIA Použitie lokálnych anestetík a systémových analgetík Uvádzané postupy sa odporúčajú, aby sa pri štúdii bezpečnosti prostredníctvom očného testovania zabránilo bolesti a ťažkostiam alebo aby sa bolesť a utrpenie minimalizovali. Tieto postupy možno nahradiť alternatívnymi postupmi, o ktorých sa preukázalo, že aspoň tak alebo ešte lepšie bránia bolesti a ťažkostiam alebo poskytujú aspoň takú alebo ešte lepšiu úľavu od bolesti a utrpenia ako tieto postupy.
Aplikácia testovanej chemikálie Testovaná chemikália by sa mala umiestniť do spojovkového vaku jedného oka každého zvieraťa po jemnom odtiahnutí spodného viečka od očnej gule. Viečka sa potom jemne pritlačia k sebe asi na jednu sekundu, aby sa zabránilo strate materiálu. Druhé oko, ktoré nebolo ovplyvňované chemikáliou, slúži ako kontrola. Vymývanie Oči testovaných zvierat by sa nemali vymývať aspoň 24 hodín po instilácii testovanej chemikálie, okrem tuhých látok (pozri bod 18) a v prípade okamžitých žieravých alebo dráždivých účinkov. Po 24 hodinách možno oči vypláchnuť, ak sa to považuje za potrebné. Použitie náhradnej skupiny zvierat na vyšetrenie vplyvu vyplachovania sa neodporúča, pokiaľ to nie je vedecky odôvodnené. Ak je náhradná skupina potrebná, mali by sa použiť dva králiky. Podmienky vyplachovania by sa mali starostlivo zdokumentovať, napr. čas vyplachovania, zloženie a teplota vyplachovacieho roztoku, trvanie, objem a rýchlosť aplikácie. Veľkosť dávky 1. Testovanie kvapalín Na testovanie kvapalín sa používa dávka 0,1 ml. Na instiláciu chemikálie priamo do oka by sa nemali použiť tlakové dávkovače aerosólu. Tekutina zo spreja by sa mala nastriekať do nádobky pred instiláciou 0,1 ml do oka. 2. Testovanie tuhých látok Pri testovaní tuhých látok, pást a chemikálií, ktoré sú tvorené z častíc, by použité množstvo malo mať objem 0,1 ml alebo hmotnosť najviac 100 mg. Testovaná chemikália by sa mala pomlieť na jemný prášok. Objem tuhého materiálu by sa mal odmerať po jemnom zhutnení, napr. poklepaním nádobky na meranie. Ak testovaná tuhá chemikália nebola fyziologicky odstránená z oka pokusného zvieraťa pri prvom pozorovaní v časovom bode 1 hodina po ovplyvňovaní, oko možno vypláchnuť fyziologickým roztokom alebo destilovanou vodou. 3. Testovanie aerosólov Odporúča sa, aby sa pred instiláciou do oka všetky chemikálie z tlakových dávkovačov a aerosóly vyprázdnil do nádobky. Jedinou výnimkou sú chemikálie v tlakových aerosólových nádobách, ktoré sa nedajú vystriekať a zozbierať kvôli vyparovaniu. V takýchto prípadoch by sa oko malo držať otvorené a testovaná chemikália by sa mala aplikovať do oka jednorazovým striekaním trvajúcim približne jednu sekundu zo vzdialenosti 10 cm priamo pred okom. Túto vzdialenosť možno meniť v závislosti od tlaku spreja a jeho obsahu. Pozornosť je potrebné venovať tomu, aby sa tlakom zo spreja nepoškodilo oko. Vo vhodných prípadoch môže byť potrebné posúdiť potenciál „mechanického” poškodenia oka tlakom kvapaliny zo spreja. Odhad dávky z aerosólu možno urobiť simulovaním testu takto: Chemikália sa nasprejuje na navažovací papier cez otvor veľkosti oka králika nachádzajúci sa priamo pred papierom. Na základe zvýšenia hmotnosti papiera sa odhadne množstvo nasprejované do oka. V prípade prchavých chemikálií možno dávku odhadnúť tak, že sa nádobka odváži pred odstránením testovanej chemikálie a po ňom. Počiatočný test (test podráždenia/poleptania oka in vivo s použitím jedného zvieraťa) Dôrazne sa odporúča, aby sa test in vivo najprv uskutočnil s použitím jedného zvieraťa (pozri doplnok k tejto testovacej metóde: Stratégia postupného testovania podráždenia a poleptania oka). Pozorovania by mali umožniť stanovenie závažnosti a vratnosti pred tým, ako sa pristúpi k potvrdzujúcemu testu na druhom zvierati. Ak z výsledkov tohto testu vyplynie, že chemikália je po použití uvedeného postupu žieravá alebo silne dráždivá pre oko, ďalšie testovanie očnej dráždivosti by sa nemalo vykonať. Potvrdzujúci test (test podráždenia oka in vivo na ďalších zvieratách) Ak sa v počiatočnom teste nezistí žieravý alebo silne dráždivý účinok, dráždivá alebo negatívna reakcia by sa mala potvrdiť na maximálne dvoch ďalších zvieratách. Ak sa dráždivý účinok zistí v počiatočnom teste, odporúča sa, aby sa potvrdzujúci test uskutočnil postupným spôsobom, naraz len na jednom zvierati, a nie súčasnou expozíciou dvoch ďalších zvierat. Ak sa na druhom zvierati prejavia žieravé alebo silne dráždivé účinky, test sa preruší. Ak sú výsledky z druhého zvieraťa dostatočné na to, aby umožnili stanovenie klasifikácie nebezpečnosti, potom nie je potrebné uskutočniť ďalšie testovanie. Dĺžka pozorovania/Doba pozorovania/Sledované obdobie/Pozorovacie obdobie Dĺžka pozorovania by mala byť dostatočná na úplné vyhodnotenie veľkosti/závažnosti a vratnosti/reverzibility zistených účinkov. Pokus by sa však mal ukončiť vždy, keď zviera vykazuje známky silnej bolesti alebo ťažkostí (8). Na stanovenie vratnosti účinkov by sa zvieratá za normálnych okolností mali pozorovať 21 dní po podaní testovanej chemikálie. Ak sa vratnosť pozoruje pred uplynutím 21 dní, pokus by sa mal v tej chvíli ukončiť. Klinické pozorovania a klasifikácia reakcií oka Oči by sa mali hodnotiť komplexne na prítomnosť alebo neprítomnosť očných lézií jednu hodinu po ATC, po ktorom nasledujú hodnotenia aspoň raz denne. Počas prvých 3 dní by sa zvieratá mali hodnotiť niekoľkokrát denne, aby sa zabezpečilo, že rozhodnutia o ukončení testu sa prijmú včas. Pokusné zvieratá by sa mali počas celého trvania štúdie pravidelne hodnotiť na prítomnosť klinických príznakov bolesti a/alebo ťažkostí (napr. opakované dotýkanie sa oka labkou alebo trenie oka, nadmerné žmurkanie, nadmerné slzenie) (9) (10) (11), a to najmenej dvakrát denne s rozostupom najmenej 6 hodín alebo v prípade potreby aj častejšie. Toto hodnotenie je potrebné, aby i) sa zvieratá náležite posúdili v záujme získania dôkazov o bolesti a ťažkostiach s cieľom prijať kvalifikované rozhodnutia o potrebe zvýšiť dávkovanie analgetík a aby ii) sa zvieratá posúdili v záujme získania dôkazov o stanovených parametroch pre humánne ukončenie postupu s cieľom prijať kvalifikované rozhodnutia o tom, či je vhodné, aby sa zvieratá humánne usmrtili, a zabezpečiť, aby sa takéto rozhodnutia prijímali včas. Farbenie fluoresceínom by sa malo používať pravidelne a v náležitých prípadoch by sa mala použiť biomikroskopia oka (štrbinová lampa a binokulárny stereomikroskop) (napr. pri posudzovaní hĺbky poranenia, ak je prítomná ulcerácia rohovky) ako pomôcky na detekciu a meranie poškodenia oka a s cieľom vyhodnotiť, či sú splnené stanovené kritériá týkajúce sa sledovaných parametrov v súvislosti s humánnym usmrtením. Na referenčné účely a na účely poskytnutia trvalého záznamu rozsahu poškodenia oka možno vyhotoviť digitálne fotografie pozorovaných lézií. Zvieratá by nemali byť podrobené testovaniu dlhšie, ako je potrebné, a mali by sa z neho vyradiť ihneď po získaní definitívnej informácie. Zvieratá vykazujúce silnú bolesť alebo ťažkosti by sa mali bezodkladne humánne usmrtiť a daná chemikália by sa mala príslušným spôsobom vyhodnotiť. Humánne usmrtiť by sa mali zvieratá, ktoré po instilácii vykazujú tieto očné lézie (pozri tabuľku 1 s opisom tried lézií): perforácia rohovky alebo významná ulcerácia rohovky vrátane stafylómu; krv v prednej komore oka; zákal rohovky 4. triedy; neprítomnosť reflexu zreničky na osvit (reakcia zrenice 2. triedy), ktorá pretrváva 72 hodín; ulcerácia spojovky; nekróza spojovky alebo žmurky; alebo odlupovanie. Je to kvôli tomu, že takéto lézie sú zvyčajne nevratné. Okrem toho sa odporúča, aby sa očné lézie uvedené ďalej v texte použili ako parametre pre humánne ukončenie postupu s cieľom ukončiť štúdie pred koncom plánovaného 21-dňového pozorovania. Tieto lézie sa považujú za predpoveď silne dráždivých alebo žieravých poranení a poranení, v prípade ktorých sa do konca 21-dňového pozorovania nepredpokladá úplné zvrátenie poškodenia (úplné zotavenie): veľká hĺbka poranenia (napr. ulcerácia rohovky presahujúca povrchové vrstvy strómy), viac ako 50 % poškodenie limbusu (čo sa prejaví vyblednutím spojovkového tkaniva) a silná infekcia oka (hnisavý výtok). Za potenciálne užitočné kritérium, ktoré môže ovplyvniť klinické rozhodnutie o predčasnom ukončení štúdie, by sa mohla považovať aj kombinácia vaskularizácie povrchu rohovky (t. j. panus), oblasti sfarbenej fluoresceínom, ktorá sa podľa každodenného posudzovania časom nezmenšuje, a/alebo nedostatočnej/neexistujúcej reepitelizácie 5 dní po aplikovaní testovanej chemikálie. Uvedené nálezy však jednotlivo nepostačujú na zdôvodnenie predčasného ukončenia štúdie. Po zistení závažných účinkov na oko by sa klinické vyšetrenie malo konzultovať s ošetrujúcim veterinárnym lekárom, veterinárnym lekárom laboratórnych zvierat alebo kvalifikovaným personálom vyškoleným na identifikáciu klinických lézií s cieľom stanoviť, či si kombinácia uvedených účinkov vyžaduje predčasné ukončenie štúdie. Triedy reakcie oka (spojovky, rohovky a dúhovky) by sa mali zisťovať a zaznamenávať po 1 hodine po aplikácii testovanej chemikálie a následne po 24, 48 a 72 hodinách (tabuľka 1). Zvieratá, u ktorých sa nevytvoria žiadne lézie oka, možno usmrtiť najskôr 3 dni po instilácii. Zvieratá s léziami oka, ktoré nemajú závažný charakter, by sa mali pozorovať do ich vymiznutia alebo 21 dní, kedy štúdia ukončí. S cieľom stanoviť stav lézií a ich vratnosť alebo nevratnosť by sa mali uskutočniť a zaznamenať pozorovania aspoň v týchto časových intervaloch: po 1 hodine, 24 hodinách, 48 hodinách, 72 hodinách, 7 dňoch, 14 dňoch a 21 dňoch. Pozorovanie by sa malo vykonávať častejšie, ak je to potrebné na zistenie toho, či by sa testované zviera malo z humánnych dôvodov usmrtiť alebo by sa malo z dôvodu negatívnych výsledkov zo štúdie vylúčiť. Pri každom vyšetrení by sa mali zaznamenať triedy lézií oka (tabuľka 1). Zaznamenať by sa mali aj všetky ďalšie lézie oka (napr. panus, sfarbenie, zmeny prednej komory oka) alebo nepriaznivé systémové účinky. Vyšetrenie reakcií možno uľahčiť použitím binokulárnej lupy, ručnej štrbinovej lampy, biomikroskopu alebo iného vhodného prístroja. Po zaznamenaní pozorovaní po 24 hodinách možno oči ďalej vyšetriť fluoresceínom. Klasifikácia reakcií oka je nevyhnutne subjektívna. Na podporu harmonizácie pri klasifikácii reakcií oka a na pomoc testovacím laboratóriám a tým, ktorí sú zainteresovaní na uskutočňovaní a interpretovaní pozorovaní, musí byť personál, ktorý pozorovania uskutočňuje, adekvátne vyškolený na používanie zavedeného systému hodnotenia. ÚDAJE A PREZENTOVANIE VÝSLEDKOV Vyhodnotenie výsledkov Triedy očnej dráždivosti by sa mali vyhodnocovať v súvislosti s charakterom a závažnosťou lézií a ich vratnosťou alebo nevratnosťou. Jednotlivé stupne nepredstavujú absolútne meradlo dráždivých vlastností chemikálie, keďže sa hodnotia aj iné účinky testovanej chemikálie. Skôr by sa na jednotlivé stupne malo nazerať ako na referenčné hodnoty, ktoré majú zmysel iba vtedy, ak sú doložené úplným opisom a vyhodnotením všetkých pozorovaní. Skúšobný protokol Skúšobný protokol by mal zahŕňať tieto informácie:
Interpretácia výsledkov Extrapolácia výsledkov štúdií očnej dráždivosti u laboratórnych zvierat na ľudí platí len v obmedzenej miere. V mnohých prípadoch je králik – albín citlivejší na látky, ktoré spôsobujú podráždenie alebo poleptanie oka, ako ľudia. Malo by sa dbať na to, aby sa pri interpretácii údajov vylúčilo podráždenie spôsobené sekundárnou infekciou. LITERATÚRA
Tabuľka 1 Klasifikácia očných lézií
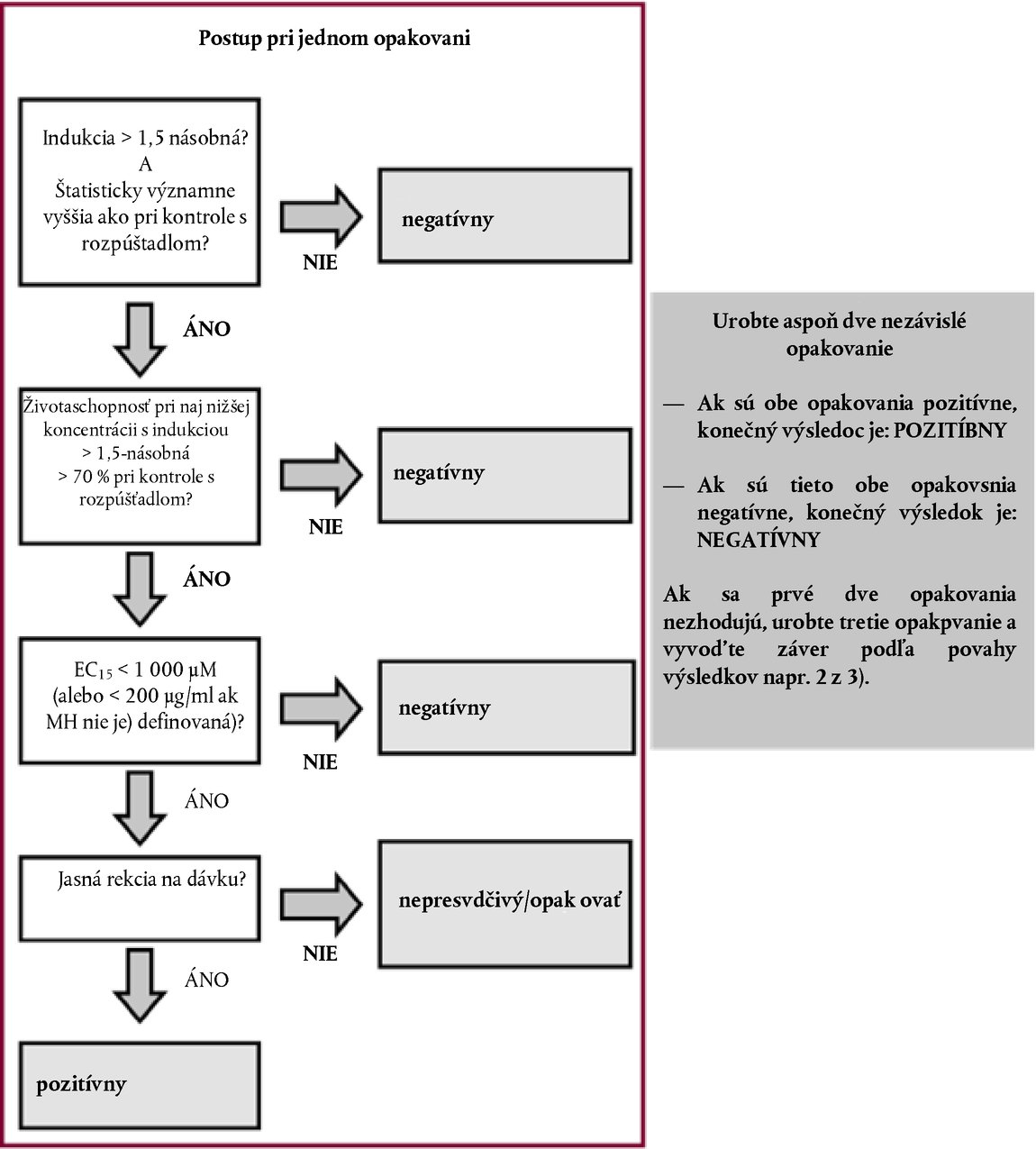
Dodatok DEFINÍCIE Tlmivá kapacita : v prípade kyslých prípravkov ide o množstvo (v g) hydroxidu sodného/100 g prípravku potrebné na dosiahnutie určitého pH. V prípade zásaditých prípravkov ide o množstvo (v g) hydroxidu sodného ekvivalentného množstvu (v g) kyseliny sírovej/100 g prípravku potrebné na dosiahnutie určitého pH (Young et al, 1988). Chemikália : látka alebo zmes. Nedráždivé chemikálie : látky, ktoré nie sú podľa EPA klasifikované ako očné dráždivé látky kategórie I, II alebo III; alebo podľa GHS ako očné dráždivé látky kategórie 1, 2, 2A alebo 2B; alebo podľa EÚ ako látky kategórie 1 alebo 2 (17) (18) (19). Očná žieravina : a) chemikália, ktorá spôsobuje nevratné poškodenie tkaniva oka; b) chemikálie, ktoré sú podľa GHS klasifikované ako očné dráždivé látky kategórie 1, alebo podľa EPA ako očné dráždivé látky kategórie I, alebo podľa EÚ ako látky kategórie 1 (17) (18) (19). Očná dráždivá látka : a) chemikália, ktorá spôsobuje vratné zmenu v oku; b) chemikálie, ktoré sú podľa EPA klasifikované ako očné dráždivé látky kategórie II alebo III; alebo podľa GHS ako očné dráždivé látky kategórie 2, 2A alebo 2B; alebo podľa EÚ ako látky kategórie 2 (17) (18) (19). Očná silne dráždivá chemikália : a) chemikália, ktorá spôsobuje poškodenia tkaniva oka, ktoré nevymizne do 21 dní po aplikácii alebo spôsobí veľmi výrazné zhoršenie zraku; b) chemikálie, ktoré sú podľa GHS klasifikované ako očná dráždivá látka kategórie 1, alebo podľa EPA ako očné dráždivé látky kategórie I, alebo podľa EÚ ako látky kategórie 1 (17) (18) (19). Testovaná chemikália : akákoľvek látka alebo zmes, ktorá sa testuje touto testovacou metódou. Viacstupňový prístup : stratégia postupného testovania, pri ktorej sa v presne určenom poradí na každom stupni preskúmavajú všetky existujúce informácie o testovanej chemikálii postupmi analýzy váhy dôkazov s cieľom určiť, či sú k dispozícii dostatočné informácie na to, aby sa mohlo prijať rozhodnutie o klasifikácii nebezpečnosti pred tým, ako sa postúpi na ďalší stupeň. Ak testovanej chemikálii možno na základe existujúcich informácií pripísať potenciál vyvolať podráždenie, nevyžaduje sa ďalšie testovanie. Ak testovanej chemikálii nemožno na základe existujúcich informácií pripísať potenciál vyvolať podráždenie, použije sa prístup postupného testovania na zvieratách v jednotlivých stupňoch, až kým ju nebude možné jednoznačne klasifikovať. Analýza váhy dôkazov (postup) : Ako základ pre vyvodenie záveru, ktorý z jednotlivých údajov nemusí byť zrejmý, sa použijú silné a slabé stránky vyplývajúce zo zozbieraných informácií. DOPLNOK K TESTOVACEJ METÓDE B.5 (4) STRATÉGIA POSTUPNÉHO TESTOVANIA PODRÁŽDENIA A POLEPTANIA OKA Všeobecné úvahy Je dôležité, aby sa v záujme vedeckej spoľahlivosti a dobrých životných podmienok zvierat zabránilo používaniu zvierat v prípade, že to nie je nevyhnutné, a aby sa minimalizovalo testovanie, ktoré u zvierat potenciálne spôsobuje závažné reakcie. Pred zvažovaním použitia testovania in vivo by sa mali posúdiť všetky informácie o chemikálii, ktoré sú relevantné z hľadiska jej potenciálu spôsobiť podráždenie/poleptanie oka. Na účely klasifikácie testovanej látky v súvislosti s jej potenciálom spôsobiť podráždenie alebo poleptanie oka už môžu existovať dostatočné dôkazy, a teda testovanie na laboratórnych zvieratách nemusí byť potrebné. Použitie analýzy váhy dôkazov a stratégie postupného testovania preto minimalizuje potrebu testovania in vivo, najmä ak by chemikália pravdepodobne spôsobila silné reakcie. Odporúča sa, aby sa na posúdenie existujúcich informácií o chemikáliách, ktoré sa týkajú podráždenia a poleptania oka, a na stanovenie potreby vykonať okrem štúdie oka in vivo aj ďalšie štúdie, použila analýza váhy dôkazov, ktorá by pomohla charakterizovať tento potenciál. Ak sú potrebné ďalšie štúdie, odporúča sa, aby sa na získanie príslušných experimentálnych údajov použila stratégia postupného testovania. V prípade látok, ktoré sa ešte netestovali, by sa na získanie údajov potrebných na vyhodnotenie ich potenciálu spôsobiť poleptanie/podráždenie oka, mala použiť stratégia postupného testovania. Stratégia prvotného testovania opísaná v tomto doplnku bola vypracovaná na seminári OECD (1). Následne bola potvrdená a rozšírená v publikácii Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances (Harmonizovaný integrovaný systém klasifikácie nebezpečnosti chemických látok pre ľudské zdravie a ich účinku na životné prostredie), podporená na 28. spoločnom zasadnutí Výboru pre chemikálie a Pracovnej skupiny pre chemikálie v novembri 1998 (2) a aktualizovaná skupinou expertov OECD v roku 2011. Hoci táto stratégia testovania nie je integrálnou súčasťou testovacej metódy B.5, vyjadruje odporúčaný prístup pre určovanie vlastností spočívajúcich v podráždení/poleptaní oka. Tento prístup predstavuje osvedčený postup, ako aj etické kritérium pre testovanie očnej dráždivosti/žieravosti in vivo. Táto testovacia metóda poskytuje usmernenie na vykonanie testu in vivo a sumarizuje faktory, ktoré treba preskúmať pred zvažovaním takéhoto testu. Súčasťou stratégie postupného testovania je prístup založený na analýze váhy dôkazov slúžiaci na vyhodnocovanie existujúcich údajov o schopnosti chemikálií podráždiť/poleptať oko a viacstupňový prístup na účely vytvorenia relevantných údajov o chemikáliách, v prípade ktorých sú potrebné ďalšie štúdie, alebo sa ešte žiadne neuskutočnili. Stratégia zahŕňa najprv vykonanie validovaných a uznaných testov in vitro alebo ex vivo a potom štúdií s testovacou metódou B.4 za špecifických okolností (3)(4). Opis stratégie postupného testovania Pred vykonaním testov ako súčasti stratégie postupného testovania (obrázok) by sa mali vyhodnotiť všetky dostupné informácie na určenie potreby očného testovania in vivo. Hoci by z hodnotenia jednotlivých parametrov (napr. extrémna hodnota pH) bolo možné získať významné informácie, mal by sa posúdiť súhrn existujúcich informácií. Pri rozhodovaní na základe analýzy váhy dôkazov by sa mali vyhodnocovať všetky relevantné údaje o účinkoch príslušnej chemikálie a jej štruktúrnych analógov a toto rozhodnutie by sa malo odôvodniť. Prednostne by sa bolo treba zamerať na existujúce údaje o účinkoch chemikálie na ľudí a zvieratá, za ktorými by mali nasledovať výsledky z testovania in vitro alebo ex vivo. Štúdie žieravých chemikálií by sa podľa možnosti nemali uskutočňovať in vivo. Faktory zvažované v stratégii testovania zahŕňajú:
STRATÉGIA TESTOVANIA A HODNOTENIA OČNEJ DRÁŽDIVOSTI/ŽIERAVOSTI
LITERATÚRA
|
|
3. |
V časti B sa kapitola B.10 nahrádza takto: „B.10 Test in vitro na chromozómové aberácie u cicavcov ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov 473 (2016). Je súčasťou série testovacích metód v oblasti genetickej toxikológie. V tejto súvislosti bol vypracovaný aj dokument OECD, ktorý poskytuje stručné informácie o vykonávaní testov v oblasti genetickej toxikológie a prehľad o súčasných zmenách, ktorými tieto usmernenia na vykonávanie testov prešli (1). Účelom testu na chromozómové aberácie in vitro je identifikovať chemikálie, ktoré spôsobujú štruktúrne chromozómové aberácie v bunkových kultúrach cicavcov (2) (3) (4). Štruktúrne chromozómové aberácie sa vyskytujú v dvoch typoch, chromozómové alebo chromatidové. V in vitro testoch na chromozómové aberácie môže vzniknúť polyploidia (vrátane endoreduplikácie). Zatiaľ čo aneugény môžu vyvolať vznik polyploidie, samotná polyploidia nenaznačuje aneugénny potenciál a môže jednoducho znamenať narušenie bunkového cyklu alebo cytotoxicitu (5). Tento test nie je určený na meranie aneuploidie. Na zistenie aneuploidie by sa mohol doporučiť in vitro mikronukleový test (6). V in vitro teste na chromozómové aberácie možno používať kultúry zavedených (permanentných) bunkových línií alebo primárne bunkové kultúry ľudského alebo hlodavčieho pôvodu. Použité bunky by sa mali vyberať na základe schopnosti rastu v kultúre, stability karyotypu (vrátane počtu chromozómov), ako aj frekvencie spontánnych chromozómových aberácií (7). Na základe v súčasnosti dostupných údajov nemožno vysloviť jednoznačné odporúčania, vyplýva z nich však to, že pri hodnotení nebezpečnosti chemikálií je dôležité zvážiť stav p53, genetickú stabilitu (stabilitu karyotypu), kapacitu na opravu DNA a pôvod (hlodavčí alebo ľudský) buniek vybratých pre testovanie. Keďže poznatky v tejto oblasti sa vyvíjajú, používateľom tejto testovacej metódy sa odporúča, aby zvážili vplyv týchto a iných charakteristík buniek na výkonnosť bunkovej línie pri detekcii indukcie chromozómových aberácií. Použité definície sú uvedené v dodatku 1. POČIATOČNÉ ÚVAHY A OBMEDZENIA Testy, ktoré sa vykonávajú in vitro, si zvyčajne vyžadujú použitie exogénneho zdroja metabolickej aktivácie okrem prípadov, keď majú bunky metabolickú kapacitu s ohľadom na testované chemikálie. Exogénny systém metabolickej aktivácie nenapodobňuje v plnej miere podmienky in vivo. Bolo by sa treba vyhnúť podmienkam, ktoré by mohli viesť k falošne pozitívnym výsledkom, t. j. poškodeniam chromozómov nespôsobeným priamou interakciou medzi testovanými chemikáliami a chromozómami. Takéto podmienky zahŕňajú zmeny pH alebo osmolality (8) (9) (10), interakciu so zložkami média (11) (12) alebo nadmerné úrovne cytotoxicity (13) (14) (15) (16). Tento test sa používa na detekciu chromozómových aberácií, ktoré môžu byť výsledkom klastogénnych udalostí. Analýza indukcie chromozómových aberácií by sa mala vykonať na bunkách v metafáze. Je preto nevyhnutné, aby bunky dosiahli mitózu v ovplyvňovaných aj v neovplyvňovaných kultúrach. V prípade vyrobených nanomateriálov môže byť potrebné túto testovaciu metódu osobitne upraviť, tieto úpravy však nie sú opísané v tejto testovacej metóde. Pred použitím testovacej metódy v prípade zmesi s cieľom generovať údaje pre stanovený regulačný účel by sa malo zvážiť, či môže poskytnúť primerané výsledky na tento účel, a ak áno, malo by sa to zdôvodniť. Takéto úvahy nie sú potrebné, ak existuje regulačná požiadavka na testovanie zmesi. PRINCÍP TESTU Bunkové kultúry ľudského pôvodu alebo pochádzajúce z iných cicavcov sú vystavené testovanej chemikálii spolu s exogénnym zdrojom metabolickej aktivácie aj bez neho, pokiaľ nie sú použité bunky so zodpovedajúcou schopnosťou metabolizácie (pozri bod 13). Vo vhodných vopred určených intervaloch po začatí expozície bunkových kultúr testovanej chemikálii sa tieto bunkové kultúry ošetria chemikáliou zastavujúcou bunkové delenie v metafáze (napr kolcemidom alebo kolchicínom), odoberú sa, zafarbia sa a bunky v metafáze sa mikroskopicky analyzujú na prítomnosť aberácií chromatidového a chromozómového typu. OPIS METÓDY Príprava Bunky Použiť možno rôzne bunkové línie [napr. bunky vaječníkov škrečka čínskeho (CHO), pľúcne bunky škrečka čínskeho V79, pľúcne bunky škrečka čínskeho (CHL)/IU, TK6] alebo primárne bunkové kultúry vrátane periférnych lymfocytov ľudí alebo iných cicavcov (7). Výber použitých bunkových línií by sa mal vedecky odôvodniť. Ak sa použijú primárne bunky, z dôvodu dobrých životných podmienok zvierat by sa malo podľa možnosti zvážiť použitie primárnych buniek ľudského pôvodu, pričom by sa mal odber vzoriek uskutočniť v súlade s etickými zásadami a právnymi predpismi. Ľudské periférne lymfocyty by sa mali získať od mladých (približne 18 až 35 ročných) nefajčiarov, ktorí podľa známych informácií netrpia nejakou chorobou, a ktorí v poslednom čase neboli vystavení genotoxickým činiteľom (napr. chemikáliám, ionizujúcemu žiareniu) na úrovniach, ktoré by zvýšili výskyt chromozómových aberácií v pozadí. Tým by sa zabezpečil nízky a ustálený výskyt chromozómových aberácií v pozadí. Základný výskyt chromozómových aberácií sa vekom zvyšuje, pričom je tento trend výraznejší u žien než u mužov (17) (18). Ak sa spoločne použijú bunky od viacerých darcov, mal by sa uviesť počet darcov. Je potrebné preukázať, že bunky sa v čase od začiatku aplikácie testovanej chemikálie do odberu vzoriek delili. Bunkové kultúry sú udržiavané v exponenciálnej fáze rastu buniek (bunkové línie) alebo sa ich delenie stimuluje (primárne kultúry lymfocytov), aby boli testovanej chemikálii vystavené bunky v rôznych fázach bunkového cyklu, pretože citlivosť jednotlivých fáz bunkového cyklu na testovanú chemikáliu nemusí byť známa. Primárne bunky, ktoré sa musia stimulovať mitogénnymi aktivátormi, aby sa delili, sa už vo všeobecnosti počas vystavenia testovanej chemikálii nesynchronizujú (napr. ľudské lymfocyty po 48 hodinách mitogénnej stimulácie). Používanie synchronizovaných buniek sa počas ovplyvňovania neodporúča, ale môže byť prijateľné, ak je to odôvodnené. Médiá a kultivačné podmienky Na udržiavanie kultúr by sa malo použiť vhodné kultivačné médium a inkubačné podmienky (kultivačné nádoby, podľa potreby atmosféra s vyššou relatívnou vlhkosťou a 5 % CO2, inkubačná teplota 37 °C). Bunkové línie by sa mali pravidelne kontrolovať, pokiaľ ide o stabilitu modálneho počtu chromozómov a o vylúčenie kontaminácie mykoplazmou (7) (19), a v prípade kontaminácie alebo zmeny modálneho počtu chromozómov by sa nemali použiť. Mal by sa stanoviť čas bežného bunkového cyklu použitej bunkovej línie alebo primárnych kultúr v testovacom laboratóriu a mal by byť zhodný s publikovanými charakteristikami buniek (20). Príprava kultúr Bunkové línie: bunky sa množia zo zásobných kultúr, zakladajú sa do rastového média, a to v takej hustote, pri ktorej sa počet buniek v suspenzii alebo v monovrstvách bude ďalej exponenciálne zvyšovať až do času odberu [napr. malo by sa zabrániť zhlukovaniu (konfluencii) buniek rastúcich v monovrstvách]. Lymfocyty: celá krv ošetrená antikoagulantom (napríklad: heparínom) alebo separované lymfocyty sa v prítomnosti mitogénu [napr. fytohemaglutinínu (PHA) v prípade ľudských lymfocytov] kultivujú (napr. počas 48 hodín v prípade ľudských lymfocytov), aby sa vyvolalo delenie buniek predtým, ako sa bunky vystavia testovanej chemikálii. Metabolická aktivácia Ak sa použijú bunky s nedostatočnou endogénnou metabolickou kapacitou, mali by sa použiť exogénne systémy metabolickej aktivácie. Najpoužívanejším systémom, ktorý sa štandardne odporúča, pokiaľ to nie je odôvodnené inak, je kofaktormi obohatená postmitochondriálna frakcia (S9) pripravená z pečene hlodavcov (väčšinou potkanov) ošetrená činidlami na indukciu enzýmov, ako napríklad Aroclorom 1254 (21) (22) (23) alebo kombináciou fenobarbitálu a beta-naftoflavónu (3-fenyl-1H-nafto[2,1-b]pyrán-1-ón) (27) (28) (29). Uvedená kombinácia nie je v rozpore so Štokholmským dohovorom o perzistentných organických látkach (30) a preukázateľne je pri indukovaní oxidáz so zmiešanými funkciami rovnako účinná ako Aroclor 1254 (24) (25) (26) (28). Frakcia S9 sa zvyčajne používa v koncentráciách v rozpätí od 1 do 2 obj. %, ale v konečnom testovacom médiu ju možno zvýšiť na 10 obj. %. Počas ovplyvňovania by sa malo zabrániť použitiu produktov, ktorými sa znižuje mitotický index, najmä produktov tvoriacich komplexy s vápnikom (31). Výber druhu a koncentrácie použitého exogénneho systému metabolickej aktivácie alebo metabolického induktora môže ovplyvniť trieda testovanej chemikálie. Príprava testovanej chemikálie Testované chemikálie v tuhom skupenstve by sa prípadne mali rozpustiť vo vhodnom rozpúšťadle pred ich aplikáciou na bunky (pozri bod 23). Testované chemikálie v kvapalnom skupenstve možno pridať priamo do testovacieho systému a/alebo ich rozriediť pred použitím na ovplyvňovanie testovacieho systému. Plynné alebo prchavé testované chemikálie by sa mali testovať tak, že sa štandardné protokoly vhodne upravia, napríklad sa v nich uskutoční ovplyvňovanie v uzavretých kultivačných nádobách (32) (33) (34). Príprava testovanej chemikálie by sa mala uskutočniť tesne pred ovplyvňovaním, pokiaľ z údajov o stabilite nevyplýva prípustnosť uskladnenia. Podmienky testu Rozpúšťadlá Rozpúšťadlo by sa malo zvoliť tak, aby sa optimalizovala rozpustnosť testovaných chemikálií bez toho, aby to malo negatívny vplyv na vykonávanie skúšky (napr. zmenou rastu buniek), ovplyvňovalo integritu testovanej chemikálie, reagovalo s kultivačnými nádobami, narušovalo systém metabolickej aktivácie. Vždy, keď je to možné, odporúčame zvážiť, aby sa prednostne použilo vodné rozpúšťadlo (alebo rastové médium). Medzi overené rozpúšťadlá patrí napr. voda alebo dimetylsulfoxid. Organické rozpúšťadlá by vo všeobecnosti nemali presiahnuť 1 obj. % a vodné rozpúšťadlá (fyziologický roztok alebo voda) by nemali presiahnuť 10 obj. % v konečnom médiu s testovanou chemikáliou. Ak sa použijú iné ako overené rozpúšťadlá (napr. etanol alebo acetón), ich použitie by malo byť podložené údajmi potvrdzujúcimi ich kompatibilitu s testovanou chemikáliou, testovacím systémom a absenciu genetickej toxicity pri použitej koncentrácii. V prípade, že tieto podkladové údaje nie sú k dispozícii, je dôležité do testu zahrnúť neovplyvňované kontroly (pozri dodatok 1) s cieľom preukázať, že zvolené rozpúšťadlo nevyvoláva žiadne rušivé alebo klastogénne účinky. Meranie proliferácie buniek a cytotoxicity a výber expozičných koncentrácií Pri stanovovaní najvyššej koncentrácie testovanej chemikálie by sa malo zabrániť použitiu koncentrácií, ktoré majú schopnosť vyvolať falošné pozitívne reakcie, napr. koncentrácií vyvolávajúcich nadmernú cytotoxicitu (pozri bod 22), zrážanie rastového média (pozri bod 23) alebo výrazné zmeny pH alebo osmolality (pozri bod 5). Ak testovaná chemikália spôsobí výrazné zmeny pH média v čase jej pridania, pH možno upraviť tlmením finálneho média s testovanou chemikáliou tak, aby sa zabránilo falošným pozitívnym výsledkom a aby sa udržali vhodné kultivačné podmienky. Aby sa zaistilo, že dostatočný počet ovplyvňovaných buniek dosiahol počas testu mitózu a že ošetrenia sa vykonávali na vhodných úrovniach cytotoxicity (pozri body 18 a 22), vykonávajú sa merania proliferácie buniek. V hlavnom experimente by sa mala stanoviť cytotoxicita s metabolickou aktiváciou a bez nej, a to použitím vhodného indikátora bunkovej smrti a rastu. Aj keď z hľadiska lepšieho definovania koncentrácií, ktoré sa majú použiť v hlavnom experimente, môže byť užitočné hodnotenie cytotoxicity v počiatočnom teste, počiatočný test nie je povinný. Ak sa vykonáva, nemal by nahradiť meranie cytotoxicity pri hlavnom experimente. Relatívne zdvojenie populácie (RPD) alebo relatívne zvýšenie počtu buniek (RICC) sú vhodné metódy na posúdenie cytotoxicity cytogenetických testoch (13) (15) (35) (36) (55) (pozri vzorce v dodatku 2). V prípade dlhodobej aplikácie chemikálie a v prípade, že sa odbery vykonávajú neskôr, ako je 1,5-násobok trvania normálneho bunkového cyklu od začiatku aplikácie (t. j. neskôr, ako je dĺžka 3 bunkových cyklov spolu), môže RPD viesť k podhodnoteniu cytotoxicity. Za týchto okolností by lepšou alternatívou mohlo byť meranie RICC alebo by na vyhodnotenie cytotoxicity po 1,5-násobku trvania bunkového cyklu bolo užitočné použiť odhad pomocou RPD. Pokiaľ ide o lymfocyty v primárnych kultúrach, meradlom cytotoxických/cytostatických účinkov je mitotický index (MI), ktorý je však ovplyvnený časom od aplikácie testovanej chemikálie do jeho merania použitým mitogénom a prípadným narušením bunkového cyklu. MI je však prijateľný, pretože iné merania cytotoxicity môžu byť náročné a nepraktické a nemusia sa vzťahovať na cieľovú populáciu lymfocytov rastúcich v dôsledku reakcie na stimuláciu pomocou PHA. Zatiaľ čo v prípade bunkových línií sú odporúčanými parametrami cytotoxicity hodnoty RICC a RPD a v prípade primárnej kultúry lymfocytov sa na rovnaký účel odporúča hodnota MI, užitočné informácie by mohli vyplynúť aj z ďalších ukazovateľov (napr. z integrity buniek, apoptózy, nekrózy, bunkového cyklu). Mali by sa vyhodnocovať aspoň tri testované koncentrácie (bez zahrnutia kontroly s rozpúšťadlom a pozitívnej kontroly), ktoré spĺňajú kritériá prípustnosti (vhodná cytotoxicita, počet buniek atď.). Pri každej testovanej koncentrácii možno použiť akýkoľvek typ buniek (bunkové línie alebo primárne kultúry lymfocytov), buď replikátne kultúry alebo jednu ovplyvňovanú kultúru. Zatiaľ čo sa odporúča používanie duplikátnych kultúr, jednotlivé kultúry sú rovnako prípustné za predpokladu, že sa hodnotí rovnaký celkový počet buniek v jednotlivých resp. duplikátnych kultúrach. Použitie jednotlivých kultúr je obzvlášť dôležité pri viac ako 3 posudzovaných koncentráciách (pozri bod 31). Výsledky získané v nezávislých replikátnych kultúrach pri danej koncentrácii možno združiť na účely analýzy údajov (38). V prípade testovaných chemikálií, ktoré preukazujú malú alebo žiadnu cytotoxicitu, sú zvyčajne vhodné približne 2 až 3-násobné intervaly testovaných koncentrácií. Pri výskyte cytotoxicity by vybrané testované koncentrácie mali pokrývať rozsah od koncentrácie, ktorá vyvoláva cytotoxicitu, ako sa opisuje v bode 22, vrátane koncentrácií, pri ktorých je cytotoxicita mierna a slabá alebo žiadna. Mnohé testované chemikálie vykazujú strmé krivky závislosti reakcie od koncentrácie a s cieľom získať údaje pri nízkej a miernej cytotoxicite alebo podrobne preskúmať vzťah medzi dávkou a reakciou bude nevyhnutné použiť viac koncentrácií s tesným odstupom a/alebo viac ako tri koncentrácie (pre jednotlivé kultúry alebo replikáty), najmä v situáciách, kde sa vyžaduje opakovať experiment (pozri bod 47). Ak je maximálna koncentrácia založená na cytotoxicite, najvyššia koncentrácia by mala dosiahnuť 55 ± 5 % cytotoxicity pri použití odporúčaných parametrov cytotoxicity (t. j. v prípade bunkových línií zníženie hodnôt RICC a RPD a v prípade primárnych kultúr lymfocytov zníženie hodnoty MI na 45 ± 5 % hodnôt súbežnej negatívnej kontroly). Pozitívne výsledky, ktoré sa zistia len pri hornej hranici tohto 55 ± 5 % rozpätia cytotoxicity, by sa mali interpretovať s mimoriadnou opatrnosťou (13). V prípade málorozpustných testovaných chemikálií, ktoré nie sú cytotoxické pri koncentráciách nižších, ako je ich rozpustnosť, by najvyššia analyzovaná koncentrácia mala na konci aplikovania testovanej chemikálie vyvolať zákal alebo zrazeninu viditeľnú voľným okom alebo pomocou inverzného mikroskopu. Aj keď sa cytotoxicita vyskytne pri koncentrácii vyššej, ako je najnižšia nerozpustná koncentrácia daných chemikálií, testovať sa odporúča len pri jednej koncentrácii vyvolávajúcej zákal alebo viditeľnú zrazeninu, pretože falošné účinky môžu byť spôsobené zrazeninou. Pri koncentráciách vyvolávajúcich zrazeninu treba dbať na to, aby nedochádzalo k interferencii zrazeniny s priebehom testu (napr. pri farbení alebo bodovom hodnotení). Mohlo by byť užitočné pred začatím experimentu stanoviť rozpustnosť v rastovom médiu. Ak sa nezistí žiadna zrazenina alebo obmedzujúca cytotoxicita, najvyššia testovaná koncentrácia by mala zodpovedať 10 mM, 2 mg/ml alebo 2 μl/ml, podľa toho, ktorá je najnižšia (39) (40) (41). Ak testovaná chemikália nemá definované zloženie, napr. látka neznámeho alebo variabilného zloženia, produkt komplexných reakcií alebo biologický materiál (UVCB) (42), environmentálny extrakt atď., je možné, že v prípade nedostatočnej cytotoxicity sa na zvýšenie koncentrácie jednotlivých zložiek danej testovanej chemikálie bude musieť najvyššia koncentrácia zvýšiť (napr. na 5 mg/ml). Je však potrebné poznamenať, že tieto požiadavky sa môžu v prípade humánnych liekov líšiť (43). Kontroly Pri každom odbere by sa mali vykonať súbežné negatívne kontroly (pozri bod 15), ktoré pozostávajú iba zo samotného rozpúšťadla v médiu s testovanou chemikáliou a ktoré sú ovplyvňované rovnakým spôsobom ako ovplyvňované kultúry. Súbežné pozitívne kontroly sú potrebné na preukázanie schopnosti laboratória identifikovať klastogény v podmienkach použitého skúšobného protokolu a v prípade potreby aj (na preukázanie) účinnosti exogénneho systému metabolickej aktivácie. Príklady pozitívnych kontrol sú uvedené v tabuľke 1. Ak je to odôvodnené, možno použiť alternatívne iné chemikálie na pozitívnu kontrolu. Pretože testy genetickej toxicity in vitro na bunkách cicavcov sú dostatočne normalizované, použitie pozitívnych kontrol možno obmedziť len na metabolickú aktiváciu, ktorá si vyžaduje klastogén. Za predpokladu, že sa takýto test vykonáva súbežne s neaktivovaným testom s použitím rovnakej dĺžky ovplyvňovania, táto jediná pozitívna reakcia kontroly bude preukazovať aktivitu systému metabolickej aktivácie, ako aj citlivosť testovacieho systému. Dlhodobé ovplyvňovanie (bez S9) by však malo mať svoju vlastnú pozitívnu kontrolu, keďže dĺžka ovplyvňovania sa bude líšiť od testu s metabolickou aktiváciou. Každá pozitívna kontrola by sa mala použiť pri jednej alebo viacerých koncentráciách, pri ktorých sa očakáva reprodukovateľný a zistiteľný nárast nad hodnoty v pozadí, aby sa preukázala citlivosť testovacieho systému (t. j. aby účinky boli jasné, ale aby sa pri odčítavaní priamo neodhaľovala identita kódovaných preparátov), pričom by reakcia nemala byť narušená cytotoxicitou prevyšujúcu limity stanovené v testovacej metóde. Tabuľka 1 Referenčné chemikálie odporúčané na posúdenie spôsobilosti laboratória a na výber pozitívnych kontrol.
POSTUP Aplikácia testovanej chemikálie Proliferujúce bunky sa ovplyvnia testovanou chemikáliou za prítomnosti aj za neprítomnosti systému metabolickej aktivácie. Čas odberu kultúry Na účely dôkladného vyhodnotenia, ktoré by bolo potrebné na vyslovenie záveru, že ide o negatívny výsledok, by sa mali vykonať testy za všetkých troch ďalej uvedených experimentálnych podmienok, a to s použitím krátkodobého ovplyvňovania testovanou chemikáliou spolu s metabolickou aktiváciou alebo bez nej a s použitím dlhodobého ovplyvňovania testovanou chemikáliou bez metabolickej aktivácie (pozri body 43, 44 a 45):
V prípade, že ktorákoľvek z uvedených experimentálnych podmienok vedie k pozitívnej reakcii, nie je potrebné preskúmať ostatné dávkovacie schémy. Chromozómové preparáty Bunkové kultúry sa ošetrujú kolcemidom alebo kolchicínom zvyčajne 1 – 3 hodiny pred odberom. Každá bunková kultúra sa na prípravu chromozómových preparátov odoberá a spracúva oddelene. Príprava chromozómových preparátov zahŕňa hypotonické ošetrenie buniek, fixáciu a farbenie. V monovrstvových bunkových kultúrach sa mitotické bunky (možno ich identifikovať ako okrúhle a oddeľujúce sa od povrchu) môžu vyskytovať na konci 3 – 6 hodinového pôsobenia. Keďže sa tieto mitotické bunky dajú ľahko oddeliť, môžu sa stratiť pri odstraňovaní média obsahujúceho testovanú chemikáliu. Ak v čase odberu existuje dôkaz o výraznom zvýšení počtu mitotických buniek v porovnaní s kontrolami, čo by poukazovalo na možné zastavenie mitózy, potom by sa bunky mali zhromaždiť odstreďovaním a vrátiť späť ku kultúram, aby sa predišlo strate buniek v mitóze, ktorým hrozí vznik chromozómových aberácií. Analýza Všetky preparáty vrátane preparátov s negatívnymi a pozitívnymi kontrolami by sa pred mikroskopickou analýzou chromozómových aberácií mali nezávisle označiť kódmi. Keďže fixačné postupy často vedú k tomu, že časť metafázových buniek stratí chromozómy, vyhodnocované bunky by preto mali obsahovať centroméry, ktorých počet by sa mal rovnať modálnemu počtu chromozómov ± 2. Hodnotiť by sa malo najmenej 300 dobre rozotretých buniek v metafáze na jednu koncentráciu a kontrolu, aby bolo možné dôjsť k záveru, že testovaná chemikália je jednoznačne negatívna (pozri bod 45). V prípade používania replikátnych kultúr by sa uvedených 300 buniek malo rovnomerne rozdeliť medzi replikáty. Ak sa pri každej koncentrácii použije len jedna kultúra (pozri bod 21), uvedených najmenej 300 dobre rozprestrených buniek v metafáze by sa malo hodnotiť z tejto jednej kultúry. Prednosťou hodnotenia 300 buniek je zvyšovanie štatistickej sily testu, pričom sa okrem toho zriedka vyskytnú nulové hodnoty (predpokladá sa len 5 %) (44). Počet hodnotených metafáz možno znížiť, ak sa zistí veľký počet buniek s chromozómovými aberáciami a testovaná chemikália sa považuje za jasne pozitívnu. Mali by sa hodnotiť bunky so štruktúrnymi chromozómovými aberáciami, a to s gapmi a bez gapov. Definície zlomov a gapov sú uvedené v dodatku 1, podľa (45) (46). Aberácie chromatídového a chromozómového typu by sa mali zaznamenávať oddelene a klasifikovať podľa druhu (zlomy, výmeny). Postupy používané v laboratóriu by mali zabezpečiť, aby analýzy chromozómových aberácií vykonávali primerane vyškolení hodnotiaci pracovníci a aby sa podľa potreby partnersky preskúmali. Hoci účelom tohto testu je zistiť štruktúrne chromozómové aberácie, v prípade polyploidie a endoreduplikácie je dôležité zaznamenať frekvenciu týchto javov. (pozri bod 2). Spôsobilosť laboratória V záujme nadobudnutia dostatočných skúseností s testom pred jeho použitím na rutinné testovanie by laboratórium malo mať uskutočnené série experimentov s referenčnými pozitívnymi chemikáliami pôsobiacimi rôznymi mechanizmami a s rôznymi negatívnymi kontrolami (s použitím rôznych rozpúšťadiel/nosičov). Tieto reakcie pozitívnych a negatívnych kontrol by mali byť konzistentné s literatúrou. Táto požiadavka sa nevzťahuje na laboratóriá, ktoré majú skúsenosti, t. j. majú dostupnú historickú databázu, ako sa vymedzuje v bode 37. Na preukázanie spôsobilosti detegovať klastogénne chemikálie a určiť účinnosť systému metabolickej aktivácie by sa mal preskúmať výber chemikálií na pozitívnu kontrolu (pozri tabuľku 1 v bode 26), a to na základe krátkodobého a dlhodobého ovplyvňovania bez metabolickej aktivácie, ako aj na základe krátkodobého pôsobenia za prítomnosti metabolickej aktivácie. V záujme preukázania citlivosti a dynamického rozsahu testovacieho systému by sa rozsah koncentrácií vybraných chemikálií mal zvoliť tak, aby vznikali reprodukovateľné reakcie zvyšujúce sa v závislosti od koncentrácie nad úrovňou v pozadí. Historické údaje o kontrolách Laboratórium by malo vytvoriť:
Pri prvom získavaní údajov súvisiacich s rozdelením historických negatívnych kontrol by súbežné negatívne kontroly mali byť v súlade s uverejnenými údajmi kontrol, ak takéto údaje existujú. S pridávaním ďalších experimentálnych údajov k rozdeleniu kontrol by súbežné negatívne kontroly mali byť v ideálnom prípade v rámci 95 % regulačných medzí tohto rozdelenia (44) (47). Historickú databázu negatívnych kontrol laboratória by na začiatku malo tvoriť minimálne 10 experimentov, ale podľa možnosti by mala pozostávať aspoň z 20 experimentov vykonaných za porovnateľných experimentálnych podmienok. Laboratóriá by mali použiť metódy kontroly kvality, ako sú regulačné diagramy [napr. tzv. „C-charts“ alebo „X-bar charts“ (48)], s cieľom zistiť variabilitu svojich údajov týkajúcich sa pozitívnych a negatívnych kontrol a preukázať, že metodika v ich laboratóriu je „pod kontrolou“ (44). Ďalšie odporúčania k vytváraniu a využívaniu historických údajov (t. j. kritériá zaradenia údajov medzi historické údaje a ich vylúčenia z historických údajov a kritériá prijateľnosti v prípade daného experimentu) možno nájsť v literatúre (47). Všetky zmeny v experimentálnom protokole by sa mali posúdiť z hľadiska ich súladu s existujúcou historickou databázou kontrol laboratória. Akékoľvek závažné nezrovnalosti by mali vyústiť do vytvorenia novej historickej databázy kontrol. Údaje týkajúce sa negatívnych kontrol by mali zahŕňať výskyt buniek s chromozómovými aberáciami z jednej kultúry alebo súčet z replikátov kultúr, ako je opísané v bode 21. Súbežné negatívne kontroly by v ideálnom prípade mali byť v rámci 95 % regulačných medzí rozloženia historickej databázy negatívnych kontrol laboratória (44) (47). Ak údaje zo súbežných negatívnych kontrol nespadajú do 95 % regulačných medzí, môžu byť prijateľné na zaradenie do rozloženia historických kontrol, pokiaľ tieto údaje nie sú extrémne odľahlými hodnotami a pokiaľ existujú dôkazy, že testovací systém je „pod kontrolou“ (pozri bod 37) a neexistujú žiadne dôkazy o technickom alebo ľudskom zlyhaní. ÚDAJE A PREZENTOVANIE VÝSLEDKOV Prezentovanie výsledkov Vyhodnotiť by sa mal percentuálny podiel buniek so štruktúrnou chromozómovou aberáciou(-ami). Aberácie chromatídového a chromozómového typu klasifikované podľa druhu (zlomy, výmeny) by mali byť uvedené oddelene spolu s ich počtami a frekvenciami výskytu v prípade experimentálnych a kontrolných kultúr. Gapy sa zaznamenávajú a uvádzajú oddelene, ale neudávajú sa pri celkovej frekvencii aberácií. Uvádza sa percentuálny podiel polyploidie a/alebo endoreduplikovaných buniek, ak boli pozorované. Mali by sa zaznamenať súbežné merania cytotoxicity pre všetky ovplyvňované, ako aj negatívne a pozitívne kontrolné kultúry v hlavnom experimente zameranom na aberácie. Mali by sa uvádzať údaje o jednotlivých kultúrach. Okrem toho by sa všetky údaje mali uvádzať v tabuľkovej podobe. Kritériá prijateľnosti Prijateľnosť vychádza z týchto kritérií:
Vyhodnotenie a interpretácia výsledkov Za predpokladu, že všetky kritériá prijateľnosti sú splnené, sa testovaná chemikália pokladá za jasne pozitívnu, ak pre ktorúkoľvek z preskúmaných experimentálnych podmienok platí, že (pozri bod 28):
Ak sú splnené všetky tieto kritériá, potom sa testovaná chemikália považuje za schopnú vyvolať chromozómové aberácie v kultivovaných bunkách cicavcov v tomto testovacom systéme. Odporúčania týkajúce sa najvhodnejších štatistických metód možno nájsť v literatúre (49) (50) (51). Za predpokladu, že všetky kritériá prijateľnosti sú splnené, sa testovaná chemikália pokladá za jasne negatívnu, ak pri všetkých preskúmaných experimentálnych podmienkach (pozri bod 28) platí, že:
Testovaná chemikália sa považuje za neschopnú vyvolať chromozómové aberácie v kultivovaných bunkách cicavcov v tomto testovacom systéme. Overenie jasnej pozitívnej alebo negatívnej reakcie sa nevyžaduje. V prípade, že reakcia nie je jednoznačne negatívna, ani jednoznačne pozitívna podľa uvedeného opisu, alebo v prípade, že ide o pomoc pri stanovovaní biologickej relevantnosti výsledku, by sa údaje mali odborne posúdiť a/alebo podrobiť ďalšiemu skúmaniu. Užitočné by mohlo byť hodnotenie ďalších buniek (ak je to vhodné) alebo opakovanie experimentu podľa možnosti za modifikovaných experimentálnych podmienok [napr. odstup koncentrácií, iné podmienky metabolickej aktivácie (t. j. koncentrácia S9 alebo pôvod S9)]. V zriedkavých prípadoch, dokonca aj po ďalších skúmaniach, z údajov nemožno vyvodiť záver o tom, či sú výsledky pozitívne alebo negatívne, a preto sa reakcia na testovanú chemikáliu uzavrie ako reakcia s nejasným výsledkom. Nárast počtu polyploidných buniek môže naznačovať, že testované chemikálie majú potenciál brzdiť mitotické procesy a indukovať numerické chromozómové aberácie (52). Nárast počtu buniek s endoreduplikovanými chromozómami môže naznačovať, že testované chemikálie majú potenciál brzdiť priebeh bunkového cyklu (53) (54) (pozri bod 2). Preto by sa incidencia polyploidných buniek a buniek s endoreduplikovanými chromozómami mala zaznamenávať oddelene. Skúšobný protokol Skúšobný protokol by mal zahŕňať tieto informácie:
LITERATÚRA
Dodatok 1 DEFINÍCIE Aneuploidia : akákoľvek odchýlka od bežného diploidného (alebo haploidného) počtu chromozómov vo forme jedného alebo viacerých chromozómov, nie však vo forme celého súboru(-ov) chromozómov (polyploidia). Apoptóza : programovaná bunková smrť charakterizovaná sériou krokov, ktoré vedú k rozpadu buniek na telieska ohraničené membránou, ktoré sa následne fagocytujú alebo vypudzujú. Proliferácia buniek : zvýšenie počtu buniek v dôsledku mitotického delenia bunky. Chemikália : látka alebo zmes. Chromatidový zlom : prerušenie jednej chromatídy so zjavným posunutím jednej z chromatíd. Chromatidový gap : nefarbiaca sa oblasť (achromatická lézia) jednej chromatídy s minimálnym posunutím chromatíd. Aberácia chromatidového typu : štruktúrne chromozómové poškodenie prejavujúce sa ako zlom jednej z chromatíd alebo zlom a opätovné spojenie medzi chromatídami. Aberácia chromozómového typu : štruktúrne chromozómové poškodenie prejavujúce sa ako zlom alebo zlom a opätovné spojenie oboch chromatíd na rovnakej strane. Klastogén : každá chemikália, ktorá spôsobuje štruktúrne chromozómové aberácie v populáciách buniek alebo eukaryotických organizmov. Koncentrácie : odkaz na konečné koncentrácie testovanej chemikálie v rastovom médiu. Cytotoxicita : V prípade skúšok uvedených v tejto testovacej metóde s využitím bunkových línií je cytotoxicita identifikovaná ako zníženie relatívneho zdvojenia populácie (RPD) alebo relatívne zvýšenie počtu buniek (RICC), pokiaľ ide o ovplyvňované bunky v porovnaní s negatívnou kontrolnou (pozri bod 17 a dodatok 2). V prípade skúšok uvedených v tejto testovacej metóde s využitím primárnych kultúr lymfocytov je cytotoxicita identifikovaná ako zníženie mitotického indexu (MI) ošetrených buniek v porovnaní s negatívnou kontrolnou (pozri bod 18 a dodatok 2). Endoreduplikácia : proces, v ktorom po S fáze replikácie DNA jadro neprechádza do mitózy, ale začína ďalšiu S fázu. Výsledkom sú chromozómy so 4, 8, 16… chromatídami. Genotoxický : všeobecný pojem, ktorý zahŕňa všetky typy poškodení DNA alebo chromozómov vrátane zlomov, delécií, aduktov, modifikácií a spojení nukleotidov, prestavby, génových mutácií, chromozómových aberácií a aneuploidie. Nie všetky typy genotoxických účinkov majú za následok mutácie alebo trvalé poškodenie chromozómu. Mitotický index (MI) : pomer medzi počtom buniek v metafáze a celkovým počtom buniek v populácii buniek, ktorý je meradlom stupňa proliferácie tejto populácie. Mitóza : delenie bunkového jadra, ktoré sa zvyčajne delí na profázu, prometafázu, metafázu, anafázu a telofázu. Mutagénny : produkujúci dedičnú zmenu sekvencie(-í) bázových párov DNA v génoch alebo štruktúre chromozómov (chromozómové aberácie). Numerická aberácia : zmena v počte chromozómov v porovnaní s bežným počtom charakteristickým pre použité bunky. Polyploidia : numerické chromozómové aberácie v bunkách alebo organizmoch, ktoré sa týkajú celého súboru(-ov) chromozómov na rozdiel od jednotlivého chromozómu alebo chromozómov (aneuploidia). Stav p53 : proteín p53 je zapojený do regulácie bunkového cyklu, apoptózy a opravy DNA. Bunky s nedostatkami vo funkčnom proteíne p53, ktoré nie sú schopné zastaviť bunkový cyklus alebo odstrániť poškodené bunky prostredníctvom apoptózy alebo iných mechanizmov (napr. indukciou opravy DNA) súvisiacich s funkciami p53 pri reakcii na poškodenie DNA, by mali byť teoreticky náchylnejšie na génové mutácie či chromozómové aberácie. Relatívne zvýšenie počtu buniek (Relative Increase in Cell Counts, RICC) : zvýšenie počtu buniek v kultúrach vystavených chemikálii voči zvýšeniu v neošetrených kultúrach, pomer vyjadrený v percentách. Relatívne zdvojenie populácie (Relative Population Doubling, RPD) : zvýšenie počtu zdvojení populácie v kultúrach vystavených chemikálii voči zvýšeniu v neošetrených kultúrach, pomer vyjadrený v percentách. Frakcia pečene S9 : supernatant homogenátu pečene po odstredení pri 9 000 g, t. j. surový pečeňový extrakt. Zmes S9 : zmes frakcie pečene S9 a kofaktorov potrebných pre aktivitu metabolických enzýmov Kontrola s aplikovaným rozpúšťadlom : všeobecný pojem na vymedzenie kontrolných kultúr, na ktoré bolo aplikované samotné rozpúšťadlo, ktoré bolo použité na rozpustenie testovanej chemikálie. Štruktúrna chromozómová aberácia : zmena v chromozómovej štruktúre rozpoznateľná mikroskopickým skúmaním metafázového štádia delenia buniek, pozorovaná ako delécie a fragmenty, intrachromozómové výmeny alebo interchromozómové výmeny. Testovaná chemikália : akákoľvek látka alebo zmes, ktorá sa testuje touto testovacou metódou. Neošetrené kontroly : kultúry, ktoré sa neovplyvňujú (t. j. ani testovanou chemikáliou ani rozpúšťadlom), ale súbežne sa spracúvajú rovnakým spôsobom ako kultúry ovplyvňované testovanou chemikáliou. Dodatok 2 VZORCE NA POSÚDENIE CYTOTOXICITY Mitotický index (MI):
Odporúča sa použiť relatívne zvýšenie počtu buniek (RICC) alebo relatívne zdvojenie populácie (RPD), pretože obidva indexy zohľadňujú pomer populácie buniek, u ktorých došlo k deleniu.
kde: Zdvojenie populácie = [log (počet buniek po ošetrení ÷ počiatočný počet buniek)] ÷ log 2. Napríklad hodnota 53 % RICC alebo RDP poukazuje na 47 % cytotoxicitu/cytostázu a 55 % cytotoxicita/cytostáza meraná prostredníctvom MI znamená, že skutočný MI predstavuje 45 % kontroly. V každom prípade by sa mal merať počet buniek pred ovplyvňovaním, ako aj počet buniek v ovplyvňovaných a negatívnych kontrolných kultúrach. Hoci sa pomer RCC (t. j. počet buniek v ovplyvňovaných kultúrach/počet buniek v kontrolných kultúrach) v minulosti používal ako parameter cytotoxicity, už sa viac neodporúča, pretože sa ním môže podceniť cytotoxicita. V negatívnych kontrolných kultúrach by zdvojenie populácie malo byť zlučiteľné s požiadavkou na odber vzorky buniek po ovplyvňovaní v čase ekvivalentnom približne 1,5-násobku dĺžky bežného bunkového cyklu a mitotický index by mal byť dostatočne zvýšený na získanie dostatočného počtu buniek v mitóze a na spoľahlivé vypočítanie 50 % zníženia. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4. |
V časti B sa kapitola B.11 nahrádza takto: „B.11 Test na chromozómové aberácie v cicavčích bunkách kostnej drene ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov 475 (2016). Je súčasťou série testovacích metód v oblasti genetickej toxikológie. V tejto súvislosti bol vypracovaný aj dokument OECD, ktorý poskytuje stručné informácie o vykonávaní testov v oblasti genetickej toxikológie a prehľad o súčasných zmenách, ktorými tieto usmernenia na vykonávanie testov prešli (1). Tento in vivo test na chromozómové aberácie v cicavčích bunkách kostnej drene je osobitne relevantný pre posúdenie genotoxicity, pretože faktory ako in vivo metabolizmus, farmakokinetika a oprava DNA sú aktívne a prispievajú k reakciám, hoci sa v prípade rôznych druhov môžu líšiť. Skúška in vivo je užitočná aj pre ďalšie skúmanie genotoxicity zistenej pomocou in vitro systému. Test na chromozómové aberácie v cicavčích bunkách in vivo sa používa na zisťovanie štruktúrnych chromozómových aberácií indukovaných testovanou chemikáliou v bunkách kostnej drene zvierat, zvyčajne hlodavcov (2) (3) (4) (5). Štruktúrne chromozómové aberácie sa vyskytujú v dvoch typoch, chromozómové alebo chromatidové. Zatiaľ čo väčšina aberácií indukovaných genotoxickou chemikáliou je chromatidového typu, vyskytujú sa aj aberácie chromozómového typu. Chromozómové poškodenia a súvisiace javy sú príčinou mnohých ľudských genetických chorôb a existujú dostatočné dôkazy o tom, že pokiaľ tieto lézie a súvisiace javy spôsobujú zmeny onkogénov a tumor supresorových génov, sú zapojené do vzniku rakoviny u ľudí a v pokusných systémoch. V in vivo testoch na chromozómové aberácie by mohla vzniknúť polyploidia (vrátane endoreduplikácie). Samotné zvýšenie polyploidie však nenaznačuje aneugénny potenciál a môže jednoducho znamenať narušenie bunkového cyklu alebo cytotoxicitu. Tento test nie je určený na meranie aneuploidie. Na detekciu aneuploidie sa odporúčajú in vivo a in vitro testy ako in vivo mikrojadrový test na erytrocytoch cicavcov (kapitola B.12 tejto prílohy) alebo in vitro mikrojadrový test bunkách cicavcov (kapitola B.49 tejto prílohy). Použité definície termínov sú uvedené v dodatku 1. ÚVODNÉ ÚVAHY V tomto teste sa zvyčajne používajú hlodavce, ale ak je to vedecky opodstatnené, v niektorých prípadoch môžu byť vhodné aj iné druhy. Cieľovým tkanivom v tomto teste je kostná dreň, pretože je to vysokovaskularizovaným tkanivom a obsahuje populáciu rýchlo sa deliacich buniek, ktoré sa dajú jednoducho izolovať a spracovať. V správe by sa malo uviesť vedecké odôvodnenie použitia iných druhov než potkanov a myší. Ak sa použijú iné druhy než hlodavce, odporúča sa, aby sa meranie chromozómových aberácií v bunkách kostnej drene začlenilo do iného vhodného testu toxicity. Ak existujú dôkazy, že testovaná chemikália, resp. testované chemikálie alebo ich metabolity nedosiahnu cieľové tkanivo, použitie tohto testu nemusí byť vhodné. Pred použitím testovacej metódy v prípade zmesi s cieľom generovať údaje pre zamýšľaný regulačný účel by sa malo zvážiť, či môže poskytnúť primerané výsledky na tento účel, a ak môže, malo by sa to zdôvodniť. Takéto úvahy nie sú potrebné, ak existuje regulačná požiadavka na testovanie zmesi. PRINCÍP TESTOVACEJ METÓDY Zvieratá sa testovanej chemikálii vystavia vhodnou cestou a vo vhodnom čase po aplikácii testovanej chemikálie sa humánne usmrtia. Pred usmrtením sa zvieratám aplikuje prostriedok zastavujúci metafázu (napr kolchicín alebo kolcemid). Následne sa z kostnej drene urobia chromozómové preparáty, zafarbia sa a bunky v metafáze sa analyzujú na chromozómové aberácie. OVEROVANIE SPÔSOBILOSTI LABORATÓRIA Zisťovanie spôsobilosti V záujme nadobudnutia dostatočných skúseností s vykonávaním skúšky pred jej použitím na rutinné testovanie by laboratórium malo preukázať schopnosť reprodukovať výsledky predpokladané na základe zverejnených údajov [napr. (6)], pokiaľ ide o frekvenciu výskytu chromozómových aberácií, s minimálne dvomi chemikáliami na pozitívnu kontrolu (vrátane slabých reakcií indukovaných nízkymi dávkami pozitívnych kontrol), ako sú chemikálie uvedené v tabuľke 1, a s kompatibilnými kontrolami s nosičom/rozpúšťadlom (pozri bod 22). Pri týchto experimentoch by sa mali používať dávky, ktoré vyvolajú reprodukovateľný a od dávky závislý nárast účinku a preukážu citlivosť a dynamický rozsah testovacieho systému v predmetnom tkanive (kostná dreň), pričom sa použije metóda hodnotenia, ktorá sa má uplatňovať v laboratóriu. Táto požiadavka sa nevzťahuje na laboratóriá, ktoré majú skúsenosti, t. j. majú dostupnú historickú databázu, ako sa vymedzuje v bodoch 10 – 14. Historické údaje o kontrolách V priebehu zisťovania spôsobilosti by malo laboratórium určiť:
Pri prvom získavaní údajov súvisiacich s rozdelením historických negatívnych kontrol by súbežné negatívne kontroly mali byť v súlade s uverejnenými údajmi týkajúcimi sa kontrol, ak takéto údaje existujú. S pridávaním ďalších experimentálnych údajov k rozdeleniu historických kontrol by súbežné negatívne kontroly mali byť v ideálnom prípade v rámci 95 % regulačných medzí tohto rozdelenia. Historická databáza negatívnych kontrol laboratória by mala byť štatisticky solídna, aby sa zaistila schopnosť laboratória posudzovať rozdelenie jeho údajov týkajúcich sa negatívnych kontrol. Na základe literatúry môže byť potrebných minimálne 10 experimentov, no bolo by vhodnejšie vykonať aspoň 20 experimentov za porovnateľných experimentálnych podmienok. Laboratóriá by mali používať metódy kontroly kvality, ako sú regulačné diagramy [napr. tzv. „C-charts“ alebo „X-bar charts“ (7)], s cieľom zistiť variabilitu svojich údajov a preukázať, že metodika v ich laboratóriu je „pod kontrolou“. Ďalšie odporúčania k vytváraniu a využívaniu historických údajov (t. j. kritériá zaradenia údajov medzi historické údaje a ich vylúčenia z historických údajov a kritériá prijateľnosti v prípade daného experimentu) možno nájsť v literatúre (8). Ak laboratórium nevykoná dostatočný počet experimentov na vytvorenie štatisticky solídneho rozdelenia negatívnych kontrol (pozri bod 11) počas zisťovania spôsobilosti (ako sa opisuje v bode 9), je prijateľné, aby sa rozdelenie vytváralo počas prvých rutinných testov. Tento postup by mal vychádzať z odporúčaní uvedených v literatúre (8) a výsledky negatívnych kontrol získané na základe týchto experimentov by mali zostať v súlade s uverejnenými údajmi týkajúcimi sa negatívnych kontrol. Všetky zmeny v experimentálnom protokole by sa mali posúdiť z hľadiska ich vplyvu na výsledné údaje, ktoré musia zostať v súlade s existujúcou historickou databázou kontrol laboratória. K vytvoreniu novej historickej databázy kontrol by mali viesť len veľké rozdiely, ak sa na základe odborného posúdenia stanoví, že sa líši od predchádzajúceho rozdelenia (pozri bod 11). Počas tejto obnovy nemusí byť na vykonanie príslušného testu potrebná úplná databáza negatívnych kontrol, ak laboratórium vie preukázať, že jeho hodnoty súbežných negatívnych kontrol sú naďalej v súlade s jeho predchádzajúcou databázou alebo s príslušnými uverejnenými údajmi. Údaje týkajúce sa negatívnych kontrol by mali zahŕňať údaje o výskyte štruktúrnych chromozómových aberácií (s výnimkou gapov) u každého zvieraťa. Súbežné negatívne kontroly by v ideálnom prípade mali byť v rámci 95 % regulačných medzí rozdelenia historickej databázy negatívnych kontrol laboratória. Ak údaje zo súbežných negatívnych kontrol nespadajú do 95 % regulačných medzí, môžu byť prijateľné na zaradenie do rozdelenia historických kontrol, pokiaľ tieto údaje nie sú extrémne odľahlými hodnotami a pokiaľ existujú dôkazy, že testovací systém je „pod kontrolou“ (pozri bod 11) a neexistujú žiadne dôkazy o technickom alebo ľudskom zlyhaní. OPIS METÓDY Príprava Výber živočíšnych druhov Mali by sa vyberať bežne používané laboratórne kmene zdravých mladých dospelých zvierat. Bežne sa používajú potkany, hoci vhodné môžu byť aj myši. Použiť možno akékoľvek iné vhodné druhy cicavcov, ak je to vedecky zdôvodnené v správe. Podmienky umiestnenia a kŕmenia zvierat V prípade hlodavcov by mala byť teplota v miestnosti pre zvieratá 22 °C (± 3 °C). Hoci ideálna relatívna vlhkosť by mala byť 50 – 60 %, mala by dosahovať minimálne 40 % a podľa možnosti by nemala presiahnuť 70 % okrem času čistenia miestnosti. Osvetlenie by malo byť umelé so striedaním 12 hodín svetla a 12 hodín tmy. Na kŕmenie možno používať bežné laboratórne krmivo s neobmedzeným prísunom pitnej vody. Výber krmiva môže byť ovplyvnený potrebou zabezpečiť vhodnú prímes testovanej chemikálie, keď sa podáva týmto spôsobom. Hlodavce by mali byť umiestnené do malých skupín (najviac päť zvierat na jednu klietku) rovnakého pohlavia a testovanej skupiny, pokiaľ sa nepredpokladá žiadne agresívne správanie, pričom sa uprednostňujú klietky s pevnou podlahou a vhodne obohateným prostredím. Zvieratá môžu byť umiestnené samostatne len vtedy, ak je to vedecky opodstatnené. Príprava zvierat Bežne sa používajú zdravé mladé dospelé zvieratá (pri hlodavcoch je ideálny vek 6 – 10 týždňov na začiatku testovania, hoci je prijateľný aj trochu vyšší vek), ktoré sa náhodne rozdelia do kontrolných a testovaných skupín. Každé zviera sa jedinečne označí humánnou, minimálne invazívnou metódou (napr. krúžkovanie, označenie štítkom, aplikácia mikročipu alebo biometrická identifikácia, nie však skracovanie uší ani prstov) a aklimatizuje sa na laboratórne podmienky v priebehu minimálne piatich dní. Klietky sa usporiadajú tak, aby sa minimalizovali prípadné vplyvy spôsobené ich umiestnením. Malo by sa zabrániť krížovej kontaminácii pozitívnou kontrolou a testovanou chemikáliou. Na začiatku štúdie by mala byť hmotnostná variácia zvierat minimálna a nemala by presiahnuť ± 20 % priemernej hmotnosti každého pohlavia. Príprava dávok Tuhé testované chemikálie by sa pred podávaním dávok zvieratám mali rozpustiť alebo rozptýliť vo vhodných rozpúšťadlách alebo nosičoch alebo primiešať do krmiva alebo pitnej vody. Kvapalné testované chemikálie sa môžu podávať priamo alebo ich pred podávaním možno rozriediť. V prípade inhalačných expozícií možno testované chemikálie v závislosti od ich fyzikálno-chemických vlastností podávať vo forme plynu, pary alebo aerosólu (tuhá látka/kvapalina). Pokiaľ sa v údajoch o stabilite neuvádza prijateľnosť skladovania a nevymedzujú sa jeho vhodné podmienky, testovaná chemikália by sa mala používať čerstvo pripravená. Rozpúšťadlo/nosič Rozpúšťadlo/nosič by nemali vyvolávať toxické účinky pri používaných dávkach a nemalo by sa o nich predpokladať, že budú chemicky reagovať s testovanými chemikáliami. Ak sa používajú iné ako dobre známe rozpúšťadlá/nosiče, ich použitie by mali podporiť referenčné údaje uvádzajúce ich kompatibilitu. Odporúča sa podľa možnosti najskôr zvážiť použitie vodného rozpúšťadla/nosiča. Príklady bežne používaných kompatibilných rozpúšťadiel/nosičov zahŕňajú vodu, fyziologický roztok, roztok metylcelulózy, roztok sodnej soli karboxymetylcelulózy, olivový olej a kukuričný olej. Ak neexistujú historické alebo zverejnené údaje o kontrolách, z ktorých vyplýva, že zvolené atypické rozpúšťadlo/nosič neindukuje tvorbu štruktúrnych chromozómových aberácií ani iné škodlivé účinky, mala by sa vykonať východisková štúdia s cieľom stanoviť prijateľnosť rozpúšťadla/nosiča ako kontroly. Kontroly Pozitívne kontroly Do každého testu by sa za normálnych okolností mala zahrnúť skupina zvierat, ktorej bola podaná chemikália na pozitívnu kontrolu. Možno od toho upustiť v prípade, že testovacie laboratórium preukázalo spôsobilosť pri vykonávaní testu a stanovilo rozsah historických pozitívnych kontrol. Ak nie je zahrnutá súbežná pozitívna kontrolná skupina, do každého experimentu by sa mali zahrnúť kontroly hodnotenia (fixované a nezafarbené preparáty). Možno ich získať tak, že sa do hodnotenia štúdie zahrnú vhodné referenčné vzorky získané a uchované zo samostatného experimentu s pozitívnou kontrolou, ktorý sa vykonáva periodicky (napr. každých 6 až 18 mesiacov) v laboratóriu, kde sa test vykonáva; napríklad počas testovania spôsobilosti a potom pravidelne, podľa potreby. Chemikálie na pozitívnu kontrolu by mali spoľahlivo vyvolať zistiteľný nárast frekvencie buniek so štruktúrnymi chromozómovými aberáciami nad spontánnu úroveň. Dávky pozitívnej kontroly by sa mali voliť tak, aby boli účinky zjavné, ale aby hodnotiteľovi priamo neodhaľovali identitu kódovaných vzoriek. Je prijateľné, aby sa pozitívne kontroly podávali inou cestou ako testovaná chemikália, na základe iného harmonogramu aplikácie, a aby sa vzorky odoberali len jeden raz. V náležitých prípadoch možno na pozitívnu kontrolu takisto zvážiť použitie chemikálií rovnakej chemickej triedy. Príklady chemikálií na pozitívnu kontrolu sú uvedené v tabuľke 1. Tabuľka 1 Príklady chemikálií na pozitívnu kontrolu
Negatívne kontroly Zvieratá v negatívnych kontrolných skupinách by mali byť zahrnuté do každého odberu a inak by sa s nimi malo zaobchádzať rovnako ako s testovanými skupinami, nebude im však podaná testovaná chemikália. Ak sa pri podávaní testovanej chemikálie použije rozpúšťadlo/nosič, kontrolná skupina by mala dostať toto rozpúšťadlo/nosič. Ak sa však na základe historických údajov o negatívnych kontrolách pri každom odbere vzoriek v danom testovacom laboratóriu preukážu konzistentné údaje o variabilite medzi zvieratami a o frekvenciách buniek so štruktúrnymi aberáciami, môže byť pre negatívnu kontrolu potrebný len jeden odber. Ak sa na negatívne kontroly použije len jeden odber, mal by to byť odber vykonaný prvý raz v štúdii. POSTUP Počet zvierat a ich pohlavie Vo všeobecnosti je reakcia vo forme vzniku mikrojadier podobná u samcov a samíc (9) a očakáva sa, že to bude platiť aj v prípade štruktúrnych chromozómových aberácií, preto by sa väčšina štúdií mohla uskutočniť na oboch pohlaviach. Údaje, ktoré poukazujú na relevantné rozdiely medzi samcami a samicami (napr. rozdiely v systémovej toxicite, metabolizme, biodostupnosti, toxicite pre kostnú dreň atď. vrátane napr. štúdie na vyhľadávanie rozsahu), by boli v prospech používania oboch pohlaví. V takomto prípade môže byť vhodné vykonať štúdiu na oboch pohlaviach, a to napr. ako súčasť štúdie toxicity po opakovaných dávkach. Ak sa použijú obe pohlavia, mohlo by byť vhodné použiť faktoriálny návrh. Podrobnosti o analýze údajov s použitím tohto návrhu sú uvedené v dodatku 2. Mala by sa stanoviť veľkosť skupín na začiatku štúdie s cieľom poskytnúť minimálne 5 analyzovateľných zvierat jedného pohlavia alebo, ak sa použijú zvieratá oboch pohlaví, 5 zvierat každého pohlavia za skupinu. V prípade, že expozícia ľudí chemikáliám potenciálne súvisí s pohlavím, ako napríklad v prípade niektorých liekov, daný test by sa mal vykonať na jedincoch príslušného pohlavia. Ako pomôcku pri bežných požiadavkách týkajúcich sa maximálneho počtu zvierat možno uviesť, že štúdia na kostnej dreni s dvomi odbermi vzoriek, tromi dávkovými skupinami a so súbežnými negatívnymi a pozitívnymi kontrolami (každá skupina zložená z piatich zvierat jedného pohlavia) by si vyžadovala 45 zvierat. Úrovne dávok Ak sa z dôvodu, že ešte nie sú dostupné vhodné údaje na pomoc pri výbere dávky, vykoná predbežná štúdia na vyhľadávanie rozsahu, mala by sa vykonať v tom istom laboratóriu s použitím toho istého druhu, kmeňa, pohlavia a dávkovacej schémy, aké majú byť použité v hlavnej štúdii (10). Štúdia by sa mala zamerať na zistenie maximálnej tolerovanej dávky (MTD) definovanej ako najvyššia dávka, ktorá sa bude tolerovať bez dôkazu toxicity obmedzujúcej štúdiu, a to vzhľadom na trvanie štúdie (napr. indukovaním zníženia telesnej hmotnosti alebo hematopoetickej systémovej cytotoxicity), ale nie smrti ani znakov bolesti, utrpenia či ťažkostí, ktoré si vyžadujú humánne usmrtenie (11). Najvyššiu dávku možno takisto definovať ako dávku, ktorá spôsobuje určité známky toxicity v kostnej dreni. Chemikálie, ktoré vykazujú saturáciu toxikokinetických vlastností alebo indukujú detoxikačné procesy, ktoré môžu viesť k zníženiu expozície po dlhodobom ovplyvňovaní, môžu byť vyňaté z kritérií na stanovenie dávok a mali by sa hodnotiť jednotlivo. V záujme získania informácií o reakcii na dávku by kompletná štúdia mala zahŕňať negatívnu kontrolnú skupinu a minimálne tri úrovne dávok vo všeobecnosti oddelené faktorom 2, ale nie vyšším ako 4. Ak testovaná chemikália nevyvoláva toxicitu v štúdii na vyhľadávanie rozsahu alebo na základe existujúcich údajov, najvyššia dávka pri jednorazovom podaní by mala byť 2 000 mg/kg telesnej hmotnosti. Ak však testovaná chemikália spôsobuje toxicitu, maximálna tolerovaná dávka by mala byť najvyššia podávaná dávka a použité úrovne dávky by mali podľa možnosti pokrývať rozsah od maximálnej dávky po dávku, ktorá spôsobuje slabú alebo nespôsobuje žiadnu toxicitu. Ak sa zistí toxicita v cieľovom tkanive (kostná dreň) pri všetkých testovaných úrovniach dávok, odporúča sa vykonať ďalšiu štúdiu s netoxickými dávkami. Štúdie, ktorých cieľom je podrobnejšie charakterizovať kvantitatívne informácie o reakcii na dávku, si môžu vyžadovať ďalšie dávkové skupiny. V prípade určitých druhov testovaných chemikálií (napr. humánne lieky), na ktoré sa vzťahujú osobitné požiadavky, sa tieto limity môžu líšiť. Limitný test Ak z pokusov na vyhľadávanie rozsahu dávok alebo existujúcich údajov týkajúcich sa príbuzných kmeňov zvierat vyplýva, že dávkovací režim, aspoň pokiaľ ide o limitujúcu dávku (opísanú ďalej v texte), nespôsobuje žiadne pozorovateľné toxické účinky (vrátane žiadneho poklesu proliferácie kostnej drene alebo iného dôkazu cytotoxicity v cieľovom tkanive), a ak by sa genotoxicita na základe in vitro štúdií genotoxicity alebo na základe údajov týkajúcich sa štrukturálne príbuzných chemikálií neočakávala, potom nemusí byť potrebná úplná štúdia s použitím troch úrovní dávok, ak sa preukázalo, že testovaná chemikália(-e) dosahuje cieľové tkanivo (kostná dreň). V takýchto prípadoch môže byť postačujúca jedna dávka na úrovni limitujúcej dávky. V prípade obdobia podávania chemikálie dlhšieho než 14 dní predstavuje limitujúca dávka 1 000 mg/kg telesnej hmotnosti/deň. V prípade období podávania chemikálie počas najviac 14 dní predstavuje limitujúca dávka 2 000 mg/kg telesnej hmotnosti/deň. Podávanie dávok Pri plánovaní skúšky by sa mal zvážiť predpokladaný spôsob expozície ľudí. Preto možno ako opodstatnené zvoliť spôsoby expozície prostredníctvom stravy, pitnej vody, topickou, subkutánnou cestou, intravenózne, perorálne (pomocou sondy), inhalačne, intratracheálne alebo implantačne. V každom prípade by sa mal zvoliť spôsob, ktorým sa zabezpečí primeraná expozícia cieľového tkaniva(-ív). Vo všeobecnosti sa neodporúča použitie intraperitoneálnej injekcie, keďže to nie je zamýšľaný spôsob expozície ľudí, a mal by sa použiť iba s osobitným vedeckým zdôvodnením. Ak je testovaná chemikália primiešaná do krmiva alebo pitnej vody, najmä v prípade jednej dávky, treba venovať pozornosť tomu, aby sa medzi spotrebou potravy a vody a odberom vzorky ponechal dostatočný čas na zistenie účinkov (pozri body 33 – 34). Maximálny objem kvapaliny, ktorá sa môže naraz podávať sondou alebo injekciou, závisí od veľkosti testovaného zvieraťa. Objem by za bežných okolností nemal prekročiť 1 ml/100 g telesnej hmotnosti okrem vodných roztokov, pri ktorých možno použiť najviac 2 ml/100 g. Požitie väčších ako uvedených objemov by malo byť opodstatnené. S výnimkou dráždivých alebo žieravých testovaných chemikálií, ktoré pri vyšších koncentráciách zvyčajne vyvolajú zhoršenie účinkov, by sa variabilita v objeme testovanej chemikálie mala minimalizovať tým, že sa koncentrácia upraví tak, aby sa na všetkých úrovniach dávok zabezpečil stály objem vo vzťahu k telesnej hmotnosti. Harmonogram aplikácie Testované chemikálie sa bežne podávajú jednorazovou aplikáciou, ale možno ich podať v delenej dávke (t. j. dve alebo viaceré aplikácie v jeden deň s časovým odstupom najviac 2 – 3 hodiny), čím sa uľahčí podávanie veľkého objemu chemikálie. Za týchto okolností alebo pri podávaní testovanej chemikálie inhalačne by sa mal čas odberu vzoriek naplánovať na základe posledného podania dávky alebo skončenia vystavenia. V prípade tohto testu existuje len málo dostupných údajov o vhodnosti protokolu opakovanej dávky. V prípadoch, kedy je žiaduce, aby tento test zahŕňal test toxicity po opakovaných dávkach, treba dbať na to, aby sa zabránilo strate mitotických buniek s poškodenými chromozómami, čo sa pri toxických dávkach môže stať. Táto integrácia je prijateľná, ak je najvyššia dávka väčšia alebo sa rovná limitujúcej dávke (pozri bod 29) a dávkovej skupine sa počas trvania testu podáva limitujúca dávka. Ak je žiaduca integrácia s inými štúdiami, v prípade chromozómových aberácií by sa ako preferovaný in vivo test mal posúdiť mikrojadrový test (testovacia metóda B.12). Vzorky kostnej drene by sa mali odoberať v dvoch rôznych časoch po jednej aplikácii testovanej chemikálie. V prípade hlodavcov by prvým intervalom odberu vzorky mal byť čas potrebný na dokončenie 1,5-násobku dĺžky bežného bunkového cyklu (zvyčajne 12 – 18 hodín) po období aplikácie chemikálie. Keďže čas potrebný na príjem a metabolizmus testovanej látky(-ok) a účinky testovanej látky na kinetiku bunkového cyklu môžu ovplyvniť optimálny čas na zistenie chromozómovej aberácie, odporúča sa neskoršie odobratie vzorky – 24 hodín po čase prvého odberu vzorky. V čase prvého odberu by sa mala všetkým dávkovým skupinám aplikovať chemikália a mali by sa odobrať vzorky na analýzu; pri neskoršom odbere(-och) je však potrebné podať len najvyššiu dávku. Ak sa na základe vedeckého zdôvodnenia používajú dávkovacie režimy dlhšie ako jeden deň, všeobecne by sa mal uskutočniť jeden odber vzorky pri približne 1,5-násobku dĺžky bežného bunkového cyklu po poslednej aplikácii chemikálie. Po ošetrení a pred odberom vzoriek sa zvieratám intraperitoneálne vstrekne vhodná dávka prostriedku zastavujúceho metafázu (napr. kolcemid alebo kolchicín) a vzorky sa odoberú po uplynutí vhodného času. V prípade myší je tento interval približne 3 – 5 hodín pred odberom a v prípade potkanov 2 – 5 hodín. Bunky sa po odobratí z kostnej drene nechajú napučať, fixujú a farbia sa a analyzujú sa na chromozómové aberácie (12). Pozorovania Najmenej raz denne by sa mali vykonať všeobecné klinické pozorovania testovaných zvierat a zaznamenať klinické príznaky, najlepšie každý deň v rovnakom čase a s ohľadom na časový interval najintenzívnejších predpokladaných účinkov po podaní dávky. Počas obdobia podávania dávok by sa mala aspoň dvakrát denne sledovať chorobnosť a úmrtnosť zvierat. Všetky zvieratá by sa mali odvážiť na začiatku štúdie, a to aspoň raz za týždeň počas štúdií s opakovanou dávkou, a potom pri usmrtení. V prípade štúdií, ktoré trvajú aspoň jeden týždeň, by sa malo aspoň raz za týždeň vykonať meranie spotreby potravy. Ak sa testovaná chemikália podáva v pitnej vode, spotreba vody by sa mala merať pri každej výmene vody a aspoň raz za týždeň. Zvieratá, ktoré vykazujú neletálne ukazovatele nadmernej toxicity, by mali byť humánne usmrtené pred ukončením testovacieho obdobia (11). Expozícia cieľového tkaniva Vzorka krvi by sa mala odobrať vo vhodnom čase(-och), aby bolo možné preskúmať úrovne testovaných chemikálií v plazme na účely preukázania, že došlo k expozícii kostnej drene, ak je to opodstatnené a ak neexistujú iné údaje o expozícii (pozri bod 45). Príprava kostnej drene a chromozómov Ihneď po humánnom usmrtení sa zo stehenných alebo holenných kostí zvierat odoberú bunky kostnej drene, ktoré sa vystavia pôsobeniu hypotonického roztoku a následne sa fixujú. Bunky v metafáze sa potom rozotrú na sklíčka a zafarbia sa bežnými metódami pozri [(3) (12)]. Analýza Všetky preparáty vrátane pozitívnych a negatívnych kontrol by sa mali pred analýzou nezávisle označiť kódmi a mali by sa náhodne usporiadať, aby hodnotiaci nebol oboznámený s podmienkami testovania. Ako meradlo cytotoxicity by sa mal stanoviť mitotický index, a to aspoň na 1 000 bunkách na jedno zviera v prípade všetkých ovplyvňovaných zvierat (vrátane pozitívnych kontrol), neovplyvňovaných alebo negatívnych kontrolných zvierat s nosičom/rozpúšťadlom. V prípade každého zvieraťa by sa malo analyzovať aspoň 200 metafáz na štruktúrne chromozómové aberácie vrátane gapov a bez gapov (6). Ak historická databáza negatívnych kontrol naznačuje, že v testovacom laboratóriu je priemerná hodnota frekvencie štruktúrnych chromozómových aberácií v pozadí < 1 %, malo by sa zvážiť hodnotenie ďalších buniek. Aberácie chromatidového a chromozómového typu by sa mali zaznamenávať oddelene a klasifikovať podľa podtypov (zlomy, výmeny). Postupy používané v laboratóriu by mali zabezpečiť, aby analýzy chromozómových aberácií vykonávali dobre vyškolení hodnotiaci pracovníci a aby sa podľa potreby partnersky preskúmali. Vzhľadom na to, že pri príprave preparátov často dochádza k zlomom časti buniek v metafáze s následnou stratou chromozómov, vyhodnocované bunky by preto mali obsahovať najmenej 2n ± 2 centromér, kde n je haploidný počet chromozómov pre daný druh. ÚDAJE A PREZENTOVANIE VÝSLEDKOV Spracovanie výsledkov Údaje o jednotlivých zvieratách by sa mali uvádzať v tabuľkovej forme. V prípade každého zvieraťa by sa mal vyhodnotiť mitotický index, počet hodnotených buniek v metafáze, počet aberácií na bunku v metafáze a percentuálny podiel buniek so štruktúrnou chromozómovou aberáciou, resp. aberáciami. V prípade ovplyvňovaných a kontrolných skupín by sa mali uvádzať rôzne typy štruktúrnych chromozómových aberácií s príslušnými počtami a frekvenciami. Gapy, polyploidné bunky a bunky s endoreduplikovanými chromozómami sa zaznamenávajú oddelene. Frekvencia gapov sa zaznamenáva, ale vo všeobecnosti sa nezahŕňa do analýzy celkovej frekvencie štruktúrnych aberácií. Ak neexistujú dôkazy o rozdieloch medzi reakciami rôznych pohlaví, údaje možno na účely štatistickej analýzy kombinovať. Mali by sa uvádzať aj údaje o toxicite a klinických príznakoch u zvierat. Kritériá prijateľnosti Prijateľnosť testu určujú tieto kritériá:
Vyhodnotenie a interpretácia výsledkov Za predpokladu, že sú splnené všetky kritériá prijateľnosti, testovaná chemikália sa pokladá za jasne pozitívnu, ak:
Ak sa v konkrétnom čase odberu vzorky preskúma len najvyššia dávka, testovaná chemikália sa pokladá za jasne pozitívnu, ak dôjde k štatisticky významnému zvýšeniu v porovnaní so súbežnou negatívnou kontrolou a výsledky sú mimo rozdelenia historických údajov týkajúcich sa negatívnych kontrol (napr. mimo 95 % regulačných medzí Poissonovho rozdelenia). Odporúčania týkajúce sa vhodných štatistických metód možno nájsť v literatúre (13). Pri vykonávaní analýzy vzťahu medzi dávkou a reakciou by sa mali analyzovať aspoň tri ovplyvňované dávkové skupiny. Pri štatistických testoch by sa malo použiť zviera ako experimentálna jednotka. Pozitívne výsledky testu na chromozómové aberácie naznačujú, že testovaná chemikália indukuje štruktúrne chromozómové aberácie v bunkách kostnej drene testovaného druhu. Za predpokladu, že sú splnené všetky kritériá prijateľnosti, sa testovaná chemikália pokladá za jasne negatívnu, ak pri všetkých preskúmaných experimentálnych podmienkach platí, že:
Odporúčania týkajúce sa najvhodnejších štatistických metód možno nájsť v literatúre (13). Ako dôkaz o expozícii kostnej drene testovanej chemikálii môže slúžiť zníženie mitotického indexu alebo meranie hladín testovanej chemikálie resp. chemikálií v plazme alebo krvi. V prípade intravenózneho podania nie je potrebný dôkaz o expozícii. Alternatívne možno na preukázanie expozície kostnej drene použiť údaje ADME získané v nezávislej štúdii s použitím toho istého spôsobu podania a toho istého druhu. Negatívne výsledky naznačujú, že za daných testovacích podmienok testovaná chemikália neindukuje štruktúrne chromozómové aberácie v bunkách kostnej drene testovaného druhu. Overenie jasnej pozitívnej alebo negatívnej reakcie sa nevyžaduje. V prípade, že reakcia nie je jednoznačne negatívna alebo pozitívna, a v prípade, že ide o pomoc pri stanovovaní biologickej relevantnosti výsledku (napr. slabé alebo hraničné zvýšenie), by sa údaje mali odborne posúdiť a/alebo by sa existujúce vykonané pokusy mali podrobiť ďalšiemu skúmaniu. V niektorých prípadoch by mohlo byť užitočné vykonať analýzu viacerých buniek alebo zopakovať experiment za upravených experimentálnych podmienok. V zriedkavých prípadoch, dokonca ani po ďalších skúmaniach, z údajov nemožno vyvodiť záver, že testovaná chemikália vedie k negatívnym alebo pozitívnym výsledkom, a preto sa štúdia uzavrie ako štúdia s nejasným výsledkom. Frekvencia výskytu polyploidných, ako aj endoreduplikovaných metafáz medzi všetkými metafázami by sa mala zaznamenávať oddelene. Nárast počtu polyploidných/endoreduplikovaných buniek môže naznačovať, že testovaná chemikália má potenciál brzdiť mitotické procesy alebo postup bunkového cyklu (pozri bod 3). Skúšobný protokol Skúšobný protokol by mal zahŕňať tieto informácie: Zhrnutie
LITERATÚRA
Dodatok 1 DEFINÍCIE Aneuploidia : akákoľvek odchýlka od bežného diploidného (alebo haploidného) počtu chromozómov vo forme jedného alebo viacerých chromozómov, nie však vo forme viacnásobkov celého(-ých) súboru(-ov) chromozómov (pozri polyploidia). Centroméra : oblasť(-ti) chromozómu, v ktorej(-ých) sa vlákna deliaceho vretienka pripájajú k chromozómu počas delenia bunky a ktorá(-é) umožňuje(-ú) riadny pohyb dcérskych chromozómov k pólom dcérskych buniek. Chemikália : látka alebo zmes. Aberácia chromatidového typu : štruktúrne chromozómové poškodenie prejavujúce sa ako zlom jednej z chromatíd alebo zlom a opätovné spojenie medzi chromatídami. Aberácia chromozómového typu : štruktúrne chromozómové poškodenie prejavujúce sa ako zlom alebo zlom a opätovné spojenie oboch chromatíd na rovnakej strane. Endoreduplikácia : proces, v ktorom po S fáze replikácie DNA jadro neprechádza do mitózy, ale začína ďalšiu S fázu. Výsledkom sú chromozómy so 4, 8, 16... chromatídami. Gap : achromatická lézia menšia ako šírka jednej chromatídy s minimálnym posunutím chromatíd. Mitotický index : pomer medzi počtom buniek v mitóze a celkovým počtom buniek v populácii, ktorý je meradlom stavu proliferácie tejto bunkovej populácie. Numerická aberácia : zmena v počte chromozómov v porovnaní s bežným počtom charakteristickým pre použité zvieratá (aneuploidia). Polyploidia : numerická chromozómová aberácia, ktorá zahŕňa zmenu počtu celých súborov chromozómov, na rozdiel od numerickej zmeny v časti súboru chromozómov (pozri aneuploidia). Štruktúrna chromozómová aberácia : zmena v chromozómovej štruktúre rozpoznateľná mikroskopickým skúmaním metafázového štádia delenia buniek, pozorovaná ako delécie a fragmenty, intrachromozomálne výmeny alebo interchromozomálne výmeny. Testovaná chemikália : akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy. Dodatok 2 FAKTORIÁLNY NÁVRH NA IDENTIFIKÁCIU ROZDIELOV MEDZI POHLAVIAMI V IN VIVO SKÚŠKE NA CHROMOZÓMOVÚ ABERÁCIU Faktoriálny návrh a jeho analýza Na základe tohto návrhu sa testuje minimálne 5 samcov a 5 samíc pri každej úrovni koncentrácie, čo vedie k návrhu s použitím minimálne 40 zvierat (20 samčekov a 20 samičiek, plus príslušné pozitívne kontroly). Uvedený návrh, ktorý predstavuje jeden z jednoduchších faktoriálnych návrhov, je ekvivalentný s dvojfaktorovou analýzou rozptylu, pričom pohlavie a úroveň koncentrácie sú hlavnými účinkami. Údaje možno analyzovať použitím mnohých štandardných softvérových balíkov pre štatistiku, ako sú napr. SPSS, SAS, STATA, Genstat, ako aj pomocou „R“. Pomocou analýzy sa variabilita v súbore údajov rozdelí na variabilitu medzi pohlaviami, variabilitu medzi koncentráciami a variabilitu v súvislosti s interakciou medzi pohlaviami a koncentráciami. Každá z podmienok sa testuje voči odhadu variability medzi paralelnými zvieratami v rámci skupín zvierat rovnakého pohlavia pri rovnakej koncentrácii. Podrobné informácie o použitej metodike sú dostupné v mnohých štandardných štatistických príručkách (pozri odkazy) a v rámci podpory poskytnutej v balíkoch pre štatistiku. Analýza prebieha formou preskúmania podmienky interakcie medzi pohlavím a koncentráciou v tabuľke ANOVA (5). Ak nenastane výrazná interakcia kombinovaných hodnôt (obe pohlavia a rôzne koncentrácie testovanej látky), platné štatistické testy ANOVA poskytnú informáciu o významnosti rozdielov medzi porovnávanými skupinami a parametrami na základe ich vnútornej variability. Analýza pokračuje rozdelením odhadovaných hodnôt pre variabilitu medzi koncentráciami na kontrasty, ktoré umožňujú testovanie na lineárne a kvadratické kontrasty reakcií pri všetkých úrovniach koncentrácií. Ak existuje významná interakcia medzi pohlavím a koncentráciou, možno túto podmienku rozdeliť aj na kontrast interakcie medzi lineárnou hodnotou a pohlavím a kontrast interakcie medzi kvadratickou hodnotou a pohlavím. Tieto podmienky umožňujú testovanie toho, či sú reakcie na koncentráciu u oboch pohlaví rovnaké, alebo či je reakcia každého pohlavia rozdielna. Na základe odhadov týkajúcich sa združených údajov v rámci skupinovej variability možno vykonať párové testy na zistenie rozdielu medzi priemernými hodnotami. Tieto porovnania by sa mohli vykonať medzi priemernými hodnotami pre obe pohlavia a medzi priemernými hodnotami pre rôzne úrovne koncentrácie, ako sú napríklad porovnania s úrovňami negatívnych kontrol. V prípadoch, keď dochádza k významnej interakcii, možno vykonať porovnania medzi priemernými hodnotami rôznych koncentrácií v rámci jedného pohlavia alebo medzi priemernými hodnotami pohlaví pri rovnakej koncentrácii. Odkazy Existuje mnoho štatistických príručiek, v ktorých sa rozoberá teória, návrh, metodika, analýza a výklad faktoriálnych návrhov počnúc najjednoduchšími dvojfaktorovými analýzami po komplexnejšie formy používané v metodike plánovania experimentu. Ide o tento neúplný zoznam. Niektoré knihy poskytujú spracované príklady porovnateľných návrhov, v niektorých prípadoch s kódom na vykonanie analýz pomocou rôznych softvérových balíkov.
|
|
5. |
V časti B sa kapitola B.12 nahrádza takto: „B.12. Mikrojadrový (mikronukleový) test na erytrocytoch cicavcov ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov 474 (2016). Je súčasťou série testovacích metód v oblasti genetickej toxikológie. Bol vypracovaný dokument OECD, ktorý obsahuje stručné informácie o testovaní v oblasti genetickej toxikológie a prehľad posledných zmien, ktoré sa vykonali v týchto usmerneniach na vykonávanie testov (1). Tento in vivo mikrojadrový test na cicavcoch je osobitne relevantný pre hodnotenie genotoxicity, pretože faktory in vivo metabolizmu, farmakokinetiky a opravných procesov DNA sú aktívne a prispievajú k reakciám, hoci sú v prípade rôznych druhov odlišné. In vivo skúška je takisto užitočná pre ďalšie skúmanie genotoxicity zistenej pomocou in vitro systému. In vivo mikrojadrový test na cicavcoch sa používa na zisťovanie poškodenia vyvolaného testovanou chemikáliou na chromozómoch alebo mitotickom aparáte erytroblastov. Testom sa hodnotí tvorba mikrojadier v erytrocytoch odobratých buď z kostnej drene alebo z periférnych krvných buniek zvierat, zvyčajne hlodavcov. Účelom mikrojadrového testu je identifikovať chemikálie spôsobujúce cytogenetické poškodenie, ktorého výsledkom je tvorba mikrojadier obsahujúcich buď oneskorené chromozómové fragmenty alebo celé chromozómy. Keď sa erytroblast kostnej drene vyvinie na nezrelý erytrocyt (niekedy sa uvádza aj ako polychromatický erytrocyt alebo retikulocyt), hlavné jadro sa vypudzuje; akékoľvek mikrojadro, ktoré sa vytvorilo, môže zostať v cytoplazme. Vizualizácia alebo detekcia mikrojadier je v týchto bunkách jednoduchšia, pretože nemajú hlavné jadro. Zvýšenie frekvencie nezrelých erytrocytov s mikrojadrami u ovplyvnených zvierat je indikáciou vyvolaných štruktúrnych alebo numerických chromozómových aberácií. Novovytvorené erytrocyty s mikrojadrami sa identifikujú a ich počty sa stanovujú farbením, po ktorom nasleduje buď vizuálne hodnotenie pomocou mikroskopu alebo automatická analýza. Použitie automatizovanej hodnotiacej platformy značne uľahčuje počítanie dostatočného množstva nezrelých erytrocytov v periférnej krvi alebo v kostnej dreni dospelých zvierat. Takéto platformy sú prijateľnými alternatívami manuálneho hodnotenia (2). Porovnávacie štúdie ukázali, že takéto metódy s použitím vhodných kalibračných štandardov môžu priniesť lepšiu vnútrolaboratórnu a medzilaboratórnu reprodukovateľnosť a citlivosť než manuálne mikroskopické hodnotenie (3) (4). Automatizované systémy, ktoré dokážu merať frekvencie erytrocytov s mikrojadrami, zahŕňajú, nie sú však obmedzené na prietokové cytometre (5), platformy obrazovej analýzy (6) (7) a laserové skenovacie cytometre (8). Hoci to nie je bežnou súčasťou testu, chromozómové fragmenty možno odlíšiť od celých chromozómov na základe niekoľkých kritérií. Tieto kritériá zahŕňajú identifikáciu prítomnosti alebo neprítomnosti kinetochoru alebo centromerickej DNA, ktoré sú charakteristické pre neporušené chromozómy. Neprítomnosť kinetochoru alebo centromerickej DNA naznačuje, že mikrojadro obsahuje len fragmenty chromozómov, zatiaľ čo ich prítomnosť je príznačná pre stratu chromozómov. Použité definície termínov sú uvedené v dodatku 1. ÚVODNÉ ÚVAHY Cieľovým tkanivom pre genetické poškodenie v tomto teste je kostná dreň mladých dospelých hlodavcov, keďže erytrocyty sa tvoria v tomto tkanive. Meranie mikrojadier v nezrelých erytrocytoch v periférnej krvi je prijateľné aj u iných druhov cicavcov, v prípade ktorých bola preukázaná primeraná citlivosť na detekciu chemikálií spôsobujúcich štruktúrne alebo numerické chromozómové aberácie v týchto bunkách (indukciou vzniku mikrojadier v nezrelých erytrocytoch) a v prípade ktorých je poskytnuté vedecké zdôvodnenie. Hlavným sledovaným parametrom je frekvencia nezrelých erytrocytov s mikrojadrami. Frekvenciu zrelých erytrocytov obsahujúcich mikrojadrá v periférnej krvi možno takisto použiť ako sledovaný parameter pri druhoch bez silného vychytávania buniek s mikrojadrami v slezine a v prípade, že sú zvieratá ovplyvňované nepretržite počas obdobia, ktoré presahuje životnosť erytrocytov u použitých druhov (napr. 4 alebo viac týždňov v prípade myší). Ak existujú dôkazy, že testovaná(-é) chemikália(-e) alebo jej/ich metabolit(-y) nedosiahne(-u) cieľové tkanivo, nemusí byť vhodné použiť tento test. Pred použitím testovacej metódy v prípade zmesi s cieľom generovať údaje pre stanovený regulačný účel by sa malo zvážiť, či môže poskytnúť primerané výsledky na tento účel, a ak môže, malo by sa to zdôvodniť. Takéto úvahy nie sú potrebné, ak existuje regulačná požiadavka na testovanie zmesi. PRINCÍP TESTOVACEJ METÓDY Zvieratá sú vystavené testovanej chemikálii vhodným spôsobom. Ak sa používa kostná dreň, zvieratá sa vo vhodnom(-ých) čase(-och) po ovplyvnení humánnym spôsobom utratia, odoberie sa kostná dreň a pripravia a zafarbia sa preparáty (9) (10) (11) (12) (13) (14) (15)sa. Ak sa používa periférna krv, odoberá sa vo vhodnom(-ých) čase(-och) po ovplyvnení a pripravia a zafarbia sa preparáty (12) (16) (17) (18). Ak sa ovplyvnenie vykoná akútne, je dôležité zvoliť časy odberu kostnej drene alebo krvi, kedy možno zistiť indukciu nezrelých erytrocytov s mikrojadrami súvisiacu s ovplyvnením. V prípade odberu periférnej krvi musí takisto ubehnúť dostatočný čas na to, aby sa tieto javy objavili v krvnom obehu. Preparáty sa analyzujú na prítomnosť mikrojadier buď vizualizáciou pod mikroskopom, obrazovou analýzou, prietokovou cytometriou alebo laserovou skenovacou cytometriou. OVEROVANIE SPÔSOBILOSTI LABORATÓRIA Zisťovanie spôsobilosti S cieľom potvrdiť dostatočné skúsenosti s vykonávaním skúšky pred jej použitím na rutinné testovanie by laboratórium malo preukázať schopnosť reprodukovať predpokladané výsledky zo zverejnených údajov (17) (19) (20) (21) (22), pokiaľ ide o frekvenciu výskytu mikrojadier, s minimálne dvoma chemikáliami na pozitívnu kontrolu (vrátane slabých reakcií vyvolaných nízkymi dávkami pozitívnych kontrol), ako sú chemikálie uvedené v tabuľke 1, a s kompatibilnými kontrolami nosiča/rozpúšťadla (pozri bod 26). Pri týchto pokusoch by sa mali používať dávky, ktoré vyvolajú reprodukovateľný a od dávky závislý nárast účinku a preukážu citlivosť a dynamický rozsah testovacieho systému v predmetnom tkanive (kostná dreň alebo periférna krv), pričom sa použije metóda hodnotenia, ktorá sa má uplatňovať v laboratóriu. Táto požiadavka sa nevzťahuje na laboratóriá, ktoré majú skúsenosti, t. j. majú dostupnú historickú databázu, ako sa vymedzuje v bodoch 14 – 18. Údaje o historických kontrolách V priebehu zisťovania spôsobilosti by malo laboratórium určiť:
Pri prvom získavaní údajov súvisiacich s rozdelením historických negatívnych kontrol by súbežné negatívne kontroly mali byť v súlade s uverejnenými údajmi o kontrolách, ak takéto údaje existujú. S pridávaním ďalších údajov k rozdeleniu historických kontrol by súbežné negatívne kontroly mali byť v ideálnom prípade v rámci 95 % regulačných medzí tohto rozdelenia. Databáza historických negatívnych kontrol laboratória by mala byť štatisticky solídna, aby sa laboratóriu zabezpečila možnosť posudzovať rozdelenie svojich údajov o negatívnych kontrolách. Na základe literatúry môže byť potrebných minimálne 10 pokusov, no bolo by vhodnejšie vykonať aspoň 20 pokusov za porovnateľných podmienok. Laboratóriá by mali použiť metódy kontroly kvality, ako sú regulačné diagramy [napr. tzv. „C-charts“ alebo „X-bar charts“ (23)], s cieľom zistiť variabilitu svojich údajov a preukázať, že metodika je v laboratóriu „pod kontrolou“. Ďalšie odporúčania ako vytvárať a využívať historické údaje (t. j. kritériá zaradenia údajov medzi historické údaje a ich vylúčenia z historických údajov a kritériá prijateľnosti v prípade daného pokusu) možno nájsť v literatúre (24). Ak laboratórium nevykoná dostatočný počet pokusov na vytvorenie štatisticky solídneho rozdelenia negatívnych kontrol (pozri bod 15) počas zisťovania spôsobilosti (ako sa opisuje v bode 13), je prijateľné, aby sa rozdelenie mohlo vytvárať počas prvých rutinných testov. Tento postup by mal vychádzať z odporúčaní uvedených v literatúre (24) a výsledky negatívnych kontrol získané na základe týchto pokusov by mali zostať v súlade s uverejnenými údajmi o negatívnych kontrolách. Všetky zmeny v experimentálnom protokole by sa mali posúdiť z hľadiska ich vplyvu na výsledné údaje, ktoré musia zostať v súlade so súčasnou databázou historických kontrol v laboratóriu. K vytvoreniu novej databázy historických kontrol by mali viesť len veľké rozdiely, ak sa na základe odborného posúdenia zistí, že sa líši od predchádzajúceho rozdelenia (pozri bod 15). Počas tejto obnovy nemusí byť potrebná úplná databáza negatívnych kontrol na vykonanie príslušného testu, ak vie laboratórium preukázať, že jeho hodnoty súbežných negatívnych kontrol sú naďalej v súlade s jeho predchádzajúcou databázou alebo s príslušnými uverejnenými údajmi. Údaje o negatívnych kontrolách by mali zahŕňať údaje o výskyte nezrelých erytrocytov s mikrojadrami v každom zvierati. Súbežné negatívne kontroly by v ideálnom prípade mali byť v rámci 95 % regulačných medzí rozdelenia databázy historických negatívnych kontrol laboratória. Ak údaje o súbežných negatívnych kontrolách nespadajú do 95 % regulačných medzí, môžu byť prijateľné na zaradenie do rozdelenia historických kontrol, pokiaľ tieto údaje nie sú extrémne mimo uvedených medzí a pokiaľ existujú dôkazy, že testovací systém je „pod kontrolou“ (pozri bod 15) a neexistujú žiadne dôkazy o technickom alebo ľudskom zlyhaní. OPIS METÓDY Príprava Výber živočíšnych druhov Mali by sa vyberať bežne používané laboratórne kmene zdravých mladých dospelých zvierat. Použiť možno myši, potkany alebo iné vhodné druhy cicavcov. Ak sa používa periférna krv, musí byť preukázané, že odstránenie buniek s mikrojadrami z krvného obehu uskutočnené v slezine neovplyvní detekciu indukovaných mikrojadier vo vybraných druhoch. Toto bolo jasne preukázané v prípade periférnej krvi myší a potkanov (2). V správe by malo byť poskytnuté vedecké zdôvodnenie použitia iných druhov než potkanov a myší. Ak sa použijú iné druhy než hlodavce, odporúča sa, aby sa meranie indukovaných mikrojadier začlenilo do iného vhodného testu toxicity. Podmienky umiestnenia a kŕmenia zvierat V prípade hlodavcov by mala byť teplota v miestnosti pre zvieratá 22 °C (± 3 °C). Hoci ideálna relatívna vlhkosť by mala byť 50 – 60 %, mala by dosahovať minimálne 40 % a podľa možnosti by nemala presiahnuť 70 % inokedy než počas čistenia miestnosti. Osvetlenie by malo byť umelé so striedaním 12 hodín svetla a 12 hodín tmy. Na kŕmenie sa môže používať bežné laboratórne krmivo s neobmedzeným prísunom pitnej vody. Výber krmiva môže byť ovplyvnený potrebou zabezpečiť vhodnú prímes testovanej chemikálie, keď sa podáva týmto spôsobom. Hlodavce by mali byť umiestnené do malých skupín (najviac päť zvierat na jednu klietku) rovnakého pohlavia a ovplyvnenej skupiny, pokiaľ sa nepredpokladá žiadne agresívne správanie, pričom sa uprednostňujú klietky s pevnou podlahou a vhodne obohateným prostredím. Zvieratá môžu byť umiestnené samostatne len vtedy, ak je to vedecky opodstatnené. Príprava zvierat Bežne sa používajú zdravé mladé dospelé zvieratá (pri hlodavcoch je ideálny vek 6 – 10 týždňov na začiatku ovplyvňovania, hoci je prijateľný aj trochu vyšší vek), ktoré sa náhodne rozdelia do kontrolných a ovplyvnených skupín. Každé zviera sa jednotlivo označí humánnou, minimálne invazívnou metódou (napr. krúžkovanie, označenie štítkom, aplikácia mikročipu alebo biometrická identifikácia, nie však skracovanie uší ani prstov) a aklimatizuje sa na laboratórne podmienky v priebehu minimálne piatich dní. Klietky sa usporiadajú tak, aby sa minimalizovali prípadné vplyvy spôsobené ich umiestnením. Malo by sa zabrániť krížovej kontaminácii pozitívnou kontrolou a testovanou chemikáliou. Na začiatku štúdie by mala byť hmotnostná variabilita zvierat minimálna a nemala by presiahnuť ± 20 % priemernej hmotnosti každého pohlavia. Príprava dávok Tuhé testované chemikálie by sa pred podávaním dávok zvieratám mali rozpustiť alebo rozptýliť vo vhodných rozpúšťadlách alebo nosičoch alebo primiešať do krmiva alebo pitnej vody. Kvapalné testované chemikálie sa môžu podávať priamo alebo ich pred podávaním možno rozriediť. V prípade inhalačných expozícií možno testované chemikálie v závislosti od ich fyzikálno-chemických vlastností podávať vo forme plynu, pary alebo aerosólu (tuhá látka/kvapalina). Pokiaľ sa v údajoch o stabilite neuvádza prijateľnosť skladovania a nevymedzujú sa jeho vhodné podmienky, testovaná chemikália by sa mala používať čerstvo pripravená. Podmienky testu Rozpúšťadlo/nosič Rozpúšťadlo/nosič by nemali vyvolávať toxické účinky pri používaných dávkach a nemali by mať schopnosť chemicky reagovať s testovanou chemikáliou. Ak sa používajú iné ako dobre známe rozpúšťadlá/nosiče, ich použitie by mali podporiť referenčné údaje uvádzajúce ich kompatibilitu. Odporúča sa podľa možnosti najskôr zvážiť použitie vodného rozpúšťadla/nosiča. Príklady bežne používaných kompatibilných rozpúšťadiel/nosičov zahŕňajú vodu, fyziologický roztok, roztok metylcelulózy, roztok sodnej soli karboxymetylcelulózy, olivový olej a kukuričný olej. Ak neexistujú historické alebo zverejnené údaje o kontrolách, z ktorých vyplýva, že zvolené atypické rozpúšťadlo/nosič neindukuje tvorbu mikrojadier ani iné škodlivé účinky, mala by sa vykonať východisková štúdia s cieľom stanoviť prijateľnosť kontroly rozpúšťadla/nosiča. Kontroly Pozitívne kontroly Do každého testu by sa za normálnych okolností mala zahrnúť skupina zvierat ovplyvnená chemikáliou na pozitívnu kontrolu. Možno od toho upustiť v prípade, že skúšobné laboratórium preukázalo spôsobilosť pri vykonávaní testu a stanovilo rozsah historických pozitívnych kontrol. Ak nie je zahrnutá súbežná pozitívna kontrolná skupina, do každého pokusu by sa mali zahrnúť kontroly hodnotenia (fixované a nezafarbené podložné sklíčka alebo vzorky bunkovej suspenzie, podľa toho, čo je pre danú metódu hodnotenia vhodné). Možno ich získať tak, že sa do hodnotenia štúdie zahrnú vhodné referenčné vzorky získané a uchované zo samostatného pokusu s pozitívnou kontrolou, ktorý sa vykonáva periodicky (napr. každých 6 až 18 mesiacov); napríklad počas testovania spôsobilosti a potom pravidelne, podľa potreby. Chemikálie na pozitívnu kontrolu by mali spoľahlivo vyvolať zistiteľný nárast frekvencie mikrojadier nad spontánnu úroveň. Pri manuálnom hodnotení pomocou mikroskopu by sa dávky pozitívnej kontroly mali zvoliť tak, aby boli účinky zjavné, ale aby hodnotiteľovi priamo neodhaľovali identitu kódovaných vzoriek. Je prijateľné, aby sa pozitívne kontroly podávali inou cestou ako testovaná chemikália, na základe iného harmonogramu ovplyvňovania a aby sa vzorky odoberali len jeden raz. V náležitých prípadoch možno na pozitívnu kontrolu takisto zvážiť použitie chemikálií rovnakej chemickej triedy. Príklady chemikálií na pozitívnu kontrolu sú uvedené v tabuľke 1 Tabuľka 1 Príklady chemikálií na pozitívnu kontrolu: Chemikálie a CAS čísla etyl-metánsulfonát [CAS číslo 62-50-0] metyl-metánsulfonát [CAS číslo 66-27-3] N-etyl-N-nitrózomočovina [CAS číslo 759-73-9] mitomycín C [CAS číslo 50-07-7] cyklofosfamid (monohydrát) [CAS číslo 50-18-0 (CAS číslo 6055-19-2)] tretamín [CAS číslo 51-18-3] kolchicín [CAS číslo 64-86-8] alebo vinblastín [CAS číslo 865-21-4] – ako aneugény Negatívne kontroly Zvieratá v negatívnych kontrolných skupinách by mali byť zahrnuté do každého odberu a inak by sa s nimi malo zaobchádzať rovnako ako s ovplyvnenými skupinami, nebudú však ovplyvnené testovanou chemikáliou. Ak sa pri podávaní testovanej chemikálie použije rozpúšťadlo/nosič, kontrolná skupina by mala dostať toto rozpúšťadlo/nosič. Ak sa však na základe historických údajov negatívnych kontrol pri každom odbere vzoriek v danom skúšobnom laboratóriu preukážu konzistentné údaje o variabilite medzi zvieratami a o frekvenciách buniek s mikrojadrami, môže byť pre negatívnu kontrolu potrebný len jeden odber. Ak sa na negatívne kontroly použije len jeden odber, mal by to byť odber vykonaný prvý raz v tejto štúdii. Ak sa použije periférna krv, je namiesto súbežnej negatívnej kontroly prijateľná vzorka pred ovplyvnením, a to v prípade krátkych štúdií, keď sú výsledné údaje v súlade s databázou historických kontrol skúšobného laboratória. Preukázalo sa, že v prípade potkanov má odber vzoriek malých objemov (napr. menej ako 100 μl/deň) pred ovplyvnením minimálny vplyv na frekvenciu mikrojadier v pozadí (25). POSTUP Počet zvierat a ich pohlavie Vo všeobecnosti je reakcia vo forme mikrojadier u samcom a samíc podobná, a preto by sa väčšina štúdií mohla vykonávať so zvieratami ktoréhokoľvek pohlavia (26). Údaje, ktoré preukazujú relevantné rozdiely medzi samcami a samicami (napr. rozdiely v systémovej toxicite, metabolizme, biodostupnosti, toxicite kostnej drene atď. vrátane napr. štúdie na zistenie rozsahu), by boli v prospech používania oboch pohlaví. V takomto prípade môže byť vhodné vykonať štúdiu na oboch pohlaviach, a to napr. ako súčasť štúdie toxicity pri opakovaných dávkach. Ak sa použijú obe pohlavia, mohlo by byť vhodné použiť faktoriálny návrh. Podrobnosti o analýze údajov s použitím tohto návrhu sú uvedené v dodatku 2. Mala by sa stanoviť veľkosť skupín na začiatku štúdie s cieľom poskytnúť minimálne 5 analyzovateľných zvierat jedného pohlavia alebo, ak sa použijú zvieratá oboch pohlaví, 5 z každého pohlavia za skupinu. Ak je možné, že vystavenie ľudí účinkom chemikálií závisí od pohlavia, ako napríklad v prípade niektorých liekov, test by sa mal vykonať na jedincoch príslušného pohlavia. Ako smerná hodnota v prípade bežných požiadaviek na maximálny počet zvierat by štúdia kostnej drene vykonaná podľa parametrov stanovených v bode 37 s troma dávkovými skupinami a so súbežnými negatívnymi a pozitívnymi kontrolami (každá skupina zložená z piatich zvierat jedného pohlavia) vyžadovala 25 a 35 zvierat. Úrovne dávok Ak sa z dôvodu, že ešte nie sú dostupné vhodné údaje na pomoc pri výbere dávky, vykoná predbežná štúdia na zistenie rozsahu, mala by sa vykonať v tom istom laboratóriu s použitím toho istého druhu, kmeňa, pohlavia a dávkovacej schémy, aké majú byť použité v hlavnej štúdii (27). Štúdia by sa mala zamerať na zistenie maximálnej tolerovanej dávky (MTD) definovanej ako najvyššia dávka, ktorá sa bude tolerovať bez dôkazu toxicity obmedzujúcej štúdiu, a to vzhľadom na trvanie štúdie [napr. indukovaním zníženia telesnej hmotnosti alebo hematopoetickej systémovej cytotoxicity, ale nie smrti ani znakov bolesti, utrpenia či stavu, ktorý si vyžaduje humánnu eutanáziu (28)]. Najvyššiu dávku možno takisto definovať ako dávka, ktorá spôsobuje toxicitu v kostnej dreni (napr. zníženie podielu nezrelých erytrocytov na celkovom počte erytrocytov v kostnej dreni alebo v periférnej krvi o viac než 50 %, no nie na menej než 20 % kontrolnej hodnoty). Pri analýze CD71 pozitívnych buniek v periférnom krvnom obehu (t. j. prietokovou cytometrickou analýzou) však táto veľmi mladá frakcia nezrelých erytrocytov reaguje na toxické výzvy rýchlejšie než väčší RNA pozitívny kohort nezrelých erytrocytov. Preto môže byť zjavná vyššia toxicita evidentná pri plánoch akútnej expozície na skúmanie frakcie CD71 pozitívnych nezrelých erytrocytov v porovnaní s tými, ktoré označujú nezrelé erytrocyty na základe obsahu RNA. Z tohto dôvodu, ak v rámci pokusov prebieha ovplyvnenie päť alebo menej dní, najvyššiu dávku testovaných chemikálií spôsobujúcich toxicitu možno definovať ako dávku, ktorá spôsobuje štatisticky významné zníženie podielu CD71 pozitívnych nezrelých erytrocytov na celkovom počte erytrocytov, no nie na menej než 5 % kontrolnej hodnoty (29). Chemikálie, ktoré vykazujú saturáciu toxikokinetických vlastností alebo indukujú detoxikačné procesy, ktoré môžu viesť k zníženiu expozície po dlhodobom podávaní, môžu byť vyňaté z kritérií na stanovenie dávok a mali by sa hodnotiť jednotlivo. Na získanie informácií o reakcii na dávku by kompletná štúdia mala zahŕňať negatívnu kontrolnú skupinu a minimálne tri úrovne dávok vo všeobecnosti oddelené faktorom 2, ale nie vyšším ako 4. Ak testovaná chemikália nevyvoláva na základe štúdie na zistenie rozsahu alebo na základe existujúcich údajov toxicitu, najvyššia dávka pri 14-dňovom alebo dlhšom období podávania by mala byť 1 000 mg/kg telesnej hmotnosti/deň alebo 2 000 mg/kg telesnej hmotnosti/deň v prípade obdobia podávania kratšieho ako 14 dní. Ak však testovaná chemikália spôsobuje toxicitu, maximálna tolerovaná dávka by mala byť najvyššia podávaná dávka a použité úrovne dávky by mali podľa možnosti pokrývať rozsah od maximálnej dávky po dávku, ktorá spôsobuje slabú alebo nespôsobuje žiadnu toxicitu. Ak sa zistí toxicita v cieľovom tkanive (kostná dreň) pri všetkých testovaných úrovniach dávok, odporúča sa vykonanie ďalšej štúdie s netoxickými dávkami. Štúdie, ktorých cieľom je podrobnejšie charakterizovať kvantitatívne informácie o reakcii na dávku, môžu vyžadovať dodatočné dávkové skupiny. V prípade určitých druhov testovaných chemikálií (napr. humánne lieky), na ktoré sa vzťahujú osobitné požiadavky, sa tieto limity môžu líšiť. Limitný test Ak pokusy na stanovenie rozsahu dávok alebo existujúce údaje týkajúce sa súvisiacich kmeňov zvierat naznačujú, že dávkovacia schéma, aspoň pokiaľ ide o limitujúcu dávku (opísanú ďalej v texte), nespôsobuje žiadne pozorovateľné toxické účinky, (vrátane žiadneho poklesu proliferácie kostnej drene ani iný dôkaz cytotoxicity v cieľovom tkanive), a ak by sa genotoxicita na základe in vitro štúdií genotoxicity alebo na základe údajov týkajúcich sa štrukturálne príbuzných chemikálií neočakávala, potom nemusí byť potrebná úplná štúdia s použitím troch úrovní dávok, ak sa ukázalo, že testovaná(-é) chemikália(-e) dosahuje(-ú) cieľové tkanivo (kostná dreň). V takýchto prípadoch môže byť postačujúca jedna dávka na úrovni limitujúcej dávky. Ak sa chemikália podáva počas 14 dní alebo dlhšie, limitujúca dávka predstavuje 1 000 mg/kg telesnej hmotnosti/deň. V prípade období podávania chemikálie kratších než 14 dní predstavuje limitujúca dávka 2 000 mg/kg telesnej hmotnosti/deň. Podávanie dávok Pri plánovaní skúšky by sa mal zvážiť predpokladaný spôsob vystavenia ľudí. Preto možno zvoliť spôsoby vystavenia, ako napríklad prostredníctvom stravy, pitnej vody, topickou, subkutánnou cestou, intravenózne, perorálne (pomocou sondy), inhalačne, intratracheálne alebo implantačne, ako opodstatnené spôsoby. V každom prípade by sa mal zvoliť spôsob, ktorým sa zabezpečí primeraná vystavenie cieľového(-ých) tkaniva(-ív). Vo všeobecnosti sa neodporúča použitie intraperitoneálnej injekcie, keďže to nie je zamýšľaný spôsob vystavenia ľudí, a mal by sa použiť iba v prípade, že je k dispozícii osobitné vedecké zdôvodnenie. Ak je testovaná chemikália primiešaná do krmiva alebo pitnej vody, najmä v prípade jednej dávky, treba venovať pozornosť tomu, aby sa medzi spotrebou potravy a vody a odberom vzorky ponechal dostatočný čas, aby sa umožnilo zistenie účinkov (pozri bod 37). Maximálny objem kvapaliny, ktorá sa môže naraz podávať sondou alebo injekciou, závisí od veľkosti testovaného zvieraťa. Objem by za bežných okolností nemal prekročiť 1 ml/100 g telesnej hmotnosti okrem vodných roztokov, pri ktorých sa môže použiť najviac 2 ml/100 g. Požitie väčších ako uvedených objemov by malo byť opodstatnené. S výnimkou dráždivých alebo žieravých testovaných chemikálií, ktoré pri vyšších koncentráciách zvyčajne zhoršia účinky, by sa variabilita v testovanom objeme mala minimalizovať tým, že sa koncentrácia upraví tak, aby sa na všetkých úrovniach dávok zabezpečil stály objem vo vzťahu k telesnej hmotnosti. Harmonogram ovplyvňovania Uprednostňujú sa 2 alebo viaceré ovplyvnenia v 24-hodinových intervaloch, najmä v prípade začlenenia tohto testu do iných toxikologických štúdií toxicity. Alternatívou môže byť jednorazové ovplyvnenie, ak je vedecky opodstatnené (napr. testované chemikálie známe ako blokátory bunkového cyklu). Testované chemikálie môžu byť podávané v rozdelenej dávke, t. j. dve alebo viaceré ovplyvnenia v jeden deň s časovým odstupom najviac 2 – 3 hodiny, čím sa uľahčí podávanie veľkého objemu chemikálie. Za týchto okolností alebo pri podávaní testovanej chemikálie inhalačne by sa čas odberu vzoriek mal naplánovať na základe posledného podania dávky alebo skončenia vystavenia. Test sa môže vykonať na myšiach alebo potkanoch jedným z týchto troch spôsobov:
Iné režimy podávania dávok alebo odberu vzoriek možno použiť vtedy, ak je to relevantné a vedecky opodstatnené, a s cieľom uľahčiť spojenie s inými testami toxicity. Pozorovania Najmenej raz denne by sa mali vykonať všeobecné klinické pozorovania testovaných zvierat a zaznamenať klinické príznaky, najlepšie každý deň v rovnakom čase a s ohľadom na časový interval najintenzívnejších predpokladaných účinkov po podaní dávky. Počas obdobia podávania dávok je potrebné aspoň dvakrát denne sledovať chorobnosť a úmrtnosť zvierat. Všetky zvieratá by sa mali odvážiť na začiatku štúdie, aspoň raz za týždeň počas štúdií s opakovanou dávkou a potom pri utratení. V prípade štúdií, ktoré trvajú aspoň jeden týždeň, by sa malo aspoň raz za týždeň vykonať meranie spotreby potravy. Ak sa testovaná chemikália podáva v pitnej vode, spotreba vody by sa mala merať pri každej výmene vody a aspoň raz za týždeň. Zvieratá, ktoré vykazujú neletálne ukazovatele nadmernej toxicity, by mali byť humánne utratené pred ukončením testovacieho obdobia (28). Za určitých okolností by sa mohla monitorovať telesná teplota zvierat, keďže hypertermia a hypotermia vyvolané ovplyvnením mohli prispieť k falošným výsledkom (32) (33) (34). Vystavenie cieľového tkaniva Vzorka krvi by sa mala odobrať vo vhodnom(-ých) čase(-och), aby bolo možné preskúmať úrovne testovaných chemikálií v plazme na účely preukázania, že došlo k vystaveniu kostnej drene, ak je to opodstatnené a ak neexistujú iné údaje o expozícii (pozri bod 48). Preparát kostnej drene/krvi Bunky kostnej drene sa zvyčajne získavajú zo stehnových kostí (femur) alebo píšťal (tibia) zvierat ihneď po humánnej eutanázii. Bunky sa zvyčajne odoberú, pripravia sa z nich preparáty a zafarbia sa použitím zavedených metód. Malé objemy periférnej krvi možno získať v súlade s primeranými normami týkajúcimi sa dobrých podmienok zvierat, a to buď pomocou metódy, ktorá umožňuje prežitie testovaného zvieraťa, ako je napríklad získanie krvi z chvostovej žily alebo inej vhodnej žily, alebo srdcovou punkciou alebo odberom vzoriek z veľkej cievy pri utratení zvierat. V prípade erytrocytov získaných z kostnej drene alebo periférnej krvi možno bunky v závislosti od metódy analýzy ihneď supravitálne zafarbiť (16) (17) (18), bunky sa rozotrú na podložnom sklíčku a vzniknuté preparáty sa zafarbia a mikroskopicky vyhodnotia, alebo sa fixujú a vhodne zafarbia na účely prietokovej cytometrickej analýzy. Použitie farbiva so špecifickou väzbou na DNA [napríklad akridínová oranžová (35) alebo Hoechst 33258 plus pyronín-Y (36)] môže eliminovať niektoré umelo vzniknuté štruktúry buniek spojené s používaním farbiva bez špecifickej väzby na DNA. Táto výhoda nebráni používaniu konvenčných farbív (napríklad Giemsa na účely mikroskopickej analýzy). Použiť možno takisto dodatočné systémy [napríklad celulózové kolóny na odstránenie buniek s jadrom (37) (38)], a to za predpokladu, že sa preukázala kompatibilita týchto systémov s prípravou vzoriek v laboratóriu. Ak sú tieto metódy uplatniteľné, na identifikáciu povahy mikrojadier (chromozómy/fragmenty chromozómov) s cieľom zistiť, či je mechanizmus indukcie mikrojadier dôsledkom klastogénnych a/alebo aneugénnych procesov, možno použiť protilátky kinetochoru (39), FISH s pancentromérovými sondami DNA (40) alebo značenie in situ pomocou primerov špecifických pre pancentroméru spolu s vhodným odfarbovacím roztokom DNA (41). Na rozlišovanie medzi klastogénmi a aneugénmi možno použiť aj iné metódy, ak sa ukázalo, že sú účinné. Analýza (ručná a automatizovaná) Všetky sklíčka alebo vzorky na analýzu vrátane pozitívnych a negatívnych kontrol by sa mali pred každou analýzou nezávisle označiť kódmi a mali by byť náhodné, aby hodnotiaci používajúci manuálnu metódu nebol oboznámený s podmienkami ovplyvnenia; takéto kódovanie nie je potrebné pri automatizovaných systémoch hodnotenia, ktoré sa neopierajú o vizuálnu kontrolu a nemôžu byť ovplyvnené zaujatosťou prevádzkovateľa. Pri každom zvierati sa stanovuje podiel nezrelých erytrocytov na celkovom počte erytrocytov (zrelých plus nezrelých), pričom sa počíta celkovo najmenej 500 erytrocytov v prípade kostnej drene a 2 000 erytrocytov v prípade periférnej krvi (42). Pri výskyte nezrelých erytrocytov s mikrojadrami by sa malo hodnotiť aspoň 4 000 nezrelých erytrocytov na jedno zviera (43). Ak databáza historických negatívnych kontrol naznačuje, že priemerná hodnota pozaďovej frekvencie nezrelých erytrocytov s mikrojadrami je < 0,1 % v skúšobnom laboratóriu, malo by sa zvážiť hodnotenie dodatočných buniek. Pri analyzovaní vzoriek by podiel nezrelých erytrocytov na celkovom počte erytrocytov u ovplyvnených zvierat nemal byť nižší ako 20 % podielu kontroly nosiča/rozpúšťadla pri mikroskopickom hodnotení a zároveň by nemal byť nižší než približne 5 % podielu kontroly nosiča/rozpúšťadla pri hodnotení CD71+ nezrelých erytrocytov cytometrickými metódami (pozri bod 31) (29). Napríklad ak je v prípade skúšky kostnej drene hodnotenej mikroskopicky podiel nezrelých erytrocytov v kostnej dreni 50 %, horná hranica toxicity by bola 10 % nezrelých erytrocytov. Pretože potkania slezina vychytáva a ničí erytrocyty s mikrojadrami, je na zachovanie vysokej citlivosti skúšky pri analýze periférnej krvi potkanov vhodnejšie obmedziť analýzu nezrelých erytrocytov s mikrojadrami na najmladšiu frakciu. Ak sa použijú automatizované metódy analýzy, možno tieto najmenej zrelé erytrocyty identifikovať na základe ich vysokého obsahu RNA alebo vysokej úrovne transferínových receptorov (CD71+) na ich povrchu (31). Z priameho porovnania rôznych metód farbenia však vyplýva, že uspokojivé výsledky možno dosiahnuť rôznymi spôsobmi vrátane konvenčného farbenia pomocou farbiva akridínová oranžová (3) (4). PREZENTOVANIE VÝSLEDKOV Spracovanie výsledkov Údaje o jednotlivých zvieratách by sa mali uvádzať v tabuľkovej forme. Pri každom zvierati podrobenom analýze by sa mal samostatne uviesť počet hodnotených nezrelých erytrocytov, počet nezrelých erytrocytov s mikrojadrami a podiel nezrelých erytrocytov na celkovom počte erytrocytov. V prípade, že sa myši ovplyvňujú nepretržite počas 4 týždňov alebo dlhšie, mali by sa uvádzať aj údaje o počte a podiele zrelých erytrocytov s mikrojadrami, ak boli odobraté. Mali by sa uvádzať aj údaje o toxicite a klinických príznakoch u zvierat. Kritériá prijateľnosti Prijateľnosť testu určujú tieto kritériá:
Vyhodnotenie a výklad výsledkov Za predpokladu, že sú splnené všetky kritériá prijateľnosti, testovaná chemikália sa pokladá za jasne pozitívnu, ak:
Ak sa preskúma len najvyššia dávka v konkrétnom čase odberu vzorky, testovaná chemikália sa pokladá za jasne pozitívnu, ak dôjde k štatisticky významnému zvýšeniu v porovnaní so súbežnou negatívnou kontrolou a výsledky sú mimo rozdelenia historických údajov negatívnych kontrol (napr. 95 % regulačné medze podľa Poissonovho rozdelenia). Odporúčania týkajúce sa najvhodnejších štatistických metód možno nájsť v literatúre (44) (45) (46) (47). Pri vykonávaní analýzy vzťahu medzi dávkou a reakciou by sa mali analyzovať aspoň tri ovplyvnené dávkové skupiny, v rámci ktorých sa podáva určitá dávka. Pri štatistických testoch by sa malo zviera použiť ako experimentálna jednotka. Pozitívne výsledky mikrojadrového testu naznačujú, že testovaná chemikália indukuje mikrojadrá, ktoré sú výsledkom chromozómového poškodenia alebo poškodenia mitotického aparátu v erytroblastoch testovaného druhu. V prípade, že sa vykonal test na zistenie centromér v mikrojadrách, testovaná chemikália, ktorá produkuje mikrojadrá obsahujúce centroméry (centromérická DNA alebo kinetochor, ktoré sú príznačné pre stratu celých chromozómov), je dôkazom toho, že testovaná chemikália je aneugén. Za predpokladu, že sú splnené všetky kritériá prijateľnosti, testovaná chemikália sa pokladá za jasne negatívnu, ak pri všetkých preskúmaných podmienkach pokusu platí, že:
Odporúčania týkajúce sa najvhodnejších štatistických metód možno nájsť v literatúre (44) (45) (46) (47). Ako dôkaz o vystavení kostnej drene účinkom testovanej chemikálie môže slúžiť zníženie pomeru medzi nezrelými a zrelými erytrocytmi alebo meranie hladín testovanej chemikálie v plazme alebo krvi. V prípade intravenózneho podania nie je potrebný dôkaz o vystavení. Alternatívne možno na preukázanie vystavenia kostnej drene použiť údaje ADME získané v nezávislej štúdii s použitím tej istej cesty podania a toho istého druhu. Negatívne výsledky naznačujú, že testovaná chemikália za daných testovacích podmienok nevytvára mikrojadrá v nezrelých erytrocytoch testovaného druhu. Neexistuje požiadavka na overenie jasnej pozitívnej alebo negatívnej reakcie. V prípadoch, keď reakcia nie je jasne negatívna ani pozitívna, a s cieľom pomôcť stanoviť biologickú relevantnosť výsledku (napr. slabé alebo hraničné zvýšenie), by na posúdenie údajov malo slúžiť odborné posúdenie a/alebo ďalšie skúmanie vykonaných pokusov. V niektorých prípadoch by mohlo byť užitočné vykonať analýzu viacerých buniek alebo zopakovať pokus s pozmenenými podmienkami. V zriedkavých prípadoch, dokonca aj po ďalších skúmaniach, údaje neumožnia vyvodiť záver, že testované chemikálie vedú k negatívnym alebo pozitívnym výsledkom, a preto sa štúdia uzavrie ako štúdia „s nejasným výsledkom“. Skúšobný protokol Skúšobný protokol by mal zahŕňať tieto informácie:
LITERATÚRA
Dodatok 1 DEFINÍCIE Centroméra : oblasť(-ti) chromozómu, v ktorej(-ých) sa vlákna deliaceho vretienka pripájajú k chromozómu počas delenia bunky a ktorá(-é) umožňuje(-ú) riadny pohyb dcérskych chromozómov k pólom dcérskych buniek. Chemikália : látka alebo zmes. Erytroblast : skoré štádium vývoja erytrocytu bezprostredne predchádzajúce štádiu nezrelého erytrocytu, v ktorom bunka ešte obsahuje jadro. Kinetochor : bielkovinová štruktúra vytvárajúca sa na centromére eukaryotických buniek, ktorá spája chromozóm s mikrotubulovými polymérmi z mitotického vretienka počas mitózy a meiózy a funguje počas delenia buniek tak, že od seba odtrháva sesterské chromatídy. Mikrojadrá : malé jadrá doplňujúce hlavné jadrá buniek a oddelené od nich, ktoré sa vytvárajú počas telofázy mitózy (meiózy) oneskorenými chromozómovými fragmentmi alebo celými chromozómami. Normochromatický alebo zrelý erytrocyt : úplne zrelý erytrocyt, ktorý stratil reziduálnu RNA, ktorá zostáva po enukleácii, a/alebo ktorý stratil iné krátko žijúce bunkové markéry, ktoré spravidla zmiznú po enukleácii po konečnom delení erytroblastov. Polychromatický alebo nezrelý erytrocyt : novovzniknutý erytrocyt na medzistupni vývoja, ktorý sa v dôsledku prítomnosti reziduálnej RNA v novovzniknutej bunke zafarbí modrými aj červenými zložkami klasických krvných farbív, ako napr. Giemsa od Wrighta. Takéto novovzniknuté bunky sú približne rovnaké ako retikulocyty, ktoré sa vizualizujú použitím vitálneho farbiva spôsobujúceho zhlukovanie reziduálnej RNA do retikula. V súčasnosti sa na identifikáciu novovzniknutých červených krviniek používajú iné metódy vrátane monochromatického farbenia RNA fluorescenčnými farbivami alebo označovanie krátko žijúcich povrchových markérov, ako je CD71, fluorescenčnými protilátkami. Polychromatické erytrocyty, retikulocyty, ako aj CD71 pozitívne erytrocyty sú nezrelé erytrocyty, hoci každý z nich má trochu odlišné vekové rozdelenie. Retikulocyt : novo vzniknutý erytrocyt zafarbený vitálnym farbivom, ktoré spôsobuje zhlukovanie reziduálnej bunkovej RNA do charakteristického retikula. Retikulocyty a polychromatické erytrocyty majú podobné bunkové vekové rozdelenie. Testovaná chemikália : akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy. Dodatok 2 FAKTORIÁLNY NÁVRH NA IDENTIFIKÁCIU ROZDIELOV MEDZI POHLAVIAMI V IN VIVO MIKRIOJADROVEJ SKÚŠKE Faktoriálny návrh a jeho analýza V tomto návrhu sa testuje minimálne 5 samcov a 5 samíc na každej úrovni koncentrácie, čo vedie k použitiu minimálne 40 zvierat (20 samčekov a 20 samičiek, spolu s príslušnými pozitívnymi kontrolami). Uvedený návrh, ktorý predstavuje jeden z jednoduchších faktoriálnych návrhov, je ekvivalentný s dvojfaktorovou analýzou rozptylu, pričom pohlavie a úroveň koncentrácie sú hlavnými účinkami. Údaje možno analyzovať použitím mnohých štandardných softvérových balíkov pre štatistiku, ako sú napr. SPSS, SAS, STATA, Genstat, ako aj pomocou „R“. Pomocou analýzy sa variabilita v súbore údajov rozdelí na variabilitu medzi pohlaviami, variabilitu medzi koncentráciami a variabilitu v súvislosti s interakciou medzi pohlaviami a koncentráciami. Každá z podmienok sa testuje voči odhadu variability medzi paralelnými zvieratami v rámci skupín zvierat rovnakého pohlavia pri rovnakej koncentrácii. Podrobné informácie o použitej metodike sú dostupné v mnohých štandardných štatistických príručkách (pozri odkazy) a v rámci podpory poskytnutej v balíkoch pre štatistiku. Analýza prebieha formou preskúmania podmienky interakcie medzi pohlavím a koncentráciou v tabuľke ANOVA (6). Ak nenastane výrazná interakcia kombinovaných hodnôt (obe pohlavia a rôzne koncentrácie testovanej látky), platné štatistické testy ANOVA poskytnú informáciu o významnosti rozdielov medzi porovnávanými skupinami a parametrami na základe ich vnútornej variability. Analýza pokračuje rozdelením odhadovaných hodnôt pre variabilitu medzi koncentráciami na kontrasty, ktoré umožňujú testovanie na lineárne a kvadratické kontrasty reakcií pri všetkých úrovniach koncentrácií. Ak existuje významná interakcia medzi pohlavím a koncentráciou, možno túto podmienku rozdeliť aj na kontrast interakcie medzi lineárnou hodnotou a pohlavím a kontrast interakcie medzi kvadratickou hodnotou a pohlavím. Tieto podmienky umožňujú testovanie toho, či sú reakcie na koncentráciu u oboch pohlaví paralelné, alebo či je reakcia každého pohlavia odlišná. Na základe odhadov týkajúcich sa združených údajov v rámci skupinovej variability možno vykonať párové testy na zistenie rozdielu medzi priemernými hodnotami. Tieto porovnania by sa mohli vykonať medzi priemernými hodnotami pre obe pohlavia a medzi priemernými hodnotami pre rôzne úrovne koncentrácie, ako sú napríklad porovnania s úrovňami negatívnych kontrol. V prípadoch, keď dochádza k významnej interakcii, možno vykonať porovnania medzi priemernými hodnotami rôznych koncentrácií v rámci jedného pohlavia alebo medzi priemernými hodnotami pohlaví pri rovnakej koncentrácii. Odkazy Existuje mnoho štatistických príručiek, v ktorých sa rozoberá teória, návrh, metodika, analýza a výklad faktoriálnych návrhov počnúc dvoma najjednoduchšími faktorovými analýzami po komplexnejšie formy používané v metodike plánovania experimentu. Ide o tento neúplný zoznam. Niektoré knihy poskytujú spracované príklady porovnateľných návrhov, v niektorých prípadoch s kódom na vykonanie analýz pomocou rôznych softvérových balíkov.
|
|
6. |
V časti B sa vypúšťa kapitola B.15. |
|
7. |
V časti B sa vypúšťa kapitola B.16. |
|
8. |
V časti B sa vypúšťa kapitola B.18. |
|
9. |
V časti B sa vypúšťa kapitola B.19. |
|
10. |
V časti B sa vypúšťa kapitola B.20. |
|
11. |
V časti B sa vypúšťa kapitola B.24. |
|
12. |
V časti B sa kapitola B.47 nahrádza takto: „B.47 Testovacia metóda zákalu a priepustnosti hovädzej rohovky na identifikáciu i) chemikálií vyvolávajúcich vážne poškodenie očí a ii) chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 437 (2013). Testovaciu metódu zákalu a priepustnosti hovädzej rohovky ohodnotil Medziagentúrny koordinačný výbor pre validáciu alternatívnych metód (Interagency Coordinating Committee on the Validation of Alternative Methods, ICCVAM) v spojení s Európskym centrom pre validáciu alternatívnych metód (European Centre for the Validation of Alternative Methods, ECVAM) a Japonským centrom pre validáciu alternatívnych metód (Japanese Center for the Validation of Alternative Methods, JaCVAM) v rokoch 2006 a 2010 (1)(2). V prvom hodnotení bola testovacia metóda zákalu a priepustnosti hovädzej rohovky hodnotená z hľadiska užitočnosti pri identifikácii chemikálií (látok a zmesí), ktoré vyvolávajú vážne poškodenie očí (1). V druhom hodnotení bola uvedená testovacia metóda zákalu a priepustnosti hovädzej rohovky hodnotená z hľadiska užitočnosti pri identifikácii chemikálií (látok a zmesí), ktoré nie sú klasifikované ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí (2). Validačná databáza testovacích metód zákalu a priepustnosti hovädzej rohovky zahŕňala spolu 113 látok a 100 zmesí (2)(3). Z týchto hodnotení a ich partnerského preskúmania sa vyvodil záver, že testovacou metódou možno správne identifikovať chemikálie (látky aj zmesi), ktoré vyvolávajú vážne poškodenie očí (kategória 1), ako aj chemikálie, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí, ako sa definuje v Globálnom harmonizovanom systéme klasifikácie a označovania chemikálií (GHS) Organizácie spojených národov (OSN) (4) a v nariadení (ES) č. 1272/2008 o klasifikácii, označovaní a balení látok a zmesí (nariadenie CLP) (7), a preto bola schválená ako vedecky platná na oba účely. Vážne poškodenie očí je vyvolanie poškodenia tkaniva v oku alebo vážne fyzické zhoršenie zraku po aplikácii testovanej chemikálie na predný povrch oka, ktoré nie je úplne reverzibilné do 21 dní po aplikácii. Testované chemikálie vyvolávajúce vážne poškodenie očí sa podľa GHS OSN klasifikujú ako kategória 1. Chemikálie neklasifikované ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí sú definované ako chemikálie, ktoré nespĺňajú požiadavky na klasifikáciu v kategórii 1 alebo 2 GHS OSN (2A alebo 2B), t. j. uvádzajú sa ako chemikálie „bez kategórie“ v zmysle GHS OSN. Táto testovacia metóda zahŕňa odporúčané použitie a obmedzenia testovacej metódy zákalu a priepustnosti hovädzej rohovky na základe jej hodnotení. Hlavné rozdiely medzi pôvodnou verziou usmernenia OECD na vykonávanie testov z roku 2009 a jeho aktualizovanou verziou z roku 2013 sa okrem iného vzťahujú na: použitie testovacej metódy zákalu a priepustnosti hovädzej rohovky na identifikáciu chemikálií, ktoré si nevyžadujú klasifikáciu podľa GHS OSN (body 2 a7); objasnenie uplatniteľnosti testovacej metódy zákalu a priepustnosti hovädzej rohovky na testovanie alkoholov, ketónov a tuhých látok (body 6 a 7) a látok a zmesí (bod 8); objasnenie toho, ako by sa mali testovať povrchovo aktívne látky (surfaktanty) a zmesi, ktoré obsahujú povrchovo aktívne látky (bod 28); aktualizácie a objasnenia týkajúce sa pozitívnych kontrol (body 39 a 40); aktualizáciu rozhodovacích kritérií, pokiaľ ide o testovaciu metódu zákalu a priepustnosti hovädzej rohovky (bod 47); aktualizáciu kritérií prijateľnosti štúdie (bod 48); aktualizáciu prvkov skúšobného protokolu (bod 49); aktualizáciu dodatku 1, pokiaľ ide o definície; doplnenie dodatku 2 o prediktívnej schopnosti testovacej metódy zákalu a priepustnosti hovädzej rohovky v rámci rôznych klasifikačných systémov; aktualizáciu dodatku 3, pokiaľ ide o zoznam chemikálií na preukázanie spôsobilosti a aktualizáciu dodatku 4, pokiaľ ide o držiak rohovky testovacej metódy zákalu a priepustnosti hovädzej rohovky (bod 1) a o opacitometer (body 2 a 3). V súčasnosti sa všeobecne uznáva, že ani jediný in vitro test očnej dráždivosti nedokáže v blízkej budúcnosti nahradiť Draizov in vivo očný test slúžiaci na predpovedanie celého radu podráždení pri rôznych triedach chemikálií. Je však možné, že Draizov očný test dokážu nahradiť strategické kombinácie niekoľkých alternatívnych testovacích metód v rámci (viacstupňovej) testovacej stratégie (5). Prístup zhora nadol (5) je určený na použitie vtedy, keď sa na základe existujúcich informácií očakáva, že chemikália bude mať veľký potenciál spôsobiť podráždenie, zatiaľ čo prístup zdola nahor (5) sa má použiť vtedy, keď sa na základe existujúcich informácií očakáva, že chemikália spôsobí podráždenie očí v dostatočnej miere na to, aby si vyžadovala klasifikáciu. Testovacia metóda zákalu a priepustnosti hovädzej rohovky je in vitro testovacia metóda, ktorú možno použiť za určitých okolností a so špecifickými obmedzeniami, pokiaľ ide o klasifikáciu chemikálií z hľadiska ich nebezpečnosti pre oči a ich označovanie. Hoci sa testovacia metóda zákalu a priepustnosti hovädzej rohovky nepokladá za platnú samostatnú náhradu za očný test in vivo na králikoch, odporúča sa ako úvodný krok v rámci testovacej stratégie, ako je prístup zhora nadol, ktorý odporúča Scott et al. (5) na identifikáciu chemikálií vyvolávajúcich vážne poškodenie očí, t. j. chemikálií, ktoré sa majú klasifikovať ako kategória 1 GHS OSN bez ďalšieho testovania (4). Testovacia metóda zákalu a priepustnosti hovädzej rohovky sa takisto odporúča na identifikáciu chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí podľa definície GHS OSN (bez kategórie v zmysle GHS OSN) (4) v rámci testovacej stratégie, ako je prístup zdola nahor (5). Chemikália, o ktorej sa na základe testovacej metódy zákalu a priepustnosti hovädzej rohovky nepredpokladá, že spôsobí vážne poškodenie očí alebo že nebude klasifikovaná ako chemikália spôsobujúca podráždenie/vážne poškodenie očí, by si však na stanovenie konečnej klasifikácie vyžadovala ďalšie testovanie (in vitro a/alebo in vivo). Účelom tejto testovacej metódy je opísať postupy používané na hodnotenie potenciálu testovanej chemikálie predstavovať nebezpečnosť pre oči, a to na základe merania jej schopnosti vyvolať zákal a zvýšenú priepustnosť v izolovanej hovädzej rohovke. Toxické účinky na rohovku sa merajú: i) zníženou priepustnosťou svetla (zákalom) a ii) zvýšeným prepúšťaním farbiva fluoresceínu sodného (priepustnosťou). Výsledky posudzovania zákalu a priepustnosti rohovky po vystavení účinkom testovanej chemikálie sa skombinujú a odvodí sa z nich skóre in vitro dráždivosti (In Vitro Irritancy Score, IVIS), ktoré sa používa na klasifikáciu úrovne dráždivosti testovanej chemikálie. Definície sa uvádzajú v dodatku 1. ÚVODNÉ ÚVAHY A OBMEDZENIA Táto testovacia metóda vychádza z protokolu testovacej metódy zákalu a priepustnosti hovädzej rohovky ICCVAM (6)(7), ktorý bol pôvodne vypracovaný na základe informácií z protokolu Inštitútu pre vedy in vitro a z protokolu INVITTOX 124 (8). Protokol INVITTOX 124 predstavuje protokol používaný pri predbežnej validačnej štúdii, ktorú financovalo Európske spoločenstvo a ktorá prebehla v rokoch 1997 – 1998. Obidva protokoly vychádzajú z testovacej metódy zákalu a priepustnosti hovädzej rohovky, ktorú prvýkrát zverejnil Gautheron et al. (9). Testovaciu metódu zákalu a priepustnosti hovädzej rohovky možno použiť na identifikáciu chemikálií vyvolávajúcich vážne poškodenie očí v zmysle GHS OSN, t. j. chemikálií, ktoré sa majú klasifikovať ako chemikálie kategórie 1 GHS OSN (4). Keď sa testovacia metóda zákalu a priepustnosti hovädzej rohovky používa na tento účel, vykazuje celkovú presnosť 79 % (150/191), mieru falošnej pozitivity 25 % (32/126) a mieru falošnej negativity 14 % (9/65) v porovnaní s údajmi z metódy očného testu in vivo na králikoch s klasifikáciou podľa klasifikačného systému GHS OSN (3) (pozri dodatok 2 tabuľku 1). Keď sa testované chemikálie v rámci určitých chemických (t. j. alkoholy, ketóny) alebo fyzikálnych (t. j. tuhé látky) tried vylúčia z databázy, testovacia metóda zákalu a priepustnosti hovädzej rohovky vykazuje podľa klasifikačného systému GHS OSN celkovú presnosť 85 % (111/131), mieru falošnej pozitivity 20 % (16/81), a mieru falošnej negativity 8 % (4/50) (3). Potenciálne nedostatky testovacej metódy zákalu a priepustnosti hovädzej rohovky pri jej použití na identifikáciu chemikálií vyvolávajúcich vážne poškodenie očí (kategória 1 GHS OSN) spočívajú vo vysokej miere falošnej pozitivity pri alkoholoch a ketónoch a vysokej miere falošnej negativity pri tuhých látkach, ktoré sa zistili vo validačnej databáze (1)(2)(3). Avšak vzhľadom na to, že nie všetky alkoholy a ketóny sú testovacou metódou zákalu a priepustnosti hovädzej rohovky nadhodnotené a o niektorých sa správne predpokladalo zaradenie do kategórie 1 GHS OSN, nepokladajú sa tieto dve organické funkčné skupiny sa za skupiny mimo oblasti uplatniteľnosti tejto testovacej metódy. Používateľ tejto testovacej metódy sa bude musieť rozhodnúť, či v prípade alkoholov a ketónov možno prípadný nadhodnotený predpoklad akceptovať, alebo či by sa malo vykonať ďalšie testovanie formou analýzy váhy dôkazov. Pokiaľ ide o miery falošnej negativity v prípade tuhých látok, malo by sa poznamenať, že tuhé látky môžu pri Draizovom in vivo teste očnej dráždivosti viesť k premenlivým a extrémnym podmienkam expozície, dôsledkom čoho môžu byť predpoklady týkajúce sa ich skutočného potenciálu spôsobiť podráždenie irelevantné (10). Malo by sa takisto uviesť, že falošne negatívne výsledky identifikované vo validačnej databáze ICCVAM (2)(3) v súvislosti s identifikáciou chemikálií vyvolávajúcich vážne poškodenie očí (kategória 1 GHS OSN) v žiadnom prípade neviedli k hodnote IVIS ≤ 3, čo je kritérium používané na identifikáciu testovanej chemikálie ako chemikálie bez kategórie v zmysle GHS OSN. Okrem toho falošné negatívne výsledky testovacej metódy zákalu a priepustnosti hovädzej rohovky v tejto súvislosti nie sú rozhodujúce, keďže všetky testované chemikálie, ktoré vedú k hodnote 3 < IVIS ≤ 55, by sa následne testovali pomocou iných adekvátne validovaných in vitro testov, alebo – ako posledná možnosť na králikoch, v závislosti od regulačných požiadaviek pomocou stratégie postupného testovania v rámci analýzy váhy dôkazov. Vzhľadom na skutočnosť, že v prípade niektorých tuhých chemikálií sa na základe testovacej metódy zákalu a priepustnosti hovädzej rohovky správne predpokladá ich zaradenie do kategórie 1 GHS OSN, nepovažuje sa ani toto fyzikálne skupenstvo za nachádzajúce sa mimo oblasti uplatniteľnosti testovacej metódy. Výskumní pracovníci by mohli zvážiť použitie tejto testovacej metódy pri všetkých typoch chemikálií, pričom hodnota IVIS > 55 by sa mala prijať ako indikátor reakcie vyvolávajúcej vážne poškodenie očí, na základe čoho by sa mala uplatniť klasifikácia v kategórii 1 GHS OSN bez ďalšieho testovania. Ako už bolo uvedené, pozitívne výsledky získané v prípade alkoholov alebo ketónov by sa však mali interpretovať opatrne, v dôsledku prípadného nadhodnotenia. Testovaciu metódu zákalu a priepustnosti hovädzej rohovky možno takisto použiť na identifikáciu chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí podľa klasifikácie GHS OSN (4). Keď sa testovacia metóda zákalu a priepustnosti hovädzej rohovky používa na tento účel, vykazuje celkovú presnosť 69 % (135/196), mieru falošnej pozitivity 69 % (61/89), a mieru falošnej negativity 0 % (0/107) v porovnaní s údajmi o metóde očného testu in vivo na králikoch s klasifikáciou podľa klasifikačného systému GHS OSN (3) (pozri dodatok 2 tabuľku 2). Zistená miera falošnej pozitivity (chemikálie bez kategórie v zmysle GHS OSN na základe testov in vivo s hodnotou IVIS > 3, pozri bod 47) je značne vysoká, no v tejto súvislosti nie je rozhodujúca, keďže všetky testované chemikálie, ktoré vedú k hodnote 3 < IVIS ≤ 55, by sa následne testovali pomocou iných adekvátne validovaných in vitro testov, alebo – ako posledná možnosť na králikoch, v závislosti od regulačných požiadaviek pomocou stratégie postupného testovania v rámci analýzy váhy dôkazov. Testovacia metóda zákalu a priepustnosti hovädzej rohovky nevykazuje žiadne osobitné nedostatky v súvislosti s testovaním alkoholov, ketónov a tuhých látok, keď je jej účelom identifikovať chemikálie, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí (bez kategórie v zmysle GHS OSN) (3). Výskumní pracovníci by mohli zvážiť použitie tejto testovacej metódy v prípade všetkých typov chemikálií, pričom negatívny výsledok (IVIS ≤ 3) by sa mal prijať ako indikátor toho, že nie je potrebná klasifikácia (bez kategórie v zmysle GHS OSN). Keďže testovacou metódou zákalu a priepustnosti hovädzej rohovky možno správne identifikovať len 31 % chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí, nemala by byť táto testovacia metóda prvou voľbou na iniciovanie prístupu zdola nahor, ak sú dostupné iné validované a uznané in vitro metódy s podobným stupňom citlivosti, no vyššou špecifickosťou. Validačná databáza testovacích metód zákalu a priepustnosti hovädzej rohovky obsahovala spolu 113 látok a 100 zmesí (2)(3). Testovacia metóda zákalu a priepustnosti hovädzej rohovky sa preto považuje za metódu uplatniteľnú na látky, ako aj zmesi. Testovacia metóda zákalu a priepustnosti hovädzej rohovky sa neodporúča na identifikáciu testovaných chemikálií, ktoré by sa mali klasifikovať ako chemikálie spôsobujúce podráždenie očí (kategória 2 alebo kategória 2A GHS OSN), alebo testovaných chemikálií, ktoré by sa mali klasifikovať ako chemikálie spôsobujúce mierne podráždenie očí (kategória 2B GHS OSN), vzhľadom na značné množstvo chemikálií kategórie 1 GHS OSN, ktoré sú zaradené do príliš nízkej kategórie, ako napr. kategória 2, 2A alebo 2B, a chemikálií bez kategórie v zmysle GHS OSN, ktoré sú zaradené do príliš vysokej kategórie, ako napr. kategória 2, 2A alebo 2B GHS OSN (2)(3). Na tento účel sa môže vyžadovať ďalšie testovanie pomocou inej vhodnej metódy. Pri všetkých postupoch, pri ktorých sa používajú hovädzie oči a hovädzie rohovky, by sa mali dodržiavať platné nariadenia a postupy pre dané testovacie zariadenie v oblasti zaobchádzania s materiálom živočíšneho pôvodu, medzi ktoré okrem iného patria tkanivá a tkanivové tekutiny. Odporúčajú sa všeobecne platné laboratórne bezpečnostné opatrenia (11). Zatiaľ čo pri testovacej metóde zákalu a priepustnosti hovädzej rohovky sa nezohľadňujú spojovkové a dúhovkové poškodenia, zohľadňujú sa v nej účinky na rohovku, ktoré sú hlavným faktorom klasifikácie in vivo pri klasifikácii v zmysle GHS OSN. Reverzibilitu lézií rohovky nemožno v testovacej metóde zákalu a priepustnosti hovädzej rohovky posudzovať ako takú. Na základe štúdií na očiach králikov sa navrhlo, aby sa posúdenie počiatočnej hĺbky poškodenia rohovky mohlo používať na identifikáciu niektorých druhov ireverzibilných účinkov (12). Na porozumenie toho, ako dochádza k ireverzibilným účinkom, ktoré nesúvisia s počiatočným vysokým stupňom poškodenia, sú však potrebné ďalšie vedecké poznatky. Nakoniec treba poznamenať, že testovacia metóda zákalu a priepustnosti hovädzej rohovky neumožňuje posúdenie potenciálu systémovej toxicity súvisiacej s vystavením očí. Táto testovacia metóda sa bude s prehodnocovaním nových informácií a údajov pravidelne aktualizovať. Napríklad v prípade potreby ucelenejšej charakteristiky poškodenia rohovky by prípadne mohla byť užitočná histopatológia. Podľa usmerňovacieho dokumentu OECD č. 160 (13) sa používateľom odporúča uchovať rohovky a pripraviť histopatologické vzorky, ktoré možno použiť na vytvorenie databázy a zavedenie rozhodovacích kritérií, ktoré by mohli ďalej zlepšiť presnosť tejto testovacej metódy V každom laboratóriu, ktoré používa túto metódu prvý raz, by sa mali použiť chemikálie na preukázanie spôsobilosti uvedené v dodatku 3. Laboratórium môže použiť tieto chemikálie na účely preukázania svojej odbornej spôsobilosti na vykonávanie testovacej metódy zákalu a priepustnosti hovädzej rohovky pred predložením údajov z testovacej metódy zákalu a priepustnosti hovädzej rohovky na účely regulačnej klasifikácie nebezpečnosti. PRINCÍP TESTU Testovacia metóda zákalu a priepustnosti hovädzej rohovky predstavuje organotypický model, ktorý poskytuje krátkodobé udržanie normálnej fyziologickej a biochemickej funkcie hovädzej rohovky in vitro. V rámci tejto testovacej metódy sa poškodenie testovanou chemikáliou posudzuje kvantitatívnymi meraniami zmien zákalu rohovky pomocou opacitometra a priepustnosti rohovky pomocou spektrofotometra vo viditeľnej oblasti svetla. Obe merania sa používajú na výpočet hodnoty IVIS, ktorá sa používa na priradenie klasifikačnej kategórie nebezpečnosti podráždenia in vitro na účely predpokladu potenciálu testovanej chemikálie spôsobiť podráždenie očí in vivo (pozri rozhodovacie kritériá v bode 48). V testovacej metóde zákalu a priepustnosti hovädzej rohovky sa používajú izolované rohovky z očí čerstvo zabitého dobytka. Zákal rohovky sa meria kvantitatívne ako množstvo rohovkou prepusteného svetla. Priepustnosť sa meria kvantitatívne ako množstvo farbiva fluoresceínu sodného, ktoré prejde celou hrúbkou rohovky, zistené v médiu v zadnej komore. Testované chemikálie sa nanášajú na epitelový povrch rohovky pridaním do prednej komory držiaka rohovky. V dodatku 4 je uvedený opis a schéma držiaka rohovky, ktorý sa používa v testovacej metóde zákalu a priepustnosti hovädzej rohovky. Držiaky rohovky sa dajú zakúpiť z rôznych zdrojov, alebo sa dajú zhotoviť. Zdroj a vek hovädzích očí a výber druhov zvierat Dobytok posielaný na bitúnky sa zvyčajne usmrcuje na ľudskú spotrebu alebo na iné komerčné použitia. Ako zdroj rohoviek na použitie v testovacej metóde zákalu a priepustnosti hovädzej rohovky sa používajú iba zdravé zvieratá, ktoré sa považujú za vhodné na vstup do ľudského potravinového reťazca. Keďže dobytok má široký rozsah hmotnosti a závisí od plemena, veku a pohlavia, neexistuje žiadne odporúčanie týkajúce sa hmotnosti zvierat v čase zabitia. Odlišné rozmery rohoviek môžu byť výsledkom použitia očí zo zvierat v rôznom veku. Rohovky s horizontálnym priemerom > 30,5 mm a so stredovou hrúbkou rohovky ≥ 1 100 μm sa zvyčajne získavajú z dobytka staršieho ako osem rokov, zatiaľ čo rohovky s horizontálnym priemerom < 28,5 mm a so stredovou hrúbkou rohovky < 900 μm sa zvyčajne získavajú z dobytka mladšieho ako päť rokov (14). Z toho dôvodu sa oči dobytka staršieho ako 60 mesiacov väčšinou nepoužívajú. Oči dobytka mladšieho ako 12 mesiacov sa takisto bežne nepoužívajú, pretože tieto oči sa ešte vyvíjajú a hrúbka rohovky a jej priemer sú značne menšie než je hrúbka a priemer rohoviek, ktoré sa uvádzajú v prípade očí dospelého dobytka. Použitie rohoviek mladých zvierat (t. j. vo veku 6 až 12 mesiacov) je však prípustné, pretože má niekoľko výhod, ako je lepšia dostupnosť, užší vekový rozsah a nižšia miera nebezpečnosti, pokiaľ ide o potenciálne vystavenie pracovníkov bovinnej spongiformnej encefalopatii (15). Keďže by bolo prínosné vykonať ďalšie posúdenie vplyvu veľkosti alebo hrúbky rohovky na schopnosť reagovať na žieravé a dráždivé chemikálie, odporúča sa, aby používatelia uvádzali odhadovaný vek a/alebo hmotnosť zvierat, ktorých rohovky boli použité v štúdii. Odber a doprava očí do laboratória Odber očí vykonávajú zamestnanci bitúnkov. V snahe minimalizovať mechanické a iné druhy poškodenia očí by sa oči mali odobrať čo najskôr po usmrtení zvieraťa a hneď po odobratí a počas prepravy by sa mali chladiť. Zamestnanci bitúnkov by pri oplachovaní hlavy zvieraťa nemali použiť žiadny detergent, aby sa predišlo vystaveniu očí účinkom potenciálne dráždivých chemikálií. Oči by sa mali úplne ponoriť do vychladnutého Hanksovho vyváženého soľného roztoku (ďalej len „HBSS“) v nádobe s vhodnou veľkosťou a dopraviť do laboratória takým spôsobom, aby sa minimalizovalo poškodenie a/alebo kontaminácia baktériami. Keďže oči sa odoberajú počas zabíjania, môžu byť vystavené krvi alebo iným biologickým materiálom vrátane baktérií a iných mikroorganizmov. Preto je dôležité zabezpečiť, aby bolo riziko kontaminácie minimálne [napr. tak, že sa nádoba, v ktorej sú oči uložené, bude počas odberu a prepravy udržiavať na mokrom ľade a že sa do HBSS, ktorý sa používa na skladovanie očí pri preprave, pridajú antibiotiká (napr. penicilín v dávke 100 IU/ml a streptomycín v dávke 100 μg/ml)]. Časový interval medzi odberom očí a použitím rohoviek v testovacej metóde zákalu a priepustnosti hovädzej rohovky by sa mal minimalizovať (zvyčajne sa rohovky použijú v ten istý deň, ako sa vykoná odber) a dokázateľne by nemal spochybniť výsledky skúšky. Tieto výsledky sú založené na kritériách výberu očí, ako aj na reakciách pozitívnych a negatívnych kontrol. Všetky oči použité v skúške by mali byť z tej istej skupiny očí odobratých v určitý deň. Kritériá výberu očí používaných v testovacej metóde zákalu a priepustnosti hovädzej rohovky Keď sa oči dopravia do laboratória, pozorne sa prekontrolujú s ohľadom na poškodenia vrátane zvýšeného zákalu, škrabnutí a neovaskularizácie. Použiť sa majú len rohovky z očí, ktoré nie sú takto poškodené. V ďalších krokoch skúšky sa posudzuje aj kvalita každej rohovky. Rohovky, ktoré majú zákal silnejší ako sedem zákalových jednotiek alebo zákal ekvivalentnej hodnoty pre použitý opacitometer a príslušné držiaky rohovky po prvej hodine dosahovania rovnovážneho stavu, sa majú vyradiť (POZNÁMKA: opacitometer by sa mal kalibrovať zákalovými štandardmi, ktoré sa použijú na určenie zákalových jednotiek, pozri dodatok 4). Každá ovplyvnená skupina (testovaná chemikália, súbežné negatívne a pozitívne kontroly) pozostáva minimálne z troch očí. V testovacej metóde zákalu a priepustnosti hovädzej rohovky by sa mali použiť tri rohovky na negatívnu kontrolu. Keďže všetky odobrané rohovky sú vyrezané z celej očnej gule a pripevnené do rohovkových komôr, existuje možnosť, že táto manipulácia bude mať vplyv na jednotlivé hodnoty zákalu a priepustnosti rohovky (vrátane negatívnej kontroly). Okrem toho hodnoty zákalu a priepustnosti rohoviek z kontrol na negatívnu kontrolu sa používajú na korigovanie hodnôt zákalu a priepustnosti rohovky po ovplyvnení testovanou chemikáliou a hodnôt z pozitívnej kontroly vo výpočtoch IVIS. POSTUP Príprava očí Rohovky, ktoré nie sú poškodené, sa vyrežú s 2 až 3 mm okrajom očného bielka, ktorý pomáha pri následnej manipulácii, pričom sa dáva pozor na to, aby nedošlo k poškodeniu epitelu a endotelu rohovky. Izolované rohovky sa upevnia do špeciálne navrhnutých držiakov rohovky pozostávajúcich z prednej a zadnej komory, ktoré sú jednotlivo prepojené s epitelovou a s endotelovou stranou rohovky. Obidve komory sa naplnia až po okraj predhriatym minimálnym základným médiom podľa Eagla (Eagle's Minimum Essential Medium, EMEM) bez fenolovej červene (najskôr zadná komora), pričom sa zabezpečí, aby sa nevytvorili bubliny. Zariadenie sa potom nechá ustáliť na teplotu 32 ± 1 °C aspoň jednu hodinu, čím sa umožní, aby sa teplota rohoviek vyrovnala s teplotou média a aby rohovky dosiahli bežnú metabolickú aktivitu v najväčšej možnej miere (približná teplota povrchu rohovky in vivo je 32 °C). Po dobe ustálovania sa do oboch komôr pridá čerstvé predhriate EMEM bez fenolovej červene a pri každej rohovke sa odčítajú základné údaje o zákale. Všetky rohovky, ktoré vykazujú makroskopické poškodenie tkaniva (napr. škrabnutia, pigmentáciu, neovaskularizáciu), alebo zákal silnejší ako sedem zákalových jednotiek, alebo ekvivalentnú hodnotu nameranú s použitím opacitometra a držiaka rohovky, sa vyradia. Minimálne tri rohovky sa vyberú ako rohovky na negatívnu kontrolu (alebo kontrolu rozpúšťadla). Zvyšné rohovky sa potom rozdelia do ovplyvnených skupín a pozitívnych kontrolných skupín. Keďže tepelná kapacita vody je vyššia ako tepelná kapacita vzduchu, voda poskytuje stabilnejšie teplotné podmienky na inkubáciu. Preto sa odporúča použiť vodný kúpeľ na udržiavanie držiaka rohovky a jeho obsahu na teplote 32 ± 1 °C. Takisto však možno použiť vzdušné inkubátory za predpokladu, že sa zabezpečí udržiavanie stabilnej teploty (napr. predhriatím držiakov a médií). Aplikácia testovanej chemikálie Používajú sa dva rôzne protokoly o ovplyvnení, jeden na kvapaliny a povrchovo aktívne látky (tuhé látky alebo kvapaliny) a jeden na povrchovo neaktívne tuhé látky. Kvapaliny sa testujú nezriedené. Polotuhé látky, krémy a vosky sa zvyčajne testujú ako kvapaliny. Čisté povrchovo aktívne látky sa testujú pri koncentrácii 10 % hmotnostnej koncentrácie v 0,9 % roztoku chloridu sodného, destilovanej vody alebo iného rozpúšťadla, v prípade ktorého sa preukázalo, že nemá nepriaznivé účinky na testovací systém. Pri alternatívnych koncentráciách zriedenia by sa mali uviesť príslušné dôvody. Zmesi s obsahom povrchovo aktívnych látok možno testovať nezriedené alebo zriedené na vhodnú koncentráciu v závislosti od príslušného expozičného scenára in vivo. Pri testovaných koncentráciách by sa mali uviesť príslušné dôvody. Rohovky sa vystavia kvapalinám a povrchovo aktívnym látkam na 10 minút. Pri použití inej doby expozície by sa malo uviesť primerané vedecké zdôvodnenie. Definíciu povrchovo aktívnej látky a zmesi, ktorá obsahuje povrchovo aktívne látky, možno nájsť v dodatku 1. Povrchovo neaktívne tuhé látky sa zvyčajne testujú ako roztoky alebo suspenzie pri koncentrácii 20 % hmotnostnej koncentrácie v 0,9 % roztoku chloridu sodného, v destilovanej vode alebo v inom rozpúšťadle, o ktorom sa preukázalo, že nemá žiadne nepriaznivé účinky na testovací systém. Za určitých okolností a pri náležitom vedeckom zdôvodnení sa tuhé látky môžu testovať aj čisté priamym nanesením na povrch rohovky s použitím metódy otvorenej komory (pozri bod 32). Rohovky sa vystavia pôsobeniu tuhých látok na štyri hodiny, no rovnako ako v prípade kvapalín a povrchovo aktívnych látok, možno použiť aj inú dĺžku vystavenia, ak sa primeraným spôsobom vedecky zdôvodní. Je možné používať rôzne metódy ovplyvnenia, ich použitie závisí od fyzikálnej povahy a chemických vlastností (napr. tuhé látky, kvapaliny, viskózne či neviskózne kvapaliny) testovanej chemikálie. Kritický faktor spočíva v zabezpečení, aby testovaná chemikália primerane pokrývala epitelový povrch a aby sa pri oplachovaní dostatočne odstránila. Metóda uzavretej komory sa zvyčajne používa pri neviskóznych až mierne viskóznych kvapalných testovaných chemikáliách, zatiaľ čo metóda otvorenej komory sa zvyčajne používa v prípade poloviskóznych a viskóznych kvapalných testovaných chemikáliách a čistých tuhých látok. V prípade metódy uzavretej komory sa do prednej komory cez dávkovacie otvory na hornom povrchu komory zavedie dostatočné množstvo testovanej chemikálie (750 μl) tak, aby sa ňou pokryla epitelová strana rohovky, a otvory komory sa následne uzavrú komorovými zátkami na čas vystavenia. Je dôležité zabezpečiť, aby každá rohovka bola vystavená pôsobeniu testovanej chemikálie počas primeranej doby. Pri metóde otvorenej komory sa pred ovplyvnením vyberie prstencový zámok okienkovej dosky a sklenená doska z prednej komory. Kontrolná alebo testovaná chemikália (750 μl alebo dostatočné množstvo testovanej chemikálie na úplné pokrytie rohovky) sa pomocou mikropipety nanesie priamo na epitelový povrch rohovky. Ak sa testovaná chemikália ťažko pipetuje, môže sa na uľahčenie dávkovania naplniť do výtlakovej piestovej pipety. Špička výtlakovej piestovej pipety sa vloží do dávkovacieho hrotu injekčnej striekačky tak, aby sa materiál mohol zaviesť do vytláčacieho hrotu pod tlakom. S posúvaním piestu pipety nahor sa súčasne tlačí na piest injekčnej striekačky. Ak sa v špičke pipety objavia vzduchové bubliny, testovaná chemikália sa odstráni (vytlačí) a postup sa opakuje, pokiaľ sa špička nenaplní bez vzduchových bublín. V prípade potreby možno použiť obyčajnú injekčnú striekačku (bez ihly), pretože umožňuje odmeranie presného objemu testovanej chemikálie a jej ľahšie nanesenie na epitelový povrch rohovky. Po dávkovaní sa sklenené okienko vráti na svoje miesto v prednej komore a tým sa obnoví uzavretý systém. Postexpozičná inkubácia Po uplynutí doby expozície sa testovaná chemikália, chemikália na negatívnu kontrolu alebo chemikália na pozitívnu kontrolu odstránia z prednej komory a epitel sa umyje aspoň trikrát (alebo pokiaľ sa nedosiahne stav, že nie sú viditeľné žiadne znaky prítomnosti testovanej chemikálie) s EMEM (obsahujúcim fenolovú červeň). Médium s obsahom fenolovej červene sa používa na oplachovanie, lebo zmena farby fenolovej červene sa môže monitorovať, čím sa zistí účinnosť oplachovania kyslých alebo zásaditých testovaných chemikálií. Rohovky sa umývajú viac ako trikrát, ak je farba fenolovej červene stále zmenená (na žltú alebo fialovú), alebo ak je testovaná chemikália stále viditeľná. Keď médium neobsahuje testovanú chemikáliu, rohovky sa opláchnu posledný raz pomocou EMEM (bez fenolovej červene). EMEM (bez fenolovej červene) sa používa na konečné opláchnutie, aby sa zabezpečilo odstránenie fenolovej červene z prednej komory pred meraním zákalu. Predná komora sa potom znova naplní čerstvým EMEM bez fenolovej červene. V prípade kvapalín alebo povrchovo aktívnych látok sa rohovky po opláchnutí inkubujú ďalšie dve hodiny pri teplote 32 ± 1 °C. Dlhší postexpozičný čas môže byť za určitých okolností užitočný a mohlo by sa o ňom uvažovať v konkrétnych prípadoch. Rohovky ovplyvnené tuhými látkami sa na konci štvorhodinovej doby expozície dôkladne opláchnu, ale nevyžaduje sa ďalšia inkubácia. Na konci postexpozičnej inkubačnej doby (v prípade kvapalín a povrchovo aktívnych látok) a na konci štvorhodinovej doby vystavenia (v prípade povrchovo neaktívnych tuhých látok) sa zaznamená zákal a priepustnosť každej rohovky. Každá rohovka sa takisto vizuálne prehliadne a zaznamenajú sa prípadné zistenia (napr. zlupovanie tkaniva, zvyšky testovanej chemikálie, vzorky s nerovnomerným zákalom). Tieto pozorovania by mohli byť dôležité, lebo sa môžu prejaviť v odchýlkach vo výsledkoch odčítavaných z opacitometra. Kontrolné chemikálie Do každého pokusu sa zaradia súbežné negatívne kontroly alebo kontroly rozpúšťadla/nosiča a pozitívne kontroly. Keď sa testuje kvapalná látka s koncentráciou 100 %, zaradí sa súbežná negatívna kontrola (napr. 0,9 % roztok chloridu sodného alebo destilovaná voda) do testovacej metódy zákalu a priepustnosti hovädzej rohovky, aby sa dali zistiť nešpecifické zmeny v testovacom systéme a aby sa poskytol základ pre sledované parametre skúšky. Tým sa takisto zabezpečí, aby v dôsledku podmienok skúšky nedošlo k neprimeranej reakcii vo forme podráždenia. Keď sa testuje zriedená kvapalina, povrchovo aktívna látka alebo tuhá látka, do testovacej metódy zákalu a priepustnosti hovädzej rohovky sa zaradí súbežná kontrolná skupina rozpúšťadla/nosiča, aby sa dali zistiť nešpecifické zmeny v testovacom systéme a aby sa poskytol základ pre sledované parametre skúšky. Môže sa použiť iba také rozpúšťadlo/nosič, u ktorého sa preukázalo, že nemá žiadne nepriaznivé účinky na testovací systém. Do každého pokusu sa zaradí chemikália známa schopnosťou vyvolať podráždenie očí ako súbežná pozitívna kontrola, čím sa overí integrita testovacieho systému a jeho správne vykonávanie. V snahe zabezpečiť možnosť posúdiť variabilitu reakcie pri pozitívnej kontrole v čase by však rozsah dráždivej reakcie nemal byť nadmerný. Príklady pozitívnych kontrol pri kvapalných testovaných chemikáliách sú 100 % etanol alebo 100 % dimetylformamid. Príkladom pozitívnej kontroly pri tuhých testovaných chemikáliách je 20 % hmotnostnej koncentrácie imidazolu v 0,9 % roztoku chloridu sodného. Referenčné chemikálie sú užitočné na posudzovanie potenciálu neznámych chemikálií určitej chemickej triedy alebo triedy výrobkov vyvolať očnú dráždivosť, alebo na posudzovanie potenciálu pomernej dráždivosti chemikálie spôsobujúcej podráždenie očí v rámci osobitného rozsahu dráždivých reakcií. Merané sledované parametre Zákal sa určuje množstvom prepusteného svetla cez rohovku. Zákal rohovky sa kvantitatívne meria pomocou opacitometra a výsledkom sú hodnoty zákalu merané na spojitej stupnici. Priepustnosť sa určuje množstvom farbiva fluoresceínu sodného, ktoré prenikne cez všetky bunkové vrstvy rohovky (t. j. od epitelu na vonkajšom povrchu rohovky cez endotel na vnútornom povrchu rohovky). Jeden ml roztoku fluoresceínu sodného (4 mg/ml pri testovaní kvapalín a povrchovo aktívnych látok alebo 5 mg/ml pri testovaní povrchovo neaktívnych tuhých látok) sa pridá do prednej komory držiaka rohovky, ktorá je spojená s epitelovou stranou rohovky, zatiaľ čo zadná komora, ktorá je spojená s endotelovou stranou rohovky, sa naplní čerstvým EMEM. Držiak sa potom inkubuje v horizontálnej polohe počas 90 ± 5 minút pri teplote 32 ± 1 °C. Množstvo fluoresceínu sodného, ktorý prejde do zadnej komory, sa kvantitatívne odmeria pomocou UV/VIS spektrofotometrie. Spektrofotometrické merania hodnotené pri 490 nm sa zaznamenajú ako hodnoty optickej hustoty (OD490) alebo absorbancie, ktoré sa merajú na spojitej stupnici. Hodnoty priepustnosti fluoresceínu sa stanovia použitím hodnôt OD490 nameraných spektrofotometrom pri viditeľnom svetle s použitím štandardnej dĺžky dráhy 1 cm. Alternatívne sa môže použiť snímač 96-jamkovej mikrotitračnej platničky za predpokladu, že i) je možné vytvoriť lineárny rozsah snímača platničiek na stanovenie hodnôt OD490 pre fluoresceín a ii) použije sa správny objem vzoriek fluoresceínu na 96-jamkovej platničke, aby výsledkom boli hodnoty OD490, ktoré sa rovnajú štandardnej dĺžke dráhy 1 cm [to by mohlo vyžadovať kompletné naplnenie jamky (zvyčajne 360 μl)]. PREENTOVANIE VÝSLEDKOV Vyhodnotenie údajov Keď sa vykoná korekcia hodnôt zákalu a priemerných hodnôt priepustnosti (OD490) na zákal pozadia a hodnoty priepustnosti OD490 pre negatívnu kontrolu, priemerné hodnoty zákalu a priepustnosti OD490 pre každú ovplyvnenú skupinu by sa mali dosadiť do empiricky odvodeného vzorca na výpočet skóre in vitro dráždivosti (ďalej len „IVIS”) pre každú ovplyvnenú skupinu takto: IVIS = priemerná hodnota zákalu + (15 × priemerná hodnota priepustnosti OD490) Sina et al. (16) oznámili, že tento vzorec bol odvodený pri vnútrolaboratórnych a medzilaboratórnych štúdiách. Údaje vypočítané pre súbor 36 zlúčenín v rámci štúdie za účasti viacerých laboratórií boli podrobené analýze podľa viacerých náhodných premenných s cieľom určiť rovnicu, ktorá by najlepšie vyjadrovala vzťah medzi údajmi in vivo a in vitro. Túto analýzu vykonali vedci v dvoch nezávislých spoločnostiach a odvodili takmer totožné rovnice. Hodnoty zákalu a priepustnosti by sa mali posudzovať aj samostatne, aby sa zistilo, či testovaná chemikália vyvolala žieravý účinok alebo silné podráždenie iba prostredníctvom jedného z dvoch sledovaných parametrov (pozri rozhodovacie kritériá). Rozhodovacie kritériá Ďalej sa uvádzajú hraničné hodnoty IVIS na identifikáciu testovaných chemikálií, ktoré vyvolávajú vážne poškodenie očí (kategória 1 GHS OSN), a testovaných chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí (bez kategórie v zmysle GHS OSN):
Kritériá prijateľnosti testu Test sa považuje za prijateľný, ak výsledkom pozitívnej kontroly je IVIS, ktoré patrí do rozsahu dvoch štandardných odchýlok aktuálneho historického priemeru, ktorý sa má aktualizovať aspoň každé tri mesiace, alebo vždy, keď sa vykoná nejaký prijateľný test v laboratóriách, v ktorých sa testy vykonávajú zriedkavo (t. j. menej ako raz za mesiac). Výsledkom reakcií negatívnej kontroly alebo kontroly rozpúšťadla/nosiča by mali byť hodnoty zákalu a priepustnosti, ktoré sú menšie ako stanovené horné medze hodnôt zákalu pozadia a priepustnosti pre hovädzie rohovky ovplyvnené príslušnou negatívnou kontrolou alebo kontrolou rozpúšťadla/nosiča. V prípade testovanej chemikálie s jednoznačnou výslednou klasifikáciou by malo byť postačujúce jedno testovanie, ktoré zahŕňa použitie aspoň troch rohoviek. Ak sa však pri prvom testovaní dosiahnu hraničné výsledky, malo by sa zvážiť druhé testovanie (no nevyžaduje sa nevyhnutne), ako aj tretie v prípade, že sa výsledky priemerného IVIS z prvých dvoch testovaní odlišujú. V tejto súvislosti sa výsledok prvého testovania pokladá za hraničný, ak predpoklady týkajúce sa troch rohoviek boli nesúhlasné tak, že:
Skúšobný protokol Skúšobný protokol by mal obsahovať tieto informácie, ak sú relevantné pre vykonanie štúdie:
LITERATÚRA
Dodatok 1 DEFINÍCIE Presnosť : blízkosť zhody medzi výsledkami testovacej metódy a akceptovanými referenčnými hodnotami. Ide o meranie analytického výkonu testovacej metódy a jeden aspekt „relevantnosti“. Tento pojem sa často zamieňa s pojmom „zhoda“ na označenie podielu správnych výsledkov testovacej metódy. Referenčná chemikália : chemikália, ktorá sa používa ako štandardná na porovnávanie s testovanou chemikáliou. Referenčná chemikália by mala mať tieto vlastnosti: i) konzistentný(-é) a spoľahlivý(-é) zdroj(-e); ii) štrukturálna a funkčná podobnosť s triedou chemikálií, ktoré sa testujú; iii) známe fyzikálno-chemické vlastnosti; iv) podporné údaje o známych účinkoch a v) známy potenciál v rozsahu želanej reakcie. Prístup zdola nahor : prístup v postupných krokoch použitý v prípade chemikálie, o ktorej sa predpokladá, že nevyžaduje klasifikáciu ako chemikália spôsobujúca podráždenie očí alebo vážne poškodenie očí. Začína odlíšením chemikálií nevyžadujúcich klasifikáciu (negatívny výsledok) od ostatných chemikálií (pozitívny výsledok). Chemikália : látka alebo zmes. Rohovka : priehľadná časť prednej strany očnej gule, ktorá pokrýva dúhovku a zrenicu a prepúšťa svetlo do vnútra oka. Zákal rohovky : meranie rozsahu zakalenia rohovky po vystavení účinkom testovanej chemikálie. Zvýšený zákal rohovky je príznakom poškodenia rohovky. Zákal možno posudzovať subjektívne, ako napr. pomocou Draizovho očného testu na králikoch, alebo objektívne pomocou prístroja, ako je „opacitometer“. Priepustnosť rohovky : kvantitatívne meranie poškodenia epitelu rohovky stanovením množstva farbiva fluoresceínu sodného, ktoré prejde cez všetky bunkové vrstvy rohovky. Podráždenie očí : vyvolanie zmien v oku po aplikácii testovanej chemikálie na vonkajší povrch oka, ktoré sú do 21 dní po aplikácii úplne reverzibilné. Zamieňa sa s pojmami „reverzibilné účinky na oči“ a „kategória 2 GHS OSN“ (4). Miera falošnej negativity : podiel všetkých pozitívnych chemikálií, ktoré sú na základe testovacej metódy nesprávne identifikované ako negatívne. Je to jeden ukazovateľ analytického výkonu testovacej metódy. Miera falošnej pozitivity : podiel všetkých negatívnych chemikálií, ktoré sú na základe testovacej metódy nesprávne identifikované ako pozitívne. Je to jeden ukazovateľ analytického výkonu testovacej metódy. Nebezpečnosť : inherentná vlastnosť činidla alebo situácia, ktorá má potenciál spôsobiť nepriaznivé účinky, ak sú organizmus, systém alebo populácia (subpopulácia) vystavené účinkom tohto činidla. Skóre in vitro dráždivosti (IVIS) : empiricky odvodený vzorec používaný v testovacej metóde zákalu a priepustnosti hovädzej rohovky, v ktorom sa priemerná hodnota zákalu a priemerná hodnota priepustnosti v každej ovplyvnenej skupine spoja do jednej hodnoty (skóre) in vitro) ovplyvnenej skupiny. IVIS = priemerná hodnota zákalu + (15 × priemerná hodnota priepustnosti). Ireverzibilné účinky na oči : pozri „vážne poškodenie očí“. Zmes : zmes alebo roztok pozostávajúce z dvoch alebo viacerých látok, ktoré v nej/ňom nereagujú (4). Negatívna kontrola : neovplyvňovaný replikát, ktorý obsahuje všetky zložky testovacieho systému. Táto vzorka sa spracuje so vzorkami ovplyvnenými testovanou chemikáliou a s inými kontrolnými vzorkami s cieľom stanoviť, či rozpúšťadlo a testovací systém na seba navzájom pôsobia. Neklasifikované : chemikálie, ktoré nie sú klasifikované v kategórii chemikálií spôsobujúcich podráždenie očí (kategória 2, 2A, alebo 2B GHS OSN) ani chemikálií spôsobujúcich vážne poškodenie očí (kategória 1 GHS OSN). Zamieňa sa s pojmom „bez kategórie v zmysle GHS OSN“. Opacitometer : prístroj na meranie „zákalu rohovky“ kvantitatívnym vyhodnotením priepustnosti svetla cez rohovku. Typický prístroj má dve priehradky, z ktorých každá má vlastný zdroj svetla a fotobunku. Jedna priehradka sa používa na ovplyvnenú rohovku, zatiaľ čo druhá sa používa na kalibrovanie a vynulovanie prístroja. Svetlo z halogénovej lampy sa vyšle cez kontrolnú priehradku (prázdna komora bez okienok alebo kvapaliny) do fotobunky a porovná sa so svetlom vyslaným do fotobunky cez testovaciu priehradku, v ktorej je umiestnená komora s rohovkou. Rozdiel v priepustnosti svetla z fotobuniek sa porovná a na číslicovom displeji sa ukáže číselná hodnota zákalu. Pozitívna kontrola : replikát obsahujúci všetky zložky testovacieho systému a ovplyvnený chemikáliou, o ktorej je známe, že vyvoláva pozitívnu reakciu. S cieľom zabezpečiť možnosť posudzovať variabilitu reakcie pozitívnej kontroly v priebehu času by rozsah pozitívnej reakcie nemal byť nadmerne veľký. Reverzibilné účinky na oči : pozri „podráždenie očí“. Spoľahlivosť : merania rozsahu, v rámci ktorého môže byť testovacia metóda v priebehu určitého času reprodukovateľná v rámci laboratórií a medzi nimi navzájom, keď sa používa ten istý protokol. Posudzuje sa vypočítaním vnútrolaboratórnej reprodukovateľnosti a medzilaboratórnej opakovateľnosti. Vážne poškodenie očí : vyvolanie poškodenia tkaniva oka alebo vážneho fyzického zhoršenia zraku po aplikácii testovanej chemikálie na vonkajší povrch oka, ktoré nie je úplne reverzibilné do 21 dní po aplikácii. Zamieňa sa s pojmami „ireverzibilné účinky na oči“ a „kategória 1 GHS OSN“ (4). Kontrola rozpúšťadla/nosiča : neovplyvnená vzorka, ktorá obsahuje všetky zložky testovacieho systému vrátane rozpúšťadla alebo nosiča a ktorá sa spracúva so vzorkami ovplyvnenými testovanou chemikáliou a s inými kontrolnými vzorkami, aby sa zistila základná reakcia vzoriek ovplyvnených testovanou chemikáliou rozpustenou v tom istom rozpúšťadle alebo nosiči. Keď sa táto vzorka testuje so súbežnou negatívnou kontrolou, preukazuje aj to, či rozpúšťadlo alebo nosič na seba s testovacím systémom navzájom pôsobia. Látka : chemické prvky a ich zlúčeniny v prirodzenom stave alebo získané akýmkoľvek procesom výroby vrátane akejkoľvek prísady potrebnej na udržanie stability produktu a akýchkoľvek nečistôt vzniknutých v použitom procese, ale s výnimkou každého rozpúšťadla, ktoré možno oddeliť bez ovplyvnenia stability látky alebo zmeny jej zloženia (4). Povrchovo aktívna látka : takisto nazývaná surfaktant, je látka, ako napríklad detergent, ktorá dokáže znížiť povrchové napätie kvapaliny, a tak jej umožniť penenie alebo prenikanie do tuhých látok. Nazýva sa aj zvlhčujúce činidlo. Zmes obsahujúca povrchovo aktívne látky : v kontexte tejto testovacej metódy je to zmes obsahujúca jednu alebo viac povrchovo aktívnych látok s konečnou koncentráciou > 5 %. Prístup zhora nadol : prístup v postupných krokoch použitý v prípade chemikálie, o ktorej sa predpokladá, že spôsobuje vážne poškodenie očí. Začína odlíšením chemikálií spôsobujúcich vážne poškodenie očí (pozitívny výsledok) od ostatných chemikálií (negatívny výsledok). Testovaná chemikália : akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy. Stratégia viacúrovňového testovania : stratégia postupného testovania, pri ktorej sa v presne určenom poradí na každej úrovni preskúmavajú všetky existujúce informácie o testovanej chemikálii pomocou analýzy váhy dôkazov s cieľom zistiť, či sú dostupné dostatočné informácie na to, aby sa mohlo prijať rozhodnutie o klasifikácii nebezpečnosti pred tým, ako sa postúpi na ďalšiu úroveň. Ak možno testovanej chemikálii na základe existujúcich informácií pripísať potenciál spôsobiť podráždenie, nevyžaduje sa ďalšie testovanie. Ak na základe existujúcich informácií nemožno testovanej chemikálii pripísať potenciál spôsobiť podráždenie očí, použije sa prístup postupného testovania na zvieratách v jednotlivých krokoch, až kým nebude možná jednoznačná klasifikácia. Globálny harmonizovaný systém klasifikácie a označovania chemikálií (GHS) Organizácie spojených národov (OSN) : systém navrhujúci klasifikáciu chemikálií (látok a zmesí) podľa štandardizovaných typov a úrovní fyzikálnych, zdravotných a enivornmentálnych nebezpečností a ich označovanie zodpovedajúcimi komunikačnými prvkami, ako sú piktogramy, výstražné slová, výstražné upozornenia, bezpečnostné upozornenia a karty bezpečnostných údajov, s cieľom poskytnúť informácie o nepriaznivých účinkoch daných chemikálií v záujme ochrany osôb (vrátane zamestnávateľov, pracovníkov, prepravcov, spotrebiteľov a subjektov reakcie na núdzové situácie) a životného prostredia (4). Kategória 1 GHS OSN : pozri „vážne poškodenie očí“. Kategória 2 GHS OSN : pozri „podráždenie očí“. Bez kategórie v zmysle GHS OSN : chemikálie, ktoré nespĺňajú požiadavky na klasifikáciu ako chemikálie kategórie 1 alebo 2 (2A alebo 2B) GHS OSN. Zamieňa sa s pojmom „neklasifikované“. Validovaná testovacia metóda : testovacia metóda, v prípade ktorej sa vykonali validačné štúdie s cieľom určiť relevantnosť (vrátane presnosti) a spoľahlivosť na konkrétny účel. Je dôležité poznamenať, že validovaná testovacia metóda nemusí poskytnúť postačujúci analytický výkon z hľadiska presnosti a spoľahlivosti, aby bola prijateľná pre navrhovaný účel. Analýza váhy dôkazov : postup posudzovania silných a slabých stránok rôznych informácií na dosiahnutie a podporu záveru, pokiaľ ide o potenciál nebezpečnosti testovanej chemikálie. Dodatok 2 PREDIKTÍVNA SCHOPNOSŤ TESTOVACEJ METÓDY ZÁKALU A PRIEPUSTNOSTI HOVÄDZEJ ROHOVKY Tabuľka 1 Prediktívna schopnosť testovacej metódy zákalu a priepustnosti hovädzej rohovky, pokiaľ ide o identifikáciu chemikálií vyvolávajúcich vážne poškodenie očí [kategória 1 GHS OSN/EÚ CLP v. iné ako kategória 1 (kategória 2 + bez kategórie); kategória I US EPA v. iné ako kategória I (kategória II + kategória III + kategória IV)]
Tabuľka 2 Prediktívna schopnosť testovacej metódy zákalu a priepustnosti hovädzej rohovky, pokiaľ ide o identifikáciu chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí („nedráždivé látky“) [bez kategórie GHS OSN/EÚ CLP v. nie bez kategórie (kategória 1 + kategória 2); kategória IV US EPA v. iné ako kategória IV (kategória I + kategória II + kategória III)]
Dodatok 3 CHEMIKÁLIE NA PREUKÁZANIE SPÔSOBILOSTI VYKONÁVAŤ TESTOVACIU METÓDU ZÁKALU A PRIEPUSTNOSTI HOVÄDZEJ ROHOVKY Pred rutinným použitím tejto testovacej metódy by laboratóriá mali preukázať technickú spôsobilosť tak, že správne určia klasifikáciu nebezpečnosti pre oči v prípade 13 chemikálií odporúčaných v tabuľke 1. Tieto chemikálie boli vybraté tak, aby predstavovali rozsah reakcií na nebezpečnosti pre oči na základe výsledkov očného testu in vivo na králikoch (TG 405) (17) a klasifikačného systému GHS OSN (t. j. kategórie 1, 2A, 2B alebo neklasifikované) (4). Ďalším kritériom výberu bola komerčná dostupnosť chemikálií, dostupnosť vysoko kvalitných referenčných údajov in vivo a dostupnosť vysoko kvalitných údajov z testovacej metódy zákalu a priepustnosti hovädzej rohovky in vitro. Referenčné údaje sú dostupné v skrátenom súhrnnom dokumente (Streamlined Summary Document) (3) a v podkladovom kontrolnom dokumente (Background Review Document) ICCVAM pre testovaciu metódu zákalu a priepustnosti hovädzej rohovky (2)(18). Tabuľka 1 Odporúčané chemikálie na preukazovanie technickej spôsobilosti na vykonávanie testovacej metódy zákalu a priepustnosti hovädzej rohovky
Dodatok 4 DRŽIAK ROHOVKY TESTOVACEJ METÓDY ZÁKALU A PRIEPUSTNOSTI HOVÄDZEJ ROHOVKY Držiaky rohoviek testovacej metódy zákalu a priepustnosti hovädzej rohovky sú vyrobené z inertného materiálu (napr. z polypropylénu). Držiaky sa skladajú z dvoch polovíc (prednej a zadnej komory) a majú dve podobné valcovité vnútorné komory. Každá komora je navrhnutá tak, aby obsiahla objem 5 ml a je ukončená skleneným okienkom, cez ktoré sa zaznamenávajú namerané údaje zákalu. Každá vnútorná komora má priemer 1,7 cm a hĺbku 2,2 cm (11). Proti presakovaniu sa používa tesniaci krúžok umiestnený na zadnej komore. Rohovky sa umiestňujú endotelovou stranou nadol na tesniaci krúžok zadných komôr a predné komory sa umiestnia na epitelovú stranu rohoviek. Komory sú zafixované na mieste tromi nehrdzavejúcimi skrutkami nachádzajúcimi sa na vonkajších okrajoch komory. Na konci každej komory je sklenené okienko, ktoré sa môže vybrať, aby sa zabezpečil ľahší prístup k rohovke. Tesniaci krúžok sa takisto nachádza medzi skleneným okienkom a komorou, aby bránil presakovaniu. Dva otvory na vrchnej strane každej komory umožňujú zavedenie a odstránenie média a testovaných chemikálií. V čase ovplyvňovania a inkubácie sú uzavreté gumovými uzávermi. Priepustnosť svetla držiakmi rohovky sa potenciálne môže zmeniť, keďže účinky opotrebovania alebo akumulácie špecifických chemických rezíduí na otvoroch vnútornej strany komory alebo na sklenených okienkach môžu ovplyvniť rozptyl alebo odraz svetla. Dôsledkom by mohla byť zvýšená alebo znížená priepustnosť základného svetla (a teda zníženie alebo zvýšenie odčítaných základných údajov o zákale) cez držiaky rohoviek, ktoré môže byť viditeľné ako markantné zmeny v očakávaných základných počiatočných meraniach zákalu rohovky v jednotlivých komorách (t. j. počiatočné hodnoty zákalu rohovky sa v určitých jednotlivých držiakoch rohoviek môžu rutinne líšiť o viac než 2 alebo 3 zákalové jednotky od očakávaných základných hodnôt). Každé laboratórium by malo zvážiť zavedenie programu na hodnotenie zmien v priepustnosti svetla cez držiaky rohoviek, a to v závislosti od povahy chemického zloženia testovaných látok a od frekvencie používania komôr. S cieľom stanoviť základné hodnoty sa držiaky rohoviek môžu pred rutinným použitím skontrolovať tak, že sa odmerajú základné hodnoty zákalu (alebo priepustnosť svetla) komôr naplnených kompletným médiom, bez rohoviek. Držiaky rohoviek sa následne pravidelne kontrolujú, či počas používania nenastali zmeny v priepustnosti svetla. Každé laboratórium si môže stanoviť frekvenciu kontrol držiakov rohoviek na základe testovaných chemikálií, frekvenciu používania a pozorovaní zmien v základných hodnotách zákalu rohoviek. Ak sa spozorujú markantné zmeny v priepustnosti svetla cez držiaky rohoviek, je potrebné zvážiť vhodné vyčistenie a/alebo vyleštenie vnútorného povrchu držiakov rohoviek alebo ich výmenu. Držiak rohovky: rozvinutý diagram 
Dodatok 5 OPACITOMETER Opacitometer je prístroj na meranie priepustnosti svetla. Napríklad v prípade zariadenia OP-KIT od výrobcu Electro Design (Riom, Francúzsko) používaného na validáciu testovacej metódy zákalu a priepustnosti hovädzej rohovky sa svetlo z halogénovej lampy vyšle cez kontrolnú priehradku (prázdna komora bez okienok alebo kvapaliny) do fotobunky a porovná sa so svetlom vyslaným do fotobunky cez testovaciu priehradku, v ktorej je umiestnená komora s rohovkou. Rozdiel v priepustnosti svetla z fotobuniek sa porovná a na číslicovom displeji sa ukáže číselná hodnota zákalu. Stanovia sa zákalové jednotky. Môžu sa používať aj iné typy opacitometrov s odlišným nastavením (napr. nevyžadujúce si paralelné merania kontrolnej a testovacej priehradky), ak sa dokáže, že vedú k podobným výsledkom ako validované zariadenie. Opacitometer by mal poskytovať lineárnu reakciu pomocou radu údajov o zákale, ktoré pokrývajú hraničné hodnoty používané pre rôzne klasifikácie opísané v prediktívnom modeli (t. j. až po hraničnú hodnotu určujúcu žieravosť/silnú dráždivosť). V snahe zabezpečiť lineárne a presné odčítanie údajov až do 75 – 80 zákalových jednotiek je potrebné vykonať kalibráciu opacitometra s použitím súboru kalibrátorov. Kalibrátory sa vložia do kalibračnej komory (komora na rohovku určená na držanie kalibrátorov) a odčíta sa údaj na opacitometri. Kalibračná komora je navrhnutá tak, aby kalibrátory boli v nej uložené približne v rovnakej vzdialenosti medzi svetlom a fotobunkou, ako by boli uložené rohovky počas meraní zákalu. Referenčné hodnoty a počiatočný nastavený bod závisia od typu použitého zariadenia. Linearita meraní zákalu by sa mala zabezpečiť vhodnými postupmi (špecifickými pre konkrétny prístroj). Napríklad v prípade zariadenia OP-KIT od výrobcu Electro Design (Rion, Francúzsko) sa opacitometer najprv kalibruje na hodnotu 0 zákalových jednotiek s použitím kalibračnej komory bez kalibrátora. Potom sa do kalibračnej komory vložia tri rôzne kalibrátory jeden po druhom a odmerajú sa zákaly. Výsledkom meraní s kalibrátormi 1, 2 a 3 by mali byť údaje o zákale, ktoré sa rovnajú ich nastaveným hodnotám 75, 150 a 225 zákalových jednotiek v uvedenom poradí ± 5 %. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
13. |
V časti B sa kapitola B.48 nahrádza takto: „B.48 Testovacia metóda izolovaného kuracieho oka na identifikáciu i) chemikálií vyvolávajúcich vážne poškodenie očí a ii) chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 438 (2013). Testovaciu metódu izolovaného kuracieho oka ohodnotil Medziagentúrny koordinačný výbor pre validáciu alternatívnych metód (Interagency Coordinating Committee on the Validation of Alternative Methods, ICCVAM) v spojení s Európskym centrom pre validáciu alternatívnych metód (European Centre for the Validation of Alternative Methods, ECVAM) a Japonským centrom pre validáciu alternatívnych metód (Japanese Centre for the Validation of Alternative Methods, JaCVAM) v rokoch 2006 a 2010 (1) (2) (3). Pri prvom hodnotení bola testovacia metóda izolovaného kuracieho oka schválená ako vedecky platná testovacia metóda na používanie ako skrínigový test na identifikáciu chemikálií (látok a zmesí), ktoré vyvolávajú vážne poškodenie očí (kategória 1) podľa Globálneho harmonizovaného systému klasifikácie a označovania chemikálií (GHS) Organizácie Spojených národov (OSN) (1) (2) (4) a nariadenia (ES) č. 1272/2008 o klasifikácii, označovaní a balení látok a zmesí (nariadenie CLP) (12). V druhom hodnotení bola testovacia metóda izolovaného kuracieho oka hodnotená z hľadiska používania ako skríningový test na identifikáciu chemikálií, ktoré nie sú klasifikované ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí podľa GHS OSN (3) (4). Výsledky validačnej štúdie a odporúčaní výboru pre partnerské preskúmanie potvrdili pôvodné odporúčanie týkajúce sa používania testovacej metódy izolovaného kuracieho oka na klasifikáciu chemikálií, ktoré vyvolávajú vážne poškodenie očí (kategória 1 GHS OSN), keďže dostupná databáza zostala nezmenená od pôvodnej validácie ICCVAM. V tomto štádiu neboli navrhnuté ďalšie odporúčania, pokiaľ ide o rozšírenie oblasti uplatniteľnosti testovacej metódy izolovaného kuracieho oka tak, aby zahŕňala iné kategórie. Prehodnotenie súboru údajov in vitro a in vivo použitých vo validačnej štúdii sa vykonalo so zameraním na vyhodnotenie užitočnosti testovacej metódy izolovaného kuracieho oka na účely identifikácie chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí (5). V závere tohto prehodnotenia sa uvádza, že testovaciu metódu izolovaného kuracieho oka možno takisto použiť na identifikáciu chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí podľa klasifikácie GHS OSN (4) (5). Táto testovacia metóda zahŕňa odporúčané použitia a obmedzenia testovacej metódy izolovaného kuracieho oka na základe týchto hodnotení. Hlavné rozdiely medzi pôvodnou verziou usmernenia OECD na vykonávanie testov z roku 2009 a jeho aktualizovanou verziou z roku 2013 sa okrem iného vzťahujú na používanie testovacej metódy izolovaného kuracieho oka na identifikáciu chemikálií, ktoré si nevyžadujú klasifikáciu podľa klasifikačného systému GHS OSN, aktualizáciu prvkov skúšobného protokolu, aktualizáciu dodatku 1, pokiaľ ide o definície, a aktualizáciu dodatku 2, pokiaľ ide o chemikálie na preukázanie spôsobilosti. V súčasnosti sa všeobecne uznáva, že v dohľadnej budúcnosti nedokáže ani jeden in vitro test očnej dráždivosti nahradiť Draizov in vivo očný test tak, aby sa dal predpokladať celý rad podráždení pri rôznych chemických triedach. Draizov očný test (6) však možno dokážu nahradiť strategické kombinácie niekoľkých alternatívnych testovacích metód v rámci (viacúrovňovej) testovacej stratégie. Prístup zhora nadol (7) sa má uplatiť vtedy, keď sa na základe existujúcich informácií očakáva, že chemikália má veľký potenciál dráždivých účinkov, zatiaľ čo prístup zdola nahor (7) sa má použiť vtedy, keď sa na základe existujúcich informácií očakáva, že chemikália nedráždi oči v dostatočnej miere na to, aby si vyžadovala klasifikáciu. Testovacia metóda izolovaného kuracieho oka je testovacia metóda in vitro, ktorú možno použiť za určitých okolností a so špecifickými obmedzeniami opísanými v bodoch 8 až 10 na klasifikáciu chemikálií z hľadiska ich nebezpečnosti pre oči a na ich označovanie. Hoci sa testovacia metóda izolovaného kuracieho oka nepokladá za platnú ako samostatná náhrada za očný test in vivo na králikoch, odporúča sa ako úvodný krok v testovacej stratégii, ako je prístup zhora nadol, ktorý odporúča Scott et al. (7) na identifikáciu chemikálií vyvolávajúcich vážne poškodenie očí, t. j. chemikálií, ktoré sa majú klasifikovať ako chemikálie kategórie 1 GHS OSN bez ďalšieho testovania (4). Testovacia metóda izolovaného kuracieho oka sa takisto odporúča na identifikáciu chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí podľa definície GHS OSN (bez kategórie) (4) a môže sa preto používať ako prvý krok v rámci prístupu testovacej stratégie zdola nahor (7). Chemikália, o ktorej sa na základe testovacej metódy izolovaného kuracieho oka nepredpokladá, že spôsobí vážne poškodenie očí alebo že nebude klasifikovaná ako chemikália spôsobujúca podráždenie/vážne poškodenie očí, by si však na stanovenie konečnej klasifikácie vyžadovala ďalšie testovanie (in vitro a/alebo in vivo). Okrem toho by sa pred použitím testovacej metódy izolovaného kuracieho oka v rámci prístupu zdola nahor podľa iných klasifikačných schém než GHS OSN malo konzultovať s príslušnými regulačnými orgánmi. Cieľom tejto testovacej metódy je opísať postupy používané na hodnotenie potenciálu testovanej chemikálie predstavovať nebezpečnosť pre oči, a to na základe merania jej schopnosti vyvolať alebo nevyvolať toxicitu v odobratom kuracom oku. Toxické účinky na rohovku sa merajú i) kvalitatívnym posúdením zákalu, ii) kvalitatívnym posúdením poškodenia epitelu na základe aplikácie fluoresceínu do oka (zadržiavanie fluoresceínu), iii) kvantitatívnym meraním zväčšenej hrúbky (opuchu) a iv) kvalitatívnym vyhodnotením makroskopického morfologického poškodenia povrchu. Posúdenie zákalu, opuchu a poškodenia rohovky po vystavení účinkom testovanej chemikálie sa hodnotia jednotlivo a potom sa zlúčia a odvodí sa klasifikácia očnej dráždivosti. Definície sa uvádzajú v dodatku 1. POČIATOČNÉ ÚVAHY A OBMEDZENIA Táto testovacia metóda vychádza z protokolu navrhnutého v usmerneňovacom dokumente OECD na vykonávanie testov 160 (8), ktorý bol vypracovaný podľa medzinárodnej validačnej štúdie ICCVAM (1) (3) (9) s príspevkami od Európskeho centra pre validáciu alternatívnych metód, Japonského centra pre validáciu alternatívnych metód a z Odboru toxikológie a aplikovanej farmakológie Organizácie pre aplikovaný prírodovedecký výskum pre kvalitu života (ďalej len „TNO”) (Holandsko). Tento protokol vychádza z informácií získaných zo zverejnených protokolov, ako aj z aktuálneho protokolu, ktorý používa TNO (10) (11) (12) (13) (14). V rámci validácie, ktorá je základom tejto testovacej metódy, bol otestovaný celý rad chemikálií a empirická databáza validačnej štúdie obsahovala 152 chemikálií, z toho 72 látok a 80 zmesí (5). Testovacia metóda je uplatniteľná na tuhé látky, kvapaliny, emulzie a gély. Kvapaliny môžu byť vodné alebo nevodné; tuhé látky môžu byť rozpustné alebo nerozpustné vo vode. Plyny a aerosóli ešte neboli vo validačnej štúdii hodnotené. Testovaciu metódu izolovaného kuracieho oka možno použiť na identifikáciu chemikálií vyvolávajúcich vážne poškodenie očí, t. j. chemikálií, ktoré sa majú klasifikovať ako kategória 1 GHS OSN (4). Pri používaní na tento účel sú zistené obmedzenia testovacej metódy izolovaného kuracieho oka založené na vysokých mierach falošnej pozitivity pri alkoholoch a vysokých mierach falošnej negativity pri tuhých látkach a povrchovo aktívnych látkach (1) (3) (9). Miery falošnej negativity v tejto súvislosti (kategória 1 GHS OSN neidentifikovaná ako kategória 1 GHS OSN) však nie sú rozhodujúce, keďže všetky testované chemikálie, ktoré majú negatívny výsledok, by sa následne testovali pomocou iného(-ých) adekvátne validovaného(-ých) in vitro testu(-ov), alebo – ako posledná možnosť – na králikoch, v závislosti od regulačných požiadaviek pomocou stratégie postupného testovania v rámci analýzy váhy dôkazov. Malo by sa poznamenať, že tuhé látky môžu spôsobiť premenlivé a extrémne podmienky expozície pri Draizovom in vivo teste očnej dráždivosti, čo môže viesť k nerelevantným predpokladom týkajúcim sa ich skutočného potenciálu spôsobiť podráždenie (15). Výskumní pracovníci by mohli zvážiť použitie tejto testovacej metódy v prípade všetkých typov chemikálií, pri ktorých by sa mal pozitívny výsledok prijať ako indikátor vážneho poškodenia očí, t. j. kategória 1 GHS OSN bez ďalšieho testovania. Pozitívne výsledky získané s použitím alkoholov by sa však mali interpretovať opatrene, keďže existuje riziko nadhodnoteného predpokladu. Keď sa testovacia metóda izolovaného kuracieho oka používa na identifikáciu chemikálií vyvolávajúcich vážne poškodenie očí (kategória 1 GHS OSN), vykazuje celkovú presnosť 86 % (120/140), mieru falošnej pozitivity 6 % (7/113), a mieru falošnej negativity 48 % (13/27) v porovnaní s údajmi o metóde očného testu in vivo na králikoch s klasifikáciou podľa klasifikačného systému GHS OSN (4) (5). Testovaciu metódu izolovaného kuracieho oka možno takisto použiť na identifikáciu chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí podľa klasifikačného systému GHS OSN (4). Pred použitím testovacej metódy izolovaného kuracieho oka v rámci prístupu zdola nahol podľa iných klasifikačných schém by sa malo konzultovať s príslušnými regulačnými orgánmi. Túto testovaciu metódu možno použiť v prípade všetkých typov chemikálií, pričom by sa mohol prijať negatívny výsledok a neklasifikovať chemikáliu ako chemikáliu spôsobujúcu podráždenie očí alebo vážne poškodenie očí. Na základe jedného výsledku z validačnej databázy však môže v prípade antivegetatívnych farieb obsahujúcich organické rozpúšťadlá dôjsť k podhodnotenému predpokladu (5). Keď sa testovacia metóda izolovaného kuracieho oka používa na identifikáciu chemikálií, ktoré si nevyžadujú klasifikáciu ako chemikálie spôsobujúce podráždenie očí alebo vážne poškodenie očí, vykazuje celkovú presnosť 82 % (125/152), mieru falošnej pozitivity 33 % (26/79), a mieru falošnej negativity 1 % (1/73) v porovnaní s údajmi o metóde očného testu in vivo na králikoch s klasifikáciou podľa klasifikačného systému GHS OSN (4) (5). Keď sa testované chemikálie v rámci určitých tried (t. j. antivegetatívne farby obsahujúce organické rozpúšťadlá) vylúčia z databázy, testovacia metóda izolovaného kuracieho oka vykazuje podľa klasifikačného systému GHS OSN presnosť 83 % (123/149), mieru falošnej pozitivity 33 % (26/78), a mieru falošnej negativity 0 % (0/71) (4) (5). Testovacia metóda izolovaného kuracieho oka sa neodporúča na identifikáciu testovaných chemikálií, ktoré by sa mali klasifikovať ako chemikálie spôsobujúce podráždenie očí (t. j. kategória 2 alebo kategória 2A GHS OSN) alebo testovaných chemikálií, ktoré by sa mali klasifikovať ako chemikálie spôsobujúce mierne podráždenie očí (kategória 2B GHS OSN) vzhľadom na značné množstvo chemikálií kategórie 1 GHS OSN, ktoré sú zaradené do príliš nízkej kategórie, ako napr. kategória 2, 2A alebo 2B GHS OSN a chemikálií bez kategórie v zmysle GHS OSN, ktoré sú zaradené do príliš vysokej kategórie, ako napr. kategória 2, 2A alebo 2B GHS OSN. Na tento účel sa môže vyžadovať ďalšie testovanie pomocou inej vhodnej metódy. Všetky postupy, pri ktorých sa používajú kuracie oči, by mali byť v súlade s platnými nariadeniami a postupmi vzťahujúcimi sa na dané testovacie zariadenie v oblasti zaobchádzania s materiálom živočíšneho pôvodu (ľudského alebo zvieracieho), medzi ktoré okrem iného patria tkanivá a tkanivové tekutiny. Odporúčajú sa všeobecne platné laboratórne bezpečnostné opatrenia (16). Zatiaľ čo pri testovacej metóde izolovaného kuracieho oka sa nezohľadňujú spojovkové a dúhovkové poškodenia, ktoré sa hodnotia v testovacej metóde očnej dráždivosti na králikoch, zohľadňujú sa v nej účinky na rohovku, ktoré sú hlavným faktorom klasifikácie in vivo pri klasifikácii v zmysle GHS OSN. Takisto je potrebné uviesť, že hoci sa reverzibilita lézií rohovky nemôže v testovacej metóde izolovaného kuracieho oka posudzovať ako taká, na základe štúdií očí králikov sa navrhlo, aby sa posúdenie počiatočnej hĺbky poškodenia rohovky mohlo používať na zistenie niektorých typov irevezibilných účinkov (17). Na porozumenie toho, ako môžu vzniknúť ireverzibilné účinky, ktoré nesúvisia s počiatočným vysokým stupňom poškodenia, sú potrebné najmä ďalšie vedecké poznatky. Testovacia metóda izolovaného kuracieho oka v konečnom dôsledku neumožňuje posúdenie potenciálu systémovej toxicity súvisiacej s vystavením očí. Táto testovacia metóda sa bude s prehodnocovaním nových informácií a údajov pravidelne aktualizovať. Napríklad v prípade potreby ucelenejšej charakteristiky poškodenia rohovky by mohla byť užitočná histopatológia. Na vyhodnotenie tejto možnosti sa používateľom odporúča uchovať oči a pripraviť histopatologické vzorky, ktoré možno použiť na vytvorenie databázy a zavedenie rozhodovacích kritérií, ktoré môžu ďalej zlepšiť presnosť tejto testovacej metódy. OECD vypracovala usmerňujúci dokument o používaní testovacích metód in vitro na hodnotenie očnej toxicity, ktorý zahŕňa podrobné postupy odberu vzoriek na histopatológiu a informácie o tom, kde treba vzorky a/alebo údaje z histopatológie predkladať (8). V každom laboratóriu, ktoré zavádza túto skúšku, by sa mali použiť chemikálie na preukázanie spôsobilosti uvedené v dodatku 2. Laboratórium môže použiť tieto chemikálie na účely preukázania svojej odbornej spôsobilosti na vykonávanie testovacej metódy izolovaného kuracieho oka pred predložením údajov o testovacej metóde izolovaného kuracieho oka na regulačné účely klasifikácie nebezpečnosti. PRINCÍP TESTU Testovacia metóda izolovaného kuracieho oka predstavuje organotypický model, ktorý poskytuje krátkodobé uchovanie kuracieho oka in vitro. Pri tejto testovacej metóde sa poškodenie testovanou chemikáliou posudzuje zistením opuchu, zákalu rohovky a zadržiavania fluoresceínu. Zatiaľ čo zákal rohovky a zadržiavanie fluoresceínu si vyžadujú kvalitatívne hodnotenie, analýza opuchu rohovky predstavuje kvantitatívne hodnotenie. Každé meranie sa buď prevedie na kvantitatívnu hodnotu, ktorá sa použije na výpočet celkového ukazovateľa podráždenia, alebo sa mu priradí kvalitatívna kategorizácia, ktorá sa použije na stanovenie klasifikácie nebezpečnosti pre oči in vitro buď ako kategória 1 GHS OSN alebo bez klasifikácie v zmysle GHS OSN. Oba uvedené výsledky možno potom použiť na predpoklad potenciálu testovanej chemikálie spôsobiť vážne poškodenie očí in vivo alebo správať sa ako chemikália, ktorá si nevyžaduje klasifikáciu ako chemikália predstavujúca nebezpečnosť pre oči (pozri rozhodovacie kritériá). V prípade chemikálií, o ktorých sa nepredpokladá, že spôsobujú vážne poškodenie očí, alebo že nebudú pomocou testovacej metódy izolovaného kuracieho oka klasifikované, sa však nemôže vykonať klasifikácia (pozri bod 11). Zdroj a vek kuracích očí Historicky sa na túto skúšku používajú oči získané z kurčiat z bitúnkov, kde sa usmrcujú na ľudskú spotrebu, čím sa odstránila potreba laboratórnych zvierat. Používajú sa iba oči zo zdravých zvierat, ktoré sa považujú za vhodné na vstup do ľudského potravinového reťazca. Hoci sa ešte nevykonala kontrolovaná štúdia na posúdenie optimálneho veku kurčiat, vek a hmotnosť kurčiat, ktoré sa historicky používajú v tejto testovacej metóde, zodpovedajú veku a hmotnosti jarných kurčiat spracovávaných tradične na hydinových bitúnkoch (t. j. približne 7 týždňové, 1,5 – 2,5 kg). Odber a doprava očí do laboratória Hlavy by sa mali sňať hneď po znehybnení kurčiat – zvyčajne elektrickým šokom a narezaním krku s následným vykrvácaním. Miestny zdroj kurčiat v blízkosti laboratória by mal byť umiestnený tak, aby sa hlavy mohli dopraviť z bitúnka do laboratória dostatočne rýchlo, čím sa minimalizuje ich znehodnotenie a/alebo kontaminácia baktériami. Časový interval medzi získaním kuracích hláv a vložením očí po ich odobratí do superfúznej komory by mal byť čo najmenší (zvyčajne do dvoch hodín), aby sa zabezpečilo splnenie kritérií prijateľnosti skúšky. Všetky oči použité v skúške by mali byť z tej istej skupiny očí odobratých v určitý deň. Keďže oči sa vyrezávajú v laboratóriu, neporušené hlavy sa dopravujú z bitúnka pri teplote okolitého prostredia (zvyčajne od 18oC do 25oC) v plastových boxoch a zvlhčujú sa utierkami namočenými do izotonického fyziologického roztoku. Kritériá výberu očí a počet očí používaných v testovacej metóde izolovaného kuracieho oka Oči, ktoré majú po odobratí vysoké počiatočné sfarbenie fluoresceínom (t. j. > 0,5) alebo vysokú hodnotu zákalu rohovky (t. j. > 0,5), sa vyradia. Každá ovplyvnená skupina a súbežná pozitívna kontrola zahŕňa najmenej tri oči. Negatívna kontrolná skupina alebo kontrola rozpúšťadla (ak sa používa iné rozpúšťadlo, ako je fyziologický roztok) obsahuje minimálne jedno oko. V prípade tuhých materiálov, ktorých použitie vedie k výsledku „bez kategórie podľa GHS OSN“, sa odporúča druhé testovanie s troma očami na potvrdenie alebo vyvrátenie negatívneho výsledku. POSTUP Príprava očí Očné viečka sa opatrne odrežú, pričom sa dbá na to, aby sa nepoškodila rohovka. Celistvosť rohovky sa rýchlo posúdi kvapkou 2 % (hmotnostnej koncentrácie) fluoresceínu sodného, ktorá sa aplikuje na povrch rohovky na niekoľko sekúnd a potom sa opláchne fyziologickým roztokom. Oči s aplikovaným fluoresceínom sa potom prehliadnu pod mikroskopom so štrbinovou lampou, aby sa zabezpečilo, že rohovka je nepoškodená (t. j. hodnota zadržiavania fluoresceínu a zákalu rohovky ≤ 0,5). Ak je rohovka nepoškodená, oko sa vyreže z lebky, pričom sa dáva pozor na to, aby sa nepoškodila rohovka. Očná guľa sa vytiahne z očnice, pričom sa tretie viečko pevne zachytí chirurgickými kliešťami a očné svaly sa prestrihnú ohnutými nožnicami s tupými hrotmi. Dôležité je zabrániť poškodeniu rohovky nadmerným tlakom (napr. kompresnými artefaktmi). Keď sa oko vyberie z očnice, mala by sa na ňom ponechať viditeľná časť očného nervu. Po vybratí z očnice sa oko položí na absorpčnú podložku a odreže sa tretie viečko a iné spojovacie tkanivá. Odobraté oko sa upevní do svorky z nehrdzavejúcej ocele tak, aby rohovka bola vo zvislej polohe. Svorka sa potom prenesie do komory superfúzneho prístroja (18). Svorky by sa mali do superfúzneho prístroja vložiť tak, aby sa fyziologický roztok dostával na celú rohovku (3 – 4 kvapky za minútu alebo 0,1 – 0,15 ml/min). Komory superfúzneho prístroja by mali mať riadenú teplotu 32 ± 1,5 °C. V dodatku 3 je uvedená schéma typického superfúzneho prístroja a očných svoriek, ktoré možno kúpiť alebo zhotoviť. Prístroj sa môže upraviť tak, aby vyhovoval potrebám konkrétneho laboratória (napr. na uloženie rôzneho počtu očí). Oči sa po vložení do superfúzneho prístroja znova prehliadnu pod mikroskopom so štrbinovou lampou a skontroluje sa, či počas vyrezávania nedošlo k ich poškodeniu. Súčasne by sa mala odmerať aj hrúbka rohovky na vrchole rohovky s použitím zariadenia na meranie hĺbky na mikroskope so štrbinovou lampou. Oči s: i) hodnotou zadržiavania fluoresceínu > 0,5; ii) hodnotou zákalu rohovky > 0,5 alebo iii) s akýmikoľvek inými znakmi poškodenia by sa mali nahradiť. Spomedzi očí, ktoré sa nevyradia na základe niektorého z týchto kritérií, sa musia vyradiť oči s hrúbkou rohovky, ktorá má odchýlku viac ako 10 % od priemernej hodnoty pre všetky oči. Používatelia by mali vedieť, že mikroskopy so štrbinovou lampou môžu poskytovať rôzne namerané hodnoty hrúbky rohovky, ak je nastavená rôzna šírka štrbiny. Šírka štrbiny by mala byť nastavená na 0,095 mm. Keď sa všetky oči prezrú a sú vyhovujúce, inkubujú sa asi 45 až 60 minút, aby sa dosiahol ustálený stav s testovacím systémom pred dávkovaním. Po dobe ustálenia sa zaznamená nulové referenčné meranie pre hrúbku a zákal rohovky, ktoré slúži ako základný stav (t. j. čas = 0). Hodnota fluoresceínu stanovená pri vyrezávaní sa používa ako základné meranie tohto sledovaného parametra. Aplikácia testovanej chemikálie Hneď po nulových referenčných meraniach sa oko (v držiaku) vyberie zo superfúzneho prístroja, uloží sa do vodorovnej polohy a na rohovku sa aplikuje testovaná chemikália. Kvapalné testované chemikálie sa zvyčajne testujú nezriedené, ale ak sa to považuje za potrebné, môžu sa zriediť (napr. ako súčasť návrhu štúdie). Ako rozpúšťadlo pre zriedené testované chemikálie sa uprednostňuje fyziologický roztok. V riadených podmienkach však možno používať aj alternatívne rozpúšťadlá, ale v prípade rozpúšťadiel iných ako fyziologický roztok by sa mala preukázať ich vhodnosť. Kvapalné testované chemikálie sa aplikujú na rohovku tak, aby celý povrch rohovky bol rovnomerne pokrytý testovanou chemikáliou; štandardný objem je 0,03 ml. Ak je to možné, tuhé testované chemikálie by sa mali čo najjemnejšie rozdrviť tĺčikom v mažiari alebo v podobnom drviacom nástroji. Prášok sa potom aplikuje na rohovku tak, aby povrch bol rovnomerne pokrytý testovanou chemikáliou; štandardné množstvo je 0,03 g. Testovaná chemikália (kvapalná alebo tuhá) sa aplikuje na 10 sekúnd a potom sa opláchne z oka fyziologickým roztokom (približne 20 ml) pri teplote okolitého prostredia. Oko (v držiaku) sa následne vráti do superfúzneho prístroja do pôvodnej zvislej polohy. V prípade potreby sa môže opláchnutie zopakovať po 10-sekundovej aplikácii a pri následných časových bodoch (napr. pri zistení rezíduí testovanej chemikálie na rohovke). Všeobecne nie je množstvo fyziologického roztoku, ktoré sa použije dodatočne, rozhodujúce, ale dôležitá je skutočnosť, že došlo k spozorovaniu priľnutia chemikálie k rohovke. Kontrolné chemikálie Do každého experimentu by sa mali zaradiť súbežné negatívne kontroly alebo kontroly rozpúšťadla/nosiča a pozitívne kontroly. Keď sa testujú kvapaliny so 100 % koncentráciou alebo tuhé látky, v testovacej metóde izolovaného kuracieho oka sa používa fyziologický roztok ako súbežná negatívna kontrola na zisťovanie nešpecifických zmien v testovacom systéme a na to, aby sa zabezpečilo, že podmienky skúšky nevedú neprimeraným spôsobom k reakcii vo forme podráždenia. Keď sa testujú zriedené kvapaliny, v testovacej metóde sa používa súbežná kontrolná skupina rozpúšťadla/nosiča na zisťovanie nešpecifických zmien v testovacom systéme a na to, aby sa zabezpečilo, že podmienky skúšky nevedú neprimeraným spôsobom k reakcii vo forme podráždenia. Ako sa uvádza v bode 31, môže sa použiť iba také rozpúšťadlo/nosič, u ktorého sa preukázalo, že nemá žiadne nepriaznivé účinky na testovací systém. Do každého pokusu sa začleňuje známa očná dráždivá látka ako súbežná pozitívna kontrola na overenie vyvolania primeranej reakcie. Keďže skúška izolovaného kuracieho oka sa používa v tejto testovacej metóde na identifikáciu žieravých alebo silne dráždivých látok, na pozitívnu kontrolu by sa mala použiť referenčná chemikália, ktorá v tejto testovacej metóde vyvoláva silnú reakciu. V snahe zabezpečiť možnosť posúdiť variabilitu reakcie na pozitívnu kontrolu v čase by však rozsah silnej reakcie nemal byť nadmerne veľký. Mali by sa vygenerovať dostatočné údaje in vitro na pozitívnu kontrolu, aby bolo možné vypočítať štatisticky definovaný prijateľný rozsah pre pozitívnu kontrolu. Ak na určitú pozitívnu kontrolu nie sú k dispozícii primerané historické údaje o testovacej metóde izolovaného kuracieho oka, môže byť potrebné vykonať štúdie, ktoré by tieto informácie poskytli. Príkladom pozitívnych kontrol na kvapalné testované chemikálie je 10 % kyselina octová alebo 5 % benzalkónium chlorid, zatiaľ čo príkladom pozitívnych kontrol na tuhé testované chemikálie je hydroxid sodný alebo imidazol. Referenčné chemikálie sú užitočné na posudzovanie potenciálu očnej dráždivosti neznámych chemikálií určitej chemickej triedy alebo triedy výrobkov alebo na posudzovanie potenciálu pomernej dráždivosti látky spôsobujúcej podráždenie očí s osobitným rozsahom dráždivých reakcií. Merané sledované parametre Ovplyvnené rohovky sa posudzujú pred ovplyvnením a 30, 75, 120, 180 a 240 minút (± 5 minút) po opláchnutí nasledujúcom po ovplyvnení. Tieto časové body poskytujú primeraný počet meraní počas štvorhodinového ovplyvňovania, pričom medzi meraniami zostáva dostatok času na vykonanie nevyhnutných pozorovaní všetkých očí. Posudzované sledované parametre sú zákal rohovky, opuch rohovky, zadržiavanie fluoresceínu v rohovke a morfologické účinky (napr. jamkovanie alebo uvoľnenie epitelu). Všetky sledované parametre s výnimkou zadržiavania fluoresceínu (ktoré sa stanovuje iba pred ovplyvnením a 30 minút po vystavení účinkom testovanej chemikálie) sa stanovujú v každom z uvedených časových bodov. Odporúča sa vyhotoviť fotografie na zdokumentovanie zákalu rohovky, zadržiavania fluoresceínu, morfologických účinkov a histopatológie, ak sa vykoná. Po poslednom prehliadnutí po štyroch hodinách sa používateľom odporúča, aby oči uložili do vhodného fixačného roztoku (napr. neutrálneho tlmeného formalínu) pre prípadné histopatologické vyšetrenie [viac podrobných informácií možno nájsť v bode 14 a odkaze (8)]. Opuch rohovky sa stanovuje meraním hrúbky rohovky optickým pachymetrom na mikroskope so štrbinovou lampou. Vyjadruje sa v percentách a vypočíta sa z meraní hrúbky rohovky podľa tohto vzorca:
Priemerná percentuálna hodnota opuchu rohovky sa pri všetkých testovaných očiach vypočíta pre všetky časové body pozorovania. Na základe najvyššej priemernej hodnoty opuchu rohovky, nameranej v hociktorom časovom bode sa potom určí celková hodnota kategórie pre každú testovanú chemikáliu (pozri bod 51). Zákal rohovky sa vyhodnocuje v tej časti rohovky, na ktorej je zákal najväčší, ako sa uvádza v tabuľke 1. Priemerná hodnota zákalu rohovky sa pri všetkých testovaných očiach vypočíta pre všetky časové body pozorovania. Na základe najvyššej priemernej hodnoty zákalu rohovky, nameranej v hociktorom časovom bode, sa potom určí celková hodnota kategórie pre každú testovanú chemikáliu (pozri bod 51). Tabuľka 1 Hodnoty zákalu rohovky
Zadržiavanie fluoresceínu sa hodnotí len pri meraní v časovom bode 30 minút, ako sa uvádza v tabuľke 2. Priemerná hodnota zadržiavania fluoresceínu pri všetkých testovaných očiach sa potom vypočíta pre časový bod 30-minútového pozorovania a použije sa na určenie celkovej hodnoty kategórie pre každú testovanú chemikáliu (pozri bod 51). Tabuľka 2 Hodnoty zadržiavania fluoresceínu
Medzi morfologické účinky patrí „jamkovanie“ buniek epitelu rohovky, „uvoľnenie epitelu“, „zdrsnenie“ povrchu rohovky a „nalepenie“ testovanej chemikálie na rohovku. Tieto zistenia môžu byť rôzne, pokiaľ ide o ich závažnosť, a môže k nim dôjsť súčasne. Klasifikácia týchto zistení je subjektívna podľa interpretácie výskumného pracovníka. PREZENTOVANIE VÝSLEDKOV Vyhodnotenie údajov Výsledné hodnoty zákalu rohovky, opuchu rohovky a zadržiavania fluoresceínu by sa mali posudzovať osobitne, aby sa stanovila trieda testovacích metód izolovaného kuracieho oka pre každý sledovaný parameter. Triedy testovacích metód izolovaného kuracieho oka sa pre každý sledovaný parameter následne spoja a stanoví sa klasifikácia dráždivosti pre každú testovanú chemikáliu. Rozhodovacie kritériá Keď sa posúdi každý sledovaný parameter, môžu sa priradiť triedy testovacích metód izolovaného kuracieho oka na základe vopred určeného rozsahu. Interpretácia opuchu rohovky (tabuľka 3), zákalu (tabuľka 4) a zadržiavania fluoresceínu (tabuľka 5) s použitím štyroch tried testovacích metód izolovaného kuracieho oka sa robí podľa nižšie uvedených hodnôt: Je dôležité upozorniť na to, že hodnoty opuchu rohovky uvedené v tabuľke 3 sa uplatňujú len vtedy, ak sa hrúbka meria mikroskopom so štrbinovou lampou (napríklad Haag-Streit BP900) so zariadením na meranie hĺbky č. 1 a pri nastavení šírky štrbiny 9 Tabuľka 3 Klasifikačné kritériá testovacích metód izolovaného kuracieho oka vzťahujúce sa na opuch rohovky
Tabuľka 4 Klasifikačné kritériá testovacích metód izolovaného kuracieho oka vzťahujúce sa na zákal
Tabuľka 5 Klasifikačné kritériá testovacích metód izolovaného kuracieho oka vzťahujúce sa na priemernú hodnotu zadržiavania fluoresceínu
Klasifikácia testovanej chemikálie in vitro sa hodnotí pomocou klasifikácie GHS, ktorá zodpovedá kombinácii kategórií získaných pre opuch rohovky, zákal rohovky a zadržiavanie fluoresceínu, ako sa uvádza v tabuľke 6. Tabuľka 6 Celkové in vitro klasifikácie
Kritéria prijateľnosti štúdie Test sa pokladá za prijateľný, ak sa súbežne negatívne kontroly alebo kontroly nosiča/rozpúšťadla a súbežne pozitívne kontroly označujú ako chemikálie bez klasifikácie v zmysle GHS OSN a chemikálie kategórie 1 GHS OSN v uvedenom poradí. Skúšobný protokol Skúšobný protokol by mal obsahovať tieto informácie, ak sú relevantné pre vykonanie štúdie:
LITERATÚRA
Dodatok 1 DEFINÍCIE Presnosť : blízkosť zhody výsledkov testovacej metódy s akceptovanými referenčnými hodnotami. Ide o meranie analytického výkonu testovacej metódy a jeden aspekt „relevantnosti“. Tento pojem sa často zamieňa s pojmom „zhoda“ na označenie podielu správnych výsledkov testovacej metódy. Referenčná chemikália : chemikália, ktorá sa používa ako štandardná na porovnávanie s testovanou chemikáliou. Referenčná chemikália by mala mať tieto vlastnosti: i) konzistentný(-é) a spoľahlivý(-é) zdroj(-e); ii) štruktúrna a funkčná podobnosť s triedou chemikálií, ktoré sa testujú; iii) známe fyzikálno-chemické vlastnosti; iv) podporné údaje o známych účinkoch a v) známy potenciál v rozsahu želanej reakcie. Prístup zdola nahor : prístup v postupných krokoch použitý v prípade chemikálie, o ktorej sa predpokladá, že nevyžaduje klasifikáciu ako chemikália spôsobujúca podráždenie očí alebo vážne poškodenie očí. Začína odlíšením chemikálií nevyžadujúcich klasifikáciu (negatívny výsledok) od ostatných chemikálií (pozitívny výsledok). Chemikália : látka alebo zmes. Rohovka : priehľadná časť prednej strany očnej gule, ktorá pokrýva dúhovku a zrenicu a prepúšťa svetlo do vnútra oka. Zákal rohovky : meranie rozsahu zakalenia rohovky po vystavení účinkom testovanej chemikálie. Zvýšený zákal rohovky je príznakom poškodenia rohovky. Opuch rohovky : objektívne meranie rozsahu zakalenia rohovky v teste izolovaného kuracieho oka po vystavení účinkom testovanej chemikálie. Je vyjadrený v percentách a vypočíta sa z meraní základnej hrúbky rohovky (na dávku) a hrúbky zaznamenávanej v pravidelných intervaloch po vystavení účinkom testovanej chemikálie v teste izolovaného kuracieho oka. Stupeň opuchu rohovky je príznakom poškodenia rohovky. Podráždenie očí : vyvolanie zmien na oku po aplikácii testovanej chemikálie na vonkajší povrch oka, ktoré sú do 21 dní po aplikácii úplne reverzibilné. Zamieňa sa s pojmami „reverzibilné účinky na oči“ a „kategória 2 GHS OSN“ (4). Miera falošnej negativity : podiel všetkých pozitívnych chemikálií, ktoré sú na základe testovacej metódy nesprávne identifikované ako negatívne. Je to jeden ukazovateľ analytického výkonu testovacej metódy. Miera falošnej pozitivity : podiel všetkých negatívnych chemikálií, ktoré sú na základe testovacej metódy nesprávne identifikované ako pozitívne. Je to jeden ukazovateľ analytického výkonu testovacej metódy. Zadržiavanie fluoresceínu : v teste izolovaného kuracieho oka subjektívne meranie rozsahu fluoresceínu sodného zadržiavaného epitelovými bunkami v rohovke po vystavení účinkom testovanej chemikálie. Stupeň zadržiavania fluoresceínu je príznakom poškodenia epitelu rohovky. Nebezpečnosť : inherentná vlastnosť činidla alebo situácia, ktorá má potenciál spôsobiť nepriaznivé účinky, ak sú organizmus, systém alebo populácia (subpopulácia) vystavené účinkom tohto činidla. Ireverzibilné účinky na oči : pozri „vážne poškodenie očí“ a „kategória 1 GHS OSN“. Zmes : zmes alebo roztok pozostávajúce z dvoch alebo viacerých látok, ktoré v nej/ňom nereagujú (4). Negatívna kontrola : neovplyvnený replikát, ktorý obsahuje všetky zložky testovacieho systému. Táto vzorka sa spracuje so vzorkami ovplyvnenými testovanou chemikáliou a s ostatnými kontrolnými vzorkami s cieľom stanoviť, či rozpúšťadlo a testovací systém na seba navzájom pôsobia. Neklasifikované : látky, ktoré nie sú klasifikované ako látky spôsobujúce podráždenie očí (kategória 2 GHS OSN) ani ako látky spôsobujúce vážne poškodenie očí (kategória 1 GHS OSN). Zamieňa sa s pojmom „bez kategórie v zmysle GHS OSN“. Pozitívna kontrola : replikát obsahujúci všetky zložky testovacieho systému a ovplyvnený chemikáliou, o ktorej je známe, že vyvoláva pozitívnu reakciu. S cieľom zabezpečiť možnosť posudzovať variabilitu reakcie pozitívnej kontroly po celý čas by rozsah silnej reakcie nemal byť nadmerne veľký. Spoľahlivosť : merania rozsahu, v rámci ktorého môže byť testovacia metóda v priebehu určitého času reprodukovateľná v rámci laboratórií a medzi nimi navzájom, keď sa používa ten istý protokol. Posudzuje sa vypočítaním vnútrolaboratórnej reprodukovateľnosti a medzilaboratórnej opakovateľnosti. Reverzibilné účinky na oči : pozri „podráždenie očí“ a „kategória 2 GHS OSN“. Vážne poškodenie očí : vyvolanie poškodenia tkaniva v oku alebo vážneho fyzického zhoršenia zraku po aplikácii testovanej chemikálie na vonkajší povrch oka, ktoré nie je úplne reverzibilné do 21 dní po aplikácii. Zamieňa sa s pojmami „ireverzibilné účinky na oči“ a „kategória 1 GHS OSN“ (4). Mikroskop so štrbinovou lampou : nástroj používaný na priame skúmanie oka pri zväčšení pod binokulárnym mikroskopom s vytvorením stereoskopického vzpriameného obrazu. V testovacej metóde izolovaného kuracieho oka sa tento prístroj používa na prehliadanie predných štruktúr kuracieho oka, ako aj na objektívne meranie hrúbky rohovky pomocou pripojeného zariadenia na meranie hĺbky. Kontrola rozpúšťadla/nosiča : neovplyvnená vzorka, ktorá obsahuje všetky zložky testovacieho systému vrátane rozpúšťadla alebo nosiča a ktorá sa spracúva so vzorkami ovplyvnenými testovanou chemikáliou a s inými kontrolnými vzorkami, aby sa zistila základná reakcia vzoriek ovplyvnených testovanou chemikáliou rozpustenou v tom istom rozpúšťadle alebo nosiči. Keď sa táto vzorka testuje so súbežnou negatívnou kontrolou, preukazuje aj to, či rozpúšťadlo alebo nosič s testovacím systémom na seba navzájom pôsobia. Látka : chemické prvky a ich zlúčeniny v prirodzenom stave alebo získané akýmkoľvek procesom výroby vrátane akejkoľvek prísady potrebnej na udržanie stability produktu a akýchkoľvek nečistôt vzniknutých v použitom procese, ale s výnimkou každého rozpúšťadla, ktoré možno oddeliť bez ovplyvnenia stability látky alebo zmeny jej zloženia (4). Povrchovo aktívna látka : takisto nazývaná surfaktant, je látka, ako napríklad detergent, ktorá dokáže znížiť povrchové napätie kvapaliny, a tak jej umožniť penenie alebo prenikanie do tuhých látok. Nazýva sa aj zvlhčujúce činidlo. Prístup zhora nadol : prístup v postupných krokoch použitý v prípade chemikálie, o ktorej sa predpokladá, že spôsobuje vážne poškodenie očí. Začína odlíšením chemikálií spôsobujúcich vážne poškodenie očí (pozitívny výsledok) od ostatných chemikálií (negatívny výsledok). Testovaná chemikália : akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy. Stratégia viacúrovňového testovania : stratégia postupného testovania, pri ktorej sa v presne určenom poradí na každej úrovni preskúmavajú všetky existujúce informácie o testovanej chemikálii pomocou analýzy váhy dôkazov s cieľom zistiť, či sú dostupné dostatočné informácie na to, aby sa mohlo prijať rozhodnutie o klasifikácii nebezpečnosti pred tým, ako sa postúpi na ďalšiu úroveň. Ak možno testovanej chemikálii na základe existujúcich informácií pripísať potenciál spôsobiť podráždenie, nevyžaduje sa ďalšie testovanie. Ak na základe existujúcich informácií nemožno testovanej chemikálii pripísať potenciál spôsobiť podráždenie očí, použije sa prístup postupného testovania na zvieratách v jednotlivých krokoch, až kým nebude možná jednoznačná klasifikácia. Globálny harmonizovaný systém klasifikácie a označovania chemikálií (GHS) Organizácie spojených národov (OSN) : systém navrhujúci klasifikáciu chemikálií (látok a zmesí) podľa štandardizovaných typov a úrovní fyzikálnych, zdravotných a enivornmentálnych nebezpečností a ich označovanie zodpovedajúcimi komunikačnými prvkami, ako sú piktogramy, výstražné slová, výstražné upozornenia, bezpečnostné upozornenia a karty bezpečnostných údajov, s cieľom poskytnúť informácie o nepriaznivých účinkoch daných chemikálií v záujme ochrany osôb (vrátane zamestnávateľov, pracovníkov, prepravcov, spotrebiteľov a subjektov reakcie na núdzové situácie) a životného prostredia (4). Kategória 1 GHS OSN : pozri „vážne poškodenie očí“ a/alebo „ireverzibilné účinky na oči“. Kategória 2 GHS OSN : pozri „podráždenie očí“ a/alebo „reverzibilné účinky na oči“. Bez kategórie v zmysle GHS OSN : látky, ktoré nespĺňajú požiadavky na klasifikáciu ako chemikálie kategórie 1 alebo 2 (2A alebo 2B) GHS OSN. Zamieňa sa s pojmom „bez kategórie“. Validovaná testovacia metóda : testovacia metóda, v prípade ktorej sa vykonali validačné štúdie s cieľom určiť relevantnosť (vrátane presnosti) a spoľahlivosť na konkrétny účel. Je dôležité poznamenať, že validovaná testovacia metóda nemusí mať dostatočný analytický výkon z hľadiska presnosti a spoľahlivosti, aby bola prijateľná pre navrhovaný účel. Analýza váhy dôkazov : postup posudzovania silných a slabých stránok rôznych informácií na dosiahnutie a podporu záveru, pokiaľ ide o potenciál nebezpečnosti chemikálie. Dodatok 2 CHEMIKÁLIE NA PREUKÁZANIE SPÔSOBILOSTI VYKONÁVAŤ TESTOVACIU METÓDU IZOLOVANÉHO KURACIEHO OKA Pred rutinným použitím testovacej metódy, ktorá sa pridržiava tejto testovacej metódy, by laboratóriá mali preukázať technickú spôsobilosť tak, že správne určia klasifikáciu nebezpečnosti pre oči v prípade 13 chemikálií odporúčaných v tabuľke 1. Tieto chemikálie boli vybraté tak, aby predstavovali rozsah reakcií na nebezpečnosti pre oči na základe výsledkov očného testu in vivo na králikoch (TG 405) a klasifikačného systému GHS OSN (t. j. kategórie 1, 2A, 2B alebo bez kategórie) (4)(6). Ďalším kritériom výberu bola komerčná dostupnosť chemikálií, dostupnosť vysoko kvalitných referenčných údajov in vivo a dostupnosť vysoko kvalitných údajov z testovacej metódy izolovaného kuracieho oka in vitro. Referenčné údaje sú dostupné v skrátenom súhrnnom dokumente (SSD) (5) a v podkladovom kontrolnom dokumente (Background Review Document) ICCVAM pre testovaciu metódu izolovaného kuracieho oka (9). Tabuľka 1 Odporúčané chemikálie na preukazovanie technickej spôsobilosti pomocou testovacej metódy izolovaného kuracieho oka
Dodatok 3 SCHEMATICKÝ NÁKRES SUPERFÚZNEHO PRÍSTROJA A OČNÝCH SVORIEK [Ďalšie generické opisy superfúzneho prístroja a očných svoriek uvádza Burton et al.(18)] 
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
14 |
V časti B sa kapitola B.49 nahrádza takto: „B.49 Mikrojadrový (mikronukleový) test na cicavčích bunkách in vitro ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov 487 (2016). Je súčasťou série testovacích metód genetickej toxikológie. Bol vypracovaný dokument OECD, ktorý obsahuje stručné informácie o testovaní v oblasti genetickej toxikológie a prehľad posledných zmien, ktoré sa vykonali v týchto usmerneniach na vykonávanie testov (1). Mikrojadrový test in vitro (MNvit) je test na genotoxicitu, ktorého cieľom je zistiť prítomnosť mikrojadier (MN) v cytoplazme buniek v interfáze. Mikrojadrá môžu pochádzať z acentrických fragmentov chromozómov (t. j. fragmentov, ktorým chýba centroméra) alebo z celých chromozómov, ktoré v štádiu anafázy pri delení bunky nie sú schopné migrovať k pólom. Preto je test MNvit metódou in vitro, ktorá poskytuje komplexný základ pre skúmanie potenciálu poškodzovania chromozómov in vitro, keďže je možné zistiť aneugény, ako aj klastogény (2) (3) v bunkách, ktoré prešli delením buniek počas vystavenia účinkom testovanej chemikálie alebo po ňom (viac podrobných informácií možno nájsť v bode 13). Mikrojadrá predstavujú poškodenie, ktoré sa prenáša na dcérske bunky, zatiaľ čo chromozómové aberácie zaznamenané v bunkách v metafáze nemožno prenášať. V oboch z týchto prípadoch je možné, že tieto zmeny nebudú zlúčiteľné s prežitím bunky. Táto testovacia metóda umožňuje použitie protokolov s inhibítorom polymerizácie aktínu, cytochalasínom B (cytoB), ako aj bez neho. Pridanie cytoB pred mitózou vedie k vzniku buniek, ktoré sú dvojjadrové, a preto umožňuje identifikáciu a analýzu mikrojadier len v tých bunkách, v ktorých prebehla jedna mitóza (4) (5). Táto testovacia metóda rovnako umožňuje použitie protokolov bez blokovania cytokinézy, pokiaľ existuje dôkaz, že analyzovaná populácia buniek prešla mitózou. Okrem použitia testu MNvit na identifikáciu chemikálií, ktoré vyvolávajú vznik mikrojadier, možno s použitím imunochemického označovania kinetochórov alebo hybridizáciou s použitím centromerických/telomerických sond [(fluorescenčná hybridizácia in situ – (FISH)] takisto získať ďalšie informácie o mechanizmoch poškodzovania chromozómov a tvorbe mikrojadier (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17). Uvedené postupy označovania a hybridizácie možno použiť vtedy, keď sa zvýši tvorba mikrojadier a výskumný pracovník chce určiť, či je tento nárast výsledkom klastogénnych a/alebo aneugénnych procesov. Keďže mikrojadrá v bunkách v interfáze možno hodnotiť relatívne objektívne, pracovníci laboratória musia zistiť len počet dvojjadrových buniek v prípade použitia cytoB a výskyt buniek s mikrojadrami vo všetkých prípadoch. Vďaka tomu možno preparáty pomerne rýchlo vyhodnotiť a analýzu možno vykonať automaticky. Takto sa počas jedného ovplyvňovania môžu vyhodnotiť prakticky tisíce, a nielen stovky buniek, čím sa zvyšuje sila testu. Nakoniec, keďže mikrojadrá môžu vzniknúť v dôsledku chýbajúcich chromozómov, existuje možnosť zistiť činitele indukujúce aneuploidiu, ktoré je ťažké skúmať pomocou bežných testov na chromozómové aberácie, napr. kapitola B.10 tejto prílohy (18). Test MNvit opísaný v tejto testovacej metóde však neumožňuje rozlišovať chemikálie indukujúce zmeny v počte chromozómov a/alebo polyploidiu od tých chemikálií, ktoré indukujú klastogenicitu bez použitia špeciálnych techník, ako je metóda FISH uvedená v bode 4. Test MNvit je spoľahlivý a možno ho vykonať v prípade rôznych druhov buniek a za prítomnosti alebo neprítomnosti cytoB. Existuje množstvo údajov na podporu validity testu MNvit s použitím rôznych druhov buniek (kultúr bunkových línií alebo primárnych bunkových kultúr) (19) (20) (21) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35) (36). Patria sem najmä medzinárodné validačné štúdie, ktoré koordinuje spoločnosť Société Française de Toxicologie Génétique (SFTG) (19) (20) (21) (22) (23), a správy z medzinárodného seminára o testovaní genotoxicity (International Workshop on Genotoxicity Testing) (5) (17). Dostupné údaje boli opätovne prehodnotené pomocou retrospektívnej validačnej štúdie založenej na analýze váhy dôkazov, ktorú uskutočnilo Európske centrum pre validáciu alternatívnych metód (ECVAM) Európskej komisie, a táto testovacia metóda bola Vedeckým poradným výborom (ESAC) ECVAM schválená ako vedecky platná (37) (38) (39). V teste MNvit na cicavčích bunkách možno použiť kultúry bunkových línií alebo primárne bunkové kultúry ľudského alebo hlodavčieho pôvodu. Keďže frekvencia mikrojadier v pozadí ovplyvní citlivosť testu, odporúča sa použiť druhy buniek, ktoré majú stabilnú a definovanú frekvenciu tvorby mikrojadier v pozadí. Použité bunky sa vyberajú na základe ich schopnosti dobrého rastu v kultúre, stability karyotypu (vrátane počtu chromozómov) a spontánnej frekvencie výskytu mikrojadier (40). Údaje, ktoré sú v súčasnosti k dispozícii, neumožňujú vyvodiť jednoznačné odporúčania. Naznačujú však, že pri hodnotení chemickej nebezpečnosti je dôležité zvážiť stav p53, genetickú stabilitu (stabilitu karyotypu), reparačnú schopnosť DNA a pôvod buniek (bunky pochádzajúce z hlodavcov versus bunky ľudského pôvodu), ktoré boli vybraté na testovanie. Používateľom tejto testovacej metódy sa preto odporúča, aby pri zisťovaní indukcie mikrojadier zvážili vplyv týchto a iných charakteristických vlastností buniek na správanie bunkovej línie, a to vzhľadom na rozvíjajúce sa poznatky v tejto oblasti. Použité definície sa uvádzajú v dodatku 1. POČIATOČNÉ ÚVAHY A OBMEDZENIA Testy, ktoré sa vykonávajú in vitro, si zvyčajne vyžadujú použitie exogénneho zdroja metabolickej aktivácie okrem prípadov, keď majú bunky metabolickú kapacitu (schopnosť) s ohľadom na testované chemikálie. Exogénny systém metabolickej aktivácie nenapodobňuje v plnej miere podmienky in vivo. Je potrebné zabrániť vzniku podmienok, ktoré by mohli viesť k umelo pozitívnym výsledkom, ktoré neodrážajú genotoxicitu testovaných chemikálií. Takéto podmienky zahŕňajú zmeny pH (41) (42) (43) alebo osmolality, interakciu s médiom na kultiváciu buniek (44) (45) alebo príliš vysoké úrovne cytotoxicity (pozri bod 29). Pri analýze indukcie mikrojadier je dôležité, aby mitóza prebehla v ovplyvňovaných aj v neovplyvňovaných kultúrach. Najinformatívnejšie štádium na hodnotenie mikrojadier je v bunkách, ktoré prešli jednou mitózou počas ovplyvňovania testovanou chemikáliou alebo po ňom. Pri vyrábaných nanomateriáloch je nutné v tejto testovacej metóde vykonať určité úpravy, ktoré však v tejto testovacej metóde nie sú opísané. Pred použitím tejto testovacej metódy na zmesi s cieľom získať údaje na zamýšľaný regulačný účel by sa malo zvážiť, či na tento účel dokáže poskytnúť primerané výsledky, a ak dokáže, z akých dôvodov. Také úvahy nie sú nutné, pokiaľ existuje regulatórna požiadavka na testovanie danej zmesi. PRINCÍP TESTU Bunkové kultúry ľudského pôvodu alebo pochádzajúce z iných cicavcov sú vystavené testovanej chemikálii s exogénnym zdrojom metabolickej aktivácie aj bez neho, pokiaľ nie sú použité bunky s dostatočnou schopnosťou metabolizácie (pozri bod 19). Počas vystavenia účinkom testovanej chemikálie alebo po nej sa bunky dostatočne dlho kultivujú, čím sa má umožniť, aby poškodenie chromozómov alebo iné účinky na bunkový cyklus/delenie buniek viedli k vytvoreniu mikrojadier v bunkách v interfáze. Na indukciu aneuploidie je zvyčajne potrebné, aby bola testovaná chemikália prítomná počas mitózy. Odobraté a zafarbené bunky v interfáze sa analyzujú na prítomnosť mikrojadier. V ideálnom prípade by sa mali mikrojadrá hodnotiť len v tých bunkách, v prípade ktorých počas vystavenia účinkom testovanej chemikálie alebo v čase po ovplyvnení (ak sa použije) prebehla mitóza. Ak boli kultúry ovplyvnené blokátorom cytokinézy, tento výsledok sa dosiahne hodnotením len dvojjadrových buniek. Ak sa blokátor cytokinézy nepoužije, je dôležité na základe zvýšenia bunkovej populácie preukázať, že analyzované bunky pravdepodobne prešli delením počas vystavenia účinkom testovanej chemikálie alebo po ňom. V prípade všetkých protokolov je dôležité preukázať, že došlo k proliferácii buniek v kontrolných, ako aj ovplyvnených kultúrach, a vo všetkých kultúrach, v prípade ktorých sa hodnotí výskyt mikrojadier, by sa mala posúdiť miera cytotoxicity alebo cytostázy vyvolané testovanou chemikáliou. OPIS METÓDY Bunky Môžu sa použiť kultivované primárne ľudské alebo iné cicavčie periférne lymfocyty (7) (20) (46) (47) a niekoľko bunkových línií hlodavcov ako CHO, V79, CHL/IU a bunky L5178Y alebo ľudské bunkové línie ako TK6 (19) (20) (21) (22) (23) (26) (27) (28) (29) (31) (33) (34) (35) (36) (pozri bod 6). V mikrojadrovom testovaní sa používajú aj iné bunkové línie, ako sú HT29 (48), Caco-2 (49), HepaRG (50) (51), bunky HepG2 (52) (53), A549 a primárne embryonálne bunky škrečka sýrskeho (54), ale v súčasnosti ešte nie sú v rozsiahlej miere validované. Preto musí byť použitie uvedených bunkových línií a typov odôvodnené na základe ich preukázaného správania sa v teste, ako sa uvádza v oddiele kritériá prijateľnosti. O cytoB bolo zaznamenané, že dokáže ovplyvniť rast buniek L5178Y, a preto sa neodporúča používať s touto bunkovou líniou (23). Pri použití primárnych buniek by sa malo z dôvodov rešpektovania dobrých podmienok zvierat, pokiaľ je to možné, zvážiť použitie buniek ľudského pôvodu a odber vzoriek by sa mal vykonať v súlade s humánnymi etickými zásadami a predpismi. Ľudské periférne lymfocyty by mali pochádzať od mladých nefajčiarov (vo veku približne od 18 do 35 rokov), o ktorých nie je známe, že by trpeli nejakou chorobou alebo že by boli v poslednom čase vystavení genotoxickým činidlám (napr. chemikáliám, ionizujúcemu žiareniu) na úrovniach, ktoré by zvýšili výskyt skrytých buniek s mikrojadrami. Tým by sa zabezpečilo, že výskyt buniek s mikrojadrami v pozadí bude nízky a stály. Základný výskyt buniek s mikrojadrami sa vekom zvyšuje a tento trend je výraznejší u žien ako u mužov (55). Ak sa používajú spoločne bunky od viac ako jedného darcu, mal by sa uviesť počet darcov. Je nevyhnutné preukázať, že bunky sa delili od začiatku ovplyvňovania testovanou chemikáliou až do vtedy, kým sa z nich odobrali vzorky. Bunkové kultúry sa udržiavajú vo fáze exponenciálneho rastu (bunkové línie) alebo sa stimulujú k deleniu (primárne kultúry lymfocytov), aby bolo možné vystavenie buniek v rôznych štádiách bunkového cyklu, pretože citlivosť buniek v jednotlivých štádiách na testované chemikálie nemusí byť známa. Primárne bunky, ktoré k deleniu potrebujú stimuláciu mitogénnymi aktivátormi, počas vystavenia účinkom testovanej chemikálie už zvyčajne nie sú synchronizované (napr. ľudské lymfocyty po 48-hodinovej mitogénnej stimulácii). Použitie synchronizovaných buniek počas ovplyvňovania testovanou chemikáliou sa neodporúča, no môže sa akceptovať, ak je odôvodnené. Médiá a podmienky kultivácie Na udržiavanie kultúr by sa mali používať vhodné rastové médiá a inkubačné podmienky (kultivačné nádoby, prípadne atmosféra s vyššou relatívnou vlhkosťou a 5 % CO2, teplota 37 °C). Bunkové línie by sa mali pravidelne kontrolovať na stabilitu modálneho počtu chromozómov a absenciu kontaminácie Mycoplasma. V prípade kontaminácie alebo zmeny modálneho počtu chromozómov by sa nemali používať. Mala by sa stanoviť dĺžka bežného bunkového cyklu bunkových línií alebo primárnych kultúr použitých v skúšobnom laboratóriu, ktorá by mala byť v súlade s bunkovými charakteristikami uvedenými v literatúre. Príprava kultúr Bunkové línie: bunky sa rozmnožujú zo zásobných kultúr, nasadia sa do rastového média v takej hustote, aby u buniek v suspenziách alebo v monovrstvách pokračoval exponenciálny rast až do odberu (napr. malo by sa zabrániť zhlukovaniu v prípade buniek rastúcich v monovrstvách). Lymfocyty: celá krv ovplyvnená antikoagulantom (napríklad. heparínom) alebo separované lymfocyty sa kultivujú (napr. 48 hodín v prípade ľudských lymfocytov) za prítomnosti mitogénu [napr. fytohemaglutinínu (PHA) v prípade ľudských lymfocytov], aby sa vyvolalo bunkové delenie pred vystavením testovanej chemikálii a cytoB. Metabolická aktivácia Ak sa použijú bunky s nedostatočnou endogénnou metabolickou kapacitou, mali by sa použiť exogénne systémy metabolickej aktivácie. Najpoužívanejším systémom, ktorý sa štandardne odporúča, pokiaľ nie je odôvodnené použitie iného systému, je postmitochondriálna frakcia obohatená o kofaktor (S9), pripravená z pečene hlodavcov (zvyčajne potkanov) ovplyvnených prípravkami na indukciu enzýmov, ako je Aroclor 1254 (56) (57), alebo zmes fenobarbitalu a beta-naftoflavónu (58) (59) (60). Použitie uvedenej zmesi nie je v rozpore so Štokholmským dohovorom o perzistentných organických látkach (61) a preukázalo sa, že táto zmes je rovnako účinná pri indukcii oxidáz so zmiešanou funkciou ako Aroclor 1254 (58) (59) (60). Frakcia S9 sa v konečnom testovacom médiu zvyčajne používa v koncentráciách od 1 obj. % do 2 obj. %, môže sa však zvýšiť až na 10 obj. %. V priebehu ovplyvňovania by sa nemali používať produkty, ktoré znižujú mitotický index, najmä vápnik-viažuce produkty (činidlá) (62). Výber typu a koncentrácie použitého exogénneho systému metabolickej aktivácie alebo metabolického induktora môže ovplyvniť trieda testovaných chemikálií. Príprava testovanej chemikálie Tuhé testované chemikálie by sa mali pred ovplyvnením buniek vo vhodnom rozpúšťadle rozpustiť a prípadne rozriediť. Kvapalné testované chemikálie možno pridať priamo do testovacieho systému a/alebo pred ovplyvnením rozriediť. Plynné alebo prchavé testované chemikálie by sa mali testovať pomocou náležite upravených štandardných protokolov, ako je napríklad ovplyvňovanie v uzatvorených nádobách (63) (64) (65). Prípravky testovanej chemikálie by sa mali pripraviť bezprostredne pred ovplyvňovaním, pokiaľ údaje o stabilite nepoukazujú na prijateľnosť uskladnenia. Podmienky testu Rozpúšťadlá Rozpúšťadlo by sa malo zvoliť tak, aby optimalizovalo rozpustnosť testovaných chemikálií bez toho, aby nepriaznivo ovplyvňovalo vykonávanie skúšky, napr. menilo rast buniek, ovplyvňovalo integritu testovanej chemikálie, reagovalo s kultivačnými nádobami, narúšalo systém metabolickej aktivácie. Odporúča sa, pokiaľ je to možné, najskôr zvážiť použitie vodného rozpúšťadla (alebo rastového média). Osvedčenými rozpúšťadlami sú voda alebo dimetylsulfoxid (DMSO). Organické rozpúšťadlá by všeobecne nemali presiahnuť 1 obj. %. Ak sa cytoB rozpustí v DMSO, celkové množstvo organického rozpúšťadla použitého na testovanú chemikáliu aj na cytoB by nemalo presiahnuť 1 obj. %, v opačnom prípade by sa mali použiť čisté kontroly, aby sa zabezpečilo, že uvedený percentuálny podiel organického rozpúšťadla nebude mať nepriaznivý účinok. Vodné rozpúšťadlá (fyziologický roztok alebo voda) by v konečnom testovacom médiu nemali presiahnuť 10 obj. %. Ak sa použijú iné ako osvedčené rozpúšťadlá (napr. etanol alebo acetón), ich použitie by malo byť podložené údajmi o ich kompatibilite s testovanou chemikáliou a testovacím systémom a o tom, že v použitej koncentrácii nie sú genotoxické. V prípade, že také údaje neexistujú, je dôležité zaradiť čisté kontroly (pozri dodatok 1), ako aj kontrou rozpúšťadla s cieľom preukázať, že zvolené rozpúšťadlo nevyvoláva škodlivé účinky ani účinky na chromozómy (napr. aneuploidiu alebo klastogenicitu). Použitie cytoB ako blokátora cytokinézy Jedným z najdôležitejších faktorov pri vykonávaní testu MNvit je zabezpečenie toho, aby v bunkách, ktoré sa hodnotia, prebehla mitóza počas ovplyvňovania alebo v inkubačnej dobe po ovplyvňovaní, ak sa použije. Preto by sa hodnotenie výskytu mikrojadier malo obmedziť len na bunky, ktoré prešli mitózou počas ovplyvňovania alebo po ňom. CytoB je najbežnejšie používané činidlo na blokovanie cytokinézy, pretože potláča tvorbu aktínu, a tým zabraňuje oddeľovaniu dcérskych buniek po mitóze, čo vedie k vytváraniu dvojjadrových buniek (6) (66) (67). Pri použití cytoB možno simultánne merať účinok testovanej chemikálie na kinetiku proliferácie buniek. CytoB by sa mal používať ako blokátor cytokinézy pri použití ľudských lymfocytov, pretože medzi rôznymi darcami budú dĺžky bunkových cyklov variabilné, a takisto preto, že nie všetky lymfocyty budú reagovať na stimuláciu PHA. Použitie cytoB nie je povinné pri iných typoch buniek, ak možno určiť, že prešli delením, ako sa opisuje v bode 27. CytoB sa okrem toho zvyčajne nepoužíva, ak sa vzorky hodnotia na mikrojadrá metódami prietokovej cytrometrie. Vhodnú koncentráciu cytoB by laboratórium malo stanoviť pre každý druh buniek, aby sa dosiahla optimálna frekvencia dvojjadrových buniek v kultúrach s kontrolou rozpúšťadla, a malo by sa preukázať, že pri tejto koncentrácii je k dispozícii dostatočné množstvo dvojjadrových buniek na hodnotenie. Vhodná koncentrácia cytoB je zvyčajne od 3 do 6 μg/ml (19). Meranie proliferácie buniek a cytotoxicity a výber expozičných koncentrácií Pri stanovovaní najvyššej koncentrácie testovanej chemikálie by sa nemali používať koncentrácie, ktoré majú schopnosť vyvolať falošné pozitívne reakcie, ako napríklad tie, ktoré spôsobujú nadmernú cytotoxicitu (pozri bod 29), zrážanie v rastovom médiu (pozri bod 30) alebo výrazné zmeny pH alebo osmolality (pozri bod 9). Ak testovaná chemikália v čase, keď sa pridáva, spôsobuje výraznú zmenu pH média, mohlo by sa pH upraviť tlmivým roztokom do konečného testovacieho média tak, aby nedošlo k falošným pozitívnym výsledkom a aby sa zachovali vhodné kultivačné podmienky. Merania bunkovej proliferácie sa vykonávajú s cieľom zabezpečiť, aby dostatočný počet ovplyvnených buniek prešiel mitózou počas testovania a aby sa ovplyvňovania vykonávali pri vhodných úrovniach cytotoxicity (bozri bod 29). Cytotoxicita by sa mala stanoviť v hlavnom pokuse s metabolickou aktiváciou a bez nej, pričom sa použije vhodná indikácia bunkovej smrti a rastu buniek (pozri body 26 a 27). Hoci hodnotenie cytotoxicity pri počiatočnom predbežnom teste môže byť užitočné na lepšie vymedzenie koncentrácií, ktoré sa majú použiť v hlavnom pokuse, počiatočný test nie je povinný. Ak sa vykoná, nemal by nahrádzať meranie cytotoxicity v hlavnom pokuse. Ovplyvňovanie kultúr s cytoB a meranie relatívnych frekvencií jednojadrových, dvojjadrových a viacjadrových buniek v kultúre predstavuje presnú metódu kvantifikácie účinkov na bunkovú proliferáciu a cytotoxického alebo cytostatického pôsobenia pri ovplyvňovaní (6) a zabezpečuje, že sa mikroskopicky hodnotia len bunky, ktoré sa delili počas ovplyvňovania alebo po ňom. Proliferačný index blokovania cytokinézy (CBPI) (6) (27) (68) alebo index replikácie (RI) minimálne z 500 buniek na kultúru (pozri vzorce v dodatku 2) sa odporúčajú na odhad cytotoxického alebo cytostatického pôsobenia pri ovplyvňovaní porovnaním hodnôt v ovplyvňovaných kultúrach a kontrolných kultúrach. Užitočné informácie by mohlo poskytnúť aj posúdenie ďalších ukazovateľov cytotoxicity (napr. integrita buniek, apoptóza, nekróza, počítanie metafáz, bunkový cyklus), tieto ukazovatele by sa však nemali používať namiesto CBPI alebo RI. V štúdiách bez použitia cytoB je potrebné preukázať, že bunky v kultúre sa rozdelili, takže podstatná časť z hodnotených buniek prešla delením počas ovplyvňovania testovanou chemikáliou alebo po ňom, inak môžu nastať falošné negatívne reakcie. Na odhad cytotoxického a cytostatického pôsobenia pri ovplyvňovaní sa odporúča vykonať meranie relatívneho zdvojenia populácie (RPD) alebo relatívneho zvýšenia počtu buniek (RICC) (17) (68) (69) (70) (71) (pozri vzorce v dodatku 2). Pri predĺžených časoch odberu vzoriek (napr. ovplyvňovanie počas obdobia zodpovedajúceho 1,5 až 2-násobku dĺžky bežného bunkového cyklu a odber po ďalšom období zodpovedajúcom 1,5 až 2-násobku dĺžky bežného bunkového cyklu, čo celkovo vedie k odberom dlhším než 3 až 4-násobok dĺžky bežného bunkového cyklu, ako sa opisuje v bodoch 38 a 39) by použitie RPD mohlo viesť k podhodnotenému odhadu cytotoxicity (71). Za týchto okolností by meranie RICC mohlo predstavovať lepšiu alternatívu alebo by bolo užitočné vykonať odhad na základe hodnotenia cytotoxicity po období zodpovedajúcom 1,5 až 2-násobku dĺžky bežného bunkového cyklu. Ďalšie užitočné informácie by mohlo poskytnúť aj posúdenie ostatných markerov cytotoxicity alebo cytostázy (napr. integrita buniek, apoptóza, nekróza, počítanie metafáz, proliferačný index (PI), bunkový cyklus, nukleoplazmatické mosty alebo jadrové zárodky), nemali by sa však používať namiesto RPD alebo RICC. Mali by sa vyhodnotiť aspoň tri testovacie koncentrácie (bez rozpúšťadla a pozitívnych kontrol), ktoré spĺňajú kritéria prijateľnosti (vhodná cytotoxicita, počet buniek atď.). Bez ohľadu na typy buniek (bunkové línie alebo primárne kultúry lymfocytov) možno pri každej testovacej koncentrácii použiť replikát alebo jednu ovplyvnenú kultúru. Hoci sa odporúča použitie duplicitných kultúr, akceptovateľná je aj jedna kultúra za predpokladu, že sa v takejto jednej kultúre alebo v duplicitných kultúrach hodnotí rovnaký celkový počet buniek. Použitie jednej kultúry je relevantné najmä v prípade, že sa posudzujú viac než 3 koncentrácie (pozri body 44 – 45). Výsledky získané z nezávislých kultúr použitých na opakovanie pri danej koncentrácii možno na účely analýzy údajov zlúčiť. V prípade testovaných chemikálií, ktoré vykazujú malú alebo nevykazujú žiadnu cytotoxicitu, budú za bežných okolností vhodné približne dvojnásobné až trojnásobné intervaly koncentrácií. Ak dôjde k cytotoxicite, mali by zvolené testovacie koncentrácie pokrývať rozpätie počnúc koncentráciou vyvolávajúcou cytotoxicitu, ako sa opisuje v bode 29, až po koncentrácie, pri ktorých dochádza k miernej a malej, alebo nedochádza k žiadnej cytotoxicite. Mnohé testované chemikálie vykazujú strmé krivky závislosti reakcie od koncentrácie a s cieľom získať údaje pri nízkej a miernej cytotoxicite alebo podrobne preštudovať závislosť reakcie od dávky bude potrebné zvoliť menšie rozdiely medzi jednotlivými koncentráciami a/alebo viac než tri koncentrácie (pre jednu kultúru alebo replikáty), a to najmä v situáciách, kedy sa vyžadujú opakované pokusy (pozri bod 60). Ak vychádza maximálna koncentrácia z cytotoxicity, mala by byť najvyššia koncentrácia taká, aby sa dosiahlo 55 ± 5 % cytotoxicity pri použití odporúčaných parametrov cytotoxicity (t. j. zníženie RICC a RPD v prípade bunkových línií, ak sa nepoužije cytoB, a zníženie CBPI alebo RI, ak sa použije cytoB, na 45 ± 5 % v prípade súbežnej negatívnej kontroly) (72). Je potrebné prihliadnuť na to, aby sa interpretovali len tie pozitívne výsledky, ktoré sú zistené pri vyššej hranici tohto 55 ± 5 % rozsahu cytotoxicity (71). V prípade slabo rozpustných testovaných chemikálií, ktoré nie sú cytotoxické pri koncentráciách nižších, než je najnižšia nerozpustná koncentrácia, by najvyššia analyzovaná koncentrácia mala na konci ovplyvňovania testovanou chemikáliou vyvolať zakalenie alebo zrazeninu viditeľnú voľným okom alebo pomocou inverzného mikroskopu. Dokonca aj v prípadoch, kedy k cytotoxicite dochádza pri koncentráciách vyšších, než je najnižšia nerozpustná koncentrácia, sa odporúča testovať len jednu koncentráciu indukujúcu zakalenie alebo viditeľnú zrazeninu, pretože vznik zrazeniny môže viesť k falošným účinkom. Pri koncentrácii, ktorá vedie k vzniku zrazeniny, je potrebné zabezpečiť, aby zrazenina neovplyvnila priebeh testovania (napr. farbenia alebo hodnotenia). Môže byť užitočné pred pokusom stanoviť rozpustnosť v rastovom médiu. Ak sa nezistí zrazenina alebo obmedzujúca cytotoxicita, mala by najvyššia testovacia koncentrácia zodpovedať 10 mM, 2 mg/ml alebo 2 μl/ml, podľa toho, ktorá z uvedených hodnôt je najnižšia (73) (74) (75). Pokiaľ testovaná chemikália nemá stanovené zloženie, ako je to napr. v prípade látok neznámeho alebo variabilného zloženia, produktov komplexných reakcií alebo biologických materiálov (UVCB) (76), prírodných extraktov atď., je možné, že najvyššia koncentrácia bude musieť byť pri nedostatočnej cytotoxicite vyššia (napr. 5 mg/ml), aby sa zvýšila koncentrácia každej zložky. Treba však poznamenať, že v prípade humánnych liekov sa tieto požiadavky môžu líšiť (93). Kontroly Pri každom odbere by sa mali zahrnúť súbežné negatívne kontroly (pozri bod 21), ktoré pozostávajú zo samotného rozpúšťadla v testovacom médiu a ktoré sú spracované rovnakým spôsobom ako ovplyvňované kultúry. Na preukázanie schopnosti laboratória identifikovať klastogény a aneugény za podmienok použitého testovacieho protokolu a účinnosti exogénneho systému metabolickej aktivácie (ak sa používa) sú nutné súbežné pozitívne kontroly. Príklady pozitívnych kontrol sú uvedené v tabuľke 1 ďalej v texte. V odôvodnených prípadoch môžu byť na pozitívnu kontrolu použité alternatívne chemikálie. V súčasnej dobe nie sú známe žiadne aneugény, ktoré by si k svojej genotoxickej aktivite vyžadovali metabolickú aktiváciu (17). Keďže testy na cicavčích bunkách in vitro na zistenie genetickej toxicity sú pri krátkodobých ovplyvňovaniach vykonávaných súbežne s metabolickou aktiváciou a bez nej a pri rovnakom čase ovplyvňovania dostatočne štandardizované, možno použitie pozitívnych kontrol obmedziť na testovanie klastogénu vyžadujúceho metabolickú aktiváciu. V tomto prípade preukáže jednoduchá odpoveď na pozitívnu klastogénnu kontrolu činnosť systému metabolickej aktivácie, ako aj vnímavosť testovacieho systému. Dlhodobé ovplyvňovanie (bez S9) by však malo mať svoju vlastnú pozitívnu kontrolu, keďže dĺžka ovplyvňovania sa bude líšiť od dĺžky testovania s použitím metabolickej aktivácie. Ak sa ako jediná pozitívna kontrola pri krátkodobom ovplyvňovaní s metabolickou aktiváciou a bez nej zvolí klastogén, mal by sa pre dlhodobé ovplyvňovanie bez metabolickej aktivácie zvoliť aneugén. Pozitívne kontroly na klastogenicitu aj aneugenicitu by sa mali použiť v prípade buniek s metabolickou kapacitou, ktoré si nevyžadujú S9. Každá pozitívna kontrola by sa mala použiť pri jednej alebo viacerých koncentráciách, pri ktorých sa očakáva, že poskytnú reprodukovateľný a detegovateľný nárast nad hodnoty v pozadí, aby sa preukázala citlivosť testovacieho systému (t. j. účinky sú jasné, ale neodhalia okamžite identitu kódovaných preparátov pri odčítaní), a reakciu by nemala rušiť cytotoxicita presahujúca hraničné hodnoty stanovené v tejto testovacej metóde. Tabuľka 1 Referenčné chemikálie odporúčané na posúdenie spôsobilosti laboratória a na výber pozitívnych kontrol
POSTUP Harmonogram ovplyvňovania S cieľom maximalizovať pravdepodobnosť detekcie aktivity aneugénu alebo klastogénu v špecifickom štádiu bunkového cyklu je dôležité, aby bol testovanej chemikálii vystavený dostatočný počet buniek reprezentujúcich všetky rôzne štádiá bunkových cyklov. Všetky ovplyvňovania by sa mali začať a skončiť v čase exponenciálneho rastu buniek a tento rast by mal pokračovať až do odberu. Harmonogram ovplyvňovania v prípade bunkových línií a primárnych bunkových kultúr sa teda môže určitým spôsobom odlišovať od harmonogramu ovplyvňovania v prípade lymfocytov, ktoré si vyžadujú stimuláciu mitogénom na to, aby sa začal ich bunkový cyklus (17). V prípade lymfocytov je najúčinnejšie začať ovplyvňovanie testovanou chemikáliou 44 – 48 hodín po stimulácii PHA, kedy sa bunky budú deliť asynchronicky (6). Publikované údaje (19) naznačujú, že väčšina aneugénov a klastogénov sa určí na základe krátkodobého ovplyvňovania trvajúceho 3 až 6 hodín s použitím S9 a bez použitia S9, po ktorom nasleduje odstránenie testovanej chemikálie a odber v období zodpovedajúcom 1,5 až 2,0-násobku dĺžky bežného bunkového cyklu po začatí ovplyvňovania (7). Na dôkladné vyhodnotenie, ktoré by bolo potrebné, aby bolo možné vyvodiť záver o negatívnom výsledku, by však mali byť zrealizované všetky tri nasledujúce podmienky pokusu s použitím krátkodobého ovplyvňovania s metabolickou aktiváciou a bez nej a dlhodobého ovplyvňovania bez metabolickej aktivácie (pozri body 56, 57 a 58):
V prípade, že niektorá z uvedených podmienok pokusu vedie k pozitívnej reakcii, je možné, že nebude potrebné skúmať žiaden iný režim ovplyvňovania. Ak je známe alebo ak existuje podozrenie, že testovaná chemikália ovplyvňuje dĺžku bunkového cyklu (napr. pri testovaní analógov nukleozidu), najmä u p53-kompetentných buniek (35) (36) (77), možno čas odberu vzoriek alebo čas obnovy kultúr predĺžiť o ďalšie obdobie zodpovedajúce maximálne 1,5 – 2,0-násobku dĺžky bežného bunkového cyklu (t. j. celkovo 3,0 – 4,0-násobok dĺžky bunkového cyklu po začatí krátkodobého a dlhodobého ovplyvňovania). Tieto možnosti sú určené pre situácie, kedy môžu vniknúť obavy týkajúce sa možných interakcií medzi testovanou chemikáliou a cytoB. Pri použití predĺžených časov odberu vzoriek (t. j. celkovo na obdobie zodpovedajúce 3,0 – 4,0-násobku dĺžky bunkového cyklu kultúr) treba zabezpečiť, aby v tomto čase stále prebiehalo aktívne delenie buniek. Napríklad v prípade lymfocytov môže exponenciálny rast v čase 96 hodín po stimulácii klesať a bunkové kultúry v monovrstvách môžu začať splývať. Navrhované harmonogramy ovplyvňovania pre bunky sú zhrnuté v tabuľke 2. Tieto všeobecné harmonogramy ovplyvňovania možno upravovať (ak je to odôvodnené) v závislosti od stability alebo reaktivity testovanej chemikálie alebo osobitných rastových charakteristík použitých buniek. Tabuľka 2 Časy ovplyvňovania a odberu vzoriek buniek v rámci testu MNvit
Na konci ovplyvňovania, ktoré trvá 3 – 6 hodín, sa v monovrstvových kultúrach môžu vyskytovať mitotické bunky (ktoré sú identifikovateľné ako okrúhle a oddeľujúce sa od povrchu). Keďže tieto mitotické bunky sa ľahko oddeľujú, môžu sa pri odstraňovaní média obsahujúceho testovanú chemikáliu stratiť. Ak existuje dôkaz o podstatnom náraste počtu mitotických buniek v porovnaní s kontrolami, čo indikuje pravdepodobné zastavenie mitózy, v čase odberu by sa bunky mali zhromaždiť odstredením a pridať späť do kultúry, aby sa zabránilo strate buniek, u ktorých prebieha mitóza a hrozí, že dôjde k vzniku mikrojadier/chromozómovej aberácii. Odber buniek a príprava preparátov Z každej kultúry by sa bunky mali odoberať a spracúvať zvlášť. Príprava buniek môže zahŕňať hypotonizáciu, tento krok však nie je potrebný, ak sa dosiahne primerané rozšírenie buniek iným spôsobom. Pri príprave preparátov možno použiť rôzne techniky za predpokladu, že sa zabezpečí vysoká kvalita bunkových preparátov na účely vyhodnocovania. Bunky s neporušenou bunkovou membránou a neporušenou cytoplazmou by sa mali uchovať, aby bolo možné zistiť mikrojadrá a (pri použití metódy s blokovaním cytokinézy) spoľahlivo identifikovať dvojjadrové bunky. Preparáty možno farbiť pomocou rôznych metód, ako je Giemsa alebo fluorescenčné farbivá so špecifickou väzbou na DNA. Použitie vhodných fluorescenčných farbív [napr. akridínová oranž (78) alebo Hoechst 33258 plus pyronin-Y (79)] môže eliminovať niektoré umelo vzniknuté štruktúry spojené s používaním farbiva bez špecifickej väzby na DNA. Ak je potrebné získať mechanistické informácie o tvorbe mikrojadier, možno na identifikáciu ich obsahu použiť protilátky proti kinetochorom, FISH s pancentromérovými sondami DNA alebo značenie in situ pomocou primerov špecifických pre pancentroméru spolu s vhodným DNA – kontrastným farbiacim roztokom (celé chromozómy sa zafarbia, zatiaľ čo acentrické fragmenty chromozómov sa nezafarbia) (16) (17). Na odlíšenie klastogénov od aneugénov možno použiť aj iné metódy, pokiaľ sa preukázali ako účinné a boli validované. Napríklad v prípade určitých bunkových línií by sa užitočné informácie mohli získať meraním jadier sub-2N ako hypodiploidných javov použitím takých techník, ako je analýza obrazu, laserová skenovacia cytometria alebo prietoková cytometria (80) (81) (82). Morfologické pozorovanie jadier by takisto mohlo poskytnúť indikácie možnej aneuploidie. Okrem toho test chromozómových aberácií v metafáze vykonaný najlepšie na tom istom type buniek a podľa protokolu s porovnateľnou citlivosťou by mohol byť takisto užitočný na stanovenie toho, či sú mikrojadrá dôsledkom zlomov chromozómov (keďže je známe, že strata chromozómov by sa v teste na chromozómovú aberáciu nezistila). Analýza Všetky preparáty vrátane preparátov z rozpúšťadiel na kontrolu a neovplyvnených (ak sa použijú) a pozitívnych kontrol by sa pred mikroskopickou analýzou frekvencií mikrojadier mali jednotlivo označiť kódom. V prípade automatizovaného systému hodnotenia by sa mali použiť vhodné techniky, ako je napr. prietoková cytometria, laserová skenovacia cytometria alebo analýza obrazu, aby boli skreslenia a posuny pod kontrolou. Bez ohľadu na to, či sa pri vyčíslení mikrojadier používa automatizovaná platforma, mali by sa súbežne posudzovať hodnoty CBPI, RI, RPD alebo RICC. V prípade kultúr ovplyvnených cytoB by sa mali analyzovať frekvencie výskytu mikrojadier aspoň v prípade 2 000 dvojjadrových buniek na každú koncentráciu a každú kontrolu (83), ktoré sa rovnomerne rozdelia medzi replikátmi, ak sa replikáty použijú. V prípade, že sa použije jedna kultúra na každú dávku (pozri bod 28), by sa malo vyhodnotiť aspoň 2 000 dvojjadrových buniek na každú kultúru v rámci tejto jednej kultúry (83). Ak je na hodnotenie pri každej koncentrácii k dispozícii podstatne menej než 1 000 dvojjadrových buniek z každej kultúry (v prípade duplicitných kultúr), alebo 2 000 (v prípade jednej kultúry) a nezistí sa významný nárast výskytu mikrojadier, test by sa mal zopakovať s použitím väčšieho počtu buniek alebo pri menších cytotoxických koncentráciách, podľa toho, ktorá z týchto dvoch možností je vhodná. Je potrebné zabezpečiť, aby sa nehodnotili dvojjadrové bunky, ktoré majú nepravidelný tvar alebo ktorých jadrá sa veľkosťou výrazne odlišujú. Okrem toho dvojjadrové bunky by sa nemali mylne zamieňať s nedostatočne rozšírenými viacjadrovými bunkami. Bunky obsahujúce viac než dve hlavné jadrá by sa nemali analyzovať na prítomnosť mikrojadier, keďže základná frekvencia mikrojadier môže byť v týchto bunkách vyššia (84). Hodnotenie jednojadrových buniek je prijateľné vtedy, ak sa preukáže, že testovaná chemikália zasahuje do pôsobenia cytoB. V takých prípadoch by mohlo byť užitočné zopakovať test bez CytoB. Hodnotenie jednojadrových buniek spolu s hodnotením dvojjadrových buniek by mohlo poskytnúť užitočné informácie (85) (86), nie je však povinné. V bunkových líniách bez ovplyvnenia pomocou cytoB by sa mali mikrojadrá hodnotiť aspoň v prípade 2 000 buniek na koncentráciu a kontrolu (83), ktoré sa rovnomerne rozdelia medzi replikátmi, ak sa replikáty použijú. V prípade, že sa použije jedna kultúra na koncentráciu (pozri bod 28), by sa malo vyhodnotiť aspoň 2 000 buniek na každú kultúru v rámci tejto jednej kultúry. Ak je na hodnotenie pri každej koncentrácii k dispozícii podstatne menej než 1 000 buniek na kultúru (v prípade duplicitných kultúr), alebo 2 000 (v prípade jednej kultúry) a ak sa nezistí výrazný nárast výskytu mikrojadier, test by sa mal zopakovať s použitím väčšieho počtu buniek alebo pri menších cytotoxických koncentráciách, podľa toho, ktorá z týchto dvoch možností je vhodná. Pri použití cytoB by sa mala určiť hodnota CBPI alebo RI na posúdenie bunkovej proliferácie (pozri dodatok 2) s použitím aspoň 500 buniek na kultúru. Ak sa ovplyvňovanie vykonáva bez prítomnosti cytoB, je nevyhnutné preukázať, že bunky v kultúre sa rozdelili, ako sa vysvetľuje v bodoch 24 až 28. Spôsobilosť laboratória Na to, aby sa pred vykonaním rutinného testu zistilo, či má laboratórium s danou skúškou dostatočné skúsenosti, malo by mať vykonanú sériu pokusov s referenčnými pozitívnymi chemikáliami pôsobiacimi prostredníctvom rôznych mechanizmov (aspoň jedna chemikália s metabolickou aktiváciou a jedna bez metabolickej aktivácie a jedna chemikália pôsobiaca prostredníctvom aneugénneho mechanizmu, pričom všetky sa vyberú zo zoznamu v tabuľke 1) a s rôznymi negatívnymi kontrolami (vrátane neovplyvnených kultúr a rôznych rozpúšťadiel/nosičov). Reakcie týchto pozitívnych a negatívnych kontrol by mali byť v súlade s príslušnou literatúrou. Tento postup sa nepoužije v prípade laboratórií, ktoré majú skúsenosti, t. j. ktoré majú k dispozícii databázu historických údajov, ako sa definuje v bodoch 49 až 52. Mal by sa preskúmať celý rad vybratých chemikálií na pozitívnu kontrolu (pozri tabuľku 1) s krátkym a dlhým ovplyvňovaním za neprítomnosti metabolickej aktivácie, ako aj s krátkym ovplyvňovaním za prítomnosti metabolickej aktivácie, aby sa preukázala spôsobilosť zistiť klastogénne a aneugénne chemikálie, stanoviť účinnosť systému metabolickej aktivácie a preukázať vhodnosť postupov hodnotenia (mikroskopická vizuálna analýza, prietoková cytometria, laserová skenovacia cytometria alebo analýza obrazu). Rozsah koncentrácií by sa u vybraných chemikálií mal zvoliť tak, aby poskytol opakovateľné zvýšenia súvisiace s jednotlivými koncentráciami v porovnaní s úrovňou pozadia, aby sa tak preukázala citlivosť a dynamické rozpätie testovacieho systému. Historické údaje na kontrolu Laboratórium by malo určiť:
Pri prvom získavaní údajov súvisiacich s distribúciou historických negatívnych kontrol by súbežné negatívne kontroly mali byť v súlade s uverejnenými negatívnymi kontrolnými údajmi, ak takéto údaje existujú. S pridávaním ďalších údajov z pokusov k distribúcii kontrol by súbežné negatívne kontroly mali byť v ideálnom prípade v rámci 95 % regulačných medzí tejto distribúcie (87) (88). Databáza historických negatívnych kontrol laboratória by mala byť najskôr vytvorená na základe minimálne 10 pokusov, ale radšej by mala zahŕňať aspoň 20 pokusov vykonaných za porovnateľných experimentálnych podmienok. Laboratóriá by mali použiť metódy kontroly kvality, ako sú regulačné diagramy [napr. tzv. „C-charts“ alebo „X-bar charts“ (88)], s cieľom zistiť variabilitu svojich údajov o pozitívnych a negatívnych kontrolách a preukázať, že metodika je v laboratóriu „pod kontrolou“ (83). Ďalšie odporúčania ako vytárať a využívať historické údaje (t. j. kritériá zaradenia údajov medzi historické údaje a ich vylúčenia z historických údajov a kritériá prijateľnosti v prípade daného pokusu) možno nájsť v literatúre (87). Všetky zmeny v experimentálnom protokole by sa mali posúdiť z hľadiska konzistentnosti údajov s databázami existujúcich historických kontrol v laboratóriu. Každý väčší nesúlad by mal viesť k zavedeniu novej databázy historických kontrol. Údaje o negatívnych kontrolách by mali zahŕňať výskyt buniek s mikrojadrami z jednej kultúry alebo zo súhrnu kultúr replikátov, ako sa opisuje v bode 28. Súbežné negatívne kontroly by v ideálnom prípade mali byť v rámci 95 % regulačných medzí distribúcie databázy historických negatívnych kontrol laboratória (87) (88). V prípade, že údaje o súbežných negatívnych kontrolách nespadajú do 95 % regulačných medzí, môžu byť prijateľné na zaradenie do distribúcie historických kontrol, pokiaľ tieto údaje nie sú extrémne mimo uvedených medzí a pokiaľ existujú dôkazy o tom, že testovací systém je „pod kontrolou“ (pozri bod 50) a dôkazy o tom, že nedošlo k technickému alebo ľudskému zlyhaniu. PREZENTOVANIE VÝSLEDKOV Prezentovanie výsledkov Ak sa použije metóda blokovania cytokinézy, pri hodnotení indukcie mikrojadier sa používajú iba frekvencie dvojjadrových buniek s mikrojadrami (bez ohľadu na počet mikrojadier v bunke). Hodnotenie počtu buniek s jedným mikrojadrom, s dvoma alebo viacerými mikrojadrami sa môže popisovať samostatne a mohlo by poskytnúť užitočné informácie, nie je však povinné. Mali by sa stanoviť súbežné merania cytotoxicity a/alebo cytostázy pre všetky ovplyvnené kultúry a kultúry na negatívnu a pozitívnu kontrolu (16). Pri všetkých ovplyvnených kultúrach a kontrolných kultúrach by sa mali vypočítať hodnoty CBPI alebo RI ako merania oneskorenia bunkového cyklu pri použití metódy blokovania cytokinézy. V prípade, že sa nepoužíva cytoB, mali by sa použiť hodnoty RDP alebo RICC (pozri dodatok 2). Mali by sa uvádzať údaje o jednotlivých kultúrach. Všetky údaje sa dodatočne sumarizujú v tabuľkovej forme. Kritériá prijateľnosti Prijateľnosť testu sa zakladá na týchto kritériách:
Hodnotenie a interpretácia výsledkov Za predpokladu, že sú splnené všetky kritériá prijateľnosti, sa testovaná chemikália pokladá za jasne pozitívnu, ak pri ktorejkoľvek z preskúmaných podmienok pokusu platí, že (pozri body 36 – 39):
Ak sú splnené všetky tieto kritériá, testovaná chemikália sa pokladá za chemikáliu schopnú vyvolať chromozómové zlomy a/alebo zvýšenie či zníženie ich počtu v tomto testovacom systéme. Odporúčania týkajúce sa najvhodnejších štatistických metód možno takisto nájsť aj v literatúre (90) (91) (92). Za predpokladu, že sú splnené všetky kritériá prijateľnosti, sa testovaná chemikália pokladá za jasne negatívnu, ak pri všetkých preskúmaných podmienkach pokusu platí, že (pozri body 36 – 39):
Testovaná chemikália sa pokladá za chemikáliu neschopnú vyvolať chromozómové zlomy a/alebo zvýšenie či zníženie ich počtu v tomto testovacom systéme. Odporúčania týkajúce sa najvhodnejších štatistických metód možno takisto nájsť aj v literatúre (90) (91) (92). Neexistuje požiadavka na potvrdenie jasnej pozitívnej alebo negatívnej reakcie. V prípade, že reakcia nie je jasne negatívna ani jasne pozitívna, ako sa opisuje vyššie v texte, a/alebo s cieľom pomôcť pri stanovení biologickej relevantnosti výsledku by sa údaje mali vyhodnotiť na základe odborného posúdenia a/alebo ďalšieho skúmania. Užitočné by mohlo byť hodnotenie dodatočných buniek (v prípade potreby) alebo zopakovanie pokusu prípadne s použitím pozmenených podmienok pokusu [napr. odstup koncentrácií, iné podmienky metabolickej aktivácie (t. j. koncentrácia S9 alebo pôvod S9)]. V zriedkavých prípadoch neumožní súbor údajov ani po ďalšom skúmaní vyvodiť záver o pozitívnom alebo negatívnom výsledku, a preto sa pokus uzavrie ako pokus „s nejasným výsledkom“. Testované chemikálie, ktoré v teste MNvit indukujú mikrojadrá, môžu mať tento účinok preto, že indukujú chromozómový zlom, ich stratu alebo kombináciu oboch javov. Na určenie toho, či je mechanizmus indukcie mikrojadier dôsledkom klastogénneho a/alebo aneugénneho pôsobenia možno použiť ďalšiu analýzu s použitím protilátok kinetochoru, sond in situ so špecifickou väzbou na centroméry alebo iných metód. Skúšobný protokol Skúšobný protokol by mal obsahovať tieto informácie:
LITERATÚRA
Dodatok 1 DEFINÍCIE Aneugén : akákoľvek chemikália alebo proces, ktoré pri interakcii so zložkami mitotického alebo meiotického aparátu bunkového cyklu vedie k aneuploidii v bunkách alebo organizmoch. Aneuploidia : akákoľvek odchýlka od bežného diploidného (alebo haploidného) počtu chromozómov vo forme jedného alebo viacerých chromozómov, nie však vo forme celého(-ých) súboru(-ov) chromozómov (polyploidia). Apoptóza : programovaná bunková smrť charakterizovaná sériou krokov, ktoré vedú k rozpadu buniek na telieska ohraničené membránou, ktoré sa následne fagocytujú alebo vypudzujú. Proliferácia buniek : zvýšenie počtu buniek v dôsledku mitotického delenia buniek. Centroméra : oblasť DNA chromozómu, v ktorej sa spájajú obe chromatídy a na ktorú sú vedľa seba pripojené oba kinetochory. Chemikália : látka alebo zmes. Koncentrácie : sú konečné koncentrácie testovanej chemikálie v rastovom médiu. Klastogén : akákoľvek chemikália alebo jav, ktorý spôsobuje štruktúrne chromozómové aberácie v populáciách buniek alebo eukaryotických organizmoch. Cytokinéza : proces delenia buniek, ktorý nasleduje ihneď po mitóze a v ktorom vznikajú dve dcérske bunky – každá s jedným jadrom. Proliferačný index blokovania cytokinézy (CBPI) : pomer druhého delenia buniek v ovplyvnenej populácii vo vzťahu k čistej kontrole (pozri vzorec v dodatku 2). Cytostáza : inhibícia rastu buniek (pozri vzorec v dodatku 2). Cytotoxicita : v prípade testov, na ktoré sa vzťahuje táto testovacia metóda a ktoré sa vykonávajú za prítomnosti cytochalasínu B, sa cytotoxicita označuje ako zníženie proliferačného indexu blokovania cytokinézy (CBPI) alebo indexu replikácie (RI) ovplyvnených buniek v porovnaní s negatívnou kontrolou (pozri bod 26 a dodatok 2). Pri skúškach, na ktoré sa vzťahuje táto testovacia metóda a ktoré sa vykonávajú za neprítomnosti cytochalasínu B, sa cytotoxicita označuje ako zníženie relatívneho zdvojenia populácie (RPD) alebo relatívneho nárastu počtu buniek (RICC) ovplyvnených buniek v porovnaní s negatívnou kontrolou (pozri bod 27 a dodatok 2). Genotoxický : všeobecný výraz, ktorý zahŕňa všetky typy poškodenia DNA alebo chromozómov vrátane zlomov, delécií, aduktov, modifikácií a prepojení nukleotidov, prestavieb, génových mutácií, chromozómových aberácií a aneuploidie. Nie všetky typy genotoxických účinkov majú za následok mutácie alebo trvalé poškodenie chromozómov. Bunky v interfáze : bunky, ktoré nie sú v štádiu mitotického delenia. Kinetochor : štruktúra obsahujúca proteíny, ktorá sa vytvára na centromére chromozómu a ku ktorej sa vlákna deliaceho vretienka pripájajú počas delenia buniek a umožňujú riadny pohyb dcérskych chromozómov k pólom dcérskych buniek. Mikrojadrá : malé jadrá doplňujúce hlavné jadrá buniek a existujúce oddelene od nich, ktoré sa vytvárajú počas telofázy mitózy alebo meiózy z oneskorených chromozómových fragmentov alebo celých chromozómov. Mitóza : rozdelenie bunkového jadra, ktoré sa zvyčajne delí na profázu, prometafázu, metafázu, anafázu a telofázu. Mitotický index : pomer buniek v metafáze vydelený celkovým počtom buniek pozorovaných v populácii buniek; udáva stupeň proliferácie buniek tejto populácie. Mutagénny : produkujúci dedičnú zmenu sekvencie(-í) párov báz DNA v génoch alebo štruktúry chromozómov (chromozómové aberácie). Nondisjunkcia : dej, pri ktorom sa spárované chromatídy riadne neoddelia a nerozdelia do vznikajúcich dcérskych buniek, čo vedie vzniku dcérskych buniek s abnormálnym počtom chromozómov. Stav p53 : proteín p53 sa zapája do regulácie bunkového cyklu, apoptózy a opravy DNA. Bunky s nedostatkom funkčného proteínu p53, ktoré nie sú schopné zastaviť bunkový cyklus alebo eliminovať poškodené bunky prostredníctvom apoptózy alebo iných mechanizmov (napr. indukciou opravy DNA) súvisiacich s funkciami p53 ako reakciu na poškodenie DNA, by mali byť teoreticky náchylnejšie na génové mutácie alebo chromozómové aberácie. Polyploidia : numerické chromozómové aberácie v bunkách alebo organizmoch, ktoré zahŕňajú celý(-é) súbor(-y) chromozómov, na rozdiel od jedného chromozómu alebo jednotlivých chromozómov (aneuploidia). Proliferačný index (PI) : metóda merania cytotoxicity bez použitia cytoB (pozri vzorec v dodatku 2). Relatívne zvýšenie počtu buniek (RICC) : metóda merania cytotoxicity bez použitia cytoB (pozri vzorec v dodatku 2). Relatívne zdvojenie populácie (RPD) : metóda merania cytotoxicity bez použitia cytoB (pozri vzorec v dodatku 2). Index replikácie (RI) : pomer bunkových cyklov, ktoré boli dokončené v ovplyvnenej kultúre, vo vzťahu k čistej kontrole počas doby expozície a obnovy (pozri vzorec v dodatku 2). Frakcia pečene S9 : supernatant pečeňového homogenátu po 9 000 g odstredení, t. j. surový pečeňový extrakt. Zmes S9 : zmes frakcie pečene S9 a kofaktorov nepotrebných pre metabolickú aktiváciu enzýmov. Kontrola rozpúšťadla : všeobecný termín na vymedzenie kontrolných kultúr, ku ktorým sa pridáva len rozpúšťadlo používané na rozpúšťanie testovanej chemikálie. Testovaná chemikália : akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy. Čistá kontrola : kultúry, ktoré sa neovplyvňujú (t. j. ani testovanou chemikáliou ani rozpúšťadlom), ale sa spracovávajú súbežne rovnakým spôsobom ako kultúry, ku ktorým sa pridáva testovaná chemikália. Dodatok 2 VZORCE NA POSÚDENIE CYTOTOXICITY Pri použití cytoB by hodnotenie cytotoxicity malo byť založené na proliferačnom indexe blokovania cytokinézy (CBPI) alebo na indexe replikácie (RI) (17) (69). CBPI udáva priemerný počet jadier na bunku a môže sa použiť na výpočet proliferácie buniek. RI udáva relatívny počet bunkových cyklov na bunku počas obdobia vystavenia cytoB v ovplyvnených kultúrach v porovnaní s kontrolnými kultúrami a možno ho použiť na percentuálny výpočet cytostázy: % cytostáza = 100 – 100{(CBPIT – 1) ÷ (CBPIC – 1)} a:
pričom:
CBPI zodpovedajúci 1 (všetky bunky sú jednojadrové) sa teda rovná 100 % cytostáze. Cytostáza = 100 – RI
Hodnota RI zodpovedajúca 53 % teda znamená, že v porovnaní s počtami buniek, ktorých delením vznikli v kontrolnej kultúre dvojjadrové a viacjadrové bunky, len 53 % z tohto počtu sa delilo v ovplyvnenej kultúre, t. j. 47 % cytostáza. Ak sa cytoB nepoužije , odporúča sa vykonať hodnotenie cytotoxicity na základe relatívneho nárastu počtu buniek (RICC) alebo relatívneho zdvojenia populácie (RPD) (69), keďže v oboch prípadoch sa zohľadňuje podiel populácie buniek, ktoré sa delili.
kde: Zdvojenie populácie = [log (počet buniek po ovplyvnení ÷ počiatočný počet buniek)] ÷ log 2 Preto 53 % RICC alebo RDP indikuje 47 % cytotoxicitu/cytostázu. Pri použití proliferačného indexu (PI) možno cytotoxicitu hodnotiť pomocou počítania počtu klonov obsahujúcich jednu bunku (cl1), 2 bunky (cl2), 3 až 4 bunky (cl4) a 5 až 8 buniek (cl8).
PI sa používa ako hodnotný a spoľahlivý parameter cytotoxicity aj pri bunkových líniách kultivovaných in vitro bez použitia cytoB (35) (36) (37) (38) a môže sa pokladať za užitočný doplnkový parameter.. V každom prípade by počet buniek pred ovplyvnením mal byť rovnaký ako počet ovplyvnených kultúr a kultúr na negatívnu kontrolu. Zatiaľ čo v minulosti sa RCC (t. j. počet buniek v ovplyvnených kultúrach/počet buniek v kontrolných kultúrach) používal ako parameter cytotoxicity, už sa neodporúča, pretože môže podhodnotiť cytotoxicitu. Pri použití automatizovaných systémov hodnotenia, napríklad prietokovej cytometrie, laserovej skenovacej cytometrie alebo analýzy obrazu, možno počet buniek vo vzorci nahradiť počtom jadier. V kultúrach na negatívnu kontrolu by zdvojenie populácie alebo index replikácie mali byť zlúčiteľné s požiadavkou na odber vzoriek z buniek po ovplyvnení v čase zodpovedajúcom približne 1,5 – 2-násobku dĺžky bežného bunkového cyklu. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
15. |
V časti B sa dopĺňajú tieto kapitoly: „B.59 Kožná senzibilizácia in Chemico: Skúška priamej peptidovej reaktivity (DPRA) ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 442C (2015). Kožný senzibilizátor je látka, ktorá po kontakte s pokožkou vyvoláva alergickú reakciu, ako sa definuje v Globálnom harmonizovanom systéme klasifikácie a označovania chemikálií (GHS) Organizácie spojených národov (OSN) (1) a v nariadení Európskej únie (ES) č. 1272/2008 o klasifikácii, označovaní a balení látok a zmesí (nariadenie CLP) (18). Táto testovacia metóda predstavuje postup in chemico (skúška priamej peptidovej reaktivity – DPRA), ktorá sa má použiť na podporu rozlíšenia kožných senzibilizátorov od nesenzibilizujúcich chemikálií v súlade s GHS OSN a CLP. Existuje všeobecná zhoda, pokiaľ ide o kľúčové biologické javy, ktoré vedú ku kožnej senzibilizácii. Súčasné poznatky o chemických a biologických mechanizmoch, ktoré súvisia s kožnou senzibilizáciou, boli zhrnuté v podobe dráhy nepriaznivého účinku (AOP) (2), ktorá začína zmenami na molekulárnej úrovni cez následné pochody až po nepriaznivý účinok, a síce alergickú kontaktnú dermatitídu u ľudí alebo kontaktnú hypersenzitivitu u hlodavcov. V rámci AOP kožnej senzibilizácie je začínajúcou zmenou na molekulárnej úrovni kovalentná väzba elektrofilných látok na nukleofilné centrá v kožných proteínoch. Posúdenie kožnej senzibilizácie zvyčajne zahŕňa použitie laboratórnych zvierat. Klasické metódy založené na morčatách, maximizačný test na morčatách podľa Magnussona a Klingmana (GPMT) a Buehlerov test [(TM B.6 (3)], sú zamerané na štúdium indukčných a elicitačných fáz kožnej senzibilizácie. Uznaný bol takisto test na myšiach, lokálna skúška lymfatických uzlín [LLNA, TM B.42 (4)] a jej dve nerádioaktívne modifikácie, LLNA: DA [TM B.50 (5)] a LLNA: BrdU-ELISA [TM B.51 (6)], z ktorých všetky slúžia výlučne na posúdenie reakcie na indukciu, keďže sú v porovnaní s testami na morčatách výhodnejšie z hľadiska dobrých podmienok zvierat a objektívneho merania indukčnej fázy kožnej senzibilizácie. V poslednej dobe sa mechanisticky založené testovacie metódy in chemico a in vitro pokladajú za vedecky platné testovacie metódy na hodnotenie nebezpečnosti chemikálií z hľadiska kožnej senzibilizácie. Avšak vzhľadom na to, že AOP mechanicky pokrýva každú zo súčasne dostupných testovacích metód bez použitia zvierat len v obmedzenom rozsahu, budú kombinácie metód bez použitia zvierat (in silico, in chemico, in vitro) v rámci integrovaných prístupov k testovaniu a hodnoteniu (Integrated Approaches to Testing and Assessment, IATA) potrebné na to, aby bolo možné súčasné testovanie na zvieratách úplne nahradiť (2) (7). Skúška DPRA je navrhnutá tak, aby preskúmala najprv začínajúcu zmenu na molekulárnej úrovni AOP kožnej senzibilizácie, a síce reaktivitu proteínov, pomocou kvantifikácie reaktivity testovaných chemikálií voči modelovým syntetickým peptidom obsahujúcim lyzín alebo cysteín (8). Percentuálne hodnoty úbytku cysteínových a lyzínových peptidov sa potom použijú na kategorizáciu látky v jednej zo štyroch tried reaktivity na podporu rozlíšenia kožných senzibilizátorov od nesenzibilizujúcich chemikálií (9). Skúška DPRA bola validovaná vo validačnej štúdii pod vedením referenčného laboratória Európskej únie pre alternatívy testovania na zvieratách (EURL ECVAM) a následne v nezávislom partnerskom preskúmaní, ktoré vykonal vedecký poradný výbor (ESAC) EURL ECVAM, a uznaná za vedecky platnú (10) na použitie ako súčasť IATA na podporu rozlíšenia kožných senzibilizátorov od nesenzibilizujúcich chemikálií na účely klasifikácie a označovania nebezpečnosti. Príklady použitia údajov zo skúšky DPRA v kombinácii s inými informáciami sú uvedené v literatúre (11) (12) (13) (14). Definície sa uvádzajú v dodatku I. POČIATOČNÉ ÚVAHY, POUŽITEĽNOSŤ A OBMEDZENIA Korelácia medzi reaktivitou proteínov a potenciálom kožnej senzibilizácie bola spoľahlivo stanovená (15) (16) (17). Keďže proteínová väzba však predstavuje len jeden kľúčový jav, a to napriek začínajúcim zmenám na molekulárnej úrovni AOP kožnej senzibilizácie, samotné informácie o reaktivite proteínov získané na základe testovacích a netestovacích metód nemusia byť dostatočné na vyvodenie záveru o neprítomnosti potenciálu chemikálií spôsobiť senzibilizáciu kože. Údaje získané na základe tejto testovacej metódy by sa preto mali zvážiť v kontexte integrovaných prístupov, ako je IATA, v kombinácii s inými doplňujúcimi informáciami, napr. pochádzajúcimi zo skúšok in vitro, ktorými sa skúmajú iné kľúčové prvky AOP kožnej senzibilizácie, ako aj z netestovacích metód vrátane prevzatých údajov odvodených z chemických analógov. Túto testovaciu metódu možno použiť v kombinácii s inými doplňujúcimi informáciami na podporu rozlíšenia kožných senzibilizátorov (t. j. kategória 1 GHS OSN/CLP) od nesenzibilizujúcich chemikálií v kontexte IATA. Túto testovaciu metódu nemožno používať samostatne, a to ani pri zaraďovaní kožných senzibilizátorov do podkategórií 1A a 1B, ako sa definuje v GHS OSN/CLP, ani pri predpovedaní potenciálu na účely rozhodnutí v súvislosti s posudzovaním bezpečnosti. V závislosti od regulačného rámca však možno pozitívny výsledok získaný na základe testovacej metódy DRPA sám o sebe použiť pri klasifikácii chemikálií do kategórie 1 GHS OSN. V prípade testovacej metódy DPRA sa preukázalo, že ju možno preniesť do laboratórií, ktoré majú skúsenosti s analýzou pomocou vysokoúčinnej kvapalinovej chromatografie (HPLC). Miera reprodukovateľnosti pri predpokladoch, ktoré možno na základe testovacej metódy očakávať, predstavuje rádovo 85 % v rámci laboratórií a 80 % medzi nimi (10). Výsledky získané vo validačnej štúdii (18) a v uverejnených štúdiách (19) celkovo indikujú, že presnosť DPRA pri odlišovaní senzibilizátorov (t. j. kategória 1 GHS OSN/CLP) od nesenzibilizujúcich chemikálií predstavuje 80 % (N = 157) s citlivosťou 80 % (88/109) a špecifickosťou 77 % (37/48) v porovnaní s výsledkami LLNA. DPRA s väčšou pravdepodobnosťou povedie k podhodnotenému predpokladu v prípade chemikálií, ktoré vykazujú nízky alebo mierny potenciál spôsobiť kožnú senzibilizáciu (t. j. podkategória 1B GHS OSN/CLP), než v prípade chemikálií vykazujúcich vysoký potenciál spôsobiť kožnú senzibilizáciu (t. j. podkategória 1A GHS OSN/CLP) (18) (19). Uvedené hodnoty presnosti DPRA ako samostatnej testovacej metódy sú však len orientačné, keďže testovacia metóda by sa mala hodnotiť v kombinácii s inými zdrojmi informácií v kontexte IATA a v súlade s ustanoveniami bodu 9. Okrem toho by sa pri hodnotení metód na zistenie kožnej senzibilizácie bez použitia zvierat malo zohľadniť to, že test LLNA ani iné testy na zvieratách nemusia v plnej miere odzrkadľovať situáciu u druhov, ktoré sú predmetom záujmu, čiže u ľudí. Na základe celkových dostupných údajov sa preukázalo, že testovaciu metódu DPRA možno použiť v prípade testovaných chemikálií, ktoré predstavujú rôzne organické funkčné skupiny, majú rôzne mechanizmy reakcie, potenciál spôsobiť kožnú senzibilizáciu (ako bolo stanovené v štúdiách in vivo) a rôzne fyzikálno-chemické vlastnosti (8) (9) (10) (19). Celkovo z týchto informácií vyplýva, že testovacia metóda DPRA je užitočná a môže prispieť k zisteniu nebezpečnosti kožnej senzibilizácie. Termín „testovaná chemikália“ sa v tejto testovacej metóde používa na označenie toho, čo sa testuje, a nesúvisí s použiteľnosťou DPRA na testovanie látok a/nebo zmesí. Túto testovaciu metódu nemožno použiť na testovanie zlúčenín kovov, keďže je o nich známe, že reagujú s proteínmi prostredníctvom mechanizmov iných než kovalentnou väzbou. Testovaná chemikália by mala byť rozpustná vo vhodnom rozpúšťadle pri konečnej koncentrácii 100 mM (pozri bod 18). Testované chemikálie, ktoré však nie sú rozpustné pri tejto koncentrácii, možno napriek tomu testovať pri nižších koncentráciách, pri ktorých sú rozpustné. V takom prípade by sa pozitívny výsledok mohol použiť na podporu identifikácie testovanej chemikálie ako kožný senzibilizátor, no z negatívneho výsledku by sa nemal vyvodzovať jednoznačný záver o nedostatočnej reaktivite. V súčasnosti sú dostupné len obmedzené informácie o použiteľnosti DPRA v prípade zmesí známeho zloženia (18) (19). Napriek tomu sa DPRA považuje za technicky použiteľnú v prípade testovania mnohozložkových látok a zmesí známeho zloženia (pozri bod 10). Pred použitím tejto testovacej metódy na zmesi s cieľom získať údaje na zamýšľaný regulačný účel by sa malo zvážiť, či na tento účel dokáže poskytnúť primerané výsledky, a ak dokáže, mali by sa zvážiť dôvody. Také úvahy nie sú nutné, pokiaľ existuje regulatórna požiadavka na testovanie danej zmesi. V dôsledku vymedzeného molárneho pomeru testovanej chemikálie a peptidu nemožno súčasný prognostický model použiť v prípade komplexných zmesí s neznámym zložením alebo látok neznámeho alebo variabilného zloženia, produktov komplexných reakcií alebo biologických materiálov (t. j. látok UVCB). Na tento účel bude potrebné vyvinúť nový prognostický model založený na gravimetrii. V prípadoch, v ktorých možno predložiť dôkaz o nepoužiteľnosti testovacej metódy pri iných špecifických kategóriách chemikálií, by sa testovacia metóda nemala používať pri týchto špecifických kategóriách chemikálií. Táto testovacia metóda je testovacia metóda in chemico, ktorá nezahŕňa metabolický systém. Pomocou tejto testovacej metódy nemožno zistiť chemikálie, ktoré na preukázanie svojho potenciálu vyvolať kožnú senzibilizáciu (pro-haptény) vyžadujú enzymatickú bioaktiváciu. Uvádza sa, že v niektorých prípadoch sú pomocou tejto testovacej metódy správne zistené chemikálie, ktoré sa stávajú senzibilizátormi po abiotickej transformácii (t. j. pre-haptény) (18). Vzhľadom na uvedenú skutočnosť by sa mali negatívne výsledky získané touto testovacou metódou interpretovať v kontexte stanovených obmedzení a spolu s ostatnými zdrojmi informácií v rámci IATA. V prípade testovaných chemikálií, ktoré sa neviažu kovalentne na peptid, ale podporujú jeho oxidáciu (t. j. dimerizácia cysteínu), by potenciálne mohlo dôjsť k príliš vysokému odhadu úbytku peptidov, čo môže viesť k falošným pozitívnym predpovediam a/alebo k zaradeniu do vyššej triedy reaktivity (pozri body 29 a 30). Ako bolo opísané, DPRA pomáha rozlišovať kožné senzibilizátory od nesenzibilizujúcich chemikálií. Môže však takisto potenciálne prispieť k posúdeniu potenciálu spôsobiť senzibilizáciu (11), ak sa použije v rámci integrovaných prístupov ako IATA. Na to, aby bolo možné určiť, ako výsledky DPRA môžu prispieť k posudzovaniu potenciálu, však bude potrebná ďalšia práca, pokiaľ možno založená na údajoch o týkajúcich sa človeka. PRINCÍP TESTU DPRA je metóda in chemico, ktorá kvantifikuje zvyškovú koncentráciu peptidu obsahujúceho cysteín alebo lyzín po 24-hodinovej inkubácii s testovanou chemikáliou pri teplote 25 ± 2,5 °C. Syntetické peptidy obsahujú fenylalanín na uľahčenie detekcie. Relatívna koncentrácia peptidov sa meria pomocou vysokoúčinnej kvapalinovej chromatografie (HPLC) s gradientovou elúciou a detekciou UV pri 220 nm. Následne sa vypočítajú percentuálne hodnoty úbytku cysteínových a lyzínových peptidov a použijú sa v prognostickom modeli (pozri bod 29), čo umožní zaradiť testovanú chemikáliu do jednej zo štyroch tried reaktivity, ktoré sa používajú na podporu rozlíšenia kožných senzibilizátorov od nesenzibilizujúcich chemikálií. Pred rutinným používaním metódy opísanej v tejto testovacej metóde by mali laboratóriá preukázať technickú spôsobilosť použitím látok na preukázanie spôsobilosti uvedených v dodatku 2. POSTUP Táto testovacia metóda vychádza z protokolu DPRA DB-ALM č. 154 (20), ktorý sa používa pri validačnej štúdii koordinovanej EURL ECVAM. Tento protokol sa odporúča používať pri vykonávaní a používaní tejto metódy v laboratóriu. Ďalej je uvedený opis hlavných zložiek a postupov DPRA. Ak sa použije alternatívne nastavenie HPLC, mala by sa preukázať jeho rovnocennosť s validovaným nastavením opísaným v protokole DB-ALM (napr. testovaním látok na preukázanie spôsobilosti uvedených v dodatku 2). Príprava peptidov obsahujúcich cysteín alebo lyzín Zásobné roztoky cysteínu (Ac-RFAACAA-COOH) a lyzínu (Ac-RFAAKAA-COOH) obsahujúce syntetické peptidy s čistotou vyššou než 85 % a pokiaľ možno v rozmedzí 90 – 95 % by sa mali pripravovať čerstvé bezprostredne pred ich inkubáciou s testovanou chemikáliou. Konečná koncentrácia cysteínových peptidov vo fosfátovom tlmivom roztoku s hodnotou pH 7,5 by mala byť 0,667 mM a konečná koncentrácia lyzínových peptidov v tlmivom roztoku octanu amónneho s hodnotou pH 10,2 by mala byť 0,667 mM. Rýchlosť úkonov HPLC by sa mala nastaviť tak, aby trvanie analýzy HPLC bolo kratšie než 30 hodín. Pri nastavení HPLC použitom vo validačnej štúdii a opísanom v tejto testovacej metóde možno pri jednom výkone HPLC spracovať až 26 analytických vzoriek (ktoré zahŕňajú testovanú chemikáliu, pozitívnu kontrolu a príslušný počet kontrol rozpúšťadla na základe počtu jednotlivých rozpúšťadiel použitých v teste, pričom každé z nich sa testuje trikrát). Pri všetkých replikátoch analyzovaných v rámci jedného testovania by sa mali použiť identické roztoky cysteínových a lyzínových peptidov. Odporúča sa, aby sa pri jednotlivých šaržiach peptidov pred ich použitím overila správna rozpustnosť. Príprava testovanej chemikálie Pred vykonaním skúšky by sa mala posúdiť rozpustnosť testovanej chemikálie vo vhodnom rozpúšťadle podľa postupu rozpúšťania popísaného v protokole DPRA DB-ALM (20). Vo vhodnom rozpúšťadle sa testovaná chemikália rozpustí úplne. Keďže pri DPRA sa testovaná chemikália inkubuje vo veľkom prebytku s cysteínovými alebo lyzínovými peptidmi, na potvrdenie toho, že sa testovaná chemikália (a v prípade testovania mnohozložkovej látky alebo zmesi všetky jej zložky) rozpustila, sa pokladá za postačujúce vykonať vizuálnu kontrolu tvorby číreho roztoku. Vhodnými rozpúšťadlami sú acetonitril, voda, zmes vody s acetonitrilom v pomere 1:1, izopropanol, acetón alebo zmes acetónu s acetonitrilom v pomere 1:1. Iné rozpúšťadlá možno použiť vtedy, ak nemajú vplyv na stabilitu peptidu sledovanú pomocou referenčných kontrol C (t. j. vzorky, ktoré tvorí len peptid rozpustený vo vhodnom rozpúšťadle; pozri dodatok 3). Poslednou možnosťou v prípade, že testovaná chemikália nie je rozpustná v žiadnom z uvedených rozpúšťadiel, je pokúsiť sa ju rozpustiť v 300 μl DMSO a výsledný roztok zriediť s 2 700 μl acetonitrilu, a pokiaľ testovaná chemikália nie je rozpustná v tejto zmesi, treba sa pokúsiť rozpúšťať to isté množstvo testovanej chemikálie v 1 500 μl DMSO a výsledný roztok zriediť s 1 500 μl acetonitrilu. Testovaná chemikália by sa mala vopred odvážiť do sklenených nádobiek a bezprostredne pred testovaním by sa mala rozpustiť vo vhodnom rozpúšťadle, aby sa získalo 10 mM roztoku. V prípade zmesí a viaczložkových látok známeho zloženia, by sa mala stanoviť jediná čistota ako súčet podielov jej zložiek (okrem vody) a jediná jasná molekulová hmotnosť na základe posúdenia jednotlivých molekulových hmotností každej zložky v zmesi (okrem vody) a ich jednotlivých podielov. Výsledná čistota a jasná molekulová hmotnosť by sa potom mali použiť na výpočet hmotnosti testovanej chemikálie, ktorá je potrebná na prípravu 100 mM roztoku. V prípade polymérov, pri ktorých nemožno stanoviť molekulovú hmotnosť hlavnej zložky, možno pri príprave 100 mM roztoku posúdiť molekulovú hmotnosť monoméru (alebo jasnú molekulovú hmotnosť rôznych momomérov tvoriacich polymér). Pri testovaní zmesí, mnohozložkových látok alebo polymérov známeho zloženia by sa však malo zvážiť aj testovanie chemikálie v čistom stave. V prípade kvapalín by sa chemikália v čistom stave mala testovať ako taká bez predchádzajúceho riedenia tak, že sa inkubuje s cysteínovými peptidmi v molárnom pomere 1:10 a lyzínovými peptidmi v molárnom pomere 1:50. V prípade tuhých látok by sa testovaná chemikália mala rozpustiť na svoju maximálnu rozpustnú koncentráciu v tom istom rozpúšťadle, ktoré bolo použité na prípravu roztoku so zdanlivou koncentráciou 100 mM. Následne by sa mala testovať bez ďalšieho riedenia tak, že sa inkubuje s cysteínovými peptidmi v molárnom pomere 1:10 a lyzínovými peptidmi v molárnom pomere 1:50. Na základe súhlasných výsledkov (reaktivita alebo nereaktivita) medzi roztokom so zdanlivou koncentráciou 100 mM a chemikáliou v čistom stave by sa mal dať vyvodiť spoľahlivý záver. Príprava pozitívnej kontroly, referenčných kontrol a koelúcie na kontrolu Cinamaldehyd (CAS číslo 104-55-2; ≥ 95 % potravinárska čistota) by sa mal použiť ako pozitívna kontrola (PC) pri koncentrácii 100 mM v acetonitrile. Možno použiť aj iné vhodné pozitívne kontroly, pokiaľ možno také, ktoré poskytujú hodnoty úbytku stredného rozsahu, ak sú k dispozícii historické údaje, z ktorých možno odvodiť porovnateľné kritériá prijateľnosti daného kola testovania. Do rýchlosti úkonov HPLC by sa navyše mali zaradiť referenčné kontroly (t. j. vzorky obsahujúce len peptidy rozpustené vo vhodnom rozpúšťadle), ktoré sa používajú na overenie vhodnosti systému HPLC pred analýzou (referenčné kontroly A), na overenie stability referenčných kontrol v priebehu času, (referenčné kontroly B) a na overenie toho, že rozpúšťadlo použité na rozpustenie testovanej chemikálie nebude mať vplyv na percentuálny úbytok peptidov (referenčné kontroly C) (pozri dodatok 3). Pri každej chemikálii sa použije vhodná referenčná kontrola na výpočet percentuálneho úbytku peptidov v prípade danej chemikálie (pozri bod 26). Okrem toho by sa do úkonov HPLC mala pri každej testovanej chemikálii, ktorá sa analyzuje, zaradiť koelúcia na kontrolu, ktorá pozostáva len z testovanej chemikálie, na detekciu prípadnej koelúcie testovanej chemikálie s lyzínovým alebo cysteínovým peptidom. Inkubácia testovanej chemikálie s roztokmi cysteínových a lyzínových peptidov Roztoky cysteínových a lyzínových peptidov by sa mali inkubovať v sklenených nádobkách na odber automatickým dávkovačom vzoriek s testovanou chemikáliou v pomere 1:10 pre cysteínové a 1:50 pre lyzínové peptidy. Ak sa hneď po pridaní roztoku testovanej chemikálie k roztoku peptidov spozoruje zrazenina v dôsledku jej nízkej rozpustnosti vo vode, nemožno mať v tomto prípade istotu, aké množstvo testovanej chemikálie zostalo v roztoku a bude môcť reagovať s peptidmi. Preto by sa v takom prípade mohol stále použiť pozitívny výsledok, ale negatívny výsledok je neistý a mal by sa interpretovať s náležitou opatrnosťou (pozri tiež ustanovenia bodu 11 o testovaní chemikálií nerozpustných až do koncentrácie 100 mM). Pred vykonaním analýzy HPLC by sa reakčný roztok mal nechať v tme pri teplote 25 ± 2,5 °C počas 24 ± 2 hodín. Každá testovaná chemikália by sa mala analyzovať trikrát v prípade oboch peptidov. Pred analýzou HPLC sa vzorky musia vizuálne skontrolovať. Ak sa zistí zrazenina alebo oddelenie fáz, možno vzorky odstrediť pri nízkej rýchlosti (100 – 400 x g), aby sa zrazenina z preventívnych dôvodov zatlačila ku dnu nádobky, keďže veľké množstvo zrazeniny môže zapchať trúbky alebo kolóny HPLC. Ak sa zrazenina alebo oddelenie fáz zistí po inkubačnej dobe, môže dôjsť k podhodnotenému odhadu úbytku peptidov a v prípade negatívneho výsledku nemožno s dostatočnou istotou vyvodiť záver o nedostatočnej reaktivite. Príprava štandardnej kalibračnej krivky pre HPLC Mala by sa vytvoriť štandardná kalibračná krivka pre cysteínové, ako aj pre lyzínové peptidy. Štandardy peptidov by sa mali pripraviť v 20 % alebo 25 % roztoku acetonitril: tlmivý roztok s použitím fosfátového tlmivého roztoku (pH 7,5) pre cysteínové peptidy a tlmivého roztoku octanu amónneho (pH 10,2) pre lyzínové peptidy. S použitím štandardov sériového riedenia peptidového zásobného roztoku (0,667 mM) by sa malo pripraviť 6 kalibračných roztokov s rozsahom od 0,534 do 0,0167 mM. Do štandardnej kalibračnej krivky by sa mala zahrnúť aj slepá skúška s riediacim tlmivým roztokom. Vhodné kalibračné krivky by mali mať r2>0,99. Príprava a analýza HPLC Pred vykonaním analýzy by sa mala overiť vhodnosť systému HPLC. Úbytok peptidov sa sleduje pomocou HPLC s pripojeným UV detektorom (detektorom s fotodiódovým poľom alebo absorpčným detektorom s fixnou vlnovou dĺžkou so signálom 220 nm). Do systému HPLC sa nainštaluje vhodná kolóna. Nastavenie HPLC opísané vo validačnej štúdii používa prednostne kolónu Zorbax SB-C-18 s rozmermi 2,1 mm × 100 mm × 3,5 mikrónu. S touto HPLC kolónou s reverznou fázou by mal byť celý systém v rovnovážnom stave pri teplote 30 °C s 50 % fázy A (0,1 obj. % kyseliny trifluóroctovej vo vode) a 50 % fázy B (0,085 obj. % kyseliny trifluóroctovej v acetonitrile) počas aspoň 2 hodín pred spustením. Analýza HPLC by sa mala vykonávať s použitím prietoku 0,35 ml/min a s lineárnym gradientom od 10 % do 25 % acetonitrilu počas 10 minút, s následným prudkým zvýšením na 90 % acetonitrilu s cieľom odstrániť ostatné materiály. Mali by sa injektovať rovnaké objemy každého štandardu, vzorky a kontroly. Kolóna by sa medzi vstreknutiami mala znovu nechať ustáliť pri pôvodných podmienkach počas 7 minút. Ak sa použije iná kolóna HPLC s reverznou fázou, možno bude potrebné upraviť opísané nastavenia parametrov, aby sa zabezpečilo primerané eluovanie a integrácia cysteínových a lyzínových peptidov vrátane injektovaného objemu, ktorý sa môže líšiť podľa použitého systému (zvyčajne v rozmedzí od 3 do 10 μl). Dôležité je, že ak sa použije alternatívne nastavenie HPLC, mala by sa preukázať jeho rovnocennosť s validovaným nastavením, ako sa opisuje vyššie (napr. testovaním látok na preukázanie spôsobilosti uvedených v dodatku 2). Absorbancia sa meria pri 220 nm. Ak sa použije detektor s fotodiódovým poľom, mala by sa zaznamenávať aj absorbancia pri 258 nm. Je potrebné poznamenať, že niektoré dodávky acetonitrilu by mohli mať negatívny dosah na stabilitu peptidov, čo sa musí posúdiť pri používaní novej šarže acetonitrilu. Ako ukazovateľ koelúcie možno použiť pomer plochy píkov pri 220 nm k ploche píkov pri 258 nm. Pri každej vzorke by pomer v rozmedzí 90 % < priemernej hodnoty (19) pomeru plochy v prípade kontrolných vzoriek < 100 % bol dobrou indikáciou toho, že ku koelúcii nedošlo. Môžu sa vyskytnúť testované chemikálie, ktoré by mohli podporovať oxidáciu cysteínových peptidov. Pík dimerizovaného cysteínového peptidu možno sledovať vizuálne. Ak sa zdá, že došlo k dimerizácii, malo by sa to zaznamenať, keďže percentuálny úbytok peptidov môže byť nadhodnotený a viesť tak k falošným pozitívnym predpovediam a/alebo k zaradeniu do vyššej triedy reaktivity (pozri body 29 a 30). Analýzu cysteínových a lyzínových peptidov pomocou metódy HPLC možno vykonávať súbežne (ak sú k dispozícii dva systémy HPLC), alebo v dvoch rôznych dňoch. Ak sa analýza vykonáva v dvoch rôznych dňoch, potom by sa všetky roztoky testovaných chemikálií mali v každý z týchto dní pripraviť čerstvé pre obe skúšky. Analýza by mala byť načasovaná tak, aby sa zaistilo, že vstreknutie prvej vzorky začne 22 až 26 hodín po tom, ako bola testovaná chemikália zmiešaná s roztokom peptidov. Rýchlosť úkonov HPLC by sa mala nastaviť tak, aby trvanie analýzy HPLC bolo kratšie než 30 hodín. Pri nastavení HPLC použitom vo validačnej štúdii a opísanom v tejto testovacej metóde možno pri jednom výkone HPLC spracovať až 26 analytických vzoriek (pozri aj bod 17). Príklad sekvencie analýzy HPLC je uvedený v dodatku 3. PREZENTOVANIE VÝSLEDKOV Vyhodnotenie údajov Koncentrácia cysteínových alebo lyzínových peptidov sa v každej vzorke stanovuje fotometricky pri 220 nm zmeraním plochy píku (plocha pod krivkou) vhodných píkov a výpočtom koncentrácie peptidov pomocou lineárnej kalibračnej krivky odvodenej zo štandardov. Percentuálny úbytok peptidov sa stanovuje v každej vzorke meraním plochy píku, ktorá sa vydelí priemernou hodnotou plochy píku príslušných referenčných kontrol C (pozri dodatok 3) podľa tohto vzorca.
Kritériá prijateľnosti Aby sa výkon pokladal za platný, mali by byť splnené tieto kritériá:
Ak nie je splnené jedno alebo viacero kritérií, mal by sa postup zopakovať. Aby sa výsledky s testovanou chemikáliou pokladali za platné, mali by byť splnené tieto kritériá:
Prognostický model Pre každú testovanú chemikáliu sa vypočíta priemerná hodnota percentuálneho úbytku cysteínu a percentuálneho úbytku lyzínu. Záporný úbytok sa pri výpočte priemernej hodnoty považuje za „0“. Pri použití prognostického modelu cysteín 1:10/lyzín 1:50, ako sa uvádza v tabuľke 1, by sa prahová hodnota 6,38 % priemerného úbytku peptidov mala použiť na podporu rozlíšenia kožných senzibilizátorov od nesenzibilizujúcich chemikálií v rámci IATA. Uplatnenie tohto prognostického modelu pri zaraďovaní testovanej chemikálie do príslušnej triedy reaktivity (t. j. nízka, mierna, vysoká reaktivita) by sa mohlo osvedčiť ako užitočné z hľadiska informácií pre posúdenie potenciálu v rámci IATA. Tabuľka 1 Prognostický model cysteín 1:10/lyzín 1:50 (20)
Môže sa stať, že testovaná chemikália (látka alebo jedna alebo viacero zložiek mnohozložkovej látky alebo zmesi) pri 220 nm výrazne absorbuje a má ten istý retenčný čas ako peptid (koelúcia). Koelúciu možno vyriešiť miernou úpravou nastavenia HPLC, aby sa viac oddelil elučný čas testovanej chemikálie a peptidu. Ak sa použije alternatívne nastavenie HPLC v snahe vyriešiť koelúciu, mala by sa preukázať jeho rovnocennosť s validovaným nastavením (napr. testovaním látok na preukázanie spôsobilosti uvedených v dodatku 2). Ak nastane koelúcia, pík peptidu nemožno integrovať a výpočet percentuálneho úbytku peptidu nie je možný. Ak dôjde ku koelúcii takýchto testovaných chemikálií s cysteínovými, ako aj lyzínovými peptidmi, mala by sa analýza označiť za analýzu „bez výsledku“. V prípadoch, kedy dochádza ku koelúcii len s lyzínovým peptidom, možno použiť prognostický model cysteín 1:10 uvedený v tabuľke 2. Tabuľka 2 Prognostický model cysteín 1:10 (22)
Mohlo by dôjsť k iným prípadom, v ktorých prekrývanie retenčného času medzi testovanou chemikáliou a niektorým z peptidov nie je úplné. V takýchto prípadoch možno percentuálne hodnoty úbytku peptidov odhadnúť a použiť ich v prognostickom modeli cysteín 1:10/lyzín 1:50, no zaradenie testovanej chemikálie do triedy reaktivity nemožno vykonať presne. Jediná analýza HPLC pre cysteínové aj lyzínové peptidy by mala byť pre testovanú chemikáliu postačujúca, ak výsledok nie je jednoznačný. Avšak v prípadoch, keď sa výsledky približujú prahovej hodnote používanej na rozlíšenie medzi pozitívnymi a negatívnymi výsledkami (t. j. hraničné výsledky), môže byť potrebné ďalšie testovanie. Ak sa priemerná hodnota percentuálneho úbytku nachádza v rozpätí od 3 % do 10 % v prípade prognostického modelu pre cysteín 1:10/lyzín 1:50, alebo ak sa percentuálny úbytok cysteínu nachádza v rozmedzí od 9 % do 17 % v prípade prognostického modelu pre cysteín 1:10, malo by sa zvážiť vykonanie druhej analýzy a v prípade nesúhlasných výsledkov medzi prvými dvomi analýzami aj vykonanie tretej analýzy. Skúšobný protokol Skúšobný protokol by mal obsahovať tieto informácie:
LITERATÚRA
Dodatok 1 DEFINÍCIE Presnosť : miera zhody výsledkov testovacej metódy s akceptovanými referenčnými hodnotami. Týka sa výkonnosti testovacej metódy a jedného z aspektov relevantnosti. Tento pojem sa často používa zameniteľne s pojmom „zhoda“ a označuje podiel správnych výsledkov testovacej metódy (21). AOP (dráha nepriaznivého účinku) : sled udalostí počnúc chemickou štruktúrou cieľovej chemikálie alebo skupiny podobných chemikálií vyvolaných molekulárnou iniciáciou až po výsledok in vivo (2), ktorý je predmetom záujmu. Kalibračná krivka : vzťah medzi experimentálnou hodnotou reakcie a analytickou koncentráciou (nazývaný aj ako štandardná krivka) známej látky. Chemikália : látka alebo zmes. Variačný koeficient : týka sa variability, ktorá sa v prípade skupiny údajov z replikátov vypočítava vydelením štandardnej odchýlky od priemeru. Môže sa vynásobiť faktorom 100 a vyjadriť v percentách. Nebezpečenstvo (ohrozenie) : inherentná vlastnosť činidla, prípadne situácia, ktorá môže vyvolať nepriaznivé účinky pri expozícii organizmu, systému alebo (sub)populácie účinkom daného činidla. IATA (integrovaný prístup k testovaniu a hodnoteniu) : štruktúrovaný prístup používaný na identifikáciu (potenciálneho) nebezpečenstva, charakterizáciu nebezpečenstva (z hľadiska potencie) a/alebo hodnotenie bezpečnosti (potenciál/potencia a expozícia) chemikálie alebo skupiny chemikálií, ktorý strategicky integruje a porovnáva všetky relevantné údaje s cieľom informovať regulačný orgán o potenciálnom nebezpečenstve a/alebo riziku a/alebo potrebe vykonania ďalších cielených, t. j. minimálnych testov. Molekulárna iniciácia : chemicky vyvolané narušenie biologického systému na úrovni molekúl, ktoré sa považuje za začiatok AOP. Zmes : zmes alebo roztok zložený z dvoch alebo viacerých látok, ktoré spolu nereagujú (1). Jednozložková látka : látka definovaná svojím kvantitatívnym zložením, v ktorej je hlavná zložka zastúpená v koncentrácii najmenej do 80 hm. %. Viaczložková látka : látka definovaná svojím kvantitatívnym zložením, v ktorej je viac ako jedna hlavná zložka zastúpená v koncentrácii ≥ 10 hm. % a < 80 hm. %. Viaczložková látka je výsledkom výrobného procesu. Rozdiel medzi zmesou a viaczložkovou látkou spočíva v tom, že zmes sa získava zmiešaním dvoch alebo viacerých látok bez toho, aby došlo k chemickej reakcii. Viaczložková látka je výsledkom chemickej reakcie. Pozitívna kontrola : replikát obsahujúci všetky zložky testovacieho systému a ovplyvnený látkou, o ktorej je známe, že vyvolá pozitívnu reakciu. Aby bolo možné vyhodnotiť premenlivosť reakcie na pozitívnu kontrolu v čase, veľkosť pozitívnej reakcie by nemala byť extrémne silná. Referenčná kontrola : neovplyvnená vzorka, ktorá obsahuje všetky zložky testovacieho systému, vrátane rozpúšťadla alebo nosiča, ktorá sa spracuje použitím ovplyvnenej testovanej chemikálie a inými kontrolami, aby sa zistila základná reakcia vzoriek upravených testovanou chemikáliou rozpustenou v tom istom rozpúšťadle alebo nosiči. Keď sa táto vzorka testuje so súbežnou negatívnou kontrolou, preukáže sa aj to, či rozpúšťadlo alebo nosič interagujú s testovacím systémom. Relevantnosť : opis vzťahu testu k účinku, ktorý je predmetom záujmu, a zmysluplnosti a užitočnosti testu na konkrétny účel. Ide o mieru, do akej test správne meria alebo predpovedá biologický účinok, ktorý je predmetom záujmu. Relevantnosť zohľadňuje presnosť (zhodu) testovacej metódy (21). Spoľahlivosť : meria rozsah, v rámci ktorého sa môže testovacia metóda počas istého časového obdobia reprodukovateľne vykonávať v rámci laboratórií a medzi nimi navzájom, pričom sa používa ten istý protokol. Hodnotí sa vypočítaním vnútrolaboratórnej a medzilaboratórnej reprodukovateľnosti a vnútrolaboratórnej opakovateľnosti (21). Reprodukovateľnosť : zhoda výsledkov získaných testovaním tej istej chemikálie s použitím toho istého skúšobného protokolu (pozri spoľahlivosť) (21). Citlivosť : podiel všetkých pozitívnych/aktívnych chemikálií správne klasifikovaných testovacou metódou. Ide o presnosť testovacej metódy, ktorá poskytuje kategorizačné výsledky a musí sa zohľadniť pri hodnotení relevantnosti testovacej metódy (21). Špecifickosť : podiel všetkých negatívnych/neaktívnych chemikálií správne klasifikovaných testovacou metódou. Ide o presnosť testovacej metódy, ktorá poskytuje kategorizačné výsledky a musí sa zohľadniť pri hodnotení relevantnosti testovacej metódy (21). Látka : chemické prvky a ich zlúčeniny v prírodnom stave alebo získané pomocou akéhokoľvek výrobného procesu, vrátane všetkých prísad potrebných na uchovanie stability výrobku a všetkých nečistôt pochádzajúcich z použitého postupu, no s vylúčením všetkých rozpúšťadiel, ktoré je možné oddeliť bez toho, aby ovplyvnili stabilitu látky alebo zmenili jej zloženie (1). Vhodnosť systému : stanovenie prístrojových parametrov (napr. citlivosti) analýzou referenčného štandardu pred spustením analytickej dávky (22). Testovaná chemikália : pojem „testovaná chemikália“ sa používa ako odkaz na to, čo sa testuje. Globálny harmonizovaný systém klasifikácie a označovania chemikálií OSN (ďalej len „GHS OSN“) : systém, ktorým sa navrhuje klasifikácia chemikálií (látok a zmesí) podľa štandardizovaných typov a miery fyzického, zdravotného a environmentálneho nebezpečenstva a označovania pomocou príslušných komunikačných prvkov, ako sú piktogramy, signalizačné výrazy, výstražné upozornenia, bezpečnostné upozornenia a karty bezpečnostných údajov, ktoré obsahujú informácie o ich škodlivých účinkoch z hľadiska ochrany ľudí (vrátane zamestnávateľov, pracovníkov, prepravcov, spotrebiteľov a záchranných zložiek) a životného prostredia (1). UVCB : látky neznámeho alebo variabilného zloženia, produkty komplexných reakcií alebo biologické materiály. Platná testovacia metóda : testovacia metóda, ktorá sa na daný účel považuje za dostatočne relevantnú a spoľahlivú a ktorá je založená na vedecky podložených zásadách. Testovacia metóda nie je nikdy platná v absolútnom zmysle, ale len vo vzťahu k vymedzenému účelu (21). Dodatok 2 CHEMIKÁLIE NA PREUKÁZANIE SPÔSOBILOSTI Kožná senzibilizácia in chemico: skúška priamej peptidovej reaktivity Pred rutinným použitím tejto testovacej metódy by mali laboratóriá preukázať technickú spôsobilosť tým, že správne získajú očakávanú prognózu výsledku skúšky priamej peptidovej reaktivity (DPRA) v prípade 10 chemikálií na preukázanie spôsobilosti odporúčaných v tabuľke 1, a získaním hodnôt úbytku cysteínu a lyzínu, ktoré spadajú do príslušného referenčného rozsahu pre 8 z 10 látok na preukázanie spôsobilosti pri každom peptide. Tieto látky na preukázanie spôsobilosti boli vybrané tak, aby reprezentovali rozpätie reakcií na nebezpečenstvo kožnej senzibilizácie. Medzi ďalšie kritériá výberu patrí ich komerčná dostupnosť, dostupnosť kvalitných referenčných údajov in vivo a údajov in vitro získaných z DPRA, ako aj skutočnosť, že boli použité vo validačnej štúdii koordinovanej referenčným laboratóriom Európskej únie pre alternatívy testovania na zvieratách (EURL ECVAM) na preukázanie úspešného zavedenia testovacej metódy laboratóriami zapojenými do štúdie. Tabuľka 1 Odporúčané chemikálie na preukázanie technickej spôsobilosti pri skúške priamej peptidovej reaktivity (DPRA)
Dodatok 3 PRÍKLADY SEKVENČNEJ ANALÝZY
B.60 Kožná senzibilizácia in vitro: testovacia metóda „ARE-Nrf2 luciferáza” ÚVOD Táto testovacia metóda (TM) zodpovedá usmerneniu OECD na vykonávanie testov (TG) 442D (2015). Pod kožným senzibilizátorom sa rozumie látka, ktorá pri kontakte s pokožkou vyvolá alergickú reakciu podľa definície v Globálnom harmonizovanom systéme klasifikácie a označovania chemických látok (GHS OSN) (1) a nariadení Európskeho parlamentu a Rady (ES) č. 1272/2008 o klasifikácii, označovaní a balení látok a zmesí (CLP) (27). Táto testovacia metóda je postupom in vitro (analýza ARE-Nrf2 luciferáza) používaným ako pomoc pri rozlišovaní medzi kožnými senzibilizátormi a látkami, ktoré senzibilizáciu nespôsobujú, v súlade s GHS OSN (1) a CLP. V prípade kľúčových biologických udalostí vedúcich ku kožnej senzibilizácii panuje všeobecná zhoda. Súčasné poznatky o chemických a biologických mechanizmoch súvisiacich s kožnou senzibilizáciou boli zhrnuté ako dráha nepriaznivého účinku (adverse outcome pathway – AOP) (2), počnúc molekulárnou iniciáciou cez parciálne udalosti až k nepriaznivému alergickému účinku, t. j. alergickej kontaktnej dermatitíde u ľudí alebo kontaktnej hypersenzitivite u hlodavcov (2) (3). Molekulárna iniciácia znamená kovalentnú väzbu elektrofilných látok s nukleofilnými jadrami kožných proteínov. K druhej kľúčovej udalosti v rámci tejto AOP dochádza v keratínocytoch, pričom zahŕňa zápalové reakcie, ako aj génovú expresiu v súvislosti so špecifickými signálnymi dráhami bunky, akými sú dráhy závislé od sekvencie ARE (antioxidant/electrophile response element). Treťou kľúčovou udalosťou je aktivácia dendritických buniek, ktorá sa zvyčajne posudzuje podľa prejavov špecifických povrchových bunkových markerov, chemokínov a cytokínov. Štvrtou kľúčovou udalosťou je proliferácia T-buniek, ktorá sa nepriamo posudzuje lokálnou skúškou lymfatických uzlín (4) na myšiach a potkanoch. Posudzovanie kožnej senzibilizácie obyčajne zahŕňalo použitie laboratórnych zvierat. Tradičné metódy založené na morčatách, t. j. Magnusson Kligmanov test na morčatách (GPMT) a Buehlerov test [TM B. 6 (5)], sledovali tak indukčnú, ako aj elicitačnú fázu kožnej senzibilizácie. Uznanie si získala aj lokálna skúška lymfatických uzlín (LLNA) [TM B. 42 (4)] u myší a potkanov a jej dve nerádioaktívne modifikácie LLNA: DA [TM B.50 (6)] a LLNA: BrdU-ELISA [TM B.51 (7)], ktorými sa posudzuje výlučne indukčná odozva, pretože sú vhodnejšie ako testy na morčatách tak z hľadiska dobrých životných podmienok zvierat, ako aj objektívneho merania indukčnej fázy kožnej senzibilizácie. Nedávno boli vedecky overené testovacie metódy in chemico a in vitro založené na mechanistických poznatkoch, ktorými sa posudzuje nebezpečnosť chemikálií z hľadiska kožnej senzibilizácie. Aby sa však dali plne nahradiť v súčasnosti používané testy na zvieratách, bude potrebné kombinovať metódy testovania bez použitia zvierat (in silico, in chemico, in vitro) v rámci integrovaných prístupov k testovaniu a hodnoteniu (IATA), vzhľadom na obmedzené mechanistické pokrytie AOP jednotlivých v súčasnosti dostupných metód testovania bez použitia zvierat (2) (3). Navrhuje sa, aby sa táto testovacia metóda (analýza ARE-Nrf2 luciferáza) používala v prípade druhej kľúčovej udalosti podľa bodu 2. Existujú informácie o tom, že kožné senzibilizátory indukujú gény regulované sekvenciou ARE (8) (9). Malé elektrofilné látky ako kožné senzibilizátory môžu vystupovať ako senzorový proteín Keap1(Kelch-like ECH-associated protein 1), napr. kovalentnou modifikáciou jeho cysteínového rezídua, ktorá povedie k jeho oddeleniu od transkripčného faktoru Nrf2 (nuclear factor-erythroid 2-related factor 2). Oddelený Nrf2 potom môže aktivovať ARE-dependentné gény, ako sú tie, ktoré kódujú detoxifikačné enzýmy druhej fázy (8) (10) (11). V súčasnosti je jedinou takouto testovacou metódou, ktorá zahŕňa skúšku ARE-Nrf2 luciferáza, skúška KeratinoSens™, v prípade ktorej boli dokončené validačné štúdie (9) (12) (13) a následne vykonané nezávislé partnerské preskúmanie referenčným laboratóriom Európskej únie pre alternatívy testovania na zvieratách (EURL ECVAM) (14). KeratinoSens™ bola považovaná za vedecky platnú skúšku, ktorá sa má na účely klasifikácie nebezpečnosti a označovania (14) používať ako súčasť IATA ako pomoc pri rozlišovaní medzi kožnými senzibilizátormi a látkami, ktoré senzibilizáciu nespôsobujú. Laboratóriá ochotné zaviesť túto testovaciu metódu môžu získať rekombinovanú bunkovú líniu používanú pri skúške KeratinoSens™ uzavretím licenčnej zmluvy so spoločnosťou, ktorá túto testovaciu metódu vyvinula (15). Definície sú uvedené v dodatku 1. ÚVODNÉ ÚVAHY, POUŽITEĽNOSŤ A OBMEDZENIA Keďže aktivácia dráhy Keap1-Nrf 2-ARE sa zaoberá len druhou kľúčovou udalosťou v rámci AOP pri kožnej senzibilizácii, informácie z testovacích metód založených na aktivácii tejto dráhy pravdepodobne nebudú stačiť v prípade, že sa na zistenie potenciálu chemikálií spôsobovať kožnú senzibilizáciu použijú samostatne. Preto by sa údaje získané pomocou tejto testovacej metódy mali zvažovať v kontexte integrovaných prístupov, ako napríklad IATA a kombinovať s inými doplňujúcimi informáciami. napr. odvodenými zo skúšok in vitro zameraných na iné kľúčové udalosti v rámci AOP pri kožnej senzibilizácii, ako aj z metód bez testov vrátane údajov prevzatých z chemických analógov. Príklady použitia testovacej metódy „ARE-Nrf2 luciferáza” v kombinácii s ďalšími informáciami sú uvedené v literatúre (13) (16) (17) (18) (19). Táto testovacia metóda sa môže použiť ako pomoc pri rozlišovaní medzi kožnými senzibilizátormi (t. j. kategória 1 GHS OSN/CLP) a látkami, ktoré senzibilizáciu nespôsobujú, v kontexte IATA. Táto testovacia metóda sa nemôže používať samostatne, ani na ďalšiu kategorizáciu kožných senzibilizátorov do podkategórií 1A a 1B podľa GHS OSN/CLP či na predpovedanie potencie pri prijímaní rozhodnutí v rámci posudzovania bezpečnosti. V závislosti od regulačného rámca sa však pozitívny výsledok môže používať samostatne pri klasifikácii chemikálie do kategórie 1 GHS OSN/CLP. Na základe súboru údajov z validačnej štúdie a interného testovania použitého na nezávislé partnerské preskúmanie testovacej metódy sa preukázalo, že skúška KeratinoSens™ sa dá preniesť aj do laboratórií, ktoré majú skúsenosti s bunkovými kultúrami. Miera reprodukovateľnosti v prognózach, ktorú možno od tejto testovacej metódy očakávať, je rádovo 85 % v rámci laboratória a medzi laboratóriami (14). Zvážením všetkých údajov, ktoré boli laboratóriu EURL ECVAM predložené na hodnotenie, ako aj výsledkov partnerského preskúmania tejto testovacej metódy, sa vypočítala presnosť (77 % – 155/201), citlivosť (78 % – 71/91) a špecifickosť (76 % – 84/110) skúšky KeratinoSens™ na účely rozlišovania medzi kožnými senzibilizátormi (t. j. kategóriou 1 GHS OSN/CLP) a látkami, ktoré senzibilizáciu nespôsobujú, v porovnaní s výsledkami LLNA. Tieto čísla sú podobné tým, ktoré boli nedávno uverejnené na základe interného testovania približne 145 látok (s presnosťou 77 %, citlivosťou 79 % a špecifickosťou 72 %) (13). Skúška KeratinoSens™ má tendenciu podhodnocovať prognózy v prípade chemikálií s nízkou až miernou potenciou kožnej senzibilizácie (t. j. podkategória 1B GHS OSN/CLP) v porovnaní s chemikáliami s vysokou potenciou kožnej senzibilizácie (t. j. podkategória 1A GHS OSN/CLP) (13) (14). V konečnom dôsledku z týchto informácií vyplýva užitočnosť skúšky KeratinoSens™ pri identifikácii nebezpečenstva kožnej senzibilizácie. Hodnoty presnosti, ktoré sa tu uvádzajú v prípade skúšky KeratinoSens™ ako samostatnej testovacej metódy, sú len orientačné, keďže táto testovacia metóda by sa mala posudzovať v spojení s inými zdrojmi informácií v rámci IATA a v súlade s ustanoveniami bodu 9 uvedeného vyššie. Okrem toho by sa pri hodnotení metód testovania kožnej senzibilizácie bez použitia zvierat nemalo zabúdať na skutočnosť, že LLNA, ako aj iné testy na zvieratách, nemusia úplne odrážať situáciu pri druhoch, ktoré sú predmetom záujmu, t. j. u ľudí. Pojem „testovaná chemikália” sa v tejto testovacej metóde používa ako odkaz na to, čo sa testuje, a netýka sa použiteľnosti testovacej metódy „ARE-Nrf2 luciferáza” na testovanie látok a/alebo zmesí. Na základe súčasných dostupných údajov sa ukázalo, že skúšku KeratinoSens™ je možné použiť v prípade testovaných chemikálií zahŕňajúcich viacero organických funkčných skupín, reakčných mechanizmov, potencií senzibilizačných účinkov na pokožku (stanovených štúdiami in vivo) a fyzikálno-chemických vlastností (9) (12) (13) (14). Testovali sa najmä jednozložkové látky, hoci obmedzené množstvo údajov existuje aj z testovania zmesí (20). Táto testovacia metóda je napriek tomu technicky použiteľná aj na testovanie viaczložkových látok a zmesí. V prípade zmesí by sa však pred použitím tejto testovacej metódy na generovanie údajov plánovaných na regulačné účely malo zvážiť, či môže poskytnúť adekvátne výsledky na daný účel a ak áno, prečo. Takéto úvahy nie sú potrebné v prípade, že existuje regulačná požiadavka na testovanie zmesi. Okrem toho by sa pri testovaní viaczložkových látok alebo zmesí mala zvážiť možná interferencia medzi cytotoxickými zložkami a pozorovanými reakciami. Táto testovacia metóda sa používa pri testovaných chemikáliách, ktoré sú rozpustné alebo vytvárajú stabilné disperzie (t. j. koloid alebo suspenziu, v ktorej sa testovaná chemikália neusadí alebo neoddelí od rozpúšťadla do rôznych fáz) buď vo vode, alebo DMSO (vrátane všetkých zložiek testovanej chemikálie v prípade testovania viaczložkových látok alebo zmesi). Testované chemikálie, ktoré nespĺňajú tieto podmienky pri najvyššej konečnej koncentrácii 2 000 μM (pozri bod 22), sa môžu stále testovať pri nižších koncentráciách. V takom prípade by sa výsledky, ktoré spĺňajú kritériá pozitivity opísané v bode 39, mohli ďalej použiť na pomoc pri identifikácii testovanej chemikálie ako kožného senzibilizátora, pričom negatívny výsledok získaný pri koncentráciách < 1 000 μM by sa mal považovať za nejednoznačný (pozri model prognózy v bode 39). Vo všeobecnosti boli úspešne testované látky s LogP do 5, pričom silne hydrofóbne látky s LogP nad 7 sú mimo rozsahu známej použiteľnosti tejto testovacej metódy (14). V prípade látok s LogP od 5 do 7 sú dostupné iba obmedzené informácie. Negatívne výsledky by sa mali interpretovať opatrne, pretože látky reagujúce výlučne na rezíduá lyzínu sa môžu pri tejto metóde ukázať ako negatívne. Okrem toho môžu z dôvodu obmedzenej metabolickej kapacity použitej bunkovej línie (21) a experimentálnych podmienok vykazovať negatívne výsledky aj prohaptény (t. j. chemikálie, ktoré musia byť aktivované enzymaticky, napríklad enzýmami P 450) a prehaptény (t. j. chemikálie aktivované autooxidáciou), zvlášť tie s pomalou oxidáciou. Na druhej strane, testované chemikálie, ktoré sa nesprávajú ako senzibilizátory, ale sú chemickými stresormi, môžu vykazovať falošné pozitívne výsledky (14). Okrem toho vysoko cytotoxické testované chemikálie nemožno vždy spoľahlivo posúdiť. Napokon treba uviesť aj to, že testované chemikálie, ktoré interferujú s luciferázou, môžu negatívne ovplyvniť činnosť luciferázy v bunkových testoch, a to buď zdanlivou inhibíciou, alebo zvýšenou luminiscenciou (22). V iných skúškach s reportérovými génmi luciferázy boli napríklad zaznamenané aj interferencie fytoestrogénu v koncentráciách nad 1 μM s luminiscenčnými signálmi z dôvodu nadmernej aktivácie reportérových génov luciferázy (23). Preto treba všetky prejavy luciferázy získané pri vysokých koncentráciách fytoestrogénov alebo podobných chemikálií, ktoré môžu, rovnako ako fytoestrogény, vyvolať nadmernú aktiváciu reportérových génov luciferázy, dôkladne preskúmať (23). V prípade, že existujú dôkazy o nepoužiteľnosti tejto testovacej metódy na iné špecifické kategórie testovaných chemikálií, by sa táto testovacia metóda nemala pri týchto špecifických kategóriách použiť. Okrem pomoci pri rozlišovaní medzi kožnými senzibilizátormi a látkami, ktoré senzibilizáciu nespôsobujú, slúži skúška KeratinoSens™ aj na získavanie informácií o vzťahu medzi koncentráciou a reakciou, ktorý môže prispieť k hodnoteniu potencie senzibilizačných pri použití integrovaných prístupov, ako je napríklad IATA (19). Je však potrebné vyvinúť ďalšie úsilie, aby sa, najlepšie na základe spoľahlivých údajov získaných u ľudí, dalo určiť, akým spôsobom môžu výsledky skúšky KeratinoSens™ prispieť k hodnoteniu potencie (24) a ku kategorizácii senzibilizátorov do podkategórií podľa GHS OSN/CLP. PRINCÍP TESTU Testovacia metóda „ARE-Nrf2 luciferáza” využíva imortalizovanú adherentnú bunkovú líniu získanú z ľudských keratinocytov HaCaT transfektovaných stabilne so zvoleným plazmidom. Táto bunková línia obsahuje gén luciferázy s transkripciou kontrolovanou konštitutívnym promotérom zlúčeným s prvkom ARE z génu o ktorom je známe, že sa vyznačuje zvýšenou reguláciou vyvolanou kontaktnými senzibilizátormi (25) (26). Signalizácia luciferázy je výsledkom aktivácie endogénnych Nrf2 dependentných génov vyvolanej senzibilizátormi, pričom bola preukázaná závislosť signalizácie luciferázy v rekombinantnej bunkovej línii od Nrf2 (27). To umožňuje kvantitatívne merania (luminiscenčnou detekciou) indukcie génu luciferázy použitím dobre známych luminiscenčných substrátov s obsahom luciferázy, ktoré sú ukazovateľom aktivity transkripčného faktora Nrf2 v bunkách následkom expozície účinkom elektrofilných látok. Testované chemikálie sa v skúške KeratinoSens™ považujú za pozitívne, ak vyvolajú takú štatisticky významnú indukciu aktivity luciferázy presahujúcu stanovený limit [t. j. viac ako 1,5-násobne alebo o 50 %) do výšky definovanej koncentrácie, ktorá významne neovplyvní životaschopnosť buniek (t. j. menej ako 1 000 μM a pri koncentrácii, ktorá zaručuje životaschopnosť buniek nad 70 % (9) (12)]. Na tento účel sa stanoví maximálny násobok indukcie aktivity luciferázy v porovnaní s (negatívnou) kontrolou s rozpúšťadlom (Imax). Okrem toho, keďže bunky sú vystavené pôsobeniu série koncentrácií testovaných chemikálií, by sa koncentrácia potrebná na účely štatisticky významnej indukcie aktivity luciferázy, ktorá prekročí limitnú hodnotu (t. j. hodnotu EC1,5) mala interpolovať z krivky závislosti reakcie od dávky (pozri výpočty v bode 32). Nakoniec by sa mali vykonať paralelné merania cytotoxicity, aby sa posúdilo, či sú indukčné hodnoty aktivity luciferázy pod úrovňou cytotoxických koncentrácií. Pred rutinným použitím skúšky ARE-Nrf2 luciferáza, ktorá zodpovedá požiadavkám tejto testovacej metódy, by mali laboratóriá preukázať technickú spôsobilosť použitím desiatich chemikálií na preukázanie spôsobilosti uvedených v dodatku 2. Normy výkonnosti (28) sú k dispozícii na to, aby uľahčili validáciu nových alebo modifikovaných in vitro testovacích metód „ARE-Nrf2 luciferáza” podobných skúške KeratinoSens™ a umožnili včasnú úpravu tejto testovacej metódy pre ich zaradenie. Vzájomné uznávanie údajov (MAD) podľa dohody OECD je možné garantovať len v prípade testovacích metód validovaných podľa noriem výkonnosti v prípade, že tieto metódy boli preskúmané a zaradené do príslušných usmernení OECD na vykonávanie testov. POSTUP V súčasnosti existuje v rámci tejto testovacej metódy jediná vedecky overená metóda – skúška KeratinoSens™ (9) (12) (13) (14). Ku skúške KeratinoSens™ boli vypracované štandardné prevádzkové postupy a mali by sa používať pri zavádzaní a využívaní tejto testovacej metódy v laboratóriu (15). Laboratóriá ochotné zaviesť túto testovaciu metódu môžu získať rekombinovanú bunkovú líniu používanú pri skúške KeratinoSens™ uzavretím licenčnej zmluvy so spoločnosťou, ktorá túto testovaciu metódu vyvinula. V nasledujúcich bodoch sú opísané základné zložky a postupy pri testovacej metóde ARE-Nrf2 luciferáza. Príprava keratínocytových kultúr Mala by sa použiť transgénová bunková línia so stabilným reportérovým génom luciferázy kontrolovaným prvkom ARE (napr. bunková línia KeratinoSens™). Po prijatí sa bunky namnožia (napr. na 2 až 4 pasáže) a skladujú zmrazené ako homogénny materiál. Bunky z tohto uskladneného materiálu sa namnožia na maximálny počet pasáží (t. j. 25 v prípade KeratinoSens™) a podrobia rutinnému testovaniu použitím vhodného udržiavacieho média (v prípade KeratinoSens™ ide o DMEM s obsahom séra a geneticínu). Na účely testovania by bunky mali byť z 80 – 90 % konfluentné, pričom treba dbať na to, aby nikdy nedošlo k úplnej konfluencii. Deň pred testovaním sa bunky odoberú a rozdelia na platničky s 96 jamkami (v prípade KeratinoSens™ pripadá na jednu jamku 10 000 buniek). Treba dbať na to, aby pri dávkovaní nedošlo k sedimentácii buniek a bunky boli do jednotlivých jamiek rozdelené rovnomerne. V opačnom prípade môžu jednotlivé jamky vykazovať výrazne odlišné hodnoty. Pri každom opakovaní sa na meranie aktivity luciferázy použijú tri replikáty, pričom jeden paralelný replikát sa použije na skúšku životaschopnosti buniek. Príprava testovanej chemikálie a kontrolných látok Testovaná chemikália a kontrolné látky sa pripravujú v deň testovania. V prípade skúšky KeratinoSens™ sa testované chemikálie rozpustia v dimetylsulfoxide (DMSO) na konečnú želanú koncentráciu (napr. 200 mM). Roztoky DMSO možno považovať za samosterilizujúce, preto nie je potrebná žiadna sterilná filtrácia. Testovaná chemikália, ktorá nie je rozpustná v DMSO, sa rozpustí v sterilnej vode alebo kultivačnom médiu a roztoky sa sterilizujú napr. filtráciou. V prípade testovanej chemikálie, ktorá nemá definovanú molekulovú hmotnosť (MH), sa pripraví zásobný roztok s koncentráciou (40 mg/ml alebo 4 hm. %), ktorá je pre skúšku KeratinoSens™ štandardná. Použitie iných rozpúšťadiel ako DMSO, voda alebo kultivačné médium treba náležite zdôvodniť. Zo zásobných roztokov DMSO testovanej chemikálie sa extrakt sériovo riedi použitím DMSO tak, aby sa získalo 12 základných koncentrácií testovanej chemikálie (od 0,098 do 200 mM pri skúške KeratinoSens™). V prípade testovanej chemikálie, ktorá nie je rozpustná v DMSO, dochádza k riedeniu na získanie základných koncentrácií použitím sterilnej vody alebo sterilného kultivačného média. Nezávisle od použitého rozpúšťadla sa základné koncentrácie ďalej 25-krát zriedia v kultivačnom médiu s obsahom séra a nakoniec sa upravia ďalším 4-násobným faktorom riedenia tak, aby bol rozsah konečných koncentrácií testovanej chemikálie pri skúške KeratinoSens™ v rozmedzí od 0,98 do 2 000 μM. Môžu sa použiť aj alternatívne koncentrácie (napr. v prípade cytotoxicity alebo slabej rozpustnosti), ak sa zdôvodnia. Negatívna kontrola (s rozpúšťadlom) používaná pri skúške KeratinoSens™ je DMSO (CAS č. 67-68-5, ≥ 99 % čistoty), ktorá sa dávkuje do šiestich jamiek na každej platničke. Prejde rovnakým riedením ako v prípade základných koncentrácií, ktorý je opísaný v bode 22, a to tak, aby výsledná negatívna kontrola (s rozpúšťadlom) bola 1 %, pričom je o nej známe, že neovplyvňuje životaschopnosť buniek a má rovnakú koncentráciu ako DMSO zistenú v testovanej chemikálii a pozitívnej kontrole. V prípade testovanej chemikálie nerozpustnej v DMSO, ktorá sa riedila vo vode, sa musí koncentrácia DMSO vo všetkých jamkách upraviť na 1 % tak, ako v prípade ostatných testovaných chemikálií a kontrolných látok. Pozitívnou kontrolou používanou pri skúške KeratinoSens™ je aldehyd kyseliny škoricovej (CAS č. 14371-10-9, s čistotou ≥ 98 %), z ktorého sa v DMSO (zásobný roztok s koncentráciou 6,4 mM) pripravia série 5 základných koncentrácií v rozmedzí od 0,4 do 6,4 mM a zriedia postupom opísaným pri základných koncentráciách v bode 22 tak, aby sa konečná koncentrácia pozitívnej kontroly pohybovala od 4 do 64 μM. Môžu sa použiť aj iné pozitívne kontroly, najlepšie také, ktoré umožnia dosiahnuť hodnotu EC1,5 pri strednom rozsahu, ak existujú predchádzajúce údaje, z ktorých sa dajú odvodiť porovnateľné kritériá prijateľnosti vykonania testu. Použitie testovanej chemikálie a kontrolných látok Pri každej testovanej chemikálii a pozitívnej kontrole je potrebné vykonať jeden pokus na odvodenie prognózy (pozitívnej alebo negatívnej), ktorý pozostáva najmenej z dvoch nezávislých opakovaní s každým z troch replikátov (t. j. n = 6). Ak sa výsledky z dvoch nezávislých opakovaní nezhodujú, je potrebné vykonať tretie opakovanie s tromi replikátmi (t. j. n = 9). Každé nezávislé opakovanie sa vykoná v iný deň, s čerstvým zásobným roztokom testovaných chemikálií a s nezávisle odobratými bunkami. Bunky však môžu pochádzať z tej istej pasáže. Po nadávkovaní opísanom v bode 20 sa bunky kultivujú 24 hodín v platničkách s 96 jamkami. Potom sa médium odstráni a nahradí čerstvým kultivačným médiom (v prípade skúšky KeratinoSens™ je to150 μl kultivačného média s obsahom séra bez geneticínu), do ktorého sa pridá 50 μl 25-násobne zriedenej testovanej chemikálie a kontrolných látok. Na každej platničke s jamkami sa nechá aspoň jedna jamka prázdna (bez buniek a bez ovplyvnenia), aby sa skontrolovali pozaďové hodnoty. Ovplyvnené platničky s jamkami sa potom inkubujú 48 hodín pri teplote 37 ± 1 °C za prítomnosti 5 % CO 2 v prípade skúšky KeratinoSens™. Treba dbať na to, aby sa zabránilo vyparovaniu prchavých testovaných chemikálií a krížovej kontaminácii medzi jamkami s testovanými chemikáliami. napr. zakrytím platničiek fóliou pred ich inkubáciou. Merania aktivity luciferázy Na odčítanie správnych hodnôt luciferázy sú kľúčové tri faktory:
Pred testovaním je potrebné skontrolovať vybavenie na vykonanie skúšky opísané v dodatku 3, aby sa zabezpečilo splnenie týchto troch bodov. Po 48-hodinovej expozícii s testovanou chemikáliou a kontrolnými látkami pri skúške KeratinoSens™ sa bunky opláchnu fosfátovým tlmivým fyziologickým roztokom a na účely odčítania luminiscenčných hodnôt sa do každej jamky pridá pri izbovej teplote na 20 minút príslušný lyzačný tlmivý roztok. Platničky s bunkovým lyzátom sa potom umiestnia do luminometra, ktorý je pri skúške KeratinoSens™ naprogramovaný tak, aby: i) do každej jamky pridal substrát luciferázy (t. j. 50 μl), ii) počkal 1 sekundu a iii) na 2 sekundy zlúčil aktivitu luciferázy. Ak sa použijú alternatívne nastavenia, napr. v závislosti od použitého modelu luminometra, mali by sa zdôvodniť. Okrem toho je možné použiť aj luminiscenčný substrát za predpokladu, že bol úspešne vykonaný pokus na kontrolu kvality opísaný v dodatku 3. Hodnotenie cytotoxicity Pri skúške životaschopnosti buniek KeratinoSens™ sa médium po 48 hodinách expozície nahradí čerstvým médiom s obsahom MTT, t. j. 2,5-difenyl-3-(4,5-dimetyltiazol-2-yl)tetrazólium-bromidu alebo tiazolylovej modrej tetrazólium-bromidu; (CAS č. 298-93-1), pričom bunky sa inkubujú 4 hodiny pri teplote 37 °C v prítomnosti 5 % CO2. MTT médium sa potom odstráni a bunky sa cez noc lyzujú (napr. pridaním 10 % roztoku SDS do každej jamky). Po pretrepaní sa fotometrom zmeria absorpcia pri 600 nm. ÚDAJE A PREZENTOVANIE VÝSLEDKOV Hodnotenie údajov Pri skúške KeratinoSens™ sa vypočítavajú tieto parametre:
Rovnica 1:
kde
hodnota EC1,5 sa vypočíta lineárnou interpoláciou podľa rovnice 2 a celková hodnota EC1,5 sa vypočíta ako geometrický priemer jednotlivých opakovaní. Rovnica 2:
kde
Životaschopnosť sa vypočíta pomocou rovnice 3: rovnica 3:
kde
hodnoty IC50 a IC30 sa vypočítajú lineárnou interpoláciou podľa rovnice 4 a celkové hodnoty IC50 a IC30 sa vypočítajú ako geometrický priemer jednotlivých opakovaní. rovnica 4:
kde
Pre každú koncentráciu vykazujúcu viac ako 1,5-násobnú indukciu aktivity luciferázy sa vypočíta štatistická významnosť (napr. dvojvýberovým Studentovým t-testom), pričom sa porovnajú hodnoty luminiscencie v prípade troch vzoriek replikátov s hodnotami luminiscencie v jamkách s negatívnou kontrolou s rozpúšťadlom, aby sa zistilo, či je indukcia aktivity luciferázy štatisticky významná (p < 0,05). Najnižšia koncentrácia s viac ako 1,5-násobnou indukciou aktivity luciferázy je hodnota, ktorá určuje hodnotu EC1,5. V každom prípade sa kontroluje, či je táto hodnota nižšia ako hodnota IC30, čo znamená, že ide o menej ako 30 % zníženie životaschopnosti buniek pri rozhodujúcej koncentrácii EC1,5. Odporúča sa údaje vizuálne skontrolovať pomocou grafov. Ak nemožno vyvodiť jednoznačnú krivku závislosti reakcie od dávky, alebo ak má získaná krivka dve fázy (t. j. dvakrát došlo k prekročeniu limitu 1,5), pokus by sa mal zopakovať, aby sa overilo, či sa tak stalo z dôvodu, ktorý je špecifický pre danú testovanú chemikáliu, alebo ide o vedľajší účinok experimentu. Ak je dvojfázová odozva reprodukovateľná v nezávislom pokuse, zaznamená sa nižšia hodnota EC1,5 (t. j. koncentrácia, pri ktorej bol limit 1,5 prekročený po prvýkrát). Vo výnimočných prípadoch, keď dôjde k štatisticky nevýznamnej indukcii prekračujúcej limit 1,5-násobku a následne k zvýšeniu koncentrácie pri štatisticky významnej indukcii, výsledky z opakovania sa považujú za platné a pozitívne, ak sa štatisticky významná indukcia prekračujúca limit 1,5 dosiahla pre necytotoxickú koncentráciu. Nakoniec sa na základe vizuálnej kontroly krivky závislosti reakcie od dávky v prípade testovaných chemikálií vykazujúcich 1,5-násobnú alebo vyššiu indukciu už pri najnižších testovaných koncentráciách 0,98 μM, stanoví hodnota EC1,5, ktorá je nižšia ako 0,98. Kritériá prijateľnosti Pri použití skúšky KeratinoSens™ by mali byť splnené tieto kritériá prijateľnosti. Po prvé, indukcia aktivity luciferázy získaná s pozitívnou kontrolou – aldehydom kyseliny škoricovej – by mala byť štatisticky významná nad limitom 1,5 (napr. použitím T-testu) aspoň pri jednej z testovaných koncentrácií (od 4 do 64 μM). Po druhé, hodnota EC1,5 by mala byť v rozmedzí dvoch štandardných odchýlok historického priemeru testovacieho zariadenia (napr. medzi 7 μM a 30 μM podľa súboru validačných údajov) a mala by sa pravidelne aktualizovať. Navyše hodnota priemernej indukcie v troch replikátoch v prípade aldehydu kyseliny škoricovej s koncentráciou 64 μM by mala byť medzi 2 a 8. Ak toto kritérium nie je splnené, mala by sa dôkladne skontrolovať závislosť reakcie od dávky aldehydu kyseliny škoricovej, pričom testy možno považovať za prijateľné iba v prípade, že je pri pozitívnej kontrole zrejmá jednoznačná závislosť reakcie od dávky pri rastúcej indukcii aktivity luciferázy. Napokon by sa pri každom opakovaní pozostávajúcom zo 6 jamiek testovaných v triplikátoch mal dosiahnuť priemerný koeficient odchýlky odčítanej hodnoty luminiscencie v prípade negatívne kontroly DMSO (s rozpúšťadlom), ktorý je nižší ako 20 %. Ak sú odchýlky vyššie, výsledky by sa mali zrušiť. Interpretácia výsledkov a model prognózy Prognóza sa pri skúške KeratinoSens™ považuje za pozitívnu, ak sú splnené uvedené 4 podmienky v 2 z 2 alebo v tých istých 2 z 3 opakovaní. Inak sa prognóza považuje za negatívnu (obrázok 1):
Ak sú pri niektorom z opakovaní splnené všetky tri prvé podmienky, ale nie je možné pozorovať vzťah medzi reakciou a dávkou pri indukcii luciferázy, tak by sa výsledok daného opakovania mal považovať za nejednoznačný a môže byť potrebné ďalšie testovanie (obrázok 1). Navyše aj negatívny výsledok získaný pri koncentráciách < 1 000 μM (alebo < 200 μg/ml v prípade testovaných chemikálií s nedefinovanou MH) by sa mal považovať za nejednoznačný (pozri bod 11). Obrázok 1 Model prognózy používaný pri skúške KeratinoSens™. Prognóza KeratinoSens™ by sa mala posudzovať v rámci IATA a v súlade s ustanoveniami bodov 9 a 11.
V zriedkavých prípadoch môžu byť testované chemikálie, ktoré indukujú aktivitu luciferázy pri úrovniach veľmi blízkych cytotoxicite, pozitívne pri niektorých opakovaniach pri necytotoxických úrovniach (t. j. rozhodujúca koncentrácia EC1,5 je nižšia (<) ako IC30), ako aj pri iných opakovaniach iba pri cytotoxických úrovniach (t. j. rozhodujúca koncentrácia EC1,5 je vyššia (>) ako IC30). Tieto testované chemikálie sa musia opakovane testovať použitím podrobnejšej analýzy vzťahu medzi reakciou a dávkou s nižším faktorom riedenia (napr. 1,33 alebo √2 (= 1,41) násobné riedenie medzi jamkami), aby sa zistilo, či pri cytotoxických úrovniach došlo k indukcii alebo nie (9). Skúšobný protokol Skúšobný protokol by mal obsahovať tieto informácie:
LITERATÚRA
Dodatok 1 DEFINÍCIE Presnosť : Miera zhody výsledkov testovacej metódy s akceptovanými referenčnými hodnotami. Týka sa výkonnosti testovacej metódy a jedného z aspektov relevantnosti. Tento pojem sa často používa zameniteľne s pojmom „zhoda“ a označuje podiel správnych výsledkov testovacej metódy (29). AOP (dráha nepriaznivého účinku) : sled udalostí počnúc chemickou štruktúrou cieľovej chemikálie alebo skupiny podobných chemikálií vyvolaných molekulárnou iniciáciou až po výsledok in vivo, ktorý je predmetom záujmu (2). ARE : antioxidačný reakčný element (nazývaný aj EpRE – elektrofilný reakčný element) je reakčný element, ktorý sa v prípade mnohých cytoprotektívnych génov a génov fázy II nachádza v „upstream“ oblasti promótoru. Ak sa aktivuje prostredníctvom Nrf2, napomáha transkripčnú indukciu týchto génov. Chemikália : látka alebo zmes. Variačný koeficient : týka sa variability, ktorá sa v prípade skupiny opakovaných údajov vypočítava vydelením štandardnej odchýlky od priemeru. Môže sa vynásobiť faktorom 100 a vyjadriť v percentách. EC1,5 : interpolovaná koncentrácia v prípade 1,5-násobnej indukcie luciferázy. IC30 : koncentrácia vyvolávajúca zníženie životaschopnosti buniek o 30 %. IC50 : koncentrácia vyvolávajúca zníženie životaschopnosti buniek o 50 %. Nebezpečenstvo (ohrozenie) : inherentná vlastnosť činidla, prípadne situácia, ktorá môže vyvolať nepriaznivé účinky pri expozícii organizmu, systému alebo (sub)populácie účinkom daného činidla. IATA (integrovaný prístup k testovaniu a hodnoteniu) : štruktúrovaný prístup používaný na identifikáciu (potenciálneho) nebezpečenstva, charakterizáciu nebezpečenstva (z hľadiska potencie) a/alebo hodnotenie bezpečnosti (potenciál/potencia a expozícia) chemikálie alebo skupiny chemikálií, ktorý strategicky integruje a porovnáva všetky relevantné údaje v záujme prijatia právneho rozhodnutia o potenciálnom nebezpečenstve a/alebo riziku a/alebo potrebe vykonania ďalších cielených, t. j. minimálnych testov. Imax : maximálny faktor indukcie aktivity luciferázy v porovnaní s (negatívnou) kontrolou s rozpúšťadlom nameraný pri ktorejkoľvek koncentrácii testovanej chemikálie. Keap1 : je senzorový proteín (Kelch-like ECH-associated protein 1), ktorý dokáže regulovať aktivitu Nrf2. Za podmienok bez indukcie vyhľadáva senzorový proteín Keap1 transkripčný faktor Nrf2, pričom dochádza k ubikvitinácii a proteolytickej degradácii v proteazóme. Kovalentná modifikácia rezíduí reakčného cysteínu v proteíne Keap1 spôsobená malými molekulami môže viesť k oddeleniu Nrf2 od Keap1 [8) (10) (11)]. Zmes : zmes alebo roztok zložený z dvoch alebo viacerých látok, ktoré spolu nereagujú (1). Jednozložková látka : látka definovaná svojím kvantitatívnym zložením, v ktorej je hlavná zložka zastúpená v koncentrácii najmenej do 80 hm. %. Viaczložková látka : látka definovaná svojím kvantitatívnym zložením, v ktorej je viac ako jedna hlavná zložka zastúpená v koncentrácii ≥ 10 hm. % a < 80 hm. %. Viaczložková látka je výsledkom výrobného procesu. Rozdiel medzi zmesou a viaczložkovou látkou spočíva v tom, že zmes sa získava zmiešaním dvoch alebo viacerých látok bez toho, aby došlo k chemickej reakcii. Viaczložková látka je výsledkom chemickej reakcie. Nrf2 : nukleárny faktor [(erythroid-derived 2)-like 2] je transkripčný faktor, ktorý je súčasťou antioxidačnej reakčnej dráhy. Ak Nrf2 nie je ubikvitinovaný, začne sa tvoriť v cytoplazme a presúva sa do jadra, kde sa v prípade mnohých cytoprotektívnych génov spája v „upstream“ oblasti promótoru s ARE a spustí ich transkripciu (8) (10) (11). Pozitívna kontrola : replikát obsahujúci všetky zložky testovacieho systému, ktorý je ovplyvnený látkou, o ktorej je známe, že vyvoláva pozitívnu reakciu. Aby bolo možné vyhodnotiť variabilitu spätnej reakcie na pozitívnu kontrolu v čase, nesmie byť jej veľkosť extrémne silná. Relevantnosť : opis vzťahu testu k účinku, ktorý je predmetom záujmu a zmysluplnosti a užitočnosti testu na konkrétny účel. Ide o mieru, do akej test správne meria alebo prognózuje biologický účinok, ktorý je predmetom záujmu. Relevantnosť zohľadňuje presnosť (zhodu) testovacej metódy (29). Spoľahlivosť : meria rozsah, v rámci ktorého sa môže testovacia metóda počas istého časového obdobia reprodukovateľne vykonávať v rámci laboratórií a medzi nimi navzájom, pričom sa používa ten istý protokol. Hodnotí sa vypočítaním vnútrolaboratórnej a medzilaboratórnej reprodukovateľnosti a vnútrolaboratórnej opakovateľnosti (29). Reprodukovateľnosť : zhoda výsledkov získaných testovaním tej istej chemikálie s použitím toho istého skúšobného protokolu (pozri spoľahlivosť) (29). Citlivosť : podiel všetkých pozitívnych/aktívnych chemikálií správne klasifikovaných testovacou metódou. Ide o presnosť testovacej metódy, ktorá poskytuje kategorizačné výsledky a musí sa zohľadniť pri hodnotení relevantnosti testovacej metódy (29). Kontrola s rozpúšťadlom/nosičom : replikát obsahujúci všetky zložky testovacieho systému okrem testovanej chemikálie, ale vrátane použitého rozpúšťadla. Používa sa na zistenie základnej spätnej reakcie vzoriek ovplyvnených testovanou chemikáliou rozpustenou v tom istom rozpúšťadle. Špecifickosť : podiel všetkých negatívnych/neaktívnych chemikálií správne klasifikovaných testovacou metódou. Ide o presnosť testovacej metódy, ktorá poskytuje kategorizačné výsledky a musí sa zohľadniť pri hodnotení relevantnosti testovacej metódy (29). Látka : chemické prvky a ich zlúčeniny v prírodnom stave alebo získané pomocou akéhokoľvek výrobného procesu vrátane všetkých prísad potrebných na uchovanie stability výrobku a všetkých nečistôt pochádzajúcich z použitého postupu, no s vylúčením všetkých rozpúšťadiel, ktoré je možné oddeliť bez toho, aby ovplyvnili stabilitu látky alebo zmenili jej zloženie (1). Testovaná chemikália : pojem „testovaná chemikália“ sa používa ako odkaz na to, čo sa testuje. Globálny harmonizovaný systém klasifikácie a označovania chemikálií OSN (ďalej len „GHS OSN“) : systém, ktorým sa navrhuje klasifikácia chemikálií (látok a zmesí) podľa štandardizovaných typov a miery fyzického, zdravotného a environmentálneho nebezpečenstva a označovania pomocou príslušných komunikačných prvkov, ako sú piktogramy, signalizačné výrazy, výstražné upozornenia, bezpečnostné upozornenia a karty bezpečnostných údajov, ktoré obsahujú informácie o ich škodlivých účinkoch z hľadiska ochrany ľudí (vrátane zamestnávateľov, pracovníkov, prepravcov, spotrebiteľov a záchranných zložiek) a životného prostredia (1). UVCB : látky neznámeho alebo variabilného zloženia, produkty komplexných reakcií alebo biologické materiály. Validná testovacia metóda : testovacia metóda, ktorá sa na daný účel považuje za dostatočne relevantnú a spoľahlivú a ktorá je založená na vedecky podložených zásadách. Testovacia metóda nie je nikdy platná v absolútnom zmysle, ale len vo vzťahu k vymedzenému účelu (29). Dodatok 2 CHEMIKÁLIE NA PREUKÁZANIE SPÔSOBILOSTI Kožná senzibilizácia in vitro: testovacia metóda „ARE-Nrf2 luciferáza“ Pred rutinným použitím tejto testovacej metódy by mali laboratóriá preukázať technickú spôsobilosť tým, že správne získajú očakávanú prognózu výsledku skúšky KeratinoSens™ v prípade 10 chemikálií na preukázanie spôsobilosti odporúčaných v tabuľke 1 a získaním hodnôt EC1,5 a IC50, ktoré spadajú do príslušného referenčného rozsahu pre najmenej 8 z 10 látok na preukázanie spôsobilosti. Tieto látky na preukázanie spôsobilosti boli vybrané tak, aby reprezentovali rozsah reakcií na nebezpečenstvo kožnej senzibilizácie. Ďalším kritériom výberu bola komerčná dostupnosť, dostupnosť kvalitnej referenčnej vzorky in vivo a kvalitných údajov in vitro zo skúšky KeratinoSens™. Tabuľka 1 Odporúčané chemikálie na preukazovanie technickej spôsobilosti pri skúške KeratinoSens™
Dodatok 3 KONTROLA KVALITY MERANÍ LUMINISCENCIE Základný pokus na zaručenie optimálnych meraní luminiscencie pri skúške KeratinoSens™ Na získanie spoľahlivých výsledkov z luminometra sú kľúčové tieto tri faktory:
Pred testom sa odporúča overiť zloženie kontrolnej štruktúry platničky spôsobom opísaným nižšie (trojnásobnou analýzou), aby sa zaručila primeranosť meraní luminiscencie. Zloženie štruktúry platničky pri prvom cvičnom pokuse
EGDMA= etylénglykol-dimetakrylát (CAS č.: 97-90-5) je silne induktívna chemikália CA= aldehyd kyseliny škoricovej, pozitívna referenčná vzorka (CAS č.: 104-55-2) Analýza kontroly kvality by mala preukázať:
B.61 Testovacia metóda úniku fluoresceínu na zisťovanie očných žieravín a silne dráždivých látok ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 460 (2012). Testovacia metóda úniku fluoresceínu (Fluorescein Leakage – FL) je testovacia metóda in vitro, ktorú je za určitých okolností možné a pri určitých obmedzeniach použiť na klasifikáciu chemikálií (látok a zmesí) ako očných žieravín a silne dráždivých látok tak, ako sú definované v Globálnom harmonizovanom systéme klasifikácie a označovania chemikálií (GHS) Organizácie spojených národov (OSN) (kategória 1), v nariadení (ES) č. 1272/2008 o klasifikácii, označovaní a balení látok a zmesí (CLP) (31) (kategória 1) a Agentúrou na ochranu životného prostredia USA (EPA) (kategória I) (1) (2). Na účely tejto testovacej metódy sa za silne dráždivé látky považujú chemikálie spôsobujúce po podaní testovanej chemikálie poškodenie očného tkaniva, ktoré je do 21 dní nezvratné, alebo spôsobujúce vážne fyzické zhoršenie zraku, pričom očné žieraviny sú chemikálie, ktoré spôsobujú nezvratné poškodenie očného tkaniva. Tieto chemikálie sú klasifikované GHS OSN v kategórii 1, CLP EÚ v kategórii 1 alebo EPA USA v kategórii I. Zatiaľ čo testovacia metóda FL sa nepovažuje za validnú a plnohodnotnú náhradu testu očí králikov in vivo, odporúča sa používať ako súčasť stratégie viacúrovňového testovania na účely klasifikácie a označovania regulačnými orgánmi. Preto sa FL odporúča ako prvý krok v rámci prístupu zhora nadol na zisťovanie očných žieravín/silne dráždivých látok, konkrétne v prípade obmedzených druhov chemikálií (t. j. látok a zmesí, ktoré sú rozpustné vo vode) (3) (4). V súčasnosti je všeobecne akceptovaný fakt, že v blízkej budúcnosti nebude existovať žiaden test podráždenia očí in vitro, ktorým by bolo možné nahradiť očný test in vivo [TM B.5 (5)] umožňujúci prognózy naprieč celým spektrom dráždivosti v rámci jednotlivých chemických tried. Je však možné, že strategické kombinácie viacerých alternatívnych testovacích metód v rámci (viacúrovňovej) stratégie testovania dokážu očný test in vivo nahradiť (4). Prístup zhora nadol (4) je navrhnutý tak, aby sa použil vo chvíli, keď je možné (na základe dostupných informácií) predpokladať, že daná chemikália bude mať vysokodráždivý potenciál. Na základe modelu prognózy podrobne opísaného v bode 35 dokáže testovacia metóda FL identifikovať chemikálie v určitej sfére použitia ako očné žieraviny/silne dráždivé látky (GHS OSN kategória 1; CLP EÚ, kategória 1; US EPA kategória I) bez ďalšieho testovania. To isté sa predpokladá v prípade zmesí, hoci zmesi neboli pri validácii použité. Preto je možné testovaciu metódu FL použiť na zistenie podráždenia očí/žieravosti chemikálií po tom, čo sa realizovala stratégia postupného testovania v rámci testovacej metódy B.5 (5). Chemikáliu, ktorá nemá prognózu očnej žeriaviny alebo silne dráždivej látky pri testovacej metóde FL, však bude potrebné podrobiť testu jednou alebo viacerými dodatočnými testovacími metódami (in vitro a/alebo in vivo), ktoré sú schopné presne určiť i) chemikálie, ktoré sú ako očné žieraviny/silne dráždivé látky pri metóde FL falošne negatívne in vitro (GHS OSN kategória 1; CLP EÚ, kategória 1; US EPA kategória I); ii) chemikálie, ktoré nie sú klasifikované ako žieravé/dráždivé pre oči (GHS OSN bez kategórie; CLP EÚ bez kategórie; US EPA kategória IV); a/alebo iii) chemikálie, ktoré sú mierne/slabo dráždivé pre oči (GHS OSN kategórie 2A a 2B; CLP EÚ, kategória 2; US EPA kategórie II a III). Účelom tejto metódy je opísať postupy hodnotenia potenciálnej očnej žieravosti alebo silnej dráždivosti testovanej chemikálie, ktorá sa meria jej schopnosťou spôsobiť poškodenie nepriepustnej súvislej monovrstvy epitelu. Integrita medziepitelovej priepustnosti je základnou funkciou epitelov, ktoré nájdeme napríklad v spojivke a rohovke. Medziepitelovú priepustnosť kontroluje niekoľko tesných spojov (zonula occludens). Ukázalo sa, že zvyšovanie priepustnosti epitelu rohovky in vivo súvisí s rozsahom zápalu a poškodenia povrchu, ku ktorým dochádza narastajúcim podráždením očí. V testovacej metóde FL sa toxické účinky po krátkodobej expozícii testovanej chemikálii merajú zvýšením priepustnosti nátrium-fluoresceínu cez monovrstvu epitelu Madinových-Darbyho buniek v psích obličkách (MDCK) kultivovaných na priepustných inzertoch. Pozorované množstvo úniku fluoresceínu je úmerné miere chemicky vyvolaného poškodenia tesných spojov, desmozomálnych spojov a bunkových membrán a môže sa použiť na odhad potenciálnej očnej toxicity testovanej chemikálie. V dodatku 1 je obrázok MDCK buniek pestovaných na inzertnej membráne na účely testovacej metódy FL. Definície sú uvedené v dodatku 2. ÚVODNÉ ÚVAHY A OBMEDZENIA Táto testovacia metóda vychádza z protokolu INVITTOX č. 71 (6), ktorý bol hodnotený prostredníctvom medzinárodnej validačnej štúdii realizovanej Európskym centrom pre validáciu alternatívnych metód (ECVAM), v spolupráci s americkým Medziagentúrnym koordinačným výborom pre validáciu alternatívnych metód (ICCVAM) a japonským Centrom pre validáciu alternatívnych metód (JaCVAM). Testovacia metóda FL sa neodporúča na identifikáciu chemikálií, ktoré by sa mali klasifikovať ako slabé/mierne dráždivé alebo chemikálií (látok a zmesí), ktoré by nemali byť klasifikované v kategórií očná dráždivosť (t. j. GHS OSN kategória 2A/2B, resp. bez kategórie; CLP EÚ kategória 2, resp. bez kategórie; US EPA kategórie II/III/IV), ako to vyplýva z validačnej štúdie (3) (7). Táto testovacia metóda sa používa iba v prípade chemikálií (látok a zmesí) rozpustných vo vode. Použitím testovacej metódy FL je možné vo všeobecnosti správne predpovedať potenciál spôsobovať vážne podráždenie očí v prípade chemikálií rozpustných vo vode a/alebo ak toxický účinok nie je ovplyvnený riedením (7). Aby bolo možné charakterizovať chemikáliu ako vo vode rozpustnú v experimentálnych podmienkach, mala by byť rozpustná v sterilnom Hanksovom vyváženom soľnom roztoku (HBSS) s koncentráciou ≥ 250 mg/ml (jedna dávka nad hraničnú hodnotu 100 mg/ml), s obsahom vápnika (pri koncentrácii 1,0 – 1,8 mM) a bez fenolovej červene. Ak je však chemikália rozpustná pri koncentrácii pod 100 mg/ml a pri tejto koncentrácii už spôsobuje 20 % indukciu FL (t. j. FL20 < 100 mg/ml), možno ju stále klasifikovať ako chemikáliu GHS OSN kategórie 1 alebo US EPA kategórie I. Zistené obmedzenia tejto testovacej metódy vylučujú zo sféry jej použitia silné kyseliny a zásady, bunkové fixatíva a vysokoprchavé chemikálie. Tieto chemikálie majú mechanizmy, ktoré sa nemerajú testovacou metódou FL, napr. rozsiahla koagulácia, zmydelnenie alebo špecifické mechanizmy chemickej reaktívnosti. Ostatné zistené obmedzenia tejto testovacej metódy vychádzajú z výsledkov prognostických možností v prípade farebných a viskóznych testovaných chemikálií (7). Predpokladá sa, že oba typy chemikálií sa po krátkodobej expozícii len ťažko odstraňujú z monovrstvy a že prognózy výsledkov tejto testovacej metódy možno vylepšiť zvýšeným počtom použitých cyklov umývania. Chemikálie v tuhej forme rovnomerne rozptýlené v kvapaline majú tendenciu sa vyzrážať, a preto môže byť ťažké stanoviť konečnú koncentráciu v bunkách. Keď sa chemikálie týchto chemických a fyzikálnych tried z databázy vylúčia, presnosť testovacej metódy FL v rámci klasifikačných systémov EÚ, US EPA a GHS OSN sa podstatne zlepší (7). Vzhľadom na účel tejto testovacej metódy (ktorým je identifikovať očné žieraviny/silne dráždivé látky) nie sú miery falošnej negativity (pozri bod 13) rozhodujúce, keďže tieto chemikálie by sa (v závislosti od požiadaviek regulačných orgánov) následne podrobili iným primerane validovaným testom in vitro alebo testom na králikoch použitím stratégie postupného testovania s prihliadnutím na závažnosť dôkazov (5) (pozri tiež body 3 a 4). Ostatné zistené obmedzenia testovacej metódy FL sú založené na miere falošných negatívnych a falošne pozitívnych výsledkov. Ak sa použije ako prvý krok v rámci prístupu zhora nadol s cieľom identifikovať vo vode rozpustné očné žieraviny/silne dráždivé látky a zmesi (GHS OSN kategória 1; CLP EÚ, kategória 1; US EPA kategória I), miera falošnej pozitivity sa v prípade testovacej metódy FL pohybovala od 7 % (7/103; GHS OSN a CLP EÚ) do 9 % (9/99; US EPA) a miera falošnej negativity od 54 % (15/28; US EPA) do 56 % (27/48; GHS OSN a CLP EÚ) v porovnaní s výsledkami in vivo. Chemické skupiny vykazujúce falošné pozitívne a/alebo falošné negatívne výsledky pri testovacej metóde FL tu nie sú definované. Určité technické obmedzenia sú špecifické pre kultúru MDCK buniek. Tesné spoje, ktoré blokujú prechod nátrium-fluoresceinového farbiva monovrstvou, sú čoraz viac oslabované rastúcim počtom bunkových pasáží. Neúplné usporiadanie tesných spojov vedie k zvýšeniu FL v neovplyvnenej kontrole. Preto je dôležité stanoviť najvyššiu prípustnú mieru úniku v neovplyvnených kontrolách (pozri bod 38: 0 % úniku). Pri všetkých testoch in vitro existuje možnosť, že časom dôjde k transformácií buniek, a preto je nevyhnutné stanoviť pri týchto skúškach rozsah počtu pasáží. Existujúce sféry použiteľnosti možno v niektorých prípadoch rozšíriť, ale až po analýze rozšíreného súboru údajov o skúmaných testovaných chemikáliách, najlepšie získaného testovaním (3). Táto testovacia metóda sa bude zodpovedajúcim spôsobom aktualizovať, keďže sa posudzujú nové informácie a údaje. V každom laboratóriu, ktoré prvýkrát túto skúšku zavádza, by sa mali použiť chemikálie na preukázanie spôsobilosti uvedené v dodatku 3. Laboratóriá môžu tieto chemikálie použiť na preukázanie svojej technickej spôsobilosti vykonávať testovaciu metódu FL na účely klasifikácie nebezpečenstva podľa právnych predpisov. PRINCÍP TESTU Testovacia metóda FL je skúška in vitro založená na cytotoxicite a funkcii buniek, ktorá sa vykonáva na súvislej monovsrtve trubicovitých epitelových buniek MDCK CB997 pestovaných na polopriepustných inzertoch a predstavujúcich model stavu epitelu rohovky in vivo bez rozmnožovania. Bunková línia MDCK je stabilná a vytvára tesné a desmozomálne spoje podobné tým, ktoré nájdeme na apikálnej strane epitelov spojivky a rohovky. Tesné a desmozomálne spoje in vivo zabraňujú prenikaniu rozpustených látok a cudzorodých materiálov do epitelu rohovky. Strata medziepitelovej nepriepustnosti z dôvodu poškodenia tesných a desmozomálnych spojov je jedným z prvých príznakov chemicky vyvolaného podráždenia očí. Testovaná chemikália sa aplikuje na súvislú vrstvu buniek pestovaných na apikálnej strane inzertu. Obyčajne sa použije krátka, minútová expozícia, aby sa zohľadnila bežná miera klírensu v prípade ľudskej expozície. Výhodou krátkej expozície je, že látky na báze vody a zmesi je možné testovať čisté, ak sa po expozícii dajú ľahko odstrániť. To umožní priamejšie porovnanie výsledkov s chemickými účinkami na ľudí. Testovaná chemikália sa potom odstráni a netoxické, vysoko fluorescenčné nátrium-fluoresceínové farbivo sa na 30 minút pridá na apikálnu stranu monovrstvy. Poškodenie tesných spojov spôsobené testovanou chemikáliou sa určí podľa množstva fluoresceínu, ktorý unikne vrstvou buniek za určitý vopred stanovený čas. Množstvo nátrium-fluoresceínového farbiva, ktoré prenikne monovrstvou a inzertnou membránou do fixného objemu roztoku v jamke (s únikom nátrium-fluoresceínového farbiva), sa určí spektrofluorometrickým meraním koncentrácie fluoresceínu v jamke. Množstvo uniknutého fluoresceínu (FL) sa vypočíta podľa údajov fluorescenčnej intenzity (FI) odčítaných z dvoch kontrol: zo slepej kontroly a z kontroly s maximálnym únikom. V porovnaní s týmito kontrolami sa potom pre každý súbor koncentrácií testovanej chemikálie vyjadrí percento úniku, a teda rozsah poškodenia. Následne sa vypočíta hodnota FL20 (t. j. koncentrácia, ktorá spôsobí 20 % úniku fluoresceínu v porovnaní s hodnotami zaznamenanými na neovplyvnenej súvislej monovrstve a inzertoch bez buniek). Hodnota FL20 (v mg/ml) sa použije v prognostickom modeli na zisťovanie očných žieravín a silne dráždivých látok (pozri bod 35). Obnoviteľnosť je významnou súčasťou profilu toxicity testovanej chemikálie a takisto sa posudzuje testom podráždenia očí in vivo. Z predbežných analýz vyplynulo, že údaje o obnoviteľnosti (do 72 hodín po expozícii účinkom chemikálie) by mohli zvýšiť prognostický potenciál protokolu 71 INVITTOX, je však potrebné vykonať ďalšie hodnotenie a získať dodatočné údaje, najlepšie ďalším testovaním (6). Táto testovacia metóda sa bude zodpovedajúcim spôsobom aktualizovať, keďže sa posudzujú nové informácie a údaje. POSTUP Príprava bunkovej monovrstvy Monovrstva zložená z buniek MDCK CB997 sa pripraví použitím subkonfluentných buniek pestovaných v kultivačných bankách s DMEM/zmes živín F12 (1x koncentrát s L-glutamínom, 15 mM HEPES, vápnik (v koncentrácii 1,0 – 1,8 mM) a 10 % tepelne inaktivovaný FCS, FBS). Je dôležité poznamenať, že všetky médiá/roztoky používané počas skúšky FL by mali obsahovať vápnik v koncentrácii medzi 1,8 mM (200 mg/l) a 1,0 mM (111 mg/l), aby sa zaručila tvorba a celistvosť tesných spojov. Rozsah počtu bunkových pasáží by sa mal kontrolovať, aby sa zaručila rovnomerná a reprodukovateľná tvorba tesných spojov. Odporúča sa, aby boli bunky v rozmedzí od 3 do 30 pasážovaní po rozmrazení, pretože bunky v tomto rozmedzí pasážovania majú podobnú funkčnosť, čo zvyšuje reprodukovateľnosť výsledkov skúšky. Pred vykonaním testovacej metódy FL sa bunky oddelia od banky trypsinizáciou, centrifugujú sa a primeraný počet buniek sa nasadí do inzertov umiestnených v platničkách s 24 jamkami (pozri dodatok 1). K nasadeniu buniek by sa mali použiť inzerty s priemerom dvanásť mm, s membránou zo zmesi esterov celulózy, s hrúbkou 80 – 150 μm a veľkosťou pórov 0,45 μm. Pri validačnej štúdii boli použité inzerty Millicell-HA 12 mm. Vlastnosti typu inzertu a membrány sú dôležité, pretože môžu ovplyvniť rast buniek a chemické väzby. Určité typy chemikálií sa môžu viazať na inzertnú membránu Millicell-HA, čo môže ovplyvniť interpretáciu výsledkov. Ak sa použijú iné membrány, mali by sa na preukázanie ich rovnocennosti použiť chemikálie na preukázanie spôsobilosti (pozri dodatok 3). Chemické väzby na inzertnú membránu sú bežnejšie v prípade katiónových chemikálií, ako napr. benzalkónium-chlorid, ktoré sú priťahované k nabitej membráne (7). Chemické väzby na inzertnú membránu môže zvyšovať čas chemickej expozície a spôsobiť nadhodnotenie toxického potenciálu chemikálie, no zároveň môžu fyzicky znížiť únik fluoresceínu cez inzert naviazaním farbiva na katiónovú chemikáliu spojenú s inzertnou membránou, čo spôsobí podhodnotenie toxického potenciálu chemikálie. To sa dá ľahko monitorovať vystavením samotnej membrány najvyššej koncentrácii testovanej chemikálie a následne pridaním farbiva s obsahom fluoresceínu sodného pri bežnej koncentrácii na štandardný čas (kontrola bez buniek). Ak dôjde k naviazaniu nátrium-fluoresceínového farbiva, inzertná membrána sa po zmytí testovaného materiálu javí ako žltá. Preto je nevyhnutné poznať väzobné vlastnosti testovanej chemikálie, aby bolo možné interpretovať vplyv chemikálie na bunky. Nasadením buniek do inzertov by sa počas chemickej expozície mala vytvoriť súvislá monovrstva. Do každého inzertu by sa malo pridať 1,6 × 105 buniek (400 μl bunkovej suspenzie s hustotou 4 × 105 buniek/ml). Za týchto podmienok sa súvislá monovrstva v kultúre obyčajne vytvorí po 96 hodinách. Inzerty by sa mali pred nasadením vizuálne skontrolovať tak, aby sa zaručilo, že akékoľvek poškodenie zaznamenané pri vizuálnej kontrole uvedenej v bode 30 bolo spôsobené manipuláciou. Bunkové kultúry MDCK by sa mali uchovávať v inkubátoroch vo zvlhčovanej atmosfére pri 5 % ± 1 % CO2 a 37 ± 1 °C. Bunky by nemali byť kontaminované baktériami, vírusmi, mykoplazmami ani hubami. Aplikácia testovaných a kontrolných chemikálií Pre každú pokusnú skúšku je potrebné pripraviť nový zásobný roztok testovanej chemikálie a použiť ho do 30 minút od prípravy. Testované chemikálie by sa mali pripravovať v HBSS s obsahom vápnika (pri koncentrácii 1,0 – 1,8 mM) a bez fenolovej červene, aby sa zabránilo väzbe proteínov zo séra. Pred testom by sa mala skontrolovať rozpustnosť chemikálie pri 250 mg/ml v HBSS. Ak pri tejto koncentrácii vytvorí chemikália do 30 minút stabilnú suspenziu alebo emulziu (t. j. zostane jednotvárna a neusadí sa ani neoddelí do viac ako jednej fázy), je možné aj naďalej použiť HBSS ako rozpúšťadlo. Ak sa však chemikália pri tejto koncentrácii v HBSS nerozpustí, malo by sa zvážiť použitie iných testovacích metód ako FL. Použitie ľahkého minerálneho oleja ako rozpúšťadla v prípadoch, že sa chemikália v HBSS nerozpustí, by sa malo posudzovať s rezervou, keďže nie je k dispozícii dostatok údajov zaručujúcich výkonnosť skúšky FL v týchto podmienkach. Všetky chemikálie, ktoré sa majú testovať, sa pripravia zo zásobného roztoku v sterilnom HBSS s obsahom vápnika (pri koncentrácii 1,0 – 1,8 mM) a bez fenolovej červene pri piatich fixných hmotnostných koncentráciách: 1, 25, 100,250 mg/ml ako čistý alebo nasýtený roztok. Pri testovaní chemikálií v tuhej forme by sa mala doplniť aj veľmi vysoká koncentrácia 750 mg/ml. Chemikália s touto koncentráciou sa môže aplikovať na bunky pipetou s priamym posunutím. Ak sa zistí toxicita v rozmedzí od 25 do 100 mg/ml, mali by sa dvakrát otestovať tieto dodatočné koncentrácie: 1, 25, 50, 75 a 100 mg/ml. Hodnota FL20 sa odvodí z týchto koncentrácií za predpokladu, že boli splnené kritériá prijateľnosti. Testované chemikálie sa aplikujú na súvislé monovrstvy buniek po odstránení kultivačného bunkového média a dvojnásobnom premytí sterilným, teplým (37 °C) HBSS s obsahom vápnika (pri koncentrácii 1,0 – 1,8 mM) a bez fenolovej červene. Predtým sa vizuálne skontrolovali filtre, aby sa zistili už existujúce poškodenia, ktoré by mohli byť nesprávne pripísané možnej nezlučiteľnosti s testovanými chemikáliami. Pri každom pokuse by sa pri každej koncentrácii testovanej chemikálie a kontrol mali použiť aspoň tri replikáty. Po expozícii trvajúcej 1 minútu pri izbovej teplote by sa testovaná chemikália mala opatrne odstrániť odsatím, monovrstva by sa mala dvakrát premyť sterilným, teplým (37 °C) HBSS s obsahom vápnika (pri koncentrácii 1,0 – 1,8 mM) a bez fenolovej červene a ihneď potom sa zmeria únik fluoresceínu. Pri každom pokuse by sa mali súbežne použiť negatívne (NK) a pozitívne kontroly (PK), aby sa preukázalo, že celistvosť monovrstvy (NK) a citlivosť buniek (PK) sú v rámci stanoveného historického rozpätia prijateľnosti. Chemikália navrhovaná ako PK je Brij 35 (CAS č. 9002-92-0) pri 100 mg/ml. Táto koncentrácia by mala spôsobiť približne 30 % únik fluoresceínu (prijateľný rozsah úniku fluoresceínu 20 – 40 %, t. j. poškodenie bunkovej vrstvy). Chemikália navrhovaná ako NK je HBSS (neovplyvnená, slepá kontrola) s obsahom vápnika (pri koncentrácii 1,0 – 1,8 mM) a bez fenolovej červene. Súčasťou každého pokusu by mala byť aj kontrola s maximálnym únikom, aby bolo možné vypočítať hodnoty FL20. Maximálny únik sa stanoví pomocou kontrolného inzertu bez buniek. Stanovenie priepustnosti fluoresceínu Ihneď po odstránení testovaných a kontrolných chemikálií sa do inzertov (napr. Millicell-HA) pridá 400 μl z 0,1 mg/ml roztoku nátrium-fluoresceínu [0,01 hm. % HBSS s obsahom vápnika (pri koncentrácii 1,0 – 1,8 mM) a bez fenolovej červene]. Kultúry sa nechajú odstáť 30 minút pri izbovej teplote. Na konci inkubácie fluoresceínom sa inzerty opatrne vyberú z každej jamky. Vykoná sa vizuálna kontrola všetkých filtrov a zaznamená sa každé poškodenie, ku ktorému mohlo dôjsť pri manipulácii. V roztoku, ktorý zostal v jamkách po odstránení inzertov, sa vyčísli množstvo fluoresceínu, ktoré uniklo cez monovrstvu a inzert. Spektrofluorimetrom sa vykonajú merania pri excitačnej vlnovej dĺžke 485 nm a emisnej vlnovej dĺžke 530 nm. Citlivosť spektrofluorimetra by sa mala nastaviť tak, aby bol čo najvyšší číselný rozdiel medzi maximálnym FL (inzert bez buniek) a minimálnym FL (inzert so súvislou monovrstvou upravenou NK). Vzhľadom na rozdiely v používaných spektrofluorimetroch sa navrhuje, aby sa použila citlivosť, ktorá poskytne intenzitu fluorescencie > 4 000 pri kontrole s maximálnym únikom fluoresceínu. Maximálna hodnota FL by nemala byť vyššia ako 9 999. Maximálna intenzita úniku fluorescencie by mala byť v lineárnom rozsahu použitého spektrofluorimetra. Interpretácia výsledkov a model prognózy Množstvo FL je úmerné chemicky vyvolanému poškodeniu tesných spojov. Percento FL pri každej testovanej koncentrácii chemikálie sa vypočíta z hodnôt FL získaných v prípade danej testovanej chemikálie s prihliadnutím na hodnoty FL z NK (odčítané zo súvislej monovrstvy buniek upravenej NK) a kontroly s maximálnym únikom (odčítané ako množstvo FL cez inzert bez buniek). Priemerná maximálna intenzita úniku fluorescencie = x Priemerná 0 % intenzita úniku fluorescencie (NK) = y Priemerný 100 % únik sa získa odpočítaním priemerného 0 % úniku od priemerného maximálneho úniku, t. j. x – y = z Percento úniku pre každej fixnej dávke sa získa odpočítaním 0 % úniku od priemernej intenzity fluorescencie z troch meraných replikátov (m) a vydelením tejto hodnoty 100 % únikom, t. j. % FL = [(m – y)/z] × 100 %, kde:
Na výpočet chemickej koncentrácie spôsobujúcej 20 % FL by sa mala použiť táto rovnica: FLD = [(A – B)/(C – B)] × (MC – MB) + MB kde:
Hraničná hodnota FL20 na predpovedanie správania chemikálií ako očných žieravín/silne dráždivých látok je:
Testovacia metóda FL sa odporúča len na účely identifikácie vo vode rozpustných očných žieravín a silne dráždivých látok (GHS OSN kategória 1, EÚ CLP kategória 1 a US EPA kategória I) (pozri body 1 a 10). Aby bolo možné identifikovať vo vode rozpustné chemikálie (látky a zmesi) (3) (6) (7) ako „spôsobujúce vážne poškodenie očí” (GHS OSN/EÚ CLP kategória 1) alebo ako „očná žieravina alebo silne dráždivá látka” (US EPA kategória I), testovaná chemikália by mala vykazovať hodnotu FL20 ≤ 100 mg/ml. Prijateľnosť výsledkov Priemerná maximálna hodnota úniku fluoresceínu (x) by mala byť vyššia ako 4 000 (pozri bod 31), priemerný 0 % únik (y) by mal byť ≤ 300 a priemerná hodnota 100 % úniku (z) by mala byť medzi 3 700 a 6 000. Test sa považuje za prijateľný, ak pozitívna kontrola spôsobila 20 % až 40 % poškodenie bunkovej vrstvy (merané ako % úniku fluoresceínu). ÚDAJE A PREZENTOVANIE VÝSLEDKOV Údaje Pri každom pokuse by sa mali do tabuľky zapísať údaje z jednotlivých jamiek s replikátmi (napr. hodnoty intenzity fluorescencie a vypočítané percentuálne hodnoty FL pre každú testovanú chemikáliu vrátane klasifikácie). Okrem toho je potrebné pri každom pokuse zaznamenať v prípade každého merania replikátov aj priemerné hodnoty ± štandardné odchýlky. Skúšobný protokol Skúšobný protokol by mal obsahovať tieto informácie:
LITERATÚRA
Dodatok 1 ZNÁZORNENIE RASTU MDCK BUNIEK NA INZERTNEJ MEMBRÁNE PRI TESTOVACEJ METÓDE FL Súvislá vrstva MDCK buniek vytvorená na polopriepustnej membráne inzertu. Inzerty sa umiestnia do jamiek 24-jamkových platničiek. 
Obrázok bol prevzatý z: Wilkinson, P.J. (2006), Development of an in vitro model to investigate repeat ocular exposure, Ph.D. dizertačná práca, University of Nottingham, Spojené kráľovstvo. Dodatok 2 DEFINÍCIE Presnosť : miera zhody výsledkov testovacej metódy s akceptovanými referenčnými hodnotami. Týka sa výkonnosti testovacej metódy a jedného z aspektov relevantnosti. Tento pojem sa často používa zameniteľne s pojmom „zhoda“ a označuje podiel správnych výsledkov testovacej metódy. Chemikália : látka alebo zmes. EPA kategória I : chemikálie, ktoré pôsobia ako žieraviny (vyvolávajúce nezvratné poškodenie očného tkaniva), príp. spôsobujú aj postihnutie rohovky alebo podráždenie, ktoré pretrváva viac ako 21 dní (2). EÚ CLP (nariadenie (ES) č. 1272/2008 o klasifikácii, označovaní a balení látok a zmesí): zavádza v Európskej únii (EÚ) systém klasifikácie chemikálií (látok a zmesí) GHS OSN. Miera falošne negatívnych nálezov : podiel všetkých pozitívnych chemikálií, ktoré boli testovacou metódou nesprávne identifikované ako negatívne. Ide o jeden z ukazovateľov výkonnosti testovacej metódy. Miera falošne pozitívnych nálezov : podiel všetkých negatívnych chemikálií, ktoré boli testovacou metódou nesprávne identifikované ako pozitívne. Ide o jeden z ukazovateľov výkonnosti testovacej metódy. FL20 : hodnota, ktorú možno určiť stanovením koncentrácie, pri ktorej testovaná chemikália spôsobí 20 % únik fluoresceínu cez bunkovú vrstvu. Únik fluoresceínu : množstvo fluoresceínu merané spektrofluorometriou, ktoré prejde bunkovou vrstvou. GHS [Globálny harmonizovaný systém klasifikácie a označovania chemikálií Organizáciou Spojených národov (OSN)] : systém, ktorým sa navrhuje klasifikácia chemikálií (látok a zmesí) podľa štandardizovaných typov a miery fyzického, zdravotného a environmentálneho nebezpečenstva a označovania pomocou príslušných komunikačných prvkov, ako sú piktogramy, signalizačné slová, výstražné upozornenia, bezpečnostné upozornenia a karty bezpečnostných údajov, ktoré obsahujú informácie o ich škodlivých účinkoch z hľadiska ochrany ľudí (vrátane zamestnávateľov, pracovníkov, prepravcov, spotrebiteľov a záchranných zložiek) a životného prostredia. GHS kategória 1 : po aplikácii testovanej chemikálie na predný okraj oka spôsobí poškodenie tkaniva v oku alebo závažné fyzické zhoršenie zraku, ktoré nie je úplne zvratné do 21 dní po aplikácii. Nebezpečenstvo (ohrozenie) : inherentná vlastnosť činidla, prípadne situácia, ktorá môže vyvolať nepriaznivé účinky pri expozícii organizmu, systému alebo (sub)populácie účinkom daného činidla. Zmes : v kontexte GHS OSN ako zmes alebo roztok zložený z dvoch alebo viacerých látok, ktoré spolu nereagujú. Negatívna kontrola : neovplyvnený replikát, ktorý obsahuje všetky zložky testovacieho systému. Táto vzorka sa spracuje vzorkami ovplyvnenými testovanou chemikáliou, ako aj inými kontrolami s cieľom zistiť, či rozpúšťadlo a testovací systém na seba navzájom pôsobia. Bez klasifikácie : chemikálie, ktoré nie sú klasifikované v kategóriách 1, 2A alebo 2B GHS OSN, kategóriách 1 alebo 2 EÚ CLP EÚ alebo v kategóriách I, II alebo III US EPA ako látky dráždivé pre oči. Chemikália žieravá pre oči : a) chemikália, ktorá spôsobuje nezvratné poškodenie očného tkaniva; b) chemikálie klasifikované v kategórii 1 GHS OSN, kategórii 1 EÚ CLP alebo v kategórii I US EPA ako látky dráždivé pre oči. Chemikália dráždivá pre oči : a) chemikália, ktorá po aplikácii na predný okraj oka spôsobí v oku zvratnú zmenu; b) chemikálie klasifikované v kategóriách 2A alebo 2B GHS OSN, kategórii 2 EÚ CLP alebo v kategóriách II alebo III US EPA ako látky dráždivé pre oči. Chemikália silne dráždivá pre oči : a) chemikália, ktorá po aplikácii na predný okraj oka spôsobí poškodenie očného tkaniva, ktoré je do 21 dní po aplikácii nezvratné, príp. spôsobí závažné fyzické zhoršenie zraku; b) chemikálie klasifikované v kategórii 1 GHS OSN, kategórii 1 EÚ CLP alebo v kategórii I US EPA ako látky dráždivé pre oči. Pozitívna kontrola : replikát obsahujúci všetky zložky testovacieho systému a ovplyvnený chemikáliou, ktorá bezpečne vyvolá pozitívnu odozvu. Aby bolo možné vyhodnotiť variabilitu odozvy na pozitívnu kontrolu v čase, veľkosť pozitívnej reakcie by nemala byť extrémne silná. Chemikálie na preukázanie spôsobilosti : podsúbor zo zoznamu referenčných chemikálií, ktoré možno použiť na preukázanie spôsobilosti neskúseného laboratória vykonávať validovanú referenčnú testovaciu metódu. Relevantnosť : opis vzťahu testu k účinku, ktorý je predmetom záujmu, a toho, či je tento účinok zmysluplný a užitočný na konkrétny účel. Ide o mieru, do akej test správne meria alebo predpovedá biologický účinok, ktorý je predmetom záujmu. Relevantnosť zohľadňuje presnosť (zhodu) testovacej metódy (8). Spoľahlivosť : meria rozsah, v rámci ktorého sa môže testovacia metóda počas istého časového obdobia reprodukovateľne vykonávať v rámci laboratórií a medzi nimi navzájom, pričom sa používa ten istý protokol. Hodnotí sa vypočítaním vnútrolaboratórnej a medzilaboratórnej reprodukovateľnosti a vnútrolaboratórnej opakovateľnosti. Náhradný test : test navrhnutý ako náhrada za test, ktorý sa bežne používa a je schválený na identifikáciu nebezpečnosti a/alebo hodnotenie rizika a o ktorom sa rozhodlo, že poskytuje rovnakú alebo zvýšenú úroveň ochrany zdravia ľudí alebo zvierat alebo životného prostredia v porovnaní so schváleným testom pre všetky možné testované situácie a chemikálie. Citlivosť : podiel všetkých pozitívnych/aktívnych chemikálií správne klasifikovaných testom. Ide o presnosť testovacej metódy, ktorá poskytuje kategorizačné výsledky a musí sa zohľadniť pri hodnotení relevantnosti testovacej metódy (8). Vážne poškodenie očí : poškodenie očného tkaniva alebo závažné fyzické zhoršenie zraku, ku ktorému dôjde po aplikácii testovanej chemikálie na predný okraj oka, ktoré nie je úplne zvratné do 21 dní po aplikácii. Kontrola s rozpúšťadlom/nosičom : neovplyvnená vzorka, ktorá obsahuje všetky zložky testovacieho systému vrátane rozpúšťadla alebo nosiča, ktorá sa spracuje ovplyvnenou testovanou chemikáliou a inými kontrolami, aby sa zistila základná odozva vzoriek ovplyvnených testovanou chemikáliou rozpustenou v tom istom rozpúšťadle alebo nosiči. Keď sa táto vzorka testuje so súbežnou negatívnou kontrolou, preukáže sa aj to, či rozpúšťadlo alebo nosič a testovací systém na seba navzájom pôsobia. Špecifickosť : podiel všetkých negatívnych/neaktívnych chemikálií správne klasifikovaných testom. Je to miera presnosti testovacej metódy, ktorá poskytuje kategorizačné výsledky. Ide o dôležité hľadisko pri hodnotení relevantnosti testovacej metódy. Látka : v kontexte GHS OSN sa pod látkou rozumejú chemické prvky a ich zlúčeniny v prírodnom stave alebo získané akýmkoľvek výrobným procesom vrátane všetkých prísad potrebných na zachovanie stálosti výrobku, ako aj všetkých nečistôt vznikajúcich pri použitom procese, ale s vylúčením všetkých rozpúšťadiel, ktoré sa môžu oddeliť bez ovplyvnenia stálosti látky alebo zmeny jej zloženia. Testovaná chemikália : akákoľvek látka alebo zmes testovaná touto testovacou metódou. Stratégia viacúrovňového testovania : stratégia postupného testovania, pri ktorej sa všetky existujúce informácie o testovanej chemikálii kontrolujú v určitom poradí analýzou váhy dôkazov na každej z úrovní, pričom sa zisťuje, či je k dispozícii dostatok informácií na rozhodnutie o klasifikácii nebezpečenstva pred prechodom na ďalšiu úroveň. Ak sa dráždivý potenciál testovanej chemikálie môže stanoviť na základe existujúcich informácií, nevyžaduje sa žiadne ďalšie testovanie. Ak dráždivý potenciál testovanej chemikálie nemožno stanoviť na základe existujúcich informácií, vykonáva sa testovanie metódou postupných krokov na zvieratách, až kým sa nedá urobiť jednoznačná klasifikácia. Validovaná testovacia metóda : testovacia metóda, v súvislosti s ktorou sa ukončili validačné štúdie na stanovenie relevantnosti (vrátane presnosti) a spoľahlivosti pre konkrétny účel. Je dôležité poznamenať, že validovaná testovacia metóda nemusí mať dostatočnú výkonnosť, pokiaľ ide o presnosť a spoľahlivosť, aby bola prijateľná pre navrhovaný účel (8). Analýza váhy dôkazov : proces posudzovania silných a slabých stránok jednotlivých informácií na dosiahnutie a podporu záveru, ktorý sa týka potenciálu nebezpečnosti danej chemikálie. Dodatok 3 CHEMIKÁLIE NA PREUKÁZANIE SPÔSOBILOSTI PRI TESTOVACEJ METÓDE FL Pred rutinným použitím tejto testovacej metódy by mali laboratóriá preukázať technickú spôsobilosť tým, že správne klasifikujú očnú žieravosť v prípade 8 látok odporúčaných v tabuľke 1. Tieto chemikálie boli vybrané tak, aby reprezentovali rozpätie odoziev na lokálne podráždenie/poleptanie oka, ktoré vychádza z výsledkov in vivo testov na očiach králikov [TG 405, TM B.5(5)] (t. j. kategórie 1, 2A, 2B alebo bez klasifikácie podľa GHS OSN). Vzhľadom na validovanú použiteľnosť skúšky FL (t. j. identifikovať výlučne očné žieraviny/silne dráždivé chemikálie) však pri preukazovaní spôsobilosti existujú len dva výsledky testov na účely klasifikácie (je žieravina/silne dráždivá chemikália alebo nie je žieravina/silne dráždivá chemikália). Ďalším kritériom výberu boli parametre ako komerčná dostupnosť chemikálií, dostupnosť kvalitných referenčných údajov in vivo a existencia kvalitných údajov z testovacej metódy FL. Z tohto dôvodu boli chemikálie na preukázanie spôsobilosti vybrané z „Revízneho dokumentu o podrobnostiach skúšky úniku fluoresceínu ako alternatívnej metódy testovania na podráždenie očí (Fluorescein Leakage Assay Background Review Document as an Alternative Method for Eye Irritation Testing)“ (8), ktorý bol retrospektívne použitý na validáciu testovacej metódy FL. Tabuľka 1 Odporúčané chemikálie na preukázanie technickej spôsobilosti pri skúške FL
B.62 Alkalický kométový test in vivo u cicavcov ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 489 (2016). Alkalický kométový test (jednobunková gélová elektroforéza) in vivo (ďalej len „kométový test“) sa používa na zistenie zlomov v reťazcoch DNA buniek alebo jadier izolovaných z viacerých živočíšnych tkanív, prevažne tkanív hlodavcov, ktoré boli vystavené účinkom potenciálne genotoxického materiálu, resp. materiálov. Kométový test bol podrobený revízii a svoje odporúčania k nemu uverejnili viaceré expertné skupiny (1) (2) (3) (4) (5) (6) (7) (8) (9) (10). Táto testovacia metóda je súčasťou série testovacích metód týkajúcich sa genetickej toxikológie. Existuje dokument OECD, ktorý poskytuje stručné informácie o testovaní genotoxicity, ako aj prehľad nedávnych zmien, ktoré boli urobené v spomínanom usmernení na vykonávanie testov (11). Účelom kométového testu je identifikovať chemikálie, ktoré poškodzujú DNA. V alkalickom prostredí (> pH 13) umožňuje kométový test odhaliť jedno- a dvojvláknové zlomy, ktoré sú napr. výsledkom priamych interakcií s DNA, alkalicky labilné miesta alebo následok prechodných zlomov v reťazcoch DNA spôsobených excíznou opravou DNA. Tieto zlomy môžu byť opravené bez trvalých následkov, môžu byť pre bunky smrteľné alebo môžu priamo súvisieť s mutáciou a spôsobiť trvalé zmeny. Zároveň môžu viesť k chromozomálnym poruchám, ktoré súvisia s mnohými ľudskými ochoreniami vrátane rakoviny. V rokoch 2006 až 2012 prebehol formálny proces validácie kométového testu in vivo u hlodavcov, ktorý koordinovalo japonské Centrum pre validáciu alternatívnych metód (JaCVAM) v spojení s Európskym centrom pre validáciu alternatívnych metód (ECVAM), Medziagentúrnym koordinačným výborom pre validáciu alternatívnych metód (ICCVAM) a Medziagentúrnym centrom NTP pre hodnotenie alternatívnych toxikologických metód (NICEATM) (12). Táto testovacia metóda obsahuje odporúčaný spôsob použitia, ako aj obmedzenia kométového testu, pričom vychádza zo záverečného protokolu (12) použitého pri validačnej skúške a z ďalších relevantných uverejnených i neuverejnených (interných laboratórnych) údajov. Definície kľúčových pojmov sú uvedené v dodatku 1. Je potrebné poznamenať, že na tento test možno použiť mnoho iných platforiem (preparáty, gélové škvrny, 96-jamkové platne atď.). Pre jednoduchosť sa v celom dokumente uvádza pojem „preparát“, zahŕňa však aj všetky ostatné platformy. ÚVODNÉ ÚVAHY A OBMEDZENIA Kométový test je metóda, ktorou sa merajú zlomy v reťazcoch DNA eukaryotických buniek. Jednotlivé bunky/jadrá vsadené do agarózy na preparáte sa lyzujú čistiacim prostriedkom a vysokou koncentráciou soli. V tejto fáze rozpadu sa bunkové a jadrové membrány vstrebú, čím sa uvoľnia zvinuté slučky DNA – všeobecne nazývané nukleoidy – a fragmenty DNA. Elektroforézou pri vysokom pH sa dosiahnu štruktúry podobné kométam, ktoré je pri správnom fluorescečnom zafarbení možné pozorovať fluorescenčným mikroskopom; fragmenty DNA sa presúvajú smerom od „hlavy“ ku „chvostu“ podľa toho, aké sú veľké, pričom intenzita chvostu kométy v porovnaní s celkovou intenzitou (hlava a chvost) ukazuje rozsah zlomu DNA (13) (14) (15). Alkalický kométový test in vivo je dôležitý najmä z hľadiska posúdenia genotoxického rizika, keďže odozvy pri tomto teste závisia od ADME in vivo (t. j. absorpcie, distribúcie, metabolizmu a exkrécie), ako aj od opravných procesov v DNA. Tieto sa môžu medzi jednotlivými druhmi, jednotlivými tkanivami a typmi poškodenia DNA líšiť. V snahe splniť požiadavky na dobré životné podmienky zvierat, zvlášť pokiaľ ide o obmedzenie používania zvierat (3 zásady „nahradiť, obmedziť a zjemniť“), je možné tento test zahrnúť aj do iných toxikologických štúdií napr. štúdií toxicity po opakovaných dávkach (10) (16) (17), alebo skombinovať sledovaný parameter s inými sledovanými genotoxickými parametrami ako napr. s in vivo skúškou mikrojadier erytrocytov na cicavcoch (18) (19) (20). Kométový test sa najčastejšie vykonáva na hlodavcoch, hoci bol použitý aj v prípade iných druhov cicavcov a necicavcov. Použitie iného druhu ako hlodavcov treba v jednotlivých prípadoch vedecky a eticky zdôvodniť, pričom sa dôrazne odporúča vykonávať kométový test na nehlodavcoch iba vtedy, ak je súčasťou inej toxikologickej štúdie, a nie samostatným testom. Výber spôsobu expozície a tkaniva, resp. tkanív, ktoré sa majú skúmať, by sa mal stanoviť na základe všetkých dostupných/existujúcich poznatkov o testovanej chemikálii, napr. zamýšľaný/očakávaný spôsob expozície u ľudí, metabolizmus a distribúcia, potenciál vyvolať účinky v mieste kontaktu, štrukturálne riziká, iné údaje o genotoxicite alebo toxicite a účel štúdie. Preto je prípadne možné analyzovať genotoxický potenciál testovaných chemikálií v cieľovom tkanive, resp. tkanivách s karcinogénnymi a/alebo inými toxickými účinkami. Tento test sa považuje za užitočný aj pri ďalšom skúmaní genotoxicity zistenej systémom in vitro. Kométový test in vivo je vhodné vykonávať na skúmanom tkanive v prípade, že možno odôvodnene predpokladať adekvátnu expozíciu skúmaného tkaniva. Tento test bol v doposiaľ najväčšom rozsahu validovaný v somatických tkanivách potkaních samcov kolaboratívnymi štúdiami napr. skúškou JaCVAM (12) a štúdiou Rothfuss et al., 2010 (10). Pri medzinárodnej validačnej skúške JaCVAM sa použili pečeň a žalúdok. Pečeň preto, že ide o najaktívnejší orgán pri metabolizme chemikálií a často aj cieľový orgán karcinogenity. Žalúdok preto, že je po orálnej expozícii obyčajne prvým miestom kontaktu s chemikáliami, hoci za kontaktné tkanivá možno považovať aj iné oblasti gastrointestinálneho traktu, ako napríklad dvanástnik alebo lačník, ktoré sú relevantnejšie pre ľudí ako žľaznatý žalúdok hlodavcov. Treba však dbať na to, aby tieto tkanivá neboli vystavené nadmerne vysokým koncentráciám testovanej chemikálie (21). Túto techniku možno v zásade použiť v prípade akýchkoľvek tkanív, z ktorých sa dajú získať analyzovateľné jednobunkové/jadrové suspenzie. Interné údaje z viacerých laboratórií preukázali jej úspešnú použiteľnosť v prípade mnohých iných tkanív, pričom existuje množstvo publikácií, ktoré potvrdzujú použiteľnosť tejto techniky aj na iné orgány alebo tkanivá ako pečeň a žalúdok, napr. na lačník (22), obličky (23) (24), pokožku (25) (26), močový mechúr (27), (28), pľúca a bunky bronchoalveolárnej laváže (vhodné v prípade štúdií inhalovaných chemikálií) (29) (30), ako aj existenciu skúšok vykonaných na viacerých orgánoch (31) (32). Napriek záujmu skúmať aj genotoxické účinky v zárodočných bunkách treba poznamenať, že štandardný alkalický kométový test opísaný v tejto testovacej metóde sa nepovažuje za vhodný na meranie zlomov v reťazcoch DNA zrelých zárodočných buniek. Keďže v odbornej literatúre týkajúcej sa použitia kométového testu na skúmanie genotoxoticity v zárodočných bunkách (33) sa uvádzajú vysoké a premenlivé pozaďové úrovne poškodenia DNA, pred zaradením kométového testu zrelých zárodočných buniek do tejto testovacej metódy sa za nevyhnutné považujú zmeny v protokole spolu so spresnením normalizačných a validačných štúdií. Navyše odporúčaný režim expozície opísaný v tejto testovacej metóde nie je optimálny a na zaručenie zmysluplnej analýzy zlomov v reťazcoch DNA zrelej spermie by si vyžadoval dlhšie expozície alebo časy odberu vzoriek. Genotoxické účinky merané kométovým testom v bunkách semenníkov v rôznych fázach ich diferenciácie boli už v odbornej literatúre opísané (34) (35). Napriek tomu treba poznamenať, že pohlavná žľaza obsahuje zmes somatických a zárodočných buniek. Preto pozitívne výsledky v celej pohlavnej žľaze (semenníku) nemusia nevyhnutne vyplývať z poškodenia zárodočných buniek, hoci dokazujú, že testovaná chemikália, resp. chemikálie a/alebo ich metabolity sa dostali do pohlavnej žľazy. Pri štandardných experimentálnych podmienkach kométového testu nie je možné spoľahlivo zistiť medzireťazcové krížne väzby. Ak sa však experimentálne podmienky určitým spôsobom upravia, umožní to zistiť medzireťazcové krížne väzby DNA-DNA a DNA-proteín, ako aj iné bázické zmeny napr. oxidované bázy (23) (36) (37) (38) (39). Adekvátna charakterizácia nevyhnutných zmien v protokole si však ešte vyžaduje ďalšie úsilie. Preto detekcia agensov spôsobujúcich medzireťazcové krížne väzby nie je primárnym účelom testu tak, ako je tu opísaný. Tento test nie je ani po úpravách vhodný na detekciu aneugénov. Podľa súčasných poznatkov je v súvislosti s kométovým testom in vivo známych niekoľko ďalších obmedzení (pozri dodatok 3). Očakáva sa, že v budúcnosti dôjde k revízii tejto testovacej metódy, pri ktorej budú prípadne zohľadnené aj získané skúsenosti. Pred použitím tejto testovacej metódy na zmesi s cieľom generovania údajov plánovaných na regulačné účely by sa malo zvážiť, či môže poskytnúť adekvátne výsledky na tento účel a ak áno, tak prečo. Takéto úvahy nie sú potrebné v prípade, že existuje regulačná požiadavka na testovanie zmesi. PRINCÍP METÓDY Zvieratá sú vystavené účinkom testovanej chemikálie príslušným spôsobom (cestou). Podrobný opis dávkovania a odberu vzoriek je uvedený v bodoch 36 až 40. Vo vybranom čase, resp. časoch odberu vzoriek sa skúmané tkanivá rezom oddelia a pripravia jednobunkové/jadrové suspenzie (v prípade potreby, napr. ak ide o pečeň, je možné vykonať perfúziu in situ), ktoré sa vsadia do mäkkého agaru, aby sa na preparátoch znehybnili. Bunky/jadrá sa upravia lyzačným tlmivým roztokom, aby sa odstránila bunková a/alebo jadrová membrána a vystavia sa pôsobeniu silnej zásady napr. s pH ≥ 13 s cieľom rozpliesť DNA a uvoľniť voľné slučky a fragmenty DNA. DNA jadra v agare sa potom podrobí elektroforéze. Normálne nefragmentované molekuly DNA zostanú na mieste, v ktorom bola DNA jadra v agare, pričom všetky fragmenty DNA a voľné slučky DNA migrujú k anóde. Po elektroforéze sa DNA zobrazí použitím vhodného fluorescenčného zafarbenia. Prípravky by sa mali analyzovať mikroskopom a plnoautomatizovanými alebo poloautomatizovanými systémami analýzy obrazu. Rozsah migrácie DNA počas elektroforézy, ako aj jej dĺžka odrážajú množstvo a veľkosť fragmentov DNA. V kométovom teste je niekoľko sledovaných parametrov. Na posúdenie poškodenia DNA sa odporúča obsah DNA na chvoste (% chvostovej DNA alebo % hustoty na chvoste)(12) (40) (41) (42). Po analýze dostatočného počtu jadier sa údaje analyzujú vhodnými metódami, aby sa posúdili výsledky testu. Treba poznamenať, že možnosti zmeny jednotlivých aspektov metodiky vrátane prípravy vzoriek, podmienok elektroforézy, parametrov vizuálnej analýzy (napr. intenzita zafarbenia, svetelná intenzita žiarovky mikroskopu a použitie mikroskopických filtrov a rozlišovacích schopností kamery) a podmienok okolia (napr. osvetlenie pozadia) boli predmetom skúmania a môžu ovplyvňovať migráciu DNA (43) (44) (45) (46). OVEROVANIE ODBORNEJ SPÔSOBILOSTI LABORATÓRIA Každé laboratórium by malo svoje experimentálne schopnosti na vykonanie kométového testu preukázať tým, že z každého cieľového tkaniva, resp. tkanív každého z použitých druhov dokáže získať jednobunkové alebo jadrové suspenzie dostatočnej kvality. Kvalita prípravkov sa najskôr hodnotí % chvostovej DNA na zvieratách ovplyvnených nosičom, ktoré patria do nižšieho rozsahu reprodukovateľnosti. Súčasné údaje naznačujú, že priemer skupiny, pokiaľ ide o % chvostovej DNA (na základe priemeru mediánov – pozri bod 57, v ktorom sú tieto pojmy vysvetlené) v pečeni potkanov, by nemal podľa možnosti prekročiť 6 %, čo by bolo v súlade s hodnotami z validačnej skúšky JaCVAM (12), ako aj z iných uverejnených a interných údajov. V súčasnosti neexistuje dostatočné množstvo údajov na to, aby bolo možné odporúčať optimálne alebo prijateľné rozpätia aj pre ďalšie tkanivá. To však nevylučuje použitie iných tkanív, ak je toto použitie opodstatnené. V skúšobnom protokole by malo byť uvedené hodnotenie výkonnosti kométového testu v týchto tkanivách v porovnaní s publikovanou odbornou literatúrou alebo na základe interných údajov. Po prvé, je vhodné, aby bolo % chvostovej DNA v kontrolách nízke, aby sa dosiahlo dostatočne dynamické rozpätie na detekciu pozitívneho účinku. Po druhé, každé laboratórium by malo byť schopné reprodukovať očakávané odpovede na priame mutagény a promutagény, a to s rôznymi spôsobmi účinku uvedenými v tabuľke 1 (bod 29). Ak je to vhodné, môžu sa po odôvodnení a preukázaní jednoznačne pozitívnych odoziev v skúmaných tkanivách zvoliť pozitívne látky napr. z validačnej skúšky JaCVAM (12) alebo z iných uverejnených údajov (pozri bod 9). Preukázať by sa mala aj schopnosť detekcie slabých účinkov známych mutagénov, napr. EMS pri malých dávkach, napríklad dosiahnutím vzťahov medzi dávkou a odozvou s príslušnými číslami a intervalmi medzi dávkami. Počiatočné úsilie by malo byť zamerané na získanie odbornej spôsobilosti v prípade najčastejšie používaných tkanív, napr. pečene hlodavcov, kde možno porovnávať s existujúcimi údajmi a očakávanými výsledkami (12). Zároveň je možné získať údaje aj z iných tkanív, napr. žalúdka/dvanástnika/lačníka, krvi atď. Laboratórium musí preukázať odbornú spôsobilosť pri každom individuálnom tkanive a každom druhu, ktorý plánuje skúmať a bude musieť preukázať, že v danom tkanive dokáže získať prijateľnú pozitívnu reakciu so známym mutagénom (napr. EMS). Údaje z nosiča/negatívnej kontroly by sa mali zozbierať preto, aby sa preukázala reprodukovateľnosť odoziev s negatívnymi údajmi a zaručila riadna kontrola technických aspektov, prípadne aby sa navrhla potreba nanovo stanoviť rozsahy historických kontrol (pozri bod 22). Treba poznamenať, že napriek možnosti pitevného odberu viacerých tkanív a ich spracovania na účely kométovej analýzy musí byť laboratórium schopné získať viacero tkanív z jedného zvieraťa, a tým zaručiť, že sa nestratí žiadna z možných lézií DNA, a teda nedôjde k spochybneniu výsledkov kométovej analýzy. Čas medzi usmrtením a odobratím tkanív na spracovanie môže byť rozhodujúci (pozri bod 44). Pri získavaní odbornej spôsobilosti na výkon tohto testu treba dbať na dobré životné podmienky zvierat, a preto je po nadobudnutí zručností vo viacerých aspektoch testu možné používať aj tkanivá zo zvierat použitých na iné testy. V jednotlivých fázach zavádzania novej testovacej metódy v laboratóriu navyše nemusí byť potrebné vykonávať kompletnú štúdiu, preto na nadobudnutie potrebných zručností bude stačiť menej zvierat alebo testovaných koncentrácií. Údaje o historických kontrolách Počas skúmania odbornej spôsobilosti by si laboratórium malo vybudovať historickú databázu, aby mohlo stanoviť rozsahy pozitívnych a negatívnych kontrol a distribúciu príslušných tkanív a druhov. Odporúčania na ukladanie a využívanie historických údajov (t. j. kritériá zaradenia a vylúčenia údajov do/z historických údajov a kritériá prijateľnosti pri danom pokuse) možno nájsť v literatúre (47). Rôzne tkanivá a rôzne druhy, ako aj rôzne nosiče a spôsoby podania môžu poskytovať iné hodnoty % chvostovej DNA získanej z negatívnej kontroly. Preto je dôležité stanoviť rozpätia negatívnych kontrol pre každé tkanivo a každý druh. Laboratóriá by mali používať metódy kontroly kvality, ako sú regulačné diagramy [napr. C-diagramy alebo diagramy Xbar (48)], aby zistili, do akej miery sú ich údaje variabilné a preukázali, že vo svojom laboratóriu majú danú metodiku „pod kontrolou“. Na účely detekcie slabých účinkov (pozri bod 17) môže byť potrebné optimalizovať výber látok vhodných na pozitívne kontroly, rozsahy dávok a experimentálne podmienky (napr. podmienky elektroforézy). Všetky zmeny v skúšobnom protokole by sa mali zvážiť z hľadiska ich súladu s existujúcimi databázami historických kontrol laboratória. Každý výrazný nesúlad by mal viesť k vytvoreniu novej databázy historických kontrol. OPIS METÓDY Prípravky Výber druhov zvierat Bežne sa používajú známe laboratórne rody mladých zdravých dospelých hlodavcov (vo veku 6 až 10 týždňov na začiatku testovania, hoci prijateľné sú aj o niečo staršie zvieratá). Výber druhu hlodavcov by mal byť založený na i) druhoch používaných pri iných štúdiách toxicity (aby bolo možné údaje prepojiť a vykonávať integrované štúdie), ii) druhoch, u ktorých sa počas štúdie karcinogenity objavil nádor (pri skúmaní mechanizmu karcinogenézy) alebo iii) druhoch s metabolizmom najviac podobným metabolizmu ľudí, ak sú známe. Najčastejšie sa pri tomto teste používajú potkany. Môžu sa však použiť aj iné druhy, ak je ich použitie eticky a vedecky opodstatnené. Podmienky umiestnenia a kŕmenia zvierat V prípade hlodavcov by ideálna teplota miestnosti pre pokusné zvieratá mala byť 22 °C (± 3 °C). Relatívna vlhkosť by mala byť v ideálnom prípade 50 – 60 %, minimálne 30 % a najlepšie nie viac ako 70 %, s výnimkou času čistenia miestnosti. Osvetlenie by malo byť umelé a malo by sa striedať 12 hodín svetla a 12 hodín tmy. Na kŕmenie sa môže používať bežné laboratórne krmivo s neobmedzenou dodávkou pitnej vody. Výber krmiva môže byť ovplyvnený potrebou zabezpečiť vhodnú prímes testovanej chemikálie, keď sa podáva týmto spôsobom. Hlodavce by mali byť umiestnené v malých skupinách (zvyčajne najviac po päť) rovnakého pohlavia, pokiaľ sa nepredpokladá agresívne správanie. Zvieratá môžu byť umiestnené samostatne len vtedy, ak je to vedecky opodstatnené. Pokiaľ je to možné, mali by sa používať pevné podlahy, pretože podlahy z drôteného pletiva môžu spôsobiť vážne poranenia (49). Zvieratá musia mať zabezpečené vhodne stimulujúce prostredie. Príprava zvierat Zvieratá sa náhodne rozdelia do kontrolných a testovaných skupín. Označia sa jedinečným identifikátorom a najmenej päť dní pred začiatkom testu sa nechajú aklimatizovať na laboratórne podmienky. Na označenie zvierat jedinečným identifikátorom treba použiť tú najmenej invazívnu metódu. Medzi vhodné metódy označenia patria krúžky, visačky, mikročipy a biometrická identifikácia. Odsekávanie prstov a prepichovanie uší sa v týchto testoch nepovažuje za vedecky opodstatnené. Klietky sa usporiadajú tak, aby sa minimalizovali prípadné následky vyplývajúce z umiestnenia klietok. Na začiatku štúdie by mala hmotnosť zvierat kolísať len minimálne a nemala by presiahnuť ± 20 %. Príprava dávok Testované chemikálie v tuhej forme by sa pred podaním zvieratám mali rozpustiť alebo rozptýliť vo vhodných nosičoch alebo primiešať do krmiva či pitnej vody. Kvapalné testované chemikálie sa môžu podávať priamo alebo rozriedené pred podávaním. V prípade inhalačných expozícií sa testované chemikálie môžu v závislosti od svojich fyzikálnochemických vlastností podávať ako plyn, výpary alebo tuhé/kvapalné aerosóly (50) (51). Ak údaje o stabilite nepreukazujú prijateľnosť uskladnenia a nestanovujú vhodné podmienky skladovania, mali by sa používať čerstvo pripravené testované chemikálie. Podmienky testu Nosič Nosič by nemal vyvolávať toxické účinky v používaných objemoch dávok a nemali by chemicky reagovať s testovanými chemikáliami. Ak sa používajú iné ako dobre známe nosiče, ich použitie by malo byť podporené referenčnými údajmi, ktoré poukazujú na ich kompatibilitu, pokiaľ ide o testované zvieratá, spôsoby podania dávky a sledovaný parameter. Vždy, keď to je možné, odporúča sa najprv zvážiť použitie vodného rozpúšťadla/nosiča. Treba poznamenať, že niektoré nosiče (najmä tie viskózne) môžu vyvolať zápal a zvýšiť tak pozaďové úrovne zlomov v reťazcoch DNA v mieste kontaktu, najmä pri viacnásobnom podaní. Kontroly Pozitívne kontroly V tejto chvíli by sa obyčajne mala do testu zahrnúť skupina minimálne 3 analyzovateľných zvierat jedného pohlavia alebo v prípade použitia oboch pohlaví aj druhého pohlavia (pozri bod 32), ovplyvnených látkou na pozitívnu kontrolu. V budúcnosti možno bude reálne preukázať primeranú odbornú spôsobilosť na zníženie potreby pozitívnych kontrol. V prípade viacerých časov odberu vzoriek (napr. s jediným administratívnym protokolom) stačí pozitívne kontroly zahrnúť iba do jedného z časov odberu, treba však zabezpečiť vyváženosť (pozri bod 48). Súbežne podávané látky na pozitívnu kontrolu nemusia byť podané rovnakou cestou ako testovaná chemikália, je však dôležité, aby sa pri meraní účinkov v mieste kontaktu použila rovnaká cesta. Látky na pozitívnu kontrolu by mali vyvolať zlomy v reťazcoch DNA všetkých skúmaných tkanív v prípade testovanej chemikálie, pričom je pravdepodobné, že zvolenou pozitívnou kontrolou bude mutagén EMS, ktorý spôsobil zlomy v reťazcoch DNA všetkých tkanív, ktoré boli predmetom výskumu. Dávky látok na pozitívnu kontrolu by sa mali zvoliť tak, aby spôsobovali mierne účinky, ktoré umožnia kriticky zhodnotiť výkonnosť a citlivosť testu, a mohli by vychádzať z kriviek závislosti odozvy od dávky stanovených laboratóriom na účely preukázania odbornej spôsobilosti. % chvostovej DNA u súbežných zvierat určených na pozitívnu kontrolu by mali byť v súlade s rozpätím vopred stanoveným laboratórnom pre každé jedno tkanivo a čas odberu vzoriek pri daných druhoch (pozri bod 16). Príklady látok na pozitívnu kontrolu a niektorých ich cieľových tkanív ( u hlodavcov) sú uvedené v tabuľke 1. Vo vedecky opodstatnenom prípade sa môžu zvoliť (aj) iné látky ako tie, ktoré sú uvedené v tabuľke 1. Tabuľka 1 Príklady látok na pozitívnu kontrolu a niektorých ich cieľových tkanív Látky a čísla v registri CAS etyl-metánsulfonát (CAS č. 62-50-0) pre všetky tkanivá etyl-nitrózomočovina (CAS č. 759-73-9) v prípade pečene a žalúdka, dvanástnika alebo lačníka metyl-metánsulfonát (CAS č. 66-27-3) v prípade pečene, žalúdka, dvanástnika alebo lačníka, buniek pľúcnej a bronchoalveolárnej laváže (BAL), obličiek, močového mechúra, pľúc, semenníkov a kostnej drene/krvi N-metyl-N′-nitro-N-nitrózoguanidín (CAS č. 70-25-7) v prípade žalúdka, dvanástnika alebo lačníka 1,2-dimetylhydrazín, dihydrochlorid (CAS č. 306-37-6) v prípade pečene a čriev N-metyl-N-nitrózomočovina (CAS č. 684-93-5) v prípade pečene, kostnej drene, krvi, obličiek, žalúdka, lačníka a mozgu. Negatívne kontroly Súčasťou každého testu by pri každom čase odberu vzoriek a každom tkanive mala byť skupina zvierat určených na negatívnu kontrolu, ovplyvnených iba nosičom a inak ovplyvnených rovnakým spôsobom ako pokusné skupiny. Percento chvostovej DNA by v prípade zvierat určených na negatívnu kontrolu malo byť v rozsahu pozaďových hodnôt, ktoré laboratórium vopred stanovilo pre každé jedno tkanivo a čas odberu vzoriek u daných druhov (pozri bod 16). Ak neexistujú historické alebo publikované kontrolné údaje, ktoré by preukazovali vyvolanie škodlivých alebo genotoxických účinkov zvoleným nosičom, počtom podaní látky alebo cestou jej podania, mali by sa pred vykonaním úplnej štúdie realizovať prvotné štúdie, ktoré umožnia stanoviť prijateľnosť kontroly s nosičom. POSTUP Počet zvierat a ich pohlavie Hoci je len málo údajov o zvieratách samičieho pohlavia, z ktorých by sa dalo urobiť porovnanie medzi pohlaviami z hľadiska kométového testu, vo všeobecnosti platí, že iné genotoxické odozvy in vivo sú medzi samcami a samicami podobné, a preto je možné väčšinu štúdií vykonávať na oboch pohlaviach. Údaje dokazujúce príslušné rozdiely medzi samcami a samicami (napr. rozdiely v systémovej toxicite, metabolizme, biodostupnosti atď. vrátane napr. štúdie na zistenie rozsahu) hovoria v prospech používania oboch pohlaví. V tomto prípade môže byť vhodné vykonať štúdiu na oboch pohlaviach, napr. ako súčasť štúdie toxicity po opakovaných dávkach. Ak sa použijú obe pohlavia, mohlo by byť vhodné využiť plánovanie pokusov. Podrobnosti o analýze údajov použitím tohto plánovania sú uvedené v dodatku 2. Mali by sa stanoviť veľkosti skupín na začiatku štúdie (a počas získavania odbornej spôsobilosti) s cieľom dosiahnuť minimálne 5 analyzovateľných zvierat jedného pohlavia alebo v prípade použitia oboch pohlaví každého pohlavia, na skupinu (menej v prípade súbežnej pozitívnej kontrolnej skupiny – pozri bod 29). Ak sa vystavenie ľudí chemikáliám môže viazať na pohlavie, ako napríklad pri niektorých farmaceutikách, mal by sa test vykonať na príslušnom pohlaví. Ako pomôcku týkajúcu sa maximálnych typických požiadaviek na zvieratá možno uviesť, že štúdia realizovaná v súlade s parametrami stanovenými v bode 33 s tromi skupinami dávok a súbežnými negatívnymi a pozitívnymi kontrolami (každá skupina zložená z piatich zvierat jedného pohlavia) by si vyžadovala okolo 25 až 35 zvierat. HARMONOGRAM OVPLYVŇOVANIA Zvieratá by mali byť ovplyvnené každý deň v trvaní 2 alebo viac dní (t. j. približne dve alebo viac ošetrení v približne 24-hodinových intervaloch), pričom vzorky sa odoberú raz za 2 – 6 hodín (alebo za Tmax) po poslednom ovplyvnení (12). Akceptujú sa aj vzorky z predĺžených dávkovacích režimov (napr. 28-dňové každodenné dávkovanie). Bola preukázaná úspešná kombinácia kométovej analýzy s testom mikrojadier erytrocytov (10) (19). Dôkladnú pozornosť však treba venovať logistike odberu vzoriek tkanív na účely kométovej analýzy, ako aj požiadavkám na odber vzoriek tkanív na iné typy toxikologických hodnotení. Odber 24 hodín po poslednej dávke, ktorý je typický pre všeobecné štúdie toxicity, nie je vo väčšine prípadov vhodný (pozri bod 40 o čase odberu vzoriek). Použitie iných harmonogramov ovplyvňovania a odberu vzoriek by sa malo zdôvodniť (pozri dodatok 3). Napríklad je možné použiť jedno ovplyvnenie s viacerými odbermi vzoriek, treba však poznamenať, že štúdia s jedným podaním látky si vyžiada viac zvierat, pretože bude potrebných niekoľko časov odberu vzoriek, hoci v niektorých prípadoch to môže byť tá preferovanješia voľba, napr. ak testovaná chemikália po opakovaných podaniach vyvolá nadmernú toxicitu. Bez ohľadu na spôsob vykonania testu sa považuje za prijateľné, ak testovaná chemikália vykazuje pozitívnu odozvu, alebo ak sa v prípade negatívnej štúdie získajú priame alebo nepriame dôkazy podporujúce expozíciu cieľového tkaniva, resp. tkanív, alebo ich toxicitu, prípadne ak sa dosiahne limitná dávka (pozri bod 36). Aby sa uľahčilo podanie veľkého objemu látky, môžu byť testované chemikálie podávané aj v rozdelených dávkach, t. j. dve ovplyvnenia v jeden deň, medzi ktorými neuplynú viac ako 2 až 3 hodiny. Za týchto okolností by sa mal čas odberu vzoriek naplánovať podľa času podania poslednej dávky (pozri bod 40). Úrovne dávok Ak sa vykoná predbežná štúdia na zistenie rozsahu dávky z dôvodu nedostatku adekvátnych údajov dostupných z iných relevantných štúdií, ktoré by pomohli pri výbere dávky, mala by sa vykonať v tom istom laboratóriu použitím toho istého druhu, rodu, pohlavia a tej istej dávkovacej schémy ako v hlavnej štúdii a podľa súčasných prístupov k vykonávaniu štúdie na zistenie rozsahu dávky. Takáto štúdia by sa mala zamerať na identifikáciu maximálnej tolerovanej dávky (MTD) definovanej ako dávka, ktorá v porovnaní s časom trvania štúdie vyvolá mierne toxické účinky (napr. jasné klinické príznaky, ako napríklad nezvyčajné správanie alebo reakcie, mierny úbytok alebo cytotoxicita v cieľovom tkanive), nie však smrť alebo známky bolesti, utrpenia, príp. ťažkosti, ktoré si vyžiadajú usmrtenie. V prípade netoxických testovaných chemikálií, ktoré sú podávané po 14 dňoch, príp. ešte neskôr, je maximálna (limitná) dávka 1 000 mg/kg telesnej hmotnosti/deň. V prípade časov podania kratších ako 14 dní je maximálna (limitná) dávka 2 000 mg/kg telesnej hmotnosti/deň. V prípade určitých typov testovaných chemikálií (napr. farmaceutiká na humánne použitie ), ktoré sa riadia osobitnými predpismi, sa môžu tieto limity líšiť. Chemikálie vykazujúce saturáciu toxikokinetických vlastností alebo vyvolávajúce detoxifikačné procesy, ktoré môžu viesť k zníženiu expozície po dlhodobom podávaní, môžu byť výnimkami z kritérií stanovovania dávok a mali by sa hodnotiť jednotlivo. Tak v prípade akútnej, ako aj subakútnej verzie kométového testu by sa okrem maximálnej dávky (MTD – maximálna možná dávka, maximálna expozícia alebo limitná dávka) mala na účely preukázania závislosti odoziev od dávky pre každý čas odberu vzoriek zvoliť klesajúca postupnosť najmenej dvoch dodatočných úrovní dávok s primeraným odstupom (najlepšie oddelených menej ako √10). Prednostne by však použité úrovne dávok mali pokrývať rozsah od maximálnej po malú, resp. žiadnu toxicitu. Ak sa v cieľovom tkanive objavia známky toxicity pri všetkých testovaných úrovniach dávok, odporúča sa vykonať ďalšiu štúdiu s netoxickými dávkami (pozri body 54 – 55). Štúdie, ktoré majú podrobnejšie preskúmať tvar krivky závislosti odozvy od dávky, si môžu vyžadovať dodatočnú skupinu, resp. skupiny dávok. Podávanie dávok Pri plánovaní testu by sa mal zvážiť predpokladaný spôsob expozície ľudí. Preto sa za opodstatnené považuje zvoliť spôsoby vystavenia ako jedlom, pitnou vodou, podkožne, intravenózne, orálne (sondou), inhaláciou, intratracheálne alebo implantáciou. V každom prípade by sa mal zvoliť taký spôsob, ktorým sa zaručí adekvátna expozícia cieľového tkaniva, resp. tkanív. Intraperitoneálna injekcia sa vo všeobecnosti neodporúča, keďže nejde o typický spôsob expozície ľudí, a preto by sa mala použiť iba v konkrétnych odôvodnených prípadoch (napr. ak ide o látky na pozitívne kontroly, na výskumné účely, alebo o lieky, ktoré sú podávané intraperitoneálne). Maximálny objem kvapaliny, ktorá sa môže naraz podávať sondou alebo injekciou, závisí od veľkosti pokusného zvieraťa. Objem nemá byť vyšší ako 1 ml/100 g telesnej hmotnosti, okrem vodných roztokov, keď sa môže použiť 2 ml/100 g telesnej hmotnosti. Požitie väčších objemov ako uvedený objem (pokiaľ to dovoľujú predpisy o dobrých životných podmienkach zvierat) by sa malo zdôvodniť. Všade, kde je to možné, by sa mali dosiahnuť rôzne úrovne dávok, a to upravením koncentrácie v zložení dávky, aby sa pri všetkých úrovniach dávok zabezpečil konštantný objem v pomere k telesnej hmotnosti. Čas odberu vzoriek Čas odberu vzoriek je kritickou premennou, pretože je určený obdobím potrebným na dosiahnutie maximálnej koncentrácie testovanej chemikálie v cieľovom tkanive a vyvolanie zlomov v reťazcoch DNA, avšak skôr, ako sa tieto zlomy odstránia, opravia alebo spôsobia bunkovú smrť. Výskyt niektorých lézií, ktoré spôsobili zlomy v reťazcoch DNA zistené kométovým testom, môže mať veľmi krátke trvanie, a to aspoň v prípade niektorých chemikálií testovaných in vitro (52) (53). Preto by sa v prípade, že sa takéto prechodné lézie DNA objavia, mali prijať opatrenia na zmiernenie ich straty tým, že sa zabezpečí, aby sa odber vzoriek z tkanív vykonal v dostatočnom predstihu, pokiaľ možno skôr, ako nastanú štandardné časy uvedené nižšie. Optimálny čas, resp. časy odberu vzoriek môžu závisieť od chemikálie alebo spôsobu/cesty napr. rýchla expozícia tkaniva s intravenóznym podaním alebo inhalačnou expozíciou. Preto by sa časy odberu vzoriek mali určovať z kinetických údajov, ak sú dostupné [napr. čas (Tmax), za ktorý sa dosiahne najvyššia koncentrácia v plazme alebo tkanive (Cmax), alebo ustálený stav v prípade viacnásobných podaní]. Pri absencii kinetických údajov sa za vhodný kompromis pri meraní genotoxicity považuje odber vzoriek po 2 – 6 hodinách od posledného testovania v prípade dvoch alebo viacerých testovaní, alebo po 2 – 6 a opäť po 16 – 26 hodinách po jednorazovom podaní, pričom však treba dbať na to, aby boli všetky zvieratá pitvané v tom istom čase od poslednej (príp. jedinej) dávky. Na výber vhodných časov odberu vzoriek je možné použiť aj informácie o výskyte toxických účinkov na cieľové orgány (ak sú k dispozícii). Pozorovania Najmenej raz denne, najlepšie v rovnakom čase, resp. časoch a po zohľadnení periódy najvyššej intenzity očakávaných účinkov po dávkovaní (54), by sa mali vykonať a zaznamenať všeobecné klinické pozorovania v súvislosti so zdravím zvierat. Najmenej dvakrát denne je u všetkých zvierat potrebné sledovať chorobnosť a úmrtnosť. Ak ide o dlhšie trvajúce štúdie, všetky zvieratá by sa mali aspoň raz týždenne a potom na konci obdobia testu odvážiť. Spotreba potravy by sa mala merať pri každej výmene potravy a aspoň raz za týždeň. Ak sa testovaná chemikália podáva v pitnej vode, mala by sa pri každej výmene vody a aspoň raz za týždeň odmerať spotreba vody. Zvieratá, ktoré nevykazujú smrteľné dávky nadmernej toxicity, by sa mali pred dokončením testovacieho obdobia usmrtiť a vo všeobecnosti sa na účely kométového testu nepoužívať. Odber tkaniva Keďže je možné skúmať indukciu zlomov v reťazcoch DNA (kométy) prakticky v každom tkanive, rozhodnutie o výbere tkaniva, resp. tkanív, ktoré sa majú odobrať, by malo byť jasne vysvetlené a podložené dôvodom vykonania štúdie spolu so všetkými existujúcimi údajmi o ADME, genotoxicite, karcinogenite alebo inej toxicite v prípade testovaných chemikálií, ktoré sú predmetom skúmania. Medzi dôležité faktory, ktoré treba zvážiť, patrí spôsob podania látky (založený na pravdepodobnom spôsobe, resp. spôsoboch expozície ľudí), predpokladaná distribúcia a absorpcia v tkanive, úloha metabolizmu, ako aj možný mechanizmus pôsobenia testovanej chemikálie. Pečeň je najčastejšie skúmaným tkanivom s najväčším počtom údajov. Preto pri absencii akýchkoľvek podkladových informácií, alebo ak sa neurčí žiadne konkrétne tkanivo záujmu, sa odber vzoriek z pečene považuje za opodstatnený, pretože ide o primárne miesto xenobiotického metabolizmu a zároveň orgán, ktorý je často vystavený tak materskej látke, resp. látkam, ako aj metabolitu, resp. metabolitom. V niektorých prípadoch môže byť najlepšie skúmať v mieste priameho kontaktu (napr. v prípade chemikálií podávaných ústne – žľaznatý žalúdok alebo dvanástnik/lačník alebo v prípade inhalovaných chemikálií – pľúca). Na základe špecifických dôvodov vykonávania testu by sa mali vybrať dodatočné alebo alternatívne tkanivá, ale môže byť užitočné preskúmať viaceré tkanivá tých istých zvierat za predpokladu, že laboratórium preukázalo spôsobilosť pracovať s týmito tkanivami a dokáže zvládnuť viacero tkanív naraz. Príprava skúšobných vzoriek V prípade procesov opísaných v týchto bodoch (44 až 49) je dôležité, aby sa všetky roztoky, príp. stabilné suspenzie použili do dátumu exspirácie, alebo aby sa v prípade potreby pripravovali čerstvé. V uvedených bodoch sa uvádza aj to, že časy potrebné na i) odobratie každého tkaniva po pitve, ii) spracovanie každého tkaniva do bunkových/jadrových suspenzií a iii) spracovanie suspenzie a prípravu preparátov sa považujú za kritické premenné (pozri definície v dodatku 1), pričom správna dĺžka času na každý z týchto krokov by sa mala určiť v čase zavádzania metódy a preukazovania spôsobilosti. Zvieratá sa vo vhodnom čase, resp. časoch po poslednom podaní testovanej chemikálie usmrtia v súlade s platnými právnymi predpismi v oblasti dobrých životných podmienok zvierat a so zásadami princípu „nahradiť, obmedziť a zjemniť“. Vybrané tkanivo, resp. tkanivá sa odoberú, oddelia rezom a časť sa použije na kométový test, pričom sa zároveň iná časť z tej istej časti tkaniva odreže a vloží do roztoku formaldehydu alebo vhodného fixačného prostriedku na účely možnej histopatologickej analýzy (pozri bod 55) podľa štandardných metód (12). Tkanivo určené na kométový test sa umiestni do rozmeľovacieho tlmivého roztoku, poriadne sa opláchne studeným rozmeľovacím tlmivým roztokom, aby sa odstránili zvyšky krvi a až do spracovania sa skladuje v ľadovom rozmeľovacom tlmivom roztoku. Môže sa vykonať aj perfúzia in situ, napr. pri pečeni alebo obličkách. Na tému izolácie buniek/jadier existuje mnoho publikovaných metód. Patria medzi ne rozomieľanie tkanív napr. pečene a obličiek, škrabanie mukóznych povrchov v prípade gastrointestinálneho traktu, homogenizácia a enzymatické natrávenie. Predmetom validačnej skúšky JaCVAM bolo iba štúdium izolovaných buniek, preto sa pri zavádzaní metódy a odvolávaní sa na údaje zo skúšky JaCVAM na účely preukázania spôsobilosti uprednostňujú izolované bunky. Ukázalo sa však, že bez ohľadu na to, či sa použijú izolované bunky alebo jadrá, vo výsledku testu nie je žiaden podstatný rozdiel (8). Aj v prípade rôznych metód izolovania buniek/jadier (napr. homogenizácia, rozomieľanie, enzymatické natrávenie a filtrácia cez sito) sa dosiahli porovnateľné výsledky (55). Preto je možné použiť buď izolované bunky alebo izolované jadrá. Laboratórium by malo dôkladne vyhodnotiť a potvrdiť platnosť tkanivových metód izolácie samostatných buniek/jadier. Ako už bolo opísané v bode 40, výskyt niektorých lézií, ktoré spôsobia zlomy v reťazcoch DNA zistené kométovým testom, môže mať len veľmi krátke trvanie (52) (53). Preto je bez ohľadu na použitú metódu prípravy jednobunkovej/jadrovej suspenzie dôležité, aby sa tkanivá spracovali čo najskôr po tom, ako boli zvieratá usmrtené a umiestnené do podmienok, vďaka ktorým sa zníži potreba odstraňovania lézií (napr. uchovávaním tkaniva pri nízkej teplote). Bunkové suspenzie by sa mali až do samotného použitia uchovávať ľadové, aby sa minimalizovali odchýlky medzi vzorkami a dosiahli správne pozitívne a negatívne kontroly. PRÍPRAVA PREPARÁTOV Preparáty by sa mali pripravovať čo najskôr (v ideálnom prípade do jednej hodiny) po preparovaní jednej bunky/jadra, pričom teplota a čas medzi smrťou zvieraťa a prípravou preparátov by mali byť prísne kontrolované a validované v laboratórnych podmienkach. Objem bunkovej suspenzie pridanej do agarózy s nízkym bodom topenia (zvyčajne 0,5 – 1,0 %) na prípravu sklíčok by nemal znížiť percentuálny podiel agarózy s nízkym bodom topenia na menej ako 0,45 %. Optimálna hustota buniek sa stanoví systémom analýzy obrazu používaným na zápis komét. Lýza Aj podmienky lýzy patria ku kritickým premenným veličinám a môžu narúšať zlomy v reťazcoch vyvolané špecifickými typmi modifikácie DNA (niektoré alkylácie DNA a bázické adukty). Preto sa odporúča, aby sa pri všetkých preparátoch v rámci pokusu udržiavali pokiaľ možno konštantné podmienky lýzy. Po príprave by sa preparáty mali aspoň na jednu hodinu (alebo na noc) ponoriť do lyzačného roztoku pri teplote okolo 2 – 8 °C, tlmenom osvetlení, tzv. žlté svetlo (alebo podmienky odolné proti svetlu), aby nedošlo k ich vystaveniu účinkom bieleho svetla, ktoré môže obsahovať zložky UV žiarenia. Po tejto inkubačnej lehote sa preparáty opláchnu, aby sa pred fázou alkalického rozpletania odstránili zvyšky detergentu a soli. Robí sa to čistenou vodou, neutralizačným alebo fosfátovým tlmivým roztokom. Môže sa použiť aj elektroforézny tlmivý roztok. Vďaka tomu sa v elektroforéznej komore zachovajú alkalické podmienky. Rozpletanie a elektroforéza Preparáty sa náhodne umiestnia do zariadenia na ponorkovú elektroforézu obsahujúceho dostatočné množstvo roztoku tak, aby boli povrchy preparátov úplne ponorené (aj hĺbka ponoru by mala byť pri každom pokuse konzistentná). Pri iných typoch elektroforéznych zariadení na účely kométového testu, t. j. s aktívnym chladením, cirkuláciou a vysokokapacitným zdrojom energie, bude mať väčší ponor v roztoku za následok vyšší elektrický prúd, pričom napätie bude naďalej konštantné. Preparáty by sa do elektroforéznej nádoby mali umiestňovať vyváženým spôsobom, aby sa zmiernili účinky akýchkoľvek trendov alebo okrajových účinkov v nádobe a minimalizovali odchýlky medzi jednotlivými dávkami, t. j. pri každej elektroforéze by mal existovať rovnaký počet preparátov z každého skúmaného zvieraťa vrátane vzoriek z rôznych skupín dávok, negatívnych a pozitívnych kontrol. Preparáty by sa mali nechať aspoň 20 minút postáť, aby mohlo dôjsť k rozpleteniu DNA, a potom podrobiť elektroforéze za kontrolovaných podmienok, ktoré umožnia maximalizovať citlivosť a dynamický rozsah testu (napr. dosiahnuť prijateľné úrovne % chvostovej DNA pri negatívnych a pozitívnych kontrolách, ktoré maximalizujú citlivosť). Úroveň migrácie DNA je priamo úmerná tak dĺžke trvania elektroforézy, ako aj potenciálu (V/cm). Podľa skúšky JaCVAM by to mohlo byť 0,7 V/cm pri najmenej 20 minútach. Dĺžka trvania elektroforézy sa považuje za kritickú premennú, pričom čas elektroforézy by mal byť stanovený, aby sa optimalizoval dynamický rozsah. Dlhšie elektroforézne časy (napr. 30 alebo 40 minút na maximalizáciu citlivosti) obyčajne vedú k výraznejším pozitívnym odozvám v prípade známych mutagénov. Dlhšie elektroforézne časy však môžu viesť aj k nadmernej migrácii v kontrolách. Napätie by malo pri každom pokuse zostať konštantné a odchýlky v prípade iných parametrov by mali byť v malom a stanovenom rozsahu napr. pri skúške JaCVAM sa pri 0.7 V/cm dosiahol štartovací prúd 300 mA. Hĺbka tlmivého roztoku by sa mala upraviť tak, aby bolo možné dosiahnuť požadované podmienky a zachovať ju počas celého pokusu. Hodnoty prúdu na začiatku a na konci elektroforézy by sa mali zaznamenať. Optimálne podmienky pre každé skúmané tkanivo by sa preto v príslušnom laboratóriu mali určovať v priebehu počiatočného preukazovania spôsobilosti. Teplota elektroforézneho roztoku počas rozpletania a elektroforézy by mala zostať nízka, obyčajne 2 – 10 °C (10). Teplota elektroforézneho roztoku na začiatku rozpletania, začiatku a konci elektroforézy by sa mala zaznamenať. Po dokončení elektroforézy by sa preparáty mali aspoň 5 minút ponárať/oplachovať neutralizačným tlmivým roztokom. Gély možno zafarbiť a hodnotiť „čerstvé“ (napr. do 1 – 2 dní), príp. ich dehydrovať na účely neskoršieho hodnotenia (napr. do 1 až 2 týždňov po zafarbení) (56). Tieto podmienky by sa však mali validovať v priebehu preukazovania spôsobilosti, pričom by sa mali získať a osobitne uchovať historické údaje týkajúce sa každej z týchto podmienok. V druhom prípade by sa preparáty mali dehydrovať ponorením na najmenej 5 minút do absolútneho etanolu, nechať oschnúť na vzduchu a potom až do hodnotenia skladovať buď pri izbovej teplote, alebo v nádobe v chladničke. Metódy merania Kométy by sa mali hodnotiť kvantitatívne pomocou automatických alebo poloautomatických systémov analýzy obrazu. Preparáty sa zafarbia primeraným fluorescenčným farbivom napr. zlatou SYBR, zelenou I (green I), propídium-jodidom alebo etídium-bromidom a merajú pri vhodnom zväčšení (napríklad 200-násobnom) pod epifluorescenčným mikroskopom s vhodnými detektormi alebo na digitálnej kamere (napr. CCD). Bunky možno zaradiť do troch kategórií opísaných v atlase kométových snímok (57), a to hodnotiteľné, nehodnotiteľné a tzv. ježe (hedgehog) (ďalšie podrobnosti sú uvedené v bode 56). Na účely výpočtu % chvostovej DNA by sa mali hodnotiť iba hodnotiteľné bunky (jasne vymedzená hlava a chvost, bez interferencie so susednými bunkami), aby sa zabránilo artefaktom. Frekvenciu výskytu nehodnotiteľných buniek netreba zapisovať do protokolu. Frekvencia výskytu „ježov“ by sa mala určovať na základe vizuálneho hodnotenia (keďže im chýba jasne definovaná hlava, čo sťažuje ich detekciu analýzou obrazu) minimálne 150 buniek na vzorku (ďalšie podrobnosti sú uvedené v bode 56) a zvlášť zapísať. Všetky preparáty určené na analýzu vrátane negatívnych a pozitívnych kontrol by mali byť nezávisle označené kódmi a hodnotené ako „slepé“, aby hodnotiteľ nepoznal spôsob ich ovplyvnenia. Z každej vzorky (jedno tkanivo na zviera) by sa malo analyzovať najmenej 150 buniek (s výnimkou „ježov“ – pozri bod 56). Hodnotenie 150 buniek na zviera s minimálne 5 zvieratami na jednu dávku (menej pri súbežnej pozitívnej kontrole – pozri bod 29) poskytuje podľa analýzy Smith et al., 2008 (5) primeranú štatistickú výpovednú hodnotu. Ak sa používajú preparáty, mohlo by ísť o hodnotenie 2 alebo 3 preparátov na vzorku, ak je v skupine päť zvierat. Pozorovania by sa mali vykonať vo viacerých oblastiach preparátu s hustotou, ktorá zaručí, že nedôjde k prekrývaniu chvostov. Okraje preparátov by sa nemali hodnotiť. Zlomy v reťazcoch DNA možno v kométovom teste merať nezávislými sledovanými parametrami, ako je % objemu chvostovej DNA, dĺžka a tzv. tail moment. Všetky tri merania možno vykonať použitím vhodného systému so softvérom na analýzu obrazu. Na vyhodnotenie a interpretáciu výsledkov (12) (40) (41) (42) sa však odporúča použiť % chvostovej DNA (tiež známe ako % hustoty na chvoste), ktoré je dané hustotou fragmentov DNA na chvoste vyjadrenou ako percento z celkovej hustoty buniek (13). Poškodenie tkaniva a cytotoxicita Pozitívne nálezy v kométovom teste nemusia byť nutne výsledkom genotoxicity, keďže aj toxicita cieľového tkaniva môže mať za následok nárast migrácie DNA (12) (41). A naopak, nízka alebo mierna cytotoxicita je často výsledkom známych genotoxínov (12), z čoho vyplýva, že pri samotnom kométovom teste nie je možné rozlíšiť migráciu DNA vyvolanú genotoxicitou od migrácie vyvolanej cytoxocitou. Ak sú však pozorované nárasty migrácie DNA, odporúča sa preskúmať jeden alebo viacero ukazovateľov cytotoxicity, čo môže pomôcť pri interpretácii zistení. Nárasty migrácie DNA v prítomnosti jasných dôkazov cytotoxicity by sa mali interpretovať opatrne. Bolo navrhnutých mnoho meraní cytotoxicity, spomedzi ktorých sa za najvhodnejší spôsob merania toxicity tkaniva považujú histopatologické zmeny. Pozorované javy, ako je zápal, bunková infiltrácia, apoptózové alebo nekrotické zmeny, sú spájané s nárastom migrácie DNA, no validačná skúška JaCVAM (12) potvrdila, že neexistuje žiadny konečný zoznam histopatologických zmien, ktoré sa vždy spájajú so zvýšenou migráciou DNA. Aj zmeny v klinických chemických ukazovateľoch (napr. AST, ALT) môžu poskytnúť užitočné informácie o poškodení tkaniva, pričom do úvahy je možné vziať aj ďalšie ukazovatele, napr. aktiváciu kaspázy, farbivo TUNEL, farbivo Annexin V atď. Existuje však len obmedzené množstvo publikovaných údajov o použití spomínaných ďalších ukazovateľov v štúdiách in vivo, pričom niektoré sú viac a iné menej spoľahlivé. „Ježe“ (alebo tiež hedgehogs, clouds alebo ghost cells) sú bunky, ktoré vytvárajú mikroskopický obraz pozostávajúci z malých alebo neexistujúcich hláv a veľkých, rozptýlených chvostov, a považujú sa za bunky s ťažkým poškodením, hoci etiológia „ježov“ je neistá (pozri dodatok 3). Pre ich vzhľad sú merania % chvostovej DNA analýzou obrazu nespoľahlivé, preto by sa „ježe“ mali vyhodnocovať osobitne. Výskyt „ježov“ by sa mal zaznamenať a uviesť do protokolu, pričom akýkoľvek relevantný nárast, ktorý sa považuje za následok testovanej chemikálie, by sa mal dôsledne preskúmať a interpretovať. Pri týchto úvahách môžu pomôcť aj poznatky o potenciálnom spôsobe pôsobenia testovanej chemikálie. ÚDAJE A PREZENTOVANIE VÝSLEDKOV Spracovanie výsledkov Zviera je pokusná jednotka, a preto by sa tak údaje o jednotlivých zvieratách, ako aj zhrnutie výsledkov mali uvádzať v tabuľke. Vzhľadom na hierarchickú povahu údajov sa odporúča, aby sa pri každom preparáte určilo priemerné % chvostovej DNA a pri každom zvierati vypočítal priemer stredných hodnôt (12). Potom sa určí priemer z priemerov za jednotlivé zvieratá, aby sa získal priemer za skupinu. Všetky tieto hodnoty by sa mali zapísať do protokolu. Môžu sa použiť aj alternatívne prístupy (pozri bod 53), ak sú vedecky a štatisticky opodstatnené. Štatistické analýzy možno urobiť použitím rôznych prístupov (58) (59) (60) (61). Pri výbere štatistických metód, ktoré sa majú použiť, by sa mala na základe skutočností uvedených v spomínaných odkazoch na literatúru zvážiť potreba transformácie údajov (napr. logaritmicky alebo druhou odmocninou) a/alebo pripočítania malého čísla (napr. 0,001) ku všetkým (dokonca aj nenulovým) hodnotám, aby sa minimalizovali účinky nulových bunkových hodnôt. Podrobnosti o analýze interakcií medzi spôsobom ovplyvnenia a pohlavím zvierat v prípade použitia oboch pohlaví, ako aj následná analýza údajov pri zistení, prípadne nezistení rozdielov, sú uvedené v dodatku 2. V protokole by mali byť uvedené aj údaje o toxicite a klinických príznakoch. Kritériá prijateľnosti Prijateľnosť skúšky je založená na týchto kritériách:
Hodnotenie a interpretácia výsledkov Za predpokladu, že boli splnené všetky kritériá prijateľnosti sa testovaná chemikália považuje za jednoznačne pozitívnu, ak:
Keď sú všetky tieto kritériá splnené, testovaná chemikália sa považuje za schopnú spôsobovať zlomy v reťazcoch DNA tkanív skúmaných týmto testovacím systémom. Ak je splnené iba jedno či dve z týchto kritérií, pozri bod 62. Za predpokladu, že boli splnené všetky kritériá prijateľnosti sa testovaná chemikália považuje za jednoznačne negatívnu, ak:
V tom prípade sa testovaná chemikália považuje za neschopnú spôsobovať zlomy v reťazcoch DNA tkanív skúmaných týmto testovacím systémom. Neexistuje požiadavka na potvrdenie jednoznačne pozitívnej alebo negatívnej odozvy. Ak odozva nie je ani jednoznačne negatívna, ani jednoznačne pozitívna (t. j. neboli splnené všetky kritériá uvedené v bodoch 59 a 60), v snahe napomôcť dosiahnutiu biologickej relevantnosti výsledku by sa mali údaje vyhodnocovať na základe odborného posudku a/alebo, ak je to vedecky opodstatnené, uskutočniť ďalšie skúmania. Užitočné môže byť aj hodnotenie dodatočných buniek (ak je to vhodné) alebo zopakovanie pokusu najlepšie po optimalizácii experimentálnych podmienok (napr. intervalov dávok, iných spôsobov podania, iných časov odberu vzoriek alebo iných tkanív). V zriedkavých prípadoch, dokonca aj po ďalších skúmaniach, nemusí byť na základe daného súboru údajov možné dospieť k záveru o pozitívnych alebo negatívnych výsledkoch, a preto sa takéto údaje považujú za nejednoznačné. Posúdenie biologickej relevantnosti pozitívneho alebo nejednoznačného výsledku, ako aj informácie o cytotoxicite v cieľovom tkanive, sú povinné (pozri body 54 – 55). Ak sú pozitívne alebo nejednoznačné nálezy pozorované iba za prítomnosti jasných dôkazov cytotoxicity, štúdia by sa mala uzavrieť ako genotoxicky nejednoznačná, pokiaľ neexistuje dostatok informácií, ktoré podporujú konečný záver. V prípadoch negatívneho výsledku štúdie, ktoré svedčia o znakoch toxicity pri všetkých testovaných dávkach, môže byť vhodné vykonať ďalšiu štúdiu s netoxickými dávkami. Skúšobný protokol Skúšobný protokol by mal obsahovať tieto informácie:
LITERATÚRA
Dodatok 1 DEFINÍCIE Alkalická jednobunková gélová elektroforéza : senzitívna technika detekcie primárneho poškodenia DNA na úrovni jednotlivých buniek/jadier. Chemikália : látka alebo zmes. Kométa : tvar podobný kométam, ktorý nadobudnú nukleoidy po tom, ako sa vložia do elektroforézneho poľa: hlavu tvorí jadro a chvost vznikne migráciou DNA z jadra pod vplyvom elektrického poľa. Kritická premenná/kritický parameter : ide o protokolovú premennú, v prípade ktorej môže aj nepatrná zmena výrazne ovplyvniť záver skúšky. Kritické premenné môžu byť viazané na konkrétne tkanivo. Kritické premenné by sa nemali meniť, najmä v rámci testu bez toho, aby sa zvážilo, do akej miery ich zmena ovplyvní odozvu na test napr. na základe sily a variability pozitívnych a negatívnych kontrol. V skúšobnom protokole by mal byť uvedený zoznam zmien kritických premenných vykonaných počas testu alebo v porovnaní so štandardným laboratórnym protokolom spolu s odôvodneniami každej zmeny. Hustota na chvoste alebo % chvostovej DNA : Ide o hustotu na chvoste kométy v porovnaní s celkovou hustotou (hlava plus chvost). Vyjadruje percentuálne množstvo zlomov DNA. Testovaná chemikália : akákoľvek látka alebo zmes testovaná touto testovacou metódou. UVCB : látky neznámeho alebo variabilného zloženia, produkty komplexných reakcií alebo biologické materiály. Dodatok 2 FAKTORIÁLNY EXPERIMENT IDENTIFIKÁCIE ROZDIELOV MEDZI POHLAVIAMI V KOMÉTOVOM TESTE IN VIVO Faktoriálny experiment a jeho analýza Pri tomto experimente sa testuje minimálne 5 samcov a 5 samíc pri každej úrovni koncentrácie, čo znamená model s použitím minimálne 40 zvierat (20 samcov a 20 samičiek, plus príslušné pozitívne kontroly). Tento model je jedným z jednoduchších faktoriálnych experimentov a zodpovedá dvojsmernej analýze rozptylu, ktorá má dva zásadné vplyvy, a to na pohlavie a úroveň koncentrácie. Údaje možno analyzovať použitím štandardných štatistických softvérových balíkov napr. SPPS, SAS, STATA, Genstat, ako aj pomocou programu R. Touto analýzou sa variabilita súboru údajov rozdelí na variabilitu medzi pohlaviami, medzi koncentráciami a na variabilitu súvisiacu s interakciou medzi pohlaviami a koncentráciami. Každý z týchto znakov sa testuje v porovnaní s odhadom variability medzi paralelnými zvieratami (replikátmi) v rámci skupín zvierat rovnakého pohlavia pri rovnakej koncentrácii. Podrobné informácie o príslušnej metodike sú dostupné v mnohých bežných štatistických publikáciách (pozri odkazy) a v príručkách ku štatistickým programom. Analýza začína kontrolou znaku interakcie pohlavia a koncentrácie v tabuľke ANOVA (35). Pri absencii významného znaku interakcie sú kombinované hodnoty naprieč pohlaviami alebo úrovňami koncentrácií validnými štatistickými testami variability medzi jednotlivými úrovňami, ktoré sú založené na skúmaní kumulovaného znaku variability v rámci skupiny analýzou ANOVA. Analýza pokračuje rozdelením odhadu variability medzi koncentrácie podľa kontrastov, čo vedie k testovaniu lineárnych a kvadratických kontrastov odoziev naprieč úrovňami koncentrácií. Ak dôjde k významnej interakcii pohlavia a koncentrácie, tento znak možno takisto ďalej rozdeliť na porovnanie interakcií lineárnosti a pohlavia, ako aj kvadratickej interakcie a pohlavia. Tieto znaky vedú k testom, ktoré preukážu, či sú odozvy na koncentrácie paralelné u oboch pohlaví, alebo či obe pohlavia vykazujú odlišné odozvy. Odhad kumulovanej variability v rámci skupiny možno použiť na párové testovanie rozdielov medzi priemernými hodnotami. Tieto porovnania by sa dali urobiť medzi priemernými hodnotami z oboch pohlaví a medzi priemermi za jednotlivú úroveň koncentrácie, ako sú napríklad porovnania s úrovňami pri negatívnych kontrolách. Ak existujú prípady významnej interakcie, je možné porovnávať priemery rozličných koncentrácií v rámci pohlavia alebo priemery za jednotlivé pohlavia pri rovnakej koncentrácii. Odkazy Existuje mnoho štatistických publikácií, ktoré rozoberajú teóriu, model, metodiku, analýzu a interpretáciu faktoriálnych experimentov, od tých najjednoduchších dvojfaktorových analýz k tým zložitejším, ktoré sú opísané v publikácii „Design of Experiment methodology“ (Model experimentálnej metodiky). Tento zoznam nie je úplný. V niektorých knihách sú uvedené vypracované príklady porovnateľných modelov, v niektorých prípadoch s kódom na vykonanie analýzy pomocou rozličných softvérových programov.
Dodatok 3 EXISTUJÚCE OBMEDZENIA SKÚŠKY Na základe súčasných poznatkov je v súvislosti s kométovým testom in vivo známych niekoľko obmedzení. Očakáva sa, že ich počet sa bude znižovať, príp. sa s pribúdajúcimi skúsenosťami s používaním testu presnejšie zadefinujú tak, aby bolo možné zodpovedať bezpečnostné otázky z hľadiska predpisov.
Odkazy
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
16. |
V časti C sa kapitola C.13 nahrádza takto: „C.13 Bioakumulácia u rýb: expozícia vo vodnom prostredí a z potravy ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 305 (2012). Hlavný cieľ tejto revízie testovacej metódy je dvojaký. Po prvé, doplniť test bioakumulácie z potravy (36) vhodný na stanovenie bioakumulačného potenciálu látok s veľmi nízkou rozpustnosťou vo vode. Po druhé, vytvoriť takú testovaciu metódu, v rámci ktorej by sa v náležitých prípadoch používalo z dôvodu dobrých životných podmienok zvierat menej rýb a bola by nákladovo efektívnejšia. Od schválenia konsolidovanej testovacej metódy C.13 (1) bolo testovaných množstvo látok a tak sa laboratóriám, ako aj regulačným orgánom podarilo získať dostatočné množstvo poznatkov. To viedlo k presvedčeniu, že zložitosť tohto testu je možné znížiť, ak sú splnené osobitné kritériá (pozri bod 88) a je možné použiť viacúrovňový prístup. Prax tiež ukázala, že výsledky môžu výrazne ovplyvniť biologické faktory ako rast a obsah lipidov v rybách, ktoré môže byť potrebné zohľadniť. Navyše sa zistilo, že testovanie látok s veľmi nízkou rozpustnosťou vo vode sa nemusí dať technicky realizovať. Okrem toho pre látky s veľmi nízkou rozpustnosťou vo vodnom prostredí môže mať expozícia vodou v porovnaní s expozíciou potravou len obmedzený význam. To viedlo k vypracovaniu testovacej metódy, v ktorej sú ryby vystavené účinkom z ich potravy (pozri body 7 – 14 a bod 97 a ďalej). Validácia (kruhovým testom) skúšky expozície z potravy bola vykonaná v roku 2010 (51). Medzi hlavné zmeny patrí:
Pred uskutočnením ktoréhokoľvek z testov bioakumulácie by mali byť známe tieto informácie o testovanej látke:
V tejto testovacej metóde je opísaný postup charakterizácie bioakumulačného potenciálu látok v rybách, a to bez ohľadu na zvolenú metódu expozície alebo spôsob odberu vzoriek. Uprednostňujú sa hlavne modely prietokového testu, pričom prípustné sú aj polostatické modely za predpokladu, že boli splnené kritériá platnosti skúšky (pozri body 24 a 113). V prípade expozície z potravy nie je na udržanie koncentrácií testovanej látky vo vodnom prostredí potrebný prietokový model, ktorý však pomáha udržiavať adekvátne koncentrácie rozpusteného kyslíka, zabezpečovať čistú vodu a odstraňovať rôzne vplyvy, napr. produkty vylučovania. Bez ohľadu na zvolenú testovaciu metódu je v tejto testovacej metóde uvedené dostatočné množstvo podrobností na uskutočnenie testu a súčasne poskytnutý adekvátny priestor na prispôsobenie pokusného modelu podmienkam jednotlivých laboratórií a na rôzne vlastnosti testovaných látok. Test vodnej expozície je najvhodnejšie použiť v prípade stálych organických látok s hodnotami log KOW medzi 1,5 a 6,0 (13), no dá sa použiť aj v prípade vysokohydrofóbnych látok (s log KOW > 6,0), ak sa preukáže stála a celkom rozpustená koncentrácia testovanej látky vo vode. Ak stálu koncentráciu testovanej látky vo vode nie je možné preukázať, štúdia vo vodnom prostredí nemusí byť vhodná, a preto sa môže vyžadovať testovanie látky v potrave rýb (hoci interpretácia a využitie výsledkov skúšky expozície z potravy môžu závisieť od regulačného rámca). Predbežné odhady biokoncentračného faktora (BCF, niekedy označovaný aj ako KB) v prípade organických látok s hodnotami log KOW približne do 9,0 možno získať použitím rovnice od Binteina a kol. (14). Predbežný odhad biokoncentračného faktora môže byť v prípade takýchto vysokohydrofóbnych látok vyšší ako hodnota biokoncentračného faktora v ustálenom stave (BCFSS), ktorá sa má dosiahnuť laboratórnymi pokusmi, zvlášť ak sa na stanovenie predbežného odhadu použije jednoduchý lineárny model. Medzi parametre charakterizujúce bioakumulačný potenciál patrí rýchlostná konštanta vychytávania (k 1), rýchlostné konštanty vylučovania vrátane rýchlostnej konštanty depurácie (k 2), biokoncentračný faktor v ustálenom stave (BCFSS), kinetický biokoncentračný faktor (BCFK) a potravový biomagnifikačný faktor (BMF) (38). Testované látky označené rádioaktívnym izotopom môžu uľahčiť analýzu vzoriek vody, potravín a rýb a môžu sa použiť pri rozhodovaní o tom, či je potrebné vykonať identifikáciu a kvantifikáciu metabolitov. Ak sa meria iba celkové množstvo rádioaktívnych rezíduí (napríklad po spálení alebo solubilizácii tkaniva), hodnota BCF alebo BMF vychádza z celkového množstva materskej látky spolu so všetkými zadržanými metabolitmi a asimilovaným uhlíkom. Hodnoty BCF alebo BMF založené na celkovom množstve rádioaktívnych rezíduí preto nemožno priamo porovnávať s hodnotami BCF alebo BMF získanými špecifickou chemickou analýzou samotnej materskej látky. Separačné postupy ako TLC, HPLC alebo GC (39) možno použiť pred analýzou v rámci štúdií látok označených rádioaktívnym izotopom s cieľom určiť hodnoty BCF alebo BMF vychádzajúce z materskej látky. Ak sa použije niektorá zo separačných techník, mala by sa vykonať identifikácia a kvantifikácia materskej látky a príslušných metabolitov (40) (pozri bod 65), ak majú hodnoty BCF a BMF vychádzať z koncentrácie materskej látky v rybách, a nie z celkového množstva rezíduí označených rádioaktívnym izotopom. Možná je aj kombinácia štúdie metabolizmu rýb alebo štúdie distribúcie in vivo so štúdiou bioakumulácie na základe analýzy a identifikácie rezíduí v tkanivách. Pravdepodobnosť metabolizmu je možné predpovedať vhodnými nástrojmi (napr. súborom nástrojov OECD QSAR Toolbox (15) a patentovanými programami QSAR). Rozhodnutie o tom, či vykonať skúšku expozície vo vodnom prostredí alebo expozície z potravy a za akých podmienok, by malo vychádzať z faktorov uvedených v bode 3 s prihliadnutím na príslušný regulačný rámec. Napríklad v prípade látok, ktoré majú vysokú hodnotu log KOW, a napriek tomu naďalej vykazujú značnú rozpustnosť vo vode vzhľadom na citlivosť dostupných analytických techník, by sa malo v prvom rade zvážiť vykonanie testu vodnej expozície. Je však možné, že informácie o rozpustnosti vo vode nie sú v prípade týchto typov hydrofóbnych látok definitívne, preto by sa pred prijatím rozhodnutia o tom, ktorú testovaciu metódu použiť, mala preskúmať možnosť pripraviť stále a merateľné koncentrácie rozpustené vo vodnom prostredí (stabilné emulzie nie sú povolené) použiteľné pre štúdiu vodnej expozície (16). K tejto metóde nie je možné vypracovať presne predpísané pokyny k jej používaniu, ktoré by boli založené na rozpustnosti vo vode a hraničných kritériách rozdeľovacieho koeficientu oktanol – voda, keďže aj iné faktory (analytické techniky, degradácia, adsorpcia atď.) môžu mať z uvedených dôvodov značný vplyv na spôsob jej uplatňovania. Avšak hodnota log KOW nad 5 a rozpustnosť vo vode pod ~0,01 – 0,1 mg/l označujú škálu látok, v prípade ktorých by testovanie použitím expozíciou vo vodnom prostredí mohlo byť čoraz ťažšie. Do úvahy by sa mali vziať aj ďalšie faktory, ktoré môžu ovplyvniť výber testu vrátane adsorpčného potenciálu látky vo vzťahu k nosičom a prístrojovému vybaveniu a jej stability vo vodnom roztoku v porovnaní so stabilitou v potrave rýb (17) (18) atď. Informácie o týchto praktických aspektoch môžu byť k dispozícii aj z iných ukončených štúdií vo vodnom prostredí. Ďalšie informácie o hodnotení aspektov týkajúcich sa výkonnosti bioakumulačných štúdií sú k dispozícii v odbornej literatúre (napr. 19). V prípade látok, pri ktorých rozpustnosť alebo udržanie koncentrácií vo vodnom prostredí, ako aj ich analýza neobmedzujú realizáciu metódy vodnej expozície, sa táto metóda uprednostňuje na určenie biokoncentračného potenciálu látky. V každom prípade by sa malo overiť, či je použitá koncentrácia, resp. koncentrácie pri expozícii vo vodnom prostredí v rozsahu rozpustnosti testovaného média. Môžu sa použiť rôzne metódy udržiavania stabilných koncentrácií rozpustenej testovanej látky, napr. použitím zásobných roztokov alebo modelov pasívneho dávkovania (napr. metódou vypierania z kolóny), pokiaľ je možné preukázať udržanie stálych koncentrácií bez toho, aby došlo k zmene testovaného média odporúčaného v bode 27. V prípade vysokohydrofóbnych látok (log KOW > 5 a rozpustnosť pod ~ 0,01 – 0,1 mg/l) môže byť testovanie expozíciou vo vodnom prostredí čoraz ťažšie. Dôvody obmedzení môžu byť napr. neschopnosť udržať dostatočne stálu úroveň koncentrácie vo vodnom prostredí (napr. z dôvodu sorpcie na sklenené expozičné nádoby, príp. rýchleho vychytávania rybami) alebo nedostatočne vysoké úrovne použitých koncentrácií vo vodnom prostredí, ktoré sú v rovnakom rozpätí alebo nižšie ako analytický kvantifikačný limit (41). V prípade týchto vysokohydrofóbnych látok sa odporúča skúška expozície z potravy za predpokladu, že je v súlade s príslušným regulačným rámcom a potrebami hodnotenia rizík. V prípade povrchovo aktívnych látok by sa na základe vlastností látky mala zvážiť realizovateľnosť testu biokoncentrácie vo vodnom prostredí, v opačnom prípade by asi bola vhodnejšia skúška expozície z potravy. Povrchovo aktívne látky sú činidlá, ktoré znižujú povrchové napätie medzi dvoma kvapalinami. Ich amfifilný charakter (t. j. obsah tak hydrofilnej, ako aj hydrofóbnej zložky) spôsobuje, že sa hromadia na rozhraniach, ako napr. voda – vzduch, voda – potrava, ako aj na sklenených stenách, čo znemožňuje presne stanoviť ich koncentráciu vo vodnom prostredí. Skúškou expozície z potravy je možné sa vyhnúť niektorým aspektom expozície v prípade komplexných zmesí obsahujúcich zložky s rozdielnou maximálnou rozpustnosťou vo vode, keďže porovnateľná expozícia účinkom všetkých zložiek zmesi je pravdepodobnejšia ako metóda vo vodnom prostredí (pozri bod 20). Treba však pripomenúť, že skúškou expozície z potravy sa získa skôr biomagnifikačný (BMF) ako biokoncentračný faktor (BCF) (42). Existujú postupy, ktorými je možné získať odhad kinetického biokoncentračného faktora (BCFK) z údajov získaných zo skúšky expozície z potravy (pozri dodatok 8), mali by sa však používať opatrne. Vo všeobecnosti totiž tieto prístupy rátajú s kinetikou prvého rádu a dajú sa použiť iba v prípade určitých skupín zlúčenín. Nie je pravdepodobné, že by sa dali použiť v prípade povrchovo aktívnych látok (pozri bod 12). Minimalistický model skúšky expozície vo vodnom prostredí s menším počtom odberu vzoriek, ktorým sa má znížiť množstvo zvierat a/alebo zdrojov (pozri bod 83 a ďalej), by sa mal použiť len v prípade takých látok, pri ktorých existuje dôvod sa domnievať, že vychytávanie i depurácia budú prebiehať podľa kinetiky prvého rádu (t. j. vo všeobecnosti ide o neionizované organické látky, pozri bod 88). C.13 – I: Test biokoncentrácie u rýb s expozíciou vo vodnom prostredí PRINCÍP TESTU Test pozostáva z dvoch fáz: z expozičnej (vychytávacej) a post-expozičnej (depuračnej) fázy. Počas vychytávacej fázy sa skupina rýb jedného druhu rýb vystaví účinkom testovanej látky pri jednej alebo viacerých zvolených koncentráciách, a to v závislosti od vlastností testovanej látky (pozri bod 49). Potom sa premiestnia do média bez testovanej látky a začne sa depuračná fáza. Depuračná fáza je vždy povinná, pokiaľ vychytávanie testovanej látky počas vychytávacej fázy nie je významné. Počas oboch fáz testu sa sleduje koncentrácia testovanej látky v/na rybách (alebo v určitých rybích tkanivách). Okrem exponovanej skupiny existuje v rovnakých podmienkach, ale bez testovanej látky, aj kontrolná skupina rýb, ktorá slúži na porovnanie možných nepriaznivých účinkov pozorovaných v priebehu skúšky biokoncentrácie s vhodnou kontrolnou skupinou, ako aj na získanie pozaďových koncentrácií testovanej látky (43). Pri skúške expozície vo vodnom prostredí trvá vychytávacia fáza obyčajne 28 dní. Jej trvanie sa môže v prípade potreby predĺžiť (pozri bod 18), alebo skrátiť, ak sa preukáže, že ustálený stav bol dosiahnutý skôr (pozri dodatok 1, definície a jednotky). Prognózu dĺžky vychytávacej fázy potrebnej na dosiahnutie ustáleného stavu možno vypočítať rovnicami, ktoré sú uvedené v dodatku 5. Depuračná fáza sa začne po tom, ako ryby prestanú byť vystavované účinkom testovanej látky a premiestnia sa do čistej nádoby s rovnakým médiom, ale bez testovanej látky. Všade, kde je to možné, sa vypočíta biokoncentračný faktor podľa možnosti ako pomer koncentrácie v rybách (C f) a vo vode (C w) pri ustálenom stave (BCFSS, pozri definíciu v dodatku 1) a ako kinetický biokoncentračný faktor (BCFK, pozri dodatok 1, definície a jednotky), ktorý sa odhaduje ako pomer rýchlostných konštánt vychytávania (k 1) a depurácie (k 2) podľa kinetiky prvého rádu (44). Ak sa ustálený stav do 28 dní nedosiahne, tak sa buď vypočíta BCF použitím kinetického prístupu (pozri bod 38), alebo sa môže predĺžiť vychytávacia fáza. Ak by to znamenalo príliš dlhú vychytávaciu fázu, ktorá sa v praxi nedá na dosiahnutie ustáleného stavu uskutočniť, (pozri body 37 a 38, dodatok 5), uprednostní sa kinetický prístup. Alternatívne sa v prípade vysoko hydrofóbnych látok môže zvážiť vykonanie skúšky expozície z potravy (45) za predpokladu, že je táto skúška v súlade s príslušným regulačným rámcom. Na základe modelu, ktorý najlepšie opisuje namerané koncentrácie testovanej látky v rybách a vo vode, sa vypočíta rýchlostná konštanta vychytávania, rýchlostná koncentrácia (vylučovania) depurácie (alebo rýchlostné konštanty v prípade komplexnejších modelov), biokoncentračný faktor (v ustálenom stave a/alebo kinetický) a tam, kde je to možné, aj intervaly spoľahlivosti každého z týchto parametrov (pozri dodatok 5). Nárastom hmotnosti rýb počas skúšky dôjde k zníženiu koncentrácie testovanej látky v rastúcich rybách (tzv. znižovanie koncentrácie látky vplyvom rastu), a tým aj k podhodnoteniu kinetického BCF, ak sa jeho hodnota neupraví o rast (pozri body 72 a 73). BCF je založený na celkovej koncentrácii v rybách (t. j. na celkovej vlhkej hmotnosti rýb). Z osobitných dôvodov sa však môžu v prípadoch dostatočnej veľkosti rýb niekedy použiť určené tkanivá alebo orgány (napríklad sval, pečeň), alebo sa môžu ryby rozdeliť na jedlé (rezy) alebo nejedlé časti (vnútornosti). Pretože pri mnohých organických látkach sa pozoruje jasná súvislosť medzi ich biokoncentračným potenciálom a hydrofóbnosťou, existuje aj príslušná súvislosť medzi obsahom lipidov v testovaných rybách a pozorovanou biokoncentráciou týchto látok. V záujme obmedzenia zdroja tejto variability výsledkov testovania dosahovaných s vysokolipofilnými látkami (t. j. s log KOW > 3) by sa preto biokoncentrácia rýb mala okrem vyjadrenia v podobe hodnoty získanej priamo zo štúdie aj normalizovať, a to podľa rýb s obsahom lipidov 5 % (na základe vlhkej hmotnosti celého tela). Tým sa získa základ, ku ktorému sa budú vzájomne prirovnávať výsledky dosiahnuté s rôznymi látkami a/alebo testovanými druhmi. Hodnota obsahu lipidov 5 % sa všade používa preto, že predstavuje priemerný obsah lipidov u rýb bežne používaných v tejto testovacej metóde (21). INFORMÁCIE O TESTOVANEJ LÁTKE Okrem vlastností testovanej látky uvedených v úvode (bod 3) sú ďalšími požadovanými informáciami toxicita u druhov rýb, ktoré sa majú testovať, najlepšie ako asymptotická LC50 (t. j. nezávislá od času) a/alebo odhadovaná toxicita z dlhodobých testov s rybami [napr. testovacie metódy C.47 (22), C.15 (23), C.14 (24)]. Na kvantifikáciu látky v testovaných roztokoch a v biologickom materiáli by mala byť k dispozícii primeraná analytická metóda so známou presnosťou a spoľahlivosťou, ako aj s údajmi o príprave a skladovaní vzorky. Okrem toho treba poznať analytický kvantifikačný limit testovanej látky tak vo vode, ako aj v rybích tkanivách. Ak sa ako testovaná látka použije látka označená rádioaktívnym izotopom, mala by mať najvyššiu možnú čistotu (podľa možnosti napr. > 98 %), pričom by malo byť známe aj percento rádioaktivity v súvislosti s nečistotami. PLATNOSŤ TESTU Na účely platnosti testu sa musia dodržať tieto podmienky:
REFERENČNÉ LÁTKY Použitie referenčných látok so známym biokoncentračným potenciálom a nízkym metabolizmom by pomohlo pri kontrole experimentálneho postupu, ak sa vyžaduje (napr. ak laboratórium nemá žiadne predchádzajúce skúsenosti s testom alebo došlo k zmene podmienok pokusu). OPIS METÓDY Prístrojové vybavenie Pri všetkých súčastiach zariadení sa treba vyhýbať používaniu materiálov, ktoré sa môžu rozpúšťať, absorbovať a lúhovať a ktoré môžu mať na ryby nepriaznivé účinky. Možno používať bežné nádrže pravouhlého alebo valcovitého tvaru z vhodného materiálu a takej veľkosti, ktorá zodpovedá veľkosti násady rýb (pozri bod 43). Pokiaľ možno, treba sa vyhýbať používaniu hadičiek a rúrok z mäkkých plastov. Mali by sa použiť rúrky z polytetrafluóretylénu, nehrdzavejúcej ocele a/alebo zo skla. Zo skúseností vyplýva, že pri testovaných látkach s vysokým adsorpčným koeficientom (napríklad pri syntetických pyretroidoch) môže byť potrebné používať posilanizované sklo. V takýchto prípadoch by sa toto zariadenie malo po použití zlikvidovať. Je vhodné, aby boli testované systémy ešte pred použitím testovaných organizmov vystavené účinkom koncentrácií testovanej látky, ktorá sa má použiť pri štúdii, a to tak dlho, ako je potrebné na preukázanie udržania stabilných expozičných koncentrácií. Voda Pri testoch sa vo všeobecnosti používa prírodná voda, ktorá by sa mala získavať z nekontaminovaných zdrojov s jednotnou kvalitou. Napriek tomu môže byť na zaručenie rovnakej kvality v čase vhodnejšia rekonštituovaná voda (t. j. demineralizovaná voda s pridanými špecifickými živinami v známych množstvách). Voda na riedenie je voda, ktorá sa zmieša s testovanou látkou pred tým, ako sa pridá do testovacej nádoby (pozri bod 30), a mala by mať takú kvalitu, aby v nej druh rýb, ktorý sa má použiť v teste, mohol prežiť fázy aklimatizácie a testu bez toho, aby vykazoval znaky abnormálneho vzhľadu alebo správania. V ideálnom prípade treba preukázať, že testovaný druh dokáže vo vode na riedenie prežívať, rásť a rozmnožovať sa (napríklad pomocou testu v laboratórnej kultúre alebo testu toxicity pre životný cyklus). Vodu na riedenie treba charakterizovať najmenej z hľadiska pH, tvrdosti, celkového obsahu tuhých látok a celkového organického uhlíka (TOC (47)) a pokiaľ možno aj obsahu amoniaku, dusitanov, ako aj z hľadiska zásaditosti a pri morských druhoch aj slanosti. Hoci parametre, ktoré sú potrebné na zaručenie optimálnych životných podmienok rýb, nie sú celkom známe, v dodatku 2 sú uvedené odporúčané maximálne koncentrácie celého radu parametrov charakterizujúcich sladkú aj morskú vodu. Voda na riedenie by mala mať konštantnú kvalitu počas celého trvania testu. Hodnota pH by sa mala pohybovať v rozmedzí 6,0 až 8,5 na začiatku testu, no počas príslušného testu by nemala kolísať o viac ako ± 0,5 jednotiek pH. Aby voda na riedenie neovplyvňovala neprimeraným spôsobom výsledky testovania (napríklad vytváraním komplexov s testovanou látkou) alebo aby nemala nepriaznivý vplyv na stav násady rýb, je potrebné zabezpečiť v pravidelných intervaloch – aspoň na začiatku a konci testu – odber vzoriek na analýzu. Ak je známe, že voda na riedenie má relatívne konštantnú kvalitu, mala by sa, napr. každé tri mesiace, zisťovať prítomnosť ťažkých kovov (napr. Cu, Pb, Zn, Hg, Cd a Ni), hlavných aniónov a katiónov (napr. Ca2+, Mg2+, Na+, K+, Cl-, a SO4 2-), pesticídov (napr. celkové organofosforečné a celkové organochlórové pesticídy) celkového organického uhlíka a tuhých suspendovaných látok. Ak sa preukázalo, že kvalita vody na riedenie bola konštantná najmenej jeden rok, spomínané zisťovanie sa môže vykonávať menej často a vo väčších časových rozostupoch (napr. každých šesť mesiacov). Obsah prirodzených tuhých častíc, ako aj celkového organického uhlíka vo vode na riedenie by mal byť čo možno najnižší, aby sa zabránilo absorpcii testovanej látky na organickú hmotu, v dôsledku čoho by sa mohla znížiť jej biologická dostupnosť, ktorá by viedla k podhodnoteniu BCF. Maximálny prípustný obsah tuhých častíc je 5 mg/l (sušina zachytená na 0,45 μm filter) a celkového organického uhlíka 2 mg/l (pozri dodatok 2). V prípade potreby treba vodu na riedenie pred použitím filtrovať. Prírastok obsahu organického uhlíka spôsobený v testovanej vode z testovaných rýb (exkrementy) a zo zvyškov krmiva by sa mal pokiaľ možno minimalizovať (pozri bod 46). Testovacie roztoky Pripravte zásobný roztok testovanej látky s vhodnou koncentráciou. Zásobný roztok treba podľa možnosti pripraviť jednoduchým zmiešaním alebo trepaním testovanej látky vo vode na riedenie. Alternatívne sa môže v niektorých prípadoch použiť dávkovací systém s desorpciou tuhej fázy. Použitie rozpúšťadiel alebo disperzných činidiel (solubilizačných prostriedkov) sa vo všeobecnosti neodporúča (pozri bod 25). Ich použitie však môže byť prijateľné, ak sa má získať zásobný roztok vhodnej koncentrácie; v tom prípade by sa ale malo vyvinúť maximálne úsilie na minimalizáciu ich použitia a zároveň zabránenie prekročenia kritickej hranice koncentrácie micel v nich (v relevantných prípadoch). Medzi rozpúšťadlá, ktoré možno použiť, patria acetón, etanol, metanol, dimetylformamid a trietylénglykol. Ako disperzné činidlá sa používajú Tween 80, 0,01 % metylcelulóza a HCO-40. Koncentrácia rozpúšťadla v konečnom testovacom médiu by mala byť pri všetkých pokusoch rovnaká (t. j. bez ohľadu na koncentráciu testovanej látky) a nemala by prekročiť zodpovedajúce hraničné hodnoty toxicity stanovené pre rozpúšťadlo v testovacích podmienkach. Maximálna koncentrácia je 100 mg/l (alebo 0,1 ml/l). Je nepravdepodobné, že by rozpúšťadlo s koncentráciou 100 mg/l výrazne zmenilo maximálnu koncentráciu rozpustenej testovanej látky, ktorú je možné v danom médiu dosiahnuť (25). Mal by byť známy prírastok z rozpúšťadla (spolu s testovanou látkou) k celkovému obsahu organického uhlíka v testovanej vode. Koncentrácia celkového organického uhlíka v testovacích nádobách by nemala počas celého trvania testu prekročiť koncentráciu organického uhlíka pochádzajúcu z testovanej látky a z rozpúšťadla, prípadne zo solubilizačného prostriedku (48), ak sa použil, a to o viac ako 10 mg/l (± 20 %). Obsah organických látok môže mať významný vplyv na množstvo voľne rozpustenej testovanej látky počas prietokových testov na rybách, zvlášť v prípade vysokolipofilných látok. Mikroextrakcia tuhej fázy (pozri bod 60) môže poskytnúť dôležité informácie o pomere medzi viazanými a voľne rozpustenými zlúčeninami, pričom voľne rozpustené zlúčeniny sú považované za biologicky dostupnú frakciu. Koncentrácia testovanej látky by mala byť nižšia ako je maximálna rozpustnosť testovanej látky v testovacom médiu napriek tomu, že sa použilo rozpúšťadlo alebo solubilizačný prostriedok. Rozpúšťadlá, ktoré ľahko podliehajú biodegradácii, treba používať s opatrnosťou, pretože môžu v prietokových testoch spôsobovať problémy s množením baktérií. Ak sa zásobný roztok nedá pripraviť bez použitia solubilizačného prostriedku, malo by sa zvážiť, či by namiesto štúdie expozície z potravy nebolo vhodné vykonať štúdiu expozície vo vodnom prostredí. Pri prietokových testoch je potrebné použiť systém nepretržitého prívodu a riedenia zásobného roztoku testovanej látky (napríklad meracie čerpadlo, prístroj na proporčné riedenie, saturačný systém) alebo dávkovací systém s desorpciou tuhej fázy, ktorým sa zabezpečí prívod testovacích koncentrácií do testovacích komôr. Ak sa dá, mal by sa objem každej testovacej komory denne aspoň päťkrát vymeniť. Treba uprednostniť prietokový systém, hoci tam, kde to nie je možné (napr. ak by to malo nepriaznivý vplyv na testované organizmy), sa môže pod podmienkou splnenia kritérií platnosti skúšky použiť aj polostatická metóda (pozri bod 24). Prietokovú rýchlosť zásobného roztoku aj vody na riedenie je potrebné skontrolovať 48 hodín pred začatím testu a potom najmenej raz denne počas celého jeho trvania. Pri tom treba skontrolovať aj rýchlosť prietoku cez každú testovaciu komoru a zabezpečiť, aby odchýlky prietoku v rámci komôr i medzi nimi nepresiahli 20 %. Výber druhov Pri výbere druhov sa treba riadiť týmito dôležitými kritériami: musia byť ľahko dostupné, možno ich získať vo vhodnej veľkosti a možno ich bez problémov chovať v laboratóriu. Ďalšie kritériá, ktoré treba pri výbere druhov rýb zohľadniť, sú: rekreačný, komerčný a ekologický význam, ako aj ich porovnateľná citlivosť, ich úspešné použitie v minulosti atď. Odporúčané testovacie druhy sú uvedené v dodatku 3. Možno použiť aj iné druhy, postup testovania však treba upraviť tak, aby sa dosiahli vhodné testovacie podmienky. V tomto prípade je potrebné zaznamenať dôvody, ktoré viedli k výberu iných druhov a experimentálnych metód. Vo všeobecnosti sa použitím menších druhov rýb skráti čas potrebný na dosiahnutie ustáleného stavu, ale možno bude treba viac rýb (vzoriek) na primeranú analýzu obsahu lipidov a koncentrácií testovanej látky v rybách. Porovnanie výsledkov medzi jednotlivými testami a testovanými druhmi môžu ovplyvniť aj rozdiely medzi mladými a staršími rybami v rýchlosti spotreby kyslíka a metabolizme. Treba poznamenať, že druhy rýb testované v (juvenilnej) životnej fáze vyznačujúcej sa rýchlym rastom môžu komplikovať interpretáciu údajov. Chov rýb (na účely skúšky expozície vo vodnom prostredí a expozície z potravy) Zásobná populácia rýb by sa mala aspoň dva týždne aklimatizovať vo vode (pozri bod 28) pri testovacej teplote a dostatočnom prísune potravy (pozri bod 45). Tak voda, ako aj potrava by mali byť zodpovedať typu, ktorý sa použije počas testu. Po 48-hodinovej adaptačnej fáze sa zaznamená úmrtnosť a uplatnia tieto kritériá:
Ryby použité v testoch by mali byť bez zjavných chorôb a abnormalít. Všetky choré ryby treba zlikvidovať. Počas dvoch týždňov predchádzajúcich testu alebo počas testu by ryby nemali byť ošetrované v súvislosti s ochorením. VYKONANIE TESTU Predbežná skúška Môže byť užitočné vykonať predbežný pokus v záujme optimalizácie podmienok hlavného testu ako napr. výber koncentrácie(-í) testovanej látky, dĺžka vychytávacej a depuračnej fázy alebo určenie potreby vykonať celý test, príp. iba jeho časť. Predbežná skúška by sa mala navrhnúť tak, aby bolo možné získať požadované informácie. Možno zvážiť aj to, či bude na stanovenie BCF stačiť minimálny test, alebo treba vykonať úplnú štúdiu (pozri body 83 až 95 o minimálnom teste). Podmienky expozície Dĺžka vychytávacej fázy Prognózu dĺžky vychytávacej fázy možno získať z praktických skúseností (napr. z predchádzajúcej štúdie alebo zo súhrnnej štúdie látok s podobnou štruktúrou) alebo na základe istých empirických vzťahov vychádzajúcich buď z poznatkov o rozpustnosti vo vodnom prostredí alebo o rozdeľovacom koeficiente oktanol/voda testovanej látky (za predpokladu, že sa vychytávanie riadi kinetikou prvého rádu, pozri dodatok 5). Vychytávacia fáza by mala trvať 28 dní, ak sa nepreukáže, že ustálený stav bol dosiahnutý skôr (pozri dodatok 1, definície a jednotky). Ustálený stav nastane, ak sa na grafickom znázornení závislosti obsahu testovanej látky v rybe (Cf) od času stane daná krivka rovnobežnou s osou času a tri po sebe idúce analýzy Cf na vzorkách odobratých minimálne v dvojdňových intervaloch sa od seba neodlišujú o viac ako ± 20 % a ak v čase medzi prvou a poslednou z po sebe idúcich analýz nedošlo k žiadnemu výraznému zvýšeniu hodnoty Cf. Pri analyzovaní hromadných vzoriek sa musia vykonať najmenej štyri po sebe idúce analýzy. Pri testovaných látkach, ktoré sú vychytávané pomaly, je primeranejším intervalom sedem dní. Ak sa ustálený stav do 28 dní nedosiahne, tak sa buď vypočíta BCF použitím iba kinetického prístupu, ktorý nezávisí od dosiahnutia ustáleného stavu, alebo sa môže predĺžiť vychytávacia fáza, pričom až do dosiahnutia ustáleného stavu, alebo počas 60 dní, podľa toho, čo nastane skôr, sa uskutočňujú ďalšie merania. Takisto koncentrácia testovanej látky v rybe musí byť na konci vychytávacej fázy dostatočne vysoká, aby sa zabezpečil spoľahlivý odhad k 2 z depuračnej fázy. Ak sa po 28 dňoch nepreukáže žiadne významné vychytávanie, test sa môže ukončiť. Dĺžka depuračnej fázy V prípade látok, ktoré sa riadia kinetikou prvého rádu, na dosiahnutie primeraného zníženia (napríklad 95 %) zaťaženia organizmu testovanou látkou obyčajne postačuje polovičná dĺžka vychytávacej fázy (vysvetlenie k tomu odhadu je uvedené v dodatku 5). Ak je čas potrebný na 95 % vylúčenie testovanej látky z praktického hľadiska pridlhý a je napríklad dva razy dlhší ako trvanie vychytávacej fázy (t. j. viac ako 56 dní), potom možno použiť kratšie obdobie (napríklad kým koncentrácia testovanej látky nebude nižšia ako 10 % koncentrácie v ustálenom stave). Pri látkach s komplexnejšími vzorcami vychytávania a depurácie ako v prípade modelu ryby s jedným kompartmentom, ktorý sa riadi kinetikou prvého rádu, sa však pravdepodobne budú musieť použiť dlhšie depuračné časy. Ak sú takéto komplexné vzorce pozorované a/alebo očakávané, odporúča sa zabezpečenie náležitého skúšobného nastavenia konzultovať s bioštatistikom a/alebo farmakokinetikom. Pri predlžovaní depuračnej fázy sa môže znižovať počet rýb na výber vzorky, pričom na výsledky môžu mať vplyv rozdiely v raste rýb. Toto obdobie bude sprevádzané ďalším obdobím, počas ktorého zostáva koncentrácia testovanej látky v rybách nad úrovňou analytického kvantifikačného limitu. Počty testovaných rýb Počty rýb na každú testovanú koncentráciu voľte tak, aby boli na každom mieste odberu vzoriek k dispozícii najmenej štyri ryby. Ryby by sa mali spájať do skupiny iba v prípade, že ich nemožno analyzovať samostatne. Ak sa chce dosiahnuť vyššia presnosť kreslenia krivky (a vypočítaných parametrov), alebo ak sú potrebné metabolické štúdie (napr. na účely odlíšenia metabolitov od materskej látky pri použití testovaných látok označených rádioaktívnym izotopom), bude musieť byť na každom mieste odberu viac rýb. Obsah lipidov by sa mal stanovovať v rovnakom biologickom materiáli, aký sa použil na stanovenie koncentrácie testovanej látky. Ak to nie je možné, môže byť potrebných viac rýb (pozri body 56 a 57). Ak sa použijú dospelé (t. j. pohlavne zrelé) ryby, nemali by byť pred ani počas testu v štádiu neresenia alebo po nedávnom oplodnení (t. j. po neresení). Malo by sa tiež uviesť, či sú na pokus použité samce, samice alebo obe pohlavia. Pri použití oboch pohlaví by sa mali zaznamenávať rozdiely v raste a obsahu lipidov medzi pohlaviami s cieľom vylúčiť ich markantnosť, a to pred začiatkom expozície, zvlášť vtedy, ak sa predpokladá, že bude nevyhnutné samce a samice rýb umiestniť spoločne na zaručenie stanoviteľnosti koncentrácií látky a/alebo obsahu lipidov. Pri akomkoľvek teste vyberajte ryby podobnej hmotnosti tak, aby hmotnosť najmenšej z nich nebola menšia ako dve tretiny hmotnosti tej najväčšej. Všetky musia mať rovnaký vek a pochádzať z toho istého zdroja. Keďže vek a hmotnosť môžu výrazne ovplyvniť hodnoty BCF (12), mali by sa údaje o nich presne zaznamenať. Odporúča sa krátko pred začatím testu odvážiť časť vzorky populácie rýb, aby sa odhadla priemerná hmotnosť (pozri bod 61). Násada Mal by sa použiť vysoký pomer množstva vody k množstvu rýb tak, aby sa minimalizovalo znižovanie koncentrácie testovanej zlúčeniny vo vode spôsobené pridaním rýb na začiatku testu a aby sa zabránilo poklesu koncentrácie rozpusteného kyslíka. Je dôležité, aby veľkosť násady zodpovedala použitému druhu rýb. V každom prípade sa však odporúča zvyčajná veľkosť násady v rozmedzí 0,1 do 1,0 g ryby (vlhká hmotnosť) na liter vody za deň. Možno použiť aj vyšší pomer množstva vody k množstvu rýb, ak možno zabezpečiť udržiavanie požadovanej koncentrácie testovanej látky v rozmedzí povolených výkyvov ± 20 % a koncentrácia rozpusteného kyslíka pritom neklesne pod 60 % saturácie (pozri bod 24). Pri výbere primeraných režimov nasadzovania vezmite do úvahy bežné prirodzené prostredie daného druhu. Napríklad ryby žijúce pri dne môžu v porovnaní s druhmi žijúcimi pri hladine vyžadovať väčšiu plochu dna nádrže pri rovnakom objeme vody. Kŕmenie Počas aklimatizačnej a testovacej fázy kŕmte ryby vhodnou potravou so známym obsahom lipidov a celkovým obsahom bielkovín v množstve dostatočnom na udržanie rýb v dobrom zdravotnom stave a pri stabilnej telesnej hmotnosti (určitý nárast hmotnosti je povolený). Počas aklimatizačnej a testovacej fázy ich kŕmte denne dávkou stanovenou v závislosti od použitých druhov, experimentálnych podmienok a kalorickej hodnoty potravy (napríklad v prípade pstruha dúhového približne medzi 1 až 2 % telesnej hmotnosti denne). Kŕmne dávky treba zvoliť tak, aby sa zabránilo rýchlemu rastu a prílišnému zvýšeniu obsahu lipidov. V snahe zachovať kŕmne dávky by sa podľa potreby, napr. raz týždenne, malo množstvo krmiva opätovne prepočítať. Na účely takéhoto výpočtu možno hmotnosť rýb nachádzajúcich sa v každej testovacej komore odhadnúť na základe hmotnosti rýb odobratých z danej komory pri poslednom odbere vzoriek. Neodporúča sa váženie rýb, ktoré zostávajú v pokusnej komore. Neskonzumovaná potrava a výkaly by sa mali z testovacej komory denne odsávať, a to krátko po skončení kŕmenia (do 30 minút až jednej hodiny). Testovacie komory by sa počas celého testu mali udržiavať v čo najčistejšom stave, aby sa pokiaľ možno čo najviac minimalizovala koncentrácia organickej hmoty (pozri bod 29), keďže prítomnosť organického uhlíka môže obmedzovať biodostupnosť testovanej látky (12). Keďže mnohé krmivá obsahujú rybiu múčku, malo by sa zabezpečiť, aby krmivo neovplyvňovalo výsledky testu, ani nevyvolávalo nepriaznivé účinky napr. obsahom (zvyškov) pesticídov, ťažkých kovov a/alebo samotnej testovanej látky. Svetlo a teplota Odporúča sa fotoperióda v rozpätí od 12 do 16 hodín, pričom teplota (± 2 °C) by mala byť vhodná pre dané testované druhy (pozri dodatok 3). Mal by byť známy typ osvetlenia a jeho vlastnosti Treba zachovávať opatrnosť z hľadiska možnej fototransformácie testovanej látky pod vplyvom svetelných podmienok štúdie. Treba udržiavať primerané osvetlenie, aby sa ryby nevystavovali účinkom neprirodzených fotoproduktov. V niektorých prípadoch môže byť potrebné používať filter na elimináciu ultrafialového žiarenia s vlnovou dĺžkou nižšou ako 290 nm. Testované koncentrácie Tento test bol pôvodne navrhnutý pre nepolárne organické látky. Očakáva sa, že pri tomto type látok bude stačiť, ak sa ryba vystaví účinkom jedinej koncentrácie, keďže sa neočakávajú žiadne účinky koncentrácie. Príslušný regulačný rámec si však môže vyžadovať dve koncentrácie. Ak sa testujú látky, ktoré nepatria do tejto oblasti, alebo ak sú známe iné znaky možnej závislosti od koncentrácie, test by sa mal uskutočniť s dvomi alebo viacerými koncentráciami. Ak sa testuje iba jedna koncentrácia, malo by sa použitie jednej koncentrácii odôvodniť (pozri bod 79). Testovaná koncentrácia by mala byť zároveň prakticky alebo technicky čo najnižšia (t. j. nie blízko limitu (maximálnej) rozpustnosti). V niektorých prípadoch možno očakávať, že biokoncentrácia látky bude závisieť od koncentrácie vo vode (napr. v prípade kovov, ktorých vychytávanie rybami možno aspoň čiastočne regulovať). V takom prípade treba testovať najmenej dve, no podľa možnosti viac koncentrácií (pozri bod 49), ktoré sú relevantné z hľadiska životného prostredia. Testovanie najmenej dvoch koncentrácií sa odporúča aj pri látkach s testovanými koncentráciami, ktoré musia byť z praktických dôvodov tesne pod hranicou maximálnej rozpustnosti, pretože to pomôže získať prehľad o spoľahlivosti expozičných koncentrácií. Výber testovaných koncentrácií by mal zahŕňať realistické koncentrácie v životnom prostredí, ako aj koncentrácie, ktoré majú pre toto špecifické hodnotenie význam. Koncentrácia, resp. koncentrácie testovanej látky by sa mali vyberať tak, aby boli nižšie ako hodnota ich chronického účinku alebo 1 % ich akútnej asymptotickej hodnoty LC50 a aby boli v rozpätí bežnom pre životné prostredie a minimálne rádovo vyššie ako limit ich kvantifikácie vo vode použitou analytickou metódou. Najvyššiu prípustnú testovanú koncentráciu možno stanoviť aj vydelením hodnoty akútnej 96-hodinovej LC50 príslušným pomerom akútnej/chronickej koncentrácie (napr. v prípade niektorých látok môže byť príslušný pomer okolo tri, inde aj viac ako 100). Ak sa použije druhá koncentrácia, mala by sa od prvej odlišovať o faktor desať. Ak to nedovoľuje kritérium toxicity (ktoré limituje vyššiu testovanú koncentráciu) a analytický limit (ktorý limituje nižšiu testovanú koncentráciu), môže sa použiť aj nižší faktor ako desať a zvážiť použitie testovanej látky označenej rádioaktívnym izotopom (najvyššej čistoty, podľa možnosti napr. > 98 %). Treba dbať na to, aby sa nepoužila koncentrácia prekračujúca maximálnu rozpustnosť testovanej látky v testovanom médiu. Kontroly Okrem sérií testov by sa mala vykonať aj jedna kontrola s vodou na riedenie, alebo v prípade potreby (pozri body 30 a 31) jedna kontrola s obsahom rozpúšťadla. Frekvencia meraní kvality vody Počas testu by sa vo všetkých testovacích a kontrolných nádobách mal zmerať obsah rozpusteného kyslíka, TOC, pH a teplota. Celkovú tvrdosť vody a (v prípade potreby) slanosť treba zmerať v kontrole, resp. kontrolách a v jednej nádobe. Ak sa testujú dve alebo viaceré koncentrácie, uvedené parametre merajte pri vyššej (alebo najvyššej) koncentrácii. Množstvo rozpusteného kyslíka a (v prípade potreby) slanosť by sa v priebehu vychytávacej fázy mali merať minimálne trikrát – na jej začiatku, približne v strede a na konci – a raz týždenne v priebehu depuračnej fázy. TOC by sa mal zmerať na začiatku testu (24 a 48 hodín pred spustením vychytávacej fázy) pred pridaním rýb a najmenej raz týždenne počas vychytávacej i depuračnej fázy. Teplota by sa mala merať a zaznamenávať denne, pH na začiatku a na konci každého obdobia a tvrdosť raz počas každého testu. Aspoň v jednej nádrži by sa malo zabezpečiť kontinuálne meranie teploty. Odber a analýza vzoriek rýb a vody Harmonogram odberu vzoriek rýb a vody Vzorky vody na stanovenie koncentrácie testovanej látky by sa z testovacích nádrží mali odobrať pred pridaním rýb a počas vychytávacej i depuračnej fázy. Vzorky vody by sa z nich mali odobrať pred kŕmením a v rovnakom čase ako vzorky rýb. Na zaručenie stabilných koncentrácií po nasadení rýb môže byť užitočný intenzívnejší odber vzoriek. Koncentrácie testovanej látky by sa mali určiť vo vychytávacej fáze, aby sa overil súlad s validačnými kritériami(bod 24). Ak sa analýzou vzoriek vody na začiatku depuračnej fázy preukáže, že testovaná látka nebola zistená, môže sa tým odôvodniť absencia ďalších meraní testovanej látky v testovanej a kontrolnej vode po zvyšok depuračnej fázy. V súvislosti s testovanou látkou by sa mali vzorky rýb v priebehu vychytávacej fázy odobrať najmenej päťkrát a v priebehu depuračnej fázy najmenej štyrikrát. Keďže v niektorých prípadoch nebude jednoduché vypočítať dostatočne presný odhad hodnoty BCF na základe tohto počtu vzoriek (najmä v prípadoch, ak počas vychytávacej a depuračnej fázy pôjde o inú ako jednoduchú kinetiku prvého rádu), odporúča sa odoberať vzorky v oboch fázach častejšie (pozri dodatok 4). Obsah lipidov by sa mal stanovovať aspoň na začiatku a na konci vychytávacej fázy a na konci depuračnej fázy, a to v rovnakom biologickom materiáli, aký sa použil na stanovenie koncentrácie testovanej látky. Ak to nie je možné, mali by sa odobrať vzorky aspoň z troch nezávislých rýb, aby sa stanovil obsah lipidov v každom z tých troch časov odberu. Počet rýb v každej nádrži by sa mal na začiatku pokusu zodpovedajúcim spôsobom upraviť (49). Ako alternatíva v prípade, že v kontrolnej skupine rýb (t. j. rýb zo zásobnej populácie) nebolo zistené žiadne významné množstvo testovanej látky, sa môže obsah lipidov testovať iba u rýb z kontrolnej skupiny, pričom sa analýza testovanej látky v testovanej skupine, resp. skupinách (a s ňou súvisiace hodnoty rýchlostnej konštanty vychytávania, rýchlostnej konštanty depurácie a BCF) môže upraviť tak, aby počas testu zohľadňovala zmeny obsahu lipidov v kontrolnej skupine (50). Uhynuté alebo choré ryby by sa nemali analyzovať ani na testovanú látku, ani na koncentráciu lipidov. Príklad prijateľného harmonogramu odberu vzoriek je uvedený v dodatku 4. Podobne možno vypočítať aj iné harmonogramy pomocou iných predpokladaných hodnôt KOW, z ktorých sa vypočíta expozičný čas potrebný na dosiahnutie 95 % vychytávania (výpočty sú uvedené v dodatku 5). Odber vzoriek vo fáze vychytávania by mal pokračovať až do dosiahnutia ustáleného stavu (pozri dodatok 1, definície a jednotky), alebo kým sa vychytávacia fáza neukončí iným spôsobom (po 28 alebo 60 dňoch, pozri body 37 a 38). Pred začatím depuračnej fázy by sa mali ryby premiestniť do čistých nádob. Odber a príprava vzoriek Vzorky vody na analýzu by sa mali odoberať napríklad odsávaním pomocou inertnej hadičky zo stredu testovacej komory. Biologicky nedostupná frakcia testovanej látky sa nedá vždy oddeliť od biodostupnej frakcie filtráciou či odstredením. Ak sa použije separačná metóda, mala by sa v skúšobnom protokole vždy odôvodniť alebo validovať vzhľadom na ťažkosti s biodostupnosťou (25). Najmä pri vysokohydrofóbnych látkach (t. j. látky s log KOW > 5) (12) (26), pri ktorých by mohlo dôjsť k ich adsorpcii na mriežku filtra alebo odstreďovacie nádoby, by sa vzorky nemali upravovať uvedenými spôsobmi. Namiesto toho by sa mali prijať opatrenia, ktorými sa zabezpečí, že nádrže zostanú v čo najväčšej miere čisté (pozri bod 46), pričom obsah celkového organického uhlíka by sa mal monitorovať tak vo vychytávacej, ako aj depuračnej fáze (pozri bod 53). Aby sa predišlo prípadným problémom so zníženou biodostupnosťou, mali by sa v prípade málorozpustných a vysokohydrofóbnych látok použiť na odber vzoriek techniky mikroextrakcie tuhej fázy. Ryby z odobratej vzorky by sa mali okamžite usmrtiť tým najvhodnejším a najhumánnejším spôsobom (pri meraniach celých rýb by sa okrem opláchnutia vodou (pozri bod 28) a dôkladného osušenia nemali vykonať žiadne ďalšie postupy). Ryby odvážte a odmerajte ich celkovú dĺžku (51). Pri každej jednej rybe by sa nameraná hmotnosť a dĺžka mala dať do súvislosti s koncentráciou analyzovanej látky (a v prípade potreby aj s obsahom lipidov), napr. označením každej ryby zo vzorky jedinečným identifikátorom. Voda aj ryby by sa mali analyzovať podľa možnosti ihneď po odbere, čím sa predíde degradácii alebo iným stratám a umožní výpočet približných rýchlostných konštánt vychytávania a depurácie v priebehu testu. Okamžitou analýzou sa predíde aj oddialeniu stanovenia dosiahnutia „plató“ (ustáleného stavu). Ak sa analýza neurobí okamžite, vzorky by sa mali vhodným spôsobom uskladniť. Pred začatím štúdie by sa mali získať informácie o správnom spôsobe skladovania v prípade danej testovanej látky – napríklad hlbokým zmrazením, udržiavaním pri teplote 4 °C, extrakciou atď. Dĺžka skladovania by sa mala zvoliť tak, aby látka počas skladovania nedegradovala. Kvalita analytickej metódy Celý postup v zásade závisí od správnosti, presnosti a citlivosti metódy použitej na analýzu testovanej látky. Treba preto experimentálne overiť, či sú správnosť, presnosť a reprodukovateľnosť analýzy látky, ako aj úroveň výťažnosti testovanej látky tak z vody, ako aj z rýb pri danej metóde uspokojivé. Malo to byť súčasťou predbežných testov. Zároveň treba overiť, či testovaná látka nie je prítomná v použitej vode na riedenie. V prípade potreby sa hodnoty koncentrácie testovanej látky vo vode a v rybách získané z testu opravia tak, aby zohľadňovali hodnoty výťažnosti a pozaďové hodnoty z kontrol. So vzorkami rýb aj vody by sa počas celého testovania malo zaobchádzať tak, aby sa minimalizovala kontaminácia a straty (vznikajúce napríklad v dôsledku adsorpcie na zariadenie slúžiace na odber vzoriek). Analýza vzoriek rýb V prípade použitia materiálov označených rádioaktívnym izotopom možno analyzovať celé množstvo označenej látky (t. j. materskú zlúčeninu a jej metabolity) alebo je možné vzorky prečistiť tak, aby sa materská látka dala analyzovať osobitne. Ak má BCF vychádzať z materskej látky, mali by sa minimálne na konci vychytávacej fázy určiť hlavné metabolity (pozri bod 6). Hlavné metabolity sú tie, ktoré predstavujú ≥ 10 % z celkového množstva rezíduí v tkanivách rýb, tie, ktoré predstavujú ≥ 5 % z dvoch za sebou nasledujúcich bodov odberu vzoriek, tie, ktoré vykazujú zvýšené hladiny vo vychytávacej fáze, ako aj tie, pri ktorých je známe toxikologické riziko. Ak hodnota BCF celých rýb vyjadrená z hľadiska celkového množstva rezíduí označených rádioaktívnym izotopom dosiahne ≥ 500, môže byť žiaduce – a v prípade určitých kategórií látok, ako sú pesticídy, sa to dôrazne odporúča – hlavné metabolity identifikovať a kvantifikovať. Kvantifikáciu týchto metabolitov môžu vyžadovať aj niektoré regulačné orgány. Po identifikácii a kvantifikácii degradačných produktov, ktoré predstavujú v rybích tkanivách ≥ 10 % celkového množstva rezíduí označených rádioaktivnym izotopom, sa odporúča aj ich identifikácia a kvantifikácia v testovanej vode. Ak to nie je možné, malo by sa to vysvetliť v protokole. Koncentráciu testovanej látky je zvyčajne potrebné stanoviť v každej jednej odváženej rybe. Ak to nie je možné, môžu sa pri každom odbere vzorky zhromaždiť napriek tomu, že sa tým obmedzia štatistické postupy, ktoré možno použiť pri spracúvaní údajov, a preto by mal byť do testu zaradený adekvátny počet rýb, ktorý umožní plánované zhromažďovanie vzoriek, štatistický postup a výpočet sily testu. Odkazy na literatúru (27) a (28) sa môžu použiť ako úvod k príslušným postupom zhromažďovania vzoriek. BCF by sa mal okrem vyjadrenia v podobe hodnoty vypočítanej priamo zo štúdie (pozri bod 21) aj normalizovať, a to podľa rýb s obsahom lipidov 5 % (podľa vlhkej hmotnosti), okrem prípadov, keď možno tvrdiť, že testovaná látka sa neakumuluje primárne v lipidoch. Ak je to možné, mal by sa obsah lipidov v rybách stanoviť pri každom odbere vzoriek, najlepšie z rovnakého extraktu, ktorý bol pripravený na analýzu testovanej látky, pretože lipidy sa musia často z extraktu odstrániť skôr, ako ich bude možné analyzovať chromatografiou. Analýza testovaných látok si však často vyžaduje špecifické extrakčné postupy, ktoré by mohli byť v rozpore s testovacími metódami na stanovovanie lipidov. V takom prípade (kým nebudú k dispozícii vhodné nedeštruktívne inštrumentálne metódy) sa odporúča použiť inú stratégiu stanovenia obsahu lipidov v rybách (pozri bod 56). Na stanovenie obsahu lipidov by sa mali použiť vhodné metódy (20). Ako štandardnú metódu (30) je možné odporučiť techniku extrakcie chloroformom/metanolom (29), no ako alternatívna technika sa odporúča aj Smedesova metóda (31). Táto metóda je charakterizovaná porovnateľnou účinnosťou extrakcie, vysokou mierou správnosti, používaním menej toxických organických rozpúšťadiel a jednoduchým postupom. Môžu sa použiť aj iné metódy, ktorých správnosť možno spoľahlivo porovnať s odporúčanými metódami, ich použitie však treba riadne odôvodniť. Je dôležité uviesť podrobné informácie o použitej metóde. Meranie rastu rýb Na začiatku testu sa musí jednotlivo odvážiť päť až desať rýb zo zásobnej populácie a zmerať ich celková dĺžka. Môže ísť o tie isté ryby, ktoré sa použili na analýzu lipidov (pozri bod 56). Hmotnosť a dĺžka rýb použitých pre každý prípad odberu vzoriek z testovaných i kontrolných skupín by sa mali merať pred chemickou a analýzou obsahu lipidov. Merania na týchto vzorkách rýb možno použiť na odhad hmotnosti a dĺžky rýb, ktoré zostanú v testovacích a kontrolných nádržiach (pozri bod 45). ÚDAJE A PREZENTOVANIE VÝSLEDKOV Spracovanie výsledkov Vychytávacia krivka testovanej látky by sa mala získať grafickým znázornením koncentrácie v/na rybách (alebo určenom tkanive) počas vychytávacej fázy v závislosti od času na aritmetických osiach. Ak krivka dosiahne plató, t. j. ak sa stane približne asymptotická k časovej osi, potom možno hodnotu BCF v ustálenom stave (BCFSS) vypočítať takto:
Vývoj hodnoty Cf môže byť ovplyvnený rastom rýb (pozri body 72 a 73). Priemerná expozičná koncentrácia (CW) je ovplyvňovaná zmenami v čase. Možno očakávať, že časovo vážený priemer koncentrácií je pri štúdiách bioakumulácie presnejší a relevantnejší aj vtedy, keď je odchýlka v primeranom validačnom rozsahu (pozri bod 24). Časovo vážený priemer (TWA) koncentrácie vo vode sa môže vypočítať podľa oddielu 1 v dodatku 5. Kinetický biokoncentračný faktor (BCFK) by sa mal stanoviť ako pomer k 1/k 2, t. j. rýchlostných konštánt kinetiky prvého rádu. Rýchlostné konštanty k 1 a k 2, ako aj hodnota BCFK sa môžu vypočítať súčasným dosádzaním hodnôt vychytávacej i depuračnej fázy. Ako alternatíva možno hodnoty k 1 a k 2 možno určiť aj sekvenčne (opis a porovnanie týchto metód sú uvedené v dodatku 5). Rýchlostná konštanta depurácie (k 2) si môže vyžadovať opravu tak, aby zohľadňovala znižovanie koncentrácie látky vplyvom rastu (pozri body 72 a 73). Ak sa vychytávacia a/alebo depuračná krivka zjavne neriadi kinetikou prvého rádu, mali by sa použiť komplexnejšie modely (pozri dodatok 5 a poraďte sa s bioštatistikom a/alebo s farmakokinetikom). Údaje o hmotnosti/dĺžke rýb Vlhká hmotnosť a celková dĺžka jednotlivých rýb pri všetkých intervaloch odberu vzoriek vo vychytávacej a depuračnej fáze sa uvedú do tabuľky zvlášť pre testovanú a zvlášť pre kontrolnú skupinu (vrátane zásobnej populácie určenej na začiatok vychytávania). Pri každej jednej rybe by sa nameraná hmotnosť a dĺžka mali dať do súvislosti s koncentráciou analyzovanej chemikálie napr. označením každej ryby zo vzorky jedinečným identifikátorom. Preferovaným meradlom rastu na účely opravy hodnôt kinetického BCF tak, aby zohľadňovali znižovanie koncentrácie látky vplyvom rastu (metóda opravy údajov na základe znižovania koncentrácie látky vplyvom rastu ryby je uvedená v bode 73 a v dodatku 5), je hmotnosť. Oprava na základe znižovania koncentrácie látky vplyvom rastu a normalizácia lipidov Rast rýb počas depuračnej fázy môže znížiť merané chemické koncentrácie v rybách, a tým spôsobiť, že celková hodnota rýchlostnej konštanty depurácie (k 2) bude vyššia ako pri samotných procesoch odbúravania (napr. dýchaním, metabolizmom, vylúčením). Kinetické biokoncentračné faktory by sa mali opraviť tak, aby zohľadňovali znižovanie koncentrácie látky vplyvom rastu. Rast ovplyvňuje aj hodnotu BCFSS, neexistuje však žiadny schválený postup na opravu hodnoty BCFSS podľa rastu. V prípadoch výrazného rastu by sa mala vypočítať aj hodnota BCFK opravená o rast (BCFKg), pretože môže byť vhodnejším meradlom ako biokoncentračný faktor. Obsah lipidov v testovaných rybách (ktorý úzko súvisí s bioakumuláciou hydrofóbnych látok) môže v skutočnosti kolísať tak, že bude potrebné normalizovať stanovený obsah lipidov v rybách (5 % hm.), aby bolo možné zmysluplne získať tak kinetický, ako aj ustálený biokoncentračný faktor, okrem prípadov, keď možno tvrdiť, že testovaná látka sa neakumuluje primárne v lipidoch (napr. niektoré perfluórované látky sa môžu viazať na proteíny). Rovnice a príklady týchto výpočtov sú uvedené v dodatku 5. Na účely opravy hodnoty kinetického BCF tak, aby zohľadňovala znižovanie koncentrácie látky vplyvom rastu, by sa podobne mala opraviť aj rýchlostná konštanta depurácie. Hodnota rýchlostnej konštanty depurácie opravená o rast (k 2g) sa vypočíta odpočítaním hodnoty rýchlostnej konštanty rastu (k g, získanej z nameraných údajov o hmotnosti) od celkovej hodnoty rýchlostnej konštanty depurácie (k 2). Následne sa vypočíta hodnota kinetického biokoncentračného faktora opravená o rast, a to vydelením hodnoty rýchlostnej konštanty vychytávania (k 1) hodnotou rýchlostnej konštanty depurácie opravenej o rast (k 2g) (pozri dodatok 5). Tento postup však neplatí vo všetkých prípadoch. Napríklad v prípade látok s veľmi pomalou depuráciou testovaných u rýchlorastúcich rýb môže byť vypočítaná hodnota k 2g príliš malá, takže chyba v dvoch rýchlostných konštantách použitých na jej výpočet sa stane kritickou a spôsobí, že v niektorých prípadoch môžu byť odhady k g vyššie ako k 2. V alternatívnom postupe, ktorým sa dá vyhnúť potrebe opravovať hodnoty o znižovanie koncentrácie látky vplyvom rastu, sa používajú hmotnostné údaje o depurácii testovanej látky za každú rybu (celú rybu) namiesto bežných hmotnostných údajov o testovanej látke (koncentrácii) na jednotku hmotnosti ryby. To sa dá ľahko dosiahnuť, keďže v skúškach podľa tejto testovacej metódy by sa zaznamenané údaje o koncentrácii v tkanivách mali vzťahovať na individuálne hmotnosti rýb. Jednoduchý návod je uvedený v dodatku 5. Pripomíname, že hodnota k 2 by sa mala zaznamenávať aj vtedy, keď sa použije alternatívny postup. Kinetický biokoncentračný faktor a ustálený biokoncentračný faktor by sa mali zaznamenávať aj vo vzťahu k štandardnému 5 % (hm.) obsahu lipidov v rybách, okrem prípadov, keď možno tvrdiť, že testovaná látka sa neakumuluje primárne v lipidoch. Údaje o koncentráciách v rybách alebo o BCF sa normalizujú podľa pomeru medzi 5 % a skutočným (individuálnym) priemerom obsahu lipidov (v % vlhkej hmotnosti) (pozri dodatok 5). Ak boli chemické analýzy a analýzy obsahu lipidov vykonané na tej istej rybe, tak by sa na výpočet hodnoty BCF s normalizovanými lipidmi mali použiť normalizované individuálne údaje o lipidoch v rybách. Ako alternatíva sa v prípade podobného rastu kontrolných a exponovaných rýb môže na opravu o lipidy použiť iba obsah lipidov v rybách z kontrolnej skupiny (pozri bod 56). Metóda výpočtu hodnoty BCF s normalizovanými lipidmi je uvedená v dodatku 5. Interpretácia výsledkov V prípadoch, v ktorých sa koncentrácie testovaných roztokov pohybujú na úrovni blízkej detekčnému limitu analytickej metódy, treba interpretovať výsledky s veľkou opatrnosťou. Priemerný rast v testovanej i kontrolnej skupine by sa v zásade nemali výrazne odlišovať, aby sa vylúčili toxické účinky. Rýchlostné konštanty rastu alebo rastové krivky v oboch skupinách by sa mali vhodným spôsobom porovnať (52). Jasne vymedzené krivky vychytávania a depurácie svedčia o dobrej kvalite údajov o biokoncentrácii. V prípade rýchlostných konštánt by mal výsledok χ2 testu dobrej zhody svedčiť o vhodnosti ]t. j. o malom percente chýb v meraní (32)] bioakumulačného modelu, takže rýchlostné konštanty by sa dali považovať za spoľahlivé (pozri dodatok 5). Ak sa použije viac ako jedna testovaná koncentrácia, mali by byť odchýlky konštánt vychytávania/depurácie medzi testovanými koncentráciami menšie ako 20 % (53). Ak nie sú, môže to svedčiť o závislosti od koncentrácie. Významné rozdiely zistené v rýchlostných konštantách vychytávania/depurácie medzi dvoma použitými testovanými koncentráciami by sa mali zaznamenať a podľa možnosti vysvetliť. Hranica 95 % spoľahlivosti hodnôt BCF sa v prípade dobre navrhnutých štúdií dosahuje vo všeobecnosti ± 20 % vypočítanej hodnoty BCF. Ak sa testujú dve alebo viaceré koncentrácie, na zistenie konzistentnosti výsledkov a prípadnej závislosti od koncentrácie sa použijú výsledky oboch, príp. všetkých koncentrácií. Ak je na účely zníženia počtu použitých zvierat a/alebo zdrojov testovaná iba jedna koncentrácia, malo by sa použitie jednej koncentrácie zdôvodniť. Výsledná hodnota BCFSS je neistá v prípade, že je hodnota BCFK podstatne vyššia ako hodnota BCFSS, keďže to môže svedčiť buď o nedosiahnutí ustáleného stavu, alebo o tom, že znižovanie koncentrácie látky vplyvom rastu a procesy vylučovania neboli zohľadnené. Ak je hodnota BCFSS oveľa vyššia ako hodnota BCFK, mali by sa výpočty rýchlostných konštánt vychytávania a depurácie skontrolovať a prehodnotiť. Iný postup dosadzovania hodnôt by mohol zlepšiť odhadovanú výslednú hodnotu BCFK (pozri dodatok 5). Skúšobný protokol Okrem informácií o testovanej látke uvedených v bode 3 by skúšobný protokol mal obsahovať tieto informácie:
C.13 – II: Minimalizovaná skúška expozície rýb vo vodnom prostredí ÚVOD Z pribúdajúcich skúseností s vykonávaním a interpretáciou úplných testov, ktoré nadobudli tak regulačné orgány, ako aj laboratóriá vyplýva, že pri určovaní rýchlostných konštánt vychytávania a depurácie platí, až na niektoré výnimky, kinetika prvého rádu. Preto možno rýchlostné konštanty vychytávania a depurácie určiť s minimálnym počtom odberu vzoriek a pritom vypočítať hodnotu kinetického BCF. Pôvodným zámerom preskúmania alternatívnych návrhov štúdií BCF bolo vymyslieť minimalizovaný test, ktorý by sa používal ako postupový test na vyvrátenie alebo potvrdenie odhadov hodnoty BCF vychádzajúcich z KOW a kvantitatívneho vzťahu štruktúry a aktivity (QSAR), a tým eliminovať potrebu úplnej štúdie v prípade mnohých látok a minimalizovať náklady a používanie zvierat znížením počtu odberov vzoriek a sekvenčných analýz. Cieľom bolo na základe hlavného návrhu predchádzajúcej testovacej metódy umožniť prepojenie výsledkov testu s existujúcimi hodnotami BCF a uľahčiť vykonávanie testov a interpretáciu údajov, a tak získať odhady BCF, ktoré by boli dostatočne správne a presné na účely prijímania rozhodnutí o hodnotení rizík. Aj v tomto prípade platia mnohé z pravidiel uplatňovaných pri úplnom teste, napr. validačné kritériá (pozri bod 24) a zastavenie testu na konci vychytávacej fázy, ak je pozorované nedostatočné vychytávanie (pozri body 16 a 38). Látky, ktoré by boli vhodné na použitie pri minimalizovanom teste, by mali patriť do všeobecnej skupiny, pre ktorú bola táto testovacia metóda vyvinutá, t. j. nepolárne organické látky (pozri bod 49). Ak existuje akýkoľvek náznak, že sa látka, ktorá sa má testovať, môže správať inak (napr. zjavne sa odchýliť od kinetiky prvého rádu), mal by sa na účely regulácie vykonať úplný test. Minimalizovaná skúška obyčajne netrvá kratšie ako štandardný BCF test, nevyžaduje si však toľko odberov vzoriek (vysvetlenie je uvedené v dodatku 6). Depuračná fáza sa však v prípade rýchle sa vylučujúcich látok môže skrátiť, aby sa zabránilo koncentráciám v rybách, ktoré pred koncom testu nedosiahnu detekčný/kvantifikačný limit. Na základe minimalizovaného testu expozície rýb s jednou koncentráciou možno zistiť potrebu uskutočniť úplný test a v prípade, že sú výsledné údaje použité na výpočet rýchlostných konštánt a hodnoty BCF spoľahlivé (pozri bod 93), nemusí sa vykonať úplný test, ak výsledná hodnota BCF ani zďaleka nedosahuje predpísané rizikové hodnoty. V niektorých prípadoch môže byť výhodné použiť návrh minimalizovanej skúšky s viac ako jednou testovanou koncentráciou ako predbežný test na zistenie, či sú odhady hodnôt BCF pre danú látku závislé od koncentrácie. Ak odhady hodnôt BCF z minimalizovanej skúšky vykazujú závislosť od koncentrácie, bude potrebné vykonať úplný test. Ak na základe takejto minimalizovanej skúšky nie sú odhady hodnôt BCF závislé od koncentrácie, no výsledky sa nepovažujú za konečné, potom by sa každý nasledujúci úplný test mohol vykonať s jednou koncentráciou, čím by sa znížil počet použitých zvierat v porovnaní s úplným testom s dvomi (alebo viacerými) koncentráciami. Látky, ktoré by boli vhodné na použitie pri minimalizovanej skúške, by mali:
HARMONOGRAM ODBERU VZORIEK PRI ŠTÚDIÁCH S NÁVRHOM MINIMALIZOVANEJ SKÚŠKY Odber vzoriek rýb Odber vzoriek rýb je zredukovaný na štyri miesta odberu vzoriek:
Odber vzoriek vody Pri minimalizovanom návrhu testu sa vzorky odoberajú ako pri úplnom teste (pozri bod 54) alebo aspoň v piatich intervaloch rovnomerne rozdelených počas vychytávacej fázy a týždenne počas depuračnej fázy. Úpravy návrhu testu Po zohľadnení vlastností testovanej látky, platných prognóz QSAR a špecifického účelu štúdie je možné zvážiť niekoľko úprav návrhu testu:
Výpočty Podstatou použitia tohto prístupu je, že biokoncentračný faktor možno v úplnom teste stanoviť buď ako ustálený biokoncentračný faktor (BCFSS), a to výpočtom pomeru koncentrácie testovanej látky v rybom tkanive ku koncentrácii testovanej látky vo vode, alebo ako výpočet hodnoty kinetického biokoncentračného faktora (BCFK) z pomeru rýchlostnej konštanty vychytávania k 1 k rýchlostnej konštante depurácie k 2. Hodnota BCFK je platná aj vtedy, ak sa počas vychytávacej fázy nedosiahne ustálená koncentrácia látky, a to za predpokladu, že sa vychytávanie a depurácia riadia približne procesmi kinetiky prvého rádu. Ako absolútne minimum sa na odhad rýchlostných konštánt vychytávania a depurácie vyžadujú dva odbery vzoriek – jeden na konci vychytávacej fázy (t. j. na začiatku depuračnej fázy) a jeden na konci (alebo po dostatočne dlhom trvaní) depuračnej fázy. Na kontrolu kinetiky vychytávania a depurácie sa odporúča uprostred spomínaných dvoch odberov urobiť ešte jeden odber (57). Výpočty sú uvedené v dodatkoch 5 a 6. Interpretácia výsledkov Ak chcete posúdiť platnosť a informačnú hodnotu testu, presvedčte sa, že depuračná fáza presiahla jeden polčas. Okrem toho by sa mala porovnať hodnota BCFKm (kinetický BCF vypočítaný pri minimalizovanom teste) s minimalizovanou hodnotou BCFSS (ide o hodnotu BCFSS vypočítanú na konci vychytávacej fázy za predpokladu dosiahnutia ustáleného stavu. Ide len o predpoklad, pretože počet odberov vzoriek nestačí na jeho potvrdenie). Ak je hodnota BCFKm < minimalizovaná hodnota BCFSS, preferovanou hodnotu by mala byť minimalizovaná hodnota BCFSS. Ak je hodnota BCFKm menšia ako 70 % minimalizovanej hodnoty BCFSS, výsledky nie sú platné a mal by sa vykonať úplný test. Ak je hodnota BCFKm dosiahnutá minimalizovanou skúškou blízko ktorejkoľvek rizikových hodnôt z hľadiska regulácie, mal by sa vykonať úplný test. Ak je výsledok ďaleko od ktorejkoľvek z predpísaných rizikových hodnôt (ďaleko vyšší alebo nižší), úplný test nemusí byť potrebný, príp. sa môže vykonať úplný test s jednou koncentráciou, ak sa to vyžaduje v príslušnom regulačnom rámci. Ak sa po minimalizovanej skúške s jednou koncentráciou zistí, že treba vykonať úplný test, môže sa vykonať s druhou koncentráciou. Ak sú výsledky konzistentné, nemusí sa ďalej vykonať úplný test s odlišnou koncentráciou, pretože sa neočakáva závislosť biokoncentrácie látky od koncentrácie. Ak sa vykonala minimalizovaná skúška s dvomi koncentráciami a jej výsledky nepreukážu závislosť od koncentrácie, celá skúška sa môže vykonať iba s jednou koncentráciou (pozri bod 87). Skúšobný protokol Skúšobný protokol k minimalizovanej skúške by mal obsahovať všetky informácie požadované v prípade úplného testu (pozri bod 81), okrem tých, ktoré nie je možné spracovať (t. j. krivka závislosti času na dosiahnutie ustáleného stavu od ustáleného biokoncentračného faktoru; namiesto ustáleného biokoncentračného faktoru by sa mala uviesť minimalizovaná hodnota BCFSS). Okrem toho by mal obsahovať aj odôvodnenie použitia minimalizovanej skúšky a výslednú hodnotu BCFKm. C.13 – III: Test biokoncentrácie u rýb s expozíciou z potravy ÚVOD Metóda opísaná v tomto oddiele by sa mala používať v prípade látok, ktoré nie sú vhodné pre metódu expozície vo vodnom prostredí (napr. preto, že nie je možné udržať stabilné, merateľné koncentrácie vo vode alebo dosiahnuť primerané celkové zaťaženie organizmu za 60 dní expozície; pozri predchádzajúce oddiely o metóde expozície vo vodnom prostredí). Treba si však uvedomiť, že konečným parametrom bude pri tejto skúške potravový biomagnifikačný faktor (BMF) a nie biokoncentračný faktor (BCF) (58). V máji 2001 bola na konferencii SETAC Europe v Madride predstavená nová metóda testovania bioakumulácie v prípade slabo rozpustných organických látok (36). Táto práca vychádza z rôznych štúdií bioakumulácie publikovaných v odbornej literatúre a využíva metódu dávkovania potravy obohatenej o testovanú látku (napr. 37). Začiatkom roka 2004 bol pracovnej skupine EÚ PBT spolu s podpornými dokumentmi (39) predložený návrh protokolu (38) merania bioakumulačného potenciálu slabo rozpustných organických látok, ktoré nie sú vhodné pre štandardnú metódu vodnej expozície. Ďalším argumentom v prospech tejto metódy bolo, že k možnej expozícii životného prostredia účinkom týchto slabo rozpustných látok (t. j. s hodnotou log KOW > 5) dochádza prevažne z potravy [pozri (40) (41) (42) (43) (44)]. Preto sa v niektorých predpisoch týkajúcich sa chemikálií uvádzajú aj skúšky expozície z potravy (59). Treba si však uvedomiť, že v rámci tu opísanej metódy je potrebné dôsledne sa vyhýbať expozícii vo vodnej fáze, preto hodnotu BMF z tejto testovacej metódy nemožno priamo porovnať s hodnotou BMF zo skúšok v teréne (kde je možné kombinovať expozíciu vo vodnom prostredí s expozíciou z potravy). Tento oddiel opisovanej testovacej metódy vychádza zo spomínaného protokolu (38) a je novou metódou, ktorá v predchádzajúcej verzii testovacej metódy C.13 nebola uvedená. Tento alternatívny test umožňuje priamo v kontrolovaných laboratórnych podmienkach preskúmať dráhu expozície z potravy. Potenciálni výskumní pracovníci by si mali naštudovať body 1 až 14 tejto testovacej metódy, aby získali informácie o tom, kedy je možné uprednostniť skúšku expozície z potravy pred skúškou expozície vo vodnom prostredí. K dispozícii sú aj informácie o rôznych koncentráciách látok, ktoré by sa mali zvážiť pred vykonaním testu. Použitie látok označených rádioaktívnymi izotopmi možno zvážiť podobne ako pri metóde expozície vo vodnom prostredí (pozri body 6 a 65). Metóda expozície z potravy sa môže použiť na testovanie viac ako jednej látky iba jedným testom, ak sú splnené určité kritériá; tie sú podrobnejšie rozobraté v bode 112. Pre zjednodušenie sa metodika, ktorá je tu opísaná, týka iba testu s jednou testovanou látkou. Skúška expozície z potravy sa v mnohých aspektoch podobá metóde expozície vo vodnom prostredí, s výnimkou zjavného rozdielu v dráhe expozície. Preto sa mnohé aspekty metódy, ktorá je tu opísaná, prekrývajú s metódou expozície vo vodnom prostredí opísanou v predchádzajúcom oddiele. Podľa možnosti sú uvádzané krížové odkazy na príslušné body v predchádzajúcom oddiele, no v záujme prehľadnosti a zrozumiteľnosti nebolo možné sa do istej miery vyhnúť duplicite. PRINCÍP TESTU Je možné použiť prietokové alebo polostatické podmienky (pozri odsek 4); prietokové podmienky sa odporúčajú na obmedzenie potenciálnej expozície testovanej látky z vody z dôvodu akejkoľvek desorpcie z obohatenej potravy alebo výkalov. Test pozostáva z dvoch fáz: vychytávacej (krmivo obohatené o testovanú látku) a depuračnej (čisté, neupravené krmivo) (pozri bod 16). Počas vychytávacej fázy sa „testovanej“ skupine rýb denne podáva presne určená dávka komerčného krmiva so známym zložením, ktoré je obohatené o testovanú látku. V ideálnom stave zožerú ryby všetku podávanú potravu (pozri bod 141). V priebehu depuračnej fázy sa potom ryby kŕmia čistým, neupraveným komerčným krmivom pre ryby. Pokiaľ ide o metódu expozície vo vodnom prostredí, môže sa v prípade potreby použiť viac ako jedna testovaná skupina s viacerými koncentráciami obohatenými o testovanú látku, ale pre väčšinu vysoko hydrofóbnych organických látok stačí jedna testovaná skupina (pozri body 49 a 107). Ak sa použijú polostatické podmienky, mali by sa ryby na konci vychytávacej fázy premiestniť do nového média a/alebo novej testovacej komory (pre prípad, že médium a/alebo testovacie zariadenia používané vo fáze vychytávania boli kontaminované testovanou látkou vyplavovaním). Počas oboch fáz testu sa merajú koncentrácie testovanej látky v rybách. Okrem skupiny rýb, ktorým sa podáva obohatené krmivo (testovaná skupina), je v podobných podmienkach držaná aj kontrolná skupina rýb, ktorá sa kŕmi rovnakým spôsobom, ale bez obohatenia komerčného krmiva pre ryby testovanou látkou. Táto kontrolná skupina umožňuje kvantifikovať pozaďové úrovne testovanej látky v neexponovaných rybách a slúži ako porovnanie akýchkoľvek nežiaducich účinkov vyvolaných pridaním testovanej látky v testovanej skupine, resp. skupinách (60). Zároveň umožňuje porovnať rýchlostné konštanty rastu medzi skupinami ako kontrola, či boli skonzumované rovnaké množstvá podanej potravy (pri vysvetľovaní rozdielov v rýchlostných konštantách rastu by sa mali zvážiť aj rozdiely v chuti jednotlivých druhov krmív; pozri bod 138). Tak vo vychytávacej, ako aj depuračnej fáze je dôležité, aby sa testovaná a kontrolná skupina kŕmili potravou vyváženej výživovej hodnoty. Podľa navrhovateľov metódy je vychytávacia fáza v trvaní 7 až 14 dní vo všeobecnosti postačujúca (38) (39). Takéto trvanie by malo minimalizovať náklady na vykonanie testu, a pritom stále zaručovať dostatočnú expozíciu pri väčšine látok. V niektorých prípadoch je však možné vychytávaciu fázu predĺžiť (pozri bod 127). Počas vychytávacej fázy nemusí koncentrácia látky v rybách dosiahnuť ustálený stav, preto spracovanie údajov a výsledky z tejto metódy obyčajne vychádzajú z kinetickej analýzy rezíduí v tkanivách. [Poznámka: Aj v tomto prípade možno použiť rovnice pre odhad času do dosiahnutia ustáleného stavu ako v skúške expozície vo vodnom prostredí – pozri dodatok 5). Depuračná fáza začína vo chvíli, keď sú ryby po prvýkrát kŕmené neobohatenou potravou a zvyčajne trvá maximálne 28 dní alebo do chvíle, kým už nie je možné testovanú látku kvantifikovať v celej rybe, podľa toho, čo nastane skôr. Depuračná fáza môže byť kratšia, ale aj dlhšia ako 28 dní, podľa toho, ako sa časom menia merané chemické koncentrácie a veľkosť rýb. Touto metódou sa v prípade testovanej látky v rybách môže stanoviť polčas špecifický pre danú látku (t 1/2, z rýchlostnej konštanty depurácie k 2), asimilačná účinnosť (absorpcia v črevách, a), kinetický potravový biomagnifikačný faktor (BMFK), kinetický potravový biomagnifikačný faktor opravený o rast (BMFKg) a kinetický potravový biomagnifikačný faktor opravený o lipidy (BMFKL) (61) (a/alebo kinetický potravový biomagnifikačný faktor opravený o rast a lipidy, BMFKgL). Tak ako v prípade metódy expozície vo vodnom prostredí, dôjde nárastom hmotnosti rýb počas skúšky k zriedeniu testovanej látky v rastúcich rybách, a tým aj k podhodnoteniu (kinetického) BMF, ak sa jeho hodnota neupraví o rast (pozri body 162 a 163). Navyše, ak sa zistí, že ustálený stav sa dosiahol vo vychytávacej fáze, je možné vypočítať orientačnú hodnotu ustáleného BMF. K dispozícii sú postupy, ktoré umožňujú odhad kinetického biokoncentračného faktora (BCFK) z údajov získaných zo skúšky expozície z potravy (napr. (44) (45) (46) (47) (48). Výhody a nevýhody takýchto prístupov sú opísané v dodatku 8. Táto skúška bola primárne navrhnutá pre slabo rozpustné nepolárne organické látky, ktorých vychytávanie a depurácia v rybách sa približne riadi procesmi kinetiky prvého rádu. V prípade testovanej látky, pri ktorej sa vychytávanie a depurácia neriadia približne procesmi kinetiky prvého rádu, by sa mali použiť komplexnejšie modely (pozri odkazy v dodatku 5) a poradiť sa s bioštatistikom a/alebo s farmakokinetikom. Hodnota BMF sa obyčajne stanovuje analýzou testovanej látky v celých rybách (na báze vlhkej hmotnosti). Ak je to relevantné pre dosiahnutie cieľa štúdie, môžu sa vzorky odoberať aj z istých konkrétnych tkanív (napríklad svalov, pečene) v prípade, že sa ryby rozdelia na jedlé a nejedlé časti (pozri bod 21). Okrem toho je možné odstrániť a samostatne analyzovať gastrointestinálny trakt, aby sa zistil jeho podiel na koncentráciách v celej rybe pri odberoch vzoriek na konci vychytávacej a tesne pred začiatkom depuračnej fázy, alebo ako súčasť prístupu založeného na rovnováhe hmotnosti. Obsah lipidov v celých rybách zo vzorky sa meria tak, aby sa koncentrácie mohli opraviť o lipidy, pričom sa berie do úvahy obsah lipidov v krmive i rybách (pozri body 56 a 57 a dodatok 7). Hmotnosť jednotlivých rýb vo vzorke by sa mala merať a zaznamenať a dať do súvislosti s koncentráciou analyzovanej chemikálie v danej rybe (napr. zaznamenaním jedinečného identifikačného kódu každej ryby zo vzorky), aby sa mohol vypočítať rast, ktorý je možné dosiahnuť počas skúšky. Ak je to možné, mala by sa zmerať aj celková dĺžka rýb (62). Údaje o hmotnosti sú potrebné aj na určenie hodnoty BCF použitím údajov z depuračnej fázy získaných počas skúšky expozície z potravy. INFORMÁCIE O TESTOVANEJ LÁTKE K dispozícii by mali byť informácie o testovanej látke opísané v bodoch 3 a 22. Analytická metóda pre koncentrácie testovanej látky vo vode obyčajne nie je potrebná; povinné sú metódy vhodnej citlivosti na meranie koncentrácií v potrave a tkanivách rýb. Táto metóda sa môže použiť na testovanie viac ako jednej látky iba jedným testom. Testované látky by však mali byť navzájom kompatibilné tak, aby nereagovali a nemenili svoju chemickú identitu po ich pridaní do potravy pre ryby. Cieľom je, aby sa výsledky namerané pri každej testovanej látke príliš nelíšili od výsledkov, ktoré by sa dosiahli individuálnym testom pri každej z testovaných látok. Predbežnou analýzou by sa malo zabezpečiť, aby bolo možné každú látku opätovne získať zo vzorky viacnásobne obohatenej potravy a rybieho tkaniva, a to i) s vysokou výťažnosťou (napr. > 85 % nominálnej hodnoty) a ii) s citlivosťou zodpovedajúcou potrebám testovania. Celková dávka všetkých testovaných látok by nemala presiahnuť kombinovanú koncentráciu, ktorá by mohla vyvolať toxické účinky (pozri bod 51). Pri návrhu skúšky by sa navyše mali vziať do úvahy možné nepriaznivé účinky vyvolané u rýb, ako aj účinky vyplývajúce z možnej interakcie (napr. metabolické účinky), ktoré sú spojené s testovaním viacerých látok súčasne. Testovanie ionizovateľných látok súčasne sa neodporúča. Pokiaľ ide o expozície, táto metóda je vhodná aj pre komplexné zmesi (pozri bod 13, hoci pre analýze platia rovnaké obmedzenia, ako pri akejkoľvek inej metóde). PLATNOSŤ TESTU Ak má byť test platný, musia platiť tieto podmienky (pozri bod 24):
REFERENČNÉ LÁTKY Ak laboratórium predtým túto skúšku nevykonávalo alebo nastali podstatné zmeny (napr. zmena kmeňa rýb alebo ich dodávateľa, iný druh rýb, markantné rozdiely v ich veľkosti, zmeny v potrave pre ryby a v metóde jej obohacovania), odporúča sa vykonať štúdiu technickej spôsobilosti použitím referenčnej látky. Referenčná látka sa používa primárne na zistenie primeranosti spôsobu obohacovania krmiva v záujme maximálnej homogenity a biodostupnosti testovaných látok. Príkladom, ktorý sa použil v prípade nepolárnych hydrofóbnych látok, je hexachlórbenzén (HCB), ale vzhľadom na nebezpečnosť HCB (63) by sa mali zvážiť aj iné látky, pri ktorých existujú spoľahlivé údaje o vychytávaní a biomagnifikácii. Ak sa použije referenčná látka, mali by sa v skúšobnom protokole uviesť základné informácie o nej vrátane názvu, čistoty, čísla CAS, štruktúry, údajov o toxicite (ak sú dostupné) tak, ako v prípade testovanej látky (pozri body 3 a 22). OPIS METÓDY Prístrojové vybavenie Mali by sa používať rovnaké materiály a prístrojové vybavenie ako v prípade skúšky expozície vo vodnom prostredí (bod 26). Mal by sa použiť prietokový alebo statický testovací systém s obnovovaním média a s dostatočným objemom vody na riedenie do testovacích nádrží. Prietokové rýchlosti by sa mali zaznamenať. Voda Mala by sa používať rovnaká testovacia voda ako v prípade skúšky expozície vo vodnom prostredí (body 27 až 29). V opise testovacieho média by sa mali uvádzať jeho vlastnosti, pričom počas testu by jeho kvalita mala byť konštantná. Obsah prirodzených tuhých častíc a celkového organického uhlíka by mal byť pred začiatkom testu čo najmenší (≤ 5 mg/l častíc, ≤ 2 mg/l celkového organicky viazaného uhlíka). TOC je potrebné merať iba pred skúškou v rámci opisu vlastností testovacej vody (pozri bod 53). Krmivo Odporúča sa komerčne dostupná potrava pre ryby (plávajúce a/alebo pomaly klesajúce krmivo v tvare peliet), ktorá obsahuje minimálne bielkoviny a tuky. Potrava by mala mať jednotnú veľkosť peliet, aby sa zvýšila účinnosť expozície z potravy, t. j. aby ryby zjedli väčšie množstvo potravy namiesto toho, aby sa zamerali na väčšie kusy potravy a menšie kusy nechali nepovšimnuté. Veľkosť peliet by mala adekvátne zodpovedať veľkosti rýb na začiatku testu (napr. sa môžu použiť pelety s priemerom okolo 0,6 – 0,85 mm pre ryby s celkovou dĺžkou od 3 do 7 cm a 0,85 – 1,2 mm pre ryby s celkovou dĺžkou od 6 do 12 cm). Veľkosť peliet možno upraviť v závislosti od rastu rýb na začiatku depuračnej fázy. Príklad vhodného zloženia komerčne dostupnej potravy je uvedený v dodatku 7. Pri navrhovaní tejto metódy sa bežne používal test krmív s celkovým obsahom lipidov medzi 15 a 20 % (hm.). V niektorých oblastiach nemusí byť dostupná potrava pre ryby s takou vysokou koncentráciou lipidov. V takýchto prípadoch je možné realizovať štúdie s nižšou koncentráciou lipidov v potrave a v prípade potreby vhodne upraviť kŕmne dávky tak, aby ryby zostali zdravé (na základe výsledkov predbežného testovania). Celkový obsah lipidov v krmive pre testovanú a kontrolnú skupinu je potrebné pred začiatkom skúšky a na konci vychytávacej fázy zmerať a zaznamenať. V skúšobnom protokole by sa mali uviesť údaje poskytnuté dodávateľmi komerčných krmív o ich analýze zameranej na živiny, vlhkosť, vlákninu, popol, a ak je to možné, aj na minerálne látky a rezíduá pesticídov (napr. „bežné“ prioritné znečisťujúce látky). Ak sa potrava obohacuje testovanou látkou, treba sa za každú cenu snažiť o zaručenie jej homogénnosti v celom množstve testovanej potravy. Koncentrácia testovanej látky v potrave určenej pre testovanú skupinu by sa mala zvoliť s ohľadom na citlivosť analytickej techniky, toxicitu testovanej látky (NOEC, ak je známa), ako aj na príslušné fyzikálno-chemické údaje. Ak sa použije referenčná látka, odporúča sa pridať ju pri koncentrácii okolo 10 % koncentrácie testovanej látky (v každom prípade však pri takej nízkej, akú je možné dosiahnuť) na základe analýzy citlivosti (napr. v prípade hexachlórbenzénu obsiahnutého v potrave je akceptovateľná koncentrácia 1 – 100 μg/g; viac informácií o asimilačnej účinnosti HCB sa uvádza v bode 47). Testovanou látkou možno potravu pre ryby obohacovať niekoľkými spôsobmi v závislosti od fyzikálnych vlastností a rozpustnosti (podrobnosti o metódach obohacovania sú uvedené v dodatku 7):
V niektorých prípadoch, napr. pri menej hydrofóbnych testovaných látkach s väčšou pravdepodobnosťou desorpcie z potravy, môže byť potrebné ponoriť pripravené pelety do malého množstva kukuričného/rybieho oleja (pozri bod 142). V takýchto prípadoch by sa malo podobne postupovať aj v prípade potravy pre kontrolnú skupinu a na účely merania lipidov by sa malo použiť hotové pripravené krmivo. Ak sa použije referenčná látka, mali by byť jej výsledky porovnateľné s údajmi zo štúdií publikovaných v odbornej literatúre, ktoré boli vykonané za podobných podmienok a s porovnateľnou kŕmnou dávkou (pozri bod 45), pričom parametre špecifické pre referenčnú látku by mali spĺňať príslušné kritériá uvedené v bode 113 (odseky 3, 4 a 5). Ak sa ako nosič testovanej látky použije olej alebo nosné rozpúšťadlo, malo by sa rovnaké množstvo toho istého nosiča (bez testovanej látky) zmiešať aj s krmivom pre kontrolnú skupinu, aby sa zachovala rovnocennosť s obohatenou potravou. Je dôležité, aby sa tak vo vychytávacej, ako aj depuračnej fáze testovaná a kontrolná skupina kŕmili potravou rovnocennej výživovej hodnoty. Obohatená potrava by sa mala skladovať v podmienkach, v ktorých sa zachová stabilita testovanej látky v kŕmnej zmesi (napr. chladením) a tieto podmienky uviesť v skúšobnom protokole. Výber druhov rýb Môžu sa použiť rovnaké druhy rýb ako pri skúške expozície vo vodnom prostredí (pozri bod 32 a dodatok 3). Pred uverejnením tejto testovacej metódy sa v štúdiách potravovej bioakumulácie s organickými látkami bežne používa pstruh dúhový (Oncorhynchus mykiss), kapor rybničný (Cyprinus carpio) a čerebľa potočná (Pimephales promelas). Testované druhy by sa pri kŕmení mali správať tak, aby sa dosiahla rýchla konzumácia podanej kŕmnej dávky, čím sa zabezpečí minimalizácia akýchkoľvek faktorov ovplyvňujúcich koncentráciu testovanej látky v potrave (napr. vyplavovanie do vody a možnosť expozície vo vodnom prostredí). Mali by sa použiť ryby v odporúčanom rozpätí veľkosti/hmotnosti (pozri dodatok 3). Ryby by nemali byť príliš malé na to, aby sa dali ľahko individuálne analyzovať. Testované druhy s rýchlym rastom v priebehu životného cyklu môžu komplikovať interpretáciu údajov, a vysoká rýchlosť rastu zase môže ovplyvniť výpočet asimilačnej účinnosti (64). Chov rýb Kritériá prijateľnosti v prípade aklimatizácie, úmrtnosti a ochorení sú rovnaké ako pri skúške expozície vo vodnom prostredí pred vykonaním testu (pozri body 33 až 35). VYKONANIE TESTU Činnosti pred uskutočnením štúdie na vyhľadávanie rozsahu Analytické prípravné práce pred štúdiou sú potrebné, aby sa preukázal výťažok látky z obohatenej potravy/obohateného rybieho tkaniva. Test na vyhľadávanie rozsahu na výber vhodných koncentrácií v potrave nie je vždy nevyhnutný. Aby sa preukázalo, že nie sú pozorované žiadne nepriaznivé účinky, ako aj na posúdenie chute obohatenej potravy, citlivosti metódy analýzy tkaniva rýb a potravy a výberu vhodnej kŕmnej dávky intervalov odberu vzoriek v depuračnej fáze atď., možno vykonať predbežné pokusy s kŕmením, ktoré však nie sú povinné. Predbežná štúdia môže byť užitočná na odhad počtu rýb potrebných na odber vzoriek počas depuračnej fázy. To by mohlo mať za následok podstatné zníženie počtu použitých rýb, najmä v prípade testovaných látok, ktoré sú mimoriadne vnímavé na metabolizmus. Podmienky expozície Dĺžka vychytávacej fázy Vychytávacia fáza v trvaní 7 až 14 dní obyčajne postačuje a počas nej sa denne kŕmi jedna skupina rýb kontrolným krmivom a druhá skupina testovaným krmivom fixnými dávkami stanovenými v závislosti od testovaných druhov zvierat a experimentálnych podmienok, napr. 1 až 2 % telesnej hmotnosti (vlhkej) v prípade pstruha dúhového. Kŕmne dávky treba zvoliť tak, aby sa zabránilo rýchlemu rastu a prílišnému zvýšeniu obsahu lipidov. V prípade potreby možno vychytávaciu fázu predĺžiť na základe praktických skúseností z predchádzajúcich štúdií alebo poznaniu vychytávania/depurácie testovanej (alebo analogickej) látky v rybách. Začiatok skúšky sa definuje ako čas prvého kŕmenia obohatenou potravou. Deň experimentu trvá od chvíle kŕmenia do chvíle krátko pred uplynutím času ďalšieho kŕmenia (napr. jedna hodina). Preto prvý experimentálny deň vychytávania trvá od okamihu prvého kŕmenia obohatenou potravou a končí krátko pred druhým kŕmením obohatenou potravou. V praxi to znamená, že sa vychytávacia fáza skončí krátko pred (napr. jedna hodina) prvým kŕmením potravou neobohatenou o testovanú látku, keďže ryby budú aj v najbližších 24 hodinách stále tráviť obohatenú potravu a absorbovať testovanú látku. Je dôležité zabezpečiť dosiahnutie primerane veľkého (netoxického) celkového zaťaženia organizmu testovanou látkou podľa potrieb analytickej metódy tak, aby bolo v depuračnej fáze možné merať aspoň o rádovo nižší pokles zaťaženia. V osobitných prípadoch predĺženej fázy vychytávania (až na 28 dní) sa môže použiť dodatočný odber vzoriek v snahe získať podrobné informácie o kinetike vychytávania. Počas vychytávania nemusí koncentrácia v rybách dosiahnuť ustálený stav. Podobne ako pri skúške expozície vo vodnom prostredí možno aj tu použiť rovnice na odhad času do dosiahnutia ustáleného stavu, ktoré slúžia ako ukazovateľ pravdepodobného trvania potrebného na dosiahnutie hodnotiteľných koncentrácií rýb (pozri dodatok 5). V niektorých prípadoch je možné, že buď v dôsledku slabej analytickej citlivosti, alebo nízkej asimilačnej účinnosti nebude vychytávanie látky rybami v trvaní 7 až 14 dní stačiť na to, aby použitá koncentrácia v potrave dosiahla takú vysokú koncentráciu v rybách, pri ktorej je možné analyzovať aspoň o rádovo nižší pokles vo fáze depurácie. V takých prípadoch môže byť vhodné predĺžiť počiatočnú fázu kŕmenia na dlhšie ako 14 dní, alebo, zvlášť v prípade vysoko metabolizovateľných látok, zvážiť vyššiu koncentráciu v potrave. Treba však dbať na to, aby celkové zaťaženie organizmu počas vychytávacej fázy zostalo pod úrovňou (odhadovanej) chronickej koncentrácie bez pozorovaného účinku (NOEC) v rybích tkanivách (pozri bod 138). Dĺžka depuračnej fázy Depurácia obyčajne trvá maximálne 28 dní od začiatku kŕmenia testovanej skupiny rýb čistou, neupravenou potravou po skončení fázy vychytávania. Depurácia začína prvým kŕmením „neobohatenou“ potravou a nie hneď po poslednom podaní „obohatenej“ potravy, keďže ryby budú aj v najbližších 24 hodinách stále tráviť potravu a absorbovať testovanú látku, ako sa uvádza v bode126. Preto sa prvá vzorka v depuračnej fáze odoberie krátko pred druhým kŕmením neobohatenou potravou. Depuračná fáza je navrhnutá tak, aby zachytila látky s možným polčasom do 14 dní, čo zodpovedá bioakumulatívnym látkam (65), takže 28 dní znamená dva polčasy týchto látok. V prípadoch látok s veľmi vysokou bioakumuláciou môže byť vhodné depuračnú fázu predĺžiť (ak tak ukáže predbežné testovanie). Ak sa látka vylučuje veľmi pomaly, takže nie je možné presne určiť polčas v depuračnej fáze, môžu tieto informácie aj naďalej stačiť na účely zistenia vysokého stupňa bioakumulácie. Naopak, ak je látka vylučovaná tak rýchlo, že nie je možné spoľahlivo odvodiť koncentráciu v čase nula (koncentrácia na konci vychytávacej/začiatku depuračnej fázy C 0,d) ani hodnotu k 2, možno urobiť konzervatívny odhad hodnoty k 2 (pozri dodatok 7). Ak z analýzy rýb v skorších intervaloch (napr. 7 alebo 14 dní) vyplýva, že sa látka pred uplynutím celého 28 dňového obdobia vylučuje pod úrovňou kvantifikácie, tak sa každý ďalší odber vzoriek preruší a skúška sa ukončí. V niektorých prípadoch nemusí na konci vychytávacej fázy (alebo s druhou depuračnou vzorkou) dôjsť k žiadnemu merateľnému vychytávaniu testovanej látky. Ak možno preukázať, že: i) kritériá platnosti v bode 113 sú splnené a ii) nulové vychytávanie nie je spôsobené iným nedostatkom pri skúške (napr. nedostatočne dlhá fáza vychytávania, nedostatky v spôsobe obohacovania potravy spôsobujúce slabú biodostupnosť, nedostatočná citlivosť analytickej metódy, ryby odmietajúce žrať potravu atď.), je možné štúdiu ukončiť bez toho, aby sa musela zopakovať s dlhšou vychytávacou fázou. Ak sa počas prípravy skúšky ukázalo, že môže nastať tento prípad, odporúča sa pokiaľ možno vykonať analýzu výkalov na nestrávenú testovanú látku ako súčasť prístupu založeného na rovnováhe hmotnosti. Počty testovaných rýb Podobne ako pri skúške expozície vo vodnom prostredí by sa mali vybrať ryby s podobnou hmotnosťou a dĺžkou, pričom najmenšie ryby by nemali vážiť menej ako dve tretiny hmotnosti najväčších (pozri body 40 až 42). Celkový počet rýb použitých v štúdii by sa mal vyberať podľa harmonogramu odberu vzoriek (minimálne jedna vzorka na konci vychytávacej fázy a štyri až šesť vzoriek počas depuračnej fázy v závislosti od dĺžok jednotlivých fáz), pričom sa zohľadňuje citlivosť analytickej techniky, pravdepodobná koncentrácia, ktorá sa dosiahne na konci vychytávacej fázy (na základe predchádzajúcich skúseností) a počas depurácie (ak je na základe predchádzajúcich skúseností možné urobiť odhad). V každom čase odberu vzoriek by sa malo odobrať päť až desať rýb a pred chemickou analýzou, príp. analýzou obsahu lipidov by sa mali odmerať parametre rastu (hmotnosť a celková dĺžka). Vzhľadom na prirodzenú odlišnosť veľkostí, mieru rastu, fyziológiu rýb, ako aj možné rozdiely v množstve podanej potravy, ktorú každá ryba skonzumuje, by sa pri každom odbere vzoriek malo odobrať aspoň päť rýb z testovanej a päť z kontrolnej skupiny, aby bolo možné adekvátne stanoviť priemernú koncentráciu a jej odchýlky. Rozdiely medzi použitými rybami môžu počas skúšky prispievať k výsledným nekontrolovaným odchýlkam viac ako prirodzené odchýlky v použitých analytických metódach, a preto sa v niektorých prípadoch môže použiť až 10 rýb na každú odobranú vzorku. Ak však nie je na začiatku depuračnej fázy možné zmerať pozaďové koncentrácie testovanej látky v rybách z kontrolnej skupiny, môže chemická analýza dvoch až troch „kontrolných“ rýb pri poslednom odbere vzoriek kontroly postačovať iba vtedy, ak sa zvyšok rýb z kontrolnej skupiny pri každom z časov odberu vzoriek naďalej odoberá na účely zisťovania hmotnosti a celkovej dĺžky (aby bol odobraný rovnaký počet vzoriek z testovanej i kontrolnej skupiny na rast). Ryby by sa mali uskladniť, jednotlivo odvážiť (aj keď sa ukáže, že výsledky zo vzorky sa budú musieť následne skombinovať) a odmerať, aby sa zistila ich celková dĺžka. Pri štandardnej skúške napr. s 28 dňovou depuračnou fázou vrátane piatich odberov vzoriek počas depurácie by to malo predstavovať celkom 59 až 120 rýb z testovanej a 50 až 110 z kontrolnej skupiny za predpokladu, že daná metóda analýzy látky umožňuje vykonať analýzu obsahu lipidov na tej istej rybe. Ak nie je možné vykonať analýzu obsahu lipidov na tej istej rybe, na ktorej sa vykonala chemická analýza, a na analýzu obsahu lipidov nie je možné použiť ani ryby z kontrolnej skupiny (pozri bod 56), bude potrebné odobrať ďalších 15 rýb (tri zo zásobnej populácie na začiatku skúšky, po tri z kontrolnej i testovanej skupiny na začiatku depurácie a po tri z kontrolnej a testovanej skupiny na konci pokusu). Príklad harmonogramu odberu vzoriek s počtom rýb sa uvádza v dodatku 4. Násada Podobne ako v prípade skúšky expozície vo vodnom prostredí (body 43 a 44) by sa mal použiť podobne vysoký pomer vody k množstvu rýb. Hoci veľkosť násady z hľadiska pomeru vody k množstvu rýb nemá v tejto skúške vplyv na expozičné koncentrácie, obyčajne sa odporúča veľkosť násady v rozmedzí od 0,1 do 1,0 g rýb (vlhká hmotnosť) na liter vody denne, aby sa zachovali primerané koncentrácie rozpusteného kyslíka a minimalizovalo vystavenie testovaných organizmov stresu. Testovacie krmivo a kŕmenie Počas obdobia aklimatizácie by sa ryby mali kŕmiť primeranou potravou tak, ako je opísané v bode 117. Ak sa skúška vykonáva v prietokových podmienkach, prietok by sa mal v čase kŕmenia rýb prerušiť. Počas skúšky by potrava pre skúšobnú skupinu mala zodpovedať podmienkam opísaným v bodoch 116 až 121. Okrem špecifických faktorov látky by sa chuť potravy mala zohľadňovať aj pri určovaní analytickej citlivosti, očakávanej koncentrácia v potrave v environmentálnych podmienkach a úrovní chronickej toxicity/celkového zaťaženia organizmu a výbere cieľovej koncentrácie obohacovania (aby ryby krmivo neodmietali). Nominálne koncentrácie obohacovania testovanou látkou by sa mali uviesť do protokolu. Na základe skúseností poskytujú koncentrácie obohacovania v rozsahu 1 – 1 000 μg/g dostatočne praktické pracovné rozpätie pri testovaných látkach, ktoré nevykazujú špecifický toxický mechanizmus. V prípade látok s nešpecifikovaným mechanizmom by hladiny rezíduí v tkanivách nemali prekročiť 5 μ/g lipidov, pretože rezíduá prekračujúce túto úroveň môžu vyvolať chronické účinky (19) (48) (50) (66). Pri ostatných látkach treba dbať na to, aby nenastali žiadne nepriaznivé účinky z akumulovanej expozície (pozri bod 127). Platí to najmä v prípade, ak sa testuje viac ako jedna látka súčasne (pozri bod 112). Potrava pre ryby sa môže obohatiť o vhodné množstvo testovanej látky jedným z troch spôsobov opísaných v bode 119 a v dodatku 7. Metódy a postup obohacovania krmiva by mali byť zdokumentované v protokole. Ryby z kontrolnej vzorky sa kŕmia neupravenou potravou, ktorá obsahuje rovnaké množstvo neobohateného olejového nosiča, ak sa použil na obohatenie potravy vo fáze vychytávania, alebo potravou upravenou „čistým“ rozpúšťadlom, ak sa na prípravu potravy pre testovanú skupinu použil nosič s rozpúšťadlom. Upravená a neupravená potrava by sa mala merať analyticky najmenej trikrát na koncentráciu testovanej látky pred začiatkom a na konci vychytávacej fázy. Po expozícii účinkom upraveného krmiva (fáza vychytávania) sa ryby (z obidvoch skupín) kŕmia neupravenou potravou (fáza depurácie). Ryby sa kŕmia fixnou kŕmnou dávkou (v závislosti od druhu, napr. približne 1 – 2 % vlhkej telesnej hmotnosti na deň v prípade pstruha dúhového). Kŕmne dávky treba zvoliť tak, aby sa zabránilo rýchlemu rastu a prílišnému zvýšeniu obsahu lipidov. Presná kŕmna dávka stanovená počas pokusu by sa mala zaznamenať. Počiatočné kŕmenia by malo byť založené na pravidelných meraniach hmotnosti rýb zo zásobnej populácie tesne pred začiatkom skúšky. Množstvo krmiva by sa malo upraviť podľa vlhkých hmotností rýb vo vzorke pri každom odbere vzoriek, aby sa zohľadnil rast počas pokusu. Hmotnosti a dĺžky rýb v testovacích a kontrolných nádržiach možno odhadnúť z hmotností a celkových dĺžok rýb použitých pri každom odbere vzoriek; nevážte a nemerajte ryby, ktoré zostanú v testovacích a kontrolných nádržiach. V priebehu experimentu je dôležité zachovať rovnakú stanovenú dávku krmiva. Kŕmenie by sa malo pozorovať, aby sa zabezpečilo, že ryby viditeľne skonzumujú všetku ponúknutú potravu, čím sa zaručí, že na výpočty sa použijú vhodné miery príjmu potravy. Pri stanovovaní kŕmnej dávky by sa mali zohľadniť pokusy s predbežným kŕmením, príp. predchádzajúce skúsenosti, aby sa zaručilo, že sa skonzumuje všetka potrava z kŕmenia raz denne. Ak ryby potravu dlhodobo nekonzumujú, odporúča sa dávku rozdeliť a časť podať v rámci jedného kŕmenia navyše, ktoré sa pridá na každý experimentálny deň (napr. kŕmenie raz denne sa nahradí kŕmením dvakrát denne s polovičným množstvom krmiva). Ak je to potrebné, malo by sa druhýkrát kŕmiť v pevne stanovenom čase a tak, aby pred odberom vzoriek uplynulo čo najviac času (napr. čas druhého kŕmenia sa stanoví na prvú polovicu experimentálneho dňa). Hoci vo všeobecnosti konzumujú ryby potravu rýchlo, je dôležité zaručiť, že látka bude aj naďalej absorbovaná v potrave. Treba sa snažiť vyhnúť tomu, aby sa testovaná látka v potrave rozptýlila vo vode, čo by spôsobilo expozíciu rýb koncentráciám testovanej látky z vodného prostredia a nie z potravy. To možno dosiahnuť odstránením neskonzumovanej potravy (aj výkalov) z testovacích a kontrolných nádrží do jednej hodiny po kŕmení, najlepšie však do 30 minút. Okrem toho je možné použiť systém, ktorým je voda neustále čistená aktívnym uhlíkovým filtrom, aby sa z nej absorbovali všetky „rozpustené“ kontaminanty. Rýchlemu odplaveniu častíc potravy a rozpustených látok môžu pomôcť prietokové systémy (67). V niektorých prípadoch je možné tento problém odstrániť aj miernou úpravou spôsobu obohacovania potravy (pozri bod 119). Svetlo a teplota Podobne ako pri skúške expozície vo vodnom prostredí (pozri bod 48) sa 12 až 16 hodinová fotoperióda a teplota (± 2 °C) odporúčajú ako vhodné podmienky pre použité testované druhy (pozri dodatok 3). Typ osvetlenia a jeho charakteristiky musia byť známe a zapísané do protokolu. Kontroly Mala by sa použiť jedna kontrolná skupina, v ktorej sú ryby kŕmené rovnakou kŕmnou dávkou ako v testovanej skupine, ale bez prítomnosti testovanej látky v krmive. Ak sa na obohatenie potravy pre testovanú skupinu použije olejový nosič alebo nosič s rozpúšťadlom, mal by sa rovnakým spôsobom upraviť aj potrava pre kontrolnú skupinu, ale bez prítomnosti testovanej látky, aby bola potrava pre testovanú i kontrolnú skupinu rovnaká (pozri body 121 a 139). Frekvencia meraní kvality vody Aj tu platia podmienky opísané v skúške s expozíciou vo vodnom prostredí, s výnimkou toho, že TOC sa musí merať iba pred skúškou ako súčasť určovania vlastností testovanej vody (pozri bod 53). Odber a analýza vzoriek rýb a potravy Analýza vzoriek potravy Vzorky potravy pre testovanú i kontrolnú skupinu by sa mali analyzovať najmenej trikrát na prítomnosť testovanej látky a obsah lipidov, a to minimálne pred začiatkom a na konci vychytávacej fázy. Analytické metódy a postupy na zabezpečenie homogénnosti krmiva by mali byť uvedené v protokole. Vzorky by sa mali na prítomnosť testovanej látky analyzovať stanovenou a platnou metódou. Prípravné práce pred štúdiou sú potrebné na stanovenie kvantifikačného limitu, percenta výťažku, interferencií a analytických odchýlok v zamýšľanej matrici odberu vzoriek. Ak sa testuje materiál označený rádioaktívnym izotopom, mali by sa zohľadňovať rovnaké skutočnosti ako v prípade skúšky expozície vo vodnom prostredí, akurát namiesto analýzy vody sa vykoná analýza potravy (pozri bod 65). Analýza rýb Pri každom odbere vzoriek rýb sa odoberie 5 až 10 rýb z exponovanej a kontrolnej skupiny (v niektorých prípadoch je možné počet rýb z kontrolnej skupiny znížiť, pozri bod 134). Odber vzoriek by mal prebiehať každý experimentálny deň v rovnakom čase (podľa času kŕmenia) a mal by sa načasovať tak, aby sa minimalizovala pravdepodobnosť pretrvávania potravy v črevách v priebehu trvania vychytávacej fázy a na začiatku depuračnej fázy, a tým sa zabránilo falošným prírastkom k celkovým koncentráciám testovanej látky (t. j. ryby vo vzorke by sa mali na konci experimentálneho dňa vybrať, pričom treba pamätať na to, že experimentálny deň začína časom kŕmenia a končí časom ďalšieho kŕmenia, čiže asi o 24 hodín neskôr. Depurácia začína prvým kŕmením neobohatenou potravou, pozri bod 128). Prvá vzorka z depuračnej fázy (odobraná krátko pred druhým kŕmením neobohatenou potravou) je dôležitá, pretože extrapolácia údajov z tohto bodu merania v predchádzajúcom dni slúži na odhad koncentrácie v čase nula (C0,d je koncentrácia v rybách na konci vychytávacej/začiatku depuračnej fázy). Nepovinne sa môže na konci vychytávacej a na 1. a 3. deň depurácie odstrániť a samostatne analyzovať gastrointestinálny trakt rýb. Pri každom odbere vzoriek by sa mali ryby z oboch testovacích nádrží vybrať a malo by sa s nimi zaobchádzať rovnako, ako v prípade skúšky expozície vo vodnom prostredí (pozri body 61 až 63). Koncentrácie testovanej látky v celých rybách (vlhká hmotnosť) sa merajú aspoň na konci vychytávacej a v priebehu depuračnej fázy tak v kontrolných, ako aj pokusných skupinách. Počas depuračnej fázy sa odporúča urobiť štyri až šesť odberov (napr. 1, 3, 7, 14 a 28 dní). Nepovinne sa po 1 – 3 dňoch vychytávania, t. j. stále blízko začiatku expozičného času, môže pridať ďalší odber vzoriek, aby sa určila asimilačná účinnosť z lineárnej fázy vychytávania. Možné sú dve hlavné odchýlky od harmonogramu: i) ak sa na účely prieskumu kinetiky vychytávania predĺži vychytávacia fáza, budú sa počas nej robiť ďalšie odbery vzoriek, takže bude potrebné pridať ďalšie ryby (pozri bod 126); ii) ak sa štúdia na konci vychytávacej fázy ukončí z dôvodu vychytávania, ktoré sa nedá merať (pozri bod 131). Každá jedna ryba odobraná do vzorky sa odváži (a zmeria sa jej celková dĺžka), aby sa mohli určiť rýchlostné konštanty rastu. Koncentrácie látky v špecifických tkanivách rýb (jedlých i nejedlých častiach) možno tiež merať na konci vychytávacej fázy a vo vybraných časoch počas depurácie. Ak sa testuje materiál označený rádioaktívnym izotopom, mali by sa zohľadňovať rovnaké skutočnosti ako v prípade skúšky expozície vo vodnom prostredí, akurát namiesto analýzy vody sa vykoná analýza potravy (pozri bod 65). V prípade pravidelného používania referenčnej látky (pozri bod 25) je vhodnejšie, aby sa koncentrácie merali v testovanej skupine na konci vychytávacej fázy a v každom čase depurácie stanovenom pre danú testovanú látku (na celých rybách); koncentrácie sa musia analyzovať iba v kontrolnej skupine na konci vychytávania (na celých rybách). Za určitých okolností (napr. ak metódy analýzy testovanej a referenčnej látky nie sú kompatibilné, takže na dodržanie harmonogramu odberu vzoriek budú potrebné ďalšie ryby) možno použiť aj iný postup (opísaný ďalej), ako minimalizovať potrebu pridania ďalších rýb. Koncentrácie referenčnej látky sa počas depuračnej fázy merajú iba v 1. a 3. deň a v ďalších dvoch časoch odberu vzoriek vybraných tak, aby bolo možné urobiť spoľahlivé odhady koncentrácie v čase nula (C0,d) a k 2 pre referenčnú látku. Ak je to možné, mal by sa stanoviť obsah lipidov v jednotlivých rybách pri každom odbere vzoriek, alebo aspoň na začiatku a na konci vychytávacej a na konci depuračnej fázy. (pozri body 56 a 67). V závislosti od použitej analytickej metódy (pozri bod 67 a dodatok 4) možno použiť tie isté ryby tak na analýzu obsahu lipidov, ako aj určovanie koncentrácie testovanej látky. Táto možnosť sa uprednostňuje v snahe minimalizovať počet rýb. Ak by to však nebolo možné, môže sa použiť rovnaký postup ako pri skúške expozície vo vodnom prostredí (pozri bod 56 pre alternatívne možnosti merania lipidov). Metóda použitá na kvantifikáciu obsahu lipidov by mala byť zdokumentovaná v protokole. Kvalita analytickej metódy Mali by sa vykonávať experimentálne kontroly, aby sa zaručila špecifickosť, správnosť, presnosť a reprodukovateľnosť analytickej techniky špecifickej pre danú látku, ako aj výťažnosť testovanej látky z potravy a rýb. Meranie rastu rýb Na začiatku testu sa musí odvážiť vzorka rýb zo zásobnej populácie (a zmerať ich celková dĺžka). Tieto ryby by mali byť odobrané do vzorky tesne (t. j. jednu hodinu) pred prvým kŕmením obohatenou potravou a zaradené do experimentálneho dňa 0. Počet rýb z tejto vzorky by mal byť minimálne rovnaký ako vo vzorkách počas skúšky. Niektoré z nich môžu byť tie isté ryby, ktoré sa použili na analýzu obsahu lipidov pred začiatkom vychytávacej fázy (pozri bod 153). Pri každom odbere vzoriek sa ryby najskôr odvážia a zmerajú. Pri každej jednej rybe by sa nameraná hmotnosť a dĺžka mala dať do súvislosti s koncentráciou analyzovanej chemikálie (a v prípade potreby aj s obsahom lipidov) napr. označením každej ryby zo vzorky jedinečným identifikátorom. Merania na týchto vzorkách rýb možno použiť na odhad hmotnosti (a dĺžky) rýb, ktoré zostanú v testovacích a kontrolných nádržiach. Experimentálne hodnotenie Prípady mortality by sa mali denne sledovať a zaznamenávať. Sledovať a zaznamenávať by sa mali aj iné nepriaznivé účinky napr. nezvyčajné správanie alebo pigmentácia. Ryby sa považujú za uhynuté, ak nemožno pozorovať žiaden respiračný pohyb ani reakciu na slabý mechanický podnet. Všetky uhynuté alebo zjavne hynúce ryby by sa mali odstrániť. ÚDAJE A PREZENTOVANIE VÝSLEDKOV Spracovanie výsledkov Výsledky skúšky sa používajú na určenie rýchlostnej konštanty depurácie (k 2) ako funkcie celkovej vlhkej hmotnosti rýb. Konštanta rýchlosti rastu k g vychádzajúca z priemeru prírastkov hmotnosti rýb sa v prípade potreby počíta a používa na získanie rýchlostnej konštanty vychytávania k 2g opravenej vzhľadom na rast. Okrem toho by sa do protokolu mala zapísať aj asimilačná účinnosť (a, absorpcia z čriev), kinetický biomagnifikačný faktor (BMFK) (ak je to potrebné, opravený vzhľadom na rast – BMFKg), jeho hodnota opravená vzhľadom na obsah lipidov (BMFKL alebo BMFKgL, ak je opravená aj vzhľadom na rast) a kŕmna dávka. Ak je možné urobiť odhad času na dosiahnutie ustáleného stavu vo vychytávacej fáze (napr. 95 % ustáleného stavu alebo t 95 = 3,0/k 2), možno pridať aj odhad hodnoty BMF v ustálenom stave (BMFSS) (pozri body 105 a 106 a dodatok 5), ak hodnota t 95 naznačuje, že sa môžu dosiahnuť podmienky ustáleného stavu. Hodnota BMFSS by sa mala opraviť vzhľadom na obsah lipidov tak isto ako hodnota kinetického BMF (BMFK), aby bolo možné získať jeho hodnotu opravenú vzhľadom na obsah lipidov – BMFSSL (upozorňujeme, že neexistuje žiaden schválený postup na opravu ustáleného BMF vzhľadom na rast). Vzorce a príklad výpočtu sú uvedené v dodatku 7. K dispozícii sú postupy, ktoré umožňujú odhad kinetického biokoncentračného faktora (BCFK) z údajov získaných zo skúšky expozície z potravy. Tieto sú opísané v dodatku 8. Údaje o hmotnosti/dĺžke rýb Do tabuľky sa zvlášť pre testovanú a kontrolnú skupinu zapíšu vlhké hmotnosti a dĺžky jednotlivých rýb v každom časovom intervale a za všetky dni odberu vzoriek vo vychytávacej fáze (zásobná populácia na začiatku vychytávania, kontrolná a testovaná skupina na konci vychytávacej fázy a v prípade, že sa uskutoční, tak aj v jej počiatočnej fáze (napr. v 1. až 3. deň vychytávania), ako aj počas depuračnej fázy (napr. dni 1, 2, 4, 7, 14, 28 v kontrolnej i testovanej skupine). Hmotnosť je preferovaným parametrom rastu na účely opravy vzhľadom na znižovanie koncentrácie látky vplyvom rastu. Metóda, resp. metódy používané na opravu údajov vzhľadom na rast sú uvedené v bodoch 162 a 163 a v dodatku 5. Údaje o koncentrácii testovanej látky v rybách Merania rezíduí testovanej látky v jednotlivých rybách (alebo v združených vzorkách rýb, ak jednotlivé merania nie sú možné) vyjadrené ako koncentrácia vo vlhkej hmotnosti (v hm. %) sa zapíšu do tabuľky pre testovanú a kontrolnú skupinu rýb pri každom jednom odbere vzoriek. Ak sa každá vzorka rýb podrobila analýze obsahu lipidov, potom je možné odvodiť a zapísať do tabuľky aj jednotlivé koncentrácie opravené vzhľadom na obsah lipidov vyjadrené ako koncentrácia lipidov (v hm. %).
Rýchlosť depurácie a biomagnifikačný faktor Na výpočet biomagnifikačného faktora z existujúcich údajov by sa najskôr mala získať hodnota asimilačnej účinnosti (absorpcie testovanej látky v črevách α). Na tento účel by sa mala použiť rovnica A7.1 uvedená v dodatku 7, pri ktorej treba poznať odvodenú hodnotu koncentrácie v čase nula depuračnej fázy (C 0,d), (celkovú) hodnotu rýchlostnej konštanty depurácie (k 2), hodnotu koncentrácie v potrave (C food), rýchlostnú konštantu trávenia potravy (I) a dĺžku vychytávacej fázy (t). Zaznamená sa smernica a úsek lineárneho vzťahu medzi ln (koncentráciou) a časom depurácie ako celková hodnota rýchlostnej konštanty depurácie (k 2= smernica) a koncentrácie v čase nula (C 0,d = eúsek), ako je opísané vyššie. Mala by sa skontrolovať biologická plauzibilita odvodených hodnôt (napr. asimilačná účinnosť ako zlomok nie je väčšia ako 1). Hodnota (I) sa vypočíta každý deň vydelením hmotnosti potravy hmotnosťou kŕmených rýb (ak sú kŕmené množstvom zodpovedajúcim 2 % telesnej hmotnosti, hodnota (I) bude 0,02). Hodnotu kŕmnej dávky použitú vo výpočte možno bude treba upraviť tak, aby zodpovedala rastu rýb (možno tak urobiť použitím známej rýchlostnej konštanty rastu na odhad hmotnosti rýb pri každom odbere vzoriek počas vychytávacej fázy, pozri dodatok 7). Ak nie je možné hodnoty k 2 a C 0,d odvodiť, napr. z dôvodu koncentrácií pod limitom detekcie v druhej vzorke z depuračnej fázy, možno urobiť konzervatívny odhad hodnoty k 2 a „hornej hranice“ hodnoty BMFk (pozri dodatok 7). Po získaní hodnoty asimilačnej účinnosti (α) sa biomagnifikačný faktor môže vypočítať vynásobením hodnoty α rýchlostnou konštantou trávenia (I) a následným vydelením tohto výsledku (celkovou) hodnotou rýchlostnej konštanty depurácie (k 2). Hodnota biomagnifikačného faktora opravená vzhľadom na rast sa vypočíta rovnako, ale s použitím hodnoty rýchlostnej konštanty depurácie opravenej vzhľadom na rast(k 2g, pozri body 162 a 163). Alternatívny odhad hodnoty asimilačnej účinnosti je možné urobiť v prípade, že ryby zo vzorky boli podrobené analýze tkaniva v počiatočnej, lineárnej fáze vychytávania, pozri bod 151 a dodatok 7). Táto hodnota predstavuje nezávislý odhad asimilačnej účinnosti pre v podstate neexponovaný organizmus (t. j. u rýb tesne pred začiatkom vychytávacej fázy). Odhad hodnoty asimilačnej účinnosti z údajov v depuračnej fáze sa obyčajne používa na odvodenie hodnoty BMF. Opravy vzhľadom na obsah lipidov a rast Rast rýb počas depuračnej fázy môže znížiť hodnoty nameraných chemických koncentrácií v rybách, a tým spôsobiť, že celková hodnota rýchlostnej konštanty depurácie (k 2) bude vyššia ako pri samotných procesoch odbúravania (napr. metabolizmom, vypudením, pozri bod 72). Obsah lipidov v testovaných rybách (ktorý úzko súvisí s bioakumuláciou hydrofóbnych látok) a obsah lipidov v potrave sa môžu v praxi líšiť tak, aby sa ich hodnoty museli opraviť, ak majú byť hodnoty faktorov biomagnifikácie odvodené zmysluplným spôsobom. Hodnota biomagnifikačného faktora by sa mala opraviť vzhľadom na rast (podobne ako hodnota kinetického BCF pri skúške expozície vo vodnom prostredí), ako aj vzhľadom na obsah lipidov v potrave v porovnaní s obsahom lipidov v rybách (korekčný faktor lipidov). Rovnice a príklady týchto výpočtov sú uvedené v dodatku 5, resp. v dodatku 7. Na účely opravy hodnôt vzhľadom na znižovanie koncentrácie látky vplyvom rastu ryby by sa mala vypočítať hodnota rýchlostnej konštanty depurácie opravená o rast (k 2g) (pozri rovnice v dodatku 5). Hodnota rýchlostnej konštanty depurácie opravená vzhľadom na rast (k 2g) sa potom použije na výpočet hodnoty biomagnifikačného faktora opravenej o rast tak, ako je uvedené v bode 73. Tento postup však v niektorých prípadoch nie je možný. Alternatívny postup, ktorým sa dá vyhnúť potrebe opravovať hodnoty o znižovanie koncentrácie látky vplyvom rastu, používa hmotnostné údaje o depurácii testovanej látky za každú rybu (celú rybu) namiesto bežných hmotnostných údajov o testovanej látke (koncentrácii) na jednotku hmotnosti ryby. To sa dá ľahko dosiahnuť, keďže v skúškach podľa tejto testovacej metódy by sa zaznamenané údaje o koncentrácii v tkanivách mali vzťahovať na individuálne hmotnosti rýb. Jednoduchý návod je uvedený v dodatku 5. Pripomíname, že hodnota k 2 by sa mala odhadovať a zaznamenávať aj vtedy, keď sa použije alternatívny postup. Na účely opravy hodnôt vzhľadom na obsah lipidov v potrave a v rybách bez vykonania analýzy obsahu lipidov na všetkých rybách zo vzorky sa odvodia priemerné hodnoty lipidových frakcií (v hm. %) v rybách a potrave (68). Korekčný faktor lipidov (L c) sa potom vypočíta vydelením priemeru lipidových frakcií v rybách priemerom lipidových frakcií v potrave. Hodnota biomagnifikačného faktora, podľa potreby opravená vzhľadom na rast, sa vydelí korekčným faktorom lipidov a získa sa hodnota biomagnifikačného faktora opravená vzhľadom na obsah lipidov. Ak sa chemická analýza a analýza obsahu lipidov pri každom odbere vzoriek vykonajú na tých istých rybách, potom možno na výpočet hodnoty BMF opravenej o obsah lipidov použiť priamo údaje získané z tkanív jednotlivých rýb a opravené vzhľadom na obsah lipidov (pozri bod 37). Z grafu hodnôt koncentrácií opravených o obsah lipidov je možné získať hodnotu C 0,d vzhľadom na obsah lipidov a hodnotu k 2. Potom je možné vykonať matematickú analýzu použitím rovnice v dodatku 7, pričom hodnota asimilačnej účinnosti (a) sa vypočíta použitím rýchlostnej konštanty trávenia potravy normalizovanej o obsah lipidov (I lipid) a koncentrácie v potrave vzhľadom na obsah lipidov (C food-lipid). Parametre opravené o obsah lipidov sa potom podobne použijú na výpočet BMF (pripomíname, že na výpočet hodnoty BMFKgL opravenej vzhľadom na rast a obsah lipidov by sa oprava rýchlostnou konštantou rastu mala použiť aj v prípade lipidovej frakcie a nie vlhkej hmotnosti rýb). Interpretácia výsledkov Priemerný rast v testovanej i kontrolnej skupine by sa v zásade nemali výrazne odlišovať, aby sa vylúčili toxické účinky. Rýchlostné konštanty rastu alebo rastové krivky v oboch skupinách by sa mali vhodným spôsobom porovnať (69). Skúšobný protokol Po ukončení štúdie sa vypracuje záverečný protokol obsahujúci informácie o testovanej látke, testovaných druhoch a podmienkach testu podľa bodu 81 (ako v prípade skúšky expozície vo vodnom prostredí). Okrem toho sa vyžadujú tieto údaje:
LITERATÚRA
Dodatok 1 DEFINÍCIE A JEDNOTKY
LITERATÚRA
Dodatok 2 NIEKTORÉ CHEMICKÉ CHARAKTERISTIKY VODY NA RIEDENIE
Dodatok 3 DRUHY RÝB ODPORÚČANÉ NA TESTOVANIE
Menej sa používajú rôzne brakické a morské druhy, napríklad:
Sladkovodné ryby uvedené v tabuľke sa ľahko chovajú a/alebo sú široko dostupné počas celého roka, zatiaľ čo dostupnosť morských a brakických druhov je čiastočne obmedzená na príslušné krajiny. V podmienkach so zabezpečením kontroly nad výskytom ochorení a parazitov sa môžu rozmnožovať a chovať buď vo farmových chovoch alebo v laboratóriách, čím sa zabezpečí dobrý zdravotný stav a známy pôvod testovaných zvierat. Tieto ryby sú dostupné v mnohých častiach sveta. LITERATÚRA
Dodatok 4 HARMONOGRAMY ODBEROV VZORIEK PRE TESTY EXPOZÍCIE PROSTREDNÍCTVOM VODNEJ FÁZY A TESTY EXPOZÍCIE PROSTREDNÍCTVOM POTRAVY 1. Teoretický príklad harmonogramu odberov v prípade testu biokoncentrácie látky s log KOW = 4 pri úplnej expozícii prostredníctvom vodnej fázy
2. Teoretický príklad harmonogramu odberov vzoriek v prípade testu bioakumulácie látky prostredníctvom potravy po 10-dňovej vychytávacej fáze 42-dňovej depuračnej fáze.
Poznámka k načasovaniu fáz a odberov vzoriek: Vychytávacia fáza sa začína prvým podaním krmiva s pridanou testovanou látkou. Pokusný deň trvá od jedného kŕmenia až takmer do druhého kŕmenia o 24 hodín neskôr. Prvý odber vzoriek (1 v tabuľke) by sa mal uskutočniť krátko (napríklad jednu hodinu) pred prvým kŕmením. Odber vzoriek v rámci štúdie by sa mal v ideálnom prípade vykonať krátko pred kŕmením uskutočneným v nasledujúci deň (t. j. približne 23 hodín po kŕmení v deň odberu vzoriek). Vychytávacia fáza sa skončí krátko pred prvým podaním krmiva bez pridanej testovanej látky, keď sa začína depuračná fáza (je pravdepodobné, že ryby z testovanej skupiny budú ešte tráviť krmivo s pridanou testovanou látkou v priebehu 24 hodín po poslednom podaní takejto stravy). To znamená, že krátko pred prvým podaním potravy bez pridanej testovanej látky by sa mala odobrať finálna vzorka z vychytávacej fázy a prvá vzorka z depuračnej fázy by sa mala odobrať približne 23 hodín po prvom podaní krmiva pridanej testovanej látky. Dodatok 5 VŠEOBECNÉ VÝPOČTY
1. ÚVOD Model všeobecnej bioakumulácie vo vodnom prostredí v prípade rýb možno charakterizovať na základe procesov vychytávania a eliminácie, pričom sa neberie do úvahy vychytávanie z potravy. Diferenciálna rovnica (dC f/dt) opisujúca mieru zmeny koncentrácie látky v rybe (mg · kg– 1 · deň– 1) je daná týmto vzťahom (1):
kde:
V prípade bioakumulatívnych látok možno očakávať, že časovo vážený priemer koncentrácií (TWA) je najvýznamnejšou expozičnou koncentráciou vo vode (Cw ) v rámci prípustného rozsahu fluktuácie (pozri bod 24). Odporúča sa vypočítať koncentráciu TWA vo vode podľa postupu uvedeného v dodatku 6 testovacej metódy C.20 (2). Treba poznamenať, že logarimtická (ln) transformácia koncentrácie látky vo vode je vhodná vtedy, keď sa medzi obdobiami obnovy očakáva exponenciálny rozkladný proces, napr. pri polostatickom pláne testu. V prietokovom systéme možno nebude potrebná logaritmická (ln) transformácia expozičných koncentrácií. V prípade odvodených koncentrácií TWA vo vode by sa tieto koncentrácie mali zaznamenať a použiť v ďalších výpočtoch. Pri štandardnom teste BCF na rybách možno vychytávanie a depuráciu charakterizovať na základe dvoch kinetických procesov prvého rádu.
V ustálenom stave za predpokladu zanedbateľného rastu a metabolizmu (t. j. hodnoty k g a k m nemožno odlíšiť od nuly) sa miera vychytávania rovná miere depurácie, a tak z kombinácie rovnice A5.2 a rovnice A5.3 vyplýva takýto vzťah:
kde:
Pomer k 1/k 2, známy ako kinetický BCF (BCFK), by sa mal rovnať BCF v ustálenom stave (BCFSS) získanému z pomeru koncentrácie v rybách a koncentrácie vo vode v ustálenom stave. Ak bol však ustálený stav neistý alebo sa na kinetický BCF uplatnili korekcie vzhľadom na rast, môžu sa vyskytnúť odchýlky. No keďže k 1 a k 2 sú konštanty, na odvodenie BCFK nie je potrebné dosiahnuť ustálený stav. Na základe týchto rovníc prvého rádu obsahuje tento dodatok 5 všeobecné výpočty nevyhnutné pre metódu bioakumulácie na základe expozície prostredníctvom vody, ako aj metódu bioakumulácie na základe expozície prostredníctvom potravy. Oddiely 5, 6 a 8 však majú význam len z hľadiska metódy týkajúcej sa expozície prostredníctvom vody, no uvádzame ich tiež, keďže ide o „všeobecné“ techniky. Vďaka metóde postupného testovania (oddiely 4 a 5) a simultánnej metóde (oddiel 6) možno vypočítať konštanty vychytávania a depurácie, ktoré sa použijú na odvodenie kinetických BCF. Metóda postupného testovania na účely stanovenia hodnoty k 2 (oddiel 4) má význam z hľadiska metódy týkajúcej sa expozície prostredníctvom potravy, keďže uvedená hodnota je potrebná na výpočet účinnosti asimilácie, ako aj BMF. V dodatku 7 sa podrobne uvádzajú výpočty, ktoré sú špecifické pre metódu týkajúcu sa expozície prostredníctvom potravy. 2. PREDPOVEĎ TRVANIA VYCHYTÁVACEJ FÁZY Pred vykonaním testu možno na základe empirických vzťahov medzi k 2 a rozdeľovacou konštantou n-oktanol-voda (K OW) alebo medzi k 1 a BCF odhadnúť hodnotu konštanty k 2, a tým aj istú percentuálnu hodnotu času potrebného na dosiahnutie ustáleného stavu. Treba si však uvedomiť, že rovnice uvedené v tomto oddiele platia iba vtedy, keď sa vychytávanie a depurácia riadia kinetikou prvého rádu. Ak zjavne nejde o tento prípad, v prípade, že sú prognózy týkajúce sa vychytávacej fázy žiaduce, odporúčame požiadať o konzultácie odborníkov v oblasti biostatiky a/alebo farmakokinetiky. Odhad hodnoty k 2 (deň– 1) možno získať viacerými metódami. V prvom rade možno použiť napríklad tieto empirické vzťahy (87):
alebo
W = priemerná hmotnosť ryby ovplyvnenej chemikáliou (v gramoch vlhkej hmotnosti) na konci vychytávacej fázy/začiatku depuračnej fázy (88) Pre ďalšie súvisiace vzťahy pozri (6). Pri odhade k 2 môže byť výhodné uplatniť komplikovanejšie modely, ak napríklad existuje pravdepodobnosť, že dôjde k významnému metabolizmu (7) (8). Pri náročnejších modeloch však treba pri interpretácii prognóz postupovať opatrnejšie. Napríklad prítomnosť nitroskupín môže poukazovať na rýchly metabolizmus, no vždy to tak nie je. Používateľ by preto mal pri časovom plánovaní štúdie zvážiť výsledky prognostických metód vzhľadom na chemickú štruktúru a všetky ďalšie relevantné informácie (napríklad predbežné štúdie). Na základe odhadu k 2– a za predpokladu, že rast a metabolizmus sú zanedbateľné, možno zo všeobecnej kinetickej rovnice udávajúcej vychytávanie a depuráciu (kinetika prvého rádu) zistiť čas potrebný na dosiahnutie istého percentuálneho podielu ustáleného stavu. Ak počas štúdie dôjde k výraznému rastu, ďalej opísané odhady nebudú spoľahlivé. V takýchto prípadoch je vhodnejšie použiť konštantu k 2g korigovanú vzhľadom na rast, ako sa opisuje ďalej v texte (pozri oddiel 7 tohto dodatku):
alebo v prípade, že koncentrácia C w je konštantná:
V blízkosti ustáleného stavu (t → ∞) možno rovnicu A5.10 zjednodušiť na vzťah [pozri (9) (10)]:
alebo
Hodnota súčinu BCF × C w sa približuje koncentrácii v rybách pri ustálenom stave (C f-SS). [Poznámka: rovnaký prístup možno uplatniť pri odhade BMF pri ustálenom stave v prípade testu expozície prostredníctvom potravy. V tomto prípade sa vo vyššie uvedených rovniciach nahrádza faktor BCF faktorom BMF a koncentrácia C w sa nahrádza koncentráciou v potrave C food.] Rovnica A5.10 sa dá prepísať ako:
alebo
Z rovnice A5.14 možno predpovedať čas na dosiahnutie určitého percentuálneho podielu ustáleného stavu, keď sa predbežný odhad hodnoty k 2 uskutoční na základe rovnice A5.5 alebo rovnice A5.6. Na orientáciu uveďme, že štatisticky optimálna dĺžka trvania vychytávacej fázy na získanie štatisticky prijateľných údajov (BCFK) je čas, za ktorý dosiahne krivka závislosti logaritmu koncentrácie testovanej látky v rybách od lineárneho času aspoň 50 % ustáleného stavu (t. j. 0,69/k 2), nie však viac 95 % ustáleného stavu (t. j. 3,0/k 2) (11). Výpočet BCFSS možno zrealizovať vtedy, ak akumulácia presahuje 95 % ustáleného stavu. Čas na dosiahnutie 80 % ustáleného stavu je (s využitím rovnice A5.14):
alebo
Obdobne čas na dosiahnutie 95 % ustáleného stavu je:
Napríklad trvanie vychytávacej fázy (t. j času na dosiahnutie istého percentuálneho podielu ustáleného stavu, napr. t 80 alebo t 95) v prípade testovanej látky s log K OW = 4 by predstavovalo (s použitím rovnice A5.5, rovnice A5.16 a rovnice A5.17): logk 2=1,47 – 0,414 · 4 k 2 = 0,652 deň– 1
alebo alternatívne, výraz:
možno použiť na vypočítanie času potrebného na dosiahnutie efektívneho ustáleného stavu (t eSS) (12). V prípade látky s log K OW = 4 sa dospeje k tomuto výsledku: teSS = 6,54 · 10 – 3 · 104 + 55,31 = 121 hodín 3. PREDPOVEĎ TRVANIA DEPURAČNEJ FÁZY Predpoveď času potrebného na zníženie záťaže organizmu na určitý percentuálny podiel počiatočnej koncentrácie možno získať aj zo všeobecnej rovnice udávajúcej vychytávanie a depuráciu [za predpokladu kinetiky prvého rádu, pozri rovnicu A5.9 (1) (13)]. Pokiaľ ide o depuračnú fázu, predpokladá sa, že koncentrácia C w (alebo koncentrácia C food v prípade testu expozície prostredníctvom potravy) sa rovná nule. Rovnicu možno preto zjednodušiť na vzťah:
alebo
kde C f,0 je koncentrácia na začiatku depuračnej fázy. 50 % depurácia sa potom dosiahne za čas (t 50):
alebo
Obdobne možno vypočítať, že 95 % depurácia sa dosiahne za:
Ak sa v prvom období dosiahne 80 % vychytávanie (1,6/k 2) a eliminácia počas depuračnej fázy predstavuje 95 % (3,0/k 2), potom depuračná fáza trvá približne dvakrát tak dlho ako vychytávacia fáza. Upozorňujeme, že tieto odhady vychádzajú z predpokladu, že procesy vychytávania a depurácie sa riadia kinetikou prvého rádu. Ak je zrejmé, že nejde o kinetiku prvého rádu, tieto odhady nie sú validné. 4. METÓDA POSTUPNÉHO TESTOVANIA: STANOVENIE RÝCHLOSTNEJ KONŠTANTY DEPURÁCIE (ELIMINÁCIE) K 2 Pri väčšine údajov týkajúcich sa biokoncentrácie sa predpokladá, že sú „dostatočne uspokojivo“ opísané pomocou modelu pozostávajúceho z dvoch kompartmentov/dvoch parametrov, ako to vyplýva z priamky, ktorá je aproximáciou bodov koncentrácií testovanej látky v rybách [na prirodzenej logaritmickej (ln) stupnici] počas depuračnej fázy.
Treba si uvedomiť, že odchýlky od lineárneho priebehu môžu poukazovať na komplikovanejší priebeh depurácie ako ten, ktorý podlieha kinetike prvého rádu. Pri riešení druhov depurácie, ktoré nepodliehajú kinetike prvého rádu, možno uplatniť grafickú metódu. Na výpočet k 2 pri niekoľkých časových bodoch (bodoch odberu vzoriek) uskutočnite lineárnu regresiu prirodzeného logaritmu (koncentrácie) v závislosti od času. Smernica regresnej priamky je odhadom rýchlostnej konštanty depurácie k 2 (89). Z daného úseku možno jednoducho vypočítať priemernú koncentráciu látky v rybách na začiatku depuračnej fázy (C 0,d, čo sa rovná priemernej koncentrácii v rybách na konci vychytávacej fázy) (vrátane tolerancií chyby) (89):
Keď sú na výpočet k 2 k dispozícii len dva časové (odberové) body (ako v minimalizovanom pláne), do uvedenej rovnice dosaďte dané dve priemerné koncentrácie,
kde ln(C f1) je prirodzený logaritmus koncentrácie v čase t 1 a ln(C f2) je prirodzený logaritmus koncentrácie v čase t 2, pričom t 2 a t 1 sú časy, kedy došlo k odberu predmetných dvoch vzoriek vzhľadom na začiatok depurácie (90). 5. METÓDA POSTUPNÉHO TESTOVANIA: STANOVENIE RÝCHLOSTNEJ KONŠTANTY VYCHYTÁVANIA K 1 (VÝLUČNE METÓDA S EXPOZÍCIOU PROSTREDNÍCTVOM VODY) Na zistenie hodnoty k 1 na základe súboru postupných časových údajov týkajúcich sa koncentrácie vo vychytávacej fáze použite počítačový program zodpovedajúci tomuto modelu:
kde k 2 vyplýva z predchádzajúceho výpočtu, C f(t) je koncentrácia látky v rybách a C w(t) je koncentrácia látky vo vode v čase t. Keď sú na výpočet k 1 k dispozícii len dva časové (odberové) body (ako v minimalizovanom pláne), použite túto rovnicu:
kde k 2 vyplýva z predchádzajúceho výpočtu, C f je koncentrácia látky v rybách na začiatku depuračnej fázy a C w je priemerná koncentrácia látky vo vode počas vychytávacej fázy (91). Na posúdenie správnosti výsledku fitovania možno použiť vizuálnu kontrolu smerníc priamok k 1 a k 2 vynesených v závislosti od nameraných údajov týkajúcich sa bodov odberu. Ak sa ukáže, že metóda postupného testovania priniesla nedostatočný odhad k 1, potom by sa mal uplatniť simultánny prístup k výpočtu konštánt k 1 a k 2 (pozri oddiel 6 ďalej). Na účely vizuálnej kontroly správnosti výsledku fitovania by sa mali výsledné smernice opäť porovnať so znázornenými nameranými údajmi. Ak je správnosť výsledku fitovania naďalej nedostatočná, môže z toho vyplývať, že nejde o kinetiku prvého rádu, a preto by sa mali využiť iné, zložitejšie modely. 6. SIMULTÁNNA METÓDA VÝPOČTU RÝCHLOSTNEJ KONŠTANTY VYCHYTÁVANIA A RÝCHLOSTNEJ KONŠTANTY DEPURÁCIE (ELIMINÁCIE) (VÝLUČNE METÓDA S EXPOZÍCIOU PROSTREDNÍCTVOM VODY) Na zistenie hodnôt k 1 a k 2 možno použiť počítačové programy, a to na základe súboru postupných časových údajov týkajúcich sa koncentrácie a s využitím tohto modelu:
kde
Tento prístup priamo poskytuje štandardné chyby odhadov konštánt k 1 a k 2. Ak sa v rovniciach A5.25 a A5.26 k 1/k 2 nahradí faktorom BCF (pozri rovnicu A5.4), možno odhadnúť aj štandardnú chybu a 95 % interval spoľahlivosti faktoru BCF. Toto je obzvlášť praktické pri porovnávaní rôznych odhadov v dôsledku transformácie údajov. Závislú premennú (koncentráciu látky v rybách) možno fitovať s logaritmickou transformáciou alebo bez nej, pričom možno vyhodnotiť výslednú neistotu BCF. Keďže medzi uvedenými dvoma parametrami k 1 a k 2 existuje silná korelácia (ak sa odhadujú simultánne), možno by bolo vhodnejšie najprv vypočítať hodnotu k 2 výlučne z údajov o depurácii (pozri vyššie);z depuračnej krivky možno vo väčšine prípadov s pomerne vysokou presnosťou odhadnúť konštantu k 2. Následne možno z údajov týkajúcich sa vychytávania s použitím nelineárnej regresie vypočítať hodnotu k 1 (92). Odporúča sa použiť rovnaký postup transformácie údajov ako pri postupnom fitovaní. Na posúdenie správnosti výsledku fitovania možno použiť vizuálnu kontrolu výsledných smerníc znázornených priamok vynesených v závislosti od nameraných údajov týkajúcich sa bodov odberu. Ak sa ukáže, že z tejto metódy vyplynul nedostatočný odhad k 1, potom možno uplatniť simultánny prístup k výpočtu konštánt k 1 a k 2. Na účely vizuálnej kontroly správnosti výsledku fitovania by sa mal fitovaný model opäť porovnať s nameranými údajmi vynesenými do grafu. Potom by sa mali výsledné parametrové odhady konštánt k 1, a k 2 a výsledný faktor BCF, ako aj s nimi súvisiace štandardné chyby a/alebo intervaly spoľahlivosti porovnať vzhľadom na jednotlivé druhy fitovania. Ak je správnosť výsledku fitovania nedostatočná, môže z toho vyplývať, že nejde o kinetiku prvého rádu, a preto by sa mali využiť iné, zložitejšie modely. Jednou z najčastejších komplikácií je rast rýb počas testu. 7. KOREKCIA KINETICKÉHO BCF A BMF VZHĽADOM NA RIEDENIE LÁTKY VPLYVOM RASTU RYBY V tomto oddiele sa opisuje štandardná metóda korekcie vzhľadom na rast rýb počas testu (tzv. „riedenie látky vplyvom rastu ryby“), ktorá je validná len pri uplatnení kinetiky prvého rádu. V prípade náznakov neuplatňovania kinetiky prvého rádu vám odporúčame, aby ste v záujme riadnej korekcie vzhľadom na riedenie látky vplyvom rastu ryby požiadali o konzultácie odborníka v oblasti biostatiky, prípadne uplatnili hmotnostný prístup opísaný ďalej. Tejto metóde, ktorá je zameraná na korekciu faktorov vzhľadom na riedenie látky vplyvom rastu ryby, chýba v niektorých prípadoch istá presnosť, respektíve niekedy nefunguje (napríklad v prípade látok s veľmi pomalou depuráciou, ktoré sa testujú na rýchlorastúcich rybách, môže byť konštanta k 2g, teda odvodená rýchlostná konštanta depurácie korigovaná vzhľadom na riedenie látky vplyvom rastu ryby, veľmi malá, a teda chyba v dvoch rýchlostných konštantách, ktoré sa použili na jej odvodenie, nadobudla kritický charakter, pričom v niektorých prípadoch môžu byť odhady konštanty k g väčšie ako k 2). V takýchto prípadoch možno uplatniť alternatívny prístup (t. j. hmotnostný prístup), ktorý funguje aj v prípade, že nejde o kinetiku prvého rádu, vďaka čomu netreba vykonať korekciu. Tento prístup sa uvádza na konci tohto oddielu. Metóda odpočítania rýchlostnej konštanty rastu na účely korekcie vzhľadom na rast Na účely štandardnej metódy sú všetky individuálne údaje týkajúce sa hmotnosti a dĺžky prevedené na prirodzené logaritmy, pričom sú logaritmické údaje, t. j. ln(hmotnosť) alebo ln(1/hmotnosť) znázornené v závislosti od času (deň), a to osobitne v prípade ovplyvňovaných a kontrolných skupín. Rovnaký postup sa uplatňuje v prípade údajov z vychytávacej a depuračnej fázy, ku ktorým sa pristupuje oddelene. Všeobecne platí, že v súvislosti s korekciou vzhľadom na riedenie vplyvom rastu ryby je na odvodenie rýchlostnej konštanty rastu (k g) vhodnejšie použiť hmotnostné údaje z celej štúdie, no zo štatisticky významných rozdielov medzi rýchlostnými konštantami rastu odvodenými pre vychytávaciu a depuračnú fázu môže vyplývať, že by sa mala použiť rýchlostná konštanta depuračnej fázy. Celkové rýchlosti rastu získané zo štúdií vo vodnom prostredí, ktoré sa týkajú testovaných a kontrolných skupín, možno použiť na kontrolu rôznych účinkov v súvislosti s ovplyvňovaním danou chemikáliou. Štandardnými štatistickými postupmi sa vypočíta korelácia lineárnej regresie (lineárna korelácia najmenších štvorcov) pre logaritmus ln(hmotnosť ryby) v závislosti od času (v dňoch) [ako aj pre ln(1/hmotnosť v závislosti od času (v dňoch)] pre každú skupinu (testované a kontrolné skupiny, individuálne údaje, nie denné priemerné hodnoty), a to pre celú štúdiu, pre vychytávaciu fázu a depuračnú fázu. Na účely vyhodnotenia štatistickej významnosti (p = 0,05) rozdielu medzi smernicami (rýchlostné konštanty rastu) sa používa vypočítaný rozptyl smerníc priamok, a to s použitím Studentovho t-testu (alebo analýzy ANOVA v prípade testovania viacerých koncentrácií). Na účely korekcie vzhľadom na rast sa vo všeobecnosti uprednostňujú údaje o hmotnosti. Obdobne sa pristupuje aj k údajom o dĺžke. Môžu sa použiť na porovnanie kontrolných a testovaných skupín v súvislosti s účinkami testovania. Ak neexistuje žiadny štatisticky významný rozdiel v analýze údajov o hmotnosti, údaje z testu a kontroly možno zlúčiť. Okrem toho možno vypočítať celkovú rýchlostnú konštantu rastu ryby za celú štúdiu (k g) ako celkovú smernicu lineárnej korelácie. Ak sa zistia štatisticky významné rozdiely, rýchlostné konštanty rastu sa vykazujú osobitne za každú skupinu rýb a/alebo fázu štúdie. Rýchlostné konštanty každej ovplyvnenej skupiny by sa potom mali použiť na účely korekcie riedenia látky vplyvom rastu rýb v danej skupine. Ak sa zaznamenali štatistické rozdiely medzi rýchlostnými konštantami vychytávacej a depuračnej fázy, mala by sa použiť odvodená rýchlostná konštanta depuračnej fázy. Vypočítanú rýchlostnú konštantu rastu (k g vyjadrenú v dňoch– 1) možno odpočítať od celkovej rýchlostnej konštanty depurácie (k 2), na základe čoho sa získa rýchlostná konštanta depurácie k 2g.
Rýchlostná konštanta vychytávania sa vydelí rýchlostnou konštantou depurácie korigovanou vzhľadom na rast, na základe čoho sa získa kinetický BCF korigovaný vzhľadom na rast, ktorý sa označuje ako BCFKg (alebo BMFKg).
V rovnici A7.5 sa na výpočet BMFKg korigovaného vzhľadom na rast používa rýchlostná konštanta rastu odvodená na účely štúdie s podávaním potravy (pozri dodatok 7). Hmotnostná metóda na účely korekcie vzhľadom na rast Namiesto už uvedenej „metódy odpočítania rýchlostnej konštanty rastu“ možno ako alternatívu použiť túto metódu, pri ktorej netreba uplatniť korekciu vzhľadom na rast. Základ spočíva vo využívaní údajov o depurácii na hmotnostnom základe (v súvislosti s celou rybou), a teda nie údajov týkajúcich sa koncentrácie. Preveďte koncentrácie látky v tkanive zistené počas depuračnej fázy (hmotnosť testovanej látky na jednotkovú hmotnosť ryby) na hmotnosť testovanej látky/ryba: priraďte koncentrácie a hmotnosti jednotlivých rýb v tabuľkovej forme (napr. pomocou počítačového tabuľkového procesoru) a pre dané meranie vynásobte každú koncentráciu celkovou hmotnosťou ryby s cieľom určiť súbor podielov hmotnostný údaj o testovanej látke/ryba pre všetky vzorky získané počas depuračnej fázy. Vyneste výsledný prirodzený logaritmus hmotnostných údajov o látke v závislosti od času experimentu (depuračná fáza) do grafu ako pri bežnom postupe. V prípade metódy expozície vo vodnom prostredí rutinným spôsobom odvoďte rýchlostnú konštantu vychytávania (pozri oddiely 4 a 6). Pripomíname, že v rovniciach zameraných na fitovanie krivky v súvislosti s konštantou k 1 by sa mala použiť „normálna“ hodnota k 2. Z vyššie uvedených údajov odvoďte rýchlostnú konštantu depurácie. Pretože výsledná hodnota rýchlostnej konštanty depurácie je nezávislá od rastu, keďže sme ju odvodili na základe hmotnosti vzhľadom na celú rybu, mala by sa označiť ako k 2g, a nie ako k 2. 8. NORMALIZÁCIA LIPIDOV NA 5 % OBSAH LIPIDOV (VÝLUČNE METÓDA EXPOZÍCIE PROSTREDNÍCTVOM VODY) Ak nemožno potvrdiť, že sa testovaná látka primárne akumuluje v lipidoch (s bielkovinami sa môžu napr. viazať niektoré plnofluórované látky), výsledky BCF (v kinetickom a ustálenom stave) vyplývajúce z testov zameraných na expozíciu prostredníctvom vody by sa mali vykazovať aj vo vzťahu k štandardnému obsahu lipidov v rybách, ktorý predstavuje 5 % vlhkej hmotnosti. Údaje o koncentráciách rýb alebo BCF je potrebné previesť na 5 % obsah lipidov pri vlhkej hmotnosti. Ak sa na meranie koncentrácií látky a obsahu lipidov vo všetkých bodoch odberu vzoriek použili tie isté ryby, v takom prípade je nevyhnutné korigovať každú jednu nameranú koncentráciu látky v rybe vzhľadom na obsah lipidov danej ryby.
kde
Ak sa analýza lipidov neuskutočnila na všetkých rybách vo vzorke, na normalizáciu BCF sa použije priemerná lipidová hodnota. V prípade BCF pri ustálenom stave by sa mala použiť priemerná hodnota zaznamenaná na konci fázy vychytávania v ovplyvnenej skupine. Pri normalizácii kinetického BCF môžu existovať prípady odôvodneného uplatnenia iného prístupu, napríklad vtedy, ak sa počas vychytávacej alebo depuračnej fázy značne zmenil obsah lipidov. Miera kŕmenia, ktorou sa minimalizujú dramatické zmeny obsahu lipidov by sa však mala rutinne používať.
kde
LITERATÚRA
Dodatok 6 ODDIEL VENOVANÝ ROVNICIAM TÝKAJÚCIM SA TESTU ZAMERANÉHO NA EXPOZÍCIU PROSTREDNÍCTVOM VODNEJ FÁZY: MINIMALIZOVANÝ PLÁN TESTU Dôvod tohto prístupu spočíva v tom, že v plnom teste možno biokoncentračný faktor stanoviť buď ako rovnovážny biokoncentračný faktor (BCFSS) na základe výpočtu pomeru koncentrácie testovanej látky v tkanive ryby ku koncentrácii testovanej látky vo vode, alebo ho možno stanoviť na základe výpočtu kinetického biokoncentračného faktoru (BCFK) ako pomer rýchlostnej konštanty vychytávania k 1 k rýchlostnej konštante depurácie k 2. BCFK je platný aj vtedy, ak sa počas vychytávacej fázy nedosiahne rovnovážna koncentrácia látky za predpokladu, že vychytávanie a depurácia prebiehajú približne podľa kinetiky prvého rádu. Ak sa meranie koncentrácie látky v tkanivách C f1) uskutočňuje v čase, keď sa expozícia končí (t 1), a koncentrácia v tkanive (C f2) sa opäť meria až po uplynutí istého obdobia (t 2), rýchlostnú konštantu depurácie (k 2) možno odhadnúť pomocou rovnice A5.22 uvedenej v dodatku 5. Rýchlostnú konštantu vychytávania k 1 potom možno stanoviť algebricky pomocou rovnice A5.23 uvedenej v dodatku 5 (kde C f sa rovná C f1 a t sa rovná t 1) (1). Kinetický biokoncentračný faktor v prípade minimalizovaného plánu testu (označený ako BCFKm v záujme jeho odlíšenia od kinetických biokoncentračných faktorov stanovených pomocou iných metód) je teda:
Koncentrácie alebo výsledky by sa mali korigovať vzhľadom na riedenie látky vplyvom rastu ryby a normalizovať na 5 % obsah lipidov v rybe, ako sa opisuje v dodatku 5. Minimalizovaný BCFSS je BCF vypočítaný na konci fázy vychytávania za predpokladu dosiahnutia ustáleného stavu. Možno ho len predpokladať, pretože počet odberových bodov nepostačuje na jeho preukázanie.
kde C f-minSS = koncentrácia v rybe pri predpokladanom ustálenom stave na konci vychytávania (mg · kg– 1 vlhkej hmotnosti). C w-minSS = koncentrácia vo vode pri predpokladanom ustálenom stave na konci vychytávania (mg · l– 1). LITERATÚRA
Dodatok 7 ODDIEL VENOVANÝ ROVNICIAM TÝKAJÚCIM SA TESTU ZAMERANÉHO NA EXPOZÍCIU PROSTREDNÍCTVOM POTRAVY
1. PRÍKLAD MNOŽSTIEV JEDNOTLIVÝCH ZLOŽIEK VHODNÉHO KOMERČNÉHO KRMIVA PRE RYBY
2. PRÍKLADY POSTUPOV PRIDÁVANIA TESTOVANEJ LÁTKY DO POTRAVY Všeobecné poznámky Kontrolná potrava by sa mala pripravovať úplne rovnako ako potrava s pridanou testovanou chemikáliou, avšak bez testovanej látky. Na kontrolu koncentrácie potravy s pridanou testovanou chemikáliou by sa mali pomocou vhodnej extrakčnej metódy vyextrahovať trojité vzorky dávkového krmiva, pričom by sa v extrahovaných vzorkách mala odmerať koncentrácia testovanej látky alebo rádioaktivita. Mala by sa preukázať vysoká analytická výťažnosť (> 85 %) s nízkou variabilitou medzi jednotlivými vzorkami (tri vzorky koncentrácie látky odobraté na začiatku testu by sa od priemernej hodnoty nemali líšiť o viac ako ± 15 %). Počas testu s expozíciou prostredníctvom potravy by sa v deň 0 a na konci vychytávacej fázy mali na analýzu odobrať tri vzorky potravy na účely stanovenia obsahu testovanej látky v potrave. Príprava krmiva pre ryby s (čistým) kvapalným testovaným materiálom Cieľová nominálna testovacia koncentrácia v ovplyvnenom krmive pre ryby sa stanoví napríklad na 500 μg testovanej látky/g potravy. Príslušné množstvo (podľa molárnej hmotnosti alebo špecifickej rádioaktivity) čistej testovanej látky sa pridá ku krmivu pre ryby so známou hmotnosťou umiestnenému v sklenej nádobe alebo rotačnej odparke. Množstvo krmiva pre ryby by malo postačovať na celú vychytávaciu fázu (s prihliadnutím na potrebu zvýšených množstiev potravy pri každom kŕmení vzhľadom na rast rýb). Krmivo pre ryby by sa malo cez noc pomaly premiešavať s testovanou látkou (napr. v miešacom zariadení typu „roto-rack“ alebo rotáciou v prípade použitia rotačnej odparky). Potrava s pridanou testovanou chemikáliou by mala byť až do použitia uskladnená za podmienok, v ktorých sa zachová stabilita testovanej látky v kŕmnej zmesi (napr. v chladiacom zariadení). Príprava krmiva pre ryby s kukuričným alebo rybím olejom ako nosičom Tuhé testované látky by sa v trecej miske mali rozdrviť na jemný prášok. Kvapalné testované látky možno priamo pridať ku kukuričnému alebo rybiemu oleju. Testovaná látka sa rozpustí v známom množstve kukuričného alebo rybieho oleja (napr. 5 – 15 ml). Olej s príslušnou dávkou sa kvantitatívne prenesie do rotačnej odparky vhodnej veľkosti. Banka použitá na prípravu dávky uvedeného oleja by sa mala dvakrát vypláchnuť malým množstvom oleja, ktoré sa následne pridá do odparky s cieľom zabezpečiť prenos všetkej rozpustenej testovanej látky. V záujme úplného rozpustenia/rozptýlenia látky v oleji (alebo ak sa v štúdii používa viac ako jedna testovaná látka) sa do banky vloží mikromiešadlo, banka sa zazátkuje a zmes sa cez noc rýchlo mieša. Na účely testu sa do odparky pridá primerané množstvo krmiva pre ryby (zvyčajne vo forme peliet) a obsah banky sa homogénne mieša jej nepretržitým otáčaním v trvaní aspoň 30 minút, no pokiaľ možno cez noc. Na zabezpečenie stability testovanej látky v krmive s prídavkom testovanej chemikálie sa toto krmivo až do jeho použitia primerane uskladní (napríklad v chladiacom zariadení). Príprava krmiva pre ryby s organickým rozpúšťadlom Primerané množstvo testovanej látky (podľa molárnej hmotnosti alebo špecifickej rádioaktivity), ktoré postačuje na dosiahnutie cieľovej dávky, sa rozpustí vo vhodnom organickom rozpúšťadle (napríklad v 10 – 40 ml cyklohexánu alebo acetónu, ale prípadne aj vo väčšom objeme v závislosti od množstva potravy, do ktorej sa má pridať testovaná chemikália). Alikvotná časť tohto roztoku alebo celý roztok (pridáva sa po častiach ) sa zmieša s primeraným množstvom krmiva pre ryby postačujúcim na to, aby sa v rámci testu dosiahla požadovaná nominálna úroveň dávky. Krmivo a testovanú látku možno zmiešať v zmiešavacej miske z nehrdzavejúcej ocele, následne možno čerstvo pripravenú dávku krmiva pre ryby v tejto miske dva dní ponechať v laboratórnom digestore (s občasným premiešaním), vďaka čomu sa z nej odparí nadbytočné rozpúšťadlo. Prípadne možno krmivo a testovanú látku zmiešať v rotačnej odparke s nepretržitou rotáciou. Nadbytočné rozpúšťadlo možno v prípade potreby odstrániť prúdom vzduchu alebo dusíkom. Treba dbať na to, aby testovaná látka po odstránení rozpúšťadla nevykryštalizovala. Potrava s pridanou testovanou chemikáliou by mala byť až do použitia uskladnená za podmienok, v ktorých sa zachová stabilita testovanej látky v kŕmnej zmesi (napr. v chladiacom zariadení). 3. VÝPOČET ASIMILAČNEJ ÚČINNOSTI A BIOMAGNIFIKAČNÉHO FAKTORA Na výpočet asimilačnej účinnosti treba najprv odhadnúť celkovú rýchlostnú konštantu depurácie podľa dodatku 5 oddielu 4 (pomocou metódy postupného testovania, t. j. štandardnej lineárnej regresie) s použitím priemerných koncentrácií vzoriek získaných z depuračnej fázy. Rýchlostná konštanta kŕmenia – I a trvanie vychytávania – t sú v rámci tejto štúdie známe parametre. Priemerná nameraná koncentrácia testovanej látky prítomnej v potrave – C food je v štúdii meranou premennou. Koncentrácia testovanej látky v rybách na konci vychytávacej fázy – C 0,d sa obvykle odvodzuje z úseku graficky znázorneného priebehu prirodzeného logaritmu ln(koncentrácie) v závislosti od dňa depurácie. Asimilačná účinnosť danej látky (a, absorpcia testovanej látky v črevách) sa vypočíta takto:
kde C 0,d = odvodená koncentrácia látky v rybe v čase „nula“ depuračnej fázy (mg kg– 1); k 2 = celková (vzhľadom na rast nekorigovaná) rýchlostná konštanta depurácie (deň– 1) vypočítaná podľa rovníc uvedených v dodatku 5 oddiele 3; I = rýchlostná konštanta požitia potravy (g potravy g– 1 ryby deň– 1); C food = koncentrácia v potrave (mg kg– 1 potravy); t= trvanie obdobia kŕmenia (deň) V záujme stanovenia presnej asimilačnej účinnosti bude však treba upraviť rýchlosť kŕmenia I, ktorá sa používa pri výpočte, vzhľadom na rast rýba. Ak v rámci testu počas vychytávacej fázy (v rámci ktorej nedôjde k žiadnej úprave krmivových dávok s cieľom zachovať nastavenú mieru kŕmenia) dochádza k výraznému rastu rýb, vzhľadom na pokračujúcu fázu vychytávania bude efektívna miera kŕmenia v porovnaní s nastavenou mierou nižšia, čo povedie k vyššej „skutočnej“ asimilačnej účinnosti. (Poznamenávame, že táto skutočnosť nemá význam pre celkový výpočet BMF, keďže veličina I sa použitím rovníc A7.1 a A7.4 fakticky vykráti). Priemernú rýchlosť kŕmenia korigovanú vzhľadom na riedenie látky vplyvom rastu – I g možno odvodiť niekoľkými spôsobmi. Priamočiara a striktná metóda spočíva v uplatnení známej rýchlostnej konštanty rastu (k g) na odhadnutie hmotnosti testovaných rýb v časových bodoch počas vychytávacej fázy, t. j.:
kde W f(t)= priemerná hmotnosť rýb v deň t vychytávania W f,0 = priemerná hmotnosť rýb na začiatku experimentu Týmto spôsobom možno odhadnúť (aspoň) priemernú hmotnosť rýb v posledný deň expozície (W f,end-of-uptake). Keďže rýchlosť kŕmenia vychádza z W f,0,efektívnu rýchlosť kŕmenia na každý deň vychytávania možno vypočítať pomocou týchto dvoch hmotnostných hodnôt. V prípade rýchleho rastu počas vychytávacej fázy treba namiesto veličiny I uplatniť rýchlosť kŕmenia korigovanú vzhľadom na rast, a to I g (g potravy g– 1 ra rybu na deň – 1), ktorú možno vypočítať takto:
Po vypočítaní/vyjadrení asimilačnej účinnosti možno BMF vypočítať vynásobením asimilačnej účinnosti rýchlostnou konštantou kŕmenia I (alebo I g, ak sa použila na výpočet α) a následným vydelením výsledku celkovou rýchlostnou konštantou depurácie k 2:
Rovnakým spôsobom by sa mal vypočítať biomagnifikačný faktor korigovaný vzhľadom na rast, a to pomocou rýchlostnej konštanty depurácie korigovanej vzhľadom na rast (na základe jej odvodenia uvedeného v dodatku 5 oddiele 7). Opäť uvádzame, že ak sa na výpočet α použila veličina I g, mala by sa použiť aj tu namiesto I:
kde: α = asimilačná účinnosť (absorpcia testovanej látky v črevách); k 2 = celková (vzhľadom na rast nekorigovaná) rýchlostná konštanta depurácie (deň– 1) vypočítaná podľa rovníc uvedených v dodatku 5 oddiele 3; k 2g = rýchlostná konštanta depurácie korigovaná vzhľadom na rast (deň – 1); I = rýchlostná konštanta požitia potravy (g potravy g– 1 ryby deň– 1); Polčas rozpadu korigovaný vzhľadom na rast (t 1/2) sa vypočíta takto:
Odhadnúť možno aj asimilačnú účinnosť látky obsiahnutej v potrave, ak sa počas lineárnej fázy vychytávania (v dňoch 1 až 3) stanovia rezíduá látky v tkanivách. V tomto prípade sa asimilačná účinnosť látky (α) určí takto:
kde C fish(t)= koncentrácia testovanej látky v rybe v čase t (mg kg– 1 vlhkej hmotnosti) 4. KOREKCIA OBSAHU LIPIDOV Ak sa meranie obsahu lipidov uskutočnilo na tej istej rybe, na ktorej sa vykonala chemická analýza vo všetkých intervaloch odberu vzoriek, potom by sa jednotlivé koncentrácie mali korigovať na základe lipidov, pričom by sa veličiny C 0,d a k 2 získali z grafického znázornenia prirodzeného logarimtu koncentrácie korigovanej vzhľadom na obsah lipidov v závislosti od depurácie (v dňoch). Asimilačnú účinnosť (rovnica A7.1) potom možno vypočítať na základe lipidov, a to pomocou C food na základe lipidov (t. j. hodnota C food sa vynásobí priemernou frakciou lipidov danej potravy). Z následného výpočtu s použitím rovnice A7.4 a rovnice A7.5 priamo vyplynie BMF korigovaný vzhľadom na obsah lipidov (a korigovaný vzhľadom na riedenie látky vplyvom rastu). V opačnom prípade sa priemer frakcie lipidov (hmotnostný zlomok) obsiahnutých v rybách a potrave vypočítajú v prípade ovplyvňovanej, ako aj kontrolnej skupiny (pokiaľ ide o potravu a ryby v kontrolnej skupine, zvyčajne ide o údaje namerané na začiatku a na konci expozície; pokiaľ ide o ryby v ovplyvňovanej skupine, zvyčajne ide o údaje namerané len na konci expozície). V niektorých štúdiách sa obsah lipidov v rybách môže výrazne zvýšiť. V takýchto prípadoch je vhodnejšie použiť priemernú koncentráciu lipidov v ovplyvňovaných rybách, ktorá sa vypočíta na základe nameraných hodnôt na konci expozície a na konci depurácie. Vo všeobecnosti by sa na odvodenie oboch frakcií lipidov mali použiť len údaje z ovplyvňovanej skupiny. Faktor korekcie vzhľadom na lipidy (Lc ) sa vypočíta takto:
kde L fish je priemerná frakcia lipidov v rybách a L food je priemerná frakcia lipidov v potrave. Faktor korekcie vzhľadom na lipidy sa použije na výpočet biomagnifikačného faktora korigovaného vzhľadom na obsah lipidov (BMFL):
5. VYHODNOTENIE ROZDIELOV MEDZI MERANOU KONCENTRÁCIOU V ČASE NULA (C 0,M) A ODVODENOU KONCENTRÁCIOU V ČASE NULA (C 0,D) Meraná koncentrácia v čase nula (C 0,m) a odvodená koncentrácia v čase nula (C 0,d) by sa mali porovnať. Ak sú veľmi podobné, potom by sa na odvodenie depuračných parametrov mal použiť model prvého rádu. V niektorých štúdiách môžu existovať výrazné rozdiely medzi C 0,d, teda odvodenou hodnotou v čase nula, a priemernou meranou koncentráciou v čase nula. C 0,m (pozri poslednú zarážku bodu 159 tejto testovacej metódy). Ak je hodnota C 0,d oveľa nižšia ako hodnota C 0,m (C 0,d << C 0,m), z rozdielu môže vyplývať, že v črevách sú prítomné zvyšky nestrávenej potravy s pridanou testovanou chemikáliou. Ak sa na konci vychytávacej fázy odobrali a uskladnili ďalšie vzorky (celé ryby), túto skutočnosť možno experimentálne otestovať vykonaním samostatnej analýzy odstráneného čreva. V opačnom prípade, ak zo štatisticky reprezentatívneho testu na odľahlé hodnoty použitého na lineárnu regresiu depuračnej fázy vyplýva, že hodnota v prvom bode odberu vzorky v depuračnej fáze je chybne zvýšená, bude potenciálne vhodné uskutočniť lineárnu regresiu na odvodenie k 2, avšak s vynechaním prvej depuračnej koncentrácie. V takýchto prípadoch, ak dôjde k značnému zníženiu neistoty lineárnej regresie a je zrejmé, že pre kinetiku v depuračnej fáze v zásade platí kinetika prvého rádu, pri výpočte asimilačnej účinnosti bude možno vhodné použiť výsledné hodnoty C 0,d a k 2. Pri uvádzaní výsledkov by sa mala táto skutočnosť plne odôvodniť. Okrem toho je možné, že v rámci depuračnej fázy fungovala kinetika iného ako prvého rádu. Ak je táto situácia pravdepodobná (t. j. je zjavné, že údaje transformované prostredníctvom prirodzeného logaritmu predstavujú krivku v porovnaní s priamkou v grafe lineárnej regresie), potom je nepravdepodobné, že výpočty k 2 a C 0,d budú platné, a teda sa treba poradiť s odborníkom v oblasti bioštatistiky. Ak je hodnota C 0,d oveľa vyššia ako nameraná hodnota (C 0,d >> C 0,m), môže to znamenať, že: v prípade danej látky došlo k veľmi rýchlej depurácii (t. j. v depuračnej fáze sa body odberu veľmi skoro priblížili k limitu kvantifikácie predmetnej analytickej metódy, pozri oddiel 6); došlo k odchýlke od depuračnej kinetiky prvého rádu; došlo k chybe v lineárnej regresii na odvodenie k 2 a C 0,d; alebo že v rámci štúdie došlo k výskytu problému týkajúceho sa meraných koncentrácií v istých časových bodoch odberu vzoriek. V takýchto prípadoch by sa mal preskúmať graf lineárnej regresie s cieľom zaznamenať vzorky v limite kvantifikácie alebo v jeho blízkosti, a to na účely zistenia extrémnych odľahlých hodnôt alebo zjavného zakrivenia (čo naznačuje kinetiku iného ako prvého rádu), a tieto skutočnosti by sa mali zdôrazniť pri uvádzaní výsledkov. Malo by sa opísať a odôvodniť každé následné prehodnotenie lineárnej regresie zamerané na zlepšenie odhadovaných hodnôt. Ak sa spozorujú značné odchýlky od kinetiky prvého rádu, potom je nepravdepodobné, že výpočty k 2 a C 0,d budú platné, a teda sa treba poradiť s odborníkom v oblasti bioštatistiky. 6. USMERNENIA TÝKAJÚCE SA TESTOVANÝCH LÁTOK S VEĽMI RÝCHLOU DEPURÁCIOU Ako sa uvádza v bode 129 testovacej metódy, niektoré látky sa môžu depurovať tak rýchlo, že nemožno dospieť k spoľahlivej koncentrácii v čase nula – C 0,d ani k hodnote k 2, pretože už ani vo vzorkách odobratých veľmi skoro v depuračnej fáze (t. j. počnúc druhou depuračnou vzorkou) sa daná látka viac fakticky nedá namerať (koncentrácie zaznamenané v limite kvantifikácie). Táto situácia bola zaznamenaná počas medzilaboratórnej porovnávacej skúšky vykonanej na podporu tejto testovacej metódy s benzo[a]pyrénom a je zdokumentovaná vo validačnej správe k tejto metóde. V takýchto prípadoch nemožno lineárnu regresiu spoľahlivo uskutočniť, keďže z nej pravdepodobne vyplynie nerealisticky vysoký odhad C 0,d, v dôsledku čoho dôjde k zdanlivej asimilačnej účinnosti, ktorá je výrazne vyššia ako 1. V takýchto prípadoch sa dá vypočítať konzervatívny odhad k 2 a „horná medza“ BMF. Pomocou uvedených dátových bodov depuračnej fázy, kde sa merala koncentrácia až po prvú nedetegovateľnú koncentráciu a vrátane nej (koncentrácia stanovená v limite kvantifikácie), sa pomocou lineárnej regresie (s použitím údajov o koncentrácii transformovaných prostredníctvom prirodzeného logaritmu v závislosti od času) bude dať odhadnúť hodnota k 2. V takýchto prípadoch sa pravdepodobne vyskytnú iba dva dátové body (napr. odbery v dni 1 a 2 depurácie) a následne možno pomocou rovnice A5.22 uvedenej v dodatku 5 odhadnúť hodnotu k 2. Tento odhad k2 možno použiť na odhad asimilačnej účinnosti podľa rovnice A7.1, pričom sa v prípade, že hodnota C0,d je podľa odhadu zjavne oveľa vyššia, než aká by sa dala dosiahnuť v teste, hodnota C0,d sa v rovnici nahradí meranou koncentráciou v čase nula (C0,m). Ak hodnota C0,m nebola merateľná, mal by sa použiť limit detekcie v tkanive ryby. Ak z toho v niektorých prípadoch vyplýva hodnota α > 1, potom sa v prípade „najhoršieho scenára“ predpokladá, že hodnota asimilačnej účinnosti je 1. Pomocou rovnice A7.4 možno potom odhadnúť maximálny BMFK, ktorý by sa mal označiť ako hodnota „oveľa menej než“ (<<). Napríklad v prípade štúdie s mierou kŕmenia 3 % a depuračným polčasom kratším ako 3 dni a s uplatnením „najhoršieho scenára“, v rámci ktorého sa α rovná 1, je pravdepodobné, že BMFK bude nižší ako asi 0,13. Vzhľadom na účel tohto odhadu, ako aj na skutočnosť, že hodnoty budú mať konzervatívny charakter, ich nie je potrebné korigovať vzhľadom na riedenie látky vplyvom rastu ryby ani na obsah lipidov v rybách a potrave. Dodatok 8 PRÍSTUPY ODHADOVANIA ORIENTAČNÝCH BCF NA ZÁKLADE ÚDAJOV ZÍSKANÝCH V ŠTÚDII ZAMERANEJ NA EXPOZÍCIU PROSTREDNÍCTVOM POTRAVY Metóda s expozíciou prostredníctvom potravy je súčasťou tejto testovacej metódy zameranej na testovanie bioakumulácie látok, ktoré v praxi nemožno testovať pomocou metódy, v ktorej sa využíva expozícia prostredníctvom vodného prostredia. Výsledkom metódy na báze expozície prostredníctvom vodného prostredia je biokoncentračný faktor, kým metóda na báze expozície prostredníctvom potravy zase vedie priamo k informáciám o magnifikačnom potenciáli krmiva. V mnohých systémoch chemickej bezpečnosti sa vyžadujú informácie o vodnej biokoncentrácii (napríklad v súvislosti s posudzovaním rizika či globálnym harmonizovaným systémom klasifikácie). Existuje teda potreba využiť údaje získané v rámci štúdie týkajúcej sa expozície prostredníctvom potravy na účely odhadu biokoncentračného faktora. Daný prístup je porovnateľný s testami vykonanými podľa metódy expozície prostredníctvom vodného prostredia (94). V tomto oddiele sa skúmajú možné prístupy na riešenie nastoleného problému, no uvádzajú sa v ňom aj nedostatky spočívajúce v predmetných odhadoch. V predmetnej štúdii zameranej na expozíciu prostredníctvom potravy sa meria depurácia s cieľom zistiť rýchlostnú konštantu depurácie k 2. Ak na základe dostupných údajov o situácii, keď boli ryby vystavené testovanej látke prostredníctvom vodného prostredia, možno odhadnúť rýchlostnú konštantu vychytávania, potom kinetický BCF možno odhadnúť. Odhad rýchlostnej konštanty vychytávania pri expozícii testovanej látke prostredníctvom vodného prostredia závisí od viacerých predpokladov, z ktorých všetky prispejú k neistote daného odhadu. Okrem toho sa pri tomto prístupe k odhadu BCF predpokladá, že celková rýchlosť depurácie (vrátane ovplyvňujúcich faktorov, medzi ktoré patrí napríklad distribúcia látky v organizme a individuálne depuračné procesy) nezávisí od spôsobu expozície, ktorý sa uplatňuje so zámerom vyvolať záťaž organizmu v dôsledku pôsobenia testovanej látky. Hlavné predpoklady obsiahnuté v odhadovacom prístupe možno zhrnúť takto: V prípade konkrétnej látky je depurácia nasledujúca po vychytávaní prostredníctvom potravy rovnaká ako depurácia, ktorá nasleduje po expozícii prostredníctvom vodného prostredia. Vychytávanie z vodného prostredia by sa riadilo kinetikou prvého rádu. V závislosti od metódy použitej na odhad vychytávania:
databáza („cvičný súbor“) používaná pri vývoji metódy odhadu vychytávania má v prípade látky, ktorá je predmetom posudzovania, reprezentatívny charakter. V niekoľkých dostupných literárnych prameňoch sa uvádzajú príklady odvodenia rovníc, v ktorých existuje vzťah medzi vychytávaním látky z vodného prostredia žiabrami rýb a rozdeľovacou konštantou oktanol–voda, hmotnosťou rýb (1) (2) (3) (4), objemom a/alebo obsahom lipidov, priepustnosťou membrány/difúznosťou 5) 6), ventilačným objemom ryby (7) a posudzovaním fugacity/materiálovej bilancie (8) (9) (10). Podrobné posúdenie týchto metód v danom kontexte sa uvádza v publikácii od autorskej dvojice Crookes a Brooke (11). V tejto súvislosti je užitočnou pomôckou aj Barberova publikácia (12) zameraná na modelovanie bioakumulácie na základe vychytávania prostredníctvom potravy, pretože obsahuje údaje vychádzajúce z modelov zameraných na rýchlosť vychytávania testovanej látky žiabrami. Tomuto aspektu bol venovaný aj oddiel sprievodného informačného dokumentu k protokolu o expozícii prostredníctvom potravy z roku 2004 (13). Zdá sa, že pri odvodzovaní týchto modelov sa využívali do istej miery obmedzené databázy. V prípade modelov, pri ktorých sú k dispozícii podrobnosti o databáze použitej pri ich zostavení, je zrejmé, že typy použitých látok majú často podobnú štruktúru alebo triedu (z hľadiska funkčnosti, napr. organochlórové zlúčeniny). Z toho popri zvažovaní takých špecifických testovacích parametrov, ako napríklad konkrétny druh, teplota atď, pramení ďalšia neistota v súvislosti s používaním modelu na účely predpovede rýchlostnej konštanty vychytávania pri inom druhu látky. V preskúmaní dostupných techník (11) zarezonovala skutočnosť, že žiadna metóda nie je „správnejšia“ ako iné. Preto by sa malo jasne odôvodniť použitie konkrétneho modelu. Ak je k dispozícii niekoľko metód, ktorých použitie možno odôvodniť, bolo by rozumné predložiť niekoľko odhadov k 1 (a tak aj BCF) alebo škály hodnôt k 1 (a BCF) podľa viacerých metód odhadu vychytávania. Vzhľadom na rozdiely v druhoch modelov a súboroch údajov, ktoré sa použili pri ich vypracovaná, by však nebolo vhodné uplatniť priemernú hodnotu získanú na základe rôznorodo odvodených odhadov. Podľa názoru niektorých výskumníkov si takýto druh odhadov BCF vyžaduje korekciu biologickej dostupnosti v záujme zohľadnenia adsorpcie látky na rozpustený organický uhlík (DOC) za podmienok expozície prostredníctvom vodného prostredia, aby sa odhad zosúladil s výsledkami štúdií venovaných expozícii vo vodnom prostredí [napr. (13) (14)]. Táto korekcia však nemusí byť vhodná vzhľadom na nízke úrovne DOC, ktoré sa vyžadujú v prípade odhadu „najhoršieho scenára“ v rámci štúdie expozície prostredníctvom vodného prostredia (t. j. pomer biologicky dostupnej látky a látky meranej v roztoku). V prípade vysokohydrofóbnych látok môže dôjsť k obmedzeniu vychytávania v žiabrach v dôsledku miery pasívnej difúzie v blízkosti povrchu žiabier. V takomto prípade je možné, že korekciou sa zohľadňuje tento účinok, a nie ten, na ktorý bola určená. Odporúčame zamerať sa na metódy, ktoré si vyžadujú vstupy, pri ktorých možno okamžite získať údaje o látkach testovaných podľa tu opísanej štúdie expozície prostredníctvom potravy (t. j. log K OW, hmotnosť ryby). Uplatniť sa dajú aj iné metódy, ktoré si vyžadujú zložitejšie vstupy, no je možné, že pri nich budú potrebné ďalšie testovacie merania alebo podrobné znalostí o testovanej látke alebo druhu rýb, a tie možno nebudú všeobecne k dispozícii. Výber modelu môže okrem toho ovplyvniť aj úroveň validácie a oblasť uplatniteľnosti [na účely preskúmania a porovnania rôznych metód pozri (11)]. Treba mať na mysli, že výsledné odhady k 1 a BCF sú neisté, a teda je možné, že sa k nim bude musieť pristupovať na základe analýzy váhy dôkazov, pričom bude v záujme celkového vnímania bioakumulačného potenciálu látky potrebné uplatniť odvodený BMF a parametre danej látky (napr. veľkosť molekúl). Interpretácia a použitie týchto parametrov môže závisieť od regulačného rámca. LITERATÚRA
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
17. |
V časti C sa kapitola C.20 nahrádza takto: „C.20 Reprodukčný test na Daphnia magna ÚVOD Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 211 (2012). Usmernenia OECD na vykonávanie testov sa pravidelne revidujú a aktualizujú vzhľadom na vedecký pokrok. Usmernenie na vykonávanie reprodukčného testu 211 vychádza z časti II usmernenia na vykonávanie testu 202, v ktorej sa uvádza reprodukčný test na Daphnia sp. (1984). Všeobecne sa uznáva, že údaje získané na základe testov vykonaných podľa uvedeného usmernenia TG 202 sa môžu líšiť. Z tohto dôvodu sa v záujme vytvorenia lepšej testovacej metódy vynaložilo značné úsilie zamerané na identifikáciu dôvodov tejto variability. Usmernenie na vykonanie testov 211 vychádza z výsledkov týchto výskumných činností, kruhových testov a validačných štúdií vykonaných v rokoch 1992 (1), 1994 (2) a 2008 (3). Toto sú hlavné rozdiely medzi pôvodnou verziou usmernenia na vykonávanie reprodukčného testu (TG 202, 1984) a jeho druhou verziou (TG 211, 1998):
V dodatku 1 sa uvádzajú definície. PRINCÍP TESTU Prvotným cieľom testu je posúdiť účinok chemikálií na reprodukčný výstup Daphnia magna. Mladé samice uvedeného druhu (rodičovské jedince), ktoré sú na začiatku testu mladšie ako 24 hodín, sú vystavené testovanej chemikálii pridávanej do vody v rôznych koncentráciách. Test trvá 21 dní. Na konci testu sa posúdi celkový počet narodených živých potomkov. Reprodukčný výstup rodičovských jedincov možno vyjadriť rôznymi spôsobmi (napr. počet žijúcich potomstva vyprodukovaného na jedinca za deň od prvého dňa, keď bolo spozorované potomstvo). Vykazovanie reprodukčného výstupu by sa však malo uskutočňovať popri vykazovaní celkového počtu živých mláďat na konci testu. Z dôvodu špecifického plánu polostatického testu v porovnaní s inými testovacími metódami týkajúcimi sa reprodukcie bezstavovcov je zároveň možné stanoviť počet živých potomkov jednotlivých rodičovských jedincov. Na rozdiel od iných testovacích metód týkajúcich sa reprodukcie bezstavovcov možno vďaka tomuto testu zabezpečiť, že ak počas testovacieho obdobia dôjde k náhodnému a/alebo mimovoľnému úhynu rodičovského jedinca, z posudzovaných údajov možno vylúčiť ním vyprodukované potomstvo. Ak sa teda u replikátov vystavených účinkom chemikálie vyskytne rodičovská úmrtnosť, malo by sa zvážiť, či v prípade danej úmrtnosti ide o zvyčajnú reakciu na koncentráciu, napr. v prípade významnej regresie reakcie na koncentráciu testovanej chemikálie s pozitívnym sklonom (na tento účel sa môže použiť štatistický test ako Cochranov a Armitageov test trendu). Ak úmrtnosť nie je reakciou na koncentráciu, potom by sa dané replikáty s rodičovskou úmrtnosťou mali z analýzy výsledkov testu vylúčiť. Ak úmrtnosť je reakciou na koncentráciu, rodičovská úmrtnosť by sa mala pripísať účinku testovanej chemikálie a replikáty by sa z analýzy nemali vylúčiť. Ak rodičovský jedinec uhynie počas testu, t. j. náhodne v dôsledku nesprávneho zaobchádzania alebo nehody, prípadne uhynie mimovoľne v dôsledku nevysvetliteľnej udalosti, ktorá nesúvisela s účinkom testovanej chemikálie, alebo ak vysvitne, že posudzovaný jedinec je samec, potom sa replikát vylúči z analýzy (viac informácií sa uvádza v bode 51). Toxické účinky testovanej chemikálie na reprodukčný výstup sa vyjadrujú buď ako ECx, a to prostredníctvom dosadzovania údajov do vhodného modelu a základe nelineárnej regresie s cieľom odhadnúť koncentráciu, ktorá by spôsobila x % zníženie reprodukčného výstupu, alebo sa vyjadrujú ako hodnota NOEC/LOEC (4). Testované koncentrácie by mali podľa možnosti zahŕňať najnižšiu z použitých účinných koncentrácií (napr. EC10), čo znamená, že táto hodnota sa vypočíta pomocou interpolácie, a nie extrapolácie. Zaznamenať by sa mal aj počet rodičovských jedincov, ktorí prežili, a čas narodenia prvého potomstva. Preskúmať možno aj iné s danou chemikáliou súvisiace účinky na parametre, ako sú napríklad rast (napr. dĺžka) a možná inherentná rýchlosť rastu populácie (pozri bod 44). INFORMÁCIE O TESTOVANEJ CHEMIKÁLII Pri výbere vhodných testovacích koncentrácií v reprodukčných testoch môžu byť užitočné výsledky testu akútnej toxicity (pozri kapitolu C.2 tejto prílohy: Test akútnej imobilizácie dafnií Daphnia sp.), ktorý sa uskutočnil s použitím druhu Daphnia magna. Je potrebné poznať rozpustnosť testovanej chemikálie vo vode a jej tlak pary, pričom by k dispozícii mala byť spoľahlivá analytická metóda na kvantifikáciu chemikálie v testovacích roztokoch so známou mierou výťažnosti a kvantifikačným limitom. Medzi informácie o testovanej chemikálii, ktoré môžu byť užitočné pri stanovovaní testovacích podmienok, patrí štruktúrny vzorec, čistota chemikálie, stabilita na svetle, stabilita za podmienok testovania, pKa, Pow a výsledky testov na ľahkú biodegradovateľnosť [pozri kapitolu C.4 (Stanovenie „ľahkej“ biodegradovateľnosti) a kapitolu C.29 (Ľahká biodegradovateľnosť – CO2 v hermeticky uzavretých nádobách) tejto prílohy]. PLATNOSŤ TESTU Aby bol test platný, pri kontrole(-ách) by sa mali splniť tieto kritériá na vykonanie testu:
Poznámka: Rovnaké validačné kritérium(20 %) možno uplatniť aj v prípade náhodnej a mimovoľnej rodičovskej úmrtnosti v prípade kontrol, ako aj každej z testovaných koncentrácií. OPIS METÓDY Prístrojové vybavenie Testovacie nádoby a iné prístroje, ktoré prichádzajú do styku s testovacími roztokmi, by mali byť celé zo skla alebo iného chemicky inertného materiálu. Testovacie nádoby sú obvykle sklenené kadičky. Okrem toho budú potrebné niektoré z týchto zariadení alebo všetky uvedené zariadenia:
Testované organizmy Druh, ktorý sa má použiť v teste je Daphnia magna Straus (95). Klony by sa mali podľa možnosti identifikovať na základe genotypov. Z výskumu (1) vyplynulo, že reprodukčná schopnosť klonu A (ktorý pochádza z IRCHA vo Francúzsku) (5), stabilne vyhovuje kritériu validity, ktorým je priemerná hodnota ≥ 60 žijúcich potomkov na rodičovského jedinca, ktorý prežíva, ak je chovaný za podmienok opísaných v tejto testovacej metóde. Akceptovateľné sú však aj iné klony, a to za podmienky, že predmetná kultúra dafnií preukázateľne spĺňa kritériá validity na účely testu. Na začiatku testu by mali byť jedince mladšie ako 24 hodín a nemali by pochádzať z prvého potomstva. Mali by pochádzať zo zdravej populácie (t. j. nemali by vykazovať príznaky stresu, akými sú napríklad vysoká úmrtnosť, prítomnosť samcov a efípií, oneskorené liahnutie prvých potomkov, jedince so zmenou sfarbenia atď.) Zásobná populácia by sa mala držať v chovných podmienkach (svetlo, teplota, médium, kŕmenie a počet jedincov na jednotku objemu) podobných tým, ktoré sa použijú pri teste. Ak sa rastové médium dafnií, ktoré sa má použiť v teste, líši od média, ktoré sa vyskytuje pri bežnej kultúre dafnií, s cieľom zabrániť spôsobovaniu stresu rodičovským jedincom sa odporúča pred testom zaradiť aklimatizačné obdobie trvajúce obvykle okolo troch týždňov (t. j. jedna generácia). Testovacie médium V tomto teste odporúčame použiť plne definované médium. Vďaka tomu sa možno vyhnúť použitiu ťažko charakterizovateľných prídavných látok (napr. rias, pôdnych extraktov), čím sa následne zlepšujú možnosti štandardizácie medzi laboratóriami. Zistilo sa, že na tento účel sú vhodné Elendtove médiá M4 (6) a M7 (pozri dodatok 2). Akceptovateľné sú však aj iné médiá, napr. (7), (8), a to za podmienky, že úžitkovosť kultúry dafnií preukázateľne spĺňa kritériá validity testu. Ak sa používajú médiá, ktoré obsahujú nedefinované prídavné látky, tieto prídavné látky by sa mali jasne špecifikovať, pričom by sa mali v skúšobnom protokole poskytnúť informácie o zložení, a to predovšetkým s prihliadnutím na obsah uhlíka, keďže práve obsah uhlíka môže prispievať k poskytovanej potrave. Odporúča sa, aby sa stanovil celkový obsah organického uhlíka (TOC) a/alebo chemická spotreba kyslíka (COD) v zásobnom roztoku organickej prídavnej látky a aby sa uskutočnil odhad výsledného vplyvu na TOC/COD v testovacom médiu. Ďalej sa odporúča, aby úrovne TOC v médiu (t. j. pred pridaním rias) boli pod 2 mg/l (9). Pri testovaní chemikálií s obsahom kovov je dôležité rozpoznať, že vlastnosti testovacieho média (t. j. tvrdosť, chelačná kapacita) môžu mať súvislosť s toxicitou testovanej chemikálie. Z tohto dôvodu je vhodné úplne definované médium. V súčasnosti sú však jedinými plne definovanými médiami, ktoré sú známe ako vhodné na dlhodobý chov kultúry Daphnia magna, Elendtove médiá M4 a M7. Obidve médiá obsahujú chelatotvorné činidlo EDTA. Zo skúseností vyplýva (2), že ak sa reprodukčný test uskutoční v médiách M4 a M7, „zjavná toxicita“ kadmia je vo všeobecnosti nižšia ako vtedy, ak sa uvedený test uskutoční v médiách, ktoré činidlo EDTA neobsahujú. Preto sa na testovanie chemikálií s obsahom kovov neodporúčajú médiá M4 a M7. Treba sa vyhnúť aj iným médiám s obsahom známych chelatotvorných činidiel. V prípade chemikálií, ktoré obsahujú kovy, sa odporúča použiť alternatívne médium, napríklad sladkú tvrdú vodu, rekonštituovanú v súlade s predpismi organizácie ASTM (9), ktorá neobsahuje žiadne činidlá EDTA. Táto kombinácia sladkej tvrdej vody, rekonštituovanej v súlade s normami organizácie ASTM, a extraktu z rias (10) je pre dlhodobý chov kultúry Daphnie magna (2) vhodná. Koncentrácia rozpusteného kyslíka by na začiatku testu a počas neho mala presahovať 3 mg/l. Hodnota pH by sa mala pohybovať v rozmedzí od 6 do 9 a zvyčajne by sa v žiadnom teste nemala líšiť o viac ako 1,5 jednotiek. Odporúča sa tvrdosť nad 140 mg/l (v podobe CaCO3). Testy na tejto úrovni a vyšších úrovniach preukazujú reprodukčnú schopnosť v súlade s kritériami validity (11) a (12). Testovacie roztoky Testovacie roztoky so zvolenou koncentráciou sa zvyčajne pripravujú zriedením zásobného roztoku. Zásobné roztoky by sa mali pripravovať podľa možnosti bez použitia akýchkoľvek rozpúšťadiel alebo dispergujúcich látok, a to miešaním alebo pretrepávaním testovanej chemikálie v testovacom médiu za použitia mechanických postupov vrátane trepania, miešania alebo utrazvuku, prípadne iných vhodných metód. Pred zavedením testovaných organizmov sa odporúča, aby sa testované systémy vystavili pôsobeniu koncentrácií testovanej chemikálie, ktorá sa má použiť v štúdii, a to tak dlho, ako je to potrebné na preukázanie stabilných expozičných koncentrácií. Ak sa testovaná chemikália ťažko rozpúšťa vo vode, malo by sa postupovať v súlade s postupmi uvedenými v usmernení OECD o zaobchádzaní s problematickými látkami (13). Používaniu rozpúšťadiel alebo dispergujúcich látok by sa síce malo vyhýbať, no v niektorých prípadoch môže byť ich použitie nevyhnutné v záujme vytvorenia zásobného roztoku, ktorý má vhodnú koncentráciu z hľadiska dávkovania. Okrem testovania s testovacími koncentráciami treba testovanie uskutočniť s kontrolou vody na riedenie s vhodným počtom replikátov a v prípade nutnosti aj s kontrolou rozpúšťadla s vhodným počtom replikátov. V teste by sa mali používať len rozpúšťadlá alebo dispergujúce látky, v prípade ktorých sa na základe skúmania potvrdilo, že nemajú žiadne významné alebo majú len minimálne účinky na hodnotu závislej premennej. V bode (13) sa uvádzajú príklady vhodných rozpúšťadiel (napr. acetón, etanol, metanol, dimetylformamid a trietylénglykol) a dispergujúcich látok (napr. Cremophor RH40, metylcelulóza 0,01 % a HCO-40). V prípade použitia rozpúšťadla alebo dispergujúcej látky by ich finálna koncentrácia nemala presahovať 0,1 ml/l (13) a s výnimkou kontrolny vody na riedenie by vo všetkých testovacích nádobách mala byť rovnaká koncentrácia. Je však potrebné usilovať sa o minimalizovanie koncentrácie rozpúšťadla. POSTUP Podmienky expozície Trvanie Test trvá 21 dní. Nasadzovanie Rodičovské jedince sa držia jednotlivo, teda jeden na testovaciu nádobu zvyčajne s objemom 50 až 100 ml (v prípade Daphnia magna). V nádobách možno použiť aj menšie objemy média, a to najmä v prípade menších dafnií, napr. druhu Ceriodaphnia dubia), pokiaľ na testovanie nie je potrebný prietokový model testu. Z hľadiska uspokojenia požiadaviek analytického postupu použitého na stanovenie koncentrácie testovanej chemikálie možno niekedy budú musieť byť potrebné väčšie objemy, hoci na účely chemickej analýzy je prípustné aj združenie replikátov. Ak sa použijú objemy väčšie ako 100 ml, možno bude treba zvýšiť dávkovanie potravy s cieľom zabezpečiť dafniám primeranú dostupnosť potravy a súlad s validačnými kritériami. Testované jedince V rámci polostatického testu sa pri každej testovanej koncentrácii používa najmenej 10 jednotlivo držaných jedincov a v kontrolných sériách najmenej 10 jednotlivo držaných jedincov. Ukázalo sa, že v prípade prietokových testov je vhodné 40 jedincov rozdeliť do štyroch skupín po 10 na každú testovanú koncentráciu (1). Môže sa použiť aj menší počet jedincov, pričom sa odporúča minimálne 20 jedincov na koncentráciu rozdelených do dvoch alebo viacerých replikátov s rovnakým počtom jedincov (napr. štyri replikáty, každý s piatimi dafniami). Pripomíname, že v rámci testov, pri ktorých sú jedince umiestnené v skupinách, nebude možné zo štatistickej analýzy vylúčiť žiadne potomstvo v prípade mimovoľnej alebo náhodnej rodičovskej úmrtnosti, keď sa už začala reprodukcia, a preto by sa v týchto prípadoch mal reprodukčný výstup vyjadriť ako celkový počet žijúcich potomkov vyprodukovaných na rodiča, ktorý bol prítomný na začiatku testu. Priradenie ovplyvňovaných skupín testovacím nádobám a všetky nasledujúce činnosti by sa mali uskutočňovať v náhodnom slede. Ak by sa takto nepostupovalo, prípadná zaujatosť by sa dala interpretovať ako účinok koncentrácie. Najmä vtedy, ak sa s experimentálnymi jednotkami zaobchádza v poradí podľa ovplyvňovania alebo koncentrácie, mohlo by v dôsledku niektorých časovo závislých účinkov, akými sú únava obsluhy alebo iná chyba, dôjsť pri vyšších koncentráciách k výraznejším účinkom. Okrem toho, ak existuje pravdepodobnosť, že počiatočné alebo environmentálne podmienky testu (napr. umiestnenie v laboratóriu) môžu ovplyvniť výsledky testu, potom by sa malo zvážiť blokové usporiadanie testu. Kŕmenie Pri polostatickom teste by sa kŕmenie malo podľa možnosti vykonávať denne, najmenej však trikrát za týždeň (napr. čo zodpovedá výmenám média). Prihliadať by sa malo na možné riedenie expozičných koncentrácií pridaním potravy, pričom by sa mu malo v maximálnej možnej miere zabrániť prostredníctvom dostatočne koncentrovanej suspenzie rias. Odchýlky od tohto stavu by sa mali zaznamenávať (napr. pri prietokových testoch). Počas testu by mala potrava rodičovských jedincov pozostávať zo živých buniek rias týchto druhov: Chlorella sp., Pseudokirchneriella subcapitata (predtým Selenastrum capricornutum) a Desmodesmus subspicatus (predtým Scenedesmus subspicatus). Množstvo podávanej potravy by malo vychádzať z množstva organického uhlíka (C) dodaného každému rodičovskému jedincovi. Z výskumu (14) vyplýva, že pokiaľ ide o Daphnia magna, úrovne dávok v rozmedzí 0,1 až 0,2 mg C/dafnia/deň postačujú na dosiahnutie požadovaného množstva živého potomstva, čím sa zabezpečuje splnenie validačných kritérií testu. Danú dávku potravy možno podávať buď počas celého trvania testu v konštantnej miere, alebo si možno zvoliť podávanie potravy v nižšej miere a počas testu túto mieru zvyšovať v záujme zohľadnenia rastu rodičovských jedincov. Aj v tomto prípade by mala daná dávka potravy po celý čas zostať v odporúčanom rozpätí 0,1 až 0,2 mg C/dafnia/deň. Ak sa na účely stanovenia požadovanej úrovne dávky potravy použijú náhradné merania, ako napr. počet buniek rias alebo absorbcia svetla (t. j. z dôvodov praktickosti, pretože meranie obsahu uhlíka je časovo náročné), každé laboratórium by si malo vytvoriť svoj vlastný nomogram súvisiaci s náhradným meraním týkajúcim sa obsahu uhlíka dotknutej kultúry rias (rady týkajúce sa tvorby nomogramov sa uvádzajú v dodatku 3). Nomogram by sa mal kontrolovať najmenej raz do roka a v prípade zmien podmienok týkajúcich sa danej kultúry rias aj častejšie. Zistilo sa, že absorpcia svetla je v porovnaní s počtom buniek vhodnejší náhradný parameter, pokiaľ ide o obsah uhlíka (15). Dafniám by sa mala podávať koncentrovaná suspenzia rias, aby sa minimalizoval objem média s kultúrou rias prenášaného do testovacích nádob. Koncentrovanie rias možno dosiahnuť odstreďovaním v centrifúge, po ktorom nasleduje opätovná suspenzácia v médiu s kultúrou dafnií. Svetlo Svetelné pôsobenie v trvaní 16 hodín s intenzitou nepresahujúcou 15 až 20 μE · m– 2 · s– 1 meranou na hladine vody v nádobe. V prípade prístrojov na meranie svetla, ktoré sú kalibrované v luxoch, rozmedzie 1 000 až 1 500 luxov pre studené biele svetlo takmer zodpovedá odporúčanej intenzite svetla 15 až 120 μE·m– 2 · s– 1. Teplota Teplota testovacieho média by sa mala pohybovať v rozmedzí 18 až 22 °C. Podľa možnosti by sa však v prípade ani jedného testu nemala daná teplota líšiť viac ako o 2 °C v rámci týchto hraničných hodnôt (t. j. 18 až 20, 19 až 21 alebo 20 až 22 °C), ktoré predstavujú denné rozpätie. Možno bude na účely monitorovania teploty vhodné použiť ďalšiu testovaciu nádobu. Prevzdušňovanie Testovacie nádoby by sa počas testu nemali prevzdušňovať. Plán testu Test na zistenie rozsahu V prípade potreby sa vykoná test na zistenie rozsahu, napríklad s piatimi koncentráciami testovanej chemikálie a dvoma replikátmi na každú expozíciu a kontrolu. Pri rozhodovaní o rozsahu koncentrácií, ktoré sa majú použiť na test na zisťovanie rozsahu, môžu byť užitočné aj dodatočné informácie o akútnej toxicite týkajúcej sa druhu Daphnia a/alebo iných vodných organizmov, ktoré vyplývajú z testov s podobnými chemikáliami alebo z literatúry. Test na zistenie rozsahu trvá 21 dní alebo dostatočný čas, v priebehu ktorého možno spoľahlivo predpovedať úrovne účinkov. Na konci testu sa posudzuje reprodukcia dafnií. Mal by sa zaznamenať počet rodičovských jedincov a výskyt potomstva. Hlavný test Zvyčajne by malo byť k dispozícii aspoň päť testovaných koncentrácií vrátane účinnej koncentrácie (napr. e.g. ECx), ktoré by mali byť zoradené do geometrických sérií so separačným faktorom, ktorý podľa možnosti nepresahuje hodnotu 3,2. Na každú testovanú koncentráciu by sa mal používať vhodný počet replikátov (pozri body 24 – 25). Ak sa použije menej ako päť koncentrácií, je potrebné uviesť zdôvodnenie. V testovacom médiu by sa chemikálie nemali testovať nad hranicou ich maximálnej rozpustnosti. Pred vykonaním testu sa odporúča zvážiť štatistickú silu daného plánu testu a použitie vhodných štatistických metód (4). Pri stanovovaní rozsahu koncentrácií treba mať na pamäti:
Ak sa v rámci testu na zistenie rozsahu pri najvyššej koncentrácii (napr. pri 10 mg/l) nepozorujú žiadne účinky, alebo ak je vysoko pravdepodobné, že testovaná chemikália bude vykazovať nízku/žiadnu toxicitu vzhľadom na absenciu toxicity vo vzťahu k iným organizmom a/alebo bude vykazovať nízke/žiadne vychytávanie, reprodukčný test možno vykonať ako limitný test s použitím testovanej koncentrácie, a to napr. 10 mg/l, ako aj kontroly. Na účely testovanej, ako aj ovplyvňovanej skupiny, by sa malo použiť desať replikátov. V prípade potenciálnej potreby vykonať limitný test v prietokovom systéme je vhodné použiť menej replikátov. Vďaka limitnému testu sa preukáže, že pri koncentračnom limite nedochádza k žiadnemu štatisticky významnému účinku, no ak dôjde k zaznamenaniu účinkov, zvyčajne je potrebné vykonať úplný test. Kontroly Okrem testovanej série by sa mala zrealizovať jedna kontrolná séria s testovacím médiom a v prípade relevantnosti aj jedna kontrolná séria obsahujúca rozpúšťadlo alebo dispergujúcu látku. V prípade použitia rozpúšťadla alebo dispergujúcej látky by ich koncentrácia mala byť rovnaká ako koncentrácia použitá v nádobách obsahujúcich testovanú chemikáliu. Mal by sa použiť náležitý počet replikátov (pozri body 23 – 24.). Ak sa test realizuje správne, variačný koeficient v blízkosti priemerného počtu žijúcich potomkov vyprodukovaných na jedného rodičovského jedinca v kontrolnej vzorke(-ách) by mal byť ≤ 25 %, pričom by sa mal zaznamenať na účely testovacích plánov, v ktorých sa používajú samostatne držané jedince. Obnova testovacieho média Frekvencia obnovy testovacieho média závisí od stability testovanej chemikálie, mala by sa však uskutočňovať najmenej trikrát za týždeň. Ak je z predbežných testov stability (pozri bod 7) zrejmé, že počas maximálneho obdobia obnovy (t. j. troch dní) je koncentrácia testovanej chemikálie nestabilná (t. j. jej hodnota sa pohybuje mimo rozpätia 80 – 120 % nominálnej hodnoty počiatočnej nameranej koncentrácie alebo klesne pod 80 % tejto koncentrácie), mala by sa zvážiť možnosť častejšej obnovy média alebo použitia prietokového testu. Ak sa pri polostatických testoch realizuje obnova média, pripraví sa druhá séria testovacích nádob, do ktorých sa (napríklad sklenou pipetou s vhodným priemerom) prenesú rodičovské jedince. Objem média preneseného s dafniami by sa mal minimalizovať. Pozorovania Výsledky pozorovaní vykonaných počas testu by sa mali zaznamenať do tabuliek (pozri príklady v dodatkoch 4 a 5). V prípade potreby ďalších meraní (pozri bod 44) sa môžu vyžadovať dodatočné pozorovania. Potomstvo Potomstvo vyprodukované každým rodičovským jedincom by sa malo podľa možnosti odobrať a denne spočítať, a to od výskytu prvého potomka, s cieľom zabrániť potomkom konzumovať potravu určenú pre rodičovského jedinca. Na účel tejto metódy je potrebné zrátať iba počet žijúcich potomkov, zaznamenať však treba aj výskyt nevyliahnutých vajíčok alebo uhynutých potomkov. Úmrtnosť Úmrtnosť u rodičovských jedincov by sa mala zaznamenávať podľa možnosti denne alebo aspoň tak často, ako sa počíta potomstvo. Ďalšie parametre Hoci účelom tejto metódy je v prvom rade posudzovanie účinkov na reprodukčný výstup, možno prostredníctvom nej dostatočne kvantifikovať aj iné účinky, čo poslúži pri štatistickej analýze. Zaznamenávať možno reprodukčný výstup na rodičovského jedinca, ktorý prežil, t. j. počet žijúcich potomkov vyprodukovaných počas testu na preživšieho rodičovského jedinca. Táto hodnota sa môže porovnať s hlavnou závisle premennou (na začiatku testu zmeraný reprodukčný výstup rodičovského jedinca, ktorý počas testu mimovoľne alebo náhodne neuhynul). Ak sa u replikátov vystavených účinkom chemikálie vyskytne rodičovská úmrtnosť, malo by sa zvážiť, či v prípade danej úmrtnosti ide o zvyčajnú reakciu na koncentráciu, napr. v prípade významnej regresie reakcie na koncentráciu testovanej chemikálie s pozitívnym sklonom (na tento účel možno použiť štatistický test ako Cochranov a Armitageov testu trendu). Ak úmrtnosť nie je reakciou na koncentráciu, potom by sa dané replikáty s rodičovskou úmrtnosťou mali z výsledkov testu vylúčiť. Ak úmrtnosť je reakciou na koncentráciu, rodičovská úmrtnosť by sa mala pripísať účinku testovanej chemikálie a replikáty by sa nemali z analýzy výsledku testu vylúčiť. Mimoriadne žiaduce sú merania rastu, keďže prinášajú informácie o možných subletálnych účinkoch, ktoré možno potenciálne využiť popri samotných reprodukčných meraniach; na konci testu sa odporúča meranie dĺžky rodičovských jedincov (t. j. dĺžky tela bez análnej plutvy). Medzi ďalšie merateľné alebo vypočítateľné parametre patrí čas, dokedy sa nenarodí prvé potomstvo (a nasledujúce potomstvá), počet a veľkosť potomstiev na jedinca, počet nevyliahnutých vajíčok, výskyt novonarodených jedincov samčieho pohlavia (OECD 2008) alebo efípií a prípadne inherentný pomer populačného rastu (pozri definície v dodatku 1 a dodatku 7 pre určenie pohlavia novonarodených jedincov). Frekvencia analytických stanovovaní a meraní Koncentrácia kyslíka, teplota, tvrdosť vody a hodnoty pH by sa mali merať aspoň raz týždene v čerstvom, ako aj starom médiu, v kontrole(-ách) a pri najvyššej koncentrácii testovanej chemikálie. Počas testu sa v pravidelných intervaloch stanovujú koncentrácie testovanej chemikálie. Pri polostatických testoch, kde sa očakáva, že koncentrácia testovanej chemikálie zostane v rozmedzí ± 20 % nominálnej hodnoty (t. j. v rozsahu 80 až 120 %, pozri body 6, 7 a 39), sa odporúča, aby sa analyzovala aspoň najvyššia a najnižšia testovaná koncentrácia, teda v momente, keď sa daná chemikália práve pripraví a v čase jej obnovy, a to v priebehu prvého týždňa testu (t. j. analýzy by sa mali vykonať na vzorke z rovnakého roztoku – v čase, keď je čerstvo pripravený a v čase jeho obnovy.) Tieto stanovenia by sa potom mali opakovať aspoň v týždňových intervaloch. V prípade testov, kde sa neočakáva, že koncentrácia testovanej chemikálie zostane v rozmedzí ± 20 % nominálnej hodnoty, je potrebné analyzovať všetky testované koncentrácie, a to v čase, keď sa chemikália čerstvo pripraví a v čase jej obnovy. No v prípade testov, kde meraná počiatočná koncentrácia testovanej chemikálie síce nie je v rozmedzí ± 20 % nominálnej hodnoty, avšak možno dostatočne preukázať, že počiatočné koncentrácie sú opakovateľné a stabilné (t. j. v rozsahu 80 až 120 % počiatočnej koncentrácie), by sa chemické stanovenia mohli znížiť v priebehu testovacích týždňov 2 a 3 na roztoky s najvyššou a najnižšou testovanou koncentráciou. Koncentrácie testovanej chemikálie pred obnovou je v každom prípade potrebné stanoviť len v jednej replikačnej nádobe pri každej testovanej koncentrácii. V prípade použitia prietokového testu je vhodné uplatniť podobný režim odberu vzoriek, ako je režim opísaný pri polostatickom teste (meranie týkajúce sa „starých“ roztokov sa však v tomto prípade neuplatňuje). V záujme zachovania stability testovaných koncentrácií však možno odporučiť, aby sa počas prvého týždňa zvýšil počet odberov (napríklad 3 série meraní). Pri týchto typoch testov by sa mal denne kontrolovať prietok riedidla a testovanej chemikálie. Ak existujú dôkazy o tom, že sa počas testu zachovala uspokojivá koncentrácia testovanej chemikálie v rozmedzí ± 20 % nominálnej koncentrácie alebo počiatočnej meranej koncentrácie, potom výsledky môžu vychádzať z nominálnych hodnôt alebo z počiatočných nameraných hodnôt. Ak je odchýlka od nominálnej alebo nameranej počiatočnej koncentrácie väčšia ako ± 20 percent, výsledky by sa mali vyjadriť ako časovo vážený priemer (pozri usmernenia pre výpočet v dodatku 6). ÚDAJE A PREZENTÁCIA VÝSLEDKOV Spracovanie výsledkov Cieľom tohto testu je stanoviť účinok testovanej chemikálie na reprodukčný výstup. Na každú testovaciu nádobu (t. j. replikát) by sa mal vypočítať celkový počet živých potomkov na rodičovského jedinca. Okrem toho možno vypočítať úroveň reprodukcie na základe produkcie živého potomstva na rodičovského jedinca, ktorý prežil. Ekologicky najvýznamnejšou závisle premennou je však celkový počet živého potomstva vyprodukovaného rodičovským jedincom, ktorý počas testu náhodne (96) alebo mimovoľne (97) neuhynul. Ak počas testu dôjde k náhodnému alebo mimovoľnému úhynu rodičovského jedinca, alebo vysvitne, že ide o jedinca mužského pohlavia, potom sa replikát vylúči z analýzy. Pri analýze sa potom bude vychádzať zo zníženého počtu replikátov. Ak sa u replikátov vystavených účinkom chemikálie vyskytne rodičovská úmrtnosť, malo by sa zvážiť, či v prípade danej úmrtnosti ide o zvyčajnú reakciu na koncentráciu, napr. v prípade významnej regresie reakcie na koncentráciu testovanej chemikálie s pozitívnym sklonom (na tento účel možno použiť štatistický test ako Cochranov a Armitageov testu trendu). Ak úmrtnosť nie je reakciou na koncentráciu, potom by sa dané replikáty s rodičovskou úmrtnosťou mali z výsledkov testu vylúčiť. Ak úmrtnosť je reakciou na koncentráciu, rodičovská úmrtnosť by sa mala pripísať účinku testovanej chemikálie a replikáty by sa nemali z analýzy výsledku testu vylúčiť. Možno teda konštatovať, že ak sa na vyjadrenie daných účinkov využívajú hodnoty LOEC a NOEC alebo ECx, pri výpočte účinku na reprodukciu sa odporúča použiť obe uvedené závisle premenné, t. j.
a potom použiť ako konečný výsledok najnižšiu hodnotu LOEC a NOEC alebo ECx vypočítanú pomocou ktorejkoľvek z týchto dvoch závisle premenných. Pred použitím štatistickej analýzy, napríklad postupov ANOVA, porovnania ovplyvňovaných skupín s kontrolnou skupinou formou Studentovho t-testu, Dunnettovho testu, Williamsovho testu alebo Jonckheereovho-Terpstrovho zostupného testu sa odporúča, aby sa v záujme splnenia požiadaviek daného štatistického testu v prípade potreby zvážila transformácia údajov. Za neparametrické alternatívy možno považovať Dunnovej test alebo Mannov a Whitneyho test. V prípade priemerných hodnôt jednotlivých ovplyvňovaní sa vypočítajú 95 % intervaly spoľahlivosti. Jedným z validačných kritérií, ktoré by sa malo dokumentovať a zaznamenávať, je počet rodičovských jedincov, ktorí prežili, v neovplyvňovaných kontrolných skupinách. V záverečnej správe by mali byť zaznamenané aj všetky ďalšie škodlivé účinky, napr. abnormálne správanie a toxikologicky významné zistenia. ECx Hodnoty ECx vrátane ich príslušných dolných a horných hraníc spoľahlivosti sa vypočítajú pomocou vhodných štatistických metód (napr. metódy logistickej alebo Weibullovej funkcie, Spearman-Karberovej metódy s orezanými údajmi alebo metódy jednoduchej interpolácie). Na účely výpočtu hodnoty EC10, EC50 alebo akejkoľvek inej hodnoty ECx, by sa mal kompletný súbor údajov podrobiť regresnej analýze. NOEC/LOEC Ak je cieľom štatistickej analýzy určenie hodnoty NOEC/LOEC, na daný účel by sa mali uplatniť vhodné štatistické metódy podľa dokumentu OECD č. 54 o súčasných prístupoch k štatistickej analýze údajov o ekotoxicite: usmernenie týkajúce sa uplatňovania (4). Vo všeobecnosti sa nepriaznivé účinky testovanej chemikálie v porovnaní s kontrolnou skupinou analyzujú pomocou jednostranného testu hypotézy s p ≤ 0,05. Normálnu distribúciu a homogenitu rozptylu možno otestovať pomocou vhodného štatistického testu, napr. Shapiro-Wilkovho testu, resp. Leveneho testu (p ≤ 0,05). Môže sa vykonať jednosmerná analýza ANOVA a následný viacnásobný porovnávací test. Na výpočet významných rozdielov (p ≤ 0,05) medzi kontrolnými skupinami a rôznymi koncentráciami testovanej chemikálie, ak existujú, sa môžu použiť viacnásobné porovnávania (napr. Dunnettov test) alebo zostupné testovania trendov (napr. Williamsov test alebo Jonckheereov-Terpstrov zostupný test) [výber odporúčaného testu podľa usmerňovacieho dokumentu OECD 54 (4)]. Inak možno na stanovenie hodnôt NOEC a LOEC použiť neparametrické metódy (napr. Bonferroniho U-test podľa Holma alebo Jonckheereov-Terpstrov test trendov). Limitný test Ak sa vykonal limitný test (porovnanie kontroly a len jednej ovplyvňovanej skupiny) a boli splnené predpoklady parametrických testovacích postupov (normalita, homogenita), metrické reakcie možno vyhodnotiť pomocou Studentovho testu (t-testu). Ak tieto podmienky nie sú splnené, možno použiť t-test s nerovnomerným rozptylom (napr. Welchov test) alebo neparametrický test, napríklad Mannov a Whitneyho U-test. Na stanovenie významných rozdielov medzi kontrolnými skupinami (kontrolná skupina a kontrolná skupina s rozpúšťadlom alebo dispergujúcou látkou) možno replikáty z každej kontrolnej skupiny otestovať podľa opisu pre limitný test. Ak sa v týchto testoch nezistia významné rozdiely, všetky replikáty kontrolnej skupiny a kontrolnej skupiny s rozpúšťadlom možno spojiť. V opačnom prípade by sa všetky ovplyvňované skupiny mali porovnať s kontrolnou skupinou s rozpúšťadlom. Skúšobný protokol Skúšobný protokol musí obsahovať tieto informácie:
LITERATÚRA
Dodatok 1 DEFINÍCIE Na účely tejto testovacej metódy sa používajú tieto definície: Náhodná úmrtnosť : úmrtnosť, ktorá nesúvisí s pôsobením chemikálie, ale ku ktorej došlo v dôsledku náhodnej udalosti (t. j. príčina je známa). Chemikália : látka alebo zmes. ECx : koncentrácia testovanej chemikálie rozpustenej vo vode, ktorá spôsobí x % zníženie reprodukcie dafnií v rámci vymedzenej dĺžky expozície. Mimovoľná úmrtnosť : úmrtnosť bez známej príčiny, ktorá nesúvisí s pôsobením chemikálie. Inherentná rýchlosť rastu populácie : meranie rastu populácie, ktoré zahŕňa reprodukčný výstup a úmrtnosť špecifickú pre isté obdobie života (1), (2), (3). V prípade populácií v ustálenom stave sa rovná nule. V prípade rastúcich populácií pôjde o kladnú a v prípade zmenšujúcich sa populácií o zápornú hodnotu. Zmenšujúca sa populácia je samozrejme neudržateľná a napokon povedie k vyhynutiu jedincov. Detekčný limit : najnižšia detegovateľná, nie však kvantifikovateľná koncentrácia. Kvantifikačný limit : najnižšia koncentrácia, ktorú možno kvantitatívne zmerať. Najnižšia koncentrácia s pozorovaným účinkom (LOEC) : najnižšia testovaná koncentrácia nameraná v rámci danej dĺžky expozície, pri ktorej sa pozoruje, že chemikália má štatisticky významný účinok na reprodukciu a rodičovskú úmrtnosť (pri p < 0,05) pri porovnaní s kontrolou. Škodlivý účinok všetkých testovaných koncentrácií nad úrovňou LOEC by však mal byť rovnaký alebo väčší ako účinky pozorované pri LOEC. Ak tieto dve podmienky nie sú splnené, je potrebné poskytnúť úplné vysvetlenie, akým spôsobom sa zvolila LOEC (a teda aj NOEC). Úmrtnosť : jedinec sa zaznamená ako uhynutý, keď sa nepohybuje, napr. keď nie je schopný plávať alebo ak sa nepozoruje žiadny pohyb končatín alebo postabdomenu do 15 sekúnd po jemnom potrasení testovacej nádoby. (Ak sa použije iná definícia, mala by sa uviesť spolu s odkazom na ňu.) Koncentrácia bez pozorovaného účinku (NOEC) : testovaná koncentrácia nameraná v rámci danej dĺžky expozície bezprostredne pod úrovňou LOEC, ktorá pri porovnaní s kontrolou nemá štatisticky významný účinok (p < 0,05). Potomstvo : mladé dafnie vyprodukované rodičovskými jedincami v priebehu testu. Rodičovské jedince : samice dafnií prítomné na začiatku testu, ktorých reprodukčný výstup je predmetom štúdie. Reprodukčný výstup : počet žijúcich potomkov vyprodukovaných na rodičovského jedinca v testovacom období Testovaná chemikália : každá látka alebo zmes testovaná pomocou tejto testovacej metódy. LITERATÚRA
Dodatok 2 PRÍPRAVA PLNE DEFINOVANÝCH ELENDTOVÝCH MÉDIÍ M7 A M4 Aklimatizácia na Elendtove médiá M7 a M4 V niektorých laboratóriách sa zaznamenali ťažkosti pri priamom prenose dafnií do médií M4 (1) a M7. Na druhej strane sa však dosiahol určitý úspech s postupnou aklimatizáciou, t. j. prenosom z vlastného média do 30 % Elendtovho média, potom do 60 % Elendtovho média a následne do 100 % Elendtovho média. Dĺžka aklimatizačného obdobia môže dosiahnuť až jeden mesiac. Príprava Stopové prvky Vo vode vykazujúcej vhodnú čistotu, napríklad v deionizovanej, destilovanej, prípadne vo vode získanej reverznou osmózou, sa najprv pripravia samostatné zásobné roztoky (I) jednotlivých stopových prvkov. Z týchto rôznych zásobných roztokov (I) sa pripraví druhý osobitný zásobný roztok (II), ktorý obsahuje všetky stopové prvky (kombinovaný roztok), t. j.:
Médiá M4 a M7 Médiá M4 a M7 sa pripravia pomocou zásobného roztoku II, makroživín a vitamínov takto:
Zásobný roztok s obsahom viacerých vitamínov sa skladuje zmrazený v malých alikvótnych množstvách. Vitamíny sa pridávajú do média tesne pred použitím.
Dodatok 3 ANALÝZA OBSAHU CELKOVÉHO ORGANICKÉHO UHLÍKA (TOC) A PRÍPRAVA NOMOGRAMU NA ZISTENIE OBSAHU TOC V KRMIVE S OBSAHOM RIAS Akceptuje sa skutočnosť, že obsah uhlíka v krmive s obsahom rias sa spravidla nemeria priamo, ale na základe korelácií (t. j. nomogramov) s náhradnými meraniami, akými je napr. počet buniek rias alebo absorpcia svetla). TOC by sa mal merať na základe oxidácie pri vysokej teplote, a nie na základe metód oxidácie pomocou UV ožarovania alebo persíranu. (Informácie možno nájsť tu: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB). Na účely nomogramu by sa mali riasy odstredením v centrifúge oddeliť od rastového média a následne resuspendovať v destilovanej vode. Trikrát odmerajte náhradný parameter a koncentráciu TOC v každej vzorke. Mali by sa analyzovať slepé vzorky s destilovanou vodou a od koncentrácie s obsahom TOC vo vzorke rias by sa mala odpočítať koncentrácia TOC. Nomogramy by mali mať lineárny charakter v rámci požadovaného rozsahu koncentrácií uhlíka. Ďalej uvádzame príklady.

Chlorella vulgaris var. viridis (CCAP 211/12). Regresia mg/l suchej hmotnosti na mg C/1. Údaje získané z koncentrovaných suspenzií buniek získaných v rámci polokontinuálnej produkcie jednorazovej kultúry rias a podrobených resuspenzácii v destilovanej vode. os x: mg C/1 koncentrovaného krmiva s obsahom rias os y: mg/1 suchej hmotnosti koncentrovaného krmiva s obsahom rias Korekčný koeficient – 0,980 
Chlorella vulgaris var. viridis (CCAP 211/12). Regresia počtu buniek na mg C/1. Údaje získané z koncentrovaných suspenzií buniek získaných v rámci semikontinuálnej produkcie jednorazovej kultúry rias a podrobených resuspenzácii v destilovanej vode. os x: mg C/1 koncentrovaného krmiva s obsahom rias os y: Počet buniek/1 koncentrovaného krmiva s obsahom rias Korekčný koeficient – 0,926 
Chlorella vulgaris var. viridis (CCAP 211/12). Regresia absorpcie na mg C/1 (1 cm kyveta). Údaje získané z koncentrovaných suspenzií buniek získaných v rámci semikontinuálnej produkcie jednorazovej kultúry rias a podrobených resuspenzácii v destilovanej vode. os x: mg C/1 koncentrovaného krmiva s obsahom rias os y: Absorpcia pri 440 nm a riedení koncentrovaného krmiva s obsahom rias v pomere 1/10 Korekčný koeficient – 0,998 Dodatok 4 VZOR TABUĽKY NA ZAZNAMENANIE OBNOVY MÉDIA, ÚDAJOV O FYZIKÁLNOM A CHEMICKOM MONITOROVANÍ, KŔMENÍ, REPRODUKCII DAFNIÍ A ÚMRTNOSTI RODIČOVSKÝCH JEDINCOV
Dodatok 5 VZOR TABUĽKY NA ZAZNAMENANIE VÝSLEDKOV CHEMICKEJ ANALÝZY a) Merané koncentrácie
b) Merané koncentrácie ako percentuálny podiel nominálnej hodnoty
Dodatok 6 VÝPOČET ČASOVO VÁŽENÉHO PRIEMERU Časovo vážený priemer Keďže koncentrácia testovanej chemikálie môže v období medzi obnovami média poklesnúť, je potrebné zvážiť, ktorá koncentrácia by sa mala zvoliť ako reprezentatívna koncentrácia v rámci škály koncentrácií, v ktorých mali možnosť rodičovské dafnie existovať. Tento výber by mal vychádzať z biologických, ako aj štatistických úvah. Ak sa napríklad predpokladá, že na reprodukciu má vplyv najmä najvyššia zistená koncentrácia, potom by sa mala použiť maximálna koncentrácia. Ak sa však za dôležitejší považuje akumulovaný alebo dlhšie trvajúci účinok toxickej látky, vhodnejšie je použiť priemernú koncentráciu. V tomto prípade je uplatniteľným náležitým priemerom časovo vážená priemerná koncentrácia, pretože sa v nej zohľadňujú zmeny v okamžitej koncentrácií v priebehu času. Obrázok 1 Príklad časovo váženého priemeru 
Obrázok 1 znázorňuje príklad (zjednodušeného) testu trvajúceho sedem dní s obnovou média v dňoch 0, 2 a 4.
Časovo vážený priemer sa vypočíta tak, že plocha pod časovo váženým priemerom sa rovná ploche pod krivkou koncentrácie. Výpočet týkajúci sa spomínaného príkladu sa uvádza v tabuľke 1. Tabuľka 1 Výpočet časovo váženého priemeru
Plocha, je plocha pod exponenciálnou krivkou pre každé obdobie obnovy média. Vypočíta sa takto:
Časovo vážený priemer (TW Mean) je celková plocha vydelená celkovým počtom dní. V prípade reprodukčného testu týkajúceho sa dafnií by sa daná tabuľka mala, samozrejme, rozšíriť tak, aby pokryla 21 dní. Je zrejmé, že pokiaľ sa pozorovania uskutočňujú iba na začiatku a konci každého obdobia obnovy média, nie je možné potvrdiť, že daný rozkladný proces má v skutočnosti exponenciálny charakter. Iná krivka by mala za následok iný výpočet plochy. Exponenciálny rozkladný proces však nie je nepravdepodobný a v prípade nedostatku ďalších informácií ide pravdepodobne o najvhodnejšiu krivku. Ak sa na konci obdobia obnovy média chemickou analýzou nepodarí zistiť žiadnu chemikáliu, je potrebné na to upozorniť. Ak nemožno odhadnúť, ako rýchlo sa chemikália stratila z roztoku, je nemožné získať realistickú plochu pod krivkou, a teda nemožno dospieť k primeranej časovo váženému priemeru. Dodatok 7 USMERNENIA TYKAJÚCE SA URČENIA POHLAVIA NOVONARODENÝCH JEDINCOV K narodeniu novonarodených jedincov mužského pohlavia môže dôjsť aj v premenlivých environmentálnych podmienkach, akými sú napríklad skrátená fotoperióda, teplota, pokles koncentrácie krmiva a zvýšenie hustoty populácie (Hobaek and Larson, 1990; Kleiven et al., 1992). Produkcia jedincov mužského pohlavia je aj známou odozvou na niektoré regulátory rastu hmyzu (Oda et al., 2005). Zvýšený počet jedincov mužského pohlavia by sa mohol očakávať za podmienok, keď chemické stresové faktory vyvolávajú pokles reprodukčného výstupu u partenogenetických samíc (OECD, 2008). Na základe dostupných informácií nemožno predpovedať, ktorý pomer pohlaví alebo pomer sledovaných parametrov týkajúcich sa reprodukcie bude citlivejší. Existujú však náznaky (odkaz na „validačnú správu“, časť 1), že tento zvýšený počet jedincov mužského pohlavia by mohol byť menej citlivý faktor ako pokles počtu potomkov. Keďže hlavným účelom tejto testovacej metódy je posúdiť počet vyprodukovaných potomkov, sledovanie výskytu jedincov mužského pohlavia nie je povinné. Ak sa tento nepovinný sledovaný parameter vyhodnotí v štúdii, potom by sa malo uplatniť dodatočné testovacie validačné kritérium, teda parameter maximálne 5 % jedincov mužského pohlavia pri kontrolných koncentráciách. Najpraktickejší a najjednoduchším spôsobom rozlišovania pohlaví u dafnií je použiť ich fenotypové charakteristiky, keďže samce a samice sú z genetického hľadiska identické a ich pohlavie je environmentálne podmienené. Samce a samice majú rozdielnu dĺžku a tvar tykadiel prvého páru, ktoré majú samce dlhšie ako samice (obr. 1). Tento rozdiel sa dá rozpoznať ihneď po narodení, hoci vekom pribúdajú ďalšie sekundárne pohlavné znaky (pozri napr. obr. 2 v publikácii Olmstead and LeBlanc, 2000). Na účely morfologického určenia pohlavia treba novonarodené jedince vyprodukované každým testovaným živočíchom preniesť pomocou pipety do Petriho misky s testovacím médiom. Médium je v záujme obmedzenia pohybu živočíchov obmedzené na minimum. Pod stereomikroskopom možno uskutočniť pozorovanie tykadiel prvého páru (× 10 – 60). Obr. 1 24 hodín starý samec (vľavo) a samica (vpravo) D. magna. Ako je znázornené na obrázku (v krúžkoch), samce možno od samíc rozlíšiť podľa dĺžky a tvaru tykadiel prvého páru (Tatarazako et al., 2004). 
ODKAZY Hobaek A and Larson P. 1990. Sex determination in Daphnia magna. Ecology 71: 2255-2268. Kleiven O.T., Larsson P., Hobaek A. 1992. Sexual reproduction in Daphnia magna requires three stimuli. Oikos 65, 197-206. Oda S., Tatarazako N, Watanabe H., Morita M., and Iguchi T. 2005. Production of male neonates in Daphnia magna (Cladocera, Crustacea) exposed to juvenile hormones and their analogs. Chemosphere 61:1168-1174. OECD, 2008. Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. OECD Series on Testing and Assessment, Number 88. Organisation for Economic Co-operation and Development, Paris. Olmstead, A.W., LeBlanc, G.A., 2000. Effects of endocrine-active chemicals on the development characteristics of Daphnia magna. Environmental Toxicology and Chemistry 19:2107-2113. Tatarazako, N., Oda, S., Abe, R., Morita M. and Iguchi T., 2004. Development of a screening method for endocrine disruptors in crustaceans using Daphnia magna (Cladocera, Crustacea). Environmental Science 17, 439-449. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
18. |
V časti C kapitole C.29 sa bod 66 nahrádza takto:
|
|
19. |
V časti C sa dopĺňajú tieto kapitoly: „C.47 Test toxicity v ranom štádiu vývoja rýb ÚVOD
PRINCÍP TESTU
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
PLATNOSŤ TESTU
OPIS METÓDY Testovacie komory
Výber druhov
Chov generačných rýb
Manipulácia s oplodnenými vajíčkami, embryami a larvami
Voda
Testovacie roztoky
POSTUP Podmienky expozície Trvanie
Nasádzanie
Svetlo a teplota
Kŕmenie
Testovacie koncentrácie
Kontroly
Frekvencia analytických stanovení a meraní
Pozorovania 26. Štádium embryonálneho vývoja : na začiatku vystavenia testovanej chemikálii by sa embryonálne štádium malo čo najpresnejšie overiť. Toto overenie možno vykonať na reprezentatívnej vzorke vajíčok vhodne uchovaných a vyčistených. 27. Liahnutie a prežitie : pozorovania liahnutia a prežívania by sa mali vykonávať najmenej raz za deň a údaje by sa mali zaznamenať. Ak sa na vajíčkach v rannom štádiu embryonálneho vývoja spozoruje pleseň (napr. v prvý alebo druhý deň testu), takéto vajíčka by sa mali spočítať a odstrániť. Mŕtve embryá, larvy a mlaď by sa mali odstrániť hneď, ako sa spozorujú, lebo sa môžu rýchlo rozkladať a môže ich narušiť činnosť ostatných rýb. Pri odstraňovaní mŕtvych jedincov treba postupovať mimoriadne opatrne, aby nedošlo k fyzickému poškodeniu susedných vajíčok/lariev. Prejavy úhynu sa líšia podľa druhu a vývojového štádia. Napríklad:
28. Abnormálny vzhľad : počet lariev alebo mlade prejavujúcich abnormality v tvare tela by sa mal zaznamenávať v primeraných časových intervaloch v závislosti od dĺžky trvania testu a charakteru opísaných abnormalít. Treba poznamenať, že abnormálne larvy a mlaď sa vyskytujú prirodzene a v kontrolných skupinách sa pri niektorých druhoch môžu vyskytnúť v počte rádovo niekoľko percent. Ak sa deformácie a súvisiace abnormálne správanie považujú za tak vážne, že organizmus značne trpí a dosiahol bod, z ktorého sa už nezotaví, možno ho odstrániť z testu. Takéto zvieratá by sa mali usmrtiť a v rámci následnej analýzy údajov by sa mali považovať za uhynuté jedince. Pri väčšine druhov odporúčaných v tejto testovacej metóde bol zaznamenaný normálny embryonálny vývoj (9) (10) (11) (12). 29. Abnormálne správanie : abnormality ako hyperventilácia, nekoordinované plávanie, netypická nehybnosť a netypické správanie pri kŕmení by sa mali zaznamenávať v primeraných časových intervaloch v závislosti od dĺžky trvania testu (napr. raz denne pri teplovodných druhoch). Tieto účinky, hoci ich je ťažké kvantifikovať, môžu (ak sú spozorované) pomôcť pri interpretácii údajov o mortalite. 30. Hmotnosť : na konci testu sa všetky živé ryby odvážia aspoň podľa replikátov (s udaním počtu zvierat v replikáte a priemernej hmotnosti na zviera): uprednostňuje sa mokrá hmotnosť (vytreté do sucha), uvádzať však možno aj údaje o suchej hmotnosti (13). 31. Dĺžka : na konci testu sa zmeria dĺžka jednotlivých jedincov. Odporúča sa celková dĺžka, ak sa však vyskytne hnitie chvostovej plutvy alebo erózia plutvy, možno použiť štandardnú dĺžku. Na všetky ryby v rámci daného testu by sa mala použiť rovnaká metóda. Dĺžku jednotlivých jedincov možno merať buď napr. posuvným meradlom, digitálnym fotoaparátom, alebo kalibrovaným okulárovým mikrometrom. Typické minimálne dĺžky sú uvedené v dodatku 2. ÚDAJE A PREZENTOVANIE VÝSLEDKOV Spracovanie výsledkov
Skúšobný protokol
LITERATÚRA
Dodatok 1 DEFINÍCIE
Dodatok 2 PODMIENKY A TRVANIE TESTU A KRITÉRIÁ PREŽITIA U ODPORUČENÝCH DRUHOV RÝB
Dodatok 3 NÁVOD NA KŔMENIE GENERAČNÝCH A TESTOVANÝCH ZVIERAT ODPORÚČANÝCH DRUHOV A NA MANIPULÁCIU S NIMI
Dodatok 4 NIEKTORÉ CHEMICKÉ VLASTNOSTI VODY VHODNEJ NA RIEDENIE
Dodatok 5 ŠTATITICKÉ USMERNENIE NA STANOVENIE NOEC Všeobecné informácie Jednotkou analýzy je nádrž s replikátom. To znamená, že pre kontinuálne merania, ako je veľkosť, by sa mala vypočítať priemerná alebo mediánová hodnota replikátu a tieto hodnoty replikátu sa stanú údajmi pre analýzu. Mala by sa preukázať sila vykonávaných testov, najlepšie na základe príslušnej historickej databázy pre každé laboratórium. Pre každý ukazovateľ by sa mal poskytnúť účinok na veľkosť, ktorý možno zistiť so 75 – 80 % silou, a to spolu so štatistickým testom, ktorý sa má použiť. Podľa databáz dostupných v čase vypracúvania tejto testovacej metódy sa určí sila, ktorá je možná na základe odporúčaných štatistických postupov. Jednotlivé laboratóriá by mali preukázať svoju schopnosť splniť túto požiadavku na silu buď vykonaním svojej vlastnej analýzy sily alebo preukázaním toho, že variačný koeficient (CV) pre žiadnu reakciu neprekračuje 90. percentil CV použitých pri vypracúvaní usmernení na vykonávanie testov. V tabuľke 1 sú uvedené tieto CV. Ak sú k dispozícii len priemerné alebo mediánové hodnoty replikátu, CV v rámci replikátu možno ignorovať. Tabuľka 1 90. percentil CV pre zvolené sladkovodné druhy
Takmer pri všetkých štatistických testoch používaných na vyhodnocovanie laboratórnych toxikologických štúdií majú dôležitosť porovnania skupín s aplikovanou chemikáliou s kontrolnými skupinami. Preto nie je vhodné pred použitím Dunnettovho alebo Williamsovho testu požadovať významný ANOVA F-test alebo pred použitím Jonckheereho-Terpstrovho, Mannovho-Whitneyho alebo Dunnovho testu požadovať významný Kruskalov-Wallisov test (Hochberg a Tamhane 1987, Hsu 1996, Dunnett 1955, 1964, Williams 1971, 1972, 1975, 1977, Robertson et al. 1988, Jonckheere 1954, Dunn 1964). Dunnettov test má v sebe zabudovanú úpravu mnohopočetnosti a na jeho mieru falošných pozitívnych a falošných negatívnych nálezov má nepriaznivý vplyv použitie F-testu ako kontrolného testu. Podobne sa step-down Williamsovým a Jonckheereho-Terpstrovým testom trendu používajúcimi v každom kroku úroveň významnosti 0,05 zachováva celková 5 % miera falošných pozitívnych nálezov a túto mieru a silu testov nepriaznivo ovplyvňuje používanie F-testu alebo Kruskalovho-Wallisovho testu ako kontrolného testu. Mannov-Whitneyho a Dunnov test sa musí upraviť na mnohopočetnosť, pričom sa odporúča Bonferroniho-Holmova úprava. Dôkladná diskusia o väčšine odporúčaní k testovaniu hypotéz a overovaniu predpokladov, z ktorých tieto testy vychádzajú, je uvedená v dokumente OECD z roku 2006, kde sa takisto uvádza rozsiahla bibliografia. Spracovanie kontrolných skupín pri použití rozpúšťadla Kontrolná skupina s vodou na riedenie aj kontrolná skupina s rozpúšťadlom by sa mali zahrnúť, ak sa používa rozpúšťadlo. V týchto dvoch kontrolných skupinách sa porovná každá reakcia a, ak sa medzi nimi nezistí žiadny významný rozdiel, skombinujú sa na účely štatistickej analýzy. Inak by sa na stanovenie NOEC alebo odhad ECx mala použiť kontrolná skupina s rozpúšťadlom a kontrolná skupina s vodou sa nepoužije. Pozri obmedzenia v kritériách platnosti (bod 7). Pokiaľ ide o dĺžku, hmotnosť, pomer vyliahnutia vajíčok, úmrtnosti lariev alebo abnormálnych lariev a prvý alebo posledný deň liahnutia alebo vyplávanie, na porovnanie kontrolnej skupiny s vodou na riedenie a kontrolnej skupiny s rozpúšťadlom pri 0,05 hladine významnosti by sa mal použiť T-test alebo Mannov-Whitneyho test, pričom by sa mali ignorovať všetky skupiny s aplikovanou chemikáliou. Výsledky týchto testov by sa mali uviesť. Merania veľkosti (dĺžka a hmotnosť) Hodnoty dĺžky a hmotnosti jednotlivých rýb môžu byť rozložené normálne alebo logaritmicko-normálne. V obidvoch prípadoch majú stredné hodnoty replikátov tendenciu byť rozložené normálne v zmysle centrálnej limitnej vety a potvrdené z údajov z vyše 100 štúdií ELS troch sladkovodných druhov. Alternatívne tam, kde z údajov alebo historických databáz vyplýva logaritmicko-normálne rozdelenie hodnôt veľkostí jednotlivých rýb, možno vypočítať logaritmus priemernej veľkosti jednotlivých rýb replikátov a ako údaje pre analýzu možno potom použiť antilogaritmy týchto logaritmov priemernej hodnoty replikátov. Údaje by sa mali vyhodnotiť z hľadiska konzistencie s normálnym rozložením a homogenitou rozptylu. Na tento účel by sa mali použiť reziduá z modelu ANOVA s koncentráciou ako jedinou vysvetľujúcou triednou premennou. Možno použiť vizuálne stanovenie z korelačných (bodových) grafov a histogramov alebo stonkových a listových (tzv. stem-and-leaf) grafov. Alternatívne možno použiť neformálny test, ako je Shapirov-Wilkov test alebo Andersonov-Darlingov test. Konzistentnosť s homogenitou rozptylu možno posúdiť na základe vizuálneho preskúmania toho korelačného (bodového) grafu alebo formálne z Levenovho testu. Len parametrické testy (napr. Williamsov, Dunnettov) treba vyhodnotiť z hľadiska normality alebo homogenity rozptylu. Mala by sa venovať pozornosť možným extrémnym hodnotám (outlier) a ich účinku na analýzu. Možno použiť Tukeyho test extrémnych hodnôt a vizuálnu kontrolu tých istých už opísaných diagramov reziduí. Treba pripomenúť, že pozorovaniami sú celé replikáty, takže k vypusteniu extrémnej hodnoty z analýzy by sa malo pristúpiť len po dôkladnom zvážení. Štatistické testy, pri ktorých sa používajú charakteristiky návrhu experimentu a biologické očakávania, sú step-down testmi trendu, ako sú Williamsov a Jonckheereho-Terpstrov test. Tieto testy predpokladajú monotónnu koncentračnú závislosť a malo by sa posúdiť, či sú údaje v súlade s týmto predpokladom. To možno vykonať vizuálne z korelačného (bodového) grafu vzťahu medzi priemernými hodnotami replikátov a koncentráciami. Tento korelačný (bodový) graf by bolo vhodné prekryť úsekovým lineárnym grafom spájajúcim priemerné koncentrácie vážené veľkosťou vzorky replikátu. Veľká odchýlka tohto úsekového lineárneho diagramu od monotónnosti by naznačovala možnú potrebu použitia netrendových testov. Alternatívne možno použiť formálne testy. Jednoduchým formálnym testom je vypočítanie lineárnych a kvadratických kontrastov priemerných koncentrácií. Ak je kvadratický kontrast významný a lineárny kontrast nie je významný, naznačuje to možný problém s monotónnosťou, ktorej ďalšie hodnotenie by sa malo uskutočniť na základe diagramov. Ak môžu normalita alebo homogenita rozptylu predstavovať problém, možno tieto kontrasty zostaviť z údajov transformovaných podľa poradia. Možno použiť alternatívne postupy, ako je Bartholomewov test monotónnosti, pridávajú však na zložitosti. Obrázok 2 Vývojový diagram NOEC s meraniami veľkosti (dĺžka a hmotnosť) 
Pokiaľ nie sú údaje v súlade s požiadavkami týchto testov, NOEC sa stanoví uplatnením step-down Williamsovho alebo Jonckheereho-Terpstrovho testu trendu. V dokumente OECD z roku 2006 sa uvádzajú podrobnosti k tomuto postupu. Pre údaje, ktoré nie sú v súlade s požiadavkami na step-down test trendu, možno použiť Dunnettov test alebo Tamhaneho-Dunnettov (T3) test, z ktorých obidva majú zabudované úpravy pre mnohopočetnosť. Tieto testy predpokladajú normalitu a, v prípade Dunnettovho testu, homogenitu rozptylu. Ak nie sú tieto podmienky splnené, možno použiť Dunnov neparametrický test. V dokumente OECD z roku 2006 sa uvádzajú podrobnosti ku všetkým týmto testom. Na obrázku 2 je uvedený prehľad o tom, ako vybrať test. Vyliahnutie vajíčok a prežitie lariev Údaje predstavujú pomery vajíčok, z ktorých sa vyliahnu larvy, alebo lariev, ktoré prežijú v jednotlivých replikátoch. Pri týchto pomeroch by sa mal posúdiť extrabinomický rozptyl, ktorý je pri takýchto nameraných hodnotách bežný, ale nie univerzálny. Vývojový diagram na obrázku 3 poskytuje usmernenie k voľbe testu; podrobné opisy nájdete v texte. Bežne sa používajú dva testy. Sú to Taroneho test C(α) (Tarone, 1979) a chí-kvadrát testy, každý použitý osobitne na každú testovaciu koncentráciu. Ak sa extrabinomický rozptyl zistí čo i len pri jednej testovacej koncentrácii, mali by sa použiť metódy, ktoré ho berú do úvahy. Vzorec 1 Taroneho test C(α) (Tarone, 1979)
kde ̂ je priemerný pomer pre danú koncentráciu, m je počet nádrží s replikátom, nj je počet subjektov v replikáte j a xj je počet reagujúcich subjektov v danom replikáte, teda nie vyliahnutých alebo mŕtvych. Tento test sa použije na každú koncentráciu osobitne. Tento test možno považovať za upravený chí-kvadrát test, ale obmedzené simulácie sily, ktoré vykonal Tarone, ukázali, že má väčšiu silu ako chí-kvadrát test. Obrázok 3 Vývojový diagram NOEC pre vyliahnutie a úmrtnosť lariev 
Tam, kde neexistuje žiadny významný dôkaz extrabinomického rozptylu, možno použiť step-down Cochranov-Armitageov test. Pri tomto teste sa ignorujú replikáty, takže tam, kde existuje dôkaz o takomto rozptyle, sa odporúča Raova-Scottova úprava Cochranovho-Armitageovho testu, ktorá zohľadňuje replikáty, veľkosti replikátov a extrabinomický rozptyl. Alternatívne testy zahŕňajú step-down Williamsov test, Jonckheereho-Terpstrov test a Dunnettov test, ako sa uvádza pri meraniach veľkosti. Tieto testy sa používajú bez ohľadu na existenciu extrabinomického rozptylu, ale majú o niečo menšiu silu (Agresti 2002, Morgan 1992, Rao and Scott 1992, 1999, Fung et al. 1994, 1996). Prvý alebo posledný deň liahnutia alebo vyplávanie Reakcia je celé číslo udávajúce, ktorý deň došlo k pozorovaniu uvedeného javu v danej nádrži s replikátom. Rozsah hodnôt je všeobecne veľmi obmedzený a často je vysoký pomer viazaných hodnôt, napr. vo všetkých kontrolných replikátoch je pozorovaný ten istý prvý deň liahnutia a možno aj v jednej alebo dvoch nízkych testovacích koncentráciách. Parametrické testy ako Williamsov a Dunnettov nie sú na takéto údaje vhodné. Pokiaľ neexistuje dôkaz o vážnej nemonotónnosti, je na zistenie účinkov testovanej chemikálie veľmi vhodný step-down Jonckheereho-Terpstrov test trendu. Inak možno použiť Dunnov test. Abnormality lariev Reakciou je počet lariev, u ktorých sa zistí nejaká forma abnormality. Táto reakcia má často malý výskyt a spája sa s rovnakými problémami ako prvý deň liahnutia, a takisto niekedy vykazuje nepravidelnosť v koncentračnej závislosti. Ak údaje aspoň zhruba sledujú monotónny tvar koncentrácie, je na zistenie účinkov vhodný step-down Jonckheereho-Terpstrov test trendu. Inak možno použiť Dunnov test. ODKAZY Agresti, A. (2002); Categorical Data Analysis, second edition, Wiley, Hoboken. Dunnett C. W. (1955); A multiple comparison procedure for comparing several treatments with a control, J. American Statistical Association 50, 1096-1121. Dunn O. J. (1964 ); Multiple Comparisons Using Rank Sums, Technometrics 6, 241-252. Dunnett C. W. (1964); New tables for multiple comparisons with a control, Biometrics 20, 482-491. Fung, K.Y., D. Krewski, J.N.K. Rao, A.J. Scott (1994); Tests for Trend in Developmental Toxicity Experiments with Correlated Binary Data, Risk Analysis 14, 639-648. Fung, K.Y, D. Krewski, R.T. Smythe (1996); A comparison of tests for trend with historical controls in carcinogen bioassay, Canadian Journal of Statistics 24, 431-454. Hochberg, Y. and A. C. Tamhane (1987); Multiple Comparison Procedures, Wiley, New York. Hsu, J.C. (1996); Multiple Comparisons: Theory and Methods; Chapman and Hall/CRC Press, Boca Raton. Jonckheere A. R. (1954); A distribution-free k-sample test against ordered alternatives, Biometrika 41, 133. Morgan, B.J.T. (1992). Analysis of Quantal Response Data, Chapman and Hall, London. OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series on Testing and Assessment, No. 54. Organisation for Economic Co-operation and Development, OECD, Paris. Rao J.N.K. and Scott A.J. (1992) – A simple method for the analysis of clustered binary data, Biometrics 48, 577-585. Rao J.N.K. and Scott A.J. (1999) – A simple method for analyzing overdispersion in clustered Poisson data, Statistics in Medicine 18, 1373-1385. Robertson, T., Wright F.T. and Dykstra R.L. (1988). Order restricted statistical inference, Wiley. Tarone, R.E. (1979). Testing the goodness of fit of the Binomial distribution, Biometrika 66, 585-590. Williams D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics 27, 103-117. Williams D.A. (1972). The comparison of several dose levels with a zero dose control, Biometrics 28, 519-531. Williams D. A. (1975). The Analysis of Binary Responses from Toxicological Experiments Involving Reproduction and Teratology, Biometrics 31, 949-952. Williams D.A. (1977). Some inference procedures for monotonically ordered normal means, Biometrika 64, 9-14. Dodatok 6 ŠTATISTICKÉ USMERNENIE NA STANOVENIE REGRESNÝCH ODHADOV Všeobecné informácie Pozorovania použité na zavedenie modelu sú stredné hodnoty replikátov (dĺžka a hmotnosť) alebo pomery replikátov (počet vyliahnutých vajíčok a úmrtnosť lariev) (OECD, 2006). Všeobecne sa odporúča vážená regresia s použitím veľkosti vzorky replikátu ako váhy. Možno použiť ďalšie systémy váženia, napríklad váženie predpokladanou priemernou reakciou alebo kombináciou tohto systému a veľkosti vzorky replikátu. Váženie recipročnou hodnotou rozptylu vzorky v rámci koncentrácie sa neodporúča (Bunke et al. 1999, Seber a Wild, 2003, Motulsky and Christopoulos 2004, Huet et al. 2003). Pri akejkoľvek transformácii reakcií pred analýzou by sa mala zachovať nezávislosť pozorovaní a hodnoty ECx a jej hranice spoľahlivosti by sa mali vyjadriť v pôvodných meracích jednotkách, nie v transformovaných jednotkách. Napríklad 20 % zmena v logaritme dĺžky nie je ekvivalentná 20 % zmene dĺžky (Lyles et.al 2008, Draper a Smith 1999). Vývojový diagram na obrázku 4 poskytuje prehľad odhadov ECx. Podrobnosti sú opísané v ďalšom texte. Obrázok 4 Vývojový diagram odhadov ECx priemernej dĺžky, hmotnosti alebo pomeru vyliahnutých lariev alebo úmrtnosti lariev replikátu, ďalšie podrobnosti nájdete v texte 
Úvahy v súvislosti s liahnutím vajíčok a úmrtnosťou lariev Pokiaľ ide o liahnutie vajíčok a úmrtnosť lariev, vo všeobecnosti je najlepšie zaviesť klesajúci model, pokiaľ sa nezavádza probitový model podľa ďalej uvedeného opisu. To znamená, že by sa mal vytvoriť model pomeru vajíčok, z ktorých sa nevyliahnu larvy, alebo lariev, ktoré uhynú. Dôvodom je to, že hodnota ECx sa vzťahuje na koncentráciu, pri ktorej dochádza k zmene rovnajúcej sa x % priemernej reakcie kontrolnej skupiny. Ak je v kontrolnej skupine 5 % vajíčok, z ktorých sa nevyliahnu larvy, a ak sa na základe toho vytvorí model nevyliahnutia, potom sa EC20 vzťahuje na koncentráciu, pri ktorej je šanca rovnajúca sa 20 % z 5 % nevyliahnutí lariev v kontrolnej skupine, čo predstavuje zmenu 0,2 * 0,05 = 0,01 alebo 1 percentuálneho bodu do 6 % nevyliahnutia lariev. Takúto malú zmenu nemožno odhadnúť žiadnym zmysluplným spôsobom z dostupných údajov a nie je biologicky významná. Ak sa však vytvára model pomeru vajec, z ktorých sa vyliahnu larvy, pomer kontrolnej skupiny by bol v tomto príklade 95 % a 20 % pokles z priemernej hodnoty kontrolnej skupiny by predstavoval zmenu 0,95 * 0,2 = 0,18, takže z 95 % úspešného vyliahnutia na 77 % (= 95 – 18) úspešné vyliahnutie, pričom túto účinnú koncentráciu možno odhadnúť a má pravdepodobne väčší význam. Nejde o problém s nameranými hodnotami veľkosti, hoci nepriaznivé účinky na veľkosť spravidla znamenajú zníženie veľkosti. Modely pre veľkosť (dĺžku alebo hmotnosť) a úspešné vyliahnutie vajíčok alebo prežitie lariev. Okrem Brainovho-Cousensovho hormetického modelu sa všetky tieto modely opisujú a odporúčajú v dokumente OECD z roku 2006. V súvislosti s modelmi nazývanými OECD 2-5 sa Slobova práca z roku 2002 takisto zaoberá experimentmi na ekotoxicitu. Existuje, samozrejme, mnoho iných modelov, ktoré môžu byť užitočné. Bunke, et al. (1999) uvádzajú početný zoznam modelov, ktoré tu nie sú zahrnuté, a existuje mnoho odkazov na ďalšie modely. Modely uvedené ďalej sa odporúčajú ako zvlášť vhodné v experimentoch na ekotoxicitu a často sa používajú. S 5 testovacími koncentráciami plus kontrolou
So 6 testovacími koncentráciami plus kontrolou
Ak existuje vizuálny dôkaz hormézy (nepravdepodobné pri úspešnom vyliahnutí alebo prežití lariev, ale občas ju možno zaznamenať pri pozorovaní veľkosti)
Alternatívne modely pre nevyliahnutie vajíčok a úmrtnosť lariev
Vhodnosť zavedenia jedného modelu
Porovnajte modely
Kvalita odhadu hodnoty ECx Interval spoľahlivosti (CI) pre hodnotu ECx by nemal byť príliš široký. Na rozhodnutie o tom, aký široký môže byť interval spoľahlivosti, aby bola hodnota ECx stále užitočná, je potrebný štatistický úsudok. Simulácie pre regresné modely prispôsobené údajom o liahnutí a veľkosti ukazujú, že okolo 75 % intervalov spoľahlivosti pre ECx (x=10, 20 alebo 30) zahŕňa nie viac ako dve testovacie koncentrácie. To poskytuje všeobecný návod na to, čo je prijateľné, a praktický návod na to, čo možno dosiahnuť. Mnohí autori tvrdia, že treba uvádzať intervaly spoľahlivosti pre všetky parametre modelu a že široké intervaly spoľahlivosti pre parametre modelov poukazujú na neprijateľné modely (Ott a Longnecker 2008, Alvord a Rossio 1993, Motulsky a Christopoulos 2004, Lyles et al. 2008, Seber a Wild 2003, Bunke et al. 1999, Environment Canada 2005). CI pre ECx (alebo akýkoľvek iný parameter modelu) by nemal obsahovať nulu (Motulsky a Christopoulos 2004). Toto je v regresnom modeli ekvivalent minimálneho významného rozdielu, ktorý sa často cituje v prístupoch k testovaniu hypotéz (napr. Wang et al 2000). Takisto zodpovedá intervalu spoľahlivosti pre stredné reakcie pri LOEC neobsahujúcej priemernú hodnotu kontroly. Treba sa zamyslieť nad tým, či sú odhady parametrov vedecky možné. Napr. ako interval spoľahlivosti pre y0 je ±20 %, žiadny odhad EC10 nie je hodnoverný. Ak model predpokladá 20 % účinok pri koncentrácii C a maximálny pozorovaný účinok pri C a nižších koncentráciách je 10 %, potom hodnota EC20 nie je hodnoverná (Motulsky and Christopoulos 2004, Wang et al. 2000, Environment Canada 2005). Hodnota ECx by si nemala vyžadovať extrapoláciu mimo rozsahu pozitívnych koncentrácií (Draper a Smith 1999, OECD 2006). Napríklad všeobecným návodom by mohlo byť, že hodnota ECx by nemala byť viac než okolo 25 % pod najnižšou testovanou koncentráciou alebo nad najvyššou testovanou koncentráciou. ODKAZY Alvord, W.G., Rossio, J.L. (1993). Determining confidence limits for drug potency in immunoassay, Journal of Immunological Methods 157, 155-163. Brain P. a Cousens R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed res. 29: 93 – 96. Bunke, O., Droge, B. a Polzehl, J. (1999). Model selection, transformations and variance estimation in nonlinear regression. Statistics 33, 197-240. Collett, D. (2002). Modelling Binary Data, second edition, Chapman and Hall, London. Collett, D. (2003). Modelling Survival Data in Medical Research, second edition, Chapman and Hall, London. Draper, N.R. a Smith, H. (1999). Applied Regression Analysis, third edition. New York: John Wiley & Sons. Environment Canada (2005). Guidance Document on Statistical Methods for Environmental Toxicity Tests, Report EPS 1/RM/46 Huet, S., A. Bouvier, M.-A. Poursat, E. Jolivet (2003). Statistical Tools for Nonlinear Regression: A Practical Guide with S-PLUS and R Examples, Springer Series in Statistics, New York. Lyles, R. H., C. Poindexter, A. Evans, M. Brown, a C.R. Cooper (2008). Nonlinear Model-Based Estimates of IC50 for Studies Involving Continuous Therapeutic Dose-Response Data, Contemp Clin Trials. 2008 November; 29(6): 878 – 886. Morgan, B.J.T. (1992). Analysis of Quantal Response Data, Chapman and Hall, London. Motulsky, H., A. Christopoulos (2004). Fitting Models to Biological Data Using Linear and Nonlinear Regression: A Practical Guide to Curve Fitting, Oxford University Press, USA. O'Hara Hines, R. J. a J. F. Lawless (1993). Modelling Overdispersion in Toxicological Mortality Data Grouped over Time, Biometrics Vol. 49, pp. 107-121 OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series Testing and Assessment, No. 54, Organisation for Economic Co-operation and Development, OECD, Paris. Ott, R.L., M.T. Longnecker, An Introduction to Statistical Methods and Data Analysis, sixth edition, 2008, Brooks-Cole, Belmont, CA Ratkowsky, D.A. (1993). Principles of nonlinear regression, Journal of Industrial Microbiology 12, 195-199. Seber, G.A.F., C.J. Wild, Nonlinear Regression, Wiley, 2003 Slob W. (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci., 66, 298-312 Wang, Q., D.L. Denton, a R. Shukla (2000). Applications and Statistical Properties Of Minimum Significant Difference-Based Criterion Testing In a Toxicity Testing Program, Environmental Toxicology and Chemistry, Vol. 19, pp. 113–117, 2000. C.48 Krátkodobý reprodukčný test na rybách ÚVOD
POČIATOČNÉ ÚVAHY A OBMEDZENIA
PRINCÍP TESTU
AKCEPTAČNÉ KRITÉRIÁ TESTU
OPIS METÓDY Prístrojové vybavenie
Voda
Testovacie roztoky
Chov rýb
Obdobie pred expozíciou a výber rýb
PLÁN ŠTÚDIE
Výber testovacích koncentrácií
POSTUP Výber a váženie testovaných rýb
Podmienky expozície Trvanie
Kŕmenie
Svetlo a teplota
Frekvencia analytických stanovení a meraní
Pozorovania
Prežitie
Správanie a vzhľad
Plodivosť
Humánne usmrcovanie rýb
Pozorovanie sekundárnych pohlavných znakov
Vitelogenín (VTG)
Vyhodnotenie histopatológie gonád
ÚDAJE A PREZENTOVANIE VÝSLEDKOV Vyhodnocovanie reakcií biomarkerov analýzou rozptylu (ANOVA)
Popis výsledkov testu
USMERNENIE KINTERPRETÁCII A AKCEPTÁCII VÝSLEDKOV TESTU
LITERATÚRA
Dodatok 1 SKRATKY A DEFINÍCIE Chemikália : látka alebo zmes CV : variačný koeficient ELISA : enzýmové imunosorbentové stanovenie Os HHG (hypothalamic-pituitary-gonadal axis, HPG) : os hypotalamus – hypofýza – gonády Veľkosť násady : mokrá hmotnosť rýb na objem vody MTC : maximálna tolerovaná koncentrácia, ktorá predstavuje približne 10 % hodnoty LC50 Chovná hustota : je počet rýb na objem vody Testovaná chemikália : akákoľvek látka alebo zmes, ktorá sa testuje touto testovacou metódou. VTG : vitelogenín je fosfolipoglykoproteín, slúžiaci ako prekurzor proteínov vaječného žĺtka, ktorý sa normálne vyskytuje v telách pohlavne aktívnych samíc všetkých vajcorodých druhov. Dodatok 2 EXPERIMENTÁLNE PODMIENKY SKRÍNINGU NA ENDOKRINNOM SYSTÉME RÝB
Dodatok 3 NIEKTORÉ CHEMICKÉ VLASTNOSTI PRIJATEĽNEJ VODY NA RIEDENIE
Dodatok 4A NERESOVÝ SUBSTRÁT PRE DANIO PRUHOVANÉ Podložka na neresenie : celosklená nádoba s rozmermi napríklad 22 x 15 x 5,5 cm (dĺžka × šírka × výška) pokrytá odnímateľnou drôtenou mriežkou z nehrdzavejúcej ocele (s veľkosťou ôk 2 mm). Mriežka by mala pokrývať otvor nádoby pod okrajom nádoby. 
Na mriežku by sa mal upevniť substrát na neresenie. Rybám by mal poskytovať štruktúru, do ktorej môžu preniknúť. Vhodné sú napríklad umelé akváriové rastliny vyrobené zo zeleného plastového materiálu (pozn.: mala by sa zvážiť možná adsorpcia testovanej chemikálie na plastový materiál). Uvedený plastový materiál by sa mal dostatočne dlho lúhovať v dostatočnom objeme teplej vody, aby sa zabezpečilo, že do vody použitej na testovanie sa neprenesú žiadne chemikálie. V prípade použitia sklených materiálov by sa malo zabezpečiť, aby sa ryby pri intenzívnom pohybe nezranili ani nezakliesnili. Vzdialenosť medzi podložkou a sklenými stenami by mala byť najmenej 3 cm, aby sa zabezpečilo, že neresenie sa nevykonáva mimo podložky. Vajíčka neresením prenesené na podložku prepadávajú cez mriežku a 45 – 60 minút po spustení osvetlenia z nich možno odobrať vzorky. Priesvitné vajíčka sú nelepivé a ľahko sa počítajú pomocou transverzálneho svetla. Pri použití piatich samíc na testovaciu nádobu možno počet vajíčok do 20 za deň považovať za nízky, od 20 do 100 za stredný a nad 100 za vysoký. Podložka na neresenie by sa mala odstrániť, vajíčka zozbierať a podložka na neresenie vložiť späť do testovacej nádoby, buď čo najneskôr večer, alebo veľmi skoro ráno. Čas, ktorý uplynie do opätovného vloženia, by nemal presiahnuť jednu hodinu, lebo inak stopa substrátu na neresenie môže vyvolať individuálne párenie a neresenie v nezvyčajnom čase. Ak si situácia vyžaduje neskoršie vloženie podložky na neresenie, malo by sa to urobiť najmenej 9 hodín po spustení osvetlenia. V tomto pokročilom dennom čase sa už neresenie nevyvoláva. Dodatok 4B NERESOVÝ SUBSTRÁT PRE ČEREBĽU POTOČNÚ Do každej testovacej komory sa umiestnia dva alebo tri kombinované plastové/keramické/sklené alebo nerezové oblúkové kryty s podložkami na neresenie (napr. 80 mm dlhý sivý polkruhový žľab uložený na podložke so zvýšeným okrajom a s dĺžkou 130 mm) (pozri obrázok). Riadne vyzreté kryty z PVC alebo keramiky sa ukázali ako vhodné miesto pre neresový substrát (Thorpe et al, 2007). Odporúča sa kryty obrúsiť, aby sa zvýšila ich priľnavosť. Podložka by mala byť prekrytá sieťkou tak, aby sa zabránilo rybám v prístupe k padajúcim vajíčkam, pokiaľ nebola preukázaná účinná lepivosť k neresovému substrátu. 
Dno je konštruované tak, aby obsahovalo všetky vajíčka, ktoré sa neprilepia k povrchu krytu a spadnú na dno nádoby (alebo vajíčka, ktoré sa uložia priamo na plochú plastovú spodnú časť). Všetky neresové substráty by sa mali pred použitím minimálne 12 hodín lúhovať vo vode na riedenie. Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90 – 98. Dodatok 5 A POSÚDENIE SEKUNDÁRNYCH POHLAVNÝCH ZNAKOV ČEREBLE POTOČNEJ NA ZISTENIE URČITÝCH CHEMIKÁLIÍ S ÚČINKOM NA ENDOKRINNÝ SYSTÉM Prehľad Medzi potenciálne dôležité znaky fyzického vzhľadu dospelých jedincov čereble potočnej pri testovaní endokrinných disruptorov patrí farba tela (t. j. svetlá/tmavá), vzorovanie (t. j. prítomnosť alebo neprítomnosť zvislých pruhov), tvar tela (t. j. tvar hlavovej a prsnej oblasti, brušná distenzia) a špecializované sekundárne pohlavné znaky (t. j. počet a veľkosť tuberkulov, veľkosť záhlavnej časti chrbta a kladielka). Tuberkuly sa nachádzajú na hlave (záhlavná časť chrbta) reprodukčne aktívnych samcov čereble potočnej a ich usporiadanie je obvykle dvojstranne symetrické (Jensen et al. 2001). Kontrolné skupiny samíc a juvenilné samce a samice nevykazujú vznik žiadnych tuberkulov (Jensen et al. 2001). Až osem jednotlivých tuberkulov sa môže nachádzať okolo očí a medzi nozdrami samcov. Najväčší počet tuberkulov, ktoré sú zároveň najväčšie, je umiestnený v dvoch rovnobežných líniách bezprostredne pod nozdrami a nad ústami. V prípade mnohých rýb sa pod dolnou čeľusťou vyskytujú skupiny tuberkulov, pričom tie, ktoré sa nachádzajú najbližšie k ústam sa spravidla vyskytujú ako jediný pár, zatiaľ čo bližšie k brušnej časti to môžu byť skupiny až štyroch tuberkulov. Celkový počet tuberkulov je zriedkavo vyšší ako 30 (v rozsahu 18 – 28; Jensen et al. 2001). Prevládajú (z hľadiska počtu) tuberkuly, ktoré tvoria samostatnú, relatívne okrúhlu štruktúru s výškou približne rovnou polomeru. Väčšina reprodukčne aktívnych samcov má takisto prinajmenšom niekoľko tuberkulov, ktoré sú zväčšené a výrazné natoľko, že sú nerozoznateľné ako jednotlivé štruktúry. Niektoré druhy chemikálií narušujúcich endokrinný systém môžu vyvolávať abnormálny výskyt určitých sekundárnych pohlavných znakov pri živočíchoch opačného pohlavia. Napríklad agonisty androgénových receptorov, ako sú 17α-metyltestosterón alebo 17β-trenbolón, môžu spôsobovať vyvinutie tuberkulov u samíc čereble potočnej (Smith 1974; Ankley et al. 2001; 2003), zatiaľ čo agonisty estrogénových receptorov môžu znížiť počet alebo veľkosť tuberkulov u samcov (Miles-Richardson et al. 1999; Harries et al. 2000). V ďalšej časti sa uvádza opis charakteristiky tuberkulov čereble potočnej na základe postupov používaných Agentúrou Spojených štátov na ochranu životného prostredia v meste Duluth v štáte Minnesota. Špecifické produkty a/alebo zariadenia možno nahradiť porovnateľnými materiálmi, ktoré sú k dispozícii. Prehliadanie sa najlepšie vykonáva osvetlenou lupou alebo svetelným stereoskopickým mikroskopom pri 3-násobnom zväčšení. Ryba sa prehliada zo strany chrbta, natočená prednou časťou dopredu (hlavou k prehliadačovi).
Počítanie a klasifikácia tuberkulov Na posúdenie prítomnosti a vyvinutosti tuberkulov u dospelých jedincov čereble potočnej bolo určených šesť špecifických oblastí. Na mapovanie umiestnenia prítomných tuberkulov a ich množstva bola vypracovaná šablóna (pozri koniec tohto dodatku). Počet tuberkulov sa zaznamenáva a ich veľkosť možno v prípade každého organizmu kvantitatívne klasifikovať takto: 0 – neprítomný, 1 – prítomný, 2 – zväčšený a 3 – výrazný (obrázok 1). Kategória 0 – neprítomný, nijaký tuberkul nie je prítomný. Kategória 1 – prítomný, identifikovaný akýkoľvek jednotlivý tuberkul, ktorého výška sa skoro rovná jeho polomeru. Kategória 2 – zväčšený, identifikovaný na základe tkaniva, ktoré vzhľadom pripomína hviezdičku, zvyčajne s veľkou radiálnou základňou s drážkami alebo so žliabkami vychádzajúcimi zo stredu. Vrchná časť tuberkula je často viac vrúbkovaná, ale niekedy môže byť čiastočne zaoblená. Kategória 3 – výrazný, zvyčajne pomerne veľký a zaoblený, s menej rozlíšenou štruktúrou. Tieto tuberkuly niekedy spoločne vytvárajú jednotnú masu v jednej oblasti alebo v kombinácii oblastí (B, C a D, ako je opísané v ďalšej časti). Sfarbenie a tvar sú podobné ako v rámci kategórie 2, ale niekedy sú dosť málo rozlíšiteľné. Použitie tohto systému klasifikácie vo všeobecnosti povedie k celkovému skóre < 50 u bežného kontrolného samca s počtom tuberkulov 18 – 20 (Jensen et al. 2001). Obrázok 1 
Skutočný počet tuberkulov na tele niektorých rýb môže byť väčší ako počet políčok v šablóne pre určitú klasifikovanú oblasť. V takom prípade je možné vyznačiť ďalšie čísla klasifikácie vpravo alebo vľavo od príslušného políčka. Zobrazenie šablóny preto nemusí byť symetrické. Ďalšou technikou mapovania tuberkulov, ktoré sú umiestnené v pároch alebo spolu vertikálne pozdĺž horizontálnej roviny úst, by mohlo byť dvojité značenie dvoch bodov klasifikácie tuberkulov v jednom políčku. Mapovanie oblastí:
ODKAZY
Dodatok 5B POSÚDENIE SEKUNDÁRNYCH POHLAVNÝCH ZNAKOV RYŽOVNÍČKY JAPONSKEJ PRI ZISŤOVANÍ URČITÝCH CHEMIKÁLIÍ S ÚČINKOM NA ENDOKRINNÝ SYSTÉM Ďalej sa uvádza opis merania papilárnych výbežkov (*10), ktoré sú sekundárnymi pohlavnými znakmi ryžovníčky japonskej (Oryzias latipes).
Meranie
Obr. 1. Obrázok znázorňujúci rozdiely medzi pohlaviami, pokiaľ ide o tvar a veľkosť análnej plutvy. A, samec; B, samica. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209 – 218. 
Obr. 2. A: Výbežky na spojených platničkách lúča análnej plutvy. J.P.: spojená platnička; A.S.: axiálny priestor; P.: výbežok. B: Distálny koniec lúča plutvy. Na úplnom konci lúča plutvy sú actinotrichia (Act.). Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209 – 218. 
Obr. 3. Fotografia tela ryby, ktorá znázorňuje miesto rezu v prípade, keď sa gonáda fixuje v inom fixačnom roztoku ako 10 % neutrálnom tlmenom formalíne. V takom prípade sa telo rozreže žiletkou medzi prednou časťou análnej plutvy a análnym otvorom (červená čiara), hlavová strana tela ryby sa vloží do fixačného roztoku na konzervovanie gonád a chvostová strana tela ryby sa vloží do 10 % neutrálneho tlmeného formalínu. 
Dodatok 6 ODPORÚČANÉ POSTUPY ODBERU VZORIEK NA ANALÝZU VITELOGENÍNU Malo by sa dbať na to, aby sa zabránilo krížovej kontaminácii medzi vzorkami VTG samcov a samíc. Postup 1A: Čerebľa potočná, odber krvi z chvostovej žily/tepny Po anestetizovaní sa chvostový pedunkulus čiastočne oddelí čepeľou skalpela a krv z chvostovej tepny/žily sa odoberie heparinizovanou mikrohematokritovou kapilárou. Po odobratí krvi sa rýchlo izoluje plazma odstreďovaním počas 3 minút pri 15 000 g (alebo alternatívne počas 10 minút pri 15 000 g a teplote 4 °C). V prípade potreby možno po odstredení stanoviť percentuálnu hodnotu hematokritu. Plazma sa odoberie z mikrohematokritovej kapiláry, vloží sa do skúmavky na odstreďovanie spolu s 0,13 jednotky aprotinínu (inhibítor proteázy) a uchová sa pri teplote – 80 °C, kým nebude možné stanoviť VTG. V závislosti od veľkosti čereble potočnej (závisí od pohlavia) sa objem plazmy, ktorú možno odobrať, vo všeobecnosti pohybuje v rozsahu 5 – 60 μl na jednu rybu (Jensen et al. 2001). Postup 1B: Čerebľa potočná, odber krvi zo srdca Alternatívne možno krv odobrať srdcovou punkciou heparinizovanou striekačkou (1 000 jednotiek heparínu na ml). Krv sa preloží do skúmaviek Eppendorf (uložených na ľade) a potom sa odstredí (5 minút pri 7 000 g a izbovej teplote). Plazma by sa mala preložiť do čistých skúmaviek Eppendorf (v alikvotných množstvách, ak to objem plazmy umožňuje) a rýchlo zmraziť pri – 80 °C, kým sa nevykoná analýza (Panter et al., 1998). Postup 2 A: Ryžovníčka japonská, vyrezanie pečene Vybratie testovanej ryby zo skúšobnej komory
Vyrezanie pečene
Po vyrezaní pečene je telo ryby k dispozícii na histológiu gonád a meranie sekundárnych pohlavných znakov. Vzorka Ak sa vzorky pečene nepoužijú na predbežnú úpravu krátko po vyrezaní z testovanej ryby, musia sa skladovať pri teplote ≤ – 70 °C. Obrázok 1 Nožnicami sa urobí rez tesne pred prsnými plutvami. 
Obrázok 2 Stredová línia brucha sa nožnicami rozstrihne k bodu približne 2 mm od kraniálnej strany análneho otvoru. 
Obrázok 3 Pomocou pinzety sa rozšíria steny brušnej dutiny a odhalí sa pečeň a ďalšie vnútorné orgány. (Alternatívne možno steny brušnej dutiny zboku pripevniť). Šípka ukazuje na pečeň. 
Obrázok 4 Pečeň sa priamo vyreže a pinzetou vyberie. 
Obrázok 5 Pinzetou sa črevá jemne odtiahnu. 
Obrázok 6 Obidva konce čriev a akékoľvek mezenteriálne pripojenia sa nožnicami oddelia. 
Obrázok 7 (samica) Postup je v prípade samíc rovnaký. 
Obrázok 8 Ukončený postup. 
Postup 2 B: Ryžovníčka japonská (Oryzias latipes), predbežná úprava pečene na analýzu vitelogenínu Zo súpravy ELISA sa vyberie fľaša tlmivého roztoku homogenátu a ochladí sa drveným ľadom (teplota roztoku: ≤ 4 °C). Ak sa použije tlmivý roztok homogenátu zo systému EnBio ELISA, nechá sa rozmraziť pri izbovej teplote a potom sa fľaša ochladí drveným ľadom. Vypočíta sa objem tlmivého roztoku homogenátu pre pečeň na základe jej hmotnosti (pridá sa 50 μl tlmivého roztoku homogenátu na 1 mg hmotnosti pečene). Napríklad ak je hmotnosť pečene 4,5 mg, objem tlmivého roztoku homogenátu pre pečeň je 225 μl. Spíše sa zoznam objemov tlmivého roztoku homogenátu pre všetky pečene. Príprava pečene na predbežnú úpravu
Postup predbežnej úpravy 1. Pridanie tlmivého roztoku homogenátu Podľa zoznamu sa zistí objem tlmivého roztoku homogenátu, ktorý sa má použiť pre konkrétnu vzorku pečene, a mikropipeta sa nastaví na príslušný objem (rozsah objemu: 100 – 1 000 μl). Na mikropipetu sa nasadí čistá špička. Tlmivý roztok homogenátu sa odoberie z reakčnej banky a pridá sa do 1,5 ml mikroskúmavky s pečeňou. Uvedeným postupom sa tlmivý roztok homogenátu pridá do všetkých 1,5 ml mikroskúmaviek s pečeňou. Špičku mikropipety netreba meniť za novú. Ak je však špička kontaminovaná, alebo by mohla byť kontaminovaná, mala by sa vymeniť. 2. Homogenizácia pečene
3. Odstreďovanie suspendovaného homogenátu pečene
4. Odber supernatantu
Uskladnenie vzoriek 0,5 ml mikroskúmavky so supernatantom homogenátu pečene sa udržiavajú pri teplote ≤ – 70 °C, až kým sa nepoužijú na test ELISA. Postup 3 A: Danio pruhované, odber krvi z chvostovej žily/tepny Bezprostredne po anestéze sa chvostový pedunkulus priečne nareže a heparinizovanou mikrohematokritovou kapilárou sa odoberie krv z chvostovej tepny/žily. Objem krvi sa pohybuje v rozsahu od 5 do 15 mikrolitrov v závislosti od veľkosti rýb. Do mikrokapiláry sa pridá rovnaký objem tlmivého roztoku aprotinínu (6 mikrogramov/ml vo fosfátovom tlmivom fyziologickom roztoku) a z krvi sa odstreďovaním oddelí plazma (5 minút pri 600 g). Plazma sa odoberie do testovacích skúmaviek a udržiava sa pri teplote –20 °C, až kým sa nezačne analyzovať na prítomnosť VTG alebo iných skúmaných proteínov. Postup 3 B: Danio pruhované, odber krvi srdcovou punkciou S cieľom zabrániť zrážaniu krvi a degradácii proteínov sa vzorky odoberajú do fosfátového tlmivého fyziologického roztoku (PBS) obsahujúceho heparín (1 000 jednotiek/ml) a inhibítor proteázy aprotinín (2 TIU/ml). Ako zložky tlmivého roztoku sa odporúčajú heparín, amóniová soľ a lyofilizovaný aprotinín. Na odber vzoriek krvi sa odporúča striekačka (1ml) s pevnou tenkou ihlou (napr. Braun Omnikan-F). Striekačka by sa mala vopred naplniť tlmivým roztokom (približne 100 mikrolitrov), aby sa úplne eluovali malé objemy krvi z každej ryby. Vzorky krvi sa odoberajú srdcovou punkciou. Ryba by sa mala najskôr anestetizovať s MS-222 (100 mg/l). Správna hladina anestézie umožňuje používateľovi rozpoznať tlkot srdca dania pruhovaného. Pri punkcii srdca treba držať piest striekačky pod miernym tlakom. Objem krvi, ktorú možno odobrať, sa pohybuje v rozsahu 20 – 40 mikrolitrov. Po srdcovej punkcii by sa mala testovacia skúmavka naplniť zmesou krvi a tlmivého roztoku. Z krvi sa odstreďovaním oddelí plazma (20 minút pri 5 000 g) a mala by sa udržiavať pri teplote –80 °C, až kým sa nezačne analyzovať. Postup 3C: Štandardný operačný postup: Danio pruhované, homogenizácia hlavy a chvosta
Dodatok 7 VZORKY OBOHATENÉ VITELOGENÍNOM A REFERENČNÁ LÁTKA-ŠTANDARD Každý deň, keď sa vykonávajú testy na zistenie VTG, sa bude analyzovať obohatená vzorka pripravená s „inter-assay“ referenčným štandardom. VTG použitý na prípravu referenčnej látky-štandardu musí pochádzať z inej dávky než VTG použitý na prípravu kalibračných štandardov pre vykonávaný test. Obohatená vzorka sa pripraví pridaním známeho množstva štandardu do vzorky plazmy kontrolných samcov. Vzorka sa obohatí tak, aby sa dosiahla koncentrácia VTG 10- až 100-násobná oproti očakávanej koncentrácii vo vzorke kontrolných samcov rýb. Vzorka plazmy kontrolných samcov, ktorá sa obohatí, môže pochádzať od jednej ryby alebo môže byť zmesou od viacerých rýb. Čiastková vzorka neobohatenej vzorky plazmy kontrolných samcov sa bude analyzovať najmenej v dvoch duplicitných súboroch. Obohatená vzorka sa bude takisto analyzovať najmenej v dvoch duplicitných súboroch. Priemerné množstvo vitelogenínu v dvoch neobohatených vzorkách plazmy kontrolných samcov sa pridá k vypočítanému množstvu VTG pridanému na obohatenie vzoriek s cieľom stanoviť očakávanú koncentráciu. Spolu s výsledkami z každého súboru testov vykonaných v daný deň sa uvádza pomer tejto očakávanej koncentrácie a nameranej koncentrácie. Dodatok 8 SCHÉMA ROZHODOVANIA PRE ŠTATISTICKÚ ANALÝZU 
C.49 Test akútnej toxicity na rybích embryách (FET) ÚVOD
PRINCÍP TESTU
ÚVODNÉ ÚVAHY
PLATNOSŤ TESTU
OPIS METÓDY
Testovacie vybavenie
Testovacie komory
Vlastnosti vody a podmienky testu
Testovacie roztoky
Chov generačných rýb
Preukázanie odbornosti
Produkcia vajíčok
Diferenciácia vajíčok
POSTUP Podmienky expozície
Testované koncentrácie
Kontroly
Začiatok expozície a trvanie testu
Rozloženie vajíčok na 24-jamkových platničkách
Pozorovania
Analytické merania
LIMITNÝ TEST
ÚDAJE A PREZENTOVANIE VÝSLEDKOV Spracovanie výsledkov
Správa o teste
LITERATÚRA
Dodatok 1 DEFINÍCIE Koncový sledovaný parameter : účinok pôsobiaci na úrovni populácie. Blastula : zhluk buniek okolo animálneho pólu, ktorý pokrýva určitú časť žĺtka. Chemikália : látka alebo zmes. Epibólia : rozsiahle šírenie prevažne epidermálnych buniek vo fáze gastrulácie embrya a ich presun z dorzálnej na ventrálnu stranu, v dôsledku čoho sa vrstvy endodermálnych buniek internalizujú procesom podobným invaginácii a žĺtok sa začlení do embrya. Prietokový test : test s neustálym prietokom testovacích roztokov cez testovací systém počas trvania expozície. Vnútorná kontrola platničky : vnútorná kontrola skladajúca sa zo 4 jamiek naplnených vodou na riedenie na každej 24-jamkovej platničke, ktorá slúži na identifikáciu možnej kontaminácie platničiek výrobcom alebo výskumným pracovníkom v priebehu postupu, ako aj všetkých vplyvov platničky, ktoré by potenciálne mohli ovplyvniť výsledok testu (napr. teplotný gradient). IUPAC : Medzinárodná únia pre čistú a aplikovanú chémiu (International Union of Pure and Applied Chemistry) Chovná voda : voda, v ktorej sa chovajú dospelé ryby. Priemerná letálna koncentrácia (LC50) : koncentrácia testovanej chemikálie, ktorá sa odhadne ako letálna pre 50 % testovacích organizmov počas trvania testu. Polostatický obnovovací test : test s pravidelným obnovovaním testovacích roztokov po stanovenom období (napr. každých 24 hodín). SMILES : zjednodušený systém zadávania molekulárnych štruktúr (Simplified Molecular Input Line Entry Specification). Somit : vo vyvíjajúcom sa embryu stavovcov sú somity zhluky mezodermy uložené laterálne od neurálnej trubice, z ktorých sa časom vyvinie koža (dermatóm), kostrové svalstvo (myotóm) a stavce (sklerotóm). Statický test : test, pri ktorom testovacie roztoky zostávajú nezmenené počas celého trvania testu. Testovaná chemikália : akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy. UVCB : látky neznámeho alebo variabilného zloženia, produkty komplexných reakcií alebo biologické materiály. Dodatok 2 CHOV, NERESENIE A TYPICKÉ PODMIENKY PRE TESTY AKÚTNEJ TOXICITY NA EMBRYÁCH DANIA PRUHOVANÉHO
Dodatok 3 NORMÁLNY VÝVIN DANIA PRUHOVANÉHO PRI TEPLOTE 26 °C 

Dodatok 4 Obr. 1 Usporiadanie 24-jamkových platničiek 
Obr. 2 Diagram testovacieho postupu akútnej toxicity na embryách dania pruhovaného (zľava doprava): produkcia vajíčok, zber vajíčok, predbežná expozícia ihneď po oplodnení v sklenených nádobách, výber oplodnených vajíčok pomocou invertovaného mikroskopu alebo binokulárneho mikroskopu a umiestnenie oplodnených vajíčok do 24-jamkových platničiek pripravených s príslušnými testovanými koncentráciami/kontrolami, n = počet vajíčok potrebných pre každú testovanú koncentráciu/kontrolu (tu 20), hpf = hodiny po oplodnení. 
Dodatok 5 ATLAS SLEDOVANÝCH LETÁLNYCH PARAMETROV PRE TEST AKÚTNEJ TOXICITY NA EMBRYÁCH DANIA PRUHOVANÉHO Tieto koncové sledované parametre poukazujú na akútnu toxicitu a následne na smrť embrya: koagulácia embrya, neoddelenie chvosta, nevytvorenie somitov a neprítomnosť srdcového tepu. Nasledujúce vybrané mikrografy ilustrujú tieto sledované parametre. Obr. 1 Koagulácia embrya: 
pri jasnom osvetlení poľa vidieť na koagulovaných embryách dania pruhovaného rôzne nepriehľadné štruktúry. Obr. 2 Nevytvorenie somitov: 
hoci vývin 24-hodinového embrya dania pruhovaného na obr. a) je spomalený o pribl. 10 hod, vidieť na ňom dobre vyvinuté somity (→), kým na embryu na obr. b) nevidieť žiadne známky tvorby somitov (→). Hoci 48-hodinové embryo dania pruhovaného na obr. c) má výrazný edém žĺtkového vaku (*), vidieť na ňom zreteľne vytvorené somity (→), kým na 96-hodinovom embryu na obr. d) nevidieť žiadne známky tvorby somitov (→). Všimnite si aj zakrivenie chrbtice (skoliózu) a perikardiálny edém (*) na embryu na obr. d). Obr. 3 Neoddelenie chvostového pupeňa pri pohľade zboku 
Obr. 4 Neprítomnosť srdcového tepu 
Neprítomnosť srdcového tepu možno z podstaty veci len ťažko ilustrovať na mikrografe. Neprítomnosť srdcového tepu sa prejavuje tým, že srdce sa nesťahuje (dvojitá šípka). Nehybnosť krvných buniek, napr. v brušnej aorte (→ vo vloženom obrázku) nie je ukazovateľom neprítomnosti srdcového tepu. Všimnite si aj nevytvorenie somitov v tomto embryu (*, homogénny, nesegmentovaný vzhľad svalového tkaniva). Dĺžka pozorovania na zaznamenanie neprítomnosti srdcového tepu by mala byť najmenej jedna minúta s minimálne 80-násobným zväčšením. C.50 Test toxicity pre stolístok klasnatý (Myriophyllum spicatum) v systéme bez sedimentu ÚVOD
PRINCÍP TESTU
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
PLATNOSŤ TESTU
REFERENČNÁ CHEMIKÁLIA
OPIS METÓDY Testovacie vybavenie
Testovací organizmus
Kultivácia
Testovacie médium
Testovacie roztoky
Testovacie a kontrolné skupiny
Expozícia
Podmienky testu
Trvanie
Merania a analytické stanovenia
Frekvencia meraní a analytických stanovení
Limitný test
ÚDAJE A PREZENTOVANIE VÝSLEDKOV Závisle premenné
Priemerná špecifická rýchlosť rastu
Výťažok
Čas zdvojnásobenia
Zakreslenie kriviek závislosti veličiny od koncentrácie
Odhad hodnoty ECx
Štatistické postupy
Prezentovanie výsledkov
LITERATÚRA
Dodatok 1 DEFINÍCIE
Dodatok 2 UPRAVENÉ ANDREWSOVO MÉDIUM NA ZÁSOBNÚ KULTÚRU A PREDKULTÚRU Z piatich samostatne pripravených živných zásobných roztokov sa pripraví upravené Andrewsovo médium potrebné na zásobnú kultúru a predkultúru pridaním 3 % sacharózy. Tabuľka 1 Zloženie Andrewsovho živného roztoku: (označenie ASTM E 1913-04)
Zásobné roztoky možno uchovávať v chladničke 6 mesiacov (pri teplote 5 – 10 °C). Jedine zásobný roztok č. 5 má nižší čas použiteľnosti (dva mesiace). Tabuľka 2 Výroba zásobného roztoku 3.1 na prípravu zásobného roztoku 3
Po vytvorení zásobného roztoku 3.1 (tabuľka 2) tento roztok hlboko zmrazte v alikvotných častiach po približne 11 ml (pri teplote aspoň – 18 °C). Hlboko zmrazené časti majú čas použiteľnosti päť rokov. Na výrobu zásobného roztoku 3 rozmrazte zásobný roztok 3.1, prelejte z neho 10 ml do 1 l kalibrovanej odmernej banky a pridajte ultračistú vodu až po mierku banky. Na získanie upraveného Andrewsovho média nalejte približne 2 500 ml ultračistej vody do 5 l kalibrovanej odmernej banky. Pridajte 50 ml z každého zásobného roztoku, doplňte ultračistú vodu do 90 % kalibrovanej odmernej banky a upravte hodnotu pH na 5,8. Potom pridajte 150 g rozpustenej sacharózy (3 % na 5 l) a doplňte do kalibrovanej odmernej banky ultračistú vodu až po mierku. Nakoniec sa živný roztok naplní do 1 l Schottových baniek a sterilizuje v autokláve pri teplote 121 °C počas 20 minút. Takto získaný živný roztok možno uchovávať sterilný v chladničke (pri teplote 5 – 10 °C) tri mesiace. Upravené Andrewsovo médium na test toxicity v systéme bez sedimentu Z piatich živných zásobných roztokov uvedených v tabuľkách 1 a 2 sa pripraví desaťkrát koncentrované upravené Andrewsovo médium potrebné na získanie testovacích roztokov pridaním 30 % sacharózy. Na jeho získanie nalejte približne 100 ml ultračistej vody do 1 l kalibrovanej odmernej banky. Pridajte 100 ml z každého zásobného roztoku a upravte hodnotu pH na 5,8. Potom pridajte 30 % rozpustenú sacharózu (300 g na 1 000 ml) a doplňte do kalibrovanej odmernej banky ultračistú vodu až po mierku. Nakoniec sa živný roztok naplní do 0,5 l Schottových baniek a sterilizuje v autokláve pri teplote 121 °C počas 20 minút. Takto získaný desaťkrát koncentrovaný upravený živný roztok možno uchovávať sterilný v chladničke (pri teplote 5 – 10 °C) tri mesiace. Dodatok 3 UDRŽIAVANIE ZÁSOBNEJ KULTÚRY V tomto dodatku 3 je opísaná zásobná kultúra druhu Myriophyllum spicatum L (103), ponorenej vodnej dvojklíčnolistovej rastliny z čeľade zrnulkovité. Od júna do augusta vystupujú nad vodnú hladinu nevýrazné ružovobiele kvety. Rastliny sú zakorenené v zemi prostredníctvom systému mohutných pakoreňov a vyskytujú sa na celej severnej pologuli v eutrofických, ale neznečistených a vápenatejších stojatých vodách s bahnitým substrátom. Myriophyllum spicatum uprednostňuje sladkú vodu, ale možno ho nájsť aj v poloslanej vode. Na zásobnú kultúru bez sedimentu v laboratórnych podmienkach sú potrebné sterilné rastliny. Sterilné rastliny sú k dispozícii od ekotoxikologického laboratória nemeckej Spolkovej agentúry pre životné prostredie (Umweltbundesamt). Alternatívne možno testovacie organizmy pripraviť z nesterilných rastlín v súlade s označením ASTM E 1913-04. V ďalšej časti textu nájdete úryvok zo štandardného usmernenia ASTM s postupom kultivácie rastliny druhu Myriophyllum sibiricum nazbieranej v teréne: „Ak chcete použiť nesterilné rastliny nazbierané v teréne, nazbierajte zimné výhonky M. sibiricum na jeseň. Umiestnite zimné výhonky do 20 l akvária obsahujúceho 5 cm vrstvu sterilného sedimentu, ktorá je pokrytá kremičitým pieskom alebo napríklad produktom Turface® a 18 l reagenčnej vody. Akvárium prevzdušňujte a udržiavajte pri teplote 15 °C a rýchlosti toku častíc 200 až 300 μmol m– 2 s– 1 počas 16 hodín denne. Rastlinnú kultúru v akváriu možno udržiavať ako rezervný zdroj rastlín pre prípad zničenia sterilných rastlinných kultúr mechanickou poruchou rastovej komory, kontamináciou alebo z iného dôvodu. Rastliny pestované v akváriu nie sú sterilné a sterilné kultúry nemožno udržiavať v kultivačnom systéme na produkciu vzoriek. Na účely sterilizácie kultúry sa rastliny vyberú z akvária a oplachujú v tečúcej deionizovanej vode približne 0,5 hodiny. Rastliny sa dezinfikujú za aseptických podmienok v komore s laminárnym prúdením vzduchu počas menej ako 20 minút (kým väčšina rastlinného tkaniva nie je odfarbená a len rastúci vrchol je stále zelený) v 3 % (w/v) roztoku chlórnanu sodného obsahujúcom 0,01 % vhodného surfaktantu. Premiešajte dezinfekčný prostriedok a rastlinný materiál. Segmenty s viacerými kolienkami sa prenesú do sterilných kultivačných skúmaviek obsahujúcich 45 ml sterilizovaného upraveného Andrewsovho média, ktoré sa uzavrú bežnými uzávermi kultivačných skúmaviek. Do každej testovacej komory sa umiestni len jeden segment rastliny. Na zabezpečenie uzavretia kultivačnej nádoby sa použije laboratórna tesniaca fólia. Keď sa vytvorila sterilná kultúra, segmenty rastliny obsahujúce viaceré kolienka by sa každých desať až dvanásť dní mali prenášať do nových testovacích komôr s čerstvým tekutým živným médiom. Ako sa preukázalo kultiváciou na agarových miskách, rastliny musia zostať sterilné osem týždňov predtým, ako možno začať s testovaním.“ Keďže upravené Andrewsovo médium obsahuje sacharózu (ktorá stimuluje rast plesní a baktérií), všetok materiál, roztoky a rastové médiá sa musia pripravovať v sterilných podmienkach. Všetky tekutiny i zariadenia sa pred použitím sterilizujú. Sterilizácia sa vykonáva vystavením horúcemu vzduchu (210 °C) na 4 hodiny alebo sterilizáciou v autokláve počas 20 minút pri teplote 121 °C. Okrem toho sa bezprostredne pred použitím všetky banky, podnosy, misky atď. a iné vybavenie sterilizujú plameňom na sterilnej pracovnej ploche. Zásobné kultúry sa môžu uchovávať pri zníženom osvetlení a teplote (50 μE m– 2 s– 1, 20 ± 2 °C) aj počas dlhšieho obdobia bez toho, aby sa museli znova pripravovať. Rastové médium pre rastliny rodu Myriophyllum má byť rovnaké ako to, ktoré sa používa na testovanie, ale na zásobné kultúry sa môžu použiť aj iné médiá bohaté na živiny. Segmenty rastliny sa rozložia axenicky do niekoľkých 500 ml Erlenmeyerových baniek naplnených 450 ml upraveného Andrewsovho média, resp. a/alebo 2 000 ml Fernbachových baniek naplnených 1 000 ml upraveného Andrewsovho média. Banky sa potom axenicky uzatvoria celulózovou zátkou. Okrem toho je bezprostredne pred použitím absolútne nevyhnutné vybavenie dôkladne sterilizovať plameňom na sterilnej pracovnej ploche. V závislosti od počtu a veľkosti sa rastliny premiestňujú do čerstvého živného roztoku približne každé tri týždne. Na túto obnovenú kultúru možno použiť vrcholy i segmenty strednej časti stonky. Počet a veľkosť premiestnených rastlín (alebo segmentov rastlín) závisia od toho, koľko rastlín je potrebných. Môžete napríklad preniesť päť segmentov výhonku do jednej Fernbachovej banky a tri segmenty výhonku do jednej Erlenmeyerovej banky, každý s dĺžkou 5 cm. Všetky časti s koreňmi, kvitnúce, mŕtve alebo inak podozrivé časti zlikvidujte. Obrázok 1 Narezanie rastlín na zásobnú kultúru a predkultúru po 3 týždňoch kultivácie. 
Kultivácia rastlín sa má vykonať v 500 ml Erlenmeyerových bankách a 2 000 ml Fernbachových bankách v chladiacom inkubátore pri teplote 20 ± 2 °C s nepretržitým svetlom s intenzitou približne 100 – 150 μE m– 2 s– 1 alebo 6 000 – 9 000 luxov (vyžarovaným osvetlením komory s teplotou farby „teplé biele svetlo“). Obrázok 2 Kultivácia rastlín v chladiacom inkubátore s osvetlením komory. 
Mali by sa použiť chemicky čisté (umyté v kyseline) a sterilné sklenené kultivačné nádoby a techniky aseptickej manipulácie. V prípade kontaminácie zásobnej kultúry, napr. riasami, plesňami a/alebo baktériami, by sa mala pripraviť nová kultúra alebo by sa na obnovu danej kultúry mala použiť zásobná kultúra z iného laboratória. Dodatok 4 UDRŽIAVANIE PREDKULTÚRY A PRÍPRAVA TESTOVACIEHO ORGANIZMU NA TESTOVANIE Na získanie predkultúry narežte výhonky zo zásobnej kultúry na segmenty po dvoch praslenoch a vložte segmenty do Fernbachových baniek naplnených upraveným Andrewsovým médiom (s 3 % sacharózou). Každá banka môže obsahovať až 50 segmentov výhonkov. Treba však dbať na to, aby segmenty boli životaschopné a nemali žiadne korene a bočné vetvy ani ich pupene (pozri obrázok 1 v dodatku 3). Organizmy v predkultúre sa kultivujú 14 až 21 dní v sterilných podmienkach v environmentálnej komore so striedavými fázami svetla/tmy 16/8 hodín. Intenzita svetla má byť v rozsahu 100 – 150 μE m– 2 s– 1. Teplota v testovacích nádobách má byť 23 ± 2 °C. Keďže upravené Andrewsovo médium obsahuje sacharózu (ktorá stimuluje rast rias, plesní a baktérií), roztoky testovanej chemikálie by sa mali pripravovať a kultivovať v sterilných podmienkach. Všetky tekutiny i zariadenia sa pred použitím sterilizujú. Sterilizácia sa vykonáva vystavením horúcemu vzduchu (210 °C) na 4 hodiny alebo sterilizáciou v autokláve počas 20 minút pri teplote 121 °C. Okrem toho sa bezprostredne pred použitím všetky banky, podnosy, misky atď. a iné vybavenie sterilizujú plameňom na sterilnej pracovnej ploche. Výhonky sa axenicky vyberú z baniek s predkultúrou, pričom sa vyberie materiál, ktorý je čo najhomogénnejší. Každé testovanie si vyžaduje aspoň 60 testovacích organizmov (testovanie s ôsmimi koncentráciami testovanej chemikálie). Na testovanie vyberte z predkultúr čerstvé bočné vetvy, skráťte ich na 2,5 cm od základne (merané pomocou pravítka) a preneste ich do kadičky obsahujúcej sterilné upravené Andrewsovo médium. Tieto čerstvé bočné vetvy sa môžu použiť na test toxicity pre Myriophyllum spicatum v systéme bez sedimentu. Obrázok 2 Narezanie rastlín z predkultúry na účely testu toxicity pre Myriophyllum spicatum v systéme bez sedimentu. 
C.51 Test toxicity pre Myriophyllum spicatum v systéme voda – sediment ÚVOD
PRINCÍP TESTU
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
PLATNOSŤ TESTU
REFERENČNÁ CHEMIKÁLIA
OPIS METÓDY Testovacie vybavenie
Testovací organizmus
Kultivácia testovacieho organizmu
Sediment
Testovacie médium
Návrh experimentu
Koncentrácie testovanej chemikálie a kontrolné skupiny
Limitný test
Testovacie roztoky
TESTOVACÍ POSTUP
Fáza založenia
Výber uniformného rastlinného materiálu
Expozícia prostredníctvom vodnej fázy
Expozícia prostredníctvom sedimentu
Udržiavanie výšky hladiny vody počas trvania testu
Podmienky testu
Trvanie testu
Merania a analytické stanovenia
Frekvencia meraní a analytických stanovení
Analytické merania testovanej chemikálie
HODNOTENIE ÚDAJOV
Závisle premenné
Priemerná špecifická rýchlosť rastu
Výťažok
Zakreslenie kriviek závislosti veličiny od koncentrácie
Odhad hodnoty ECx
Štatistické postupy
PREZENTOVANIE VÝSLEDKOV
LITERATÚRA
Dodatok 1 ZLOŽENIE SMARTOVHO A BARKOVHO MÉDIA
Dodatok 2 DEFINÍCIE
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(1) Žiadna hodnota pri 20 °C nie je k dispozícii, ale možno predpokladať, že variabilita výsledkov merania je vyššia než teplotná závislosť, ktorú možno očakávať.
(2) Nariadenie Európskeho parlamentu a Rady (ES) č. 1907/2006 z 18. decembra 2006 o registrácii, hodnotení, autorizácii a obmedzovaní chemikálií (REACH) a o zriadení Európskej chemickej agentúry, o zmene a doplnení smernice 1999/45/ES a o zrušení nariadenia Rady (EHS) č. 793/93 a nariadenia Komisie (ES) č. 1488/94, smernice Rady 76/769/EHS a smerníc Komisie 91/155/EHS, 93/67/EHS, 93/105/ES a 2000/21/ES. Ú. v. EÚ L 304, 22.11.2007, s. 1.
(3) Výbor pre overovanie alternatívnych metód „US Interagency Coordinating Committee on the Validation of Alternative Methods“.
(*1) Mala by sa zaznamenať oblasť zakalenia rohovky
(4) Na použitie integrovanej stratégie testovania podráždenia oka podľa REACH pozri aj Usmernenie ECHA k požiadavkám na informácie a k hodnoteniu chemickej bezpečnosti, kapitola R.7a: Usmernenia ku konkrétnemu sledovanému parametru http://echa.europa.eu/documents/10162/13632/information_requirements_r7a_en.pdf
(5) Štatistici, ktorí si zvolia vzorový postup, ako napríklad použitie všeobecných lineárnych modelov (General Linear Models, GLM), môžu vykonať analýzu odlišným, no porovnateľným spôsobom, nemusia však nevyhnutne vychádzať z tabuľky ANOVA, ktorá pochádza z obdobia, kedy sa pri výpočte štatistík vypracúvaných v období pred počítačovou érou uplatňovali algoritmické postupy.
(6) Štatistici, ktorí si zvolia vzorový postup, ako napríklad použitie všeobecných lineárnych modelov (General Linear Models, GLM), môžu vykonať analýzu odlišným, no porovnateľným spôsobom, nemusia však nevyhnutne vychádzať z tabuľky ANOVA, ktorá pochádza z obdobia, kedy sa pri výpočte štatistík vypracúvaných v období pred počítačovou érou uplatňovali algoritmické postupy.
(7) Nariadenie Európskeho parlamentu a Rady (ES) č. 1272/2008 zo 16. decembra 2008 o klasifikácii, označovaní a balení látok a zmesí, o zmene, doplnení a zrušení smerníc 67/548/EHS a 1999/45/ES a o zmene a doplnení nariadenia (ES) č. 1907/2006, Ú. v. EÚ L 353, 31.12.2008, s. 1.
(8) Chemické triedy boli stanovené pre každú testovanú chemikáliu s použitím štandardnej klasifikačnej schémy na základe klasifikačného systému National Library of Medicine Medical Subject Headings (MeSH) (dostupné na http//www.nlm.nih.gov/mesh).
(9) Na základe výsledkov očného testu na králikoch in vivo (OECD TG 405) (17) a s použitím GHS OSN (4).
(10) Klasifikácia v kategóriách 2A alebo 2B závisí od interpretácie kritéria GHS OSN pre rozlišovanie medzi týmito dvoma kategóriami, t. j. 1 z 3 v. 2 z 3 zvierat s účinkami v deň 7 potrebnými na klasifikáciu v kategórii 2A. Do štúdie in vivo boli zahrnuté 3 zvieratá. Všetky sledované parametre s výnimkou začervenania spojoviek v prípade jedného zvieraťa sa do dňa 7 alebo skôr vrátili na nulovú hodnotu. Toto jedno zviera, ktoré sa do dňa 7 v plnej miere nezotavilo, vykazovalo (v deň 7) začervenanie spojoviek s hodnotou 1, ktorá sa v deň 10 úplne vrátila na pôvodnú hodnotu.
(11) Uvedené rozmery vychádzajú z držiaka rohovky, ktorý sa používa v prípade kráv vo veku od 12 do 60 mesiacov. V prípade, že sa používajú zvieratá vo veku 6 až 12 mesiacov, držiak by sa musel navrhnúť tak, aby každá komora obsiahla objem 4 ml a aby každá vnútorná komora mala priemer 1,5 cm a hĺbku 2,2 cm. Pri novom návrhu držiaka rohovky je veľmi dôležité, aby pomer vystavenej plochy povrchu rohovky k objemu zadnej komory bol taký istý ako tento pomer v prípade tradičného držiaka rohovky. Je to potrebné na to, aby sa zabezpečilo správne určenie hodnôt priepustnosti na výpočet IVIS podľa navrhnutého vzorca.
(12) Nariadenie Európskeho parlamentu a Rady (ES) č. 1272/2008 z o16. decembra 2008 o klasifikácii, označovaní a balení látok a zmesí, o zmene, doplnení a zrušení smerníc 67/548/EHS a 1999/45/ES a o zmene a doplnení nariadenia (ES) č. 1907/2006, Ú. v. EÚ L 353, 31.12.2008, s. 1.
(*2) Najvyššia priemerná hodnota nameraná v ktoromkoľvek časovom bode
(*3) Maximálna priemerná hodnota pozorovaná v ktoromkoľvek časovom bode (založená na hodnotách zákalu uvedených v tabuľke 1).
(*4) Na základe hodnôt uvedených v tabuľke 2.
(*5) Výskyt uvedených kombinácií je menej pravdepodobný.
(13) Chemické triedy boli stanovené pre každú testovanú chemikáliu s použitím štandardnej klasifikačnej schémy na základe klasifikačného systému National Library of Medicine Medical Subject Headings (MeSH) (dostupné na http//www.nlm.nih.gov/mesh).
(14) Na základe výsledkov in vivo očného testu na králikoch (OECD TG 405) a s použitím GHS OSN (4)(6).
(15) Na základe výsledkov testovacej metódy izolovaného kuracieho oka, ako sa uvádza v tabuľke 6.
(16) Kombinácia výsledkov testovacej metódy izolovaného kuracieho oka, iných ako sú výsledky uvedené v tabuľke 6 týkajúce sa identifikácie chemikálií bez kategórie v zmysle GHS OSN a chemikálií kategórie 1 GHS OSN (pozri tabuľku 6).
(17) Klasifikácia v kategóriách 2A alebo 2B závisí od interpretácie kritéria GHS OSN pre rozlišovanie medzi týmito dvoma kategóriami, t. j. 1 z 3 v. 2 z 3 zvierat s účinkami v deň 7, potrebného na klasifikáciu v kategórii 2A. Do štúdie in vivo boli zahrnuté 3 zvieratá. Všetky sledované parametre s výnimkou začervenania spojoviek v prípade jedného zvieraťa sa do dňa 7 alebo skôr vrátili na nulovú hodnotu. Toto jedno zviera, ktoré sa do dňa 7 v plnej miere nezotavilo, vykazovalo (v deň 7) začervenanie spojoviek s hodnotou 1, ktoré sa v deň 10 vrátilo na pôvodnú hodnotu.
(18) Nariadenie Európskeho parlamentu a Rady (ES) č. 1272/2008 zo 16. decembra 2008 o klasifikácii, označovaní a balení látok a zmesí, o zmene, doplnení a zrušení smerníc 67/548/EHS a 1999/45/ES a o zmene a doplnení nariadenia (ES) č. 1907/2006 No 1907/2006, Ú. v. EÚ L 353, 31.12.2008, s. 1.
(19) Priemerná hodnota v celom dokumente znamená aritmetický priemer.
(20) Tieto číselné údaje sa vzťahujú na štatisticky vygenerované prahové hodnoty a nesúvisia s presnosťou merania.
(21) Predpoklad DPRA by sa mal zvážiť v rámci IATA a v súlade s ustanoveniami bodov 9 a 12.
(22) Tieto číselné údaje sa vzťahujú na štatisticky vygenerované prahové hodnoty a nesúvisia s presnosťou merania.
(23) Predpoklad DPRA by sa mal zvážiť v rámci IATA a v súlade s ustanoveniami bodov 9 a 12.
(24) Prognózy nebezpečnosti a (potencie) in vivo vychádzajú z údajov LLNA (19). Potencia in vivo je odvodená pomocou kritérií navrhnutých ECETOC (23).
(25) Prognóza DPRA by sa mala zvážiť v rámci IATA a v súlade s ustanoveniami bodov 9 a 11.
(26) Rozsahy určené na základe minimálne 10 hodnôt úbytku vytvorených 6 nezávislými laboratóriami.
(27) Nariadenie Európskeho parlamentu a Rady (ES) č. 1272/2008 zo 16. decembra 2008 o klasifikácii, označovaní a balení látok a zmesí, o zmene, doplnení a zrušení smerníc 67/548/EHS a 1999/45/ES a o zmene a doplnení nariadenia (ES) č. 1907/2006 (Ú. v. EÚ L 353, 31.12.2008, s. 1).
(28) Prognózy nebezpečnosti (a potencie) in vivo vychádzajú z údajov LLNA (13). Potencia in vivo je odvodená pomocou kritérií navrhnutých ECETOC (24).
(29) Prognóza KeratinoSens™ by sa mala posudzovať v rámci IATA a v súlade s ustanoveniami bodov 9 a 11 tejto testovacej metódy.
(30) Na základe hodnôt pozorovaných v minulosti (12).
(31) Nariadenie Európskeho parlamentu a Rady (ES) č. 1272/2008 zo 16. decembra 2008 o klasifikácii, označovaní a balení látok a zmesí, o zmene, doplnení a zrušení smerníc 67/548/EHS a 1999/45/ES a o zmene a doplnení nariadenia (ES) č. 1907/2006 (Ú. v. EÚ L 353, 31.12.2008, s. 1).
(32) Chemické triedy boli priradené každej testovanej chemikálii použitím štandardného postupu klasifikácie podľa klasifikačného systému National Library of Medicine Medical Subject Headings – MeSH (dostupnom na http://www.nlm.nih.gov/mesh).
(33) Na základe výsledkov in vivo testu na očiach králikov (OECDTG 405, TM B.5) a použitím GHS OSN a EÚ CLP.
(34) Na základe výsledkov zo skúšky FL [protokol INVITTOX č. 71(6)]
(35) Štatistici používajúci metódu modelovania, akou sú napríklad všeobecné lineárne modely (General Linear Model – GLM), môžu pristupovať k analýze iným, no porovnateľným spôsobom, hoci nemusia nevyhnutne vypracovať tradičnú tabuľku ANOVA, ktorej pôvod siaha k algoritmickým prístupom používaným na výpočet štatistických údajov z obdobia pred nástupom počítačov.
(36) Definície a jednotky sú uvedené v dodatku 1.
(37) Niekedy sa označuje aj ako P OW; stanovuje sa metódou trepačkovej banky opísanou v TM A.8 (3), metódou HPLC opísanou v TM.24 (4) a metódou pomalého miešania opísanou v TM A.23 (5). Na stanovenie log KOW sa niekedy používa technika generátorových kolón. Existuje istý počet štúdií, v ktorých je táto technika použitá, najmä v prípade chlórovaných bifenylov a dibenzodioxínov (napr. Li and Doucette, 1993) (3). V prípade látok, ktoré môžu ionizovať, by mala log KOW platiť pre neionizovanú formu.
(38) Definície a jednotky sú uvedené v dodatku 1.
(39) TLC: chromatografia na tenkej vrstve, HPLC: vysokoúčinná kvapalinová chromatografia, GC: plynová chromatografia.
(40) V niektorých regulačných rámcoch môže byť povinné uskutočniť analýzu metabolitov za predpokladu splnenia určitých podmienok (pozri bod 65).
(41) Vo všeobecnosti by koncentrácie vo vode merané vo fáze vychytávania mali byť aspoň o rádovú hodnotu vyššie ako kvantifikačný limit, aby bolo možné zmerať viac ako jeden polčas záťaže organizmu v depuračnej fáze štúdie.
(42) Definície a jednotky sú uvedené v dodatku 1.
(43) Pri väčšine testovaných látok by v ideálnom prípade mala byť voda s kontrolnou skupinou bez nálezov. Pozaďové koncentrácie by mali byť relevantné iba v prípade prirodzene zastúpených materiálov (napr. niektorých kovov) a látok, ktoré sú v životnom prostredí všadeprítomné.
(44) V prípade zjavného nedodržania kinetiky prvého rádu treba použiť komplexnejšie modely (pozri odkazy na literatúru v dodatku 5) a poradiť sa s bioštatistikom.
(45) Pri skúške biokoncentrácie sa vychytávanie môže nízkymi expozičnými koncentráciami z dôvodu nízkej rozpustnosti vo vode obmedziť, kým skúškou expozície z potravy možno dosiahnuť ďaleko vyššie expozičné koncentrácie.
(46) V prípade mnohozložkových látok, UVCB a zmesí by sa pri určovaní vhodných expozičných koncentrácií mala zvážiť rozpustnosť každej zo zastúpených zložiek vo vode.
(47) TOC sa skladá z organického uhlíka z častíc a rozpusteného organického uhlíka, t. j. TOC = POC + DOC.
(48) Napriek tomu, že sa takéto použitie vo všeobecnosti neodporúča, tak v prípade, že sa použije rozpúšťadlo alebo solubilizačný prostriedok, mal by sa pri zisťovaní koncentrácie organického uhlíka v testovacích nádobách sčítať organický uhlík pochádzajúci z činidla s organickým uhlíkom z testovanej látky.
(49) Ak sa obsah lipidov neanalyzuje u tých istých rýb ako testovaná látka, ryby by mali mať aspoň podobnú hmotnosť a (v prípade potreby) aj rovnaké pohlavie.
(50) Táto alternatíva platí iba vtedy, ak sú ryby zo všetkých testovaných skupín držané v skupinách podobných veľkostí, sú odobrané rovnakým postupom a kŕmené rovnakým spôsobom. Tým sa zabezpečí, že rast rýb vo všetkých testovaných skupinách bude v prípade testovaných koncentrácií pod úrovňou toxicity podobný. Ak je rast podobný, možno očakávať, že podobný bude aj obsah lipidov. Rozdielny rast v kontrolnej skupine by znamenal účinok látky a štúdia by sa stala neplatnou.
(51) Okrem hmotnosti by sa mala zaznamenať aj celková dĺžka, pretože porovnanie prírastku dĺžky počas testu je dobrým ukazovateľom toho, či nedošlo k nežiaducemu účinku.
(52) Môže sa vykonať t-skúška rýchlostných konštánt rastu na porovnanie rozdielov rastu medzi kontrolnou a testovanou skupinou, alebo F-skúška v prípade analýzy rozptylu. V prípade potreby môže použitie F-skúšky alebo skúšky miery pravdepodobnosti pomôcť pri výbere vhodného modelu rastu (OECD, monografia 54 (32).
(53) Tieto percentá naznačujú, že analytické metódy sú spoľahlivé a polčas je < 14 dní. Ak majú analytické metódy menšiu spoľahlivosť, alebo ak je polčas (podstatne) vyšší, budú aj tieto čísla vyššie.
CI: interval spoľahlivosti (ak sa dá odhadnúť)
SD: štandardná odchýlka (ak sa dá odhadnúť)
(56) Minimalizovaná skúška sa v skutočnosti môže použiť aj na preukázanie rýchleho metabolizmu, ak je známe, že rýchly metabolizmus môže byť pravdepodobný.
(57) Ak sa meria iba pri dvoch odberoch, môžu sa odhady hranice spoľahlivosti hodnoty BCFKm dosiahnuť použitím metód opakovaných výberov (bootstrap). Ak sú dostupné aj údaje z odberu uprostred, hranice spoľahlivosti hodnoty BCFKm sa môžu vypočítať tak ako v úplnom teste.
(58) Definície a jednotky sú uvedené v dodatku 1.
(59) Na účely nariadenia (ES) č. 1907/2006 o registrácii, hodnotení, autorizácii a obmedzovaní chemikálií (REACH) (Ú. v. EÚ L 396, 30.12.2006, s. 1) je táto otázka predmetom dokumentu „Usmernenie k informačným požiadavkám a posudzovaniu chemickej bezpečnosti“, kapitola R.7c, R.7.10.3.1, s. 13; kapitola R.7.10.4.1, s. 31-32 a obrázok R7.10-2, s. 50.
(60) Pri väčšine testovaných látok by v ideálnom prípade mala byť voda s kontrolnou skupinou bez nálezov. Pozaďové koncentrácie by mali byť relevantné iba v prípade prirodzene zastúpených materiálov (napr. niektorých kovov) a látok, ktoré sú v životnom prostredí všadeprítomné.
(61) Keďže BMF je definovaný ako pomer medzi koncentráciou látky v organizme k ustálenej koncentrácii látky obsiahnutej v potrave podávanej organizmu, a to pri zohľadnení lipidov opravou hodnoty BMF o obsah lipidov v organizme a v potrave, tento postup sa preto presnejšie označuje ako „oprava“. Ide o iný postup ako „normalizácia“ stanoveného obsahu lipidov v organizme, ktorá platí pre test biokoncentrácie s expozíciou vo vodnom prostredí.
(62) Celková dĺžka by sa mala počas skúšky zaznamenávať aj preto, že je dobrým ukazovateľom výskytu nežiaduceho účinku.
(63) HCB je uvedený v prílohách A a C k Štokholmskému dohovoru a v prílohách I a III k nariadeniu (ES) č. 850/2004 o perzistentných organických znečisťujúcich látkach (Ú. v. EÚ L 158, 30.4.2004, s. 7).
(64) Z dôvodu rýchleho rastu vo vychytávacej fáze bude skutočná kŕmna dávka nižšia ako tá na začiatku testu.
(65) V skúške expozície vo vodnom prostredí by 14 dňový polčas zodpovedal hodnote BCF okolo 10 000 l/kg u rýb s hmotnosťou 1 g pri rýchlosti vychytávania 500 l/kg za deň [podľa rovnice publikovanej Sijm a kol. (46)].
(66) Keďže skutočné vnútorné koncentrácie možno určiť až po vykonaní skúšky, je potrebné urobiť odhad očakávanej vnútornej koncentrácie (napr. na základe očakávanej hodnoty BMF a koncentrácie v potrave, pozri rovnicu A5.8 v dodatku 5).
(67) Prítomnosť testovanej látky v testovacom médiu v dôsledku jej vylučovania rybami alebo vyplavovaním z potravy nie je možné úplne vylúčiť. Jednou z možností je preto merať koncentráciu látky vo vode na konci vychytávacej fázy, najmä ak sa použije polostatický systém, aby sa zistilo, či nedošlo k expozícii vo vodnom prostredí.
(68) Tento postup je špecifický pre štúdie expozície z potravy a líši sa od postupu pri skúške expozície vo vodnom prostredí. Preto sa namiesto pojmu „normalizácia“ používa pojem „oprava“, aby sa predišlo ich zámene, pozri aj poznámku pod čiarou (37).
(69) Môže sa vykonať t-skúška rýchlostných konštánt rastu na porovnanie rozdielov rastu medzi kontrolnou a testovanou skupinou, alebo F-skúška v prípade analýzy rozptylu. V prípade potreby môže použitie F-skúšky alebo skúšky miery pravdepodobnosti pomôcť pri výbere vhodného modelu rastu (OECD, monografia 54 (32).
(70) Metódy analýzy potravín na bielkoviny, tuky, obsah hrubej vlákniny a popola; tieto informácie obyčajne poskytuje dodávateľ krmív.
CI: interval spoľahlivosti (ak sa dá zistiť)
SD: štandardná odchýlka (ak sa dá zistiť)
(73) Meyer et al. (1)
(74) Treba poznamenať, že v samotnom teste sa ako meradlo rýchlostnej konštanty zmien veľkosti a rastu uprednostňuje hmotnosť. Uznáva sa však, že praktickejšou mierou je dĺžka, ak je nutné na začiatku experimentu uskutočniť výber ryby na základe pohľadu (t. j. z danej zásoby populácie).
(75) Toto dĺžkové rozpätie sa uvádza v testovacích metódach pre nové chemické látky atď. na základe japonského zákona o kontrole chemických látok (CSCL).
(76) Čísla v zátvorkách udávajú počet vzoriek (vody, rýb), ktoré sa majú odobrať v prípade dodatočného odoberania vzoriek.
(77) Hodnota k2 odhadnutá pred testovaním pre látky s log K OW rovným 4,0 je 0,652 dňa– 1. Celkové trvanie experimentu je 3 × t SS = 3 × 4,6 dňa, t. j. 14 dní. Spôsob odhadu t SS je uvedený v dodatku 5.
(78) Vodu odoberajte až po pridaní najmenej troch „objemov testovacej komory“.
(79) Tieto ryby sa odoberajú zo zásobnej populácie.
(80) Ak je potrebná väčšia presnosť alebo metabolické štúdie, ktoré si vyžadujú väčšie množstvo rýb, dané ryby by sa mali odoberať špecificky na konci vychytávacej a depuračnej fázy (pozri bod 40).
(81) Je možné, že na účely analýzy obsahu lipidov budú potrebné aspoň 3 ďalšie ryby, ak nie je možné použiť tie isté ryby, ktoré sa odobrali na účely stanovenia koncentrácií testovanej látky na začiatku testu, na konci vychytávacej fázy a na konci depuračnej fázy. Poznamenávame, že v mnohých prípadoch by malo byť možné používať iba uvedené 3 kontrolné ryby (pozri bod 56).
(82) Na účely stanovenia koncentrácií testovanej látky a obsahu lipidov sa analyzovali 3 vzorky krmiva z kontrolnej, ako aj testovanej skupiny.
(83) Ryby sa odoberajú zo zásobnej populácie čo najskôr na začiatku štúdie; na účely stanovenia obsahu lipidov by sa mali na začiatku testu odobrať zo zásobnej populácie aspoň 3 ryby.
(84) (Nepovinné) Vďaka odberom v ranom štádiu vychytávacej fázy sa získajú údaje slúžiace na výpočet asimilácie testovanej látky prostredníctvom potravy, ktoré možno porovnať s asimilačnou účinnosťou vypočítanou na základe údajov týkajúcich sa depuračnej fázy.
(85) Analýze špecifických tkanív možno podrobiť 5 ďalších rýb.
(86) Je možné, že na účely analýzy obsahu lipidov budú potrebné aspoň 3 ďalšie ryby, ak nie je možné použiť tie isté ryby, ktoré sa odobrali na účely stanovenia koncentrácií testovanej látky na začiatku testu, na konci vychytávacej fázy a na konci depuračnej fázy. Poznamenávame, že v mnohých prípadoch by malo byť možné používať iba uvedené 3 kontrolné ryby (pozri body 56 a 153).
(87) Ako pri všetkých empirických vzťahoch by sa malo overiť, či testovaná látka patrí do oblasti uplatniteľnosti daného vzťahu.
(88) Hmotnosť rýb na konci vychytávacej fázy možno odhadnúť na základe údajov z predchádzajúcej štúdie alebo na základe poznatkov týkajúcich sa pravdepodobného zvýšenia veľkosti testovaných druhov z typickej hmotnosti na začiatku testovania a v priebehu typického trvania fázy vychytávania (napr. 28 dní).
(89) Vo väčšine programov, v ktorých je možná lineárna regresia, sa udávajú aj štandardné chyby a interval spoľahlivosti (CI) odhadov, napr. v programe Microsoft Excel sa využíva súbor nástrojov na analýzu údajov.
(90) Na rozdiel od metódy lineárnej regresie sa na základe tohto vzorca nevypočíta štandardná chyba pre konštantu k 2.
(91) Na rozdiel od postupu lineárneho fitovania sa na základe tejto metódy zvyčajne nezistí štandardná chyba ani interval spoľahlivosti pre odhadovanú konštantu k1.
(92) Treba si uvedomiť si, že neistota odhadu konštanty k2 sa pri modeli bioakumulácie nevyužíva správne, keď sa tento model v zásade považuje za konštantný pri fitovaní konštanty k1 v rámci metódy postupného fitovania. Výsledná neistota BCF sa preto bude pri simultánnej metóde a metóde postupného fitovania líšiť.
(93) Je možné, že v niektorých regiónoch sa dá získať len krmivo pre ryby s koncentráciu lipidov, ktorá zďaleka nedosahuje túto hornú hranicu. V takých prípadoch by sa v štúdii malo použiť krmivo v dodávanej forme, s nižšou koncentráciou lipidov, pričom by sa kŕmna dávka mala primerane upraviť s cieľom zachovať zdravie rýb. Obsah lipidov v potrave by sa nemal umelo zvyšovať pridávaním oleja.
(94) Pokiaľ ide o veľmi hydrofóbne látky, je pravdepodobné, že vo voľnej prírode dochádza k najzávažnejším expozíciám vo vodnom prostredí najmä v dôsledku ich požitia. Preto odhad BCF striktne nereprezentuje bioakumulačný potenciál takejto látky.
(95) Použiť sa môžu aj iné druhy dafnií za podmienky, že spĺňajú príslušné validačné kritériá (v rámci kontrol by kritérium validity týkajúce sa reprodukčného výstupu malo platiť pre všetky pre druhy dafnií.) V prípade použitia iných druhov čeľade dafniovité by sa mal daný druh jasne identifikovať a jeho použitie opodstatniť.
(96) Náhodná úmrtnosť: úmrtnosť, ktorá nesúvisí s pôsobením chemikálie, ale k nej došlo v dôsledku náhodnej udalosti (t. j. príčina je známa)
(97) Mimovoľná úmrtnosť: úmrtnosť bez známej príčiny, ktorá nesúvisí s pôsobením chemikálie
(*6) Označte, ktorá nádoba sa použila na experiment
(*7) Do príslušnej kolónky zaznamenajte pod značkou „AB“ počet nevyliahnutých vajíčok
(*8) Do príslušnej kolónky zaznamenajte pod značkou „M“ úmrtnosť všetkých rodičovských jedincov
(98) Typická minimálna priemerná celková dĺžka nie je kritériom validity, ale odchýlky pod uvedenou hodnotou by sa mali dôkladne preskúmať vo vzťahu k citlivosti testu. Minimálna priemerná celková dĺžka je odvodená z výberu aktuálne dostupných údajov.
(99) Konkrétny kmeň testovaného pstruha dúhového si môže vyžadovať použitie iných teplôt. Chov generačných rýb sa musí držať pri rovnakej teplote ako násada, ktorá sa má použiť na vajíčka. Po získaní vajíčok od komerčného chovateľa je po príchode potrebná krátka adaptácia (napr. 1 – 2 hod.) na testovaciu teplotu.
(100) Tma pre larvy až do jedného týždňa po vyliahnutí okrem vykonávania kontroly, následne tlmené osvetlenie počas celého testu (12 – 16-hodinová fotoperióda) (4).
(101) Pri akýchkoľvek podmienkach testu by mal byť režim osvetlenia konštantný.
(102) V prípade akéhokoľvek testu sa to vykoná do ± 20/00.
(*9) Potrava by sa mala podávať až do nasýtenia. Nadbytočná potrava a výkaly by sa mali podľa potreby odstrániť, aby sa nehromadil odpad.
|
FBS |
mrazené žiabronôžky soľné; dospelé jedince Artemia sp. |
|
BSN |
nauplia žiabronôžok soľných; novo vyliahnuté |
|
BSN48 |
nauplia žiabronôžok soľných; 48 hodín staré |
(1) larvy so žĺtkovým vakom si nevyžadujú žiadnu potravu
(2) filtrované zo zmiešanej kultúry
(3) granule z fermentačného procesu
(*10) Papilárne výbežky sa spravidla vyskytujú len u dospelých samcov a nachádzajú sa na lúčoch análnej plutvy od druhého po siedmy alebo ôsmy, počítajúc od zadného konca análnej plutvy (obrázok 1 a 2). Výbežky sa však len zriedka vyskytujú na prvom lúči od zadného konca análnej plutvy. Tento štandardný operačný postup sa vzťahuje na meranie výbežkov na prvom lúči plutvy (poradové číslo lúča análnej plutvy sa v rámci tohto štandardného operačného postupu vzťahuje na poradie od zadného konca análnej plutvy).
(*11) Homogenizačný tlmivý roztok:
|
— |
(50 mM Tris-HCl pH 7,4; 1 % zmes inhibítora proteázy (Sigma)): 12 ml Tris-HCl pH 7,4 + 120 μl zmes inhibítora proteázy. |
|
— |
TRIS: TRIS-ULTRA PURE (ICN) napríklad od Bie & Berntsen, Dánsko. |
|
— |
zmes inhibítora proteázy: od Sigma (pre tkanivá cicavcov), číslo výrobku P 8340. |
POZNÁMKA: Homogenizačný tlmivý roztok by sa mal použiť v deň, keď bol pripravený. Počas použitia musí byť uložený na ľade.
(103) Carl von Linné (* 23. mája 1707, Råshult /Älmhult; † 10. januára1778, Uppsala).
(*12) demineralizovaná (t. j. destilovaná alebo deionizovaná) voda

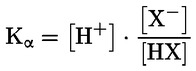





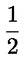 , ktorá sa rovná 0,095 mm. Používatelia by mali vedieť, že mikroskopy so štrbinovou lampou by mohli poskytovať rôzne namerané hodnoty hrúbky rohovky, ak je nastavená rôzna šírka štrbiny.
, ktorá sa rovná 0,095 mm. Používatelia by mali vedieť, že mikroskopy so štrbinovou lampou by mohli poskytovať rôzne namerané hodnoty hrúbky rohovky, ak je nastavená rôzna šírka štrbiny.