EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32007R0829
Commission Regulation (EC) No 829/2007 of 28 June 2007 amending Annexes I, II, VII, VIII, X and XI to Regulation (EC) No 1774/2002 of the European Parliament and of the Council as regards the placing on the market of certain animal by-products (Text with EEA relevance)
Regulamento (CE) n.° 829/2007 da Comissão, de 28 de Junho de 2007 , que altera os anexos I, II, VII, VIII, X e XI do Regulamento (CE) n.° 1774/2002 do Parlamento Europeu e do Conselho, no que diz respeito à colocação no mercado de certos subprodutos animais (Texto relevante para efeitos do EEE)
Regulamento (CE) n.° 829/2007 da Comissão, de 28 de Junho de 2007 , que altera os anexos I, II, VII, VIII, X e XI do Regulamento (CE) n.° 1774/2002 do Parlamento Europeu e do Conselho, no que diz respeito à colocação no mercado de certos subprodutos animais (Texto relevante para efeitos do EEE)
OJ L 191, 21.7.2007, p. 1–99
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 No longer in force, Date of end of validity: 03/03/2011; revog. impl. por 32009R1069
No longer in force, Date of end of validity: 03/03/2011; revog. impl. por 32009R1069
|
21.7.2007 |
PT |
Jornal Oficial da União Europeia |
L 191/1 |
REGULAMENTO (CE) N.o 829/2007 DA COMISSÃO
de 28 de Junho de 2007
que altera os anexos I, II, VII, VIII, X e XI do Regulamento (CE) n.o 1774/2002 do Parlamento Europeu e do Conselho, no que diz respeito à colocação no mercado de certos subprodutos animais
(Texto relevante para efeitos do EEE)
A COMISSÃO DAS COMUNIDADES EUROPEIAS,
Tendo em conta o Tratado que institui a Comunidade Europeia,
Tendo em conta o Regulamento (CE) n.o 1774/2002 do Parlamento Europeu e do Conselho, de 3 de Outubro de 2002, que estabelece regras sanitárias relativas aos subprodutos animais não destinados ao consumo humano (1), nomeadamente o segundo parágrafo do artigo 28.o, o n.o 3, primeiro parágrafo, do artigo 29.o e o n.o 1 do artigo 32.o,
Considerando o seguinte:
|
(1) |
O Regulamento (CE) n.o 1774/2002 estabelece requisitos de saúde pública e de sanidade animal aplicáveis à importação e ao trânsito na Comunidade de certos subprodutos animais e de produtos deles derivados. O mesmo regulamento estabelece requisitos gerais de higiene aplicáveis à transformação de matérias das categorias 1, 2 e 3, assim como requisitos aplicáveis à colocação no mercado desses subprodutos animais e de produtos deles derivados, incluindo modelos de certificados sanitários para a sua importação na Comunidade. |
|
(2) |
Devido à ameaça da introdução do pequeno besouro das colmeias na Comunidade, actualmente livre desse parasita, é necessário estabelecer requisitos aplicáveis à importação de cera de abelhas, destinada a fins técnicos, assim como alterar a definição de produtos apícolas constante do anexo I do Regulamento (CE) n.o 1774/2002. Por conseguinte, a definição em causa do anexo I desse regulamento, os requisitos aplicáveis à importação estabelecidos no capítulo IX do anexo VIII e o modelo de certificado sanitário estabelecido no capítulo 13 do anexo X do mesmo diploma devem ser alterados em conformidade. |
|
(3) |
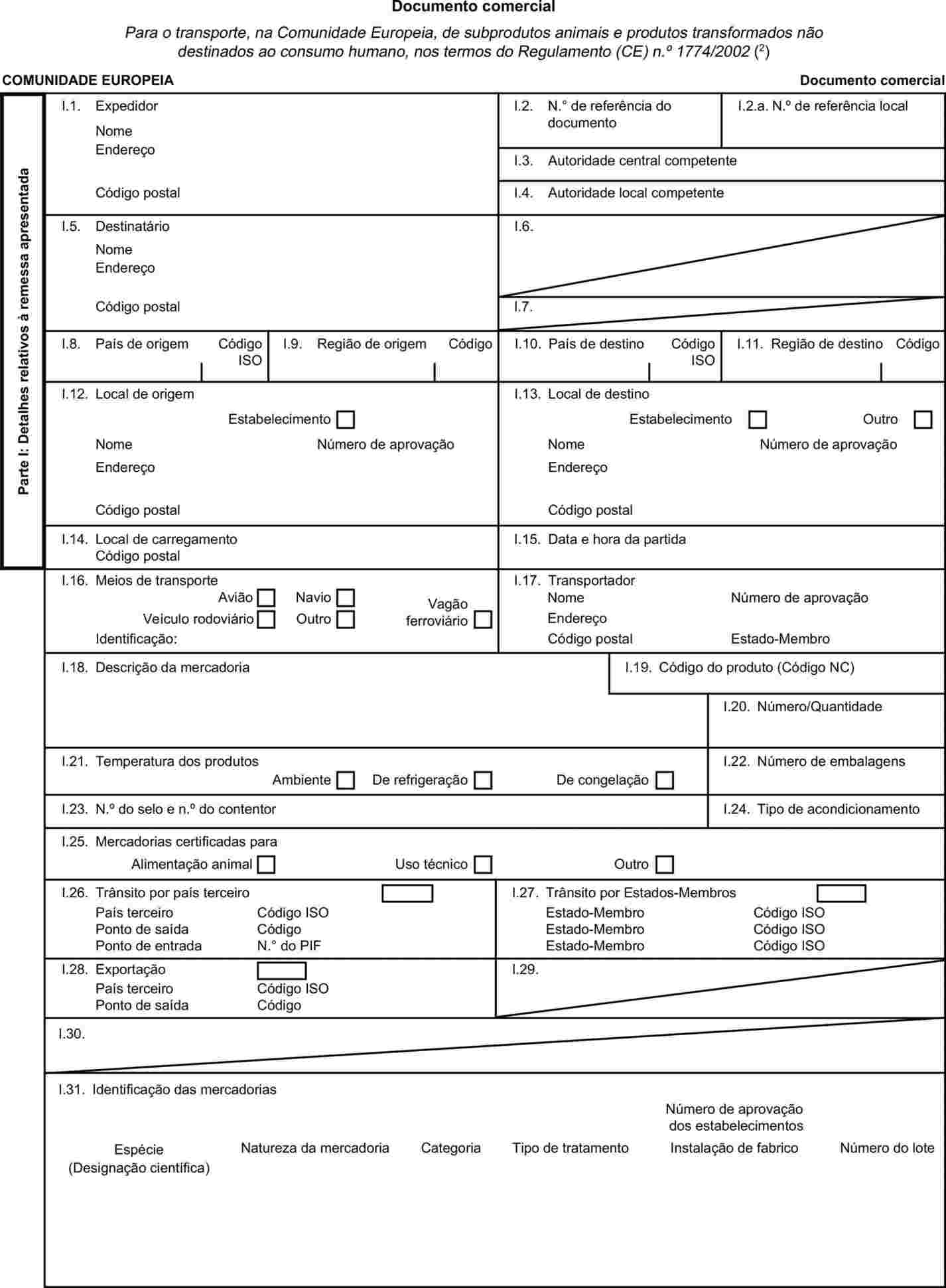
O capítulo X do anexo II do Regulamento (CE) n.o 1774/2002 estabelece um modelo de documento comercial para acompanhamento, durante o transporte, de subprodutos animais e produtos transformados. Por forma a melhorar a rastreabilidade de couros e peles durante o transporte, é necessário alterar o referido modelo de documento. É, pois, conveniente, alterar o anexo II do referido regulamento. |
|
(4) |
O Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho, de 22 de Maio de 2001, que estabelece regras para a prevenção, o controlo e a erradicação de determinadas encefalopatias espongiformes transmissíveis (2), aplica-se à produção e à colocação no mercado de animais vivos e de produtos de origem animal. O mesmo diploma proíbe a utilização de proteínas animais transformadas na alimentação de animais de criação mantidos, engordados ou criados para a produção de alimentos. |
|
(5) |
Embora a proibição constante do Regulamento (CE) n.o 999/2001 se mantenha em vigor, devem aplicar-se requisitos de transformação menos estritos do que os estabelecidos no capítulo II do anexo VII do Regulamento (CE) n.o 1774/2002 relativamente ao actual método de transformação 1 no que diz respeito às proteínas animais transformadas derivadas de sangue de suínos, uma vez que não há indicações científicas que confirmem a existência de um risco de transmissão de EET através desses animais. É, no entanto, necessário, por motivos de saúde pública e de sanidade animal, introduzir um requisito de temperatura mínima aplicável à transformação do sangue de suínos. Por conseguinte, deve ser alterado em conformidade o capítulo II do anexo VII do Regulamento (CE) n.o 1774/2002 da Comissão. |
|
(6) |
A parte A, ponto 1, do capítulo II do anexo VIII do Regulamento (CE) n.o 1774/2002 autoriza a utilização de partes de animais abatidos, próprias para consumo humano, mas que, por motivos comerciais, não se destinem ao consumo humano, no fabrico de alimentos crus para animais de companhia na Comunidade. Sucede que são rejeitadas enquanto impróprias para consumo humano partes de tais animais que não dão, no entanto, mostras de quaisquer sinais de doença transmissível aos seres humanos ou aos animais e que podem ser igualmente utilizadas com segurança na alimentação animal. A parte A, ponto 1, do capítulo II e o capítulo XI do anexo VIII daquele diploma, tratando este último capítulo das disposições aplicáveis à importação na Comunidade, devem ser, por conseguinte, alterados em conformidade. |
|
(7) |
É necessário alterar os modelos de certificados sanitários vigentes relativos à importação de couros e peles na Comunidade, por forma a introduzir algumas modificações técnicas. No interesse da clareza, os requisitos específicos aplicáveis a estes produtos e estabelecidos no capítulo VI do anexo VIII, assim como os modelos de certificados sanitários estabelecidos no capítulo 5, partes A, B e C, do anexo X do Regulamento (CE) n.o 1774/2002 devem, por conseguinte, ser alterados em conformidade. |
|
(8) |
A Autoridade Europeia para a Segurança dos Alimentos (AESA), no seu Parecer científico sobre os aspectos de sanidade e bem-estar animal relacionados com a gripe aviária, adoptado em 13 e 14 de Setembro de 2005, concluiu que, no sentido de reduzir o risco possível de propagação da gripe aviária através das penas, estas devem ser tratadas antes de serem comercializadas. O capítulo VIII do anexo VIII do Regulamento (CE) n.o 1774/2002 estabelece as medidas comunitárias permanentes relativas à colocação no mercado e à importação de penas. À luz daquele parecer e da actual situação epidemiológica mundial relativa à gripe aviária, é adequado alterar as medidas comunitárias em causa aplicáveis à importação e ao tratamento de penas antes da importação. É, pois, conveniente alterar o anexo VIII do referido regulamento. |
|
(9) |
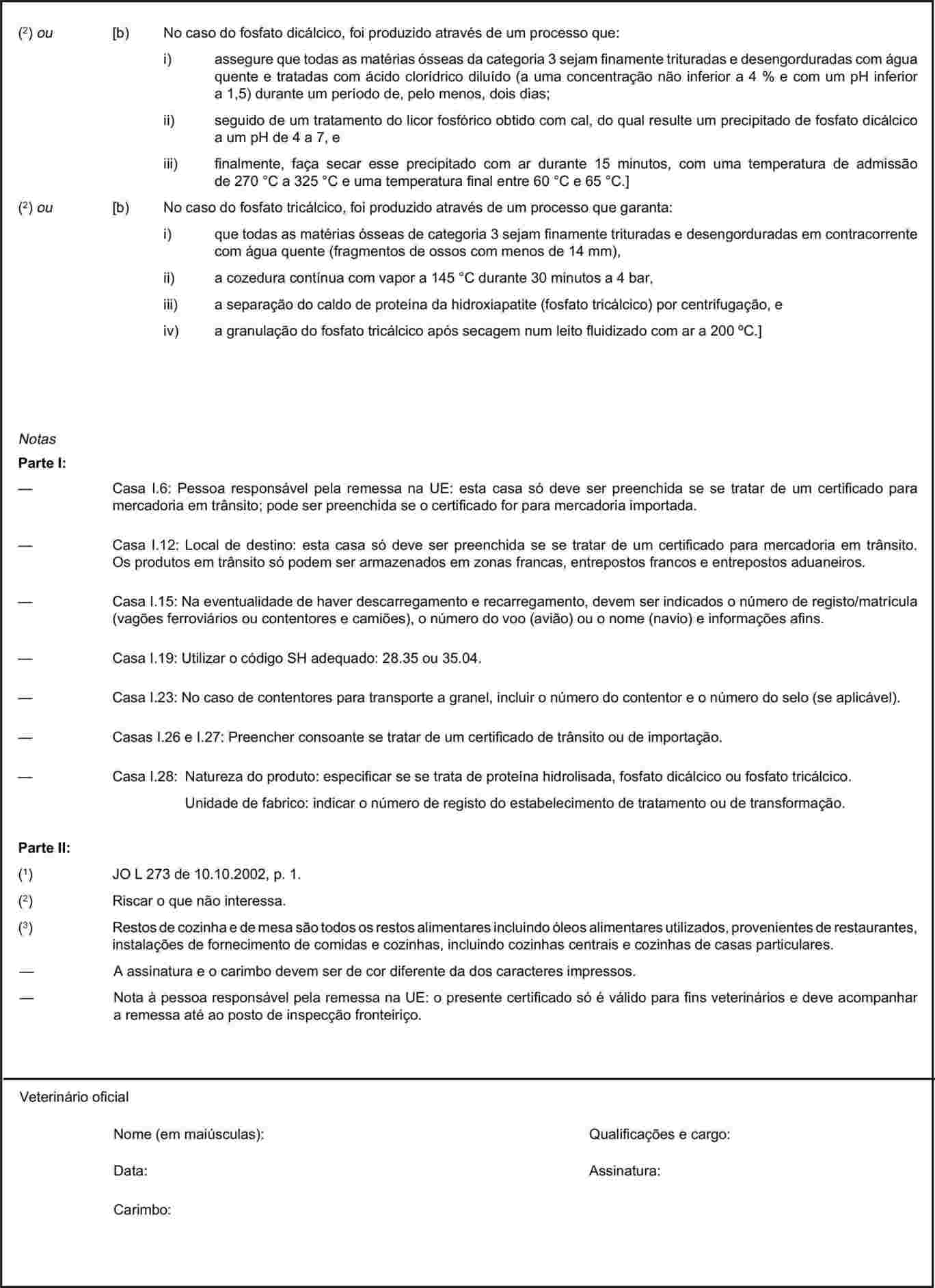
O certificado sanitário relevante, estabelecido no capítulo 1 do anexo X do Regulamento (CE) n.o 1774/2002, relativo às importações na Comunidade de proteínas animais transformadas, não destinadas ao consumo humano e de produtos, com excepção dos alimentos para animais de companhia, que contenham essas proteínas, deve ser alterado em conformidade, de modo a prever possibilidades de transformação equivalentes em países terceiros às que existem na Comunidade. Por conseguinte, deve ser alterado em conformidade o capítulo 1 do anexo X do Regulamento (CE) n.o 1774/2002. |
|
(10) |
O capítulo 3(B) do anexo X do Regulamento (CE) n.o 1774/2002 estabelece o modelo de certificado sanitário aplicável à importação na Comunidade de alimentos transformados para animais de companhia, com excepção dos alimentos enlatados. Sucede que os alimentos transformados para animais são, cada vez mais, produzidos em países terceiros, misturando ingredientes já transformados que foram tratados individualmente em conformidade com os requisitos do regulamento referido. A submissão de tais ingredientes a um tratamento térmico poderia ter efeitos adversos nas suas qualidades nutricionais. Por conseguinte, a importação na Comunidade de alimentos transformados para animais de companhia compostos destes ingredientes seguros deveria ser permitida e o modelo de certificado sanitário constante do capítulo 3(B) do anexo X do Regulamento (CE) n.o 1774/2002 deve ser alterado em conformidade. |
|
(11) |
O Regulamento (CE) n.o 1774/2002 prevê que certos subprodutos animais utilizados no fabrico de alimentos para animais de companhia possam ser importados na Comunidade ainda que contenham matérias derivadas de animais tratados com determinadas substâncias proibidas. Contudo, a importação na Comunidade de alimentos transformados para animais de companhia, ossos de couro e vísceras organolépticas que contenham tais matérias não é, actualmente, autorizada. Já que é claro que a importação na Comunidade destas matérias para produção de alimentos transformados para animais de companhia não representa um risco sanitário superior à importação das mesmas matérias na forma de ingredientes de alimentos transformados para animais de companhia, ossos de couro e vísceras organolépticas, a importação na Comunidade destes produtos transformados contendo essas matérias deve igualmente ser autorizada. Por conseguinte, os modelos de certificados sanitários estabelecidos nos capítulos 3(A), 3(B), 3(C) e 3(E) do anexo X do Regulamento (CE) n.o 1774/2002 devem ser alterados em conformidade. |
|
(12) |
O capítulo 3(B) do anexo X do Regulamento (CE) n.o 1774/2002 prevê que o certificado sanitário relativo a alimentos transformados para animais de companhia, com excepção dos alimentos enlatados, deve incluir a referência de que os alimentos foram embalados em embalagens novas, ostentando estas a menção «não destinado ao consumo humano». A Directiva 79/373/CEE do Conselho, de 2 de Abril de 1979, relativa à comercialização de alimentos compostos para animais (3) já prevê requisitos de marcação equivalentes que impeçam uma utilização, não intencional ou negligente, de tais produtos na alimentação humana. Os requisitos aplicáveis ao modelo de certificado sanitário constante do capítulo 3(B) do anexo X do Regulamento (CE) n.o 1774/2002 deveriam ter em conta essa legislação e serem, por conseguinte, alterados em conformidade. |
|
(13) |
O anexo VIII do Regulamento (CE) n.o 1774/2002 estabelece os requisitos aplicáveis à introdução no mercado e à importação na Comunidade de alimentos para animais de companhia, ossos de couro e produtos técnicos. A parte B, ponto 4, do capítulo II do mesmo anexo estabelece que os ossos de couro deverão ter sido submetidos a um tratamento térmico suficiente para destruir os organismos patogénicos. Vários Estados-Membros solicitaram a autorização de outros tipos de tratamento, aplicados durante a transformação dos ossos de couro, que fornecem garantias de segurança equivalentes. Por conseguinte, a parte B, ponto 4, do capítulo II do anexo VIII do Regulamento (CE) n.o 1774/2002 deve ser alterada em conformidade. |
|
(14) |
O capítulo 3(C) do anexo X do Regulamento (CE) n.o 1774/2002 estabelece o modelo de certificado sanitário aplicável à importação na Comunidade de ossos de couro. Uma vez que serão autorizados na transformação de ossos de couro na Comunidade outros tipos de tratamentos, além do tratamento térmico, esses mesmos tratamentos também deviam ser permitidos no caso de ossos de couro importados. Alguns ossos de couro são produzidos, de acordo com métodos tradicionais, a partir de peixe. Neste caso, os requisitos de sanidade animal não obrigam a um tratamento térmico. Por conseguinte, o modelo de certificado sanitário constante do capítulo 3(C) do anexo X do regulamento referido deve ser alterado em conformidade. |
|
(15) |
A parte B, ponto 6, do capítulo II do anexo VIII do Regulamento (CE) n.o 1774/2002 estabelece normas microbiológicas aplicáveis aos alimentos crus para animais de companhia produzidos na Comunidade. Estas normas deviam ser impostas igualmente às importações na Comunidade de alimentos crus para animais de companhia para venda directa e aos subprodutos animais destinados à alimentação de animais de criação para produção de peles com pêlo, destinados a expedição para a Comunidade. O capítulo 3(D) do anexo X daquele regulamento deve, por conseguinte, ser alterado em conformidade. |
|
(16) |
O anexo XI do Regulamento (CE) n.o 1774/2002 estabelece listas de países terceiros dos quais os Estados-Membros podem autorizar a importação de subprodutos animais não destinados ao consumo humano. A parte XIII do mesmo anexo contém uma lista de países terceiros dos quais os Estados-Membros podem autorizar a importação de soro de equídeo. Em conformidade com a referida parte XIII, esta lista inclui países terceiros referidos no anexo I da Decisão 2004/211/CE da Comissão, de 6 de Janeiro de 2004, que estabelece a lista de países terceiros e partes dos seus territórios a partir dos quais os Estados-Membros autorizam as importações de equídeos vivos e sémen, óvulos e embriões de equídeos e que altera as Decisões 93/195/CEE e 94/63/CE (4), dos quais a importação de equídeos para abate é permitida. |
|
(17) |
O soro de equídeo pode, contudo, ser proveniente de animais vivos. Por conseguinte, o estatuto zoossanitário que autoriza a inclusão de um país terceiro na lista de países terceiros dos quais é permitida a importação de equídeos para criação e produção deve ser suficiente para determinar se o soro de equídeo pode ser importado do país terceiro em causa. Isto permitiria, nomeadamente, a importação de soro de equídeo a partir do México. Por conseguinte, a parte XIII do anexo XI do Regulamento (CE) n.o 1774/2002 deve ser alterada em conformidade. |
|
(18) |
Os certificados veterinários devem ser fornecidos no formato estabelecido na Decisão 2007/240/CE da Comissão (5) relativo à adopção de modelos harmonizados de certificados veterinários relativos à importação na Comunidade Europeia de animais vivos e produtos de origem animal. O documento comercial estabelecido no anexo II, capítulo X, do Regulamento (CE) n.o 1774/2002 e os modelos de certificados sanitários estabelecidos no anexo X do mesmo diploma devem ser alterados em conformidade. |
|
(19) |
Após a data de entrada em vigor do presente regulamento deve prever-se um período de transição, por forma a permitir a continuação da importação na Comunidade de subprodutos animais e de produtos deles derivados abarcados pelo Regulamento (CE) n.o 1774/2002 e acompanhados de certificados sanitários em obediência àquele diploma. |
|
(20) |
As medidas previstas no presente regulamento estão em conformidade com o parecer do Comité Permanente da Cadeia Alimentar e da Saúde Animal, |
ADOPTOU O PRESENTE REGULAMENTO:
Artigo 1.o
Os anexos I, II, VII, VIII, X e XI do Regulamento (CE) n.o 1774/2002 são alterados em conformidade com o anexo do presente regulamento.
Artigo 2.o
Durante um período de transição de seis meses a contar da data de entrada em vigor do presente regulamento, o documento comercial estabelecido no anexo II do Regulamento (CE) n.o 1774/2002 e os modelos de certificados sanitários constantes do anexo X do mesmo diploma, preenchidos em conformidade com as disposições aplicáveis antes da entrada em vigor do presente regulamento, podem continuar a acompanhar os produtos abarcados por aquele tipo de documentos ou certificados.
Artigo 3.o
O presente regulamento entra em vigor e é aplicável a partir do terceiro dia seguinte ao da sua publicação no Jornal Oficial da União Europeia.
O presente regulamento é obrigatório em todos os seus elementos e directamente aplicável em todos os Estados-Membros.
Feito em Bruxelas, em 28 de Junho de 2007.
Pela Comissão
Markos KYPRIANOU
Membro da Comissão
(1) JO L 273 de 10.10.2002, p. 1. Regulamento com a última redacção que lhe foi dada pelo Regulamento (CE) n.o 2007/2006 da Comissão (JO L 379 de 28.12.2006, p. 98).
(2) JO L 147 de 31.5.2001, p. 1. Regulamento com a última redacção que lhe foi dada pelo Regulamento (CE) n.o 1923/2006 da Comissão (JO L 404 de 30.12.2006, p. 1).
(3) JO L 86 de 6.4.1979, p. 30. Directiva com a última redacção que lhe foi dada pelo Regulamento (CE) n.o 807/2003 (JO L 122 de 16.5.2003, p. 36).
(4) JO L 73 de 11.3.2004, p. 1. Decisão alterada pelo Regulamento (CE) n.o 1792/2006 (JO L 362 de 20.12.2006, p. 1).
(5) JO L 104 de 21.4.2007, p. 37.
ANEXO
Os anexos do Regulamento (CE) n.o 1774/2002 são alterados do seguinte modo:
|
1. |
O anexo I é alterado do seguinte modo:
|
|
2. |
No anexo II, o capítulo X passa a ter a seguinte redacção: «CAPÍTULO X Documento comercial
MODELO DE DOCUMENTO COMERCIAL PARA O TRANSPORTE, NA COMUNIDADE EUROPEIA, DE SUBPRODUTOS ANIMAIS E PRODUTOS TRANSFORMADOS Notas
|
|
3. |
No anexo VII, o primeiro parágrafo do ponto 1, letra A, do capítulo II passa a ter a seguinte redacção: «As proteínas de mamíferos transformadas devem ter sido submetidas ao método de transformação 1. No entanto, o sangue de suínos pode ser submetido a qualquer um dos métodos de transformação 1 a 5 ou ao método de transformação 7, desde que, neste último caso, tenha sido aplicado um tratamento térmico a uma temperatura de, pelo menos, 80 °C em toda a massa.» |
|
4. |
O anexo VIII é alterado do seguinte modo:
|
|
5. |
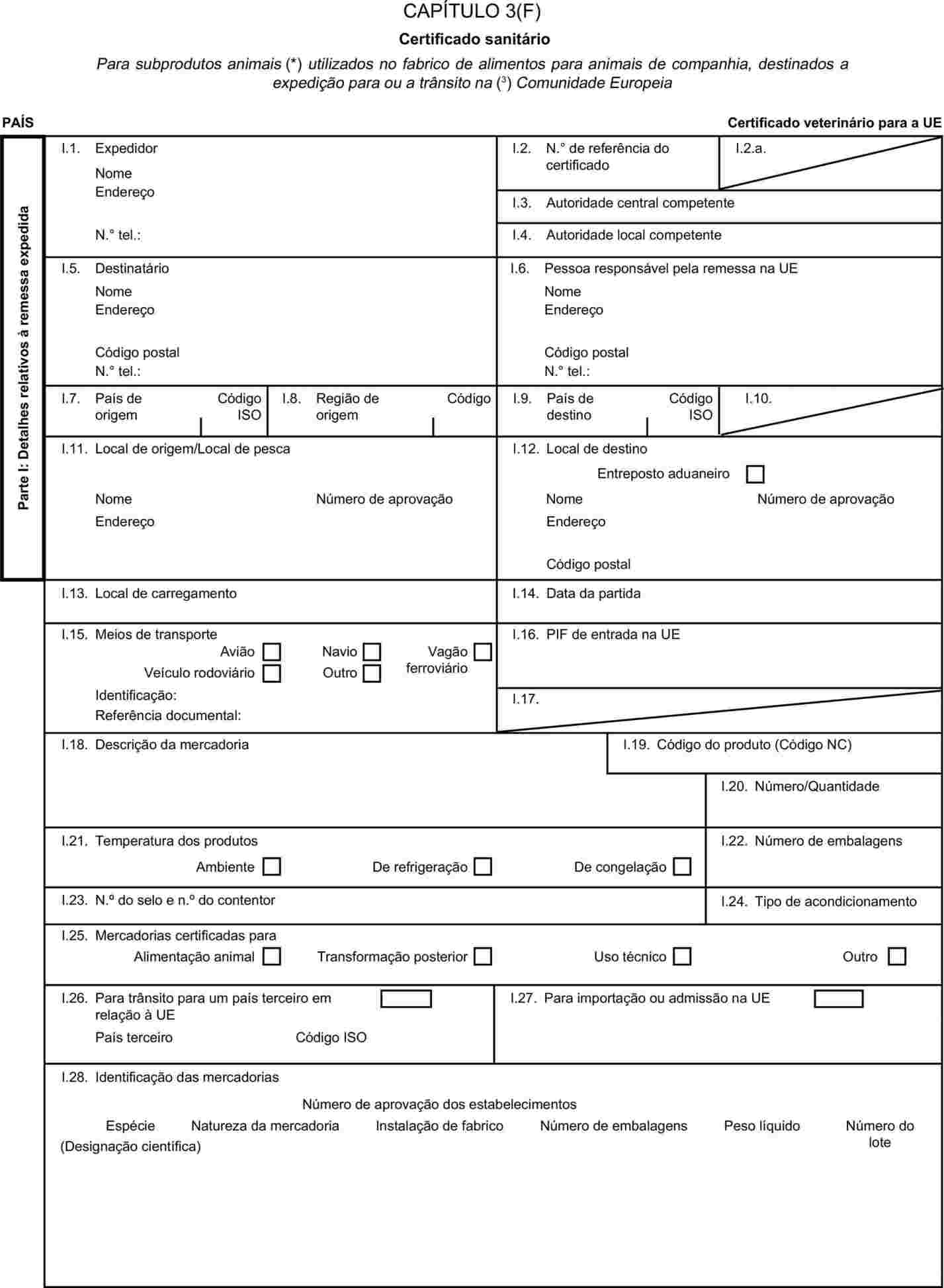
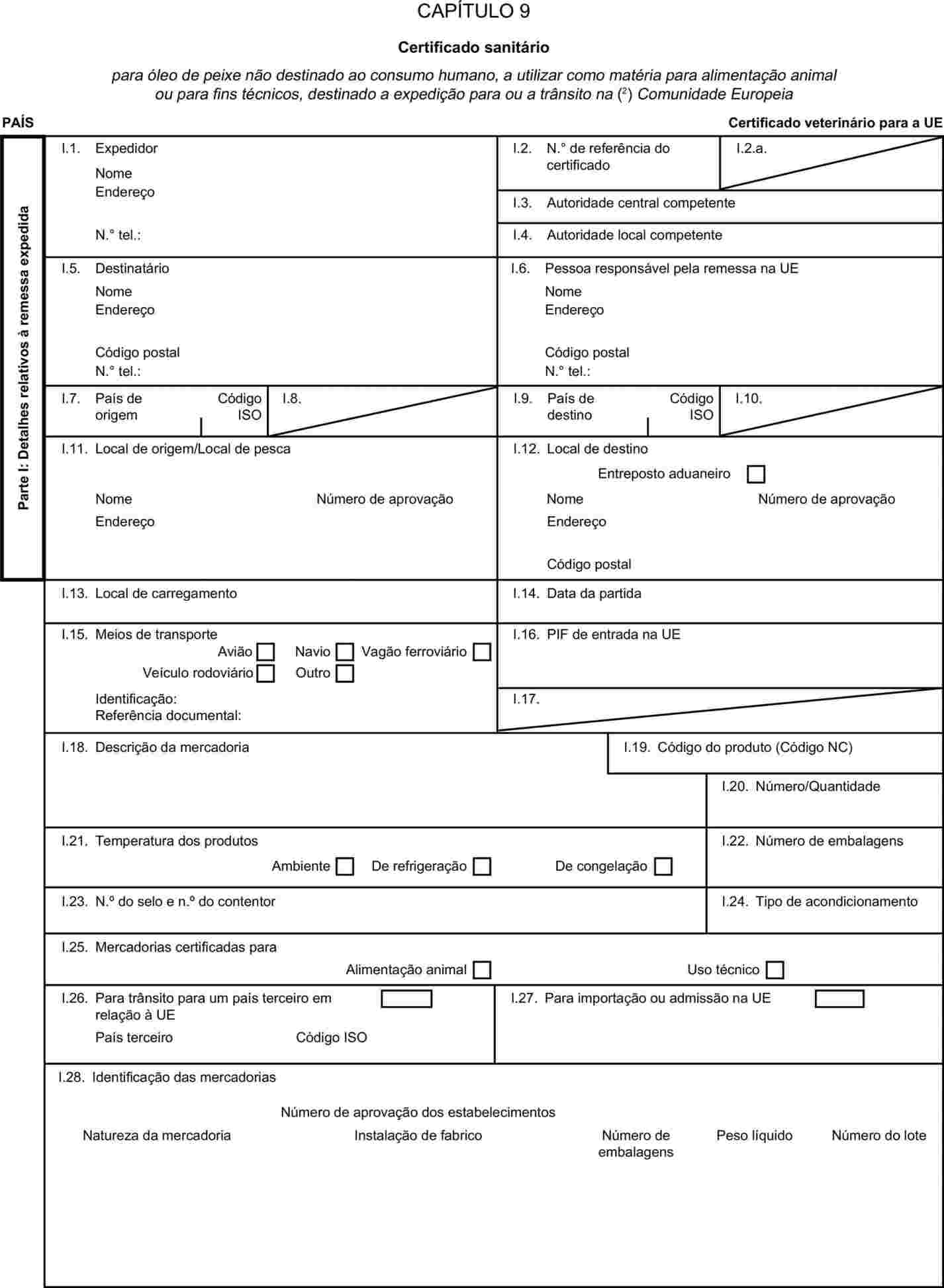
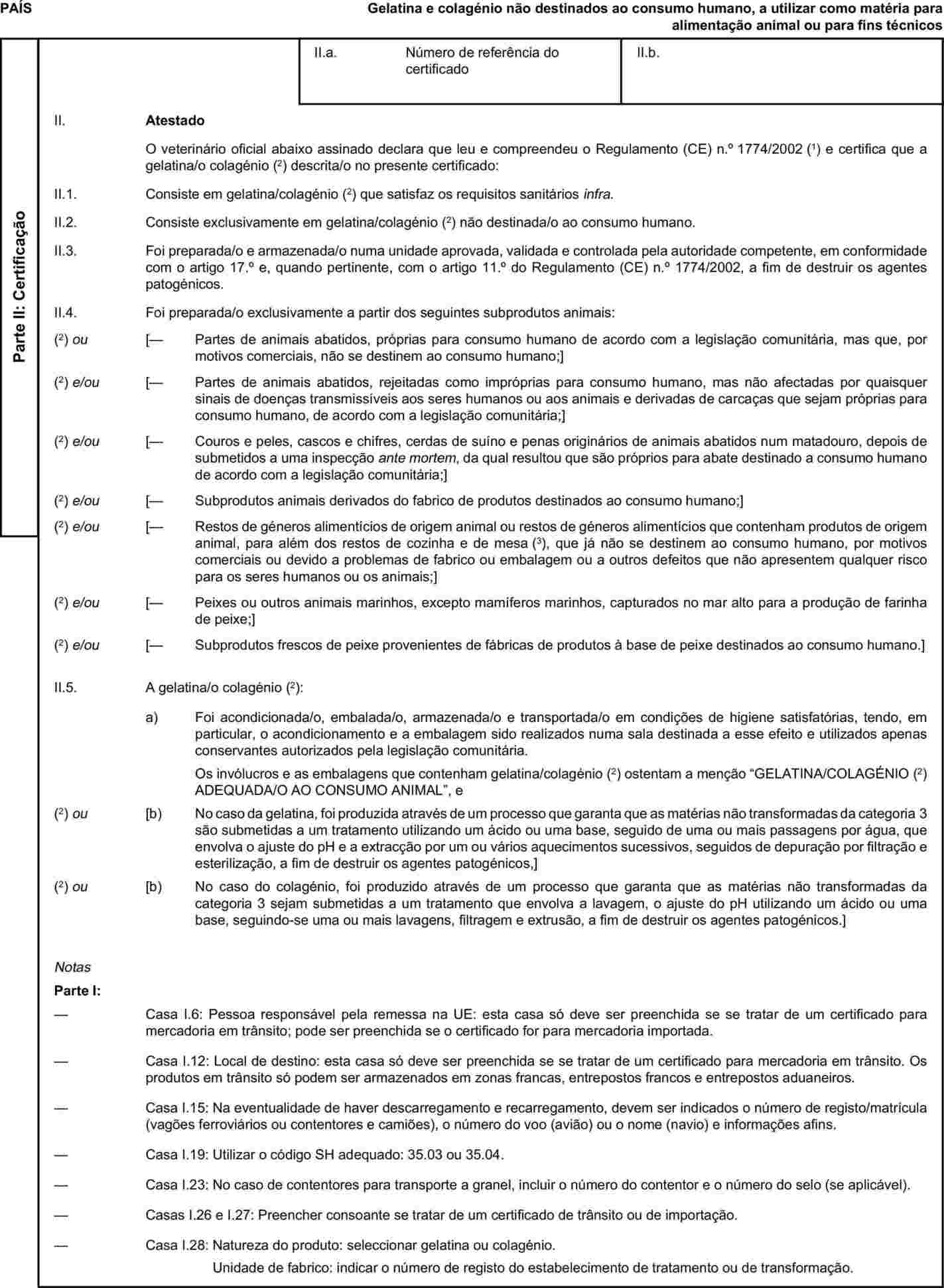
O anexo X passa a ter a seguinte redacção: «ANEXO X MODELOS DE CERTIFICADOS SANITÁRIOS PARA A IMPORTAÇÃO A PARTIR DE PAÍSES TERCEIROS E PARA O TRÂNSITO NA COMUNIDADE EUROPEIA DE CERTOS SUBPRODUTOS ANIMAIS E PRODUTOS DELES DERIVADOS Notas
|
|
6. |
O anexo XI é alterado do seguinte modo:
|
(1) JO L 139 de 30.4.2004, p. 55. Rectificação: JO L 226 de 25.6.2004, p. 22.»