ISSN 1977-0766
doi:10.3000/19770766.L_2014.010.pol
Dziennik Urzędowy
Unii Europejskiej
L 10

Wydanie polskie
Legislacja
Tom 57
15 stycznia 2014
|
ISSN 1977-0766 doi:10.3000/19770766.L_2014.010.pol |
||
|
Dziennik Urzędowy Unii Europejskiej |
L 10 |
|

|
||
|
Wydanie polskie |
Legislacja |
Tom 57 |
|
Spis treści |
|
II Akty o charakterze nieustawodawczym |
Strona |
|
|
|
ROZPORZĄDZENIA |
|
|
|
* |
||
|
|
* |
||
|
|
* |
||
|
|
* |
||
|
|
* |
Rozporządzenie Komisji (UE) nr 31/2014 z dnia 14 stycznia 2014 r. uchylające decyzje 2004/301/WE i 2004/539/WE oraz rozporządzenie (UE) nr 388/2010 ( 1 ) |
|
|
|
* |
||
|
|
|
||
|
|
|
DECYZJE |
|
|
|
|
2014/10/UE |
|
|
|
* |
||
|
|
|
2014/11/UE |
|
|
|
* |
Decyzja wykonawcza Komisji z dnia 20 grudnia 2013 r. zmieniająca załącznik II do decyzji wykonawczej 2012/707/UE określającej wspólny format dokumentów służących przekazywaniu informacji zgodnie z dyrektywą Parlamentu Europejskiego i Rady 2010/63/UE w sprawie ochrony zwierząt wykorzystywanych do celów naukowych (notyfikowana jako dokument nr C(2013) 9220) ( 1 ) |
|
|
|
|
|
(1) Tekst mający znaczenie dla EOG |
|
PL |
Akty, których tytuły wydrukowano zwykłą czcionką, odnoszą się do bieżącego zarządzania sprawami rolnictwa i generalnie zachowują ważność przez określony czas. Tytuły wszystkich innych aktów poprzedza gwiazdka, a drukuje się je czcionką pogrubioną. |
II Akty o charakterze nieustawodawczym
ROZPORZĄDZENIA
|
15.1.2014 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 10/1 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 27/2014
z dnia 19 grudnia 2013 r.
rejestrujące w rejestrze chronionych nazw pochodzenia i chronionych oznaczeń geograficznych nazwę [Anglesey Sea Salt/Halen Môn (ChNP)]
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 1151/2012 z dnia 21 listopada 2012 r. w sprawie systemów jakości produktów rolnych i środków spożywczych (1), w szczególności jego art. 52 ust. 2,
a także mając na uwadze, co następuje,
|
(1) |
Zgodnie z art. 50 ust. 2 lit. a) rozporządzenia (UE) nr 1151/2012 wniosek Zjednoczonego Królestwa w sprawie rejestracji nazwy „Anglesey Sea Salt/Halen Môn” został opublikowany w Dzienniku Urzędowym Unii Europejskiej (2). |
|
(2) |
Ponieważ do Komisji nie wpłynęło żadne oświadczenie o sprzeciwie zgodnie z art. 51 rozporządzenia (UE) nr 1151/2012, nazwa ta powinna zostać zarejestrowana, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Nazwa wymieniona w załączniku do niniejszego rozporządzenia zostaje zarejestrowana.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 19 grudnia 2013 r.
W imieniu Komisji, za Przewodniczącego,
Dacian CIOLOȘ
Członek Komisji
(1) Dz.U. L 343 z 14.12.2012, s. 1.
(2) Dz.U. C 232 z 10.8.2013, s. 17.
ZAŁĄCZNIK
Produkty rolne przeznaczone do spożycia przez ludzi wymienione w załączniku I do Traktatu:
Klasa 1.8 Inne produkty wymienione w załączniku I do Traktatu (przyprawy itp.)
ZJEDNOCZONE KRÓLESTWO
Anglesey Sea Salt/Halen Môn (ChNP)
|
15.1.2014 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 10/3 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 28/2014
z dnia 19 grudnia 2013 r.
rejestrujące w rejestrze chronionych nazw pochodzenia i chronionych oznaczeń geograficznych nazwę [West Country Lamb (ChOG)]
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 1151/2012 z dnia 21 listopada 2012 r. w sprawie systemów jakości produktów rolnych i środków spożywczych (1), w szczególności jego art. 52 ust. 2,
a także mając na uwadze, co następuje,
|
(1) |
Zgodnie z art. 50 ust. 2 lit. a) rozporządzenia (UE) nr 1151/2012 wniosek Zjednoczonego Królestwa o rejestrację nazwy „West Country Lamb” został opublikowany w Dzienniku Urzędowym Unii Europejskiej (2). |
|
(2) |
Ponieważ do Komisji nie wpłynęło żadne oświadczenie o sprzeciwie zgodnie z art. 51 rozporządzenia (UE) nr 1151/2012, nazwa ta powinna zostać zarejestrowana, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Nazwa wymieniona w załączniku do niniejszego rozporządzenia zostaje zarejestrowana.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 19 grudnia 2013 r.
W imieniu Komisji, za Przewodniczącego,
Dacian CIOLOȘ
Członek Komisji
(1) Dz.U. L 343 z 14.12.2012, s. 1.
(2) Dz.U. C 231 z 9.8.2013, s. 9.
ZAŁĄCZNIK
Produkty rolne przeznaczone do spożycia przez ludzi wymienione w załączniku I do Traktatu:
Klasa 1.1 Mięso świeże (i podroby)
ZJEDNOCZONE KRÓLESTWO
West Country Lamb (ChOG)
|
15.1.2014 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 10/5 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 29/2014
z dnia 19 grudnia 2013 r.
rejestrujące w rejestrze chronionych nazw pochodzenia i chronionych oznaczeń geograficznych nazwę [West Country Beef (ChOG)]
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 1151/2012 z dnia 21 listopada 2012 r. w sprawie systemów jakości produktów rolnych i środków spożywczych (1), w szczególności jego art. 52 ust. 2,
a także mając na uwadze, co następuje,
|
(1) |
Zgodnie z art. 50 ust. 2 lit. a) rozporządzenia (UE) nr 1151/2012 wniosek Zjednoczonego Królestwa o rejestrację nazwy „West Country Beef” został opublikowany w Dzienniku Urzędowym Unii Europejskiej (2). |
|
(2) |
Ponieważ do Komisji nie wpłynęło żadne oświadczenie o sprzeciwie zgodnie z art. 51 rozporządzenia (UE) nr 1151/2012, nazwa ta powinna zostać zarejestrowana, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Nazwa wymieniona w załączniku do niniejszego rozporządzenia zostaje zarejestrowana.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 19 grudnia 2013 r.
W imieniu Komisji, za Przewodniczącego,
Dacian CIOLOȘ
Członek Komisji
(1) Dz.U. L 343 z 14.12.2012, s. 1.
(2) Dz.U. C 231 z 9.8.2013, s. 14.
ZAŁĄCZNIK
Produkty rolne przeznaczone do spożycia przez ludzi wymienione w załączniku I do Traktatu:
Klasa 1.1 Mięso świeże (i podroby)
ZJEDNOCZONE KRÓLESTWO
West Country Beef (ChOG)
|
15.1.2014 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 10/7 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 30/2014
z dnia 13 stycznia 2014 r.
zatwierdzające znaczną zmianę elementów specyfikacji nazwy zarejestrowanej w rejestrze chronionych nazw pochodzenia i chronionych oznaczeń geograficznych [Κονσερβολιά Ροβιών (Konservolia Rovion) (ChNP)]
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 1151/2012 z dnia 21 listopada 2012 r. w sprawie systemów jakości produktów rolnych i środków spożywczych (1), w szczególności jego art. 52 ust. 2,
a także mając na uwadze, co następuje:
|
(1) |
Zgodnie z art. 53 ust. 1 akapit pierwszy rozporządzenia (UE) nr 1151/2012 Komisja rozpatrzyła wniosek Grecji o zatwierdzenie zmiany elementów specyfikacji chronionej nazwy pochodzenia „Κονσερβολιά Ροβιών” (Konservolia Rovion) zarejestrowanej na podstawie rozporządzenia Komisji (WE) nr 1263/96 (2). |
|
(2) |
Ponieważ proponowana zmiana nie jest nieznaczna w rozumieniu art. 53 ust. 2 rozporządzenia (UE) nr 1151/2012, Komisja opublikowała wniosek o wprowadzenie zmiany w trybie art. 50 ust. 2 lit. a) wymienionego rozporządzenia w Dzienniku Urzędowym Unii Europejskiej (3). |
|
(3) |
Ponieważ do Komisji nie wpłynęło żadne oświadczenie o sprzeciwie zgodnie z art. 51 rozporządzenia (UE) nr 1151/2012, wymienioną zmianę specyfikacji należy zatwierdzić, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Zatwierdza się zmianę specyfikacji opublikowaną w Dzienniku Urzędowym Unii Europejskiej dotyczącą nazwy wymienionej w załączniku do niniejszego rozporządzenia.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 13 stycznia 2014 r.
W imieniu Komisji, za Przewodniczącego,
Dacian CIOLOȘ
Członek Komisji
(1) Dz.U. L 343 z 14.12.2012, s. 1.
(2) Dz.U. L 163 z 2.7.1996, s. 19.
(3) Dz.U. C 228 z 7.8.2013, s. 30.
ZAŁĄCZNIK
Produkty rolne przeznaczone do spożycia przez ludzi wymienione w załączniku I do Traktatu:
Klasa 1.6. Owoce, warzywa i zboża, świeże lub przetworzone
GRECJA
Κονσερβολιά Ροβιών (Konservolia Rovion) (ChNP)
|
15.1.2014 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 10/9 |
ROZPORZĄDZENIE KOMISJI (UE) NR 31/2014
z dnia 14 stycznia 2014 r.
uchylające decyzje 2004/301/WE i 2004/539/WE oraz rozporządzenie (UE) nr 388/2010
(Tekst mający znaczenie dla EOG)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie (WE) nr 998/2003 Parlamentu Europejskiego i Rady z dnia 26 maja 2003 r. w sprawie wymogów dotyczących zdrowia zwierząt, stosowanych do przemieszczania zwierząt domowych o charakterze niehandlowym, i zmieniające dyrektywę Rady 92/65/EWG (1), w szczególności jego art. 19 i 21,
a także mając na uwadze, co następuje:
|
(1) |
Rozporządzenie (WE) nr 998/2003 ustanawia wymogi dotyczące zdrowia zwierząt, stosowane do przemieszczania zwierząt domowych o charakterze niehandlowym, oraz zasady stosowane do kontroli takiego przemieszczania. Rozporządzenie to ma zastosowanie do przemieszczania zwierząt domowych gatunków wymienionych w załączniku I do tego rozporządzenia między państwami członkowskimi lub z państw trzecich. Psy, koty i fretki są wymienione w części A i B tego załącznika. Rozporządzenie (WE) nr 998/2003 stosuje się od dnia 3 lipca 2004 r. |
|
(2) |
W decyzji Komisji 2003/803/WE z dnia 26 listopada 2003 r. ustanawiającej wzór paszportu do celu wewnątrzwspólnotowego przemieszczania psów, kotów i fretek (2) ustanawia się wzór paszportu do celu przemieszczania zwierząt domowych należących do gatunków psów, kotów i fretek między państwami członkowskimi, jak przewidziano w art. 5 ust. 1 lit. b) rozporządzenia (WE) nr 998/2003. |
|
(3) |
W celu ułatwienia przejścia do ustaleń rozporządzenia (WE) nr 998/2003 przyjęta została decyzja Komisji 2004/301/WE z dnia 30 marca 2004 r. wprowadzająca odstępstwo od decyzji 2003/803/WE i 2004/203/WE w odniesieniu do formularzy świadectw i paszportów dla przemieszczania o charakterze niehandlowym psów, kotów i fretek oraz zmieniająca decyzję 2004/203/WE (3), aby świadectwa i paszporty wydane dla zwierząt domowych przed datą rozpoczęcia stosowania rozporządzenia (WE) nr 998/2003 były w dalszym ciągu stosowane, pod warunkiem że są zgodne z określonymi warunkami. |
|
(4) |
Ponadto decyzja Komisji 2004/539/WE z dnia 1 lipca 2004 r. ustanawiająca środek przejściowy dla wdrożenia rozporządzenia (WE) nr 998/2003 w sprawie wymagań dotyczących zdrowia zwierząt stosowanych do niehandlowego przemieszczania zwierząt domowych (4) stanowi, że państwa członkowskie miały pozwolić na wprowadzanie na ich terytorium do dnia 1 października 2004 r. zwierząt domowych z gatunków wymienionych w załączniku I do rozporządzenia (WE) nr 998/2003 zgodnie z przepisami krajowymi obowiązującymi przed dniem 3 lipca 2004 r. |
|
(5) |
Rozporządzenie Parlamentu Europejskiego i Rady (UE) nr 576/2013 z dnia 12 czerwca 2013 r. w sprawie przemieszczania o charakterze niehandlowym zwierząt domowych i uchylające rozporządzenie (WE) nr 998/2003 (5) uchyla i zastępuje rozporządzenie (WE) nr 998/2003. Środki przyjęte w celu ułatwienia przejścia do ustaleń rozporządzenia (WE) nr 998/2003 są zatem nieaktualne. Należy zatem uchylić decyzje 2004/301/WE oraz 2004/539/WE. |
|
(6) |
Ponadto rozporządzenie Komisji (UE) nr 388/2010 z dnia 6 maja 2010 r. w sprawie wykonania rozporządzenia (WE) nr 998/2003 Parlamentu Europejskiego i Rady w zakresie maksymalnej liczby zwierząt domowych niektórych gatunków, jakie mogą być przedmiotem przemieszczania o charakterze niehandlowym (6), zostało przyjęte w celu uniknięcia ryzyka fałszywego deklarowania przemieszczania psów, kotów i fretek o charakterze handlowym jako przemieszczania o charakterze niehandlowym, gdy zwierzęta te są przemieszczane między państwami członkowskimi lub do państwa członkowskiego z państwa trzeciego wymienionego w części B sekcja 2 załącznika II do rozporządzenia (WE) nr 998/2003. |
|
(7) |
Przepisy rozporządzenia (UE) nr 388/2010 zostały poddane przeglądowi i włączone do rozporządzenia (UE) nr 576/2013. Rozporządzenie (UE) nr 576/2013 stosuje się od dnia 29 grudnia 2014 r. Rozporządzenie (UE) nr 388/2010 staje się zatem nieaktualne od daty rozpoczęcia stosowania rozporządzenia (UE) nr 576/2013 i dlatego powinno zostać uchylone ze skutkiem od tej daty. |
|
(8) |
Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Stałego Komitetu ds. Łańcucha Żywnościowego i Zdrowia Zwierząt i ani Parlament Europejski, ani Rada nie wyraziły wobec nich sprzeciwu, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Decyzje 2004/301/WE i 2004/539/WE tracą moc.
Artykuł 2
Rozporządzenie (UE) nr 388/2010 traci moc od dnia 29 grudnia 2014 r.
Artykuł 3
Niniejsze rozporządzenie wchodzi w życie dwudziestego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 14 stycznia 2014 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 146 z 13.6.2003, s. 1.
(2) Dz.U. L 312 z 27.11.2003, s. 1.
(3) Dz.U. L 98 z 2.4.2004, s. 55.
(4) Dz.U. L 237 z 8.7.2004, s. 21.
(5) Dz.U. L 178 z 28.6.2013, s. 1.
(6) Dz.U. L 114 z 7.5.2010, s. 3.
|
15.1.2014 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 10/11 |
ROZPORZĄDZENIE KOMISJI (UE) NR 32/2014
z dnia 14 stycznia 2014 r.
wszczynające przegląd pod kątem nowego eksportera dotyczący rozporządzenia wykonawczego Rady (UE) nr 1008/2011 nakładającego ostateczne cło antydumpingowe na przywóz ręcznych wózków paletowych oraz ich zasadniczych części pochodzących z Chińskiej Republiki Ludowej zmienionego rozporządzeniem wykonawczym Rady (UE) nr 372/2013, uchylające cło w odniesieniu do przywozu od jednego eksportera w tym państwie i poddające ten przywóz wymogowi rejestracji
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Rady (WE) nr 1225/2009 z dnia 30 listopada 2009 r. w sprawie ochrony przed przywozem produktów po cenach dumpingowych z krajów niebędących członkami Wspólnoty Europejskiej („rozporządzenie podstawowe”) (1), w szczególności jego art. 11 ust. 4,
po konsultacji z Komitetem Doradczym zgodnie z art. 11 ust. 4 i art. 14 ust. 5 rozporządzenia podstawowego,
a także mając na uwadze, co następuje:
A. WNIOSEK
|
(1) |
Komisja Europejska („Komisja”) otrzymała wniosek o dokonanie przeglądu pod kątem nowego eksportera na podstawie art. 11 ust. 4 rozporządzenia podstawowego. |
|
(2) |
Wniosek został złożony w dniu 3 maja 2013 r. przez Ningbo Logitrans Handling Equipment Co., Ltd. („wnioskodawca”), producenta eksportującego ręcznych wózków paletowych oraz ich zasadniczych części w Chińskiej Republice Ludowej („państwo, którego dotyczy postępowanie”). |
B. PRODUKT
|
(3) |
Produktem objętym niniejszym przeglądem są ręczne wózki paletowe oraz ich zasadnicze części, tj. podwozia i systemy hydrauliczne, obecnie objęte kodami CN ex 8427 90 00 (kody TARIC 8427900011 i 8427900019) i ex 8431 20 00 (kody TARIC 8431200011 i 8431200019), pochodzące z Chińskiej Republiki Ludowej. |
C. OBOWIĄZUJĄCE ŚRODKI
|
(4) |
Obecnie obowiązującym środkiem jest ostateczne cło antydumpingowe nałożone rozporządzeniem wykonawczym Rady (UE) nr 1008/2011 (2) ostatnio zmienionym rozporządzeniem wykonawczym Rady (UE) nr 372/2013 (3), zgodnie z którym przywóz do Unii produktu objętego przeglądem, w tym produktu wytwarzanego przez wnioskodawcę, podlega ostatecznemu cłu antydumpingowemu w wysokości 70,8 %. Zgodnie z rozporządzeniem Rady (WE) nr 499/2009 (4) środki te mają również zastosowanie do przywozu ręcznych wózków paletowych oraz ich zasadniczych części wysyłanych z Tajlandii, zgłoszonych lub niezgłoszonych jako pochodzące z Tajlandii. |
D. PODSTAWA WNIOSKU
|
(5) |
Wnioskodawca twierdzi, że działa w warunkach gospodarki rynkowej, określonych w art. 2 ust. 7 lit. c) rozporządzenia podstawowego. |
|
(6) |
Wnioskodawca twierdzi również, że nie dokonywał wywozu produktu objętego przeglądem do Unii w okresie objętym dochodzeniem, na którym oparto środki antydumpingowe, tj. w okresie od dnia 1 kwietnia 2003 r. do dnia 31 marca 2004 r. („okres objęty pierwotnym dochodzeniem”). |
|
(7) |
Wnioskodawca twierdzi również, że nie jest powiązany z żadnym z producentów eksportujących produktu objętego przeglądem, którzy podlegają wyżej wspomnianym środkom antydumpingowym. |
|
(8) |
Ponadto wnioskodawca twierdzi, że rozpoczął wywóz produktu objętego przeglądem do Unii po upływie okresu objętego pierwotnym dochodzeniem. |
E. PROCEDURA
|
(9) |
Po zbadaniu dostępnych dowodów Komisja doszła do wniosku, że istnieją wystarczające dowody uzasadniające wszczęcie przeglądu pod kątem nowego eksportera, na podstawie art. 11 ust. 4 rozporządzenia podstawowego, w celu ustalenia indywidualnego marginesu dumpingu wnioskodawcy i, w przypadku stwierdzenia dumpingu, poziomu cła, któremu powinien podlegać jego przywóz produktu objętego przeglądem do Unii. Po otrzymaniu wniosku o traktowanie na zasadach rynkowych zostanie ustalone, czy wnioskodawca działa w warunkach gospodarki rynkowej, określonych w art. 2 ust. 7 lit. c) rozporządzenia podstawowego. |
|
(10) |
Jeżeli zostanie ustalone, że wnioskodawca spełnia wymagania pozwalające na objęcie go indywidualną stawką cła, konieczna może się okazać zmiana stawki cła stosowanej obecnie na podstawie art. 1 ust. 2 rozporządzenia wykonawczego (UE) nr 1008/2011 zmienionego rozporządzeniem wykonawczym (UE) nr 372/2013. |
a) Kwestionariusze
|
(11) |
W celu uzyskania informacji uznanych za niezbędne dla dochodzenia Komisja prześle wnioskodawcy kwestionariusz. |
b) Gromadzenie informacji i przeprowadzanie przesłuchań
|
(12) |
Wszystkie zainteresowane strony niniejszym wzywa się do przedstawienia swoich opinii na piśmie oraz do dostarczenia dowodów potwierdzających zgłaszane fakty. |
|
(13) |
Zainteresowani producenci unijni zostali poinformowani o wniosku o dokonanie przeglądu i mieli możliwość przedstawienia uwag. |
|
(14) |
Ponadto Komisja może przesłuchać zainteresowane strony, pod warunkiem że wystąpiły one z pisemnym wnioskiem o przesłuchanie, wskazując szczególne powody, dla których powinny zostać wysłuchane. |
c) Traktowanie na zasadach rynkowych
|
(15) |
W przypadku gdy wnioskodawca dostarczy wystarczające dowody, iż prowadzi działalność w warunkach gospodarki rynkowej, tzn. spełnia kryteria ustanowione w art. 2 ust. 7 lit. c) rozporządzenia podstawowego, normalna wartość zostanie określona zgodnie z art. 2 ust. 7 lit. b) rozporządzenia podstawowego. W tym celu należycie uzasadnione wnioski należy złożyć w szczególnym terminie ustalonym w art. 4 niniejszego rozporządzenia. Komisja prześle formularze wniosku wnioskodawcy, a także władzom Chińskiej Republiki Ludowej. |
d) Wybór państwa o gospodarce rynkowej
|
(16) |
W przypadku gdy wnioskodawcy nie zostanie przyznany status podmiotu traktowanego na zasadach rynkowych, w celu ustalenia wartości normalnej dla Chińskiej Republiki Ludowej wykorzystane zostanie odpowiednie państwo o gospodarce rynkowej, zgodnie z art. 2 ust. 7 lit. a) rozporządzenia podstawowego. Komisja przewiduje w tym celu wykorzystanie Brazylii, tak jak to miało miejsce w przypadku dochodzenia, które doprowadziło do wprowadzenia środków względem przywozu z Chińskiej Republiki Ludowej. Zainteresowane strony są proszone o wypowiedzenie się na temat stosowności wyboru tego państwa w szczególnym terminie określonym w art. 4 niniejszego rozporządzenia. |
|
(17) |
W przypadku przyznania wnioskodawcy statusu podmiotu traktowanego na zasadach rynkowych przy jednoczesnym braku wymaganych przez Komisję wiarygodnych danych w Chińskiej Republice Ludowej Komisja może w razie potrzeby wykorzystać również ustalenia dotyczące wartości normalnej określonej w odpowiednim państwie o gospodarce rynkowej, np. w celu zastąpienia wszelkich niewiarygodnych elementów kosztów lub cen w Chińskiej Republice Ludowej, niezbędnych do ustalenia wartości normalnej. Komisja przewiduje wykorzystanie Brazylii również do tego celu. |
F. UCHYLENIE OBOWIĄZUJĄCEGO CŁA I REJESTRACJA PRZYWOZU
|
(18) |
Na mocy art. 11 ust. 4 rozporządzenia podstawowego obowiązujące cło antydumpingowe powinno zostać uchylone w odniesieniu do przywozu produktu objętego przeglądem, wytwarzanego i sprzedawanego przez wnioskodawcę na wywóz do Unii. Jednocześnie przywóz ten powinien zostać poddany wymogowi rejestracji zgodnie z art. 14 ust. 5 rozporządzenia podstawowego, w celu zagwarantowania, że, gdyby w wyniku przeglądu stwierdzono dumping ze strony wnioskodawcy, cła antydumpingowe będzie można nałożyć od dnia rejestracji tego przywozu. Na tym etapie dochodzenia nie można oszacować kwoty ewentualnych przyszłych zobowiązań wnioskodawcy. |
G. TERMINY
|
(19) |
W interesie dobrego zarządzania należy określić terminy, w których:
|
|
(20) |
Należy zwrócić uwagę na fakt, iż korzystanie z większości praw proceduralnych ustanowionych w rozporządzeniu podstawowym jest uwarunkowane zgłoszeniem się przez stronę w terminie wskazanym w art. 4 niniejszego rozporządzenia. |
H. BRAK WSPÓŁPRACY
|
(21) |
W przypadkach, w których zainteresowana strona odmawia dostępu do niezbędnych informacji, nie dostarcza ich w określonych terminach albo znacznie utrudnia dochodzenie, istnieje możliwość dokonania ustaleń potwierdzających lub zaprzeczających na podstawie dostępnych faktów zgodnie z art. 18 rozporządzenia podstawowego. |
|
(22) |
W przypadku ustalenia, że zainteresowana strona dostarczyła nieprawdziwe lub wprowadzające w błąd informacje, informacje te będą pominięte, a ustalenia mogą być dokonywane na podstawie dostępnych faktów. |
|
(23) |
Jeżeli zainteresowana strona nie współpracuje lub współpracuje jedynie częściowo i z tego względu ustalenia opierają się na dostępnych faktach zgodnie z art. 18 rozporządzenia podstawowego, wynik może być mniej korzystny dla wymienionej strony niż w przypadku, gdyby strona ta współpracowała. |
|
(24) |
Nieudzielenie odpowiedzi w formie skomputeryzowanej nie będzie traktowane jako odmowa współpracy, pod warunkiem że zainteresowana strona wykaże, że udzielenie żądanej odpowiedzi spowodowałoby dodatkowe obciążenia lub nieuzasadnione dodatkowe koszty. Strona ta powinna niezwłocznie poinformować o tym Komisję. |
I. HARMONOGRAM DOCHODZENIA
|
(25) |
Dochodzenie zostanie zamknięte, zgodnie z art. 11 ust. 5 rozporządzenia podstawowego, w terminie dziewięciu miesięcy od daty opublikowania niniejszego rozporządzenia w Dzienniku Urzędowym Unii Europejskiej. |
J. PRZETWARZANIE DANYCH OSOBOWYCH
|
(26) |
Należy zauważyć, iż wszelkie dane osobowe zgromadzone podczas niniejszego dochodzenia będą traktowane zgodnie z rozporządzeniem (WE) nr 45/2001 Parlamentu Europejskiego i Rady z dnia 18 grudnia 2000 r. o ochronie osób fizycznych w związku z przetwarzaniem danych osobowych przez instytucje i organy wspólnotowe i o swobodnym przepływie takich danych (5). |
K. RZECZNIK PRAW STRON
|
(27) |
Zainteresowane strony mogą wystąpić o interwencję urzędnika Dyrekcji Generalnej ds. Handlu pełniącego rolę rzecznika praw stron. Rzecznik praw stron pośredniczy w kontaktach między zainteresowanymi stronami i służbami Komisji prowadzącymi dochodzenie. Rzecznik praw stron rozpatruje wnioski o dostęp do akt, spory dotyczące poufności dokumentów, wnioski o przedłużenie terminów i wnioski stron trzecich o przesłuchanie. Rzecznik praw stron może zorganizować przesłuchanie indywidualnej zainteresowanej strony i podjąć się mediacji, aby zapewnić pełne wykonanie prawa zainteresowanych stron do obrony. Rzecznik praw stron umożliwi zorganizowanie przesłuchania z udziałem stron, pozwalającego na przedstawienie różnych stanowisk i odpierających je argumentów. |
|
(28) |
Wniosek o przesłuchanie z udziałem rzecznika praw stron należy sporządzić na piśmie i złożyć w terminach określonych przez Komisję w korespondencji ze stronami. Strony powinny taki wniosek uzasadnić. |
|
(29) |
Dodatkowe informacje i dane kontaktowe zainteresowane strony mogą uzyskać na stronach internetowych Dyrekcji Generalnej ds. Handlu dotyczących rzecznika praw stron: http://ec.europa.eu/commission_2010-2014/degucht/contact/hearing-officer/ |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Niniejszym wszczyna się przegląd dotyczący rozporządzenia wykonawczego (UE) nr 1008/2011 zmienionego rozporządzeniem wykonawczym (UE) nr 372/2013 na podstawie art. 11 ust. 4 rozporządzenia (WE) nr 1225/2009 celem określenia, czy i w jakim stopniu przywóz ręcznych wózków paletowych oraz ich zasadniczych części, tj. podwozi i systemów hydraulicznych, obecnie objętych kodami CN ex 8427 90 00 (kody TARIC 8427900011 i 8427900019) i ex 8431 20 00 (kody TARIC 8431200011 i 8431200019), pochodzących z Chińskiej Republiki Ludowej, wytwarzanych i sprzedawanych na wywóz do Unii przez przedsiębiorstwo Ningbo Logitrans Handling Equipment Co., Ltd. (dodatkowy kod TARIC A070), powinien podlegać cłu antydumpingowemu nałożonemu rozporządzeniem wykonawczym (UE) nr 1008/2011 zmienionym rozporządzeniem wykonawczym (UE) nr 372/2013, czy też na przywóz ten należy nałożyć indywidualną stawkę cła.
Na potrzeby niniejszego rozporządzenia ręczne wózki paletowe określa się jako wózki kołowe wyposażone w podnośniki widłowe służące do przewozu palet, pchane, ciągnięte i sterowane ręcznie przez pieszego operatora za pomocą przegubowej sterownicy, przystosowane do gładkich, płaskich i twardych nawierzchni. Ręczne wózki paletowe, są przeznaczone wyłącznie do podnoszenia ładunku, poprzez pompowanie sterownicą, na wysokość wystarczającą do jego przewożenia; nie mają żadnych dodatkowych funkcji, jak na przykład: (i) przenoszenie i podnoszenie ładunku w celu umieszczenia na wysokości lub wspomaganie prac magazynowych (wózki paletowe wysokiego składowania); (ii) ustawianie palet jedna na drugiej (wózki podnośnikowe); (iii) podnoszenie ładunku na wysokość roboczą (wózki krzyżakowe); czy też (iv) podnoszenie i ważenie ładunku (wózki z wagą).
Artykuł 2
Niniejszym uchyla się cło antydumpingowe nałożone rozporządzeniem wykonawczym (UE) nr 1008/2011 zmienionym rozporządzeniem wykonawczym (UE) nr 372/2013 w odniesieniu do przywozu określonego w art. 1 niniejszego rozporządzenia.
Artykuł 3
Na podstawie art. 11 ust. 4 oraz art. 14 ust. 5 rozporządzenia (WE) nr 1225/2009 organy celne podejmują właściwe kroki w celu rejestrowania przywozu do Unii określonego w art. 1 niniejszego rozporządzenia.
Rejestracja wygasa po upływie dziewięciu miesięcy od dnia wejścia w życie niniejszego rozporządzenia.
Artykuł 4
1. Zainteresowane strony, jeżeli ich wnioski mają być uwzględnione podczas dochodzenia, muszą zgłosić się do Komisji, przedstawić swoje opinie na piśmie i przedłożyć odpowiedzi na pytania zawarte w kwestionariuszu, o którym mowa w motywie 12 niniejszego rozporządzenia, lub przedstawić wszelkie inne informacje w terminie 37 dni od daty wejścia w życie niniejszego rozporządzenia, chyba że wskazano inaczej.
2. Zainteresowane strony mogą również składać wnioski o przesłuchanie przez Komisję w tym samym terminie 37 dni.
3. Należycie uzasadniony wniosek o traktowanie na zasadach rynkowych musi wpłynąć do Komisji w terminie 37 dni od wejścia w życie niniejszego rozporządzenia.
4. Strony dochodzenia, które pragną przedstawić uwagi na temat stosowności wyboru Brazylii, która ma zostać wykorzystana jako państwo o gospodarce rynkowej, muszą przedłożyć swoje uwagi w terminie 10 dni od wejścia w życie niniejszego rozporządzenia.
5. Wszystkie pisemne zgłoszenia, łącznie z informacjami wymaganymi w niniejszym zawiadomieniu, wypełnione kwestionariusze i korespondencję dostarczone przez zainteresowane strony, w odniesieniu do których wnioskuje się o ich traktowanie na zasadzie poufności, należy oznakować „Limited” (6).
6. Zgodnie z art. 19 ust. 2 rozporządzenia podstawowego zainteresowane strony przedstawiające informacje oznakowane „Limited” powinny przedłożyć ich streszczenia bez klauzuli poufności, oznakowane „For inspection by interested parties”. Streszczenia powinny być wystarczająco szczegółowe, żeby pozwolić na prawidłowe zrozumienie istoty informacji przekazanych z klauzulą poufności. Jeżeli zainteresowana strona przekazująca poufne informacje nie dostarczy ich niepoufnego streszczenia w wymaganym formacie i o wymaganej jakości, takie poufne informacje mogą zostać pominięte.
7. Zainteresowane strony proszone są o składanie wszystkich oświadczeń i wniosków w formie elektronicznej (oświadczenia niepoufne pocztą elektroniczną, poufne na płytach CD-R/DVD) oraz o wskazanie swojej nazwy, adresu, adresu e-mail, numeru telefonu i faksu. Pełnomocnictwa, podpisane poświadczenia oraz ich aktualizacje towarzyszące formularzom wniosku o MET lub odpowiedzi na pytania zawarte w kwestionariuszu należy jednak składać w formie papierowej, tj. pocztą lub osobiście, na adres podany poniżej. Zainteresowane strony mogą uzyskać dodatkowe informacje dotyczące korespondencji z Komisją na odpowiedniej stronie internetowej Dyrekcji Generalnej ds. Handlu: http://ec.europa.eu/trade/tackling-unfair-trade/trade-defence
Adres Komisji do celów korespondencji:
|
European Commission |
|
Directorate-General for Trade |
|
Directorate H |
|
Office: N105 08/020 |
|
1049 Bruxelles/Brussel |
|
BELGIQUE/BELGIË |
|
E-mail: TRADE-HPT-DUMPING@ec.europa.eu |
Artykuł 5
Niniejsze rozporządzenie wchodzi w życie następnego dnia po jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 14 stycznia 2014 r.
W imieniu Komisji
José Manuel BARROSO
Przewodniczący
(1) Dz.U. L 343 z 22.12.2009, s. 51.
(2) Dz.U. L 268 z 13.10.2011, s. 1.
(3) Dz.U. L 112 z 24.4.2013, s. 1.
(4) Dz.U. L 151 z 16.6.2009, s. 1.
(5) Dz.U. L 8 z 12.1.2001, s. 1.
(6) Dokument oznakowany „Limited” jest uważany za dokument poufny zgodnie z art. 19 rozporządzenia Rady (WE) nr 1225/2009 (Dz.U. L 343 z 22.12.2009, s. 51) i art. 6 Porozumienia WTO o stosowaniu artykułu VI Układu ogólnego w sprawie taryf celnych i handlu 1994 (porozumienie antydumpingowe). Jest on także dokumentem chronionym zgodnie z art. 4 rozporządzenia (WE) nr 1049/2001 Parlamentu Europejskiego i Rady (Dz.U. L 145 z 31.5.2001, s. 43).
|
15.1.2014 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 10/15 |
ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) NR 33/2014
z dnia 14 stycznia 2014 r.
ustanawiające standardowe wartości w przywozie dla ustalania ceny wejścia niektórych owoców i warzyw
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając rozporządzenie Rady (WE) nr 1234/2007 z dnia 22 października 2007 r. ustanawiające wspólną organizację rynków rolnych oraz przepisy szczegółowe dotyczące niektórych produktów rolnych („rozporządzenie o jednolitej wspólnej organizacji rynku”) (1),
uwzględniając rozporządzenie wykonawcze Komisji (UE) nr 543/2011 z dnia 7 czerwca 2011 r. ustanawiające szczegółowe zasady stosowania rozporządzenia Rady (WE) nr 1234/2007 w odniesieniu do sektorów owoców i warzyw oraz przetworzonych owoców i warzyw (2), w szczególności jego art. 136 ust. 1,
a także mając na uwadze, co następuje:
|
(1) |
Rozporządzenie wykonawcze (UE) nr 543/2011 przewiduje – zgodnie z wynikami wielostronnych negocjacji handlowych Rundy Urugwajskiej – kryteria, na których podstawie ustalania Komisja ustala standardowe wartości dla przywozu z państw trzecich, w odniesieniu do produktów i okresów określonych w części A załącznika XVI do wspomnianego rozporządzenia. |
|
(2) |
Standardowa wartość w przywozie jest obliczana każdego dnia roboczego, zgodne z art. 136 ust. 1 rozporządzenia wykonawczego (UE) nr 543/2011, przy uwzględnieniu podlegających zmianom danych dziennych. Niniejsze rozporządzenie powinno zatem wejść w życie z dniem jego opublikowania w Dzienniku Urzędowym Unii Europejskiej, |
PRZYJMUJE NINIEJSZE ROZPORZĄDZENIE:
Artykuł 1
Standardowe wartości celne w przywozie, o których mowa w art. 136 rozporządzenia wykonawczego (UE) nr 543/2011, są ustalone w załączniku do niniejszego rozporządzenia.
Artykuł 2
Niniejsze rozporządzenie wchodzi w życie z dniem jego opublikowania w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporządzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich państwach członkowskich.
Sporządzono w Brukseli dnia 14 stycznia 2014 r.
W imieniu Komisji, za Przewodniczącego,
Jerzy PLEWA
Dyrektor Generalny ds. Rolnictwa i Rozwoju Obszarów Wiejskich
(1) Dz.U. L 299 z 16.11.2007, s. 1.
(2) Dz.U. L 157 z 15.6.2011, s. 1.
ZAŁĄCZNIK
Standardowe wartości w przywozie dla ustalania ceny wejścia niektórych owoców i warzyw
|
(EUR/100 kg) |
||
|
Kod CN |
Kod państw trzecich (1) |
Standardowa wartość w przywozie |
|
0702 00 00 |
AL |
78,9 |
|
IL |
182,0 |
|
|
MA |
80,3 |
|
|
TN |
93,2 |
|
|
TR |
141,4 |
|
|
ZZ |
115,2 |
|
|
0707 00 05 |
MA |
158,2 |
|
TR |
139,7 |
|
|
ZZ |
149,0 |
|
|
0709 93 10 |
MA |
63,8 |
|
TR |
113,2 |
|
|
ZZ |
88,5 |
|
|
0805 10 20 |
EG |
60,3 |
|
MA |
64,3 |
|
|
TR |
75,9 |
|
|
ZA |
59,1 |
|
|
ZZ |
64,9 |
|
|
0805 20 10 |
IL |
193,6 |
|
MA |
69,7 |
|
|
ZZ |
131,7 |
|
|
0805 20 30, 0805 20 50, 0805 20 70, 0805 20 90 |
IL |
181,1 |
|
JM |
93,8 |
|
|
MA |
117,9 |
|
|
TR |
80,3 |
|
|
ZZ |
118,3 |
|
|
0805 50 10 |
EG |
66,2 |
|
TR |
73,1 |
|
|
ZZ |
69,7 |
|
|
0808 10 80 |
CA |
147,4 |
|
MK |
25,7 |
|
|
US |
164,0 |
|
|
ZZ |
112,4 |
|
|
0808 30 90 |
CN |
65,3 |
|
TR |
161,1 |
|
|
US |
139,6 |
|
|
ZZ |
122,0 |
|
(1) Nomenklatura krajów ustalona w rozporządzeniu Komisji (WE) nr 1833/2006 (Dz.U. L 354 z 14.12.2006, s. 19). Kod „ZZ” odpowiada „innym pochodzeniom”.
DECYZJE
|
15.1.2014 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 10/17 |
DECYZJA RADY
z dnia 13 stycznia 2014 r.
w sprawie mianowania do Europejskiego Komitetu Ekonomiczno-Społecznego jednego członka ze Szwecji
(2014/10/UE)
RADA UNII EUROPEJSKIEJ,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej, w szczególności jego art. 302,
uwzględniając wniosek rządu Szwecji,
uwzględniając opinię Komisji Europejskiej,
a także mając na uwadze, co następuje:
|
(1) |
W dniu 13 września 2010 r. Rada przyjęła decyzję 2010/570/UE, Euratom w sprawie mianowania członków Europejskiego Komitetu Ekonomiczno-Społecznego na okres od dnia 21 września 2010 r. do dnia 20 września 2015 r. (1). |
|
(2) |
Jedno stanowisko członka Europejskiego Komitetu Ekonomiczno-Społecznego zwolniło się w związku z wygaśnięciem mandatu Ellen NYGREN, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Na stanowisko członka Europejskiego Komitetu Ekonomiczno-Społecznego na pozostały okres kadencji, czyli do dnia 20 września 2015 r., zostaje mianowana Lise-Lotte LENBERG.
Artykuł 2
Niniejsza decyzja staje się skuteczna z dniem jej przyjęcia.
Sporządzono w Brukseli dnia 13 stycznia 2014 r.
W imieniu Rady
D. KOURKOULAS
Przewodniczący
(1) Dz.U. L 251 z 25.9.2010, s. 8.
|
15.1.2014 |
PL |
Dziennik Urzędowy Unii Europejskiej |
L 10/18 |
DECYZJA WYKONAWCZA KOMISJI
z dnia 20 grudnia 2013 r.
zmieniająca załącznik II do decyzji wykonawczej 2012/707/UE określającej wspólny format dokumentów służących przekazywaniu informacji zgodnie z dyrektywą Parlamentu Europejskiego i Rady 2010/63/UE w sprawie ochrony zwierząt wykorzystywanych do celów naukowych
(notyfikowana jako dokument nr C(2013) 9220)
(Tekst mający znaczenie dla EOG)
(2014/11/UE)
KOMISJA EUROPEJSKA,
uwzględniając Traktat o funkcjonowaniu Unii Europejskiej,
uwzględniając dyrektywę Parlamentu Europejskiego i Rady 2010/63/UE z dnia 22 września 2010 r. w sprawie ochrony zwierząt wykorzystywanych do celów naukowych (1), w szczególności jej art. 54 ust. 4,
a także mając na uwadze, co następuje:
|
(1) |
W wyniku weryfikacji wykryto błędy w załączniku II do decyzji wykonawczej 2012/707/UE (2). W schemacie zawartym w tym załączniku mylnie wskazano, że kategorie danych „Badanie toksyczności oraz inne badania bezpieczeństwa wymagane przepisami” i „Wymogi prawne” dotyczą jedynie kategorii „Badania toksyczności i inne badania bezpieczeństwa, w tym farmakologiczne”, a nie wszystkich pozostałych podkategorii ujętych w kategorii „Badania w celach regulacyjnych i produkcja rutynowa według rodzaju”. W celu wyjaśnienia tej kwestii należy zmienić układ schematu. Aby to bardziej unaocznić, tytuł kategorii danych „Badanie toksyczności oraz inne badania bezpieczeństwa wymagane przepisami” należy zamienić na „Badania wymagane przepisami”. Inne nieznaczne zmiany do układu schematu powinny zostać wprowadzone w celu zapewnienia większej przejrzystości. |
|
(2) |
Zmiany wprowadzone w schemacie należy odzwierciedlić w drugiej części załącznika II do decyzji wykonawczej 2012/707/UE, zawierającej szczegółowe instrukcje. |
|
(3) |
Należy zatem odpowiednio sprostować decyzję wykonawczą 2012/707/UE. |
|
(4) |
Środki przewidziane w niniejszej decyzji są zgodne z opinią komitetu ustanowionego na mocy art. 56 ust. 1 dyrektywy 2010/63/UE, |
PRZYJMUJE NINIEJSZĄ DECYZJĘ:
Artykuł 1
Załącznik II do decyzji wykonawczej 2012/707/UE zastępuje się załącznikiem do niniejszej decyzji.
Artykuł 2
Niniejsza decyzja skierowana jest do państw członkowskich.
Sporządzono w Brukseli dnia 20 grudnia 2013 r.
W imieniu Komisji
Janez POTOČNIK
Członek Komisji
(1) Dz.U. L 276 z 20.10.2010, s. 33.
(2) Decyzja wykonawcza Komisji 2012/707/UE z dnia 14 listopada 2012 r. określająca wspólny format dokumentów służących przekazywaniu informacji zgodnie z dyrektywą Parlamentu Europejskiego i Rady 2010/63/UE w sprawie ochrony zwierząt wykorzystywanych do celów naukowych (Dz.U. L 320 z 17.11.2012, s. 33).
ZAŁĄCZNIK
„ZAŁĄCZNIK II
CZĘŚĆ A
SCHEMAT KATEGORII WPROWADZANYCH DANYCH STATYSTYCZNYCH ZGODNIE Z ART. 54 UST. 2
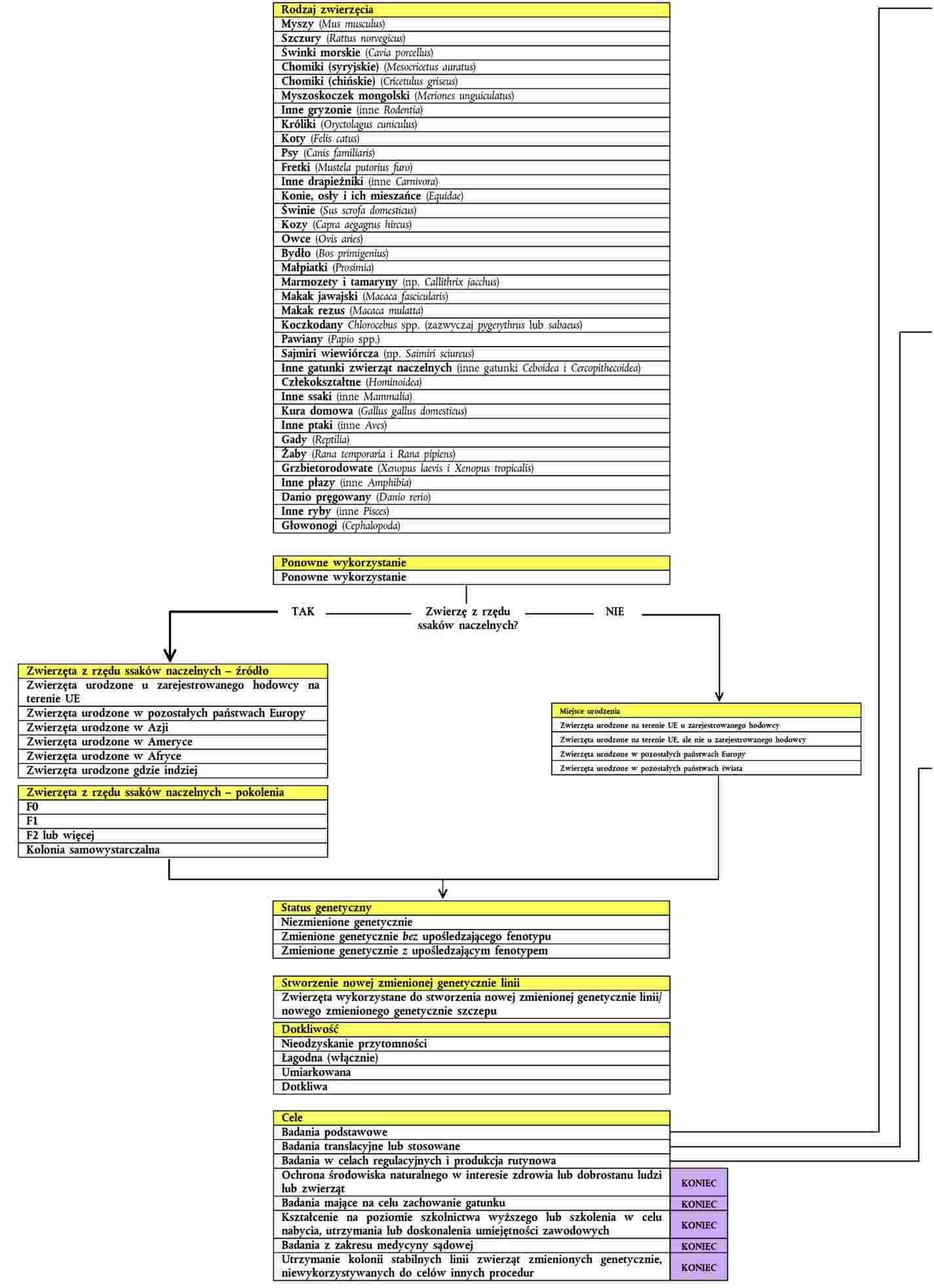

CZĘŚĆ B
SZCZEGÓŁOWE INSTRUKCJE W ZAKRESIE DOSTARCZANIA DANYCH STATYSTYCZNYCH DOTYCZĄCYCH WYKORZYSTANIA ZWIERZĄT DO CELÓW NAUKOWYCH ZGODNIE Z ART. 54 UST. 2
FORMAT DOKUMENTÓW SŁUŻĄCYCH PRZEKAZYWANIU INFORMACJI, O KTÓRYCH MOWA W ART. 54 UST. 2 DYREKTYWY 2010/63/UE
|
1. |
Należy wprowadzać dane dotyczące każdego wykorzystania zwierzęcia. |
|
2. |
Przy wprowadzaniu danych dotyczących zwierzęcia można wybrać tylko jedną opcję w ramach danej kategorii. |
|
3. |
Zwierzęta uśmiercone w celu pobrania ich narządów i tkanek, jak również wykorzystywane jako organizmy bioindykatorowe, są wyłączone z danych statystycznych, chyba że uśmiercanie odbywa się na podstawie pozwolenia na projekt metodą nieuwzględnioną w załączniku IV lub w przypadku zwierzęcia, które poddano przed uśmierceniem wcześniejszym zabiegom i które doznało bólu powyżej minimalnego progu, cierpienia, dystresu i trwałych uszkodzeń. |
|
4. |
Niewykorzystane i następnie uśmiercone zwierzęta nie są ujęte w danych statystycznych, z wyjątkiem zwierząt zmienionych genetycznie z zamierzonym i przejawianym upośledzającym fenotypem. |
|
5. |
Wlicza się formy larwalne zwierząt, gdy tylko stają się zdolne do samodzielnego pobierania pokarmu. |
|
6. |
Formy zarodkowe i płodowe gatunków ssaków nie są uwzględniane; wlicza się jedynie zwierzęta, które zostały urodzone, w tym przez cięcie cesarskie, i są żywe. |
|
7. |
Ilekroć dotkliwość procedury przekroczy kategorię »dotkliwa«, niezależnie od tego, czy udzielono na to wcześniej zezwolenia czy nie, zwierzęta te i ich wykorzystanie należy zgłaszać podobnie jak w przypadku każdego innego wykorzystania oraz w kategorii »dotkliwa«. Należy umieścić komentarz w sekcji opisowej wypełnianej przez dane państwo członkowskie zawierający informacje na temat gatunków i liczby zwierząt oraz ewentualnego przyznania odstępstwa, szczegółowe informacje dotyczące wykorzystania i powody, dla których przekroczono kategorię »dotkliwe«. |
|
8. |
Dane są przekazywane w roku, w którym procedura zostaje zakończona. W przypadku badań obejmujących dwa lata kalendarzowe, wszystkie zwierzęta mogą być rozliczone w roku, w którym zostaje zakończona ostatnia z procedur, jeżeli zwolnienia z obowiązku przedstawienia sprawozdania rocznego udzielił właściwy organ. W odniesieniu do projektów realizowanych przez okres dłuższy niż dwa lata kalendarzowe zwierzęta są zgłaszane w roku, w którym zostały uśmiercone lub padły. |
|
9. |
Stosowanie kategorii »Inne« wymaga obowiązkowego wpisu w sekcji opisowej w celu podania dalszych informacji. |
A. ZWIERZĘTA ZMIENIONE GENETYCZNIE
|
1. |
Na potrzeby sprawozdawczości statystycznej termin »zwierzęta zmienione genetycznie« obejmuje zwierzęta zmienione genetycznie (transgenicznie, metodą knock-out i za pomocą innych modyfikacji genetycznych) oraz zwierzęta, u których mutacja wystąpiła naturalnie lub została indukowana. |
|
2. |
Informacje na temat zwierząt zmienionych genetycznie są przekazywane w przypadku gdy:
|
|
3. |
Wszystkie zwierzęta ze zmianami genetycznymi należy zgłaszać w momencie tworzenia nowej linii. Ponadto należy również zgłaszać zwierzęta wykorzystywane do celów superowulacji, wazektomii i implantacji zarodków (mogą one być zmienione genetycznie lub nie). Nie należy zgłaszać zwierząt bez anomalii genetycznych (typ dziki potomstwa), wyhodowanych w wyniku utworzenia nowej zmienionej genetycznie linii. |
|
4. |
W kategorii »Cele« zwierzęta wykorzystane do stworzenia nowej zmienionej genetycznie linii należy zgłaszać w ramach »badań podstawowych« lub »badań translacyjnych i stosowanych«w kategorii, dla której dana linia jest tworzona. |
|
5. |
Nowy szczep lub linię zwierząt zmienionych genetycznie uważa się za »stabilne«, gdy przekazywanie modyfikacji genetycznej jest stabilne, co oznacza, że obejmuje co najmniej dwa pokolenia, oraz gdy zakończono ocenę dobrostanu zwierząt. |
|
6. |
W ocenie dobrostanu zostanie ustalone, czy nowo powstała linia będzie charakteryzować się zamierzonym upośledzającym fenotypem. Jeżeli tak, zwierzęta od tego momentu należy zgłaszać w kategorii »Utrzymanie kolonii stabilnych linii zwierząt zmienionych genetycznie, niewykorzystywanych do celów innych procedur«, lub odpowiednio, w ramach innych procedur, w których są one wykorzystywane. Jeżeli w ocenie dobrostanu stwierdzono, że linia nie będzie charakteryzować się upośledzającym fenotypem, jej hodowla nie wchodzi w zakres procedury i nie musi już być zgłaszana. |
|
7. |
Kategoria »Utrzymanie kolonii stabilnych linii zwierząt zmienionych genetycznie, niewykorzystywanych do celów innych procedur« obejmuje zwierzęta potrzebne do utrzymania kolonii zwierząt zmienionych genetycznie ze stabilnych linii z zamierzonym upośledzającym fenotypem i które przejawiały oznaki bólu, cierpienia, dystresu lub trwałego uszkodzenia na skutek upośledzającego genotypu. Nie zgłasza się zamierzonego celu, dla którego linia ta jest utrzymywana. |
|
8. |
Wszystkie zwierzęta zmienione genetycznie, które są wykorzystywane do celów innych procedur (nie dla stworzenia lub utrzymania linii zmienionej genetycznie), należy zgłaszać w ramach odpowiednich celów (w taki sam sposób, jak każde zwierzę niezmienione genetycznie). Zwierzęta te mogą przejawiać upośledzający fenotyp lub nie. |
|
9. |
Zwierzęta zmienione genetycznie, przejawiające upośledzający fenotyp i uśmiercone w celu pobrania ich narządów lub tkanek, należy zgłaszać w ramach odpowiednich podstawowych celów, dla których wykorzystano organy lub tkanki. |
B. KATEGORIE DANYCH
Poniższe sekcje uporządkowane są zgodnie z kategoriami i powiązanymi z nimi pozycjami przedstawionymi w schemacie blokowym.
1. Rodzaj zwierzęcia
|
(i) |
Wszystkie gatunki głowonogów należy zgłaszać w ramach pozycji Głowonogi, od momentu, w którym zwierzę staje się zdolne do samodzielnego pobierania pokarmu, tj. natychmiast po wykluciu się z jaj w przypadku ośmiornic i kałamarnic; natomiast w przypadku mątw – ok. siedem dni po wykluciu się z jaj. |
|
(ii) |
Ryby należy liczyć od momentu, w którym są zdolne samodzielnie pobierać pokarm. Danio pręgowany, hodowany w optymalnych warunkach (około +28 °C) powinien być liczony od piątego dnia po zapłodnieniu. |
|
(iii) |
Na skutek niewielkich rozmiarów niektórych ryb i gatunków głowonogów liczenie można przeprowadzać na podstawie szacunków. |
2. Ponowne wykorzystanie
|
(i) |
Każde wykorzystanie zwierzęcia należy zgłaszać po zakończeniu każdej procedury. |
|
(ii) |
Statystyki będą uwzględniały liczbę zwierząt niepoddanych eksperymentom (naive animals) jedynie pod kątem gatunku i miejsca urodzenia. Z tego względu w przypadku zwierząt wykorzystanych ponownie nie odnotowuje się ich miejsca urodzenia. |
|
(iii) |
Wszelkie kolejne kategorie będą przedstawiały liczbę przypadków wykorzystania zwierząt w procedurach. Z tego względu liczby te nie mogą być odnoszone do całkowitej liczby zwierząt niepoddanych eksperymentom. |
|
(iv) |
Liczba zwierząt, które są ponownie wykorzystywane, nie może być wyprowadzona na podstawie danych z uwagi na fakt, że niektóre zwierzęta mogą być wykorzystywane wielokrotnie. |
|
(v) |
Należy zgłosić rzeczywiste cierpienie zwierzęcia odczuwane przez nie na skutek procedury. W niektórych przypadkach na takie cierpienie może wywierać wpływ uprzednie wykorzystanie. Jednak dotkliwość nie zawsze będzie wzrastać w kolejnych wykorzystaniach, a w niektórych przypadkach może nawet w rezultacie maleć (przyzwyczajenie). Z tego względu nie należy automatycznie dodawać stopni dotkliwości na podstawie uprzednich wykorzystań. Decyzję w tym zakresie należy podejmować osobno dla poszczególnych przypadków. |
Wykorzystanie ponowne a wykorzystanie ciągłe
Procedura oznacza wykorzystanie jednego zwierzęcia do pojedynczego celu naukowego/doświadczalnego/edukacyjnego/szkoleniowego. Pojedyncze wykorzystanie obejmuje okres od momentu zastosowania w odniesieniu do zwierzęcia pierwszej techniki doświadczalnej aż do zakończenia procesu zbierania danych czy obserwacji lub po osiągnięciu celu edukacyjnego. Jest to zazwyczaj pojedynczy eksperyment, badanie lub ćwiczenie techniki.
Pojedyncza procedura może obejmować szereg etapów (technik doświadczalnych) – wszystkie ukierunkowane są na osiągnięcie jednego rezultatu i we wszystkich wykorzystywane jest to samo zwierzę.
Użytkownik końcowy zgłasza całą procedurę, w tym etap przygotowań (bez względu na miejsce, w którym się one odbywały), i uwzględnia dotkliwość związaną z przygotowaniami.
Przykłady przygotowań obejmują procedury chirurgiczne (takie jak kaniulacja, wszczepienie urządzeń telemetrycznych, wycięcie jajników, kastracja, wycięcie przysadki itp.) i niechirurgiczne (takie jak podawanie zmodyfikowanej karmy, wywoływanie cukrzycy itp.). To samo odnosi się do hodowli zwierząt zmienionych genetycznie, tj. jeśli zwierzę jest wykorzystywane w zamierzonej procedurze, użytkownik końcowy zgłasza całą procedurę, uwzględniając dotkliwość związaną z danym fenotypem. Więcej szczegółów w sekcji dotyczącej zwierząt zmienionych genetycznie.
Jeśli ze szczególnych powodów zwierzę, które przygotowano, nie zostało wykorzystane do celów naukowych, ośrodek, który zwierzę przygotował, powinien przedstawić szczegółowe informacje na temat przygotowania jako niezależnej procedury w statystykach dotyczących zamierzonego celu, pod warunkiem że przygotowanie zwierzęcia odbywało się powyżej minimalnego progu bólu, cierpienia, dystresu lub trwałego uszkodzenia.
3. Miejsce urodzenia
|
(i) |
Pochodzenie wiąże się z miejscem urodzenia, tj. miejscem, gdzie zwierzę zostało urodzone, a nie miejscem, skąd zwierzę dostarczono. |
|
(ii) |
Kategoria Zwierzęta urodzone na terenie UE u zarejestrowanego hodowcy obejmuje zwierzęta urodzone u hodowców, którzy otrzymali pozwolenia i zostali zarejestrowani na mocy art. 20 dyrektywy 2010/63/UE. |
|
(iii) |
Kategoria Zwierzęta urodzone na terenie UE, ale nie u zarejestrowanego hodowcy, obejmuje zwierzęta urodzone poza zarejestrowaną hodowlą, takie jak zwierzęta dzikie, zwierzęta gospodarskie (chyba że hodowca otrzymał pozwolenie i został zarejestrowany), jak również zwierzęta objęte odstępstwami na podstawie art. 10 ust. 3 dyrektywy 2010/63/UE. |
|
(iv) |
Kategorie Zwierzęta urodzone w pozostałych państwach Europy i Zwierzęta urodzone w pozostałych państwach świata obejmują wszystkie zwierzęta niezależnie od tego, czy były one hodowane w zarejestrowanych ośrodkach hodowlanych czy w innych ośrodkach, a także pozyskane dzikie zwierzęta. |
4. Zwierzęta z rzędu ssaków naczelnych – źródło
Do celów niniejszej sprawozdawczości:
|
(i) |
Kategoria Zwierzęta urodzone w pozostałych państwach Europy obejmuje zwierzęta urodzone w Turcji, Rosji oraz Izraelu. |
|
(ii) |
Kategoria Zwierzęta urodzone w Azji obejmuje zwierzęta urodzone w Chinach. |
|
(iii) |
Kategoria Zwierzęta urodzone w Ameryce obejmuje zwierzęta urodzone w Ameryce Północnej, Środkowej i Południowej. |
|
(iv) |
Kategoria Zwierzęta urodzone w Afryce obejmuje zwierzęta urodzone na Mauritiusie. |
|
(v) |
Kategoria Zwierzęta urodzone gdzie indziej obejmuje zwierzęta urodzone w Australazji. |
Pochodzenie zwierząt zarejestrowanych w kategorii Zwierzęta urodzone gdzie indziej należy szczegółowo przedstawić właściwemu organowi w momencie przekazywania danych.
5. Zwierzęta z rzędu ssaków naczelnych – pokolenia
|
(i) |
Dopóki kolonia nie stanie się kolonią samowystarczalną, zwierzęta urodzone w tej kolonii należy zgłaszać w rubryce F0, F1, F2 lub więcej według liczby pokoleń ze strony matki. |
|
(ii) |
Gdy kolonia staje się samowystarczalna, wszystkie zwierzęta urodzone w tej kolonii należy zgłaszać w rubryce Kolonia samowystarczalna niezależnie od tego, do którego pokolenia ze strony matki należą. |
6. Status genetyczny
|
(i) |
Kategoria Niezmienione genetycznie obejmuje wszystkie zwierzęta, które nie zostały genetycznie zmienione, w tym zwierzęta niezmienione genetycznie wykorzystane do stworzenia nowej linii/szczepu zwierząt zmienionych genetycznie. |
|
(ii) |
Kategoria Zmienione genetycznie bez upośledzającego fenotypu obejmuje zwierzęta wykorzystane do stworzenia nowej linii, zmienione genetycznie, które nie przejawiają upośledzającego fenotypu, i zwierzęta zmienione genetycznie wykorzystane do celów innych procedur (nie dla stworzenia lub utrzymania), które nie przejawiają upośledzającego fenotypu. |
|
(iii) |
Kategoria Zmienione genetycznie z upośledzającym fenotypem obejmuje:
|
7. Stworzenie nowej zmienionej genetycznie linii
Kategoria Zwierzęta wykorzystane do stworzenia nowej zmienionej genetycznie linii/nowego zmienionego genetycznie szczepu określa zwierzęta, które zostały wykorzystane do stworzenia nowej zmienionej genetycznie linii/nowego zmienionego genetycznie szczepu, wyodrębniając je spośród innych zwierząt wykorzystanych do celów »badań podstawowych« lub »badań translacyjnych i stosowanych«.
8. Dotkliwość
|
(i) |
Kategoria: terminalne, bez odzyskania przytomności przez zwierzę – zwierzęta, które zostały poddane procedurom przeprowadzonym całkowicie w znieczuleniu ogólnym, po których zwierzę nie odzyskuje przytomności, zgłasza się jako terminalne, bez odzyskania przytomności przez zwierzę. |
|
(ii) |
Kategoria: łagodne (włącznie) – zwierzęta, które zostały poddane procedurom, w wyniku których zwierzęta mogą doświadczać krótkotrwałego łagodnego bólu, cierpienia lub dystresu, jak również procedurom bez istotnego niekorzystnego oddziaływania na dobrostan lub ogólny stan zwierząt, zgłasza się jako łagodne. NB. Kategoria ta powinna obejmować również wszelkie zwierzęta wykorzystane w zatwierdzonym projekcie, lecz które ostatecznie nie przejawiały oznak bólu, cierpienia, dystresu lub trwałych uszkodzeń równoważnych z tymi spowodowanymi przez wprowadzenie igły, zgodnie z dobrą praktyką weterynaryjną, z wyjątkiem zwierząt potrzebnych do utrzymania kolonii zwierząt zmienionych genetycznie ze stabilnych linii z zamierzonym upośledzającym fenotypem i które nie przejawiały oznak bólu, cierpienia, dystresu lub trwałego uszkodzenia na skutek upośledzającego genotypu. |
|
(iii) |
Kategoria: umiarkowane – zwierzęta, które zostały poddane procedurom, w wyniku których zwierzęta mogą doświadczać krótkotrwałego umiarkowanego bólu, cierpienia lub dystresu lub długotrwałego łagodnego bólu, cierpienia lub dystresu, jak również procedurom, które mogą powodować umiarkowane niekorzystne oddziaływanie na dobrostan lub ogólny stan zwierząt, zgłasza się jako umiarkowane. |
|
(iv) |
Kategoria: dotkliwe – zwierzęta, które zostały poddane procedurom, w wyniku których zwierzęta mogą doświadczać dotkliwego bólu, cierpienia lub dystresu lub długotrwałego umiarkowanego bólu, cierpienia lub dystresu, jak również procedury, które mogą powodować dotkliwe niekorzystne oddziaływanie na dobrostan lub ogólny stan zwierząt, zgłasza się jako dotkliwe. |
|
(v) |
Jeśli zostanie przekroczona kategoria: »dotkliwe«, niezależnie od tego, czy udzielono na to wcześniej zezwolenia, zwierzęta te i ich wykorzystanie należy zgłaszać w kategorii dotkliwe. Należy umieścić komentarz w sekcji opisowej wypełnianej przez dane państwo członkowskie zawierający informacje na temat gatunków i liczby zwierząt oraz ewentualnego przyznania odstępstwa, szczegółowe informacje dotyczące wykorzystania i powody, dla których przekroczono kategorię »dotkliwe«. |
9. Cele
(i) Badania podstawowe
Badania podstawowe obejmują badanie podstawowych czynności, w tym fizjologii. Badania, które zmierzają do zdobycia wiedzy na temat prawidłowych i nieprawidłowych cech struktury, funkcjonowania i zachowania żywych organizmów i środowiska, w tym podstawowe badania z zakresu toksykologii. Gromadzenie i analiza danych skoncentrowane na lepszym lub pełniejszym zrozumieniu tematu, zjawiska lub podstawowego prawa natury, zamiast na konkretnym praktycznym zastosowaniu wyników badań.
Zwierzęta wykorzystane do stworzenia nowej zmienionej genetycznie linii zwierząt (łącznie z krzyżowaniem dwóch linii) przeznaczonej do celów badań podstawowych (np. w zakresie biologii rozwoju czy immunologii) należy zgłaszać w zależności od celu, w jakim zostały one stworzone. Ponadto należy je zgłosić w ramach kategorii »Stworzenie nowej linii genetycznej – zwierzęta wykorzystane do stworzenia nowej zmienionej genetycznie linii/nowego zmienionego genetycznie szczepu«.
Wszystkie zwierzęta ze zmianami genetycznymi należy zgłaszać w momencie tworzenia nowej linii. W tej kategorii zgłasza się również zwierzęta wykorzystane w procedurach tworzenia, takich jak superowulacja, wazektomia i implantacja zarodków. Nie należy zgłaszać potomstwa bez genetycznych anomalii (typu dzikiego).
Nowy szczep lub linię zwierząt zmienionych genetycznie uważa się za »stabilne«, gdy przekazywanie modyfikacji genetycznej jest stabilne, co oznacza, że obejmuje co najmniej dwa pokolenia, oraz gdy zakończono ocenę dobrostanu zwierząt.
(ii) Badania translacyjne lub stosowane
Badania translacyjne i stosowane obejmują zwierzęta wykorzystywane do celów opisanych w art. 5 lit. b) i c), wyłączając wszelkie wykorzystania regulacyjne zwierząt.
Obejmuje to również toksykometrię i gromadzenie danych w ramach przygotowań do złożenia wniosku o rejestrację i rozwoju metod. Nie obejmuje to badań wymaganych dla celów złożenia wniosku o rejestrację.
Zwierzęta wykorzystane do stworzenia nowej zmienionej genetycznie linii zwierząt (łącznie z krzyżowaniem dwóch linii) przeznaczonej do celów badań translacyjnych i stosowanych (np. w zakresie badań nad nowotworami, opracowywania szczepionek) należy zgłaszać w zależności od celu, w jakim zostały one stworzone. Ponadto należy je zgłosić w ramach kategorii: »Stworzenie nowej linii genetycznej – zwierzęta wykorzystane do stworzenia nowej zmienionej genetycznie linii/nowego zmienionego genetycznie szczepu«.
Wszystkie zwierzęta ze zmianami genetycznymi należy zgłaszać w momencie tworzenia nowej linii. W tej kategorii zgłasza się również zwierzęta wykorzystane w procedurach tworzenia, takich jak superowulacja, wazektomia i implantacja zarodków. Nie należy zgłaszać potomstwa bez genetycznych anomalii (typu dzikiego).
Nowy szczep lub linię zwierząt zmienionych genetycznie uważa się za »stabilne«, gdy przekazywanie modyfikacji genetycznej jest stabilne, co oznacza, że obejmuje co najmniej dwa pokolenia, oraz gdy zakończono ocenę dobrostanu zwierząt.
(iii) Badania w celach regulacyjnych i produkcja rutynowa według rodzaju
Wykorzystywanie zwierząt w procedurach prowadzonych w celu przestrzegania wymogów prawnych dotyczących wytwarzania produktów/substancji, wprowadzania ich do obrotu i utrzymywania ich w obrocie, w tym ocena bezpieczeństwa i ryzyka w odniesieniu do żywności i paszy. Obejmuje to badania przeprowadzone w odniesieniu do produktów/substancji, dla których ostatecznie nie złożono wniosku o rejestrację, jeżeli badania te byłyby załączone do wniosku o rejestrację, gdyby do złożenia takiego wniosku doszło (tj. badań przeprowadzonych na tych produktach/substancjach, którym nie udało się przejść do końca procesu rozwojowego).
Obejmuje to również zwierzęta wykorzystywane w procesie wytwarzania produktów, jeśli proces produkcyjny wymaga uzyskania zgody organu regulacyjnego (np. zwierzęta wykorzystywane w produkcji produktów leczniczych na bazie surowicy powinny zostać uwzględnione w tej kategorii).
Wyklucza się badania skuteczności w trakcie opracowywania nowych produktów leczniczych – należy zgłaszać je w kategorii »Badania translacyjne i stosowane«.
(iv) Ochrona środowiska naturalnego w interesie zdrowia lub dobrostanu ludzi lub zwierząt
Ta kategoria obejmuje badania mające na celu zbadanie i zrozumienie zjawisk takich jak zanieczyszczenie środowiska, utrata różnorodności biologicznej, a także badania epidemiologiczne u zwierząt dzikich.
Wyklucza się wszelkie zastosowania regulacyjne zwierząt dla celów w zakresie ekotoksykologii.
(v) Kształcenie na poziomie szkolnictwa wyższego lub szkolenia w celu nabycia, utrzymania lub doskonalenia umiejętności zawodowych
Obejmuje to szkolenia, prowadzone w celu nabycia i utrzymania praktycznych kompetencji w zakresie technik, zgodnie z wymogami art. 23 ust. 2.
(vi) Utrzymanie kolonii stabilnych linii zwierząt zmienionych genetycznie, niewykorzystywanych do celów innych procedur
Ta kategoria obejmuje szereg zwierząt potrzebnych do utrzymania kolonii zwierząt zmienionych genetycznie ze stabilnych linii z zamierzonym upośledzającym fenotypem i które przejawiały oznaki bólu, cierpienia, dystresu lub trwałego uszkodzenia na skutek upośledzającego genotypu. Nie zgłasza się zamierzonego celu, dla którego linia ta jest hodowana.
Nie dotyczy to wszystkich zwierząt potrzebnych do stworzenia nowej linii zmienionej genetycznie oraz zwierząt wykorzystanych w innych procedurach (innych niż tworzenie/hodowla).
10. Badania z zakresu badań podstawowych
(i) Onkologia
Każde badanie z zakresu onkologii należy włączyć do tej kategorii, niezależnie od badanego układu.
(ii) Układ nerwowy
Kategoria ta obejmuje neuronaukę, badania obwodowego lub centralnego układu nerwowego, psychologię.
(iii) Narządy zmysłów (skóra, oczy i uszy)
Badania dotyczące nosa należy zgłaszać w ramach kategorii »Układ oddechowy«, a dotyczące języka powinny być zgłaszane w ramach kategorii »Układ żołądkowo-jelitowy z uwzględnieniem wątroby«.
(iv) Badania obejmujące wiele układów
Ta kategoria powinna obejmować wyłącznie badania, w których podstawowy przedmiot zainteresowania stanowi więcej niż jeden układ, jak w przypadku niektórych chorób zakaźnych, i z wyłączeniem badań w zakresie onkologii.
(v) Kategoria Etologia/Zachowanie zwierząt/Biologia zwierząt obejmuje zarówno zwierzęta w środowisku naturalnym, jak i w niewoli, a główny cel polega na lepszym poznaniu konkretnych gatunków.
(vi) Inne
Badania, które nie wiążą się z organem/układem wymienionym powyżej lub nie dotyczą konkretnego organu/układu.
(vii) Uwagi
Ta kategoria obejmuje zwierzęta wykorzystane do produkcji i utrzymywania czynników zakaźnych, nosicieli i nowotworów, zwierzęta wykorzystane na potrzeby innych materiałów biologicznych oraz zwierzęta wykorzystane do produkcji przeciwciał poliklonalnych do celów badań translacyjnych lub stosowanych, lecz z wyłączeniem produkcji przeciwciał monoklonalnych z zastosowaniem metody wodobrzusza (która jest uwzględniona w kategorii »Badania w celach regulacyjnych i produkcja rutynowa według rodzaju«), które należy zgłaszać w odpowiednich rubrykach kategorii »Badania podstawowe« lub »Badania translacyjne i stosowane«. Należy dokładnie określić cel badań, ponieważ mogą mieć zastosowanie kryteria dotyczące dwóch kategorii, a zgłoszony zostanie jedynie cel główny.
11. Badania translacyjne lub stosowane
(i) Wszelkie badania stosowane nad nowotworami i chorobami zakaźnymi człowieka powinny być uwzględnione niezależnie od badanego układu.
(ii) Wszelkie wykorzystanie zwierząt dla celów regulacyjnych należy wykluczyć, jak np. badania dotyczące rakotwórczości dla celów regulacyjnych.
(iii) Badania dotyczące chorób nosa należy zgłaszać w kategorii »Zaburzenia układu oddechowego«, a choroby języka należy zgłaszać w ramach kategorii »Zaburzenia układu żołądkowo-jelitowego, z uwzględnieniem wątroby, u człowieka«.
(iv) Diagnostyka chorób obejmuje zwierzęta wykorzystywane w bezpośrednim diagnozowaniu chorób takich jak wścieklizna czy zatrucie jadem kiełbasianym, ale z wyłączeniem badań sklasyfikowanych w kategorii wykorzystania regulacyjnego.
(v) Nieregulacyjna toksykologia obejmuje toksykometrię i gromadzenie danych w ramach przygotowań do złożenia wniosku o rejestrację i rozwoju metod. Kategoria ta nie obejmuje badań wymaganych dla celów złożenia wniosku o rejestrację (badania wstępne, maksymalna tolerowana dawka (MTD)).
(vi) Badania dotyczące dobrostanu zwierząt powinny obejmować badania zgodnie z art. 5 lit. b) ppkt (iii) dyrektywy 2010/63/UE.
(vii) Uwagi
Ta kategoria obejmuje zwierzęta wykorzystane do produkcji i utrzymywania czynników zakaźnych, nosicieli i nowotworów, zwierzęta wykorzystane na potrzeby innych materiałów biologicznych oraz zwierzęta wykorzystane do produkcji przeciwciał poliklonalnych do celów badań translacyjnych lub stosowanych, lecz z wyłączeniem produkcji przeciwciał monoklonalnych z zastosowaniem metody wodobrzusza (która jest uwzględniona w kategorii »Badania w celach regulacyjnych i produkcja rutynowa według rodzaju«), które należy zgłaszać w odpowiednich rubrykach kategorii »Badania podstawowe« lub »Badania translacyjne i stosowane«. Należy dokładnie określić cel badań, ponieważ mogą mieć zastosowanie kryteria dotyczące dwóch kategorii, a zgłoszony zostanie jedynie cel główny.
12. Badania w celach regulacyjnych i produkcja rutynowa
|
(i) |
Wykorzystywanie zwierząt w procedurach prowadzonych w celu przestrzegania wymogów prawnych dotyczących wytwarzania produktów/substancji, wprowadzania ich do obrotu i utrzymywania ich w obrocie, w tym ocena bezpieczeństwa i ryzyka w odniesieniu do żywności i paszy. |
|
(ii) |
Obejmuje to badania przeprowadzone w odniesieniu do produktów/substancji, dla których ostatecznie nie złożono wniosku o rejestrację, ale badania te byłyby załączone do wniosku o rejestrację, gdyby do złożenia tego wniosku doszło (tj. badania przeprowadzone na tych produktach/substancjach, których nie poddano do końca procesowi rozwoju). |
|
(iii) |
Obejmuje to również zwierzęta wykorzystywane w procesie wytwarzania produktów, jeśli proces produkcyjny wymaga uzyskania zgody organu regulacyjnego (np. zwierzęta wykorzystywane w produkcji produktów leczniczych na bazie surowicy powinny zostać uwzględnione w tej kategorii). |
13. Badania w celach regulacyjnych i produkcja rutynowa według rodzaju
|
(i) |
Wyklucza się badania skuteczności w trakcie opracowywania nowych produktów leczniczych – należy zgłaszać je w kategorii »Badania translacyjne i stosowane«. |
|
(ii) |
Kontrola jakości obejmuje zwierzęta wykorzystywane w testowaniu czystości, stabilności, skuteczności, aktywności biologicznej i innych parametrów kontroli jakości w odniesieniu do produktu końcowego i jego składników oraz wszelkie kontrole przeprowadzane podczas procesu wytwarzania dla celów rejestracji, w celu spełnienia wszelkich krajowych lub międzynarodowych wymogów regulacyjnych lub wymogów wewnętrznej polityki producenta. W tym również badania gorączkotwórczości. |
|
(iii) |
Inne badania skuteczności i tolerancji: w tej kategorii uwzględniono badania skuteczności biocydów i pestycydów, jak również badania tolerancji dodatków stosowanych w żywieniu zwierząt. |
|
(iv) |
Badania toksyczności i inne badania bezpieczeństwa (w tym ocena bezpieczeństwa produktów i urządzeń stosowanych w medycynie, stomatologii i weterynarii) obejmuje badania przeprowadzone na produktach lub substancjach, aby określić ich potencjał w zakresie wywoływania wszelkich niebezpiecznych lub niepożądanych skutków u ludzi i zwierząt w wyniku ich prawidłowego i nieprawidłowego zastosowania, produkcji, jak również w zakresie powodowania potencjalnego lub rzeczywistego zanieczyszczenia środowiska. |
|
(v) |
Produkcja rutynowa obejmuje produkcję przeciwciał monoklonalnych (metodą wodobrzusza) i produktów z krwi, łącznie z surowicą odpornościową poliklonalną, ustalonymi metodami. Wyłącza się tu immunizację zwierząt dla celów produkcji hybrydomy, która powinna być ujęta w kategorii badań podstawowych lub stosowanych w ramach odpowiedniej kategorii. |
14. Badania wymagane przepisami
|
(i) |
Wymóg prawny należy zgłaszać według zamierzonego podstawowego wykorzystania. |
|
(ii) |
Jakość wody: jeśli dotyczy np. wody z kranu, należy zgłosić w ramach prawodawstwa dotyczącego żywności. |
15. Wymogi prawne
|
(i) |
Kategoria ta umożliwia określenie stopnia harmonizacji między różnymi wymogami prawnymi. Czynnikiem decydującym nie jest kategoria podmiotu wnioskującego o przeprowadzenie badania, lecz kategoria prawodawstwa, którego wymogi będą spełnione, przy czym należy priorytetowo traktować jak najszerszy poziom harmonizacji. |
|
(ii) |
W przypadku gdy podstawą dla ustawodawstwa krajowego jest prawodawstwo UE, należy wybrać kategorię Prawodawstwo spełniające wymogi UE. |
|
(iii) |
Kategoria Prawodawstwo spełniające wymogi UE obejmuje również wszelkie wymogi międzynarodowe, które jednocześnie spełniają wymogi UE (takie jak badania spełniające wymogi zawarte w wytycznych ICH, VICH, OECD, monografiach Farmakopei Europejskiej). |
|
(iv) |
Kategorię Prawodawstwo spełniające jedynie wymogi krajowe (w ramach UE) należy wybierać jedynie wówczas, gdy badanie jest przeprowadzane w celu spełnienia wymogów jednego lub większej liczby państw członkowskich; niekoniecznie tego, w którym prowadzone są prace. Nie istnieje jednak równoważny wymóg w UE. |
|
(v) |
Kategorię Prawodawstwo spełniające jedynie wymogi prawodawstwa spoza UE należy wybrać, gdy nie istnieje równoważny wymóg przeprowadzenia badania w celu spełnienia wymogów UE. |
16. Kontrola jakości (w tym testowanie bezpieczeństwa i aktywności biologicznej serii)
Badanie bezpieczeństwa serii wyklucza badanie gorączkotwórczości. Zgłasza się je w odrębnej kategorii Badanie gorączkotwórczości.
17. Badania toksyczności i inne badania bezpieczeństwa według typu badania
|
(i) |
Badania z zakresu immunotoksykologii należy zgłaszać w kategorii Badanie toksyczności dawki powtarzalnej. |
|
(ii) |
Kinetyka (farmakokinetyka, toksykokinetyka, badania dotyczące zanikania pozostałości) – jeżeli badanie z zakresu toksykokinetyki jest przeprowadzane jako część wymaganego do rejestracji wniosku badania toksyczności dawki powtarzalnej, to należy je zgłosić jako Badanie toksyczności dawki powtarzalnej. |
|
(iii) |
Badania nad bezpieczeństwem żywności i paszy obejmują badania wody pitnej (w tym badania w zakresie bezpieczeństwa zwierząt docelowych). |
|
(iv) |
Badania w zakresie bezpieczeństwa zwierząt docelowych to badania mające zapewnić bezpieczne stosowanie produktu przeznaczonego dla konkretnych zwierząt w odniesieniu do tego gatunku (z wyłączeniem badań bezpieczeństwa serii, które są objęte badaniami kontroli jakości). |
18. Badania toksyczności ostrej i podostrej
19. Toksyczność dla dawki powtarzanej
20. Wykorzystywanie zwierząt do produkcji regulowanej według rodzaju produktu
21. Ekotoksyczność
C. SEKCJA OPISOWA DLA DANEGO PAŃSTWA CZŁONKOWSKIEGO
|
1. |
Ogólne informacje na temat wszelkich zmian w tendencjach zaobserwowane od poprzedniego okresu sprawozdawczego. |
|
2. |
Informacje na temat istotnego wzrostu lub spadku wykorzystania zwierząt w każdym z poszczególnych obszarów i analiza przyczyn. |
|
3. |
Informacje dotyczące wszelkich zmian w tendencjach w zakresie rzeczywistej dotkliwości i analiza przyczyn. |
|
4. |
Szczególne starania na rzecz rozpowszechnienia zasady zastąpienia, ograniczenia i udoskonalenia wykorzystywania zwierząt i ich wpływ na statystyki, jeśli taki ma miejsce. |
|
5. |
Dodatkowe informacje na temat korzystania z kategorii »Inne«, jeśli znaczna część wykorzystywanych zwierząt jest zgłaszana w tej kategorii. |
|
6. |
Szczegółowe informacje na temat przypadków, w których dotkliwość procedury przekroczyła kategorię »dotkliwa«, niezależnie od tego, czy udzielono na to wcześniej zezwolenia czy nie, obejmujące informacje na temat gatunków i liczby zwierząt oraz ewentualnego przyznania odstępstwa, szczegółowe informacje dotyczące wykorzystania i powody, dla których dotkliwość procedury przekroczyła kategorię »dotkliwa«.” |