1992L0065 — PL — 03.07.2004 — 007.002
Dokument ten służy wyłącznie do celów dokumentacyjnych i instytucje nie ponoszą żadnej odpowiedzialności za jego zawartość
zmienione przez:
zmienione przez:
▼B
DYREKTYWA RADY 92/65/EWG
z dnia 13 lipca 1992 r.
ustanawiająca wymagania dotyczące zdrowia zwierząt regulujące handel i przywóz do Wspólnoty zwierząt, nasienia, komórek jajowych i zarodków nieobjętych wymaganiami dotyczącymi zdrowia zwierząt ustanowionymi w szczególnych zasadach Wspólnoty określonych w załączniku A pkt I do dyrektywy 90/425/EWG
RADA WSPÓLNOT EUROPEJSKICH,
uwzględniając Traktat ustanawiający Europejską Wspólnotę Gospodarczą, w szczególności jego art. 43,
uwzględniając wniosek Komisji (
1
),
uwzględniając opinię Parlamentu Europejskiego (
2
),
uwzględniając opinię Komitetu Ekonomiczno-Społecznego (
3
),
a także mając na uwadze, co następuje:
żywe zwierzęta i produkty pochodzenia zwierzęcego są umieszczone w wykazie produktów zawartym w załączniku II do Traktatu; wprowadzanie do obrotu takich zwierząt i produktów stanowi źródło dochodu dla części ludności rolniczej;
w celu zapewnienia racjonalnego rozwoju w tym sektorze i zwiększenia wydajności przepisy dotyczące zdrowotności zwierząt i produktów pochodzenia zwierzęcego należy ustanowić na poziomie wspólnotowym;
Wspólnota musi przyjąć środki zmierzające stopniowo w okresie do dnia 31 grudnia 1992 r. do ustanowienia wewnętrznego rynku;
ze względu na wyżej wymienione cele Rada ustanowiła przepisy dotyczące zdrowotności zwierząt mające zastosowanie do bydła, trzody chlewnej, owiec i kóz, zwierząt z rodziny koniowatych, drobiu i jaj wylęgowych, ryb i produktów rybnych, małży dwuskorupowych, nasienia buhajów i knurów, zarodków owczych, świeżego mięsa, mięsa drobiowego, produktów mięsnych, dziczyzny i mięsa króliczego;
należy przyjąć przepisy dotyczące zdrowotności zwierząt odnoszące się do wprowadzania do obrotu zwierząt i produktów pochodzenia zwierzęcego nie objętych wcześniej wyżej wspomnianymi przepisami;
należy przewidzieć stosowanie niniejszej dyrektywy bez uszczerbku dla rozporządzenia Rady (EWG) nr 3626/82 z dnia 3 grudnia 1982 r. w sprawie wprowadzenia we Wspólnocie Konwencji o międzynarodowym handlu zagrożonymi gatunkami dzikiej fauny i flory (
4
);
jeżeli chodzi o pewne względy techniczne, należy odnieść się do dyrektywy Rady 64/432/EWG z dnia 26 czerwca 1964 r. sprawie problemów zdrowotnych zwierząt wpływających nahandel wewnątrzwspólnotowy bydłem i trzodą chlewną (
5
), oraz do dyrektywy 85/511/EWG z dnia 18 listopada 1985 r. wprowadzającej wspólnotowe środki zwalczania pryszczycy (
6
);
w odniesieniu do organizacji kontroli i ich przebiegu, jak również środków ochronnych które zostaną wprowadzone w życie, należy odnieść się do ogólnych zasad ustanowionych w dyrektywie Rady 90/425/EWG z dnia 26 czerwca 1990 r. dotycząca kontroli weterynaryjnych i zootechnicznych mających zastosowanie w handlu wewnątrzwspólnotowym niektórymi żywymi zwierzętami i produktami mając na względzie wprowadzenie rynku wewnętrznego (
7
);
z zastrzeżeniem odmiennych przepisów, handel zwierzętami i produktami pochodzenia zwierzęcego musi zostać zliberalizowany, bez uszczerbku dla uciekania się do ewentualnych środków ochronnych;
uwzględniając ryzyko rozprzestrzeniania się chorób na jakie narażone są zwierzęta, należy sprecyzować konkretne wymogi w stosunku do niektórych zwierząt i produktów pochodzenia zwierzęcego nakładane z chwilą wprowadzenia tych zwierząt i produktów do obrotu w celach handlowych, w szczególności jeśli kierowane są do regionów posiadających dobry status zdrowotny;
specyficzna sytuacja typowa dla Zjednoczonego Królestwa Wielkiej Brytanii i Irlandii Północnej, biorąc pod uwagę wyspiarskie położenie tych krajów oraz fakt, że były wolne od wścieklizny przez znaczny okres czasu, uzasadnia konkretne przepisy mające na celu zagwarantowanie, że wprowadzenie do obrotu w Zjednoczonym Królestwie i Irlandii psów i kotów, które nie pochodzą z tych krajów, nie niesie ryzyka wprowadzenia wścieklizny do tych państw, jednakże pozostaje bez wpływu na zniesienie kontroli weterynaryjnych na granicach między Państwami Członkowskimi;
świadectwo zdrowia jest najbardziej właściwym sposobem zagwarantowania i monitorowania zgodności z tymi wymogami;
aby utrzymać sytuację zdrowotną we Wspólnocie przy jednoczesnym wprowadzeniu do obrotu zwierząt i produktów pochodzenia zwierzęcego określonych w niniejszej dyrektywie, powinny one podlegać minimalnym wymaganiom ustanowionym dla handlu, oraz zgodności z nimi monitorowanej zgodnie z zasadami i przepisami ustanowionymi w dyrektywie Rady 90/675/EWG z dnia 10 grudnia 1990 r. ustanawiającej zasady regulujące organizację kontroli weterynaryjnych produktów wprowadzanych do Wspólnoty z państw trzecich (
8
);
należy wprowadzić procedurę ustanawiającą bliską współpracę między Komisją a Państwem Członkowskim w ramach Stałego Komitetu Weterynaryjnego;
ostateczny termin transpozycji do prawa krajowego, ustalony na dzień 1 stycznia 1994 r. w art. 29, nie powinien mieć wpływu na zniesienie kontroli weterynaryjnych na granicach w dniu 1 stycznia 1993 r.,
PRZYJMUJE NINIEJSZĄ DYREKTYWĘ:
ROZDZIAŁ 1
Przepisy ogólne
Artykuł 1
▼M7
Niniejsza dyrektywa ustanawia wymogi zdrowia zwierząt regulujące handel i przywóz do Wspólnoty zwierząt, nasienia, komórek jajowych i zarodków, które nie zostały objęte warunkami zdrowia zwierząt ustanowionymi w szczególnych aktach Wspólnoty określonych w załączniku F.
▼B
Niniejszą dyrektywę stosuje się bez uszczerbku dla przepisów przyjętych zgodnie z rozporządzeniem (EWG) nr 3626/82.
Niniejsza dyrektywa nie ma wpływu na przepisy prawa krajowego stosowane do zwierząt domowych, aczkolwiek utrzymanie tych przepisów nie może zagrozić zniesieniu kontroli weterynaryjnych na granicach między Państwami Członkowskimi.
Artykuł 2
1. Do celów niniejszej dyrektywy:
a) „handel” oznacza handel jak określono w art. 2 ust. 3 dyrektywy 90/425/EWG;
b) „zwierzęta” oznaczają okazy gatunków zwierząt innych niż te wymienione w dyrektywach 64/432/EWG, 90/426/EWG (
9
), 90/539/EWG (
10
), 91/67/EWG (
11
), 91/68/EWG (
12
), 91/492/EWG (
13
) oraz 91/493/EWG (
14
);
c) „zatwierdzona jednostka, instytut lub ośrodek” oznacza wszelkie stałe, geograficznie ograniczone zakłady, zatwierdzone zgodnie z art. 13, w których na stałe trzyma się, lub hoduje, zwierzęta z jednego lub kilku gatunków, w celach handlowych lub nie, i wyłącznie do jednego lub kilku z następujących celów:
— wystawy zwierząt i edukacja społeczeństwa,
— badania naukowe podstawowe lub stosowane, lub hodowla zwierząt do celów takich badań,
d) „choroby podlegające obowiązkowi zgłaszania” oznaczają choroby wymienione w załączniku A.
2. Ponadto definicje inne niż te dotyczące zatwierdzonych ośrodków i jednostek, zawarte w art. 2 dyrektyw 64/432/EWG, 91/67/EWG oraz 90/539/EWG, obowiązują mutatis mutandis.
ROZDZIAŁ II
Przepisy mające zastosowanie w handlu
Artykuł 3
Państwa Członkowskie zapewniają, że nie zakazuje się ani nie ogranicza handlu określonego w art. 1 akapit pierwszy, z powodów związanych ze zdrowiem zwierząt, innych niż te wynikające ze stosowania niniejszej dyrektywy lub prawodawstwa wspólnotowego, w szczególności wszelkich podjętych środków ochronnych.
▼A1
Do czasu podjęcia wspólnotowych postanowień tym zakresie, Szwecja może utrzymywać swoje krajowe zasady w odniesieniu do węży i innych gadów wysyłanych do niej.
▼B
Artykuł 4
Państwa Członkowskie podejmują konieczne środki, aby zapewnić, że do celów zastosowania art. 4 ust. 1 lit. a) dyrektywy 90/425/EWG, zwierzęta określone w art. 5-10 niniejszej dyrektywy mogą, bez uszczerbku dla art. 13 i dla szczególnych przepisów, jakie mają zostać przyjęte w związku z wprowadzeniem w życie art. 24, być przedmiotem handlu tylko wówczas, gdy spełniają warunki ustanowione w art. 5-10, oraz gdy pochodzą z gospodarstw lub przedsiębiorstw wymienionych w art. 12 ust. 1 i 3 niniejszej dyrektywy, zarejestrowanych przez właściwy organ i podejmujących się:
— poddawania posiadanych zwierząt regularnym badaniom zgodnie z art. 3 ust. 3 dyrektywy 90/425/EWG,
— powiadamiania właściwego organu o ogniskach chorób podlegających obowiązkowi zgłoszenia, a także o ogniskach chorób wymienionych w załączniku B dla których zainteresowane Państwo Członkowskie przygotowało program zwalczania lub program monitorowania,
— przestrzegania szczególnych krajowych środków dotyczących zwalczania choroby, która ma szczególne znaczenie dla danego Państwa Członkowskiego i jest objęta programem sporządzonym zgodnie z art. 14, lub decyzją zgodną z art. 15 ust. 2,
— wprowadzenia do obrotu do celów handlu tylko takimi zwierzętami, które nie wykazują objawów choroby, i które pochodzą z gospodarstw lub obszarów nie podlegających żadnemu zakazowi z powodów związanych ze zdrowiem zwierząt i odnośnie do zwierząt, którym nie towarzyszy świadectwo zdrowia, lub dokument handlowy przewidziany w art. 5-11, jedynie zwierząt, którym towarzyszy zaświadczenie od podmiotu stwierdzającego, że w czasie wysyłki dane zwierzęta nie wykazywały widocznych objawów chorobowych i że jego gospodarstwo nie podlega żadnym ograniczeniom związanym ze zdrowiem zwierząt,
— spełniania wymogów zapewniających dobrostan zwierząt hodowlanych.
Artykuł 5
1. Państwa Członkowskie zagwarantują, że handel małpami człekokształtnymi (simiae i prosimiae) ogranicza się wyłącznie do zwierząt przesyłanych z i do jednostki, instytutu lub ośrodka zatwierdzonego przez właściwe władze Państw Członkowskich zgodnie z art. 13, oraz że zwierzętom tym towarzyszy świadectwo weterynaryjne odpowiadające wzorowi podanemu w załączniku E, z deklaracją wypełnioną przez urzędowego lekarza weterynarii w jednostce, instytucie, lub ośrodku pochodzenia zwierzęcia, w celu zagwarantowania zdrowia tych zwierząt.
2. Właściwy organ Państwa Członkowskiego może na zasadzie odstępstwa od ust. 1, zezwolić na nabycie małp człekokształtnych należących do osób prywatnych przez zatwierdzone jednostkę, instytut lub ośrodek.
Artykuł 6
A. Bez uszczerbku dla art. 14 i 15, Państwa Członkowskie zapewniają, aby zwierzęta kopytne z gatunków innych niż te wymienione w dyrektywach 64/432/EWG, 90/426/EWG i 91/68/EWG mogły być przedmiotem handlu jedynie wówczas, gdy spełniają następujące wymagania:
1) ogólne:
a) muszą być zidentyfikowane zgodnie z art. 3 ust. 1 lit. c) dyrektywy 90/426/EWG;
b) nie mogą być przeznaczone na ubój zgodnie z programem mającym na celu zwalczenie choroby zakaźnej;
c) nie mogły być szczepione przeciwko pryszczycy oraz muszą spełniać odnośne wymogi dyrektywy 85/511/EWG i art. 4a dyrektywy 64/432/EWG;
d) muszą pochodzić z gospodarstwa określonego w art. 3 ust. 2 lit. b) i c) dyrektywy 64/432/EWG, które nie jest przedmiotem środków zdrowia zwierząt, w szczególności środków podjętych zgodnie z dyrektywami 85/511/EWG, 80/217/EWG (
15
) i 91/68/EWG i były w nim trzymane na stałe od chwili narodzin, lub przez ostatnich trzydzieści dni przed wysyłką;
▼M7
e) musi im towarzyszyć świadectwo odpowiadające wzorowi podanemu w załączniku E część 1, zawierające następującą deklarację:

▼M7 —————
▼B
2) W przypadku przeżuwaczy:
a) muszą one pochodzić ze stada urzędowo wolnego od gruźlicy i urzędowo wolnego od brucelozy zgodnie z dyrektywą 64/432/EWG i dyrektywą 91/68/EWG oraz spełniać, jeśli chodzi o przepisy dotyczące zdrowia zwierząt, odnośne wymogi ustalone dla gatunków bydła w art. 3 ust. 2 lit. c), d), f), g) i h) dyrektywy 64/432/EWG, lub art. 3 dyrektywy 91/68/EWG;
▼M7
b) jeżeli zwierzęta nie pochodzą ze stada spełniającego warunki ustanowione w lit. a), muszą one pochodzić z gospodarstwa, w którym nie notowano przypadków brucelozy lub gruźlicy w ciągu 42 dni poprzedzających załadunek zwierząt i w którym przeżuwacze poddane były, w ciągu 30 dni poprzedzających załadunek, testom z wynikami negatywnymi na gruźlicę i brucelozę;
▼A1
c) zgodnie z procedurą ustanowioną w art. 26, można przyjąć przepisy dotyczące białaczki.
▼B
3) W przypadku świniowatych:
a) nie mogą pochodzić z obszaru podlegającego zakazom związanym z obecnością afrykańskiego pomoru świń zgodnie z art. 9a dyrektywy 64/432/EWG;
b) muszą pochodzić z gospodarstwa, które nie jest przedmiotem jakichkolwiek ograniczeń, określonych w dyrektywie 80/217/EWG, z powodu klasycznego pomoru świń;
c) muszą pochodzić z gospodarstwa wolnego od brucelozy zgodnie z dyrektywą 64/432/EWG oraz spełniać odnośne warunki co zdrowia zwierząt, ustanowione dla trzody chlewnej w dyrektywie 64/432/EWG;
d) jeśli zwierzęta nie pochodzą ze stada spełniającego warunki ustalone w lit. c), w ciągu 30 dni poprzedzających załadunek, muszą zostać poddane testowi opracowanemu pod kątem wykazywania braku przeciwciał na brucelozę, z wynikami ujemnymi.
▼M7 —————
▼M7
4) Wymogi dotyczące testów określone w niniejszym artykule oraz ich kryteria mogą być ustanowione zgodnie z procedurą przewidzianą w art. 26. Decyzje te uwzględniają przypadki przeżuwaczy hodowanych w regionach arktycznych Wspólnoty.
Do czasu podjęcia decyzji przewidzianych w poprzednim akapicie nadal stosuje się przepisy krajowe.
▼B
B. W dyrektywie 64/432/EWG wprowadza się następujące zmiany:
1) W art. 2 lit. b) i c) wyrazy „bydło” zastępuje się wyrazami „zwierzęta z gatunku bydła (wraz z Bubalus bubalus)”
2) Dodaje się artykuł w brzmieniu:
„Artykuł 10a
Zgodnie z procedurą przewidzianą w art. 12 świadectwa zdrowia, których wzory podano w załączniku F, można zmieniać lub uzupełniać, szczególnie celem uwzględnienia wymogów zawartych w art. 6 dyrektywy 92/65/EWG”
.
Artykuł 7
A. Państwa Członkowskie zapewniają, aby ptaki inne niż te określone w dyrektywie 90/539/EWG mogły być przedmiotem handlu jedynie wówczas, gdy spełniają następujące wymogi:
1) co do zasady muszą:
a) pochodzić z gospodarstwa, w którym na 30 dni przed wysyłką nie zdiagnozowano influenzy drobiu;
b) pochodzić z gospodarstwa, lub obszaru, nie podlegającego jakimkolwiek ograniczeniom wynikającym ze środków stosowanych w zwalczaniu rzekomego pomoru drobiu.
Do czasu wdrożenia środków wspólnotowych określonych w art. 19 dyrektywy 90/539/EWG, przy zwalczaniu rzekomego pomoru drobiu obowiązują nadal wymogi krajowe, zgodnie z ogólnymi przepisami Traktatu;
c) muszą uprzednio, zgodnie z art. 10 ust. 1 tiret trzecie dyrektywy 91/496/EWG przejść kwarantannę, jeśli przywożono je z państwa trzeciego, w gospodarstwie, do którego zostały zabrane po wwiezieniu na terytorium Wspólnoty;
2) ponadto ptaki z rodziny papug:
a) nie mogą pochodzić z gospodarstwa, ani też pozostawać w kontakcie ze zwierzętami pochodzącymi z gospodarstwa, w którym zdiagnozowano chorobę papuzią (Chlamydia psittaci).
Okres obowiązywania zakazu od czasu ostatniego zanotowanego przypadku oraz okres leczenia pod nadzorem weterynaryjnym, uznanym zgodnie z procedurą przewidzianą w art. 26, musi wynosić przynajmniej dwa miesiące;
b) muszą być identyfikowane zgodnie z art. 3 ust. 1 lit. c) dyrektywy 90/425/EWG.
Metodę identyfikacyjną ptaków z rodziny papug, szczególnie chorych ptaków z rodziny papug, ustala się zgodnie z procedurą przewidzianą w art. 26;
c) musi im towarzyszyć dokument handlowy podpisany przez urzędowego lekarza weterynarii lub lekarza weterynarii odpowiedzialnego za gospodarstwo lub przedsiębiorstwo, z którego pochodzą zwierzęta, i upoważnionego do tego celu przez właściwy organ.
B. W art. 2 ust. 2 akapit drugi dyrektywy Rady 91/495/EWG z dnia 27 listopada 1990 r. dotyczącej zdrowia publicznego i problemów zdrowotnych zwierząt wpływających na produkcję i wprowadzanie do obrotu mięsa króliczego oraz dziczyzny hodowlanej (
16
), słowa „i bezgrzebieniowce (Ratitae)” dodaje się w trzecim wierszu po słowach „dyrektywa 90/538/EWG”.
W art. 2 ust. 2 pkt 1 Rady 90/539/EWG z dnia 15 października 1990 r. w sprawie wymagań dotyczących zdrowia zwierząt regulujących handel wewnątrzwspólnotowy i przywóz z państw trzecich drobiu i jaj wylęgowych (
17
), wyrazy „i bezgrzebieniowce (Ratitae)” wprowadza się po wyrazach „i kuropatwy”.
Artykuł 8
Państwa Członkowskie zapewniają, aby pszczoły (Apis melifera) mogły być przedmiotem handlu jedynie wówczas, gdy spełniają następujące warunki:
a) pochodzą z obszaru, który nie podlega zakazom związanym z występowaniem zgnilca amerykańskiego.
Okres obowiązywania zakazu musi wynosić, co najmniej 30 dni od stwierdzenia ostatniego przypadku, i od dnia, w którym wszystkie ule, w obrębie promienia trzech kilometrów, zostały sprawdzone przez właściwy organ i wszystkie zainfekowane ule zostały spalone lub też poddane odpowiednim zabiegom i inspekcji aż do spełnienia wymogów właściwego organu.
Zgodnie z procedurą przewidzianą w art. 26, i po konsultacji z Naukowym Komitetem Weterynaryjnym, wymogi obowiązujące dla pszczół (Apis melifera) lub wymogi im równoważne mogą obowiązywać dla trzmieli;
b) towarzyszy im świadectwo zdrowia, zgodne ze wzorem podanym z załączniku E, z deklaracją wypełnioną przez właściwy organ w celu poświadczenia, że wymogi ustalone w lit. a) zostały spełnione.
Artykuł 9
1. Państwa Członkowskie zapewniają, aby zwierzęta zającowate mogły być przedmiotem handlu tylko wówczas, gdy spełniają następujące wymogi:
a) nie mogą pochodzić, ani mieć kontaktu ze zwierzętami pochodzącymi z gospodarstwa, w którym panuje wścieklizna, lub podejrzewa się że panowała tam przez ostatni miesiąc;
b) muszą pochodzić z gospodarstwa, w którym żadne zwierzę nie wykazuje klinicznych objawów myksomatozy królików.
2. Państwa Członkowskie, które wymagają świadectwa zdrowia dla przemieszczania się na ich terytorium zwierząt zającowatych, mogą wymagać aby wysyłanym do nich zwierzętom towarzyszyło świadectwo zdrowia odpowiadające wzorowi podanemu w załączniku E, uzupełnione o następującą deklarację:
„Ja, niżej podpisany,…, zaświadczam, że powyższa przesyłka spełnia wymogi art. 9 dyrektywy 92/65/EWG i że przewożone zwierzęta nie wykazywały podczas badania żadnych klinicznych objawów choroby”
.
Świadectwo takie musi być wydane przez urzędowego lekarza weterynarii lub przez lekarza weterynarii odpowiedzialnego za dane gospodarstwo pochodzenia zwierząt i upoważnionego do tego celu przez właściwy organ, a dla zwierząt z hodowli przemysłowej, przez urzędowego lekarza weterynarii. Państwa Członkowskie zamierzające skorzystać z tej opcji powiadamiają o tym Komisję, która musi zagwarantować, że wymogi ustalone w akapicie pierwszym zostały spełnione.
3. Irlandia oraz Zjednoczone Królestwo mogą wymagać przedłożenia świadectwa zdrowia gwarantującego, że wymogi ustanowione w ust. 1 lit. a) zostały spełnione.
Artykuł 10
1. Państwa Członkowskie gwarantują obowiązywanie zakazu handlu
►M5
————— ◄ norkami i lisami, które pochodzą lub miały kontakt ze zwierzętami pochodzącymi z gospodarstwa, w którym panuje wścieklizna, lub podejrzewa się, że panowała tam przez ostatnie sześć miesięcy, ponieważ nie stosowano programu systematycznych szczepień.
▼M5
2. Aby być przedmiotem handlu, psy, koty i fretki muszą spełniać wymogi określone w art. 5 i 16 rozporządzenia (WE) nr 998/2003 Parlamentu Europejskiego i Rady z dnia 26 maja 2003 r. w sprawie wymogów dotyczących zdrowia zwierząt stosowanych do przemieszczania zwierząt domowych o charakterze niehandlowym i zmieniające dyrektywę Rady 92/65/EWG (
18
).
Świadectwo posiadane przez zwierzęta musi również stwierdzać, że na 24 godziny przed wysyłką zwierząt, przeprowadzone zostało badanie kliniczne przez lekarza weterynarii upoważnionego przez właściwe władze, które wykazało, że zwierzęta są zdrowe i mogą odbyć podróż do swojego miejsca miejsce przeznaczenia.
3. W drodze odstępstwa od ust. 2, jeżeli handel skierowany jest do Irlandii, Zjednoczonego Królestwa lub Szwecji, psy, koty i fretki podlegają warunkom określonym w art. 6 i 16 rozporządzenia (WE) nr 998/2003.
Świadectwo posiadane przez zwierzęta musi również stwierdzać, że na 24 godziny przed wysyłką zwierząt przeprowadzone zostało badanie kliniczne przez lekarza weterynarii upoważnionego przez właściwe władze, które wykazało, że zwierzęta są zdrowe i mogą odbyć podróż do swojego miejsca miejsce przeznaczenia.
▼A2
4. Irlandia, Cypr, Malta oraz Zjednoczone Królestwo mogą, nie naruszając przepisów ust. 2 i 3, utrzymać krajowe regulacje dotyczące kwarantanny obejmującej wszystkie ssaki mięsożerne,
►M5
z wyjątkiem gatunków określonych w ust. 2 i 3, ◄ ssaki z rzędu naczelnych, nietoperze oraz inne zwierzęta, u których możliwe jest wystąpienie wścieklizny, objęte przez niniejszą dyrektywę, jeżeli w stosunku do powyżej wymienionych zwierząt nie można wykazać, iż urodziły się w gospodarstwie pochodzenia i od urodzenia były przetrzymywane w zamknięciu, choć utrzymanie tych regulacji nie może przeszkodzić w zniesieniu kontroli weterynaryjnej na granicach pomiędzy Państwami Członkowskimi.
▼B
5. W decyzji 90/638/EWG wprowadza się następujące zmiany:
1) w art. 1 dodaje się tiret w brzmieniu:
„— dla programów zwalczania wścieklizny: kryteria wymienione w załączniku III”
,
2) dodaje się załącznik w brzmieniu:
„ZAŁĄCZNIK III
Kryteria dla programów zwalczania wścieklizny
Programy zwalczania wścieklizny zawierają przynajmniej:
a) kryteria wymienione w pkt 1-7 załącznika 1;
b) szczegółowe informacje dotyczące regionu lub regionów, w których ma się odbyć immunizacja lisów metodą doustną i naturalne granice tego przedsięwzięcia. Ten region lub regiony musi obejmować przynajmniej 6 000 km2, lub całkowity obszar Państwa Członkowskiego i może obejmować przyległe obszary państwa trzeciego;
c) szczegółowe informacje dotyczące wykorzystywanych szczepionek, systemu dystrybucji, gęstości i częstotliwości wykładania przynęt;
d) w miarę potrzeb, wszystkie szczegóły, koszt i cel projektów ochrony i zachowania flory i fauny podjętych przez organizacje dobrowolne na terytorium objętym takimi projektami.”
6. Rada, stanowiąc większością kwalifikowaną na wniosek Komisji, tworzy specjalny instytut celem ustanowienia kryteriów koniecznych dla normalizacji testów serologicznych i decyduje o jego obowiązkach.
7. Państwa Członkowskie zapewniają, aby koszty stosowania testów serologicznych ponosili importerzy.
▼M5 —————
▼A1
Artykuł 10a
W odniesieniu do wścieklizny i zgodnie z procedurą ustanowioną w art. 26, po przedstawieniu odpowiedniej podstawy, art. 9 i 10 zostaną zmienione, biorąc pod uwagę sytuację w Finlandii i Szwecji w celu zastosowania do nich tych samych postanowień jakie są stosowane do Państw Członkowskich, znajdujących się w takiej samej sytuacji.
▼B
Artykuł 11
1. Państwa Członkowskie zapewniają, aby bez uszczerbku dla decyzji, jakie mają zostać podjęte przy wykonaniu art. 21 i 23, przedmiotem handlu były jedynie: nasienie, komórki jajowe i zarodki spełniające wymogi ustalone w ust. 2, 3 i 4.
2. Bez uszczerbku dla wszelkich kryteriów jakich należy spełniać przy wpisywaniu zwierząt koniowatych do ksiąg rodowodowych dla niektórych specyficznych ras, nasienie zwierząt z gatunku owiec, kóz i koni, musi:
— zostać zebrane i poddane obróbce w celu sztucznej zapłodnienia w stacji uznanej z punktu widzenia zdrowotności zgodnie z załącznikiem D rozdział I, lub w przypadku owiec i kóz, na zasadzie odstępstwa od powyższego, w gospodarstwie spełniającym wymogi dyrektywy 91/68/EWG,
— zostać pobrane od zwierząt spełniających warunki ustalone w załączniku D rozdział II (przyjęcie i rutynowe badania zwierząt)
— zostać pobrane, poddane obróbce i konserwowane zgodnie z załącznikiem D rozdział III;
— być przewożone do innego Państwa Członkowskiego wraz ze świadectwem zdrowia odpowiadającym wzorowi ustalanemu zgodnie z procedurą przewidzianą w art. 26.
3. Komórki jajowe i zarodki zwierząt z gatunku owiec/kóz i koni oraz trzody chlewnej muszą:
— zostać pobrane przez zespół pobierający zatwierdzony przez właściwy organ Państwa Członkowskiego i poddane obróbce we właściwym laboratorium oraz pochodzić od dawczyń spełniających warunki ustalone w załączniku D rozdział IV,
— być traktowane i przechowywane zgodnie z załącznikiem D rozdział III,
— być przewożone do innego Państwa Członkowskiego wraz ze świadectwem zdrowia odpowiadającym wzorowi ustalanemu zgodnie z procedurą przewidzianą w art. 26.
Nasienie użyte do zapłodnienia dawczyni musi spełniać przepisy ust. 2 w przypadku owiec, kóz, i koni, oraz przepisy dyrektywy 90/429/EWG dla trzody chlewnej. Wszelkie dodatkowe gwarancje można ustalać zgodnie z procedurą przewidzianą w art. 26.
4. Przed dniem 31 grudnia 1997 r. Komisja przedłoży sprawozdanie wraz z odpowiednimi wnioskami w sprawie wdrożenia niniejszego artykułu szczególnie w świetle rozwoju naukowego i technologicznego.
Artykuł 12
1. Przepisy dotyczące kontroli ustanowionych dyrektywą 90/425/EWG obowiązują, w szczególności w odniesieniu do organizacji kontroli i jej przebiegu, w stosunku do zwierząt, nasienia, komórek jajowych i zarodków objętych niniejszą dyrektywą, którym towarzyszy świadectwo zdrowia. Inne zwierzęta muszą pochodzić z gospodarstw podlegających zasadom tej dyrektywy, jeśli chodzi o kontrole w miejscu pochodzenia i przeznaczenia.
2. Artykuł 10 dyrektywy 90/425/EWG stosuje się w stosunku do zwierząt, nasienia, komórek jajowych i zarodków objętych niniejszą dyrektywą.
3. Do celów handlowych, zastosowanie art. 12 dyrektywy 90/425/EWG obejmuje dodatkowo pośredników, trzymających na stałe lub okazjonalnie zwierzęta wymienione w art. 7, 9 i 10.
4. Komunikacja z miejscem przeznaczenia, jak przewidziano w art. 4 ust. 2 dyrektywy 90/425/EWG odbywa się, odnośnie do zwierząt, nasienia, komórek jajowych i zarodków, którym towarzyszy świadectwo zdrowia, zgodnie z niniejszą dyrektywą przy użyciu systemu Animo.
5. Bez uszczerbku dla szczególnych przepisów niniejszej dyrektywy, jeśli zachodzi podejrzenie, że niniejsza dyrektywa nie jest przestrzegana lub, jeśli istnieją wątpliwości co do zdrowia zwierząt, albo jakości nasienia, komórek jajowych i zarodków wymienionych w art. 1, właściwy organ przeprowadza wszelkie kontrole jakie uzna za stosowne.
6. Państwa Członkowskie podejmują odpowiednie środki administracyjne lub karne w celu karania wszelkich naruszeń niniejszej dyrektywy, szczególnie jeśli okazuje się, że sporządzone świadectwa lub dokumenty nie odpowiadają rzeczywistemu stanowi zwierząt określonych w art. 1, że identyfikacja tych zwierząt, lub oznakowanie nasienia, komórek jajowych i zarodków, nie spełniają wymogów niniejszej dyrektywy lub że zwierzęta bądź produkty, o których mowa, nie przeszły kontroli przewidzianych w niniejszej dyrektywie.
Artykuł 13
1. Handel zwierzętami z gatunków podatnych na choroby wymienione w załączniku A lub na choroby wymienione w załączniku B, jeśli Państwo Członkowskie miejsca przeznaczenia stosuje gwarancje przewidziane w art. 14 i 15, oraz handel nasieniem, komórkami jajowymi i zarodkami tych zwierząt wysyłanych do i z jednostek, instytutów i ośrodków, podlega obowiązkowi okazania dokumentu przewozowego odpowiadającego wzorowi podanemu w załączniku E. Dokument ten, który musi być wypełniony przez lekarza weterynarii odpowiedzialnego za jednostkę, instytut, lub ośrodek pochodzenia, musi stwierdzać, że zwierzęta, nasienie, komórki jajowe lub zarodki pochodzą z jednostki, instytutu, lub ośrodka zatwierdzonego zgodnie z załącznikiem C i muszą im towarzyszyć podczas transportu.
2.
a) Aby uzyskać zatwierdzenie, jednostka, instytut lub ośrodek przedkładają właściwemu organowi w danym Państwie Członkowskim wszelkie stosowne dokumenty towarzyszące odnoszące się do wymogów zawartych w załączniku C odnośnie do chorób podlegających obowiązkowi zgłoszenia.
b) Po otrzymaniu akt dotyczących wniosku o zatwierdzenie, lub odnowienie zatwierdzenia, właściwy organ bada je w świetle informacji jakie zawierają i, w miarę potrzeb, wyników testów przeprowadzanych na miejscu.
c) Właściwy organ wycofuje zgodę na zatwierdzenie zgodnie z pkt 3 załącznika C.
d) Każde Państwo Członkowskie przesyła do Komisji wykaz zatwierdzonych jednostek, instytutów i ośrodków, wraz ze wszelkimi zmianami dokonanymi w tym wykazie. Komisja przekazuje te informacje innym Państwom Członkowskim.
▼A1
e) Szwecja będzie miała okres dwóch lat od daty wejścia w życie Traktatu o Przystąpieniu na wprowadzenie w życie ustanowionych środków w odniesieniu do organów, instytutów i centrów.
▼B
Artykuł 14
1. Jeśli Państwo Członkowskie sporządza lub sporządziło, bezpośrednio lub poprzez hodowców, dobrowolny lub obowiązkowy program zwalczania lub monitorowania jednej z chorób określonej w załączniku B, może ono przedstawić ten program Komisji, podając w szczególności:
— rozmieszczenie choroby na jego terytorium
— czy choroba ta podlega obowiązkowi zgłoszenia
— powody przedsięwzięcia takiego programu, z uwzględnieniem jego efektywności pod względem kosztów i znaczenia choroby,
— obszar geograficzny, na którym program ma być wprowadzany,
— kategorie statusu stosowane wobec placówek, wymogi dla każdego gatunku wprowadzanego do gospodarstwa i procedury wykorzystywane przy wykonywaniu testów,
— procedury monitorowania programu łącznie z zaangażowaniem hodowców we wdrażanie programów zwalczania lub monitorowania choroby,
— działania jakie należy podjąć jeżeli, z jakichś względów, gospodarstwo straci swój status,
— działania jakie należy podjąć, jeżeli wyniki testów przeprowadzonych w ramach programu są pozytywne,
— niedyskryminacyjny charakter handlu na terytorium zainteresowanego Państwa Członkowskiego w odniesieniu do handlu wewnątrzwspólnotowego.
2. Komisja bada programy przedstawione przez Państwa Członkowskie. Programy mogą być zatwierdzone w ramach procedury przewidzianej w art. 26 zgodnie z kryteriami ustalonymi w ust. 1. W ramach tej samej procedury dodatkowe gwarancje, ogólne lub ograniczone, które mogą być wymagane w handlu, zostają określone w tym samym czasie lub najpóźniej trzy miesiące po przedstawieniu programów. Gwarancje te nie mogą przekraczać gwarancji jakie stosuje u siebie Państwo Członkowskie.
3. Programy przedłożone przez Państwa Członkowskie mogą być zmieniane lub uzupełniane zgodnie z procedurą ustaloną w art. 26. Zgodnie z tą samą procedurą, można wprowadzać poprawki do gwarancji wymienionych w ust. 2.
Artykuł 15
1. Jeśli Państwo Członkowskie uznaje, że jego terytorium, lub część jego terytorium, jest wolne od jednej z chorób wymienionych w załączniku B, na którą podatne są zwierzęta objęte niniejszą dyrektywą, przedstawia Komisji odpowiednią dokumentację dodatkową, podającą w szczególności:
— charakter choroby oraz historię jej występowania na swoim terytorium,
— wyniki testów kontrolnych opartych o badania serologiczne, mikrobiologiczne, patologiczne lub epidemiologiczne,
— okres czasu, w którym choroba podlegała zgłoszeniu do właściwych władz
— okres czasu, w którym przeprowadzano kontrole
— jeśli dotyczy, okres czasu, w którym zakazano szczepień przeciwko tej chorobie oraz obszar geograficzny objęty zakazem,
— uzgodnienia dotyczące sprawdzenia obecności choroby.
2. Komisja bada dokumentację przewidzianą w ust. 1 i przedstawia Stałemu Komitetowi Weterynaryjnemu decyzję zatwierdzającą lub odrzucającą plan przedstawiony przez Państwo Członkowskie. Jeśli plan zostanie przyjęty, dodatkowe gwarancje, ogólne lub konkretne, które mogą być wymagane w handlu, zostaną określone zgodnie z procedurą przewidzianą w art. 26. Nie mogą one przekraczać gwarancji jakie Państwo Członkowskie wprowadza u siebie.
Do czasu podjęcia decyzji, zainteresowane Państwo Członkowskie może utrzymać w swoich transakcjach handlowych stosowne warunki konieczne dla utrzymania swojego statusu.
3. Zainteresowane Państwo Członkowskie notyfikuje Komisji wszelkie zmiany w danych szczegółowych określonych w ust. 1. Gwarancje określone zgodnie z ustaleniami ust. 2 mogą, w świetle takiej notyfikacji, ulegać zmianom, lub zostać wycofane zgodnie z procedurą określoną w art. 26.
ROZDZIAŁ III
Przepisy mające zastosowanie w przywozie do Wspólnoty
Artykuł 16
Warunki obowiązujące w przywozie zwierząt, nasienia, komórek jajowych i zarodków objętych niniejszą dyrektywą muszą być co najmniej równoważne warunkom ustalonym w rozdziale II.
▼M5
W odniesieniu do kotów, psów i fretek warunki przywozu muszą być co najmniej równoważne warunkom określonym w rozdziale III rozporządzenia (WE) nr 998/2003.
Świadectwo posiadane przez zwierzęta musi również stwierdzać, że na 24 godziny przed wysyłką zwierząt przeprowadzone zostało badanie kliniczne przez lekarza weterynarii upoważnionego przez właściwe władze, które wykazało, że zwierzęta są zdrowe i mogą odbyć podróż do swojego miejsca miejsce przeznaczenia.
▼B
Artykuł 17
1. W celu jednolitego stosowania art. 16 stosuje się przepisy zawarte w kolejnych ustępach.
2. Jedynie zwierzęta, nasienie, komórki jajowe i zarodki wymienione w art. 1 i spełniające następujące wymogi mogą być przywożone do Wspólnoty:
a) muszą pochodzić z państwa trzeciego znajdującego się w wykazie, sporządzonym zgodnie z ust. 3 lit. a);
b) musi towarzyszyć im świadectwo zdrowia odpowiadające wzorowi, który sporządza się zgodnie z procedurą przewidzianą w art. 26, podpisane przez właściwy organ w kraju wywozu i zaświadczające że zwierzęta, nasienie, komórki jajowe i zarodki spełniają warunki dodatkowe lub oferują równoważne gwarancje określone w ust. 4 i pochodzą w zatwierdzonych ośrodków, jednostek, instytutów i ośrodków lub punktów poboru oferujących takie gwarancje.
3. Zgodnie z procedurą określoną w art. 26 ustala się, co następuje:
▼M7
a) wykaz państw trzecich lub części państw trzecich będących w stanie zapewnić Państwom Członkowskim oraz Komisji gwarancje równoważne tym, przewidzianych w rozdziale II w odniesieniu do zwierząt, nasienia, komórek jajowych oraz zarodków
i
b) bez uszczerbku dla decyzji Komisji 94/63/WE z dnia 31 stycznia 1994 r. ustanawiającej tymczasowy wykaz państw trzecich, z których Państwa Członkowskie dopuszczają przywóz nasienia, komórek jajowych i zarodków owiec, kóz i koniowatych oraz komórek jajowych i zarodków świń (
19
), wykaz ośrodków zbierania dla których te państwa trzecie są w stanie zapewnić gwarancje przewidziane w art. 11.
Komisja powiadamia Państwa Członkowskie o wszelkich wnioskowanych zmianach w wykazach ośrodków zbierania a Państwa Członkowskie mają dziesięć dni roboczych, od dni otrzymania wnioskowanych zmian, na wysłanie pisemnych uwag do Komisji.
W przypadku braku pisemnych uwag od Państw Członkowskich w ciągu tego okresu dziesięciu dni roboczych, wnioskowane zmiany uważa się za zatwierdzone przez Państwa Członkowskie a przywóz zostaje dopuszczony zgodnie ze zmienionymi wykazami, gdy Komisja powiadamia właściwe organy Państw Członkowskich oraz dane państwo trzecie, że zmiany zostały opublikowane na internetowej stronie Komisji.
Gdy pisemne uwagi zostają otrzymane co najmniej od jednego Państwa Członkowskiego w ciągu tego okresu dziesięciu dni roboczych, Komisja powiadamia Państwa Członkowskie oraz Stały Komitet ds. Łańcucha Pokarmowego i Zdrowia Zwierząt na swoim następnym posiedzeniu w celu przyjęcia decyzji zgodnie z procedurą określoną w art. 26 drugi akapit.
▼B
c) szczególne warunki zdrowia zwierząt – w szczególności w celu ochrony Wspólnoty przed niektórymi chorobami egzotycznymi – lub gwarancje równoważne gwarancjom przewidzianym w niniejszej dyrektywie.
Szczególne wymogi i równoważne gwarancje ustalone dla państw trzecich nie mogą być bardziej uprzywilejowane niż te przewidziane w rozdziale II.
4. Wykaz przewidziany w ust. 3 może obejmować jedynie te państwa trzecie, lub części państw trzecich:
a) z których przywóz nie jest zakazany:
— na skutek występowania jednej z chorób określonych w załączniku A, lub jakiejkolwiek innej choroby egzotycznej we Wspólnocie,
— na podstawie art. 6, 7 i 14 dyrektywy 72/462/EWG i art. 17 dyrektywy 91/495/EWG oraz dyrektywy 71/118/EWG (
20
), lub w przypadku innych zwierząt objętych niniejszą dyrektywą zgodnie z decyzją podjętą w ramach procedury przewidzianej w art. 26 z uwzględnieniem ich stanu zdrowia;
b) które z uwagi na swoje ustawodawstwo oraz organizację służb weterynaryjnych i inspekcji i nadzór, jakiemu są poddane, zostały uznane zgodnie z art. 3 ust. 2 dyrektywy 72/462/EWG za zdolne do zagwarantowania wprowadzenia w życie obowiązującego w nich ustawodawstwa;
c) w których służby weterynaryjne są w stanie zagwarantować, że wymogi sanitarne, przynajmniej równoważne tym ustalonym w rozdział II, są przestrzegane.
5. Eksperci z Komisji oraz z Państw Członkowskich przeprowadzą szereg inspekcji na miejscu w celu zweryfikowania, czy gwarancje udzielone przez państwo trzecie w odniesieniu do warunków produkcji i wprowadzenia do obrotu można uznać za równoważne w stosunku do tych stosowanych we Wspólnocie.
Eksperci z Państw Członkowskich odpowiedzialnych za te inspekcje są powoływani przez Komisję stanowiącą na wniosek Państw Członkowskich.
Inspekcje są wykonywane w imieniu Wspólnoty, która ponosi koszty związane z wszelkimi związanymi z tym wydatkami.
6. Do czasu zorganizowania inspekcji określonych w ust. 5 nadal obowiązują przepisy krajowe mające zastosowanie do inspekcji w państwach trzecich, z zastrzeżeniem powiadamiania poprzez Stały Komitet Weterynaryjny o wszelkich przypadkach nieprzestrzegania gwarancji zaoferowanych zgodnie z ust. 3, na jakie natrafiono podczas takich inspekcji.
Artykuł 18
1. Państwa Członkowskie zapewniają, aby zwierzęta, nasienia, komórki jajowe i zarodki objęte niniejszą dyrektywą były przywożone do Wspólnoty jedynie wówczas, gdy:
— towarzyszy im świadectwo sporządzane przez urzędowego lekarza weterynarii.
— Wzór świadectwa sporządza się, zależnie od gatunku, zgodnie z procedurą ustaloną w art. 26,
— przeszły z wynikiem pozytywnym kontrole wymagane dyrektywami 90/675/EWG i 91/496/EWG (
21
),
— przeszły, przed wysyłką na terytorium Wspólnoty, kontrolę przeprowadzoną przez urzędowego lekarza weterynarii w celu zagwarantowania, że warunki przewozu określone w dyrektywie 91/628/EWG (
22
) zostały spełnione, w szczególności w odniesieniu do pojenia i karmienia,
— w przypadku zwierząt określonych w art. 5-10, przeszły kwarantannę zanim zostały umieszczone na rynku, zgodnie ze szczegółowymi przepisami ustanawianymi zgodnie z procedurą ustaloną w art. 26.
2. Do czasu ustanowienia szczególnych przepisów dla wykonania niniejszego artykułu nadal obowiązują przepisy krajowe mające zastosowanie wobec przywozu z państw trzecich, dla których takie wymogi nie zostały przyjęte na poziomie wspólnotowym, pod warunkiem, że nie są bardziej preferencyjne niż przepisy określone w rozdział II.
Artykuł 19
Następujące kwestie uzgadnia się zgodnie z procedurą ustanowioną w art. 26:
a) szczególne wymogi w zakresie zdrowia zwierząt obowiązujące w przywozie do Wspólnoty, charakter i treść dokumentów towarzyszących dla zwierząt przeznaczonych do ogrodów zoologicznych, cyrków, parków rozrywki lub laboratoriów eksperymentalnych, w zależności od gatunku;
b) dodatkowe gwarancje oprócz tych już przewidzianych w odniesieniu do różnych gatunków zwierząt objętych niniejszą dyrektywą, w celu ochrony odnośnych gatunków we Wspólnocie.
Artykuł 20
Zasady i przepisy ustanowione w dyrektywie 90/675/EWG stosuje się w szczególności w odniesieniu do organizacji kontroli i następstw kontroli, które mają być przeprowadzone przez Państwa Członkowskie oraz środków ochronnych, które należy wprowadzić.
Do czasu wprowadzenia w życie decyzji przewidzianych w art. 8 ust. 3 i art. 30 dyrektywy 91/496/EWG, stosuje się nadal odpowiednie przepisy krajowe w celu stosowania art. 8 ust. 1 i art. 2 wyżej wymienionej dyrektywy, bez uszczerbku dla zgodności z przepisami i zasadami określonymi w akapicie pierwszym niniejszego artykułu.
ROZDZIAŁ IV
Wspólne przepisy końcowe
Artykuł 21
Wszelkie wzory świadectw obowiązujących w handlu i wymagania dotyczące zdrowia zwierząt, jakie muszą być spełnione, aby umożliwić handel zwierzętami, nasieniem, komórkami jajowymi i zarodkami innymi niż te objęte art. 5-11 ustala się, w miarę potrzeb, zgodnie z procedurą przewidzianą w art. 26.
Artykuł 22
Załączniki do niniejszej dyrektywy ulegają zmianom, jeśli zachodzi taka potrzeba, zgodnie z procedurą przewidzianą w art. 26.
▼A1
Załącznik B podlegał będzie ponownemu przeglądowi przed datą wejścia w życie Traktatu o Przystąpieniu, w szczególności celem zmian w wykazie chorób, polegających na wprowadzeniu tych, na które podatne są przeżuwacze i świniowate oraz te, które są przenoszone przez zapłodnione jaja, nasienie oraz zarodki.
▼B
Artykuł 23
Zgodnie z procedurą przewidzianą w art. 26 można ustanowić specjalne wymogi, jeśli to konieczne, na zasadzie odstępstwa
►M7
————— ◄ od rozdziału II, dla przemieszczania się zwierząt należących do cyrków i wesołych miasteczek oraz dla handlu zwierzętami, nasieniem, komórkami jajowymi i zarodkami przeznaczonymi dla ogrodów zoologicznych.
Artykuł 24
1. Państwa Członkowskie są upoważnione do uzależnienia wwozu na ich terytorium zwierząt (łącznie z ptakami żyjącymi w klatkach), nasienia, komórek jajowych i zarodków określonych w niniejszej dyrektywie, które były transportowane przez terytorium państwa trzeciego od wystawienia świadectwa zdrowia, poświadczającego zgodność z wymogami niniejszej dyrektywy.
2. Państwa Członkowskie uciekające się do możliwości ustanowionej w ust. 1 powiadamiają o tym Komisję i inne Państwa Członkowskie wchodzące w skład Stałego Komitetu Weterynaryjnego.
Artykuł 25
W załączniku A do dyrektywy 90/425/EWG dodaje się, co następuje:
„Dyrektywa Rady 92/65/EWG z dnia 13 lipca 1992 r. ustanawiająca wymagania dotyczące zdrowia zwierząt regulujące handel i przywóz do Wspólnoty zwierząt, nasienia, komórek jajowych i zarodków nieobjętych wymaganiami dotyczącymi zdrowia zwierząt ustanowionymi w szczególnych zasadach Wspólnoty określonych w załączniku A pkt I do dyrektywy 90/425/EWG (Dz.U. L 268 z 14.9.1992, str. 54.)”
▼M7
Artykuł 26
1. Komisja jest wspomagana przez Stały Komitet ds. Łańcucha Pokarmowego i Zdrowia Zwierząt powołany na mocy art. 58 rozporządzenia (WE) nr 178/2002 Parlamentu Europejskiego i Rady. (
23
)
2. W przypadku dokonania odniesienia do niniejszego ustępu, zastosowanie mają art. 5 i 7 decyzji 1999/468/WE.
Okres, ustanowiony w art. 5 ust. 6 decyzji 1999/468/WE (
24
) ustala się na trzy miesiące.
3. Komitet uchwala swój regulamin wewnętrzny.
▼B
Artykuł 27
Państwa Członkowskie wprowadzające w życie alternatywny system kontroli zapewniający gwarancje równoważne gwarancjom ustalonym w niniejszej dyrektywie w odniesieniu do przemieszczania się na ich terytorium zwierząt, nasienia, komórek jajowych i zarodków, objętych niniejszą dyrektywą, mogą na zasadzie wzajemności zezwalać na odstępstwa od art. 6 część A ust. 1 lit. f), art. 8 lit. b) i art. 11 ust. 1 lit. d).
Artykuł 28
Zgodnie z procedurą przewidzianą w art. 26 można przyjmować środki przejściowe przez okres trzech lat celem ułatwienia przejścia na nowe ustalenia określone w niniejszej dyrektywie.
Artykuł 29
1. Państwa Członkowskie wprowadzą w życie przepisy ustawowe, wykonawcze i administracyjne niezbędne do wykonania niniejszej dyrektywy przed 1 stycznia 1994 r. i niezwłocznie powiadomią o tym Komisję.
Przepisy przyjęte przez Państwa Członkowskie zawierają odniesienie do niniejszej dyrektywy lub odniesienie takie towarzyszy ich urzędowej publikacji. Metody dokonywania takiego odniesienia określane są przez Państwa Członkowskie.
2. Państwa Członkowskie przekażą Komisji teksty podstawowych przepisów prawa krajowego, przyjętych w dziedzinach objętych niniejszą dyrektywą.
3. Ustalenie ostatecznego terminu na transpozycję do prawa krajowego na dzień 1 stycznia 1994 r. pozostaje bez uszczerbku dla zniesienia kontroli weterynaryjnych na granicach przewidzianego w dyrektywie 89/662/EWG oraz w dyrektywie 90/425/EWG.
Artykuł 30
Niniejsza dyrektywa skierowana jest do Państw Członkowskich.
▼M6
ZAŁĄCZNIK A
CHOROBY PODLEGAJĄCE OBOWIĄZKOWI ZGŁOSZENIA W KONTEKŚCIE NINIEJSZEJ DYREKTYWY
|
Choroba
|
Rząd/rodzina/gatunek,którego głównie dotyczy
|
|
Afrykański pomór koni
|
Equidae
|
|
Afrykański pomór świń
|
Suidae i ayassuidae
|
|
Influenza ptaków
|
Aves
|
|
Zgnilec amerykański pszczół
|
Apis
|
|
Wąglik
|
Bovidae, Camelidae, Cervidae, Elephantidae, Equidae i Hippopotamidae
|
|
Choroba niebieskiego języka
|
Antilocarpidae, Bovidae, Cervidae, Giraffidae i Rhinocerotidae
|
|
Bruceloza bydła
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae i Tragulidae
|
|
Bruceloza owiec i kóz
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae i Tragulidae
|
|
Bruceloza owiec
|
Camelidae, Tragulidae, Cervidae, Giraffidae, Bovidae i Antilocapridae
|
|
Bruceloza świń
|
Cervidae, Leporidae, Ovibos moschatus, Suidae i Tayassuidae
|
|
Klasyczny pomór świń
|
Suidae i Tayassuidae
|
|
Zaraza płucna bydła
|
Bydło (włącznie z zebu, bawołem, żubrem i jakiem)
|
|
Ebola
|
Naczelne nieczłekokształtne
|
|
Pryszczyca
|
Parzystokopytne i słoń azjatycki
|
|
Zakaźna martwica układu krwiotwórczego ryb łososiowatych
|
Salmonidae
|
|
Guzowata choroba skóry bydła
|
Bovidae i Giraffidae
|
|
Ospa małp
|
Gryzonie i naczelne nieczłekokształtne
|
|
Gruźlica bydła
|
Ssaki, w szczególności Bovidae, Camelidae, Cervidae, Giraffidae i Tragulidae
|
|
Rzekomy pomór drobiu
|
Aves
|
|
Pomór małych przeżuwaczy
|
Bovidae i Suidae
|
|
Enterowirusowe zapalenie mózgu i rdzenia u świń
|
Suidae
|
|
chlamydioza ptaków (choroba papuzia)
|
ptaki papugowate
|
|
Wścieklizna
|
Mięsożerne i nietoperze
|
|
Gorączka doliny Rift
|
Bovidae, gatunki Camelus i Rhinocerotidae
|
|
Pomór bydła
|
Parzystokopytne
|
|
Mały chrząszcz ulowy (Aethina tumida)
|
Apis i Bombus
|
|
Ospa owiec i kóz
|
Bovidae
|
|
Choroba pęcherzykowa świń
|
Suidae i Tayassuidae
|
|
Roztocz Tropilaelaps (Tropilaelaps spp).
|
Apis
|
|
Pęcherzykowe zapalenie jamy ustnej
|
Parzystokopytne i koniowate
|
|
TSE
|
Bovidae,Cervidae, Felidae i Mustelidae
|
▼B
ZAŁĄCZNIK B
WYKAZ CHORÓB, DLA KTÓRYCH PROGRAMY KRAJOWE MOGĄ BYĆ UZNANE ZGODNIE Z NINIEJSZĄ DYREKTYWĄ
|
Norki
|
Wirusowe zapalenie jelit
Choroba Aleucka
|
|
Pszczoły
|
Zgnilec europejski
Waroza i choroba roztoczowa
|
|
Małpy człekokształtne i zwierzęta kotowate
|
Gruźlica
|
|
Przeżuwacze
|
Gruźlica
|
|
Zwierzęta zającowate
|
Myksomatoza królików
Wirusowa choroba krwotoczna
Tularemia
|
▼M3
ZAŁĄCZNIK C
WARUNKI REGULUJĄCE ZATWIERDZENIE JEDNOSTEK, INSTYTUTÓW LUB OŚRODKÓW
1. Aby otrzymać urzędowe zatwierdzenie, zgodnie z art. 13 ust. 2 niniejszej dyrektywy, jednostka, instytut lub ośrodek jak określono je w art. 2 ust. 1 lit. c) powinny:
a) być wyraźnie ogrodzone i odizolowane od otoczenia albo zwierzęta zamknięte oraz rozmieszczone w taki sposób, by nie powodować zagrożenia zdrowotnego dla gospodarstw rolnych, których stan zdrowia może być zagrożony;
b) mieć odpowiednie środki do łapania, trzymania oraz izolowania zwierząt oraz dostępne odpowiednie pomieszczenia do kwarantanny oraz zatwierdzone procedury dla zwierząt pochodzących z niezatwierdzonych źródeł;
c) być wolne od chorób wymienionych w załączniku A oraz chorób wymienionych w załączniku B, podczas gdy dany kraj ma program na podstawie art. 14. Aby jednostka, instytut lub ośrodek był zadeklarowany jako wolny od tych chorób, właściwy organ ocenia zapisy stanu zdrowia zwierząt przechowywane co najmniej przez poprzednie trzy lata oraz wyniki testów klinicznych oraz badań laboratoryjnych przeprowadzanych na zwierzętach w jednostce, instytucie lub ośrodku. Jednakże, na zasadzie odstępstwa od niniejszych wymagań, nowe zakłady są zatwierdzane, jeśli zwierzęta tworzące zbiór wywodzą się z zatwierdzonych zakładów;
d) prowadzić bieżący rejestr zawierający:
i) liczbę i tożsamość (wiek, płeć, gatunek oraz indywidualne oznaczenia, gdy jest to praktyczne) zwierząt z każdego gatunku obecnych w zakładzie;
ii) liczbę i tożsamość (wiek, płeć, gatunek oraz indywidualne oznaczenie, gdy jest to praktyczne) zwierząt przybywających do zakładu albo go opuszczających wraz z informacją o ich pochodzeniu albo przeznaczeniu, transporcie z albo do placówki oraz stanie zdrowia zwierząt;
iii) wyniki badań krwi lub innych badań diagnostycznych;
iv) przypadki zachorowań i, jeśli to konieczne, zastosowane leczenie;
v) wyniki badania pośmiertnego zwierząt, które padły w zakładzie, włączając zwierzęta urodzone martwo;
vi) obserwacje poczynione podczas każdej izolacji albo okresu kwarantanny;
e) poczynić ustalenia z właściwymi laboratorium w celu przeprowadzenia badania pośmiertnego albo posiadać jedno albo więcej właściwych pomieszczeń, gdzie badanie może być przeprowadzone przez właściwą osobę z upoważnienia zatwierdzonego weterynarza;
f) poczynić odpowiednie ustalenia albo posiadać na miejscu obiekty do odpowiedniego rozmieszczania ciał zwierząt, które padły na skutek choroby albo zostały uśpione;
g) zapewnić, w drodze umowy albo za pomocą instrumentów prawnych, usługi lekarza weterynarii zatwierdzonego przez właściwy organ oraz działającego pod jego kontrolą, który:
i) spełnia mutatis mutandis wymogi określone w art. 14 ust. 3 lit. b) dyrektywy 64/432/EWG;
ii) zapewnia by właściwy nadzór choroby oraz środki kontroli w odniesieniu do sytuacji chorobowej danego państwa były zatwierdzone przez właściwy organ oraz były stosowane w jednostce, instytucie lub ośrodku. Środki takie obejmują:
— roczne plany nadzoru choroby obejmujące zwalczanie zoonozy,
— kliniczne, laboratoryjne oraz pośmiertne badania zwierząt podatnych na choroby przenaszalne,
— szczepienia podatnych zwierząt przeciwko chorobom zakaźnym, gdy to właściwe, tylko zgodnie z prawodawstwem wspólnotowym;
iii) zapewnia, iż każda podejrzana śmierć albo obecność wszelkich innych symptomów sugerujących, iż zwierzęta zapadły na jedną albo więcej chorób określonych w załączniku A oraz B, jest bezzwłocznie zgłaszana właściwemu organowi, jeśli choroba ta podlega obowiązkowi zgłoszenia w danym Państwie Członkowskim;
iv) zapewniają, iż przybywające zwierzęta zostały, jeśli konieczne, odizolowane w zgodzie z wymogami niniejszej dyrektywy oraz instrukcjami, jeśli były takie wydane przez właściwy organ;
v) są odpowiedzialni za bieżącą zgodność z warunkami zdrowia zwierząt w niniejszej dyrektywie oraz z prawodawstwem wspólnotowym w sprawie dobrostanu zwierząt w czasie transportu i usuwania odpadów zwierzęcych;
h) jeśli trzyma zwierzęta przeznaczone do przeprowadzania doświadczeń laboratoryjnych – w zgodności z przepisami art. 5 dyrektywy 86/609/EWG.
2. Zatwierdzenie zostaje utrzymane, gdy spełnione są następujące wymogi:
a) pomieszczenia są pod kontrolą urzędowego lekarza weterynarii zatwierdzonego przez właściwy organ, który:
i) wizytuje pomieszczenia jednostki, instytutu lub ośrodka co najmniej raz w roku;
ii) kontroluje działalność zatwierdzonego lekarza weterynarii oraz wprowadzanie rocznego planu nadzoru choroby;
iii) zapewnia, że przepisy niniejszej dyrektywy są przestrzegane;
b) do placówki wprowadzane są wyłącznie zwierzęta pochodzące z innych zatwierdzonych jednostek, instytutów lub ośrodków, w zgodzie z zapisami niniejszej dyrektywy;
c) urzędowy lekarz weterynarii weryfikuje, czy:
— przepisy niniejszej dyrektywy są wypełniane,
— wyniki badań klinicznych, pośmiertnych i laboratoryjnych przeprowadzanych na zwierzętach nie ujawniły występowania chorób określonych w załącznikach A oraz B;
d) jednostka, instytut lub ośrodek prowadzą rejestry określone w pkt 1 lit. d) po zatwierdzeniu przez okres co najmniej 10 lat.
3. W drodze odstępstwa od art. 5 ust. 1 niniejszej dyrektywy oraz pkt 2 lit. b) niniejszego Załącznika, zwierzęta włączając małpy człekokształtne (simiae i prosimiae) mające pochodzenie inne niż z zatwierdzonej jednostki, instytutu lub ośrodka mogą zostać wprowadzone do zatwierdzonej jednostki, instytutu lub ośrodka, pod warunkiem iż zwierzęta te przejdą kwarantannę w ramach urzędowej kontroli oraz w zgodzie z instrukcjami danymi przez właściwy organ zanim zostaną dołączone do zbioru.
Dla małp człekokształtnych (simiae oraz prosimiae) przestrzegane są warunki kwarantanny ustanowione w OIE Międzynarodowym Kodeksie Zdrowia Zwierząt (rozdział 2.10.1 oraz dodatek 3.5.1).
Dla innych zwierząt przechodzących kwarantannę zgodnie z ust. 2 lit. b) niniejszego Załącznika, okres kwarantanny musi wynosić co najmniej 30 dni w odniesieniu do chorób wymienionych w załączniku A.
4. Zwierzęta umieszczone w zatwierdzonej jednostce instytucie lub ośrodku opuszczają te zakłady wyłącznie jeśli przeznaczone są do innych zatwierdzonej jednostce instytucie lub ośrodku w tym Państwie Członkowskim albo innym Państwie Członkowskim; jakkolwiek, jeśli nie są przeznaczone do zatwierdzonej jednostki instytutu lub ośrodka, mogą opuścić je tylko w zgodzie z wymogami właściwego organu by zapewnić wyeliminowanie ryzyka prawdopodobnego rozprzestrzenienia się choroby.
5. Gdy Państwo Członkowskie korzysta z dodatkowych gwarancji w ramach prawa wspólnotowego, może domagać się dodania do zatwierdzonej jednostki instytutu lub ośrodka właściwych wymogów dodatkowych oraz świadectw dla gatunków podatnych.
6. Procedury częściowego albo całkowitego zawieszenia, wycofania albo przywrócenia zatwierdzenia mają miejsce:
a) gdy właściwy organ stwierdzi, iż wymogi z pkt 2 nie zostały wypełnione albo miała miejsce zmiana użycia, która nie jest już objęta art. 2 niniejszej dyrektywy, zatwierdzenie jest zawieszane albo wycofywane;
b) gdy zgłoszono podejrzenie występowania jednej z chorób wymienionych w załączniku A albo B, właściwy organ zawiesza zatwierdzenie jednostki instytutu lub ośrodka do czasu, gdy podejrzenie zostanie oficjalnie wyeliminowane. W zależności od zaistniałej choroby oraz ryzyka przeniesienia choroby zawieszenie może odnosić się do zakładu jako całości albo wyłącznie do określonych kategorii zwierząt podatnych na daną chorobę. Właściwy organ zapewnia, iż środki niezbędne do potwierdzenia albo wyeliminowania podejrzenia oraz uniknięcia jakiegokolwiek rozprzestrzenienia się choroby są podjęte w zgodzie z prawodawstwem wspólnotowym regulującym środki podejmowane przeciwko danym chorobom oraz w odniesieniu handlu zwierzętami;
c) gdy podejrzewana choroba zostanie potwierdzona, jednostka instytut lub ośrodek są ponownie zatwierdzane wyłącznie wtedy, gdy po usunięciu choroby oraz źródła infekcji w pomieszczeniach, obejmujących odpowiednie czyszczenie oraz dezynfekcję, warunki ustanowione w pkt 1 niniejszego Załącznika, z wyjątkiem pkt 1 lit. c), są ponownie spełnione;
d) właściwy organ powiadamia Komisję o zawieszeniu, wycofaniu albo przywróceniu zatwierdzenia dla jednostki instytutu lub ośrodka.
▼B
ZAŁĄCZNIK D
▼M1
ROZDZIAŁ I
I. Zasady regulujące zatwierdzanie punktów pobierania nasienia
Punkt pobierania nasienia musi:
1. być poddany stałemu nadzorowi lekarza weterynarii punktu pobierania nasienia;
2. mieć co najmniej
a) zamykane pomieszczenie dla zwierząt, a jeśli zachodzi taka potrzeba dla zwierząt z rodziny koniowatych również wybiegi, które są fizycznie oddzielone od pomieszczeń pobierania nasienia, pomieszczeń przetwarzania nasienia i magazynowania nasienia;
b) wydzielone pomieszczenia niemające bezpośredniego połączenia z pomieszczeniami stałego przebywania zwierząt;
c) wydzielone pomieszczenia służące do pobierania nasienia, w tym również wydzielone pomieszczenie do czyszczenia i dezynfekowania lub sterylizacji sprzętu;
d) wydzielone pomieszczenie do przetwarzania nasienia, oddzielone od pomieszczenia, gdzie jest ono pobierane, i które nie musi koniecznie znajdować się w tym samym miejscu;
e) wydzielone pomieszczenie służące do magazynowania nasienia, które nie musi koniecznie znajdować się w tym samym miejscu;
3. być tak skonstruowany lub odizolowany, aby wykluczyć kontakt z okolicznym żywym inwentarzem;
4. być skonstruowany w sposób umożliwiający łatwe oczyszczenie i zdezynfekowanie całego punktu z wyjątkiem biur, a w przypadku zwierząt z rodziny koniowatych również wybiegów.
II. Warunki nadzoru punktów pobierania nasienia
Punkty pobierania nasienia muszą:
1. być nadzorowane tak, aby znajdowały się w nich tylko zwierzęta gatunku, którego nasienie ma być pobierane;
Jednakże dopuszcza się przyjmowanie innych zwierząt domowych, pod warunkiem że nie stanowią one zagrożenia dla zdrowia zwierząt gatunków, których nasienie ma być pobierane, i spełniają warunki przewidziane przez lekarza weterynarii punktu.
W przypadku zwierząt z rodziny koniowatych, gdy punkt pobierania nasienia znajduje się na tym samym terenie co punkt sztucznego unasienniania lub punkt kopulacyjny, przyjmuje się również klacze, ogiery próbniki i ogiery wykorzystywane do krycia naturalnego pod warunkiem, że spełniają warunki załącznika D rozdział II pkt A 1, 2, 3 i 4;
2. być monitorowane w celu zapewnienia prowadzenia rejestrów wykazujących:
— gatunek, rasę, datę urodzenia i tożsamość każdego zwierzęcia, które znalazło się w punkcie,
— informacje o przemieszczaniu zwierząt przyjmowanych i opuszczających punkt,
— historię zdrowia i wszelkie badania diagnostyczne wraz z wynikami, przeprowadzone leczenie i szczepienia wykonane na zwierzętach znajdujących się w punkcie,
— datę pobrania i przetwarzania nasienia,
— informacje o miejscu przeznaczenia nasienia,
— informacje o magazynowaniu nasienia;
3. być kontrolowane co najmniej raz w roku przez urzędowego lekarza weterynarii podczas sezonu rozpłodowego w przypadku zwierząt rozmnażanych sezonowo i dwa razy w roku w przypadku reprodukcji niesezonowej w celu rozpatrzenia i zweryfikowania wszelkich spraw odnoszących się do warunków zatwierdzenia i nadzoru punktu;
4. być pod nadzorem uniemożliwiającym dostęp osobom nieupoważnionym. Ponadto osoby upoważnione muszą przestrzegać warunków przewidzianych przez lekarza weterynarii punktu;
5. zatrudniać kompetentnych pracowników, którzy zostali odpowiednio wyszkoleni w zakresie technik dezynfekowania i higieny zapobiegających rozprzestrzenianiu chorób;
6. być monitorowane, w celu zapewnienia, że:
— żadne zwierzę trzymane w punkcie nie jest używane do krycia naturalnego w okresie co najmniej 30 dni przed pierwszym pobraniem nasienia i w okresie pobierania,
— pobieranie, przetwarzanie i magazynowanie nasienia odbywa się tylko w pomieszczeniach do tego przeznaczonych,
— wszelkie przyrządy i naczynia mające styczność z nasieniem lub dawcą podczas pobierania lub przetwarzania są każdorazowo dezynfekowane lub sterylizowane przed użyciem albo są nowe, jednorazowego użytku i usuwane po użyciu,
— jeżeli w przypadku zwierząt z rodziny koniowatych punkt pobierania nasienia znajduje się w tym samym miejscu co punkt sztucznego unasienniania lub punkt kopulacyjny, musi być zachowana ścisła separacja instrumentów i sprzętu używanego do sztucznego unasienniania i krycia naturalnego oraz instrumentów i sprzętu mającego styczność z dawcami lub innymi zwierzętami przechowywanymi w punkcie od nasienia,
— produkty pochodzenia zwierzęcego, takie jak rozcieńczalniki i dodatki lub rozrzedzalniki stosowane podczas przetwarzania nasienia, nie stanowią zagrożenia dla zdrowia zwierząt lub zostały poddane uprzedniej obróbce eliminującej takie zagrożenie,
— w przypadku zamrożonego lub chłodzonego nasienia stosowane są czynniki zamrażające, które nie były uprzednio stosowane w przypadku innych produktów pochodzenia zwierzęcego,
— wszelkie kontenery do magazynowania i do transportu nasienia są każdorazowo uprzednio odkażane bądź sterylizowane przed użyciem lub stosowane są nowe, jednorazowego użytku i usuwane po użyciu;
7. zapewniać, że każda pojedyncza dawka nasienia jest oznakowana w sposób trwały umożliwiający ustalenie Państwa Członkowskiego pochodzenia, daty pobrania, gatunku, rasy, tożsamości dawcy oraz nazwy lub numeru zatwierdzonego punktu, w którym dokonano pobrania nasienia.
▼B
ROZDZIAŁ II
Warunki stosowane w punktach pobierania nasienia
Wymagania odnosząc się do przyjęcia dawców
▼M1
A. OGIERY
Wyłącznie ogier, który według lekarza weterynarii punktu spełnia następujące warunki, może być wykorzystany do pobrania nasienia:
1. w czasie dopuszczenia i w dniu pobierania nasienia nie może wykazywać żadnych objawów infekcji lub choroby zakaźnej;
2. musi pochodzić z terytorium lub, w przypadku regionalizacji, z części terytorium Państwa Członkowskiego lub państwa trzeciego i gospodarstwa znajdującego się pod nadzorem weterynaryjnym, spełniającego warunki dyrektywy Rady 90/426/EWG;
3. na 30 dni przed pobraniem nasienia był trzymany w gospodarstwach, gdzie żadne zwierzę z rodziny koniowatych nie wykazało w tym okresie klinicznych objawów wirusowego zapalenia tętnic;
4. na 60 dni przed pobraniem nasienia był trzymany w gospodarstwach, gdzie żadne zwierzę z rodziny koniowatych nie wykazało w tym okresie klinicznych objawów zakaźnego zapalenia macicy u klaczy;
5. w ciągu 30 dni przed pobraniem nasienia nie był używany do krycia naturalnego;
6. został poddany następującym badaniom, przeprowadzanym i poświadczanym w laboratorium uznanym przez właściwe organy, zgodnie z programem określonym w ust. 7:
i) wykrywający niedokrwistość zakaźną koni, test immunodyfuzji w żelu agarowym, zwany „testem Cogginsa”;
ii) wykrywający wirusowe zapalenie tętnic koni, test seroneutralizacyjny (rozcieńczenie surowicy < ¼), uzupełniony, w przypadku otrzymania wyniku pozytywnego, o badanie wirusologiczne całkowitej objętości nasienia z wynikiem ujemnym;
iii) wykrywający zakaźne zapalenie macicy u klaczy, test przeprowadza się dwukrotnie w siedmiodniowych odstępach czasu poprzez wyizolowanie drobnoustroju chorobotwórczego Taylorella equigenitalis z frakcji przedejakulacyjnej nasienia lub próbek nasienia i z wymazów pobranych z napletka lub cewki moczowej, z wynikiem ujemnym;
7. został poddany jednemu z następujących programów badań:
i) w przypadku pozyskiwania nasienia do celów handlu nasieniem świeżym lub chłodzonym:
— i ogier dawca przebywał nieprzerwanie w punkcie pobierania nasienia przez okres co najmniej 30 dni przed dniem pierwszego pobrania nasienia i podczas okresu pobierania nasienia oraz żadne zwierzę z rodziny koniowatych w punkcie pobierania nie miało bezpośredniego kontaktu ze zwierzętami z rodziny koniowatych o pogorszonym stanie zdrowia, badania wymagane na mocy ust. 6 i), ii) i iii) przeprowadza się co najmniej po 14 dniach od początku okresu przebywania ogiera w punkcie pobierania nasienia i co najmniej raz w roku na początku sezonu rozpłodowego,
— i ogier dawca nie przebywał nieprzerwanie w punkcie pobierania nasienia lub inne zwierzęta z rodziny koniowatych w punkcie pobierania miały bezpośredni kontakt ze zwierzętami z rodziny koniowatych o pogorszonym stanie zdrowia, badania wymagane na mocy ust. 6 i), ii) i iii) przeprowadza się w okresie 14 dni przed pierwszym pobraniem nasienia i co najmniej raz w roku na początku sezonu rozpłodowego. Ponadto badanie wymagane na mocy ust. 6 i) powtarza się co 120 dni podczas okresu pobierania nasienia. Badanie wymagane na mocy ust. 6 ii) przeprowadza się nie później niż 30 dni przed każdym pobraniem nasienia, chyba że stan braku siewstwa u serododatniego ogiera na wirusowe zapalenie tętnic koni został potwierdzony testem izolacji wirusa, który musi być przeprowadzany corocznie;
ii) w przypadku pobierania nasienia do celów handlu nasieniem mrożonym stosuje się programy badań, jak określono w ust. 7 i) tiret pierwsze i drugie, lub alternatywnie, badania wymagane na mocy ust. 6 i), ii) i iii) przeprowadzane podczas obowiązkowego 30-dniowego okresu magazynowania nasienia i nie wcześniej niż po 14 dniach od pobrania nasienia, niezależnie od tego, czy ogier przebywał nieprzerwanie w punkcie pobierania nasienia.
▼B
B. OWCE I KOZY
1. Jedynie owce i kozy z ośrodków lub gospodarstw, które zdaniem urzędowego lekarza weterynarii spełniają następujące wymagania, mogą być wykorzystane do pobierania nasienia:
a) są w dobrym stanie zdrowia w dniu pobierania nasienia;
b) spełniają wymogi ustalone w art. 4, 5 i 6 dyrektywy 91/68/EWG w sprawie handlu wewnątrz Wspólnoty.
Dodatkowo, zwierzęta dawcy muszą przejść, w okresie trzydziestu dni przed pobraniem nasienia, z ujemnymi wynikami:
— test wykrywający brucelozę kóz i owiec (B. melitensis) zgodnie z załącznikiem C do dyrektywy 91/68EWG,
— test na zakaźne zapalenie najądrzy (B. ovis) zgodnie z załącznikiem D do dyrektywy 91/68/EWG,
— test na wykrycie wirusa choroby granicznej;
c) przeszły odpowiednie testy lub kontrole opracowane w celu zapewnienia zgodności z wymogami wymienionymi w lit. a) i b) powyżej.
2. Testy określone w pkt 1, muszą być wykonywane przez laboratorium zatwierdzone przez Państwo Członkowskie.
▼M1
|
C.
|
Jeżeli wynik któregokolwiek z badań określonych w A lub B jest pozytywny, zwierzę musi być izolowane, a pobrane od niego nasienie, licząc od ostatniego negatywnego wyniku badania, nie może być wprowadzone do obrotu. Ten sam przepis znajduje zastosowanie do nasienia pobranego od innych zwierząt podatnych na daną chorobę w gospodarstwie lub punkcie pobierania nasienia po dniu, w którym przeprowadzone zostało badanie z wynikiem pozytywnym. Handel nasieniem zostaje wznowiony po przywróceniu odpowiedniego stanu zdrowia punktu.
|
ROZDZIAŁ III
Warunki stosowane w odniesieniu do nasienia, komórek jajowych i zarodków
Nasienie, komórki jajowe i zarodki pobiera się, przetwarza i konserwuje zgodnie z następującymi zasadami:
a) płukanie komórek jajowych i zarodków nawet w przypadku zwierząt z rodziny koniowatych przeprowadza się według warunków ustanowionych zgodnie z procedurą przewidzianą w art. 26. Do czasu przyjęcia takich warunków stosuje się międzynarodowe normy.
Osłonka przejrzysta (zona pellucida) komórki jajowej i zarodka musi być nienaruszona przed płukaniem i pozostać nienaruszona po zakończeniu procesu płukania.
Dopuszcza się płukanie w tej samej pożywce komórek jajowych i zarodków pochodzących od tej samej dawczyni.
Po zakończeniu procesu płukania osłonka przejrzysta poszczególnej komórki jajowej lub poszczególnego zarodka podlega badaniu mikroskopowemu na całkowitym obszarze powierzchni, co najmniej w 50-krotnym powiększeniu, w celu potwierdzenia nienaruszalności ciągłości osłonki przejrzystej oraz potwierdzenia usunięcia z niej wszystkich przywierających do niej ciał obcych.
b) Pożywka i roztwory stosowane podczas pobierania, przetwarzania (badanie, płukanie i obróbka), konserwacji lub zamrażania komórek jajowych i zarodków powinny być wyjaławiane zgodnie z zatwierdzonymi metodami i poddawane odpowiednim zabiegom zapewniającym ich sterylność.
Środki stosowane podczas pobierania, płukania i konserwacji komórek jajowych i zarodków oraz rozrzedzania nasienia zawierają dodatek antybiotyków. W razie potrzeby ustanawia się szczegółowe zasady zgodnie z procedurą przewidzianą w art. 26.
c) Do zabiegów związanych z pobieraniem, przetwarzaniem i konserwacją lub zamrażaniem nasienia, komórek jajowych i zarodków muszą być używane narzędzia każdorazowo odkażone lub wysterylizowane przed zabiegiem lub narzędzia nowe, jednorazowego użytku, usuwane po użyciu.
d) Dopuszcza się przeprowadzanie dodatkowych badań zgodnie z procedurą przewidzianą w art. 26, w szczególności w celu wykluczenia obecności czynników chorobotwórczych w płynach płuczących.
e) Komórki jajowe i zarodki, które zadowalająco zostały poddane badaniom przewidzianym w lit. a), oraz nasienie umieszcza się w sterylnych pojemnikach, które zostały należycie oznakowane, zawierają materiał biologiczny od tylko jednego ogiera lub klaczy i które są niezwłocznie plombowane.
Oznaczanie ustanowione na mocy procedury przewidzianej w art. 26 zapewnia ustalenie co najmniej kraju pochodzenia, daty pobrania, gatunku, rasy, tożsamości zwierząt, od których pobrano komórki jajowe i zarodki, nazwę lub numer punktu pobrania/zespołu.
f) Zamrożone nasienie, komórki jajowe lub zarodki umieszcza się w sterylnych pojemnikach z ciekłym azotem, które nie stanowią zagrożenia zanieczyszczenia pobranego materiału biologicznego.
g) Zamrożone nasienie, komórki jajowe i zarodki muszą być magazynowane w zatwierdzonych warunkach przez okres co najmniej 30 dni przed wysyłką.
h) Nasienie, komórki jajowe i zarodki muszą być transportowane w pojemnikach, które przed użyciem zostały oczyszczone, zdezynfekowane lub wysterylizowane lub w pojemnikach nowych, jednorazowego użytku i usuwanych po użyciu.
ROZDZIAŁ IV
Dawczynie
Dopuszcza się pobieranie zarodków lub komórek jajowych wyłącznie od zwierząt, które same, jak również stada, z których pochodzą, według oceny urzędowego lekarza weterynarii spełniają warunki odpowiednich dyrektyw dotyczących wewnątrzwspólnotowego handlu żywymi zwierzętami przeznaczonymi do hodowli i rozrodu poszczególnych gatunków.
Przepisy dyrektywy Rady 64/432/EWG stosuje się do trzody chlewnej oraz przepisy dyrektywy Rady 91/68/EWG stosuje się do owiec i kóz.
Oprócz warunków ustanowionych mocą dyrektywy Rady 90/426/EWG zwierzęta z rodziny koniowatych, przed dniem pobrania komórek jajowych lub zarodków, muszą być chowane w gospodarstwach wolnych od klinicznych objawów zakaźnego zapalenia macicy u klaczy przez okres 60 dni. W terminie 30 dni przed dniem pobrania komórek jajowych i zarodków zwierzęta te nie mogą być wykorzystywane do krycia naturalnego.
▼M3
ZAŁĄCZNIK E
Część 1

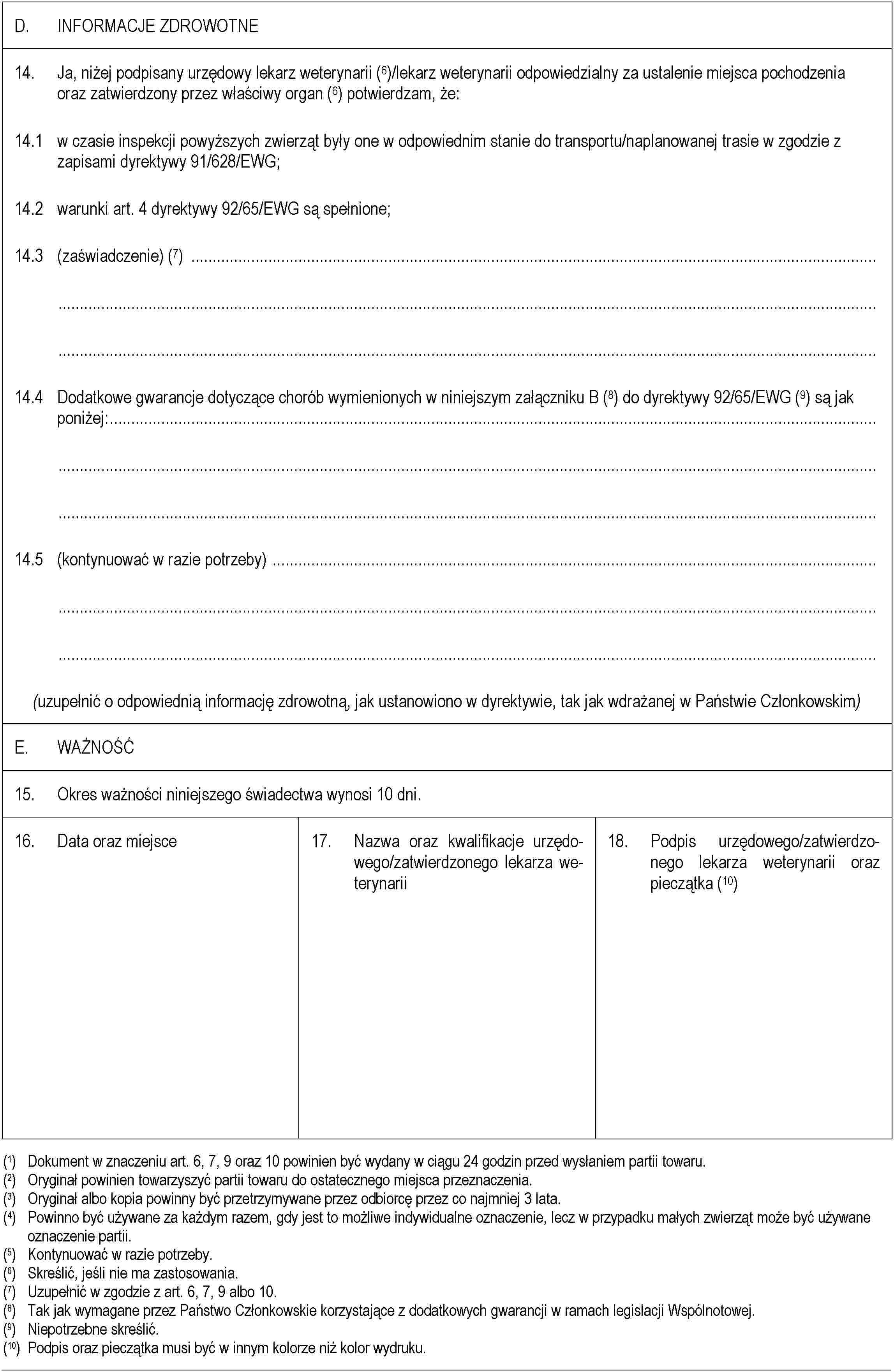
Część 2


Część 3
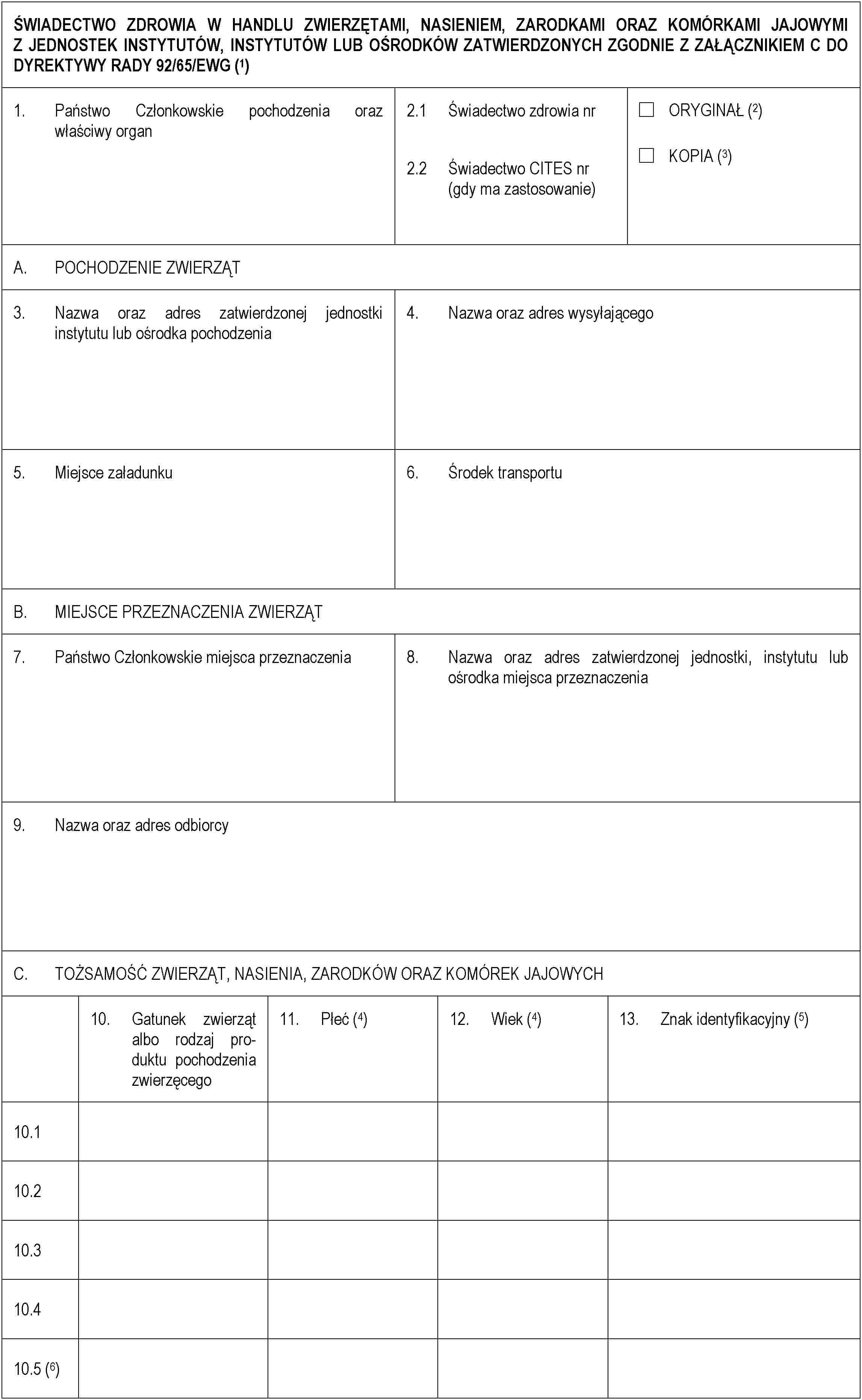

▼M7
ZAŁĄCZNIK F
Dyrektywa Rady 64/432/EWG z dnia 26 czerwca 1964 r w sprawie problemów zdrowotnych zwierząt wpływających na handel wewnątrzwspólnotowy bydłem i trzodą chlewną
Dyrektywa Rady 88/407/EWG z dnia 14 czerwca 1988 r. ustanawiająca warunki zdrowotne zwierząt wymagane w handlu wewnątrzwspólnotowym oraz w przywozie zamrożonego nasienia bydła domowego
Dyrektywa Rady 89/556/EWG z dnia 25 września 1989 r. w sprawie warunków zdrowotnych zwierząt regulujących wewnątrzwspólnotowy handel i przywóz zarodków bydła domowego z państw trzecich
Dyrektywa Rady 90/426/EWG z dnia 26 czerwca 1990 r. w sprawie warunków zdrowotnych zwierząt regulujących przemieszczanie i przywóz zwierząt z rodziny koniowatych z państw trzecich
Dyrektywa Rady 90/429/EWG z dnia 26 czerwca 1990 r. ustanawiająca wymagania dotyczące zdrowia zwierząt mające zastosowanie w handlu wewnątrzwspólnotowym oraz przywozie nasienia trzody chlewnej
Dyrektywa Rady 90/539/EWG z dnia 15 października 1990 r. w sprawie warunków zdrowotnych zwierząt regulujące handel wewnątrzwspólnotowy i przywóz z państw trzecich drobiu i jaj wylęgowych
Dyrektywa Rady 91/67/EWG z dnia 28 stycznia 1991 r. dotycząca warunków zdrowotnych zwierząt obowiązujących przy wprowadzaniu do obrotu zwierząt i produktów akwakultury
Dyrektywa Rady 91/68/EWG z dnia 28 stycznia 1991 r. w sprawie warunków zdrowotnych zwierząt regulujących handel wewnątrzwspólnotowy owcami i kozami
Dyrektywa Rady 68/2004/WE z dnia 26 kwietnia 2004 r. ustanawiająca warunki zdrowia zwierząt regulujące przywóz do oraz tranzyt przez terytorium Wspólnoty niektórych żywych zwierząt kopytnych, zmieniająca dyrektywy 90/426/EWG oraz 92/65/EWG i uchylająca dyrektywę 72/462/EWG.






