BIJLAGE II
Certificaat van erkenning, aanwijzing, machtiging of vergunning dat door de bevoegde autoriteit of autoriteiten moet worden afgegeven aan importerende weefselinstellingen
|
9.4.2015 |
NL |
Publicatieblad van de Europese Unie |
L 93/56 |
RICHTLIJN (EU) 2015/566 VAN DE COMMISSIE
van 8 april 2015
tot uitvoering van Richtlijn 2004/23/EG aangaande de procedures om na te gaan of er sprake is van gelijkwaardige kwaliteits- en veiligheidsnormen voor ingevoerde weefsels en cellen
(Voor de EER relevante tekst)
DE EUROPESE COMMISSIE,
Gezien het Verdrag betreffende de werking van de Europese Unie,
Gezien Richtlijn 2004/23/EG van het Europees Parlement en de Raad van 31 maart 2004 tot vaststelling van kwaliteits- en veiligheidsnormen voor het doneren, verkrijgen, testen, bewerken, bewaren en distribueren van menselijke weefsels en cellen (1), en met name artikel 9, lid 4,
Overwegende hetgeen volgt:
|
(1) |
Richtlijn 2004/23/EG bevat kwaliteits- en veiligheidsnormen voor het doneren, verkrijgen, testen, bewerken, preserveren, bewaren en distribueren van alle menselijke weefsels en cellen, bestemd voor toepassing op de mens, en voor het doneren, verkrijgen en testen van menselijke weefsels en cellen die worden opgenomen in bereide producten, bestemd voor toepassing op de mens, indien die producten onder andere wetgeving van de Unie vallen, om een hoog niveau van bescherming van de menselijke gezondheid in de Unie te verzekeren. |
|
(2) |
Uitwisselingen van weefsels en cellen vinden steeds vaker wereldwijd plaats en derhalve vereist Richtlijn 2004/23/EG dat de invoer van weefsels en cellen verricht wordt door weefselinstellingen die daartoe erkend, aangewezen of gemachtigd zijn door, dan wel een vergunning hebben gekregen van de lidstaten. Uitzonderingen op die eis staan in artikel 9, lid 3, van Richtlijn 2004/23/EG, waardoor de bevoegde autoriteiten onder de in artikel 6 van Richtlijn 2006/17/EG van de Commissie (2) vastgestelde voorwaarden of in noodgevallen de invoer van specifieke weefsels en cellen rechtstreeks kunnen toestaan. Van deze uitzonderingen wordt regelmatig maar niet uitsluitend gebruikgemaakt om toestemming te verlenen voor de invoer van hematopoëtische stamcellen uit beenmerg, perifeer bloed of navelstrengbloed dat wordt gebruikt bij de behandeling van een aantal levensbedreigende aandoeningen. |
|
(3) |
Richtlijn 2004/23/EG vereist bovendien dat de lidstaten en de importerende weefselinstellingen ervoor zorgen dat de invoer van weefsels en cellen voldoet aan kwaliteits- en veiligheidsnormen die gelijkwaardig zijn aan die van Richtlijn 2004/23/EG; die richtlijn schrijft ook de vaststelling voor van procedures om na te gaan of er sprake is van gelijkwaardige kwaliteits- en veiligheidsnormen voor de invoer van weefsels en cellen. Die procedures moeten in de onderhavige richtlijn worden vastgesteld, onverminderd de douanewetgeving van de Unie. |
|
(4) |
Met name moeten machtigings- en inspectieprocedures worden vastgesteld die aansluiten bij de bestaande verificatie van werkzaamheden in de Unie die verband houden met weefsels en cellen. Ook moeten de procedures worden bepaald die de importerende weefselinstellingen moeten volgen in hun betrekkingen met hun leveranciers uit derde landen. |
|
(5) |
Met uitzondering van de invoer waarvoor de bevoegde autoriteiten op grond van artikel 9, lid 3, van Richtlijn 2004/23/EG rechtstreeks toestemming verlenen, moet alle invoer van weefsels en cellen uit derde landen door importerende weefselinstellingen worden verricht. Wanneer bevoegde autoriteiten op grond van artikel 9, lid 3, van Richtlijn 2004/23/EG rechtstreeks toestemming voor invoer verlenen, hebben de bevoegde autoriteiten de verantwoordelijkheid ervoor te zorgen dat deze invoer voldoet aan kwaliteits- en veiligheidsnormen die gelijkwaardig zijn aan die van die richtlijn. |
|
(6) |
In beginsel moeten weefsels en cellen worden ingevoerd door weefselbanken of ziekenhuisafdelingen die voor hun importactiviteiten in het bezit zijn van een erkenning, aanwijzing, machtiging of vergunning als importerende weefselinstelling. Weefselbanken of ziekenhuisafdelingen moeten als importerende weefselinstellingen worden beschouwd indien zij partij zijn bij een contractuele overeenkomst met een leverancier uit een derde land voor de invoer van weefsels en cellen. Een organisatie die makelaarsdiensten aanbiedt en partij is bij een contractuele overeenkomst met een leverancier uit een derde land om de invoer van weefsels en cellen te vergemakkelijken maar niet voor de invoer zelf, dient niet als importerende weefselinstelling te worden beschouwd. De lidstaten kunnen ervoor kiezen dergelijke diensten die buiten het toepassingsgebied van deze richtlijn vallen te reglementeren. |
|
(7) |
Wanneer andere instanties, zoals met toepassing op de mens belaste organisaties, fabrikanten van geneesmiddelen voor geavanceerde therapie, artsen of particulieren, partij zijn bij een contractuele overeenkomst met een leverancier uit een derde land voor de invoer van weefsels en cellen, moeten zij als importerende weefselinstelling worden beschouwd. Zij moeten voldoen aan de eisen van deze richtlijn en aan alle relevante bepalingen van Richtlijn 2004/23/EG, en voor hun importactiviteiten als importerende weefselinstelling erkend, aangewezen of gemachtigd zijn door, dan wel een vergunning hebben gekregen van de relevante bevoegde autoriteiten. Indien zij de ingevoerde weefsels en cellen na invoer ook testen, bewerken, preserveren, bewaren of distribueren, moeten zij voor die werkzaamheden eveneens erkend, aangewezen of gemachtigd zijn door, dan wel een vergunning hebben gekregen van de relevante bevoegde autoriteiten en aan de eisen van Richtlijn 2004/23/EG voldoen. Ook kunnen zij weefsels en cellen van oorsprong uit derde landen verkrijgen van weefselbanken of ziekenhuisafdelingen die in de Unie gevestigd zijn en als importerende weefselinstelling erkend, aangewezen of gemachtigd zijn door, dan wel een vergunning hebben gekregen van de relevante bevoegde autoriteiten. |
|
(8) |
Indien importerende weefselinstellingen ook voor hun werkzaamheden in de Unie in het bezit zijn van een erkenning, aanwijzing, machtiging of vergunning als weefselinstelling, mogen de lidstaten hun machtigings-, inspectie- en rapportageprocedures harmoniseren op voorwaarde dat de in deze richtlijn voorgeschreven procedures worden gevolgd. |
|
(9) |
Om ingevoerde weefsels en cellen gemakkelijker in de Unie te distribueren, ook grensoverschrijdend, moet het certificaat waaruit de erkenning, aanwijzing, machtiging of vergunning van de importerende weefselinstelling blijkt, worden afgegeven door de bevoegde autoriteit of autoriteiten. |
|
(10) |
Inspectiemaatregelen zijn belangrijk om na te gaan of ingevoerde weefsels en cellen voldoen aan kwaliteits- en veiligheidsnormen die gelijkwaardig zijn aan die van Richtlijn 2004/23/EG. Derhalve worden de lidstaten aangemoedigd om in voorkomend geval ook inspecties te verrichten bij leveranciers uit derde landen en samen te werken met de andere lidstaten waar de ingevoerde weefsels en cellen waarschijnlijk zullen worden gedistribueerd. De lidstaten waarin de importerende weefselinstellingen zijn gevestigd, blijven verantwoordelijk om vast te stellen welke de meest passende maatregelen zijn en of het nodig is leveranciers uit derde landen ter plaatse te inspecteren. |
|
(11) |
De handleiding over inspecties voor bevoegde autoriteiten is bijgewerkt om rekening te houden met inspecties van importerende weefselinstellingen en hun leveranciers uit derde landen; de lidstaten kunnen die gebruiken als leidraad bij de uitvoering van dergelijke inspectiemaatregelen. |
|
(12) |
De importerende weefselinstellingen moeten nagaan of de kwaliteits- en veiligheidsnormen voor de weefsels en cellen die zij in de Unie invoeren, gelijkwaardig zijn aan die van Richtlijn 2004/23/EG. De schriftelijke overeenkomsten met leveranciers uit derde landen en de documentatie die moet worden verstrekt en ter beschikking moet worden gesteld aan de bevoegde autoriteiten vormen wezenlijke elementen om ervoor te zorgen dat dit inderdaad wordt nagegaan en met name om de traceerbaarheid naar de donor te waarborgen en ervoor te zorgen dat overeenkomstig Richtlijn 2004/23/EG het beginsel van vrijwillige en onbetaalde donatie in acht wordt genomen. De importerende weefselinstellingen worden ook aangemoedigd om in het kader van deze verificatie audits te verrichten bij hun leveranciers uit derde landen. |
|
(13) |
De importerende weefselinstellingen moeten ervoor zorgen dat de uniforme Europese code overeenkomstig Richtlijn 2006/86/EG van de Commissie (3) op ingevoerde weefsels en cellen wordt toegepast, hetzij door dat zelf te doen, hetzij door de taak te delegeren aan hun leveranciers uit derde landen in de schriftelijke overeenkomsten met die leveranciers. |
|
(14) |
De lidstaten moeten de mogelijkheid hebben om voor eenmalige invoer vrijstelling toe te staan van de eisen van de onderhavige richtlijn ten aanzien van documentatie en schriftelijke overeenkomsten. Zulke eenmalige invoer moet echter worden verricht door importerende weefselinstellingen die in het bezit zijn van een erkenning, aanwijzing, machtiging of vergunning, en mag in het algemeen niet geregeld of herhaaldelijk van dezelfde leverancier uit een derde land afkomstig zijn. De toepassing van die vrijstellingen moet worden beperkt tot situaties waarin een of meer personen weefsels en cellen voor toekomstig gebruik hebben laten bewaren in een derde land, met name in geval van partnerdonatie van geslachtscellen, autologe donatie of donatie aan naaste verwanten, en zij deze weefsels of cellen vervolgens zelf willen laten invoeren in de Unie. Zulke invoer van specifieke soorten weefsel of cellen dient in beginsel niet vaker dan een keer voor een bepaalde ontvanger plaats te vinden en mag geen betrekking hebben op weefsels of cellen voor derden. |
|
(15) |
Deze richtlijn belet de lidstaten niet om met betrekking tot de invoer van weefsels en cellen verdergaande maatregelen te handhaven of te treffen, met name om ervoor te zorgen dat het beginsel van vrijwillige en onbetaalde donatie in acht wordt genomen, op voorwaarde dat de bepalingen van het Verdrag worden geëerbiedigd. |
|
(16) |
De in deze richtlijn vervatte maatregelen zijn in overeenstemming met het advies van het bij artikel 29, lid 3, van Richtlijn 2004/23/EG opgerichte regelgevend comité weefsels en cellen, |
HEEFT DE VOLGENDE RICHTLIJN VASTGESTELD:
HOOFDSTUK I
ALGEMENE BEPALINGEN
Artikel 1
Toepassingsgebied
1. Deze richtlijn is van toepassing op de invoer in de Unie van:
|
a) |
menselijke weefsels en cellen, bestemd voor toepassing op de mens; en |
|
b) |
bereide producten, afkomstig van menselijke weefsels en cellen, bestemd voor toepassing op de mens, indien die producten niet onder andere wetgeving van de Unie vallen. |
2. Indien de menselijke weefsels en cellen die worden ingevoerd, uitsluitend bestemd zijn voor gebruik in bereide producten die onder andere wetgeving van de Unie vallen, is deze richtlijn alleen van toepassing op de activiteiten van doneren, verkrijgen en testen die buiten de Unie plaatsvinden, en op het waarborgen van de traceerbaarheid van donor tot ontvanger en omgekeerd.
3. Deze richtlijn is niet van toepassing op:
|
a) |
de invoer van weefsels en cellen als bedoeld in artikel 9, lid 3, onder a), van Richtlijn 2004/23/EG die door de bevoegde autoriteit of autoriteiten rechtstreeks wordt toegestaan; |
|
b) |
de invoer van weefsels en cellen als bedoeld in artikel 9, lid 3, onder b), van Richtlijn 2004/23/EG die in noodgevallen rechtstreeks wordt toegestaan; |
|
c) |
bloed en bloedbestanddelen als omschreven in Richtlijn 2002/98/EG; |
|
d) |
organen of orgaandelen als omschreven in Richtlijn 2004/23/EG. |
Artikel 2
Definities
Voor de toepassing van deze richtlijn wordt verstaan onder:
a) „noodgeval”: elke onvoorziene situatie waarin het in de praktijk niet anders kan dan dat weefsels en cellen dringend uit een derde land in de Unie worden ingevoerd voor onmiddellijke toepassing op een of meer bekende ontvangers van wie de gezondheid zonder die invoer ernstig in gevaar zou komen;
b) „importerende weefselinstelling”: een weefselbank, ziekenhuisafdeling of andere instantie die in de Unie is gevestigd en partij is bij een met een leverancier uit een derde land gesloten contractuele overeenkomst voor de invoer van weefsels en cellen, bestemd voor toepassing op de mens, uit een derde land in de Unie;
c) „eenmalige invoer”: invoer van specifieke soorten weefsel of cellen, bestemd voor persoonlijk gebruik door een of meer beoogde ontvangers die bij de importerende weefselinstelling en de leverancier uit een derde land bekend zijn vóór de invoer plaatsvindt. Zulke invoer van specifieke soorten weefsel of cellen vindt in beginsel niet vaker dan een keer voor een bepaalde ontvanger plaats. Invoer die geregeld of herhaaldelijk van dezelfde leverancier uit een derde land afkomstig is, wordt niet als „eenmalige invoer” beschouwd;
d) „leverancier uit een derde land”: een weefselinstelling of andere instantie die in een derde land gevestigd is en die verantwoordelijk is voor de uitvoer naar de Unie van weefsels en cellen die zij aan een importerende weefselinstelling levert. Een leverancier uit een derde land kan eveneens buiten de Unie weefsels en cellen die in de Unie worden ingevoerd, doneren, verkrijgen, testen, bewerken, preserveren, bewaren of distribueren.
HOOFDSTUK II
VERPLICHTINGEN VAN DE AUTORITEITEN VAN DE LIDSTATEN
Artikel 3
Verlenen van een erkenning, aanwijzing, machtiging of vergunning aan importerende weefselinstellingen
1. Onverminderd artikel 1, lid 3, zorgen de lidstaten ervoor dat alle invoer van weefsels en cellen uit derde landen uitsluitend wordt verricht door importerende weefselinstellingen die daartoe erkend, aangewezen of gemachtigd zijn door, dan wel een vergunning hebben gekregen van een bevoegde autoriteit of van bevoegde autoriteiten.
2. Nadat de in bijlage I bij deze richtlijn vermelde informatie door de bevoegde autoriteit of autoriteiten is verkregen en nadat door de bevoegde autoriteit of autoriteiten is gecontroleerd of de importerende weefselinstelling aan de eisen van deze richtlijn voldoet, wordt door de bevoegde autoriteit of autoriteiten aan de importerende weefselinstelling een erkenning, aanwijzing, machtiging of vergunning voor de invoer van weefsels en cellen afgegeven, waarbij, indien van toepassing, voorwaarden worden gesteld, zoals beperkingen inzake de voor invoer toegelaten soorten weefsel en cellen of inzake de leveranciers uit derde landen. Aan de importerende weefselinstelling die in het bezit is van een erkenning, aanwijzing, machtiging of vergunning wordt door de bevoegde autoriteit of autoriteiten het in bijlage II bij deze richtlijn vermelde certificaat afgegeven.
3. De importerende weefselinstelling mag haar importactiviteiten niet ingrijpend wijzigen zonder voorafgaande schriftelijke toestemming van de bevoegde autoriteit of autoriteiten. Met name alle wijzigingen met betrekking tot de ingevoerde soorten weefsel en cellen, met betrekking tot de werkzaamheden die in derde landen worden verricht voor zover deze van invloed kunnen zijn op de kwaliteit en veiligheid van de ingevoerde weefsels en cellen, of met betrekking tot de leveranciers uit derde landen, worden als ingrijpende wijzigingen beschouwd. Indien een importerende weefselinstelling een eenmalige invoer van weefsels of cellen, afkomstig van een leverancier uit een derde land, verricht die niet onder haar erkenning, aanwijzing, machtiging of vergunning valt, dan wordt deze invoer niet als ingrijpende wijziging beschouwd indien de importerende weefselinstelling gemachtigd is tot de invoer van dezelfde soort weefsel of cellen, afkomstig van een of meer andere leveranciers uit een derde land.
4. De erkenning, aanwijzing, machtiging of vergunning van een importerende weefselinstelling kan door de bevoegde autoriteit of autoriteiten geheel of gedeeltelijk worden opgeschort of ingetrokken, met name indien na inspecties of andere controlemaatregelen blijkt dat de weefselinstelling niet langer aan de eisen van deze richtlijn voldoet.
Artikel 4
Inspecties en andere controlemaatregelen
1. De lidstaten zorgen ervoor dat de bevoegde autoriteit of autoriteiten regelingen treffen voor inspecties en andere controlemaatregelen ten aanzien van de importerende weefselinstellingen en, in voorkomend geval, hun leveranciers uit derde landen, en dat de importerende weefselinstellingen passende controles verrichten om te waarborgen dat de kwaliteits- en veiligheidsnormen van de ingevoerde weefsels en cellen gelijkwaardig zijn aan die van Richtlijn 2004/23/EG. Voor geen enkele importerende weefselinstelling mag het tijdsverloop tussen inspecties meer dan twee jaar bedragen.
2. Deze inspecties worden verricht door ambtenaren die de bevoegde autoriteit of autoriteiten vertegenwoordigen en die:
|
a) |
gemachtigd zijn om inspecties te verrichten ten aanzien van de importerende weefselinstellingen en, in voorkomend geval, de werkzaamheden van leveranciers uit derde landen; |
|
b) |
in de importerende weefselinstellingen en inrichtingen van leveranciers uit derde landen de procedures en werkzaamheden beoordelen en controleren die relevant zijn om de gelijkwaardigheid van de kwaliteits- en veiligheidsnormen van de ingevoerde weefsels en cellen aan die van Richtlijn 2004/23/EG te waarborgen; |
|
c) |
kennisnemen van alle documenten of andere gegevensbestanden die relevant zijn voor deze beoordeling en controle. |
3. De lidstaten verstrekken op een met redenen omkleed verzoek van een andere lidstaat of van de Commissie informatie over de resultaten van de inspecties en andere controlemaatregelen ten aanzien van de importerende weefselinstellingen en leveranciers uit derde landen.
4. De lidstaten waarin weefsels en cellen worden ingevoerd, overwegen op een met redenen omkleed verzoek van een andere lidstaat waar de ingevoerde weefsels en cellen vervolgens worden gedistribueerd, inspecties of andere controlemaatregelen te verrichten ten aanzien van de importerende weefselinstellingen en de werkzaamheden van leveranciers uit derde landen. De lidstaat waar de importerende weefselinstelling is gevestigd, stelt na raadpleging van de lidstaat die het verzoek heeft ingediend passende maatregelen vast.
5. Indien naar aanleiding van dat verzoek een inspectie ter plaatse wordt verricht, wordt door de bevoegde autoriteit of autoriteiten van de lidstaat waar de importerende weefselinstelling is gevestigd met de bevoegde autoriteit of autoriteiten van de lidstaat die het verzoek heeft ingediend, overeengekomen of en hoe de lidstaat die het verzoek heeft ingediend aan de inspectie deelneemt. Het definitieve besluit over een dergelijke deelname is aan de lidstaat waar de importerende weefselinstelling is gevestigd. De redenen voor een besluit tot weigering van deelname worden uiteengezet voor de lidstaat die het verzoek heeft ingediend.
HOOFDSTUK III
VERPLICHTINGEN VAN DE IMPORTERENDE WEEFSELINSTELLINGEN
Artikel 5
Aanvraag tot verlening van een erkenning, aanwijzing, machtiging of vergunning als importerende weefselinstelling
1. Importerende weefselinstellingen die maatregelen hebben genomen om ervoor te zorgen dat de invoer van weefsels en cellen voldoet aan kwaliteits- en veiligheidsnormen die gelijkwaardig zijn aan die van Richtlijn 2004/23/EG en dat de ingevoerde weefsels en cellen kunnen worden getraceerd van donor tot ontvanger en omgekeerd, dienen een aanvraag tot verlening van een erkenning, aanwijzing, machtiging of vergunning als importerende weefselinstelling in door:
|
a) |
aan de bevoegde autoriteit of autoriteiten de vereiste informatie en documentatie te verstrekken als vermeld in bijlage I bij deze richtlijn; |
|
b) |
de in bijlage III van deze richtlijn vermelde documentatie ter beschikking te stellen en deze op verzoek van de bevoegde autoriteit of autoriteiten te verstrekken. |
2. De lidstaten kunnen ervoor kiezen de eisen inzake documentatie van bijlage I, deel F, en van bijlage III bij deze richtlijn niet te laten gelden voor eenmalige invoer als omschreven in artikel 2 van deze richtlijn, op voorwaarde dat passende nationale maatregelen voorhanden zijn om deze invoer te reglementeren. Die nationale maatregelen moeten:
|
a) |
traceerbaarheid van donor tot ontvanger en omgekeerd waarborgen; en |
|
b) |
waarborgen dat de ingevoerde weefsels en cellen niet op iemand anders dan de beoogde ontvangers worden toegepast. |
Artikel 6
Bijgewerkte informatie
1. Indien importerende weefselinstellingen voornemens zijn hun importactiviteiten ingrijpend te wijzigen, met name in geval van de in artikel 3, lid 3, bedoelde ingrijpende wijzigingen, verzoeken zij de bevoegde autoriteit of autoriteiten voorafgaandelijk om schriftelijke toestemming, en zij stellen de bevoegde autoriteit of autoriteiten in kennis van hun besluit om de importactiviteiten geheel of gedeeltelijk stop te zetten.
2. Importerende weefselinstellingen geven de bevoegde autoriteit of autoriteiten onverwijld kennis van alle vermoedelijke of daadwerkelijke ernstige ongewenste voorvallen of bijwerkingen die hun door leveranciers uit derde landen worden gemeld en die van invloed kunnen zijn op de kwaliteit en veiligheid van de weefsels en cellen die zij invoeren. De in de bijlagen III en IV bij Richtlijn 2006/86/EG vermelde informatie wordt in deze kennisgevingen opgenomen.
3. De importerende weefselinstellingen geven de bevoegde autoriteit of autoriteiten onverwijld kennis van:
|
a) |
elke gehele of gedeeltelijke intrekking of opschorting van de machtiging van een leverancier uit een derde land om weefsels en cellen uit te voeren; en |
|
b) |
elk ander besluit op grond van niet-naleving dat door de bevoegde autoriteit of autoriteiten van het land waar de leverancier uit een derde land is gevestigd, wordt genomen en dat van belang kan zijn voor de kwaliteit en de veiligheid van de ingevoerde weefsels en cellen. |
Artikel 7
Schriftelijke overeenkomsten
1. De importerende weefselinstellingen beschikken over schriftelijke overeenkomsten met leveranciers uit derde landen indien weefsels en cellen die voor invoer in de Unie zijn bestemd, buiten de Unie worden gedoneerd, verkregen, getest, bewerkt, gepreserveerd, bewaard of naar de Unie worden uitgevoerd.
De lidstaten kunnen ervoor kiezen deze eis niet te laten gelden voor eenmalige invoer als omschreven in artikel 2 van deze richtlijn, op voorwaarde dat passende nationale maatregelen voorhanden zijn om deze invoer te reglementeren. Die nationale maatregelen moeten:
|
a) |
traceerbaarheid van donor tot ontvanger en omgekeerd waarborgen; en |
|
b) |
waarborgen dat de ingevoerde weefsels en cellen niet op iemand anders dan de beoogde ontvangers worden toegepast. |
2. In de schriftelijke overeenkomst tussen de importerende weefselinstelling en de leverancier uit een derde land wordt vermeld aan welke kwaliteits- en veiligheidseisen moet zijn voldaan om te waarborgen dat de kwaliteits- en veiligheidsnormen van de ingevoerde weefsels en cellen gelijkwaardig zijn aan die van Richtlijn 2004/23/EG. Met name bevat de schriftelijke overeenkomst ten minste de in bijlage IV bij deze richtlijn vermelde informatie.
3. De schriftelijke overeenkomst voorziet in de bevoegdheid van de bevoegde autoriteit of autoriteiten om de werkzaamheden van leveranciers uit derde landen, met inbegrip van hun inrichtingen, te inspecteren tijdens de duur van de overeenkomst en tot twee jaar daarna.
4. De importerende weefselinstellingen verstrekken de bevoegde autoriteit of autoriteiten een afschrift van de schriftelijke overeenkomsten met leveranciers uit derde landen als onderdeel van hun aanvraag tot verlening van een erkenning, aanwijzing, machtiging of vergunning.
Artikel 8
Register van importerende weefselinstellingen
1. De importerende weefselinstellingen houden een register van hun werkzaamheden bij, met informatie over de soorten en hoeveelheden ingevoerde weefsels en cellen, alsmede over de oorsprong en de bestemming ervan. Dit register bevat dezelfde informatie voor elke eenmalige invoer. Het in artikel 10, lid 1, van Richtlijn 2004/23/EG bedoelde jaarverslag bevat informatie over deze werkzaamheden.
2. De importerende weefselinstellingen worden door de bevoegde autoriteit of autoriteiten opgenomen in het in artikel 10, lid 2, van Richtlijn 2004/23/EG genoemde openbaar register van weefselinstellingen.
3. Informatie over de erkenningen, aanwijzingen, machtigingen of vergunningen van importerende weefselinstellingen wordt ook ter beschikking gesteld via het in artikel 10, lid 3, van Richtlijn 2004/23/EG bedoelde netwerk van registers.
HOOFDSTUK IV
SLOTBEPALINGEN
Artikel 9
Omzetting
1. De lidstaten dienen uiterlijk op 29 oktober 2016 de nodige wettelijke en bestuursrechtelijke bepalingen vast te stellen en bekend te maken om aan deze richtlijn te voldoen. Zij delen de Commissie de tekst van die bepalingen onverwijld mede.
Zij passen die bepalingen toe vanaf 29 april 2017.
Wanneer de lidstaten die bepalingen aannemen, wordt in die bepalingen zelf of bij de officiële bekendmaking ervan naar deze richtlijn verwezen. De regels voor die verwijzing worden vastgesteld door de lidstaten.
2. De lidstaten delen de Commissie de tekst van de belangrijkste bepalingen van intern recht mede die zij op het onder deze richtlijn vallende gebied vaststellen.
Artikel 10
Inwerkingtreding
Deze richtlijn treedt in werking op de twintigste dag na die van de bekendmaking ervan in het Publicatieblad van de Europese Unie.
Artikel 11
Adressaten
Deze richtlijn is gericht tot de lidstaten.
Gedaan te Brussel, 8 april 2015.
Voor de Commissie
De voorzitter
Jean-Claude JUNCKER
(1) PB L 102 van 7.4.2004, blz. 48.
(2) Richtlijn 2006/17/EG van de Commissie van 8 februari 2006 ter uitvoering van Richtlijn 2004/23/EG van het Europees Parlement en de Raad wat betreft bepaalde technische voorschriften voor het doneren, verkrijgen en testen van menselijke weefsels en cellen (PB L 38 van 9.2.2006, blz. 40).
(3) Richtlijn 2006/86/EG van de Commissie van 24 oktober 2006 ter uitvoering van Richtlijn 2004/23/EG van het Europees Parlement en de Raad wat betreft de traceerbaarheidsvereisten, de melding van ernstige bijwerkingen en ernstige ongewenste voorvallen en bepaalde technische voorschriften voor het coderen, bewerken, preserveren, bewaren en distribueren van menselijke weefsels en cellen (PB L 294 van 25.10.2006, blz. 32).
BIJLAGE I
Minimumeisen inzake informatie en documentatie die importerende weefselinstellingen moeten verstrekken bij hun aanvraag tot verlening van een erkenning, aanwijzing, machtiging of vergunning voor importactiviteiten
De importerende weefselinstelling die een aanvraag indient tot verlening van een erkenning, aanwijzing, machtiging of vergunning voor importactiviteiten, verstrekt bij haar aanvraag de meest actuele informatie en, voor deel F, documentatie over het volgende, tenzij zij dat reeds heeft gedaan bij een eerdere aanvraag tot verlening van een erkenning, aanwijzing, machtiging of vergunning als weefselinstelling of importerende weefselinstelling:
A. Algemene informatie over de importerende weefselinstelling (IWI)
|
1. |
Naam van de IWI (naam van de onderneming). |
|
2. |
Bezoekadres van de IWI. |
|
3. |
Postadres van de IWI (indien verschillend). |
|
4. |
Status van de aanvragende IWI: hier moet worden vermeld of dit de eerste aanvraag is tot verlening van een erkenning, aanwijzing, machtiging of vergunning als IWI of, in voorkomend geval, een aanvraag tot verlenging. Indien de aanvrager reeds in het bezit is van een erkenning, aanwijzing, machtiging of vergunning als weefselinstelling, moet de code uit het repertorium van weefselinstellingen worden vermeld. |
|
5. |
Naam van de eenheid die de aanvraag indient (indien verschillend van de naam van de onderneming). |
|
6. |
Bezoekadres van de eenheid die de aanvraag indient. |
|
7. |
Postadres van de eenheid die de aanvraag indient (indien verschillend). |
|
8. |
Naam van de plaats van ontvangst van de invoer (indien verschillend van de namen van de onderneming en de eenheid die de aanvraag indient). |
|
9. |
Bezoekadres van de plaats van ontvangst. |
|
10. |
Postadres van de plaats van ontvangst (indien verschillend). |
B. Contactgegevens in verband met de aanvraag
|
1. |
Naam van de contactpersoon voor de aanvraag. |
|
2. |
Telefoonnummer. |
|
3. |
E-mailadres. |
|
4. |
Naam van de verantwoordelijke persoon (indien verschillend van de contactpersoon). |
|
5. |
Telefoonnummer. |
|
6. |
E-mailadres. |
|
7. |
URL van de website van de IWI (indien beschikbaar). |
C. Gegevens over de weefsels en cellen die worden ingevoerd
|
1. |
Lijst van de soorten weefsel en cellen die worden ingevoerd, met inbegrip van eenmalige invoer van specifieke soorten weefsel of cellen. |
|
2. |
Productnaam (indien van toepassing, overeenkomstig de algemene lijst van de EU) van alle soorten weefsel en cellen die worden ingevoerd. |
|
3. |
Handelsnaam (indien verschillend van de productnaam) van alle soorten weefsel en cellen die worden ingevoerd. |
|
4. |
Naam van de leverancier uit een derde land voor elke soort weefsel en cellen die wordt ingevoerd. |
D. Plaats van de werkzaamheden
|
1. |
Lijst waarin per soort weefsel of cellen wordt gespecificeerd of de leverancier uit een derde land de weefsels of cellen vóór invoer doneert, verkrijgt, test, bewerkt, preserveert of bewaart. |
|
2. |
Lijst waarin per soort weefsel of cellen wordt gespecificeerd of onderaannemers van de leverancier uit een derde land de weefsels of cellen vóór invoer doneren, verkrijgen, testen, bewerken, preserveren of bewaren. |
|
3. |
Lijst per soort weefsel of cellen van alle werkzaamheden die de IWI na invoer verricht. |
|
4. |
Namen van de derde landen waar de werkzaamheden vóór invoer plaatsvinden, per soort weefsel of cellen. |
E. Gegevens over de leveranciers uit een derde land
|
1. |
Naam van de leverancier(s) uit een derde land (naam van de onderneming). |
|
2. |
Naam van de contactpersoon. |
|
3. |
Bezoekadres. |
|
4. |
Postadres (indien verschillend). |
|
5. |
Telefoonnummer met internationaal netnummer. |
|
6. |
Noodnummer (indien verschillend). |
|
7. |
E-mailadres. |
F. Documentatie die bij de aanvraag moet worden gevoegd
|
1. |
Afschrift van de schriftelijke overeenkomst met de leverancier(s) uit een derde land. |
|
2. |
Gedetailleerde beschrijving van de weg die ingevoerde weefsels en cellen afleggen tussen de verkrijging en de ontvangst in de IWI. |
|
3. |
Afschrift van het certificaat van machtiging tot uitvoer van de leverancier uit een derde land of, indien geen specifiek certificaat van machtiging tot uitvoer is afgegeven, de certificering door de relevante bevoegde autoriteit of autoriteiten van het derde land waarbij de leverancier uit een derde land wordt gemachtigd tot werkzaamheden die verband houden met weefsels en cellen, met inbegrip van uitvoer. Deze documentatie omvat tevens de contactgegevens van de bevoegde autoriteit of autoriteiten van het derde land. Voor derde landen waarvoor dergelijke documentatie niet beschikbaar is, wordt documentatie in een andere vorm verstrekt, zoals auditverslagen van de leverancier uit een derde land. |
BIJLAGE II
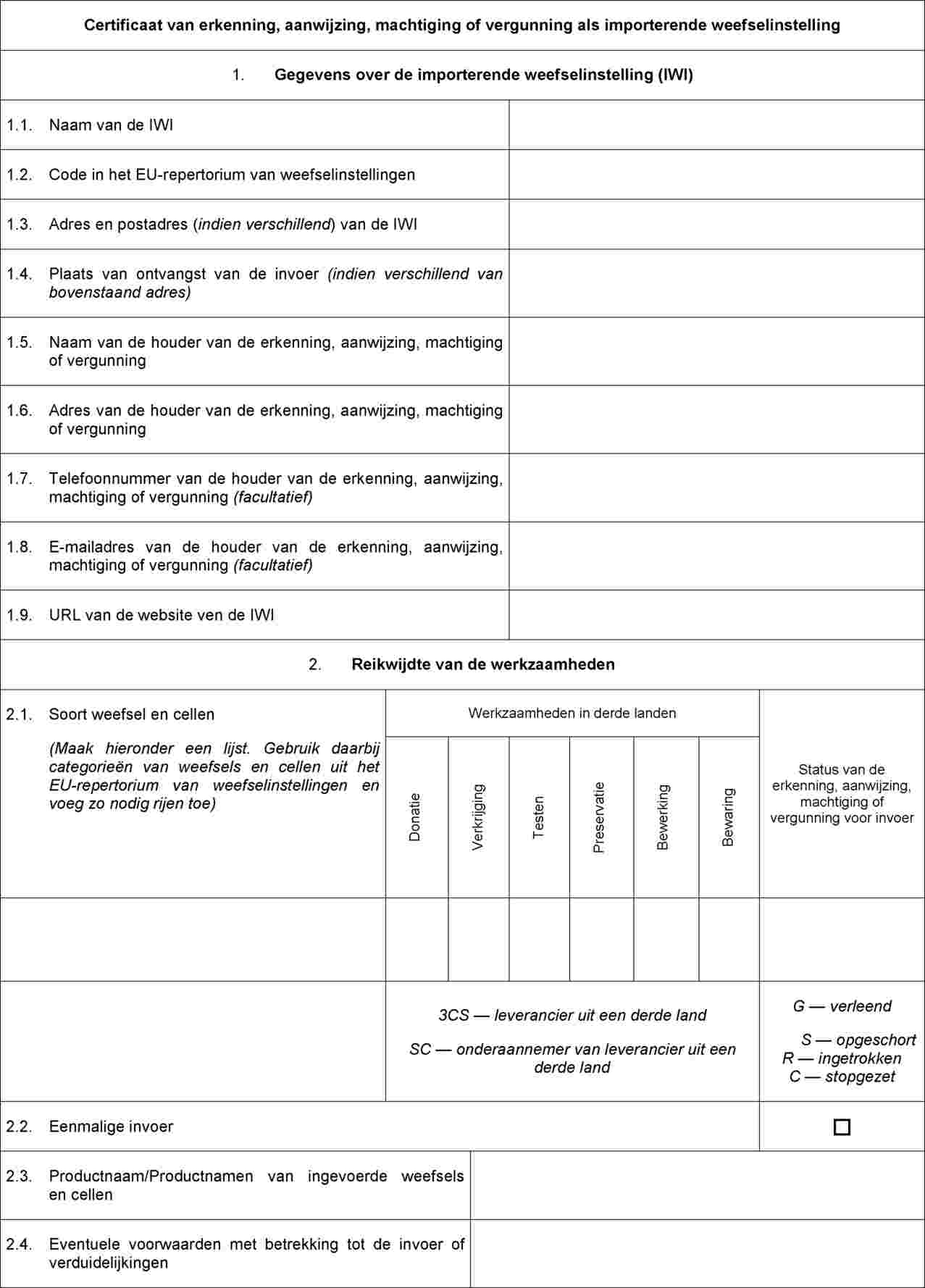
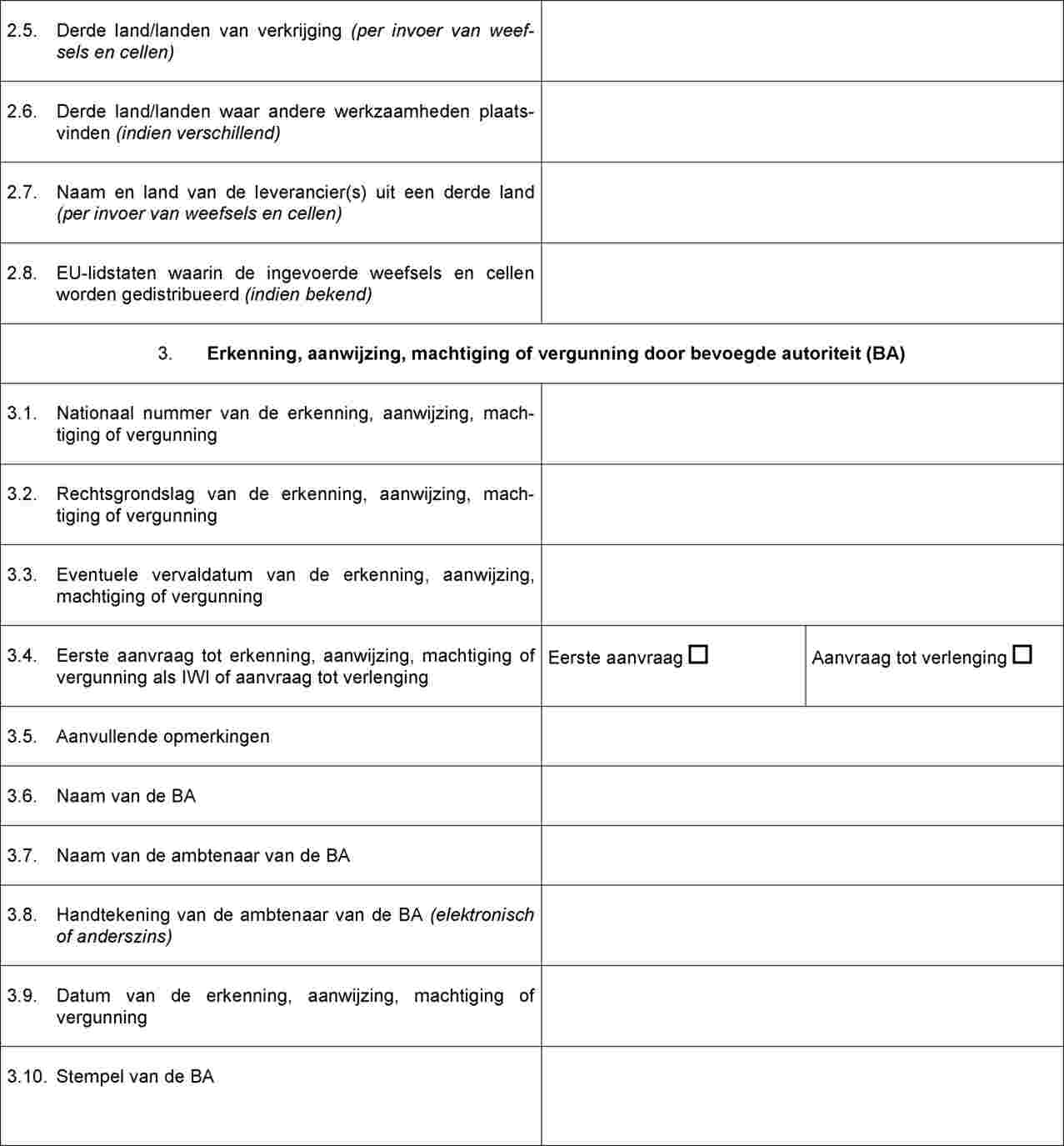
Certificaat van erkenning, aanwijzing, machtiging of vergunning dat door de bevoegde autoriteit of autoriteiten moet worden afgegeven aan importerende weefselinstellingen


BIJLAGE III
Minimumeisen inzake documentatie die aan de bevoegde autoriteit of autoriteiten ter beschikking moet worden gesteld door weefselinstellingen die van plan zijn weefsels en cellen uit derde landen in te voeren
Met uitzondering van eenmalige invoer als omschreven in artikel 2 van deze richtlijn, waarvoor vrijstelling van deze eisen inzake documentatie is verleend, stelt de importerende weefselinstelling die een aanvraag indient de meest actuele versie van de volgende documenten met betrekking tot de aanvrager en zijn leverancier(s) uit een derde land ter beschikking en verstrekt zij die op verzoek van de bevoegde autoriteit of autoriteiten, tenzij zij dat reeds heeft gedaan bij een eerdere aanvraag tot verlening van een erkenning, aanwijzing, machtiging of vergunning als importerende weefselinstelling of als weefselinstelling.
A. Documentatie met betrekking tot de importerende weefselinstelling
|
1. |
Functiebeschrijving van de verantwoordelijke persoon en gegevens over zijn/haar relevante kwalificaties en opleiding, zoals bepaald in Richtlijn 2004/23/EG; |
|
2. |
kopie van het etiket van de primaire verpakking, van het etiket van de omverpakking, van de buitenverpakking en van de vervoerscontainer; |
|
3. |
lijst van relevante en geactualiseerde versies van standaardpraktijkvoorschriften met betrekking tot de importactiviteiten van de instelling, met inbegrip van standaardpraktijkvoorschriften inzake de toepassing van de uniforme Europese code, de ontvangst en de bewaring van de ingevoerde weefsels en cellen in de importerende weefselinstelling, het beheer van ongewenste voorvallen en bijwerkingen, het beheer van terugroepingen en de traceerbaarheid van donor tot ontvanger. |
B. Documentatie met betrekking tot de leverancier(s) uit een derde land
|
1. |
Gedetailleerde beschrijving van de gehanteerde criteria voor donoridentificatie en -beoordeling, van de aan de donor of zijn familie verstrekte informatie, van de wijze waarop toestemming van de donor of zijn familie wordt verkregen en of er al dan niet sprake was van vrijwillige en onbetaalde donatie; |
|
2. |
gedetailleerde informatie over de testcentra die door leveranciers uit derde landen worden gebruikt en over de testen die door deze centra worden verricht; |
|
3. |
gedetailleerde informatie over de methoden die bij de bewerking van de weefsels en cellen worden toegepast, met inbegrip van bijzonderheden over de validatie van de kritische bewerkingsprocedure; |
|
4. |
gedetailleerde beschrijving van de inrichtingen, de kritische apparatuur en materieel en de criteria voor kwaliteitsbewaking en controle van de omgeving voor alle door de leverancier uit een derde land verrichte werkzaamheden; |
|
5. |
gedetailleerde informatie over de voorwaarden voor vrijgave van weefsels en cellen door de leverancier(s) uit een derde land; |
|
6. |
gegevens over eventuele onderaannemers van de leveranciers uit derde landen, met inbegrip van de naam, vestigingsplaats en verrichte werkzaamheden; |
|
7. |
samenvatting van de meest recente inspectie van de leverancier uit een derde land door de bevoegde autoriteit of autoriteiten van het derde land, met inbegrip van de datum en de soort van de inspectie en de belangrijkste conclusies; |
|
8. |
samenvatting van de meest recente audit van de leverancier uit een derde land die door of namens de importerende weefselinstelling werd verricht; |
|
9. |
elke relevante nationale of internationale erkenning. |
BIJLAGE IV
Minimumeisen inzake de inhoud van schriftelijke overeenkomsten tussen importerende weefselinstellingen en hun leveranciers uit derde landen
Met uitzondering van eenmalige invoer als omschreven in artikel 2 van deze richtlijn, waarvoor vrijstelling van deze eisen is verleend, bevat de schriftelijke overeenkomst tussen de importerende weefselinstelling en de leverancier uit een derde land ten minste de volgende bepalingen.
|
1. |
Gedetailleerde informatie over de specificaties van de importerende weefselinstelling die ervoor moeten zorgen dat aan de kwaliteits- en veiligheidsnormen van Richtlijn 2004/23/EG is voldaan, en de onderling overeengekomen taken en verantwoordelijkheden van beide partijen om de gelijkwaardigheid van de kwaliteits- en veiligheidsnormen van de ingevoerde weefsels en cellen te waarborgen; |
|
2. |
een bepaling dat de leverancier uit een derde land aan de importerende weefselinstelling de in bijlage III B bij deze richtlijn vermelde informatie moet verstrekken; |
|
3. |
een bepaling dat de leverancier uit een derde land de importerende weefselinstelling in kennis moet stellen van alle vermoedelijke of daadwerkelijke ernstige ongewenste voorvallen of bijwerkingen die van invloed kunnen zijn op de kwaliteit en veiligheid van de weefsels en cellen die de importerende weefselinstelling heeft ingevoerd of zal invoeren; |
|
4. |
een bepaling dat de leverancier uit een derde land de importerende weefselinstelling in kennis moet stellen van alle ingrijpende wijzigingen van haar werkzaamheden, met inbegrip van elke gehele of gedeeltelijke intrekking of opschorting van haar machtiging om weefsels en cellen uit te voeren of elk ander besluit op grond van niet-naleving door de bevoegde autoriteit of autoriteiten van het derde land dat van invloed kan zijn op de kwaliteit en de veiligheid van de weefsels en cellen die de importerende weefselinstelling heeft ingevoerd of zal invoeren; |
|
5. |
een bepaling waarin aan de bevoegde autoriteit of autoriteiten de bevoegdheid wordt verleend om de werkzaamheden van de leverancier uit een derde land te inspecteren, desgewenst ook door middel van inspecties ter plaatse als onderdeel van de inspectie van de importerende weefselinstelling. Deze bepaling moet ook voorzien in de bevoegdheid van de importerende weefselinstelling om regelmatig een audit ten aanzien van haar leverancier uit een derde land te verrichten; |
|
6. |
de voorwaarden voor het vervoer van weefsels en cellen die de leverancier uit een derde land en de importerende weefselinstelling zijn overeengekomen; |
|
7. |
een bepaling dat de leverancier uit een derde land of zijn onderaannemer donordossiers met betrekking tot de ingevoerde weefsels en cellen gedurende 30 jaar na verkrijging bewaart overeenkomstig de EU-regels voor gegevensbescherming en dat ingeval de leverancier uit een derde land zijn werkzaamheden zou stopzetten de nodige voorzieningen voor de bewaring van die dossiers worden getroffen; |
|
8. |
bepalingen inzake de regelmatige toetsing en, in voorkomend geval, herziening van de schriftelijke overeenkomst, onder meer om rekening te houden met eventuele wijzigingen van de eisen van de Europese kwaliteits- en veiligheidsnormen van Richtlijn 2004/23/EG; |
|
9. |
lijst van alle standaardpraktijkvoorschriften van de leverancier uit een derde land met betrekking tot de kwaliteit en veiligheid van de ingevoerde weefsels en cellen en een toezegging om die voorschriften op verzoek te verstrekken. |