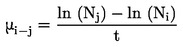|
(6)
|
de volgende hoofdstukken C.31 tot C.46 worden toegevoegd: „C.31. TEST MET TERRESTRISCHE PLANTEN: OPKOMST EN GROEI VAN ZAAILINGEN
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan testrichtlijn (TG) 208 (2006) van de OESO. Testmethoden worden periodiek herzien in het licht van de wetenschappelijke vooruitgang en om aan de regelgeving te kunnen blijven voldoen. Deze bijgewerkte testmethode is bedoeld om de potentiële effecten van chemische stoffen op de opkomst en groei van zaailingen te bepalen. De methode als zodanig heeft geen betrekking op chronische effecten en effecten op de voortplanting (d.w.z. zaadzetting, bloemvorming, vruchtrijping). De blootstellingsomstandigheden en de eigenschappen van de chemische stof zijn bepalende factoren bij het kiezen van de juiste testmethoden (bij het testen van metalen/metaalverbindingen moet bijvoorbeeld rekening worden gehouden met effecten van de pH en de desbetreffende tegenionen (1). Deze testmethode heeft geen betrekking op planten die aan dampen van chemische stoffen worden blootgesteld. De testmethode is geschikt voor het testen van algemene chemische stoffen, biociden en gewasbeschermingsmiddelen (ook bekend als plantenbeschermingsmiddelen of pesticiden). De methode is ontwikkeld op basis van bestaande methoden (2) (3) (4) (5) (6) (7). Ook andere literatuur over plantentests is in aanmerking genomen (8) (9) (10). De gebruikte definities zijn opgenomen in aanhangsel 1.
|
PRINCIPE VAN DE TEST
|
2.
|
Met de test worden de effecten op de opkomst van zaailingen en de vroege groei van hogere planten bepaald na blootstelling aan de teststof in de grond (of een geschikte grondmatrix). Zaden worden in contact gebracht met grond die is behandeld met de teststof, en worden 14 tot 21 dagen na opkomst van 50 % van de zaailingen in de controlegroep op effecten onderzocht. De gemeten eindpunten zijn visuele vaststelling van de zaailingenopkomst, het drooggewicht van de scheuten (of versgewicht van de scheuten) en in bepaalde gevallen de hoogte van de scheuten, alsook een beoordeling van zichtbare schadelijke effecten op verschillende delen van de plant. Deze metingen en observaties worden vergeleken met die gedaan aan onbehandelde controleplanten.
|
|
3.
|
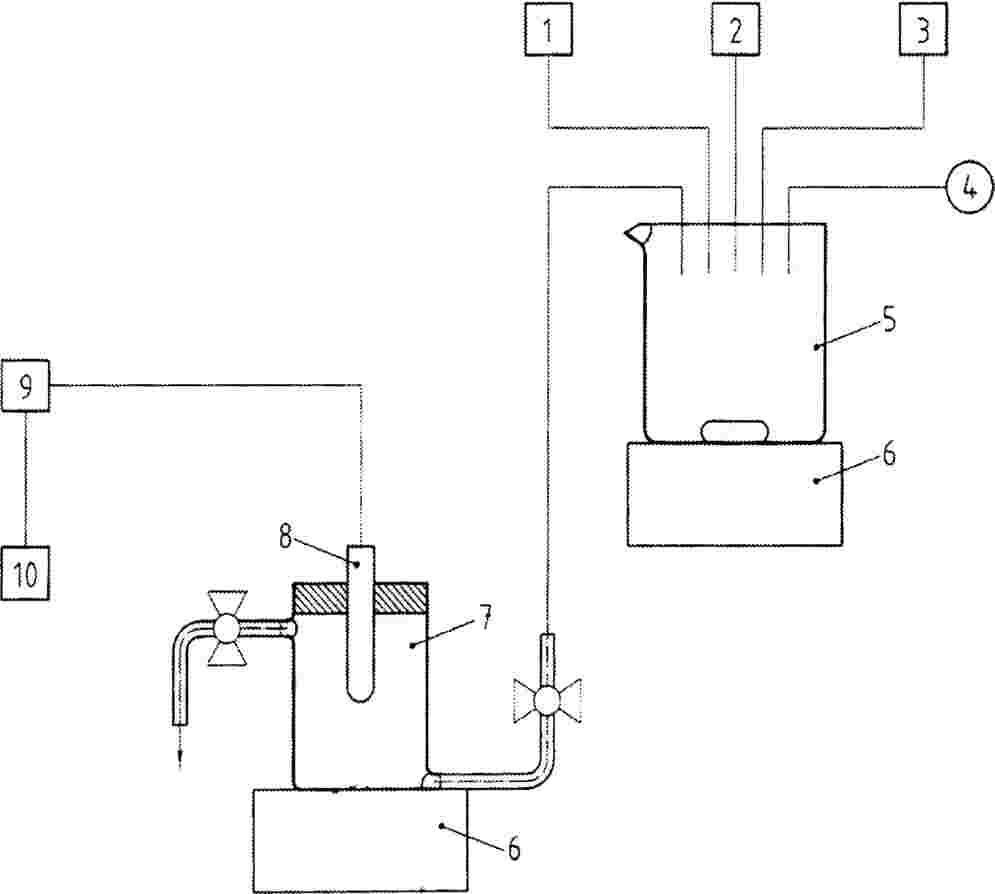
Afhankelijk van de verwachte blootstellingsroute wordt de teststof hetzij opgenomen in de grond (of eventueel een kunstmatige grondmatrix) of aangebracht op het oppervlak van de grond. Voor opname in de grond wordt een grote hoeveelheid grond behandeld. Deze wordt vervolgens in potten gedaan, waarna zaden van de betreffende plant in de grond worden geplant. Aanbrenging op het oppervlak gebeurt op grond in potten waarin de zaden al zijn geplant. De testeenheden (controlepotten en potten met behandelde grond, plus zaden) worden vervolgens onder omstandigheden geplaatst die bevorderlijk zijn voor de kieming/groei van de planten.
|
|
4.
|
De test kan worden opgezet met het doel de dosis-responscurve te bepalen of kan in één concentratie/dosering worden uitgevoerd als een limiettest, naargelang van het doel van het onderzoek. Als de resultaten van de test met één concentratie/dosering een bepaald toxiciteitsniveau overschrijden (bv. wanneer er effecten groter dan x % worden waargenomen), kan een bereikbepalingstest worden uitgevoerd om de boven- en ondergrens voor de toxiciteit te bepalen, gevolgd door een test met meerdere concentraties/doseringen om een dosis-responscurve te verkrijgen. Er wordt een passende statistische analyse uitgevoerd om de effectieve concentratie ECx of de effectieve toepassingsdosering ERx (bv. EC25, ER25, EC50, ER50) voor de meest gevoelige gemeten parameter(s) te verkrijgen. Bij deze test kunnen ook de concentratie zonder waargenomen effect (NOEC) en de laagste concentratie met waargenomen effect (LOEC) worden berekend.
|
INFORMATIE OVER DE TESTSTOF
|
5.
|
De volgende informatie is nuttig voor het vaststellen van de verwachte route van blootstelling aan de chemische stof en het ontwerpen van de test: structuurformule, zuiverheid, wateroplosbaarheid, oplosbaarheid in organische oplosmiddelen, 1-octanol/water-verdelingscoëfficiënt, sorptiegedrag van de grond, dampspanning, chemische stabiliteit in water en licht, en biologische afbreekbaarheid.
|
GELDIGHEID VAN DE TEST
|
6.
|
Voor een geldige test moet in de controles aan de volgende prestatiecriteria worden voldaan:
|
—
|
ten minste 70 % van de zaailingen moet opkomen;
|
|
—
|
de zaailingen mogen geen zichtbare tekenen van fytotoxische effecten vertonen (bv. chlorose, necrose, verwelking, blad- en stengelmisvormingen) en de planten mogen alleen de variatie in groei en uiterlijk vertonen die voor die specifieke soort normaal is;
|
|
—
|
de gemiddelde overleving van opgekomen controlezaailingen aan het eind van de onderzoeksperiode moet minstens 90 % zijn;
|
|
—
|
de omgevingsomstandigheden voor alle planten van een bepaalde soort moeten identiek zijn en de groeimedia moeten dezelfde hoeveelheid grondmatrix, hulpmedium of substraat bevatten uit dezelfde bron.
|
|
REFERENTIESTOF
|
7.
|
Met regelmatige tussenpozen kan een referentiestof worden getest om te verifiëren dat de prestaties van de test, de respons van de betreffende testplanten en de testomstandigheden niet beduidend zijn veranderd in de loop van de tijd. De prestaties van het testsysteem in een bepaald laboratorium kunnen ook worden beoordeeld aan de hand van historische metingen van de biomassa of groei van controleplanten, en op deze manier kan de kwaliteit binnen een laboratorium worden bewaakt..
|
BESCHRIJVING VAN DE METHODE
Natuurlijke grond — kunstmatig substraat
|
8.
|
Planten kunnen in potten worden gekweekt in zanderige leemgrond, lemige zandgrond of zanderige kleileemgrond die ten hoogste 1,5 % organische koolstof bevat (circa 3 % organisch materiaal). In de handel verkrijgbare potgrond of een kunstmatig grondmengsel met ten hoogste 1,5 % organische koolstof kan eveneens worden gebruikt. Kleigrond is niet geschikt indien van de teststof bekend is dat deze een hoge affiniteit voor klei heeft. Bodemgrond moet gezeefd worden over een zeef met mazen van 2 mm om de grond te homogeniseren en grove korrels te verwijderen. Van de uiteindelijk bereide grond moeten de soort, de textuur, het percentage organische koolstof, de pH, het zoutgehalte en de elektrische geleidbaarheid worden gerapporteerd. De grond moet worden ingedeeld volgens een standaardclassificatiediagram (11). Om het effect van bodempathogenen te beperken kan de grond gepasteuriseerd worden of met hitte worden behandeld.
|
|
9.
|
Het gebruik van natuurlijke grond kan de interpretatie van de resultaten bemoeilijken en de variabiliteit ervan vergroten door variërende fysisch-chemische eigenschappen en microbiële populaties. Deze variabelen zijn van invloed op het vochtvasthoudend vermogen, het vermogen om chemische stoffen te binden, de luchtdoorlatendheid en het gehalte aan nutriënten en spoorelementen. Naast de variaties in fysische factoren zullen er ook variaties in chemische eigenschappen zijn, zoals de pH en redoxpotentiaal, die invloed kunnen hebben op de biologische beschikbaarheid van de teststof (12) (13) (14).
|
|
10.
|
Kunstmatige substraten worden doorgaans niet voor het testen van gewasbeschermingsmiddelen gebruikt; ze kunnen wel van nut zijn voor het testen van algemene chemische stoffen of wanneer het wenselijk is de variabiliteit die kenmerkend is voor natuurlijke grond te minimaliseren en de vergelijkbaarheid van de testresultaten te vergroten. Substraten dienen uit inerte materialen te bestaan die minimale interactie met de teststof, het als drager fungerende oplosmiddel, of beide, vertonen. Zuurgewassen kwartszand, minerale wol en glaskorrels (bv. 0,35 tot 0,85 mm in diameter) zijn geschikte inerte materialen die de teststof (15) nauwelijks absorberen, zodat de stof maximaal beschikbaar is voor opname door de zaailing via de wortel. Ongeschikte substraten zijn onder meer vermiculiet, perliet en andere sterk absorberende materialen. Er moeten nutriënten voor de groei van de plant worden toegevoegd om stress door nutriëntentekorten te voorkomen, en waar mogelijk moet dit worden beoordeeld door middel van biochemische analyses of visuele beoordeling van controleplanten.
|
Criteria voor het selecteren van soorten voor de test
|
11.
|
De selectie van soorten moet redelijk breed zijn, bv. wat betreft taxonomische diversiteit in het plantenrijk, verspreiding, abundantie, soortspecifieke levenscycluskenmerken en habitat, zodat uiteenlopende responsen worden verkregen (8) (10) (16) (17) (18) (19) (20). Bij de selectie moeten de volgende kenmerken in aanmerking worden genomen:
|
—
|
de soort heeft uniforme zaden die gemakkelijk verkrijgbaar zijn bij een of meer betrouwbare standaard zaadbronnen en vertoont consistente, betrouwbare en gelijkmatige kieming en een gelijkvormige groei van de zaailingen.
|
|
—
|
de plant leent zich voor laboratoriumtests en kan betrouwbare resultaten opleveren die reproduceerbaar zijn binnen één testfaciliteit en tussen verschillende testfaciliteiten;
|
|
—
|
de gevoeligheid van de geteste soort is in overeenstemming met de respons van planten die worden aangetroffen in de omgeving die blootstaat aan de chemische stof;
|
|
—
|
ze zijn in enige mate gebruikt in eerdere toxiciteitstests, en uit hun gebruik in bijvoorbeeld herbicide-bioassays, screening op zware metalen, tests op zout- of mineralenstress of allelopathiestudies is gebleken dat ze gevoelig zijn voor een grote verscheidenheid van stressoren;
|
|
—
|
ze kunnen groeien onder de groeiomstandigheden van de testmethode;
|
|
—
|
ze voldoen aan de geldigheidscriteria van de test.
|
Aanhangsel 2 bevat een beperkte lijst van soorten die van oudsher het meest worden gebruikt, en aanhangsel 3 een lijst van mogelijke niet-gewassoorten.
|
|
12.
|
Hoeveel soorten er getest moeten worden hangt af van de toepasselijke wettelijke voorschriften, en daarom wordt dit niet gespecificeerd in deze testmethode.
|
Aanbrenging van de teststof
|
13.
|
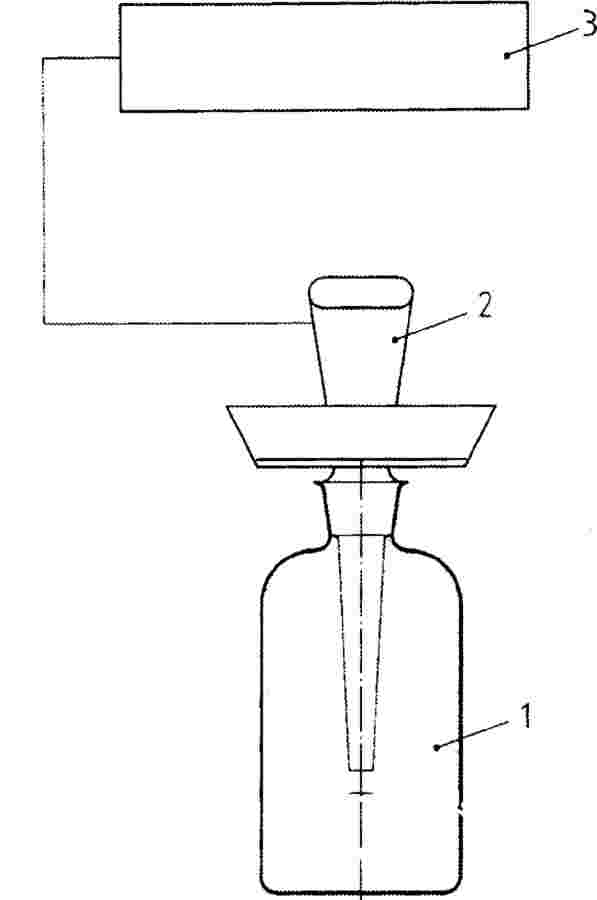
De chemische stof moet in een geschikte drager (bv. water, aceton, ethanol, polyethyleenglycol, Arabische gom, zand) worden aangebracht. Ook mengsels (geformuleerde producten of formuleringen) met werkzame en diverse toevoegingsstoffen kunnen getest worden.
|
Verwerking in grond/kunstmatig substraat
|
14.
|
Chemische stoffen die in water oplosbaar of suspendeerbaar zijn, worden aan water toegevoegd waarna de oplossing met een geschikt mengapparaat wordt vermengd met grond. Dit type test kan geschikt zijn als de blootstelling via grond of poriënwater plaatsvindt en er bezorgdheid is over opname via de wortels. Het watervasthoudend vermogen van de grond mag niet worden overschreden door de toevoeging van de teststof. Voor elke testconcentratie moet hetzelfde volume water worden toegevoegd, maar om klontering van de grond tot agglomeraten te voorkomen mag dit volume niet te groot zijn.
|
|
15.
|
Slecht in water oplosbare stoffen water moeten in een geschikt vluchtig oplosmiddel (bv. aceton, ethanol) worden opgelost en met zand worden vermengd. Het oplosmiddel kan dan met een luchtstroom onder voortdurend mengen uit het zand worden verwijderd. Het behandelde zand wordt vermengd met de experimentele grond. Aan een tweede controle worden alleen zand en oplosmiddel toegevoegd. Er worden gelijke hoeveelheden zand, behandeld met oplosmiddel dat weer verwijderd is, aan alle dosisniveaus en de tweede controle toegevoegd. Voor vaste, onoplosbare teststoffen worden droge grond en de chemische stof in een geschikt mengapparaat vermengd. Hierna wordt de grond in potten gedaan en worden de zaden direct gezaaid.
|
|
16.
|
Wanneer in plaats van grond een kunstmatig substraat wordt gebruikt, kunnen wateroplosbare stoffen vlak voor de test in de nutriëntenoplossing worden opgelost. Stoffen die onoplosbaar zijn in water, maar die in water kunnen worden gesuspendeerd door een oplosmiddel als drager te gebruiken, moeten met de drager aan de nutriëntenoplossing worden toegevoegd. Niet in water oplosbare chemische stoffen waarvoor geen niet-toxische wateroplosbare drager beschikbaar is, moeten in een geschikt vluchtig oplosmiddel worden opgelost. De oplossing wordt vermengd met zand of glaskorrels en vervolgens in een rotatieverdamper verdampt, waardoor een gelijkmatige laag van de stof achterblijft op het zand of de korrels. Voordat de potten worden gevuld moet een gewogen deel van de korrels met hetzelfde organische oplosmiddel worden geëxtraheerd en het gehalte aan chemische stof worden bepaald.
|
Aanbrenging op het oppervlak
|
17.
|
Voor gewasbeschermingsmiddelen wordt de teststof vaak aangebracht door het grondoppervlak te bespuiten met de testoplossing. Alle apparatuur die bij het uitvoeren van de tests wordt gebruikt, met inbegrip van apparatuur voor de bereiding en toediening van de chemische stof, moet een zodanige kwaliteit en capaciteit hebben dat de tests op een nauwkeurige wijze kunnen worden uitgevoerd en een reproduceerbare bedekking wordt verkregen. De bedekking moet voor alle grondoppervlakken hetzelfde zijn. Omstandigheden waarbij stoffen aan apparatuur kunnen adsorberen of ermee kunnen reageren moeten worden vermeden (bv. het gebruik van plastic slangen bij lipofiele chemische stoffen of stalen onderdelen en elementen). De manier waarop de teststof op het grondoppervlak wordt gespoten is een nabootsing van typische spuittanktoepassingen. De spuitvolumes moeten in het algemeen overeenkomen met die in de normale landbouwpraktijk en dienen gerapporteerd te worden (hoeveelheid water enz.). Er moet een type straalpijp worden gekozen dat een gelijkmatige bedekking van het grondoppervlak geeft. Wanneer oplosmiddelen en dragers worden gebruikt, moet een tweede groep van controleplanten worden opgezet die alleen oplosmiddel/drager krijgen. Dit is niet nodig voor gewasbeschermingsmiddelen die als formuleringen worden getest.
|
Verificatie van de concentratie/dosering van de teststof
|
18.
|
De toegepaste concentraties/doseringen moeten op passende wijze geverifieerd worden. Voor oplosbare chemische stoffen kan verificatie van alle testconcentraties/-doseringen plaatsvinden door de hoogste in de test gebruikte concentratie testoplossing te analyseren waarbij de verdere verdunning wordt gedocumenteeerd en er gekalibreerde toepassingsapparatuur wordt gebruikt (bv. gekalibreerd analytisch glaswerk, kalibratie van spuitapparatuur). Voor onoplosbare chemische stoffen moet bij de verificatie het gewicht van de aan de grond toegevoegde teststof worden vermeld. Een analyse van de grond kan nodig zijn indien de homogeniteit moet worden aangetoond.
|
PROCEDURE
Testopzet
|
19.
|
Zaden van dezelfde soort worden in potten geplant. Hoeveel zaden er per pot worden geplant is afhankelijk van de soort, grootte van de potten en duur van de test. Het aantal planten per pot moet zodanig zijn dat de groeiomstandigheden adequaat zijn en de potten in de loop van de test niet overvol raken. De maximale plantdichtheid is ongeveer 3-10 zaden per 100 cm2, afhankelijk van de grootte van de zaden. Voorbeelden van aanbevolen aantallen zijn: voor maïs, soja, tomaat, komkommer en suikerbiet 1 à 2 planten per pot van 15 cm, voor koolzaad en erwt 3 planten per pot van 15 cm, en voor ui, tarwe en andere soorten met kleine zaden 5 à 10 planten per pot van 15 cm. Het aantal zaden en replicaatpotten (een replicaat is gedefinieerd als een pot; planten in dezelfde pot zijn dus geen replicaten) moet optimale statistische analyse mogelijk maken (21). Er moet worden opgemerkt dat de variabiliteit groter zal zijn voor soorten waarbij een kleiner aantal grote zaden per pot (replicaat) wordt gebruikt dan voor soorten waarbij per pot een groter aantal kleine zaden kan worden gebruikt. Deze variabiliteit kan worden beperkt door in elke pot evenveel zaden te planten.
|
|
20.
|
Het gebruik van controlegroepen moet waarborgen dat de waargenomen effecten samenhangen met of zijn toe te schrijven aan blootstelling aan de teststof. De controlegroep dient in elk opzicht identiek te zijn aan de testgroep, behalve wat betreft blootstelling aan de teststof. Binnen een test moeten alle planten, ook de controles, afkomstig zijn uit dezelfde bron. Voor vertekening te voorkomen moeten de test- en controlepotten willekeurig worden ingedeeld.
|
|
21.
|
Zaden omhuld met een dunne laag insecticide of fungicide (d.w.z. gecoate zaden) moeten worden vermeden. Het gebruik van bepaalde niet-systemische contactfungiciden (bv. captan, thiram) wordt door sommige regelgevende instanties echter wel toegestaan (22). Bij bezorgdheid over zaadoverdraagbare pathogenen kunnen de zaden kort in een oplossing met een lage concentratie (5 %) natriumhypochloriet worden geweekt, gevolgd door grondig spoelen onder stromend water en drogen. Herstelbehandeling met een ander gewasbeschermingsmiddel is niet toegestaan.
|
Testomstandigheden
|
22.
|
De testomstandigheden moeten de omstandigheden die vereist zijn voor normale groei van de geteste soorten en variëteiten benaderen (aanhangsel 4 bevat voorbeelden van testomstandigheden). De opkomende planten moeten volgens goede tuinbouwpraktijken in klimaatkamers, fytotrons of kassen worden gekweekt. Bij het gebruik van kweekfaciliteiten omvatten deze praktijken meestal het reguleren en voldoende frequent (bv. dagelijks) registreren van de temperatuur, vochtigheid, koolstofdioxideconcentratie, licht (intensiteit, golflengte, fotosynthetisch actieve straling) en lichtperiode, manier van bewatering enz. om een goede groei te waarborgen, die wordt afgelezen aan de controleplanten van die specifieke soort. De kastemperatuur moet gereguleerd worden met ventilatie-, verwarmings- en/of koelingssystemen. Voor in kassen uitgevoerde tests worden in het algemeen de volgende omstandigheden aanbevolen:
|
—
|
temperatuur: 22 °C ± 10 °C;
|
|
—
|
vochtigheid: 70 % ± 25 %;
|
|
—
|
fotoperiode: minimaal 16 uur licht
|
|
—
|
lichtintensiteit: 350 ± 50 μE/m2/s. Extra verlichting kan nodig zijn als de intensiteit lager wordt dan 200 μE/m2/s, in het golflengtebereik 400-700 nm, behalve voor bepaalde soorten die minder licht nodig hebben.
|
Tijdens het onderzoek moeten de omgevingsomstandigheden worden gemonitord en gerapporteerd. De planten worden in niet-poreuze plastic of glazen potten gekweekt, met onder de pot een bak of schotel. De potten kunnen periodiek worden verplaatst om de variabiliteit in de groei van de planten (door verschillen in testomstandigheden binnen de kweekfaciliteit) te minimaliseren. De potten moeten groot genoeg zijn om normale groei mogelijk te maken.
|
|
23.
|
Er kunnen extra nutriënten aan de grond worden toegevoegd voor zover dat nodig is om een goede groeikracht te behouden. Of en op welk moment dit moet gebeuren kan worden beoordeeld door observatie van de controleplanten. Het wordt aanbevolen de planten van onderaf te bewateren (bv. gebruikmakend van pitten van glasvezels). In eerste instantie mag wel van bovenaf worden bewaterd om de zaadkieming te stimuleren en om op het oppervlak aangebrachte teststof sneller in de grond te laten dringen.
|
|
24.
|
De specifieke kweekomstandigheden dienen te worden afgestemd op de geteste soort en de onderzochte teststof. Controle- en behandelde planten moeten onder dezelfde omgevingsomstandigheden worden gehouden, waarbij wel passende maatregelen moeten worden genomen om (bv. bij een vluchtige teststof) kruisblootstelling tussen verschillende behandelingen en van controles aan de teststof te voorkomen.
|
Tests met één concentratie/dosering
|
25.
|
Om te bepalen welke concentratie/dosering van de chemische stof geschikt is voor het uitvoeren van een test met één concentratie of dosering (challenge test/limiettest), moet rekening worden gehouden met een aantal factoren. Voor algemene chemische stoffen zijn onder meer de fysisch-chemische eigenschappen van belang. Voor gewasbeschermingsmiddelen moet gekeken worden naar de fysisch-chemische eigenschappen en het gebruikspatroon van de chemische stof, de maximale concentratie of toepassingsdosering, het aantal toepassingen per seizoen en/of de persistentie van de teststof. Om vast te stellen of een algemene chemische stof fytotoxische eigenschappen heeft, kan het zinvol zijn om bij de maximale concentratie van 1 000 mg/kg droge grond te testen.
|
Bereikbepalingstest
|
26.
|
Indien nodig kan een bereikbepalingstest worden uitgevoerd om een indicatie te krijgen van de concentraties/doseringen die in het definitieve dosis-responsonderzoek moeten worden getest. De testconcentraties/-doseringen voor een bereikbepalingstest moeten ruim uit elkaar liggen (bv. 0,1, 1,0, 10, 100 en 1 000 mg/kg droge grond). Voor gewasbeschermingsmiddelen kunnen de concentraties/doseringen gebaseerd worden op de aanbevolen of maximale concentratie of toepassingsdosering, bv. 1/100, 1/10, 1/1 van de aanbevolen/maximale concentratie of toepassingsdosering.
|
Tests met meerdere concentraties/doseringen
|
27.
|
Een test met meerdere concentraties/doseringen wordt uitgevoerd om een dosis-responsrelatie vast te stellen en een ECx of ERx-waarde te bepalen voor opkomst, biomassa en/of zichtbare effecten, in vergelijking met niet-blootgestelde controles, zoals vereist door regelgevende instanties.
|
|
28.
|
Het aantal en de onderlinge afstand van de concentraties of doseringen moeten zodanig zijn dat een betrouwbare dosis-responsrelatie en regressievergelijking worden verkregen en de ECx. of ERx. kan worden geschat. De gekozen concentraties/doseringen moeten de te bepalen ECx of ERxwaarden omvatten. Als bijvoorbeeld een EC50-waarde moet worden bepaald, is het wenselijk de test uit te voeren met doseringen die 20 tot 80 % effect veroorzaken. Om dit te bereiken worden bij voorkeur ten minste vijf testconcentraties/-doseringen gebruikt in een meetkundige reeks met een reden van ten hoogste 3, plus een onbehandelde controle. Voor elke dosisgroep en de controlegroep moet het aantal replicaten ten minste vier zijn en het totale aantal zaden ten minste 20. Bij bepaalde planten met een laag kiemingspercentage of een variabel groeigedrag zijn wellicht meer replicaten nodig om de statistische power te vergroten. Als een groter aantal testconcentraties/-doseringen wordt gebruikt, kan met minder replicaten worden volstaan. Als schatting van de NOEC nodig is, zijn mogelijk meer replicaten nodig om de gewenste statistische power te verkrijgen (23).
|
Observaties
|
29.
|
Gedurende de observatieperiode, d.w.z. 14 tot 21 dagen na opkomst van 50 % van de controleplanten (dit kunnen ook oplosmiddelcontroles zijn), worden de planten regelmatig geobserveerd (ten minste wekelijks en zo mogelijk dagelijks) op opkomst, zichtbare tekenen van fytotoxiciteit en sterfte. Aan het eind van de test moeten het opkomstpercentage en de biomassa van overlevende planten worden geregistreerd, alsook zichtbare schadelijke effecten op verschillende delen van de plant. Het kan hierbij gaan om een afwijkend uiterlijk van de opgekomen zaailingen, dwerggroei, chlorose, verkleuring, sterfte en effecten op de ontwikkeling van de plant. De biomassa aan het eind kan gemeten worden als het uiteindelijke gemiddelde drooggewicht van de scheuten, door de scheuten vanaf het grondoppervlak te oogsten en tot een constant gewicht te drogen bij 60 °C. De biomassa aan het eind kan ook gemeten worden als het versgewicht van de scheuten. De hoogte van de scheuten kan een ander eindpunt zijn als de regelgeving dat vereist. Er moet een uniform scoringssysteem voor zichtbare schade worden gebruikt om de waarneembare toxische reponsen te evalueren. Voorbeelden van kwalitatieve en kwantitatieve visuele beoordelingen zijn te vinden in literatuur (23) (24).
|
GEGEVENS EN RAPPORTAGE
Statistische analyse
Test met één concentratie/dosering
|
30.
|
De gegevens voor elke plantensoort moeten met behulp van een passende statistische methode worden geanalyseerd (21). Het niveau van het effect bij de testconcentratie/dosering, of de waarneming dat een bepaald effect niet wordt bereikt bij de testconcentratie/dosering, moet gerapporteerd worden (bv. < x% effect waargenomen bij y concentratie of dosering).
|
Test met meerdere concentraties/doseringen
|
31.
|
Er wordt een dosis-responsrelatie vastgesteld in de vorm van een regressievergelijking. Er kunnen verschillende modellen worden gebruikt. Voor het schatten van ECx of ERx (bv. EC25, ER25, EC50, ER50) en de bijbehorende betrouwbaarheidsgrenzen voor de opkomst van zaailingen als een binaire respons kunnen de logit-, probit-, Weibull-, Spearman-Karber-, getrimde Spearman-Karber-methode enz. geschikt zijn. Voor de groei van de zaailingen (gewicht en hoogte) als continue eindpunten kunnen de ECx of ERx en de bijbehorende betrouwbaarheidsgrenzen worden geschat door middel van geschikte regressieanalyse (bv. niet-lineaire regressieanalyse volgens Bruce-Versteeg (25)). Waar mogelijk moet de R2 0,7 of hoger zijn voor de meest gevoelige soort en moeten de gebruikte testconcentraties/-doseringen het gebied tussen 20 % tot 80 % effect omvatten. Als de NOEC moet worden geschat, worden bij voorkeur krachtige statistische tests toegepast die gekozen worden op basis van gegevensverdeling (21) (26).
|
Testverslag
|
32.
|
Het testverslag moet de onderzoeksresultaten bevatten, alsook een gedetailleerde beschrijving van de testomstandigheden, een diepgaande bespreking van de resultaten, analyse van de meetgegevens en de uit de analyse getrokken conclusies. Een overzichtstabel en een samenvatting van de resultaten zijn eveneens vereist. In het testverslag moet informatie worden opgenomen:
|
|
Teststof:
|
—
|
chemische idententificatiegegevens, relevante eigenschappen van de geteste chemische stof (bv. log Pow, oplosbaarheid in water, dampspanning en informatie over het lot en het gedrag in het milieu, indien beschikbaar);
|
|
—
|
details over de bereiding van de testoplossing en verificatie van testconcentraties zoals beschreven in punt 18.
|
|
|
|
Geteste soort:
|
—
|
gegevens over het testorganisme: soort/variëteit, plantenfamilies, wetenschappelijke en gewone naam, bron en geschiedenis van het zaad, zo gedetailleerd mogelijk (d.w.z. naam van de leverancier, kiemingspercentage, grootte van de zaden klasse, partij- of lotnummer, jaar of groeiseizoen waarin het zaad werd geoogst, datum van beoordeling van kieming), levensvatbaarheid, enz.;
|
|
—
|
aantal geteste mono- en dicotyle soorten;
|
|
—
|
motivering van de keuze van de soort;
|
|
—
|
beschrijving van de bewaring, behandeling en instandhouding van het zaad.
|
|
|
|
Testomstandigheden:
|
—
|
testfaciliteit (bv. klimaatkast, fytotron en kas);
|
|
—
|
beschrijving van het testsysteem (bv. afmetingen en materiaal van de potten en hoeveelheden grond);
|
|
—
|
kenmerken van de grond (textuur of soort grond: korrelgrootteverdeling en indeling, fysische en chemische eigenschappen met inbegrip van % organisch materiaal, % organische koolstof en pH);
|
|
—
|
bereiding van grond/substraat (bv. grond, kunstmatige grond, zand e.a.) voorafgaand aan test;
|
|
—
|
beschrijving van het voedingsmedium, indien gebruikt;
|
|
—
|
aanbrenging van de teststof: beschrijving van de aanbrengingsmethode, beschrijving van apparatuur, blootstellingsdoseringen en -volumes met inbegrip van chemische verificatie, beschrijving van de kalibratiemethode en beschrijving van omgevingsomstandigheden tijdens de aanbrenging;
|
|
—
|
groeiomstandigheden: lichtintensiteit (bv. fotosynthetisch actieve straling (PAR)), fotoperiode, max/min temperaturen, bewateringsschema en — methode,
|
|
—
|
aantal zaden per pot, aantal planten per dosis, aantal replicaten (potten) per blootstellingsdosering;
|
|
—
|
soort en aantal controles (negatieve en/of positieve controles, oplosmiddelcontrole indien gebruikt);
|
|
|
|
Resultaten:
|
—
|
tabel met alle eindpunten voor elk replicaat, testconcentratie/dosering en soort;
|
|
—
|
aantal en percentage opgekomen planten in vergelijking met controles;
|
|
—
|
gemeten biomassa (drooggewicht of versgewicht van scheuten) van de planten uitgedrukt als percentage van de controles;
|
|
—
|
scheuthoogte van de planten als percentage van de controles, indien gemeten;
|
|
—
|
percentage zichtbare schade en een kwalitatieve en kwantitatieve beschrijving van zichtbare schade (chlorose necrose, verweking, blad- en stengelmisvorming, alsook eventuele afwezigheid van effecten) door de teststof in vergelijking met controleplanten;
|
|
—
|
beschrijving van de waarderingsschaal gebruikt voor het beoordelen van zichtbare schade, indien visuele waarderingen worden opgegeven;
|
|
—
|
voor onderzoeken met één dosering moet het percentage schade worden vermeld;
|
|
—
|
ECx of ERx (bv. EC50, ER50, EC25, ER25)-waarden en bijbehorende betrouwbaarheidsgrenzen. Als regressieanalyse is uitgevoerd moeten de standaardfout voor de regressievergelijking en de standaardfout voor individuele parameterschattingen (helling, snijpunt met de y-as) worden opgegeven;
|
|
—
|
NOEC (en LOEC) indien berekend;
|
|
—
|
beschrijving van de gebruikte statistische procedures en aannames;
|
|
—
|
grafische weergave van deze gegevens en de dosis-responsrelatie voor de geteste soort.
|
|
Afwijkingen van de in deze testmethode beschreven procedures en eventuele ongebruikelijke gebeurtenissen tijdens de test.
|
LITERATUUR
|
(1)
|
Schrader G., Metge K., and Bahadir M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189-193.
|
|
(2)
|
International Organisation of Standards. (1993). ISO 11269-1 Soil Quality -- Determination of the Effects of Pollutants on Soil Flora — Part 1: Method for the Measurement of Inhibition of Root Growth.
|
|
(3)
|
International Organisation of Standards. (1995). ISO 11269-2 Soil Quality -- Determination of the Effects of Pollutants on Soil Flora — Part 2: Effects of Chemicals on the Emergence and Growth of Higher Plants.
|
|
(4)
|
American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
U.S. EPA. (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
|
|
(6)
|
US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background — Non-target Plant Testing;
|
|
—
|
850.4025: Target Area Phytotoxicity;
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850.4225: Seedling Emergence, Tier II;
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR, X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1. (1993) Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K.E. and Keddy, C.J. (1993). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No.145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Canada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C., and Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms — A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. No 48.
|
|
(10)
|
Hale, B., Hall, J.C., Solomon, K., and Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario Canada.
|
|
(11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sc. Soc. Amer. Proc. 26:305 (1962).
|
|
(12)
|
Audus, L.J. (1964). Herbicide behaviour in the soil. In: Audus, L.J. ed. The Physiology and biochemistry of Herbicides, London, New York, Academic Press, NY, Chapter 5, pp. 163-206.
|
|
(13)
|
Beall, M.L., Jr. and Nash, R.G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571-575.
|
|
(14)
|
Beetsman, G.D., Kenney, D.R. and Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247-250.
|
|
(15)
|
U.S. Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 pp., FDA, Washington, DC.
|
|
(16)
|
McKelvey, R.A., Wright, J.P., Honegger, J.L. and Warren, L.W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161-1174
|
|
(17)
|
Boutin, C.; Elmegaard, N. and Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Comité risicobeoordeling Ecotoxicology vol. 13(4): 349-369.
|
|
(18)
|
Boutin, C., and Rogers, C.A. (2000). Patterns of sensitivity of plant species to various herbicides — An analysis with two databases. Ecotoxicology vol.9(4):255-271.
|
|
(19)
|
Boutin, C. and Harper, J.L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155-271.
|
|
(20)
|
Boutin, C., Lee, H.-B., Peart, T.E., Batchelor, S.P. and Maguire, R.J.. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532-2541.
|
|
(21)
|
OECD (2006). Draft Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment No 54, Organisation for Economic Co-operation and Development, Paris.
|
|
(22)
|
Hatzios, K.K. and Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1-63.
|
|
(23)
|
Hamill, P.B., Marriage, P.B. and G. Friesen. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386-389.
|
|
(24)
|
Frans, R.E. and Talbert, R.E. (1992). Design of field experiments and the measurement and analysis of plant response. In: B. Truelove (Ed.) Research Methods in Weed Science, 2nd ed. Southern weed Science Society, Auburn, 15-23.
|
|
(25)
|
Bruce, R.D. and Versteeg, D. J.(1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485-1492.
|
|
(26)
|
Hoofdstuk C.33 van deze bijlage: Voortplantingstest met regenwormen (Eisenia fetida/Eisenia andrei).
|
Aanhangsel 1
Definities
Werkzaam bestanddeel (of werkzame stof)
: een materiaal bedoeld om een specifiek biologisch effect teweeg te brengen (bv. ter bestrijding van insecten, plantenziekten of onkruid in het behandelde gebied), ook bekend als werkzaam bestanddeel van de technisch zuivere stof).
Chemische stof
: een stof of een mengsel.
Gewasbeschermingsmiddelen of pesticiden
: materialen met een specifieke biologische activiteit die doelbewust worden gebruikt om gewassen te beschermen tegen plagen (bv. schimmelziekten, insecten en concurrerende planten).
ECx
— concentratie voor x % effect, of ERx
— dosering voor x % effect
: de concentratie of dosering die in vergelijking met de controle een ongewenste verandering in het eindpunt van de test veroorzaakt van x % (25 % of 50 % afname van de opkomst van zaailingen, het scheutgewicht of het uiteindelijke aantal aanwezige planten, of toename van zichtbare schade correspondeert bijvoorbeeld respectievelijk met een EC25/ER25 of EC50/ER50).
Opkomst
: het boven de grond verschijnen van het coleoptiel of de zaadlob.
Formulering
: het in de handel verkrijgbare geformuleerde product dat de werkzame stof ( werkzame bestanddeel) bevat; ook bekend als „eindpreparaat” (8) of „voor het typische eindgebruik bestemde product”.
LOEC (Lowest Observed Effect Concentration)
: de laagste concentratie teststof waarbij effect werd waargenomen. In deze test heeft de concentratie die overeenkomt met de LOEC een statistisch significant effect (p < 0,05) binnen een bepaalde blootstellingsperiode, in vergelijking met de controle, en is deze concentratie hoger dan de NOEC-waarde.
Niet-doelwitplanten
: die planten die zich buiten het gebied van de doelplanten bevinden. Voor gewasbeschermingsmiddelen zijn dit meestal planten buiten het behandelingsgebied.
NOEC (No Observed Effect Concentration)
: de hoogste concentratie teststof waarbij geen effect werd waargenomen. In deze test heeft de concentratie die overeenkomt met de NOEC geen statistisch significant effect (p < 0,05) binnen een bepaalde blootstellingsperiode in vergelijking met de controle.
Fytoxicity
: schadelijke afwijkingen (vastgesteld door metingen en visuele beoordeling) van het normale beeld van opkomst en groei van planten als reactie op een bepaalde chemische stof.
Replicaat
: de experimentele eenheid die representatief is voor een controlegroep en/of dosisgroep. In deze onderzoeken wordt de pot gedefinieerd als replicaat.
Visuele beoordeling
: waardering van zichtbare schade op basis van waarnemingen van de plantstand, groeikracht, misvormingen, chlorose, necrose en het algehele uiterlijk in vergelijking met een controle.
Teststof
: alle volgens deze testmethode geteste stoffen of mengsels.
Aanhangsel 2
Lijst van soorten die van oudsher bij plantentests worden gebruikt
|
Familie
|
Soort
|
Gewone namen
|
|
DICOTYLEDONAE
|
|
Apiaceae (Umbelliferae)
|
Daucus carota
|
Wortel
|
|
Asteraceae (Compositae)
|
Helianthus annuus
|
Zonnebloem
|
|
Asteraceae (Compositae)
|
Lactuca sativa
|
sla
|
|
Brassicaceae (Cruciferae)
|
Sinapis alba
|
Witte mosterd
|
|
Brassicaceae (Cruciferae)
|
Brassica campestris var. chinensis
|
Paksoi
|
|
Brassicaceae (Cruciferae)
|
Brassica napus
|
Koolzaad
|
|
Brassicaceae (Cruciferae)
|
Brassica oleracea var. capitata
|
Kool
|
|
Brassicaceae (Cruciferae)
|
Brassica rapa
|
Meiraap/stoppelknol
|
|
Brassicaceae (Cruciferae)
|
Lepidium sativum
|
Tuinkerszaad
|
|
Brassicaceae (Cruciferae)
|
Raphanus sativus
|
Radijs
|
|
Chenopodiaceae
|
Beta vulgaris
|
Suikerbieten
|
|
Cucurbitaceae
|
Cucumis sativus
|
Komkommer
|
|
Fabaceae (Leguminosae)
|
Glycine max (G. soja)
|
Soja
|
|
Fabaceae (Leguminosae)
|
Phaseolus aureus
|
Mungbonen
|
|
Fabaceae (Leguminosae)
|
Phaseolus vulgaris
|
Stamboon, prinsessenboon, tuinboon
|
|
Fabaceae (Leguminosae)
|
Pisum sativum
|
Erwt
|
|
Fabaceae (Leguminosae)
|
Trigonella foenum-graecum
|
Fenegriek
|
|
Fabaceae (Leguminosae)
|
Lotus corniculatus
|
Rolklaver
|
|
Fabaceae (Leguminosae)
|
Trifolium pratense
|
Rode klaver
|
|
Fabaceae (Leguminosae)
|
Vicia sativa
|
Wikken
|
|
Linaceae
|
Linum usitatissimum
|
Vlas
|
|
Polygonaceae
|
Fagopyrum esculentum
|
Boekweit
|
|
Solanaceae
|
Solanum lycopersicon
|
Tomaat
|
|
MONOCOTYLEDONAE
|
|
Liliaceae (Amarylladaceae)
|
Allium cepa
|
Uien
|
|
Poaceae (Gramineae)
|
Avena sativa
|
Haver
|
|
Poaceae (Gramineae)
|
Hordeum vulgare
|
Gerst
|
|
Poaceae (Gramineae)
|
Lolium perenne
|
Perennial ryegrass
|
|
Poaceae (Gramineae)
|
Oryza sativa
|
Rijst
|
|
Poaceae (Gramineae)
|
Secale cereale
|
Rogge
|
|
Poaceae (Gramineae)
|
Sorghum bicolor
|
Graansorgho, kafferkoren
|
|
Poaceae (Gramineae)
|
Triticum aestivum
|
Tarwe
|
|
Poaceae (Gramineae)
|
Zea mays
|
Maïs
|
Aanhangsel 3
Lijst van mogelijke niet-gewassoorten
Mogelijke soorten voor toxiciteitstests met planten volgens de OESO
Opmerking: De volgende tabel bevat informatie over 52 niet-gewassoorten (literatuur is tussen haakjes vermeld voor alle gegevens) De vermelde opkomstpercentages zijn afkomstig uit gepubliceerde literatuur en zijn uitsluitend als indicatie bedoeld. Persoonlijke ervaringen kunnen variëren naargelang van de zaadbron en andere factoren.
|
FAMILIE Soort Botanische naam
(gewone Nederlandse naam)
|
Levensduur (9) en habitat
|
Zaadgewicht
(mg)
|
Fotoperiode voor kieming of groei (10)
|
Plantdiepte
(mm) (11)
|
Kiemtijd
(dagen) (12)
|
Speciale behandelingen (13)
|
Toxiciteitstest (14)
|
Zaadleveranciers (15)
|
Andere referenties (16)
|
|
APIACEAE
Torilis japónica
(heggendoornzaad)
|
E, T verstoorde terreinen, hagen, weiden (16, 19)
|
1,7 - 1,9 (14, 19)
|
L = D (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
koude stratificatie (7, 14, 18, 19) rijping kan nodig zijn (19) kieming geremd in het donker (1, 19) geen speciale behandelingen (5)
|
POST (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(madeliefje)
|
M
grasland, akkers, vaak gemaaide grasgrond (16, 19)
|
0,09-0,17 (4, 19)
|
L = D (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
kieming niet beïnvloed door bestraling (18, 19) geen speciale behandelingen (4, 14)
|
POST (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(korenbloem)
|
A
akkers, bermen, open habitats (16)
|
4,1-4,9 (4, 14)
|
L = D (14)
|
0-3 (2, 4, 14)
|
14-21 (100 %) (14)
|
geen speciale behandelingen (2, 4)
|
POST (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(knoopkruid)
|
M
akkers, bermen, open habitats (16, 19)
|
2,4-2,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
rijping kan nodig zijn (18, 19) kieming geremd in het donker (19) geen speciale behandelingen (5, 14, 26)
|
POST (5, 22, 26)
|
A
|
|
|
Inula helenium
Griekse alant
|
M
vochtige, verstoorde terreinen
(16)
|
1 - 1,3 (4, 14, 29)
|
|
0
(4, 29)
|
|
geen speciale behandelingen (4)
|
POST (4)
|
A, F
|
|
|
Leontodon hispidus
(leeuwentand)
|
M
akkers, bermen, open habitats (16 19)
|
0,85-1,2 (14, 19)
|
L = D (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
kieming geremd in het donker (17, 18, 19) geen speciale behandelingen (5, 23)
|
POST (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(rudbeckia)
|
T, M verstoorde terreinen
(16)
|
0,3 (4, 14)
|
L = D (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
geen speciale behandelingen
(4, 14, 33)
|
POST (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
Canadese guldenroede
|
M
weide, open terreinen (16)
|
0,06-0,08 (4, 14)
|
L = D (11)
|
0
(4)
|
14-21
(11)
|
1:1 vermengen met zand en 24 uur weken in 500 ppm GA (11) geen speciale behandelingen (4)
|
POST (4)
|
E, F
|
|
|
Xanthium pensylvanicum
—
|
A
akkers, open habitats (16)
|
25-61 (14, 29)
|
|
0 (1)
5 (29)
|
|
kieming mogelijk geremd in het donker (1) 12 uur weken in warm water (29)
|
PRE en POST (31)
|
A
|
|
|
Xanthium spinosum
(stekelnoot)
|
A
open habitats (16)
|
200 (14)
|
L = D (14)
L > D (6)
|
10
(6)
|
|
scarificatie (14) geen speciale behandelingen (6)
|
PRE en POST (6)
|
A
|
|
|
Xanthium strumarium
(Iate stekelnoot)
|
A
akkers, open habitats (16)
|
67,4 (14)
|
L = D (14)
|
10-20 (6, 21)
|
|
geen speciale behandelingen
(6, 14, 21)
|
PRE en POST (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Cardamine pratensis
(pinksterbloem)
|
M
akkers, bermen, vaak gemaaide grasvelden (16 19)
|
0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
kieming geremd in het donker (18, 19) geen speciale behandelingen (5, 14, 22)
|
POST (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
(echte koekoeksbloem)
|
M
(16)
|
0,21 (14)
|
L = D (14)
|
|
< 14 (100 %) (14, 25)
|
rijping kan nodig zijn (18) geen speciale behandelingen (5, 14, 15, 22-26)
|
POST (5, 15, 22-26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(ganzenvoet)
|
A
akkerranden, verstoorde terreinen (16 19)
|
0,7 - 1,5 (14, 19, 34)
|
L = D (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
behandeling verschilt afhankelijk van de zaadkleur (19) kiemrust bij droge opslag (19) kieming geremd in het donker (1, 18, 19) koude stratificatie (18) geen speciale behandeling (14, 34)
|
PRE en POST (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(sint-janskruid)
|
M
akkers, bouwland, open habitats (16 19)
|
0,1-0,23
(14, 19)
|
L = D
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
kieming geremd in het donker (1, 18, 19)
geen speciale behandelingen (5, 14, 15, 25, 27)
|
POST
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
—
|
A
bermen, open habitats, maïsvelden (16)
|
28,2
(14)
|
L > D
(6, 10)
|
10-20
(6, 10, 21)
|
4 (100 %)
(10)
|
kieming niet beïnvloed door bestraling (1)
geen speciale behandelingen (6, 21)
|
PRE en POST
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
—
|
M
bouwland, weiden, bermen (16, 30)
|
0,2
(14)
|
L = D
(14)
|
0 (1)
10-20 (6, 10)
|
12 (91 %)
(10)
|
kieming geremd in het donker (1)
geen speciale behandelingen (6, 10, 14)
|
PRE en POST
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
(rolklaver)
|
M
grassige gebieden, bermen, open habitats (16, 19)
|
1-1,67
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
scarificatie (14, 19)
kieming niet beïnvloed door bestraling (18, 19) geen speciale behandelingen (23, 25)
|
POST
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
—
|
A
natte bossen (16)
|
23-28
(9)
|
L = D (14)
L > D (9)
|
10-20
(6,9)
|
|
zaden 24 uur in water weken (9)
scarificatie (14) zaadlevensvatbaarheid zaad verschilt afhankelijk van de kleur (1) geen speciale behandelingen (6)
|
POST
(6,9)
|
A
|
|
|
Sesbania exaltata
—
|
A
alluviale grond (16)
|
11-13
(9, 14)
|
L > D (9)
|
10-20
(9, 21)
|
|
zaden 24 uur in water weken (9)
kieming niet beïnvloed door bestraling (1) geen speciale behandelingen (21)
|
PRE en POST
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(rode klaver)
|
M
akkers, bermen, bouwland (16, 19)
|
1,4 - 1,7
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
scarificatie (14, 18)
rijping kan nodig zijn (19) kieming niet beïnvloed door bestraling (1, 19) geen speciale behandelingen (5)
|
POST
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(hartgespan)
|
M
open terreinen (16)
|
0,75-1,0
(4, 14)
|
L = D (14)
|
0
(4)
|
|
geen speciale behandelingen
(4, 14)
|
POST
(4)
|
F
|
|
|
Mentha spicata
(aarmunt)
|
M
vochtige gebieden (16)
|
2,21
(4)
|
|
0
(4)
|
|
geen speciale behandelingen
(4)
|
POST
(4)
|
F
|
|
|
Nepeta cataria
(kattenkruid)
|
M
verstoorde terreinen (16)
|
0,54
(4, 14)
|
L = D (14)
|
0
(4)
|
|
geen speciale behandelingen
(2, 4, 14)
|
POST
(2,4)
|
F
|
|
|
Prunella vulgaris
(brunel)
|
M
akkers, grassige gebieden, verstoorde terreinen (16, 19)
|
0,58-1,2
(4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
5 (50 %) (19)
7 (91 %) (18)
|
kieming geremd in het donker (18, 19)
meer kieming bij grotere zaden (1) geen speciale behandelingen (4, 14, 22)
|
POST
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(betonie)
|
M
graslanden, akkerranden (19)
|
14-18
(14, 19)
|
L = D (14)
|
|
7 (50 %)
(19)
|
geen speciale behandelingen
(5, 14, 22)
|
POST
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilón theophrasti
(fluweelblad)
|
A
akkers, open habitats (16)
|
8,8
(14)
|
L = D (14)
|
10-20
(6, 10, 21)
|
4 (84 %)
(10)
|
scarificatie (14)
geen speciale behandelingen (5, 10, 21)
|
PRE en POST
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
—
|
A
akkers, bermen (16)
|
3,8
(14)
|
L = D (14)
|
10-20
(6, 21)
|
|
scarificatie (14)
kieming niet beïnvloed door bestraling (1) geen speciale behandelingen (6, 21)
|
PRE en POST
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(grote klaproos)
|
A
akkers, bouwland, verstoorde terreinen (16 19)
|
0,1-0,3
(4, 14, 19, 29)
|
L = D (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
koude stratificatie, en scarificatie (1, 19, 32)
geen speciale behandelingen (4, 14, 29)
|
POST
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis
(gewoon struisgras)
|
gazons, weiden (16)
|
0,07 (14)
|
L > D (Ю)
|
20 (10)
|
10 (62 %) (10)
|
kieming geremd in het donker (1, 17, 19) geen speciale behandelingen (10)
|
POST (10)
|
A, E
|
|
|
Alopecurus myosuroides
(duist)
|
A
akkers, open habitats (16)
|
0,9-1,6
(29, 34)
|
L = D (14)
|
2
(29)
|
< 24 (30 %) (34)
|
scarificatie (14) behandelen met 101 mg/l KNO3 (14) warme stratificatie (1) kieming geremd in het donker (1) geen speciale behandelingen (34)
|
PRE en POST
(28, 34)
|
A
|
32
|
|
Avena fatua
(oot)
|
A
beteelde terreinen, open habitats (16)
|
7-37,5 (14, 30)
|
L = D (14)
L > D (6)
|
10-20 (6, 10)
|
3 (70 %) (18)
|
scarificatie (7, 32) kieming geremd in het donker (1)
koude stratificatie (1, 18) geen speciale behandelingen (6, 10, 14)
|
PRE en POST (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(zwenkdravik)
|
A
akkers, bermen, bouwland (16)
|
0,45-2,28 (14, 29)
|
L = D (14)
|
3 (29)
|
|
rijpingsperiode (1, 7, 32) kieming geremd door licht (1 ) geen speciale behandelingen (14)
|
PRE en POST (28, 31)
|
A
|
|
|
Cynosurus cristatus
(kamgras)
|
P
akkers, bermen, open habitats (16, 19)
|
0,5-0,7 (14, 19, 29)
|
L = D (14)
|
0 (29)
|
3 (50 %) (19)
|
kieming niet beïnvloed door bestraling (19) geen speciale behandelingen (14, 29)
|
POST (5)
|
A
|
|
|
Digitaria sanguinalis
(harig vingergras)
|
A
akkers, bermen, open habitats (16)
|
0,52-0,6 (14, 30)
|
L = D (14)
|
10-20 (21).
|
7 (75 %)
14 (94 %) (7)
|
scarificatie, koude stratificatie, en maturatie (1, 7, 14, 32) behandelen met 101 mg/l KNO3 (14) kieming geremd in het donker (1) geen speciale behandelingen (21)
|
PRE en POST (18, 25, 31)
|
A
|
|
|
Echinochloa crusgalli
(Europese hanenpoot)
|
A
(16)
|
1,5 (14)
|
L = D (14)
L > D (3)
|
10-20 (7, 21)
|
|
scarificatie (7, 32) kieming niet beïnvloed door bestraling (1) geen speciale behandelingen (3, 14, 21)
|
PRE en POST (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
—
|
P
oevers, verstoorde terreinen (16)
|
4-5 (14, 30)
|
L = D (11)
|
1
(11)
|
14-28
(11)
|
geen speciale behandelingen
(2, 11)
|
POST (2)
|
C, D, E
|
|
|
Festuca pratensis
(beemdlangbloem)
|
P
akkers, vochtige gebieden (16 19)
|
1,53-2,2 (16, 19)
|
L = D (14)
L > D (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
geen speciale behandelingen
(10, 19)
|
POST (10)
|
A
|
7
|
|
Hordeum pusillum
—
|
A
weiden, bermen, open habitats (16)
|
3,28 (14)
|
|
|
|
warme stratificatie (1) kieming niet beïnvloed door bestraling (1)
|
PRE (31)
|
|
7
|
|
Phleum pratense
—
|
P
akkers, bouwland, verstoorde terreinen (16 19)
|
0,45 (14, 19)
|
L > D (10, 14)
|
0-10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
kieming geremd in het donker (19) kieming niet beïnvloed door bestraling (17) geen speciale behandelingen (10, 14, 17, 19)
|
POST (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(zwaluwtong)
|
A
open habitats, bermen (16)
|
5-8 (4, 14, 29)
|
L = D (20)
|
0-2 (4, 29)
|
|
koude stratificatie gedurende 4-8 weken (1, 2, 4, 20, 29) kieming niet beïnvloed door bestraling (1)
|
PRE en POST 1, 2, 20, 28, 31
|
A
|
32
|
|
Polygonum lapathifolium
(beklierde duizendknoopa)
|
A
vochtige grond (16)
|
1,8-2,5 (14).
|
L > D (6)
|
|
5 (94 %) (18)
|
kieming niet beïnvloed door bestraling (1) kieming geremd in het donker (18) koude stratificatie (1) geen speciale behandelingen (5)
|
PRE en POST (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
—
|
A
akkers, open habitats (16)
|
3,6-7 (14, 29)
|
|
2 (29)
|
|
koude stratificatie gedurende 4 weken bij 0 — 5 °C (1, 29) kieming geremd in het donker (1)
|
PRE (31)
|
A, E
|
|
|
Polygonum periscaria
(perzikkruid)
|
A
verstoorde terreinen, bouwland (16, 19)
|
2,1-2,3 (14, 19)
|
L > D (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
scarificatie, koude stratificatie, GA-behandeling (14) koude stratificatie, rijping (17-19) kieming geremd in het donker (19) geen speciale behandelingen (13)
|
POST (13)
|
A
|
32
|
|
Rumex crispus
(krukzuring)
|
P
akkers, bermen, open terreinen (16, 19)
|
1,3-1,5 (4, 14, 19)
|
L = D (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
kieming geremd in het donker (18, 19) rijping kan nodig zijn (18) geen speciale behandelingen (4, 14, 33)
|
POST (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
—
|
A
akkers, open terreinen, verstoorde terreinen (16, 19)
|
0,4-0,5 (4, 14, 19)
|
L = D (14)
|
|
1 (50 %) (19)
|
koude stratificatie, GA-behandeling (1, 14, 18, 19, 32) licht vereist voor kieming (1 ) geen speciale behandelingen (2, 4)
|
POST (2,4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(boterbloem)
|
M
akkers, bermen, open terreinen (16, 19)
|
1,5-2 (14, 19, 29)
|
L = D (14)
|
1
(29)
|
41 -56 (19, 29)
|
geen speciale behandelingen
(5, 14, 22, 24-26)
|
POST (5, 22, 24-26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(geel nagelkruid)
|
M
hagen, vochtige gebieden
(16, 19)
|
0,8 - 1,5 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
kieming geremd in het donker (18, 19) warme stratificatie (1) geen speciale behandelingen (5, 14, 22, 25, 26)
|
POST (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(kleefkruid)
|
A
akkers, open terreinen, verstoorde terreinen (16, 19)
|
7-9 (14, 19)
|
L = D (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
koude stratificatie (1, 18, 19) kieming niet beïnvloed door bestraling (18, 19) kieming geremd door licht (1) geen speciale behandelingen (6, 14)
|
PRE en POST (6, 28)
|
A
|
32
|
|
Galium mollugo
(glad walstro)
|
M
houtwallen, open terreinen (8)
|
7
(29)
|
L = D (14)
|
2
(29)
|
|
geen speciale behandelingen
(5, 14, 22, 24, 26, 29)
|
POST (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(vingerhoedskruid)
|
T, M houtwallen, open terreinen (16, 19)
|
0,1 -0,6 (4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
6 (50 %) (19)
8 (99 %) (18)
|
kieming geremd in het donker (1, 17-19) geen speciale behandelingen (4, 22-26)
|
POST (4, 22 — 26)
|
D, G, F
|
|
|
Veronica persica
(ereprijsl)
|
A
akkers, open terreinen, verstoorde terreinen (16, 19)
|
0,5-0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (19)
5 (96 %) (18)
|
kieming geremd in het donker (18, 19) koude stratificatie (18) geen speciale behandelingen (14)
|
PRE en POST (28)
|
A
|
32
|
Genoemde zaadleveranciers
|
ID leverancier
|
Gegevens van leverancier
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ VERENIGD KONINKRIJK +44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 V.S.
|
|
(727) 344 — 4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla — Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 CANADA (519) 586 — 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 USA (303) 431 — 7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 V.S.
|
|
(800) 873 — 3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB VERENIGD KONINKRIJK
|
|
+44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 CANADA (800) 274 — 7333
|
|
www.thompson-morgan.com
|
|
GENOEMDE LITERATUUR
|
(1)
|
Baskin, C.C. & Baskin, J.M. 1998. Seeds. Academic Press, Toronto
|
|
(2)
|
Blackburn, L.G. & Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-UpÒ). Ecotoxicology, 12:271-285.
|
|
(3)
|
Boutin, C., Lee, H-B., Peart, T., Batchelor, P.S., & Maguire, R.J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
|
|
(4)
|
Boutin, C., Elmegaard, N., & Kjaer, C. 2004. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349-369.
|
|
(5)
|
Breeze, V., Thomas, G., & Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669-677.
|
|
(6)
|
Brown, R.A., & Farmer, D. 1991. Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. In: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J.W. Gorsuch, W.R. Lower, W.Wang, & M.A. Lewis, eds. American Society for Testing & Materials, Philadelphia. pp 197 — 208.
|
|
(7)
|
Buhler, D.D. & Hoffman, M.L. 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
(8)
|
Clapham, A.R., Tutin, T.G., & Warburg, E.F. 1981. Excursion flora of the British Isles, 3rd ed. Cambridge University Press, Cambridge
|
|
(9)
|
Clay, P.A. & Griffin, J.L. 2000. Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481-486.
|
|
(10)
|
Cole, J.F.H. & Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC — Weeds. pp. 151 — 156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds). 2004. Persoonlijke mededeling. (www.ernstseed.com)
|
|
(12)
|
Fletcher, J.S., Johnson, F.L., & McFarlane, J.C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769-776.
|
|
(13)
|
Fletcher, J.S., Pfleeger, T.G., Ratsch, H.C., & Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189-1196.
|
|
(14)
|
Flynn, S., Turner, R.M., and Dickie, J.B. 2004. Seed Information Database (release 6.0, Oct 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid)
|
|
(15)
|
Franzaring, J., Kempenaar, C., & van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21-28.
|
|
(16)
|
Gleason, H.A. & Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2nd ed. New York Botanical Garden, Bronx, NY
|
|
(17)
|
Grime, J.P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555-558.
|
|
(18)
|
Grime, J.P., Mason, G., Curtis, A.V., Rodman, J., Band, S.R., Mowforth, M.A.G., Neal, A.M., & Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017-1059.
|
|
(19)
|
Grime, J.P., Hodgson, J.G., & Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London
|
|
(20)
|
Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453-459.
|
|
(21)
|
Klingaman, T.E., King, C.A., & Oliver, L.R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227-232.
|
|
(22)
|
Marrs, R.H., Williams, C.T., Frost, A.J., & Plant, R.A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71-86.
|
|
(23)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223-235.
|
|
(24)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25-42.
|
|
(25)
|
Marrs, R.H., Frost, A.J., Plant, R.A., & Lunnis, P. 1993. Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283-293.
|
|
(26)
|
Marrs, R.H. & Frost, A.J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369-388.
|
|
(27)
|
Marshall, E.J.P. & Bernie, J.E. 1985. Herbicide effects on field margin flora. BCPC — Weeds. pp. 1021-1028.
|
|
(28)
|
McKelvey, R.A., Wright, J.P., & Honegger, J.L. 2002. A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161-1174.
|
|
(29)
|
Morton, S. (Herbiseed). 2004. Persoonlijke mededeling. (http://www.herbiseed.com)
|
|
(30)
|
USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA
|
|
(31)
|
USEPA. 1999. One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
(32)
|
Webster, R.H. 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L. & Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Persoonlijke mededeling.
|
|
(34)
|
Zwerger, P. & Pestemer, W. 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711-718.
|
Aanhangsel 4
Voorbeelden van geschikte groeiomstandigheden voor bepaalde gewassoorten
De volgende omstandigheden zijn voor tien gewassoorten geschikt bevonden en kunnen ook voor bepaalde andere soorten als richtsnoer voor tests in klimaatkasten worden gebruikt:
|
|
Koolstofdioxideconcentratie: 350 ± 50 ppm;
|
|
|
Relatieve vochtigheid: 70 ± 5 % in lichte perioden en 90 ± 5 % in donkere perioden;
|
|
|
Temperatuur: 25 ± 3 °C bij dag, 20 ± 3 °C bij nacht;
|
|
|
Fotoperiode: 16 uur licht/8 uur donker, uitgaande van een gemiddelde golflengte van 400 tot 700 nm;
|
|
|
Licht: luminantie van 350 ± 50 μE/m2/s, gemeten vlak boven het bladerdek.
|
De gewassoorten zijn:
|
—
|
tomaat (Solanum lycopersicon);
|
|
—
|
komkommer (Cucumis sativus);
|
|
—
|
sojaboon (Glycine max);
|
|
—
|
kool (Brassica oleracea var. capitata);
|
|
—
|
wortel (Daucus carota);
|
|
—
|
Engels raaigras (Lolium perenne);
|
C.32. Voortplantingstest met Enchytraeidae
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan testrichtlijn (TG) 220 (2004) van de OESO. De test is opzet om de effecten van stoffen op het voortplantingsresultaat van enchytreeën, Enchytraeus albidus Henle 1873, in de bodem te beoordelen. Zij is in principe gebaseerd op een methode die door het Umweltbundesamt in Duitsland (1) is ontwikkeld en die is onderworpen aan een ringtest (2). Er is ook rekening gehouden met andere methoden voor het testen van het toxisch effect van stoffen op enchytreeën en regenwormen (3)(4)(5)(6)(7)(8).
|
INLEIDENDE OVERWEGINGEN
|
2.
|
In de bodem levende ringwormen (Annelidae) van het geslacht Enchytraeus zijn ecologisch belangrijke soorten voor ecotoxicologische tests. Hoewel enchytreeën vaak worden aangetroffen in bodems die regenwormen bevatten, zijn ze vaak ook talrijk in bodems waarin geen regenwormen worden gevonden. Enchytreeën kunnen zowel in laboratoriumproeven als in semiveld- en veldexperimenten worden gebruikt. Vanuit praktisch oogpunt zijn veel Enchytraeus-soorten gemakkelijk te hanteren en te kweken, en hun generatietijd is aanzienlijk korter dan die van regenwormen. De duur van een voortplantingstest met enchytreeën is daardoor slechts 4 tot 6 weken, terwijl deze voor regenwormen (Eisenia fetida) 8 weken is.
|
|
3.
|
Meer informatie over de ecologie en ecotoxicologie van enchytreeën in het terrestrische milieu is te vinden in (9)(10)(11)(12).
|
PRINCIPE VAN DE TEST
|
4.
|
Volwassen enchytreeën worden blootgesteld aan een bereik van concentraties van de teststof die door kunstmatige grond zijn gemengd. De test kan in twee stappen worden gesplitst: (a) een bereikbepalingstest, indien er onvoldoende informatie beschikbaar is, waarin de mortaliteit het belangrijkste eindpunt is dat na twee weken blootstelling wordt beoordeeld, en (b) een definitieve voortplantingstest, waarin het totale aantal door een moederdier voortgebrachte nakomelingen en de overleving van de moederdieren worden beoordeeld. De definitieve test duurt zes weken. Na de eerste drie weken worden de volwassen wormen verwijderd en worden de morfologische veranderingen geregistreerd. Na nog eens drie weken wordt het aantal nakomelingen geteld dat uit de door de volwassen dieren geproduceerde cocons is gekomen. Het voortplantingsresultaat van de dieren die zijn blootgesteld aan de teststof, wordt vergeleken met dat van de controle(s) om (i) de No Observed Effect Concentration (NOEC) en/of (ii) de ECx (bv. EC10, EC50) te bepalen door met een regressiemodel een schatting te maken van de concentratie die zou leiden tot een afname van het voortplantingsresultaat met x %. De ECx (bv. EC10, EC50) moet binnen de testconcentraties vallen, zodat de ECx daarna afkomstig is van interpolatie in plaats van extrapolatie.
|
INFORMATIE OVER DE TESTSTOF
|
5.
|
Bij voorkeur zijn de oplosbaarheid in water, de log Kow, de grond/water-verdelingscoëfficiënt (bv. hoofdstuk C.18 of C.19 van deze bijlage) en de dampspanning van de teststof bekend. Aanvullende informatie over het lot van de teststof in de bodem, zoals de fotolyse- en hydrolysesnelheid, is gewenst.
|
|
6.
|
Deze testmethode kan zowel voor in water oplosbare als voor in water onoplosbare stoffen worden gebruikt. De wijze van aanbrengen van de teststof zal echter verschillen. De testmethode is niet van toepassing op vluchtige stoffen, d.w.z. stoffen waarvoor de Henry-constante of de lucht/water-verdelingscoëfficiënt groter dan één is, of stoffen waarvoor de dampspanning bij 25 °C groter dan 0,0133 Pa is.
|
GELDIGHEID VAN DE TEST
|
7.
|
Voor een geldige test moet in de controles aan de volgende prestatiecriteria worden voldaan:
|
—
|
de mortaliteit van volwassen dieren mag aan het eind van de bereikbepalingstest en na de eerste drie weken van de voortplantingstest niet hoger zijn dan 20 %.
|
|
—
|
aannemende dat bij de opzet van de test 10 volwassen dieren per vat zijn gebruikt, moeten aan het eind van de test gemiddeld ten minste 25 nakomelingen per vat zijn voortgebracht.
|
|
—
|
de variatiecoëfficiënt rond het gemiddelde aantal jonge dieren mag aan het eind van de voortplantingstest niet hoger zijn dan 50 %.
|
Wanneer een test niet aan de hierboven genoemde geldigheidscriteria voldoet, moet de test worden beëindigd, tenzij voortzetting van de test kan worden gemotiveerd. De motivering moet in het testverslag worden opgenomen.
|
REFERENTIESTOF
|
8.
|
Een referentiestof moet hetzij op gezette tijden of als onderdeel van elke test worden getest om te verifiëren dat de respons van de testorganismen in de loop van de tijd niet significant is gewijzigd. Een geschikte referentiestof is carbendazim, waarvan is aangetoond dat het de overleving en voortplanting van enchytreeën beïnvloedt (13)(14), maar er kunnen ook andere stoffen worden gebruikt waarvan de toxiciteitsgegevens goed bekend zijn. In een ringtest is een formulering van carbendazim gebruikt die bekend is onder de handelsnaam Derosal ™, wordt geleverd door AgrEvo Company (Frankfurt, Duitsland) en 360 g/l (32,18 %) werkzaam bestanddeel bevat (2). De in de ringtest bepaalde EC50 voor de voortplanting lag in het bereik van 1,2 ± 0,8 mg werkzaam bestanddeel (w.b.)/kg droge massa (2). Indien in de testreeks een positieve toxische standaard wordt opgenomen, wordt één concentratie gebruikt en moet het aantal replicaten hetzelfde zijn als in de controles. Voor carbendazim wordt het testen van 1,2 mg w.b./kg drooggewicht (getest als vloeibare formulering) aanbevolen.
|
BESCHRIJVING VAN DE TEST
Benodigdheden
|
9.
|
De testvaten moeten van glas of een ander chemisch inert materiaal gemaakt zijn. Glazen potten (bv. inhoud: 0,20 - 0,25 liter; diameter: ≈ ≈ 6 cm) zijn geschikt. De vaten moeten een transparant deksel hebben (bv. van glas of polyethyleen) dat zo is ontworpen dat verdampingsverlies wordt tegengegaan, maar gasuitwisseling tussen de grond en de lucht mogelijk is. De deksels moeten transparant zijn om licht door te kunnen laten.
|
|
10.
|
Een standaard-laboratoriumuitrusting is vereist, in het bijzonder:
|
—
|
geschikte nauwkeurige weegschalen;
|
|
—
|
adequate apparatuur voor temperatuurregeling;
|
|
—
|
adequate apparatuur voor vochtigheidsregeling (niet noodzakelijk als de blootstellingsvaten een deksel hebben);
|
|
—
|
incubator of kleine kast met klimaatregelaar;
|
|
Bereiding van de kunstmatige grond
|
11.
|
In deze test wordt een kunstmatige grond gebruikt (5)(7) die als volgt is samengesteld (gebaseerd op drooggewicht, gedroogd tot een constant gewicht bij 105 °C):
|
—
|
10 % veenmosturf, luchtdroog en fijngemalen (een deeltjesgrootte van 2 ± 1 mm is aanvaardbaar); er wordt aanbevolen te controleren dat grond die is gemaakt op basis van een verse batch turf, geschikt is voor het kweken van de wormen, voordat de grond in een test wordt gebruikt;
|
|
—
|
20 % kaolienklei (met bij voorkeur meer dan 30 % kaoliniet);
|
|
—
|
ongeveer 0,3 tot 1,0 % calciumcarbonaat (CaCO3, verpulverd, analytisch zuiver) om een pH van 6,0 ± 0,5 te verkrijgen; de toe te voegen hoeveelheid calciumcarbonaat zal vooral afhangen van de kwaliteit/aard van de turf;
|
|
—
|
ongeveer 70 % luchtdroog kwartszand (afhankelijk van de benodigde hoeveelheid CaCO3), overwegend bestaande uit fijn zand; meer dan 50 % van de deeltjes moet een grootte tussen 50 en 200 micron hebben.
|
Het is raadzaam aan te tonen dat de kunstmatige grond geschikt is voor het kweken van de wormen en geschikt is om aan het geldigheidscriterium te voldoen, voordat de grond in een definitieve test wordt gebruikt. In het bijzonder wordt aangeraden een dergelijke controle uit te voeren om te garanderen dat de uitvoering van de test niet in het gedrang komt wanneer het gehalte organische koolstof van de kunstmatige grond wordt verlaagd, bv. door vermindering van het turfgehalte tot 4-5 % en dienovereenkomstige verhoging van het zandgehalte. Door een dergelijke verlaging van het gehalte organische koolstof kan de hechting van de teststof aan de grond (organische koolstof) afnemen en kan de beschikbaarheid van de teststof voor de wormen toenemen. Aangetoond is dat Enchytraeus albidus aan de geldigheidscriteria voor de voortplanting kan voldoen bij tests in veldgrond met een lager gehalte organische koolstof dan hierboven genoemd (bv. 2,7 %) (15), en de — weliswaar beperkte — ervaring leert dat dit ook kan worden bereikt in kunstmatige grond met 5 % turf.
Noot: Wanneer in aanvullende tests (bv. van de latere fasen) natuurlijke grond wordt gebruikt, moet eveneens worden aangetoond dat de grond geschikt is en dat wordt voldaan aan de geldigheidscriteria.
|
|
12.
|
De droge bestanddelen van de grond worden grondig gemengd (bv. in een grote laboratoriummenger). Dit moet ten minste één week voor aanvang van de test geschieden. De gemengde grond moet ten minste twee dagen worden opgeslagen om de zuurgraad te equilibreren/stabiliseren. Voor de bepaling van de pH moet een mengsel van grond en een oplossing van 1 M kaliumchloride (KCl) of 0,01 M calciumchloride (CaCl2) in een verhouding van 1:5 worden gebruikt (zie (16) en aanhangsel 3). Als de grond zuurder is dan het vereiste bereik (zie punt 11), kan de zuurgraad worden verlaagd door toevoeging van een passende hoeveelheid CaCO3. Als de grond te alkalisch is, kan dit worden gecorrigeerd door toevoeging van meer van het in punt 11 bedoelde mengsel, maar zonder CaCO3
|
|
13.
|
Het maximale waterhoudend vermogen (WHV) van de kunstmatige grond wordt bepaald overeenkomstig de procedures als beschreven in aanhangsel 2. Een of twee dagen voor aanvang van de test wordt de droge kunstmatige grond vooraf bevochtigd door genoeg gedeïoniseerd water toe te voegen om ongeveer de helft van het uiteindelijke watergehalte te verkrijgen, d.w.z. 40 tot 60 % of het maximale waterhoudend vermogen. Bij aanvang van de test wordt de vooraf bevochtigde grond verdeeld in zoveel porties als het aantal testconcentraties (en in voorkomend geval referentiestof) en controles dat voor de test wordt gebruikt. Het vochtgehalte wordt aangepast tot 40-60 % van WHVmax door de teststofoplossing en/of gedestilleerd of gedeïoniseerd water toe te voegen (zie de punten 19-21). Het vochtgehalte wordt aan het begin en aan het eind van de test bepaald (door droging tot constant gewicht bij 105 °C) en moet binnen het optimale bereik voor de overleving van de wormen liggen. Een ruwe controle van het vochtgehalte van de grond wordt verkregen wanneer men de grond lichtjes in de hand knijpt. Als het vochtgehalte in orde is, moeten kleine druppels water tussen de vingers verschijnen.
|
Selectie en voorbereiding van de proefdieren
|
14.
|
De aanbevolen testsoort is Enchytraeus albidus, Henle 1837 (witte potworm), een lid van de familie der Enchytraeidae (orde Oligochaeta, stam Annelida). E. albidus is een van de grootste soorten enchytreeën, met een geregistreerde lengte tot 35 mm (17)(18). E. albidus komt over de hele wereld voor en wordt aangetroffen in mariene, limnische en terrestrische habitats, hoofdzakelijk in ontbindend organisch materiaal (zeewier, compost) en zelden in weiden (9). Deze brede ecologische tolerantie en een aantal morfologische variaties zouden erop kunnen duiden dat er verschillende rassen bestaan.
|
|
15.
|
E. albidus is in de handel verkrijgbaar als voeding voor vissen. Gecontroleerd dient te worden of de cultuur verontreinigd is door andere, gewoonlijk kleinere soorten (1) (19). Indien verontreiniging optreedt, moeten alle wormen met water worden gewassen in een petrischaal. Vervolgens moeten grote volwassen exemplaren van E. albidus worden geselecteerd (met behulp van een stereomicroscoop) om een nieuwe cultuur te beginnen, en moeten alle overige wormen worden vernietigd. E. albidus kan worden gekweekt in een grote diversiteit aan organische stoffen (zie aanhangsel 4). De levenscyclus van E. albidus is kort, aangezien volwassenheid wordt bereikt tussen 33 dagen (bij 18 °C) en 74 dagen (bij 12 °C) (1). Voor de test worden enkel culturen gebruikt die zonder problemen gedurende ten minste 5 weken (één generatie) in het laboratorium zijn gehouden.
|
|
16.
|
Andere soorten van het geslacht Enchytraeus zijn ook geschikt, bv. E. buchholzi Vejdovsky 1879 of E. crypticus Westheide & Graefe 1992 (zie aanhangsel 5). Indien andere soorten van het geslacht Enchytraeus worden gebruikt, moeten ze duidelijk worden geïdentificeerd en moet de motivering van de keuze van de soort worden gerapporteerd.
|
|
17.
|
De dieren die in de tests worden gebruikt, zijn volwassen wormen. Zij moeten eitjes (witte stipjes) in de clitellumstreek hebben en van ongeveer gelijke lengte zijn (circa 1 cm). Synchronisatie van de kweekcultuur is niet noodzakelijk.
|
|
18.
|
Als de enchytreeën niet in hetzelfde type grond en onder dezelfde omstandigheden (inclusief voeding) worden gekweekt als gebruikt voor de uiteindelijke test, moeten zij ten minste 24 uur en maximaal drie dagen worden geacclimatiseerd. In eerste instantie moet een groter aantal volwassen dieren worden geacclimatiseerd dan voor de uitvoering van de test benodigd is, om rekening te houden met de mogelijke afkeuring van beschadigde of anderszins ongeschikte exemplaren. Aan het eind van de acclimatiseringsperiode worden voor de test enkel wormen geselecteerd die eitjes hebben en geen gedragsafwijkingen vertonen (bv. uit de grond proberen te ontsnappen). De wormen worden voorzichtig met een juwelierspincet, haken of ogen verwijderd en geplaatst in een petrischaal met een kleine hoeveelheid zoet water. Synthetisch zoet water als voorgesteld in hoofdstuk C.20 van deze bijlage (Daphnia magna voortplantingstest) heeft voor dit doel de voorkeur, omdat gedeïoniseerd, gedemineraliseerd of kraanwater schadelijk kan zijn voor de wormen. De wormen worden onder een stereomicroscoop geïnspecteerd, en wormen die geen eitjes bevatten worden verwijderd. Mijten en springstaarten die de culturen mogelijk hebben geïnfecteerd, worden zorgvuldig verwijderd. Gezonde wormen die niet voor de test worden gebruikt, worden teruggeplaatst in de stamcultuur.
|
Bereiding van testconcentraties
In water oplosbare teststof
|
19.
|
Een oplossing van de teststof wordt bereid in gedeïoniseerd water in een hoeveelheid die voldoende is voor alle replicaten van één testconcentratie. Aanbevolen wordt een passende hoeveelheid water te gebruiken om het vereiste vochtgehalte te bereiken, d.w.z. 40 tot 60 % van WHVmax (zie punt 13). Elke oplossing van de teststof wordt grondig door één batch vooraf bevochtigde grond gemengd voordat de grond in het testvat wordt gedaan.
|
In water onoplosbare teststof
|
20.
|
Indien de teststof niet in water oplosbaar is, maar wel oplosbaar in organische oplosmiddelen, kan de teststof worden opgelost in een zo klein mogelijk volume van een geschikt organisch oplosmiddel (bv. aceton). Enkel vluchtige oplosmiddelen mogen worden gebruikt. Het oplosmiddel wordt op een kleine hoeveelheid, bv. 2.5 g, fijn kwartszand gespoten of daarmee vermengd. Het oplosmiddel wordt verwijderd door het gedurende ten minste één uur in een afzuigkast te verdampen. Het mengsel van kwartszand en teststof wordt toegevoegd aan de vooraf bevochtigde grond en, na toevoeging van een passende hoeveelheid gedeïoniseerd water, grondig gemengd om het vereiste vochtgehalte te verkrijgen. Het uiteindelijke mengsel wordt in de testvaten gedaan.
|
|
21.
|
Voor chemische stoffen die slecht in water en slecht in organische oplosmiddelen oplosbaar zijn, kan het equivalent van 2,5 g fijngemalen kwartszand per testvat worden gemengd met de hoeveelheid teststof die nodig is om de gewenste testconcentratie te verkrijgen. Dit mengsel van kwartszand en teststof wordt toegevoegd aan de vooraf bevochtigde grond en, na toevoeging van een passende hoeveelheid gedeïoniseerd water, grondig gemengd om het vereiste vochtgehalte te verkrijgen. Het uiteindelijke mengsel wordt verdeeld over de testvaten. De procedure wordt voor iedere testconcentratie herhaald en tevens wordt een passende controlegroep bereid.
|
|
22.
|
Stoffen mogen normaal gesproken niet worden getest bij concentraties die hoger zijn dan 1 000 mg/kg droge massa grond. Testen bij hogere concentraties kan voor de doelstellingen van een specifieke test echter noodzakelijk zijn.
|
UITVOERING VAN DE PROEVEN
Test-en controlegroepen
|
23.
|
Voor elke testconcentratie wordt een hoeveelheid testgrond overeenkomend met 20 g drooggewicht in het testvat gedaan (zie de punten 19-21). Er worden ook controles, zonder de teststof, voorbereid. Aan elk vat wordt voeding toegevoegd overeenkomstig de in punt 29 beschreven procedures. Aan elk testvat worden willekeurig tien wormen toegewezen. De wormen worden voorzichtig naar elk testvat overgebracht en met behulp van bijvoorbeeld een juwelierspincet, haken of ogen op de oppervlakte van de grond geplaatst. Het aantal replicaten voor testconcentraties en voor controles hangt af van de gebruikte testopzet (zie punt 34). De testvaten worden willekeurig in de testincubator geplaatst en deze posities worden wekelijks opnieuw gerandomiseerd.
|
|
24.
|
Als voor de toevoeging van de teststof een oplosmiddel wordt gebruikt, moet er naast de testreeksen één controlereeks zijn die besproeid kwartszand of kwartszand vermengd met oplosmiddel bevat. De concentratie van het oplosmiddel of dispergeermiddel moet dezelfde zijn als die in de vaten met de teststof. Er moet een controlereeks met extra kwartszand (2,5 g per vat) worden uitgevoerd voor stoffen die moeten worden toegediend overeenkomstig de in punt 21 beschreven procedures.
|
Testomstandigheden
|
25.
|
De testtemperatuur is 20 ± 2 °C. Om wormen te ontmoedigen uit de grond te ontsnappen, wordt de test uitgevoerd bij gecontroleerde licht-donkercycli (bij voorkeur 16 uur licht en 8 uur donker), met een verlichting van 400 tot 800 lux in het gebied van de testvaten.
|
|
26.
|
Om de vochtigheidsgraad van de grond te controleren, worden de vaten aan het begin van de test en vervolgens één keer per week gewogen. Gewichtsverlies wordt aangevuld door de toevoeging van een passende hoeveelheid gedeïoniseerd water. Er zij opgemerkt dat het vochtverlies kan worden beperkt door in de testincubator een hoge luchtvochtigheid (> 80 %) te handhaven.
|
|
27.
|
Het vochtgehalte en de pH moeten aan het begin en aan het eind van de bereikbepalingstest en de definitieve test worden gemeten. De metingen moeten geschieden in de controlegrondmonsters en in de behandelde grondmonsters (alle concentraties) die op dezelfde wijze zijn bereid en worden bewaard als de testculturen, maar geen wormen bevatten. Aan deze grondmonsters mag uitsluitend aan het begin van de test voedsel worden toegevoegd om de microbiële activiteit te bevorderen. De hoeveelheid toegevoegd voedsel moet gelijk zijn aan die van de testculturen. Het is niet nodig om tijdens de test verder voedsel aan deze vaten toe te voegen.
|
Voeding
|
28.
|
Er mag voedsel worden gebruikt dat de populatie enchytreeën in stand kan houden. Havervlokken, bij voorkeur vóór gebruik in een autoclaaf gesteriliseerd om microbiële besmetting te voorkomen (verhitting is ook geschikt) zijn als voedingsstof geschikt bevonden.
|
|
29.
|
Voedsel wordt de eerst keer verstrekt door vóór de plaatsing van de wormen 50 mg gemalen havervlokken met de grond in elk vat te vermengen. Daarna wordt wekelijks tot en met dag 21 voedsel verstrekt. Op dag 28 wordt geen voeding verstrekt, omdat de volwassen dieren in die fase zijn verwijderd en de jonge wormen vanaf dit punt relatief weinig aanvullende voeding nodig hebben. De voeding tijdens de test bestaat uit 25 mg gemalen havervlokken per vat en wordt voorzichtig op het oppervlak van de grond aangebracht om beschadiging van de wormen te vermijden. Om schimmelgroei te beperken moeten de havervlokken in de grond worden begraven door ze te bedekken met kleine hoeveelheden grond. Als het voedsel niet volledig wordt opgegeten, moet de portie worden verkleind.
|
Opzet van de bereikbepalingstest
|
30.
|
Indien nodig wordt een bereikbepalingstest uitgevoerd met bijvoorbeeld vijf teststofconcentraties van 0,1, 1,0, 10, 100 en 1 000 mg/kg (drooggewicht grond). Eén replicaat voor elke behandeling en controle volstaat.
|
|
31.
|
De bereikbepalingstest duurt twee weken. Aan het eind van de test wordt de mortaliteit van de wormen beoordeeld. Een worm wordt als dood geregistreerd indien hij niet reageert op een mechanische stimulus op de kop. Aanvullende informatie over de mortaliteit kan ook nuttig zijn om de reeks concentraties voor de definitieve test vast te stellen. Veranderingen in het gedrag van de volwassen dieren (bv. onvermogen om in de grond te graven, bewegingsloos tegen de glazen wand van het testvat liggen) en de morfologie van de volwassen dieren (bv. de aanwezigheid van open wonden) moeten daarom ook worden geregistreerd, evenals de aanwezigheid van eventuele nakomelingen. Dit laatste kan worden vastgesteld aan de hand van de in aanhangsel 6 beschreven kleuringsmethode.
|
|
32.
|
De LC50 kan worden geschat door het meetkundig gemiddelde van de mortaliteitsgegevens te berekenen. Bij het vaststellen van het concentratiebereik voor de definitieve test worden de effecten op de voortplanting geacht maximaal een factor 10 kleiner te zijn dan de LC50. Dit is echter een empirisch verband dat in specifieke gevallen anders kan zijn. Aanvullende waarnemingen die tijdens de bereikbepalingstest worden gedaan, zoals het voorkomen van nakomelingen, kunnen het concentratiebereik van de teststof dat in de definitieve test moet worden gebruikt, helpen verfijnen.
|
|
33.
|
Voor een nauwkeurige bepaling van de LC50 wordt aanbevolen de test uit te voeren met ten minste vier replicaten elk van de teststofconcentratie en een toereikend aantal concentraties om ten minste vier statistisch significant verschillende gemiddelde responsen op deze concentraties te veroorzaken. Indien van toepassing wordt voor de controles hetzelfde aantal concentraties en replicaten gebruikt.
|
Opzet van de definitieve voortplantingstest
|
34.
|
Op basis van de aanbevelingen voortvloeiende uit een ringtest (2) worden drie opzetten voorgesteld.
|
—
|
Voor de bepaling van de NOEC moeten ten minste vijf concentraties worden getest die een meetkundige reeks vormen. Aanbevolen wordt vier replicaten voor elke testconcentratie plus acht controles te gebruiken. De concentraties moeten worden gekozen met intervallen die onderling verschillen met een factor van niet meer dan 1,8.
|
|
—
|
Voor de bepaling van de ECx (bv. EC10, EC50) moeten ten minste vijf concentraties worden getest en moet de ECx in het concentratiebereik liggen om bepaling van ECx door interpolatie in plaats van extrapolatie mogelijk te maken. Het wordt aanbevolen ten minste vier replicaten voor elke testconcentratie en vier replicaten voor de controles te gebruiken. De intervalsfactor kan variëren, d.w.z. kleiner dan of gelijk aan 1,8 in het verwachte effectbereik en groter dan 1,8 bij de hogere en lagere concentraties.
|
|
—
|
Een gecombineerde aanpak maakt het mogelijk om zowel de NOEC als de ECx te bepalen. Er moeten acht behandelingsconcentraties die een meetkundige reeks vormen, worden gebruikt. Aanbevolen wordt vier replicaten voor iedere behandeling plus acht controles te gebruiken. De concentraties moeten worden gekozen met intervallen die onderling verschillen met een factor van niet meer dan 1,8.
|
|
|
35.
|
Er moeten tien volwassen wormen per testvat worden gebruikt (zie punt 23). Voedsel wordt aan het begin van de test en vervolgens één keer per week aan de testvaten toegevoegd (zie punt 29) tot en met dag 21. Op dag 21 worden de grondmonsters voorzichtig met de hand doorzocht, worden de levende volwassen wormen geobserveerd en geteld en worden veranderingen in het gedrag (bv. onvermogen om in de grond te graven, bewegingsloos tegen de glazen wand van het testvat liggen) en de morfologie (bv. de aanwezigheid van open wonden) geregistreerd. Alle volwassen wormen worden vervolgens uit de testvaten en de testgrond verwijderd. De testgrond die geproduceerde cocons bevat, wordt nog eens drie weken onder dezelfde testomstandigheden geïncubeerd, behalve dat enkel op dag 35 voedsel wordt toegevoegd (d.w.z. 25 mg gemalen havervlokken per vat).
|
|
36.
|
Na zes weken worden de nieuw uitgekomen wormen geteld. De methode gebaseerd op kleuring met Bengaals rood (zie aanhangsel 6) wordt aanbevolen, maar er is ook aangetoond dat andere natte (maar niet warme) extractie- en drijftechnieken (zie aanhangsel 6) geschiktheid zijn (4)(10)(11)(20). Kleuring met Bengaals rood wordt aanbevolen, omdat natte extractie uit een grondsubstraat hinder kan ondervinden van troebelheid als gevolg van gesuspendeerde kleideeltjes.
|
Limiettest
|
37.
|
Als bij de hoogste concentratie in de bereikbepalingstest (d.w.z. 1 000 mg/kg) geen effecten worden waargenomen, kan de voortplantingstest worden uitgevoerd als een limiettest, waarbij 1 000 mg/kg wordt gebruikt om aan te tonen dat de NOEC voor de voortplanting groter is dan deze waarde.
|
Samenvatting en tijdschema van de test
|
38.
|
De stappen van de test kunnen als volgt worden samengevat:
|
Tijdstip
|
Bereikbepalingstest
|
Definitieve test
|
|
Dag – 7 of eerder
|
|
—
|
Bereid kunstmatige grond (mengen van droge bestanddelen)
|
|
|
—
|
Bereid kunstmatige grond (mengen van droge bestanddelen)
|
|
|
Dag – 5
|
|
—
|
Controleer de pH van de kunstmatige grond
|
|
—
|
Meet WHVmax van de grond
|
|
|
—
|
Controleer de pH van de kunstmatige grond
|
|
—
|
Meet WHVmax van de grond
|
|
|
Dag – 5 tot – 3
|
|
—
|
Sorteer de wormen voor acclimatisering
|
|
|
—
|
Sorteer de wormen voor acclimatisering
|
|
|
Dag – 3 tot 0
|
|
—
|
Acclimatiseer de wormen gedurende ten minste 24 uur
|
|
|
—
|
Acclimatiseer de wormen gedurende ten minste 24 uur
|
|
|
Dag – 1
|
|
—
|
Bevochtig vooraf de kunstmatige grond en verdeel de grond in batches
|
|
|
—
|
Bevochtig vooraf de kunstmatige grond en verdeel de grond in batches
|
|
|
Dag 0
|
|
—
|
Weeg het testsubstraat af in de testvaten
|
|
—
|
Meng het voedsel erdoorheen
|
|
—
|
Meet de pH en het vochtgehalte van de grond
|
|
|
—
|
Weeg het testsubstraat af in de testvaten
|
|
—
|
Meng het voedsel erdoorheen
|
|
—
|
Meet de pH en het vochtgehalte van de grond
|
|
|
Dag 7
|
|
—
|
Controleer het vochtgehalte van de grond
|
|
|
—
|
Controleer het vochtgehalte van de grond
|
|
|
Dag 14
|
|
—
|
Bepaal de mortaliteit van de volwassen dieren
|
|
—
|
Schat het aantal nakomelingen
|
|
—
|
Meet de pH en het vochtgehalte van de grond
|
|
|
—
|
Controleer het vochtgehalte van de grond
|
|
|
Dag 21
|
|
|
—
|
Observeer het gedrag van de volwassen dieren
|
|
—
|
Verwijder de volwassen dieren
|
|
—
|
Bepaal de mortaliteit van de volwassen dieren
|
|
—
|
Controleer het vochtgehalte van de grond
|
|
|
Dag 28
|
|
|
—
|
Controleer het vochtgehalte van de grond
|
|
|
Dag 35
|
|
|
—
|
Controleer het vochtgehalte van de grond
|
|
|
Dag 42
|
|
|
—
|
Meet de pH en het vochtgehalte van de grond
|
|
|
GEGEVENS EN RAPPORTAGE
Verwerking van de resultaten
|
39.
|
Hoewel aanhangsel 7 een overzicht bevat, wordt in deze testmethode geen definitieve statistische richtsnoer voor de analyse van de testresultaten gegeven.
|
|
40.
|
In de bereikbepalingstest is het belangrijkste eindpunt de mortaliteit. Veranderingen in het gedrag (bv. onvermogen om in de grond te graven, bewegingsloos tegen de glazen wand van het testvat liggen) en de morfologie (bv. de aanwezigheid van open wonden) van de volwassen wormen moeten echter ook worden geregistreerd, evenals de aanwezigheid van eventuele nakomelingen. Normaal gesproken moet probit-analyse (21) of logistische regressie worden toegepast om de LC50 te bepalen. In gevallen waarin deze analysemethode niet geschikt is (bv. als er minder dan drie concentraties met gedeeltelijke sterfte beschikbaar zijn), kunnen echter andere methoden worden gebruikt. Tot deze methoden behoren onder andere voortschrijdende gemiddelden (22), de getrimde Spearman-Karber-methode (23) of eenvoudige interpolatie (bv. meetkundig gemiddelde van LC0 en LC100, berekend als de vierkantswortel van LC0 vermenigvuldigd met LC100).
|
|
41.
|
In de definitieve test is de vruchtbaarheid (d.w.z. het aantal voortgebrachte jonge dieren) het eindpunt van de test. Net als in de bereikbepalingstest moeten echter ook hier alle andere schadelijke tekenen worden geregistreerd in het eindverslag. De statistische analyse vereist dat het rekenkundig gemiddelde en de standaardafwijking per behandeling en per controle voor de voortplanting worden berekend.
|
|
42.
|
Als een variantieanalyse is uitgevoerd, kunnen de standaardafwijking (s) en het aantal vrijheidsgraden (df) worden vervangen door respectievelijk de schatting van de gepoolde variantie verkregen uit de ANOVA en haar aantal vrijheidsgraden, mits de variantie niet afhankelijk is van de concentratie. Gebruik in dit geval de afzonderlijke varianties van de controle en de behandelingen. Deze waarden worden doorgaans berekend door commerciële statistische software met de resultaten per vat als replicaten. Als het poolen van de gegevens voor de negatieve en oplosmiddelcontroles redelijk lijkt, in plaats van het toetsen tegen een hiervan, moet worden getoetst of ze niet significant verschillen (zie punt 45 en aanhangsel 7 voor geschikte toetsen).
|
|
43.
|
De verdere statistische toetsen en gevolgtrekkingen hangen af van de vraag of de replicaatwaarden normaal verdeeld zijn en homogeen zijn voor wat betreft hun variantie.
|
Schatting van NOEC
|
44.
|
De toepassing van krachtige toetsen heeft de voorkeur. Er dient gebruik te worden gemaakt van informatie uit bv. eerdere ervaring met ringtesten of andere historische gegevens over de vraag of gegevens ongeveer normaal verdeeld zijn. Homogeniteit van variantie (homoscedasticiteit) is crucialer. De ervaring leert dat de variantie vaak toeneemt bij een hoger gemiddelde. In deze gevallen zou een gegevenstransformatie kunnen leiden tot homoscedasticiteit. Een dergelijke transformatie moet echter worden gebaseerd op de ervaring met historische gegevens in plaats van op gegevens van het lopende onderzoek. Bij homogene gegevens moeten multipele t-toetsen zoals de Williams-toets (α = 0,05, eenzijdig) (24)(25) of in bepaalde gevallen de toets van Dunnett (26)(27) worden uitgevoerd. Er zij opgemerkt dat in het geval van ongelijke aantallen replicaten de tabel met t-waarden moet worden aangepast zoals voorgesteld door Dunnett en Williams. Soms nemen de responsen als gevolg van grote variatie niet regelmatig toe of af. In het geval van een sterke afwijking van monotoniciteit is de toets van Dunnett geschikter. Als er afwijkingen van homoscedasticiteit zijn, kan het redelijk zijn om mogelijke effecten op varianties nader te onderzoeken om te bepalen of de t-toetsen kunnen worden toegepast zonder al te zeer aan statistisch onderscheidingsvermogen in te boeten (28). Anders kan een multipele Mann-Whitney-toets, bv. de Bonferroni-toets volgens Holm (29), of wanneer deze gegevens heteroscedasticiteit vertonen maar anderszins consistent zijn met een onderliggende monotone dosis-respons, een andere verdelingsvrije toets (bv. Jonckheere-Terpstra (30) (31) of Shirley (32) (33)) worden toegepast, en deze zal doorgaans de voorkeur hebben boven t-toetsen voor ongelijke varianties. (Zie ook het schema in aanhangsel 7.)
|
|
45.
|
Als een limiettest is uitgevoerd en er is voldaan aan de voorwaarden van parametrische toetsprocedures (normaliteit, homogeniteit), kan de gepaarde t-toets worden gebruikt, of anders de Mann-Whitney-toets (29).
|
Schatting van ECx
|
46.
|
Om een ECx-waarde te berekenen worden de gemiddelden per behandeling gebruikt voor regressieanalyse (lineair of niet-lineair), nadat een passende dosis-responsfunctie is verkregen. Voor de groei van wormen als een continue respons kunnen ECx-waarden worden geschat met behulp van geschikte regressieanalyse (35). Tot de geschikte functies voor binaire gegevens (mortaliteit/overleving en aantal geproduceerde nakomelingen) behoren de normale sigmoïde, logistische of Weibull-functies, met twee tot vier parameters, waarvan sommige ook hormetische responsen kunnen modelleren. Als een dosis-responsfunctie werd gefit door lineaire regressieanalyse, moet bij de regressieanalyse een significante r2 (determinatiecoëfficiënt) en/of helling worden gevonden voordat de ECx kan worden geschat door in de door de regressieanalyse gevonden vergelijking een waarde in te vullen die overeenkomt met x % van het controlegemiddelde. De 95 %-betrouwbaarheidsgrenzen worden berekend overeenkomstig Fieller (geciteerd in Finney (21)) of andere passende moderne methoden.
|
|
47.
|
De respons kan ook worden gemodelleerd als een percentage of proportie van de modelparameter die wordt geïnterpreteerd als de gemiddelde respons van de controle. In deze gevallen kan de normale (logistische, Weibull) sigmoïde curve vaak gemakkelijk aan de resultaten worden gefit met de probit-regressieprocedure (21). In deze gevallen moet de weegfunctie aan de metrische responsen worden aangepast zoals aangegeven door Christensen (36). Als echter hormese is waargenomen, moet probit-analyse worden vervangen door een logistische of Weibull-functie met vier parameters, die wordt gefit met een niet-lineaire regressieprocedure (36). Als geen geschikte dosis-responsfunctie aan de gegevens kan worden gefit, kunnen alternatieve methoden worden gebruikt om de ECx en de betrouwbaarheidsgrenzen te schatten, zoals voortschrijdende gemiddelden volgens Thompson (22) en de getrimde Spearman-Karber-methode (23).
|
TESTVERSLAG
|
48.
|
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Teststof:
|
—
|
fysische aard en relevante fysisch-chemische eigenschappen (bv. oplosbaarheid in water, dampspanning);
|
|
—
|
chemische naam volgens de IUPAC-nomenclatuur, CAS-nummer, batch, partij, structuurformule en zuiverheid van de teststof;
|
|
—
|
datum waarop de geldigheidsduur van het monster verstrijkt.
|
|
|
|
Diersoort:
|
—
|
gebruikte testdieren: soort, wetenschappelijke naam, bron van de organismen en kweekomstandigheden.
|
|
|
|
Testomstandigheden:
|
—
|
ingrediënten en bereiding van de kunstmatige grond;
|
|
—
|
wijze van aanbrengen van de teststof;
|
|
—
|
beschrijving van de testomstandigheden, met inbegrip van de temperatuur, het vochtgehalte, de pH, enz.;
|
|
—
|
volledige beschrijving van de testopzet en procedures.
|
|
|
|
Testresultaten:
|
—
|
mortaliteit van de volwassen wormen na twee weken en het aantal nakomelingen aan het eind van de bereikbepalingstest;
|
|
—
|
mortaliteit van de volwassen wormen na drie weken blootstelling en de volledige gegevens over nakomelingen aan het eind van de definitieve test;
|
|
—
|
eventuele waargenomen fysieke of pathologische symptomen en gedragsveranderingen in de testorganismen;
|
|
—
|
de LC50, de NOEC en/of ECx (bv. EC50, EC10) voor de voortplanting als een of meer hiervan van toepassing zijn, met betrouwbaarheidsintervallen en een grafiek van het gefitte model dat is gebruikt voor de berekening ervan, en alle informatie en waarnemingen die van nut zijn voor de interpretatie van de resultaten.
|
|
Afwijkingen van de procedures beschreven in deze testmethode en alle ongebruikelijke voorvallen tijdens de test.
|
LITERATUUR
|
(1)
|
Römbke J (1989). Entwicklung eines Reproduktionstests an Bodenorganismen — Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke, J. & Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 blz.
|
|
(3)
|
Westheide, W. & Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, In: Modern Ecology: Basic and Applied Aspects. Esser, G. & Overdieck, D. (eds.). blz. 497-508. Elsevier, Amsterdam,
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R. & Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(5)
|
Hoofdstuk C.8 van deze bijlage, Toxiciteit voor regenwormen.
|
|
(6)
|
ISO (International Organization for Standardization) (1993). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using Artificial Soil substrate, No. 11268-1. ISO, Geneve.
|
|
(7)
|
ISO (International Organization for Standardization) (1996). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(8)
|
Rundgren, S. & A.K. Augustsson (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). In: Løkke, H. & C.A.M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73-94.
|
|
(9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217-232.
|
|
(10)
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF — Z. Umweltchem. Ökotox. 7, 246-249.
|
|
(11)
|
Dunger, W. & Fiedler, H.J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
(12)
|
Didden, W.A.M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2-29.
|
|
(13)
|
Becker, H. (1991). Bodenorganismen — Prüfungskategorien der Forschung. UWSF — Z. Umweltchem. Ökotox. 3, 19-24.
|
|
(14)
|
Römbke, J. & Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79-96.
|
|
(15)
|
Römbke, J., Riepert, F. & Achazi R. (2000): Enchytraeen als Testorganismen. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(16)
|
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
|
(17)
|
Bell, A.W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1-13.
|
|
(18)
|
Nielsen, C.O. & Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1-160.
|
|
(19)
|
Bouguenec, V. & Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9-22.
|
|
(20)
|
Korinkova, J. & Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(21)
|
Finney, D. J. (1971). Probit Analysis (3rd ed.), blz. 19-76. Cambridge Univ. Press.
|
|
(22)
|
Finney, D. J. (1978). Statistical Method in Biological Assay. — Charles Griffin & Company Ltd, London.
|
|
(23)
|
Hamilton, M.A., R.C. Russo & R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correctie Environ. Sci. Technol. 12(1998), 417.
|
|
(24)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(25)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(26)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(27)
|
Dunnett, C.W., (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(28)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(29)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(30)
|
Jonckheere, A. R. (1954). A Distribution-free k-Sample Test Against Ordered Alternatives. Biometrika 41, 133-145.
|
|
(31)
|
Terpstra, T. J. (1952). The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking. Indagationes Math. 14, 327-333.
|
|
(32)
|
Shirley, E. A. (1979). The comparison of treatment to control group means in toxicology studies. Applied Statistics 28, 144-151.
|
|
(33)
|
Williams, D.A. (1986). A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control. Biometrics 42, 183-186.
|
|
(34)
|
Sokal, R.R. & F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(35)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(36)
|
Van Ewijk, P.H. & J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Aanhangsel 1
Definities
Voor de toepassing van deze testmethode worden de volgende definities gehanteerd:
|
|
Stof betekent een substantie of mengsel.
|
|
|
ECx
(Effect concentration for x % effect) is de concentratie die binnen een bepaalde blootstellingstijd x % van een effect op testorganismen veroorzaakt ten opzichte van een controle. In deze test worden de effectconcentraties uitgedrukt als een massa van de teststof per droge massa van de testgrond.
|
|
|
LC0
(No lethal concentration) is de concentratie van een teststof die binnen een bepaalde blootstellingstijd geen van de blootgestelde testorganismen doodt. In deze test wordt de LC0 uitgedrukt als een massa van de teststof per droge massa van de testgrond.
|
|
|
LC50
(Median lethal concentration) is de concentratie van een teststof die binnen een bepaalde blootstellingstijd 50 % van de blootgestelde testorganismen doodt. In deze test wordt de LC50 uitgedrukt als een massa van de teststof per droge massa van de testgrond.
|
|
|
LC100
(Totally lethal concentration) is de concentratie van een teststof die binnen een bepaalde blootstellingstijd 100 % van de blootgestelde testorganismen doodt. In deze test wordt de LC100 uitgedrukt als een massa van de teststof per droge massa van de testgrond.
|
|
|
LOEC (Lowest Observed Effect Concentration) is de laagste concentratie van een teststof die tot een statistisch significant effect (p < 0,05) leidt. In deze test wordt de LOEC uitgedrukt als een massa van de teststof per droge massa van de testgrond. Alle geteste concentraties boven de LOEC moeten gewoonlijk een effect laten zien dat statistisch afwijkt van de controle. Alle afwijkingen van het bovenstaande bij het vaststellen van de LOEC moeten in het testverslag worden verantwoord.
|
|
|
NOEC (No Observed Effect Concentration) is de hoogste concentratie van de teststof direct onder de LOEC waarbij geen effect wordt waargenomen. In deze test heeft de concentratie die overeenkomt met de NOEC geen statistisch significant effect (p < 0,05) binnen een bepaalde blootstellingsperiode in vergelijking met de controle.
|
|
|
Voortplantingssnelheid is het gemiddelde aantal jonge wormen op een bepaald aantal volwassen wormen dat gedurende de testperiode wordt geproduceerd.
|
|
|
Teststof betekent alle volgens deze testmethode geteste stoffen en mengsels.
|
Aanhangsel 2
Bepaling van het maximale waterhoudend vermogen
Bepaling van het waterhoudend vermogen van de kunstmatige grond
De volgende methode is geschikt bevonden. Zij is beschreven in bijlage C bij ISO DIS 11268-2.
Verzamel met een geschikt apparaat (grondboorbuis enz.) een vastgestelde hoeveelheid testgrondsubstraat (bv. 5 g). Bedek de onderkant van de buis met een stuk filterpapier, vul een waterbad en plaats de buis op een rek in het bad. De buis zou geleidelijk onder water moeten komen te staan, tot het water de bovenkant van de grond bereikt. Laat de buis gedurende ongeveer drie uur in het water. Niet alle water dat door de bodemcapillairen wordt geabsorbeerd, kan worden vastgehouden. Laat het grondmonster daarom gedurende twee uur uitlekken door de buis op een bed van zeer nat fijngemalen kwartszand in een afgesloten vat te plaatsen (om droging te voorkomen). Het monster moet vervolgens worden gewogen, gedroogd tot een constante massa bij 105 °C. Het waterhoudend vermogen (WHV) kan vervolgens als volgt worden berekend:

waarbij:
|
S
|
=
|
met water verzadigd substraat + massa van buis + massa van filterpapier
|
|
T
|
=
|
leeggewicht (massa van buis + massa van filterpapier)
|
|
D
|
=
|
droge massa van substraat
|
LITERATUUR:
ISO (International Organization for Standardization) (1996). Soil Quality -Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
Aanhangsel 3
Bepaling van de pH van de grond
De volgende methode voor het bepalen van de pH van een grondmonster is gebaseerd op de beschrijving in ISO 10390 (Bodemkwaliteit — Bepaling van de pH-waarde).
Een vastgestelde hoeveelheid grond wordt gedurende ten minste 12 uur bij kamertemperatuur gedroogd. Vervolgens wordt een suspensie van de grond (die ten minste 5 g grond bevat) gemaakt in vijf keer zijn volume van hetzij een 1 M-oplossing van analytisch zuiver kaliumchloride (KCl) of een 0,01 M-oplossing van analytisch zuiver calciumchloride (CaCl2). De suspensie wordt daarna vijf minuten lang goed geschud. Na het schudden krijgt de suspensie ten minste 2 uur, maar niet langer dan 24 uur, gelegenheid om te bezinken. Daarna wordt de pH van de vloeibare fase gemeten met een pH-meter die vóór elke meting is geijkt met een passende reeks bufferoplossingen (bv. pH 4,0 en 7,0).
LITERATUUR:
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
Aanhangsel 4
Kweekomstandigheden van Enchytraeus sp.
Enchytreeën van de soort Enchytraeus albidus (alsmede andere Enchytraeus-soorten) kunnen worden gekweekt in grote plastic bakken (bv. 30 × 60 × 10 cm) die gevuld zijn met een 1:1-mengsel van kunstmatige grond en natuurlijke, niet verontreinigde tuinaarde. Compostmateriaal moet worden vermeden, aangezien dit toxische stoffen zoals zware metalen kan bevatten. Voordat de grond wordt gebruikt, moet alle fauna eruit worden verwijderd (bv. door diepvriezen). Een substraat van uitsluitend kunstmatige grond kan ook worden gebruikt, maar de voortplantingssnelheid zou lager kunnen zijn dan bij gebruik van een substraat van gemengde grond. Het substraat dat voor de kweek wordt gebruikt, moet een pH van 6,0 ± 0,5 hebben.
De cultuur moet op een temperatuur tussen 15 °C en 20 °C ± 2 °C worden gehouden. Temperaturen hoger dan 23 °C moeten worden vermeden. De grond moet vochtig worden gehouden, maar niet nat. Bij de juiste vochtigheidsgraad van de grond verschijnen kleine druppels water tussen de vingers wanneer men de grond lichtjes in de hand knijpt. Het ontstaan van anoxische omstandigheden moet worden vermeden door ervoor te zorgen dat deksels op kweekbakken voldoende uitwisseling van gassen met de lucht mogelijk maken. De grond moet elke week voorzichtig worden losgemaakt om de beluchting te bevorderen.
De wormen kunnen worden gevoed met havervlokken. De havervlokken moeten in een afgesloten verpakking worden bewaard en moeten voor gebruik in een autoclaaf worden gesteriliseerd of worden verhit om infestering met meelmijten (bv. Glycyphagus sp., Astigmata, Acarina) of roofmijten (bv. Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina) te voorkomen. Na een warmtebehandeling moet het voedsel worden vermalen, zodat het gemakkelijk op het grondoppervlak kan worden gestrooid. Van tijd tot tijd kunnen de havervlokken worden aangevuld met vitaminen, melk en levertraan. Andere geschikte voedselbronnen zijn bakkersgist of het visvoer „TetraMin”.
De voeding wordt ongeveer twee keer per week verstrekt. Een passende hoeveelheid havervlokken wordt op het grondoppervlak gestrooid of voorzichtig in het substraat gemengd wanneer de grond wordt losgemaakt om de beluchting te bevorderen. De absolute hoeveelheid verstrekt voedsel hangt af van het aantal wormen in het substraat. Als richtsnoer, moet de hoeveelheid voedsel worden verhoogd als deze binnen één dag na verstrekking helemaal is geconsumeerd. Omgekeerd, moet de hoeveelheid voedsel worden verlaagd als er op het moment van de tweede voeding (één week later) nog steeds voedsel op het oppervlak aanwezig is. Verontreinigd voedsel met schimmelgroei moet worden verwijderd en vervangen. Na drie maanden moeten de wormen worden overgebracht naar een vers bereid substraat.
De kweekomstandigheden worden toereikend geacht als de wormen: (a) niet proberen het grondsubstraat te verlaten, (b) zich snel door de grond voortbewegen, (c) een glanzend buitenoppervlak hebben waaraan geen gronddeeltjes kleven, (d) een min of meer wittige kleur hebben, en (e) als er wormen van verschillende leeftijden zichtbaar zijn in de culturen en (f) de wormen zich voortdurend voortplanten.
Aanhangsel 5
Uitvoering van de test met andere Enchytraeus-soorten
Keuze van de soorten
Er mogen andere soorten dan E. albidus worden gebruikt, maar de testprocedure en de geldigheidscriteria moeten in dat geval dienovereenkomstig worden aangepast. Omdat veel Enchytraeus-soorten gemakkelijk verkrijgbaar zijn en op bevredigende wijze in het laboratorium kunnen worden gehouden, zijn het belangrijkste criterium voor het kiezen van een andere soort dan E. albidus het ecologisch belang en, daarnaast, de relatieve gevoeligheid. Er kunnen ook formele redenen zijn om een andere soort te kiezen. Zo zal het in landen waar E. albidus niet voorkomt en niet kan worden geïmporteerd (bv. vanwege quarantainebeperkingen), nodig zijn een andere Enchytraeus-soort te gebruiken.
Voorbeelden van geschikte alternatieve soorten
|
—
|
Enchytraeus crypticus (Westheide & Graefe 1992): In de afgelopen jaren is deze soort vaak gebruikt in ecotoxicologische studies vanwege de eenvoud van kweken en testen. De soort is echter klein en dit maakt de hantering moeilijker in vergelijking met Enchytraeus albidus (vooral in de fasen vóór gebruik van de kleuringsmethode). Het staat niet vast dat E. crypticus in het veld voorkomt, aangezien de soort alleen in regenwormculturen is beschreven. De ecologische behoeften van de soort zijn derhalve onbekend.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky 1879): Deze naam dekt waarschijnlijk een groep nauwverwante soorten die morfologisch moeilijk van elkaar te onderscheiden zijn. Het gebruik van de soort in tests wordt afgeraden, tenzij kan worden vastgesteld tot welke soort de in een test te gebruiken afzonderlijke wormen behoren. E. buchholzi komt gewoonlijk voor in weiden en op verstoorde plekken, zoals wegkanten.
|
|
—
|
Enchytraeus luxuriosus: Deze soort stond oorspronkelijk bekend als E. „minutus”, maar is onlangs beschreven (1). Hij werd voor het eerst aangetroffen door U. Graefe (Hamburg) in een weide in de buurt van St. Peter-Ording (Schleswig-Holstein, Duitsland). E. luxuriosus is ongeveer half zo groot als E. albidus, maar is groter dan de andere soorten die hier worden besproken; deze soort kan daardoor een goed alternatief zijn voor E. albidus.
|
|
—
|
Enchytraeus bulbosus (Nielsen & Christensen 1963): Deze soort is tot nu toe aangetroffen in Duitse en Spaanse minerale gronden, waar de soort algemeen voorkomt, maar gewoonlijk niet zeer talrijk is. De soort is gemakkelijk te herkennen vergeleken met andere kleine soorten van dit geslacht. Er is niets bekend over het gedrag van de soort in laboratoriumtests of over zijn gevoeligheid voor chemische stoffen. De soort blijkt echter wel gemakkelijk te kweken (E. Belotti, persoonlijke mededeling).
|
Kweekomstandigheden
Alle hierboven genoemde Enchytraeus-soorten kunnen in dezelfde substraten worden gekweekt als gebruikt voor E. albidus. Door de kleinere omvang van de wormen kunnen de kweekbakken kleiner zijn. Weliswaar kan dezelfde voeding worden gebruikt, maar de portiegrootte moet worden aangepast. De levenscyclus van deze soorten is korter dan die van E. albidus en er moet vaker voedsel worden verstrekt.
Testomstandigheden
De testomstandigheden zijn doorgaans dezelfde als gelden voor E. albidus, behalve:
|
—
|
de omvang van het testvat kan kleiner zijn, maar dat hoeft niet;
|
|
—
|
de duur van de voortplantingstest kan korter zijn, d.w.z. vier in plaats van zes weken, maar dat hoeft niet; de duur van de bereikbepalingstest mag echter niet worden gewijzigd;
|
|
—
|
gelet op de geringe grootte van de jonge wormen wordt het gebruik van de kleuringsmethode voor het tellen ten zeerste aanbevolen;
|
|
—
|
het geldigheidscriterium voor „het aantal jonge wormen per testvat in de controle” moet worden vervangen door „50”.
|
LITERATUUR
|
(1)
|
Schmelz, R.M. & Collado, R. (1999). Enchytraeus luxuriosus sp. nov., a new terrestrial oligochaete species (Enchytraeide, Clitellata, Annelida). Carolinea 57, 93-100.
|
Aanhangsel 6
Gedetailleerde beschrijving van extractietechnieken
Kleuring met Bengaals rood
Deze methode, die oorspronkelijk werd ontwikkeld in de limnische ecologie (1), werd voor het eerst voor het tellen van jonge enchytreeën in de Enchytraeidae-voortplantingstest voorgesteld door W. de Coen (Universiteit van Gent, België). Onafhankelijk hiervan werd een gewijzigde versie (Bengaals rood gemengd met formaldehyde in plaats van ethanol) ontwikkeld door het RIVM in Bilthoven, Nederland (2)(3).
Aan het eind van de definitieve test (d.w.z. na zes weken) moet de grond in de testvaten worden overgebracht naar een ondiepe houder. Voor dit doel kunnen een Bellaplast-bak of een fotobad met geribbelde bodem worden gebruikt; laatstgenoemde is geschikt omdat de „ribbels” de beweging van de wormen binnen het waarnemingsveld beperken. De jonge wormen worden gefixeerd met ethanol (ca. 5 ml per replicaat). De vaten worden vervolgens gevuld met water tot een laag van 1 tot 2 cm. Er worden enkele druppels (200 tot 300 μl) Bengaals rood (1 %-oplossing in ethanol) toegevoegd (0,5 % eosine is een alternatief) en de twee bestanddelen worden voorzichtig gemengd. Na 12 uur moeten de wormen een rode kleur hebben gekregen en moeten ze gemakkelijk te tellen zijn, omdat ze op het oppervlak van het substraat liggen. Het substraat/alcoholmengsel kan ook, als alternatief, worden gewassen door een zeef (maaswijdte: 0,250 mm) vóór het tellen van de wormen. Wanneer deze methode wordt toegepast, wordt de kaoliniet, turf en een deel van het zand uitgewassen en zullen de roodgekleurde wormen gemakkelijker te zien en te tellen zijn. Het gebruik van verlichte lenzen (lensgrootte ten minste 100 × 75 mm met een vergrotingsfactor van 2 tot 3×) zal het tellen ook vergemakkelijken.
De kleuringstechniek verkort de benodigde tijd voor het tellen tot een paar minuten per vat. In de regel zou één persoon alle vaten van één test in maximaal twee dagen moeten kunnen beoordelen.
Natte extractie
Met de natte extractie moet worden begonnen zodra de test eindigt. De grond van elk testvat wordt in plastic zeven met een maaswijdte van circa 1 mm geplaatst. De zeven worden vervolgens op zodanige wijze in plastic kommen gehangen dat zij de bodem niet raken. De kommen worden voorzichtig met water gevuld tot de monsters in de zeven volledig onder water staan. Om een recoverypercentage van meer dan 90 % van de aanwezige wormen te waarborgen, moet een extractieperiode van 3 dagen bij 20 ± 2 °C worden aangehouden. Aan het eind van de extractieperiode worden de zeven uit de kommen gehaald en wordt het water (behalve wanneer het om een kleine hoeveelheid gaat) langzaam gedecanteerd, waarbij erop wordt gelet dat het sediment op de bodem van de kommen niet wordt verstoord. De plastic kommen worden daarna licht geschud om het sediment te suspenderen in het bovenstaande water. Het water wordt overgebracht in een petrischaal, en wanneer de gronddeeltjes zijn bezonken, kunnen de enchytreeën worden geïdentificeerd, verwijderd en geteld met behulp van een stereomicroscoop en een zacht stalen tangetje.
Flotatie
In een notitie van R. Kuperman is een methode gebaseerd op flotatie beschreven (4). Nadat de inhoud van een testvat met ethanol is gefixeerd, wordt de grond overstroomd met Ludox (AM-30 colloïdaal silicium, 30 gewichtspercent suspensie in water) tot een niveau van 10 tot 15 mm boven het grondoppervlak. Nadat de grond 2 tot 3 minuten grondig is gemengd met het flotatiemiddel, kunnen de jonge wormen die op het oppervlak drijven, gemakkelijk worden geteld.
LITERATUUR
|
(1)
|
Korinkova, J. & Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R. & Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R.P.M. & Dirven-Van Breemen, E.M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Effect of 3,4-dichloroaniline on the early life stages of the Zebrafish (Brachydanio rerio): results of a comparative laboratory study. Envir. Safety 38, 108-121.
|
|
(4)
|
Phillips, C.T., Checkai, R.T. & Kuperman, R.G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, USA. Abstract Book No. PMP069, blz. 157.
|
Aanhangsel 7
Overzicht van de statistische beoordeling van gegevens (NOEC-bepaling)

C.33. VOORTPLANTINGSTEST MET REGENWORMEN (EISENIA FETIDA/EISENIA ANDREI)
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan testrichtlijn (TG) 222 (2004) van de OESO. De test is opgezet om de effecten van stoffen in de bodem op het voortplantingsresultaat (en andere subletale eindpunten) van de regenwormsoorten Eisenia fetida (Savigny 1826) en Eisenia andrei (Andre 1963) te beoordelen (1)(2). De test is onderworpen aan een ringtest (3). Er bestaat een testmethode voor de acute toxiciteitstest voor regenwormen (4). Er is ook een aantal andere internationale en nationale richtsnoeren voor acute en chronische tests voor regenwormen gepubliceerd (5)(6)(7)(8).
|
|
2.
|
Eisenia fetida /Eisenia andrei worden beschouwd als vertegenwoordigers van bodemfauna en regenwormen in het bijzonder. Achtergrondinformatie over de ecologie van regenwormen en hun gebruik in ecotoxicologische tests is te vinden in (7)(9)(10)(11)(12).
|
PRINCIPE VAN DE TEST
|
3.
|
Volwassen wormen worden blootgesteld aan een concentratiebereik van de teststof die door de grond is gemengd of, in het geval van pesticiden, wordt aangebracht in of op de grond volgens procedures die overeenkomen met het gebruikspatroon van de stof. De wijze van aanbrengen is specifiek voor het doel van de test. Het bereik van testconcentraties wordt zo gekozen dat de concentraties die waarschijnlijk binnen een periode van acht weken zowel subletale als letale effecten zullen hebben, binnen het bereik vallen. De effecten op de mortaliteit en groei van de volwassen wormen worden na 4 weken blootstelling bepaald. De volwassen wormen worden dan uit de grond verwijderd, en na nog eens 4 weken worden de effecten op de voortplanting beoordeeld door het aantal nakomelingen te tellen dat in de grond aanwezig is. Het voortplantingsresultaat van de wormen die zijn blootgesteld aan de teststof, wordt vergeleken met dat van de controle(s) om het volgende te bepalen: (i) de concentratie waarbij geen effect wordt waargenomen (no observed effect concentration, NOEC) en/of (ii) ECx (bv. EC10, EC50) door met een regressiemodel een schatting te maken van de concentratie die zou leiden tot een afname van het voortplantingsresultaat met x %. De ECx (bv. EC10, EC50) moet in het bereik van de testconcentraties liggen, zodat de ECx kan worden bepaald door interpolatie in plaats van extrapolatie (zie aanhangsel 1 voor definities).
|
INFORMATIE OVER DE TESTSTOF
|
4.
|
Over de teststof moeten de volgende gegevens beschikbaar zijn om passende testprocedures te helpen opzetten:
|
—
|
oplosbaarheid in water;
|
|
—
|
en, indien mogelijk, informatie over het lot en het gedrag in het milieu (bv. fotolyse- en hydrolysesnelheid voor zover relevant voor aanbrengingspatronen).
|
|
|
5.
|
Deze testmethode is van toepassing op alle stoffen, ongeacht hun oplosbaarheid in water. De testmethode is niet van toepassing op vluchtige stoffen, d.w.z. stoffen waarvoor de Henry-constante of de lucht/water-verdelingscoëfficiënt groter dan één is, of op stoffen waarvoor de dampspanning bij 25 °C groter dan 0,0133 Pa is.
|
|
6.
|
In deze testmethode wordt geen rekening gehouden met mogelijke afbraak van de teststof in de loop van de test. Er kan dus niet worden aangenomen dat de blootstellingsconcentraties gedurende de gehele test hun beginwaarde behouden. Een chemische analyse van de teststof aan het begin en het eind van de test is in dat geval aanbevolen.
|
REFERENTIESTOF
|
7.
|
De NOEC en/of de ECx van een referentiestof moeten worden bepaald om zekerheid te verkrijgen dat de testomstandigheden in het laboratorium toereikend zijn en om na te gaan dat de respons van de testorganismen in de loop van de tijd niet statistisch wijzigt. Het is raadzaam ten minste één keer per jaar of, wanneer de test met een vrij lage frequentie wordt uitgevoerd, tegelijk met de bepaling van de toxiciteit van een teststof een referentiestof te testen. Carbendazim of benomyl zijn geschikte referentiestoffen waarvan is aangetoond dat zij de voortplanting beïnvloeden (3). Er zouden significante effecten moeten worden waargenomen tussen (a) 1 en 5 mg werkzaam bestanddeel (w.b.)/kg droge massa of (b) 250-500 g/ha of 25-50 mg/m2. Indien in de testreeks een positieve toxische standaard wordt opgenomen, wordt één concentratie gebruikt en moet het aantal replicaten hetzelfde zijn als in de controles.
|
GELDIGHEID VAN DE TEST
|
8.
|
Wil een testresultaat geldig zijn, dan moet in de controlegroep aan de volgende criteria worden voldaan:
|
—
|
elk replicaat (10 volwassen wormen bevattende) moet aan het eind van de test ≥ 30 nakomelingen hebben voortgebracht;
|
|
—
|
de variatiecoëfficiënt van de voortplanting moet ≤ 30 % zijn;
|
|
—
|
de mortaliteit van volwassen wormen in de eerste 4 weken van de test moet ≤ 10 % zijn.
|
Wanneer een test niet aan de hierboven genoemde geldigheidscriteria voldoet, moet de test worden beëindigd, tenzij voortzetting van de test kan worden gemotiveerd. De motivering dient in het verslag te worden opgenomen.
|
BESCHRIJVING VAN DE TEST
Benodigdheden
|
9.
|
Er moeten testvaten worden gebruikt die van glas of een ander chemisch inert materiaal gemaakt zijn en een inhoud hebben van een tot twee liter. De vaten moeten een oppervlakte van de doorsnede van circa 200 cm2 hebben, zodat een vochtige substraatdikte van ongeveer 5-6 cm wordt bereikt wanneer 500 tot 600 g droge massa substraat wordt toegevoegd. De afsluiting van de vaten moet zo zijn ontworpen dat uitwisseling van gassen tussen het substraat en de lucht mogelijk is en licht wordt doorgelaten (bv. door middel van een geperforeerd transparant deksel), maar wordt voorkomen dat de wormen ontsnappen. Als de gebruikte hoeveelheid testsubstraat substantieel meer is dan 500 tot 600 g per testvat, moet het aantal wormen proportioneel worden verhoogd.
|
|
10.
|
Een standaard-laboratoriumuitrusting is vereist, in het bijzonder:
|
—
|
geschikte nauwkeurige weegschalen;
|
|
—
|
adequate apparatuur voor temperatuurregeling;
|
|
—
|
adequate apparatuur voor vochtigheidsregeling (niet noodzakelijk als de blootstellingsvaten een deksel hebben);
|
|
—
|
incubator of kleine kast met klimaatregelaar;
|
|
Bereiding van de kunstmatige grond
|
11.
|
In deze test wordt een kunstmatige grond gebruikt (5)(7) met de volgende samenstelling (gebaseerd op drooggewicht, gedroogd tot een constant gewicht bij 105 °C):
|
—
|
10 % veenmosturf (de pH moet zo dicht mogelijk bij 5,5 tot 6,0 liggen, zonder zichtbare plantenresten, fijngemalen, gedroogd tot gemeten vochtgehalte);
|
|
—
|
20 % kaolienklei (met bij voorkeur meer dan 30 % kaoliniet);
|
|
—
|
0,3 tot 1,0 % calciumcarbonaat (CaCO3, verpulverd, analytisch zuiver) om een beginwaarde van de pH te verkrijgen van 6,0 ± 0,5.
|
|
—
|
70 % luchtdroog kwartszand (afhankelijk van de benodigde hoeveelheid CaCO3), overwegend bestaande uit fijn zand; meer dan 50 % van de deeltjes moet een grootte tussen 50 en 200 micron hebben.
|
Noot 1: De benodigde hoeveelheid CaCO3 zal afhangen van de bestanddelen van het grondsubstraat inclusief voeding en moet worden bepaald door metingen van gronddeelmonsters direct vóór de test. De pH wordt gemeten in een gemengd monster in een 1 M-oplossing van kaliumchloride (KCl) of een 0,01 M-oplossing van calciumchloride (CaCl2) (13).
Noot 2: Het gehalte organische koolstof van de kunstmatige grond kan worden verlaagd, bv. door vermindering van het turfgehalte tot 4-5 % en dienovereenkomstige verhoging van het zandgehalte. Door een dergelijke verlaging van het gehalte organische koolstof kan de adsorptie van de teststof aan de grond (organische koolstof) afnemen en kan de beschikbaarheid van de teststof voor de wormen toenemen. Aangetoond is dat Eisenia fetida kan voldoen aan de geldigheidscriteria voor de voortplanting bij tests in veldgrond met een lager gehalte organische koolstof (bv. 2,7 %) (14), en de ervaring leert dat dit ook bereikt kan worden in kunstmatige grond met 5 % turf. Het is daarom niet nodig om vóór het gebruik van een dergelijke grond in een definitieve test aan te tonen dat de kunstmatige grond geschikt is om aan de geldigheidscriteria te voldoen, tenzij het turfgehalte tot onder het hierboven genoemde gehalte wordt verlaagd.
Noot 3: Wanneer in aanvullende tests (bv. van de latere fasen) natuurlijke grond wordt gebruikt, moet eveneens worden aangetoond dat de grond geschikt is en dat wordt voldaan aan de geldigheidscriteria.
|
|
12.
|
De droge bestanddelen van de grond worden in een goed geventileerde ruimte grondig gemengd (bv. in een grote laboratoriummenger). Vóór aanvang van de test wordt de droge kunstmatige grond bevochtigd door genoeg gedeïoniseerd water toe te voegen om ongeveer de helft van het uiteindelijke watergehalte te verkrijgen, d.w.z. 40 % tot 60 % van het maximale waterhoudend vermogen (overeenkomend met 50 ± 10 % vochtgehalte van de droge massa). Dit levert een substraat op dat geen staand of vrij water heeft wanneer het in de hand wordt geknepen. Het maximale waterhoudend vermogen (WHV) van de kunstmatige grond wordt bepaald overeenkomstig de procedures als beschreven in aanhangsel 2, ISO 11274 (15) of een gelijkwaardige EU-norm.
|
|
13.
|
Als de teststof zonder water op het grondoppervlak wordt aangebracht of met de grond wordt gemengd, kan de uiteindelijke hoeveelheid water in de kunstmatige grond worden gemengd tijdens de bereiding van de grond. Als de teststof met water door de grond wordt gemengd, kan de aanvullende hoeveelheid water tezamen met de teststof worden toegevoegd (zie punt 19).
|
|
14.
|
Het vochtgehalte van de grond wordt aan het begin en aan het eind van de test bepaald overeenkomstig ISO 11465 (16) of een gelijkwaardige EU-norm, en de pH-waarde van de grond wordt bepaald overeenkomstig aanhangsel 3 of ISO 10390 (13) of een gelijkwaardige EU-norm. Deze bepalingen moeten worden uitgevoerd in een monster controlegrond en een monster van elke testconcentratiegrond. De pH-waarde van de grond mag niet worden aangepast wanneer zure of basische stoffen worden getest. Het vochtgehalte moet gedurende de gehele test worden bewaakt door de vaten periodiek te wegen (zie de punten 26 en 30).
|
Selectie en voorbereiding van de proefdieren
|
15.
|
De testsoort is Eisenia fetida of Eisenia andrei (1)(2). Om de test te beginnen zijn volwassen wormen tussen twee maanden en één jaar oud met een clitellum nodig. De wormen moeten worden gekozen uit een gesynchroniseerde cultuur met een relatief homogene leeftijdsstructuur (aanhangsel 4). Individuele wormen in een testgroep mogen in leeftijd niet meer dan 4 weken van elkaar verschillen.
|
|
16.
|
De geselecteerde wormen moeten gedurende ten minste één dag worden geacclimatiseerd met het type kunstmatig grondsubstraat dat in de test zal worden gebruikt. Tijdens deze periode moeten de wormen worden gevoed met hetzelfde voedsel dat in de test zal worden gebruikt (zie de punten 31 tot en met 33).
|
|
17.
|
Aan het begin van de test moeten groepen van 10 wormen afzonderlijk worden gewogen en moeten de groepen aselect worden toegewezen aan de testvaten. De wormen worden vóór het wegen gewassen (met gedeïoniseerd water), en het overtollige water wordt verwijderd door de wormen kort op filterpapier te leggen. De natte massa van de afzonderlijke wormen moet tussen 250 en 600 mg zijn.
|
Bereiding van testconcentraties
|
18.
|
Voor het aanbrengen van de teststof kunnen twee methoden worden gebruikt: menging van de teststof in de grond (zie hiervoor de punten 19-21) of aanbrenging op het grondoppervlak (zie hiervoor de punten 22-24.). De keuze van de juiste methode hangt af van het doel van de test. In het algemeen wordt aangeraden de teststof door de grond te mengen. Het kan echter nodig zijn aanbrengingsprocedures te gebruiken die overeenkomen met de normale landbouwpraktijk (bv. sproeien van vloeibare formulering of gebruik van speciale formuleringen van pesticiden zoals granulaten of zaadbehandelingen). Oplosmiddelen die als hulpstof worden gebruikt bij de behandeling van de grond met de teststof, moeten worden gekozen op basis van hun laag toxisch effect op regenwormen, en er moet een geschikte oplosmiddelcontrole in de testopzet worden opgenomen (zie punt 27).
|
Mengen van de teststof in de grond
In water oplosbare teststof
|
19.
|
Vlak voor het begin van de test wordt een oplossing van de teststof in gedeïoniseerd water bereid in een hoeveelheid die voldoende is voor alle replicaten van één concentratie. Er kan een co-solvent nodig zijn om het bereiden van de testoplossing te vergemakkelijken. Het is handig om voldoende oplossing te bereiden om het uiteindelijke vochtgehalte (40 tot 60 % van het maximale waterhoudend vermogen) te bereiken. De oplossing wordt goed vermengd met het grondsubstraat voordat dit naar een testvat wordt overgebracht.
|
In water onoplosbare teststof
|
20.
|
De teststof wordt opgelost in een kleine hoeveelheid geschikt organisch oplosmiddel (bv. aceton) en vervolgens op een kleine hoeveelheid fijn kwartszand gesproeid of erdoorheen gemengd. Het oplosmiddel wordt daarna verwijderd door het gedurende tenminste enkele minuten in een afzuigkast te verdampen. Vervolgens wordt het behandelde zand goed gemengd met de vooraf bevochtigde kunstmatige grond. Daarna wordt gedeïoniseerd water toegevoegd, in een hoeveelheid die nodig is om een uiteindelijke vochtigheidsgraad van 40 tot 60 % van het maximale waterhoudend vermogen te bereiken, en door de grond gemengd. De grond is daarna gereed om naar de testvaten te worden overgebracht. Er dient op te worden gelet dat sommige oplosmiddelen een toxisch effect kunnen hebben op regenwormen.
|
In water en organische oplosmiddelen onoplosbare teststof
|
21.
|
Er wordt een mengsel bereid bestaande uit 10 g fijngemalen industrieel kwartszand en een hoeveelheid van de teststof die nodig is om de testconcentratie in de bodem te bereiken. Vervolgens wordt het mengsel goed gemengd met de vooraf bevochtigde kunstmatige grond. Daarna wordt gedeïoniseerd water toegevoegd, in een hoeveelheid die nodig is om een uiteindelijke vochtigheidsgraad van 40 tot 60 % van het maximale waterhoudend vermogen te bereiken, en door de grond gemengd. De grond is daarna gereed om naar de testvaten te worden overgebracht.
|
Aanbrengen van de teststof op het grondoppervlak
|
22.
|
De grond wordt behandeld nadat de wormen zijn toegevoegd. De testvaten worden eerst gevuld met het bevochtigde grondsubstraat, waarna de gewogen wormen op het oppervlak worden geplaatst. Gezonde wormen graven zich gewoonlijk onmiddellijk in het substraat in. Wormen die na 15 minuten nog op het oppervlak zijn achtergebleven, worden daarom als beschadigd beschouwd en moeten worden vervangen. Als wormen worden vervangen, moeten de nieuwe wormen en de vervangen wormen worden gewogen, zodat het totale levend gewicht van de blootstellingsgroep en het totale gewicht van het vat met wormen aan het begin bekend is.
|
|
23.
|
De teststof wordt aangebracht. De teststof mag niet binnen een half uur na de plaatsing van de wormen aan de grond worden toegevoegd (en evenmin als er wormen op het grondoppervlak aanwezig zijn), om directe blootstelling aan de teststof door contact met de huid te vermijden. Wanneer de teststof een pesticide is, kan het aangewezen zijn de teststof door sproeien op het grondoppervlak aan te brengen. De teststof moet zo gelijkmatig mogelijk op het grondoppervlak worden aangebracht met behulp van een geschikte laboratoriumsproeier om aanbrenging door sproeien in het veld te simuleren. Vóór aanbrenging dient het deksel van het testvat te worden verwijderd en te worden vervangen door een binnenkuip die de zijwanden van het vat beschermt tegen de spray. De binnenkuip kan worden gemaakt van een testvat waaruit de bodem is verwijderd. De aanbrenging dient te geschieden bij een temperatuur van 20 ± 2 °C en voor waterige oplossingen, emulsies of dispersies bij een wateraanbrenging van 600 tot 800 μl/m2. De verhouding moet worden gecontroleerd met een passende kalibratietechniek. Speciale formuleringen zoals granulaten of zaadbehandelingen moeten worden aangebracht op een wijze die overeenkomt met de landbouwpraktijk.
|
|
24.
|
Testvaten moeten gedurende één uur onafgedekt blijven, zodat vluchtig oplosmiddel dat is gebruikt bij de aanbrenging van de teststof, kan verdampen. Er moet op worden gelet dat er in deze tijd geen wormen uit de testvaten ontsnappen.
|
PROCEDURE
Test-en controlegroepen
|
25.
|
Aanbevolen wordt een aantal van 10 regenwormen in 500 tot 600 g droge massa van de kunstmatige grond (d.w.z. 50-60 g grond per worm). Als grotere hoeveelheden grond worden gebruikt, zoals het geval kan zijn als pesticiden worden getest met speciale aanbrengingswijzen zoals zaadbehandelingen, moet de hoeveelheid van 50-60 g grond per worm worden aangehouden door het aantal wormen te vergroten. Voor elk controle- en behandelingsvat worden tien wormen voorbereid. De wormen worden met water gewassen en drooggeveegd en vervolgens kort op absorberend papier geplaatst, zodat overtollig water kan wegstromen.
|
|
26.
|
Om systematische fouten in de verdeling van de wormen over de testvaten te voorkomen, moet de homogeniteit van de testpopulatie worden vastgesteld door 20 aselect gekozen wormen uit de populatie waaruit de testwormen zullen worden gehaald, afzonderlijk te wegen. Nadat de homogeniteit is gewaarborgd, worden met een randomiseringsprocedure batches van wormen samengesteld, gewogen en aan de testvaten toegewezen. Na plaatsing van de testwormen moet het gewicht van elk testvat worden bepaald, zodat het begingewicht bekend is en als basis kan dienen voor het gedurende de test bewaken van het vochtgehalte van de grond als beschreven in punt 30. De testvaten worden vervolgens afgesloten als beschreven in punt 9 en in de testruimte geplaatst.
|
|
27.
|
Voor elk van de aanbrengingsmethoden van de teststof worden passende controles voorbereid als beschreven in de punten 18 tot en met 24. Voor de voorbereiding van de controles worden de beschreven toepasselijke procedures gevolgd, zij het dat geen teststof wordt gevoegd. Voor zover van toepassing worden dus organische oplosmiddelen, kwartszand of andere media op de controles aangebracht in concentraties/hoeveelheden die overeenkomen met die in de behandelingen. Wanneer een oplosmiddel of ander medium wordt gebruikt om de teststof aan te brengen, moet ook een extra controle zonder het medium of de teststof worden voorbereid en getest om te waarborgen dat het medium het resultaat niet beïnvloedt.
|
Testomstandigheden
|
28.
|
De testtemperatuur is 20 ± 2 °C. De test wordt uitgevoerd bij gecontroleerde licht-donkercycli (bij voorkeur 16 uur licht en 8 uur donker), met een verlichting van 400 tot 800 lux in het gebied van de testvaten.
|
|
29.
|
De testvaten worden tijdens de test niet belucht, maar het ontwerp van de afsluiting van de testvaten moet uitwisseling van gassen wel mogelijk maken, maar de verdamping van vocht beperken (zie punt 9).
|
|
30.
|
Het watergehalte van het grondsubstraat in de testvaten wordt gedurende de hele test gehandhaafd door de testvaten (zonder hun afsluiting) periodiek opnieuw te wegen. Het verloren vocht wordt, indien nodig, aangevuld met gedeïoniseerd water. Het watergehalte mag niet meer dan 10 % afwijken van het gehalte aan het begin van de test.
|
Voeding
|
31.
|
Elk voedsel van een kwaliteit waarvan is aangetoond dat het geschikt is om het gewicht van de wormen tijdens de test ten minste in stand te houden, wordt aanvaardbaar geacht. De ervaring leert dat havervlokken, koeien- of paardenmest geschikte voedselbronnen zijn. Er moeten controles plaatsvinden om te waarborgen dat koeien of paarden waarvan mest wordt verkregen, geen medicijnen gebruiken en niet worden behandeld met een chemische stof, zoals groeibevorderaars, nematiciden of soortgelijke diergeneesmiddelen die tijdens de test een negatief effect op de wormen zouden kunnen hebben. Het wordt aangeraden om zelfverzamelde koeienmest te gebruiken, want de ervaring leert dat commercieel verkrijgbare koeienmest die als meststof in tuinen wordt gebruikt, negatieve effecten op de wormen kan hebben. De mest moet vóór gebruik aan de lucht worden gedroogd, fijngemalen en gepasteuriseerd.
|
|
32.
|
Elke verse batch voedsel moet, voordat de batch in een test wordt gebruikt, worden verstrekt aan een wormcultuur die geen deel uitmaakt van de test, om te waarborgen dat de batch van toereikende kwaliteit is. De groei en coconproductie mag niet lager zijn dan die van wormen die worden gehouden in een substraat dat de nieuwe batch voedsel niet bevat (voorwaarden als beschreven in testmethode C.8(4)).
|
|
33.
|
Voedsel wordt voor het eerst verstrekt één dag na de plaatsing van de wormen en de aanbrenging van de teststof op de grond. Ongeveer 5 g voeding wordt over het grondoppervlak van elk vat verspreid en bevochtigd met gedeïoniseerd water (ongeveer 5 ml tot 6 ml per vat). Daarna wordt gedurende de testperiode van 4 weken één keer per week voedsel verstrekt. Als het voedsel niet volledig wordt opgegeten, moet de portie worden verkleind om schimmelgroei te voorkomen. De volwassen wormen worden op dag 28 van de test uit de grond verwijderd. Vervolgens wordt aan elk testvat nog eens 5 g voedsel toegediend. In de resterende 4 weken van de test wordt geen voeding meer verstrekt.
|
Selectie van testconcentraties
|
34.
|
Wanneer er vooraf iets bekend is over de toxiciteit van de teststof, bijvoorbeeld uit een acute test (4) en/of bereikbepalingstests, kan dit nuttig zijn bij het kiezen van geschikte testconcentraties. Indien nodig, wordt een bereikbepalingstest uitgevoerd met bijvoorbeeld vijf teststofconcentraties van 0,1, 1,0, 10, 100 en 1 000 mg/kg (drooggewicht grond). Eén replicaat voor elke behandeling en controle volstaat. De tijdsduur van de bereikbepalingstest is twee weken, en de mortaliteit wordt aan het eind van de test beoordeeld.
|
Proefopzet
|
35.
|
Omdat voor de test niet één samenvattende statistiek kan worden voorgeschreven, voorziet deze testmethode in de bepaling van de NOEC en de ECx. In de nabije toekomst zal door regelgevende autoriteiten waarschijnlijk een NOEC worden geëist. Op grond van statistische en ecologische overwegingen kan in de nabije toekomst ook de ECx algemener worden gebruikt. Op basis van de aanbevelingen voortvloeiende uit een ringtest van een voortplantingstestmethode voor enchytreeën worden daarom drie opzetten voorgesteld (17).
|
|
36.
|
Bij de vaststelling van het concentratiebereik moet aandacht worden geschonken aan het volgende:
|
—
|
Voor de bepaling van de NOEC moeten ten minste vijf/twaalf concentraties worden getest die een meetkundige reeks vormen. Aanbevolen wordt vier replicaten voor elke testconcentratie plus acht controles te gebruiken. De concentraties moeten worden gekozen met intervallen die onderling verschillen met een factor van niet meer dan 2,0.
|
|
—
|
Voor de bepaling van de ECx (bv. EC10, EC50) wordt aanbevolen voldoende concentraties te gebruiken om ten minste vier statistisch significant verschillende gemiddelde responsen op deze concentraties te veroorzaken. Aanbevolen wordt ten minste twee replicaten voor elke testconcentratie plus zes controles te gebruiken. De intervalsfactor kan variëren, d.w.z. kleiner dan of gelijk aan 1,8 in het verwachte effectbereik en groter dan 1,8 bij de hogere en lagere concentraties.
|
|
—
|
Een gecombineerde aanpak maakt het mogelijk om zowel de NOEC als ECx te bepalen. Er moeten acht behandelingsconcentraties die een meetkundige reeks vormen, worden gebruikt. Aanbevolen wordt vier replicaten voor iedere behandeling plus acht controles te gebruiken. De concentraties moeten worden gekozen met intervallen die onderling verschillen met een factor van niet meer dan 1,8.
|
|
Testduur en metingen
|
37.
|
Op dag 28 worden de levende volwassen wormen geobserveerd en geteld. Alle ongebruikelijke gedragingen (bv. onvermogen om in de grond te graven, bewegingsloos tegen de glazen wand van het testvat liggen) en ongebruikelijke morfologie (bv. de aanwezigheid van open wonden) worden ook geregistreerd. Alle volwassen wormen worden vervolgens uit de testvaten verwijderd en geteld en gewogen. Het zoeken naar volwassen wormen kan makkelijker worden gemaakt door de grond met daarin de wormen vóór de beoordeling over te brengen naar een schone schaal. De uit de grond geëxtraheerde wormen moeten vóór het wegen worden gewassen (met gedeïoniseerd water) en het overtollige water moet worden verwijderd door de wormen kort op filterpapier te leggen. Wormen die op dat moment niet worden aangetroffen, moeten als dood worden geregistreerd, omdat moet worden aangenomen dat deze wormen vóór de beoordeling zijn overleden en ontbonden.
|
|
38.
|
Als de grond uit de vaten is verwijderd, wordt deze weer terug in de vaten gebracht (zonder de volwassen wormen, maar met de eventuele cocons die zijn geproduceerd). De grond wordt vervolgens gedurende nog eens vier weken onder dezelfde testomstandigheden geïncubeerd, behalve dat enkel aan het begin van deze testfase voeding wordt verstrekt (zie punt 33).
|
|
39.
|
Aan het eind van de tweede periode van vier weken wordt het aantal jonge wormen dat uit de cocons in de testgrond is gekomen, en het aantal cocons bepaald met de procedures als beschreven in aanhangsel 5. Gedurende de gehele testperiode moeten alle tekenen van letsel of beschadiging van de worm worden geregistreerd.
|
Limiettest
|
40.
|
Als bij de hoogste concentratie in de bereikbepalingstest (d.w.z. 1 000 mg/kg) geen effecten worden waargenomen, wordt de voortplantingstest uitgevoerd als een limiettest met 1 000 mg/kg als testconcentratie. Een limiettest biedt de mogelijkheid om aan te tonen dat de NOEC voor de voortplanting groter is dan de hoogste concentratie, en om het aantal gebruikte wormen in de test tot een minimum te beperken. Zowel voor de behandelde grond als voor de controle moeten acht replicaten worden gebruikt.
|
GEGEVENS EN RAPPORTAGE
Verwerking van de resultaten
|
41.
|
Hoewel aanhangsel 6 een overzicht bevat, wordt in deze testmethode geen definitieve statistische richtsnoer voor de analyse van de testresultaten gegeven.
|
|
42.
|
Een van de eindpunten is de mortaliteit. Veranderingen in het gedrag (bv. onvermogen om in de grond te graven, bewegingsloos tegen de glazen wand van het testvat liggen) en de morfologie (bv. de aanwezigheid van open wonden) van de volwassen wormen moeten echter ook worden geregistreerd, evenals de aanwezigheid van eventuele nakomelingen. Normaal gesproken moet probit-analyse (18) of logistische regressie worden toegepast om de LC50 te bepalen. In gevallen waarin deze analysemethode niet geschikt is (bv. als er minder dan drie concentraties met gedeeltelijke sterfte beschikbaar zijn), kunnen echter andere methoden worden gebruikt. Tot deze methoden behoren onder andere voortschrijdende gemiddelden (19), de getrimde Spearman-Karber-methode (20) of eenvoudige interpolatie (bv. meetkundig gemiddelde van LC0 en LC100, berekend als de vierkantswortel van LC0 vermenigvuldigd met LC100).
|
|
43.
|
Het andere eindpunt is de vruchtbaarheid (d.w.z. het aantal voortgebrachte nakomelingen). Net als in de bereikbepalingstest moeten echter ook hier alle andere schadelijke tekenen worden geregistreerd in het eindverslag. De statistische analyse vereist dat het rekenkundig gemiddelde
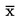
en de standaardafwijking per behandeling en per controle voor de voortplanting worden berekend. |
|
44.
|
Als een variantieanalyse is uitgevoerd, kunnen de standaardafwijking (s) en het aantal vrijheidsgraden (df) worden vervangen door respectievelijk de schatting van de gepoolde variantie verkregen uit de ANOVA en haar aantal vrijheidsgraden, mits de variantie niet afhankelijk is van de concentratie. Gebruik in dit geval de afzonderlijke varianties van de controle en de behandelingen. Deze waarden worden doorgaans berekend door commerciële statistische software met de resultaten per vat als replicaten. Als het poolen van de gegevens voor de negatieve en oplosmiddelcontroles redelijk lijkt, in plaats van het toetsen tegen een hiervan, moeten ze worden getoetst om te bepalen of ze significant afwijken (zie punt 47 en aanhangsel 6 voor de geschikte toets).
|
|
45.
|
De verdere statistische toetsen en gevolgtrekkingen hangen af van de vraag of de replicaatwaarden normaal verdeeld zijn en homogeen zijn voor wat betreft hun variantie.
|
Schatting van NOEC
|
46.
|
De toepassing van krachtige toetsen heeft de voorkeur. Er dient gebruik te worden gemaakt van informatie uit bv. eerdere ervaring met ringtesten of andere historische gegevens over de vraag of gegevens ongeveer normaal verdeeld zijn. Homogeniteit van variantie (homoscedasticiteit) is crucialer. De ervaring leert dat de variantie vaak toeneemt bij een hoger gemiddelde. In deze gevallen zou een gegevenstransformatie kunnen leiden tot homoscedasticiteit. Een dergelijke transformatie moet echter worden gebaseerd op de ervaring met historische gegevens in plaats van op gegevens van het lopende onderzoek. Bij homogene gegevens moeten multipele t-toetsen zoals de Williams-toets (α = 0,05, eenzijdig) (21)(22) of in bepaalde gevallen de toets van Dunnett (23)(24) worden uitgevoerd. Er zij opgemerkt dat in het geval van ongelijke aantallen replicaten de tabel met t-waarden moet worden aangepast zoals voorgesteld door Dunnett en Williams. Soms nemen de responsen als gevolg van grote variatie niet regelmatig toe of af. In het geval van een sterke afwijking van monotoniciteit is de toets van Dunnett geschikter. Als er afwijkingen van homoscedasticiteit zijn, kan het redelijk zijn om mogelijke effecten op varianties nader te onderzoeken om te bepalen of de t-toetsen kunnen worden toegepast zonder al te zeer aan statistisch onderscheidingsvermogen in te boeten (25). Anders kan een multipele Mann-Whitney-toets, bv. de Bonferroni-toets volgens Holm (26), of wanneer deze gegevens heteroscedasticiteit vertonen maar anderszins consistent zijn met een onderliggende monotone dosis-respons, een andere verdelingsvrije toets (bv. Jonckheere-Terpstra (27) (28) of Shirley (29) (30)) worden toegepast, en deze zal doorgaans de voorkeur hebben boven t-toetsen voor ongelijke varianties. (Zie ook het schema in aanhangsel 6.)
|
|
47.
|
Als een limiettest is uitgevoerd en er is voldaan aan de voorwaarden van parametrische toetsprocedures (normaliteit, homogeniteit), kan de gepaarde t-toets worden gebruikt, of anders de Mann-Whitney-toets (31).
|
Schatting van ECx
|
48.
|
Om een ECx-waarde te berekenen worden de gemiddelden per behandeling gebruikt voor regressieanalyse (lineair of niet-lineair), nadat een passende dosis-responsfunctie is verkregen. Voor de groei van wormen als een continue respons kunnen ECx-waarden worden geschat met behulp van geschikte regressieanalyse (32). Tot de geschikte functies voor binaire gegevens (mortaliteit/overleving) en aantal geproduceerde nakomelingen behoren de normale sigmoïde, logistische of Weibull-functies, met twee tot vier parameters, waarvan sommige ook hormetische responsen kunnen modelleren. Als een dosis-responsfunctie werd gefit door lineaire regressieanalyse, moet bij de regressieanalyse een significante r2 (determinatiecoëfficiënt) en/of helling worden gevonden voordat de ECx kan worden geschat door in de door de regressieanalyse gevonden vergelijking een waarde in te vullen die overeenkomt met x % van het controlegemiddelde. De 95 %-betrouwbaarheidsgrenzen worden berekend overeenkomstig Fieller (geciteerd in Finney (18)) of andere passende moderne methoden.
|
|
49.
|
De respons kan ook worden gemodelleerd als een percentage of proportie van de modelparameter die wordt geïnterpreteerd als de gemiddelde respons van de controle. In deze gevallen kan de normale (logistische, Weibull) sigmoïde curve vaak gemakkelijk aan de resultaten worden gefit met de probit-regressieprocedure (18). In deze gevallen moet de weegfunctie aan de metrische responsen worden aangepast zoals aangegeven door Christensen (33). Als echter hormese is waargenomen, moet probit-analyse worden vervangen door een logistische of Weibull-functie met vier parameters, die wordt gefit met een niet-lineaire regressieprocedure (34). Als geen geschikte dosis-responsfunctie aan de gegevens kan worden gefit, kunnen alternatieve methoden worden gebruikt om de ECx en de betrouwbaarheidsgrenzen te schatten, zoals voortschrijdende gemiddelden volgens Thompson (19) en de getrimde Spearman-Karber-methode (20).
|
TESTVERSLAG
|
50.
|
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Teststof:
|
—
|
een ondubbelzinnige beschrijving van de teststof, batch, partij en CAS-nummer, zuiverheid;
|
|
—
|
eigenschappen van de teststof (bv. log Kow, oplosbaarheid in water, dampspanning, Henry-constante (H) en informatie over het lot en gedrag).
|
|
|
|
Testorganismen:
|
—
|
gebruikte testdieren: soort, wetenschappelijke naam, bron van de organismen en kweekomstandigheden;
|
|
—
|
leeftijd, grootte- (massa-) bereik van de testorganismen.
|
|
|
|
Testomstandigheden:
|
—
|
gegevens over de voorbereiding van de testgrond;
|
|
—
|
het maximale waterhoudend vermogen van de grond;
|
|
—
|
een beschrijving van de techniek die is gebruik voor het aanbrengen van de teststof op de grond;
|
|
—
|
gedetailleerde gegevens over hulpstoffen gebruikt bij de toediening van de teststof;
|
|
—
|
gegevens over de kalibratie van het sproeiapparaat, indien van toepassing;
|
|
—
|
beschrijving van de testopzet en procedure;
|
|
—
|
grootte van testvaten en volume van de testgrond;
|
|
—
|
testomstandigheden: lichtintensiteit, duur van licht-donkercycli, temperatuur;
|
|
—
|
een beschrijving van het voedingsschema, het type en de hoeveelheid voedsel dat in de test is gebruikt, voedingsdatums;
|
|
—
|
de pH en het watergehalte van de grond aan het begin en het eind van de test;
|
|
|
|
Testresultaten:
|
—
|
de mortaliteit van de volwassen wormen ( %) in elk testvat aan het eind van de eerste 4 weken van de test;
|
|
—
|
de totale massa van de volwassen wormen aan het begin van de test in elk testvat;
|
|
—
|
veranderingen in lichaamsgewicht van de levende volwassen wormen ( % van het begingewicht) in elk testvat na de eerste vier weken van de test;
|
|
—
|
het aantal geproduceerde nakomelingen in elk testvat aan het eind van de test;
|
|
—
|
een beschrijving van zichtbare of pathologische symptomen of opvallende veranderingen in het gedrag;
|
|
—
|
de resultaten verkregen met de referentieteststof;
|
|
—
|
de LC50, de NOEC en/of ECx (bv. EC50, EC10) voor de voortplanting als een of meer hiervan van toepassing zijn, met betrouwbaarheidsintervallen en een grafiek van het gefitte model dat is gebruikt voor de berekening ervan, en alle informatie en waarnemingen die van nut zijn voor de interpretatie van de resultaten;
|
|
—
|
een grafiek van de dosis-responsrelatie;
|
|
—
|
de resultaten die voor elk testvat gelden;
|
|
Afwijkingen van de procedures beschreven in deze testmethode en alle ongebruikelijke voorvallen tijdens de test.
|
LITERATUUR
|
(1)
|
Jaenicke, J. (1982). „Eisenia foetida” is two biological species. Megadrilogica 4, 6-8.
|
|
(2)
|
Oien, N. & J. Stenerson (1984). Esterases of earthworm — III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Verplicht Biochem. Physiol. 78c (2), 277 — 282.
|
|
(3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei — comparison of two ringtests. In: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, blz. 50-82.
|
|
(4)
|
Hoofdstuk C.8 van deze bijlage, Acute toxiciteitstest voor regenwormen.
|
|
(5)
|
ISO (International Organization for Standardization) (1996). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(6)
|
ISO (International Organization for Standardization) (1993). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using artificial soil substrate, No. 11268-1. ISO, Geneve.
|
|
(7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S.C., Bembridge, J.D., Holmstrup, M., & L. Posthuma, (eds). SETAC Press, 456 blz.
|
|
(8)
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, April 1996.
|
|
(9)
|
Bouché, M.B. (1972). Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C.A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN, Commission of European Communities.
|
|
(11)
|
Greig-Smith, P.W., H. Becker, P.J. Edwards & F. Heimbach (eds.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C.A. & J. P. Bohlen, (1996). Biology and ecology of Earthworms, 3rd Edition. Chapman and Hall, London.
|
|
(13)
|
(ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
|
(14)
|
Hund-Rinke, K, Römbke, J., Riepert, F. & Achazi R. (2000): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(15)
|
ISO (International Organization for Standardization) (1992). Soil Quality –Determination of water retention characteristics –Laboratory methods, No. 11274. ISO, Geneve.
|
|
(16)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis — Gravimetric method, No. 11465. ISO, Geneve.
|
|
(17)
|
Römbke, J. & Th. Moser (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150+ 223 blz.
|
|
(18)
|
Finney, D. J. (1971). Probit Analysis (3rd ed.), blz. 19-76. Cambridge Univ. Press.
|
|
(19)
|
Finney, D. J. (1978). Statistical Method in Biological Assay. — Charles Griffin & Company Ltd, London.
|
|
(20)
|
Hamilton, M.A., R.C. Russo & R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correctie Environ. Sci. Technol. 12(1998), 417.
|
|
(21)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(22)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(23)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(24)
|
Dunnett, C.W., (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(25)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(26)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(27)
|
Jonckheere, A. R. (1954). A Distribution-free k-Sample Test Against Ordered Alternatives. Biometrika 41, 133-145.
|
|
(28)
|
Terpstra, T. J. (1952). The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking. Indagationes Math. 14, 327-333.
|
|
(29)
|
Shirley, E. A. (1979). The comparison of treatment to control group means in toxicology studies. Applied Statistics 28, 144-151.
|
|
(30)
|
Williams, D.A. (1986). A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control. Biometrics 42, 183-186.
|
|
(31)
|
Sokal, R.R. & F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(32)
|
Bruce R.D. and Versteeg D.J. (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485-1494
|
|
(33)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(34)
|
Van Ewijk, P.H. & J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Aanhangsel 1
Definities
Voor de toepassing van deze testmethode worden de volgende definities gehanteerd:
|
|
Stof betekent een substantie of mengsel.
|
|
|
ECx
(Effect concentration for x % effect) is de concentratie die binnen een bepaalde blootstellingstijd x % van een effect op testorganismen veroorzaakt ten opzichte van een controle. De EC50 is bijvoorbeeld de geschatte concentratie die gedurende een bepaalde blootstellingsperiode bij 50 % van een blootgestelde populatie een effect op een testeindpunt zal hebben. In deze test worden de effectconcentraties uitgedrukt als een massa van de teststof per droge massa van de testgrond of als een massa van de teststof per oppervlakte-eenheid van de grond.
|
|
|
LC0
(No lethal concentration) is de concentratie van een teststof die binnen een bepaalde blootstellingstijd geen van de blootgestelde testorganismen doodt. In deze test wordt de LC0 uitgedrukt als een massa van de teststof per droge massa van de testgrond.
|
|
|
LC50
(Median lethal concentration) is de concentratie van een teststof die binnen een bepaalde blootstellingstijd 50 % van de blootgestelde testorganismen doodt. In deze test wordt de LC50 uitgedrukt als een massa van de teststof per droge massa van de testgrond of als een massa van de teststof per oppervlakte-eenheid van de grond.
|
|
|
LC100
(Totally lethal concentration) is de concentratie van een teststof die binnen een bepaalde blootstellingstijd 100 % van de blootgestelde testorganismen doodt. In deze test wordt de LC100 uitgedrukt als een massa van de teststof per droge massa van de testgrond.
|
|
|
LOEC (Lowest Observed Effect Concentration) is de laagste concentratie van een teststof die tot een statistisch significant effect (p < 0,05) leidt. In deze test wordt de LOEC uitgedrukt als een massa van de teststof per droge massa van de testgrond of als een massa van de teststof per oppervlakte-eenheid van de grond. Alle geteste concentraties boven de LOEC moeten gewoonlijk een effect laten zien dat statistisch afwijkt van de controle. Alle afwijkingen van het bovenstaande moeten in het testverslag worden verantwoord.
|
|
|
NOEC (No Observed Effect Concentration) is de hoogste concentratie van de teststof direct onder de LOEC waarbij geen effect wordt waargenomen. In deze test heeft de concentratie die overeenkomt met de NOEC geen statistisch significant effect (p < 0,05) binnen een bepaalde blootstellingsperiode in vergelijking met de controle.
|
|
|
Voortplantingssnelheid Is het gemiddelde aantal jonge wormen op een bepaald aantal volwassen wormen dat gedurende de testperiode wordt geproduceerd.
|
|
|
Teststof betekent alle volgens deze testmethode geteste stoffen en mengsels.
|
Aanhangsel 2
Bepaling van het maximale waterhoudend vermogen van de grond
De volgende methode voor de bepaling van het maximale waterhoudend vermogen van de grond is geschikt bevonden. Zij is beschreven in bijlage C van ISO DIS 11268-2 (1).
Verzamel met een geschikt bemonsteringsapparaat (grondboorbuis enz.) een vastgestelde hoeveelheid van het testgrondsubstraat (bv. 5 g). Bedek de onderkant van de buis met een stuk filterpapier, vul een waterbad en plaats de buis op een rek in het bad. De buis zou geleidelijk onder water moeten komen te staan, tot het water de bovenkant van de grond bereikt. Laat de buis gedurende ongeveer drie uur in het water. Niet alle water dat door de bodemcapillairen wordt geabsorbeerd, kan worden vastgehouden. Laat het grondmonster daarom gedurende twee uur uitlekken door de buis op een bed van zeer nat fijngemalen kwartszand in een afgesloten vat te plaatsen (om droging te voorkomen). Het monster moet vervolgens worden gewogen, gedroogd tot een constante massa bij 105 °C. Het waterhoudend vermogen (WHV) kan vervolgens als volgt worden berekend:

waarbij:
|
S
|
=
|
met water verzadigd substraat + massa van buis + massa van filterpapier
|
|
T
|
=
|
leeggewicht (massa van buis + massa van filterpapier)
|
|
D
|
=
|
droge massa van substraat
|
LITERATUUR:
|
(1)
|
ISO International Organization for Standardization (Internationale Organisatie voor Normalisatie) (1996). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
Aanhangsel 3
Bepaling van de pH van de grond
De volgende methode voor het bepalen van de pH van een grondmonster is gebaseerd op de beschrijving in ISO DIS 10390: Bodemkwaliteit — Bepaling van de pH-waarde (1).
Een vastgestelde hoeveelheid grond wordt gedurende ten minste 12 uur bij kamertemperatuur gedroogd. Vervolgens wordt een suspensie van de grond (die ten minste 5 g grond bevat) gemaakt in vijf keer zijn volume van hetzij een 1 M-oplossing van analytisch zuiver kaliumchloride (KCl) of een 0,01 M-oplossing van analytisch zuiver calciumchloride (CaCl2). De suspensie wordt daarna vijf minuten goed geschud. Na het schudden krijgt de suspensie ten minste 2 uur, maar niet langer dan 24 uur, gelegenheid om te bezinken. Daarna wordt de pH van de vloeibare fase gemeten met een pH-meter die vóór elke meting is geijkt met een passende reeks bufferoplossingen (bv. pH 4,0 en 7,0).
LITERATUUR:
|
(1)
|
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
Aanhangsel 4
Kweken van Eisenia fetida/Eisenia andrei
De kweek dient bij voorkeur plaats te vinden in een klimaatkamer bij 20 °C ± 2 °C. Bij deze temperatuur en bij voldoende voedselverstrekking zijn de wormen na ongeveer 2 tot 3 maanden volwassen.
Beide soorten kunnen worden gekweekt in een grote diversiteit aan dierlijke afvalstoffen. Het aanbevolen kweekmedium is een 50:50-mengsel van paarden- of koeienmest en turf. Er moeten controles plaatsvinden om te waarborgen dat koeien of paarden waarvan mest wordt verkregen, geen medicijnen gebruiken en niet worden behandeld met een chemische stof, zoals groeibevorderaars, nematiciden of soortgelijke diergeneesmiddelen die tijdens de test een negatief effect op de wormen zouden kunnen hebben. Het wordt aangeraden om zelfverzamelde mest van „biologische” oorsprong te gebruiken, want de ervaring leert dat commercieel verkrijgbare mest die als meststof in tuinen wordt gebruikt, negatieve effecten op de wormen kan hebben. Het medium moet een pH-waarde van ongeveer 6 tot 7 hebben (gereguleerd met calciumcarbonaat), moet een lage ionische geleidbaarheid hebben (minder dan 6 mS/cm of 0,5 % zoutconcentratie) en mag niet overmatig verontreinigd zijn met ammoniak of dierlijke urine. Het substraat dient vochtig maar niet te nat te zijn. Kweekbakken met een inhoud van 10 tot 50 liter zijn geschikt.
Om wormen met een standaardleeftijd en -grootte (-massa) te verkrijgen, kan de cultuur het beste worden begonnen met cocons. Wanneer de cultuur eenmaal is opgezet, wordt deze in stand gehouden door volwassen wormen gedurende 14 tot 28 dagen in een kweekbak met vers substraat te plaatsen om ze de gelegenheid te geven meer cocons te produceren. De volwassen wormen worden daarna verwijderd, en de jonge wormen die uit de cocons zijn gekomen, worden als basis voor de volgende cultuur gebruikt. De wormen worden voortdurend gevoed met dierlijke afvalstoffen en van tijd tot tijd overgeplaatst op vers substraat. De ervaring leert dat aan de lucht gedroogde, fijngemalen koeien- of paardenmest of havervlokken geschikte voedselbronnen zijn. Er moet worden gecontroleerd dat koeien of paarden waarvan mest wordt verkregen, geen medicijnen gebruiken en niet worden behandeld met een chemische stof, zoals groeibevorderaars, die tijdens een langlopende kweek een negatief effect op de wormen zouden kunnen hebben. De uit de cocons gekomen wormen worden voor de tests gebruikt wanneer ze 2 tot 12 maanden oud zijn en als volwassen worden beschouwd.
Wormen kunnen als gezond worden beschouwd als ze zich door het substraat voortbewegen, niet proberen om het substraat te verlaten en zich voortdurend voortplanten. Het substraat is uitgeput wanneer de wormen zich zeer traag voortbewegen en een geel achtereind hebben. In dat geval wordt aanbevolen vers substraat te verstrekken en/of het aantal dieren per bak te verlagen.
Aanhangsel 5
Technieken voor het tellen van uit cocons gekomen jonge wormen
Het is heel tijdrovend om wormen uit het grondsubstraat met de hand te sorteren. Daarom worden twee alternatieve methoden aanbevolen.
|
(a)
|
De testvaten worden in een waterbad geplaatst met een temperatuur van aanvankelijk 40 °C, maar oplopend tot 60 °C. Na ongeveer 20 minuten moeten de jonge wormen op het grondoppervlak verschijnen, waar ze gemakkelijk van kunnen worden verwijderd en geteld.
|
|
(b)
|
De testgrond kan door een zeef worden gewassen met de methode die is ontwikkeld door Van Gestel et al. (1), mits de aan de grond toegevoegde turf en mest of havervlokken tot een fijn poeder zijn vermalen. Twee zeven (diameter 30 cm) met een maaswijdte van 0,5 mm worden op elkaar geplaatst. De inhoud van een testvat wordt onder een krachtige straal kraanwater door de zeven gewassen, zodat de jonge wormen en cocons hoofdzakelijk in de bovenste zeef achterblijven. Het is belangrijk op te merken dat tijdens deze handeling het gehele oppervlak van de bovenste zeef nat moet worden gehouden, zodat de jonge wormen op een film van water drijven en niet door de openingen van de zeef kunnen kruipen. Het beste resultaat wordt verkregen wanneer een douchekop wordt gebruikt.
|
Wanneer het grondsubstraat geheel door de zeef is weggewassen, kunnen de jonge wormen en cocons uit de bovenste zeef in een kom worden gespoeld. De inhoud van de kom krijgt daarna gelegenheid te rusten, zodat de lege cocons op het wateroppervlak komen drijven en de volle cocons en jonge wormen naar de bodem zinken. Het staande water kan vervolgens worden afgegoten en de jonge wormen en cocons kunnen worden overgebracht in een petrischaal met daarin een klein beetje water. De wormen kunnen met een naald of een pincet worden verwijderd om ze te tellen.
De ervaring leert dat methode (a) geschikter is voor de extractie van jonge wormen die mogelijk zelfs door een zeef met een maaswijdte van 0,5 mm worden weggewassen.
De efficiëntie van de gebruikte methode om de wormen (en cocons, in voorkomend geval) uit het grondsubstraat te verwijderen moet altijd worden bepaald. Als jonge wormen worden verzameld door ze handmatig te sorteren, is het raadzaam om de handeling op alle monsters twee keer uit te voeren.
LITERATUUR:
|
(1)
|
Van Gestel, C.A.M., W.A. van Dis, E.M. van Breemen, P.M. Sparenburg (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367-371.
|
Aanhangsel 6
Overzicht van de statistische beoordeling van gegevens (NOEC-bepaling)

C.34. BEPALING VAN DE REMMING VAN DE ACTIVITEIT VAN ANAEROBE BACTERIËN — VERLAGING VAN DE GASPRODUCTIE UIT ANAEROOB GISTEND (RIOOL)SLIB
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan TG 224 (2007) van de OESO. Stoffen die in het aquatisch milieu worden geloosd, passeren zowel aerobe als anaerobe zones, waar ze kunnen worden afgebroken en/of de bacteriële activiteit kunnen remmen; in sommige gevallen kunnen ze ongestoord decennia lang, of nog langer, in anaerobe zones aanwezig blijven. De eerste fase in afvalwaterbehandeling, primaire bezinking, is aeroob in de bovenstaande vloeistof en anaeroob in het onderstaande slib. Dit wordt in de tweede fase gevolgd door een aerobe zone in de beluchtingstank met actief slib en een anaerobe zone in het onderstaande slib in de secundaire bezinkingsvijver. Slib uit deze beide fasen wordt gewoonlijk onderworpen aan een anaerobe behandeling, waarbij methaan en koolstofdioxide worden geproduceerd, die doorgaans worden gebruikt voor de opwekking van elektriciteit. In de grotere omgeving zullen stoffen die sedimenten in baaien, estuaria en de zee bereiken, waarschijnlijk voor onbepaalde tijd in deze anaerobe zones aanwezig blijven als ze niet biologisch afbreekbaar zijn. Grotere hoeveelheden van sommige stoffen zullen bij voorkeur in deze zones terechtkomen, vanwege hun fysische eigenschappen, zoals geringe oplosbaarheid in water, hoge adsorptie aan gesuspendeerde vaste stoffen, alsook onvermogen om op aerobe wijze biologisch te worden afgebroken.
|
|
2.
|
Hoewel het wenselijk is dat stoffen die in het milieu worden geloosd, biologisch afbreekbaar zijn onder zowel aerobe als anaerobe omstandigheden, is het essentieel dat deze stoffen de activiteit van micro-organismen in deze zones niet remmen. In het Verenigd Koninkrijk hebben zich enkele gevallen voorgedaan van volledige remming van de methaanproductie door bijvoorbeeld de aanwezigheid van pentachloorfenol in industriële lozingen, waardoor hoge kosten moesten worden gemaakt om geremd slib van de gistingstanks naar 'veilige' locaties te vervoeren en gezond gistend slib van nabije installaties aan te voeren. Er zijn echter ook veel gevallen geweest van minder ernstige verstoring van de gisting door diverse andere stoffen, waaronder alifatische halokoolwaterstoffen (stomerijen) en detergenten, waardoor de efficiëntie van gistingstanks aanzienlijk werd geschaad.
|
|
3.
|
Slechts één testmethode, C.11 (1), betreffende de remming van de bacteriële activiteit (ademhaling van actief slib), beoordeelt het effect van teststoffen op het zuurstofverbruik bij aanwezigheid van substraat. Deze methode wordt op grote schaal gebruikt om een vroege waarschuwing voor mogelijk schadelijke effecten van stoffen op de aerobe behandeling van afvalwater af te geven en om niet-remmende concentraties van teststoffen aan te wijzen die in de verschillende tests voor de biologische afbreekbaarheid moeten worden gebruikt. Testmethode C.43 (2) maakt het beperkt mogelijk de toxiciteit van een teststof op de gasproductie door anaeroob slib dat tot een tiende van de normale concentratie vaste stoffen is verdund, te bepalen om het percentage biologische afbraak met de vereiste nauwkeurigheid te kunnen beoordelen. Omdat verdund slib gevoeliger kan zijn voor remmende stoffen, heeft de ISO-groep besloten een methode vast te stellen waarin onverdund slib wordt gebruikt. Er zijn ten minste drie teksten bestudeerd (uit Denemarken, Duitsland en het Verenigd Koninkrijk) en uiteindelijk zijn twee ISO-normen opgesteld, een waarin onverdund slib wordt gebruikt, ISO 13 641-1 (3), en een andere waarin tot een honderdste verdund slib wordt gebruikt, ISO 13 641-2 (4), om modders en sedimenten met weinig bacteriepopulaties te representeren. Beide methoden zijn onderworpen aan een ringtest (5); van deel 1 werd bevestigd dat het een aanvaardbare standaard is, maar er was verschil van mening over deel 2. Het Verenigd Koninkrijk was van mening dat de methode nader moet worden onderzocht, omdat een belangrijk deel van de deelnemers heel weinig of geen gasproductie meldde, ten dele doordat het percentage gasruimte (75 %) te hoog was voor een optimale gevoeligheid.
|
|
4.
|
In eerder werk in het Verenigd Koninkrijk (6)(7) werd een manometrische methode beschreven die gebruikmaakte van onverdund gistend slib, plus niet-behandeld rioolslib als substraat, in kolven van 500 ml; de opstelling was lastig om mee te werken en de stank van het niet-behandelde slib was uiterst onaangenaam. Nadien is de compactere en handigere opstelling van Shelton en Tiedje (8) als ontwikkeld door Battersby en Wilson (9) met succes toegepast door Wilson et al. (10). Kawahara et al. (11) hebben in het laboratorium met succes meer standaardslibben bereid om te gebruiken in tests voor de anaerobe biologische afbreekbaarheid en remming van een aantal stoffen. Ook werd niet-behandeld slib als substraat vervangen om een test uit te voeren hetzij door tot een honderdste verdund anaeroob slib of door modders, sedimenten enz. met geringe bacteriële activiteit.
|
|
5.
|
Deze methode kan informatie verschaffen die nuttig is om het waarschijnlijke effect van een teststof op de gasproductie in anaerobe gistingstanks te voorspellen. Alleen langere tests waarin werkende gistingstanks nauwkeuriger worden gesimuleerd, kunnen echter aangeven of de micro-organismen zich aan de teststof kunnen aanpassen of dat stoffen die waarschijnlijk worden geabsorbeerd en geadsorbeerd aan slib, zich in de loop van een langere periode dan de duur van de test kunnen ophopen tot een concentratie die een toxisch effect heeft.
|
PRINCIPE VAN DE TEST
|
6.
|
Porties van een mengsel van anaeroob gistend slib (20 g/l tot 40 g/l totaal aan vaste stoffen) en een afbreekbare substraatoplossing worden, apart en gelijktijdig met een reeks van concentraties van de teststof, gedurende maximaal 3 dagen geïncubeerd in afgesloten vaten. De hoeveelheid geproduceerd gas (methaan plus koolstofdioxide) wordt gemeten door de toename van de druk (Pa) in de flessen. Het remmingspercentage van de gasproductie door de verschillende concentraties van de teststof wordt berekend op basis van de geproduceerde hoeveelheden in de respectievelijke test- en controleflessen. De EC50 en andere effectieve concentraties worden berekend uit grafieken van het remmingspercentage als functie van de concentratie van de teststof of, gebruikelijker, de logaritme ervan.
|
INFORMATIE OVER DE TESTSTOF
|
7.
|
Teststoffen moeten doorgaans worden gebruikt in de zuiverste vorm die gemakkelijk verkrijgbaar is, omdat onzuiverheden in sommige stoffen, bv. chloorfenolen, veel toxischer kunnen zijn dan de teststof zelf. Er moet echter rekening worden gehouden met de noodzaak om teststoffen te testen in de vorm waarin zij worden geproduceerd/commercieel verkrijgbaar zijn. Het gebruik van geformuleerde producten wordt in de regel niet aanbevolen, maar bij slecht oplosbare teststoffen kan het gebruik van geformuleerd materiaal aangewezen zijn. Eigenschappen van de teststof die beschikbaar moeten zijn, zijn de oplosbaarheid in water en enkele organische oplosmiddelen, de dampspanning, adsorptiecoëfficiënt, hydrolyse en biologische afbreekbaarheid onder anaerobe omstandigheden.
|
TOEPASBAARHEID VAN DE METHODE
|
8.
|
De test kan worden gebruikt zowel voor stoffen die oplosbaar zijn in water als voor stoffen die onoplosbaar zijn in water, met inbegrip van vluchtige stoffen. Bijzondere zorgvuldigheid is vereist bij materialen met een lage oplosbaarheid in water (zie ref. (12)) of een hoge vluchtigheid. Entmateriaal van andere anaerobe locaties, bv. modders, verzadigde bodems, sedimenten, mag eveneens worden gebruikt. Anaerobe bacteriële systemen die eerder zijn blootgesteld aan toxische stoffen, kunnen zijn geconditioneerd om hun activiteit in aanwezigheid van xenobiotische stoffen te behouden. Entmateriaal van geconditioneerde bacteriële systemen kunnen een hogere tolerantie voor de teststoffen vertonen dan entmateriaal verkregen van niet-geconditioneerde systemen.
|
REFERENTIESTOFFEN
|
9.
|
Om de procedure te controleren, wordt een referentiestof getest door passende vaten op te zetten en op te nemen in de normale testreeksen; 3,5-dichloorfenol heeft bewezen een consistente remmer van anaerobe gasproductie te zijn, alsook van het zuurstofverbruik door actief slib en andere biochemische reacties. Van twee andere stoffen is aangetoond dat ze de methaanproductie meer remmen dan 3,5-dichloorfenol, namelijk, methyleen-bis-thiocyanaat en pentachloorfenol, maar de resultaten met deze stoffen zijn niet gevalideerd. Pentachloorfenol wordt niet aanbevolen, omdat het niet gemakkelijk in zuivere vorm verkrijgbaar is.
|
REPRODUCEERBAARHEID VAN DE RESULTATEN
|
10.
|
In een internationale ringtest (5) was slechts sprake van een redelijke reproduceerbaarheid in de EC50-waarden tussen de 10 deelnemende laboratoria voor 3,5-dichloorfenol en 2-broomethaansulfonzuur. (Het bereik voor eerstgenoemde stof was 32 mg/l tot 502 mg/l en dat voor laatstgenoemde stof 220-2 190 mg/l.)
|
Aantal laboratoria
|
In mg/l
|
In mg/g slib
|
|
gemiddelde
|
s.d.
|
cv (%)
|
gemiddelde
|
s.d.
|
cv (%)
|
|
|
3,5-Dichloorfenol
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
2-Broomethaansulfonzuur
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
EC50-gegevens van ringtest — onverdund slib
|
11.
|
De hoge variatiecoëfficiënten (cv) tussen de laboratoria weerspiegelen grotendeels verschillen in de gevoeligheid van de micro-organismen in het slib als gevolg van wel of geen eerdere blootstelling aan de teststof of daaraan chemisch verwante andere stoffen. De nauwkeurigheid waarmee de EC50-waarde op basis van de slibconcentratie werd bepaald, was nauwelijks beter dan de 'volumetrische' waarde (mg/l). De drie laboratoria die de nauwkeurigheid van hun EC50-waarden voor 3,5-dichloorfenol rapporteerden, vertoonden veel lagere variatiecoëfficiënten (respectievelijk 22, 9 en 18 % voor EC50 mg/g) dan de gemiddelden van alle tien laboratoria. De afzonderlijke gemiddelden voor de drie laboratoria waren respectievelijk 3,1, 3,2 en 2,8 mg/g. De lagere, aanvaardbare variatiecoëfficiënten binnen de laboratoria in vergelijking met de veel hogere variatiecoëfficiënten tussen de laboratoriumwaarden, namelijk 9-22 % in vergelijking met 92 %, wijzen op significante verschillen in de eigenschappen van de afzonderlijke slibben.
|
BESCHRIJVING VAN DE METHODE
Apparatuur
|
12.
|
Vereist zijn een standaard-laboratoriumuitrusting en het volgende:
|
a)
|
Incubator — vonkvrij en gereguleerd bij 35 °C ± 2 °C;
|
|
b)
|
Drukbestendige glazen testvaten van een geschikte nominale grootte (17), elk voorzien van een gasdicht gecoat septum, bestand tegen ongeveer 2 bar of 2 × 105 Pa (gebruik voor de coating bv. PTFE = polytetrafluoretheen). Glazen serumflessen met een nominale inhoud van 125 ml, met een werkelijke inhoud van circa 160 ml, verzegeld met serumsepta (18) en aluminium krimpringen worden aanbevolen, maar ook flessen met een totale inhoud tussen 0,1 en 1 liter kunnen met succes worden gebruikt;
|
|
c)
|
Precisiedrukmeter
(19)
met naald
Totale gasproductie (methaan plus koolstofdioxide) gemeten door middel van een drukmeter die is aangepast om het meten en laten wegstromen van geproduceerd gas mogelijk te maken. Een voorbeeld van een geschikt instrument is een handheld precisiedrukmeter verbonden met een injectienaald; een gasdicht driewegventiel vergemakkelijkt het laten ontsnappen van overdruk (aanhangsel 1). De interne inhoud van de druktransductorslang en het ventiel moet zo laag mogelijk worden gehouden, zodat fouten die worden ingevoerd door het volume van de apparatuur, onbetekenend zijn;
|
|
d)
|
Geïsoleerde containers voor het transport van gistend slib;
|
|
f)
|
Zeef met een maasgrootte van 1 mm2;
|
|
g)
|
Reservoir voor gistend slib, een fles van glas of polyethyleen met een hoge dichtheid en met een inhoud van ongeveer 5 liter, voorzien van een roerder en voorzieningen voor het doorvoeren van een stroom stikstofgas door de gasruimte (zie punt 13);
|
|
h)
|
membraanfilters (0,2 μm) voor het steriliseren van het substraat;
|
|
i)
|
micro-injectiespuiten, voor de gasdichte verbinding van de druktransductor (zie punt 12(c)) met de gasruimte in de flessen (zie punt 12(b)); ook voor het toevoegen van onoplosbare vloeibare teststoffen aan de flessen;
|
|
j)
|
handschoenkast, facultatief, maar aanbevolen, met een licht positieve stikstofdruk.
|
|
Reagentia
|
13.
|
Er wordt steeds gebruikgemaakt van reagentia pro analysi. Er dient steeds stikstofgas van een hoge zuiverheid met een gehalte van minder dan 5μl/l zuurstof te worden gebruikt.
|
Water
|
14.
|
Gebruik gedeïoniseerd water dat vooraf ontlucht is, als op enig moment verdunning noodzakelijk is. Analytische controles van dit water zijn niet nodig, maar zie erop toe dat het deïoniseringsapparaat regelmatig wordt onderhouden. Gebruik ook gedeïoniseerd water voor het bereiden van stamoplossingen. Zorg ervoor dat een oplossing of verdunning van teststof zuurstofvrij is, voordat er anaeroob entmateriaal aan wordt toegevoegd. Dit gebeurt door gedurende 1 uur voorafgaand aan de toevoeging van het entmateriaal stikstofgas door het verdunningswater (of door de verdunningen) te blazen, of door het verdunningswater tot het kookpunt te verwarmen en in een zuurstofvrije omgeving tot kamertemperatuur te laten afkoelen.
|
Uitgegist slib
|
15.
|
Verzamel actief gistend slib uit een gistingstank bij een waterzuiveringsinstallatie of uit een installatie op laboratoriumschaal, die slib van hoofdzakelijk huishoudelijk afvalwater behandelt. Praktische informatie over slib van een gistingstank op laboratoriumschaal is elders te vinden (11). Als het de bedoeling is om aangepast entmateriaal te gebruiken, kan gistend slib van een industriële waterzuiveringsinstallatie worden overwogen. Gebruik voor het verzamelen van slib flessen met een brede nek, gemaakt van polyethyleen met een hoge dichtheid of een vergelijkbaar materiaal, dat kan uitzetten. Vul de monsterflessen met slib tot ongeveer 1 cm onder de bovenrand van de flessen, sluit de flessen goed af, bij voorkeur met een veiligheidsafsluiter (punt 12(e)), en plaats ze in geïsoleerde containers (punt 12(d)) om de temperatuurschok zo klein mogelijk te maken, tot ze in een incubator met een temperatuur van 35 °C ± 2 °C worden geplaatst. Zorg ervoor dat bij het openen van de flessen de overtollige gasdruk wordt weggenomen, hetzij door de afsluiter voorzichtig los te maken of door middel van het driewegdrukventiel (punt 12(e)). Het heeft de voorkeur het slib binnen enkele uren na het verzamelen te gebruiken. Bewaar het slib anders maximaal 3 dagen, waarin gewoonlijk weinig verlies van activiteit optreedt, bij 35 °C ± 2 °C onder een gasruimte van stikstof.
Waarschuwing — Gistend slib produceert ontvlambare gassen die brand- en ontploffingsgevaar opleveren, en het bevat ook potentieel pathogene organismen. Neem dus passende voorzorgsmaatregelen bij het hanteren van slib. Gebruik om veiligheidsredenen géén glazen vaten voor het verzamelen van slib.
|
Entmateriaal
|
16.
|
Meng het slib onmiddellijk vóór het gebruik door het voorzichtig te roeren, en giet het daarna door een zeef met een maasgrootte van 1 mm2 (punt 12(f)) in een geschikte fles (punt 12(g)) door de gasruimte waarvan een stroom stikstof wordt geleid. Houd een monster apart om de concentratie totale droge vaste stoffen te meten (zie bv. ISO 11 923 (13) of gelijkwaardige EU-norm). Gebruik het slib in het algemeen zonder het te verdunnen. De concentratie vaste stoffen ligt gewoonlijk tussen 2 % en 4 % (massaconcentratie). Controleer de pH-waarde van het slib en pas deze, indien nodig, aan tot 7 ± 0,5.
|
Testsubstraat
|
17.
|
Los 10 g kweekbouillon (bv. Oxoid), 10 g gistextract en 10 g D-glucose op in gedeïoniseerd water en verdun tot 100 ml. Steriliseer door filtratie door een 0,2 μm membraanfilter (punt 12(h)) en gebruik onmiddellijk of bewaar niet langer dan 1 dag bij 4 °C.
|
Teststof
|
18.
|
Bereid een aparte stamoplossing voor elke in water oplosbare teststof met bijvoorbeeld 10 g/l van de stof in zuurstofvrij verdunningswater (punt 14). Gebruik passende hoeveelheden van deze stamoplossingen om de reactiemengsels met daarin verschillende concentraties te bereiden. Als alternatief kan een oplossingenreeks van elke stamoplossing worden gemaakt zodat het aan de testflessen toegevoegde volume voor elke vereiste uiteindelijke concentratie hetzelfde is. De pH-waarde van de stamoplossingen moet, indien nodig, worden aangepast tot 7 ± 0,2.
|
|
19.
|
Raadpleeg ISO 10 634 (12) of een gelijkwaardige EU-norm voor teststoffen die onvoldoende in water oplosbaar zijn. Vermijd, als een organisch oplosmiddel moet worden gebruikt, oplosmiddelen zoals chloroform en koolstoftetrachloride, waarvan bekend is dat ze de methaanproductie sterk remmen. Bereid een oplossing van een passende concentratie van de niet in water oplosbare stof in een geschikt vluchtig oplosmiddel, bijvoorbeeld aceton of diethylether. Voeg de vereiste hoeveelheden oplosmiddeloplossing toe aan de lege testflessen (punt 12(b)) en laat het oplosmiddel verdampen voordat slib wordt toegevoegd. Gebruik voor andere behandelingen ISO 10 634 (12) of een gelijkwaardige EU-norm, maar wees ervan bewust dat eventuele oppervlakte-actieve stoffen die worden gebruikt voor de productie van emulsies, de anaerobe gasproductie kunnen remmen. Als wordt gedacht dat de aanwezigheid van organische oplosmiddelen en emulgeermiddelen artefacten veroorzaakt, kan de teststof direct als poeder of als vloeistof aan het testmengsel worden toegevoegd. Vluchtige stoffen en niet in water oplosbare vloeibare teststoffen kunnen met mirco-injectiespuiten in de flessen met geënt serum worden geïnjecteerd (punt 12(i)).
|
|
20.
|
Voeg teststoffen aan de flessen toe zodat een meetkundige reeks concentraties wordt verkregen, bijvoorbeeld 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l en 15,6 mg/l. Voer eerst een voorafgaande bereikbepalingstest uit met de concentraties 1 000 mg/l, 100 mg/l en 10 mg/l om het juiste bereik vast te stellen, als het toxiciteitsbereik niet bekend is van soortgelijke stoffen.
|
Referentiestof
|
21.
|
Bereid een waterige oplossing van 3,5-dichloorfenol (10 g/l) door langzaam, onder voortdurend schudden, een zo klein mogelijke hoeveelheid van een 5 mol/l natriumhydroxide-oplossing aan de vaste stof toe te voegen, tot de stof is opgelost. Voeg vervolgens het gedeoxygeneerd oplossingswater toe (punt 14) tot het vereiste volume; ultrasoonbehandeling kan de oplossing bevorderen. Er mogen andere referentiestoffen worden gebruikt wanneer het gemiddelde bereik van de EC50 is verkregen in ten minste drie tests met verschillende entmaterialen (afkomstig van verschillende bronnen of verzameld op verschillende tijdstippen).
|
INTERFERENTIE/FOUTEN
|
22.
|
Sommige bestanddelen van slib zouden, naar verluidt, kunnen reageren met potentiële remmers zodat ze niet meer beschikbaar zijn voor micro-organismen en dus een geringere, of geen, remming geven. Ook als het slib al een remmende stof bevat, zouden foute resultaten worden verkregen wanneer die stof aan de test zou worden onderworpen. Afgezien van deze mogelijkheden, zijn er diverse geïdentificeerde factoren die tot foute resultaten kunnen leiden. Deze zijn opgenomen in aanhangsel 3, tezamen met methoden om fouten te elimineren of tenminste te beperken.
|
TESTPROCEDURE
|
23.
|
Het benodigde aantal replicaten hangt af van de mate van precisie die voor de remmingsindices vereist is. Zet voor elke vereiste concentratie slechts één batch (ten minste in drievoud) testflessen op als de afsluiters van de flessen gedurende de gehele test voldoende gasdicht zijn. Zet evenzo slechts één batch flessen met de referentiestof en één set controles op. Zet echter een batch (bv. in drievoud) testflessen op voor elk interval (t) waarvoor resultaten voor alle concentraties van een te testen teststof vereist zijn, als de afsluiters van de flessen slechts betrouwbaar zijn zolang ze slechts één keer of enkele keren worden doorstoken. Zet evenzo 't' batches van flessen op voor de referentiestof en voor de controles.
|
|
24.
|
Het gebruik van een handschoenkast (punt 12(j)) wordt aanbevolen. Laat gedurende ten minste 30 minuten voor aanvang van de test een stroom stikstofgas door de handschoenkast met daarin alle benodigde apparatuur stromen. Zorg ervoor dat de temperatuur van het slib tijdens het hanteren en afsluiten van de flessen 35 °C ± 2 °C is.
|
Inleidende test
|
25.
|
Als de activiteit van het slib onbekend is, wordt aanbevolen een inleidende test uit te voeren. Zet controles op om bijvoorbeeld concentraties van vaste stoffen van 10 g/l, 20 g/l en 40 g/l plus substraat, maar geen teststof te verkrijgen. Gebruik ook verschillende volumes reactiemengsel om drie of vier verhoudingen tussen volume van de gasruimte en volume van de vloeistof te verkrijgen. Bepaal op basis van de resultaten van de gasvolumes die op verschillende tijdstippen zijn geproduceerd, de voorwaarden die het meest geschikt zijn om twee dagelijkse metingen te kunnen doen die aanzienlijke volumes gas opleveren, en verlaging van de druk per dag bij optimale gevoeligheid (20) zonder angst voor ontploffingen.
|
Toevoeging van teststoffen
|
26.
|
Voeg aan de lege testflessen (punt 12(b)) in water oplosbare teststoffen toe als waterige oplossingen (punt 18). Gebruik voor elk concentratiebereik sets van flessen, ten minste in drievoud (punt 20). Injecteer, in geval van een onoplosbare of slecht oplosbare teststof, oplossingen daarvan in organische oplosmiddelen met behulp van een micro-injectiespuit in lege flessen om sets van replicaten van alle vijf de concentraties van de teststof te verkrijgen. Verdamp het oplosmiddel door een straal stikstofgas over het oppervlak van de oplossingen in de testflessen te laten stromen. Als alternatief kunnen ook onoplosbare vaste stoffen als gewogen hoeveelheden van de vaste stof direct aan de testflessen worden toegevoegd.
|
|
27.
|
Als onoplosbare en slecht in water oplosbare teststoffen niet met behulp van een oplosmiddel worden toegevoegd, voeg ze dan met een micro-injectiespuit direct aan de testflessen toe na de toevoeging van entmateriaal en testsubstraat (zie punt 30). Vluchtige teststoffen kunnen op dezelfde wijze worden toegevoegd.
|
Toevoeging van entmateriaal en substraat
|
28.
|
Roer een geschikte hoeveelheid gezeefd gistend slib (zie punt 16) in een 5-literfles (punt 12(g)), terwijl een stroom stikstofgas door de gasruimte stroomt. Spoel de testflessen, met daarin waterige oplossingen of verdampte oplosmiddeloplossingen van teststoffen, gedurende ongeveer twee minuten met een stroom stikstofgas om lucht te verwijderen. Breng met behulp van een pipet met grote punt of een maatcilinder porties van bv. 100 ml van het goed gemengde slib in de testflessen. Het is van essentieel belang de pipet in één keer te vullen tot precies het vereiste volume slib, omdat vaste slibdeeltjes gemakkelijk kunnen bezinken. Als meer slib nodig is, leeg de pipet dan en begin opnieuw.
|
|
29.
|
Voeg vervolgens voldoende substraatoplossing toe (punt 17) om een concentratie van 2 g/l van elk van de voedingsbouillon, het gistextract en de D-glucose in het mengsel te verkrijgen, terwijl de stikstof nog steeds doorstroomt. Hieronder ziet u een voorbeeld voor testbatches:
|
Uiteindelijke massaconcentratie van de teststof in testflessen
(mg/l)
|
Volume van de teststof
(ml)
|
Reagentia en media
(ml)
|
|
Voorraadoplossing a)10 g/lpunt 18
|
Voorraadoplossing b)1 g/lpunt 18
|
Verdunningswater
punt 14
|
Entmateriaal
punt 16
|
Substraat
punt 17
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Totaal volume van fles = 160 ml. Volume van vloeistof = 103 ml.
Volume van gas = 57 ml, of 35,6 % van het totale volume.
|
|
|
30.
|
Spoel op dezelfde wijze ook voldoende lege testflessen met stikstofgas uit voor eventuele vluchtige en onoplosbare vloeibare teststoffen (zie punt 27).
|
Controles en referentiestof
|
31.
|
Zet sets van flessen op, ten minste in drievoud, met daarin enkel slib en substraat, om als controles te dienen. Zet voorts replicaatflessen op met daarin slib en substraat plus voldoende stamoplossing van de referentiestof, 3,5-dichloorfenol (punt 21), om een uiteindelijke concentratie van 150 mg/l te verkrijgen. Deze concentratie moet de gasproductie met ongeveer 50 % remmen. Zet, als alternatief, een reeks concentraties van de referentiestof op. Zet voor pH-metingen bovendien vier extra flessen op met daarin slib, gedeoxygeneerd water en substraat. Voeg de teststof toe aan twee flessen in de hoogste concentratie die wordt getest, en voeg gedeoxygeneerd water toe aan de andere twee flessen.
|
|
32.
|
Zorg ervoor dat alle flessen — teststof, referentiestoffen en controles — hetzelfde volume (VR) aan vloeistof bevatten; voeg, waar nodig, gedeoxygeneerd, gedeïoniseerd water toe (punt 14) om het juiste volume te verkrijgen. De gasruimte dient tussen de 10 % en 40 % van het volume van de fles in te nemen, waarbij de werkelijke waarde wordt geselecteerd uit de gegevens die uit de inleidende test zijn verkregen. Verwijder, wanneer alle bestanddelen aan de flessen zijn toegevoegd, de naald waardoor het gas werd aangevoerd, en sluit elke fles af met een rubber stop en een aluminium dop (punt 12(b)). Bevochtig de stop daarbij eerst met een druppel gedeïoniseerd water, zodat hij gemakkelijker in te brengen is. Meng de inhoud van elke fles door te schudden.
|
Incubatie van flessen
|
33.
|
Breng de flessen over naar de thermostatisch gereguleerde incubator, die bij voorkeur is uitgerust met een schudapparaat en op een temperatuur van 35 °C ± 2 °C wordt gehouden. De flessen worden in het donker geïncubeerd. Maak de druk in de flessen na ongeveer 1 uur gelijk aan de omgevingsdruk door de injectienaald die is verbonden met de drukmeter (punt 12(c)), door de afsluiters van de verschillende flessen te steken, open het ventiel tot de drukmeter op nul staat, en sluit tot slot het ventiel. De naald dient onder een hoek van ongeveer 45° te worden ingebracht om weglekken van gas uit de flessen te voorkomen. Als de flessen worden geïncubeerd in een incubator zonder schudapparaat, schud de flessen dan gedurende de gehele incubatieperiode twee keer per dag met de hand om het systeem in evenwicht te brengen. Incubeer de flessen en draai ze om om verlies van gas door het septum te voorkomen. Omkering is echter ongeschikt in gevallen waarin onoplosbare teststoffen zich aan de bodem van de fles kunnen hechten.
|
Drukmeting
|
34.
|
Meet en noteer de pH van de inhoud van twee van de vier flessen die voor dit doel zijn opgezet, wanneer de flessen een temperatuur van 35 °C ± 2 °C hebben bereikt, en gooi de inhoud vervolgens weg; zet de incubatie van de overige flessen in het donker voort. Meet en noteer in de volgende 48 tot 72 uur twee keer per dag de druk in de flessen door de naald van de drukmeter door de afsluiters van de verschillende flessen te steken en de naald tussen de metingen te drogen. Houd tijdens de meting, die zo snel mogelijk moet worden uitgevoerd, alle delen van de fles op de incubatietemperatuur. Laat de stand van de drukmeter stabiliseren en noteer het resultaat. Open vervolgens het ventiel voor ventilatie en sluit het wanneer de drukmeter 0 aangeeft. Zet de test voort, gewoonlijk gedurende 48 uur vanaf het moment waarop de druk voor het eerst in evenwicht is gebracht, aangeduid als 'tijdstip 0'. Het aantal aflezingen en ventilaties moet voor vluchtige stoffen worden beperkt tot één (aan het eind van de incubatie) of twee om het verlies van de teststof tot een minimum te beperken (10).
|
|
35.
|
Open het ventiel niet als de meter een negatieve druk aangeeft. Soms hoopt zich vocht in de injectienaald en slangen op, wat blijkt uit een kleine negatieve stand van de drukmeter. Verwijder in dit geval de naald, schud aan de slang, droog af met een tissue en plaats een nieuwe naald.
|
pH-meting
|
36.
|
Meet en noteer de pH van de inhoud van elke fles na de laatste drukmeting.
|
GEGEVENS EN RAPPORTAGE
Uitdrukking van de resultaten
|
37.
|
Bereken de som en het gemiddelde van de genoteerde drukken op elk tijdstip voor elke set replicaatflessen en bereken de gemiddelde cumulatieve bruto gasdruk op elk tijdstip voor elke set replicaten. Teken voor de controle-, test- en referentieflessen curves van de gemiddelde cumulatieve gasproductie (Pa) als functie van de tijd. Selecteer een tijdstip op het lineaire gedeelte van de curve, doorgaans 48 uur, en bereken het remmingspercentage (I) voor elke concentratie volgens de volgende formule [1]:
|
I = (1 – Pt/PC) × 100
|
[1],
|
waarin:
|
I
|
=
|
remmingspercentage, in %;
|
|
Pt
|
=
|
de met testmateriaal geproduceerde gasdruk op de geselecteerde tijd, in Pascal (Pa);
|
|
Pc
|
=
|
de in de controle geproduceerde gasdruk op dezelfde tijd, in Pascal (Pa).
|
Het is raadzaam beide grafieken te tekenen, d.w.z. de grafiek van I als functie van de concentratie en ook de grafiek van I als functie van de logaritme van de concentratie, zodat de curve kan worden gekozen die een lineair verband het dichtst benadert. Bepaal de EC50-waarde (mg/l) visueel of door regressieanalyse op basis van de meest lineaire curve. Voor vergelijkende doeleinden kan het nuttiger zijn om de concentratie van de stof uit te drukken in mg stof/g totale droge vaste stoffen. Deel, om deze concentratie te verkrijgen, de volumetrische concentratie (mg/l) door de volumetrische concentratie van de droge vaste stoffen in het slib (g/l) (punt 16).
|
|
38.
|
Bereken hetzij het remmingspercentage dat is bereikt door de ene concentratie van de gebruikte referentiestof, of de EC50, als voldoende concentraties zijn onderzocht.
|
|
39.
|
Gebruik de kalibratiecurve van de drukmeter (aanhangsel 2) om de gemiddelde druk van het geproduceerde gas in de controle Pc (Pa) te converteren naar het volume en bereken hieruit de gasopbrengst, uitgedrukt als het volume dat in 48 uur wordt geproduceerd uit 100 ml onverdund slib bij een concentratie van 2 % (20 g/l) tot 4 % (40 g/l) vaste stoffen.
|
Geldigheidscriteria
|
40.
|
Uit de resultaten van de ISO-interlaboratoriumproef (5) is gebleken dat de referentiestof (3,5-dichloorfenol) 50 % remming van de gasproductie in een concentratiebereik van 32 mg/l tot 510 mg/l (gemiddeld 153 mg/l) veroorzaakt (punt 10). Dit bereik is zo breed dat geen betrouwbare, harde grenzen voor de remming als geldigheidscriteria kunnen worden vastgesteld; dit zou wel mogelijk moeten zijn wanneer uit ontwikkelingen is gebleken hoe consistentere entmaterialen kunnen worden geproduceerd. De volumes gas die in 48 uur in de controleflessen werden geproduceerd, varieerden van 21 ml/g slib (droge stof) tot 149 ml/g (gemiddeld 72 ml/g). Er werd geen duidelijk verband gevonden tussen het volume van het geproduceerde gas en de bijbehorende EC50-waarde. De uiteindelijke pH varieerde tussen 6,1 en 7,5.
|
|
41.
|
De test wordt als geldig beschouwd wanneer een remming van meer dan 20 % is verkregen in de referentiecontrole met 150 mg/l 3,5-dichloorfenol, meer dan 50 ml gas per g droge stof is geproduceerd in de blanco controle en de pH-waarde aan het eind van de test tussen 6,2 en 7,5 ligt.
|
Testverslag
|
42.
|
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Teststof
|
—
|
de triviale naam, de chemische naam, het CAS-nummer, de structuurformule en relevante fysisch-chemische eigenschappen;
|
|
—
|
de zuiverheid (verontreinigingen) van de teststof.
|
|
|
|
Testomstandigheden
|
—
|
volumes van vloeibare inhoud en van de gasruimte in de testvaten;
|
|
—
|
beschrijvingen van de testvaten en gasmeting (bv. type drukmeter);
|
|
—
|
de manier waarop de teststof en de referentiestof aan het testsysteem zijn toegevoegd, de gebruikte testconcentraties en het gebruik van oplosmiddelen;
|
|
—
|
gedetailleerde gegevens over het gebruikte entmateriaal: naam van de waterzuiveringsinstallatie, beschrijving van de oorsprong van het behandelde afvalwater (bv. werktemperatuur, slibretentietijd, hoofdzakelijk huishoudelijk afvalwater of industrieel afvalwater, enz.), concentratie van vaste stoffen, gasproductieactiviteit van anaerobe gistingstank, eerdere blootstelling of mogelijke voorafgaande conditionering aan toxische stoffen of plaats van verzamelen van modder, sediment, enz.;
|
|
—
|
incubatietemperatuur en bereik;
|
|
|
|
Resultaten
|
—
|
pH-waarden aan het eind van de test;
|
|
—
|
alle gemeten gegevens die in de test-, blanco- en referentiestofcontrolevaten zijn verzameld, als passend (bv. druk in Pa of millibar) in tabelvorm;
|
|
—
|
remmingspercentage in test- en referentieflessen, en remming-concentratiecurven;
|
|
—
|
berekening van EC50-waarden, uitgedrukt in mg/l en mg/g;
|
|
—
|
gasproductie per g slib in 48 uur;
|
|
—
|
eventuele redenen om de testresultaten te verwerpen;
|
|
—
|
bespreking van de resultaten, met inbegrip van afwijkingen van de procedures in deze testmethode en bespreking van eventuele afwijkingen in de testresultaten als gevolg van interferenties en fouten ten opzichte van wat werd verwacht;
|
|
—
|
tevens bespreking of de test ten doel had het toxisch effect op eerder blootgestelde of op niet eerder blootgestelde micro-organismen te meten.
|
|
|
LITERATUUR
|
(1)
|
Hoofdstuk C.11 van deze bijlage: Actief slib: remming ademhaling.
|
|
(2)
|
Hoofdstuk C.43 van deze bijlage: Anaerobe biologische afbreekbaarheid van organische bestanddelen in uitgegist slib: methode door meting van de gasproductie.
|
|
(3)
|
International Organisation for Standardisation (2003) ISO 13 641-1 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 1: General Test.
|
|
(4)
|
International Organisation for Standardisation (2003) ISO 13 641-2 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 2: Test for low biomass concentrations.
|
|
(5)
|
ISO (2000) Ring test of ISO 13 641-1 and ISO 13 641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
(6)
|
Swanwick JD, Foulkes M (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Control Fed. Control, 70, 58-70.
|
|
(7)
|
HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, In: Methods for the Examination of Waters and Associated Materials UK.
|
|
(8)
|
Shelton DR, Tiedje JM (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47 850-857.
|
|
(9)
|
Battersby NS & Wilson V (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441-2460.
|
|
(10)
|
Wilson V, Painter HA & Battersby NS (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Germany (1990). Eds. Steinberg C & Kettrup A, blz. 117-132 (1992).
|
|
(11)
|
Kawahara K, Yakabe Y, Chida T & Kida K (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007-2018.
|
|
(12)
|
International Organization for Standardization (1995) ISO 10 634 Water Quality — Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(13)
|
International Organization for Standardization (1997) ISO 11 923 Water Quality — Determination of suspended solids by filtration through glass-fibre filters.
|
Aanhangsel 1
Voorbeeld van een apparaat om de biogasproductie te meten door de gasdruk
Legenda:
|
1
|
—
|
Drukmeter
|
|
2
|
—
|
Gasdicht driewegventiel
|
|
3
|
—
|
Injectienaald
|
|
4
|
—
|
Gasdichte afsluiter (krimpsluiting en septum)
|
|
5
|
—
|
Gasruimte
|
|
6
|
—
|
Uitgegist slibentmateriaal
|
Testvaten in een omgeving van 35 °C ± 2 °C
Aanhangsel 2
Conversie van de drukmeter
De standen van de drukmeter kunnen door middel van een standaardcurve worden gerelateerd aan gasvolumes en hieruit kan het geproduceerde volume gas per g droog slib per 48 uur worden berekend. Deze activiteitsindex wordt gebruikt als een van de criteria op basis waarvan de geldigheid van de testresultaten wordt beoordeeld. De kalibratiecurve wordt opgesteld door bekende volumes gas bij 35 °C ± 2 °C te injecteren in serumflessen met daarin een volume aan water gelijk aan dat van het reactiemengsel, VR;
|
—
|
Breng porties van VR ml water, bewaard bij 35 °C ± 2 °C, in vijf serumflessen. Sluit de flessen af en plaats ze gedurende 1 uur in een waterbad bij 35 °C ± 2 °C om een evenwichtstoestand te bereiken;
|
|
—
|
Zet de drukmeter aan, laat deze stabiliseren en stel hem in op nul;
|
|
—
|
Steek de injectienaald door de afsluiter van een van de flessen, open het ventiel tot de drukmeter nul aangeeft, en sluit het ventiel;
|
|
—
|
Herhaal deze procedure voor de overige flessen;
|
|
—
|
Injecteer in elke fles 1 ml lucht van 35 °C ± 2 °C. Steek de naald (op de meter) door de afsluiter van een van de flessen en wacht tot de stand van de drukmeter is gestabiliseerd; Noteer de druk, open het ventiel tot de drukmeter nul aangeeft, en sluit het ventiel;
|
|
—
|
Herhaal deze procedure voor de overige flessen;
|
|
—
|
Herhaal de totale procedure met 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml en 50 ml lucht;
|
|
—
|
Teken een conversiecurve van de druk (Pa) als functie van het geïnjecteerde gasvolume (ml). De respons van het instrument is lineair in het bereik van 0 Pa tot 70 000 Pa, en van 0 ml tot 50 ml gasproductie.
|
Aanhangsel 3
Geïdentificeerde factoren die tot foute resultaten kunnen leiden
(a) Kwaliteit van de flesdoppen
Er zijn verschillende typen septa voor de serumflessen commercieel verkrijgbaar; vele daarvan, waaronder septa van butylrubber, verliezen hun gasdichtheid wanneer ze onder de omstandigheden van deze test met een injectienaald worden doorstoken. Soms daalt de druk heel langzaam wanneer het septum met een injectienaald is doorstoken. Het gebruik van gasdichte septa wordt aanbevolen om lekken tegen te gaan (punt 12(b)).
(b) Vocht in de injectienaald
Soms hoopt zich vocht in de injectienaald en slang op, wat blijkt uit een kleine negatieve stand van de drukmeter. Verwijder, om dit recht te zetten, de naald, schud aan de slang, droog af met een tissue en plaats een nieuwe naald (punten 12(c) en 35).
(c) Vervuiling door zuurstof
Anaerobe methoden zijn gevoelig voor fouten als gevolg van verontreiniging door zuurstof, die tot een lagere gasproductie kan leiden. In deze methode moet deze mogelijkheid tot een minimum worden beperkt door het gebruik van strikt anaerobe technieken, met inbegrip van het gebruik van een handschoenkast.
(d) Grove substraten in slib
De anaerobe gasproductie en de gevoeligheid van het slib worden beïnvloed door substraten die met het entmateriaal naar de testflessen worden overgebracht. Uitgegist slib van huishoudelijke anaerobe gistingstanks bevat vaak nog herkenbare zaken zoals haar en plantenresten van cellulose, die het doorgaans moeilijk maken om representatieve monsters te nemen. De grove onoplosbare materie in het slib kan worden verwijderd door het slib te zeven, waarna monsters vaker representatief zullen zijn (punt 16).
(e) Vluchtige teststoffen
Vluchtige teststoffen zullen vrijkomen in de gasruimte van de testflessen. Dit kan ertoe leiden dat tijdens de ventilatie na de drukmetingen een deel van de teststof uit het systeem verdwijnt, wat onjuiste hoge EC50-waarden oplevert. Door een geschikte keuze van de verhouding tussen het volume van de gasruimte en het vloeistofvolume en door niet te ventileren na de drukmetingen, kan de fout worden beperkt (10).
(f) Niet-lineariteit van gasproductie
Als de grafiek van de gemiddelde cumulatieve gasproductie als functie van de incubatieperiode over 48 uur niet bij benadering lineair is, kan de nauwkeurigheid van de test afnemen. Om dit tegen te gaan, kan het raadzaam zijn gistend slib van een andere bron te gebruiken en/of een hogere concentratie van de testsubstraat-voedingsbouillon, gistextract en glucose toe te voegen (punt 29).
Aanhangsel 4
Toepassing op milieumonsters met een lage concentratie biomassa — anaerobe modders, sedimenten, enz.
INLEIDING
A.1 In het algemeen is de specifieke microbiële activiteit (volume van geproduceerd gas per g droge vaste stoffen) van van nature voorkomende anaerobe modders, sedimenten, bodems, enz. veel lager dan die van anaeroob slib afkomstig van afvalwater. Daarom moeten enkele van de experimentele omstandigheden worden aangepast wanneer de remmende effecten van deze minder actieve monsters moeten worden gemeten. Voor deze minder actieve monsters zijn twee algemene handelswijzen mogelijk:
|
(a)
|
Voer een aangepaste inleidende test uit (punt 25) met het onverdunde monster modder, bodem, enz. bij 35 °C ± 2 °C of bij de temperatuur van de plaats waar het monster is genomen, voor een nauwkeurigere simulatie (als in deel 1 van ISO 13 641);
|
|
(b)
|
Of voer de test uit met verdund (1 op 100) slib uit een gistingstank om de lage activiteit te simuleren die van het milieumonster wordt verwacht, maar houd de temperatuur op 35 °C ± 2 °C (als in deel 2 van ISO 13 641).
|
A.2 Optie (a) kan worden verwezenlijkt door de methode te volgen die hier wordt beschreven (gelijk aan deel 1 van ISO 13 641), maar het is noodzakelijk een inleidende test (punt 25) uit te voeren om optimale omstandigheden te waarborgen, tenzij deze al bekend zijn uit eerdere tests. Het modder- of sedimentmonster moet grondig worden gemengd, bv. in een blender, en, indien nodig, worden verdund met een kleine portie ontlucht, verdunningswater (punt 14), zodat het voldoende mobiel is om door een pipet met grove punt of een maatcilinder te worden overgebracht. Als wordt gedacht dat er mogelijk een tekort aan voedingsstoffen is, kan het moddermonster worden gecentrifugeerd (onder anaerobe omstandigheden) en opnieuw worden gesuspendeerd in het minerale medium met gistextract (A.11).
A.3 Optie (b). Dit bootst de lage activiteit van milieumonsters redelijk na, maar heeft niet de hoge concentratie gesuspendeerde vaste stoffen van deze monsters. Het is niet bekend welke rol deze vaste stoffen spelen in de remming, maar de reactie tussen de teststoffen en bestanddelen van de modder, alsook de adsorptie van de teststoffen aan de vaste stoffen zouden tot een lager toxisch effect van de teststof kunnen leiden.
A.4 Temperatuur is een andere belangrijke factor: voor een strikte simulatie moeten tests worden uitgevoerd bij de temperatuur van de plaats waar het monster is genomen, omdat bekend is dat verschillende groepen methaanproducerende consortia van bacteriën binnen verschillende temperatuurbereiken werkzaam zijn, namelijk thermofielen (~30-35 °C), mesofielen (20-25 °C) en psychrofielen (< 20 °C), die verschillende remmingspatronen kunnen vertonen.
A.5 Duur. In de algemene test, deel 1, met onverdund slib, was de gasproductie in de 2 tot 4 dagen altijd voldoende, terwijl in deel 2 met tot een honderdste verdund slib in deze periode in de ringtest onvoldoende gas, of helemaal geen gas, werd geproduceerd. Madsen et al. (1996) zeggen in hun beschrijving van laatstgenoemde test dat minstens 7 dagen de tijd moet worden genomen.
Testen met lage concentratie biomassa (Optie b)
De volgende wijzigingen en aanpassingen moeten worden aangebracht, waarbij enkele bestaande punten en alinea's van de hoofdtekst worden aangevuld of vervangen.
A.6 Toevoegen aan punt 6: Principe van de test;
„Deze techniek mag worden gebruikt met 1:100-verdund anaeroob slib, gedeeltelijk om de lage activiteit van modders en sediment te simuleren. De incubatietemperatuur kan 35 °C zijn of die van de plaats waar het monster werd verzameld. Omdat de bacteriële activiteit veel lager is dan in onverdund slib, moet de incubatietijd worden verlengd tot ten minste 7 dagen.”
A.7 Toevoegen aan punt 12 (a):
„de incubator moet kunnen werken bij lage temperaturen tot 15 °C.”
A.8 Toevoegen van een extra reagens na punt 13:
„Fosforzuur (H3PO4), 85 % in massa in water.”
A.9 Toevoegen aan het eind van punt 16:
„Gebruik in de test een definitieve concentratie van 0,20 ± 0,05 g/l totale droge vaste stoffen.”
A.10 Punt 17. Testsubstraat
Dit substraat mag niet worden gebruikt, maar wordt vervangen door gistextract (zie de punten 17; A.11, A.12, A.13).
A.11 Een mineraal medium, met inbegrip van sporenelementen, voor het verdunnen van anaeroob slib is vereist, en voor het gemak wordt aan dit medium het organisch substraat, gistextract, toegevoegd.
Toevoegen na punt 17.
|
„(a)
|
Mineraal testmedium, met gistextract.
|
Dit wordt bereid uit een tien keer geconcentreerd testmedium (punt 17 (b); A.12) met een sporenelementenoplossing (punt 17 (c); A.13). Gebruik vers geleverd natriumsulfidenonahydraat (punt 17 (b); A.12) of was en droog het voor gebruik, om te waarborgen dat het voldoende reductiecapaciteit heeft. Als de test wordt uitgevoerd zonder gebruikmaking van een handschoenkast (punt 12 (j)), moet de concentratie natriumsulfide in de stamoplossing worden verhoogd tot 2 g/l (van 1 g/l). Natriumsulfide kan ook worden toegevoegd uit een geschikte stamoplossing door het septum van de gesloten testflessen, omdat deze procedure het risico van oxidatie verkleint, om een uiteindelijke concentratie van 0,2 g/l te verkrijgen. Als alternatief mag titanium(III)citraat (punt 17 (b)) worden gebruikt. Voeg het door het septum van de gesloten testflessen toe om een concentratie van 0,8 mmol/l tot 1,0 mmol/l te verkrijgen. Titanium(III)citraat is een zeer effectief, laagtoxisch reductiemiddel, dat als volgt wordt bereid: Los 2,94 g trinatriumcitraatdihydraat op in 50 ml zuurstofvrij verdunningswater (punt 14) (wat resulteert in een 200 mmol/l-oplossing) en voeg 5 ml titanium(III)chloride-oplossing (15 g/100 ml verdunningswater) toe. Neutraliseer tot een pH van 7 ± 0,5 met natriumcarbonaat en breng over in een geschikte serumfles onder een stroom stikstofgas. De concentratie van het titanium(III)citraat in deze stamoplossing is 164 mmol/l. Gebruik het testmedium onmiddellijk of bewaar het niet langer dan 1 dag bij 4 °C.
|
A.12
|
(b)
|
Tienmaal geconcentreerd testmedium, bereid met:
|
watervrij kaliumdiwaterstoffosfaat (KH2PO4)
|
2,7 g
|
|
Dinatriumwaterstoffosfaat (Na2HPO4)
|
4,4 g
|
|
(of 11,2 g dodecahydraat)
ammoniumchloride (NH4Cl)
|
5,3 g
|
|
calciumchloridedihydraat (CaCl2 · 2H2O)
|
0,75 g
|
|
magnesiumchloridehexahydraat (MgCl2 · 6H2O)
|
1,0 g
|
|
ijzer(II)chloridetetrahydraat (FeCl2 · 4H2O)
|
0,2 g
|
|
resazurine (redoxindicator)
|
0,01 g
|
|
natriumsulfidenonahydraat (Na2S · 9H2O)
|
1,0 g
|
|
(of titanium(III)citraat) uiteindelijke concentratie
|
0,8 mmol/l tot 1,0 mmol/l
|
|
sporenelementenoplossing (zie punt 17 (c); A.13)
|
10,0 ml
|
|
gistextract
|
100 g
|
|
In verdunningswater oplossen (punt 14) en aanvullen tot:
|
1 000 ml
|
|
|
A.13
|
(c)
|
Sporenelementenoplossing, bereid met:
|
mangaan(II)chloridetetrahydraat (MnCl2 · 4H2O)
|
0,5 g
|
|
orthoboorzuur (H3BO3)
|
0,05 g
|
|
zinkchloride (ZnCl2)
|
0,05 g
|
|
koper(II)chloride (CuCl2)
|
0,03 g
|
|
natriummolybdaatdihydraat (Na2MoO4 · 2H2O)
|
0,01 g
|
|
kobalt(II)chloridehexahydraat (CoCl2 · 6H2O)
|
1,0 g
|
|
nikkel(II)chloridehexahydraat (NiCl2 · 6H2O)
|
0,1 g
|
|
dinatriumseleniet (Na2SeO3)
|
0,05 g
|
|
In verdunningswater oplossen (punt 14) en aanvullen tot:
|
1 000 ml”
|
|
A.14 Punt 25: Inleidende test
Het is van essentieel belang dat een inleidende test wordt uitgevoerd als beschreven in punt 24, behalve dat de concentratie van de vaste stoffen in het slib een honderdste moet zijn van de opgegeven concentraties, d.w.z. 0,1 g/l, 0,2 g/l en 0,4 g/l. De incubatietijd moet ten minste 7 dagen zijn.
Noot: In de ringtest (5) was de gasruimte met 75 % totaalvolume veel te hoog; de gasruimte moet in het aanbevolen bereik van 10 %-40 % liggen. Het toepasselijke criterium is dat het volume van het geproduceerde gas bij circa 80 % remming met een acceptabele precisie (bv. ± 5 % tot ± 10 %) moet kunnen worden gemeten.
A.15 Punt 26 tot en met 30: Toevoeging van teststoffen, entmateriaal en substraat
De toevoegingen vinden plaats op dezelfde wijze als beschreven in deze punten, maar de substraatoplossing (punt 17) wordt vervangen door het testmedium plus gistextractsubstraat (A.11).
Ook wordt de uiteindelijke concentratie van de droge vaste stoffen in het slib verlaagd van 2 g/l — 4 g/l naar 0,2 ± 0,05 g/l (A.9). In tabel A.1, die de tabel in punt 29 vervangt, worden twee voorbeelden van de toevoeging van bestanddelen aan het testmengsel gegeven.
A.16 Punt 33: Incubatie van flessen
De incubatietijd is ten minste 7 dagen, vanwege de verwachte lagere gasproductie.
A.17 Punt 34: Drukmetingen
Voor het meten van de druk in de gasruimte van de flessen wordt dezelfde procedure gebruikt als beschreven in punt 34, als de hoeveelheden in de gasvormige fase vereist zijn. Als de totale hoeveelheden CO2 plus CH4 moeten worden gemeten, wordt de pH van de vloeibare fase verlaagd tot circa pH 2 door injectie van H3PO4 in elk van de relevante flessen en meting van de druk na 30 minuten schudden bij de testtemperatuur. Meer informatie over de kwaliteit van het entmateriaal kan echter worden verkregen door de druk in elke fles vóór en na aanzuring te meten. Wanneer het tempo van de CO2-productie bijvoorbeeld veel hoger is dan dat van methaan, kan de gevoeligheid van de fermentatieve bacteriën zijn gewijzigd en/of worden vooral methaanbacteriën beïnvloed door de teststof.
A.18 Punt 36: pH-meting
Als H3PO4 wordt gebruikt, moeten speciaal voor de pH-meting enkele extra flessen worden opgezet waaraan geen H3PO4 wordt toegevoegd.
REFERENTIE:
Madsen, T, Rasmussen, HB & Nilsson, L (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No. 336, Water Quality Institute, Danish Environment Protection Agency, Copenhagen.
Tabel A.1
Voorbeelden van de testopzet voor testbatches
|
Bestanddelen reactiemengsel
|
Voorbeeld 1
|
Voorbeeld 2
|
Normale volgorde van de toevoegingen
|
|
Concentratie van bereid entmateriaal (g/l)
|
0,42
|
2,1
|
—
|
|
Volume van toegevoegd entmateriaal (ml)
|
45
|
9
|
4
|
|
Concentratie van entmateriaal in testflessen (g/l)
|
0,20
|
0,20
|
—
|
|
Volume van toegevoegd testmedium (ml)
|
9
|
9
|
2
|
|
Volume van toegevoegd verdunningswater (ml)
|
36
|
72
|
3
|
|
Concentratie van gistextract in testflessen (g/l)
|
9,7
|
9,7
|
—
|
|
Volume van stamoplossing van de teststof (ml)
|
3
|
3
|
1
|
|
Totaal vloeibaar volume (ml)
|
93
|
93
|
—
|
Aanhangsel 5
Definities
Voor de toepassing van deze testmethode worden de volgende definities gehanteerd:
|
|
Stof betekent een substantie of mengsel.
|
|
|
Teststof: alle volgens deze testmethode geteste stoffen en mengsels.
|
C.35 TEST TER BEPALING VAN DE TOXICITEIT VOOR LUMBRICULUS IN SEDIMENTEN EN WATER M.B.V. VERRIJKT SEDIMENT
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan testrichtlijn (TG) 225 (2007) van de OESO. Sediment-opnemende endobenthische dieren zijn voorwerp van een potentieel hoge blootstelling aan sedimentgebonden stoffen en moeten daarom extra aandacht krijgen, bv. (1), (2), (3). Van deze sediment-opnemende dieren spelen de aquatische Oligochaetae een belangrijke rol in de sedimenten van aquatische systemen. Door bioturbatie van het sediment en doordat ze als prooi dienen, kunnen deze dieren een grote invloed hebben op de biologische beschikbaarheid van chemische stoffen voor andere organismen, bv. benthische vissen. In tegenstelling tot epibenthische organismen, graven endobenthische aquatische Oligochaetae (bv. Lumbriculus variegatus) zich in het sediment in en nemen zij onder het sedimentoppervlak sedimentdeeltjes op. Dit zorgt voor blootstelling van de testorganismen aan de teststof via alle mogelijk opnameroutes (bv. contact met en opname van verontreinigde sedimentdeeltjes, maar ook via poriënwater en bovenstaand water).
|
|
2.
|
Deze testmethode is bedoeld om de effecten van langdurige blootstelling van endobenthische Oligochaetae Lumbriculus variegatus (Müller) aan sedimentgerelateerde stoffen te bepalen. Zij is gebaseerd op bestaande protocollen voor toxiciteits- en bioaccumulatietests in sedimenten, bv. (3), (4), (5), (6), (7), (8), (9), (10). De methode is beschreven voor statische testomstandigheden. Bij het in deze testmethode gebruikte blootstellingsscenario wordt het sediment verrijkt met de teststof. Het gebruik van verrijkt sediment heeft ten doel een sediment te simuleren dat is verontreinigd met de teststof.
|
|
3.
|
De stoffen die moeten worden getest voor in het sediment levende organismen, zijn gewoonlijk gedurende lange tijd persistent in dit compartiment. De in het sediment levende organismen kunnen via een aantal routes worden blootgesteld. Het relatieve belang van elke blootstellingsroute, en de tijd die verstrijkt voordat elk van de routes bijdraagt aan de algehele toxische effecten, hangen af van de fysisch-chemische eigenschappen van de betrokken stof en zijn uiteindelijke lot in het dier. Voor sterk adsorberende stoffen (bijvoorbeeld met log Kow > 5) of voor stoffen die een covalente binding met het sediment aangaan, kan opname van besmet voedsel een belangrijke blootstellingsroute zijn. Om de toxiciteit van dergelijke stoffen niet te onderschatten, wordt het voedsel dat nodig is voor de voortplanting en groei van de testorganismen, vóór de aanbrenging van de teststof aan het sediment toegevoegd (11). De beschreven testmethode is voldoende gedetailleerd om de test te kunnen uitvoeren en ruimte te bieden voor aanpassingen in de proefopzet afhankelijk van de omstandigheden in bepaalde laboratoria en de verschillende kenmerken van teststoffen.
|
|
4.
|
De testmethode heeft ten doel de effecten van een teststof op de voortplanting en de biomassa van de testorganismen te bepalen. De gemeten biologische parameters zijn het totale aantal overlevende wormen en de biomassa (drooggewicht) aan het eind van de blootstelling. Deze gegevens worden geanalyseerd door hetzij met een regressiemodel een schatting te maken van de concentratie die zou leiden tot een afname van x % (bv. EC50, EC25 en EC10), hetzij statistische hypothesen te toetsen om de No Observed Effect Concentration (NOEC) en de Lowest Observed Effect Concentration (LOEC) te bepalen.
|
|
5.
|
Hoofdstuk C.27 van deze bijlage, „Test ter bepaling van de toxiciteit voor chironomiden in sedimenten en water m.b.v. verrijkt sediment” (6), verschaft veel essentiële en nuttige nadere gegevens met betrekking tot de uitvoering van de onderhavige testmethode ter bepaling van de toxiciteit in sedimenten. Dit document dient daarom als basis waarop noodzakelijke wijzigingen voor het uitvoeren van tests om met Lumbriculus variegatus de toxiciteit in sedimenten te bepalen werden uitgewerkt. Andere documenten waarnaar wordt verwezen, zijn bijvoorbeeld de ASTM-standaardrichtsnoer voor de bepaling van de bioaccumulatie van sedimentgerelateerde verontreinigende stoffen met bentische gewervelde dieren (3), de Amerikaanse EPA-methoden voor het meten van de toxiciteit en bioaccumulatie van sedimentgerelateerde verontreinigende stoffen met gewervelde zoetwaterdieren (7), en de ASTM-standaardrichtsnoer voor het verzamelen, bewaren, kenschetsen en hanteren van sedimenten voor toxicologische tests en voor de selectie van bemonsteringsapparaten voor het verzamelen van benthische gewervelde dieren (12). Daarnaast zijn praktische ervaring die is opgedaan tijdens de ringtest voor de testmethode ((13), rapport over de ringtest), en gedetailleerde gegevens uit de literatuur belangrijke informatiebronnen geweest voor het opstellen van het onderhavige document.
|
VEREISTE EN BEGELEIDENDE INFORMATIE
|
6.
|
Vóór het begin van de studie moet informatie over de teststof worden verzameld, zoals voorzorgsmaatregelen, passende opslagomstandigheden en de analysemethoden. Richtsnoeren voor het testen van stoffen met zodanige fysisch-chemische eigenschappen dat de uitvoering van de test problematisch is, zijn opgenomen in (14).
|
|
7.
|
Vóór de uitvoering van een test moet de volgende informatie over de teststof bekend zijn:
|
—
|
de triviale naam, chemische naam (bij voorkeur de IUPAC-naam), structuurformule, CAS-registratienummer, zuiverheid;
|
|
—
|
oplosbaarheid in water.
|
|
|
8.
|
De volgende aanvullende informatie wordt geacht van nut te zijn vóór aanvang van de test:
|
—
|
octanol/water-verdelingscoëfficiënt, Kow;
|
|
—
|
organisch koolstof/water-verdelingscoëfficiënt, uitgedrukt als Koc;
|
|
—
|
fototransformatie in water;
|
|
—
|
biologische afbreekbaarheid;
|
|
|
9.
|
Informatie over bepaalde kenmerken van het te gebruiken sediment moet worden verkregen vóór de start van de test (7). Zie de punten 22 tot en met 25 voor nadere gegevens.
|
PRINCIPE VAN DE TEST
|
10.
|
Wormen in een vergelijkbare fysiologische toestand (gesynchroniseerd als beschreven in aanhangsel 5) worden blootgesteld aan een reeks concentraties van een toxische stof aangebracht op de sedimentfase van een sediment/watersysteem. Kunstmatig sediment en synthetisch water moeten als media worden gebruikt. Testvaten zonder aangebrachte teststof dienen als controle. Het sediment wordt voor elk concentratieniveau in bulk met de teststof verrijkt om de variabiliteit tussen de replicaten van elk concentratieniveau tot een minimum te beperken. Daarna worden de testorganismen aan de testvaten met de gestabiliseerde sediment- en waterconcentraties toegevoegd (zie punt 29). De testdieren worden gedurende een periode van 28 dagen blootgesteld aan de sediment/watersystemen. Gezien het lage gehalte aan voedingsstoffen van het kunstmatige sediment, moet het sediment worden aangepast met een voedingsbron (zie de punten 22 en 23 en aanhangsel 4) om te waarborgen dat de wormen zich onder de controleomstandigheden zullen ontwikkelen en voortplanten. Op deze manier wordt gewaarborgd dat de testdieren via het water en het sediment alsook via hun voedsel worden blootgesteld.
|
|
11.
|
Het eindpunt van dit type studie is bij voorkeur de ECx (bv. EC50, EC25 en EC10; effectconcentratie waarbij bij x % van de testorganismen een effect optreedt) voor respectievelijk de voortplanting en biomassa, vergeleken met de controle. Gezien de hoge onzekerheid van een lage ECx (bv. EC10, EC25) met extreem hoge 95 %-betrouwbaarheidsgrenzen (bv. (15)) en het statistisch onderscheidingsvermogen berekend tijdens het toetsen van hypothesen, zij echter opgemerkt dat de EC50 als het meest robuuste eindpunt wordt beschouwd. Daarnaast kunnen de concentratie zonder waargenomen effecten (NOEC) en de laagste concentratie met waargenomen effecten (LOEC) worden bepaald voor de biomassa, en voor de voortplanting, als de testopzet en de gegevens deze berekeningen ondersteunen (zie de punten 34 tot en met 38). Het doel van de studie, afleiding van de ECx of NOEC, bepaalt de testopzet.
|
REFERENTIETEST
|
12.
|
Er wordt verwacht dat de prestaties van de controle-organismen voldoende aantonen in hoeverre een laboratorium in staat is om de test uit te voeren en, als er historische gegevens beschikbaar zijn, in hoeverre de test herhaalbaar is. Daarnaast kunnen met regelmatige tussenpozen referentietoxiciteitstests worden uitgevoerd met een toxische referentiestof om de gevoeligheid van de test-organismen te beoordelen. Referentietoxiciteitstests van 96 uur in uitsluitend water kunnen op bevredigende wijze de gevoeligheid en toestand van de testdieren aantonen (4)(7). Informatie over de toxiciteit van pentachloorfenol (PCP) in complete tests (28 dagen blootstelling aan verrijkt sediment) is opgenomen in aanhangsel 6 en in het rapport over de ringtest van de testmethode (13). De acute toxiciteit van PCP in uitsluitend water is bijvoorbeeld beschreven in (16). Deze informatie kan worden gebruikt om de gevoeligheid van testorganismen in referentietests met PCP als toxische referentiestof te vergelijken. Kaliumchloride (KCl) of kopersulfaat (CuSO4) zijn aanbevolen als toxische referentiestoffen voor L. variegatus (4)(7). Tot op heden is de vaststelling van kwaliteitscriteria op basis van toxiciteitsgegevens voor KCl moeilijk door het ontbreken van literatuurgegevens voor L. variegatus. Zie (17) tot en met (21) voor informatie over het toxisch effect van koper op L. variegatus.
|
GELDIGHEID VAN DE TEST
|
13.
|
Voor een geldige test moet aan de volgende eisen zijn voldaan:
|
—
|
Uit een ringtest (13) is gebleken dat, voor Lumbriculus variegatus, het gemiddelde aantal levende wormen per replicaat in de controles aan het eind van de blootstelling moet zijn toegenomen met ten minste een factor 1,8 ten opzichte van het aantal wormen per replicaat aan het begin van de blootstelling.
|
|
—
|
Het bovenstaande water moet gedurende de hele test een pH-waarde tussen 6 en 9 hebben.
|
|
—
|
Het zuurstofgehalte in het bovenstaande water moet tijdens de test ten minste 30 % van de verzadigingswaarde van lucht bij de testtemperatuur bedragen.
|
|
BESCHRIJVING VAN DE TESTMETHODE
Testsysteem
|
14.
|
Statische systemen zonder verversing van het bovenstaande water worden aanbevolen. Als de sediment/water-verhouding (zie punt 15) juist is, zal voorzichtige beluchting gewoonlijk volstaan om de waterkwaliteit voor de testorganismen op een aanvaardbaar niveau te houden (bv. maximalisatie van het gehalte opgeloste zuurstof, minilae ophoping van excretieproducten). Semistatische of doorstroomsystemen met periodieke of continue verversing van het bovenstaande water mogen alleen in uitzonderlijke gevallen worden gebruikt, omdat verwacht wordt dat regelmatige verversing van het bovenstaande water het chemische evenwicht zal aantasten (bv. verlies van teststof uit het testsysteem).
|
Testvaten en apparatuur
|
15.
|
De blootstelling moet plaatsvinden in bekerglazen met een inhoud van bv. 250 ml en een diameter van 6 cm. Ook andere glazen vaten mogen worden gebruikt, mits zij voldoende diep zijn voor het bovenstaande water en het sediment. Elk vat moet een laag van ongeveer 1,5-3 cm geformuleerd sediment krijgen. De verhouding tussen de dikte van de sedimentlaag en de diepte van het bovenliggende water moet 1:4 zijn. De vaten moeten een volume hebben dat geschikt is voor de densiteit, d.w.z. voor het aantal testwormen dat per gewichtseenheid sediment wordt toegevoegd (zie ook punt 39).
|
|
16.
|
Testvaten en andere apparatuur die in contact komen met de teststof, moeten volledig van glas of een ander chemisch inert materiaal zijn gemaakt. Voor alle onderdelen van de apparatuur moet het gebruik van materialen die teststoffen kunnen oplossen of absorberen of andere stoffen kunnen logen en die een schadelijk effect op de testdieren hebben, worden vermeden. Voor apparatuur die in contact komt met de testmedia, moet polytetrafluoroethyleen (PTFE), roestvrij staal en/of glas worden gebruikt. Voor organische stoffen waarvan bekend is dat zij aan glas adsorberen, kan het nodig zijn gesilaniseerd glas te gebruiken. In een dergelijk geval moet de apparatuur na gebruik worden verwijderd (geen hergebruik).
|
Diersoort
|
17.
|
De testdiersoort die in dit type studies wordt gebruikt, is zoetwater Oligochaeta Lumbriculus variegatus (Müller). Deze diersoort verdraagt een breed scala van sedimenttypen en wordt veel gebruikt in tests voor het bepalen van de toxiciteit en de bioaccumulatie in sediment (bv. (3), (5), (7), (9), (13), (15), (16), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34), (35)). De herkomst van de testdieren, de bevestiging van de identiteit van de soort (bv. (36)) en de kweekomstandigheden moeten in het verslag worden opgenomen. Er hoeft niet voorafgaand aan iedere test identificatie van de soort plaats te vinden als de organismen uit eigen kweek afkomstig zijn.
|
Kweken van de testorganismen
|
18.
|
Om voldoende wormen te hebben voor het uitvoeren van tests ter bepaling van de toxiciteit van sedimenten is het handig de wormen in een permanente laboratoriumcultuur te houden. Aanhangsel 5 bevat een richtsnoer voor methoden voor het kweken van Lumbriculus variegatus in een laboratorium, alsook bronnen van starterculturen. Zie de literatuur (3), (7) en (27) voor nadere informatie over het kweken van deze soort.
|
|
19.
|
Het wordt ten zeerste aanbevolen culturen van één enkele soort op te zetten, om te waarborgen dat de tests worden uitgevoerd met dieren van dezelfde soort. Zorg ervoor dat de culturen en in het bijzonder de wormen die in de tests gebruikt worden, vrij zijn van waarneembare ziekten en abnormaliteiten.
|
Water
|
20.
|
Als bovenstaand water in de tests wordt synthetisch water conform hoofdstuk C.1 van deze bijlage (37) aanbevolen; dit kan ook worden gebruikt voor de laboratoriumculturen van de wormen (zie aanhangsel 2 voor de bereiding). Indien nodig, kant natuurlijk water worden gebruikt. Het gekozen water moet van zodanige kwaliteit zijn dat de testsoort daarin gedurende de acclimatisatie en de looptijd van de test kan groeien en zich kan voortplanten zonder een abnormaal aspect of gedrag te gaan vertonen. Het is aangetoond dat Lumbriculus variegatus in dit type water kan overleven, groeien en zich voortplanten (30), en er wordt zo gezorgd voor maximale standaardisatie van de test- en kweekomstandigheden. Als synthetisch water wordt gebruikt, moet de samenstelling daarvan in het testverslag worden opgenomen, en het water moet vóór gebruik worden gekarakteriseerd met ten minste pH, zuurstofgehalte en hardheid (uitgedrukt in mg CaCO3/l). Analyse van het water op microverontreinigingen vóór gebruik kan in dit verband nuttige informatie opleveren (zie bv. aanhangsel 3).
|
|
21.
|
Het bovenstaande water moet een pH-waarde tussen 6,0 en 9,0 hebben (zie punt 13). Als een verhoogde ammoniakontwikkeling wordt verwacht, is het nuttig de pH tussen 6,0 en 8,0 te houden. Voor het testen van bv. zwak organische zuren is het raadzaam de pH aan te passen door het in de test te gebruiken water te bufferen als beschreven in bv. (16). De totale hardheid van het in de test te gebruiken water moet voor natuurlijk water tussen 90 en 300 mg CaCO3 per liter liggen. Aanhangsel 3 geeft een overzicht van aanvullende criteria voor aanvaardbaar verdunningswater overeenkomstig OESO-richtsnoer nr. 210 (38).
|
Sediment
|
22.
|
Aangezien niet-verontreinigde natuurlijke sedimenten uit een bepaalde bron mogelijk niet het hele jaar beschikbaar zijn en inheemse organismen alsook de aanwezigheid van microverontreinigingen de test kunnen beïnvloeden, moet bij voorkeur een geformuleerd sediment (ook gereconstituteerd, kunstmatig of synthetisch sediment genoemd) worden gebruikt. Gebruik van een geformuleerd sediment beperkt de variabiliteit van de testomstandigheden en de introductie van inheemse fauna tot een minimum. Het volgende geformuleerde sediment is gebaseerd op het kunstmatige sediment overeenkomstig (6), (39) en (40). Het wordt aanbevolen voor gebruik in dit type test ((6), (10), (30), (41), (42), (43)):
|
(a)
|
4-5 % (drooggewicht) veenmosturf; het is belangrijk turf in poedervorm te gebruiken, mate van decompositie: „medium”, fijngemalen (deeltjesgrootte ≤ 0,5 mm), en alleen aan de lucht gedroogd.
|
|
(b)
|
20 ± 1 % (drooggewicht) kaolienklei (met bij voorkeur meer dan 30 % kaoliniet);
|
|
(c)
|
75-76 % (drooggewicht) kwartszand (fijn zand; korrelgrootte: ≤ 2 mm, maar > 50 % van de deeltjes moet binnen het bereik 50-200 μm liggen).
|
|
(d)
|
Gedeïoniseerd water, 30-50 % van het sediment (drooggewicht), naast de droge sedimentbestanddelen.
|
|
(e)
|
Er wordt chemisch zuiver calciumcarbonaat (CaCO3) toegevoegd om de pH van het uiteindelijke sedimentmengsel aan te passen.
|
|
(f)
|
Het totale gehalte aan organische koolstof (TOC) van het uiteindelijke mengsel moet 2 % (± 0,5 %) van het drooggewicht van het sediment bedragen en moet worden aangepast door toevoeging van extra turf en zand overeenkomstig (a) en (c).
|
|
(g)
|
Voedingsstoffen, bv. poedervormige bladeren van de grote brandnetel (Urtica sp., in overeenstemming met farmaceutische normen, voor menselijke consumptie), of een mengsel van poedervormige bladeren van Urtica sp. en alfacellulose (1: 1), bij 0,4-0,5 % sediment (drooggewicht), naast de droge sedimentbestanddelen; zie aanhangsel 4 voor gedetailleerde gegevens.
|
|
|
23.
|
De bron van de turf, de kaolienklei, de voedingsstoffen en het zand moet bekend zijn. Behalve punt (g), noemt hoofdstuk C.27 van deze bijlage (6) andere plantmaterialen die als voedingsbron kunnen worden gebruikt: gedroogde bladeren van de witte moerbei (Morus alba), witte klaver (Trifolium repens), spinazie (Spinacia oleracea) of graan.
|
|
24.
|
De gekozen voedingsbron moet worden toegevoegd vóór of tijdens de verrijking van het sediment met de teststof. De gekozen voedingsbron moet ten minste acceptabele voortplantingsresultaten in de controles mogelijk maken. Analyse van het kunstmatige sediment of de bestanddelen ervan op microverontreinigingen vóór gebruik kan in dit verband nuttige informatie opleveren. In aanhangsel 4 wordt een voorbeeld gegeven van de bereiding van kunstmatig sediment. Menging van droge bestanddelen is ook aanvaardbaar, mits wordt aangetoond dat na toevoeging van het bovenstaande water geen scheiding van de bestanddelen van het sediment plaatsvindt (bv. drijvende turfdeeltjes) en dat de turf of het sediment voldoende geconditioneerd is (zie ook punt 25 en aanhangsel 4). Het kunstmatige sediment moet worden gekarakteriseerd met ten minste de oorsprong van de bestanddelen, de deeltjesgrootteverdeling (percentage zand, silt en klei), het totale gehalte aan organische koolstof (TOC), het watergehalte en de pH. Meting van het redoxpotentieel is facultatief.
|
|
25.
|
Indien nodig, bv. voor specifieke testdoeleinden, kunnen natuurlijke sedimenten van niet-verontreinigde terreinen ook als test- en/of kweeksediment dienen (3). Als echter natuurlijk sediment wordt gebruikt, moet dit worden gekarakteriseerd met ten minste de oorsprong (plaats van verzamelen), de pH en het ammoniakgehalte van het poriënwater, totaal gehalte aan organische koolstof (TOC) en gehalte aan stikstof, deeltjesgrootteverdeling (percentage zand, silt en klei) en procentueel watergehalte (7), en moet het vrij zijn van verontreinigingen en andere organismen die de testorganismen zouden kunnen beconcurreren of consumeren. Meting van het redoxpotentieel en het kationenuitwisselingsvermogen is facultatief. Ook wordt aanbevolen het natuurlijke sediment, voordat het wordt verrijkt met de teststof, zeven dagen te laten rusten onder dezelfde omstandigheden die ook in de test zullen heersen. Aan het eind van deze conditioneringsperiode moet het bovenstaande water worden verwijderd en weggegooid.
|
|
26.
|
Het te gebruiken sediment moet van zodanige kwaliteit zijn dat de controleorganismen daarin gedurende de blootstelling kunnen overleven en zich kunnen voortplanten zonder een abnormaal aspect of gedrag te gaan vertonen. De controlewormen moeten zich in het sediment ingraven en sediment opnemen. De voortplanting in de controles dient ten minste te voldoen aan het in punt 13 beschreven geldigheidscriterium. De aan- of afwezigheid van fecaal materiaal op het sedimentoppervlak, die duiden op opname van sediment door de wormen, moet worden genoteerd en kan nuttige informatie zijn voor de interpretatie van de testresultaten voor wat betreft de blootstellingsroutes. Aanvullende informatie over opname van sediment kan worden verkregen door de methoden te gebruiken als beschreven in (24), (25), (44) en (45), die sedimentopname of deeltjesselectie in de testorganismen specificeren.
|
|
27.
|
Manipulatieprocedures voor natuurlijke sedimenten vóór het gebruik ervan in het laboratorium zijn beschreven in (3), (7) en (12). In aanhangsel 4 wordt een beschrijving gegeven van de bereiding en bewaring van het kunstmatig sediment waarvan het gebruik in de Lumbriculus-test wordt aanbevolen.
|
Het aanbrengen van de teststof
|
28.
|
Het sediment moet worden verrijkt met de teststof. Omdat van de meeste teststoffen wordt verwacht dat ze slecht in water oplosbaar zijn, moeten ze worden opgelost in een zo klein mogelijk volume van een geschikt organisch oplosmiddel (bv. aceton, n-hexaan of cyclohexaan) om de stamoplossing te bereiden. De stamoplossing moet met hetzelfde oplosmiddel worden verdund om de testoplossingen te bereiden. De toxiciteit en vluchtigheid van het oplosmiddel alsmede de oplosbaarheid van de teststof in het gekozen oplosmiddel moeten de voornaamste criteria zijn op basis waarvan een geschikte solubilisator wordt gekozen. Voor elk concentratieniveau moet hetzelfde volume van de corresponderende oplossing worden gebruikt. Om de variabiliteit tussen replicaten van de teststofconcentratie tot een minimum te beperken, moet het sediment voor elk concentratieniveau in bulk worden verrijkt. Elk van deze testoplossingen wordt vervolgens gemengd met kwartszand als beschreven in punt 22 (bv. 10 g kwartszand per testvat). Een volume van 0,20 tot 0,25 ml per g zand is voldoende gebleken om het kwartszand volledig te doordrenken. Daarna moet het oplosmiddel worden verdampt tot het kwartszand droog is. Om verliezen van de teststof door gelijktijdige verdamping (bv. afhankelijk van de dampspanning van de stof) tot een minimum te beperken, moet het gecoate zand onmiddellijk na droging worden gebruikt. Vervolgens wordt het droge zand gemengd met een geschikte hoeveelheid geformuleerd sediment van het corresponderende concentratieniveau. Bij de bereiding van het sediment moet rekening worden gehouden met de hoeveelheid zand die in het mengsel van teststof en zand aanwezig is (het sediment wordt dus met minder zand bereid). Het grote voordeel van deze procedure is dat vrijwel geen oplosmiddel in het sediment terechtkomt (7). Als alternatief, bv. voor veldsediment, kan de teststof worden toegevoegd door een gedroogd en fijngemalen deel van het sediment te verrijken op de wijze zoals hierboven voor kwartszand is beschreven, of door de teststof door het vochtige sediment te roeren, met daarna verdamping indien een solubilisator is gebruikt. De aan het sediment toegevoegde teststof moet zorgvuldig en gelijkmatig over het sediment worden verdeeld. Zo nodig kunnen deelmonsters worden geanalyseerd om de doelconcentraties in het sediment te bevestigen en de homogeniteit te bepalen. Het kan ook nuttig zijn om deelmonsters van de testoplossingen te analyseren om de doelconcentraties in het sediment te bevestigen. Aangezien een oplosmiddel wordt gebruikt om de teststof op het kwartszand te coaten, moet een oplosmiddelcontrole worden ingezet die met dezelfde hoeveelheid oplosmiddel is bereid als de testsedimenten. De verrijkingsmethode en de redenen voor het kiezen van een specifieke verrijkingsprocedure anders dan de hierboven beschreven procedure moeten worden gerapporteerd. De verrijkingsmethode kan worden aangepast aan de fysisch-chemische eigenschappen van de teststof, bv. om verdampingsverliezen tijdens de verrijking of equilibratie te vermijden. Aanvullende richtsnoeren voor verrijkingsprocedures worden gegeven in Environment Canada (1995) (46).
|
|
29.
|
Nadat het verrijkte sediment is bereid, in de replicaattestvaten is gebracht en is overgoten met het testwater, is het wenselijk de teststof zich vanuit het sediment te laten verspreiden naar de waterfase (bv. (3)(7)(9)). Dit moet bij voorkeur gebeuren onder de in de test heersende temperatuur- en beluchtingsomstandigheden. De tijd die nodig is voor equilibratie, hangt af van het sediment en de stoffen en kan variëren van enkele uren tot verscheidene dagen en soms zelfs weken (4-5 weken) (bv. (27)(47)). In deze test wordt niet gewacht tot een evenwicht is ontstaan, maar wordt een equilibratieperiode van 48 uur tot 7 dagen aanbevolen. De tijd voor afbraak van de teststof wordt dus tot een minimum beperkt. Afhankelijk van het doel van de studie, bijvoorbeeld wanneer milieuomstandigheden moeten worden nagebootst, kan het verrijkte sediment gedurende een langere periode geëquilibreerd of „gerijpt” worden.
|
|
30.
|
Aan het eind van deze nadere equilibratieperiode worden in het bovenstaande water en het bulksediment, bij ten minste de hoogste en een lagere concentratie, monsters genomen om de concentratie van de teststof te bepalen. Op basis van deze analysen van de teststof zou de massabalans moeten kunnen worden berekend en zouden de resultaten als gemeten beginconcentraties moeten kunnen worden uitgedrukt. In het algemeen verstoort of vernietigt monstername het sediment/watersysteem. Het is daardoor doorgaans niet mogelijk om dezelfde replicaten te gebruiken voor monstername van sediment en wormen. Er moeten extra „analytische” vaten van geschikte grootte worden opgezet die op dezelfde wijze worden behandeld (inclusief toevoeging van testorganismen), maar niet voor biologische waarnemingen worden gebruikt. De grootte van de vaten moet zo worden gekozen dat monsters van de door de analytische methode vereiste omvang kunnen worden genomen. Gedetailleerde informatie over de monstername is beschreven in punt 53.
|
UITVOERING VAN DE TEST
Inleidende test
|
31.
|
Als er geen informatie beschikbaar is over het toxisch effect van de teststof op Lumbriculus variegatus, kan het nuttig zijn een inleidend experiment uit te voeren om het bereik van concentraties te bepalen dat in de definitieve test moet worden getest, en om de testomstandigheden van de definitieve test te optimaliseren. Daarvoor wordt een reeks sterk gespreide concentraties van de teststof gebruikt. De wormen worden aan elke concentratie van de teststof blootgesteld gedurende een periode (bv. 28 dagen zoals in de definitieve test) die een schatting van de wenselijke testconcentraties mogelijk maakt, en er zijn geen replicaten vereist. Het gedrag van de wormen, bijvoorbeeld vermijding van sediment, dat door de teststof en/of het sediment kan worden veroorzaakt, moet in een inleidende test worden geobserveerd en geregistreerd. Concentraties hoger dan 1 000 mg/kg sediment (drooggewicht) hoeven in de inleidende test niet te worden getest.
|
Definitieve test
|
32.
|
In de definitieve test moeten ten minste vijf concentraties worden gebruikt en geselecteerd op basis van bv. de resultaten van de inleidende bereikbepalingstest (punt 31), zoals beschreven in de punten 35 tot en met 38.
|
|
33.
|
Naast de testreeks wordt ook een controle (zie de punten 36, 37 en 38 voor replicatie) met daarin alle bestanddelen, behalve de teststof, uitgevoerd. Indien voor het aanbrengen van de teststof een solubilisator wordt gebruikt, mag deze geen significante effecten op de testorganismen hebben, hetgeen moet blijken uit een extra controlegroep met uitsluitend oplosmiddel.
|
Testopzet
|
34.
|
De testopzet betreft het aantal testconcentraties en de factor waarmee ze van elkaar verschillen, het aantal vaten per concentratieniveau en het aantal toegevoegde wormen per vat. In de punten 35 tot en met 38 wordt een beschrijving gegeven van testopzetten voor de schatting van de ECx, de schatting van de NOEC en de uitvoering van een limiettest.
|
|
35.
|
De in de test gebruikte concentraties moeten de effectconcentratie (bv. EC50, EC25, EC10) en het concentratiebereik waarbinnen het effect van de teststof van belang is, omvatten. Extrapolaties ver onder de laagste concentratie die van invloed is op de testorganismen, of boven de hoogste geteste concentratie moeten worden vermeden. Als, in uitzonderlijke gevallen, een dergelijke extrapolatie toch wordt uitgevoerd, moet in het testverslag een volledige toelichting worden gegeven.
|
|
36.
|
Als een ECx moet worden geschat, worden ten minste vijf concentraties getest met ten minste drie replicaten; voor de controle of — indien gebruikt — de oplosmiddelcontrole wordt zes replicaten aanbevolen, teneinde de schatting van de variabiliteit van de controle te verbeteren. In alle gevallen is het raadzaam bij voldoende concentraties te testen om een goede modelschatting mogelijk te maken. Het verschil tussen de concentraties mag niet meer dan een factor 2 bedragen (als de concentratie-responscurve een geringe helling vertoont, kan hiervan eventueel worden afgeweken). Het aantal replicaten voor elke testgroep kan worden verlaagd wanneer het aantal testconcentraties met een respons in het bereik van 5 - 95 % wordt verhoogd. Als het aantal replicaten wordt verhoogd of de intervallen tussen de testconcentraties worden verkleind, worden de betrouwbaarheidsintervallen van de test gewoonlijk kleiner.
|
|
37.
|
Als de LOEC-/NOEC moeten worden geschat, worden ten minste vijf concentraties getest met ten minste vier replicaten (voor de controle of — indien gebruikt — de oplosmiddelcontrole wordt zes replicaten aanbevolen om de schatting van de variabiliteit van de controle te verbeteren) en mag het verschil tussen de concentraties niet meer dan een factor 2 bedragen. In aanhangsel 6 wordt informatie gegeven over het statistisch onderscheidingsvermogen bij het toetsen van hypothesen in de ringtest van de testmethode.
|
|
38.
|
Er kan een limiettest worden uitgevoerd (één testconcentratie en controlegroep) als geen effecten worden verwacht tot 1 000 mg/kg sediment (drooggewicht) (bv. uit een inleidende bereikbepalingstest), of als het testen van één enkele concentratie voldoende zal zijn om een NOEC-waarde van belang te bepalen. In het laatste geval dient in het testverslag een gedetailleerde onderbouwing van de gekozen limietconcentratie te worden opgenomen. Deze limiettest wordt uitgevoerd bij een concentratie die voldoende hoog is om de besluitvormers in staat te stellen mogelijke toxische effecten van de stof uit te sluiten; deze concentratie wordt vastgesteld op een niveau dat zich naar verwachting in geen enkele situatie zal voordoen. Een concentratie van 1 000 mg/kg (drooggewicht) wordt aanbevolen. Gewoonlijk zijn ten minste zes replicaten voor zowel de testgroep als de controlegroepen nodig. In aanhangsel 6 wordt informatie gegeven over het statistisch onderscheidingsvermogen bij het toetsen van hypothesen in de ringtest van de testmethode.
|
Blootstellingsomstandigheden
Testorganismen
|
39.
|
De test wordt uitgevoerd met ten minste 10 wormen voor elk replicaat dat voor de bepaling van biologische parameters wordt gebruikt. Dit aantal wormen komt overeen met ongeveer 50-100 mg natte biomassa. Uitgaande van een drogestofgehalte van 17,1 % (48), levert dit ongeveer 9-17 mg droge biomassa per vat op. U.S. EPA (2000 (7)) beveelt aan een dichtheid te gebruiken van niet meer dan 1: 50 (droge biomassa: TOC). Voor het geformuleerde sediment als beschreven in punt 22 komt dit overeen met ongeveer 43 g sediment (drooggewicht) per 10 wormen bij een TOC-gehalte van 2,0 % van het droog sediment. Indien meer dan 10 wormen per vat worden gebruikt, moeten de hoeveelheden sediment en bovenstaand water dienovereenkomstig worden aangepast.
|
|
40.
|
De wormen die in een test worden gebruikt, moeten alle van dezelfde bron afkomstig zijn en moeten dieren in een vergelijkbare fysiologische toestand zijn (zie aanhangsel 5). Er moeten wormen van vergelijkbare grootte worden geselecteerd (zie punt 39). Het verdient aanbeveling vóór de test een steekproef uit de batch of het wormenbestand te wegen om een schatting van het gemiddelde gewicht te verkrijgen.
|
|
41.
|
De in een test te gebruiken wormen worden uit de cultuur verwijderd (zie aanhangsel 5 voor details). Grote (volwassen) dieren die geen tekenen van recente fragmentatie vertonen, worden overgebracht naar glazen schalen (bv. petrischalen) met schoon water. Ze worden vervolgens gesynchroniseerd als beschreven in aanhangsel 5. Na een regeneratieperiode van 10 tot 14 dagen moeten voor de test intacte, complete wormen van vergelijkbare grootte worden gebruikt die na een voorzichtige mechanische stimulus actief zwemmen of kruipen. Als de testomstandigheden verschillen van de cultuuromstandigheden (bv. qua temperatuur, lichtregime en bovenstaand water), moet een acclimatiseringsfase van bv. 24 uur bij hetzelfde temperatuur- en lichtregime en met hetzelfde bovenstaande water als in de test volstaan om de wormen aan de testomstandigheden te laten wennen. De geacclimatiseerde Oligochaetae worden willekeurig over de testvaten verdeeld.
|
Voeding
|
42.
|
Omdat vóór (of tijdens) het aanbrengen van de teststof voedsel aan het sediment wordt toegevoegd, krijgen de wormen tijdens de test geen extra voedsel verstrekt.
|
Licht en temperatuur
|
43.
|
De fotoperiode in de cultuur en de test duurt doorgaans 16 uur (3), (7). De lichtintensiteit moet laag gehouden worden (bv. 100-500 lx) om natuurlijke omstandigheden op het sedimentoppervlak na te bootsen, en moet ten minste één keer in de blootstellingsperiode worden gemeten. De temperatuur moet gedurende de gehele test 20 °C ± 2 °C zijn. Op een gegeven meetdatum mag het verschil in temperatuur tussen de testvaten niet groter zijn dan ± 1 °C. De testvaten moeten op gerandomiseerde wijze in de testincubator of in de testruimte worden geplaatst, bv. om bias in de voortplanting als gevolg van de plaats van een vat tot een minimum te beperken.
|
Beluchting
|
44.
|
Het bovenstaande water van de testvaten moet voorzichtig worden belucht (bv. 2-4 bellen per seconde) via een pasteurpipet dat ongeveer 2 cm boven het sedimentoppervlak is geplaatst, om perturbatie van het sediment zo veel mogelijk te beperken. Er moet op worden gelet dat het gehalte aan opgeloste zuurstof niet lager wordt dan 30 % van de verzadigingswaarde van lucht. De luchttoevoer moet op werkdagen ten minste één keer per dag worden gecontroleerd en — indien nodig — worden aangepast.
|
Metingen van de waterkwaliteit
|
45.
|
De volgende kwaliteitsparameters moeten in het bovenstaand water worden onderzocht:
|
Temperatuur:
|
één keer per week, alsook aan het begin en aan het eind van de blootstellingsperiode ten minste in één testvat van elk concentratieniveau en één testvat van de controles; indien mogelijk, kan ook de temperatuur in het omliggende medium (omgevingslucht of waterbad) worden geregistreerd, bv. om het uur;
|
|
Gehalte opgeloste zuurstof:
|
één keer per week, alsook aan het begin en aan het eind van de blootstellingsperiode ten minste in één testvat van elk concentratieniveau en één testvat van de controles; uitgedrukt in mg/l en % verzadigingswaarde van lucht;
|
|
Luchttoevoer:
|
moet op werkdagen ten minste één keer per dag worden gecontroleerd en — indien nodig — worden aangepast;
|
|
pH:
|
één keer per week, alsook aan het begin en aan het eind van de blootstellingsperiode ten minste in één testvat van elk concentratieniveau en één testvat van de controles;
|
|
Totale hardheid van water:
|
ten minste in één replicaat van de controles en één testvat bij de hoogste concentratie aan het begin en aan het eind van de blootstellingsperiode; uitgedrukt in mg/l CaCO3;
|
|
Totale ammoniak-gehalte:
|
ten minste in één replicaat van de controles en één testvat bij elk concentratieniveau aan het begin en aan het eind van de blootstellingsperiode, en daarna drie keer per week; uitgedrukt in mg/l NH4
+ of NH3 of totaal ammoniak-N.
|
Als voor het meten van de parameters van de waterkwaliteit aanzienlijke watermonsters uit de vaten moeten worden genomen, kan het raadzaam zijn om aparte vaten voor de waterkwaliteitsmetingen op te zetten om de water/sediment-volumeverhouding niet te wijzigen.
|
Biologische waarnemingen
|
46.
|
De testvaten moeten tijdens de blootstelling worden geobserveerd om visueel eventuele verschillen in gedrag tussen de wormen en de controles te beoordelen (bv. vermijden van sediment, zichtbare aanwezigheid van fecaal materiaal op het sedimentoppervlak). De waarnemingen moeten worden geregistreerd.
|
|
47.
|
Aan het eind van de test wordt elk replicaat onderzocht (extra vaten ten behoeve van chemische analysen mogen van het onderzoek worden uitgesloten). Alle wormen moeten met een geschikte methode uit de testvaten worden verwijderd. Er dient op te worden gelet dat de wormen bij de verwijdering geen letsel oplopen. Een van de mogelijke methoden is de wormen uit het sediment te zeven. Daarvoor kan een roestvrij staalgaas met een gepaste maaswijdte worden gebruikt. Het grootste deel van het bovenstaand water wordt voorzichtig gedecanteerd, en het overblijvende sediment en water worden geschud zodat een suspensie wordt verkregen, die daarna door de zeef kan worden gegoten. Bij gebruik van een gaas met openingen van 500 μm zullen de meeste sedimentdeeltjes heel snel door de zeef stromen; het zeven moet echter snel gebeuren om te voorkomen dat de wormen in of door het gaas kruipen. Gebruik van een gaas met openingen van 250 μm verhindert dat de wormen in of door het gaas kruipen; er moet echter op worden gelet dat zo min mogelijk sedimentdeeltjes in het gaas achterblijven. De gezeefde suspensie van elk replicaatvat kan een tweede keer door de zeef worden gespoeld om te waarborgen dat alle wormen eruit worden gezeefd. Een alternatieve methode is het sediment te verwarmen door de testvaten in een waterbad van 50-60 °C te plaatsen; de wormen zullen het sediment verlaten en kunnen met een gevuurpolijst pipet met brede mond van het sedimentoppervlak worden verzameld. Een alternatief is een sedimentsuspensie te maken en deze suspensie op een ondiepe schaal van geschikte grootte te gieten. De wormen kunnen met een stalen naald of horlogemakerspincet (te gebruiken als een vork in plaats van als een pincet om beschadiging van de wormen te voorkomen) uit de ondiepe schaal met suspensie worden geschept en in schoon water worden overgebracht. Wanneer de wormen zijn gescheiden van de sedimentsuspensie, worden ze gespoeld in testmedium en geteld.
|
|
48.
|
Onafhankelijk van de gebruikte methode, moeten laboratoria aantonen dat hun personeelsleden in staat zijn om gemiddeld ten minste 90 % van de organismen uit het hele sediment te halen. Er kan bijvoorbeeld een bepaald aantal testorganismen aan het controlesediment of de testsedimenten worden toegevoegd, waarna na 1 uur het recoverypercentage kan worden bepaald (7).
|
|
49.
|
Het totale aantal levende en dode dieren per replicaat moet worden geregistreerd en beoordeeld. De volgende groepen wormen worden als dood beschouwd:
|
a)
|
er is geen reactie na een voorzichtige mechanische stimulus
|
|
b)
|
er zijn tekenen van ontbinding (in combinatie met „a”)
|
|
c)
|
het aantal wormen dat ontbreekt
|
Daarnaast kunnen de levende wormen in een van de volgende drie groepen worden ingedeeld:
|
a)
|
grote complete wormen (volwassen dieren) zonder geregenereerde gebieden van het lichaam
|
|
b)
|
complete wormen met geregenereerde, lichter gekleurde gebieden van het lichaam (d.w.z. met een nieuw achterste deel, met een nieuw voorste deel of met zowel een nieuw achterste als voorste deel)
|
|
c)
|
incomplete wormen (d.w.z. onlangs gefragmenteerde wormen met niet geregenereerde gebieden van het lichaam)
|
Deze aanvullende waarnemingen zijn niet verplicht, maar kunnen worden gebruikt voor aanvullende interpretatie van de biologische resultaten (bijvoorbeeld, een hoog aantal wormen in groep c kan duiden op een vertraagde voortplanting of regeneratie in een bepaalde testgroep). Als verschillen in uiterlijk (bv. laesies van het integument, oedemateuze delen van het lichaam) worden waargenomen tussen behandelde wormen en controlewormen, moeten ook deze verschillen worden geregistreerd.
|
|
50.
|
Onmiddellijk na de telling/beoordeling worden de levende wormen die in elk replicaat zijn aangetroffen, overgebracht naar droge, vooraf gewogen en gelabelde weegschalen (één per replicaat) en gedood met een druppel ethanol per schaal. De weegschalen worden een nacht lang in een droogoven bij 100 ± 5 °C geplaatst om te drogen, waarna ze in een droogkast worden geplaatst om af te koelen, worden gewogen en het drooggewicht van de wormen wordt bepaald (bij voorkeur in g met ten minste 4 cijfers achter de komma).
|
|
51.
|
Behalve het totale drooggewicht, kan het asvrije drooggewicht worden bepaald als beschreven in (49) om rekening te houden met anorganische bestanddelen die afkomstig zijn van opgenomen sediment dat aanwezig is in het spijsverteringskanaal van de wormen.
|
|
52.
|
De biomassa wordt bepaald als de totale biomassa per replicaat, inclusief volwassen en jonge wormen. Bij de bepaling van de biomassa per replicaat worden de dode wormen niet meegerekend.
|
Verificatie van de concentraties van de teststof
Monstername
|
53.
|
Monsters voor de chemische analyse van de teststof moeten worden genomen bij ten minste de hoogste en een lagere concentratie, ten minste aan het eind van de equilibratieperiode (vóór toevoeging van de testorganismen) en aan het eind van de test. Voor de analyse moeten ten minste monsters worden genomen van het bulksediment en het bovenstaande water. Op elke monsternamedatum moeten per matrix en behandeling ten minste twee monsters worden genomen. Een van de twee monsters kan als reserve worden bewaard (bv. om te analyseren in geval het resultaat van de eerste analyse meer dan 20 % afwijkt van de nominale concentratie). In geval van specifieke chemische eigenschappen, bv. als een snelle afbraak van het testmateriaal wordt verwacht, kan het analyseschema op basis van het oordeel van deskundigen worden verfijnd (bv. frequentere monstername, analyse van meer concentratieniveaus). Er kunnen dan monsters worden genomen op tussenliggende dagen (bv. op dag zeven na het begin van de blootstelling).
|
|
54.
|
Het bovenstaande water moet worden bemonsterd door het bovenstaande water voorzichtig te decanteren of af te hevelen, zodat de perturbatie van het sediment tot een minimum wordt beperkt. Het volume van de monsters moet worden geregistreerd.
|
|
55.
|
Na de verwijdering van het bovenstaande water moet het sediment worden gehomogeniseerd en overgebracht in een geschikte houder. Het gewicht van het natte sedimentmonster wordt geregistreerd.
|
|
56.
|
Als daarnaast de teststof in het poriënwater moet worden geanalyseerd, moeten de gehomogeniseerde en gewogen sedimentmonsters worden gecentrifugeerd om het poriënwater te verkrijgen. Ongeveer 200 ml nat sediment kan bijvoorbeeld worden overgebracht in centrifugebekers van 250 ml. Daarna moeten de monsters zonder filtering worden gecentrifugeerd om het poriënwater te isoleren, bv. bij 10 000 ± 600 × g gedurende 30 tot 60 minuten bij een temperatuur die de testtemperatuur niet overschrijdt. Na het centrifugeren wordt de bovenliggende vloeistof gedecanteerd of gepipetteerd, waarbij erop wordt gelet dat geen sedimentdeeltjes worden meegenomen, en wordt het volume geregistreerd. Het gewicht van het resterende sedimentmateriaal wordt geregistreerd. De massabalans of de recovery van de teststof in het water/sediment-systeem kan mogelijk gemakkelijker worden geschat als op elke monsternamedatum het drooggewicht van het sediment wordt bepaald. In sommige gevallen kan analyse van de concentraties in het poriewater onmogelijk zijn doordat het monster te klein is.
|
|
57.
|
Wanneer de analyse niet onmiddellijk plaatsvindt, moeten alle monsters op passende wijze worden bewaard, bv. onder bewaaromstandigheden als aanbevolen voor een minimale afbraak van de specifieke teststof (milieumonsters worden bv. doorgaans bewaard in het donker bij – 18 °C). Verzamel vóór aanvang van het onderzoek informatie over de juiste bewaaromstandigheden voor de betreffende teststof (bv. bewaarduur en -temperatuur, extractieprocedures enz.).
|
Analysemethode
|
58.
|
De gehele procedure wordt in feite bepaald door de nauwkeurigheid, precisie en gevoeligheid van de analytische methode die voor de teststof wordt gebruikt. Controleer daarom experimenteel dat de precisie en reproduceerbaarheid van de chemische analyse, alsook de recovery van de teststof uit water- en sedimentmonsters bij ten minste de laagste en hoogste testconcentratie bevredigend zijn voor de betreffende methode. Controleer ook dat de teststof in de controlekamers niet detecteerbaar is in hogere concentraties dan de bepaalbaarheidsgrens. Corrigeer, indien nodig, de nominale concentraties voor de recovery van verrijkte kwaliteitscontrolemonsters (bv. wanneer de recovery buiten het bereik van 80-120 % van de verrijkte hoeveelheid ligt). Hanteer alle monsters tijdens de gehele test zodanig dat verontreiniging en verlies (bv. als gevolg van adsorptie van de teststof aan het bemonsteringsapparaat) tot een minimum worden beperkt.
|
|
59.
|
De recovery van de teststof, de bepaalbaarheidsgrens en de detectiegrens in sediment en water moeten worden geregistreerd en gerapporteerd.
|
GEGEVENS EN RAPPORTAGE
Verwerking van de resultaten
|
60.
|
De belangrijkste verplichte responsvariabelen van de test die statistisch moeten worden geëvalueerd, zijn de biomassa en het totale aantal wormen per replicaat. Facultatief kunnen ook de voortplanting (toename van de aantallen wormen) en groei (toename van de droge biomassa) worden geëvalueerd. In dit geval moet een schatting van het drooggewicht van de wormen aan het begin van de blootstelling worden verkregen, bv. door meting van het drooggewicht van een representatief deelmonster van de batch gesynchroniseerde wormen die voor de test zal worden gebruikt.
|
|
61.
|
Hoewel mortaliteit geen eindpunt van deze test is, moeten de mortaliteiten toch zo veel mogelijk worden geëvalueerd. Om de mortaliteiten te schatten moeten de wormen die geen reactie vertonen op een voorzichtige mechanische stimulus, wormen die tekenen van ontbinding vertonen en de ontbrekende wormen als dood worden beschouwd. De mortaliteiten moeten ten minste worden geregistreerd en er moet rekening mee worden gehouden bij de interpretatie van de testresultaten.
|
|
62.
|
Effectieve concentraties moeten worden uitgedrukt in mg/kg sediment (drooggewicht). Als de recovery van de teststof gemeten in het sediment, of in het sediment en het bovenstaande water aan het begin van de blootstelling, tussen 80 % en 120 % van de nominale concentraties ligt, mogen de effectieve concentraties (ECx, NOEC, LOEC) worden uitgedrukt op basis van de nominale concentraties. Als de recovery van de nominale concentraties meer dan ± 20 % afwijkt van de nominale concentraties, moeten de effectieve concentraties (ECx, NOEC, LOEC) worden gebaseerd op de aanvankelijk gemeten concentraties aan het begin van de blootstelling, bv. om rekening te houden met de massabalans van de teststof in het testsysteem (zie punt 30). In deze gevallen kan aanvullende informatie worden verkregen uit analyse van de stam- en/of aanbrengingsoplossingen om te bevestigen dat de testsedimenten juist werden bereid.
|
ECx
|
63.
|
ECx-waarden voor de in punt 60 beschreven parameters worden berekend met behulp van passende statistische methoden (bv. probit-analyse, logistische of Weibull-functie, getrimde Spearman-Karber-methode of eenvoudige interpolatie). Zie (15) en (50) voor richtsnoeren voor de statistische evaluatie. Een ECx wordt verkregen door de waarde die correspondeert met x % van het controlegemiddelde in de gevonden vergelijking in te vullen. Voor de berekening van de EC50 of een andere ECx kunnen de gemiddelden (
) per behandeling worden onderworpen aan een regressieanalyse. |
NOEC/LOEC
|
64.
|
Als het doel van een statistische analyse is de NOEC/LOEC te bepalen, zijn statistieken per vat noodzakelijk (individuele vaten worden als replicaten beschouwd). Er moeten geschikte statistische methoden worden gebruikt. In het algemeen worden schadelijke effecten van de teststof ten opzichte van de controle onderzocht met een toets voor een eenzijdige (kleinere) nulhypothese bij p ≤ 0,05. In de onderstaande punten worden voorbeelden gegeven. Zie (15) en (50) voor richtsnoeren voor de keuze van geschikte statistische methoden.
|
|
65.
|
Of gegevens normaal verdeeld zijn, kan worden getoetst met bv. de Kolmogorov-Smirnovtoets voor goodness-of-fit, de toets op het quotiënt van het bereik en de standaarddeviatie ('Range to standard deviation ratio'-toets) of de Shapiro-Wilk-toets, (tweezijdig, p ≤ 0,05). De Cochran-toets, Levene-toets of Bartlett-toets (tweezijdig, p ≤ 0,05) kunnen worden gebruikt om op homogeniteit van variantie te toetsen. Als aan de voorwaarden van parametrische toetsprocedures (normaliteit, homogeniteit van variantie) is voldaan, kunnen een éénwegs variantieanalyse (ANOVA, One-way Analysis of Variance) en daaropvolgende toetsen voor meervoudige vergelijkingen worden uitgevoerd. Paarsgewijze vergelijkingen (bv. t-toets van Dunnett) of stap-omlaag-trendtoetsen (bv. Williams-toets) kunnen worden gebruikt om na te gaan of er significante verschillen (p ≤ 0,05) zijn tussen de controles en de verschillende concentraties van de teststof. Anders moeten verdelingsvrije toetsen (bv. Bonferroni-toets volgens Holm of de Jonckheere-Terpstra-trendtoets) worden gebruikt om de NOEC en LOEC te bepalen.
|
Limiettest
|
66.
|
Als een limiettest (vergelijking van de controle en slechts één behandeling) is uitgevoerd en er is voldaan aan de voorwaarden van parametrische toetsprocedures (normaliteit, homogeniteit), kunnen metrische responsen (totaal aantal wormen, en de biomassa als drooggewicht wormen) worden geëvalueerd met de t-toets. Als niet aan die voorwaarden wordt voldaan, kan de t-toets voor ongelijke varianties (Welch-toets) of een verdelingsvrije toets, zoals de Mann-Whitney-toets, worden gebruikt. In aanhangsel 6 wordt informatie gegeven over het statistisch onderscheidingsvermogen bij het toetsen van hypothesen in de ringtest van de methode.
|
|
67.
|
Om significante verschillen tussen de controles (controle en oplosmiddelcontrole) vast te stellen, kunnen de replicaten van de beide controles worden getoetst als beschreven voor de limiettest. Als uit deze toetsen geen significante verschillen naar voren komen, mogen alle replicaten van de controle en oplosmiddelcontrole worden gepoold. Anders dienen alle behandelingen te worden vergeleken met de oplosmiddelcontrole.
|
Interpretatie van de resultaten
|
68.
|
De resultaten moeten voorzichtig worden geïnterpreteerd als van deze testmethode is afgeweken, of als testconcentraties zijn gemeten die dicht bij de detectiegrens van de gebruikte analytische methode liggen. Alle afwijkingen van deze testmethode moeten worden genoteerd.
|
Testverslag
|
69.
|
In het testverslag moet ten minste de volgende informatie worden opgenomen:
|
—
|
Teststof:
|
—
|
identificatiegegevens van de stof (triviale naam, chemische naam, structuurformule, CAS-nummer enz.) met inbegrip van de zuiverheid en de analysemethode voor de kwantitatieve bepaling van de teststof; oorsprong van de teststof en, in voorkomend geval, identiteit en concentratie van het gebruikte oplosmiddel.
|
|
—
|
alle beschikbare informatie over de fysische toestand en fysisch-chemische kenmerken als verkregen vóór het begin van de test (bv. oplosbaarheid in water, dampspanning, verdelingscoëfficiënt in de bodem (of in sediment, indien beschikbaar), log Kow, stabiliteit in water enz.);
|
|
|
—
|
Diersoort:
|
—
|
wetenschappelijke naam, oorsprong, eventuele voorafgaande behandeling, acclimatisatie, kweekomstandigheden enz.
|
|
|
—
|
Testomstandigheden:
|
—
|
gebruikte testprocedure (bv. statisch, semistatisch of doorstroom);
|
|
—
|
testopzet (bv. aantal, materiaal en grootte van de testbakken, watervolume per vat, sedimentmassa en -volume per vat, (voor doorstroom- of semistatische procedures: verversingssnelheid van het water), gebruikte beluchting vóór en tijdens de test, aantal replicaten, aantal wormen per replicaat bij begin van de blootstelling, aantal testconcentraties, duur van de conditionerings-, equilibratie- en blootstellingsperioden, frequentie van de bemonstering);
|
|
—
|
dikte van de sedimentlaag en diepte van het bovenliggende water;
|
|
—
|
methode van voorafgaande behandeling en verrijking/aanbrenging van teststof;
|
|
—
|
de nominale testconcentraties, details over de bemonstering voor chemische analyse, en de analytische methoden waarmee concentraties van de teststof zijn verkregen;
|
|
—
|
kenmerken van het sediment als beschreven in de punten 24 en 25, en alle andere metingen die zijn verricht; bereiding van het geformuleerde sediment;
|
|
—
|
bereiding van het testwater (bij gebruik van synthetisch water) en eigenschappen (zuurstofgehalte, pH, geleidbaarheid, hardheid en alle andere metingen die zijn verricht) vóór het begin van de test;
|
|
—
|
details over het voedsel, met inbegrip van soort voedsel, bereiding, hoeveelheid en voederregime;
|
|
—
|
lichtintensiteit en fotoperiode(n);
|
|
—
|
de gebruikte methoden voor de bepaling van alle biologische parameters (bv. monstername, inspectie, weging van testorganismen) en alle abiotische parameters (bv. kwaliteitsparameters voor water en sediment);
|
|
—
|
volumes en/of gewichten van alle monsters voor chemische analyse;
|
|
—
|
gedetailleerde informatie over de verwerking van alle monsters voor chemische analyse, met inbegrip van details van de bereiding, bewaring, verrijkingsprocedures, extractie en analyseprocedures (en -precisie) voor de teststof, en de recovery van de teststof.
|
|
|
—
|
Resultaten:
|
—
|
kwaliteit van het water in de testvaten (pH, temperatuur, gehalte opgeloste zuurstof, hardheid, ammoniakgehaltes en alle andere metingen die zijn verricht);
|
|
—
|
totaal gehalte organische koolstof (TOC), de verhouding tussen drooggewicht en natgewicht, pH van het sediment en alle andere metingen die zijn verricht;
|
|
—
|
het totale aantal wormen en, indien bepaald, het aantal complete en incomplete wormen in elke testbak aan het eind van de test;
|
|
—
|
drooggewicht van de wormen in elke testbak aan het eind van de test en, indien bepaald, drooggewicht van een deelmonster van de wormen aan het eind van de test;
|
|
—
|
alle waargenomen abnormale gedragingen in vergelijking met de controles (bv. vermijding van sediment, aanwezigheid of afwezigheid van fecaal materiaal);
|
|
—
|
alle waargenomen mortaliteiten;
|
|
—
|
schattingen van toxische eindpunten (bv. ECx, NOEC en/of LOEC), en de statistische methoden waarmee zij zijn bepaald;
|
|
—
|
de nominale testconcentraties, de gemeten testconcentraties en de resultaten van alle analysen die zijn verricht om de concentratie van de teststof in de testvaten te bepalen;
|
|
—
|
alle afwijkingen van de geldigheidscriteria.
|
|
|
—
|
Evaluatie van de resultaten:
|
—
|
overeenstemming van de resultaten met de in punt 13 vermelde geldigheidscriteria;
|
|
—
|
bespreking van de resultaten, met inbegrip van een eventuele beïnvloeding van de resultaten van de test die een gevolg is van afwijkingen van deze testmethode.
|
|
|
LITERATUUR
|
(1)
|
EC (2003). Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I — IV. Office for Official Publications of the EC (European Commission), Luxembourg.
|
|
(2)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. & Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ. Toxicol. Chem. 12, 269-279.
|
|
(6)
|
Hoofdstuk C.27 van deze bijlage, „Test ter bepaling van de toxiciteit voor chironomiden in sedimenten en water m.b.v. verrijkt sediment”.
|
|
(7)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(8)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
(9)
|
Hill, I.R., Matthiessen, P., Heimbach, F. (eds), 1993. Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments. From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8-10 November 1993, Renesse (NL).
|
|
(10)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H. Köpp. Berlin 1995.
|
|
(11)
|
Riedhammer C. & B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105-110.
|
|
(12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(14)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(15)
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests; fifth draft, March 2003; Report EPS 1/RM/___
|
|
(16)
|
Nikkilä A., Halme A., Kukkonen J.V.K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35-46.
|
|
(17)
|
Baily H.C., & Liu D.H.W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. blz. 205-215. In: J.C. Eaton, P.R. Parrish, & A.C. Hendricks (eds). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
(18)
|
Chapman K. K., Benton M. J., Brinkhurst R. O. & Scheuerman P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271-278.
|
|
(19)
|
Meyer J.S., Boese C.J. & Collyard S.A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Verplicht Biochem. Physiol. Part C 133:99-109.
|
|
(20)
|
Schubauer-Berigan M.K., Dierkes J.R., Monson P.D. & Ankley G.T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxciol. Chem. 12(7):1261-1266.
|
|
(21)
|
West, C.W., V.R. Mattson, E.N. Leonard, G.L. Phipps & G.T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57-63.
|
|
(22)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. & Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(23)
|
Kukkonen, J. & Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(24)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(25)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(26)
|
Landrum, P.F., Gedeon, M.L., Burton, G.A., Greenberg. M.S., & Rowland, C.D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42: 292-302.
|
|
(27)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(28)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. & Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(29)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph. Oehlmann, J., & Knacker, Th. (2005). Bioaccumulation of 14C-17α -ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271-280.
|
|
(31)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, blz. 2000–2007.
|
|
(32)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(33)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
(34)
|
Dermott R. & Munawar M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407-414.
|
|
(35)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(36)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(37)
|
Hoofdstuk C.1 van deze bijlage, Acute toxiciteitstest voor vissen.
|
|
(38)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Parijs.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(40)
|
Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel & B. Streit. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10-20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on „Bioaccumulation: Sediment test using benthic oligochaetes”, 26.-27.4.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(42)
|
Suedel, B.C. & Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
(43)
|
Naylor, C. & C. Rodrigues. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
|
|
(44)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(46)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(47)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588-595.
|
|
(48)
|
Brooke, L.T., Ankley, G.T., Call, D.J. & Cook, P.M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223-228.
|
|
(49)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
(50)
|
OESO, 2006. Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment No. 54, OECD, Paris, France.
|
|
(51)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten — Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. blz. 107-119.
|
Aanvullende literatuur over statistische procedures:
Dunnett, C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
Finney, D. J. (1978). (1971). Probit Analysis (3rd ed.), blz. 19-76. Cambridge Univ. Press.
Finney, D. J. (1978). (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M.A., R.C. Russo & R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correctie: Environ. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
Sokal, R.R. & F.J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
Miller, R.G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro S.S. & Wilk M.B (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591-611.
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
Aanhangsel 1
Definities
Voor de toepassing van deze testmethode worden de volgende definities gehanteerd:
|
|
Stof betekent een substantie of mengsel.
|
|
|
De conditioneringsperiode wordt gebruikt om het microbiële deel van het sediment te stabiliseren en bv. ammoniak afkomstig van sedimentbestanddelen te verwijderen; deze conditionering vindt plaats voordat het sediment wordt verrijkt met de teststof. Gewoonlijk wordt het bovenstaande water na de conditionering weggegooid.
|
|
|
De ECx
is de concentratie van de teststof in het sediment die binnen een bepaalde blootstellingsperiode leidt tot een effect op een biologische parameter van x % (bv. 50 %).
|
|
|
De equilibratieperiode wordt gebruikt om de teststof zich over de vaste fase, het poriënwater en het bovenstaande water te laten verspreiden; deze equilibratie vindt plaats nadat het sediment met de teststof is verrijkt en voordat de testorganismen worden toegevoegd.
|
|
|
De blootstellingsfase is de periode gedurende welke de testorganismen aan de teststof worden blootgesteld.
|
|
|
„kunstmatig sediment” (ook wel bereid, gereconstitueerd of synthetisch sediment genoemd): een mengsel van materialen waarmee de fysische bestanddelen van natuurlijk sediment worden nagebootst;
|
|
|
De Lowest Observed Effect Concentration (LOEC) is de laagste geteste concentratie van een teststof waarbij de stof een significant toxisch effect (p ≤ 0,05) heeft vergeleken met de controlegroep. Alle testconcentraties boven de LOEC moeten echter een effect hebben dat ten minste gelijk is aan het bij de LOEC waargenomen effect. Wanneer niet aan deze twee voorwaarden kan worden voldaan, moet een volledige toelichting worden gegeven op de wijze waarop de LOEC (en dus de NOEC) is bepaald.
|
|
|
De No Observed Effect Concentration (NOEC) is de testconcentratie direct onder de LOEC die, in vergelijking met de controle, geen statistisch significant effect heeft (p ≤ 0,05) binnen een aangegeven blootstellingsperiode.
|
|
|
De octanol/water-verdelingscoëfficiënt (Kow; soms ook aangeduid als Pow) is de verhouding tussen de oplosbaarheid van een stof in n-octanol en water bij evenwicht en geeft de lipofiliciteit van een stof weer (hoofdstuk A.24 van deze bijlage). Kow of de logaritme van Kow (log Kow) wordt gebruikt als een indicatie van het bioaccumulatiepotentieel van een chemische stof door in het water levende organismen.
|
|
|
De organischekoolstof/water-verdelingscoëfficiënt (Koc) is de verhouding tussen de concentratie van een stof in of op de fractie organische koolstof van een sediment en de concentratie van die stof in water in een toestand van evenwicht.
|
|
|
Bovenstaand water is het water dat in het testvat op het sediment staat.
|
|
|
Poriënwater, ook wel interstitieel water genoemd, is het water in de ruimten tussen de sediment- of bodemdeeltjes.
|
|
|
Verrijkt sediment is sediment waaraan teststof is toegevoegd.
|
|
|
Teststof: alle volgens deze testmethode geteste stoffen en mengsels.
|
Aanhangsel 2
Samenstelling van het aanbevolen synthetisch water
(gebaseerd op hoofdstuk C.1 van deze bijlage (1))
|
(a)
|
Calciumchlorideoplossing
Los 11,76 g CaCl2 · 2H2O op in gedeïoniseerd water; vul aan met gedeïoniseerd water tot 1 l
|
|
(b)
|
magnesiumsulfaatoplossing
Los 4,93 g MgSO4 · 7H2O op in gedeïoniseerd water; vul aan met gedeïoniseerd water tot 1 l
|
|
(c)
|
Natriumbicarbonaatoplossing
Los 2,59 g NaHCO3 op in gedeïoniseerd water; vul aan met gedeïoniseerd water tot 1 l
|
|
(d)
|
Kaliumchlorideoplossing
Los 0,23 g KCl op in gedeïoniseerd water; vul aan met gedeïoniseerd water tot 1 l
|
Alle chemicaliën moeten van pro-analyse kwaliteit zijn.
Het geleidend vermogen van het gedestilleerde of gedeïoniseerde water mag niet groter zijn dan 10 μS cm– 1.
25 ml van elk van de oplossingen (a) tot en met (d) wordt gemengd en het totale volume wordt met gedeïoniseerd water aangevuld tot 1 l. Het totaal van de calcium- en magnesiumionen in deze oplossingen is 2,5 mmol/l.
De verhouding van Ca-ionen:Mg-ionen is 4:1 en die van Na-ionen:K-ionen 10:1. Het zuurbindend vermogen KS4.3 van deze oplossing is 0,8 mmol/l.
Belucht het oplossingswater tot het is verzadigd met zuurstof, en bewaar het oplossingswater daarna zonder verdere beluchting gedurende ongeveer twee dagen tot gebruik.
REFERENTIE
|
(1)
|
Hoofdstuk C.1 van deze bijlage, Acute toxiciteitstest voor vissen.
|
Aanhangsel 3
Fysisch-chemische kenmerken van aanvaardbaar verdunningswater
|
Onderdeel
|
Concentraties
|
|
Vaste deeltjes
|
< 20 mg/l
|
|
Totaalgehalte aan organische koolstof
|
< 2 μg/l
|
|
Niet-geïoniseerde ammonia
|
< 1 μg/l
|
|
Restchloorgehalte
|
< 10 μg/l
|
|
Totaal organofosforpesticiden
|
< 50 ng/l
|
|
Totaalgehalte aan organochloor-pesticiden en polychloorbifenylen
|
< 50 ng/l
|
|
Totaalgehalte aan organisch chloor
|
< 25 ng/l
|
|
(overgenomen uit OECD (1992) (1))
|
REFERENTIE
|
(1)
|
OECD (1992). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Parijs.
|
Aanhangsel 4
Aanbevolen kunstmatig sediment — aanbevelingen voor de voorbereiding en opslag
Bestanddelen van sediment
|
Bestanddeel
|
Kenmerken
|
% van het sediment (drooggewicht)
|
|
Turf
|
Veenmosturf, mate van decompositie: „medium”, aan de lucht gedroogd, geen zichtbare plantenresten, fijngemalen (deeltjesgrootte≤ 0,5 mm)
|
5 ± 0,5
|
|
Kwartszand
|
Korrelgrootte: ≤ 2 mm, maar > 50 % van de deeltjes moet binnen het bereik 50-200 μm liggen
|
75 - 76
|
|
Kaolienklei
|
Gehalte aan kaoliniet ≥ 30 %
|
20 ± 1
|
|
Voedselbron
|
bv. Urtica-poeder (Folia urticae), bladeren van Urtica dioica (grote brandnetel), fijngemalen (deeltjesgrootte ≤ 0,5 mm); in overeenstemming met farmaceutische normen, voor menselijke consumptie; naast droog sediment
|
0,4 - 0,5 %
|
|
Organische koolstof
|
Aangepast door toevoeging van turf en zand
|
2 ± 0,5
|
|
Calciumcarbonaat
|
CaCO3, verpulverd, chemisch zuiver, naast droog sediment
|
0,05 - 1
|
|
Gedeïoniseerd water
|
Geleidend vermogen ≤ 10 μS/cm,, naast droog sediment
|
30 - 50
|
Noot: Als verhoogde ammoniakconcentraties worden verwacht, bv. als bekend is dat de teststof de nitrificatie remt, kan het nuttig zijn om 50 % van het stikstofrijke urtica-poeder te vervangen door cellulose (bv. α-cellulosepoeder, chemisch zuiver, deeltjesgrootte ≤ 0,5 mm; (1) (2)).
Voorbereiding
De turf wordt aan de lucht gedroogd en tot een fijn poeder vermalen. Er wordt een suspensie van de vereiste hoeveelheid turfpoeder in gedeïoniseerd water bereid met een kwalitatief hoogwaardig homogeniseerapparaat. De pH van deze suspensie wordt aangepast tot 5,5 ± 0,5 met CaCO3. De suspensie wordt ten minste twee dagen lang onder zachtjes roeren bij 20 ± 2 °C geconditioneerd om de pH te stabiliseren en een stabiele microbiële component te verkrijgen. De pH wordt opnieuw gemeten en moet nu 6,0 ± 0,5 bedragen. Vervolgens wordt de turfsuspensie met de andere bestanddelen (zand en kaolienklei) en gedeïoniseerd water vermengd om een homogeen sediment te verkrijgen met een watergehalte van 30-50 % van het drooggewicht van het sediment. De pH van het uiteindelijke mengsel wordt nogmaals gemeten en zo nodig met CaCO3 tot 6,5-7,5 aangepast. Als een verhoogde ammoniakontwikkeling wordt verwacht, kan het echter nuttig zijn de pH van het sediment onder 7 (bv. tussen 6,0 en 6,5) te houden. Er worden monsters van het sediment genomen om het drooggewicht en het gehalte aan organische koolstof te bepalen. Als een verhoogde ammoniakontwikkeling wordt verwacht, kan het kunstmatige sediment zeven dagen worden geconditioneerd onder dezelfde omstandigheden die ook in de test zullen heersen (bv. sediment/water-verhouding 1: 4, dikte van de sedimentlaag als in de testvaten), voordat het wordt verrijkt met de teststof, d.w.z. het moet worden overgoten met water, dat moet worden belucht. Aan het eind van de conditioneringsperiode moet het bovenstaande water worden verwijderd en weggegooid. Daarna wordt het verrijkte kwartszand gemengd met het sediment voor elk behandelingsniveau, wordt het sediment over de replicaattestvaten verdeeld en overgoten met het testwater. De vaten worden daarna geïncubeerd onder dezelfde omstandigheden die ook in de test heersen. Hier begint de equilibratieperiode. Het bovenstaande water moet worden belucht.
De gekozen voedingsbron moet worden toegevoegd vóór of tijdens de verrijking van het sediment met de teststof. Het voedsel kan in eerste instantie door de turfoplossing worden gemengd (zie hierboven). Overmatige achteruitgang van de voedselbron vóór de toevoeging van de testorganismen — bv. in geval van een lange equilibratieperiode — kan echter worden voorkomen door de tijdsperiode tussen de toevoeging van het voedsel en het begin van de blootstelling zo kort mogelijk te houden. Om te waarborgen dat het voedsel met de teststof wordt verrijkt, moet de voedselbron uiterlijk op de dag waarop het sediment wordt verrijkt met de teststof, door het sediment worden gemengd.
Opslag
De droge bestanddelen van het kunstmatige sediment kunnen op een droge en koele plaats bij kamertemperatuur worden bewaard. Het bereide, met de teststof verrijkte sediment moet onmiddellijk in de test worden gebruikt. Monsters van verrijkt sediment kunnen tot de analyse onder de voor de desbetreffende teststof aanbevolen omstandigheden worden bewaard.
LITERATUUR
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(2)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten — Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. blz. 107-119.
|
Aanhangsel 5
Kweekmethoden voor Lumbriculus variegatus
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta is een bewoner van zoetwatersedimenten en wordt veel gebruikt in ecotoxicologische tests. Hij is gemakkelijk onder laboratoriumomstandigheden te kweken. Hieronder wordt een kort overzicht van de kweekmethoden gegeven.
Kweekmethoden
De kweekomstandigheden voor Lumbriculus variegatus zijn in detail beschreven in Phipps et al. (1993) (1), Brunson et al. (1998) (2), ASTM (2000) (3), U.S. EPA (2000) (4). Hieronder wordt een korte samenvatting van deze omstandigheden gegeven. Een groot voordeel van L. variegatus is zijn snelle voortplanting, die leidt tot snel toenemende biomassa in populaties die in het laboratorium worden gekweekt (bv. (1), (3), (4), (5)).
De wormen kunnen worden gekweekt in grote aquaria (57-80 l) bij 23 °C met een 16 L:8 D fotoperiode (100-1 000 lx) en met natuurlijk water dat elke dag wordt ververst (45-50 l per aquarium). Het substraat wordt bereid door ongebleekte bruine papieren handdoeken in repen te knippen en deze enkele seconden te mengen met kweekwater, zodat kleine stukjes papiersubstraat ontstaan. Dit substraat kan direct in de kweekaquaria voor Lumbriculus worden gebruikt door de bodem van de bak ermee te bedekken, of het kan in gedeïoniseerd water worden ingevroren voor later gebruik. Nieuw substraat in de bak zal doorgaans een houdbaarheid van ongeveer twee maanden hebben.
Elke wormcultuur wordt begonnen met 500 tot 1 000 wormen en wordt 3 keer per week onder verversings- of doorstroomomstandigheden gevoed met een 10 ml-suspensie met 6 g startvoer voor forellen. Statische of semistatische culturen moeten een lagere dosering voer krijgen om bacterie- en schimmelgroei te voorkomen. .
Onder deze omstandigheden verdubbelt het aantal dieren in de cultuur doorgaans in ongeveer 10 tot 14 dagen.
Als alternatief kan Lumbriculus variegatus ook worden gekweekt in een systeem bestaande uit een laag kwartszand zoals gebruikt voor het kunstmatig sediment (1-2 cm dik), en synthetisch water. Als kweekvaten kunnen glazen of roestvrijstalen bakken met een hoogte van 12 tot 20 cm worden gebruikt. Het water moet voorzichtig worden belucht (bv. 2 bellen per seconde) via een pasteurpipet dat ongeveer 2 cm boven het sedimentoppervlak is geplaatst. Om ophoping van bv. ammoniak te voorkomen, moet het bovenstaande water worden ververst, hetzij via een doorstroomsysteem of, ten minste één keer per week, handmatig. De Oligochaetae kunnen worden gehouden bij kamertemperatuur met een fotoperiode van 16 uur licht (intensiteit 100 tot 1 000 lx) en 8 uur donker. In de semistatische kweek (waterverversing één keer per week) worden de wormen twee keer per week gevoerd met TetraMin (bv. 0,6-0,8 mg per cm2 sedimentoppervlak), dat kan worden toegediend als een suspensie van 50 mg TetraMin per ml gedeïoniseerd water.
Lumbriculus variegatus kan uit de culturen worden verwijderd door bv. substraat met fijnmazig gaas, of organismen met een gevuurpolijste glazen pipet met brede mond (diameter van ongeveer 5 mm) naar een aparte beker over te brengen. Als er ook substraat naar deze beker wordt overgebracht, moet de beker met daarin de wormen en het substraat een nacht onder doorstroomomstandigheden rusten, waardoor het substraat uit de beker zal verdwijnen, terwijl de wormen op de bodem van de beker zullen achterblijven. De wormen kunnen daarna in nieuw voorbereide kweekbakken worden geplaatst of voor de test verder worden verwerkt zoals uiteengezet in (3) en (4) of zoals hierna beschreven.
Een punt waar goed rekening mee moet worden gehouden bij gebruik van L. variegatus in sedimenttests, is de wijze van voortplanting van de soort (architomie of morphallaxis, bv. (6)). Deze aseksuele voortplanting leidt tot twee fragmenten, die gedurende enige tijd geen voedsel tot zich nemen, tot het kop- of staartdeel is geregenereerd (bv. (7), (8)). Dit betekent dat er in L. variegatus geen ononderbroken blootstelling via opname van verontreinigd sediment is.
Er moet daarom een synchronisatie plaatsvinden om ongecontroleerde voortplanting en regeneratie en latere hoge variatie in de testresultaten zoveel mogelijk te beperken. Een dergelijke grote variatie kan optreden wanneer sommige dieren die zich in stukken hebben gedeeld en dus gedurende enige tijd geen voer tot zich nemen, minder worden blootgesteld aan de teststof dan dieren die zich tijdens de test niet in stukken delen (9), (10), (11). 10 tot 14 dagen vóór het begin van de blootstelling moeten de wormen kunstmatig in stukken worden gedeeld (synchronisatie). Voor de synchronisatie moeten grote (volwassen) wormen worden geselecteerd die bij voorkeur geen tekenen van recente morphallaxis vertonen. Deze wormen kunnen op een glazen objectglaasje in een druppel kweekwater worden gelegd en met een scalpel in het middendeel van het lichaam in stukken worden gedeeld. Er dient op te worden gelet dat de achterste einden van gelijke grootte zijn. De achterste einden moeten vervolgens in een kweekvat met daarin hetzelfde substraat als gebruikt in de cultuur en hetzelfde synthethische water tot het begin van de blootstelling met rust gelaten worden om nieuwe koppen te regenereren. Wanneer de gesynchroniseerde wormen zich ingraven in het substraat, is dit een teken van regeneratie van nieuwe koppen (de aanwezigheid van geregenereerde koppen kan worden bevestigd door een representatieve steekproef onder een stereoscopische microscoop te inspecteren). De testorganismen zullen daarna naar verwacht in een vergelijkbare fysiologische toestand verkeren. Dit betekent dat, wanneer zich tijdens de test bij gesynchroniseerde wormen voortplanting door morphallaxis voordoet, vrijwel alle dieren naar verwacht in gelijke mate zullen zijn blootgesteld aan het verrijkte sediment. Het voeren van de gesynchroniseerde wormen dient één keer plaats te vinden, zodra de wormen zich in het substraat beginnen in te graven, of 7 dagen na de dissectie. Het voederregime moet vergelijkbaar zijn met dat van de reguliere culturen, maar het kan raadzaam zijn de gesynchroniseerde wormen dezelfde voedselbronnen te geven als in de test zullen worden gebruikt. De wormen moeten worden gehouden bij de testtemperatuur, bij 20 ± 2 °C. Na de regeneratieperiode moeten voor de test intacte, complete wormen worden gebruikt die na een voorzichtige mechanische stimulus actief zwemmen of kruipen. Verwondingen of autotomie van de wormen moeten worden voorkomen, bv. door voor het hanteren van deze wormen pipetten met gevuurpolijste randen of roestvrijstalen tandenstokers te gebruiken.
Bronnen van starterculturen voor Lumbriculus variegatus (adressen in de VS overgenomen uit (4))
|
Europa
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Duitsland
|
|
|
Bayer Crop Science AG
|
|
Development — Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Duitsland
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Box 111
|
|
FIN-80101 Joensuu
|
|
Finland
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Duitsland
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
Verenigde Staten
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
LITERATUUR
|
(1)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. & Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ. Toxicol. Chem. 12, 269-279.
|
|
(2)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(5)
|
Kukkonen, J. & Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(6)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(7)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(8)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(9)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, blz. 2000–2007.
|
|
(10)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(11)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
Aanhangsel 6
Samenvatting van de resultaten van de ringtest
„Toxiciteitstest voor Lumbriculus variegatus in sediment”
Tabel 1
Resultaten van afzonderlijke uitvoeringen van de ringtest: Gemiddelde aantal wormen in de controles en oplosmiddelcontroles aan het eind van de test; SD = standaarddeviatie; CV = variatiecoëfficiënt.
|
|
gemiddelde aantal wormen in de controles
|
SD
|
CV (%)
|
n
|
gemiddelde aantal wormen in de oplosmiddel-controles
|
SD
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
interlaboratoriumgemiddelde
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min.
|
16,3
|
|
|
|
15,0
|
|
|
|
|
max.
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Tabel 2
Resultaten van afzonderlijke uitvoeringen van de ringtest: Gemiddeld totaal drooggewicht van de wormen per replicaat in de controles en oplosmiddelcontroles aan het eind van de test; SD = standaarddeviatie; CV = variatiecoëfficiënt.
|
|
totaal droog-gewicht van wormen per replicaat (controles)
|
SD
|
CV (%)
|
n
|
totaal drooggewicht van wormen per replicaat (oplosmiddel-controles)
|
SD
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
Interlabora-torium-gemiddelde
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min.
|
12,9
|
|
|
|
10,5
|
|
|
|
|
max.
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Tabel 3
Toxiciteit van PCP: Samenvatting van de eindpunten in de ringtest; interlaboratoriumgemiddelden voor EC50, NOEC en LOEC; SD = standaarddeviatie; CV = variatiecoëfficiënt.
|
biologische parameter
|
|
Inter-laboratorium-gemiddelde (mg/kg)
|
min.
|
max.
|
Inter-labora-torium-factor
|
SD
|
CV (%)
|
Meet-kundig gemiddelde (mg/kg)
|
|
totaal aantal wormen
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
MDD %
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
totaal drooggewicht van wormen
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
MDD %
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
mortaliteit/overleving
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
voortplanting (toename aantal wormen per replicaat)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
MDD %
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
groei (toename biomassa per replicaat)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
MDD %
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
MDD: minimum detectable difference (kleinst detecteerbare verschil) van de controlewaarden tijdens het toetsen van een hypothese; gebruikt als maat voor het statistisch onderscheidingsvermogen
|
REFERENTIE
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
C.36 VOORTPLANTINGSTEST MET ROOFMIJTEN (HYPOASPIS (GEOLAELAPS) ACULEIFER) IN BODEM
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan testrichtlijn (TG) 226 (2008) van de OESO. De testmethode is opzet om de effecten van stoffen in de bodem op het voortplantingsresultaat van de in de bodem levende roofmijtensoort Hypoaspis (Geolaelaps) aculeifer Canestrini (Acari: Laelapidae) te beoordelen en zo de remming van de groei van de specifieke populatie te kunnen schatten (1, 2). Onder voortplantingsresultaat wordt hier verstaan het aantal nakomelingen aan het eind van de testperiode. H. aculeifer vertegenwoordigt een extra trofisch niveau naast dat van de soorten waarvoor al testmethoden beschikbaar zijn. Voor de toepassing van deze testmethode wordt een voortplantingstest zonder onderscheid tussen en kwantificering van de verschillende fasen van de voortplantingscyclus als toereikend beschouwd. Voor chemische stoffen met een ander blootstellingsscenario dan via de bodem kunnen andere benaderingen geschikt zijn (3).
|
|
2.
|
Hypoaspis (Geolaelaps) aculeifer wordt beschouwd als een relevante vertegenwoordiger van de bodemfauna en van de roofmijten in het bijzonder. De soort komt over de gehele wereld voor (5) en kan gemakkelijk worden verzameld en in een laboratorium worden grootgebracht. Aanhangsel 7 bevat een overzicht van de biologie van H. aculeifer. Achtergrondinformatie over de ecologie van de mijtensoort en het gebruik van de soort in ecotoxicologische tests is te vinden in (4), (5), (6), (7), (8), (9), (10), (11), (12).
|
PRINCIPE VAN DE TEST
|
3.
|
Volwassen vrouwelijke mijten worden blootgesteld aan een concentratiebereik van de teststof die door de grond is gemengd. De test wordt begonnen met 10 volwassen vrouwtjes per replicaatvat. Er worden in de test geen mannelijke mijten gebruikt, omdat de ervaring heeft geleerd dat vrouwtjes onmiddellijk of kort nadat ze uit het deutonymfstadium zijn gekomen, paren als er mannetjes aanwezig zijn. Wanneer mannetjes in de test zouden worden opgenomen, zou de test bovendien zoveel langer duren dat het noodzakelijk zou zijn het veeleisende onderscheid tussen de leeftijdsfasen te maken. Paring maakt zelf dus geen deel uit van de test. De vrouwtjes worden 28-35 dagen na het begin van de legperiode in de synchronisatie (zie aanhangsel 4) in de test gebracht, omdat dan mag worden aangenomen dat de vrouwtjes hebben gepaard en de pre-ovipositieperiode achter zich hebben. Bij 20 °C eindigt de test op dag 14 na de plaatsing van de vrouwtjes (dag 0), zodat de eerst controlenakomelingen het deutonymfstadium kunnen bereiken (zie aanhangsel 4). Als hoofdvariabelen worden het aantal nakomelingen per testvat en verder het aantal overlevende vrouwelijke mijten bepaald. Het voortplantingsresultaat van de mijten die zijn blootgesteld aan de teststof, wordt vergeleken met dat van de controles om de ECx (bv. EC10, EC50) of de concentratie waarbij geen effect wordt waargenomen (no observed effect concentration, NOEC) (zie aanhangsel 1 voor definities) te bepalen, afhankelijk van de testopzet (zie punt 29). In aanhangsel 8 wordt een overzicht van het testschema gegeven.
|
INFORMATIE OVER DE TESTSTOF
|
4.
|
Bij voorkeur zijn de oplosbaarheid in water, de log Kow, de grond/water-verdelingscoëfficiënt en de dampspanning van de teststof bekend. Aanvullende informatie over het lot van de teststof in de bodem, zoals de snelheid van de biotische en abiotische afbraak, is gewenst.
|
|
5.
|
Deze testmethode kan zowel voor in water oplosbare als voor in water onoplosbare stoffen worden gebruikt. De wijze van aanbrengen van de teststof zal echter verschillen. De testmethode is niet van toepassing op vluchtige stoffen, d.w.z. stoffen waarvoor de Henry-constante of de lucht/water-verdelingscoëfficiënt groter dan één is, of stoffen waarvoor de dampspanning bij 25 °C groter dan 0,0133 Pa is.
|
GELDIGHEID VAN DE TEST
|
6.
|
Wil het testresultaat geldig zijn, dan moet in de onbehandelde controlegroepen aan de volgende criteria worden voldaan:
|
—
|
De gemiddelde mortaliteit van volwassen vrouwelijke dieren mag aan het eind van de test niet hoger zijn dan 20 %.
|
|
—
|
Het gemiddelde aantal nakomelingen per replicaat (met 10 volwassen vrouwelijke dieren geplaatst) moet aan het eind van de test ten minste 50 zijn
|
|
—
|
De voor het aantal nakomelingen per replicaat berekende variatiecoëfficiënt mag aan het eind van de definitieve test niet hoger dan 30 % zijn.
|
|
REFERENTIESTOF
|
7.
|
De ECx en/of NOEC van een referentiestof moet worden bepaald om zekerheid te verkrijgen dat de testomstandigheden in het laboratorium toereikend zijn en om na te gaan dat de respons van de testorganismen in de loop van de tijd niet is gewijzigd. Dimethoaat (CAS 60-51-5) is een geschikte referentiestof waarvan bekend is dat deze de populatiegrootte beïnvloedt (4). Als alternatieve referentiestof kan boorzuur (CAS 10043-35-3) worden gebruikt. Met deze stof is minder ervaring opgedaan. Er zijn twee opzetten mogelijk:
|
—
|
De referentiestof kan worden getest tegelijk met de bepaling van de toxiciteit van elke teststof bij één bepaalde concentratie, waarvan vooraf in een dosis-responsonderzoek moet zijn aangetoond dat zij tot een afname van het aantal nakomelingen met > 50 % leidt. In dit geval moet het aantal replicaten gelijk zijn aan dat voor de controles (zie punt 29).
|
|
—
|
Als alternatief kan de referentiestof 1 of 2 keer per jaar in een dosis-responstest worden getest. Afhankelijk van de gekozen opzet, verschillen weliswaar het aantal concentraties en replicaten en de intervalsfactor (zie punt 29), maar moet toch een respons van 10 % tot 90 % effect worden bereikt (intervalsfactor van 1,8). De EC50 voor dimethoaat op basis van het aantal nakomelingen moet tussen 3,0 en 7,0 mg actieve stof/kg grond (drooggewicht) liggen. Op basis van de tot nu toe met boorzuur verkregen resultaten zou de EC50 voor boorzuur op basis van het aantal nakomelingen tussen 100 en 500 mg/kg grond (drooggewicht) moeten liggen.
|
|
BESCHRIJVING VAN DE TEST
Testvaten en apparatuur
|
8.
|
Er moeten testvaten worden gebruikt met een diameter van 3-5 cm (grondlaag van ≥1,5 cm dik), van glas of een ander chemisch inert materiaal en met een goed sluitende afsluiting. Een schroefdeksel heeft de voorkeur. In dat geval kunnen de vaten twee keer per week worden belucht. Als alternatief kunnen afsluitingen worden gebruikt die directe gasuitwisseling tussen het substraat en de omgeving toelaten (bv. gaas). Omdat het vochtgehalte tijdens de test voldoende hoog moet worden gehouden, is het van essentieel belang tijdens de test het gewicht van elk proefvat te controleren en, indien nodig, water aan te vullen. Dit kan in het bijzonder van belang zijn als geen schroefdeksels beschikbaar zijn. Als een niet-transparant testvat wordt gebruikt, moet de afsluiting zijn gemaakt van materiaal dat licht doorlaat (bv. een geperforeerd transparant deksel), maar verhindert dat de mijten ontsnappen. De grootte en het type van het testvat hangt af van de extractiemethode (zie aanhangsel 5 voor details). Als warmte-extractie direct op het vat wordt toegepast, kan een bodemgaas met een passende maaswijdte worden toegevoegd (afgesloten tot de extractie), en moet de dikte van de grondlaag voldoende zijn om een temperatuur en vochtigheidsgradiënt mogelijk te maken.
|
|
9.
|
Een standaard-laboratoriumuitrusting is vereist, in het bijzonder:
|
—
|
bij voorkeur glazen vaten met schroefdeksels;
|
|
—
|
borstels voor het overbrengen van de mijten;
|
|
—
|
geschikte nauwkeurige weegschalen;
|
|
—
|
adequate apparatuur voor temperatuurregeling;
|
|
—
|
adequate apparatuur voor luchtvochtigheidsregeling (niet noodzakelijk als de blootstellingsvaten worden afgedekt door een deksel);
|
|
—
|
incubator of kleine kast met temperatuurregeling;
|
|
—
|
uitrusting voor extractie (zie aanhangsel 5) (13).
|
|
—
|
aanstralend lichtpaneel met lichtregelaar;
|
|
—
|
verzamelpotten voor geëxtraheerde mijten.
|
|
Bereiding van de kunstmatige grond
|
10.
|
Voor deze test wordt een kunstmatige grond gebruikt. De kunstmatige grond bestaat uit de volgende bestanddelen (alle waarden gebaseerd op droge massa):
|
—
|
5 % veenmosturf, luchtdroog en fijngemalen (een deeltjesgrootte van 2 ± 1 mm is aanvaardbaar);
|
|
—
|
20 % kaolienklei (met bij voorkeur meer dan 30 % kaoliniet);
|
|
—
|
ongeveer 74 % luchtdroog industrieel zand (afhankelijk van de benodigde hoeveelheid CaCO3), overwegend bestaande uit fijn zand; meer dan 50 % van de deeltjes moet een grootte tussen 50 en 200 micron hebben. De exacte hoeveelheid zand hangt af van de hoeveelheid CaCO3 (zie hieronder); samen moeten ze 75 % vormen.
|
|
—
|
< 1,0 % calciumcarbonaat (CaCO3, verpulverd, analytisch zuiver) om een pH van 6,0 ± 0,5 te verkrijgen; de toe te voegen hoeveelheid calciumcarbonaat hangt in beginsel af van de kwaliteit/aard van de turf (zie noot 1).
|
Noot 1: De benodigde hoeveelheid CaCO3 zal afhangen van de bestanddelen van het grondsubstraat en moet worden bepaald door meting van de pH van gronddeelmonsters direct vóór de test (14).
Noot 2: Het turfgehalte van de kunstmatige grond wijkt af van dat in andere testmethoden met bodemorganismen, waarbij in de meeste gevallen 10 % turf wordt gebruikt (bv. (15)). Volgens de EPPO (16) heeft een typische landbouwbodem echter niet meer dan 5 % organisch materiaal, en de verlaging van het turfgehalte weerspiegelt dus de geringere mogelijkheden van een natuurlijke bodem tot adsorptie van de teststof aan organische koolstof.
Noot 3: Indien nodig, bv. voor specifieke testdoeleinden, kunnen natuurlijke gronden van niet-verontreinigde terreinen ook als test- en/of kweeksubstraat dienen. Als echter natuurlijke grond wordt gebruikt, moet deze worden gekarakteriseerd met ten minste de oorsprong (plaats van verzameling), pH, textuur (deeltjesgrootteverdeling) en gehalte aan organisch materiaal. Indien beschikbaar, moeten het type en de naam van de grond volgens de bodemclassificatie worden opgenomen, en de grond moet vrij zijn van verontreinigingen. In geval de teststof een metaal of organometaal is, moet ook de kationuitwisselingscapaciteit (CEC) van de natuurlijke grond worden bepaald. Er moet in het bijzonder op worden gelet dat aan de geldigheidscriteria wordt voldaan, want achtergrondinformatie over natuurlijke bodems is doorgaans zeldzaam.
|
|
11.
|
De droge bestanddelen van de grond worden grondig gemengd (bv. in een grote laboratoriummenger). Voor de bepaling van de pH moet een mengsel van grond en een oplossing van 1 M kaliumchloride (KCl) of 0,01 M calciumchloride (CaCl2) in een verhouding van 1:5 worden gebruikt (zie (14) en aanhangsel 3). Als de grond zuurder is dan het vereiste bereik (zie punt 10), kan de zuurgraad worden verlaagd door toevoeging van een passende hoeveelheid CaCO3. Als de grond te alkalisch is, kan hij worden aangepast door toevoeging van meer van het mengsel van de eerste drie bestanddelen die in punt 10 zijn genoemd, maar zonder de CaCO3.
|
|
12.
|
Het maximale waterhoudend vermogen (WHV) van de kunstmatige grond wordt bepaald overeenkomstig de procedures als beschreven in aanhangsel 2. Twee tot zeven dagen voor aanvang van de test wordt de droge kunstmatige grond vooraf bevochtigd door genoeg gedestilleerd of gedeïoniseerd water toe te voegen om ongeveer de helft van het uiteindelijke watergehalte te verkrijgen, d.w.z. 40 tot 60 % van WHVmax. Het vochtgehalte wordt aangepast tot 40-60 % van WHVmax door de oplossing van de teststof toe te voegen en/of gedestilleerd of gedeïoniseerd water toe te voegen (zie de punten 16-18). Een aanvullende ruwe controle van het vochtgehalte van de grond wordt verkregen door de grond lichtjes in de hand te knijpen. Als het vochtgehalte in orde is, moeten kleine druppels water tussen de vingers verschijnen.
|
|
13.
|
Het vochtgehalte van de grond wordt aan het begin en aan het eind van de test bepaald door droging tot een constant gewicht bij 105 °C overeenkomstig ISO 11465 (17), en de pH-waarde van de grond wordt bepaald overeenkomstig aanhangsel 3 of ISO 10390 (14). Deze metingen moeten worden uitgevoerd in aanvullende monsters zonder mijten, zowel van de controlegrond als van elke testconcentratiegrond. De pH-waarde van de grond mag niet worden aangepast wanneer zure of basische stoffen worden getest. Het vochtgehalte moet gedurende de gehele test worden bewaakt door de vaten periodiek te wegen (zie de punten 20 en 24).
|
Selectie en voorbereiding van de proefdieren
|
14.
|
De soort die in de test wordt gebruikt, is Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). Om met de test te beginnen zijn volwassen vrouwelijke mijten nodig die zijn verkregen uit een gesynchroniseerd cohort. De mijten moeten worden geplaatst circa 7-14 dagen nadat ze volwassen zijn geworden, 28-35 dagen na het begin van de leg in de synchronisatie (zie punt 3 en aanhangsel 4). De herkomst van de mijten of de leverancier en gegevens over de instandhouding van de laboratoriumcultuur moeten worden geregistreerd. Als een laboratoriumcultuur wordt gehouden, wordt aanbevolen de identiteit van de soort ten minste één keer per jaar te bevestigen. Een identificatieblad is opgenomen als aanhangsel 6.
|
Bereiding van testconcentraties
|
15.
|
De teststof wordt door de grond gemengd. Organische oplosmiddelen die als hulpstof worden gebruikt bij de behandeling van de grond met de teststof, moeten worden gekozen op basis van hun lage toxiciteit voor mijten, en in de testopzet moet een geschikte oplosmiddelcontrole worden opgenomen (zie punt 29).
|
In water oplosbare teststof
|
16.
|
Een oplossing van de teststof wordt in gedeïoniseerd water bereid in een hoeveelheid die voldoende is voor alle replicaten van één testconcentratie. Aanbevolen wordt een passende hoeveelheid water te gebruiken om het vereiste vochtgehalte te bereiken, d.w.z. 40 tot 60 % van WHVmax (zie punt 12). Elke oplossing van de teststof wordt grondig door één batch vooraf bevochtigde grond gemengd voordat de grond in het testvat wordt gedaan.
|
In water onoplosbare teststof
|
17.
|
Indien de teststof niet in water oplosbaar is, maar wel oplosbaar in organische oplosmiddelen, kan de teststof worden opgelost in een zo klein mogelijk volume van een geschikt organisch oplosmiddel (bv. aceton). Enkel vluchtige oplosmiddelen mogen worden gebruikt. Wanneer dergelijke oplosmiddelen worden gebruikt, moeten alle testconcentraties en de controle dezelfde minimale hoeveelheid van het oplosmiddel bevatten. Het oplosmiddel wordt op een kleine hoeveelheid, bv. 10 g, fijn kwartszand gespoten of daarmee vermengd. Het totale zandgehalte van het substraat moet voor deze hoeveelheid worden gecorrigeerd. Het oplosmiddel wordt verwijderd door het gedurende ten minste één uur in een afzuigkast te verdampen. Het mengsel van kwartszand en teststof wordt toegevoegd aan de vooraf bevochtigde grond en grondig gemengd na toevoeging van een passende hoeveelheid gedeïoniseerd water om het vereiste vochtgehalte te verkrijgen. Het uiteindelijke mengsel wordt in de testvaten gedaan. Er zij opgemerkt dat sommige oplosmiddelen een toxisch effect kunnen hebben op mijten. Het wordt daarom aanbevolen een extra watercontrole zonder oplosmiddel te gebruiken als het toxisch effect van het oplosmiddel op mijten niet bekend is. Als afdoend is aangetoond dat het oplosmiddel (in de toe te passen concentraties) geen effecten heeft, mag de watercontrole achterwege worden gelaten.
|
In water en organische oplosmiddelen slecht oplosbare teststof
|
18.
|
Voor chemische stoffen die slecht in water en in organische oplosmiddelen oplosbaar zijn, kan het equivalent van 2,5 g fijn gemalen kwartszand per testvat (bijvoorbeeld 10 g fijn kwartszand voor vier replicaten) worden gemengd met de hoeveelheid teststof die nodig is om de gewenste testconcentratie te verkrijgen. Het totale zandgehalte van het substraat moet voor deze hoeveelheid worden gecorrigeerd. Het mengsel van kwartszand en teststof wordt toegevoegd aan de vooraf bevochtigde grond en grondig gemengd na toevoeging van een passende hoeveelheid gedeïoniseerd water om het vereiste vochtgehalte te verkrijgen. Het uiteindelijke mengsel wordt verdeeld over de testvaten. De procedure wordt voor iedere testconcentratie herhaald en tevens wordt een passende controlegroep bereid.
|
PROCEDURE
Test-en controlegroepen
|
19.
|
Voor elk controlevat en behandelingsvat wordt aanbevolen tien volwassen vrouwelijke dieren in 20 g droge massa van de kunstige grond te gebruiken. De testorganismen moeten binnen twee uur na de bereiding van het definitieve testsubstraat (d.w.z. na aanbrenging van de teststof) worden geplaatst. In specifieke gevallen (bv. wanneer veroudering als een bepalende factor wordt beschouwd) kan de tijd tussen de bereiding van het definitieve testsubstraat en de plaatsing van de mijten worden verlengd (zie (18) voor gedetailleerde informatie over dergelijke veroudering). In dergelijke gevallen moet echter een wetenschappelijke onderbouwing worden gegeven.
|
|
20.
|
Nadat de mijten op de grond zijn geplaatst, worden ze gevoerd en moet het begingewicht van elk testvat worden bepaald, zodat dit gedurende de test als referentie kan dienen voor het bewaken van het vochtgehalte van de grond als beschreven in punt 24. De testvaten worden vervolgens afgesloten als beschreven in punt 8 en in de testruimte geplaatst.
|
|
21.
|
Voor elk van de aanbrengingsmethoden van de teststof worden passende controles bereid als beschreven in de punten 15 tot en met 18. Voor de voorbereiding van de controles worden de beschreven toepasselijke procedures gevolgd, zij het dat geen teststof wordt gevoegd. Voor zover van toepassing worden dus organische oplosmiddelen, kwartszand of andere media op de controles aangebracht in concentraties/hoeveelheden als in de behandelingen. Wanneer een oplosmiddel of ander medium wordt gebruikt om de teststof aan te brengen, moet ook een extra controle zonder het medium of de teststof worden voorbereid en getest in geval de toxiciteit van het medium niet bekend is (zie punt 17).
|
Testomstandigheden
|
22.
|
De testtemperatuur moet 20 ± 2 °C zijn. De temperatuur moet ten minste elke dag worden geregistreerd en, indien nodig, aangepast. De test wordt uitgevoerd bij gecontroleerde licht-donkercycli (bij voorkeur 16 uur licht en 8 uur donker) met een verlichting van 400 tot 800 lux in de nabijheid van de testvaten. Ten behoeve van de vergelijkbaarheid zijn deze omstandigheden dezelfde als in andere ecotoxicologische tests in bodems (bv. (15)).
|
|
23.
|
Indien schroefdeksels worden gebruikt, moet gasuitwisseling worden gewaarborgd door de testvaten ten minste twee keer per week te beluchten. Indien gaasafsluitingen worden gebruikt, moet bijzondere aandacht worden geschonken aan behoud van het vochtgehalte van de bodem (zie de punten 8 en 24).
|
|
24.
|
Het watergehalte van het grondsubstraat in de testvaten wordt gedurende de hele test op peil gehouden door de testvaten periodiek (bv. één keer per week) te wegen en, indien nodig, opnieuw water te geven. Het verloren vocht wordt, indien nodig, aangevuld met gedeïoniseerd water. Het vochtgehalte mag tijdens de test niet meer dan 10 % afwijken van de beginwaarde.
|
Voeding
|
25.
|
Er is aangetoond dat kaasmijten (Tyrophagus putrescentiae (Schrank, 1781)) een geschikte voedselbron zijn. Kleine collembola (springstaarten) (bv. jonge Folsomia candida Willem, 1902 of Onychiurus fimatus (19), (20), enchytreeën (bv. Enchytraeus crypticus Westheide & Graefe, 1992) of nematoden (rondwormen) (bv. Turbatrix silusiae de Man, 1913)) kunnen ook geschikt zijn (21). Het wordt aangeraden het voedsel te controleren voordat het in een test wordt gebruikt. Het type en de hoeveelheid voeding moet waarborgen dat er een toereikend aantal nakomelingen wordt geproduceerd om aan de geldigheidscriteria te voldoen (punt 6). Bij de keuze van de prooi-organismen moet rekening worden gehouden met het type werking van de teststof (een acaricide kan bv. ook een toxisch effect op de voedselmijten hebben, zie punt 26).
|
|
26.
|
Voeding moet ad libitum worden verstrekt, d.w.z. elke keer in een kleine hoeveelheid (punt van een spatel). Voor dit doel kan ook een afzuigventilator met geringe zuigkracht als voorgesteld in de collembolatest of een fijn penseel worden gebruikt. Doorgaans volstaat het om aan het begin van de test en daarna twee of drie keer per week voeding te verstrekken. Wanneer de teststof toxisch blijkt te zijn voor de prooi-organismen, moet een verhoogde dosering van de voeding en/of een alternatieve voedselbron worden overwogen.
|
Selectie van testconcentraties
|
27.
|
Wanneer er vooraf iets bekend is over de toxiciteit van de teststof, bijvoorbeeld uit bereikbepalingstests, kan dit nuttig zijn bij het kiezen van geschikte testconcentraties. Indien nodig wordt een bereikbepalingstest uitgevoerd met vijf teststofconcentraties in het bereik van 0,1 tot 1 000 mg/kg droge grond, met ten minste één replicaat voor behandelingen en controle. De duur van de bereikbepalingstest is 14 dagen, waarna de mortaliteit van de volwassen mijten en het aantal nakomelingen worden bepaald. Het concentratiebereik in de definitieve test moet bij voorkeur zo worden gekozen dat het de concentraties omvat waarbij een effect op het aantal nakomelingen optreedt, maar de overleving van de moedergeneratie niet wordt beïnvloed. Voor stoffen die bij vrijwel dezelfde concentraties letale en subletale effecten hebben, kan dit echter onmogelijk zijn. De in de test gebruikte concentraties moeten de effectconcentratie (bv. EC50, EC25, EC10) en het concentratiebereik waarbinnen het effect van de teststof van belang is, omvatten. Extrapolaties ver onder de laagste concentratie die van invloed is op de testorganismen, of ver boven de hoogste geteste concentratie moeten uitsluitend in uitzonderlijke gevallen worden uitgevoerd, en in het verslag moet een volledige toelichting worden gegeven.
|
Proefopzet
Dosis-responstests
|
28.
|
Op basis van de aanbevelingen voortvloeiende uit een andere ringtest (voortplantingstest met Enchytraeidae (22)) worden drie testopzetten voorgesteld. De algemene geschiktheid van al deze opzetten werd bevestigd door de uitkomst van een validatie met H. aculeifer.
|
|
29.
|
Bij de vaststelling van het concentratiebereik moet aandacht worden geschonken aan het volgende:
|
—
|
Voor de bepaling van de ECx (bv. EC10, EC50), moeten twaalf concentraties worden getest. Aanbevolen wordt ten minste twee replicaten voor elke testconcentratie plus zes controles te gebruiken. De intervalsfactor kan variëren, d.w.z. kleiner dan of gelijk aan 1,8 in het verwachte effectbereik en groter dan 1,8 bij de hogere en lagere concentraties.
|
|
—
|
Voor de bepaling van de NOEC moeten ten minste vijf concentraties worden getest die een meetkundige reeks vormen. Aanbevolen wordt vier replicaten voor elke testconcentratie plus acht controles te gebruiken. De concentraties moeten worden gekozen met intervallen die onderling verschillen met een factor van niet meer dan 2,0.
|
|
—
|
Een gecombineerde aanpak maakt het mogelijk om zowel de NOEC als ECx te bepalen. Er moeten acht behandelingsconcentraties die een meetkundige reeks vormen, worden gebruikt. Aanbevolen wordt vier replicaten voor iedere behandeling plus acht controles te gebruiken. De concentraties moeten worden gekozen met intervallen die onderling verschillen met een factor van niet meer dan 1,8.
|
|
Limiettest
|
30.
|
Als bij de hoogste concentratie in de bereikbepalingstest (d.w.z. 1 000 mg/kg drooggewicht grond) geen effecten worden waargenomen, kan de definitieve voortplantingstest worden uitgevoerd als een limiettest, waarbij 1 000 mg/kg drooggewicht grond als testconcentratie wordt gebruikt. Een limiettest biedt de mogelijkheid om aan te tonen dat de NOEC of de EC10 voor de voortplanting groter is dan de hoogste concentratie, en het aantal gebruikte mijten in de test tot een minimum te beperken. Er moeten acht replicaten worden gebruikt voor zowel de behandelde grond als de controle.
|
Testduur en metingen
|
31.
|
Alle waargenomen verschillen tussen het gedrag en de morfologie van de mijten in de controle en van die in de behandelde vaten moeten worden geregistreerd.
|
|
32.
|
Op dag 14 worden de overlevende mijten uit de grond geëxtraheerd door warmte/licht-extractie of via een andere passende methode (zie aanhangsel 5). De aantallen nakomelingen (d.w.z. larven, protonymfen en deutonymfen) en volwassen mijten worden apart geteld. Alle volwassen mijten die op dit moment niet worden aangetroffen, moeten als dood worden geregistreerd, omdat moet worden aangenomen dat deze mijten vóór de beoordeling zijn overleden en ontbonden. De efficiëntie van de extractie moet een of twee keer per jaar worden gevalideerd in controles met bekende aantallen volwassen en jonge dieren. De gecombineerde efficiëntie voor alle ontwikkelingsstadia moet gemiddeld groter dan 90 % zijn (zie aanhangsel 5). De tellingen van de volwassen dieren en jonge dieren worden niet gecorrigeerd voor de efficiëntie.
|
GEGEVENS EN RAPPORTAGE
Verwerking van de resultaten
|
33.
|
De punten 36 tot en met 41 bevatten informatie over de statistische methoden die kunnen worden gebruikt voor de analyse van de testresultaten. Daarnaast moet document 54 van de OESO, „Current Approaches in the Statistical Analysis of Ecotoxicity Data: Guidance to Application” (31), worden geraadpleegd.
|
|
34.
|
Het belangrijkste eindpunt van de test is het voortplantingsresultaat, dat hier het aantal geproduceerde nakomelingen per replicaattestvat is (bij 10 geplaatste volwassen vrouwelijke dieren). De statistische analyse vereist dat het rekenkundig gemiddelde (X) en de variantie (s2) voor het voortplantingsresultaat per behandeling en per controle worden berekend. X en s2 worden gebruikt voor ANOVA-procedures zoals de t-toets, toets van Dunnett of Williams-toets alsook voor de berekening van 95 %-betrouwbaarheidsintervallen.
Noot: Dit belangrijkste eindpunt is gelijk aan de vruchtbaarheid gemeten als het aantal levende jonge dieren dat tijdens de test is voortgebracht, gedeeld door het aantal ouderdieren dat aan het begin van de test is geplaatst.
|
|
35.
|
Het aantal overlevende vrouwelijke dieren in de onbehandelde controles is een belangrijk geldigheidscriterium en moet worden gedocumenteerd. Net als in de bereikbepalingstest moeten ook alle andere schadelijke tekenen in het eindverslag worden geregistreerd.
|
ECx
|
36.
|
ECx-waarden en de bijbehorende onder- en bovengrens van het 95 %-betrouwbaarheidsinterval voor de in punt 34 beschreven parameter worden berekend met behulp van passende statistische methoden (bv. probit-analyse, logistische of Weibull-functie, getrimde Spearman-Karber-methode of eenvoudige interpolatie). Een ECx wordt verkregen door de waarde die correspondeert met x % van het controlegemiddelde in de gevonden vergelijking in te vullen. Voor de berekening van de EC50 of een andere ECx kunnen de gemiddelden (X) per behandeling worden onderworpen aan een regressieanalyse.
|
NOEC/LOEC
|
37.
|
Als het doel van een statistische analyse is de NOEC/LOEC te bepalen, zijn statistieken per vat nodig (individuele vaten worden als replicaten beschouwd). Er moeten passende statistische methoden worden gebruikt (conform document 54 van de OESO, „Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application”). In het algemeen worden schadelijke effecten van de teststof ten opzichte van de controle onderzocht met een toets voor een eenzijdige (kleinere) nulhypothese bij p ≤ 0,05. In de onderstaande punten worden voorbeelden gegeven.
|
|
38.
|
Een normale verdeling van gegevens kan worden getoetst met bv. de Kolmogorov-Smirnovtoets voor goodness-of-fit, de toets op het quotiënt van het bereik en de standaarddeviatie ('Range to standard deviation ratio'-toets) of de Shapiro-Wilk-toets (tweezijdig, p ≤ 0,05). De Cochran-toets, Levene-toets of Bartlett-toets (tweezijdig, p ≤ 0,05) kunnen worden gebruikt om op homogeniteit van variantie te toetsen. Als aan de voorwaarden van parametrische toetsprocedures (normaliteit, homogeniteit van variantie) is voldaan, kunnen een éénwegs variantieanalyse (ANOVA, One-way Analysis of Variance) en daaropvolgende toetsen voor meervoudige vergelijkingen worden uitgevoerd. Toetsen voor meervoudige vergelijkingen (bv. t-toets van Dunnett) of stap-omlaag-trendtoetsen (bv. Williams-toets in geval van een monotone dosis-responsrelatie) kunnen worden gebruikt om na te gaan of er significante verschillen (p ≤ 0,05) zijn tussen de controles en de verschillende concentraties van de teststof (selectie van de aanbevolen toets overeenkomstig document 54 van de OESO, „Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application”). Anders moeten verdelingsvrije toetsen (bv. Bonferroni-toets volgens Holm of de Jonckheere-Terpstra-trendtoets) worden gebruikt om de NOEC en LOEC te bepalen.
|
Limiettest
|
39.
|
Als een limiettest (vergelijking van de controle en slechts één behandeling) is uitgevoerd en er is voldaan aan de voorwaarden van parametrische toetsprocedures (normaliteit, homogeniteit), kunnen metrische responsen worden geëvalueerd met de t-toets. Als niet aan die voorwaarden wordt voldaan, kan de t-toets voor ongelijke varianties (Welch-toets) of een verdelingsvrije toets, zoals de Mann-Whitney-toets, worden gebruikt.
|
|
40.
|
Om significante verschillen tussen de controles (controle en oplosmiddelcontrole) vast te stellen, kunnen de replicaten van de beide controles worden getoetst als beschreven voor de limiettest. Als uit deze toetsen geen significante verschillen naar voren komen, mogen alle replicaten van de controle en oplosmiddelcontrole worden gepoold. Anders dienen alle behandelingen te worden vergeleken met de oplosmiddelcontrole.
|
Testverslag
|
41.
|
In het testverslag moet ten minste de volgende informatie worden opgenomen:
|
—
|
Teststof
|
—
|
de identificatie van de teststof, naam, batch, partij en CAS-nummer, zuiverheid;
|
|
—
|
fysisch-chemische eigenschappen van de teststof (bv. log Kow, oplosbaarheid in water, dampspanning, Henry-constante (H) en bij voorkeur informatie over het lot van de teststof in de bodem).
|
|
|
—
|
Testorganismen
|
—
|
identificatie en leverancier van de testorganismen, beschrijving van de kweekomstandigheden;
|
|
—
|
leeftijdsbereik van de testorganismen.
|
|
|
—
|
Testomstandigheden
|
—
|
beschrijving van de testopzet en procedure;
|
|
—
|
gegevens over de voorbereiding van de testgrond; gedetailleerde specificatie als natuurlijke grond wordt gebruikt (oorsprong, geschiedenis, deeltjesgrootteverdeling, pH, gehalte organische materialen en, indien beschikbaar, de bodemclassificatie);
|
|
—
|
het maximale waterhoudend vermogen van de grond;
|
|
—
|
een beschrijving van de techniek die is gebruik voor het aanbrengen van de teststof op de grond;
|
|
—
|
gedetailleerde gegevens over hulpstoffen gebruikt bij de toediening van de teststof;
|
|
—
|
grootte van de testvaten en de droge massa van de testgrond per vat;
|
|
—
|
testomstandigheden: lichtintensiteit, duur van licht-donkercycli, temperatuur;
|
|
—
|
een beschrijving van het voedingsschema, het type en de hoeveelheid voedsel dat in de test is gebruikt, voedingsdatums;
|
|
—
|
de pH en het watergehalte van de grond aan het begin en tijdens de test (voor de controle en alle behandelingen);
|
|
—
|
gedetailleerde beschrijving van de extractiemethode en de efficiëntie van de extractie.
|
|
|
—
|
Testresultaten
|
—
|
het aantal nakomelingen in elk testvat dat aan het eind van de test is bepaald;
|
|
—
|
het aantal volwassen vrouwelijke dieren en de mortaliteit van de volwassen dieren ( %) in elk testvat aan het eind van de test;
|
|
—
|
een beschrijving van de zichtbare symptomen of opvallende veranderingen in het gedrag;
|
|
—
|
de resultaten verkregen met de referentieteststof;
|
|
—
|
samenvattende statistieken (ECx en/of NOEC ), met inbegrip van 95 %-betrouwbaarheidsgrenzen en een beschrijving van de berekeningsmethode;
|
|
—
|
een grafiek van de concentratie-responsrelatie;
|
|
—
|
afwijkingen van de procedures beschreven in deze testmethode en alle ongebruikelijke voorvallen tijdens de test.
|
|
|
LITERATUUR
|
(1)
|
Casanueva, M.E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21-46.
|
|
(2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259-274.
|
|
(3)
|
Bakker, F.M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. & van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS — Journal of Soils and Sediments 3, 73-77.
|
|
(4)
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. 2nd edition. In: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 blz.
|
|
(5)
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the popualation development of Hypoaspis aculeifer (Acari: Parasitiformes). In: F. Dusbabek & V. Bukva (eds.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487-492
|
|
(6)
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: blz. 241-249.
|
|
(7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: blz. 621-628.
|
|
(8)
|
Krogh, P.H. & Axelsen, J.A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. In: Lokke, H. & van Gestel, C.A.M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, blz. 239-251.
|
|
(9)
|
Løkke, H., Janssen, C.R., Lanno, R.P., Römbke, J., Rundgren, S. & Van Straalen, N.M. (2002). Soil Toxicity Tests — Invertebrates. In: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P.W., Van Straalen, N.M. & Tarazona, J.V. (eds.). SETAC Press, Pensacola, USA. 128 pp.
|
|
(10)
|
Schlosser, H.-J. & Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395-433.
|
|
(11)
|
Schlosser, H.-J. & Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413-433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K. & Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154-7157.
|
|
(13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95-122.
|
|
(14)
|
ISO (International Organization for Standardization) (1994). Soil Quality — Determination of pH, No. 10390. ISO, Geneve.
|
|
(15)
|
Hoofdstuk C.8 van deze bijlage — Toxiciteit voor regenwormen..
|
|
(16)
|
EPPO (2003). Norm Environmental risk assessment scheme for plant protection products. Hoofdstuk 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195-209.
|
|
(17)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis — Gravimetric method, No. 11465. ISO, Geneve.
|
|
(18)
|
Fairbrother, A., Glazebrock, P.W., Van Straalen, N.M. & Tarazona, J.V. 2002. Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, USA.
|
|
(19)
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges. allg. angew. Ent. 3:122-125.
|
|
(20)
|
Schlosser, H.J. & Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool. Beitr. N.F. 34(3):395-433.
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. & Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130-135.
|
|
(22)
|
Hoofdstuk C.32 van deze bijlage — Voortplantingstest met Enchytraeidae.
|
|
(23)
|
ISO (International Organization for Standardization) (1994). Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(24)
|
Southwood, T.R.E. (1991). Ecological methods. With particular reference to the study of insect populations. (2nd ed.). Chapman & Hall, London, 524 blz.
|
|
(25)
|
Dunger, W. & Fiedler, H.J. (1997). Methoden der Bodenbiologie (2nd ed.). G. Fischer, Jena, 539 blz.
|
|
(26)
|
Lesna, I. & Sabelis, M.W. (1999). Diet-dependent female choice for males with „good genes” in a soil predatory mite. Nature 401, 581-583.
|
|
(27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103-107.
|
|
(28)
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
(29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11-59.
|
|
(30)
|
Kevan, D.K. McE. & Sharma, G.D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647-658.
|
|
(31)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
Aanhangsel 1
Definities
Voor de toepassing van deze testmethode worden de volgende definities gehanteerd (in deze test worden alle effectconcentraties uitgedrukt als massa van de teststof per droge massa van de testgrond):
|
|
Stof betekent een substantie of mengsel.
|
|
|
NOEC (No Observed Effect Concentration) is de hoogste concentratie van de teststof waarbij geen effect wordt waargenomen. In deze test heeft de concentratie die overeenkomt met de NOEC geen statistisch significant effect (p < 0,05) binnen een bepaalde blootstellingsperiode in vergelijking met de controle.
|
|
|
LOEC (Lowest Observed Effect Concentration) is de laagste concentratie van de teststof die binnen een bepaalde blootstellingstijd tot een statistisch significant effect (p < 0,05) leidt in vergelijking met de controle.
|
|
|
ECx
(Effect concentration for x % effect) is de concentratie die binnen een bepaalde blootstellingstijd x % van een effect op testorganismen veroorzaakt ten opzichte van een controle. De EC50 is bijvoorbeeld de geschatte concentratie die gedurende een bepaalde blootstellingsperiode bij 50 % van een blootgestelde populatie een effect op een testeindpunt zal hebben.
|
|
|
Teststof betekent alle volgens deze testmethode geteste stoffen en mengsels.
|
Aanhangsel 2
Bepaling van het maximale waterhoudend vermogen van de grond
De volgende methode voor de bepaling van het maximale waterhoudend vermogen van de grond wordt geschikt geacht. Zij is beschreven in bijlage C van ISO DIS 11268-2 („Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction” (23)).
Verzamel met een geschikt bemonsteringsapparaat (grondboorbuis enz.) een vastgestelde hoeveelheid van het testgrondsubstraat (bv. 5 g). Bedek de onderkant van de buis met een stuk filterpapier, vul een waterbad en plaats de buis op een rek in het bad. De buis zou geleidelijk onder water moeten komen te staan, tot het water de bovenkant van de grond bereikt. Laat de buis gedurende ongeveer drie uur in het water. Niet alle water dat door de bodemcapillairen wordt geabsorbeerd, kan worden vastgehouden. Laat het grondmonster daarom gedurende twee uur uitlekken door de buis op een bed van zeer nat fijngemalen kwartszand in een afgesloten vat te plaatsen (om droging te voorkomen). Het monster moet vervolgens worden gewogen, gedroogd tot een constante massa bij 105 °C. Het waterhoudend vermogen (WHV) kan vervolgens als volgt worden berekend:

waarbij:
S= met water verzadigd substraat + massa van buis + massa van filterpapier
T= leeggewicht (massa van buis + massa van filterpapier)
D= droge massa van substraat
Aanhangsel 3
Bepaling van de pH van de grond
De volgende methode voor het bepalen van de pH van een grondmonster is gebaseerd op de beschrijving in ISO DIS 10390: Bodemkwaliteit — Bepaling van de pH-waarde (16).
Een vastgestelde hoeveelheid grond wordt gedurende ten minste 12 uur bij kamertemperatuur gedroogd. Vervolgens wordt een suspensie van de grond (die ten minste 5 g grond bevat) gemaakt in vijf keer zijn volume van hetzij een 1 M-oplossing analytisch zuiver kaliumchloride (KCl) of een 0,01 M-oplossing van analytisch zuiver calciumchloride (CaCl2). De suspensie wordt daarna vijf minuten goed geschud. Na het schudden krijgt de suspensie ten minste 2 uur, maar niet langer dan 24 uur, gelegenheid om te bezinken. Daarna wordt de pH van de vloeibare fase gemeten met een pH-meter die vóór elke meting is geijkt met een passende reeks bufferoplossingen (bv. pH 4,0 en 7,0).
Aanhangsel 4
Kweken van Hypoaspis (Geolaelaps) aculeifer, voedselmijten en synchronisatie van cultuur
Kweken van Hypoaspis (Geolaelaps) aculeifer:
Culturen kunnen worden gehouden in plastic vaten of glazen potten gevuld met een mengsel van pleisterkalk en houtskoolpoeder (verhouding 9:1). De pleisterkalk kan vochtig worden gehouden door, indien nodig, enkele druppels gedestilleerd of gedeïoniseerd water toe te voegen. De optimale kweektemperatuur is 20 ± 2 °C, en het licht/donker-regime is voor deze soort niet van belang. Als prooi-organismen kunnen Typrophagus putrescentiae of Caloglyphus sp. mijten worden gebruikt (met voedselmijten moet voorzichtigheid worden betracht, omdat ze bij mensen allergieën kunnen veroorzaken), maar nematoden, enchytreeën en collembola zijn ook geschikt als prooi. Hun herkomst moet worden geregistreerd. De ontwikkeling van een populatie kan beginnen met één enkel vrouwelijk dier, want de mannetjes ontwikkelen zich in niet-bevruchte eitjes. De generaties overlappen elkaar grotendeels. Een vrouwtje kan ten minste 100 dagen oud worden en kan tijdens haar leven ongeveer 100 eitjes leggen. Tussen 10 en 40 dagen na het bereiken van het volwassen stadium wordt met 2,2 eitjes per vrouwtje per dag de piek van de leg bereikt. De ontwikkeltijd van eitje tot volwassen vrouwelijk dier is bij 20 °C ongeveer 20 dagen. Er moet meer dan één cultuur in stand worden gehouden en als reserve worden aangehouden.
Kweken van Typrophagus putrescentiae:
De mijten worden gehouden in een glazen vat gevuld met fijn brouwersgistpoeder dat in een plastic emmer gevuld met KNO3-oplossing wordt geplaatst om ontsnappen te voorkomen. De voedselmijten worden op dit poeder geplaatst. Daarna worden ze met een spatel voorzichtig door het poeder gemengd (dat twee keer per week moet worden vervangen).
Synchronisatie van de cultuur:
Exemplaren die in de test worden gebruikt, moeten van vergelijkbare leeftijd zijn (ca. 7 dagen na het bereiken van het volwassen stadium). Bij een kweektemperatuur van 20 °C wordt dit bereikt door
Vrouwtjes over te brengen naar een schoon kweekvat en voldoende voedsel toe te voegen
|
—
|
Geef de vrouwtjes twee tot drie dagen gelegenheid om eitjes te leggen, en verwijder daarna de vrouwtjes
|
|
—
|
Neem voor de test tussen dag 28 en dag 35 na het begin volwassen vrouwtjes uit het vat en plaats ze in schone kweekvaten.
|
Volwassen vrouwtjes zijn gemakkelijk te onderscheiden van mannetjes en andere ontwikkelingsstadia door hun grotere afmetingen, opgeblazen vorm en bruine dorsale schild (mannetjes zijn slanker en plat, onvolwassen dieren zijn wit tot crèmekleurig). De ontwikkeling van de mijten verloopt bij 20 °C ongeveer volgens het hieronder beschreven patroon (figuur): Eitje 5d, Larve 2d, Protonymf 5d, Deutonymf 7d, pre-ovipositieperiode van het vrouwtje 2d. Daarna zijn de mijten volwassen.
Figuur
Ontwikkeling van Hypoaspis (Geolaelaps) aculeifer bij 20 °C. ('verwijdering' = verwijdering van vrouwtjes die voor de test worden gebruikt)
De volwassen testdieren worden tussen dag 28 en dag 35, nadat de moederdieren zijn begonnen met eitjes leggen (d.w.z. 7-14 dagen nadat ze het volwassen stadium hebben bereikt), uit de gesynchroniseerde cultuur verwijderd en in de testvaten geplaatst. Dit waarborgt dat de testdieren hun pre-ovipositieperiode al achter de rug hebben en hebben gepaard met mannetjes die ook in het kweekvat aanwezig zijn. Waarnemingen in laboratoriumculturen wijzen erop dat vrouwtjes onmiddellijk of kort na het bereiken van het volwassen stadium paren als er mannetjes aanwezig zijn (Ruf, Vaninnen, persoonlijke waarnemingen). De periode van zeven dagen is gekozen om de integratie in de laboratoriumroutine te vergemakkelijken en om een buffer te vormen voor variabiliteit in de individuele ontwikkeling van de mijten. De ovipositie moet worden aangevangen met ten minste hetzelfde aantal vrouwtjes als uiteindelijk benodigd is voor de test. (Als in de test bijvoorbeeld 400 vrouwtjes benodigd zijn, moeten ten minste 400 vrouwtjes twee tot drie dagen gelegenheid krijgen om eitjes te leggen. Het uitgangspunt voor de gesynchroniseerde populatie is ten minste 1 200 eitjes (sekse-ratio ca. 0,5, mortaliteit ca. 0,2). Om kannibalisme te voorkomen, is het handiger om niet meer dan 20 tot 30 eitjes leggende vrouwtjes in één vat te houden.
Aanhangsel 5
Extractiemethoden
Voor microgeleedpotigen is een warmtebehandeling een geschikte methode om exemplaren van de grond/het substraat te scheiden (zie onderstaande figuur). De methode is gebaseerd op de activiteit van de organismen, dus alleen mobiele exemplaren maken kans om te worden geregistreerd. Het beginsel van warmte-extractie is dat de omstandigheden voor de organismen in het monster geleidelijk slechter worden gemaakt, zodat ze het substraat zullen verlaten en in een fixeervloeistof vallen (bv. ethanol). Cruciale punten zijn de duur van de extractie en de gradiënt van goede naar matige naar slechte omstandigheden voor de organismen. De duur van de extractie voor ecotoxicologische tests moet zo kort mogelijk zijn, omdat elke populatiegroei tijdens de extractie de resultaten vertekent. Aan de andere kant moeten de temperatuur- en vochtigheidsomstandigheden in het monster altijd binnen een bereik liggen dat de mijten in staat stelt te bewegen. De verwarming van een grondmonster leidt tot uitdroging van het substraat. Als de uitdroging te snel plaatsvindt, kunnen ook sommige mijten uitdrogen voordat ze erin slagen te ontsnappen.
Daarom wordt de volgende procedure voorgesteld (24) (25):
|
|
Apparatuur Tullgren-trechter of vergelijkbare methoden zoals bv. McFadyen (verwarming van boven, het monster wordt boven een trechter geplaatst)
|
|
|
Verwarmingsregime: 25 °C gedurende 12 uur, 35 °C gedurende 12 uur, 45 °C gedurende 24 uur (in totaal 48 uur). De temperatuur moeten in het substraat worden gemeten.
|
|
|
Fixatievloeistof: 70 % ethanol
|
|
|
Details vismachtiging: Neem een glazen fles die voor de test is gebruikt. Verwijder het deksel en wikkel een stuk gaas of stof om de halsopening. De stof moet een maaswijdte van 1,0 tot 1,5 mm hebben. Zet de stof vast met een elastische band. Draai de fles voorzichtig op zijn kop en plaats hem in het extractieapparaat. De stof verhindert dat het substraat in de fixatievloeistof druppelt, maar laat wel toe dat mijten het monster verlaten. Begin het verwarmingsproces pas wanneer alle flessen zijn geplaatst. Beëindig de extractie na 48 uur. Verwijder de fixatie van de flessen en tel de mijten met behulp van een stereomicroscoop.
|
De efficiëntie van de gekozen extractiemethode moet één of twee keer per jaar zijn bepaald met vaten die een bekend aantal jonge mijten en volwassen mijten bevatten die in onbehandeld testsubstraat worden gehouden. De gecombineerde efficiëntie voor alle ontwikkelingsstadia moet gemiddeld groter dan 90 % zijn.
Tullgren-achtig extractieapparaat

Wijze van voorbereiden van de testfles na beëindiging van de test, vóór de extractie
Aanhangsel 6
Identificatie van Hypoaspis (Geolaelaps) aculeifer
|
Onderklasse/klasse/onderorde:
|
|
Familie:
|
|
Geslacht/ondergeslacht/soort:
|
|
Acari/Parasitiformes/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Auteur en datum:
|
F. Faraji, Ph.D. (MITOX), 23 januari 2007
|
|
Geraadpleegde literatuur:
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, 2e herziene editie: 1-523.
Hughes, A.M. (1976). The mites of stored food and houses. Ministry of Agriculture, Fisheries and Food, Technical Bulletin 9: 400 blz.
Krantz, G.W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 blz.
|
|
Deterministische kenmerken:
|
Tectum met afgeronde getande rand; hypostomale groeven met meer dan 6 dentikels; caudale dorsale setae van Z4 niet erg lang; dorsale setae borstelvormig; genitaal schild normaal, niet erg vergroot en reikt niet tot het anaal schild; achterste helft van dorsaal schild zonder ongepaarde setae; poten II en IV met enkele dikke macrosetae; dorsale seta Z5 ongeveer twee keer zo groot als J5; vaste vingers van cheliceren met 12-14-tanden en beweegbare vinger met 2 tanden; idiosoma 520-685 μm lang.
Hypoaspis miles wordt ook gebruikt in biologische bestrijding en wordt soms verward met H. aculeifer. Het belangrijkste verschil is:
H. miles behoort tot het ondergeslacht Cosmolaelaps en heeft mesachtige dorsale setae, terwijl H. aculeifer tot het ondergeslacht Geolaelaps behoort en borstelvormige dorsale setae heeft.
|

Aanhangsel 7
Basisinformatie over de biologie van Hypoaspis (Geolaelaps) aculeifer
Hypoaspis aculeifer behoort tot de familie van de Lealapidae, orde Acari (mijten), klasse Arachnida, tak Arthropoda. Ze komen voor in allerlei soorten grond en voeden zich met andere mijten, nematoden, enchytreeën en collembola (26). Bij voedseltekort stappen ze over op kannibalisme (27). Roofmijten zijn gesegmenteerd in een idiosoma en gnathosoma. Een duidelijke differentiatie van het idiosoma in een prosoma (kopborststuk) en opisthosoma (achterlijf) ontbreekt. Het gnathosoma (hoofdschild) bevat de instrumenten om te eten, zoals palpen (tasters) en cheliceren. De cheliceren zijn in drieën gevorkt en hebben tanden van verschillende vorm. Behalve voor de opname van voedsel gebruiken de mannetjes hun cheliceren hoofdzakelijk om de spermatoforen naar de vrouwtjes over te brengen. Een dorsaal schild bedekt het idiosoma vrijwel volledig. Een groot deel van het idiosoma van vrouwtjes wordt in beslag genomen door de voortplantingsorganen, die met name kort voor de afzetting van eitjes duidelijk herkenbaar is. Er zijn twee schilden aan de buikzijde, het sternale schild en het genitale schild. Alle poten zijn voorzien van borstelharen en doornen. De borstelharen worden door de dieren gebruikt om zich vast te grijpen wanneer ze zich in of op de grond voortbewegen. Het eerste paar poten wordt hoofdzakelijk als antenne gebruikt. Het tweede paar poten wordt niet alleen gebruikt voor de voortbeweging, maar ook om prooien vast te grijpen. De doornen van het vierde paar poten kunnen als bescherming en als 'voortbewegingsmotor' dienen (28). Mannetjes zijn 0,55 tot 0,65 mm lang en wegen 10 tot 15 μg. Vrouwtjes zijn 0,8 tot 0,9 mm lang en wegen 50 tot 60 μg (8) (28) (figuur 1).
Figuur 1
Vrouwtje, mannetje, protonymf en larve van H. aculeifer.

Bij 23 °C worden de mijten seksueel rijp na respectievelijk 16 dagen (vrouwtjes) en 18 dagen (mannetjes) (6). De vrouwtjes brengen de zaadcellen via de solenostom over naar het ovarium. In het ovarium rijpen de zaadcellen en worden ze opgeslagen. Bevruchting vindt pas plaats wanneer de zaadcellen in het ovarium rijp zijn. De bevruchte of onbevruchte eitjes worden door de vrouwtjes afgezet in klompjes of apart, bij voorkeur in spleten of holen. Vrouwtjes die hebben gepaard, kunnen nakomelingen van beide seksen voortbrengen, terwijl uit eitjes van vrouwtjes die niet hebben gepaard, uitsluitend mannelijke nakomelingen komen. Tijdens de ontwikkeling tot volwassen dier worden vier ontwikkelingsstadia doorlopen (eitje — larve, larve — protonymf, protonymf — deutonymf en deutonymf — volwassen dier).
Het eitje is melkwit, glasachtig, elliptisch en ongeveer 0,37 mm lang met een stevige mantel. Volgens (8) zijn de larven 0,42 tot 0,45 mm groot. Ze hebben slechts drie paar poten. In het kopgedeelte worden palpen (tasters) en cheliceren ontwikkeld. De cheliceren, die een paar kleine dentikels hebben, worden gebruikt om uit het eitje te komen. Na de eerste vervelling, 1 tot 2 dagen na het uitkomen, worden de protonymfen ontwikkeld. Deze zijn ook wit, hebben een grootte van 0,45 tot 0,62 mm (8) en hebben vier paar poten. Op de cheliceren zijn de tanden al volledig aanwezig. Vanaf dit stadium beginnen de mijten te foerageren. Daartoe wordt de cuticula van de prooi door de cheliceren doorboord en wordt in de prooi een secretie uitgescheiden voor de vertering buiten de darm. De voedselbrij kan daarna door de mijt worden opgezogen. De cheliceren kunnen ook worden gebruikt om grotere delen uit voedselklompjes te scheuren (28). Na nog een vervelling worden de deutonymfen ontwikkeld. Deze zijn 0,60 tot 0,80 mm groot (8) en geel tot lichtbruin van kleur. Vanaf dit stadium kunnen de dieren worden gescheiden in vrouwtjes en mannetjes. Na nog een vervelling, gedurende welke de dieren inactief zijn en het bruine schild zich ontwikkelt (ongeveer na 14 dagen), zijn de mijten volwassen (28) (29) (30). Hun levensduur is 48 tot 100 dagen bij 25 °C (27).
Aanhangsel 8
Samenvatting en tijdschema van de belangrijkste handelingen die voor het uitvoeren van de Hypoaspis-test moeten worden verricht
|
Tijd (dagen)
begin van test = dag 0
|
Activiteit/taak
|
|
Dag – 35
tot – 28
|
Breng vrouwtjes uit de stamcultuur over naar schone vaten om de synchronisatie te beginnen
2 dagen later: verwijdering van vrouwtjes
twee of drie keer week: verstrek voldoende voedsel
|
|
Dag – 5 (+/– 2)
|
Bereid de kunstmatige grond
|
|
Dag – 4 (+/– 2)
|
Bepaal WHV van de kunstmatige grond
Droog gedurende de nacht
Volgende dag: weeg monsters en bereken WHV
|
|
Dag – 4 (+/– 2)
|
Bevochtig vooraf de kunstmatige grond tot 20 - 30 % van WHV
|
|
Dag 0
|
Begin de test: voeg de teststof toe aan de kunstmatige grond
Breng 10 vrouwtjes in elk replicaat
Weeg elk replicaat
Zet abiotische controles voor het vochtgehalte en de pH op, 2 replicaten voor elke behandeling
Droog de controles voor het vochtgehalte gedurende de nacht
Volgende dag: weeg de controles voor het vochtgehalte
Volgende dag: meet de pH van de gedroogde abiotische controles
|
|
Dag 3, 6, 9, 12 (ongeveer)
|
Voeg aan elk replicaat voldoende prooi-organismen toe
Weeg elk replicaat en voeg het verdampte water weer toe
|
|
Dag 14
|
Beëindig de test, zet de extractie op met alle replicaten, alsmede controles voor de efficiëntie van de extractie
Droog de controles voor het watergehalte gedurende de nacht
Volgende dag: weeg de controles voor het watergehalte
Volgende dag: meet de pH van de gedroogde controles
|
|
Dag 16
|
Beëindig de extractie
|
|
Dag 16+
|
Registreer het aantal volwassen dieren en het aantal nakomelingen in het geëxtraheerde materiaal
Doe verslag van de resultaten in de sjabloontabellen
Doe verslag van de testprocedure op de testprotocolbladen
|
C.37. 21-DAAGSE VISTEST: KORTETERMIJNSCREENING OP OESTROGENE EN ANDROGENE ACTIVITEIT EN OP AROMATASEREMMERS
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan OESO-testrichtsnoer (TG) 230 (2009). De noodzaak om een vistest te ontwikkelen en te valideren waarmee bepaalde actieve endocriene chemische stoffen kunnen worden gedetecteerd, komt voort uit de bezorgdheid dat de chemicaliënniveaus in het milieu schadelijke effecten kunnen hebben bij mensen en dieren als gevolg van de interactie van deze chemicaliën met het hormoonstelsel. In 1998 is de OESO een actie gestart om bestaande richtsnoeren te herzien en nieuwe richtsnoeren te ontwikkelen voor het screenen en testen op potentiële hormoonontregelaars. Eén onderdeel van de actie was de ontwikkeling van een testrichtsnoer voor het screenen van chemische stoffen die uitwerken op het hormoonstelsel van vissoorten. De 21-daagse endocriene screeningtest bij vissen heeft een uitgebreid validatieprogramma ondergaan, bestaande uit interlaboratoriumstudies met geselecteerde chemicaliën om de relevantie en betrouwbaarheid van de test voor de detectie van oestrogene aromatase-remmende chemicaliën (1, 2, 3, 4, 5) aan te tonen in de drie onderzochte vissoorten (de Amerikaanse dikkop-elrits, het Japanse rijstvisje en de zebravis). Detectie van androgene activiteit is mogelijk in de dikkop-elrits en het rijstvisje, maar niet in de zebravis. Met deze testmethode is het niet mogelijk anti-androgene chemicaliën te detecteren. De validatiewerkzaamheden zijn collegiaal getoetst door een panel van deskundigen die zijn benoemd door de nationale coördinatoren van het programma voor testrichtsnoeren (6). De test is niet ontworpen voor de herkenning van specifieke mechanismen van hormonale ontwrichting omdat de proefdieren een intacte hypothalamus-hypofyse-gonade-as (HPG-as) hebben, die kan reageren op chemische stoffen die op verschillende niveaus uitwerken op de HPG-as. De test voor kortetermijneffecten op de voortplanting van vissen (testrichtsnoer (TG) 229 van de OESO) heeft betrekking op de fertiliteit en, indien van toepassing, de gonade histopathologie van de Amerikaanse dikkop-elrits, evenals alle eindpunten die in deze testmethode zijn opgenomen. TG 229 van de OESO voorziet in een screening van chemische stoffen die van invloed zijn op de voortplanting door middel van verschillende mechanismen, waaronder endocriene middelen. Dit moet in aanmerking worden genomen voordat de meest geschikte testmethode wordt gekozen.
|
|
2.
|
Deze testmethode beschrijft een screening in vivo waarbij geslachtsrijpe mannetjes- en kuitschietende vrouwtjesvissen bij elkaar worden gehouden en gedurende een beperkt deel van hun levenscyclus (21 dagen) worden blootgesteld aan een chemische stof. Na afloop van de 21-daagse blootstellingsperiode worden, afhankelijk van de gebruikte soort, een of twee eindpunt-biomerkers bij de mannetjes en de vrouwtjes gemeten als indicatoren van oestrogene, aromatase-remmende of androgene activiteit van de teststof; deze eindpunten zijn vitellogenine en secundaire geslachtskenmerken. De vitellogenine wordt gemeten bij de Amerikaanse dikkop-elrits, het Japanse rijstvisje en de zebravis, terwijl de secundaire geslachtskenmerken alleen worden gemeten bij de Amerikaanse dikkop-elrits en het Japanse rijstvisje.
|
|
3.
|
Deze bioassay dient als in-vivoscreeningtest voor bepaalde endocriene werkingsmechanismen en de toepassing ervan moet worden beschouwd in het kader van het begrippenkader van de OESO voor het testen en beoordelen van hormoonontregelende chemische stoffen (28).
|
INLEIDENDE OVERWEGINGEN EN BEPERKINGEN
|
4.
|
Vitellogenine (VTG) wordt gewoonlijk geproduceerd door de lever van vrouwelijke gewervelde oviparen in reactie op doorstromend endogeen oestrogeen. Vitellogenine is een precursor van eidooierproteïnen en wordt vanuit de lever in de bloedbaan naar het ovarium getransporteerd en daar opgenomen en gemodificeerd door de zich ontwikkelende eieren. Vitellogenine is vrijwel niet detecteerbaar in het plasma van onvolwassen vrouwtjes- en mannetjesvissen omdat deze over onvoldoende circulerend oestrogeen beschikken; hun lever is echter wel in staat om vitellogenine samen te stellen en af te scheiden in reactie op exogene oestrogeenstimulatie.
|
|
5.
|
Het meten van vitellogenine dient om chemische stoffen met verschillende oestrogene werkingsmechanismen te detecteren. De detectie van oestrogene chemicaliën is mogelijk door de inductie van vitellogenine in mannetjesvissen te meten en is overvloedig gedocumenteerd in de collegiaal getoetste wetenschappelijke literatuur (bijvoorbeeld (7)). Vitellogenine-inductie is ook aangetoond na blootstelling aan aromatiseerbare androgenen (8, 9). Een vermindering in het circulatieniveau van oestrogenen bij vrouwtjes, bijvoorbeeld door de remming van de aromatase die het endogene androgeen omzet in het natuurlijke oestrogeen 17β -estradiol, veroorzaakt een afname van het vitellogenineniveau, dat wordt gebruikt om chemicaliën met aromatase-remmende eigenschappen te detecteren (10, 11). De biologische relevantie van de vitellogeninereactie na remming van oestrogenen/aromatase is vastgesteld en ruimschoots gedocumenteerd. Mogelijk wordt de productie van VTG bij vrouwtjes echter ook beïnvloed door algemene toxiciteit en niet-endocriene toxische werkingsmechanismen, bijvoorbeeld hepatotoxiciteit.
|
|
6.
|
Er zijn verschillende meetmethoden ontwikkeld en gestandaardiseerd voor routinegebruik. Dit is het geval bij soortspecifieke methoden van Enzyme-Linked Immunosorbent Assay (ELISA) waarbij gebruik wordt gemaakt van immunochemie voor de kwantificering van vitellogenine die wordt geproduceerd in kleine bloed- of levermonsters van afzonderlijke vissen (12, 13, 14, 15, 16, 17, 18). Voor de VTG-meting worden bloedmonsters van de Amerikaanse dikkop-elrits, bloedmonsters of een kop-/staarthomogenaat van de zebravis, en levermonsters van het Japanse rijstvisje genomen. Bij het rijstvisje is er een goede correlatie tussen de in het bloed en in de lever gemeten VTG (19). In aanhangsel 6 worden de aanbevolen procedures voor monsterneming ten behoeve van vitellogenine-analyse beschreven. Uitrustingen voor het meten van vitellogenine zijn op grote schaal beschikbaar. Dergelijke uitrustingen moeten zijn gebaseerd op een gevalideerde soortspecifieke ELISA-methode.
|
|
7.
|
Secundaire geslachtskenmerken van bepaalde soorten mannetjesvissen zijn extern zichtbaar en kwantificeerbaar, en reageren op circulatieniveaus van endogene androgenen. Dit geldt voor de Amerikaanse dikkop-elrits en het Japanse rijstvisje, maar niet voor de zebravis, die geen kwantificeerbare secundaire geslachtskenmerken heeft. Vrouwtjes behouden de mogelijkheid om mannelijke secundaire geslachtskenmerken te ontwikkelen wanneer ze worden blootgesteld aan androgene chemicaliën in water. Er bestaan in de wetenschappelijke literatuur verscheidene studies waarin dit type reactie is gedocumenteerd bij de Amerikaanse dikkop-elrits (20) en het Japanse rijstvisje (21). Een afname van de secundaire geslachtskenmerken bij mannetjes moet met de nodige omzichtigheid worden geïnterpreteerd vanwege het geringe statistische onderscheidingsvermogen en dient te worden gebaseerd op het oordeel van deskundigen en het gewicht van het bewijs. De bruikbaarheid van zebravissen in deze test is beperkt in verband met het ontbreken van kwantificeerbare secundaire geslachtskenmerken die reageren op androgeen werkende chemische stoffen.
|
|
8.
|
Bij de Amerikaanse dikkop-elrits is de voornaamste indicator van exogene androgene blootstelling het aantal nuptiale papillen op de bek van het vrouwtje. Bij het Japanse rijstvisje vormt het aantal papillaire uitsteeksels de voornaamste aanwijzing voor exogene blootstelling aan androgene chemicaliën bij de vrouwtjesvis. In aanhangsels 5A en 5B worden de procedures aanbevolen die moeten worden gevolgd voor de evaluatie van geslachtskenmerken bij respectievelijk de Amerikaanse dikkop-elrits en het Japanse rijstvisje.
|
|
9.
|
De in deze testmethode gebruikte definities staan in aanhangsel 1.
|
PRINCIPE VAN DE TEST
|
10.
|
In deze test worden mannetjes- en vrouwtjesvissen in geslachtsrijpe staat samen blootgesteld in testbakken. Hun volwassen en geslachtsrijpe staat maakt een duidelijk onderscheid naar sekse en daardoor een sekse-afhankelijke analyse van elk eindpunt mogelijk, en waarborgt hun gevoeligheid voor exogene chemische stoffen. Aan het eind van de test wordt het geslacht bevestigd door macroscopisch onderzoek van de geslachtsklieren na opening van het onderlijf aan de buikzijde met een schaar. Een overzicht van de toepasselijke bioassay-omstandigheden staat in aanhangsel 2. De test wordt gewoonlijk begonnen met vissen die als steekproef zijn genomen uit een populatie die tot kuitschieten in staat is; oudere dieren moeten niet worden gebruikt. Richtsnoeren voor de leeftijd van de vissen en hun reproductieve status worden gegeven in het onderdeel over de selectie van vissen. De test wordt uitgevoerd met drie concentraties van blootstelling aan chemicaliën en een controlegroep in water, alsook, indien nodig, een controlegroep in een oplossing. Er worden twee bakken of duplo's per behandeling gebruikt (met in elke bak 5 mannetjes en 5 vrouwtjes) voor het Japanse rijstvisje en de zebravis, terwijl er vier bakken of duplo's per behandeling worden gebruikt (met in elke bak 2 mannetjes en 4 vrouwtjes) voor de Amerikaanse dikkop-elrits. Deze indeling is aangepast aan het territoriumgedrag van het dikkop-elritsmannetje en waarborgt tevens voldoende onderscheidend vermogen. De blootstelling vindt plaats gedurende 21 dagen en de monsters van de vissen worden genomen op dag 21 van de blootstelling.
|
|
11.
|
Bij de monsterneming op dag 21 worden alle dieren op humane wijze gedood. Secundaire geslachtskenmerken worden gemeten bij de Amerikaanse dikkop-elrits en het Japanse rijstvisje (zie aanhangsels 5A en 5B); bloedmonsters worden genomen voor de vaststelling van vitellogenine bij de zebravis en de Amerikaanse dikkop-elrits, als alternatief kan de kop/staart worden genomen voor de vaststelling van vitellogenine bij de zebravis (aanhangsel 6); voor de VTG-analyse van het Japanse rijstvisje wordt de lever uitgenomen (aanhangsel 6).
|
AANVAARDBAARHEIDSCRITERIA VOOR DE TEST
|
12.
|
De uitkomsten van de test zijn alleen aanvaardbaar als aan de onderstaande voorwaarden wordt voldaan:
|
—
|
het sterftecijfer in de controlegroepen in water (oplosmiddel) mag aan het eind van de blootstellingsperiode niet hoger zijn dan 10 %;
|
|
—
|
het gehalte aan opgeloste zuurstof moet gedurende de gehele blootstellingsperiode minimaal 60 % van de verzadigingswaarde van lucht zijn geweest;
|
|
—
|
het verschil in watertemperatuur tussen de testbakken mag op geen enkel moment tijdens de blootstellingsperiode groter zijn dan ± 1,5 °C. Tevens mag de watertemperatuur niet meer dan 2 °C hoger of lager zijn dan het temperatuurbereik dat voor de vissoort wordt gespecificeerd (aanhangsel 2);
|
|
—
|
er moet bewijs beschikbaar zijn waaruit blijkt dat de gehalten aan teststof in de oplossing binnen ± 20 % van de gemiddelde gemeten waarden zijn gehouden.
|
|
BESCHRIJVING VAN DE METHODE
Apparatuur
|
13.
|
Standaardlaboratoriumapparatuur, met name:
|
a)
|
zuurstof- en pH-meters;
|
|
b)
|
apparatuur voor het bepalen van de hardheid en alkaliteit van water;
|
|
c)
|
geschikte apparatuur voor de temperatuurregeling en bij voorkeur ook voor continue bewaking;
|
|
d)
|
bakken van chemisch inert materiaal met een inhoud die geschikt is voor de aanbevolen densiteit en bezettingsgraad (zie aanhangsel 2);
|
|
e)
|
kuitsubstraat voor de Amerikaanse dikkop-elrits en de zebravis (zie aanhangsel 4 voor de nodige details);
|
|
f)
|
weegschaal met een toereikende nauwkeurigheid (d.w.z. nauwkeurig tot op ± 0,5 mg).
|
|
Water
|
14.
|
Water waarin de gekozen testsoort langdurig kan overleven en groeien is geschikt als testwater. Gedurende de testperiode moet de waterkwaliteit constant zijn. De pH-waarde moet binnen een bereik van 6,5 tot 8,5 blijven, maar tijdens een test mag deze niet meer dan ± 0,5 pH-eenheden schommelen. Om ervoor te zorgen dat het verdunningswater de testresultaten niet noemenswaardig beïnvloedt (bijvoorbeeld door complexvorming met de teststof), moeten regelmatig monsters worden genomen en geanalyseerd. Zware metalen (bijvoorbeeld Cu, Pb, Zn, Hg, Cd en Ni), de belangrijkste anionen en kationen (bijvoorbeeld Ca2+, Mg2+, Na+, K+, Cl- en SO4
2-), bestrijdingsmiddelen (bijvoorbeeld het totaalgehalte aan organofosforpesticiden en het totaalgehalte aan organochloorpesticiden) en het totaalgehalte aan organische koolstof en zwevende deeltjes moeten bijvoorbeeld om de drie maanden worden bepaald als van het verdunningswater bekend is dat het een relatief constante kwaliteit heeft. Indien is aangetoond dat de waterkwaliteit gedurende ten minste één jaar constant blijft, zijn minder frequente bepalingen en langere intervallen (bijvoorbeeld zes maanden) toelaatbaar. In aanhangsel 3 worden enkele chemische kenmerken van aanvaardbaar verdunningswater vermeld.
|
Testoplossingen
|
15.
|
De testoplossingen met de gekozen concentraties worden bereid door verdunning van een stamoplossing. De stamoplossing wordt bij voorkeur bereid door eenvoudig mengen en schudden van de teststof in verdunningswater met mechanische middelen (bijvoorbeeld door te roeren of met ultrasone trillingen). Voor het maken van een stamoplossing van een passende concentratie kunnen verzadigingskolommen (oplosbaarheidskolommen) worden gebruikt. Het gebruik van een draagvloeistof wordt niet aanbevolen. Indien echter een oplosmiddel noodzakelijk is, moet gelijktijdig een controletest met het oplosmiddel worden uitgevoerd, met dezelfde oplosmiddelconcentratie als voor de chemische behandelingen wordt gebruikt. Voor moeilijke teststoffen kan een oplosmiddel uit technisch oogpunt de beste keuze zijn; raadpleeg hiervoor de OESO-leidraad voor het testen op aquatische toxiciteit bij moeilijke stoffen en mengsels (22). De keuze van het juiste oplosmiddel hangt af van de chemische eigenschappen van de teststof. In de OESO-leidraad wordt een maximum van 100 μl/l aanbevolen, dat in acht dient te worden genomen. In een recente bespreking (23) worden echter aanvullende bedenkingen geuit over het gebruik van oplosmiddelen voor het testen van endocriene activiteit. Derhalve wordt aanbevolen de oplosmiddelconcentratie, indien nodig, tot het minimum te beperken als dit technisch uitvoerbaar is (afhankelijk van de fysisch-chemische eigenschappen van de teststof).
|
|
16.
|
Er moet gebruik worden gemaakt van een doorstroomtestsysteem. Een dergelijk systeem verdeelt en verdunt continu de stamoplossing van de teststof (bijvoorbeeld met een doseerpomp, mechanisme voor evenredige verdunning of saturatorsysteem) om ervoor te zorgen dat de testkamers de juiste testconcentratie krijgen toegediend. De stroomsnelheid van de stamoplossingen en het verdunningswater moet regelmatig, bij voorkeur dagelijks, worden gecontroleerd en mag gedurende de gehele test hooguit 10 % afwijken. Er moet goed op worden gelet dat het gebruik van laagwaardige plastic slangen en andere materialen die biologisch actieve chemicaliën kunnen bevatten, worden vermeden. Bij de keuze van het materiaal voor het doorstroomsysteem moet rekening worden gehouden met mogelijke adsorptie van de teststof aan dit materiaal.
|
Leefomstandigheden van de vis
|
17.
|
De testvissen moeten worden geselecteerd uit een laboratoriumpopulatie, bij voorkeur van één stam, die bij het begin van de test minimaal twee weken gehouden is onder omstandigheden die qua waterkwaliteit en verlichting overeenkomen met die tijdens de test. Het is van belang dat de densiteit en de bezettingsgraad (zie voor definities aanhangsel 1) worden afgestemd op de gekozen vissoort (zie aanhangsel 2).
|
|
18.
|
Na een aanpassingsperiode van 48 uur wordt de sterfte geregistreerd en worden de volgende criteria toegepast:
|
—
|
sterfte groter dan 10 % van de populatie in zeven dagen: de hele partij wordt afgekeurd;
|
|
—
|
sterfte tussen 5 % en 10 % van de populatie: acclimatisering gedurende nog zeven dagen; als de sterfte gedurende deze zeven dagen hoger dan 5 % is, wordt de gehele partij afgekeurd;
|
|
—
|
sterfte minder dan 5 % van de populatie binnen zeven dagen: de gehele partij wordt geaccepteerd.
|
|
|
19.
|
Vissen mogen tijdens de acclimatiseringsperiode, de pre-blootstellingsperiode of de blootstellingsperiode niet worden behandeld voor ziekten.
|
Pre-blootstellingsperiode en selectie van de vissen
|
20.
|
Aanbevolen wordt de dieren gedurende een pre-blootstellingsperiode van één week in bakken te houden die soortgelijk zijn aan de testbakken. De vissen kunnen tijdens deze periode en de blootstellingsfase naar believen worden gevoederd. De blootstellingsfase begint met seksueel dimorfe volwassen vissen uit een laboratoriumaanbod van geslachtsrijpe dieren (bijvoorbeeld met duidelijk zichtbare secundaire geslachtskenmerken bij de Amerikaanse dikkop-elrits en het Japanse rijstvisje) die actief kuitschieten. Slechts als algemene richtsnoer (niet toe te passen zonder aandacht te schenken aan de feitelijke reproductieve status van een gegeven partij vissen) geldt dat Amerikaanse dikkop-elritsen ongeveer 20 (± 2) weken oud moeten zijn, aangenomen dat ze hun hele leven zijn gehouden bij 25 (± 2) °C. Japanse rijstvisjes moeten ongeveer 16 (± 2) weken oud zijn, aangenomen dat ze hun hele leven zijn gehouden bij 25 (± 2) °C. Zebravissen moeten ongeveer 16 (± 2) weken oud zijn, aangenomen dat ze hun hele leven zijn gehouden bij 26 (± 2) °C.
|
TESTOPZET
|
21.
|
Er wordt gebruikgemaakt van drie concentraties van de teststof, één controletest (met water) en indien nodig één controletest met oplosmiddel. De gegevens kunnen worden geanalyseerd om statistisch significante verschillen vast te stellen tussen de reacties op behandeling en op de controles. Deze analyses brengen aan het licht of nadere langdurige tests op schadelijke effecten (op het gebied van overleven, ontwikkeling, groei en voortplanting) eerder nodig zijn voor de teststof dan voor gebruik ten behoeve van risicobeoordeling (24).
|
|
22.
|
Voor de zebravis en het Japanse rijstvisje worden op dag 21 van het experiment mannetjes en vrouwtjes van elke behandelingsconcentratie (5 mannetjes en 5 vrouwtjes in elk van beide duplo's) en van de controlegroep(en) genomen voor het meten van de vitellogenine en, voor zover van toepassing, de secundaire geslachtskenmerken. Voor de Amerikaanse dikkop-elrits worden op dag 21 van de blootstelling mannetjes en vrouwtjes (2 mannetjes en 4 vrouwtjes in elk van de vier duplo's) en van de controlegroep(en) genomen voor het meten van de vitellogenine en de secundaire geslachtskenmerken.
|
Selectie van testconcentraties
|
23.
|
Voor de doeleinden van deze test moet de hoogste testconcentratie worden ingesteld op de laagste van de volgende waarden: de maximale toegelaten concentratie (MTC), die wordt bepaald met een dosisbereikstest of op basis van andere toxiciteitsgegevens, 10 mg/l of de maximale oplosbaarheid in water. De MTC is gedefinieerd als de hoogste testconcentratie van de teststof die tot minder dan 10 % sterfte leidt. In deze benadering wordt ervan uitgegaan dat er empirische gegevens over acute toxiciteit of andere toxiciteitsgegevens bestaan op basis waarvan de MTC kan worden geschat. Omdat de schatting van de MTC onnauwkeurig kan zijn is een deskundig oordeel normaliter noodzakelijk.
|
|
24.
|
Drie testconcentraties met een constante tussenliggende factor van maximaal 10, en een verdunningswatercontrole (en indien nodig een oplosmiddelcontrole), zijn verplicht. Aanbevolen wordt een bereik van tussenliggende factoren van 3,2 tot 10.
|
PROCEDURE
Selectie en weging van de testvissen
|
25.
|
Het is belangrijk om de variatie in het gewicht van de vissen aan het begin van de test zoveel mogelijk te beperken. In aanhangsel 2 worden geschikte gewichtbereiken aangegeven voor de verschillende vissoorten die worden aanbevolen voor deze test. Voor de gehele partij vissen die in deze test wordt gebruikt, geldt dat het bereik van het afzonderlijke gewicht van mannetjes en vrouwtjes aan het begin van de test indien mogelijk binnen ± 20 % van het rekenkundig gemiddelde van het betreffende geslacht moet worden gehouden. Het verdient aanbeveling om voorafgaande aan de test een steekproef te nemen om het gemiddelde gewicht te bepalen.
|
Blootstellingsomstandigheden
Duur
|
26.
|
De test duurt 21 dagen, volgend op een pre-blootstellingsperiode. De aanbevolen pre-blootstellingsperiode is één week.
|
Voeding
|
27.
|
De vissen dienen naar believen voldoende te worden gevoederd met passende voeding (aanhangsel 2) om hun lichamelijke conditie op peil te houden. Bacteriegroei en troebelheid van het water moeten zoveel mogelijk worden voorkomen. Als algemene richtsnoer geldt dat de dagelijkse hoeveelheid voeder kan worden verdeeld in twee of drie gelijke porties voor meer dan één voeding per dag, met ten minste drie uur tijd tussen elke voeding. Eén grotere portie is ook aanvaardbaar, met name tijdens weekeinden. De vissen dienen niet gevoederd te worden gedurende de 12 uur voorafgaande aan de monsterneming/necropsie.
|
|
28.
|
Het visvoeder dient te worden gecontroleerd op de aanwezigheid van verontreinigende stoffen zoals organochloorpesticiden, polycyclische aromatische koolwaterstoffen (PAK's) en polychloorbifenylen (PCB's). Voeder met een verhoogd gehalte aan fyto-oestrogenen die de testreactie op een bekende oestrogeenagonist (bijvoorbeeld 17ß-oestradiol) kunnen verstoren, dient te worden vermeden.
|
|
29.
|
Ongebruikt voeder en fecaal materiaal moet ten minste tweemaal per week uit de testbakken worden verwijderd, bijvoorbeeld door de bodem van elke tank zorgvuldig te reinigen met een hevel.
|
Licht en temperatuur
|
30.
|
De fotoperiode en watertemperatuur moeten worden afgestemd op de gekozen vissoort (zie aanhangsel 2).
|
Frequentie van de analytische bepalingen en metingen
|
31.
|
Voor aanvang van de blootstellingsperiode moet de juiste werking van het afgiftesysteem van de teststof zijn gewaarborgd. Alle noodzakelijke analysemethoden moeten zijn vastgesteld, inclusief voldoende kennis over de chemische stabiliteit in het testsysteem. Tijdens de test worden de concentraties van de teststof regelmatig als volgt gemeten: de stroomsnelheid van het verdunningswater en de toxische stamoplossing moet bij voorkeur dagelijks, maar minimaal tweemaal per week, worden gecontroleerd en mag gedurende de gehele test hooguit 10 % afwijken. Het is raadzaam de feitelijke concentraties van de teststof in alle bakken bij aanvang van de test en vervolgens met wekelijkse tussenpozen te meten.
|
|
32.
|
Het is wenselijk de resultaten te baseren op gemeten concentraties. Indien de concentratie van de teststof in de oplossing gedurende de gehele test goed binnen een marge van ± 20 % van de nominale concentratie is gehouden, mogen de resultaten echter worden gebaseerd op nominale of gemeten waarden.
|
|
33.
|
Monsters moeten mogelijk worden gefilterd (bijvoorbeeld met een 0,45 μm poriëngrootte) of gecentrifugeerd. Indien nodig verdient centrifugeren de voorkeur. Als het testmateriaal echter niet aan filters adsorbeert, is filtratie mogelijk een aanvaardbaar alternatief.
|
|
34.
|
In de loop van de test moet het gehalte aan opgeloste zuurstof, de temperatuur en de pH in alle testbakken ten minste één keer per week worden gemeten. De totale hardheid en alkaliteit moeten ten minste één keer per week worden gemeten in de bakken met de controlegroepen en in één bak met de hoogste concentratie teststof. De temperatuur moet bij voorkeur in ten minste één testbak continu worden gecontroleerd.
|
Waarnemingen
|
35.
|
In de loop van de test of na afloop van de test worden een aantal algemene reacties (bijvoorbeeld overleven) en biologische reacties (bijvoorbeeld de vitellogenineniveaus) bepaald. Meting en beoordeling van deze eindpunten worden hierna beschreven.
|
Overleven
|
36.
|
De vissen moeten gedurende de test dagelijks worden onderzocht. De sterfte moet worden geregistreerd en de dode vissen moeten zo snel mogelijk worden verwijderd. Dode vissen mogen noch in de controle- noch in de behandelbakken worden vervangen. Het geslacht van de vissen die tijdens de test sterven, moet worden vastgesteld door macroscopisch onderzoek van de geslachtsklieren.
|
Gedrag en uiterlijk
|
37.
|
Elke vorm van afwijkend gedrag (ten opzichte van de controlegroepen) moet worden genoteerd. Dit kan zich uitstrekken tot tekenen van algemene toxiciteit waaronder hyperventilatie, ongecoördineerd zwemmen, evenwichtsverlies en atypisch(e) onbeweeglijkheid of eetgedrag. In aanvulling hierop moeten ook externe afwijkingen (zoals bloedingen, ontkleuring) worden genoteerd. Dergelijke tekenen van toxiciteit dienen bij de interpretatie van de gegevens zorgvuldig in beschouwing te worden genomen, omdat ze kunnen duiden op concentraties waarbij biomerkers van endocriene activiteit niet meer betrouwbaar zijn. Dergelijke gedragswaarnemingen kunnen ook bruikbare kwalitatieve informatie opleveren voor mogelijke vistestvoorschriften in de toekomst. Zo is bijvoorbeeld agressief territoriumgedrag waargenomen bij normale mannetjes of gemasculiniseerde vrouwtjes van Amerikaanse dikkop-elritsen bij blootstelling aan androgenen; bij zebravissen wordt het kenmerkende paar- en paaigedrag na zonsopgang verminderd of verstoord door blootstelling aan oestrogenen of anti-androgenen.
|
|
38.
|
Omdat sommige aspecten van het uiterlijk (vooral de kleur) bij behandeling snel kunnen veranderen, is het van belang dat kwalitatieve waarnemingen worden genoteerd voordat dieren uit het testsysteem worden gehaald. De ervaringen die tot nu toe met Amerikaanse dikkop-elritsen zijn opgedaan, duiden erop dat sommige endocrien actieve stoffen in eerste instantie veranderingen in de volgende externe kenmerken teweeg kunnen brengen: lichaamskleur (licht of donker), kleurpatronen (aanwezigheid van verticale banen) en lichaamsvorm (kop en borstregio). Er dienen derhalve tijdens de test en aan het einde van het onderzoek waarnemingen te worden genoteerd over het fysieke voorkomen van de vissen.
|
Op humane wijze doden van de vissen
|
39.
|
Op dag 21, d.w.z. bij beëindiging van de blootstelling, dienen de vissen te worden geëuthanaseerd met passende hoeveelheden tricaïne (tricaïne-methaansulfonaat, metacaïne, MS-222 (CAS 886-86-2), 100-500 mg/l gebufferd met 300 mg/l NaHCO3 (natriumbicarbonaat, CAS 144-55-8)) ter vermindering van slijmvliesirritatie; vervolgens worden bloed- of weefselmonsters genomen om het vitellogenineniveau te bepalen, zoals toegelicht in het onderdeel over vitellogenine.
|
Waarneming van secundaire geslachtskenmerken
|
40.
|
Sommige endocrien actieve stoffen kunnen tot veranderingen leiden in bepaalde secundaire geslachtskenmerken (aantal nuptiale papillen bij het mannetje van de Amerikaanse dikkop-elrits, papillaire uitsteeksels bij het mannetje van het Japanse rijstvisje). Met name stoffen met bepaalde werkingsmechanismen kunnen een abnormaal optreden van secundaire geslachtskenmerken veroorzaken bij dieren van de andere sekse. Zo kunnen androgene receptoragonisten, zoals trenbolone, methyltestosteron en dihydrotestosteron, tot gevolg hebben dat vrouwelijke dikkop-elritsen geprononceerde nuptiale papillen ontwikkelen of dat vrouwelijke rijstvisjes papillaire uitsteeksels ontwikkelen (11, 20, 21). Ook is beschreven dat oestrogene receptoragonisten het aantal nuptiale papillen en de grootte van de dorsale nekverdikking bij volwassen mannetjes kunnen verminderen (25, 26). Dergelijke morfologische waarnemingen kunnen bruikbare kwalitatieve en kwantitatieve informatie opleveren voor mogelijke vistestvoorschriften in de toekomst. Het aantal en de grootte van nuptiale papillen bij Amerikaanse dikkop-elritsen en papillaire uitsteeksels bij Japanse rijstvisjes kunnen hetzij direct, hetzij meer praktisch bij geconserveerde specimina worden gekwantificeerd. De aanbevolen procedures voor de beoordeling van secundaire geslachtskenmerken bij Amerikaanse dikkop-elritsen en Japanse rijstvisjes zijn respectievelijk beschikbaar in aanhangsel 5A en 5B.
|
Vitellogenine (VTG)
|
41.
|
Er wordt bloed afgenomen uit de staartader of -slagader met een gehepariniseerd microhematocriet capillair buisje, of door een hartpunctie met een injectiespuit. Afhankelijk van de grootte van de vissen lopen de af te nemen hoeveelheden bloed gewoonlijk uiteen van 5 tot 60 μl per stuk voor Amerikaanse dikkop-elritsen en van 5 tot 15 μl per stuk voor zebravissen. Het plasma wordt van het bloed gescheiden door middel van centrifuge en bij – 80 °C bewaard met een proteaseremmer totdat het wordt onderzocht op vitellogenine. Als alternatief wordt bij Japanse rijstvisjes de lever gebruikt en kan bij zebravissen het kop-/staarthomogenaat worden gebruikt als weefselbron voor de bepaling van vitellogenine (aanhangsel 6). De VTG-meting moet zijn gebaseerd op een gevalideerde homologe ELISA-methode met homologe VTG-norm en homologe antilichamen. Aanbevolen wordt een methode te gebruiken waarmee VTG-niveaus kunnen worden gemeten van slechts een paar ng/ml plasma (of ng/mg weefsel), dat wil zeggen het basisniveau bij niet-blootgestelde mannetjesvissen.
|
|
42.
|
De kwaliteitscontrole van de vitellogenineanalyse wordt verricht door het gebruik van normen, blanco-bepalingen en ten minste analyse in duplo. Voor elke ELISA-methode moet het matrixeffect (effect van de verdunning van het monster) worden getest om de minimale verdunningsfactor per monster te bepalen. Elke ELISA-plaat die voor VTG-analyses wordt gebruikt, dient de volgende kwaliteitscontrolemonsters te bevatten: ten minste 6 kalibratienormen die het bereik van de verwachte vitellogenineconcentraties bestrijken en ten minste één assayblanco met niet-specifieke binding (in duplo geanalyseerd). De absorptie van deze blanco's moet minder bedragen dan 5 % van de maximale absorptie volgens de kalibratienorm. Er worden ten minste twee aliquots (tankduplicaten) van elk verdunningsmonster geanalyseerd. Tankduplicaten die meer dan 20 % verschillen, dienen opnieuw te worden geanalyseerd.
|
|
43.
|
De correlatiecoëfficiënt (R2) voor kalibratiecurves moet groter zijn dan 0,99. Een hoge correlatie is echter niet voldoende om een toereikende voorspelling van de concentratie in het gehele bereik te waarborgen. Behalve dat de correlatie voor de kalibratiecurve voldoende hoog moet zijn, moet de concentratie van elke norm, zoals berekend vanuit de kalibratiecurve, altijd tussen 70 en 120 % van de nominale concentratie van die norm vallen. Als de nominale concentraties gaan afwijken van de kalibratieregressielijn (bijvoorbeeld bij lagere concentraties), kan het noodzakelijk zijn de kalibratiecurve te splitsen in een laag en een hoog bereik of een non-lineair model toe te passen dat past bij de absorptiegegevens. Als de curve wordt gesplitst, moet voor beide lijnsegmenten gelden dat R2 > 0,99.
|
|
44.
|
De detectiegrens wordt gedefinieerd als de concentratie van de laagste analysenorm en de kwantificeringsgrens als de concentratie van de laagste analysenorm vermenigvuldigd met de laagste verdunningsfactor.
|
|
45.
|
Op elke dag dat er vitellogeninetests worden uitgevoerd, wordt een verrijkt monster geanalyseerd dat is gemaakt volgens een testonafhankelijke referentienorm (aanhangsel 7). De verhouding tussen de verwachte concentratie en de gemeten concentratie wordt gerapporteerd samen met de resultaten van elke set tests die op die dag is uitgevoerd.
|
GEGEVENS EN RAPPORTAGE
Evaluatie van biomerkerreacties door variantieanalyse
|
46.
|
Om mogelijke endocriene activiteit van een stof te constateren, worden de reacties van behandel- en controlegroepen vergeleken met behulp van variantieanalyse. Wanneer een oplosmiddelcontrole wordt gebruikt, moet een passende statistische test worden uitgevoerd op het verdunningswater en de oplosmiddelcontroles voor elk eindpunt. Richtsnoeren voor de behandeling van gegevens over verdunningswater en oplosmiddelcontroles in de daaropvolgende statistische analyse zijn te vinden in het OESO-document over actuele benaderingen van de statistische analyse van milieugiftigheidsgegevens (OESO 2006c) (27). Alle gegevens over biologische reacties moeten worden geanalyseerd en gerapporteerd naar geslacht. Als niet wordt voldaan aan de vereiste voorwaarden voor parametermethoden — niet-normale verdeling (bijvoorbeeld de test van Shapiro-Wilk) of heterogene variantie (test van Barlett of test van Levene) — moet worden overwogen om de gegevens te transformeren om varianties te homogeniseren alvorens de variantieanalyse of een gewogen variantieanalyse uit te voeren. De (parametrische) test van Dunnett op meerdere paarsgewijze vergelijkingen of een (niet-parametrische) Mann-Whitney-test met Bonferroni-correctie kan worden gebruikt voor een niet-monotone dosisrespons. Andere statistische tests zijn mogelijk (bijvoorbeeld die van Jonckheere-Terpstra of van Williams) als de dosisrespons bij benadering monotoon is. In aanhangsel 8 wordt een statistisch stroomdiagram gepresenteerd dat kan helpen bij de keuze voor het gebruik van de meest geschikte statistische test. Aanvullende informatie is ook te vinden in het OESO-document over actuele benaderingen van de statistische analyse van milieugiftigheidsgegevens (27).
|
Rapportage van testresultaten
|
47.
|
Het onderzoeksrapport moet de volgende gegevens bevatten:
|
|
Testfaciliteit:
|
—
|
verantwoordelijke medewerkers en hun verantwoordelijkheden in het onderzoek;
|
|
—
|
elk laboratorium dient aantoonbare bekwaamheid in het gebruik van een aantal representatieve chemische stoffen te hebben.
|
|
|
|
Teststof:
|
—
|
karakterisering van de teststof;
|
|
—
|
fysische aard en relevante fysisch-chemische eigenschappen;
|
|
—
|
methode en frequentie van bereiding van testconcentraties;
|
|
—
|
informatie over stabiliteit en biologische afbreekbaarheid.
|
|
|
|
Oplosmiddel:
|
—
|
karakterisering van oplosmiddel (kenmerken, gebruikte concentratie);
|
|
—
|
motivering van de keuze van het oplosmiddel (wanneer dat geen water is).
|
|
|
|
Proefdieren:
|
—
|
leverancier en diens specifieke faciliteit;
|
|
—
|
leeftijd van vissen bij aanvang test en reproductie-/paaistatus;
|
|
—
|
gegevens over acclimatiseringsprocedure voor de dieren;
|
|
—
|
lichaamsgewicht van vissen bij aanvang blootstelling (van een substeekproef uit totaal aantal vissen).
|
|
|
|
Testomstandigheden:
|
—
|
gebruikte testprocedure (testtype, densiteit, bezettingsgraad, enz.);
|
|
—
|
bereidingswijze van stamoplossingen en testconcentraties;
|
|
—
|
de nominale testconcentraties, wekelijks gemeten concentraties van de testoplossingen en gebruikte analysemethode, gemiddelden van de gemeten waarden en standaarddeviaties in de testbakken, en bewijs dat de metingen betrekking hebben op de concentraties van de teststof in ware oplossing;
|
|
—
|
karakteristieken van verdunningswater (waaronder pH-graad, hardheid, alkaliteit, temperatuur, opgeloste zuurstofconcentratie, chloorresiduen, totaalgehalte aan organische koolstof, zwevende deeltjes en andere metingen die zijn gedaan);
|
|
—
|
de waterkwaliteit in testbakken: pH-graad, hardheid, temperatuur en opgeloste zuurstofconcentratie;
|
|
—
|
gedetailleerde informatie over voeding (e.g. soort voeding, oorsprong, toegediende hoeveelheid en frequentie, en indien beschikbaar analyses van relevante verontreinigende stoffen (bijvoorbeeld PCB's, PAK's en organochloorpesticiden).
|
|
|
|
Resultaten:
|
—
|
bewijs dat de controles voldoen aan de aanvaardbaarheidscriteria van de test;
|
|
—
|
gegevens over de sterftecijfers in de testconcentraties en de controlegroepen;
|
|
—
|
de gebruikte statistische analysetechnieken, behandeling van gegevens en motivering van toegepaste technieken;
|
|
—
|
gegevens over biologische waarnemingen van de morfologie, waaronder secundaire geslachtskenmerken en vitellogenine;
|
|
—
|
resultaten van data-analyses, bij voorkeur in de vorm van tabellen en diagrammen;
|
|
—
|
gevallen van abnormale reacties van vissen en zichtbare effecten die zijn veroorzaakt door de teststof.
|
|
|
RICHTSNOEREN VOOR INTERPRETATIE EN AANVAARDING VAN DE TESTRESULTATEN
|
48.
|
Dit hoofdstuk bevat een aantal overwegingen die in aanmerking dienen te worden genomen bij de interpretatie van testresultaten voor de verschillende gemeten eindpunten. De resultaten moeten zorgvuldig worden geïnterpreteerd wanneer de teststof klaarblijkelijk openlijke toxiciteit veroorzaakt of gevolgen heeft voor de algemene conditie van het proefdier.
|
|
49.
|
Teneinde een zinvolle interpretatie van de gegevens mogelijk te maken, moet bij de vaststelling van het bereik van testconcentraties erop worden toegezien dat de maximale toegelaten concentratie niet wordt overschreden. Het is van belang dat er ten minste één behandeling is zonder tekenen van toxische effecten. Tekenen van ziekte en van toxische effecten dienen grondig te worden beoordeeld en gerapporteerd. Mogelijk wordt de productie van VTG bij vrouwtjes bijvoorbeeld ook beïnvloed door algemene toxiciteit en niet-endocriene toxische werkingsmechanismen, zoals hepatotoxiciteit. De interpretatie van effecten kan echter worden versterkt door andere behandelniveaus die niet zijn verstoord door systemische toxiciteit.
|
|
50.
|
Er zijn enkele aspecten die in aanmerking moeten worden genomen bij de aanvaarding van testresultaten. Als richtsnoer geldt dat de VTG-niveaus in controlegroepen van mannetjes en vrouwtjes zich van elkaar moeten onderscheiden met ongeveer een factor drie bij de Amerikaanse dikkop-elritsen en de zebravissen en met ongeveer een factor één bij de Japanse rijstvisjes. Voorbeelden van het waardenbereik dat wordt aangetroffen in controle- en behandelgroepen zijn beschikbaar in de validatierapporten (1, 2, 3, 4). Hoge VTG-waarden bij controlemannetjes zouden ten koste kunnen gaan van de gevoeligheid van de test en het vermogen om zwakke oestrogene agonisten te detecteren. Lage VTG-waarden bij controlevrouwtjes zouden ten koste kunnen gaan van de gevoeligheid van de test en het vermogen om aromataseremmers en oestrogene antagonisten te detecteren. Deze richtsnoer is gebaseerd op de validatiestudies.
|
|
51.
|
Als een laboratorium de test niet eerder heeft uitgevoerd of als er sprake is van materiële wijzigingen (bijvoorbeeld een verandering van visstam of leverancier), wordt aanbevolen een technische bekwaamheidsstudie uit te voeren. Het verdient aanbeveling stoffen te gebruiken die uiteenlopende werkingsmechanismen of effecten op een aantal van de testeindpunten bestrijken. In de praktijk wordt elk laboratorium aangemoedigd zijn eigen historische controlegegevens voor mannetjes en vrouwtjes samen te stellen en een positieve controlestof te gebruiken voor oestrogene activiteit (bijvoorbeeld met 100 ng/l 17β-estradiol, of een bekende zwakke agonist) die resulteert in een verhoogde VTG-waarde bij mannetjesvissen, alsmede een positieve controlestof voor aromataseremming (bijvoorbeeld 300 μg/l fadrozole of prochloraz) die resulteert in een verlaagde VTG-waarde bij vrouwtjesvissen, en een positieve controlestof voor androgene activiteit (bijvoorbeeld 5 μg/l 17β-trenbolone) die leidt tot de inductie van secundaire geslachtskenmerken bij vrouwelijke Amerikaanse dikkop-elritsen en Japanse rijstvisjes. Al deze gegevens kunnen worden vergeleken met beschikbare gegevens uit de validatiestudies (1, 2, 3) om de bekwaamheid van het laboratorium te waarborgen.
|
|
52.
|
In het algemeen moeten vitellogeninemetingen als positief worden beschouwd als er een statistisch significante toename van de VTG-waarde bij mannetjes optreedt (p < 0,05), of een statistisch significante afname bij vrouwtjes (p < 0,05), althans bij de hoogste geteste dosis, in vergelijking met de controlegroep, en in afwezigheid van tekenen van algemene toxiciteit. Een positief resultaat wordt verder ondersteund doordat een biologisch plausibele relatie tussen de dosis en de responscurve wordt aangetoond. Zoals vermeld, is de daling van de vitellogeninewaarde mogelijk niet geheel van endocriene oorsprong. Toch dient een positief resultaat in het algemeen te worden opgevat als bewijs van endocriene activiteit in vivo en normaal gesproken te leiden tot maatregelen voor verdere opheldering.
|
LITERATUUR
|
(1)
|
OESO (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006)27.
|
|
(2)
|
OESO (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006)29.
|
|
(3)
|
OESO (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007)25.
|
|
(4)
|
Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (bekeken 18.9.2008).
|
|
(5)
|
US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Ongepubliceerd verslag van 15 december 2007. US Environmental Protection Agency, Washington, DC. 104 blz.
|
|
(6)
|
OESO, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008)21.
|
|
(7)
|
Sumpter and Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7:173-8 Review.
|
|
(8)
|
Pawlowski S, Sauer A, Shears JA, Tyler CR, Braunbeck T (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277-91.
|
|
(9)
|
Andersen L, Goto-Kazato R, Trant JM, Nash JP, Korsgaard B, Bjerregaard P (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4):343-52.
|
|
(10)
|
Ankley GT, Kahl MD, Jensen KM, Hornung MW, Korte JJ, Makynen EA, Leino RL (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences;67(1):121-30.
|
|
(11)
|
Panter GH, Hutchinson TH, Hurd KS, Sherren A, Stanley RD, Tyler CR (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11-21.
|
|
(12)
|
Parks LG, Cheek AO, Denslow ND, Heppell SA, McLachlan JA, LeBlanc GA, Sullivan CV (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2):113-25.
|
|
(13)
|
Panter GH, Tyler CR, Maddix S, Campbell PM, Hutchinson TH, Länge R, Lye C, Sumpter JP, 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Brussel, België.
|
|
(14)
|
Fenske M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217-232.
|
|
(15)
|
Holbech H, Andersen L, Petersen GI, Korsgaard B, Pedersen KL, Bjerregaard P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119-131
|
|
(16)
|
Rose J, Holbech H, Lindholst C, Noerum U, Povlsen A, Korsgaard B, Bjerregaard P. 2002. Vitellogenin induction by 17β-estradiol and 17β-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131: 531-539.
|
|
(17)
|
Brion F, Nilsen BM, Eidem JK, Goksoyr A, Porcher JM, Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699-1708.
|
|
(18)
|
Yokota H, Morita H, Nakano N, Kang IJ, Tadokoro H, Oshima Y, Honjo T, Kobayashi K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87–98.
|
|
(19)
|
Tatarazako N, Koshio M, Hori H, Morita M and Iguchi T., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50:301-308.
|
|
(20)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray LE (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350-60.
|
|
(21)
|
Seki M, Yokota H, Matsubara H, Maeda M, Tadokoro H, Kobayashi K (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3):774-81.
|
|
(22)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. ENV/JM/MONO(2000)6
|
|
(23)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; blz. 69–92.
|
|
(24)
|
Hutchinson TH, Ankley GT, Segner H, Tyler CR, 2006b. Screening and testing for endocrine disruption in fish-biomarkers as „signposts”, not „traffic lights”, in risk assessment. Environmental Health Perspectives;114 Suppl 1:106-14.
|
|
(25)
|
Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure to 17β-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129-145.
|
|
(26)
|
Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve and G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478-488.
|
|
(27)
|
OESO (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
|
(28)
|
OESO (2012) OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No 150. ENV/JM/MONO(2012)22
|
Aanhangsel 1
Afkortingen en definities
Chemische stof
: een stof of mengsel.
VC
: variatiecoëfficiënt.
ELISA
: enzyme-linked immunosorbent assay.
Densiteit
: het natte gewicht van de vissen per volume water.
Bezettingsgraad
: het aantal vissen per volume water.
VTG (Vitellogenine)
: phospholipoglycoproteïne precursor van eidooierproteïne die gewoonlijk voorkomt bij seksueel actieve vrouwtjes van alle ovipare soorten.
HPG-as
: hypothalamus-hypofyse-gonade-as.
MTC
: maximale toegelaten concentratie, dat wil zeggen circa 10 % van de LC50.
Teststof
: alle volgens deze testmethode geteste stoffen of mengsels.
Aanhangsel 2
Proefvoorwaarden voor de endocriene screeningtest bij vissen
|
|
Amerikaanse dikkop-elrits
(Pimephales promelas)
|
Japans rijstvisje
(Oryzias latipes)
|
Zebravis
(Danio rerio)
|
|
|
Doorstroomtest
|
Doorstroomtest
|
Doorstroomtest
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
|
Fluorescentielampen (breed spectrum)
|
Fluorescentielampen (breed spectrum)
|
Fluorescentielampen (breed spectrum)
|
|
|
10-20 μE/m2/s, 540-1 000 lux, of 50-100 ft-c (laboratoriumomgeving)
|
10-20 μE/m2/s, 540-1 000 lux, of 50-100 ft-c (laboratoriumomgeving)
|
10-20 μE/m2/s, 540-1 000 lux, of 50-100 ft-c (laboratoriumomgeving)
|
|
6.
|
Fotoperiode (overgangen naar zonsopgang/-ondergang zijn optioneel, maar worden niet noodzakelijk geacht)
|
|
16 uur licht, 8 uur donker
|
12-16 uur licht, 12-8 uur donker
|
12-16 uur licht, 12-8 uur donker
|
|
|
< 5 g per l
|
< 5 g per l
|
< 5 g per l
|
|
|
10 l (minimum)
|
2 l (minimum)
|
5 l (minimum)
|
|
9.
|
Hoeveelheid testoplossing
|
|
8 l (minimum)
|
1,5 l (minimum)
|
4 l (minimum)
|
|
10.
|
Verwisselingen van testoplossingen
|
|
Minimaal 6 per dag
|
Minimaal 5 per dag
|
Minimaal 5 per dag
|
|
11.
|
Leeftijd van testorganismen
|
|
Zie punt 20
|
Zie punt 20
|
Zie punt 20
|
|
12.
|
Het natte gewicht van volwassen vis bij benadering (g)
|
|
Vrouwtjes: 1,5 ± 20 %
Mannetjes: 2,5 ± 20 %
|
Vrouwtjes: 0,35 ± 20 %
Mannetjes: 0,35 ± 20 %
|
Vrouwtjes: 0,65 ± 20 %
Mannetjes: 0,4 ± 20 %
|
|
13.
|
Aantal vissen per testbak
|
|
6 (2 mannetjes, 4 vrouwtjes)
|
10 (5 mannetjes, 5 vrouwtjes)
|
10 (5 mannetjes, 5 vrouwtjes)
|
|
|
= 3 (plus afdoende controles)
|
= 3 (plus afdoende controles)
|
= 3 (plus afdoende controles)
|
|
15.
|
Aantal bakken per behandeling
|
|
Min. 4
|
Min. 2
|
Min. 2
|
|
16.
|
Aantal vissen per testconcentratie
|
|
16 volwassen vrouwtjes en 8 mannetjes (4 vrouwtjes en 2 mannetjes in elke replicaatbak)
|
10 volwassen vrouwtjes en 10 mannetjes (5 vrouwtjes en 5 mannetjes in elke replicaatbak)
|
10 volwassen vrouwtjes en 10 mannetjes (5 vrouwtjes en 5 mannetjes in elke replicaatbak)
|
|
|
Levende of bevroren volwassen of larvale pekelkreeftjes twee of drie maal daags (naar believen), in de handel verkrijgbaar voedsel, of een combinatie van beide
|
Larvale pekelkreeftjes twee of drie maal daags (naar believen), in de handel verkrijgbaar voedsel, of een combinatie van beide
|
Larvale pekelkreeftjes twee of drie keer daags (naar believen), in de handel verkrijgbaar voedsel, of een combinatie van beide
|
|
|
Geen, tenzij concentratie opgeloste zuurstof onder 60 % van de verzadigingswaarde van de lucht komt
|
Geen, tenzij concentratie opgeloste zuurstof onder 60 % van de verzadigingswaarde van de lucht komt
|
Geen, tenzij concentratie opgeloste zuurstof onder 60 % van de verzadigingswaarde van de lucht komt
|
|
|
Schoon oppervlakte- of bronwater, synthetisch water of ontchloord kraanwater
|
Schoon oppervlakte- of bronwater, synthetisch water of ontchloord kraanwater
|
Schoon oppervlakte- of bronwater, synthetisch water of ontchloord kraanwater
|
|
20.
|
Pre-blootstellingsperiode
|
|
7 dagen (aanbevolen)
|
7 dagen (aanbevolen)
|
7 dagen (aanbevolen)
|
|
21.
|
Duur van de blootstelling
|
|
21 dagen
|
21 dagen
|
21 dagen
|
|
22.
|
Biologische eindpunten
|
|
overleving
gedrag
sec. gesl.kenmerken
VTG
|
overleving
gedrag
sec. gesl.kenmerken
VTG
|
overleving
gedrag
VTG
|
|
23.
|
Aanvaardbaarheid van de test
|
|
Opgeloste zuurstof > 60 % van verzadigingswaarde; gem. temperatuur van 25 ± 2 °C; 90 % overlevende vissen in de controlegroepen; gemeten testconcentraties binnen 20 % van gemiddelde gemeten waarden per behandelingsniveau.
|
Opgeloste zuurstof > 60 % van verzadigingswaarde; gem. temperatuur van 24 ± 2 °C; 90 % overlevende vissen in de controlegroepen; gemeten testconcentraties binnen 20 % van gemiddelde gemeten waarden per behandelingsniveau.
|
Opgeloste zuurstof > 60 % van verzadigingswaarde; gem. temperatuur van 26 ± 2 °C; 90 % overlevende vissen in de controlegroepen; gemeten testconcentraties binnen 20 % van gemiddelde gemeten waarden per behandelingsniveau.
|
Aanhangsel 3
Enkele chemische kenmerken van aanvaardbaar verdunningswater
|
Onderdeel
|
Concentraties
|
|
Deeltjes
|
< 20 mg/l
|
|
Totale hoeveelheid organische koolstof
|
< 2 mg/l
|
|
Niet-geïoniseerde ammonium
|
< 1 μg/l
|
|
Chloorresiduen
|
< 10 μg/l
|
|
Totale hoeveelheid organofosfaat-bestrijdingsmiddelen
|
< 50 ng/l
|
|
Totale hoeveelheid organochloor-bestrijdingsmiddelen plus polychloorbifenylen
|
< 50 ng/l
|
|
Totale hoeveelheid organisch chloor
|
< 25 ng/l
|
Aanhangsel 4A
Kuitsubstraat voor de zebravis
Paaiblad
: geheel glazen instrumentenschaal, bijvoorbeeld van 22 × 15 × 5,5 cm (l × b × d), bedekt met verwijderbaar roestvrijstalen gaas (met openingen van 2 mm breed). Het gaas moet de opening van de instrumentenschaal bedekken op een niveau dat onder de rand ligt.

Op het gaas dient kuitsubstraat te worden bevestigd. Het moet de vissen een structuur bieden die ze kunnen binnengaan. Kunstmatige aquariumplanten van groen kunststofmateriaal zijn hiervoor bijvoorbeeld geschikt. (N.B. Houd rekening met mogelijke adsorptie van de teststof aan het kunststofmateriaal.) Het kunststofmateriaal moet gedurende voldoende tijd worden uitgeloogd in een ruime hoeveelheid warm water om te waarborgen dat geen chemische stoffen kunnen worden afgegeven aan het testwater. Bij het gebruik van glasmateriaal moet erop worden toegezien dat de vissen niet gewond of beklemd raken tijdens hun krachtige bewegingen.
De afstand tussen het blad en de glazen wanden dient ten minste 3 cm te bedragen om te waarborgen dat het paaien niet buiten het blad plaatsvindt. De op het blad gelegde eitjes vallen door het gaas; 45-60 minuten na het begin van de belichting kunnen er monsters van worden genomen. De transparante eitjes kleven niet en kunnen gemakkelijk worden geteld met behulp van transversaal licht. Wanneer 5 vrouwtjes per bak worden gebruikt, kunnen aantallen tot 20 per dag als laag, tot 100 per dag als gemiddeld en boven de 100 per dag als hoog worden beschouwd. Zo laat mogelijk in de avond of zo vroeg mogelijk in de ochtend moet het paaiblad worden verwijderd om de eitjes te verzamelen en vervolgens het paaiblad weer aan te brengen in de testbak. De tijd tussen het verwijderen en weer aanbrengen van het blad mag niet langer dan 1 uur bedragen omdat anders de komst van het kuitsubstraat kan leiden tot afzonderlijk paren en paaien op een ongebruikelijk tijdstip. Als de situatie met zich meebrengt dat het paaiblad later moet worden aangebracht, dient dit ten minste 9 uur na het begin van de belichting te geschieden. Op zo'n laat tijdstip wordt geen paaigedrag meer uitgelokt.
Aanhangsel 4B
Kuitsubstraat voor de amerikaanse dikkop-elrits
In elk van de testkamers worden twee of drie gecombineerde paaibuizen en -bladen van kunststof/keramiek/glas of roestvrij staal geplaatst, bijvoorbeeld een grijze halfronde buis van 80 mm lengte op een blad met opstaande rand van 130 mm lengte (zie afbeelding). Goed geacclimatiseerde buizen van pvc of keramiek zijn aantoonbaar geschikt als kuitsubstraat (Thorpe et al., 2007).
Aanbevolen wordt geschuurde buizen te gebruiken om de adhesie te verbeteren. Ook moet het blad worden afgeschermd om te voorkomen dat de vissen de gevallen eitjes bereiken, tenzij de adhesiewerking voor het gebruikte kuitsubstraat is aangetoond.

De bladbodem is zo ontworpen dat deze alle eitjes bevat die zich niet aan het buisoppervlak hechten en anders op de bodem van de bak zouden vallen (en de eitjes die rechtstreeks op de platte kunststofbodem worden gelegd). Alle kuitsubstraten moeten voor gebruik minimaal 12 uur worden uitgeloogd in verdunningswater.
VERWIJZINGEN
Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98.
Aanhangsel 5A
Beoordeling van secundaire geslachtskenmerken bij amerikaanse dikkop-elritsen voor de opsporing van bepaalde endocrien actieve chemische stoffen
Overzicht
Potentieel belangrijke kenmerken van het fysieke voorkomen van volwassen Amerikaanse dikkop-elritsen tijdens tests met hormoonontregelaars zijn de lichaamskleur (licht/donker), kleurpatronen (aan- of afwezigheid van verticale banen), lichaamsvorm (vorm van de kop en borstregio, zwelling van de buik) en speciale secundaire geslachtskenmerken (aantal en grootte van nuptiale papillen, grootte van de nekverdikking en de legbuis).
Nuptiale papillen bevinden zich op de kop (nekverdikking) van seksueel actieve mannetjes van de Amerikaanse dikkop-elrits, gewoonlijk in een tweezijdig symmetrisch patroon (Jensen et al. 2001). Controlevrouwtjes en jonge mannetjes en vrouwtjes vertonen geen papillaire ontwikkeling (Jensen et al. 2001). Er kunnen zich tot acht afzonderlijke papillen rond de ogen en tussen de neusgaten van de mannetjes bevinden. De meeste en de grootste papillen worden in twee evenwijdige lijnen direct onder de neusgaten en boven de bek aangetroffen. Veel vissen hebben groepen papillen onder de onderkaak. Die welke het dichtst bij de bek zitten, vormen meestal één paar, terwijl de reeks dichter bij de buik kan bestaan uit maximaal vier papillen. Het feitelijke aantal papillen is zelden meer dan 30 (bereik van 18-28; Jensen et al. 2001). De overheersende papillen (in aantal) zijn aanwezig als een enkele, relatief ronde structuur met een hoogte die ongeveer gelijk is aan de diameter. De meeste seksueel actieve mannetjes hebben ook ten minste een aantal papillen die zo vergroot en geprononceerd zijn dat ze niet als afzonderlijke structuren te onderscheiden zijn.
Sommige soorten hormoonverstorende stoffen kunnen leiden tot abnormaal optreden van bepaalde secundaire geslachtskenmerken bij de andere sekse. Zo kunnen androgene receptoragonisten, zoals 17β-methyltestosteron of 17β-trenbolone, bijvoorbeeld bij vrouwelijke Amerikaanse dikkop-elritsen de ontwikkeling van nuptiale papillen veroorzaken (Smith 1974; Ankley et al. 2001; 2003), terwijl oestrogene receptoragonisten het aantal of de grootte van nuptiale papillen bij mannetjes kunnen verkleinen (Miles-Richardson et al. 1999; Harries et al. 2000).
Hierna volgt een beschrijving van de kenmerken van nuptiale papillen bij Amerikaanse dikkop-elritsen op basis van procedures die worden gebruikt in het laboratorium van het Amerikaanse Environmental Protection Agency in Duluth (Minnesota). Specifieke producten en/of apparaten kunnen worden vervangen door vergelijkbare beschikbare materialen.
De beste weergave wordt bereikt met behulp van een verlicht vergrootglas of 3x vergrotende verlichte ontleedmicroscoop. Geef de vis dorsaal en met de kop naar voren (in de richting van de kijker) weer.
|
a)
|
Plaats de vis op een petrischaaltje (bijvoorbeeld 100 mm doorsnee), met de kop naar voren en de buikzijde omlaag. Stel de zoeker scherp om identificatie van papillen mogelijk te maken. Rol de vis langzaam en voorzichtig van zijde naar zijde om gebieden met papillen te identificeren. Tel en beoordeel de papillen.
|
|
b)
|
Herhaal de waarneming op het ventrale kopoppervlak door de vis met de rug naar voren op het petrischaaltje te leggen.
|
|
c)
|
De waarnemingen moeten per vis binnen twee minuten voltooid zijn.
|
Tellen en beoordelen van de papillen
Er zijn zes specifieke gebieden aangewezen die moeten worden beoordeeld op aanwezigheid en ontwikkeling van papillen bij volwassen Amerikaanse dikkop-elritsen. Er is een sjabloon ontwikkeld om de locatie en de hoeveelheid papillen in kaart te brengen (zie einde van dit aanhangsel). Het aantal papillen wordt genoteerd, waarbij de grootte per organisme als volgt kan worden aangegeven: 0-afwezig, 1-aanwezig, 2-vergroot en 3-geprononceerd (fig. 1).
De score 0-afwezig betekent dat geen enkele papil aanwezig is. De score 1-aanwezig wordt toegekend aan elke papil die uit één punt bestaat waarvan de hoogte bijna gelijk is aan de doorsnee (diameter). De score 2-vergroot wordt toegekend aan weefsel dat eruitziet als een asterisk, gewoonlijk met een brede ronde basis met groeven of sporen die vanuit het midden lopen. De papilhoogte is meestal grilliger maar kan soms enigszins afgerond zijn. De score 3-geprononceerd geldt voor een tamelijk grote, afgeronde papil met een minder duidelijk gedefinieerde structuur. Soms komen deze papillen samen zodat ze één geheel vormen op één of meer gebieden (B, C en D, hierna beschreven). Kleur en vorm zijn soortgelijk aan score 2 maar af en toe tamelijk ongedifferentieerd. Toepassing van dit beoordelingssysteem leidt in het algemeen tot een totale papilscore van < 50 bij een normaal controlemannetje met 18 tot 20 papillen (Jensen et al. 2001).
Figuur 1
Het werkelijke aantal papillen kan bij sommige vissen groter zijn dan het aantal vakjes in de sjablonen (aanhangsel A) voor een bepaald gebied. Als dit het geval is, kunnen extra scorecijfers worden genoteerd in of naast het kader. De sjabloon hoeft derhalve geen symmetrie te vertonen. Een aanvullende methode om papillen in kaart te brengen die paarsgewijs of verticaal verbonden langs het horizontale vlak van de bek voorkomen, is het noteren van dubbele scores voor twee papillen in één vakje.
In kaart te brengen gebieden:
A— Papillen rond het oog. Van dorsaal naar ventraal getekend rond de voorste oogrand. Gewoonlijk meerdere bij volwassen controlemannetjes, niet aanwezig bij controlevrouwtjes, in het algemeen in paren (één bij elk oog) of één bij vrouwtjes die zijn blootgesteld aan androgenen.
B— Papillen tussen de neusgaten, (zintuigkanaalporiën). Normaal in paren bij controlemannetjes met hogere scores (2-vergroot of 3-geprononceerd). Niet aanwezig bij controlevrouwtjes, wel enige incidentie en ontwikkeling bij vrouwtjes die zijn blootgesteld aan androgenen.
C— Papillen onmiddellijk voor de neusgaten, evenwijdig aan de bek. Gewoonlijk vergroot of geprononceerd bij volwassen controlemannetjes. Aanwezig of vergroot bij minder ontwikkelde mannetjes of met androgenen behandelde vrouwtjes.
D— Papillen evenwijdig aan de beklijn. In het algemeen ontwikkeld bij controlemannetjes. Afwezig bij controlevrouwtjes maar aanwezig bij vrouwtjes die zijn blootgesteld aan androgenen.
E— Papillen op de onderkaak, dicht bij de bek, meestal klein en gewoonlijk in paren. Verschillend bij controlemannetjes of behandelde mannetjes, en bij behandelde vrouwtjes.
F— Papillen aan de buikzijde van E. Gewoonlijk klein en in paren. Aanwezig bij controlemannetjes en aan androgenen blootgestelde vrouwtjes.
VERWIJZINGEN
|
(1)
|
Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276-1290.
|
|
(2)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Hornung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray EL. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22:1350-1360.
|
|
(3)
|
Harries JE, Runnalls T, Hill E, Harris CA, Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003-3011.
|
|
(4)
|
Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128:127-141.
|
|
(5)
|
Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515-523.
|
|
(6)
|
Miles-Richardson SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47:129-145.
|
|
(7)
|
Smith RJF. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52:1031-1038.
|
|
Papillensjabloon
|
Numerieke score
|
|
ID
|
1-aanwezig
|
|
Datum
|
2-vergroot
|
|
Totaalscore
|
3-geprononceerd
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Aanhangsel 5B
Beoordeling van secundaire geslachtskenmerken bij japanse rijstvisjes voor de opsporing van bepaalde endocrien actieve chemische stoffen
Hierna volgt een beschrijving van het meten van de papillaire uitsteeksels (21) die de secundaire geslachtskenmerken van het Japanse rijstvisje (Oryzias latipes) vormen.
|
1)
|
Na de excisie van de lever (aanhangsel 6) wordt het karkas in een conische reageerbuis met ongeveer 10 ml 10 % neutraal gebufferde formaline geplaatst (hoofd boven, staart beneden). Als de geslachtsklier is ingespoten met een andere oplossing dan 10 % neutraal gebufferde formaline, wordt met een scheermes het karkas dwars doorgesneden tussen de regio vóór de anaalvin en de anus, waarbij zorgvuldig dient te worden vermeden dat de geslachtsopening en de geslachtsklier zelf beschadigd raken (fig. 3). Plaats de craniale zijde van de vis in de fixeeroplossing om de geslachtsklier te conserveren en de staartzijde van de vis in de 10 % neutraal gebufferde formaline zoals hierboven beschreven.
|
|
2)
|
Houd, nadat de vis in 10 % neutraal gebufferde formaline is geplaatst, het voorste deel van de anaalvin met een pincet ongeveer 30 seconden omgevouwen om de anaalvin open te houden. Wanneer u de anaalvin met een pincet beetpakt, pakt u voorzichtig een paar vinstralen in het voorste gedeelte beet om geen krassen op de papillaire uitsteeksels te veroorzaken.
|
|
3)
|
Nadat u de anaalvin ongeveer 30 seconden open hebt gehouden, bewaart u het karkas van de vis bij kamertemperatuur in 10 % neutraal gebufferde formaline totdat de papillaire uitsteeksels worden gemeten (ten minste 24 uur na de fixatie).
|
Meting
|
1)
|
Nadat het karkas van de vis ten minste 24 uur is gefixeerd in de 10 % neutraal gebufferde formaline, haalt u het uit de conische reageerbuis en veegt u de formaline af op het filterpapier (of keukenpapier).
|
|
2)
|
Leg de vis met de buik naar boven. Knip de anaalvin met een kleine ontleedschaar voorzichtig af (bij voorkeur met een kleine hoeveelheid ondersteunend been).
|
|
3)
|
Neem het voorste deel van de afgesneden anaalvin met een pincet en leg het op een glasplaatje met een aantal druppels water. Bedek de anaalvin vervolgens met een dekglaasje. Pas op dat u de papillaire uitsteeksels niet bekrast wanneer u de anaalvin met het pincet oppakt.
|
|
4)
|
Bepaal het nummer van de verbindingsplaat met papillaire uitsteeksels met behulp van de teller onder een biologische microscoop (staande microscoop of omgekeerde microscoop). De papillaire uitsteeksels zijn herkenbaar wanneer een kleine uitstulping zichtbaar is op de achterrand van de verbindingsplaat. Noteer het nummer van de verbindingsplaat en het aantal papillaire uitsteeksels voor elke vinstraal in het werkblad (bijvoorbeeld eerste vinstraal: 0, tweede vinstraal: 10, derde vinstraal: 12, enz.) en voer het totaal van deze aantallen voor elke afzonderlijke vis in in het Excel-spreadsheet. Indien nodig kunt u een foto van de anaalvin maken en het aantal verbindingsplaten met papillaire uitsteeksels op de foto tellen.
|
|
5)
|
Na de meting bewaart u de anaalvin in de bij (1) genoemde conische reageerbuis.
|
Fig. 1.
Diagram met verschillen naar geslacht in vorm en grootte van de anaalvin. A = mannetje; B = vrouwtje. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.
Fig. 2.
A. Uitsteeksels op verbindingsplaten van anaalvinstralen. J.P. = verbindingsplaat; A.S. = axiale ruimte; P. = uitsteeksel. B. Distaal uiteinde van vinstraal. Actinotrichia (Act.) bevinden zich aan de punt. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

Fig. 3.
Foto van vis met de plaats van de snede voor het fixeren van de geslachtsklier in een andere fixeeroplossing dan 10 % neutraal gebufferde formaline. In dat geval wordt het karkas doorgesneden met een scheermes tussen de regio vóór de anaalvin en de anus (rode streep), en wordt de kopzijde van de vis in de fixeeroplossing voor de geslachtsklier en de staartzijde van de vis in de 10 % neutraal gebufferde formaline geplaatst.

Aanhangsel 6
Aanbevolen procedures voor monsterneming ten behoeve van vitellogenine-analyse
Er moet zorgvuldig worden voorkomen dat kruisbesmetting tussen VTG-monsters van mannetjes en vrouwtjes optreedt.
Procedure 1A: Amerikaanse dikkop-elrits: bloedafname uit de staartader of -slagader
Na anesthesering wordt de staartwortel gedeeltelijk afgesneden met een ontleedmesje en wordt bloed afgenomen uit de staartader of -slagader met een gehepariniseerd microhematocriet capillair buisje. Na de bloedafname wordt het plasma snel geïsoleerd door middel van centrifugeren gedurende 3 minuten bij 15 000 g (of gedurende 10 minuten bij 15 000 g en een temperatuur van 4 °C). Indien gewenst kan na het centrifugeren het hematocrietpercentage worden bepaald. Het plasmadeel wordt vervolgens uit het microhematocriet buisje genomen en in een centrifugebuis met 0,13 eenheden aprotinine (een proteaseremmer) bewaard bij – 80 °C totdat de vitellogeninebepaling kan plaatsvinden. Afhankelijk van de grootte van de Amerikaanse dikkop-elrits (die sekse-afhankelijk is) lopen de af te nemen hoeveelheden plasma meestal uiteen van 5 tot 60 microliter per vis (Jensen et al. 2001).
Procedure 1B: Amerikaanse dikkop-elrits: bloedafname uit het hart
Als alternatief kan ook bloed worden afgenomen door middel van een hartpunctie met een gehepariniseerde injectiespuit (1 000 eenheden heparine per ml). Het bloed wordt overgebracht naar eppendorfbuizen (op ijs bewaard) en vervolgens gecentrifugeerd (5 minuten bij 7 000 g en kamertemperatuur). Het plasma moet daarna worden overgebracht naar schone eppendorfbuizen (in aliquots als de hoeveelheid plasma dit mogelijk maakt) en onmiddellijk worden bevroren en bewaard bij – 80 °C totdat het wordt geanalyseerd (Panter et al. 1998).
Procedure 2A: Japans rijstvisje: excisie van de lever
De testvissen uit de testkamer scheppen
|
(1)
|
Testvissen moeten uit de testkamer worden gehaald met een klein schepnet. Pas op dat u de vissen niet in andere testkamers laat vallen.
|
|
(2)
|
In principe moeten de testvissen in deze volgorde worden opgeschept: controle, oplosmiddelcontrole (indien van toepassing), laagste concentratie, middelste concentratie, hoogste concentratie en positieve controle. Bovendien moeten alle mannetjes uit één testkamer worden geschept voordat de vrouwtjes uit die testkamer worden opgeschept.
|
|
(3)
|
Het geslacht van elke vis wordt vastgesteld op basis van uitwendige secundaire geslachtskenmerken (bijvoorbeeld de vorm van de anaalvin).
|
|
(4)
|
Zet de testvissen in een transportbak en breng deze naar het werkstation voor excisie van de lever. Controleer voor de zekerheid de labels van de testkamer en de transportbak om te verifiëren dat zowel het aantal testvissen dat uit de testkamer is verwijderd als het aantal vissen dat in de testkamer overblijft, het verwachte aantal is.
|
|
(5)
|
Als het geslacht niet kan worden bepaald aan de hand van het uiterlijk van de vissen, verwijdert u alle vissen uit de testkamer. In dat geval moet het geslacht worden vastgesteld door waarneming van de geslachtsklier of secundaire geslachtskenmerken onder een stereoscopische microscoop.
|
Excisie van de lever
|
(1)
|
Breng de testvis van de transportbak over naar de anesthetische oplossing met het kleine schepnet.
|
|
(2)
|
Leg de testvis, nadat deze is verdoofd, op het filterpapier (of keukenpapier) met een gewoon pincet. Grijp met het pincet de testvis bij de kop om te voorkomen dat de staart breekt.
|
|
(3)
|
Dep het water op het oppervlak van de testvis op met het filterpapier (of keukenpapier).
|
|
(4)
|
Leg de vis met de buik naar boven. Breng met een ontleedschaar een kleine dwarsincisie aan ergens tussen de nekregio aan de buikzijde en het midden van de buikregio.
|
|
(5)
|
Steek de ontleedschaar in de kleine incisie en snij de buik in vanaf een punt aan de staartzijde van de kieuwmantel tot de craniale zijde van de anus langs de middellijn van de buik. Pas op dat u de ontleedschaar niet te diep inbrengt om te voorkomen dat de lever en de geslachtsklier beschadigd raken.
|
|
(6)
|
Voer de volgende handelingen uit onder de stereoscopische microscoop.
|
|
(7)
|
Leg de testvis met de buikzijde omhoog op het keukenpapier (een glazen petrischaaltje en glasplaatje zijn ook beschikbaar).
|
|
(8)
|
Trek de wanden van de buikholte met een precisiepincet opzij en breng de inwendige organen naar buiten. Indien nodig mogen de inwendige organen ook naar buiten worden gebracht door één zijde van de buikholtewand te verwijderen.
|
|
(9)
|
Leg het onderling verbonden deel van de lever en de galblaas bloot met behulp van nog een precisiepincet. Neem vervolgens het galkanaal en snij de galblaas af. Wees voorzichtig, zodat de galblaas niet breekt.
|
|
(10)
|
Neem de slokdarm en snij op dezelfde wijze het spijsverteringskanaal los van de lever. Wees voorzichtig, zodat de inhoud niet uit het spijsverteringskanaal lekt. Snij het staarteinde van het spijsverteringskanaal los van de anus en verwijder het kanaal uit de buikholte.
|
|
(11)
|
Snij de vetmassa en andere weefsels rond de lever weg. Wees voorzichtig, zodat er geen krassen op de lever komen.
|
|
(12)
|
Pak de leverpoort met het precisiepincet en verwijder de lever uit de buikholte.
|
|
(13)
|
Leg de lever op het glasplaatje. Gebruik het precisiepincet om zo nodig al het extra vet en uitwendig weefsel (bijvoorbeeld buikranden) van het leveroppervlak te verwijderen.
|
|
(14)
|
Bepaal het gewicht van de lever, met een microbuisje van 1,5 ml als tarra, met behulp van een elektronische precisiebalans. Noteer de waarde op het werkblad (nauwkeurigheid: 0,1 mg). Verifieer de identificatiegegevens op het label van het microbuisje.
|
|
(15)
|
Sluit het kapje van het microbuisje met de lever. Bewaar de buis in een koel- of ijsrek.
|
|
(16)
|
Reinig de incisie-instrumenten na het uitnemen van één lever of vervang ze door schone exemplaren.
|
|
(17)
|
Verwijder op bovenvermelde wijze de lever uit alle vissen in de transportbak.
|
|
(18)
|
Nadat de lever is verwijderd uit elk van de vissen in de transportbak (d.w.z. alle mannetjes of vrouwtjes uit een testkamer), worden alle levermonsters in een buizenrek met een identificatielabel geplaatst en in een vriezer bewaard. Wanneer de levers kort na de excisie beschikbaar worden gesteld voor voorbehandeling, worden de monsters in een koel- of ijsrek naar het volgende werkstation gebracht.
|
Na de leverexcisie is het karkas beschikbaar voor het meten van secundaire geslachtskenmerken.
Monsters
Bewaar de uit de testvissen genomen levermonsters bij ≤ – 70 °C als ze niet kort na de excisie worden gebruikt voor de voorbehandeling.
Fig. 1.
Net voor de borstvinnen wordt een snede aangebracht met een schaar.

Fig. 2.
De middellijn van de buik wordt met een schaar opengesneden tot ongeveer 2 mm van de craniale zijde van de anus.
Fig. 3.
De buikwanden worden gespreid met een tang om de lever en andere inwendige organen bloot te leggen. (Als alternatief kunnen de buikwanden lateraal worden vastgezet).
Fig. 4.
De lever wordt grofweg ontleed en uitgenomen met een tang.

Fig. 5.
De ingewanden worden voorzichtig opzij getrokken met een tang.

Fig. 6.
Beide uiteinden van de ingewanden en alle mesenterische aanhechtingen worden doorgesneden met een schaar.

Fig. 7. (vrouwtje)
De procedure is identiek voor de vrouwtjesvis.

Fig. 8.
De procedure is afgerond.
Procedure 2 B: Japans rijstvisje (Oryzias latipes): voorbehandeling van de lever ten behoeve van vitellogenineanalyse
Neem de fles homogenaatbuffer uit de ELISA-uitrusting en koel deze met gemalen ijs (temperatuur van de oplossing: ≤ 4 °C). Als gebruik wordt gemaakt van homogenaatbuffer van het EnBio ELISA-systeem, ontdooit u de oplossing bij kamertemperatuur en koelt u de fles vervolgens met gemalen ijs.
Bereken het volume homogenaatbuffer voor de lever op basis van het gewicht van de lever (voeg 50 μl homogenaatbuffer per mg levergewicht toe voor het homogenaat). Als het gewicht van de lever bijvoorbeeld 4,5 mg is, bedraagt het volume homogenaatbuffer voor die lever 225 μl. Stel een lijst op van de volumes homogenaatbuffer voor alle levers.
De lever prepareren voor de voorbehandeling
|
(1)
|
Neem het microbuisje van 1,5 ml met de lever vlak voor de voorbehandeling uit de vriezer.
|
|
(2)
|
De voorbehandeling van de levers van mannetjes moet worden uitgevoerd voor die van de vrouwtjes om vitellogeninebesmetting te voorkomen. Bovendien moet de voorbehandeling voor de testgroepen in deze volgorde worden uitgevoerd: controle, oplosmiddelcontrole (indien van toepassing), laagste concentratie, middelste concentratie, hoogste concentratie en positieve controle.
|
|
(3)
|
Het aantal microbuisjes van 1,5 ml met levermonsters dat op een gegeven moment uit de vriezer wordt genomen, mag niet groter zijn dan het aantal dat op dat moment kan worden gecentrifugeerd.
|
|
(4)
|
Plaats de microbuisjes van 1,5 ml met levermonsters op het ijsrek in de volgorde van de monsternummers (het is niet nodig de lever te ontdooien).
|
De voorbehandeling uitvoeren
1. Toevoeging van de homogenisatiebuffer
|
(1)
|
Controleer in de lijst het volume homogenaatbuffer dat moet worden gebruikt voor een bepaald levermonster en stel de micropipet (volumebereik: 100-1 000 μl) in op het juiste volume. Bevestig een schone tip aan de micropipet.
|
|
(2)
|
Neem de homogenaatbuffer uit de fles met reagens en voeg de buffer toe aan het microbuisje van 1,5 ml dat de lever bevat.
|
|
(3)
|
Voeg volgens de hierboven beschreven procedure de homogenaatbuffer toe aan alle microbuisjes van 1,5 ml die een lever bevatten. Het is niet nodig de tip van de micropipet te vervangen door een nieuwe. Als de tip echter besmet of mogelijk besmet is, moet de tip wel worden vervangen.
|
2. Homogenisatie van de lever
|
(1)
|
Bevestig een nieuwe homogenisatiestamper aan de homogenisator van het microbuisje.
|
|
(2)
|
Steek de stamper in het microbuisje van 1,5 ml. Neem de homogenisator van het microbuisje in de hand en druk de lever fijn tussen het oppervlak van de stamper en de binnenwand van het microbuisje van 1,5 ml.
|
|
(3)
|
Gebruik de homogenisator van het microbuisje gedurende 10 tot 20 seconden. Koel tijdens deze handeling het microbuisje van 1,5 ml met gemalen ijs.
|
|
(4)
|
Til de stamper uit het microbuisje van 1,5 ml en laat hem ongeveer 10 seconden rusten. Voer vervolgens een visuele inspectie van de staat van de suspensie uit.
|
|
(5)
|
Als er stukjes lever in de suspensie worden waargenomen, herhaalt u de bewerkingen (3) en (4) om een bevredigend leverhomogenaat te bereiden.
|
|
(6)
|
Koel het gesuspendeerde leverhomogenaat op het ijsrek tot het centrifugeren.
|
|
(7)
|
Vervang de stamper voor elk homogenaat door een nieuwe.
|
|
(8)
|
Homogeniseer alle levers met homogenaatbuffer volgens de hierboven beschreven procedure.
|
3. Centrifugeren van het gesuspendeerde leverhomogenaat
|
(1)
|
Verifieer dat de temperatuur in de gekoelde centrifugekamer ≤ 5 °C is.
|
|
(2)
|
Plaats de microbuisjes van 1,5 ml met het gesuspendeerde leverhomogenaat in de gekoelde centrifuge (pas indien nodig de balans aan).
|
|
(3)
|
Centrifugeer het gesuspendeerde leverhomogenaat bij 13 000 g en ≤ 5 °C gedurende 10 minuten. Als de supernatantia goed gescheiden zijn, kunnen de centrifugale kracht en tijdsduur indien nodig worden aangepast.
|
|
(4)
|
Controleer na het centrifugeren of de supernatantia voldoende gescheiden zijn (oppervlakte: vet, tussenlaag: supernatans, onderlaag: leverweefsel). Als de scheiding ontoereikend is, centrifugeert u de suspensie opnieuw onder dezelfde omstandigheden.
|
|
(5)
|
Neem alle monsters uit de gekoelde centrifuge en plaats ze op monsternummer op het ijsrek. Pas op dat elk van de gescheiden lagen niet opnieuw wordt gesuspendeerd na het centrifugeren.
|
4. Afname van het supernatans
|
(1)
|
Zet vier microbuisjes van 0,5 ml in het rek om er het supernatans in op te slaan.
|
|
(2)
|
Neem 30 μl van elk supernatans (gescheiden als tussenlaag) met behulp van de micropipet en druppel dit in één microbuisje van 0,5 ml. Pas op dat er geen vet van het oppervlak of leverweefsel uit de onderlaag wordt meegenomen.
|
|
(3)
|
Neem het supernatans en druppel het in twee andere microbuisjes van 0,5 ml op de hierboven beschreven wijze.
|
|
(4)
|
Verzamel de rest van het supernatans met de micropipet (indien mogelijk: ≥ 100 μl). Druppel dit supernatans in het resterende microbuisje van 0,5 ml. Pas op dat er geen vet van het oppervlak of leverweefsel uit de onderlaag wordt meegenomen.
|
|
(5)
|
Sluit het kapje van dit microbuisje van 0,5 ml en noteer het volume van het supernatans op het label. Koel de microbuisjes vervolgens onmiddellijk op het ijsrek.
|
|
(6)
|
Vervang de tip van de micropipet voor elk supernatans door een nieuwe. Als zich een grote hoeveelheid vet aan de tip hecht, moet u deze meteen door een nieuwe vervangen om te voorkomen dat het leverextract door het vet verontreinigd raakt.
|
|
(7)
|
Druppel al het gecentrifugeerde supernatans in vier microbuisjes van 0,5 ml volgens de hierboven beschreven procedure.
|
|
(8)
|
Zodra het supernatans is verdeeld over de microbuisjes van 0,5 ml, plaatst u deze allemaal in het buizenrek met het identificatielabel en bevriest ze vervolgens onmiddellijk in de vriezer. Als de VTG-concentraties onmiddellijk na de voorbehandeling worden gemeten, houdt u één microbuisje van 0,5 ml (met 30 μl supernatans) gekoeld in het buizenrek en brengt u dit over naar het werkstation waar de ELISA-test wordt uitgevoerd. In dat geval plaatst u de overige microbuisjes in de buizenrekken en bevriest u deze in de vriezer.
|
|
(9)
|
Gooi na het verzamelen van het supernatans het residu op passende wijze weg.
|
Opslag van de monsters
Bewaar de microbuisjes van 0,5 ml met het supernatans van het leverhomogenaat bij een temperatuur van ≤ – 70 °C totdat ze voor de ELISA-test worden gebruikt.
Procedure 3A: Zebravis: bloedafname uit de staartader of -slagader
Na anesthesering wordt de staartwortel overdwars afgesneden en wordt bloed afgenomen uit de staartader of -slagader met een gehepariniseerd microhematocriet capillair buisje. De hoeveelheden bloed lopen uiteen van 5 tot 15 μl, afhankelijk van de visgrootte. Er wordt een gelijke hoeveelheid aprotininebuffer (6 μgml in PBS) aan het microcapillaire buisje toegevoegd en het plasma wordt van het bloed gescheiden door middel van centrifugeren (5 minuten bij 600 g). Het plasma wordt verzameld in de reageerbuisjes en bewaard bij – 20 °C totdat het wordt geanalyseerd op vitellogenine of andere belangwekkende proteïnen.
Procedure 3B: Zebravis: bloedafname door middel van hartpunctie
Om coagulatie van het bloed en proteïneafbraak te voorkomen, worden de monsters verzameld in een fosfaatgebufferde zoutoplossing (PBS) die heparine (1 000 eenheden/ml) en de proteaseremmer aprotinine (2 TIU/ml) bevat. Als ingrediënten voor de buffer worden ammoniumzout van heparine en gevriesdroogde aprotinine aanbevolen. Voor de bloedafname wordt een injectiespuit (1 ml) met een vaste dunne naald (bijvoorbeeld Braun Omnikan-F) aanbevolen. De spuit moet vooraf gevuld zijn met de buffer (ongeveer 100 μl) om de kleine hoeveelheden bloed volledig uit de vissen te wassen. De bloedmonsters worden afgenomen door middel van een hartpunctie. Eerst moet de vis worden geanestheseerd met MS-222 (100 mg/l). Met het juiste anesthesieniveau kan de gebruiker de hartslag van de zebravis onderscheiden. Houd tijdens de hartpunctie de zuiger van de injectiespuit onder lichte druk. De af te nemen hoeveelheden bloed lopen uiteen van 20 tot 40 microliter. Na de hartpunctie moet het mengsel van bloed en buffer in de reageerbuis worden gespoten. Het plasma wordt van het bloed gescheiden door middel van centrifuge (20 minuten bij 5 000 g) en moet bij een temperatuur van – 80 °C worden bewaard totdat het nodig is voor analyse.
Procedure 3C: SOP: zebravis: homogenisatie van kop en staart
|
(1)
|
De vissen worden verdoofd en geëuthanaseerd volgens de testbeschrijving.
|
|
(2)
|
De kop en de staart worden van de vis afgesneden volgens figuur 1.
|
Belangrijk: alle ontleedinstrumenten en de snijplank moeten goed worden gespoeld en gereinigd (bijvoorbeeld met 96 % ethanol) na de bewerking van elke vis om „vitellogeninevervuiling” van vrouwtjes of paaiende mannetjes op niet-paaiende mannetjes te voorkomen.
Figuur 1

|
(3)
|
Het totaalgewicht van de kop en staart wordt per vis tot op 1 mg nauwkeurig gemeten.
|
|
(4)
|
Nadat ze zijn gewogen worden de lichaamsdelen in geschikte buisjes gedaan (bijvoorbeeld eppendorfbuizen van 1,5 ml) en bevroren bij – 80 °C tot ze worden gehomogeniseerd, of onmiddellijk gehomogeniseerd op ijs met twee plastic stampers. (Er kunnen andere methoden worden toegepast, mits uitgevoerd op ijs en mits het resultaat een homogene massa is.) Belangrijk: de buisjes moeten correct worden genummerd zodat de koppen en staarten van de vissen kunnen worden gerelateerd aan hun respectieve lichamen die worden gebruikt voor de histologie van de geslachtsklier.
|
|
(5)
|
Wanneer een homogene massa is bereikt, wordt 4 × het weefselgewicht van de ijskoude homogenisatiebuffer (22) toegevoegd. Blijf de stampers bewegen totdat het mengsel homogeen is. Belangrijke opmerking: voor elke vis moeten nieuwe stampers worden gebruikt.
|
|
(6)
|
De monsters worden op ijs bewaard totdat ze gedurende 30 minuten bij 4 °C en 50 000 g worden gecentrifugeerd.
|
|
(7)
|
Gebruik een pipet om porties van 20 μl supernatans in ten minste twee buisjes te druppelen door de tip van de pipet onder de vetlaag aan de oppervlakte te houden en het supernatans zorgvuldig zonder vet- of pelletdeeltjes op te zuigen.
|
|
(8)
|
De buisjes worden tot gebruik bewaard bij een temperatuur van – 80 °C.
|
Aanhangsel 7
Verrijkte vitellogeninemonsters en testonafhankelijke referentienorm
Op elke dag dat er vitellogeninetests worden uitgevoerd, wordt een verrijkt monster geanalyseerd dat is gemaakt volgens een testonafhankelijke referentienorm. De vitellogenine die wordt gebruikt voor de testonafhankelijke referentienorm is afkomstig uit een andere partij dan die welke is gebruikt om kalibratienormen samen te stellen voor de test die wordt uitgevoerd.
Het verrijkte monster wordt gemaakt door toevoeging van een bekende hoeveelheid van de testonafhankelijke referentienorm aan een plasmamonster van controlemannetjes. Het monster wordt verrijkt om een vitellogenineconcentratie te bereiken die 10 tot 100 keer zo groot is als de verwachte vitellogenineconcentratie in de controlemannetjes. Het plasmamonster van controlemannetjes dat wordt verrijkt, mag afkomstig zijn van één vis of van meerdere vissen.
Een submonster van het nog niet verrijkte plasmamonster van controlemannetjes wordt ten minste in duplo geanalyseerd. Het verrijkte monster wordt eveneens ten minste in duplo geanalyseerd. De gemiddelde hoeveelheid vitellogenine in de twee niet verrijkte plasmamonsters van controlemannetjes wordt opgeteld bij de berekende hoeveelheid vitellogenine die is toegevoegd aan de verrijkte monsters om een verwachte concentratie te bepalen. De verhouding tussen deze verwachte concentratie en de gemeten concentratie wordt gerapporteerd samen met de resultaten van elke set tests die op die dag is uitgevoerd.
Aanhangsel 8
Beslisdiagram voor de statistische analyse

C.38. AMFIBISCHE METAMORFOSETEST (AMA)
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan testrichtsnoer (TG) 231 (2009) van de OESO. De behoefte om een test te ontwikkelen en te valideren voor het opsporen van chemische stoffen die actief zijn in het schildkliersysteem van gewervelde diersoorten, komt voort uit bezorgdheid dat de gehaltes aan chemische stoffen in het milieu schadelijke effecten kunnen veroorzaken bij zowel mensen als dieren. In 1998 is de OESO een actie gestart om bestaande testrichtsnoeren te herzien en nieuwe testrichtsnoeren te ontwikkelen voor het screenen en testen op potentiële hormoonontregelaars. Eén onderdeel van de actie was de ontwikkeling van een testrichtsnoer voor het screenen van chemische stoffen die een uitwerking hebben op het schildklierstelsel van gewervelde diersoorten. Er werd een verbetering voorgesteld van zowel de 28-daagse test op orale toxiciteit bij herhaalde toediening aan knaagdieren (hoofdstuk B.7 van deze bijlage) als de amfibische metamorfosetest (Amphibian Metamorphosis Assay of AMA). De verbeterde testmethode B.7 heeft een validatieprocedure ondergaan en er is een herziene testmethode uitgegeven. De AMA werd onderworpen aan een uitvoerig validatieprogramma met intra- en interlaboratoriumstudies om de relevantie en betrouwbaarheid van de methode aan te tonen (1, 2). Vervolgens is de validatie van de testmethode het onderwerp geweest van collegiale toetsing door een panel van onafhankelijke deskundigen (3). Deze testmethode is het resultaat van de ervaring die is opgedaan tijdens de validatiestudies voor het opsporen van op de schildklier inwerkende stoffen, en van werk dat elders in OESO-landen is verricht.
|
PRINCIPE VAN DE TEST
|
2.
|
De amfibische metamorfosetest (AMA) is een screening die bedoeld is om op empirische wijze chemicaliën te identificeren die de normale werking van het hypothalamus-hypofyse-schildkliersysteem (de HPT-as) kunnen verstoren. De AMA hanteert een gegeneraliseerd model voor gewervelden in die zin dat de test is gebaseerd op de geconserveerde structuren en functies van de HPT-as. Het is een belangrijke test omdat de amfibische metamorfose een goed onderzocht schildkliergebonden proces is dat reageert op chemische stoffen die actief zijn binnen de HPT-as. Het is bovendien de enige bestaande test die schildklieractiviteit opspoort bij een dier dat morfologische ontwikkeling ondergaat.
|
|
3.
|
De algemene experimentele opzet houdt in dat kikkervisjes stadium 51 van Xenopus laevis gedurende 21 dagen worden blootgesteld aan minstens drie verschillende concentraties van een teststof en een controle met verdunningswater. Van elke testgroep worden vier duplo's uitgevoerd. De larvale dichtheid bij aanvang van de test is 20 kikkervisjes per testbak voor alle testgroepen. De gemeten eindpunten zijn lengte van de achterpoten, lengte van snuit tot anus (snout to vent, SVL), ontwikkelingsstadium, nat gewicht, schildklierhistologie en dagelijkse sterfte.
|
BESCHRIJVING VAN DE METHODE
Testsoort
|
4.
|
Xenopus laevis wordt stelselmatig gekweekt in laboratoria over de hele wereld en is gemakkelijk te verkrijgen via commerciële leveranciers. Reproductie kan bij deze soort gedurende het gehele jaar gemakkelijk worden opgewekt met behulp van injecties met humaan choriongonadotrofine (hCG) en de resulterende larven kunnen stelselmatig in grote aantallen worden opgekweekt tot geselecteerde ontwikkelingsstadia om het gebruik van stadiumspecifieke testprotocollen mogelijk te maken. Bij voorkeur zijn de gebruikte larven afkomstig van volwassen dieren uit eigen huis. Hoewel dit niet de voorkeur heeft, kunnen eieren of embryo's worden getransporteerd naar het laboratorium dat de test uitvoert en mogen ze daar acclimatiseren; vervoer in een larvaal stadium voor gebruik in de test is onaanvaardbaar.
|
Uitrusting en benodigdheden
|
5.
|
Voor de uitvoering van deze test zijn de volgende uitrusting en benodigdheden vereist:
|
a)
|
blootstellingssysteem (zie onderstaande beschrijving);
|
|
b)
|
glazen of roestvrijstalen aquaria (zie onderstaande beschrijving);
|
|
d)
|
apparatuur voor temperatuurbeheersing (bijv. verwarming of koeling (instelbaar op 22 ± 1 °C));
|
|
f)
|
binoculaire ontleedmicroscoop;
|
|
g)
|
digitale camera met een resolutie van minimaal 4 megapixel en een microfunctie;
|
|
h)
|
beelddigitalisatiesoftware;
|
|
i)
|
petrischaaltje (bijv. 100 × 15 mm) of transparante kunststof houder van vergelijkbare grootte;
|
|
j)
|
precisiebalans met een nauwkeurigheid van drie decimalen (mg);
|
|
m)
|
lichtsterktemeter die in luxeenheden kan meten;
|
|
n)
|
divers laboratoriumglaswerk en -gereedschap;
|
|
o)
|
instelbare pipetten (10 tot 5 000 μl) of diverse pipetten van gelijkwaardige formaten;
|
|
p)
|
teststof in voldoende hoeveelheden om het onderzoek uit te voeren, bij voorkeur uit één zending;
|
|
q)
|
analytische instrumenten die geschikt zijn voor de geteste stof of gecontracteerde analysediensten.
|
|
Testbaarheid van de stof
|
6.
|
De AMA is gebaseerd op een waterig blootstellingsprotocol waarbij teststof in de testkamers wordt ingebracht via een doorstroomsysteem. Doorstroommethoden brengen echter beperkingen met zich mee wat betreft de soorten stoffen die kunnen worden getest, afhankelijk van de fysisch-chemische eigenschappen van de stof. Daarom is het nodig, alvorens dit protocol te gebruiken, basisinformatie over de stof die relevant is voor het vaststellen van de testbaarheid, in te winnen en de richtsnoeren van de OESO voor het testen op aquatische toxiciteit bij moeilijke stoffen en mengsels (4) te raadplegen. Kenmerken die erop duiden dat de stof wellicht moeilijk te testen is in waterige systemen, zijn een hoge octanol-waterverdelingscoëfficiënt (log Kow), een grote vluchtigheid, gevoeligheid voor hydrolyse en gevoeligheid voor fotolyse in de lichtomstandigheden van het laboratorium. Ook andere factoren kunnen relevant zijn voor de vaststelling van de testbaarheid; deze moeten van geval tot geval worden bepaald. Als een goede test voor de stof niet mogelijk is met een doorstroomsysteem, kan een statisch verversingssysteem worden toegepast. Als geen van beide systemen geschikt is voor de teststof, is de norm dat de stof niet wordt getest volgens dit protocol.
|
Blootstellingssysteem
|
7.
|
Indien mogelijk moet de voorkeur gegeven worden aan een verdunningssysteem met doorstroming in plaats van statisch verversing. Als fysische en/of chemische eigenschappen van een van de teststoffen niet samengaan met een doorstroomverdunningssysteem, kan er een alternatief blootstellingssysteem (bijv. met statische verversing) worden toegepast. De systeemonderdelen die in contact met water komen, moeten gemaakt zijn van glas, roestvrij staal en/of polytetrafluorethyleen. Er kunnen echter ook geschikte kunststoffen worden gebruikt als deze de test niet verstoren. De bakken waarin de blootstelling plaatsvindt, dienen met standbuizen uitgeruste glazen of roestvrijstalen aquaria te zijn met een inhoud tussen 4,0 en 10,0 l en een minimale waterdiepte van 10 tot 15 cm. Het systeem moet geschikt zijn voor alle testconcentraties en een controle, met vier duplo's per testgroep. De doorstroomsnelheid naar elke bak dient constant te zijn ten behoeve van de instandhouding van de biologische omstandigheden en de blootstelling aan de teststof (bijv. 25 ml/min). De testbakken moeten willekeurig worden toegewezen aan een positie in het blootstellingssysteem teneinde mogelijke locatie-effecten, zoals lichte verschillen in temperatuur, lichtsterkte e.d., te beperken. Er dienen fluorescentielampen te worden gebruikt om een fotoperiode van 12 uur licht en 12 uur donker te realiseren met een lichtsterkte die uiteenloopt van 600 tot 2 000 lux (lumen/m2) op het wateroppervlak. De watertemperatuur moet in elke testbak op 22 ± 1 °C worden gehouden, de pH-waarde tussen 6,5 en 8,5 en het gehalte aan opgeloste zuurstof (DO) > 3,5 mg/l (> 40 % van de verzadigingswaarde van de lucht). De watertemperatuur, de pH-waarde en het gehalte aan opgeloste zuurstof moeten minimaal eens per week worden gemeten. Bij voorkeur wordt de temperatuur in ten minste één testbak permanent gemeten. In aanhangsel 1 worden de proefomstandigheden beschreven waaronder het protocol moet worden uitgevoerd. Voor meer informatie over de opzet van blootstellingssystemen met doorstroming en/of statische verversing wordt verwezen naar de ASTM-normen voor het uitvoeren van acute toxiciteitsproeven op testmaterialen met vissen, macro-invertebraten en amfibieën (5) en algemene richtsnoeren voor aquatische toxicologische tests.
|
Waterkwaliteit
|
8.
|
Elk water dat lokaal beschikbaar is (bijv. bronwater of met koolstof gefilterd kraanwater) en waarin normaal een normale groei en ontwikkeling van de X. laevis-kikkervisjes mogelijk is, kan worden gebruikt. Omdat de lokale waterkwaliteit van regio tot regio aanmerkelijk kan verschillen, moet een analyse van de waterkwaliteit worden uitgevoerd, met name als er geen historische gegevens over de bruikbaarheid van het water voor het kweken van Xenopus beschikbaar zijn. Er moet vooral op worden toegezien dat het water vrij is van koper, chloor en chloramine, die alle giftig zijn voor kikkers en kikkervisjes. Verder wordt aanbevolen het water te analyseren op achtergrondwaarden voor fluoride, perchloraat en chloraat (bijproducten van het desinfecteren van drinkwater), aangezien al deze anionen substraten van de jodiumtransporteur van de schildklier zijn en verhoogde waarden van deze ionen de uitkomsten van het onderzoek kunnen verstoren. De analyse moet worden uitgevoerd voordat het testen begint en het testwater moet normaliter vrij van deze anionen zijn.
|
Jodiumgehalte in testwater
|
9.
|
De schildklier kan alleen TH produceren als er voor de larven voldoende jodium beschikbaar is uit een combinatie van water- en voedingsbronnen. Op het ogenblik bestaan er geen empirisch gefundeerde richtsnoeren voor de minimale jodiumgehaltes. De beschikbaarheid van jodium kan echter de reactiviteit van het schildklierstelsel voor op de schildklier inwerkende stoffen beïnvloeden en het is bekend dat deze beschikbaarheid de basisactiviteit van de schildklier moduleert, een aspect dat in aanmerking moet worden genomen bij de interpretatie van de resultaten van de histopathologie van de schildklier. Daarom moeten de in het testwater gemeten jodiumconcentraties worden gerapporteerd. Op basis van de gegevens uit de validatiestudies blijkt het protocol goed te werken met een gehalte aan jodium (I-) in het testwater tussen 0,5 en 10 μg/l. Idealiter is het minimumgehalte aan jodium in het testwater 0,5 μg/l. Als het synthetisch water op basis van gedeïoniseerd water wordt gebruikt, moet minimaal 0,5 μg/l jodium worden toegevoegd. Elke andere toevoeging van jodium of andere zouten aan het testwater moet worden opgenomen in het verslag.
|
Leefomstandigheden van de dieren
Verzorging van volwassen dieren en kweek
|
10.
|
De verzorging van volwassen dieren en de kweek van jonge dieren geschieden overeenkomstig de standaardrichtsnoeren. De lezer wordt voor uitvoerige informatie verwezen naar de richtsnoeren voor het uitvoeren van de Frog Embryo Teratogenesis Assay (FETAX) (6). Dergelijke standaardrichtsnoeren bevatten voorbeelden van de juiste verzorgings- en kweekmethoden, al is strikte naleving niet vereist. Om voortplanting op te wekken, worden paren (3-5) volwassen vrouwtjes en mannetjes geïnjecteerd met humaan choriongonadotrofine (hCG). Vrouwelijke en mannelijke specimina worden geïnjecteerd met respectievelijk ongeveer 800-1 000 IU en 600-800 IU hCG in 0,6-0,9 % zoutoplossing. De paren worden ongestoord en onder statische omstandigheden in grote bakken gehouden om de paargreep (amplexus) te bevorderen. De vloer van elke kweekbak moet zijn voorzien van een dubbele bodem van roestvrijstalen of kunststof gaas waardoor de eiermassa op de bodem van de bak kan vallen. Kikkers die in de late namiddag zijn geïnjecteerd, zullen gewoonlijk het merendeel van hun eieren halverwege de ochtend van de volgende dag gelegd hebben. Nadat voldoende eieren zijn gelegd en bevrucht, moeten de volwassen dieren uit de kweekbakken worden verwijderd.
|
Verzorging en selectie van larven
|
11.
|
Nadat de volwassen dieren uit de kweekbakken zijn verwijderd, worden de eieren verzameld en beoordeeld op levensvatbaarheid met behulp van een representatieve steekproef van embryo's uit alle kweekbakken. De beste individuele broedsels (aangeraden wordt: 2-3 om de kwaliteit te beoordelen) wat betreft levensvatbaarheid van de embryo's en aanwezigheid van een toereikend aantal (minimaal 1 500) embryo's, moeten worden geselecteerd. Alle in een onderzoek gebruikte organismen moeten afkomstig zijn van één broedsel (d.w.z. dat de broedsels niet mogen worden gemengd). De embryo's worden overgebracht naar een grote platte kom of schaal en alle eieren die duidelijk dood of abnormaal zijn (zie de definitie in (5)), worden met behulp van een pipet of oogdruppelaar verwijderd. De gezonde embryo's uit elk van de drie broedsels worden overgebracht naar drie aparte broedbakken. Vier dagen na plaatsing in de broedbakken wordt het beste broedsel gekozen op basis van levensvatbaarheid en uitkomstresultaat. De geselecteerde larven worden overgeplaatst in een geschikt aantal opfokbakken bij een temperatuur van 22 ± 1 °C. Bovendien worden enkele larven verplaatst naar extra bakken om als vervangers te dienen in geval van sterfte in de opfokbakken tijdens de eerste week. Met deze procedure wordt een consistente dichtheid van organismen gehandhaafd, waardoor de kans op uiteenlopende ontwikkeling binnen de cohort van één broedsel wordt verkleind. Alle opfokbakken moeten dagelijks schoon worden geheveld. Als voorzorg verdienen handschoenen van vinyl of nitril de voorkeur boven latex handschoenen. Sterfgevallen moeten dagelijks worden verwijderd en tijdens de eerste week worden aangevuld met vervangende larven om de dichtheid van organismen in stand te houden. Het voeren dient ten minste tweemaal daags plaats te vinden.
|
|
12.
|
Tijdens de periode voorafgaand aan de blootstelling wennen de kikkervisjes aan de omstandigheden van de feitelijke blootstellingsfase, waaronder het type voeding, de temperatuur, de cyclus van licht en donker en het kweekmedium. Daarom wordt aanbevolen hetzelfde kweek-/verdunningswater te gebruiken vóór en tijdens de blootstellingsfase. Als een statisch kweeksysteem wordt gebruikt voor het houden van de kikkervisjes tijdens de fase voorafgaand aan de blootstelling, moet het kweekmedium ten minste tweemaal per week volledig worden vervangen. Overbevolking als gevolg van grote larvale dichtheid in de preblootstellingsperiode dient te worden vermeden, omdat dit belangrijke gevolgen kan hebben voor de ontwikkeling van de kikkervisjes in de testfase. Daarom mag de dichtheid niet groter zijn dan ongeveer vier kikkervisjes/l kweekmedium (statisch blootstellingssysteem) of 10 kikkervisjes/l kweekmedium (met bijv. 50 ml/min debiet in het preblootstellings- of kweeksysteem). Onder deze omstandigheden moeten de kikkervisjes zich binnen 12 dagen van stadium 45/46 tot stadium 51 ontwikkelen. Representatieve kikkervisjes van deze stampopulatie dienen dagelijks gecontroleerd te worden op hun ontwikkelingsstadium om zo het juiste tijdstip voor het begin van de blootstelling te schatten. Er moet zorgvuldig worden gestreefd naar minimalisering van stress en trauma bij de kikkervisjes, met name tijdens het verplaatsen, het schoonmaken van aquaria en het manipuleren van de larven. Stressvolle omstandigheden/activiteiten, zoals hard en/of onophoudelijk geluid, tikken op aquaria, trillingen in de aquaria, buitensporige activiteit in het laboratorium en snelle veranderingen in het mediummilieu (lichtbeschikbaarheid, temperatuur, pH-waarde, gehalte aan opgeloste zuurstof, waterstroomsnelheid enz.), dienen te worden vermeden. Als de kikkervisjes zich niet binnen 17 dagen na de bevruchting tot stadium 51 ontwikkelen, kan buitensporige stress worden beschouwd als mogelijke boosdoener.
|
Kweken en voeren van de larven
|
13.
|
Kikkervisjes worden gedurende de gehele periode voorafgaand aan de blootstelling (na stadium 45/46 van Nieuwkoop en Faber (NF) (8)) en tijdens de gehele testperiode van 21 dagen gevoerd met bijvoorbeeld het in de handel verkrijgbare voer dat is gebruikt in de validatiestudies (zie ook aanhangsel 1), of een ander dieet dat aantoonbaar dezelfde resultaten mogelijk maakt als de amfibische metamorfosetest. Het voederregime tijdens de preblootstellingsperiode moet zorgvuldig worden afgestemd op de vereisten van de zich ontwikkelende kikkervisjes. Dat wil zeggen dat er meermaals per dag (minimaal tweemaal) kleine porties voeding aan de pas uitgekomen kikkervisjes moeten worden gegeven. Een overmatige hoeveelheid voer dient te worden vermeden om i) de waterkwaliteit op peil te houden en ii) te voorkomen dat de kieuwfilters verstopt raken met voedsel- en afvaldeeltjes. Voor het kikkervissenvoer dat in de validatiestudies is gebruikt, moeten de dagelijkse hoeveelheden naarmate de kikkervisjes groeien worden verhoogd tot ongeveer 30 mg/dier/dag vlak voor aanvang van de test. Validatiestudies hebben aangetoond dat dit commerciële voer een goede groei en ontwikkeling van X. laevis-kikkervisjes ondersteunt. Het bestaat uit fijne deeltjes die lange tijd in suspensie in de waterkolom blijven en wegspoelen met de waterstroom. Daarom moet de totale dagelijkse hoeveelheid worden verdeeld in kleinere porties en ten minste tweemaal daags worden toegediend. Het voederregime voor deze voeding is uitgewerkt in tabel 1. Voedertijden en toegediende hoeveelheden moeten worden geregistreerd. Het voer kan in droge vorm of als een in verdunningswater bereide stamoplossing worden toegediend. Een dergelijke stamoplossing moet om de andere dag vers worden bereid en voor en na toediening worden bewaard bij 4 °C.
Tabel 1.
Voederregime met het commercieel kikkervissenvoer dat is gebruikt in de validatiestudies voor kikkervisjes van X. laevis gedurende het in-vivo-gedeelte van de AMA met doorstroming
|
Onderzoeksdag
|
Portie (mg voer/dier/dag)
|
|
0-4
|
30
|
|
5-7
|
40
|
|
8-10
|
50
|
|
11-14
|
70
|
|
15-21
|
80
|
|
Analytische scheikunde
|
14.
|
Voordat een onderzoek wordt uitgevoerd, moet de stabiliteit van de teststof worden beoordeeld met behulp van bestaande informatie over de oplosbaarheid, afbreekbaarheid en vluchtigheid ervan. Ten behoeve van scheikundige analyses moeten monsters worden genomen van de testoplossingen in elk van de replicaatbakken bij elke concentratie op de dag waarop de test begint (dag 0) en vervolgens wekelijks gedurende de test voor minimaal vier monsters. Ook wordt aanbevolen dat elke testconcentratie wordt geanalyseerd tijdens het gereedmaken van het systeem, voor aanvang van de test, om de systeemprestaties te verifiëren. Bovendien is het raadzaam de stamoplossingen te analyseren wanneer ze worden verwisseld, met name als de hoeveelheid stamoplossing ontoereikende hoeveelheden teststof oplevert voor de gehele duur van de periode van dagelijkse monsterneming. In het geval van chemische stoffen die niet kunnen worden gedetecteerd bij sommige of alle in een test gebruikte concentraties, moeten de stamoplossingen worden gemeten en de doorstroomsnelheden in het systeem worden geregistreerd om de nominale concentraties te berekenen.
|
Afgifte van de teststof
|
15.
|
De methode die wordt toegepast om de teststof in het systeem te brengen, kan verschillen en is afhankelijk van de fysisch-chemische eigenschappen van de stof. In water oplosbare stoffen kunnen worden opgelost in aliquots met testwater in een concentratie die afgifte met het beoogde testgehalte in een doorstroomsysteem mogelijk maakt. Stoffen die bij kamertemperatuur vloeibaar zijn en slechts in geringe mate oplossen in water, kunnen worden afgegeven met behulp van vloeistof:vloeistof-saturatie. Stoffen die bij kamertemperatuur vast zijn en slechts in geringe mate oplossen in water, kunnen worden afgegeven met behulp van glaswolsaturatie (7). Het verdient de voorkeur om een systeem zonder draagvloeistof te gebruiken, maar verschillende teststoffen hebben verschillende fysisch-chemische eigenschappen die waarschijnlijk een verschillende aanpak bij de bereiding van het water voor de chemische blootstelling vereisen. Oplosmiddelen en draagvloeistoffen dienen bij voorkeur te worden te vermeden omdat: i) bepaalde oplosmiddelen zelf toxiciteit en/of ongewenste of onverwachte endocrinologische reacties kunnen veroorzaken, ii) het testen van chemicaliën boven hun oplosbaarheid in water (zoals vaak gebeurt door het gebruik van oplosmiddelen) kan leiden tot een onnauwkeurige bepaling van de effectieve concentraties, en iii) het gebruik van oplosmiddelen in tests op langere termijn kan leiden tot de vorming van een aanzienlijke „biofilm” gekoppeld aan microbiële activiteit. Voor moeilijk te testen stoffen kan in laatste instantie een oplosmiddel de beste keuze zijn; raadpleeg de richtsnoeren van de OESO voor het testen op aquatische toxiciteit bij moeilijke stoffen en mengsels (4) om de beste methode te bepalen. De keuze van het juiste oplosmiddel hangt af van de chemische eigenschappen van de teststof. Oplosmiddelen waarvan de effectiviteit voor het testen op aquatische toxiciteit is gebleken, zijn aceton, ethanol, methanol, dimethylformamide en triëthyleenglycol. Indien een oplosmiddel als draagvloeistof wordt gebruikt, moeten de concentraties oplosmiddel zich beneden de concentratie zonder waargenomen effect (No Observed Effect Concentration, NOEC) bevinden. In de richtsnoeren van de OESO wordt een maximum van 100 μl/l aanbevolen, terwijl in een recente studie het gebruik van oplossingsconcentraties van slechts 20 μl/l verdunningswater wordt aangeraden (12). Indien oplosmiddelen als draagvloeistof worden gebruikt, moeten goede controles op het oplosmiddel worden beoordeeld in aanvulling op de controles zonder oplosmiddel (schoon water). Als het niet mogelijk is een teststof via het water af te geven vanwege fysisch-chemische eigenschappen (lage oplosbaarheid) of beperkte chemische beschikbaarheid, kan worden overwogen de stof via de voeding toe te dienen. Er worden inleidende werkzaamheden op het gebied van blootstelling via het eten verricht, maar deze methode is niet gangbaar. De keuze voor een methode dient te worden gedocumenteerd en analytisch te worden geverifieerd.
|
Selectie van testconcentraties
Vaststelling van de hoogste testconcentratie
|
16.
|
Ten behoeve van deze test moet de hoogste testconcentratie worden ingesteld op de laagste van de volgende drie waarden: de maximale oplosbaarheid van de teststof, de maximale toegelaten concentratie (MTC) voor acuut toxische stoffen of 100 mg/l.
|
|
17.
|
De MTC is gedefinieerd als de hoogste testconcentratie van de teststof die tot minder dan 10 % acute sterfte leidt. In deze benadering wordt ervan uitgegaan dat er empirische gegevens over acute sterfte bestaan op basis waarvan de MTC kan worden geschat. De schatting van de MTC kan onnauwkeurig zijn en vereist gewoonlijk enig professioneel inzicht. Hoewel het gebruik van regressiemodellen technisch gezien de meest solide methode voor het schatten van de MTC is, kan een bruikbare benaderende MTC ook worden afgeleid van bestaande gegevens over acute sterfte, door 1/3 van de acute LC50-waarde te nemen. Het is echter mogelijk dat het voor de geteste soort ontbreekt aan gegevens over acute toxiciteit. Als soortspecifieke gegevens over acute toxiciteit niet beschikbaar zijn, kan een 96-urige LC50-test worden uitgevoerd met kikkervisjes die representatief zijn voor de dieren die in de AMA worden getest (d.w.z. zich in hetzelfde ontwikkelingsstadium bevinden). Eventueel kan, wanneer gegevens van andere aquatische soorten beschikbaar zijn (bijv. LC50-onderzoek bij andere amfibieën of vissen), met professioneel inzicht een waarschijnlijke MTC worden geschat door extrapolatie naar een andere soort.
|
|
18.
|
Als daarentegen de stof niet acuut toxisch én voor meer dan 100 mg/l oplosbaar is, moet 100 mg/l worden beschouwd als de hoogste testconcentratie (HTC), aangezien deze concentratie gewoonlijk als „praktisch niet-giftig” wordt opgevat.
|
|
19.
|
Hoewel ze niet de aanbevolen procedure vormen, kunnen statische verversingsmethoden worden toegepast wanneer doorstroommethoden ontoereikend zijn om de MTC te halen. Als gebruik wordt gemaakt van statische verversingsmethoden, moet de stabiliteit van de teststofconcentratie worden gedocumenteerd en binnen de grenzen van de prestatiecriteria blijven. Aanbevolen worden verversingsperioden van 24 uur. Verversingsperioden van meer dan 72 uur zijn onaanvaardbaar. Bovendien moeten parameters voor de waterkwaliteit (gehalte aan opgeloste zuurstof, temperatuur, pH-waarde enz.) worden gemeten aan het einde van elke verversingsperiode, onmiddellijk voorafgaand aan de verversing.
|
Bereik van testconcentraties
|
20.
|
Er is een voorgeschreven minimum van drie testconcentraties en een controle met schoon water (en indien nodig een dragercontrole). Het minimale verschil in testconcentratie tussen de hoogste en de laagste concentratie moet ongeveer één orde van grootte bedragen. De maximale dosisseparatie is 0,1, de minimale 0,33.
|
PROCEDURE
Aanvang en uitvoering van de test
Dag 0
|
21.
|
De blootstelling moet worden gestart wanneer een voldoende aantal kikkervisjes van de stampopulatie in de preblootstellingsperiode volgens Nieuwkoop en Faber (8) ontwikkelingsstadium 51 heeft bereikt terwijl ze maximaal 17 dagen oud zijn vanaf de bevruchting. Ten behoeve van de selectie van proefdieren moeten gezonde en normaal uitziende kikkervisjes van de stampopulatie worden samengebracht in één bak die een passende hoeveelheid verdunningswater bevat. Voor de vaststelling van hun ontwikkelingsstadium dienen kikkervisjes afzonderlijk uit de verzamelbak te worden gevist met een klein netje of zeefje en overgebracht naar een transparante meetruimte (bijv. een petrischaaltje van 100 mm) met verdunningswater. Bij voorkeur wordt voor de vaststelling van het stadium geen anesthesie toegepast, maar de kikkervisjes mogen voor de hantering wel afzonderlijk worden verdoofd met 100 mg/l tricainemethaansulfonaat (bijv. MS-222), voldoende gebufferd met natriumbicarbonaat (pH 7,0). Indien hiervan gebruik wordt gemaakt, moet de juiste methodologie voor correct gebruik van bijv. MS-222 voor anesthesiedoeleinden worden verkregen van ervaren laboratoria en bij de testresultaten worden vermeld. De dieren moeten tijdens dit overbrengen omzichtig worden behandeld om de stress van de verplaatsing tot een minimum te beperken en verwondingen te vermijden.
|
|
22.
|
Het ontwikkelingsstadium van de dieren wordt vastgesteld met behulp van een binoculaire ontleedmicroscoop. Om de uiteindelijke variatie in de ontwikkelingsstadia te verkleinen, is het van belang dat deze vaststelling zo nauwkeurig mogelijk gebeurt. Volgens Nieuwkoop en Faber (8) is het primaire ontwikkelingskenmerk voor de selectie van organismen in stadium 51 de morfologie van de achterpoten. De morfologische kenmerken van de achterpoten moeten onder de microscoop worden onderzocht. Hoewel de complete richtsnoeren van Nieuwkoop en Faber (8) dienen te worden geraadpleegd voor uitgebreide informatie over de stadiumbepaling van kikkervisjes, kan worden gesteld dat men het stadium betrouwbaar kan vaststellen aan de hand van opvallende morfologische kenmerken. Met behulp van de volgende tabel kan de stadiumbepaling gedurende het gehele onderzoek worden vereenvoudigd en gestandaardiseerd door middel van identificatie van die opvallende morfologische kenmerken die bij een normale ontwikkeling worden geassocieerd met de verschillende stadia.
Tabel 2.
Opvallende morfologische kenmerken van de verschillende stadia op basis van de richtsnoeren van Nieuwkoop en Faber.
|
Opvallende morfologische kenmerken
|
Ontwikkelingsstadium
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Achterpoot
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Voorpoot
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Craniofaciale structuur
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Reukzenuwmorfologie
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Staartlengte
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
Bij aanvang van de test moeten alle kikkervisjes zich in stadium 51 bevinden. Het meest opvallende morfologische kenmerk van dit stadium is de morfologie van de achterpoten, zoals wordt getoond in figuur 1.
Figuur 1.
Morfologie van de achterpoten van een X. laevis-kikkervisje in stadium 51.

|
|
24.
|
Naast selectie op basis van ontwikkelingsstadium kan optioneel ook selectie op basis van de grootte van de proefdieren worden toegepast. Voor dit doel moet op dag 0 de totale lichaamslengte (niet de SVL) worden gemeten bij een steekproef van ongeveer 20 kikkervisjes in NF-stadium 51. Nadat de gemiddelde totale lichaamslengte van deze groep dieren is berekend, kunnen minima en maxima voor de totale lichaamslengte van de proefdieren worden vastgesteld door een afwijking van de gemiddelde waarde met ± 3 mm toe te staan (de gemiddelde waarden voor de totale lichaamslengte van kikkervisjes in stadium 51 lopen uiteen van 24,0 tot 28,1 mm). Het ontwikkelingsstadium blijft echter de primaire parameter voor de vaststelling van de geschiktheid van een proefdier. Kikkervisjes met grove zichtbare misvormingen of verwondingen moeten worden uitgesloten van de test.
|
|
25.
|
Kikkervisjes die aan bovenstaande stadiumcriteria voldoen, worden in een bak met schoon kweekwater gehouden totdat de stadiumbepaling is voltooid. Vervolgens worden de larven willekeurig verdeeld over de testbakken totdat elke bak 20 larven bevat. Elke testbak wordt vervolgens gecontroleerd op dieren met abnormale uiterlijke kenmerken (bijv. wonden, afwijkend zwemgedrag enz.). Openlijk ongezond uitziende kikkervisjes moeten uit de testbakken worden verwijderd en worden vervangen door nieuwe geselecteerde larven uit de verzamelbak.
|
Opmerkingen
|
26.
|
Voor uitgebreidere informatie over testbeëindigingsprocedures en de behandeling van kikkervisjes kunt u de richtsnoeren van de OESO over de schildklierhistologie bij amfibieën (9) raadplegen.
|
Metingen op dag 7
|
27.
|
Op dag 7 worden vijf willekeurig gekozen kikkervisjes per duplo uit elk van de testbakken genomen. De gebruikte willekeurige selectieprocedure moet waarborgen dat elk organisme in de test een gelijke kans heeft om te worden geselecteerd. Dit kan worden bereikt met elke gerandomiseerde methode maar vereist dat alle kikkervisjes in een net worden gevangen. Vervolgens worden de niet geselecteerde kikkervisjes teruggezet in de oorspronkelijke bak en de geselecteerde kikkervisjes op humane wijze geëuthanaseerd in 150 tot 200 mg/l van bijv. MS-222, voldoende gebufferd met natriumbicarbonaat tot pH 7,0. De geëuthanaseerde kikkervisjes worden gespoeld in water en afgedroogd met vloeipapier, waarna het lichaamsgewicht wordt vastgesteld, afgerond op een hele milligram. Voor elk kikkervisje worden verder de lengte van de achterpoten, de lengte van snuit tot anus (SVL) en het ontwikkelingsstadium (met behulp van een binoculaire ontleedmicroscoop) bepaald.
|
Metingen op dag 21 (einde van de test)
|
28.
|
Bij het einde van de test (dag 21) worden de resterende kikkervisjes uit de testbakken genomen en op humane wijze geëuthanaseerd in 150 tot 200 mg/l van bijv. MS-222, voldoende gebufferd met natriumbicarbonaat als hiervoor beschreven. De kikkervisjes worden gespoeld in water en afgedroogd met vloeipapier, waarna het lichaamsgewicht wordt vastgesteld, afgerond op een hele milligram. Van elk kikkervisje wordt het ontwikkelingsstadium, de SVL en de lengte van de achterpoten bepaald.
|
|
29.
|
Voor de histologische onderzoeken worden alle larven gedurende 48 tot 72 uur in fixeermiddel van Davidson geplaatst, hetzij in de vorm van complete lichaamsmonsters, hetzij als afgesneden kopweefselmonsters inclusief onderkaak. Ten behoeve van de histopathologie moeten in totaal vijf kikkervisjes per replicaatbak als monster worden genomen. Omdat de folliculaire celhoogte stadiumafhankelijk is (10), worden bij de bemonstering voor histologische analyses wanneer mogelijk het best individuen in hetzelfde stadium genomen. Om de selectie van individuen in hetzelfde stadium mogelijk te maken, moet van alle larven eerst het stadium worden vastgesteld, voorafgaand aan de selectie en daaropvolgende verwerking ten behoeve van gegevensverzameling en conservatie. Dit is noodzakelijk omdat de normale divergentie in ontwikkeling zal leiden tot een andere stadiumverdeling per replicaatbak.
|
|
30.
|
De voor histopathologie geselecteerde dieren (n = 5 van elke duplo) moeten voor zover mogelijk overeenkomen met het mediaanstadium van de controles (verzamelde duplo's). Als er replicaatbakken zijn met meer dan vijf larven in het geschikte stadium, moeten willekeurig vijf larven worden geselecteerd.
|
|
31.
|
Als er replicaatbakken zijn met minder dan vijf larven in het geschikte stadium, moeten willekeurig geselecteerde individuen uit het naastgelegen eerdere of latere stadium worden geselecteerd om tot een steekproef van in totaal vijf larven per duplo te komen. Bij voorkeur wordt de beslissing om extra larven te selecteren uit het vorige of het volgende ontwikkelingsstadium gebaseerd op een algehele beoordeling van de stadiumverdeling in de controle- en testgroepen. Als de chemische behandeling in verband wordt gebracht met een vertraagde ontwikkeling, moeten aanvullende larven worden geselecteerd uit het eerstvolgende vroegere stadium. Als de chemische behandeling daarentegen in verband wordt gebracht met een versnelde ontwikkeling, moeten aanvullende larven worden geselecteerd uit het eerstvolgende latere stadium.
|
|
32.
|
In gevallen van ernstige veranderingen in de ontwikkeling van de kikkervisjes als gevolg van de blootstelling aan een teststof is er mogelijk geen overlap van de stadiumverdeling in de testbakken met het berekende mediane ontwikkelingsstadium in de controlegroep. Alleen in die gevallen moet het selectieproces worden aangepast door een ander stadium dan het mediane controlestadium te gebruiken voor de steekproef van larven voor de schildklierhistologie. Als de stadia onbepaald zijn (in geval van asynchrone ontwikkeling), moeten er willekeurig 5 kikkervisjes uit elke duplo worden gekozen voor de histologische analyse. De reden waarom larven worden geselecteerd die zich niet in een stadium bevinden dat equivalent is aan het mediane controlestadium, moet worden gerapporteerd.
|
Bepaling van biologische eindpunten
|
33.
|
Tijdens de blootstellingsfase van 21 dagen wordt een meting van de primaire eindpunten uitgevoerd op de dagen 7 en 21. Daarnaast is ook dagelijkse observatie van de proefdieren nodig. In tabel 3 wordt een overzicht gegeven van de te meten eindpunten en de bijbehorende observatiemomenten. Meer gedetailleerde informatie over technische procedures voor het meten van apicale eindpunten en het uitvoeren van histologische beoordelingen is beschikbaar in de richtsnoeren van de OESO (9).
Tabel 3.
Observatiemomenten voor primaire eindpunten in de AMA
|
Apicale eindpunten
|
Dagelijks
|
Dag 7
|
Dag 21
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Lengte snuit-anus (SVL)
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
|
|
|
ߦ
|
|
Apicale eindpunten
|
34.
|
Ontwikkelingsstadium, achterpootlengte, SVL en nat gewicht zijn de apicale eindpunten van de AMA. Elk ervan wordt hierna kort besproken. Meer technische informatie over het verzamelen van deze gegevens is beschikbaar in de richtsnoeren waarnaar wordt verwezen, met inbegrip van aanbevolen procedures voor computeranalyse.
|
Ontwikkelingsstadium
|
35.
|
Het ontwikkelingsstadium van kikkervisjes van X. laevis wordt bepaald aan de hand van de stadiëringscriteria van Nieuwkoop en Faber (8). Gegevens over het ontwikkelingsstadium worden gebruikt om te bepalen of de ontwikkeling versneld, asynchroon, vertraagd of normaal verloopt. Versnelling of vertraging in de ontwikkeling wordt vastgesteld door een vergelijking te maken tussen het mediane stadium dat is bereikt door de controlegroep en dat van de behandelde groepen. Asynchrone ontwikkeling dient te worden gerapporteerd wanneer de onderzochte weefsels niet misvormd of abnormaal zijn maar de relatieve timing van de morfogenese of ontwikkeling van verschillende weefsels binnen één kikkervisje is verstoord.
|
Lengte achterpoten
|
36.
|
Differentiatie en groei van de achterpoten worden gestuurd door schildklierhormonen en zijn belangrijke ontwikkelingskenmerken die al worden gebruikt voor de bepaling van het ontwikkelingsstadium. De ontwikkeling van de achterpoten wordt in kwalitatieve zin gebruikt voor de bepaling van het ontwikkelingsstadium, maar wordt hier als kwantitatief eindpunt beschouwd. Daarom wordt de lengte van de achterpoten gemeten als eindpunt om effecten op de schildklieras op te sporen (figuur 2). Met het oog op de consistentie wordt de lengte gemeten van de linkerachterpoot. De lengte van de achterpoten wordt zowel op dag 7 als op dag 21 van de test gemeten. Op dag 7 is de achterpoot eenvoudig te meten, zoals wordt geïllustreerd in figuur 2. Het meten van de achterpoot op dag 21 is echter lastiger als gevolg van buigingen in het ledemaat. Daarom moet de meting van de achterpootlengte op dag 21 beginnen bij de lichaamswand en de middellijn van het ledemaat volgen langs eventuele angulaire afwijkingen. Veranderingen in de lengte van de achterpoten op dag 7 worden, ook als ze niet zichtbaar zijn op dag 21, toch als significant beschouwd voor mogelijke schildklieractiviteit. De lengtemetingen worden verricht op digitale foto's met behulp van software voor beeldanalyse zoals beschreven in de richtsnoer van de OESO over schildklierhistologie bij amfibieën (9).
|
Lengte en nat gewicht
|
37.
|
De bepalingen van de lengte van snuit tot anus (SVL) (figuur 2) en het natte gewicht zijn in het testprotocol opgenomen om mogelijke effecten van teststoffen op het groeitempo van kikkervisjes in vergelijking met de controlegroep vast te stellen en zijn bruikbaar voor het opsporen van gegeneraliseerde toxiciteit van de teststof. Omdat het verwijderen van aanhangend water kan leiden tot stress bij de kikkervisjes en huidbeschadiging wordt het gewicht van de in de steekproef opgenomen kikkervisjes bepaald op dag 7 en bij alle overige kikkervisjes aan het einde van de test (dag 21). Gebruik ten behoeve van de consistentie de craniale zijde van de anus als het eindpunt van de lengtemeting.
|
|
38.
|
Met de lengte van snuit tot anus (SVL) wordt de groei van het kikkervisje beoordeeld, zoals geïllustreerd in figuur 2.
Figuur 2.
(A) Typen lichaamslengtemeting en (B) meting van de achterpoten bij kikkervisjes van X. laevis (1)
|
Schildklierhistologie
|
39.
|
Hoewel het ontwikkelingsstadium en de lengte van de achterpoten belangrijke eindpunten zijn voor de beoordeling van veranderingen in de gedaanteveranderende ontwikkeling onder invloed van blootstelling, kan de uitgestelde ontwikkeling op zich niet worden beschouwd als diagnostische indicator van schildklierremmende activiteit. Sommige veranderingen kunnen alleen waarneembaar zijn bij alledaagse histopathologische analyse. Diagnostische criteria zijn hypertrofie/atrofie van de schildklier, folliculaire hypertrofie en folliculaire hyperplasie, met als aanvullende kwalitatieve criteria het folliculair lumen, de colloïdekwaliteit en de hoogte/vorm van de folliculaire cel. De ernst van de afwijkingen moet (in 4 gradaties) worden gerapporteerd. Informatie over het nemen en verwerken van steekproeven ten behoeve van histologische analyse en het uitvoeren van histologische analyses op weefselmonsters is beschikbaar in de volgende documentatie: „Amphibian Metamorphosis Assay: Part 1 — Technical guidance for morphologic sampling and histological preparation” en „Amphibian Metamorphosis Assay: Part 2 — Approach to reading studies, diagnostic criteria, severity grading and atlas” (9). Laboratoria die de test voor de eerste keer uitvoeren, dienen zich te laten adviseren en trainen door ervaren pathologen alvorens de schildklier histologisch te analyseren en te evalueren. Openlijke en significante veranderingen in apicale eindpunten die wijzen op een versnelde of asynchrone ontwikkeling, kunnen een histopathologische analyse van de schildklieren overbodig maken. Bij afwezigheid van openlijke morfologische veranderingen of bewijs van ontwikkelingsvertraging zijn histologische analyses echter geboden.
|
Sterfte
|
40.
|
Dagelijks moeten alle testbakken worden gecontroleerd op dode kikkervisjes en moet het aantal sterfgevallen per bak worden genoteerd. Daarbij moeten de datum, de concentratie en het baknummer van de waargenomen sterfte worden geregistreerd. Dode dieren dienen na waarneming uit de testbak te worden verwijderd. Sterftecijfers van meer dan 10 % kunnen duiden op ongewenste testomstandigheden of toxische effecten van de teststof.
|
Aanvullende opmerkingen
|
41.
|
Gevallen van abnormaal gedrag en grove zichtbare misvormingen en verwondingen moeten worden geregistreerd. Voor elk dergelijk geval moeten de datum, de concentratie en het baknummer worden bijgehouden. Normaal gedrag vertonende kikkervisjes zweven met de staart opgericht boven hun kop in de waterkolom, slaan regelmatig met de staartvin, komen geregeld aan de oppervlakte, hebben een werkend kieuwdeksel en reageren op stimuli. Abnormaal gedrag omvat bijvoorbeeld drijven aan de oppervlakte, liggen op de bakbodem, achteruit of onregelmatig zwemmen, niet boven water komen en niet reageren op stimuli. Daarnaast moeten grove verschillen in voedselconsumptie tussen de behandelingen worden geregistreerd. Grove misvormingen en verwondingen zijn bijvoorbeeld morfologische afwijkingen (bijv. aan de ledematen), bloeduitstortingen, bacteriële of schimmelinfecties enz. Deze vaststellingen zijn kwalitatief, vergelijkbaar met klinische tekenen van ziekte of stress en moeten worden vergeleken met die bij controledieren. Als de verschijnselen in testbakken ernstiger zijn of vaker voorkomen dan in de controlebakken, moeten ze worden beschouwd als bewijs van openlijke toxiciteit.
|
GEGEVENS EN RAPPORTAGE
Verzameling van gegevens
|
42.
|
Alle gegevens moeten worden verzameld met behulp van elektronische of handmatige systemen die voldoen aan goede laboratoriumpraktijken. Het onderzoeksverslag moet de volgende gegevens bevatten:
|
|
Teststof:
|
—
|
karakterisering van de teststof: fysisch-chemische eigenschappen; informatie over stabiliteit en biologische afbreekbaarheid;
|
|
—
|
chemische informatie: methode en frequentie van bereiding van verdunningen. De chemische informatie over de teststof omvat de werkelijke en nominale concentraties van de teststof en in sommige gevallen van de niet-oorspronkelijke stof, indien van toepassing. Chemische testwaarden kunnen niet alleen voor testoplossingen maar ook voor stamoplossingen vereist zijn;
|
|
—
|
verdunningsmiddel (indien geen water): motivatie van de keuze voor het verdunningsmiddel en karakterisering van het verdunningsmiddel (kenmerken, gebruikte concentratie).
|
|
|
|
Testomstandigheden:
|
—
|
geregistreerde operationele gegevens: deze bestaan uit opmerkingen over de werking van het testsysteem en de ondersteunende omgeving en infrastructuur. Typische geregistreerde gegevens zijn: omgevingstemperatuur, testtemperatuur, fotoperiode, status van kritieke componenten van het blootstellingssysteem (bijv. pompen, toerentellers, drukmeters), stroomsnelheden, waterniveaus, stamflesvervangingen en voedergegevens. Algemene parameters van de waterkwaliteit zijn pH-waarde, gehalte aan opgeloste zuurstof, geleidbaarheid, totaal aan jodium, alkaliniteit en hardheid;
|
|
—
|
afwijkingen van de testmethode: deze informatie moet gegevens of narratieve beschrijvingen bevatten van afwijkingen van de testmethode.
|
|
|
|
Resultaten:
|
—
|
biologische waarnemingen en gegevens, zoals dagelijkse gegevens over sterfte, voedselconsumptie, abnormaal zwemgedrag, lethargie, evenwichtsverlies, misvormingen, verwondingen enz. Met vooraf bepaalde intervallen worden gegevens en waarnemingen geregistreerd over het ontwikkelingsstadium, de lengte van de achterpoten, de lengte van snuit tot anus en het natte gewicht;
|
|
—
|
statistische analysetechnieken en een motivatie van de gebruikte technieken; de uitkomsten van de statistische analyse, bij voorkeur in tabelvorm;
|
|
—
|
histologische gegevens: deze omvatten narratieve beschrijvingen en ook gradatiecijfers over de ernst en de incidentie van bepaalde waarnemingen, zoals uitvoerig beschreven in de histopathologische richtsnoeren;
|
|
—
|
ad-hocwaarnemingen: deze omvatten narratieve beschrijvingen van het onderzoek die buiten de hierboven beschreven categorieën vallen.
|
|
|
Rapportage van gegevens
|
43.
|
Aanhangsel 2 bevat spreadsheets voor dagelijks verzamelde gegevens die als richtsnoeren kunnen dienen voor het invoeren van de ruwe gegevens en voor de berekening van statistische overzichten. Bovendien worden rapportagetabellen verschaft waarmee op eenvoudige wijze samengevatte eindpuntgegevens kunnen worden bekendgemaakt. Rapportagetabellen voor histologische beoordelingen zijn te vinden in aanhangsel 2.
|
Prestatiecriteria en aanvaardbaarheid/geldigheid van de test
|
44.
|
Over het algemeen leiden grove afwijkingen van de testmethode tot gegevens die onaanvaardbaar zijn voor interpretatie- of rapportagedoeleinden. Daarom zijn in tabel 4 de volgende criteria geformuleerd als richtsnoer voor het bepalen van de kwaliteit van de uitgevoerde test en de algemene prestaties van de controleorganismen.
Tabel 4.
Prestatiecriteria voor de AMA
|
Criterium
|
Aanvaardbare grenswaarden
|
|
Testconcentraties
|
Gehandhaafd op ≤ 20 % VC (variatie in gemeten testconcentratie) gedurende de 21-daagse test
|
|
Sterfte in de controlegroep
|
≤ 10 % — de sterfte per duplo mag in de controlegroep nooit hoger dan 2 kikkervisjes zijn
|
|
Minimale mediane ontwikkelingsstadium van de controlegroep aan het eind van de test
|
57
|
|
Spreiding van ontwikkelingsstadium in de controlegroep
|
Het verschil tussen het 10e en het 90e percentiel van de ontwikkelingsstadiumverdeling mag niet groter zijn dan 4 stadia
|
|
Gehalte aan opgeloste zuurstof
|
≥ 40 % van de luchtverzadigingswaarde (23)
|
|
pH
|
De pH-waarde moet worden gehandhaafd tussen 6,5 en 8,5. De verschillen tussen duplo's/testgroepen mogen niet groter zijn dan 0,5
|
|
Watertemperatuur
|
22° ± 1 °C — het verschil tussen de verschillende replicaat-/testbakken mag niet groter zijn dan 0,5 °C
|
|
Testconcentraties zonder openlijke toxiciteit
|
≥ 2
|
|
Prestaties van duplo's
|
≤ 2 duplo's in de gehele test mogen gecompromitteerd zijn
|
|
Speciale voorwaarden voor gebruik van een oplosmiddel
|
Als gebruik wordt gemaakt van een oplosmiddel als draagvloeistof, moet zowel een controlegroep met oplosmiddel als een controlegroep met schoon water worden gebruikt en moet over beide controles worden gerapporteerd
|
|
Statistisch significante verschillen tussen oplosmiddelcontroles en watercontroles worden op een speciale manier behandeld. Zie hierna voor meer informatie
|
|
Speciale voorwaarden voor een statisch verversingssysteem
|
Er moeten representatieve chemische analyses voor en na de verversing worden gerapporteerd
|
|
Onmiddellijk voorafgaand aan verversing moeten de ammoniagehaltes worden gemeten
|
|
Onmiddellijk voorafgaand aan verversing moeten alle parameters voor de waterkwaliteit uit tabel 1 van aanhangsel 1 worden gemeten
|
|
De periode tot de volgende verversing mag niet langer zijn dan 72 uur
|
|
Een geschikt voederschema (50 % van de dagelijkse portie commercieel kikkervissenvoer)
|
|
Geldigheid van de test
|
45.
|
Een test kan alleen als aanvaardbaar/geldig worden beschouwd wanneer aan de volgende voorwaarden is voldaan:
|
|
Geldig experiment in een test met een negatieve uitslag voor schildklieractiviteit:
|
(1)
|
Voor elke gegeven testgroep (inclusief controles) mag de sterfte niet hoger zijn dan 10 %. Voor elke gegeven duplo mag de sterfte niet hoger zijn dan drie kikkervisjes; anders wordt de duplo als gecompromitteerd beschouwd.
|
|
(2)
|
Er moeten ten minste twee testniveaus, met alle vier ongecompromitteerde duplo's, beschikbaar zijn voor analyse.
|
|
(3)
|
Er moeten ten minste twee testniveaus zonder openlijke toxiciteit beschikbaar zijn voor analyse.
|
|
|
|
Geldig experiment in een test met een positieve uitslag voor schildklieractiviteit:
|
(1)
|
Sterfte van niet meer dan twee kikkervisjes per duplo in de controlegroep is toegestaan.
|
|
|
Beslisdiagram voor uitvoering van de AMA
|
46.
|
Er is een beslisdiagram ontwikkeld voor de AMA, dat logische hulp biedt bij de uitvoering en interpretatie van de biotest (zie stroomdiagram in figuur 3). In het beslisdiagram wordt in die zin een afweging tussen de eindpunten gemaakt dat een ontwikkelingsvoorsprong, asynchrone ontwikkeling en schildklierhistologie zwaar wegen terwijl vertraagde ontwikkeling, SVL en nat lichaamsgewicht, parameters die kunnen worden beïnvloed door algemene toxiciteit, minder zwaar wegen.
Figuur 3.
Beslisdiagram voor uitvoering van de AMA.

|
Ontwikkelingsvoorsprong (vastgesteld aan de hand van ontwikkelingsstadium, SVL en achterpootlengte)
|
47.
|
Een voorsprong in ontwikkeling komt voor zover bekend alleen voor als gevolg van effecten in verband met schildklierhormonen. Dit kunnen effecten in perifeer weefsel zijn, zoals directe interactie met de schildklierhormoonreceptor (zoals T4), of effecten die de niveaus van het circulerende schildklierhormoon beïnvloeden. In beide gevallen wordt dit beschouwd als voldoende bewijs dat de stof schildklieractiviteit vertoont. Een ontwikkelingsvoorsprong wordt op een van twee manieren beoordeeld. Ten eerste kan het algemene ontwikkelingsstadium worden beoordeeld op de standaardwijze zoals beschreven in Nieuwkoop en Faber (8). Ten tweede kunnen specifieke morfologische kenmerken worden gekwantificeerd op dag 7 en dag 21, zoals de lengte van de achterpoten, die positief is gerelateerd aan agonistische effecten op de schildklierhormoonreceptor. Als zich statistisch significante voorsprongen in ontwikkeling of achterpootlengte voordoen, duidt de test erop dat de teststof inwerkt op de schildklier.
|
|
48.
|
De beoordeling van proefdieren op de aanwezigheid van versnelde ontwikkeling ten opzichte van de controlepopulatie moet zijn gebaseerd op de uitkomsten van statistische analyses die worden uitgevoerd op de volgende vier eindpunten:
|
—
|
achterpootlengte (genormaliseerd met SVL) op testdag 7;
|
|
—
|
achterpootlengte (genormaliseerd met SVL) op testdag 21;
|
|
—
|
ontwikkelingsstadium op testdag 7;
|
|
—
|
ontwikkelingsstadium op testdag 21.
|
|
|
49.
|
Statistische analyses van de achterpootlengte moeten worden uitgevoerd op basis van metingen van de lengte van de linkerachterpoot. De achterpootlengte wordt genormaliseerd door de verhouding tussen de achterpootlengte en de SVL van het individuele kikkervisje te nemen. De gemiddelde genormaliseerde waarden per testniveau worden vervolgens vergeleken. Een versnelde ontwikkeling wordt dan aangegeven door een significante toename van de gemiddelde (genormaliseerde) achterpootlengte in een testgroep ten opzichte van de controlegroep op dag 7 en/of dag 21 van het onderzoek (zie aanhangsel 3).
|
|
50.
|
Statistische analyses van het ontwikkelingsstadium moeten worden uitgevoerd op basis van de bepaling van de ontwikkelingsstadia volgens de morfologische criteria van Nieuwkoop en Faber (8). Een versnelde ontwikkeling is geïndiceerd wanneer uit de multi-dichotome analyse een significante stijging van de ontwikkelingsstadiumwaarden in een testgroep ten opzichte van de controlegroep blijkt op dag 7 en/of dag 21 van het onderzoek.
|
|
51.
|
In de opzet van de AMA wordt een significant effect op een van de bovengenoemde eindpunten beschouwd als voldoende voor een positief resultaat ten aanzien van versnelde ontwikkeling. Dit wil zeggen dat significante effecten op de achterpootlengte op één tijdstip niet hoeven te worden ondersteund door significante effecten op de achterpootlengte op het andere tijdstip en evenmin door significante effecten op het ontwikkelingsstadium op dat ene tijdstip. Omgekeerd hoeven significante effecten op het ontwikkelingsstadium op één tijdstip niet te worden ondersteund door significante effecten op het ontwikkelingsstadium op het andere tijdstip en evenmin door significante effecten op de achterpootlengte op dat ene tijdstip. Het gewicht van het bewijs voor versnelde ontwikkeling neemt echter wel toe indien significante effecten worden geconstateerd op meer dan één eindpunt.
|
Asynchrone ontwikkeling (vastgesteld aan de hand van criteria voor het ontwikkelingsstadium)
|
52.
|
Asynchrone ontwikkeling wordt gekenmerkt door een verstoring van de relatieve timing van de morfogenese of ontwikkeling van verschillende weefsels binnen één kikkervisje. Als het onmogelijk is het ontwikkelingsstadium van een organisme duidelijk vast te stellen met behulp van de reeks morfologische eindpunten die als typerend voor een bepaald stadium worden beschouwd, betekent dit dat de weefsels zich tijdens de metamorfose asynchroon ontwikkelen. Asynchrone ontwikkeling is een indicator van schildklieractiviteit. De enige bekende werkingsmechanismen die asynchrone ontwikkeling veroorzaken, zijn de effecten van stoffen op de hormoonactiviteit in de perifere schildklier en/of de schildklierhormoonstofwisseling in weefsels in ontwikkeling, zoals waargenomen bij deiodinaseremmers.
|
|
53.
|
De beoordeling van proefdieren op de aanwezigheid van asynchrone ontwikkeling ten opzichte van de controlepopulatie wordt gebaseerd op de grove morfologische evaluatie van de proefdieren op dag 7 en dag 21 van het onderzoek.
|
|
54.
|
De beschrijving van de normale ontwikkeling van Xenopus laevis in Nieuwkoop en Faber (8) verschaft het referentiekader voor de herkenning van de normale sequentie van weefselveranderingen. Het begrip „asynchrone ontwikkeling” verwijst specifiek naar die afwijkingen in de grove morfologische ontwikkeling van kikkervisjes die de definitieve vaststelling van een ontwikkelingsstadium volgens de criteria van Nieuwkoop en Faber (8) onmogelijk maken omdat belangrijke morfologische herkenningspunten de kenmerken van verschillende stadia vertonen.
|
|
55.
|
Zoals de term 'asynchrone ontwikkeling' impliceert, dienen alleen gevallen in aanmerking te worden genomen waarin afwijkingen in de voortgang van de vormverandering van specifieke weefsels ten opzichte van de voortgang van de vormverandering van andere weefsels worden geconstateerd. Enkele klassieke fenotypen zijn vertraging of afwezigheid van de komst van de voorpoten ondanks normale of versnelde ontwikkeling van de achterpoten en staartweefsels, of het vroegtijdig resorberen van de kieuwen ten opzichte van het stadium van de morfogenese van de achterpoten en het resorberen van de staart. Asynchrone ontwikkeling wordt geregistreerd als een dier niet kan worden toegeschreven aan een stadium omdat het niet voldoet aan de meeste ontwikkelingscriteria voor één stadium volgens Nieuwkoop en Faber (8), of als er sprake is van extreme vertraging of versnelling van een of meer sleutelkenmerken (bijv. staart volledig geresorbeerd maar voorpoten nog niet aanwezig). Dit is een kwalitatieve beoordeling waarbij alle door Nieuwkoop en Faber (8) genoemde belangrijke kenmerken moeten worden onderzocht. Het is echter niet nodig om de ontwikkelingsstatus van de verschillende kenmerken van de beoordeelde dieren te registreren. Aan dieren waarvoor een asynchrone ontwikkeling is geregistreerd, wordt geen ontwikkelingsstadium van Nieuwkoop en Faber (8) toegekend.
|
|
56.
|
Een centraal criterium voor het typeren van abnormale morfologische ontwikkeling als 'asynchrone ontwikkeling' is een verstoorde relatieve timing van de vormverandering en de morfogenese van weefsels terwijl de morfologie van de betrokken weefsels niet openlijk abnormaal is. Een voorbeeld dat deze interpretatie van grove morfologische afwijkingen illustreert, is dat een vertraagde morfogenese van de achterpoten ten opzichte van de ontwikkeling van andere weefsels voldoet aan het criterium voor 'asynchrone ontwikkeling', terwijl gevallen van ontbrekende achterpoten, abnormale tenen (bijv. ectrodactylie of polydactylie) of andere openlijke misvormingen van de ledematen niet mogen worden beschouwd als 'asynchrone ontwikkeling'.
|
|
57.
|
In dit verband moeten als belangrijkste morfologische kenmerken voor de gecoördineerde voortgang van hun metamorfose in elk geval de morfogenese van de achterpoten, de morfogenese van de voorpoten, de komst van de voorpoten, het resorptiestadium van de staart (met name van de staartvin) en de morfologie van de kop (bijv. grootte en resorptiestadium van de kieuwen, morfologie van de onderkaak, protrusie van het kraakbeen van Meckel) worden beoordeeld.
|
|
58.
|
Afhankelijk van het chemische werkingsmechanisme kunnen verschillende grove morfologische fenotypen optreden. Enkele klassieke fenotypen zijn vertraging of afwezigheid van de komst van de voorpoten ondanks normale of versnelde ontwikkeling van de achterpoten en staartweefsels, en vroegtijdige resorptie van de kieuwen ten opzichte van de vormverandering van de achterpoten en de staart.
|
Histopathologie
|
59.
|
Als de teststof geen openlijke toxiciteit veroorzaakt, de ontwikkeling niet versnelt noch tot asynchrone ontwikkeling leidt, wordt de histopathologie van de schildklieren beoordeeld met behulp van de toepasselijke richtsnoeren (9). Vertraagde ontwikkeling bij afwezigheid van toxiciteit is een sterke indicator van schildklierremmende activiteit, maar de analyse van het ontwikkelingsstadium is minder gevoelig en minder diagnostisch dan de histopathologische analyse van de schildklier. Daarom is in dit geval het uitvoeren van histopathologische analyses van de schildklieren vereist. Effecten op de histologie van de schildklier bij afwezigheid van ontwikkelingseffecten zijn aangetoond. Indien veranderingen in de histopathologie van de schildklier optreden, wordt de teststof als schildklieractief beschouwd. Indien geen vertragingen in de ontwikkeling of histologische verwondingen in de schildklieren worden geconstateerd, wordt de teststof als schildklierinactief beschouwd. De reden voor deze beslissing is dat de schildklier onder invloed van thyreotropine (TSH) staat en dat elke teststof die het circulerende schildklierhormoon voldoende wijzigt om de afscheiding van TSH te wijzigen, histopathologische veranderingen in de schildklieren zal veroorzaken. Er zijn verschillende werkingsmechanismen die het circulerende schildklierhormoon kunnen wijzigen. Dus hoewel het schildklierhormoongehalte duidt op een schildkliergerelateerd effect, is het ontoereikend om vast te stellen welk werkingsmechanisme verantwoordelijk is voor de reactie.
|
|
60.
|
Omdat dit eindpunt zich niet leent tot een elementaire statistische benadering, kan alleen een deskundig patholoog zeggen of een effect al dan niet verband houdt met de blootstelling aan een chemische stof.
|
Ontwikkelingsachterstand (vastgesteld aan de hand van ontwikkelingsstadium, achterpootlengte, lichaamsgewicht en SVL)
|
61.
|
Vertraging in de ontwikkeling kan optreden als gevolg van schildklierremmende mechanismen en door indirecte toxiciteit. Matige ontwikkelingsachterstanden in combinatie met openlijke tekenen van toxiciteit duiden waarschijnlijk op een niet-specifiek toxisch effect. Evaluatie van niet-schildkliergebonden toxiciteit is een essentieel onderdeel van de test ter vermindering van de kans op valse positieven. Buitensporige sterfte is een onmiskenbare aanwijzing dat er andere toxische mechanismen in het spel zijn. Evenzo suggereren matige afnames van de groei, zoals vastgesteld aan de hand van het natte gewicht en/of de SVL, niet-schildkliergebonden toxiciteit. Een klaarblijkelijke toename van de groei wordt meestal waargenomen bij teststoffen die de normale ontwikkeling negatief beïnvloeden. Derhalve duidt de aanwezigheid van grotere dieren niet noodzakelijkerwijs op niet-schildkliergebonden toxiciteit. Er mag echter nooit uitsluitend op de groei worden afgegaan bij het vaststellen van schildkliertoxiciteit. De groei moet in combinatie met het ontwikkelingsstadium en de histopathologie van de schildklier worden gebruikt om schildklieractiviteit vast te stellen. Ook andere eindpunten moeten worden beoordeeld bij het vaststellen van openlijke toxiciteit, waaronder oedeem, bloeduitstortingen, lethargie, verminderd voedselconsumptie, grillig/veranderd zwemgedrag enz. Als bij alle testconcentraties tekenen van openlijke toxiciteit worden geconstateerd, moet de teststof opnieuw worden beoordeeld bij lagere testconcentraties voordat wordt vastgesteld of de teststof schildklieractief dan wel schildklierinactief is.
|
|
62.
|
Bij afwezigheid van andere tekenen van openlijke toxiciteit duiden statistisch significante ontwikkelingsachterstanden erop dat de teststof schildklieractief (antagonistisch) is. Als overtuigende statistische reacties ontbreken, kan deze uitkomst worden aangevuld met de uitkomsten van de histopathologie van de schildklier.
|
Statistische analyses
|
63.
|
Statistische analyses van de gegevens moeten bij voorkeur worden uitgevoerd volgens de procedures die zijn beschreven in Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application (11). Op alle continue kwantitatieve eindpunten (achterpootlengte, SVL, nat gewicht) waarvoor een monotone dosisreactie wordt verwacht, moet de step-down trendtoets van Jonckheere-Terpstra worden toegepast om een significant testeffect vast te stellen.
|
|
64.
|
Voor continue eindpunten waarvoor geen monotone dosisreactie wordt verwacht, moeten de gegevens worden beoordeeld op normale verdeling (bij voorkeur met behulp van de toets van Shapiro-Wilk of Anderson-Darling) en homogene variantie (bij voorkeur met behulp van de toets van Levene). Beide tests worden uitgevoerd op de residuen van een variantieanalyse. In plaats van deze formele tests kan ook het oordeel van deskundigen over de normale verdeling en de homogene variantie worden gebruikt, al gaat de voorkeur uit naar de formele tests. Wanneer een niet-normale verdeling of heterogene variantie wordt geconstateerd, moet naar een normaliserende, variantiedempende transformatie worden gestreefd. Als de gegevens (eventueel na transformatie) normaal verdeeld zijn met een homogene variantie, wordt een significant testeffect bepaald met de toets van Dunnett. Als de gegevens (eventueel na transformatie) normaal verdeeld zijn met een heterogene variantie, wordt een significant testeffect bepaald met de toets van Tamhane-Dunnett of de T3-toets of met de U-toets van Mann-Whitney-Wilcoxon. Wanneer geen normaliserende transformatie kan worden bereikt, wordt een significant testeffect bepaald met de U-toets van Mann-Whitney-Wilcoxon met behulp van een correctie op de p-waarden volgens Bonferroni-Holm. De toets van Dunnett wordt toegepast onafhankelijk van enige F-toets van de variantieanalyse, en de Mann-Whitney-toets wordt toegepast onafhankelijk van enige algemene Kruskall-Wallis-toets.
|
|
65.
|
Significante sterfte wordt niet verwacht maar dient te worden vastgesteld met de toets van Cochran-Armitage, toegepast met stapjes omlaag, wanneer de gegevens consistent zijn met een monotone dosisrespons en anders met de Exact-toets van Fisher met correctie volgens Bonferroni-Holm.
|
|
66.
|
Een significant testeffect op het ontwikkelingsstadium wordt vastgesteld met de step-down trendtoets van Jonckheere-Terpstra toegepast op de medianen van de duplo's. Een alternatief dat de voorkeur verdient voor de effectbeoordeling is de multi-dichotome toets van Jonckheere voor het 20ste tot 80ste percentiel, omdat daarmee wijzigingen in het verdelingsprofiel in aanmerking worden genomen.
|
|
67.
|
De juiste analyse-eenheid is de duplo; daarom bestaan de gegevens uit medianen van duplo's als de toets van Jonckheere-Terpstra of de U-toets van Mann-Whitney wordt gebruikt, of uit de gemiddelden van de duplo's als de toets van Dunnett wordt gebruikt. De monotone dosisrespons kan visueel worden beoordeeld op basis van de gemiddelden of medianen van de duplo's en de testgroepen of formele tests zoals hiervoor beschreven (11). Bij minder dan vijf duplo's per test- of controlegroep moeten, indien beschikbaar, de exacte permutatieversies van de toetsen van Jonckheere-Terpstra en Mann-Whitney worden gebruikt. De statistische significantie van alle aangegeven toetsen wordt beoordeeld op het significantieniveau 0,05.
|
|
68.
|
Figuur 4 is een stroomdiagram voor de uitvoering van statistische toetsen op continue gegevens.
Figuur 4.
Stroomdiagram voor de statistische benadering van continue responsgegevens

|
Speciale overwegingen met betrekking tot gegevensanalyse
Gebruik van aangetaste testniveaus
|
69.
|
Er worden verschillende factoren meegewogen bij de vaststelling of een duplo of een gehele testgroep openlijke toxiciteit vertoont en uit de analyse moet worden weggenomen. Openlijke toxiciteit is gedefinieerd als > 2 sterftegevallen in een duplo die alleen kunnen worden verklaard door toxiciteit en niet door technisch falen. Andere tekenen van openlijke toxiciteit zijn bloedingen, abnormaal gedrag, abnormale zwempatronen, anorexia en alle overige klinische ziektesymptomen. Voor niet-dodelijke tekenen van toxiciteit kunnen kwalitatieve beoordelingen nodig zijn, die altijd moeten worden uitgevoerd onder verwijzing naar de controlegroep in schoon water.
|
Controlegroepen met oplosmiddel
|
70.
|
Het gebruik van een oplosmiddel mag alleen in laatste instantie worden overwogen, wanneer alle overige mogelijkheden om de teststof aan te bieden zijn uitgesloten. Als gebruik wordt gemaakt van een oplosmiddel, moet een bijbehorende controle met water worden uitgevoerd. Aan het einde van de test moeten de mogelijke effecten van het oplosmiddel worden beoordeeld door middel van een statistische vergelijking van de controlegroep met oplosmiddel en de controlegroep met water. De meest relevante eindpunten voor deze beoordeling zijn het ontwikkelingsstadium, de SVL en het natte gewicht, omdat deze kunnen worden beïnvloed door niet-schildkliergerelateerde vormen van toxiciteit. Als statistisch significante verschillen in deze eindpunten worden ontdekt tussen de controlegroep met schoon water en de controlegroep met oplosmiddel, moeten de eindpunten voor de mate van respons worden bepaald aan de hand van de controle met schoon water. Als er geen statistisch significant verschil wordt ontdekt tussen de controlegroep met schoon water en de controlegroep met oplosmiddel voor alle gemeten responsvariabelen, moeten de eindpunten voor de mate van respons worden bepaald aan de hand van de controles met verzameld verdunningswater en oplosmiddel.
|
Testgroepen die ontwikkelingsstadium 60 en hoger bereiken
|
71.
|
Na stadium 60 vertonen kikkervisjes een afname van grootte en gewicht als gevolg van weefselresorptie en vermindering van hun absolute watervolume. Daarom zijn metingen van het natte gewicht en de SVL niet goed bruikbaar in statistische analyses van verschillen in groeitempo. Derhalve moeten deze gewicht- en lengtegegevens van organismen > NF60 worden geschrapt en kunnen ze niet worden gebruikt in analyses van duplogemiddelden of -medianen. Er zijn twee andere methoden beschikbaar om deze groeiparameters te analyseren.
|
|
72.
|
De ene houdt in dat alleen kikkervisjes tot en met ontwikkelingsstadium 60 worden gebruikt voor statistische analyses van het natte gewicht en/of de SVL. Deze methode levert naar verwachting voldoende betrouwbare gegevens op over de ernst van mogelijke groei-effecten, mits slechts een klein deel van de proefdieren (≤ 20 %) uit de analyses wordt weggelaten. Als een groter aantal kikkervisjes (≥ 20 %) in een of meer van de nominale concentraties een ontwikkeling voorbij stadium 60 vertoont, moet een bifactoriële variantieanalyse met een geneste variantiestructuur worden uitgevoerd op alle kikkervisjes om de groei-effecten in verband met chemische behandeling te bepalen, rekening houdend met het effect van het latere ontwikkelingsstadium op de groei. Aanhangsel 3 bevat richtsnoeren voor het uitvoeren van de bifactoriële variantieanalyse van gewicht en lengte.
|
LITERATUUR
|
(1)
|
OECD (2004) Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 — Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 77, Paris.
|
|
(2)
|
OECD (2007) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 — Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 76. Paris
|
|
(3)
|
OECD (2008) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 92. Paris
|
|
(4)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris
|
|
(5)
|
ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729-96(2002), Philadelpia, PA
|
|
(6)
|
ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay — Xenopus (FETAX). E 1439-98
|
|
(7)
|
Kahl,M.D., Russom,C.L., DeFoe,D.L. & Hammermeister,D.E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, pp. 539-551
|
|
(8)
|
Nieuwkoop,P.D. & Faber,J. (1994) Normal Table of Xenopus laevis. Garland Publishing, New York
|
|
(9)
|
OECD (2007) Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 82. Paris
|
|
(10)
|
Dodd,M.H.I. & Dodd,J.M. (1976) Physiology of Amphibia. Lofts,B. (ed.), Academic Press, New York, pp. 467-599
|
|
(11)
|
OECD (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 54. Paris
|
|
(12)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp.69–92.
|
Aanhangsel 1
Tabel 1
Proefomstandigheden voor de 21-daagse amfibische metamorfosetest
|
Proefdier
|
Xenopus laevis-larven
|
|
Initieel larvaal stadium
|
Stadium 51 volgens Nieuwkoop en Faber
|
|
Blootstellingstermijn
|
21 dagen
|
|
Selectiecriteria larven
|
Ontwikkelingsstadium en totale lengte (facultatief)
|
|
Testconcentraties
|
Minimaal 3 concentraties waarvan de laagste en de hoogste circa één orde van grootte uiteenlopen
|
|
Blootstellingsregime
|
Doorstroming (bij voorkeur) en/of statische verversing
|
|
Stroomsnelheid testsysteem
|
25 ml/min (volledig volume ongeveer elke 2,7 uur vervangen)
|
|
Primaire eindpunten / Meetdagen
|
Sterfte
|
Dagelijks
|
|
Ontwikkelingsstadium
|
D 7 en 21
|
|
Lengte achterpoten
|
D 7 en 21
|
|
Lengte snuit-anus (SVL)
|
D 7 en 21
|
|
Nat gewicht
|
D 7 en 21
|
|
Schildklierhistologie
|
D 21
|
|
Verdunningswater/Laboratoriumcontrole
|
Ontchloord kraanwater (met koolstof gefilterd) of gelijkwaardige laboratoriumbron
|
|
Larvale dichtheid
|
20 larven per testbak (5/l)
|
|
Testoplossing/Testbak
|
4-10 l (minimaal 10-15 cm water) / Glazen of roestvrijstalen testbak (bijv. 22,5 × 14 × 16,5 cm)
|
|
Duplicatie
|
4 replicaatbakken / testconcentratie en controle
|
|
Aanvaardbare sterfte in controlegroepen
|
≤ 10 % per replicaatbak
|
|
Schildklierfixatie
|
Gefixeerd aantal
|
Alle kikkervisjes (5/duplo initieel beoordeeld)
|
|
Regio
|
Kop of geheel lichaam
|
|
Fixeervloeistof
|
Fixeermiddel van Davidson
|
|
Voeding
|
Voedsel
|
Sera MicronÒ of gelijkwaardig
|
|
Hoeveelheid/Frequentie
|
Zie tabel 1 voor voederregime met Sera Micron®
|
|
Verlichting
|
Fotoperiode
|
12 u licht: 12 u donker
|
|
Intensiteit
|
600 tot 2 000 lux (gemeten aan wateroppervlak)
|
|
Watertemperatuur
|
22 ± 1 °C
|
|
pH
|
6,5 – 8,5
|
|
Gehalte aan opgeloste zuurstof
|
> 3,5 mg/l (> 40 % luchtverzadiging)
|
|
Chemische monsteranalyse
|
Eenmaal per week (4 monsternemingen per test)
|
Aanhangsel 2
Rapporttabellen voor ruwe gegevens en overzichtsgegevens
Tabel 1
Algemene informatie over de teststof
|
Chemische informatie
|
|
|
Vul teststof, concentratie-eenheden en behandelingen in
|
|
|
Teststof:
|
|
|
|
|
Concentratie-eenheden:
|
|
|
|
|
Behandeling 1
|
|
|
|
|
Behandeling 2
|
|
|
|
|
Behandeling 3
|
|
|
|
|
Behandeling 4
|
|
|
|
|
|
|
|
|
|
Datum (dag 0):
|
|
Vul datum in (mm/dd/jj)
|
|
|
Datum (dag 7):
|
|
Vul datum in (mm/dd/jj)
|
|
|
Datum (dag 21):
|
|
Vul datum in (mm/dd/jj)
|
Tabel 2
Invulbladen ruwe gegevens op dag 7 en dag 21
|
DAG X
DATUM 00/00/00
|
|
|
Concentratie
|
Behandeling nr.
|
Duplo nr.
|
Individu nr.
|
Individu id.
|
Ontwikkelingsstadium
|
SVL (mm)
|
Achterpootlengte (mm)
|
Nat gewicht organisme (mg)
|
|
RIJ
|
TRT
|
TRT#
|
DUP
|
IND
|
ID#
|
STADIUM
|
BL
|
HLL
|
GEWICHT
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Tabel 3
Berekende samenvattingen van eindpuntgegevens op dag 7 en dag 21
|
|
|
Ontwikkelingsstadium
|
SVL (mm)
|
Achterpootlengte (mm)
|
Gewicht (mg)
|
|
TRT
|
DUP
|
MIN
|
MEDIAAN
|
MAX
|
GEM
|
STD AFW
|
GEM
|
STD AFW
|
GEM
|
STD AFW
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
N.B. De berekeningen in de cellen worden uitgevoerd met de in tabel 2 ingevoerde waarden.
|
Tabel 4
Dagelijkse sterftecijfers
|
Testdag
|
Datum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totaal duplo
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Totaal behandeling
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
N.B. De berekeningen in de cellen worden uitgevoerd met de in tabel 1 ingevoerde waarden.
|
Tabel 5
Criteria voor waterkwaliteit
Blootstellingssysteem (doorstroming/statische verversing):
Temperatuur:
Lichtsterkte:
Cyclus licht-donker:
Voeding:
Voederfrequentie:
pH-waarde water:
Jodiumgehalte in testwater:
Tabel 6
Samenvatting scheikundige gegevens
|
Chemische benaming
|
|
CAS:
|
|
Testdag
|
Datum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N.B. De berekeningen in de cellen worden uitgevoerd met de in tabel 1 ingevoerde waarden.
|
Tabel 7
Histopathologie: rapporttabellen voor kerncriteria
|
Datum:
|
Stof:
|
|
|
Patholoog:
|
|
|
Schildklier hypertrofie
|
Schildklier atrofie
|
Folliculaire hypertrofie
|
Folliculaire hyperplasie
|
|
Schildklier hypertrofie
|
Schildklier atrofie
|
Folliculaire hypertrofie
|
Folliculaire hyperplasie
|
|
Controledier-id — duplo 1
|
|
|
|
|
|
Dosisdier-id duplo 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Controledier-id — duplo 2
|
|
|
|
|
|
Dosisdier-id — duplo 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totaal:
|
|
|
|
|
Totaal:
|
|
|
|
|
|
|
Schildklier hypertrofie
|
Schildklier atrofie
|
Folliculaire hypertrofie
|
Folliculaire hyperplasie
|
|
|
Schildklier hypertrofie
|
Schildklier atrofie
|
Folliculaire hypertrofie
|
Folliculaire hyperplasie
|
|
Dosisdier-id — duplo 1
|
|
|
|
|
|
Dosisdier-id — duplo 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dosisdier-id — duplo 2
|
|
|
|
|
|
Dosisdier-id — duplo 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totaal:
|
|
|
|
|
Totaal:
|
|
|
|
|
Tabel 8
Histopathologie: aanvullende criteria
|
Datum:
|
Stof:
|
|
|
Patholoog:
|
|
|
|
|
|
|
|
|
Toename folliculair lumen
|
Afname folliculair lumen
|
Toename folliculair lumen
|
Afname folliculair lumen
|
|
Controledier-id — duplo 1
|
|
|
|
Dosisdier-id — duplo 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Controledier-id — duplo 2
|
|
|
|
Dosisdier -id — duplo 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totaal:
|
|
|
Totaal:
|
|
|
|
|
Toename folliculair lumen
|
Afname folliculair lumen
|
|
|
Toename folliculair lumen
|
Afname folliculair lumen
|
|
Dosisdier-id — duplo 1
|
|
|
|
Dosisdier-id — duplo 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dosisdier-id — duplo 2
|
|
|
|
Dosisdier-id — duplo 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totaal:
|
|
|
Totaal:
|
|
|
Tabel 9
Narratieve beschrijvingen voor histopathologische bevindingen
|
Datum:
|
|
Stof:
|
|
Patholoog:
|
|
|
Narratieve beschrijving
|
|
Controledier-id — duplo 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Controledier-id — duplo 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dosisdier-id — duplo 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dosisdier-id — duplo 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dosisdier-id — duplo 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dosisdier-id — duplo 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dosisdier-id — duplo 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dosisdier-id — duplo 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabel 10
Samenvattend rapportmodel voor dag x (7 of 21) van de AMA
|
|
|
Controle
|
Dosis 1
|
Dosis 2
|
Dosis 3
|
|
Eindpunt
|
Duplo
|
Gem.
|
SA
|
VC
|
N
|
Gem.
|
SA
|
VC
|
N
|
p-waarde
|
Gem.
|
SA
|
VC
|
N
|
p-waarde
|
Gem.
|
SA
|
VC
|
N
|
p-waarde
|
|
Achterpootlengte
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gem.:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SVL
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gem.:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nat gewicht
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gem.:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabel 11
Samenvattend rapportmodel voor het ontwikkelingsstadium op dag x (7 of 21) van de AMA
|
|
|
Controle
|
Dosis 1
|
Dosis 2
|
Dosis 3
|
|
|
Duplo
|
Mediaan
|
Min.
|
Max.
|
N
|
Mediaan
|
Min.
|
Max.
|
N
|
p-waarde
|
Mediaan
|
Min.
|
Max.
|
N
|
p-waarde
|
Mediaan
|
Min.
|
Max.
|
Mediaan
|
p-waarde
|
|
Ontwikkelingsstadium
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gem.:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aanhangsel 3
Alternatieve analyse van gewicht en lengte in geval van ontwikkeling naar latere stadia bij meer dan 20 % van de kikkervisjes in een of meer concentraties
Als een groter aantal kikkervisjes (≥ 20 %) in een of meer van de nominale concentraties een ontwikkeling voorbij stadium 60 vertoont, moet een bifactoriële variantieanalyse met een geneste variantiestructuur worden uitgevoerd op alle kikkervisjes om de groei-effecten in verband met chemische behandeling te bepalen, rekening houdend met het effect van het latere ontwikkelingsstadium op de groei.
Het voorstel is om alle gegevens te gebruiken maar rekening te houden met het effect van de ontwikkeling tot latere stadia. Dit is mogelijk met een bifactoriële variantieanalyse met een geneste variantiestructuur. Definieer LateStage=’Yes’ [later stadium = ja] voor een dier dat zich in ontwikkelingsstadium 61 of hoger bevindt. Anders definieert u LateStage=’No’ [later stadium = nee]. Vervolgens kan er een bifactoriële variantieanalyse worden uitgevoerd op de concentratie, het latere ontwikkelingsstadium en hun interactie, met Rep(Conc) [duplo(concentratie)] als random factor en Tadpole(Rep) [kikkervisje(duplo)] als ander random effect. Zo blijft de duplo de analyse-eenheid en worden in wezen dezelfde uitkomsten bereikt als met een gewogen analyse van rep*latestage means [duplo*gemiddelden bij later ontwikkelingsstadium], gewogen naar het aantal dieren per gemiddelde. Als de gegevens inbreuk maken op de vereiste normale verdeling of homogene variantie van de variantieanalyse, kan een genormaliseerde rangordetransformatie worden uitgevoerd om dat bezwaar weg te nemen.
Naast de standaard F-toets voor variantieanalyse van de effecten van Conc, LateStage en hun interactie kan de F-toets van de interactie worden „opgesplitst” in twee aanvullende F-tests, de ene van de gemiddelde respons voor alle concentraties bij LateStage=„No” en de andere van de gemiddelde respons voor alle concentraties bij LateStage=„Yes”. Verdere vergelijking van testgemiddelden versus controlegemiddelden vindt plaats binnen elk niveau van LateStage. Er kan een soort trendanalyse worden gemaakt met behulp van geschikte contrasten of er kunnen eenvoudigweg paarsgewijze vergelijkingen worden uitgevoerd als er aanwijzingen zijn voor niet-monotone dosisrespons binnen een niveau van de LateStage-variabele. Een correctie op de p-waarden volgens Bonferroni-Holm wordt alleen aangebracht als het bijbehorende F-deel niet significant is. Deze correctie kan worden uitgevoerd in SAS en waarschijnlijk ook in andere softwareprogramma's. Er kunnen complicaties optreden wanneer in sommige concentraties geen dieren in latere ontwikkelingsstadia voorkomen, maar zulke situaties kunnen direct en eenvoudig worden opgelost.
Aanhangsel 4
Definities
Chemische stof
: een stof of mengsel.
Teststof
: alle volgens deze testmethode geteste stoffen of mengsels.
C.39. REPRODUCTIETEST MET SPRINGSTAARTEN IN DE BODEM
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan testrichtsnoer (TG) 232 (2009) van de OESO. Deze testmethode is ontworpen om de effecten van chemische stoffen op het reproductieresultaat van springstaarten in de bodem vast te stellen en is gebaseerd op bestaande procedures (1) (2). De parthenogenetische Folsomia candida en de zich seksueel reproducerende Folsomia fimetaria zijn twee van de meest toegankelijke soorten van de springstaart. Ze zijn ook kweekbaar en commercieel beschikbaar. Wanneer specifieke, niet door de twee soorten bestreken habitats moeten worden beoordeeld, kan de procedure ook worden uitgebreid naar andere soorten van de springstaart op voorwaarde dat ze voldoen aan de geldigheidscriteria van de test.
|
|
2.
|
In de bodem levende springstaarten zijn ecologische relevante soorten voor ecotoxicologische tests. Springstaarten zijn zespotigen met een dun exoskelet dat zeer lucht- en waterdoorlaatbaar is. Ze vormen een soort geleedpotigen met een andere blootstellingsroute en een ander exposietempo dan regenwormen en enchytreeën.
|
|
3.
|
De populatiedichtheid van de springstaart bereikt gewoonlijk 105 m– 2 in lagen aarde en bladafval in veel terrestriale ecosystemen (3) (4). Volwassen dieren meten meestal 0,5 — 5 mm en hun bijdrage aan de totale dierlijke biomassa en bodemdoorluchting is laag, naar schatting tussen 1 en 5 % (5). Hun belangrijkste rol is daarom waarschijnlijk die van mogelijke procesregelaars door predatie van microbivoren en microfauna. Springstaarten zijn prooidieren voor een grote variëteit aan ondergronds en bovengronds levende ongewervelde dieren, zoals mijten, duizendpoten, spinnen, loopkevers en kortschildkevers. Springstaarten dragen bij aan de afbraakprocessen in zure bodems, waar ze naast enchytreeën de belangrijkste in de bodem levende ongewervelde dieren zijn, aangezien er doorgaans geen regenwormen en miljoenpoten voorkomen.
|
|
4.
|
De soort F. fimetaria komt over heel de wereld voor en is gangbaar in verschillende typen bodems, gaande van zandig tot lemig en van mull tot mor. Het is een oogloze, ongepigmenteerde springstaart. Hij is gedocumenteerd in agrarische gronden overal in Europa (6). Hij heeft een omnivore eetgewoonte, met schimmeldraden, bacteriën, protozoa en afval in zijn voedsel. Hij heeft door zijn eetgewoonte interactie met infecties van plantenziekteverwekkende schimmels (7) en is mogelijk van invloed op mycorrhiza, zoals zeker het geval is bij F. candida. Zoals de meeste springstaartsoorten plant deze soort zich geslachtelijk voort, waarbij de permanente aanwezigheid van mannetjes noodzakelijk is voor bevruchting van de eieren.
|
|
5.
|
F. candida komt eveneens op de hele wereld voor. Hij wordt in de meeste natuurlijke bodems niet vaak aangetroffen, maar komt wel veel in grote aantallen voor op humusrijke plaatsen. Ook deze springstaart heeft geen ogen en is niet gepigmenteerd. Hij heeft een goed ontwikkelde furca (springorgaan), vertoont actieve renbewegingen en springt snel als hij wordt verstoord. De ecologische rol van F. candida is soortgelijk als die van F. fimetaria, maar zijn habitats bestaan uit organischer, rijkere bodems. Deze soort plant zich parthenogenetisch voort. Soms is minder dan 1 op de 1 000 van een populatie mannelijk.
|
PRINCIPE VAN DE TEST
|
6.
|
Synchrone volwassen (F. fimetaria) of juveniele (F. candida) springstaarten worden blootgesteld aan uiteenlopende concentraties van de teststof die is gemengd door gemodificeerde kunstmatige grond (8) met behulp van 5 % organische bodemstoffen (of andere grond). Het testscenario bestaat uit twee stappen:
|
—
|
een bereikbepalingstest, in het geval dat niet voldoende informatie over toxiciteit beschikbaar is, waarin sterfte en reproductie de belangrijkste eindpunten zijn die na 2 weken worden beoordeeld voor F. fimetaria en na 3 weken voor F. candida.
|
|
—
|
een definitieve reproductietest waarin het totale aantal juvenielen dat door de oorspronkelijke dieren is voortgebracht en het aantal overlevende volwassen dieren worden vastgesteld. De duur van deze definitieve test is 3 weken voor F. fimetaria of 4 weken voor F. candida.
|
Het toxische effect van de teststof op de sterfte onder volwassenen en op het reproductieresultaat wordt uitgedrukt in LCx en ECx door de gegevens in een geschikt model onder te brengen door middel van non-lineaire regressie teneinde de concentratie te berekenen die respectievelijk x % sterfte of vermindering van het reproductieresultaat zou veroorzaken, of uitgedrukt in de NOEC/LOEC-waarde (9).
|
INFORMATIE OVER DE TESTSTOF
|
7.
|
De fysische eigenschappen, de wateroplosbaarheid, de log Kow, de bodem-water-verdelingscoëfficiënt en de dampdruk van de teststof dienen bij voorkeur bekend te zijn. Aanvullende informatie over het lot van de teststof in de bodem, zoals de snelheid van fotolyse, hydrolyse en biologische afbraak, is gewenst. Indien beschikbaar moeten de chemische identificatiegegevens van de teststof volgens de IUPAC-nomenclatuur, het CAS-nummer, de partij, de zending, de structuurformule en de zuiverheid worden gedocumenteerd.
|
|
8.
|
Deze testmethode kan worden gebruikt voor in water oplosbare en niet in water oplosbare stoffen. De wijze waarop de teststof wordt toegepast, verschilt dan echter dienovereenkomstig. De testmethode is niet bruikbaar voor vluchtige stoffen, d.w.z. stoffen waarvoor de constante van Henry of de lucht-waterverdelingscoëfficiënt groter is dan één of stoffen waarvan de dampdruk bij 25 °C hoger is dan 0,0133 Pa.
|
GELDIGHEID VAN DE TEST
|
9.
|
Voor een geldig testresultaat moet in de onbehandelde controlegroepen aan de volgende criteria zijn voldaan:
|
—
|
De gemiddelde sterfte onder volwassen dieren mag aan het eind van de test niet hoger zijn dan 20 %.
|
|
—
|
Het gemiddelde aantal juvenielen per potje moet aan het eind van de test minimaal 100 zijn.
|
|
—
|
De voor het aantal juvenielen berekende variatiecoëfficiënt moet aan het eind van de test minder dan 30 % zijn.
|
|
REFERENTIESTOF
|
10.
|
Er dient voor de gekozen testbodemsoort een referentiestof te worden getest bij een concentratie van EC50 (met regelmatige intervallen of indien mogelijk als onderdeel van elke testuitvoering) om te controleren of de respons van de testorganismen in het testsysteem op het normale niveau ligt. Een geschikte referentiestof is boorzuur, dat de reproductie bij beide soorten met 50 % zou moeten verminderen (10) (11) bij ongeveer 100 mg/kg droog bodemgewicht.
|
BESCHRIJVING VAN DE TEST
Monsterpotjes en uitrusting
|
11.
|
Geschikte monsterpotjes zijn houders die 30 g vochtige aarde kunnen bevatten. Ze moeten gemaakt zijn van glas of inert kunststof (niet-toxisch). Het gebruik van kunststof houders dient echter te worden vermeden indien de blootstelling aan de teststof afneemt als gevolg van sorptie. De doorsnede van de monsterpotjes moet een feitelijke gronddikte in het potje van 2-4 cm mogelijk maken. De potjes moeten zijn voorzien van deksels (bijv. van glas of polyetheen) die zijn ontworpen om waterverdamping tegen te gaan en gaswisseling tussen bodem en lucht toe te laten. De houder moet ten minste gedeeltelijk transparant zijn om lichtdoorlating mogelijk te maken.
|
|
12.
|
Er is een normale laboratoriumuitrusting vereist, meer specifiek de volgende onderdelen:
|
—
|
weegschalen met toereikende nauwkeurigheid;
|
|
—
|
geschikte apparatuur voor temperatuurregeling;
|
|
—
|
geschikte apparatuur voor luchtvochtigheidsbeheersing (niet essentieel indien de monsterpotjes met deksels zijn afgesloten);
|
|
—
|
incubator of kleine ruimte met temperatuurregeling;
|
|
—
|
tang of luchtaanzuigapparaat.
|
|
Wijze van bereiding van de testbodem
|
13.
|
Er wordt gebruikgemaakt van gemodificeerde kunstmatige grond (8) met een gehalte aan organische stoffen van 5 %. Als alternatief kan natuurlijke grond worden gebruikt wanneer de kunstmatige grond niet overeenkomt met natuurlijke grondsoorten. De aanbevolen samenstelling van de kunstmatige grond is als volgt (op basis van droog gewicht, gedroogd tot constant gewicht bij 105 °C):
|
—
|
5 % veenmosturf, aan de lucht gedroogd en fijngemalen (een korrelgrootte van 2 ± 1 mm is aanvaardbaar);
|
|
—
|
20 % kaolienklei (met bij voorkeur meer dan 30 % kaoliniet);
|
|
—
|
ongeveer 74 % aan de lucht gedroogd industrieel zand (afhankelijk van de benodigde hoeveelheid CaCO3), overwegend fijn zand waarvan meer dan 50 % van de korrels tussen 50 en 200 micron groot is. De exacte hoeveelheid zand hangt af van de hoeveelheid CaCO3 (zie onder). Samen moeten deze hoeveelheden 75 % bedragen.
|
|
—
|
1,0 % calciumcarbonaat (CaCO3, in poedervorm, van analytische kwaliteit) om een pH van 6,0 ± 0,5 te bereiken; de toe te voegen hoeveelheid calciumcarbonaat kan hoofdzakelijk afhangen van de kwaliteit/aard van de turf (zie noot 1).
|
Noot 1: De vereiste hoeveelheid CaCO3 hangt af van de componenten van het bodemsubstraat en moet worden bepaald door het meten van de pH-waarde van nog niet geïncubeerde vochtige grondmonsters onmiddellijk voorafgaand aan de test.
Noot 2: Het verdient aanbeveling de pH-waarde en facultatief de C/N-verhouding, de capaciteit voor kationuitwisseling (CEC) en het gehalte aan organische stoffen van de grond te meten teneinde in een later stadium normalisatie en een betere interpretatie van de resultaten mogelijk te maken.
Noot 3: Indien vereist, bijvoorbeeld voor specifieke testdoeleinden, kan ook natuurlijke grond afkomstig van niet-verontreinigde plaatsen als test- en/of kweeksubstraat dienen. Wanneer natuurlijke grond wordt gebruikt, moet deze worden gekarakteriseerd met ten minste de oorsprong (plaats van waar hij afkomstig is), de pH, de textuur (korrelgrootteverdeling), de CEC en het gehalte aan organische stoffen. Bovendien moet de grond vrij zijn van elke vorm van verontreiniging. Er wordt aanbevolen alvorens natuurlijke grond in een definitieve test te gebruiken, aan te tonen dat de grond geschikt is voor testdoeleinden en voldoet aan de geldigheidscriteria van de test.
|
|
14.
|
De droge bestanddelen van de grond worden grondig gemengd (bijv. in een grote laboratoriummenger). Het maximale waterhoudende vermogen (WHC) van de kunstmatige grond wordt bepaald overeenkomstig de in aanhangsel 5 beschreven procedures. Het vochtgehalte van de testgrond moet worden geoptimaliseerd om een losse, poreuze bodemstructuur te verkrijgen waarin de poriën toegankelijk zijn voor springstaarten. Dit gehalte is gewoonlijk 40-60 % van het maximale WHC.
|
|
15.
|
De droge kunstmatige grond wordt vooraf bevochtigd door toevoeging van genoeg gedeïoniseerd water om 2 tot 7 dagen voor aanvang van de test ongeveer de helft van het uiteindelijke vochtgehalte te verkrijgen teneinde de zuurgraad in evenwicht te brengen en te stabiliseren. Voor de bepaling van de pH wordt een mengsel van grond en een oplossing van 1 M kaliumchloride (KCl) of 0,01 M calciumchloride (CaCl2) in een verhouding 1:5 gebruikt (overeenkomstig aanhangsel 6). Als de zuurgraad hoger is dan het voorgeschreven bereik, kan deze worden gecorrigeerd door toevoeging van een passende hoeveelheid CaCO3. Als de grond te basisch is, kan dit worden gecorrigeerd door toevoeging van een anorganisch zuur dat onschadelijk is voor springstaarten.
|
|
16.
|
De vooraf bevochtigde grond wordt in porties verdeeld die overeenkomen met het aantal testconcentraties (en referentiestoffen, voor zover van toepassing) en controlegroepen dat voor de test wordt gebruikt. De teststoffen worden toegevoegd en het watergehalte wordt geregeld zoals beschreven in punt 24.
|
Selectie en preparatie van de proefdieren
|
17.
|
De parthenogenetische F. candida is de aanbevolen soort, aangezien deze soort bij de ringtests van de testmethode (11) vaker dan V. fimetaria voldeed aan de geldigheidscriteria voor overleving. Als er een andere soort wordt gebruikt, moet deze voldoen aan de in punt 9 uiteengezette geldigheidscriteria. Aan het begin van de test moeten de dieren goed doorvoed zijn en 23-26 dagen oud voor F. fimetaria of 9-12 dagen voor F. candida. Het vereiste aantal F. fimetaria bedraagt voor iedere duplo 10 mannetjes en 10 vrouwtjes. Voor F. candida moeten 10 vrouwtjes worden gebruikt (zie bijlage 2 en bijlage 3). De synchrone dieren worden willekeurig uit de houders geselecteerd en hun gezondheid en fysieke conditie wordt gecontroleerd voor elke partij die in een duplo wordt geplaatst. Iedere groep van 10/20 individuen wordt in een willekeurig gekozen testbak geplaatst en de grote vrouwtjes van F. fimetaria worden geselecteerd omdat ze duidelijk te onderscheiden zijn van de mannetjes van dezelfde soort.
|
Bereiding van de testconcentraties
|
18.
|
Er kunnen vier methoden worden gebruikt om de teststof toe te passen: 1) menging van de teststof in de grond met water als draagstof, 2) menging van de teststof in de grond met een organisch oplosmiddel als draagstof, 3) menging van de teststof in de grond met zand als draagstof of 4) aanbrengen van de teststof op het grondoppervlak. De keuze van de meest geschikte methode hangt af van de kenmerken van de teststof en het doel van de test. In het algemeen wordt aanbevolen de teststof in de grond te mengen. Aanbrengen kan echter geboden zijn als de aanbrengprocedure overeenstemt met het gebruik van de teststof in de praktijk (bijv. verneveling van vloeistofformuleringen of gebruik van speciale bestrijdingsmiddelformuleringen zoals korrels of zaadbehandelingen). De grond wordt behandeld voordat de springstaarten worden toegevoegd. Alleen wanneer de teststof wordt aangebracht op het grondoppervlak moeten de springstaarten eerst de gelegenheid krijgen de grond binnen de dringen.
|
Teststof oplosbaar in water
|
19.
|
Er wordt een oplossing van de teststof in gedeïoniseerd water bereid in een hoeveelheid die voldoende is voor alle duplo's van één testconcentratie. Elke teststofoplossing wordt grondig gemengd met één partij vooraf bevochtigde grond alvorens in het monsterpotje te worden gebracht.
|
Teststof onoplosbaar in water
|
20.
|
Voor stoffen die niet in water maar wel in organische oplosmiddelen kunnen worden opgelost, kan de teststof worden opgelost in de kleinst mogelijke hoeveelheid van een geschikt oplosmiddel (bijv. aceton) terwijl toch wordt toegezien op de juiste menging van de stof in de grond en met een deel van het vereiste kwartszand. Er dienen uitsluitend vluchtige oplosmiddelen te worden gebruikt. Wanneer een organisch oplosmiddel wordt gebruikt, moeten alle testconcentraties en een extra negatieve oplosmiddelcontrole dezelfde minimumhoeveelheid oplosmiddel bevatten. Houders waarin de teststof is aangebracht, moeten gedurende een bepaalde periode onbedekt blijven om het bij het aanbrengen van de teststof gebruikte oplosmiddel te laten verdampen, waarbij erop moet worden toegezien dat onderwijl geen dissipatie van de toxische stof optreedt.
|
Teststof slecht oplosbaar in water en organische oplosmiddelen
|
21.
|
Voor stoffen die slecht oplosbaar zijn in water en organische oplosmiddelen, wordt kwartszand, dat deel moet uitmaken van de totale hoeveelheid zand die aan de grond wordt toegevoegd, gemengd met de hoeveelheid teststof die nodig is om de gewenste testconcentratie te verkrijgen. Het mengsel van kwartszand en teststof wordt toegevoegd aan de vooraf bevochtigde grond en grondig gemengd nadat een passende hoeveelheid gedeïoniseerd water is toegevoegd om het vereiste vochtgehalte te verkrijgen. Het uiteindelijke mengsel wordt over de monsterpotjes verdeeld. Deze procedure wordt voor elke testconcentratie herhaald en tevens wordt een geschikte controle bereid.
|
Aanbrengen van de teststof op het grondoppervlak
|
22.
|
Wanneer de teststof een bestrijdingsmiddel is, kan deze soms het beste op het grondoppervlak worden aangebracht door middel van verneveling. De grond wordt behandeld nadat de springstaarten zijn toegevoegd. De monsterpotjes worden eerst gevuld met het bevochtigde grondsubstraat, daarna worden de dieren toegevoegd en vervolgens worden de monsterpotjes gewogen. Om directe blootstelling van de dieren aan de teststof door rechtstreeks contact te vermijden, wordt de teststof pas minimaal een halfuur na de introductie van de springstaarten aangebracht. De teststof moet zo gelijkmatig mogelijk op het grondoppervlak worden aangebracht met behulp van een geschikt benevelingsapparaat van laboratoriumformaat waarmee de toepassing in het veld wordt gesimuleerd. Het aanbrengen moet gebeuren bij een maximale temperatuurafwijking van ± 2 °C. Voor waterige oplossingen, emulsies of dispersies moet een toepassingsdosis gebruikt worden die in overeenstemming is met de aanbevelingen van de risicoanalyse. De snelheid moet worden gecontroleerd met behulp van een geschikte kalibratiemethode. Speciale formuleringen, zoals korrels of zaadbehandelingen, kunnen worden aangebracht op een wijze die overeenstemt met agrarisch gebruik. Voedsel wordt toegevoegd na de beneveling.
|
PROCEDURE
Testomstandigheden
|
23.
|
De gemiddelde testtemperatuur dient 20 ± 1 °C te zijn bij een temperatuurbereik van 20 ± 2 °C. De test wordt uitgevoerd in geregelde cycli van licht en donker (bij voorkeur 12 uur licht en 12 uur donker) met een belichting van 400 tot 800 lux in de ruimte met de monsterpotjes.
|
|
24.
|
Om de grondvochtigheid na te gaan, worden de potjes gewogen bij aanvang, halverwege en aan het eind van de test. Gewichtsverlies van > 2 % wordt ongedaan gemaakt door toevoeging van gedeïoniseerd water. Hierbij zij opgemerkt dat het waterverlies kan worden beperkt door handhaving van een hoge luchtvochtigheid (> 80 %) in de testincubator.
|
|
25.
|
De pH-waarde moet worden gemeten aan het begin en het einde van zowel de bereikbepalingstest als de definitieve test. Er moeten metingen worden uitgevoerd op één extra controlemonster en één extra monster van (alle concentraties) behandelde bodemmonsters die op dezelfde wijze zijn bereid en onderhouden als de testkweken, maar zonder toevoeging van springstaarten.
|
Testprocedure en -metingen
|
26.
|
Voor elke testconcentratie wordt een hoeveelheid testgrond die overeenkomt met 30 g vers gewicht in het monsterpotje gebracht. Ook worden watercontroles, zonder teststof, bereid. Als er een drager wordt gebruikt voor het aanbrengen van de teststof, moet er naast de testreeks één controlereeks worden gemaakt die alleen de drager bevat. De oplosmiddel- of dispergeermiddelconcentratie moet dezelfde zijn als in de potjes met de teststof.
|
|
27.
|
De individuele springstaarten worden voorzichtig overgebracht naar een monsterpotje (waaraan ze willekeurig zijn toegewezen) en op het grondoppervlak geplaatst. Om de dieren doeltreffend over te brengen, kan een luchtaanzuigapparaat worden gebruikt. Het aantal duplo's voor testconcentraties en voor controles hangt af van de testopzet. De monsterpotjes worden willekeurig in de incubator geplaatst en hun posities worden wekelijks opnieuw gerandomiseerd.
|
|
28.
|
Voor de test met F. fimetaria moeten er per monsterpotje 20 volwassen dieren, 10 mannetjes en 10 vrouwtjes, van 23-26 dagen oud worden gebruikt. Op dag 21 worden de springstaarten uit de grond geëxtraheerd en geteld. Bij F. fimetaria worden de geslachten onderscheiden naar grootte in de gesynchroniseerde partij dieren die voor de test wordt gebruikt. De vrouwtjes zijn kenmerkend groter dan de mannetjes (zie aanhangsel 3).
|
|
29.
|
Voor de test met F. candida moeten er per monsterpotje 10 juvenielen van 9-12 dagen oud worden gebruikt. Op dag 28 worden de springstaarten uit de grond geëxtraheerd en geteld.
|
|
30.
|
Als geschikte voedingsbron wordt een toereikende hoeveelheid, bijv. 2-10 mg, voor huishoudelijk gebruik verkrijgbare bakkersgistkorrels in elk van de potjes gebracht bij aanvang van de test en na ongeveer 2 weken.
|
|
31.
|
Aan het eind van de test worden de sterfte en de reproductie geanalyseerd. Na 3 weken (F. fimetaria) of 4 weken (F. candida) worden de springstaarten uit de testgrond geëxtraheerd (zie aanhangsel 4) en geteld (12). Een springstaart die bij de extractie ontbreekt, wordt geregistreerd als gestorven. De extractie- en telmethode moet worden gevalideerd. Tot de validatiecriteria behoort een extractiedoeltreffendheid voor juvenielen van meer dan 95 %, bijv. door bij het aantal een bekend aantal in de grond op te tellen.
|
|
32.
|
Een praktische samenvatting en een tijdschema voor de testprocedure vindt u in aanhangsel 2.
|
Testopzet
Bereikbepalingstest
|
33.
|
Indien noodzakelijk wordt er een bereikbepalingstest uitgevoerd met bijvoorbeeld vijf teststofconcentraties van 0,1, 1,0, 10, 100 en 1 000 mg/kg drooggewicht van de grond en twee duplo's voor elke test- en controlegroep. Ook aanvullende informatie over sterfte of reproductie van springstaarten, afkomstig uit tests met soortgelijke stoffen of uit de literatuur, kan bruikbaar zijn bij de keuze van de te gebruiken testconcentraties in de bereikbepalingstest.
|
|
34.
|
De duur van de bereikbepalingstest is twee weken voor F. fimetaria en drie weken voor F. candida, om te garanderen dat één legsel van juvenielen is geproduceerd. Aan het eind van de test worden de sterfte en de reproductie van de springstaarten vastgesteld. De aantallen volwassen dieren en juvenielen moeten worden geregistreerd.
|
Definitieve test
|
35.
|
Voor de bepaling van ECx (bijv. EC10, EC50) moeten er twaalf concentraties worden getest. Aanbevolen worden ten minste twee duplo's per testconcentratie en zes controleduplo's. De tussenliggende factor kan variëren afhankelijk van het dosisresponspatroon.
|
|
36.
|
Voor de bepaling van de NOEC/LOEC moeten er ten minste vijf concentraties in een geometrische reeks worden getest. Aanbevolen worden vier duplo's per testconcentratie plus acht controles. De concentraties moeten worden gescheiden door een tussenliggende factor van ten hoogste 1,8.
|
|
37.
|
Met een gecombineerde aanpak kunnen zowel de NOEC/LOEC als ECx worden bepaald. Voor deze gecombineerde aanpak moeten er acht testconcentraties in een geometrische reeks worden gebruikt. Aanbevolen worden vier duplo's per behandeling plus acht controles. De concentraties moeten worden gescheiden door een tussenliggende factor van ten hoogste 1,8.
|
|
38.
|
Als er geen effecten worden waargenomen bij de hoogste concentratie in de bereikbepalingstest (d.w.z. 1 000 mg/kg), kan de reproductietest worden uitgevoerd als limiettest met een testconcentratie van 1 000 mg/kg en de controle. Een limiettest biedt de gelegenheid om aan te tonen dat er geen statistisch significant effect optreedt bij de limietconcentratie. Er moeten acht duplo's worden gebruikt voor zowel de behandelde grond als de controle.
|
GEGEVENS EN RAPPORTAGE
Verwerking van de resultaten
|
39.
|
Het reproductieresultaat is het voornaamste eindpunt (bijv. het aantal geproduceerde juvenielen per monsterpotje). In de statistische analyse, bijv. de variantieanalyse, worden de behandelconcentraties vergeleken met de T-toets van Student, de toets van Dunnett of de toets van Williams. Voor afzonderlijke testgemiddelden worden betrouwbaarheidsintervallen van 95 % berekend.
|
|
40.
|
Het aantal overlevende volwassen dieren in de onbehandelde controlegroepen is een belangrijk geldigheidscriterium en moet worden gedocumenteerd. Evenals bij de bereikbepalingstest moeten ook alle overige tekenen van schade worden vermeld in het eindverslag.
|
LCx en ECx
|
41.
|
ECx-waarden, inclusief de bijbehorende minimale en maximale 95 % betrouwbaarheid voor de parameter, worden berekend met behulp van geschikte statistische methoden (bijv. de logistische of Weibull-functie, de vereenvoudigde methode van Spearman-Karber of eenvoudige interpolatie). Een ECx wordt verkregen door een waarde die overeenstemt met x % van het controlegemiddelde in te voegen in de gevonden vergelijking. Om EC50 of een andere ECx te berekenen, moet de volledige dataset worden onderworpen aan regressieanalyse. LC50 wordt gewoonlijk geschat door middel van probitanalyse of een soortgelijke analyse waarin rekening wordt gehouden met de binomiaal verdeelde sterftecijfers.
|
NOEC/LOEC
|
42.
|
Als een statistische analyse is gericht op de bepaling van de NOEC/LOEC, zijn er statistische gegevens per potje (afzonderlijke potjes worden als duplo's beschouwd) vereist. De geschikte statistische methoden moeten worden gebruikt volgens de toepassingsrichtsnoeren in OESO-document 54 over actuele benaderingen van de statistische analyse van milieugiftigheidsgegevens (9). In het algemeen worden negatieve effecten van de teststof in vergelijking met de controle onderzocht met behulp van een eenzijdige hypothesetoets bij p ≤ 0,05.
|
|
43.
|
De normale verdeling en de homogene variantie kunnen worden getest met een geschikte statistische toets, bijv. respectievelijk de toets van Shapiro-Wilk en de toets van Levene (p ≤ 0,05). Er kunnen een unidirectionele variantieanalyse en daaropvolgende multi-vergelijkingstoetsen worden uitgevoerd. Meervoudige vergelijkingen (bijv. de toets van Dunnett) of step-down trendtoetsen (bv. de toets van Williams) kunnen worden gebruikt om uit te rekenen of er significante verschillen (p ≤ 0,05) bestaan tussen de controles en de verschillende teststofconcentraties (selectie van de aanbevolen toets volgens OESO-document 54 (9)). Anders zouden verdelingsvrije methoden (bijv. de U-toets van Bonferroni volgens Holm of de trendtoets van Jonckheere-Terpstra) kunnen worden toegepast om de NOEC en de LOEC te bepalen.
|
Limiettest
|
44.
|
Als er een limiettest (vergelijking tussen controle en slechts één testgroep) is uitgevoerd en de voorwaarden voor parametrische toetsprocedures (normale verdeling, homogeniteit) zijn vervuld, kunnen meetresponsen worden beoordeeld met de T-toets van Student. Als die voorwaarden niet zijn vervuld, kan de T-toets voor ongelijke variantie (T-toets van Welch) of een verdelingsvrije toets, zoals de U-toets van Wilcoxon-Mann-Whitney, worden gebruikt.
|
|
45.
|
Om significante verschillen tussen de controles (controle en controle met oplosmiddel) te bepalen, kunnen de duplo's van elke controle worden getoetst zoals beschreven voor de limiettest. Als bij deze toetsen geen significante verschillen worden geconstateerd, mogen alle controleduplo's en controleduplo's met oplosmiddel bij elkaar worden genomen. Anders moeten alle behandelingen worden vergeleken met de controle met oplosmiddel.
|
Testverslag
|
46.
|
Het testverslag moet ten minste de volgende informatie bevatten:
|
|
Teststof
|
—
|
de identificatiegegevens van de teststof, het CAS-nummer, de partij, de zending, de zuiverheid;
|
|
—
|
indien beschikbaar, de fysisch-chemische eigenschappen van de teststof (bijv. log Kow, wateroplosbaarheid, dampdruk, constante van Henry (H) en bij voorkeur informatie over het lot van de teststof in de bodem);
|
|
—
|
specificatie van de formulering van de teststof en de toegevoegde middelen indien niet de zuivere stof wordt getest;
|
|
|
|
Testorganismen
|
—
|
identificatie van de soort en de leverancier van de testorganismen, een beschrijving van de kweekomstandigheden en het leeftijdsbereik van de testorganismen;
|
|
|
|
Testomstandigheden
|
—
|
beschrijving van de testopzet en -procedure;
|
|
—
|
details van de bereiding van de testgrond; gedetailleerde specificatie indien natuurlijke grond wordt gebruikt (oorsprong, geschiedenis, korrelgrootteverdeling, pH, gehalte aan organische stoffen);
|
|
—
|
waterhoudend vermogen van de grond;
|
|
—
|
beschrijving van de toegepaste methode om de teststof in/op de grond aan te brengen;
|
|
—
|
testomstandigheden: lichtsterkte, duur van licht-donkercycli, temperatuur;
|
|
—
|
beschrijving van het voederregime, de soort en hoeveelheid voedsel die is gebruikt, voederdata;
|
|
—
|
pH en watergehalte van de grond bij aanvang en aan het eind van de test (controle en elk van de testgroepen);
|
|
—
|
gedetailleerde beschrijving van de extractiemethode en de doeltreffendheid van de extractie;
|
|
|
|
Testresultaten
|
—
|
het aantal juvenielen dat per monsterpotje aan het eind van de test is vastgesteld;
|
|
—
|
het aantal volwassen dieren en hun sterfte ( %) per monsterpotje aan het eind van de test;
|
|
—
|
een beschrijving van onmiskenbare fysiologische of pathologische symptomen of karakteristieke gedragsveranderingen;
|
|
—
|
de resultaten die zijn verkregen met de referentiestof;
|
|
—
|
de NOEC/LOEC-waarden, LCx voor sterfte en EGx voor reproductie (vooral LC50, LC10, EG50 en EG10) samen met 95 % betrouwbaarheidsintervallen. Een diagram van het toegepaste model voor de berekening, de functievergelijking en de parameters (zie (9));
|
|
—
|
alle informatie en opmerkingen die nuttig kunnen zijn voor de interpretatie van de resultaten;
|
|
—
|
onderscheidend vermogen van de feitelijke test indien toetsing van een hypothese plaatsvindt (9);
|
|
—
|
afwijkingen van in deze testmethode beschreven procedures en eventuele ongebruikelijke gebeurtenissen tijdens de test;
|
|
—
|
geldigheid van de test;
|
|
—
|
wanneer de NOEC is geschat, het minimaal detecteerbare verschil.
|
|
|
LITERATUUR
|
(1)
|
Wiles JA and Krogh PH (1998) Testing with the collembolans I. viridis, F. candida and F. fimetaria. In Handbook of soil invertebrate toxicity tests (ed. H Løkke and CAM Van Gestel), pp. 131-156. John Wiley & Sons, Ltd., Chichester
|
|
(2)
|
ISO (1999) Soil Quality — Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. No. 11267. International Organisation for Standardisation, Geneve
|
|
(3)
|
Burges A and Raw F (Eds) (1967) Soil Biology. Academic Press. London
|
|
(4)
|
Petersen H and Luxton M (1982) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287-388
|
|
(5)
|
Petersen H (1994) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111-118
|
|
(6)
|
Hopkin SP (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330 pp. (ISBN 0-19-854084-1)
|
|
(7)
|
Ulber B (1983) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In New trends in soil Biology (Lebrun Ph, André HM, De Medts A, Grégoire-Wibo, Wauthy G (Eds), Proceedings of the VI. international colloquium on soil zoology, Louvain-la-Neuve (Belgium), 30 August-2 September 1982, I Dieu-Brichart, Ottignies-Louvain-la-Neuve, pp. 261-268
|
|
(8)
|
Hoofdstuk C.36 van deze bijlage, Reproductieproef voor roofmijten (Hypoaspis (Geolaelaps) aculeifer) in de grond.
|
|
(9)
|
OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006)18, OECD Paris
|
|
(10)
|
Scott-Fordsmand JJ and Krogh PH (2005) Background report on prevalidation of an OECD springtail test guideline. Environmental Project Nr. 986. Miljøstyrelsen 61 pp. Danish Ministry for the Environment.
|
|
(11)
|
Krogh, P.H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danish Environmental Protection Agency, Environmental Project No. 1256, pp. 66.
|
|
(12)
|
Krogh PH, Johansen K and Holmstrup M (1998) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201-205
|
|
(13)
|
Fjellberg A (1980) Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
(14)
|
Edwards C.A. (1955) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan D.K. McE., Ed). Butterworths, London, pp. 412-416
|
|
(15)
|
Goto HE (1960) Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96:138-140.
|
Aanhangsel 1
Definities
Voor deze testmethode gelden de volgende definities (in deze test worden alle uitkomstconcentraties uitgedrukt als een massa teststof per droge massa testgrond):
|
|
ECx (effect concentration for x % effect) is de concentratie die binnen een gegeven blootstellingperiode x % van een effect op testorganismen veroorzaakt in vergelijking met een controlegroep. EC50 is bijvoorbeeld een concentratie op een eindpunt in de test die een uitwerking heeft bij naar schatting 50 % van een blootgestelde populatie in een gedefinieerde blootstellingstermijn.
|
|
|
LOEC (lowest observed effect concentration) is de laagste concentratie van de teststof waarbij binnen een gegeven blootstellingperiode wel een statistisch significant effect wordt waargenomen (p < 0,05) in vergelijking met de controlegroep.
|
|
|
NOEC (no observed effect concentration) is de concentratie van de teststof waarbij geen effect wordt waargenomen. In deze test heeft de met de NOEC overeenkomende concentratie binnen een gegeven blootstellingstermijn geen statistisch significant effect (p < 0,05) in vergelijking met de controlegroep.
|
|
|
Stof betekent een stof of een mengsel.
|
|
|
Teststof betekent een volgens deze testmethode geteste stof.
|
Aanhangsel 2
Belangrijkste handelingen en tijdschema voor een test met springstaarten
De stappen in de test kunnen als volgt worden samengevat:
|
Tijd (dag)
|
Handeling
|
|
– 23 tot – 26
|
Bereiden van synchrone kweek F. fimetaria
|
|
– 14
|
Bereiden van kunstmatige grond (mengen van droge bestanddelen)
Controle en eventuele correctie van de pH van de kunstmatige grond
Meten van max. WHC van de grond
|
|
– 9 tot –12
|
Bereiden van synchrone kweek F. candida
|
|
– 2 tot – 7
|
Vooraf bevochtigen van grond
|
|
– 1
|
Verdelen van juvenielen in partijen
Bereiden stamoplossingen en aanbrengen teststof indien oplosmiddel vereist is
|
|
0
|
Bereiden stamoplossingen en aanbrengen teststof indien vaste stof, in water oplosbare stof of aanbrengen op oppervlak vereist is
Meten van grond-pH en wegen van de houders
Voeding aanbrengen. Springstaarten inbrengen
|
|
14
|
Bereikbepalingstest met F. fimetaria: beëindigen test, extractie dieren, meten van grond-pH en waterverlies (gewicht)
Definitieve tests: meten van vochtgehalte, aanvullen van water en toevoeging 2-10 mg gist
|
|
21
|
Definitieve test met F. fimetaria: beëindigen test, extractie dieren, meten van grond-pH en waterverlies (gewicht)
Bereikbepalingstest met F. candida: beëindigen test, extractie dieren, meten van grond-pH en waterverlies (gewicht)
|
|
28
|
Definitieve test met F. candida: beëindigen test, extractie dieren, meten van grond-pH en waterverlies (gewicht)
|
Aanhangsel 3
Richtsnoeren voor het opfokken en synchroniseren van F. fimetaria en F. candida
De tijden en tijdsduren in deze richtsnoeren moeten worden gecontroleerd voor elke specifieke springstaartstam om ervoor te zorgen dat de timing voldoende gesynchroniseerde juvenielen mogelijk maakt. In principe is de meest geschikte dag om de eieren en de synchrone juvenielen te verzamelen, afhankelijk van wanneer de volwassen dieren, nadat ze zijn overgebracht naar een vers substraat, eitjes gaan leggen en wanneer deze eitjes uitkomen.
Het verdient aanbeveling een permanente stamcultuur aan te houden, bestaande uit bijv. 50 houders/petrischaaltjes. De stamcultuur moet in goed gevoede staat worden gehouden door wekelijks voederen, drenken en verwijdering van oud voedsel en karkassen. Een tekort aan springstaarten op het substraat kan leiden tot inhibitie door meer schimmelgroei. Als de stamcultuur te vaak voor eierproductie wordt gebruikt, kan de cultuur vermoeidheid gaan vertonen. Tekenen van vermoeidheid zijn dode volwassen dieren en schimmel op het substraat. De eitjes die overblijven van de productie van synchrone dieren, kunnen worden gebruikt om de cultuur te verjongen.
In een synchrone cultuur van F. fimetaria onderscheiden de mannetjes zich voornamelijk in grootte van de vrouwtjes. De mannetjes zijn duidelijk kleiner dan vrouwtjes en ze lopen ook sneller. De juiste selectie van de geslachten vereist weinig oefening en kan worden bevestigd door microscopische inspectie van het genitale gebied (13).
1. Opfokken
1.a. Bereiding van het kweeksubstraat
Het kweeksubstraat is pleisterkalk (calciumsulfaat) met actieve koolstof. Dit zorgt voor een vochtig substraat, waarbij het koolstof dient om afvalgassen en uitwerpselen te absorberen (14) (15). Er kunnen verschillende vormen van koolstof worden gebruikt om de waarnemingen van springstaarten mogelijk te maken. Zo wordt bijvoorbeeld koolstofpoeder gebruikt voor F. candida en F. fimetaria (dat zwartgrijs pleisterkalk oplevert):
Substraatbestanddelen:
|
—
|
200 ml gedistilleerd water
|
of
|
—
|
50 g actief koolstofpoeder
|
|
—
|
260-300 ml gedistilleerd water
|
Het substraatmengsel mag stollen voor gebruik.
1.b. Kweken
Springstaarten worden gehouden in houders zoals petrischaaltjes (90 × 13 mm), waarvan de bodem is bedekt met een laag van 0,5 cm pleisterkalk-koolstofsubstraat. Ze worden gekweekt bij 20 ± 1 °C met een licht-donkercyclus van 12-12 uur (400-800 lux). De houders worden voortdurend vochtig gehouden, waarbij erop wordt toegezien dat de relatieve luchtvochtigheid in de houders 100 % is. Dat kan worden gewaarborgd door de aanwezigheid van water in de poreuze kalk, waarbij echter moet worden vermeden dat een waterlaagje op het kalkoppervlak ontstaat. Waterverlies kan worden voorkomen met vochtige lucht in de omgeving. Eventuele dode individuen moeten verwijderd worden, net als beschimmeld voedsel. Om de eierproductie te stimuleren, moeten de volwassen dieren overgebracht worden naar petrischaaltjes met een pas bereid substraat van pleisterkalk en koolstof.
1.c. Voedingsbron
Bakkersgistkorrels worden gebruikt als enige voedselvoorziening voor zowel F. candida als F fimetaria. Om beschimmelen te vermijden, wordt een- of tweemaal per week vers voedsel verstrekt. Dit wordt direct in een klein hoopje op de pleisterkalk geplaatst. De massa van het aangeboden bakkersgist moet worden afgestemd op de omvang van de springstaartpopulatie, maar in de regel is 2-15 mg toereikend.
2. Synchronisatie
Opdat de testdieren een homogene groep zouden vormen wat betreft levensstadium en grootte, moet de test worden uitgevoerd met gesynchroniseerde dieren. De synchronisatie maakt het verder mogelijk om vanaf de leeftijd van 3 weken de mannetje en vrouwtjes van F. fimetaria te onderscheiden op basis van geslachtsdimorfisme, d.w.z. verschillen in grootte. Onderstaande procedure is een suggestie voor de wijze waarop gesynchroniseerde dieren kunnen worden verkregen (de praktische stappen zijn facultatief).
2.a. Synchronisatie
|
—
|
Prepareer houders met een laag van 0,5 cm pleisterkalk-koolstofsubstraat.
|
|
—
|
Verplaats voor de eierleg 150-200 volwassen F. fimetaria en 50-100 F. candida uit de beste 15-20 houders van de stamcultuur met 4-8 weken oud substraat naar de houders en voeder ze met 15 mg bakkersgist. Vermijd het samenbrengen van juvenielen en volwassen dieren omdat de aanwezigheid van juvenielen de eierproductie kan remmen.
|
|
—
|
Bewaar de kweek bij 20 ± 1 °C (gemiddeld 20 °C) en een licht-donkercyclus van 12-12 uur (400-800 lux). Zorg ervoor dat vers voedsel beschikbaar is en dat de lucht is verzadigd met water. Gebrek aan voedsel kan ertoe leiden dat de dieren zich ontlasten op de eieren waardoor er schimmelgroei op de eieren ontstaat of kan tot gevolg hebben dat F. candida de eigen eieren kannibaliseert. Na 10 dagen worden de eieren voorzichtig verzameld met een naald en een spatel en verplaatst naar „eierpapier” (kleine stukjes filterpapier gedoopt in pleisterkalk-koolstoofsmurrie) dat in een houder met vers pleisterkalk-koolstofsubstraat is geplaatst. Er worden een paar korrels gist aan het substraat toegevoegd om de juvenielen aan te trekken en ertoe aan te zetten het eierpapier te verlaten. Het is belangrijk dat het eierpapier en het substraat vochtig zijn, anders drogen de eitjes uit. Als alternatief kunnen de volwassen dieren uit de synchronisatiecultuurbakken worden gehaald nadat ze gedurende 2 of 3 dagen eieren hebben geproduceerd.
|
|
—
|
Na drie dagen zijn de meeste eitjes op het eierpapier uitgekomen. Onder het eierpapier zullen enkele juveniele dieren te vinden zijn.
|
|
—
|
Om juvenielen van gelijke leeftijd te verkrijgen, wordt het eierpapier met niet-uitgekomen eieren met een tang van het petrischaaltje verwijderd. De juvenielen, nu 0-3 dagen oud, blijven in het schaaltje en worden gevoed met bakkersgist. Niet-uitgekomen eieren worden afgevoerd.
|
|
—
|
De eieren en de uitgekomen juvenielen worden gehouden op dezelfde manier als de volwassen dieren. Met name voor F. fimetaria moeten de volgende maatregelen worden genomen: zorgen voor voldoende vers voedsel, oud en beschimmeld voedsel verwijderen, na 1 week de juvenielen verdelen over nieuwe petrischaaltjes mits de dichtheid boven de 200 is.
|
2.b. Behandeling van springstaarten bij aanvang van de test
|
—
|
De 9-12 dagen oude F. candida of de 23-26 dagen oude F. fimetaria worden verzameld, bijv. door suctie, en vrijgelaten in een kleine houder met vochtig pleisterkalk-koolstofsubstraat. Ook wordt hun fysieke toestand gecontroleerd onder de binoculaire microscoop (gewonde en beschadigde dieren worden afgevoerd). Al deze stappen moeten worden uitgevoerd terwijl de springstaarten in vochtige lucht worden gehouden om droogtestress te vermijden, bijvoorbeeld door gebruikmaking van nat gemaakte oppervlakken enz.
|
|
—
|
Draai de houder ondersteboven en klop op de bodem om de springstaarten op de grond te laten vallen. Statische elektriciteit moet worden geneutraliseerd omdat de dieren anders misschien gewoon de lucht invliegen of aan de zijde van de testhouder blijven hangen en uitdrogen. Voor de neutralisatie kan een ionisator of een vochtige doek onder de houder worden gebruikt.
|
|
—
|
Het voedsel moet over heel het grondoppervlak worden verspreid en niet in één klont blijven liggen.
|
|
—
|
Tijdens het transport en gedurende de testperiode moet worden vermeden dat er tegen de testhouders wordt gestoten of dat deze anderszins fysiek verstoord worden, omdat hierdoor de bodemdichtheid kan worden vergroot waardoor de interactie van de springstaarten wordt bemoeilijkt.
|
3. Alternatieve springstaartsoorten
Ook andere springstaartsoorten kunnen worden gekozen voor tests volgens deze testmethode, zoals Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi en Mesaphorura macrochaeta. Er moet vooraf aan een aantal voorwaarden worden voldaan voordat de alternatieve soorten worden gebruikt:
|
—
|
Ze moeten ondubbelzinnig worden geïdentificeerd.
|
|
—
|
De keuze voor de soort moet worden verantwoord.
|
|
—
|
Er moet worden gewaarborgd dat de reproductieve biologie deel uitmaakt van de testfase zodat deze een mogelijk doel is tijdens de blootstelling.
|
|
—
|
De levensgeschiedenis moet bekend zijn: leeftijd bij rijpwording, duur van de eierontwikkeling en het stadium dat wordt onderworpen aan blootstelling.
|
|
—
|
Optimale voorwaarden voor groei en reproductie moeten worden verschaft door het testsubstraat en de voeding.
|
|
—
|
De variatie moet klein genoeg zijn om een exacte en correcte schatting van de toxiciteit te maken.
|
Aanhangsel 4
Dieren extraheren en tellen
1. Er kunnen twee extractiemethoden worden toegepast.
|
1.a.
|
Eerste methode: er kan een extractor met geregelde temperatuurgradiënt op basis van de principes van MacFadyen worden gebruikt (1). De warmte komt van een verwarmingselement boven op de extractiebox (en wordt geregeld met een thermoweerstand die op het oppervlak van het grondmonster is geplaatst). De temperatuur in de gekoelde vloeistof die de verzamelbak omringt, wordt geregeld met een thermoweerstand die op het oppervlak van de verzamelbox is geplaatst (onder de kern van de grond). De thermoweerstanden zijn verbonden met een programmeerbare besturingseenheid die de temperatuur verhoogt volgens een voorgeprogrammeerd schema. De dieren worden verzameld in een gekoelde verzamelbox (2 °C) met op de bodem een laag pleisterkalk-koolstof. Het extraheren begint bij 25 °C en de temperatuur wordt om de 12 uur met 5 °C verhoogd. De extractie duurt in totaal 48 uur. Na 12 uur bij 40 °C is de extractie voltooid.
|
|
1.b.
|
Tweede methode: na de experimentele incubatieperiode wordt het aantal aanwezige juveniele springstaarten bepaald door flotatie. Met dat doel wordt de test uitgevoerd in de potjes van ongeveer 250 ml inhoud. Aan het eind van de test wordt circa 200 ml gedistilleerd water toegevoegd. De grond wordt voorzichtig geroerd met een fijn penseel om de springstaarten op het wateroppervlak te laten drijven. Er mag een kleine hoeveelheid, ca. 0,5 ml, zwarte Kentmere-foto-inkt toegevoegd worden aan het water om het tellen te vergemakkelijken door het contrast tussen het water en de witte springstaarten te vergroten. Deze kleurstof is niet giftig voor springstaarten.
|
2. Tellen:
De aantallen kunnen geteld worden met het blote oog of onder een lichtmicroscoop waarbij een raster over het drijfschaaltje geplaatst wordt of door het oppervlak van ieder schaaltje te fotograferen en later de springstaarten te tellen op vergrote afdrukken of geprojecteerde slides. Tellingen kunnen ook worden uitgevoerd met behulp van digitale beeldverwerkingstechnieken (12). Alle methoden moeten worden gevalideerd.
Aanhangsel 5
Bepaling van het maximale WHC van de grond
De volgende methode voor het bepalen van het maximale waterhoudende vermogen (WHC) van de grond is geschikt bevonden. Deze wordt beschreven in bijlage C van ISO DIS 11268-2 (Soil Quality — Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction).
Verzamel een gedefinieerde hoeveelheid (bijv. 5 g) van het testgrondsubstraat met behulp van een geschikt instrument voor monsterneming (vijzelbuisje o.i.d.). Bedek de bodem van het buisje met een nat stuk filterpapier en plaats het vervolgens op een rek in een waterbad. Het buisje moet geleidelijk worden ondergedompeld totdat het waterpeil boven het grondoppervlak is gestegen. Daarna moet het gedurende ongeveer drie uur in het water worden gelaten. Omdat niet al het door de grondaderen geabsorbeerde water kan worden vastgehouden, moet het grondmonster gedurende twee uur kunnen uitdruipen en op een bed van zeer nat, fijn gemalen kwartszand in een afgedekt potje (ter voorkoming van uitdrogen) worden geplaatst. Het monster moet vervolgens worden gewogen en gedroogd tot een constante massa bij 105 °C. Het waterhoudende vermogen (WHC) moet als volgt worden berekend:

Waarbij:
|
S
|
=
|
waterverzadigd substraat + massa buisje + massa filterpapier
|
|
T
|
=
|
tarra (massa buisje + massa filterpapier)
|
|
D
|
=
|
droge substraatmassa
|
Aanhangsel 6
Bepaling van de pH van de grond
De volgende methode voor het bepalen van de pH-waarde van de grond is gebaseerd op de beschrijving in ISO DIS 10390: Soil Quality — Determination of pH.
Een gedefinieerde hoeveelheid grond wordt gedurende ten minste 12 uur gedroogd bij kamertemperatuur. Vervolgens wordt een suspensie van de grond (die minimaal 5 g grond bevat) gemaakt in een vijfmaal zo groot volume van hetzij een 1 M oplossing kaliumchloride (KCl) pro analysi, hetzij een 0,01 M oplossing calciumchloride (CaCl2) pro analysi. De suspensie wordt daarna gedurende 5 minuten grondig geschud en vervolgens met rust gelaten gedurende ten minste 2 uur maar niet langer dan 24 uur. De pH van de vloeibare fase wordt dan gemeten met een pH-meter die voor elke meting is gekalibreerd met een geschikte reeks bufferoplossingen (bijv. pH 4,0 en 7,0).
C.40. LEVENSLANGE TOXICITEITSTEST OP CHIRONOMIDEN IN SEDIMENT-WATERSYSTEMEN MET BEHULP VAN VERRIJKT WATER OF VERRIJKT SEDIMENT
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan testrichtsnoer (TG) 233 (2010) van de OESO. Ze is opgezet om de effecten vast te stellen van levenslange blootstelling aan chemische stoffen op de zoetwatermug Chironomus sp., en bestrijkt de volledige eerste generatie (P-generatie) en het vroege deel van de tweede generatie (F1-generatie). De methode is een uitbreiding op de bestaande testmethoden C.28 (1) en C.27 (15), die respectievelijk gebruikmaken van een blootstellingsscenario met verrijkt water en een blootstellingsscenario met verrijkt sediment. Voor deze methode zijn bestaande toxiciteitstestprotocollen voor Chironomus riparius en Chironomus dilutus (voorheen C. tentans genaamd (2)) in aanmerking genomen, die zijn ontwikkeld in Europa en Noord-Amerika (3) (4) (5) (6) (7) (8) (9) en later ringtests hebben ondergaan (1) (7) (10) (11) (12). Er kunnen ook andere goed gedocumenteerde chironomiden worden gebruikt, bijvoorbeeld Chironomus yoshimatsui (13)(14). De volledige blootstellingsduur bedraagt ca. 44 dagen voor C. riparius en C. yoshimatsui en ca. 100 dagen voor C. dilutus.
|
|
2.
|
Zowel het blootstellingsscenario met water als dat met sediment wordt in deze testmethode beschreven. Welk blootstellingsscenario geschikt is, hangt af van het doel van de test. Het waterblootstellingsscenario, waarbij de waterkolom wordt verrijkt, is bedoeld om een gebeurtenis na te bootsen waarbij een gespoten bestrijdingsmiddel overwaait; het scenario heeft betrekking op de initiële concentratiepiek in het oppervlaktewater. Waterverrijking is ook bruikbaar voor andersoortige blootstelling (waaronder weglekkende chemische stoffen), maar niet voor accumulatieprocessen in het sediment die langer duren dan de testperiode. In dat geval, en ook wanneer afvloeiing de voornaamste route is waarlangs bestrijdingsmiddelen in waterlichamen terechtkomen, kan een testopzet met verrijkt sediment geschikter zijn. Als andere blootstellingsscenario's van belang zijn, kan de testopzet eenvoudig worden aangepast. Als bijvoorbeeld de verdeling van de teststof tussen de waterfase en de sedimentlaag niet van belang is en adsorptie aan het sediment moet worden geminimaliseerd, kan het gebruik van een vervangend kunstmatig sediment (bijv. kwartszand) worden overwogen.
|
|
3.
|
Stoffen die moeten worden getest op in het sediment levende organismen, kunnen gedurende langere tijd in het sediment aanwezig blijven. In het sediment levende organismen kunnen via een aantal routes worden blootgesteld. Het relatieve belang van elke blootstellingsroute en de tijd die elke route nodig heeft om bij te dragen aan het algehele toxische effect, hangen af van de fysisch-chemische eigenschappen van de stof. Voor sterk adsorberende stoffen of voor stoffen die een covalente binding met het sediment aangaan, kan ingestie van besmet voedsel een belangrijke blootstellingsroute zijn. Om de toxiciteit van zeer lipofiele stoffen niet te onderschatten, kan worden overwogen vóór aanbrenging van de teststof voedsel aan het sediment toe te voegen (zie punt 31). Het is derhalve mogelijk om alle blootstellingsroutes en alle levensstadia in de test op te nemen.
|
|
4.
|
Gemeten eindpunten zijn het totale aantal volwassen muggen dat zich heeft ontwikkeld (zowel eerste als tweede generatie), het ontwikkelingstempo (zowel eerste als tweede generatie), de geslachtsverhouding van volledig ontwikkelde en levende volwassen muggen (zowel eerste als tweede generatie), het aantal eiersnoeren per vrouwtje (alleen eerste generatie) en de fertiliteit van de eiersnoeren (alleen eerste generatie).
|
|
5.
|
Het gebruik van kunstmatig sediment wordt ten sterkste aanbevolen. Kunstmatig sediment heeft verschillende voordelen ten opzichte van natuurlijke sedimenten:
|
—
|
de experimentele variabiliteit wordt beperkt omdat het een reproduceerbare 'genormaliseerde matrix' vormt en er niet gezocht hoeft te worden naar niet-besmet schoon sediment;
|
|
—
|
het testsediment kent geen seizoensveranderingen en op ieder moment kunnen tests worden gestart; het sediment hoeft niet te worden voorbehandeld om inheemse fauna te verwijderen;
|
|
—
|
de kosten zijn lager dan voor de in het veld verzamelde hoeveelheden die toereikend zijn voor dagelijks testen;
|
|
—
|
kunstmatig sediment maakt toxiciteitsvergelijkingen tussen verschillende onderzoeken en het dienovereenkomstig rangschikken van stoffen mogelijk (3).
|
|
|
6.
|
De gebruikte definities zijn opgenomen in aanhangsel 1.
|
PRINCIPE VAN DE TEST
|
7.
|
Larven in het eerste stadium van chironomiden worden in een sediment-watersysteem aan een concentratiebereik van de teststof blootgesteld. De test begint met het plaatsen van larven in het eerste stadium (eerste generatie) in testbekers die verrijkt sediment bevatten. De teststof kan ook aan het water worden toegevoegd na het inbrengen van de larven. De ontwikkeling van de chironomiden, de ontwikkelingstijd en de geslachtsverhouding van de volledig ontwikkelde en levende muggen worden vastgesteld. Ontwikkelde volwassen muggen worden overgebracht naar kweekkooien om te bevorderen dat ze gaan zwermen, paren en eieren leggen. Het aantal geproduceerde eiersnoeren en de fertiliteit ervan worden vastgesteld. Van deze eiersnoeren worden larven in het eerste stadium van de tweede generatie verkregen. Deze larven worden in vers geprepareerde testbekers geplaatst (verrijkingsprocedure als voor de eerste generatie) om de levensvatbaarheid van de tweede generatie te bepalen door vaststelling van hun ontwikkeling, de ontwikkelingstijd en de geslachtsverhouding van de volledig ontwikkelde en levende muggen (een schematische weergave van de levenscyclustest wordt gepresenteerd in aanhangsel 5). Alle gegevens worden geanalyseerd, hetzij met een regressiemodel waarmee de concentratie wordt geschat die X % verlaging op het desbetreffende eindpunt zou veroorzaken, hetzij door toetsing van een hypothese om een concentratie zonder waargenomen effect (No Observed Effect Concentration of NOEC) te bepalen. In het laatste geval worden de testresponsen door middel van statistische toetsen met de geschikte controleresponsen vergeleken. Hierbij moet worden opgemerkt dat in het scenario met verrijkt water bij snel afbrekende stoffen de latere levensstadia van elke generatie (bijv. de popfase) kunnen worden blootgesteld aan een aanmerkelijk lager concentratieniveau in het bovenliggende water dan de larven in het eerste stadium. Als dit een probleem is omdat voor elk levensstadium een vergelijkbaar blootstellingsniveau nodig is, kunnen de volgende aanpassingen van de testmethode worden overwogen:
|
—
|
parallelle uitvoering met verrijking in verschillende levensstadia, of
|
|
—
|
herhaalde verrijking (of verversing van het bovenliggende water) van het testsysteem in beide testfasen (eerste en tweede generatie), waarbij de tijd tussen de verrijkingen (verversingen) moet worden afgestemd op de lotskenmerken van de teststof.
|
Dergelijke aanpassingen zijn alleen haalbaar in het scenario met verrijkt water, niet in het scenario met verrijkt sediment.
|
INFORMATIE OVER DE TESTSTOF
|
8.
|
De oplosbaarheid in water van de teststof, de dampspanning en log K
ow ervan, de gemeten of berekende verdeling in sediment en de stabiliteit in water en sediment moeten bekend zijn. Er moet een betrouwbare analysemethode, met een bekende en gerapporteerde nauwkeurigheid en detectiegrens, beschikbaar zijn voor de kwantitatieve bepaling van de teststof in bovenliggend water, poriewater en sediment. Andere nuttige informatie zijn de structuurformule en de zuiverheid van de teststof. Het uiteindelijke chemische lot van de teststof (bijv. dissipatie, niet-biologische en biologische afbraak enz.) is eveneens nuttige informatie. Nadere richtsnoeren voor het testen van stoffen met zodanige fysisch-chemische eigenschappen dat de uitvoering van de test problematisch is, zijn in (16) opgenomen.
|
REFERENTIESTOFFEN
|
9.
|
Er kunnen regelmatig tests met referentiestoffen worden uitgevoerd om te waarborgen dat de gevoeligheid van de laboratoriumpopulatie niet is veranderd. Net als bij daphnia zou het voldoende zijn om een 48-uurs test op acute toxiciteit (volgens 17) uit te voeren. Zolang er echter geen gevalideerde richtsnoeren voor een acute toxiciteitstest beschikbaar zijn, kan een chronische toxiciteitstest overeenkomstig hoofdstuk C.28 van deze bijlage worden overwogen. Voorbeelden van met succes in ringtests en validatiestudies toegepaste giftige referentiestoffen zijn lindaan, trifluralin, pentachloorfenol, cadmiumchloride en kaliumchloride (1) (3) (6) (7) (18).
|
GELDIGHEID VAN DE TEST
|
10.
|
De test is alleen geldig als aan de onderstaande voorwaarden is voldaan:
|
—
|
de gemiddelde ontwikkeling in de controlegroep moet aan het eind van de blootstellingstermijn ten minste 70 % zijn voor beide generaties (1) (7);
|
|
—
|
voor C. riparius en C. yoshimatsui moet 85 % van het totale aantal ontwikkelde volwassen muggen uit de controlegroep van beide generaties aangetroffen worden tussen 12 en 23 dagen na introductie van de larven in het eerste stadium in de bekers; voor C. dilutus is een periode van 20 tot 65 dagen aanvaardbaar;
|
|
—
|
de gemiddelde geslachtsverhouding van volledig ontwikkelde en levende volwassen muggen (mannetjes vs. vrouwtjes) moet in de controlegroep van beide generaties minimaal 0,4 en maximaal 0,6 zijn;
|
|
—
|
voor elke kweekkooi moet het aantal eiersnoeren in de controlegroepen van de eerste generatie ten minste 0,6 per in de kweekkooi geïntroduceerd vrouwtje bedragen;
|
|
—
|
het aandeel vruchtbare eiersnoeren per kweekkooi van de controlegroepen van de eerste generatie moet minimaal 0,6 zijn;
|
|
—
|
aan het eind van de blootstellingstermijn voor beide generaties worden de pH en het gehalte aan opgeloste zuurstof in elke beker gemeten. Het zuurstofgehalte moet ten minste 60 % bedragen van de verzadigingswaarde van lucht (ASV (24)) en het bovenliggende water moet in alle testbekers een pH-waarde tussen 6 en 9 hebben;
|
|
—
|
de watertemperatuur mag niet meer dan ± 1,0 °C verschillen.
|
|
BESCHRIJVING VAN DE METHODE
Monsterpotjes en kweekkooien
|
11.
|
De larven worden aan de teststof blootgesteld in glasbekers van 600 ml met een diameter van circa 8,5 cm (zie aanhangsel 5). Ook andere houders kunnen geschikt zijn, mits zij voldoende diep zijn voor het bovenliggende water en het sediment. Het sedimentoppervlak moet ten minste 2 tot 3 cm2 per larve bedragen. De verhouding tussen de dikte van de sedimentlaag en de diepte van het bovenliggende water moet circa 1:4 zijn. Er moeten kweekkooien (van minimaal 30 cm in alle drie dimensies) worden gebruikt met gaas (maaswijdte circa 1 mm) aan de bovenkant en minimaal één zijkant van de kooi (zie aanhangsel 5). In elke kooi wordt een kristalliseerschaal van 2 l met testwater en sediment geplaatst voor de eitjes. Ook bij de kristalliseerschaal moet de verhouding tussen de dikte van de sedimentlaag en de diepte van het bovenliggende water circa 1:4 zijn. Nadat de eiersnoeren zijn verzameld van de kristalliseerschaal, worden ze in een microtiterplaat met 12 gaten geplaatst (één snoer per gat dat ten minste 2,5 ml water uit de verrijkte kristalliseerschaal bevat), waarna de plaat wordt afgedekt met een deksel om verdamping te voorkomen. Er kunnen ook andere geschikte houders voor het bewaren van de eiersnoeren worden gebruikt. Uitgezonderd de microtiterplaten moeten alle testbekers en andere apparaten die in contact komen met het testsysteem, volledig gemaakt zijn van glas of een ander chemisch inert materiaal (bijv. polytetrafluorethyleen).
|
Keuze van de soorten
|
12.
|
Als testsoort heeft Chironomus riparius de voorkeur. C. yoshimatsui mag ook worden gebruikt. C. dilutus is ook geschikt maar is lastiger in het gebruik en vergt een langere testperiode. Aanhangsel 2 bevat bijzonderheden over de kweekmethoden van C. riparius. Er is ook informatie beschikbaar over de kweekomstandigheden van andere soorten, namelijk C. dilutus (5) en C. yoshimatsui (14). Vóór de test moet de identificatie van de soorten worden bevestigd; als de organismen uit eigen kweek afkomstig zijn, is geen bevestiging voorafgaand aan iedere test nodig.
|
Sediment
|
13.
|
Er wordt bij voorkeur kunstmatig sediment gebruikt (ook wel bereid, gereconstitueerd of synthetisch sediment genoemd). Als echter natuurlijk sediment wordt gebruikt, moet dit worden gekarakteriseerd (ten minste pH en gehalte aan organische koolstof; bepaling van parameters als C/N-verhouding en korrelgrootteverdeling worden eveneens aanbevolen) en moet het vrij zijn van verontreinigingen en andere organismen die de larven van chironomiden zouden kunnen beconcurreren of opeten. Het verdient ook aanbeveling sedimenten voorafgaand aan de test zeven dagen onder testomstandigheden te conditioneren. Het volgende kunstmatige sediment, beschreven in (1), wordt aanbevolen (1) (20) (21):
|
a.
|
4-5 % (drooggewicht) turf: zo dicht mogelijk bij pH-waarde 5,5 tot 6,0. Het is belangrijk uitsluitend fijngemalen turf in poedervorm te gebruiken (partikelgrootte ≤ 1 mm) die uitsluitend aan de lucht gedroogd is;
|
|
b.
|
20 % (drooggewicht) kaolienklei (met bij voorkeur meer dan 30 % kaoliniet);
|
|
c.
|
75-76 % (drooggewicht) kwartszand (fijn zand moet overheersen; meer dan 50 procent van de partikels moet tussen de 50 en 200 μm groot zijn);
|
|
d.
|
gedeïoniseerd water wordt toegevoegd om het vochtgehalte van het definitieve mengsel op 30-50 % te brengen;
|
|
e.
|
Chemisch zuiver calciumcarbonaat (CaCO3) wordt toegevoegd om de pH-waarde van het definitieve mengsel van het sediment op 7,0 ± 0,5 te brengen;
|
|
f.
|
Het gehalte aan organische koolstof van het definitieve mengsel moet 2 % (± 0,5 %) bedragen. Dit kan worden gecorrigeerd met de juiste hoeveelheden turf en zand, overeenkomstig (a) en (c).
|
|
|
14.
|
De bron van de turf, de kaolienklei en het zand moet bekend zijn. De bestanddelen van het sediment moeten worden gecontroleerd op verontreiniging met chemische stoffen (bijv. zware metalen, organische chloor- en fosforverbindingen). In aanhangsel 3 wordt een voorbeeld gegeven van de bereiding van kunstmatig sediment. Menging van droge bestanddelen is ook aanvaardbaar, mits wordt aangetoond dat na toevoeging van het bovenliggende water geen scheiding van de bestanddelen van het sediment plaatsvindt (bijv. door drijvende turfdeeltjes) en dat de turf of het sediment voldoende geconditioneerd is.
|
Water
|
15.
|
Elk water dat aan de in de aanhangsels 2 en 4 vermelde chemische eigenschappen van aanvaardbaar verdunningswater voldoet, is geschikt als testwater. Als kweek- en testwater is elk geschikt water, natuurlijk water (oppervlakte- of grondwater), synthetisch water (zie aanhangsel 2) of ontchloord kraanwater aanvaardbaar, mits de chironomiden daarin gedurende het kweken en testen overleven zonder tekenen van stress te vertonen. Aan het begin van de test moet het testwater een pH-waarde tussen 6 en 9 hebben en mag de totale hardheid, uitgedrukt als CaCO3, niet hoger zijn dan 400 mg/l. Als er echter een wisselwerking vermoed wordt tussen de hardheidsionen en de geteste chemische stof, verdient zachter water de voorkeur (Elendt Medium M4 is bijgevolg niet geschikt in deze situatie). Voor de gehele studie moet één soort water worden gebruikt. De in aanhangsel 4 vermelde kwaliteitskenmerken voor water moeten ten minste twee keer per jaar worden gemeten, of wanneer vermoed wordt dat er een significante verandering heeft plaatsgevonden.
|
Stamoplossingen — verrijkt water
|
16. a.
|
De testconcentraties worden berekend op basis van de concentraties in de waterkolom, d.w.z. het boven het sediment liggende water. Testoplossingen van de gekozen concentraties worden gewoonlijk bereid door verdunning van een stamoplossing. De stamoplossingen worden bij voorkeur bereid door oplossing van de teststof in het testwater. Het gebruik van oplosmiddelen of dispergeermiddelen kan in bepaalde gevallen nodig zijn om een stamoplossing van een passende concentratie te verkrijgen. Voorbeelden van geschikte oplosmiddelen zijn aceton, ethyleenglycolmonoëthylether, ethyleenglycoldimethylether, dimethylformamide en triëthyleenglycol. Als dispergeermiddelen mogen Cremophor RH40, Tween 80, 0,01 % methylcellulose en HCO-40 worden gebruikt. De concentratie oplosmiddel in de laatste testfase moet minimaal (bijv. ≤ 0,1 ml/l) zijn en moet hetzelfde zijn voor alle behandelingen. Wanneer een solubilisator wordt gebruikt, mag deze geen significante effecten hebben op het overleven. Dit moet blijken uit een controle met oplosmiddel in vergelijking met een negatieve (water)controle. Het gebruik van deze stoffen moet echter zo veel mogelijk worden vermeden.
|
Stamoplossingen — verrijkt sediment
|
16. b.
|
Verrijkte sedimenten worden gewoonlijk in de gekozen concentratie bereid door rechtstreeks een oplossing van de teststof aan het sediment toe te voegen. Een stamoplossing van de in gedeïoniseerd water opgeloste teststof wordt met het kunstmatige sediment gemengd met behulp van een wals of een voedermixer of door handmatig mengen. Indien de teststof slecht in water oplosbaar is, kan deze worden opgelost in een zo klein mogelijk volume van een geschikt organisch oplosmiddel (bijv. hexaan, aceton of chloroform). Deze oplossing wordt vervolgens gemengd met 10 g fijn kwartszand per testbeker. Het oplosmiddel mag verdampen en dient volledig uit het zand te worden verwijderd. Vervolgens wordt het zand gemengd met een geschikte hoeveelheid sediment. Voor het oplossen, dispergeren of emulgeren van de teststof mogen alleen gemakkelijk verdampende oplosmiddelen worden gebruikt. Bij de bereiding van het sediment moet rekening worden gehouden met het zand dat in het mengsel van teststof en zand aanwezig is (het sediment wordt dus met minder zand bereid). De aan het sediment toegevoegde teststof moet zorgvuldig en gelijkmatig over het sediment worden verdeeld. Zo nodig kunnen deelmonsters worden geanalyseerd om de homogeniteit te bepalen.
|
TESTOPZET
|
17.
|
De testopzet heeft betrekking op het aantal testconcentraties en het interval ertussen, het aantal vaten per concentratieniveau, het aantal larven per vat, het aantal kristalliseerschalen en kweekkooien. Opzetten voor ECx, NOEC en een limiettest worden hieronder beschreven.
|
Opzet voor regressieanalyse
|
18.
|
De effectconcentratie (ECx) en het concentratiebereik waarbinnen het effect van de teststof van belang is, moeten begrepen zijn onder de test, zodanig dat het eindpunt niet buiten de grenzen van de gegenereerde gegevens wordt geëxtrapoleerd. Extrapolaties ver onder de laagste of boven de hoogste concentraties moeten worden vermeden. Een voorafgaande test om het meetgebied vast te stellen volgens testmethoden C.27 of C.28 kan nuttig zijn voor het selecteren van een geschikt bereik van testconcentraties.
|
|
19.
|
Voor een ECx-benadering zijn minstens vijf concentraties en acht duplo's voor elke concentratie vereist. Voor elke concentratie moeten twee kweekkooien (A en B) worden gebruikt. De acht duplo's worden verdeeld in twee groepen van vier duplo's voor elke kweekkooi. Deze samenvoeging van duplo's is noodzakelijk vanwege het aantal muggen dat nodig is voor deugdelijke beoordelingen van de voortplanting. De tweede generatie heeft echter weer acht duplo's, die geïnitieerd worden vanuit de blootgestelde populaties in de kweekkooien. Het verschil tussen de concentraties mag niet meer dan factor 2 bedragen (als de dosis-responscurve een geringe helling vertoont, kan hiervan worden afgeweken). Het aantal duplo's voor elke testgroep kan worden verlaagd naar zes (drie voor elke kweekkooi) wanneer het aantal testconcentraties met een verschillende respons wordt verhoogd. Als het aantal duplo's wordt verhoogd of de intervallen tussen de testconcentraties worden verkleind, worden de betrouwbaarheidsintervallen rond de ECX gewoonlijk kleiner.
|
Opzet voor de schatting van een NOEC
|
20.
|
Voor een NOEC-benadering moeten vijf testconcentraties met ten minste acht duplo's (4 voor elke kweekkooi A en B) worden gebruikt en mag het verschil tussen de concentraties niet meer dan factor 2 bedragen. Het aantal duplo's moet toereikend zijn om voldoende onderscheidend vermogen te waarborgen om een verschil van 20 % met de controlegroep te kunnen vaststellen bij een significantieniveau van 5 % (α = 0,05). Voor het ontwikkelingstempo, de fecunditeit en vruchtbaarheid is doorgaans een variantieanalyse (ANOVA) geschikt, gevolgd door de Dunnett-toets of Williams-toets (22-25). Voor het uitkomstquotiënt en de geslachtsverhouding kan de toets van Cochran-Armitage, de exacte toets van Fisher (met correctie van Bonferroni) of de toets van Mantel-Haenszel geschikt zijn.
|
Limiettest
|
21.
|
Als in de facultatieve voorafgaande test om het meetgebied vast te stellen geen effecten worden waargenomen, kan een limiettest worden uitgevoerd (één testconcentratie en controlegroep(en)). De limiettest dient om aanwijzingen te verzamelen dat de toxische effecten van de teststof groter zijn dan de geteste limietconcentratie. Voor water wordt 100 mg/l aanbevolen en voor sediment 1 000 mg/kg (drooggewicht). Gewoonlijk zijn ten minste acht duplo's voor zowel de testgroep als de controlegroep nodig. Aangetoond moet worden dat het onderscheidend vermogen groot genoeg is om een verschil van 20 % met de controlegroep te kunnen vaststellen bij een significantieniveau van 5 % (α = 0,05). Voor de meetresponsen (bijv. ontwikkelingstempo) is de T-toets een geschikte statistische methode, indien de gegevens aan de voorwaarden van deze test voldoen (normale verdeling, homogene variantie). Als niet aan die voorwaarden wordt voldaan, kan een T-toets voor ongelijke variantie of een niet-parametrische toets, zoals de Wilcoxon-Mann-Whitney-toets, worden gebruikt. Voor het uitkomstquotiënt is de exacte toets van Fisher geschikt.
|
PROCEDURE
Blootstellingsomstandigheden
Bereiding van het water-sedimentsysteem (verrijking [„spiking”] van water)
|
22. a.
|
Kunstmatig sediment (zie punten 13-14 en aanhangsel 3) wordt aan elke testvat en elke kristalliseerschaal toegevoegd om een laag te vormen van ten minste 1,5 cm (voor de kristalliseerschaal kan dit wat lager zijn), maar maximaal 3 cm. Water (zie punt 15) wordt toegevoegd zodat de verhouding van de diepte van de sedimentlaag en de diepte van het water niet groter is dan 1:4. Na de bereiding van de testvaten moet het sediment-watersysteem ongeveer zeven dagen voorzichtig belucht worden alvorens de larven in het eerste stadium van de eerste of tweede generatie toe te voegen (zie punt 14 en aanhangsel 3). Het sediment-watersysteem van de kristalliseerschalen wordt tijdens de test niet belucht, aangezien hierop geen larven hoeven te overleven (vóór het uitkomen worden de eistrengen al verzameld). Om te voorkomen dat tijdens de toevoeging van testwater aan de waterkolom bestanddelen zich van het sediment afscheiden en fijn materiaal in resuspensie wordt gebracht, kan het sediment tijdens het gieten worden afgedekt met een kunststof schijf. De schijf wordt onmiddellijk daarna verwijderd. Ook andere middelen kunnen geschikt zijn.
|
Bereiding van het water-sedimentsysteem (verrijkt sediment)
|
22. b.
|
De verrijkte sedimenten die volgens punt 16b bereid zijn, worden in de vaten en kristalliseerschaal geplaatst en er wordt bovenstaand water toegevoegd om een volumeverhouding tussen sediment en water van 1:4 te bereiken. De diepte van de sedimentlaag moet in het bereik van 1,5 tot 3 cm liggen (voor de kristalliseerschaal mag dit wat lager zijn). Om te voorkomen dat tijdens de toevoeging van testwater aan de waterkolom bestanddelen zich van het sediment afscheiden en fijn materiaal in resuspensie wordt gebracht, kan het sediment tijdens het gieten worden afgedekt met een kunststof schijf, die onmiddellijk daarna wordt verwijderd. Ook andere middelen kunnen geschikt zijn. Nadat het verrijkte sediment met bovenstaand water is voorbereid, is het wenselijk een verdeling van de teststof te doen plaatsvinden vanuit het sediment naar de waterfase (4) (5) (7) (18). Dit moet bij voorkeur gebeuren onder de in de test heersende temperatuur- en beluchtingsomstandigheden. De tijd die nodig is voor equilibratie hangt af van het sediment en de stof en kan variëren van enkele uren tot verscheidene dagen en soms vijf weken. Aangezien veel stoffen ondertussen zouden kunnen afbreken, wordt niet gewacht tot een evenwicht is ontstaan, maar wordt een equilibratieperiode van 48 uur aanbevolen. Wanneer bekend is dat de afbraakhalfwaardetijd van de stof in sediment lang is (zie punt 8), kan de equilibratietijd verlengd worden. Aan het eind van deze extra equilibratieperiode wordt in het bovenstaande water, het poriënwater en het sediment, bij ten minste de hoogste en een lagere concentratie, de concentratie van de teststof gemeten (zie punt 38). Door deze analysen van de teststof kan de massabalans worden berekend en kunnen de resultaten op basis van gemeten concentraties worden weergegeven.
|
|
23.
|
De testvaten worden (bijvoorbeeld met glasplaten) afgedekt. Om verdampingsverliezen te compenseren, kan het waterniveau tijdens de studie worden aangevuld tot het oorspronkelijke volume. Om zoutophoping te voorkomen, moet hiervoor gedestilleerd of gedeïoniseerd water worden gebruikt. Kristalliseerschalen in de kweekkooien worden niet afgedekt en kunnen, maar hoeven niet bijgevuld worden om te compenseren voor waterverlies tijdens de testperiode, omdat de eistrengen maar één dag in contact zijn met het water en de schalen alleen in een korte fase van de test worden gebruikt.
|
Toevoeging van testorganismen
|
24.
|
Vier tot vijf dagen voordat de larven in het eerste stadium voor de eerste generatie in de testvaten worden ingebracht, worden eipakketten uit de kweek genomen en in kleine vaten in een kweekmedium geplaatst. Er kan ouder medium uit de stamcultuur of vers bereid medium worden gebruikt. In ieder geval wordt aan het kweekmedium een kleine hoeveelheid voedsel, zoals enkele druppels filtraat uit een fijngemalen suspensie van vissenvoervlokken, toegevoegd (zie aanhangsel 2). Er worden alleen vers afgezette eipakketten gebruikt. Normaliter komen de larven enkele dagen nadat de eieren gelegd zijn uit (2 tot 3 dagen voor C. riparius bij 20 °C en 1 tot 4 dagen voor C. dilutus bij 23 °C en C. yoshimatsui bij 25 °C) en vindt de groei van de larven in vier stadia van elk 4-8 dagen plaats. Voor de test worden larven in het eerste stadium (maximaal 48 uur na uitkomen) gebruikt. Het stadium van de larven kan mogelijk worden gecontroleerd aan de hand van de breedte van het epicranium (7).
|
|
25.
|
Twintig larven in het eerste stadium voor de eerste generatie worden met een stompe pipet willekeurig verdeeld over elke testvat die het sediment-watersysteem bevat. Tijdens het inbrengen van de larven in de testvaten en de eerste 24 uur daarna wordt de beluchting van het water uitgezet (zie punt 32). Volgens de gebruikte testopzet (zie punten 19 en 20) is het aantal gebruikte larven per concentratie ten minste 120 (6 duplo's per concentratie) voor de ECX-benadering en 160 voor de NOEC-benadering (8 duplo's per concentratie). In de opzet met verrijkt sediment begint de blootstelling met het inbrengen van de larven.
|
Verrijken van het bovenstaande water
|
26.
|
Vierentwintig uur na het inbrengen van de larven in het eerste stadium voor de eerste generatie wordt de teststof aan de bovenstaande waterkolom toegevoegd en wordt er weer voorzichtig belucht (zie punt 7 voor mogelijke wijzigingen van de testopzet). Onder het wateroppervlak worden met een pipet kleine hoeveelheden van de stamoplossing van de teststof ingebracht. Vervolgens wordt het bovenstaande water voorzichtig gemengd, zonder het sediment te verstoren. In de opzet met verrijkt water begint de blootstelling met het verrijken van het water (d.w.z. één dag na inbrengen van de larven).
|
Verzamelen van uitgekomen volwassen muggen
|
27.
|
Uitgekomen muggen van de eerste generatie worden ten minste één keer, maar bij voorkeur twee keer per dag verzameld (zie punt 36) uit de testvaten met behulp van een zuigapparaat of soortgelijk hulpmiddel (zie aanhangsel 5). Dit dient voorzichtig te gebeuren om de volwassen muggen niet te beschadigen. De verzamelde muggen uit vier testvaten binnen één behandeling worden vrijgelaten in een kweekkooi waaraan zij eerder werden toegewezen. Op de dag van het eerste uitkomen (van mannetjes) worden de kristalliseerschalen verrijkt door een klein volume van de stamoplossing van de teststof onder het wateroppervlak te pipetteren (opzet met verrijkt water). Vervolgens wordt het bovenstaande water voorzichtig gemengd, zonder het sediment te verstoren. De nominale teststofconcentratie in de kristalliseerschaal is dezelfde als in de testvaten die aan de betreffende kweekkooi zijn toegewezen. Voor de opzet met verrijkt sediment worden de kristalliseerschalen rond dag 11 na het begin van de blootstelling (d.w.z. het inbrengen van de eerste generatie larven) voorbereid, zodat ze ongeveer 48 uur kunnen equilibreren voordat de eerste eistrengen worden geproduceerd.
|
|
28.
|
Eistrengen worden met behulp van een pincet of een stompe pipet uit de kristalliseerschaal in de kweekkooi verzameld. Elke eistreng wordt geplaatst in een vat met kweekmedium uit de kristalliseerschaal waaruit hij verzameld was (bijv. een well van een 12-wells-microtiterplaat, samen met ten minste 2,5 ml medium). De vaten met de eistrengen worden met een deksel afgedekt om aanzienlijke verdamping te voorkomen. Eistrengen worden gedurende ten minste zes dagen nadat ze gelegd zijn ter observatie bewaard zodat ze als vruchtbaar of onvruchtbaar kunnen worden ingedeeld.
Voor het beginnen van de tweede generatie worden ten minste drie, maar bij voorkeur zes vruchtbare eistrengen uit elke kweekkooi geselecteerd en laat men ze met wat voedsel uitkomen. Deze eistrengen moeten geproduceerd zijn in de piek van het eitjes leggen, die in de controles normaliter rond testdag 19 ligt. In het ideale geval wordt op dezelfde dag begonnen met de tweede generatie van alle bewerkingen, maar dit is vanwege effecten van de stof op de ontwikkeling van de larven wellicht niet altijd mogelijk. In zo'n geval is het mogelijk om met de hogere concentraties later te beginnen dan met de lagere bewerkingen en de (oplosmiddel)controle.
|
|
29. a.
|
In de opzet met verrijkt water wordt het sediment-watersysteem voor de tweede generatie bereid door de teststof ca. 1 uur vóór het in de testvaten inbrengen van de larven in het eerste stadium aan de bovenstaande waterkolom toe te voegen. Onder het wateroppervlak worden met een pipet kleine hoeveelheden van de teststofoplossingen ingebracht. Vervolgens wordt het bovenstaande water voorzichtig gemengd, zonder het sediment te verstoren. Na het verrijken wordt voorzichtig belucht.
|
|
29. b.
|
In de opzet met verrijkt sediment worden de blootstellingsvaten die het sediment-watersysteem voor de tweede generatie bevatten, op dezelfde manier als voor de eerste generatie voorbereid.
|
|
30.
|
Twintig larven in het eerste stadium (maximaal 48 u na uitkomen) van de tweede generatie worden met een stompe pipet willekeurig verdeeld over de testvaten met het verrijkte sediment-watersysteem. Tijdens het in de testvaten inbrengen van de larven in het eerste stadium en de eerste 24 uur daarna wordt de beluchting van het water uitgezet. Volgens de gebruikte testopzet (zie punten 19 en 20) is het aantal gebruikte larven per concentratie ten minste 120 (6 duplo's per concentratie) voor de ECX-benadering en 160 voor de NOEC-benadering (8 duplo's per concentratie).
|
Voedsel
|
31.
|
De larven in de testvaten moeten bij voorkeur dagelijks of ten minste drie keer per week worden gevoerd. Voor jonge larven lijkt in de eerste 10 dagen van de ontwikkeling 0,25-0,5 mg vissenvoer (een suspensie in water of fijngemalen voedsel, bijv. Tetra-Min of Tetra-Phyll; zie details in aanhangsel 2) per larve per dag voldoende te zijn (0,35-0,5 mg voor C. yoshimatsui). Oudere larven kunnen iets meer voedsel nodig hebben: 0,5 – 1,0 mg per larve per dag zou voor de rest van de test voldoende moeten zijn. Als schimmelgroei wordt waargenomen of sterfte in de controlegroepen wordt geconstateerd, moet het voedselrantsoen in alle test- en controlegroepen worden verlaagd. Als de schimmelontwikkeling niet kan worden gestopt, moet de test worden herhaald.
De toxicologische relevantie van blootstelling via inslikken is in het algemeen hoger bij stoffen met een sterke affiniteit tot organische koolstof of stoffen die covalent aan het sediment binden. Bij het testen van stoffen met dergelijke eigenschappen kan de benodigde hoeveelheid voedsel voor de overleving en natuurlijke groei van de larven daarom vóór de stabilisatieperiode worden toegevoegd aan het kunstmatige sediment, afhankelijk van de wettelijke eis. Om verslechtering van de waterkwaliteit te voorkomen moet in plaats van visvoer plantaardig materiaal worden gebruikt, bijv. 0,5 % (drooggewicht) fijngemalen bladeren van brandnetel (Urtica dioica), witte moerbei (Morus alba), witte klaver (Trifolium repens), spinazie (Spinacia oleracea) of ander plantaardig materiaal (Cerophyl of α-cellulose). Toevoeging van het volledige rantsoen van een organische voedingsbron aan het sediment voorafgaand aan de verrijking is niet triviaal met het oog op de waterkwaliteit en biologische prestaties (21), noch een gestandaardiseerde methode, maar recente studies geven aan dat deze methode werkt (19) (26). Volwassen muggen in de kweekkooi hebben normaliter geen voer nodig, maar de fecunditeit en vruchtbaarheid worden verbeterd wanneer een in verzadigde sucroseoplossing gedrenkt wattenschijfje als voedingsbron voor uitgekomen volwassen muggen wordt aangeboden (34).
|
Incubatieomstandigheden
|
32.
|
In het bovenstaande water in de testvaten wordt 24 uur na toevoeging van de larven in het eerste stadium voorzichtige beluchting toegepast en gedurende de test voortgezet (waarbij erop moet worden gelet dat het gehalte aan opgeloste zuurstof niet lager wordt dan 60 % van de verzadigingswaarde van lucht (air saturation value — ASV). De beluchting vindt plaats via een glazen pasteurpipet waarvan de opening 2-3 cm boven de sedimentlaag wordt vastgezet en die enkele luchtbellen/sec afgeeft. Bij het testen van vluchtige stoffen moet worden opgelet dat het sediment-watersysteem niet wordt belucht terwijl tegelijkertijd aan het validiteitscriterium van minimaal 60 % van de ASV (punt 10) dient te worden voldaan. Nadere richtsnoeren zijn opgenomen in (16).
|
|
33.
|
De test met C. riparius wordt uitgevoerd bij een constante temperatuur van 20 °C (± 2 °C). Voor C. dilutus en C. yoshimatsui bedraagt de aanbevolen temperatuur respectievelijk 23 °C en 25 °C (± 2 °C). Er wordt een fotoperiode van 16 h gebruikt bij een lichtintensiteit van 500 tot 1 000 lux. Voor de kweekkooien kan een extra eenurige fase van ochtend- en avondschemering worden opgenomen.
|
Blootstellingsduur
|
34.
|
Opzet met verrijkt water: De blootstellingsperiode van de eerste generatie begint wanneer de teststof in het bovenstaande water van de testvaten wordt gebracht (één dag na inbrengen van de larven — zie punt 7 voor mogelijke wijzigingen van de blootstellingsopzet). Blootstelling van de tweede larvegeneratie begint onmiddellijk, aangezien zij worden ingebracht in een sediment-watersysteem dat reeds verrijkt is. De maximale blootstellingsduur is voor de eerste generatie 27 dagen en voor de tweede generatie 28 dagen (de eerste generatie larven brengt één dag in de vaten door zonder blootstelling) voor C. riparius en C. yoshimatsui. Met inachtneming van de overlap is de duur van de volledige test ongeveer 44 dagen. Voor C. dilutus is de maximale blootstellingsduur respectievelijk 64 en 65 dagen voor de eerste en tweede generatie. De totale duur is ongeveer 100 dagen.
Opzet met verrijkt sediment: de blootstelling begint met het inbrengen van de larven en duurt maximaal 28 dagen voor beide generaties voor C. riparius en C. yoshimatsui, en maximaal 65 dagen voor beide generaties voor C. dilutus.
|
Waarnemingen
Uitkomst van muggen
|
35.
|
De ontwikkelingstijd en het totale aantal volledig uitgekomen en levende mannelijke en vrouwelijke muggen worden voor beide generaties bepaald. Mannetjes zijn gemakkelijk te herkennen aan hun veerachtige antennes en dunne postuur.
|
|
36.
|
De testvaten van beide generaties worden ten minste drie keer per week geobserveerd om een visuele beoordeling van eventueel afwijkend gedrag van de larven te verrichten (bijv. verlating van het sediment, ongewoon zwemgedrag), waarbij met de controlegroep wordt vergeleken. Tijdens de periode van het uitkomen, die ongeveer 12 dagen na het inbrengen van de larven begint voor C. riparius en C. yoshimatsui (na 20 dagen voor C. dilutus), worden uitgekomen muggen ten minste één keer, maar bij voorkeur twee keer per dag ('s ochtends vroeg en laat in de middag) geteld en gesekst. Na identificatie worden de muggen van de eerste generatie voorzichtig verwijderd uit de vaten en overgebracht in een kweekkooi. Muggen van de tweede generatie worden verwijderd en na identificatie gedood. Eventuele eistrengen die in de testvaten van de eerste generatie zijn afgezet, moeten individueel worden verzameld en met ten minste 2,5 ml natief water worden overgebracht in 12-wells-microtiterplaten (of andere geschikte vaten) die met een deksel worden afgedekt om aanzienlijke verdamping te voorkomen. Ook worden het aantal dode larven en zichtbare poppen die niet zijn uitgekomen geregistreerd. Voorbeelden van een kweekkooi, testvat en zuigapparaat worden in aanhangsel 5 gegeven.
|
Voortplanting
|
37.
|
Effecten op de voortplanting worden beoordeeld aan de hand van het aantal eistrengen dat door de eerste generatie muggen is geproduceerd en de vruchtbaarheid van deze eistrengen. Eens per dag worden de eistrengen verzameld uit de kristalliseerschaal die in elk kweekvat is geplaatst. De eistrengen worden verzameld en met ten minste 2,5 ml natief water overgebracht in een 12-wells-microtiterplaat (één eistreng in elke well) of andere geschikte vaten, die met een deksel afgedekt worden om aanzienlijke verdamping te voorkomen. De volgende kenmerken worden voor elke eistreng geregistreerd: dag van productie, formaat (normaal, d.w.z. 1,0 ± 0,3 cm, of klein, doorgaans ≤ 0,5 cm), en structuur (normaal = banaanvormig met spiraalvormige eistreng of abnormaal, bijv. niet-spiraalvormige eistreng) en vruchtbaarheid (vruchtbaar of onvruchtbaar). In de loop van zes dagen na de productie wordt de vruchtbaarheid van een eistreng beoordeeld. Een eistreng wordt als vruchtbaar beschouwd wanneer ten minste een derde van de eitjes uitkomt. Het totaal aantal vrouwtjes dat in de kweekkooi wordt gebracht, wordt gebruikt om het aantal eistrengen per vrouwtje en het aantal vruchtbare eistrengen per vrouwtje te berekenen. Indien vereist kan het aantal eitjes in een eistreng niet-destructief worden geschat volgens de ringtellingsmethode (uitvoerig beschreven onder punten 32 en 33).
|
Analytische bepalingen
Concentratie van de teststof
|
38.
|
Er moeten ten minste bij de hoogste en een lagere concentratie monsters van het bovenstaande water, het poriënwater en het sediment worden geanalyseerd bij het begin van de blootstelling (in het geval van waterverrijking bij voorkeur een uur na aanbrenging van de teststof) en aan het einde van de test. Dit geldt voor vaten van beide generaties. Van de kristalliseerschalen in de kweekkooi wordt alleen het bovenstaande water geanalyseerd, aangezien de eistrengen hiermee in contact komen (voor de opzet met verrijkt sediment kan een analytische bevestiging van de sedimentconcentratie worden overwogen). Er kunnen tijdens de test verdere metingen van sediment, poriënwater of bovenstaand water worden uitgevoerd indien dit noodzakelijk wordt geacht. Deze bepalingen van de teststofconcentratie leveren informatie op over het gedrag en de verdeling van de teststof in het water-sedimentsysteem. Bij bemonstering van sediment en poriënwater aan het begin van en tijdens de test (zie punt 39) zijn aanvullende testvaten nodig om analytische bepalingen te verrichten. Metingen in het sediment in de opzet met verrijkt water zijn mogelijk niet noodzakelijk als in een water/sedimentstudie onder vergelijkbare omstandigheden (bijv. verhouding sediment/water, soort toepassing, gehalte organische koolstof van het sediment) de verdeling van de teststof tussen het water en het sediment duidelijk is bepaald, of als blijkt dat de gemeten concentraties in het bovenstaande water binnen 80 tot 120 % van de nominale of gemeten aanvankelijke concentraties blijven.
|
|
39.
|
Wanneer tussenliggende metingen worden verricht (bijv. op dag 7 en/of 14) en voor de analyse grotere monsters nodig zijn die niet uit de testvaten kunnen worden genomen zonder het testsysteem te beïnvloeden, worden analytische bepalingen verricht op monsters uit aanvullende testvaten die op dezelfde wijze zijn behandeld (inclusief toevoeging van testorganismen), maar niet voor biologische waarnemingen zijn gebruikt.
|
|
40.
|
Om het interstitiële water (poriënwater) te isoleren, wordt aanbevolen te centrifugeren, bijvoorbeeld 30 min bij 10 000 g en een temperatuur van 4 °C. Filtratie kan echter ook aanvaardbaar zijn, mits aangetoond is dat de teststof niet aan filters adsorbeert. In sommige gevallen kan analyse van de concentraties in het poriënwater onmogelijk zijn doordat het monster te klein is.
|
Fysisch-chemische eigenschappen
|
41.
|
De pH, het gehalte aan opgeloste zuurstof in het testwater en de temperatuur van het water in de testvaten en de kristalliseerschalen moeten op een geschikte wijze worden gemeten (zie punt 10). De hardheid en het ammoniumgehalte moeten bij het begin en het eind van de test in de controlevaten en in één testvat en kristalliseerschaal worden gemeten bij de hoogste concentratie.
|
GEGEVENS EN RAPPORTAGE
Bewerking van de resultaten
|
42.
|
Het doel van deze levenscyclustest is het bepalen van het effect van de teststof op de voortplanting en, voor twee generaties, het ontwikkelingstempo en het totaal aantal volledig uitgekomen en levende mannelijke en vrouwelijke muggen. Voor het uitkomstquotiënt moeten de gegevens van mannetjes en vrouwtjes worden samengevoegd. Als zich geen statistisch significante verschillen voordoen in gevoeligheid in het ontwikkelingstempo tussen de seksen, kunnen de resultaten voor mannetjes en vrouwtjes worden samengevoegd voor statistische analyse.
|
|
43.
|
Effectconcentraties, uitgedrukt als concentraties in het bovenstaande water (voor verrijkt water) of in het sediment (voor verrijkt sediment) worden doorgaans berekend aan de hand van de bij het begin van de blootstelling gemeten concentraties (zie punt 38). Daarom worden de concentraties voor verrijkt water doorgaans gemeten aan het begin van de blootstelling in het bovenstaande water van de vaten voor beide generaties en worden die van de kristalliseerschalen voor elke behandeling gemiddeld. Voor verrijkt sediment worden de concentraties die doorgaans aan het begin van de blootstelling worden gemeten in de vaten voor beide generaties (en eventueel die van de kristalliseerschalen) voor elke behandeling gemiddeld.
|
|
44.
|
Om een puntschatting te berekenen, d.w.z. een ECx, kunnen de statistieken per vat en per kweekkooi worden gebruikt als echte duplo's. Bij de berekening van een betrouwbaarheidsinterval voor elke ECx moet rekening worden gehouden met de variabiliteit tussen vaten, tenzij wordt aangetoond dat deze verwaarloosbaar klein is. Wanneer voor het model de kleinstekwadratenmethode wordt toegepast, worden de gegevens per vat getransformeerd om de homogeniteit van de variantie te vergroten. Voordat de ECx-waarden worden berekend, moet de respons echter zijn teruggetransformeerd naar de oorspronkelijke waarde (31).
|
|
45.
|
Wanneer de statistische analyse dient om de NOEC te bepalen door toetsing van een hypothese, moet rekening worden gehouden met de variabiliteit tussen vaten. Dit wordt gegarandeerd door gebruik te maken van ANOVA-methoden (bijv. Williams- en Dunnett-toets). De Williams-toets is geschikt wanneer een monotone dosisrespons in theorie wordt verwacht en de Dunnett-toets is geschikt wanneer de hypothese van monotoniciteit niet standhoudt. Als de gebruikelijke ANOVA-aannamen niet opgaan (31), kunnen robuustere toetsen (27) wenselijk zijn.
|
Uitkomstquotiënt
|
46.
|
Het uitkomstquotiënt betreft een binaire respons en kan, wanneer een monotone dosisrespons wordt verwacht en de gegevens consistent zijn met die verwachting, worden geanalyseerd met de toets van Cochran-Armitage, toegepast met stapjes omlaag. Als dit niet het geval is, kan de exacte toets van Fisher of de toets van Mantel-Haenszel worden gebruikt, met volgens Bonferroni-Holm gecorrigeerde p-waarden. Als er aanwijzingen zijn dat de variabiliteit tussen duplo's met dezelfde concentratie groter is dan een binomiale verdeling zou uitwijzen (zogeheten „extrabinomiale” variantie), moet een robuuste toets van Cochran-Armitage of een exacte toets van Fisher, zoals voorgesteld onder punt 27, worden gebruikt.
De som van levende muggen (mannetjes plus vrouwtjes) die per vat uitgekomen zijn, ne
, wordt bepaald en gedeeld door het aantal ingebrachte larven, na
:

waarin:
|
ER
|
=
|
uitkomstquotiënt (emergence ratio);
|
|
ne
|
=
|
aantal levende muggen uitgekomen per vat;
|
|
na
|
=
|
aantal larven dat in één vat is ingebracht (normaliter 20).
|
Wanneer ne
groter is dan na
(d.w.z. wanneer onbedoeld meer dan het voorziene aantal larven werd ingebracht), moet na
gelijk worden gesteld met ne
.
|
|
47.
|
Bij wijze van alternatief, dat vooral voor grote monsters geschikt is, kan, in geval van extrabinomiale variantie, het uitkomstquotiënt als een continue respons worden behandeld en kunnen procedures die overeenkomen met deze ER-gegevens worden gebruikt. Als grote monsters worden hier beschouwd monsters waarvan per duplo (vat) zowel het aantal uitgekomen als het aantal niet-uitgekomen muggen groter is dan vijf.
|
|
48.
|
Voordat ANOVA-methoden worden toegepast, moeten de waarden van het uitkomstquotiënt eerst een hoektransformatie of een freeman-tukeytransformatie ondergaan om een approximatieve normale verdeling te verkrijgen en de variantie te egaliseren. Wanneer de absolute frequenties worden gebruikt, kan de toets van Cochran-Armitage, de exacte toets van Fisher (Bonferroni) of de toets van Mantel-Haenszel worden gebruikt. De hoektransformatie wordt uitgevoerd door de arcsinus (sin– 1) van de vierkantswortel van het uitkomstquotiënt te nemen.
|
|
49.
|
Voor uitkomstquotiënten worden ECx-waarden berekend aan de hand van regressieanalyse (bijv. probit-, logit- of Weibull-modellen (28)). Als geen regressieanalyse mogelijk is (bijv. als er minder dan twee partiële responsen zijn), kunnen andere niet-parametrische methoden, zoals voortschrijdend gemiddelde of eenvoudige interpolatie, worden gebruikt.
|
Ontwikkelingstempo
|
50.
|
Met de gemiddelde ontwikkelingstijd wordt bedoeld de gemiddelde tijd tussen het moment waarop de larven in het vat worden gebracht (dag 0 van de test) en het moment waarop de experimentele cohort muggen uitkomt (voor berekening van de ware ontwikkelingstijd moet rekening worden gehouden met de leeftijd van de larven ten tijde van het inbrengen). Het ontwikkelingstempo (eenheid: 1/dag) is de reciproque waarde van de ontwikkelingstijd en staat voor het deel van de larvenontwikkeling dat per dag plaatsvindt. Het ontwikkelingstempo heeft de voorkeur voor de evaluatie van deze sedimenttoxiciteitsstudies, omdat deze in vergelijking met de ontwikkelingstijd een kleinere variantie en een grotere homogeniteit heeft en de normale verdeling beter benadert. Daarom kunnen sterke parametrische testprocedures op het ontwikkelingstempo in plaats van de ontwikkelingstijd worden toegepast. Voor het ontwikkelingstempo als continue respons kunnen ECx-waarden worden geschat door middel van regressieanalyse (bijv. (29)(30)). Een NOEC voor het gemiddelde ontwikkelingstempo kan worden bepaald aan de hand van ANOVA-methoden, bijv. Williams- of Dunnett-toets. Aangezien mannetjes eerder uitkomen dan vrouwtjes (d.w.z. ze hebben een hoger ontwikkelingstempo), is het logisch om het ontwikkelingstempo voor elk geslacht apart te berekenen, naast dat voor de totale muggenpopulatie.
|
|
51.
|
Bij de statistische tests wordt aangenomen dat het op inspectiedag x waargenomen aantal muggen is uitgekomen in het midden van het tijdsinterval tussen dag x en dag x - l (l = lengte van het inspectie-interval, doorgaans 1 dag). Het gemiddelde ontwikkelingstempo per vat (
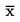
) wordt als volgt berekend:

waarin:
|

|
:
|
gemiddeld ontwikkelingstempo per vat;
|
|
i
|
:
|
index van het inspectie-interval;
|
|
m
|
:
|
maximumaantal inspectie-intervallen;
|
|
fi
|
:
|
in inspectie-interval i uitgekomen aantal muggen;
|
|
ne
|
:
|
totaal aantal uitgekomen muggen aan het eind van de proef (Σfi
)
|
|
xi
|
:
|
ontwikkelingstempo van de in interval i uitgekomen muggen;
|
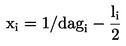
waarbij:
|
dagi
|
:
|
inspectiedag (dagen sinds inbrengen van de larven)
|
|
li
|
:
|
lengte van inspectie-interval i (dagen, gewoonlijk één dag).
|
|
Geslachtsverhouding
|
52.
|
De geslachtsverhouding betreft een binaire respons en wordt daarom geëvalueerd aan de hand van de exacte toets van Fisher of andere geschikte methoden. De natuurlijke geslachtsverhouding van C. riparius is één, d.w.z. er zijn evenveel mannetjes als vrouwtjes. Voor beide generaties moet de gegevens wat betreft de geslachtsverhouding identiek worden behandeld. Aangezien het maximumaantal muggen per vat (d.w.z. 20) te laag is voor zinvolle statistische analyse, wordt het totaal aantal volledig uitgekomen en levende muggen voor elk geslacht van alle vaten van één test opgeteld. Deze niet-getransformeerde gegevens worden getoetst tegen de (oplosmiddel)controle of gepoolde controlegegevens in een contingentietabel van 2 × 2.
|
Voortplanting
|
53.
|
Voortplanting, als fecunditeit, wordt berekend als het aantal eistrengen per vrouwtje. Meer bepaald wordt het totaal aantal eistrengen dat in een kweekkooi geproduceerd is, gedeeld door het totaal aantal levende en niet-beschadigde vrouwtjes dat in die kooi is ingebracht. Een NOEC voor fecunditeit kan worden bepaald aan de hand van ANOVA-methoden, bijv. Williams- of Dunnett-toets.
|
|
54.
|
Vruchtbaarheid van de eistrengen wordt gebruikt om het aantal vruchtbare eistrengen per vrouwtje te kwantificeren. Het totaal aantal vruchtbare eistrengen dat in een kweekkooi geproduceerd is, wordt gedeeld door het totaal aantal levende en niet-beschadigde vrouwtjes dat in die kooi is ingebracht. Een NOEC voor vruchtbaarheid kan worden bepaald aan de hand van ANOVA-methoden, bijv. Williams- of Dunnett-toets.
|
Testverslag
|
55.
|
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Teststof:
|
—
|
fysieke aard en fysisch-chemische eigenschappen (oplosbaarheid in water, dampspanning, log K
ow, verdelingscoëfficiënt in de bodem (of in sediment, indien beschikbaar), stabiliteit in water en sediment enz.);
|
|
—
|
identificatiegegevens van de stof (triviale naam, chemische naam, structuurformule, CAS-nummer enz.) met inbegrip van de zuiverheid en de analysemethode voor de kwantitatieve bepaling van de teststof.
|
|
|
|
Geteste soort:
|
—
|
gebruikte testorganismen: soort, wetenschappelijke naam, bron van de organismen en kweekomstandigheden;
|
|
—
|
informatie over hoe de eipakketten en larven werden gehanteerd;
|
|
—
|
informatie over behandeling van de uitgekomen volwassen muggen van de eerste generatie met hulp van een zuigapparaat enz. (zie aanhangsel 5);
|
|
—
|
leeftijd van het testorganismen ten tijde van inbrengen in de testvaten van de eerste generatie.
|
|
|
|
Testomstandigheden:
|
—
|
gebruikt sediment, d.w.z. natuurlijk of kunstmatig sediment;
|
|
—
|
natuurlijk sediment: locatie en beschrijving van bemonsteringslocatie, indien mogelijk met inbegrip van verontreinigingsgeschiedenis; kenmerken van het sediment: pH, organischekoolstofgehalte, C/N-verhouding en korrelgrootteverdeling (indien van toepassing).
|
|
—
|
kunstmatig sediment: bereiding, ingrediënten en eigenschappen (organischekoolstofgehalte, pH, vocht enz. gemeten aan het begin van de test);
|
|
—
|
bereiding van het testwater (bij gebruik van synthetisch water) en eigenschappen (zuurstofgehalte, pH, hardheid enz. gemeten aan het begin van de test);
|
|
—
|
diepte van sediment en bovenstaand water voor de testvaten en kristalliseerschalen;
|
|
—
|
volume van bovenstaand water en poriënwater; gewicht aan nat sediment met en zonder poriënwater voor de testvaten en kristalliseerschalen;
|
|
—
|
testvaten (materiaal en afmetingen);
|
|
—
|
kristalliseerschalen (materiaal en afmetingen);
|
|
—
|
kweekkooien (materiaal en afmetingen);
|
|
—
|
bereidingswijze van stamoplossingen en testconcentraties voor de testvaten en kristalliseerschalen;
|
|
—
|
inbrengen van de teststof in de testvaten en kristalliseerschalen: testconcentraties, aantal duplo's en oplosmiddelen indien nodig;
|
|
—
|
incubatieomstandigheden voor de testvaten: temperatuur, lichtcyclus en -intensiteit, beluchting (luchtbellen per seconde);
|
|
—
|
incubatieomstandigheden voor de kweekkooien en de kristalliseerschalen: temperatuur, lichtcyclus en -intensiteit;
|
|
—
|
incubatieomstandigheden voor de eistrengen in de microtiterplaten (of andere vaten): temperatuur, lichtcyclus en -intensiteit;
|
|
—
|
details over het voedsel, met inbegrip van soort voedsel, bereiding, hoeveelheid en voederregime.
|
|
|
|
Resultaten:
|
—
|
de nominale testconcentraties, de gemeten testconcentraties en de resultaten van alle analysen die zijn verricht om de concentratie van de teststof in de testvaten en kristalliseerschalen te bepalen;
|
|
—
|
waterkwaliteit in de testvaten en kristalliseerschalen, d.w.z. pH, temperatuur, opgeloste zuurstof, hardheid en ammonium;
|
|
—
|
vervanging van verdampt testwater voor de testvaten, indien van toepassing;
|
|
—
|
aantal uitgekomen mannelijke en vrouwelijke muggen per vat en per dag voor de eerste en tweede generatie;
|
|
—
|
geslachtsverhouding van volledig uitgekomen en levende muggen per test voor de eerste en tweede generatie;
|
|
—
|
aantal niet tot mug ontwikkelde larven per vat voor de eerste en tweede generatie;;
|
|
—
|
percentage/fractie van uitkomst per duplo en testconcentratie (mannelijke en vrouwelijke muggen samengevoegd) voor de eerste en tweede generatie;
|
|
—
|
gemiddeld ontwikkelingstempo van volledig uitgekomen muggen per duplo en behandeling (mannelijke en vrouwelijke muggen apart en ook gecombineerd) voor de eerste en tweede generatie;
|
|
—
|
aantal eistrengen afgezet in de kristalliseerschalen per kweekkooi en dag;
|
|
—
|
kenmerken van elke eistreng (formaat, vorm en vruchtbaarheid);
|
|
—
|
fecunditeit — totaal aantal eistrengen per totaal aantal in de kweekkooi gebrachte vrouwtjes;
|
|
—
|
vruchtbaarheid — totaal aantal vruchtbare eistrengen per totaal aantal in de kweekkooi gebrachte vrouwtjes;
|
|
—
|
schattingen van toxische eindpunten, bijv. ECx (met bijbehorende betrouwbaarheidsintervallen), NOEC en de statistische methoden waarmee zij zijn bepaald;
|
|
—
|
bespreking van de resultaten, met inbegrip van een eventuele beïnvloeding van de resultaten van de test die een gevolg is van afwijkingen van deze testmethode.
|
|
|
LITERATUUR
|
(1)
|
Hoofdstuk C.28 van deze bijlage, Test ter bepaling van de toxiciteit voor Chironomidae in sediment en water m.b.v. verrijkt water.
|
|
(2)
|
Shobanov, N.A., Kiknadze, I.I. en M.G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311–322.
|
|
(3)
|
Fleming, R. et al. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, eindverslag aan de Europse Commissie, verslag nr.: EC 3738. Augustus 1994. WRc, UK.
|
|
(4)
|
SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, From the WOSTA Workshop held in the Netherlands.
|
|
(5)
|
ASTM International (2009), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
(6)
|
Environment Canada (1997), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, December 1997.
|
|
(7)
|
US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, tweede uitgave, EPA 600/R-99/064, maart 2000, herziening van de eerste uitgave van juni 1994.
|
|
(8)
|
US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates.
|
|
(9)
|
US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment toxicity Test.
|
|
(10)
|
Milani, D., Day, K.E., McLeay, D.J. and R.S. Kirby (1996), Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canada.
|
|
(11)
|
Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R. and C.D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662-2674.
|
|
(12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. and L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221-230.
|
|
(13)
|
Sugaya, Y. (1997), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345-350.
|
|
(14)
|
Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47-57.
|
|
(15)
|
Hoofdstuk C.27 van deze bijlage, Test ter bepaling van de toxiciteit voor Chironomidae in sediment en water m.b.v. verrijkt sediment.
|
|
(16)
|
OESO (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000)6, OESO, Parijs.
|
|
(17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. and M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
(18)
|
Environment Canada. (1995), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, September 1995.
|
|
(19)
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. and J. Oehlmann (2005), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: 353-361.
|
|
(20)
|
Suedel, B.C. and J.H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163-1175.
|
|
(21)
|
Naylor, C. and C. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291-3303.
|
|
(22)
|
Dunnett, C.W. (1964), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096-1121.
|
|
(23)
|
Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: 482-491.
|
|
(24)
|
Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117.
|
|
(25)
|
Williams, D.A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28: 510-531.
|
|
(26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L. and H.M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94-102.
|
|
(27)
|
Rao, J.N.K. and A.J. Scott (1992), A simple method for the analysis of clustered binary data. Biometrics, 48: 577-585.
|
|
(28)
|
Christensen, E.R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213-221.
|
|
(29)
|
Bruce, R.D. and D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485-1494.
|
|
(30)
|
Slob, W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298-312.
|
|
(31)
|
OESO (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No. 54, 146 blz., ENV/JM/MONO(2006)18, OESO, Parijs.
|
|
(32)
|
Benoit, D.A., Sibley, P.K., Juenemann, J.L. and G.T. Ankley (1997), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165-1176.
|
|
(33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. and J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) — baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: 1-9.
|
|
(34)
|
OESO (2010), Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OESO, Parijs.
|
Aanhangsel 1
Definities
Voor de toepassing van deze testmethode worden de volgende definities gebruikt:
|
|
Stof is een chemische stof of mengsel.
|
|
|
Kunstmatig sediment (ook wel bereid, gereconstitueerd, kunstmatig of synthetisch sediment genoemd) is een mengsel van materialen waarmee de fysische bestanddelen van natuurlijk sediment worden nagebootst.
|
|
|
Bovenstaand water is het water dat in het testvat op het sediment wordt gegoten.
|
|
|
Poriënwater (ook wel interstitieel water genoemd) is het water in de ruimten tussen de sediment- en bodemdeeltjes.
|
|
|
Verrijkt water is het testwater waaraan teststof is toegevoegd.
|
|
|
Teststof is elke volgens deze testmethode getest(e) stof of mengsel.
|
Aanhangsel 2
Aanbevelingen voor de kweek van Chironomus riparius
|
1.
|
Chironomus-larven kunnen worden gekweekt in kristalliseerschalen of grotere houders. Op de bodem van de houder wordt een 5 tot 10 mm dikke laag fijn kwartszand gestrooid. Ook kiezelgoer (bijv. Merck, art. 8117) is geschikt gebleken als substraat (in dat geval volstaat een dunnere laag van slechts enkele mm). Geschikt water wordt daarna toegevoegd tot een diepte van enkele cm. Het waterniveau moet zo nodig worden aangevuld om verlies door verdamping te compenseren en uitdroging te voorkomen. Indien nodig kan het water worden vervangen. Er wordt voorzichtige beluchting toegepast. De larvenkweekvaten worden in een geschikte kooi geplaatst, zodat de volwassen muggen niet kunnen ontsnappen. De kooi moet groot genoeg zijn om de uitgekomen volwassen muggen te laten zwermen, omdat anders mogelijk niet wordt gecopuleerd (ten minste ca. 30 × 30 × 30 cm).
|
|
2.
|
De kooien worden op kamertemperatuur of in een kamer met een constant klimaat bij 20 ± 2 °C gehouden, met een lichtregime van 16 uur licht (intensiteit ca. 1 000 lux), 8 uur donker. Gerapporteerd is dat een relatieve luchtvochtigheid van minder dan 60 % de voortplanting kan belemmeren.
|
Verdunningswater
|
3.
|
Elk geschikt natuurlijk of synthetisch water kan worden gebruikt. Gebruikelijk zijn bronwater, ontchloord kraanwater en kunstmatige media (bijv. Elendt-media M4 en M7, zie hieronder). Voor gebruik moet het water worden belucht. Indien nodig kan het kweekwater worden ververst door voorzichtig het gebruikte water uit de kweekvaten te gieten of hevelen zonder de larvenhulzen te beschadigen.
|
Toediening van voedsel aan larven
|
4.
|
Chironomus-larven worden dagelijks gevoerd met ongeveer 250 mg vissenvoervlokken (Tetra Min®, Tetra Phyll® of een soortgelijk merk vissenvoer) per vat. Dit voer kan worden gegeven als droog gemalen poeder of als suspensie in water: aan 20 ml verdunningswater wordt 1,0 g voedervlokken toegevoegd en gemengd, zodat een homogeen mengsel ontstaat. Dit preparaat kan met ongeveer 5 ml per vat per dag worden gevoerd. (schudden voor gebruik.) Aan oudere larven kan meer voer worden gegeven.
|
|
5.
|
Het voedsel wordt aangepast op basis van de waterkwaliteit. Als het kweekmedium troebel wordt, wordt de hoeveelheid voedsel verminderd. De toediening van voedsel moet zorgvuldig worden gecontroleerd. Als te weinig voer wordt gegeven, zullen de larven naar de waterkolom uitwijken; als te veel voer wordt gegeven, neemt de microbiële activiteit toe en daalt het zuurstofgehalte. Beide condities kunnen tot lagere groeisnelheden leiden.
|
|
6.
|
Wanneer nieuwe kweekvaten worden ingericht, kunnen ook enige cellen van groene algen (bijv. Scenedesmus subspicatus, Chlorella vulgaris) worden toegevoegd.
|
Toediening van voedsel aan uitgekomen volwassen muggen
|
7.
|
Enkele onderzoekers hebben erop gewezen dat een in een sucroseoplossing gedrenkt wattenschijfje als voedsel kan dienen voor uitgekomen volwassen muggen.
|
Uitkomst van muggen
|
8.
|
In de larvenkweekvaten zullen zich bij 20 ± 2 °C na ongeveer 13-15 dagen volwassen muggen ontwikkelen. Mannetjes zijn gemakkelijk te herkennen aan hun veerachtige antennes en dunne lichaam.
|
Eipakketten
|
9.
|
Zodra in de kweekkooi volwassen muggen aanwezig zijn, worden alle larvenkweekvaten drie keer per week gecontroleerd op afgezette geleiachtige eipakketten. Als eipakketten aanwezig zijn, worden zij voorzichtig verwijderd. Zij worden overgebracht naar een klein schaaltje met een monster van het kweekwater. De eipakketten worden gebruikt om een nieuw kweekvat te beginnen (bijv. 2-4 eipakketten per vat) of worden voor toxiciteitstests gebruikt.
|
|
10.
|
Larven in het eerste stadium moeten na 2-3 dagen uitkomen.
|
Inrichting van nieuwe kweekvaten
|
11.
|
Zodra kweken zijn opgezet, moet het mogelijk zijn één keer per week, of minder vaak naargelang de testvoorschriften, een vers larvenkweekvat in te richten, waarbij de oudere vaten worden verwijderd nadat zich volwassen muggen hebben ontwikkeld. Dit systeem zorgt voor een regelmatige aanvoer van volwassen muggen met een minimum aan beheer.
|
Bereiding van de testoplossingen M4 en M7
|
12.
|
Elendt (1990) heeft het medium M4 beschreven. Het medium M7 wordt op dezelfde wijze als M4 bereid, maar met een vier keer zo lage concentratie van de in tabel 1 vermelde stoffen. De testoplossing mag niet volgens Elendt en Bias (1990) worden bereid, omdat de voor de stamoplossingen vermelde concentraties van NaSiO3 × 5H2O, NaNO3, KH2PO4 en K2HPO4 niet geschikt zijn.
|
Bereiding van het medium M7
|
13.
|
Elke stamoplossing (I) wordt apart bereid en met deze stamoplossingen (I) wordt een gecombineerde stamoplossing (II) bereid (zie tabel 1). Het medium M7 wordt bereid uit 50 ml gecombineerde stamoplossing (II) en de in tabel 2 vermelde hoeveelheden van elke stamoplossing van macronutriënten en tot 1 liter gedeïoniseerd water aangevuld. Een vitaminestamoplossing wordt bereid door overeenkomstig tabel 3 drie vitaminen toe te voegen aan gedeïoniseerd water; kort voor gebruik wordt 0,1 ml van de gecombineerde vitaminestamoplossing aan het definitieve medium M7 toegevoegd De vitaminestamoplossing wordt in bevroren toestand in kleine porties bewaard. Het medium wordt belucht en gestabiliseerd.
|
Tabel 1
Stamoplossingen van spoorelementen voor de media M4 en M7
|
Stamoplossingen (I)
|
Hoeveelheid (mg) aangevuld tot 1 liter gedeïoniseerd water
|
Gecombineerde stamoplossing (II) bereiden door de volgende hoeveelheden (ml) van de stamoplossingen (I) te mengen en tot 1 liter gedeïoniseerd water aan te vullen
|
Uiteindelijke concentraties in testoplossingen (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7H2O (25)
(26)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tabel 2
Stamoplossingen van macronutriënten voor de media M4 en M7
|
|
Hoeveelheid aangevuld tot 1 liter gedeïoniseerd water
(mg)
|
Hoeveelheid stamoplossing van macronutriënten die wordt toegevoegd om de media M4 en M7 te bereiden
(ml/l)
|
Uiteindelijke concentraties in de testoplossingen M4 en M7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabel 3
Vitaminestamoplossing voor de media M4 en M7
De drie vitamineoplossingen worden tot één vitaminestamoplossing samengevoegd.
|
|
Hoeveelheid aangevuld tot 1 liter gedeïoniseerd water
(mg)
|
Hoeveelheid vitaminestamoplossing die wordt toegevoegd om de media M4 en M7 te bereiden
(ml/l)
|
Uiteindelijke concentraties in de testoplossingen M4 en M7
(mg/l)
|
|
Thiaminehydrochloride
|
750
|
0,1
|
0,075
|
|
Cyanocobalamine (B12)
|
10
|
0,1
|
0,0010
|
|
Biotine
|
7,5
|
0,1
|
0,00075
|
REFERENTIES
BBA (1995), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, Edited by M. Streloke and H. Köblz. Berlijn.
Elendt, B.P. (1990), Selenium deficiency in Crustacea, Protoplasma, 154: 25-33.
Elendt, B.P. and W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157-1167.
Aanhangsel 3
Bereiding van kunstmatig sediment
SAMENSTELLING VAN HET SEDIMENT
Het kunstmatige sediment wordt als volgt samengesteld:
|
Bestanddeel
|
Kenmerken
|
% van het sediment (drooggewicht)
|
|
Turf
|
Veenmosturf, zo dicht mogelijk bij pH 5,5-6,0, zonder zichtbare plantenresten, fijngemalen (deeltjesgrootte ≤ 1 mm) en aan de lucht gedroogd
|
4 - 5
|
|
Kwartszand
|
Korrelgrootte: > 50 % van de deeltjes moet binnen het bereik 50-200 μm liggen
|
75 - 76
|
|
Kaolienklei
|
Kaoliengehalte ≥ 30 %
|
20
|
|
Organische koolstof
|
Aangepast door toevoeging van turf en zand
|
2 (± 0,5)
|
|
Calciumcarbonaat
|
CaCO3, poedervormig, chemisch zuiver
|
0,05 - 0,1
|
|
Watergehalte
|
Geleidbaarheid ≤ 10 μS/cm
|
30 - 50
|
BEREIDING
De turf wordt aan de lucht gedroogd en tot een fijn poeder vermalen. Er wordt een suspensie van de vereiste hoeveelheid turfpoeder in gedeïoniseerd water bereid met een kwalitatief hoogwaardig homogeniseerapparaat. De pH van deze suspensie wordt met CaCO3 aangepast tot 5,5 ± 0,5. De suspensie wordt ten minste twee dagen lang onder zachtjes roeren bij 20 ± 2 °C geconditioneerd om de pH te stabiliseren en een stabiele microbiële component te verkrijgen. De pH wordt opnieuw gemeten en moet nu 6,0 ± 0,5 bedragen. Vervolgens wordt de turfsuspensie met de andere bestanddelen (zand en kaolienklei) en gedeïoniseerd water vermengd om een homogeen sediment te verkrijgen met een watergehalte van 30-50 % van het drooggewicht van het sediment. De pH van het uiteindelijke mengsel wordt nogmaals gemeten en zo nodig met CaCO3 tot 6,5-7,5 aangepast. Er worden monsters van het sediment genomen om het drooggewicht en het gehalte aan organische koolstof te bepalen. Aanbevolen wordt het kunstmatige sediment, voordat het in een test ter bepaling van de toxiciteit voor Chironomidae wordt gebruikt, zeven dagen te laten rusten onder dezelfde omstandigheden die ook in de test zullen heersen.
OPSLAG
De droge bestanddelen voor de bereiding van het kunstmatige sediment kunnen op een droge en koele plaats bij kamertemperatuur worden bewaard. Het kunstmatige (natte) sediment mag niet worden opgeslagen voordat het in de test wordt gebruikt. Het moet onmiddellijk na afloop van de zevendaagse conditioneringsperiode die de bereiding afsluit, worden gebruikt.
REFERENTIES
OESO (1984), Earthworm, Acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OESO, Parijs.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. and B. Streit (1998), Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10-20.
Aanhangsel 4
Chemische kenmerken van aanvaardbaar verdunningswater
|
BESTANDDEEL
|
CONCENTRATIES
|
|
Deeltjes
|
< 20 mg/l
|
|
Totale hoeveelheid organische koolstof
|
< 2 mg/l
|
|
Niet-geïoniseerde ammonium
|
< 1 μg/l
|
|
Hardheid uitgedrukt als CaCO3
|
< 400 mg/l (27)
|
|
Chloorresiduen
|
< 10 μg/l
|
|
Totale hoeveelheid organofosfaat-bestrijdingsmiddelen
|
< 50 ng/l
|
|
Totale hoeveelheid organochloor-bestrijdingsmiddelen plus polychloorbifenylen
|
< 50 ng/l
|
|
Totale hoeveelheid organisch chloor
|
< 25 ng/l
|
Aanhangsel 5
Richtsnoer voor uitvoering van de test
Voorbeeld van een kweekkooi:

|
A
|
:
|
gaas bovenop en aan ten minste één zijde van de kooi (maaswijdte ca. 1 mm)
|
|
B
|
:
|
opening voor het uitzetten van uitgekomen volwassen muggen in de kweekkooi en om de gelegde eistrengen uit de kristalliseerschalen te verwijderen (niet in deze afbeelding getoond)
|
|
C
|
:
|
minimale afmetingen van de kweekkooi: 30 cm lang, 30 cm hoog en 30 cm breed
|
Voorbeeld van een testvat:

|
A
|
:
|
pasteurpipet voor luchttoevoer aan het bovenstaande water
|
|
B
|
:
|
glazen deksel om ontsnapping van uitgekomen muggen te voorkomen
|
|
C
|
:
|
wateroppervlak
|
|
D
|
:
|
testvat (glazen beker van minimaal 600 ml)
|
|
E
|
:
|
sedimentlaag
|
Voorbeeld van een zuigapparaat voor het vangen van volwassen muggen (pijlen geven richting van luchtstroom aan):

|
A
|
:
|
glazen buis (binnendiameter ca. 5 mm) aangesloten op een zelfaanzuigende pomp
|
|
B
|
:
|
stop van gevulkaniseerd rubber, geperforeerd met glazen buis (A). Aan de binnenkant is de opening van glazen buis (A) bedekt met watten en een gaas (maaswijdte ca. 1 mm) om te voorkomen dat de muggen beschadigd raken als ze in het apparaat worden gezogen
|
|
C
|
:
|
doorzichtige houder (plastic of glas, lengte ca. 15 cm) voor het vangen van muggen
|
|
D
|
:
|
stop van gevulkaniseerd rubber, geperforeerd met glazen buis (E). Om de muggen in de kweekkooi los te laten, wordt stop D van houder C losgemaakt
|
|
E
|
:
|
buis (plastic of glas, binnendiameter ca. 8 mm) om volwassen muggen uit het vat te verzamelen
|
Schematische voorstelling van een levenscyclustest:

|
A
|
:
|
eerste generatie — testvaten met een sediment-watersysteem, acht duplo's, 20 larven in het eerste stadium per vat
|
|
B
|
:
|
vier testvaten per kweekkooi A en B
|
|
C
|
:
|
kweekkooien (A en B) voor zwermen, paren en eitjes leggen
|
|
D
|
:
|
kristalliseerschalen voor afzetting van eistrengen
|
|
E
|
:
|
microtiterplaten, één well per eistreng
|
|
F
|
:
|
tweede generatie — testvaten met een sediment-watersysteem, acht duplo's, 20 larven in het eerste stadium per vat
|
C.41. GESLACHTELIJKE-ONTWIKKELINGSTEST MET VISSEN
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan OESO-testrichtsnoer (TG) 234 (2011). De methode is gebaseerd op een besluit uit 1998 om bestaande richtsnoeren te herzien en nieuwe richtsnoeren te ontwikkelen voor het screenen en testen op potentiële hormoonontregelaars. Er is vastgesteld dat de geslachtelijke-ontwikkelingstest met vissen (Fish Sexual Development Test, FSDT) een veelbelovende testmethode is die een gevoelig levensstadium van vissen behandelt waarin zij gevoelig zijn voor oestrogeen- en androgeenachtige stoffen. De testmethode is van 2006 tot 2010 in het laboratorium gevalideerd. Daar zijn het Japanse rijstvisje (Oryzias latipes), de zebravis (Danio rerio) en de driedoornige stekelbaars (Gasterosteus aculeatus) gevalideerd en is de Amerikaanse dikkop-elrits (Pimephales promelas) gedeeltelijk gevalideerd (41) (42) (43). Dit protocol omvat het Japanse rijstvisje, de driedoornige stekelbaars en de zebravis. Het protocol is in principe een uitbreiding van OESO TG 210 „Fish, Early Life Stage Toxicity Test” (1), waarbij de blootstelling wordt voortgezet totdat de vissen geslachtelijk gedifferentieerd zijn, d.w.z. ongeveer 60 dagen na uitkomen (days post-hatch, dph) voor het Japanse rijstvisje, de driedoornige stekelbaars en de zebravis (de blootstellingsperiode kan korter of langer zijn voor andere soorten die in de toekomst worden gevalideerd), en de hormoongevoelige eindpunten worden toegevoegd. Aan de hand van de FSDT wordt een beoordeling gemaakt van de effecten in het vroege levensstadium en de mogelijke schadelijke gevolgen van vermeende hormoonontregelende stoffen (bijv. oestrogenen, androgenen en remmers van de steroïdogenese) op de geslachtelijke ontwikkeling. Door de combinatie van de twee centrale endocriene eindpunten, de concentratie van vitellogenine (VTG) en fenotypische geslachtsverhouding, kan de test aanwijzingen geven over het werkingsmechanisme van de teststof. Wegens de voor de populatie relevante verandering in de fenotypische geslachtsverhouding kan de FSDT gebruikt worden voor gevaren- en risicobeoordeling. Als de test voor gevaren- of risicobeoordeling wordt gebruikt, dient de stekelbaars echter niet te worden gebruikt omdat de tot nu toe beschikbare validatiegegevens erop wijzen dat bij deze soort de veranderingen in de fenotypische geslachtsverhouding door de teststoffen ongewoon waren.
|
|
2.
|
Het protocol is gebaseerd op vissen die via het water aan stoffen worden blootgesteld tijdens de geslachtelijk labiele periode waarin de vissen naar verwachting het gevoeligst zijn voor de effecten van hormoonontregelende stoffen die de geslachtelijke ontwikkeling verstoren. Twee centrale eindpunten worden gemeten als indicatoren van met endocrien verband houdende ontwikkelingsafwijkingen, de VTG-concentraties en geslachtsverhoudingen, bepaald aan de hand van histologie van de geslachtsklieren. Histopathologie van de geslachtsklieren (evaluatie en bepaling van de ontwikkelingsstadia van oöcyten en spermatogenetische cellen) is facultatief. Daarnaast wordt waar mogelijk het genetische geslacht bepaald (bijv. bij het Japanse rijstvisje en de driedoornige stekelbaars). De aanwezigheid van een genetische geslachtsmarker is een aanzienlijk voordeel omdat die het onderscheidend vermogen van de statistieken van de geslachtsverhouding verhoogt en de detectie van individuele fenotypische geslachtsomkering mogelijk maakt. Andere apicale eindpunten die gemeten moeten worden zijn uitkomstpercentage, overleving, lengte en lichaamsgewicht. De testmethode kan mogelijk aangepast worden voor andere dan de bovengenoemde soorten, mits de andere soorten een validatie ondergaan die gelijkwaardig is aan die voor het Japanse rijstvisje, de driedoornige stekelbaars en de zebravis, de controlevissen aan het einde van de test geslachtelijk gedifferentieerd zijn, de VTG-gehaltes hoog genoeg zijn om significante stofgerelateerde variaties te detecteren, en mits de gevoeligheid van het testsysteem wordt vastgesteld met behulp van referentiestoffen met endocriene activiteit ((anti-)oestrogenen, (anti-)androgenen, aromataseremmers enz.). Daarnaast moeten eventuele validatierapporten die verwijzen naar FSDT-gegevens met andere soorten door de OESO beoordeeld worden, en moet de uitkomst van de validatie als bevredigend worden beschouwd.
|
Inleidende overwegingen en beperkingen
|
3.
|
VTG wordt normaliter aangemaakt door de lever van vrouwelijke eierleggende gewervelde dieren, als reactie op circulerend endogeen oestrogeen (2). Het is een voorloper van dooiereiwitten. Nadat het in de lever is aangemaakt, gaat het via de bloedsomloop naar de eierstok waar het door ontwikkelende eitjes wordt opgenomen en aangepast. De VTG-synthese is zeer beperkt, maar wel detecteerbaar, bij onvolwassen vissen en volwassen mannelijke vissen omdat zij niet genoeg circulerend oestrogeen hebben. Als reactie op exogene oestrogeenstimulatie kan de lever echter VTG synthetiseren en afscheiden (3) (4) (5).
|
|
4.
|
De meting van VTG dient voor de detectie van stoffen met oestrogene, anti-oestrogene of androgene werkingsmechanismen en stoffen die de steroïdogenese verstoren, zoals bijvoorbeeld aromataseremmers. De detectie van oestrogene stoffen is mogelijk aan de hand van de meting van VTG-inductie bij mannelijke vissen, waarover uitvoerig is geschreven in de collegiaal getoetste wetenschappelijke literatuur. VTG-inductie is ook aangetoond na blootstelling aan aromatiseerbare androgenen (6) (7). Een verlaging van de circulerende oestrogeenspiegel bij vrouwtjes, bijvoorbeeld door remming van het aromatase dat het endogene androgeen omzet in het natuurlijke oestrogeen 17β-oestradiol, veroorzaakt een afname in de VTG-concentratie. Deze wordt gebruikt voor de detectie van stoffen met aromataseremmende eigenschappen of, in bredere zin, van remmers van de steroïdogenese (33). De biologische relevantie van de VTG-respons na remming van oestrogeen/aromatase is vastgesteld en uitvoerig gedocumenteerd (8) (9). Het is echter mogelijk dat de aanmaak van VTG bij vrouwtjes ook verstoord kan worden door algemene toxiciteit en niet-endocriene toxische werkingsmechanismen.
|
|
5.
|
Er zijn meerdere meetmethoden met succes ontwikkeld en gestandaardiseerd voor routinegebruik om VTG te kwantificeren in monsters van bloed, lever, het hele lichaam of kop-/staarthomogenaat uit afzonderlijke vissen. Dit is het geval voor de zebravis, de driedoornige stekelbaars en het Japanse rijstvisje, evenals voor de gedeeltelijk gevalideerde soort dikkop-elrits; er zijn soortspecifieke Enzyme-Linked Immunosorbent Assay- (ELISA-) methoden beschikbaar, waarbij gebruik wordt gemaakt van immunochemie, voor de kwantificering van VTG (5) (10) (11) (12) (13) (14) (15) (16). Bij het Japanse rijstvisje en de zebravis is er een goede correlatie tussen VTG gemeten in bloedplasma-, lever- en homogenaatmonsters, hoewel homogenaten doorgaans iets lagere waarden vertonen dan plasma (17) (18) (19). Aanhangsel 5 beschrijft de aanbevolen procedures voor bemonstering voor VTG-analyse.
|
|
6.
|
Verandering in de fenotypische geslachtsverhouding is een eindpunt dat een afspiegeling is van geslachtsomkering. In principe kunnen oestrogenen, anti-oestrogenen, androgenen, anti-androgenen en remmers van de steroïdogenese de geslachtsverhouding van ontwikkelende vissen beïnvloeden (20). Bij de zebravis is aangetoond dat deze geslachtsomkering gedeeltelijk omkeerbaar is (21) na blootstelling aan oestrogeenachtige stoffen, terwijl de geslachtsomkering na blootstelling aan androgeenachtige stoffen blijvend is (30). Het geslacht wordt gedefinieerd als vrouwelijk, mannelijk, interseksueel (zowel oöcyten als spermatogenetische cellen in één geslachtsklier) of ongedifferentieerd, vastgesteld bij individuele vissen door middel van histologisch onderzoek van de geslachtsklieren. Richtsnoeren zijn te vinden in aanhangsel 7 en in de OESO-leidraad „Diagnosis of Endocrine-Related Histopathology of Fish Gonads” (22).
|
|
7.
|
Het genetische geslacht wordt onderzocht aan de hand van genetische markers, wanneer deze bij een gegeven vissoort aanwezig zijn. Bij het Japanse rijstvisje kunnen de vrouwelijke XX- of mannelijke XY-genen door middel van polymerasekettingreactie (PCR) worden gedetecteerd, of kan het Y-gekoppelde DM-domeingen (DMY) worden geanalyseerd (DMY-negatief of -positief), zoals beschreven in (23) (24). Voor de driedoornige stekelbaars wordt een gelijkwaardige PCR-methode voor genetische geslachtsbepaling beschreven in aanhangsel 10. Wanneer het genetische geslacht individueel gekoppeld kan worden aan het fenotypische geslacht, is het onderscheidend vermogen van de test hoger. Daarom moet het genetische geslacht bepaald worden bij soorten met beschreven genetische geslachtsmarkers.
|
|
8.
|
De twee centrale endocriene eindpunten, VTG en geslachtsverhouding, kunnen samen het endocriene werkingsmechanisme (mode of action, MOA) van de stof aantonen (tabel 1). De geslachtsverhouding is een voor de populatie relevante biomarker (25) (26) en voor enkele goed omschreven werkingsmechanismen kunnen de FSDT-resultaten gebruikt worden voor gevaren- en risicobeoordeling, wanneer dit door de regelgevingsinstantie geschikt wordt bevonden. Deze werkingsmechanismen betreffen op het moment oestrogenen, androgenen en steroïdogeneseremmers.
Tabel 1
Reactie van de endocriene eindpunten op verschillende werkingsmechanismen van stoffen:
↑= verhogend, ↓ = verlagend, — = niet onderzocht
|
MOA
|
VTG ♂
|
VTG ♀
|
Geslachtsverhouding
|
Referenties
|
|
Zwakke oestrogeenagonist
|
↑
|
↑
|
↑♀ of ↑ongediff.
|
(27) (40)
|
|
Sterke oestrogeenagonist
|
↑
|
↑
|
↑♀ of ↑ongediff., geen ♂
|
(28) (40)
|
|
Oestrogeenantagonist
|
—
|
—
|
↓♀, ↑ongediff.
|
(29)
|
|
Androgeenagonist
|
↓ of —
|
↓ of —
|
↑ ♂, geen ♀
|
(28) (30)
|
|
Androgeenantagonist
|
—
|
—
|
↑♀
↑Interseksueel
|
(31)
|
|
Aromataseremmer
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
De FSDT behandelt niet het levensstadium van voortplanting van de vissen en daarom moeten stoffen die vermoedelijk de voortplanting beïnvloeden bij lagere concentraties dan de geslachtelijke ontwikkeling, worden onderzocht in een test die de voortplanting behandelt.
|
|
10.
|
De in deze testmethode gebruikte definities worden gegeven in aanhangsel 1.
|
|
11.
|
De in vivo-FSDT is bedoeld voor de detectie van stoffen met androgene en oestrogene eigenschappen, alsmede anti-androgene, anti-oestrogene en steroïdogenese-remmende eigenschappen. De FSDT-validatiefasen (1 en 2) behandelden oestrogene, androgene en steroïdogenese-remmende stoffen. De effecten in de FSDT van oestrogeen- en androgeenantagonisten staan in tabel 1, maar deze MOA's zijn momenteel minder goed beschreven.
|
PRINCIPE VAN DE TEST
|
12.
|
In de test worden vissen vanaf net bevruchte eitjes tot volledige geslachtsdifferentiatie blootgesteld aan ten minste drie concentraties van de in water opgeloste teststof. De test moet worden uitgevoerd in een doorstroomprocedure, tenzij dit niet mogelijk is wegens de beschikbaarheid of aard (bijv. beperkte oplosbaarheid) van de teststof. De test begint met het plaatsen van net bevruchte eitjes (vóór de splitsing van de kiemschijf) in de testkamers. Het beladen van de kamers wordt voor elke soort beschreven onder punt 27. Voor de gevalideerde vissoorten (het Japanse rijstvisje, de driedoornige stekelbaars en de zebravis) wordt de test beëindigd op 60 dph. Bij beëindiging van de test worden alle vissen op humane wijze gedood. Er wordt een biologisch monster (bloedplasma, lever- of kop-/staarthomogenaat) bij elke vis afgenomen voor VTG-analyse en het overgebleven deel wordt gefixeerd voor histologische evaluatie van de geslachtsklieren om het fenotypische geslacht te bepalen. Eventueel kan er histopathologie (stadiumbepaling van geslachtsklieren, ernst van interseksualiteit) worden verricht. Bij soorten met geschikte markers wordt een biologisch monster (de anaal- of rugvin) genomen voor bepaling van het genetische geslacht (aanhangsels 9 en 10).
|
|
13.
|
Een overzicht van de relevante testomstandigheden specifiek voor gevalideerde soorten (het Japanse rijstvisje, de driedoornige stekelbaars en de zebravis) wordt in aanhangsel 2 gegeven.
|
INFORMATIE OVER DE TESTSTOF
|
14.
|
De resultaten van een acute-toxiciteitstest of andere toxiciteitstest voor de korte termijn [bijv. testmethode C.14 (34) en OESO TG 210 (1)], bij voorkeur uitgevoerd met de voor deze test gekozen soorten, dienen beschikbaar te zijn. Dit betekent dat de oplosbaarheid in water en de dampspanning van de teststof bekend moeten zijn en dat er een betrouwbare analysemethode, met een bekende en gerapporteerde nauwkeurigheid en detectiegrens, beschikbaar is voor de kwantitatieve bepaling van de stof in de testkamers.
|
|
15.
|
Andere nuttige gegevens over de teststof zijn de structuurformule, de zuiverheid van de stof, de stabiliteit van de stof in water en licht, pKa, Pow en de resultaten van een onderzoek naar de mate van gemakkelijke biologische afbreekbaarheid (testmethode C.4) (35).
|
Aanvaardbaarheidscriteria voor de test
|
16.
|
De testresultaten zijn alleen geldig als aan de onderstaande voorwaarden wordt voldaan:
|
—
|
het gehalte aan opgeloste zuurstof moet gedurende de gehele test minimaal 60 % van de verzadigingswaarde van lucht (ASV) zijn geweest;
|
|
—
|
het verschil in watertemperatuur tussen de testkamers mag op geen enkel moment tijdens de blootstelling groter zijn dan ± 1,5 °C. Tevens moet de watertemperatuur gehandhaafd worden binnen het temperatuurbereik dat voor de vissoort wordt gespecificeerd (aanhangsel 2).
|
|
—
|
er moet een gevalideerde methode beschikbaar zijn voor de analyse van de betreffende stof met een detectiegrens ruim onder de laagste nominale concentratie en er moet bewijs worden verzameld om aan te tonen dat de concentraties van de teststof in oplossing op bevredigende wijze binnen ± 20 % van de gemiddelde meetwaarden zijn gehouden;
|
|
—
|
het totale percentage bevruchte eitjes in de controlegroep en eventueel bij de oplosmiddelcontroles, moet groter dan of gelijk zijn aan de minimale percentages zoals gedefinieerd in aanhangsel 2;
|
|
—
|
criteria voor acceptatie met betrekking tot groei en geslachtsverhouding bij beëindiging van de test zijn gebaseerd op gegevens uit de controlegroepen (samengevoegde oplosmiddel- en watercontrole, tenzij deze significant verschillen, in dat geval alleen oplosmiddel):
|
|
Japanse rijstvisje
|
Zebravis
|
Driedoornige stekelbaars
|
|
Groei
|
Natgewicht vis, drooggedept
|
> 150 mg
|
> 75 mg
|
> 120 mg
|
|
Lengte (standaardlengte)
|
> 20mm
|
> 14 mm
|
> 20 mm
|
|
Geslachtsverhouding (% mannetjes of vrouwtjes)
|
30-70 %
|
30-70 %
|
30-70 %
|
|
|
—
|
wanneer een oplosmiddel wordt gebruikt, moet dit geen statistisch significant effect op de overleving hebben en geen hormoonontregelende effecten of andere schadelijke effecten uitoefenen op de vroege levensstadia, zoals aangetoond aan de hand van een oplosmiddelcontrole.
|
Als er wordt afgeweken van de aanvaardbaarheidscriteria voor de test, moeten de gevolgen wat betreft de betrouwbaarheid van de testgegevens in overweging worden genomen en moeten deze overwegingen in de rapportage worden opgenomen.
|
BESCHRIJVING VAN DE TESTMETHODE
Testkamers
|
17.
|
Elke glazen, roestvrijstalen of andere chemisch inerte kamer kan worden gebruikt. De grootte van de kamers moet geschikt zijn om aan de hieronder beschreven densiteitscriteria te kunnen voldoen. Het is wenselijk om de testkamers willekeurig in het testgebied te plaatsen. Een willekeurige blokopzet waarin elke concentratie in elk blok aanwezig is, verdient de voorkeur boven een compleet willekeurig ontwerp. De testkamers moeten worden beschermd tegen ongewenste invloeden van buitenaf.
|
Keuze van de soorten
|
18.
|
In aanhangsel 2 worden aanbevolen vissoorten opgesomd. De procedures voor het opnemen van nieuwe soorten worden onder punt 2 gegeven.
|
Leefomstandigheden van de oudervissen
|
19.
|
Meer informatie over de relatief beste leefomstandigheden voor de oudervissen vindt u in OESO TG 210(1). Oudervissen worden één of twee keer per dag gevoerd met geschikt voer.
|
Omgaan met embryo's en larven
|
20.
|
Aanvankelijk kunnen embryo's en larven binnen een hoofdkamer worden onderverdeeld in kleinere glazen of roestvrijstalen kamers die zijn voorzien van gaaswanden of uiteinden waardoor de teststof vrij door de kamer kan stromen. Een niet-turbulente stroming in deze kleine kamers kan worden verkregen door deze aan een arm te hangen die ze op en neer beweegt en tegelijkertijd de organismen onder water houdt.
|
|
21.
|
Indien er eihouders, roosters of gaaswerken zijn gebruikt om de eitjes in de hoofdtestkamer op hun plaats te houden, moeten deze worden verwijderd zodra de larven uitkomen. Stukken gaas die voorkomen dat vissen ontsnappen, mogen niet worden verwijderd. Als het nodig is om de larven over te plaatsen, mogen ze niet aan de lucht worden blootgesteld en mogen er geen netten worden gebruikt om vissen uit de eihouders te halen. Het moment van overplaatsing is afhankelijk van de soort. Soms is overplaatsing niet nodig.
|
Water
|
22.
|
Elk water waarin de testsoort minstens zo goed kan overleven als in het water dat wordt beschreven in aanhangsel 3, is geschikt als testwater. Gedurende de testperiode moet de waterkwaliteit constant zijn. Om ervoor te zorgen dat het verdunningswater de testresultaten niet noemenswaardig beïnvloedt (bijvoorbeeld door reactie met de teststof) en geen ongunstige invloed heeft op de conditie van de broedvissen, moeten regelmatig monsters worden genomen en geanalyseerd. Totale organische koolstof, geleidbaarheid, pH en gesuspendeerde vaste stoffen moeten bijvoorbeeld elke drie maanden gemeten worden als bekend is dat het verdunningswater betrekkelijk constant van kwaliteit is. Zware metalen (bijv. Cu, Pb, Zn, Hg, Cd, Ni), belangrijke anionen en kationen (bijv. Ca2+, Mg2+, Na+, K+, Cl–, SO42–) en pesticiden moeten gemeten worden als het water van twijfelachtige kwaliteit is. Meer informatie over chemische analyse en waterafname is te vinden onder punt 34.
|
Testoplossingen
|
23.
|
Indien praktisch mogelijk wordt een doorstroomsysteem gebruikt. Voor doorstroomtests is een systeem vereist dat een stamoplossing van de teststof continu verdeelt en verdunt, en ervoor zorgt dat de testkamers de juiste testconcentratie krijgen toegediend (bijvoorbeeld met een doseerpomp, mechanisme voor evenredige verdunning of saturatorsysteem). De stroomsnelheid van de stamoplossingen en het verdunningswater moet regelmatig worden gecontroleerd en mag gedurende de gehele test hooguit 10 % afwijken. Een stroomsnelheid die overeenkomt met ten minste vijf testkamervolumes per 24 uur is wenselijk (1). Het gebruik van plastic slangen of andere materialen die mogelijk biologisch actieve stoffen bevatten of de teststof kunnen opnemen, moet worden vermeden.
|
|
24.
|
De stamoplossing wordt bij voorkeur bereid zonder oplosmiddelen te gebruiken door eenvoudig mengen en schudden van de teststof in het verdunningswater met mechanische middelen (bijvoorbeeld door te roeren of met ultrasone trillingen). Als de teststof moeilijk in water oplosbaar is, moeten procedures zoals beschreven in de OESO-leidraad over aquatische toxiciteitstesten van moeilijke stoffen en mengsels worden gevolgd (36). Het gebruik van oplosmiddelen dient vermeden te worden, maar kan in bepaalde gevallen nodig zijn om een stamoplossing van een passende concentratie te verkrijgen. Voorbeelden van geschikte oplosmiddelen worden in (36) gegeven.
|
|
25.
|
Semistatische testomstandigheden moeten vermeden worden, tenzij deze gerechtvaardigd worden door dwingende redenen met betrekking tot de teststof (bijv. stabiliteit, beperkte beschikbaarheid, hoge kosten of gevaar). Voor de semistatische techniek kunnen twee verschillende verversingsprocedures worden toegepast. Nieuwe testoplossingen worden bereid in schone kamers en overlevende eitjes en larven worden voorzichtig overgeplaatst in de nieuwe kamers, of de testorganismen worden in de testkamers gehouden terwijl een deel (ten minste twee derde) van het testwater dagelijks wordt ververst.
|
PROCEDURE
Blootstellingsomstandigheden
Verzamelen van eitjes en duur
|
26.
|
Om genetische bias te voorkomen, worden eitjes verzameld uit minimaal drie broedparen of groepen, gemengd en willekeurig geselecteerd om aan de test te beginnen. Zie voor de driedoornige stekelbaars de beschrijving van kunstmatige bevruchting in aanhangsel 11. De test begint zo snel mogelijk nadat de eitjes zijn bevrucht, waarbij de embryo's bij voorkeur in de testoplossingen worden ondergedompeld voordat de splitsing van de kiemschijf begint, of zo snel mogelijk na dit stadium en niet later dan 12 uur na bevruchting. De test duurt voort tot de geslachtsdifferentiatie in de controlegroep voltooid is (60 dph voor het Japanse rijstvisje, de driedoornige stekelbaars en de zebravis).
|
Densiteit
|
27.
|
Het aantal bevruchte eitjes aan het begin van de test moet ten minste 120 per concentratie zijn, verdeeld tussen minimaal 4 duplo's (de vierkantswortelindeling mag op de controle worden toegepast). De eitjes worden willekeurig verdeeld (met behulp van statistische tabellen voor randomisatie) tussen testgroepen. De densiteit (zie aanhangsel 1 voor de definitie) moet laag genoeg zijn om te zorgen dat een concentratie opgeloste zuurstof van ten minste 60 % van de ASV gehandhaafd kan worden zonder directe beluchting van de kamers. Bij doorstroomtests wordt een densiteit van maximaal 0,5 g/l per 24 uur en maximaal 5 g/l oplossing op een willekeurig moment aanbevolen. Niet later dan 28 dagen na bevruchting moet het aantal vissen per duplo opnieuw worden verdeeld, zodat elke duplo een zo gelijk mogelijk aantal vissen bevat. Als er aan blootstelling gerelateerde sterfte optreedt, moet het aantal duplo's dienovereenkomstig worden verminderd zodat de visdichtheid tussen testniveaus zo gelijk mogelijk wordt gehouden.
|
Licht en temperatuur
|
28.
|
De fotoperiode en watertemperatuur moeten geschikt zijn voor de testsoort (zie aanhangsel 2 voor proefomstandigheden voor de FSDT).
|
Voeding
|
29.
|
Voedsel en voeding zijn van kritisch belang en het is essentieel dat het juiste voedsel voor elk stadium wordt geleverd met de juiste tussenpozen en in een voldoende mate om normale groei te ondersteunen. Voer dient ad libitum te worden verstrekt met zo min mogelijk overschot. Om een voldoende groeitempo te bereiken, moeten vissen ten minste twee keer per dag worden gevoerd (waarbij eenmaal daags in het weekend wordt aanvaard), met tussenpozen van ten minste drie uur tussen elke voederbeurt. Overmaat aan voer en uitwerpselen moeten voor zover noodzakelijk worden verwijderd om ophoping van afval te vermijden. Naarmate ervaring wordt opgedaan worden voedings- en voerschema's voortdurend verfijnd om de overleving te verbeteren en de groei te optimaliseren. Daarom moet moeite worden gedaan om het voorgestelde schema te laten bevestigen door erkende deskundigen. 24 uur voor het einde van de test moet met voeren worden gestopt. Voorbeelden van geschikt voer worden in aanhangsel 2 opgesomd (zie ook de Fish Testing Framework van de OESO (39)).
|
Testconcentraties
|
30.
|
Teststoffen worden gespreid zoals beschreven in aanhangsel 4. Er worden minimaal drie testconcentraties in ten minste vier duplo's gebruikt. Bij het selecteren van de reeks concentraties moet rekening worden gehouden met de curve van LC50 tegen blootstellingsperiode tijdens de acute toxiciteitsonderzoeken. Vijf testconcentraties worden aanbevolen als de gegevens worden gebruikt voor risicobeoordeling.
|
|
31.
|
Er hoeven geen concentraties van de stof te worden gebruikt die hoger zijn dan de LC50 of, indien dit lager is, 10 mg/l. De maximale testconcentratie voor het larve-/juveniele stadium is 10 % van de LC50.
|
Controles
|
32.
|
Een controle van verdunningswater (≥ 4 duplo's) en, indien van toepassing, een oplosmiddelcontrole (≥ 4 duplo's) worden naast de testconcentraties gebruikt. Bij de test mogen alleen oplosmiddelen worden gebruikt waarvan na onderzoek is vastgesteld dat ze geen statistisch significante invloed op de testeindpunten hebben.
|
|
33.
|
Wanneer een oplosmiddel wordt gebruikt, mag de eindconcentratie niet hoger zijn dan 0,1 ml/l (36) en deze moet in alle testkamers dezelfde zijn, behalve in de controle met verdunningswater. Elke inspanning moet echter worden gedaan om het gebruik van een oplosmiddel te vermijden of om de oplosmiddelconcentratie tot een minimum te beperken.
|
Frequentie van analytische bepalingen en metingen
|
34.
|
Alvorens de test te starten, wordt een chemische analyse van de teststofconcentratie verricht om te controleren of aan de aanvaardbaarheidscriteria wordt voldaan. Alle duplo's worden aan het begin en eind van de test afzonderlijk geanalyseerd. Eén duplo per testconcentratie wordt tijdens de test ten minste eens per week geanalyseerd, waarbij systematisch tussen de duplo's wordt gewisseld (1,2,3,4,1,2….). Als er monsters worden opgeslagen om later te worden geanalyseerd, moet de opslagmethode van de monsters eerder zijn gevalideerd. De monsters moeten worden gefiltreerd (bijv. met een poriëngrootte van 0,45 μm) of gecentrifugeerd om te garanderen dat de bepalingen worden verricht op de stof in de oplossing.
|
|
35.
|
Tijdens de test worden opgeloste zuurstof, pH, totale hardheid, geleidbaarheid, zoutgehalte (indien relevant) en temperatuur in alle testkamers gemeten. Opgeloste zuurstof, zoutgehalte (indien relevant) en temperatuur worden minimaal wekelijks gemeten, en pH, geleidbaarheid en hardheid aan het begin en eind van de test. De temperatuur moet bij voorkeur in ten minste één testkamer continu worden gecontroleerd.
|
|
36.
|
De resultaten moeten gebaseerd zijn op gemeten concentraties. Als de concentratie van de teststof in oplossing gedurende de gehele test echter op bevredigende wijze binnen ± 20 % van de nominale concentratie is gehouden, dan kunnen de resultaten worden gebaseerd op de nominale waarden of de gemeten waarden.
|
Waarnemingen en metingen
Stadium van embryonale ontwikkeling
|
37.
|
De blootstelling begint zo snel mogelijk na de bevruchting en voordat de splitsing van de kiemschijf begint, en niet later dan 12 uur na de bevruchting om te zorgen voor blootstelling tijdens de vroege embryonale ontwikkeling.
|
Uitkomen en overleven
|
38.
|
Minimaal één keer per dag moet uitkomen en overleven worden geobserveerd en de aantallen geregistreerd. Dode embryo's, larven en juveniele vissen moeten direct nadat ze worden opgemerkt, worden verwijderd, omdat ze snel kunnen ontbinden en door de andere vissen afgebroken kunnen worden. Het verwijderen van dode organismen moet zeer voorzichtig gebeuren om aanstoten en beschadigen van naastgelegen eitjes/larven te voorkomen. Deze zijn namelijk uitermate fragiel en gevoelig. De criteria voor „dood” variëren per stadium:
|
—
|
eitjes: met name in de eerste stadia duidelijk minder doorzichtig en een verandering van kleur als gevolg van coagulatie en/of precipitatie van proteïne, hetgeen resulteert in een wit ondoorschijnend uiterlijk;
|
|
—
|
larven en juveniele vissen: onbeweeglijkheid en/of geen ademhaling en/of geen hartslag en/of witte ondoorschijnende kleur van het centrale zenuwstelsel en/of geen reactie op een mechanische prikkel.
|
|
Afwijkend uiterlijk
|
39.
|
Het aantal larven of vissen met een afwijkende lichaamsvorm wordt geregistreerd, en het uiterlijk en de aard van de afwijking worden beschreven. Embryo's en larven met een afwijking kunnen van nature voorkomen en bij sommige vissoorten kan het aantal oplopen tot enkele procenten van de controlegroep(en). Dieren met een afwijking mogen alleen uit de testkamers worden verwijderd als ze dood zijn. Volgens Richtlijn 2010/63/EU van het Europees Parlement en van de Raad van 22 september 2010 betreffende de bescherming van dieren die voor wetenschappelijke doeleinden worden gebruikt, moeten de dieren, als de afwijkingen leiden tot pijn, lijden en angst of blijvende schade en als de dood betrouwbaar kan worden voorspeld, worden verdoofd en gedood volgens de beschrijving onder punt 44 en voor de gegevensanalyse worden behandeld als sterfte.
|
Afwijkend gedrag
|
40.
|
Afwijkingen, zoals hyperventilatie, ongecoördineerd zwemmen, atypische onbeweeglijkheid en atypisch eetgedrag worden bij constatering gerapporteerd.
|
Gewicht
|
41.
|
Aan het eind van de test worden alle overlevende vissen gedood (verdoofd als er bloedmonsters moeten worden afgenomen) en wordt het individuele natgewicht (drooggedept) gemeten.
|
Lengte
|
42.
|
Aan het eind van de test wordt de individuele lengte (standaardlengte) gemeten.
|
|
43.
|
Deze waarnemingen zullen leiden tot enkele van of alle onderstaande gegevens die beschikbaar zijn voor rapportage:
|
—
|
aantal gezonde vissen aan het eind van de test;
|
|
—
|
tijd tot begin van uitkomen en einde van uitkomen;
|
|
—
|
lengte en gewicht van overlevende dieren;
|
|
—
|
aantal misvormde larven;
|
|
—
|
aantal vissen dat afwijkend gedrag vertoont.
|
|
Bemonstering van vissen
|
44.
|
Bemonstering van vissen wordt bij beëindiging van de test verricht. Vissen waarbij bemonstering wordt verricht, worden gedood met bijv. MS-222 (100-500 mg per l, gebufferd met 200 mg NaHCO3 per l) of FA-100 (4-allyl-2-methoxyfenol: eugenol) en individueel gemeten en gewogen als natgewicht (drooggedept), of verdoofd als er een bloedmonster moet worden genomen (zie punt 49).
|
Bemonstering voor VTG-analyse en geslachtsbepaling via histologische evaluatie
|
45.
|
Alle vissen worden bemonsterd en voorbereid voor analyse van het geslacht en VTG. Alle vissen worden histologisch geanalyseerd om het geslacht te bepalen. Voor de VTG-metingen wordt een deelsteekproef van ten minste 16 vissen uit elke duplo aanvaard. Er moeten meer vissen op VTG worden geanalyseerd als de resultaten van de deelsteekproef onduidelijk blijken.
|
|
46.
|
De bemonsteringsprocedure voor VTG en geslachtsbepaling hangt af van de VTG-analysemethoden:
|
Kop-/staarthomogenaat-methode voor VTG-analyse
|
47.
|
De vis wordt gedood. Kop en staart van elke vis worden van het lichaam van de vis gescheiden door middel van sneden net achter de borstvinnen en net achter de rugvin, met behulp van een scalpel (zie figuur 1). De kop- en staartdelen van elke vis worden samengevoegd, gewogen en afzonderlijk genummerd, in vloeibare stikstof ingevroren en bewaard bij – 70 °C of kouder voor VTG-analyse. Het lichaamsdeel van de vis wordt genummerd en gefixeerd in een geschikt fixeermiddel voor histologische evaluatie (22). Via deze methode worden VTG en histopathologie geëvalueerd voor elk individu en kan derhalve een mogelijke verandering in het VTG-niveau worden gerelateerd aan het fenotypische geslacht van de vis of het genetische geslacht (het Japanse rijstvisje en de driedoornige stekelbaars) van de vis. Zie voor meer informatie het richtsnoer voor homogenisatie (aanhangsel 5) en het richtsnoer voor VTG-kwantificering (aanhangsel 6).
|
Leverhomogenaat-methode voor VTG-analyse
|
48.
|
De vis wordt gedood. De lever wordt uitgesneden en bewaard bij – 70 °C of kouder. Aanbevolen procedures voor het uitsnijden van de lever en voorbehandeling zijn te vinden in OESO TG 229 (37) of hoofdstuk C.37 van dit aanhangsel (38). De levers worden daarna individueel gehomogeniseerd zoals beschreven in OESO TG 229 of hoofdstuk C.37 van dit aanhangsel. Het verzamelde supernatans wordt gebruikt voor het meten van VTG met behulp van een homologe ELISA-techniek (zie aanhangsel 6 voor een voorbeeld van kwantificering bij de zebravis of OESO TG 229 (37) voor het Japanse rijstvisje). Volgens deze benadering is het ook mogelijk om gegevens van afzonderlijke vissen over zowel VTG als histologie van de geslachtsklieren te verkrijgen.
|
Bloedplasmamethode voor VTG-analyse
|
49.
|
Bloed wordt uit de verdoofde vis afgenomen door middel van hartpunctie, snede in de caudale ader of staart, en bij 4 °C gecentrifugeerd voor verzameling van plasma. Het plasma wordt bewaard bij – 70 °C of kouder tot gebruik. De hele vis wordt gedood en gefixeerd voor histologie. Zowel plasmamonsters als vissen worden individueel genummerd om de VTG-niveaus aan het geslacht van de vis te kunnen relateren.
Figuur 1
Het snijden van een vis voor VTG-meting in kop-/staarthomogenaat en histologische evaluatie van het middendeel

|
Bepaling van het genetische geslacht
|
50.
|
Een biologisch monster voor de bepaling van het genetische geslacht wordt bij afzonderlijke vissen afgenomen bij soorten met geschikte markers. Bij het Japanse rijstvisje wordt de anaalvin of rugvin afgenomen. Een uitvoerige beschrijving wordt gegeven in aanhangsel 9, waarin ook weefselbemonstering en geslachtsbepaling aan de hand van een PCR-methode aan de orde komen. In aanhangsel 10 worden weefselbemonstering en geslachtsbepaling aan de hand van een PCR-methode voor de driedoornige stekelbaars beschreven.
|
VTG-meting
|
51.
|
De meting van VTG moet gebaseerd zijn op een kwantitatieve en analytisch gevalideerde methode. Er moet informatie beschikbaar zijn over de variabiliteit tussen en binnen testen van de gebruikte methode in een laboratorium. De bron van de variabiliteit tussen en binnen laboratoria is (hoogstwaarschijnlijk) gebaseerd op de verschillende ontwikkelingsstadia van de vispopulatie. Gezien de variabiliteit van VTG-meting, moeten NOEC's op basis van dit eindpunt met grote zorgvuldigheid worden behandeld. Er zijn verschillende methoden beschikbaar om de aanmaak van VTG in de voor deze test relevante vissoorten te beoordelen. Een relatief gevoelige en specifieke meettechniek is de bepaling van eiwitconcentraties aan de hand van een enzymgekoppelde immunosorbent-assay (ELISA). Er moeten homologe antilichamen (opgewekt tegen VTG van dezelfde soort) en de belangrijkste homologe standaarden worden gebruikt.
|
Geslachtsbepaling
|
52.
|
Afhankelijk van de VTG-bemonsteringsprocedure wordt de hele vis of het resterende middendeel van de vis in een vooraf geëtiketteerde verwerkingscassette geplaatst en gefixeerd in een geschikt fixeermiddel voor histologische geslachtsbepaling (eventueel ook voor stadiumbepaling van de geslachtsklieren). Richtsnoeren over fixatie en inbedding zijn te vinden in aanhangsel 7 en in de OESO-leidraad „Diagnosis of Endocrine-Related Histopathology of Fish Gonads” (22). Na verwerking wordt de vis ingebed in paraffineblokken. De afzonderlijke vissen worden in de lengte in het paraffineblok geplaatst. Uit elk organisme worden ten minste zes lengtecoupes (3-5 μm dik) genomen in een frontaal vlak inclusief geslachtsklierweefsel uit beide geslachtsklieren. De ruimte tussen deze coupes is ongeveer 50 μm voor mannetjes en 250 μm voor vrouwtjes. Maar omdat elk blok vaak zowel mannetjes als vrouwtjes bevat (als er meer dan één organisme in elk blok ingebed wordt), moet de ruimte tussen coupes uit deze blokken ongeveer 50 μm zijn totdat er ten minste zes coupes van de geslachtsklieren uit elk mannetje worden verkregen. Daarna kan de ruimte tussen coupes worden vergroot tot ongeveer 250 μm voor de vrouwtjes. De coupes worden daarna gekleurd met hematoxyline en eosine, en met een lichtmicroscoop onderzocht op geslacht (mannelijk, vrouwelijk, interseksueel of ongedifferentieerd). Interseksueel wordt gedefinieerd als de aanwezigheid van meer dan één oöcyt in testis per zes geanalyseerde coupes of spermatogenetische cellen (ja/nee) in eierstokken. Histopathologie en stadiumbepaling van eierstokken en testis is optioneel, maar als hieraan onderzoek wordt verricht moeten de resultaten statistisch geanalyseerd en gerapporteerd worden. Opgemerkt moet worden dat bij sommige vissoorten van nature een volledig ontwikkeld paar geslachtsklieren ontbreekt en er mogelijk slechts één geslachtsklier aanwezig is (bijv. bij het Japanse rijstvisje en soms bij de zebravis). Al dit soort waarnemingen moet worden gerapporteerd.
|
|
53.
|
De genetische geslachtsbepaling van afzonderlijke Japanse rijstvisjes is gebaseerd op de aanwezigheid of afwezigheid van het mannelijk-geslachtsbepalende gen, DMY, dat zich op het Y-chromosoom bevindt. Het genotypische geslacht van het rijstvisje kan vastgesteld worden door sequencing van het DMY-gen uit DNA dat verkregen is uit bijvoorbeeld een stuk aars- of rugvin. De aanwezigheid van DMY wijst ongeacht het fenotype op een XY-individu (mannetje), terwijl de afwezigheid van DMY ongeacht het fenotype wijst op een XX-individu (vrouwtje) (23). In aanhangsel 9 wordt een richtsnoer gegeven voor het prepareren van weefsel en de PCR-methode. De genetische geslachtsbepaling van afzonderlijke driedoornige stekelbaarzen wordt ook aan de hand van een PCR-methode uitgevoerd, zoals beschreven in aanhangsel 10.
|
|
54.
|
Het aantreffen van interseksuele dieren (zie aanhangsel 1 voor de definitie) moet worden gerapporteerd.
|
Secundaire geslachtskenmerken
|
55.
|
Secundaire geslachtskenmerken staan bij soorten zoals het Japanse rijstvisje onder endocriene controle. Daarom worden waarnemingen van het fysieke voorkomen van de vissen indien mogelijk aan het einde van de blootstelling gedaan. Bij het Japanse rijstvisje is de vorming van papillen op het achtereinde van de anaalvin bij vrouwtjes gevoelig voor androgenen. In hoofdstuk C.37 van dit aanhangsel (38) staan relevante foto's van mannelijke secundaire geslachtskenmerken en geandrogeniseerde vrouwtjes.
|
GEGEVENS EN RAPPORTAGE
Bewerking van de resultaten
|
56.
|
Het is van belang dat de sterkste geldige statistische test het eindpunt bepaalt. De duplo is de experimentele eenheid, maar variabiliteit tussen duplo's moet in de statistische toetsing opgenomen worden. In aanhangsel 8 staat een beslisboom om te helpen de meest geschikte statistische test te kiezen op basis van het kenmerk van de uit de test verkregen gegevens. Het statistische significantieniveau is voor alle eindpunten 0,05.
|
Geslachtsverhoudingen en genetisch geslacht
|
57.
|
De geslachtsverhoudingen worden geanalyseerd op significant effect (NOEC/LOEC-benadering) van blootstelling volgens Jonckheere-Terpstra (trendtoets) als er een monotone dosisrespons bestaat. Als er niet-monotoniciteit wordt gevonden, dan wordt een paarsgewijze toets toegepast: Gebruik de Dunnett-toets als er normaliteit en homogene variantie kan worden verkregen. Gebruik Tamhane-Dunnett als er heterogene variantie aanwezig is. Gebruik anders de exacte Mann-Whitney-toets met Bonferroni-Holm-correctie. In aanhangsel 8 staat een stroomdiagram dat de statistieken van de geslachtsverhoudingen beschrijft. De geslachtsverhoudingen worden gepresenteerd in tabellen als concentratieverhoudingen ± SD van mannelijke, vrouwelijke, interseksuele en ongedifferentieerde organismen. Statistische significantie wordt gemarkeerd. Voorbeelden worden beschreven in het FSDT Phase 2 validatierapport (42). Het genetische geslacht wordt gerapporteerd als percentage van fenotypische geslachtsomkering van mannelijke, vrouwelijke, interseksuele en ongedifferentieerde organismen.
|
VTG-concentraties
|
58.
|
VTG-concentraties worden geanalyseerd op significant effect (NOEC/LOEC-benadering) van blootstelling. De Dunnett-toets wordt verkozen boven de t-toets met Bonferroni-correctie. Als er een Bonferroni-correctie wordt gebruikt, verdient de Bonferroni-Holm-correctie de voorkeur. Er moet voorzien worden in log-transformatie van VTG om normaliteit en homogeniteit van variantie te bereiken. Als de concentratie-respons overeenkomt met monotoniciteit, dan verdient de Jonckheere-Terpstra-toets de voorkeur boven elk van bovenstaande. Als de t-toets of Dunnett-toets wordt gebruikt, is er geen ANOVA significantie-F-toets nodig om verder te gaan. Zie het stroomdiagram in aanhangsel 8 voor details. De resultaten worden gerapporteerd in tabellen als concentratiegemiddelden ± SD afzonderlijk voor mannelijke, vrouwelijke, interseksuele en ongedifferentieerde organismen. Statistische significantie voor fenotypische vrouwtjes en fenotypische mannetjes wordt gemarkeerd. Voorbeelden worden beschreven in het FSDT Phase 2 validatierapport (42).
|
Teststof: feitelijke concentraties
|
59.
|
De feitelijke concentraties van de teststof in de kamer worden geanalyseerd in de onder punt 34 beschreven frequenties. De resultaten worden gerapporteerd in tabellen als gemiddelde concentratie ± SD op basis van duplo en op basis van concentratie, met informatie over het aantal monsters en met gemarkeerde uitschieters van de gemiddelde testconcentratie ± 20 %. Voorbeelden worden beschreven in het FSDT Phase 2 validatierapport (42).
|
Interpretatie van resultaten
|
60.
|
De testresultaten moeten met de nodige omzichtigheid worden geïnterpreteerd als de gemeten concentraties van de teststof in testoplossingen dicht bij de detectiegrens van de analysemethode liggen.
|
Testverslag
|
61.
|
In het testverslag moeten de volgende gegevens worden opgenomen:
|
|
Teststof
|
—
|
Relevante fysisch-chemische kenmerken; chemische identificatiegegevens met inbegrip van de zuiverheid en de analysemethode voor het bepalen van de teststof.
|
|
|
|
Testomstandigheden
|
—
|
Toegepaste testprocedure (bijv. doorstroom semistatisch/verversing); testopzet, inclusief testconcentraties, bereidingsmethode van stamoplossingen (in een bijlage), verversingsfrequentie (indien een ontsluitingsmiddel is gebruikt, moet de concentratie daarvan worden vermeld);
|
|
—
|
Nominale testconcentraties, de gemiddelden van de in de testkamers gemeten waarden en de standaardafwijkingen en de methode waarmee zij zijn bepaald (de gebruikte analysemethode wordt in een bijlage beschreven); gegevens waaruit blijkt dat de resultaten van de metingen betrekking hebben op de concentraties van de teststof in de oplossing;
|
|
—
|
Waterkwaliteit in de testkamers: pH, hardheid, temperatuur en gehalte aan opgeloste zuurstof;
|
|
—
|
Gedetailleerde informatie over de voeding (bijv. type voedsel, leverancier, het rantsoen en de frequentie, en analyses van verontreinigingen (bijv. PCB's, PAK's en organochloor-pesticiden), indien relevant).
|
|
|
|
Resultaten
|
—
|
Gegevens waaruit blijkt dat de controlegroepen voldeden aan de validiteitscriteria: gegevens over het uitkomstpercentage worden gepresenteerd in tabellen als percentage per duplo en per concentratie. Uitschieters van de aanvaardingscriteria (in controlegroepen) worden gemarkeerd. Overleving wordt gepresenteerd als percentage per duplo en per concentratie. Uitschieters van de aanvaardingscriteria (in controlegroepen) worden gemarkeerd;
|
|
—
|
Duidelijke indicatie van de verkregen resultaten over de verschillende waargenomen eindpunten: embryonale overleving en uitkomen eitjes; uitwendige afwijkingen; lengte en gewicht; VTG-metingen (ng/g homogenaat, ng/ml plasma of ng/mg lever); histologie van de geslachtsklieren, geslachtsverhouding, gegevens over het genetische geslacht; incidentie van eventuele ongewone reacties van de vissen en eventuele door de teststof veroorzaakte zichtbare effecten.
|
|
|
|
62.
|
De resultaten worden weergegeven als gemiddelde waarden ± standaardafwijking (SD) of standaardfout (SE). De statistieken worden gerapporteerd als minimaal NOEC en LOEC en betrouwbaarheidsintervallen. Het statistische stroomdiagram (aanhangsel 8) wordt gevolgd.
|
LITERATUUR
|
(1)
|
OESO (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OESO, Parijs.
|
|
(2)
|
Jobling, S., D. Sheahan, J.A. Osborne, P. Matthiessen, and J.P. Sumpter, 1996, „Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals”, Environmental Toxicology and Chemistry 15, blz. 194-202.
|
|
(3)
|
Sumpter, J.P. and S. Jobling, 1995, „Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment”, Environmental Health Perspectives 103, blz. 173-178.
|
|
(4)
|
Tyler, C.R., R.van Aerle, T.H. Hutchinson, S. Maddix, and H. Trip (1999), „An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin”, Environmental Toxicology and Chemistry 18, blz. 337-347.
|
|
(5)
|
Holbech, H., L. Andersen, G.I. Petersen, B. Korsgaard, K.L. Pedersen, and P. Bjerregaard (2001a), „Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, blz. 119-131.
|
|
(6)
|
Andersen, L., P. Bjerregaard, and B. Korsgaard ( 2003), „Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters”, Fish Physiology and Biochemistry 28, blz. 319-321.
|
|
(7)
|
Orn, S., H. Holbech, T.H. Madsen, L. Norrgren, and G.I. Petersen (2003), „Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone”, Aquatic Toxicology 65, blz. 397-411.
|
|
(8)
|
Panter, G.H., T.H. Hutchinson, R. Lange, C.M. Lye, J.P. Sumpter, M. Zerulla, and C.R. Tyler (2002), „Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances”, Environmental Toxicology and Chemistry 21, blz. 319-326.
|
|
(9)
|
Sun, L.W., J.M. Zha, P.A. Spear, and Z.J. Wang (2007), „Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, blz. 533-541.
|
|
(10)
|
Parks, L.G., A.O. Cheek, N.D. Denslow, S.A. Heppell, J.A. McLachlan, G.A. LeBlanc, and C.V.Sullivan (1999), „Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, blz. 113-125.
|
|
(11)
|
Brion, F., B.M. Nilsen, J.K. Eidem, A. Goksoyr, and J.M. Porcher (2002), „Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)”, Environmental Toxicology and Chemistry 21, blz. 1699-1708.
|
|
(12)
|
Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara, and E. Tamiya (2002), „Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, blz. 161-169.
|
|
(13)
|
Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James, and B.E. Bengtsson (2004), „The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption — II — kidney hypertrophy, vitellogenin and spiggin induction”, Aquatic Toxicology 70, blz. 311-326.
|
|
(14)
|
Tatarazako, N., M. Koshio, H. Hori, M. Morita, and T. Iguchi (2004), „Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka”, Journal of Health Science 50, blz. 301-308.
|
|
(15)
|
Eidem, J.K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Panter, T. Hutchinson, and A. Goksoyr (2006), „Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology”, 78, blz. 202-206.
|
|
(16)
|
Jensen, K.M. and G.T. Ankley (2006), „Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)”, Ecotoxicology and Environmental Safety 64, blz. 101-105.
|
|
(17)
|
Holbech, H., Petersen, G. I., Norman, A., Örn, S, Norrgren, L., and Bjerregaard, P (2001b), „Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)”, Nordic Council of Ministers, TemaNord 2001:597, blz. 48-51.
|
|
(18)
|
Nilsen, B.M., K. Berg, J.K. Eidem, S.I. Kristiansen, F. Brion, J.M. Porcher, and A. Goksoyr (2004), „Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening”, Analytical and Bioanalytical Chemistry 378, blz. 621-633.
|
|
(19)
|
Orn, S., S. Yamani, and L. Norrgren (2006), „Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone”, Archives of Environmental Contamination and Toxicology 51, blz. 237-243.
|
|
(20)
|
Scholz, S. and N. Kluver (2009), „Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish, Sexual Development 3”, blz. 136-151.
|
|
(21)
|
Fenske, M., G. Maack, C. Schafers, and H. Segner (2005), „An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio”, Environmental Toxicology and Chemistry 24, blz. 1088-1098.
|
|
(22)
|
OESO (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OESO, Parijs.
|
|
(23)
|
Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi, A. Suzuki, N. Saito, M. Nakamoto, N. Shibata, and Y. Nagahama (2004), „Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes”, Developmental Dynamics 231, blz. 518-526.
|
|
(24)
|
Shinomiya, A., H. Otake, K. Togashi, S. Hamaguchi, and M. Sakaizumi (2004), „Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations”, Zoological Science 21, blz. 613-619.
|
|
(25)
|
Kidd, K.A., P.J. Blanchfield, K.H. Mills, V.P. Palace, R.E. Evans, J.M. Lazorchak, and R.W. Flick (2007), „Collapse of a fish population after exposure to a synthetic estrogen”, Proceedings of the National Academy of Sciences of the United States of America 104, blz. 8897-8901.
|
|
(26)
|
Palace,V.P., R.E. Evans, K.G. Wautier, K.H. Mills, P.J. Blanchfield, B.J. Park, C.L. Baron, and K.A. Kidd (2009), „Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake”, Canadian Journal of Fisheries and Aquatic Sciences 66, blz. 1920-1935.
|
|
(27)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, J. Bamforth, R.D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno, and C.R. Tyler (2006), „Development of chronic tests for endocrine active chemicals — Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)”, Aquatic Toxicology 77, blz. 279-290.
|
|
(28)
|
Holbech, H., K. Kinnberg, G.I. Petersen, P. Jackson, K. Hylland, L. Norrgren, and P. Bjerregaard (2006), „Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, blz. 57-66.
|
|
(29)
|
Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard, and P. Bjerregaard (2004), „Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)”, Fish Physiology and Biochemistry 30, blz. 257-266.
|
|
(30)
|
Morthorst, J.E., H. Holbech, and P. Bjerregaard (2010), „Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations”, Aquatic Toxicology 98, blz. 336-343.
|
|
(31)
|
Kiparissis,Y., T.L. Metcalfe, G.C. Balch, and C.D. Metcalf (2003), „Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)”, Aquatic Toxicology 63, blz. 391-403.
|
|
(32)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, A. Sherren, R.D. Stanley, and C.R. Tyler (2004), „Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development”, Aquatic Toxicology 70, blz. 11-21.
|
|
(33)
|
Kinnberg, K., H. Holbech, G.I. Petersen, and P. Bjerregaard (2007), „Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, blz. 165-170.
|
|
(34)
|
Hoofdstuk C.14 van deze bijlage, Groeitest onvolwassen vissen.
|
|
(35)
|
Hoofdstuk C.4 van deze bijlage, Gemakkelijke biologische afbreekbaarheid.
|
|
(36)
|
OESO (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OESO, Parijs.
|
|
(37)
|
OESO (2009), Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OESO, Parijs.
|
|
(38)
|
Hoofdstuk C.37 van deze bijlage, 21-Day Fish Assay: A Short Term Screening for Oestrogenic and Androgenic Activity, and Aromatase Inhibition.
|
|
(39)
|
OESO (2012), Fish Toxicity Testing Framework, Series on Testing and Assessment No. 171, OESO, Parijs
|
|
(40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H (2007), „Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio” Journal of Toxicology and Environmental Health-Part A, 70, 9-10 pp 768-779.
|
|
(41)
|
OESO (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OESO, Parijs.
|
|
(42)
|
OESO (2011), Validation Report ( Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OESO, Parijs.
|
|
(43)
|
OESO (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OESO, Parijs.
|
|
(44)
|
Richtlijn 2010/63/EU van het Europees Parlement en de Raad van 22 september 2010 betreffende de bescherming van dieren die voor wetenschappelijke doeleinden worden gebruikt. PB L 276 van 20.10.2010, blz. 33.
|
Aanhangsel 1
Afkortingen en definities
Apicaal eindpunt
: causaal effect op populatieniveau
ASV
: verzadigingswaarde van lucht
Biomarker
: causaal effect op individueel niveau
Densiteit
: natgewicht aan vis per volume water
Dph
: dagen na uitkomen
DMY
: Y-specifiek DM-domein-gen dat nodig is voor mannelijke ontwikkeling bij het Japanse rijstvisje
ELISA
: enzyme-linked immunosorbent assay
FSDT
: geslachtelijke-ontwikkelingstest met vissen
HPG-as
: hypothalamus-hypofyse-gonaden-as
Interseksuele vis
: vis met meer dan één oöcyt in testis per zes geanalyseerde coupes of spermatogenetische cellen in eierstokken (ja/nee)
MOA
: werkingsmechanisme
Ongedifferentieerde vis
: vis met geslachtsklieren zonder waarneembare kiemcellen.
RT-PCR
: reverse-transcriptase-polymerasekettingreactie
Stof
: een stof of mengsel.
Teststof
: alle volgens deze testmethode geteste stoffen of mengsels.
Visgewicht
: Natgewicht vis (drooggedept)
VTG
: vitellogenine
Aanhangsel 2
Testomstandigheden voor de FSDT (zoetwatersoorten)
|
|
Japanse rijstvisje (Oryzias latipes)
|
Zebravis (Danio rerio)
|
Driedoornige stekelbaars (Gasterostreus aculeatus)
|
|
|
Doorstroom of semistatisch
|
Doorstroom of semistatisch
|
Doorstroom of semistatisch
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
|
Fluorescente lampen (breed spectrum)
|
Fluorescente lampen (breed spectrum)
|
Fluorescente lampen (breed spectrum)
|
|
|
10-20 μE/m2/s, 540-1 080 lux of 50-100 ft-c (omgevingsniveau in laboratorium)
|
10-20 μE/m2/s, 540-1 080 lux of 50-100 ft-c (omgevingsniveau in laboratorium)
|
10-20 μE/m2/s, 540-1 080 lux of 50-100 ft-c (omgevingsniveau in laboratorium)
|
|
|
12-16 h licht, 8-12 h donker
|
12-16 h licht, 8-12 h donker
|
16 h licht, 8 h donker
|
|
|
Afzonderlijke kamers moeten minimaal 7 l water bevatten
|
Afzonderlijke kamers moeten minimaal 7 l water bevatten
|
Afzonderlijke kamers moeten minimaal 7 l water bevatten
|
|
8.
|
Volumewisselingen van testoplossingen
|
|
Minimaal 5 per dag
|
Minimaal 5 per dag
|
Minimaal 5 per dag
|
|
9.
|
Leeftijd van testorganisme aan het begin van blootstelling
|
|
Net bevruchte eitjes (vroeg blastulastadium)
|
Net bevruchte eitjes (vroeg blastulastadium)
|
Net bevruchte eitjes
|
|
10.
|
Aantal eitjes per behandeling
|
|
Ten minste 120
|
Ten minste 120
|
Ten minste 120
|
|
|
Minimaal 3 (plus afdoende controles)
|
Minimaal 3 (plus afdoende controles)
|
Minimaal 3 (plus afdoende controles)
|
|
12.
|
Aantal duplo's per behandeling
|
|
Minimaal 4 (tenzij de vierkantswortelindeling op de controles wordt toegepast)
|
Minimaal 4 (tenzij de vierkantswortelindeling op de controles wordt toegepast)
|
Minimaal 4 (tenzij de vierkantswortelindeling op de controles wordt toegepast)
|
|
|
Levende Artemia, bevroren volwassen pekelkreeftjes, voervlokken enz. Het wordt aanbevolen om twee keer per dag te voeren
|
Speciaal voer voor jonge vissen, levende Artemia, bevroren volwassen pekelkreeftjes, voervlokken enz. Het wordt aanbevolen om twee keer per dag te voeren
|
Levende Artemia, bevroren volwassen pekelkreeftjes, voervlokken enz. Het wordt aanbevolen om twee keer per dag te voeren
|
|
|
Geen, tenzij de concentratie opgeloste zuurstof onder 60 % verzadiging daalt
|
Geen, tenzij de concentratie opgeloste zuurstof onder 60 % verzadiging daalt
|
Geen, tenzij de concentratie opgeloste zuurstof onder 70 % verzadiging daalt
|
|
|
Schoon oppervlaktewater, bronwater of synthetisch water
|
Schoon oppervlaktewater, bronwater of synthetisch water
|
Schoon oppervlaktewater, bronwater of synthetisch water
|
|
16.
|
Duur van blootstelling aan teststof
|
|
60 dph
|
60 dph
|
60 dph
|
|
17.
|
Biologische eindpunten
|
|
Uitkomen eitjes, overleving, macroscopische morfologie, VTG,histologie van geslachtsklieren, genetisch geslacht,geslachtsverhouding
|
Uitkomen eitjes, overleving,macroscopische morfologie, VTG,histologie van geslachtsklieren, geslachtsverhouding
|
Uitkomen eitjes, overleving,macroscopische morfologie, VTG,histologie van geslachtsklieren, geslachtsverhouding
|
|
18.
|
Aanvaardbaarheidscriteria van de test voor samengevoegde duplo's van controles
|
|
Uitkomen eitjes > 80 %
|
Uitkomen eitjes > 80 %
|
Uitkomen eitjes > 80 %
|
|
Overleving na uitkomen ≥ 70 %
|
Overleving na uitkomen eitjes ≥ 70 %
|
Overleving na uitkomen eitjes ≥ 70 %
|
|
groei (natgewicht vis, drooggedept) > 150 mg
|
groei (natgewicht vis, drooggedept) > 75 mg
|
groei (natgewicht vis, drooggedept) > 120 mg
|
|
Lengte (standaardlengte) > 20 mm
|
Lengte (standaardlengte) > 14 mm
|
Lengte (standaardlengte) > 20 mm
|
|
Geslachtsverhouding (% mannetjes of vrouwtjes)
30 %-70 %
|
Geslachtsverhouding (% mannetjes of vrouwtjes) 30 %-70 %
|
Geslachtsverhouding (% mannetjes of vrouwtjes) 30 %-70 %
|
Aanhangsel 3
Chemische kenmeken van aanvaardbaar verdunningswater
|
BESTANDDEEL
|
CONCENTRATIE
|
|
Deeltjes
|
< 20 mg/l
|
|
Totale hoeveelheid organische koolstof
|
< 2 mg/l
|
|
Niet-geïoniseerde ammonium
|
< 1 ug/l
|
|
Chloorresiduen
|
< 10 μg/l
|
|
Totale hoeveelheid organofosfaat-bestrijdingsmiddelen
|
< 50 ng/l
|
|
Totale hoeveelheid organochloor-bestrijdingsmiddelen plus polychloorbifenylen
|
< 50 ng/l
|
|
Totaalgehalte aan organisch chloor
|
< 25 ng/l
|
Aanhangsel 4
Uit testmethode C.14/Richtsnoer voor testconcentraties
|
Kolom (aantal concentraties tussen 100 en 10 of tussen 10 en 1) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
Aanhangsel 5
Richtsnoer voor homogenisering van kop en staart van de juveniele zebravis, de dikkop-elrits, de driedoornige stekelbaars en het Japanse rijstvisje
Het doel van dit onderdeel is het beschrijven van de procedures die plaatsvinden voordat de VTG-concentratie wordt bepaald. Er kunnen ook andere procedures worden gebruikt die een vergelijkbare kwantificering van VTG opleveren. Het is een optie om de VTG-concentratie in bloedplasma of de lever te bepalen in plaats van in kop-/staarthomogenaat.
Procedure
|
1.
|
De vissen worden volgens de testbeschrijving verdoofd en gedood.
|
|
2.
|
De kop en staart worden volgens de testbeschrijving van de vis afgesneden. Belangrijk: Alle instrumenten voor ontleding en het snijbord moeten tussen het verwerken van elke vis goed gespoeld en gereinigd worden (bijv. met 96 % ethanol), om „VTG-verontreiniging” vanuit vrouwtjes of geïnduceerde mannetjes naar niet-geïnduceerde mannetjes te voorkomen.
|
|
3.
|
Het gewicht van de samengevoegde kop en staart van elke vis wordt op het dichtstbijzijnde mg afgerond.
|
|
4.
|
Na het wegen worden de delen in geschikte buizen geplaatst (bijv. 1,5 ml eppendorf) en bij – 80 °C ingevroren tot homogenisatie, of direct gehomogeniseerd op ijs met twee plastic stampers. (Er kunnen andere methoden worden gebruikt mits ze op ijs worden uitgevoerd en het resultaat een homogene massa is). Belangrijk: De buizen moeten goed worden genummerd zodat de kop en staart van de vis gerelateerd kunnen worden aan het overeenkomstige rompdeel dat voor histologie van de geslachtsklieren wordt gebruikt.
|
|
5.
|
Als een homogene massa is bereikt, wordt een hoeveelheid van 4-10 maal het weefselgewicht aan ijskoude homogenisatiebuffer
(29) toegevoegd (noteer de verdunning). Blijf met de stampers werken tot het mengsel homogeen is. Belangrijke opmerking: Voor elke vis worden nieuwe stampers gebruikt.
|
|
6.
|
De monsters worden op ijs bewaard tot ze worden gecentrifugeerd bij 4 °C bij 50 000 g gedurende 30 minuten.
|
|
7.
|
Verdeel met een pipet porties van 20 tot 50 μl (noteer de hoeveelheid) supernatans in ten minste twee buizen door de punt van de pipet onder de vetlaag op het oppervlak te dopen en voorzichtig het supernatans zonder vet of pellet op te zuigen.
|
|
8.
|
De buizen worden tot gebruik bewaard bij – 80 °C.
|
Opmerking: De homogenisatiebuffer moet op de dag van bereiding gebruikt worden. Tijdens gebruik op ijs zetten.
Aanhangsel 6
Richtsnoer voor kwantificering van vitellogenine uit kop- en staarthomogenaat van de zebravis (Danio rerio) (aangepast uit Holbech et al., 2001). er kunnen andere procedures, gebruikmakend van homologe antilichamen en standaarden worden gebruikt
|
1.
|
Microtiterplaten (gecertificeerd Maxisorp F96, Nunc, Roskilde Denemarken) van tevoren gecoat met 5 μg/ml anti-zebravis-lipovitelline-IgG worden ontdooid en 3 keer gewassen met wasbuffer (*).
|
|
2.
|
Gezuiverde zebravis-vitellogeninestandaard (30) wordt serieel verdund tot 0,2, 0,5, 1, 2, 5, 10 en 20 ng/ml in verdunningsbuffer (**) en monsters worden ten minste 200 keer verdund (om matrixeffect te voorkomen) in verdunningsbuffer en op de platen aangebracht. Een assaycontrole wordt in duplo aangebracht. In elke well wordt 150 μl aangebracht. Standaarden worden in duplo aangebracht en monsters in triplo. Incubeer een nacht bij 4 °C op een schudder.
|
|
3.
|
De platen worden 5 keer gewassen met wasbuffer (*)
|
|
4.
|
HRP gekoppeld aan een dextraanketen (bijv. AMDEX A/S, Denemarken) en geconjugeerde antilichamen worden verdund in wasbuffer. Feitelijke verdunning verschilt per batch en leeftijd. 150 μl wordt in elke well aangebracht en de platen worden 1 uur bij kamertemperatuur op een schudder geïncubeerd.
|
|
5.
|
De platen worden 5 keer gewassen met wasbuffer (*) en de bodem van de platen wordt voorzichtig met ethanol gereinigd.
|
|
6.
|
In elke well wordt 150 μl TMB plus (***) aangebracht. Bescherm de plaat met aluminiumfolie tegen licht en bekijk de kleurontwikkeling op een schudder.
|
|
7.
|
Als de standaardcurve volledig is ontwikkeld, wordt de enzymactiviteit gestopt door toevoeging van 150 μl 0,2 M H2SO4 aan elke well.
|
|
8.
|
De absorbantie wordt bij 450 nm gemeten (bijv. op een Thermomax plaatlezer van Molecular Devices). De gegevens worden geanalyseerd op de bijbehorende software (bijv. Softmax).
|
|
(*)
|
Wasbuffer:
|
PBS-stam (****)
|
500,0
|
ml
|
|
BSA
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
pH instellen op 7,3 en aanvullen tot 5 l met millipore H2O. Bewaren bij 4 °C.
|
|
|
(**)
|
Verdunningsbuffer:
|
PBS-stam (****)
|
100,0
|
ml
|
|
BSA
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
pH instellen op 7,3 en aanvullen tot 1 l met millipore H2O. Bewaren bij 4 °C.
|
|
|
(***)
|
TMB plus is een „gebruiksklaar” substraat dat geproduceerd wordt door KemEnTec (Denemarken). Het is gevoelig voor licht. Bewaren bij 4 °C.
|
|
(****)
|
PBS-stamoplossing
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4
.2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
pH instellen op 6,8 en aanvullen tot 2 l met millipore H2O. Bewaren bij kamertemperatuur.
|
|
Aanhangsel 7
Richtsnoer voor de bereiding van weefselcoupes voor geslachtsbepaling en stadiumbepaling van de geslachtsklieren
Het doel van dit aanhangsel is het beschrijven van de procedures die voorafgaan aan de evaluatie van histologische coupes. Er kunnen ook andere procedures gevolgd worden die leiden tot vergelijkbare geslachtsbepaling en stadiumbepaling van de geslachtsklieren.
Afgezien van enkele verschillen zijn deze procedures vergelijkbaar voor het Japanse rijstvisje (JMD) en de zebravis (ZF).
Euthanasie, necropsie en weefselfixatie
Doelstellingen:
|
1.
|
Zorgen dat de vissen op humane wijze geëuthanaseerd worden.
|
|
2.
|
Verkrijgen van noodzakelijke lichaamsgewichten en -metingen.
|
|
3.
|
Evalueren van secundaire geslachtskenmerken.
|
|
4.
|
Ontleden van weefsels voor VTG-analyse.
|
|
5.
|
Fixatie van de geslachtsklieren.
|
Procedures:
|
1.
|
Vissen worden onmiddellijk voorafgaand aan necropsie gedood. Daarom worden er niet meerdere vissen tegelijk gedood, tenzij er meerdere prosectoren beschikbaar zijn.
|
|
2.
|
Een vis wordt met behulp van een schepnetje uit de testkamer verwijderd en in de transporthouder naar de necropsieruimte gebracht.
|
|
3.
|
De vis wordt in de euthanasieoplossing gelegd. De vis wordt uit de oplossing gehaald als hij niet meer ademt en niet meer reageert op externe prikkels.
|
|
4.
|
De vis wordt nat gewogen.
|
|
5.
|
Voor de bereiding van weefsels voor VTG-analyse kan de vis op een kurkplaat op het platform van een ontledingsmicroscoop worden gelegd.
|
a.
|
Voor de zebravis wordt de kop net achter de borstvin afgesneden en wordt de staart net achter de rugvin afgesneden.
|
|
b.
|
Voor het Japanse rijstvisje wordt de buikholte geopend via een zorgvuldige incisie langs de ventrale middellijn, van de pectorale gordel tot een punt net craniaal van de anus. De lever wordt met behulp van een kleine tang en kleine schaar voorzichtig verwijderd.
|
|
|
6.
|
Monsters voor VT-analyse worden in eppendorfbuizen geplaatst en onmiddellijk ingevroren in vloeibare stikstof.
|
|
7.
|
Het karkas, inclusief de geslachtsklieren, wordt in een vooraf geëtiketteerde plastic weefselcassette geplaatst en in Davidson- of Bouin-fixeermiddel overgebracht. Het volume aan fixeermiddel is ten minste 10 maal het geschatte volume van de weefsels. De fixeermiddelhouder wordt vijf seconden zacht geschud om luchtbellen uit de cassette te verwijderen.
|
|
8.
|
|
a.
|
Alle weefsels blijven een nacht in Davidson-fixeermiddel, waarna ze de volgende dag worden overgebracht in afzonderlijke houders met 10 % neutraal gebufferde formaline. De houders met cassettes worden 5 seconden zacht geschud om te zorgen dat de formaline afdoende in de cassettes doordringt.
|
|
b.
|
De weefsels blijven 24 uur in Bouin-fixeermiddel en worden daarna overgebracht in 70 % ethanol.
|
|
Verwerking van weefsel
Doelstellingen:
|
1.
|
Weefsel uitdrogen voor afdoende doordringing van paraffine.
|
|
2.
|
Impregneren van het weefsel met paraffine om de integriteit van het weefsel te behouden en een stevig oppervlak voor microtomie te verkrijgen.
|
Procedures:
|
3.
|
Geëtiketteerde weefselcassettes worden uit de formaline/ethanol-opslag gehaald en in de verwerkingsmand(en) geplaatst. De verwerkingsmand wordt in de weefselverwerker gezet.
|
|
4.
|
Het verwerkingsschema wordt gekozen.
|
|
5.
|
Nadat de weefselverwerker de verwerkingscyclus heeft voltooid, kan/kunnen de mand(en) naar het inbeddingsstation worden overgebracht.
|
Inbedding
Doelstelling:
Het monster naar behoren in vaste paraffine oriënteren voor microtomie.
Procedures:
|
1.
|
De mand(en) van cassettes wordt/worden uit de verwerker gehaald en ondergedompeld in de met paraffine gevulde voorste kamer van de thermische console van het inbeddingsstation, of de cassettes worden verplaatst naar een aparte paraffineverwarmer.
|
|
2.
|
De eerste in te bedden cassette wordt uit de voorste kamer van de thermische console of de paraffineverwarmer gehaald. Het deksel van de cassette wordt verwijderd en weggegooid, en het etiket van de cassette wordt vergeleken met de diergegevens om mogelijke discrepanties voorafgaand aan inbedding te voorkomen.
|
|
3.
|
Er wordt een inbeddingsvorm van de juiste afmetingen gekozen.
|
|
4.
|
De vorm wordt onder de tuit van de dispenserconsole gehouden en gevuld met gesmolten paraffine.
|
|
5.
|
Het monster wordt uit de cassette gehaald en in de gesmolten paraffine in de vorm geplaatst. Dit wordt voor elke paraffinevorm met 4-8 monsters herhaald. De positie van individuele vissen wordt gemarkeerd door vis nr. 1 180 graden ten opzichte van vissen 2-4/8 te plaatsen.
|
|
6.
|
Er wordt extra paraffine toegevoegd om het monster te bedekken.
|
|
7.
|
De vorm met de cassettebasis wordt op de koelplaat van de cryoconsole gezet.
|
|
8.
|
Nadat de paraffine gestold is, wordt het blok (d.w.z. de uitgeharde paraffine met daarin de weefsels en de cassettebasis) van de vorm verwijderd.
|
Microtomie
Doelstelling:
Snijden en monteren van histologische coupes voor kleuring.
Procedures:
|
1.
|
De eerste fase van microtomie, genaamd „facing”, wordt als volgt uitgevoerd:
|
a.
|
Het paraffineblok wordt in de klem van de microtoom gezet.
|
|
b.
|
De klem wordt naar voren bewogen door aan het wiel van de microtoom te draaien. Dikke coupes worden van het paraffineoppervlak gesneden totdat het mes de ingebedde weefsels bereikt.
|
|
c.
|
De coupedikte wordt op de microtoom ingesteld op 3 tot 5 micron. De klem wordt naar voren bewogen en er worden meerdere coupes van het blok gesneden om eventuele artefacten te verwijderen die op het snijoppervlak van het weefsel kunnen zijn ontstaan door ruw afsnijden.
|
|
d.
|
Het blok kan uit de klem worden gehaald en met het snijvlak naar beneden op ijs worden gelegd om het weefsel te weken.
|
|
|
2.
|
De volgende fase van de microtomie is het uiteindelijke snijden en aanbrengen van de weefselcoupes op objectglaasjes. Deze procedures worden als volgt uitgevoerd:
|
a.
|
Als het blok op ijs is gelegd, kan het blok uit het ijs worden gehaald en weer in de klem van de microtoom worden gelegd.
|
|
b.
|
Met een op de microtoom ingestelde coupedikte van 3 tot 5 micron wordt de klem naar voren bewogen door aan het wiel van de microtoom te draaien. Coupes worden van het blok afgesneden totdat er een „lint” met daarin ten minste één aanvaardbare coupe, waaronder de geslachtsklieren, is gemaakt. (Indien nodig kan het blok tijdens het snijden uit de klem worden gehaald, op ijs worden gelegd om het weefsel te weken, en weer in de klem worden teruggezet).
|
|
c.
|
De coupes worden plat op het wateroppervlak van het waterbad gelegd. Er wordt geprobeerd om ten minste één coupe te krijgen zonder rimpels of ingevangen luchtbellen.
|
|
d.
|
Onder de beste coupe wordt een objectglaasje ondergedompeld, en met behulp van het objectglaasje uit het water gehaald. Dit proces wordt het „monteren” van de coupe op het objectglaasje genoemd.
|
|
e.
|
Voor een reeks vissen worden drie coupes geprepareerd. De tweede en derde coupes worden met een tussenruimte van 50 micron na de eerste coupe genomen. Als de vissen niet met hun geslachtsklieren op dezelfde snijniveau zijn ingebed, worden meer coupes gemaakt om te garanderen dat ten minste zes coupes met de geslachtsklieren van elke vis worden verkregen.
|
|
f.
|
Het bloknummer waaruit de coupe is gemaakt wordt met een merkstift op het objectglaasje genoteerd.
|
|
g.
|
Het objectglaasje wordt in een rek voor kleuring gezet.
|
|
h.
|
Het blok wordt uit de klem gehaald en met het snijvlak naar beneden geplaatst voor opslag.
|
|
Kleuren, dekglaasje aanbrengen en etiketteren van het glaasje
Doelstellingen:
|
—
|
Kleuren van de coupes voor histopathologisch onderzoek
|
|
—
|
Permanent afdekken van gemonteerde en gekleurde weefsels
|
|
—
|
Permanent identificeren van gekleurde coupes om volledige traceerbaarheid mogelijk te maken.
|
Procedures:
|
1.
|
Kleuren
|
a.
|
De objectglaasjes worden een nacht aan de lucht gedroogd alvorens ze te kleuren.
|
|
b.
|
De coupes worden gekleurd met hematoxyline-eosine.
|
|
|
2.
|
Dekglaasjes aanbrengen
|
a.
|
Dekglaasjes kunnen handmatig of automatisch worden aangebracht.
|
|
b.
|
Een objectglaasje wordt in xyleen of TissueClear gedoopt en de overmaat aan xyleen/TissueClear wordt voorzichtig van het objectglaasje af getikt.
|
|
c.
|
Er wordt ongeveer 0,1 ml montagemedium aangebracht bij het uiteinde van het objectglaasje dat het verst van het matglazen deel ligt, of op het dekglaasje.
|
|
d.
|
Het dekglaasje wordt onder een schuine hoek gehouden en op het objectglaasje aangebracht.
|
|
|
3.
|
Etikettering
|
a.
|
Het etiket van het objectglaasje bevat de volgende informatie:
|
iii.
|
Monsternr. / Objectglaasjesnr.
|
|
iv.
|
Stof / Behandelingsgroep
|
|
|
Aanhangsel 8
Statistisch stroomdiagram voor analyse van vitellogenine

Statistisch stroomdiagram voor analyse van geslachtsverhouding
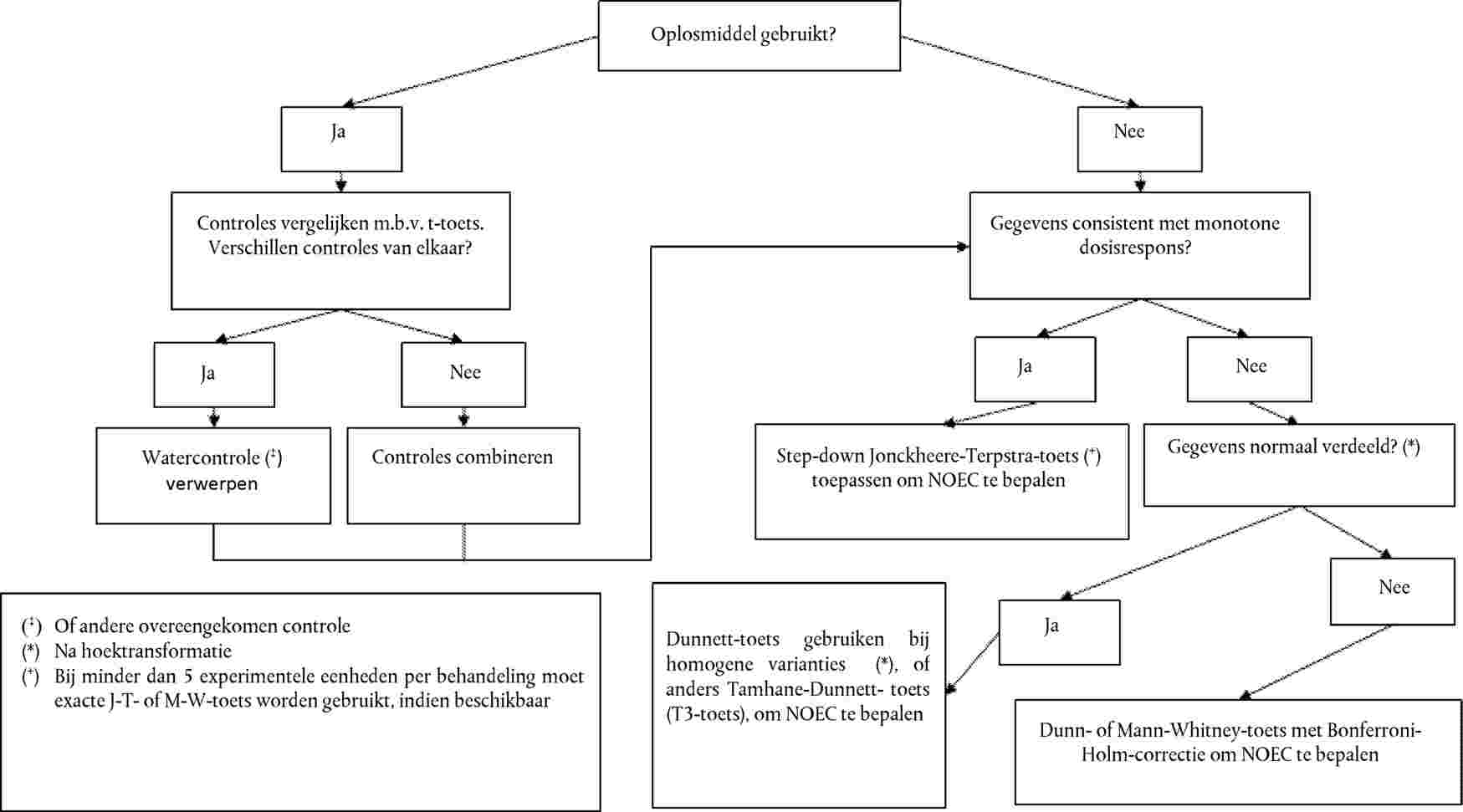
Aanhangsel 9
Richtsnoer voor weefselbemonstering voor genetische geslachtsbepaling en voor genetische geslachtsbepaling door middel van PCR
Bemonstering, preparatie en opslag van weefsel voor genetische geslachtsbepaling door middel van PCR voor het Japanse rijstvisje (opgesteld door het Laboratory for Aquatic Organisms van Bayer CropScience AG)
|
1.
|
Met een fijne schaar wordt de aars- of rugvin van elke vis afgesneden en in een buis gedaan met daarin 100 μl extractiebuffer 1 (zie onder voor details over bereiding van de buffer). De schaar wordt na elke vis gereinigd in een beker met gedestilleerd H2O en met een papieren doekje gedroogd.
|
|
2.
|
De vinweefsels worden nu gehomogeniseerd met behulp van een teflon microbuisstamper om de cellen te lyseren. Voor elke buis wordt een nieuwe stamper gebruikt om verontreinigingen te voorkomen. De stampers worden een nacht in 0,5 M NaOH gelegd, 5 minuten gespoeld in gedestilleerd H2O en in ethanol of steriel na autoclaveren bewaard tot ze gebruikt worden.
|
|
3.
|
Het is ook mogelijk om het vinweefsel zonder extractiebuffer 1 te bewaren op droogijs en daarna bij – 80 °C om afbraak van het DNA te voorkomen. Maar de extractie verloopt beter als het DNA tegelijkertijd wordt geëxtraheerd (zie boven voor behandeling; monsters worden op ijs ontdooid na opslag bij – 80 °C alvorens de buffer in de buizen te doen).
|
|
4.
|
Na homogeniseren worden alle buizen in een waterbad gezet en 15 minuten gekookt bij 100 °C.
|
|
5.
|
Daarna wordt in elke buis 100 μl van extractiebuffer 2 gepipetteerd (zie onder voor details over de bereiding van de buffer). De monsters worden 15 minuten bij kamertemperatuur bewaard en ondertussen af en toe zachtjes met de hand geschud.
|
|
6.
|
Daarna worden alle buizen weer in een waterbad gezet en nog eens 15 minuten gekookt bij 100 °C.
|
|
7.
|
Tot verdere analyse worden de buizen bij – 20 °C ingevroren.
|
Bereiding van buffers
PCR-buffer 1:
|
|
500 mg N-lauroylsarcosine (bijv. Merck KGaA, Darmstadt, DE)
|
|
|
voeg toe: 100 ml gedest. H2O
|
PCR-buffer 2:
|
|
20 g Chelex (bijv. Biorad, München, DE)
|
|
|
Zwellen in 100 ml gedest. H2O
|
Bepaling van het genetische geslacht (door middel van PCR) bij het Japanse rijstvisje (opgesteld door het Laboratory for Aquatic Organisms van Bayer CropScience AG en Universität Würzburg Biozentrum)
De geprepareerde en ingevroren buizen (zoals hierboven beschreven) worden op ijs ontdooid. Daarna worden ze gecentrifugeerd in een eppendorf-centrifuge (30 seconden bij max. snelheid bij kamertemperatuur). Voor de PCR wordt het heldere supernatans apart van de neerslag gebruikt. Het moet absoluut worden vermeden dat spoortjes Chelex (gelokaliseerd in de neerslag) worden overgebracht naar de PCR-reactie, omdat dit de activiteit van „Taq”-polymerase zal verstoren. Het supernatans wordt direct gebruikt of kan ingevroren worden bewaard (bij – 20 °C) en weer ontdooid voor latere analyses. Dit kan zelfs worden herhaald zonder negatieve invloed op het DNA.
1. Bereiding van de „reactiemix” (25 μl per monster):
|
|
Volume
|
Uiteindelijke concentratie
|
|
Sjabloon-DNA
|
0,5 μl tot 2 μl
|
|
|
10xPCR-buffer met MgCl2
|
2,5 μl
|
1x
|
|
Nucleotiden (elk van dATP, dCTP, dGTP, dTTP)
|
4 μl (5 mM)
|
200 μM
|
|
Voorwaartse primer (10 μM) (zie onder 3-5)
|
0,5 μl
|
200 nM
|
|
Achterwaartse primer (10 μM) (zie onder 3-5)
|
0,5 μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Water (PCR-kwaliteit)
|
tot 25 μl
|
|
|
Taq E-polymerase
|
0,3 μl
|
1,5 U
|
|
10xPCR-buffer met MgCl2: 670 mM Tris/HCl (pH 8,8 bij 25 °C), 160 mM (NH4)2SO4, 25 mM MgCl2, 0,1 % Tween 20
|
Benodigd voor elke PCR (zie onder 3-5) is de speciale primer als een nieuwe combinatie van „reactiemix” en de benodigde hoeveelheid sjabloon-DNA voor elk monster (zie boven). De respectievelijke volumes worden met behulp van pipetten in nieuwe buizen overgebracht. Daarna worden alle buizen afgesloten, geroerd (ca. 10 sec.) en gecentrifugeerd (10 sec. bij kamertemperatuur). Nu kunnen de respectievelijke PCR-programma's worden gestart. Daarnaast worden een positieve controle (voorbeeld-DNA-monster met bekende activiteit en duidelijke resultaten) en een negatieve controle (1 μl gedest. H2O) in elk PCR-programma gebruikt.
2. Bereiding van de agarosegel (1 %) — Tijdens het uitvoeren van PCR-programma's:
|
—
|
Los 3 g agarose op in 300 ml 1 × TAE-buffer (1 % agarosegel).
|
|
—
|
Deze oplossing wordt gekookt in een magnetron (ca. 2-3 min.).
|
|
—
|
Breng de hete oplossing over in een speciale gietvorm die op ijs ligt.
|
|
—
|
Na ca. 20 min. is de agarosegel klaar voor gebruik.
|
|
—
|
Bewaar de agarosegel in 1 × TAE-buffer tot het eind van de PCR-programma's.
|
3. Actine-PCR-programma:
Deze PCR-reactie is bedoeld om aan te tonen dat het DNA in het monster niet beschadigd is.
|
—
|
Speciale primer:
|
—
|
„Mact1(upper/forward)” → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
„Mact2(lower/reverse)” → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Programma:
|
—
|
Cyclus (35 keer):
|
Denaturatie
|
→ 45 sec. bij 95 °C
|
|
Hybridisatie
|
→ 45 sec. bij 56 °C
|
|
Verlenging
|
→ 1 min. bij 68 °C
|
|
|
4. X- en Y-gen-PCR-programma:
De monsters met intact DNA worden in dit PCR-programma gebruikt om de X- en Y-genen te detecteren. Mannelijk DNA zou één dubbele band moeten vertonen en vrouwelijk DNA één enkele band (na kleuring en gelelektroforese). Voor dit programma moet één positieve controle voor mannetjes (XY-monster) en één voor vrouwtjes (XX-monster) worden opgenomen.
|
—
|
Speciale primer:
|
—
|
„PG 17.5” (upper/forward) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
„PG 17.6” (lower/reverse) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Programma:
|
—
|
Cyclus (40 keer):
|
Denaturatie
|
→ 45 sec. bij 95 °C
|
|
Hybridisatie
|
→ 45 sec. bij 55 °C
|
|
Verlenging
|
→ 1 min 30 sec. bij 68 °C
|
|
|
5. Y-gen-PCR-programma als „controle” voor X- en Y-gen-PCR-programma:
Met dit PCR-programma worden de resultaten van het „X- en Y-gen-PCR-programma” geverifieerd. De „mannelijke monsters” zouden één band moeten vertonen en de „vrouwelijke monsters” zouden geen band moeten vertonen (na kleuring en gelelektroforese).
|
—
|
Speciale primer:
|
—
|
„DMTYa (upper/forward)” → GGC CGG GTC CCC GGG TG
|
|
—
|
„DMTYd (lower/reverse)” → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Programma:
|
—
|
Cyclus (40 keer):
|
Denaturatie
|
→ 45 sec. bij 95 °C
|
|
Hybridisatie
|
→ 45 sec. bij 56 °C
|
|
Verlenging
|
→ 1 min. bij 68 °C
|
|
|
6. Kleuring van de PCR-monsters:
Kleuroplossing:
Pipetteer 1 μl van de kleuroplossing in elke buis.
7. Start van de gelelektroforese:
|
—
|
De bereide 1 % agarosegel wordt overgebracht in een elektroforesekamer, gevuld met 1 × TAE-buffer.
|
|
—
|
10-15 μl van elk gekleurd PCR-monster wordt in een agarosegel-slotje gepipetteerd.
|
|
—
|
Tevens wordt 5-15 μl van de 1 kb-„ladder” (Invitrogen) in een afzonderlijk slotje gepipetteerd.
|
|
—
|
Start de gelelektroforese bij 200 V.
|
8. Bepaling van de banden:
|
—
|
Reinig de agarosegel in gedistilleerd H2O.
|
|
—
|
Breng nu de agarosegel over in ethidiumbromide en laat hem daar 15-30 min. liggen.
|
|
—
|
Daarna wordt een foto van de agarosegel genomen in een uv-lichtdoos.
|
|
—
|
Tot slot worden de monsters geanalyseerd in vergelijking met de band(en) van de positieve controle en de ladder.
|
Aanhangsel 10
Richtsnoer voor weefselbemonstering voor genetische geslachtsbepaling door middel van PCR bij de driedoornige stekelbaars
Weefselbemonstering en DNA-extractie
DNA kan worden geëxtraheerd met een verscheidenheid aan in de handel verkrijgbare reagentia en met behulp van handmatige en geautomatiseerde extractiesystemen. Het in het Cefas Weymouth-laboratorium gebruikte protocol wordt hieronder beschreven en de alternatieve benaderingen zijn waar van toepassing toegevoegd.
|
1.
|
Met een fijne schaar wordt een stukje weefsel (10-20 mg) van het dorsolaterale gebied (na afsnijden van kop en staart voor VTG-analyse), bij elke vis afgenomen. Het weefsel wordt in een buis gedaan en deze wordt ofwel direct in vloeibare stikstof gedaan (voor opslag bij – 80 °C) of gevuld met 70 % ethanol (voor transport en vervolgens opslag bij 4 °C). De schaar wordt na elke vis gereinigd in 70 % ethanol en daarna in gedestilleerd water, en gedroogd met een papieren doekje.
|
|
2.
|
De ethanol (indien aanwezig) wordt verwijderd door afzuiging en het weefsel wordt gedurende een nacht gedigereerd met proteïnase K in 400 μl ATL-buffer (Qiagen). Een aliquot (200 μl) van het digest wordt overgebracht in een 96-well S-blok (Qiagen) en het DNA wordt geëxtraheerd in een 96-well format met behulp van de Qiagen Universal BioRobot en de QIamp Investigator BioRobot kit. Het DNA wordt geëlueerd in 50 μl DNase- en RNase-vrij water. Voor het extraheren van DNA uit harde weefsels (zoals een stekel of een borstvin) kan het nodig zijn om het monster in de lysisbuffer te homogeniseren met behulp van een FastPrep® weefsellyseerder of gelijkwaardig systeem voor weefsellysis.
Alternatieve mogelijkheden zijn:
|
a)
|
het digereren van weefsel gedurende een nacht met proteïnase K in 400 μl G2-lysisbuffer (Qiagen) en het extraheren van DNA uit 200 μl van dit digest met behulp van ofwel de EZ-1 DNA easy tissue kit en de EZ-1 biorobot, dan wel de DNA easy tissue mini kit. Het DNA wordt geëlueerd in een volume van 50 μl.
|
|
b)
|
De weefsels worden verwerkt met het reagens DNAzol. In het kort worden de weefselmonsters 10 minuten gelyseerd in 1 ml DNAzol in een microcentrifugebuis van 1,5 ml en daarna 5 minuten bij 13 000 rpm gecentrifugeerd om eventuele deeltjes te verwijderen. Het gelyseerde monster wordt daarna overgebracht in een nieuwe microcentrifugebuis van 1,5 ml met daarin 500 μl 100 % moleculaire kwaliteit ethanol en daarna 10 minuten bij 13 000 rpm gecentrifugeerd om het DNA neer te slaan. De ethanol wordt verwijderd en vervangen door 400 μl 70 % moleculaire kwaliteit ethanol. Het mengsel wordt 5 minuten bij 13 000 rpm gecentrifugeerd, waarna de DNA-neerslag wordt opgelost in 50 μl moleculair DNase- en RNase-vrij water. Wederom geldt dat voorafgaand aan het extraheren van DNA uit harde weefsels (borstvin) het nodig kan zijn om het monster in de lysisbuffer te homogeniseren met behulp van een FastPrep® weefsellyseerder of gelijkwaardig systeem voor weefsellysis.
|
|
|
3.
|
Het DNA wordt, totdat het nodig is, bewaard bij – 20 °C.
|
Belangrijke opmerking: tijdens de procedures moeten handschoenen worden gedragen.
Polymerasekettingreactie- (PCR-)analyse
Amplificaties werden uitgevoerd met gebruikmaking van 2,5 μl van het DNA-extract in een reactievolume van 50 μl met gebruikmaking van de IDH-locusprimers (zoals beschreven door Peichel et al., 2004. Current Biology 1:1416-1424):
|
Forward primer
|
5' GGG ACG AGC AAG ATT TAT TGG 3'
|
|
Reverse primer
|
5' TAT AGT TAG CCA GGA GAT GG 3'
|
Er zijn talloze leveranciers van geschikte PCR-reagentia. De in het onderstaande beschreven methode is de methode die op dit moment wordt gebruikt door het Cefas Weymouth-laboratorium.
1. Bereiding van het „reactiemengsel” (50 μl per monster):
Een stammengsel wordt als volgt bereid. Het mengsel kan van tevoren worden bereid en bewaard in bevroren toestand bij – 20 °C, totdat het nodig is. Bereid voldoende stammengsel voor een negatieve controle (alleen moleculair-biologisch zuiver water).
|
|
Volume (conc. stamoplossing)/ monster
|
Uiteindelijke concentratie
|
|
5xGoTaq® reactiebuffer
|
10μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nucleotiden (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (25 mM elk)
|
250 μM elk
|
|
Forward primer
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Reverse primer
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Moleculair-biologisch zuiver water
|
30,75 μl
|
|
|
GoTaq polymerase
|
0,25 μl
|
1,25 U
|
|
—
|
47,5 μl wordt overgebracht in een gemerkt PCR-buisje van 0,5 ml met een dunne wand.
|
|
—
|
2,5 μl van het gezuiverde DNA wordt toegevoegd aan het correct gemerkte buisje. Herhaal voor alle monsters en de negatieve controle.
|
|
—
|
Dek af met een deklaagje van 2 druppels minerale olie. In plaats daarvan kunt u ook een thermocycler met een verwarmd deksel gebruiken.
|
|
—
|
Monsters werden gedenatureerd in een Peltier PTC-225 thermocycler bij 94 ± 2 °C gedurende 5 minuten gevolgd door 39 cycli van 94 ± 2 °C gedurende 1 minuut, 55 ± 2 °C gedurende 1 minuut, 72 ± 2 °C gedurende 1 minuut, en een laatste verlenging bij 72 ± 2 °C gedurende 10 minuten.
|
2. Bereiding van de agarosegel (2 %):
Traditioneel worden de PCR-producten opgelost in een agarosegel van 20 % die ethidiumbromide bevat.
Capillaire elektroforesesystemen kunnen ook worden gebruikt.
|
—
|
2 g agarose wordt afgewogen in 100 ml 1 × TAE-buffer.
|
|
—
|
In een magnetron (ca. 2-3 min.) opwarmen om het agarose op te lossen.
|
|
—
|
2 druppels ethidiumbromide in de uiteindelijke concentratie 0,5 μg/ml worden toegevoegd.
|
|
—
|
De hete oplossing wordt overgeheveld in het gelgietapparaat.
|
|
—
|
Laat de gel hard worden.
|
3. Gelelektroforese:
|
—
|
De agarosegel wordt overgebracht naar het elektroforeseapparaat en ondergedompeld in 1 × TAE-buffer.
|
|
—
|
20 μl van elk monster wordt geïnjecteerd in een afzonderlijke well en een merkstof voor molecuulgewicht (100 bp DNA ladder, Promega) wordt aan een reserve-well toegevoegd.
|
|
—
|
Elektroforese wordt uitgevoerd bij 120 V gedurende 30-45 minuten.
|
4. Visualisering van de amplificatieproducten
Indien het ethidiumbromide op de hierboven beschreven wijze in de agarosegel is opgenomen, worden de DNA-producten gevisualiseerd onder een UV-lichtbron. In plaats daarvan kan de agarosegel voorafgaand aan de visualisering worden gekleurd door de gel gedurende 30 minuten onder te dompelen in een verdunde ethidiumbromideoplossing (0,5 μg/ml in water).
Aanhangsel 11
Richtsnoer voor de procedure van de kunstmatige bevruchting voor de driedoornige stekelbaars
Het doel van dit deel is om de procedures te beschrijven voor het verkrijgen van bevruchte eitjes uit de driedoornige stekelbaars om deze te gebruiken in de FSDT.
Procedures
Sperma uit de mannetjes verkrijgen
|
1.
|
Een goed gekleurd mannetje van de doelpopulatie wordt geëuthanaseerd.
|
|
2.
|
De testes worden aan beide zijden van de vis uitgesneden. De testes zijn over het algemeen felgekleurde, staafvormige structuren die duidelijk te zien zijn bij de laterale middenlijn van het lichaam. Pas een van de volgende methoden toe:
|
|
3.
|
Gebruik een fijne schaar, begin bij de cloaca en maak een incisie van 1-1,5 cm met één knip met een hoek van ongeveer 45 graden.
|
|
4.
|
Gebruik een scalpel om een kleine incisie te maken in de zijkant van de vis iets achter het bekken en precies ventraal ten opzichte van de beenplaten.
|
|
5.
|
De testes worden verwijderd met behulp van een fijn tangetje en in een petrischaal geplaatst.
|
|
6.
|
Elke testis wordt bedekt met 100 μl vers bereide Hank's gebalanceerde zoutoplossing (HBSS)
(31).
|
|
7.
|
De testes worden in kleine blokjes gesneden met een scheermesje of scalpel. Hierdoor komt het sperma vrij en gaat de Hank's oplossing er melkachtig uitzien.
|
|
8.
|
De vloeistof met daarin het sperma wordt toegevoegd aan een buis, waarbij tijdens het pipetteren moet worden vermeden dat stukjes weefsel van de testes meekomen.
|
|
9.
|
800 μl Hank's gebalanceerde zoutoplossing wordt aan de buis toegevoegd en goed gemengd.
|
|
10.
|
Indien nodig kan het mannetje worden geconserveerd door fixatie in 100 % ethanol of desgewenst een andere fixeerstof. Dit is met name van belang, indien het onderzoek vaststelt van welke ouders nakomelingen afstammen.
|
Belangrijke opmerking: Hoewel de meeste benodigde stamoplossingen van tevoren kunnen worden bereid, moeten stamoplossing 5 en vervolgens de gebalanceerde zoutoplossing op de dag van gebruik vers worden bereid.
|
Stamoplossing 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Gedistilleerd water
|
100 ml
|
|
Stamoplossing 2
|
|
Na2HPO4 (watervrij)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
Gedistilleerd water
|
100 ml
|
|
Stamoplossing 3
|
|
CaCl2
|
0,72 g
|
|
Gedistilleerd water
|
50 ml
|
|
Stamoplossing 4
|
|
MgSO4 · 7H2O
|
1,23 g
|
|
Gedistilleerd water
|
50 ml
|
|
Stamoplossing 5 (vers bereid)
|
|
NaHCO3
|
0,35 g
|
|
Gedistilleerd water
|
10 ml
|
Opmerking: Als u reeds enkele van bovengenoemde zouten hebt, maar met een ander watergehalte (d.w.z. 2H2O in plaats van watervrij), kunt u deze zouten nog steeds gebruiken, als u het gewicht eerst aanpast op basis van het molecuulgewicht).
Combineer voor Hank's gebalanceerde zoutoplossing in de volgende volgorde:
|
stamoplossing 1
|
1,0 ml
|
|
stamoplossing 2
|
0,1 ml
|
|
stamoplossing 3
|
0,1 ml
|
|
gedistilleerd water
|
8,6 ml
|
|
stamoplossing 4
|
0,1 ml
|
|
stamoplossing 5
|
0,1 ml
|
Goed mengen alvorens te gebruiken.
Bevruchting
|
1.
|
Grote, drachtige vrouwtjes worden geïdentificeerd binnen de doelpopulatie; vrouwtjes zijn pas klaar om geknepen te worden als zichtbaar is dat de eitjes uit de cloaca steken. Als vrouwtjes klaar zijn, vertonen ze de karakteristieke houding met de „kop omhoog”
|
|
2.
|
Wrijf voorzichtig met uw vinger of duim langs de zijkant van de vis in de richting van de staart om het uitscheiden van een eizakje in een schoon petrischaaltje te stimuleren. Herhaal aan de andere kant en breng de vis weer over naar haar bak.
|
|
3.
|
De eitjes kunnen met een fijn penseel worden uitgespreid (zodat ze een monolaag vormen). Het is belangrijk om zoveel mogelijk eitjes aan het sperma bloot te stellen en daarom is het nuttig om een zo groot mogelijk oppervlak van eitjes te maken. Belangrijke opmerking: Houd de eitjes vochtig door een vochtige tissue rond de eitjes te leggen (het is belangrijk dat de eitjes niet rechtstreeks met water in aanraking komen, aangezien dit kan leiden tot voortijdige verharding van het eivlies, waardoor bevruchting onmogelijk wordt). Het aantal eitjes dat elk vrouwtje kan produceren, varieert in aanzienlijke mate, maar gemiddeld zouden gemakkelijk ongeveer 150 eitjes uit één drachtig vrouwtje moeten kunnen worden verkregen.
|
|
4.
|
25μl sperma in Hank's oplossing wordt gelijkelijk verspreid over het gehele oppervlak van de eitjes met behulp van het penseel. De eitjes zullen snel hard worden en van kleur veranderen (binnen een minuut), zodra de bevruchting is begonnen. Herhaal de procedure, indien het geschatte aantal eitjes groter is dan 150. Voeg wat meer sperma toe, indien de eitjes niet binnen een minuut hard worden. Belangrijke opmerking: Het toevoegen van meer sperma verbetert niet noodzakelijkerwijs het bevruchtingspercentage.
|
|
5.
|
De eitjes en het sperma moeten ten minste 15 minuten de tijd krijgen voor de onderlinge „interactie” en de bevruchte eitjes moeten binnen 1,5 uur na de bevruchting in de blootstellingsaquaria worden geplaatst.
|
|
6.
|
De procedure wordt herhaald met een ander vrouwtje, totdat het gewenste aantal eitjes is verzameld.
|
|
7.
|
Houd enkele eitjes uit de laatste batch apart en fixeer ze in 10 % azijnzuur.
|
Eitjes tellen en verdelen over testaquaria
|
1.
|
De eitjes moeten gelijkelijk worden verdeeld tussen de verschillende behandelingsniveaus om genetische vertekening te voorkomen. Elke batch bevruchte eitjes moet worden opgedeeld in groepen (zoveel als er behandelingsniveaus zijn) van gelijke grootte door een stomp instrument te gebruiken (d.w.z. een entomologische tang met een breed blad of een entoog). Als u 4 duplo's per behandeling met 20 eitjes per duplo als doel hebt, moet u 80 eitjes per blootstellingsaquarium verdelen. Belangrijke opmerking: Het is aan te bevelen om 20 % extra (d.w.z. 96 eitjes per behandelingsniveau) toe te voegen, totdat u ervan overtuigd bent dat u bevruchtingspercentages van 100 % hebt bereikt.
|
|
2.
|
Eitjes van stekelbaarzen zijn buiten het door de vader bewaakte nest zeer vatbaar voor schimmelinfecties. In dit verband is het van essentieel belang dat alle eitjes tijdens de eerste 5 dagen van de test met methyleenblauw worden behandeld. Een stamoplossing methyleenblauw wordt bereid met 1 mg/ml en toegevoegd aan de blootstellingsaquaria om een maximale totale concentratie van 2,125 mg/l te verkrijgen. Belangrijke opmerking: Stekelbaarzen mogen niet aan methyleenblauw worden blootgesteld zodra ze zijn uitgekomen; dus het systeem moet op dag 6 vrij zijn van methyleenblauw.
|
|
3.
|
De eitjes worden dagelijks geïnspecteerd en eventuele dode of onbevruchte eitjes worden als zodanig geregistreerd. Belangrijke opmerking: De eitjes mogen nooit buiten het water zijn, zelfs niet gedurende korte tijd, totdat ze uitkomen.
|
C.42 BIOLOGISCHE AFBREEKBAARHEID IN ZEEWATER
ALGEMENE INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan OESO-testrichtsnoer (TG) 306 (1992). Toen de oorspronkelijke testmethoden werden ontwikkeld, was niet bekend in hoeverre resultaten uit de screeningtests voor gemakkelijke biologische afbreekbaarheid met gebruikmaking van zoet water, en van effluent van afvalwater of actief slib als entmateriaal, zouden kunnen worden toegepast op het mariene milieu. De in dit verband gemelde resultaten (bijv. (1)) variëren.
|
|
2.
|
Veel industrieel afvalwater, dat diverse chemische stoffen bevat, bereikt de zee hetzij door directe lozing, hetzij via estuaria en rivieren, waarin de stoffen relatief kort verblijven in vergelijking met de tijd die nodig is voor de volledige biologische afbraak van veel van de aanwezige chemische stoffen. Vanwege het groeiende bewustzijn omtrent de noodzaak om het mariene milieu te beschermen tegen de toenemende belasting met chemische stoffen evenals de noodzaak om de waarschijnlijke concentratie van de in de zee aanwezige chemische stoffen te bepalen, zijn er testmethoden voor de biologische afbreekbaarheid in zeewater ontwikkeld.
|
|
3.
|
De hier beschreven methoden gebruiken natuurlijk zeewater niet alleen als waterfase, maar ook als bron van micro-organismen. Om te proberen deze methoden in overeenstemming te brengen met de methoden voor gemakkelijke biologische afbreekbaarheid in zoet water, is het gebruik van ultragefiltreerd en gecentrifugeerd zeewater onderzocht, evenals het gebruik van mariene sedimenten als entmateriaal. Deze onderzoeken leverden geen succes op. Het testmedium is derhalve natuurlijk zeewater dat voorbehandeld is om er grove deeltjes uit te verwijderen.
|
|
4.
|
Om de totale biologische afbreekbaarheid te evalueren met de schudflesmethode (shake flask method), moeten relatief hoge concentraties teststof worden gebruikt vanwege de geringe gevoeligheid van de analysemethode met opgeloste organische koolstof (dissolved organic carbon, DOC). Dit betekent verder dat het nodig is om aan het zeewater minerale nutriënten (N en P) toe te voegen, omdat ze anders in zodanig lage concentraties zouden voorkomen dat de verwijdering van DOC daardoor beperkt zou worden. Ook bij de gesloten-flesmethode is het nodig om de nutriënten toe te voegen vanwege de concentratie van de toegevoegde teststof.
|
|
5.
|
Daarom zijn deze methoden geen tests voor gemakkelijke biologische afbreekbaarheid, aangezien er geen entmateriaal wordt toegevoegd naast de reeds in het zeewater aanwezige micro-organismen. Noch simuleren de tests het mariene milieu, aangezien nutriënten worden toegevoegd en de concentratie van de teststof zeer veel hoger is dan het geval zou zijn in de zee. Om deze redenen worden de methoden voorgesteld onder een nieuwe onderafdeling „Biologische afbreekbaarheid in zeewater”.
|
TOEPASSING
|
6.
|
De resultaten van de tests, die toegepast zouden worden omdat het patroon van het gebruik en de lozing van de stof in kwestie duiden op een route naar de zee, geven een eerste indruk van biologische afbreekbaarheid in zeewater. Indien het resultaat positief is (> 70 % DOC verwijderd; > 60 % theoretisch zuurstofverbruik (theoretical oxygen demand, ThOD), kan worden geconcludeerd dat de mogelijkheid van biologische afbreekbaarheid in het mariene milieu bestaat. Echter, een negatief resultaat sluit een dergelijke mogelijkheid niet uit, maar duidt erop dat verder onderzoek nodig is, bijvoorbeeld met gebruik van een zo laag mogelijke concentratie van de teststof.
|
|
7.
|
Indien een meer definitieve waarde voor het percentage of de mate van biologische afbreekbaarheid in zeewater op een bepaalde locatie vereist is, moeten in ieder geval complexere en meer geavanceerde, en daardoor ook duurdere, methoden worden toegepast. Een simulatietest zou bijvoorbeeld kunnen worden toegepast met gebruikmaking van een concentratie teststof die dichter in de buurt komt bij de concentratie die waarschijnlijk in het milieu voorkomt. Ook zou gebruik kunnen worden gemaakt van niet-verrijkt, niet-voorbehandeld zeewater dat wordt verzameld op de locatie in kwestie, waarna de primaire biologische afbreekbaarheid gevolgd zou kunnen worden door middel van specifieke chemische analyse. Voor de totale biologische afbreekbaarheid zouden met 14C gemerkte stoffen nodig zijn om de verdwijningspercentages van oplosbare organische 14C en de productie van 14CO2 te kunnen meten bij in milieuopzicht realistische concentraties.
|
KEUZE VAN METHODEN
|
8.
|
De selectie van de te gebruiken methode is afhankelijk van een aantal factoren; onderstaande tabel is bedoeld als hulp bij de selectie. Stoffen met een oplosbaarheid in water van minder dan het equivalent van ongeveer 5 mg C/l kunnen niet worden getest in de schudflesmethode, terwijl slecht oplosbare stoffen wel kunnen worden getest, althans in principe, in de gesloten-flesmethode.
Tabel
Voordelen en nadelen van de schudflesmethode en de gesloten-flesmethode
|
METHODE
|
VOORDELEN
|
NADELEN
|
|
SCHUDFLES
|
|
—
|
eenvoudig apparaat met uitzondering van het C-analyseapparaat
|
|
—
|
duur van 60 d is geen probleem
|
|
—
|
geen interferentie door nitrificatie
|
|
—
|
kan aan vluchtige stoffen worden aangepast
|
|
|
—
|
vereist een C-analyseapparaat
|
|
—
|
gebruikt 5-40 mg DOC/1, zou remmend kunnen werken
|
|
—
|
DOC-bepaling is moeilijk bij lage concentraties in zeewater (chloride-effect)
|
|
—
|
DOC soms hoog in zeewater
|
|
|
GESLOTEN FLES
|
|
—
|
eenvoudige bepaling van de totaalwaarden
|
|
—
|
gebruikt lage concentraties teststof (2 mg/l), dus minder kans op remmende werking
|
|
—
|
gemakkelijk aan te passen aan vluchtige stoffen
|
|
|
—
|
de luchtdichtheid van flessen zou moeilijk te handhaven kunnen zijn
|
|
—
|
groei van bacteriën op wanden kan leiden tot onjuiste waarden
|
|
—
|
de blanco-opnamewaarden voor O2 kunnen hoog zijn, met name na 28 dagen; zou verholpen kunnen worden door veroudering van het zeewater
|
|
—
|
mogelijke interferentie vanwege O2-opname door nitrificatie
|
|
|
SCHUDFLESMETHODE
INLEIDING
|
1.
|
Deze methode is een zeewatervariant van de gewijzigde OESO-screeningtest (Modified OECD Screening Test) die wordt beschreven in hoofdstuk C.4B van deze bijlage (2). De methode is in zijn definitieve vorm opgesteld als resultaat van een ringtest die voor de Europese Commissie (EC) werd georganiseerd door het Deense Waterkwaliteitsinstituut (3).
|
|
2.
|
Zoals bij de hier eveneens besproken gesloten-flesmethode moeten de resultaten van deze test niet worden beschouwd als indicatoren van gemakkelijke biologische afbreekbaarheid, maar specifiek worden gebruikt om informatie te verkrijgen over de biologische afbreekbaarheid van stoffen in mariene omgevingen.
|
PRINCIPE VAN DE METHODE
|
3.
|
Een vooraf bepaalde hoeveelheid teststof wordt opgelost in het testmedium, totdat een concentratie van 5-40 mg opgeloste organische koolstof (DOC)/l wordt bereikt. Indien de gevoeligheidsgrenzen van analyses van organische koolstof verbeterd worden, zou het gebruik van lagere concentraties teststof voordelen kunnen opleveren, in het bijzonder voor stoffen met een remmend effect. De oplossing van de teststof in het testmedium wordt onder roeren en in het donker geïncubeerd of in diffuus licht onder aerobe omstandigheden bij een vaste temperatuur (constant gehouden met ± 2 °C), die normaal binnen het bereik 15-20 °C zal vallen. Ingeval het doel van het onderzoek is om milieuomstandigheden te simuleren, kunnen tests worden uitgevoerd buiten dit normale temperatuurbereik. De aanbevolen maximale duur van de test is ongeveer 60 dagen. Afbraak wordt gevolgd door DOC-metingen (uiteindelijke afbraak) en, in sommige gevallen, door specifieke analyse (primaire afbraak).
|
INFORMATIE OVER DE TESTSTOF
|
4.
|
Om te weten of de test kan worden toegepast op een bepaalde stof, moeten enkele eigenschappen van die stof bekend zijn. Het gehalte organische koolstof van de stof moet worden bepaald, de vluchtigheid ervan moet zodanig zijn dat er geen aanzienlijke verliezen optreden tijdens het verloop van de test en de oplosbaarheid ervan in water moet groter zijn dan het equivalent van 25-40 mg C/l. Ook mag de stof geen aanzienlijke adsorptie op glazen oppervlakken vertonen. Informatie over de zuiverheid of de relatieve verhoudingen van belangrijke componenten van de teststof is nodig, opdat de verkregen resultaten kunnen worden geïnterpreteerd, in het bijzonder wanneer het resultaat dicht ligt bij het niveau waarop de test wordt doorstaan.
|
|
5.
|
Informatie over de giftigheid van de teststof voor bacteriën, zoals die bijvoorbeeld wordt gemeten bij korte ademhalingssnelheidstests (4), kan nuttig zijn bij het selecteren van geschikte testconcentraties en kan essentieel zijn voor de correcte interpretatie van lage waarden voor biologische afbreekbaarheid. Dergelijke informatie is echter niet altijd toereikend voor de interpretatie van de in de biologische-afbreekbaarheidstest verkregen resultaten en de in punt 18 beschreven procedure is geschikter.
|
REFERENTIESTOFFEN
|
6.
|
Geschikte referentiestoffen moeten worden gebruikt om de microbiële activiteit van het zeewatermonster te controleren. Natriumbenzoaat, natriumacetaat en aniline zijn voorbeelden van stoffen die voor dit doel kunnen worden gebruikt. De referentiestoffen moeten worden afgebroken binnen een redelijk korte tijd; anders wordt aanbevolen dat de test wordt herhaald met gebruikmaking van een ander zeewatermonster.
|
|
7.
|
In de EC-ringtest, waarbij zeewatermonsters werden genomen op verschillende locaties en op verschillende momenten in het jaar (3), waren de aanloopfase (tL) en de tijd die nodig was om 50 procent afbraak te bereiken (t50), exclusief de aanloopfase, respectievelijk 1 tot 4 dagen en 1 tot 7 dagen voor natriumbenzoaat. Voor aniline varieerde tL van 0 tot 10 dagen, terwijl t50 varieerde van 1 tot 10 dagen.
|
REPRODUCEERBAARHEID EN GEVOELIGHEID VAN DE METHODE
|
8.
|
De reproduceerbaarheid van de methode is bepaald in de ringtest (3). De laagste concentratie teststof waarbij deze methode kan worden gebruikt met DOC-analyse, wordt grotendeels bepaald door de detectiegrenswaarde van de analyse van organische koolstof (op dit moment ongeveer 0,5 mg) en de concentratie opgeloste organische koolstof in het gebruikte zeewater (gewoonlijk in de orde van 3-5 mg/l voor water uit open zee). De achtergrondconcentratie DOC mag niet hoger zijn dan 20 % van de totale DOC-concentratie na toevoeging van de teststof. Als dit niet haalbaar is, kan de achtergrondconcentratie DOC in sommige gevallen worden verlaagd door het zeewater vóór het testen te laten verouderen. Indien de methode alleen met specifieke chemische analyse (waarmee primaire afbraak wordt gemeten) wordt gebruikt, moet de onderzoeker door het verstrekken van aanvullende informatie documenteren of uiteindelijke afbreekbaarheid te verwachten is. Deze aanvullende informatie kan bestaan uit de resultaten van andere tests voor gemakkelijke of inherente biologische afbreekbaarheid.
|
BESCHRIJVING VAN DE METHODE
Apparatuur
|
9.
|
Gewone laboratoriumapparatuur en:
|
a.
|
schudmachine die geschikt is voor erlenmeyers van 0,5 tot 2 liter, hetzij met automatische temperatuurregeling, hetzij gebruikt in een kamer met constante temperatuur bij 15-20 °C, constant gehouden met ± 2 °C;
|
|
b.
|
erlenmeyers van 0,5 tot 2 liter met nauwe hals;
|
|
c.
|
membraanfiltratieapparaat of centrifuge;
|
|
d.
|
membraanfilters, 0,2-0,45 μm;
|
|
e.
|
koolstofanalyseapparaat;
|
|
f.
|
apparatuur voor specifieke analyse (facultatief).
|
|
Zeewater
|
10.
|
Neem een zeewatermonster en vervoer het in een zorgvuldig gereinigd vat naar het laboratorium, bij voorkeur binnen een of twee dagen na de monstername. Tijdens het vervoer moet worden voorkomen dat de temperatuur van het monster veel hoger wordt dan de in de test te gebruiken temperatuur. Identificeer de locatie van de monstername nauwkeurig en beschrijf daarbij de status van de locatie in termen van verontreiniging en nutriënten. Met name voor kustwateren moet deze karakterisering een telling omvatten van heterotrofe microbiële kolonies evenals de bepaling van de concentraties van opgeloste nitraat, ammonium en fosfaat.
|
|
11.
|
Voor het zeewatermonster zelf wordt de volgende informatie gerapporteerd:
|
—
|
voorkomen van het monster — troebel, enz.;
|
|
—
|
temperatuur op het moment van de monstername;
|
|
—
|
vertraging tussen de monstername en het gebruik ervan in de test.
|
|
|
12.
|
Indien het DOC-gehalte van het zeewater hoog blijkt te zijn (punt 8), wordt aanbevolen om het zeewater voorafgaand aan gebruik ongeveer een week te laten verouderen. Laat het zeewater verouderen onder aerobe omstandigheden bij de testtemperatuur en in het donker of bij diffuus licht. Indien nodig wordt voorzichtige beluchting toegepast om aerobe omstandigheden te handhaven. Tijdens het verouderen wordt het gehalte gemakkelijk afbreekbaar organisch materiaal verminderd. In de ringtest (3) werd geen verschil aangetoond tussen het afbraakpotentieel van verouderde en vers genomen zeewatermonsters. Het zeewater moet, voordat het wordt gebruikt, worden voorbehandeld om er grove deeltjes uit te verwijderen, bijv. door filtratie met een nylon filter of een grof papieren filter (geen membraan- of GPC-filters) of door bezinken en decanteren. De gebruikte procedure moet worden gerapporteerd. Als veroudering wordt toegepast, moet daarna de voorbehandeling worden uitgevoerd.
|
Stamoplossingen voor minerale nutriënten
|
13.
|
Bereid met analytisch zuivere reagentia de volgende stamoplossingen:
|
(a)
|
kaliumdiwaterstoforthofosfaat, KH2PO4
|
8,50 g
|
|
dikaliumwaterstoforthofosfaat, K2HPO4
|
21,75 g
|
|
dinatriumwaterstoforthofosfaatdihydraat, Na2HPO4 · 2H2O
|
33,30 g
|
|
ammoniumchloride, NH4Cl
|
0,50 g
|
|
Oplossen en aanvullen met gedistilleerd water tot 1 liter.
|
|
|
(b)
|
calciumchloride, CaCl2
|
27,50 g
|
|
Oplossen en aanvullen met gedistilleerd water tot 1 liter.
|
|
|
(c)
|
magnesiumsulfaatheptahydraat, MgSO4 · 7H2O
|
22,50 g
|
|
Oplossen en aanvullen met gedistilleerd water tot 1 liter.
|
|
|
(d)
|
ijzer(III)chloridehexahydraat, FeCl3 · 6H2O
|
0,25 g
|
|
Oplossen en aanvullen met gedistilleerd water tot 1 liter.
|
|
Neerslag in oplossing (d) kan worden voorkomen door één druppel geconcentreerd HCl of 0,4 g ethyleendiaminetetraazijnzuur (EDTA, dinatriumzout) per liter toe te voegen. Als er zich neerslag vormt in een stamoplossing, moet deze worden vervangen door een vers bereide oplossing.
|
Bereiding van testmedium
|
14.
|
Voeg 1 ml van elk van bovenstaande stamoplossingen toe per liter voorbehandeld zeewater.
|
Entmateriaal
|
15.
|
Naast de reeds in het zeewater aanwezige micro-organismen wordt geen specifiek entmateriaal toegevoegd. Het aantal kolonievormende heterotrofen in het zeewatertestmedium (en bij voorkeur ook in de oorspronkelijke zeewatermonsters) wordt (facultatief) bepaald, bijv. door platen te tellen met gebruikmaking van zee-agar. Dit is in het bijzonder wenselijk voor monsters van kust- of verontreinigde locaties. De heterotrofe microbiële activiteit in het zeewater wordt gecontroleerd door een test met een referentiestof uit te voeren.
|
Bereiding van de testoplossingen
|
16.
|
Zorg ervoor dat alle glazen voorwerpen vóór gebruik grondig schoon zijn, niet noodzakelijk steriel, (bijv. met gebruikmaking van alcoholhoudend zoutzuur), en gespoeld en gedroogd zijn om verontreiniging met resten van voorgaande tests te voorkomen. De flessen moeten ook worden gereinigd voor het eerste gebruik.
|
|
17.
|
Evalueer teststoffen tegelijkertijd in duploflessen, samen met één fles voor de referentiestof. Voor de bepaling van de analytische blanco's wordt een blancotest uitgevoerd, in duplo, met noch de rest- noch de referentiestof. De teststoffen worden opgelost in het testmedium; ze kunnen gemakkelijk worden toegevoegd via een geconcentreerde stamoplossing om de gewenste beginconcentraties van normaal gesproken 5-40 mg DOC/l te bereiken. De referentiestof wordt op de gewone wijze getest bij een beginconcentratie die overeenkomt met 20 mg DOC/l. Bij gebruik van stamoplossingen van test- en/of referentiestoffen moet ervoor worden gezorgd dat het zoutgehalte van het zeewatermedium niet al te zeer verandert.
|
|
18.
|
Indien toxische effecten te verwachten zijn of niet kunnen worden uitgesloten, kan het raadzaam zijn om in de testopzet een remmingsexperiment, in duplo, op te nemen. De test- en referentiestoffen worden toegevoegd aan dezelfde fles, waarbij de concentratie van de referentiestof normaal gesproken dezelfde is als in de controletest (d.w.z. 20 mg DOC/l), zodat vergelijken mogelijk is.
|
|
19.
|
Toereikende hoeveelheden testoplossing worden in de erlenmeyers gebracht (een toereikende hoeveelheid is ongeveer de helft van het flesvolume), waarna elke fles wordt voorzien van een losse afdekking (bijv. aluminiumfolie) die de uitwisseling van gas tussen de fles en de omringende lucht mogelijk maakt. (Katoenen stoppen zijn ongeschikt indien DOC-analyse wordt toegepast). Plaats de flessen op de schudmachine en laat ze continu schudden met een lage snelheid (bijv. 100 tpm) gedurende de gehele test. Regel de temperatuur (15-20 °C en tot op ± 2 °C) en bescherm de flessen tegen licht om de groei van algen te voorkomen. Zorg ervoor dat de lucht vrij is van toxische stoffen.
|
Fysisch-chemische controletest (facultatief)
|
20.
|
Indien abiotische afbraak of verliesmechanismen vermoed worden, zoals hydrolyse (alleen een probleem bij specifieke analyse), verdamping of adsorptie, is het aan te bevelen om een fysisch-chemisch controle-experiment uit te voeren. Dit kan worden gedaan door kwik(II)chloride (HgCl2) (32) (50-100 mg/l) toe te voegen aan flessen met teststof om microbiële activiteit tot stilstand te brengen. Een aanzienlijke verlaging van de concentratie DOC of de concentratie van een specifieke stof in de fysisch-chemische controletest wijst op abiotische verwijdermechanismen. (Als kwikchloride wordt gebruikt, moet worden gelet op interferenties of katalysatorvergiftiging in de DOC-analyse.)
|
Aantal flessen
|
21.
|
In een doorsneeproef worden de volgende flessen gebruikt:
|
flessen 1 & 2
|
bevatten teststof (testsuspensie);
|
|
flessen 3 & 4
|
bevatten alleen zeewater (blanco);
|
|
fles 5
|
bevat referentiestof (procedurecontrole);
|
|
fles 6
|
bevat test- en referentiestof (toxiciteitscontrole) — facultatief;
|
|
fles 7
|
bevat teststof en steriliserend middel (abiotische steriele controle) — facultatief.
|
|
DOC-analyse
|
22.
|
Haal tijdens het verloop van de test met passende tussenpozen monsters uit de test voor de DOC-analyse (aanhangsel 1). Neem altijd monsters aan het begin van de test (dag 0) en op dag 60. Minimaal vijf monsters in totaal zijn nodig om het tijdsverloop van de afbraak te beschrijven. Vanwege de uiteenlopende biologische afbraaksnelheden kan geen vast tijdsschema worden gegeven voor de monstername. Voer de DOC-bepaling in duplo uit voor elk monster.
|
Monstername
|
23.
|
Het vereiste volume van de monsters is afhankelijk van de analysemethode (specifieke analyse), het gebruikte koolstofanalyseapparaat en de voor de voorbehandeling van het monster gebruikte procedure (membraanfiltratie of centrifugering) voorafgaande aan de koolstofbepaling (punten 25 en 26). Zorg er vóór de monstername voor dat het testmedium goed is gemengd en dat eventueel aan de fleswand plakkend materiaal wordt opgelost of gesuspendeerd.
|
|
24.
|
Pas onmiddellijk membraanfiltratie toe of centrifugeer onmiddellijk na de monstername. Bewaar, indien nodig, de gefiltreerde of gecentrifugeerde monsters bij 2-4 °C gedurende maximaal 48 uur of bij minder dan 18 °C gedurende langere perioden (pas, indien bekend is dat de stof geen effecten ondervindt, de zuurtegraad van de monsters aan tot pH 2 alvorens ze op te slaan).
|
|
25.
|
Membraanfilters (0,2-0,45 μm) zijn geschikt, indien gewaarborgd wordt dat ze noch koolstof afgeven, noch de stof in de filtratiestap absorberen, zoals membraanfilters van polycarbonaat. Sommige membraanfilters zijn geïmpregneerd met oppervlakteactieve stoffen voor hydrofilisering, waardoor er aanzienlijke hoeveelheden opgeloste koolstof uit vrij kunnen komen. Prepareer dergelijke filters door ze te koken in gedeïoniseerd water gedurende drie opeenvolgende perioden van één uur elk. Bewaar de filters na het koken in gedeïoniseerd water. Gooi de eerste 20 ml van het filtraat weg.
|
|
26.
|
Als alternatief voor membraanfiltratie kan ervoor worden gekozen de monsters te centrifugeren. Centrifugeer bij 40 000 m.s– 2 (~ 4 000 g) gedurende 15 minuten, bij voorkeur in een gekoelde centrifuge.
Opmerking: Differentiatie tussen het totale gehalte organische koolstof (total organic carbon, TOC) en DOC (TOC/DOC) door centrifugeren bij zeer lage concentraties lijkt niet te werken, aangezien niet alle bacteriën worden verwijderd of de koolstof die deel uitmaakt van het bacteriële plasma opnieuw wordt opgelost. Bij hogere testconcentraties (> 10 mg C per liter) lijkt de centrifugeringsfout relatief klein.
|
Bemonsteringsfrequentie
|
27.
|
Indien analysen direct na monstername worden uitgevoerd, moet het daaropvolgende monsternamemoment worden bepaald aan de hand van het resultaat van de analytische bepaling.
|
|
28.
|
Indien monsters worden geconserveerd (punt 24) voor analyse op een later moment, moeten meer monsters worden genomen dan het vereiste minimumaantal van vijf. Analyseer de laatst genomen monsters eerst, waarna door een stapsgewijze „achterwaartse” selectie van geschikte monsters voor analyse een goede beschrijving van de afbraakcurve kan worden verkregen met een relatief klein aantal analytische bepalingen. Indien aan het einde van de test geen biologische afbraak heeft plaatsgevonden, hoeven geen verdere monsters te worden geanalyseerd en in deze situatie kan de „achterwaartse” strategie zorgen voor een aanzienlijke besparing op analysekosten.
|
|
29.
|
Beëindig de test indien vóór dag 60 een plateau in de curve wordt vastgesteld. Indien afbraak duidelijk vóór dag 60 begonnen is, maar nog geen plateau heeft bereikt, zet u het experiment voort gedurende een verdere periode.
|
GEGEVENS EN RAPPORTAGE
Bewerking van de resultaten
|
30.
|
De analyseresultaten worden genoteerd op het bijgevoegde gegevensformulier (aanhangsel 2) en de afbraakwaarden voor beide tests en referentiestoffen worden berekend met onderstaande vergelijking:
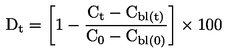
waarin:
|
Dt
|
=
|
procentuele afbraak van DOC of verwijdering van specifieke stof op moment t,
|
|
Co
|
=
|
beginconcentratie van DOC of specifieke stof in het testmedium,
|
|
Ct
|
=
|
concentratie van DOC of specifieke stof in het testmedium op moment t,
|
|
Cbl(0)
|
=
|
beginconcentratie van DOC of specifieke stof in de blanco,
|
|
Cbl(t)
|
=
|
concentratie van DOC of specifieke stof in de blanco op moment t.
|
|
|
31.
|
Afbraak wordt uitgedrukt als het percentage verwijderde DOC (uiteindelijke afbraak) of als het percentage verwijderde specifieke stof (primaire afbraak) op moment t. De DOC-concentraties worden berekend tot op 0,1 mg per liter en de gemiddelden van de Dt-waarden worden afgerond op het dichtstbijzijnde hele procent.
|
|
32.
|
Het verloop van de afbraak wordt inzichtelijk gemaakt in een diagram zoals getoond in de figuur in „Geldigheid en interpretatie van de resultaten”. Als er voldoende gegevens zijn, worden op basis van de curve de aanloopfase (tL) en de tijd die nodig is om 50 procent verwijdering te bereiken vanaf het einde van de aanloopfase (t50) berekend.
|
Testverslag
|
33.
|
Het testverslag moet de volgende informatie bevatten:
|
|
Teststof:
|
—
|
fysische aard en, indien relevant, fysisch-chemische eigenschappen;
|
|
|
|
Testomstandigheden:
|
—
|
locatie en beschrijving van de monsternamelocatie; status in termen van verontreiniging en nutriënten (kolonietelling, nitraat, ammonium, fosfaat indien van toepassing);
|
|
—
|
kenmerken van het monster (datum van monstername, diepte, voorkomen, temperatuur, zoutgehalte, DOC (facultatief), vertraging tussen monstername en gebruik in de test;
|
|
—
|
voor veroudering van het zeewater gebruikte methode (indien van toepassing);
|
|
—
|
voor voorbehandeling van het zeewater gebruikte methode (filtratie/bezinking);
|
|
—
|
voor DOC-bepaling gebruikte methode;
|
|
—
|
voor specifieke analyse gebruikte methode (facultatief);
|
|
—
|
voor de bepaling van het aantal heterotrofen in het zeewater gebruikte methode (tellen van plaatjes of andere procedure) (facultatief);
|
|
—
|
andere methoden (facultatief) die zijn gebruikt om de kenmerken van het zeewater vast te leggen (ATP-metingen, enz.).
|
|
|
|
Resultaten:
|
—
|
op een gegevensformulier gerapporteerde analytische gegevens (aanhangsel 2);
|
|
—
|
het verloop van de afbraaktest wordt schematisch weergegeven in een diagram dat de aanloopfase (tL) toont evenals de helling en tijd (beginnend vanaf het einde van de aanloopfase) benodigd om 50 procent verwijdering te bereiken (t50). De aanloopfase kan grafisch worden geschat zoals getoond in de figuur in het onderdeel „Geldigheid en interpretatie van de resultaten” of kan gemakkelijk worden berekend als de tijd die nodig is om 10 procent afbraak te bereiken;
|
|
—
|
procentuele afbraak gemeten na 60 dagen of aan het einde van de test.
|
|
|
|
Bespreking van de resultaten.
|
|
Geldigheid en interpretatie van de resultaten
|
34.
|
De resultaten die zijn behaald met de referentiestoffen, bijv. natriumbenzoaat, natriumacetaat of aniline, moeten kunnen worden vergeleken met resultaten die zijn behaald in de ringtest (3) (zie het onderdeel over „Referentiestoffen”, punt 7). Indien met referentiestoffen behaalde resultaten atypisch zijn, moet de test worden herhaald met gebruikmaking van een ander zeewatermonster. Hoewel de interpretatie van remmingstests mogelijk niet altijd direct voor de hand ligt vanwege de bijdrage aan het DOC-gehalte door de teststof, is een aanzienlijke vermindering van de totale procentuele verwijdering van DOC in vergelijking met die van de controle een positief teken van toxische effecten.
|
|
35.
|
Gezien de relatief hoge testconcentraties die worden gebruikt in vergelijking met de meeste natuurlijke systemen (en daardoor de ongunstige verhouding tussen de concentraties teststoffen en andere koolstofbronnen) moet de methode worden beschouwd als een voorlopige test die kan worden gebruikt om aan te geven of een stof al dan niet gemakkelijk biologisch afbreekbaar is. Dienovereenkomstig hoeft een laag resultaat niet noodzakelijkerwijs te betekenen dat de teststof niet biologisch afbreekbaar is in mariene omgevingen, maar duidt het op de noodzaak om meer werk te verrichten teneinde dit vast te stellen.
Een voorbeeld van een theoretisch afbraakexperiment dat een haalbare manier toont om de waarden te schatten van tL (duur van „aanloopfase”) en t50 (tijdsinterval, beginnend bij tL, dat nodig is om 50 procent verwijdering te bereiken), wordt gegeven in onderstaande figuur.

|
GESLOTEN-FLESMETHODE
INLEIDING
|
1.
|
Deze methode is een zeewatervariant van de gesloten-flesmethode (5) en is in zijn definitieve vorm opgesteld als resultaat van een ringtest die voor de Europese Commissie (EC) werd georganiseerd door het Deense Waterkwaliteitsinstituut (3).
|
|
2.
|
Zoals bij de hier eveneens besproken schudflesmethode moeten de resultaten van deze test niet worden beschouwd als aanwijzingen van gemakkelijke biologische afbreekbaarheid, maar specifiek worden gebruikt om informatie te verkrijgen over de biologische afbreekbaarheid van stoffen in mariene omgevingen.
|
PRINCIPE VAN DE METHODE
|
3.
|
Een vooraf bepaalde hoeveelheid teststof wordt opgelost in het testmedium in een concentratie van doorgaans 2-10 mg teststof per liter (een of meer concentraties kunnen worden gebruikt). De oplossing wordt in het donker bewaard in een gevulde gesloten fles in een thermostatisch bad of vat bij een constant gehouden temperatuur (± 1 °C) binnen het bereik van 15-20 °C. Indien het doel van het onderzoek is om milieuomstandigheden te simuleren, kunnen tests worden uitgevoerd buiten dit normale temperatuurbereik, mits er geschikte aanpassingen worden doorgevoerd met het oog op de temperatuurbeheersing. De afbraak wordt gevolgd door zuurstofanalysen gedurende een periode van 28 dagen.
|
|
4.
|
De ringtest toonde aan dat, als de test na 28 dagen werd verlengd, er in de meeste gevallen geen bruikbare informatie kon worden verzameld vanwege ernstige interferenties. De waarden voor het biologische zuurstofverbruik (BOD) in de blancotest waren buitensporig hoog, waarschijnlijk door groei op de wanden die wordt veroorzaakt door het gebrek aan beweging en nitrificatie. Derhalve is de aanbevolen duur 28 dagen, maar als de blanco-BOD-waarde binnen de grens van 30 procent blijft (punten 15 en 40), kan de test eventueel worden verlengd.
|
INFORMATIE OVER DE TESTSTOF
|
5.
|
Om te weten of de test kan worden toegepast op een bepaalde stof, moeten enkele eigenschappen van die stof bekend zijn. De empirische formule is vereist, zodat het theoretische zuurstofverbruik (ThOD) kan worden berekend (zie aanhangsel 3); anders moet het chemische zuurstofverbruik (COD) van de stof worden bepaald om te dienen als referentiewaarde. Het gebruik van COD is minder gewenst, omdat bepaalde stoffen niet volledig worden geoxideerd in de COD-test.
|
|
6.
|
De oplosbaarheid van de stof moet ten minste 2 mg/l zijn, hoewel minder goed oplosbare stoffen in principe kunnen worden getest (bijv. met gebruik van ultrasone celafbraak) evenals vluchtige stoffen. Informatie over de zuiverheid of de relatieve verhoudingen van belangrijke componenten van de teststof is nodig, opdat de verkregen resultaten kunnen worden geïnterpreteerd, in het bijzonder wanneer het resultaat dicht ligt bij het niveau waarop de test wordt doorstaan.
|
|
7.
|
Informatie over de giftigheid van de stof voor bacteriën, zoals die bijvoorbeeld wordt gemeten bij korte ademhalingssnelheidstests (4), kan zeer nuttig zijn bij het selecteren van geschikte testconcentraties en kan cruciaal zijn voor de correcte interpretatie van lage waarden voor biologische afbreekbaarheid. Dergelijke informatie is echter niet altijd toereikend voor de interpretatie van de in de biologische-afbraaktest verkregen resultaten en de in punt 27 beschreven procedure is geschikter.
|
REFERENTIESTOFFEN
|
8.
|
Geschikte referentiestoffen moeten worden gebruikt om de microbiële activiteit van het zeewatermonster te controleren. Bijvoorbeeld aniline, natriumacetaat en natriumbenzoaat kunnen voor dit doel worden gebruikt. Ten minste 60 procent (van het ThOD) van deze stoffen moet worden afgebroken binnen een redelijk korte tijd; anders wordt aanbevolen dat de test wordt herhaald met gebruikmaking van een ander zeewatermonster.
|
|
9.
|
In de EC-ringtest, waarbij zeewatermonsters werden genomen op verschillende locaties en op verschillende momenten in het jaar, waren de aanloopfase (tL) en de tijd die nodig was om 50 procent afbraak te bereiken (t50), de aanloopfase niet inbegrepen, respectievelijk 0 tot 2 dagen en 1 tot 4 dagen voor natriumbenzoaat. Voor aniline waren de waarden van tL en t50 respectievelijk 0 tot 7 en 2 tot 12 dagen.
|
REPRODUCEERBAARHEID
|
10.
|
De reproduceerbaarheid van de methoden is bepaald in de ringtest (3).
|
BESCHRIJVING VAN DE METHODE
Apparatuur
|
11.
|
Gewone laboratoriumuitrusting en:
|
(a)
|
BOD-flessen van 250-300 ml met glazen stoppen of flessen van 250 ml met een nauwe hals en glazen stoppen kunnen worden gebruikt;
|
|
(b)
|
enkele flessen van 2-, 3- en 4- liter met litermarkeringen om het experiment voor te bereiden en om de BOD-flessen te vullen;
|
|
(c)
|
waterbad of kamer met constante temperatuur om de temperatuur van de flessen constant te houden (± 1 °C) zonder blootstelling aan licht.
|
|
(d)
|
apparatuur voor de analyse van opgeloste zuurstof;
|
|
(e)
|
membraanfilters, 0,2-0,45 μm (facultatief);
|
|
(f)
|
apparatuur voor specifieke analyse (facultatief).
|
|
Zeewater
|
12.
|
Neem een zeewatermonster en vervoer het in een zorgvuldig gereinigd vat naar het laboratorium, bij voorkeur binnen een of twee dagen na de monstername. Tijdens het vervoer moet worden voorkomen dat de temperatuur van het monster veel hoger wordt dan de in de test te gebruiken temperatuur.
|
|
13.
|
Identificeer de locatie van de monstername nauwkeurig en beschrijf daarbij de status van de locatie in termen van verontreiniging en nutriënten. Met name voor kustwateren of verontreinigde wateren moet deze karakterisering een telling omvatten van heterotrofe microbiële kolonies evenals de bepaling van concentraties van opgeloste nitraat, ammonium en fosfaat.
|
|
14.
|
Voor het zeewatermonster zelf wordt de volgende informatie gerapporteerd:
|
—
|
voorkomen van het monster — troebel, enz.;
|
|
—
|
temperatuur op het moment van de monstername;
|
|
—
|
opgeloste organische koolstof (DOC)
|
|
—
|
vertraging tussen de monstername en het gebruik ervan in de test.
|
|
|
15.
|
Als het DOC-gehalte van het monster hoog blijkt te zijn of als wordt vermoed dat het biologische zuurstofverbruik in de blancotest na 28 dagen meer zou zijn dan 30 procent van dat van de referentiestoffen, wordt aanbevolen om het zeewater voorafgaande aan het gebruik gedurende ongeveer een week te laten verouderen.
|
|
16.
|
Laat het monster verouderen onder aerobe omstandigheden bij de testtemperatuur en in het donker of bij diffuus licht. Indien nodig wordt voorzichtige beluchting toegepast om aerobe omstandigheden te handhaven. Tijdens het verouderen wordt het gehalte gemakkelijk afbreekbaar organisch materiaal verminderd. In de ring-test (3) is geen verschil aangetoond tussen het afbraakpotentieel van verouderde en vers verzamelde zeewatermonsters.
|
|
17.
|
Vóór gebruik moet het zeewater worden voorbehandeld om er grove deeltjes uit te verwijderen, bijvoorbeeld door filtratie met behulp van een nylon filter of een grof papieren filter (geen membraan- of GF-C-filters) of door bezinken en decanteren. De toegepaste methode moet worden gerapporteerd. Als veroudering wordt toegepast, moet daarna de voorbehandeling worden uitgevoerd.
|
Stamoplossingen voor minerale nutriënten
|
18.
|
De onderstaande stamoplossingen worden bereid met gebruikmaking van reagentia van analytische kwaliteit:
|
(a)
|
kaliumdiwaterstoforthofosfaat, KH2PO4
|
8,50 g
|
|
dikaliumwaterstoforthofosfaat K2HPO4
|
21,75 g
|
|
dinatriumwaterstoforthofosfaatdihydraat, Na2HPO4 · 2H2O
|
33,30 g
|
|
ammoniumchloride, NH4Cl
|
0,50 g
|
|
Oplossen in water en aanvullen met gedistilleerd water tot 1 liter.
|
|
|
(b)
|
calciumchloride, CaCl2
|
27,50 g
|
|
Oplossen in water en aanvullen met gedistilleerd water tot 1 liter.
|
|
|
(c)
|
magnesiumsulfaatheptahydraat, MgSO4 · 7H2O
|
22,50 g
|
|
Oplossen in water en aanvullen met gedistilleerd water tot 1 liter.
|
|
|
(d)
|
ijzer(III)chloridehexahydraat, FeCl3 · 6H2O
|
0,25 g
|
|
Oplossen en aanvullen met gedistilleerd water tot 1 liter.
|
|
Neerslag in oplossing (d) kan worden voorkomen door één druppel geconcentreerd HCl of 0,4 g ethyleendiaminetetraazijnzuur (EDTA, dinatriumzout) per liter toe te voegen. Als er zich neerslag vormt in een stamoplossing, moet deze worden vervangen door een vers bereide oplossing.
|
Bereiding van testmedium
|
19.
|
Per liter voorbehandeld zeewater wordt 1 ml van elk van bovenstaande stamoplossingen toegevoegd. Het testmedium wordt bij de testtemperatuur met lucht verzadigd door te beluchten met schone perslucht gedurende ongeveer 20 minuten. Ter controle wordt de concentratie opgeloste zuurstof bepaald. De verzadigde concentratie van opgeloste zuurstof als een functie van het zoutgehalte en de temperatuur kan worden afgelezen in het monogram dat bij deze methode is gevoegd (aanhangsel 4).
|
Entmateriaal
|
20.
|
Naast de reeds in het zeewater aanwezige micro-organismen wordt geen specifiek entmateriaal toegevoegd. Het aantal kolonievormende heterotrofen in het zeewatertestmedium (en bij voorkeur ook in het oorspronkelijke zeewatermonster) wordt (facultatief) bepaald, bijv. door platen te tellen met gebruikmaking van zee-agar. Dit is in het bijzonder wenselijk voor monsters van kust- of verontreinigde locaties. De heterotrofe microbiële activiteit in het zeewater wordt gecontroleerd door een test met een referentiestof uit te voeren.
|
Bereiding van testoplossingen
|
21.
|
Alle nodige manipulaties met inbegrip van veroudering en voorbehandeling van het zeewater worden verricht bij de gekozen testtemperatuur tussen 15 en 20 °C, waarbij er zorg voor moet worden gedragen dat alle glazen voorwerpen schoon zijn, maar niet steriel.
|
|
22.
|
Voor de bepaling van het biologische zuurstofgebruik (BOD) van de teststof en referentiestoffen in gelijktijdige proefseries worden groepen van BOD-flessen bereid. Alle analysen worden verricht op duploflessen (blanco's, referentiestoffen en teststoffen), d.w.z. per bepaling worden twee flessen bereid. Op de dagen 0, 5, 15 and 28 (vier bepalingen) worden analysen uitgevoerd. Voor zuurstofanalysen zijn voor vier bepalingen in totaal 3 × 2 × 4 = 24 flessen nodig (blanco, referentie- en teststof) en derhalve is ongeveer 8 liter testmedium (voor één concentratie van de teststof) nodig.
|
|
23.
|
Afzonderlijke oplossingen van test- en referentiestoffen worden bereid in grote flessen met een toereikend volume (punt 11) door eerst de test- en referentiestoffen hetzij direct toe te voegen, hetzij door gebruik te maken van een geconcentreerde stamoplossing voor de gedeeltelijk gevulde grote flessen. De gewenste totale concentraties worden bereikt door meer testmedium toe te voegen. Bij gebruik van stamoplossingen van test- en/of referentiestoffen moet ervoor worden gezorgd dat het zoutgehalte van het zeewatermedium niet al te zeer verandert.
|
|
24.
|
De concentraties van de test- en referentiestoffen worden geselecteerd met inachtneming van:
|
a)
|
de oplosbaarheid van opgeloste zuurstof in zeewater bij de gekozen testtemperatuur en het zoutgehalte (zie bijgevoegd nomogram in aanhangsel 4);
|
|
b)
|
het biologische zuurstofverbruik van het zeewater in de blancotest; en
|
|
c)
|
de verwachte biologische afbreekbaarheid van de teststof.
|
|
|
25.
|
Bij 15 °C en 20 °C en een zoutgehalte van 32 deeltjes per duizend (zeewater) is de oplosbaarheid van opgeloste zuurstof respectievelijk ongeveer 8,1 en 7,4 mg/l. Het zuurstofverbruik van het zeewater zelf (ademhaling in blancotest) kan 2 mg O2/l of meer zijn, als het zeewater niet is verouderd. Derhalve moet, om te waarborgen dat een significante zuurstofconcentratie overblijft na oxidatie van de teststof, een beginconcentratie van de teststof worden gebruikt van ongeveer 2-3 mg/l (afhankelijk van het ThOD) voor de stoffen die naar verwachting volledig worden afgebroken onder de omstandigheden van de test (zoals referentiestoffen). Minder goed afbreekbare stoffen moeten worden getest bij hogere concentraties, tot ongeveer 10 mg/l, mits er geen toxische effecten optreden. Het kan gunstig zijn om parallelle tests te verrichten met een lage (ongeveer 2 mg/l) en een hoge (ongeveer 10 mg/l) concentratie van de teststof.
|
|
26.
|
In een blancotest moet het zuurstofgehalte parallel worden bepaald in flessen die noch de teststof noch een referentiestof bevatten.
|
|
27.
|
Als de test remmende effecten moet aantonen, worden de volgende reeks oplossingen bereid in afzonderlijke grote flessen (punt 13):
|
(a)
|
2 mg per liter van een gemakkelijk afbreekbare stof, bijv. een van de voornoemde referentiestoffen;
|
|
(b)
|
x mg per liter teststof (x is doorgaans 2);
|
|
(c)
|
2 mg per liter gemakkelijk afbreekbare stof plus x mg per liter teststof.
|
|
Fysisch-chemische controletest (facultatief)
|
28.
|
Als ervoor wordt gekozen om specifieke analysen te gebruiken, kan een fysisch-chemisch experiment worden uitgevoerd om te controleren of de teststof is verwijderd door abiotische mechanismen, zoals hydrolyse of adsorptie. Een fysisch-chemische controletest kan worden uitgevoerd door kwik(II)chloride (HgCl2) (33) (50-100 mg/l) toe te voegen aan duploflessen met de teststof om microbiële activiteit tot stilstand te brengen. Een aanzienlijke verlaging van de concentratie van een specifieke stof tijdens het verloop van de test wijst op abiotische verwijdermechanismen.
|
Aantal BOD-flessen in een doorsneebepaling
|
29.
|
In een doorsneebepaling worden de volgende flessen gebruikt:
|
—
|
ten minste 8 die de teststof bevatten;
|
|
—
|
ten minste 8 die alleen met nutriënten verrijkt zeewater bevatten;
|
|
—
|
ten minste 8 die de referentiestof bevatten; en indien nodig
|
|
—
|
6 flessen die de test- en referentiestoffen bevatten (toxiciteitscontrole).
|
|
PROCEDURE
|
30.
|
Na de bereiding moet elke oplossing onmiddellijk worden overgeheveld uit het onderste deel (niet van de bodem) in de overeenkomstige grote fles, om de respectieve groep BOD-flessen te vullen. Vervolgens worden onmiddellijk de tijdstip-nulmonsters geanalyseerd voor opgeloste zuurstof (punt 33) of deze worden geconserveerd voor chemische analyse op een later tijdstip door precipitatie met MnCl2 (mangaan(II)chloride) en NaOH (natriumhydroxide).
|
|
31.
|
De resterende parallelle BOD-flessen worden bij de testtemperatuur (15-20 °C) geïncubeerd, in het donker bewaard en met passende tussenpozen uit de incubatieruimte verwijderd (bijv. ten minste na 5, 15 en 28 dagen) en geanalyseerd op de aanwezigheid van opgeloste zuurstof (punt 33).
|
|
32.
|
De monsters voor specifieke analyses worden met een membraanfilter (0,2--0,45 μm) gefiltreerd of gecentrifugeerd, gedurende 15 minuten (facultatief). De monsters worden gedurende maximaal 48 uren bij 2-4 °C of gedurende een langere periode bij -18 °C bewaard, als ze niet onmiddellijk worden geanalyseerd (indien bekend is dat de teststof hiervan geen effecten ondervindt, moet de zuurtegraad ervan worden aangepast tot pH 2, voordat de stof wordt opgeslagen).
|
Bepaling van het gehalte opgelost zuurstof
|
33.
|
De concentratie opgeloste zuurstof wordt bepaald met behulp van een chemische of elektrochemische methode die nationaal of internationaal wordt erkend.
|
GEGEVENS EN RAPPORTAGE
Bewerking van de resultaten
|
34.
|
De analytische resultaten worden op de bijgevoegde gegevensformulieren (aanhangsel 5) genoteerd.
|
|
35.
|
Het biologische zuurstofverbruik (BOD) wordt berekend als het verschil tussen de zuurstofdepletie tussen een blancomonster en een oplossing van de teststof onder de omstandigheden van de test. De nettozuurstofdepletie wordt gedeeld door de concentratie (w/v) van de stof om het BOD uit te drukken als mg BOD/mg teststof. De afbraak wordt gedefinieerd als de verhouding van het biochemische zuurstofverbruik tot hetzij, bij voorkeur, het theoretische zuurstofverbruik (ThOD), hetzij het chemische zuurstofverbruik (COD) en wordt uitgedrukt als een percentage (zie punt 36).
|
|
36.
|
De biologische-afbraakwaarden voor ieder monsternametijdstip worden berekend voor zowel de test- als de referentiestof met behulp van een van onderstaande vergelijkingen:


waarin:
|
ThOD
|
=
|
theoretisch zuurstofverbruik (berekening, aanhangsel 3)
|
|
COD
|
=
|
chemisch zuurstofverbruik, experimenteel bepaald.
|
Opmerking: In sommige gevallen leiden de twee berekeningswijzen (percentage van het ThOD of percentage van het COD) niet tot dezelfde resultaten; ThOD moet bij voorkeur worden gebruikt, omdat bepaalde stoffen in de COD-test niet volledig worden geoxideerd.
|
|
37.
|
Het verloop van de afbraak wordt inzichtelijk gemaakt in een diagram (zie voorbeeld in het onderdeel „Geldigheid en interpretatie van de resultaten”). Als er voldoende gegevens zijn, worden op basis van de curve voor biologische afbraak de aanloopfase (tL) en de tijd die nodig is om 50 procent verwijdering te bereiken vanaf het einde van de aanloopfase (t50) berekend.
|
|
38.
|
Indien specifieke analyse wordt toegepast (facultatief), wordt het percentage voor primaire afbraak uitgedrukt als de procentuele verwijdering van de specifieke stof binnen de testperiode (gecorrigeerd voor analytische blanco's).
|
Testverslag
|
39.
|
Het testverslag moet de volgende informatie bevatten:
|
|
Teststof:
|
—
|
fysische aard en, indien relevant, fysisch-chemische eigenschappen;
|
|
|
|
Testomstandigheden:
|
—
|
locatie en beschrijving van de monsternamelocatie; status in termen van verontreiniging en nutriënten (kolonietelling, nitraat, ammonium, fosfaat indien van toepassing);
|
|
—
|
kenmerken van het monster (datum van monstername, diepte, voorkomen, temperatuur, zoutgehalte, DOC (facultatief), vertraging tussen monstername en gebruik in de test);
|
|
—
|
voor veroudering van het zeewater gebruikte methode (indien van toepassing);
|
|
—
|
voor voorbehandeling van het zeewater gebruikte (filtratie/bezinking);
|
|
—
|
voor de COD-bepaling gebruikte methode (indien uitgevoerd);
|
|
—
|
voor de zuurstofmetingen gebruikte methoden;
|
|
—
|
dispersieprocedure voor stoffen die moeilijk oplosbaar zijn onder de testomstandigheden;
|
|
—
|
voor de bepaling van het aantal heterotrofen in het zeewater gebruikte methode (tellen van plaatjes of andere procedure);
|
|
—
|
voor de bepaling van DOC in zeewater gebruikte methode (facultatief);
|
|
—
|
voor specifieke analyse gebruikte methode (facultatief);
|
|
—
|
andere facultatieve methoden die zijn gebruikt om de kenmerken van het zeewater vast te leggen (ATP-metingen, enz.).
|
|
|
|
Resultaten:
|
—
|
op een gegevensformulier (bijgevoegd, aanhangsel 5) gerapporteerde analytische gegevens;
|
|
—
|
het verloop van de afbraaktest, schematisch weergegeven in een diagram dat de aanloopfase (tL) toont evenals de helling en tijd (beginnend vanaf het einde van de aanloopfase) benodigd om 50 procent van de door oxidatie van de teststof veroorzaakte uiteindelijke zuurstofopname te bereiken (t50). De aanloopfase kan grafisch worden geschat zoals getoond in de bijgevoegde figuur of kan gemakkelijk worden berekend als de tijd die nodig is om 10 procent afbraak te bereiken;
|
|
—
|
na 28 dagen gemeten procentuele afbraak.
|
|
|
|
Bespreking van de resultaten.
|
|
Geldigheid en interpretatie van de resultaten
|
40.
|
De ademhaling in de blancotest mag niet hoger zijn dan 30 procent van de zuurstof in de testfles. Ingeval het niet mogelijk is om aan dit criterium te voldoen met vers verzameld zeewater, moet het zeewater verouderen (stabiliseren) alvorens het gebruikt kan worden.
|
|
41.
|
Er moet rekening worden gehouden met de mogelijkheid dat stikstofhoudende stoffen de resultaten beïnvloeden.
|
|
42.
|
Resultaten die met de referentiestoffen natriumbenzoaat en aniline zijn verkregen, moeten kunnen worden vergeleken met de in de ringtest (3) verkregen resultaten (punt 9). Indien met referentiestoffen behaalde resultaten atypisch zijn, moet de test worden herhaald met gebruikmaking van een ander zeewatermonster.
|
|
43.
|
De teststof kan worden geacht remmend te werken op bacteriën (bij de gebruikte concentratie), indien het BOD van het mengsel van referentiestoffen lager is dan de som van het BOD van de afzonderlijke oplossingen van de twee stoffen.
|
|
44.
|
Gezien de relatief hoge testconcentraties in vergelijking met de meeste natuurlijke systemen en daardoor de ongunstige verhouding tussen de concentraties teststof en andere koolstofbronnen, moet de methode worden beschouwd als een voorlopige test die kan worden gebruikt om aan te geven of een stof al dan niet gemakkelijk biologisch afbreekbaar is. Dienovereenkomstig hoeft een laag resultaat niet noodzakelijkerwijs te betekenen dat de teststof niet biologisch afbreekbaar is in mariene omgevingen, maar duidt het op de noodzaak om meer werk te verrichten teneinde dit vast te stellen.
Een voorbeeld van een theoretisch afbraakexperiment dat een haalbare manier toont om de waarden te schatten van tL (duur van „aanloopfase”) en t50, het tijdsinterval (beginnend bij tL) dat nodig is om 50 procent van de door oxidatie van de teststof veroorzaakte uiteindelijke zuurstofopname te bereiken, wordt gegeven in onderstaande figuur:
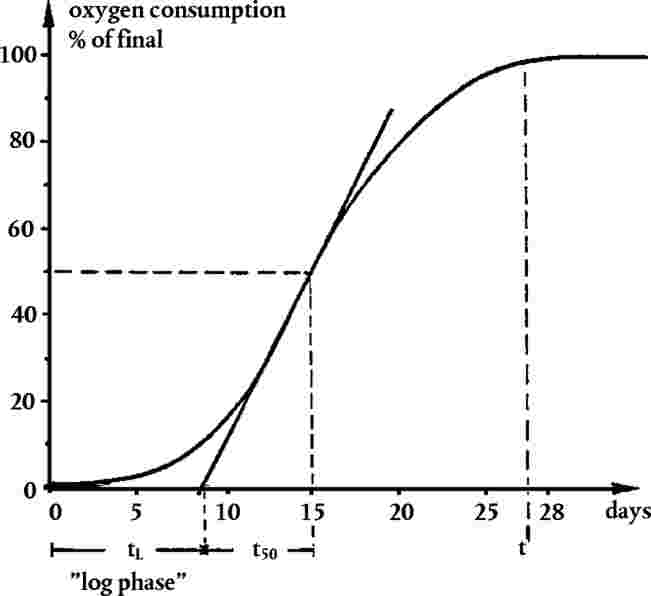
|
LITERATUUR
|
(1)
|
de Kreuk J.F. and Hanstveit A.O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561-573.
|
|
(2)
|
Hoofdstuk C.4-B van deze bijlage: Bepaling van de „gemakkelijke” biologische afbreekbaarheid, deel III van de gewijzigde OESO-screeningtest.
|
|
(3)
|
Nyholm N. and Kristensen P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Eindverslag van het ringtestprogramma 1984--1985, maart 1987, Commissie van de Europese Gemeenschappen.
|
|
(4)
|
Hoofdstuk C.11 van deze bijlage: Biologische afbraak — Actief slib: ademhalingsremmingstest.
|
|
(5)
|
Hoofdstuk C.4-E van deze bijlage: Bepaling van de „gemakkelijke” biologische afbreekbaarheid, deel VI Gesloten-flestest.
|
Aanhangsel 1
Bepaling van organische koolstof in zeewater
SCHUDFLESMETHODE
Voor de bepaling van het gehalte organische koolstof van een watermonster worden de organische verbindingen in het monster geoxideerd tot koolstofdioxide, waarbij over het algemeen een van onderstaande drie technieken wordt gebruikt:
|
—
|
natte oxidatie door middel van persulfaat/UV-bestraling;
|
|
—
|
natte oxidatie door middel van persulfaat/hogere temperatuur (116-130 °C);
|
De CO2-ontwikkeling wordt gekwantificeerd door gebruik te maken van infraroodspectrometrie of titratie. Een andere mogelijkheid is CO2 te reduceren tot methaan, dat vervolgens wordt gekwantificeerd op een vlamionisatiedetector (flame ionization detector, FID).
De persulfaat/UV-methode wordt gewoonlijk gebruikt voor de analyse van „schoon” water met een lage concentratie vaste deeltjes. De twee laatstgenoemde methoden kunnen worden toegepast op de meeste soorten watermonsters, waarbij de oxidatiemethode met persulfaat/hogere temperatuur het geschiktst is voor monsters met lage concentraties en de verbrandingstechniek toegepast kan worden op monsters met een gehalte niet-vluchtige organische koolstof (non-volatile organic carbon, NVOC) van ruim meer dan 1 mg C/l.
Interferenties
De drie methoden zijn alle gebaseerd op de verwijdering of compensatie van anorganische koolstof (inorganic carbon, IC) die in het monster aanwezig is. Het onttrekken van CO2 aan het aangezuurde monster is de vaakst gebruikte methode voor het verwijderen van de IC, hoewel dit ook leidt tot een verlies van vluchtige organische verbindingen (1). De volledige verwijdering of compensatie van IC moet worden gewaarborgd voor iedere monstermatrix en het gehalte vluchtige organische koolstof (volatile organic carbon, VOC) moet worden bepaald in aanvulling op het gehalte NVOC, afhankelijk van het type monster.
Hoge chlorideconcentraties leiden tot verminderde oxidatie-efficiëntie wanneer de persulfaat/UV-methode wordt gebruikt (2). Echter, door een oxidatiereagens te gebruiken dat is aangepast door de toevoeging van kwik(II)nitraat, kan deze interferentie worden uitgesloten. Aanbevolen wordt dat het maximaal toegestane monstervolume wordt gebruikt om ieder type chloridehoudend monster te evalueren. Hoge zoutconcentraties in monsters die worden geanalyseerd met de verbrandingsmethode kunnen een zoutafzetting op de katalysator en buitensporige corrosie van de verbrandingsbuis veroorzaken. Voorzorgsmaatregelen moeten worden getroffen overeenkomstig de handleiding van de fabrikant.
Bij zeer troebele monsters en bij monsters die deeltjes bevatten, kan onvolledige oxidatie plaatsvinden wanneer de persulfaat/UV-methode wordt gebruikt.
Een voorbeeld van een geschikte methode
Niet-vluchtige organische koolstof wordt bepaald door oxidatie met persulfaat/UV-bestraling en vervolgens de kwantificering van de CO2-ontwikkeling met behulp van niet-dispergerende infraroodspectrometrie.
Het oxidatiereagens wordt aangepast overeenkomstig de in (2) gegeven aanwijzingen, als beschreven in de handleiding van de fabrikant:
|
a)
|
8,2 g HgCl2 en 9,6 g Hg(NO3)2·H2O wordt opgelost in enkele honderden milliliters reagenswater met een laag koolstofgehalte.
|
|
b)
|
20 g K2S2O8 wordt opgelost in de kwikzoutoplossing.
|
|
c)
|
5 ml HNO3 (geconc.) wordt aan het mengsel toegevoegd.
|
|
d)
|
het reagens wordt verdund tot 1 000 ml.
|
De interferentie door chloride wordt uitgesloten door een monstervolume van 40 μl voor 10 procent chloride te gebruiken en een monstervolume van 200 μl voor 1,9 procent chloride. Monsters met hoge chlorideconcentraties en/of grotere monstervolumes kunnen met deze methode worden geanalyseerd, mits voorkomen wordt dat chloride wordt gevormd in het oxidatievat. De bepaling van vluchtige organische koolstof kan vervolgens worden uitgevoerd, indien relevant, voor het type monster in kwestie.
LITERATUUR
|
(1)
|
ISO, Water quality — determination of total organic carbon. Draft International Standard ISO/DIS 8245, 16 januari 1986.
|
|
(2)
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16th edition, 1985.
Tevens van belang (geeft een beschrijving van een autoanalysesysteem):
|
|
(3)
|
Schreurs W. (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137-142.
|
Aanhangsel 2
Biologische afbraak in zeewater
SCHUDFLESMETHODE
GEGEVENSFORMULIER
|
2.
|
DATUM AAN HET BEGIN VAN DE TEST:
|
|
3.
|
TESTSTOF:
Naam:
|
Concentratie stamoplossing:
|
mg/l als vaste stof
|
|
Initiële concentratie in medium, to:
|
mg/l als vaste stof
|
|
:
|
mg DOC/l
|
|
|
4.
|
ZEEWATER:
Bron:
Datum van monstername:
Monsternemingsdiepte:
Voorkomen op moment van monstername (bijv. troebel, enz.):
|
Zoutgehalte bij monstername:
|
‰
|
|
Temperatuur bij monstername:
|
°C
|
|
DOC „x” uren na de monstername
|
mg/l
|
Voorbehandeling voorafgaand aan test (bijv. filtratie, bezinken, veroudering, enz.):
|
Telling microbiële kolonies
|
|
—
|
oorspronkelijk monster:
|
|
kolonies/ml
|
|
|
|
—
|
bij het begin van de test:
|
|
kolonies/ml
|
|
Overige kenmerken
|
|
|
|
|
5.
|
KOOLSTOFBEPALINGEN:
Koolstofanalyseapparaat:
|
|
Flesnr.
|
|
DOC na dagen (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Test: met nutriënten verrijkt zeewater met de teststof
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
gemiddelde, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
gemiddelde, Cb(t)
|
|
|
|
|
|
|
Blanco: met nutriënten verrijkt zeewater zonder de teststof
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
gemiddelde, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
gemiddelde, Cd(t)
|
|
|
|
|
|
| gemiddelde,
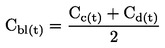
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
EVALUATIE VAN VERKREGEN GEGEVENS:
|
Flesnr.
|
Berekening van de resultaten
|
% afbraak na n dagen
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|

|
0
|
|
|
|
|
|
Gemiddelde (34)
|

|
0
|
|
|
|
|
|
Opmerking:
|
Een soortgelijk schema kan worden gebruikt wanneer de afbraak wordt gevolgd met behulp van specifieke analyse en voor de referentiestof en toxiciteitscontroles.
|
|
|
7.
|
NIET-BIOLOGISCHE AFBRAAK (facultatief)
|
|
Tijd (dagen)
|
|
0
|
t
|
|
DOC-conc. (mg/l) in steriele controle
|
Cs(o)
|
Cs(t)
|
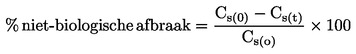
|
Aanhangsel 3
Berekening van het theoretische biochemische zuurstofverbruik
GESLOTEN-FLESMETHODE
Het ThOD van de stof CcHhClclNnNanaOoPpSs met molecuulgewicht MW wordt als volgt berekend:

Deze berekening impliceert dat C wordt gemineraliseerd tot CO2 en H tot H2O, P tot P2O5 en Na tot Na2O. Halogeen wordt verwijderd als waterstofhalogenide en stikstof als ammoniak.
Voorbeeld:
Glucose C6H12O6, MW = 180

Het molecuulgewicht van andere zouten dan die van de alkalimetalen wordt berekend op basis van de aanname dat de zouten gehydrolyseerd zijn.
Zwavel wordt verondersteld zeswaardig te zijn geoxideerd.
Voorbeeld:
Natrium n-dodecylbenzeensulfonaat C18H29SO3Na, MW = 348
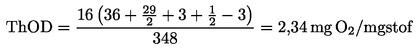
Bij stikstofhoudende verbindingen kan de stikstof worden verwijderd als ammoniak, nitriet of nitraat afhankelijk van de waarde van het theoretische biochemische zuurstofverbruik.
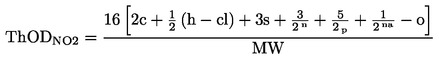

Stel dat tijdens een analyse volledige nitraatvorming zou zijn waargenomen in geval van een secundair amine:
(C12H25)2 NH, MW = 353

Aanhangsel 4

Aanhangsel 5
Biologische afbraak in zeewater
GESLOTEN-FLESMETHODE
GEGEVENSFORMULIER
|
2.
|
DATUM AAN HET BEGIN VAN DE TEST:
|
|
3.
|
TESTSTOF:
Naam:
|
Concentratie stamoplossing:
|
mg/l
|
|
Initiële conc. in zeewatermedium:
|
mg/l
|
|
ThOD of COD:
|
mg O2/mg teststof
|
|
|
4.
|
ZEEWATER:
Bron:
Datum van winning:
Monsternemingsdiepte:
Voorkomen op moment van monstername (bijv. troebel, enz.):
|
Zoutgehalte bij monstername:
|
‰
|
|
Temperatuur bij monstername:
|
°C
|
|
DOC „x” uren na de monstername
|
mg/l
|
Voorbehandeling voorafgaand aan test (bijv. filtratie, bezinken, veroudering, enz.):
|
Telling microbiële kolonies
|
|
—
|
oorspronkelijk monster:
|
|
kolonies/ml
|
|
|
|
—
|
bij het begin van de test:
|
|
kolonies/ml
|
|
Overige kenmerken:
|
|
|
|
|
5.
|
TESTMEDIUM:
|
Temperatuur na beluchting:
|
°C
|
|
O2-concentratie na beluchting en status voor het begin van de test:
|
mg O2/l
|
|
|
6.
|
DO-BEPALING:
Methode: Winkler/elektrode
|
|
Flesnr.
|
|
mg O2/l na n dagen
|
|
0
|
5
|
15
|
28
|
|
Test: met nutriënten verrijkt zeewater met de teststof
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Gemiddelde test
|

|
|
|
|
|
|
Blanco: met nutriënten verrijkt zeewater, maar zonder de teststof
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Gemiddelde blanco
|

|
|
|
|
|
Opmerking: Een soortgelijk schema kan worden gebruikt voor de referentiestof en de toxiciteitscontroles.
|
|
7.
|
DO-AFNAME: % AFBRAAK ( % D):
|
|
DO-afname na n dagen
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|

|
|
|
|
|
C.43. ANAEROBE BIOLOGISCHE AFBREEKBAARHEID VAN ORGANISCHE STOFFEN IN UITGEGIST SLIB: DOOR METING VAN DE GASPRODUCTIE
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan OESO-testrichtsnoer (TG) 311 (2006). Er is een aantal screeningtests voor de beoordeling van de aerobe biologische afbreekbaarheid van organische stoffen (testmethoden C.4, C.9, C.10 en C.11 (1) alsmede OESO TG 302C (2)) en de resultaten van de toepassing van deze tests zijn met succes gebruikt om het lot van stoffen in het aerobe milieu te voorspellen, in het bijzonder in de aerobe fasen van rioolwaterzuivering. Diverse gehalten niet in water oplosbare stoffen en stoffen die adsorberen op vaste afvalstoffen, worden tevens op aerobe wijze behandeld, aangezien ze in gezuiverd afvalwater voorkomen. Echter, deze stoffen worden voor het grootste deel gebonden aan het primaire gezuiverde afvalwater, dat van het onbehandelde afvalwater wordt gescheiden in bezinkingstanks, voordat het gezuiverde, of bovenliggende, afvalwater aeroob wordt gezuiverd. Het slib, dat enkele van de oplosbare stoffen in het poriewater heeft, wordt vervolgens naar verwarmde gistingstanks overgeheveld voor anaerobe zuivering. Vooralsnog zijn er geen tests in deze serie voor de beoordeling van de anaerobe biologische afbreekbaarheid in anaerobe gistingstanks en deze test is bedoeld om dit hiaat te vullen; de test is niet noodzakelijkerwijs toepasbaar op andere anoxische milieucompartimenten.
|
|
2.
|
Respirometrische technieken die de geproduceerde hoeveelheden gas, hoofdzakelijk methaan (CH4) en koolstofdioxide (CO2), meten onder anaerobe omstandigheden zijn met succes gebruikt voor de beoordeling van de anaerobe biologische afbreekbaarheid. Birch et al (3) hebben deze procedures geëvalueerd en kwamen tot de conclusie dat het werk van Shelton en Tiedje (4), dat is gebaseerd op eerdere onderzoeken (5)(6)(7), het meest uitgebreid was. De methode (4), die verder is ontwikkeld door anderen (8) en die de Amerikaanse normen (9)(10) is geworden, loste niet de problemen op met betrekking tot de verschillende oplosbaarheid van CO2 en CH4 in het testmedium en de berekening van de theoretische gasproductie van een teststof. Het ECETOC-rapport (3) bevatte als aanbeveling de aanvullende meting van het gehalte opgeloste anorganische koolstof (DIC) van de bovenliggende vloeistof, waardoor de techniek breder toepasbaar werd. De ECETOC-methode werd onderworpen aan een internationale kalibratie-exercitie (of ringtest) en is de ISO-norm ISO 11734 (11) geworden.
|
|
3.
|
De onderhavige testmethode, die is gebaseerd op ISO 11734 (11), beschrijft een screeningmethode voor de beoordeling van de mogelijke anaerobe biologische afbreekbaarheid van organische stoffen onder specifieke omstandigheden (d.w.z. in een anaerobe gistingstank op een bepaald moment en binnen een bepaald concentratiebereik van micro-organismen). Omdat verdund slib met een relatief hoge concentratie teststof wordt gebruikt en de duur van de test gewoonlijk langer is dan de retentietijd in anaerobe gistingstanks, komen de omstandigheden van de test niet noodzakelijkerwijs overeen met de omstandigheden in anaerobe gistingstanks, noch is de test toepasbaar voor de beoordeling van anaerobe biologische afbreekbaarheid onder andere milieuomstandigheden. Slib wordt aan de teststof blootgesteld gedurende maximaal 60 dagen, wat langer is dan de normale slibretentietijd (25 tot 30 dagen) in anaerobe gistingstanks, hoewel de retentietijd op industriële locaties veel langer kan zijn. Op basis van de resultaten van deze test kunnen niet zo overtuigend als in het geval van aerobe biologische afbraak voorspellingen worden gedaan, aangezien het bewijs dat wordt verzameld over het gedrag van de teststof in „uitontwikkelde” aerobe tests alsmede in simulatietests en het aerobe milieu voldoende is om met overtuiging een verband vast te kunnen stellen; voor het anaerobe milieu bestaat er weinig soortgelijk bewijs. Volledige anaerobe biologische afbraak kan geacht worden te hebben plaatsgevonden, indien een theoretische gasproductie van 75 %-80 % bereikt wordt De hoge verhoudingen van stof ten opzichte van biomassa die in deze tests worden toegepast, betekenen dat de stof die de test doorstaat meer kans heeft om in een anaerobe gistingstank te worden afgebroken. Daarnaast is het mogelijk dat stoffen die in de test niet in gas worden omgezet, bij meer milieurealistische stof-biomassaverhoudingen alsnog worden verwijderd. Ook treden er andere anaerobe reacties op waardoor stoffen in elk geval gedeeltelijk worden afgebroken, bijv. door dechlorinatie, maar deze test detecteert dergelijke reacties niet. Echter, door de toepassing van specifieke analysemethoden voor de bepaling van de teststof, kan het verdwijnen ervan worden gevolgd (zie punt 6, 30, 44 en 53).
|
PRINCIPE VAN DE TEST
|
4.
|
Gewassen uitgegist slib (36), dat lage (< 10 mg/l) concentraties anorganische koolstof (IC) bevat, wordt met ongeveer een factor tien verdund tot een totale concentratie vaste stof van 1 g/l tot 3 g/l en geïncubeerd bij 35 °C ± 2 °C in luchtdicht afgesloten vaten met de teststof in een concentratie van 20 tot 100 mg C/l gedurende maximaal 60 dagen. De activiteit van het slib wordt hierbij gemeten door parallelle blancocontroles uit te voeren met slibentmateriaal in het medium, maar zonder de teststof.
|
|
5.
|
De stijging van de gasruimtedruk in de vaten die het gevolg is van de productie van koolstofdioxide en methaan wordt gemeten. Veel van de geproduceerde CO2 zal onder de testomstandigheden in de vloeibare fase worden omgezet in carbonaat of waterstofcarbonaat. Deze anorganische koolstof wordt gemeten aan het einde van de test.
|
|
6.
|
De hoeveelheid koolstof (anorganisch plus methaan) die het resultaat is van de biologische afbraak van de teststof, wordt berekend aan de hand van de overmaat van de nettogasproductie en netto-IC-vorming in de vloeibare fase ten opzichte van de bij de blancocontroles gemeten waarden. De mate van biologische afbraak wordt berekend aan de hand van de totale IC- en methaanproductie als percentage van de gemeten of berekende hoeveelheid koolstof die als teststof is toegevoegd. Het verloop van de biologische afbraak kan worden gevolgd door tussentijdse metingen uit te voeren voor alleen de gasproductie. Daarnaast kan de primaire biologische afbraak worden bepaald door specifieke analysen aan het begin en einde van de test.
|
INFORMATIE OVER DE TESTSTOF
|
7.
|
De zuiverheid, oplosbaarheid in water, vluchtigheid en adsorptie-eigenschappen van de teststof moeten bekend zijn om de resultaten goed te kunnen interpreteren. Het gehalte aan organische koolstof (gewichtspercent) van de teststof moet bekend zijn, hetzij op basis van de chemische structuur ervan, hetzij door het te meten. Voor vluchtige teststoffen is een gemeten of berekende constante van de wet van Henry nuttig om te bepalen of de test toepasbaar is. Informatie over de toxiciteit van de teststof voor anaerobe bacteriën is nuttig voor het kiezen van de juiste testconcentratie en voor het interpreteren van resultaten die op slechte biologische afbreekbaarheid duiden. Aanbevolen wordt om de remmingscontrole uit te voeren, tenzij bekend is dat de teststof geen remmend effect heeft op microbiële activiteiten (zie punt 21 en ISO 13641-1 (12)).
|
TOEPASBAARHEID VAN DE TESTMETHODE
|
8.
|
De testmethode kan worden toegepast op in water oplosbare stoffen en kan tevens worden toegepast op slecht oplosbare en onoplosbare stoffen, mits een methode voor exacte dosering wordt toegepast, zie bijv. ISO 10634 (13). Over het algemeen moet voor vluchtige stoffen per geval een beslissing worden genomen. Mogelijk moeten speciale maatregelen worden getroffen om, bijvoorbeeld, tijdens de test geen gas te laten ontsnappen.
|
REFERENTIESTOFFEN
|
9.
|
Ter controle van de procedure wordt een referentiestof getest door parallelle geschikte vaten op te stellen als onderdeel van de gewone proeven. Voorbeelden van referentiestoffen zijn fenol, natriumbenzoaat en polyethyleenglycol 400, die naar verwachting worden afgebroken met een theoretische gasproductie van meer dan 60 % (d.w.z. methaan en anorganische koolstof) binnen 60 dagen (3)(14).
|
REPRODUCEERBAARHEID VAN TESTRESULTATEN
|
10.
|
In een internationale ringtest (14) was er tussen triplovaten een goede reproduceerbaarheid van de gasdrukmetingen. De relatieve standaardafwijking (variatiecoëfficiënt, COV) bleef voornamelijk onder 20 %, hoewel deze waarde vaak steeg tot > 20 % in de aanwezigheid van toxische stoffen of aan het einde van de incubatieperiode van 60 dagen. Hogere afwijkingen werden ook aangetroffen in vaten met een volume < 150 ml. De uiteindelijke pH-waarden van de testmedia lagen binnen het bereik 6,5-7,0.
|
|
11.
|
De volgende resultaten werden verkregen in de ringtest.
|
Teststof
|
Totale gegevens
n1
|
Gemiddelde afbraak
(van totale gegevens)
(%)
|
Relatieve standaardafwijking
(van totale gegevens)
(%)
|
Geldige gegevens
n2
|
Gemiddelde afbraak
(van geldige gegevens)
(%)
|
Relatieve standaardafwijking
(van geldige gegevens)
(%)
|
Gegevens >60 % afbraak in geldige tests
n3
|
|
Palmitinezuur
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (37)
|
|
Polyetheen Glycol 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
De variatiecoëfficiënten (COV's) van het gemiddelde voor alle waarden die werden verkregen met palmitinezuur en polyethyleenglycol 400 waren niet minder dan respectievelijk 45 % (n = 36) en 35 % (n = 38). Wanneer waarden van < 40 % en > 100 % werden weggelaten (eerstgenoemde waarden werden verondersteld verband te houden met minder dan optimale omstandigheden, laatstgenoemde waarden hadden een onbekende oorzaak), werden de COV's verlaagd tot respectievelijk 26 % en 23 %. Het aandeel van „geldige” waarden die ten minste 60 % afbraak vertegenwoordigden, was 70 % voor palmitinezuur en 83 % voor polyethyleenglycol 400. Het aandeel van de procentuele biologische afbraak dat werd verkregen met DIC-metingen was relatief laag, maar variabel. Voor palmitinezuur was het bereik 0-35 %, het gemiddelde 12 %, met een COV van 92 %, en voor polyethyleenglycol 400 was het bereik 0-40 %, het gemiddelde 24 %, met een COV van 54 %.
|
BESCHRIJVING VAN DE TESTMETHODE
Apparatuur
|
13.
|
Vereist zijn een standaard-laboratoriumuitrusting en het volgende:
|
a)
|
incubator — vonkvrij en met een constant gehouden temperatuur van 35 °C ± 2 °C;
|
|
b)
|
drukbestendige glazen testvaten van een geschikte nominale grootte (38), elk voorzien van een gasdicht septum, bestand tegen ongeveer 2 bar. Het gasruimtevolume moet ongeveer 10 % tot 30 % van het totale volume uitmaken. Indien biogas regelmatig wordt afgelaten, is een gasruimtevolume van ongeveer 10 % geschikt, maar als het gas alleen aan het einde van de test wordt afgelaten, wordt 30 % aanbevolen. Glazen serumflessen met een nominale inhoud van 125 ml, met een totale inhoud van ongeveer 160 ml, verzegeld met serumsepta (39) en aluminium krimpringen worden aanbevolen, indien de druk bij ieder monsternamemoment wordt afgelaten.
|
|
c)
|
drukmeetapparaat (40) dat is aangepast om het meten en laten wegstromen van geproduceerd gas mogelijk te maken, bijvoorbeeld een met de hand bediende precisiedrukmeter verbonden met een geschikte injectienaald; een gasdicht driewegventiel vergemakkelijkt het laten ontsnappen van overdruk (aanhangsel 1). De interne inhoud van de druktransductorslang en het ventiel moet zo laag mogelijk worden gehouden, zodat fouten die worden ingevoerd door het volume van de apparatuur, insignificant zijn;
Opmerking — De standen van de drukmeter worden rechtstreeks gebruikt om de hoeveelheid in de gasruimte geproduceerde koolstof te berekenen (punten 42 tot en met 44). Een andere mogelijkheid is de standen van de drukmeter om te rekenen naar volumes (bij 35 °C, atmosferische druk) met behulp van een omrekeningsgrafiek. Deze grafiek wordt opgebouwd met gegevens die worden verkregen door bekende volumes stikstofgas te injecteren in een reeks testvaten (bijv. serumflessen) bij 35° +/- 2 °C en de resulterende gestabiliseerde drukmeterstanden te rapporteren (zie aanhangsel 2). De berekening wordt getoond in punt 44.
Waarschuwing — Micro-injectiespuiten moeten zorgvuldig worden gehanteerd om prikletsel te voorkomen.
|
|
d)
|
koolstofanalyseapparaat dat geschikt is voor de directe bepaling van het gehalte anorganische koolstof in het bereik van 1 mg/l tot 200 mg/l;
|
|
e)
|
hoogprecisie-injectienaalden voor gasvormige en vloeibare monsters;
|
|
f)
|
magneetroerders en roerbonen (facultatief);
|
|
g)
|
handschoenkast (aanbevolen).
|
|
Reagentia
|
14.
|
Er moet steeds gebruik worden gemaakt van analytisch zuivere reagentia.
|
Water
|
15.
|
Gedistilleerd of gedeïoniseerd water (waaraan de zuurstof is onttrokken door uitwassen met stikstofgas dat minder dan 5 μl/l zuurstof bevat), met daarin minder dan 2 mg/l opgeloste organische koolstof (DOC).
|
Testmedium
|
16.
|
Bereid het verdunde medium op zodanige manier dat het de volgende bestanddelen in de aangegeven hoeveelheden bevat:
|
Watervrij kaliumdiwaterstoffosfaat (KH2PO4)
|
0,27 g
|
|
Dinatriumwaterstoffosfaatdodecahydraat (Na2HPO4 · 12H2O))
|
1,12 g
|
|
Ammoniumchloride (NH4Cl)
|
0,53 g
|
|
Calciumchloridedihydraat (CaCl2 · 2H2O)
|
0,075 g
|
|
Magnesiumchloridehexahydraat (MgCl2 · 6H2O)
|
0,10 g
|
|
IJzer(II)chloridetetrahydraat (FeCl2 · 4H2O)
|
0,02 g
|
|
Resazurine (zuurstofindicator)
|
0,001 g
|
|
Natriumsulfidenonahydraat (Na2S · 9H2O)
|
0,10 g
|
|
Stamoplossing van sporenelementen (facultatief, punt 18)
|
10 ml
|
|
Voeg gedeoxygeneerd water toe (punt 15)
|
tot 1 liter
|
Opmerking: Vers geleverd natriumsulfide moet worden gebruikt of natriumsulfide dat is gewassen en gedroogd voor het gebruik, om te waarborgen dat het voldoende reductiecapaciteit heeft. De test kan worden uitgevoerd zonder gebruik te maken van een handschoenkast (zie punt 26). In dat geval moet de uiteindelijke concentratie natriumsulfide in het medium worden verhoogd tot 0,20 g Na2S×9H2O per liter. Natriumsulfide kan ook worden toegevoegd uit een geschikte anaerobe stamoplossing door het septum van de gesloten testvaten, omdat deze procedure het risico van oxidatie verkleint. Natriumsulfide kan worden vervangen door titanium(III)citraat, dat wordt toegevoegd door het septum van gesloten testvaten tot een uiteindelijke concentratie van 0,8 tot 1,0 mmol/l is bereikt. Titanium(III)citraat is een zeer effectief, laagtoxisch reductiemiddel, dat als volgt wordt bereid: Los 2,94 g trinatriumcitraatdihydraat op in 50 ml gedeoxygeneerd water (wat resulteert in een oplossing van 200 mmol/l) en voeg 5 ml titanium(III)chloride-oplossing (15 %, gewichtspercent) toe. Neutraliseer tot een pH 7 ± 0,2 met mineraal alkali en breng over in een geschikt vat onder een stroom stikstofgas. De concentratie van het titanium(III)citraat in deze stamoplossing is 164 mmol/l.
|
|
17.
|
De componenten van het testmedium met uitzondering van het reductiemiddel (natriumsulfide of titanium(III)citraat) worden gemengd en de oplossing wordt net vóór het gebruik gedurende ongeveer 20 min uitgewassen met stikstofgas om zuurstof te verwijderen. Vervolgens wordt het juiste volume vers bereide oplossing van het reductiemiddel (bereid in gedeoxygeneerd water) net voor het gebruik van medium toegevoegd. De pH-waarde van het medium moet, indien nodig, worden aangepast met verdund anorganisch zuur of alkali tot 7 ± 0,2.
|
Stamoplossing van sporenelementen (facultatief)
|
18.
|
Aanbevolen wordt dat het testmedium de volgende sporenelementen bevat om anaerobe afbraakprocessen te verbeteren, met name indien lage concentraties (bijv. 1 g/l) entmateriaal worden gebruikt (11).
|
Mangaanchloridetetrahydraat (MnCl2 · 4H2O)
|
50 mg
|
|
Boorzuur (H3BO3)
|
5 mg
|
|
Zinkchloride (ZnCl2)
|
5 mg
|
|
Koper(II)chloride (CuCl2)
|
3 mg
|
|
Natriummolybdaatdihydraat (Na2MoO4 · 2H2O)
|
1 mg
|
|
Kobaltchloridehexahydraat (CoCl2 · 6H2O)
|
100 mg
|
|
Nikkelchloridehexahydraat (NiCl2 · 6H2O)
|
10 mg
|
|
Natriumseleniet (Na2SeO3)
|
5 mg
|
|
Voeg gedeoxygeneerd water toe (punt 15)
|
tot 1 liter
|
|
Teststof
|
19.
|
De teststof wordt toegevoegd als een stamoplossing, suspensie, emulsie, of rechtstreeks als vaste stof of vloeistof, of geabsorbeerd op een glasvezelfilter, totdat een concentratie van niet meer dan 100 mg/l organische koolstof is bereikt. Indien stamoplossingen worden gebruikt, wordt een geschikte oplossing bereid met water (punt 15) (waaraan eerder de zuurstof is onttrokken door uitwassen met stikstofgas) in een dusdanige concentratie dat het toegevoegde volume minder is dan 5 % van het totale volume van het reactiemengsel. De pH-waarde van de stamoplossing moet, indien nodig, worden aangepast tot 7 ± 0,2. Raadpleeg ISO 10634 (13) voor teststoffen die onvoldoende in water oplosbaar zijn. Indien een oplosmiddel wordt gebruikt, moet een aanvullende controleproef worden uitgevoerd, waarbij het oplosmiddel alleen wordt toegevoegd aan het geënte medium. Organische oplosmiddelen waarvan bekend is dat ze de methaanproductie remmen, zoals chloroform en koolstoftetrachloride, moeten worden vermeden.
Waarschuwing — Toxische stoffen en stoffen waarvan de eigenschappen niet bekend zijn, moeten met voorzichtigheid worden gehanteerd.
|
Referentiestoffen
|
20.
|
Referentiestoffen zoals natriumbenzoaat, fenol en polyethyleenglycol 400 zijn met succes gebruikt om de procedure te controleren, waarbij ze binnen 60 dagen voor meer dan 60 % biologisch werden afgebroken. Een stamoplossing van de gekozen referentiestof wordt bereid (in water waaraan de zuurstof is onttrokken) op dezelfde wijze als bij de teststof en de pH-waarde wordt, indien nodig, aangepast tot 7 ± 0,2.
|
Remmingscontrole (conditioneel)
|
21.
|
Om informatie te verkrijgen over de toxiciteit van de teststof voor anaerobe micro-organismen teneinde de geschiktste testconcentratie te vinden, wordt de teststof en referentiestof toegevoegd aan een vat met daarin het testmedium (zie punt 16), elk in dezelfde respectieve concentraties als de toegevoegde concentraties (zie de punten 19 en 20 en zie tevens ISO 13641-1 (12)).
|
Uitgegist slib
|
22.
|
Verzamel uitgegist slib uit een gistingstank bij een rioolwaterzuiveringsinstallatie die hoofdzakelijk huishoudelijk afvalwater zuivert. Het slib moet volledig worden gekarakteriseerd en de achtergrondinformatie ervan moet worden gerapporteerd (zie punt 54). Als het de bedoeling is om aangepast entmateriaal te gebruiken, kan uitgegist slib van een industriële waterzuiveringsinstallatie worden overwogen. Gebruik voor het verzamelen van het uitgegiste slib flessen met een brede hals, gemaakt van polyethyleen met een hoge dichtheid of een vergelijkbaar materiaal, dat kan uitzetten. Vul de flessen met slib tot ongeveer 1 cm onder de bovenrand van de flessen, sluit de flessen goed af, bij voorkeur met een veiligheidsafsluiter. Na vervoer naar het laboratorium kan het verzamelde slib direct worden gebruikt of in een gistingstank op laboratoriumschaal worden gebracht. Laat het overtallige biogas ontsnappen door de flessen met slib voorzichtig te openen. In plaats daarvan kan in het laboratorium bereid slib worden gebruikt als een bron van entmateriaal, maar daarvan kan het activiteitsspectrum negatief zijn beïnvloed.
Waarschuwing — Uitgegist slib produceert ontvlambare gassen die brand- en ontploffingsgevaar opleveren, en het bevat ook potentieel pathogene organismen. Neem dus passende voorzorgsmaatregelen bij het hanteren van slib. Gebruik om veiligheidsredenen géén glazen vaten voor het verzamelen van slib.
|
|
23.
|
Teneinde de achtergrondgasproductie en de invloed van de blancocontroles te verminderen kan worden overwogen om het slib vooraf te laten uitgisten. Laat, indien uitgisting vooraf nodig is, het slib uitgisten zonder toevoeging van nutriënten of substraten bij 35 °C ± 2 °C gedurende maximaal 7 dagen. Gebleken is dat uitgisting vooraf gedurende ongeveer 5 dagen doorgaans zorgt voor een optimale vermindering van de gasproductie van de blanco zonder onaanvaardbare stijgingen van de aanloop- of incubatieperioden tijdens de testfase of verlies van activiteit voor een klein aantal geteste stoffen.
|
|
24.
|
Voor teststoffen die (naar verwachting) slecht biologisch afbreekbaar zijn, moet worden overwogen het slib vooraf bloot te stellen aan de teststof om entmateriaal te verkrijgen dat geschikter is. In een dergelijk geval wordt de teststof in een concentratie organische koolstof van 5 mg/l tot 20 mg/l toegevoegd aan het uitgegiste slib en gedurende maximaal twee weken geïncubeerd. Was het vooraf aan de teststof blootgestelde slib zorgvuldig uit vóór gebruik (zie punt 25) en rapporteer in het testverslag de omstandigheden van de blootstelling vooraf.
|
Entmateriaal
|
25.
|
Het slib wordt kort vóór het gebruik uitgewassen (zie de punten 22 tot en met 24) om de IC-concentratie te verlagen tot minder dan 10 mg/l in de uiteindelijke testsuspensie. Het slib wordt gecentrifugeerd in luchtdicht afgesloten buizen (bijv. 3 000 g gedurende 5 min) en de bovenliggende vloeistof wordt afgetapt. De resulterende pellet wordt gesuspendeerd in medium waaraan de zuurstof is onttrokken (punten 16 en 17), centrifugeer de suspensie opnieuw en tap de bovenliggende vloeistof af. Als de IC-concentratie niet voldoende is verlaagd, kan de procedure voor het uitwassen van het slib maximaal twee keer worden herhaald. De micro-organismen lijken hiervan geen negatieve effecten te ondervinden. Tot slot wordt de pellet gesuspendeerd in het vereiste volume testmedium en wordt de concentratie van het totaal aan vaste stoffen bepaald [bijv. ISO 11923 (15)]. De uiteindelijke concentratie van het totaal aan vaste stoffen moet in het bereik van 1 g/l tot 3 g/l liggen (of ongeveer 10 % daarvan in onverdund uitgegist slib). Bovenstaande bewerkingen moeten op een dusdanige wijze worden uitgevoerd dat contact tussen het slib en zuurstof tot een minimum wordt beperkt (gebruik bijvoorbeeld een omgeving met stikstof).
|
TESTPROCEDURE
|
26.
|
De volgende initiële procedures moeten worden uitgevoerd om het contact tussen uitgegist slib en zuurstof zo minimaal als praktisch haalbaar is te houden. Hiertoe kan het bijvoorbeeld nodig zijn om te werken binnen een handschoenkast in een stikstofomgeving en/of om de flessen te spoelen met stikstof (4).
|
Voorbereiding van de test en de controlebepalingen
|
27.
|
Prepareer ten minste triplotestvaten (zie punt 13-b) voor de teststof, blancocontroles, de referentiestof, remmingscontroles (facultatief) en drukregelkamers (facultatieve procedure) (zie de punten 7, 19 tot en met 21). Aanvullende vaten voor de beoordeling van de primaire biologische afbraak kunnen tevens worden geprepareerd. Dezelfde reeks blancocontroles kan worden gebruikt in dezelfde test, mits de gasruimtevolumes overeenkomen.
|
|
28.
|
Bereid het verdunde entmateriaal alvorens het aan de vaten toe te voegen, bijvoorbeeld met behulp van een pipet met brede opening. Voeg aliquots van goed gemengd entmateriaal (punt 25) toe, zodat de concentratie van het totaal aan vaste stoffen dezelfde is in alle vaten (tussen 1 g/l en 3 g/l). Stamoplossingen van de test- en referentiestof worden toegevoegd na aanpassing van de pH-waarde tot 7 ± 0,2, indien nodig. De teststof en de referentiestof moeten worden toegevoegd met gebruikmaking van de geschiktste toedieningsweg (punt 19).
|
|
29.
|
De testconcentratie van organische koolstof moet gewoonlijk tussen 20 en 100 mg/l liggen (punt 4). Indien de teststof toxisch is, moet de testconcentratie worden verlaagd tot 20 mg C/l of zelfs lager als alleen primaire biologische afbraak met specifieke analyses moet worden gemeten. Opgemerkt zij dat de variatie tussen de testresultaten toeneemt bij lagere testconcentraties.
|
|
30.
|
Voor blancovaten wordt een gelijkwaardige hoeveelheid van de gebruikte draagstof toegevoegd om de teststof t doseren in plaats van een stamoplossing, suspensie of emulsie. Indien de teststof werd toegediend met gebruikmaking van glasvezelfilters of organische oplosmiddelen, moet voor de blanco's een filter worden toegevoegd of een hoeveelheid oplosmiddel die gelijkwaardig is aan de verdampte hoeveelheid. De teststof wordt in een extra duplovat gebracht voor de meting van de pH-waarde. De pH-waarde moet, indien nodig, tot 7 ± 0,2 worden aangepast met kleine hoeveelheden verdund anorganisch zuur of alkali. Dezelfde hoeveelheden neutraliserende middelen moeten aan alle testvaten worden toegevoegd. Deze toevoegingen zouden niet nodig moeten zijn, omdat de pH-waarde van de stamoplossingen van de teststof en de referentiestof reeds is aangepast (zie de punten 19 en 20). Als het de bedoeling is om de primaire biologische afbraak te meten, moet een geschikt monster worden genomen uit het pH-controlevat of uit een aanvullend testvat en moet de teststofconcentratie worden gemeten met behulp van specifieke analyses. Bedekte magneten kunnen worden toegevoegd aan alle vaten, als de reactiemengsels moeten worden geroerd (facultatief).
|
|
31.
|
Gewaarborgd moet worden dat het totale volume van vloeistof V1 en het volume van gasruimte Vh gelijk zijn in alle vaten; noteer en rapporteer de waarden van V1 en Vh. Ieder vat moet luchtdicht worden afgesloten met een gasseptum en vanuit de handschoenkast (zie punt 26) worden overgebracht naar de incubator (zie punt 13-a).
|
Onoplosbare teststoffen
|
32.
|
Gewogen hoeveelheden slecht in water oplosbare stoffen worden rechtstreeks aan de geprepareerde vaten toegevoegd. Indien het gebruik van een oplosmiddel nodig is (zie punt 19), wordt de teststofoplossing of -suspensie overgebracht naar lege vaten. Laat, indien mogelijk, het oplosmiddel verdampen door stikstofgas door de vaten te laten stromen en voeg vervolgens de andere ingrediënten toe, namelijk verdund slib (punt 25) en zoveel van zuurstof ontdaan water als nodig is. Een aanvullend controlemonster voor het oplosmiddel moet tevens worden bereid (zie punt 19). Raadpleeg ISO 10634 (13) voor andere methoden om onoplosbare stoffen toe te voegen. Vloeibare teststoffen kunnen met een injectienaald worden toegevoegd aan de volledig geprepareerde en luchtdicht afgesloten vaten, indien verwacht wordt dat de initiële pH-waarde niet hoger zal zijn dan 7 ± 1; doseer anders zoals in het bovenstaande (zie punt 19) wordt omschreven.
|
Incubatie en gasdrukmetingen
|
33.
|
De geprepareerde vaten worden gedurende 1 uur geïncubeerd bij 35 °C ± 2 °C voor equilibratie en om overtollig gas te laten ontsnappen naar de atmosfeer, door bijvoorbeeld elk vat afzonderlijk te schudden en de naald van de drukmeter (punt 13-c) door de afdichting te steken en de afsluiter te openen totdat de drukmeter de stand nul bereikt. Indien op dat moment, of bij het verrichten van tussentijdse metingen, de druk in de gasruimte lager is dan atmosferisch, moet stikstofgas worden toegevoegd om de atmosferische druk te herstellen. Sluit de afsluiter (zie punt 13-c) en zet de incubatie voort in het donker, waarbij gewaarborgd moet worden dat de temperatuur van alle onderdelen van de vaten constant wordt gehouden op het niveau van de gistingstemperatuur. Observeer de vaten na incubatie gedurende 24 to 48 uur. Vaten moeten worden afgekeurd, als de inhoud van de vaten een duidelijk roze verkleuring in de bovenliggende vloeistof vertoont, d.w.z. als resazurine (zie punt 16) heeft gezorgd voor een kleurverandering die duidt op de aanwezigheid van zuurstof (zie punt 50). Hoewel het systeem bestand is tegen kleine hoeveelheden zuurstof, kunnen hogere concentraties een ernstig remmend effect hebben op het verloop van anaerobe biologische afbraak. Het afkeuren van een enkel vat of van een reeks triplo's kan aanvaardbaar zijn, maar als meer bepalingen mislukken, moeten de experimentele procedures worden onderzocht en moet de test worden herhaald.
|
|
34.
|
De inhoud van elk vat moet ten minste 2 of drie maal per week en kort voor iedere drukmeting zorgvuldig worden gemengd door enkele minuten te roeren of te schudden. Door schudden wordt het entmateriaal opnieuw gesuspendeerd en wordt gewaarborgd dat het gas zich in een staat van evenwicht bevindt. Alle drukmetingen moeten snel worden uitgevoerd, aangezien de temperatuur van de testvaten kan dalen, wat leidt tot onjuiste drukmeterstanden. Tijdens het meten van de druk moet de temperatuur van het gehele testvat met inbegrip van de gasruimte constant worden gehouden op het niveau van de gistingstemperatuur. De gasdruk kan bijvoorbeeld worden gemeten door de injectienaald die op de drukmeter is aangesloten door het septum te steken (punt 13-c). Voorkom dat water in de injectiespuit komt; als dit gebeurt, moeten de natte onderdelen worden afgedroogd en moet een nieuwe naald worden gemonteerd. De druk moet worden gemeten in millibar (zie punt 42). De gasdruk in de vaten kan periodiek, bijv. wekelijks, worden gemeten en facultatief kan het overtollige gas worden afgelaten naar de atmosfeer. Een andere mogelijkheid is de druk alleen aan het einde van de test te meten om de hoeveelheid geproduceerd biogas te bepalen.
|
|
35.
|
Aanbevolen wordt dat tussentijdse drukmetingen worden uitgevoerd, omdat de stijging van de druk een richtsnoer vormt ten aanzien van de vraag wanneer de test kan worden beëindigd en omdat daardoor de kinetiek kan worden gevolgd (zie punt 6).
|
|
36.
|
Normaal gesproken wordt de test na een incubatieperiode van 60 dagen beëindigd, tenzij de curve voor biologische afbraak die wordt verkregen op basis van de drukmetingen voordien de plateaufase heeft bereikt. De plateaufase is de fase waarin de maximale afbraak is bereikt en de curve voor biologische afbraak afgevlakt is. Als de plateaufasewaarde minder dan 60 % is, is de interpretatie problematisch, omdat dit erop wijst dat slechts een deel van de molecuul gemineraliseerd is of dat er een fout is gemaakt. Indien aan het einde van de normale incubatieperiode gas wordt geproduceerd, maar een plateaufase duidelijk nog niet is bereikt, moet worden overwogen om de test te verlengen teneinde te controleren of de plateaufasewaarde (> 60 %) alsnog wordt bereikt.
|
Meting van anorganische koolstof
|
37.
|
Laat het slib aan het einde van de test na de laatste gasdrukmeting bezinken. Open elk vat en neem onmiddellijk een monster voor de bepaling van de concentratie (mg/l) van de anorganische koolstof (IC) in de bovenliggende vloeistof. De bovenliggende vloeistof mag noch worden gecentrifugeerd noch gefiltreerd, aangezien dit zou leiden tot een onaanvaardbaar verlies van opgelost koolstofdioxide. Indien de vloeistof na bemonstering niet kan worden geanalyseerd, moet deze in een gesloten fles zonder gasruimte opgeslagen en gedurende 2 dagen gekoeld worden bij ongeveer 4 °C. Na de IC-meting wordt de pH-waarde gemeten en gerapporteerd.
|
|
38.
|
In plaats daarvan kan de IC in de bovenliggende vloeistof indirect worden bepaald door de opgeloste IC af te laten als koolstofdioxide dat in de gasruimte kan worden gemeten. Na de laatste meting van de gasdruk wordt de gasdruk in elk testvat aangepast tot de atmosferische druk. De inhoud van elk testvat wordt aangezuurd tot ongeveer pH 1 door geconcentreerd anorganisch zuur (bijv. H2SO4) toe te voegen door het septum van de gesloten vaten. De geschudde vaten worden bij 35 °C ± 2 °C gedurende ongeveer 24 uur geïncubeerd en de gasdruk die het gevolg is van de koolstofdioxideontwikkeling wordt met de drukmeter gemeten.
|
|
39.
|
Voer soortgelijke metingen uit voor de bijbehorende blanco, referentiestof en, indien van toepassing, remmingscontrolevaten (zie punt 21).
|
|
40.
|
In sommige gevallen, met name indien dezelfde controlevaten worden gebruikt voor verschillende teststoffen, moeten tussentijdse metingen van de IC-concentraties in de test- en controlevaten worden overwogen, voor zover van toepassing. In dat geval moet een voldoende aantal vaten worden geprepareerd voor alle tussentijdse metingen. Deze procedure verdient de voorkeur boven monstername uit slechts één vat. Laatstgenoemde methode mag alleen worden toegepast, indien het voor DIC-analyse vereiste volume niet te hoog wordt geacht. De DIC-meting moet na het meten van de gasdruk zonder aflaten van overtollig gas als volgt worden uitgevoerd:
|
—
|
een zo klein mogelijk volume van een monster van de bovenliggende vloeistof wordt met een injectiespuit door het septum in de vaten gebracht zonder deze te openen, waarna het IC-gehalte in het monster wordt bepaald;
|
|
—
|
na het inbrengen van het monster wordt het overtollige gas al dan niet afgelaten;
|
|
—
|
hierbij moet rekening worden gehouden met het feit dat zelfs een kleine vermindering van het volume van de bovenliggende vloeistof (bijv. ongeveer 1 %) kan leiden tot een significante toename van het gasruimtevolume (Vh);
|
|
—
|
de vergelijkingen (zie punt 44) worden gecorrigeerd door Vh in vergelijking 3 zo nodig te verhogen.
|
|
Specifieke analysen
|
41.
|
Indien het de bedoeling is om primaire anaerobe afbraak te (zie punt 30) te bepalen, wordt een monster van voldoende volume genomen voor specifieke analysen aan het begin en aan het einde van de test uit de vaten die de teststof bevatten. Als dit wordt gedaan, moeten de volumes van de gasruimte (Vh) en van de vloeistof (Vl) worden veranderd en moet hiermee rekening worden gehouden bij de berekening van de gasproductieresultaten. Een andere mogelijkheid is monsters voor specifieke analysen te nemen uit aanvullende mengsels die eerder voor dit doel zijn bereid (punt 30).
|
GEGEVENS EN RAPPORTAGE
Bewerking van de resultaten
|
42.
|
Om praktische redenen moet de druk van het gas worden gemeten in millibar (1 mbar = 1 hPa = 102 Pa; 1 Pa = 1 N/m2), het volume in liter en de temperatuur in graden Celsius.
|
Koolstof in de gasruimte
|
43.
|
Aangezien 1 mol methaan en 1 mol koolstofdioxide elk 12 g koolstof bevatten, kan de massa van de koolstof per volume-eenheid geproduceerd gas worden uitgedrukt als:
|
m= 12 × 103×n
|
Vergelijking [1]
|
waarin:
|
m
|
=
|
massa van de koolstof (mg) in een volume-eenheid geproduceerd gas;
|
|
12
|
=
|
relatieve atoommassa van koolstof;
|
|
n
|
=
|
aantal molen gas in de volume-eenheid.
|
Als een ander gas dan methaan of koolstofdioxide (bijv. N2O) in aanzienlijke hoeveelheden wordt gevormd, moet de formule [1] worden aangepast om de mogelijkheid van effecten door de geproduceerde gassen te beschrijven.
|
|
44.
|
Op grond van de gaswetten kan n worden uitgedrukt als
|

|
Vergelijking [2]
|
waarin:
|
p
|
=
|
druk van het gas (pascal);
|
|
V
|
=
|
volume van het gas (m3);
|
|
R
|
=
|
molaire gasconstante [8,314 J/(mol K)];
|
|
T
|
=
|
incubatietemperatuur (kelvin).
|
Door combinatie van de vergelijkingen [1] en [2] en rationalisering voor de productie van gas in de blancocontrole:
|
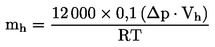
|
Vergelijking [3]
|
waarin:
|
mh
|
=
|
massa van de nettohoeveelheid in de gasruimte geproduceerde koolstof (mg);
|
|
Dp
|
=
|
gemiddelde van het verschil tussen de begin- en einddruk in de testvaten minus het overeenkomstige gemiddelde in de blancovaten (millibar);
|
|
Vh
|
=
|
volume van de gasruimte in het vat (l);
|
|
0,1
|
=
|
herleidingsfactor voor de omrekening van newton/m2 naar millibar en van m3 naar liter.
|
Vergelijking [4] moet worden gebruikt voor de normale incubatietemperatuur van 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
Vergelijking [4]
|
Opmerking: Alternatieve volumeberekening. Drukmeterstanden worden omgerekend naar ml geproduceerd gas met behulp van de standaardcurve die wordt gevormd door het geïnjecteerde volume (ml) uit te zetten tegen de drukmeterstanden (aanhangsel 2). Het aantal molen (n) gas in de gasruimte van elk vat wordt berekend door de cumulatieve gasproductie (ml) te delen door 25 286 ml/mol, hetgeen het volume is dat wordt ingenomen door één mol gas bij 35 °C en de atmosferische standaarddruk. Aangezien 1 mol CH4 en 1 mol CO2 elk 12 g koolstof bevatten, wordt de hoeveelheid koolstof (mg) in de gasruimte (mh
) gegeven door vergelijking [5]:
|
mh
= 12 × 103×n
|
Vergelijking [5]
|
Rationalisering voor de productie van gas in de blancocontrole:
|

|
Vergelijking [6]
|
waarin:
|
mh
|
=
|
massa van de nettohoeveelheid in de gasruimte geproduceerde koolstof (mg);
|
|
ΔV
|
=
|
gemiddelde van het verschil in het in de gasruimte geproduceerde gasvolume tussen de testvatenm en de blancocontrolevaten;
|
|
25 286
|
=
|
volume dat wordt ingenomen door 1 mol gas bij 35 °C, 1 atmosfeer.
|
|
|
45.
|
Het verloop van de biologische afbraak kan worden gevolgd door de stijging van de gecumuleerde druk Dp (millibar) uit te zetten tegen de tijd, indien van toepassing. Identificeer en rapporteer op basis van deze curve de aanloopfase (dagen). De aanloopfase is de tijd vanaf het begin van de test totdat significante afbraak aanvangt (zie bijvoorbeeld aanhangsel 3). Indien tussentijds monsters van de bovenliggende vloeistof zijn genomen en geanalyseerd (zie de punten 40, 46 en 47), kan de totale hoeveelheid geproduceerde C (in gas en in vloeistof) worden uitgezet in plaats van alleen de cumulatieve druk.
|
Koolstof in de vloeistof
|
46.
|
De hoeveelheid methaan in de vloeistof wordt genegeerd, aangezien bekend is dat de oplosbaarheid ervan in water zeer slecht is. De massa van de anorganische koolstof in de vloeistof van de testvaten wordt berekend met vergelijking [7]:
|
ml
=Cnet
×Vl
|
Vergelijking [7]
|
waarin:
|
ml
|
=
|
massa van de anorganische koolstof in de vloeistof (mg);
|
|
Cnetto
|
=
|
concentratie van de anorganische koolstof in de testvaten minus de concentratie daarvan in de controlevaten aan het einde van de test (mg/l);
|
|
Vl
|
=
|
volume van de vloeistof in het vat (l).
|
|
Totale hoeveelheid in gas omgezette koolstof
|
47.
|
Bereken de totale massa van de in gas omgezette koolstof in het vat met vergelijking [8]:
|
mt
=mh
+ml
|
Vergelijking [8]
|
waarin:
|
|
mt = totale massa van in gas omgezette koolstof (mg);
|
|
|
voor mh
en ml
gelden bovenstaande definities.
|
|
Koolstofgehalte van de teststof
|
48.
|
Bereken de totale massa koolstof in de testvaten die afkomstig is van de toegevoegde teststof met vergelijking [9]:
|
mv
=Cc
×Vl
|
Vergelijking [9]
|
waarin:
|
mv
|
=
|
massa van de teststofkoolstof (mg);
|
|
Cc
|
=
|
concentratie van de teststofkoolstof in het testvat (mg/l)
|
|
Vl
|
=
|
volume van de vloeistof in het testvat (l).
|
|
Mate van biologische afbraak
|
49.
|
Bereken de procentuele biologische afbraak aan de hand van het gas in de gasruimte met vergelijking [10] en de totale biologische afbraak met vergelijking [11]:
|
Dh
= (mh
/mv
) × 100
|
Vergelijking [10]
|
|
Dt
= (mt
/mv
) × 100
|
Vergelijking [11]
|
waarin:
|
|
Dh
= biologische afbraak op basis van het gas in de gasruimte ( %);
|
|
|
Dt
= totale biologische afbraak (%);
|
|
|
voor mh
, mv
en mt
gelden bovenstaande definities.
|
De mate van primaire biologische afbraak wordt berekend aan de hand van de (facultatieve) metingen van de concentratie van de teststof aan het begin en einde van de incubatie, met vergelijking [12]:
|
Dp
= (1 –Se
/Si
) × 100
|
Vergelijking [12]
|
waarin:
|
Dp
|
=
|
primaire afbraak van de teststof (%);
|
|
Si
|
=
|
beginconcentratie van de teststof (mg/l);
|
|
Se
|
=
|
concentratie van de teststof aan het einde (mg/l).
|
Indien de analysemethode wijst op significante concentraties van de teststof in het ongewijzigde anaerobe slibentmateriaal, moet vergelijking [13] worden gebruikt:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
Vergelijking [13]
|
waarin:
|
Dp
1
|
=
|
gecorrigeerde primaire afbraak van de teststof (%);
|
|
Sib
|
=
|
„schijnbare” beginconcentratie van de teststof in de blancocontroles (mg/l);
|
|
Seb
|
=
|
„schijnbare” concentratie van de teststof in de blancocontroles aan het einde (mg/l).
|
|
Geldigheid van de resultaten
|
50.
|
Drukmeterstanden moeten alleen worden gebruikt van vaten die geen roze verkleuring vertonen (zie punt 33). Verontreiniging door zuurstof wordt tot een minimum beperkt door de toepassing van geschikte anaerobe behandelingstechnieken.
|
|
51.
|
De test moet als geldig worden beschouwd wanneer de referentiestof een plateau bereikt dat meer dan 60 % biologische afbraak vertegenwoordigt. (41)
|
|
52.
|
Indien de pH-waarde aan het einde van de test meer dan 7 ± 1 is en er onvoldoende biologische afbraak heeft plaatsgevonden, moet de test worden herhaald met een grotere buffercapaciteit van het medium.
|
Remming van de afbraak
|
53.
|
De gasproductie in vaten die zowel de teststof als de referentiestof bevatten, moet ten minste gelijkwaardig zijn aan de gasproductie in de vaten die alleen de referentiestof bevatten; zo niet, dan wijst dit op remming van de gasproductie. In sommige gevallen zal de gasproductie in vaten die de teststof bevatten zonder de referentiestof lager zijn dan die in de blancocontroles, wat erop wijst dat de teststof remmend is.
|
Testverslag
|
54.
|
In het testverslag worden de volgende gegevens opgenomen:
|
|
Teststof:
|
—
|
de triviale naam, de chemische naam, het CAS-nummer, de structuurformule en relevante fysisch-chemische eigenschappen;
|
|
—
|
de zuiverheid (verontreinigingen) van de teststof.
|
|
|
|
Testomstandigheden:
|
—
|
volumes van de verdunde gistingstankvloeistof (Vl
) en van de gasruimte (Vh
) in het vat;
|
|
—
|
beschrijving van de testvaten, de belangrijkste kenmerken van de biogasmeting (bijv. type drukmeter) en van het IC-analyseapparaat;
|
|
—
|
de manier waarop de teststof en de referentiestof aan het testsysteem zijn toegevoegd: de gebruikte testconcentratie en eventueel gebruik van oplosmiddelen;
|
|
—
|
gedetailleerde gegevens over het gebruikte entmateriaal: naam van de waterzuiveringsinstallatie, beschrijving van de oorsprong van het behandelde afvalwater (bijv. werktemperatuur, slibretentietijd, hoofdzakelijk huishoudelijk afvalwater, enz.), concentratie, eventuele informatie ter onderbouwing hiervan en informatie over eventuele voorbehandeling van het entmateriaal (bijv. voorafgaande uitgisting, voorafgaande blootstelling);
|
|
|
|
Resultaten:
|
—
|
pH- en IC-waarden aan het einde van de test;
|
|
—
|
concentratie van de teststof aan het begin en aan het einde van de test, indien een specifieke meting is uitgevoerd;
|
|
—
|
alle meetgegevens die zijn verzameld in de test-, blanco-, referentiestof- en remmingscontrolevaten, al naar gelang het geval (bijv. druk in millibar, concentratie van anorganische koolstof (mg/l)) in tabelvorm (meetgegevens voor de gasruimte en de vloeistof moeten afzonderlijk worden gerapporteerd);
|
|
—
|
statistische behandeling van gegevens, testduur en een diagram van de biologische afbraak van de teststof, referentiestof en inhibitiecontrole;
|
|
—
|
procentuele biologische afbraak van de teststof en referentiestof;
|
|
—
|
eventuele redenen om de testresultaten te verwerpen;
|
|
—
|
een bespreking van de resultaten.
|
|
|
LITERATUUR
|
(1)
|
De volgende hoofdstukken van deze bijlage:
|
|
C.4, Bepaling van gemakkelijke biologische afbreekbaarheid;
|
|
|
C.9, Biologische afbraak — Zahn-Wellens test;
|
|
|
C.10, Simulatietest — aerobe rioolwaterzuivering:
A: Actiefslibinstallaties, B: Biofilms
|
|
|
C.11, Biologische afbraak — Actief slib: ademhalingsremmingstest
|
|
|
(2)
|
OESO (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OESO, Parijs
|
|
(3)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W.E., Pagga,U., Steber, J., Reust, H. and Bontinck, W.J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550. (Ook gepubliceerd als ECETOC Technical Report No. 28, juni 1988).
|
|
(4)
|
Shelton D.R. and Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. Appl. Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Mircobiology, 47, 850-857.
|
|
(5)
|
Owen, W.F., Stuckey, DC., Healy J.B., Jr, Young L.Y. en McCarty, P.L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485-492.
|
|
(6)
|
Healy, J.B.Jr. en Young, L.Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84-89.
|
|
(7)
|
Gledhill, W.E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Philadelphia.
|
|
(8)
|
Battersby, N.S. and Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441-2460.
|
|
(9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
|
|
(10)
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
(11)
|
Internationale Organisatie voor Normalisatie (1995) ISO 11 734 Water Quality — Evaluation of the ultimate anaerobic biodegradation of organic compounds in digested sludge — Method by measurement of the biogas production.
|
|
(12)
|
Internationale Organisatie voor Normalisatie (2003) ISO 13 641-1 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 1 General Test.
|
|
(13)
|
Internationale Organisatie voor Normalisatie (1995) ISO 10 634 Water Quality — Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(14)
|
Pagga, U. and Beimborn, D.B., (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499-1509.
|
|
(15)
|
Internationale Organisatie voor Normalisatie (1997) ISO 11 923 Water Quality — Determination of suspended solids by filtration through glass-fibre filters.
|
Aanhangsel 1
Voorbeeld van een apparaat om de biogasproductie te meten door de gasdruk
Legenda:
|
1
|
—
|
Drukmeter
|
|
2
|
—
|
Gasdicht driewegventiel
|
|
3
|
—
|
Injectienaald
|
|
4
|
—
|
Gasdichte afsluiter (krimpsluiting en septum)
|
|
5
|
—
|
Gasruimte (Vh
)
|
|
6
|
—
|
Uitgegist slibentmateriaal (Vl
)
|
Testvaten in een omgeving van 35 °C ± 2 °C
Aanhangsel 2
Conversie van de drukmeter
De standen van de drukmeter kunnen aan gasvolumes worden gerelateerd door middel van een standaardcurve die wordt opgesteld door bekende volumes lucht bij 35 °C ± 2 °C te injecteren in serumflessen met daarin een volume aan water dat gelijk is aan dat van het reactiemengsel, V
R:
|
—
|
Breng porties van V
R ml water, bewaard bij 35 °C ± 2 °C, in vijf serumflessen. Sluit de flessen af en plaats ze gedurende 1 uur in een waterbad bij 35 °C om een evenwichtstoestand te bereiken;
|
|
—
|
Zet de drukmeter aan, laat hem stabiliseren en stel hem in op nul;
|
|
—
|
Steek de injectienaald door de afsluiter van een van de flessen, open het ventiel tot de drukmeter nul aangeeft, en sluit het ventiel;
|
|
—
|
Herhaal de procedure voor de overige flessen;
|
|
—
|
Injecteer in elke fles 1 ml lucht van 35 °C ± 2 °C. Steek de naald (op de meter) door de afsluiter van een van de flessen en wacht tot de stand van de drukmeter is gestabiliseerd; Noteer de druk, open het ventiel tot de drukmeter nul aangeeft, en sluit het ventiel;
|
|
—
|
Herhaal de procedure voor de overige flessen;
|
|
—
|
Herhaal de totale, hierboven beschreven procedure met 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml en 50 ml lucht;
|
|
—
|
Zet een conversiecurve van de druk (Pa) uit tegen het geïnjecteerde gasvolume Vb (ml). De respons van het instrument is lineair in het bereik van 0 Pa tot 70 000 Pa, en van 0 ml tot 50 ml gasproductie.
|
Aanhangsel 3
Voorbeeld van een afbraakcurve (cumulatieve nettodrukstijging)

Aanhangsel 4
Voorbeeld van gegevensformulieren voor de anaerobe biologische-afbraaktest — Gegevensformulier voor de teststof
|
Laboratorium…
|
Teststof: …
|
Testnr.: …
|
|
Testtemperatuur:(°C):…
|
Volume van gasruimte (V
h): …(1)
|
Volume van vloeistof (Vl
): …(l)
|
|
Koolstof in teststof Cc,v
: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Dag
|
p
1 (test)
(mbar)
|
p
2 (test)
(mbar)
|
p
3 (test)
(mbar)
|
p (test)
gemiddelde
(mbar)
|
p
4 (blanco)
(mbar)
|
p
5 (blanco)
(mbar)
|
p
6 (blanco)
(mbar)
|
p (blanco)
gemiddelde
(mbar)
|
p (netto)
test — blanco
gemiddelde (mbar)
|
Δp (netto)
Cumulatief
(mbar)
|
mh
gasruimte C
(43)
(mg)
|
Dh
Biologische afbraak (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
test
(mg)
|
C
IC, 2
test
(mg)
|
C
IC, 3
test
(mg)
|
C
IC
test gemiddelde
(mg)
|
C
IC, 4
blanco
(mg)
|
C
IC, 5
blanco
(mg)
|
C
IC, 6
blanco
(mg)
|
C
IC
blanco gemiddelde
(mg)
|
C
IC, netto
test -blanco
gemiddelde
(mg)
|
m
l
vloeistof C (45)
(mg)
|
m
t
totaal C (46)
(mg)
|
D
t
Biologische afbraak (47)
(%)
|
|
IC (totaal)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (totaal)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laboratorium …
|
Referentiestof: …
|
Testnr.: …
|
|
Testtemperatuur:(°C): …
|
Volume van gasruimte (Vh
): …(l)
|
Volume van vloeistof (Vl
) (liter): …
|
|
Koolstof in referentiestof C
c,v (mg/l): …
|
mv
(48) (mg):
|
|
|
Dag
|
p
1 (ref.)
(mbar)
|
p
2 (ref.)
(mbar)
|
p
3 (ref.)
(mbar)
|
p (ref.)
gemiddelde
(mbar)
|
p
4 (remming)
(mbar)
|
p
5 (remming)
(mbar)
|
p
6(remming)
(mbar)
|
p (remming)
gemiddelde
(mbar)
|
p (ref.)
ref. — blanco
(mbar)
|
Δp (ref.)
cumulatief
(mbar)
|
m
h
gasruimte C
(49)
(mg)
|
D
h
Biologische afbraak (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
ref.
(mg)
|
C
IC, 2
ref.
(mg)
|
C
IC, 3
ref.
(mg)
|
C
IC
ref. gemiddelde
(mg)
|
C
IC, 4
remming
(mg)
|
C
IC, 5
remming
(mg)
|
C
IC, 6
remming
(mg)
|
C
IC
remming gemiddelde
(mg)
|
C
IC, netto
ref. — remming
(mg)
|
m
l
vloeistof C (51)
(mg)
|
m
t
totaal C (52)
(mg)
|
D
t
Biologische afbraak (53)
(%)
|
|
IC (totaal)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (totaal)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. UITLOGING IN BODEMKOLOMMEN
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan OESO-testrichtsnoer (TG) 312 (2004). Synthetische chemische stoffen kunnen de bodem rechtstreeks bereiken via doelbewust gebruik (bijv. in de landbouw gebruikte chemische stoffen) of via indirecte routes (bijv. via afvalwater → zuiveringsslib → bodem of lucht → natte/droge afzetting). Voor de beoordeling van de risico's van deze chemische stoffen is het belangrijk om een schatting te maken van hun potentieel voor transformatie in de bodem en voor beweging (uitloging) in de richting van diepere bodemlagen en uiteindelijk het grondwater.
|
|
2.
|
Er bestaan meerdere methoden om het uitlogingspotentieel van chemische stoffen in de bodem onder gecontroleerde laboratoriumomstandigheden te meten, namelijk dunnebodemlaagchromatografie, dikkebodemlaagchromatografie, bodemkolomchromatografie en adsorptie-/desorptiemetingen (1)(2). Voor niet-geïoniseerde chemische stoffen kan met de n-octanol/water-verdelingscoëfficiënt (Pow) een vroege schatting worden gemaakt van hun adsorptie- en uitlogingspotentieel (3)(4)(5).
|
|
3.
|
De in deze testmethode beschreven methode is gebaseerd op bodemkolomchromatografie in verstoorde bodems (zie aanhangsel 1 voor een definitie). Er worden twee typen experimenten uitgevoerd om het volgende te bepalen: (i) het uitlogingspotentieel van de teststof en (ii) het uitlogingspotentieel van de omzettingsproducten (te onderzoeken met verouderde residuen) in bodems onder gecontroleerde laboratoriumomstandigheden (54). Deze testmethode is gebaseerd op bestaande methoden (6)(7)(8)(9)(10)(11).
|
|
4.
|
Bij een OESO-workshop over bodem-/sedimentselectie die in 1995 in Belgirate, Italië, werd gehouden (12) werden het aantal bodemmonsters en de bodemtypes die in deze testmethode moeten worden gebruikt vastgesteld. De workshop leverde tevens aanbevelingen op met betrekking tot het verzamelen, behandelen en bewaren van bodemmonsters voor uitlogingsexperimenten.
|
PRINCIPE VAN DE TESTMETHODE
|
5.
|
Kolommen gemaakt van geschikt inert materiaal (bijv. glas, roestvrij staal, aluminium, teflon, PVC, enz.) worden gevuld met grond en nadien verzadigd en geëquilibreerd met een „kunstmatige-regenoplossing” (zie aanhangsel 1 voor een definitie). Laat de kolommen vervolgens uitlekken. Het oppervlak van iedere bodemkolom wordt vervolgens behandeld met de teststof en/of verouderde residuen van de teststof. Daarop worden de bodemkolommen blootgesteld aan kunstmatige regen en wordt de uitloogvloeistof verzameld. Na het uitloogproces wordt de grond uit de kolommen verwijderd en opgedeeld in een geschikt aantal segmenten, afhankelijk van de informatie die het onderzoek beoogt te achterhalen. Ieder bodemsegment en de uitloogvloeistof worden vervolgens geanalyseerd om het gehalte teststof te bepalen en, indien van toepassing, omzettingsproducten of andere chemische stoffen van belang.
|
TOEPASBAARHEID VAN DE TESTMETHODE
|
6.
|
De testmethode kan worden gebruikt voor chemische stoffen (die al dan niet radioactief gemerkt zijn, bijv. met 14C) waarvoor een analysemethode met een afdoende nauwkeurigheid en gevoeligheid beschikbaar is. De testmethode mag niet worden gebruikt voor chemische stoffen die vluchtig zijn in de bodem en in het water en die derhalve niet in de bodem en/of de uitloogvloeistof blijven onder de experimentele omstandigheden van deze testmethode.
|
INFORMATIE OVER DE TESTSTOF
|
7.
|
Ongemerkte of radioactief gemerkte teststoffen kunnen worden gebruikt om het uitlooggedrag in bodemkolommen te meten. Radioactief gemerkt materiaal is vereist om de uitloging van omzettingsproducten (verouderde residuen van de teststof) te onderzoeken en voor bepaling van de massabalans. Merking met 14C wordt aanbevolen, maar ook het gebruik van andere isotopen zoals 13C, 15N, 3H, 32P kan nuttig zijn. De merkstof moet zo veel mogelijk in het meest stabiele gedeelte of de meest stabiele gedeelten van het molecuul worden aangebracht. De zuiverheid van de teststof moet ten minste 95 % zijn.
|
|
8.
|
De meeste chemische stoffen moeten als één stof worden gebruikt. Echter, voor actieve stoffen in gewasbeschermingsmiddelen kunnen geformuleerde producten worden gebruikt om het uitlogen van de oorspronkelijke teststof te onderzoeken, maar deze stoffen moeten in het bijzonder worden getest indien er een grote kans bestaat dat het mengsel de afgiftesnelheid negatief beïnvloedt (bijv. korrelige formules of formules met gereguleerde afgifte). Wat betreft voor het mengsel specifieke vereisten voor de opzet van de test kan het nuttig zijn om voor het uitvoeren van de test eerst met de regelgevingsinstantie te overleggen. Voor uitloogonderzoeken met verouderde residuen moet de oorspronkelijke teststof in zuivere vorm worden gebruikt.
|
|
9.
|
Vóór de uitvoering van uitloogtests in bodemkolommen moet bij voorkeur de volgende informatie over de teststof bekend zijn:
|
(1)
|
de oplosbaarheid in water [testmethode A.6] (13);
|
|
(2)
|
de oplosbaarheid in organische oplosmiddelen;
|
|
(3)
|
de dampspanning [testmethode A.4] (13) en de constante van de wet van Henry;
|
|
(4)
|
de n-octanol/water partitiecoëfficiënt [testmethoden A.8 en A.24] (13);
|
|
(5)
|
de adsorptiecoëfficiënt (Kd, Kf of KOC) [testmethoden C.18 en/of C.19] (13);
|
|
(6)
|
de hydrolyse [testmethode C.7] (13);
|
|
(7)
|
de dissociatieconstante (pKa) [OESO-TG 112] (25);
|
|
(8)
|
de aerobe en anaerobe omzetting in de bodem [testmethode C.23] (13)
|
Opmerking: De temperatuur waarbij deze metingen zijn verricht, moeten in de respectieve testverslagen worden gerapporteerd.
|
|
10.
|
De hoeveelheid teststof waaraan de bodemkolommen worden blootgesteld, moet voldoende zijn om ten minste 0,5 % van de toegepaste dosis te kunnen detecteren in één segment. Voor actieve chemische stoffen in gewasbeschermingsmiddelen mag de hoeveelheid gebruikte teststof overeenkomen met de maximale aanbevolen gebruikshoeveelheid (één voorgeschreven dosis).
|
|
11.
|
Er moet een geschikte analysemethode met een bekende juistheid, precisie en gevoeligheid voor de kwantitatieve bepaling van de chemische stof en, indien relevant, van de omzettingsproducten ervan in de bodem en in de uitloogvloeistof, beschikbaar zijn. De analytische detectiegrenswaarde voor de teststof en de belangrijkste omzettingsproducten ervan (normaal gesproken ten minste alle omzettingsproducten ≥ 10 % van de toegepaste dosis die zijn waargenomen in onderzoeken naar omzettingsroutes, maar bij voorkeur alle relevante omzettingsproducten) moet tevens bekend zijn (zie punt 17).
|
REFERENTIESTOFFEN
|
12.
|
Referentiestoffen met bekend uitlooggedrag zoals atrazine of monuron, die kunnen worden beschouwd als gemiddelde uitlogers, moeten worden gebruikt om de relatieve mobiliteit van de teststof in de bodem te beoordelen (1)(8)(11). Het gebruik van een niet-afbreekbare polaire chemische stof die geen sorptie vertoont (bijv. tritium, bromide, fluoresceïne, eosine) om de beweging van water in de kolom te volgen kan ook nuttig zijn om de hydrodynamische eigenschappen van de bodemkolom te bevestigen.
|
|
13.
|
Ook kunnen chemische stoffen van pro-analysekwaliteit worden gebruikt voor de karakterisering en/of identificatie van omzettingsproducten die worden aangetroffen in bodemsegmenten en in de uitloogvloeistoffen door middel van chromatografie, spectroscopie of andere toepasselijke methoden.
|
DEFINITIES EN EENHEDEN
KWALITEITSCRITERIA
Recovery
|
15.
|
Bij uitloogexperimenten wordt de recovery gevormd door de som van de percentages van de teststof die zijn aangetroffen in de bodemsegmenten en de uitloogvloeistof van de kolommen na het uitlogen. De recovery moet in het bereik van 90 % tot 110 % liggen voor radioactief gemerkte chemische stoffen (11) en in het bereik van 70 % tot 110 % voor ongemerkte chemische stoffen (8).
|
Herhaalbaarheid en gevoeligheid van de analysemethode
|
16.
|
De herhaalbaarheid van de analysemethode voor de kwantitatieve bepaling van de teststof en omzettingsproducten kan worden gecontroleerd aan de hand van een duploanalyse van dezelfde extractie van een bodemsegment of van een uitloogvloeistof (zie punt 11).
|
|
17.
|
De detectiegrens (limit of detection, LOD) van de analysemethode voor de teststof en voor de omzettingsproducten moet ten minste 0,01 mg · kg- 1 zijn in elk bodemsegment of elke uitloogvloeistof (als teststof) of 0,5 % van de gebruikte dosis in elk afzonderlijk segment, als dit lager is. Ook de bepaalbaarheidsgrens (limit of quantification, LOQ) moet worden gespecificeerd.
|
BESCHRIJVING VAN DE TESTMETHODE
Testsysteem
|
18.
|
Voor de test worden uitloogkolommen (al dan niet opdeelbaar in compartimenten) gebruikt die gemaakt zijn van geschikt inert materiaal (bijv. glas, roestvrij staal, aluminium, teflon, PVC, enz.) met een binnendiameter van ten minste 4 cm en een minimumhoogte van 35 cm. De kolommaterialen moeten worden getest op potentiële interactie met de teststof en/of de omzettingsproducten van de teststof. Voorbeelden van geschikte, in compartimenten opdeelbare en niet-opdeelbare kolommen worden getoond in aanhangsel 2.
|
|
19.
|
Een lepel, stamper en trilapparaat worden gebruikt voor de vulling en pakking van de bodemkolommen.
|
|
20.
|
Voor de blootstelling van de bodemkolommen aan kunstmatige regen kunnen zuiger- of peristaltische pompen, douchekoppen, mariotteflessen of eenvoudige druppeltrechters worden gebruikt.
|
Laboratoriumuitrusting en chemische stoffen
|
21.
|
Een standaard-laboratoriumuitrusting is vereist, in het bijzonder:
|
(1)
|
analyse-apparatuur zoals GLC-, HPLC- en TLC-apparatuur, met inbegrip van de nodige detectiesystemen voor de analyse van al dan niet radioactief gemerkte chemische stoffen of de inverse isotoopverdunningsmethode;
|
|
(2)
|
instrumenten voor kwalitatieve analyse (MS, GC-MS, HPLC-MS, NMR, enz.);
|
|
(3)
|
vloeistof-scintillatieteller voor radioactief gemerkte teststof;
|
|
(4)
|
oxidans voor de verbranding van gemerkt materiaal;
|
|
(5)
|
extractieapparaat (bijvoorbeeld centrifugebuizen voor koude extractie en een Soxhlet-apparaat voor continue extractie onder terugvloeiing);
|
|
(6)
|
instrumenten voor de concentratie van oplossingen en extracten (bijvoorbeeld een rotatieverdamper);
|
|
|
22.
|
De gebruikte chemische stoffen zijn: organische oplosmiddelen, analytisch zuiver, zoals aceton, methanol, enz.; scintillatievloeistof; oplossing van 0,01 M CaCl2 in gedistilleerd of gedeïoniseerd water (= kunstmatige regen).
|
Teststof
|
23.
|
De teststof moet worden opgelost in water (gedeïoniseerd of gedistilleerd) om te kunnen worden gebruikt in de test. Als de teststof slecht oplosbaar is in water, kan de stof worden gebruikt als hetzij een geformuleerd product (na suspenderen of emulgeren in water, indien nodig) hetzij in een willekeurig organisch oplosmiddel. Bij gebruik van een organisch oplosmiddel moet het oplosmiddel tot een minimum worden beperkt en moet het zijn verdampt van het oppervlak van de bodemkolom, voordat met de uitloogprocedure wordt begonnen. Vaste geformuleerde stoffen, zoals granulaten, moeten in de vaste toestand worden gebruikt zonder water. Om te zorgen voor een betere verdeling over het oppervlak van de bodemkolom kan het geformuleerde product vóór gebruik worden gemengd met een kleine hoeveelheid kwartszand (bijv. 1 g).
|
|
24.
|
De hoeveelheid teststof waaraan de bodemkolommen worden blootgesteld, moet voldoende zijn om ten minste 0,5 % van de toegepaste dosis te kunnen detecteren in één segment. Voor actieve chemische stoffen in gewasbeschermingsproducten kan deze hoeveelheid worden gebaseerd op de aanbevolen maximale gebruikshoeveelheid (één voorgeschreven dosis), waarbij de hoeveelheid voor de uitloging van zowel de oorspronkelijke teststof als de verouderde residuen verband moet houden met de grootte van het oppervlak van de gebruikte bodemkolom (55).
|
Referentiestof
|
25.
|
In de uitloogexperimenten moet een referentiestof worden gebruikt (zie punt 12). De referentiestof moet op soortgelijke wijze als de teststof in het oppervlak van de bodemkolom worden gebracht en in een passende hoeveelheid die toereikende detectie mogelijk maakt, hetzij als interne standaard samen met de teststof in dezelfde bodemkolom, hetzij alleen in een aparte bodemkolom. De referentie- en teststof moeten bij voorkeur aan dezelfde kolom worden toegevoegd, behalve wanneer ze beide een soortgelijke merking hebben.
|
Grond
Bodemselectie
|
26.
|
Voor uitloogonderzoeken met de oorspronkelijke teststof moeten drie tot vier bodemtypes worden gebruikt met een variërende pH, organisch-koolstofgehalte en textuur (12). Een richtsnoer voor de selectie van bodemtypes voor uitloogexperimenten wordt gegeven in onderstaande tabel 1. Voor ioniseerbare teststoffen moeten de geselecteerde bodemtypes een breed pH-bereik beslaan om de mobiliteit van de teststof in zijn geïoniseerde en niet-geïoniseerde vorm te kunnen bepalen; ten minste drie bodemtypes moeten een pH hebben waarbij de teststof in zijn mobiele vorm is.
Tabel 1
Richtsnoer voor de selectie van bodemtypes voor uitloogonderzoeken
|
Bodemnr.
|
pH-waarde
|
Organische koolstof
%
|
Kleigehalte
%
|
Textuur (56)
|
|
1
|
> 7,5
|
3,5 - 5,0
|
20 - 40
|
kleileem
|
|
2
|
5,5 - 7,0
|
1,5 - 3,0
|
15 - 25
|
siltleem
|
|
3
|
4,0 - 5,5
|
3,0 - 4,0
|
15 - 30
|
leem
|
|
4
|
< 4,0 - 6,0 (57)
|
< 0,5 - 1,5 (57)
(58)
|
< 10 - 15 (57)
|
lemig zand
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
lemig zand/zand
|
|
|
27.
|
Andere bodemtypes kunnen in sommige gevallen nodig zijn om regio's met een koeler, gematigd of tropisch klimaat te vertegenwoordigen. Dit betekent dat, indien de voorkeur wordt gegeven aan andere bodemtypes, ze gekarakteriseerd moeten worden door dezelfde parameters en vergelijkbare variaties in eigenschappen moeten hebben als de variaties die worden beschreven in het richtsnoer voor de selectie van de bodem voor uitloogonderzoeken (zie bovenstaande tabel 1), zelfs als ze niet exact aan de criteria voldoen.
|
|
28.
|
Voor uitloogonderzoeken met „verouderde residuen” moet één bodemtype worden gebruikt (12). Dit type moet een zandgehalte van > 70 % hebben en een organisch-koolstofgehalte tussen 0,5 — 1,5 % (bijv. bodem nr. 4 in tabel 1). Meer bodemtypes moeten mogelijk worden gebruikt, indien informatie over de omzettingsproducten belangrijk is.
|
|
29.
|
Alle bodemtypes moeten worden gekarakteriseerd voor textuur [% zand, % silt, % klei overeenkomstig de classificatiesystemen van de FAO en USDA (14)], pH, kationenuitwisselingsvermogen, gehalte organische koolstof, dichtheid van de droge grond (voor verstoorde bodems) en het waterhoudend vermogen. De microbiële biomassa hoeft alleen te worden gemeten voor het bodemtype dat is gebruikt in de verouderings-/incubatieperiode die plaatsvindt voor het uitloogexperiment met verouderde residuen. Informatie over aanvullende bodemeigenschappen (bijv. bodemclassificatie, kleimineralogie, specifiek deel van het oppervlak) kan nuttig zijn voor de interpretatie van de resultaten van dit onderzoek. Voor de bepaling van de bodemkenmerken kunnen de in de referenties (15)(16)(17)(18)(19) aanbevolen methoden worden gebruikt.
|
Verzameling en opslag van grond
|
30.
|
Grond moet uit de bovenste laag (A-horizon) worden verzameld met een maximale diepte van 20 cm. Resten van vegetatie, macrofauna en stenen moeten worden verwijderd. De grond (met uitzondering van de grond die wordt gebruikt voor de veroudering van de teststof) wordt aan de lucht gedroogd bij kamertemperatuur (bij voorkeur tussen 20-25 C). Bij het losmaken moet zo weinig mogelijk kracht worden gebruikt om de oorspronkelijke textuur van de bodem zo veel mogelijk intact te houden. De grond wordt gezeefd met een zeef van ≤ 2 mm. Een zorgvuldige homogenisering wordt aanbevolen, aangezien de reproduceerbaarheid van de resultaten daardoor wordt bevorderd. Vóór gebruik kan de grond worden opgeslagen bij omgevingstemperatuur en luchtgedroogd worden bewaard (12). Er is geen aanbevolen houdbaarheidstermijn, maar grond die meer dan drie jaar is bewaard moet vóór gebruik opnieuw worden geanalyseerd op zijn gehalte aan organische koolstof en pH.
|
|
31.
|
Er moet gedetailleerde achtergrondinformatie over de veldlocaties zijn waar de gebruikte bodem is verzameld. Daarbij gaat het bijvoorbeeld om de exacte ligging [exact vastgesteld door middel van UTM (Universal Transversal Mercator-projectie/European Horizontal Datum) of geografische coördinaten], vegetatie, behandelingen met gewasbeschermingsmiddelen, behandeling met organische en anorganische meststoffen, biologische toevoegingen of onopzettelijke verontreiniging (12). Indien de grond in de voorgaande vier jaar is behandeld met de teststof of zijn qua structuur analoge verbindingen, mag van deze grond geen gebruik worden gemaakt voor uitloogonderzoeken.
|
Testomstandigheden
|
32.
|
Tijdens de testperiode moeten de bodemuitloogkolommen zich in het donker bevinden bij omgevingstemperatuur, mits deze temperatuur constant wordt gehouden met ± 2 °C. De aanbevolen temperatuur ligt in het bereik van 18 tot 25 °C.
|
|
33.
|
Het oppervlak van de bodemkolommen moet continu worden blootgesteld aan kunstmatige regen (0,01 M CaCl2) met een neerslaghoeveelheid van 200 mm gedurende een periode van 48 uur (60); deze hoeveelheid komt overeen met het gebruik van 251 ml voor een kolom met een binnendiameter van 4 cm. Indien nodig voor de doeleinden van de test kunnen andere hoeveelheden kunstmatige regen en een langere duur aanvullend worden toegepast.
|
Uitvoering van de test
Uitlogen met de oorspronkelijke teststof
|
34.
|
Uitloogkolommen, in minimaal duplo, worden gevuld met onbehandelde, aan de lucht gedroogde en gezeefde grond (< 2 mm) tot een hoogte van ongeveer 30 cm. Om een gelijkvormig aangedrukt monster te verkrijgen wordt de grond met een lepel in kleine hoeveelheden toegevoegd en met een stamper aangedrukt onder gelijktijdig voorzichtig trillen van de kolom, totdat de bovenkant van de bodemkolom niet verder inzakt. Een uniforme vulling is nodig om reproduceerbare resultaten met de uitloogkolommen te verkrijgen. Zie de referenties (20), (21) en (22) voor nadere informatie over technieken voor het vullen van de kolommen. Om de reproduceerbaarheid van de vulprocedure te controleren wordt het totale gewicht van de grond in de kolommen bepaald (61); het gewicht van de duplokolommen moet ongeveer gelijk zijn.
|
|
35.
|
Na het vullen worden de bodemkolommen vooraf bevochtigd met kunstmatige regen (0,01 M CaCl2) van de bodem naar de bovenkant om de lucht in de poriën te vervangen door water. Vervolgens worden de bodemkolommen met rust gelaten om te equilibreren en lekt de overmaat aan water weg door de zwaartekracht. Methoden voor de verzadiging van de kolommen worden besproken in referentie (23).
|
|
36.
|
Vervolgens worden de teststof en/of de referentiestof aangebracht op de bodemkolommen (zie ook de punten 23-25). Om een homogene verdeling te bereiken moeten de oplossingen, suspensies of emulsies van de test- en/of referentiestof gelijkmatig worden verdeeld over het oppervlak van de bodemkolommen. Indien opname in grond wordt aanbevolen voor het toedienen van de teststof, moet de teststof worden gemengd met een kleine hoeveelheid (bijv. 20 g) grond en toegevoegd aan het oppervlak van de bodemkolom.
|
|
37.
|
De oppervlakken van de bodemkolommen worden vervolgens afgedekt met een glazen sinterschijf, glazen parels, glasvezelfilters of een rond stuk filterpapier om de kunstmatige regen gelijkmatig over het gehele oppervlak te verspreiden en om verstoring van het bodemoppervlak door de regendruppels te voorkomen. Hoe groter de diameter van de kolom, des te meer zorg moet worden besteed aan de blootstelling van de bodemkolommen aan de kunstmatige regen om een gelijkmatige verspreiding van de kunstmatige regen over het bodemoppervlak te waarborgen. Vervolgens wordt de kunstmatige regen druppelsgewijs aan de bodemkolommen toegevoegd met behulp van een zuiger of een peristaltische pomp of druppeltrechter. De uitloogvloeistoffen moeten bij voorkeur worden verzameld in fracties en hun respectieve volumes worden gerapporteerd (62).
|
|
38.
|
Na het uitlogen en uitlekken van de kolommen worden de bodemkolommen opgedeeld in een geschikt aantal segmenten afhankelijk van de informatie die het onderzoek beoogt te achterhalen, de segmenten worden geëxtraheerd met geschikte oplosmiddelen of mengsels van oplosmiddelen en worden geanalyseerd op de teststof en, indien van toepassing, op omzettingsproducten, totale radioactiviteit en de referentiestof. De uitloogvloeistoffen of fracties van uitloogvloeistoffen worden onmiddellijk of na extractie geanalyseerd op dezelfde stoffen. Wordt een radioactief gemerkte teststof gebruikt, dan moeten alle fracties die ≥ 10 % van de toegepaste radioactiviteit bevatten, worden geïdentificeerd.
|
Uitlogen met verouderde residuen
|
39.
|
Verse grond (die niet eerder aan de lucht is gedroogd) wordt behandeld met een hoeveelheid die overeenkomt met het oppervlak van de bodemkolommen (zie punt 24) met de radioactief gemerkte teststof en geïncubeerd onder aerobe omstandigheden overeenkomstig testmethode C.23 (13). De incubatie- (verouderings-)periode moet lang genoeg zijn om aanzienlijke hoeveelheden omzettingsproducten te produceren; een verouderingsperiode van één halveringsperiode van de teststof wordt aanbevolen (63), maar deze mag niet langer dan 120 dagen duren. Vóór het uitlogen wordt de verouderde grond geanalyseerd op aanwezigheid van de teststof en de omzettingsproducten ervan.
|
|
40.
|
De uitloogkolommen worden gevuld tot een hoogte van 28 cm met dezelfde (maar aan de lucht gedroogde) grond als die gebruikt is in het in punt 24 beschreven verouderingsexperiment en het totale gewicht van de gevulde bodemkolommen wordt eveneens bepaald. De bodemkolommen worden daarop vooraf bevochtigd zoals beschreven in punt 35.
|
|
41.
|
Vervolgens worden de teststof en de omzettingsproducten ervan toegevoegd aan het oppervlak van de bodemkolommen in de vorm van verouderde bodemresiduen (zie punt 39) als een bodemsegment van 2 cm. De totale hoogte van de bodemkolommen (onbehandelde grond + verouderde grond) mag bij voorkeur niet meer zijn dan 30 cm (zie punt 34).
|
|
42.
|
Het uitlogen wordt uitgevoerd zoals beschreven in punt 37.
|
|
43.
|
Na het uitlogen worden de bodemsegmenten en uitloogvloeistoffen geanalyseerd zoals aangegeven in punt 38 voor de teststof, de omzettingsproducten van de teststof en de niet-geëxtraheerde radioactiviteit. Om te bepalen hoeveel van het verouderde residu overblijft in de bovenste laag van 2 cm na het uitlogen, moet dit segment apart worden geanalyseerd.
|
GEGEVENS EN RAPPORTAGE
Bewerking van de resultaten
|
44.
|
De hoeveelheden teststof, omzettingsproducten, niet-extraheerbare stoffen en, indien van toepassing, referentiestof moeten worden aangeduid in % van de toegediende begindosis voor elk bodemsegment en elke fractie van de uitloogvloeistof. Elke kolom moet in een grafiek worden weergegeven door de gevonden percentages uit te zetten als een functie van de bodemdiepte.
|
|
45.
|
Indien in deze kolomuitloogonderzoeken een referentiestof wordt gebruikt, kan het uitlogen van een stof worden beoordeeld op een relatieve schaal met behulp van relatieve mobiliteitsfactoren (RMF; zie aanhangsel 3 voor een definitie) (1) (11) die het mogelijk maken om de uitlooggegevens te vergelijken van diverse chemische stoffen die met verschillende bodemsoorten zijn verkregen. Voorbeelden van RMF-waarden voor een aantal verschillende gewasbeschermingsmiddelen worden gegeven in aanhangsel 3.
|
|
46.
|
Schattingen van Koc (genormaliseerde adsorptiecoëfficiënt van organische koolstof) en Kom (genormaliseerde verdelingscoëfficiënt van organisch materiaal) kunnen ook worden verkregen op basis van kolomuitloogresultaten door gebruik te maken van de gemiddelde uitloogafstand of vastgestelde correlaties tussen RMF en respectievelijk Kom en Koc (4) of door de toepassing van elementaire chromatografische theorie (24). De laatstgenoemde methode moet echter met enige terughoudendheid worden gebruikt, in het bijzonder gezien het feit dat het uitloogproces niet uitsluitend betrekking heeft op verzadigde stromingsomstandigheden, maar eerder op onverzadigde systemen.
|
Interpretatie van de resultaten
|
47.
|
De kolomuitloogonderzoeken die in deze methode worden beschreven, maken het mogelijk om het uitlogings- of mobiliteitspotentieel van de teststof in de bodem (in het uitloogonderzoek met de oorspronkelijke teststof) en/of de omzettingsproducten van de teststof (in het uitloogonderzoek met verouderde residuen) te bepalen. Deze tests leiden niet tot een kwantitatieve voorspelling van uitlooggedrag onder veldomstandigheden, maar kunnen worden gebruikt om de 'uitloogbaarheid' van één chemische stof te vergelijken met andere stoffen waarvan het uitlooggedrag mogelijk bekend is (24). Deze tests omvatten ook geen kwantitatieve meting van het percentage teststof dat het grondwater zou kunnen bereiken (11). De resultaten van kolomuitloogonderzoeken kunnen echter behulpzaam zijn bij het nemen van een besluit over de vraag of aanvullende proeven moeten worden uitgevoerd, geheel of gedeeltelijk onder veldomstandigheden, voor stoffen die een hoog mobiliteitspotentieel vertonen in laboratoriumtests.
|
Testverslag
|
48.
|
In het verslag moeten zijn opgenomen:
|
|
Teststof en referentiestof (indien gebruikt):
|
—
|
de triviale naam, de chemische naam (IUPAC- en CAS-nomenclatuur), het CAS-nummer, de chemische structuur (waarin de plaats van de merkstof wordt aangegeven bij gebruik van een radioactief gemerkte stof) en relevante fysisch-chemische eigenschappen;
|
|
—
|
de zuiverheid (verontreinigingen) van de teststof;
|
|
—
|
de zuiverheid van het label van gemerkte chemicaliën en molaire activiteit (indien van toepassing).
|
|
|
|
De gebruikte bodem:
|
—
|
gegevens over de plaats waar de monsters zijn verzameld;
|
|
—
|
eigenschappen van de bodem zoals de pH, het gehalte aan organische koolstof en het kleigehalte, de textuur en de dichtheid van de droge bodem (voor een verstoorde bodem);
|
|
—
|
de microbiële activiteit in de bodem (alleen indien de bodem is gebruikt voor veroudering van de teststof);
|
|
—
|
de periode gedurende welke en de omstandigheden waaronder de monsters zijn opgeslagen.
|
|
|
|
De testomstandigheden:
|
—
|
de data waarop het onderzoek is uitgevoerd;
|
|
—
|
de lengte en diameter van de uitloogkolommen;
|
|
—
|
het totale gewicht van de grond in de bodemkolommen;
|
|
—
|
de aangebrachte hoeveelheid teststof en, indien van toepassing, referentiestof;
|
|
—
|
het aantal, de frequentie en de duur van de blootstellingen aan kunstmatige regen;
|
|
—
|
de temperatuur van de proefopstelling;
|
|
—
|
het aantal duplobepalingen (ten minste twee);
|
|
—
|
analysemethoden voor de teststof, omzettingsproducten en, indien van toepassing, de referentiestof in de diverse bodemsegmenten en uitloogvloeistoffen;
|
|
—
|
methoden voor de karakterisering en identificatie van omzettingsproducten in de bodemsegmenten en uitloogvloeistoffen.
|
|
|
|
De testresultaten:
|
—
|
tabellen met resultaten uitgedrukt als % van de gebruikte dosis voor bodemsegmenten en uitloogvloeistoffen;
|
|
—
|
de massabalans, indien van toepassing;
|
|
—
|
de volumes van de uitloogvloeistoffen;
|
|
—
|
de uitloogafstanden en, indien van toepassing, de relatieve mobiliteitsfactoren;
|
|
—
|
grafische weergave waarin het in de bodemsegmenten aangetroffen percentage wordt uitgezet tegen de diepte van het bodemsegment;
|
|
—
|
een bespreking en interpretatie van de resultaten.
|
|
|
LITERATUUR
|
(1)
|
Guth, J.A., Burkhard, N. and Eberle, D.O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
(2)
|
Russel, M.H. (1995). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals — T.R. Roberts and P.C. Kearney, Eds.). J. Wiley & Sons.
|
|
(3)
|
Briggs, G.G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J.Agric. Food Chem. 29, 1050-1059.
|
|
(4)
|
Chiou, C.T., Porter, P.E. and Schmedding, D.W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227-231.
|
|
(5)
|
Guth, J.A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26-33.
|
|
(6)
|
US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(7)
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
(8)
|
Bijlage I bij Richtlijn 95/36/EG van de Commissie van 14 juli 1995 tot wijziging van Richtlijn 91/414/EEG van de Raad betreffende het op de markt brengen van gewasbeschermingsmiddelen, PB L 172 van 22.7.1995, blz. 8.
|
|
(9)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
(11)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
(12)
|
OESO (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italië, 18-20 januari 1995.
|
|
(13)
|
De volgende hoofdstukken van deze bijlage:
|
|
Hoofdstuk A.4, Dampspanning
|
|
|
Hoofdstuk A.6, Oplosbaarheid in water
|
|
|
Hoofdstuk A.8, Verdelingscoëfficiënt, schudflesmethode
|
|
|
Hoofdstuk A.24, Verdelingscoëfficiënt, HPLC-methode
|
|
|
Hoofdstuk C.7, Afbraak — niet-biologische afbraak: hydrolyse in afhankelijkheid van de pH
|
|
|
Hoofdstuk C.18, Bepaling van de adsorptie/desorptie met behulp van een batch-evenwichtsmethode
|
|
|
Hoofdstuk C.23, Aerobe en anaerobe omzetting in de bodem
|
|
|
(14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
|
|
(15)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods (A. Klute, Ed.). Agronomy Series No. 9, 2nd Edition.
|
|
(16)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A.L. Page, R.H. Miller and D.R. Kelney, Eds.). Agronomy Series No. 9, 2nd Edition.
|
|
(17)
|
ISO Standard Compendium Environment (1994). Soil Quality — General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
|
|
(18)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
(19)
|
Scheffer, F. and Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(20)
|
Weber, J.B. and Peeper, T.F. (1977). In Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, 73-78.
|
|
(21)
|
Weber, J.B., Swain, L.R., Strek, H.J. and Sartori, J.L. (1986). In Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, 190-200.
|
|
(22)
|
Oliveira, et al. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): 49-53.
|
|
(23)
|
Shackelford, C. D. (1991). Laboratory diffusion testing for waste disposal. — A review. J. Contam. Hydrol. 7, 177-217.
|
|
(24)
|
(Hamaker, J.W. (1975). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V.H. Freed, Eds), 115-133. Plenum Press, New York.
|
|
(25)
|
OESO (1981). Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112, OESO, Parijs
|
Aanhangsel 1
Definities en eenheden
Verouderd bodemresidu
: teststof en omzettingsproducten daarvan die in de bodem aanwezig zijn na aanbrenging en na een periode die zo lang is dat transport-, adsorptie-, metabolisme- en verspreidingsprocessen de verdeling en chemische aard van de aangebrachte teststof kunnen wijzigen (1).
Kunstmatige regen
: een oplossing van 0,01 M CaCl2 in gedistilleerd of gedeïoniseerd water.
Gemiddelde uitloogafstand
: onderzijde van het bodemdeel waar de cumulatieve recovery van de teststof = 50 % van de totale recovery van de teststof [gewoon uitloogexperiment], of; (onderzijde van bodemdeel waar de cumulatieve recovery van de teststof = 50 % van de totale recovery van de teststof) — ((dikte van laag verouderd residu)/2) [uitloogonderzoek met verouderd residu].
Stof
: een stof of een mengsel.
Uitloogvloeistof
: waterfase die door een bodemprofiel of een bodemkolom is gesijpeld (1).
Uitloging
: proces waarin een stof neerwaarts door het bodemprofiel of een bodemkolom beweegt (1).
Uitloogafstand
: diepste bodemsegment waarin ≥ 0,5 % van de gebruikte teststof of verouderd residu na het uitloogproces werd aangetroffen (gelijkwaardig aan de penetratiediepte).
Aantoonbaarheidsgrens en bepaalbaarheidsgrens
: de aantoonbaarheidsgrens is de laagste concentratie van een stof waarbij de identiteit van de stof nog kan worden onderscheiden van analytische artefacten. De bepaalbaarheidsgrens is de laagste concentratie van een stof waarbij de concentratie nog met aanvaardbare nauwkeurigheid kan worden bepaald.
Relatieve mobiliteitsfactor (RMF): (uitloogafstand van teststof (cm)) / (uitloogafstand van referentiestof (cm))
Teststof
: alle volgens deze testmethode geteste stoffen of mengsels.
Omzettingsproduct
: alle stoffen die ontstaan bij biotische of abiotische omzettingsreacties van de teststof, met inbegrip van CO2 en in residuen gebonden producten.
Bodem
: een mengsel van minerale en organische chemische bestanddelen, waarbij de chemische bestanddelen verbindingen bevatten met een hoog koolstof- en stikstofgehalte en een hoog molecuulgewicht, waarin kleine (voornamelijk micro-)organismen leven. De conditie van de te behandelen bodem kan twee variaties vertonen:
|
—
|
onverstoord, zoals de bodem zich mettertijd heeft ontwikkeld, in karakteristieke lagen bestaande uit een aantal diverse grondsoorten;
|
|
—
|
verstoord, zoals de bodem gewoonlijk wordt aangetroffen in akkerlanden of als het gevolg van graven bij de monstername, d.w.z. de methode die in deze testmethode wordt toegepast (2).
|
|
(1)
|
Holland, P.T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, 1167-1193.
|
|
(2)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (goedgekeurd op 12 mei 1981).
|
Aanhangsel 2
Figuur 1
Voorbeeld van niet in compartimenten opdeelbare glazen uitloogkolommen
met een lengte van 35 cm en een binnendiameter van 5 cm (1)

|
(1)
|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden — 70 Jahre Agrarforschung der BASF AG, 225-236. Verlag Wissenschaft und Politik, Keulen.
|
Figuur 2
Voorbeeld van een in compartimenten opdeelbare metalen kolom met een binnendiameter van 4 cm (1)

|
(1)
|
Burkhard, N., Eberle D.O. and Guth, J.A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203-213.
|
Aanhangsel 3
Voorbeelden van relatieve mobiliteitsfactoren
(64)
(RMF) voor diverse gewasbeschermingsmiddelen (1)(2) en overeenkomstige mobiliteitsklassen
(66)
|
RMF-bereik
|
Stof (RMF)
|
Mobiliteitsklasse
|
|
≤ 0,15
|
Parathion (< 0,15), fluorodifen (0,15)
|
I
immobiel
|
|
0,15 - 0,8
|
Profenofos (0,18), propiconazool (0,23), diazinon (0,28), diuron (0,38), terbutylazine (0,52), methidathion (0,56), prometryn (0,59), propazine (0,64), alachloor (0,66), metolachloor (0,68)
|
II
enigszins mobiel
|
|
0,8 - 1,3
|
Monuron (65) (1,00), atrazine (1,03), simazine (1,04), fluometuron (1,18)
|
III
matig mobiel
|
|
1,3 - 2,5
|
Prometon (1,67), cyanazine (1,85), bromacil (1,91), karbutilaat (1,98)
|
IV
redelijk mobiel
|
|
2,5 - 5,0
|
Carbofuraan (3,00), dioxacarb (4,33)
|
V
mobiel
|
|
> 5,0
|
Monocrotofos (> 5,0), dicrotofos (> 5,0)
|
VI
zeer mobiel
|
|
(1)
|
Guth, J.A. (1985). Adsorption/desorption. In Joint International Symposium „Physicochemical Properties and their Role in Environmental Hazard Assessment” Canterbury, VK, 1-3 juli 1985.
|
|
(2)
|
Guth, J.A. and Hörmann, W.D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91-106.
|
|
(3)
|
Harris, C.I. (1967). Movement of herbicides in soil. Weeds 15, 214-216.
|
|
(4)
|
Helling, C.S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, 743-748.
|
|
(5)
|
McCall, P.J., Laskowski, D.A., Swann, R.L. and Dishburger, H.J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
(6)
|
Hollis, J.M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, 165-174.
|
C.45. RAMING VAN EMISSIES NAAR HET MILIEU VAN MET CONSERVERINGSMIDDEL BEHANDELD HOUT: LABORATORIUMMETHODE VOOR HOUTEN PRODUCTEN DIE NIET ZIJN BEKLEED EN DIE CONTACT MAKEN MET ZOET WATER OF ZEEWATER
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan OESO-testrichtsnoer (TG) 313 (2007). De emissies naar het milieu van met conserveringsmiddel behandeld hout moeten worden gekwantificeerd om een milieurisicobeoordeling van het behandelde hout mogelijk te maken. Deze testmethode beschrijft een laboratoriummethode voor de raming van emissies van met conserveringsmiddel behandeld hout in twee situaties waarin de emissies in het milieu terecht kunnen komen:
|
—
|
emissies van behandeld hout dat in contact staat met zoet water. Emissies kunnen uit het oppervlak van het behandelde hout in het water terechtkomen;
|
|
—
|
emissies van behandeld hout dat in contact staat met zeewater. Emissies kunnen uit het oppervlak van het behandelde hout in het zeewater terechtkomen.
|
|
|
2.
|
Deze testmethode is bedoeld voor het testen van de emissies uit hout en houten producten die niet bekleed zijn en die contact maken met zoet water of zeewater. Gebruiksklassen worden internationaal gebruikt als indeling voor het biologische risico waaraan de behandelde producten zullen worden blootgesteld. Gebruiksklassen definiëren tevens de situatie waarin het behandelde product wordt gebruikt en omvatten een bepaling van de milieucompartimenten (lucht, water, bodem) waarvoor het met conserveringsmiddel behandelde hout mogelijk een risico vormt.
|
|
3.
|
De testmethode is een laboratoriumprocedure voor het verzamelen van monsters (uitgeloogde emissies) uit water waarin behandeld hout is ondergedompeld, met steeds langer durende tussenpozen na de blootstelling. De hoeveelheid emissies in de uitgeloogde emissies wordt gekoppeld aan het oppervlak van het hout en de duur van de blootstelling om een stroom in mg/m2/dag te berekenen. De stroom (uitlogingsgraad) na steeds langer durende blootstellingsperioden kan aldus worden geraamd.
|
|
4.
|
De hoeveelheid emissies kan worden gebruikt in een milieurisicobeoordeling van het behandelde hout.
|
INLEIDENDE OVERWEGINGEN
|
5.
|
Het mechanisme van uitloging aan het houtoppervlak door zoet water wordt niet verondersteld identiek van aard en intensiteit te zijn aan uitloging aan een houtoppervlak door zeewater. Derhalve is voor houtconserveringsmiddelen of mengsels die worden gebruikt om hout te behandelen en die in zeewateromgevingen worden gebruikt, een uitloogonderzoek voor zeewater nodig.
|
|
6.
|
Ingeval met een houtconserveringsmiddel behandeld hout wordt gebruikt, moet dit hout representatief zijn voor in de handel verkrijgbaar hout. Het moet worden behandeld overeenkomstig de instructies van de fabrikant van het conserveringsmiddel en conform de toepasselijke normen en specificaties. De parameters voor het conditioneren van behandeld hout voorafgaand aan de test moeten worden gerapporteerd.
|
|
7.
|
De gebruikte houtmonsters moeten representatief zijn voor de gebruikte producten (bijv. met betrekking tot de soort, dichtheid en andere kenmerken).
|
|
8.
|
De test kan worden toegepast op hout met gebruikmaking van een penetratieproces of oppervlakkige aanbrenging of op behandeld hout dat een aanvullende verplichte oppervlaktebehandeling heeft gehad (bijv. de toepassing van lak als een vereiste voor commercieel gebruik).
|
|
9.
|
De samenstelling, hoeveelheid, pH en de fysieke vorm van water is belangrijk voor het bepalen van de hoeveelheid, het gehalte aan en de aard van emissies uit hout.
|
PRINCIPE VAN DE TESTMETHODE
|
10.
|
Testmonsters van met conserveringsmiddel behandeld hout worden ondergedompeld in water. Het water (uitgeloogde emissies) wordt gedurende de blootstellingsperiode voldoende vaak bemonsterd en geanalyseerd om statistische berekeningen mogelijk te maken. Emissiewaarden uitgedrukt in mg/m2/dag worden berekend aan de hand van de analyseresultaten. De bemonsteringsperioden moeten worden genoteerd. Tests met monsters van onbehandeld hout kunnen worden stopgezet, indien er geen achtergrondconcentratie wordt gedetecteerd in de eerste drie datapunten.
|
|
11.
|
Het testen van monsters van onbehandeld hout maakt het mogelijk om de achtergrondconcentraties voor andere uitgeloogde emissies uit hout dan het gebruikte conserveringsmiddel te bepalen.
|
KWALITEITSCRITERIA
Nauwkeurigheid
|
12.
|
De nauwkeurigheid van de ramingen van emissies in deze testmethode is afhankelijk van de vraag of de testmonsters representatief zijn voor in de handel verkrijgbaar behandeld hout, hoe representatief het water is voor echt water en in hoeverre het blootstellingsregime representatief is voor natuurlijke omstandigheden.
|
|
13.
|
De nauwkeurigheid, precisie en herhaalbaarheid van de analysemethode moeten worden bepaald vóór uitvoering van de test.
|
Reproduceerbaarheid
|
14.
|
Drie watermonsters worden verzameld en geanalyseerd, waarbij de gemiddelde waarde als emissiewaarde geldt. De reproduceerbaarheid van de resultaten in één laboratorium en tussen verschillende laboratoria is afhankelijk van het onderdompelingsregime en van het als testmonsters gebruikte hout.
|
Aanvaardbaar resultatenbereik
|
15.
|
Een bereik van met deze test verkregen resultaten is aanvaardbaar, indien de boven- en ondergrenswaarden een afwijking van minder dan één orde van grootte vertonen.
|
TESTVOORWAARDEN
Water
|
16.
|
Uitloogscenario's met zoet water: gedeïoniseerd water (bijv. ASTM D 1193 type II) wordt aanbevolen voor gebruik in de uitloogtest die bedoeld is om hout dat is blootgesteld aan zoet water te beoordelen. De watertemperatuur moet 20 °C +/- 2 °C zijn en de gemeten pH en watertemperatuur moeten in het verslag worden gerapporteerd. Door analyse van monsters van het gebruikte water die worden genomen voordat de behandelde testmonsters worden ondergedompeld, kunnen de geanalyseerde stoffen in het water worden geschat. Dit is een controletest om de achtergrondconcentraties van stoffen te bepalen, die vervolgens chemisch worden geanalyseerd.
|
|
17.
|
Uitloogscenario's met zeewater: synthetisch zeewater (bijv. ASTM D 1141 surrogaatzeewater, zonder zware metalen) wordt aanbevolen voor gebruik in de uitloogtest die bedoeld is om hout dat is blootgesteld aan zeewater te beoordelen. De watertemperatuur moet 20 °C +/- 2 °C zijn en de gemeten pH en watertemperatuur moeten in het verslag worden gerapporteerd. Door analyse van monsters van het gebruikte water die worden genomen voordat de behandelde testmonsters worden ondergedompeld, kunnen de geanalyseerde stoffen in het water worden geschat. Dit is een controletest om de achtergrondconcentraties van belangrijke stoffen te bepalen.
|
Houttestmonsters
|
18.
|
De houtsoort moet overeenkomen met de houtsoort die wordt gebruikt voor tests op de doeltreffendheid van houtconserveringsmiddelen. De aanbevolen soorten zijn Pinus sylvestris L. (grove den), Pinus resinosa Ait. (harsige den) of Pinus spp (den). Aanvullende tests kunnen met andere houtsoorten worden uitgevoerd.
|
|
19.
|
Er moet gebruik worden gemaakt van hout met rechte nerven zonder knoesten. Materiaal met een harsachtig voorkomen moet worden vermeden. Het hout moet representatief zijn voor in de handel verkrijgbaar hout. De bron en de dichtheid van en het aantal jaarringen per 10 mm moeten worden gerapporteerd.
|
|
20.
|
De aanbevolen houttestmonsters zijn sets van vijf blokken met een omvang conform EN 113 (afmetingen: 25 mm × 50 mm × 15 mm) waarbij de longitudinale oppervlakken parallel lopen aan de draad van het hout, hoewel andere afmetingen zoals 50 mm bij 150 mm bij 10 mm ook kunnen worden gebruikt. Het testmonster moet volledig in water worden ondergedompeld. Testmonsters moeten voor 100 % uit spinthout bestaan. Elk monster wordt van een unieke markering voorzien, zodat het gedurende de gehele test kan worden geïdentificeerd.
|
|
21.
|
Alle testmonsters moeten afgeschaafde of afgezaagde oppervlakken hebben, die niet mogen worden gezandstraald.
|
|
22.
|
Er moeten ten minste vijf sets houttestmonsters worden gebruikt: drie sets monsters worden met conserveringsmiddel behandeld, één set monsters wordt niet behandeld en één set monsters word gebruikt voor de raming van het ovendroge vochtgehalte van de testmonsters vóór behandeling. Voldoende testmonsters worden bereid om drie sets monsters te kunnen selecteren die binnen 5 % van de gemiddelde waarde van de conserveringsmiddelretenties van het totale aantal testmonsters blijven.
|
|
23.
|
Alle testmonsters worden afgedicht met een chemische stof die verhindert dat het conserveringsmiddel tot in het kopshout van de monsters doordringt of die uitloging uit de monsters via het kopshout verhindert. Er moet onderscheid worden gemaakt tussen monsters die worden gebruikt voor oppervlakkige aanbrenging en penetratieprocessen voor het aanbrengen van de afdichtende stof. De afdichtende stof moet enkel in geval van oppervlakkige aanbrenging worden aangebracht vóór de behandeling.
|
|
24.
|
Het kopshout moet open zijn voor behandeling door penetratieprocessen. De monsters moeten daarom aan het einde van de conditioneringsperiode worden afgedicht. De emissie hoeft alleen voor het longitudinale oppervlak te worden geraamd. Afdichtingsmiddelen moeten worden geïnspecteerd en opnieuw aangebracht alvorens met het uitlogen te beginnen en mogen niet opnieuw worden aangebracht, nadat het uitlogen is begonnen.
|
Onderdompelingsvat
|
25.
|
Het vat is gemaakt van een inert materiaal en is groot genoeg om vijf houten monsters conform EN113 te bevatten in 500 ml water, resulterend in een verhouding tussen oppervlakte en watervolume van 0,4 cm2/ml.
|
Testinrichting voor de monsters
|
26.
|
De testmonsters worden gedragen door een inrichting die ervoor zorgt dat alle blootgestelde oppervlakken in aanraking komen met het water.
|
PROCEDURE VOOR DE BEHANDELING MET CONSERVERINGSMIDDEL
Bereiding van de behandelde testmonsters
|
27.
|
Het met conserveringsmiddel te behandelen houttestmonster wordt behandeld met behulp van de methode die voor het conserveringsmiddel wordt voorgeschreven; dit kan zijn een penetrerende behandelingsmethode of een proces van oppervlakkige aanbrenging, bijvoorbeeld door onderdompelen, spuiten of aanbrengen met een kwast.
|
Conserveringsmiddelen die met behulp van een penetratieproces worden aangebracht
|
28.
|
Er moet een oplossing van het conserveringsmiddel worden bereid die de gespecificeerde opname of retentie tot stand brengt, wanneer het wordt aangebracht met gebruikmaking van het penetrerende behandelingsproces. Het houttestmonster wordt gewogen en de afmetingen ervan worden gemeten. Het penetrerende behandelingsproces moet worden uitgevoerd als gespecificeerd voor de aanbrenging van conserveringsmiddel op hout van gebruiksklasse 4 of 5. Het monster wordt na de behandeling opnieuw gewogen en de retentie van het conserveringsmiddel (kg/m3) wordt berekend met de vergelijking:

|
|
29.
|
Opgemerkt zij dat hout dat is behandeld in een industriële installatie voor de bewerking van hout (bijv. door middel van impregnering onder vacuüm) ook in deze test kan worden gebruikt. De gebruikte procedures moeten worden gerapporteerd en de retentie van materiaal op deze manier moet worden geanalyseerd en gerapporteerd.
|
Conserveringsmiddelen die door middel van oppervlakkige aanbrenging worden aangebracht
|
30.
|
Bij het proces van oppervlakkige aanbrenging kan het gaan om onderdompelen, spuiten of met een kwast bewerken van de testmonsters. Het proces en de dosering (bijv. liter/m2) moeten worden uitgevoerd als gespecificeerd voor de oppervlakkige aanbrenging van het conserveringsmiddel.
|
|
31.
|
Ook in dit geval kan hout dat is behandeld in een industriële installatie voor de bewerking van hout in de test worden gebruikt. De gebruikte procedures moeten worden gerapporteerd en de retentie van materiaal op deze manier moet worden geanalyseerd en gerapporteerd.
|
Conditionering van de testmonsters na behandeling
|
32.
|
Nadat ze zijn behandeld, moeten de testmonsters worden geconditioneerd overeenkomstig de aanbevelingen van de fabrikant van het conserveringsmiddel conform de vereisten op het etiket van het conserveringsmiddel of conform in de handel gangbare behandelingspraktijken of conform de norm EN 252.
|
Bereiding en selectie van testmonsters
|
33.
|
Na de op de behandeling volgende conditionering wordt de gemiddelde retentie van de groep testmonsters berekend en worden drie representatieve sets monsters met een retentie binnen 5 % van het gemiddelde voor de groep volgens steekproef gekozen voor uitloogmetingen.
|
PROCEDURE VOOR METINGEN VAN CONSERVERINGSMIDDELEMISSIES
Onderdompelingsmethode
|
34.
|
De testmonsters worden gewogen en vervolgens volledig ondergedompeld in het water, waarbij de datum en het tijdstip worden genoteerd. Het vat wordt afgedekt om verdamping te verminderen.
|
|
35.
|
Het water wordt op de volgende momenten ververst: na 6 uur, 1 dag, 2 dagen, 4 dagen, 8 dagen, 15 dagen, 22 dagen, 29 dagen (opmerking: het gaat steeds om de totale duur, niet de duur van een interval). Het tijdstip en de datum van de waterverversingen alsmede de massa van het uit het vat verwijderde water moeten worden gerapporteerd.
|
|
36.
|
Na iedere waterverversing wordt een monster van het water waarin een set testmonsters is ondergedompeld apart gehouden om chemisch te worden geanalyseerd.
|
|
37.
|
Deze bemonsteringsprocedure maakt het mogelijk om het profiel van de hoeveelheid emissies uitgezet tegen de tijd te berekenen. Monsters moeten worden opgeslagen onder omstandigheden waardoor de te analyseren stof behouden blijft, bijv. in een koeler in het donker om microbiële groei in het monster vóór de analyse te verminderen.
|
EMISSIEMETINGEN
Behandelde monsters
|
38.
|
Het bemonsterde water wordt chemisch geanalyseerd op de actieve stof en/of relevante afbraak-/omzettingsproducten, indien van toepassing.
|
Onbehandelde monsters
|
39.
|
Door het bemonsterde water (uitgeloogde emissies) in dit systeem te analyseren op stoffen die uit de onbehandelde houtmonsters zijn geloogd, kan de mogelijke emissiewaarde van het conserveringsmiddel uit onbehandeld hout worden geraamd. Door de uitgeloogde emissies te bemonsteren en analyseren na steeds langer durende blootstellingsperioden, kan de verandering in de emissiewaarde na verloop van tijd worden geraamd. Deze analyse is een controleprocedure om de achtergrondconcentraties van de teststof in onbehandeld hout te bepalen teneinde te bevestigen dat het hout dat als een bron van testmonsters wordt gebruikt, niet eerder reeds met het conserveringsmiddel is behandeld.
|
GEGEVENS EN RAPPORTAGE
Chemische analysen
|
40.
|
Het bemonsterde water wordt chemisch geanalyseerd en het resultaat van de wateranalyse wordt uitgedrukt in passende eenheden, bijv. μg/l.
|
Rapportage van gegevens
|
41.
|
Alle resultaten worden gerapporteerd. Het aanhangsel bevat een voorbeeld van een voorgesteld rapportageformulier voor één set behandelde testmonsters alsmede de samenvattende tabel voor het berekenen van de gemiddelde emissiewaarden voor elk monsternemingsinterval.
|
|
42.
|
De dagelijkse emissiestroom in mg/m2/dag wordt berekend door het gemiddelde van de drie metingen van de drie duplo's te nemen en dit te delen door het aantal dagen gedurende welke de monsters ondergedompeld waren.
|
Testverslag
|
43.
|
Het testverslag moet ten minste de volgende informatie bevatten:
|
—
|
de naam van de leverancier van het geteste conserveringsmiddel;
|
|
—
|
de specifieke en unieke naam of code van het geteste conserveringsmiddel;
|
|
—
|
de in de handel gebruikte of triviale naam van het actieve bestanddeel/de actieve bestanddelen met een generieke beschrijving van de formuleringshulpstoffen (bijv. oplosmiddel, hars) en de samenstelling in % m/m van de bestanddelen;
|
|
—
|
de relevante retentie of belasting (in respectievelijk kg/m3 of l/m2) die is gespecificeerd voor hout dat wordt gebruikt terwijl het in aanraking komt met water;
|
|
—
|
de gebruikte houtsoort, met inbegrip van de dichtheid ervan en de groeisnelheid in ringen per 10 mm;
|
|
—
|
de belasting of retentie van het geteste conserveringsmiddel en de formule die is gebruikt om de retentie te berekenen, uitgedrukt in l/m2 of kg/m3;
|
|
—
|
de methode van aanbrenging van het conserveringsmiddel, waarbij het voor een penetratieproces gebruikte behandelingsregime moet worden gespecificeerd, alsmede de methode van aanbrenging, indien een oppervlakkige behandeling is gebruikt;
|
|
—
|
de datum van de aanbrenging van het conserveringsmiddel en een raming van het vochtgehalte van de testmonsters, uitgedrukt als een percentage;
|
|
—
|
de toegepaste conditioneringsprocedures, waarbij het type, de omstandigheden en de duur moeten worden aangegeven;
|
|
—
|
opgave van het gebruikte afdichtingsmiddel en het aantal keren dat het is aangebracht;
|
|
—
|
opgave van eventuele bijkomende behandeling van het hout, bijv. opgave van de leverancier, het type, de kenmerken en de belasting van een lak;
|
|
—
|
het tijdstip en de datum van elke onderdompeling, de gebruikte hoeveelheid water voor de onderdompeling van de testmonsters bij elke onderdompeling en de hoeveelheid door het hout tijdens de onderdompeling geabsorbeerde water;
|
|
—
|
eventuele afwijkingen van de beschreven methode en eventuele factoren die mogelijk van invloed waren op de resultaten.
|
|
LITERATUUR
|
(1)
|
Europese norm, EN 84 — 1997. Wood preservatives. Accelerated ageing of treated wood prior to biological testing. Leaching procedure.
|
|
(2)
|
Europese norm, EN 113/A1 — 2004. Wood preservatives. Test method for determining the protective effectiveness against wood destroying basidiomycetes. Determination of the toxic values.
|
|
(3)
|
Europese norm, EN 252 — 1989. Field test method for testing the relative protective effectiveness of a wood preservative in ground contact.
|
|
(4)
|
Europese norm, EN 335 — Part 1: 2006. Durability of wood and wood-based products — Definition of use classes — Part 1: General.
|
|
(5)
|
American Society for Testing and Materials Standards, ASTM D 1141 — 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
(6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II — 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
Aanhangsel 1
Rapportageforulier voor testmethode
Raming van emissies naar het milieu van met conserveringsmiddel behandeld hout: laboratoriummethode voor houten producten die niet zijn bekleed en die contact maken met zoet water of zeewater
|
Testlaboratorium
|
|
|
Houtconserveringsmiddel
|
|
Leverancier van het conserveringsmiddel
|
|
|
Specifieke en unieke naam of code van het geteste conserveringsmiddel
|
|
|
In de handel gebruikte of triviale naam van het conserveringsmiddel
|
|
|
Formuleringshulpstoffen
|
|
|
Relevante retentie voor hout dat wordt gebruikt terwijl het in contact komt met water
|
|
|
Aanbrenging
|
|
Aanbrengingsmethode
|
|
|
Datum van aanbrenging
|
|
|
Voor de berekening van de retentie gebruikt formule:
|
|
|
Conditioneringsprocedure
|
|
|
Duur van de conditionering
|
|
|
Afdichtingsmiddel/aantal keren aangebracht
|
|
|
Nabehandeling
|
indien van toepassing
|
|
Testmonsters
|
|
Houtsoort
|
|
|
Dichtheid van het hout
|
(minimum … gemiddelde … maximum)
|
|
Groeisnelheid (ringen per 10 mm)
|
(minimum … gemiddelde … maximum)
|
|
Vochtgehalte
|
|
|
Testinrichtingen
(67)
|
Retentie (bijv. kg/m3)
|
|
Behandeld „x”
|
Gemiddelde waarde en standaardafwijking of bereik voor 5 monsters
|
|
Behandeld „y”
|
Gemiddelde waarde en standaardafwijking of bereik voor 5 monsters
|
|
Behandeld „z”
|
Gemiddelde waarde en standaardafwijking of bereik voor 5 monsters
|
|
Onbehandeld
|
|
|
Variatie van testmethodeparameters
|
bijv. waterkwaliteit, afmetingen van testmonsters, enz.
|
|
Tijd
|
Waterverversing
|
Massa van testmonster
|
Wateropname
|
Watermonster
|
|
Behandeld (gemiddelde)
|
Onbehandeld
|
Behandeld (gemiddelde)
|
Onbehandeld
|
|
Testwater
|
x
|
y
|
z
|
|
|
Datum
|
g
|
g
|
g
|
g
|
nr.
|
pH
|
pH
|
pH
|
pH
|
|
Start
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 u
|
|
|
|
|
|
1
|
|
|
|
|
|
24 u
|
|
|
|
|
|
2
|
|
|
|
|
|
2 d
|
|
|
|
|
|
3
|
|
|
|
|
|
4 d
|
|
|
|
|
|
4
|
|
|
|
|
|
8 d
|
|
|
|
|
|
5
|
|
|
|
|
|
15 d
|
|
|
|
|
|
6
|
|
|
|
|
|
22 d
|
|
|
|
|
|
7
|
|
|
|
|
|
29 d
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
Vul een afzonderlijke tabel in voor ieder actief bestanddeel
|
Tijd
|
Waterverversing
|
Analyseresultaten
|
|
Onbehandelde testmonsters
|
Behandelde testmonsters
|
|
Concentratie actief bestanddeel in water
mg/l
|
Geëmitteerde hoeveelheid
mg/m2
|
Emissiewaarde
mg/m2/d
|
Concentratie actief bestanddeel in water
|
Geëmitteerde hoeveelheid
|
Emissiewaarde
|
|
x
|
y
|
z
|
Gemiddelde
|
x
|
y
|
z
|
Gemiddelde
|
x
|
y
|
z
|
Gemiddelde
|
|
|
Datum
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
|
6 u
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 u
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Toelichting: Aangezien met het onbehandelde monster verkregen resultaten mogelijk moeten worden gebruikt om met het behandelde monster verkregen emissiewaarden te corrigeren, moeten de resultaten van het onbehandelde monster eerst komen en worden alle waarden voor behandelde monsters geacht „gecorrigeerde waarden” te zijn. Er kan ook een correctie voor de initiële wateranalyse zijn.
Aanhangsel 2
Definities
Stof
: een stof of een mengsel.
Teststof
: alle volgens deze testmethode geteste stoffen of mengsels.
C.46. BIOACCUMULATIE IN IN SEDIMENT LEVENDE BENTISCHE OLIGOCHAETAE
INLEIDING
|
1.
|
Deze testmethode is gelijkwaardig aan OESO-testrichtsnoer (TG) 315 (2008). Sediment opnemende endobentische dieren zijn voorwerp van een potentiële blootstelling aan sedimentgebonden stoffen (1). Van deze sediment opnemende dieren spelen de aquatische Oligochaetae een belangrijke rol in de bodems van de aquatische systemen. Ze leven in het sediment en zijn vaak de meest voorkomende soort, met name in habitats met milieuomstandigheden die ongunstig zijn voor andere dieren. Door bioturbatie van het sediment en doordat ze als prooi dienen, kunnen deze dieren een grote invloed hebben op de biologische beschikbaarheid van chemische stoffen voor andere organismen, bijv. bentische vissen. In tegenstelling tot epibentische organismen, graven endobentische aquatische Oligochaetae zich in het sediment in en nemen zij onder het sedimentoppervlak sedimentdeeltjes op. Als gevolg hiervan worden deze organismen blootgesteld aan stoffen via vele opnameroutes, waaronder direct contact, opname van verontreinigde sedimentdeeltjes, poriënwater en bovenstaand water. In aanhangsel 6 zijn een aantal van de momenteel in ecotoxicologische tests gebruikte soorten bentische Oligochaetae beschreven.
|
|
2.
|
De parameters die kenmerkend zijn voor de bioaccumulatie van een teststof zijn in de eerste plaats de bioaccumulatiefactor (BAF), de sedimentopnamesnelheidsconstante (ks) en de eliminatiesnelheidsconstante (ke). In aanhangsel 1 zijn gedetailleerde definities van deze parameters opgenomen.
|
|
3.
|
Voor onderzoek naar het bioaccumulatiepotentieel van stoffen in het algemeen en naar de bioaccumulatie van stoffen met de neiging zich in of over de sedimenten te verdelen, is een compartimentspecifieke test nodig (1)(2)(3)(4).
|
|
4.
|
Deze testmethode is bedoeld om de bioaccumulatie van sedimentgebonden stoffen in endobentische Oligochaetae te beoordelen. Het sediment wordt verrijkt met de teststof. Het gebruik van verrijkt sediment heeft ten doel een verontreinigd sediment te simuleren.
|
|
5.
|
De onderhavige methode is gebaseerd op bestaande methoden voor toxiciteits- en bioaccumulatietests in sedimenten, bijv. (1)(4)(5)(6)(7)(8)(9). Andere nuttige documenten zijn de discussies en resultaten van een internationale workshop (11) en de uitkomsten van een internationale ringtest (12).
|
|
6.
|
Deze test is van toepassing op stabiele, neutrale organische stoffen die een neiging tot hechting aan sedimenten vertonen. Bioaccumulatie van sedimentgebonden, stabiele metallo-organische verbindingen kan eveneens met deze methode worden gemeten (12). De methode is niet toepasbaar op metalen en andere sporenelementen (11) zonder aanpassing van de testopzet met betrekking tot substraat en watervolumes, en mogelijk de omvang van weefselmonsters.
|
VEREISTEN EN INFORMATIE MET BETREKKING TOT DE TESTSTOF
|
7.
|
Er zijn momenteel slechts enkele afdoende bewezen kwantitatieve structuur-activiteitsrelaties (Quantitative Structure-Activity Relationships, QSAR) betreffende bioaccumulatieprocessen beschikbaar (14). De vaakst gebruikte relatie is de correlatie tussen respectievelijk de bioaccumulatie en bioconcentratie van stabiele organische stoffen en hun lipofiliciteit (uitgedrukt als de logaritme van de octanol-waterverdelingscoëfficiënt (log Kow); zie aanhangsel 1 voor een definitie), die ontwikkeld is om de verdeling van een stof tussen water en vis te beschrijven. Correlaties voor het sedimentcompartiment zijn met behulp van deze relatie tevens vastgesteld (15)(16)(17)(18). De correlatie tussen log Kow en log BCF (bioconcentratiefactor) als een belangrijke QSAR kan nuttig zijn voor een eerste voorlopige raming van het bioaccumulatiepotentieel van sedimentgebonden stoffen. De BAF kan echter worden beïnvloed door het vetgehalte van het testorganisme en het gehalte organische koolstof van het sediment. Daarom kan de koolstof-waterverdelingscoëfficiënt (Koc) ook worden gebruikt als een belangrijke bepalende factor voor de bioaccumulatie van sedimentgebonden organische stoffen.
|
|
8.
|
Deze test is van toepassing op:
|
—
|
stabiele, organische stoffen met een log Kow tussen 3,0 en 6,0 (5)(19) alsmede zeer lipofiele stoffen die een log Kow van meer dan 6,0 vertonen (5);
|
|
—
|
stoffen die behoren tot een klasse van organische stoffen waarvan bekend is dat ze kunnen bioaccumuleren in levende organismen, bijv. oppervlakteactieve stoffen of stoffen met een hoog adsorptievermogen (bijv. hoge Koc).
|
|
|
9.
|
Vóór het begin van de studie moet informatie over de teststof worden verzameld, zoals voorzorgsmaatregelen, passende opslagomstandigheden en stabiliteit alsmede de analysemethoden. Richtsnoeren voor het testen van stoffen met zodanige fysisch-chemische eigenschappen dat ze moeilijk te testen zijn, worden gegeven in (20) en (21). Vóór de uitvoering van een bioaccumulatietest met bentische Oligochaetae moet de volgende informatie over de teststof bekend zijn:
|
—
|
de triviale naam, chemische naam (bij voorkeur de IUPAC-naam), structuurformule, CAS-registratienummer, zuiverheid;
|
|
—
|
de oplosbaarheid in water [testmethode A.6 (22) ];
|
|
—
|
de octanol-waterverdelingscoëfficiënt, Kow [testmethoden A.8, A.24 (22)];
|
|
—
|
de sediment-waterverdelingscoëfficiënt, uitgedrukt als Kd of Koc [testmethode C.19 (22)];
|
|
—
|
de hydrolyse [testmethode C.7 (22)];
|
|
—
|
de fototransformatie in water (23);
|
|
—
|
de dampspanning [testmethode A.4 (22)];
|
|
—
|
de gemakkelijke biologische afbreekbaarheid [testmethoden C.4 en C.29 (22)];
|
|
—
|
de oppervlaktespanning [testmethode A.5 (22)];
|
|
—
|
de kritische micelconcentratie (24).
|
Daarnaast is de volgende informatie, indien beschikbaar, relevant:
|
—
|
de biologische afbraak in het aquatische milieu [testmethoden C.24 en C.25 (22)];
|
|
—
|
de constante van de wet van Henry.
|
|
|
10.
|
Radioactief gemerkte teststoffen kunnen de analyse van water-, sediment- en biologische monsters vergemakkelijken en kunnen worden gebruikt om te bepalen of de afbraakproducten moeten worden gekwantificeerd. De hier beschreven methode is gevalideerd in een internationale ringtest (12) voor met 14C gemerkte stoffen. Indien het totaal aan radioactieve residuen wordt gemeten, wordt de bioaccumulatiefactor (BAF) gebaseerd op de oorspronkelijke stof met inbegrip van eventuele retentie van afbraakproducten. Het is ook mogelijk om een metabolismeonderzoek te combineren met een bioaccumulatieonderzoek door middel van de analyse en kwantificering van het percentage van de oorspronkelijke teststof en de afbraakproducten daarvan in monsters die worden genomen aan het einde van de opnamefase of op het piekniveau van bioaccumulatie. In ieder geval wordt aanbevolen de berekening van de BAF te baseren op de concentratie van de oorspronkelijke teststof in de organismen en niet alleen op het totaal aan actieve residuen.
|
|
11.
|
In aanvulling op de kenmerken van de teststof is er informatie nodig over de toxiciteit ervan voor de soort Oligochaetae die in de test wordt gebruikt, zoals een mediane letale concentratie (LC50) voor de voor de opnamefase benodigde tijd, om te waarborgen dat de gekozen blootstellingsconcentraties veel lager zijn dan toxische concentraties. De voorkeur moet worden gegeven aan toxiciteitswaarden die zijn afgeleid uit langetermijnonderzoek naar subletale eindpunten (EC50). Indien dergelijke gegevens niet beschikbaar zijn, kan nuttige informatie worden ontleend aan een test op acute toxiciteit onder omstandigheden die identiek zijn aan die van bioaccumulatietests of aan toxiciteitsgegevens over andere surrogaatsoorten.
|
|
12.
|
Er moet een geschikte analysemethode met een bekende juistheid, precisie en gevoeligheid voor de kwantificering van de chemische stof in de testoplossingen, in het sediment en in het biologische materiaal beschikbaar zijn, alsook nadere gegevens met betrekking tot monsterbereiding en -opslag en veiligheidsinformatiebladen voor materialen. De analytische aantoonbaarheidsgrenzen van de teststof in water, sediment en wormweefsel moeten eveneens bekend zijn. Indien een radioactief gemerkte teststof wordt gebruikt, moeten de specifieke radioactiviteit (d.w.z. Bq mol– 1), de positie van het radioactief gemerkte atoom en het percentage van de met onzuiverheden verbonden radioactiviteit bekend zijn. De specifieke radioactiviteit van de teststof moet zo hoog mogelijk zijn om zo laag mogelijke teststofconcentraties te kunnen aantonen (11).
|
|
13.
|
Er moet informatie beschikbaar zijn over kenmerken van het te gebruiken sediment (bijv. de oorsprong van het sediment of de bestanddelen ervan, de pH-waarde en de ammoniakconcentratie van het poriënwater (veldsedimenten), het gehalte organische koolstof (TOC), de deeltjesgrootteverdeling (percentage zand, silt en klei) en het percentage drooggewicht) (6).
|
PRINCIPE VAN DE TEST
|
14.
|
De test bestaat uit twee fasen: de opnamefase (blootstelling) en de eliminatiefase (na blootstelling). Tijdens de opnamefase worden wormen blootgesteld aan met de teststof verrijkt sediment dat is overgoten met synthetisch water en zo nodig geëquilibreerd (11). Groepen controlewormen worden onder identieke omstandigheden zonder de teststof gehouden.
|
|
15.
|
Voor de eliminatiefase worden de wormen overgebracht naar een sediment-watersysteem dat vrij is van teststof. Een eliminatiefase is nodig om informatie te verkrijgen over de snelheid waarmee de teststof door de testorganismen wordt uitgescheiden (19)(25). Een eliminatiefase is altijd nodig, tenzij opname van de teststof tijdens de blootstellingsfase verwaarloosbaar was (bijv. als er geen statistisch verschil was tussen de concentratie van de teststof in test- en controlewormen). Indien tijdens de opnamefase geen stationaire toestand is bereikt, kan de bepaling van de kinetische parameters — kinetische bioaccumulatiefactor BAFk, opname- en eliminatiesnelheidsconstante(n) — worden gebaseerd op de resultaten van de eliminatiefase. De verandering in de concentratie van de teststof in/op de wormen wordt gedurende beide fasen gemonitord.
|
|
16.
|
Tijdens de opnamefase worden metingen uitgevoerd totdat BAF een plateaufase of stationaire toestand heeft bereikt. De duur van de opnamefase moet standaard 28 dagen zijn. De praktijk heeft uitgewezen dat een opnamefase van 12 tot 14 dagen voldoende is om meerdere stabiele, neutrale organische stoffen een stationaire toestand te laten bereiken (6)(8)(9).
|
|
17.
|
Als de stationaire toestand binnen 28 dagen niet is bereikt, wordt de eliminatiefase gestart door de aan de teststof blootgestelde Oligochaetae over te brengen naar vaten met daarin hetzelfde medium, maar zonder de teststof. De eliminatiefase wordt beëindigd hetzij wanneer een in de wormen gemeten concentratie van 10 % op dag 28 van de opnamefase wordt bereikt, hetzij na een maximale duur van 10 d. De residuconcentratie in de wormen aan het einde van de eliminatiefase wordt gerapporteerd als een aanvullend eindpunt, bijv. als niet-geëlimineerde residuen (NER). De bioaccumulatiefactor (BAFss) wordt bij voorkeur berekend op twee manieren: als de verhouding tussen de concentratie in wormen (Ca) en in het sediment (Cs) bij een kennelijke stationaire toestand, en als een kinetische bioaccumulatiefactor, BAFK, zijnde de verhouding tussen de snelheidsconstante van opname uit het sediment (ks) en de eliminatiesnelheidsconstante (ke), uitgaande van eersteordekinetiek. Indien een stationaire toestand niet wordt bereikt binnen 28 dagen, moet BAFK worden berekend aan de hand van de opnamesnelheids- en eliminatiesnelheidsconstante(n). Zie aanhangsel 2 voor de berekening. Indien eersteordekinetiek niet van toepassing is, moeten complexere modellen worden gebruikt (aanhangsel 2 en referentie (25).
|
|
18.
|
Indien binnen 28 dagen geen stationaire toestand wordt bereikt, kan de opnamefase facultatief worden verlengd door groepen aan de teststof blootgestelde wormen, indien beschikbaar, te onderwerpen aan verdere metingen totdat de stationaire toestand wordt bereikt. Desondanks moet in dat geval de eliminatiefase parallel worden gestart op dag 28 van de opnamefase.
|
|
19.
|
De opnamesnelheidsconstante, de eliminatiesnelheidsconstante (of -constanten, indien complexere modellen gebruikt worden), de kinetische bioaccumulatiefactor (BAFK) en, indien mogelijk, de betrouwbaarheidsgrenzen van elk van deze parameters worden berekend met behulp van gecomputeriseerde modelvergelijkingen (zie aanhangsel 2 voor modellen). De geschiktheid voor regressieanalyse van ieder model dat wordt gebruikt, kan worden bepaald aan de hand van bijvoorbeeld de correlatiecoëfficiënt of de determinatiecoëfficiënt (coëfficiënten die in de buurt van één liggen, duiden op goede geschiktheid).
|
|
20.
|
Ter vermindering van de variabiliteit in de testresultaten voor teststoffen met een hoge lipofiliciteit moeten de bioaccumulatiefactoren aanvullend worden uitgedrukt in verhouding tot het vetgehalte en het gehalte aan organische koolstof (TOC) in het sediment (biota-sedimentaccumulatiefactor (BSAF) in kg sediment TOC kg– 1 vetgehalte van de wormen). Deze aanpak is gebaseerd op ervaringen en theoretische correlaties voor het aquatische compartiment, waarin er voor sommige chemische klassen een duidelijk verband bestaat tussen het bioaccumulatiepotentieel van een stof en de lipofiliciteit ervan; dit is duidelijk vastgesteld voor vissen (14)(25)(27). Er bestaat tevens een verband tussen het vetgehalte van de testvis en de geconstateerde bioaccumulatie van dergelijke stoffen. Voor bentische organismen zijn soortgelijke correlaties gevonden, (15)(16)(17)(18). Indien voldoende wormweefsel beschikbaar is, kan het vetgehalte van de proefdieren op hetzelfde biologische materiaal worden bepaald als het materiaal dat gebruikt is om de concentratie van de teststof te bepalen. Om praktische redenen wordt echter aanbevolen om geacclimatiseerde controledieren minimaal bij de start te gebruiken of, bij voorkeur, aan het einde van de opnamefase om het vetgehalte te meten, dat vervolgens kan worden gebruikt om de BAF-waarden te normaliseren.
|
GELDIGHEID VAN DE TEST
|
21.
|
Een test is uitsluitend onder de volgende voorwaarden geldig:
|
—
|
de cumulatieve mortaliteit van de wormen (controle- en blootgestelde groepen) tot het einde van de test mag niet meer dan 20 % van het oorspronkelijke aantal bedragen;
|
|
—
|
daarnaast moet worden aangetoond dat de wormen zich in het sediment ingraven, wat maximale blootstelling mogelijk maakt. Zie punt 28 voor nadere gegevens.
|
|
BESCHRIJVING VAN DE METHODE
Diersoort
|
22.
|
Diverse soorten aquatische Oligochaetae kunnen voor de test worden gebruikt. De vaakst gebruikte soorten worden vermeld in aanhangsel 6.
|
|
23.
|
Toxiciteitstests (96 uur, uitsluitend in water) moeten op regelmatige basis (bijv. eenmaal per maand) worden uitgevoerd met een toxische referentiestof zoals kaliumchloride (KCl) of kopersulfaat (CuSO4) (1) om de gezondheidstoestand van de proefdieren aan te tonen (1)(6). Indien referentietoxiciteitstests niet op regelmatige basis worden uitgevoerd, moet de totale groep organismen die in een sedimentbioaccumulatietest wordt gebruikt, worden gecontroleerd met gebruikmaking van een toxische referentiestof. Metingen van het vetgehalte kan ook nuttige informatie over de conditie van de dieren geven.
|
Kweken van de testorganismen
|
24.
|
Om te zorgen voor voldoende wormen voor de uitvoering van bioaccumulatietests moeten de wormen mogelijk permanent worden gehouden in een laboratoriumcultuur met één soort. Laboratoriumkweekmethoden voor de gekozen testsoorten worden samengevat in aanhangsel 6. Zie voor nadere gegevens de referenties (8)(9)(10)(18)(28)(29)(30)(31)(32).
|
Apparatuur
|
25.
|
Voor alle onderdelen van de apparatuur moet het gebruik van materialen die teststoffen kunnen oplossen of absorberen of andere stoffen kunnen logen en die een schadelijk effect op de proefdieren hebben, worden vermeden. Er kan gebruik worden gemaakt van rechthoekige of cilindervormige standaardkamers met een passend volume van een chemisch inert materiaal die geschikt zijn voor de densiteit, d.w.z. het aantal testwormen. Het gebruik van zachte kunststof slangen voor het toedienen van water of lucht moet worden vermeden. Voor apparatuur die in contact komt met de testmedia, moet polytetrafluoroethyleen, roestvrij staal en/of glas worden gebruikt. Voor stoffen met een hoge adsorptiecoëfficiënt, zoals synthetische pyretroïden, kan het noodzakelijk zijn gesilaniseerd glas te gebruiken. In deze situaties moet de apparatuur na gebruik als afval worden verwijderd (5). Bij radioactief gemerkte stoffen en bij vluchtige stoffen moet stripping en het ontsnappen van de gestripte stof worden voorkomen. Er moeten afscheiders (bijv. gaswasflessen van glas) met geschikte absorptiemiddelen worden gebruikt om eventuele residuen die uit de testkamers verdampen, op te vangen (11).
|
Water
|
26.
|
Het bovenstaande water moet zodanig zijn dat de testsoort daarin gedurende de acclimatisatie en de looptijd van de test kan overleven zonder dat de specimens een abnormaal aspect of gedrag gaan vertonen. Synthetisch water conform testmethode C.1 (25) wordt aanbevolen om te gebruiken als bovenstaand water en in de laboratoriumculturen van de wormen. Het is aangetoond dat diverse testsoorten in dit water kunnen overleven, groeien en zich kunnen voortplanten (8) en dat er zo wordt gezorgd voor maximale standaardisatie van de test- en kweekomstandigheden. Het water moet worden gekarakteriseerd voor in elk geval de pH-waarde, het geleidende vermogen en de hardheid. Analyse van het water op microverontreinigingen vóór gebruik kan in dit verband nuttige informatie opleveren (aanhangsel 4).
|
|
27.
|
Het water dient gedurende de test een constante kwaliteit te vertonen. Het bovenstaande water moet een pH-waarde tussen 6 en 9 hebben. De totale hardheid moet bij het begin van de test tussen 90 en 400 mg CaCO3 per liter liggen (7). Het pH-bereik en het hardheidsbereik in het voornoemde synthetische water worden gegeven in testmethode C.1 (25). Indien er een interactie tussen de hardheidsionen en de teststof wordt vermoed, moet water met een lagere hardheid worden gebruikt. Aanhangsel 4 geeft een overzicht van aanvullende criteria voor aanvaardbaar verdunningswater overeenkomstig OESO-testrichtsnoer (TG) 210 (34).
|
Sediment
|
28.
|
Het sediment moet van een dusdanige kwaliteit zijn dat de testorganismen kunnen overleven en, bij voorkeur, zich kunnen voortplanten gedurende de acclimatiserings- en testperioden, zonder een abnormaal uiterlijk te hebben of abnormaal gedrag te vertonen. De wormen moeten tunnels in het sediment graven. Graafgedrag kan van invloed zijn op de blootstelling en daardoor ook op de BAF. Daarom moet vermijding van het sediment of het graafgedrag van de testorganismen worden gerapporteerd, voor zover de troebelheid van het bovenstaande water dergelijke waarnemingen toelaat. De wormen (controle- en blootgestelde groepen) moeten zich in het sediment ingraven binnen een periode van 24 uur na toevoeging aan de testvaten. Indien de wormen permanent geen tunnels graven of het sediment blijven vermijden (bijv. meer dan 20 % gedurende meer dan de helft van de opnamefase), duidt dit erop dat de testomstandigheden niet passend zijn of dat de testorganismen niet gezond zijn of dat de concentratie van de teststof dit gedrag veroorzaakt. In een dergelijk geval moet de test worden stopgezet en herhaald onder verbeterde omstandigheden. Aanvullende informatie over opname van sediment kan worden verkregen door de methoden te gebruiken als beschreven in (35) en (36), die sedimentopname of deeltjesselectie in de testorganismen specificeren. Indien dit kan worden waargenomen, moet de aan- of afwezigheid van fecaal materiaal op het sedimentoppervlak, die duiden op opname van sediment door de wormen, worden genoteerd en in overweging worden genomen bij de interpretatie van de testresultaten voor wat betreft de blootstellingsroutes.
|
|
29.
|
Een kunstmatig sediment op basis van de in testmethode C.8 (40) kunstmatige grond wordt aanbevolen voor gebruik in zowel de tests als de laboratoriumculturen van de wormen (aanhangsel 5), aangezien natuurlijke sedimenten van toereikende kwaliteit mogelijk niet gedurende het gehele jaar verkrijgbaar zijn. Daarnaast kunnen inheemse organismen alsook de mogelijke aanwezigheid van microverontreinigingen in natuurlijke sedimenten van invloed zijn op de test. Diverse testsoorten kunnen overleven, groeien en zich voortplanten in het kunstmatige sediment (8).
|
|
30.
|
Het kunstmatige sediment moet worden gekarakteriseerd met ten minste de oorsprong van de bestanddelen, de deeltjesgrootteverdeling (percentage zand, silt en klei), het gehalte aan organische koolstof (TOC), het watergehalte en de pH. Meting van het redoxpotentiaal is facultatief. Natuurlijke sedimenten van niet-verontreinigde terreinen kunnen echter ook als test- en/of kweeksediment dienen (1). Natuurlijke sedimenten moeten worden gekarakteriseerd met ten minste de oorsprong (plaats van verzameling), pH en ammoniakgehalte van het poriënwater, gehalte aan organische koolstof (TOC), deeltjesgrootteverdeling (percentage zand, silt en klei) en het procentuele watergehalte (6). Aanbevolen wordt het natuurlijke sediment, voordat het wordt verrijkt met de teststof, zeven dagen te laten rusten onder dezelfde omstandigheden die ook in de test zullen heersen, indien ammoniakontwikkeling wordt verwacht. Aan het eind van deze conditioneringsperiode moet het bovenstaande water worden verwijderd en weggegooid. Analyse van het sediment of de bestanddelen ervan op microverontreinigingen vóór gebruik kan in dit verband nuttige informatie opleveren.
|
Voorbereiding
|
31.
|
De bewerking van natuurlijke sedimenten vóór het gebruik ervan in het laboratorium is beschreven in (1)(6)(44). De bereiding van het kunstmatige sediment wordt beschreven in aanhangsel 5.
|
Opslag
|
32.
|
Natuurlijke sedimenten moeten zo kort mogelijk in het laboratorium worden opgeslagen. U.S. EPA (6) beveelt een maximale opslagperiode van 8 weken aan, in het donker bij 4 ± 2 °C. In de opslagvaten mag boven het sediment geen gasruimte zijn. Aanbevelingen voor de opslag van kunstmatig sediment worden gegeven in aanhangsel 5.
|
Het aanbrengen van de teststof
|
33.
|
Het sediment wordt verrijkt met de teststof. De verrijkingsprocedure houdt in dat op een of meer bestanddelen een laag teststof wordt aangebracht. Zo kan het kwartszand, of een deel ervan (bijv. 10 g kwartszand per testvat) worden doordrenkt met een oplossing van de teststof in een geschikt oplosmiddel, dat vervolgens langzaam wordt ingedampt. Vervolgens kan het met een laag van de teststof bedekte deel met het vochtige sediment worden gemengd. Bij de bereiding van het sediment moet rekening worden gehouden met de hoeveelheid zand die in het mengsel van teststof en zand aanwezig is (het sediment wordt dus met minder zand bereid) (6).
|
|
34.
|
In geval van een natuurlijk sediment kan de teststof worden toegevoegd door een gedroogd deel van het sediment te verrijken op de wijze zoals hierboven voor het kunstmatige sediment is beschreven, of door de teststof door het vochtige sediment te roeren, met daarna verdamping indien een solubilisator is gebruikt. Geschikte oplosmiddelen voor het verrijken van vochtig sediment zijn ethanol, methanol, ethyleenglycol-monomethylether, ethyleenglycol-dimethylether, demithylformamide en triëthyleenglycol (5)(34). De toxiciteit en vluchtigheid van het oplosmiddel alsmede de oplosbaarheid van de teststof in het gekozen oplosmiddel moeten de voornaamste criteria zijn op basis waarvan een geschikte solubilisator wordt gekozen. Aanvullende richtsnoeren voor verrijkingsprocedures worden gegeven in Environment Canada (1995)(41). De aan het sediment toegevoegde teststof moet zorgvuldig en gelijkmatig over het sediment worden verdeeld. Deelsteekproeven in duplo van het verrijkte sediment moeten worden geanalyseerd om de concentraties van de teststof in het sediment te controleren en om de mate van homogeniteit van de teststofverdeling te bepalen.
|
|
35.
|
Nadat het verrijkte sediment met bovenstaand water is bereid, is het wenselijk de teststof zich te laten verdelen tussen het sediment en de waterfase. Dit moet bij voorkeur gebeuren onder de in de test heersende temperatuur- en beluchtingsomstandigheden. De tijd die nodig is voor equilibratie, hangt af van het sediment en de stoffen en kan variëren van enkele uren tot verscheidene dagen en soms zelfs weken (4-5 weken) (28)(42). In deze test wordt niet gewacht tot een evenwicht is ontstaan, maar wordt een equilibratieperiode van 48 uur tot 7 dagen aanbevolen. Afhankelijk van het doel van de studie, bijvoorbeeld wanneer milieuomstandigheden moeten worden nagebootst, kan het verrijkte sediment gedurende een langere periode geëquilibreerd of „gerijpt” worden (11).
|
UITVOERING VAN DE TEST
Inleidende test
|
36.
|
Het verdient aanbeveling een verkennende proef uit te voeren om de testomstandigheden bij de definitieve test (bijvoorbeeld teststofconcentraties, duur van de opname- en de eliminatiefase) te optimaliseren. Het gedrag van wormen, bijvoorbeeld vermijding van sediment, waarbij wormen uit het sediment ontsnappen, hetgeen door de teststof en/of het sediment zelf kan worden veroorzaakt, moet in een inleidende test worden geobserveerd en geregistreerd. Vermijding van sediment kan ook worden gebruikt als een subletale parameter in een inleidende test voor het ramen van de in een bioaccumulatietest te gebruiken teststofconcentratie(s).
|
Blootstellingsomstandigheden
Duur van de opnamefase
|
37.
|
De testorganismen worden tijdens de opnamefase aan de teststof blootgesteld. Het eerste monster moet 4 tot 24 uur na het begin van de opnamefase worden genomen. De opnamefase dient maximaal 28 dagen te duren (1)(6)(11), tenzij kan worden aangetoond dat reeds eerder een evenwicht wordt bereikt. De stationaire toestand treedt op, wanneer: (i) de bioaccumulatiefactoren bij iedere bemonsteringsperiode, in een grafiek uitgezet tegen de tijd, evenwijdig gaan lopen aan de tijdas; (ii) drie opeenvolgende analysen van BAF van monsters die zijn genomen met tussenpozen van ten minste twee dagen een variatie van niet meer dan ± 20 % ten opzichte van elkaar vertonen; en (iii) er geen significante verschillen zijn tussen de drie bemonsteringsperioden (op basis van statistische vergelijkingen, bijv. analyse van variatie en regressieanalyse). Indien de stationaire toestand na 28 dagen niet is bereikt, kan de opnamefase worden beëindigd door de eliminatiefase te starten, waarbij de BAFK kan worden berekend aan de hand van de opname- en eliminatiesnelheidsconstanten (zie ook de punten 16 tot en met 18).
|
Duur van de eliminatiefase
|
38.
|
Het eerste monster moet 4 tot 24 uur na het begin van de eliminatiefase worden genomen, aangezien zich in de beginperiode snelle veranderingen in weefselresidu kunnen voordoen. Aanbevolen wordt om de eliminatiefase te beëindigen, hetzij wanneer de concentratie van de teststof minder dan 10 % van de concentratie in stationaire toestand is hetzij na een maximale duur van 10 dagen. De residuconcentratie in de wormen aan het einde van de eliminatiefase wordt gerapporteerd als een secundair eindpunt. De duur van de fase kan echter afhankelijk zijn van de tijd gedurende welke de concentratie van de teststof in de wormen boven de analytische aantoonbaarheidsgrens blijft.
|
Testorganismen
Aantal testwormen
|
39.
|
Het aantal wormen per monster moet een dusdanige massa wormweefsel opleveren dat de massa van de teststof per monster aan respectievelijk het begin van de opnamefase en het einde van de eliminatiefase significant hoger is dan de detectiegrens voor de teststof in biologisch materiaal. In de voornoemde fasen van de opname- en eliminatiefasen is de concentratie in de proefdieren gewoonlijk relatief laag (6)(8)(18). Aangezien het individuele gewicht bij vele soorten aquatische Oligochaetae zeer laag is (5-10 mg natgewicht per individueel dier voor Lumbriculus variegatus en Tubifex tubifex), kunnen de wormen van een duplotestkamer in een groep worden gebundeld voor het bepalen van het gewicht en de analyse van de teststof. Voor testsoorten met een hoger individueel gewicht (bijv. Branchiura sowerbyi) kunnen duplo's met één individueel dier worden gebruikt, maar in dergelijke gevallen moet het aantal duplo's worden verhoogd tot vijf per bemonsteringspunt (11). Opgemerkt zij echter dat B. sowerbyi geen deel uitmaakte van de ringtest (12) en daarom niet wordt aanbevolen als een soort die bij voorkeur binnen deze methode moet worden gebruikt.
|
|
40.
|
Er moeten wormen van vergelijkbare grootte worden geselecteerd (zie aanhangsel 6 voor L. variegatus). Ze moeten afkomstig zijn van dezelfde bron en het moeten volwassen of grote dieren van dezelfde leeftijdsklasse zijn (zie aanhangsel 6). Het gewicht en de leeftijd van een dier kunnen een significant effect hebben op de BAF-waarden (bijv. vanwege een verschillend vetgehalte en/of de aanwezigheid van eitjes); deze parameters moeten nauwkeurig gerapporteerd worden. Vóór het begin van de test moet een deelsteekproef van wormen worden gewogen om een schatting van het gemiddelde nat- en drooggewicht te verkrijgen.
|
|
41.
|
Van Tubifex tubifex en Lumbriculus variegatus wordt verwacht dat ze zich tijdens de testperiode voortplanten. Het uitblijven van voortplanting in een bioaccumulatietest moet worden gerapporteerd en in aanmerking worden genomen bij de interpretatie van de testresultaten.
|
Densiteit
|
42.
|
Er moet gebruik worden gemaakt van hoge sediment-worm- en water-wormverhoudingen om de verlaging van de teststofconcentratie in het sediment tijdens de opnamefase tot een minimum te beperken en om vermindering van de opgeloste-zuurstofconcentratie te voorkomen. De gekozen densiteit moet ook overeenkomen met de in de natuur voorkomende populatiedichtheid van de gekozen soort (43). Voor Tubifex tubifex bijvoorbeeld wordt een densiteit van 1-4 mg wormweefsel (natgewicht) per gram vochtig sediment aanbevolen (8)(11). In de referenties (1) en (6) wordt voor L. variegatus een densiteit aanbevolen van ≤ 1 g drooggewicht wormweefsel per 50 g organische koolstof in het sediment.
|
|
43.
|
De in een test te gebruiken wormen worden uit de cultuur verwijderd door het sediment van de cultuur te zeven. De dieren (volwassen of grote wormen zonder tekenen van recente fragmentatie) worden overgebracht naar glazen schalen (bijv. petrischalen) met schoon water. Als de testomstandigheden verschillen van de cultuuromstandigheden, moet een acclimatiseringsfase van 24 uur volstaan. Voordat de wormen worden gewogen, moet aanhangend water van de wormen worden verwijderd. Dit kan worden gedaan door de wormen voorzichtig op een vooraf bevochtigde papieren tissue te plaatsen. Het gebruik van absorberend papier wordt voor dit doel niet aanbevolen, aangezien dit stress voor of beschadiging van de wormen kan veroorzaken. Brunson et al. (1998) hebben het gebruik van niet-drooggedepte wormen van ongeveer 1,33 maal de gewenste biomassa aanbevolen. Deze extra 33 % komt overeen met het verschil tussen drooggedepte en niet-drooggedepte wormen (28).
|
|
44.
|
Bij het begin van de opnamefase (dag 0 van de test) worden de testorganismen uit de acclimatiseringskamer verwijderd en steekproefsgewijs verdeeld over schalen (bijv. petrischalen) met daarin synthetisch water door aan iedere schaal groepen van twee wormen toe te voegen, totdat elke schaal tien wormen bevat. Elk van deze groepen wormen worden vervolgens steekproefsgewijs verdeeld naar afzonderlijke testvaten, bijv. met behulp van een zacht stalen tangetje. De testvaten worden vervolgens onder testomstandigheden geïncubeerd.
|
Voeding
|
45.
|
Gezien het lage gehalte aan nutriënten van het kunstmatige sediment moet aan het sediment een voedselbron worden toegevoegd. Om de blootstelling van de testorganismen niet te onderschatten, bijv. door selectief niet-verontreinigd voedsel toe te dienen, moet het voedsel dat nodig is voor de voortplanting en groei van de testorganismen eenmaal aan het sediment worden toegevoegd vóór of tijdens de aanbrenging van de teststof (zie aanhangsel 5).
|
Sediment-waterverhouding
|
46.
|
De aanbevolen sediment-waterverhouding is 1:4 (45). Deze verhouding wordt verondersteld geschikt te zijn om de juiste zuurstofconcentraties te handhaven en het ontstaan van ammoniak in het bovenstaande water te voorkomen. Het zuurstofgehalte in het bovenstaande water moet worden gehandhaafd op een verzadigingsniveau van ≥ 40 %. Het bovenstaande water van de testvaten moet voorzichtig worden belucht (bijv. 2-4 bellen per seconde) via een pasteurpipet dat ongeveer 2 cm boven het sedimentoppervlak is geplaatst, om perturbatie van het sediment zo veel mogelijk te beperken.
|
Licht en temperatuur
|
47.
|
De fotoperiode in de cultuur en de test duurt doorgaans 16 uur (1)(6). De lichtintensiteit in de testomgeving moet op een niveau van ongeveer 500-1 000 lux worden gehouden. De temperatuur moet gedurende de gehele test 20 ± 2 °C zijn.
|
Testconcentraties
|
48.
|
Eén testconcentratie (zo laag mogelijk) wordt gebruikt voor de bepaling van de opnamekinetiek, maar een tweede (hogere) concentratie kan worden gebruikt (bijv. (46)). In dat geval worden monsters genomen en geanalyseerd wanneer ze de stationaire toestand hebben bereikt of na 28 d om de bij de lagere concentratie gemeten BAF te bevestigen (11). De hogere concentratie moet zo worden gekozen dat nadelige effecten kunnen worden uitgesloten (bijv. door ongeveer 1 % te kiezen van de laagste bekende concentratie met een chronisch effect, ECx, op basis van relevante onderzoeken naar chronische toxiciteit). De lagere testconcentratie moet significant hoger zijn dan de detectiegrens in sediment- en biologische monsters voor de gebruikte analysemethode. Indien de effectconcentratie van de teststof dicht bij de analytische aantoonbaarheidsgrens ligt, verdient het aanbeveling om een radioactief gemerkte teststof met een hoge specifieke radioactiviteit te gebruiken.
|
Met teststof behandelde duplo's en controleduplo's
|
49.
|
Het minimumaantal behandelde duplo's voor kinetische metingen moet drie per bemonsteringspunt zijn (11) gedurende de opname- en eliminatiefase. Aanvullende duplo's moeten worden gebruikt voor bijvoorbeeld facultatieve aanvullende bemonsteringsdagen. Voor de eliminatiefase wordt een overeenkomstig aantal duplo's bereid met niet-verrijkt sediment en bovenstaand water, zodat de behandelde wormen kunnen worden overgebracht van de behandelde vaten naar niet-behandelde vaten aan het einde van de opnamefase. Het totale aantal behandelde duplo's moet voldoende zijn voor zowel de opname- als de eliminatiefase.
|
|
50.
|
In plaats daarvan kunnen de wormen die zijn geselecteerd voor bemonstering tijdens de eliminatiefase in één groot vat worden blootgesteld aan verrijkt sediment van dezelfde batch als die is gebruikt voor de opnamekinetiek. Aangetoond moet worden dat de testomstandigheden (bijv.sedimentdiepte, sediment-waterverhouding, densiteit, temperatuur, waterkwaliteit) vergelijkbaar zijn met de duplo's die zijn geselecteerd voor de opnamefase. Aan het einde van de opnamefase moeten water-, sediment- en wormmonsters uit dit vat worden genomen voor analyse en een voldoende aantal grote wormen die geen tekenen van recente fragmentatie vertonen, moeten voorzichtig worden verwijderd en overgebracht naar de duplovaten die voor de eliminatiefase zijn bereid (bijv. tien organismen per duplovat).
|
|
51.
|
Indien geen ander oplosmiddel dan water wordt gebruikt, moeten ten minste 9 duplo's van een negatieve controle (ten minste 3 die zijn bemonsterd bij het begin, 3 aan het eind van de opnamefase en 3 aan het eind van de eliminatiefase) beschikbaar zijn voor biologische en achtergrondconcentratieanalyse. Indien een solubilisator wordt gebruikt om de teststof aan te brengen, moet een oplosmiddelcontrole worden uitgevoerd (3 duplo's moeten aan het begin worden bemonsterd, 3 aan het eind aan de opnamefase en 3 aan het eind van de eliminatiefase). In dat geval moeten ten minste 4 duplo's van een negatieve controle (geen oplosmiddel) beschikbaar zijn voor monstername aan het eind van de opnamefase. Deze duplo's kunnen biologisch worden vergeleken met de oplosmiddelcontrolegroep om informatie te verkrijgen over een mogelijk effect van het oplosmiddel op de testorganismen. Zie aanhangsel 3 voor nadere gegevens.
|
Frequentie van de metingen van de waterkwaliteit
|
52.
|
Tijdens de opname- en eliminatiefase moeten ten minste de volgende waterkwaliteitsparameters worden gemeten in het bovenstaande water:
|
temperatuur
|
in één vat van elk behandelingsniveau op elke bemonsteringsdag, en in één controlevat eenmaal per week en aan het begin en eind van de opname- en eliminatieperiode; de temperatuur in het omringende medium (omgevingslucht of waterbad) of in één representatief testvat kan ook worden gerapporteerd, bijv. als continumeting of met tussenpozen van een uur;
|
|
gehalte opgeloste zuurstof
|
in één vat van elk behandelingsniveau, en in één controlevat op elke bemonsteringsdag; uitgedrukt als mg/L en % verzadigingswaarde van lucht;
|
|
luchttoevoer
|
ten minste eenmaal per dag (werkdagen) controleren en indien nodig aanpassen;
|
|
pH
|
in één behandeld vat van elk behandelingsniveau op elke bemonsteringsdag, en in één controlevat eenmaal per week en aan het begin en eind van de opname- en eliminatieperiode;
|
|
totale hardheid van het water
|
ten minste in één behandeld vat en één controlevat aan het begin en eind van de opname- en eliminatieperiode, uitgedrukt als mg/l CaCO3;
|
|
totaal gehalte ammoniak
|
ten minste in één behandeld vat en één controlevat aan het begin en eind van de opname- en eliminatieperiode; uitgedrukt als mg/l NH4
+ of NH3 of totaal ammoniak-N.
|
|
Bemonstering en analyse van wormen, sediment en water
Bemonsteringsschema
|
53.
|
Voorbeelden van bemonsteringsschema's voor een opnamefase van 28 dagen en een eliminatiefase van 10 dagen zijn opgenomen in aanhangsel 3.
|
|
54.
|
Het water en het sediment in de testkamers worden bemonsterd om de concentratie teststof vóór toevoeging van de wormen en tijdens zowel de opname- als de eliminatiefase te bepalen. Tijdens de test worden de concentraties van de teststof in de wormen, het sediment en het water bepaald om de verdeling van de teststof tussen de compartimenten van het teststof te volgen.
|
|
55.
|
De wormen, het sediment en het water moeten ten minste zes maal worden bemonsterd tijdens zowel de opname- als de eliminatiefase.
|
|
56.
|
Ga verder met monsternemingen, totdat een plateaufase (stationaire toestand) is vastgesteld (zie aanhangsel 1) of gedurende 28 dagen. Indien binnen 28 dagen geen plateaufase wordt bereikt, wordt er begonnen met de eliminatiefase. Wanneer met de eliminatiefase wordt begonnen, moeten de daarvoor gekozen wormen worden overgebracht naar duplokamers met daarin onbehandeld sediment en water (zie ook de punten 17 en 18).
|
Bemonstering en monsterbereiding
|
57.
|
Verzamel watermonsters door een hoeveelheid water die voldoende is voor het meten van de hoeveelheid teststof in het monster te decanteren, overhevelen of pipetteren.
|
|
58.
|
Het resterende bovenstaande water wordt zorgvuldig uit de testkamer(s) gedecanteerd of overgeheveld. Sedimentmonsters moeten voorzichtig worden genomen, waarbij de wormen zo min mogelijk worden verstoord.
|
|
59.
|
Verwijder op het moment van monstername alle wormen uit de testduplo, bijv. door het sediment te suspenderen met bovenstaand water en de inhoud van iedere duplo op een ondiepe schaal uit te spreiden, waarna de wormen met een zacht stalen tangetje kunnen worden opgepakt. Spoel ze snel af met water in een ondiepe glazen of stalen schaal. Verwijder het aanhangende water. Breng de wormen voorzichtig over naar een van tevoren gewogen bak en weeg ze. De wormen worden geëuthanaseerd door middel van bevriezing (bijv. ≤ – 18 °C). De aanwezigheid van en het aantal cocons en/of nakomelingen moeten worden gerapporteerd.
|
|
60.
|
Over het algemeen moeten de wormen worden gewogen en geëuthanaseerd onmiddellijk na de monstername zonder een darmontlastingsfase om een conservatieve BAF te verkrijgen die ook betrekking heeft op verontreinigde darminhoud en om verlies van in het lichaam aanwezige residuen tijdens een darmontlastingsfase in alleen water te voorkomen (8). Van stoffen met een log Kow van meer dan 5 wordt niet verwacht dat ze in significante mate worden verwijderd tijdens een darmontlastingsfase in alleen water, terwijl stoffen met een log Kow van minder dan 4 in aanzienlijke hoeveelheden verloren kunnen gaan (47).
|
|
61.
|
Tijdens de eliminatiefase ontlasten de wormen hun darmen in schoon sediment. Dit betekent dat metingen onmiddellijk vóór de eliminatiefase ook betrekking hebben op verontreinigde darminhoud, terwijl aangenomen wordt dat het grootste deel van de verontreinigde darminhoud na de initiële 4 tot 24 uur van de eliminatiefase wordt vervangen door schoon sediment (11)(47). De concentratie in de wormen van dit monster kunnen in dat geval worden beschouwd als de weefselconcentratie na ontlasting van de darm. Om rekening te houden met de verdunning van de teststofconcentratie door opname van niet-verontreinigd sediment tijdens de eliminatiefase, kan het gewicht van de darminhoud worden geschat op basis van de verhouding natgewicht/asgewicht van de worm of de verhouding drooggewicht/asgewicht van de worm.
|
|
62.
|
Indien het doel van een specifiek onderzoek is om de biobeschikbaarheid en werkelijke residuen in het weefsel van testorganismen te meten, moet ten minste een deelsteekproef van behandelde dieren (bijv. uit drie aanvullende duplovaten), bij voorkeur bemonsterd tijdens de stationaire toestand, worden gewogen, in schoon water worden gehouden gedurende 6 uur om de wormen hun darmen te laten ontlasten (47) en vóór analyse opnieuw gewogen. Gegevens met betrekking tot het wormgewicht en de lichaamsconcentratie van deze deelsteekproef kunnen vervolgens worden vergeleken met waarden die zijn verkregen met wormen die hun darmen niet hebben ontlast. De wormen die zijn gekozen voor de eliminatiemeting mogen niet aan een darmontlastingsfase worden onderworpen alvorens ze naar schoon sediment worden overgebracht, om de dieren aan zo min mogelijk stress bloot te stellen.
|
|
63.
|
De water-, sediment- en wormmonsters moeten bij voorkeur onmiddellijk na verwijdering (d.w.z. binnen 1-2 dagen) worden geanalyseerd om ontbinding of andere verliezen te voorkomen en de opname- en eliminatiesnelheden moeten bij benadering worden berekend naarmate de test vordert. Indien de analyse meteen wordt uitgevoerd, wordt ook vermeden dat te veel tijd voorbijgaat alvorens het bereiken van het plateau wordt geconstateerd.
|
|
64.
|
Als de monsters niet onmiddellijk worden geanalyseerd, moeten ze onder passende omstandigheden worden bewaard. Verzamel vóór aanvang van het onderzoek informatie over de stabiliteit en juiste opslagomstandigheden voor de betreffende teststof (bijv. opslagduur en -temperatuur, extractieprocedures, enz.). Indien dergelijke informatie niet beschikbaar is, kunnen met teststof verrijkte monsters aan een controletest worden onderworpen om de opslagstabiliteit te bepalen.
|
Kwaliteit van de analysemethode
|
65.
|
Aangezien de nauwkeurigheid, de precisie en de gevoeligheid van de analysemethode ten aanzien van de teststof bepalend zijn voor de kwaliteit van de hele procedure, moet experimenteel worden gecontroleerd of de precisie en de reproduceerbaarheid van de chemische analyse alsmede de recovery van de teststof in de water-, sediment- en wormmonsters bevredigend zijn voor de gekozen methode. Controleer ook of de teststof niet detecteerbaar is in de controlekamers in hogere concentraties dan de achtergrondconcentratie. Corrigeer zo nodig de waarden van Cw, Cs en Ca voor de recovery- en achtergrondwaarden van controles. Hanteer alle monsters tijdens de gehele test zodanig dat verontreiniging en verlies (bijv. als gevolg van adsorptie van de teststof aan het bemonsteringsapparaat) tot een minimum worden beperkt.
|
|
66.
|
De totale recovery en de teststofrecovery in wormen, sediment, water en, indien gebruikt, in afscheiders met absorptiemiddelen om verdampte teststof op te vangen, moeten worden geregistreerd en gerapporteerd.
|
|
67.
|
Aangezien het gebruik van radioactief gemerkte stoffen wordt aanbevolen, is het mogelijk om te analyseren op totale radioactiviteit (d.w.z. de oorspronkelijke teststof en afbraakproducten). Voor zover dit haalbaar is in de analyse, kan de kwantificering van de oorspronkelijke teststof en de afbraakproducten in stationaire toestand of aan het eind van de opnamefase echter ook belangrijke informatie opleveren. Als het de bedoeling is om dergelijke metingen te verrichten, moeten de monsters vervolgens worden onderworpen aan geschikte extractieprocedures, zodat de oorspronkelijke stof apart kan worden gekwantificeerd. Ingeval een gedetecteerd omzettingsproduct een significant percentage (bijv. > 10 %) vertegenwoordigt van de radioactief die is gemeten in de testorganismen in stationaire toestand of aan het eind van de opnamefase, wordt aanbevolen dergelijke afbraakproducten te identificeren (5).
|
|
68.
|
Vanwege de geringe individuele biomassa is het vaak niet mogelijk om de teststofconcentratie in elke individuele worm te bepalen, tenzij Branchiura sowerbyi (40-50 mg natgewicht per worm) als testsoort wordt gebruikt (11). Daarom is het toegestaan om bemonsterde individuele wormen uit een bepaald testvat in in een groep te bundelen, hoewel dit een beperking vormt voor de statistische procedures die op de gegevens toegepast kunnen worden. Indien een specifieke statistische procedure en statische kracht belangrijke overwegingen zijn, moet de test een toereikend aantal proefdieren en/of duplotestkamers omvatten om het gewenste bundelen van wormen in groepen en de gewenste statische procedure en kracht mogelijk te maken.
|
|
69.
|
Het verdient aanbeveling om de BAF uit te drukken als functie van het totale natgewicht, van het totale drooggewicht en, indien nodig (bijv. voor zeer lipofiele stoffen), als functie van het vetgehalte en TOC van het sediment. Voor de bepaling van het vetgehalte moeten geschikte methoden worden gebruikt (48)(49). De extractietechniek met chloroform/methanol (50) kan als standaardmethode worden aanbevolen (48). Om het gebruik van gechloreerde oplosmiddelen te vermijden, kan echter een aangepaste versie van de methode van Bligh en Dyer (50), als beschreven in (51), worden gebruikt. Aangezien de verschillende methoden verschillende resultaten opleveren (48), is het van belang dat bijzonderheden over de gebruikte methode worden verstrekt. De meting van het vetgehalte wordt, indien mogelijk, d.w.z. als voldoende wormweefsel voorhanden is, uitgevoerd op hetzelfde monster of extract als voor de analyse van de teststof wordt gebruikt — de vetten moeten immers meestal toch worden verwijderd alvorens het extract door middel van chromatografie kan worden geanalyseerd (5). Om praktische redenen wordt echter aanbevolen om geacclimatiseerde controledieren minimaal bij de start te gebruiken of, bij voorkeur, aan het einde van de opnamefase om het vetgehalte te meten, bijv. in drie monsters.
|
GEGEVENS EN RAPPORTAGE
Bewerking van de resultaten
|
70.
|
De opnamecurve van de teststof wordt verkregen door de teststofconcentratie in/op de wormen tijdens de opnamefase uit te zetten tegen de tijd in een lineair coördinatenstelsel. Indien de curve een plateau heeft bereikt, wordt de BAFss in stationaire toestand gemeten:

|
|
71.
|
De kinetische bioaccumulatiefactor (BAFK) wordt bepaald als de verhouding ks/ke. De eliminatiesnelheidsconstante (ke) wordt gewoonlijk bepaald op basis van de eliminatiecurve (d.w.z. de uitgezette concentratie van de teststof in de wormen tijdens de eliminatiefase). De opnamesnelheidsconstante (ks) wordt vervolgens berekend aan de hand van de opnamecurvekinetiek. Het verdient de voorkeur BAFK en de snelheidsconstanten ks en ke te berekenen met behulp van een gecomputeriseerde niet-lineaire parameterschattingstechniek (zie aanhangsel 2). Als de eliminatie duidelijk niet van de eerste orde is, moeten complexere modellen worden toegepast (25)(27)(52).
|
|
72.
|
De biota-sedimentaccumulatiefactor (BSAF) wordt bepaald door de BAFK te normaliseren voor het vetgehalte van de wormen en het totale koolstofgehalte in het sediment.
|
Interpretatie van resultaten
|
73.
|
De resultaten moeten met de nodige omzichtigheid worden geïnterpreteerd als de gemeten concentraties van de teststofconcentraties in de buurt liggen van de detectiegrens van de gebruikte analysemethode.
|
|
74.
|
Bioaccumulatiegegevens van goede kwaliteit resulteren in scherp afgetekende opname- en eliminatiecurven. De betrouwbaarheidsgrenzen voor de BAF-waarden van onderzoeken met een goede testopzet mogen niet hoger zijn dan 25 % (5).
|
Testverslag
|
75.
|
In het testverslag moet de volgende informatie worden opgenomen:
|
|
Teststof
|
—
|
fysieke aard en fysisch-chemische eigenschappen, bijv. log Kow, oplosbaarheid in water;
|
|
—
|
chemische identificatiegegevens, bron van de teststof, identiteit en concentratie van eventueel gebruikte oplosmiddelen;
|
|
—
|
indien radioactief gemerkt, de precieze positie van de gemerkte atomen, de specifieke radioactiviteit en de procentuele radioactiviteit die in verband wordt gebracht met onzuiverheden.
|
|
|
|
Diersoort
|
—
|
wetenschappelijke naam, stam, oorsprong, eventuele voorafgaande behandeling, acclimatisatie, leeftijd, grootte-interval enz.
|
|
|
|
Testomstandigheden
|
—
|
gebruikte testprocedure (bijv. statisch, semistatisch of doorstroom);
|
|
—
|
aard en kenmerken van de gebruikte verlichting en de fotoperiode(s);
|
|
—
|
testopzet (bijv. aantal, materiaal en grootte van de testkamers, watervolume, sedimentmassa en -volume, verversingssnelheid van het water (voor doorstroom- of semistatische procedures), gebruikte beluchting vóór en tijdens de test, aantal duplo's, aantal wormen per duplo, aantal testconcentraties, duur van de opname- en eliminatiefasen, frequentie van de bemonstering);
|
|
—
|
methode voor het bereiden en aanbrengen van de teststof en de redenen voor het kiezen van een specifieke methode;
|
|
—
|
de nominale testconcentraties;
|
|
—
|
bron van de bestanddelen van de kunstmatige grond of — bij gebruik van natuurlijke media — oorsprong van de grond, beschrijving van eventuele voorbehandeling, resultaten van eventuele proeven om aan te tonen dat de proefdieren kunnen leven en/of zich kunnen voortplanten in het gebruikte medium, sedimentkenmerken (pH en ammoniakgehalte van het poriënwater (natuurlijke sedimenten), totale gehalte aan organische koolstof (TOC), deeltjesgrootteverdeling (percentage zand, silt en klei), procentuele watergehalte en eventuele andere verrichte metingen) alsmede waterkenmerken (pH, hardheid, geleidend vermogen, temperatuur, gehalte opgeloste zuurstof, chloorresiduen (indien gemeten) en eventuele andere verrichte metingen);
|
|
—
|
het nominale en gemeten drooggewicht in % van het natgewicht (of de verhouding tussen drooggewicht en natgewicht) van het kunstmatige sediment; het gemeten drooggewicht in % van het natgewicht (of de verhouding tussen drooggewicht en natgewicht) van veldsedimenten;
|
|
—
|
waterkwaliteit binnen de testkamers, gekarakteriseerd aan de hand van de temperatuur, pH, totale hardheid en concentratie opgeloste koolstof;
|
|
—
|
gedetailleerde informatie over de verwerking van water-, sediment- en wormmonsters, met inbegrip van details van de bereiding, opslag, verrijkingsprocedures, extractie en analyseprocedures (en -precisie) voor de teststof en het vetgehalte en de recovery van de teststof.
|
|
|
|
Resultaten
|
—
|
mortaliteit van de controlewormen en de wormen in elke testkamer alsmede eventueel waargenomen subletale effecten met inbegrip van abnormaal gedrag (bijv. vermijding van het sediment, aanwezigheid of afwezigheid van fecaal materiaal, uitblijven van voortplanting);
|
|
—
|
het gemeten drooggewicht in % van het natgewicht (of de verhouding tussen drooggewicht en natgewicht) van het sediment en de testorganismen (nuttig voor normalisatie);
|
|
—
|
het vetgehalte van de wormen;
|
|
—
|
grafieken van de opname- en eliminatiekinetiek van de teststof in de wormen en van de tijd tot de stationaire toestand;
|
|
—
|
Ca, Cs en Cw (met standaardafwijking en bereik, indien van toepassing) voor alle bemonsteringstijdstippen (Ca uitgedrukt in g kg– 1 nat- en drooggewicht van het hele lichaam, Cs uitgedrukt in g kg– 1 nat- en drooggewicht van het sediment en Cw in mg l– 1). Indien een biota-sedimentaccumulatiefactor (BSAF; zie aanhangsel 1 voor een definitie) nodig is (bijv. om de resultaten van twee of meer tests die met dieren met een ander vetgehalte zijn uitgevoerd, te kunnen vergelijken), moet Ca aanvullend worden uitgedrukt in g kg– 1 vetgehalte van het organisme en moet Cs worden uitgedrukt in g kg– 1 organische koolstof (OC) van het sediment;
|
|
—
|
BAF (uitgedrukt in kg vochtig sediment·kg– 1 natgewicht worm), de sedimentopnamesnelheidsconstante ks (uitgedrukt in g vochtig sediment· kg– 1 van natgewicht worm d– 1) en de eliminatiesnelheidsconstante ke (uitgedrukt in d– 1); BSAF (uitgedrukt in kg OC in het sediment kg– 1 vetgehalte van de worm) kan aanvullend worden gerapporteerd;
|
|
—
|
niet-geëlimineerde residuen (NER) aan het eind van de eliminatiefase;
|
|
—
|
indien gemeten: percentages van de oorspronkelijke stof, afbraakproducten en gebonden residuen (d.w.z. het percentage van de teststof dat niet geëxtraheerd kan worden met normale extractiemethoden) die in de proefdieren zijn aangetoond;
|
|
—
|
voor statistische analysen van de gegevens gebruikte methoden.
|
|
|
|
Evaluatie van de resultaten
|
—
|
overeenstemming van de resultaten met de in punt 21 vermelde geldigheidscriteria;
|
|
—
|
onverwachte of ongewone resultaten, bijv. onvolledige eliminatie van de teststof uit de proefdieren; in dergelijke gevallen kunnen de resultaten van een eventueel inleidend onderzoek nuttige informatie opleveren.
|
|
|
Aanhangsel 1
Definities en eenheden
|
|
Bioaccumulatie is de toename van de concentratie van de teststof in of op een organisme ten opzichte van de concentratie van de teststof in het omringende medium. Bioaccumulatie is het gevolg van zowel bioconcentratie- als biomagnificatieprocessen (zie hieronder).
|
|
|
De bioaccumulatiefactor (BAF) op enig moment van de opnamefase van deze bioaccumulatietest, is de verhouding tussen de concentratie van de teststof in of op het testorganisme (Ca in g kg– 1 natgewicht of drooggewicht) en de concentratie van die stof in het omringende medium (Cs in kg– 1 natgewicht of drooggewicht van sediment). Om te verwijzen naar de eenheden van Ca en Cs heeft de BAF de eenheden van kg sediment kg– 1 worm (15).
|
|
|
De bioaccumulatiefactor in stationaire toestand (BAFss) is de BAF in stationaire toestand en ondergaat gedurende langere tijd geen significante wijzigingen als de concentratie van de teststof in het omringende medium (Cs in g kg– 1 natgewicht of drooggewicht van sediment) constant blijft tijdens deze periode.
|
|
|
Bioaccumulatiefactoren die rechtstreeks op basis van de verhouding tussen de sedimentopnamesnelheidsconstante en de eliminatiesnelheidsconstanten (respectievelijk ks en ke, zie hieronder) worden berekend, worden aangeduid met de term kinetische bioaccumulatiefactor (BAFK).
|
|
|
Bioconcentratie is de toename van de concentratie van de teststof in of op een organisme ten gevolge van uitsluitend de opname via het lichaamsoppervlak ten opzichte van de concentratie van de teststof in het omringende medium.
|
|
|
Biomagnificatie is de toename van de concentratie van de teststof in of op een organisme ten gevolge van voornamelijk de opname van verontreinigde voeding of prooi ten opzichte van de concentratie van de teststof in de voeding of prooi. Biomagnificatie kan leiden tot een overdracht of accumulatie van de teststof binnen voedselketens.
|
|
|
De biota-grondaccumulatiefactor (BSAF) is de verhouding tussen de voor vetgehalte genormaliseerde concentratie van de teststof in of op het testorganisme en de voor organische koolstof genormaliseerde concentratie van de teststof in het sediment in stationaire toestand. Ca wordt uitgedrukt in g kg– 1 vetgehalte van het organisme en Cs in g kg– 1 gehalte organische stof in het sediment.
|
|
|
Bovenstaand water is het water dat in het testvat op het sediment ligt.
|
|
|
De conditioneringsperiode wordt gebruikt om het microbiële deel van het sediment te stabiliseren en bijv. ammoniak afkomstig van sedimentbestanddelen te verwijderen; deze conditionering vindt plaats voordat het sediment wordt verrijkt met de teststof. Gewoonlijk wordt het bovenstaande water na de conditionering weggegooid.
|
|
|
De eliminatie van een teststof is het verlies van die stof uit het weefsel van het testorganisme door actieve of passieve processen die optreden ongeacht of de teststof in het omringende medium aanwezig is.
|
|
|
De eliminatiefase is de periode die begint op het moment waarop de testorganismen van een medium dat de teststof bevat worden overgebracht naar een medium dat die stof niet bevat, en gedurende welke de eliminatie (of het nettoverlies) van de teststof uit het testorganisme wordt bestudeerd.
|
|
|
De equilibratieperiode wordt gebruikt om de teststof zich over de vaste fase, het poriënwater en het bovenstaande water te laten verspreiden; deze equilibratie vindt plaats nadat het sediment met de teststof is verrijkt en voordat de testorganismen worden toegevoegd.
|
|
|
De eliminatiesnelheidsconstante (ke) is de numerieke waarde die de snelheid aangeeft waarmee de concentratie van de teststof in of op het testorganisme afneemt na overbrenging van de testorganismen uit een medium dat de teststof bevat naar een medium dat de teststof niet bevat; ke wordt uitgedrukt in d– 1.
|
|
|
Kunstmatig sediment (ook wel bereid, gereconstitueerd of synthetisch sediment genoemd) is een mengsel van materialen waarmee de fysische bestanddelen van natuurlijk sediment worden nagebootst.
|
|
|
De octanol-waterverdelingscoëfficiënt (Kow) is de verhouding tussen de oplosbaarheid van een stof in n-octanol en in water bij evenwicht; deze verhouding wordt soms ook uitgedrukt als Pow. Het logaritme van Kow (log Kow) wordt gebruikt als een indicatie van het bioaccumulatiepotentieel van een stof door in het water levende organismen.
|
|
|
De opname- of blootstellingsfase is de periode gedurende welke de testorganismen aan de teststof worden blootgesteld.
|
|
|
De organische koolstof-waterverdelingscoëfficiënt (Koc) is de verhouding tussen de concentratie van een stof in of op de fractie organische koolstof van een sediment en de concentratie van die stof in water in een toestand van evenwicht.
|
|
|
Een plateau of stationaire toestand wordt gedefinieerd als het evenwicht tussen de opname- en eliminatieprocessen die gelijktijdig optreden tijdens de blootstellingsfase. De stationaire toestand wordt bereikt wanneer in een grafiek van de BAF op ieder bemonsteringspunt als functie van de tijd de curve evenwijdig gaat lopen met de tijdas en drie opeenvolgende bepalingen van BAF op monsters die met tussenpozen van ten minste twee dagen worden genomen, niet meer dan 20 % van elkaar verschillen en er bovendien geen statistisch significant verschil bestaat tussen de waarden verkregen op de drie bemonsteringstijdstippen. Voor teststoffen die langzaam worden opgenomen, verdient het de voorkeur om intervallen van zeven dagen te gebruiken (5).
|
|
|
Poriënwater, ook wel interstitieel water genoemd, is het water in de ruimten tussen de sediment- of bodemdeeltjes.
|
|
|
De sedimentopnamesnelheidsconstante (ks) is de numerieke waarde die aangeeft hoe snel de concentratie van de teststof in of op de testorganismen toeneemt ten gevolge van de opname uit de sedimentfase. ks wordt uitgedrukt in g sediment kg– 1 van worm d– 1.
|
|
|
Verrijkt sediment is sediment waaraan teststof is toegevoegd;
|
Aanhangsel 2
Berekening van opname- en eliminatieparameters
Het belangrijkste eindpunt van een bioaccumulatietest is de bioaccumulatiefactor, BAF. De gemeten BAF kan worden berekend door de concentratie van de teststof in het testorganisme, Ca, te delen door de concentratie van de teststof in het sediment, Cs, in stationaire toestand. Indien de stationaire toestand tijdens de opnamefase niet wordt bereikt, wordt de BAF op dezelfde manier berekend voor dag 28. Er dient echter opgetekend te worden of de BAF al dan niet gebaseerd is op concentraties in stationaire toestand.
De manier waarop de kinetische bioaccumulatiefactor (BAFK), de grondopnamesnelheidsconstante (ks) en de eliminatiesnelheidsconstante (ke) bij voorkeur verkregen moeten worden, is om gebruik te maken van gecomputeriseerde niet-lineaire parameterschattingstechnieken. Op basis van de tijdreeks van gemiddelde accumulatiefactoren (Ca, gemiddelde waarden van elke bemonsteringsdag/Cs, gemiddelde waarden van elke bemonsteringsdag = AF) van de opnamefase op basis van het natgewicht van wormen en sediment alsmede de modelvergelijking
|
AF(t) = BAF × (1 – eke × t)
|
[vergelijking 1]
|
waarbij AF(t) de verhouding is tussen de concentratie van teststof in wormen en de concentratie van de teststof in het sediment op een willekeurig moment (t) van de opnamefase, berekenen deze computerprogramma's waarden voor BAFK, ks en ke.
Indien de stationaire toestand wordt bereikt tijdens de opnamefase (d.w.z. t = ∞), kan vergelijking 1 worden gereduceerd tot
|

|
[vergelijking 2]
|
waarbij
|
ks
|
=
|
opnamesnelheidsconstante in weefsel [g sediment kg– 1 van worm d– 1];
|
|
ke
|
=
|
eliminatiesnelheidsconstante [d– 1];
|
Hierbij benadert ks/ke ×Cs de concentratie van de teststof in het wormweefsel in stationaire toestand (Ca,ss).
De biota-sedimentaccumulatiefactor (BSAF) moet als volgt worden berekend:

waarbij foc de fractie organische koolstof in het sediment op basis van drooggewicht is en flip de fractie wormvet op basis van hetzij drooggewicht hetzij natgewicht.
Aan de hand van een reeks tegen de tijd uitgezette concentratiewaarden kan de eliminatiekinetiek worden gemodelleerd door gebruik te maken van de volgende modelvergelijking en een gecomputeriseerde, op berekening gebaseerde niet-lineaire parameterschattingsmethode.
Het gemiddelde gemeten in het lichaam aanwezige residu aan het einde van de opnamefase wordt aanbevolen als het standaardbeginpunt. De waarde die is gemodelleerd/geschat op basis van de opnamefase moet alleen worden gebruikt indien de gemeten waarde bijvoorbeeld significant afwijkt van het gemodelleerde in het lichaam aanwezige residu. Zie tevens punt 50 voor alternatieve voorafgaande blootstelling van wormen die voor de eliminatiefase zijn geselecteerd; bij deze aanpak worden monsters van deze vooraf blootgestelde wormen op dag 0 van de eliminatiefase geacht een realistisch residugehalte in het lichaam te hebben om de eliminatiekinetiek mee te beginnen.
Als de tegen de tijd uitgezette gegevens wijzen op een constante exponentiële afname van de concentratie van de teststof in de dieren, kan een een-compartimentmodel (vergelijking [4]) worden gebruikt om het tijdsverloop van de eliminatie te beschrijven.
|

|
[vergelijking 3]
|
Eliminatieprocessen lijken soms uit twee fasen te bestaan in de zin dat ze tijdens de eerste fasen een snelle afname van Ca vertonen, waarna dit verandert in een langzamer verlies van teststoffen in de latere fasen van de eliminatie (8)(19)(25). De twee fasen kunnen worden verklaard aan de hand van de aanname dat er twee verschillende compartimenten in het organisme zijn, waaruit de teststof met verschillende snelheden verloren gaat. In deze gevallen moet specifieke literatuur worden bestudeerd (15)(16)(17)(25).
Een eliminatie in twee compartimenten wordt beschreven door, bijvoorbeeld, de volgende vergelijking (25):
|
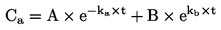
|
[vergelijking 4]
|
A en B staan voor de grootte van de compartimenten (in percentage van het totale residu in het weefsel) waarbij A het compartiment is met een snel verlies van de teststof en B het compartiment met een langzaam verlies van de stof. De som van A en B is gelijk aan 100 % van het gehele volume van het dierencompartiment in stationaire toestand. ka en kb staan voor de overeenkomstige eliminatieconstanten [d– 1]. Als het tweecompartimentenmodel wordt toegepast voor regressieanalyse van de depuratiegegevens, kan de opnamesnelheidsconstante ks als volgt worden bepaald (53)(54):
|

|
[vergelijking 5]
|
Deze modelvergelijkingen moeten echter met voorzichtigheid worden gebruikt, in het bijzonder indien tijdens de test de biobeschikbaarheid van de teststof verandert (42).
Als alternatief voor de bovenstaande modelvergelijkingen kan de kinetiek (ks en ke) ook worden berekend in één uitvoering van de test door het eersteordekinetiekmodel op alle gegevens van zowel de opname- als de eliminatiefase samen toe te passen. Voor een beschrijving van een methode die een dergelijke gecombineerde berekening van opname- en eliminatiesnelheidsconstanten mogelijk maakt, kunnen (55), (56) en (57) worden geraadpleegd.
De niet-geëlimineerde residuen (NER) moeten worden berekend als een secundair eindpunt door de verhouding tussen de gemiddelde concentratie in de wormen (Ca) op dag 10 van de eliminatiefase en de gemiddelde concentratie in de wormen (Ca) in stationaire toestand (dag 28 van de opnamefase) te vermenigvuldigen met 100:
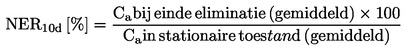
Aanhangsel 3
Voorbeeld van een bemonsteringsschema voor een bioaccumulatietest van 28 dagen
a) Opnamefase (met inbegrip van een equilibratiefase van 4 dagen)
|
Dag
|
Activiteiten
|
|
– 6
|
Turfsuspensie voor sediment bereiden; conditionering van de suspensie gedurende 48 uur.
|
|
– 4
|
Sediment of sedimentfractie verrijken; alle bestanddelen van het sediment mengen; sedimentmonsters van behandeld sediment en oplosmiddelcontrolesediment verwijderen voor de bepaling van de teststofconcentratie; bovenstaand water toevoegen; incubatie onder testomstandigheden (equilibratiefase).
|
|
– 3/– 2
|
De testorganismen verwijderen uit de cultuur voor acclimatisering.
|
|
0
|
Waterkwaliteit meten (zie punt 52); duplo's verwijderen voor het nemen van water- en sedimentmonsters voor de bepaling van de teststofconcentratie; steekproefsgewijze verdeling van de wormen over de testkamers; voldoende deelsteekproeven van wormen apart houden voor de bepaling van de analytische achtergrondwaarden; luchttoevoer regelen, indien een gesloten testsysteem wordt gebruikt.
|
|
1
|
Duplo's verwijderen voor monstername; regelen van luchttoevoer, wormgedrag, waterkwaliteit (zie punt 56); water-, sediment- en wormmonsters nemen voor de bepaling van de teststofconcentratie.
|
|
2
|
Luchttoevoer regelen, wormgedrag en temperatuur registreren.
|
|
3
|
Zelfde als dag 1.
|
|
4 - 6
|
Zelfde als dag 2.
|
|
7
|
Zelfde als dag 1; verdampt water zo nodig aanvullen.
|
|
8 - 13
|
Zelfde als dag 2.
|
|
14
|
Zelfde als dag 1; verdampt water zo nodig aanvullen.
|
|
15 - 20
|
Zelfde als dag 2.
|
|
21
|
Zelfde als dag 1; verdampt water zo nodig aanvullen.
|
|
22 - 27
|
Zelfde als dag 2.
|
|
28
|
Zelfde als dag 1; waterkwaliteit meten (zie punt 52); einde van opnamefase; voldoende deelsteekproeven van wormen apart houden voor de bepaling van de analytische achtergrondwaarden, nat- en drooggewicht en vetgehalte; wormen overbrengen van resterende blootgestelde duplo's naar vaten met daarin schoon sediment voor de eliminatiefase (geen ontlasting van de darm); water-, sediment- en wormmonsters nemen uit de oplosmiddelcontroles; bemonstering van afscheidingsoplossingen, indien geïnstalleerd.
|
|
|
Bij de planning van activiteiten die aan de blootstelling voorafgaan (equilibratiefase), moet rekening worden gehouden met de eigenschappen van de teststof. Indien nodig, conditionering van het bereide sediment onder bovenstaand water bij 20 ± 2 °C gedurende 7 dagen; in dit geval moet het sediment eerder worden bereid!
|
|
|
De voor dag 2 beschreven activiteiten moeten dagelijks worden uitgevoerd (althans op werkdagen).
|
b) Eliminatiefase
|
Dag
|
Activiteiten
|
|
– 6
|
Turfsuspensie voor sediment bereiden; conditionering van de suspensie gedurende 48 uur.
|
|
– 4
|
Alle bestanddelen van het sediment mengen; sedimentmonsters van behandeld sediment en oplosmiddelcontrolesediment verwijderen voor de bepaling van de teststofconcentratie; bovenstaand water toevoegen; incubatie onder testomstandigheden.
|
|
0 (dag 28 van de opnamefase)
|
Waterkwaliteit meten (zie punt 52); wormen overbrengen van resterende blootgestelde duplo's naar vaten met daarin schoon sediment; na 4 — 6 uur duplo's verwijderen voor het nemen van water-, sediment- en wormmonsters voor de bepaling van de teststofconcentratie; steekproefsgewijze verdeling van de wormen over de testkamers;
|
|
1
|
Duplo's verwijderen voor monstername; regelen van luchttoevoer, wormgedrag, waterkwaliteit (zie punt 52); water-, sediment- en wormmonsters nemen voor de bepaling van de teststofconcentratie.
|
|
2
|
Luchttoevoer regelen, wormgedrag en temperatuur registreren.
|
|
3
|
Zelfde als dag 1.
|
|
4
|
Zelfde als dag 2.
|
|
5
|
Zelfde als dag 1.
|
|
6
|
Zelfde als dag 2.
|
|
7
|
Zelfde als dag 1; verdampt water zo nodig aanvullen.
|
|
8 - 9
|
Zelfde als dag 2.
|
|
10
|
Zelfde als dag 1; einde van eliminatiefase; waterkwaliteit meten (zie punt 52); nemen van water-, sediment- en wormmonsters van de oplosmiddelcontroles; bemonstering van afscheidingsoplossingen, indien geïnstalleerd.
|
|
|
Het sediment wordt voor aanvang van de eliminatiefase op dezelfde manier voorbereid als voor de opnamefase.
|
|
|
De voor dag 2 beschreven activiteiten moeten dagelijks worden uitgevoerd (althans op werkdagen).
|
Aanhangsel 4
Enkele fysisch-chemische kenmerken van aanvaardbaar verdunningswater
|
BESTANDDEEL
|
CONCENTRATIES
|
|
Deeltjes
|
< 20 mg/l
|
|
Totale hoeveelheid organische koolstof
|
< 2μg/l
|
|
Niet-geïoniseerd ammonium
|
< 1 μg/l
|
|
Chloorresiduen
|
< 10 μg/l
|
|
Totale hoeveelheid organofosfaat-bestrijdingsmiddelen
|
< 50 ng/l
|
|
Totale hoeveelheid organochloor-bestrijdingsmiddelen plus polychloorbifenylen
|
< 50 ng/l
|
|
Totale hoeveelheid organisch chloor
|
< 25 ng/l
|
SAMENSTELLING VAN HET AANBEVOLEN SYNTHETISCH WATER
|
a)
|
Calciumchlorideoplossing
Los 11,76 g CaCl2·2H2O op in gedeïoniseerd water; vul aan met gedeïoniseerd water tot 1 l
|
|
b)
|
Magnesiumsulfaatoplossing
Los 4,93 g MgSO4·7H2O op in gedeïoniseerd water; vul aan met gedeïoniseerd water tot 1 l
|
|
c)
|
Natriumbicarbonaatoplossing
Los 2,59 g NaHCO3 op in gedeïoniseerd water; vul aan met gedeïoniseerd water tot 1 l
|
|
d)
|
Kaliumchlorideoplossing
Los 0,23 g KCl op in gedeïoniseerd water; vul aan met gedeïoniseerd water tot 1 l
|
Alle chemicaliën moeten van pro-analyse kwaliteit zijn.
Het geleidend vermogen van het gedestilleerde of gedeïoniseerde water mag niet groter zijn dan 10 μS cm– 1.
25 ml van elk van de oplossingen (a) tot en met (d) wordt gemengd en het totale volume wordt met gedeïoniseerd water aangevuld tot 1 l. Het totaal van de calcium- en magnesiumionen in deze oplossing is 2,5 mmol/l.
De verhouding van Ca-ionen:Mg-ionen is 4:1 en die van Na-ionen:K-ionen 10:1. Het zuurbindend vermogen KS4.3 van deze oplossing is 0,8 mmol/l.
Belucht het oplossingswater tot het is verzadigd met zuurstof, en bewaar het oplossingswater daarna zonder verdere beluchting gedurende ongeveer twee dagen tot gebruik.
Het oplossingswater moet een pH-waarde tussen 6 en 9 hebben.
Aanhangsel 5
Kunstmatig sediment — aanbevelingen voor de bereiding en opslag
In afwijking van de vereisten in testmethode C.8 (40) is het aanbevolen turfgehalte van het kunstmatige sediment 2 % in plaats van 10 % van het drooggewicht, overeenkomstig het lage tot matige organische gehalte van natuurlijke sedimenten (58).
Percentage van droge bestanddelen van het kunstmatige sediment:
|
Bestanddeel
|
Kenmerken
|
% van droog sediment
|
|
Turf
|
Veenmosturf, mate van decompositie: „medium”, aan de lucht gedroogd, geen zichtbare plantenresten, fijngemalen (deeltjesgrootte ≤ 0,5 mm)
|
2 ± 0,5
|
|
Kwartszand
|
Korrelgrootte: ≤ 2 mm, maar > 50 % van de deeltjes moet binnen het bereik 50-200 μm liggen
|
76
|
|
Kaolienklei
|
Met ≥ 30 % kaoliniet
|
22 ± 1
|
|
Voedselbron
|
Folia urticae, bladeren van Urtica sp. (grote brandnetel) in poedervorm, fijngemalen (deeltjesgrootte ≤ 0,5 mm) of een mengsel van bladeren van Urtica sp. in poedervorm met alfacellulose (1: 1); in overeenstemming met farmaceutische normen, voor menselijke consumptie; naast droog sediment
|
0,4 - 0,5 %
|
|
Calciumcarbonaat
|
CaCO3, verpulverd, chemisch zuiver, naast droog sediment
|
0,05 - 1
|
|
Gedeïoniseerd water
|
Geleidend vermogen ≤ 10 μS/cm, naast droog sediment
|
30 - 50
|
Als verhoogde ammoniakconcentraties worden verwacht, bijv. als bekend is dat de teststof de nitrificatie remt, kan het nuttig zijn om 50 % van het stikstofrijke urtica-poeder te vervangen door cellulose (bijv., α-cellulosepoeder, chemisch zuiver, deeltjesgrootte ≤ 0,5 mm).
Voorbereiding
De turf wordt aan de lucht gedroogd en gemalen tot een fijn poeder (deeltjesgrootte ≤ 0,5 mm, geen zichtbare plantenresten). Een suspensie van de vereiste hoeveelheid turfpoeder wordt bereid door een deel van het gedeïoniseerde water te gebruiken dat moet worden toegevoegd aan het droge sediment (een watervolume van 11,5 × drooggewicht van turf is bruikbaar gebleken om een turfsuspensie (8) te maken die geroerd kan worden) met behulp van een homogeniseerapparaat met een hoge capaciteit.
De pH van deze suspensie wordt met CaCO3 aangepast tot 5,5 ± 0,5. De suspensie wordt ten minste twee dagen lang onder zachtjes roeren bij 20 ± 2 °C geconditioneerd om de pH te stabiliseren en een stabiele microbiële component te verkrijgen. De pH wordt nogmaals gemeten en zo nodig met CaCO3 tot 6,0 ± 0,5 aangepast. Vervolgens wordt de gehele oplossing gemengd met de andere droge bestanddelen, rekening houdend met een eventueel voor verrijking gebruikt deel. Het resterende gedeïoniseerde water wordt toegevoegd om een homogeen sediment te verkrijgen. De pH wordt nogmaals gemeten en zo nodig met CaCO3 tot 6,5 - 7,5 aangepast. Als een verhoogde ammoniakontwikkeling wordt verwacht, kan het echter nuttig zijn de pH van het sediment onder 7 (bijv. tussen 6,0 en 6,5) te houden. Er worden monsters van het sediment genomen om het drooggewicht en het gehalte aan organische koolstof te bepalen. Als een verhoogde ammoniakontwikkeling wordt verwacht, kan het kunstmatige sediment zeven dagen worden geconditioneerd onder dezelfde omstandigheden die ook in de test zullen heersen (bijv. sediment-waterverhouding 1: 4, dikte van de sedimentlaag als in de testvaten), voordat het wordt verrijkt met de teststof, d.w.z. het moet worden overgoten met water, dat moet worden belucht. Aan het eind van de conditioneringsperiode moet het bovenstaande water worden verwijderd en weggegooid. Er worden monsters van het sediment genomen om het drooggewicht en het gehalte aan organische koolstof te bepalen (bijv. drie monsters).
Daarna wordt het verrijkte kwartszand gemengd met het sediment voor elk behandelingsniveau, wordt het sediment over de duplotestvaten verdeeld en overgoten met het testwater (bv een sediment-waterverhouding van 1: 4, dikte van de sedimentlaag als in de testvaten). De vaten worden daarna geïncubeerd onder dezelfde omstandigheden die ook in de test heersen. Hier begint de equilibratieperiode. Het bovenstaande water moet worden belucht.
De gekozen voedingsbron moet worden toegevoegd vóór of tijdens de verrijking van het sediment met de teststof. Het voedsel kan in eerste instantie door de turfsuspensie worden gemengd (zie hierboven). Overmatige achteruitgang van de voedselbron vóór de toevoeging van de testorganismen — bijv. in geval van een lange equilibratieperiode — kan echter worden voorkomen door de tijdsperiode tussen de toevoeging van het voedsel en het begin van de blootstelling zo kort mogelijk te houden. Om te waarborgen dat het voedsel voldoende in contact komt met de teststof, moet de voedselbron uiterlijk op de dag waarop het sediment wordt verrijkt met de teststof, door het sediment worden gemengd. Hierop kunnen uitzonderingen worden gemaakt in gevallen waarin de duur van de equilibratieperiode leidt tot overmatige microbiële afbraak van het voedsel, voordat de testorganismen worden toegevoegd. Er worden monsters van het sediment genomen om het drooggewicht en het gehalte aan organische koolstof te bepalen (bijv. drie monsters van verrijkt sediment of controlesediment).
Het drooggewicht van de bestanddelen (turf, zand, kaolien) moet worden gerapporteerd in g en in procenten van het totale drooggewicht.
Het watervolume dat wordt toegevoegd aan de droge bestanddelen tijdens de bereiding van het sediment moet ook worden gerapporteerd in procenten van het totale drooggewicht (bijv. 100 % drooggewicht + 46 % water betekent 1 000 g drooggewicht ontvangt in totaal 460 ml water, resulterend in 1 460 g vochtig sediment).
Opslag
De droge bestanddelen van het kunstmatige sediment kunnen op een droge en koele plaats bij kamertemperatuur worden bewaard. Het bereide, vochtige sediment kan worden opgeslagen (voor later gebruik in uitsluitend de cultuur) bij 4 ± 2 °C in het donker gedurende een periode van 2 tot 4 weken vanaf de dag van bereiding (8).
Sediment dat met de teststof verrijkt is, moet onverwijld worden gebruikt, tenzij informatie beschikbaar is die erop duidt dat het sediment in kwestie bewaard kan worden zonder dat dit van invloed is op de toxiciteit en biobeschikbaarheid van de teststof. Monsters van verrijkt sediment kunnen tot de analyse onder de voor de desbetreffende teststof aanbevolen omstandigheden worden bewaard.
Aanhangsel 6
Voor bioaccumulatietests aanbevolen soorten Oligochaetae
Tubifex tubifex (MÜLLER), Tubificidae, Oligochaeta
De Oligochaeta-worm van de familie Tubificidae Tubifex tubifex (Müller) leeft in zoetwatersedimenten in buisjes die bekleed zijn met slijm. In deze buisjes leven de wormen met hun naar beneden gericht, waarbij ze sedimentdeeltjes opnemen met gebruikmaking van de bijbehorende micro-organismen en organische resten. Het achterste deel bevindt zich gewoonlijk in het bovenstaande water voor ademhalingsdoeleinden. Hoewel deze soort leeft in een groot aantal verschillende sedimenttypen op het gehele noordelijke halfrond, geeft Tubifex tubifex de voorkeur aan relatief geringe korrelgrootten (59). De geschiktheid van deze soort voor ecotoxicologische tests wordt beschreven in bijvoorbeeld (8)(29)(31)(39)(60)(62)(63).
Kweekmethoden
Om te zorgen voor een voldoende aantal Tubifex tubifex voor de uitvoering van bioaccumulatietests moeten de wormen worden gehouden in een permanente laboratoriumcultuur. Een systeem bestaande uit kunstmatig sediment op basis van de kunstmatige grond conform testmethode C.8 (40) en synthetisch water conform testmethode C.1 wordt aanbevolen voor het kweken van T. tubifex (8).
Als kweekvaten kunnen glazen of roestvrijstalen bakken met een hoogte van 12 tot 20 cm worden gebruikt. In elk kweekvat wordt een laag vochtig kunstmatig sediment ingebracht dat is bereid als beschreven in aanhangsel 5. De diepte van de sedimentlaag moet dusdanig zijn dat de wormen hun natuurlijke graafgedrag kunnen vertonen (minimale diepte voor T. tubifex 2 cm). Synthetisch water wordt aan het systeem toegevoegd. Verstoring van het sediment moet worden voorkomen. Het water moet voorzichtig worden belucht (bijv. 2 bellen per seconde met lucht die is gefilterd met 0,45 μm) via een pasteurpipet dat 2 cm boven het sedimentoppervlak is geplaatst. De aanbevolen temperatuur van de cultuur is 20 ± 2 °C.
De wormen worden aan het kweeksysteem toegevoegd met een maximale densiteit van 20 000 individuele wormen/m2 sedimentoppervlak. Een hogere densiteit kan een vermindering van de groei- en voortplantingssnelheden veroorzaken (43).
In culturen met kunstmatig sediment moeten de wormen van voedsel worden voorzien. Fijngemalen visvoer, bijv. TetraMin® kan dienen als aanvullende voeding (8); Klerks 1994, persoonlijke mededeling. De hoeveelheid voeding moet toereikend zijn voor voldoende groei en voortplanting en tegelijkertijd het ontstaan van ammoniak en schimmelgroei in de cultuur tot een minimum beperken. Voedsel kan tweemaal per week worden toegediend (bijv. 0,6 - 0,8 mg per cm2 sedimentoppervlak). Praktijkervaringen hebben uitgewezen dat de toediening van voedsel dat gesuspendeerd en gehomogeniseerd is in gedeïoniseerd water kan bijdragen aan een homogene verdeling van het voedsel over het sedimentoppervlak in de kweekvaten.
Om ophoping van ammoniak te voorkomen, moet het bovenstaande water worden ververst, hetzij via een doorstroomsysteem of, ten minste één keer per week, handmatig. Het sediment in de stamculturen moet eens per drie maanden worden ververst.
Het nemen van wormmonsters kan worden gedaan door het sediment van de cultuur te zeven met een zeef van 1 mm, indien uitsluitend volwassen dieren nodig zijn. Voor het verwijderen van cocons kan gaas van 0,5 mm en voor jonge wormen kan een zeef van 0,25 mm worden gebruikt. Nadat het sediment erdoorheen is gegaan, kunnen de zeven in synthetisch water worden geplaatst. De wormen verlaten het gaas en kunnen dan uit het water worden gepakt met een zachte stalen tangetje of een pipet met gevuurpolijste randen.
Uitsluitend intacte en duidelijk geïdentificeerde specimens van Tubifex tubifex (bijv. (64)) worden gebruikt om een test of nieuwe culturen te beginnen. Zieke of gewonde wormen evenals cocons die aangetast zijn door schimmeldraden moeten worden verwijderd.
Een gesynchroniseerde cultuur kan desgewenst en wanneer nodig zorgen voor wormen van een bepaalde leeftijd. Nieuwe kweekvaten worden ingericht na de gekozen intervallen (bijv. eens in de twee weken), beginnend met dieren van een bepaalde leeftijd (bijv. cocons). Onder de hier beschreven cultuuromstandigheden zijn de wormen na 8 tot 10 weken volwassen. De culturen kunnen worden geoogst, wanneer de wormen nieuwe cocons hebben gelegd, bijv. na tien weken. De bemonsterde volwassen wormen kunnen worden gebruikt voor tests en met de cocons kunnen nieuwe culturen worden gestart.
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta
Lumbriculus variegatus (Lumbriculidae, Oligochaeta) is ook een bewoner van zoetwatersedimenten overal ter wereld en wordt veel gebruikt in ecotoxicologische tests. Informatie over de biologie, cultuuromstandigheden en gevoeligheid van de soort is te vinden in (1)(6)(9)(36). Lumbriculus variegatus kan ook worden gekweekt in het kunstmatige sediment dat wordt aanbevolen voor T. tubifex volgens (8) binnen bepaalde beperkingen. Aangezien L. variegatus in de natuur de voorkeur geeft aan grovere sedimenten dan T. tubifex (59), kunnen laboratoriumculturen met het voor T. tubifex gebruikte kunstmatige sediment na 4 tot 6 maanden ophouden te bestaan. Praktijkervaring heeft uitgewezen dat L. variegatus gedurende enkele jaren kan worden gehouden in een substraat van zandachtig materiaal (bijv. kwartszand, fijn grind) in een doorstroomsysteem met gebruikmaking van visvoer als voedingsbron, zonder dat het substraat ververst hoeft te worden. Een groot voordeel van L. variegatus in vergelijking met andere aquatische soorten Oligochaetae is zijn snelle voortplanting, die leidt tot snel toenemende biomassa in populaties die in het laboratorium worden gekweekt (1)(6)(9)(10).
Kweekmethoden
De kweekomstandigheden voor Lumbriculus variegatus zijn in detail beschreven in Phipps et al. (1993) (10), Brunson et al. (1998) (28), ASTM (2000) (1), U.S. EPA (2000) (6). Hieronder wordt een korte samenvatting van deze omstandigheden gegeven.
De wormen kunnen worden gekweekt in grote aquaria (57-80 l) bij 23 °C met een 16 L:8 D fotoperiode (100-1 000 lux) en met natuurlijk water dat elke dag wordt ververst (45-50 l per aquarium). Het substraat wordt bereid door ongebleekte bruine papieren handdoeken in repen te knippen en deze enkele seconden te mengen met kweekwater, zodat kleine stukjes papiersubstraat ontstaan. Dit substraat kan direct in de kweekaquaria voor Lumbriculus worden gebruikt door de bodem van de bak ermee te bedekken, of het kan in gedeïoniseerd water worden ingevroren voor later gebruik. Nieuw substraat in de bak zal doorgaans een houdbaarheid van ongeveer twee maanden hebben.
Elke wormcultuur wordt begonnen met 500 tot 1 000 wormen en wordt 3 keer per week onder verversings- of doorstroomomstandigheden gevoed met een 10 ml-suspensie met 6 g startvoer voor forellen. Statische of semistatische culturen moeten een lagere dosering voer krijgen om bacterie- en schimmelgroei te voorkomen. Voedsel en papieren substraat moeten worden geanalyseerd op de stoffen die in de bioaccumulatietests worden gebruikt.
Onder deze omstandigheden verdubbelt het aantal dieren in de cultuur doorgaans in ongeveer 10 tot 14 dagen.
Lumbriculus variegatus kan uit de culturen worden verwijderd door bijv. substraat met fijnmazig gaas, of organismen met een gevuurpolijste glazen pipet met brede mond (diameter van ongeveer 5 mm) naar een aparte beker over te brengen. Als er ook substraat naar deze beker wordt overgebracht, moet de beker met daarin de wormen en het substraat een nacht onder doorstroomomstandigheden rusten, waardoor het substraat uit de beker zal verdwijnen, terwijl de wormen op de bodem van de beker zullen achterblijven. De wormen kunnen daarna in nieuw voorbereide kweekbakken worden geplaatst of voor de test verder worden verwerkt zoals uiteengezet in (1) en (6). Verwondingen of autotomie van de wormen moeten worden voorkomen, bijv. door voor het behandelen van deze wormen pipetten met gevuurpolijste randen of roestvrijstalen staafjes te gebruiken.
Een punt waar goed rekening mee moet worden gehouden bij gebruik van L. variegatus in sedimentbioaccumulatietests, is de wijze van voortplanting van de soort (architomie gevolgd door morphallaxis). Deze aseksuele voortplanting leidt tot twee fragmenten, die gedurende enige tijd geen voedsel tot zich nemen, tot het kop- of staartdeel is geregenereerd (bijv. (36), (37)). Dit betekent de opname van sediment en verontreinigingen in L. variegatus mogelijk niet continu plaatsvindt zoals bij wormen van de familie Tubificidae, die zich niet door middel van fragmentatie voortplanten.
Er moet daarom een synchronisatie plaatsvinden om ongecontroleerde voortplanting en regeneratie en latere hoge variatie in de testresultaten zoveel mogelijk te beperken. Een dergelijke grote variatie kan optreden wanneer sommige dieren die zich in stukken hebben gedeeld en dus gedurende enige tijd geen voer tot zich nemen, minder worden blootgesteld aan de teststof dan dieren die zich tijdens de test niet in stukken delen, bijv. (38). 10 tot 14 dagen vóór het begin van de blootstelling moeten de wormen kunstmatig in stukken worden gedeeld (synchronisatie) (65). Grote wormen moeten worden gebruikt, die bij voorkeur geen tekenen van recente fragmentatie vertonen. Deze wormen kunnen op een glazen objectglaasje in een druppel kweekwater worden gelegd en met een scalpel in het middendeel van het lichaam in stukken worden gedeeld. Er dient op te worden gelet dat de achterste einden van gelijke grootte zijn. De achterste einden moeten vervolgens in een kweekvat met daarin hetzelfde substraat als gebruikt in de cultuur en hetzelfde synthetische water tot het begin van de blootstelling met rust gelaten worden om nieuwe koppen te regenereren. Wanneer de gesynchroniseerde wormen zich ingraven in het substraat, is dit een teken van regeneratie van nieuwe koppen (de aanwezigheid van geregenereerde koppen kan worden bevestigd door een representatieve steekproef onder een stereoscopische microscoop te inspecteren). De testorganismen zullen daarna naar verwacht in een vergelijkbare fysiologische toestand verkeren. Dit betekent dat, wanneer zich tijdens de test bij gesynchroniseerde wormen regeneratie door morphallaxis voordoet, verwacht wordt dat vrijwel alle dieren in gelijke mate zijn blootgesteld aan het verrijkte sediment. Het voeren van de gesynchroniseerde wormen dient plaats te vinden zodra de wormen zich in het substraat beginnen in te graven, of 7 dagen na de dissectie. Het voederregime moet vergelijkbaar zijn met dat van de reguliere culturen, maar het kan raadzaam zijn de gesynchroniseerde wormen dezelfde voedselbronnen te geven als in de test zullen worden gebruikt. De wormen moeten worden gehouden bij de testtemperatuur, bij 20 ± 2 °C. Na de regeneratieperiode moeten voor de test intacte, complete wormen worden gebruikt die na een voorzichtige mechanische stimulus actief zwemmen of kruipen. Verwondingen of autotomie van de wormen moeten worden voorkomen, bijv. door voor het behandelen van deze wormen pipetten met gevuurpolijste randen of roestvrijstalen staafjes te gebruiken.
Als in de test Lumbriculus variegatus wordt gebruikt, moet het aantal wormen tijdens de test vanwege de specifieke voortplantingswijze van deze soort toenemen, mits de omstandigheden daarvoor geschikt zijn (6). Het uitblijven van voortplanting in een bioaccumulatietest met L. variegatus moet worden gerapporteerd en in aanmerking worden genomen bij de interpretatie van de testresultaten.
Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (niet gevalideerd in de ringtest)
Branchiura sowerbyi leeft in diverse sedimenttypen van reservoirs, meren, vijvers en rivieren, en bewoont oorspronkelijk tropische gebieden. Ze zijn ook te vinden in warme waterlichamen van het noordelijke halfrond. Ze komen echter in grotere aantallen voor in kleimoddersedimenten met een hoog gehalte aan organisch materiaal. Voorts leven de wormen in de sedimentlaag. Zelfs het achterste deel van de wormen wordt gewoonlijk ingegraven. Deze soort is gemakkelijk te herkennen aan de kieuwdraden op het achterste deel van de worm. De volwassen dieren kunnen een lengte van 9 — 11 cm en een natgewicht van 40-50 mg bereiken. De wormen hebben een hoge voortplantingssnelheid, met een verdubbeling van de populatie binnen minder dan 2 weken onder de in het onderstaande beschreven temperatuur- en voedingsomstandigheden (Aston et al., 1982, (65)). B. sowerbyi is gebruikt in zowel toxiciteits- als bioaccumulatieonderzoeken (respectievelijk Marchese & Brinkhurst 1996, (31) en Roghair et al. 1996, (67)).
Kweekmethoden
Een samenvatting van de kweekomstandigheden voor Branchiura sowerbyi wordt in het onderstaande gegeven (verstrekt door Mercedes R. Marchese, INALI, Argentinië, en Carla J. Roghair, RIVM, Nederland).
Er is niet één voorgeschreven techniek voor het kweken van de testorganismen. De organismen kunnen worden gekweekt met gebruikmaking van niet-verontreinigd, natuurlijk sediment (31). De praktijk wijst uit dat een medium bestaande uit natuurlijk sediment en zand de conditie van de wormen verbetert in vergelijking met zuiver natuurlijk sediment (32)(67). Bekers van 3 l met daarin 1 500 ml sediment-watermedium, bestaande uit 375 ml natuurlijk, niet-verontreinigd sediment (ongeveer 10 % totaal gehalte aan organische koolstof; ongeveer 17 % van de deeltjes ≤ 63 μm), 375 ml schoon zand (M32) en 750 ml synthetisch of gedechlorineerd kraanwater kunnen voor de cultuur worden gebruikt (31)(32)(67). Papieren doeken kunnen ook worden gebruikt als een kweeksubstraat, maar de populatiegroei is geringer dan in natuurlijk sediment. In semistatische systemen wordt de waterlaag in de beker langzaam belucht en moet het bovenstaande water wekelijks worden ververst.
Elke beker bevat 25 jonge wormen om mee te beginnen. Na twee maanden worden de grote wormen uit het sediment verwijderd met een pincet en in een nieuwe beker met vers bereid sediment-watermedium. De oude beker bevat ook cocons en jonge wormen. Tot 400 jonge wormen per beker kunnen op deze manier worden geoogst. Volwassen wormen kunnen gedurende ten minste één jaar voor voortplanting worden gebruikt.
De temperatuur van de culturen moet worden gehandhaafd tussen 21 en 25 °C. De variatie van de temperatuur moet minder zijn dan ± 2 °C. De tijd die nodig is voor de embryo-ontwikkeling vanaf het moment waarop een eitje wordt gelegd tot het moment waarop het jong de cocon verlaat, is ongeveer drie weken bij 25 °C. De productie van eitjes die werd verkregen per overlevende worm van de soort B. sowerbyi bleek te variëren van 6,36 (31) tot 11,2 (30) in modder bij 25 °C. Het aantal eitjes per cocon varieert van 1,8 tot 2,8 (66)(69) of tot 8 (68).
Wekelijkse metingen moeten worden verricht voor opgeloste zuurstof, waterhardheid, temperatuur en pH. Visvoer (bijv. TetraMin®) kan twee of drie keer per week als suspensie ad libitum worden toegevoegd. De wormen kunnen ook ad libitum met ontdooide sla worden gevoerd.
Een belangrijk voordeel van deze soort is de grote individuele biomassa (maximaal 40 — 50 mg natgewicht per individueel dier). Om deze reden kan deze soort worden gebruikt in bioaccumulatietests voor teststoffen die niet radioactief gemerkt zijn. De soort kan worden blootgesteld in de systemen die voor T. tubifex of L. variegatus worden gebruikt met één individuele worm per duplo (11). In dat geval moet echter een groter aantal duplo's worden gebruikt, tenzij grotere testkamers worden gebruikt (11). Ook moet het geldigheidscriterium in verband met graafgedrag voor deze soort worden aangepast.
LITERATUUR
|
(1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(2)
|
Europese Commissie (EC) (2003). Technische leidraad voor risicobeoordeling ter ondersteuning van Richtlijn 93/67/EEG van de Commissie betreffende de risicobeoordeling van nieuwe aangemelde stoffen, Verordening (EG) nr. 1488/94 van de Commissie inzake de risicobeoordeling van bestaande stoffen, en Richtlijn 98/8/EG van het Europees Parlement en de Raad betreffende het op de markt brengen van biociden; Deel I — IV. Bureau voor officiële publicaties van de Europese Gemeenschappen, Luxemburg.
|
|
(3)
|
OESO (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisatie voor Economische Samenwerking en Ontwikkeling (OESO), Parijs.
|
|
(4)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Envir. Toxicol. 14, 1885-1894.
|
|
(5)
|
Hoofdstuk C.13 van deze bijlage, Bioconcentratie: doorstroomtest met vissen.
|
|
(6)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(7)
|
Hoofdstuk C.27 van deze bijlage, Test ter bepaling van de toxiciteit voor chironomiden in sedimenten en water m.b.v. verrijkt sediment.
|
|
(8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(9)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(10)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Toxicol. 12, 269-279.
|
|
(11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop „Bioaccumulation: Sediment test using benthic oligochaetes”, 26.-27.4.1999, Hochheim/Main. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(12)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
(13)
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. & Morton, R.D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301-310.
|
|
(14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim
|
|
(15)
|
Landrum, P.F., Lee II, H., & Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709-1725.
|
|
(16)
|
Markwell, R.D., Connell, D.W. & Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443-1450.
|
|
(17)
|
Gabric, A.J., Connell, D.W. & Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Wat. Res. 24, 1225-1231.
|
|
(18)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. and Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501-1514.
|
|
(20)
|
OESO (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(21)
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
(22)
|
De volgende hoofdstukken van deze bijlage:
|
|
Hoofdstuk A.4, Dampspanning
|
|
|
Hoofdstuk A.5, Oppervlaktespanning
|
|
|
Hoofdstuk A.6, Oplosbaarheid in water
|
|
|
Hoofdstuk A.8, Verdelingscoëfficiënt, schudflesmethode
|
|
|
Hoofdstuk A.24, Verdelingscoëfficiënt, HPLC-methode
|
|
|
Hoofdstuk C.7, Afbraak — niet-biologische afbraak: hydrolyse in afhankelijkheid van de pH
|
|
|
Hoofdstuk C.4 A-F Bepaling van de gemakkelijke biologische afbreekbaarheid
|
|
|
Hoofdstuk C.19, Raming van de adsorptiecoëfficiënt (Koc) aan de bodem en aan rioolslib met behulp van hogedrukvloeistofchromatografie (HPLC)
|
|
|
Hoofdstuk C.29, gemakkelijke biologische afbreekbaarheid — CO2 in gesloten vaten
|
|
|
(23)
|
OESO (1996). Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OESO, Parijs.
|
|
(24)
|
Antoine, M.D., Dewanathan, S. & Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165-172.
|
|
(25)
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke & G. Studinger (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation — New Aspects and Developments. Springer-Verlag Berlijn Heidelberg: 235-276.
|
|
(26)
|
Spacie, A. & Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309-320.
|
|
(27)
|
Hawker, D.W. & Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Wat. Res. 22, 701-707.
|
|
(28)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(29)
|
Reynoldson, T.B., Thompson, S.P. and Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061-1072.
|
|
(30)
|
Aston, R.J. & Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155-160.
|
|
(31)
|
Marchese, M.R. & Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163-168.
|
|
(32)
|
Roghair, C.J. & Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
(33)
|
Hoofdstuk C.1 van deze bijlage, Acute toxiciteitstest voor vissen.
|
|
(34)
|
OESO (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OESO, Parijs.
|
|
(35)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(36)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(37)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(38)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
(39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(40)
|
Hoofdstuk C.8 van deze bijlage, Toxiciteit voor regenwormen.
|
|
(41)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(42)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588-595.
|
|
(43)
|
Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). In: R.O. Brinkhurst and D.G. Cook (eds.): Aquatic Oligochaeta Biology, 175-184. Plenum Press, New York.
|
|
(44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
|
|
(45)
|
Hooftman, R.N., van de Guchte, K. & Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
(46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, 1897-1905.
|
|
(47)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Envir. Toxicol. 18, 1244-1249.
|
|
(48)
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Toxicol. 10, 1431-1436.
|
|
(49)
|
Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099-1105.
|
|
(50)
|
Bligh, E.G. & Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911-917.
|
|
(51)
|
De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
(52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
(53)
|
Zok, S., Görge, G., Kalsch, W. & Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411-421
|
|
(54)
|
Nagel, R. (1988). Umweltchemikalien und Fische — Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz.
|
|
(55)
|
Janssen, M.P.M., A Bruins, T.H. De Vries & Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305-312.
|
|
(56)
|
Van Brummelen, T.C. & Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Envir. 31: 277-285.
|
|
(57)
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Envir. Chemistry 22: 1167-1171.
|
|
(58)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Envir. Toxicol. 13, 1163-1175.
|
|
(59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310-386.
|
|
(60)
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Sci. Technol. 21, 785-790.
|
|
(61)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47-67.
|
|
(62)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69-78.
|
|
(63)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(64)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(65)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(66)
|
Aston, R.J., Sadler, K. & Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137-145.
|
|
(67)
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. & Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
(68)
|
Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89-94.
|
|
(69)
|
Bonacina, C., Pasteris, A., Bonomi, G. & Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267-274
|
” |

 In force
In force