EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32007R0829
Commission Regulation (EC) No 829/2007 of 28 June 2007 amending Annexes I, II, VII, VIII, X and XI to Regulation (EC) No 1774/2002 of the European Parliament and of the Council as regards the placing on the market of certain animal by-products (Text with EEA relevance)
Verordening (EG) nr. 829/2007 van de Commissie van 28 juni 2007 tot wijziging van de bijlagen I, II, VII, VIII, X en XI bij Verordening (EG) nr. 1774/2002 van het Europees Parlement en de Raad wat betreft het in de handel brengen van bepaalde dierlijke bijproducten (Voor de EER relevante tekst)
Verordening (EG) nr. 829/2007 van de Commissie van 28 juni 2007 tot wijziging van de bijlagen I, II, VII, VIII, X en XI bij Verordening (EG) nr. 1774/2002 van het Europees Parlement en de Raad wat betreft het in de handel brengen van bepaalde dierlijke bijproducten (Voor de EER relevante tekst)
OJ L 191, 21.7.2007, p. 1–99
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 No longer in force, Date of end of validity: 03/03/2011; stilzwijgende opheffing door 32009R1069
No longer in force, Date of end of validity: 03/03/2011; stilzwijgende opheffing door 32009R1069
|
21.7.2007 |
NL |
Publicatieblad van de Europese Unie |
L 191/1 |
VERORDENING (EG) Nr. 829/2007 VAN DE COMMISSIE
van 28 juni 2007
tot wijziging van de bijlagen I, II, VII, VIII, X en XI bij Verordening (EG) nr. 1774/2002 van het Europees Parlement en de Raad wat betreft het in de handel brengen van bepaalde dierlijke bijproducten
(Voor de EER relevante tekst)
DE COMMISSIE VAN DE EUROPESE GEMEENSCHAPPEN,
Gelet op het Verdrag tot oprichting van de Europese Gemeenschap,
Gelet op Verordening (EG) nr. 1774/2002 van het Europees Parlement en de Raad van 3 oktober 2002 tot vaststelling van gezondheidsvoorschriften inzake niet voor menselijke consumptie bestemde dierlijke bijproducten (1), en met name op artikel 28, tweede alinea, artikel 29, lid 3, eerste alinea, en artikel 32, lid 1,
Overwegende hetgeen volgt:
|
(1) |
Verordening (EG) nr. 1774/2002 bevat veterinairrechtelijke en gezondheidsvoorschriften voor de invoer in en doorvoer door de Gemeenschap van bepaalde dierlijke bijproducten en daarvan afgeleide producten. Die verordening bevat algemene hygiënevoorschriften voor de verwerking van materiaal van de categorieën 1, 2 en 3, alsmede voorschriften voor het in de handel brengen van die dierlijke bijproducten en daarvan afgeleide producten, met inbegrip van modellen van gezondheidscertificaten voor de invoer ervan in de Gemeenschap. |
|
(2) |
In verband met de dreiging van insleep van de kleine bijenkastkever in de Gemeenschap, die op dit moment vrij is van die parasiet, moeten er voorschriften worden vastgesteld voor de invoer van bijenwas voor technisch gebruik en moet de definitie van producten van de bijenteelt in bijlage I bij Verordening (EG) nr. 1774/2002 worden gewijzigd. De desbetreffende definitie in bijlage I bij die verordening, de invoervoorschriften in bijlage VIII, hoofdstuk IX, en het model van het gezondheidscertificaat in bijlage X, hoofdstuk 13, bij die verordening moeten dienovereenkomstig worden gewijzigd. |
|
(3) |
Bijlage II, hoofdstuk X, bij Verordening (EG) nr. 1774/2002 bevat een model van een handelsdocument waarvan dierlijke bijproducten en verwerkte producten tijdens het vervoer vergezeld moeten gaan. Met het oog op een betere traceerbaarheid van huiden tijdens het vervoer moet dat model worden gewijzigd. Bijlage II bij die verordening moet dus dienovereenkomstig worden gewijzigd. |
|
(4) |
Verordening (EG) nr. 999/2001 van het Europees Parlement en de Raad van 22 mei 2001 houdende vaststelling van voorschriften inzake preventie, bestrijding en uitroeiing van bepaalde overdraagbare spongiforme encefalopathieën (2) is van toepassing op de productie en het in de handel brengen van levende dieren en producten van dierlijke oorsprong. Die verordening verbiedt het vervoederen van verwerkte dierlijke eiwitten aan landbouwhuisdieren die worden gehouden, vetgemest of gefokt voor de productie van voedingsmiddelen. |
|
(5) |
Onder handhaving van dat verbod van Verordening (EG) nr. 999/2001 moeten voor verwerkte dierlijke eiwitten die afkomstig zijn uit varkensbloed, minder strenge verwerkingsnormen gelden dan verwerkingsmethode 1 die overeenkomstig bijlage VII, hoofdstuk II, bij Verordening (EG) nr. 1774/2002 nu als enige is toegestaan, aangezien er geen wetenschappelijke aanwijzingen zijn dat via varkens TSE’s kunnen worden overgedragen. Wel moet met het oog op de volksgezondheid en de diergezondheid een minimumtemperatuur voor de verwerking van varkensbloed worden voorgeschreven. Bijlage VII, hoofdstuk II, bij Verordening (EG) nr. 1774/2002 moet dus dienovereenkomstig worden gewijzigd. |
|
(6) |
Volgens bijlage VIII, hoofdstuk II, onder A, punt 1, bij Verordening (EG) nr. 1774/2002 mogen delen van geslachte dieren die geschikt zijn verklaard voor menselijke consumptie, maar om commerciële redenen niet voor menselijke consumptie bestemd zijn, in de Gemeenschap voor de productie van rauw voeder voor gezelschapsdieren worden gebruikt. Delen van geslachte dieren die ongeschikt zijn verklaard voor menselijke consumptie, maar die geen symptomen van op mens of dier overdraagbare ziekten vertonen, blijken ook veilig te kunnen worden gebruikt in voeder voor gezelschapsdieren. Bijlage VIII, hoofdstuk II, onder A, punt 1, bij Verordening (EG) nr. 1774/2002 moet dus dienovereenkomstig worden gewijzigd en hetzelfde geldt voor bijlage VIII, hoofdstuk XI, bij die verordening, dat de desbetreffende voorschriften voor invoer in de Gemeenschap bevat. |
|
(7) |
In de bestaande modellen van gezondheidscertificaten voor de invoer van huiden in de Gemeenschap moeten enkele technische wijzigingen worden aangebracht. Voor de duidelijkheid moeten de specifieke voorschriften voor die producten in bijlage VIII, hoofdstuk VI, en de modellen van gezondheidscertificaten in bijlage X, hoofdstukken 5 (A), 5 (B) en 5 (C), bij Verordening (EG) nr. 1774/2002 dienovereenkomstig worden gewijzigd. |
|
(8) |
De Europese Autoriteit voor voedselveiligheid (EFSA) heeft in haar wetenschappelijke advies over de diergezondheids- en dierenwelzijnsaspecten van aviaire influenza van 13 en 14 september 2005 geconcludeerd dat veren een behandeling moeten ondergaan voordat zij in de handel gebracht worden, om het risico van verspreiding van aviaire influenza te beperken. Bijlage VIII, hoofdstuk VIII, bij Verordening (EG) nr. 1774/2002 bevat permanente communautaire maatregelen betreffende het in de handel brengen en de invoer van veren. Gezien het bovengenoemde advies en de huidige epizoötiologische situatie met betrekking tot aviaire influenza in de wereld moeten de desbetreffende communautaire maatregelen voor de invoer van veren en de behandeling daarvan voordat zij worden ingevoerd, worden gewijzigd. Bijlage VIII bij die verordening moet dus dienovereenkomstig worden gewijzigd. |
|
(9) |
Het gezondheidscertificaat in bijlage X, hoofdstuk 1, bij Verordening (EG) nr. 1774/2002 voor de invoer in de Gemeenschap van niet voor menselijke consumptie bestemde verwerkte dierlijke eiwitten alsmede producten, met uitzondering van voeder voor gezelschapsdieren, die dergelijke eiwitten bevatten, moet dienovereenkomstig worden gewijzigd, zodat voor derde landen en voor de Gemeenschap gelijkwaardige verwerkingsopties gelden. Bijlage X, hoofdstuk 1, bij Verordening (EG) nr. 1774/2002 moet dus dienovereenkomstig worden gewijzigd. |
|
(10) |
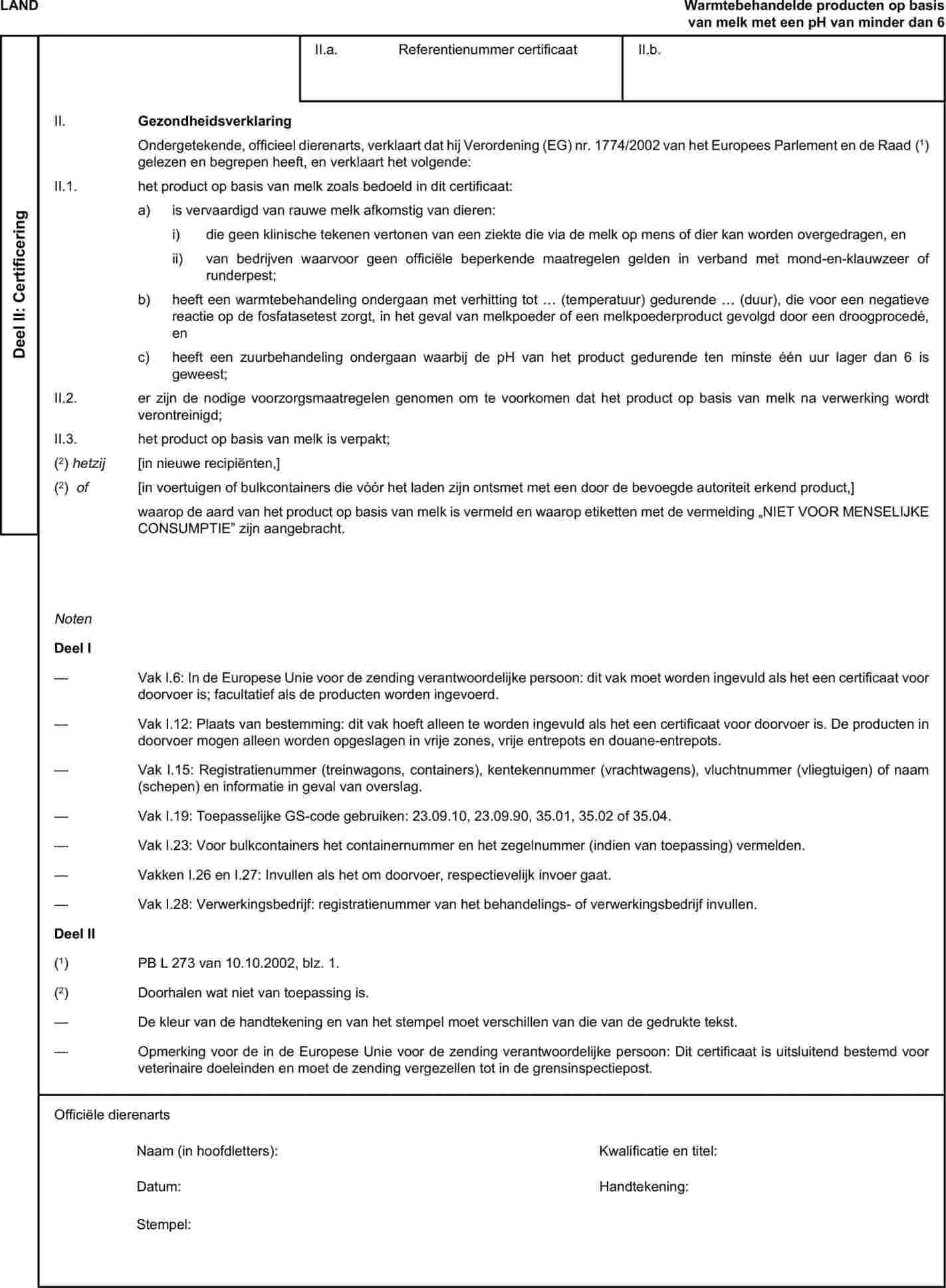
Bijlage X, hoofdstuk 3 (B), bij Verordening (EG) nr. 1774/2002 bevat het model van het gezondheidscertificaat voor de invoer in de Gemeenschap van verwerkt voeder voor gezelschapsdieren, met uitzondering van blikvoeder voor gezelschapsdieren. Steeds vaker blijkt verwerkt voeder voor gezelschapsdieren in derde landen te worden geproduceerd door menging van verwerkte bestanddelen die elk op zich al overeenkomstig de voorschriften van die verordening zijn behandeld. Warmtebehandeling van die bestanddelen zou hun voedingseigenschappen nadelig kunnen beïnvloeden. Daarom moet de invoer in de Gemeenschap van verwerkt voeder voor gezelschapsdieren dat uit dergelijke veilige bestanddelen bestaat, worden toegestaan en moet het model van het gezondheidscertificaat in bijlage X, hoofdstuk 3 (B), bij Verordening (EG) nr. 1774/2002 dienovereenkomstig worden gewijzigd. |
|
(11) |
Volgens Verordening (EG) nr. 1774/2002 mogen bepaalde dierlijke bijproducten die bestemd zijn voor de productie van voeder voor gezelschapsdieren, ook in de Gemeenschap worden ingevoerd als zij materiaal bevatten afkomstig van dieren die met bepaalde verboden stoffen zijn behandeld. De invoer in de Gemeenschap van verwerkt voeder voor gezelschapsdieren, hondenkluiven en smaakgevende ingewanden die dergelijk materiaal bevatten, is momenteel echter niet toegestaan. Aangezien het gezondheidsrisico bij de invoer van dergelijk materiaal voor de productie van voeder voor gezelschapsdieren in de Gemeenschap niet groter zal zijn dan wanneer dat materiaal een bestanddeel is van ingevoerde verwerkte voeders voor gezelschapsdieren, hondenkluiven en smaakgevende ingewanden, moet de invoer in de Gemeenschap van die verwerkte producten met dergelijk materiaal ook worden toegestaan. Daarom moeten de modellen van gezondheidscertificaten in bijlage X, hoofdstukken 3 (A), 3 (B), 3 (C) en 3 (E), bij Verordening (EG) nr. 1774/2002 dienovereenkomstig worden gewijzigd. |
|
(12) |
Overeenkomstig bijlage X, hoofdstuk 3 (B), bij Verordening (EG) nr. 1774/2002 moet het gezondheidscertificaat voor verwerkt voeder voor gezelschapsdieren, met uitzondering van blikvoeder voor gezelschapsdieren, een verklaring bevatten waarin staat dat het voeder in nieuwe verpakkingen is verpakt met etiketten waarop „NIET VOOR MENSELIJKE CONSUMPTIE” is vermeld. Richtlijn 79/373/EEG van de Raad van 2 april 1979 betreffende het verkeer van mengvoeders (3) voorziet al in gelijkwaardige etiketteringseisen om te voorkomen dat dergelijke producten onopzettelijk of uit onachtzaamheid voor menselijke consumptie worden gebruikt. De voorschriften voor het model van het gezondheidscertificaat in bijlage X, hoofdstuk 3 (B), bij Verordening (EG) nr. 1774/2002 moeten met die bepalingen rekening houden en daarom dienovereenkomstig worden gewijzigd. |
|
(13) |
Bijlage VIII bij Verordening (EG) nr. 1774/2002 vermeldt de eisen voor het in de handel brengen en de invoer in de Gemeenschap van voeder voor gezelschapsdieren, hondenkluiven en technische producten. Volgens hoofdstuk II, onder B, punt 4, van die bijlage moeten hondenkluiven een zodanige warmtebehandeling ondergaan dat ziekteverwekkers worden gedood. Verscheidene lidstaten hebben erom verzocht andere behandelingen die gelijkwaardige veiligheidsgaranties bieden bij de verwerking van hondenkluiven toe te staan. Bijlage VIII, hoofdstuk II, onder B, punt 4, bij Verordening (EG) nr. 1774/2002 moet daarom dienovereenkomstig worden gewijzigd. |
|
(14) |
Bijlage X, hoofdstuk 3 (C), bij Verordening (EG) nr. 1774/2002 bevat het model van het gezondheidscertificaat voor de invoer van hondenkluiven in de Gemeenschap. Aangezien voor de verwerking van hondenkluiven in de Gemeenschap andere behandelingen dan warmtebehandeling zullen worden toegestaan, moeten die behandelingen ook voor ingevoerde hondenkluiven worden toegestaan. Sommige hondenkluiven worden op traditionele wijze van vis gemaakt. In dat geval is warmtebehandeling om redenen van diergezondheid niet nodig. Het model van het gezondheidscertificaat in bijlage X, hoofdstuk 3 (C), bij Verordening (EG) nr. 1774/2002 moet dus dienovereenkomstig worden gewijzigd. |
|
(15) |
Bijlage VIII, hoofdstuk II, onder B, punt 6, bij Verordening (EG) nr. 1774/2002 bevat microbiologische normen voor rauw voeder voor gezelschapsdieren dat in de Gemeenschap wordt geproduceerd. Die normen moeten ook verplicht worden gesteld voor in de Gemeenschap ingevoerd rauw voeder voor gezelschapsdieren voor rechtstreekse verkoop en voor dierlijke bijproducten die als voeder voor pelsdieren worden gebruikt, bestemd voor verzending naar de Europese Gemeenschap. Bijlage X, hoofdstuk 3 (D), bij Verordening (EG) nr. 1774/2002 moet daarom dienovereenkomstig worden gewijzigd. |
|
(16) |
Bijlage XI bij Verordening (EG) nr. 1774/2002 omvat lijsten van derde landen waaruit de lidstaten de invoer kunnen toestaan van dierlijke bijproducten die niet voor menselijke consumptie bestemd zijn. Deel XIII van die bijlage bevat een lijst van derde landen waaruit de lidstaten de invoer van serum van paardachtigen kunnen toestaan. Die lijst van deel XIII omvat de derde landen die zijn opgenomen in bijlage I bij Beschikking 2004/211/EG van de Commissie van 6 januari 2004 tot vaststelling van de lijst van derde landen en delen van hun grondgebied waaruit de lidstaten de invoer toestaan van levende paardachtigen en sperma, eicellen en embryo’s van paarden en tot wijziging van de Beschikkingen 93/195/EEG en 94/63/EG (4) en waaruit de invoer van paarden voor de slacht is toegestaan. |
|
(17) |
Serum van paardachtigen kan echter van levende dieren worden verkregen. Als een derde land op grond van zijn diergezondheidsstatus is opgenomen in die lijst van derde landen waaruit de invoer van fok- en gebruikspaardachtigen is toegestaan, moet ook serum van paardachtigen uit dat derde land ingevoerd kunnen worden. Aldus zou met name de invoer van serum van paardachtigen uit Mexico toegestaan worden. Bijlage XI, deel XIII, bij Verordening (EG) nr. 1774/2002 moet daarom dienovereenkomstig worden gewijzigd. |
|
(18) |
Veterinaire certificaten moeten eruitzien zoals bepaald in Beschikking 2007/240/EG van de Commissie (5), waarin geharmoniseerde modellen worden vastgesteld voor veterinaire certificaten voor de invoer van levende dieren en producten van dierlijke oorsprong in de Europese Gemeenschap. Het handelsdocument in bijlage II, hoofdstuk X, bij Verordening (EG) nr. 1774/2002 en de modellen van gezondheidscertificaten in bijlage X bij die verordening moeten dienovereenkomstig worden gewijzigd. |
|
(19) |
Er moet na de inwerkingtreding van deze verordening een overgangsperiode komen zodat de invoer in de Gemeenschap van dierlijke bijproducten en daarvan afgeleide producten die onder Verordening (EG) nr. 1774/2002 vallen en vergezeld gaan van gezondheidscertificaten die met die verordening in overeenstemming zijn, toegestaan blijft. |
|
(20) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Permanent Comité voor de voedselketen en de diergezondheid, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
Artikel 1
De bijlagen I, II, VII, VIII, X en XI bij Verordening (EG) nr. 1774/2002 worden gewijzigd overeenkomstig de bijlage bij deze verordening.
Artikel 2
Gedurende een overgangsperiode van zes maanden na de inwerkingtreding van deze verordening mogen het handelsdocument in bijlage II bij Verordening (EG) nr. 1774/2002 en de modellen van gezondheidscertificaten in bijlage X bij die verordening, indien zij overeenkomstig de vóór de inwerkingtreding van deze verordening geldende bepalingen zijn ingevuld, de producten waarvoor die documenten respectievelijk certificaten bedoeld zijn, blijven vergezellen.
Artikel 3
Deze verordening treedt in werking op de derde dag volgende op die van haar bekendmaking in het Publicatieblad van de Europese Unie.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 28 juni 2007.
Voor de Commissie
Markos KYPRIANOU
Lid van de Commissie
(1) PB L 273 van 10.10.2002, blz. 1. Verordening laatstelijk gewijzigd bij Verordening (EG) nr. 2007/2006 van de Commissie (PB L 379 van 28.12.2006, blz. 98).
(2) PB L 147 van 31.5.2001, blz. 1. Verordening laatstelijk gewijzigd bij Verordening (EG) nr. 1923/2006 van de Commissie (PB L 404 van 30.12.2006, blz. 1).
(3) PB L 86 van 6.4.1979, blz. 30. Richtlijn laatstelijk gewijzigd bij Verordening (EG) nr. 807/2003 (PB L 122 van 16.5.2003, blz. 36).
(4) PB L 73 van 11.3.2004, blz. 1. Beschikking gewijzigd bij Verordening (EG) nr. 1792/2006 (PB L 362 van 20.12.2006, blz. 1).
(5) PB L 104 van 21.4.2007, blz. 37.
BIJLAGE
De bijlagen bij Verordening (EG) nr. 1774/2002 worden als volgt gewijzigd:
|
1) |
Bijlage I wordt als volgt gewijzigd:
|
|
2) |
Bijlage II, hoofdstuk X, komt als volgt te luiden: „HOOFDSTUK X Handelsdocument
MODEL VOOR EEN HANDELSDOCUMENT VOOR HET VERVOER VAN DIERLIJKE BIJPRODUCTEN EN VERWERKTE PRODUCTEN BINNEN DE EUROPESE GEMEENSCHAP Noten
|
|
3) |
In bijlage VII, hoofdstuk II, onder A, punt 1, komt de tekst van de eerste alinea als volgt te luiden: „Verwerkte dierlijke eiwitten van zoogdieren moeten met verwerkingsmethode 1 zijn behandeld. Varkensbloed mag echter met een van de verwerkingsmethoden 1 tot en met 5 of met verwerkingsmethode 7 zijn behandeld, mits in het laatste geval een kerntemperatuur van ten minste 80 °C is bereikt.”. |
|
4) |
Bijlage VIII wordt als volgt gewijzigd:
|
|
5) |
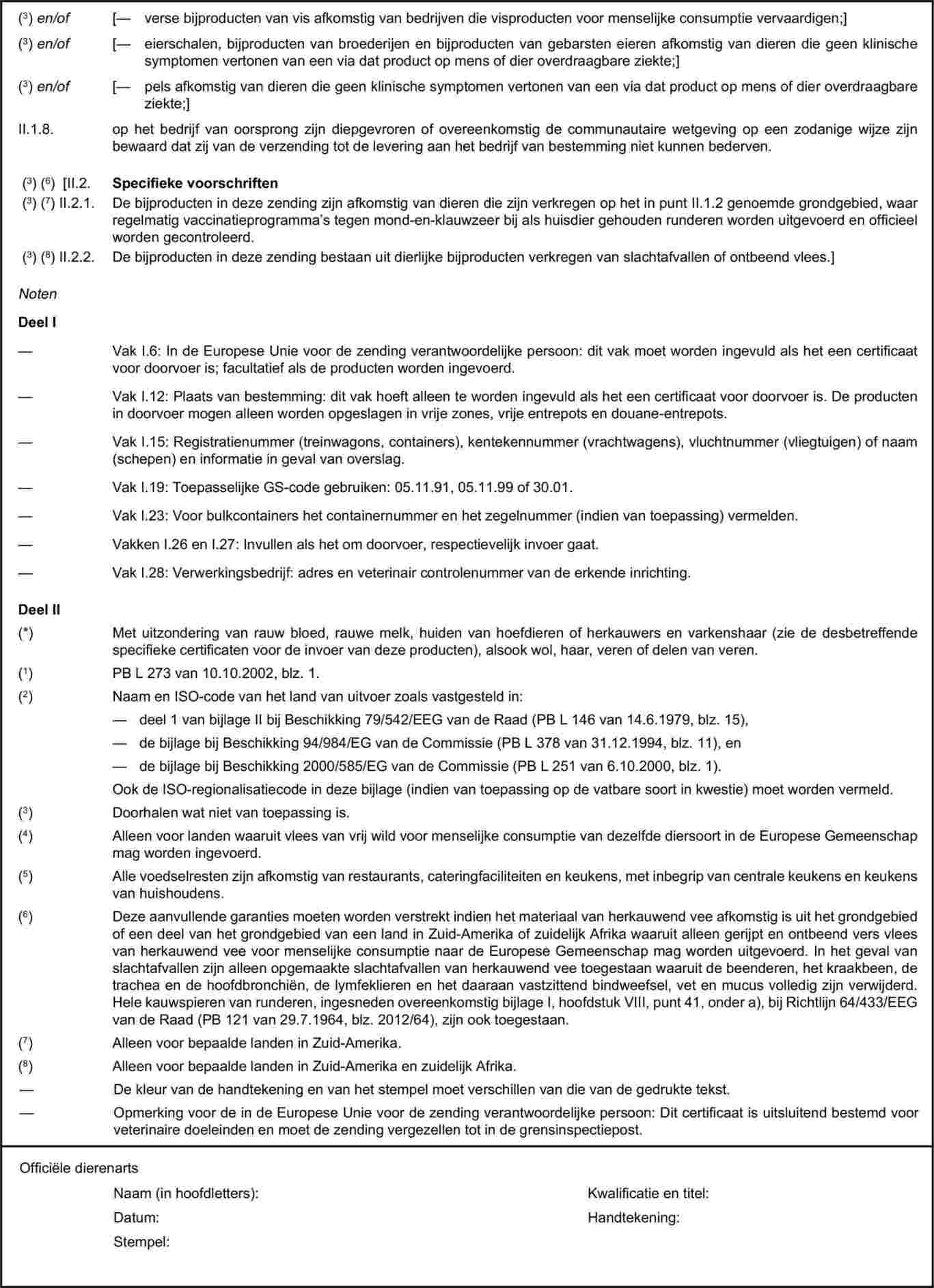
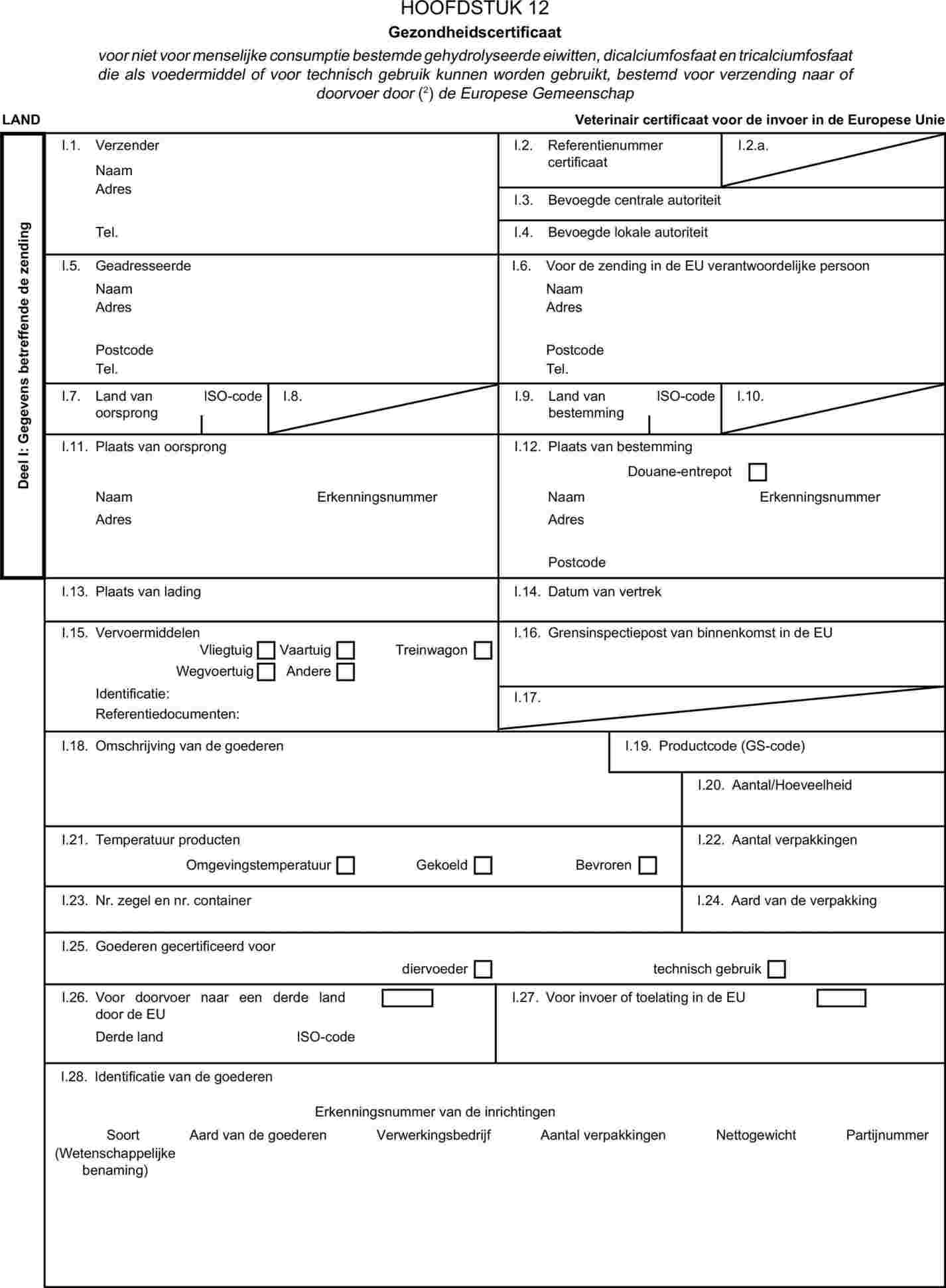
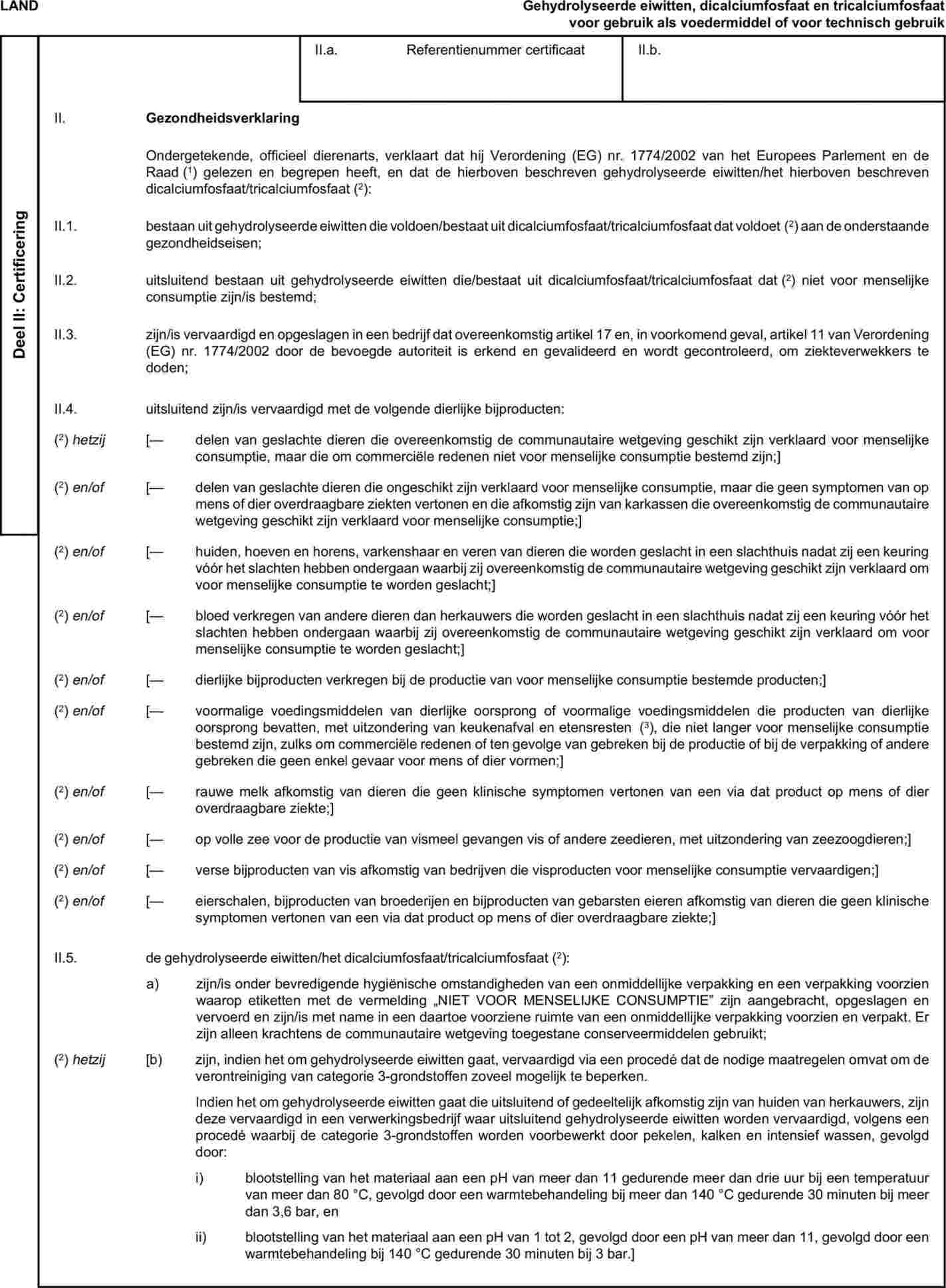
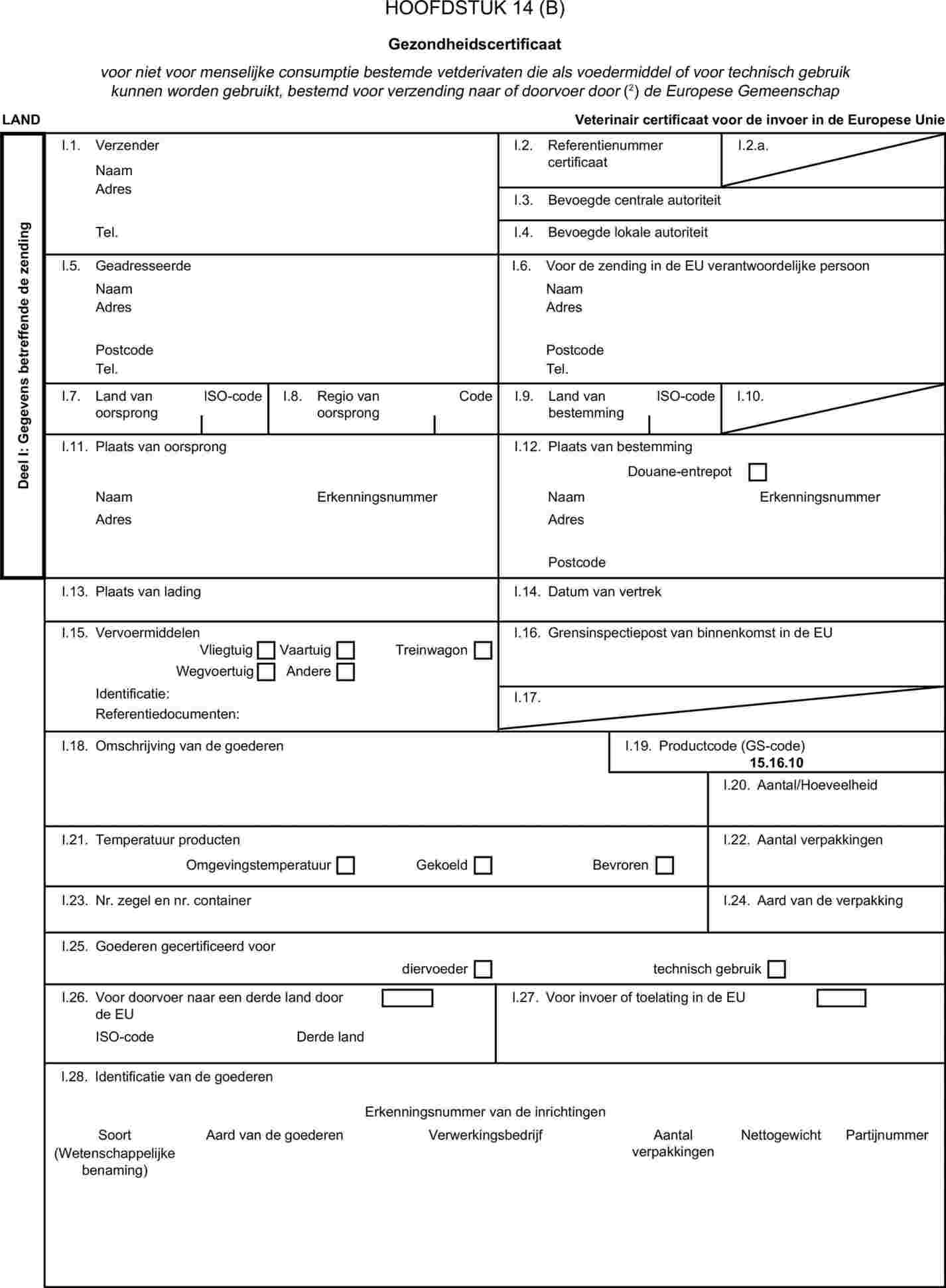
Bijlage X komt als volgt te luiden: „BIJLAGE X MODELLEN VAN GEZONDHEIDSCERTIFICATEN VOOR DE INVOER VAN BEPAALDE DIERLIJKE BIJPRODUCTEN EN DAARVAN AFGELEIDE PRODUCTEN UIT DERDE LANDEN EN VOOR DE DOORVOER ERVAN DOOR DE EUROPESE GEMEENSCHAP Noten
|
|
6) |
Bijlage XI wordt als volgt gewijzigd:
|
(1) PB L 139 van 30.4.2004, blz. 55, gerectificeerd in PB L 226 van 25.6.2004, blz. 22.”;