EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32008R0273
Commission Regulation (EC) No 273/2008 of 5 March 2008 laying down detailed rules for the application of Council Regulation (EC) No 1255/1999 as regards methods for the analysis and quality evaluation of milk and milk products
Verordening (EG) nr. 273/2008 van de Commissie van 5 maart 2008 tot vaststelling van gedetailleerde voorschriften voor de toepassing van Verordening (EG) nr. 1255/1999 van de Raad ten aanzien van methoden voor de analyse en de kwaliteitsbeoordeling van melk en zuivelproducten
Verordening (EG) nr. 273/2008 van de Commissie van 5 maart 2008 tot vaststelling van gedetailleerde voorschriften voor de toepassing van Verordening (EG) nr. 1255/1999 van de Raad ten aanzien van methoden voor de analyse en de kwaliteitsbeoordeling van melk en zuivelproducten
OJ L 88, 29.3.2008, p. 1–115
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
Special edition in Croatian: Chapter 03 Volume 010 P. 139 - 253
 No longer in force, Date of end of validity: 06/02/2018; opgeheven door 32018R0150
No longer in force, Date of end of validity: 06/02/2018; opgeheven door 32018R0150
|
29.3.2008 |
NL |
Publicatieblad van de Europese Unie |
L 88/1 |
VERORDENING (EG) Nr. 273/2008 VAN DE COMMISSIE
van 5 maart 2008
tot vaststelling van gedetailleerde voorschriften voor de toepassing van Verordening (EG) nr. 1255/1999 van de Raad ten aanzien van methoden voor de analyse en de kwaliteitsbeoordeling van melk en zuivelproducten
DE COMMISSIE VAN DE EUROPESE GEMEENSCHAPPEN,
Gelet op het Verdrag tot oprichting van de Europese Gemeenschap,
Gelet op Verordening (EG) nr. 1255/1999 van de Raad van 17 mei 1999 houdende een gemeenschappelijke ordening der markten in de sector melk en zuivelproducten (1), en met name op de artikelen 10 en 15, artikel 26, lid 3, artikel 29, lid 1, en artikel 31, lid 4,
Overwegende hetgeen volgt:
|
(1) |
Bij Verordening (EG) nr. 213/2001 van de Commissie (2) zijn gedetailleerde voorschriften vastgesteld voor de toepassing van Verordening (EG) nr. 1255/1999 van de Raad ten aanzien van methoden voor de analyse en kwaliteitsbeoordeling van melk en zuivelproducten. In het licht van de technische ontwikkelingen op het gebied van analysemethoden moeten hierin opnieuw ingrijpende wijzigingen worden aangebracht. Met het oog op de duidelijkheid en de efficiëntie en gezien het aantal en de technische aard van deze wijzigingen dient Verordening (EG) nr. 213/2001 te worden ingetrokken en door een nieuwe verordening te worden vervangen. |
|
(2) |
De eisen voor de samenstelling en de kwaliteit van melk en zuivelproducten die zijn vastgesteld in het kader van de regelingen van Verordening (EG) nr. 1255/1999, moeten worden gecontroleerd om te garanderen dat zij strikt in acht worden genomen. |
|
(3) |
De referentiemethoden voor dergelijke controles zijn vaak methoden die worden gepubliceerd door internationale organisaties zoals de Europese Commissie voor normalisatie (CEN), de Internationale Zuivelbond (IDF), de Internationale Organisatie voor normalisatie (ISO) en de wetenschappelijke vereniging die zich inzet voor kwalitatief hoogwaardige analyse (AOAC International) en die regelmatig door die organisaties worden bijgewerkt. In bepaalde gevallen is een communautaire referentiemethode vastgesteld, terwijl er in andere gevallen geen referentiemethode in de communautaire wetgeving is gespecificeerd. Om een uniforme toepassing van de referentiemethoden te garanderen dient er een lijst van referentiemethoden te worden vastgesteld en dient de Commissie de lijst waar nodig aan te passen. |
|
(4) |
Het gebruik van routinemethoden mag niet worden uitgesloten. Derhalve moeten de minimale voorwaarden voor het gebruik daarvan worden gespecificeerd. |
|
(5) |
Er moeten ook gemeenschappelijke procedures worden vastgesteld om te komen tot een uniforme praktijk bij de beoordeling van de analyseresultaten, bij de sensorische evaluatie van de betrokken producten en bij heronderzoek van resultaten die worden betwist. |
|
(6) |
Voor bepaalde analyses bestaan momenteel geen internationaal aanvaarde en gevalideerde referentiemethodes, zodat er geen informatie beschikbaar is over de verschillen in analyseresultaten tussen laboratoria. Derhalve moeten er communautaire methoden worden vastgesteld die volgens internationaal vastgestelde regels zijn gevalideerd en die als referentiemethode moeten worden toegepast. |
|
(7) |
In Verordening (EG) nr. 1898/2005 van de Commissie (3) worden gedetailleerde voorschriften vastgesteld voor de toepassing van Verordening (EG) nr. 1255/1999 van de Raad ten aanzien van maatregelen voor de afzet van room, boter en boterconcentraat op de markt van de Gemeenschap en wordt bepaald dat in sommige omstandigheden verklikstoffen aan room, boter en boterconcentraat moeten worden toegevoegd om te garanderen dat deze producten de voorgeschreven eindbestemming krijgen. De toevoeging van verklikstoffen is belangrijk voor het deugdelijk functioneren van de regeling. Om een gelijke behandeling van de marktdeelnemers die van die regeling gebruik maken te garanderen, moeten er gemeenschappelijke methoden worden vastgesteld voor de kwantitatieve bepaling van sommige van die verklikstoffen. |
|
(8) |
Op grond van artikel 9 van Verordening (EG) nr. 1255/1999 mag steun voor de particuliere opslag van uit schapenmelk vervaardigde kaas worden verleend. Op grond van artikel 31 van die verordening kan voor dezelfde producten een bijzondere restitutie worden toegekend. Uit bepaalde derde landen mag onder preferentiële voorwaarden kaas van schapen-, geiten- of buffelmelk of van mengsels van schapen-, geiten- en buffelmelk in de Gemeenschap worden ingevoerd. Met het oog op het voorgaande moet via adequate controles worden geverifieerd of in de betrokken producten geen koemelk is verwerkt. Derhalve dient een communautaire referentiemethode voor de detectie van koemelk te worden vastgesteld, hetgeen geen beletsel mag zijn voor de toepassing van routinemethoden, mits die aan bepaalde criteria beantwoorden. |
|
(9) |
Krachtens Verordening (EEG) nr. 2921/90 van de Commissie van 10 oktober 1990 betreffende de steunverlening voor ondermelk die tot caseïne en caseïnaten wordt verwerkt (4), moet de afwezigheid van colibacteriën worden aangetoond. De internationaal aanvaarde referentiemethode voor de detectie van colibacteriën in melk en zuivelproducten is ISO 4831. Voor de detectie van colibacteriën is op basis van bovengenoemde norm een communautaire referentiemethode vastgesteld. |
|
(10) |
In Verordening (EEG) nr. 2658/87 van de Raad van 23 juli 1987 met betrekking tot de tarief- en statistieknomenclatuur en het gemeenschappelijk douanetarief (5) is de hoogte van de invoerrechten voor mengvoeders van GN-code 2309 gedifferentieerd volgens het gehalte aan zuivelproducten. Om ervoor te zorgen dat de betrokken bepalingen uniform worden toegepast, moet een algemeen erkende methode voor de analyse van het lactosegehalte worden vastgesteld, waarvan het gebruik in alle lidstaten verplicht is. |
|
(11) |
In Verordening (EG) nr. 1255/1999 is bepaald dat boter en mageremelkpoeder voor interventie, en mageremelkpoeder voor vervoedering aan bepaalde kwaliteitseisen moeten voldoen. Derhalve moeten referentiemethoden voor de toetsing aan die eisen worden vastgesteld. |
|
(12) |
Sommige methoden worden in deze verordening voor het eerst ingevoerd. Er moet een afdoende overgangsperiode vanaf de datum van inwerkingtreding van deze verordening worden vastgesteld om te zorgen dat de laboratoria deze nieuwe methoden op correcte wijze kunnen invoeren en gebruiken. Wanneer een in bijlage I vermelde referentiemethode door de normstellende organisatie wordt herzien en gepubliceerd, moeten de laboratoria zes maanden tijd krijgen om hun analyseprocedures zodanig aan te passen dat ze aan de nieuwe norm voldoen. |
|
(13) |
De in deze verordening vervatte maatregelen zijn in overeenstemming met het advies van het Comité van beheer voor melk en zuivelproducten, |
HEEFT DE VOLGENDE VERORDENING VASTGESTELD:
HOOFDSTUK I
ALGEMENE BEPALINGEN
Artikel 1
Doel en toepassingsgebied
1. In deze verordening worden bepaalde referentiemethoden vastgesteld voor de chemische, fysische en microbiologische analyse en de sensorische evaluatie van melk en zuivelproducten die worden gebruikt krachtens de regelingen die zijn opgenomen in de gemeenschappelijke ordening der markten in de sector melk en zuivelproducten die bij Verordening (EG) nr. 1255/1999 is vastgesteld, alsmede de voorschriften voor de toepassing van die methoden.
2. De lijst van de referentiemethoden voor de in lid 1 bedoelde analyses wordt in bijlage I van deze verordening vastgesteld.
3. De Commissie actualiseert de lijst volgens de procedure van artikel 42 van Verordening (EG) nr. 1255/1999.
Artikel 2
Routinemethoden
Voor de op grond van de communautaire regelgeving uit te voeren analyses mogen routinemethoden worden gebruikt, mits deze goed worden gekalibreerd en regelmatig aan de referentiemethode worden getoetst. De resultaten worden vergeleken met inachtneming van de systematische fout, de herhaalbaarheid en de reproduceerbaarheid.
Bij geschillen gelden de resultaten volgens de referentiemethode.
De lidstaten stellen de Commissie op de hoogte van het gebruik van routinemethoden bij de in artikel 1 bedoelde analyses.
HOOFDSTUK II
ANALYSEMETHODEN
Artikel 3
Beoordeling of een partij aan een wettelijke grenswaarde voldoet
Met uitzondering van de analyse van verklikstoffen is bijlage II van deze verordening van toepassing om te bepalen of aan de wettelijke eisen inzake de samenstelling wordt voldaan.
Artikel 4
Sensorische evaluatie
1. Voor melk en andere zuivelproducten dan boter voor openbare opslag gebruiken de lidstaten als referentiemethode voor de sensorische evaluatie IDF-norm 99C:1997 of andere vergelijkbare methodes, die zij aan de Commissie meedelen.
De in bijlage III beschreven procedures worden toegepast om het werk van de beoordelaars en de betrouwbaarheid van de resultaten bij sensorische analyses te controleren.
2. Voor boter voor openbare opslag worden de in bijlage III beschreven procedures toegepast om het werk van de beoordelaars en de betrouwbaarheid van de resultaten bij sensorische analyses te controleren.
De in bijlage IV beschreven procedure wordt als referentiemethode voor de sensorische evaluatie toegepast.
Artikel 5
Verklikstoffen
1. De in bijlage V vastgestelde analysemethode wordt gebruikt als referentiemethode voor de bepaling van het gehalte aan n-heptaanzuur-triglyceride van boter, butteroil en room.
2. De in bijlage VI vastgestelde analysemethode wordt gebruikt als referentiemethode voor de bepaling van het vanillinegehalte van boterconcentraat, boter en room.
3. De in bijlage VII vastgestelde analysemethode wordt gebruikt als referentiemethode voor de bepaling van het gehalte aan de ethylester van β-apo-8'-caroteenzuur van boterconcentraat en boter.
4. De in bijlage VIII vastgestelde analysemethode wordt gebruikt als referentiemethode voor de bepaling van het gehalte aan β-sitosterol of stigmasterol van boter en boterconcentraat.
5. Boterconcentraat, boter en room worden geacht overeenkomstig de betrokken communautaire regelgeving van verklikstoffen te zijn voorzien, als de resultaten overeenstemmen met de specificaties van de punten 10 en 11 van bijlage V en punt 8 van de bijlagen VI, VII en VIII.
Artikel 6
Detectie van koemelkcaseïne
1. De in bijlage IX vastgestelde referentieanalysemethode wordt gebruikt om te garanderen dat kaas die uitsluitend uit schapen-, geiten- of buffelmelk of uit een mengsel van schapen-, geiten- en buffelmelk mag zijn vervaardigd, geen koemelkcaseïne bevat.
Koemelkcaseïne wordt geacht aanwezig te zijn als het gehalte aan koemelkcaseïne van het geanalyseerde monster gelijk is aan of hoger is dan het gehalte van het referentiemonster van bijlage IX, dat 1 % koemelk bevat.
2. Voor de detectie van koemelkcaseïne in de in lid 1 bedoelde kaassoorten mogen routinemethoden worden gebruikt mits:
|
a) |
de detectiegrens ten hoogste 0,5 % is en |
|
b) |
er geen vals-positieve resultaten zijn en |
|
c) |
de koemelkcaseïne ook na lange rijpingsperiodes, zoals die in de handel gebruikelijk kunnen zijn, met de vereiste gevoeligheid kan worden gedetecteerd. |
Als aan een van bovenstaande voorwaarden niet wordt voldaan, wordt de in bijlage IX vastgestelde referentiemethode gebruikt.
Artikel 7
Detectie van colibacteriën
Colibacteriën in boter, mageremelkpoeder, caseïne en caseïnaten worden gedetecteerd volgens de in bijlage X vastgestelde referentiemethode.
Artikel 8
Bepaling van het lactosegehalte
Het lactosegehalte van de producten van GN-code 2309 wordt bepaald volgens de in bijlage XI vastgestelde referentiemethode.
Artikel 9
Detectie van lebwei
1. Lebwei in voor openbare opslag bestemd mageremelkpoeder wordt gedetecteerd volgens de in bijlage XII vastgestelde referentiemethode.
2. Lebwei in mageremelkpoeder en voor gebruik als diervoeder bestemde mengsels wordt gedetecteerd volgens de in bijlage XII vastgestelde referentiemethode. Wanneer lebwei wordt gedetecteerd, wordt bijlage XIII toegepast.
Artikel 10
Detectie van karnemelk
Karnemelk in mageremelkpoeder wordt gedetecteerd volgens de in bijlage XIV vastgestelde referentiemethode.
Artikel 11
Detectie van antibioticaresiduen
Antibioticaresiduen in mageremelkpoeder worden gedetecteerd volgens de in bijlage XV vastgestelde referentiemethode.
Artikel 12
Bepaling van het gehalte aan mageremelkpoeder
Het gehalte aan mageremelkpoeder van mengvoeders wordt bepaald volgens de in bijlage XVI vastgestelde referentiemethode.
Artikel 13
Detectie van zetmeel
Zetmeel in mageremelkpoeder, gedenatureerd melkpoeder en mengvoeders wordt gedetecteerd volgens de in bijlage XVII vastgestelde referentiemethode.
Artikel 14
Bepaling van het vochtgehalte van gedroogde room
Het vochtgehalte van gedroogde room wordt bepaald volgens de in bijlage XVIII vastgestelde referentiemethode.
Artikel 15
Bepaling van het vochtgehalte van zurekarnemelkpoeder
Het vochtgehalte van voor gebruik in diervoeders bestemd zurekarnemelkpoeder wordt bepaald volgens de in bijlage XIX vastgestelde referentiemethode.
Artikel 16
Bepaling van de zuiverheid van melkvet
De zuiverheid van melkvet wordt bepaald volgens de in bijlage XX vastgestelde referentiemethode.
HOOFDSTUK III
ALGEMENE EN SLOTBEPALINGEN
Artikel 17
Kwaliteitsborging
De analyses worden uitgevoerd in laboratoria die een kwaliteitsborgingsysteem voor analyses met inbegrip van interne kwaliteitscontroleprocedures hebben. Niet-erkende laboratoria nemen ten minste één keer per jaar deel aan geschiktheidsproeven en hun resultaten mogen niet meer dan 2σR (standaarddeviatie van de reproduceerbaarheid van de referentiemethode) van de consensuswaarde afwijken. Een gedetailleerde beschrijving van de gebruikte systemen moet in het laboratorium kunnen worden geraadpleegd.
Laboratoria die erkend zijn overeenkomstig de in artikel 12 van Verordening (EG) nr. 882/2004 van het Europees Parlement en de Raad van 29 april 2004 inzake officiële controles op de naleving van de wetgeving inzake diervoeders en levensmiddelen en de voorschriften inzake diergezondheid en dierenwelzijn (6) bedoelde normen, worden vrijgesteld van de verplichting om aan geschiktheidsproeven deel te nemen.
Artikel 18
Monsterneming en betwisting van de analyseresultaten
1. De monsterneming gebeurt overeenkomstig de relevante regelgeving voor het desbetreffende product. Als er geen monsternemingsbepalingen zijn, worden de bepalingen gevolgd die zijn opgenomen in ISO 707|IDF 50: Melk en melkproducten — Leidraad voor monsterneming.
2. De laboratoriumverslagen van de resultaten van de analyse moeten voldoende informatie bevatten om de resultaten overeenkomstig bijlage II en bijlage XXI te kunnen beoordelen.
3. Voor de krachtens de communautaire regelgeving vereiste analyses moeten monsters in duplo worden genomen.
4. Wanneer de resultaten van een analyse niet door de betrokken marktdeelnemer worden geaccepteerd, wordt de in bijlage XXI beschreven procedure gevolgd.
5. Als de fabrikant binnen vijf werkdagen na de monsterneming kan aantonen dat de monsternemingsprocedure niet correct is uitgevoerd, moet de monsterneming indien mogelijk worden herhaald. Als de monsterneming niet kan worden herhaald, moet de partij worden geaccepteerd.
Artikel 19
Overgangsperiode
De nalevingsbeoordeling overeenkomstig bijlage II van deze verordening wordt binnen twaalf maanden na de inwerkingtreding uitgevoerd. De lidstaten brengen indien nodig onmiddellijk verslag uit bij de Commissie als er gedurende deze periode problemen van enige omvang met de statistische controleprocedure worden ondervonden.
Artikel 20
Intrekking
Verordening (EG) nr. 213/2001 wordt ingetrokken.
Verwijzingen naar de ingetrokken verordening gelden als verwijzingen naar deze verordening en worden overeenkomstig de correlatietabel in bijlage XXII gelezen.
Artikel 21
Inwerkingtreding
Deze verordening treedt in werking op de derde dag volgende op die van haar bekendmaking in het Publicatieblad van de Europese Unie.
Zij is met ingang van 31 maart 2008 van toepassing.
Deze verordening is verbindend in al haar onderdelen en is rechtstreeks toepasselijk in elke lidstaat.
Gedaan te Brussel, 5 maart 2008.
Voor de Commissie
Mariann FISCHER BOEL
Lid van de Commissie
(1) PB L 160 van 26.6.1999, blz. 48. Verordening laatstelijk gewijzigd bij Verordening (EG) nr. 1152/2007 (PB L 258 van 4.10.2007, blz. 3). Verordening (EG) nr. 1255/1999 wordt per 1 juli 2008 vervangen door Verordening (EG) nr. 1234/2007 (PB L 299 van 16.11.2007, blz. 1).
(2) PB L 37 van 7.2.2001, blz. 1.
(3) PB L 308 van 25.11.2005, blz. 1. Verordening laatstelijk gewijzigd bij Verordening (EG) nr. 1546/2007 (PB L 337 van 21.12.2007, blz. 68).
(4) PB L 279 van 11.10.1990, blz. 22. Verordening laatstelijk gewijzigd bij Verordening (EG) nr. 1487/2006 (PB L 278 van 10.10.2006, blz. 8).
(5) PB L 256 van 7.9.1987, blz. 1. Verordening laatstelijk gewijzigd bij Verordening (EG) nr. 1352/2007 van de Commissie (PB L 303 van 21.11.2007, blz. 3).
(6) PB L 165 van 30.4.2004, blz. 1.
BIJLAGE I
(Artikel 1)
LIJST VAN REFERENTIEMETHODEN
Index Min. = minimum, Max. = maximum, Bijlage = bijlage bij de geciteerde verordening, VDS = vetvrije droge stof, PG = peroxidegetal, V = voorkomen, S = smaak, C = consistentie, TKG = totaal kiemgetal, Therm = kiemgetal thermofielen, LS = lidstaat, IDF = Internationale Zuivelbond, ISO = Internationale Organisatie voor normalisatie, IUPAC = International Union of Pure and Applied Chemistry, ADPI = American Dairy Products Institute, GMS = gecondenseerde volle melk met suiker, GMR = geëvaporeerde melk of room.
DEEL A
|
Verordening van de Commissie |
Product |
Parameter |
Grenswaarde (1) |
Referentiemethode |
Opmerking |
||||||
|
Verordening (EG) nr. 2771/1999 — Openbare opslag |
Ongezouten boter |
Vet |
Min. 82 % m/m |
ISO 17189:2003|IDF 194:2003 |
|
||||||
|
|
|
Water |
Max. 16 % m/m |
ISO 3727-1:2001|IDF 80-1:2001 |
|
||||||
|
|
|
VDS |
Max. 2 % m/m |
ISO 3727-2:2001|IDF 80-2:2001 |
|
||||||
|
|
|
Vrije vetzuren |
1,2 mmol/100 g vet |
ISO 1740:2004|IDF 6:2004 |
|
||||||
|
|
|
PG (max.) |
0,3 meq. zuurstof/1 000 g vet |
ISO 3976:2006|IDF 74:2006 |
Opmerking 1 |
||||||
|
|
|
Colibacteriën |
Niet detecteerbaar in 1 g |
Bijlage X |
Opmerking 3 |
||||||
|
|
|
Niet van melk afkomstig vet |
Niet detecteerbaar door triglyceride-analyse |
Bijlage XX |
|
||||||
|
|
|
Sterol-verklikstoffen |
Niet detecteerbaar, β-sitosterol ≤ 40 mg/kg |
Bijlage VIII |
|
||||||
|
|
|
Andere verklikstoffen: |
|
|
|
||||||
|
|
|
|
Niet detecteerbaar |
Bijlage VI |
|
||||||
|
|
|
|
≤ 6 mg/kg |
Bijlage VII |
|
||||||
|
|
|
|
Niet detecteerbaar |
Bijlage V |
|
||||||
|
|
|
Sensorische kenmerken |
Ten minste 4 van de 5 punten voor V, S en C |
Bijlage IV |
|
||||||
|
|
|
Waterdispersie |
Ten minste 4 punten |
ISO 7586:1985 — IDF 112A:1989 |
|
||||||
|
Verordening (EG) nr. 2771/1999 — Particuliere opslag |
Ongezouten boter |
Vet |
Min. 82 % m/m |
ISO 17189:2003|IDF 194:2003 |
|
||||||
|
|
|
Water |
Max. 16 % m/m |
ISO 3727-1:2001|IDF 80-1:2001 |
|
||||||
|
|
|
VDS |
Max. 2 % m/m |
ISO 3727-2:2001|IDF 80-2:2001 |
|
||||||
|
Verordening (EG) nr. 2771/1999 — Particuliere opslag |
Gezouten boter |
Vet |
Min. 80 % m/m |
ISO 17189:2003|IDF 194:2003 |
|
||||||
|
|
|
Water |
Max. 16 % m/m |
ISO 3727-1:2001|IDF 80-1:2001 |
|
||||||
|
|
|
VDS (exclusief zout) |
Max. 2 % m/m |
ISO 3727-2:2001|IDF 80-2:2001 |
|
||||||
|
|
|
Zout |
Max. 2 % m/m |
ISO 15648:2004|IDF 179:2004 |
|
||||||
|
Verordening (EG) nr. 1898/2005, hoofdstuk II |
Ongezouten boter |
Vet |
Min. 82 % m/m |
ISO 17189:2003|IDF 194:2003 |
|
||||||
|
|
|
Niet van melk afkomstig vet |
|
Bijlage XX |
|
||||||
|
|
|
Water |
Max. 16 % m/m |
ISO 3727-1 2001|IDF 80-1:2001 |
|
||||||
|
|
|
VDS |
Max. 2 % m/m |
ISO 3727-2:2001|IDF 80-2:2001 |
|
||||||
|
|
|
Verklikstoffen: |
|
|
|
||||||
|
|
|
|
Zie bijlage VIII |
Bijlage VIII |
|
||||||
|
|
|
|
Zie bijlage VI |
Bijlage VI |
|
||||||
|
|
|
|
Zie bijlage VII |
Bijlage VII |
|
||||||
|
|
|
|
Zie bijlage V |
Bijlage V |
|
||||||
|
Verordening (EG) nr. 1898/2005, hoofdstuk II |
Gezouten boter |
Vet |
Min. 80 % m/m |
ISO 17189:2003|IDF 194:2003 |
|
||||||
|
|
|
Niet van melk afkomstig vet |
|
Bijlage XX |
|
||||||
|
|
|
Water |
Max. 16 % m/m |
ISO 3727-1:2001|IDF 80-1:2001 |
|
||||||
|
|
|
VDS (exclusief zout) |
Max. 2 % m/m |
ISO 3727-2:2001|IDF 80-2:2001 |
|
||||||
|
|
|
Zout |
Max. 2 % m/m |
ISO 15648:2004|IDF 179:2004 |
|
||||||
|
|
|
Verklikstoffen: |
|
|
|
||||||
|
|
|
|
Zie bijlage VIII |
Bijlage VIII |
|
||||||
|
|
|
|
Zie bijlage VI |
Bijlage VI |
|
||||||
|
|
|
|
Zie bijlage VII |
Bijlage VII |
|
||||||
|
|
|
|
Zie bijlage V |
Bijlage V |
|
||||||
|
Verordening (EG) nr. 1898/2005, hoofdstuk II |
Boterconcentraat |
Vet |
Min. 99,8 % m/m |
IDF 24:1964 |
|
||||||
|
|
|
Water en VDS |
Max. 0,2 % m/m |
ISO 5536:2002|IDF 23:2002 (vocht) IDF 24:1964 (VDS) |
|
||||||
|
|
|
Vrije vetzuren |
1,2 mmol/100 g vet |
ISO 1740:2004|IDF 6:2004 |
|
||||||
|
|
|
PG (max.) |
0,5 meq. zuurstof/1 000 g vet |
ISO 3976:2006|IDF 74:2006 |
Opmerking 1 |
||||||
|
|
|
Niet van melk afkomstig vet |
Niet aanwezig |
Bijlage XX |
|
||||||
|
Smaak |
Vers |
||||||||||
|
Geur |
Geen vreemde geuren |
||||||||||
|
Overige |
Geen neutraliserende stoffen, antioxidanten of conserveermiddelen |
||||||||||
|
|
|
Verklikstoffen: |
|
|
|
||||||
|
Zie bijlage VIII |
Bijlage VIII |
|||||||||
|
Zie bijlage VI |
Bijlage VI |
|||||||||
|
Zie bijlage VII |
Bijlage VII |
|||||||||
|
Zie bijlage V |
Bijlage V |
|||||||||
|
Verordening (EG) nr. 1898/2005, hoofdstuk II |
Room |
Vet |
Min. 35 % m/m |
ISO 2450:1999|IDF 16 C:1987 |
|
||||||
|
|
|
Niet van melk afkomstig vet |
|
Bijlage XX |
|
||||||
|
|
|
Verklikstoffen: |
|
|
|
||||||
|
Zie bijlage VIII |
|
Opmerking 2 |
||||||||
|
|
|
|
Zie bijlage VI |
Bijlage VI |
|
||||||
|
|
|
|
Zie bijlage VII |
|
Opmerking 2 |
||||||
|
|
|
|
Zie bijlage V |
Bijlage V |
|
||||||
|
Verordening (EG) nr. 1898/2005, hoofdstuk III |
Boterconcentraat |
Vet |
Min. 96 % m/m |
|
Opmerking 2 |
||||||
|
|
|
Niet van melk afkomstig vet |
|
Bijlage XX |
|
||||||
|
|
|
VDS |
Max. 2 % m/m |
|
Opmerking 2 |
||||||
|
|
|
Verklikstoffen: |
|
|
|
||||||
|
15 g/100 kg boterconcentraat |
Bijlage VIII |
|||||||||
|
|
|
|
17 g/100 kg boterconcentraat |
Bijlage VIII |
|
||||||
|
|
|
|
10,34 kg/t boterconcentraat |
Bijlage V |
|
||||||
|
|
|
|
|
|
Opmerking 2 |
||||||
|
|
|
|
|
|
Opmerking 2 |
||||||
|
|
|
lecithine (E 322) |
Max. 0,5 % m/m |
|
Opmerking 2 |
||||||
|
|
|
NaC1 |
Max. 0,75 % m/m |
ISO 15648:2004|IDF 179:2004 |
|
||||||
|
|
|
Vrije vetzuren |
1,2 mmol/100 g vet |
ISO 1740:2004|IDF 6:2004 |
|
||||||
|
|
|
PG (max.) |
Max. 0,5 meq. zuurstof/1 000 g vet |
ISO 3976:2006|IDF 74:2006 |
Opmerking 1 |
||||||
|
|
|
Smaak |
Vers |
|
|
||||||
|
|
|
Geur |
Geen vreemde geuren |
|
|
||||||
|
|
|
Overige |
Geen neutraliserende stoffen, antioxidanten of conserveermiddelen |
|
|
||||||
|
Verordening (EG) nr. 1898/2005, hoofdstuk IV |
Ongezouten boter |
Vet |
Min. 82 % m/m |
ISO 17189:2003|IDF 194:2003 |
|
||||||
|
|
|
Water |
Max. 16 % m/m |
ISO 3727-1:2001|IDF 80-1:2001 |
|
||||||
|
|
|
VDS |
Max. 2 % m/m |
ISO 3727-2:2001|IDF 80-2:2001 |
|
||||||
|
Verordening (EG) nr. 1898/2005, hoofdstuk IV |
Gezouten boter |
Vet |
Min. 80 % m/m |
ISO 17189:2003|IDF 194:2003 |
|
||||||
|
|
|
Water |
Max. 16 % m/m |
ISO 3727-1:2001|IDF 80-1:2001 |
|
||||||
|
|
|
VDS (exclusief zout) |
Max. 2 % m/m |
ISO 3727-2:2001|IDF 80-2:2001 |
|
||||||
|
|
|
Zout |
Max. 2 % m/m |
ISO 15648:2004|IDF 179:2004 |
|
||||||
|
Artikel 9 en titel II van Verordening (EG) nr. 1255/1999 |
Kaas van schapen- en/of geitenmelk |
Koemelk |
< 1 % m/m |
Bijlage IX |
|
||||||
|
Verordening (EEG) nr. 2921/90 |
Bijlage I — Zuurcaseïne |
Water |
Max. 12,00 % m/m |
ISO 5550:2006|IDF 78:2006 |
|
||||||
|
|
|
Vet |
Max. 1,75 % m/m |
ISO 5543:2004|IDF127:2004 |
|
||||||
|
|
|
Vrije vetzuren |
Max. 0,30 ml 0,1 N NaOH-oplossing/g |
ISO 5547:1978|IDF 91:1979 |
|
||||||
|
Verordening (EEG) nr. 2921/90 |
Bijlage I — Lebcaseïne |
Water |
Max. 12,00 % m/m |
ISO 5550:2006|IDF 78:2006 |
|
||||||
|
|
|
Vet |
Max. 1,00 % m/m |
ISO 5543:2004|IDF 127:2004 |
|
||||||
|
|
|
As |
Min. 7,50 % m/m |
ISO 5545:1978|IDF 90:1979 |
|
||||||
|
Verordening (EEG) nr. 2921/90 |
Bijlage I — Caseïnaat |
Water |
Max. 6,00 % m/m |
ISO 5550:2006|IDF 78:2006 |
|
||||||
|
|
|
Melkeiwitten |
Min. 88,00 % m/m |
ISO 5549:1978|IDF 92:1979 |
|
||||||
|
|
|
Vet en as |
Max. 6,00 % m/m |
ISO 5543:2004|IDF 127:2004 |
|
||||||
|
|
|
Vaste as |
|
ISO 5544:1978|IDF 89:1979 |
|
||||||
|
|
|
As |
|
ISO 5545:1978|IDF 90:1979 |
|
||||||
|
Verordening (EEG) nr. 2921/90 |
Bijlage II — Zuurcaseïne |
Water |
Max. 10,00 % m/m |
ISO 5550:2006|IDF 78:2006 |
|
||||||
|
|
|
Vet |
Max. 1,50 % m/m |
ISO 5543:2004|IDF 127:2004 |
|
||||||
|
|
|
Vrije vetzuren |
Max. 0,20 ml 0,1 N NaOH-oplossing/g |
ISO 5547:1978|IDF 91:1979 |
|
||||||
|
|
|
TKG (max.) |
30 000/ g |
ISO 4833:2003 |
Opmerking 3 |
||||||
|
|
|
Colibacteriën |
Geen in 0,1 g |
Bijlage X |
Opmerking 3 |
||||||
|
|
|
Therm. (max.) |
5 000/ g |
ISO 4833:2003 |
Opmerkingen 3 en 4 |
||||||
|
Verordening (EEG) nr. 2921/90 |
Bijlage II — Lebcaseïne |
Water |
Max. 8,00 % m/m |
ISO 5550:2006|IDF 78:2006 |
|
||||||
|
|
|
Vet |
Max. 1,00 % m/m |
ISO 5543:2004|IDF 127:2004 |
|
||||||
|
|
|
As |
Min. 7,50 % m/m |
ISO 5545:1978|IDF 90:1979 |
|
||||||
|
|
|
TKG (max.) |
30 000/ g |
ISO 4833:2003 |
Opmerking 3 |
||||||
|
|
|
Colibacteriën |
Geen in 0,1 g |
Bijlage X |
Opmerking 3 |
||||||
|
|
|
Therm. (max.) |
5 000/ g |
ISO 4833:2003 |
Opmerkingen 3 en 4 |
||||||
|
Verordening (EEG) nr. 2921/90 |
Bijlage II — Caseïnaat |
Water |
Max. 6,00 % m/m |
ISO 5550:2006|IDF 78:2006 |
|
||||||
|
|
|
Melkeiwitten |
Min. 88,00 % m/m |
ISO 5549:1978|IDF 92:1979 |
|
||||||
|
|
|
Vet en as |
Max. 6,00 % m/m |
ISO 5543:2004|IDF 127:2004 ISO 5544:1978|IDF 89:1979 of ISO 5545:1978|IDF 90:1979 |
|
||||||
|
|
|
TKG (max.) |
30 000/ g |
ISO 4833:2003 |
Opmerking 3 |
||||||
|
|
|
Colibacteriën |
Geen in 0,1 g |
Bijlage X |
Opmerking 3 |
||||||
|
|
|
Therm. (max.) |
5 000/g |
ISO 4833:2003 |
Opmerkingen 3 en 4 |
||||||
|
Verordening (EEG) nr. 2921/90 |
Bijlage III — Caseïnaat |
Water |
Max. 6,00 % m/m |
ISO 5550:2006|IDF 78:2006 |
|
||||||
|
|
|
Melkeiwitten |
Min. 85,00 % m/m |
ISO 5549:1978|IDF 92:1979 |
|
||||||
|
|
|
Vet |
Max. 1,50 % m/m |
ISO 5543:2004|IDF 127:2004 |
|
||||||
|
|
|
Lactose |
Max. 1,00 % m/m |
ISO 5548:2004|IDF 106:2004 |
|
||||||
|
|
|
As |
Max. 6,50 % m/m |
ISO 5544:1978|IDF 89:1979 of ISO 5545:1978|IDF 90:1979 |
|
||||||
|
|
|
TKG (max.) |
30 000/g |
ISO 4833:2003 |
Opmerking 3 |
||||||
|
|
|
Colibacteriën |
Geen in 0,1 g |
Bijlage X |
Opmerking 3 |
||||||
|
|
|
Therm. (max.) |
5 000/ g |
ISO 4833:2003 |
Opmerkingen 3 en 4 |
||||||
|
Verordening (EG) nr. 2799/1999 |
Mengvoeders en mageremelkpoeder (MMP) (voor diervoeding) |
Water (zurekarnemelkpoeder) |
Max. 5 % m/m |
Bijlage XIX |
|
||||||
|
|
|
Eiwit |
Min. 31,4 % m/m van de vetvrije droge stof |
ISO 8968-1|2|3:2001|IDF 20-1|2|3:2001 |
|
||||||
|
|
|
Water (MMP) |
Max. 5 % m/m |
ISO 5537:2004|IDF 26:2004 |
|
||||||
|
|
|
Vet (MMP) |
Max. 11 % m/m |
ISO 1736:2000|IDF 9C:1987 |
|
||||||
|
|
|
Lebwei (MMP) |
Geen |
Bijlage XIII |
Opmerking 6 |
||||||
|
|
|
Zetmeel (MMP) |
Geen |
Bijlage XVII |
|
||||||
|
|
|
Water (mengsels) |
Max. 5 % m/m van de vetvrije stof |
ISO 5537:2004|IDF 26:2004 |
|
||||||
|
|
|
Vet (mengsels) |
|
Richtlijn 84/4/EEG van de Commissie (PB L 15 van 18.1.1984, blz. 29) |
|
||||||
|
|
|
Lebwei (mengsels) |
Geen |
Bijlage XIII |
|
||||||
|
|
|
MMP-gehalte (eindproduct) |
Min. 50 % m/m |
Bijlage XVI |
|
||||||
|
|
|
Vet (eindproduct) |
Min. 2,5 % m/m of 5 % m/m |
Richtlijn 84/4/EEG van de Commissie (PB L 15 van 18.1.1984, blz. 29) |
Opmerking 7 |
||||||
|
|
|
Zetmeel (eindproduct) |
Min. 2 % m/m |
Bijlage XVII |
Opmerking 8 |
||||||
|
|
|
Koper (eindproduct) |
25 ppm |
Richtlijn 78/633/EEG van de Commissie (PB L 206 van 26.7.1987, blz. 43) |
|
||||||
|
Verordening (EG) nr. 214/2001 |
MMP (spray) |
Vet |
Max. 1,0 % m/m |
ISO 1736:2000|IDF 9C:1987 |
|
||||||
|
|
|
Eiwit |
Min. 31,4 % (2)m/m van de vetvrije droge stof |
ISO 8968-1/2:2001|IDF 20-1/2:2001 |
|
||||||
|
|
|
Water |
Max. 3,5 % m/m |
ISO 5537:2004|IDF 26:2004 |
|
||||||
|
|
|
Zuurgraad |
Max. 19,5 ml 0,1 N NaOH, 10 g vetvrije droge stof |
ISO 6091:1980|IDF 86:1981 |
|
||||||
|
|
|
Lactaten |
Max. 150 mg/100 g vetvrije droge stof |
ISO 8069:2005|IDF 69:2005 |
|
||||||
|
|
|
Fosfatase |
Negatief |
ISO 11816-1:2006|IDF 155-1:2006 |
|
||||||
|
|
|
Onoplosbaarheid |
Max. 0,5 ml bij 24 °C |
ISO 8156:2005|IDF 129:2005 |
|
||||||
|
|
|
Verbrande deeltjes |
Filterschijf A of B (15,0 mg) |
ADPI (1990) |
|
||||||
|
|
|
TKG |
40 000/ g |
ISO 4833:2003 |
Opmerking 3 |
||||||
|
|
|
Colibacteriën |
Negatief/ 0,1 g |
Bijlage X |
Opmerking 3 |
||||||
|
|
|
Karnemelk |
Negatief |
Bijlage XIV |
|
||||||
|
|
|
Lebwei |
Negatief |
Bijlage XII |
|
||||||
|
|
|
Zure wei |
Negatief |
|
Opmerking 2 |
||||||
|
|
|
Antibiotica |
|
Bijlage XV |
|
DEEL B
De in deel B opgenomen referentiemethoden kunnen worden gebruikt voor de analyse van producten die onder een van de in kolom 1 vermelde verordeningen vallen.
|
Verordening van de Commissie |
Product |
GN-code |
Parameter |
Grenswaarde |
Referentiemethode |
Opmerking |
|
Verordening (EEG) nr. 2658/87 Verordening (EG) nr. 2535/2001 Verordening (EG) nr. 1282/2006 |
Melk en room, niet ingedikt, zonder toegevoegde suiker of andere zoetstoffen |
0401 |
Vet (≤ 6 % m/m) |
De grenswaarden zijn vermeld in de omschrijving van de GN-code voor het betrokken product en eventueel in deel 9 van bijlage I (restitutienomenclatuur) van Verordening (EEG) nr. 3846/87 van de Commissie (PB L 366 van 24.12.1987, blz. 1) of in Verordening (EG) nr. 2535/2001 (PB L 341 van 22.12.2001, blz. 29). |
ISO 1211:2001|IDF 1D:1996 |
|
|
|
|
|
Vet (> 6 % m/m) |
|
ISO 2450:1999|IDF 16C:1987 |
|
|
|
Melk en room, ingedikt of met toegevoegde suiker of andere zoetstoffen |
0402 |
Vet (vloeibare vorm) |
|
ISO 1737:1999|IDF 13C:1987 |
|
|
|
|
|
Vet (vaste vorm) |
|
ISO 1736:2000|IDF 9C:1987 |
|
|
|
|
|
Eiwit |
|
ISO 8968-1|2|3:2001|IDF 20-1|2|3:2001 |
|
|
|
|
|
Sucrose (normaal gehalte) |
|
ISO 2911:2004| IDF 35:2004 |
|
|
|
|
|
Sucrose (laag gehalte) |
|
|
Opmerking 2 |
|
|
|
|
Droge stof (GMS) |
|
ISO 6734:1989|IDF 15B:1991 |
|
|
|
|
|
Droge stof (GMR) |
|
ISO 6731:1989|IDF 21B:1987 |
|
|
|
|
|
Water (melkpoeder) |
|
ISO 5537:2004|IDF 26:2004 |
|
|
|
|
|
Water (roompoeder) |
|
Bijlage XVIII |
|
|
|
Karnemelk, gefermenteerde of aangezuurde melk en room, al dan niet ingedikt, met toegevoegde suiker of andere zoetstoffen |
0403 |
Vet |
|
ISO 1211:2001|IDF 1D:1996 ISO 1736:2000|IDF 9C:1987 ISO 2450:1999|IDF 16 C:1987 ISO 7208:1999|IDF 22B:1987 ISO 8262-3:2005|IDF 124-3:2005 |
|
|
|
|
|
Eiwit |
|
ISO 8968-1|2|3:2001|IDF 20-1|2|3:2001 |
|
|
|
|
|
Sucrose (normaal gehalte) |
|
ISO 2911:2004|IDF 35:2004 |
|
|
|
|
|
Sucrose (laag gehalte) |
|
|
Opmerking 2 |
|
|
|
|
Water (zurekarnemelkpoeder) |
|
Bijlage XIX |
|
|
|
|
|
Water (zoetekarnemelkpoeder) |
|
ISO 5537:2004|IDF26:2004 |
|
|
|
|
|
Droge stof (andere producten) |
|
Door de bevoegde autoriteit goedgekeurde methoden |
|
|
|
Wei, al dan niet ingedikt of met toegevoegde suiker of andere zoetstoffen; producten die uit natuurlijke melkbestanddelen bestaan |
0404 |
Vet |
|
ISO 1736:2000|IDF 9C:1987 ISO 2450:1999|IDF 16C:1987 ISO 7208:1999|IDF 22B:1987 |
|
|
|
|
|
Eiwit |
|
ISO 8968-1|2|3:2001|IDF 20-1|2|3:2001 |
|
|
|
|
|
Sucrose (normaal gehalte) |
|
ISO 2911:2004|IDF 35:2004 |
|
|
|
|
|
Sucrose (laag gehalte) |
|
|
Opmerking 2 |
|
|
|
0404 90 |
Eiwit |
|
ISO 8968 1/2 2001|IDF 20-1/2:2001 |
|
|
|
|
|
Water |
|
IDF 21B:1987 |
|
|
|
|
|
Droge stof |
|
ISO 6734:1989|IDF 15B:1991 |
|
|
|
|
|
(Ingedikte producten) |
|
ISO 6731:1989|IDF 21B:1987 |
|
|
|
Boter en andere melkvetten; zuivelpasta's |
0405 |
Vet (als ≤ 85 % m/m) |
|
ISO 17189:2003|IDF 194:2003 |
|
|
|
|
Boter |
Water |
|
ISO 3727-1:2001|IDF 80-1:2001 |
|
|
|
|
|
VDS |
|
ISO 3727-2:2001|IDF 80-2:2001 |
|
|
|
|
|
NaCl |
|
ISO 15648:2004|IDF 179:2004 |
|
|
|
|
|
Vet (als > 99 % m/m) |
|
IDF 24:1964 |
|
|
|
Butteroil |
|
Water (als vet < 99 % m/m) |
|
ISO 5536:2002|IDF 23:2002 |
|
|
|
Kaas en wrongel |
0406 |
Vet |
|
ISO 1735:2004|IDF 5:2004 |
|
|
|
|
|
Droge stof |
|
ISO 5534:2004|IDF 4:2004 |
|
|
|
|
|
Droge stof (Ricotta) |
|
ISO 2920:2004|IDF 58:2004 |
|
|
|
|
|
NaCl |
|
ISO 5943:2006|IDF 88:2006 |
|
|
|
|
|
Lactose |
|
ISO 5765-1/2:2002|IDF 79-1/2:2002 |
|
|
Verordening (EEG) nr. 2658/87 |
Mengvoeders |
2309 |
Lactose |
|
Bijlage XI |
|
Opmerkingen bij de lijst van EU-referentiemethoden:
Opmerking 1: Isolatie melkvet zoals beschreven in ISO 1740:1991 (donker bewaren).
Opmerking 2: Er is geen referentiemethode vastgesteld. De methoden worden door de bevoegde autoriteit goedgekeurd.
Opmerking 3: Monstervoorbehandeling volgens ISO 8261:2001|IDF 122:2001.
Opmerking 4: Incubatie gedurende 48 uur bij een temperatuur van 55 °C; let op dat uitdroging van het kweekmedium wordt voorkomen.
Opmerking 5: % VDS m/m = % droge stof m/m — % vet m/m.
Opmerking 6: Richtlijn 84/4/EEG van de Commissie.
Opmerking 7: Verordening (EG) nr. 2799/1999 van de Commissie (PB L 340 van 31.12.1999, blz. 3-27).
Opmerking 8: Richtlijn 78/633/EEG van de Commissie.
(1) Unbeschadet der Anforderungen der jeweiligen Verordnung.
(2) Per 1 september 2009 is het minimale eiwitgehalte 34 %.
BIJLAGE II
(Artikel 3)
BEOORDELING OF EEN PARTIJ AAN DE WETTELIJKE GRENSWAARDE VOLDOET
1. PRINCIPE
Wanneer in de desbetreffende wetgeving gedetailleerde monsternemingsprocedures worden vermeld, worden deze procedures gevolgd. In alle andere gevallen wordt een monster gebruikt dat bestaat uit ten minste drie componenten die aselect worden genomen uit de partij die moet worden gecontroleerd. Er kan een samengesteld monster worden bereid. Het verkregen resultaat wordt met de wettelijke grenswaarden vergeleken door berekening van een 95 %-betrouwbaarheidsinterval als 2 x standaarddeviatie, waarbij als standaarddeviatie wordt gebruikt: 1) als de methode via internationale samenwerking is gevalideerd, de waarden voor σr en σR; 2) bij een interne validering, de berekende interne reproduceerbaarheid. Dit betrouwbaarheidsinterval wordt vervolgens gelijkgesteld aan de meetonzekerheid van het resultaat.
2. DE METHODE IS VIA INTERNATIONALE SAMENWERKING GEVALIDEERD
In dit geval zijn de standaarddeviatie van de herhaalbaarheid σr en de standaarddeviatie van de reproduceerbaarheid σR bepaald en kan het laboratorium aantonen of de prestatiekenmerken van de gevalideerde methode worden gehaald.
Berekening het rekenkundig gemiddelde 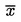 van de n herhaalde metingen.
van de n herhaalde metingen.
Bereken de totale onzekerheid (k = 2) van  als:
als:

Als het eindresultaat x van de meting wordt berekend met een vergelijking van de vorm x = y 1 + y 2, x = y 1 – y 2, x = y 1 · y 2 of x = y 1 / y 2, moeten de gebruikelijke procedures voor de combinatie van standaarddeviaties in dergelijke gevallen worden gevolgd.
De partij wordt geacht niet aan de bovenste wettelijke grenswaarde UL te voldoen als:
 ;
;
in alle andere gevallen wordt de partij geacht wel aan UL te voldoen.
De partij wordt geacht niet aan de onderste wettelijke grenswaarde LL te voldoen als:
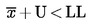 ;
;
in alle andere gevallen wordt de partij geacht wel aan LL te voldoen.
3. INTERNE VALIDERING MET BEREKENING VAN DE STANDAARDDEVIATIE VAN DE INTERNE REPRODUCEERBAARHEID
Wanneer methoden worden gebruikt die niet in deze verordening worden vermeld en er geen maat voor de precisie is bepaald, moet een interne validering worden uitgevoerd. In de vergelijkingen voor de berekening van de totale onzekerheid U moeten de standaarddeviatie van de interne herhaalbaarheid sir en de standaarddeviatie van de interne reproduceerbaarheid siR worden gebruikt in plaats van respectievelijk σr en σR.
De beslisregels zijn dezelfde als in geval 1). Als de partij echter wordt geacht niet aan de wettelijke grenswaarde te voldoen, moeten de metingen worden herhaald met de in deze verordening vermelde methode en de beslisprocedure van geval 1).
BIJLAGE III
(Artikel 4)
EVALUATIE VAN DE BEOORDELAARS EN DE BETROUWBAARHEID VAN DE RESULTATEN BIJ SENSORISCHE ANALYSES
De volgende procedures zijn van toepassing als methoden van puntentoekenning worden gebruikt (IDF-norm 99C:1997).
A) BEPALING VAN DE „HERHAALBAARHEIDSINDEX”
Over een periode van 12 maanden moet een beoordelaar minstens tien monsters als blinde duplo's analyseren. Dit zal meestal tijdens verscheidene sessies gebeuren. De resultaten voor de afzonderlijke productkenmerken worden met de volgende vergelijking geëvalueerd:

Hierbij is:
|
wI |
: |
herhaalbaarheidsindex |
|
xi1 |
: |
score voor de eerste evaluatie van monster xi |
|
xi2 |
: |
score voor de tweede evaluatie van monster xi |
|
n |
: |
aantal monsters |
De te evalueren monsters moeten representatief zijn voor een grote kwaliteitsspreiding. Daarbij mag wI niet hoger zijn dan 1,5 (op een schaal met vijf punten).
B) BEPALING VAN DE „DEVIATIE-INDEX”
Deze index dient te worden gebruikt om na te gaan of een beoordelaar dezelfde schaal voor de evaluatie van de kwaliteit gebruikt als een ervaren groep beoordelaars. De door de beoordelaar verkregen scores worden met het gemiddelde van de door de groep beoordelaars verkregen scores vergeleken.
De resultaten worden met de volgende vergelijking geëvalueerd:
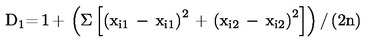
Hierbij is:
|
xi1; xi2 |
: |
zie onder A) |
|
|
: |
Gemiddelde score van de groep beoordelaars voor respectievelijk de eerste en de tweede evaluatie van monster xi |
|
n |
: |
aantal monsters (minstens tien per 12 maanden) |
De te evalueren monsters moeten representatief zijn voor een grote kwaliteitsspreiding. Daarbij mag D1 niet hoger zijn dan 1,5 (op een schaal met vijf punten).
De lidstaten moeten eventuele problemen die zij bij de toepassing van deze procedure ondervinden, melden.
Wanneer een bepaalde beoordelaar de grenswaarde van 1,5 voor de deviatie-index of de herhaalbaarheidsindex blijkt te overschrijden, moeten de deskundigen van de officiële instantie een of meer aselecte „herhalingstoetsen” uitvoeren bij monsters die door hen in de weken daarna worden geclassificeerd, of een of meer „begeleide” toetsen met deze beoordelaar uitvoeren. Er is intensief toezicht nodig om te kunnen beslissen of de diensten van deze beoordelaar verder zullen worden gebruikt. De resultaten dienen te worden gedocumenteerd en als bewijs van de follow-up te worden bewaard.
C) VERGELIJKING VAN DE IN VERSCHILLENDE REGIO'S VAN EEN LIDSTAAT EN IN VERSCHILLENDE LIDSTATEN VERKREGEN RESULTATEN
Indien van toepassing, moet minstens eenmaal per jaar een toets worden georganiseerd om de resultaten van beoordelaars uit verschillende regio's te vergelijken. Als er significante verschillen worden geconstateerd, moeten de nodige maatregelen worden genomen om de oorzaken daarvan te achterhalen en tot vergelijkbare resultaten te komen.
De lidstaten mogen toetsen organiseren om de resultaten van hun eigen beoordelaars en de beoordelaars van naburige lidstaten te vergelijken. Bij significante verschillen moet er een diepgaand onderzoek worden ingesteld teneinde tot vergelijkbare resultaten te komen.
De lidstaten moeten de resultaten van deze vergelijkingen aan de Commissie meedelen.
BIJLAGE IV
(Artikel 4)
SENSORISCHE EVALUATIE VAN BOTER
1. DOEL
Het doel van deze procedure voor de sensorische evaluatie van boter is een uniforme methode vast te stellen die in alle lidstaten van toepassing is.
Zie voor meer bijzonderheden de huidige versie van de internationale IDF-norm voor melk en zuivelproducten: IDF 99 — delen 1,2 en 3 over sensorische evaluatie.
2. DEFINITIES
Sensorische evaluatie (beoordeling): een onderzoek van de eigenschappen van een product met behulp van de zintuigen.
Panel: een groep geselecteerde beoordelaars die tijdens de beoordeling, zonder onderling contact en zonder elkaar te beïnvloeden, hun werk doen.
Beoordelaar: iemand die wordt gekozen op grond van zijn of haar vermogen om een sensorisch onderzoek uit te voeren. Een dergelijke beoordelaar kan een beperkte ervaring hebben.
Deskundige beoordelaar: iemand met een hoge mate van sensorische gevoeligheid en ervaring met sensorische methoden, die consistente en betrouwbare sensorische beoordelingen van uiteenlopende producten kan uitvoeren. Een dergelijke beoordelaar zal een goed sensorisch lange termijngeheugen hebben.
Toekennen van punten: een sensorische evaluatie door een panel met gebruikmaking van een cijferschaal. Er moet een nomenclatuur voor de afwijkingen worden gehanteerd.
Classificatie: een indeling in een kwaliteitsklasse op grond van de toegekende punten.
Controledocumenten: documenten die worden gebruikt om de individuele punten per eigenschap en de uiteindelijke classificatie van het product te noteren. (Dit document kan ook worden gebruikt om de chemische samenstelling te registreren.)
3. ONDERZOEKRUIMTE
Zie voor meer bijzonderheden ISO 8589 en ISO/DIS 22935-2 | IDF 99-2, punt 7.
Er moeten voorzorgsmaatregelen worden genomen om ervoor te zorgen dat de beoordelaars in de onderzoekruimte niet door uitwendige factoren worden beïnvloed.
De onderzoekruimte moet vrij van vreemde geuren en gemakkelijk schoon te houden zijn. De muren moeten licht van kleur en niet reflecterend zijn.
De onderzoekruimte en verlichting ervan moeten zodanig zijn dat ze de eigenschappen van de te beoordelen producten niet beïnvloeden.
De temperatuur van de ruimte moet zodanig kunnen worden geregeld dat de temperatuur van de boter constant blijft. Tijdens de classificatie moet de temperatuur van de boter 12 °C (±2 °C) zijn.
4. SELECTIE VAN DE BEOORDELAARS
Een beoordelaar moet vertrouwd zijn met boterproducten en de vaardigheden hebben om een sensorische evaluatie uit te voeren. Zijn/haar vaardigheid moet periodiek (minstens eens per jaar) door de bevoegde autoriteit worden gecontroleerd.
4.1. ISO/DIS 22935-1 | IDF 99-1, punt 4 (rekrutering) en punt 5.1, dienen te worden geraadpleegd voor bijzonderheden over algemene eisen en screeningstoetsen die kunnen worden gebruikt alvorens een nieuwe beoordelaar officieel werkzaam is.
Het is van cruciaal belang dat er continue opleiding is en er moeten periodiek algemene bijeenkomsten worden gehouden. Zie ISO 8586-1 voor informatie over de opleiding van panels.
4.2. De aanvankelijke opleiding omvat:
|
— |
algemene theorie en praktisch belang van sensorische evaluatie, |
|
— |
methoden, schalen en beschrijving van sensorische indrukken, |
|
— |
waarneming en herkenning van sensorische eigenschappen en specifieke sensorische termen, |
|
— |
achtergrondopleiding over de fabricage van boter, |
|
— |
gevalideerde referenties en monsters om de beoordelaar te helpen bij het herkennen van specifieke smaken en de smaakintensiteit in het product. |
5. EISEN VOOR HET PANEL
Het aantal beoordelaars in het panel moet oneven zijn; het minimale aantal is drie. De meeste beoordelaars moeten werknemers van de bevoegde autoriteit zijn of bevoegde personen die niet in dienst zijn bij de zuivelindustrie.
De leider van het panel is verantwoordelijk voor de hele procedure en kan aan het panel deelnemen.
Om te zorgen dat de panelleden een optimale prestatie leveren, moet vóór de evaluatie met een aantal factoren rekening worden gehouden:
|
— |
de panelleden mogen niet aan een ziekte lijden die hun prestaties nadelig kan beïnvloeden; indien dit wel het geval is, moet de beoordelaar in het panel door een ander worden vervangen; |
|
— |
de panelleden moeten op tijd komen om aan de evaluatie te kunnen deelnemen en ervoor zorgen dat zij voldoende tijd hebben om de evaluatie uit te voeren; |
|
— |
de panelleden mogen geen sterk geurende stoffen als parfum, aftershave of deodorant gebruiken, mogen geen sterk aromatische (bijv. sterk gekruide) voeding eten enz.; |
|
— |
de panelleden mogen een half uur vóór de evaluatie niet roken, eten of iets anders dan water drinken. |
6. PRESTATIES
Alle beoordelaars dienen geregeld aan en als voor sensorische evaluatie deel te nemen om hun vaardigheden op peil te houden. De frequentie is afhankelijk van de hoeveelheid boter en de omzet en moet minimaal één panel per maand zijn.
Ook ervaren beoordelaars moeten elk jaar aan een aantal panels deelnemen, zo mogelijk ten minste één keer per kwartaal.
7. MONSTERNEMING EN VOORBEHANDELING VAN HET MONSTER
Om mogelijke vooroordelen te voorkomen is het van cruciaal belang dat de identiteit van de monsters tijdens de beoordeling geheim blijft. De monsters dienen te worden gecodeerd.
Dit moet vóór de evaluatie worden georganiseerd. Er moeten eisen worden gesteld aan de temperatuur van de boter tijdens het vervoer naar de onderzoekruimte (6 °C ± 2 °C).
Wanneer de sensorische evaluatie in een koelhuis wordt uitgevoerd, wordt het monster met een boterboor genomen. Als de sensorische evaluatie op een andere plaats dan het koelhuis wordt uitgevoerd, moet een monster van minstens 500 g worden genomen. Tijdens de evaluatie moet de boter een temperatuur hebben van 12 °C (±2 °C). (NB: in ISO/DIS 22935-2 | IDF 99-2 is de evaluatietemperatuur van boter 14 °C ± 2 °C). Grote afwijkingen moeten tot elke prijs worden vermeden.
8. BEOORDELING VAN DE WAARDE PER EIGENSCHAP
8.1. Bij de sensorische evaluatie moeten de volgende drie eigenschappen worden beoordeeld: voorkomen, consistentie en smaak.
Voorkomen betreft de volgende kenmerken: kleur, zichtbare zuiverheid, ontbreken van fysische verontreiniging, ontbreken van schimmelgroei en uniformiteit van de waterdispersie. De waterdispersie wordt onderzocht volgens IDF-norm 112A/1989.
Consistentie betreft de volgende kenmerken: samenhang („body”), textuur en vastheid. De smeerbaarheid kan met fysische methoden worden gemeten als een lidstaat dit wenst om aan de eisen van de consument te voldoen. De Commissie kan besluiten de methoden hiervoor in de toekomst te harmoniseren.
Body is de term die verwijst naar de cohesie van het product zoals het wordt geconsumeerd. Deze wordt normaal gesproken geassocieerd met vastheid en smeerbaarheid en moet in het hele product uniform zijn. Deze eigenschap hangt nauw samen met de textuur en is het vermogen van het product om zijn eigen gewicht te kunnen dragen. De weerstand bij snijden is een indicatie en meting is mogelijk langs mechanische weg en via het mondgevoel en het vingergevoel.
Smaak is het kenmerk dat in de mond wordt waargenomen, voornamelijk door de smaakpapillen van de tong.
Geur is het kenmerk dat door de neus en de reukzin wordt waargenomen.
Bij een significante afwijking van de aanbevolen temperatuur is een betrouwbare evaluatie van de consistentie en de smaak onmogelijk. De temperatuur is van het grootste belang.
De classificatie van boter moet worden uitgesteld als de temperatuur buiten het aanbevolen interval ligt.
8.2. Elke eigenschap moet apart sensorisch worden geëvalueerd. De punten moeten volgens tabel 1 worden toegekend.
8.3. Het kan wenselijk zijn dat de beoordelaars, voordat ze aan de beoordeling beginnen, gezamenlijk punten toekennen aan voorkomen, consistentie en smaak van een of meer referentiemonsters teneinde tot uniformiteit te komen.
8.4. De punten voor goedkeuring van de boter worden als volgt toegekend:
Zie punt 7: Nomenclatuur en beschrijving van de criteria voor punten bij de toekenning.
|
|
Maximaal |
Vereist |
|
Voorkomen |
5 |
4 |
|
Consistentie |
5 |
4 |
|
Smaak/geur |
5 |
4 |
|
— |
Als de vereiste punten niet worden gehaald, moet een omschrijving van de afwijking worden gegeven. |
|
— |
De door iedere beoordelaar per eigenschap toegekende punten moeten in het controledocument worden genoteerd. |
|
— |
Het product wordt op grond van een meerderheidsbesluit goed- of afgekeurd. |
|
— |
Gevallen waarin verschillen tussen de afzonderlijke punten per eigenschap groter zijn dan 1 punt, mogen niet vaak voorkomen (hoogstens eens per 20 monsters). Als dat wel zo is, dient de panelleider de vaardigheid van het panel te controleren. |
9. TOEZICHT
Een panelleider, die een officiële werknemer van de bevoegde autoriteit moet zijn en lid van het panel mag zijn, is verantwoordelijk voor de hele gang van zaken. Hij of zij moet de individuele punten per eigenschap in het controledocument noteren en vastleggen of het product goed- of afgekeurd is.
10. NOMENCLATUUR
Zie tabel 2.
11. REFERENTIES
FIL-IDF 99C:1997 Sensory evaluation of dairy products by scoring — Reference method
ISO/DIS 22935 | IDF 99 Internationale norm voor melk en zuivelproducten — Sensorische analyse — Delen 1-3
ISO 8586-1: Sensorische analyse — Algemene leidraad voor de selectie, training en inspectie van beoordelaars — Deel 1
ISO 8589 Sensorische analyse — Algemene leidraad voor het ontwerp van onderzoekruimtes
FIL-IDF 112A:1989 Butter- Determination of water dispersion value
Tabel 1
Puntenwaardering voor boter
|
Voorkomen |
Consistentie |
Smaak + geur |
||||||
|
Punten |
Nr (1). |
Opmerkingen |
Punten (kwaliteitsklasse) |
Nr (1). |
Opmerkingen |
Punten (kwaliteitsklasse) |
Nr (1). |
Opmerkingen |
|
5 |
|
Zeer goed ideaal type hoogste kwaliteit (volledig droog) |
5 |
|
Zeer goed ideaal type hoogste kwaliteit (goed smeerbaar) |
5 |
|
Zeer goed ideaal type hoogste kwaliteit (absoluut zuivere fijnste smaak) |
|
4 |
|
Goed (2) geen duidelijke afwijkingen |
4 |
17 18 |
Goed (2) hard zacht |
4 |
|
Goed (2) geen duidelijke afwijkingen |
|
3 |
1 2 3 4 5 6 7 8 |
Redelijk (geringe afwijkingen) nat (vrij vocht) niet uniform, twee kleuren streperig gevlekt, gemarmerd vlekkerig olieafscheiding te sterk gekleurd slap, open textuur |
3 |
14 15 16 17 18 |
Redelijk (geringe afwijkingen) kort, brokkelig, kruimelig deegachtig, vettig kleverig hard zacht |
3 |
21 22 25 27 33 34 35 |
Redelijk (geringe afwijkingen) onzuiver vreemde smaak zuur kooksmaak, branderig voersmaak ruw, bitter te zout |
|
2 |
1 3 4 5 6 10 11 12 |
Slecht (duidelijke afwijkingen) nat (vrij vocht) streperig gevlekt, gemarmerd vlekkerig olieafscheiding vreemde stoffen beschimmeld onopgelost zout |
2 |
14 15 16 17 18 |
Slecht (duidelijke afwijkingen) kort, brokkelig, kruimelig deegachtig, vettig kleverig hard zacht |
2 |
21 22 23 25 32 33 34 35 36 38 |
Slecht (duidelijke afwijkingen) onzuiver vreemde smaak muf zuur oxidatiesmaak, metaalsmaak voersmaak ruw, bitter te zout goor, bedorven chemische smaak |
|
1 |
1 3 4 5 6 7 9 10 11 12 |
Zeer slecht (grote afwijkingen) nat (vrij vocht) streperig gevlekt, gemarmerd vlekkerig olieafscheiding te sterk gekleurd korrelig vreemde stoffen beschimmeld onopgelost zout |
1 |
14 15 16 17 18 |
Zeer slecht (grote afwijkingen) kort, brokkelig, kruimelig deegachtig, vettig kleverig hard zacht |
1 |
22 24 25 26 28 29 30 31 32 34 35 36 37 38 |
Zeer slecht (grote afwijkingen) vreemde smaak kazig, kaasgeur zuur gistachtig schimmelsmaak ranzig olieachtig, visachtig talkachtig oxidatiesmaak, metaalsmaak ruw, bitter te zout goor, bedorven moutachtig chemische smaak |
Tabel 2
Tabel van boterafwijkingen
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
||
|
(1) Zie tabel 2.
(2) De onder „goed” vermelde afwijkingen zijn slechts zeer geringe afwijkingen van het ideale type.
(3) Deze aanduiding moet zo weinig mogelijk worden gebruikt en alleen wanneer de afwijking niet nauwkeuriger kan worden beschreven.
BIJLAGE V
(Artikel 5)
BEPALING VAN HET GEHALTE AAN N-HEPTAANZUUR-TRIGLYCERIDE VAN BOTER, BUTTEROIL EN ROOM DOOR GASCHROMATOGRAFISCHE ANALYSE VAN TRIGLYCERIDEN
1. TOEPASSINGSGEBIED
Dit is een methode voor de bepaling van het gehalte aan n-heptaanzuur-triglyceride van butteroil, boter en room.
2. TERMINOLOGIE EN DEFINITIE
Gehalte aan n-heptaanzuur: het gehalte aan het triglyceride van n-heptaanzuur, zoals bepaald volgens deze methode.
NB: Het gehalte aan n-heptaanzuur wordt voor butteroil en boter uitgedrukt in kg per ton product en voor room in kg per ton melkvet.
3. PRINCIPE
Melkvet wordt overeenkomstig ISO 14156|IDF 172:2001 uit de verschillende producten geëxtraheerd. Het gehalte aan n-heptaanzuur-triglyceride in het geëxtraheerde vet wordt met behulp van capillaire gaschromatografie (GC) kwantitatief bepaald. Het resultaat voor het monster wordt aan de hand van capronzuur-triglyceride als interne standaard beoordeeld.
NB: Ook tributyrine blijkt een geschikte interne standaard te zijn.
4. REAGENTIA
Gebruik alleen reagentia waarvan vaststaat dat ze van analysekwaliteit zijn.
4.1. n-Hexaan.
4.2. Standaard capronzuur-triglyceride, ten minste 99 % zuiver.
4.3. Standaard n-heptaanzuur-triglyceride, ten minste 99 % zuiver.
4.4. Watervrij natriumsulfaat (Na2SO4).
5. APPARATUUR
Gangbare laboratoriumapparatuur en met name:
5.1. Analytische balans, tot op 1 mg nauwkeurig.
5.2. Maatkolven, 10 ml en 20 ml.
5.3. Centrifugebuizen, 30 ml.
5.4. Rotatieverdamper.
5.5. Droogstoof die op een temperatuur van 50 °C ± 5 °C kan worden gehouden.
5.6. Filtreerpapier, normale porositeit, diameter ongeveer 15 cm.
Apparatuur voor gaschromatografie.
5.7.1. Gaschromatograaf met een split/splitless of on-column injector en een vlamionisatiedetector (FID).
GC-kolom met een stationaire fase die met succes voor de scheiding van triglyceriden is gebruikt (100 % dimethylpolysiloxaan of 5 % fenyl- met 95 % methylpolysiloxaan). Kies de stationaire fase, de lengte van de kolom (tussen 4 m en 15 m), de inwendige diameter (tussen 0,22 mm en 0,50 mm) en de laagdikte (0,12 μm of meer) met inachtneming van de ervaringen van het laboratorium en het gebruikte injectiesysteem. In elk geval moet de gekozen kolom zorgen voor een volledige scheiding tussen de oplosmiddelpiek en capronzuur-triglyceride en een basislijnresolutie tussen de pieken van capronzuur- en n-heptaanzuur-triglyceride. Bijvoorbeeld onderstaande omstandigheden kunnen worden gebruikt.
5.7.2.1. Voorbeeld van de omstandigheden die bij een split-injector kunnen worden gebruikt:
|
— |
Draaggas: helium |
|
— |
Kolomdruk (top): 100 kPa |
|
— |
Kolom: kwartsglas, lengte 12 m, inwendige diameter 0,5 mm, laagdikte 0,1 μm |
|
— |
Stationaire fase: 100 % dimethylpolysiloxaan of 5 % fenyl- en 95 % dimethylpolysiloxaan (bijv. HT5) |
|
— |
Kolomtemperatuur: aanvankelijke temperatuur 130 °C gedurende 1 min, met 20 °C/min opgevoerd tot 260 °C en vervolgens met 30 °C/min opgevoerd tot 360 °C; gedurende 10 min op 360 °C houden |
|
— |
Detectortemperatuur: 370 °C |
|
— |
Injectortemperatuur: 350 °C |
|
— |
Splitverhouding 1:30 |
|
— |
Geïnjecteerde hoeveelheid monster: 1 μl |
5.7.2.2. Voorbeeld van de omstandigheden die bij een on-column injector kunnen worden gebruikt:
|
— |
Draaggas: waterstof (constant debiet) |
|
— |
Kolomdruk (top): 89 kPa |
|
— |
Kolom: kwartsglas, lengte 4 m, inwendige diameter 0,32 mm, laagdikte 0,25 μm |
|
— |
Stationaire fase: 5 % fenyl- en 95 % dimethylpolysiloxaan |
|
— |
Kolomtemperatuur: aanvankelijke temperatuur 60 °C gedurende 2 min, met 35 °C/min opgevoerd tot 340 °C; gedurende 5 min op deze temperatuur houden |
|
— |
Detectortemperatuur: 350 °C |
|
— |
Geïnjecteerde hoeveelheid monster: 1 μl |
5.8. Injectiespuit, 5 μl.
6. MONSTERNEMING
Het is belangrijk dat het laboratorium een monster ontvangt dat echt representatief is en niet tijdens het vervoer of de opslag is beschadigd of gewijzigd.
De monsterneming is niet in de in deze bijlage gespecificeerde methode opgenomen. Zie voor een aanbevolen monsternemingsmethode de norm IDF 50C:1995 of ISO 707-1997 — Melk en zuivelproducten — Leidraad voor monsterneming.
7. PROCEDURE
7.1. Voorbehandeling van het monster en de analysehoeveelheid
Zie ISO 14156 | IDF 172:2001.
7.1.1. Butteroil, Boter
7.1.1.1. Smelt 50-100 g monster in de droogstoof (5.5).
7.1.1.2. Weeg 0,5-1,0 g watervrij natriumsulfaat (4.4) af in een vouwfilter.
7.1.1.3. Filtreer het vet over het filter met watervrij natriumsulfaat en vang het filtraat op in een in de droogstoof (5.5) geplaatst bekerglas. Let op dat er bij het overschenken van de gesmolten boter op het filter geen serum wordt overgebracht.
7.1.2. Room
7.1.2.1. Breng het monster op een temperatuur van 20 °C ± 2 °C.
7.1.2.2. Meng of roer het monster grondig.
7.1.2.3. Verdun een zodanige hoeveelheid monster dat een analysehoeveelheid van 100 ml wordt verkregen met ongeveer 4 % m/m vet.
7.1.2.4. Volg de procedure voor rauwe melk en gehomogeniseerde melk (zie ISO 14156 | IDF 172:2001, §8.3) om het vet uit de room te extraheren.
7.1.2.5. Weeg in een maatkolf van 10 ml (5.2) tot op 1 mg nauwkeurig 1 g geëxtraheerd vet af. Voeg 1 ml van oplossing 7.2.2 toe. Vul met n-hexaan (4.1) aan tot 10 ml en meng.
7.1.2.6. Breng 1 ml van oplossing 7.1.1.2 in een maatkolf van 10 ml (5.2) en verdun met n-hexaan (4.1) aan tot 10 ml.
7.2. Bereiding van de kalibratiestandaards
7.2.1. Los 100 mg n-heptaanzuur-triglyceride (4.3) op in 10 ml n-hexaan (4.1).
7.2.2. Los 100 mg capronzuur-triglyceride (4.2) op in 10 ml n-hexaan (4.1).
7.2.3. Breng 1 ml van oplossing 7.2.2 in een maatkolf van 10 ml (5.2). Vul met n-hexaan (4.1) aan tot 10 ml.
7.2.4. Breng 1 ml van oplossing 7.2.1 en 1 ml van oplossing 7.2.2 in een maatkolf van 10 ml (5.2). Vul met n-hexaan (4.1) aan tot 10 ml.
7.2.5. Breng 1 ml van oplossing 7.2.4 in een maatkolf van 10 ml (5.2). Vul met n-hexaan (4.1) aan tot 10 ml.
7.3. Chromatografische bepaling
7.3.1. Injecteer twee maal 1 μl van standaardoplossing 7.2.5.
7.3.2. Injecteer 1 μl van elke monsteroplossing.
NB: Als een on-column injector wordt gebruikt, moeten zowel de standaard- als de monsteroplossingen verder worden verdund.
7.3.3. Herhaal 7.3.1 om de drie monsters, zodat de monsters worden gegroepeerd tussen duplo-standaardinjecties. De resultaten worden gebaseerd op het rekenkundig gemiddelde van de responsfactoren uit de standaard-chromatogrammen.
8. BEREKENING VAN DE RESULTATEN
Integreer bij elk chromatogram het piekoppervlak voor de triglyceriden van n-heptaanzuur en capronzuur.
Volg deze instructies voor elke groep, d.w.z. voor elke verzameling gegroepeerde monsters. De vlak daarvoor tweemaal geïnjecteerde standaard is STD1 en de vlak daarna tweemaal geïnjecteerde standaard is STD2.
8.1. Kalibratie
8.1.1. Bereken de responsfactor voor elke duplo van STD1, Rf1(a) en Rf1(b)
Rf1(a) of Rf1(b) = (Piekoppervlak voor capronzuur-triglyceride/Piekoppervlak voor n-heptaanzuur-triglyceride) × 100
Bereken het rekenkundig gemiddelde van de responsfactor Rf1:
Rf1 = (Rf1(a) + Rf1(b)) / 2
8.1.2. Bereken evenzo het rekenkundig gemiddelde van de responsfactor STD2 en Rf2
8.1.3. Bereken het rekenkundig gemiddelde van de responsfactor Rf
Rf = (Rf1 + Rf2) /2
8.2. Monsters
Bereken voor elk monster-chromatogram tussen STD1 en STD2 het n-heptaanzuurgehalte C (kg/t):
C = (Piekoppervlak voor n-heptaanzuur-triglyceride × Rf × 100)/(Piekoppervlak voor capronzuur-triglyceride × Wt × 1 000)
Hierbij is:
|
— |
Wt = Gewicht van het afgewogen vet (g); |
|
— |
100 = verdunningsvolume voor het monster; |
|
— |
1 000 = omrekeningsfactor (van μg/g naar kg/ton). |
Houd bij botermonsters rekening met het vetgehalte van de boter en bereken een gecorrigeerde concentratie Cboter (kg/ton boter)
Cboter = Cvet × F
Hierbij is F het vetgehalte van de boter.
9. PRECISIE
Zie punt 12 voor de details over de methode voor de precisieberekening bij een ringonderzoek met boter volgens ISO 5725-1 en ISO 5725-2.
De waarden voor de herhaalbaarheids- en reproduceerbaarheidsgrens zijn voor het 95 %-betrouwbaarheidsniveau en mogen niet op andere dan de vermelde concentratiebereiken en matrices worden toegepast.
9.1. Herhaalbaarheid
Het absolute verschil tussen twee aparte testresultaten die binnen korte tijd door dezelfde persoon met dezelfde apparatuur in hetzelfde laboratorium met dezelfde methode en identiek testmateriaal worden verkregen, mag in niet meer dan 5 % van de gevallen groter zijn dan 0,35 kg/t.
9.2. Reproduceerbaarheid
Het absolute verschil tussen twee aparte testresultaten die door verschillende personen met verschillende apparatuur in verschillende laboratoria met dezelfde methode en identiek testmateriaal worden verkregen, mag in niet meer dan 5 % van de gevallen groter zijn dan 0,66 kg/t.
10. TOLERANTIEGRENZEN: ONDERGRENZEN (ONVOLDOENDE HOEVEELHEDEN)
10.1. Er moeten drie monsters van het product met de verklikstof worden genomen om te controleren of de toevoeging van de verklikstof correct is gebeurd.
10.2. Boter en boterconcentraat
10.2.1. De toe te voegen hoeveelheid bedraagt 11 kg ten minste 95 % zuiver n-heptaanzuur-triglyceride per ton boter, d.w.z. 10,45 kg/t.
10.2.2. De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het laagste van deze resultaten wordt met de volgende grenswaarden vergeleken:
|
— |
9,51 kg/t (95 % van de minimaal toe te voegen hoeveelheid 95 % zuiver n-heptaanzuur-triglyceride, één bepaling); |
|
— |
6,89 kg/t (70 % van de minimaal toe te voegen hoeveelheid 95 % zuiver n-heptaanzuur-triglyceride, één bepaling); |
|
— |
De concentratie van de verklikstof in het monster met het laagste resultaat wordt in combinatie met interpolatie tussen 9,51 kg/t en 6,89 kg/t gebruikt. |
10.3. Room
10.3.1. De toe te voegen hoeveelheid bedraagt 10 kg ten minste 95 % zuiver n-heptaanzuur-triglyceride per ton melkvet, d.w.z. 9,50 kg/t melkvet met verklikstof
10.3.2. De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het laagste van deze resultaten wordt met de volgende grenswaarden vergeleken:
|
— |
8,60 kg/t (95 % van de minimaal toe te voegen hoeveelheid 95 % zuiver n-heptaanzuur-triglyceride, één bepaling); |
|
— |
6,23 kg/t (70 % van de minimaal toe te voegen hoeveelheid 95 % zuiver n-heptaanzuur-triglyceride, één bepaling). |
|
— |
De concentratie van de verklikstof in het monster met het laagste resultaat wordt in combinatie met interpolatie tussen 8,60 kg/t en 6,23 kg/t gebruikt. |
11. TOLERANTIEGRENZEN: BOVENGRENZEN (HOEVEELHEDEN DIE MEER DAN 20 % TE GROOT ZIJN)
11.1. Er moeten drie monsters van het product met de verklikstof worden genomen om te controleren of de toevoeging van de verklikstof correct is gebeurd.
11.2. Boter en boterconcentraat
11.2.1. De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het gemiddelde van deze resultaten wordt met de volgende grenswaarde vergeleken:
|
— |
De bovengrens is 12,96 kg/t. |
11.3. Room
11.3.1. De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het gemiddelde van deze resultaten wordt met de volgende grenswaarde vergeleken:
|
— |
De bovengrens is 11,82 kg/t. |
12. AANVULLENDE INFORMATIE: STATISTISCHE ANALYSE VAN DE RESULTATEN VAN DE BEPALING VAN TRIHEPTANOAAT IN BOTERVET MET BEHULP VAN TRIGLYCERIDE-ANALYSE
Er zijn vier ringonderzoeken uitgevoerd voor de bepaling van het triheptanoaatgehalte van boter met verklikstof.
Aan het eerste ringonderzoek hebben negen laboratoria deelgenomen en er zijn geen specificaties vermeld over de gebruikte analysemethoden.
Aan het tweede ringonderzoek hebben tien laboratoria deelgenomen en daarbij zijn vier verschillende methoden gebruikt:
|
— |
Kwantitatieve bepaling van methylheptanoaat met behulp van n-nonaan of methylnonanoaat als interne standaard; |
|
— |
Kwantitatieve bepaling van triheptanoaat met behulp van tricaproaat als interne standaard; |
|
— |
Kwantitatieve bepaling van methylheptanoaat met behulp van een kalibratiemonster/mengsel; |
|
— |
Kwantitatieve bepaling van methylheptanoaat met behulp van een kalibratiemengsel. |
Bij de analyse van methylvetzuren (FAME) werden bovendien twee verschillende methyleringsprocedures gebruikt (De Francesco en Christopherson & Glass).
Gelet op de verkregen resultaten werden voor de uitvoering van het derde ringonderzoek twee methoden gekozen:
|
— |
Kwantitatieve bepaling van methylheptanoaat met behulp van n-nonaan of methylnonanoaat als interne standaard; |
|
— |
Kwantitatieve bepaling van triheptanoaat met behulp van tricaproaat als interne standaard. |
Uit de resultaten van de zeven laboratoria blijkt dat de FAME-methode een hogere variabiliteit oplevert en daarom werd besloten alleen de bepaling van triheptanoaat als triglyceride te gebruiken volgens de methode voor de kwantitatieve bepaling van triheptanoaat met behulp van tricaproaat als interne standaard. Daarnaast moet de triglyceride-analyse met behulp van een capillaire kolom worden uitgevoerd.
Bij het vierde ringonderzoek werden vier monsters (A, B, C en D) door negen laboratoria geanalyseerd (zie de tabellen 1 en 2).
Twee laboratoria (DE en EU) hebben de monsters met behulp van de FAME-methode geanalyseerd.
Vanwege het beperkte aantal laboratoria is de statistische berekening zowel bij het volledige gegevenspakket (figuren 1 en 2) mèt de FAME-resultaten als bij de gegevens van de TG-analyse uitgevoerd.
Tests op uitbijters:
|
— |
monster A: bij de Dixon-, Cochran- en Grubbs-toets op niveaus 1 en 5 % bleek één laboratorium uitbijter te zijn. |
|
— |
monster B: bij de Grubbs-toets op niveau 5 % bleek één laboratorium uitbijter te zijn. |
|
— |
monster C: bij de Dixon- en Grubbs-toets op niveaus 1 en 5 % bleek één laboratorium uitbijter te zijn. |
|
— |
monster D: bij de Dixon- en Grubbs-toets op niveaus 1 en 5 % bleek één laboratorium uitbijter te zijn. |
De uitbijter is niet in de berekening meegenomen.
Vermeldenswaardig is dat de resultaten van de FAME-methode met de gebruikte toetsen nooit als uitbijter werden aangemerkt.
Precisieparameters
De tabellen 1 en 2 bevatten de resultaten van alle laboratoria en de precisieparameters, berekend met een aanvaardbaar aantal (8) laboratoria maar helaas niet afkomstig van dezelfde analysemethode.
De tabellen 3 en 4 bevatten de resultaten van uitsluitend de TG-methode en de bijbehorende precisieparameters. Deze parameters zijn alleen aanvaardbaar als het geringe aantal laboratoria (6) aanvaardbaar is.
De figuren 2 en 3 tonen de trend van Sr en SR, berekend met de vier monsters van bovengenoemde twee gegevensverzamelingen.
Tabel 5 bevat de Sr- en SR-waarden met de bijbehorende gecombineerde waarden en de totale r- en R-parameters.
Ten slotte is het kritieke verschil bij het 95 %-waarschijnlijkheidsniveau (KrD95) berekend.
Tabel 1:
Statistische resultaten van de methoden TG + FAME*
|
Monster A |
|
R1 |
R2 |
Gem. |
Aantal laboratoria na eliminatie uitbijters |
8 |
|
RENNES |
FR1 |
11,0 |
11,1 |
11,1 |
Aantal uitbijters |
1 |
|
RIKILT |
NL |
11,2 |
11,2 |
11,2 |
Uitbijters |
DК |
|
ZPLA |
DE* |
11,6 |
11,8 |
11,7 |
Gemiddelde waarde |
11,3 |
|
ADAS |
GB |
11,4 |
11,2 |
11,3 |
Werkelijke waarde |
11,0 |
|
CNEVA |
FR2 |
11,4 |
11,4 |
11,4 |
Standaarddeviatie herhaalbaarheid (Sr) |
0,09 |
|
LODI |
IT |
11,1 |
11,3 |
11,2 |
Relatieve sd herhaalbaarheid (RSDr%) |
0,80 |
|
EELA |
FI |
11,3 |
11,2 |
11,3 |
Herhaalbaarheid r (95 %) |
0,26 |
|
ISPRA |
EU* |
11,0 |
11,0 |
11,0 |
Relatieve herhaalbaarheid r % |
2,24 |
|
D.V.F.A. |
DK |
13,3 |
11,8 |
12,6 |
Standaarddeviatie reproduceerbaarheid (SR) |
0,23 |
|
|
|
|
|
|
Relatieve sd reproduceerbaarheid (RSDR%) |
2,04 |
|
|
|
|
|
|
Reproduceerbaarheid R (95 %) |
0,84 |
|
|
|
|
|
|
Relatieve reproduceerbaarheid R % |
5,71 |
|
Monster B |
|
R1 |
R2 |
Gem. |
Aantal laboratoria na eliminatie uitbijters |
8 |
|
RENNES |
FR1 |
12,7 |
12,8 |
12,8 |
Aantal uitbijters |
1 |
|
RIKILT |
NL |
13,5 |
13,3 |
13,4 |
Uitbijters |
DK |
|
ZPLA |
DE* |
14,0 |
13,8 |
13,9 |
Gemiddelde waarde |
13,4 |
|
ADAS |
GB |
13,4 |
13,5 |
13,5 |
Werkelijke waarde |
13,5 |
|
CNEVA |
FR2 |
13,3 |
13,4 |
13,4 |
Standaarddeviatie herhaalbaarheid (Sr) |
0,14 |
|
LODI |
IT |
13,9 |
13,5 |
13,7 |
Relatieve sd herhaalbaarheid (RSDr%) |
1,04 |
|
EELA |
FI |
13,4 |
13,2 |
13,3 |
Herhaalbaarheid r (95 %) |
0,40 |
|
ISPRA |
EU* |
13,2 |
13,3 |
13,3 |
Relatieve herhaalbaarheid r % |
2,91 |
|
D.V.F.A. |
DK |
14,1 |
14,8 |
14,5 |
Standaarddeviatie reproduceerbaarheid (SR) |
0,35 |
|
|
|
|
|
|
Relatieve sd reproduceerbaarheid (RSDR%) |
2,61 |
|
|
|
|
|
|
Reproduceerbaarheid R (95 %) |
0,99 |
|
|
|
|
|
|
Relatieve reproduceerbaarheid R % |
7,31 |
Tabel 2:
Statistische resultaten van de methoden TG + FAME*
|
Monster C |
|
R1 |
R2 |
Gem. |
Aantal laboratoria na eliminatie uitbijters |
8 |
|
RENNES |
FR1 |
8,9 |
9,2 |
9,1 |
Aantal uitbijters |
1 |
|
RIKILT |
NL |
9,2 |
9,3 |
9,3 |
Uitbijters |
DK |
|
ZPLA |
DE* |
9,2 |
9,4 |
9,3 |
Gemiddelde waarde |
9,3 |
|
ADAS |
GB |
9,5 |
9,3 |
9,4 |
Werkelijke waarde |
9,3 |
|
CNEVA |
FR2 |
9,4 |
9,4 |
9,4 |
Standaarddeviatie herhaalbaarheid (Sr) |
0,14 |
|
LODI |
IT |
9,2 |
9,5 |
9,4 |
Relatieve sd herhaalbaarheid (RSDr%) |
1,50 |
|
EELA |
FI |
9,4 |
9,6 |
9,5 |
Herhaalbaarheid r (95 %) |
0,40 |
|
ISPRA |
EU* |
9,4 |
9,3 |
9,4 |
Relatieve herhaalbaarheid r % |
4,20 |
|
D.V.F.A. |
DK |
10,7 |
10,9 |
10,8 |
Standaarddeviatie reproduceerbaarheid (SR) |
0,17 |
|
|
|
|
|
|
Relatieve sd reproduceerbaarheid (RSDR%) |
1,82 |
|
|
|
|
|
|
Reproduceerbaarheid R (95 %) |
0,47 |
|
|
|
|
|
|
Relatieve reproduceerbaarheid R % |
5,10 |
|
Monster D |
|
R1 |
R2 |
Gem. |
Aantal laboratoria na eliminatie uitbijters |
8 |
|
RENNES |
FR1 |
1,6 |
1,6 |
1,6 |
Aantal uitbijters |
1 |
|
RIKILT |
NL |
2,1 |
2,1 |
2,1 |
Uitbijters |
DK |
|
ZPLA |
DE* |
2,3 |
2,3 |
2,3 |
Gemiddelde waarde |
2,1 |
|
ADAS |
GB |
2,1 |
2,2 |
2,2 |
Werkelijke waarde |
2,1 |
|
CNEVA |
FR2 |
2,1 |
2,1 |
2,1 |
Standaarddeviatie herhaalbaarheid (Sr) |
0,08 |
|
LODI |
IT |
2,2 |
1,9 |
2,1 |
Relatieve sd herhaalbaarheid (RSDr%) |
3,81 |
|
EELA |
FI |
2,3 |
2,3 |
2,3 |
Herhaalbaarheid r (95 %) |
0,22 |
|
ISPRA |
EU* |
2,3 |
2,3 |
2,3 |
Relatieve herhaalbaarheid r % |
10,67 |
|
D.V.F.A. |
DK |
3,4 |
2,9 |
3,2 |
Standaarddeviatie reproduceerbaarheid (SR) |
0,24 |
|
|
|
|
|
|
Relatieve sd reproduceerbaarheid (RSDR%) |
11,43 |
|
|
|
|
|
|
Reproduceerbaarheid R (95 %) |
0,67 |
|
|
|
|
|
|
Relatieve reproduceerbaarheid R % |
32,00 |
Tabel 3:
Statistische resultaten van de methoden TG + FAME*
|
Monster A |
|
R1 |
R2 |
Gem. |
Aantal laboratoria na eliminatie uitbijters |
6 |
|
RENNES |
FR1 |
11,0 |
11,1 |
11,1 |
Aantal uitbijters |
1 |
|
RIKILT |
NL |
11,2 |
11,2 |
11,2 |
Uitbijters |
DК |
|
ADAS |
GB |
11,4 |
11,2 |
11,3 |
Gemiddelde waarde |
11,2 |
|
CNEVA |
FR2 |
11,4 |
11,4 |
11,4 |
Werkelijke waarde |
11,0 |
|
LODI |
IT |
11,1 |
11,3 |
11,2 |
Standaarddeviatie herhaalbaarheid (Sr) |
0,09 |
|
EELA |
FI |
11,3 |
11,2 |
11,3 |
Relatieve sd herhaalbaarheid (RSDr%) |
0,80 |
|
D.V.F.A. |
DK |
13,3 |
11,8 |
12,6 |
Herhaalbaarheid r (95 %) |
0,25 |
|
|
|
|
|
|
Relatieve herhaalbaarheid r % |
2,24 |
|
|
|
|
|
|
Standaarddeviatie reproduceerbaarheid (SR) |
0,13 |
|
|
|
|
|
|
Relatieve sd reproduceerbaarheid (RSDR%) |
1,16 |
|
|
|
|
|
|
Reproduceerbaarheid R (95 %) |
0,36 |
|
|
|
|
|
|
Relatieve reproduceerbaarheid R % |
3,25 |
|
Monster B |
|
R1 |
R2 |
Gem. |
Aantal laboratoria na eliminatie uitbijters |
6 |
|
RENNES |
FR1 |
12,7 |
12,8 |
12,8 |
Aantal uitbijters |
1 |
|
RIKILT |
NL |
13,5 |
13,3 |
13,4 |
Uitbijters |
DК |
|
ADAS |
GB |
13,4 |
13,5 |
13,5 |
Gemiddelde waarde |
13,3 |
|
CNEVA |
FR2 |
13,3 |
13,4 |
13,4 |
Werkelijke waarde |
13,5 |
|
LODI |
IT |
13,9 |
13,5 |
13,7 |
Standaarddeviatie herhaalbaarheid (Sr) |
0,15 |
|
EELA |
FI |
13,4 |
13,2 |
13,3 |
Relatieve sd herhaalbaarheid (RSDr%) |
1,13 |
|
D.V.F.A. |
DK |
14,1 |
14,8 |
14,5 |
Herhaalbaarheid r (95 %) |
0,42 |
|
|
|
|
|
|
Relatieve herhaalbaarheid r % |
3,16 |
|
|
|
|
|
|
Standaarddeviatie reproduceerbaarheid (SR) |
0,33 |
|
|
|
|
|
|
Relatieve sd reproduceerbaarheid (RSDR%) |
2,48 |
|
|
|
|
|
|
Reproduceerbaarheid R (95 %) |
0,93 |
|
|
|
|
|
|
Relatieve reproduceerbaarheid R % |
6,94 |
Tabel 4:
Statistische resultaten van de TG-methode
|
Monster C |
|
R1 |
R2 |
Gem. |
Aantal laboratoria na eliminatie uitbijters |
6 |
|
RENNES |
FR1 |
8,9 |
9,2 |
9,1 |
Aantal uitbijters |
1 |
|
RIKILT |
NL |
9,2 |
9,3 |
9,3 |
Uitbijters |
DК |
|
ADAS |
GB |
9,5 |
9,3 |
9,4 |
Gemiddelde waarde |
9,3 |
|
CNEVA |
FR2 |
9,4 |
9,4 |
9,4 |
Werkelijke waarde |
9,3 |
|
LODI |
IT |
9,2 |
9,5 |
9,4 |
Standaarddeviatie herhaalbaarheid (Sr) |
0,15 |
|
EELA |
FI |
9,4 |
9,6 |
9,5 |
Relatieve sd herhaalbaarheid (RSDr%) |
1,61 |
|
D.V.F.A. |
DK |
10,7 |
10,9 |
10,8 |
Herhaalbaarheid r (95 %) |
0,42 |
|
|
|
|
|
|
Relatieve herhaalbaarheid r % |
4,51 |
|
|
|
|
|
|
Standaarddeviatie reproduceerbaarheid (SR) |
0,19 |
|
|
|
|
|
|
Relatieve sd reproduceerbaarheid (RSDR%) |
2,04 |
|
|
|
|
|
|
Reproduceerbaarheid R (95 %) |
0,53 |
|
|
|
|
|
|
Relatieve reproduceerbaarheid R % |
5,71 |
|
Monster D |
|
R1 |
R2 |
Gem. |
Aantal laboratoria na eliminatie uitbijters |
6 |
|
RENNES |
FR1 |
1,6 |
1,6 |
1,6 |
Aantal uitbijters |
1 |
|
RIKILT |
NL |
2,1 |
2,1 |
2,1 |
Uitbijters |
DК |
|
|
|
|
|
|
Gemiddelde waarde |
2,1 |
|
ADAS |
GB |
2,1 |
2,2 |
2,2 |
Werkelijke waarde |
2,1 |
|
CNEVA |
FR2 |
2,1 |
2,1 |
2,1 |
Standaarddeviatie herhaalbaarheid (Sr) |
0,09 |
|
LODI |
IT |
2,2 |
1,9 |
2,1 |
Relatieve sd herhaalbaarheid (RSDr%) |
4,29 |
|
EELA |
FI |
2,3 |
2,3 |
2,3 |
Herhaalbaarheid r (95 %) |
0,26 |
|
D.V.F.A. |
DK |
3,4 |
2,9 |
3,2 |
Relatieve herhaalbaarheid r % |
12,01 |
|
|
|
|
|
|
Standaarddeviatie reproduceerbaarheid (SR) |
0,25 |
|
|
|
|
|
|
Relatieve sd reproduceerbaarheid (RSDR%) |
11,90 |
|
|
|
|
|
|
Reproduceerbaarheid R (95 %) |
0,69 |
|
|
|
|
|
|
Relatieve reproduceerbaarheid R % |
33,32 |
Tabel 5
Herhaalbaarheid en reproduceerbaarheid (met FAME*)
|
|
Aantal labs |
Uitbijters |
Herhaalbaarheid Sr (95 %) |
Reproduceerbaarheid SR (95 %) |
||
|
Monster A |
8 |
1 |
0,09 |
0,23 |
||
|
Monster Β |
8 |
1 |
0,14 |
0,35 |
||
|
Monster C |
8 |
1 |
0,14 |
0,17 |
||
|
Monster D |
8 |
1 |
0,08 |
0,24 |
||
|
Gecombineerde waarde |
|
|
0,116 |
0,256 |
||
|
|
|
|
R |
R |
||
|
Gecombineerde waarde * 2,8 |
|
|
0,324 |
0,716 |
||
|
KrD95 = 0,40 Voor triheptanoaat vermelde minimale zuiverheid = 95 % Voor triheptanoaat in botervet vermelde minimale grenswaarde = 11 kg/t Rekening houdend met het kritieke verschil bij het 95 %-waarschijnlijkheidsniveau mag het gemiddelde van de twee resultaten niet lager zijn dan:
|
||||||
Herhaalbaarheid en reproduceerbaarheid (zonder FAME*)
|
|
Aantal labs |
Uitbijters |
Herhaalbaarheid Sr (95 %) |
Reproduceerbaarheid SR (95 %) |
||
|
Monster A |
6 |
1 |
0,09 |
0,13 |
||
|
Monster Β |
6 |
1 |
0,15 |
0,33 |
||
|
Monster C |
6 |
1 |
0,15 |
0,19 |
||
|
Monster D |
6 |
1 |
0,09 |
0,25 |
||
|
Gecombineerde waarde |
|
|
0,124 |
0,237 |
||
|
|
|
|
r |
R |
||
|
Gecombineerde waarde * 2,8 |
|
|
0,347 |
0,663 |
||
|
KrD95 = 0,36 Voor triheptanoaat vermelde minimale zuiverheid = 95 % Voor triheptanoaat in botervet vermelde minimale grenswaarde = 11 kg/t Rekening houdend met het kritieke verschil bij het 95 %-waarschijnlijkheidsniveau mag het gemiddelde van de twee resultaten niet lager zijn dan:
|
||||||
Figuur 1 (1)
Experimentele resultaten: monster A

Experimentele resultaten: monster B

Experimentele resultaten: monster C

Experimentele resultaten: monster D

Figuur 2
Standaarddeviatie herhaalbaarheid en reproduceerbaarheid bij verschillende niveau's (TG + FAME)

Figuur 3
Standaarddeviatie herhaalbaarheid en reproduceerbaarheid bij verschillende niveau's (TG)

Figuur 4
Voorbeeld met een on-column injector

(1) = FAME-methode
BIJLAGE VI
(Artikel 5)
BEPALING VAN HET VANILLINEGEHALTE VAN BOTERCONCENTRAAT, BOTER OF ROOM MET BEHULP VAN HOGEDRUKVLOEISTOFCHROMATOGRAFIE (HPLC)
1. DOEL EN TOEPASSINGSGEBIED
In deze methode wordt een werkwijze beschreven voor de kwantitatieve bepaling van vanilline in boterconcentraat, boter of room.
2. PRINCIPE
Een bekende hoeveelheid monster wordt met een mengsel van isopropanol/ethanol/acetonitril (1:1:2) geëxtraheerd. Het grootste gedeelte van het vet wordt neergeslagen door af te koelen tot een temperatuur tussen –15 en –20 °C en vervolgens te centrifugeren.
Na verdunnen met water wordt het vanillinegehalte met behulp van hogedrukvloeistofchromatografie (HPLC) bepaald.
3. APPARATUUR
Gangbare laboratoriumapparatuur en met name:
3.1. Diepvriezer met een temperatuurbereik van –15 °C tot –20 °C.
3.2. Wegwerpinjectiespuiten, 2 ml.
3.3. Membraanmicrofilters met een poriegrootte van 0,45 μm en bestand tegen een oplossing met 5 % extractievloeistof (4.4).
3.4. Vloeistofchromatografiesysteem, bestaande uit een pomp (stroomsnelheid 1,0 ml/min), een injector (20 μl injectie, automatisch of manueel), een UV-detector (ingesteld op 306 nm, 0,01 Å volle schaaluitslag), een recorder of integrator en een kolomthermostaat, ingesteld op 25 °C.
3.5. Analysekolom (250 mm × 4,6 mm ID), gepakt met LiChrospher RP 18 (Merck, 5 μm) of gelijkwaardig.
3.6. Voorkolom (ongeveer 20 mm × 3 mm ID), droog gepakt met LiChrospher RP 18 (5-10 μm) of gelijkwaardig.
3.7. Centrifuge, 2 000 rpm.
4. REAGENTIA
Alle gebruikte reagentia moeten van analysekwaliteit zijn.
4.1. Isopropanol
4.2. Ethanol 96 % (v/v)
4.3. Acetonitril
4.4. Extractievloeistof
Meng isopropanol (4.1), ethanol (4.2) en acetonitril (4.3) in de verhouding 1:1:2 (v/v).
Vanilline (4-hydroxy-3-methoxybenzaldehyde) ≥ 98 %
4.5.1. Stamoplossing vanilline (= 500 μg/ml)
Weeg tot op 0,1 mg nauwkeurig ongeveer 50 mg (CM mg) vanilline (4.5) af in een maatkolf van 100 ml; voeg 25 ml extractievloeistof (4.4) toe en vul aan met water.
4.5.2. Standaardoplossing vanilline (= 10 μg/ml)
Pipetteer 5 ml van de stamoplossing vanilline (4.5.1) in een maatkolf van 250 ml en vul aan met water.
4.5.3. Methanol, HPLC-kwaliteit
4.5.4. IJsazijn
4.5.5. Water, HPLC-kwaliteit
4.5.6. Mobiele fase HPLC
Meng 300 ml methanol (4.5.3), ongeveer 500 ml water (4.5.5) en 20 ml ijsazijn (4.5.4) in een maatkolf van 1 000 ml en vul aan met water (4.5.5). Filtreer over een filter van 0,45 μm (3.3).
5. PROCEDURE
5.1. Voorbehandeling van het monster
5.1.1. Boter
Verwarm het monster totdat dit begint te smelten. Vermijd plaatselijke oververhitting bij ongeveer 30 °C. De boter mag hoe dan ook niet in twee fasen scheiden. Homogeniseer het monster, wanneer het zacht genoeg is, door het te schudden. Roer de boter 15 s voordat er een testmonster wordt genomen. Weeg tot op 1 mg nauwkeurig ongeveer 5 g (SM g) boter af in een maatkolf van 100 ml.
5.1.2. Boterconcentraat
Plaats vlak voor de monsterneming de verpakking met boterconcentraat in een oven van 40-50 °C totdat het product volledig is gesmolten. Meng het monster door zwenken of roeren, maar voorkom dat luchtbellen ontstaan doordat te hard wordt geroerd. Weeg tot op 1 mg nauwkeurig ongeveer 4 g (SM g) boterconcentraat af in een maatkolf van 100 ml.
5.1.3. Room
Verwarm het monster in een waterbad of droogstoof bij een temperatuur van 35-40 °C. Verdeel het vet homogeen door zwenken en, indien nodig, door roeren. Koel het monster snel af tot 20 ± 2 °C. Het monster moet er homogeen uitzien, anders moet de werkwijze worden herhaald. Weeg tot op 1 mg nauwkeurig ongeveer 10 g (SM g) room af in een maatkolf van 100 ml.
5.2. Bereiding van de testoplossing
Voeg ongeveer 75 ml extractievloeistof (4.4) toe aan het testmonster (5.1.1, 5.1.2 of 5.1.3), roer of schud krachtig gedurende ongeveer 15 minuten en vul aan met extractievloeistof (4.4). Breng ongeveer 10 ml van dit extract over in een reageerbuis, die afgesloten wordt met een stop. Plaats de reageerbuis ongeveer 30 minuten in de diepvriezer (3.1). Centrifugeer het koude extract gedurende 5 minuten bij ongeveer 2 000 rpm en decanteer onmiddellijk. Laat de gedecanteerde oplossing op kamertemperatuur komen. Pipetteer 5 ml van de gedecanteerde oplossing in een maatkolf van 100 ml en vul aan met water. Filtreer een hoeveelheid met een injectiespuit (3.2) door een membraanmicrofilter (3.3). Het filtraat is gereed voor de bepaling met behulp van HPLC.
5.3. Kalibratie
Pipetteer 5 ml van de standaardoplossing vanilline (4.5.2) in een maatkolf van 100 ml. Voeg 5 ml extractievloeistof (4.4) toe en vul met water aan tot de maatstreep. Deze oplossing bevat 0,5 μg vanilline/ml.
5.4. Bepaling met behulp van HPLC
Laat het chromatografiesysteem ongeveer 30 minuten stabiliseren. Injecteer de standaardoplossing (5.3). Herhaal dit totdat het verschil in piekoppervlakte of piekhoogte tussen twee opeenvolgende injecties kleiner is dan 2 %. Onder de beschreven omstandigheden bedraagt de retentietijd van vanilline ongeveer 9 minuten. Analyseer de standaardoplossing (5.3) in duplo door injectie van 20 μl. Injecteer 20 μl van de testoplossingen (5.2). Bepaal het oppervlak of de hoogte van de vanillinepiek. Herhaal de duplobepaling van de standaardoplossing (5.3) na tien injecties van de testoplossingen (5.2).
6. BEREKENING VAN DE RESULTATEN
Bereken het gemiddelde oppervlak (of de gemiddelde hoogte) (AC) van de vanillinepieken die horen bij de duplo-injecties van de standaardoplossingen vóór en na iedere reeks testoplossingen (vier piekoppervlakken of piekhoogtes in totaal).
Bereken de responsfactor (R):

Hierbij is CM de massa vanilline in mg (4.5.1).
Het gehalte (mg/kg) aan vanilline (C) van het testmonster is:
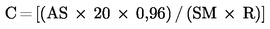
Hierbij is:
|
AS |
= |
het oppervlak of de hoogte van de vanillinepiek van het testmonster |
|
SM |
= |
de massa van het testmonster in g (5.1.1, 5.1.2 of 5.1.3) |
NB: Bij analyse van vanilline in room moet de concentratie van de verklikstof worden uitgedrukt in mg verklikstof/kg melkvet. Hiertoe wordt C vermenigvuldigd met 100/f, waarbij f het vetgehalte van de room in procent m/m is.
|
20 |
= |
de verdunningsfactor van de standaard en het testmonster |
|
0,96 |
= |
de correctiefactor voor het vetgehalte van de eerste verdunning van het testmonster |
NB: In plaats van het piekoppervlak kan de piekhoogte worden gebruikt (zie punt 8.3).
7. NAUWKEURIGHEID VAN DE METHODE
7.1. Herhaalbaarheid (r)
Het verschil tussen de resultaten van twee bepalingen die binnen een zo kort mogelijke tijd door dezelfde persoon met dezelfde apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 16 mg/kg.
7.2. Reproduceerbaarheid (R)
Het verschil tussen de resultaten van twee bepalingen die door verschillende personen in verschillende laboratoria met verschillende apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 27 mg/kg.
8. TOLERANTIEGRENZEN
8.1. Voor de controle op een homogene verdeling van de verklikstof moeten drie monsters van het product worden genomen.
Uit vanille of synthetische vanilline vervaardigde verklikstof
8.2.1. De toe te voegen hoeveelheid voor 4-hydroxy-3-methoxybenzaldehyde is 250 g per ton boterconcentraat of boter. Voor room is de toe te voegen hoeveelheid 250 g per ton melkvet.
8.2.2. De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het laagste van deze resultaten wordt met de volgende grenswaarden vergeleken:
|
— |
220,8 mg/kg (95 % van de minimaal toe te voegen hoeveelheid); |
|
— |
158,3 mg/kg (70 % van de minimaal toe te voegen hoeveelheid). |
De concentratie van de verklikstof in het monster met het laagste resultaat wordt in combinatie met interpolatie tussen 220,8 mg/kg en 158,3 mg/kg gebruikt.
Uitsluitend uit vanillepeulen of integrale extracten daarvan vervaardigde verklikstof:
8.3.1. De toe te voegen hoeveelheid voor 4-hydroxy-3-methoxybenzaldehyde is 100 g per ton boterconcentraat of boter. Voor room is de toe te voegen hoeveelheid 100 g per ton melkvet.
8.3.2. De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het laagste van deze resultaten wordt met de volgende grenswaarden vergeleken:
|
— |
78,3 mg/kg (95 % van de minimaal toe te voegen hoeveelheid); |
|
— |
53,3 mg/kg (70 % van de minimaal toe te voegen hoeveelheid). |
De concentratie van de verklikstof in het monster met het laagste resultaat wordt in combinatie met interpolatie tussen 78,3 mg/kg en 53,3 mg/kg gebruikt.
9. OPMERKINGEN
9.1. De recovery van toegevoegd vanilline bij een gehalte van 250 mg/kg butteroil varieert van 97,0 tot 103,8 %. Het gemiddelde gehalte dat gevonden werd, bedroeg 99,9 % met een standaarddeviatie van 2,7 %.
9.2. De standaardoplossing bevat 5 % extractievloeistof ter compensatie van de piekverbreding als gevolg van de aanwezigheid van 5 % extractievloeistof in de testoplossing. Hierdoor is kwantificering met behulp van de piekhoogte mogelijk.
9.3. De analyse is gebaseerd op een lineaire kalibratiecurve door de oorsprong.
9.4. Met behulp van geschikte verdunningen van de standaardoplossing (4.5.2) moet de lineariteit de eerste keer dat de analyse wordt uitgevoerd en vervolgens met regelmatige tussenpozen en na veranderingen in of herstel van de HPLC-apparatuur worden gecontroleerd. Vanilline kan door enzymen in ongepasteuriseerde room of producten daarvan worden afgebroken tot vanillinezuur, divanilline en andere verbindingen.
BIJLAGE VII
(Artikel 5)
BEPALING VAN DE ETHYLESTER VAN BETA-APO-8'-CAROTEENZUUR IN BOTERCONCENTRAAT EN BOTER MET BEHULP VAN SPECTROMETRIE
1. DOEL EN TOEPASSINGSGEBIED
In deze methode wordt een werkwijze beschreven voor de kwantitatieve bepaling van de ethylester van beta-apo-8'-caroteenzuur (apocaroteenzuurester) in boterconcentraat en boter. Onder apocaroteenzuurester wordt verstaan de totale hoeveelheid van alle stoffen in een extract van monsters, verkregen op de in de methode beschreven wijze, die bij 440 nm licht absorberen.
2. PRINCIPE
Het botervet wordt opgelost in petroleumether en vervolgens wordt de absorptie bij 440 nm gemeten. Het gehalte aan apocaroteenzuurester wordt met behulp van een externe standaard bepaald.
3. APPARATUUR
3.1. Meetpipetten, 0,25, 0,50, 0,75 en 1,0 ml.
3.2. Spectrofotometer, geschikt voor meting bij 440 nm (en 447-449 nm) en voorzien van cuvetten met een optische weglengte van 1 cm.
3.3. Maatkolven, 20 ml en 100 ml.
3.4. Analytische balans met een gevoeligheid van 0,1 mg, tot op 1 mg nauwkeurig en tot op 0,1 mg afleesbaar.
3.5. Oven, 45 °C ± 1 °C.
3.6. Asvrije filters, snel filtrerend.
4. REAGENTIA
Alle reagentia moeten van analysekwaliteit zijn.
Suspensie van apocaroteenzuurester (ongeveer 20 %).
4.1.1. Bepaal het gehalte van deze suspensie als volgt:
Verwarm de suspensie tot 45-50 °C en homogeniseer in de ongeopende oorspronkelijke verpakking. Weeg nauwkeurig ongeveer 400 mg af in een maatkolf (100 ml), los op in 20 ml chloroform (4.4) en vul met cyclohexaan (4.5) aan tot de maatstreep. Verdun 5 ml van deze oplossing met cyclohexaan tot 100 ml (oplossing A). Verdun 5 ml van oplossing A met cyclohexaan tot 100 ml. Meet de absorptie bij 447-449 nm (meet het maximum met cyclohexaan als blanco in cuvetten met een optische weglengte van 1 cm).
Gehalte aan apocaroteenzuurester P (%) = (Absmax × 40 000)/(Msusp × 2 550) of werk uit: (Absmax / 2 550) × (100/5) × (100/5) × (100/Msusp)
|
Absmax |
= |
absorptie van de meetoplossing bij het maximum |
|
Msusp |
= |
massa van de suspensie (g) |
|
2 550 |
= |
referentie-absorptie (1 %, 1 cm) |
|
P |
= |
zuiverheid (gehalte) van de suspensie (%) |
NB: Een suspensie van apocaroteenzuurester is gevoelig voor lucht, warmte en licht. Een ongeopende oorspronkelijke verpakking (luchtdicht onder stikstof) kan op een koele plaats gedurende ongeveer twaalf maanden worden bewaard. Na opening moet de inhoud binnen korte tijd worden gebruikt.
4.1.2. Standaardoplossing apocaroteenzuurester, ongeveer 0,2 mg/ml
Weeg tot op 1 mg nauwkeurig ongeveer 0,100 g suspensie apocaroteenzuurester (4.1.1) af (W), los dit op in petroleumether (4.2), breng de oplossing kwantitatief over in een maatkolf van 100 ml en vul met petroleumether aan tot de maatstreep.
Deze oplossing bevat (W × P)/10 mg apocaroteenzuurester/ml.
NB: De oplossing moet op een koele donkere plaats worden bewaard. Na een maand is de oplossing niet meer bruikbaar.
4.2. Petroleumether (40-60 °C).
4.3. Natriumsulfaat (watervrije korrels), vooraf gedurende twee uur gedroogd bij 102 °C.
4.4. Chloroform.
4.5. Cyclohexaan.
5. PROCEDURE
5.1. Bereiding van het testmonster
5.1.1. Boterconcentraat
Smelt het monster in een oven bij ongeveer 45 °C.
5.1.2. Boter
Smelt het monster in een oven bij ongeveer 45 °C en filtreer een representatieve hoeveelheid in een omgeving zonder sterk natuurlijk of kunstlicht bij 45 °C over een filter dat ongeveer 10 g watervrij natriumsulfaat (4.3) bevat. Vang een geschikte hoeveelheid botervet op.
5.2. Bepaling
Weeg tot op 1 mg nauwkeurig ongeveer 1 g boterconcentraat (of geëxtraheerd botervet (5.1.2)) af (M). Breng met behulp van petroleumether (4.2) kwantitatief over in een maatkolf van 20 ml (V), vul aan tot de maatstreep en meng goed.
Breng een hoeveelheid over in een cuvet van 1 cm en meet de absorptie bij 440 nm met petroleumether als blanco. Lees de concentratie van apocaroteenzuurester in de oplossing af uit de kalibratiecurve (C μg/ml).
5.3. Kalibratie
Pipetteer 0, 0,25, 0,5, 0,75 en 1,0 ml standaardoplossing apocaroteenzuurester (4.1.2) in vijf maatkolven van 100 ml. Vul met petroleumether (4.2) aan tot de maatstreep en meng.
De concentraties van de oplossingen liggen tussen 0 en ongeveer 2 μg/ml en worden nauwkeurig berekend aan de hand van de concentratie van de standaardoplossing (4.1.2): (W × P)/10 mg/ml. Meet de absorptie bij 440 nm met petroleumether (4.2) als blanco.
Zet de absorptie op de y-as uit tegen de concentratie apocaroteenzuurester op de x-as. Bereken de vergelijking van de kalibratiecurve.
6. BEREKENING VAN DE RESULTATEN
6.1. Het gehalte aan apocaroteenzuurester, uitgedrukt als mg/kg product, is:
Voor boterconcentraat: (C × V)/M
Voor boter: 0,82 (C ×V)/M
Hierbij is:
|
C |
= |
het gehalte aan apocaroteenzuurester in μg/ml, afgelezen uit de kalibratiecurve (5.3) |
|
V |
= |
volume (ml) van de testoplossing (5.2) |
|
M |
= |
de massa (g) van het testmonster (5.2) |
|
0,82 |
= |
een correctiefactor voor het gehalte van boter aan botervet. |
7. NAUWKEURIGHEID VAN DE METHODE
7.1. Herhaalbaarheid
7.1.1. Analyse van boter
Het verschil tussen de resultaten van twee bepalingen die binnen een zo kort mogelijke tijd door dezelfde persoon met dezelfde apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 1,4 mg/kg.
7.1.2. Analyse van boterconcentraat
Het verschil tussen de resultaten van twee bepalingen die binnen een zo kort mogelijke tijd door dezelfde persoon met dezelfde apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 1,6 mg/kg.
7.2. Reproduceerbaarheid
7.2.1. Analyse van boter
Het verschil tussen de resultaten van twee bepalingen die door verschillende personen in verschillende laboratoria met verschillende apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 4,7 mg/kg.
7.3. 2. Analyse van boterconcentraat
Het verschil tussen de resultaten van twee bepalingen die door verschillende personen in verschillende laboratoria met verschillende apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 5,3 mg/kg.
7.4. Herkomst van de precisiegegevens
De precisiegegevens zijn afkomstig van een experiment dat in 1995 in elf laboratoria is uitgevoerd met twaalf monsters met verklikstoffen (zes blinde duplo's) voor boter en twaalf monsters met verklikstoffen (zes blinde duplo's) voor boterconcentraat.
8. TOLERANTIEGRENZEN
8.1. Er moeten drie monsters van het product met de verklikstof worden genomen om te controleren of de toevoeging van de verklikstof correct is gebeurd.
8.2. Boter
8.2.1. De toe te voegen hoeveelheid voor boter is, rekening houdend met de achtergrondabsorptie, 22 mg/kg.
8.2.2. De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het laagste van deze resultaten wordt met de volgende grenswaarden vergeleken:
|
— |
17,7 mg/kg (95 % van de minimaal toe te voegen hoeveelheid); |
|
— |
12,2 mg/kg (70 % van de minimaal toe te voegen hoeveelheid). |
De concentratie van de verklikstof in het monster met het laagste resultaat wordt in combinatie met interpolatie tussen 17,7 mg/kg en 12,2 mg/kg gebruikt.
8.3. Boterconcentraat
8.3.1. De toe te voegen hoeveelheid voor boterconcentraat is, rekening houdend met de achtergrondabsorptie, 24 mg/kg.
De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het laagste van deze resultaten wordt met de volgende grenswaarden vergeleken:
|
— |
19,2 mg/kg (95 % van de minimaal toe te voegen hoeveelheid); |
|
— |
13,2 mg/kg (70 % van de minimaal toe te voegen hoeveelheid). |
De concentratie van de verklikstof in het monster met het laagste resultaat wordt in combinatie met interpolatie tussen 19,2 mg/kg en 13,2 mg/kg gebruikt.
BIJLAGE VIII
(Artikel 5)
BEPALING VAN SITOSTEROL OF STIGMASTEROL IN BOTER OF BOTERCONCENTRAAT MET BEHULP VAN CAPILLAIRE GASCHROMATOGRAFIE
1. DOEL EN TOEPASSINGSGEBIED
In deze methode wordt een werkwijze beschreven voor de kwantitatieve bepaling van sitosterol of stigmasterol in boter en boterconcentraat. Onder sitosterol wordt verstaan de totale hoeveelheid β-sitosterol en 22-dihydro-β-sitosterol; overige sitosterolen gelden als te verwaarlozen.
2. PRINCIPE
De boter of het boterconcentraat wordt met een ethanolische kaliumhydroxideoplossing verzeept, waarna het onverzeepbaar residu met diethylether wordt geëxtraheerd.
De sterolen worden in trimethylsilylethers omgezet en met behulp van capillaire gaschromatografie kwantitatief bepaald, waarbij betulinol als interne standaard wordt gebruikt.
3. APPARATUUR
3.1. Verzepingskolf, 150 ml, voorzien van een refluxkoeler met slijpstukken.
3.2. Scheitrechters, 500 ml.
3.3. Kolven, 250 ml.
3.4. Tegendrukscheitrechters, 250 ml, of soortgelijke apparatuur voor het opvangen van gebruikte diethylether.
3.5. Glazen kolom, 350 mm × 20 mm, met een filterplaat van gesinterd glas.
3.6. Waterbad of verwarmingsmantel.
3.7. Reactieflesjes, 2 ml.
Gaschromatograaf, geschikt voor het werken met een capillaire kolom, voorzien van een splitsysteem en bestaande uit:
3.8.1. een oven met thermostaat waarmee de kolommen met een nauwkeurigheid van ±1 °C op de gewenste temperatuur kunnen worden gehouden;
3.8.2. een verdampingseenheid met regelbare temperatuur;
3.8.3. een vlamionisatiedetector met versterker/verzwakker;
3.8.4. een integrator/recorder, geschikt voor gebruik met de versterker/verzwakker (3.8.3).
3.9. Een kwartsglas capillaire kolom, volledig gecoat met BP1 of equivalent (of een andere kolom met ten minste dezelfde resolutie) met een uniforme dikte van 0,25 μm; met deze kolom moet resolutie van de trimethylsilylderivaten van lanosterol en sitosterol mogelijk zijn. Hiervoor kan een kolom met een lengte van 12 m en een inwendige diameter van 0,2 mm worden gebruikt.
3.10. Chromatografische injectiespuit met geharde naald, 1 μl.
4. REAGENTIA
Alle reagentia dienen van analysekwaliteit te zijn. Het gebruikte water dient gedestilleerd water of water van ten minste gelijkwaardige zuiverheid te zijn.
4.1. Ethanol, minimaal 95 % zuiver.
4.2. Kaliumhydroxide, 60 %-oplossing. Los 600 g kaliumhydroxide (minimaal 85 %) op in water en vul met water aan tot 1 liter.
Betulinol, minimaal 99 % zuiver.
Oplossingen van betulinol in diethylether (4.4):
4.3.1.1. De concentratie van de betulinoloplossing voor de bepaling van sitosterol moet 1,0 mg/ml zijn;
4.3.1.2. De concentratie van de betulinoloplossing voor de bepaling van stigmasterol moet 0,4 mg/ml zijn.
4.4. Diethylether, analysekwaliteit (peroxide- en restvrij).
4.5. Natriumsulfaat (watervrije korrels), vooraf gedurende twee uur gedroogd bij 102 °C.
4.6. Silyleringsreagens, b.v. TRI-SIL (verkrijgbaar bij Pierce Chemical Co, cat.nr. 49001) of gelijkwaardig. (Waarschuwing: TRI-SIL is ontvlambaar, toxisch, bijtend en mogelijkerwijs carcinogeen. Het laboratoriumpersoneel moet op de hoogte zijn van de veiligheidsvoorschriften voor TRI-SIL en de nodige voorzorgsmaatregelen nemen.)
4.7. Lanosterol.
Sitosterol, bekende zuiverheid (P) minimaal 90 %.
NB 1: De zuiverheid van het voor de kalibratie gebruikte standaardmateriaal moet volgens de normalisatiemethode worden bepaald. Aangenomen wordt dat alle in het monster aanwezige sterolen in het chromatogram voorkomen, dat het totale piekoppervlak overeenkomt met 100 % van de sterol-bestanddelen en dat de detector voor alle sterolen dezelfde respons geeft. Er moet worden nagegaan of het systeem op het betrokken concentratiebereik lineair is.
4.8.1. Sitosterol-standaardoplossing: bereid een oplossing die tot op 0,001 mg/ml nauwkeurig ongeveer 0,5 mg/ml (W1) sitosterol (4.8) in diethylether (4.4) bevat.
Stigmasterol, bekende zuiverheid (P) minimaal 90 %.
4.9.1. Stigmasterol-standaardoplossing: bereid een oplossing die tot op 0,001 mg/ml nauwkeurig ongeveer 0,2 mg/ml (W1) stigmasterol (4.9) in diethylether (4.4) bevat.
4.10. Mengsel voor controle van de resolutie: bereid een oplossing die 0,05 mg/ml lanosterol (4.7) en 0,5 mg/ml sitosterol (4.8) in diethylether (4.4) bevat.
5. PROCEDURE
5.1. Bereiding van de standaardoplossingen voor chromatografie
De interne standaardoplossing (4.3.1.) moet op hetzelfde moment aan zowel de desbetreffende standaardoplossing met sterolen als aan het verzeepte monster (5.2.2.) worden toegevoegd.
5.1.1. Standaardoplossing sitosterol voor chromatografie: breng 1 ml van de sitosterol- standaardoplossing (4.8.1) in elk van twee reactieflesjes (3.7) en damp de diethylether af met een stikstofstroom. Voeg 1 ml interne standaardoplossing (4.3.1.1) toe en damp de diethylether af met een stikstofstroom.
5.1.2. Standaardoplossing stigmasterol voor chromatografie: breng 1 ml van de stigmasterol- standaardoplossing (4.9.1) in elk van de twee reactieflesjes (3.7) en damp de diethylether af met een stikstofstroom. Voeg 1 ml interne standaardoplossing (4.3.1.2) toe en damp de diethylether af met een stikstofstroom.
5.2. Bereiding van het onverzeepbaar residu
5.2.1. Laat het botermonster smelten bij een temperatuur van ten hoogste 35 °C en meng het monster zorgvuldig door het te roeren.
Weeg tot op 1 mg nauwkeurig ongeveer 1 g boter (W2) of boterconcentraat (W2) af in een kolf van 150 ml (3.1). Voeg 50 ml ethanol (4.1) en 10 ml kaliumhydroxideoplossing (4.2) toe. Bevestig de refluxkoeler, verwarm gedurende 30 minuten tot ongeveer 75 °C. Verwijder de koeler en laat de kolf afkoelen tot kamertemperatuur.
5.2.2. Voeg 1,0 ml interne standaardoplossing toe (4.3.1.1 als sitosterol wordt bepaald of 4.3.1.2 als stigmasterol wordt bepaald). Meng zorgvuldig en breng de inhoud van de kolf kwantitatief over in een scheitrechter van 500 ml (3.2), waarna de kolf achtereenvolgens wordt gewassen met 50 ml water en 250 ml diethylether (4.4). Schud de scheitrechter krachtig gedurende 2 minuten en wacht tot de fasen gescheiden zijn. Laat de waterige onderlaag weglopen en was de etherlaag door viermaal te schudden met 100 ml water.
NB 2: Om emulsievorming te voorkomen moet het wassen met water de eerste twee maal voorzichtig gebeuren (tienmaal omkeren). De derde maal kan gedurende 30 seconden krachtig worden geschud. Indien er een emulsie ontstaat, kan deze worden afgebroken door 5-10 ml ethanol toe te voegen. Indien ethanol wordt toegevoegd, moet er nog eens twee maal krachtig met water worden gewassen.
5.2.3. Laat de heldere zeepvrije etherlaag door een glazen kolom (3.5) met 30 g watervrij natriumsulfaat (4.5) lopen. Vang de ether op in een kolf van 250 ml (3.3). Voeg een kooksteentje toe en damp de oplossing vrijwel droog op een waterbad of met een verwarmingsmantel. Zorg er daarbij voor dat het verdampte oplosmiddel wordt opgevangen.
NB 3: Als de vloeistof bij een te hoge temperatuur volledig wordt drooggedampt, is het mogelijk dat er ook sterolen verloren gaan.
5.3. Bereiding van de trimethylsilylethers
5.3.1. Breng de in de kolf resterende etheroplossing met 2 ml diethylether over in een reactieflesje van 2 ml (3.7) en damp de ether af met een stikstofstroom. Was de kolf tweemaal als volgt: breng 2 ml diethylether in de kolf, breng deze over naar het reactieflesje en damp de ether af met stikstof.
5.3.2. Silyleer het monster door 1 ml TRI-SIL (4.6) toe te voegen. Sluit het flesje af en schud krachtig om de sterolen op te lossen. Verwarm, als de sterolen niet volledig oplossen, tot 65-70 °C. Laat de oplossing gedurende ten minste 5 minuten staan alvorens deze in de gaschromatograaf te injecteren. Silyleer de standaardoplossing en het mengsel om de resolutie te controleren (4.10) op dezelfde manier als de monsters.
NB 4: Het silyleren moet in een watervrij milieu gebeuren. Wanneer betulinol onvolledig is gesilyleerd, verschijnt er vlak bij de betulinol-piek een tweede piek.
Het silyleringsproces wordt gestoord door de aanwezigheid van ethanol in de oplossing, die een gevolg kan zijn van onvoldoende wassen na de extractie. Indien dit probleem aanhoudt, kan na de extractie nog een vijfde maal worden gewassen, waarbij gedurende 30 seconden krachtig wordt geschud.
5.4. Gaschromatografie
5.4.1. Keuze van de werkomstandigheden:
Volg voor de instelling van de gaschromatograaf de instructies van de fabrikant.
Voor de werkomstandigheden gelden de volgende richtlijnen:
|
— |
kolomtemperatuur: 265 °C |
|
— |
injectortemperatuur: 265 °C |
|
— |
detectortemperatuur: 300 °C |
|
— |
stroomsnelheid draaggas: 0,6 ml/minuut |
|
— |
waterstofdruk: 84 kPa |
|
— |
luchtdruk: 155 kPa |
|
— |
splitverhouding: 10:1 tot 50:1; de splitverhouding moet volgens de instructies van de fabrikant worden geoptimaliseerd en vervolgens moet worden gecontroleerd of de respons van de detector op het betrokken concentratiebereik lineair is. NB 5: Het is vooral belangrijk dat de liner van de injector regelmatig wordt schoongemaakt. |
|
— |
geïnjecteerde hoeveelheid: 1 μl TMSE-oplossing. |
Laat het systeem equilibreren en begin niet met de analyse voordat de respons voldoende stabiel is.
Stel deze omstandigheden afhankelijk van de kenmerken van de kolom en de gaschromatograaf zodanig in dat er chromatogrammen worden verkregen die aan de volgende eisen voldoen:
|
— |
de resolutie tussen de sitosterol-piek en de lanosterol-piek moet afdoende zijn. Bij een gesilyleerd mengsel voor controle op de resolutie (4.10) moet een soortgelijk chromatogram worden verkregen als in figuur 1 is weergegeven; |
|
— |
voor onderstaande sterolen moet ongeveer de daarbij vermelde relatieve retentietijd worden verkregen:
|
|
— |
de retentietijd voor betulinol moet ongeveer 24 minuten zijn. |
5.4.2. Analyse
Injecteer 1 μl gesilyleerde standaardoplossing (stigmasterol of sitosterol) en stel de kalibratieparameters van de integrator in.
Injecteer nog eens 1 μl gesilyleerde standaardoplossing om de responsfactor in vergelijking met betulinol te bepalen.
Injecteer 1 μl gesilyleerde monsteroplossing en meet de piekoppervlakken. Voor en na elke chromatografische reeks moet er standaardoplossing worden geïnjecteerd.
Een leidraad is dat vóór en na elke reeks van 6 injecties met monsteroplossing standaardoplossing moet worden geïnjecteerd.
NB 6: Bij de integratie van de stigmasterol-piek moet ook het oppervlak van eventuele staarten, zoals aangegeven bij de punten 1, 2 en 3 in figuur 2b, worden meegerekend.
Wanneer de totale hoeveelheid sitosterol wordt bepaald, moet bij de integratie van de sitosterol-piek ook het oppervlak van de piek van 22-dihydro-β-sitosterol (stigmastanol), dat vlak na sitosterol elueert (zie figuur 3b), worden meegerekend.
6. BEREKENING VAN DE RESULTATEN
6.1. Bepaal het oppervlak van de sterol-pieken en de betulinol-pieken van beide standaardoplossingen voor en na een reeks en bereken R1:
R1 = (gemiddeld oppervlak van de sterol-piek in de standaard)/(gemiddeld oppervlak van de betulinol-piek in de standaard)
Bepaal het oppervlak van de sterol-piek (stigmasterol en sitosterol) en de betulinolpiek in de monsteroplossing en bereken R2:
R2 = (oppervlak van de sterol-piek in het monster)/(oppervlak van de betulinol-piek in het monster)
|
W1 |
= |
hoeveelheid sterol (mg) in 1 ml standaardoplossing (4.8.1 of 4.9.1); |
|
W2 |
= |
gewicht van het monster (g) (5.2.1); |
|
P |
= |
zuiverheid van de standaard-sterol (4.8 of 4.9). |
Sterolgehalte van het monster (mg/kg) = ((R 2)/(R 1)) × ((W 1)/(W 2)) × P × 10.
7. NAUWKEURIGHEID VAN DE METHODE
7.1. Boter
7.1.1. Herhaalbaarheid
7.1.1.1. Stigmasterol
Het verschil tussen de resultaten van twee bepalingen die binnen een zo kort mogelijke tijd door dezelfde persoon met dezelfde apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 19,3 mg/kg.
7.1.1.2. Sitosterol
Het verschil tussen de resultaten van twee bepalingen die binnen een zo kort mogelijke tijd door dezelfde persoon met dezelfde apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 23,0 mg/kg.
7.1.2. Reproduceerbaarheid
7.1.2.1. Stigmasterol
Het verschil tussen de resultaten van twee bepalingen die door verschillende personen in verschillende laboratoria met verschillende apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 31,9 mg/kg.
7.1.2.2. Sitosterol
Het verschil tussen de resultaten van twee bepalingen die door verschillende personen in verschillende laboratoria met verschillende apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 8,7 % van het gemiddelde van de bepalingen.
7.1.3. Herkomst van de precisiegegevens
De precisiegegevens zijn afkomstig van een experiment dat in 1992 in acht laboratoria is uitgevoerd met zes monsters (drie blinde duplo's) voor stigmasterol en zes monsters (drie blinde duplo's) voor sitosterol.
7.2. Boterconcentraat
7.2.1. Herhaalbaarheid
7.2.1.1. Stigmasterol
Het verschil tussen de resultaten van twee bepalingen die binnen een zo kort mogelijke tijd door dezelfde persoon met dezelfde apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 10,2 mg/kg.
7.2.1.2. Sitosterol
Het verschil tussen de resultaten van twee bepalingen die binnen een zo kort mogelijke tijd door dezelfde persoon met dezelfde apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 3,6 % van het gemiddelde van de bepalingen.
7.2.2. Reproduceerbaarheid
7.2.2.1. Stigmasterol
Het verschil tussen de resultaten van twee bepalingen die door verschillende personen in verschillende laboratoria met verschillende apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 25,3 mg/kg.
7.2.2.2. Sitosterol
Het verschil tussen de resultaten van twee bepalingen die door verschillende personen in verschillende laboratoria met verschillende apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 8,9 % van het gemiddelde van de bepalingen.
7.2.3. Herkomst van de precisiegegevens
De precisiegegevens zijn afkomstig van een experiment dat in 1991 in negen laboratoria is uitgevoerd met zes monsters (drie blinde duplo's) voor stigmasterol en zes monsters (drie blinde duplo's) voor sitosterol.
8. TOLERANTIEGRENZEN
8.1. Er moeten drie monsters van het product met de verklikstof worden genomen om te controleren of de toevoeging van de verklikstof correct is gebeurd.
8.2. Boter
8.2.1. Stigmasterol
8.2.1.1. De toe te voegen hoeveelheid stigmasterol bedraagt 150 g ten minste 95 % zuiver stigmasterol per ton boter, d.w.z. 142,5 mg/kg, of 170 g ten minste 85 % zuiver stigmasterol per ton boter, d.w.z. 144,5 mg/kg.
8.2.1.2. De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het laagste van deze resultaten wordt met de volgende grenswaarden vergeleken:
|
— |
115,8 mg/kg (95 % van de minimaal toe te voegen hoeveelheid voor 95 % zuiver stigmasterol); |
|
— |
117,7 mg/kg (95 % van de minimaal toe te voegen hoeveelheid voor 85 % zuiver stigmasterol); |
|
— |
80,1 mg/kg (70 % van de minimaal toe te voegen hoeveelheid voor 95 % zuiver stigmasterol); |
|
— |
81,5 mg/kg (70 % van de minimaal toe te voegen hoeveelheid voor 85 % zuiver stigmasterol). |
De concentratie van de verklikstof in het monster met het laagste resultaat wordt in combinatie met interpolatie tussen respectievelijk 115,8 mg/kg en 80,1 mg/kg of 117,7 mg/kg en 81,5 mg/kg gebruikt.
8.2.2. Sitosterol
8.2.2.1. De toe te voegen hoeveelheid sitosterol bedraagt 600 g ten minste 90 % zuiver sitosterol per ton boter, d.w.z. 540 mg/kg.
8.2.2.2. De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het laagste van deze resultaten wordt met de volgende grenswaarden vergeleken:
|
— |
482,6 mg/kg (95 % van de minimaal toe te voegen hoeveelheid voor 90 % zuiver sitosterol); |
|
— |
347,6 mg/kg (70 % van de minimaal toe te voegen hoeveelheid voor 90 % zuiver sitosterol). |
De concentratie van de verklikstof in het monster met het laagste resultaat wordt in combinatie met interpolatie tussen 482,6 mg/kg en 347,6 mg/kg gebruikt.
8.3. Boterconcentraat
8.3.1. Stigmasterol
8.3.1.1. De toe te voegen hoeveelheid stigmasterol bedraagt 150 g ten minste 95 % zuiver stigmasterol per ton boterconcentraat, d.w.z. 142,5 mg/kg, of 170 g ten minste 85 % zuiver stigmasterol per ton boterconcentraat, d.w.z. 144,5 mg/kg.
8.3.1.2. De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het laagste van deze resultaten wordt met de volgende grenswaarden vergeleken:
|
— |
118,5 mg/kg (95 % van de minimaal toe te voegen hoeveelheid voor 95 % zuiver stigmasterol); |
|
— |
120,4 mg/kg (95 % van de minimaal toe te voegen hoeveelheid voor 85 % zuiver stigmasterol); |
|
— |
82,9 mg/kg (70 % van de minimaal toe te voegen hoeveelheid voor 95 % zuiver stigmasterol); |
|
— |
84,3 mg/kg (70 % van de minimaal toe te voegen hoeveelheid voor 85 % zuiver stigmasterol). |
De concentratie van de verklikstof in het monster met het laagste resultaat wordt in combinatie met interpolatie tussen respectievelijk 118,5 mg/kg en 82,9 mg/kg of 120,4 mg/kg en 84,3 mg/kg gebruikt.
8.3.2. Sitosterol
8.3.2.1. De toe te voegen hoeveelheid sitosterol bedraagt 600 g ten minste 90 % zuiver sitosterol per ton boterconcentraat, d.w.z. 540 mg/kg.
8.3.2.2. De resultaten voor de drie monsters die bij de analyse van het product worden verkregen, worden gebruikt om te controleren of de verklikstof in de juiste hoeveelheid en voldoende homogeen is toegevoegd en het laagste van deze resultaten wordt met de volgende grenswaarden vergeleken:
|
— |
480,9 mg/kg (95 % van de minimaal toe te voegen hoeveelheid voor 90 % zuiver sitosterol); |
|
— |
345,9 mg/kg (70 % van de minimaal toe te voegen hoeveelheid voor 90 % zuiver sitosterol). |
De concentratie van de verklikstof in het monster met het laagste resultaat wordt in combinatie met interpolatie tussen 480,9 mg/kg en 345,9 mg/kg gebruikt.
Figuur 1
Chromatogram van het mengsel voor controle van de resolutie
Volledige resolutie, waarbij de recorderpen na de piek van lanosterol op de basislijn terugkomt alvorens de piek voor sitosterol begint, verdient de voorkeur, maar onvolledige resolutie is aanvaardbaar.

|
Figuur 2a |
Figuur 2b |
|
Stigmasterol-standard |
Botermonster, gedenatureerd met stigmasterol |
|
|
|
|
NB: Bij integratie van de piek voor stigmasterol moeten ook eventuele staarten, zoals aangegewen bij de punten 1, 2 en 3, worden meegerekend. |
|
|
Figuur 3a |
Figuur 3b |
|
β-sitosterol-standard |
Botermonster, gedenatureerd met β-sitosterol |
|
|
|
|
NB: β-sitosterol bevat vaak een verontreiniging (stigmastanol) die onmiddellijk na β-sitosterol elueert. Wanneer de totale hoeveelheid β-sitosterol wordt bepaald, moeten de oppervlakken van deze twee pieken bij elkaar worden opgeteld. |
|
BIJLAGE IX
(Artikel 6)
REFERENTIEMETHODE VOOR DE DETECTIE VAN KOEMELK EN KOEMELKCASEÏNAAT IN KAAS VAN SCHAPEN-, GEITEN- OF BUFFELMELK OF VAN MENGSELS VAN SCHAPEN-, GEITEN- EN BUFFELMELK
1. DOEL
Detectie van koemelk en koemelkcaseïnaat in kaas van schapen-, geiten- of buffelmelk of mengsels van schapen-, geiten- en buffelmelk door middel van iso-elektrische focussering van γ-caseïnen na plasminolyse.
2. TOEPASSINGSGEBIED
De methode is bruikbaar voor een gevoelige specifieke detectie van niet-warmtebehandelde en warmtebehandelde koemelk en koemelkcaseïnaat in verse en gerijpte kaas die is gemaakt van schapen-, geiten- of buffelmelk of mengsels van schapen-, geiten- en buffelmelk. Zij is niet geschikt voor de detectie van melk- en kaasvervalsing door gebruik van warmtebehandelde concentraten van eiwit uit wei van runderen.
3. PRINCIPE VAN DE METHODE
3.1. De caseïnen worden uit kaas en de referentiestandaards geïsoleerd.
3.2. De geïsoleerde caseïnen worden opgelost en met plasmine (EC.3.4.21.7) geïncubeerd.
3.3. De met plasmine behandelde caseïnen worden in aanwezigheid van ureum iso-elektrisch gefocusseerd en de eiwitten worden gekleurd.
3.4. De gekleurde patronen van γ3-caseïne en γ2-caseïne (deze tonen koemelk aan) worden beoordeeld door het patroon van het monster te vergelijken met het patroon van de referentiestandaards met 0 % en 1 % koemelk in dezelfde gel.
4. REAGENTIA
Tenzij anders aangegeven, moeten chemicaliën van analysekwaliteit worden gebruikt. Water moet tweemaal gedestilleerd of van gelijkwaardige zuiverheid zijn.
NB: De onderstaande bijzonderheden zijn van toepassing op in eigen laboratorium vervaardigde ureumhoudende polyacrylamidegels van 265 × 125 × 0,25 mm. Bij gebruik van gels van een ander type of met andere afmetingen moeten de scheidingsomstandigheden wellicht worden aangepast.
Iso-elektrische focussering
4.1. Reagentia voor de bereiding van de ureumhoudende polyacrylamidegels
4.1.1. Stamoplossing voor de gels
Los:
4,85 g acrylamide,
0,15 g N, N'-methyleenbisacrylamide (BIS),
48,05 g ureum en
15,00 g glycerol (87 % m/m)
op in water en vul aan tot 100 ml. Bewaar de oplossing in een bruine glazen fles in de koelkast.
NB: In plaats van de vermelde hoeveelheden neurotoxische acrylamiden kan ook een in de handel verkrijgbare kant-en-klare acrylamide/BIS-oplossing worden gebruikt. Indien deze oplossing 30 % (m/v) acrylamide en 0,8 % (m/v) BIS bevat, wordt in plaats van de vermelde hoeveelheden een volume van 16,2 ml gebruikt. De stamoplossing is maximaal tien dagen houdbaar; indien de geleidbaarheid meer dan 5 μS bedraagt wordt gedeïoniseerd door eerst 30 minuten met 2 g Amberlite MB-3 te roeren en vervolgens door een 0,45 μm membraan te filtreren.
4.1.2. Geloplossing
Bereid een geloplossing door additieven en amfolyten met de stamoplossing (4.1.1) te mengen:
9,0 ml stamoplossing,
24 mg β-alanine,
500 μl amfolyt pH 3,5-9,5 (1),
250 μl amfolyt pH 5-7 (1),
250 μl amfolyt pH 6-8 (1).
Meng de geloplossing en ontgas 2 tot 3 minuten in een ultrasoonbad of in vacuüm.
NB: Bereid de geloplossing vlak voor het gieten van de gel (6.2).
4.1.3. Katalysatoroplossingen
4.1.3.1. N, N, N', N'-tetramethylethyleendiamine (Temed)
4.1.3.2. 40 % (m/v) ammoniumpersulfaat (PER):
Los 800 mg PER op in 2 ml water.
NB: Gebruik altijd een vers bereide PER-oplossing.
4.2. Contactvloeistof
Petroleum of vloeibare paraffine
4.3. Anodeoplossing
Los 5,77 g fosforzuur (85 % m/m) op in 100 ml water.
4.4. Kathodeoplossing
Los 2,00 g natriumhydroxide op in 100 ml water.
Monstervoorbereiding
4.5. Reagentia voor eiwitisolatie
4.5.1. Verdund azijnzuur (25,0 ml ijsazijn, met water verdund tot 100 ml)
4.5.2. Dichloormethaan
4.5.3. Aceton
4.6. Eiwitoplossende buffer
Los:
5,75 g glycerol (87 % m/m),
24,03 g ureum en
250 mg dithiotreitol
op in 50 ml gedestilleerd water.
NB: In de koelkast bewaren; deze oplossing is één week houdbaar.
4.7. Reagentia voor plasminesplitsing van caseïnen
4.7.1. Ammoniumcarbonaatbuffer
Titreer een oplossing van 0,2 mol/l ammoniumwaterstofcarbonaat (1,58 g/100 ml water) die 0,05 mol/l ethyleendiaminetetraazijnzuur (EDTA, 1,46 g/100 ml) bevat, met een oplossing van 0,2 mol/l ammoniumcarbonaat (1,92 g/100 ml water) die 0,05 mol/l EDTA bevat, tot pH 8.
4.7.2. Runderplasmine (EC. 3.4.21.7), activiteit ten minste 5 U/ml
4.7.3. ε-Aminocapronzuuroplossing voor enrymremming
Los 2,624 g ε-aminocapronzuur (6-amino-n-hexaanzuur) op in 100 ml 40 % (v/v) ethanol.
4.8. Standaards
4.8.1. Gecertificeerde referentiestandaards van een mengsel van gestremde magere schapen- en geitenmelk met 0 % en 1 % koemelk zijn verkrijgbaar bij het Instituut voor referentiematerialen en -metingen van de Commissie, B-2440 Geel, België.
4.8.2. Bereiding van tijdelijke laboratoriumstandaards van gestremde buffelmelk met 0 % en 1 % koemelk.
Magere melk wordt bereid door losse rauwe buffelmelk of koemelk bij 37 °C gedurende 20 minuten bij 2 500 g te centrifugeren. Nadat de buis met inhoud snel tot 6-8 °C is afgekoeld, wordt de bovendrijvende vetlaag volledig verwijderd. Voeg voor de bereiding van de standaard van 1 % in een bekerglas van 1 liter 5,00 ml magere koemelk aan 495 ml magere buffelmelk toe en breng de pH door toevoeging van verdund melkzuur (10 % m/v) op 6,4. Stel de temperatuur in op 35 °C, voeg 100 μl kalfsstremsel (1:10 000, circa 3 000 U/ml) toe, roer gedurende één minuut, dek het bekerglas met aluminiumfolie af en laat het gedurende één uur bij 35 °C staan, zodat de wrongel zich kan vormen. Nadat de wrongel is gevormd, wordt de gestremde melk in zijn geheel gevriesdroogd zonder deze eerst te homogeniseren of de wei af te tappen. Na het vriesdrogen wordt het product tot een homogeen poeder fijngemalen. Volg voor de bereiding van de 0 %-standaard dezelfde werkwijze met zuivere magere buffelmelk. De standaards moeten bij –20 °C worden opgeslagen.
NB: Het verdient aanbeveling de zuiverheid van de buffelmelk vóór de bereiding van de standaards door iso-elektrische focussering van de met plasmine behandelde caseïnen te controleren.
Reagentia voor eiwitkleuring
4.9. Fixeeroplossing
Los 150 g trichloorazijnzuur op in 1 000 ml water.
4.10. Ontkleuroplossing
Verdun 500 ml methanol en 200 ml ijsazijn met gedestilleerd water tot 2 000 ml.
NB: De ontkleuroplossing moet dagelijks vers worden bereid; dit kan gebeuren door gelijke volumes stamoplossingen met 50 % (v/v) methanol en 20 % (v/v) ijsazijn met elkaar te mengen.
4.11. Kleuroplossingen
4.11.1. Kleuroplossing (stamoplossing 1)
Los 3,0 g Coomassie briljantblauw G 250 (C.I. 42655) met behulp van een magneetroerder (ongeveer 45 minuten) op in 1 000 ml 90 % (v/v) methanol en filtreer over twee middelsnelle vouwfilters.
4.11.2. Kleuroplossing (stamoplossing 2)
Los 5,0 g kopersulfaat-pentahydraat op in 1 000 ml 20 % (v/v) azijnzuur.
4.11.3. Kleuroplossing (werkoplossing)
Meng vlak vóór de kleuring 125 ml van beide stamoplossingen (4.11.1 en 4.11.2).
NB: De kleuroplossing moet op de dag van gebruik worden bereid.
5. APPARATUUR
5.1. Glasplaten (265 × 125 × 4 mm); rubberen rol (breedte 15 cm); waterpas tafel
5.2. Gel-dragerfolie (265 × 125 mm)
5.3. Afdekfolie (280 × 125 mm). Plak op beide lange zijden een strook plakband (280 × 6 × 0,25 mm) als afstandshouder (zie figuur 1)
5.4. Elektrofocusseringskamer met koelplaat (bv. 265 × 125 mm) met geschikte spanningsbron (≥ 2,5 kV) of automatisch elektroforeseapparaat
5.5. Rondpompcryostaat, ingesteld op 12 ± 0,5 °C
5.6. Centrifuge, geschikt voor 3 000 g
5.7. Elektrodestroken (≥ 265 mm lang)
5.8. Plastic druppelflessen voor anodeoplossing en kathodeoplossing
5.9. Monsterdragers (10 × 5 mm, viscose of filtreerpapier met geringe eiwitadsorptie)
5.10. Roestvast stalen schaar, mes en pincet
5.11. Roestvast stalen of glazen kleurings- en ontkleuringsschalen (bv. instrumentbakjes van 280 × 150 mm)
5.12. Instelbare staafhomogenisator (schachtdiameter 10 mm), 8 000 tot 20 000 rpm
5.13. Magneetroerder
5.14. Ultrasoonbad
5.15. Folie-lasapparaat
5.16. Micropipetten, 25 μl
5.17. Vacuümverdamper of vriesdroger
5.18. Thermostatisch geregeld waterbad, instelbaar op 35 en 40 ± 1 °C, met schudder
5.19. Densitometer met aflezing bij λ = 634 nm
6. PROCEDURE
6.1. Monstervoorbereiding
6.1.1. Isolatie van caseïnen
Weeg een hoeveelheid kaas die overeenkomt met 5 g droge massa of de referentiestandaard af in een centrifugebuis van 100 ml, voeg 60 ml gedestilleerd water toe en homogeniseer met een staafhomogenisator (8 000-10 000 rpm). Breng de pH met verdund azijnzuur (4.5.1) op 4,6 en centrifugeer (5 minuten, 3 000 g). Decanteer het vet en de wei, homogeniseer het residu bij 20 000 rpm in 40 ml gedestilleerd water dat met verdund azijnzuur (4.5.1) op pH 4,5 is gebracht, voeg 20 ml dichloormethaan (4.5.2) toe, homogeniseer opnieuw en centrifugeer (5 minuten, 3 000 g). Verwijder de caseïnelaag die tussen de waterfase en de organische fase drijft (zie figuur 2) met een spatel en decanteer beide fasen. Homogeniseer de caseïne opnieuw in 40 ml gedestilleerd water (zie boven) en 20 ml dichloormethaan (4.5.2) en centrifugeer. Herhaal deze procedure tot beide extractiefasen kleurloos zijn (twee tot drie maal). Homogeniseer het eiwitresidu met 50 ml aceton (4.5.3) en filtreer over een middelsnel vouwfilter. Was het residu op het filter tweemaal met telkens 25 ml aceton, laat het aan de lucht of onder een stikstofstroom drogen en verpulver het in een mortier tot een fijn poeder.
NB: Droge caseïne-isolaten moeten bij –20 °C worden bewaard.
6.1.2. Splitsing van β-caseïnen met plasmine om de γ-caseïnen te intensiveren
Dispergeer 25 mg geïsoleerde caseïne (6.1.1) in 0,5 ml ammoniumcarbonaat-buffer (4.7.1) en homogeniseer 20 minuten, bijvoorbeeld in een ultrasoonbad. Verwarm tot 40 °C, voeg 10 μl plasmine (4.7.2) toe, meng en incubeer één uur bij 40 °C onder voortdurend schudden. Voeg vervolgens 20 μl ε-aminocapronzuuroplossing (4.7.3) toe om het enzym te remmen en daarna 200 mg vast ureum en 2 mg dithiotreitol.
NB: Teneinde meer symmetrie in de gefocusseerde caseïnebanden te verkrijgen verdient het aanbeveling de oplossing na de toevoeging van het ε-aminocapronzuur te vriesdrogen en de residuen vervolgens in 0,5 ml eiwitoplossende buffer (4.6) op te lossen.
6.2. Bereiding van de ureumhoudende polyacrylamidegels
Rol de gel-dragerfolie (5.2) met behulp van enkele druppels water op een glasplaat (5.1) en verwijder eventueel overtollig water met een papieren handdoek of een tissue. Rol de afdekfolie (5.3) met plakband (0,25 mm) op dezelfde manier op een tweede glasplaat. Leg de plaat horizontaal op een waterpas tafel.
Voeg aan de ontgaste geloplossing (4.1.2) 10 μl Temed (4.1.3.1) toe, voeg na roeren 10 μl PER-oplossing (4.1.3.2) toe, meng grondig en giet het mengsel onmiddellijk gelijkmatig uit op het midden van de afdekfolie. Zet de plaat met dragerfolie (met de folie naar beneden) aan één kant op de plaat met afdekfolie en laat de plaat langzaam zakken, zodat zich tussen de platen met folie een gellaag vormt die zich gelijkmatig en zonder luchtbellen verspreidt (zie figuur 3). Laat de plaat met dragerfolie aan een dunne spatel voorzichtig helemaal naar beneden zakken en leg bij wijze van gewicht nog drie glasplaten op de plaat. Verwijder, wanneer de polymerisatie is voltooid (na ongeveer 60 minuten), de op de dragerfolie gepolymeriseerde gel samen met het afdekfolie door op de glasplaten te tikken. Reinig de achterkant van de dragerfolie zorgvuldig om gelresten en ureum te verwijderen. Las de gel-sandwich in een foliebuis en bewaar deze in de koelkast (maximaal zes weken).
NB: De afdekfolie met plakband kan opnieuw worden gebruikt. De polyacrylamidegel kan in kleinere stukken worden gesneden, hetgeen aanbeveling verdient wanneer er weinig monsters zijn of wanneer een automatisch elektroforeseapparaat wordt gebruikt (twee gels, afmetingen 4,5 × 5 cm).
6.3. Iso-elektrische focussering
Stel de koelthermostaat in op 12 °C. Veeg de achterkant van de gel-dragerfolie af met petroleum en breng midden op het koelblok enkele druppels petroleum (4.2). Leg de gel-sandwich met de dragerfolie naar beneden op het koelblok en zorg ervoor dat er geen luchtbellen ontstaan. Veeg eventuele overmaat petroleum weg en verwijder de afdekfolie. Bevochtig de elektrodestroken met de elektrodeoplossingen (4.3 en 4.4), knip ze af op de lengte van de gel en leg ze op hun plaats (afstand tussen de elektroden 9,5 cm).
Omstandigheden voor de iso-elektrische focussering:
6.3.1. Gelformaat: 265 × 125 × 0,25 mm
|
Stap |
Tijd (minuten) |
Voltage (V) |
Stroomsterkte (mA) |
Vermogen (W) |
Voltuur (Vh) |
||
|
30 |
maximaal 2 500 |
maximaal 15 |
constant 4 |
ca. 300 |
||
|
60 |
maximaal 2 500 |
maximaal 15 |
constant 4 |
ca. 1 000 |
||
|
60 |
maximaal 2 500 |
maximaal 5 |
maximaal 20 |
ca. 3 000 |
||
|
40 |
maximaal 2 500 |
maximaal 6 |
maximaal 20 |
ca. 3 000 |
|||
|
30 |
maximaal 2 500 |
maximaal 7 |
maximaal 25 |
ca. 3 000 |
NB: Als de dikte of de breedte van de gels wordt veranderd, moeten de waarden voor de stroomsterkte en het vermogen dienovereenkomstig worden aangepast (bv. een verdubbeling van stroomsterkte en vermogen als een gel van 265 × 125 × 0,5 mm wordt gebruikt).
6.3.2. Voorbeeld van een voltageprogramma voor een automatisch elektroforeseapparaat (twee gels van 5,0 × 4,5 cm), elektroden zonder stroken rechtstreeks op de gel aangebracht
|
Stap |
Spanning |
Stroomsterkte |
Vermogen |
Temperatuur |
Voltuur |
||
|
1 000 V |
10,0 mA |
3,5 W |
8 °C |
85 Vh |
||
|
250 V |
5,0 mA |
2,5 W |
8 °C |
30 Vh |
||
|
1 200 V |
10,0 mA |
3,5 W |
8 °C |
80 Vh |
||
|
1 500 V |
5,0 mA |
7,0 W |
8 °C |
570 Vh |
Breng de monsterdrager in stap 2 bij 0 Vh aan.
Verwijder de monsterdrager in stap 2 bij 30 Vh.
6.4. Eiwitkleuring
6.4.1. Eiwitfixatie
Verwijder de elektrodestroken direct na het uitschakelen van de stroom en leg de gel onmiddellijk in een (ont)kleuringsschaal met 200 ml fixeeroplossing (4.9); laat 15 minuten staan onder voortdurend schudden.
6.4.2. Wassen en kleuren van de gelplaat
Giet de fixeeroplossing volledig af en was de gelplaat tweemaal telkens 30 seconden met 100 ml ontkleuroplossing (4.10). Giet de ontkleuroplossing af en vul de schaal met 250 ml kleuroplossing (4.11.3); laat de kleur onder zachtjes schudden gedurende 45 minuten ontwikkelen.
6.4.3. Ontkleuren van de gelplaat
Giet de kleuroplossing af, was de gelplaat tweemaal met telkens 100 ml ontkleuroplossing (4.10) en schud daarna gedurende 15 minuten met 200 ml ontkleuroplossing. Herhaal deze ontkleurstap ten minste twee of drie keer, totdat de achtergrond schoon en ongekleurd is. Spoel de gelplaat vervolgens met gedestilleerd water (2 × 2 minuten) en droog aan de lucht (2 tot 3 uur) of met een föhn (10 tot 15 minuten).
NB 1: Het fixeren, wassen, kleuren en ontkleuren gebeurt bij 20 °C. Gebruik geen hoge temperaturen.
NB 2: Indien de voorkeur wordt gegeven aan de gevoeligere zilverkleuring (bv. Silver Staining Kit, Protein, Pharmacia Biotech, codenr. 17-1150-01), moeten de met plasmine behandelde caseïnemonsters tot 5 mg/ml worden verdund.
7. BEOORDELING
De beoordeling vindt plaats door vergelijking van de eiwitpatronen van het onbekende monster met die van referentiestandaards op dezelfde gel. De detectie van koemelk in kaas van schapen-, geiten- en buffelmelk of mengsels van schapen-, geiten- en buffelmelk gebeurt via de γ3- en γ2-caseïnen, waarvan het iso-elektrisch punt tussen pH 6,5 en pH 7,5 ligt (zie de figuren 4a, 4b en 5). De detectielimiet ligt lager dan 0,5 %.
7.1. Visuele beoordeling
Voor een visuele beoordeling van de hoeveelheid koemelk verdient het aanbeveling de concentraties van monsters en standaards zodanig aan te passen dat de intensiteit voor de γ2- en γ3-caseïnen van schapen, geiten en/of buffels vergelijkbaar is (zie „γ2 E,G,B” en „γ3 E,G,B” in de figuren 4a, 4b en 5). Daarna kan de hoeveelheid koemelk (minder dan, gelijk aan of meer dan 1 %) in het onbekende monster rechtstreeks worden bepaald door de intensiteit voor de γ3- en γ2-caseïnen van runderen (zie „γ3 C” en „γ2 C” in de figuren 4a, 4b en 5) te vergelijken met die van de 0 %- en 1 %-referentiestandaards (schapen, geiten) of tijdelijke laboratoriumstandaards (buffel).
7.2. Densitometrische beoordeling
Gebruik zo mogelijk densitometrie (5.19) om de verhouding te bepalen tussen het piekoppervlak voor de γ2- en γ3-caseïnen van runderen en het piekoppervlak voor de γ2- en γ3-caseïnen van schapen, geiten en/of buffels (zie figuur 5). Vergelijk deze waarde met de piekoppervlakverhouding voor de γ2- en γ3-caseïnen bij de op dezelfde gel geanalyseerde 1 %-referentiestandaard (schapen of geiten) of tijdelijke laboratoriumstandaard (buffel).
NB: De methode werkt bevredigend wanneer er in de 1 %-referentiestandaard een duidelijk positief signaal is voor zowel γ2- als γ3-caseïnen van runderen, maar niet in de 0 %-referentiestandaard. Is dat niet het geval, dan moet de procedure worden geoptimaliseerd, waarbij de methode exact tot in de details moet worden gevolgd.
Een monster wordt als positief beoordeeld als de intensiteit van zowel de γ2- als de γ3-caseïnen van runderen of de bijbehorende piekoppervlakverhoudingen gelijk zijn aan of groter zijn dan bij de 1 %-referentiestandaard.
8. REFERENTIES
|
1. |
Addeo F., Moio L., Chianese L., Stingo C., Resmini P., Berner I., Krause I., Di Luccia A., Bocca A.: Use of plasmin to increase the sensitivity of the detection of bovine milk in ovine and/or caprine cheese by gel isoelectric focusing of γ2-caseins, Milchwissenschaft 45, 708-711 (1990). |
|
2. |
Addeo F., Nicolai M.A., Chianese L., Moio L., Spagna Musso S., Bocca A., Del Giovine L.: A control method to detect bovine milk in ewe and water buffallo cheese using immunoblotting, Milchwissenschaft 50, 83-85 (1995). |
|
3. |
Krause I., Berner I., Klostermeyer H.: Sensitive detection of cow milk in ewe and goal milk and cheese by carrier ampholyte — and carrier ampholyte/immobilized pH gradient — isoelectric focusing of γ-caseins using plasmin as signal amplifier, Electrophoresis-Forum '89 (B. J. Radola, ed.) blz. 389-393, Bode-Verlag, München (1989). |
|
4. |
Krause I., Belitz H.-D., Kaiser K.-P.: Nachweis von Kuhmilch in Schaf- und Ziegenmilch bzw. -käse durch isoelektrische Fokussierung in harnstoffhaltigen Polyacrylamidgelen, Z. Lebensm. Unters. Forsch. 174, 195-199 (1982). |
|
5. |
Radola B.J.: Ultrathin-layer isoelectric focusing in 50-100 μm polyacrylamide gels on silanised glass plates or polyester films, Electrophoresis 1, 43-56 (1980). |
Figuur 1:
Schematische tekening van de afdekfolie
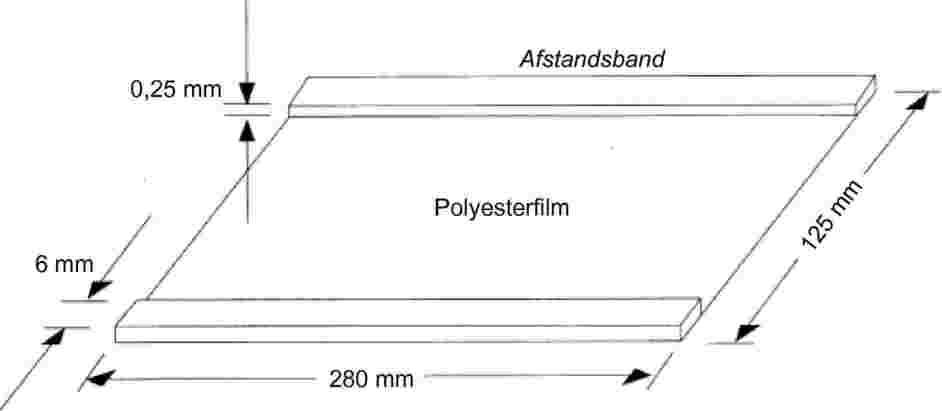
Figuur 2:
Caseïnelaag die na centrifugeren tussen de water- en de organische fase drijft

Figuur 3:
Omklapmethode voor het gieten van ultradunne polyacrylamidegels

a = afstandsband (0,25 mm); b = afdekfolie (5.3); c, e = glasplaten (5.1); d = geloplossing (4.1.2); f = gel-dragerfolie (5.2)
Figuur 4a:
Iso-elektrische focussering van met plasmine behandelde caseïnen uit kaas van schapen- en geitenmelk met verschillende hoeveelheden koemelk.
% CM = percentage koemelk; C = koe; E = schaap; G = geit.
Bovenste helft van de IEF-gel.
Figuur 4b:
Iso-elektrische focussering van met plasmine behandelde caseïnen uit kaas van mengsels van schapen-, geiten- en buffelmelk met verschillende hoeveelheden koemelk.
% CM = percentage koemelk; 1 + = monster met 1 % koemelk waaraan in het midden zuivere rundercaseïne is toegevoegd; C = koe; E = schaap; G = geit; B = buffel.
Totale scheidingsafstand van de IEF-gel.
Figuur 5:
Superpositie van densitogrammen van standaards (STD) en van monsters kaas van een mengsel van schapen- en geitenmelk na iso-elektrische focussering

a, b = standaards met 0 en 1 % koemelk; c-g = kaasmonsters met 0,1,2,3 en 7 % koemelk. C = koe; E = schaap; G = geit.
De bovenste helft van de IEF-gel is gemeten bij λ = 634 nm.
(1) De producten Ampholine® pH 3,5-9,5 (Pharmacia) en Resolyte® pH 5-7 en pH 6-8 (BDH, Merck) blijken bijzonder geschikt te zijn voor de gewenste scheiding van γ-caseïnen.
(2) Opbrengen van het monster: pipetteer na de prefocussering (stap 1) 18 μl van de monster- en standaardoplossingen op de monsterdragers (10 × 5 mm); leg deze met een onderlinge afstand van 1 mm en in de lengterichting op 5 mm van de anode op de gel en druk ze zachtjes aan. Voer de focussering onder bovenstaande omstandigheden uit en verwijder de monsterdragers voorzichtig na de 60 minuten monsterfocussering.
BIJLAGE X
(Artikel 7)
REFERENTIEMETHODE VOOR DE DETECTIE VAN COLIBACTERIËN IN BOTER, MAGEREMELKPOEDER, CASEÏNE EN CASEÏNATEN
1. VOORBEHANDELING VAN DE MONSTERS
Zie ISO-norm 8261.
2. PROCEDURE
Zie ISO-norm 4831.
Monsters die overeenkomen met 1 g boter of 0,1 g mageremelkpoeder of caseïne/caseïnaten, worden in het kweekmedium geënt.
Per monster worden drie buizen beënt.
3. RESULTATEN
Als de drie buizen drie negatieve resultaten opleveren, is het resultaat: „voldoet aan de eisen”.
Als de drie buizen twee of drie positieve resultaten opleveren, is het resultaat: „voldoet niet aan de eisen”.
Als de drie buizen twee negatieve resultaten opleveren, wordt de analyse twee keer herhaald (met twee buizen):
|
— |
Als de twee resultaten negatief zijn, is het resultaat: „voldoet aan de eisen”. |
|
— |
Als ten minste één resultaat positief is, is het resultaat: „voldoet niet aan de eisen”. |
BIJLAGE XI
(Artikel 8)
BEPALING VAN HET LACTOSEGEHALTE VAN MENGVOEDERS
1. DOEL EN TOEPASSINGSGEBIED
Bepaling van het lactosegehalte van mengvoeders.
2. REFERENTIE
Het lactosegehalte wordt gedefinieerd als het massapercentage, zoals bepaald met de beschreven methode.
3. DEFINITIE
Het watervrije lactosegehalte wordt uitgedrukt in gram per 100 g.
4. PRINCIPE
Het mengvoeder wordt opgelost in water. Aan een verdunde afgewogen hoeveelheid wordt een „Biggs”-oplossing toegevoegd om het vet en het eiwit in het mengvoeder neer te slaan. Het monster wordt gefiltreerd (of gecentrifugeerd) en het filtraat (of het supernatans) wordt geïnjecteerd op een HPLC-kationenwisselaarkolom in de loodvorm met water van HPLC-kwaliteit als mobiele fase. De geëlueerde lactose wordt met een differentiële refractometer gedetecteerd (1).
5. REAGENTIA
5.1. Algemeen
Gebruik alleen reagentia van analysekwaliteit, tenzij anders wordt vermeld, en ontgast water van HPLC-kwaliteit.
5.2. Lactose
D-Lactosemonohydraat ((C12H22)O11. H2O) kan extra vocht opnemen. Meet vóór gebruik de werkelijke hoeveelheid water volgens Karl-Fisher of verwijder het extra vocht door lactose gedurende 8 uur bij 105 °C in een oven te drogen (hierbij verdwijnt niet het kristalwater van lactose).
5.3. Geconcentreerde Biggs/Szijarto-oplossing (2)
Los in een maatkolf van 100 ml 9,10 g zinkacetaatdihydraat (Zn(CH3COO)2.2H2O) en 5,46 g fosfowolfraamzuurmonohydraat (H3[P(W3O10)4.xH2O]) op in ongeveer 70 ml water van HPLC-kwaliteit (6.8).
Voeg 5,81 ml ijsazijn (CH3COOH) toe. Vul met water van HPLC-kwaliteit (6.8) aan tot 100 ml en meng. Deze oplossing kan één jaar bij kamertemperatuur worden bewaard.
5.4. Verdunde Biggs/Szijarto-oplossing
Verdun 25 ml geconcentreerde Biggs/Szijarto-oplossing (5.3) in een maatkolf met water tot 500 ml. Deze oplossing kan één maand bij kamertemperatuur worden bewaard.
5.5. Bereiding van water van HPLC-kwaliteit
Filtreer het ultrazuivere water (6.8) over het vacuüm-filtreersysteem (6.9). Ontgas de mobiele fase dagelijks met een van de beschikbare technieken (bijv. uitwassen met helium, ultrasoonbehandeling of lijn-ontgassen) om de pomp beter te laten werken en een stabiele basislijn te krijgen.
NB: Om de levensduur van de kolom te verlengen is het cruciaal dat het kooldioxidegehalte van de loopvloeistof zo laag mogelijk is en dat heropname wordt voorkomen.
6. APPARATUUR
Gangbare laboratoriumapparatuur en met name:
6.1. HPLC-ionenwisselaarkolom
Pakking van de kolom: 8 % vernette polystyreen/divinylbenzeen-copolymeer, gefunctionaliseerd met kationwisselaargroepen in de loodvorm.
Afmetingen van de kolom: lengte 300 mm, inwendige diameter ca. 8 mm.
Ook een andere diameter kan worden gebruikt, mits het debiet daaraan wordt aangepast.
6.2. Voorkolom
De voorkolom is een in serie geschakelde combinatie van een aparte kationwisselaar (H+) en anionwisselaar (CO3-), elk gepakt in kolommen van ca. 30 mm × 4,6 mm (L × ID) (bv. micro-voorkolommen in een micro-voorkolomhouder), of een „mixed bed” dat bestaat uit AG 50W-X4, 200-400 mesh (H+) en AG3-X4A, 200-400 mesh (OH-) in de verhouding 35:65 m/m, handmatig gepakt in een kolom van ca. 20 × 9 mm (L × ID).
6.3. Kolomoven
Oven die op een constante temperatuur van 85 °C ± 1 °C kan worden gehouden.
6.4. HPLC-pomp
Pomp die een constant (< 0,5 % fluctuatie) debiet van 0,2-1,0 ml/min kan leveren.
6.5. HPLC-injector
Autosampler die 25 µl kan injecteren en een herhaalbaarheid < 0,5 % heeft.
Ook een handmatige injector kan worden gebruikt (die aan dezelfde eisen moet voldoen als de autosampler).
6.6. HPLC-detector
Zeer gevoelige brekingsindexdetector met een ruis van < 5,10–9 RI-eenheden.
6.7. Integrator
Software of integrator voor de vastlegging en verwerking van gegevens en de registratie van piekoppervlakken en piekhoogtes, die naar lactoseconcentraties kunnen worden omgerekend.
6.8. Waterzuiveringsysteem
Systeem dat ultrazuiver water (type 1) kan leveren met een soortelijke weerstand >14 MΩ.cm.
6.9. Oplosmiddelfiltratiesysteem
Systeem waarmee water kan worden gefiltreerd met een membraanfilter met een poriegrootte van 0,45 µm.
NB: Veel waterzuiveringsystemen (6.8) hebben een ingebouwde filtratie van 0,45 of 0,2 µm. Als dit water direct wordt gebruikt, kan extra filtratie achterwege blijven.
6.10. Analytische balans
Balans met een aflezing van 0,1 mg.
6.11. Waterbad
Waterbad dat op een temperatuur van 40 °C (±0,5 °C) kan worden gehouden.
6.12. Centrifuge
Geschikt voor ten minste 3 000 g voor eppendorfbuisjes of gelijkwaardig of een groter soort potjes.
6.13. Maatkolf, 50 ml
Inhoud 50 ml, klasse A.
NB: Als rekening wordt gehouden met de volumefactor, kunnen ook kolven met een andere inhoud worden gebruikt.
6.14. Maatkolf, 100 ml
Inhoud 100 ml, klasse A.
6.15. Meetpipet
Meetpipet, 10 ml.
NB: Er kan ook een handpipet met een inhoud van 5 ml worden gebruikt; in dat geval wordt twee keer 5 ml reagens (5.3) toegevoegd.
7. MONSTERNEMING
Het is belangrijk dat het laboratorium een overeenkomstig ISO 707/IDF 50 (3) genomen monster ontvangt dat echt representatief is en niet tijdens het vervoer of de opslag is beschadigd.
8. BEREIDING VAN DE LACTOSE-STANDAARDOPLOSSING
8.1. Standaard 1
Los een nauwkeurig (tot op 0,1 mg nauwkeurig afgelezen) afgewogen hoeveelheid van ongeveer 50 mg lactosemonohydraat (5.2) af in een maatkolf van 100 ml (6.14) en vul met water aan tot de maatstreep.
8.2. Standaard 2
Los een nauwkeurig (tot op 0,1 mg nauwkeurig afgelezen) afgewogen hoeveelheid van ongeveer 100 mg lactosemonohydraat (5.2) af in een maatkolf van 100 ml (6.14) en vul met water aan tot de maatstreep.
NB: De standaardoplossingen kunnen ten hoogste één week bij ongeveer 5 °C worden bewaard.
9. BEREIDING VAN HET TESTMONSTER
9.1. Oplossing van het monster
Weeg ongeveer 5 g poeder af in een maatkolf van 50 ml (6.13) en noteer het gewicht tot op 1 mg nauwkeurig (W1 (11)). Voeg 50 ml water toe en noteer de gewichtstoename (W2 (11)) tot op 0,01 g nauwkeurig. Zet de gesloten kolf gedurende 30 minuten op het waterbad en keer de kolf gedurende deze periode enkele keren om. Laat afkoelen tot kamertemperatuur.
9.2. Monsterbehandeling
Breng ongeveer 1 g van deze oplossing in een maatkolf van 50 ml (6.13), noteer het gewicht tot op 1 mg nauwkeurig (W3 (11)), voeg 20 ml water en vervolgens 10 ml verdund Biggs/Szijarto-reagens (5.4) toe en vul met water aan tot de maatstreep. Keer de kolf gedurende de eerste 30 minuten vijf keer voorzichtig om.
Neem na 1 uur een portie en centrifugeer (6.12) gedurende 10 minuten bij 3 000 g (bij een hogere snelheid kan een evenredig kortere tijd worden gebruikt). Gebruik een portie supernatans voor de HPLC-analyse.
10. HPLC-BEPALING
10.1. Voorbereiding van HPLC
10.1.1. Installatie van de kolom en de voorkolom
Installeer de voorkolom (6.2) buiten de kolomoven (6.3) en de kolom (6.1) in de oven.
NB: Als de oven geen buis bevat om de loopvloeistof voor te verwarmen, moet de loopvloeistof in de oven door een ongeveer 15 cm lange roestvrij stalen buis worden geleid voordat deze in de kolom komt (het is absoluut noodzakelijk dat de loopvloeistof opgewarmd is voordat deze in de kolom komt, omdat er anders piekverbreding optreedt).
10.1.2. Detector en aanvankelijk debiet
Schakel de detector (6.6) ten minste 24 uur voor het begin van de analyse in om een stabiele basislijn te krijgen. Stel de interne temperatuur van de detector in op 35 °C. Stel het debiet gedurende ten minste 20 minuten in op 0,2 ml/min (6.4), terwijl de kolomoven (6.3) op kamertemperatuur wordt ingesteld.
10.1.3. Kolomoven en uiteindelijk debiet
Stel de kolomoven (6.3) in op 85 °C. Voer, wanneer die temperatuur wordt bereikt, na 30 minuten het debiet geleidelijk op van 0,2 ml/min tot 0,6 ml/min (6.4). Laat het systeem met dat debiet bij 85 °C gedurende 2 uur of totdat een stabiele basislijn wordt verkregen, equilibreren.
10.1.4. Integratie
Kies zorgvuldig de vastleggings- en integratieparameters (6.7), zoals de gegevenssnelheid, de gevoeligheid, de tijdconstante, de piekbreedte en de drempelwaarde.
De retentietijd van lactose is ongeveer 11 minuten.
NB: Met veel softwareprogramma's voor gegevensvastlegging (6.7) kan het theoretische schotelgetal gemakkelijk worden gemeten. Meet periodiek het theoretische schotelgetal van standaard 1 (8.1) en vervang de kolom (6.1) wanneer het schotelgetal 25 % lager is dan de aanvankelijke waarde van een nieuwe kolom.
10.1.5. Test van de voorkolom
Controleer regelmatig (ten minste één keer per reeks) het vermogen van de voorkolom (6.2) om zouten uit het monster te verwijderen door 25 µl van een 0,05 %-natriumchlorideoplossing te injecteren. Zodra er pieken verschijnen, moet de voorkolom worden vervangen.
10.2. Analyse van standaards
Injecteer aan het begin van elke reeks analyses 25 µl (6.5) van standaard 1 (8.1) en vervolgens van standaard 2 (8.2). Herhaal dit om de 10 tot 20 monsters en doe dit ook aan het eind van de reeks.
10.3. Analyse van monsters
Injecteer 25 µl van het supernatans (9.2) van het monster.
11. BEREKENING EN WEERGAVE VAN DE RESULTATEN
11.1. Kalibratie
Normaal gesproken wordt voor de berekening van de resultaten de piekhoogte gebruikt, maar als het signaal te veel ruis bevat kan het piekoppervlak worden gebruikt (kwantificering via piekhoogte wordt minder beïnvloed door pieken van componenten met een lage concentratie die gedeeltelijk maar niet voldoende van de lactosepiek gescheiden zijn).
Met de software (6.7) wordt een lineaire kalibratiecurve berekend die door de oorsprong geforceerd wordt. Controleer of de curve eventueel niet lineair is (schijnbare niet-lineariteit wordt meestal veroorzaakt door een vergissing bij de bereiding van standaard 1 (8.1) of 2 (8.2), een slechte integratie of (minder waarschijnlijk) een slecht werkende injector).
Ga uit van de berekende lactoseconcentratie in mg/ml van standaard 1 (8.1) en 2 (8.2) als watervrije lactose.
De helling (RF) van de kalibratiecurve wordt gedefinieerd als oppervlak/concentratie in mg/ml.
11.2. Monsters
Het resultaat van de analyse wordt verkregen als g/100 g en berekend met de software (6.7) of de volgende vergelijking:

Hierbij is:
|
C |
: |
lactoseconcentratie in g/100 g poeder |
|
H |
: |
piekhoogte van lactose van het monster |
|
RF |
: |
responsfactor (of helling) van de kalibratiecurve in mV/mg/ml |
|
W1 |
: |
gewicht van het poedermonster in g (9.1) |
|
W2 |
: |
gewicht van het aan het poedermonster toegevoegde water in g (9.1) |
|
W3 |
: |
gewicht van de gebruikte hoeveelheid van het in water opgeloste poeder in g (9.2) |
|
50 |
: |
volume van de in (9.2) gebruikte maatkolf |
|
0,1 |
: |
omrekening van het resultaat naar g/100 g |
12. PRECISIE
De uit dit ringonderzoek afgeleide waarden kunnen wellicht niet op andere dan de vermelde concentratiebereiken en matrices worden toegepast. De waarden voor de herhaalbaarheid en reproduceerbaarheid zullen worden afgeleid uit de resultaten van een overeenkomstig ISO 5725 (4) uitgevoerd ringonderzoek.
12.1. Herhaalbaarheid
Het absolute verschil tussen twee aparte testresultaten die binnen korte tijd door dezelfde persoon met dezelfde apparatuur in hetzelfde laboratorium met dezelfde methode en identiek testmateriaal worden verkregen, mag in niet meer dan 5 % van de gevallen groter zijn dan xxx (te bepalen door een ringonderzoek) (5).
12.2. Reproduceerbaarheid
Het absolute verschil tussen twee aparte testresultaten die door verschillende personen met verschillende apparatuur in verschillende laboratoria met dezelfde methode en identiek testmateriaal worden verkregen, mag in niet meer dan 5 % van de gevallen groter zijn dan 0,5 g/100 g (te bepalen door een ringonderzoek).
13. REFERENTIES
(1) J. Koops en C. Olieman, Netherlands Milk and Dairy Journal, 39 (1985) 89-106.
(2) D.A. Biggs en L. Szijarto, Journal of Dairy Science, 46 (1963) 1196.
(3) ISO 707 (IDF 50): Melk en melkproducten — Leidraad voor monsterneming.
(4) ISO 5725-1: Nauwkeurigheid (juistheid en precisie) van meetmethoden en -resultaten — Deel 1: Algemene beginselen en definities.
(5) ISO 5725-2: Nauwkeurigheid (juistheid en precisie) van meetmethoden en -resultaten — Deel 2: Basismethode voor de bepaling van herhaalbaarheid en reproduceerbaarheid van een standaardmeetmethode.
BIJLAGE XII
(Artikel 9)
DETECTIE VAN LEBWEI IN VOOR OPENBARE OPSLAG BESTEMD MAGEREMELKPOEDER DOOR DE BEPALING VAN CASEÏNEMACROPEPTIDEN MET BEHULP VAN HOGEDRUKVLOEISTOFCHROMATOGRAFIE (HPLC)
1. DOEL EN TOEPASSINGSGEBIED
Met deze methode kan lebwei in voor openbare opslag bestemd mageremelkpoeder worden gedetecteerd door middel van bepaling van de caseïnemacropeptiden.
2. REFERENTIE
Internationale norm ISO 707: Melk en melkproducten — Leidraad voor monsterneming, overeenkomstig de in bijlage I, punt 2, onder c), laatste alinea, vermelde richtsnoeren.
3. DEFINITIE
Het gehalte aan vaste lebweibestanddelen wordt gedefinieerd als het massapercentage, zoals bepaald door het gehalte aan caseïnemacropeptiden volgens onderstaande methode.
4. PRINCIPE
|
— |
Het mageremelkpoeder wordt opgelost en de vetten en eiwitten worden verwijderd met trichloorazijnzuur, gevolgd door centrifugeren of filtreren. |
|
— |
De hoeveelheid caseïnemacropeptiden (CMP) in het supernatans wordt met behulp van hogedrukvloeistofchromatografie (HPLC) bepaald. |
|
— |
Het voor de monsters verkregen resultaat wordt aan de hand van standaardmonsters die bestaan uit mageremelkpoeder waaraan al dan niet een bekend percentage weipoeder is toegevoegd, beoordeeld. |
5. REAGENTIA
Alle reagentia dienen van analysekwaliteit te zijn. Het gebruikte water dient gedestilleerd water of water van ten minste gelijkwaardige zuiverheid te zijn.
5.1. Trichloorazijnzuuroplossing
Los 240 g trichloorazijnzuur (CCl3COOH) op in water en vul aan tot 1 000 ml. De oplossing moet helder en kleurloos zijn.
5.2. Loopvloeistof, pH 6,0
Los 1,74 g dikaliumwaterstoffosfaat (K2HPO4), 12,37 g kaliumdiwaterstoffosfaat (KH2PO4) en 21,41 g natriumsulfaat (Na2SO4) op in ongeveer 700 ml water. Zo nodig wordt de pH met verdund fosforzuur of een kaliumhydroxideoplossing op 6,0 gebracht.
Vul met water aan tot 1 000 ml en meng.
NB: De samenstelling van de loopvloeistof kan worden aangepast om aan het certificaat van de standaaards of de aanbevelingen van de fabrikant van het pakkingsmateriaal van de kolom te voldoen.
Filtreer de loopvloeistof vóór gebruik over een membraanfilter met een poriegrootte van 0,45 μm.
5.3. Spoelvloeistof
Meng één deel acetonitril (CH3CN) met negen delen water. Filtreer het mengsel vóór gebruik over een membraanfilter met een poriegrootte van 0,45 μm.
NB: Elke andere oplossing met een bactericide werking die geen nadelige effecten op het scheidend vermogen van de kolom heeft, kan worden gebruikt.
5.4. Standaardmonsters
5.4.1. Mageremelkpoeder dat aan de eisen van deze verordening voldoet (standaard [0]).
5.4.2. Hetzelfde mageremelkpoeder dat is vermengd met 5 % m/m lebweipoeder met een standaardsamenstelling (standaard [5]).
6. APPARATUUR
6.1. Analytische balans.
6.2. Eventueel een centrifuge met een centrifugaalkracht tot minimaal 2 200 g, voorzien van centrifugebuizen met stop of dop met een inhoud van ongeveer 50 ml.
6.3. Mechanisch schudapparaat.
6.4. Magneetroerder.
6.5. Glazen trechters, diameter ongeveer 7 cm.
6.6. Filtreerpapier, normaal, diameter ongeveer 12,5 cm.
6.7. Glazen filtreerapparaat met membraanfilter met een poriegrootte van 0,45 μm.
6.8. Meetpipetten, geschikt voor 10 ml (ISO 648, klasse A, of ISO/R 835) of een doseersysteem dat in twee minuten 10,0 ml kan toevoegen.
6.9. Doseersysteem dat 20,0 ml water bij ongeveer 50 °C kan toevoegen.
6.10. Waterbad met thermostaat, ingesteld op 25 ± 0,5 °C.
HPLC-apparaat bestaande uit:
6.11.1. pomp;
6.11.2. injector, al dan niet automatisch, capaciteit 15 tot 30 μl;
6.11.3. twee kolommen in serie, TSK 2000-SW (lengte 30 cm, inwendige diameter 0,75 cm) of gelijkwaardig (b.v. TSK 2000-SWxl en Agilent Technologies Zorbax GF 250), en een voorkolom (3 cm × 0,3 cm), gepakt met I 125 of gelijkwaardig materiaal;
6.11.4. kolomoven met thermostaat, ingesteld op 35 ± 1 °C;
6.11.5. UV-detector met variabele golflengte, instelbaar op 205 nm, met een gevoeligheid van 0,008 Å;
6.11.6. integrator waarmee van dal tot dal kan worden geïntegreerd.
NB: Zo nodig kan met kolommen op kamertemperatuur worden gewerkt, maar het scheidend vermogen daarvan is iets lager. In dergelijke gevallen mogen de temperatuurschommelingen binnen een analyseserie niet meer dan ± 5 °C bedragen.
7. MONSTERNEMING
7.1. De monsters moeten worden genomen volgens de procedure van internationale norm ISO 707. De lidstaten mogen echter een andere monsternemingsmethode gebruiken, mits deze de beginselen van bovengenoemde norm in acht neemt.
7.2. Bewaar het monster onder zodanige omstandigheden dat bederf of wijziging van de samenstelling uitgesloten is.
8. PROCEDURE
8.1. Bereiding van het testmonster
Breng het melkpoeder over in een houder waarvan de inhoud ongeveer twee keer zo groot is als het volume van het poeder, voorzien van een luchtdicht deksel. Sluit de houder onmiddellijk. Meng het melkpoeder grondig door de houder herhaaldelijk om te keren.
8.2. Testhoeveelheid
Weeg in een centrifugebuis (6.2) of een geschikte kolf met stop (50 ml) 2,000 ± 0,001 g testmonster af.
8.3. Verwijdering van vetten en eiwitten
8.3.1. Voeg aan de testhoeveelheid 20,0 ml warm water (50 °C) toe. Los het poeder op door gedurende 5 minuten op het schudapparaat (6.3) te schudden. Zet de buis in het waterbad (6.10) en equilibreer op 25 °C.
8.3.2. Voeg in 2 minuten onder krachtig roeren met de magneetroerder (6.4) 10,0 ml trichloorazijnzuuroplossing (5.1) van ongeveer 25 °C toe. Zet de buis gedurende 60 minuten in een waterbad (6.10).
8.3.3. Centrifugeer (6.2) gedurende 10 minuten bij 2 200 g of filtreer over filtreerpapier (6.6), waarbij de eerste 5 ml filtraat niet wordt opgevangen.
8.4. Chromatografische bepaling
8.4.1. Injecteer een nauwkeurig afgemeten hoeveelheid van 15-30 μl supernatans of filtraat (8.3.3) in het HPLC-apparaat (6.11) bij een debiet van 1,0 ml loopvloeistof (5.2) per minuut.
NB 1: Afhankelijk van de inwendige diameter van de gebruikte kolommen of de aanwijzingen van de fabrikant van de kolom kan een ander debiet worden gebruikt.
NB 2: Houd de loopvloeistof (5.2) gedurende de hele chromatografische analyse op 85 °C om de vloeistof ontgast te houden en bacteriegroei te voorkomen. Ook andere voorzorgsmaatregelen met een vergelijkbaar effect kunnen worden toegepast.
NB 3: Spoel de kolommen gedurende elke onderbreking met water. Laat nooit loopvloeistof (5.2) in de kolommen staan.
Spoel de kolommen vóór elke onderbreking van meer dan 24 uur met water en vervolgens gedurende ten minste drie uur met oplossing (5.3) bij een debiet van 0,2 ml per minuut.
8.4.2. De resultaten van de chromatografische analyse van het testmonster [E] worden verkregen in de vorm van een chromatogram, waarin elke piek als volgt wordt geïdentificeerd door zijn retentietijd RT:
|
Piek II: |
De tweede piek van het chromatogram met een RT van ongeveer 12,5 minuten. |
|
Piek III: |
De derde piek van het chromatogram (de piek van de CMP) met een RT van 15,5 minuten. |
De keuze van de kolom(men) kan een significante invloed hebben op de retentietijd van de verschillende pieken.
De integrator (6.11.6) berekent automatisch het oppervlak A van elke piek:
|
AII: |
het oppervlak van piek II |
|
AIII: |
het oppervlak van piek III |
Om eventuele onregelmatigheden ten gevolge van slecht werkende apparatuur of kolommen of de herkomst en aard van het geanalyseerde monster te kunnen signaleren, moet vóór de kwantitatieve interpretatie het algemene beeld van elk chromatogram worden bekeken.
Bij twijfel wordt de analyse herhaald.
8.5. Kalibratie
8.5.1. Volg voor de standaardmonsters (5.4) exact de onder 8.2 tot en met 8.4.2 beschreven procedure.
Gebruik vers bereide oplossingen omdat CMP in 8 % trichloorazijnzuur ontleden. Het verlies wordt bij 30 °C geraamd op 0,2 % per uur.
8.5.2. Conditioneer de kolommen vóór de chromatografische bepaling van de monsters door herhaaldelijk het standaardmonster (5.4.2) in oplossing (8.5.1) te injecteren totdat het oppervlak en de retentietijd van de CMP-piek constant zijn.
8.5.3. Bepaal de responsfactoren R door hetzelfde volume filtraat (8.5.1) te injecteren als voor de monsters is gebruikt.
9. WEERGAVE VAN DE RESULTATEN
9.1. Berekeningswijze en formules
9.1.1. Berekening van de responsfactoren R:
|
Piek II: |
RII = 100/(AII[0]) |
Hierbij is:
|
RII |
= |
de responsfactor voor piek II |
|
AII[0] |
= |
het oppervlak van piek II van standaardmonster [0], verkregen bij 8.5.3 |
|
Piek III: |
RIII = W/(AIII[5] – AIII[0]) |
Hierbij is:
|
RIII |
= |
de responsfactor voor piek III |
|
AIII[0] en AIII[5] |
= |
het oppervlak van piek III van respectievelijk standaardmonster [0] en standaardmonster [5], verkregen bij 8.5.3 |
|
W |
= |
de hoeveelheid wei in standaardmonster [5], d.w.z. 5 |
9.1.2. Berekening van het relatieve oppervlak van de pieken van monster [E]
SII[E] = RII × AII[E]
SIII[E] = RIII × AIII[E]
SIV[E] = RIV × AIV[E]
Hierbij is:
|
SII[E], SIII[E] en SIV[E] |
= |
het relatieve oppervlak van respectievelijk de pieken II, III en IV van monster [E] |
|
AII[E] en AIII[E] |
= |
het oppervlak van respectievelijk de pieken II en III van monster [E], verkregen bij 8.4.2 |
|
RII en RIII |
= |
de bij punt 9.1.1 berekende responsfactoren |
9.1.3. Berekening van de relatieve retentietijd van piek III van monster [E]: RRTIII[E] = (RTIII[E])/(RTIII[5])
Hierbij is:
|
RRTIII[E] |
= |
de relatieve retentietijd van piek III van monster [E] |
|
RTIII[E] |
= |
de retentietijd van piek III van monster [E], verkregen bij 8.4.2 |
|
RTIII[5] |
= |
de retentietijd van piek III van standaardmonster [5], verkregen bij 8.5.3 |
9.1.4. Experimenteel is aangetoond dat er tot 10 % een lineair verband is tussen de relatieve retentietijd van piek III (RRTIII[E]) en het toegevoegde percentage weipoeder:
|
— |
RRTIII[E] < 1,000 bij een weigehalte > 5 % |
|
— |
RRTIII[E] ≥ 1,000 bij een weigehalte ≤ 5 % |
De toegestane onzekerheid voor de waarden van RRTIII is ±0,002.
Doorgaans verschilt de waarde RRTIII[0] weinig van 1,034. Afhankelijk van de toestand van de kolommen mag deze waarde 1,000 benaderen, maar moet zij wel altijd groter dan 1,000 blijven.
9.2. Bereken het percentage lebweipoeder in het monster:
W = SIII[E] – [1,3 + (SIII[0] – 0,9)]
Hierbij is:
|
W |
= |
het percentage m/m lebwei in monster [E] |
|
SIII[E] |
= |
het relatieve oppervlak van piek III van monster [E], verkregen bij 9.1.2 |
|
1,3 |
= |
het gemiddelde relatieve oppervlak van piek III, uitgedrukt in gram lebwei per 100 g, bepaald in onvermengde mageremelkpoeder van verschillende herkomst. Deze waarde is experimenteel vastgesteld |
|
SIII[0] |
= |
het relatieve oppervlak van piek III, dat gelijk is aan RIII × AIII[0]. Deze waarden zijn bij respectievelijk 9.1.1 en 8.5.3 verkregen |
|
(SIII[0] – 0,9) |
= |
de correctie voor het gemiddelde relatieve oppervlak 1,3 als SIII[0] afwijkt van 0,9. Het gemiddelde relatieve oppervlak van piek III van standaardmonster [0] is experimenteel vastgesteld op 0,9 |
9.3. Nauwkeurigheid van de methode
9.3.1. Herhaalbaarheid
Het verschil tussen de resultaten van twee bepalingen die tegelijkertijd of kort na elkaar door dezelfde persoon met dezelfde apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 0,2 % m/m.
9.3.2. Reproduceerbaarheid
Het verschil tussen twee aparte en onafhankelijke resultaten die in twee verschillende laboratoria op identiek testmateriaal zijn verkregen, mag niet groter zijn dan 0,4 % m/m.
9.4. Interpretatie
9.4.1. Wei wordt geacht afwezig te zijn als het relatieve oppervlak van piek III (SIII[E]), uitgedrukt in gram lebwei per 100 g product, ≤ 2,0 + (SIII[0] – 0,9) is, waarbij:
|
2,0 |
= |
de maximaal toelaatbare waarde voor het relatieve oppervlak van piek III, rekening houdend met het gemiddelde relatieve oppervlak van piek III, d.w.z. 1,3, de onzekerheid ten gevolge van de variatie in de samenstelling van mageremelkpoeder en de reproduceerbaarheid van de methode (9.3.2) |
|
(SIII[0] – 0,9) |
= |
de correctie die nodig is als het oppervlak SIII[0] afwijkt van 0,9 (zie 9.2) |
9.4.2. Bepaal, als het relatieve oppervlak van piek III (SIII[E]) > 2,0 + (SIII[0] – 0,9) is en het relatieve oppervlak van piek II (SII[E]) ≤ 160 is, het lebweigehalte volgens 9.2.
Bepaal, als het relatieve oppervlak van piek III (SIII[E]) > 2,0 + (SIII[0] – 0,9) is en het relatieve oppervak van piek II (SII[E]) ≤ 160 is, het totale eiwitgehalte (P %); zie vervolgens de figuren 1 en 2.
9.4.3.1. De resultaten van de analyse van monsters onvermengde mageremelkpoeder met een hoog totaal eiwitgehalte zijn verzameld in de figuren 1 en 2.
De doorgetrokken lijn is het resultaat van de lineaire regressie, waarvan de coëfficiënten worden berekend volgens de kleinste kwadratenmethode.
De onderbroken lijn is de bovengrens van het relatieve oppervlak van piek III die met een waarschijnlijk van 90 % niet zal worden overschreden.
De vergelijkingen voor de onderbroken lijnen van de figuren 1 en 2 zijn:
|
SIII = 0,376 P % – 10,7 |
(figuur 1) |
|
SIII = 0,0123 SII[E] + 0,93 |
(figuur 2) |
Hierbij is:
|
SIII |
= |
het relatieve oppervlak van piek III, berekend aan de hand van het totale eiwitgehalte of aan de hand van het relatieve oppervlak van piek SII[E] |
|
P % |
= |
het totale eiwitgehalte, uitgedrukt in gewichtspercenten |
|
SII[E] |
= |
het bij 9.1.2 berekende relatieve oppervlak van het monster |
Deze vergelijkingen komen overeen met het bij 9.2 vermelde getal 1,3.
De afwijking (T1 en T2) tussen het gevonden relatieve oppervlak SIII[E] en het relatieve oppervlak SIII is: T1 = SIII[E] – [(0,376 P % – 10,7) + (SIII[0] – 0,9)] T2 = SIII[E] — [(0,0123 SII[E] + 0,93) + (SIII[0] — 0,9)]
|
Als T1 en/of T2 |
gelijk aan nul of negatief zijn, kan de aanwezigheid van lebwei niet worden vastgesteld. |
|
Als T1 en/of T2 |
positief zijn, dan is lebwei aanwezig. |
Het lebweigehalte wordt berekend met de volgende vergelijking: W = T2+0,91
Hierbij is:
0,91 = de afstand op de verticale as tussen de doorgetrokken lijn en de onderbroken lijn.
Mageremelkpoeder

Mageremelkpoeder

BIJLAGE XIII
(Artikel 9)
BEPALING VAN VASTE LEBWEIBESTANDDELEN IN MAGEREMELKPOEDER EN DE IN VERORDENING (EG) NR. 2799/1999 BEDOELDE MENGSELS
1. DOEL: DETECTIE VAN DE TOEVOEGING VAN VASTE LEBWEIBESTANDDELEN AAN:
|
a) |
mageremelkpoeder als gedefinieerd in artikel 2 van Verordening (EG) nr. 2799/1999; en |
|
b) |
mengsels als gedefinieerd in artikel 4 van Verordening (EG) nr. 2799/1999. |
2. REFERENTIES: INTERNATIONALE NORM ISO 707
3. DEFINITIE
Het gehalte aan vaste lebweibestanddelen wordt gedefinieerd als het massapercentage, zoals bepaald door het gehalte aan caseïnemacropeptiden volgens onderstaande methode.
4. PRINCIPE
Het gehalte aan caseïnemacropeptiden wordt overeenkomstig bijlage XII bepaald. Monsters die positieve resultaten opleveren, worden met behulp van reversed phase hogedrukvloeistofchromatografie (HPLC) geanalyseerd op caseïnemacropeptide A. De monsters kunnen ook direct met behulp van reversed phase HPLC worden geanalyseerd. Het resultaat wordt aan de hand van standaardmonsters die bestaan uit mageremelkpoeder waaraan al dan niet een bekend percentage weipoeder is toegevoegd, beoordeeld. Een resultaat dat hoger is dan 1 % m/m geeft aan dat vaste lebweibestanddelen aanwezig zijn.
5. REAGENTIA
Alle reagentia dienen van analysekwaliteit te zijn. Het gebruikte water dient gedestilleerd water of water van ten minste gelijkwaardige zuiverheid te zijn. Acetonitril moet van spectroscopie- of HPLC-kwaliteit zijn.
De voor de methode benodigde reagentia worden in bijlage XII van deze verordening beschreven.
Reagentia voor reversed phase HPLC:
5.1. Trichloorazijnzuuroplossing
Los 240 g trichloorazijnzuur (CCl3COOH) op in water en vul aan tot 1 000 ml. De oplossing moet helder en kleurloos zijn.
5.2. Loopvloeistoffen A en B
Loopvloeistof A: breng 150 ml acetonitril (CH3CN), 20 ml isopropanol (CH3CHOHCH3) en 1,00 ml trifluorazijnzuur (TFA, CF3COOH) in een maatkolf van 1 000 ml. Vul met water aan tot 1 000 ml.
Loopvloeistof B: breng 550 ml acetonitril, 20 ml isopropanol en 1,00 ml TFA in een maatkolf van 1 000 ml. Vul met water aan tot 1 000 ml. Filtreer de loopvloeistof vóór gebruik over een membraanfilter met een poriegrootte van 0,45 μm.
5.3. Conservering van de kolommen
Na de analyses wordt de kolom gespoeld met loopvloeistof B (volgens een gradiënt) en vervolgens met acetonitril (volgens een gradiënt gedurende 30 minuten). De kolom wordt in acetonitril bewaard.
5.4. Standaardmonsters
5.4.1. Mageremelkpoeder dat aan de eisen voor openbare opslag voldoet (standaard [0]).
5.4.2. Hetzelfde mageremelkpoeder dat is vermengd met 5 % m/m lebweipoeder met een standaardsamenstelling (standaard [5]).
5.4.3. Hetzelfde mageremelkpoeder dat is vermengd met 50 % m/m lebweipoeder met een standaardsamenstelling (standaard [50]) (1).
6. APPARATUUR
De voor de methode benodigde apparatuur wordt in bijlage XII van deze verordening beschreven.
6.1. Analytische balans.
6.2. Eventueel een centrifuge met een centrifugaalkracht tot minimaal 2 200 g, voorzien van centrifugebuizen met stop of dop met een inhoud van ongeveer 50 ml.
6.3. Mechanisch schudapparaat.
6.4. Magneetroerder.
6.5. Glazen trechters, diameter ongeveer 7 cm.
6.6. Filtreerpapier, normaal, diameter ongeveer 12,5 cm.
6.7. Glazen filtreerapparaat met membraanfilter met een poriegrootte van 0,45 μm.
6.8. Meetpipetten, geschikt voor 10 ml (ISO 648, klasse A, of ISO/R 835) of een doseersysteem dat in 2 minuten 10,0 ml kan toevoegen.
6.9. Doseersysteem dat 20,0 ml water bij ongeveer 50 °C kan toevoegen.
6.10. Waterbad met thermostaat, ingesteld op 25 ± 0,5 °C.
HPLC-apparaat bestaande uit:
6.11.1. binaire gradiëntpomp;
6.11.2. injector, al dan niet automatisch, capaciteit 100 μl;
6.11.3. kolom Agilent Technologies Zorbax 300 SB-C3 (lengte 25 cm, inwendige diameter 0,46 cm) of een gelijkwaardige reversed phase silica-kolom met grote poriën;
6.11.4. kolomoven met thermostaat, ingesteld op 35 ± 1 °C;
6.11.5. UV-detector met variabele golflengte, instelbaar op 210 nm (indien nodig kan een langere golflengte tot 220 nm worden gebruikt), met een gevoeligheid van 0,02 Å;
6.11.6. integrator waarmee de integratie kan worden ingesteld op gemeenschappelijke basislijn of dal-tot-dal.
NB: Zo nodig kan met kolommen op kamertemperatuur worden gewerkt, mits de kamertemperatuur dan niet meer dan 1 °C fluctueert, omdat de variatie in de retentietijd van CMPA anders te groot wordt.
7. MONSTERNEMING
7.1. De monsters moeten worden genomen volgens de procedure van internationale norm ISO 707. De lidstaten mogen echter een andere monsternemingsmethode gebruiken, mits deze de beginselen van bovengenoemde norm in acht neemt.
7.2. Bewaar het monster onder zodanige omstandigheden dat bederf of wijziging van de samenstelling uitgesloten is.
8. PROCEDURE
8.1. Bereiding van het testmonster
Breng het melkpoeder over in een houder waarvan de inhoud ongeveer twee keer zo groot is als het volume van het poeder, voorzien van een luchtdicht deksel. Sluit de houder onmiddellijk. Meng het melkpoeder grondig door de houder herhaaldelijk om te keren.
8.2. Testhoeveelheid
Weeg in een centrifugebuis (6.2) of een geschikte kolf met stop (50 ml) 2,00 ± 0,001 g testmonster af.
NB: Weeg bij mengsels een zodanige hoeveelheid testmonster af dat de ontvette testhoeveelheid overeenkomt met 2,00 g.
8.3. Verwijdering van vetten en eiwitten
8.3.1. Voeg aan de testhoeveelheid 20,0 ml warm water (50 °C) toe. Los het poeder op door gedurende 5 of voor zure karnemelk 30 minuten op het schudapparaat (6.3) te schudden. Zet de buis in het waterbad (6.10) en equilibreer op 25 °C.
8.3.2. Voeg in 2 minuten onder krachtig roeren met de magneetroerder (6.4) met constante snelheid 10,0 ml trichloorazijnzuuroplossing (5.1) van ongeveer 25 °C toe. Zet de buis gedurende 60 minuten in een waterbad (6.10).
8.3.3. Centrifugeer (6.2) gedurende 10 minuten bij 2 200 g of filtreer over filtreerpapier (6.6), waarbij de eerste 5 ml filtraat niet wordt opgevangen.
8.4. Chromatografische bepaling
8.4.1. Voer de in bijlage XII beschreven HPLC-analyse uit. Als een negatief resultaat wordt verkregen, bevat het geanalyseerde monster geen vaste lebweibestanddelen in detecteerbare hoeveelheden. Als het resultaat positief is, moet onderstaande reversed phase HPLC-procedure worden uitgevoerd. De reversed phase HPLC-methode kan ook direct worden uitgevoerd. Als zurekarnemelkpoeder aanwezig is, kan dit met de in bijlage XII beschreven methode tot vals-positieve resultaten leiden. Deze mogelijkheid is bij de reversed phase HPLC-methode uitgesloten.
8.4.2. Voordat de reversed phase HPLC-analyse wordt uitgevoerd, moeten de gradiëntomstandigheden worden geoptimaliseerd. Voor gradiëntsystemen met een dood volume (d.w.z. het volume vanaf het punt waar de twee loopvloeistoffen samenkomen tot en met het volume in de injectorlus) van ongeveer 6 ml is een retentietijd van 26 ± 2 minuten voor CMPA optimaal. Voor gradiëntsystemen met een kleiner dood volume (bv. 2 ml) moet 22 minuten als optimale retentietijd worden gehanteerd.
Neem oplossingen van de standaardmonsters (5.4) met en zonder 50 % lebwei.
Injecteer 100 μl supernatans of filtraat (8.3.3) in het HPLC-apparaat bij de in tabel 1 vermelde verkennende gradiëntomstandigheden.
Tabel 1
Verkennende gradiëntomstandigheden om de chromatografische analyse te optimaliseren
|
Tijd (min) |
Debiet (ml/min) |
%A |
%B |
Curve |
|
Aanvankelijk |
1,0 |
90 |
10 |
* |
|
27 |
1,0 |
60 |
40 |
lineair |
|
32 |
1,0 |
10 |
90 |
lineair |
|
37 |
1,0 |
10 |
90 |
lineair |
|
42 |
1,0 |
90 |
10 |
lineair |
Door de twee chromatogrammen te vergelijken kan de plaats van de CMPA-piek worden bepaald.
Met onderstaande vergelijking kan de beginsamenstelling van de loopvloeistof voor de normale gradiënt (8.4.3) worden berekend: %B = 10 – 2,5 + (13,5 + (RTCMPA – 26) / 6) × 30 / 27 % B = 7,5 + (13,5 + (RTCMPA – 26) / 6) × 1,11
Hierbij is:
|
RTcmpA |
: |
de retentietijd van CMPA in de verkennende gradiënt; |
|
10 |
: |
aanvankelijke %B van de verkennende gradiënt; |
|
2,5 |
: |
%B halverwege minus aanvankelijke %B van de normale gradiënt; |
|
13,5 |
: |
tijdstip halverwege de verkennende gradiënt; |
|
26 |
: |
vereiste retentietijd voor CMPA; |
|
6 |
: |
verhouding van de hellingen van de verkennende en de normale gradiënt; |
|
30 |
: |
aanvankelijke %B minus %B na 27 minuten van de verkennende gradiënt; |
|
27 |
: |
looptijd van de verkennende gradiënt. |
8.4.3. Neem oplossingen van de testmonsters:
Injecteer een nauwkeurig afgemeten hoeveelheid van 100 μl supernatans of filtraat (8.3.3) in het HPLC-apparaat bij een debiet van 1,0 ml loopvloeistof (5.2) per minuut.
De samenstelling van de loopvloeistof bij het begin van de analyse wordt volgens 8.4.2 bepaald. Normaliter is deze ongeveer A:B = 76:24 (5.2). Onmiddellijk na het injecteren wordt een lineaire gradiënt gestart die leidt tot een 5 % hoger percentage B na 27 minuten. Vervolgens wordt een nieuwe lineaire gradiënt gestart die het percentage B in de loopvloeistof in 5 minuten op 90 % brengt. Deze samenstelling wordt gedurende 5 minuten gehandhaafd, waarna de samenstelling via een lineaire gradiënt in 5 minuten wordt gewijzigd tot de aanvankelijke samenstelling. Afhankelijk van het interne volume van het pompsysteem kan 15 minuten na het bereiken van de aanvankelijke samenstelling opnieuw worden geïnjecteerd.
NB1: De retentietijd van CMPA moet 26 ± 2 minuten zijn. Dit kan worden bereikt door de aanvankelijke en eindsamenstelling van de eerste gradiënt te variëren. Het verschil in %B tussen de aanvankelijke en eindsamenstelling van de eerste gradiënt moet echter 5 % blijven.
NB2: De loopvloeistoffen moeten afdoende worden ontgast en moeten ook ontgast blijven. Dit is essentieel voor een goede werking van het gradiëntpompsysteem. De standaarddeviatie voor de retentietijd van de CMPA-piek moet kleiner zijn dan 0,1 minuut (n = 10).
NB3: Om de vijf monsters moet referentiemonster [5] worden geïnjecteerd en worden gebruikt om een nieuwe responsfactor R (9.1.1) te berekenen.
8.4.4. De resultaten van de chromatografische analyse van het testmonster [E] worden verkregen in de vorm van een chromatogram waarop de CMPA-piek aan de hand van zijn retentietijd van ongeveer 26 minuten kan wordt geïdentificeerd.
De integrator (6.11.6) berekent automatisch de piekhoogte H van de CMPA-piek. Op ieder chromatogram moet de plaats van de basislijn worden gecontroleerd. Als de basislijn zich niet op de juiste plaats bevindt, moet de analyse of de integratie worden herhaald.
NB: Als de CMPA-piek afdoende van de andere pieken gescheiden is, moet de dal-tot-dal basislijn worden gebruikt; in andere gevallen worden loodlijnen getrokken naar een gemeenschappelijke basislijn die in de buurt van de CMPA-piek moet beginnen (dus niet bij t = 0!). Gebruik voor de standaard en de monsters dezelfde integratievorm en controleer bij een gemeenschappelijke basislijn of deze voor de monsters en de standaard consistent is.
Om eventuele onregelmatigheden ten gevolge van slecht werkende apparatuur of kolommen of in verband met de herkomst en aard van het geanalyseerde monster te kunnen signaleren, moet vóór de kwantitatieve interpretatie het algemene beeld van elk chromatogram worden bekeken. Bij twijfel wordt de analyse herhaald.
8.5. Kalibratie
8.5.1. Volg voor de standaardmonsters (5.4.1 tot 5.4.2) exact de onder 8.2 tot en met 8.4.4 beschreven procedure. Gebruik vers bereide oplossingen omdat CMP in 8 % trichloorazijnzuur bij kamertemperatuur ontleden. Bij 4 °C blijft de oplossing 24 uur stabiel. Bij een lange reeks analyses is het gebruik van een gekoelde monsterhouder in de automatische injector wenselijk.
NB: 8.4.2. kan worden overgeslagen als de aanvankelijke %B uit eerdere analyses bekend is.
Het chromatogram van referentiemonster [5] moet analoog zijn aan figuur 1. In deze figuur wordt de CMPA-piek voorafgegaan door twee kleine pieken. Het is essentieel dat eenzelfde scheiding wordt verkregen.
8.5.2. Injecteer vóór de chromatografische bepaling van de monsters 100 μl standaardmonster [0] zonder lebwei (5.4.1)
Het chromatogram mag geen piek vertonen op de retentietijd van de CMPA-piek.
8.5.3. Bepaal de responsfactoren R door hetzelfde volume filtraat (8.5.1) te injecteren als voor de monsters is gebruikt.
9. WEERGAVE VAN DE RESULTATEN
9.1. Berekeningswijze en formules
9.1.1. Berekening van de responsfactor R:
CMPA-piek: R = W/H
Hierbij is:
|
R |
= |
de responsfactor voor de CMPA-piek |
|
H |
= |
de hoogte van de CMPA-piek |
|
W |
= |
de hoeveelheid wei in standaardmonster [5] |
9.2. Berekening van het percentage lebweipoeder in het monster
W[E] = R × H[E]
Hierbij is:
|
W[E] |
= |
het percentage m/m lebwei in monster [E] |
|
R |
= |
de responsfactor van de CMPA-piek (9.1.1) |
|
H[E] |
= |
de hoogte van de CMPA-piek van monster [E] |
Als W[E] groter is dan 1 % en het verschil tussen de retentietijd en die van standaardmonster [5] kleiner is dan 0,2 minuut, zijn er vaste lebweibestanddelen aanwezig.
9.3. Nauwkeurigheid van de methode
9.3.1. Herhaalbaarheid
Het verschil tussen de resultaten van twee bepalingen die tegelijkertijd of kort na elkaar door dezelfde persoon met dezelfde apparatuur op identiek testmateriaal zijn uitgevoerd, mag niet groter zijn dan 0,2 % m/m.
9.3.2. Reproduceerbaarheid
Niet bepaald.
9.3.3. Lineariteit
Van 0 tot 16 % lebwei moet er een lineaire relatie worden verkregen met een correlatiecoëfficiënt > 0,99.
9.4. Interpretatie
De grenswaarde van 1 % is bepaald overeenkomstig de bepalingen van Verordening (EG) nr. 214/2001, bijlage XIX, punten 9.2 en 9.4.1, en hierin is ook de onzekerheid vanwege de reproduceerbaarheid is opgenomen.
Figuur 1
Ni–4,6 standaard

(1) Lebweipoeder met een standaardsamenstelling en het reeds vermengde mageremelkpoeder zijn verkrijgbaar bij het NIZO, Kernhemseweg 2, Postbus 20, NL-6710 BA Ede. Poeders die vergelijkbare resultaten geven als de NIZO-poeders, mogen echter ook worden gebruikt.
BIJLAGE XIV
(Artikel 10)
MAGEREMELKPOEDER: KWANTITATIEVE BEPALING VAN FOSFATIDYLSERINE EN FOSFATIDYLETHANOLAMINE
Methode: reversed phase HPLC.
1. DOEL EN TOEPASSINGSGEBIED
De methode beschrijft een procedure voor de kwantitatieve bepaling van fosfatidylserine (PS) en fosfatidylethanolamine (PE) in mageremelkpoeder (MMP) en is geschikt voor de detectie van vaste stoffen uit karnemelk in MMP.
2. DEFINITIE
Gehalte aan PS + PE: de massafractie van de met de hier beschreven methode bepaalde stof. Het resultaat wordt uitgedrukt in milligram dipalmitoyl-fosfatidylethanolamine (DPPE) per 100 g poeder.
3. PRINCIPE VAN DE METHODE
De aminofosfolipiden worden met methanol uit opgelost melkpoeder geëxtraheerd. PS en PE worden met behulp van reversed phase HPLC en fluorescentiedetectie als o-ftaaldialdehyde-derivaten bepaald. Het gehalte aan PS en PE in het testmonster wordt aan de hand van een standaardmonster met een bekend gehalte aan DPPE gekwantificeerd.
4. REAGENTIA
Alle reagentia dienen van analysekwaliteit te zijn. Het gebruikte water dient gedestilleerd water of water van ten minste gelijkwaardige zuiverheid te zijn, tenzij anders wordt vermeld.
4.1. Standaardmateriaal: DPPE met een zuiverheid van ten minste 99 %
NB: Het standaardmateriaal moet bij – 18°C worden bewaard.
4.2. Reagentia voor de bereiding van het standaardmonster en het testmonster
4.2.1. Methanol, HPLC-kwaliteit
4.2.2. Chloroform, HPLC-kwaliteit
4.2.3. Tryptamine-monohydrochloride
4.3. Reagentia voor de o-ftaaldialdehyde-derivatisering
4.3.1. Natriumhydroxide, 12 M oplossing in water
4.3.2. Boorzuur, 0,4 M oplossing in water, waarvan de pH met natriumhydroxide (4.3.1) op 10,0 is gebracht
4.3.3. 2-Mercaptoethanol
4.3.4. o-Ftaaldialdehyde (OPA)
4.4. Loopvloeistoffen voor HPLC
4.4.1. De loopvloeistoffen moeten met reagentia van HPLC-kwaliteit worden bereid.
4.4.2. Water van HPLC-kwaliteit
4.4.3. Methanol met een fluorimetrisch bepaalde zuiverheid
4.4.4. Tetrahydrofuraan
4.4.5. Natriumdiwaterstoffosfaat
4.4.6. Natriumacetaat
4.4.7. Azijnzuur
5. APPARATUUR
5.1. Analytische balans, tot op 1 mg nauwkeurig en tot op 0,1 mg afleesbaar
5.2. Bekerglazen, 25 en 100 ml
5.3. Pipetten waarmee 1 en 10 ml kan worden toegevoegd
5.4. Magneetroerder
5.5. Meetpipetten waarmee 0,2, 0,5 en 5 ml kan worden toegevoegd
5.6. Maatkolven, 10, 50 en 100 ml
5.7. Injectiespuiten, 20 en 100 μl
5.8. Ultrasoonbad
5.9. Centrifuge, geschikt voor 27 000 × g
5.10. Glazen flesjes, ongeveer 5 ml
5.11. Maatcilinder, 25 ml
5.12. pH-meter, tot op 0,1 pH-eenheid nauwkeurig
HPLC-apparatuur:
5.13.1. gradiëntpompsysteem, geschikt voor een debiet van 1,0 ml/minuut bij 200 bar
5.13.2. autosampler, geschikt voor derivatisering
5.13.3. kolomverwarming, geschikt om de kolom op 30 °C ± 1 °C te houden
5.13.4. fluorescentiedetector, geschikt voor een excitatiegolflengte van 330 nm en een emissiegolflengte van 440 nm
5.13.5. integrator of software voor gegevensverwerking, geschikt voor piekoppervlakmeting
5.13.6. kolom: Lichrosphere-100 (250 × 4,6 mm) of een vergelijkbare kolom, gepakt met octadecylsilaan (C 18) met een deeltjesgrootte van 5 μm
6. MONSTERNEMING
De monsters moeten overeenkomstig ISO-norm 707 worden genomen.
7. PROCEDURE
7.1. Bereiding van de interne standaardoplossing
7.1.1. Weeg 30,0 ± 0,1 mg tryptamine-monohydrochloride (4.2.3) af in een maatkolf van 100 ml (5.6) en vul met methanol (4.2.1) aan tot de maatstreep.
7.1.2. Pipetteer 1 ml (5.3) van deze oplossing in een maatkolf van 10 ml (5.6) en vul met methanol (4.2.1) aan tot de maatstreep voor een tryptamineconcentratie van 0,15 mM.
7.2. Bereiding van de testoplossing
7.2.1. Weeg 1,000 ± 0,001 g MMP-monster af in een bekerglas van 25 ml (5.2). Voeg met een pipet (5.3) 10 ml gedestilleerd water van 40 °C ± 1 °C toe en roer gedurende 30 minuten met een magneetroerder (5.4) om eventuele klontjes op te lossen.
7.2.2. Pipetteer 0,2 ml (5.5) melkpoederoplossing in een maatkolf van 10 ml (5.6), voeg met een injectiespuit (5.7) 100 μl 0,15 mM tryptamineoplossing (7.1) toe en vul met methanol (4.2.1) aan tot de maatstreep. Meng zorgvuldig door omkeren en ultrasoonbehandeling (5.8) gedurende 15 minuten.
7.2.3. Centrifugeer (5.9) gedurende 10 minuten bij 27 000 g en vang het supernatans in een glazen flesje (5.10) op.
NB: De testoplossing moet bij 4 °C worden bewaard totdat de HPLC-analyse wordt uitgevoerd.
7.3. Bereiding van de externe standaardoplossing
7.3.1. Weeg 55,4 mg DPPE (4.1) af in een maatkolf van 50 ml (5.6) en voeg met een maatcilinder (5.11) ongeveer 25 ml chloroform (4.2.2) toe. Verwarm de kolf (met een stop erop) tot 50 °C ± 1 °C en meng zorgvuldig tot het DPPE oplost. Koel de kolf af tot 20 °C, vul met methanol (4.2.1) aan tot de maatstreep en meng door omkeren.
7.3.2. Pipetteer 1 ml (5.3) van deze oplossing in een maatkolf van 100 ml (5.6) en vul met methanol (4.2.1) aan tot de maatstreep. Pipetteer 1 ml (5.3) van deze oplossing in een maatkolf van 10 ml (5.6), voeg 100 μl (5.7) 0,15 mM tryptamineoplossing (7.1) toe en vul met methanol (4.2.1) aan tot de maatstreep. Meng door omkeren.
NB: De standaardoplossing moet bij 4 °C worden bewaard totdat de HPLC-analyse wordt uitgevoerd.
7.4. Bereiding van het derivatiseringsreagens
Weeg 25,0 ± 0,1 mg OPA (4.3.4) af in een maatkolf van 10 ml (5.6), voeg 0,5 ml (5.5) methanol (4.2.1) toe en meng zorgvuldig om het OPA op te lossen. Vul met boorzuuroplossing (4.3.2) aan tot de maatstreep en voeg met een injectiespuit (5.7) 20 μl 2-mercaptoethanol (4.3.3) toe.
NB: Het derivatiseringsreagens moet bij 4 °C in een bruine fles worden bewaard en is gedurende één week stabiel.
7.5. Bepaling met HPLC
7.5.1. Loopvloeistoffen (4.4)
Vloeistof A: oplossing van 0,3 mM natriumdiwaterstoffosfaat en 3 mM natriumacetaat (met azijnzuur op pH 6,5 ± 0,1 gebracht):methanol:tetrahydrofuraan = 558:440:2 (v/v/v).
Vloeistof B: methanol.
7.5.2. Aanbevolen loopvloeistofgradiënt:
|
Tijd (min) |
Vloeistof A (%) |
Vloeistof B (%) |
Debiet (ml/min) |
|
Aanvankelijk |
40 |
60 |
0 |
|
0,1 |
40 |
60 |
0,1 |
|
5,0 |
40 |
60 |
0,1 |
|
6,0 |
40 |
60 |
1,0 |
|
6,5 |
40 |
60 |
1,0 |
|
9,0 |
36 |
64 |
1,0 |
|
10,0 |
20 |
80 |
1,0 |
|
11,5 |
16 |
84 |
1,0 |
|
12,0 |
16 |
84 |
1,0 |
|
16,0 |
10 |
90 |
1,0 |
|
19,0 |
0 |
100 |
1,0 |
|
20,0 |
0 |
100 |
1,0 |
|
21,0 |
40 |
60 |
1,0 |
|
29,0 |
40 |
60 |
1,0 |
|
30,0 |
40 |
60 |
0 |
NB: De loopvloeistofgradiënt moet wellicht enigszins worden gewijzigd om de resolutie van figuur 1 te krijgen.
Kolomtemperatuur: 30 °C.
7.5.3. Geïnjecteerd volume: 50 μl derivatiseringsreagens en 50 μl testoplossing
7.5.4. Equilibreren van de kolom
Spoelen de kolom elke dag eerst gedurende 15 minuten met 100 % vloeistof B; breng vervolgens de verhouding A:B op 40:60 en equilibreer gedurende 15 minuten bij 1 ml/minuut. Voer een blancobepaling uit door methanol (4.2.1) te injecteren.
NB: Spoel de kolom, als deze lange tijd niet wordt gebruikt, gedurende 30 minuten met methanol:chloroform = 80:20 (v/v).
7.5.5. Bepaal het gehalte aan PS + PE van het testmonster
7.5.6. Voer de reeks chromatografische analyses uit, waarbij de tijd van run tot run constant wordt gehouden om constante retentietijden te krijgen. Injecteer om de 5-10 testoplossingen de externe standaardoplossing (7.3) om de responsfactor te berekenen
NB: Om de 20-25 runs moet de kolom worden gereinigd door gedurende ten minste 30 minuten met 100 % vloeistof B (7.5.1) te spoelen.
7.6. Wijze van integratie
7.6.1. DPPE-piek
DPPE wordt als één piek geëlueerd. Bepaal het piekoppervlak door dal-tot-dal integratie.
7.6.2. Tryptamine-piek
Tryptamine wordt als één piek geëlueerd (figuur 1). Bepaal het piekoppervlak door dal-tot-dal integratie.
7.6.3. PS- en PE-piekgroepen
Onder de beschreven omstandigheden (figuur 1) wordt PS geëlueerd als twee hoofdpieken die elkaar gedeeltelijk overlappen, voorafgegaan door een kleinere piek. PE wordt geëlueerd als drie hoofdpieken die elkaar gedeeltelijk overlappen. Bepaal het totale oppervlak van elke piekgroep, waarbij de basislijn overeenkomstig figuur 1 wordt bepaald.
8. BEREKENING EN WEERGAVE VAN DE RESULTATEN
Het gehalte aan PS en PE in het testmonster wordt als volgt berekend: C = 55,36 × ((A2)/(A1)) × ((T1)/(T2))
Hierbij is:
|
C |
= |
gehalte aan PS of PE (mg/100 g poeder) in het testmonster |
|
A1 |
= |
DPPE-piekoppervlak van de standaardoplossing (punt 7.3) |
|
A2 |
= |
PS- of PE-piekoppervlak van de testoplossing (punt 7.2) |
|
T1 |
= |
tryptamine-piekoppervlak van de standaardoplossing (punt 7.3) |
|
T2 |
= |
tryptamine-piekoppervlak van de testoplossing (7.2) |
9. NAUWKEURIGHEID VAN DE METHODE
NB: De waarden voor de herhaalbaarheid zijn berekend volgens de internationale IDF-norm (1). De voorlopige grenswaarde voor de reproduceerbaarheid is berekend volgens de procedure van bijlage III, punt b), van deze norm.
9.1. Herhaalbaarheid
De relatieve standaarddeviatie van de herhaalbaarheid, die een maat is voor de variabiliteit van onafhankelijke analyseresultaten die binnen korte tijd door dezelfde persoon met dezelfde apparatuur onder dezelfde omstandigheden met hetzelfde testmonster worden verkregen, mag niet groter zijn dan 2 %. Als twee bepalingen onder deze omstandigheden worden uitgevoerd, mag het relatieve verschil tussen de twee resultaten niet groter zijn dan 6 % van het rekenkundig gemiddelde van de resultaten.
9.2. Reproduceerbaarheid
Als twee resultaten door personen in verschillende laboratoria met verschillende apparatuur onder verschillende omstandigheden bij de analyse van hetzelfde testmonster worden verkregen, mag het relatieve verschil tussen de twee resultaten niet groter zijn dan 11 % van het rekenkundig gemiddelde van de resultaten.
10. REFERENTIES
10.1 Resmini P., Pellegrino L., Hogenboom J.A., Sadini V., Rampilli M.: „Detection of buttermilk solids in skimmilk powder by HPLC quantification of aminophospholipids”, Sci. Tecn. Latt.-Cas., 39,395 (1988).
Figuur 1
HPLC-patroon van OPA-derivaten van fosfatidylserine (PS) en fosfatidylethanolamine (PE) in methanolextract van opgelost mageremelkpoeder. De integratiewijze voor de pieken van PS, PE en tryptamine (interne standaard) wordt gerapporteerd

(1) Internationale IDF-norm 135B/1991. Melk en melkproducten. Precisie van analysemethoden. Schets van een procedure voor een ringonderzoek.
BIJLAGE XV
(Artikel 11)
DETECTIE VAN ANTIBIOTICARESIDUEN IN MAGEREMELKPOEDER
Met Geobacillus stearothermophilus var. calidolactis ATCC 10149 (identiek aan stam C953) als testorganisme wordt een screeningtest op bacterieremming uitgevoerd, die gevoelig genoeg is om 4 μg benzylpenicilline per kg melk en 100 μg sulfadimidine per kg melk aan te tonen. Er zijn testkits in de handel verkrijgbaar die kunnen worden gebruikt als zij de vereiste gevoeligheid voor benzylpenicilline en sulfadimidine hebben.
Voor de test wordt opgelost mageremelkpoeder gebruikt (1 g poeder +9 ml gedestilleerd water). De test wordt uitgevoerd volgens de beschrijving in ISO/TS 26844:2006: Melk en melkproducten — Bepaling van antibioticaresiduen — Buisdiffusietest, IDF-bulletin nr. 258/1991, deel 1, hoofdstuk 2, of volgens de instructies van de fabrikant van de testkit (1).
Positieve resultaten worden als volgt geïnterpreteerd:
|
1. |
De aanwezigheid van β-lactamen kan worden bevestigd door de test te herhalen en daarbij penicillinase aan het testsysteem toe te voegen (2): Negatief resultaat: De remmende stof is een β-lactam-antibioticum. Opnieuw positief resultaat: De remmende stof kan zo niet worden geïdentificeerd, ga door naar punt 2. |
|
2. |
De aanwezigheid van sulfonamiden kan worden bevestigd door de test te herhalen en daarbij p-aminobenzoëzuur aan het testsysteem toe te voegen: Negatief resultaat: De remmende stof is een sulfonamide. Opnieuw positief resultaat: De remmende stof kan zo niet worden geïdentificeerd, ga door naar punt 3. |
|
3. |
De aanwezigheid van een combinatie van een β-lactam en een sulfonamide kan worden bevestigd door de test te herhalen en daarbij zowel penicillinase als p-aminobenzoëzuur aan het testsysteem toe te voegen: Negatief resultaat: De remmende stof is een combinatie van een β-lactam-antibioticum met een sulfonamide. Positief resultaat: De remmende stof kan niet met deze methode worden geïdentificeerd. |
(1) Belangrijke opmerking: Bij de analyse van mageremelkpoeder zijn vals-positieve resultaten mogelijk. Het is daarom belangrijk te controleren dat de gebruikte testkit geen vals-positieve resultaten oplevert.
(2) Sommige β-lactamen zijn minder gevoelig voor β-lactamase. In dergelijke gevallen wordt een extra voorbehandeling van het monster (1 ml testmonster met 0,3 ml penaseconcentraat bij 37 °C gedurende twee uur) aanbevolen.
BIJLAGE XVI
(Artikel 12)
KWANTITATIEVE BEPALING VAN MAGEREMELKPOEDER IN MENGVOEDERS DOOR ENZYMATISCHE COAGULATIE VAN PARACASEÏNE
1. DOEL
Kwantitatieve bepaling van mageremelkpoeder in mengvoeders door enzymatische coagulatie van paracaseïne.
2. TOEPASSINGSGEBIED
Deze methode is van toepassing voor mengvoeders die ten minste 10 % mageremelkpoeder bevatten; grote hoeveelheden karnemelk en/of bepaalde andere eiwitten dan melkeiwitten kunnen de bepaling storen.
3. PRINCIPE VAN DE METHODE
3.1. De in het mengvoeder aanwezige caseïne wordt opgelost door extractie met een natriumcitraatoplossing.
3.2. De calciumionen-concentratie wordt opgevoerd om paracaseïne door de toevoeging van stremsel neer te kunnen slaan.
3.3. Het stikstofgehalte van het paracaseïneneerslag wordt volgens de Kjeldahl-methode, zoals beschreven in ISO 8968-2:2001/IDF 20-2:2001, bepaald; de hoeveelheid mageremelkpoeder wordt op basis van een minimaal caseïnegehalte van 27,5 % berekend (zie 8.1).
4. REAGENTIA
De gebruikte reagentia moeten van analysekwaliteit zijn. Het gebruikte water moet gedestilleerd water of water van een gelijkwaardige zuiverheid zijn. Met uitzondering van stremsel (4.5) moeten alle reagentia en oplossingen vrij van stikstofhoudende stoffen zijn.
4.1. Trinatriumcitraat-dihydraat (1 %-oplossing (g/v))
4.2. Calciumchlorideoplossing (ongeveer 5M)
Los door schudden 75 g CaCl2 · 2H2O op in 100 ml gedestilleerd water (pas op voor de exotherme reactie). Laat een nacht staan en filtreer de oplossing. Bewaar de oplossing in een koelkast.
4.3. Natriumhydroxide, 0,1 N
4.4. Zoutzuur, 0,1 N
4.5. Vloeibaar lebstremsel (sterkte ongeveer 100 IMCU/ml volgens de norm ISO 11815/IDF 157). Bewaar in een koelkast bij 4-6 °C
4.6. Reagentia voor de kwantitatieve bepaling van stikstof volgens de Kjeldahl-methode, zoals beschreven in ISO 8968-2:2001/IDF 20-2:2001
5. APPARATUUR
Gangbare laboratoriumapparatuur en met name:
5.1. Mortier of homogenisator
5.2. Analytische balans, tot op 1 mg nauwkeurig en tot op 0,1 mg afleesbaar
5.3. Tafelcentrifuge (500 g of 2 000-3 000 rpm) met buizen van 50 ml en 2 000 g
5.4. Magneetroerder met staafjes (10-15 mm)
5.5. Bekerglazen, 150-200 ml
5.6. Kolven, 250 ml en 500 ml
5.7. Glazen trechters, diameter 60-80 mm
5.8. Asvrije filters, snel filtrerend, diameter 150 mm (Whatman nr. 41 of gelijkwaardig)
5.9. Pipetten, uiteenlopende inhoud
5.10. Waterbad met thermostaat, ingesteld op 37 °C ± 1 °C
5.11. pH-meter, tot op 0,1 eenheid nauwkeurig
5.12. Thermometers, tot op 1 °C nauwkeurig
6. PROCEDURE
6.1. Voorbehandeling van het monster
Homogeniseer 10-20 g monster in de mortier of homogenisator om een homogeen mengsel te krijgen.
6.2. Oplossing van melkpoeder en scheiding van het onoplosbare residu
6.2.1. Weeg 1,000 ± 0,002 g goed gehomogeniseerd mengvoeder (6.1) direct in een centrifugebuis van 50 ml af. Voeg 30 ml trinatriumcitraatoplossing (4.1) toe, die vooraf tot 45 °C ± 2 °C is verwarmd. Meng gedurende ten minste 5 minuten met de magneetroerder of door krachtig met de hand te schudden.
6.2.2. Centrifugeer gedurende 10 minuten bij 500 g (2 000-3 000 rpm) en decanteer het heldere waterige supernatans in een bekerglas van 150-200 ml. Zorg ervoor dat er geen los materiaal van de bodem meegaat.
6.2.3. Extraheer het residu nog twee keer volgens dezelfde procedure en voeg de extracten aan het eerste extract toe.
6.2.4. Koel het extract, als zich op het oppervlak een olielaag vormt, in de koelkast totdat het vet stolt en verwijder de vaste laag met een spatel.
6.3. Coagulatie van caseïne met de stremselenzymen
6.3.1. Voeg onder voortdurend roeren druppelsgewijs 2 ml calciumchloride (4.2) aan het totale waterige extract (ongeveer 100 ml) toe. Stel de pH met de NaOH-oplossing (4.3) of verdund HCl (4.4) in op 6,4-6,5. Zet het bekerglas gedurende 15-20 minuten in het waterbad van 37 °C ± 1 °C, zodat het zoutevenwicht zich kan instellen. Dit wordt zichtbaar door de vorming van een lichte troebeling.
6.3.2. Breng de vloeistof over in een centrifugebuis en centrifugeer gedurende 10 minuten bij 2 000 g om het gevormde neerslag te verwijderen. Breng het supernatans zonder het neerslag te wassen over in een andere centrifugebuis.
6.3.3. Breng de temperatuur van het supernatans opnieuw op 37 °C ± 1 °C. Voeg al roerend druppelsgewijs 0,5 ml vloeibaar stremsel (4.5) aan het extract toe. De coagulatie begint binnen 2 minuten.
6.3.4. Zet het monster weer gedurende 15 minuten in het waterbad van 37 °C ± 1 °C. Haal het monster uit het bad en breek de wrongel door roeren. Centrifugeer gedurende 10 minuten bij 2 000 g. Filtreer het supernatans over geschikt filtreerpapier (5.8) en bewaar het filtreerpapier. Was het neerslag in de centrifugebuis met 50 ml water van ongeveer 35 °C door het neerslag te roeren.
Centrifugeer opnieuw gedurende 10 minuten bij 2 000 g. Filtreer het supernatans over het bewaarde filtreerpapier.
6.4. Bepaling van caseïnestikstof
6.4.1. Breng het neerslag (na wassen) met gedestilleerd water kwantitatief over op het na 6.3.4 bewaarde filtreerpapier. Breng het gedroogde filtreerpapier over in de Kjeldahl-kolf. Bepaal de stikstof volgens de Kjeldahl-methode, zoals beschreven in de norm ISO 8968-2:2001/IDF 20-2:2001.
7. BLANCOBEPALING
7.1. Voer regelmatig een blancobepaling uit door een asvrij filtreerpapier (5.8), bevochtigd met een mengsel van 90 ml trinatriumcitraatoplossing (4.1), 2 ml calciumchlorideoplossing (4.2) en 0,5 ml vloeibaar stremsel (4.5) en gewassen met 3 × 15 ml gedestilleerd water, volgens de Kjeldahl-methode, zoals beschreven in de norm ISO 8968-2:2001/IDF 20-2:2001, te mineraliseren.
7.2. Trek het volume zuur dat bij de blancobepaling is gebruikt, af van het volume zuur (4.4) dat bij de titratie van het monster is gebruikt.
8. WEERGAVE VAN DE RESULTATEN
8.1. Het percentage mageremelkpoeder in het mengvoeder wordt met de volgende vergelijking berekend:

Hierbij is:
N = het percentage paracaseïnestikstof;
27,5 = de factor om de bepaalde caseïne in het percentage mageremelkpoeder om te rekenen;
2,81 en 0,908 = correctiefactoren die bij regressieanalye zijn verkregen.
9. NAUWKEURIGHEID VAN DE METHODE
9.1. Herhaalbaarheid
In ten minste 95 % van de bestudeerde gevallen mogen duplobepalingen die door dezelfde persoon in hetzelfde laboratorium met hetzelfde monster worden uitgevoerd, geen grotere verschillen in de resultaten opleveren dan 2,3 g mageremelkpoeder in 100 g mengvoeder.
9.2. Reproduceerbaarheid
In ten minste 95 % van de bestudeerde gevallen mogen bepalingen die door twee laboratoria met hetzelfde monster worden uitgevoerd, geen grotere verschillen in de resultaten opleveren dan 6,5 g mageremelkpoeder in 100 g mengvoeder.
10. OPMERKINGEN
10.1. Toevoeging van hoge percentages van bepaalde andere eiwitten dan melkeiwitten en met name sojaeiwitten kan, als deze samen met het mageremelkpoeder worden verwarmd, door coprecipitatie met de paracaseïne van melk te hoge resultaten opleveren.
10.2. Toevoeging van karnemelk kan, doordat alleen het niet-vette gedeelte wordt bepaald, iets te lage resultaten opleveren. Toevoeging van bepaalde zurekarnemelkpoeders kan, doordat deze niet volledig in de citraatoplossing oplossen, veel te lage resultaten opleveren.
10.3. Toevoeging van 0,5 % of meer lecithine kan ook te lage resultaten opleveren.
10.4. Toevoeging van „high heat” mageremelkpoeder kan door coprecipitatie van bepaalde wei-eiwitten met de paracaseïne van melk te hoge resultaten opleveren.
BIJLAGE XVII
(Artikel 13)
DETECTIE VAN ZETMEEL IN MAGEREMELKPOEDER, GEDENATUREERD MELKPOEDER EN MENGVOEDERS
1. TOEPASSINGSGEBIED
Deze methode dient voor de detectie van zetmeel, dat in gedenatureerd melkpoeder als verklikstof wordt gebruikt.
De detectielimiet van de methode is ongeveer 0,05 g zetmeel per 100 g monster.
2. PRINCIPE
De reactie is gebaseerd op de in de jodometrie gebruikte reactie:
|
— |
het vrije jood wordt in waterige oplossing door de colloïden gefixeerd; |
|
— |
het wordt door de zetmeelmicellen geabsorbeerd en er ontstaat een kleur. |
3. REAGENTIA
3.1. Joodoplossing
|
— |
jood: 1,0 g, |
|
— |
kaliumjodide: 2,0 g, |
|
— |
gedestilleerd water: 100 ml, |
|
— |
Los 1,0 g jood en 2,0 g kaliumjodide in een maatkolf van 100 ml op in water. Vul met water aan tot de maatstreep en meng. |
4. APPARATUUR
4.1. Analytische balans
4.2. Kokend waterbad
4.3. Reageerbuizen, 25 mm × 200 mm
5. PROCEDURE
Weeg 1,0 g monster tot op 0,1 g nauwkeurig af en breng dit in de reageerbuis (4.3).
Voeg 20 ml gedestilleerd water toe en schud om het monster te dispergeren.
Zet de reageerbuis gedurende 5 minuten in het kokende waterbad (4.2).
Neem de reageerbuis uit het waterbad en laat tot kamertemperatuur afkoelen.
Voeg 0,5 ml joodoplossing (3.1) toe, schud en kijk welke kleur er ontstaat.
6. WEERGAVE VAN DE RESULTATEN
Een blauwe kleur wijst op de aanwezigheid van natief zetmeel in het monster.
Wanneer het monster gemodificeerd zetmeel bevat, is de kleur niet noodzakelijkerwijs blauw.
7. OPMERKINGEN
De kleur, de intensiteit van de kleur en het microscopisch voorkomen van het zetmeel zullen afhankelijk van de herkomst van het natieve zetmeel (bv. maïs of aardappel) en het type gemodificeerd zetmeel in het monster variëren.
Als het monster gemodificeerd zetmeel bevat, ontstaat er afhankelijk van de mate waarin de kristallijne structuur van natief zetmeel gewijzigd is, een paarse, rode of bruine kleur.
BIJLAGE XVIII
(Artikel 14)
BEPALING VAN HET VOCHTGEHALTE VAN GEDROOGDE ROOM
1. TOEPASSINGSGEBIED
Deze bijlage specificeert een methode voor de bepaling van het vochtgehalte van gedroogde room.
2. TERMEN EN DEFINITIES
Voor deze bijlage is de volgende definitie van toepassing:
Vochtgehalte: Het massaverlies, zoals bepaald met behulp van de in deze bijlage gespecificeerde procedure.
Het vochtgehalte wordt uitgedrukt als massapercentage.
3. PRINCIPE
Een testhoeveelheid wordt bij 102 ± 2 °C gedroogd tot constante massa en gewogen om het massaverlies te bepalen.
4. APPARATUUR
De gangbare laboratoriumapparatuur en met name:
4.1. Analytische balans, tot op 1 mg nauwkeurig en tot op 0,1 mg afleesbaar.
4.2. Droogstoof, goed geventileerd, waarvan de temperatuur in de hele werkruimte met een thermostaat op 102 ± 2 °C kan worden gehouden.
4.3. Exsiccator, voorzien van vers gedroogde silicagel met een hygrometrische indicator of een ander effectief droogmiddel.
4.4. Schalen met platte bodem, diepte ongeveer 25 mm en doorsnede ongeveer 50 mm, gemaakt van een geschikt materiaal (bv. glas, roestvrij staal, nikkel of aluminium) en voorzien van een goed passend gemakkelijk verwijderbaar deksel.
4.5. Flessen met goed passende stoppen om de laboratoriummonsters te mengen.
5. MONSTERNEMING
Het is belangrijk dat het laboratorium een monster ontvangt dat echt representatief is en niet tijdens het vervoer of de opslag is beschadigd of gewijzigd.
De monsterneming is niet in de methode in deze bijlage opgenomen. Zie voor een aanbevolen monsternemingsmethode ISO 707|IDF 50.
Bewaar het monster zodanig dat bederf of wijziging van de samenstelling wordt voorkomen.
6. VOORBEHANDELING VAN HET TESTMONSTER
Meng het monster grondig door herhaaldelijk te schudden en de houder om te keren (breng indien nodig eerst alle monsters over in een luchtdichte houder die groot genoeg is om dit te kunnen doen).
Neem, als met deze procedure niet een volledig homogeen monster wordt verkregen, de testhoeveelheden (voor twee aparte bepalingen) op twee plaatsen van het voorbehandelde monster die zo ver mogelijk uit elkaar liggen.
7. PROCEDURE
7.1. Voorbehandeling van de schaal
7.1.1. Verwarm een schaal zonder deksel en het deksel (4.4) gedurende ten minste één uur in de droogstoof (4.2) die is ingesteld op 102 ± 2 °C.
7.1.2. Leg het deksel op de schaal, zet de schaal met deksel in de exsiccator (4.3) en laat tot de temperatuur van de weegkamer afkoelen. Weeg tot op 1 mg nauwkeurig en registreer het gewicht met een nauwkeurigheid van 0,1 mg.
7.2. Testhoeveelheid
Breng ongeveer 1-3 g van het voorbehandelde monster (6) in de schaal en dek de schaal met het deksel af. Weeg tot op 1 mg nauwkeurig en registreer het gewicht met een nauwkeurigheid van 0,1 mg.
7.3. Bepaling
7.3.1. Neem het deksel van de schaal en plaats de schaal met het deksel gedurende twee uur in de droogstoof (4.2) die is ingesteld op 102 ± 2 °C.
7.3.2. Leg het deksel weer op de schaal, zet de schaal met deksel in de exsiccator en laat tot de temperatuur van de weegkamer afkoelen. Weeg tot op 1 mg nauwkeurig en registreer het gewicht met een nauwkeurigheid van 0,1 mg.
7.3.3. Neem het deksel van de schaal en verwarm de schaal met het deksel opnieuw gedurende één uur in de droogstoof. Herhaal vervolgens punt 7.3.2.
7.3.4. Herhaal de verwarmings- en weegprocedure totdat de massa hetzij 1 mg of minder lichter, hetzij zwaarder is dan bij de vorige weging.
Gebruik bij de berekening de laagste geregistreerde massa.
8. BEREKENING EN WEERGAVE VAN DE RESULTATEN
8.1. Berekening
Het vochtgehalte, uitgedrukt in g/100g, is gelijk aan:

Hierbij is:
m0 = de massa, in gram, van de schaal met het deksel (7.1.2);
m1 = de massa, in gram, van de schaal, het deksel en de testhoeveelheid vóór drogen (7.2);
m2 = de massa, in gram, van de schaal, het deksel en de testhoeveelheid na drogen (7.3.4).
Rapporteer het resultaat met twee decimalen.
9. PRECISIE
NB: De waarden voor de herhaalbaarheid en de reproduceerbaarheid zijn afgeleid uit de resultaten van een ringonderzoek (zie Steiger, G., Bulletin of IDF nr. 285/1993, blz. 21-28), dat is uitgevoerd overeenkomstig IDF-norm 135B:1991: Melk en melkproducten — Precisie van analysemethoden — Schets van een procedure voor een ringonderzoek
9.1. Herhaalbaarheid
Het absolute verschil tussen twee onafhankelijke aparte testresultaten die binnen korte tijd door dezelfde persoon met dezelfde apparatuur in hetzelfde laboratorium met dezelfde methode en identiek testmateriaal worden verkregen, mag in niet meer dan 5 % van de gevallen groter zijn dan 0,20 g vocht per 100 g product.
9.2. Reproduceerbaarheid
Het absolute verschil tussen twee onafhankelijke aparte testresultaten die door verschillende personen met verschillende apparatuur in verschillende laboratoria met dezelfde methode en identiek testmateriaal worden verkregen, mag in niet meer dan 5 % van de gevallen groter zijn dan 0,40 g vocht per 100 g product.
10. TESTVERSLAG
In het testverslag worden vermeld:
|
— |
alle informatie die nodig is voor de volledige identificatie van het monster, |
|
— |
de gebruikte monsternemingsmethode, indien deze bekend is, |
|
— |
de gebruikte testmethode, waarbij naar deze bijlage wordt verwezen, |
|
— |
alle praktische details die niet in deze bijlage worden vermeld of die als facultatief worden beschouwd, alsmede details van eventuele gebeurtenissen die de resultaten van de test kunnen hebben beïnvloed, |
de verkregen testresultaten en, als de herhaalbaarheid is gecontroleerd, het uiteindelijke officiële eindresultaat.
BIJLAGE XIX
(Artikel 15)
BEPALING VAN HET VOCHTGEHALTE VAN ZUREKARNEMELKPOEDER
1. TOEPASSINGSGEBIED
Bepaling van het vochtgehalte van oorspronkelijk voor diervoeders bestemd zurekarnemelkpoeder.
2. PRINCIPE
Het monster wordt onder vacuüm gedroogd. Het massaverlies wordt door wegen bepaald.
3. APPARATUUR
3.1. Analytische balans, tot op 1 mg nauwkeurig en tot op 0,1 mg afleesbaar.
3.2. Schalen, roestvrij metaal of glas, met luchtdicht afsluitende deksels en met een zodanig nuttig oppervlak dat het monster kan worden uitgespreid tot ongeveer 0,3 g/cm2.
3.3. Instelbare elektrische vacuümdroogstoof met oliepomp, voorzien van een mechanisme voor de toevoer van warme lucht die is gedroogd in een droogtoren met bijvoorbeeld calciumoxide of calciumsulfaat (met vochtindicator).
3.4. Exsiccator met een effectief droogmiddel.
3.5. Droogstoof, geventileerd, met thermostaat ingesteld op 102 ± 2 °C.
4. PROCEDURE
Verwarm een schaal (3.2) met deksel gedurende ten minste één uur in de droogstoof (3.5). Leg het deksel op de schaal, zet deze onmiddellijk in de exsiccator (3.4) en laat afkoelen tot kamertemperatuur. Weeg tot op 1 mg nauwkeurig en registreer het gewicht met een nauwkeurigheid van 0,1 mg.
Neem het deksel van de schaal en breng ongeveer 5 g monster in de schaal. Weeg tot op 1 mg nauwkeurig en registreer het gewicht met een nauwkeurigheid van 0,1 mg. Zet de schaal en het deksel in de vooraf tot 83 °C verwarmde vacuümdroogstoof (3.3). Doe dit zo snel mogelijk om te voorkomen dat de temperatuur van de droogstoof teveel daalt.
Stel de druk in op 100 Torr (13,3 kPa) en droog het monster bij deze druk onder toevoer van droge warme lucht tot constant gewicht (ongeveer 4 uur).
Bereken de droogtijd vanaf het moment waarop de droogstoof weer op 83 °C is gekomen. Breng de droogstoof voorzichtig weer op atmosferische druk. Open de droogstoof en leg het deksel onmiddellijk op de schaal. Neem de schaal uit de droogstoof en laat gedurende 30-45 minuten in een exsiccator (3.4) afkoelen. Weeg tot op 1 mg nauwkeurig en registreer het gewicht met een nauwkeurigheid van 0,1 mg. Droog nog eens 30 minuten bij 83 °C in de vacuümdroogstoof (3.3) en weeg opnieuw. Herhaal de verwarmings- en weegprocedure totdat de massa van de schaal met deksel hetzij 1 mg of minder lichter, hetzij zwaarder is dan bij de vorige weging. Gebruik bij de berekening de laagste geregistreerde massa.
5. BEREKENING
% Vocht = (m1-m2) / (m1-m0) × 100 %
Hierbij is:
|
m0 |
de massa van de schaal met het deksel; |
|
m1 |
de massa van de schaal, het deksel en de testhoeveelheid vóór drogen; |
|
m2 |
de massa van de schaal, het deksel en de testhoeveelheid na drogen. |
Rapporteer het resultaat met een nauwkeurigheid van 0,1 g/100 g.
6. PRECISIE
6.1. Herhaalbaarheid
Het absolute verschil tussen twee onafhankelijke aparte testresultaten die binnen korte tijd door dezelfde persoon met dezelfde apparatuur in hetzelfde laboratorium met dezelfde methode en identiek testmateriaal worden verkregen, mag in niet meer dan 5 % van de gevallen groter zijn dan 0,4 g water/100 g zurekarnemelkpoeder.
6.2. Reproduceerbaarheid
Het absolute verschil tussen twee onafhankelijke aparte testresultaten die door verschillende personen met verschillende apparatuur in verschillende laboratoria met dezelfde methode en identiek testmateriaal worden verkregen, mag in niet meer dan 5 % van de gevallen groter zijn dan 0,6 g water/100 g zurekarnemelkpoeder.
6.3. Herkomst van de precisiegegevens
De precisiegegevens zijn vastgesteld op basis van een experiment dat in 1995 met twaalf monsters (zes blinde duplo's) in acht laboratoria is uitgevoerd.
BIJLAGE XX
(Artikel 16)
REFERENTIEMETHODE VOOR DE BEPALING VAN DE ZUIVERHEID VAN MELKVET MET BEHULP VAN GASCHROMATOGRAFISCHE ANALYSE VAN TRIGLYCERIDEN — REVISIE 2
1. DOEL EN TOEPASSINGSGEBIED
Met deze norm wordt een referentiemethode vastgesteld voor de bepaling van de zuiverheid van melkvet met behulp van gaschromatografische analyse van triglyceriden. Zowel plantaardige vetten als dierlijke vetten, zoals rund- en varkensvet, kunnen worden gedetecteerd.
De zuiverheid van melkvet wordt aan de hand van vaste triglyceridenvergelijkingen bepaald. In principe is de methode ongeacht de voeder-, fok- of lactatieomstandigheden geschikt voor onverpakte rundermelk of daarvan vervaardigde producten. Alleen bij het uitzonderlijk intensief voeren van zuivere plantaardige oliën, zoals koolzaadolie, kunnen er vals-positieve resultaten optreden. Ook melkproducten van individuele koeien kunnen vals-positieve resultaten opleveren.
De methode is met name geschikt voor vet dat is geëxtraheerd uit melkproducten waarvan wordt gesteld dat ze zuiver melkvet met een ongewijzigde samenstelling bevatten, zoals boter, room, melk en melkpoeder. Een technologische behandeling van melkvet, zoals verwijdering van cholesterol of fractionering, kan tot vals-positieve resultaten leiden. Dit geldt ook voor melkvet dat van magere melk of karnemelk is verkregen. De methode is niet altijd geschikt voor vet dat uit kaas afkomstig is, omdat het rijpingsproces de vetsamenstelling zo sterk kan beïnvloeden dat dit tot een vals-positief resultaat leidt.
NB 1: Boterzuur (n-butaanzuur, C4) komt uitsluitend in melkvet voor en op grond daarvan kunnen kleine tot middelgrote hoeveelheden melkvet in plantaardige en dierlijke vetten kwantitatief worden bepaald. Door de grote variatie in het massapercentage C4 op het bereik tussen 3,1 % en 3,8 % is het echter moeilijk kwalitatieve en kwantitatieve informatie te geven voor massafracties vreemd vet/zuiver melkvet tot 20 % [1].
NB 2: Uit het sterolgehalte van plantaardige vetten kunnen in de praktijk geen kwantitatieve resultaten worden afgeleid, omdat dit afhankelijk is van de productie en bewerking. Zelfs een kwalitatieve bepaling van vreemd vet met behulp van sterolen is twijfelachtig.
2. DEFINITIE
Zuiverheid van melkvet: de afwezigheid van plantaardige en dierlijke vetten, zoals bepaald volgens de hier gespecificeerde procedure.
NB: De zuiverheid wordt bepaald met behulp van S-waarden, die op basis van de triglyceride-samenstelling worden berekend. De triglyceride-massafracties worden als percentage uitgedrukt.
3. PRINCIPE VAN DE METHODE
Het uit melk of melkproducten geëxtraheerde vet wordt met behulp van gaschromatografie met een gepakte of korte capillaire kolom geanalyseerd om de triglyceriden (TG's) te bepalen, gescheiden op basis van het totale aantal koolstofatomen. Door de massafractie, uitgedrukt als percentage, van de vetzuurmoleculen van verschillende grootte (C24-C54 — alleen even aantallen) in geschikte triglyceridenvergelijkingen in te vullen, worden de S-waarden berekend. Als de S-waarden de met zuiver melkvet vastgestelde grenswaarden overschrijden, wordt de aanwezigheid van vreemd vet gedetecteerd.
NB 1: De geschiktheid en gelijkwaardigheid van gepakte en capillaire kolommen is reeds eerder aangetoond [2-4].
NB 2: De S-waarde is een som van TG-massafracties, die elk met hun eigen vaste factoren worden vermenigvuldigd.
4. REAGENTIA
Alle reagentia dienen van analysekwaliteit te zijn.
4.1. Draaggas: stikstof (eventueel helium of waterstof), alle met een zuiverheid van ten minste 99,995 %.
Standaardvetten voor de bereiding van gestandaardiseerd melkvet volgens punt 7.3.3.
4.2.1. Triglyceridestandaard, verzadigd; er zijn geschikte producten in de handel verkrijgbaar.
4.2.2. Cholesterolstandaard.
4.3. Methanol (CH3OH), watervrij.
4.4. n-Hexaan (CH3(CH2)4CH3).
4.5. n-Heptaan (CH3(CH2)5CH3).
4.6. Andere gassen: waterstof, zuiverheid ten minste 99,995 %, zonder organische verontreinigingen (CnHm < 1 µl/l); synthetische lucht, zonder organische verontreinigingen (CnHm < 1 µl/l).
4.7. Natriumsulfaat (Na2SO4), watervrij.
5. APPARATUUR
De gangbare laboratoriumapparatuur en met name:
5.1. Gaschromatograaf voor hoge temperaturen
De gaschromatograaf voor hoge temperaturen moet geschikt zijn voor temperaturen van ten minste 400 °C en voorzien zijn van een vlamionisatiedetector (FID). De in de injector gebruikte septa moeten bestand zijn tegen hoge temperaturen en de „bleeding” moet zeer gering zijn. Gebruik voor capillaire GC een on-column injector. Gebruik altijd een grafietpakking voor de aansluiting van de kolom en de injector en/of detector (indien van toepassing).
5.2. Chromatografiekolom
5.2.1. Gepakte kolom
Gebruik een glazen kolom met een inwendige diameter van 2 mm en een lengte van 500 mm, gepakt met een stationaire fase van 3 % OV-1 op 125-150 µm (100-120 mesh) GasChromQ (1). De bereiding (silaniseren, vullen en conditioneren) van de gepakte kolom wordt in aanhangsel A beschreven.
Ook een capillaire kolom (5.2.2) kan worden gebruikt.
5.2.2. Capillaire kolom
Gebruik een korte capillaire kolom, bijvoorbeeld 5 m lang, met een apolaire stationaire fase die bestand is tegen temperaturen van 400 °C of meer (2). Conditioneer de kolom door in twee tot drie dagen 20 analyses van een melkvetoplossing (7.2) uit te voeren met de in punt 7.3.4.2 vermelde instelling. Daarna moeten de responsfactoren (7.3.3) in de buurt van 1 liggen en lager zijn dan 1,20.
NB: Er kunnen ook kolommen worden gebruikt met andere afmetingen en een andere apolaire stationaire fase die tegen hoge temperaturen bestand is, mits de resultaten daarvan in overeenstemming zijn met deze norm. Zie ook punt 7.3.4.2.
5.3. Extrelut-kolom, volume 1-3 ml, gevuld met silicagel, alleen nodig voor de extractie van melkvet volgens 7.1.3.
5.4. Grafietpakkingen, bestand tegen temperaturen van ten minste 400 °C, te gebruiken voor de aansluiting van de GC-kolom en de injector en/of detector.
5.5. Waterbad dat op een temperatuur van 50 °C ± 2 °C kan worden gehouden.
5.6. Droogstoof, geschikt voor gebruik bij 50 °C ± 2 °C en 100 °C ± 2 °C.
5.7. Microliterpipet.
5.8. Meetpipet, 5 ml.
5.9. Rondbodemkolf, 50 ml.
5.10. Erlenmeyer, 250 ml.
5.11. Trechter.
5.12. Filtreerpapier, fijn.
5.13. Rotatieverdamper.
5.14. Ampullen, 1 ml, voorzien van een aluminium krimpdop of schroefdop met een bekleding van polytetrafluorethyleen.
5.15. Injectiespuit waarvan de plunjer niet tot de punt van de naald mag komen (GC met gepakte kolom).
NB: Met dergelijke spuiten is een betere herhaalbaarheid van de resultaten mogelijk.
5.16. Analytische balans, tot op 1 mg nauwkeurig en tot op 0,1 mg afleesbaar.
6. MONSTERNEMING
Het laboratorium moet een representatief monster toegestuurd krijgen. Het mag niet tijdens het vervoer of de opslag zijn beschadigd of gewijzigd.
De monsterneming is niet in de methode in deze internationale norm opgenomen. Zie voor een aanbevolen monsternemingsmethode ISO 707|IDF 50 [5].
7. PROCEDURE
7.1. Voorbehandeling van de monsters
Gebruik voor de voorbehandeling van de monsters een van de drie volgende methoden voor de extractie van melkvet.
7.1.1. Isolatie uit boter of butteroil
Smelt bij 50 °C 50-100 g monster op een waterbad (5.5) of in een droogstoof (5.6). Breng 0,5-1,0 g natriumsulfaat (4.7) in een vouwfilter (5.12). Verwarm een erlenmeyer van 250 ml (5.10) en een trechter (5.11) met daarin het filtreerpapier in de droogstoof (5.6) die op 50 °C is ingesteld. Filtreer de vetlaag van het gesmolten monster, terwijl de voorverwarmde kolf en trechter met daarin het filtreerpapier in de droogstoof blijven. Let op dat er geen serum wordt overgebracht.
Alleen wanneer er een beperkte hoeveelheid monster beschikbaar is, mag een kleiner monster worden gebruikt. In dat geval moet de procedure daaraan worden aangepast. Bij gebruik van een kleiner monster is het risico dat het monster niet representatief is, echter groter.
NB 1: Boter kan door karnen en grondig wassen van de resulterende boterkorrels uit room worden verkregen.
NB 2: Het volgens de procedure van 7.1.1 verkregen melkvet bevat vrijwel geen fosfolipiden.
7.1.2. Extractie volgens de gravimetrische methode van Röse-Gottlieb
Extraheer de vetfractie uit het monster met behulp van de gravimetrische methode die is beschreven in een van de normen ISO 1211IDF 001D, ISO 2450IDF 016C of ISO 7328IDF 116A.
NB: Als het verkregen melkvet fosfolipiden bevat, zal er een cholesterolpiek worden verkregen die met ongeveer 0,1 % verhoogd is. De invloed hiervan op de TG-samenstelling die is gestandaardiseerd op 100 % inclusief cholesterol, is te verwaarlozen.
7.1.3. Extractie uit melk met behulp van silicagelkolommen
Breng met een microliterpipet (5.7) 0,7 ml monster van 20 °C op een 1-3 ml Extrelut-kolom (5.3). Laat het zich gedurende ongeveer 5 minuten gelijkmatig over de silicagel verdelen.
Breng daarna voor de denaturering van de eiwit-lipidecomplexen met de meetpipet (5.8) 1,5 ml methanol (4.3) op de Extrelut-kolom. Extraheer vervolgens met 20 ml n-hexaan (4.4) de vetfractie uit het monster. Voeg n-hexaan langzaam in kleine hoeveelheden toe. Vang het oplosmiddel dat uit de kolom komt, op in een rondbodemkolf van 50 ml (5.9) die vooraf is gedroogd tot constante massa en tot op 1 mg nauwkeurig is gewogen (registreer de massa tot op 0,1 mg nauwkeurig).
Laat de kolom na de extractie geheel leeglopen. Destilleer het oplosmiddel in een rotatieverdamper (5.13) op een waterbad van 40-50 °C uit het eluaat af. Droog de kolf, nadat het oplosmiddel is afgedestilleerd, en weeg vervolgens de kolf met inhoud tot op 1 mg nauwkeurig (registreer de massa tot op 0,1 mg nauwkeurig). Bepaal de massa van het vet door de massa van de gedroogde lege kolf van de massa van de kolf met inhoud af te trekken.
NB: Vetextracties volgens Gerber, Weibull-Berntrop of Schmid-Bondzynski-Ratzlaff of isolering van melkvet met behulp van detergenten (BDI-methode) zijn niet geschikt voor TG-analyse, omdat bij deze methoden aanzienlijke hoeveelheden partiële glyceriden of fosfolipiden in de vetfase kunnen overgaan. Deze internationale norm is derhalve voor bepaalde producten zoals met name kaas beperkt bruikbaar.
7.2. Bereiding van de monsteroplossing
Bereid voor gaschromatografie met een gepakte kolom een 5 %-oplossing (v/v) van het (volgens 7.1 verkregen) vet in n-hexaan (4.4) of n-heptaan (4.5). Gebruik, afhankelijk van de afmetingen van de kolom, een concentratie van 1 % (0,53 mm ID, wide-bore) of minder bij on-column injectie op een capillaire kolom.
Bepaal op basis van de gebruikte kolom en de bij 7.1.3 verkregen vetmassa de hoeveelheid oplosmiddel (4.4 of 4.5) die aan het monstermateriaal in de kolf moet worden toegevoegd, waarbij tot op 1 mg nauwkeurig wordt gewogen (registreer de massa tot op 0,1 mg nauwkeurig). Los het restant volledig op.
Breng ongeveer 1 ml monsteroplossing in een ampul (5.14).
7.3. Chromatografische bepaling van triglyceriden
7.3.1. Fluctuatie van de basislijn
Om oplopen van de basislijn tot een minimum te beperken moet de kolom volgens 5.2.2 (capillaire kolom) of punt A.4 van aanhangsel A (gepakte kolom) worden geconditioneerd.
NB: Vanwege de hoge kolomtemperatuur is de TG-analyse bijzonder gevoelig voor het oplopen van de basislijn op het interval met langere ketens.
7.3.2. Injectietechniek
7.3.2.1. Gepakte kolom
Gebruik teneinde discriminatie-effecten te voorkomen de „hete-naald”-techniek om de kwantificering van de hoogkokende TG-componenten te verbeteren. Vul de naald met lucht door de vetoplossing in de injectiespuit op te zuigen. Steek de naald in de injector. Laat de naald vóór injectie ongeveer drie seconden opwarmen. Injecteer daarna snel de inhoud van de spuit.
7.3.2.2. Capillaire kolom
Steek bij koude on-column injectie (7.3.4.2) de naald van de injectiespuit in de injector en injecteer onmiddellijk. De verblijftijd van de naald in de injectiepoort moet zodanig zijn dat er geen lange staart van de oplosmiddelpiek ontstaat.
NB: De optimale verblijftijd is normaal gesproken ongeveer 3 seconden.
7.3.3. Kalibratie
7.3.3.1. Algemeen
Voer voor de kalibratie van de monsters aan het begin van elke dag twee of drie analyses van gestandaardiseerd melkvet uit. Gebruik de laatste analyse van het gestandaardiseerde melkvet voor de bepaling van de responsfactoren RFSi (massafractie/oppervlakfractie) van de TG's en van cholesterol en gebruik deze responsfactoren bij de daaropvolgende monsters (zie 9.1):
![]() (1)
(1)
Hierbij is:
|
w si |
de massafractie, uitgedrukt als percentage, van elk TG of cholesterol in het gestandaardiseerde melkvet; |
|
A si |
de numerieke waarde van het piekoppervlak van elk TG of cholesterol in het gestandaardiseerde melkvet. |
Gestandaardiseerd melkvet met een bekende TG-samenstelling wordt volgens 7.3.3.2 of 7.3.3.3 verkregen.
7.3.3.2. In de handel verkrijgbaar gestandaardiseerd melkvet
Het gebruik van gestandaardiseerd melkvet met een gecertificeerde TG-samenstelling is de beste manier om de responsfactor van elk bestanddeel van het monster te bepalen.
NB: Een geschikte standaard is CRM 519 (watervrij melkvet), verkrijgbaar bij het Instituut voor referentiematerialen en -metingen (IRMM), Geel, België (3).
7.3.3.3. In het laboratorium vervaardigd gestandaardiseerd melkvet
Bereid ongeveer 1 g van een mengsel van de standaardvetten (4.2), dat ten minste de verzadigde TG's C24, C30, C36, C42, C48 en C54 en cholesterol bevat en bij voorkeur ook C50 en C52, door ze tot op 1 mg nauwkeurig af te wegen (registreer de massa tot op 0,1 mg nauwkeurig) om een relatieve TG-samenstelling te krijgen die vergelijkbaar is met melkvet.
Analyseer een oplossing van het gestandaardiseerde vetmengsel in n-hexaan (4.4) of n-heptaan (4.5) een aantal malen volgens 7.3.4. Analyseer in dezelfde reeks melkvet met een gemiddelde samenstelling een aantal malen.
Bepaal de TG-responsfactoren op grond van het gestandaardiseerde vetmengsel. Tussenliggende responsfactoren van TG's die niet in het mengsel zijn opgenomen, kunnen door mathematische interpolatie worden berekend. Pas de zo verkregen responsfactoren toe op het melkvet om een gestandaardiseerde samenstelling te verkrijgen. Het zo verkregen gestandaardiseerde melkvet is enkele jaren houdbaar als het bij ten hoogste — 18 °C onder stikstof wordt bewaard.
7.3.4. Chromatografische bepaling
NB: Het gebruik van gepakte of capillaire kolommen levert in het algemeen een resolutie op die vergelijkbaar is met figuur 1. Normaal gesproken treedt er geen splitsing van TG's met een even aantal C-atomen op en dit dient te worden vermeden.
7.3.4.1. Gepakte kolom
|
a) |
Temperatuurprogramma: Stel de aanvankelijke oventemperatuur in op 210 °C. Houd deze temperatuur 1 minuut aan. Voer daarna de temperatuur met 6 °C/minuut op tot 350 °C. Houd deze (eind)temperatuur 5 minuten aan. |
|
b) |
Detector- en injectortemperatuur: beide 370 °C. |
|
c) |
Draaggas: Gebruik stikstof met een constant debiet van ongeveer 40 ml/minuut. Pas het exacte debiet van het draaggas zodanig aan dat C54 bij 341 °C elueert. |
|
d) |
Duur van de analyse: 29,3 minuten. |
|
e) |
Injectievolume: Injecteer 0,5 µl van een 5 %-monsteroplossing (v/v). |
Als er geen TG-analyses worden uitgevoerd, moeten de onder a) vermelde aanvankelijke oventemperatuur, de onder b) vermelde detector- en injectortemperatuur en het onder c) vermelde debiet van het draaggas op een constant niveau worden gehouden, ook 's nachts en tijdens de weekends en vakanties. Dit garandeert dat de prestaties van de kolom optimaal zijn.
7.3.4.2. Capillaire kolom
|
a) |
Temperatuurprogramma: Stel de aanvankelijke oventemperatuur in op 80 °C. Houd deze temperatuur 0,5 minuut aan. Voer daarna de temperatuur met 50 °C/minuut op tot 190 °C en vervolgens met 6 °C/minuut tot 350 °C. Houd deze (eind)temperatuur 5 minuten aan. |
|
b) |
Detectortemperatuur: 370 °C. |
|
c) |
Draaggas: Gebruik stikstof met een constant debiet van ongeveer 3 ml/minuut. |
|
d) |
Duur van de analyse: 34,4 minuten. |
|
e) |
Injectievolume: Injecteer 0,5 µl van een 1 %-monsteroplossing (v/v). |
Houd deze instellingen, om optimale prestaties te waarborgen, ook aan als de apparatuur niet wordt gebruikt (zie 7.3.4.1).
De in 7.3.4.2 vermelde instellingen zijn geschikt voor een wide-bore kolom (0,53 mm ID), zoals gespecificeerd in 5.2.2. Als een kolom met andere afmetingen of een andere fase wordt gebruikt, moeten wellicht andere omstandigheden worden gehanteerd.
8. INTEGRATIE, EVALUATIE EN CONTROLE VAN DE ANALYSEPRESTATIES
Evalueer de chromatogrampieken met een integratiesysteem dat de basislijn kan uitzetten en kan herintegreren. Figuur 1 bevat een correct geïntegreerd chromatogram, terwijl figuur 2 een sporadische fout aan het eind van de basislijn na C54 laat zien, die de percentages van alle TG's beïnvloedt. Desalniettemin worden pieken die na C54 elueren, van de evaluatie uitgesloten.
Combineer een TG met een oneven aantal acyl-C (2n + 1) met het voorgaande TG met een even aantal (2n). Sluit het lage C56-gehalte uit. Vermenigvuldig de oppervlakpercentages van de resterende TG's inclusief cholesterol met de respectieve responsfactoren van het gestandaardiseerde melkvet (meest recente kalibratie) en normaliseer het geheel volgens 9.1 op 100 %.
Figuur 1:
Voorbeeld van een triglyceride-chromatogram van melkvet met een correcte basislijn
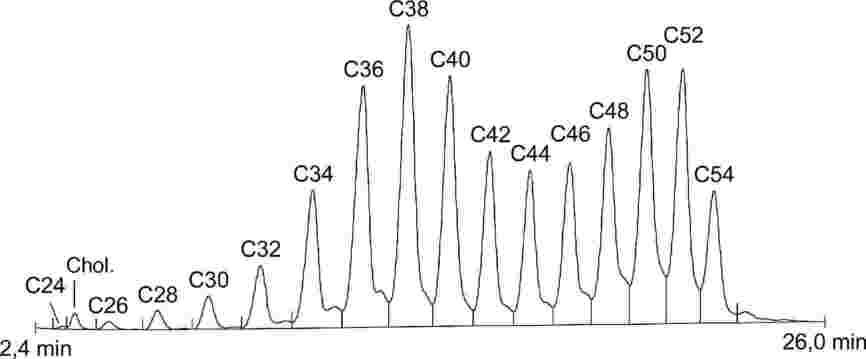
Figuur 2:
Voorbeeld van een triglyceride-chromatogram van melkvet met een onjuist uitgezette basislijn
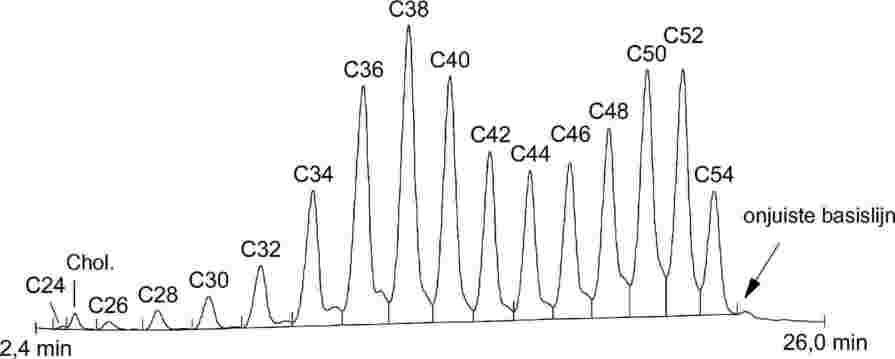
Vergelijk ter controle van de meetomstandigheden met de variatiecoëfficiënten (VC's), uitgedrukt als percentages, van de verschillende TG's in tabel 1, die zijn gebaseerd op 19 opeenvolgende analyses van hetzelfde melkvetmonster.
Als de VC's aanzienlijk hoger zijn dan de waarden in tabel 1, zijn de chromatografie-omstandigheden niet correct.
NB: De waarden in tabel 1 zijn niet verplicht, maar geven een indicatie met het oog op kwaliteitscontrole.
Wanneer hogere VC-waarden worden geaccepteerd, moeten de in punt 10 vermelde grenswaarden voor de herhaalbaarheid en de reproduceerbaarheid echter wel in acht worden genomen.
Tabel 1
Variatiecoëfficiënten van triglyceride-gehaltes (19 opeenvolgende analyses)
|
Triglyceride |
VC (%) |
|
C24 |
10,00 |
|
C26 |
2,69 |
|
C28 |
3,03 |
|
C30 |
1,76 |
|
C32 |
1,03 |
|
C34 |
0,79 |
|
C36 |
0,25 |
|
C38 |
0,42 |
|
C40 |
0,20 |
|
C42 |
0,26 |
|
C44 |
0,34 |
|
C46 |
0,37 |
|
C48 |
0,53 |
|
C50 |
0,38 |
|
C52 |
0,54 |
|
C54 |
0,60 |
9. BEREKENING EN WEERGAVE VAN DE RESULTATEN
9.1. Triglyceride-samenstelling
9.1.1. Berekening
Bereken de massafractie van elk TG (voor i = C24, C26, C28, C30, C32, C34, C36, C38, C40, C42, C44, C46, C48, C50, C52 en C54) plus cholesterol (wi ), uitgedrukt als percentage, van het totale TG-gehalte van het monster met behulp van de volgende vergelijking:
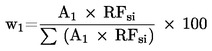 (2)
(2)
Hierbij is:
|
Ai |
de numerieke waarde van het piekoppervlak van elk TG in het monster; |
|
RFsi |
de responsfactor van elk TG, bepaald door kalibratie (7.3.3). |
9.1.2. Weergave van de testresultaten
De resultaten worden met twee decimalen vermeld.
9.2. S-waarden
9.2.1. Berekening
9.2.1.1. Bereken de S-waarden, uitgedrukt als percentage, door de berekende wi (9.1.1) van de desbetreffende TG-percentages in de vergelijkingen (3) tot (7) in te vullen. Gebruik alle vergelijkingen, ongeacht de aard van het vermoedelijke vreemde vet.
9.2.1.2. Sojaolie, zonnebloemolie, olijfolie, koolzaadolie, lijnolie, tarwekiemolie, maïskiemolie, katoenzaadolie en visolie.
S = 2,098 3 · w C30 + 0,728 8 · w C34 + 0,692 7 · w C36 + 0,635 3 · w C38 + 3,745 2 · w C40 – 1,292 9 · w C42 + 1,354 4 · w C44 + 1,701 3 · w C46 + 2,528 3 · w C50 (3)
9.2.1.3. Kokosvet en palmpittenvet.
S = 3,745 3 · w C32 + 1,113 4 · w C36 + 1,364 8 · w C38 + 2,154 4 · w C42 + 0,427 3 · w C44 + 0,580 9 · w C46 + 1,292 6 · w C48 + 1,030 6 · w C50 + 0,995 3 · w C52 + 1,239 6 · w C54 (4)
9.2.1.4. Palmolie en rundvet.
S = 3,664 4 · w C28 + 5,229 7 · w C30 – 12,507 3 · w C32 + 4,428 5 · w C34 – 0,201 0 · w C36 + 1,279 1 · w C38 + 6,743 3 · w C40 – 4,271 4 · w C42 + 6,373 9 · w C46 (5)
9.2.1.5. Varkensvet.
S = 6,512 5 · w C26 + 1,205 2 · w C32 + 1,733 6 · w C34 + 1,755 7 · w C36 + 2,232 5 · w C42 + 2,800 6 · w C46 + 2,543 2 · w C52 + 0,989 2 · w C54 (6)
9.2.1.6. Totaal.
S = – 2,757 5 · w C26 + 6,407 7 · w C28 + 5,543 7 · w C30 – 15,324 7 · w C32 + 6,260 0 · w C34 + 8,010 8 · w C40 – 5,033 6 · w C42 + 0,635 6 · w C44 + 6,017 1 · w C46 (7)
9.2.2. Weergave van de testresultaten
De resultaten worden met twee decimalen vermeld.
9.3. Detectie van vreemd vet
Vergelijk de vijf S-waarden die in 9.2.1 zijn verkregen, met de bijbehorende S-grenswaarden in tabel 2.
Beschouw het monster als zuiver melkvet als alle vijf S-waarden binnen de grenswaarden van tabel 2 vallen. Als er echter een S-waarde buiten de desbetreffende grenswaarden valt, wordt het monster geacht een vreemd vet te bevatten.
De individuele vergelijkingen (3) tot en met (6) zijn weliswaar gevoeliger voor bepaalde vreemde vetten dan totaalvergelijking (7) (zie tabel B.1), maar op grond van een positief resultaat met slechts één van de vergelijkingen (3) tot en met (6) kunnen geen conclusies worden getrokken over de aard van het vreemde vet.
Aanhangsel B beschrijft een procedure voor de berekening van het gehalte aan plantaardig of dierlijk vet van het vermengde melkvet. Deze procedure is niet gevalideerd en wordt uitsluitend ter informatie vermeld.
Tabel 2:
S-grenswaarden voor zuiver melkvet
|
Vreemd vet |
Vergelijking |
S-grenswaarden (4) |
|
Sojaolie, zonnebloemolie, olijfolie, koolzaadolie, lijnolie, tarwekiemolie, maïskiemolie, katoenzaadolie en visolie |
(3) |
98,05 tot 101,95 |
|
Kokosvet en palmpittenvet |
(4) |
99,42 tot 100,58 |
|
Palmolie en rundvet |
(5) |
95,90 tot 104,10 |
|
Varkensvet |
(6) |
97,96 tot 102,04 |
|
Totaal |
(7) |
95,68 tot 104,32 |
10. PRECISIE
10.1. Rondzendproef
De waarden voor de herhaalbaarheid en reproduceerbaarheid zijn op basis van de vergelijkingen (3) tot en met (7) met zuiver melkvet bepaald en zijn wellicht niet geldig voor andere dan de vermelde matrices.
10.2. Herhaalbaarheid
Het absolute verschil tussen twee aparte testresultaten die binnen korte tijd door dezelfde persoon met dezelfde apparatuur in hetzelfde laboratorium met dezelfde methode en identiek testmateriaal worden verkregen, mag in niet meer dan 5 % van de gevallen groter zijn dan de in tabel 3 vermelde grenswaarden.
Tabel 3:
Grenswaarden herhaalbaarheid (r) voor de vergelijkingen (3) tot en met (7)
|
Vreemd vet |
Vergelijking |
r (%) |
|
Sojaolie, zonnebloemolie, olijfolie, koolzaadolie, lijnolie, tarwekiemolie, maïskiemolie, katoenzaadolie en visolie |
(3) |
0,67 |
|
Kokosvet en palmpittenvet |
(4) |
0,12 |
|
Palmolie en rundvet |
(5) |
1,20 |
|
Varkensvet |
(6) |
0,58 |
|
Totaal |
(7) |
1,49 |
10.3. Reproduceerbaarheid
Het absolute verschil tussen twee aparte testresultaten die door verschillende personen met verschillende apparatuur in verschillende laboratoria met dezelfde methode en identiek testmateriaal worden verkregen, mag in niet meer dan 5 % van de gevallen groter zijn dan de in tabel 4 vermelde grenswaarden.
Tabel 4:
Grenswaarden reproduceerbaarheid (R) voor de vergelijkingen (3) tot en met (7)
|
Vreemd vet |
Vergelijking |
R (%) |
|
Sojaolie, zonnebloemolie, olijfolie, koolzaadolie, lijnolie, tarwekiemolie, maïskiemolie, katoenzaadolie en visolie |
(3) |
1,08 |
|
Kokosvet en palmpittenvet |
(4) |
0,40 |
|
Palmolie en rundvet |
(5) |
1,81 |
|
Varkensvet |
(6) |
0,60 |
|
Totaal |
(7) |
2,07 |
11. ONZEKERHEID VAN DE METING
Met de herhaalbaarheid (r) en de reproduceerbaarheid (R) kan de totale onzekerheid voor een S-waarde worden berekend.
Opneming van de totale onzekerheid (op basis van duplo-analyses) in de S-grenswaarden van tabel 2 levert uitgebreide S-grenswaarden op, die in tabel 5 worden vermeld.
Tabel 5:
Uitgebreide S-grenswaarden voor zuiver melkvet waarin de totale onzekerheid is opgenomen
|
Vreemd vet |
Vergelijking |
Uitgebreide S-grenswaarden |
|
Sojaolie, zonnebloemolie, olijfolie, koolzaadolie, lijnolie, tarwekiemolie, maïskiemolie, katoenzaadolie en visolie |
(3) |
97,36 tot 102,64 |
|
Kokosvet en palmpittenvet |
(4) |
99,14 tot 100,86 |
|
Palmolie en rundvet |
(5) |
94,77 tot 105,23 |
|
Varkensvet |
(6) |
97,65 tot 102,35 |
|
Totaal |
(7) |
94,42 tot 105,58 |
12. TESTVERSLAG
In het testverslag worden vermeld:
|
— |
alle informatie die nodig is voor de volledige identificatie van het monster, |
|
— |
de gebruikte monsternemingsmethode, indien deze bekend is, |
|
— |
de gebruikte testmethode, waarbij naar deze internationale norm wordt verwezen, |
|
— |
alle praktische details die niet in deze internationale norm worden vermeld of die als facultatief worden beschouwd, alsmede details van eventuele gebeurtenissen die de resultaten van de test kunnen hebben beïnvloed, |
|
— |
de verkregen testresultaten en, als de herhaalbaarheid is gecontroleerd, het uiteindelijke officiële eindresultaat. |
(1) Voorbeeld van een geschikt in de handel verkrijgbaar product. Deze informatie wordt ten behoeve van de gebruikers van deze internationale norm verstrekt en betekent niet dat dit product wordt aanbevolen.
(2) CP-Ultimetal SimDist (5 m × 0,53 mm × 0,17 µm) is een voorbeeld van een geschikt in de handel verkrijgbaar product. Deze informatie wordt ten behoeve van de gebruikers van deze internationale norm verstrekt en betekent niet dat dit product wordt aanbevolen.
(3) Voorbeeld van een geschikt in de handel verkrijgbaar product. Deze informatie wordt ten behoeve van de gebruikers van deze internationale norm verstrekt en betekent niet dat dit product wordt aanbevolen.
(4) Berekend op een 99 %-betrouwbaarheidsniveau, zodat de toevoeging van vreemd vet alleen wordt gesignaleerd als de detectielimieten van de desbetreffende vergelijking worden overschreden (zie tabel B.1).
AANHANGSEL A
(normatief)
BEREIDING VAN DE GEPAKTE KOLOM
A.1 REAGENTIA EN APPARATUUR
A.1.1 Tolueen (C6H5CH3).
A.1.2 Dimethyldichloorsilaan-oplossing [Si(CH3)2Cl2].
Los 50 ml dimethyldichloorsilaan op in 283 ml tolueen (A.1.1).
A.1.3 Cacaoboter-oplossing met een massafractie van 5 % cacaoboter in n-hexaan (4.4) of n-heptaan (4.5).
A.1.4 Stationaire fase, 3 % OV-1 op 125-150 µm (100-120 mesh) GasChromQ (1).
NB: De korrelgrootte is omgerekend in micrometers overeenkomstig BS 410 (alle delen) [6].
A.1.5 Glazen kolom, inwendige diameter 2 mm en lengte 500 mm, U-vormig.
Apparatuur voor het vullen van de gepakte kolom.
A.1.6.1 Vulkolom, met schroefdoppen aan de uiteinden en met een merkteken tot waar de kolom met stationaire fase kan worden gevuld.
A.1.6.2 Fijne zeef, maaswijdte ongeveer 100 µm, met schroefdop die volgens figuur A.3 op de glazen kolom kan worden aangesloten.
A.1.6.3 Gesilaniseerde glaswol, geïnactiveerd.
A.1.6.4 Vibrator, voor een uniforme verdeling van de stationaire fase bij het vullen.
A.1.6.5 Silaniseerapparatuur, om het glazen oppervlak van de kolom te silaniseren.
A.1.6.6 Woulff'se fles.
A.1.6.7 Waterstraalpomp.
A.2 SILANISEREN (INACTIVERING VAN HET GLAZEN OPPERVLAK)
Sluit de Woulff'se fles (A.1.6.6) aan op de waterstraalpomp (A.1.6.7) en dompel vervolgens buisje 2 (zie figuur A.1) in de dimethyldichloorsilaan-oplossing (A.1.2). Vul de kolom (A.1.5) met die oplossing door de kraan te sluiten. Open de kraan weer en verwijder daarna de twee buisjes. Bevestig de kolom aan een statief. Vul de kolom volledig met een pipet met dimethyldichloorsilaan-oplossing (A.1.2).
Figuur A.1:
Silaniseeropstelling
![]()
Betekenis van de cijfers:
|
1 |
Buisje 1 |
|
2 |
Buisje 2 |
|
3 |
Waterstraalpomp |
|
4 |
Kraan |
|
5 |
Glazen kolom |
|
6 |
Dimethyldichloorsilaan in tolueen |
Laat de kolom 20-30 minuten staan. Vervang vervolgens de Woulff'se fles door een filtreerkolf. Leeg de kolom door deze op de waterstraalpomp (A.1.6.7) aan te sluiten (zie figuur A.2). Was de geleegde kolom met achtereenvolgens 75 ml tolueen (A.1.1) en 50 ml methanol (4.3) door buisje 2 in het oplosmiddel te dompelen. Droog de gewassen kolom gedurende ongeveer 30 minuten in de droogstoof (5.6) bij 100 °C.
Figuur A.2:
Wasopstelling
![]()
Betekenis van de cijfers:
|
1 |
Buisje 1 |
|
2 |
Buisje 2 |
|
3 |
Waterstraalpomp |
|
4 |
Filtreerkolf |
|
5 |
Glazen kolom |
|
6 |
Wasvloeistof |
A.3 VULLEN
Vul de kolom met de in figuur A.3 weergegeven opstelling. Vul de vulkolom (A.1.6.1) tot het merkteken met de stationaire fase (A.1.4). Sluit de onderkant van de te vullen glazen kolom af met een ongeveer 1 cm lange prop samengeperste gesilaniseerde glaswol (A.1.6.3). Sluit het uiteinde van de kolom af met de fijne zeef (A.1.6.2).
Figuur A.3:
Vullen van de glazen kolom

Betekenis van de cijfers:
|
1 |
Stikstofinlaatbuis |
|
2 |
Vulkolom die tot het merkteken met OV-1 wordt gevuld |
|
3 |
Te vullen glazen kolom |
|
4 |
Schroefdop met filter waar de glaswol en de stationaire fase tegenaan gedrukt wordt |
Vul de kolom onder druk (300 kPa en een stikstofstroom) met de stationaire fase. Beweeg tijdens het vullen een vibrator op en neer tegen de glazen kolom om een uniforme, continue en stevige pakking te krijgen. Duw na het vullen een stevige prop gesilaniseerde glaswol (A.1.6.3) in het andere uiteinde van de gepakte kolom. Snijd de uitstekende stukken af. Duw de prop met een spatel enkele millimeters in de kolom.
A.4 CONDITIONEREN
Sluit tijdens de stappen a) tot en met c) het uiteinde van de kolom niet op de detector aan om verontreiniging te voorkomen. Conditioneer de gevulde kolom (A.3) als volgt:
|
a) |
spoel de kolom gedurende 15 minuten met stikstof, waarbij het debiet wordt ingesteld op 40 ml/minuut en de oven van de gaschromatograaf op 50 °C; |
|
b) |
voer de kolomtemperatuur met 1 °C/minuut op tot 355 °C, waarbij het stikstofdebiet wordt ingesteld op 10 ml/minuut; |
|
c) |
houd de kolomtemperatuur gedurende 12-15 uur op 355 °C; |
|
d) |
injecteer twee keer 1 µl cacaoboter-oplossing (A.1.3) en gebruik daarbij het onder 7.3.4.1 vermelde temperatuurprogramma voor de gepakte kolom; NB: Cacaoboter bestaat vrijwel uitsluitend uit hoogkokende C50- tot C54-TG's en maakt dus de kolomconditionering ten aanzien van de respectieve responsfactoren eenvoudiger. |
|
e) |
injecteer binnen twee tot drie dagen 20 keer 0,5 µl melkvetoplossing volgens 7.2 met de onder 7.3.4.1 vermelde instelling voor de gepakte kolom.
|
(1) Voorbeeld van een geschikt in de handel verkrijgbaar product. Deze informatie wordt ten behoeve van de gebruikers van deze internationale norm verstrekt en betekent niet dat dit product door de ISO of de IDF wordt aanbevolen.
AANHANGSEL B
(ter informatie)
KWANTIFICERING VAN HET GEHALTE AAN VREEMD VET
B.1 ALGEMEEN
Tabel B.1 bevat de detectielimieten voor de verschillende vreemde vetten, berekend met een betrouwbaarheidsniveau van 99 %. In de middelste kolom worden de detectielimieten voor de beste individuele vergelijking van de vergelijkingen (3) tot en met (6) vermeld.
De rechterkolom bevat de detectielimieten voor de totaalvergelijking (7), die enigszins hoger zijn. In principe is alleen vergelijking (7) nodig om de hoeveelheid vreemd vet te kwantificeren.
Met alle vergelijkingen kunnen ook combinaties van de verschillende vreemde vetten worden gedetecteerd. De variatie van de TG-samenstelling tussen individuele monsters van één soort vreemd vet heeft geen significante invloed op de detectielimieten.
Wanneer zowel de individuele vergelijkingen als de totaalvergelijking worden gebruikt, gelden de detectielimieten van de individuele vergelijkingen. In bepaalde gevallen is voor kwantificering echter de S-waarde van de totaalvergelijking nodig (B.2).
Tabel B.1:
99 %-detectielimieten van vreemd vet dat aan melkvet is toegevoegd (in %)
|
Vreemd vet |
Individuele vergelijking (%) |
Totaalvergelijking (%) |
|
Sojaolie |
2,1 |
4,4 |
|
Zonnebloemolie |
2,3 |
4,8 |
|
Olijfolie |
2,4 |
4,7 |
|
Kokosvet |
3,5 |
4,3 |
|
Palmolie |
4,4 |
4,7 |
|
Palmpittenvet |
4,6 |
5,9 |
|
Koolzaadolie |
2,0 |
4,4 |
|
Lijnolie |
2,0 |
4,0 |
|
Tarwekiemolie |
2,7 |
6,4 |
|
Maïskiemolie |
2,2 |
4,5 |
|
Katoenzaadolie |
3,3 |
4,4 |
|
Varkensvet |
2,7 |
4,7 |
|
Rundvet |
5,2 |
5,4 |
|
Gehydrogeneerde visolie |
5,4 |
6,1 |
B.2 BEREKENING
Voer alleen een kwantitatieve bepaling van vreemd vet uit als ten minste één van de S-grenswaarden (tabel 2 of tabel 5) wordt overschreden. Bereken, om kwantitatieve informatie te verkrijgen, de massafractie van het vreemde vet of het mengsel van vreemde vetten in het monster (w f), uitgedrukt als percentage, met de volgende vergelijking:

Hierbij is:
|
S |
het resultaat van de invulling van TG-gegevens van melkvet waaraan een vreemd vet of een mengsel van vreemde vetten is toegevoegd, in een van de vergelijkingen (3) tot en met (7); |
|
S f |
een constante die afhankelijk is van de aard van het toegevoegde vreemde vet. |
Gebruik, als onbekend is welk type vreemd vet aan het melkvet is toegevoegd, een algemene S f-waarde van 7,46 (tabel B.2). Gebruik altijd de uit vergelijking (7) verkregen S-waarde, zelfs als de S-waarden daarvan niet worden overschreden maar die van een andere vergelijking wel.
Vul bij bekende vreemde vetten hun individuele S f-waarden (tabel B.2) in vergelijking (B.1) in. Kies voor de berekening van S de relevante vergelijking voor vreemd vet uit de vergelijkingen (3) tot en met (6).
Tabel B.2:
S f-waarden van enkele vreemde vetten
|
Vreemd vet |
S f |
|
Onbekend |
7,46 |
|
Sojaolie |
8,18 |
|
Zonnebloemolie |
9,43 |
|
Olijfolie |
12,75 |
|
Kokosvet |
118,13 |
|
Palmolie |
7,55 |
|
Palmpittenvet |
112,32 |
|
Koolzaadolie |
3,30 |
|
Lijnolie |
4,44 |
|
Tarwekiemolie |
27,45 |
|
Maïskiemolie |
9,29 |
|
Katoenzaadolie |
41,18 |
|
Varkensvet |
177,55 |
|
Rundvet |
17,56 |
|
Visolie |
64,12 |
B.3 WEERGAVE VAN DE TESTRESULTATEN
De testresultaten worden met twee decimalen vermeld.
Bibliografie
|
(1) |
Molkentin, J., Precht, D. Representative determination of the butyric acid content in European milk fats. Milchwissenschaft, 52, 1987, pp. 82-85 |
|
(2) |
Precht, D., Molkentin, J. Quantitative triglyceride analysis using short capillary columns. Chrompack News, 4, 1993, pp. 16-17 |
|
(3) |
Molkentin, J., Precht, D. Comparison of packed and capillary columns for quantitative gas chromatography of triglycerides in milk fat. Chromatographia, 39, 1994, pp. 265-270 |
|
(4) |
Molkentin, J., Precht, D. Equivalence of packed and capillary GC columns with respect to suitability for foreign fat detection in butter using the triglyceride formula method. Chromatographia, 52, 2000, pp. 791-797 |
|
(5) |
ISO 707|IDF 50: Melk en melkproducten — Leidraad voor monsterneming |
|
(6) |
BS 410:1988, Test sieves — Technical requirements and testing |
|
(7) |
Precht, D. Control of milk fat purity by gas chromatographic triglyceride analysis. Kieler Milchwirtsch. Forschungsber., 43, 1991, pp. 219-242 |
|
(8) |
Precht, D. Detection of adulterated milk fat by fatty acid and triglyceride analyses. Fat Sci. Technol., 93, 1991, pp. 538-544 |
|
(9) |
DIN 10336:1994, Nachweis und Bestimmung von Fremdfetten in Milchfett anhand einer gaschromatographischen Triglyceridanalyse [Detectie en bepaling van vreemd vet in melkvet met behulp van een gaschromatografische analyse van triglyceriden] |
|
(10) |
Commissie van de Europese Gemeenschappen: Consideration of results from the first, second, third, fourth, fifth and sixth EEC collaborative trial: Determination of triglycerides in milk fat; Doc. No VI/2644/91, VI/8.11.91, VI/1919/92, VI 3842/92. VI/5317/92, VI/4604/93 |
|
(11) |
Molkentin, J. Detection of foreign fat in milk fat from different continents by triacylglycerol analysis. Eur. J. Lipid Sci. Technol., 109, 2007, pp. 505-510 |
BIJLAGE XXI
(Artikel 18)
PROCEDURE DIE WORDT GEVOLGD WANNEER DE RESULTATEN VAN EEN ANALYSE WORDEN BETWIST (CHEMISCHE ANALYSE)
1. Op verzoek van de fabrikant wordt in een ander door de bevoegde autoriteit erkend laboratorium met de desbetreffende methode een nieuwe analyse uitgevoerd, mits er verzegelde duplo-monsters van het product beschikbaar zijn die op correcte wijze bij de bevoegde autoriteit zijn bewaard. Het verzoek wordt binnen zeven werkdagen na de kennisgeving van de resultaten van de eerste analyse ingediend. De analyse wordt binnen 21 werkdagen na de ontvangst van het verzoek uitgevoerd. De bevoegde autoriteit zendt deze monsters op verzoek en op kosten van de fabrikant naar een tweede laboratorium. Het laboratorium moet bevoegd zijn om officiële analyses uit te voeren en moet hebben aangetoond dat het over de deskundigheid beschikt om de desbetreffende analyse uit te voeren.
2. De totale onzekerheid (k = 2) van het gemiddelde  van de
van de  herhaalde metingen in laboratorium 1 en van het gemiddelde
herhaalde metingen in laboratorium 1 en van het gemiddelde  van de
van de 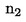 herhaalde metingen in laboratorium 2 is:
herhaalde metingen in laboratorium 2 is:
3. 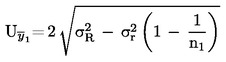 respectievelijk
respectievelijk  , waarbij
, waarbij 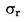 de standaarddeviatie van de herhaalbaarheid en
de standaarddeviatie van de herhaalbaarheid en ![]() de standaarddeviatie van de reproduceerbaarheid van de desbetreffende methode is. Als het eindresultaat y van de meting in de laboratoria wordt berekend met een vergelijking van de vorm
de standaarddeviatie van de reproduceerbaarheid van de desbetreffende methode is. Als het eindresultaat y van de meting in de laboratoria wordt berekend met een vergelijking van de vorm  ,
,  ,
,  of
of 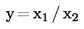 , moeten de gebruikelijke procedures voor de combinatie van standaarddeviaties in dergelijke gevallen worden gevolgd om de onzekerheid te verkrijgen.
, moeten de gebruikelijke procedures voor de combinatie van standaarddeviaties in dergelijke gevallen worden gevolgd om de onzekerheid te verkrijgen.
4. Om te testen of de resultaten van de twee laboratoria in overeenstemming zijn met de standaarddeviatie van de reproduceerbaarheid ![]() van de methode, wordt de totale onzekerheid van het verschil
van de methode, wordt de totale onzekerheid van het verschil  berekend:
berekend:
5. 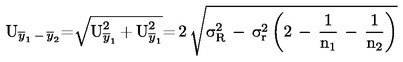 . Als de absolute waarde van het verschil tussen de gemiddelden van de laboratoria
. Als de absolute waarde van het verschil tussen de gemiddelden van de laboratoria 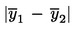 niet groter is dan de onzekerheid daarvan
niet groter is dan de onzekerheid daarvan 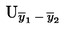 :
:
![]() ,
,
zijn de resultaten van de twee laboratoria in overeenstemming met de standaarddeviatie van de reproduceerbaarheid (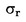 ) en wordt het rekenkundig gemiddelde van de twee gemiddelden van de laboratoria,
) en wordt het rekenkundig gemiddelde van de twee gemiddelden van de laboratoria,
 ,
,
als eindresultaat gerapporteerd. De totale onzekerheid daarvan is:
 .
.
De partij wordt geacht niet aan de bovenste wettelijke grenswaarde UL te voldoen en wordt derhalve afgekeurd als:
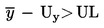 ;
;
in alle andere gevallen wordt de partij geacht wel aan UL te voldoen en wordt deze goedgekeurd.
De partij wordt geacht niet aan de onderste wettelijke grenswaarde LL te voldoen en wordt derhalve afgekeurd als:
 ;
;
in alle andere gevallen wordt de partij geacht wel aan LL te voldoen en wordt deze goedgekeurd.
Als de absolute waarde van het verschil tussen de gemiddelden van de laboratoria  groter is dan de onzekerheid daarvan
groter is dan de onzekerheid daarvan  :
:
![]() ,
,
zijn de resultaten van de twee laboratoria niet in overeenstemming van de standaarddeviatie van de reproduceerbaarheid.
In dit geval wordt de partij geacht niet aan de eisen te voldoen en wordt deze derhalve afgekeurd als de tweede analyse de eerste analyse bevestigt. In alle andere gevallen wordt de partij geacht wel aan de eisen te voldoen en wordt deze goedgekeurd.
Het eindresultaat moet zo spoedig mogelijk door de bevoegde autoriteit aan de fabrikant worden meegedeeld. Als de partij wordt afgekeurd, zijn de kosten van de tweede analyse voor rekening van de fabrikant.
BIJLAGE XXII
CORRELATIETABEL
|
Verordening (EG) nr. 213/2001 |
Deze verordening |
|
Artikel 1 |
Artikel 1 |
|
Artikel 2 |
Artikel 1 |
|
Artikel 3 |
Artikel 2 |
|
— |
Artikel 3 |
|
Artikel 4 |
— |
|
Artikel 5 |
— |
|
Artikel 6 |
Artikel 4 |
|
Artikel 7 |
Artikel 18 |
|
Artikel 8 |
— |
|
Artikel 9 |
Artikel 5 |
|
Artikel 10 |
Artikel 6 |
|
Artikel 11 |
Artikel 7 |
|
Artikel 12 |
Artikel 8 |
|
Artikel 13 |
Artikel 9 |
|
Artikel 14 |
Artikel 10 |
|
Artikel 15 |
Artikel 11 |
|
Artikel 16 |
Artikel 12 |
|
Artikel 17 |
Artikel 13 |
|
— |
Artikel 14 |
|
Artikel 18 |
Artikel 15 |
|
Artikel 19 |
Artikel 16 |
|
|
Artikel 17 |
|
|
Artikel 19 |
|
Artikel 20 |
— |
|
Artikel 21 |
— |
|
Artikel 22 |
Artikel 20 |
|
Artikel 23 |
Artikel 21 |







