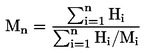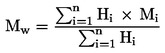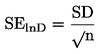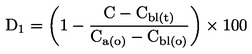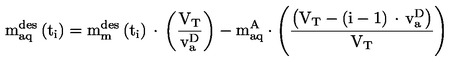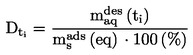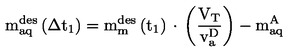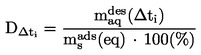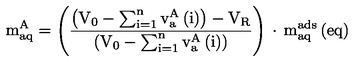EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 02008R0440-20120723
Commission Regulation (EC) No 440/2008 of 30 May 2008 laying down test methods pursuant to Regulation (EC) No 1907/2006 of the European Parliament and of the Council on the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) (Text with EEA relevance)
Consolidated text: Komisijas Regula (EK) Nr. 440/2008 ( 2008. gada 30. maijs ) par testēšanas metožu noteikšanu saskaņā ar Eiropas Parlamenta un Padomes Regulu (EK) Nr. 1907/2006, kas attiecas uz ķimikāliju reģistrēšanu, vērtēšanu, licencēšanu un ierobežošanu ( REACH ) (Dokuments attiecas uz EEZ)
Komisijas Regula (EK) Nr. 440/2008 ( 2008. gada 30. maijs ) par testēšanas metožu noteikšanu saskaņā ar Eiropas Parlamenta un Padomes Regulu (EK) Nr. 1907/2006, kas attiecas uz ķimikāliju reģistrēšanu, vērtēšanu, licencēšanu un ierobežošanu ( REACH ) (Dokuments attiecas uz EEZ)
2008R0440 — LV — 23.07.2012 — 003.001
Šis dokuments ir izveidots vienīgi dokumentācijas nolūkos, un iestādes neuzņemas nekādu atbildību par tā saturu
|
KOMISIJAS REGULA (EK) Nr. 440/2008 (2008. gada 30. maijs) par testēšanas metožu noteikšanu saskaņā ar Eiropas Parlamenta un Padomes Regulu (EK) Nr. 1907/2006, kas attiecas uz ķimikāliju reģistrēšanu, vērtēšanu, licencēšanu un ierobežošanu (REACH) (OV L 142, 31.5.2008, p.1) |
Grozīta ar:
|
|
|
Oficiālais Vēstnesis |
||
|
No |
page |
date |
||
|
L 220 |
1 |
24.8.2009 |
||
|
KOMISIJAS REGULA (ES) Nr. 1152/2010 (2010. gada 8. decembris), |
L 324 |
13 |
9.12.2010 |
|
|
L 193 |
1 |
20.7.2012 |
||
KOMISIJAS REGULA (EK) Nr. 440/2008
(2008. gada 30. maijs)
par testēšanas metožu noteikšanu saskaņā ar Eiropas Parlamenta un Padomes Regulu (EK) Nr. 1907/2006, kas attiecas uz ķimikāliju reģistrēšanu, vērtēšanu, licencēšanu un ierobežošanu (REACH)
(Dokuments attiecas uz EEZ)
EIROPAS KOPIENU KOMISIJA,
ņemot vērā Eiropas Kopienas dibināšanas līgumu,
ņemot vērā Eiropas Parlamenta un Padomes 2006. gada 18. decembra Regulu (EK) Nr. 1907/2006, kas attiecas uz ķimikāliju reģistrēšanu, vērtēšanu, licencēšanu un ierobežošanu (REACH) un ar kuru izveido Eiropas Ķimikāliju aģentūru, groza Direktīvu 1999/45/EK un atceļ Padomes Regulu (EEK) Nr. 793/93 un Komisijas Regulu (EK) Nr. 1488/94, kā arī Padomes Direktīvu 76/769/EEK un Komisijas Direktīvu 91/155/EEK, Direktīvu 93/67/EEK, Direktīvu 93/105/EK un Direktīvu 2000/21/EK ( 1 ), un jo īpaši tās 13. panta 3. punktu,
tā kā:|
(1) |
Saskaņā ar Regulu (EK) Nr. 1907/2006 informācijas iegūšanai par vielu raksturīgajām īpašībām izmantojamās testēšanas metodes jāpieņem Kopienas līmenī. |
|
(2) |
Vielu un preparātu fizikāli ķīmisko īpašību, toksicitātes un ekotoksicitātes noteikšanas metodes norādītas V pielikumā Padomes 1967. gada 27. jūnija Direktīvā 67/548/EEK par to normatīvo un administratīvo aktu tuvināšanu, kas attiecas uz bīstamu vielu klasifikāciju, iepakošanu un marķēšanu ( 2 ). No 2008. gada 1. jūnija Direktīvas 67/548/EEK V pielikums tiek svītrots ar Eiropas Parlamenta un Padomes Direktīvu 2006/121/EK. |
|
(3) |
Testēšanas metodes, kas norādītas Direktīvas 67/548/EEK V pielikumā, jāiekļauj šajā regulā. |
|
(4) |
Ar šo regulu neizslēdz citu testēšanas metožu izmantošanu, ja vien to izmantošana notiek saskaņā ar Regulas (EK) Nr. 1907/2006 13. panta 3. punktu. |
|
(5) |
Izstrādājot testēšanas metodes, pilnībā jāņem vērā iespējas izmēģinājumus ar dzīvniekiem aizstāt, samazināt to apjomu vai tos pilnveidot, jo īpaši gadījumos, kad kļūst pieejamas attiecīgas validētas metodes, ar kurām izmēģinājumus ar dzīvniekiem var aizstāt, samazināt to apjomu vai tos pilnveidot. |
|
(6) |
Šīs regulas noteikumi ir saskaņā ar atzinumu, ko sniegusi komiteja, kura izveidota saskaņā ar Regulas (EK) Nr. 1907/2006 133. pantu, |
IR PIEŅĒMUSI ŠO REGULU.
1. pants
Regulas (EK) Nr. 1907/2006 piemērošanai izmantojamās testēšanas metodes tiek noteiktas šīs regulas pielikumā.
2. pants
Lai uzlabotu veidu, kādā veic izmēģinājumus ar mugurkaulniekiem, tos aizstātu vai samazinātu šādu izmēģinājumu apjomu, šajā regulā noteiktās testēšanas metodes Komisija pēc vajadzības pārskata.
3. pants
Visas atsauces uz Direktīvas 67/548/EEK V pielikumu uzskata par atsaucēm uz šo regulu.
4. pants
Šī regula stājas spēkā nākamajā dienā pēc tās publicēšanas Eiropas Savienības Oficiālajā Vēstnesī.
To piemēro no 2008. gada 1. jūnija.
PIELIKUMS
A DAĻA: FIZIKĀLI ĶĪMISKO ĪPAŠĪBU NOTEIKŠANAS METODES
|
SATURS |
|
|
A.1. |
KUŠANAS/SASALŠANAS TEMPERATŪRA |
|
A.2. |
VIRŠANAS TEMPERATŪRA |
|
A.3. |
RELATĪVAIS BLĪVUMS |
|
A.4. |
TVAIKA SPIEDIENS |
|
A.5. |
VIRSMAS SPRAIGUMS |
|
A.6. |
ŠĶĪDĪBA ŪDENĪ |
|
A.8. |
SADALĪŠANĀS KOEFICIENTS |
|
A.9. |
UZLIESMOŠANAS TEMPERATŪRA |
|
A.10. |
UZLIESMOŠANAS SPĒJA (CIETAS VIELAS) |
|
A.11. |
UZLIESMOŠANAS SPĒJA (GĀZĒM) |
|
A.12. |
UZLIESMOŠANAS SPĒJA (KONTAKTĀ AR ŪDENI) |
|
A.13. |
CIETVIELU UN ŠĶIDRUMU PIROFORĀS ĪPAŠĪBAS |
|
A.14. |
SPRĀDZIENBĪSTAMĪBA |
|
A.15. |
PAŠAIZDEGŠANĀS TEMPERATŪRA (ŠĶIDRUMI UN GĀZES) |
|
A.16. |
RELATĪVĀS PAŠAIZDEGŠANĀS TEMPERATŪRAS NOTEIKŠANA CIETVIELĀM |
|
A.17. |
OKSIDĒJOŠĀS ĪPAŠĪBAS (CIETVIELAS) |
|
A.18. |
POLIMĒRU VIDĒJĀ MOLEKULAS MASA UN MOLEKULAS MASU SADALĪJUMS |
|
A.19. |
MAZU MOLEKULU MASU SATURS POLIMĒROS |
|
A.20. |
POLIMĒRU ŠĶĪŠANA/EKSTRAKCIJA ŪDENĪ |
|
A.21. |
OKSIDIZĒJOŠAS ĪPAŠĪBAS (ŠĶIDRUMI) |
|
A.22. |
GARUMU SVĒRTAIS ĢEOMETRISKAIS VIDĒJAIS ŠĶIEDRU DIAMETRS |
A.1. KUŠANAS/SASALŠANAS TEMPERATŪRA
1. METODE
Aprakstīto metožu lielākās daļas pamatā ir ESAO Testēšanas norādījumi (1). Pamatprincipi aprakstīti izmantotās literatūras avotos (2) un (3).
1.1. IEVADS
Šeit aprakstītās metodes un ierīces izmantojamas vielu kušanas temperatūras noteikšanai neatkarīgi no to tīrības pakāpes.
Izvēloties noteikšanas metodi, jāņem vērā attiecīgās vielas īpašības. Rezultātā ierobežojošais faktors ir tas, vai viela ir viegli saberžama pulvera veidā, saberžama ar grūtībām vai arī tā pulvera veidā nav saberžama.
Dažām vielām labāk noteikt sasalšanas vai sacietēšanas temperatūru, tāpēc šajā metodē iekļauti noteikumi par to noteikšanas kārtību.
Ja vielas īpašību dēļ nav ērti nosakāms neviens no iepriekšminētajiem rādītājiem, to vietā var noteikt sastingšanas temperatūru.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Kušanas temperatūra ir tāda temperatūra, kurā pie atmosfēras spiediena notiek fāžu pāreja no cieta agregātstāvokļa šķidrā, un šī temperatūra pilnīgi sakrīt ar sasalšanas temperatūru.
Tā kā daudzām vielām fāžu pāreja notiek zināmā temperatūras intervālā, to parasti norāda kušanas temperatūras intervāla veidā.
Mērvienību pārvēršana (K uz oC)
t = T – 273,15
|
t |
: |
temperatūra pēc Celsija skalas, Celsija grādi ( oC) |
|
T |
: |
termodinamiskā temperatūra, kelvini (K) |
1.3. STANDARTVIELAS
Pārbaudot jaunu vielu, ne visos gadījumos jāizmanto standartvielas. Tās galvenokārt izmanto metodes izpildījuma periodiskām pārbaudēm un dažādu metožu salīdzināšanai.
Dažas kalibrēšanas vielas ir uzskaitītas izmantotās literatūras sarakstā (4).
1.4. METODES PRINCIPS
Nosaka fāžu pārejas temperatūru (temperatūras intervālu) pārejai no cieta agregātstāvokļa šķidrā. Praktiski nosaka parauga kušanas/sasalšanas sākumu un beigas, paraugu sildot/dzesējot. Aprakstītas piecas dažādas metodes, konkrēti – kapilāra metode, metodes, kurās izmanto sildvirsmas, sasalšanas temperatūras noteikšanas metodes, termiskās analīzes metodes un sastingšanas temperatūras noteikšana (naftas eļļām).
Dažkārt kušanas temperatūras vietā var būt ērtāk noteikt sasalšanas temperatūru.
1.4.1. Kapilāra metode
1.4.1.1. Kušanas temperatūras noteikšanas ierīces ar šķidruma vannu
Nelielu sīki sasmalcinātas vielas daudzumu ievieto kapilārā un sablīvē. Kapilāru kopā ar termometru silda un sildīšanas ātrumu noregulē tā, lai kušanas laikā temperatūra paaugstinātos ne vairāk par 1 K/min. Nosaka temperatūru kušanas sākumā un beigās.
1.4.1.2. Kušanas temperatūras noteikšanas ierīces ar metāla bloku
Tāpat kā aprakstīts 1.4.1.1. punktā, izņemot to, ka kapilārs un termometrs ievietoti apsildāmā metāla blokā, un tos var novērot pa blokā izveidotām atverēm.
1.4.1.3. Fotometriska noteikšana
Paraugu, kas atrodas kapilārā, automātiski karsē metāla cilindrā. Caur cilindrā izurbtu caurumu gaismas kūli novirza uz vielu un tālāk uz precīzi kalibrētu fotoelementu. Kušanas laikā vielas lielākoties kļūst optiski caurspīdīgas. Uz fotoelementu krītošās gaismas intensitāte palielinās, un tas dod signālu ciparu indikatoram nolasīt sildīšanas kamerā ievietota platīna pretestības termometra rādījumu. Šī metode neder spilgti krāsainām vielām.
1.4.2. Sildvirsmas
1.4.2.1. Koflera sildvirsma
Koflera sildvirsma sastāv no diviem metāla stieņiem ar atšķirīgu siltuma vadītspēju, kurus karsē ar elektrības palīdzību, turklāt pats stienis ir izgatavots tā, lai temperatūras gradients visā tā garumā būtu gandrīz lineārs. Sildvirsmas temperatūru var mainīt no 283 līdz 573 K, un tā aprīkota ar īpašu temperatūras nolasīšanas ierīci, kam ir kustīga bultiņa un skala, kura pielāgota tieši šai sildvirsmai. Kušanas temperatūras noteikšanai vielu plānā slānī uzklāj tieši sildvirsmai. Pēc dažām sekundēm starp šķidro un cieto fāzi parādās skaidri redzama dalījuma līnija. Temperatūru pie dalījuma līnijas nolasa, novietojot bultiņu tieši pie līnijas.
1.4.2.2. Kausējamais mikroskops
Kušanas temperatūras noteikšanai, kurai vajadzīgs ļoti mazs vielas daudzums, izmanto vairāku veidu mikroskopus ar apsildāmu galdiņu. Parasti sildāmā galdiņa temperatūras mērīšanai izmanto jutīgu termopāri, tomēr dažkārt izmanto arī dzīvsudraba termometrus. Parasti kušanas temperatūras noteikšanas aparātam ar mikroskopu un sildāmu galdiņu ir sildīšanas kamera, kurā ir metāla plate, uz kuras novieto priekšmetstikliņu ar paraugu. Metāla plates vidū ir atvere, caur kuru krīt gaisma no mikroskopa apgaismošanas spoguļa. Noteikšanas laikā kameru noslēdz ar stikla plāksnīti, lai izspiestu gaisu no parauga zonas.
Parauga sildīšanas ātrumu regulē ar reostatu. Augstas precizitātes instrumentos, veicot mērījumus optiski anizotropām vielām, var izmantot polarizētu gaismu.
1.4.2.3. Meniska metode
Šo metodi izmanto poliamīdiem.
Vizuāli nosaka temperatūru, kurā pārvietojas silikoneļļas menisks, kas atrodas starp sildvirsmu un segstiklu, ar kuru pārklāts poliamīda paraugs.
1.4.3. Sasalšanas temperatūras noteikšanas metode
Paraugu ievieto speciālā mēģenē, ko ievieto sasalšanas temperatūras noteikšanas aparātā. Dzesēšanas laikā paraugu pastāvīgi uzmanīgi maisa un ar piemērotiem intervāliem nolasa temperatūru. Tiklīdz temperatūra vairāku nolasījumu laikā nemainās, šo temperatūru (kurai veic termometra kļūdas korekciju) reģistrē kā sasalšanas temperatūru.
Jāizvairās paraugu pārdzesēt, pastāvīgi uzturot līdzsvaru starp cieto un šķidro fāzi.
1.4.4. Termiskā analīze
1.4.4.1. Diferenciālā termiskā analīze (DTA)
Pēc šīs metodes reģistrē nosakāmās vielas un standartvielas temperatūras starpību atkarībā no temperatūras, uz vielu un standartvielu iedarbojoties ar vienu un to pašu regulējamas temperatūras programmu. Kad paraugam notiek fāžu pāreja ar entalpijas izmaiņām, par tām liecina endoterma (kušana) vai eksoterma (sasalšana) nobīde no reģistrētās temperatūras bāzes līnijas.
1.4.4.2. Diferenciālā skenēšanas kalorimetrija (DSK)
Pēc šīs metodes reģistrē nosakāmās vielas un standartvielas patērētās enerģijas starpību atkarībā no temperatūras, uz vielu un standartvielu iedarbojoties ar vienu un to pašu regulējamas temperatūras programmu. Šī ir enerģija, kas vajadzīga, lai iestātos temperatūras nulles starpība starp nosakāmo vielu un standartvielu. Kad paraugam notiek fāžu pāreja ar entalpijas izmaiņām, par tām liecina endoterma (kušana) vai eksoterma (sasalšana) nobīde no reģistrētās siltumenerģija plūsmas bāzes līnijas.
1.4.5. Sastingšanas temperatūra
Šī metode izstrādāta naftas eļļu analīzēm un ir piemērota eļļveida vielām ar zemu kušanas temperatūru.
Paraugu vispirms sasilda un pēc tam ar noteiktu ātrumu atdzesē, ik pēc 3 K pārbaudot plūstamību. Par sastingšanas temperatūru uzskata un reģistrē zemāko temperatūru, kurā novērojama vielas kustība.
1.5. KVALITĀTES KRITĒRIJI
Dati par kušanas temperatūras/kušanas temperatūras intervāla noteikšanas metožu lietojamību un precizitāti apkopoti turpmāk tabulā:
TABULA: METOŽU LIETOJAMĪBA
A. Kapilāra metodes
|
Mērīšanas metode |
Vielas, kuras var saberzt pulverī |
Vielas, kuras nevar viegli saberzt pulverī |
Temperatūras diapazons |
Novērtētā precizitāte (1) |
Standartmetode |
|
Kušanas temperatūras noteikšanas ierīces ar šķidruma vannu |
jā |
tikai daļa |
273–573 K |
± 0,3 K |
JIS K 0064 |
|
Kušanas temperatūras noteikšanas ierīces ar metāla bloku |
jā |
tikai daļa |
293 līdz > 573 K |
± 0,5 K |
ISO 1218 (E) |
|
Fotometriska noteikšana |
jā |
der dažādām vielām, izmantojot papildierīces |
253–573 K |
± 0,5 K |
|
|
(1) Atkarībā no instrumenta tipa un vielas tīrības. |
|||||
B. Sildvirsmas metodes un sasalšanas temperatūras noteikšana
|
Mērīšanas metode |
Vielas, kuras var saberzt pulverī |
Vielas, kuras nevar viegli saberzt pulverī |
Temperatūras diapazons |
Novērtētā precizitāte (1) |
Standartmetode |
|
Koflera sildvirsma |
jā |
nē |
283 līdz > 573 K |
± 1 K |
ANSI/ASTM D 3451-76 |
|
Kausējamais mikroskops |
jā |
tikai daļa |
273 līdz > 573 K |
± 0,5 K |
DIN 53736 |
|
Meniska metode |
nē |
der tikai poliamīdiem |
293 līdz > 573 K |
± 0,5 K |
ISO 1218 (E) |
|
Sasalšanas temperatūras noteikšanas metodes |
jā |
jā |
223 līdz 573 K |
± 0,5 K |
e.g. BS 4695 |
|
(1) Atkarībā no instrumenta tipa un vielas tīrības. |
|||||
C. Termiskā analīze
|
Mērīšanas metode |
Vielas, kuras var saberzt pulverī |
Vielas, kuras nevar viegli saberzt pulverī |
Temperatūras diapazons |
Novērtētā precizitāte (1) |
Standartmetode |
|
Diferenciālā termiskā analīze |
jā |
jā |
173 līdz 1 273 K |
līdz 600 K ± 0,5 K līdz 1 273 K ± 2,0 K |
ASTM E 537-76 |
|
Diferenciālā skenēšanas kalorimetrija |
jā |
jā |
173 līdz 1 273 K |
līdz 600 K ± 0,5 K līdz 1 273 K ± 2,0 K |
ASTM E 537-76 |
|
(1) Atkarībā no instrumenta tipa un vielas tīrības. |
|||||
D. Sastingšanas temperatūra
|
Mērīšanas metode |
Vielas, kuras var saberzt pulverī |
Vielas, kuras nevar viegli saberzt pulverī |
Temperatūras diapazons |
Novērtētā precizitāte (1) |
Standartmetode |
|
Sastingšanas temperatūra |
naftas eļļām un eļļveida vielām |
naftas eļļām un eļļveida vielām |
223 līdz 323 K |
± 3,0 K |
ASTM D 97-66 |
|
(1) Atkarībā no instrumenta tipa un vielas tīrības. |
|||||
1.6. METOŽU APRAKSTI
Gandrīz visu šeit minēto metožu apraksts ir iekļauts starptautiskos un atsevišķu valstu standartos (skatīt 1. papildinājumu).
1.6.1. Kapilāra metodes
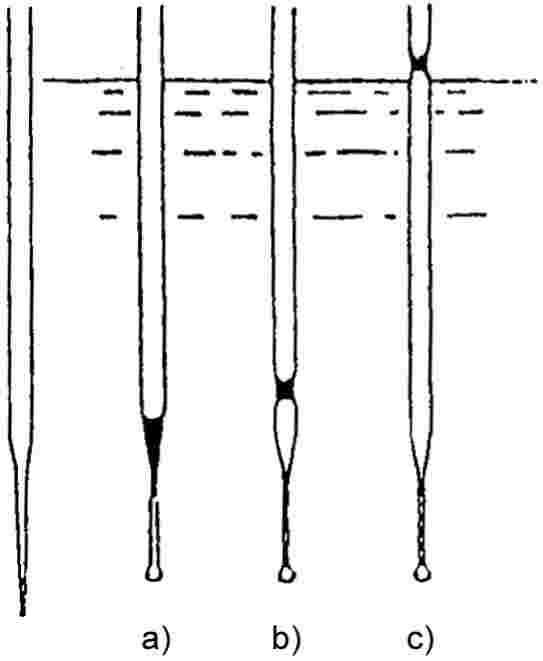
Lēni paaugstinot temperatūru, smalka pulvera veidā sasmalcinātām vielām parasti novērojamas 1. attēlā parādītās kušanas stadijas.
Nosakot kušanas temperatūru, reģistrē kušanas sākumā un beigās novēroto temperatūru.
1.6.1.1. Kušanas temperatūras noteikšanas ierīces ar šķidruma vannu
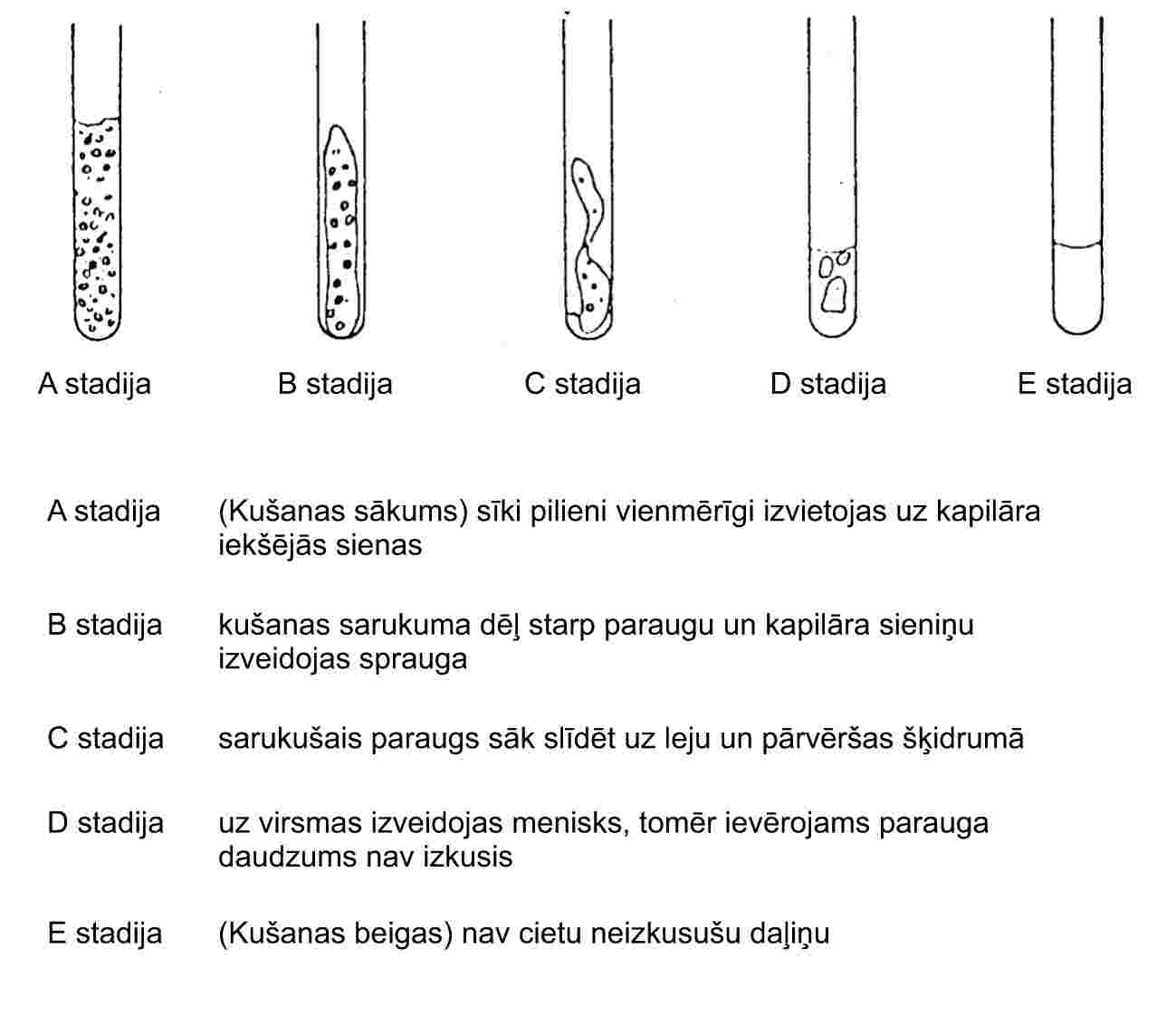
Standartizēts kušanas temperatūras noteikšanas aparāts parādīts 2. attēlā (JIS K 0064); visi izmēri norādīti milimetros.
Izvēlas piemērotu šķidrumu. Šķidrumu izvēlas atkarībā no nosakāmās kušanas temperatūras, piemēram, vazelīneļļu kušanas temperatūrām līdz 473 K, silikoneļļu temperatūrām līdz 573 K.
Kušanas temperatūru noteikšanai, kuras ir lielākas par 523 K, var izmantot maisījumu, kas sastāv no trijām masas daļām sērskābes un divām daļām kālija sulfāta. Izmantojot šāda veida maisījumus, jāievēro visi vajadzīgie piesardzības pasākumi.
Jāizmanto tikai tādi termometri, kuri atbilst šādos vai tiem ekvivalentos standartos noteiktajām prasībām:
ASTM E 1-71, DIN 12770, JIS K 8001.
Sausu vielu smalki saberž piestā un ievieto kapilārā, kuram viens gals ir aizkausēts, pēc sablīvēšanas tai jāaizņem aptuveni 3 mm no kapilāra garuma. Lai iegūtu vienveidīgu parauga blīvumu, kapilāru iemet apmēram 700 mm garā stikla caurulē, kas stāvus novietota uz pulksteņstikla.
Piepildīto kapilāru ievieto vannā tā, lai termometra dzīvsudraba rezervuāra vidusdaļa pieskartos kapilāram vietā, kurā atrodas paraugs. Parasti kapilāru aparātā ievieto tad, kad vannas šķidruma temperatūra ir par apmēram 10 K zemāka par nosakāmo kušanas temperatūru.
Šķidruma temperatūru vannā paaugstina ar ātrumu apmēram 3 K/min. Šķidrums vannā jāmaisa. Kad temperatūra ir aptuveni 10 K zem kušanas temperatūras, tā nedrīkst pieaugt ātrāk par 1 K/min.
Kušanas temperatūru aprēķina šādi:
T = TD+ 0,00016 (TD – TE) n
kur:
|
T |
= |
koriģētā kušanas temperatūra (K), |
|
TD |
= |
D termometra temperatūras rādījums (K), |
|
TE |
= |
E termometra temperatūras rādījums (K), |
|
n |
= |
to D termometra dzīvsudraba stabiņa iedaļu skaits, kuras atrodas virs šķidruma. |
1.6.1.2. Kušanas temperatūras noteikšanas ierīces ar metāla bloku
Iekārtā ietilpst:
— cilindrisks metāla bloks ar dobu augšdaļu, kas veido kameru (skatīt 3. attēlu),
— metāla aizbāznis ar divām vai vairākām atverēm, caur kurām metāla blokā ievieto kapilārus,
— metāla bloka sildīšanas sistēma, piemēram, blokā ievietota elektriskā pretestība,
— reostats elektriskās jaudas regulēšanai, ja izmanto elektrisko sildīšanu,
— četri termiski izturīga stikla logi kameras pretējās sānu sienās taisnā leņķī vienam pret otru. Pie viena no šiem logiem ir okulārs kapilāra novērošanai. Pārējos trīs logus izmanto iekšējās telpas apgaismošanai ar lampām,
— vienā galā noslēgts kapilārs no karstumizturīga stikla (skatīt 1.6.1.1. punktu).
Skatīt 1.6.1.1. punktā minētos standartus. Var izmantot arī termoelektriskās mērierīces ar līdzīgu precizitāti.

1.6.1.3. Fotometriska noteikšana
Aprīkojums un procedūra
Iekārta sastāv no metāla kameras ar automātisku apsildes sistēmu. Trīs kapilārus aizpilda, kā tas norādīts 1.6.1.1. punktā, un ievieto kamerā.
Aparatūras kalibrēšanai iespējams izmantot lineāru temperatūras paaugstināšanos ar vairākiem ātrumiem, un vajadzīgo temperatūras lineāro paaugstināšanos elektriski regulē ar iepriekš izraudzītu ātrumu. Reģistrācijas ierīces rāda faktisko krāsns temperatūru un kapilāros esošo vielu temperatūru.
1.6.2. Sildvirsmas
1.6.2.1. Koflera sildvirsma
Skatīt papildinājumu.
1.6.2.2. Kausējamais mikroskops
Skatīt papildinājumu.
1.6.2.3. Meniska metode (poliamīdiem)
Skatīt papildinājumu.
Sildīšanas ātrumam kušanas temperatūras diapazonā ap kušanas temperatūru jābūt mazākam par 1 K/min.
1.6.3. Sasalšanas temperatūras noteikšanas metodes
Skatīt papildinājumu.
1.6.4. Termiskā analīze
1.6.4.1. Diferenciālā termiskā analīze
Skatīt papildinājumu.
1.6.4.2. Diferenciālā skenēšanas kalorimetrija
Skatīt papildinājumu.
1.6.5. Sastingšanas temperatūras noteikšana
Skatīt papildinājumu.
2. IEGŪTIE DATI
Atsevišķos gadījumos ir jāveic termometra kalibrēšana.
3. PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— lietotā metode,
— vielas precīzs apraksts (identifikācija un tīrība), iepriekšēja attīrīšana, ja tiek veikta,
— precizitātes novērtējums.
Par kušanas temperatūru uzdod divu tādu mērījumu rezultātu vidējo vērtību, kuri ir novērtētās precizitātes (skatīt tabulā) robežās.
Ja temperatūras starpība kušanas sākumā un beigās ir metodes precizitātes robežās, par kušanas temperatūru uzdod temperatūru, kas noteikta kušanas beigu stadijā; pārējos gadījumos uzdod abas temperatūras, kas noteiktas kušanas sākuma un beigu stadijās.
Ja vielas sadalās vai sublimējas, nesasniedzot kušanas temperatūru, uzdod temperatūru, kurā novēro minētās parādības.
Jāiekļauj visa informācija un piezīmes, kas saistītas ar rezultātu interpretāciju, jo īpaši attiecībā uz vielas piemaisījumiem un tās agregātstāvokli.
4. IZMANTOTĀ LITERATŪRA
(1) OECD, Paris, 1981, Test Guideline 102, Decision of the Council C(81) 30 final.
(2) IUPAC, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London 1975, Vol. II, p. 803–834.
(3) R. Weissberger ed.: Technique of organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, Vol. I, Part I, Chapter VII.
(4) IUPAC, Physicochemical measurements: Catalogue of reference materials from national laboratories, Pure and applied chemistry, 1976, Vol. 48, p. 505–515.
Papildinājums
Sīkāki tehniski dati atrodami šādos standartos:
1. Kapilāra metodes
1.1. Kušanas temperatūras noteikšanas ierīces ar šķidruma vannu
|
ASTM E 324-69 |
Standard test method for relative initial and final melting points and the melting range of organic chemicals |
|
BS 4634 |
Method for the determination of melting point and/or melting range |
|
DIN 53181 |
Bestimmung des Schmelzintervalles von Harzen nach Kapilarverfarehn |
|
JIS K 00-64 |
Testing methods for melting point of chemical products |
1.2. Kušanas temperatūras noteikšanas ierīces ar metāla bloku
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
|
ISO 1218 (E) |
Plastics – polyamides – determination of “melting point” |
2. Sildvirsmas
2.1. Koflera sildvirsma
|
ANSI/ASTM D 3451-76 |
Standard recommended practices for testing polymeric powder coatings |
2.2. Kausējamais mikroskops
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
2.3. Meniska metode (poliamīdiem)
|
ISO 1218 (E) |
Plastics – polyamides – determination of “melting point” |
|
ANSI/ASTM D 2133-66 |
Standard specification for acetal resin injection moulding and extrusion materials |
|
NF T 51-050 |
Résines de polyamides. Détermination du “point de fusion” méthode du menisque |
3. Sasalšanas temperatūras noteikšanas metodes
|
BS 4633 |
Method for the determination of crystallizing point |
|
BS 4695 |
Method for Determination of Melting Point of petroleum wax (Cooling Curve) |
|
DIN 51421 |
Bestimmung des Gefrierpunktes von Flugkraftstoffen, Ottokraftstoffen und Motorenbenzolen |
|
ISO 2207 |
Cires de petrole: determination de la temperature de figeage |
|
DIN 53175 |
Bestimmung des Erstarrungspunktes von Fettsäuren |
|
NF T 60-114 |
Point de fusion des paraffines |
|
NF T 20-051 |
Methode de determination du point de cristallisation (point de congelation |
|
ISO 1392 |
Method for the determination of the freezing point |
4. Termiskā analīze
4.1. Diferenciālā termiskā analīze
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
4.2. Diferenciālā skenēšanas kalorimetrija
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
5. Sastingšanas temperatūras noteikšana
|
NBN 52014 |
Echantillonnage et analyse des produits du petrole: Point de trouble et point d'ecoulement limite – Monsterneming en ontleding van aardolieproducten: Troebelingspunt en vloeipunt |
|
ASTM D 97-66 |
Standard test method for pour point of petroleum oils |
|
ISO 3016 |
Petroleum oils – Determination of pour point |
A.2. VIRŠANAS TEMPERATŪRA
1. METODE
Aprakstīto metožu lielākās daļas pamatā ir ESAO Testēšanas norādījumi (1). Pamatprincipi aprakstīti izmantotās literatūras avotos (2) un (3).
1.1. IEVADS
Šeit aprakstītās metodes un iekārtas var izmantot šķidrām vielām un vielām ar zemu kušanas temperatūru, ja ar tām par viršanas temperatūru zemākā temperatūrā nenotiek ķīmiskas reakcijas (piemēram: autooksidēšanās, pārgrupēšanās, sadalīšanās u. c.). Šīs metodes piemērotas gan attīrītiem, gan neattīrītiem šķidrumiem.
Priekšroka dodama metodēm, kurās izmanto fotoelektrisko detektēšanu un termisko analīzi, jo pēc šīm metodēm var noteikt gan kušanas temperatūru, gan viršanas temperatūru. Turklāt mērījumus var veikt automātiskā režīmā.
Dinamiskajai metodei ir priekšrocības, kas saistās ar iespēju to izmantot arī tvaika spiediena noteikšanai, un nav jāveic viršanas temperatūras korekcija pēc atmosfēras spiediena normālos apstākļos (101,325 kPa), jo normālo atmosfēras spiedienu var noregulēt mērīšanas laikā ar manostatu.
Piezīmes
Piemaisījumu ietekme uz viršanas temperatūras noteikšanas rezultātu galvenokārt ir atkarīga no piemaisījumu rakstura. Ja paraugā ir gaistoši piemaisījumi, kuri var ietekmēt viršanas temperatūras noteikšanas rezultātus, vielu pirms tam var attīrīt.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Parasti viršanas temperatūru definē kā temperatūru, kurā šķidruma tvaika spiediens ir 101,325 kPa.
Ja viršanas temperatūru nenosaka normālā atmosfēras spiedienā, temperatūras izmaiņu aprakstīšanai atkarībā no spiediena var izmantot Klauziusa-Klapeirona vienādojumu:
![]()
kur:
|
P |
= |
vielas tvaika spiediens, paskālos, |
|
ΔHv |
= |
vielas iztvaikošanas siltums, J mol -l, |
|
R |
= |
universālā molārā gāzu konstante = 8,314 J mol-l K-l, |
|
T |
= |
termodinamiskā temperatūra, K. |
Viršanas temperatūru uzdod kopā ar atmosfēras spiedienu tās noteikšanas laikā.
Pārvēršana
Spiediens (mērvienības: kPa)
|
100 kPa |
= |
1 bar = 0,1 MPa (“bar” var joprojām izmantot, lai gan tas nebūtu ieteicams). |
|
133 Pa |
= |
1 mm Hg = 1 Torr (mērvienības “mm Hg” un “Torr” izmantot nav pieļaujams). |
|
1 atm |
= |
standarta atmosfēra = 101 325 Pa (mērvienību “atm” izmantot nav pieļaujams). |
Temperatūra (mērvienības: K)
t = T – 273,15
|
t |
: |
temperatūra pēc Celsija skalas, Celsija grādi ( oC) |
|
T |
: |
termodinamiskā temperatūra, kelvini (K) |
1.3. STANDARTVIELAS
Pārbaudot jaunu vielu, ne visos gadījumos jāizmanto standartvielas. Tās galvenokārt izmanto metodes izpildījuma periodiskām pārbaudēm un dažādu metožu salīdzināšanai.
Dažas kalibrēšanas vielas ir minētas papildinājumā iekļauto metožu aprakstā.
1.4. METODES PRINCIPS
Piecas viršanas temperatūras (viršanas temperatūras intervāla) noteikšanas metodes pamatojas uz viršanas temperatūras mērīšanu, bet divām citām izmanto termisko analīzi.
1.4.1. Noteikšana ar ebulioskopu
Ebulioskopus sākotnēji izveidoja molekulmasas noteikšanai pēc temperatūras paaugstināšanās, taču tie ir piemēroti arī precīzas viršanas temperatūras noteikšanai. Ļoti vienkārša iekārta ir aprakstīta standartā ASTM D 1120-72 (skatīt papildinājumu). Šajā iekārtā līdzsvara apstākļos šķidrumu silda līdz viršanai atmosfēras spiedienā.
1.4.2. Dinamiskā metode
Pēc šīs metodes vārīšanās laikā ar piemērotu termometru mēra tvaika kondensācijas temperatūru attecē. Pēc šīs metodes var mainīt spiedienu.
1.4.3. Viršanas temperatūras noteikšana ar destilācijas metodi
Ar šo metodi veic tvaika kondensācijas temperatūras mērījumus šķidruma destilācijas laikā un nosaka destilāta daudzumu.
1.4.4. Sivolobova metode
Paraugu silda mēģenē, kas iegremdēta šķidrumā sildīšanas vannā. Tajā pašā mēģenē ar paraugu iegremdē aizkausētu kapilāru ar gaisa burbuli apakšējā galā.
1.4.5. Fotometriska noteikšana
Saskaņā ar Sivolobova principu automātiski veic fotoelektriskus mērījumus gaisa burbuļu celšanās brīdī.
1.4.6. Diferenciālā termiskā analīze
Pēc šīs metodes reģistrē nosakāmās vielas un standartvielas temperatūras starpību atkarībā no temperatūras, uz vielu un standartvielu iedarbojoties ar vienu un to pašu regulējamas temperatūras programmu. Kad paraugam notiek fāžu pāreja ar entalpijas izmaiņām, par tām liecina endoterma (viršana) nobīde no reģistrētās temperatūras bāzes līnijas.
1.4.7. Diferenciālā skenēšanas kalorimetrija
Pēc šīs metodes reģistrē nosakāmās vielas un standartvielas patērētās enerģijas starpību atkarībā no temperatūras, uz vielu un standartvielu iedarbojoties ar vienu un to pašu regulējamas temperatūras programmu. Šī ir enerģija, kas vajadzīga, lai iestātos temperatūras nulles starpība starp nosakāmo vielu un standartvielu. Kad paraugam notiek fāžu pāreja ar entalpijas izmaiņām, par tām liecina endoterma (viršana) nobīde no reģistrētās siltumenerģijas plūsmas bāzes līnijas.
1.5. KVALITĀTES KRITĒRIJI
Dati par viršanas temperatūras/viršanas temperatūras intervāla noteikšanas metožu lietojamību un precizitāti apkopoti 1. tabulā.
1. tabula
Metožu salīdzinājums
|
Mērīšanas metode |
Novērtētā precizitāte |
Standarti |
|
Ebulioskopija |
ASTM D 1120-72 (1) |
|
|
Dinamiskā metode |
± 0,5 K (līdz 600 K) (2) |
|
|
Destilācijas metode (viršanas diapazons) |
± 0,5 K (līdz 600 K) |
ISO/R 918, DIN 53171, BS 4591/71 |
|
Sivolobova metode |
± 2 K (līdz 600 K) (2) |
|
|
Fotometriska noteikšana |
± 0,3 K (līdz 373 K) (2) |
|
|
Diferenciālā termiskā analīze |
± 0,5 K (līdz 600 K) ± 2,0 K (līdz 1 273 K) |
ASTM E 537-76 |
|
Diferenciālā skenēšanas kalorimetrija |
± 0,5 K (līdz 600 K) ± 2,0 K (līdz 1 273 K) |
ASTM E 537-76 |
|
(1) Šāda precizitāte ir tikai noteikšanai ar vienkāršu ierīci, kura aprakstīta, piemēram, standartā ASTM D 1120-72; to var uzlabot, izmantojot pilnīgākas ebulioskopijas iekārtas. (2) Tikai tīru vielu viršanas temperatūras noteikšanai. Citos gadījumos šīs metodes izmantošana ir jāpamato. |
||
1.6. METOŽU APRAKSTI
Dažu šeit minēto metožu apraksts ir iekļauts starptautiskos un atsevišķu valstu standartos (skatīt papildinājumu).
1.6.1. Ebulioskopija
Skatīt papildinājumu.
1.6.2. Dinamiskā metode
Skatīt tvaika spiediena noteikšanas A.4. metodi.
Reģistrē viršanas temperatūru, kas novērota 101,325 kPa spiedienā.
1.6.3. Destilācijas metode (viršanas temperatūras intervāls)
Skatīt papildinājumu.
1.6.4. Sivolobova metode
Apmēram 5 mm diametra parauga mēģenē ievietotu paraugu silda aparātā līdz viršanas temperatūrai (1. attēls).
Standartizēts kušanas temperatūras noteikšanas aparāts parādīts 1. attēlā. (JIS K 0064) (aparāts izgatavots no stikla, visi izmēri milimetros).

Caurulē ar paraugu ievieto kapilāru (viršanas kapilāru), kas aizkausēts apmēram 1 cm attālumā no apakšējā gala. Pārbaudāmās vielas līmenim jābūt tādam, lai kapilāra aizkausētais posms atrastos zem šķidruma virsmas. Cauruli ar paraugu un viršanas kapilāru piestiprina pie termometra ar tievu gumiju vai šim nolūkam izmanto sānu stiprinājumu (skatīt 2. attēlu).
|
2. attēls Sivolobova metodes princips |
3. attēls Modificētās metodes princips |
|
|
|
Vannas šķidrumu izvēlas atkarībā no viršanas temperatūras. Temperatūrām līdz 573 K var izmantot silikoneļļu. Šķidro parafīnu var izmantot tikai temperatūrām līdz 473 K. Sākumā šķidrums vannā jāsilda ar ātrumu 3 K/min. Šķidrums vannā ir jāmaisa. Apmēram 10 K zemāk par sagaidāmo viršanas temperatūru sildīšanas intensitāti samazina tā, lai temperatūra paaugstinātos ne vairāk par 1 K/min. Tuvojoties viršanas temperatūrai, viršanas kapilārā sākas strauja burbuļu veidošanās.
Viršanas temperatūra ir temperatūra, kurā sākot dzesēšanu burbuļu veidošanās apstājas un kapilārā sākas strauja šķidruma līmeņa celšanās. Attiecīgais termometra rādījums atbilst vielas viršanas temperatūrai.
Pēc modificētās metodes (3. attēls) viršanas temperatūru nosaka, izmantojot kušanas temperatūras noteikšanai paredzēto kapilāru. To izstiepj, izveidojot apmēram 2 cm garu smailu galu (a), un tajā iesūc nelielu daudzumu parauga. Kapilāra vaļējo smailo galu aizkausē, atstājot pašā galā mazu gaisa burbuli. Sildot kušanas temperatūras noteikšanas aparātā (b), gaisa burbulis izplešas. Viršanas temperatūra atbilst temperatūrai, kurā viela sasniedz vannas šķidruma virsmu (c).
1.6.5. Fotometriska noteikšana
Kapilāru ar paraugu karsē, tam atrodoties sildāmā metāla blokā.
Caur attiecīgām atverēm blokā gaismas kūli caur vielu novada tālāk uz precīzi kalibrētu fotoelementu.
Paaugstinoties parauga temperatūrai, no viršanas kapilāra izdalās atsevišķi gaisa burbuļi. Sasniedzot viršanas temperatūru, ievērojami palielinās izdalījušos burbulīšu daudzums. Tas ietekmē gaismas intensitāti, ko reģistrē fotoelements, un mērierīce, kura nolasa platīna pretestības termometra temperatūru blokā, saņem stopsignālu.
Šī metode ir īpaši noderīga, jo tā ļauj veikt mērījumus, kad temperatūra ir zemāka par istabas temperatūru, līdz 253,15 K (–20 oC), nemainot pašu iekārtu. Aparāts tikai jāievieto vannā ar dzesēšanas šķidrumu.
1.6.6. Termiskā analīze
1.6.6.1. Diferenciālā termiskā analīze
Skatīt papildinājumu.
1.6.6.2. Diferenciālā skenēšanas kalorimetrija
Skatīt papildinājumu.
2. DATI
Ja novirzes no normālā atmosfēras spiediena ir nelielas (ne vairāk par ± 5 kPa), viršanas temperatūru standartizē līdz Tn pēc Sidneja-Janga vienādojuma:
Tn = T + (fT × Δp)
kur:
|
Δp |
= |
(101,325 – p) [ievērot zīmi], |
|
P |
= |
gaisa spiediena mērījums (kPa), |
|
fT |
= |
viršanas temperatūras izmaiņas atkarībā no temperatūras K/kPa, |
|
T |
= |
izmērītā viršanas temperatūra (K), |
|
Tn |
= |
viršanas temperatūra (K), kas koriģēta, ņemot vērā normālu atmosfēras spiedienu. |
Temperatūras korekcijas koeficienti f, j un aproksimēšanas vienādojumi daudzām vielām norādīti iepriekšminētajos starptautiskajos un valstu standartos.
Piemēram, standartā DIN 53171 aplūkotās metodes aprakstā minēti šādi korekcijas koeficienti krāsu šķīdinātājiem:
2. tabula
TEMPERATŪRAS KOREKCIJAS KOEFICIENTI fT
|
Temperatūra T (K) |
Korekcijas koeficients fT (K/kPa) |
|
323,15 |
0,26 |
|
348,15 |
0,28 |
|
373,15 |
0,31 |
|
398,15 |
0,33 |
|
423,15 |
0,35 |
|
448,15 |
0,37 |
|
473,15 |
0,39 |
|
498,15 |
0,41 |
|
523,15 |
0,44 |
|
548,15 |
0,45 |
|
573,15 |
0,47 |
3. PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— lietotā metode,
— vielas precīzs apraksts (identifikācija un tīrība), iepriekšēja attīrīšana, ja tiek veikta,
— precizitātes novērtējums.
Par viršanas temperatūru uzdod divu tādu mērījumu rezultātu vidējo vērtību, kuri ir novērtētās precizitātes (skatīt 1. tabulu) robežās.
Norāda spiedienu kPa, kādā mērīta viršanas temperatūra un noteikta tās vidējā vērtība. Spiedienam jābūt iespējami tuvu normālajam atmosfēras spiedienam.
Jāiekļauj jebkura informācija un piezīmes, kas attiecas uz rezultātu interpretāciju, jo īpaši par vielas piemaisījumiem un tās agregātstāvokli.
4. IZMANTOTĀ LITERATŪRA
(1) OECD, Paris, 1981, Test Guideline 103, Decision of the Council C (81) 30 final.
(2) IUPAC, B. Le Neindre, B. Vodar, editions. Experimental thermodynamics, Butterworths, London 1975, Vol. II.
(3) R. Weissberger edition: Technique of organic chemistry, Physical methods of organic chemistry, Third Edition, Interscience Publications, New York, 1959, Vol. I, Part I, Chapter VIII.
Papildinājums
Papildus tehniskie dati ir ietverti, piemēram, šādos standartos:
1. Ebulioskops
1.1. Kušanas temperatūras noteikšanas ierīces ar šķidruma vannu
|
ASTM D 1120-72 |
Standard test method for boiling point of engine anti-freezes |
2. Destilācijas metode (viršanas temperatūras intervāls)
|
ISO/R 918 |
Test Method for Distillation (Distillation Yield and Distillation Range) |
|
BS 4349/68 |
Method for determination of distillation of petroleum products |
|
BS 4591/71 |
Method for the determination of distillation characteristics |
|
DIN 53171 |
Losungsmittel fur Anstrichstoffe, Bestimmung des Siedeverlaufes |
|
NF T 20-608 |
Distillation:determination du rendement et de l'intervalle de distillation |
3. Diferenciālā thermiskā analīze un diferenciālā skenēšanas kalorimetrija
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
A.3. RELATĪVAIS BLĪVUMS
1. METODE
Aplūkotās metodes balstās uz ESAO Testēšanas norādījumiem (1). Pamatprincipi aprakstīti literatūras avotā (2).
1.1. IEVADS
Aprakstītās metodes relatīvā blīvuma noteikšanai ir derīgas cietām vielām un šķidrumiem neatkarīgi no tīrības pakāpes. Izmantojamās metodes ir uzskaitītas 1. tabulā.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Relatīvais blīvums vielām un šķidrumiem ir vielas tilpuma masas pie 20 oC un tāda paša tilpuma ūdens masas pie 4 oC attiecība. Relatīvais blīvums ir bezdimensiju lielums.
Vielas blīvums P ir tās masas m un tilpuma v attiecība.
Blīvuma p mērvienība SI sistēmā ir kg/m3.
1.3. STANDARTVIELAS (1) (3)
Pārbaudot jaunu vielu, ne visos gadījumos jāizmanto standartvielas. Tās galvenokārt izmanto metodes izpildījuma periodiskām pārbaudēm un dažādu metožu salīdzināšanai.
1.4. METOŽU PRINCIPS
Izmanto četru veidu metodes.
1.4.1. Flotācijas metodes
1.4.1.1. Areometrs (šķidrām vielām)
Pietiekami precīzi un ātri blīvumu var noteikt ar iegremdējamiem areometriem, pēc kuriem šķidruma blīvumu nolasa pēc areometra graduētās daļas skalas iegrimes.
1.4.1.2. Hidrostatiskie svari (šķidrumiem un cietām vielām)
Blīvuma noteikšanai var izmantot nosakāmās vielas masas starpību, kas noteikta gaisā un piemērotā šķidrumā (piemēram, ūdenī).
Cietām vielām blīvuma mērījumu rezultāti attiecināmi tikai uz vienu konkrētu paraugu. Šķidrumu blīvuma noteikšanai zināma tilpuma (v) ķermeni vispirms nosver gaisā un tad šķidrumā.
1.4.1.3. Iegremdētā ķermeņa metode (šķidrumiem) (4)
Ar šo metodi šķidruma blīvumu nosaka pēc svērumu starpības pirms un pēc zināma tilpuma ķermeņa iegremdēšanas šķidrumā, kura blīvums jānosaka.
1.4.2. Piknometriskās metodes
Cietām vielām un šķidrumiem var izmantot dažādas formas un zināma tilpuma piknometrus. Blīvumu aprēķina pēc pilna un tukša piknometra masas starpības, ņemot vērā tā tilpumu.
1.4.3. Piknometrs salīdzināšanai ar gaisu (cietām vielām)
Jebkuras formas cietvielas blīvumu istabas temperatūrā var noteikt ar gāzu salīdzināšanas piknometru. Vielas tilpumu mēra gaisā vai inertā gāzē, to ievietojot kalibrētā cilindrā ar mainīgu tilpumu. Lai aprēķinātu blīvumu, pēc tilpuma mērījumiem paraugs vienreiz jānosver.
1.4.4. Oscilāciju densimetrs (5) (6) (7)
Šķidrumu blīvumu var mērīt ar oscilāciju densimetru. U-veida caurules mehānisko oscilatoru iesvārsta ar oscilatora rezonanses frekvenci, kas ir atkarīga no tā masas. Tajā ievadot paraugu, mainās oscilatora rezonanses frekvence. Šo ierīci kalibrē, izmantojot divus šķidrumus ar zināmu blīvumu. Ieteicams izvēlēties tādas vielas, kuru blīvums aptver visu mērījumu diapazonu.
1.5. KVALITĀTES KRITĒRIJI
Tabulā ir apkopotas dažādas metodes, ko izmanto relatīvā blīvuma noteikšanai, norādot to izmantošanas iespējas.
1.6. METOŽU APRAKSTI
Piemēru veidā papildinājumā minētajos standartos atrodama papildu tehniskā informācija.
Noteikšana jāveic 20 oC temperatūrā, izdarot vismaz divus mērījumus.
2. IEGŪTIE DATI
Skatīt standartus.
3. PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— lietotā metode,
— vielas precīzs apraksts (identifikācija un tīrība), iepriekšēja attīrīšana, ja tiek veikta.
Relatīvais blīvums,
![]()
, jāuzdod saskaņā ar 1.2. punktu, norādot vielas agregātstāvokli.
Jāiekļauj visa informācija un piezīmes, kas attiecas uz rezultātu interpretāciju, jo īpaši par vielas piemaisījumiem un tās agregātstāvokli.
Tabula
Metožu lietojamība
|
Mērīšanas metode |
Blīvums |
Maksimāli iespējamā dinamiskā viskozitāte |
Standartmetode |
|
|
cietvielas |
šķidrumi |
|||
|
1.4.1.1. Areometrs |
jā |
5 Pa s |
ISO 387, ISO 649-2, NF T 20-050 |
|
|
1.4.1.2. Hidrostatiskie svari |
||||
|
a) cietām vielām |
jā |
ISO 1183 (A) |
||
|
b) šķidrumiem |
jā |
5 Pa s |
ISO 901 un 758 |
|
|
1.4.1.3. Iegremdētā ķermeņa metode |
jā |
20 Pa s |
DIN 53217 |
|
|
1.4.2. Piknometrs |
ISO 3507 |
|||
|
a) cietām vielām |
jā |
ISO 1183(B), NF T 20-053 |
||
|
b) šķidrumiem |
jā |
500 Pa s |
ISO 758 |
|
|
1.4.3. Piknometrs salīdzināšanai ar gaisu |
jā |
DIN 55990 Teil 3, DIN 53243 |
||
|
1.4.4. Oscilāciju densimetrs |
jā |
5 Pa s |
||
4. IZMANTOTĀ LITERATŪRA
(1) OECD, Paris, 1981, Test Guideline 109, Decision of the Council C(81) 30 final.
(2) R. Weissberger ed., Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Chapter IV, Interscience Publ., New York, 1959, Vol. I, Part 1.
(3) IUPAC, Recommended reference materials for realization of physico-chemical properties, Pure and applied chemistry, 1976, Vol. 48, p. 508.
(4) Wagenbreth, H., Die Tauchkugel zur Bestimmung der Dichte von Flüssigkeiten, Technisches Messen tm, 1979, Vol. II, 427–430.
(5) Leopold, H., Die digitale Messung von Flüssigkeiten, Elektronik, 1970, Vol. 19, p. 297–302.
(6) Baumgarten, D., Füllmengenkontrolle bei vorgepackten Erzeugnissen -Verfahren zur Dichtebestimmung bei flüssigen Produkten und ihre praktische Anwendung, Die Pharmazeutische Industrie, 1975, Vol. 37, p. 717–726.
(7) Riemann, J., Der Einsatz der digital en Dichtemessung im Brauereilaboratorium, Brauwissenschaft, 1976, Vol. 9, p. 253-255.
Papildinājums
Papildu tehniskie dati ir, piemēram, šādos standartos:
1. Flotācijas metodes
1.1. Areometrs
|
DIN 12790, ISO 387 |
Hydrometer; general instructions |
|
DIN 12791 |
Part I: Density hydrometers; construction, adjustment and use Part II: Density hydrometers; standardized sizes, designation Part III: Use and test |
|
ISO 649-2 |
Laboratory glassware: Density hydrometers for general purpose |
|
NF T 20-050 |
Chemical products for industrial use – Determination of density of liquids – Areometric method |
|
DIN 12793 |
Laboratory glassware: range find hydrometers |
1.2. Hidrostatiskie svari
|
ISO 1183 |
Method A: Methods for determining the density and relative density of plastics excluding cellular plastics |
|
NF T 20-049 |
Chemical products for industrial use – Determination of the density of solids other than powders and cellular products – Hydrostatic balance method |
|
ASTM-D-792 |
Specific gravity and density of plastics by displacement |
|
DIN 53479 |
Testing of plastics and elastomers; determination of density |
|
ISO 901 |
ISO 758 |
|
DIN 51757 |
Testing of mineral oils and related materials; determination of density |
|
ASTM D 941-55, ASTM D 1296-67 un ASTM D 1481-62 |
|
|
ASTM D 1298 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
|
BS 4714 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
1.3. Iegremdētā ķermeņa metode
|
DIN 53217 |
Testing of paints, varnishes and similar coating materials; determination of density; immersed body method |
2. Piknometra metodes
2.1. Šķidrumiem
|
ISO 3507 |
Pycnometers |
|
ISO 758 |
Liquid chemical products; determination of density at 20 oC |
|
DIN 12797 |
Gay-Lussac pycnometer (for non-volatile liquids which are not too viscous) |
|
DIN 12798 |
Lipkin pycnometer (for liquids with a kinematic viscosity of less than l00,10-6 m2 s-1 at 15 oC) |
|
DIN 12800 |
Sprengel pycnometer (for liquids as DIN 12798) |
|
DIN 12801 |
Reischauer pycnometer (for liquids with a kinematic viscosity of less than l00, 10-6 m2 s-1 at 20 oC, applicable in particular also to hydrocarbons and aqueous solutions as well as to liquids with higher vapour pressure, approximately 1 bar at 90 oC) |
|
DIN 12806 |
Hubbard pycnometer (for viscous liquids of all types which do not have too high a vapour pressure, in particular also for paints, varnishes and bitumen) |
|
DIN 12807 |
Bingham pycnometer (for liquids, as in DIN 12801) |
|
DIN 12808 |
Jaulmes pycnometer (in particular for ethanol – water mixture) |
|
DIN 12809 |
Pycnometer with ground-in thermometer and capillary side tube (for liquids which are not too viscous) |
|
DIN 53217 |
Testing of paints, varnishes and similar products; determination of density by pycnometer |
|
DIN 51757 |
Point 7: Testing of mineral oils and related materials; determination of density |
|
ASTM D 297 |
Section 15: Rubber products – chemical analysis |
|
ASTM D 2111 |
Method C: Halogenated organic compounds |
|
BS 4699 |
Method for determination of specific gravity and density of petroleum products (graduated bicapillary pycnometer method) |
|
BS 5903 |
Method for determination of relative density and density of petroleum products by the capillary – stoppered pycnometer method |
|
NF T 20-053 |
Chemical products for industrial use – Determination of density of solids in powder and liquids – Pyknometric method |
2.2. Cietām vielām
|
ISO 1183 |
Method B: Methods for determining the density and relative density of plastics excluding cellular plastics |
|
NF T 20-053 |
Chemical products for industrial use – Determination of density of solids in powder and liquids – Pyknometric method |
|
DIN 19683 |
Determination of the density of soils |
3. Piknometrs salīdzināšanai ar gaisu
|
DIN 55990 |
Part 3: Prüfung von Anstrichstoffen und ähnlichen Beschichrungsstoffen; Pulverlack; Bestimmung der Dichte |
|
DIN 53243 |
Anstrichstoffe; Chlorhaltige Polymere; Prüfung |
A.4. TVAIKA SPIEDIENS
1. METODE
Šī metode ir ekvivalenta OECD TG 104 (2004).
1.1. IEVADS
Šajā A.4. metodes (1) pārstrādātajā versijā papildus ir iekļauta efūzijas metode – izotermiskā termogravimetrija, kas paredzēta tvaika spiediena noteikšanai vielām, kurām tas ir ļoti zems (līdz pat 10–10 Pa). Ņemot vērā vajadzību pēc noteikšanas metodēm, īpaši, lai noteiktu tvaika spiedienu vielām, kurām tas ir zems, tiek atkārtoti izvērtēti citi šie metodes paņēmieni izmantošanai citos spiediena intervālos.
Termodinamiskā līdzsvara apstākļos tīras vielas tvaika spiediens ir atkarīgs tikai no temperatūras. Pamatprincipu aprakstu sk. (2)(3).
Nevienu mērīšanas paņēmienu nevar izmantot visā tvaika spiedienu intervālā no mazāk kā 10–10 līdz 105 Pa. Šajā metodikā ir iekļautas astoņas tvaika spiediena mērīšanas metodes, kuras var izmantot dažādos tvaika spiediena intervālos. Metožu salīdzinājums, ņemot vērā to pielietojumu un mērījumu intervālu, dots 1. tabulā. Šīs metodes var izmantot tikai testēšanas apstākļos stabilu vielu tvaika spiediena noteikšanai. Ja šīs eksperimentālās metodes tehnisku iemeslu dēļ izmantot nevar, tvaika spiedienu var noteikt pēc aprēķina metodes, un ieteicamā aprēķinu metode ir aprakstīta pielikumā.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Vielas tvaika spiediens tiek definēts kā piesātināta tvaika spiediens virs cietas vai šķidras vielas.
Jāizmanto SI sistēmas spiediena mērvienība, t. i., paskāls (Pa). Citas agrāk izmantotas mērvienības un sakarības starp tām ir šādas:
|
1 tors |
= |
1 mm Hg |
= |
1,333 × 102 Pa |
|
1 atm |
= |
1,013 × 105 Pa |
||
|
1 bar |
= |
105 Pa |
SI sistēmas temperatūras mērvienība ir kelvins (K). Temperatūru no Celsija skalas grādiem kelvinos pārrēķina pēc šādas formulas:
T = t + 273,15
kur T ir temperatūra kelvinos jeb termodinamiskā temperatūra un t ir temperatūra pēc Celsija.
1. tabula
|
Mērīšanas metode |
Vielas |
Novērtētā atkārtojamība |
Novērtētā reproducējamība |
Ieteicamais intervāls |
|
|
Cietas vielas |
Šķidras vielas |
||||
|
Dinamiskā metode |
ar zemu kušanas temp. |
Jā |
līdz 25 % no 1 līdz 5 % |
līdz 25 % no 1 līdz 5 % |
103 Pa līdz 2 × 103 Pa 2 × 103 Pa līdz 105 Pa |
|
Statiskā metode |
Jā |
Jā |
no 5 līdz 10 % |
no 5 līdz 10 % |
no 10 Pa līdz 105 Pa no 10–2 Pa līdz 105 Pa (1) |
|
Izoteniskopa metode |
Jā |
Jā |
no 5 līdz 10 % |
no 5 līdz 10 % |
no 102 Pa līdz 105 Pa |
|
Efūzijas metode: tvaika spiediena svari |
Jā |
Jā |
no 5 līdz 20 % |
līdz 50 % |
no 10–3 līdz 1 Pa |
|
Efūzijas metode: Knudsena šūna |
Jā |
Jā |
no 10 līdz 30 % |
— |
no 10–10 līdz 1 Pa |
|
Efūzijas metode: izotermiskā termogravimetrija |
Jā |
Jā |
no 5 līdz 30 % |
līdz 50 % |
no 10–10 līdz 1 Pa |
|
Gāzes piesātināšanas metode |
Jā |
Jā |
no 10 līdz 30 % |
līdz 50 % |
no 10–10 līdz 103 Pa |
|
Rotējošā rotora metode |
Jā |
Jā |
no 10 līdz 20 % |
— |
no 10–4 līdz 0,5 Pa |
|
(1) Izmantojot kapacitātes manometru |
|||||
1.3. METODES PRINCIPS
Kopumā tvaika spiedienu nosaka dažādās temperatūrās. Ierobežotā temperatūru intervālā tīras vielas tvaika spiediena logaritms ir apgriezti proporcionāls termodinamiskajai temperatūrai saskaņā ar vienkāršotu Klapeirona-Klauziusa vienādojumu.
![]()
kur:
|
p |
= |
tvaika spiediens (Pa) |
|
ΔHv |
= |
iztvaikošanas siltums J mol–1 |
|
R |
= |
gāzu universālā konstante 8,314 J mol–1 K–1 |
|
T |
= |
temperatūra K |
1.4. STANDARTVIELAS
Standartvielas nav nepieciešamas. Tās galvenokārt izmanto metodes veiktspējas periodiskām pārbaudēm un pēc dažādām metodēm iegūtu rezultātu salīdzināšanai.
1.5. METODES APRAKSTS
1.5.1. Dinamiskā metode (Kotrela metode)
1.5.1.1. Princips
Tvaika spiedienu nosaka, mērot vielas vārīšanās temperatūru pie dažādiem spiedieniem aptuveni no 103 līdz 105 Pa. Šo metodi ir ieteicams izmantot arī viršanas temperatūras noteikšanai. Šajā nolūkā metodi ieteicams izmantot līdz 600 K. Hidrostatiskā spiediena dēļ šķidrumu viršanas temperatūra 3 līdz 4 cm dziļumā ir par aptuveni 0,1 °C augstāka nekā uz virsmas. Kotrela metodē (4) termometru novieto tvaikos virs šķidruma virsmas, un virstošais šķidrums nepārtraukti apskalo termometra rezervuāru. Rezervuāru pārklāj plāns šķidruma slānis, kas ir līdzsvarā ar tvaiku pie atmosfēras spiediena. Tādējādi termometrs uzrāda faktisko viršanas temperatūru bez kļūdām, ko rada šķidruma pārkaršana vai hidrostatiskais spiediens. Sūknis, kuru pirmo reizi izmantojis Kotrels, ir parādīts 1. att. Mēģenē A atrodas virstošais šķidrums. Pamatnē iekausētā platīna stieple B veicina vienmērīgu viršanu. Sānu caurulīte C ir savienota ar dzesinātāju, un apvalks D aukstajam kondensātam neļauj nokļūt pie termometra E. Šķidrumam A virstot, piltuves uztvertie burbuļi un šķidrums pa diviem sūkņa F zariem apskalo termometra rezervuāru.
|
1. attēls |
2. attēls |
Kotrela sūknis (4)
A: Termopāris
B: Vakuuma bufertvertne
C: Manometrs
D: Vakuums
E: Mērīšanas punkts
F: Sildelements, apm. 150 W
1.5.1.2. Aparatūra
Ļoti precīzs aparāts, kas darbojas pēc Kotrela principa, parādīts 2. att. Tas sastāv no caurules ar viršanas sekciju apakšējā daļā, dzesinātāju vidusdaļā, kā arī izeju un uzmalu augšējā daļā. Kotrela sūkni ievieto viršanas sekcijā, ko silda ar elektrisko sildelementu. Temperatūru mēra, izmantojot termopāri apvalkā vai pretestības termometru, ko ievieto cauri uzmalai no augšas. Izeja savienota ar sistēmu spiediena regulēšanai. Tā sastāv no vakuumsūkņa, bufertvertnes, manostata spiediena regulēšanai, ievadot slāpekli, un manometra.
1.5.1.3. Procedūra
Vielu ievieto viršanas sekcijā. Problēmas var radīt cietas vielas, kas nav pulvera veidā, taču tās dažkārt var atrisināt ar dzesēšanas apvalka sildīšanu. Aparātu noslēdz pie uzmalas, un vielu atgāzo. Putojošām vielām šo metodi izmantot nevar.
Tad iestata zemāko nepieciešamo spiedienu un ieslēdz sildītāju. Tajā pašā laikā reģistrējošajai ierīcei pievieno temperatūras sensoru.
Līdzsvars tiek sasniegts, kad pastāvīgā spiedienā tiek reģistrēta nemainīga viršanas temperatūra. Īpaša uzmanība jāpievērš tam, lai novērstu pārkaršanu viršanas laikā. Bez tam dzesinātājā ir jāpanāk tvaiku pilnīga kondensācija. Nosakot tvaika spiedienu cietām vielām ar zemu kušanas temperatūru, jāraugās, lai tās nenosprostotu dzesinātāju.
Pēc līdzsvara punkta reģistrēšanas iestata augstāku spiedienu. Procesu šādi turpina, līdz tiek sasniegti 105 Pa (kopumā apmēram 5 līdz 10 mērījumu punkti). Pārbaudei līdzsvara punkti jāsasniedz, spiedienu pazeminot.
1.5.2. Statiskā metode
1.5.2.1. Princips
Statiskajā metodē (5) tvaika spiedienu termodinamiskā līdzsvara stāvoklī nosaka noteiktā temperatūrā. Šī metode piemērota tvaika spiediena noteikšanai vielām un daudzkomponentu maisījumiem, kas ir šķidras vai cietas vielas, intervālā no 10 līdz 105 Pa, un arī intervālā no 1 līdz 10 Pa ar nosacījumu, ka tiek veikti nepieciešamie pasākumi.
1.5.2.2. Aparatūra
Iekārta sastāv no vannas, kurā uztur pastāvīgu temperatūru (ar precizitāti ± 0,2 K), parauga konteinera, kas pievienots vakuuma līnijai, manometra un sistēmas spiediena regulēšanai. Parauga kamera (3a. attēls) ir pievienota vakuuma līnijai ar vārstu un diferenciālo manometru (U-veida caurulīti ar piemērotu manometra šķidrumu), ko izmanto par nulles indikatoru. Diferenciālajā manometrā atkarībā no spiedienu intervāla un testējamās vielas ķīmiskajām īpašībām var izmantot dzīvsudrabu, silikonus un ftalātus. Tomēr, rūpējoties par vidi, no dzīvsudraba izmantošanas būtu pēc iespējas jāizvairās. Testējamā viela nedrīkst ievērojami šķīst, kas ir U-veida caurulītē, vai ar to reaģēt. U-veida caurulītes vietā var izmantot manometru (3.b attēls). Manometrā dzīvsudrabu var izmantot intervālā no parastā atmosfēras spiediena līdz 102 Pa, bet silikona šķidrumi un ftalāti ir piemēroti spiedieniem, kas ir zemāki par 102 Pa līdz 10 Pa. Ir citi manometri, ko var izmantot, ja spiediens ir zemāks par 102 Pa, un sildāmās membrānas kapacitātes manometrus var izmantot pat tad, ja spiediens ir zemāks par 10–1 Pa. Temperatūru mēra uz trauka ārējās sienas, kurā atrodas paraugs, vai pašā traukā.
1.5.2.3. Procedūra
Izmantojot 3a. att. parādīto aparātu, uzpilda U-veida caurulīti ar izvēlēto šķidrumu, kas pirms mērījumiem paaugstinātā temperatūrā ir jāatbrīvo no gāzēm. Testējamo vielu ievieto aparātā un pazeminātā temperatūrā atbrīvo no gāzēm. Izmantojot daudzkomponentu paraugus, temperatūrai jābūt pietiekami zemai, lai nenotiktu materiāla sastāva izmaiņas. Līdzsvara iestāšanos paātrina ar maisīšanu. Paraugu var atdzesēt ar šķidro slāpekli vai sauso ledu, raugoties lai nenotiktu gaisa mitruma vai sūkņa šķidruma kondensācija. Virs parauga trauka atver vakuuma krānu un paraugu vairākas minūtes atgaiso ar vakuumu. Ja nepieciešams, atgaisošanu atkārto vairākas reizes.
|
3.a attēls |
3.b attēls |
Sildot paraugu, kad krāns ir aizvērts, pieaug tvaika spiediens. Tādēļ izmainās šķidruma līdzsvars U-veida caurulītē. Lai to kompensētu, aparātā ievada slāpekli vai gaisu, līdz diferenciālais spiediena indikators atkal atrodas nulles stāvoklī. Tam nepieciešamo spiedienu nolasa ar manometru vai precīzāku instrumentu. Šis spiediens atbilst vielas tvaika spiedienam mērījuma temperatūrā. Izmantojot 3.b att. parādīto aparātu, tvaika spiedienu nosaka ar tiešiem mērījumiem.
Tvaika spiedienu līdz nepieciešamajai maksimālajai temperatūrai nosaka piemērotos nelielos temperatūras intervālos (kopumā apmēram 5 līdz 10 mērījumu punkti).
Pārbaudei jāatkārto nolasījumi zemās temperatūrās. Ja atkārtotos mērījumos noteiktās temperatūras neatbilst līknei, kas iegūta, temperatūru pakāpeniski paaugstinot, tam var būt šādi iemesli:
i) paraugā vēl ir gaiss (piemēram, izteikti viskozu materiālu gadījumā) vai arī vielas ar zemu viršanas temperatūru, kas izdalās sildīšanas laikā;
ii) izmantotajā temperatūras intervālā vielā ar vielu notiek ķīmiska reakcija (piemēram, sadalīšanās, polimerizācija).
1.5.3. Izoteniskopa metode
1.5.3.1. Princips
Izoteniskopā (6) izmanto statiskās metodes principu. Pēc šīs metodes vielas paraugu pārnes rezervuārā, kuram uztur nemainīgu temperatūru un ir savienots ar manometru un vakuumsūkni. Piemaisījumi, kuru gaistamība ir lielāka nekā testējamajai vielai, tiek atdalīti ar degazāciju pazeminātā spiedienā. Parauga tvaika spiediens izvēlētajā temperatūrā tiek līdzsvarots ar inertas gāzes zināmu spiedienu. Izoteniskops tika izstrādāts, lai noteiktu atsevišķu šķidro ogļūdeņražu tvaika spiedienu, tas ir piemērots arī cietu vielu analīzei. Metode parasti nav piemērota daudzkomponentu sistēmām. Ja paraugs satur negaistošus piemaisījumus, rezultātu kļūda ir neliela. Ieteicamais noteikšanas intervāls ir no 102 līdz 105 Pa.
1.5.3.2. Aparatūra
Mērinstrumenta paraugs parādīts 4. att. Pilnīgāks metodes apraksts ir atrodams ASTM D 2879–86 (6).
1.5.3.3. Procedūra
Analizējot šķidrumu, pati viela kļūst par diferenciālā manometra šķidrumu. Izoteniskopā pārnes tik daudz šķidruma, lai piepildītu rezervuāru un manometra īso atzaru. Izoteniskopu pieslēdz vakuumam un atgaiso, tad piepilda ar slāpekli. Atbrīvošanu no gāzēm un attīrīšanu atkārto divas reizes, lai izdalītu atlikušo skābekli. Uzpildīto izoteniskopu novieto horizontāli tā, lai paraugs plānā slānī izklātu parauga rezervuāru un manometru. Sistēmā spiedienu samazina līdz 133 Pa, un paraugu uzmanīgi silda, līdz tas sāk vārīties (atbrīvošanai no izšķīdušajām gāzēm). Tad izoteniskopu novieto tā, lai paraugs ieplūstu atpakaļ rezervuārā un piepildītu manometra īso zaru. Uztur 133 Pa spiedienu. Parauga rezervuāra pagarināto galu ar nelielu liesmu silda, līdz sāk izdalīties un pietiekami izplešas testējamās vielas tvaiks, izspiežot daļu parauga no rezervuāra augšējās daļas manometra zarā, un izveidojas ar tvaiku pildīta telpa, kurā nav slāpekļa. Tad izoteniskopu novieto vannā, kurā uztur pastāvīgu temperatūru, un regulē slāpekļa spiedienu, līdz tas ir līdzsvarā ar testējamās vielas parauga tvaika spiedienu. Līdzsvara stāvoklī slāpekļa spiediens atbilst vielas tvaika spiedienam.

Cietām vielām atkarībā no spiediena un temperatūras intervāliem izmanto tādus manometra šķidrumus kā silikonus vai ftalātus. Degazēto manometra šķidrumu iepilda izcilnī uz izoteniskopa garā zara. Tad testējamo cieto vielu ievieto parauga rezervuārā un paaugstinātā temperatūrā degazē. Pēc tam izoteniskopu noliec tā, lai manometra šķidrums ieplūstu U-veida caurulītē.
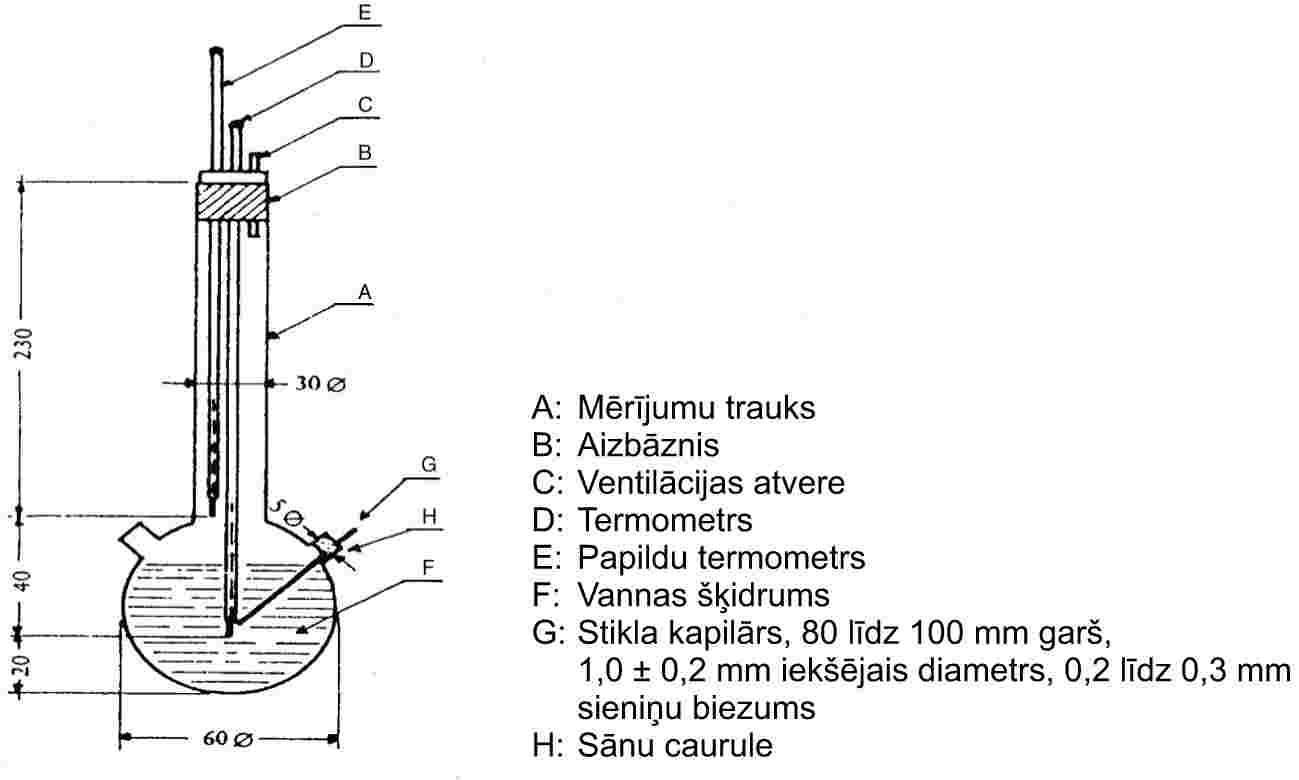
1.5.4. Efūzijas metode: tvaika spiediena svari (7)
1.5.4.1. Princips
Testējamās vielas paraugu karsē nelielā krāsnī, kas novietota zem kupola, no kura atsūknēts gaiss. Krāsnij ir vāks ar sīkiem noteikta diametra urbumiem. Vielas tvaiki, izplūstot pa vienu no urbumiem, tiek novirzīti uz ļoti jutīgu svaru kausu, kas arī atrodas zem kupola, no kura evakuēts gaiss. Dažās konstrukcijās svaru kausam, uz kura kondensējas izplūstošais tvaiks, ir dzesēšanas kamera, nodrošinot siltuma aizvadīšanu termiskās kondukcijas ceļā, un to atdzesē starojums. Tvaika strūklas enerģija darbojas kā spēks uz svariem. Tvaika spiedienu var aprēķināt divos veidos: tieši, ņemot vērā spēku, kas darbojas uz svaru kausu, un iztvaikošanas ātrumu, izmantojot Herca-Knudsena vienādojumu (2):

kur:
|
G |
= |
iztvaikošanas ātrums (kg s–1 m–2) |
|
M |
= |
molmasa (g mol–1) |
|
T |
= |
temperatūra (K) |
|
R |
= |
gāzu universālā konstante (J mol–1 K–1) |
|
p |
= |
tvaika spiediens (Pa) |
Ieteicamais noteikšanas intervāls ir no 10–3 līdz 1 Pa.
1.5.4.2. Aparatūra
Aparāta principiālo shēmu sk. 5. att.
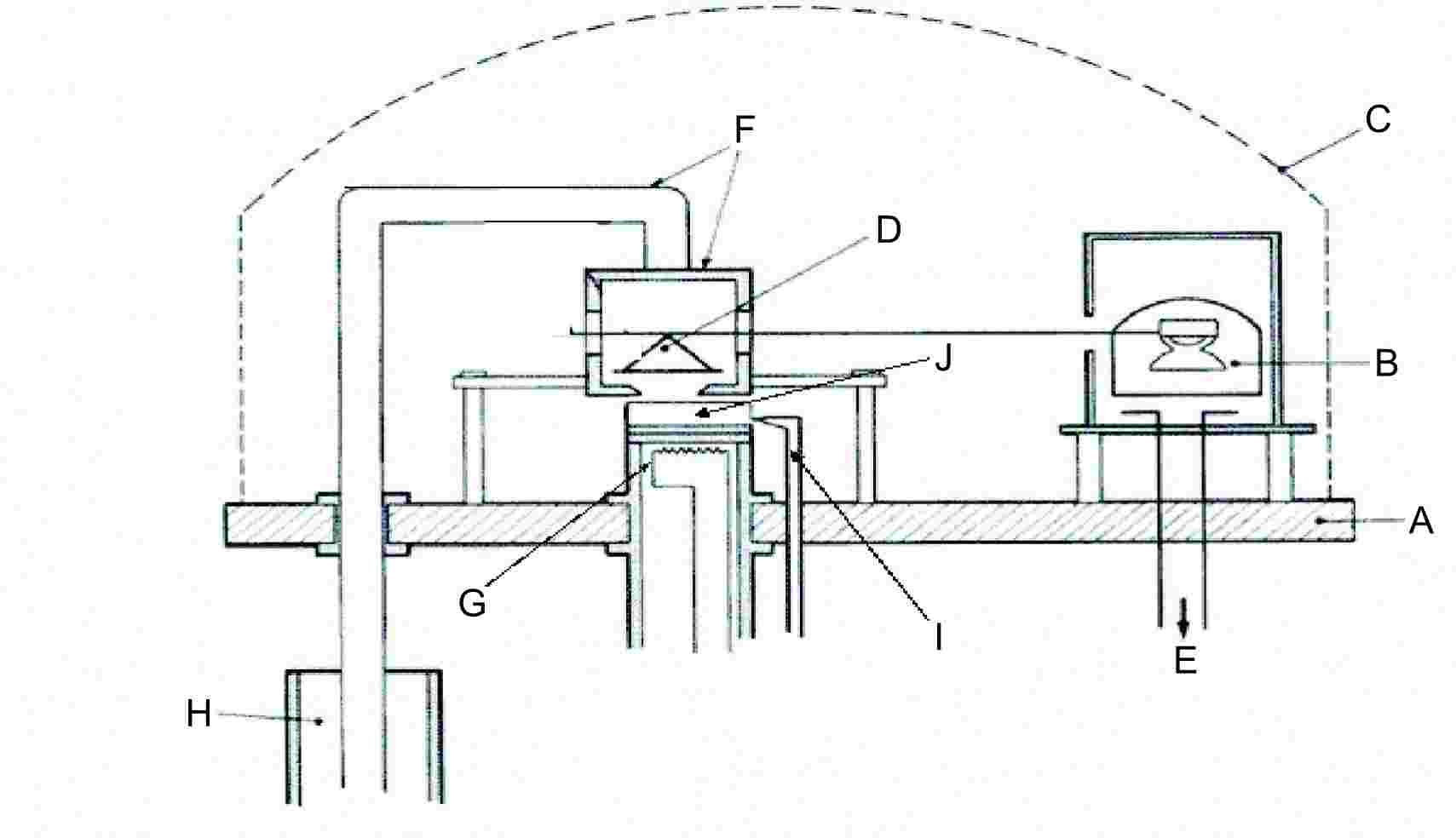
|
A: |
Pamata plāksne |
F: |
Dzesēšanas kamera un dzesēšanas stienis |
|
B: |
Mērinstruments ar kustīgu tinumu |
G: |
Iztvaicēšanas krāsns |
|
C: |
Kupols |
H: |
Djuāra trauks ar šķidro slāpekli |
|
D: |
Svari ar svaru kausu |
I: |
Parauga temperatūras mērīšana |
|
E: |
Vakuuma mērīšanas ierīce |
J: |
Testējamā viela |
1.5.5. Efūzijas metode: Knudsena šūna
1.5.5.1. Princips
Metodes pamatā ir testējamās vielas masas noteikšana, kas ultravakuuma apstākļos laika vienībā tvaika veidā pa mikroatveri izplūst no Knudsena šūnas (8). Izplūdušā tvaika masu var noteikt pēc šūnas masas zuduma, vai vielas tvaikus zemā temperatūrā kondensējot un ar hromatogrāfiju nosakot iztvaicētās vielas daudzumu. Tvaika spiedienu aprēķina pēc Herca-Knudsena vienādojuma (sk. 1.5.4.1.) un izmantojot no aparāta parametriem atkarīgus korekcijas koeficientus (9). Ieteicamais noteikšanas intervāls ir no 10–10 līdz 1 Pa (10)(11)(12)(13)(14).
1.5.5.2. Aparatūra
Aparāta principiālo shēmu sk. 6. att.

|
1: |
Savienojums ar vakuumu |
7: |
Vāks ar vītni |
|
2: |
Platīna pretestības termometra vai temperatūras regulēšanas ierīces ligzdas |
8: |
Spārnuzgrieznis |
|
3: |
Vakuumkameras vāks |
9: |
Skrūves |
|
4: |
Blīve |
10: |
Nerūsējošā tērauda efūzijas šūnas |
|
5: |
Alumīnija vakuumkamera |
11: |
Sildelements |
|
6: |
Mehānisms efūzijas šūnu ievietošanai un izņemšanai |
1.5.6. Efūzijas metode: izotermiskā termogravimetrija
1.5.6.1. Princips
Šīs metodes pamatā ir testējamās vielas palielināta iztvaikošanas ātruma noteikšana paaugstinātās temperatūrās pie atmosfēras spiediena, izmantojot termogravimetriju (10)(15)(16)(17)(18)(19)(20). Iztvaikošanas ātrumi vT tiek iegūti, uz testējamo vielu iedarbojoties ar lēnu inertas gāzes plūsmu un atbilstošos laika periodos nosakot masas zudumus izotermiskos apstākļos pie definētajām temperatūrām T (kelvinos). Tvaika spiedienus pT aprēķina no vT vērtībām, izmantojot lineāru sakarību starp tvaika spiediena logaritmu un iztvaikošanas ātruma logaritmu. Ja nepieciešams, izmantojot log pT regresiju atkarībā no 1/T, var veikt ekstrapolāciju 20 un 25 °C. Šī metode ir piemērota vielām, kuru tvaika spiediens ir pat 10–10 Pa (10–12 mbar) un tīrības pakāpe ir iespējami tuvu 100 %, lai izvairītos no kļūdām noteikto masas zudumu interpretācijā.
1.5.6.2. Aparatūra
Eksperimentālās iekārtas principiālā shēma 7. att.

Parauga nesējplāksnīti, kas piekārta mikrosvariem kamerā ar kontrolējamu temperatūru, izkustina sausa gāzveida slāpekļa plūsma, kas nes iztvaicētās testējamās vielas molekulas. Izplūstot no kameras, vielu sorbcijas iekārtā uztver no gāzes plūsmas.
1.5.6.3. Procedūra
Testējamo vielu homogēnā slānī uzklāj uz stikla plāksnītes ar nelīdzenu virsmu. Analizējot cietas vielas, plāksni vienmērīgi samitrina ar vielas šķīdumu piemērotā šķīdinātājā un žāvē inertā atmosfērā. Lai veiktu mērījumus, pārklāto plāksni piekar termogravimetriskajā analizatorā, un pēc tam masas zudumus mēra nepārtraukti kā laika funkciju.
Iztvaikošanas ātrumu vT noteiktā temperatūrā aprēķina, izmantojot parauga plāksnes masas zudumu Δm
![]()
kur F ir ar testējamo vielu pārklātās plāksnītes virsmas laukums, parasti parauga plāksnītes virsmas laukums, un t – laiks, kurā novēro masas zudumu Δm.
Tvaika spiedienu pT aprēķina kā funkciju no iztvaikošanas ātruma vT:
log pT = C + D log vT
kur C un D ir ar izmantoto eksperimentālo iekārtu saistītas konstantes, kas atkarīgas no mērījumu kameras diametra un gāzes plūsmas ātruma. Šīs konstantes jānosaka vienreiz, analizējot vairākus savienojumus ar zināmu tvaika spiedienu un aprēķinot log pT regresiju atkarībā no log vT (11)(21)(22).
Tvaika spiedienu pT atkarībā no temperatūras T (kelvinos) apraksta ar sakarību
log pT = A + B 1/T
kur A un B ir konstantes, ko nosaka, aprēķinot log pT regresiju pēc 1/T. Izmantojot šo vienādojumu, ar ekstrapolāciju var aprēķināt tvaika spiedienu jebkurā citā temperatūrā.
1.5.7. Gāzes piesātināšanas metode (23)
1.5.7.1. Princips
Pār testējamo vielu istabas temperatūrā laiž inertas gāzes plūsmu ar noteiktu ātrumu, kas ir pietiekami mazs, lai nodrošinātu gāzes piesātināšanos. Gāzes fāzes piesātinājumam ir būtiska nozīme. Pārnesto vielu uztver, parasti izmantojot sorbentu, un nosaka tās daudzumu. Kā alternatīvu tvaika sorbcijai un tai sekojošai vielas daudzuma noteikšanai var izmantot analītiskās metodes, kurās notiek vielas pārnese, piemēram, gāzu hromatogrāfiju, lai kvantitatīvi noteiktu pārnestās vielas daudzumu. Tvaika spiedienu aprēķina pieņemot, ka ir spēkā ideālas gāzes likums, un tāpēc gāzu maisījuma kopējais spiediens ir vienāds ar tās atsevišķo komponentu spiedienu summu. Testējamās vielas parciālo spiedienu, t. i., tvaika spiedienu, aprēķina, zinot gāzes kopējo tilpumu un tās pārnestās vielas masu.
Gāzes piesātināšanas metode ir izmantojama vielām šķidru un cietu vielu veidā. To var izmantot pat tik zema tvaika spiediena noteikšanai kā 10–10 Pa (10)(11)(12)(13)(14). Šī metode ir drošākā tvaika spiedieniem, kas ir zemāki par 103 Pa. Virs 103 Pa noteiktās tvaika spiediena vērtības parasti ir paaugstinātas, iespējams, aerosolu veidošanās dēļ. Tā kā tvaika spiedienu mēra istabas temperatūrā, nav nepieciešams ekstrapolēt paaugstinātās temperatūrās iegūtus datus, kas bieži rada nopietnas kļūdas.
1.5.7.2. Aparatūra
Jāizmanto kamera, kurā uztur pastāvīgu temperatūru. Shēmā 8. att. parādīta kamera ar trijiem cietu vielu un trijiem šķidru vielu paraugu turētājiem, kas dod iespējas veikt cietas vai šķidras vielas parauga analīzi trijos atkārtojumos. Temperatūru uztur ar precizitāti vismaz ± 0,5 °C vai ar augstāku precizitāti.

Parasti par inertu nesējgāzi izmanto slāpekli, taču atsevišķos gadījumos var būt nepieciešama cita gāze (24). Nesējgāzei jābūt sausai. Gāzes plūsmu, ko regulē ar adatvārstiem (apm. 0,79 mm atvere), sadala 6 daļās un pa vara caurulīti ar iekšējo diametru 3,8 mm ievada kamerā. Pēc temperatūras līdzsvarošanas gāze plūst cauri paraugam, uztvērējam ar sorbentu un izplūst ārā no kameras.
Cietās vielas paraugu ievieto stikla caurulītē ar iekšējo diametru 5 mm, un tās abus galus noslēdz ar stikla vates aizbāžņiem (sk. 9. att.). Šķidru vielu paraugu turētājs un sorbcijas sistēma parādīta 10. att. Labāk reproducējamus šķidrumu tvaika spiediena mērījumu rezultātus iegūst, ja turētāju piepilda ar stikla lodītēm vai inertu sorbentu, piemēram, silīcija dioksīdu, uz kuru virsmas uznesta šķidra viela. Otra iespēja ir nesējgāzi laist cauri rupjam fritam un barbotēt caur testējamo vielu, kas ir šķidruma veidā.
|
9. attēls |
10. attēls |
Sorbcijas sistēmā ir plūsmai pretējā un aizmugurējā sorbenta daļa. Pie ļoti zema tvaika spiediena sorbents vielu aiztur tikai nelielā daudzumā, un par nopietnu problēmu var kļūt adsorbcija uz stikla vates un stikla caurulītes sieniņām posmā starp paraugu un sorbentu.
Cits efektīvs iztvaicētās vielas uztveršanas paņēmiens ar izmantot uztvērēju, ko dzesē ar cietu CO2. Tas nerada pretspiedienu uz piesātināšanas kolonnas, un uztvertā viela ir kvantitatīvi vienkārši pārnesama.
1.5.7.3. Procedūra
Nesējgāzes plūsmas ātrumu mēra istabas temperatūrā. Plūsmas ātrumu eksperimenta laikā kontrolē pietiekami bieži, lai nodrošinātu, ka nesējgāzes tilpums tiek noteikts precīzi. Ieteicams veikt nepārtrauktus masas plūsmas mērījumus. Gāzes fāzes piesātināšanai var būt vajadzīgs visai ilgs kontakta laiks, un tāpēc pavisam neliels gāzes plūsmas ātrums (25).
Eksperimenta beigās priekšējo un aizmugurējo sorbenta daļu analizē atsevišķi. Vielu no katras sorbenta daļas atsevišķi desorbē ar šķīdinātāju. Iegūtajos šķīdumos kvantitatīvi nosaka no abām sorbenta daļām desorbētās vielas masu. Analītiskās metodes izvēle (arī sorbenta un desorbcijas šķīdinātāja izvēle) ir atkarīga no testējamās vielas īpašībām. Desorbcijas efektivitāti novērtē, noteikta lieluma paraugu pārnesot uz sorbenta, desorbējot un nosakot atgūstamību. Desorbcijas efektivitāte jāpārbauda, izmantojot parauga koncentrāciju testēšanas apstākļos, vai tai iespējami līdzīgu koncentrāciju.
Lai pārliecinātos par nesējgāzes piesātināšanos ar testējamo vielu, noteikšanu veic pie trijiem atšķirīgiem gāzes plūsmas ātrumiem. Ja aprēķinātais tvaika spiediens nav atkarīgs no plūsmas ātruma, gāzi uzskata par piesātinātu.
Tvaika spiedienu aprēķina pēc šāda vienādojuma:
![]()
kur:
|
p |
= |
tvaika spiediens (Pa) |
|
W |
= |
iztvaikojušās testējamās vielas masa (g) |
|
V |
= |
piesātinātas gāzes tilpums (m3) |
|
R |
= |
gāzu universālā konstante 8,314 (J mol–1 K–1) |
|
T |
= |
temperatūra (K) |
|
M |
= |
testējamās vielas molmasa (g mol–1) |
Jāveic izmērītā tilpuma korekcija, ņemot vērā spiediena un temperatūras atšķirības plūsmas mērīšanas ierīcē un piesātināšanas kamerā.
1.5.8. Rotējošā rotora metode
1.5.8.1. Princips
Šajā metodē izmanto rotējošā rotora viskozimetru, kurā mērelements ir magnētiskajā laukā piekārta neliela izmēra tērauda lodīte, kas griežas rotējošā laukā (26)(27)(28). Uztveršanas spoles ļauj noteikt rotācijas ātrumu. Kad lodīte ir sasniegusi noteikto rotācijas ātrumu, parasti apmēram 400 apgr./s, aktivāciju pārtrauc, un ātrums sāk palēnināties gāzes radītās berzes dēļ. Rotācijas ātruma samazināšanos mēra kā laika funkciju. Tvaika spiedienu nosaka pēc tērauda lodītes palēninājuma, kas atkarīgs no spiediena. Ieteicamais noteikšanas intervāls ir no 10–4 līdz 0,5 Pa.
1.5.8.2. Aparatūra
Eksperimentālās iekārtas shematisks zīmējums parādīts 11. att. Mērelements ir apvalkā ar pastāvīgu temperatūru, ko regulē ar 0,1 °C precizitāti. Parauga konteineru ievieto atsevišķā apvalkā, kurā arī regulē temperatūru ar 0,1 °C precizitāti. Visās pārējās iekārtas daļās tiek uzturēta augstāka temperatūra, lai novērstu kondensāciju. Visa aparatūra ir pievienota sistēmai, kas tajā rada dziļu vakuumu.

2. REZULTĀTI UN PĀRSKATS
2.1. REZULTĀTI
Tvaika spiediens, izmantojot jebkuru no minētajām metodēm, jānosaka vismaz divās temperatūrās. Ieteicams izmantot trīs vai vairāk temperatūras intervālā no 0 līdz 50 °C, lai pārbaudītu tvaika spiediena līknes linearitāti. Izmantojot efūzijas metodi (Knudsena šūnu, izotermisko termogravimetriju) un gāzes piesātināšanas metodi, ieteicamais noteikšanas temperatūru intervāls ir nevis 0 līdz 50 °C, bet gan 120 līdz 150 °C.
2.2. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jāiekļauj šāda informācija:
— izmantotā metode,
— vielas precīzs apraksts (identitāte un piemaisījumi) un attīrīšanas paņēmieni, ja to veic,
— vismaz divas tvaika spiediena un temperatūras vērtības – un ieteicams trīs vai vairāk – intervālā no 0 līdz 50 °C (vai 120 līdz 150 °C),
— vismaz vienai temperatūrai ir jābūt 25 °C vai par to zemākai, ja tas ir iespējams saskaņā ar izvēlēto metodi,
— visi izejas dati,
— log p pret 1/T līkne,
— aprēķinātais tvaika spiediens 20 vai 25 °C temperatūrā.
Ja novērojamas testējamās vielas pārvērtības (agregātstāvokļa maiņa, sadalīšanās), jānorāda šāda informācija:
— pārvērtības veids;
— temperatūra, kurā pārvērtība notiek pie atmosfēras spiediena;
— tvaika spiediens 10 un 20 °C zem izmaiņu temperatūras un 10 un 20 °C virs šīs temperatūras (izņemot, ja ir pāreja no cieta agregātstāvokļa gāzveida stāvoklī).
Jānorāda visa rezultātu interpretācijai nepieciešamā informācija, īpaši ziņas par piemaisījumiem un vielas fizikālo stāvokli.
3. LITERATŪRA
(1) Eiropas Kopienu Oficiālais Vēstnesis L 383 A, 26–47 (1992).
(2) Ambrose, D. (1975). Experimental Thermodynamics, Vol. II, Le Neindre, B., and Vodar, B., Eds., Butterworths, London.
(3) Weissberger R., ed. (1959). Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Vol. I, Part I. Chapter IX, Interscience Publ., New York.
(4) Glasstone, S. (1946). Textbook of Physical Chemistry, 2nd ed., Van Nostrand Company, New York.
(5) NF T 20–048 AFNOR (September 1985). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within a range from 10–1 to 105 Pa – Static method.
(6) ASTM D 2879–86, Standard test method for vapour pressure – temperature relationship and initial decomposition temperature of liquids by isoteniscope.
(7) NF T 20–047 AFNOR (September 1985). Chemical products for industrial use –Determination of vapour pressure of solids and liquids within range from 10–3 to 1 Pa – Vapour pressure balance method.
(8) Knudsen, M. (1909). Ann. Phys. Lpz., 29, 1979; (1911), 34, 593.
(9) Ambrose, D., Lawrenson, I.J., Sprake, C.H.S. (1975). J. Chem. Thermodynamics 7, 1173.
(10) Schmuckler, M.E., Barefoot, A.C., Kleier, D.A., Cobranchi, D.P. (2000), Vapor pressures of sulfonylurea herbicides; Pest Management Science 56, 521–532.
(11) Tomlin, C.D.S. (ed.), The Pesticide Manual, Twelfth Edition (2000)
(12) Friedrich, K., Stammbach, K., Gas chromatographic determination of small vapour pressures determination of the vapour pressures of some triazine herbicides. J. Chromatog. 16 (1964), 22–28
(13) Grayson, B.T., Fosbraey, L.A., Pesticide Science 16 (1982), 269–278.
(14) Rordorf, B.F., Prediction of vapor pressures, boiling points and enthalpies of fusion for twenty-nine halogenated dibenzo-p-dioxins, Thermochimia Acta 112 Issue 1 (1987), 117–122.
(15) Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection; Pesticide Science 4 (1973) 137–147.
(16) Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection II. Application to Formulated Products; Pesticide Science 5 (1974) 393–400.
(17) Gückel, W., Kaestel, R., Lewerenz, J., Synnatschke, G., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection. Part III: The Temperature Relationship between Vapour Pressure and Evaporation Rate; Pesticide Science 13 (1982) 161–168.
(18) Gückel, W., Kaestel, R., Kroehl, T., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part IV: An Improved Thermogravimetric Determination Based on Evaporation Rate; Pesticide Science 45 (1995) 27–31.
(19) Kroehl, T., Kaestel, R., Koenig, W., Ziegler, H., Koehle, H., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part V: Thermogravimetry Combined with Solid Phase MicroExtraction (SPME); Pesticide Science, 53 (1998) 300–310.
(20) Tesconi, M., Yalkowsky, S.H., A Novel Thermogravimetric Method for Estimating the Saturated Vapor Pressure of Low-Volatility Compounds; Journal of Pharmaceutical Science 87(12) (1998) 1512–20.
(21) Lide, D.R. (ed.), CRC Handbook of Chemistry and Physics, 81th ed.(2000), Vapour Pressure in the Range – 25 °C to 150 °C.
(22) Meister, R.T. (ed.), Farm Chemicals Handbook, Vol. 88 (2002)
(23) 40 CFR, 796. (1993). pp 148–153, Office of the Federal Register, Washington DC
(24) Rordorf B.F. (1985). Thermochimica Acta 85, 435.
(25) Westcott et al. (1981). Environ. Sci. Technol. 15, 1375.
(26) Messer G., Röhl, P., Grosse G., and Jitschin W. (1987). J. Vac. Sci. Technol. (A), 5(4), 2440.
(27) Comsa G., Fremerey J.K., and Lindenau, B. (1980). J. Vac. Sci. Technol. 17(2), 642.
(28) Fremerey, J.K. (1985). J. Vac. Sci. Technol. (A), 3(3), 1715.
Papildinājums
Aprēķina metode
IEVADS
Pēc aprēķina metodes noteiktās tvaika spiediena vērtības var izmantot:
— lai izvēlētos piemērotākās eksperimentālās metodes;
— aptuvenas vērtības vai robežvērtības noteikšanai gadījumos, kad eksperimentālā metode nav izmantojama tehnisku iemeslu dēļ.
APRĒĶINA METODE
Šķidru un cietu vielu tvaika spiedienu var aprēķināt, izmantojot modificētu Vatsona korelāciju (a). Eksperimentāli jānosaka tikai viršanas punkts normālos apstākļos. Šī metode ir piemērota tvaika spiediena aprēķināšanai, kas ir intervālā no 105 Pa līdz 10–5 Pa.
Detalizēta informācija par metodi ir sniegta “Handbook of Chemical Property Estimation Methods” (b). Sk. arī OECD Environmental Monograph No 67 (c).
APRĒĶINĀŠANA
Tvaika spiedienu aprēķina pēc formulas:

kur:
|
T |
= |
temperatūra, kurai aprēķina tvaiku spiedienu |
|
Tb |
= |
viršanas punkts normālos apstākļos |
|
Pvp |
= |
tvaika spiediens temperatūrā T |
|
ΔHvb |
= |
iztvaikošanas siltums |
|
ΔZb |
= |
saspiežamības faktors (novērtēts kā 0,97) |
|
m |
= |
empīrisks koeficients, kas atkarīgs no vielas fizikālā stāvokļa attiecīgajā temperatūrā |
Turklāt
![]()
kur KF ir empīrisks koeficients, kas ir atkarīgs no vielas polaritātes. Vairākiem savienojumu tipiem KF koeficienti norādīti literatūras avotā (b).
Bieži ir pieejami dati par viršanas punktu pazeminātā spiedienā. Šajā gadījumā tvaika spiedienu aprēķina:

kur T1 ir viršanas punkts pazeminātā spiedienā P1.
PĀRSKATS
Izmantojot aprēķina metodi, pārskatā pilnībā jādokumentē viss aprēķins.
LITERATŪRA
(a) Watson, K. M. (1943). Ind. Eng. Chem, 35, 398.
(b) Lyman, W.J., Reehl, W.F., Rosenblatt, D. H. (1982). Handbook of Chemical Property Estimation Methods, McGraw-Hill.
(c) OECD Environmental Monograph No.67. Application of Structure-Activity Relationships to the Estimation of Properties Important in Exposure Assessment (1993).
A.5. VIRSMAS SPRAIGUMS
1. METODE
Aprakstīto metožu pamatā ir ESAO Testēšanas norādījumi (1). Pamatprincipi aprakstīti literatūras avotā (2).
1.1. IEVADS
Aplūkotās metodes paredzētas ūdens šķīdumu virsmas spraiguma mērīšanai.
Pirms šo pārbaužu veikšanas ir lietderīgi jau iepriekš ievākt datus par pārbaudāmās vielas šķīdību ūdenī, tās uzbūvi, hidrolīzes īpašībām un micellu veidošanās robežkoncentrāciju.
Šeit aprakstītās metodes ir izmantojamas gandrīz visām ķīmiskajām vielām neatkarīgi no to tīrības.
Ar gredzenveida tenzometru var noteikt virsmas spraigumu tikai tādiem ūdens šķīdumiem, kuru dinamiskā viskozitāte ir zemāka par 200 mPa s.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Virsmas spraigums ir virsmas brīvā entalpija uz virsmas laukuma vienību.
Virsmas spraigumam ir šādas mērvienības:
N/m (SI mērvienība) vai
mN/m (SI apakšmērvienība),
1 N/m = 103 dini/cm,
1 mN/m = 1 dins/cm novecojušajā cgs mērvienību sistēmā.
1.3. STANDARTVIELAS
Pārbaudot jaunu vielu, ne visos gadījumos jāizmanto standartvielas. Tās galvenokārt izmanto metodes izpildījuma periodiskām pārbaudēm un dažādu metožu salīdzināšanai.
Standartvielas, kuru virsmas spraigums aptver plašu diapazonu, ir uzskaitītas izmantotās literatūras sarakstā (1) (3).
1.4. METOŽU PRINCIPS
Ar šīm metodēm nosaka maksimālo spēku, kas vertikāli jāpieliek cilpai vai gredzenam, kurš ir saskarē ar pārbaudāmā šķidruma virsmu mērtraukā, lai to atrautu no šīs virsmas, vai spēku, kas jāpieliek plātnei, kuras mala pieskaras šķidruma virsmai, lai pievilktu izveidojušos virsmas slāni.
Vielas, kuras ir šķīstošas ūdenī koncentrācijā vismaz līdz 1 mg/l, testē ūdens šķīdumā vienā koncentrācijā.
1.5. KVALITĀTES KRITĒRIJI
Šīm metodēm ir augstāka precizitāte par vides novērtējumam vajadzīgo.
1.6. METOŽU APRAKSTI
Vielu izšķīdina destilētā ūdenī. Šķīduma koncentrācijai jābūt 90 % no vielas piesātināta šķīduma koncentrācijas; ja šī koncentrācija ir lielāka par 1 g/l, noteikšanu veic šķīdumam ar koncentrāciju 1 g/l. Virsmas spraigums nav jānosaka vielām, kuru šķīdība ir mazāka par 1 mg/l.
1.6.1. Plātnes metode
Skatīt ISO 304 un NF T 73-060 (Virsmaktīvās vielas – virsmas spraiguma noteikšana, izmantojot šķidrumu plēvītes).
1.6.2. Cilpas metode
Skatīt ISO 304 un NF T 73-060 (Virsmaktīvās vielas – virsmas spraiguma noteikšana, izmantojot šķidrumu plēvītes).
1.6.3. Gredzena metode
Skatīt ISO 304 un NF T 73-060 (Virsmaktīvās vielas – virsmas spraiguma noteikšana, izmantojot šķidrumu plēvītes).
1.6.4. ESAO gredzena metode
1.6.4.1. Aprīkojums
Šo mērījumu veikšanai der pārdošanā esošie tenzometri. Šīs ierīces sastāv no šādiem mezgliem:
— grozāma parauga plate,
— dinamometrs,
— mērierīce (gredzens),
— mērtrauks.
1.6.4.1.1.
Grozāmo plati izmanto kā paliktni termostatējamam mērtraukam, kurā iepilda pārbaudāmo šķidrumu. Tas ir piestiprināts pie statīva kopā ar dinamometru.
1.6.4.1.2.
Dinamometrs (skatīt attēlu) atrodas virs parauga plates. Spēka mērījumu kļūda nedrīkst būt lielāka par ± 10-6 N, kas atbilst masas mērījumu kļūdai ± 0,1 mg. Pārdošanā esošo tenzometru mērījumu skala lielākoties kalibrēta mN/m mērvienībās, kas ļauj nolasīt virsmas spraiguma rādījumus tieši mN/m ar 0,1 mN/m precizitāti.
1.6.4.1.3.
Gredzenu parasti izgatavo no platīna-indija sakausējuma 0,4 mm stieples, un tā vidējais apkārtmērs ir 60 mm. Stieple parasti ir pacelta horizontālā virzienā no metāla tapas un stieples turētāja, lai izveidotu savienojumu ar dinamometru (skatīt attēlu).
(Visi izmēri norādīti milimetros)
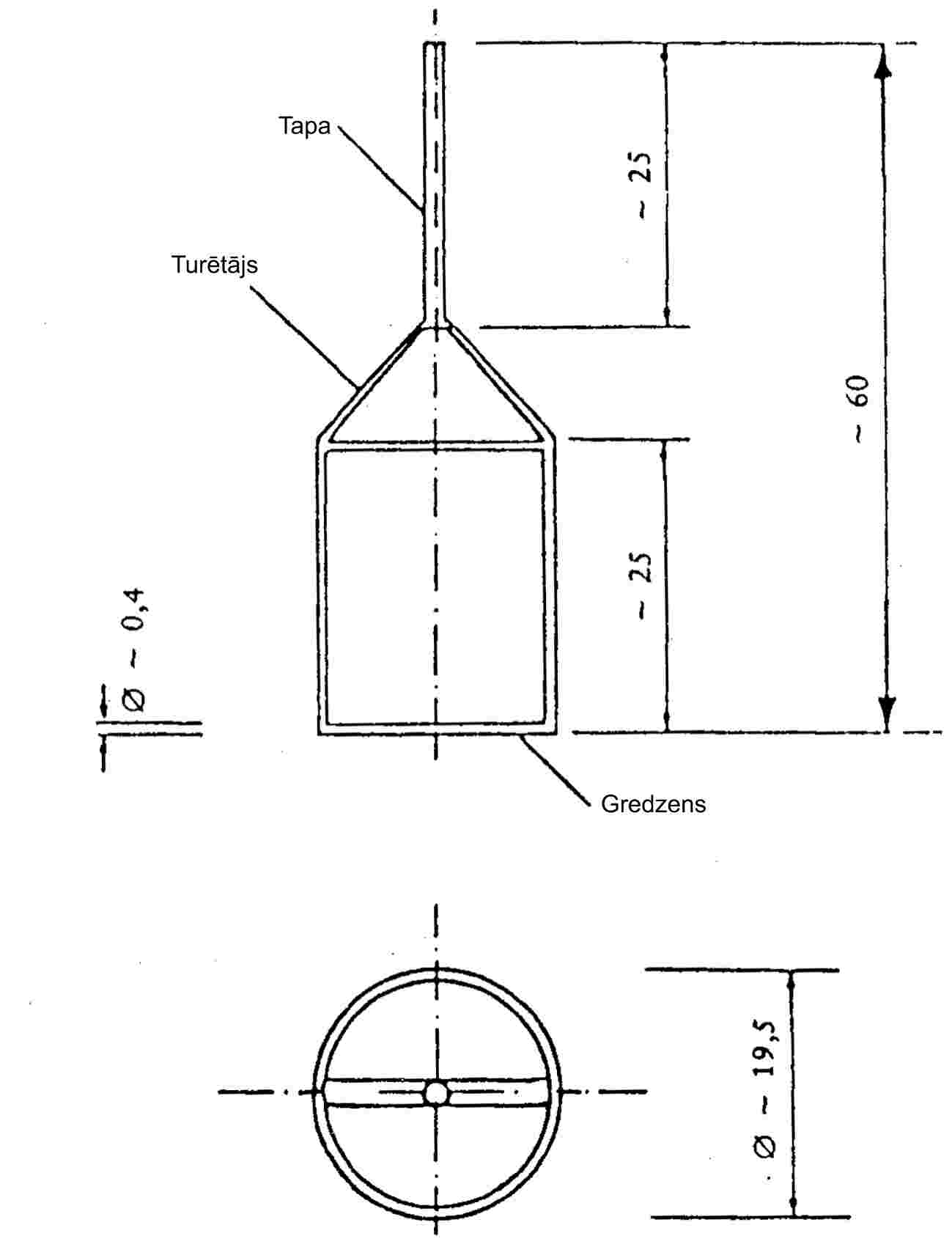
1.6.4.1.4.
Mērtraukam, kurā ir pārbaudāmais šķīdums, jābūt izgatavotam no stikla, un tam jābūt termostatējamam. Mērījumu laikā tā konstrukcijai jānodrošina nemainīga temperatūra pārbaudāmā šķīduma šķidrajā fāzē un gāzes fāzē (virs tās) un jānovērš parauga iztvaikošana. Šim nolūkam der stikla cilindri ar iekšējo diametru ne mazāku par 45 mm.
1.6.4.2. Iekārtas sagatavošana
1.6.4.2.1.
Rūpīgi jāgādā par stikla trauku tīrību. Vajadzības gadījumā tos mazgā ar bihromāta šķīdumu un pēc tam ar sīrupveidīgu fosforskābi (83–98 masas % H3PO4), tad rūpīgi skalo ūdensvada ūdenī un visbeidzot skalo ar bidestilātu, kamēr iegūst neitrālu reakciju, un tad traukus žāvē vai skalo ar pārbaudāmo šķidrumu.
Gredzenu vispirms rūpīgi skalo ūdenī, lai atbrīvotos no ūdenī šķīstošām vielām, tad uz īsu brīdi to iegremdē bihromāta šķīdumā, skalo bidestilātā, kamēr iegūst neitrālu reakciju, un visbeidzot īslaicīgi karsē virs degoša metanola liesmas.
Piezīme
No tādiem piemaisījumiem, kas nešķīst un nesadalās bihromāta šķīdumā vai fosforskābē, piemēram, no silikoniem, atbrīvojas, izmantojot piemērotu organisku šķīdinātāju.
1.6.4.2.2.
Iekārtu sagatavojot mērīšanai, pārbauda nulles punktu un to noregulē tā, lai instrumenta rādījumi ļautu iegūt ticamus virsmas spraiguma mērījumu rezultātus mN/m.
Iekārtu novieto horizontāli uz tenzometra pamatnes, piemēram, izmantojot līmeņrādi un regulējot līmeņotājskrūves pamatnē.
Pēc gredzena uzstādīšanas un pirms tā iegremdēšanas šķidrumā tenzometram iestata nulles punktu un pārliecinās, ka gredzena plakne ir paralēla šķidruma virsmai. Šim nolūkam šķidruma virsmu var izmantot kā spoguli.
Iekārtas kalibrēšanu var veikt divējādi:
a) ar atsvariem: izmantojot uz gredzena novietotus atsvaru jātnieciņus ar masu no 0,1 g līdz 1,0 g. Kalibrēšanas koeficientu Φa, ar kuru jāreizina visi instrumenta rādījumi, aprēķina pēc vienādojuma (1):
|
|
(1) |
kur:
![]()
|
m |
= |
svaru jātnieciņa masa (g), |
|
g |
= |
brīvās krišanas paātrinājums (981 cm s-2 jūras līmenī), |
|
b |
= |
gredzena vidējais apkārtmērs (cm), |
|
σa |
= |
tenzometra rādījums pēc jātnieciņa novietošanas uz gredzena (mN/m); |
b) ar ūdeni: izmantojot tīru ūdeni, kura virsmas spraigums, piemēram, 23 oC temperatūrā, ir 72,3 mN/m. Šī procedūra ir vienkāršāka un ātrāka nekā kalibrēšana ar atsvariem, tomēr vienmēr pastāv iespēja, ka ūdens virsmas spraigums mainījies neliela virsmaktīvo vielu izraisīta piesārņojuma dēļ.
Kalibrēšanas koeficientu Φb, ar kuru jāreizina visi instrumenta rādījumi, aprēķina pēc vienādojuma (2):
|
|
(2) |
kur:
|
σo |
= |
ūdens virsmas spraiguma vērtība pēc literatūras avotu datiem (mN/m), |
|
σg |
= |
ūdens virsmas spraiguma izmērītā vērtība (mN/m), tajā pašā temperatūrā. |
1.6.4.3. Paraugu sagatavošana
Analizējamās vielas izšķīdina ūdenī vajadzīgajā koncentrācijā, turklāt šķīdumā nedrīkst būt neizšķīdušas vielas daļiņas.
Šķīdumi jāuzglabā nemainīgā (± 0,5oC) temperatūrā. Tā kā šķīduma virsmas spraigums mērtraukā mainās laika gaitā, jāveic vairāki mērījumi dažādā laikā un grafiski jāattēlo līkne, kas raksturo virsmas spraiguma izmaiņas laika ritumā. Ja izmaiņas vairs nenotiek, tad ir sasniegts līdzsvara stāvoklis.
Putekļi vai gāzveida vielu piemaisījumi ietekmē mērījumu rezultātus. Tāpēc mērījumi jāveic zem aizsargkupola.
1.6.5. Testēšanas apstākļi
Mērījumus veic aptuveni 20 oC temperatūrā, tās svārstības nedrīkst pārsniegt ± 0,5oC.
1.6.6. Testēšana
Šķīdumu, kura virsmas spraigums jānosaka, pārnes rūpīgi izmazgātā mērtraukā, raugoties, lai tas neputotos, un pēc tam mērtrauku novieto uz mēraparāta galdiņa. Galdiņu ar mērtrauku paceļ, līdz gredzens iegrimst zem šķidruma, kura virsmas spraigums jānosaka. Tad plates virsu pakāpeniski un vienmērīgi nolaiž (ar ātrumu ap 0,5 cm/min), mēģinot atraut gredzenu no šķīduma virsmas, līdz sasniegts maksimālais spēks. Šķidruma slāni, kas saskaras ar gredzenu, nedrīkst atraut no gredzena. Pabeidzot mērījumu, gredzenu atkal iegremdē šķidrumā un atkārto mērījumus, kamēr iegūst nemainīgu virsmas spraiguma lielumu. Katram mērījumam jāatzīmē kopš šķīduma pārnešanas mērtraukā pagājušais laiks. Rezultātus nolasa brīdī, kad pielietots maksimālais spēks, mēģinot atraut gredzenu no šķidruma virsmas.
2. DATI
Virsmas spraiguma aprēķināšanai aparāta nolasījuma vērtību (mN/m) vispirms reizina ar kalibrēšanas koeficientu φa vai φb (atkarībā no izmantotās kalibrēšanas procedūras). Šādi iegūst tikai aptuvenu lielumu, kas ir jākoriģē.
Hārkinss [Harkins] un Džordans [Jordan] (4), veicot mērījumus ar gredzena metodi, empīriski noteica virsmas spraiguma korekcijas koeficientus, kas atkarīgi no gredzena izmēriem, šķidruma blīvuma un tā virsmas spraiguma.
Tā kā katram mērījumam noteikt korekcijas koeficientu pēc Hārkinsa un Džordana tabulām ir sarežģīti, ūdens šķīdumu virsmas spraiguma aprēķināšanai var izmantot vienkāršotu koriģēto virsmas spraiguma vērtību nolasīšanas procedūru tieši no tabulām. (Rādījumiem, kas nav atrodami tabulā, koriģēto vērtību iegūst interpolējot.)
Tabula
Virsmas spraiguma mērījumu korekcija
Tikai ūdens šķīdumiem, ρ ≅ 1 g/cm3
|
r |
= 9,55 mm (gredzena rādiusa vidējā vērtība), |
|
r |
= 0,185 mm (gredzena stieples rādiuss). |
|
Eksperimentāli noteiktā vērtība (mN/m) |
Koriģētā vērtība (mN/m) |
|
|
Kalibrēšana ar atsvariem (skatīt 1.6.4.2.2. a)) |
Kalibrēšana ar ūdeni (skatīt 1.6.4.2.2. b)) |
|
|
20 |
16,9 |
18,1 |
|
22 |
18,7 |
20,1 |
|
24 |
20,6 |
22,1 |
|
26 |
22,4 |
24,1 |
|
28 |
24,3 |
26,1 |
|
30 |
26,2 |
28,1 |
|
32 |
28,1 |
30,1 |
|
34 |
29,9 |
32,1 |
|
36 |
31,8 |
34,1 |
|
38 |
33,7 |
36,1 |
|
40 |
35,6 |
38,2 |
|
42 |
37,6 |
40,3 |
|
44 |
39,5 |
42,3 |
|
46 |
41,4 |
44,4 |
|
48 |
43,4 |
46,5 |
|
50 |
45,3 |
48,6 |
|
52 |
47,3 |
50,7 |
|
54 |
49,3 |
52,8 |
|
56 |
51,2 |
54,9 |
|
58 |
53,2 |
57,0 |
|
60 |
55,2 |
59,1 |
|
62 |
57,2 |
61,3 |
|
64 |
59,2 |
63,4 |
|
66 |
61,2 |
65,5 |
|
68 |
63,2 |
67,7 |
|
70 |
65,2 |
69,9 |
|
72 |
67,2 |
72,0 |
|
74 |
69,2 |
— |
|
76 |
71,2 |
— |
|
78 |
73,2 |
— |
Šī tabula sastādīta pēc Hārkinsa un Džordana korekcijas metodes. Tā ir līdzīga standartā DIN 53914 dotajai tabulai ūdenim un ūdens šķīdumiem (blīvums p = 1 g/cm3) un gataviem nopērkamiem gredzeniem ar gredzena rādiusa vidējo vērtību R = 9,55 mm un gredzena stieples rādiusu r = 0,185 mm. Šajā tabulā ir iekļauti koriģētās virsmas spraiguma vērtības mērījumi, ko veic pēc kalibrēšanas ar atsvariem vai pēc kalibrēšanas ar ūdeni.
Pastāv arī iespēja aprēķināt virsmas spraigumu bez iepriekšējas kalibrēšanas pēc šādas formulas:
![]()
kur:
|
F |
= |
spēks, kas iedarbojas uz šķidruma virsmas slāni tā atraušanās brīdī (dinamometra rādījums), |
|
R |
= |
gredzena rādiuss, |
|
f |
= |
korekcijas koeficients (1). |
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— lietotā metode,
— izmantotais ūdens vai šķīdums,
— precīzs vielas apraksts (identifikācija un piemaisījumi),
— mērījumu rezultāti: virsmas spraigums (nolasījums), norādot gan atsevišķos nolasījumus, gan to vidējo aritmētisko vērtību, kā arī vidējā aritmētiskā koriģēto vērtību (ņemot vērā iekārtas koeficientu un korekcijas tabulu),
— šķīduma koncentrācija,
— temperatūra noteikšanas laikā,
— izmantotā šķīduma vecums; jo īpaši no šķīduma pagatavošanas līdz mērījumu veikšanai pagājušais laiks,
— virsmas spraiguma izmaiņas laikā pēc šķīduma pārnešanas mērtraukā,
— visa informācija un piezīmes, kas vajadzīgas uzdoto rezultātu interpretēšanai, jo īpaši dati par piemaisījumiem un vielas agregātstāvokli.
3.2. REZULTĀTU INTERPRETĒŠANA
Ņemot vērā, ka destilēta ūdens virsmas spraigums 20 oC temperatūrā ir 72,75 mN/m, vielas, kuru virsmas spraigums, kas noteikts pēc šīs metodes, ir mazāks par 60 mN/m, ir uzskatāmas par virsmaktīvām vielām.
4. IZMANTOTĀ LITERATŪRA
(1) OECD, Paris, 1981, Test Guideline 115, Decision of the Council C(81) 30 final.
(2) R. Weissberger ed.: Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, Vol. I, Part I, Chapter XIV.
(3) Pure Appl. Chem., 1976, Vol. 48, p. 511.
(4) Harkins, W.D., Jordan, H.F., J. Amer. Chem. Soc., 1930, Vol. 52, p. 1751.
A.6. ŠĶĪDĪBA ŪDENĪ
1. METODE
Aprakstīto metožu pamatā ir ESAO Testēšanas norādījumi (1).
1.1. IEVADS
Pirms šīs pārbaudes veikšanas ir lietderīgi jau iepriekš iegūt informāciju par pārbaudāmās vielas struktūrformulu, tvaika spiedienu, disociācijas konstanti un hidrolīzi (atkarībā no pH līmeņa).
Nav nevienas metodes, kas būtu izmantojama visā šķīdības diapazonā.
Abas turpmāk aprakstītās metodes aptver visu šķīdības diapazonu, taču nav izmantojamas gaistošu vielu šķīdības noteikšanai:
— viena no tām izmantojama praktiski tīru, ūdenī stabilu, slikti šķīstošu vielu šķīdības noteikšanai (< 10-2 grami litrā) – “kolonnas eluēšanas metode”,
— otra izmantojama praktiski tīru, ūdenī stabilu, nedaudz labāk šķīstošu vielu šķīdības noteikšanai (> 10-2 grami litrā) – “kolbas metode”.
Vielas šķīdība ūdenī var būtiski mainīties piemaisījumu ietekmē.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Vielas šķīdību ūdenī nosaka pēc vielas piesātinājuma masas koncentrācijas ūdenī kādā noteiktā temperatūrā. Šķīdību ūdenī norāda masas vienībās uz vienu šķīduma tilpuma vienību. SI mērvienība ir kg/m3 (var izmantot arī g/l).
1.3. STANDARTVIELAS
Pārbaudot jaunu vielu, ne visos gadījumos jāizmanto standartvielas. Tās galvenokārt izmanto metodes izpildījuma periodiskām pārbaudēm un dažādu metožu salīdzināšanai.
1.4. TESTA METODES PRINCIPS
Aptuveno parauga daudzumu un laiku, kas vajadzīgs, lai sasniegtu piesātinājuma masas koncentrāciju, nosaka vienkāršotā orientējošā izmēģinājumā.
1.4.1. Kolonnas eluēšanas metode
Šīs metodes pamatā ir testējamās vielas eluēšana ar ūdeni no mikrokolonnas, kurā uz inerta nesēja, piemēram, stikla lodītēm vai smiltīm, ir testējamās vielas pārākuma pārklājums. Šķīdību ūdenī nosaka tad, kad eluāta masas koncentrācija kļūst nemainīga. Par to liecina koncentrācijas plato, kas uz šķīdības līknes iestājas pēc noteikta laika.
1.4.2. Kolbas metode
Ja izmanto šo metodi, vielu (cietas vielas jāsaberž pulverī) izšķīdina ūdenī temperatūrā, kas ir nedaudz augstāka par temperatūru, kurā nosaka šķīdību. Pēc piesātināta šķīduma iegūšanas maisījumu maisot atdzesē un tur testēšanas temperatūrā, līdz iestājas līdzsvars. Noteikšanu var veikt arī tieši tajā temperatūrā, kurai nosaka šķīdību, ja ar pienācīgu paraugu ņemšanas programmu var nodrošināt piesātinājuma līdzsvara sasniegšanu. Pēc tam ar piemērotu analīzes metodi nosaka vielas masas koncentrāciju ūdens šķīdumā, kas nedrīkst saturēt neizšķīdušas daļiņas.
1.5. KVALITĀTES KRITĒRIJI
1.5.1. Atkārtojamība
Kolonnas eluēšanas metodei var sasniegt atkārtojamību < 30 %; pēc kolbas metodes atkārtojamībai jābūt < 15 %.
1.5.2. Jutība
Jutība ir atkarīga no noteikšanas metodes, tomēr ir iespējams noteikt masas koncentrācijas līdz pat 10-6 gramiem litrā.
1.6. TESTA METODES APRAKSTS
1.6.1. Testēšanas apstākļi
Testēšanu vēlams veikt 20 ± 0,5oC temperatūrā. Ja šķīdība, iespējams, ir atkarīga no temperatūras (> 3 %/ oC), šķīdība jānosaka arī temperatūrā, kas ir vismaz 10 oC virs un vismaz 10 oC zem sākotnēji izraudzītās noteikšanas temperatūras. Šādā gadījumā temperatūra jāmēra un jāuztur ar precizitāti ± 0,1oC. Izraudzītā temperatūra pastāvīgi jāuztur visās attiecīgajās iekārtas daļās.
1.6.2. Orientējoša noteikšana
Pie apmēram 0,1 g parauga (cietvielas jāsaberž pulverī) graduētā cilindrā ar stikla aizbāzni istabas temperatūrā pievieno pieaugošā daudzumā destilētu ūdeni saskaņā ar tabulu:
|
0,1 g vielas, kas izšķīst “x” mililitros ūdens |
0,1 |
0,5 |
1 |
2 |
10 |
100 |
> 100 |
|
Aptuvenā šķīdība (grami litrā) |
> 1 000 |
1 000 līdz 200 |
200 līdz 100 |
100 līdz 50 |
50 līdz 10 |
10 līdz 1 |
< 1 |
Pēc katra norādītā ūdens daudzuma pievienošanas maisījumu enerģiski krata 10 minūtes un vizuāli konstatē, vai tajā vēl ir neizšķīdušas parauga daļiņas. Ja pēc 10 ml ūdens pievienošanas viss paraugs vai tā daļas nav izšķīdušas, noteikšana jāatkārto 100 ml cilindrā, ņemot lielākus ūdens daudzumus. Vielām ar zemāku šķīdību pilnīgai izšķīšanai vajadzīgais laiks var būt ievērojami lielāks (jāatstāj vismaz uz 24 stundām). Aptuvenā šķīdība ir norādīta tabulā zem tā pievienotā ūdens daudzuma, kurā notiek parauga pilnīga izšķīšana. Ja arī pēc tam viela ir acīm redzami pilnīgi neizšķīdusi, to atstāj uz laiku ilgāku par 24 h (ne vairāk kā līdz 96 stundām) vai atšķaidīšanu turpina, lai pārliecinātos par to, vai šķīdības noteikšana nebūs jāveic pēc kolonnas eluēšanas metodes.
1.6.3. Kolonnas eluēšanas metode
1.6.3.1. Nesējs, šķīdinātājs un eluents
Eluēšanas kolonnās jāizmanto inerts nesējs. Šim nolūkam var izmantot tādus materiālus kā stikla lodītes un smiltis. Pārbaudāmās vielas adsorbēšanai uz nesēja izmanto piemērotu analītiski tīru gaistošu šķīdinātāju. Par eluentu izmanto bidestilētu ūdeni, kas iegūts destilācijas aparātā no stikla vai kvarca.
Piezīme
Nedrīkst izmantot ūdeni, kas iegūts, tieši izmantojot organiskos jonu apmaiņas sveķus.
1.6.3.2. Nesēja uzpildīšana
Apaļkolbā (50 ml) iesver apmēram 600 mg nesēja.
Iesver vajadzīgo pārbaudāmās vielas daudzumu un to izšķīdina izvēlētajā šķīdinātājā. Šo šķīdumu vajadzīgajā daudzumā pievieno nesējam. Šķīdinātāju pilnīgi iztvaicē, piemēram, rotācijas vakuumietvaicētājā; citādi sadalīšanās dēļ uz nesēja virsmas netiek panākta nesēja piesātināšanās ar ūdeni.
Nesēja uzpildīšana var radīt grūtības (kļūdainus rezultātus), ja pārbaudāmā viela nogulsnējas līdzīgi eļļai vai veido citu kristālisko fāzi. Šīs grūtības jāpārbauda eksperimentāli, un rezultāti jāatspoguļo pārskatā.
Sagatavoto nesēju apmēram divas stundas mērcē aptuveni 5 ml ūdens, pēc tam suspensiju iepilda mikrokolonnā. Otra iespēja ir sausu sagatavotu nesēju ievadīt mikrokolonnā, kurā iepildīts ūdens, un apmēram divas stundas uzbriedināt.
Vielas eluēšanu no nesēja var veikt divējādi:
— ar cirkulācijas sūkni (skatīt 1. attēlu),
— ar savienoto trauku (skatīt 4. attēlu).
1.6.3.3. Eluēšanas kolonna ar cirkulācijas sūkni
Parastā sistēma shematiski attēlota 1. attēlā. Piemērota mikrokolonna redzama 2. attēlā, lai gan var izmantot dažādu izmēru kolonnas, ja tās atbilst reproducējamības un atkārtojamības kritērijiem. Kolonnas augšdaļai jābūt neaizpildītai vismaz par pieciem ūdens slāņa tilpumiem, un tajā jāietilpst vismaz pieciem paraugiem. Pastāv arī iespēja samazināt izmērus, ja sākotnējo piecu eluāta tilpumu papildināšanai, kuri izvadīti kopā ar piemaisījumiem, no jauna ievada šķīdinātāju.
Kolonnu pievieno cirkulācijas sūknim, ar kuru var regulēt šķidruma plūsmas līdz 25 ml/h. Sūkni pievieno, izmantojot politetrafluroetilēna (PTFE) un/vai stikla savienojumus. Pēc kolonnas un sūkņa uzstādīšanas jānodrošina iespēja ņemt efluenta paraugus un līdzsvarot augšgala tilpuma spiedienu ar atmosfēras spiedienu. Nesēju kolonnā palīdz saturēt neliels (5 mm) stikla vates tampons, kas vienlaicīgi aiztur arī neizšķīdušās daļiņas. Par cirkulācijas sūkni var izmantot, piemēram, peristaltisko sūkni vai membrānas sūkni (jāraugās, lai nenotiktu piesārņošana ar caurulīšu materiālu un/vai tā absorbcija).
Kolonna sāk darboties. Ieteicamais plūsmas ātrums ir apmēram 25 ml/h (kas atbilst aprakstītās kolonnas 10 slāņa tilpumiem). (Vismaz) piecus pirmos slāņa tilpumus atmet, lai atdalītu ūdenī šķīstošos piemaisījumus. Tad iedarbina cirkulācijas sūkni, kamēr iestājas līdzsvars, par ko liecina pieci secīgi paraugi, kuru koncentrācija neatkarīgi no paraugu secības neatšķiras vairāk par ± 30 %. Šos paraugus ņem ar tādu laika intervālu, lai tajā pagūtu iziet tāds eluenta daudzums, kas atbilst vismaz 10 kolonnas slāņa tilpumiem.
1.6.3.4. Eluēšanas kolonna ar savienoto trauku
Savienotais trauks: savienoto trauku kolonnai pievieno, izmantojot pieslīpēta stikla savienojumu, kas pievienots PTFE caurulei. Ieteicams izmantot plūsmas ātrumu ap 25 ml/h. Pēc secīgu eluāta frakciju savākšanas tās analizē, izmantojot izraudzīto metodi.
Vielas šķīdības noteikšanai ūdenī ņem tās eluāta piecas secīgās vidējās frakcijas, kurās vielas koncentrācija nemainās (± 30 %).
Pēc abām metodēm (ar cirkulācijas sūkni un ar savienoto trauku) jāsagatavo otra paraugu sērija, ko iegūst ar divreiz mazāku eluēšanas ātrumu nekā pirmo. Ja pēc abām paraugu sērijām iegūtie rezultāti sakrīt, noteikšana veikta pareizi; ja ar mazāku plūsmas ātrumu noteiktā šķīdība ir lielāka, tad plūsmas ātrums divkārt jāsamazina tik ilgi, kamēr pēc divām secīgām paraugu sērijām iegūtie rezultāti sakrīt.
Abos gadījumos (izmantojot cirkulācijas sūkni vai savienoto trauku) jāpārbauda, vai frakcijas nesatur koloīdus, par ko liecina Tindala efekts (gaismas izkliede). Šādu daļiņu klātbūtne padara rezultātus neizmantojamus, un noteikšana jāatkārto pēc kolonnas filtrācijas spējas uzlabošanas.
Jāreģistrē katra parauga pH līmenis. Pārbaudi atkārto tādā pašā temperatūrā.
1.6.4. Kolbas metode
1.6.4.1. Aprīkojums
Kolbas metodei nepieciešams šāds aprīkojums:
— parastie laboratorijas trauki un iekārtas,
— pastāvīgā regulējamā temperatūrā šķīdumu maisīšanai piemērota ierīce,
— centrifūga (vēlams termostatējama), ja vajadzīga emulsijām, un
— iekārta analītiskai noteikšanai.
1.6.4.2. Mērījumu procedūra
Pārbaudāmās vielas daudzumu, kas nepieciešams vajadzīgā ūdens tilpuma piesātināšanai, vispirms nosaka orientējošā izmēģinājumā. Vajadzīgais ūdens daudzums ir atkarīgs no analīzes metodes un šķīdības. Katrā no trim stikla traukiem ar stikla aizbāzni (piemēram, centrifūgas mēģenēs vai kolbās) iesver apmēram piecreiz lielāku vielas daudzumu, nekā noteikts iepriekš. Katrā traukā iepilda izvēlēto ūdens tilpumu un traukus cieši noslēdz. Pēc tam noslēgto trauku saturu maisa 30 oC temperatūrā. (Jāizmanto kratītājs vai maisītājs, kas var darboties pastāvīgā temperatūrā, piemēram, jāmaisa ar magnētisko maisītāju termostatējamā ūdens vannā.) Pēc vienas dienas vienu no traukiem izņem un atstāj uz 24 stundām izmēģinājuma temperatūrā, to periodiski sakratot, kamēr atkal iestājas līdzsvara stāvoklis. Trauka saturu tad centrifugē temperatūrā, kurā nosaka šķīdību, un ar piemērotu analītisko metodi nosaka vielas koncentrāciju dzidrajā ūdens šķīdumā. Līdzīgi rīkojas ar pārējām divām kolbām, kad attiecīgi divu un triju dienu laikā ir iestājies līdzsvars 30 oC temperatūrā. Ja iegūtie rezultāti vismaz pēdējos divos traukos atbilst vajadzīgajai reproducējamībai, uzskata, ka noteikšanas rezultāti ir apmierinoši. Izmēģinājums pilnībā jāatkārto, izmantojot ilgāku līdzsvara iestāšanās laiku, ja ar 1., 2. un 3. trauku iegūtajiem rezultātiem ir tendence paaugstināties.
Noteikšanu var veikt arī bez iepriekšējas inkubēšanas 30 oC temperatūrā. Lai noteiktu piesātinājuma iestāšanās ātrumu, paraugus ņem līdz laikam, kamēr analizējamā šķīduma koncentrācija vairs nav atkarīga no maisīšanas ilguma.
Jāreģistrē katra parauga pH līmenis.
1.6.5. Analīze
Šim nolūkam ieteicams izmantot analīzes metodi, kas piemērota tieši šai vielai, jo piemaisījumi pat nelielā daudzumā var radīt nopietnas kļūdas šķīdības mērījumu rezultātos. Kā piemēru var minēt šādas metodes: gāzes šķidruma hromatogrāfija, titrēšanas metodes, fotometriskās metodes, voltampērmetriskās metodes.
2. DATI
2.1. KOLONNAS ELUĒŠANAS METODE
Katrā izmēģinājumā jāaprēķina vismaz piecu secīgu paraugu vidējā vērtība, kuri ņemti nemainīgā piesātinājuma fāzē, kā arī standartnovirze. Rezultātus uzdod masas vienībās uz šķīduma tilpumu.
Salīdzinot divu noteikšanu rezultātu vidējās vērtības, kuri iegūti ar dažādiem plūsmas ātrumiem, to atkārtojamībai jābūt ne lielākai par 30 %.
2.2. KOLBAS METODE
Uzdod atsevišķi noteikšanas rezultātus no visām trijām kolbām un pēc rezultātiem, kuri uzskatāmi par vienādiem (atkārtojamība ne lielāka par 15 %), aprēķina vidējo vērtību, ko izsaka masas vienībās uz šķīduma tilpumu. Šajā gadījumā var gadīties, ka masas vienības jāpārvērš tilpuma vienībās, bet, ja šķīdība ir ļoti augsta (> 100 g/l), jāizmanto blīvums.
3. PĀRSKATS
3.1. KOLONNAS ELUĒŠANAS METODE
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— orientējošas noteikšanas rezultāti,
— precīzs vielas apraksts (identifikācija un piemaisījumi),
— atsevišķi katram paraugam noteiktās koncentrācijas, plūsmas ātrumi un pH,
— no katras paraugu sērijas pēc vismaz pieciem paraugiem no piesātinājuma plato noteiktās vidējās vērtības un standartnovirzes,
— divu secīgu pieņemamu rezultātu sēriju vidējās vērtības,
— ūdens temperatūra piesātināšanas procesa laikā,
— izmantotā analīzes metode,
— izmantotais nesējs,
— nesēja sagatavošana noteikšanai,
— izmantotais šķīdinātājs,
— pierādījumi par vielas ķīmisko nestabilitāti noteikšanas laikā un izmantotā metode,
— visa informācija un piezīmes, kas vajadzīgas uzdoto rezultātu interpretēšanai, īpaši dati par piemaisījumiem un vielas agregātstāvokli.
3.2. KOLBAS METODE
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— orientējošas noteikšanas rezultāti,
— precīzs vielas apraksts (identifikācija un piemaisījumi),
— atsevišķo paraugu analīžu rezultāti un vidējās vērtības gadījumos, kad no vienas kolbas iegūti vairāki rezultāti, to vidējā vērtība,
— katra parauga reakcija pH,
— no vairākām kolbām iegūto sakrītošo rezultātu vidējā vērtība,
— noteikšanas temperatūra,
— izmantotā analītiskā metode,
— pierādījumi par vielas ķīmisko nestabilitāti noteikšanas laikā un izmantotā metode,
— visa informācija un piezīmes, kas vajadzīgas uzdoto rezultātu interpretēšanai, īpaši dati par piemaisījumiem un vielas agregātstāvokli.
4. IZMANTOTĀ LITERATŪRA
(1) OECD, Paris, 1981, Test Guideline 105, Decision of the Council C(81) 30 final.
(2) NF T 20-045 (AFNOR) (Sept. 85). Chemical products for industrial use –Determination of water solubility of solids and liquids with low solubility – Column elution method.
(3) NF T 20-046 (AFNOR) (Sept. 85). Chemical products for industrial use –Determination of water solubility of solids and liquids with high solubility – Flask method.
Papildinājums
1. attēls
Eluēšanas kolonna ar cirkulācijas sūkni

2. attēls
Mikrokolonnas paraugs
(Visi izmēri norādīti milimetros)

3. attēls
Mikrokolonnas paraugs
(Visi izmēri norādīti milimetros)

4. attēls
Eluēšanas kolonna ar līdzsvarošanas trauku

A.8. SADALĪŠANĀS KOEFICIENTS
1. METODE
Aprakstītās “kolbu kratīšanas” metodes pamatā ir ESAO Testēšanas norādījumi (1).
1.1. IEVADS
Pirms noteikt sadalīšanās koeficientu, ir lietderīgi iegūt sākotnēju informāciju par vielas struktūru, disociācijas konstanti, šķīdību ūdenī, hidrolīzi, šķīdību n-oktanolā un virsmas spraigumu.
To nosaka tikai jonizējamu vielu nejonizētajām formām (brīvām skābēm vai bāzēm), kas rodas, izmantojot piemērotu buferšķīdumu ar pH, kas ir vismaz vienu pH vienību zem (brīvām skābēm) vai vienu pH vienību virs (brīvām bāzēm) tās pK.
Šajā noteikšanas metodē ietilpst divas atsevišķas procedūras: “kolbu kratīšanas” metode un augstas izšķirtspējas šķidruma hromatogrāfija (HPLC). Pirmo izmanto gadījumos, kad log Pow vērtība (skatīt definīcijas turpmāk) ir no –2 līdz 4, bet otro – ja tā ir no 0 līdz 6. Pirms veikt eksperimentālu noteikšanu pēc kādas no minētajām metodēm, vispirms jāveic sadalīšanās koeficienta orientējoši aprēķini.
“Kolbu kratīšanas” metode izmantojama tikai praktiski tīrām vielām, kuras šķīst ūdenī un n-oktanolā. Tā nav izmantojama virsmaktīvām vielām (kurām norāda aprēķināto vērtību vai novērtējumu pēc šķīdības atsevišķi n-oktanolā un ūdenī).
Augstas izšķirtspējas šķidrumu hromatogrāfijas metode nav izmantojama stiprām skābēm un bāzēm, metālu kompleksajiem savienojumiem, virsmaktīvajām vielām un vielām, kuras reaģē ar eluentu. Šīm vielām uzdod sadalīšanās koeficenta aprēķināto vērtību vai pēc šķīdības atsevišķi n-oktanolā un ūdenī novērtēto vērtību.
Augstas izšķirtspējas šķidrumu hromatogrāfijas metode ir mazāk jutīga pret nosakāmās vielas piemaisījumiem nekā “kolbu kratīšanas” metode. Tomēr dažos gadījumos piemaisījumi apgrūtina rezultātu interpretāciju, jo ne vienmēr ir iespējama visu signālu identificēšana. Maisījumiem, kuri dod neidentificētu signālu, jānorāda log P augšējās un apakšējās robežas.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Sadalīšanās koeficientu (P) definē kā izšķīdušās vielas līdzsvara koncentrāciju attiecību (q), iestājoties līdzsvaram divfāžu sistēmā, ko veido divi šķīdinātāji, kam ir savstarpēji ierobežota šķīdība. n-oktanols/ūdens sistēmā:
![]()
Tātad sadalīšanās koeficients (P) ir divu koncentrāciju attiecība, kas parasti izteikta decimāllogaritma veidā (log P).
1.3. STANDARTVIELAS
“Kolbu kratīšanas” metode
Pārbaudot jaunu vielu, ne visos gadījumos jāizmanto standartvielas. Tās galvenokārt izmanto metodes izpildījuma periodiskām pārbaudēm un pēc dažādām metodēm iegūto rezultātu salīdzināšanai.
Augstas izšķirtspējas šķidruma hromatogrāfijas metode
Lai saistītu savienojuma hromatogrāfijas datus ar tā P vērtību, pēc vismaz 6 punktiem jāizveido kalibrēšanas grafiks par log P vērtību atkarībā no hromatogrāfijas datiem. Piemērotas standartvielas izraugās pats metodes lietotājs. Visos iespējamajos gadījumos vismaz vienas standartvielas Pow ir jābūt zemākai par šā rādītāja vērtību nosakāmajai vielai, bet otras – par to augstākai. Ja log P ir mazāks par 4, kalibrēšanai izmanto pēc “kolbu kratīšanas” metodes iegūtos datus. Ja log P ir lielāks par 4, kalibrēšanai var izmantot apstiprinātus literatūras datus, ja tie atbilst aprēķinātajām vērtībām. Precizitātes paaugstināšanai ir ieteicams izmantot standartvielas, kuru struktūra ir līdzīga nosakāmās vielas struktūrai.
Par daudzām ķīmisko vielu grupām ir publicēti (2) (3) plaši log Pow saraksti. Ja nav datu par sadalīšanās koeficientu vērtībām savienojumiem ar līdzīgu struktūru, var izmantot vispārīgāku kalibrēšanu pēc citām standartvielām.
Ieteicamo standartvielu saraksts un to Pow vērtības dotas 2. papildinājumā.
1.4. METODES PRINCIPS
1.4.1. “Kolbu kratīšanas” metode
Lai noteiktu sadalīšanās koeficientu, ir jāiestājas līdzsvaram starp visiem mijiedarbībā esošiem sistēmas komponentiem un jānosaka abās fāzēs izšķīdušo vielu koncentrācija. Attiecīgās literatūras norādes liecina par to, ka šo problēmu var atrisināt ar dažādiem tehniskiem paņēmieniem, proti, atdalot abas fāzes pēc to rūpīgas sajaukšanas, lai noteiktu analizējamās vielas koncentrāciju, iestājoties līdzsvaram.
1.4.2. Augstas izšķirtspējas šķidruma hromatogrāfijas metode
Augstas izšķirtspējas šķidruma hromatogrāfijai izmanto kolonnas ar gatavas nopērkamas cietās fāzes pildījumu, kas satur garas ogļūdeņražu virknes (piemēram, C8, C18), kas ķīmiski saistītas ar silīcija dioksīdu. Šādā kolonnā ievadītās vielas tajā pārvietojas ar dažādu ātrumu atšķirīgas sadalīšanās dēļ starp kustīgo fāzi un ogļūdeņražu nekustīgo fāzi. Ķīmisko vielu maisījumi eluējas to hidrofobitātes secībā, vispirms eluējas ūdenī šķīstošās vielas, bet pēc tam – eļļās šķīstošās vielas proporcionāli to sadalīšanās koeficientam ogļūdeņražos/ūdenī. Tas rada iespējas noteikt aiztures laika sakarību šādā (apgriezto fāžu) kolonnā ar sadalīšanās koeficientu n-oktanolā/ūdenī. Sadalīšanās koeficientu nosaka pēc ietilpības koeficienta k, kuru aprēķina šādi:
![]()
kur tR = ir nosakāmās vielas aiztures laiks un to = ir vidējais laiks, kādā šķīdinātāja molekula iziet cauri kolonnai (tukšais laiks).
Kvantitatīva noteikšana nav vajadzīga, un ir jānosaka tikai eluēšanās laiki.
1.5. KVALITĀTES KRITĒRIJI
1.5.1. Atkārtojamība
Lai nodrošinātu precīzu sadalīšanās koeficienta noteikšanu, jāveic divi mērījumi trīs dažādos režīmos, turklāt var mainīt pārbaudāmās vielas daudzumu un šķīdinātāju tilpumu attiecību. Eksperimentāli noteiktā sadalīšanās koeficienta decimāllogaritmu atšķirības nedrīkst pārsniegt ± 0,3 log vienības.
Lai paaugstinātu mērījumu rezultātu ticamību, noteikšana jāveic divos atkārtojumos. Pēc atsevišķiem mērījumiem noteikto log P vērtību atšķirības nedrīkst pārsniegt ± 0,1 log vienības.
1.5.2. Jutība
Metodes mērījumu diapazons ir atkarīgs no analītiskās metodes noteikšanas robežas. Tai jādod iespējas noteikt log Pow vērtības robežās no –2 līdz 4 (atsevišķos gadījumos šo intervālu var paplašināt līdz log Pow vērtībām līdz pat 5), ja izšķīdušās vielas koncentrācija kādā no fāzēm nepārsniedz 0,01 mol/l.
Pēc augstas izšķirtspējas šķidruma hromatogrāfijas metodes var noteikt sadalīšanās koeficientu log Pow vērtības intervālā no 0 līdz 6.
Parasti vielas sadalīšanās koeficientu var noteikt ar precizitāti ± 1 log vienība salīdzinājumā ar “kolbu kratīšanas” metodi. Korelācijas norādītas literatūras avotos (4) (5) (6) (7) (8). Parasti augstāku precizitāti panāk, ja korelācijas grafikiem izmanto līdzīgas struktūras savienojumus (9).
1.5.3. Specifiskums
Nernsta sadalījuma likums attiecas tikai uz atšķaidītiem šķīdumiem, kuru temperatūra, spiediens un pH līmenis ir nemainīgi. To var droši piemērot tīrai vielai, kas sadalījusies starp diviem tīriem šķīdinātājiem. Ja vienā vai abās fāzēs vienlaicīgi atrodas vairākas izšķīdušas vielas, tas var ietekmēt iegūtos rezultātus.
Šķīdumā esošo molekulu disociācijas vai asociācijas dēļ novēro atkāpes no Nernsta sadalījuma likuma. Par šādām atkāpēm liecina tas, ka sadalījuma koeficients kļūst atkarīgs no šķīduma koncentrācijas.
Tā kā vienlaikus iestājas vairāki sadalījuma līdzsvari, šī metode bez attiecīgas korekcijas nav izmantojama jonizējamiem savienojumiem. Šajā gadījumā var mēģināt ūdens vietā izmantot buferšķīdumus; buferšķīduma pH vismaz par 1 pH vienību jāatšķiras no vielas pKa, un jāņem vērā šā pH ietekme uz vidi.
1.6. METODES APRAKSTS
1.6.1. Sadalīšanās koeficienta orientējoša noteikšana
Sadalīšanās koeficientu vēlams noteikt pēc aprēķinu metodes (skatīt 1. papildinājumu) vai attiecīgos gadījumos pēc testējamās vielas šķīdības tīros šķīdinātājos (10).
1.6.2. “Kolbu kratīšanas” metode
1.6.2.1. Sagatavošana
n-oktanols: sadalīšanās koeficienta noteikšanai izmanto ļoti tīru analītisko reaģentu.
Ūdens: izmanto stikla vai kvarca destilācijas aparātā iegūtu destilētu vai bidestilētu ūdeni. Piemērotos gadījumos jonizējamu vielu sadalīšanās koeficienta noteikšanai ūdens vietā jāizmanto buferšķīdumi.
Piezīme
Nedrīkst izmantot ūdeni, kas tieši iegūts, izmantojot jonu apmaiņas sveķus.
1.6.2.1.1.
Pirms noteikt sadalīšanās koeficientu, šķīdinātāju sistēmas fāzes tiek savstarpēji piesātinātas, kratot noteikšanas temperatūrā. Šim nolūkam iesaka mehāniskajā kratītājā uz 24 stundām ievietot divas lielas pudeles ar analītiski ļoti tīru n-oktanolu vai ūdeni, kam pietiekamā daudzumā pievienots arī otrs šķīdinātājs, un pēc tam nostādina, lai fāzes sadalītos un iestātos piesātinājums.
1.6.2.1.2.
Divfāžu sistēma pēc tilpuma piepilda gandrīz visu izmēģinājuma trauku. Šādi var novērst vielas iztvaikošanas zudumus. Izmantojamo vielu tilpumu attiecību un daudzumu izvēlas, pamatojoties uz:
— sadalīšanās koeficienta orientējošu novērtējumu (skatīt iepriekš),
— nosakāmās vielas minimālo daudzumu, kas nepieciešams analīzes veikšanai, un
— maksimālās koncentrācijas ierobežojumiem abām fāzēm, kas ir 0,01 mols/l.
Jāveic trīs izmēģinājumi. Pirmajā izmanto aprēķināto n-oktanola un ūdens attiecību; otrajā šo attiecību samazina uz pusi; trešajā to divas reizes palielina (piemēram, 1:1, 1:2, 2:1).
1.6.2.1.3.
Pagatavo vielas standartšķīdumu n-oktanolā, kas piesātināts ar ūdeni. Standartšķīduma faktisko masas koncentrāciju nosaka precīzi, pirms to izmanto sadalīšanās koeficienta noteikšanai. Šo šķīdumu glabā apstākļos, kuros tiek nodrošināta to stabilitāte.
1.6.2.2. Pārbaudes apstākļi
Pārbaudes laikā jānodrošina nemainīga (± 1 oC) temperatūra no 20 līdz 25 oC diapazonā.
1.6.2.3. Mērījumu procedūra
1.6.2.3.1.
Izmantošanai katrā noteikšanas režīmā sagatavo divus izmēģinājuma traukus, kas satur abus šķīdinātājus precīzi nomērītā daudzumā, kā arī standartšķīdumu vajadzīgā daudzumā.
n-oktanola fāzes mēra pēc tilpuma. Abi izmēģinājuma trauki jāievieto kratītājā vai tie jākrata ar roku. Izmantojot centrifūgas mēģenes, tās ieteicams ātri griezt par 180o ap šķērsasi tā, lai tajās esošais gaiss paceltos cauri abām fāzēm. Pieredze liecina, ka sadalīšanās līdzsvars iestājas pēc apmēram 50 šādiem apgriezieniem. Precizitātes labad ieteicams izdarīt 100 šādus apgriezienus piecu minūšu laikā.
1.6.2.3.2.
Lai atdalītu fāzes, maisījums jācentrifugē. Šim nolūkam izmanto laboratorijas centrifūgu istabas temperatūrā vai, ja centrifūgai nav termostata, centrifūgas stobriņi pirms analīzes vismaz vienu stundu jāuzglabā noteikšanas temperatūrā, lai atkal iestātos līdzsvars.
1.6.2.4. Analīze
Lai iegūtu sadalījuma koeficientu, ir jānosaka pārbaudāmās vielas koncentrācija abās fāzēs. To var izdarīt, paņemot no katras mēģenes visos pārbaudes režīmos alikvoto daļu no abām fāzēm un analizējot tās pēc izvēlētās metodes. Aprēķina vielas kopējo daudzumu abās fāzēs un salīdzina to ar sākotnēji ievadīto vielas daudzumu.
Ūdens fāzes paraugi jāņem tā, lai samazinātu iespējas paraugā iekļūt n-oktanolam: ūdens fāzes paraugu ņemšanai var izmantot stikla šļirci ar maināmu adatu. Sākumā šļircei jābūt daļēji piepildītai ar gaisu. Gaisu lēni izspiež, adatu vadot caur oktanola slāni. Šļircē iesūc vajadzīgo ūdens fāzes daudzumu. Šļirci ātri izvelk no šķīduma un noņem adatu. Šļirces saturu var izmantot par ūdens fāzes paraugu. Vielas koncentrāciju abās atdalītajās fāzēs vēlams noteikt ar attiecīgajai vielai piemērotu metodi. Iespējamās analīžu metodes ir:
— fotometriskās metodes,
— gāzu hromatogrāfija,
— augstas izšķirtspējas šķidruma hromatogrāfija.
1.6.3. Augstas izšķirtspējas šķidruma hromatogrāfijas metode
1.6.3.1. Sagatavošana
Ar sūkni, kas nerada pulsācijas, aprīkots šķidruma hromatogrāfs ar piemērotu detektēšanas ierīci. Ieteicams izmantot inžekcijas vārstu ar inžektora cilpu. Polāru grupu klātbūtne nekustīgajā fāzē var nopietni pasliktināt kolonnas darbības efektivitāti. Tāpēc nekustīgajā fāzē jābūt iespējami mazam polāro grupu saturam (11). Var izmantot gatavas nopērkamas kolonnas ar pildījumu vai mikrodaļiņu apgrieztās fāzes pildījumu. Starp inžekcijas sistēmu un analītisko kolonnu var uzstādīt aizsargkolonnu.
Eluentu pirms lietošanas degazē, un tā pagatavošanai izmanto HPLC tīrības pakāpes metanolu un HPLC tīrības pakāpes ūdeni. Izmanto izokrātisko eluēšanu. Jāizmanto metanola/ūdens maisījumi ar minimālo ūdens saturu 25 %. Parasti ar metanola-ūdens maisījumu 3:1 (v/v) stundas laikā ar plūsmas ātrumu 1 ml/min eluējas savienojumi, kuru log P ir 6. Savienojumiem ar augstu log P vērtību (un arī standartvielām) eluēšanas laiks var būt jāsamazina, samazinot kustīgās fāzes polaritāti vai kolonnas garumu.
Vielām ar ļoti zemu šķīdību n-oktanolā pēc augstas izšķirtspējas šķidruma hromatogrāfijas metodes nosaka stipri pazeminātas log Pow vērtības; šādu vielu signāli dažkārt ir kopā ar šķīdinātāja fronti. Iespējams, tas ir tādēļ, ka sadalīšanās process notiek pārāk lēni, lai sasniegtu līdzsvaru laikā, kādā parasti augstas izšķirtspējas šķidruma hromatogrāfijā notiek sadalīšanās pa fāzēm. Šādos gadījumos ticamas vērtības noteikšanai var noderēt plūsmas ātruma un/vai metanola/ūdens attiecības samazināšana.
Lai nosakāmo vielu un standartvielu varētu detektēt, tām jābūt pietiekamā koncentrācijā šķīstošām kustīgajā fāzē. Piedevas metanola-ūdens maisījumam izmanto tikai izņēmuma gadījumos, jo piedevu ietekmē mainās kolonnas īpašības. Hromatogrammām ar piedevām obligāti jāizmanto tāda paša veida atsevišķa kolonna. Ja metanola-ūdens maisījumu nevar izmantot, var lietot citus maisījumus, piemēram, etanola ūdens vai acetonitrila-ūdens maisījumu.
Jonizējamiem savienojumiem ļoti svarīgs eluenta pH. Tam jābūt kolonnas pH darbības intervālā, kas parasti ir no 2 līdz 8. Ieteicams izmantot buferšķīdumus. Jāraugās, lai nenotiktu sāļu nogulsnēšanās un kolonnas bojāšanās, kuru izraisa daži organiskās fāzes/buferu maisījumi. Nav ieteicams augstas izšķirtspējas šķidruma hromatogrāfijai izmantot nekustīgās fāzes uz silīcija dioksīda bāzes ar pH virs 8, jo bāziska kustīgā fāze var izraisīt strauju kolonnas efektivitātes pasliktināšanos.
Jāizmanto iespējami tīras standartvielas. Kalibrēšanai izmantojamās vielas, ja iespējams, jāšķīdina kustīgajā fāzē.
Mērījumu laikā temperatūra nedrīkst mainīties vairāk par ± 2 K.
1.6.3.2. Mērījumi
Tukšo laiku t0 var noteikt, izmantojot homologu sērijas (piemēram, n-alkilmetilketonus) vai organiskos savienojumus, kas netiek aizturēti (piemēram, tiourīnviela vai formamīds). Tukšā laika t0 aprēķināšanai, izmantojot homologus, injicē vismaz septiņus homologus un nosaka to aiztures laikus. Neapstrādātus aiztures laikus tr (nc+ 1) izsaka kā tr (nc) funkciju, izmantojot regresijas vienādojuma brīvo locekli a un virziena koeficientu b:
tr (n c + 1) = a + b tr (n c)
(nc = ir oglekļa atomu skaits). Tukšo laiku t0 tad aprēķina šādi:
to = a/(l – b)
Nākamais posms ir attiecīgajām standartvielām noteikt log k korelāciju ar log P vērtībām. Praktiski vienlaicīgi injicē un nosaka aiztures laikus 5 līdz 10 tādām standartvielām, kuru log P ir sagaidāmajā intervālā, vēlams izmantot reģistrējošu integratoru, kas savienots ar detektēšanas sistēmu. Aprēķina ietilpības koeficientu k attiecīgos logaritmus, kurus izsaka kā log P funkciju, kas noteikta pēc “kolbu kratīšanas” metodes. Kalibrēšanu veic regulāri vismaz reizi dienā tā, lai varētu ņemt vērā iespējamās kolonnas efektivitātes izmaiņas.
Testējamo vielu injicē iespējami mazā kustīgās fāzes daudzumā. Nosaka aiztures laiku (divos atkārtojumos), pēc kura aprēķina ietilpības koeficientu k. Pēc standartvielu korelācijas grafika interpolē nosakāmās vielas sadalīšanās koeficientu. Ļoti zemas un ļoti augstas sadalīšanās koeficienta vērtības ir jānosaka ekstrapolējot. Šādos gadījumos īpaša vērība jāveltī regresijas līnijas ticamības robežām.
2. DATI
“Kolbu kratīšanas” metode
Noteikto P vērtību ticamību var pārbaudīt, salīdzinot divu mērījumu vidējo vērtību ar kopējo vidējo vērtību.
3. PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— precīzs vielas apraksts (raksturojums un piemaisījumi),
— gadījumos, kad aprakstītās metodes nav izmantojamas (piemēram, virsmaktīvām vielām), norāda aprēķināto vērtību vai novērtējumu pēc šķīdības atsevišķi n-oktanolā un ūdenī,
— visa informācija un piezīmes, kas vajadzīgas uzdoto rezultātu interpretēšanai, īpaši dati par piemaisījumiem un vielas agregātstāvokli.
“Kolbu kratīšanas” metodei:
— orientējošas noteikšanas rezultāti, ja tā veikta,
— temperatūra noteikšanas laikā,
— dati par analītisko metodi, kas izmantota koncentrācijas noteikšanai,
— centrifugēšanas ilgums un ātrums, ja to izmanto,
— noteiktās koncentrācijas abās fāzēs katrai noteikšanai (tas nozīmē, ka pavisam jānorāda 12 koncentrācijas),
— nosakāmās vielas masa, katras fāzes tilpums katrā izmēģinājuma traukā un pārbaudāmās vielas kopējais aprēķinātais daudzums katrā fāzē pēc līdzsvara iestāšanās,
— pārskatā jāiekļauj aprēķinātās sadalīšanās koeficienta (P) vērtības katrā pārbaudes režīmā, kā arī mērījumu rezultātu vidējās vērtības. Ja var secināt, ka sadalīšanās koeficients ir atkarīgs no koncentrācijas, tas jānorāda protokolā,
— jānorāda atsevišķo P vērtību standartnovirzes no vidējās vērtības,
— jānorāda arī visu mērījumu vidējās P vērtības decimāllogaritms,
— aprēķinātā teorētiskā Pow vērtība, ja tāda ir noteikta vai ja mērījumu rezultāts ir > 104,
— izmantotā ūdens un ūdens fāzes pH līmenis eksperimenta laikā,
— ja izmanto buferšķīdumus, jāpamato, kāpēc tie izmantoti ūdens vietā, buferšķīdumu sastāvs, koncentrācija un pH, ūdens fāzes pH noteikšanas sākumā un beigās.
Augstas izšķirtspējas šķidruma hromatogrāfijas metodei:
— orientējošas noteikšanas rezultāti, ja tā veikta,
— nosakāmā viela, standartvielas, to tīrība,
— noteikšanas temperatūru intervāls,
— pH, kādā veikta noteikšana,
— analītiskās kolonnas un aizsargkolonnas, kustīgās fāzes un detektēšanas līdzekļu apraksts,
— kalibrēšanai izmantoto standartvielu aiztures laiku un literatūrā norādītās log P vērtības,
— regresijas (log k atkarībā no log P) dati,
— testējamās vielas vidējais aiztures laiks un interpolētā log P vērtība,
— iekārtas un tās darbības režīma apraksts,
— eluēšanās raksturojums,
— kolonnā ievadītie testējamās vielas un standartvielu daudzumi,
— tukšais laiks un tā noteikšanas paņēmiens.
4. IZMANTOTĀ LITERATŪRA
(1) OECD, Paris, 1981, Test Guideline 107, Decision of the Council C(81) 30 final.
(2) C. Hansch and A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979.
(3) Log P and Parameter Database, A tool for the quantitative prediction of bioactivity (C. Hansch, chairman, A.J. Leo, dir.) – Available from Pomona College Medical Chemistry Project 1982, Pomona College, Claremont, California 91711.
(4) L. Renberg, G. Sundström and K. Sundh-Nygärd, Chemosphere, 1980, Vol. 80, p. 683.
(5) H. Ellgehausen, C. D'Hondt and R. Fuerer, Pestic. Sci., 1981, Vol. 12, 219 (1981).
(6) B. McDuffie, Chemosphere, 1981, Vol. 10, p. 73.
(7) W.E. Hammers et al., J. Chromatogr., 1982, Vol. 247, p. 1.
(8) J.E. Haky and A.M. Young, J. Liq. Chromat., 1984, Vol. 7, p. 675.
(9) S. Fujisawa and E. Masuhara, J. Biomed. Mat. Res., 1981, Vol. 15, p. 787.
(10) O. Jubermann, Verteilen und Extrahieren, in Methoden der Organischen Chemie (Houben Weyl), Allgemeine Laboratoriumpraxis (edited by E.Muller), Georg Thieme Verlag, Stuttgart, 1958, Band I/1, 223–339.
(11) R.F. Rekker and H.M. de Kort, Euro. J. Med. Chem., 1979, Vol. 14, p. 479.
(12) A. Leo, C. Hansch and D. Elkins, Partition coefficients and their uses. Chem. Rev., 1971, Vol. 71, p. 525.
(13) R.F. Rekker, The Hydrophobic Fragmental Constant, Elsevier, Amsterdam, 1977.
(14) NF T 20-043 AFNOR (1985). Chemical prqducts for industrial use – Determination of partition coefficient – Flask shaking method.
(15) C.V. Eadsforth and P. Moser, Chemosphere, 1983, Vol. 12, p. 1459.
(16) A. Leo, C. Hansch and D. Elkins, Chem. Rev., 1971, Vol. 71, p. 525.
(17) C. Hansch, A. Leo, S.H. Unger, K.H. Kim, D. Nikaitani and E.J. Lien, J. Med. Chem., 1973, Vol. 16, p. 1207.
(18) W.B. Neely, D.R. Branson and G.E. Blau, Environ. Sci. Technol., 1974, Vol. 8, p. 1113.
(19) D.S. Brown and E.W. Flagg, J. Environ. Qual., 1981, Vol. 10, p. 382.
(20) J.K. Seydel and K.J. Schaper, Chemische Struktur und biologische Aktivität von Wirkstoffen, Verlag Chemie, Weinheim, New York, 1979.
(21) R. Franke, Theoretical Drug Design Methods, Elsevier, Amsterdam, 1984,
(22) Y.C. Martin, Quantitative Drug Design, Marcel Dekker, New York, Base1, 1978.
(23) N.S. Nirrlees, S.J. Noulton, C.T. Murphy, P.J. Taylor; J. Med. Chem., 1976, Vol. 19, p. 615.
1. Papildinājums
Aprēķinu/novērtēšanas metodes
IEVADS
Vispārīgs aprēķinu metožu apskats, dati un piemēri ir atrodami rokasgrāmatā “Handbook of Chemical Property Estimation Methods” (a).
Pow aprēķinātās vērtības var izmantot:
— piemērotāko eksperimentālo metožu izvēlei (“kolbu kratīšanas” metode: log Pow: –2 līdz 4, HPLC metode: log Pow: 0 līdz 6),
— piemērotāko noteikšanas apstākļu izvēlei (piemēram, lai izraudzītos standartvielas HPLC metodei, n-oktanola/ūdens tilpuma attiecības noteikšanai “kolbu kratīšanas” metodei),
— laboratorijas iekšējai pārbaudei iespējamo eksperimentālo kļūdu noteikšanai,
— gadījumos, kad tehnisku iemeslu dēļ Pow nav iespējams noteikt eksperimentāli, tā novērtētās vērtības noteikšanai.
NOVĒRTĒJUMA METODE
Sadalīšanās koeficienta orientējoša novērtēšana
Sadalīšanās koeficienta vērtību var novērtēt pēc testējamās vielas šķīdības tīros šķīdinātājos. Šajā gadījumā aptuvenais P novērtējums = piesātinājuma koncentrācija n-oktanolā (C)/piesātinājuma koncentrācija ūdenī (C):
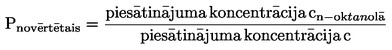
APRĒĶINA METODES
Aprēķinu metožu būtība
Visu aprēķina metožu pamatā ir molekulas formāla sadalīšana struktūrelementos ar zināmu log Pow. Visas molekulas log Pow aprēķina kā attiecīgo struktūrelementu summu, kurai pieskaita iekšmolekulārās mijiedarbības korekciju.
Struktūrelementu fragmentu konstantes un korekcijas atrodamas (b), (c), (d), (e). Daļa no tiem tiek regulāri atjaunināti un papildināti (b).
Kvalitātes kritēriji
Parasti aprēķinu metodes ticamība pazeminās, paaugstinoties testējamā savienojuma struktūras sarežģītībai. Vienkāršām molekulām ar nelielu molekulmasu un vienu vai divām funkcionālajām grupām pēc dažādām sadalīšanās metodēm noteiktās log Pow vērtības var atšķirties no eksperimentāli noteiktajām par 0,1 līdz 0,3 vienībām. Sarežģītākas struktūras savienojumiem šīs atšķirības var būt lielākas. Tās ir atkarīgas no struktūrfragmentu konstanšu pieejamības un to ticamības, kā arī iespējām ņemt vērā iekšmolekulāro mijiedarbību (piemēram, ūdeņraža saites) un korekciju pareizu ieviešanu (šī problēma ir mazāka, izmantojot datorprogrammu CLOGP-3) (b). Savienojumiem, kas jonizējas, svarīgi ir pareizi ņemt vērā lādiņu vai jonizācijas pakāpi.
Aprēķināšanas procedūras
Sākotnēji hidrofobā aizvietotāja konstanti πx ieviesa Fujita u. c.πx definē šādi:
πx = log Pow (PhX) - log Pow (PhH)
kur Pow (PhX) ir aromātiskā atvasinājuma sadalīšanās koeficients un Pow (PhH) izejas savienojuma sadalīšanās koeficients
(piemēram, πCl = log Pow (C6H5Cl) - log Pow (C6H6) = 2,84 – 2,13 = 0,71).
Saskaņā ar definīciju π-metode galvenokārt izmantojama aizvietotajiem aromātiskajiem savienojumiem. Ļoti lielam skaitam aizvietotāju π vērības apkopotas tabulu veidā (b) (c) (d). Tās izmantojamas aromātisko savienojumu vai struktūrelementu log Pow aprēķināšanai.
Pēc Rekera (g) log Pow vērtību aprēķina šādi:

kur fi ir dažādu molekulas fragmentu konstantes un ai ir to parādīšanās biežums pētamajā molekulā. Korekcijas locekļus var izteikt vienas konstantes Cm (t. s. “maģiskās konstantes”) veselu skaitļu daudzkārtņu veidā. Struktūras fragmentu konstantes fi un Cm noteiktas pēc 1 054 eksperimentāli iegūtām Pow vērtībām (825 savienojumi), izmantojot daudzfaktoru regresijas analīzi (c), (h). Korekcijas locekļus nosaka pēc literatūrā (e), (h), (i) aprakstītajiem noteikumiem.
Pēc Henša un Leo (c) log Pow vērtību aprēķina šādi:

kur fi ir dažādu molekulas fragmentu konstantes, Fi ir korekcijas locekļi, bet ai bj – to parādīšanās biežums. Ar mēģinājumu un kļūdu metodi, izmantojot eksperimentāli noteiktās Pow vērtības, sastādīts atomu un grupu fragmentu vērtību korekcijas locekļu Fj (t. s. “koeficientu”) saraksts. Korekcijas locekļi iedalīti vairākās klasēs (a) (c). Ņemt vērā visus noteikumus un korekcijas locekļus ir diezgan sarežģīti, un tas prasa daudz laika. Šim nolūkam ir izstrādāta īpaša programmatūra (b).
Sarežģītām molekulām log Pow aprēķinus var ievērojami uzlabot, ja molekulu dala lielākos struktūras fragmentos, kuriem noteiktas ticamas log Pow vērtības, pēc tabulām (b) (c) vai pašu veiktos eksperimentos. Šādus fragmentus (piemēram, heterocikli, antrahinons, azobenzols) pēc tam var apvienot ar Henša π vērtībām vai Rekera vai Leo fragmentu konstantēm.
Piezīmes
i) Aprēķinu metodes var izmantot tikai daļēji vai pilnīgi jonizētiem savienojumiem, kad ir iespējams ņemt vērā vajadzīgos korekcijas koeficientus.
ii) Ja iespējams, ka savienojumā ir iekšmolekulāras ūdeņraža saites, jāpievieno attiecīgie korekcijas locekļi (apmēram + 0,6 līdz + 1,0 log Pow vienības) (a). Norādes par šādu saišu esamību var iegūt pēc molekulu struktūras telpiskajiem modeļiem vai spektroskopijas datiem.
iii) Ja savienojumam iespējamas vairākas tautomērās formas, aprēķinus izdara pēc iespējamākās no tām.
iv) Uzmanīgi jāseko struktūrfragmentu konstanšu tabulu pārskatīšanai.
Pārskats
Izmantojot aprēķinu/novērtēšanas metodes, testēšanas pārskatā, ja iespējams, iekļauj šādu informāciju:
— vielas apraksts (maisījums, piemaisījumi u. c.),
— norādes uz iespējamajām iekšmolekulārajām saitēm, disociāciju, lādiņu un dažādiem citiem neraksturīgiem efektiem (piemēram, tautomēriju),
— aprēķinu metodes apraksts,
— datubāzes identifikācija vai izmantotie dati,
— struktūrfragmentu izraudzīšanās īpatnības,
— aprēķinu sīka dokumentēšana.
LITERATŪRA
(a) W.J. Lyman, W.F. Reehl and D.H. Rosenblatt (ed.), Handbook of Chemical Property Estimation Methods, McGraw-Hill, New York, 1983.
(b) Pomona College, Medicinal Chemistry Project, Claremont, California 91711, USA, Log P Database and Med. Chem. Software (Program CLOGP-3).
(c) C. Hansch, A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979.
(d) A. Leo, C. Hansch, D. Elkins, Chem. Rev., 1971, Vol. 71, p. 525.
(e) R.F. Rekker, H.M. de Kort, Eur. J. Med. Chem. -Chill. Ther. 1979, Vol. 14, p. 479.
(f) T. Fujita, J. Iwasa and C. Hansch, J. Amer. Chem. Soc., 1964, Vol. 86, p. 5175.
(g) R.F. Rekker, The Hydrophobic Fragmental Constant, Pharmacochemistry Library, Elsevier, New York, 1977, Vol. 1.
(h) C.V. Eadsforth, P. Moser, Chemosphere, 1983, Vol. 12, p. 1459.
(i) R.A. Scherrer, ACS, American Chemical Society, Washington D.C., 1984, Symposium Series 255, p. 225.
2. Papildinājums
Augstas izšķirtspējas šķidruma hromatogrāfijai ieteicamās standartvielas
|
Nr. |
Standartviela |
log Pow |
pKa |
|
1. |
2-Butanons |
0,3 |
|
|
2. |
4-Acetilpiridīns |
0,5 |
|
|
3. |
Anilīns |
0,9 |
|
|
4. |
Acetanilīds |
1,0 |
|
|
5. |
Benzilspirts |
1,1 |
|
|
6. |
p-Metoksifenols |
1,3 |
pKa = 10,26 |
|
7. |
Fenoksietiķskābe |
1,4 |
pKa = 3,12 |
|
8. |
Fenols |
1,5 |
pKa = 9,92 |
|
9. |
2,4-Dinitrofenols |
1,5 |
pKa = 3,96 |
|
10. |
Benzonitrils |
1,6 |
|
|
11. |
Fenilacetonitrils |
1,6 |
|
|
12. |
4-Metilbenzilspirts |
1,6 |
|
|
13. |
Acetofenons |
1,7 |
|
|
14. |
2-Nitrofenols |
1,8 |
pKa = 7,17 |
|
15. |
3-Nitrobenzoskābe |
1,8 |
pKa = 3,47 |
|
16. |
4-Hloranilīns |
1,8 |
pKa = 4,15 |
|
17. |
Nitrobenzols |
1,9 |
|
|
18. |
Kanēļspirts |
1,9 |
|
|
19. |
Benzoskābe |
1,9 |
pKa = 4,19 |
|
20. |
p-Krezols |
1,9 |
pKa = 10,17 |
|
21. |
Kanēļskābe |
2,1 |
pKa = 3,89 cis 4,44 trans |
|
22. |
Anizols |
2,1 |
|
|
23. |
Metilbenzoāts |
2,1 |
|
|
24. |
Benzols |
2,1 |
|
|
25. |
3-Metilbenzoskābe |
2,4 |
pKa = 4,27 |
|
26. |
4-Hlorfenols |
2,4 |
pKa = 9,1 |
|
27. |
Trihloretilēns |
2,4 |
|
|
28. |
Atrazīns |
2,6 |
|
|
29. |
Etilbenzoāts |
2,6 |
|
|
30. |
2,6-Dihlorbenzonitrils |
2,6 |
|
|
31. |
3-Hlorbenzoskābe |
2,7 |
pKa = 3,82 |
|
32. |
Toluols |
2,7 |
|
|
33. |
1-Naftols |
2,7 |
pKa = 9,34 |
|
34. |
2,3-Dihloranilīns |
2,8 |
|
|
35. |
Hlorbenzols] |
2,8 |
|
|
36. |
Alilfenilēteris |
2,9 |
|
|
37. |
Brombenzols |
3,0 |
|
|
38. |
Etilbenzols |
3,2 |
|
|
39. |
Benzofenons |
3,2 |
|
|
40. |
4-Fenilfenols |
3,2 |
pKa = 9,54 |
|
41. |
Timols |
3,3 |
|
|
42. |
1,4-Dihlorbenzols |
3,4 |
|
|
43. |
Difenilamīns |
3,4 |
pKa = 0,79 |
|
44. |
Naftalīns |
3,6 |
|
|
45. |
Fenilbenzoāts |
3,6 |
|
|
46. |
Izopropilbenzols |
3,7 |
|
|
47. |
2,4,6-Trihlorfenols |
3,7 |
pKa = 6 |
|
48. |
Bifenils |
4,0 |
|
|
49. |
Benzilbenzoāts |
4,0 |
|
|
50. |
2,4-Dinitro-6 sec. butilfenols |
4,1 |
|
|
51. |
1,2,4-Trihlorbenzols |
4,2 |
|
|
52. |
Dodekānskābe |
4,2 |
|
|
53. |
Difenilēteris |
4,2 |
|
|
54. |
n-Butilbenzols |
4,5 |
|
|
55. |
Fenantrēns |
4,5 |
|
|
56. |
Fluorantrēns |
4,7 |
|
|
57. |
Dibenzils |
4,8 |
|
|
58. |
2,6-Difenilpiridīns |
4,9 |
|
|
59. |
Trifenilamīns |
5,7 |
|
|
60. |
DDT |
6,2 |
|
|
Citas standartvielas ar zemu log Pow vērtību |
|||
|
1. |
Nikotīnskābe |
- 0,07 |
|
A.9. UZLIESMOŠANAS TEMPERATŪRA
1. METODE
1.1. IEVADS
Pirms šīs pārbaudes veikšanas ir lietderīgi jau iepriekš iegūt informāciju par vielas uzliesmojamību. Šī metode ir izmantojama šķidrumiem, kuru tvaiki var uzliesmot aizdegšanās avotu ietekmē. Ar šeit aplūkotajām noteikšanas metodēm var iegūt ticamus rezultātus tikai tajā uzliesmošanas temperatūras diapazonā, kas noteikts katrai atsevišķai metodei.
Izraugoties noteikšanas metodi, jāņem vērā iespējas notikt ķīmiskām reakcijām starp vielu un paraugu turētāju.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Uzliesmošanas temperatūra ir zemākā atmosfēras spiedienam 101,325 kPa koriģētā temperatūra, kurā testēšanas metodē definētajos apstākļos no šķidruma izdalās tvaiki tādā daudzumā, ka testēšanas traukā veidojas uzliesmojošs tvaika/gaisa maisījums.
Mērvienības: oC
t = T – 273,15
(t atbilst oC, bet T norādīts K mērvienībās)
1.3. STANDARTVIELAS
Testējot jaunu vielu, ne visos gadījumos jāizmanto standartvielas. Tās galvenokārt izmanto metodes izpildījuma periodiskām pārbaudēm un pēc dažādām metodēm iegūto rezultātu salīdzināšanai.
1.4. METODES PRINCIPS
Vielu pārnes testēšanas traukā un silda vai dzesē līdz testēšanas temperatūrai konkrētajā testēšanas metodē noteiktajā kārtībā. Lai pārliecinātos, vai paraugs testēšanas temperatūrā aizdegas, veic aizdedzināšanas mēģinājumus.
1.5. KVALITĀTES KRITĒRIJI
1.5.1. Atkārtojamība
Atkārtojamība ir atkarīga no uzliesmošanas temperatūras intervāla un izmantotās noteikšanas metodes; līdz 2 oC.
1.5.2. Jutība
Jutība ir atkarīga no izmantotās noteikšanas metodes.
1.5.3. Specifiskums
Dažas noteikšanas metodes izmantojamas tikai noteiktā uzliesmošanas temperatūras diapazonā un ir atkarīgas no vielas īpašībām (piemēram, no viskozitātes).
1.6. METODES APRAKSTS
1.6.1. Sagatavošanās
Testējamās vielas paraugu ievieto noteikšanas iekārtā saskaņā ar 1.6.3.1. un/vai 1.6.3.2. punktu.
Drošības labad, testējot stipri iedarbīgas vai toksiskas vielas, ieteicams izmantot nelielu paraugu – apm. 2 cm3.
1.6.2. Noteikšanas apstākļi
Ciktāl tas atbilst drošības prasībām, aparātam jāatrodas vietā, kur nedarbojas velkme un kas ir pasargāta no caurvēja.
1.6.3. Noteikšana
1.6.3.1. Līdzsvara metode
Skatīt standartus ISO 1516, ISO 3680, ISO 1523, ISO 3679.
1.6.3.2. Bezlīdzsvara metode
Skatīt BS 2000 (170. daļa), NF M07-011, NF T66-009.
Skatīt standartus EN 57, DIN 51755 1. daļu (temperatūras diapazons 5–65 oC), DIN 51755 2. daļu (temperatūra zem 5 oC), NF M07-036.
Skatīt ASTM D 56.
Skatīt standartus ISO 2719, EN 11, DIN 51758, ASTM D 93, BS 2000-34, NF M07-019.
Ja ar 1.6.3.2. punktā minēto bezlīdzsvara metodi noteiktā uzliesmošanas temperatūra ir 0 ± 2 oC, 21 ± 2 oC, 55 ± 2 oC, tā jāapstiprina ar līdzsvara metodi, izmantojot to pašu iekārtu.
Publicēšanai izmantojamas tikai tādas noteikšanas metodes, pēc kurām var sasniegt uzliesmošanas temperatūru.
Uzliesmošanas temperatūras noteikšanai viskoziem šķidrumiem (krāsām, sveķiem u. c.), kas satur šķīdinātājus, jālieto tikai tādas iekārtas un noteikšanas metodes, kuras ir izmantojamas viskozu šķidrumu uzliesmošanas temperatūras noteikšanai.
Skatīt standartus ISO 3679, ISO 3680, ISO 1523, DIN 53213 1. daļu.
2. IEGŪTIE DATI
3. PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— precīzs vielas apraksts (identifikācija un piemaisījumi),
— izmantotā metode, kā arī pieļautās atkāpes no tajā noteiktajām prasībām,
— rezultāti un papildu piezīmes, kas vajadzīgas rezultātu interpretācijai.
4. IZMANTOTĀ LITERATŪRA
Nav.
A.10. UZLIESMOŠANAS SPĒJA (CIETAS VIELAS)
1. METODE
1.1. IEVADS
Pirms šīs pārbaudes veikšanas ir lietderīgi jau iepriekš iegūt informāciju par testējamās vielas iespējamo sprādzienbīstamību.
Šī metode izmantojama tikai pulverveida, granulu un pastveida vielu uzliesmošanas spējas noteikšanai.
Lai nebūtu jāiekļauj visas vielas, kuras var aizdegties, bet tikai tās, kuras ātri uzliesmo vai kuru degšanas process ir īpaši bīstams, uzskata, ka pie viegli uzliesmojošām vielām pieskaitāmas tikai tādas vielas, kuru degšanas ātrums pārsniedz noteiktu robežvērtību.
Tas var būt īpaši bīstami, ja kvēlošana izplatās cauri metāla pulverim tāpēc, ka uguns ir grūti nodzēšama. Metālu pulveri jāuzskata par ļoti uzliesmojošiem, ja to masā noteiktu laiku notiek kvēlošana.
1.2. DEFINĪCIJA UN MĒRVIENĪBAS
Degšanas ilgumu norāda sekundēs.
1.3. STANDARTVIELAS
Nav norādītas.
1.4. METODES PRINCIPS
Vielu izveido vismaz 250 mm garas nepārtrauktas sloksnes vai pulvera joslas veidā, un vispirms veic orientējošu testu, aizdedzinot ar gāzes degļa liesmu, lai noteiktu, vai uguns izplatās ar liesmu vai gruzdot. Ja uguns 200 mm attālumā izplatās noteiktā laikā, testēšanu veic pēc pilnas programmas, lai noteiktu degšanas ātrumu.
1.5. KVALITĀTES KRITĒRIJI
Nav noteikti.
1.6. METODES APRAKSTS
1.6.1. Orientējoša noteikšana
Uz nedegošas pamatplates no materiāla bez porām un zemu siltumvadītspēju vielu izveido vismaz 250 mm garas, 20 mm platas un 10 mm nepārtrauktas sloksnes vai pulvera joslas veidā. Pulvera joslu vienā galā dedzina ar karstu gāzes degļa liesmu (minimālais diametrs – 5 mm), līdz pulveris aizdegas, bet ne ilgāk par 2 minūtēm (5 minūtes metālu vai metālu sakausējumu pulveriem). Jānovēro, vai uguns 200 mm joslā izplatās 4 minūšu laikā (40 minūšu laikā metālu pulveriem). Ja viela neaizdegas un uguns neizplatās, degot ar liesmu vai gruzdot 200 mm garumā 4 minūšu (vai 40 minūšu) testēšanas laikā, viela nav uzskatāma par viegli uzliesmojošu un tā vairs nav jātestē. Ja vielā izplatās uguns pulvera joslā 200 mm garumā par 4 minūtēm īsākā laikā vai ātrāk nekā 40 minūtēs metāla pulveros, jāveic turpmāk aprakstītā procedūra (1.6.2. un turpmākajos punktos).
1.6.2. Degšanas ātruma noteikšana
1.6.2.1. Sagatavošana
Pulverveida vielas vai vielas granulu veidā nesablīvējot iepilda 250 mm garā veidnē ar trijstūra šķērsgriezumu, kuras iekšējais augstums ir 10 mm, bet platums – 20 mm. Veidnes abās pusēs garenvirzienā sānu norobežošanai piestiprina divas metāla plāksnes, kuras izvirzītas 2 mm virs trijstūra šķērsgriezuma (skatīt attēlu). Tad veidni ar pārbaudāmo vielu trīs reizes met uz cietas virsmas no 2 cm augstuma. Vajadzības gadījumā veidni pēc tam atkal piepilda. Tad noņem sānu norobežojumus un vielas pārākumu noņem. Veidnei uzliek pamatplati no nedegama materiāla bez porām un zemu siltuma vadītspēju, apgriež otrādi un veidni noņem.
Pastveida vielas izlīdzina uz pamatplates no nedegama materiāla bez porām un zemu siltuma vadītspēju 250 mm gara valnīša veidā ar apmēram 1 cm2 šķērsgriezumu.
1.6.2.2. Pārbaudes apstākļi
Higroskopiskas vielas pārbauda cik vien ātri iespējams, uzreiz pēc izņemšanas no taras.
1.6.2.3. Pārbaudes norise
Pārbaudāmās vielas valnīti ievieto velkmes skapī perpendikulāri gaisa plūsmai.
Gaisa plūsmas ātrumu noteikšanas laikā izmainīt nedrīkst, un tam jābūt pietiekami lielam, lai dūmi neiekļūtu laboratorijā. Ap iekārtu jānovieto ekrāns, kas to aizsargā no gaisa plūsmas.
Valnīti no viena gala aizdedzina ar karstu gāzes degļa liesmu (minimālais diametrs – 5 mm). Kad valnītis nodedzis 80 mm garumā, reģistrē nākamo 100 mm degšanas ilgumu.
Noteikšanu veic sešas reizes, katru reizi ņemot jaunu tīru plati, ja pozitīvs rezultāts netiek novērots ātrāk.
2. DATI
Novērtēšanai izmanto orientējošā izmēģinājumā (1.6.1.) noteikto degšanas ilgumu un īsāko no sešās noteikšanas reizēs (1.6.2.3.) noteiktajiem degšanas ilgumiem.
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— precīzs vielas apraksts (raksturojums un piemaisījumi),
— testējamās vielas apraksts, tās fizikālais stāvoklis un mitruma saturs,
— skrīninga orientējošās testēšanas rezultāti un degšanas ātrums, ja tas noteikts,
— visas papildu piezīmes, kas attiecas uz rezultātu interpretāciju.
3.2. REZULTĀTU INTERPRETĀCIJA
Pulverveida, granulētas un pastveida vielas uzskatāmas par viegli uzliesmojošām, ja degšanas laiks, kas noteikts pēc 1.6.2. punktā aprakstītās procedūras, ir mazāks par 45 sekundēm. Metālu vai to sakausējumu pulveri ir pieskaitāmi pie viegli uzliesmojošām vielām, ja tie spēj aizdegties un liesma vai reakcijas zona aptver visu paraugu ne ilgāk kā 10 minūtēs.
4. IZMANTOTĀ LITERATŪRA
NF T 20-042 (September 85). Chemical products for industrial use. Determination of the flammability of solids.
Papildinājums
Attēls
Veidne un papildu aprīkojums degšanas ilguma noteikšanai
(Visi izmēri norādīti milimetros)
A.11. UZLIESMOŠANAS SPĒJA (GĀZĒM)
1. METODE
1.1. IEVADS
Pēc šīs metodes nosaka, vai gāzu maisījumi ar gaisu istabas temperatūrā (apm. 20 oC) un atmosfēras spiedienā ir uzliesmojoši un, ja tie ir uzliesmojoši, tad kādā koncentrāciju intervālā. Palielinot testējamās gāzes koncentrāciju gaisā, pārbauda, kā maisījums reaģē uz elektrisku dzirksteli, un novēro, vai notiek aizdegšanās.
1.2. DEFINĪCIJA UN MĒRVIENĪBAS
Uzliesmošanas intervāls ir koncentrāciju intervāls starp apakšējo un augšējo sprādzienbīstamības robežu. Apakšējā un augšējā sprādzienbīstamības robeža ir uzliesmojošas gāzes tāda robežkoncentrācija gaisā, kurā liesma tālāk neizplatās.
1.3. STANDARTVIELAS
Nav noteiktas.
1.4. METODES PRINCIPS
Gāzes koncentrāciju gaisā pakāpeniski palielina un pēc katras palielināšanas pārbauda, kā maisījums reaģē uz elektrisku dzirksteli.
1.5. KVALITĀTES KRITĒRIJI
Nav noteikti.
1.6. TESTA METODES APRAKSTS
1.6.1. Aprīkojums
Testēšanas trauks ir otrādi apgriezts stikla cilindrs ar minimālo iekšējo diametru 50 mm un minimālo augstumu 300 mm. Attālums starp aizdedzināšanas elektrodiem ir 3 līdz 5 mm, un tie novietoti 60 mm attālumā no cilindra apakšas. Cilindrs ir aprīkots ar liekā spiediena vārstuli. Iekārta ir jānodrošina ar aizsargvairogu, lai samazinātu sprādziena radītos bojājumus.
Kā aizdegšanās avots kalpo indukcijas dzirkstele, kuras ilgums ir 0,5 s un ko ģenerē augstsprieguma transformators ar izejas spriegumu 10–15 kV (maksimālā ieejas jauda 300 W). Noteikšanai piemērota aparatūra aprakstīta (2).
1.6.2. Pārbaudes apstākļi
Testēšanu veic istabas temperatūrā (apm. 20 oC).
1.6.3. Pārbaudes norise
Ar dozētājsūkņa palīdzību stikla cilindrā ievada noteiktas koncentrācijas gāzes un gaisa maisījumu. Maisījumā uzšķiļ dzirksteli un novēro, vai liesma spēj atdalīties no aizdegšanās avota un patstāvīgi izplatīties tālāk. Gāzes koncentrāciju pakāpeniski palielina par 1 tilp. %, līdz notiek aizdegšanās iepriekš aprakstītajā veidā.
Ja gāzveida vielas ķīmiskā struktūra liecina, ka tā varētu nebūt uzliesmojoša, un ir iespējams aprēķināt stehiometrisko attiecību maisījumam ar gaisu, pakāpeniski ar soli 1 tilp. % testē maisījumus, kuru koncentrācija ir 10 % virs un zem stehiometriskās attiecības.
2. DATI
Liesmas izplatīšanās ir vienīgais drošais rādītājs šīs īpašības noteikšanai.
3. PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— precīzs vielas apraksts (raksturojums un piemaisījumi),
— izmantotās iekārtas apraksts, norādot tās izmērus,
— temperatūra, kurā veikta testēšana,
— pārbaudītās koncentrācijas un iegūtie rezultāti,
— pārbaudes rezultāts: gāze nav uzliesmojoša vai ir viegli uzliesmojoša,
— ja izdarīts secinājums, ka gāze nav uzliesmojoša, norāda koncentrāciju intervālu, kurā tā testēta ar soli 1 tilp. %,
— protokolā jānorāda informācija un piezīmes, kas attiecas uz rezultātu interpretāciju.
4. IZMANTOTĀ LITERATŪRA
(1) NF T 20-041 (SEPT 85). Chemical products for industrial use. Determination of the flammability of gases.
(2) W.Berthold, D.Conrad, T.Grewer, H.Grosse – einer Standard-Apparatur zur Messung von Explosionsgrenzen. Chem.-Ing. – Tech. 1984, Vol. 56, 2, p. 126–127. Wortmann, T.Redeker und H.Schacke. Entwicklung.
A.12. UZLIESMOŠANAS SPĒJA (KONTAKTĀ AR ŪDENI)
1. METODE
1.1. IEVADS
Ar šo metodi var noteikt, vai, vielai reaģējot ar ūdeni, bīstamā daudzumā izdalās viegli uzliesmojošas gāzes.
Šo metodi var izmantot gan cietu vielu, gan šķidrumu uzliesmošanas spējas noteikšanai. Šī metode nav izmantojama tādu vielu testēšanai, kuras spontāni aizdegas saskarē ar gaisu.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Viegli uzliesmojošas vielas: vielas, kas saskarē ar ūdeni vai mitru gaisu izdala viegli uzliesmojošas gāzes bīstamā daudzumā vismaz 1 l/kg stundā.
1.3. METODES PRINCIPS
Vielu testē posmos turpmāk aprakstītajā secībā; ja notiek aizdegšanās, testēšana nākamajos posmos nav jāturpina. Ja zināms, ka viela ar ūdeni strauji nereaģē, testēšanu veic, kā aprakstīts 4. posmā (1.3.4.).
1.3.1. 1. posms
Testējamo vielu ievieto tvertnē ar destilētu ūdeni 20 oC temperatūrā un pārbauda, vai izdalījusies gāze aizdegas.
1.3.2. 2. posms
Testējamo vielu uzliek uz filtrpapīra, kas peld traukā ar destilētu ūdeni 20 oC temperatūrā, un pārbauda, vai izdalījusies gāze aizdegas. Filtrpapīru izmanto tikai tāpēc, lai viela būtu vienkopus, kas palielina aizdegšanās iespējamību.
1.3.3. 3. posms
No testējamās vielas izveido apmēram 2 cm augstu kaudzīti 3 cm diametrā. Uz kaudzītes uzpilina ūdeni un pārbauda, vai izdalījusies gāze aizdegas.
1.3.4. 4. posms
Testējamo vielu sajauc ar destilētu ūdeni 20 oC temperatūrā un septiņu stundu laikā ik pēc stundas mēra gāzes izdalīšanās ātrumu. Ja gāze izdalās nevienmērīgi vai izdalīšanās ātrums pēc 7 stundām palielinās, mērījumu ilgums jāpagarina, bet ne vairāk kā līdz 5 dienām. Testēšanu var pārtraukt jebkurā laikā, kad gāzes izdalīšanās ātrums kļūst lielāks par 1 l/kg stundā.
1.4. STANDARTVIELAS
Nav noteiktas.
1.5. KVALITĀTES KRITĒRIJI
Nav noteikti.
1.6. METODES APRAKSTS
1.6.1. 1. posms
1.6.1.1. Pārbaudes apstākļi
Testēšanu veic istabas temperatūrā (apm. 20 oC).
1.6.1.2. Pārbaudes norise
Nelielu daudzumu (ap 2 mm diametrā) testējamās vielas ievieto tvertnē ar destilētu ūdeni. Novēro, vai i) izdalās gāze un vai ii) notiek gāzes aizdegšanās. Ja novēro gāzes aizdegšanos, turpmāka vielas testēšana nav nepieciešama, jo tad tā ir pieskaitāma bīstamām vielām.
1.6.2. 2. posms
1.6.2.1. Aprīkojums
Jebkurā piemērotā traukā, piemēram, iztvaicēšanas bļodiņā (diametrs 100 mm) ar destilētu ūdeni, uz ūdens virsmas uzliek filtrpapīru.
1.6.2.2. Pārbaudes apstākļi
Testēšanu veic istabas temperatūrā (apm. 20 oC).
1.6.2.3. Pārbaudes norise
Nelielu daudzumu testējamās vielas (ap 2 mm diametrā) novieto filtrpapīra vidū. Novēro, vai i) izdalās gāze un vai ii) notiek gāzes aizdegšanās. Ja novēro gāzes aizdegšanos, turpmāka vielas testēšana nav nepieciešama, jo tad tā ir pieskaitāma bīstamām vielām.
1.6.3. 3. posms
1.6.3.1. Pārbaudes apstākļi
Testēšanu veic istabas temperatūrā (apm. 20 oC).
1.6.3.2. Pārbaudes norise
No testējamās vielas izveido apmēram 2 cm augstu kaudzīti (3 cm diametrā) ar iedobi virsējā daļā. Šajā iedobē iepilina ūdeni un novēro, vai i) izdalās gāze un vai ii) notiek gāzes aizdegšanās. Ja novēro gāzes aizdegšanos, turpmāka vielas testēšana nav nepieciešama, jo tad tā pieskaitāma bīstamām vielām.
1.6.4. 4. posms
1.6.4.1. Aprīkojums
Sastāda attēlā parādīto aparātu.
1.6.4.2. Pārbaudes apstākļi
Jāpārliecinās, ka pārbaudāmās vielas iepakojums nesatur pulveri (daļiņu lielums < 500 μm). Ja pulveris veido vairāk nekā 1 tilp. % no kopējā daudzuma vai ja paraugs ir sagulējies, tas pirms testēšanas jāsaberž pulverī, lai samazinātu daļiņu lielumu uzglabāšanas laikā un pirms izmantošanas; citādi viela jātestē veidā, kādā tā saņemta bez papildu sagatavošanas. Testēšana jāveic istabas temperatūrā (20 oC) un atmosfēras spiedienā.
1.6.4.3. Pārbaudes norise
Aparāta pilināmajā piltuvē ielej 10 līdz 20 ml ūdens, bet koniskajā kolbā pārnes 10 g testējamās vielas. Ar jebkuriem piemērotiem līdzekļiem mēra izdalījušās gāzes tilpumu. Koniskajā kolbā ielaiž ūdeni, atverot pilināmās piltuves krānu, un iedarbina hronometru. Izdalījušās gāzes daudzumu septiņu stundu laikā mēra ik pēc stundas. Ja šajā laikā izdalītais gāzes daudzums mainās vai arī minētā perioda beigās gāzes izdalīšanās ātrums palielinās, mērījumi jāturpina līdz piecām dienām. Ja mērījumu laikā gāzes izdalīšanās ātrums pārsniedz 1 l/kg stundā, testēšanu var pārtraukt. Testēšana jāveic trīs reizes.
Ja gāzes ķīmiskais sastāvs nav zināms, jāveic tās analīze. Ja gāze satur viegli uzliesmojošus komponentus un nav zināms, vai arī pats maisījums ir viegli uzliesmojošs, jāpagatavo tāda paša sastāva maisījums un tas jāpārbauda pēc A.11. nodaļā aprakstītās metodes.
2. DATI
Viela uzskatāma par bīstamu, ja:
— kādā testēšanas posmā notiek tā pašaizdegšanās
— vai
— izdalās uzliesmojoša gāze ar ātrumu, kas ir lielāks par 1 l/kg vielas stundā.
3. PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— precīzs vielas apraksts (raksturojums un piemaisījumi),
— sīkas ziņas par testējamās vielas sagatavošanu uzliesmošanas spējas noteikšanai,
— testēšanas rezultāti (1., 2., 3. un 4. posmā),
— izdalījušās gāzes sastāvs,
— gāzes izdalīšanās ātrums, ja veikts testēšanas 4. posms (1.6.4.),
— jebkuras papildu piezīmes, kas attiecas uz rezultātu interpretāciju.
4. IZMANTOTĀ LITERATŪRA
(1) Recommendations on the transport of dangerous goods, test and criteria, 1990, United Nations, New York.
(2) NF T 20-040 (September 85). Chemical products for industrial use. Determination of the flammability of gases formed by the hydrolysis of solid and liquid products.
Papildinājums
Attēls
Aprīkojums

A.13. CIETVIELU UN ŠĶIDRUMU PIROFORĀS ĪPAŠĪBAS
1. METODE
1.1. IEVADS
Testēšanas metode izmantojama cietvielām un šķidrām vielām, kurām nelielos daudzumos pēc saskares ar gaisu istabas temperatūrā (apm. 20 oC) notiek to pašaizdegšanās.
Šo metodi neizmanto vielām, kurām, lai notiku pašaizdegšanās, jāatrodas kontaktā ar gaisu istabas temperatūrā vai paaugstinātā temperatūrā vairākas stundas vai dienas.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Uzskata, ka vielas ir piroforas, ja tās 1.6. punktā aprakstītajos apstākļos aizdegas vai izraisa pārogļošanos.
Var būt vajadzīgs noteikt šķidrumu pašaizdegšanās spēju pēc metodes A.15. “Pašaizdegšanās temperatūra (šķidrumiem un gāzēm)”.
1.3. STANDARTVIELAS
Nav norādītas.
1.4. METODES PRINCIPS
Cietvielu vai vielu, kas ir šķidruma veidā, pievieno inertam nesējam un uz piecām minūtēm istabas temperatūrā novieto saskarē ar gaisu. Ja vielas, kas ir šķidrumi, neaizdegas, tās absorbē uz filtrpapīra un piecas minūtes istabas temperatūrā (apm. 20 oC) novieto saskarē ar gaisu. Ja cietviela vai šķidrums aizdegas vai pārogļo filtrpapīru, viela uzskatāma par piroforu.
1.5. KVALITĀTES KRITĒRIJI
Atkārtojamība: drošības apsvērumu dēļ viela tiek uzskatīta par piroforu, ja tiek iegūts viens pozitīvs rezultāts.
1.6. TESTĒŠANAS METODES APRAKSTS
1.6.1. Aprīkojums
Istabas temperatūrā (apm. 20 oC) porcelāna bļodiņā (diametrs apm. 10 cm) iepilda diatomītu, lai tā augstums būtu aptuveni 5 mm.
Piezīme
Diatomītu vai kādu citu līdzīgu, viegli pieejamu inertu vielu izmanto par augsnes aizstājēju, modelējot augsnes piesārņošanu ar pārbaudāmo vielu avārijas gadījumā.
Sauss filtrpapīrs vajadzīgs tādu šķidrumu testēšanai, kuri uz inerta nesēja neaizdegas kontaktā ar gaisu.
1.6.2. Noteikšana
a) Pulverveida cietvielas
Pulverveida vielu (1–2 cm3) ber no aptuveni 1 m augstuma uz ugunsdrošas virsmas un novēro, vai tā aizdegas krītot vai piecu minūšu laikā pēc nosēšanās.
Ja nenotiek aizdegšanās, mēģinājumu atkārto sešas reizes.
b) Šķidrumi
Pārbaudāmo šķidrumu (apm. 5 cm3) lej iepriekš sagatavotā porcelāna bļodiņā un piecas minūtes novēro, vai šī viela aizdegas.
Ja sešos mēģinājumos aizdegšanās nenotiek, veic šādas pārbaudes:
ar šļirci 0,5 ml testējamā parauga pārnes uz robota filtrpapīra un novēro, vai pēc tam piecu minūšu laikā notiek filtrpapīra aizdegšanās vai pārogļošanās. Ja nenotiek aizdegšanās vai pārogļošanās, mēģinājumu atkārto trīs reizes.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Pārbaudi var pārtraukt, tiklīdz kādā no pārbaudēm iegūst pozitīvu rezultātu.
2.2. NOVĒRTĒŠANA
Viela uzskatāma par piroforu, ja viela piecu minūšu laikā pēc pievienošanas inertam nesējam gaisā aizdegas vai šķidra viela pārogļo vai aizdedzina filtrpapīru gaisa klātienē piecās minūtēs pēc tās uznešanas filtrpapīram.
3. PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— precīzs vielas apraksts (raksturojums un piemaisījumi),
— testēšanas rezultāti,
— jebkuras papildu piezīmes, kas attiecas uz rezultātu interpretāciju.
4. IZMANTOTĀ LITERATŪRA
(1) NF T 20-039 (September 85). Chemical products for industrial use. Determination of the spontaneous flammability of solids and liquids.
(2) Recommendations on the Transport of Dangerous Goods, Test and criteria, 1990, United Nations, New York.
A.14 . SPRĀDZIENBĪSTAMĪBA
1. METODE
1.1. IEVADS
Metodē aprakstīta testēšanas shēma, pēc kuras nosaka cietvielu un pastveida vielu sprādzienbīstamību, uz tām iedarbojoties liesmai (termiskā jutība) vai triecieniem vai berzei (jutība uz mehānisku iedarbību), un šķidru vielu sprādzienbīstamību, uz tām iedarbojoties ar liesmu vai triecienu.
Metode paredz trīs dažādas pārbaudes:
a) termiskās jutības pārbaudi (1);
b) trieciena iedarbības mehāniskās jutības pārbaudi (1);
c) berzes iedarbības mehāniskās jutības pārbaudi (1).
Ar šo metodi var iegūt datus, kas ļauj novērtēt eksplozijas iespējamību dažu plaši izplatītu faktoru ietekmē. Metode nav paredzēta, lai noteiktu, vai viela ir sprādzienbīstama jebkuros apstākļos.
Metode piemērota, lai noteiktu vielas sprādzienbīstamību (termisko jutību un jutību uz mehānisko iedarbību) konkrētos apstākļos, kas norādīti direktīvā. Tā pamatojas uz pasaulē plaši izmantotiem vairāku veidu aparātiem, ar kuriem iegūst ticamus rezultātus. Tajā pašā laikā ir jāatzīst, ka šī metode nesniedz galīgu atbildi. Var izmantot ne tikai šeit noteiktos, bet arī citus aparātus, ja tie ir starptautiski atzīti un ar tiem iegūtie rezultāti korelē ar rezultātiem, kuri iegūti ar šeit noteiktajiem aparātiem.
Testēšana nav jāveic gadījumos, kad ir pieejami termodinamiskie dati (piemēram, rašanās siltums, sadalīšanās siltums) un/vai molekulā nav dažas reaģētspējīgas grupas (2), kas dod pietiekamu pamatu uzskatīt, ka viela nevar strauji sadalīties, izdalot gāzes vai siltumenerģiju (t. i., viela nav sprādzienbīstama). Šķidrumiem nav jāveic tests mehāniskajai jutībai uz berzes iedarbību.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Sprādzienbīstamas vielas:
vielas, kuras var eksplodēt, uz tām iedarbojoties liesmai, vai kuras ir jutīgas pret trieciena vai berzes iedarbību noteiktajā aparatūrā (vai kuras ir jutīgākas uz mehānisko iedarbību nekā 1,3-dinitrobenzols alternatīvā aparatūrā).
1.3. STANDARTVIELAS
Berzes un trieciena iedarbības noteikšanai: 1,3-dinitrobenzols, tehnisks kristālisks produkts, kas iziet cauri 0,5 mm sietam.
Berzes un trieciena iedarbības testēšanas otrajai sērijai: perhidro-l,3,5-trinitro-l,3,5-triazīns (RDX, heksogēns, ciklonīts – CAS 121-82-4), pārkristalizēts no cikloheksanona šķīduma ūdenī, un kas mitrā veidā sijājot iziet cauri a 250 μm sietam un paliek uz 150 μm sieta, žāvēts 103 ± 2 oC temperatūrā (četras stundas).
1.4. METODES PRINCIPS
Drošu apstākļu noskaidrošanai, testējot jutību pret triju veidu iedarbību, vispirms jāveic orientējošas pārbaudes.
1.4.1. Drošas apiešanās pārbaudes (3)
Pirms veikt galvenās pārbaudes, drošības apsvērumu dēļ ļoti mazus vielas paraugus (apm. 10 mg) vaļējā veidā silda gāzes degļa liesmā, pakļauj trieciena iedarbībai, izmantojot āmuru un laktu, un berzes iedarbībai jebkāda veida berzes iekārtā. Tas nepieciešamas, lai noskaidrotu, vai viela ir tik jutīga un sprādzienbīstama, ka noteiktie jutības testi, jo īpaši jutība pret paaugstinātas temperatūras iedarbību, ir tik liela, ka jāveic piesardzības pasākumi, lai to laikā neciestu operators.
1.4.2. Termiskā jutība
Pēc šīs metodes vielu karsē tērauda caurulē, kas noslēgta ar plāksnēm, kurās ir dažāda diametra atveres, lai noteiktu, vai viela var eksplodēt, intensīvi sildot definēti norobežotā telpā.
1.4.3. Mehāniskā jutība (pret triecienu)
Pēc šīs metodes vielu pakļauj trieciena iedarbībai, ko rada noteikta lieluma masa, krītot no noteikta augstuma.
1.4.4. Mehāniskā jutība (pret berzi)
Pēc šīs metodes cietvielu vai pastveida vielu pakļauj berzei starp standartvirsmām, ievērojot norādītos slodzes un savstarpējās kustības apstākļus.
1.5. KVALITĀTES KRITĒRIJI
Nav noteikti.
1.6. METODES APRAKSTS
1.6.1. Termiskā jutība (pret liesmas iedarbību)
1.6.1.1. Aprīkojums
Aparāts sastāv no vienreizlietojamas tērauda caurules un atkārtoti izmantojamas noslēgierīces (1. attēls), kas uzstādīta sildierīcei un aizsargierīcei. Caurule ir izvilkta no lokšņu tērauda (skatīt papildinājumu), un tās iekšējais diametrs ir 24 mm, garums 75 mm un sieniņu biezums 0,5 mm. Caurules vaļējam galam ir atloks, pie kura stiprina mezglu, kurā ietilpst plāksne ar atverēm. Tas sastāv no spiedienizturīgas plāksnes ar atverēm, kurā ir centrālā atvere un kura stingri piestiprināta caurulei ar divdaļīgu skrūvju savienojumu (uzgrieznis un vītņsavienojums). Uzgrieznis un vītņsavienojums izgatavoti no hroma-mangāna tērauda (skatīt papildinājumu), kas nerada dzirksteles līdz 800 oC. Atveres plates ir 6 mm biezas, izgatavotas no karstumizturīga tērauda (skatīt papildinājumu) un ir ar dažādu atveres diametru.
1.6.1.2. Testēšanas apstākļi
Parasti vielu testē tādā paša veidā, kādā tā saņemta, lai gan dažkārt, piemēram, ja tā ir sapresēta, kausēta vai citādi sablīvēta, var būt vajadzīgs vielu pirms testēšanas sasmalcināt.
Cietvielu testēšanai izmantojamā materiāla masu nosaka, izmantojot divpakāpju procedūru pēc sausā paņēmiena. Tarētā caurulē iepilda 9 cm3 vielas, ko sablīvē ar 80 N spēku, ko pieliek visam caurules šķērsgriezumam. Drošības apsvērumu dēļ vai gadījumos, kad parauga fizikālais stāvoklis pēc saspiešanas var izmainīties, var lietot citus uzpildīšanas paņēmienus; piemēram, ja viela ir ļoti jutīga pret berzes iedarbību, to blīvēt nedrīkst. Ja materiāls ir saspiežams, pieliek un sablīvē tā papildu daudzumu, līdz caurule ir piepildīta līdz 55 mm no caurules augšmalas. Nosaka kopējo vielas masu, kas vajadzīga caurules piepildīšanai līdz 55 mm līmenim, un pievieno vēl divas papildu parauga daļas, kuras katru sablīvē ar 80 N spēku. Tad materiālu pēc vajadzības pievieno sablīvējot vai izņem ārā tā, lai caurule būtu piepildīta līdz 15 mm līmenim no augšmalas. Tad veic otru noteikšanu pēc sausā paņēmiena, sākot ar trešdaļu kopējās masas, kas noteikta pirmajā reizē, un to sablīvējot. Pievieno vēl divas parauga daļas, sablīvējot ar 80 N spēku, un vielas līmeni caurulē noregulē līdz 15 mm no augšmalas, pēc vajadzības vielu pievienojot vai izņemot. Katram izmēģinājumam izmanto cietvielas daudzumu, kas noteikts otrajā mēģinājumā pēc sausā paņēmiena; piepildīšanu veic trijās vienādās daļās, katru no tām saspiežot līdz 9 cm3 ar spēku, kas vajadzīgs šādam nolūkam. (To var veikt, izmantojot atstarpes gredzenus.)
Šķidrumus un gelus caurulē iepilda līdz 60 mm augstumam, īpaši raugoties, lai gelos neizveidotos tukšumi. Vītņsavienojumu caurulei uzliek no apakšas, ievieto plāksni ar vajadzīgā lieluma atveri, un pēc ieziešanas ar nelielu daudzumu molibdēna disulfīda ziedes pievelk uzgriezni. Noteikti jāpārbauda, vai testējamā viela nav nokļuvusi starp plāksni un atloku vai uz vītnēm.
Karsēšanai izmanto propānu no gāzes balona, kas aprīkots ar spiediena reduktoru (60 līdz 70 mbar) un plūsmas mērītāju un tiek vienādi padots uz četriem gāzes degļiem (vizuāli novērtējot pēc degļu liesmas). Degļus novieto apkārt testēšanas kamerai, kā parādīts 1. attēlā. Visu četru degļu kopējais propāna patēriņš ir apmēram 3,2 litri propāna minūtē. Var izmantot citas gāzes un citādus degļus, tomēr karsēšanas ātrumam jāatbilst 3. attēlā norādītajam. Visiem aparātiem periodiski jāpārbauda karsēšanas ātrums, izmantojot caurules ar dibutilftalāta pildījumu, kā parādīts 3. attēlā.
1.6.1.3. Pārbaužu norise
Katru noteikšanu veic tik ilgi, līdz caurule pārsprāgst vai caurule ir karsēta piecas minūtes. Tests, kurā caurule sasprāgst vismaz trijās daļās, kuras dažkārt var turēties kopā ar šaurām metāla sloksnēm, kā parādīts 2. attēlā, tiek novērtēts par sprādzienu. Tests, kurā rodas mazāk caurules gabalu vai tā nesaplīst, netiek novērtēts par sprādzienu.
Vispirms trīs reizes testu veic, izmantojot plāksni ar atveri 6,0 mm diametrā, un, ja šādā veidā sprādzieni nenotiek, testu veic vēl trīs reizes, izmantojot plāksni ar atveri 2,0 mm diametrā. Jebkurā izmēģinājumu sērijā notiekot sprādzienam, testēšanu turpināt nav vajadzīgs.
1.6.1.4. Vērtēšana
Testēšanas rezultāts uzskatāms par pozitīvu, ja sprādziens notiek kādā no iepriekšminēto izmēģinājumu sērijām.
1.6.2. Mehāniskā jutība (pret triecienu)
1.6.2.1. Aparatūra (4. attēls)
Svarīgākās krītošā āmura iekārtas sastāvdaļas ir liets tērauda bloks ar pamatni, lakta, statnis, vadotnes, krītoši atsvari, palaišanas ierīce un parauga turētājs. Tērauda lakta 100 mm (diametrs) × 70 mm (augstums) ir pieskrūvēta tērauda blokam 230 mm (garums) × 250 mm (platums) × 200 mm (augstums) uz lietas pamatnes 450 mm (garums) × 450 mm (platums) × 60 mm (augstums). Statnis, kas izgatavots no izvilktas bezšuves tērauda caurules, tiek iestiprināts turētājā, kas pieskrūvēts tērauda blokam. Ar četrām enkurskrūvēm iekārta piestiprināta masīvam betona blokam 60 × 60 × 60 cm tā, lai vadotņu sliedes būtu pilnīgi vertikālas un krītošie atsvari brīvi kristu. Lietošanai izmantojami 5 un 10 kg masīva tērauda atsvari. Atsvaru triecienvirsma ir no rūdīta tērauda, HRC 60 līdz 63, ar minimālo diametru 25 mm.
Testējamo paraugu ievieto triecienierīcē, kura sastāv no diviem vienam virs otra novietotiem koaksiāliem masīva tērauda cilindriem dobā tērauda cilindrveida vadotnē. Masīva tērauda cilindru diametrs ir 10 (- 0,003, - 0,005) mm un augstums 10 mm, ar pulētām virsmām, noapaļotām šķautnēm (noapaļojuma rādiuss 0,5 mm) un cietību HRC 58 līdz 65. Dobā cilindra ārējam diametram jābūt 16 mm, pulētu urbumu ar izmēru 10 (+ 0,005, + 0,010) mm un augstumu 13 mm. Triecienierīce samontēta uz starplaktas (diametrs 26 mm un augstums 26 mm), kas izgatavota no tērauda un centrēta, izmantojot gredzenu ar izgriezumiem, pa kuriem izplūst dūmiem.
1.6.2.2. Pārbaudes apstākļi
Parauga tilpums ir 40 mm3 vai jebkurš tilpums, kas piemērots attiecīgajām alternatīvajām iekārtām. Cietvielas jātestē sausā veidā, un tās sagatavojamas šādi:
a) vielas pulvera veidā sijā (caur 0,5 mm sietu); testēšanai izmanto visu caur sietu izgājušo materiālu;
b) presētas, kausētas vai citādi sablīvētas vielas sasmalcina gabaliņos un sijā; testēšanai izmanto daļiņu frakciju ar izmēru 0,5 līdz 1 mm, un tai jāatbilst sākotnējai vielai.
Vielas, kuras parasti piegādā pastveidā, ja iespējams, jātestē sausas vai jebkurā gadījumā iespējami pilnīgi atdalot atšķaidītāju. Šķidras vielas testē ar 1 mm atstarpi starp augšējo un apakšējo cilindru.
1.6.2.3. Pārbaužu norise
Veic sešu izmēģinājumu sēriju, metot 10 kg lielu masu no 0,40 m augstuma (40 J). Ja sešos izmēģinājumos ar 40 J iegūst eksploziju, jāveic vēl seši izmēģinājumi, metot 5 kg masu no 0,15 m augstuma (7,5 J). Citos aparātos paraugu salīdzina ar izraudzīto standartvielu, ievērojot noteiktu procedūru (piemēram, turp un atpakaļ paņēmienu u. c.).
1.6.2.4. Novērtēšana
Testēšanas rezultāts uzskatāms par pozitīvu, ja eksplozija (ar aizdegšanos un/vai novērojums, kas uzskatāms par eksploziju) notiek vismaz vienreiz jebkurā no izmēģinājumiem, izmantojot iepriekš noteikto iekārtu, vai paraugs ir jutīgāks pret trieciena iedarbību nekā 1,3-dinitrobenzolu vai RDX (heksogēnu) alternatīvā izmēģinājumā.
1.6.3. Mehāniskā jutība (pret berzi)
1.6.3.1. Aparatūra (5. attēls)
Berzes iekārta sastāv no lietas tērauda pamatplates, kurai uzmontēta berzes ierīce. Tā sastāv no nekustīgas porcelāna kājas un kustīgas plates no porcelāna. Porcelāna plate ir nostiprināta rāmī, kas pārvietojas divās vadotnēs. Rāmi caur savienotājstieni, ekscentra mehānismu un piemērotu pārvadu piedzen elektromotors tā, ka plāksni tikai vienreiz pārvieto turp un atpakaļ un uz priekšu aiz porcelāna kājas 10 mm. Porcelāna kāju var slogot ar, piemēram, 120 vai 360 N.
Līdzenās porcelāna plates ir izgatavotas no tehniskā porcelāna (raupjums 9 līdz 32 μm), un to izmēri ir 25 mm (garums) × 25 mm (platums) × 5 mm (augstums). Cilindriskā porcelāna kāja arī ir izgatavota no baltā tehniskā porcelāna, un tā ir 15 mm gara, 10 mm diametrā un raupjām sfēriskām galu virsmām ar noapaļojuma rādiusu 10 mm.
1.6.3.2. Pārbaudes apstākļi
Parauga tilpums ir 10 mm3 vai jebkurš tilpums, kas piemērots attiecīgajām alternatīvajām iekārtām.
Cietvielas jātestē sausā veidā, un tās sagatavojamas šādi:
a) vielas pulvera veidā sijā (caur 0,5 mm sietu); testēšanai izmanto visu caur sietu izgājušo materiālu;
b) presētas, kausētas vai citādi sablīvētas vielas sasmalcina gabaliņos un sijā; testēšanai izmanto frakciju ar daļiņu izmēru < 0,5 mm.
Ja iespējams, vielas pastu veidā ir jātestē sausas. Ja vielas testēšanai nevar sagatavot sausā veidā, pastas (pēc iespējami pilnīgas atšķaidītāja atdalīšanas) testē ar šablonu sagatavotas plēves veidā, kuras biezums ir 0,5 mm, platums 2 mm, bet garums 10 mm.
1.6.3.3. Pārbaužu norise
Porcelāna kāju novieto uz testējamā parauga un slogo. Porcelāna plāksnītē sūkļa atstātajām švīkām pārbaudes laikā jābūt vērstām šķērsvirzienā attiecībā pret kustības virzienu. Jāpārliecinās, ka kāja atspiežas pret paraugu, ka zem kājas ir pietiekami daudz pārbaudāmās vielas un ka plate zem kājas kustas pareizā virzienā. Pastveida vielas platei uzklāj ar 0,5 mm biezuma kalibru, kura spraugas izmērs ir 2 × 10 mm. Porcelāna platei zem porcelāna kājas 0,44 sekunžu laikā jāpārvietojas turp un atpakaļ 10 mm. Plates virsmas daļas un kāju drīkst izmantot tikai vienreiz; katras kājas abi gali izmantojami diviem izmēģinājumiem, bet katra no abām plates virsmām – trijiem izmēģinājumiem.
Veic sešu izmēģinājumu sērijas ar 360 N slodzi. Ja šo sešu izmēģinājumu laikā tiek konstatēts pozitīvs rezultāts, veic vēl sešu izmēģinājumu sēriju ar 120 N slodzi. Citos aparātos paraugu salīdzina ar izraudzīto standartvielu, ievērojot noteiktu procedūru (piemēram, turp un atpakaļ paņēmienu u. c.).
1.6.3.4. Novērtēšana
Testēšanas rezultāts uzskatāms par pozitīvu, ja eksplozija (krakšķēšana un/vai aizdegšanās novērojums uzskatāmi par eksploziju) notiek vismaz vienreiz jebkurā no izmēģinājumiem, izmantojot iepriekš noteikto berzes iekārtu, vai atbilst ekvivalentiem kritērijiem alternatīvā berzes izmēģinājumā.
2. DATI
Viela principā uzskatāma par sprādzienbīstamu direktīvas nozīmē, ja pozitīvs testēšanas rezultāts iegūts termiskajā, trieciena vai berzes izmēģinājumā.
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— testējamās vielas identifikācija, sastāvs, tīrība, mitruma saturs u. c.,
— parauga fizikālais stāvoklis, norādes par tā sasmalcināšanu un/vai sijāšanu,
— termiskās jutības testēšanas laikā veiktie novērojumi (piemēram, parauga masa, fragmentu skaits u. c.),
— mehāniskās jutības testēšanas laikā veiktie novērojumi (piemēram, dūmu veidošanās ievērojamā daudzumā, pilnīga sadalīšanās bez atlikuma, uzliesmošana, dzirksteļošana, krakšķēšana u. c.),
— visos testēšanas veidos iegūtie rezultāti,
— ja izmantota cita iekārta, šādas izvēles zinātniskais pamatojums, kā arī pierādījums tam, ka iegūtie rezultāti ir salīdzināmi ar rezultātiem, kas iegūti ar iekārtu, kura ieteikta šīs pārbaudes veikšanai,
— jebkuras noderīgas piezīmes, piemēram, atsauces uz līdzīgu produktu pārbaudēm, kas var noderēt pienācīgai rezultātu interpretācijai,
— jebkuras papildu piezīmes, kas attiecas uz rezultātu interpretāciju.
3.2. REZULTĀTU NOVĒRTĒŠANA UN INTERPRETĀCIJA
Testēšanas pārskatā jānorāda visi rezultāti, kas uzskatāmi par kļūdainiem, netipiskiem vai nereprezentatīviem. Ja kādi rezultāti nav iekļaujami pārskatā, tas jāpaskaidro, kā arī jānorāda visi citos vai papildu izmēģinājumos iegūtie rezultāti. Ja netipisku rezultātu izskaidrot nevar, tas jāpieņem pēc nominālvērtības un pēc tā viela attiecīgi jāklasificē.
4. IZMANTOTĀ LITERATŪRA
(1) Recommendations on the Transport of Dangerous Goods: Tests and criteria, 1990, United Nations, New York.
(2) Bretherick, L., Handbook of Reactive Chemical Hazards, 4th edition, Butterworths, London, ISBN 0-750-60103-5, 1990.
(3) Koenen, H., Ide, K.H. and Swart, K.H., Explosivstoffe, 1961, Vol. 3, p. 6–13 and p. 30–42.
(4) NF T 20-038 (Sept. 85). Chemical products for industrial use – Determination of explosion risk.
Papildinājums
Termiskās jutības testēšanai vajadzīgo materiālu testēšana (skatīt DIN 1623)
1. Caurule: materiāla specifikācija Nr. 1.0336.505 g.
2. Plate ar atveri: materiāla specifikācija Nr. 1.4873.
3. Vītņsavienojums un uzgrieznis: materiāla specifikācija Nr. 1.3817.
1. attēls
Termiskās jutības testēšanas iekārta
(visi izmēri norādīti milimetros)
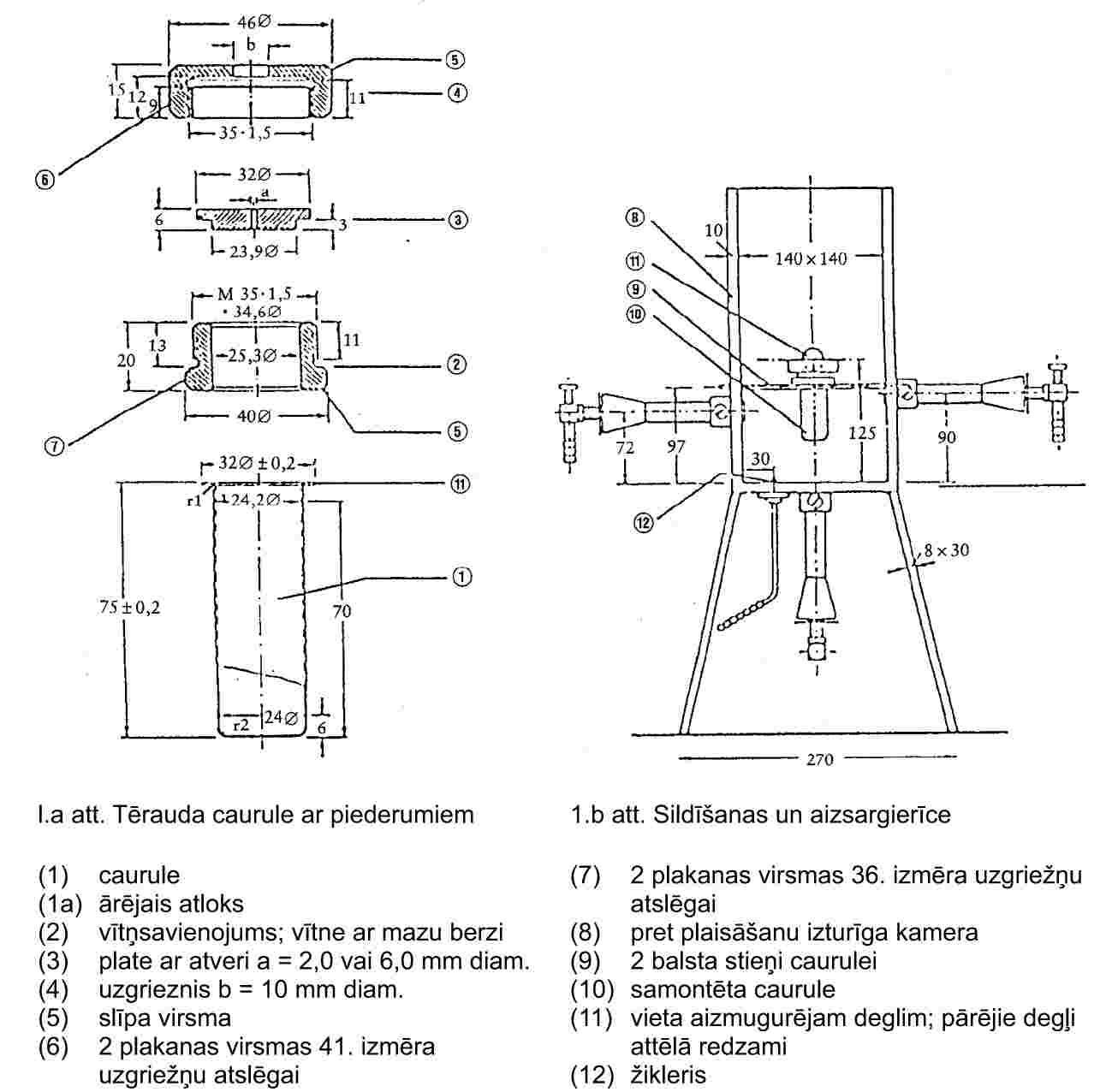
2. attēls
Termiskās jutības tests
(fragmentācijas paraugi)
3. attēls
Sildīšanas ātruma kalibrēšana termiskās jutības testēšanai

Temperatūras/laika grafiks, kas iegūts, sildot dibutilftalātu (27 cm3) slēgtā caurulē (atveres izmērs 1,5 mm), izmantojot propāna plūsmas ātrumu 3,2 l/min. Temperatūru mēra ar 1 mm diametra hromela/alumela termopāri tērauda apvalkā, kas novietots centrā 43 mm zem caurules atloka. Sildīšanas ātrumam no 135 oC līdz 285 oC ir jābūt no 185 līdz 215 K/min.
4. attēls
Trieciena testa aparāts
(visi izmēri norādīti milimetros)

4. attēls
(turpinājums)
5. attēls
Berzes jutības testēšanas iekārta

A.15. PAŠAIZDEGŠANĀS TEMPERATŪRA (ŠĶIDRUMI UN GĀZES)
1. METODE
1.1. IEVADS
Šai pārbaudei pakļauj sprādzienbīstamas vielas un vielas, kas saskarē ar gaisu spontāni aizdegas apkārtējā temperatūrā. Testēšanas procedūra izmantojama gāzēm, šķidrumiem un tvaikiem, kuri gaisa klātbūtnē var aizdegties no karstas virsmas.
Pašaizdegšanās temperatūra var ievērojami pazemināties katalītisku piemaisījumu klātbūtnē, no virsmas materiāla vai palielinot testēšanas trauka tilpumu.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Pašaizdegšanās spēju raksturo ar pašaizdegšanās temperatūru. Pašaizdegšanās temperatūra ir zemākā temperatūra, kurā testējamā viela aizdegas, kad to sajauc ar gaisu, ievērojot pārbaudes metodē paredzētos apstākļus.
1.3. STANDARTVIELAS
Standartvielas norādītas attiecīgajos standartos (skatīt 1.6.3. punktu). Tās galvenokārt izmanto metodes izpildījuma periodiskām pārbaudēm un dažādu metožu salīdzināšanai.
1.4. METODES PRINCIPS
Pēc šīs metodes nosaka kameras iekšējās virsmas minimālo temperatūru, kurā notiek kamerā ievadītās gāzes, tvaika vai šķidruma aizdegšanās.
1.5. KVALITĀTES KRITĒRIJI
Atkārtojamība ir atkarīga no pašaizdegšanās temperatūras intervāla un izmantotās noteikšanas metodes.
Jutība un specifiskums ir atkarīgi no izmantotās metodes.
1.6. TESTA METODES APRAKSTS
1.6.1. Aprīkojums
Šī iekārta ir aplūkota 1.6.3. punktā minētās metodes aprakstā.
1.6.2. Pārbaudes apstākļi
Vielas paraugu pārbauda pēc metodes, kas minēta 1.6.3. punktā.
1.6.3. Pārbaudes norise
Skatīt IEC 79-4, DIN 51794, ASTM-E 659-78, BS 4056, NF T 20-037.
2. DATI
Reģistrē temperatūru pārbaudes laikā, atmosfēras spiedienu, izmantotā parauga lielumu, laika sprīdi līdz aizdegšanās brīdim.
3. PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— precīzs vielas apraksts (raksturojums un piemaisījumi),
— izmantotā parauga lielums, atmosfēras spiediens,
— izmantotā iekārta,
— mērījumu rezultāti (temperatūra pārbaudes laikā, rezultāti, kas raksturo aizdegšanos, laika sprīdis līdz aizdegšanās brīdim),
— jebkuras papildu piezīmes, kas attiecas uz rezultātu interpretāciju.
4. IZMANTOTĀ LITERATŪRA
Nav.
A.16. RELATĪVĀS PAŠAIZDEGŠANĀS TEMPERATŪRAS NOTEIKŠANA CIETVIELĀM
1. METODE
1.1 IEVADS
Šai pārbaudei pakļauj sprādzienbīstamas vielas un vielas, kas saskarē ar gaisu spontāni aizdegas apkārtējā temperatūrā.
Šīs pārbaudes mērķis ir iegūt orientējošu informāciju par cietu vielu pašaizdegšanos paaugstinātā temperatūrā.
Ja siltumu, kas rodas, vielai reaģējot ar skābekli vai tai eksotermiski sadaloties, pietiekami ātri neuzņem apkārtējā vide, pašsasilšana izraisa pašaizdegšanos. Tāpēc pašaizdegšanās notiek tad, ja siltuma rašanās ātrums pārsniedz siltuma izkliedēšanās ātrumu.
Šī metode ir noderīga, veicot cietu vielu orientējošu testēšanu. Ņemot vērā cietu vielu aizdegšanās un degšanas procesa sarežģīto raksturu, pašaizdegšanās temperatūra, ko nosaka ar šo metodi, ir izmantojama tikai salīdzināšanai.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Pašaizdegšanās temperatūra, ko nosaka ar šo metodi, ir viszemākā apkārtējā temperatūra ( oC), kurā aizdegas konkrēts vielas daudzums, kas pakļauts iepriekš noteiktiem apstākļiem.
1.3. STANDARTVIELA
Nav.
1.4. METODES PRINCIPS
Noteiktu daudzumu testējamās vielas ievieto krāsnī istabas temperatūrā; parauga centrā uzņem temperatūras izmaiņu līkni atkarībā no laika, līdz krāsns temperatūra sasniedz 400 oC, vai līdz kušanas temperatūrai, ja tā ir zemāka, sildot ar ātrumu 0,5oC/min. Šajā testā par pašaizdegšanās temperatūru uzskata krāsns temperatūru, kurā parauga temperatūra sasniedz 400 oC pašsakaršanas dēļ.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
1.6.1. Aprīkojums
1.6.1.1. Krāsns
Laboratorijas krāsns ar programmējamu temperatūru (tilpums ap 2 l) ir aprīkota ar gaisa apmaiņas sistēmu un preteksplozijas vārstu. Lai novērstu iespējamo sprādzienu, vielas sadalīšanās procesā radušās gāzes nedrīkst nonākt kontaktā ar sildelementiem.
1.6.1.2. Stiepļu pinuma kubs
Nerūsējoša tērauda stiepļu pinuma sietu ar acu izmēru 0,045 mm sagriež pēc 1. attēlā dotā parauga. Sietu saloka un nostiprina ar stiepli, izveidojot kubu ar vaļēju augšdaļu.
1.6.1.3. Termopāri
Piemēroti termopāri.
1.6.1.4. Pašrakstītājs
Der jebkurš divkanālu pašrakstītājs, kas kalibrēts 0–600 oC temperatūrai vai attiecīgajam spriegumam.
1.6.2. Pārbaudes apstākļi
Vielas testē veidā, kādā tās saņem.
1.6.3. Pārbaudes norise
Kubā iepilda pārbaudāmo vielu un pēc vieglas sakratīšanas to papildina, kamēr kubs ir pilns līdz augšai. Paraugu iekar krāsns vidū istabas temperatūrā. Vienu termoelementu novieto krāsns vidū un otru – krāsns temperatūras reģistrēšanai – starp kubu un krāsns sienu.
Kamēr krāsns temperatūra pieaug ar ātrumu 0,5oC/min līdz 400 oC vai līdz cietās vielas kušanas temperatūrai, nepārtraukti reģistrē krāsns un parauga temperatūru.
Vielai aizdegoties, parauga termoelements uzrāda ļoti strauju temperatūras pieaugumu virs krāsns temperatūras.
2. DATI
Novērtējumam izmanto krāsns temperatūru, kurā paraugs ir sasniedzis 400 oC pašsakaršanas rezultātā (skatīt 2. attēlu).
3. PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— pārbaudāmās vielas apraksts,
— mērījumu rezultāti kopā ar temperatūras līkni,
— jebkuras papildu piezīmes, kas attiecas uz rezultātu interpretāciju.
4. IZMANTOTĀ LITERATŪRA
NF T 20-036 (September 85). Chemical products for industrial use. Determination of the relative temperature of the spontaneous flammability of solids.
1. attēls
Pārbaudē izmantojamā 20 mm kuba piegrieztne
2. attēls
Raksturīga temperatūras līkne

A.17. OKSIDĒJOŠĀS ĪPAŠĪBAS (CIETVIELAS)
1. METODE
1.1. IEVADS
Pirms šīs pārbaudes veikšanas ir lietderīgi jau iepriekš iegūt informāciju par pārbaudāmās vielas iespējamo sprādzienbīstamību.
Šī metode nav izmantojama šķidrumiem, gāzēm, sprādzienbīstamām vai viegli uzliesmojošām vielām un organiskajiem peroksīdiem.
Šis tests nav jāveic gadījumos, kad vielas struktūrformula nepārprotami liecina, ka viela nevar stāties eksotermiskās reakcijās ar viegli uzliesmojošiem materiāliem.
Lai noskaidrotu, vai pārbaudes gaitā būtu jāievēro īpaša piesardzība, ir jāveic orientējoši izmēģinājumi.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Degšanas ilgums ir reakcijas ilgums sekundēs, kurā reakcijas zona aptver visu paraugu saskaņā ar 1.6. punktā aprakstīto metodi.
Degšanas ātrums: izteikts milimetros sekundē.
Maksimālais degšanas ātrums: lielākais degšanas ātrums, kas noteikts maisījumiem, kuros ir 10 līdz 90 masas % oksidētāja.
1.3. STANDARTVIELA
Testēšanai un orientējošiem izmēģinājumiem par standartvielu izmanto analītiski tīru bārija nitrātu.
Par standartmaisījumu izmanto bārija nitrāta (parasti izmanto 60 masas % bārija nitrāta) maisījumu ar celulozes pulveri, kas pagatavots, kā norādīts 1.6. punktā, un kam piemīt maksimālais degšanas ātrums.
1.4. METODES PRINCIPS
Orientējošu izmēģinājumu veic drošības apsvērumu dēļ. Papildu testēšana nav jāveic gadījumos, kad orientējošos izmēģinājumos skaidri redzams, ka vielai ir oksidētāja īpašības. Ja tā nenotiek, testēšanu veic pēc pilnas programmas.
Šajā gadījumā pārbaudāmo vielu sajauc ar labi zināmu ugunsnedrošu vielu dažādās attiecībās. Pēc tam no katra maisījuma izveido valnīti un no viena gala to aizdedzina. Iegūto maksimālo degšanas ātrumu salīdzina ar standartmaisījuma maksimālo degšanas ātrumu.
1.5. KVALITĀTES KRITĒRIJI
Vajadzības gadījumā var izmantot jebkuru smalcināšanas un sajaukšanas paņēmienu, lai panāktu, ka maksimālais degšanas ātrums sešās atsevišķās pārbaudēs neatšķiras no aritmētiskā vidējā vairāk par 10 %.
1.6. TESTA METODES APRAKSTS
1.6.1. Sagatavošana
1.6.1.1. Pārbaudāmā viela
Samazina pārbaudāmā parauga daļiņu lielumu līdz < 0,125 mm, kā tas norādīts tālāk: vielu sijā un rupjo frakciju sasmalcina, šo procedūru atkārto, līdz viss testējamais vielas daudzums iziet caur sietu.
Var izmantot jebkuru smalcināšanas un sijāšanas paņēmienu, kas atbilst kvalitātes kritērijiem.
Pirms maisījuma pagatavošanas vielu žāvē 105 oC temperatūrā, līdz tās svars kļūst nemainīgs. Ja pārbaudāmās vielas sadalīšanās temperatūra ir zemāka par 105 oC, tā attiecīgi jāžāvē zemākā temperatūrā.
1.6.1.2. Ugunsnedrošā viela
Kā ugunsnedrošo vielu izmanto celulozes pulveri. Šim nolūkam der celuloze, kas paredzēta izmantošanai plānslāņa hromatogrāfijā vai kolonnu hromatogrāfijā. Kā rāda pieredze, tā var būt celuloze, kurai 85 % šķiedru ir garumā no 0,020 līdz 0,075 mm. Celulozes pulveri izsijā caur sietu ar acu izmēru 0,125 mm. Visai testēšanai jāizmanto celulozes no vienas un tās pašas partijas.
Pirms maisījuma pagatavošanas celulozes pulveri žāvē 105 oC temperatūrā, līdz tās svars kļūst nemainīgs.
Ja orientējošam izmēģinājumam izmanto koksnes putekļus, ņem skujkoku koksnes putekļus, kas izsijāti caur sietu ar acu lielumu 1,6 mm, rūpīgi tās samaisa un tad žāvē četras stundas 105 oC temperatūrā, izklājot tās 25 mm biezā kārtā. Pēc atdzesēšanas tās līdz izmantošanas brīdim (vēlams 24 stundu laikā pēc žāvēšanas) glabā hermētiskā tvertnē, ko piepilda iespējami pilnu.
1.6.1.3. Aizdegšanās avots
Par uguns avotu izmanto gāzes degļa karstu liesmu (minimālais diametrs – 5 mm). Ja izmanto citu uguns avotu (piemēram, veicot testēšanu inertā atmosfērā), tas attiecīgi jāapraksta un jāpamato.
1.6.2. Pārbaudes norise
Piezīme
Oksidētāju maisījumi ar celulozi vai koksnes putekļiem ir sprādzienbīstami, tāpēc ir jāievēro piesardzības pasākumi.
1.6.2.1. Orientējošs izmēģinājums
Izžāvēto vielu sajauc ar sausu celulozi vai koksnes putekļiem, lai pārbaudāmās vielas un celulozes vai koksnes putekļu masas attiecība būtu 2:1, un, iepildot koniskas formas traukā, (piemēram, stikla piltuvē ar aizbāztu kātu) no maisījuma nepieblīvējot izveido nelielu konisku kaudzīti, kuras izmēri ir 3,5 cm (apakšējais diametrs) × 2,5 cm (augstums).
Kaudzīti novieto uz vēsas nedegoša materiāla plātnes ar zemu siltumvadītspēju. Pārbaudi veic velkmes skapī, kā norādīts 1.6.2.2. punktā.
Ar uguns avotu pieskaras konusam. Novēro un reģistrē notiekošās reakcijas intensitāti un ilgumu.
Ja reakcija noris spēji, uzskata, ka vielai ir oksidētāja īpašības.
Ja rezultāti vieš šaubas, katrreiz jāveic pilna pārbaude, kā tas norādīts tālāk.
1.6.2.2. Sliedes tests
Sagatavo oksidētāja/celulozes maisījumus, kas satur no 10 līdz 90 masas % oksidētāja, ar 10 % palielinājumu. Strīdīgos gadījumos izmanto oksidētāja/celulozes maisījumus ar mazāku palielinājumu, lai precīzāk noteiktu maksimālo degšanas ātrumu.
No pārbaudāmās vielas ar veidnes palīdzību izveido valnīti. Veidne ir izgatavota no metāla, tās garums ir 250 mm un trijstūra šķērsgriezumu ar augstumu iekšpusē 10 mm, bet platumu iekšpusē – 20 mm. Veidnes abās pusēs garenvirzienā sānu norobežošanai piestiprina divas metāla plāksnes, kuras izvirzītas 2 mm virs trijstūra šķērsgriezuma (skatīt attēlu). To nesablīvējot piepilda ar maisījumu nelielā pārākumā. Pēc veidnes kritiena uz cietas virsmas no 2 cm augstuma lieko vielu noņem ar slīpi novietotu skārda sloksni. Tad noņem norobežotājplāksnes un atlikušo pulveri izlīdzina ar veltni. Veidnei uzliek pamatplati no nedegoša materiāla bez porām un zemu siltuma vadītspēju, apgriež otrādi un veidni noņem.
Pārbaudāmās vielas valnīti ievieto velkmes skapī perpendikulāri gaisa plūsmai.
Gaisa plūsmas ātrumam jābūt pietiekami lielam, lai dūmi neiekļūtu laboratorijā, un to nedrīkst mainīt pārbaudes gaitā. Ap iekārtu jānovieto ekrāns, kas to aizsargā no gaisa plūsmas.
Ņemot vērā celulozes un pārbaudāmo vielu higroskopiskumu, pārbaude jāveic cik iespējams ātri.
Valnīti no viena gala aizdedzina, pieskaroties ar liesmu.
Reakcijas ilgumu reģistrē 200 mm posmā pēc tam, kad reakcijas zona ir aptvērusi pirmos 30 mm.
Testēšanu veic, izmantojot standartvielu un vismaz vienreiz ar katru no testējamās vielas maisījumiem ar celulozi.
Ja tiek konstatēts, ka maksimālais degšanas ātrums ir ievērojami lielāks par standartvielas degšanas ātrumu, testēšanu var neturpināt; citādi izmēģinājums ar trijiem maisījumiem, kuriem ir lielākais degšanas ātrums, ir jāatkārto piecas reizes.
Ja ir aizdomas, ka iegūtais rezultāts ir šķietami pozitīvs, tests jāatkārto ar inertu vielu celulozes vietā, kurai ir līdzīgs daļiņu izmērs, piemēram, ar kizelgūru. Otra iespēja ir inertā atmosfērā (< 2 % v/v skābekļa) atkārtoti testēt to testējamās vielas/celulozes maisījumu, kuram ir lielākais degšanas ātrums.
2. DATI
Drošības apsvērumu dēļ uzskata, ka pārbaudāmās vielas oksidējošās īpašības raksturo maksimālais degšanas ātrums, nevis tā vidējā vērtība.
Novērtēšanai pietiek ar maksimālo degšanas ātrumu, kas noteikts sešu pārbaužu sērijā ar vienu izvēlēto maisījumu.
Katram maisījumam konstruē maksimālā degšanas ātruma grafiku atkarībā no oksidētāja koncentrācijas tajā. Pēc šā grafika nosaka maksimālo degšanas ātrumu.
Izmēģinājumu sērijā noteiktās sešas noteiktās degšanas ātruma vērtības maisījumam ar maksimālo degšanas ātrumu nedrīkst atšķirties vairāk par 10 % no to vidējās aritmētiskās vērtības; citādi jāpilnveido sasmalcināšanas un maisījumu sagatavošanas metodes.
Iegūto maksimālo degšanas ātrumu salīdzina ar standartmaisījuma maksimālo degšanas ātrumu (skatīt 1.3. punktu).
Ja testēšanu veic inertā atmosfērā, maksimālo reakcijas ātrumu salīdzina ar standartvielas maksimālo reakcijas ātrumu inertā atmosfērā.
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda šāda informācija:
— testējamās vielas identifikācija, sastāvs, tīrība, mitruma saturs u. c.,
— analizējamā parauga sagatavošana (piemēram, smalcināšana, žāvēšana u. tml.),
— izmēģinājumos izmantotais uguns avots,
— mērījumu rezultāti,
— reakcijas gaita (piemēram, virsējās kārtas uzliesmošana, visa parauga degšana, jebkuri dati par sadegšanas produktiem u. tml.),
— jebkuras papildu piezīmes, kas attiecas uz rezultātu interpretāciju, tostarp dati par pārbaudāmās vielas un standartvielas reakcijas intensitāti (uzliesmošana, dzirksteļošana, dūmu rašanās, lēna gruzdēšana utt.) un aptuveno ilgumu, kas gūti sākotnējā drošības pārbaudē vai orientējošā izmēģinājumā,
— testēšanas rezultāti ar inertu vielu, ja tie veikti,
— testēšanas rezultāti inertā atmosfērā, ja tie veikti.
3.2. REZULTĀTU INTERPRETĀCIJA
Uzskata, ka vielai piemīt oksidējošas īpašības, ja:
a) orientējošā izmēģinājumā tā izraisa intensīvu reakciju;
b) analizējamo maisījumu maksimālais degšanas ātrums pārbaudes laikā pārsniedz vai ir vienāds ar standartmaisījuma (celuloze un bārija nitrāts) maksimālo degšanas ātrumu.
Lai neiegūtu šķietami pozitīvu rezultātu, rezultātus interpretējot, ņem vērā rezultātus, kuri iegūti, testējamo vielu sajaucot ar inertu materiālu un/vai veicot testēšanu inertā atmosfērā.
4. IZMANTOTĀ LITERATŪRA
NF T 20-035 (September 85). Chemical products for industrial use. Determination of the oxidizing properties of solids.
Papildinājums
Attēls
Veidne un papildu aprīkojums degšanas ilguma noteikšanai
(visi izmēri norādīti milimetros)

A.18. POLIMĒRU VIDĒJĀ MOLEKULAS MASA UN MOLEKULAS MASU SADALĪJUMS
1. METODE
Šī gelhromatogrāfijas metode ir OECD (Ekonomiskās sadarbības un attīstības organizācija) TG 118 (1996) kopija. Pamatprincipi un tehniskā informācija ir izmantotās literatūras sarakstā (1).
1.1. IEVADS
Tā kā polimēru īpašības ir tik dažādas, nav iespējams aprakstīt vienu atsevišķu metodi, kas precīzi izklāstītu sadalīšanas un novērtēšanas apstākļus, kuri aptvertu visus gadījumus un specifiskās īpatnības, kuras sastopamas polimēru sadalīšanā. Īpaši sarežģītas polimēru sistēmas bieži nepakļaujas gelhromatogrāfijai (GPC – Gel permeation chromatography). Ja GPC nevar izmantot, molekulas masu var noteikt ar citām metodēm (skatīt pielikumu). Tādos gadījumos būtu jādod visa informācija par lietoto metodi un pamatojums.
Aprakstītās metodes pamatā ir DIN (Deutsches Institut fur Normung – Vācijas valsts standartu institūts) standarts 55672 (1). Detalizētu informāciju par to, kā veikt eksperimentus un novērtēt datus, var atrast šajā DIN standartā. Ja eksperimenta apstākļi jāmodificē, šīs izmaiņas jāpamato. Citus standartus var izmantot, ja uz tiem dod pilnīgi visas atsauces. Šī metode apraksta polistirola paraugu ar zināmu polidispersiju izmantošanu kalibrēšanai, un tā varbūt jāmodificē, lai būtu piemērota noteiktiem polimēriem, piemēram, ūdenī šķīstošiem un sazarotiem polimēriem ar garām ķēdītēm.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Skaitlisko vidējo molekulas masu Mn un masas vidējo molekulas masu Mw nosaka, izmantojot šādus vienādojumus:
|
|
|
kur:
Hi = detektora signāla līmenis no bāzes līnijas aizturēšanas tilpumam Vi,
Mi = molekulas masa polimēra frakcijai pie aizturēšanas tilpuma Vi,
n = datu punktu skaits.
Molekulu masu sadalījuma platumu, kas ir sistēmas dispersijas pakāpes mērs, nosaka attiecība Mw/Mn.
1.3. STANDARTVIELAS
Tā kā GPC ir relatīva metode, jāveic kalibrēšana. Šim nolūkam parasti izmanto lineārus polistirola standartus ar šauru sadalījuma diapazonu, zināmām vidējām molekulas masām Mn un Mw un zināmu molekulu masu sadalījumu. Kalibrēšanas līkni, nosakot nezināma parauga molekulas masu, var izmantot tikai tad, ja parauga un standarta sadalīšanas apstākļi ir izvēlēti identiski.
Noteiktā attiecība starp molekulas masu un eluēšanas tilpumu ir ticama tikai konkrēta eksperimenta specifiskos apstākļos. Apstākļi vispirms ietver temperatūru, šķīdinātāju (vai šķīdinātāju maisījumu), hromatografēšanas apstākļus un sadalīšanas kolonnu vai kolonnu sistēmu.
Šādi noteikto molekulas masu lielumi ir relatīvi, un tos apzīmē kā “polistirola ekvivalenta molekulas masas”. Tas nozīmē, ka atkarībā no uzbūves un ķīmiskām atšķirībām starp paraugu un standartu molekulu masas var lielākā vai mazākā mērā atšķirties no absolūtās vērtības. Ja lieto citus standartus, piemēram, polietilenglikolu, polietilenoksīdu, polimetilmetakrilātu, poliakrilskābi, tas būtu jāpamato.
1.4. PĀRBAUDES METODES PRINCIPS
Izmantojot GPC metodi, var noteikt gan molekulu masu sadalījumu, gan vidējās molekulu masas (Mn un Mw). GPC ir īpaša veida šķidruma hromatogrāfija, kur paraugu sadala atbilstoši atsevišķo sastāvdaļu hidrodinamiskiem tilpumiem (2).
Sadalīšana notiek, paraugam izejot caur kolonnu, kas ir pildīta ar porainu materiālu, parasti ar organisku gelu. Mazas molekulas var iespiesties porās, bet lielas molekulas nevar. Lielo molekulu ceļš tādēļ ir īsāks, un tās pirmās tiek eluētas. Vidēji lielas molekulas iekļūst dažās no porām, tādēļ tiek eluētas vēlāk. Mazākās molekulas, kuru hidrodinamiskais rādiuss ir mazāks nekā gela poras, var iekļūt visās porās. Tās tiek eluētas visvēlāk.
Ideālā situācijā sadalīšanu pilnībā nosaka molekulu lielums, bet praksē ir grūti izvairīties vismaz no dažiem absorbcijas radītiem traucējumiem. Nevienāds kolonnas pildījums un kolonnā nesorbēto vielu aiztures laiks stāvokli var padarīt vēl sliktāku (2).
Noteikšanu veic, piemēram, izmantojot laušanas koeficientu vai UV absorbciju, un iegūst vienkāršu sadalījuma līkni. Tomēr, lai faktiskās molekulas masas vērtības attiecinātu uz līkni, jākalibrē kolonna, izlaižot cauri polimērus ar zināmu molekulas masu un ideālā variantā ar aptuveni līdzīgu uzbūvi, piemēram, dažādas polistirola standartvielas. Parasti iegūst Gausa sadalījuma līkni, dažkārt deformētu ar nelielu asti mazo molekulu masu pusē; uz šī grafika vertikālās ass ir eluēto vielu, kam ir dažāda molekulas masa, svara daudzumi, un uz horizontālās ass ir molekulas masas logaritms.
1.5. KVALITĀTES KRITĒRIJI
Eluēšanas tilpuma atkārtojamībai (relatīvā standarta novirze – Relative Standart Deviation: RSD) būtu jābūt labākai par 0,3 %. Analīzes vajadzīgā atkārtojamība jānodrošina ar korekciju, izmantojot iekšējo standartu, ja hromatogramma ir izrādījusies atkarīga no laika un neatbilst iepriekšminētajam kritērijam (1). Polidispersitāte ir atkarīga no standartu molekulu masām. Polistirola standartiem parastās vērtības ir:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw/Mn < 1,20 |
(Mp ir standartvielas molekulas masa pīķa maksimuma punktā.)
1.6. PĀRBAUDES METODES APRAKSTS
1.6.1. Polistirola standartšķīduma pagatavošana
Polistirola standartus, rūpīgi maisot, izšķīdina izvēlētajā eluentā. Šķīdumus pagatavojot, jāievēro ražotāja instrukcijas.
Izvēlētās standartšķīdumu koncentrācijas ir atkarīgas no dažādiem faktoriem, piemēram, iešļircināmā tilpuma, šķīduma viskozitātes un jutības pret analīzes detektoru. Maksimālais iešļircināmais tilpums jāpieskaņo kolonnas garumam, lai izvairītos no pārslodzes. Parasti analītiskām sadalīšanām, izmantojot GPC ar kolonnas izmēriem 30 cm × 7,8 mm, iešļircināmie tilpumi ir starp 40 un 100 μl. Ir iespējams izmantot lielākus tilpumus, bet tiem nevajadzētu pārsniegt 250 μl. Pirms kolonnas faktiskās kalibrēšanas jānosaka optimālā attiecība starp iešļircināmo tilpumu un koncentrāciju.
1.6.2. Parauga šķīduma pagatavošana
Principā parauga pagatavošanai ir tādas pašas prasības. Paraugu, uzmanīgi kratot, izšķīdina piemērotā šķīdinātājā, piemēram, tetrahidrofurānā (THF). Nekādā ziņā šķīdināt nedrīkst, izmantojot ultraskaņas vannu. Ja vajag, parauga šķīdumu tīra, filtrējot caur membrānas filtru ar poru diametru starp 0,2 un 2 μm.
Neizšķīdušu daļiņu klātiene jāatzīmē beigu protokolā, jo tās var rasties no augstmolekulārām vielām. Jālieto piemērota metode, lai noteiktu izšķīdušo daļiņu svara procentu. Šķīdums jāizlieto 24 stundu laikā.
1.6.3. Aparatūra
— Šķīdinātāja rezervuārs,
— atgāzētājs (ja vajadzīgs),
— sūknis,
— impulsu dempferis (ja vajadzīgs),
— iešļircināšanas sistēma,
— hromatogrāfiskā kolonna,
— detektors,
— plūsmas mērītājs (ja vajadzīgs),
— datu reģistrēšanas-apstrādes iekārta,
— trauks atkritumiem.
Jānodrošina, lai GPC sistēma būtu inerta pret lietojamiem šķīdinātājiem (piemēram, izmantojot tērauda kapilārus THF šķīdinātājam).
1.6.4. Iešļircināšanas un šķīdinātāja padeves sistēma
Parauga šķīduma noteiktu tilpumu ievada kolonnā vai nu ar autosampleru, vai ar roku precīzi noteiktā zonā. Pārāk ātra šļirces virzuļa atvilkšana vai nospiešana ar roku var radīt konstatētā molekulas masu sadalījuma maiņas. Šķīdinātāja padeves sistēmai, ciktāl tas ir iespējams, būtu jādarbojas bez impulsiem, tādēļ ideālā variantā sistēmā būtu jāiemontē impulsu dempferis. Plūsmas ātruma kārtas lielums ir 1 ml/min.
1.6.5. Kolonna
Atkarībā no parauga polimēru analizē, izmantojot vai nu vienu kolonnu, vai vairākas secīgas kolonnas. Tirdzniecībā ir pieejami vairāki kolonnu materiāli ar noteiktām īpašībām (piemēram, poru lielumu, molekulas izmēru robežām). Sadalīšanas gela vai kolonnas garuma izvēle ir atkarīga no parauga īpašībām (hidrodinamiskie tilpumi, molekulu masu sadalījums) un sadalīšanas specifiskiem apstākļiem, piemēram, šķīdinātāja, temperatūras un plūsmas ātruma (1) (2) (3).
1.6.6. Teorētiskie šķīvji
Sadalīšanai lietojamā kolonna vai kolonnu apvienojums jāraksturo ar teorētisko šķīvju skaitu. Tas ietver, ja par eluēšanas šķīdinātāju lieto THF, etilbenzola vai cita piemērota nepolāra šķīdinātāja ievadīšanu noteikta garuma kolonnā. Teorētisko šķīvju skaitu aprēķina ar šādu vienādojumu:
|
|
kur: |
|
kur:
|
N |
= |
teorētisko šķīvju skaits, |
|
Ve |
= |
eluēšanas tilpums pīķa maksimumā, |
|
W |
= |
pīķa platums pie bāzes līnijas, |
|
W1/2 |
= |
pīķa platums pusē no tā augstuma. |
1.6.7. Sadalīšanas efektivitāte
Bez teorētisko šķīvju skaita, kas nosaka pīķa platumu, nozīme ir arī sadalīšanas efektivitātei, ko nosaka kalibrācijas līknes stāvums. Kolonnas sadalīšanas efektivitāti var aprēķināt no šādas sakarības:
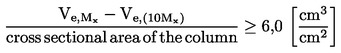
kur:
|
Ve, Mx |
= |
eluēšanas tilpums polistirolam ar molekulas masu Mx, |
|
Ve,(10M) |
= |
eluēšanas tilpums polistirolam ar 10 reižu lielāku molekulas masu, |
|
L |
= |
kolonnas šķērsgriezuma laukums. |
Sistēmas izšķirtspēju parasti definē šādi:
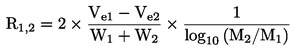
kur:
|
Ve1, Ve2 |
= |
divu polistirola standartu eluēšanas tilpumi pīķa maksimuma punktā, |
|
W1, W2 |
= |
pīķa platums pie bāzes līnijas, |
|
M1, M2 |
= |
molekulas masas pīķa maksimumā (tām būtu jāatšķiras 10 reižu). |
Kolonnas sistēmai R vērtībai būtu jābūt lielākai par 1,7 (4).
1.6.8. Šķīdinātāji
Visiem šķīdinātājiem jābūt augstas tīrības pakāpes (THF izmanto ar tīrības pakāpi 99,5 %). Šķīdinātāja rezervuāram (ja vajadzīgs, inertas gāzes atmosfērā) jābūt pietiekami lielam, lai veiktu kolonnas kalibrēšanu un vairākas paraugu analīzes. Pirms šķīdinātāju ievada kolonnā ar sūkni, tam jābūt atbrīvotam no gāzēm.
1.6.9. Temperatūras kontrole
Galveno iekšējo sastāvdaļu (inžektora cilpa, kolonnas, detektors un caurules) temperatūrai jābūt konstantai un jāatbilst izvēlētajam šķīdinātājam.
1.6.10. Detektors
Detektora uzdevums ir kvantitatīvi reģistrēt parauga, kas eluējas no kolonnas, koncentrāciju. Lai izvairītos no nevēlamas pīķu paplašināšanās, detektora šūnas ķivetes tilpumam jābūt tik mazam, cik iespējams. Tam nevajadzētu būt lielākam par 10 μl, izņemot gaismas izkliedes un viskozitātes detektorus. Detektēšanai parasti izmanto diferenciālo refraktometriju. Tomēr, ja to prasa specifiskas parauga vai eluēšanas šķīdinātāja īpašības, var izmantot citu veidu detektorus, piemēram, UV/VIS, IR, viskozitātes detektorus utt.
2. DATI UN PROTOKOLI
2.1. DATI
Par detalizētiem novērtēšanas kritērijiem un prasībām, kas attiecas uz datu savākšanu un apstrādi, skatīt DIN standartu (1).
Katram paraugam jāizdara divi neatkarīgi eksperimenti. Tie jāanalizē atsevišķi.
Mn, Mw, Mw/Mn un Mp jāsniedz katram mērījumam. Skaidri jānorāda, ka izmērītie lielumi ir relatīvi lielumi, kas ir ekvivalenti izmantoto standartvielu molekulu masām.
Pēc aiztures tilpumu vai aiztures laiku noteikšanas (ja iespējams, koriģējot ar iekšējo standartu) uz grafika atliek log Mp (Mp ir kalibrēšanas standarta pīķa maksimums) pret vienu no šiem abiem lielumiem. Uz molekulu masu dekādi ir vajadzīgi vismaz divi kalibrēšanas punkti, un visai kalibrēšanas līknei vajadzīgi vismaz pieci punkti, šai līknei jāietver noteiktā parauga molekulas masa. Kalibrēšanas līknes mazo molekulu masu galapunktu nosaka ar n-heksilbenzolu vai citu piemērotu izšķīdināto vielu. Skaita vidējo vai svara vidējo molekulas masu parasti nosaka, izmantojot elektronisko datu apstrādi, kas pamatojas uz formulām, kas dotas 1.2. sadaļā. Ja datus apstrādā ar roku, var izmantot ASTM D 3536-91 (3).
Sadalījuma līkne jāsagatavo tabulas veidā vai līknes veidā (kā diferenciālas frekvences vai procentu no summas attiecība pret log M). Grafiskajā attēlā vienai molekulu masu dekādei parasti būtu jābūt ap 4 cm platai un pīķa maksimumam jābūt ap 8 cm augstam. Integrālai sadalījuma līknei starpībai starp 0 un 100 % uz ordinātas būtu jābūt ap 10 cm.
2.2. PĀRBAUDES PROTOKOLS
Pārbaudes protokolā jābūt šādai informācijai:
2.2.1. Pārbaudāmā viela
— Par pārbaudāmo vielu pieejamā informācija (identiskums, piedevas, piemaisījumi),
— parauga apstrādes apraksts, novērojumi, problēmas.
2.2.2. Iekārtas
— Eluenta rezervuārs, inerta gāze, eluenta atgāzēšana, eluenta sastāvs, piemaisījumi,
— sūknis, impulsu dempferis, iešļircināšanas sistēma,
— sadalīšanas kolonnas (ražotājs, visa informācija par kolonnas raksturlielumiem, piemēram, poru izmēri, sadalītājs materiāls utt., izmantoto kolonnu skaits, garums un sakārtojums,
— kolonnas (vai to apvienojuma) teorētisko šķīvju skaits, sadalīšanas efektivitāte (sistēmas izšķirtspēja),
— informācija par pīķu simetriju,
— kolonnas temperatūra, temperatūras kontroles veids,
— detektors (mērījumu princips, tips, ķivetes tilpums),
— plūsmas mērītājs, ja to lieto (ražotājs, mērīšanas princips),
— reģistrēšanas un datu apstrādes sistēma (aparatūra, programmatūra).
2.2.3. Sistēmas kalibrēšana
— Kalibrēšanas līknes konstruēšanai izmantotās metodes sīks apraksts,
— informācija par šīs metodes kvalitātes kritērijiem (piemēram, korelācijas koeficients, kvadrātisko kļūdu summa utt.),
— informācija par visām ekstrapolācijām, eksperimenta procedūru, pieņēmumi un tuvinājumi novērtēšanas un datu apstrādes laikā,
— visiem mērījumiem, kas izmantoti kalibrācijas līknes konstruēšanai, jābūt dokumentētiem tabulā, kas ietver šādu informāciju katram kalibrācijas punktam:
—— parauga nosaukums,
— parauga ražotājs,
— standartu raksturīgās Mp, Mn, Mw un Mw/Mn vērtības, ko devis ražotājs vai kas iegūtas mērījumos, kā arī noteikšanas metožu detaļas,
— iešļircinātais tilpums un iešļircinātā šķīduma koncentrācija,
— kalibrēšanā izmantotā Mp vērtība,
— eluēšanas tilpums vai koriģētais aiztures laiks, kas izmērīts pīķa maksimumā,
— pīķa maksimumā aprēķinātais Mp,
— aprēķinātā Mp kļūda procentos un kalibrēšanas vērtība.
2.2.4. Novērtēšana
— Novērtēšana, ņemot vērā laiku: metodes, kas izmantotas, lai nodrošinātu vajadzīgo atkārtojamību (koriģēšanas metode, iekšējais standarts utt.),
— informācija par to, vai novērtēšana veikta, pamatojoties uz eluēšanas tilpumu vai aiztures laiku,
— informācija par novērtēšanas robežām, ja pīķis nav pilnībā izanalizēts,
— nogludināšanas metožu apraksts, ja tādas ir lietotas,
— parauga iepriekšējās apstrādes un sagatavošanas procedūras,
— neizšķīdušu daļiņu klātbūtne, ja tādas ir,
— iešļircinātais tilpums μl un iešļircinātā šķīduma koncentrācija (mg/ml),
— novērojumi, kas norāda uz ietekmēm, kas rada novirzes no ideāla GPC profila,
— visu pārbaudes procedūras grozījumu sīks apraksts,
— detaļas par kļūdu diapazonu,
— visa pārējā informācija un novērojumi, kas attiecas uz rezultātu interpretāciju.
3. IZMANTOTĀ LITERATŪRA
(1) DIN 55672 (1995) Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1.
(2) Yau, W.W., Kirkland, J.J., and Bly, D.D. eds, (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons.
(3) ASTM D 3536-91 (1991). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania.
(4) ASTM D 5296-92 (1992). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania.
Papildinājums
Polimēru skaita vidējā molekulsvara (Mn) citu noteikšanas metožu piemēri
Gelhromatogrāfija (GPC) ir vispiemērotākā metode Mn noteikšanai, īpaši, ja ir pieejams standartu komplekts, kuru uzbūve ir salīdzināma ar polimēra uzbūvi. Tomēr, ja GPC izmantošanā ir praktiskas grūtības vai ir sagaidāms, ka viela neatbildīs noteicošajam Mn kritērijam (kas jāapstiprina), tad ir pieejamas alternatīvas metodes, piemēram:
1. No molekulu skaita atkarīgo īpašību izmantošana
1.1. Ebulioskopija/krioskopija
Ietver šķīdinātāja viršanas punkta paaugstinājuma (ebulioskopija) vai sasalšanas temperatūras pazeminājuma (krioskopija) mērīšanu, kad šķīdinātājam ir pievienots polimērs. Metode pamatojas uz to, ka izšķīdušā polimēra ietekme uz šķidruma vārīšanās/sasalšanas temperatūru ir atkarīga no polimēra molekulas masas (1) (2).
Pielietojamība: Mn < 20 000.
1.2. Tvaika spiediena pazeminājums
Ietver izvēlētā standartšķidruma tvaika spiediena mērījumus pirms un pēc zināmu polimēra daudzumu pievienošanas (1) (2).
Pielietojamība: Mn < 20 000 (teorētiski; praktiski tomēr metodes vērtība ir ierobežota).
1.3. Membrānas osmometrija
Pamatojas uz osmozes principu, t. i., šķīdinātāja molekulu tieksmi iet cauri puscaurlaidīgām membrānām no atšķaidītāka uz koncentrētāku šķīdumu, lai sasniegtu līdzsvaru. Šķīdinātāja iešana caur membrānu rada spiediena starpību, kas ir atkarīga no polimēra koncentrācijas un molekulu masas (1) (3) (4).
Pielietojamība: Mn starp 20 000–200 000.
1.4. Tvaika fāzes osmometrija
Saistīta ar tīra šķīdinātāja aerosola iztvaikošanas ātruma salīdzināšanu ar vismaz trīs aerosolu, kas satur polimēru dažādās koncentrācijās, iztvaikošanas ātrumu (1) (2) (4).
Pielietojamība: Mn < 20 000.
2. Gala grupu analīze
Lai izmantotu šo metodi, jāzina gan polimēra vispārējā uzbūve, gan ķēdes noslēdzošās grupas (kam jābūt atšķiramām no galvenā skeleta, piemēram, ar KMR metodi vai ar titrēšanu/derivatizāciju). Polimēra gala grupu molekulārās koncentrācijas noteikšana var noskaidrot molekulu masu lielumu (7) (8) (9).
Pielietojamība: Mn līdz 50 000 (ticamība samazinās, palielinoties molekulu masai).
3. Izmantotā literatūra
(1) Billmeyer, F.W. Jr. (1984). Textbook of Polymer Science, 3rd Edn., John Wiley, New York.
(2) Glover, C.A. (1975). Absolute Colligative Property Methods. Chapter 4. In: Polymer Molecular Weights, Part I P.E. Slade, Jr. ed., Marcel Dekker, New York.
(3) ASTM D 3750-79 (1979). Standard Practice for Determination of Number-Average Molecular Weight of Polymers by Membrane Osmometry. American Society for Testing and Materials, Philadelphia, Pennsylvania.
(4) Coll, H. (1989). membrane Osmometry. In: Determination of Molecular Weight, A.R. Cooper ed., J. Wiley and Sons, p. 25–52.
(5) ASTM 3592-77 (1977). Standard Recommended Practice for Determination of Molecular Weight by Vapour Pressure, American Society for Testing and Materials, Philadelphia, Pennsylvania.
(6) Morris, C.E.M. (1989). Vapour Pressure osmometry. In: Determinationn of Molecular Weight, A.R. Cooper ed., John Wiley and Sons.
(7) Schröder, E., Müller, G., and Arndt, K-F. (1989). Polymer Characterisation, Carl Hanser Verlag, Munich.
(8) Garmon, R.G. (1975). End-Group Determinations, Chapter 3 In: Polymer Molecular Weights, Part I, P.E. Slade, Jr. ed. Marcel Dekker, New York.
(9) Amiya, S., et al. (1990). Pure and Applied Chemistry, 62, p. 2139–2146.
A.19. MAZU MOLEKULU MASU SATURS POLIMĒROS
1. METODE
Šī gelhromatogrāfijas metode ir OECD TG 119 (1996) kopija. Pamatprincipi un sīkāka tehniskā informācija ir dota atsaucēs.
1.1. IEVADS
Tā kā polimēru īpašības ir tik dažādas, ir neiespējami aprakstīt vienu metodi, kas precīzi izklāstītu sadalīšanas un novērtēšanas apstākļus, kas aptvertu visas iespējamības un īpatnības, kādas sastopamas polimēru sadalīšanā. Jo īpaši ar gelhromatogrāfiju (GPC) bieži nav analizējamas sarežģītas polimēru sistēmas. Ja GPC nav izmantojama, molekulas masu var noteikt ar citām metodēm (skatīt pielikumu). Tādos gadījumos būtu jāsniedz visas izmantotās metodes detaļas un pamatojums.
Šeit aprakstītā metode pamatojas uz DIN standartu 55672 (1). Sīki izstrādāta informācija, kā veikt eksperimentus un kā izvērtēt datus, ir atrodama šajā DIN standartā. Ja nepieciešams mainīt eksperimenta apstākļus, šīs izmaiņas jāpamato. Citus standartus var izmantot, ja dod visas atsauces. Šeit aprakstītā metode kalibrēšanai izmanto polistirola paraugus ar zināmu polidispersitāti, un tā varbūt jāmodificē, lai tā atbilstu noteiktiem polimēriem, piemēram, ūdenī šķīstošiem un sazarotiem polimēriem ar garu ķēdi.
1.2. DEFINĪCIJAS UN VIENĪBAS
Maza molekulas masa nosacīti ir definēta kā molekulas masa, kas mazāka par 1 000 daltoniem.
Skaita vidējo molekulas masu Mn un svara vidējo molekulas masu Mw nosaka, izmantojot šādus vienādojumus:
|
|
|
kur:
|
HI |
= |
detektora signāla līmenis, skaitot no bāzes līnijas, aiztures tilpumam Vi, |
|
Mi |
= |
polimēra frakcijas molekulas masa ar aiztures tilpumu Vi un n ir datu punktu skaits |
Molekulu masu sadalījuma līknes platumu, kas ir sistēmas dispersitātes mērs, nosaka attiecība Mw/Mn.
1.3. STANDARTVIELAS
Tā kā GPC ir relatīva metode, jāizdara kalibrēšana. Parasti šim nolūkam izmanto lineāras uzbūves polistirola standartvielas ar zināmām molekulu masām Mn un Mw un ar šauru masu sadalījuma diapazonu. Nezināma parauga molekulas masas noteikšanai šo kalibrācijas līkni var izmantot tikai tad, ja sadalīšanas apstākļi paraugam un standartvielām ir izvēlēti identiski.
Noteiktā molekulu masu un eluēšanas tilpuma sakarība ir ticama tikai konkrēta eksperimenta specifiskos apstākļos. Šie apstākļi, pirmkārt, ietver temperatūru, šķīdinātāju (vai šķīdinātāju maisījumu), hromatografēšanas apstākļus un sadalīšanas kolonnu vai kolonnu sistēmu.
Šādi noteiktās parauga molekulu masas ir relatīvi lielumi, un tos apzīmē kā “polistirola ekvivalentās molekulu masas”. Tas nozīmē, ka atkarībā no uzbūves un ķīmiskajām atšķirībām starp paraugu un standartiem molekulu masas lielākā vai mazākā mērā var atšķirties no absolūtajiem lielumiem. Ja izmanto citus standartus, piemēram, polietilenglikolu, polietilenoksīdu, polimetilmetakrilātu, poliakrilskābi, iemesls būtu jāpamato.
1.4. PĀRBAUDES METODES PRINCIPS
Ar GPC var noteikt gan parauga molekulu masu sadalījumu, gan vidējās molekulu masas (Mn, Mw). GPC ir īpaša veida šķidrumu hromatogrāfija, kas paraugu sadala atbilstīgi atsevišķo sastāvdaļu hidrodinamiskiem tilpumiem (2).
Sadalīšana notiek, paraugam ejot caur kolonnu, kas ir pildīta ar porainu materiālu, parasti ar organisku gelu. Mazas molekulas var iekļūt porās, kamēr lielas molekulas tur neiekļūst. Lielo molekulu ceļš tādēļ ir īsāks un tās eluējas pirmās. Vidēji lielas molekulas iekļūst dažās porās un eluējas vēlāk. Vismazākās molekulas, kuru vidējais hidrodinamiskais rādiuss ir mazāks par gela porām, var iekļūt visās porās. Tās eluējas visvēlāk.
Ideālā gadījumā sadalīšanu pilnībā nosaka molekulu lielums, bet praksē ir grūti izvairīties vismaz no dažām traucējošām absorbcijas ietekmēm. Nevienāds kolonnas pakojums un kolonnā nesorbēto vielu aiztures laiks var stāvokli vēl pasliktināt (2).
Detektēšanu veic, piemēram, izmantojot laušanas koeficientu vai UV absorbciju, un iegūst vienkāršu sadalījuma līkni. Lai uz līkni attiecinātu faktiskos molekulu masu lielumus, tomēr jākalibrē kolonna, caur to laižot polimērus ar zināmu molekulas masu un ideālā gadījumā ar aptuveni līdzīgu uzbūvi, piemēram, dažādus polistirola standartus. Parasti iegūst Gausa sadalījuma līkni, kas dažkārt ir izkropļota ar nelielu asti mazo molekulu masu pusē. Līknes vertikālā koordinātu ass rāda dažādu eluēto molekulu, kam ir atšķirīgas molekulu masas, svara daudzumus un horizontālā ass rāda molekulu masas logaritmu.
Mazu molekulu masu saturu izrēķina no šīs līknes. Aprēķins precīzs var būt tikai tad, ja vielas ar mazām molekulu masām izturas tāpat kā polimērs kopumā.
1.5. KVALITĀTES KRITĒRIJI
Eluēšanas tilpuma atkārtojamībai (relatīvajai standartnovirzei – Relative Standard Deviation: RSD) būtu jābūt labākai par 0,3 %. Analīzei vajadzīgā atkārtojamība jānodrošina, koriģējot ar iekšējo standartu, ja hromatogramma ir novērtēta kā atkarīga no laika un neatbilst iepriekš minētajam kritērijam (1). Polidispersitāte ir atkarīga no standartvielu molekulu masām. Polistirola standartu gadījumā parastie lielumi ir:
|
Mp < 2 000 |
Mw/Mn < 1,20, |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05, |
|
Mp > 106 |
Mw/Mn < 1,20. |
(Mp ir standartvielas molekulas masa pīķa maksimumā.)
1.6. PĀRBAUDES METODES APRAKSTS
1.6.1. Polistirola standartšķīdumu pagatavošana
Polistirola standartvielas izšķīdina izvēlētajā eluentā, rūpīgi maisot. Gatavojot šķīdumus, jāievēro ražotāja norādījumi.
Izvēlētās standartvielu koncentrācijas ir atkarīgas no vairākiem faktoriem, piemēram, iešļircināmā tilpuma, šķīduma viskozitātes un analīzes detektora jutības. Maksimālais iešļircināmais tilpums jāpieskaņo kolonnas garumam, lai izvairītos no pārslodzes. Parasti, izmantojot GPC, ja kolonnas izmēri ir 30 cm × 7,8 mm, iešļircināmie tilpumi analītiskām sadalīšanām ir starp 40 un 100 μl. Ir iespējams izmantot lielākus tilpumus, bet tiem nevajadzētu pārsniegt 250 μl. Pirms kolonnas faktiskās kalibrēšanas jānosaka optimālā attiecība starp iešļircināmo tilpumu un koncentrāciju.
1.6.2. Parauga šķīduma pagatavošana
Principā tās pašas prasības attiecas uz parauga šķīduma sagatavošanu. Paraugu izšķīdina piemērotā šķīdinātājā, piemēram, tetrahidrofurānā (THF), uzmanīgi kratot. Nekādā ziņā paraugu nedrīkst šķīdināt, izmantojot ultraskaņu. Ja vajadzīgs, parauga šķīdumu tīra caur membrānas filtru ar poru izmēriem starp 0,2 un 2 μm.
Neizšķīdušo daļiņu klātbūtne jāatzīmē galaprotokolā, jo tās var būt radušās vielu, kam ir lielāka molekulu masa, klātbūtnes dēļ. Būtu jāizmanto piemērota metode, lai noteiktu neizšķīdušo daļiņu svara procentus. Šķīdumi būtu jāizlieto 24 stundu laikā.
1.6.3. Korekcija uz piemaisījumu un piedevu saturu
Vielu ar M < 1 000 satura korekcija uz klātesošiem nepolimēru specifiskiem komponentiem (piemēram, piemaisījumiem vai piedevām) parasti ir nepieciešama, ja vien izmērītais saturs jau nav mazāks par 1 %. To veic ar GPC eluāta vai polimēra šķīduma tiešo analīzi.
Gadījumos, kad eluāta šķīdums pēc iznākšanas no kolonnas ir pārāk atšķaidīts tālākai analīzei, tas jāsakoncentrē. Var būt vajadzīgs eluātu ietvaicēt līdz sausam un vēlreiz atšķaidīt. Eluāta koncentrēšana jāveic apstākļos, kas nodrošina, ka eluātā nenotiek nekādas pārmaiņas. Eluāta apstrāde pēc GPC posma ir atkarīga no kvantitatīvai noteikšanai izmantojamās metodes.
1.6.4. Aparatūra
GPC iekārtai ir šādas galvenās sastāvdaļas:
— šķīdinātāja rezervuārs,
— eluenta atgāzētājs (ja vajadzīgs),
— sūknis,
— impulsu dempferis (ja vajadzīgs),
— iešļircināšanas sistēma,
— hromatogrāfijas kolonnas,
— detektors,
— plūsmas mērītājs (ja vajadzīgs),
— datu reģistrācijas un apstrādes sistēma,
— trauks atkritumiem.
Jānodrošina, lai GPC sistēma būtu inerta attiecībā uz lietojamiem šķīdinātājiem (piemēram, lietojot tērauda kapilārus THF šķīdinātājam).
1.6.5. Iešļircināšanas un šķīdinātāja padeves sistēma
Parauga šķīduma noteiktu daudzumu ievada kolonnā, vai nu izmantojot autosampleru, vai ar roku precīzi noteiktā zonā. Ja, ievadot ar roku, šļirces virzuli atvelk vai nospiež pārāk ātri, tas var mainīt novērojamo molekulu masu sadalījumu. Šķīdinātāja padeves sistēmai, cik iespējams, būtu jābūt bez impulsiem, ideālā gadījumā tajā būtu jābūt impulsu dempferim. Plūsmas ātruma kārtas lielums ir 1 ml/min.
1.6.6. Kolonna
Atkarībā no parauga polimēru analizē, izmantojot vai nu vienu kolonnu, vai vairākas secīgi savienotas kolonnas. Pārdošanā ir pieejami vairāki kolonnu materiāli ar noteiktām īpašībām (piemēram, poru lielumu, izslēgšanas robežas). Sadalītāja gela vai kolonnas garuma izvēle ir atkarīga no parauga īpašībām (hidrodinamiskais tilpums, molekulu masu sadalījums) un no specifiskiem sadalīšanas apstākļiem, piemēram, šķīdinātāja, temperatūras un plūsmas ātruma (1) (2) (3).
1.6.7. Teorētiskie šķīvji
Sadalīšanai izmantotā kolonna vai kolonnu apvienojums jāraksturo ar teorētisko šķīvju skaitu. Ja par eluēšanas šķīdinātāju lieto THF, tas ietver etilbenzola vai citas piemērotas nepolāras vielas šķīduma ievadīšanu zināma garuma kolonnā. Teorētisko šķīvju skaitu aprēķina ar šādiem vienādojumiem:
|
|
vai |
|
kur:
|
N |
= |
teorētisko šķīvju skaits, |
|
Ve |
= |
eluētais tilpums pīķa maksimuma punktā, |
|
W |
= |
pīķa platums pie bāzes līnijas, |
|
W1/2 |
= |
pīķa platums pusē no augstuma. |
1.6.8. Sadalīšanas efektivitāte
In addition to the number of theoretical plates, which is a quantity determining the bandwidth, a part is also played by the separation efficiency, this being determined by the steepness of the calibration curve. The separation efficiency of a column is obtained from the following relationship:

kur:
|
Ve, Mx |
= |
polistirola ar molekulas masu Mx eluētais tilpums, |
|
Ve,(10Mx) |
= |
polistirola ar 10 reižu lielāku molekulas masu eluētais tilpums, |
|
L |
= |
kolonnas šķērsgriezuma laukums |
Sistēmas izšķirtspēju parasti nosaka šādi:
kur:
|
Ve1, Ve2 |
= |
divu polistirola standartu eluēšanas tilpumi pīķa maksimumā, |
|
W1, W2 |
= |
pīķa platumi pie bāzes līnijas, |
|
M1, M2 |
= |
molekulu masas pīķu maksimumos (tām būtu jāatšķiras 10 reižu). |
Kolonnu sistēmas R lielumam būtu jābūt lielākam par 1,7 (4).
1.6.9. Šķīdinātāji
Visiem šķīdinātājiem jābūt augstas tīrības (THF lieto ar tīrības pakāpi 99,5 %). Šķīdinātāja rezervuāram (ja vajadzīgs, inertas gāzes atmosfērā) jābūt pietiekami lielam, lai veiktu kolonnas kalibrēšanu un vairākas paraugu analīzes. Šķīdinātājs jāatbrīvo no gāzēm, pirms to ar sūkni pievada kolonnai.
1.6.10. Temperatūras kontrole
Svarīgāko iekšējo sastāvdaļu (inžektora cilpas, kolonnu, detektora un cauruļu) temperatūrai būtu jābūt konstantai un atbilstošai izvēlētajam šķīdinātājam.
1.6.11. Detektors
Detektoram kvantitatīvi jāreģistrē no kolonnas eluētā parauga koncentrācija. Lai izvairītos no nevajadzīgas pīķa paplašināšanās, detektora šūnas ķivetes tilpumam vajadzētu būt pēc iespējas mazākam. Tam nevajadzētu būt lielākam par 10 μl, izņemot gaismas izkliedes un viskozitātes detektorus. Parasti detektēšanai izmanto diferenciālo refraktometriju. Tomēr, ja tas vajadzīgs parauga vai eluēšanas šķīdinātāja specifisko īpašību dēļ, var izmantot citu veidu detektorus, piemēram, UV/VIS, IR, viskozitātes detektorus utt.
2. DATI UN PROTOKOLĒŠANA
2.1. DATI
Detalizētus izvērtēšanas kritērijus un prasības, kas attiecas uz datu savākšanu un apstrādi, skatīt DIN standartā (1).
Katram paraugam jāizdara divi neatkarīgi eksperimenti. Tie jāanalizē atsevišķi. Visos gadījumos ir būtiski svarīgi iegūt arī tukšo mēģinājumu datus tādos pašos apstākļos, kā veikta parauga analīze.
Skaidri jānorāda, ka izmērītie lielumi ir relatīvi lielumi, kas ir ekvivalenti lietotā standarta molekulu masām.
Pēc aiztures tilpumu vai aiztures laiku noteikšanas (iespējams, koriģējot ar iekšējo standartu) log Mp lielumus (Mp ir kalibrēšanas standarta pīķa maksimuma vērtība) atliek grafikā pret vienu no minētajiem lielumiem. Vajadzīgi vismaz divi kalibrēšanas punkti uz molekulu masas dekādi, visai līknei vajadzīgi vismaz pieci kalibrēšanas punkti, kam būtu jāietver parauga noteiktā molekulas masa. Kalibrēšanas līknes zemāko molekulu masu galapunktu nosaka ar n-heksilbenzolu vai citu piemērotu nepolāru izšķīdināmo vielu. Līknes daļu, kas atbilst molekulu masām zem 1 000, nosaka un, ja vajadzīgs, koriģē attiecībā uz piemaisījumiem un piedevām. Eluēšanas līknes parasti izvērtē ar elektronisko datu apstrādi. Skaitļojot ar roku, var konsultācijai izmantot ASTM D 3536-91 (3).
Ja kolonnā ir aizturēts kāds nešķīstošs polimērs, tā molekulas masa varētu būt lielāka par šķīstošo frakciju molekulas masu un, ja to neņem vērā, zemo molekulu masu saturu novērtē pārāk augstu. Pielikumā dotas vadlīnijas, kā koriģēt zemo molekulu masu saturu uz nešķīstoša polimēra klātbūtni.
Sadalījuma līkne jāsagatavo tabulas vai zīmējuma veidā (diferenciālais biežums vai procenti no summas pret log M). Attēlojot grafiski, vienai molekulu masas dekādei būtu jābūt ap 4 cm platai un pīķa maksimumam būtu jābūt ap 8 cm augstam. Integrālajām sadalījuma līknēm starpībai uz ordinātas starp 0 un 100 % vajadzētu būt ap 10 cm.
2.2. PĀRBAUDES PROTOKOLS
Pārbaudes protokolam jāietver šāda informācija:
2.2.1. Pārbaudāmā viela
— Pieejamā informācija par analizējamo vielu (identiskums, piedevas, piemaisījumi),
— parauga apstrādes apraksts, novērojumi, problēmas.
2.2.2. Iekārtas
— Eluenta rezervuārs, inerta gāze, eluenta atgāzēšana, eluenta sastāvs, piemaisījumi,
— sūknis, impulsu dempferis, inžektora sistēma,
— sadalīšanas kolonnas (ražotājs, visa informācija par kolonnas raksturlielumiem, piemēram, poru izmēri, sadalīšanas materiāls utt., izmantoto kolonnu skaits, garums un sakārtojums),
— kolonnas (vai to apvienojuma) teorētisko šķīvju skaits, sadalīšanas efektivitāte (sistēmas izšķirtspēja),
— informācija par pīķu simetriju,
— kolonnas temperatūra, temperatūras kontroles veids,
— detektors (mērījumu princips, tips, ķivetes tilpums),
— plūsmas mērītājs, ja to lieto (ražotājs, mērīšanas princips),
— reģistrēšanas un datu apstrādes sistēma (aparatūra, programmatūra).
2.2.3. Sistēmas kalibrēšana
— Kalibrēšanas līknes konstruēšanai izmantotās metodes sīks apraksts,
— informācija par šīs metodes kvalitātes kritērijiem (piemēram, korelācijas koeficients, kvadrātisko kļūdu summa utt.),
— informācija par visām ekstrapolācijām, eksperimenta procedūru, novērtēšanas un datu apstrādes laikā izdarītie pieņēmumi un tuvinājumi,
— visiem mērījumiem, kas izmantoti kalibrācijas līknes konstruēšanai, jābūt dokumentētiem tabulā, kas ietver šādu informāciju katram kalibrācijas punktam:
—— parauga nosaukums,
— parauga ražotājs,
— standartu raksturīgās Mp, Mn, Mw un Mw/Mn vērtības, ko devis ražotājs vai kas iegūtas mērījumos, kā arī noteikšanas metožu detaļas,
— iešļircinātais tilpums un iešļircinātā šķīduma koncentrācija,
— kalibrēšanā izmantotā Mp vērtība,
— eluēšanas tilpums vai koriģētais aiztures laiks, kas izmērīts pīķa maksimumā,
— pīķa maksimumā aprēķinātais Mp,
— aprēķinātā Mp kļūda procentos un kalibrēšanas vērtība.
2.2.4. Informācija par polimēra saturu ar zemu molekulas masu
— Analīzē izmantoto metožu apraksts un veids, kā eksperimenti veikti,
— informācija par vielu ar mazu molekulas masu procentuālo daudzumu (svars/svars) attiecībā uz visu paraugu,
— informācija par piemaisījumiem, piedevām un citu vielu, kas nav polimēri, saturu svara procentos attiecībā uz visu paraugu.
2.2.5. Novērtēšana
— Novērtēšana, ņemot vērā laiku: visas metodes, kas izmantotas, lai nodrošinātu vajadzīgo atkārtojamību (koriģēšanas metode, iekšējais standarts utt.),
— informācija par to, vai novērtēšana veikta, pamatojoties uz eluēšanas tilpumu vai aiztures laiku,
— informācija par novērtēšanas robežām, ja aparatūra pīķi nav pilnīgi izanalizējusi,
— nogludināšanas metožu apraksts, ja tādas ir lietotas,
— parauga pirmapstrādes un pirmsagatavošanas procedūras,
— neizšķīdušu daļiņu klātbūtne, ja tādas ir,
— iešļircinātais tilpums (μl) un iešļircinātā šķīduma koncentrācija (mg/ml),
— novērojumi, kas norāda uz ietekmēm, kas rada novirzes no ideāla GPC profila,
— visu analīzes procedūras grozījumu sīks apraksts,
— detaļas par kļūdu diapazonu,
— cita informācija un novērojumi, kas attiecas uz rezultātu interpretāciju.
3. IZMANTOTĀ LITERATŪRA
(1) DIN 55672 (1995) Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1.
(2) Yau, W.W., Kirkland, J.J., and Bly, D.D. eds. (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons.
(3) ASTM D 3536-91 (1991). Standard Test method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania.
(4) ASTM D 5296-92 (1992). Standard Test method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania.
Papildinājums
Norādījumi mazmolekulāru vielu satura koriģēšanai nešķīstoša polimēra klātbūtnē
Ja paraugā ir klāt nešķīstošs polimērs, tad GPC analīzes laikā rodas masas zudums. Nešķīstošo polimēru neatgriezeniski aiztur kolonnā vai uz parauga filtra, bet parauga šķīstošā daļa iziet cauri kolonnai. Ja polimēra laušanas koeficienta inkrementu (dn/dc) var novērtēt vai izmērīt, var novērtēt kolonnā zudušo parauga masu. Šajā gadījumā izdara korekciju, izmantojot ārējo kalibrēšanu ar standartmateriāliem, kam ir zināma koncentrācija un dn/dc, lai nokalibrētu refraktometra atbildes signālu. Turpmāk minētajā piemērā ir izmantots polimetilmetakrilāta (pMMA) standarts.
Ārējā kalibrēšanā, lai veiktu akrilpolimēru analīzi ar GPC metodi, analizē zināmas koncentrācijas pMMA standartšķīdumu tetrahidrofurānā un iegūtos datus izmanto, lai atrastu refraktometra konstanti saskaņā ar vienādojumu:
K = R/(C × V × dn/dc)
kur:
|
K |
= |
refraktometra konstante (mikrovoltsekundes/ml), |
|
R |
= |
atbildes signāls uz pMMA standartu (mikrovoltsekundes), |
|
C |
= |
pMMA standarta koncentrācija (mg/ml), |
|
V |
= |
iešļircināmais tilpums (ml) un |
|
dn/dc |
= |
laušanas koeficienta inkrements pMMA šķīdumam tetrahidrofurānā (ml/mg). |
PMMA standartam ir raksturīgi šādi dati:
|
R |
= |
2 937 891, |
|
C |
= |
1,07 mg/ml, |
|
V |
= |
0,1 ml, |
|
dn/dc |
= |
9 × 10-s ml/mg. |
Iegūto K vērtību 3,05 × 1011 izmanto, lai aprēķinātu detektora teorētisko atbildes signālu, ja 100 % no iešļircinātā polimēra ir eluēts caur detektoru.
A.20. POLIMĒRU ŠĶĪŠANA/EKSTRAKCIJA ŪDENĪ
1. METODE
Aprakstītā metode ir OECD TG 120 (1997) pārskatītās versijas kopija. Sīkāku tehnisku informāciju skatīt izmantotās literatūras sarakstā (1).
1.1. IEVADS
Dažiem polimēriem, tādiem kā emulsiju polimēri, var būt vajadzīgs sākotnējs sagatavošanas darbs, pirms var izmantot turpmāk aprakstīto metodi. Šo metodi nevar izmantot šķidriem polimēriem un polimēriem, kas analīzes apstākļos reaģē ar ūdeni.
Ja metodi izmantot nav praktiski vai nav iespējams, šķīšanu/ekstrakciju var pētīt ar citām metodēm. Tādos gadījumos jādod pilnīgas izmantotās metodes detaļas un pamatojums.
1.2. STANDARTVIELAS
Nav.
1.3. PĀRBAUDES METODES PRINCIPS
Polimēru šķīšanu/ekstrakciju ūdens vidē nosaka, izmantojot kolbas metodi (skatīt A.6. “Šķīdība ūdenī; Kolbas metode”), kas ir modificēta, kā aprakstīts turpmāk.
1.4. KVALITĀTES KRITĒRIJI
Nav.
1.5. PĀRBAUDES METODES APRAKSTS
1.5.1. Iekārtas
Metodei ir vajadzīgas šādas iekārtas:
— sasmalcināšanas ierīce, piemēram, smalcinātājs, lai veidotu zināma lieluma daļiņas,
— kratītājs ar temperatūras kontroles iespējām,
— membrānas filtru sistēma,
— piemērots ķīmiskais aprīkojums,
— standartizēti sieti.
1.5.2. Parauga sagatavošana
Reprezentatīvs paraugs vispirms jāsamazina līdz daļiņu izmēriem 0,125 un 0,25 mm, izmantojot piemērotus sietus. Parauga stabilizēšanai vai sasmalcināšanas procesam var būt vajadzīga dzesēšana. Sveķiem līdzīgus materiālus var sasmalcināt šķidrā slāpekļa temperatūrā (1).
Ja frakcija ar vajadzīgā lieluma daļiņām nav iegūstama, jārīkojas tā, lai daļiņu lielumu samazinātu tik lielā mērā, cik tas iespējams, un rezultāts jāprotokolē. Protokolā jānorāda, kā sasmalcinātais paraugs ir glabāts pirms pārbaudes.
1.5.3. Procedūra
Trīs paraugus, kas satur pa 10 g analizējamās vielas, nosver katru savā traukā, kam ir stikla aizbāžņi, un katrā traukā pievieno 1 000 ml ūdens. Ja rīcība ar 10 g polimēra izrādās neizpildāma, jāizmanto nākošais lielākais daudzums, ar ko var rīkoties, un attiecīgi jāpieskaņo ūdens tilpums.
Traukus cieši noslēdz un pēc tam krata 20o temperatūrā. Jālieto kratīšanas vai maisīšanas ierīce, kas var darboties konstantā temperatūrā. Pēc 24 stundām katra trauka saturu centrifugē vai nofiltrē un ar piemērotu analītisku metodi nosaka polimēra daudzumu dzidrajā ūdens fāzē. Ja ūdens fāzei piemērotas analītiskas metodes nav pieejamas, tad kopējo šķīdību/ekstrahējamību var noteikt no filtrēšanas atlikuma vai centrifugēto nogulšņu sausā atlikuma.
Parasti ir nepieciešams kvantitatīvi atšķirt piemaisījumus un piedevas, no vienas puses, un vielas ar mazu molekulas masu, no otras puses. Nosakot gravimetriski, ir arī svarīgi izdarīt tukšo mēģinājumu bez analizējamās vielas, lai ņemtu vērā novirzes, kas rodas eksperimenta procedūras dēļ.
Polimēru šķīdību/ekstrahējamību ūdenī pie 37 oC un pH 2 un pH 9 var noteikt tāpat, kā ir aprakstīts eksperimenta izpildei pie 20 oC. Vajadzīgās pH vērtības var sasniegt, pieliekot vai nu piemērotus buferšķīdumus, vai piemērotas skābes vai bāzes, piemēram, sālsskābi, etiķskābi, nātrija vai kālija hidroksīdu(analīžu kvalitātes), vai NH3.
Atkarībā no izmantotās analīžu metodes būtu jāizdara viens vai divi mēģinājumi. Ja ir pieejamas pietiekami specifiskas metodes ūdens fāzes tiešai analīzei uz polimēra komponentu, viens mēģinājums, kā aprakstīts iepriekš, ir pietiekams. Ja tādas metodes nav pieejamas un polimēra šķīdības/ekstrahējamības noteikšana ir ierobežota ar netiešu analīzi, nosakot ūdens ekstrakta kopējo oglekļa saturu (Total Organic Carbon Content – TOC), tad tomēr būtu jāveic papildu analīze. Šī papildu analīze būtu jāveic arī trešoreiz, lietojot 10 reizes mazāku polimēra paraugu un to pašu ūdens daudzumu, kas lietots pirmajā mēģinājumā.
1.5.4. Analīze
1.5.4.1. Mēģinājums, ko veic ar viena lieluma paraugu
Var būt pieejamas metodes polimēra komponentu tiešai analīzei ūdens fāzē. Alternatīvi var apsvērt arī izšķīdušo/ekstrahēto polimēru komponentu netiešo analīzi, nosakot kopējo šķīstošo daļu saturu un koriģējot uz nepolimēru specifiskiem komponentiem.
Ūdens fāzes analīze kopējā polimēru saturu noteikšanai ir iespējama:
vai nu ar pietiekami jutīgu metodi, piemēram:
— TOC, izmantojot noārdīšanu ar persulfātu vai dihromātu līdz CO2 un sekojošu noteikšanu, izmantojot IR vai ķīmisko analīzi,
— atomu absorbcijas spektrometriju (AAS) vai ar tās induktīvi saistīto plazmas (ICP) emisijas ekvivalento metodi silīciju un metālus saturošiem polimēriem,
— UV absorbcijas vai spektrofluorimetriju arilpolimēriem,
— LC-MS (šķidrumu hromatogrāfija-masspektometrija) paraugiem ar mazu molekulas masu,
vai ūdens ekstraktu iztvaicējot vakuumā līdz sausam atlikumam un atlikumu analizējot ar spektroskopiskām metodēm (IR, UV utt.) vai ar AAS/ICP analīzi.
Ja ūdens fāzes analīzi nevar izdarīt tieši, ūdens ekstrakts būtu jāekstrahē ar šķīdinātāju, kas nejaucas ar ūdeni, piemēram, hloru saturošiem ogļūdeņražiem. Šķīdinātāju pēc tam iztvaicē un atlikumu analizē, lai noteiktu attiecīgā polimēra saturu, kā iepriekš minēts. Visu to komponentu saturs, kas identificēti kā piemaisījumi vai piedevas, jāatņem, lai noteiktu paša polimēra šķīdības/ekstrahēšanas pakāpi.
Ja klāt ir relatīvi lieli šādu vielu daudzumi, var būt vajadzīgs atlikumam izdarīt, piemēram, HPLC vai GC analīzi, lai atšķirtu klātesošo monomēru un no monomēriem atvasinātu vielu piemaisījumus tā, lai varētu noteikt šo pēdējo vielu īsto saturu.
Dažos gadījumos var būt pietiekami, ja organisko šķīdinātāju vienkārši iztvaicē līdz sausam un sauso atlikumu nosver.
1.5.4.2. Analīze parauga diviem dažādiem lielumiem
Visus ūdens ekstraktus analizē, lai noteiktu TOC.
Gravimetrisko noteikšanu izdara neizšķīdušai/neizekstrahētai parauga daļai. Ja pēc katra trauka satura centrifugēšanas vai filtrēšanas polimēra atlikums paliek pielipis pie trauka sienām, trauks jāskalo ar filtrātu, līdz no trauka ir notīrītas jebkādas redzamas daļiņas. Pēc tam filtrātu vēlreiz centrifugē vai filtrē. Atlikumu, kas palicis uz filtra vai centrifugēšanas caurulītē, žāvē vakuumā 40 oC temperatūrā un nosver. Žāvē līdz konstantam svaram.
2. DATI
2.1. VIENA LIELUMA PARAUGA ANALĪZE
Jāuzrāda atsevišķie rezultāti katrai no trim kolbām un vidējie lielumi, kas izteikti masas vienībās šķīduma tilpumā (parasti mg/l) vai masas vienībās uz polimēra masas vienību (parasti mg/g). Bez tam jāuzrāda arī parauga masas zudums (ko aprēķina kā izšķīdušās vielas masas dalījumu ar sākotnējā parauga masu). Jāizrēķina relatīvās standartnovirzes (RSD – relative standart deviation). Jādod arī atsevišķie skaitļi par kopējo analizējamo paraugu (polimērs + svarīgākās piedevas utt.) un pašu polimēru (t. i., pēc šādu piedevu satura atskaitīšanas).
2.2. DIVU DAŽĀDU PARAUGA LIELUMU ANALĪZE
Jāsniedz divu trīskārt atkārtotu eksperimentu TOC lielumi ūdens ekstraktiem un katra eksperimenta vidējais lielums, kas izteikts masas vienībās šķīduma tilpumā (parasti mgC/l), kā arī masas vienības uz sākotnējā parauga masu (parasti mgC/g).
Ja nav atšķirību starp rezultātiem lielai un mazai parauga/ūdens attiecībai, tas var norādīt, ka ekstrahējamie komponenti tiešām ir ekstrahējušies. Tādā gadījumā parasti tiešā analīze nav vajadzīga.
Jādod atsevišķās atlikumu masas, un tās jāizsaka procentos no paraugu sākotnējām masām. Katram eksperimentam jāizrēķina vidējie lielumi. Starpības starp 100 % un atrastajiem procentiem ir šķīstošās un ekstrahējamās vielas procentuālais daudzums sākotnējā paraugā.
3. PROTOKOLI
3.1. PĀRBAUDES PROTOKOLS
Pārbaudes protokolā jābūt šādai informācijai:
3.1.1. Pārbaudāmā viela
— Pieejamā informācija par analizējamo vielu (identitāte, piedevas, piemaisījumi, vielu saturs ar mazu molekulas masu).
3.1.2. Eksperimenta apstākļi
— Izmantoto procedūru un eksperimenta apstākļu apraksts,
— analīzes un detektēšanas metožu apraksts.
3.1.3. Rezultāti
— Šķīdība/ekstrahējamība mg/l; atsevišķie un vidējie lielumi ekstrakcijas analīzēm dažādos šķīdinātājos, atsevišķi uzdodot polimēru saturu un piemaisījumus, piedevas utt.,
— polimēra šķīdība/ekstrahējamība mg/g,
— ūdens ekstraktu TOC lielumi, izšķīdušās vielas svars un izrēķinātie procenti, ja tie ir mērīti,
— katra parauga pH,
— informācija par tukšos mēģinājumos iegūtiem lielumiem,
— ja vajadzīgs, norādes uz analizējamā parauga nestabilitāti pārbaudes un analīzes procesā,
— visa informācija, kas ir svarīga rezultātu interpretācijai.
4. IZMANTOTĀ LITERATŪRA
DIN 53733 (1976) Zerkleinerung von Kunststofferzeugnissen fur Prufzwecke.
A.21. OKSIDIZĒJOŠAS ĪPAŠĪBAS (ŠĶIDRUMI)
1. METODE
1.1. IEVADS
Šī testa metode paredzēta, lai noteiktu šķidruma spēju palielināt degošu vielu degšanas ātrumu vai degšanas intensitāti vai arī spēju veidot pašaizdegošos maisījumu ar degošu vielu, tos rūpīgi sajaucot. Metodes pamatā ir ANO oksidējošu šķidrumu tests (1), un tā ir šim testam līdzvērtīga. Tomēr tāpēc, ka šī metode A21. galvenokārt paredzēta, lai ievērotu Regulu (EK) Nr. 1907/2006, ir nepieciešams salīdzinājums tikai ar vienu standartvielu. Testēšana un salīdzinājums ar papildu standartvielām var būt vajadzīgi gadījumos, kad testu rezultātus izmanto citiem nolūkiem ( 3 ).
Šis tests nav jāveic gadījumos, kad vielas struktūrformula nepārprotami liecina, ka viela nevar stāties eksotermiskās reakcijās ar viegli uzliesmojošiem materiāliem.
Pirms noteikt šo rādītāju, ir lietderīgi iegūt sākotnēju informāciju par testējamās vielas iespējamo sprādzienbīstamību.
Šī metode nav izmantojama cietvielām, gāzēm, sprādzienbīstamām vai viegli uzliesmojošām vielām un organiskajiem peroksīdiem.
Testēšana pēc šīs metodes nav jāveic, ja jau ir pieejami attiecīgās vielas testēšanas rezultāti pēc ANO oksidējošu šķidrumu testa (1).
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Vidējais spiediena paaugstināšanās laiks ir vidējais laiks, kādā testējamais maisījums izraisa spiediena paaugstināšanos no 690 kPa līdz 2 070 kPa virs atmosfēras spiediena.
1.3. STANDARTVIELA
Par standartvielu izmanto (analītiski tīru) 65 % (masas %) slāpekļskābes ūdens šķīdumu ( 4 ).
Ja eksperimentators paredz, ka testēšanas rezultātus, iespējams, izmantos arī citiem nolūkiem (4) , var būt lietderīgi papildus testēt arī citas standartvielas ( 5 ).
1.4. TESTA METODES PRINCIPS
Testējamo šķidrumu masas attiecībā 1:1 sajauc ar celulozes šķiedru un ievieto spiedtvertnē. Ja maisījuma sajaukšanas vai ievietošanas laikā notiek pašaizdegšanās, testēšanu neturpina.
Ja nenotiek pašaizdegšanās, testēšanu veic pilnībā. Maisījumu spiedientvertnē karsē un nosaka vidējo laiku, kādā spiediens paaugstinās no 690 kPa līdz 2 070 kPa virs atmosfēras spiediena. To salīdzina ar vidējo spiediena paaugstināšanās laiku, kāds ir standartvielas(-u) un celulozes maisījumam attiecībā 1:1.
1.5. KVALITĀTES KRITĒRIJI
Piecu izmēģinājumu rezultāti ar vienu vielu nedrīkst atšķirties vairāk par 30 % no to vidējās aritmētiskās vērtības. Izbrāķē rezultātus, kas no vidējās aritmētiskās vērtības atšķiras vairāk par 30 %, testēšanu atkārto pēc maisījuma sajaukšanas un ievietošanas procedūras pilnveidošanas.
1.6. METODES APRAKSTS
1.6.1. Sagatavošana
1.6.1.1. Viegli uzliesmojoša viela
Par viegli uzliesmojošu materiālu izmanto sausas celulozes šķiedras ar šķiedru garumu no 50 līdz 250 μm un vidējo diametru 25 μm ( 6 ). Celulozi līdz nemainīgai masai četras stundas žāvē līdz 25 mm biezā slānī 105 oC temperatūrā, pēc tam atdzesē un līdz lietošanai glabā eksikatorā virs žāvētāja. Sausas celulozes mitruma saturs nedrīkst pārsniegt 0,5 % no bezūdens masas ( 7 ). Lai to panāktu, žāvēšanas laiks, ja vajadzīgs, ir jāpagarina ( 8 ). Visai testēšanai jāizmanto celuloze no vienas un tās pašas partijas.
1.6.1.2. Iekārta
1.6.1.2.1.
Nepieciešama spiedtvertne. Tvertne sastāv no 89 mm gara tērauda spiedtvertnes ar ārējo diametru 60 mm (skatīt 1. attēlu). Cilindra pretējās pusēs izslīpētas divas plakanas virsmas (samazinot šķērsgriezumu līdz 50 mm), ko izmanto fiksēšanai, ieskrūvējot ventilācijas atveres ventili un aizdedzināšanas ventili. Tvertnes abos galos ir izveidots 19 mm dziļš urbums 20 mm diametrā ar iekšējo Lielbritānijas standarta 1' cauruļvītni vai tai līdzvērtīgu metriskās sistēmas vītni. Spiediena novada īscauruli ieskrūvē spiedtvertnes liektajā virsmā 90o leņķī pret izslīpētajām plakanajām virsmām 35 mm attālumā no viena gala. Šim nolūkam līdz 12 mm dziļumam izveido urbumu un iegriež ½' Lielbritānijas standarta cauruļvītni (vai tai līdzvērtīgu metriskās sistēmas vītni), kas atbilst īscaurules vītnei. Ja vajadzīgs, hermētiskuma nodrošināšanai izmanto inerta materiāla blīvi. Īscaurules garums ārpus spiedtvertnes korpusa ir 55 mm, un tās urbuma diametrs ir 6 mm. Īscaurules galā ir urbums ar vītni, kurā ieskrūvē diafragmas tipa spiediena devēju. Var izmantot visas spiediena mērīšanas ierīces, kuru darbību neietekmē karstas gāzes vai sadalīšanās produkti un kuru reakcijas laiks uz spiediena paaugstināšanos no 690 līdz 2 070 kPa nepārsniedz 5 m/s.
No īscaurules attālāko spiedtvertnes galu noslēdz ar aizdedzināšanas ventili, kas sastāv no diviem elektrodiem, no kuriem viens izolēts no ierīces aizbāžņa, bet otrs ar to savienots. Spiedtvertnes otru galu noslēdz ar pārraujamu disku (pārraušanas spiediens apmēram 2 200 kPa), ko nostiprina ar uzgriezni, kurā ir 20 mm diametra urbums. Ja vajadzīgs, aizdedzināšanas ventiļa hermētiskuma nodrošināšanai izmanto inerta materiāla blīvi. Lietošanas laikā ierīci pareizā stāvoklī notur statīvā (2. attēls). Tas parasti sastāv no mazleģēta tērauda pamatloksnes (235 mm × 184 mm x 6 mm) un 180 mm gara doba kvadrātveida šķērsgriezuma (70 mm × 70 mm × 4 mm) profila.
No kvadrātveida šķērsgriezuma profila pretējās pusēs vienā galā izveidots izgriezums tā, ka izveidojas konstrukcija ar divām plakanām gludām kājām ar 86 mm garu neskartu daļu. Šīs plakanās daļas nogriež 60o leņķī pret horizontāli un piemetina pamatplatei. Pamatnes augšējā daļā vienā pusē izgriež 22 mm platu 46 mm dziļu spraugu tā, lai, statīvā ievietojot spiedtvertnes mezglu ar aizdedzināšanas ventili uz leju, spraugā atrastos īscaurule. Apakšējai iekšējai virsmai piemetina 30 mm platu un 6 mm biezu tērauda gabaliņu, kas kalpo par starpliku. Spiedtvertni cieši fiksē ar divām pretējā virsmā ieskrūvētām 7 mm spārnskrūvēm. No apakšas spiedtvertni balsta divas 12 mm platas 6 mm biezas tērauda lentes, kas piemetinātas sānu gabaliem un pieguļ pamatnei.
1.6.1.2.2.
Aizdedzināšanas sistēma sastāv no 25 cm garas 0,6 mm diametra nihroma stieples ar pretestību 3,85 omi/m. Stiepli uz 5 mm diametra stieņa savij spirālē un piestiprina aizdedzināšanas ventiļa elektrodiem. Spirāli savij kādā no 3. attēlā parādītajiem veidiem. Aizdedzināšanas spirāles apakšai jābūt vismaz 20 mm attālumā no tvertnes dibena. Ja elektrodi nav regulējami, aizdedzināšanas stieples gali starp spirāli un tvertnes apakšu jāizolē ar keramikas apvalku. Stiepli sakarsē no pastāvīga barošanas avota, kas nodrošina vismaz 10 A stipru strāvu.
1.6.2. Testa norise ( 9 )
Iekārtu ar uzmontētu spiediena devēju un aizdedzināšanas sistēmu, neuzstādot pārraujamo disku, nostiprina statīvā ar aizdedzināšanas ventili uz leju. Stikla vārglāzē ar stikla spieķīti sajauc 2,5 g testējamā šķidruma ar 2,5 g sausas celulozes ( 10 ). Drošības labad sajaukšana jāveic, lietotājam atrodoties aiz aizsargekrāna. Ja maisījums aizdegas tā sajaukšanas vai iepildīšanas laikā, testēšana nav jāturpina. Maisījumu nelielās daļās sablīvējot pārnes spiedtvertnē un raugās, lai maisījums tiktu sablīvēts ap aizdedzināšanas spirāli un ir ar to labā kontaktā. Svarīgi, lai sablīvēšanas laikā spirāle netiktu deformēta, jo tādēļ var iegūt kļūdainus rezultātus ( 11 ). Ievieto pārraujamo disku un to nostiprina, cieši ieskrūvējot uzgriezni. Uzpildīto tvertni ar pārraujamo disku uz augšu ievieto statīvā velkmes skapī vai dedzināšanas kamerā. Aizdedzināšanas ventiļa ārējos izvadus pieslēdz elektrībai un padod 10 A stipru strāvu. Laiks no maisījuma sajaukšanas līdz elektriskās strāvas ieslēgšanai nedrīkst pārsniegt 10 minūtes.
Spiediena devēja signālu reģistrē, izmantojot piemērotu reģistrācijas sistēmu, kas nodrošina gan radītā spiediena izmaiņu novērtēšanu, gan pastāvīgu reģistrēšanu (piemēram, pārejas procesu reģistrētājs, kas apvienots ar diagrammas reģistrētāju). Maisījumu karsē, līdz saplīst pārraujamais disks vai vismaz 60 sekundes. Ja pārraujamais disks nesaplīst, pirms iekārtu izjaukt, maisījumam ļauj atdzist, veicot piesardzības pasākumus, kas saistīti ar iespējamo spiediena paaugstināšanos iekārtā. Testējamās vielas un standartvielas(-u) izmēģinājumus atkārto piecas reizes. Atzīmē laiku, kādā paaugstinās spiediens no 690 kPa līdz 2 070 kPa virs atmosfēras spiediena. Aprēķina vidējo spiediena paaugstināšanās laiku.
Dažkārt vielas var izraisīt spiediena paaugstināšanos (pārlieku augstu vai pārāk zemu) ar to oksidējošajām īpašībām nesaistītu ķīmisko reakciju dēļ. Šādos gadījumos, lai noskaidrotu reakcijas raksturu, testēšana var būt jāatkārto, celulozes vietā izmantojot inertas vielas, piemēram, diatomītu (kizelguru).
2. REZULTĀTI
Spiediena paaugstināšanās laiks testējamās vielas un standartvielas(-u) izmēģinājumos. Spiediena paaugstināšanās laiks izmēģinājumos ar inertu vielu, ja tie tiek veikti.
2.1. REZULTĀTU APSTRĀDE
Aprēķina vidējo spiediena paaugstināšanās laiku testējamajai vielai un standartvielai(-ām).
Aprēķina vidējo spiediena paaugstināšanās laiku izmēģinājumos ar inertu vielu (ja tiek veikti).
Daži rezultātu piemēri norādīti 1. tabulā.
1. tabula
Rezultātu piemēri ()
|
Viela () |
Vidējais spiediena paaugstināšanās laiks 1:1 maisījumam ar celulozi (m/s) |
|
Amonija dihromāts, piesātināts ūdens šķīdums |
20 800 |
|
Kalcija nitrāts, piesātināts ūdens šķīdums |
6 700 |
|
Dzelzs nitrāts, piesātināts ūdens šķīdums |
4 133 |
|
Litija perhlorāts, piesātināts ūdens šķīdums |
1 686 |
|
Magnija perhlorāts, piesātināts ūdens šķīdums |
777 |
|
Niķeļa nitrāts, piesātināts ūdens šķīdums |
6 250 |
|
Slāpekļskābe, 65 % |
4 767 () |
|
Perhlorskābe, 50 % |
121 () |
|
Perhlorskābe, 55 % |
59 |
|
Kālija nitrāts, 30 % ūdens šķīdums |
26 690 |
|
Sudraba nitrāts, piesātināts ūdens šķīdums |
|
|
Nātrija hlorāts, 40 % ūdens šķīdums |
2 555 () |
|
Nātrija nitrāts, 45 % ūdens šķīdums |
4 133 |
|
Inerta viela |
|
|
Ūdens – celuloze |
|
|
(1) Klasifikācijai pēc ANO transporta shēmas skatīt izmantotās literatūras sarakstā (1). (2) Piesātinātie šķīdumi jāpagatavo 20 oC. (3) Starplaboratoriju salīdzinošajā izmēģinājumā noteiktā vidējā vērtība. (4) Maksimālais spiediens 2 070 kPa nav sasniegts. |
|
3. PĀRSKATA SAGATAVOŠANA
3.1. PĀRSKATS PAR TESTU
Pārskatā par testu jāiekļauj šāda informācija:
— testējamās vielas identifikācija, sastāvs, tīrība u. c.,
— testējamās vielas koncentrācija,
— izmantotās celulozes žāvēšanas procedūra,
— izmantotās celulozes ūdens saturs,
— mērījumu rezultāti,
— testēšanas rezultāti ar inertu vielu, ja tā veikta,
— aprēķinātais vidējais spiediena paaugstināšanās laiks,
— atkāpes no minētās metodes un to iemesli,
— papildu informācija vai piezīmes, kas attiecas uz rezultātu interpretāciju.
3.2. REZULTĀTU INTERPRETĀCIJA ( 12 )
Testēšanas rezultātus novērtē, ņemot vērā:
a) vai notiek testējamās vielas un celulozes maisījuma pašaizdegšanās; un
b) vidējā spiediena paaugstināšanās laika no 690 kPa līdz 2 070 kPa salīdzinājumu ar standartvielai(-ām) noteikto.
Šķidrums uzskatāms par oksidētāju, ja:
a) notiek vielas maisījuma ar celulozi masas attiecībā 1:1 pašaizdegšanās, vai
b) vielas, kuru maisījumiem ar celulozi masas attiecībā 1:1 testējot vidējais spiediena paaugstināšanās laiks ir vienāds vai mazāks nekā 65 masas % no slāpekļskābes ūdens šķīduma un celulozes (1:1 pēc masas) maisījumam noteiktā.
Lai neiegūtu šķietami pozitīvus rezultātus, rezultātu interpretācijai ņem vērā arī rezultātus, kas iegūti, vielu testējot maisījumā ar inertu vielu.
4. IZMANTOTĀ LITERATŪRA
(1) Recommendations on the Transport of Dangerous Goods, Manual of Tests and Criteria. 3rd revised edition. UN Publication No: ST/SG/AC.10/11/Rev. 3, 1999, p. 342. Test O.2: Test for oxidizing liquids.
1. attēls
Spiedtvertne

2. attēls
Statīvs
3. attēls
Aizdedzināšanas sistēma

Piezīme. Var izmantot jebkuru no abām konfigurācijām.
A.22. GARUMU SVĒRTAIS ĢEOMETRISKAIS VIDĒJAIS ŠĶIEDRU DIAMETRS
1. METODE
1.1. IEVADS
Šī metode apraksta Garumu svērtā ģeometriskā vidējā šķiedru diametra (GSĢVD) mērīšanas procedūru mākslīgām minerālajām šķiedrām (MMŠ). Sakarā ar to, ka kopumam noteiktais GSĢVD ar 95 % varbūtību atrodas 95 % ticamības līmeņu starpā (GSĢVD ± divas standartkļūdas), tad ziņojumā norādītā vērtība (testa vērtība) būs zemākais parauga 95 % ticamības līmenis (t. i., GSĢVD – 2 standartkļūdas). Šī metode pamatojas uz HSE nozares procedūras projekta redakciju (1994.gada jūnijs), kas apstiprināta ECFIA un HSE sanāksmē Česterā 26.9.1993. un izstrādāta otrajam starplaboratoriju izmēģinājumam un pamatojoties uz to (1,2). Šī mērījumu metode var tikt izmantota, lai raksturotu šķiedru diametru nesakārtotā stāvoklī esošām vielām vai produktiem, kas satur MMŠ, ieskaitot ugunsizturīgas keramikas šķiedras (UKŠ), mākslīgas stikla šķiedras (MSŠ), kristāliskās un polikristāliskās šķiedras.
Svēršana pēc garumiem ir līdzeklis kā kompensēt paraugu ņemšanas vai materiāla apstrādes nodarītā garu šķiedru pārrāvuma ietekmi uz diametra sadalījumu. Ģeometriskos statistiskos datus (ģeometriskos vidējos) izmanto, lai novērtētu MMŠ diametru izmēru sadalījumu, jo šiem diametriem parasti ir izmēru sadalījums, kas aproksimējamas uz logaritmisko normālo.
Gan garuma, gan diametra mērīšana ir nogurdinošs un darbietilpīgs darbs, bet ja mēra tikai tās šķiedras, kas pieskaras bezgalīgai tievai līnijai SEM redzes laukā, tad dotās šķiedras izvēles varbūtība ir proporcionāla tās garumam. Tā kā minētais ņem vērā garumu garuma svēršanas aprēķinos, tad vienīgais mērījums, kas ir nepieciešams, ir diametrs, bet GSĢVD-2SE var aprēķināt kā aprakstīts turpmāk.
1.2. DEFINĪCIJAS
Daļiņa: objekts ar garuma pret platumu attiecību mazāku par 3:1.
Šķiedra: objekts ar garuma pret platumu attiecību (aspekta attiecība) vismaz 3:1.
1.3. PIELIETOJUMI UN IEROBEŽOJUMI
Šī metode ir izstrādāta, lai apskatītu diametru sadalījumu, kurās vidēji diametri sastāda no 0,5 μm līdz 6 μm. Lielākus diametrus var izmērīt, izmantojot mazākus SEM palielinājumus, bet metodes pielietojamība smalkākām šķiedru sadalījumam pakāpeniski samazinās, tāpēc ieteicams pielietot TEM (transmisijas elektronisko mikroskopu), ja vidējais diametrs ir mazāks par 0,5 μm.
1.4. TESTĒŠANAS METODES PRINCIPS
No šķiedru paklāja vai vaļīgām šķiedrām ņem kādu reprezentatīvu serdes paraugu skaitu. Vaļīgām šķiedrām samazina garumu, pielietojot sasmalcināšanas procedūru un attiecīgi sagatavoto reprezentatīvo paraugu disperģē ūdenī. Alikvotas ekstrahē un filtrē caur polikarbonāta filtru ar 0,2 μm lielām porām un sagatavo pētīšanai ar skenēšanas elektroniskās mikroskopijas (SEM) metodi. Šķiedru diametrus mēra pie attēla palielinājuma ×10 000 vai vairāk ( 13 ), izmantojot līnijas šķērsojuma metodi, iegūstot nesagrozītu vidējā diametra novērtējumu. Zemāko 95 % ticamības intervālu (pamatojoties uz vienas puses testu) aprēķina, lai novērtētu mazāko materiāla šķiedras ģeometriskā vidējā diametra vērtību.
1.5. TESTEŠANAS METODES APRAKSTS
1.5.1. Drošība/piesardzības pasākumi
Jāsamazina personu ekspozīcija gaisā lidojošām šķiedrām un jāizmanto velkmes skapis vai kamera ar cimdiem, strādājot ar sausām šķiedrām. Periodiski jāpārbauda personu ekspozīcija, lai novērtētu aizsardzības metožu efektivitāti. Strādājot ar MMŠ, jāvalkā vienreizējas lietošanas cimdi, lai samazinātu ādas kairinājumu un novērstu abpusēju piesārņošanu.
1.5.2. Aparatūra/iekārta
— Prese un presforma, kas spēj nodrošināt 10 MPa.
— Polikarbonāta filtri ar kapilārporām 0,2 μm (filtra diametrs 25 mm).
— Celulozes estera membrānas filtrs ar 5 μm porām, kas izmantojams kā palīgfiltrs.
— Stikla ierīce filtrēšanai (vai vienreizējas lietošanas filtrēšanas sistēmas), kas paredzēta 25 mm diametra filtram (piem., Millipore stikla komplekts mikroanalīzei, tips XX10 025 00).
— Svaigs destilēts ūdens, kas nofiltrēts caur filtru ar 0,2 μm lielām porām, lai atdalītu mikroorganismus.
— Pārklājums uzsmidzinātājs ar zelta vai zelta/pallādija anodu.
— Skenējošais elektronu mikroskops ar izšķirtspēju līdz 10 nm un palielinājumu x10 000.
— Dažādi piederumi: lāpstiņas, 24. tipa skalpelis, pincete, SEM lampas, oglekļa līme vai oglekļa līmlente, sudraba putekļi.
— Ultraskaņas zonde vai galda ultraskaņas vanna.
— Rīks serdes paraugu ņemšanai vai parauga ņemšanas urbis serdes paraugu ņemšanai no MMŠ paklāja.
1.5.3. Testa procedūra
1.5.3.1. Paraugu ņemšana
Paklāju un segu gadījumā šķērsgriezuma paraugu ņemšanai jāizmanto 25 mm rīks serdes paraugu ņemšanai vai parauga ņemšanas urbis. Paraugus ņem vienādās atstarpēs maza paklāja gabala platumā vai ņem pēc nejaušības principa izvēlētās vietās, ja rīcībā ir garāki paklāja gabali. Tos pašus piederumus var izmantot, ņemot paraugus pēc nejaušības principa no vaļīgām šķiedrām. Ja iespējams, jāņem seši paraugi, lai atspoguļotu nesakārtotā materiāla telpisko neviendabīgumu.
Seši serdes paraugi jāsasmalcina 50 mm diametra presformā pie 10 MPa. Materiālu samaisa ar lāpstiņu un atkārtoti saspiež pie 10 MPa. Pēc tam materiālu izņem no presformas un glabā noslēgtā stikla traukā.
1.5.3.2. Paraugu sagatavošana
Ja nepieciešams, no organiskajām saistvielām var atbrīvoties, ievietojot šķiedru krāsnī pie 450 °C aptuveni uz vienu stundu.
Paraugs jānoskalda un jāsadala četrās daļas (tas jādara putekļu aizsargkamerā).
Mazu parauga daudzumu (< 0,5 g) pievieno ar lāpstiņu 100 ml svaiga destilēta ūdens, kas nofiltrēts caur 0,2 μm membrānas filtru (var izmantot alternatīvus augstākās tīrības ūdens avotus, ja šo avotu atbilstība ir pierādīta). Rūpīgi disperģē, pielietojot ultraskaņas zondi ar jaudu 100 W, zondi noregulējot tā, ka notiek kavitācija. (Ja zondes nav pieejama, jāpielieto šāda metode: nepārtraukti sakrata un apgroza 30 sekunžu laikā; apstrādā ar ultraskaņu galda ultraskaņas vannā 5 minūšu laikā; pēc tam atkal sakrata un apgroza turpmāko 30 sekunžu laikā).
Tūlīt pēc šķiedras dispērģēšanas jāņem vairākas alikvotas (piem., trīs alikvotas pa 3, 6 un 10 ml) ar platmutes pipeti.
Katrai alikvotai veic vakuuma filtrēšanu caur 0,2 μm polikarbonāta filtru ar 5 μm lielu poru MEC palīgfiltru, izmantojot 25 mm stikla filtra piltuvi ar cilindrisku trauku. Aptuveni 5 ml nofiltrētā destilēta ūdens jāielej piltuvē un alikvotu lēnām pilina ūdenī ar pipetes palīdzību, turot pipetes galu zem meniska. Pēc pilināšanas pipete un trauks rūpīgi jānoskalo, jo tievām šķiedrām ir tendence novietoties uz virsmas.
Piesardzīgi noņem filtru un atdala no palīgfiltra, pēc tam ievieto traukā žāvēšanai.
Nogriež ceturtdaļu vai pusi no nofiltrētās nogulsnes filtra, izmantojot 24.tipa skalpeli ar šūpojošo kustību. Nogriezto daļu piesardzīgi piestiprina pie SEM galviņas ar oglekļa līmlenti vai oglekļa līmi. Sudraba putekļus jāuzklāj vismaz trīs vietās, lai uzlabotu elektrisko kontaktu filtra un galviņas malās. Kad līme/sudraba putekļi ir izžuvuši, jāuzsmidzina aptuveni 50 nm bieza zelta vai zelta/pallādija kārta uz nogulsnes virsmas.
1.5.3.3. SEM kalibrēšana un darbība
1.5.3.3.1. Kalibrēšana
SEM kalibrēšana jāpārbauda vismaz vienu reizi nedēļā (ideāli būtu reizi dienā) ar sertificētā kalibrēšanas režģa palīdzību. Kalibrēšana jāārbauda pēc sertificētā etalona un ja izmērītā vērtība (SEM) neatbilst ± 2 % no sertificētās vērtības, tad SEM kalibrēšana jāregulē un jāpārbauda atkārtoti.
SEM jābūt spējīgam izšķirt vismaz minimālo saskatāmu diametru 0,2 μm, izmantojot reālo parauga matricu pie palielinājuma × 2 000.
1.5.3.3.2. Darbība
SEM jāpielieto pie palielinājuma 10 000 ( 14 ) apstākļos, kas nodrošina labu izšķiršanu ar pieņemamu attēlu pie lēniem skenēšanas ātrumiem, piemēram, 5 sekundes uz kadru. Kaut gan ekspluatācijas prasības dažādiem SEM var būt dažādas, parasti labākas redzamības un izšķiršanas nodrošināšanai relatīvi mazu atomsvaru materiālu gadījumā jāpielieto paātrinājuma spriegumi 5–10 keV ar mazu punktu izmēru uzstādīšanu un īsu darba attālumu. Veicot lineāro pārskatīšanu, jāizmanto 0o slīpums, lai minimizētu atkārtotu nostādīšanu fokusā, vai, ja SEM ir centrētā režīmā, jāizmanto pret centru mērāmais darba attālums. Mazāku palielinājumu var izmantot, ja materiāls nesatur mazas (pēc diametra) šķiedras un šķiedru diametri ir lieli (> 5 μm)
1.5.3.4. Izmēru noteikšana
1.5.3.4.1. Pētījums pie maza palielinājuma, novērtējot paraugu
Paraugs jāpēta vispirms pie maza palielinājuma, meklējot lielu šķiedru sablīvēšanās pierādījumus un novērtējot šķiedras blīvumu. Pārmērīgas sablīvēšanās gadījumā ieteicams sagatavot jaunu paraugu.
Lai nodrošinātu statistisko precizitāti, jāmēra minimāls šķiedru daudzums, turklāt ir ieteicams liels šķiedru blīvums, jo tukšu lauku pētīšana ir laikietilpīga un neveicina analīzi. Tomēr ja filtrs ir pārblīvēts, tad grūti izmērīt visas mērāmās šķiedras, jo lielākās šķiedras var aizsegt mazākās un tās var tikt nepamanītas.
GSĢVD pārvērtēšanas tendence iespējama gadījumā, ja šķiedru blīvums pārsniedz 150 šķiedras uz milimetru lineārās pārskatīšanas. Savukārt, maza šķiedru koncentrācija palielina analīzes laiku un bieži izdevīgāk būtu sagatavot paraugu ar šķiedru blīvumu, kas tuvāks optimālam, nekā turpināt skaitīt uz filtra ar mazu šķiedru koncentrāciju. Optimālam šķiedru blīvumam jādod vidēji viena vai divas saskaitāmās šķiedras uz redzeslauku pie 5 000 palielinājuma. Tomēr optimālais blīvums ir atkarīgs no šķiedru izmēra (diametra), tāpēc nepieciešams, lai operators pamatotos uz profesionālu pieredzi, lai noteiktu, vai šķiedru blīvums ir vai nav tuvs optimālam.
1.5.3.4.2. Šķiedru diametra svēršana attiecībā pret garumiem
Jāskaita tikai tās šķiedras, kas pieskaras (vai šķērso) bezgalīgo tievo līniju SEM ekrānā. Šim nolūkam jānovelk horizontāla (vai vertikāla) līnija caur ekrāna centru.
Alternatīva varētu būt viena punkta izmantošana ekrāna centrā un nepārtrauktas skenēšanas uzsākšana vienā virzienā filtrā. Jāmēra un jāreģistrē diametrs katrai šķiedrai ar garuma pret platumu attiecību, kas ir lielāka par 3:1, un kas pieskaras vai šķērso šo punktu.
1.5.3.4.3. Šķiedru izmēru noteikšana
Ieteicams izmērīt vismaz 300 šķiedras. Katru šķiedru mēra tikai vienu reizi krustošanās punktā ar punktu vai līniju, kas novilkta attēlā (vai krustošanās punkta tuvumā, ja šķiedras malas ir neskaidras). Ja gadās šķiedras ar neregulāriem šķērsgriezumiem, tad jāveic mērījums, kas atspoguļotu vidējo šķiedru diametru. Jāievēro piesardzība, nosakot malas un mērot īsāko atstarpi starp šķiedru malām. Izmēru noteikšanu var veikt līnijās vai ārlīnijās, izmantojot saglabātus attēlus vai fotogrāfijas. Ieteicams pielietot pusautomātiskas attēla mērīšanas sistēmas, kas datus lejupielādē tieši izklājlapā, jo šīs sistēmas ļauj ietaupīt laiku, novērš kopēšanas kļūdas un var automatizēt aprēķinus.
Garu šķiedru gali jāapskata pie maza palielinājuma, lai pārliecinātos, ka tie nav ielocījušies atpakaļ mērāmajā redzes laukā un tiek izmērīti tikai vienu reizi.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Parasti šķiedru diametriem nav normālā sadalījuma. Tomēr, veicot logaritmisko pārveidošanu, var iegūt sadalījumu, kas aproksimējama uz normālo.
Aprēķina n šķiedru diametru (D) naturālā logaritma (lnD) aritmētisko vidējo (vidējais lnD) un standartnovirzi (SDlnD).
|
|
(1) |
|
|
(2) |
Standartnovirzi dala ar mērījumu skaita (n) kvadrātsakni, iegūstot standartkļūdu (SElnD).
|
|
(3) |
Divkāršoto standartkļūdu atskaita no vidējā un aprēķina šo vērtību eksponenciāli (vidējo atskaitot divkāršoto standartkļūdu), iegūstot ģeometrisko vidējo (formulā apzīmēts kā LWGMD) mīnuss divas ģeometriskās standartkļūdas.
|
|
(4) |
3. ZIŅOJUMS
TESTA PĀRSKATS
Testa pārskatā jāiekļauj vismaz šāda informācija:
— GSĢVD-2SE vērtība.
— Attiecīgs pamatojums jebkādām atkāpēm, it īpaši tādām, kas varētu ietekmēt rezultātu precizitāti un pareizību.
4. IZMANTOTĀ LITERATŪRA
1. B. Tylee SOP MF 240. Health and Safety Executive. February 1999.
2. G. Burdett and G. Revell. Development of a standard method to measure the length-weigthed geometric mean fibre diameter: Results of the Second inter-laboratory exchange. IR/L/MF/94/07. Project R42.75 HPD. Health and Safety Executive. Research and Laboratory Services Division. 1994.
B DAĻA: TOKSICITĀTES UN CITU IETEKMJU UZ VESELĪBU NOTEIKŠANAS METODES
|
SATURS |
|
|
VISPĀRĪGS IEVADS |
|
|
B.1.a |
AKŪTAIS PERORĀLAIS TOKSISKUMS – FIKSĒTĀS DEVAS METODE |
|
B.1.b |
AKŪTS PERORĀLS TOKSISKUMS – AKŪTA TOKSISKUMA KLASES METODE |
|
B.2. |
AKŪTA TOKSICITĀTE (PĒC IEELPOŠANAS) |
|
B.3. |
AKŪTA TOKSICITĀTE (ĀDAS) |
|
B.4. |
AKŪTS TOKSISKUMS – KAIRINĀJUMS/KODĪGA IEDARBĪBA UZ ĀDU |
|
B.5. |
AKŪTS TOKSISKUMS – KAIRINĀJUMS/KODĪGA IEDARBĪBA UZ ACĪM |
|
B.6. |
ĀDAS SENSIBILIZĀCIJA |
|
B.7. |
VAIRĀKKĀRTĒJĀS DEVAS (28 DIENU) TOKSICITĀTE (ORĀLĀ) |
|
B.8. |
ATKĀRTOTĀS DEVAS (28 DIENU) TOKSICITĀTE (IEELPOŠANAS) |
|
B.9. |
ATKĀRTOTĀS DEVAS (28 DIENU) TOKSICITĀTE (ĀDAS) |
|
B.10. |
MUTAGENITĀTE – ZĪDĪTĀJU HROMOSOMU IZMAIŅU TESTS IN VITRO |
|
B.11. |
MUTAGENITĀTE – ZĪDĪTĀJU KAULU SMADZEŅU HROMOSOMU IZMAIŅU TESTS IN VIVO |
|
B.12. |
MUTAGENITĀTE – ZĪDĪTĀJU ERITROCĪTU MIKROKODOLU TESTS IN VIVO |
|
B.13./14. |
MUTAGENITĀTE – BAKTĒRIJU REVERSĀS MUTĀCIJAS |
|
B.15. |
MUTAGENITĀTES NOTEIKŠANA KOPĀ AR KANCEROGENITĀTES PRIEKŠNOVĒRTĒJUMU GĒNU MUTĀCIJAS SACCHAROMYCES CEREVISIAE ŠŪNĀS |
|
B.16. |
MITOTISKĀ REKOMBINĀCIJA – SACCHAROMYCES CEREVISIAE ŠŪNĀS |
|
B.17. |
MUTAGENITĀTE – ZĪDĪTĀJU ŠŪNU GĒNU MUTĀCIJU TESTS IN VITRO |
|
B.18. |
DNS BOJĀJUMI UN TO REPARĀCIJA – DNS ĀRPUSFĀZES SINTĒZE – ZĪDĪTĀJU ŠŪNAS IN VITRO |
|
B.19. |
MĀSHROMATĪDU APMAIŅAS NOTEIKŠANA IN VITRO |
|
B.20. |
AR DZIMUMU SAISTĪTO RECESĪVO LETĀLO MUTĀCIJU NOTEIKŠANA (DROSOPHILA MELANOGASTER) |
|
B.21. |
ZĪDĪTĀJU ŠŪNU TRANSFORMĀCIJA IN VITRO |
|
B.22. |
DOMINANTO LETĀĻU NOTEIKŠANA GRAUZĒJIEM |
|
B.23. |
ZĪDĪTĀJU SPERMATOGONĀLO HROMOSOMU IZMAIŅU TESTS |
|
B.24. |
PEĻU PLANKUMAINĪBAS TESTS |
|
B.25. |
PĀRMANTOJAMO TRANSLOKĀCIJU NOTEIKŠANA PELĒM |
|
B.26. |
SUBHRONISKĀS ORĀLĀS TOKSICITĀTES TESTS – ATKĀRTOTO DEVU 90 DIENU ORĀLĀS TOKSICITĀTES PĒTĪJUMS AR GRAUZĒJIEM |
|
B.27. |
SUBHRONISKĀS ORĀLĀS TOKSICITĀTES TESTS – ATKĀRTOTO DEVU 90 DIENU ORĀLĀS TOKSICITĀTES PĒTĪJUMS AR DZĪVNIEKIEM, KAS NAV GRAUZĒJI |
|
B.28. |
SUBHRONISKĀS TOKSICITĀTES NOTEIKŠANA PĒC ĀRĪGAS APLIKĀCIJAS – ATKĀRTOTA ĀRĪGA APLIKĀCIJA GRAUZĒJIEM (90 DIENAS) |
|
B.29. |
SUBHRONISKĀS TOKSICITĀTES NOTEIKŠANA PĒC INHALĀCIJAS – TOKSICITĀTES NOTEIKŠANA GRAUZĒJIEM PĒC ATKĀRTOTAS INHALĀCIJAS (90 DIENAS) |
|
B.30. |
HRONISKĀS TOKSICITĀTES NOTEIKŠANA |
|
B.31. |
PRENATĀLĀS ONTOĢENĒZES TOKSICITĀTES PĒTĪJUMS |
|
B.32. |
KANCEROGENITĀTES NOTEIKŠANA |
|
B.33. |
VIENLAICĪGA HRONISKĀS TOKSICITĀTES UN KANCEROGENITĀTES NOTEIKŠANA |
|
B.34. |
TOKSICITĀTES IETEKME UZ VIENAS PAAUDZES REPRODUKTĪVO FUNKCIJU |
|
B.35. |
DIVU PAAUDŽU REPRODUKTĪVĀS TOKSICITĀTES PĒTĪJUMS |
|
B.36. |
TOKSIKOKINĒTIKA |
|
B.37. |
FOSFORORGANISKO VIELU AIZKAVĒTĀ NEIROTOKSICITĀTE PĒC AKŪTAS IEDARBĪBAS |
|
B.38. |
FOSFORORGANISKO VIELU AIZKAVĒTĀS NEIROTOKSICITĀTES 28 DIENU VAIRĀKKĀRTĒJAS DEVAS PĒTĪJUMS |
|
B.39. |
NEPROGRAMMĒTAS DNS SINTĒZES (UDS) TESTS AR ZĪDĪTĀJU AKNU ŠŪNĀM IN VIVO |
|
B.40. |
IN VITRO ĀDAS EROZIJA: TRANSKUTĀNĀS ELEKTRISKĀS PRETESTĪBAS (TEP) TESTS |
|
B.40.a |
A ĀDAS EROZIJAS IN VITRO TESTS: CILVĒKA ĀDAS MODEĻA TESTS |
|
B.41. |
FOTOTOKSICITĀTES IN VITRO 3T3 NRU TESTS |
|
B.42. |
ĀDAS SENSIBILIZĀCIJA: LOKĀLO LIMFMEZGLU NOTEIKŠANA (LLNA) |
|
B.43. |
ŽURKU NEIROTOKSICITĀTES PĒTĪJUMS |
|
B.44. |
ABSORBCIJA ĀDĀ: IN VIVO METODE |
|
B.45. |
ABSORBCIJA ĀDĀ: IN VITRO METODE |
|
B.46. |
ĀDAS KAIRINĀJUMA NOTEIKŠANA AR CILVĒKA EPIDERMAS REKONSTRUKCIJAS MODEĻA IN VITRO TESTU |
|
B.47. |
LIELLOPU RADZENES DUĻĶOŠANĀS UN CAURLAIDĪBAS TESTĒŠANAS METODE NOPIETNUS ACU BOJĀJUMUS VAI NOPIETNU KAIRINĀJUMU IZRAISĪTĀJU VIELU IDENTIFICĒŠANAI |
|
B.48. |
IZOLĒTAS VISTAS ACS TESTĒŠANAS METODE NOPIETNUS ACU BOJĀJUMUS VAI NOPIETNU KAIRINĀJUMU IZRAISĪTĀJU VIELU IDENTIFICĒŠANAI |
|
B.49. |
IN VITRO ZĪDĪTĀJU ŠŪNU MIKROKODOLU TESTS |
|
B.50. |
ĀDAS SENSIBILIZĀCIJA: LOKĀLO LIMFMEZGLU NOTEIKŠANA (LLNA:DA) |
|
B.51. |
ĀDAS SENSIBILIZĀCIJA: LOKĀLO LIMFMEZGLU NOTEIKŠANA (LLNA:BrdU-ELISA) |
VISPĀRĪGS IEVADS
A. TESTA VIELAS RAKSTUROJUMS
Pirms toksicitātes pētījuma uzsākšanas ir jābūt zināmai testa vielas uzbūvei, iekļaujot galvenos piemaisījumus, un tās attiecīgajām fizikāli ķīmiskajām īpašībām, iekļaujot stabilitāti.
Testa vielas fizikāli ķīmiskās īpašības sniedz svarīgu informāciju, lai izvēlētos ievadīšanas veidu, katra konkrēta pētījuma plānu un veidu, kā rīkoties ar testa vielu un kā to glabāt.
Pirms pētījuma uzsākšanas jāizveido analītiskā metode testa vielas kvantitatīvai un kvalitatīvai noteikšanai (ja iespējams, iekļaujot galvenos piemaisījumus) dozēšanas vidē un bioloģiskajā materiālā.
Visa informācija, kas attiecas uz testa vielas identifikāciju, fizikāli ķīmiskajām īpašībām, tīrību un izturēšanos, ir jāiekļauj testa ziņojumā.
B. DZĪVNIEKU KOPŠANA
Toksicitātes testos būtiski svarīga ir stingra vides apstākļu kontrole un pareiza dzīvnieku kopšanas tehnika.
i) Turēšanas apstākļi
Vides apstākļiem eksperimenta dzīvnieku telpās vai iežogojumos ir jābūt testa dzīvniekiem piemērotiem. Žurkām, pelēm un jūrascūciņām piemēroti apstākļi ir telpas temperatūra 22 oC ± 3 oC ar relatīvo mitrumu 30 līdz 70 %; trušiem temperatūrai jābūt 20 oC ± 3 oC ar relatīvo mitrumu 30 līdz 70 %.
Dažas eksperimenta metodes ir īpaši jutīgas pret temperatūras ietekmi, un tādos gadījumos datus par attiecīgajiem apstākļiem iekļauj testa metodes aprakstā. Visos toksisko ietekmju pētījumos temperatūra un mitrums ir jākontrolē, jāreģistrē un jāiekļauj pētījuma galaziņojumā.
Apgaismojumam jābūt mākslīgam, secība ir 12 stundas gaismas, 12 stundas tumsas. Sīkas ziņas par apgaismojuma apstākļiem ir jāreģistrē un jāiekļauj pētījuma galaziņojumā.
Ja metodē nav noteikts citādi, dzīvniekus var turēt atsevišķi vai turēt būros nelielās viena dzimuma grupās; turot grupās, vienā būri nedrīkst ievietot vairāk par pieciem dzīvniekiem.
Ziņojumos par eksperimentiem ar dzīvniekiem ir svarīgi norādīt izmantoto būros turēšanas veidu un katrā būrī ievietoto dzīvnieku skaitu gan ķīmiskās vielas iedarbības laikā, gan arī katrā turpmākajā novērošanas laikposmā.
ii) Barošanas apstākļi
Diētai ir jāatbilst visām testējamās sugas vajadzībām attiecībā uz barību. Ja testa vielas dzīvniekiem ievada ar diētu, uzturvērtība var samazināties vielas un diētas sastāvdaļas savstarpējā iedarbībā. Šādas reakcijas iespēja ir jāņem vērā, interpretējot testu rezultātus. Var izmantot parastās laboratorijas diētas ar neierobežotu dzeramā ūdens piegādi. Diētas izvēli var ietekmēt vajadzība nodrošināt piemērotu testa vielas piejaukšanu, ja vielu ievada ar šo metodi.
Diētas piesārņotāji, par kuriem ir zināms, ka tie ietekmē toksicitāti, nedrīkst būt klāt iedarbīgās koncentrācijās.
C. ALTERNATĪVA TESTĒŠANA
Eiropas Savienības zinātniskais mērķis ir izveidot un apstiprināt alternatīvas metodes, kas var sniegt to pašu informācijas līmeni kā pašreizējie testi ar dzīvniekiem, bet kas izmanto mazāk dzīvnieku, izraisa mazāk ciešanu vai pilnīgi izvairās izmantot dzīvniekus.
Tādas metodes, kad tās kļūst pieejamas, jāņem vērā, kur vien iespējams, lai raksturotu bīstamību un izdarītu piemītošās bīstamības klasifikāciju un marķēšanu.
D. NOVĒRTĒŠANA UN INTERPRETĀCIJA
Novērtējot un interpretējot testus, ir jāņem vērā ierobežojumi, kādā mērā pētījumus ar dzīvniekiem un in vitro pētījumus var tieši ekstrapolēt uz cilvēku, un tādēļ pierādījumus par kaitīgu ietekmi uz cilvēkiem, ja pierādījumi ir pieejami, var izmantot testēšanas rezultātu apstiprināšanai.
E. LITERATŪRAS NORĀDES
Vairums šo metožu ir izveidotas ESAO testēšanas pamatnostādņu programmas satvarā, un tās ir jāveic atbilstīgi Labas laboratorijas prakses principiem, lai iespējami plaši nodrošinātu “datu savstarpējo atzīšanu”.
Papildu informācija ir atrodama ESAO pamatnostādnēs un citur publicētā attiecīgā literatūrā.
B.1.a AKŪTAIS PERORĀLAIS TOKSISKUMS – FIKSĒTĀS DEVAS METODE
1. METODE
Šī testēšanas metode ir līdzvērtīga ESAO 420 (2001) vadlīnijā noteiktajai metodei.
1.1. IEVADS
Akūtā toksiskuma novērtēšanas tradicionālajās metodēs par beigu punktu izmanto dzīvnieku nobeigšanos. Jaunu pieeju akūtā toksiskuma noteikšanai, kuras pamatā ir vairāku fiksētu devu ievadīšana, 1984. gadā ieteica Britu Toksikoloģijas biedrība (1). Saskaņā ar šo pieeju izvairās par beigu punktu izmantot dzīvnieku nobeigšanos, tās vietā novērojot vairāku fiksētu devu toksiskuma pazīmes. Pēc Apvienotajā Karalistē (2) un starptautiski (3) in vivo veiktajiem validācijas pētījumiem šī procedūra 1992. gadā tika pieņemta par testa metodi. Tādējādi, izmantojot matemātiskos modeļus, fiksēto devu procedūras statistiskie raksturlielumi vēlāk tika novērtēti vairākos pētījumos (4) (5) (6). Modelēšanas pētījumi un in vivo pētījumi uzskatāmi parādījuši, ka procedūra ir reproducējama, tai jāizmanto mazāk dzīvnieku, izraisa mazāk ciešanu nekā tradicionālās metodes un nodrošina iespējas novērtēt vielas līdzvērtīgā veidā kā ar citām akūtā toksiskuma testa metodēm.
Norādījumi par katrā konkrētā gadījumā piemērotāko testa metodi atrodami pamatnostādnēs par akūtā perorālā toksiskuma testēšanu Guidance Document on Acute Oral Toxicity Testing (7). Šajās pamatnostādnēs ir arī papildu informācija par testa metodes B.1.a veikšanu un pēc tās iegūto rezultātu interpretāciju.
Saskaņā ar metodes principu galvenajos pētījumos izmanto tikai mēreni toksiskas devas un jāizvairās lietot tādas devas, kurām varētu būt letāla iedarbība. Tāpat nav jāievada devas, par kurām ir zināms, ka tās izraisa izteiktas sāpju un briesmu sajūtas kodīgo vai stipri kairinošo īpašību dēļ. Bojā ejoši dzīvnieki, kā arī dzīvnieki, kas acīm redzami cieš sāpes vai pārdzīvo stipru un ilgstošu briesmu sajūtu, ir humāni jānonāvē, un, interpretējot testa rezultātus, tie jāņem vērā tieši tāpat kā testos nobeigušies dzīvnieki. Kritēriji, pēc kuriem pieņem lēmumu nonāvēt bojā ejošus dzīvniekus vai dzīvniekus, kuriem ir smagas ciešanas, kā arī norādījumi par paredzamu vai neizbēgamu nobeigšanos norādīti citās pamatnostādnēs (8).
Metode sniedz informāciju par bīstamajām īpašībām un dod iespējas novērtēt un klasificēt vielas ar akūti toksisku iedarbību saskaņā ar Vispārējo saskaņoto ķīmisko vielu klasifikācijas sistēmu (VSS) (9).
Pirms uzsākt pētījumus, testēšanas laboratorijai jāņem vērā visa par testējamo vielu pieejamā informācija. Pie šādas informācijas pieder tās identifikācija un ķīmiskā struktūra, fizikāli ķīmiskās īpašības, citu in vitro vai in vivo veikto testu rezultāti, toksikoloģiskie dati par struktūras ziņā saistītām vielām, vielas paredzamo(-ajiem) izmantošanas veidu(-iem). Šī informācija ir vajadzīga, lai nodrošinātu, ka testi tiek veikti cilvēku veselības aizsardzībai piemērotā veidā un tiek pareizi izraudzīta sākotnējā deva.
1.2. DEFINĪCIJAS
Akūts perorāls toksiskums: attiecas uz to kaitīgo iedarbību, kāda ir 24 stundu laikā pēc vienas vai vairāku vielas devu ievadīšanas caur muti.
Aizkavēta nāve: ir tad, ja dzīvnieks 48 stundu laikā nav nobeidzies vai neizbēgami nav gājis bojā, bet krīt vēlāk 14 dienu novērošanas perioda laikā.
Deva: ievadītās testējamās vielas daudzums. Devu izsaka testējamās vielas svara veidā uz testa dzīvnieka svara vienību (piemēram, mg/kg).
Izteikts toksiskums: ir vispārīgs termins, ar ko raksturo acīm redzamas toksiskas iedarbības pazīmes pēc testējamo vielu ievadīšanas (piemēram, skatīt izmantotās literatūras sarakstā (3)), un nākamās lielākās devas iedarbībā var sagaidīt izmēģinājuma dzīvnieku lielākās daļas nobeigšanos, izraisot stipras sāpes vai smagas un ilgstošas ciešanas (kritēriji noteikti Humane Endpoints Guidance Document (8)).
VSS: Vispārējā saskaņotā ķīmisko vielu un maisījumu klasifikācijas sistēma. Kopīgs ESAO (cilvēku veselības un vides aizsardzība), ANO Bīstamo kravu pārvadājumu ekspertu komitejas (fizikāli ķīmiskās īpašības) un ILO – Starptautiskās Darba organizācijas (kaitīguma paziņošana) – pasākums, ko koordinē Ķīmisko vielu drošas apsaimniekošanas starporganizāciju programma (IOMC).
Neizbēgama nāve ir, ja miršana vai nāves iestāšanās sagaidāma pirms nākamā plānotā novērojumu laika. Pazīmes, kas liecina par šā stāvokļa iestāšanos grauzējiem var būt konvulsijas, gulēšana uz sāniem vai augšpēdus un drebēšana. (Sīkāk skatīt Humane Endpoint Guidance Document (8).)
LD 50 (vidējā letālā deva): statistiski noteikta vielas deva, kas, ievadot perorāli, var izraisīt 50 % dzīvnieku nobeigšanos. LD50 vērtību izsaka kā testējamās vielas svaru uz testa dzīvnieka svara vienību (mg/kg).
Robeždeva attiecas uz devas augšējo ierobežojumu testā (2 000 vai 5 000 mg/kg).
Mirstošs: atrašanās stāvoklī, kad mirst vai nav iespēju izdzīvot, arī saņemot ārstēšanu. (Sīkāk skatīt Humane Endpoint Guidance Document (8).)
Prognozējama nāve: klīniskās pazīmes, kas liecina par nāves iestāšanos pēc zināma laika, nesagaidot eksperimenta plānotās beigas, piemēram – nespēja sasniegt ūdeni vai barību. (Sīkāk skatīt Humane Endpoint Guidance Document (8).)
1.3. TESTA METODES PRINCIPS
Viena dzimuma dzīvnieku grupām dod pakāpeniski palielinātas fiksētas devas 5, 50, 300 un 2 000 mg/kg (izņēmuma gadījumos var izmantot papildu fiksētu devu 5 000 mg/kg, skatīt 1.6.2. punktu). Sākotnējās devas līmeni izraugās pēc devu diapazona pētījumiem kā devu, kas var izraisīt toksiskas iedarbības pazīmes, bet kas nav stipri toksiska un neizraisa nobeigšanos. Klīniskās pazīmes un stāvokļi, kas saistīti ar sāpēm, ciešanām un neizbēgamu nāvi, sīki aprakstīti ESAO pamatnostādnēs (8). Atkarībā no toksiskuma pazīmēm vai mirstības papildu dzīvnieku grupām var ievadīt par to augstākas vai zemākas fiksētas devas. Šo procedūru turpina, līdz fiksētā deva izraisa izteiktas toksiskuma pazīmes, tiek konstatēts ne vairāk kā viens nobeigšanās gadījums, augstākajai devai netiek konstatētas toksiskas iedarbības pazīmes vai notiek nobeigšanās zemākās devas iedarbībā.
1.4. TESTA METODES APRAKSTS
1.4.1. Dzīvnieku sugu izvēle
Ieteicamākā grauzēju suga ir žurkas, kaut arī var izmanot citas grauzēju sugas. Parasti izmanto sievišķā dzimuma īpatņus (7). Tas tāpēc, ka parasto LD50 testu literatūras pārskati liecina, ka abu dzimumu jutība daudz neatšķiras, taču gadījumos, kad tā ir atšķirīga, sievišķā dzimuma īpatņi ir nedaudz jutīgāki (10). Tomēr, ja dati par struktūras ziņā līdzvērtīgu vielu toksikoloģiskajām un toksikokinētiskajām īpašībām liecina, ka uz testējamās vielas iedarbību tēviņi varētu būt jutīgāki, testi jāveic ar vīrišķā dzimuma īpatņiem. Ja testus veic ar vīrišķā dzimuma īpatņiem, tas ir jāpamato.
Jāizmanto jauni, veseli, pieauguši parasti izmantojamo laboratorijas līniju dzīvnieki. Mātītes nedrīkst būt iepriekš dzemdējušas vai grūsnas. Visiem testa dzīvniekiem testēšanas sākumā jābūt 8 līdz 12 nedēļas veciem, un to svaram jābūt ± 20 % no testiem iepriekš izmantoto dzīvnieku vidējā svara.
1.4.2. Turēšanas un barošanas nosacījumi
Telpā, kurā tur izmēģinājumu dzīvniekus, jābūt 22 oC (± 3 oC) temperatūrai. Lai gan, izņemot telpu uzkopšanas laiku, relatīvajam mitrumam jābūt vismaz 30 % un vēlams ne vairāk kā 70 %, tas jāuztur 50–60 % robežās. Apgaismojumam jābūt mākslīgam, secība ir 12 stundas gaismas, 12 stundas tumsas. Var izmantot parasto laboratorijas barību ar neierobežotu dzeramā ūdens piegādi. Dzīvniekus būros var turēt grupās atbilstoši devai, bet to skaits vienā būrī nedrīkst apgrūtināt katra dzīvnieka novērošanu.
1.4.3. Dzīvnieku sagatavošana
Veselus, pieaugušus, jaunus dzīvniekus izvēlas izlases veidā, marķē individuālai identificēšanai un tur būros vismaz piecas dienas pirms devu ievadīšanas sākuma, lai aklimatizētu laboratorijas apstākļiem.
1.4.4. Devu sagatavošana
Parasti testējamās vielas jāievada visām pārbaudāmajām devām vienādā tilpumā, mainot ievadāmā preparāta koncentrāciju. Taču, ja jātestē galaprodukts, kas ir šķidrums vai maisījums, vielas bīstamības novērtēšanai tā var būt jāizmanto neatšķaidītā testējamās vielas veidā, t. i., ar nemainīgu koncentrāciju, un tā ir arī dažu reglamentējošo iestāžu prasība. Jebkurā gadījumā nedrīkst pārsniegt ievadāmās devas maksimālo tilpumu. Maksimālais šķidruma tilpums, ko vienā paņēmienā var ievadīt, ir atkarīgs no testa dzīvnieka lieluma. Grauzējiem šis tilpums parasti nedrīkst pārsniegt 1ml/100 g ķermeņa svara; tomēr ūdens šķīdumu gadījumā var ievadīt līdz 2 ml/100 g ķermeņa svara. Ņemot vērā ievadāmā preparāta sastāvu, vienmēr, kad iespējams, ieteicams izmantot šķīdumu/suspensiju/emulsiju ūdenī, ja ne, tad šķīdumu/suspensiju/emulsiju eļļā (piemēram, kukurūzas eļļā) un tikai pēc tam šķīdumu citos nesējos. Ja par nesēju neizmanto ūdeni, jānoskaidro tā toksikoloģiskās īpašības. Ja nav datu par preparāta pietiekamu stabilitāti visā tā lietošanas laikā, devas jāsagatavo neilgi pirms ievadīšanas.
1.5. PROCEDŪRA
1.5.1. Devu ievadīšana
Testējamo vielu dzīvniekiem ievada vienā devā, mākslīgi barojot, izmantojot kuņģa zondi vai piemērotu intubācijas kanulu. Ja kādu apstākļu dēļ ievadīt vienā devā nav iespējams, to var dot mazākās daļās laika posmā, kas nepārsniedz 24 stundas.
Pirms ievadīšanas dzīvniekus nedrīkst barot (piemēram, žurkas pārstāj barot iepriekšējā dienā, dodot tikai dzert ūdeni; peles nebaro 3–4 stundas iepriekš, dodot dzert tikai ūdeni). Pirms ievada testējamo vielu pēc nebarošanas perioda, dzīvnieki ir jānosver. Pēc testējamās vielas ievadīšanas žurkas var nebarot vēl 3–4 stundas, bet peles – 1–2 stundas. Ja devu ievada pa daļām ilgākā laika posmā, var būt nepieciešams dzīvniekiem dot barību un ūdeni atkarībā no šā laika posma ilguma.
1.5.2. Devu diapazona pētījums
Devu diapazona pētījuma mērķis ir noteikt galvenajā pētījumā izmantojamo sākotnējo devu. Testējamo vielu atsevišķiem dzīvniekiem ievada pēc 1. papildinājumā noteiktajām diagrammām. Devu diapazona pētījumu beidz, kad var pieņemt lēmumu par galvenajā pētījumā izmantojamo sākotnējo devu (vai kad pie mazākās fiksētās devas tiek konstatēta dzīvnieku nobeigšanās).
Devu diapazona pētījumam attiecībā uz sākotnējo devu izraugās no fiksēto līmeņu devām 5, 50, 300 un 2 000 mg/kg to devu, kurai paredzams izteikts toksiskums, par ko, iespējams, ir pierādījumi par tās pašas vielas vai struktūras ziņā līdzvērtīgu vielu in vitro un in vivo testu rezultātiem. Ja šādas informācijas nav, par sākotnējo devu izmanto 300 mg/kg.
Katram dzīvniekam vielas ievadīšanas starplaikam jābūt vismaz 24 stundām. Visi dzīvnieki jānovēro vismaz 14 dienas.
Augšējo devu 5 000 mg/kg var izmantot tikai izņēmuma gadījumos, kad tā ir pamatota ar īpašām reglamentējošām prasībām (skatīt 3. papildinājumu). Pamatojoties ar dzīvnieku labturības apsvērumiem nav ieteicams testēt dzīvniekus ar VSS 5. kategorijas devām (2 000–5 000 mg/kg), un tās jātestē tikai tādos gadījumos, kad ir lielas iespējas, ka šādu testu rezultāti ir ļoti nepieciešami cilvēku vai dzīvnieku veselības vai vides aizsardzībai.
Gadījumos, kad devu diapazona pētījumā nobeidzas dzīvnieks, kuram pārbaudīta mazākās fiksētās devas (5 mg/kg) iedarbība, parasti pētījumu izbeidz un attiecīgo vielu klasificē VSS 1. kategorijā (kā norādīts 1. papildinājumā). Tomēr, ja ir nepieciešams precīzāks klasifikācijas apstiprinājums, papildus var veikt šādu fakultatīvu procedūru. 5 mg/kg devu ievada vēl otram dzīvniekam. Ja arī šis otrs dzīvnieks nobeidzas, VSS 1. kategorija tiek apstiprināta un pētījumi nekavējoties jāizbeidz. Ja šis otrais dzīvnieks nenobeidzas, 5 mg/kg devu ievada vēl ne vairāk kā trijiem dzīvniekiem. Tā kā ir augsts mirstības risks, ievērojot labturības apsvērumus, šiem dzīvniekiem devu ievada noteiktā secībā. Starplaikam, pēc kāda vielu ievada nākamajam dzīvniekam, ir jābūt pietiekami ilgam, lai varētu konstatēt, ka iepriekšējais dzīvnieks varētu izdzīvot. Ja tiek konstatēts otrs bojāejas gadījums, devu ievadīšanas noteikto secību nekavējoties pārtrauc un deva nevienam dzīvniekam vairāk nav ievadāma. Pēc otrā bojāejas gadījuma (neatkarīgi no dzīvnieku skaita, ar kuriem izdarīti testi testēšanas izbeigšanas laikā) tiek noteikts A rezultāts (divi vai vairāki bojāejas gadījumi) un tiek ievērots 2. papildinājumā noteiktais klasifikācijas noteikums par 5 mg/kg fiksēto devu (1. kategorija, ja ir divi vai vairāki bojāejas gadījumi, vai 2. kategorija, ja tiek konstatēts ne vairāk kā viens bojāejas gadījums). Turklāt 4. papildinājumā ir norādījumi par klasifikāciju ES sistēmā līdz laikam, kamēr tiek ieviesta jaunā VSS sistēma.
1.5.3. Galvenais pētījums
1.5.3.1. Dzīvnieku skaits un devu līmeņi
Lēmumi, kas jāpieņem pēc testiem ar sākotnējo devu, ir norādīti diagrammās 2. papildinājumā. Jāpieņem kāds no trijiem lēmumiem – testēšanu pārtraukt un piešķirt atbilstošu bīstamības klasi, veikt testus ar augstāko fiksēto devu vai arī ar zemāko fiksēto devu. Tomēr, pamatojoties uz apsvērumiem, kas saistīti ar dzīvnieku aizsardzību, nav jātestē devu līmenis, kas devu diapazona pētījumā ir izraisījis dzīvnieku nobeigšanos (skatīt 2. papildinājumu). Līdzšinējā pieredze liecina, ka ticamākais sākotnējās devas testu rezultāts ir tāds, ka vielu iespējams klasificēt bez jebkādiem papildu testiem.
Katra līmeņa devu testēšanai parasti izmanto pavisam piecus viena dzimuma dzīvniekus. Šo piecu dzīvnieku grupu izvēlas, izmantojot vienu dzīvnieku no devu diapazona pētījuma, kam ievadīta izraudzītā līmeņa deva, un papildus vēl četrus dzīvniekus (izņemot gadījumus, kad galvenajā pētījumā izmantotais devu līmenis nav bijis iekļauts devu diapazona pētījumā, taču parasti tā nav).
Vielas ievadīšanas reižu starplaiku katram devu līmenim nosaka atkarībā no toksiskuma pazīmju parādīšanās, ilguma un smaguma. Vielas nākamās devas ievadīšana ir jāatliek līdz laikam, kamēr rodas pārliecība par iepriekš devu saņēmušo dzīvnieku izdzīvošanu. Ja vajadzīgs, lai novērotu aizkavētu toksisko iedarbību, ieteicams ievērot trīs līdz četru dienu starplaiku katrai devu līmeņa ievadīšanai. Starplaiku var koriģēt pēc vajadzības, piemēram, gadījumos, kad atbildes reakcija uz vielas iedarbību nav pārliecinoša.
Ja tiek pieņemts lēmums izmantot augstāko fiksēto devu 5 000 mg/kg, jāievēro 3. papildinājumā noteiktā procedūra (skatīt arī 1.6.2. punktu).
1.5.3.2. Pieļaujamības tests
Pieļaujamības testu galvenokārt izmanto gadījumos, kad eksperimenta veicēja rīcībā ir informācija, kas liecina, ka vielai, iespējams, nav toksiskas iedarbības, t. i., tā ir toksiska tikai devās, kas ierobežotas ar reglamentējošām pieļaujamības devām. Informāciju par testējamās vielas toksiskumu var iegūt pēc testu datiem ar līdzīgiem maisījumiem vai produktiem, ņemot vērā identitāti un to komponentu īpatsvaru, kuru toksiskums ir zināms. Šādās situācijās, kad nav informācijas par toksiskumu vai tā ir nepietiekama, vai arī sagaidāms, ka testējamā viela varētu būt toksiska, ir jāveic galvenais tests.
Izmantojot parasto procedūru, devu diapazona pētījuma sākotnējo devu 2 000 mg/kg (vai izņēmuma gadījumā 5 000 mg/kg) ievada papildu četriem dzīvniekiem, ko izmanto pieļaujamības testam saskaņā ar šiem norādījumiem.
1.6. NOVĒROJUMI
Pēc ievadīšanas pirmo 30 minūšu laikā dzīvniekus individuāli novēro vismaz vienreiz, pirmo 24 stundu laikā periodiski, īpašu uzmanību veltot pirmajām četrām stundām un pēc tam reizi dienā, pavisam 14 dienas, izņemot gadījumus, kad tie gājuši bojā vai pētījumi jāizbeidz, dzīvnieku labturības apsvērumu dēļ tos humāni nonāvējot. Tomēr novērošanas ilgums nav stingri jānosaka. Tas jānosaka pēc toksiskuma reakcijām, to parādīšanās laika un atveseļošanās ilguma, un tādēļ novērojumu ilgumu var pagarināt, ja ir vajadzīgs. Laiki, kad parādās un izzūd toksiskuma pazīmes, ir svarīgi, īpaši, ja tām ir tendence aizkavēties (11). Visus novērojumus regulāri reģistrē, par katru dzīvnieku izdarot individuālus reģistrus.
Ja dzīvnieki turpina uzrādīt toksiskas iedarbības pazīmes, ir vajadzīgi papildu novērojumi. Novērojot dzīvniekus, jāpievērš uzmanība izmaiņām, kas skar to ādu un apmatojumu, acis un gļotādas, kā arī elpošanas orgānus, asinsriti, veģetatīvo un centrālo nervu sistēmu, somatomotoriku un uzvedības reakcijas. Uzmanība jāpievērš drebuļu, krampju, siekalošanās, caurejas, letarģijas, miega un komas novērojumiem. Jāņem vērā principi un kritēriji, kas apkopoti Humane Endpoints Guidance Document (8). Visi mirstošie dzīvnieki un dzīvnieki, kas izrāda lielu sāpju un ilgstošu briesmu sajūtu pazīmes, ir humāni jānonāvē. Ja dzīvnieki ir nonāvēti humānu apsvērumu dēļ vai atrasti nobeigušies, iespējami precīzi jāreģistrē nāves iestāšanās laiks.
1.6.1. Ķermeņa svars
Visi dzīvnieki jānosver neilgi pirms testējamās vielas ievadīšanas un pēc tam vismaz reizi nedēļā. Svara izmaiņas ir jāaprēķina un jāreģistrē. Testu beigās izdzīvojušos dzīvniekus nosver, tad humāni nonāvē.
1.6.2. Patoloģija
Visiem testa dzīvniekiem (arī tiem, kuri testa laikā nobeigušies vai ar kuriem dzīvnieku labturības apsvērumu dēļ pētījumi izbeigti) ir jāizdara pilna autopsija. Visas makroskopiskās patoloģiskās izmaiņas jāreģistrē par katru dzīvnieku. Var apsvērt arī orgānu, kuros parādās makroskopiskās patoloģijas pierādījumi, mikroskopisko izmeklēšanu dzīvniekiem, kas pēc sākotnējās devas izdzīvojuši 24 stundas vai ilgāk, jo tāda apskate var sniegt noderīgu informāciju.
2. DATI
Norāda datus par atsevišķiem dzīvniekiem. Turklāt visi dati ir jāapkopo tabulas veidā, norādot dzīvnieku skaitu, kas izmantots katrā testa grupā, dzīvnieku skaitu, kuriem parādījušās toksiskuma pazīmes, dzīvnieku skaitu, kuri testa laikā atrasti nobeigušies vai nonāvēti humānu apsvērumu dēļ, atsevišķo dzīvnieku nobeigšanās laiku, toksiskās iedarbības veidu un to atgriezeniskuma aprakstu un gaitu, kā arī autopsijā iegūtos novērojumus.
3. PĀRSKATA SAGATAVOŠANA
3.1. PĀRSKATS PAR TESTU
Pārskatā par testu jāiekļauj šāda informācija.
Testējamā viela:
— fizikālās īpašības, tīrība un attiecīgos gadījumos arī fizikāli ķīmiskās īpašības (tostarp izomerizācija),
— identifikācijas dati, tostarp CAS numurs.
Nesējs (ja vajadzīgs):
— nesēja izvēles pamatojums, ja nesējs nav ūdens.
Testa dzīvnieki:
— izmantotā suga/līnija,
— dzīvnieku mikrobioloģiskais statuss, ja tas zināms,
— dzīvnieku skaits, vecums un dzimums (tostarp, ja vajadzīgs, vīrišķā dzimuma īpatņu izmantošanu sievišķā dzimuma īpatņu vietā),
— izcelsme, turēšanas apstākļi, barība u. c.
Testa apstākļi:
— sīkas ziņas par testējamās vielas preparātu, tostarp dati par ievadītā materiāla fizikālo formu,
— sīkas ziņas par testējamās vielas ievadīšanu, iekļaujot dozēšanas tilpumus un dozēšanas laikus,
— sīkas ziņas par barības un ūdens kvalitāti (iekļaujot veidu/izcelsmi, ūdens avotu),
— sākotnējās devas izvēles pamatojums.
Rezultāti:
— datu tabula par atbildes reakcijām un devu līmeņiem (t. i., dzīvniekiem, kas uzrādījuši toksiskuma pazīmes, tostarp nobeigšanās gadījumus, iedarbības veidu, smagumu un ilgumu),
— datu tabula par ķermeņa svaru un ķermeņa svara izmaiņām,
— katra dzīvnieka svars ievadīšanas dienā un pēc tam ar nedēļas starplaikiem, kā arī nobeigšanās vai nonāvēšanas laikā,
— nobeigšanās datums un laiks, ja tā notikusi pirms paredzētās nonāvēšanas,
— toksiskuma pazīmju parādīšanās gaita katram dzīvniekam, un vai tās ir bijušas atgriezeniskas,
— katra dzīvnieka autopsijas konstatācijas un histopatoloģiskās konstatācijas, ja tās pieejamas.
Rezultātu apspriešana un interpretācija.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) British Toxicology Society Working Party on Toxicity (1984). Special report: a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol., 3, p. 85–92.
(2) Van den Heuvel, M.J., Dayan, A.D. and Shillaker, R.O. (1987). Evaluation of the BTS approach to the testing of substances and preparations for their acute toxicity. Human Toxicol.‚ 6, p. 279–291.
(3) Van den Heuvel, M.J., Clark, D.G., Fielder, R.J., Koundakjian, P.P., Oliver, G.J.A., Pelling, D., Tomlinson, N.J. and Walker, A.P. (1990). The international validation of a fixed-dose procedure as an alternative to the classical LD50 test. Fd. Chem. Toxicol., 28, p. 469–482.
(4) Whitehead, A. and Curnow, R.N. (1992). Statistical evaluation of the fixed-dose procedure. Fd. Chem. Toxicol., 30, p. 313–324.
(5) Stallard, N. and Whitehead, A. (1995). Reducing numbers in the fixed-dose procedure. Human Exptl. Toxicol., 14, p. 315–323. Human Exptl. Toxicol.
(6) Stallard, N., Whitehead, A. and Ridgeway, P. (2002). Statistical evaluation of the revised fixed dose procedure. Hum. Exp. Toxicol., 21, p. 183–196.
(7) OECD (2001). Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris.
(8) OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assesment N. 19.
(9) OECD (1998). Harmonised Integrated Hazard Classification for Human Health and Environmental Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html].
(10) Lipnick, R.L., Cotruvo, J.A., Hill, R.N., Bruce, R.D., Stitzel, K.A., Walker, A.P., Chu, I., Goddard, M., Segal, L., Springer, J.A. and Myers, R.C. (1995). Comparison of the Up-and-Down, Conventional LD50, and Fixed-Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33, 223–231.
(11) Chan P.K and Hayes, A.W. (1994). Chapter 16 Acute Toxicity and Eye Irritation. In: Principles and Methods of Toxicology. 3rd Edition. A.W. Hayes, Editor. Raven Press, Ltd. New York, USA.
1. PAPILDINĀJUMS
DEVU DIAPAZONA PĒTĪJUMU DIAGRAMMA


2. PAPILDINĀJUMS
GALVENĀ PĒTĪJUMA DIAGRAMMA

3.PAPILDINĀJUMS
KLASIFIKĀCIJAS KRITĒRIJI TESTĒJAMAJĀM VIELĀM AR PAREDZAMAJĀM LD50 VĒRTĪBĀM VIRS 2 000 MG/KG, NEVEICOT TESTUS
Kritēriji, kas noteikti 5. bīstamības kategorijai, ir vērsti uz tādu testējamo vielu identifikāciju, kurām gan ir relatīvi zems akūtais toksiskums, tomēr zināmos apstākļos tās var būt jutīgām populācijām bīstamas. Šo vielu paredzamā LD50, ievadot caur muti vai uzsūcoties caur ādu, ir 2 000–5 000 mg/kg vai citiem ievadīšanas veidiem tām līdzvērtīgas devas. Testējamās vielas var iedalīt šajā bīstamības kategorijā, kas noteikta – 2 000 mg/kg < LD50 < 5 000 mg/kg (VSS 5. kategorija) šādos gadījumos:
a) ja šī kategorija noteikta pēc kādas no 2. papildinājumā norādītajām testēšanas shēmām, pamatojoties uz bojāejas gadījumiem;
b) ja ir ticami pierādījumi, kas norāda, ka LD50 ir 5. kategorijai noteiktajā vērtību diapazonā, vai pētījumi ar citiem dzīvniekiem, vai arī toksiskā iedarbība uz cilvēka organismu ir tāda, ka tai ir akūtas iedarbības raksturs;
c) izmantojot datu ekstrapolāciju, aprēķinu vai mērījumu metodes, ja nav nepieciešams piešķirt augstāku bīstamības kategoriju, un
— ir pieejama ticama informācija, kas liecina par būtisku toksisku iedarbību uz cilvēka organismu, vai
— novēroti bojāejas gadījumi, veicot testēšanu līdz 4. kategorijas vērtībām, ievadot orāli, vai
— ja, veicot testēšanu līdz 4. kategorijas vērtībām, izņemot caureju, piloerekciju vai izskatu ekspertu slēdziens apstiprina būtiskas klīniskas toksiskuma pazīmes, vai
— ja ekspertu slēdziens apstiprina ticamu citos pētījumos iegūtu informāciju par būtisku toksisku iedarbību uz dzīvniekiem.
TESTĒŠANA AR DEVĀM VIRS 2 000 MG/KG
Papildu nemainīgās devas līmeni 5 000 mg/kg var izmantot izņēmuma gadījumos un tikai tad, kad tā ir pamatota ar īpašām reglamentējošām prasībām. Sakarā ar nepieciešamību ievērot dzīvnieku labturības prasības nav ieteicams veikt testēšanu ar devām, kas pārsniedz 5 000 mg/kg, un tie jāveic tikai tādos gadījumos, kad ir ļoti lielas iespējas, ka tie ir tieši saistīti ar dzīvnieku aizsardzību vai cilvēku veselības aizsardzību (9).
Devu diapazona pētījums
Noteikumi par lēmumu pieņemšanu attiecībā uz 1. papildinājumā noteikto pakāpenisko procedūru tiek paplašināti, iekļaujot devu līmeni 5 000 mg/kg. Tādējādi, ja devu diapazona pētījumā izmanto sākotnējo devu 5 000 mg/kg, iegūstot rezultātu A (bojāeja), ir jāveic testi ar otru dzīvnieku, testējot devu līmeni 2 000 mg/kg; iegūstot rezultātus B un C (izteikts toksiskums vai nav toksiskas iedarbības), galvenajā pētījumā par sākotnējo devu var izmantot 5 000 mg/kg. Līdzvērtīgi, ja izmanto sākotnējo devu, kas nav 5 000 mg/kg, testus veic ar devām līdz 5 000 mg/kg, ja ar devu 2 000 mg/kg iegūst rezultātus B vai C; pēc tam 5 000 mg/kg testēšanas rezultāts A nosaka, ka galvenā pētījuma sākotnējā deva ir 2 000 mg/kg, bet rezultāti B un C nosaka, ka galvenā pētījuma sākotnējā deva ir 5 000 mg/kg.
Galvenais pētījums
Noteikumi par lēmumu pieņemšanu attiecībā uz 2. papildinājumā noteikto secīgo procedūru tiek paplašināti, iekļaujot devu līmeni 5 000 mg/kg. Tādējādi, ja devu diapazona pētījumā izmanto sākotnējo devu 5 000 mg/kg, iegūstot rezultātu A (≥ 2 bojāejas gadījumi), ir jāveic testi ar otru grupu, testējot devu līmeni 2 000 mg/kg; iegūstot rezultātu B (izteikts toksiskums un/vai ≤ 1 bojāejas gadījums) vai C (nav toksiskas iedarbības), vielu saskaņā ar VSS neklasificē. Līdzvērtīgi, ja izmanto sākotnējo devu, kas nav 5 000 mg/kg, testus veic ar devām līdz 5 000 mg/kg, ja ar devu 2 000 mg/kg iegūst rezultātu C; ja pēc tam ar devu 5 000 mg/kg iegūst rezultātu A, viela pieskaitāma VSS 5. kategorijai, bet, iegūstot rezultātus B vai C, vielu saskaņā ar VSS neklasificē.
4. PAPILDINĀJUMS
TESTA METODE B.1.a
Norādījumi par klasifikāciju saskaņā ar ES sistēmu pārejas perioda laikā līdz Vispārējās saskaņotās sistēmas (VSS) pilnīgai īstenošanai (literatūras saraksts (8)))


B.1.b AKŪTS PERORĀLS TOKSISKUMS – AKŪTA TOKISKUMA KLASES METODE
1. METODE
Šī testa metode ir līdzvērtīga ESAO 423. (2001) vadlīnijā noteiktajai metodei.
1.1. IEVADS
Šajā testā norādītā akūtā toksiskuma klases noteikšanas metode (1) ir posmveida procedūra, kuras katrā posmā izmanto trīs viena dzimuma dzīvniekus. Atkarībā no dzīvnieku mirstības un/vai mirstošo dzīvnieku skaita testējamās vielas akūtā toksiskuma noteikšanai vidēji var būt vajadzīgi 2–4 posmi. Šī procedūra ir reproducējama, tajā izmanto ļoti nelielu skaitu dzīvnieku, un pēc tās iespējams vielas klasificēt līdzvērtīgi kā pēc citām akūtā toksiskuma noteikšanas metodēm. Akūtā toksiskuma klases noteikšanas metodes pamatā ir biometriski novērtējumi (2) (3) (4) (5) ar fiksētām devām, kas ir atbilstoši atdalītas tā, lai vielu varētu novērtēt gan klasifikācijas vajadzībām, gan bīstamības noteikšanai. Kopš tās pieņemšanas 1996. gadā metode plaši in vivo validēta gan valstu līmenī (6), gan starptautiski (7) salīdzinājumā ar datiem, kas iegūti no literatūras.
Norādījumi par katrā konkrētā gadījumā piemērotāko testa metodi atrodami pamatnostādnēs par akūtā perorālā toksiskuma testēšanu Guidance Document on Acute Oral Toxicity Testing (8). Šajās pamatnostādnēs ir arī papildu informācija par testēšanas metodes B.1.b veikšanu un pēc tās iegūto rezultātu interpretāciju.
Testējamās vielas devās, par kurām ir zināms, ka tās izraisa izteiktas sāpju un briesmu sajūtas kodīgo vai stipri kairinošo īpašību dēļ, nav jāievada. Bojā ejoši dzīvnieki, kā arī dzīvnieki, kas acīm redzami cieš sāpes vai pārdzīvo stipras un ilgstošas briesmu sajūtas, ir humāni jānonāvē, un, interpretējot testēšanas rezultātus, tie jāņem vērā tieši tāpat kā testos nobeigušies dzīvnieki. Kritēriji, pēc kuriem pieņem lēmumu nonāvēt bojā ejošus dzīvniekus vai dzīvniekus, kuriem ir smagas ciešanas, kā arī norādījumi par paredzamu vai neizbēgamu nobeigšanos doti citās atsevišķās pamatnostādnēs (9).
Metodē izmanto iepriekš noteiktas fiksētas devas, un pēc tās iegūtie rezultāti dod iespējas vielas ar akūti toksisku iedarbību novērtēt un klasificēt saskaņā ar Vispārējo saskaņoto ķīmisko vielu klasifikāciju (10).
Šī metode principā nav paredzēta precīzai LD50 aprēķināšanai, bet ļauj noteikt iedarbības diapazonu, kurā ir sagaidāms letāls iznākums, jo šā testa galvenais beigu punkts ir kādas testa dzīvnieku daļas nobeigšanās. Pēc šīs metodes LD50 vērtību var noteikt tikai tādos gadījumos, kad vismaz divas devas izraisa nobeigšanos, kas ir augstāka nekā 0 % un zemāka nekā 100 %. Izmantojot iepriekš noteiktas devas, kas nav atkarīgas no konkrētās testējamās vielas, tās klasifikāciju tieši saistot ar dažādos stāvokļos novēroto dzīvnieku skaitu, uzlabo dažādās laboratorijās iegūto rezultātu atbilstību un atkārtojamību.
Pirms sākt pētījumus, testēšanas laboratorijai jāņem vērā visa par testējamo vielu pieejamā informācija. Pie šādas informācijas pieder tās identifikācija un ķīmiskā struktūra, fizikāli ķīmiskās īpašības, citu in vitro vai in vivo veikto toksiskuma testu rezultāti, toksikoloģiskie dati par struktūras ziņā līdzīgām vielām, vielas paredzamais(-ie) izmantošanas veids(-i). Šī informācija ir vajadzīga, lai nodrošinātu, ka testi tiek veikti cilvēku veselības aizsardzībai piemērotā veidā un tiek pareizi izraudzīta sākotnējā deva.
1.2. DEFINĪCIJAS
Akūts perorāls toksiskums: kaitīgā iedarbība, kāda ir 24 stundu laikā pēc vienas vai vairāku vielas devu ievadīšanas caur muti.
Aizkavēta nāve ir tad, ja dzīvnieks 48 stundu laikā nav nobeidzies vai neizbēgami nav gājis bojā, bet nobeidzas vēlāk 14 dienu novērošanas perioda laikā.
Deva: ievadītās testējamās vielas daudzums. Devu izsaka testējamās vielas svara veidā uz testa dzīvnieka svara vienību (piemēram, mg/kg).
VSS: Vispārējā saskaņotā ķīmisko vielu un maisījumu klasifikācijas sistēma. Kopīgs ESAO (veselības un vides aizsardzība), ANO Bīstamo kravu pārvadājumu ekspertu komitejas (fizikāli ķīmiskās īpašības) un ILO – Starptautiskās Darba organizācijas (kaitīguma paziņošana) – pasākums, ko koordinē Ķīmisko vielu drošas apsaimniekošanas starporganizāciju programma (IOMC).
Neizbēgama nāve ir tad, ja miršana vai nāves iestāšanās sagaidāma pirms nākamā plānotā novērojumu laika. Pazīmes, kas liecina par šā stāvokļa iestāšanos grauzējiem var būt konvulsijas, gulēšana uz sāniem vai augšpēdus un drebēšana. (Sīkāk skatīt Humane Endpoint Guidance Document (9).)
LD 50 (vidējā letālā deva): statistiski noteikta vielas deva, kas, ievadot perorāli, var izraisīt 50 % dzīvnieku nobeigšanos. LD50 vērtību izsaka kā testējamās vielas svaru uz testa dzīvnieku svara vienību (mg/kg).
Robeždeva attiecas uz devas augšējo ierobežojumu testā (2 000 vai 5 000 mg/kg).
Mirstošs: atrašanās stāvoklī, kad mirst vai nav iespēju izdzīvot, arī saņemot ārstēšanu. (Sīkāk skatīt Humane Endpoint Guidance Document (9).)
Prognozējama nāve: klīniskās pazīmes, kas liecina par nāves iestāšanos pēc zināma laika, nesagaidot eksperimenta plānotās beigas, piemēram, nespēja sasniegt ūdeni vai barību. (Sīkāk skatīt Humane Endpoint Guidance Document (9).)
1.3. METODES PRINCIPS
Metodes princips ir tāds, ka, pamatojoties uz posmveida procedūru, kuras katrā posmā izmanto minimālu skaitu dzīvnieku, tiek iegūta klasifikācijai pietiekama informācija par testējamās vielas akūto toksiskumu. Vielu izmēģinājuma dzīvnieku grupai ievada perorāli vienā no noteiktajām devām. Vielu testē, izmantojot posmveida procedūru, katrā posmā izmanto trīs viena (parasti sievišķā) dzimuma dzīvniekus. Ar vielu saistīta testa dzīvnieku bojāeja vai tās neesamība nosaka nākamo posmu, t. i.:
— turpmāka testēšana nav vajadzīga,
— to pašu devu ievada vēl trijiem dzīvniekiem,
— vēl trijiem dzīvniekiem ievada nākamo augstāko vai zemāko devu.
Testa procedūra sīkāk aprakstīta 1. papildinājumā. Metode dod iespējas testējamo vielu novērtēt, to klasificējot kādā no toksiskuma klasēm, kas noteiktas pēc fiksētām LD50 robežvērtībām.
1.4. METODES APRAKSTS
1.4.1. Dzīvnieku sugu izvēle
Ieteicamākā grauzēju suga ir žurkas, lai gan var izmanot arī citas grauzēju sugas. Parasti izmanto sieviešu dzimuma īpatņus (9). Tas tāpēc, ka parasto LD50 testu literatūras apskati liecina, ka abu dzimumu jutība daudz neatšķiras, taču gadījumos, kad tā ir atšķirīga, sieviešu dzimuma īpatņi parasti ir nedaudz jutīgāki (11). Tomēr, ja dati par struktūras ziņā līdzīgu vielu toksikoloģiskajām un toksikokinētiskajām īpašībām liecina, ka uz testējamās vielas iedarbību tēviņi varētu būt jutīgāki, tests jāveic ar vīriešu dzimuma īpatņiem. Ja testu veic ar vīrišķā dzimuma īpatņiem, tas ir jāpamato.
Ir jāizmanto jauni, veseli, pieauguši parasti izmantojamo laboratorijas līniju dzīvnieki. Mātītes nedrīkst būt iepriekš dzemdējušas vai grūsnas. Visiem testa dzīvniekiem testēšanas sākumā jābūt 8 līdz 12 nedēļas veciem, un to ķermeņa svaram jābūt ± 20 % no testiem iepriekš izmantoto dzīvnieku vidējā svara.
1.4.2. Turēšanas un barošanas nosacījumi
Telpā, kurā tur izmēģinājumu dzīvniekus, jābūt 22 oC (± 3 oC) temperatūrai. Lai gan, izņemot telpu uzkopšanas laiku, relatīvajam mitrumam jābūt vismaz 30 % un vēlams ne vairāk kā 70 %, tas jāuztur 50–60 % robežās. Apgaismojumam jābūt mākslīgam, secība ir 12 stundas gaismas, 12 stundas tumsas. Var izmantot parasto laboratorijas barību ar neierobežotu dzeramā ūdens piegādi. Dzīvniekus būros var turēt grupās atbilstoši devai, bet to skaits vienā būrī nedrīkst apgrūtināt katra dzīvnieka novērošanu.
1.4.3. Dzīvnieku sagatavošana
Veselus, pieaugušus, jaunus dzīvniekus izvēlas izlases veidā, marķē individuālai identificēšanai un tur būros vismaz piecas dienas pirms izmēģinājuma sākuma, lai tie aklimatizētos laboratorijas apstākļos.
1.4.4. Devu sagatavošana
Parasti testējamās vielas jāievada visām pārbaudāmajām devām vienādā tilpumā, mainot ievadāmā preparāta koncentrāciju. Taču, ja jātestē galaprodukts, kas ir šķidrums vai maisījums, vielas bīstamības novērtēšanai tā var būt jāizmanto neatšķaidītā veidā, t. i., ar nemainīgu koncentrāciju, un tā ir arī dažu reglamentējošo iestāžu prasība. Jebkurā gadījumā nedrīkst pārsniegt ievadāmo devas maksimālo tilpumu. Maksimālais šķidruma tilpums, ko vienā paņēmienā var ievadīt, ir atkarīgs no testa dzīvnieka lieluma. Žurkām tas parasti nedrīkst pārsniegt 1ml/100 g ķermeņa svara; tomēr ūdens šķīdumus var ievadīt līdz 2 ml/100 g ķermeņa svara. Ņemot vērā ievadāmā preparāta sastāvu, vienmēr, kad iespējams, ieteicams izmantot šķīdumu/suspensiju/emulsiju ūdenī, ja ne, tad šķīdumu/suspensiju/emulsiju eļļā (piemēram, kukurūzas eļļā) un tikai pēc tam šķīdumu citos nesējos. Ja nesējs nav ūdens, jānoskaidro tā toksiskās īpašības. Ja nav datu par preparāta pietiekamu stabilitāti visā tā lietošanas laikā, devas jāsagatavo neilgi pirms ievadīšanas.
1.5. PROCEDŪRA
1.5.1. Devu ievadīšana
Testējamo vielu dzīvniekiem ievada vienā devā, mākslīgi barojot, izmantojot kuņģa zondi vai piemērotu intubācijas kanulu. Ja kādu apstākļu dēļ ievadīt vienā devā nav iespējams, to var dot mazākās daļās laika posmā, kas nepārsniedz 24 stundas.
Dzīvniekus pirms devu ievadīšanas nebaro (piemēram, žurkas pārtrauc barot iepriekšējā dienā, dodot tikai dzert, bet peles – 3–4 stundas pirms devu ievadīšanas). Pirms ievadīt testējamo vielu pēc nebarošanas perioda, dzīvnieki ir jānosver. Pēc testējamās vielas ievadīšanas žurkas var nebarot vēl 3–4 stundas, bet peles – 1–2 stundas. Ja vielas devu ievada pa daļām kādā laika posmā, atkarībā no tā ilguma var gadīties, ka dzīvnieki ir jānodrošina ar barību un ūdeni.
1.5.2. Dzīvnieku skaits un devu līmeņi
Katrā posmā izmato trīs dzīvniekus. Devas līmeni, ko izmanto par sākotnējo devu, izvēlas kā vienu no četriem noteiktiem līmeņiem, t. i., 5, 50, 300 un 2 000 mg/kg ķermeņa svara. Sākotnējam devas līmenim jābūt tādam, kas ar lielu varbūtību varētu izraisīt vismaz dažu devu saņēmušo dzīvnieku bojāeju. Diagrammās 1. papildinājumā norādīta procedūra, kas jāievēro atkarībā no sākotnējās devas. Papildus 4. papildinājumā ir norādījumi par klasifikāciju ES sistēmā līdz laikam, kamēr tiek ieviesta jaunā VSS sistēma.
Ja pieejamā informācija liek domāt, ka pie lielākā sākotnējās devas līmeņa (2 000 mg/kg ķermeņa svara) mirstība ir mazticama, tad ir jāizdara pieļaujamības tests. Ja par testējamo vielu nav informācijas, dzīvnieku labturības dēļ ir ieteicams izmantot sākotnējo devu 300 mg/kg ķermeņa svara.
Laika intervālu starp vielas atkārtotu ievadīšanu izmēģinājumu dzīvnieku grupām nosaka atkarībā no toksiskuma pazīmju parādīšanās, ilguma un smaguma. Vielas nākamās devas ievadīšana ir jāatliek līdz laikam, kamēr rodas pārliecība par iepriekš devu saņēmušo dzīvnieku izdzīvošanu.
Augšējo devu 5 000 mg/kg ķermeņa svara var izmantot tikai izņēmuma gadījumos, kad tā ir pamatota ar īpašām reglamentējošām prasībām (skatīt 2. papildinājumu). Pamatojoties ar dzīvnieku labturības apsvērumiem nav ieteicams ar dzīvniekiem izmēģināt VSS 5. kategorijas devas (2 000–5 000 mg/kg), un tās jātestē tikai tādos gadījumos, ja ir lielas iespējas, ka šādu testu rezultāti ir ļoti nepieciešami cilvēku vai dzīvnieku veselības vai vides aizsardzībai.
1.5.3. Pieļaujamības tests
Pieļaujamības testu galvenokārt izmanto gadījumos, kad eksperimenta veicēja rīcībā ir informācija, kas liecina, ka vielai varētu nebūt toksiskas iedarbības, t. i., tā ir toksiska tikai devās, kas ierobežotas ar reglamentējošiem dokumentiem. Informāciju par testējamā materiāla toksiskumu var iegūt pēc testu datiem ar līdzīgiem maisījumiem vai produktiem, ņemot vērā identitāti un to sastāvdaļu procentuālo īpatsvaru, kuru toksiskums ir zināms. Šādās situācijās, kad nav informācijas par toksiskumu vai tā ir nepietiekama, vai arī paredzams, ka testējamā viela varētu būt toksiska, ir jāveic galvenais tests.
Pieļaujamības testu pie viena devas līmeņa 2 000 mg/kg ķermeņa svara var izdarīt ar sešiem dzīvniekiem (katrā posmā pa trijiem). Izņēmuma gadījumos pieļaujamības testu var veikt ar devu 5 000 mg/kg ķermeņa svara, izmantojot trīs dzīvniekus (skatīt 2. papildinājumu). Ja tiek konstatēta ar vielas ievadīšanu saistīta bojāeja, var būt nepieciešams veikt nākamās zemākās devas testus.
1.6. NOVĒROJUMI
Pēc ievadīšanas pirmo 30 minūšu laikā dzīvniekus individuāli novēro vismaz vienreiz, pirmo 24 stundu laikā periodiski, īpašu uzmanību veltot pirmajām četrām stundām, un pēc tam reizi dienā, pavisam 14 dienas, izņemot gadījumus, kad dzīvnieki gājuši bojā vai pētījumi jāizbeidz, dzīvnieku labturības apsvērumu dēļ tos humāni nonāvējot. Tomēr novērošanas ilgums nav stingri jānosaka. Tas ir jānosaka pēc toksiskās iedarbības reakcijām, to parādīšanās laika un atveseļošanās ilguma, un tādēļ ilgumu var pagarināt, ja uzskata par vajadzīgu. Laiki, kad parādās un izzūd toksiskuma pazīmes, ir svarīgi, īpaši, ja tām ir tendence aizkavēties (12). Visus novērojumus sistemātiski reģistrē, par katru dzīvnieku izdarot individuālu reģistrēšanu.
Ja dzīvniekiem turpinās toksiskās iedarbības pazīmes, ir vajadzīgi papildu novērojumi. Novērojot dzīvniekus, jāpievērš uzmanība izmaiņām, kas skar to ādu un apmatojumu, acis un gļotādas, kā arī elpošanas orgānus, asinsriti, veģetatīvo un centrālo nervu sistēmu, somatomotoriku un uzvedības reakcijas. Uzmanība jāpievērš drebuļu, krampju, siekalošanās, caurejas, letarģijas, miega un komas novērojumiem. Jāņem vērā principi un kritēriji, kas apkopoti Humane Endpoints Guidance Document (9). Visi mirstošie dzīvnieki un dzīvnieki, kas izrāda lielu sāpju un ilgstošu briesmu sajūtu pazīmes, ir humāni jānonāvē. Ja dzīvnieki ir nonāvēti humānu apsvērumu dēļ vai atrasti miruši, iespējami precīzi ir jāreģistrē nobeigšanās laiks.
1.6.1. Ķermeņa svars
Visi dzīvnieki jānosver neilgi pirms testējamās vielas ievadīšanas un pēc tam vismaz reizi nedēļā. Svara izmaiņas ir jāaprēķina un jāreģistrē. Testa beigās pirms humānas nonāvēšanas izdzīvojušos dzīvniekus nosver.
1.6.2. Patoloģija
Visiem testa dzīvniekiem (arī tiem, kuri testa laikā nobeigušies vai ar kuriem dzīvnieku labturības apsvērumu dēļ pētījumi izbeigti) ir jāveic pilna autopsija. Visas patoloģiskās izmaiņas reģistrē par katru dzīvnieku. Var apsvērt arī orgānu, kuros parādās visas patoloģijas pierādījumi, mikroskopisko izmeklēšanu dzīvniekiem, kas izdzīvojuši 24 stundas vai ilgāk, jo tāda apskate var sniegt noderīgu informāciju.
2. DATI
Norāda datus par atsevišķiem dzīvniekiem. Turklāt visi dati ir jāapkopo tabulas veidā, norādot dzīvnieku skaitu, kas izmantots katrā testa grupā, dzīvnieku skaitu, kuriem parādījušās toksiskuma pazīmes, dzīvnieku skaitu, kuri testa laikā atrasti nobeigušies vai nonāvēti humānu apsvērumu dēļ, atsevišķo dzīvnieku nobeigšanās laiku, toksiskās iedarbības veidu un tā atgriezeniskuma aprakstu un gaitu, kā arī autopsijā iegūtos novērojumus.
3. PĀRSKATA SAGATAVOŠANA
3.1. Pārskats par testu
Pārskatā par testu jāiekļauj šāda informācija.
Testējamā viela:
— fizikālās īpašības, tīrība un attiecīgos gadījumos arī fizikāli ķīmiskās īpašības (ieskaitot izomerizāciju),
— identifikācijas dati, tostarp CAS numurs.
Nesējs (ja vajadzīgs):
— nesēja izvēles pamatojums, ja nesējs nav ūdens.
Testa dzīvnieki:
— izmantotā suga/līnija,
— dzīvnieku mikrobioloģiskais statuss, ja tas zināms,
— dzīvnieku skaits, vecums un dzimums (ietverot, ja vajadzīgs, vīrišķā dzimuma īpatņu izmantošanu sievišķā dzimuma īpatņu vietā),
— izcelsme, turēšanas apstākļi, barība u. c.
Testa apstākļi:
— informācija par testējamās vielas preparātu, ietverot datus par ievadītā materiāla fizikālo formu,
— sīkas ziņas par testējamās vielas ievadīšanu, iekļaujot ievadāmos tilpumus un ievadīšanas laikus,
— sīkas ziņas par barības un ūdens kvalitāti (iekļaujot veidu/izcelsmi, ūdens avotu),
— sākotnējās devas izvēles pamatojums.
Rezultāti:
— katra dzīvnieka atbildes reakciju datu tabula un devas līmenis (t. i., dzīvniekiem, kas uzrādījuši toksiskuma pazīmes, tostarp nobeigšanās gadījumus, iedarbības veidu, smagumu un ilgumu),
— datu tabula par ķermeņa svaru un ķermeņa svara izmaiņām,
— katra dzīvnieka svars ievadīšanas dienā un pēc tam ar nedēļas starplaikiem, kā arī nobeigšanās vai nonāvēšanas laikā,
— nobeigšanās datums un laiks, ja tā notikusi pirms paredzētās nonāvēšanas,
— toksiskuma pazīmju parādīšanās gaita katram dzīvniekam, un vai tās ir bijušas atgriezeniskas,
— katra dzīvnieka autopsijā konstatētais un histopatoloģiskās konstatācijas, ja tās pieejamas.
Rezultātu apspriešana un interpretācija.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Roll R., Höfer-Bosse Th. And Kayser D. (1986). New Perspectives in Acute Toxicity Testing of Chemicals. Toxicol. Lett., Suppl. 31, p. 86.
(2) Roll R., Riebschläger M., Mischke U. and Kayser D. (1989). Neue Wege zur Bestimmung der akuten Toxizität von Chemikalien. Bundesgesundheitsblatt 32, p. 336–341.
(3) Diener W., Sichha L., Mischke U., Kayser D. and Schlede E. (1994). The Biometric Evaluation of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 68, p. 559–610.
(4) Diener W., Mischke U., Kayser D. and Schlede E. (1995). The Biometric Evaluation of the OECD Modified Version of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, p. 729–734.
(5) Diener W., and Schlede E. (1999) Acute Toxicity Class Methods: Alterations to LD/LC50 Tests. ALTEX 16, p. 129–134.
(6) Schlede E., Mischke U., Roll R. and Kayser D. (1992). A National Validation Study of the Acute-Toxic- Class Method – An Alternative to the LD50 Test. Arch. Toxicol. 66, p. 455–470.
(7) Schlede E., Mischke U., Diener W. and Kayser D. (1994). The International Validation Study of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69,p. 659–670.
(8) OECD (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris.
(9) OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N 19.
(10) OECD (1998) Harmonized Integrated Hazard Classification System For Human Health And Environmental Effects Of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html].
(11) Lipnick R L, Cotruvo, J A, Hill R N, Bruce R D, Stitzel K A, Walker A P, Chu I; Goddard M, Segal L, Springer J A and Myers R C (1995) Comparison of the Up-and Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol 33, p. 223–231.
(12) Chan P.K. and A.W. Hayes (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A.W. Hayes, Editor. Raven Press, Ltd., New York, USA.
1. PAPILDINĀJUMS
KATRAI SĀKOTNĒJAI DEVAI IEVĒROJAMĀ PROCEDŪRA
VISPĀRĪGAS PIEZĪMES
Attiecībā uz katru sākotnējo devu ir jāievēro procedūra, kas izklāstīta attiecīgās testēšanas shēmās, kuras iekļautas šajā papildinājumā.
— 1.a papildinājums – sākotnējā deva 5 mg/kg ķermeņa svara,
— 1.b papildinājums – sākotnējā deva 50 mg/kg ķermeņa svara,
— 1.c papildinājums – sākotnējā deva 300 mg/kg ķermeņa svara,
— 1.d papildinājums – sākotnējā deva 2 000 mg/kg ķermeņa svara.
Humānu apsvērumu dēļ nonāvēto vai bojāgājušo dzīvnieku skaita testēšanas procedūra jāveic, kā norādīts ar bultiņām.
1.A PAPILDINĀJUMS
TESTĒŠANAS PROCEDŪRA AR SĀKOTNĒJO DEVU 5 MG/KG ĶERMEŅA SVARA
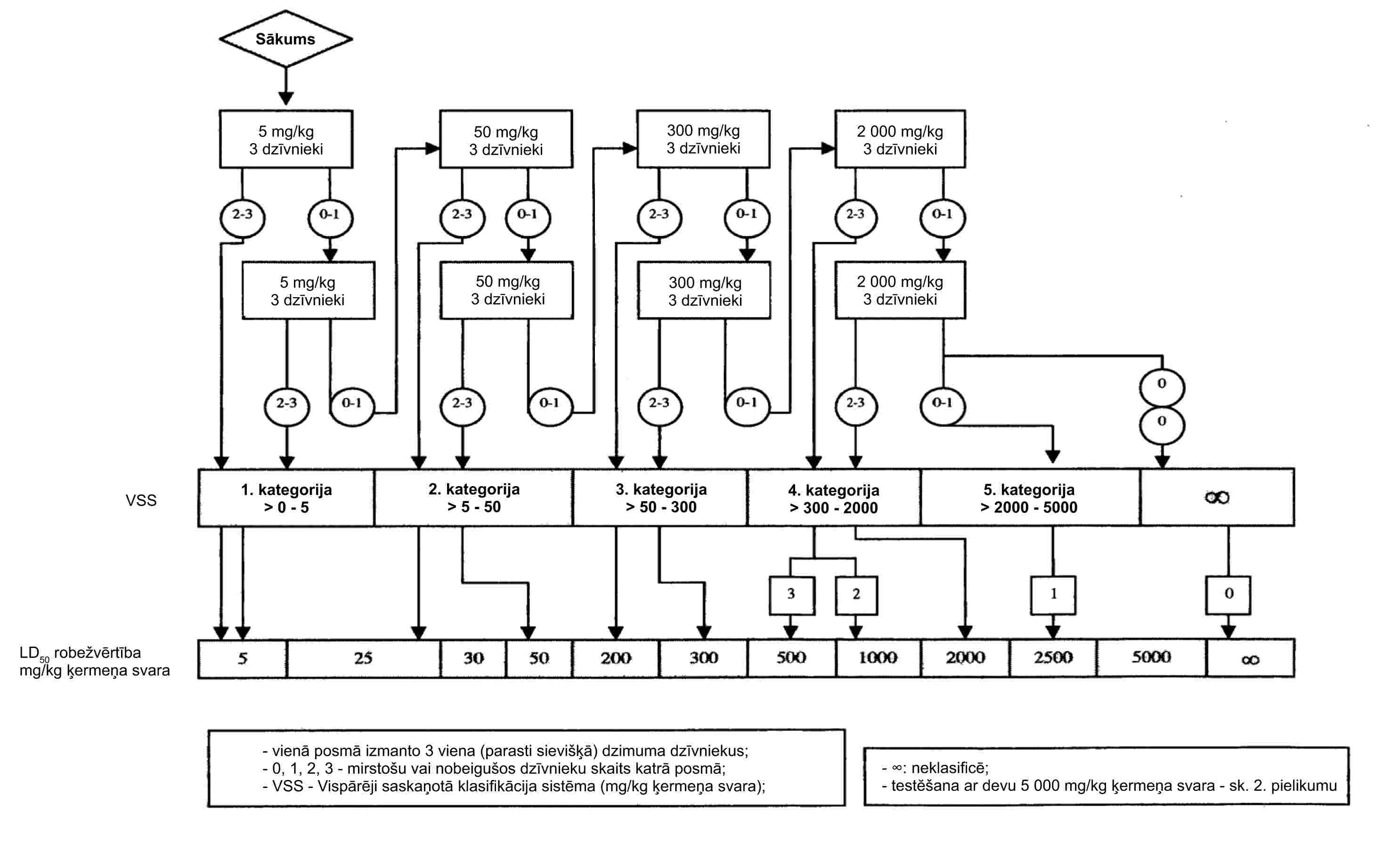
1.B PAPILDINĀJUMS
TESTĒŠANAS PROCEDŪRA AR SĀKOTNĒJO DEVU 50 MG/KG ĶERMEŅA SVARA

1.C PAPILDINĀJUMS
TESTĒŠANAS PROCEDŪRA AR SĀKOTNĒJO DEVU 300 MG/KG ĶERMEŅA SVARA

1.D PAPILDINĀJUMS
TESTĒŠANAS PROCEDŪRA AR SĀKOTNĒJO DEVU 2 000 MG/KG ĶERMEŅA SVARA

2. PAPILDINĀJUMS
KLASIFIKĀCIJAS KRITĒRIJI TESTĒJAMAJĀM VIELĀM AR PAREDZAMAJĀM LD50 VĒRTĪBĀM VIRS 2 000 MG/KG, NEVEICOT TESTUS
Kritēriji, kas noteikti 5. bīstamības kategorijai, ir vērsti uz tādu testējamo vielu identifikāciju, kurām ir gan relatīvi zems akūtais toksiskums, tomēr zināmos apstākļos tās var būt bīstamas jutīgām populācijām. Šo vielu sagaidāmā LD50, ievadot caur muti vai uzsūcoties caur ādu, ir 2 000–5 000 mg/kg vai citiem ievadīšanas veidiem tām līdzvērtīgas. Testējamās vielas var iedalīt šajā bīstamības kategorijā, kas noteikta: 2 000 mg/kg < LD50 < 5 000 mg/kg (VSS 5. kategorija) šādos gadījumos:
a) ja šī kategorija noteikta pēc kādas no 1.a–1.d papildinājumā norādītajām testēšanas shēmām, pamatojoties uz mirstības gadījumiem;
b) ja ir ticami dati, kas norāda, ka LD50 ir 5. kategorijai noteiktajā vērtību diapazonā, vai pētījumi ar citiem dzīvniekiem vai arī toksiskā iedarbība uz cilvēka organismu ir tāda, ka tai ir akūtas iedarbības raksturs;
c) izmantojot datu ekstrapolāciju, aprēķinu vai mērījumu metodes, ja nav nepieciešams piešķirt augstāku bīstamības kategoriju, un
— ir pieejama ticama informācija, kas liecina par būtisku toksisku iedarbību uz cilvēka organismu, vai
— novēroti bojāejas gadījumi, veicot testus līdz 4. kategorijas vērtībām, ievadot orāli, vai
— ja, veicot testus līdz 4. kategorijas vērtībām, izņemot caureju, piloerekciju vai izskatu, ekspertu slēdziens apstiprina būtiskas klīniskas toksiskuma pazīmes, vai
— ja ekspertu slēdziens apstiprina ticamu citos pētījumos ar dzīvniekiem iegūtu informāciju par būtisku toksisku iedarbību.
TESTĒŠANA AR DEVĀM VIRS 2 000 MG/KG
Sakarā ar nepieciešamību ievērot dzīvnieku labturības prasības nav ieteicams veikt testus ar 5. kategorijas devām, kas pārsniedz 5 000 mg/kg, un tie jāveic tikai tādos gadījumos, kad ir ļoti lielas iespējas, ka tie ir tieši saistīti ar dzīvnieku aizsardzību vai cilvēku veselības aizsardzību (10). Nav jāveic papildu testēšana ar augstākām devām.
Ja jāveic testi ar 5 000 mg/kg devu, tas jāveic tikai vienā posmā, t. i., ar trijiem dzīvniekiem. Ja pirmais dzīvnieks, kam šī deva ievadīta, nobeidzas, saskaņā ar diagrammu 1. papildinājumā nākamā ievadāmā deva ir 2 000 mg/kg. Ja pirmais dzīvnieks izdzīvo, devu ievada vēl diviem dzīvniekiem. Ja no trijiem dzīvniekiem nobeidzas tikai viens, paredzams, ka LD50 vērtība ir augstāka nekā 5 000 mg/kg. Ja iet bojā abi dzīvnieki, nākamā ievadāmā deva ir 2 000 mg/kg.
3. PAPILDINĀJUMS
TESTĒŠANAS METODE B.1.b. Nosacījumi par klasifikāciju saskaņā ar ES sistēmu pārejas laikā līdz Vispārējās saskaņotās sistēmas (VSS) pilnīgai ieviešanai (literatūras sarakstā (8))




B.2. AKŪTA TOKSICITĀTE (PĒC IEELPOŠANAS)
1. METODE
1.1. IEVADS
Lietderīgi iegūt orientējošu informāciju par vielas daļiņu izmēru sadalījumu, tvaika spiedienu, kušanas temperatūru, viršanas temperatūru, uzliesmošanas temperatūru un sprādzienbīstamību (ja vajadzīgs).
Skatīt vispārīgā ievada B daļas A iedaļu.
1.2. DEFINĪCIJAS
Skatīt vispārīgā ievada B daļas B iedaļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES PRINCIPS
Vairākas izmēģinājumu dzīvnieku grupas noteiktu laiku pakļauj pārbaudāmās vielas iedarbībai dažādā koncentrācijā, katrai grupai saņemot vienādu koncentrāciju. Pēc tam novēro toksisko iedarbību un reģistrē nāves gadījumus. Izmēģinājuma laikā mirušos dzīvniekus uzšķērž, beidzoties izmēģinājumam, sekciju izdara arī izdzīvojušajiem dzīvniekiem.
Dzīvnieki, kas uzrāda smagas un ilgstošas ciešanu un sāpju pazīmes, var būt jānonāvē humānu apsvērumu dēļ. Pārbaudāmo vielu dozēšana nav jāizdara veidā, par ko ir zināms, ka tas izraisa izteiktas sāpes un ciešanas kodīgo un kairinošo īpašību dēļ.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
1.6.1. Sagatavošanas darbi
Dzīvniekus pirms izmēģinājuma vismaz piecas dienas pieradina pie izmitināšanas un barošanas apstākļiem. Veselus un jaunus dzīvniekus pēc nejaušības principa sadala izmēģinājumu grupās. Ekspozīcijas apstākļu simulāciju veic tikai tad, ja šādu nepieciešamību nosaka izmantojamās iekārtas īpatnības.
Pārbaudāmās cietvielas var būt ļoti smalki jāsasmalcina, lai iegūtu vajadzīgā izmēra daļiņas.
Vajadzības gadījumā pārbaudāmo vielu sajauc ar piemērotu nesējvielu, kas palīdz iegūt vajadzīgo vielas koncentrāciju atmosfērā, vienlaikus paredzot kontroles grupu, kuru pakļauj nesējvielas iedarbībai. Ja vieglākai dozēšanai izmanto šķīdinātāju vai citas piedevas, jāpārliecinās par to netoksiskumu. Vajadzības gadījumā var izmantot agrāk iegūtus datus.
1.6.2. Pārbaudes apstākļi
1.6.2.1. Izmēģinājumu dzīvnieki
Ja nav citu ieteikumu, vēlams izmantot žurkas. Jāizmanto plaši pazīstamas laboratorijas dzīvnieku līnijas. Abu dzimumu grupās dzīvnieku masas atšķirības izmēģinājuma sākumā nedrīkst būt lielākas par ± 20 % no attiecīgās vidējās vērtības.
1.6.2.2. Dzīvnieku skaits un dzimums
Katru koncentrāciju izmēģina vismaz uz 10 grauzējiem (piecas mātītes un pieci tēviņi). Mātītes nedrīkst būt iepriekš dzemdējušas vai grūsnas.
Piezīme. Akūtās toksicitātes izmēģinājumiem izmantojot par grauzējiem augstāk attīstītus dzīvniekus, jāapsver iespējas izmantot to mazāku skaitu. Devas jāizraugās ļoti rūpīgi, un jācenšas nepārsniegt devas, kurām ir vidēji toksiska iedarbība. Šādos izmēģinājumos izvairās ievadīt tādas pārbaudāmās vielas devas, kurām ir letāla iedarbība.
1.6.2.3. Pārbaudāmās koncentrācijas
Jāizvēlas vairākas devas, vismaz trīs devas pietiekami plašā diapazonā, lai izmēģinājumu grupās būtu iespējams novērot atšķirīgu toksisko iedarbību un mirstību. Jāiegūst pietiekami daudz datu, lai varētu noskaidrot mirstības atkarību no koncentrācijas un, ja iespējams, pienācīgi noteikt LD50.
1.6.2.4. Pieļaujamās koncentrācijas tests
Ja pēc četru stundu iedarbības uz pieciem vīriešu kārtas un pieciem sieviešu kārtas testa dzīvniekiem, izmantojot 20 mg vielas uz litru gāzes vai 5 mg vielas uz litru aerosola vai makrodaļiņu (vai, ja tas nav iespējams pārbaudāmās vielas fizikālo, ķīmisko īpašību, kā arī sprādzienbīstamības dēļ, izmantojot maksimāli iespējamo koncentrāciju), 14 dienu laikā šis savienojums neizraisa dzīvnieku nāvi, uzskata, ka turpmākā testēšana nav nepieciešama. (18. ATP, Direktīva 93/21/EEK, Ll10/93).
1.6.2.5. Ekspozīcijas ilgums
Minimālais ekspozīcijas ilgums ir četras stundas.
1.6.2.6. Iekārta
Izmēģinājumos ar dzīvniekiem izmanto inhalācijas iekārtu, kas nodrošina dinamisku gaisa plūsmu un stundas laikā vismaz 12 reizes apmaina gaisu, lai būtu pietiekams skābekļa saturs un vienmērīga atmosfēra ekspozīcijas laikā. Ja izmanto inhalācijas kameru, tās konstrukcijai jābūt tādai, kas neļauj dzīvniekiem drūzmēties un maksimāli nodrošina pārbaudāmās vielas iedarbību ekspozīcijas laikā. Lai kamerā būtu noturīga atmosfēra, izmēģinājumu dzīvnieku kopējais “tilpums” parasti nedrīkst pārsniegt 5 % no kameras tilpuma. Var izmantot kameras, kas ļauj vielai iedarboties tikai uz mutes un deguna dobumu, galvu vai visu ķermeni; pirmos divos gadījumos līdz minimumam samazināta pārbaudāmās vielas uzņemšana citādā veidā.
1.6.2.7. Novērošanas periods
Dzīvniekus novēro vismaz 14 dienas. Tomēr novērošanas ilgumu var ietekmēt dažādi apstākļi. To nosaka novērotās toksiskās reakcijas, to iestāšanās ātrums un dzīvnieku atveseļošanās ilgums; tāpēc vajadzības gadījumā to var pagarināt. Svarīgi zināt brīdi, kad parādās un izzūd toksiskuma pazīmes, un brīdi, kurā iestājas nāve, jo īpaši tad, ja tā iestājas novēloti.
1.6.3. Procedūra
Dzīvniekus nosver tieši pirms izmēģinājuma un, kad pārbaudāmās vielas koncentrācija izvēlētajā iekārtā sasniedz līdzsvaru, tos vismaz četras stundas pakļauj vajadzīgās koncentrācijas iedarbībai. Koncentrācijas līdzsvaram jāiestājas īsā laikā. Izmēģinājuma laikā jāuztur 22 ± 3 oC temperatūra. Relatīvo mitrumu vēlams uzturēt robežās no 30 % līdz 70 %, tomēr dažkārt (piemēram, veicot izmēģinājumus ar daļu aerosolu) tas var nebūt iespējams. Kamerā uzturot nedaudz pazeminātu spiedienu (būris, 5 mm ūdens staba), novērš iespējas vielai izplūst apkārtējā vidē. Ekspozīcijas laikā dzīvniekus nebaro un nedzirda. Izmēģinājumu laikā jāizmanto piemērotas atmosfēras temperatūras uzturēšanas un kontroles sistēmas. Sistēmai pēc iespējas ātrāk jānodrošina nemainīgi ekspozīcijas apstākļi. Kameras konstrukcijai un ekspluatācijai jābūt tādai, lai tajā tiktu uzturēta viendabīga testējamā atmosfēra.
Jāmēra un jāuzrauga:
a) gaisa plūsmas ātrums (nepārtraukti);
b) testa vielas faktiskā koncentrācija, kas mērīta elpošanas zonā vismaz trīs reizes iedarbības laikā (dažām atmosfērām, piemēram, aerosoliem lielās koncentrācijās, var būt vajadzīga biežāka uzraudzība). Vielas koncentrācijas svārstības iedarbības laikā nedrīkst pārsniegt ± 15 % no vidējās vērtības. Tomēr, ja izmanto dažus aerosolus, to nevar panākt, un tad ir pieļaujams plašāks svārstību diapazons. Aerosolu daļiņu lieluma analīze jāveic tik bieži, cik nepieciešams (vismaz vienreiz uz testa grupu);
c) temperatūra un mitrums, ja iespējams, nepārtraukti.
Iedarbības laikā novērojumus veic un reģistrē sistemātiski; atsevišķi pieraksta datus par katru dzīvnieku. Pirmajā dienā novērošanu veic biežāk. Katru darbdienu vismaz vienreiz veic rūpīgu klīnisko izmeklēšanu, pārējos novērojumus veic ik dienas, pienācīgi gādājot par to, lai samazinātu izmēģinājumu dzīvnieku zudumus, piemēram, mirušos dzīvniekus secē vai ievieto ledusskapī, bet vārgus un mirstošus īpatņus nošķir vai nogalina.
Novērojot dzīvniekus, jāpievērš uzmanība izmaiņām, kas skar to ādu un apmatojumu, acis, gļotādas, elpošanas orgānus, asinsriti, veģetatīvo un centrālo nervu sistēmu, somatomotoriku un uzvedības reakcijas. Īpaša vērība jāpievērš elpošanas orgānu darbībai, trīcei, konvulsijām, salivācijai, caurejai, letarģijai, miegam un komas stāvoklim. Nāves iestāšanās brīdi reģistrē, cik vien precīzi iespējams. Beidzoties iedarbības laikam, katru dzīvnieku nosver vienreiz nedēļā un pēc nāves iestāšanās.
Dzīvniekus, kas miruši testa laikā, un izdzīvojušos dzīvniekus testa beigās secē, īpašu uzmanību pievēršot izmaiņām augšējos un apakšējos elpošanas ceļos. Reģistrē visas novērotās patoloģiskās izmaiņas. Vajadzības gadījumā ņem audu paraugus histopatoloģiskai izmeklēšanai.
2. DATI
Dati jāapkopo tabulā, norādot dzīvnieku skaitu katrā grupā pirms testa, nāves iestāšanās brīdi katram dzīvniekam, to dzīvnieku skaitu, kuriem novērotas citas toksiskuma pazīmes, toksiskās ietekmes izpausmes un autopsijas rezultātus. Ja dzīvnieki izdzīvo ilgāk nekā vienu dienu, jāaprēķina un jāpieraksta svara izmaiņas. Dzīvniekus, kas ir humāni nogalināti ar savienojumu saistīto briesmu sajūtu un sāpju dēļ, reģistrē kā mirušus saistībā ar savienojumu. LD50 aprēķina pēc atzītas metodes. Izvērtējot datus, jānoskaidro, vai pastāv korelācija starp testa vielas iedarbību un novēroto anomāliju biežumu un smagumu, ieskaitot uzvedības izmaiņas, klīniskās novirzes, makropatoloģiskās izmaiņas, ķermeņa svara izmaiņas, mirstību un pārējos toksikoloģiskos rādītājus.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šāda informācija:
— dzīvnieku suga, līnija, izcelsme, vides apstākļi, barība u. tml.,
— testa apstākļi: inhalācijas iekārtas apraksts, iekļaujot konstrukciju, tipu, izmērus, gaisa avotu, aerosolu ģenerēšanas sistēmu, gaisa kondicionēšanas metodi un dzīvnieku ievietošanas metodi testa kamerā, ja to izmanto. Jāapraksta temperatūras, mitruma, aerosola koncentrāciju un daļiņu lieluma mērīšanas aprīkojums.
Iedarbības režīms
Šie dati jāapkopo tabulā, norādot vidējās vērtības, kā arī svārstību diapazonu (piemēram, standartnovirzi), un, ja iespējams, jāiekļauj:
a) gaisa plūsmas ātrums caur inhalācijas aprīkojumu;
b) gaisa temperatūra un mitrums;
c) nominālās koncentrācijas (inhalācijas iekārtā ievadītais testa vielas kopējais daudzums, kas izdalīts ar gaisa daudzumu);
d) nesēja veids, ja to izmanto;
e) faktiskās koncentrācijas testa elpošanas zonā;
f) masas vidējais aerodinamiskais diametrs (MVAD) un ģeometriskā standartnovirze (ĢSN);
g) līdzsvara iestāšanās ilgums;
h) iedarbības ilgums;
— atbildes reakcijas datu tabula pēc dzimuma un iedarbības līmeņa (t. i., testa laikā mirušo vai nogalināto dzīvnieku skaits); dzīvnieku skaits, kam parādās toksiskuma pazīmes; iedarbībai pakļauto dzīvnieku skaits,
— nāves brīdis iedarbības laikā vai pēc tās, dzīvnieku humānās nogalināšanas iemesli un kritēriji,
— visi novērojumi,
— LC50 katra dzimuma dzīvniekiem, beidzoties novērošanas laikam (norādot aprēķina metodi),
— LD50 95 % ticamības intervāls (ja var aprēķināt),
— devas/mirstības līkne un slīpuma koeficients (ja to ļauj noteikšanas metode),
— autopsijas konstatācijas,
— histopatoloģiskas konstatācijas,
— rezultātu apspriešana (īpaša uzmanība jāpievērš, kāda ietekme dzīvnieku humānai nogalināšanai testa laikā varētu būt uz aprēķināto LC50 lielumu),
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļas D iedaļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļas E iedaļu.
B.3. AKŪTĀ TOKSICITĀTE (ĀDAS)
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļas A iedaļu.
1.2. DEFINĪCIJA
Skatīt vispārīgā ievada B daļas B iedaļu.
1.3. STANDARTVIELAS
Nav.
1.4. TESTA METODES PRINCIPS
Ar testa vielu pakāpeniskās devās apstrādā ādu vairāku izmēģinājumu grupu dzīvniekiem, katrai grupai saņemot vienādu devu. Pēc tam novēro toksisko iedarbību un reģistrē nāves gadījumus. Testa laikā mirušos dzīvniekus secē, beidzoties testam, secē arī izdzīvojušos dzīvniekus.
Dzīvnieki, kas uzrāda smagas un ilgstošas briesmu sajūtas un sāpju pazīmes, var būt humāni jānogalina. Tāda testa devu došana, par ko ir zināms, ka tā izraisa izteiktas sāpes un briesmu sajūtu kodīgo vai kairinošo īpašību dēļ, nav jāveic.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. TESTA METODES APRAKSTS
1.6.1. Sagatavošanas darbi
Dzīvniekus eksperimenta būros pirms testa vismaz piecas dienas pieradina pie izmitināšanas un barošanas apstākļiem. Pirms testa veselus un jaunus pieaugušus dzīvniekus pēc nejaušības principa sadala izmēģinājumu grupās. Apmēram 24 stundas pirms testa dzīvniekiem nocērp vai noskuj apmatojumu uz muguras. Cērpot vai skujot apmatojumu, nedrīkst nobrāzt ādu, jo tas var izmainīt ādas caurlaidību. Testa vielas uzlikšanai jāsagatavo vismaz 10 % ķermeņa virsmas. Pārbaudot cietas vielas, kuras vajadzības gadījumā var saberzt pulverī, testa viela jāsamitrina ar pietiekamu daudzumu ūdens vai, ja nepieciešams, ar piemērotu nesēju, lai tai būtu laba saskare ar ādu. Ja izmanto nesēju, ir jāņem vērā, ka tas var izmainīt ādas caurlaidību attiecībā pret testa vielu. Analizējamos šķidrumus parasti neatšķaida.
1.6.2. Testa apstākļi
1.6.2.1. Izmēģinājuma dzīvnieki
Var izmantot pieaugušas žurkas vai trušus. Var izmantot arī citas sugas dzīvniekus, bet tad šī izvēle jāpamato. Jāizmanto parasti lietojamās laboratorijas dzīvnieku līnijas. Katra dzimuma dzīvnieku svara atšķirības testa sākumā nedrīkst pārsniegt ± 20 % no attiecīgā vidējā lieluma.
1.6.2.2. Dzīvnieku skaits un dzimums
Katrā devas līmenī izmanto vismaz piecus dzīvniekus. Visiem jābūt viena dzimuma. Ja izmanto mātītes, tās nedrīkst būt iepriekš dzemdējušas vai grūsnas. Ja ir pieejama informācija, kas rāda, ka viens dzimums ir izteikti jutīgāks, devas ir jādod šā dzimuma dzīvniekiem.
Piezīme. Akūtās toksicitātes testā ar dzīvniekiem, kas ir augstāki par grauzējiem, ir jāapsver mazāka skaita izmantošana. Devas ir rūpīgi jāizvēlas, un jāpieliek visas pūles, lai nepārsniegtu vidēji toksiskas devas. Tādos testos ir jāizvairās dot testa vielu letālās devās.
1.6.2.3. Devu līmeņi
Jāizvēlas vairākas devas, vismaz trīs devas pietiekami plašā diapazonā, lai testa grupās būtu iespējams novērot atšķirīgu toksisko iedarbību un mirstību. Izvēloties devu līmeņus, jāņem vērā tas, ka vielas var būt kairinošas vai kodīgas. Jāiegūst pietiekami daudz datu, lai varētu noskaidrot iedarbības atkarību no devas un, ja iespējams, pienācīgi noteikt LD50.
1.6.2.4. Pieļaujamības tests
Pieļaujamības testu pie viena devas līmeņa, kas ir vismaz 2 000 mg/kg ķermeņa svara, var izdarīt piecu vīriešu dzimuma un piecu sieviešu dzimuma dzīvnieku grupai, izmantojot turpmāk aprakstīto procedūru. Ja rodas ar savienojumu saistīta mirstība, var būt jāapsver pilns pētījums.
1.6.2.5. Novērošanas laika posms
Dzīvniekus novēro vismaz 14 dienas. Tomēr novērošanas ilgumu var ietekmēt dažādi apstākļi. To nosaka novērotās toksiskās reakcijas, to iestāšanās ātrums un dzīvnieku atveseļošanās ilgums; tāpēc vajadzības gadījumā to var pagarināt. Svarīgi zināt brīdi, kad parādās un izzūd toksiskuma pazīmes, to ilgumu un brīdi, kurā iestājas nāve, jo īpaši tad, ja tā iestājas novēloti.
1.6.3. Procedūra
Katru dzīvnieku tur atsevišķā būrī. Testa vielu vienmērīgi uztriepj uz ādas, kuras platība veido apmēram 10 % no kopējās ķermeņa virsmas. Ja vielas ir ļoti toksiskas, apstrādājamo ādas platību var samazināt, bet tai jābūt pēc iespējas lielākai, un viela jāuztriepj, cik vien var plāni un vienmērīgi.
Testa vielas saskari ar ādu visā 24 stundu garajā iedarbības laikā nodrošina ar porainas marles pārsēju un nekairinošu plāksteri. Apstrādātā vieta pēc tam vēl jāpārklāj tā, lai nostiprinātu marles pārsēju ar testa vielu un lai dzīvnieki nevarētu to norīt. Lai testa viela nenonāktu barības vadā, var daļēji ierobežot dzīvnieku kustību, taču pilnīga imobilizācija nebūtu vēlama.
Beidzoties iedarbības laikam, testa vielas atlikumu, ja praktiski iespējams, noņem ar ūdeni vai kādu citu piemērotu ādas mazgāšanas līdzekli.
Jāveic regulāri novērojumi, un tie uzreiz jāprotokolē. Atsevišķi pieraksta datus par katru dzīvnieku. Pirmajā dienā novērošanu veic biežāk. Katru darbdienu vismaz vienreiz veic rūpīgu klīnisko izmeklēšanu, pārējos novērojumus veic ik dienas, pienācīgi gādājot par to, lai samazinātu izmēģinājumu dzīvnieku zudumus, piemēram, mirušos dzīvniekus secē vai ievieto ledusskapī, bet vārgus un mirstošus dzīvniekus nošķir vai nogalina.
Novērojot dzīvniekus, jāpievērš uzmanība izmaiņām, kas skar apmatojumu, apstrādāto ādu, acis un gļotādas, kā arī elpošanas orgānus, asinsriti, veģetatīvo un centrālo nervu sistēmu, somatomotoriku un uzvedības reakcijas. Īpaša vērība jāpievērš trīcei, konvulsijām, salivācijai, caurejai, letarģijai, miegam un komas stāvoklim. Nāves iestāšanās brīdi reģistrē, cik vien precīzi iespējams. Dzīvniekus, kas miruši testa laikā, secē; beidzoties testam, secē arī izdzīvojušos dzīvniekus. Reģistrē visas novērotās patoloģiskās izmaiņas. Vajadzības gadījumā ņem audu paraugus histopatoloģiskai izmeklēšanai.
Pēc pētījuma pabeigšanas ar vienu dzimumu vismaz vienai otra dzimuma piecu dzīvnieku grupai dod devu, lai noskaidrotu, vai šā dzimuma dzīvnieki nav izteikti jutīgāki pret testa vielu. Mazāka dzīvnieku skaita izmantošana var būt pamatota konkrētos apstākļos. Ja ir pieejama pietiekama informācija, lai parādītu, ka testētā dzimuma dzīvnieki ir izteikti jutīgāki, var iztikt bez otra dzimuma dzīvnieku testēšanas.
2. DATI
Dati jāapkopo tabulā, norādot dzīvnieku skaitu katrā grupā pirms testa, nāves iestāšanās brīdi katram dzīvniekam, to dzīvnieku skaitu, kuriem novērotas citas toksiskuma pazīmes, toksiskās iedarbības izpausmes un autopsijas rezultātus. Katra dzīvnieka svaru reģistrē īsi pirms testa vielas pielietošanas, pēc nedēļas un nāves iestāšanās brīdī; ja dzīvnieki izdzīvo ilgāk nekā vienu dienu, jāaprēķina un jāpieraksta svara izmaiņas. Dzīvniekus, kas ir humāni nogalināti ar savienojumu saistīto briesmu sajūtas un sāpju dēļ, reģistrē kā mirušus saistībā ar savienojumu. LD50 aprēķina pēc atzītas metodes.
Izvērtējot datus, jānoskaidro, vai pastāv korelācija starp testa vielas iedarbību un novēroto anomāliju biežumu un smagumu, ieskaitot uzvedības izmaiņas, klīniskās novirzes, makropatoloģiskās izmaiņas, ķermeņa svara svārstības, mirstību un pārējos toksikoloģiskos rādītājus.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šāda informācija:
— dzīvnieku suga, līnija, izcelsme, turēšanas un barošanas apstākļi, barība u. tml.,
— testa apstākļi (iekļaujot ādas notīrīšanas metodi un pārsējuma veidu – okluzīvs vai neokluzīvs),
— izmantotās devas (vajadzības gadījumā arī nesējs un koncentrācija),
— devu saņēmušo dzīvnieku dzimums,
— atbildes reakcijas datu tabula pēc dzimuma un devu līmeņa (t. i., testa laikā nobeigušos vai nogalināto dzīvnieku skaits; dzīvnieku skaits, kam parādās toksiskuma pazīmes; iedarbībai pakļauto dzīvnieku skaits),
— nāves brīdis pēc devas saņemšanas, dzīvnieku humānās nogalināšanas iemesli un kritēriji,
— visi novērojumi,
— LD50 lielums, kas noteikts pēc 14 dienām dzimumam, kam izdarīts pilns pētījums, un noteikšanas metode,
— LD50 95 % ticamības intervāls (ja var aprēķināt),
— devas/mirstības līkne un slīpuma koeficients (ja to ļauj noteikšanas metode),
— autopsijas konstatācijas,
— histopatoloģiskas konstatācijas,
— testa rezultāti ar otru dzimumu,
— rezultātu apspriešana (īpaša uzmanība jāpievērš tam, kāda ietekme dzīvnieku humānai nogalināšanai testa laikā varētu būt uz aprēķināto LD50 lielumu),
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļas D iedaļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļas E iedaļu.
B.4. AKŪTS TOKSISKUMS – KAIRINĀJUMS/KODĪGA IEDARBĪBA UZ ĀDU
1. METODE
Šī testēšanas metode ir līdzvērtīga ESAO 404. (2002) vadlīnijā noteiktai metodei.
1.1. IEVADS
Izstrādājot šo pilnveidoto metodi, īpaša vērība tika veltīta tās iespējamajiem uzlabojumiem, kas attiecas uz dzīvnieku labturību un visas esošās informācijas izvērtēšanu par testējamo vielu, lai neveiktu nevajadzīgus testus ar laboratorijas dzīvniekiem. Šajā metodē ietilpst arī ieteikums pirms vielas aprakstīto kodīgo/kairinošo īpašību pārbaudes in vivo testos par esošajiem atbilstīgajiem datiem veikt zinātnisko datu nozīmīguma analīzi. Ja esošie dati ir nepietiekami, tos var iegūt secīgā testēšanā (1). Testēšanas stratēģijā ietilpst validētu un vispārpieņemtu in vitro testu veikšana, un tā pievienota papildinājumam, kurā aprakstīta šī metode. Bez tam attiecīgā gadījumā ieteicams sākotnējā testa in vivo trīs daļas veikt nevis vienlaicīgi, bet secīgi.
Gan zinātniskās precizitātes dēļ, gan ņemot vērā dzīvnieku labturības apsvērumus, in vivo testus neveic, kamēr zinātnisko datu nozīmīguma analīzē nav izvērtēti visi pieejamie dati par vielas kodīgo/kairinošo iedarbību uz ādu. Šādi dati ir – ar cilvēkiem un/vai laboratorijas dzīvniekiem veiktajos pētījumos iegūtie zinātniskie dati, liecības par vienas vai vairāku struktūras ziņā līdzīgu vielu vai vielu maisījumu kodīgajām/kairinošajām īpašībām, dati, kas liecina, ka attiecīgajai vielai ir stipru skābju vai bāzu īpašības (2) (3), kā arī validētos un vispārpieņemtos in vitro vai ex vivo testos iegūti rezultāti (4) (5) (5.a). Šāda analīze samazina nepieciešamību veikt in vivo testus, nosakot kodīgās/kairinošās īpašības tādām vielām, par kurām citos pētījumos jau ir iegūts pietiekami daudz zinātnisku datu par šiem diviem galamērķiem.
Ieteicamā secīgā testēšanas stratēģija, pie kuras pieder validētu un vispārpieņemtu in vitro vai ex vivo izmēģinājumu veikšana kodīgo/kairinošo īpašību noteikšanai, ir pievienota šīs metodes papildinājumā. Šo stratēģiju izstrādājusi un vienprātīgi ieteikusi ESAO darba grupa (6), un tā pieņemta par ieteicamo testēšanas stratēģiju Vispārējā saskaņotā ķīmisko vielu klasifikācijas sistēma (VSS) (7). Šo stratēģiju ieteicams ievērot pirms in vivo testiem. Lai iegūtu zinātniski pamatotus datus par konkrētās vielas kodīgajām īpašībām/kairinošo iedarbību, testus ar jaunām vielām ieteicams veikt secīgos posmos. Attiecībā uz esošajām vielām, par kurām nav pietiekamu datu, kas raksturo to kodīgās/kairinošās īpašības, jāizmanto nepieciešamā stratēģija, kas vajadzīga, lai iegūtu trūkstošos datus. Ir jābūt pamatojumam par atšķirīgu testēšanas stratēģiju vai procedūru izmantošanu vai arī par lēmumu – neveikt testu secīgos posmos.
Ja kodīgās vai kairinošās īpašības nav iespējams noteikt zinātnisko datu nozīmīguma analīzē, ievērojot secīgās testēšanas stratēģiju, jāveic atbilstoši in vivo testi (skatīt papildinājumā).
1.2. DEFINĪCIJAS
Ādas kairinājums: ādas atgriezenisks bojājums, kas rodas pēc testējamās vielas aplicēšanas līdz četru stundas ilgā ekspozīcijas laikā.
Kodīga iedarbība uz ādu (ādas saēšana): ādas neatgriezenisku bojājumu radīšana, t. i., nekrozes novērošana caur epidermu un zemādā, kas rodas pēc testējamās vielas aplicēšanas līdz četru stundas ilgā ekspozīcijas laikā. Kodīgajai iedarbībai parasti raksturīgas čūlas, asiņošana, asiņainas kreveles un 14 dienu novērojumu perioda beigās atkrāsošanās ādas izbalēšanas dēļ, rodas zonas, kurās izkritis apmatojums un veidojas rētas. Lai novērtētu neskaidrus bojājumus, jāveic histopataloģiski izmeklējumi.
1.3. TESTA METODES PRINCIPS
Uz izmēģinājumu dzīvnieku ādas aplicē vienu devu testējamās vielas. Par kontroli izmanto tā paša izmēģinājumu dzīvnieka ādas neskartās daļas. Nosaka kairinājuma/kodīgās iedarbības pakāpi, ko atzīmē pēc noteiktiem intervāliem un iedarbības pilnīgai novērtēšanai apraksta sīkāk. Pētījumi jāveic tik ilgi, lai varētu novērtēt novērotās iedarbības atgriezeniskumu vai neatgriezeniskumu.
Visos testa posmos dzīvnieki, kuriem ilgstoši novēro stipru ciešanu un/vai sāpju pazīmes, ir humāni jānonāvē, un atbilstoši jānovērtē testējamās vielas iedarbība. Kritēriji, pēc kuriem pieņemami lēmumi par to dzīvnieku humānu nonāvēšanu, kuri iet bojā vai kuriem ir stipras ciešanas, atrodami literatūras sarakstā (8).
1.4. TESTA METODES APRAKSTS
1.4.1. Sagatavošana testiem in vivo
1.4.1.1. Dzīvnieku sugu izvēle
Piemērotākais dzīvnieks laboratorijas izmēģinājumiem ir albīnais trusis, tiem izmanto jaunus veselus pieaugušus dzīvniekus. Jābūt atbilstošam pamatojumam, ja izmanto citu sugu dzīvniekus.
1.4.1.2. Dzīvnieku sagatavošana
Apmēram 24 stundas pirms testa uzsākšanas dzīvniekiem muguras daļā no ķermeņa nocērp apmatojumu. Jāraugās, lai netiktu noberzta āda, un jāizmanto tikai tie dzīvnieki, kam ir vesela un nebojāta āda.
Dažām trušu līnijām ir bieži spalvu kušķi, kas zināmos gadalaikos kļūst biezāki. Šādas vietas, kur apmatojums uz ķermeņa ir ļoti blīvs, testēšanai izmantot nevar.
1.4.1.3. Turēšanas un barošanas nosacījumi
Dzīvnieki jātur atsevišķi. Telpā, kurā tur izmēģinājumu dzīvniekus, trušiem nepieciešama 20 oC (± 3 oC) temperatūra. Lai gan, izņemot telpu uzkopšanas laiku, relatīvajam mitrumam jābūt vismaz 30 % un vēlams ne vairāk kā 70 %, tas jāuztur 50–60 % robežās. Apgaismojumam jābūt mākslīgam, secība ir 12 stundas gaismas, 12 stundas tumsas. Var izmantot parasto laboratorijas barību ar neierobežotu piekļuvi dzeramajam ūdenim.
1.4.2. Testa procedūra
1.4.2.1. Testējamās vielas aplicēšana
Testējamo vielu uztriepj uz nelielas ādas virsmas platības (apmēram 6 cm2) un šo vietu pārklāj ar marles gabaliņu, ko piestiprina ar nekairinošu plāksteri. Gadījumos, kad tieša aplicēšana nav iespējama (piemēram, šķidrumiem vai daļai pastu), testējamo vielu vispirms pārnes uz marles tamponu, ar kuru pēc tam apstrādā ādu. Marlei jābūt ne pārāk ciešā saskarē ar ādu, ko panāk, iedarbības laikā izmantojot piemērotu puspiegulošu pārsēju. Ja testējamā viela pārnesta uz marles tampona, tas ādai jāpiestiprina tā, lai vielai ar ādu būtu laba saskare un tā visā laukumā būtu sadalīta vienmērīgi. Jāpanāk, lai dzīvnieki nevarētu aiztikt marli, tādējādi izslēdzot iespēju, ka pārbaudāmā viela nonāk barības vadā vai elpošanas ceļos.
Testējamās vielas, kas ir šķidrumi, parasti neatšķaida. Testējot cietvielas (kuras, ja uzskata par vajadzīgu, var saberzt pulverī), testējamā viela jāsamitrina ar ļoti nelielu daudzumu ūdens (vai vajadzības gadījumā citā piemērotā nesējā), kas ir pietiekams labas saskares nodrošināšanai ar ādu. Ja izmanto nevis ūdeni, bet citus nesējus, nesēja kairinošajai iedarbībai uz ādu, ja tāda ir, jābūt iespējami minimālai.
Iedarbības perioda beigās, kas parasti ir četras stundas, testējamās vielas atliekas no ādas noņem, ja iespējams, izmantojot ūdeni vai citu piemērotu šķīdinātāju, kas neietekmē izveidojušos atbildes reakciju uz vielu un nerada epidermas bojājumus.
1.4.2.2. Devas līmenis
Uz pārbaužu vietas aplicē 0,5 ml šķidruma vai 0,5 g cietvielas vai pastas.
1.4.2.3. Sākotnējs tests (In vivo ādas kairinājuma/kodīgās iedarbības tests, izmantojot vienu dzīvnieku)
Testi in vivo noteikti jāsāk ar vienu dzīvnieku, īpaši gadījumos, kad testējamā viela varētu būt kodīga. Tas atbilst secīgas testēšanas stratēģijai (skatīt 1. papildinājumu).
Ja, spriežot pēc zinātnisko datu nozīmīguma analīzes, viela ir kodīga, ar dzīvniekiem nav nepieciešams veikt papildu testus. Ar lielāko daļu vielu, kas varētu būt kodīgas, parasti papildu testi in vivo nav vajadzīgi. Tomēr tādos gadījumos, kad nepietiekamu zinātnisku datu dēļ tiek uzskatīts, ka ir jāiegūst papildu dati, ar dzīvniekiem veic ierobežota apjoma testus pēc turpmāk aprakstītās pieejas. Vienam dzīvniekam secīgi aplicē trīs marles tamponus ar testējamo vielu. Pirmo marles tamponu noņem pēc trim minūtēm. Ja netiek novērota nopietna ādas reakcija, uzliek otru marles tamponu, ko noņem pēc stundas. Ja novērojumi šajā testa posmā liecina, ka ir humāni iedarbības laiku pagarināt līdz četrām stundām, uzliek trešo tamponu, ko noņem pēc četrām stundām, un novērtē atbildes reakciju.
Ja kodīgā iedarbība tiek novērota pēc jebkuras no trijām secīgi veiktajām testējamās vielas iedarbībām, testus nekavējoties pārtrauc. Ja kodīgā iedarbība netiek konstatēta pēc pēdējā marles tampona noņemšanas, dzīvnieku novēro 14 dienas, ja kodīgā iedarbība neattīstās jau līdz šā termiņa beigām.
Gadījumos, kad testējamā viela nevarētu būt kodīga, bet tai iespējama kairinoša iedarbība, vienam dzīvniekam uz četrām stundām aplicē vienu marles tamponu.
1.4.2.4. Apstiprinājuma tests (In vivo ādas kairinājuma tests, izmantojot papildu dzīvniekus)
Ja sākotnējā testā kodīgums nav novērots, kairinošā iedarbība vai tās neesamība jāapstiprina izmēģinājumos ar diviem papildu dzīvniekiem, katram aplicējot vienu tamponu, kuru tur četras stundas. Ja kairinošā iedarbība novērota sākotnējā testā, apstiprinājuma testu var veikt secīgi vai arī abus dzīvniekus vienlaicīgi pakļaujot vielas iedarbībai. Izņēmuma gadījumā, kad sākotnējs tests netiek veikts, diviem vai trijiem dzīvniekiem aplicē vienu tamponu, ko noņem pēc četrām stundām. Ja, izmantojot divus dzīvniekus, to abu reakcijas uz vielas iedarbību ir vienādas, turpmāka testēšana nav nepieciešama. Ja tā nav, jāveic testi ar vēl vienu dzīvnieku. Neskaidru reakciju novērtēšanai var būt nepieciešami vairāki papildu dzīvnieki.
1.4.2.5. Novērošanas periods
Novērojumi jāveic pietiekami ilgi, lai pilnībā varētu novērtēt novērotās iedarbības atgriezeniskumu vai neatgriezeniskumu. Taču izmēģinājumi vienmēr jāpārtrauc uzreiz tad, ja dzīvniekiem parādās pastāvīgas smagu sāpju vai ciešanu pazīmes. Lai novērtētu iedarbības atgriezeniskumu, pēc tamponu noņemšanas dzīvnieki jānovēro līdz 14 dienām. Izmēģinājumus attiecīgi beidz drīzāk, ja iedarbības atgriezeniskumu konstatē pirms 14 dienu perioda beigām.
1.4.2.6. Klīniskie novērojumi un ādas reakciju klasificēšana
Visiem dzīvniekiem jāpārbauda eritēmas un tūskas veidošanās pazīmes un iedarbība 60 minūtes pēc marles tampona noņemšanas un turpmāk pēc 24, 48 un 72 stundām. Sākotnējā testā ar vienu dzīvnieku tūlīt pēc marles tampona noņemšanas apskata arī testēšanas vietu. Ādas reakcijas novērtē un reģistrē pēc turpmāk dotās klasifikācijas tabulas. Ja ir ādas bojājums, ko pēc 72 stundām nevar identificēt par kairinājumu vai kodīgas iedarbības rezultātu, iedarbības atgriezeniskuma noteikšanai novērojumi var būt jāturpina līdz 14. dienai. Papildus kairinājuma novērojumiem pilnībā jāraksturo un jāreģistrē arī visu veidu lokāla toksiska iedarbība, piemēram, ādas attaukošana un visu veidu sistēmiski kaitīga iedarbība (piemēram, ietekme uz toksiskuma klīniskajām pazīmēm un ķermeņa svara izmaiņām). Neskaidru reakciju noskaidrošanai var būt vajadzīgi histopatoloģiskie izmeklējumi.
Ādas reakciju klasifikācija ir neizbēgami subjektīva. Lai veicinātu ādas reakciju klasifikācijas saskaņošanu un palīdzētu testēšanas laboratorijām, novērojumu veicējiem un interpretētājiem, personālam, kas veic novērojumus, jābūt pietiekami apmācītam par izmantojamo klasifikācijas sistēmu (skatīt turpmāko tabulu). Var būt lietderīgi izmantot ilustrētus norādījumus par ādas kairinājuma un citu bojājumu klasifikāciju (9).
2. DATI
2.1. REZULTĀTU NOFORMĒŠANA
Pētījumu rezultāti jāapkopo tabulas veidā testēšanas galīgajā pārskatā, kurā jāiekļauj visi 3.1. iedaļā uzskaitītie jautājumi.
2.2. REZULTĀTU IZVĒRTĒŠANA
Ādas kairinājums punktos jānovērtē saistībā ar bojājumu raksturu un smagumu, to atgriezeniskumu vai neatgriezeniskumu. Konkrētie punkti nav uzskatāmi par vielas kairinošo īpašību absolūtu standartu, jo tiek novērtēta arī testējamā materiāla citu veidu iedarbība. Gluži otrādi, atsevišķie punkti uzskatāmi par standartvērtībām, kuras jānovērtē saistībā ar visiem citiem pētījumā veiktajiem novērojumiem.
Kairinošās iedarbības novērtējumā jāņem vērā ādas bojājumu atgriezeniskums. Ja līdz 14 dienu novērošanas perioda beigām saglabājas tādas reakcijas kā apmatojuma zaudējums (ierobežotā platībā), hiperkeratoze – ādas pārragošanās, hiperplāzija un plaisāšana, testējamā viela jāuzskata par kairinošu.
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jābūt iekļautai šādai informācijai.
Pamatojums testu veikšanai in vivo – iepriekš veiktajos testos iegūto zinātnisko datu nozīmīguma analīze, tostarp secīgajā testēšanas stratēģijā iegūto rezultātu analīze:
— atbilstošu iepriekš veiktajos testos iegūto datu apraksts,
— visos testēšanas stratēģijas posmos iegūtie dati,
— in vitro veikto testu apraksts, tostarp sīkas ziņas par izmantotajām procedūrām, rezultātiem, kas iegūti ar testējamajām vielām un standartvielām,
— in vivo pētījumam nepieciešamā zinātnisko datu nozīmīguma analīze.
Testējamā viela:
— identifikācijas dati, (piemēram, CAS numurs, avots, tīrība, zināmie piemaisījumi, partijas numurs),
— fizikālās un fizikāli ķīmiskās īpašības (piemēram, pH, gaistamība, šķīdība, stabilitāte),
— attiecībā uz maisījumiem to sastāvs un atsevišķo komponentu relatīvais īpatsvars.
Nesējs:
— identifikācija, koncentrācija (ja vajadzīgs), izmantotais tilpums,
— nesēja izvēles pamatojums.
Testa dzīvnieki:
— izmantotā suga/līnija, izvēles pamatojums gadījumos, kad neizmanto albīnos trušus,
— katra dzimuma dzīvnieku skaits,
— katra dzīvnieka svars testa sākumā un beigās,
— vecums izmēģinājumu sākumā,
— dzīvnieku izcelsme, turēšanas apstākļi, barība u. c.
Testa apstākļi:
— tampona pielikšanas vietas sagatavošanas paņēmiens,
— sīkas ziņas par tamponam izmantotajiem materiāliem un tampona uzlikšanas paņēmienu,
— sīkas ziņas par testējamās vielas sagatavošanu, aplicēšanu un noņemšanu.
Rezultāti:
— kairinošās/kodīgās iedarbības punktu tabulas veidā apkopoti dati par katru dzīvnieku visos novērojumu laikos,
— visu novēroto bojājumu apraksts,
— apraksts stāstījuma veidā par novēroto kairinošo iedarbību vai kodīgumu un histopatoloģiskajos izmeklējumos iegūtajiem datiem,
— papildu ādas kairinājumam vai kodīgajai iedarbībai citas nevēlamas vietējas (piemēram, ādas attaukošanas) vai sistēmiska rakstura iedarbības apraksts.
— Rezultātu izvērtējums.
4. IZMANTOTĀ LITERATŪRA
(1) Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, p. 410–429.
(2) Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicology In Vitro, 2, p. 19–26.
(3) Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M. (1998) Evaluation of the proposed OECD Testing Strategy for skin corrosion. ATLA 26, p. 709–720.
(4) ECETOC (1990) Monograph No 15, “Skin Irritation”, European Chemical Industry, Ecology and Toxicology Centre, Brussels.
(5) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, p. 483–524.
(5.a) Testing Method B.40 Skin Corrosion.
(6) OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22–24 January 1996 (http://www.oecd1.org/ehs/test/background.htm).
(7) OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28 th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd1.org/ehs/Class/HCL6.htm).
(8) OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No 19 (http://www.oecd1.org/ehs/test/monos.htm).
(9) EPA (1990). Atlas of Dermal Lesions, (20T-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, August 1990.
(Var saņemt, pieprasot no ESAO sekretariāta.)
I tabula
ĀDAS REAKCIJAS KLASIFICĒŠANA
Eritēmas un kreveļu veidošanās
|
Eritēmas nav … |
0 |
|
Ļoti viegla eritēma (tikko pamanāma) … |
1 |
|
Labi izteikta eritrēma … |
2 |
|
Mērena līdz smaga eritēma … |
3 |
|
Smaga eritrēma (liellopa gaļas sarkanums) ar kreveļu veidošanos, kas nedod eritrēmas klasifikācijas iespējas … |
4 |
Maksimāli iespējamie: 4
Tūskas veidošanās
|
Tūskas nav … |
0 |
|
Pavisam neliela tūska (tikko pamanāma) … |
1 |
|
Neliela tūska (skarto vietu var viegli noteikt pēc izteikta pietūkuma) … |
2 |
|
Mērena tūska (pietūkums apmēram 1 mm augstumā) … |
3 |
|
Smaga tūska (pietūkums vairāk nekā 1 mm un ir plašāks nekā iedarbības vieta) … |
4 |
Maksimāli iespējamie: 4
Neskaidru reakciju noskaidrošanai var būt vajadzīgi histopatoloģiskie izmeklējumi.
PAPILDINĀJUMS
Vielas ādas kairinājuma un kodīgās iedarbības secīgas testēšanas stratēģija
VISPĀRĪGI APSVĒRUMI
Ņemot vērā zinātniskās precizitātes un dzīvnieku labturības apsvērumus, ir jāizvairās veikt nevajadzīgus izmēģinājumus ar dzīvniekiem un iespējami jāsamazina tādi testi, kam varētu būt spēcīga iedarbība uz dzīvniekiem. Pirms veikt testus in vivo, jāizvērtē visa informācija, kas attiecas uz vielas iespējamo kodīgumu/kairinājumu, iedarbojoties uz ādu. Var būt, ka jau ir pietiekami pierādījumi, lai testējamo vielu klasificētu pēc tās izraisītā kodīguma vai kairinājuma, iedarbojoties uz ādu, neveicot testus ar laboratorijas dzīvniekiem. Tāpēc, izmantojot zinātnisko datu nozīmīguma analīzi un secīgas testēšanas stratēģiju, var samazināt vajadzību veikt testus in vivo, īpaši tad, ja vielai var būt ļoti spēcīgas reakcijas.
Ieteicams izmantot zinātnisko datu nozīmīguma analīzi esošās informācijas izvērtēšanai par vielu kairinošo un kodīgo iedarbību uz ādu, lai noteiktu, vai papildu pētījumiem uz ādas in vivo šādas iespējamās iedarbības raksturošanai nav jāveic vēl citi pētījumi. Ja vajadzīgi papildu pētījumi, attiecīgo eksperimentālo datu iegūšanai ieteicams izmantot secīgās testēšanas stratēģiju. Par vielām bez testēšanas vēstures to iespējamās kairinošās/kodīgās iedarbības novērtēšanai nepieciešamās datu kopas iegūšanai jāizmanto secīgās testēšanas stratēģija. Šajā papildinājumā aprakstītā testēšanas stratēģija izstrādāta ESAO darba grupā (1) un vēlāk apstiprināta un paplašināta Vispārīgajā saskaņotajā ķīmisko vielu integrētajā cilvēku veselības un vides bīstamības klasifikācijas sistēmā, kas akceptēta Ķīmisko vielu komitejas un Ķīmisko vielu darba grupas 28. kopīgajā sanāksmē 1998. gada novembrī (2).
Lai gan šī secīgās testēšanas stratēģija nav B.4. testēšanas metodes sastāvdaļa, tajā norādīta ieteicamā pieeja, kā nosakāmi raksturlielumi vielu kairinošās/kodīgās iedarbības uz ādu novērtēšanai. Šajā pieejā apkopota ādas kairinājuma/kodīgās iedarbības testēšanas in vivo laba prakse un ētiskie sliekšņi. Šajā testēšanas metodē sniegti norādījumi par testa in vivo veikšanu un apkopoti faktori, kas jāņem vērā pirms to uzsākšanas. Stratēģijā noteikta pieeja, kā izvērtējami esošie dati par testējamo vielu kairinošo/kodīgo iedarbību uz ādu, un daudzpakāpju pieeja, kādā iegūstami attiecīgie dati par vielām, par kurām vajadzīgi papildu pētījumi, vai par vielām, par kurām nav pētījumu. Tajā ir arī ieteikumi īpašos gadījumos veikt validētus un vispārpieņemtus in vitro vai ex vivo testus par kodīgo iedarbību uz ādu vai tās kairinājumu.
IZVĒRTĒŠANAS UN TESTĒŠANAS STRATĒĢIJAS APRAKSTS
Pirms veikt testus, kas ir secīgās testēšanas stratēģijas daļa (attēlā), jāizvērtē visa pieejamā informācija, lai noteiktu nepieciešamību veikt in vivo testus uz ādas. Lai gan būtisku informāciju var iegūt, izvērtējot atsevišķus rādītājus (piemēram, pH robežas), jāņem vērā viss esošās informācijas kopums. Izstrādājot lēmumu par zinātnisko datu nozīmīguma analīzi, jāizvērtē visi esošie dati par konkrēto vielu vai tās analogiem, kā arī jāsniedz lēmuma pieņemšanas pamatojums. Galvenais uzsvars jāliek uz esošajiem datiem par vielas iedarbību uz cilvēka organismu un uz dzīvniekiem un pēc tam uz in vitro un ex vivo testu rezultātiem. Ja iespējams, jāizvairās veikt kodīgu vielu pētījumus in vivo. Testēšanas stratēģijā ņem vērā šādus faktorus.
Esošo datu izvērtēšana par iedarbību uz cilvēka organismu un dzīvniekiem (1. posms). Esošie dati par iedarbību uz cilvēka organismu, piemēram, klīniskie pētījumi vai pētījumi par profesionālām slimībām un slimības vēsturēm, un/vai dati par testiem ar dzīvniekiem, piemēram, toksiskuma pētījumi par vienreizējas vai atkārtotas devas iedarbību uz ādu ir jāizvērtē vispirms, jo tie var sniegt informāciju, kas tieši saistīta ar iedarbību uz ādu. Vielas ar noskaidrotu kairinošu iedarbību vai kodīgumu, kā arī vielas, par kurām ir skaidras liecības, ka tās nav ne kairinošas, ne kodīgas, nav jātestē in vivo pētījumos.
Struktūras aktivitātes savstarpējās saistības analīze (SSA) (2. posms). Jāņem vērā struktūras ziņā līdzīgu vielu testu rezultāti, ja tie ir pieejami. Ja ir pietiekami daudz pētījumos ar cilvēkiem un/vai dzīvniekiem iegūtu datu par struktūras ziņā līdzīgu vielu vai to maisījumu kodīgo/kairinošo iedarbību uz ādu, var pieņemt, ka uz novērtējamās testējamās vielas iedarbību būs tādas pašas atbildes reakcijas. Šādos gadījumos var neveikt testus ar testējamo vielu. Negatīvi dati par struktūras ziņā saistītu vielu vai to maisījumu iedarbību nav pietiekami zinātniskie dati par to, ka arī viela, ko pārbauda pēc secīgās testēšanas stratēģijas, nebūs kodīga vai tai nebūs kairinošas iedarbības. Lai identificētu iespējamo kodīgumu vai kairinošo iedarbību, jāizmanto validēta un vispārpieņemta pieeja struktūras un aktivitātes savstarpējās saistības analīzei (SSA).
Fizikāli ķīmiskās īpašības un ķīmiskā reaģētspēja (3. posms). Vielām ar ļoti augstu vai zemu pH vērtību, piemēram, ≤ 2,0 un ≥ 11,5, var būt stipra vietēja iedarbība. Ja viela, pamatojoties uz ekstrēmu pH vērtību, ir identificēta kā kodīga, iedarbojoties uz ādu, var ņemt arī vērā tās skābuma/bāziskuma rezervi (vai buferspēju) (3) (4). Ja buferspēja liecina, ka viela varētu nebūt kodīga, iedarbojoties uz ādu, jāveic papildu testēšana, lai to apstiprinātu, vēlams izmantojot validētu un vispārpieņemtu testēšanas metodi in vitro vai ex vivo testu (skatīt 5. un 6. posmu).
Toksiskums saskarē ar ādu (4. posms). Ja pierādīts, ka viela ir ļoti toksiska, tai uzsūcoties caur ādu, veikt ādas kairinājuma/kodīgās iedarbības pētījumus in vivo var būt praktiski neiespējami, jo parasti aplicējamais vielas daudzums var pārsniegt ļoti toksiskas iedarbības devu, tādējādi izraisot dzīvnieku bojāeju vai tiem radot smagas ciešanas. Bez tam, ja toksiskums saskarē ar ādu jau ir noteikts līdz 2 000 mg/kg, kas ir pieļaujamais devas līmeņa daudzums uz ķermeņa svaru, vai augstākām devām, izmantojot albīnos trušus, un ādas kairinājums vai kodīga iedarbība uz ādu nav novērota, nav vajadzības veikt papildu testus ādas kairinājuma/kodīgās iedarbības noteikšanai. Novērtējot iepriekš veiktajos pētījumos noteikto akūto toksisko iedarbību saskarē ar ādu, ir jāņem vērā vairāki apsvērumi. Piemēram, publicētā informācija par ādas bojājumiem var būt nepilnīga. Testi un novērojumi var būt veikti nevis ar trušiem, bet citiem dzīvniekiem, un dažādu sugu atbildes reakciju jutība var būt ievērojami atšķirīga. Var būt arī, ka dzīvniekiem aplicētā testējamās vielas forma nav bijusi piemērota ādas kairinājuma/kodīgās iedarbības novērtēšanai (piemēram, atšķaidījums, nosakot toksiskumu saskarē ar ādu) (5). Tomēr gadījumos, kad ar trušiem veikti pareizi plānoti un pienācīgi veikti pētījumi toksiskuma noteikšanai saskarē ar ādu, tajos iegūtos negatīvos rezultātus var uzskatīt par pietiekamiem zinātniskiem datiem, ka vielai nav kodīgas vai kairinošas iedarbības uz ādu.
Testos in vitro vai ex vivo iegūtie rezultāti (5. un 6. posms). Testos ar dzīvniekiem nav jāpārbauda vielas, kurām validētos un vispārpieņemtos in vitro vai ex vivo testos konstatēta kodīga vai spēcīga kairinoša iedarbība (6) (7), un tie īpaši veikti šādas iedarbības novērtēšanai. Var uzskatīt, ka šādām vielām būs līdzvērtīga veida spēcīga iedarbība arī in vivo.
Testi ar trušiem in vivo (7. un 8. posms). Ja pēc zinātnisko datu nozīmīguma analīzes tiek pieņemts lēmums veikt testus in vivo, tie jāsāk ar sākotnēju testu, kam izmanto vienu dzīvnieku. Ja tā rezultāti liecina, ka vielai ir kodīga iedarbība uz ādu, tās testēšana nav jāturpina. Ja sākotnējā testā kodīgums nav novērots, kairinošā iedarbība vai tās neesamība jāapstiprina testos ar diviem papildu dzīvniekiem četras stundas ilgā iedarbībā. Ja kairinošā iedarbība novērota sākotnējā testā, apstiprinājuma testu var veikt secīgā veidā vai arī abus dzīvniekus vielas iedarbībai pakļaujot vienlaicīgi.
IZMANTOTĀ LITERATŪRA
(1) OECD (1996). Test Guidelines Programme: Final Report on the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held on Solna, Sweden, 22–24 January 1996 (http://www1.oecd.org/ehs/test/background.htm).
(2) OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm).
(3) Worth, A.P., Fentem J.H., Balls M., Botham P.A., Curren R.D., Earl L.K., Esdaile D.J., Liebsch M. (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, p. 709–720.
(4) Young, J.R., How, M.J., Walker, A.P., Worth, W.M.H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing on Animals. Toxicology In Vitro, 2 (1) p. 19–26.
(5) Patil, S.M., Patrick, E., Maibach, H.I. (1996) Animal, Human, and In Vitro Test Methods for Predicting Skin Irritation, in: Francis N. Marzulli and Howard I. Maibach (editors): Dermatotoxicology. Fifth Edition ISBN 1-56032-356-6, Chapter 31, p. 411–436.
(6) Testing Method B.40.
(7) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, p. 483–524.
Attēls
ĀDAS KAIRINĀJUMA/KODĪGĀS IEDARBĪBAS UZ ĀDU TESTĒŠANAS UN NOVĒRTĒŠAS STRATĒĢIJA

B.5. AKŪTS TOKSISKUMS – KAIRINĀJUMS/KODĪGA IEDARBĪBA UZ ACĪM
1. METODE
Šī testēšanas metode ir līdzvērtīga ESAO 405. (2002) vadlīnijā noteiktajai metodei.
1.1. IEVADS
Izstrādājot šo pilnveidoto metodi, īpaša vērība tika veltīta tās iespējamajiem uzlabojumiem, izvērtējot visu esošo informāciju par testējamo vielu, lai nav jāveic nevajadzīgi testi ar laboratorijas dzīvniekiem un tādējādi ievērotu dzīvnieku labturības prasības. Šajā metodē ietilpst arī ieteikums par zinātnisko datu nozīmīguma analīzes (1) veikšanu saistībā ar esošajiem atbilstošajiem datiem pirms aprakstīto vielas kodīgo/kairinošo īpašību pārbaudes in vivo testos. Ja esošie dati ir pietiekami, tos var iegūt secīgā testēšanā (2) (3). Testēšanas stratēģijā ietilpst validētu un vispārpieņemtu in vitro testu veikšana, un tā pievienota papildinājumam, kurā ir noteikta testa metode. Bez tam, pirms veikt in vivo testus kodīgās iedarbības testēšanai uz acīm, šādas iedarbības prognozēšanai ieteicams veikt in vivo testus kairinošās kodīgās iedarbības noteikšanai uz ādu.
Gan zinātniskās precizitātes dēļ, gan ņemot vērā dzīvnieku labturības apsvērumus, in vivo testi nav jāveic, kamēr zinātnisko datu nozīmīguma analīzē nav izvērtēti visi pieejamie atbilstošie dati par vielas iespējamo kodīgo/kairinošo iedarbību uz acīm. Tie ir – ar cilvēkiem un/vai laboratorijas dzīvniekiem veiktajos pētījumos iegūtie dati, liecības par vienas vai vairāku struktūras ziņā saistītu vielu vai vielu maisījumu kodīgajām/kairinošajām īpašībām, dati, kas liecina, ka attiecīgajai vielai ir stipru skābju vai bāzu īpašības (4) (5), kā arī validētos un vispārpieņemtos in vitro vai ex vivo testos iegūti rezultāti par kodīgo un kairinošo iedarbību uz ādu (6) (6.a). Pētījumus var veikt pirms zinātnisko datu nozīmīguma analīzes vai pēc tās.
Par dažām vielām šāda analīze var norādīt uz vajadzību veikt in vivo pētījumus par to kodīgumu/kairinošajām īpašībām, iedarbojoties uz acīm. Visos šādos gadījumos, pirms pieņemt lēmumu veikt iedarbības testus uz acīm in vivo, ieteicams vispirms veikt pētījumus in vivo attiecīgās vielas iedarbībai saskarē ar ādu un tos izvērtēt saskaņā ar B.4. testa metodi (7). Izmantojot zinātnisko datu nozīmības analīzi un secīgas testēšanas stratēģiju, samazinās vajadzība veikt in vivo testus to vielu kodīgās/kairinošās iedarbības noskaidrošanai uz acīm, par kurām citos pētījumos iegūti pietiekami zinātniskie dati. Ja kodīgo vai kairinošo iedarbību uz acīm nevar noteikt, drīkst veikt izmēģinājumus in vivo kodīgās/kairinošās iedarbības noteikšanai uz acīm, izmantojot secīgas testēšanas stratēģiju pat pēc tam, kad jau ir veikti izmēģinājumi in vivo tās kodīgās un kairinošās iedarbības noteikšanai uz ādu.
Ieteicamā secīgā testēšanas stratēģija, pie kuras pieder validētu un vispārpieņemtu in vitro vai ex vivo testu veikšana kodīgo/kairinošo īpašību noteikšanai, ir pievienota papildinājumā, kurā ir šī testa metode. Šo stratēģiju izstrādājusi un vienprātīgi ieteikusi ESAO darba grupa (8), un tā pieņemta par ieteicamo stratēģiju Vispārīgā saskaņotā ķīmisko vielu klasifikācijas sistēmā (VSS) (9). Šo stratēģiju ieteicams ievērot pirms in vivo testiem. Lai iegūtu zinātniski pamatotus datus par konkrētās vielas kodīgajām īpašībām/kairinošo iedarbību, testus ar jaunām vielām ieteicams veikt secīgos posmos. Jāizmanto nepieciešamā stratēģija trūkstošo datu iegūšanai par esošajām vielām, par kurām nav pietiekamu datu, kas raksturo to kodīgās/kairinošās īpašības. Jābūt pamatojumam par lēmumu, kas attiecas uz atšķirīgu testēšanas stratēģiju vai procedūru izmantošanu vai arī par lēmumu neveikt testu secīgos posmos.
1.2. DEFINĪCIJAS
Acu kairinājums: izmaiņas acī, kas rodas pēc testējamās vielas aplikācijas uz acs ābola priekšējās virsmas un ir pilnīgi atgriezeniskas 21 dienas laikā pēc aplikācijas.
Kodīga iedarbība uz acīm: acs ābola audu bojājums vai nopietni fiziski redzes bojājumi, kas rodas pēc testējamās vielas aplikācijas uz acs ābola priekšējās virsmas un nav pilnīgi atgriezeniski 21 dienas laikā pēc aplikācijas.
1.3. TESTA METODES PRINCIPS
Uz izmēģinājuma dzīvnieka vienas acs ābola aplicē vienu devu testējamās vielas; otru aci izmanto kontroles nolūkos. Kairinājumu/kodīgo iedarbību uz aci novērtē pēc konjunktīvas, radzenes un varavīksnenes bojājumu pakāpes noteiktos laika intervālos. Lai iedarbību novērtētu pilnīgi, apraksta arī citu veidu iedarbību uz aci, kā ar kaitīgu sistēmisku iedarbību. Pētījumi jāveic tik ilgi, lai varētu novērtēt novērotās iedarbības atgriezeniskumu vai neatgriezeniskumu.
Visos testu posmos dzīvnieki, kuriem ilgstoši novēro stipru ciešanu un/vai sāpju pazīmes, ir humāni jānonāvē, un atbilstoši jānovērtē testējamās vielas iedarbība. Kritēriji, pēc kuriem pieņemami lēmumi par to dzīvnieku humānu nonāvēšanu, kuri iet bojā vai kuriem ir stipras ciešanas, atrodami literatūras sarakstā (10).
1.4. TESTA METODES APRAKSTS
1.4.1. Sagatavošana testiem in vivo
1.4.1.1. Dzīvnieku sugu izvēle
Piemērotākais dzīvnieks laboratorijas izmēģinājumiem ir albīnais trusis, tiem izmanto jaunus veselus pieaugušus dzīvniekus. Jābūt atbilstošam pamatojumam, ja izmanto citu sugu vai līniju dzīvniekus.
1.4.1.2. Dzīvnieku sagatavošana
Katram iepriekš atlasītam testa dzīvniekam 24 stundas pirms testa pārbauda abas acis. Dzīvnieki ar acu iekaisumu, okulārajiem defektiem vai radzenes bojājumiem nav izmantojami.
1.4.1.3. Turēšanas un barošanas nosacījumi
Dzīvnieki jātur atsevišķi. Telpā, kurā tur izmēģinājumu dzīvniekus, trušiem nepieciešama 20 oC (± 3 oC) temperatūra. Lai gan, izņemot telpu uzkopšanas laiku, relatīvajam mitrumam jābūt vismaz 30 % un vēlams ne vairāk kā 70 %, tas jāuztur 50–60 % robežās. Apgaismojumam jābūt mākslīgam, secība ir 12 stundas gaismas, 12 stundas tumsas. Var izmantot parasto laboratorijas barību ar neierobežotu piekļuvi dzeramajam ūdenim.
1.4.2. Testa metode
1.4.2.1. Testējamās vielas aplicēšana
Testējamo vielu katram dzīvniekam ievada acs konjunktīvas maisiņā, pirms tam viegli pavelkot apakšējo plakstiņu nost no acs ābola. Pēc tam plakstiņus apmēram vienu sekundi viegli tur kopā, lai viela neizplūstu. Otrā acs paliek neapstrādāta, un to izmanto kontroles nolūkos.
1.4.2.2. Skalošana
Testa dzīvniekiem acis nedrīkst skalot vismaz 24 stundas pēc testējamās vielas ievadīšanas, izņemot gadījumus, kad ievada cietvielas (skatīt 1.4.2.3.2. punktu), kā arī tad, kad novērojama tūlītēja kairinoša vai kodīga iedarbība. Vajadzības gadījumā pēc 24 stundām acis var izskalot.
Izņemot gadījumus, kad tas ir zinātniski pamatoti, nav ieteicams veikt pētījumus ar otru dzīvnieku grupu, lai noskaidrotu skalošanas ietekmi. Ja ir vajadzīga otra dzīvnieku grupa, tai jāizmanto divi truši. Precīzi jādokumentē skalošanas apstākļi, piemēram, skalošanas laiks; skalojamā šķīduma sastāvs un temperatūra; tās ilgums, apjoms un ātrums.
1.4.2.3. Devas līmenis
1.4.2.3.1. Šķidrumu testēšana
Šķidrumu testēšanai izmanto 0,1 ml devu. Vielas ievadīšanai tieši acī nedrīkst izmantot smidzinātājus. Pirms iepilināt acī 0,1 ml šķidra aerosola, tas vispirms jāizsmidzina un jāsavāc tvertnē.
1.4.2.3.2. Cietvielu testēšana
Testējot cietvielas, pastas un vielas daļiņu veidā, izmantojamajam daudzumam jābūt 0,1 ml tilpumam vai ne vairāk kā 100 mg. Testējamais materiāls jāsaberž smalkā pulverī. Cietu vielu tilpums jāmēra pēc to vieglas sablīvēšanas, piemēram, mērtvertnē sakratot. Ja testējamā cietviela nav izvadīta no testa dzīvnieka acs ar fizioloģiskiem mehānismiem līdz pirmajam novērojumu termiņam vienu stundu pēc ievadīšanas, aci var izskalot ar sālsūdeni vai destilētu ūdeni.
1.4.2.3.3. Aerosolu testēšana
Ieteicams pirms iepilināšanas acī visus ar sūkni vai propellentu izsmidzināmos aerosolus vispirms izsmidzināt un savākt tvertnē. Vienīgais izņēmums ir vielas aerosola balonā, kuras nav iespējams savākt tvertnē iztvaikošanas dēļ. Šādos gadījumos acs jātur atvērta un testējamā viela jāievada acī, to izsmidzinot apmēram vienu sekundi no 10 cm attāluma tieši uz acs ābola. Attālumu var mainīt atkarībā no spiediena aerosola balonā un tā satura. Jāraugās, lai neradītu acs bojājumu no aerosola balona spiediena. Atsevišķos gadījumos var būt vajadzīgs novērtēt acs iespējamos “mehāniskos” bojājumus no aerosola balona spiediena spēka.
Ar aerosola balonu ievadīto devu var noteikt, testu imitējot šādi – vielu izsmidzina uz nosvērta papīra gabala, uz kura novietots ekrāns ar truša acs lieluma atveri. Papīra masas palielinājumu izmanto acī iesmidzinātās devas aptuvenai noteikšanai. Gaistošām vielām devu var noteikt, uztvērēja tvertni nosverot pirms un pēc testējamās vielas izņemšanas.
1.4.2.4. Sākotnējs tests (in vivo acu kairinājuma/kodīgās iedarbības tests, izmantojot vienu dzīvnieku)
Kā skaidri noteikts secīgās testēšanas stratēģijā (skatīt 1. papildinājumu), in vivo testi jāsāk, izmantojot vienu dzīvnieku.
Ja pēc iepriekš aprakstītās procedūras iegūtie testa rezultāti liecina, ka vielai ir kodīga vai stipri kairinoša iedarbība uz acīm, turpmāko acs kairinājuma testēšanu neveic.
1.4.2.5. Vietējā anestēzija
Pēc vajadzības katrā atsevišķā gadījumā var lietot vietējo anestēziju. Ja zinātnisko datu nozīmīguma analīze liecina, ka vielas iedarbība var radīt sāpes, vai arī sākotnējā testā noskaidrojas, ka rodas sāpju reakcija, pirms testējamās vielas iepilināšanas var lietot vietējo anestēziju. Rūpīgi jāizraugās vietējās anestēzijas veids, koncentrācija un deva tā, lai nodrošinātu, ka no tās lietošanas nerodas reakcijas atšķirības uz testējamās vielas iedarbību. Tāda pati anestēzija jādod acij, ko izmanto kontroles nolūkos.
1.4.2.6. Apstiprinājuma tests (in vivo ādas kairinājuma tests, izmantojot papildu dzīvniekus)
Ja kodīga iedarbība nav novērota sākotnējā testā, kairinošā iedarbība vai tās neesamība jāapstiprina testos ar vienu vai diviem papildu dzīvniekiem. Ja sākotnējā testā novērota stipri kairinoša iedarbība, kas norāda uz iespējamu stipru (neatgriezenisku) iedarbību apstiprināšanas testā, apstiprinošo testu ieteicams veikt secīgi, vienā reizē izmantojot vienu dzīvnieku, nevis pakļaut vielas iedarbībai abus papildu dzīvniekus vienlaicīgi. Ja otrajam dzīvniekam konstatē kodīgu vai stipri kairinošu iedarbību, tests nav jāturpina. Papildu dzīvnieki var būt vajadzīgi vājas vai mēreni kairinošas iedarbības apstiprināšanai.
1.4.2.7. Novērošanas periods
Novērojumi jāveic pietiekami ilgi, lai varētu pilnīgi novērtēt novērotās iedarbības lielumu, atgriezeniskumu vai neatgriezeniskumu. Taču izmēģinājumi vienmēr uzreiz jāpārtrauc tad, ja dzīvniekiem parādās pastāvīgas smagu sāpju vai ciešanu pazīmes (9). Lai noteiktu iedarbības atgriezeniskumu, dzīvnieki parasti jānovēro 21 dienu pēc testējamās vielas ievadīšanas. Izmēģinājumus attiecīgi beidz drīzāk, ja iedarbības atgriezeniskumu konstatē pirms 21 dienas perioda beigām.
1.4.2.7.1. Klīniskie novērojumi un acs reakciju klasificēšana
Acis jāpārbauda 1, 24, 48 un 72 stundas pēc testējamās vielas aplicēšanas. Dzīvnieki testā nav jātur ilgāk par galīgas informācijas iegūšanai vajadzīgo laiku. Dzīvniekus ar ilgstošām smagu sāpju vai ciešanu pazīmēm nekavējoties humāni nonāvē un attiecīgi novērtē testējamo vielu. Humāni nonāvē dzīvniekus, kuriem pēc vielas iepilināšanas rodas šādi acs bojājumi – radzenes perforācija vai radzenes ievērojama čūla, tostarp stafiloma; asinis acs ābola priekšējā kamerā; 4. pakāpes radzenes aptumšošanās, kas saglabājas 48 stundas; nav refleksa uz gaismu (2. pakāpes varavīksnenes reakcija) ilgāk nekā 72 stundas; konjunktīvas plēves čūla; konjunktīvas vai mirkšķināšanas membrānas nekroze; vai noslīdēšana. Tā rīkojas tāpēc, ka šādi bojājumi parasti ir neatgriezeniski.
Dzīvniekus, kuriem neveidojas acs bojājumi, var nonāvēt ne ātrāk kā trīs dienas pēc vielas iepilināšanas. Dzīvnieki ar viegliem līdz mēreniem bojājumiem jānovēro, līdz bojājumi beidzas vai 21 dienu, kad pētījumus izbeidz. Novērojumi jāveic pēc 7, 14 un 21 dienas, lai novērtētu bojājumu stāvokli un to atgriezeniskumu vai neatgriezeniskumu.
Acs (konjunktīvas, radzenes, varavīksnenes) reakcijas pakāpes reģistrē visos novērojumos (I tabula). Reģistrē arī visus citus acs bojājumus (piemēram, radzenes apduļķošanos, krāsošanos) un kaitīgu sistēmisku iedarbību.
Novēroto reakciju novērošanai var izmantot binokulāro lupu, pārnēsājamu spraugas lampu, bioloģisko mikroskopu vai citas piemērotas ierīces. Kad reģistrēti novērojumi pēc 24 stundām, turpmākām acu pārbaudēm var izmantot fluoresceīnu.
Acs reakciju klasifikācija ir neizbēgami subjektīva. Lai veicinātu acu reakciju klasifikācijas saskaņošanu un palīdzētu testēšanas laboratorijām, kā arī novērojumu veicējiem un interpretētājiem, personālam, kas veic novērojumus, jābūt pietiekami apmācītiem par izmantojamo klasifikācijas sistēmu.
2. DATI
2.2. REZULTĀTU IZVĒRTĒŠANA
Acu kairinājums jānovērtē saistībā ar bojājumu raksturu un smagumu, to atgriezeniskumu vai neatgriezeniskumu. Konkrētie punkti nav uzskatāmi par vielas kairinošo īpašību absolūtu standartu, jo tiek novērtēta arī testējamā materiāla citu veidu iedarbība. Tāpēc atsevišķie punkti jāuzskata par standartvērtībām un tiem ir nozīme tikai tad, ja tiek pamatoti ar pilnīgiem aprakstiem un visu novērojumu izvērtējumu.
3. PĀRSKATS
3.1. TESTA PĀRSKATS
Testēšanas pārskatā jābūt šādai informācijai. Testa veikšanas in vivo pamatojums:
iepriekš veikto testu rezultātu zinātnisko datu nozīmīguma analīze, tostarp pēc secīgās testēšanas stratēģijas iegūto rezultātu,
— atbilstošu iepriekš veiktajos testos iegūto datu apraksts,
— visos testēšanas stratēģijas posmos iegūtie dati,
— in vitro veikto testu apraksts, tostarp sīkas ziņas par izmantotajām procedūrām, rezultātiem, kas iegūti ar testējamajām un standartvielām,
— veikto in vivo ādas kairinājuma/kodīgās iedarbības pētījumu apraksti, tostarp iegūtie rezultāti,
— in vivo pētījumam nepieciešamā zinātnisko datu nozīmīguma analīze.
Testējamā viela:
— identifikācijas dati (piemēram, CAS numurs, avots, tīrība, zināmie piemaisījumi, partijas numurs),
— fizikālās un fizikāli ķīmiskās īpašības (piemēram, pH, gaistamība, šķīdība, stabilitāte, reaģētspēja ar ūdeni),
— maisījumiem – sastāvs un atsevišķo komponentu relatīvais īpatsvars,
— ja izmantota vietējā anestēzija, tās identifikācija, tīrība, veids, deva un iespējamā mijiedarbība ar testējamo vielu.
Nesējs:
— identifikācija, koncentrācija (ja vajadzīgs), izmantotais tilpums,
— nesēja izvēles pamatojums.
Testa dzīvnieki:
— izmantotā suga/līnija, izvēles pamatojums gadījumos, kad neizmanto albīnos trušus,
— katra dzīvnieka vecums pētījuma sākumā,
— katra dzimuma dzīvnieku skaits testa un kontroles grupās (ja vajadzīgs),
— katra dzīvnieka svars testa sākumā un beigās,
— izcelsme, turēšanas apstākļi, barība u. c.
Rezultāti:
— visos novērojumu termiņos kairinājuma novērtēšanai izmantoto metožu apraksts (piemēram, pārnēsājamā spraugas lampa, bioloģiskais mikroskops, fluoresceīns),
— tabulā apkopoti kairinošās/kodīgās iedarbības dati par katru dzīvnieku visos novērošanas termiņos līdz testa pārtraukšanai ar to,
— novērotās kairinošās vai kodīgās iedarbības pakāpes un rakstura apraksts,
— citu novēroto acs bojājumu apraksts (piemēram, vaskularizācija, radzenes saduļķošanās, saaugumu, rētaudu veidošanās, krāsojums),
— ar aci nesaistīta kaitīga vietēja vai sistēmiska iedarbība un histopatoloģisko izmeklējumu rezultāti, ja tie veikti.
Rezultātu apspriešana.
3.2. REZULTĀTU INTERPRETĀCIJA
Ar dzīvniekiem iegūtu acu kairinājuma pētījumu rezultātu ekstrapolācijas iespējas uz cilvēkiem ir derīgas tikai līdz zināmai pakāpei. Daudzos gadījumos albīnie truši pret acīm kodīgām vai kairinošām vielām ir jutīgāki nekā cilvēki.
Interpretējot rezultātus, jāraugās, lai tiktu izslēgts kairinājums, ko rada sekundāra infekcija.
4. IZMANTOTĀ LITERATŪRA
(1) Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, p. 410–429.
(2) De Silva, O., Cottin, M., Dami, N., Roguet, R., Catroux, P., Toufic, A., Sicard, C., Dossou, K.G., Gerner, I., Schlede, E., Spielmann, H., Gupta, K.C., Hill, R.N. (1997) Evaluation of Eye Irritation Potential: Statistical Analysis and Tier Testing Strategies. Food Chem. Toxicol 35, p. 159–164.
(3) Worth A.P. and Fentem J.H. (1999) A general approach for evaluating stepwise testing strategies ATLA 27, p. 161–177.
(4) Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicology In Vitro, 2, p. 19–26.
(5) Neun, D.J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, p. 227–231.
(6) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, p. 483–524.
(6.a) Testing Method B.40 Skin Corrosion.
(7) Testing method B.4. Acute toxicity: dermal irritation/corrosion.
(8) OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22–24 January 1996 (http://www.oecd.org/ehs/test/background.htm).
(9) OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm).
(10) OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No 19 (http://www.oecd.org/ehs/test/monos.htm).
I tabula
ACS BOJĀJUMU KLASIFIKĀCIJA
Radzene
Duļķošanās – blīvuma pakāpe (nolasījumi jāveic visblīvākajā zonā) ( 15 )
|
Nav novērota čūlu veidošanās vai duļķošanās … |
0 |
|
Izkaisītas vai difūzas duļķošanās zonas (izņemot normāla spīduma vieglu blāvumu); labi redzamas varavīksnenes daļas … |
1 |
|
Labi izšķirama caurspīdīgā daļa; varavīksnenes daļas redzamas nedaudz neskaidri … |
2 |
|
Perlamutra zona; varavīksnenes daļas redzamas; acs zīlītes izmērs tikko redzams … |
3 |
|
Radzene necaurredzama; cauri duļķojumam varavīksnene nav samanāma … |
4 |
Maksimāli iespējamie – 4
PIEZĪMES
Varavīksnene
|
Norma … |
0 |
|
Krokas redzami padziļinātas, hiperēmija, pietūkums, mērena radzenes hiperēmija vai asinsizplūdums; varavīksnene reaģē uz gaismu (par reakciju uzskata arī vāju vai lēnu reakciju) … |
1 |
|
Asiņošana, vispārējs bojājums vai nav reakcijas uz gaismu … |
2 |
Maksimāli iespējamie – 2
Konjunktīva
Apsārtums (attiecas uz plakstiņu un acs ābola konjunktīvu; izņemot radzeni un varavīksneni)
|
Norma … |
0 |
|
Daži asinsvadi izteikti hiperēmiski (piepildīti) … |
1 |
|
Difūza, tumšsarkana krāsa; atsevišķie asinsvadi grūti izšķirami … |
2 |
|
Difūza tumši sarkana liellopu gaļas krāsa … |
3 |
Maksimāli iespējamie – 3
Hemoze
Pietūkums (attiecas uz plakstiņiem un/vai mirkšķināšanas membrānām)
|
Norma … |
0 |
|
Neliels pietūkums virs normas … |
1 |
|
Acīm redzams pietūkums ar plakstiņu daļēju izgriešanos … |
2 |
|
Pietūkums, plakstiņi gandrīz pusaizvērti … |
3 |
|
Pietūkums, plakstiņi vairāk nekā pusaizvērti … |
4 |
Maksimāli iespējamie – 4
PAPILDINĀJUMS
Vielas acu kairinājuma un kodīgās iedarbības secīgas testēšanas stratēģija
VISPĀRĪGI APSVĒRUMI
Ņemot vērā zinātniskās precizitātes un dzīvnieku labturības apsvērumus, ir svarīgi izvairīties no testiem ar dzīvniekiem, kas nav vajadzīgi, un iespējami jāsamazina testi, kam varētu būt spēcīga iedarbība uz dzīvniekiem. Jāizvērtē visa informācija, kas attiecas uz tās iespējamo kodīgumu/kairinājumu, iedarbojoties uz acīm, pirms testēšanas in vivo. Var būt, ka jau ir pietiekami zinātniskie dati, kas vajadzīgi, lai testējamo vielu klasificētu pēc tās izraisītās kairinošās vai kodīgās iedarbības uz acīm, neveicot testus ar laboratorijas dzīvniekiem. Tāpēc, izmantojot zinātnisko datu nozīmīguma analīzi un secīgas testēšanas stratēģiju, var samazināt vajadzību veikt testus in vivo, īpaši tad, ja vielai var būt ļoti spēcīga iedarbība.
Ieteicams izmantot zinātnisko datu nozīmīguma analīzi esošās informācijas izvērtēšanai par vielu kairinošo un kodīgo iedarbību uz acīm, kas vajadzīga, lai noteiktu, vai papildus šiem pētījumiem tās iedarbības raksturošanai nav jāveic vēl citi in vivo pētījumi. Ja vajadzīgi papildu pētījumi, attiecīgo eksperimentālo datu iegūšanai ieteicams izmantot secīgās testēšanas stratēģiju. Par vielām bez testēšanas vēstures to kairinošās/kodīgās iedarbības uz acīm novērtēšanai nepieciešamo datu iegūšanai jāizmanto secīgās testēšanas stratēģija. Šajā papildinājumā aprakstītā stratēģija izstrādāta ESAO darba grupā (1). Pēc tam tā apstiprināta un paplašināta Vispārīgajā saskaņotajā ķīmisko vielu iedarbības uz cilvēku veselību un vides bīstamību klasifikācijas sistēmā, kas akceptēta Ķīmisko vielu komitejas un Ķīmisko vielu darba grupas 28. kopīgajā sanāksmē 1998. gada novembrī (2).
Lai gan šī secīgās testēšanas stratēģija nav B.5. testa metodes sastāvdaļa, tajā norādīta ieteicamā pieeja, kā nosakāmi raksturlielumi vielu kairinošās/kodīgās iedarbības uz acīm novērtēšanai. Šajā pieejā apkopota acu kairinājuma/kodīgās iedarbības testēšanas in vivo laba prakse un ētiskie sliekšņi. Šajā testēšanas metodē sniegti norādījumi par testiem in vivo un apkopoti faktori, kas jāņem vērā pirms to uzsākšanas. Secīgajā stratēģijā noteikta zinātnisko datu nozīmīguma analīzes pieeja par to, kā izvērtējami esošie dati par testējamo vielu kairinošo/kodīgo iedarbību uz acīm, un daudzpakāpju pieeja, saskaņā ar ko iegūstami attiecīgie dati par vielām, par kurām vajadzīgi papildu pētījumi, vai par vielām, par kurām nav pētījumu. Stratēģijā vispirms paredzēta validētu un vispārpieņemtu in vitro un ex vivo testu veikšana, un pēc tam B.4. testa metode ādas kairinājuma/kodīgo īpašību noteikšana īpašos apstākļos (3) (4).
SECĪGAS TESTĒŠANAS STRATĒĢIJAS APRAKSTS
Pirms veikt testus, kas ir secīgās testēšanas stratēģijas daļa (attēlā), jāizvērtē visa pieejamā informācija, lai noteiktu nepieciešamību veikt in vivo testus iedarbības noteikšanai uz acīm. Lai gan būtisku informāciju var iegūt, izvērtējot atsevišķus rādītājus (piemēram, pH robežas), jāņem vērā viss esošās informācijas kopums. Pieņemot lēmumu par zinātnisko datu nozīmīguma analīzi, jāizvērtē visi esošie dati par konkrēto vielu vai tās analogiem, un jāsniedz šā lēmuma pamatojums. Galvenais uzsvars jāliek uz esošajiem datiem par vielas iedarbību uz cilvēka organismu un uz dzīvniekiem un pēc tam uz in vitro un ex vivo testu rezultātiem. Ja iespējams, jāizvairās veikt kodīgu vielu pētījumus in vivo. Testēšanas stratēģijā ņemti vērā šādi faktori.
Esošo datu izvērtēšana par iedarbību uz cilvēka organismu un dzīvniekiem (1. posms). Esošie dati par iedarbību uz cilvēka organismu, piemēram, klīniskie pētījumi vai pētījumi par profesionālajām slimībām un slimības vēsturēm, un/vai testa dati par pētījumiem ar dzīvniekiem, piemēram, par iedarbību uz acīm, ir jāizvērtē vispirms, jo tie var sniegt informāciju, kas tieši saistīta ar iedarbību uz acīm. Pēc tam jāizvērtē par cilvēkiem un/vai dzīvniekiem pieejamie izmeklējumu dati attiecībā uz kodīgo/kairinošo iedarbību uz ādu. Dzīvniekiem acīs nedrīkst pilināt ne vielas, par kurām zināms, ka tām ir kodīga/kairinoša iedarbība uz acīm, ne vielas, kurām ir kodīga vai kairinoša iedarbība uz acīm; jāuzskata, ka arī uz acīm tām būs kodīga/kairinoša iedarbība. Tāpat in vivo pētījumos nav jāpārbauda arī vielas, par kurām iepriekš veiktajos pētījumos par iedarbību uz acīm iegūti pietiekami zinātniskie dati, kas liecina, ka tās nav ne kodīgas, ne arī kairinošas.
Struktūras un aktivitātes savstarpējās saistības analīze (SSA) (2. posms). Jāņem vērā struktūras ziņā līdzvērtīgu vielu testu rezultāti, ja tie ir pieejami. Ja ir pietiekami daudz pētījumos ar cilvēkiem un/vai dzīvniekiem iegūtu datu par struktūras ziņā līdzvērtīgu vielu vai to maisījumu kodīgo/kairinošo iedarbību uz acīm, var pieņemt, ka uz novērtējamās testējamās vielas iedarbību būs tādas pašas atbildes reakcijas. Šādos gadījumos testus ar šo vielu var neveikt. Negatīvi dati par struktūras ziņā līdzvērtīgu vielu vai to maisījumu iedarbību nav pietiekami zinātniskie dati par to, ka arī viela, ko pārbauda pēc secīgās testēšanas stratēģijas, nebūs kodīga vai tai nebūs kairinošas iedarbības. Lai identificētu iespējamo kodīgumu vai kairinošo iedarbību, jāizmanto validēta un vispārpieņemta pieeja struktūras un aktivitātes savstarpējās saistības analīzei (SSA).
Fizikāli ķīmiskās īpašības un ķīmiskā reaģētspēja (3. posms). Vielām ar ļoti augstu vai zemu pH vērtību, piemēram, ≤ 2,0 vai ≥ 11,5, var būt stipra vietēja iedarbība. Ja viela, pamatojoties uz ekstrēmu pH vērtību, ir identificēta par acīm kodīgu vai kairinošu, var ņemt arī vērā tās skābuma/bāziskuma rezervi (vai buferspēju) (5) (6). Ja buferspēja liecina, ka viela, iespējams, nav acīm kodīga, jāveic papildu testēšana, lai to apstiprinātu, vēlams, izmantojot validētu un vispārpieņemtu testēšanas metodi – in vitro vai ex vivo testu (skatīt 5. un 6. posmu).
Citas esošās informācijas izskatīšana (4. posms). Šajā posmā jāizvērtē visa pieejamā informācija par sistēmisko toksiskumu, uzsūcoties caur ādu. Jāizskata arī testējamās vielas akūtais toksiskums, uzsūcoties caur ādu. Ja pierādīts, ka vielai, uzsūcoties caur ādu, ir ļoti toksiska iedarbība, iespējams, ka nav vajadzības testēt tās iedarbību uz acīm. Lai gan akūts toksiskums, iedarbojoties caur ādu, ne vienmēr ir tieši saistāms ar kairinošu/kodīgu iedarbību uz acīm, var uzskatīt, ka gadījumos, kad viela, uzsūcoties caur ādu, ir ļoti toksiska, tai būs arī ļoti toksiska iedarbība, kad to iepilina acī. Šos datus var izskatīt arī starp 2. un 3. posmu.
Testos in vitro vai ex vivo iegūtie rezultāti (5. un 6. posms). Vielas, kurām validētos un vispārpieņemtos in vitro vai ex vivo testos konstatēta kodīga vai spēcīga kairinoša iedarbība (7) (8) un minētie testi veikti kodīgas/kairinošas iedarbības novērtēšanai uz ādu vai acīm, nav jāpārbauda testos ar dzīvniekiem. Var uzskatīt, ka šādām vielām būs līdzvērtīga spēcīga iedarbība arī in vivo. Ja validētu un vispārpieņemtu in vitro/ex vivo testi nav veikti, 5. un 6. posmu izlaiž un pāriet tieši uz 7. posmu.
Vielas kairinošās vai kodīgās iedarbības uz ādu novērtēšana in vivo testos (7. posms). Ja nav pietiekamu esošo datu, lai veiktu noteiktu zinātnisko datu analīzi par vielas iespējamo kairinošo/kodīgo iedarbību uz acīm, pamatojoties uz iepriekšminētajiem pētījumiem, vispirms jānovērtē tās kodīgā/kairinošā iedarbība uz ādu in vivo, izmantojot B.4. testa metodi (4) un tās papildinājumu (9). Ja noskaidrojas, ka viela saēd ādu vai rada tās spēcīgu kairinājumu, jāuzskata, ka acīm tā ir kodīga vai kairinoša, ja nav citas informācijas, kas apstiprina pretēju secinājumu. Tādējādi in vivo testi par iedarbību uz acīm, iespējams, nav vajadzīgi. Ja viela nesaēd ādu vai nerada tās spēcīgu kairinājumu, jāizdara iedarbības in vivo testi uz acīm.
Izmēģinājumi ar trušiem in vivo testos (8. un 9. posms). Iedarbības testi uz acīm in vivo jāsāk ar sākotnēju testu, kuram izmanto vienu dzīvnieku. Ja tā rezultāti liecina, ka vielai ir spēcīga kairinoša vai kodīga iedarbība uz acīm, tās testēšana turpmāk nav veicama. Ja šajā testā kodīga vai kairinoša iedarbība netiek konstatēta, jāveic apstiprināšanas tests ar diviem dzīvniekiem.
IZMANTOTĀ LITERATŪRA
(1) OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22–24 January 1996 (http://www.oecd.org/ehs/test/background.htm).
(2) OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm).
(3) Worth, A.P. and Fentem J.H. (1999). A General Approach for Evaluating Stepwise Testing Strategies. ATLA 27, p. 161–177.
(4) Testing method B.4. Acute Toxicity: dermal irritation/corrosion.
(5) Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicology In Vitro, 2, p. 19–26.
(6) Neun, D.J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, p. 227–231.
(7) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, p. 483–524.
(8) Testing Method B.40 Skin Corrosion.
(9) Annex to Testing method B.4: A Sequential Testing Strategy for Skin Irritation and Corrosion.
Attēls
ACU KAIRINĀJUMA/KODĪGĀS IEDARBĪBAS UZ ACĪM TESTĒŠANAS UN NOVĒRTĒŠANAS STRATĒĢIJA
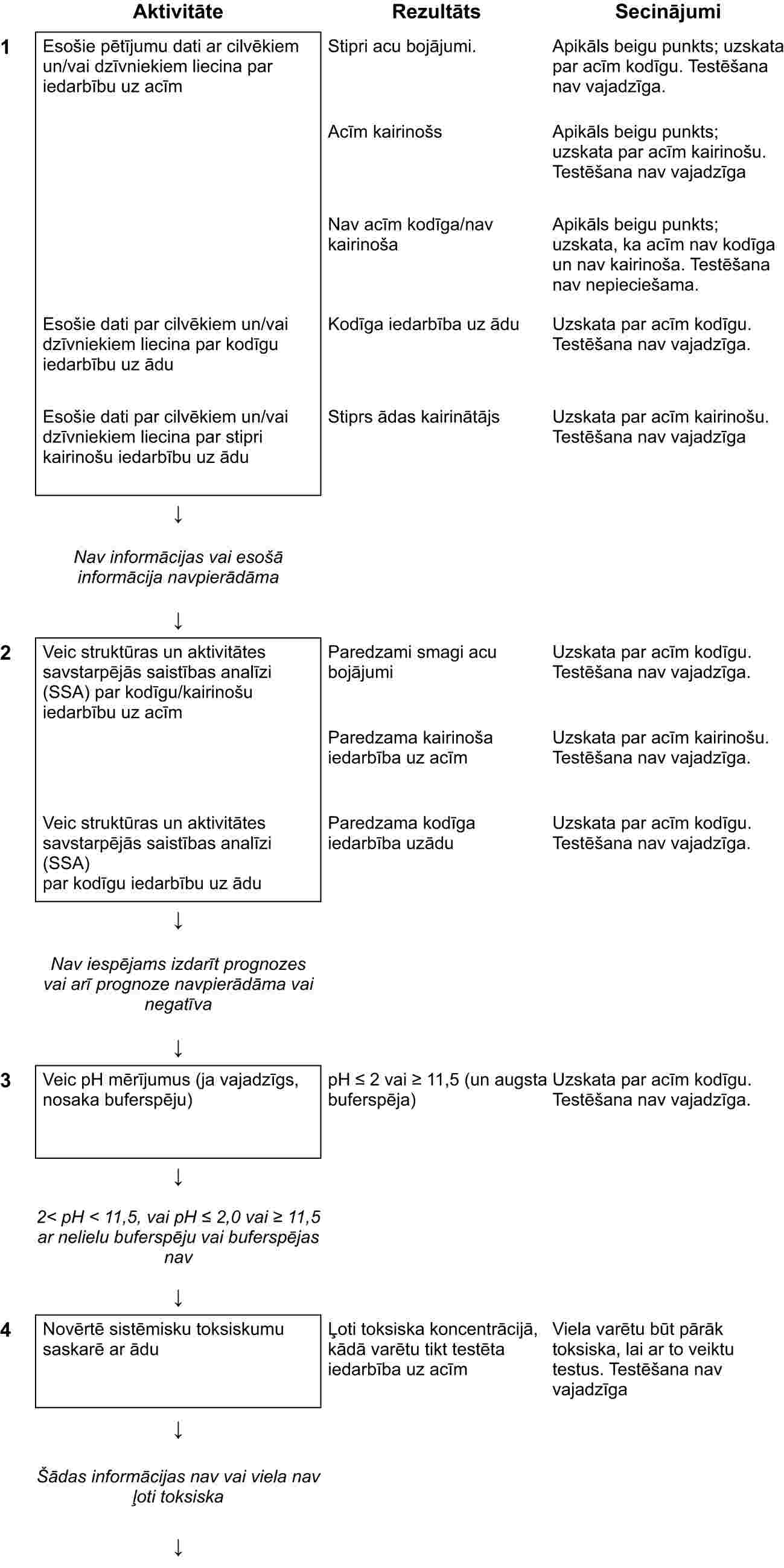
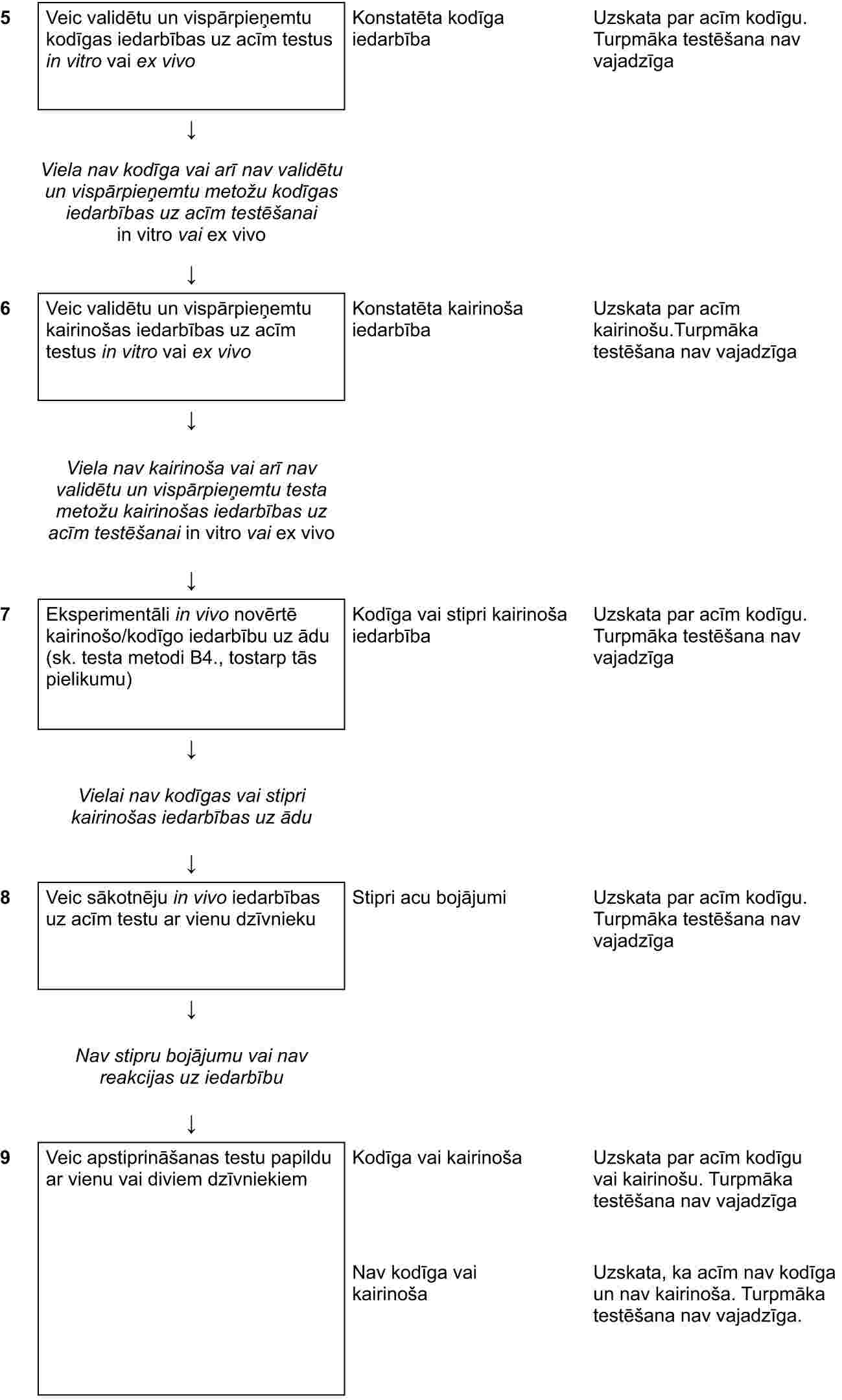
B.6. ĀDAS SENSIBILIZĀCIJA
1. METODE
1.1. IEVADS
Piezīmes
Testu jutīgumu un to spēju noteikt potenciālos cilvēku ādas sensibilizatorus uzskata par svarīgu klasifikācijas sistēmā, kas attiecas uz sabiedrības veselības aizsardzību.
Nav vienas testa metodes, kas adekvāti identificētu visas cilvēku ādu potenciāli sensibilizējošas vielas un kas attiektos uz visām vielām.
Izvēloties testu, ir jāņem vērā tādi faktori kā vielas fizikālās īpašības, iekļaujot tās spēju iekļūt ādā.
Ir izveidoti divi testu tipi, kuros izmanto jūrascūciņas: testi ar adjuvantiem, kuros alerģisko stāvokli veicina, izšķīdinot vai suspendējot testa vielu Freinda pilnajā adjuvantā (FCA), un testi bez adjuvantiem.
Testi ar adjuvantiem parasti precīzāk paredz vielas iespējamo sensibilizējošo ietekmi uz cilvēku nekā metodes, kas neizmanto Freinda pilno adjuvantu, un tādēļ tie ir ieteicamākie testi.
Maksimizācijas tests jūrascūciņām (GPMT) ir plaši lietojams tests ar adjuvantiem. Kaut arī, lai noteiktu vielas spēju izraisīt ādas sensibilizācijas reakciju, var izmantot vairākas citas metodes, par ieteicamāko metodi ar adjuvantiem uzskata GPMT.
Daudzām ķīmisko vielu klasēm testus bez adjuvantiem (ieteicamākais no tiem ir Bīlera tests) uzskata par mazāk jutīgiem.
Dažos gadījumos var būt pamatoti iemesli izvēlēties Bīlera testu, kas saistīts ar pielietošanu uz ādas, nevis ar intradermālu injekciju, kuru izmanto jūrascūciņu maksimizācijas testā. Ja izmanto Bīlera testu, ir jāsniedz zinātnisks pamatojums.
Jūrascūciņu maksimizācijas tests (GPMT) un Bīlera tests ir aprakstīts šajā metodē. Var izmantot citas metodes ar nosacījumu, ka tās ir labi novērtētas un ir dots zinātnisks pamatojums.
Ja atzītā skrīninga testā ir redzams pozitīvs rezultāts, testa vielu var apzīmēt kā potenciālu sensibilizatoru, un turpmāka testa ar jūrascūciņām izdarīšana var nebūt vajadzīga. Tomēr, ja šādā testā ir redzams negatīvs rezultāts, tests ar jūrascūciņām, izmantojot šajā testa metodē aprakstīto procedūru, ir jāizdara.
Skatīt arī vispārējā ievada B daļu.
1.2. DEFINĪCIJAS
Ādas sensibilizācija: (alerģiskais kontaktdermatīts) ir imunoloģiski nosacīta ādas reakcija uz vielu. Cilvēka atbildes reakcijas var raksturot nieze, apsārtums, uztūkums, mezgliņi, pūslīši, tulznas vai to apvienojums. Citu sugu atbildes reakcijas var atšķirties, un var būt redzams tikai apsārtums un uztūkums.
Pakļaušana inducējošai iedarbībai: pētījuma objekta eksperimentāla pakļaušana testa vielas iedarbībai, lai inducētu hiperjutības stāvokli.
Indukcijas laikposms: vismaz vienu nedēļu ilgs laikposms pēc pakļaušanas inducējošai iedarbībai, kura laikā var izveidoties hiperjutības stāvoklis.
Provokatīvais mijiedarbības tests iepriekš apstrādāta pētījumu objekta eksperimentāla pakļaušana testa vielas iedarbībai pēc indukcijas laika posma, lai noteiktu, ka pētījumu objekts reaģē hiperjutīgi.
1.3. STANDARTVIELAS
Lietotās eksperimenta metodes jutība un ticamība ir jānovērtē reizi sešos mēnešos, izmantojot vielas, par kurām ir zināms, ka tām ir vieglas līdz vidējas ādu sensibilizējošas īpašības.
Pareizi izdarītā testā viegliem/vidējiem sensibilizatoriem ir sagaidāma vismaz 30 % atbildes reakcija testā ar adjuvantiem un vismaz 15 % testā bez adjuvantiem.
Priekšroka ir dodama šādām vielām:
|
CAS numurs |
Einecs numurs |
Einecs nosaukums |
Parastais nosaukums |
|
101-86-0 |
202-983-3 |
α-heksilkaneļaldehīds |
α-heksilkaneļaldehīds |
|
149-30-4 |
205-736-8 |
benzotiazol-2-tiols (merkaptobenzotiazols) |
kaptakss |
|
94-09-7 |
202-303-5 |
benzokaīns |
nordkaīns |
Var būt apstākļi, kad ar pienācīgu pamatojumu var izmantot citas kontroles vielas, kas atbilst iepriekšminētajiem kritērijiem.
1.4. TESTA METODES PRINCIPS
Testa dzīvniekus sākotnēji pakļauj testa vielas iedarbībai, izmantojot intradermālas injekcijas un/vai pielietojot epidermāli (pakļaušana inducējošai iedarbībai). Pēc 10 līdz 14 dienu miera laikposma (indukcijas laikposms), kura laikā var izveidoties imūnreakcija, dzīvniekus pakļauj provokatīvās devas iedarbībai. Testa dzīvnieku ādas reakcijas apmēru un pakāpi provokatīvajā mijiedarbības testā salīdzina ar to, ko uzrāda kontrolgrupas dzīvnieki, kuriem indukcijas laikā izdarīts tukšais mēģinājums, un iegūst provokatīvo iedarbību.
1.5. TESTA METOŽU APRAKSTS
Ja testa vielas noņemšanu uzskata par vajadzīgu, tas jāsasniedz, izmantojot ūdeni vai piemērotu šķīdinātāju, nemainot esošo atbildes reakciju vai epidermas veselumu.
1.5.1. Jūrascūciņu maksimizācijas tests (GPMT)
1.5.1.1.
Veselas, jaunas, pieaugušas albīnas jūrascūciņas vismaz piecas dienas pirms testa aklimatizē laboratorijas apstākļos. Pirms testa dzīvniekus izvēlas pēc nejaušās izvēles principa un iedala vielas ievadīšanas un kontroles grupās. Apmatojumu noņem cērpot, skujot vai varbūt ar ķīmisko depilāciju atkarībā no izmantotās testa metodes. Jāpievērš vērība, lai nenobrāztu ādu. Dzīvniekus nosver pirms testa uzsākšanas un testa beigās.
1.5.1.2.
1.5.1.2.1. Testa dzīvnieki
Izmanto parasti izmantojamās albīno jūrascūciņu laboratorijas līnijas.
1.5.1.2.2. Skaits un dzimums
Var izmantot vīriešu un/vai sieviešu dzimuma dzīvniekus. Ja izmanto mātītes, tām jābūt nedzemdējušām un negrūsnām.
Vielas ievadīšanas grupā izmanto vismaz 10 dzīvniekus un kontrolgrupā vismaz 5 dzīvniekus. Ja izmanto mazāk nekā 20 testa un mazāk nekā 10 kontroles jūrascūciņas un ja nav iespējams secināt, ka testa viela ir sensibilizators, ir noteikti ieteicama papildu dzīvnieku testēšana, lai kopā būtu vismaz 20 testa dzīvnieki un 10 kontroles dzīvnieki.
1.5.1.2.3. Devu līmeņi
Katrā pakļaušanā induktīvai iedarbībai testa vielas koncentrācijai jābūt dzīvnieka organismam sistēmiski labi panesamai un tai jābūt lielākajai, kas rada vieglu līdz vidēju ādas kairinājumu. Provokatīvajā mijiedarbības testā izmantotajai koncentrācijai jābūt lielākajai devai, kas kairinājumu nerada. Vajadzības gadījumā atbilstīgās koncentrācijas var noteikt ievadpētījumā, kurā izmanto divus vai trīs dzīvniekus. Jāņem vērā, ka šajā nolūkā jāizmanto dzīvnieki, kas saņem Freinda pilno adjuvantu (FCA).
1.5.1.3.
1.5.1.3.1. Indukcija
0. diena – vielas ievadīšanas grupa
Pleca rajonā, kas ir atbrīvots no apmatojuma, intradermāli ievada trīs pārus 0,1 ml tilpuma injekciju tā, lai no katra pāra viena injekcija būtu savā viduslīnijas pusē.
1. injekcija: FCA/ūdens vai FCA/fizioloģiskā sāls šķīduma maisījums attiecībā 1:1 (tilp./tilp.).
2. injekcija: testa viela piemērotā nesējā izraudzītajā koncentrācijā.
3. injekcija: testa viela izraudzītajā koncentrācijā, kas sagatavota FCA/ūdens vai FCA/fizioloģiskā sāls šķīduma maisījumā attiecībā 1:1 (tilp./tilp.).
3. injekcijai ūdenī šķīstošās vielas pirms sajaukšanas ar FCA izšķīdina ūdens fāzē. Taukos šķīstošās vai nešķīstošās vielas pirms ūdens fāzes pievienošanas suspendē FCA. Testa vielas galīgā koncentrācija ir vienāda ar koncentrāciju, ko izmanto 2. injekcijā.
1. un 2. injekciju ievada tuvu vienu otrai un tuvāk galvai, bet 3. injekciju ievada testa laukuma kaudālajā daļā.
0. diena – kontroles grupa
Intradermāli ievada trīs pārus 0,1 ml tilpuma injekciju tajās pašās vietās kā vielas ievadīšanas grupas dzīvniekiem.
1. injekcija: FCA/ūdens vai FCA/fizioloģiskā sāls šķīduma maisījums attiecībā 1:1 (tilp./tilp.).
2. injekcija: neatšķaidīts nesējs.
3. injekcija: 50 % svars/tilp. attiecībā nesējs samaisīts ar FCA/ūdens vai FCA/fizioloģiskā sāls šķīduma 1:1 (tilp./tilp.) maisījumu.
5.–7. diena – vielas ievadīšanas un kontroles grupa
Aptuveni 24 stundas pirms vietējās indukcijas pielietošanas, ja viela nekairina ādu, testa laukumu pēc nocirpšanas tuvu ādai un/vai noskūšanas apstrādā ar 0,5 ml 10 % nātrija laurilsulfāta vazelīnā, lai radītu vietēju kairinājumu.
6.–8. diena – vielas ievadīšanas grupa
Testa laukumā vēlreiz notīra apmatojumu. Filtrpapīru (2 × 4 cm) pilnīgi piesātina ar testa vielu piemērotā nesējā, uzliek testa laukumam un tur saskarē ar ādu 48 stundas, izmantojot okluzīvu pārsēju. Nesēja izvēle ir jāpamato. Cietas vielas sasmalcina smalkā pulverī un iejauc piemērotā nesējā. Šķidrumus var attiecīgā gadījumā pielietot neatšķaidītus.
6.–8. diena – kontroles grupa
Testa laukumā vēlreiz notīra apmatojumu. Testa laukumā līdzīgi pielieto tikai nesēju un tur saskarē ar ādu 48 stundas, izmantojot okluzīvu pārsēju.
1.5.1.3.2. Provocēšana
20.–22. diena – vielas ievadīšanas un kontroles grupa
Vielas ievadīšanas un kontroles dzīvnieku sāniem notīra apmatojumu. Ar testa vielu piesātinātu kompresi vai pildītu iedobi pieliek vienam dzīvnieka sānam un attiecīgā gadījumā ar nesēju piesātinātu kompresi vai pildītu iedobi pieliek otram sānam. Kompreses tur saskarē ar ādu 24 stundas, izmantojot okluzīvu pārsēju.
1.5.1.3.3. Novērošana un izvērtēšana: vielas ievadīšanas un kontroles grupa
— Aptuveni 21 stundu pēc kompreses noņemšanas provocēto laukumu notīra un tuvu ādai nocērp un/vai noskuj un vajadzības gadījumā izdara depilāciju,
— aptuveni trīs stundas vēlāk (aptuveni 48 stundas pēc provocēšanas sākuma) izdara ādas reakcijas novērojumus un protokolē saskaņā ar pielikumuma papildinājumā parādītajām pakāpēm,
— aptuveni 24 stundas pēc šo novērojumu izdarīšanas izdara otru (72 stundu) novērojumu un vēlreiz protokolē.
Ir atbalstāmi aklie nolasījumi testa un kontroles dzīvniekiem.
Ja ir jāprecizē pirmajā provocēšanā iegūtie rezultāti, ir jāapsver otrā provocēšana (t. i., atkārtota provocēšana) vajadzības gadījumā ar jaunu kontroles grupu aptuveni nedēļu pēc pirmās provocēšanas. Atkārtoto provocēšanu var izdarīt arī ar sākotnējo kontroles grupu.
Visas ādas reakcijas un neparastas konstatācijas, iekļaujot organisma sistēmiskās reakcijas, ko izraisījušas indukcijas un provocēšanas procedūras, ir jānovēro un jāprotokolē saskaņā ar Magnusona/Kligmana novērtējuma skalu (skatīt pielikuma papildinājumu). Lai precizētu neskaidras reakcijas, var izdarīt citas procedūras, piemēram, histopatoloģiskus izmeklējumus, ādas krokas biezuma mērījumus.
1.5.2. Bīlera tests
1.5.2.1.
Veselas, jaunas, pieaugušas albīnas jūrascūciņas vismaz piecas dienas pirms testa aklimatizē laboratorijas apstākļos. Pirms testa dzīvniekus izvēlas pēc nejaušās izvēles principa un iedala vielas ievadīšanas grupās. Apmatojumu noņem, cērpot, skujot vai varbūt ar ķīmisko depilāciju atkarībā no izmantotās testa metodes. Jāpievērš uzmanība, lai nenobrāztu ādu. Dzīvniekus nosver pirms testa uzsākšanas un testa beigās.
1.5.2.2.
1.5.2.2.1. Testa dzīvnieki
Izmanto albīno jūrascūciņu parasti izmantojamās laboratorijas līnijas.
1.5.2.2.2. Skaits un dzimums
Var izmantot vīriešu un/vai sieviešu dzimuma dzīvniekus. Ja izmanto mātītes, tām jābūt nedzemdējušām un negrūsnām.
Vielas ievadīšanas grupā izmanto vismaz 20 dzīvniekus un kontroles grupā vismaz 10 dzīvniekus.
1.5.2.2.3. Devu līmeņi
Katrā inducējošā iedarbībā testa vielas koncentrācijai jābūt iespējami lielākajai, kas rada vieglu līdz vidēju ādas kairinājumu. Provokatīvajā mijiedarbības testā izmantotajai koncentrācijai jābūt lielākajai devai, kas kairinājumu nerada. Vajadzības gadījumā atbilstīgās koncentrācijas var noteikt ievadpētījumā, kurā izmanto divus vai trīs dzīvniekus.
Par ūdenī šķīstošu testa materiālu nesēju ir lietderīgi izmantot ūdeni vai atšķaidītu nekairinošu virsmaktīvas vielas šķīdumu. Citu testa materiālu indukcijā ir vēlams 80 % etanola/ūdens maisījums un provocēšanā acetons.
1.5.2.3.
1.5.2.3.1. Indukcija
0. diena – vielas ievadīšanas grupa
Vienam sānam notīra apmatojumu (nocērp tuvu ādai). Testa kompreses sistēmai jābūt pilnīgi piesātinātai ar testa vielu piemērotā nesējā (nesēja izvēle ir jāpamato; šķidras testa vielas var attiecīgā gadījumā pielietot neatšķaidītas).
Testa kompreses sistēmu pielieto testa laukumam un tur saskarē ar ādu, izmantojot okluzīvu kompresi vai iedobi un piemērotu pārsēju sešas stundas.
Testa kompreses sistēmai jābūt okluzīvai. Kokvilnas spilventiņš ir piemērots un var būt apaļš vai četrstūrains, bet tam jābūt aptuveni 4–6 cm2. Lai nodrošinātu oklūziju, vēlams izmantot fiksāciju ar piemērotu fiksatoru. Ja izmanto apsaitēšanu, var būt vajadzīgas papildu pakļaušanas iedarbībai.
0. diena – kontroles grupa
Vienam sānam notīra apmatojumu (nocērp tuvu ādai). Pielieto tikai nesēju līdzīgi kā vielas ievadīšanas grupai. Testa kompreses sistēmu tur saskarē ar ādu sešas stundas, izmantojot okluzīvu kompresi vai iedobi un piemērotu pārsēju. Ja var parādīt, ka tukšā mēģinājuma kontroles grupa nav vajadzīga, var izmantot kontroles grupu, kas neko nesaņem.
6.–8. un 13.–15. diena – vielas ievadīšanas grupa un kontroles grupa
Rīkojas tāpat kā 0. dienā ar tā paša sāna to pašu testa laukumu (vajadzības gadījumā notīrot apmatojumu) 6.–8. dienā un vēlreiz 13.–15. dienā.
1.5.2.3.2. Provocēšana
27.–29. diena – vielas ievadīšanas un kontroles grupa
Vielas ievadīšanas un kontroles grupas dzīvnieku neapstrādātajam sānam notīra apmatojumu (nocērp tuvu ādai). Okluzīvu kompresi vai iedobi, kas satur atbilstīgu testa vielas daudzumu maksimālā nekairinošā koncentrācijā pielieto uz vielas ievadīšanas un kontroles dzīvnieku neapstrādātā sāna aizmugures daļas.
Attiecīgā gadījumā okluzīvu kompresi vai iedobi, kas satur tikai nesēju, arī pielieto uz vielas ievadīšanas un kontroles dzīvnieku neapstrādātā sāna aizmugures daļas. Kompreses vai iedobes sešas stundas tur saskarē ar ādu, izmantojot piemērotu pārsēju.
1.5.2.3.3. Novērošana un izvērtēšana
— Aptuveni 21 stundu pēc kompreses noņemšanas provocētajā laukumā notīra apmatojumu,
— aptuveni trīs stundas vēlāk (aptuveni 30 stundas pēc provocēšanas kompreses pielietošanas) izdara ādas reakcijas novērojumus un protokolē saskaņā ar pielikuma papildinājumā parādītajām pakāpēm,
— aptuveni 24 stundas pēc 30 stundu novērojumiem (aptuveni 54 stundas pēc provocēšanas kompreses pielietošanas) vēlreiz izdara ādas reakcijas novērojumus un protokolē.
Ir atbalstāmi aklie nolasījumi testa un kontroles dzīvniekiem.
Ja ir jāprecizē pirmajā provocēšanā iegūtie rezultāti, ir jāapsver otrā provocēšana (t. i., atkārtota provocēšana) vajadzības gadījumā ar jaunu kontroles grupu aptuveni nedēļu pēc pirmās provocēšanas. Atkārtoto provocēšanu var izdarīt arī ar sākotnējo kontroles grupu.
Visas ādas reakcijas un neparastas konstatācijas, iekļaujot organisma sistēmiskās reakcijas, ko izraisījušas indukcijas un provocēšanas procedūras, ir jānovēro un jāprotokolē saskaņā ar Magnusona/Kligmana novērtējuma skalu (skatīt pielikuma papildinājumu). Lai precizētu neskaidras reakcijas, var izdarīt citas procedūras, piemēram, histopatoloģiskus izmeklējumus, ādas krokas biezuma mērījumus.
2. DATI (GPMT un Bīlera tests)
Dati ir jāapkopo tabulas veidā, parādot katra dzīvnieka ādas reakcijas katrā novērošanā.
3. ZIŅOJUMA SASTĀDĪŠANA (GPMT un Bīlera tests)
Ja skrīninga testu izdara pirms jūrascūciņu testa, tad testa apraksts vai norāde uz to (piemēram, vietējais limfmezglu tests (LLNA), peļu ausu pietūkuma tests (MEST)), iekļaujot sīkus datus par procedūru, ir jāsniedz kopā ar rezultātiem, kas iegūti ar testa vielām un standartvielām.
Testa ziņojums (GPMT un Bīlera tests)
Testa ziņojumā, ja iespējams, iekļauj šādu informāciju.
Testa dzīvnieki:
— izmantotā jūrascūciņu līnija,
— dzīvnieku skaits, vecums un dzimums,
— izcelsme, turēšanas apstākļi, barība u. c.,
— atsevišķo dzīvnieku svars testa sākumā.
Testa apstākļi:
— kompreses vietas sagatavošanas paņēmiens,
— sīkas ziņas par izmantotajiem kompreses materiāliem un kompreses uzlikšanas paņēmienu,
— ievadpētījuma rezultāti ar secinājumu par testā izmantojamām inducēšanas un provocēšanas koncentrācijām,
— sīkas ziņas par testa vielas sagatavošanu, pielietošanu un noņemšanu,
— nesēja izvēles pamatojums,
— inducēšanā un provocēšanā izmantotās nesēja un testa vielas koncentrācijas un inducēšanā un provocēšanā izmantotais kopējais vielas daudzums.
Rezultāti:
— pēdējās jutības un ticamības pārbaudes rezultātu kopsavilkums (skatīt 1.3.), iekļaujot informāciju par izmantoto vielu, koncentrāciju un nesēju,
— visi novērojumi par katru dzīvnieku, iekļaujot vērtējumu,
— sīki izstrādāts apraksts par novēroto ietekmju būtību un pakāpi,
— histopatoloģiskas konstatācijas.
Rezultātu izvērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
Šī metode ir analoga ESAO TG 406.
Papildinājums
TABULA
Magnusona/Kligmana novērtējumu skala kompreses provocēšanas testa reakcijām
0 = nav redzamu izmaiņu
1 = atsevišķi vai plankumveida apsārtumi
2 = vidēji stipri un saplūduši apsārtumi
3 = intensīvs apsārtums un uztūkums
B.7. VAIRĀKKĀRTĒJĀS DEVAS (28 DIENU) TOKSICITĀTE (ORĀLĀ)
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Skatīt vispārīgā ievada B daļu.
1.3. TESTA METODES PRINCIPS
Testa vielu perorāli ievada katru dienu pakāpeniskās devās vairākām testa dzīvnieku grupām, vienu devas līmeni uz grupu 28 dienu laikposmā. Vielas ievadīšanas laikposmā dzīvniekus katru dienu rūpīgi apskata, vai nav novērojamas toksicitātes pazīmes. Dzīvniekiem, kas nobeidzas vai ko nogalina testa laikā, izdara autopsiju, un eksperimenta beigās izdzīvojušos dzīvniekus nogalina, un tiem izdara autopsiju.
Šī metode vairāk uzsver neiroloģiskās ietekmes kā īpašu beigu punktu un uzsver vajadzību izdarīt rūpīgus dzīvnieku klīniskos novērojumus, lai iegūtu iespējami daudz informācijas. Metodei jāidentificē vielas ar neirotoksisku potenciālu, kas varētu radīt vajadzību izdarīt šajā aspektā turpmākus padziļinātus pētījumus. Turklāt metode var dot norādi par imunoloģisko ietekmi un toksicitāti uz reproduktīvajiem orgāniem.
1.4. TESTA METODES APRAKSTS
1.4.1. Sagatavošanās
Veselus, jaunus, pieaugušus dzīvniekus pēc nejaušās izvēles principa sadala kontroles un vielas saņemšanas grupās. Būrus izvieto tā, lai iespējami samazinātu būru novietojuma varbūtējo ietekmi. Dzīvniekiem piešķir īpašu identifikāciju, un līdz izmēģinājumu sākumam tos vismaz piecas dienas tur būros, lai tie aklimatizētos laboratorijas apstākļos.
Testa vielu ievada, mākslīgi barojot vai ar barību vai dzeramo ūdeni. Perorālās ievadīšanas metode ir atkarīga no pētījuma mērķa un no vielu fizikāli ķīmiskajām īpašībām.
Vajadzības gadījumā testa vielu izšķīdina vai suspendē piemērotā nesējā. Ir ieteicams, ja tas iespējams, vispirms apsvērt ūdens šķīduma/suspensijas lietošanu, pēc tam apsvērt eļļas (piemēram, kukurūzas eļļas) šķīduma/emulsijas lietošanu un pēc tam iespējamu šķīdināšanu citos nesējos. Ir jābūt zināmām nesēju, kas nav ūdens, toksiskajām īpašībām. Ir jānosaka testa vielas stabilitāte nesējā.
1.4.2. Testa apstākļi
1.4.2.1. Testa dzīvnieki
Ieteicamākā grauzēju suga ir žurkas, kaut arī var izmanot citas grauzēju sugas. Ir jāizmanto jauni, veseli, pieauguši parasti izmantojamo laboratorijas līniju dzīvnieki. Mātītēm jābūt nedzemdējušām un negrūsnām. Dozēšana jāsāk iespējami drīz pēc zīdīšanas pārtraukšanas un katrā ziņā ne vēlāk kā tad, kad dzīvnieki ir deviņas nedēļas veci.
Izmēģinājuma sākumā dzīvnieku masas atšķirībām jābūt minimālām un tās nedrīkst pārsniegt ± 20 % no vidējās masas, kas noteikta katram dzimumam atsevišķi.
Ja vairākkārtējās devas perorālu pētījumu izdara kā ilgtermiņa pētījuma iepriekšēju pētījumu, ir ieteicams abos pētījumos izmantot vienas līnijas un izcelsmes dzīvniekus.
1.4.2.2. Skaits un dzimums
Katram devas līmenim jāizmanto vismaz 10 dzīvnieki (pieci sieviešu dzimuma un pieci vīriešu dzimuma). Ja plāno izdarīt nogalināšanas pētījuma gaitā, skaits ir jāpalielina par tik dzīvniekiem, cik plānots nogalināt pirms pētījuma pabeigšanas.
Turklāt 10 dzīvnieku satelītgrupai (pieci katra dzimuma dzīvnieki) var ievadīt augsta līmeņa devu 28 dienas un novērot 14 dienas pēc vielas ievadīšanas attiecībā uz toksisko ietekmju atgriezenību, noturību vai aizkavētu parādīšanos. Izmanto arī 10 kontroles dzīvnieku satelītgrupu (piecus katra dzimuma dzīvniekus).
1.4.2.3. Devu līmeņi
Parasti jāizmanto vismaz trīs testa grupas un kontroles grupa. Izņemot testa vielas ievadīšanu, ar kontroles grupas dzīvniekiem rīkojas tieši tāpat kā ar testa grupu dzīvniekiem. Ja vielas ievadīšanā izmanto nesēju, kontroles grupai jāsaņem lielākais izmantotais nesēja tilpums.
Ja saskaņā ar citu datu izvērtējumu pie devas līmeņa 1 000 mg/kg dzīvnieka svara dienā nav sagaidāma nekāda ietekme, var izdarīt pieļaujamā daudzuma testu. Ja piemēroti dati nav pieejami, var izdarīt diapazona atrašanas pētījumu, kas palīdzētu noteikt izmantojamās devas.
Devu līmeņi jāizvēlas, ņemot vērā esošos toksicitātes un (toksisko-)kinētikas datus, kas ir pieejami par vielu vai par radniecīgiem materiāliem. Augstākais devas līmenis ir jāizvēlas ar mērķi izraisīt toksiskas ietekmes, bet ne nobeigšanos vai smagas ciešanas. Pēc tam jāizvēlas devu līmeņi lejupejošā secībā, lai parādītu visas ar dozēšanu saistītās atbildes reakcijas un lai zemākais devas līmenis būtu nenovērotas nelabvēlīgas ietekmes līmenis (NOAEL). Lejupejošo devu līmeņu uzdošanai bieži optimāli ir divkārši līdz četrkārši intervāli un ceturtās testa grupas pievienošana bieži ir ieteicamāka par ļoti plašu (piemēram, vairāk par 10 reizēm) intervālu izmantošanu starp dozēšanām.
Vielām, ko ievada ar barību vai dzeramo ūdeni, ir svarīgi nodrošināt, lai iesaistītie testa vielas daudzumi netraucētu normālu barības vai ūdens līdzsvaru. Ja testa vielu ievada ar barību, var izmantot nemainīgu koncentrāciju barībā (milj. daļas) vai nemainīgu devas līmeni uz dzīvnieka ķermeņa svaru; izmantotā alternatīva ir jānorāda. Ja vielu ievada, mākslīgi barojot, deva katru dienu jāievada līdzīgā laikā un pēc vajadzības jāpielāgo, lai uzturētu nemainīgu devas līmeni attiecībā pret dzīvnieka ķermeņa svaru.
Ja vairākkārtējās devas pētījumu izmanto kā ilgtermiņa pētījuma iepriekšēju pētījumu, abos pētījumos jāizmanto līdzīga diēta.
1.4.2.4. Pieļaujamā daudzuma tests
Ja pie viena devas līmeņa, kas ir vismaz 1 000 mg/kg ķermeņa svara dienā vai līdzvērtīgs procentuālais daudzums barībā vai dzeramajā ūdenī, ievadot vielu ar barību vai dzeramo ūdeni (pamatojoties uz ķermeņa svara noteikšanām), testā, kuru izdara ar šā pētījuma veikšanai aprakstītajām procedūrām, nerodas novērojamas toksiskas ietekmes un ja toksicitāte nav sagaidāma, pamatojoties uz datiem par radniecīgas struktūras vielām, tad pilnu pētījumu, kurā izmanto trīs devu līmeņus, nevar uzskatīt par vajadzīgu. Pieļaujamā daudzuma testu pielieto, izņemot gadījumus, kad iedarbība uz cilvēkiem norāda, ka ir jāizmanto augstāks devas līmenis.
1.4.2.5. Novērošanas laikposms
Novērošanas laikposmam jābūt 28 dienas. Satelītgrupas dzīvnieki, kas plānoti papildu novērojumiem, ir jātur vismaz vēl 14 dienas bez vielas saņemšanas, lai noteiktu toksisko ietekmju aizkavētu parādīšanos vai noturību vai izveseļošanos no tām.
1.4.3. Procedūra
Dzīvniekiem testa vielu ievada katru dienu septiņas dienas nedēļā 28 dienu laika posmā; ja vielu dozē piecas dienas nedēļā, tas ir jāpamato. Ja testa vielu dzīvniekiem ievada ar mākslīgo barošanu, tas jāizdara vienā devā, izmantojot kuņģa zondi vai piemērotu intubācijas kanulu. Maksimālais šķidruma tilpums, ko vienā paņēmienā var ievadīt, ir atkarīgs no izmēģinājumu dzīvnieka lieluma. Tilpums nedrīkst pārsniegt 1 ml/100 g ķermeņa svara, izņemot ūdens šķīdumus, ko var ievadīt 2 ml/100 g ķermeņa svara. Izņemot kairinošas un kodīgas vielas, kuru iedarbība lielākās koncentrācijās parasti ir izteiktāka, izmēģinājumiem lietotā tilpuma mainības ietekmi samazina, koriģējot tilpumu tā, lai pie visām devām tas būtu vienāds.
1.4.3.1. Vispārēji novērojumi
Vispārējie klīniskie novērojumi jāizdara vismaz reizi dienā, vēlams, katru dienu vienā(-os) laikā(-os) un ņemot vērā sagaidāmo ietekmju maksimuma laika posmu pēc dozēšanas. Dzīvnieku veselības stāvoklis ir jāprotokolē. Vismaz divreiz dienā visus dzīvniekus novēro attiecībā uz saslimstību un mirstību. Mirstoši dzīvnieki un dzīvnieki, kam ir smagas ciešanas, ja tie ievēroti, ir jāizņem, humāni jānogalina un tiem jāizdara autopsija.
Vienreiz pirms pakļaušanas iedarbībai (lai varētu izdarīt salīdzināšanu vienam un tam pašam dzīvniekam) un pēc tam vismaz vienu reizi nedēļā jāizdara detalizēti visu dzīvnieku klīniskie novērojumi. Šie novērojumi jāizdara ārpus dzīvnieka turēšanas krātiņa standartnožogojumā, ieteicams, katru reizi vienā un tajā pašā laikā. Novērojumi rūpīgi jāprotokolē, vēlams izmantot vērtēšanas sistēmas, ko skaidri noteikusi testēšanas laboratorija. Ir jācenšas nodrošināt, lai izmaiņas testa apstākļos būtu minimālas un, ieteicams, lai novērošanu izdarītu novērotāji, kas nav informēti par vielas ievadīšanu. Protokolējamās pazīmēs ir jāiekļauj izmaiņas ādā, apmatojumā, acīs, gļotādā, sekrēcijas, izdalīšanās un veģetatīvā aktivitāte (piemēram, asarošana, piloarekcija, acs zīlītes diametrs un neraksturīga elpošana), bet ar to nav jāaprobežojas. Jāprotokolē arī izmaiņas gaitā, stājā un atbildes reakcijās uz manipulācijām, kā arī klonisko un tonisko kustību klātesamība, izmaiņas stereotipos (piemēram, pārmērīga kopšanās, atkārtota riņķošana) vai savāda izturēšanās (piemēram, pašsakropļošanās, staigāšana atmuguriski).
Ceturtajā iedarbības nedēļā ir jānovērtē sensorās reakcijas uz dažāda veida kairinājumiem (piemēram, dzirdes, redzes un proprioceptīvajiem kairinātājiem), kā arī jānovērtē satveršanas stiprums un motoriskā aktivitāte. Sīkāki dati par izmantojamām procedūrām ir izklāstīti literatūrā (skatīt vispārējā ievada B daļu).
Ceturtajā iedarbības nedēļā funkcionālos novērojumus var neizdarīt, ja pētījumu veic kā turpmāka subhroniska (90 dienu) pētījuma iepriekšēju pētījumu. Tādā gadījumā funkcionālie novērojumi ir jāiekļauj šajā vēlākajā pētījumā. No otras puses, vairākkārtējās devas pētījumā iegūtie funkcionālo novērojumu dati var atvieglot devu līmeņu izvēli turpmākajam subhroniskās toksicitātes pētījumam.
Izņēmuma kārtā funkcionālos novērojumus var neizdarīt arī grupām, kas citā veidā uzrāda tik izteiktas toksicitātes pazīmes, ka tās ievērojami traucētu funkcionālo testu izdarīšanu.
1.4.3.2. Ķermeņa svars un barības/ūdens patēriņš
Visi dzīvnieki jāsver vismaz reizi nedēļā. Barības un ūdens patēriņš ir jāmēra vismaz reizi nedēļā. Ja testa vielu ievada ar dzeramo ūdeni, arī ūdens patēriņš ir jāmēra vismaz reizi nedēļā.
1.4.3.3. Hematoloģija
Testa laika posma beigās ir jāizdara šādi hematoloģiski izmeklējumi: hematokrītu, hemoglobīna koncentrācijas, eritrocītu skaita, leikocītu skaita un leikocitārās formulas, trombocītu skaita un asins recēšanas laika/spējas noteikšana.
Asins paraugi jāņem no nosauktas vietas tieši pirms dzīvnieku nogalināšanas procedūras vai kā daļa no tās un jāglabā piemērotos apstākļos.
1.4.3.4. Klīniskā bioķīmija
Klīniskās bioķīmijas noteikšana, lai izpētītu galvenās toksiskās ietekmes audos un konkrēti ietekmes uz nierēm un aknām, jāveic ar tiem asins paraugiem, kuri paņemti no katra dzīvnieka tieši pirms dzīvnieku nogalināšanas procedūras vai kā daļa no tās (tas neattiecas uz dzīvniekiem, kuri atrasti mirstoši un/vai nogalināti pētījuma gaitā). Ir ieteicams nedot dzīvniekiem barību uz nakti pirms asins analīžu ņemšanas ( 16 ). Plazmā vai serumā nosaka nātriju, kāliju, glikozi, kopējo holesterīnu, urīnvielu, kreatinīnu, kopējās olbaltumvielas un albumīnu un vismaz divus fermentus, kas norāda uz hepatocelulārajām ietekmēm (piemēram, alanīna aminotransferāze, aspartāta aminotransferāze, alkalīnfosfatāze, gamma glutamiltranspeptidāze un sorbīta dehidrogenāze). Papildu fermentu (aknu vai citas izcelsmes) un žultsskābju noteikšana var sniegt noderīgu informāciju pie dažiem nosacījumiem.
Neobligāti pēdējā pētījuma nedēļā var izdarīt šādas urīna analīzes, izmantojot urīna tilpuma savākšanu noteiktā laikā: izskats, tilpums, osmolalitāte vai īpatsvars, pH, olbaltumvielas, glikoze un asinis/asins šūnas.
Turklāt ir jāapsver vispārēju audu bojājumu seruma marķieru pētījumi. Citas noteikšanas, kuras būtu jāveic, ja testa vielas zināmās īpašības ietekmē attiecīgās metaboliskās īpašības vai ja ir aizdomas par tādu ietekmi, iekļauj kalciju, fosforu, tukšas dūšas triglicerīdus, specifiskus hormonus, methemoglobīnu un holīnesterāzi. Tās ir jānosaka dažu klašu vielām vai atkarībā no gadījuma.
Vispār ir vajadzīga elastīga pieeja, kas ir atkarīga no sugas un dotajai vielai novērotās un/vai sagaidāmās ietekmes.
Ja agrākie izejas dati nav atbilstīgi, ir jāapsver hematoloģisko un klīniskās bioķīmijas rādītāju noteikšana, pirms uzsāk dozēšanu.
1.4.3.5. Autopsija
Visiem pētījuma dzīvniekiem izdara pilnu detalizētu autopsiju, kurā iekļauj rūpīgu ķermeņa ārējās virsmas, visu atveru un galvaskausa dobuma, torakālā dobuma un vēdera dobuma un šo dobumu satura apskati. Aknas, nieres, virsnieru dziedzeri, sēklinieki, sēklinieku piedēkļi, liesa, smadzenes un sirds jāatbrīvo no attiecīgajiem apkārtējiem audiem un iespējami drīz pēc secēšanas jānosver, lai izvairītos no izžūšanas.
Šādi audi jāglabā vispiemērotākajā fiksācijas vidē audu veida izmeklēšanai un paredzētai vēlākai histopatoloģiskai izmeklēšanai: visi audi ar makroskopiskiem bojājumiem, smadzenes (reprezentatīvi apgabali, iekļaujot lielās smadzenes, smadzenītes un iegarenās smadzenes/smadzeņu tiltu), muguras smadzenes, kuņģis, tievās un resnās zarnas (iekļaujot kopu limfātiskos jeb Peijera mezgliņus), aknas, nieres, virsnieru dziedzeri, liesa, sirds, hipofīze, vairogdziedzeris, traheja un plaušas (konservētas, piepūšot ar fiksatoru un pēc tam iegremdējot), dzimumdziedzeri, akcesorie dzimumorgāni (piemēram, dzemde, prostata), urīnpūslis, limfmezgli (vēlams, viens limfmezgls, kas ir uz ievadīšanas ceļa, un otrs, kas ir attālu no ievadīšanas ceļa, lai konstatētu sistēmiskās ietekmes), perifēriskais nervs (sēžas nervs vai tibiālais nervs), vēlams, tiešā muskuļa tuvumā un kaulu smadzeņu izgriezums (vai, alternatīvi, svaigs kaulu smadzeņu aspirāts). Klīniskās un citas konstatācijas var ierosināt domu par vajadzību papildus izmeklēt citus audus. Ir jāsaglabā arī visi orgāni, ko uzskata par iespējamiem mērķa orgāniem, pamatojoties uz zināmajām testa vielas īpašībām.
1.4.3.6. Histopatoloģiskie izmeklējumi
Visu kontroles grupas un lielākās devas grupas dzīvnieku konservētajiem orgāniem un audiem jāizdara pilni histopatoloģiskie izmeklējumi. Ja lielākās devas grupā ir novērotas ar dozēšanu saistītas izmaiņas, minētie izmeklējumi jāpaplašina uz visu citu dozēšanas grupu dzīvniekiem.
Jāizmeklē visi makroskopiskie bojājumi.
Ja izmanto satelītgrupu, histopatoloģiskā izmeklēšana jāizdara audiem un orgāniem, kuros ietekmes konstatētas vielu saņēmušajām grupām.
2. DATI
Norāda datus par atsevišķiem dzīvniekiem. Turklāt visi dati jāapkopo tabulā, katrai testa grupai parādot dzīvnieku skaitu testa sākumā, dzīvnieku skaitu, kas testa laikā ir nobeigušies vai humānu apsvērumu dēļ nogalināti, un katras nobeigšanās vai humānas nogalināšanas laiku, dzīvnieku skaitu, kam novērotas toksicitātes pazīmes, novēroto toksicitātes pazīmju aprakstu, iekļaujot toksisko ietekmju sākuma laiku, ilgumu un smagumu, dzīvnieku skaitu, kam novēroti audu bojājumi, bojājumu veidus un dzīvnieku, kuriem parādījušies katra tipa bojājumi, procentuālo daudzumu.
Ja iespējams, skaitliskie rezultāti jānovērtē ar piemērotu un vispārpieņemtu statistikas metodi. Statistikas metodes un analizējamie dati jāizvēlas, plānojot pētījumu.
3. ZIŅOJUMU SASTĀDĪŠANA
TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, iekļauj šādu informāciju.
Testa dzīvnieki:
— izmantotā suga/līnija,
— dzīvnieku skaits, vecums un dzimums,
— izcelsme, turēšanas apstākļi, barība u. c.,
— atsevišķo dzīvnieku svars testa sākumā, nedēļas intervālos pēc tam un testa beigās.
Testa apstākļi:
— nesēja izvēles pamatojums, ja nesējs nav ūdens,
— devu izvēles pamatojums,
— sīkas ziņas par testa vielas preparāta/diētas sagatavošanu, iegūto koncentrāciju, stabilitāti un homogenitāti,
— sīkas ziņas par testa vielas ievadīšanu,
— testa vielas koncentrācijas (milj. daļas) barībā vai dzeramajā ūdenī pārrēķins faktiskajā dienas devā (mg/kg ķermeņa masas dienā) attiecīgā gadījumā,
— sīkas ziņas par barības un ūdens kvalitāti.
Rezultāti:
— ķermeņa svars/ķermeņa svara izmaiņas,
— barības patēriņš un attiecīgā gadījumā ūdens patēriņš,
— dati par toksisko atbildes reakciju pa dzimumiem un devu līmeņiem, iekļaujot toksicitātes pazīmes,
— klīnisko novērojumu specifika, smagums un ilgums (atgriezenība vai neatgriezenība),
— sensorās aktivitātes, tvēriena stipruma un kustību aktivitātes vērtējums,
— hematoloģiskie testi ar attiecīgajiem nulles līnijas lielumiem,
— klīniskās bioķīmijas testi ar attiecīgajiem nulles līnijas lielumiem,
— dati par ķermeņa svaru pēc nogalināšanas un orgānu svaru,
— autopsijas konstatācijas,
— visu histopatoloģisko konstatāciju sīki izstrādāts apraksts,
— absorbcijas dati, ja tie ir pieejami,
— attiecīgā gadījumā rezultātu statistiskā apstrāde.
Rezultātu izvērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
Šī metode ir analoga ESAO TG 407.
B.8. ATKĀRTOTĀS DEVAS (28 DIENU) TOKSICITĀTE (IEELPOŠANAS)
1. METODE
1.1. IEVADS
Ir lietderīgi, ja ir iepriekšēja informācija par vielas daļiņu lieluma sadalījumu, tvaika spiedienu, kušanas temperatūru, viršanas temperatūru, uzliesmošanas temperatūru un sprādzienbīstamību (attiecīgā gadījumā).
Skatīt arī vispārīgā ievada B daļas A iedaļu.
1.2. DEFINĪCIJA
Skatīt vispārīgā ievada B daļas B iedaļu.
1.3. STANDARTVIELAS
Nav.
1.4. TESTA METODES PRINCIPS
Uz vairākām izmēģinājumu dzīvnieku grupām katru dienu noteiktā laika posmā iedarbojas ar atšķirīgām testa vielas koncentrācijām, kopumā 28 dienas, vienas grupas dzīvnieki saņem vielu vienādā koncentrācijā. Ja izmanto nesēju, kas palīdz iegūt vajadzīgo testa vielas koncentrāciju atmosfērā, jābūt kontroles grupai, uz kuru iedarbojas nesējs. Testa laikā dzīvniekus katru dienu novēro un reģistrē toksiskuma pazīmes. Pārbaudes laikā mirušos dzīvniekus secē, beidzoties pārbaudei, secē arī izdzīvojušos dzīvniekus.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. TESTA METODES APRAKSTS
1.6.1. Sagatavošanas darbi
Dzīvniekus pirms testa vismaz piecas dienas pieradina pie izmitināšanas un barošanas apstākļiem. Veselus un jaunus dzīvniekus pirms testa pēc nejaušības principa sadala vajadzīgajā skaitā grupu. Ja nepieciešams, testa vielu var sajaukt ar piemērotu nesēju, kas palīdz iegūt vajadzīgo vielas koncentrāciju atmosfērā. Ja izmanto nesēju vai citu piedevu, kas atvieglo dozēšanu, ir jāpārliecinās, ka tās nav toksiskas. Vajadzības gadījumā var izmantot agrāk iegūtus datus.
1.6.2. Testa apstākļi
1.6.2.1. Izmēģinājumu dzīvnieki
Ja nav noteikts citādi, vēlams izmantot žurkas. Jāizmanto jauni un veseli parasti izmantojamu laboratorijas līniju dzīvnieki.
Uzsākot testus, dzīvnieku ķermeņa svara atšķirību diapazons nedrīkst pārsniegt ± 20 % no vidējā svara.
1.6.2.2. Skaits un dzimums
Katrā testu grupā jābūt vismaz 10 (pieciem sieviešu un pieciem vīriešu dzimuma) dzīvniekiem. Mātītes nedrīkst būt iepriekš dzemdējušas vai grūsnas. Ja dzīvnieku nonāvēšana paredzēta arī testa laikā, to skaits ir jāpalielina par to dzīvnieku skaitu, kuri tiks nonāvēti testa gaitā. Bez tam var izveidot papildu grupu no 10 dzīvniekiem (pa pieciem no katra dzimuma), kas 28 dienas saņem lielāko koncentrāciju, un 14 dienu laikā pēc apstrādes novēro, vai toksiskā iedarbība ir atgriezeniska, noturīga vai iestājas novēloti. Izmanto arī 10 kontroles dzīvnieku papildu grupu (piecus katra dzimuma dzīvniekus).
1.6.2.3. Koncentrācija, ar ko iedarbojas uz dzīvniekiem
Jāizmanto vismaz trīs dažādas koncentrācijas, kā arī jābūt kontroles grupai, bet, ja izmanto nesēju, jābūt arī kontroles dzīvniekiem, kas saņem tikai nesēju (tā lielākajā koncentrācijā). Izņemot apstrādi ar testa vielu, ar kontroles grupas dzīvniekiem rīkojas tāpat kā ar pārējiem dzīvniekiem. Jāizvēlas tāda lielākā koncentrācija, kam ir toksiska ietekme, bet kas neizraisa vai reti izraisa dzīvnieku nāvi. Viela vismazākajā koncentrācijā nedrīkst izraisīt toksisku ietekmi. Ja pieejami provizoriskie dati par to, ar kādu koncentrāciju saskaras cilvēki, vismazākajai koncentrācijai jābūt lielākai par to. Būtu vēlams, ka vidēji lielās koncentrācijas toksicitāte izpaužas minimāli. Ja izmanto vairākas vidējā intervāla koncentrācijas, to toksiskajai iedarbībai jābūt manāmi atšķirīgai. Mazās un vidēji lielās devas grupās, kā arī kontroles grupā jābūt zemai mirstībai, lai iegūtu statistiski nozīmīgus novērtēšanas rezultātus.
1.6.2.4. Iedarbības laiks
Iedarbības ilgums katru dienu ir sešas stundas, bet to var mainīt atkarībā no konkrētām prasībām.
1.6.2.5. Iekārta
Testos ar dzīvniekiem izmanto inhalācijas iekārtu, kas nodrošina dinamisku gaisa plūsmu ar vismaz 12 gaisa nomaiņām stundā, pietiekamu skābekļa koncentrāciju un vienmērīgu atmosfēras sadalījumu iedarbības laikā. Ja izmanto kameru, tās konstrukcijai jābūt tādai, kas neļauj dzīvniekiem drūzmēties un nodrošina maksimālo testa vielas iedarbību inhalācijas laikā. Lai kamerā būtu noturīga atmosfēra, izmēģinājumu dzīvnieku kopējais “tilpums” parasti nedrīkst pārsniegt 5 % no testa kameras tilpuma. Var izmantot kameras, kas ļauj vielai iedarboties tikai uz mutes un deguna dobumu, galvu vai visu ķermeni; divas pirmās minētās iespējami samazina vielas uzņemšanu citos veidos.
1.6.2.6. Novērošanas laika posms
Visā iedarbības un atveseļošanās laikā izmēģinājumu dzīvniekus katru dienu apskata un reģistrē toksiskuma pazīmes. Tiem reģistrē nāves iestāšanās brīdi, kā arī laiku, kad parādās vai izzūd toksiskuma pazīmes.
1.6.3. Procedūra
Dzīvniekus 28 dienu laikā katru dienu no piecām līdz septiņām dienām nedēļā pakļauj testa vielas iedarbībai. Papildu grupu dzīvnieki, kas paredzēti tālākai novērošanai, turpmākās 14 dienas nesaņem testa vielu, lai varētu izsekot tam, kā tie atveseļojas un cik ilgi saglabājas toksiskā ietekme. Testa laikā jānodrošina 22 ± 3 oC temperatūra.
Parasti jānodrošina 30 līdz 70 % relatīvais mitrums, lai gan atsevišķos gadījumos (piemēram, aerosolu testos) to nav iespējams panākt. Neliela negatīva spiediena (≤ 5 mm ūdens) uzturēšana kamerā novērsīs testa vielas izplūdi apkārtējā vidē. Iedarbības laikā dzīvniekus nebaro un nedzirda.
Jāizmanto dinamiska inhalācijas sistēma, kas nodrošina pienācīgu koncentrācijas kontroli. Lai noteiktu vajadzīgo vielas koncentrāciju, iesaka veikt priekšizmēģinājumu. Gaisa plūsma jānoregulē tā, lai visā inhalācijas kamerā būtu nodrošināti viendabīgi apstākļi. Sistēmai pēc iespējas ātrāk jānodrošina nemainīgi iedarbības apstākļi.
Jāmēra un jāuzrauga:
a) gaisa plūsmas ātrums (nepārtraukti);
b) testa vielas faktiskā koncentrācija inhalācijas zonā. Vielas koncentrācijas svārstības iedarbības laikā nedrīkst pārsniegt ± 15 % no vidējās vērtības. Tomēr dažu aerosolu gadījumā to nevar panākt, un tad ir pieļaujams plašāks svārstību diapazons. Visu testa laiku, katru dienu jācenšas nodrošināt pēc iespējas nemainīgu vielas koncentrāciju. Katru nedēļu jāveic vismaz viena aerosolu daļiņu lieluma analīze katrai testa grupai;
c) temperatūra un mitrums, ja iespējams, jāanalizē nepārtraukti.
Iedarbības laikā un pēc tās novērojumus veic un reģistrē sistemātiski; atsevišķi pieraksta datus par katru dzīvnieku. Dzīvniekus novēro katru dienu, reģistrējot toksiskuma pazīmes, kā arī to parādīšanās brīdi, smaguma pakāpi un ilgumu. Novērojot dzīvniekus, jāpievērš uzmanība izmaiņām, kas skar ādu un apmatojumu, acis, gļotādas, elpošanas orgānus, asinsriti, veģetatīvo un centrālo nervu sistēmu, somatomotoriku un uzvedības reakcijas. Dzīvnieki katru nedēļu jānosver. Ieteicams arī katru nedēļu noteikt barības patēriņu. Sistemātiska dzīvnieku novērošana ļauj testa laikā novērst dzīvnieku zudumus kanibālisma, audu autolīzes vai nepiemērotu turēšanas apstākļu dēļ. Beidzoties izmēģinājumam, visus izdzīvojušos dzīvniekus, izņemot papildu grupas dzīvniekus, secē. Mirstoši dzīvnieki un dzīvnieki, kam ir stipra baiļu sajūta vai sāpes, ja tie ievēroti, ir jāizņem, humāni jānogalina, un jāizdara autopsija.
Testa beigās visiem dzīvniekiem, arī kontroles dzīvniekiem, veic šādas pārbaudes:
i) hematoloģiskās pārbaudes, kas iekļauj vismaz hematokrīta, hemoglobīna koncentrācijas, eritrocītu skaita, leikocītu skaita un leikocitārās formulas noteikšanu, kā arī asins recēšanas mērījumus;
ii) klīnisko asins bioķīmiju, tai skaitā vismaz vienu aknu un nieru funkcijas parametru: seruma alanīna aminotransferāzes (agrāk pazīstama kā glutamīnpirovīnogskābes transamināze), seruma aspartāta aminotransferāzes (agrāk pazīstama kā glutamīnskābeņetiķskābes transamināze), urīnvielas slāpekļa, albumīna, asins kreatinīna, kopējā bilirubīna un kopējo seruma proteīnu mērījumus.
Citas analīzes, kas var būt nepieciešamas pienācīgai toksikoloģiskai novērtēšanai, paredz kalcija, fosfora, hlorīdu, nātrija, kālija, tukšas dūšas glikozes, lipīdu, hormonu, skābju/bāzu līdzsvara, methemoglobīna un holīnesterāzes aktivitātes noteikšanu.
Vajadzības gadījumā var veikt arī citus klīniskās bioķīmijas izmeklējumus, lai padziļināti izpētītu vielas toksisko ietekmi.
1.6.3.1. Autopsija
Visiem izmēģinājumu dzīvniekiem veic pilnu autopsiju. Vismaz aknas, nieres, virsnieru dziedzerus un sēkliniekus nosver uzreiz pēc sekcijas, lai tie nesažūtu. Orgāni un audi (elpošanas orgāni, aknas, nieres, liesa, sēklinieki, virsnieru dziedzeri, sirds, kā arī pārējie orgāni, ja tiem novēro makroskopiskus bojājumus vai izmaiņas izmēros) jāsaglabā piemērotā vidē turpmākai histopatoloģiskai izmeklēšanai. Plaušas jāizņem neskartas, tās jānosver un jāapstrādā ar piemērotu fiksatoru, kas ļauj saglabāt plaušu struktūru.
1.6.3.2. Histopatoloģiskā izmeklēšana
Histoloģiski izmeklē uzglabātos orgānus un audus, kas iegūti no lielākās koncentrācijas grupas dzīvniekiem un no kontroles dzīvniekiem. Ja testa viela lielākajā devā rada bojājumus orgānos un audos, tie jāizmeklē arī visiem pārējiem mazāku devu grupu dzīvniekiem. Histoloģiski izmeklējot papildu grupu dzīvniekus, īpašu uzmanību pievērš tiem orgāniem un audiem, kuros novērotas toksiskuma pazīmes pārējās apstrādes grupās.
2. DATI
Dati jāapkopo tabulā, norādot dzīvnieku skaitu katrā grupā testa sākumā un to dzīvnieku skaitu, kam ir novēroti vienādi bojājumi.
Visi iegūtie rezultāti jāizvērtē ar piemērotu statistikas metodi. Var izmantot jebkuru atzītu statistikas metodi.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šāda informācija:
— dzīvnieku suga, līnija, izcelsme, turēšanas un barošanas apstākļi, barība u. tml.,
— testa apstākļi:
— inhalācijas iekārtas apraksts, norādot tās konstrukciju, modeli, izmērus, gaisa avotu, aerosolu ģenerēšanas sistēmu, gaisa kondicionēšanas paņēmienu, izplūdes gaisa apstrādi un dzīvnieku izmitināšanas metodi izmēģinājumu kamerā, ja to izmanto. Jāapraksta iekārtas temperatūras, gaisa mitruma un vajadzības gadījumā aerosolu koncentrācijas noturīguma vai daļiņu lielumu sadalījuma noteikšanai.
— Iedarbības dati
— Šie dati jāapkopo tabulā, norādot vidējos lielumus, kā arī svārstību diapazonu (piemēram, standartnovirzi) un, ja iespējams, minot:
—a) gaisa plūsmas ātrumu caur inhalācijas iekārtu;
b) gaisa temperatūru un mitrumu;
c) nominālo koncentrāciju (inhalācijas iekārtā ievadītais testa vielas kopējais daudzums, kas izdalīts ar gaisa tilpumu);
d) nesēja veidu, ja to izmanto;
e) faktiskās koncentrācijas testa elpošanas zonā;
f) masas vidējo aerodinamisko diametru (MVAD) un ģeometrisko standartnovirzi (ĢSN);
— datus par toksiskajām reakcijām atkarībā no dzimuma un koncentrācijas,
— nāves iestāšanās brīdi testa laikā vai norādi, ka dzīvnieki ir izdzīvojuši,
— toksiskās ietekmes vai citas ietekmes raksturojumu; netoksisko devas līmeni,
— atsevišķu anomālu pazīmju parādīšanās brīdi un to tālāko attīstību,
— barības patēriņu un ķermeņa svara izmaiņas,
— hematoloģiskos izmeklējumus un to rezultātus,
— klīniskās bioķīmijas izmeklējumus un to rezultātus,
— autopsijas konstatācijas,
— visu histopatoloģisko konstatāciju sīki izstrādātu aprakstu,
— rezultātu statistisko apstrādi, ja iespējams,
— rezultātu iztirzājumu,
— rezultātu interpretāciju.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļas D iedaļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļas E iedaļu.
B.9. ATKĀRTOTĀS DEVAS (28 DIENU) TOKSICITĀTE (ĀDAS)
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļas A iedaļu.
1.2. DEFINITIONS
Skatīt vispārīgā ievada B daļas B iedaļu.
1.3. STANDARTVIELAS
Nav.
1.4. TESTA METODES PRINCIPS
Testa vielu dažādās devās katru dienu 28 dienu laikā uztriepj uz ādas vairāku grupu izmēģinājumu dzīvniekiem; vienas grupas dzīvnieki saņem vienādu devu. Vielas pielietošanas laikā dzīvniekus katru dienu novēro un reģistrē toksiskuma pazīmes. Pārbaudes laikā mirušos dzīvniekus secē, beidzoties pārbaudei, secē arī izdzīvojušos dzīvniekus.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. TESTA METODES APRAKSTS
1.6.1. Sagatavošanas darbi
Dzīvniekus pirms testa vismaz piecas dienas pieradina pie izmitināšanas un barošanas apstākļiem. Veselus un jaunus dzīvniekus pirms testa pēc nejaušības principa sadala apstrādes un kontroles grupās. Neilgi pirms testa nocērp apmatojumu uz izmēģinājumu dzīvnieku muguras. Ādu var arī noskūt, bet tas jādara 24 stundas pirms testa. Parasti cirpšanu vai skūšanu apmēram ik pēc nedēļas atkārto. Cērpot vai skujot apmatojumu, jāuzmanās, lai nenobrāztu ādu. Testa vielas uzlikšanai jāsagatavo ne mazāk kā 10 % no ķermeņa virsmas. Lemjot par to, cik lielai ādas virsmai jābūt brīvai no apmatojuma, lai to apstrādātu ar vielu, ņem vērā dzīvnieku svaru. Pārbaudot cietas vielas, kuras vajadzības gadījumā var saberzt pulverī, testa viela jāsamitrina ar pietiekamu daudzumu ūdens vai, ja nepieciešams, ar piemērotu nesēju, lai tai būtu laba saskare ar ādu. Testa šķidrumus parasti neatšķaida. Parasti vielu pielieto vienreiz dienā piecas līdz septiņas dienas nedēļā.
1.6.2. Testa apstākļi
1.6.2.1. Izmēģinājumu dzīvnieki
Var izmantot pieaugušas žurkas, trušus vai jūrascūciņas. Var izmantot arī citas sugas dzīvniekus, bet šī izvēle jāpamato.
Uzsākot testus, dzīvnieku ķermeņa svara svārstības nedrīkst pārsniegt ± 20 % no vidējā svara.
1.6.2.2. Dzīvnieku skaits un dzimums
Vienu un to pašu devas līmeni izmanto vismaz 10 (pieciem sieviešu un pieciem vīriešu dzimuma) dzīvniekiem ar veselu ādu. Mātītes nedrīkst būt iepriekš dzemdējušas vai grūsnas. Ja dzīvnieku nonāvēšana paredzēta arī testa laikā, to skaits ir jāpalielina par to dzīvnieku skaitu, kuri tiks nogalināti testa gaitā. Turklāt 10 dzīvnieku papildu grupai (pieci katra dzimuma dzīvnieki) var ievadīt augsta līmeņa devu 28 dienas un novērot 14 dienas pēc vielas ievadīšanas attiecībā uz toksisko ietekmju atgriezeniskumu, noturību vai aizkavētu parādīšanos. Izmanto arī 10 kontroles dzīvnieku papildu grupu (piecus katra dzimuma dzīvniekus).
1.6.2.3. Izmantotās devas
Jāizmanto vismaz trīs devas, kā arī jābūt kontrolei, un, ja lieto nesēju, kontroles dzīvniekiem jāsaņem tikai nesējs. Iedarbības laikam jābūt vismaz sešas stundas dienā. Testa vielu pielieto katru dienu vienādā laikā un devas periodiski pielāgo (ik pēc nedēļas vai divām nedēļām), lai tās būtu nemainīgas attiecībā pret dzīvnieku ķermeņa svaru. Ar kontroles dzīvniekiem jārīkojas tāpat kā ar pārējiem dzīvniekiem, tie tikai nesaņem testa vielu. Ja izmanto nesēju, kas atvieglo dozēšanu, kontroles dzīvnieki saņem tādu pašu daudzumu nesēja kā dzīvnieki, kuri saņem lielāko testa vielas devu. Jāizvēlas tāda lielākā deva, kas ir toksiska, bet kas neizraisa vai reti izraisa dzīvnieku nāvi. Vielas mazākā deva nedrīkst izraisīt toksiskuma pazīmes. Ja pieejami provizoriskie dati par to, ar kādām devām saskaras cilvēki, vismazākajai devai jābūt lielākai par tām. Būtu vēlams, ka vidēji lielās devas toksiskums izpaužas minimāli. Ja izmanto vairākas vidējā intervāla devas, to toksiskajai iedarbībai jābūt manāmi atšķirīgai. To dzīvnieku grupās, kas saņem mazo un vidēji lielo devu, jābūt zemam mirstības līmenim, lai varētu statistiski novērtēt rezultātus.
Ja testa vielas lietošana izraisa smagu ādas kairinājumu, tās koncentrācija jāsamazina, un tāpēc var samazināties vai neizpausties citas toksiskas reakcijas, lietojot lielo devu. Turklāt, ja āda ir nopietni bojāta, var gadīties, ka ir jāpārtrauc tests un jāizvēlas mazāka koncentrācija.
1.6.2.4. Pieļaujamības tests
Ja iepriekšējā pārbaudē izmanto 1 000 mg/kg devu vai vēl lielāku devu, kas atbilst devai, ar kādu parasti saskaras cilvēki, ja tāda ir zināma, un nenovēro toksisku ietekmi, var uzskatīt, ka turpmākā pārbaude nav nepieciešama.
1.6.2.5. Novērošanas laika posms
Izmēģinājumu dzīvniekus katru dienu novēro un reģistrē toksiskuma pazīmes. Tiem reģistrē nāves iestāšanās brīdi un laiku, kad parādās vai izzūd toksiskuma pazīmes.
1.6.3. Procedūra
Katru dzīvnieku tur atsevišķā būrī. Dzīvnieki parasti saņem testa vielu septiņas dienas nedēļā 28 dienu laikā. Dzīvnieki papildu grupās, kas paredzēti tālākai novērošanai, turpmākās 14 dienas nesaņem testa vielu, lai varētu izsekot tam, kā tie atveseļojas un cik ilgi saglabājas toksiskā iedarbība. Iedarbības ilgums ir vismaz sešas stundas dienā.
Testa vielu vienmērīgi uztriepj uz ādas, kuras platība veido apmēram 10 % no kopējās ķermeņa virsmas. Ja vielas ir ļoti toksiskas, apstrādājamās ādas laukumu var samazināt, bet tam jābūt pietiekami lielam, un viela jāuztriepj pēc iespējas plānāk un vienmērīgāk.
Testa vielas saskari ar ādu iedarbības laikā nodrošina ar poraina marles pārsēja un nekairinoša plākstera palīdzību. Apstrādātā vieta pēc tam vēl jāpārklāj tā, lai nostiprinātu marles pārsēju ar testa vielu un lai dzīvnieki nevarētu to norīt. Lai testa viela nenonāktu barības vadā, var daļēji ierobežot dzīvnieku kustību, taču pilnīga imobilizācija nav ieteicama. Kā alternatīvu var izmantot apkakles veida aizsargierīci.
Beidzoties iedarbības laikam, testa vielas atlikumu, ja iespējams, noņem ar ūdeni vai izmanto kādu citu piemērotu ādas notīrīšanas paņēmienu.
Visus dzīvniekus novēro katru dienu, reģistrējot toksiskuma pazīmes, to parādīšanās brīdi, smaguma pakāpi un ilgumu. Novērojot dzīvniekus, jāpievērš uzmanība izmaiņām, kas skar to ādu un apmatojumu, acis un gļotādas, kā arī elpošanas orgānus, asinsriti, veģetatīvo un centrālo nervu sistēmu, somatomotoriku un uzvedības reakcijas Dzīvnieki katru nedēļu jānosver. Ieteicams arī katru nedēļu noteikt barības patēriņu. Sistemātiska dzīvnieku novērošana ļauj testa laikā novērst dzīvnieku zudumus kanibālisma, audu autolīzes vai nepiemērotu turēšanas apstākļu dēļ. Beidzoties izmēģinājumam, visus izdzīvojušos dzīvniekus, izņemot papildu grupas dzīvniekus, secē. Mirstoši dzīvnieki un dzīvnieki, kam ir stipra baiļu sajūta vai sāpes, ja tie ievēroti, ir jāizņem, humāni jānogalina, un jāizdara autopsija.
Testa beigās visiem dzīvniekiem, arī kontroles dzīvniekiem, veic šādas pārbaudes:
1) hematoloģiskās pārbaudes, kas paredz vismaz hematokrīta, hemoglobīna koncentrācijas, eritrocītu skaita, leikocītu skaita un leikocitārās formulas noteikšanu, kā arī asins recēšanas mērījumus;
2) klīnisko asins bioķīmiju, tai skaitā vismaz vienu aknu un nieru funkcijas parametru: seruma alanīna aminotransferāzes (agrāk pazīstama kā glutamīnpirovīnogskābes transamināze), seruma aspartāta aminotransferāzes (agrāk pazīstama kā glutamīnskābeņetiķskābes transamināze), urīnvielas slāpekļa, albumīna, asins kreatinīna, kopējā bilirubīna un kopējo seruma proteīnu mērījumus.
Citas analīzes, kas var būt nepieciešamas pienācīgai toksikoloģiskai novērtēšanai, paredz kalcija, fosfora, hlorīdu, nātrija, kālija, tukšas dūšas glikozes, lipīdu, hormonu, skābju/bāzu līdzsvara, methemoglobīna un holīnesterāzes aktivitātes noteikšanu.
Vajadzības gadījumā var veikt arī citus klīniskās bioķīmijas izmeklējumus, lai padziļināti izpētītu vielas novēroto ietekmi.
1.6.4. Autopsija
Visiem izmēģinājumu dzīvniekiem veic pilnu autopsiju. Vismaz aknas, nieres, virsnieru dziedzerus un sēkliniekus nosver uzreiz pēc sekcijas, lai novērstu sažūšanu. Orgāni un audi, proti, vesela un apstrādāta āda, aknas, nieres, liesa, sēklinieki, virsnieru dziedzeri, sirds un mērķorgāni (orgāni, kuros novēroti makroskopiski bojājumi vai izmaiņas izmēros), jāsaglabā piemērotā vidē turpmākai histopatoloģiskai izmeklēšanai.
1.6.5. Histopatoloģiskā izmeklēšana
Histoloģiski izmeklē saglabātos orgānus un audus, kas iegūti no lielās devas grupas un no kontroles grupas dzīvniekiem. Ja testa viela lielākajā devā rada bojājumus orgānos un audos, tie jāizmeklē arī visiem pārējiem mazāku devu saņēmušo grupu dzīvniekiem. Histoloģiski izmeklējot papildu grupas dzīvniekus, īpašu uzmanību pievērš tiem orgāniem un audiem, kuros novērotas toksiskuma pazīmes pārējās grupās pēc apstrādes.
2. DATI
Dati jāapkopo tabulā, norādot dzīvnieku skaitu katrā grupā testa sākumā un to dzīvnieku skaitu, kam ir novēroti vienādi bojājumi.
Visi iegūtie rezultāti jāizvērtē ar piemērotu statistikas metodi. Var izmantot jebkuru atzītu statistikas metodi.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šāda informācija:
— dati par dzīvniekiem (suga, līnija, izcelsme, turēšanas apstākļi, uzturs u. tml.),
— testa apstākļi (iekļaujot pārsēja veidu – okluzīvs vai neokluzīvs),
— devu līmeņi (jānorāda arī nesējs, ja tādu izmanto) un koncentrācijas,
— netoksiskas devas līmenis, ja var noteikt,
— dati par toksiskajām reakcijām atkarībā no dzimuma un devas,
— nāves iestāšanās brīdis testa laikā vai norāde, ka dzīvnieki ir izdzīvojuši,
— toksiska vai cita ietekme,
— katras anomālas pazīmes parādīšanās brīdis un tālākā attīstība,
— barības patēriņš un ķermeņa svara izmaiņas,
— hematoloģiskie izmeklējumi un to rezultāti,
— klīniskās bioķīmijas izmeklējumi un to rezultāti,
— autopsijas konstatācijas,
— visu histopatoloģisko konstatāciju sīki izstrādāts apraksts,
— rezultātu statistiskā apstrāde, ja iespējams,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļas D iedaļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļas E iedaļu.
B.10. MUTAGENITĀTE – ZĪDĪTĀJU HROMOSOMU IZMAIŅU TESTS IN VITRO
1. METODE
Šī metode ir ESAO TG 473 metodes “Zīdītāju hromosomu izmaiņu tests in vitro” (1997) kopija.
1.1. IEVADS
Pēc hromosomu izmaiņu testa in vitro nosaka vielas, kas zīdītāju šūnu kultūrās rada hromosomu struktūras izmaiņas (1) (2) (3). Struktūras izmaiņas var būt divu veidu – hromosomu izmaiņas vai hromatīdu izmaiņas. Lielākā daļa ķīmisko mutagēnu izraisa hromatīdu izmaiņas, tomēr notiek arī hromosomu izmaiņas. Poliploīdijas palielināšanās var liecināt, ka ķīmiskā viela, iespējams, rada hromosomu skaita izmaiņas. Taču šī metode nav paredzēta šādu izmaiņu noteikšanai šūnās, un parasti to tādām vajadzībām neizmanto. Hromosomu mutācijas un ar tām saistītās ģenētiskās pārmaiņas ir daudzu cilvēka ģenētisko slimību cēlonis, turklāt ir pierādīts, ka hromosomu mutācijas un ar tām saistītās pārmaiņas somatiskajās šūnās rada onkogēnu un tumorsupresoro gēnu izmaiņas, izraisot vēzi cilvēkiem un izmēģinājumu dzīvniekiem.
Hromosomu izmaiņu testam in vitro var izmantot izveidotas šūnu līnijas, šūnu celmus vai primāro šūnu kultūras. Testam izmantojamās šūnas izvēlas pēc to augšanas spējām kultūrā, kariotipa stabilitātes, hromosomu skaita, hromosomu daudzveidības un hromosomu spontāno izmaiņu biežuma.
Testiem, ko izdara in vitro, metaboliskai aktivācijai parasti jāizmanto eksogēns avots. Šāda metaboliskas aktivācijas sistēma nevar pilnībā imitēt apstākļus zīdītāju organismā in vivo. Būtu jāpievērš uzmanība tam, lai testa laikā novērstu apstākļus, kuros iegūtie pozitīvie rezultāti neliecina par testa vielām piemītošo mutagenitāti, bet kuru cēlonis ir vides pH izmaiņas, osmoze vai paaugstināta citotoksicitāte (4) (5).
Šo testu izmanto zīdītājiem potenciāli mutagēnu un kancerogēnu vielu skrīningam. Daudzi savienojumi, kam šis tests ir pozitīvs, ir zīdītājiem kancerogēni; tomēr pilnīgas šā testa pozitīva rezultāta korelācijas ar vielas kancerogēnajām īpašībām nav. Korelācija atkarīga no ķimikāliju grupas, pie kuras pieder testa viela, un kļūst skaidrs, ka ar šo testu neatklāj tādus kancerogēnus, kuri tieši nebojā DNS, bet kuriem piemīt cita veida kaitīgā iedarbība.
Skatīt arī vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Hromatīdu tipa izmaiņas: hromosomas struktūras bojājumi, kas izpaužas kā viena hromatīda pārrāvums vai hromatīda pārrāvums un tā rekombinācija.
Hromatīdu tipa izmaiņas: hromosomas struktūras bojājumi, kas izpaužas kā abu hromatīdu pārrāvums vai pārrāvums un rekombinācija vienā un tajā pašā vietā.
Endoreduplikācija: process, kurā pēc DNS replikācijas S perioda nenotiek šūnas kodola mitoze, bet sākas nākamais S periods. Rezultātā izveidojas hromosomas ar 4, 8, 16,… hromatīdiem.
Pārrāvums: ahromatisks bojājums ar nelielu hromatīdu nobīdi, kas ir mazāka par viena hromatīda platumu.
Mitotiskais indekss: metafāzē esošu šūnu skaita attiecība pret šūnu kopējo skaitu populācijā; raksturo šūnu populācijas vairošanās spēju.
Hromosomu skaita izmaiņas: testam izmantojamajām šūnām raksturīgā parastā hromosomu skaita izmaiņas.
Poliploīds hromosomu skaits: haploīda hromosomu skaita (n) daudzkārtnis, izņemot hromosomu diploīdu skaitu (t. i., 3n, 4n utt.).
Struktūras izmaiņas: hromosomu struktūras izmaiņas, kas redzamas mikroskopā šūnu dalīšanās metafāzē, ko novēro kā trūkstošus posmus, fragmentus, iekšējas vai savstarpējas rekombinācijas.
1.3. TESTA METODES PRINCIPS
Šūnas pakļauj testa vielas iedarbībai gan ar metabolisku aktivāciju, gan bez tās. Noteiktos laika intervālos pēc testa vielas iedarbības uz šūnu kultūrām, tās apstrādā ar kādu metafāzi apturošu vielu (piemēram, Colcemid® vai kolhicīnu), šūnas metafāzē savāc, iekrāso un mikroskopiski analizē hromosomu izmaiņas.
1.4. TESTA METODES APRAKSTS
1.4.1. Sagatavošana
1.4.1.1. Šūnas
Var izmantot dažādas šūnu līnijas, celmus vai primārās šūnu kultūras (piemēram, Ķīnas kāmju fibroblastus, cilvēku un citu zīdītāju perifēro asiņu limfocītus).
1.4.1.2. Barotnes un kultivēšanas apstākļi
Kultūru uzturēšanai lieto piemērotas barotnes un ievēro atbilstošus kultivēšanas apstākļus (trauki kultūrām, CO2 koncentrācija, temperatūra un mitrums). Stabilām šūnu līnijām un celmiem pārbauda hromosomu skaita stabilitāti un mikoplazmas radīto piesārņojumu; piesārņotas šūnu kultūras neizmanto. Jābūt zināmam šūnu cikla ilgumam un šūnu kultivēšanas apstākļiem.
1.4.1.3. Kultūru sagatavošana
Stabilas šūnu līnijas un celmi: šūnas pavairo no kultūru krājumiem, ko izsēj barotnē ar tādu blīvumu, lai līdz novākšanas laikam šūnu kultūras nesaplūstu, un inkubē 37 oC temperatūrā.
Limfocīti: ar antikoagulantu (piemēram, heparīnu) apstrādātas asinis vai izdalītus limfocītus, kas iegūti no veseliem indivīdiem, pievieno barotnei, kura satur mitogēnu (piemēram, fitohemaglutinīnu), un inkubē 37 oC temperatūrā.
1.4.1.4. Metabolisma aktivācija
Šūnas pakļauj testa vielas iedarbībai gan piemērotas metabolisma aktivācijas sistēmas klātbūtnē, gan bez tās. Plašāk izmantojamā aktivācijas sistēma ir ar kofaktoru papildināta pēcmitohondriskā frakcija (S9), ko pagatavo no grauzēju aknām, kas apstrādātas ar enzīmstimulējošām vielām, piemēram, Aroclor 1254 (6) (7) (8) (9) vai fenobarbitona un β-naftoflavona maisījumu (10) (11) (12).
Pēcmitahondrālo frakciju parasti izmanto pēdējā testa barotnē koncentrācijā no 1 līdz 10 tilp. %. Metabolisma aktivācijas sistēmas stāvoklis var būt atkarīgs no ķimikāliju grupas, pie kuras pieder testa viela. Dažos gadījumos pēcmitohondriskā frakcija var būt jālieto vairākās koncentrācijās.
Endogēnai aktivācijai var izmantot dažādus paņēmienus, arī ar gēnu inženierijas metodēm iegūtas šūnu līnijas, kas izdala īpašus aktivācijas enzīmus. Izmantojamo šūnu līniju izvēlei jābūt zinātniski pamatotai (piemēram, ar citohroma P450 izoenzīma nepieciešamību testa vielas metabolismam).
1.4.1.5. Testa viela/preparāts
Pirms šūnu apstrādes ar cietām testa vielām tās vispirms izšķīdina vai suspendē piemērotos šķīdinātājos vai nesējos un, ja vajadzīgs, atšķaida. Šķidras testa vielas var tieši pievienot testa sistēmās un/vai pirms šūnu apstrādes atšķaidīt. Ja dati par testa vielu preparātu stabilitāti rāda, ka tos uzglabāt nevar, pārbaudēm izmanto svaigi pagatavotus preparātus.
1.4.2 Testa apstākļi
1.4.2.1. Šķīdinātājs/nesējs
Šķīdinātājs vai nesējs nedrīkst būt reaģētspējīgs ar testa vielu, un tam jābūt saderīgam ar šūnu dzīvotspēju un S9 aktivitāti. Izmantojot kādus citus, mazāk izpētītus šķīdinātājus vai nesējus, jābūt datiem par to saderību. Vienmēr, kad tas iespējams, ieteicams vispirms izmantot ūdeni saturošus šķīdinātājus vai nesējus. Pārbaudot ūdens vidē nestabilas vielas, izmanto bezūdens organiskos šķīdinātājus. Ūdeni var atdalīt, pievienojot molekulāros sietus.
1.4.2.2. Pārbaudāmās koncentrācijas
Starp kritērijiem, kas jāņem vērā, nosakot testa vielas lielāko koncentrāciju, ir tās citotoksicitāte, šķīdība testa sistēmā, kā arī ietekme uz pH izmaiņām un osmoze.
Citotoksicitāti nosaka galvenajā eksperimentā ar metabolisma aktivāciju un bez tās, izmantojot piemērotus šūnu integritātes un augšanas rādītājus, piemēram, saplūšanas pakāpi, dzīvotspējīgo šūnu skaitu vai mitotisko indeksu. Var būt lietderīgi iepriekšējā eksperimentā noteikt vielas citotoksicitāti un šķīdību.
Būtu jāizmanto vismaz trīs analizējamas koncentrācijas. Ja viela ir citotoksiska, koncentrāciju intervālā jāietver maksimāli toksiskās koncentrācijas, kā arī vielas maztoksiskās vai netoksiskās koncentrācijas; parasti koncentrācijām vajadzētu atšķirties ne vairāk kā 2 līdz √10 reizes. Šūnu novākšanas laikā pie lielākās koncentrācijas vajadzētu būt novērojamam būtiskam saplūšanas pakāpes, dzīvotspējīgo šūnu skaita un mitotiskā indeksa samazinājumam (vairāk nekā par 50 %). Mitotiskais indekss citotoksisko vai citostatisko iedarbību raksturo tikai netieši un ir atkarīgs no laika, kas pagājis pēc šūnu apstrādes ar testa vielu. Tomēr mitotiskā indeksa izmantošana ir pieņemama suspensiju kultūrām, kurās citu toksicitāti raksturojošu rādītāju noteikšana var būt apgrūtināta vai pat neiespējama. Kā papildu informāciju var izmantot datus par šūnas cikla kinētiku, piemēram, vidējo ģenerācijas ilgumu (AGT), lai gan tas ir kopējais vidējais rādītājs, kas ne vienmēr liecina par aizkavētu apakšpopulāciju pastāvēšanu, turklāt pat pavisam neliela vidējā ģenerācijas ilguma palielināšanās var būt saistīta ar būtisku tā laika aizturi, pēc kura optimāli novērojamas hromosomu izmaiņas.
Vielām ar relatīvi nelielu citotoksicitāti maksimālajai testa koncentrācijai vajadzētu būt 5 μl/ml, 5 mg/ml vai 0,01 M, no kurām izvēlas mazāko.
Relatīvi nešķīstošām vielām, kuras nav toksiskas koncentrācijās, kas mazākas par piesātināta šķīduma koncentrāciju, lielākajai pārbaudāmajai devai vajadzētu būt tādai koncentrācijai, kas pārsniedz šķīdības robežu galīgās kultūras barotnē apstrādes perioda beigās. Dažkārt (piemēram, gadījumos, kad viela ir toksiska tikai koncentrācijās, kas pārsniedz piesātināta šķīduma koncentrāciju) ieteicams testam izmantot vielas vairākas koncentrācijas, pie kurām novērojama tās izgulsnēšanās. Var būt lietderīgi novērtēt vielas šķīdību tās apstrādes sākumā un beigās, jo testa sistēmā šķīdība var mainīties šūnu, S9 seruma un citu faktoru ietekmē. Neizšķīdušas vielas klātbūtni var noteikt vizuāli. Neizšķīdušas vielas klātbūtne nedrīkst traucēt skaitīšanu.
1.4.2.3. Negatīvas un pozitīvas kontroles
Katrā eksperimentā gan ar metabolisma aktivāciju, gan bez tās vienlaicīgi iekļauj pozitīvu un negatīvu (šķīdinātāja vai nesēja) kontroli. Izmantojot metabolisma aktivāciju, pozitīvai kontrolei izvēlas vielu, kuras mutagēnai iedarbībai ir vajadzīga aktivācija.
Pozitīvai kontrolei izmanto zināmu elastogēnu koncentrācijās, kuras dod reproducējamu un nosakāmu palielinājumu virs fona līmeņa, kas skaidri parāda testa sistēmas jutību.
Pozitīvās kontroles vielu koncentrācijas izvēlas tā, lai to iedarbība būtu skaidri redzama, tomēr kodēto priekšmetstikliņu identitāti to nolasītājs nevarētu konstatēt uzreiz. Pie pozitīvās kontroles vielām pieder:
|
Metabolisma aktivācijas apstākļi |
Viela |
CAS Nr. |
Einecs Nr. |
|
Bez eksogēnas metabolisma aktivācijas |
metilmetānsulfonāts |
66-27-3 |
200-625-0 |
|
etilmetānsulfonāts |
62-50-0 |
200-536-7 |
|
|
nitrozoetilurīnviela |
759-73-9 |
212-072-2 |
|
|
mitomicīns C |
50-07-7 |
200-008-6 |
|
|
4-nitrohinolīn-N-oksīds |
56-57-5 |
200-281-1 |
|
|
Ar eksogēnu metabolisma aktivāciju |
benozpirēns |
50-32-8 |
200-028-5 |
|
ciklofosfamīds ciklofosfamīda monohidrāts |
50-18-0 6055-19-2 |
200-015-4 |
Pozitīvai kontrolei var izmantot arī citas piemērotas vielas. Ja iespējams, pozitīvai kontrolei izmanto savienojumus, kas pieder pie atbilstošām vielu grupām.
Negatīvu kontroli, kur apstrādes barotnē ietilpst tikai šķīdinātājs vai nesējs, iekļauj visās šūnu novākšanas reizēs, un ar to rīkojas tieši tāpat, kā ar apstrādes kultūrām. Turklāt jāizmanto arī tukšie mēģinājumi, izņemot gadījumus, kad ir iepriekš iegūti vēsturiski kontroldati, kas skaidri parāda, ka izvēlētajam šķīdinātājam nav kaitīgas mutagēnas iedarbības.
1.4.3. Procedūra
1.4.3.1. Iedarbība ar testa vielu
Šūnas, kas vairojas, apstrādā ar testa vielu gan piemērotas metabolisma aktivācijas sistēmas klātbūtnē, gan bez tās. Limfocītus apstrādā aptuveni 48 stundas pēc mitozes stimulācijas.
1.4.3.2. Dublikātu kultūras parasti izmanto visām koncentrācijām, un tās noteikti jāizmanto negatīvas/šķīdinātāja kontroles kultūrām. Ja iepriekš iegūtie vēsturiskie dati liecina, ka dublikātu kultūru atšķirības ir minimālas (13) (14), pie katras koncentrācijas var izmantot tikai vienu kultūru.
Gāzveida vai gaistošu vielu pārbaudēm jāizmanto atbilstošas metodes, piemēram, kultivēšana hermētiski noslēgtos traukos (15) (16).
1.4.3.3. Kultūru novākšanas laiks
Pirmajā eksperimentā šūnas 3–6 stundas pakļauj testa vielas iedarbībai gan ar metabolisma aktivāciju, gan bez tās un ņem paraugu pēc laika perioda, kas atbilst aptuveni 1,5 normāliem šūnas cikliem pēc apstrādes sākuma (12). Ja šādi iegūst negatīvus rezultātus gan ar metabolisma aktivāciju, gan bez tās, izdara papildu eksperimentu bez aktivācijas, ar testa vielu nepārtraukti apstrādājot kultūru līdz parauga ņemšanai, ko veic pēc laika perioda, kas atbilst aptuveni 1,5 normāliem šūnas cikliem. Dažas ķīmiskas vielas var labāk noteikt, ja to apstrādes/paraugu ņemšanas laiks ir ilgāks par 1,5 šūnas cikliem. Negatīvi rezultāti, kas iegūti ar metabolisma aktivāciju, katrā konkrētā gadījumā ir jāapstiprina. Gadījumos, kad negatīvu rezultātu apstiprināšanu uzskata par nevajadzīgu, tas ir jāpamato.
1.4.3.4. Hromosomu sagatavošana
Šūnu kultūras 1–3 stundas pirms novākšanas apstrādā ar Colcemid® vai kolhicīnu. Hromosomu preparēšanai paredzētās šūnu kultūras novāc un apstrādā katru atsevišķi. Hromosomu preparēšana ietver šūnu hipotonisku apstrādi, fiksāciju un iekrāsošanu.
1.4.3.5. Analīze
Visus priekšmetstikliņus, arī pozitīvas un negatīvas kontroles priekšmetstikliņus, pirms mikroskopiskās analīzes kodē. Tā kā fiksācijā bieži tiek bojātas metafāzes šūnas, zaudējot hromosomas, uzskaitāmajās šūnās jābūt centromēru skaitam, kas vienāds ar modālo skaitli ≠ 2 visiem šūnu tipiem. Uz katru koncentrāciju un kontroli jāuzskaita vismaz 200 labi sadalījušās metafāzes, ko sadala līdzīgās daļās starp dublikātiem gadījumos, kad tos izmanto. Šo skaitli var samazināt gadījumos, kad novēro lielu skaitu izmaiņu.
Tā kā testa mērķis ir noteikt hromosomu struktūras izmaiņas, ir jāatzīmē poliploīdija un endoreduplikācija gadījumos, kad šīs parādības tiek novērotas.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Eksperimenta vienība ir šūna, tāpēc jānovērtē to šūnu daļa, kurās radušās hromosomu struktūras izmaiņas. Uzskaita dažāda veida hromosomu struktūras izmaiņas, norādot to skaitu un biežumu gan eksperimentālajām, gan kontrolei izmantojamajām kultūrām. Pārrāvumus uzskaita un norāda atsevišķi, bet kopējā izmaiņu biežumā tos parasti neiekļauj.
Norāda arī vienlaicīgi veiktos pasākumus citotoksiskuma novēršanai visām apstrādātajām un negatīvas kontroles kultūrām, ko izmanto galvenajam izmaiņu noteikšanas eksperimentam.
Norāda datus par atsevišķām kultūrām. Bez tam visus datus apkopo tabulas veidā.
Attiecībā uz pozitīvas reakcijas verificēšanu nav noteiktu prasību. Apšaubāmus rezultātus pārbauda, veicot atkārtotu pārbaudi, turklāt papildu testiem vēlams mainīt eksperimenta apstākļus. Negatīvu rezultātu apstiprināšana aprakstīta 1.4.3.3. punktā. Eksperimenta apstākļu parametru izmaiņas novērtē un nosaka kontroles eksperimentos. Eksperimenta parametri, kurus var mainīt, ir pārbaudāmo koncentrāciju atšķirības un metabolisma aktivācijas apstākļi.
2.2. REZULTĀTU NOVĒRTĒŠANA UN INTERPRETĀCIJA
Pozitīvu rezultātu nosaka pēc vairākiem kritērijiem, pie kuriem pieder tādi rādītāji kā ar koncentrācijas izmaiņām saistītā to šūnu skaita vai reproducējamā skaita palielināšanās, kurās ir hromosomu izmaiņas. Vispirms rezultātus izvērtē bioloģiski. Kā palīglīdzekli pārbaužu rezultātu izvērtēšanai var izmantot statistikas metodes (3) (13). Statistiskais nozīmīgums nedrīkst būt vienīgais faktors, pēc kā nosaka pozitīvu atbildes reakciju.
Poliploīdo šūnu skaita palielināšanās var norādīt uz to, ka testa viela, iespējams, kavē mitotiskos procesus un rada hromosomu skaita izmaiņas. Tādu šūnu skaita palielināšanās, kurās ir endoreduplicētas hromosomas, var norādīt uz to, ka testa viela, iespējams, kavē šūnu cikla attīstību (17) (18).
Uzskata, ka testa viela šajā sistēmā nav mutagēna, ja tās pārbaudes rezultāti neatbilst iepriekšminētajiem kritērijiem.
Lai gan lielākajā daļā eksperimentu iegūst skaidri pozitīvus vai negatīvus rezultātus, tomēr dažkārt pēc iegūtajiem datiem nevar noteikti spriest par testa vielas aktivitāti. Turklāt rezultāti var būt nedroši vai apšaubāmi arī neatkarīgi no eksperimenta atkārtojumu skaita.
Zīdītāju hromosomu izmaiņu testā in vitro iegūti pozitīvi rezultāti liecina, ka testa viela rada zīdītāju somatisko šūnu hromosomu struktūras izmaiņas. Negatīvi rezultāti norāda, ka testa apstākļos testa viela nerada zīdītāju somatisko šūnu hromosomu struktūras izmaiņas.
3. ZIŅOJUMU SASTĀDĪŠANA
TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
Šķīdinātājs/nesējs:
— nesēja izvēles pamatojums,
— testa vielas stabilitāte šķīdinātājā/nesējā, ja tā ir zināma.
Šūnas:
— šūnu veids un izcelsme,
— izmantoto šūnu kariotipa īpatnības un piemērotība,
— mikoplazmas trūkums gadījumos, kad tas vajadzīgs,
— dati par šūnas cikla ilgumu,
— asinsdonoru dzimums; nesadalītas asinis vai atdalīti limfocīti; izmantotais mitogēns,
— pārneses reižu skaits, ja vajadzīgs,
— šūnu kultūru uzturēšanas metode, ja vajadzīgs,
— hromosomu modālais skaits.
Testa apstākļi:
— metafāzes apturēšanai izmantojamās vielas identifikācija, tās koncentrācija un šūnu apstrādes ilgums,
— vielas koncentrāciju un šūnu kultūru skaita izvēles pamatojums, piemēram, dati par citotoksicitāti un šķīdības robežām, ja tie ir pieejami,
— barotnes sastāvs, CO2 koncentrācija gadījumos, kad to izmanto,
— testa vielas koncentrācija,
— pievienotā nesēja un testa vielas tilpums,
— inkubēšanas temperatūra,
— inkubēšanas ilgums,
— apstrādes ilgums,
— šūnu blīvums to izsējas laikā, gadījumos, kad tas jānorāda,
— metabolisma aktivācijas sistēmas veids un sastāvs, norādot pieņemamības kritērijus,
— pozitīvas un negatīvas kontroles,
— priekšmetstikliņu sagatavošanas metodes,
— izmaiņu uzskaites kritēriji,
— analizēto metafāžu skaits,
— toksicitātes novērtēšanas metodes,
— kritēriji, pēc kuriem novērtē, vai testa rezultāts ir pozitīvs, negatīvs vai neskaidrs.
Rezultāti:
— toksicitātes pazīmes, piemēram, saplūšanas pakāpe, dati par šūnas ciklu, šūnu skaitu, mitotisko indeksu,
— izgulsnēšanās pazīmes,
— dati par apstrādes barotnes pH un osmozi, ja tie noteikti,
— izmaiņu veids, ieskaitot pārrāvumus,
— to šūnu skaits, kurās ir hromosomu izmaiņas un izmaiņu veids, ko atsevišķi norāda kultūrām, ko apstrādā ar testa vielu, un kontrolei izmantotajām kultūrām,
— ploīdijas izmaiņas, ja tās tiek novērotas,
— ja iespējams, devas un reakcijas attiecības,
— statistiskās analīzes rezultāti, ja tā veikta,
— līdztekus iegūtie negatīvas (šķīdinātāja/nesēja) un pozitīvas kontroles rezultāti,
— līdzšinējie negatīvas (šķīdinātāja/nesēja) un pozitīvas kontroles rezultāti, norādot robežas, vidējo lielumu un standartnovirzes.
Rezultātu izvērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Evans, H.J. (1976). Cytological Methods for Detecting Chemical Mutagens. In: Chemical mutagens, Principles and Methods for their Detection, Vol. 4, Hollaender, A. (ed) Plenum Press, New York and London, p. 1–29.
(2) Ishidate, M.Jr. and Sofuni, T. (1985). The In Vitro Chromosomal Aberration Test Using Chinese Hamster Lung (CHL) Fibroblast Cells in Culture. In: Progress in Mutation Research, Vol. 5, Ashby, J. et al., (Eds) Elsevier Science Publishers, Amsterdam-New York-Oxford, p. 427–432.
(3) Galloway, S.M., Armstrong, M.J., Reuben, C., Colman, S., Brown, B., Cannon, C., Bloom, A.D., Nakamura, F., Ahmed, M., Duk, S., Rimpo, J., Margolin, G.H., Resnick, MA, Anderson, G. and Zeiger, E. (1978). Chromosome aberration and sister chromatic exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals. Environs. Molec. Mutagen 10 (suppl. 10), p. 1–175.
(4) Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M.Jr., Brusick, D., Ashby, J. and Myhr, B.C. (1991). Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9. Mutation Res., 257, p. 147–204.
(5) Morita, T., Nagaki, T., Fukuda, I. and Okumura, K., (1992). Clastogenicity of low pH to Various Cultured Mammalian Cells. Mutation Res., 268, p. 297–305.
(6) Ames, B.N., McCann, J. and Yamasaki, E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test. Mutation Res., 31, p. 347–364.
(7) Maron, D.M. and Ames, B.N. (1983). Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, p. 173–215.
(8) Natarajan, A.T., Tates, A.D., van Buul, P.P.W., Meijers, M. and de Vogel, N. (1976). Cytogenetic Effects of Mutagen/Carcinogens after Activation in a Microsomal System in Vitro, I. Induction of Chromosome Aberrations and Sister Chromatid Exchange by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes. Mutation Res., 37, p. 83–90.
(9) Matsuoka, A., Hayashi, M. and Ishidate, M. Jr. (1979). Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In Vitro. Mutation Res., 66, p. 277–290.
(10) Elliot, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992). Report of UK Environmental Mutagen Society Working Party. Alternatives to Aroclor 1254-induced S9 in In Vitro Genotoxicity Assays. Mutagenesis, 7, p. 175–177.
(11) Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976). A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. In: de Serres, F.J., Fouts, J.R., Bend, J.R. and Philpot, R.M. (eds) In Vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, p. 85–88.
(12) Galloway, S.M., Aardema, M.J., Ishidate, M.Jr., Ivett, J.L., Kirkland, D.J., Morita, T., Mosesso, P., Sofuni, T. (1994). Report from Working Group on in In Vitro Tests for Chromosomal Aberrations. Mutation Res., 312, p. 241–261.
(13) Richardson, C., Williams, D.A., Allen, J.A., Amphlett, G., Chanter, D.O. and Phillips, B. (1989). Analysis of Data from In Vitro Cytogenetic Assays. In: Statistical Evaluation of Mutagenicity Test Data. Kirkland, D.J., (ed) Cambridge University Press, Cambridge, p. 141–154.
(14) Soper, K.A. and Galloway, S.M. (1994). Replicate Flasks are not Necessary for In Vitro Chromosome Aberration Assays in CHO Cells. Mutation Res., 312, p. 139–149.
(15) Krahn, D.F., Barsky, F.C. and McCooey, K.T. (1982). CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. In: Tice, R.R., Costa, D.L., Schaich, K.M. (eds). Genotoxic Effects of Airborne Agents. New York, Plenum, p. 91–103.
(16) Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983). Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environmental Mutagenesis, 5, p. 795–801.
(17) Locke-Huhle, C. (1983). Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest. Mutation Res., 119, p. 403–413.
(18) Huang, Y., Change, C. and Trosko, J.E. (1983). Aphidicolin – induced endoreduplication in Chinese hamster cells. Cancer Res., 43, p. 1362–1364.
B.11. MUTAGENITĀTE – ZĪDĪTĀJU KAULU SMADZEŅU HROMOSOMU IZMAIŅU TESTS IN VIVO
1. METODE
Šī metode ir ESAO TG 475 metodes “Zīdītāju kaulu smadzeņu hromosomu izmaiņu tests” (1997) kopija.
1.1. IEVADS
Zīdītāju hromosomu izmaiņu testu in vivo izmanto tādu hromosomu struktūras izmaiņu noteikšanai, ko testa viela izraisa dzīvnieku, parasti grauzēju, kaulu smadzeņu šūnās (1) (2) (3) (4). Struktūras izmaiņas var būt divu veidu – hromosomu izmaiņas vai hromatīdu izmaiņas. Poliploīdijas palielināšanās var liecināt, ka ķīmiskā viela, iespējams, rada hromosomu skaita izmaiņas. Lielākā daļa ķīmisko mutagēnu izraisa hromatīdu izmaiņas, tomēr notiek arī hromosomu izmaiņas. Hromosomu mutācijas un ar tām saistītās pārmaiņas ir daudzu cilvēka ģenētisko slimību cēlonis, turklāt ir pierādīts, ka hromosomu mutācijas un ar tām saistītie procesi rada onkogēnu un tumorsupresoro gēnu izmaiņas, izraisot vēzi cilvēkiem un izmēģinājumu dzīvniekiem.
Šim testam parasti izmanto grauzējus. Šajā testā mērķaudi ir kaulu smadzenes, jo tās ir ļoti labi apasiņotas, turklāt šo audu šūnu cikls ir īss un tās ir viegli izolējamas un apstrādājamas. Šai metodei neizmanto citu sugu dzīvniekus vai cita veida audus.
Šis hromosomu izmaiņu tests ir īpaši piemērots ar vielu mutagēnajām īpašībām saistītā kaitīguma noteikšanai, jo iespējams novērtēt in vivo metabolisma faktorus, farmakokinētiku un DNS reparācijas procesus, kas gan dažādām sugām attiecīgajos audos var būt atšķirīgi. Testu in vivo var izmantot arī in vitro konstatētās mutagēnās iedarbības sīkākai izpētei.
Gadījumos, kad noskaidrots, ka testa viela vai tās reaģētspējīgs metabolisma produkts mērķaudos nenonāk, šo testu neizmanto.
Skatīt arī vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Hromatīdu tipa izmaiņas: hromosomas struktūras bojājumi, kas izpaužas kā atsevišķu hromatīdu pārrāvumi, vai hromatīdu pārrāvumi un to rekombinācija.
Hromosomas tipa izmaiņas: hromosomas struktūras bojājumi, kas izpaužas kā abu hromatīdu pārrāvums vai pārrāvums un rekombinācija vienā un tajā pašā vietā.
Endoreduplikācija: process, kurā pēc DNS replikācijas S perioda nenotiek šūnas kodola mitoze, bet sākas otrs S periods. Rezultātā izveidojas hromosomas ar 4, 8, 16,… hromatīdiem.
Pārrāvums: ahromatisks bojājums ar nelielu hromatīda(-u) nobīdi, kas ir mazāks par viena hromatīda platumu.
Hromosomu skaita izmaiņas: testam izmantojamajām šūnām raksturīgā parastā hromosomu skaita izmaiņas.
Poliploīdija: haploīda hromosomu skaita (n) daudzkārtnis, izņemot hromosomu diploīdu skaitu (t. i., 3n, 4n utt).
Struktūras izmaiņas: hromosomu struktūras izmaiņas, kas redzamas mikroskopā šūnu dalīšanās metafāzē, ko novēro kā trūkstošus posmus, fragmentus, iekšējas vai savstarpējas rekombinācijas.
1.3. TESTA METODES PRINCIPS
Dzīvniekus pakļauj testa vielas iedarbībai, izmantojot piemērotu tās uzņemšanas veidu, un tad nogalina noteiktā laikā pēc apstrādes. Pirms nogalināšanas dzīvniekiem ievada metafāzi apturošu vielu (piemēram, kolhicīnu vai Colcemid®). Tad no kaulu smadzeņu šūnām pagatavo hromosomu preparātus, ko iekrāso, un metafāzes šūnām nosaka hromosomu izmaiņas.
1.4. TESTA METODES APRAKSTS
1.4.1. Sagatavošana
1.4.1.1. Dzīvnieku sugu izvēle
Parasti izmanto žurkas, peles un Ķīnas kāmjus, tomēr var izmantot jebkuras piemērotas sugas zīdītājus. Parasti izmanto jaunus, veselīgus, pieaugušus laboratorijas dzīvniekus. Izmēģinājuma sākumā dzīvnieku masas atšķirībām jābūt minimālām un tās nedrīkstētu pārsniegt ± 20 % no vidējās masas, kas noteikta katram dzimumam atsevišķi.
1.4.1.2. Turēšanas un barošanas nosacījumi
Piemēro vispārējos nosacījumus, kas minēti vispārīgā ievada B daļā, bet mitrumam vajadzētu būt 50–60 %.
1.4.1.3 Dzīvnieku sagatavošana
Veselīgus, jaunus, pieaugušus dzīvniekus pēc gadījuma izvēles principa sadala kontroles un apstrādes grupās. Būrus izvieto tā, lai iespējami samazinātu būru novietojuma varbūtējo ietekmi. Katram dzīvniekam atsevišķi piešķir identifikāciju. Dzīvniekus laboratorijas apstākļiem aklimatizē vismaz piecas dienas.
1.4.1.4. Devu sagatavošana
Pirms došanas dzīvniekiem cietas testa vielas vispirms izšķīdina vai suspendē piemērotos šķīdinātājos vai nesējos un, ja vajadzīgs, atšķaida. Šķidras testa vielas var dozēt tieši vai pirms dozēšanas atšķaidīt. Ja dati par testa vielu preparātu stabilitāti liecina, ka tos uzglabāt nevar, pārbaudēm izmanto svaigi pagatavotus preparātus.
1.4.2. Testa apstākļi
1.4.2.1. Šķīdinātājs/nesējs
Lietotajās devās šķīdinātājam vai nesējam nedrīkst būt toksiskas iedarbības, un tas nedrīkst būt reaģētspējīgs ar testa vielu. Izmantojot citus, mazāk izpētītus šķīdinātājus vai nesējus, jābūt datiem par to saderību. Vienmēr, kad tas iespējams, ieteicams vispirms izmantot ūdeni saturošus šķīdinātājus vai nesējus.
1.4.2.2. Kontroles
Visos testos katram dzīvnieku dzimumam līdztekus iekļauj pozitīvu un negatīvu (šķīdinātāja/nesēja) kontroli. Izņemot apstrādi ar testa vielu, ar kontroles grupu dzīvniekiem rīkojas tieši tāpat kā ar apstrādāto grupu dzīvniekiem.
Pozitīvā kontrolē iegūst hromosomu struktūras izmaiņas in vivo pie ekspozīcijas robežvērtībām, kas dod nosakāmu palielinājumu virs fona līmeņa. Pozitīvās kontroles vielu koncentrācijas izvēlas tā, lai to iedarbība būtu skaidri redzama, tomēr kodēto priekšmetstikliņu identitāti to nolasītājs nevarētu konstatēt uzreiz. Pieļaujams, ka pozitīvai kontrolei tiek izmantots cits iedarbības veids nekā testa vielai un paraugu ņem tikai vienreiz. Ja iespējams, kā pozitīvās kontroles vielas izmanto savienojumus, kas pieder pie atbilstošām vielu grupām. Pie pozitīvās kontroles vielām pieder:
|
Viela |
CAS Nr. |
Einecs Nr. |
|
etilmetānsulfonāts |
62-50-0 |
200-536-7 |
|
nitrozoetilurīnviela |
759-73-9 |
212-072-2 |
|
mitomicīns C |
50-07-7 |
200-008-6 |
|
ciklofosfamīds ciklofosfamīda monohidrāts |
50-18-0 6055-19-2 |
200-015-4 |
|
trietilēnmelamīns |
51-18-3 |
200-083-5 |
Ja nav pieņemamu vēsturisku kontroles datu par dzīvnieku savstarpējām atšķirībām un tādu šūnu parādīšanās biežumu, kurās ir hromosomu struktūras izmaiņas, katrā paraugu ņemšanas laikā iekļauj negatīvas kontroles dzīvniekus, ko apstrādā tikai ar šķīdinātāju vai nesēju, bet ar ko citādi rīkojas tāpat kā ar apstrādes grupu dzīvniekiem. Ja negatīvai kontrolei paraugus ņem tikai vienreiz, piemērotākais laiks ir pirmā paraugu ņemšanas reize. Turklāt jāizmanto arī tukšie mēģinājumi, izņemot gadījumus, kad ir iepriekš iegūti vēsturiski vai publicēti kontroldati, kas skaidri parāda, ka izvēlētajam šķīdinātājam nav kaitīgas vai mutagēnas iedarbības.
1.5. PROCEDŪRA
1.5.1. Dzīvnieku skaits un dzimums
Katrā apstrādes un kontroles grupā iekļauj vismaz piecus abu dzimumu dzīvniekus. Ja izmēģinājuma veikšanas laikā ir pieejami citos testos iegūti dati par tās pašas sugas dzīvniekiem, kam izmantots tas pats iedarbības veids, un šie dati liecina, ka toksiskā iedarbība uz abu dzimumu īpatņiem būtiski neatšķiras, testam var izmantot tikai viena dzimuma dzīvniekus. Gadījumos, kad ķīmiskās vielas iedarbība uz cilvēka organismu katram dzimumam var būt atšķirīga, piemēram, dažiem farmaceitiskajiem preparātiem, testu veic ar attiecīgā dzimuma dzīvniekiem.
1.5.2. Apstrādes shēma
Ieteicams izmēģināt vienreizēju apstrādi ar vielu. Testa vielas devu var dot arī dalīti, t. i., divreiz vienā un tajā pašā dienā ik pēc dažām stundām, kas var būt vajadzīgs gadījumos, kad jādod liels vielas tilpums. Citiem devu režīmiem jābūt zinātniski pamatotiem.
Pēc apstrādes paraugus ņem vienā dienā divos atsevišķos laikos. Grauzējiem pirmais paraugu ņemšanas termiņš ir pēc 1,5 normāliem šūnas cikliem (kas parasti ir 12 līdz 18 stundas pēc apstrādes). Tā kā testa vielas uzņemšanai un metabolismam, kā arī tās iedarbībai uz šūnas cikla kinētiku vajadzīgs laiks, kas var ietekmēt optimālo laiku hromosomu izmaiņu noteikšanai, ieteicams paraugus otrreiz ņemt 24 stundas pēc tam, kad paraugi ņemti pirmoreiz. Ja devu režīms pārsniedz vienas dienas ilgumu, paraugus ņem vienreiz pēc 1,5 šūnas cikliem pēc tam, kad veikta pēdējā apstrāde.
Pirms nogalināšanas dzīvniekiem intraperitoniāli injicē atbilstošu devu metafāzi apturošas vielas (piemēram, kolhicīnu vai Colcemid®). Pēc tam ar atbilstošiem intervāliem ņem dzīvnieku paraugus. Pelēm šis intervāls ir aptuveni 3–5 stundas; Ķīnas kāmjiem šis intervāls ir aptuveni 4–5 stundas. Savāc kaulu smadzeņu šūnas, un tām nosaka hromosomu izmaiņas.
1.5.3. Devu lielums
Ja atbilstošu datu trūkuma dēļ vispirms veic orientējošu izmēģinājumu, tas jāizdara tajā pašā laboratorijā, kurā veiks galveno izmēģinājumu, izmantojot tās pašas sugas un dzimuma dzīvniekus un ievērojot to pašu apstrādes režīmu (5). Ja viela ir toksiska, pirmajā paraugu ņemšanas reizē izmanto trīs devas. Šo devu intervālā ietver maksimāli toksiskās devas, kā arī vielas maztoksiskās vai netoksiskās devas. Vēlākajā paraugu ņemšanas laikā jāizmanto tikai lielākā deva. Kā lielāko nosaka devu ar tādām pašām toksiskās iedarbības pazīmēm kā lielākajai devai, kam varētu būt letāla iedarbība pēc tāda paša devu režīma. Vielām ar specifisku bioloģisko aktivitāti maztoksiskās un netoksiskās devās (piemēram, hormoniem un mitogēniem) var būt citi devu noteikšanas kritēriji, ko katrā konkrētā gadījumā izvērtē atsevišķi. Kā lielāko var noteikt arī devu, kas liecina par toksisku iedarbību uz kaulu smadzenēm (piemēram, lielāku par tādu devu, kas izraisa mitotiskā indeksa samazināšanos par 50 %).
1.5.4. Iedarbības robežu tests
Ja testā ar vienu vielas devu, kas ir vismaz 2 000 mg/kg ķermeņa svara, vienā paņēmienā vai divos paņēmienos vienā dienā toksisku iedarbību nekonstatē un pēc datiem par struktūras ziņā līdzīgām vielām var pamatoti uzskatīt, ka viela nav genotoksiska, pilnīgus izmēģinājumus ar trim vielas devām var uzskatīt par nevajadzīgiem. Ilgstošākos izmēģinājumos – līdz 14 dienām – maksimālā dienas deva ir 2 000 mg/kg ķermeņa svara un 1 000 mg/kg ķermeņa svara izmēģinājumos, kas pārsniedz 14 dienas. Paredzamā iedarbība uz cilvēku var norādīt uz to, ka devu iedarbības robežu pārbaudē jālieto lielāka deva.
1.5.5. Devu došana
Testa vielu parasti dod, mākslīgi barojot pa kuņģa caurulīti, piemērotu inkubācijas kanulu vai intraperitonālas injekcijas veidā. Var izmantot arī citus iedarbības veidus, ja šādai rīcībai ir pietiekams pamatojums. Maksimālais šķidruma tilpums, ko vienā paņēmienā var dot vai injicēt, ir atkarīgs no izmēģinājumu dzīvnieka lieluma. Tilpums nedrīkst pārsniegt 2 ml uz 100 g ķermeņa masas. Lielāka tilpuma lietošana par norādīto ir jāpamato. Izņemot kairinošas un kodīgas vielas, kuru iedarbība lielākās koncentrācijās parasti ir izteiktāka, testos lietotā tilpuma mainības ietekmi samazina, koriģējot tilpumu tā, lai pie visām devām tas būtu vienāds.
1.5.6. Hromosomu sagatavošana
Pēc nogalināšanas nekavējoties izņem kaulu smadzenes, tās apstrādā hipotoniskā šķīdumā un fiksē. Tad šūnas uznes uz priekšmetstikliņiem un iekrāso.
1.5.7. Analīze
Lai noteiktu citotoksicitāti, jānosaka mitotiskais indekss vismaz 1 000 šūnām no katra apstrādātā dzīvnieka (ieskaitot pozitīvas kontroles), kā arī no katra tukšās negatīvas kontroles dzīvnieka.
No katra dzīvnieka analizē vismaz 100 šūnu. Šo daudzumu var samazināt gadījumos, kad novēro lielu skaitu hromosomu izmaiņu. Visus priekšmetstikliņus, arī pozitīvas un negatīvas kontroles priekšmetstikliņus, pirms mikroskopiskās analīzes kodē. Tā kā priekšmetstikliņu sagatavošanas procedūrā bieži tiek bojātas metafāzes šūnas, kuras zaudē hromosomas, uzskaitāmajās šūnās jābūt centromēru skaitam, kas vienāds ar 2n ± 2.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Datus par katru dzīvnieku apkopo tabulas veidā. Eksperimenta vienība ir viens dzīvnieks. Katram dzīvniekam novērtē uzskaitīto šūnu daudzumu, hromosomu izmaiņu skaitu uz vienu šūnu un šūnu daļu ar hromosomu struktūras izmaiņām. Uzskaita dažāda veida hromosomu struktūras izmaiņas, norādot to skaitu un biežumu gan apstrādātajām, gan kontrolei izmantotajām dzīvnieku grupām. Pārrāvumus uzskaita un norāda atsevišķi, bet kopējā izmaiņu biežumā tos parasti neiekļauj. Ja nekas neliecina par vielas iedarbības atšķirībām atkarībā no dzīvnieku dzimuma, statistiskās analīzes veikšanai par abu dzimumu dzīvniekiem iegūtos datus var apvienot.
2.2. REZULTĀTU NOVĒRTĒŠANA UN INTERPRETĀCIJA
Pozitīvu rezultātu nosaka pēc vairākiem kritērijiem, piemēram, ar devu saistīta to šūnu daļas palielināšanās, kurās ir hromosomu struktūras izmaiņas, vai izmainītu šūnu skaita palielināšanās, pārbaudot vienu devu ar vienu paraugu ņemšanas laiku. Vispirms rezultātus izvērtē bioloģiski. Kā palīglīdzekli testa rezultātu izvērtēšanai var izmantot statistikas metodes (6). Statistiskais nozīmīgums nedrīkst būt vienīgais faktors, pēc kā nosaka pozitīvu atbildes reakciju. Apšaubāmus rezultātus pārbauda, veicot testu atkārtoti, turklāt atkārtotiem testiem vēlams mainīt eksperimenta apstākļus.
Poliploīdijas palielināšanās var liecināt, ka testa viela, iespējams, rada hromosomu skaita izmaiņas. Tādu šūnu skaita palielināšanās, kurās ir endoreduplicētas hromosomas, var norādīt uz to, ka testa viela, iespējams, kavē šūnu cikla attīstību (7) (8).
Uzskata, ka testa vielas mutagēnās īpašības nav konstatētas, ja tās pārbaudes rezultāti neatbilst iepriekšminētajiem kritērijiem.
Lai gan lielākajā daļā eksperimentu iegūst nepārprotami pozitīvus vai negatīvus rezultātus, tomēr dažkārt pēc iegūtajiem datiem nevar noteikti spriest par testa vielas aktivitāti. Turklāt rezultāti var būt nedroši vai apšaubāmi arī neatkarīgi no eksperimenta atkārtojumu skaita.
Pozitīvi rezultāti hromosomu izmaiņu testā in vivo liecina, ka testa viela izmēģinājumu dzīvnieku sugai izraisa hromosomu izmaiņas kaulu smadzenēs. Negatīvi rezultāti liecina, ka izmēģinājuma apstākļos testa viela izmēģinājumu dzīvnieku sugai nerada hromosomu izmaiņas kaulu smadzenēs.
Jāizvērtē varbūtība, ka testa viela vai tās metabolīti sasniedz centrālās asinsrites sistēmu un jo īpaši mērķaudus (piemēram, sistēmiska toksicitāte).
3. ZIŅOJUMU SASTĀDĪŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
Šķīdinātājs/nesējs:
— nesēja izvēles pamatojums,
— testa vielas stabilitāte šķīdinātājā/nesējā, ja tā ir zināma.
Testa dzīvnieki:
— izmantotā suga/līnija,
— dzīvnieku skaits, vecums un dzimums,
— izcelsme, turēšanas apstākļi, barība u. c.,
— dzīvnieku masa testa sākumā, katrā grupā norādot robežas, vidējo lielumu un standartnovirzi.
Testa apstākļi:
— pozitīvas un negatīvas (nesēja/šķīdinātāja) kontroles,
— devu intervāla noteikšanas testa rezultāti gadījumos, kad tas veikts,
— pēc lieluma mazatšķirīgu devu izvēles pamatojums,
— informācija par testa vielas sagatavošanu,
— informācija par testa vielas došanu,
— iedarbības veida izvēles pamatojums,
— metodes, ar kurām nosaka, ka testa viela nonākusi centrālajā asinsritē vai mērķaudos gadījumos, kad tas nepieciešams,
— testa vielas koncentrācijas (ppm) barībā vai dzeramajā ūdenī pārrēķins faktiskajā dienas devā (mg/kg ķermeņa masas) gadījumos, kad tas nepieciešams,
— sīkas ziņas par barības un ūdens kvalitāti,
— sīks apstrādes un paraugu ņemšanas shēmas apraksts,
— toksicitātes novērtēšanas metodes,
— metafāzes apturēšanai izmantojamās vielas identifikācija, tās koncentrācija un apstrādes ilgums,
— priekšmetstikliņu sagatavošanas metodes,
— izmaiņu uzskaites kritēriji,
— analizēto šūnu skaits no viena dzīvnieka,
— kritēriji, pēc kuriem novērtē, vai testa rezultāts ir pozitīvs, negatīvs vai neskaidrs.
Rezultāti:
— toksicitātes pazīmes,
— mitotiskais indekss,
— izmaiņu veids un skaits, ko norāda katram dzīvniekam atsevišķi,
— kopējais izmaiņu skaits grupās, norādot vidējos lielumus un standartnovirzes,
— grupās kopējais šūnu skaits ar izmaiņām, norādot vidējos lielumus un standartnovirzes,
— ploīdijas izmaiņas, ja tās tiek novērotas,
— ja iespējams, reakcijas uz devu novērtējums,
— statistiskās analīzes rezultāti, ja tā veikta,
— līdztekus veiktās negatīvās kontroles dati,
— līdz šim iegūtie negatīvas kontroles vēsturiskie dati, norādot robežas, vidējos lielumus un standartnovirzes,
— līdztekus veiktās pozitīvās kontroles dati.
Rezultātu izvērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Adler, I.D. (1984). Cytogenetic Tests in Mammals. In: Mutagenicity Testing: a Practical Approach. S. Venitt and J.M. Parry (Eds). IRL Press, Oxford, Washington D.C., p. 275–306.
(2) Preston, R.J., Dean, B.J., Galloway, S., Holden, H., McFee, A.F. and Shelby, M. (1987). Mammalian In Vivo Cytogenetic Assays: Analysis of Chromosome Aberrations in Bone Marrow Cells. Mutation Res., 189, p. 157–165.
(3) Richold, M., Chandley, A., Ashby, J., Gatehouse, D.G., Bootman, J. and Henderson, L. (1990). In Vivo Cytogenetic Assays. In: D.J. Kirkland (Ed.) Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report. Part I revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, p. 115–141.
(4) Tice, R.R., Hayashi, M., MacGregor, J.T., Anderson, D., Blakey, D.H., Holden, H.E., Kirsch-Volders, M., Oleson Jr., F.B., Pacchierotti, F., Preston, R.J., Romagna, F., Shimada, H., Sutou, S. and Vannier, B. (1994). Report from the Working Group on the In Vivo Mammalian Bone Marrow Chromosomal Aberration Test. Mutation Res., 312, p. 305–312.
(5) Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Richold, M. (1992). Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In Vivo Mutagenicity Assays. Mutagenesis, 7, p. 313–319.
(6) Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K. (1989). Statistical Analysis of In Vivo Cytogenetic Assays. In: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report Part III. Statistical Evaluation of Mutagenicity Test Data. D.J. Kirkland, (Ed.) Cambridge University Press, Cambridge, p. 184–232.
(7) Locke-Huhle, C. (1983). Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest. Mutation Res. 119, p. 403–413.
(8) Huang, Y., Change, C. and Trosko, J.E. (1983). Aphidicolin – induced endoreduplication in Chinese hamster cells. Cancer Res., 43, p. 1362–1364.
B.12. MUTAGENITĀTE – ZĪDĪTĀJU ERITROCĪTU MIKROKODOLU TESTS IN VIVO
1. METODE
Šī metode ir ESAO TG 474 metodes “Zīdītāju eritrocītu mikrokodolu tests” (1997) kopija.
1.1. IEVADS
Zīdītāju in vivo mikrokodolu testu izmanto, lai noteiktu testa vielas kaitīgumu eritroblastu hromosomām vai mitotiskajam aparātam, analizējot eritrocītus, kas iegūti no dzīvnieku, parasti grauzēju, kaulu smadzeņu un/vai perifēro asiņu šūnām.
Ar mikrokodolu testu nosaka vielas, kas izraisa citoģenētiskus bojājumus, kuru dēļ veidojas mikrokodoli, kuros aizturēti hromosomu fragmenti vai veselas hromosomas.
Kad kaulu smadzeņu eritroblasts attīstās par polihromatisku eritrocītu, galvenais kodols tiek izspiests; izveidojušies mikrokodoli var palikt ārpus citādi anukleotīdās citoplazmas. Šajās šūnās tiek veicināta mikrokodolu parādīšanās, jo tām nav galvenā kodola. Tādu polihromatisku eritrocītu skaita pieaugums apstrādātajos dzīvniekos, kas satur mikrokodolus, liecina par izraisītiem hromosomu bojājumiem.
Šim testam parasti izmanto grauzēju kaulu smadzenes, jo šajos audos veidojas polihromatiski eritrocīti. Nenobriedušus (polihromatiskus) mikrokodolu eritrocītus perifērajās asinīs var mērīt visām dzīvnieku sugām, kurām konstatēta liesas nespēja aizvākt mikrokodolu eritrocītus vai kuras ir pietiekami jutīgas pret vielām, kas rada hromosomu struktūras vai skaita izmaiņas. Mikrokodolus var atšķirt pēc vairākiem kritērijiem. Pie tiem pieder kinetohoras vai centromēru DNS klātbūtne vai trūkums mikrokodolos. Svarīgākais rādītājs ir nenobriedušu (polihromatisku) mikrokodolu eritrocītu daudzums. Gadījumos, kad izmēģinājuma dzīvniekus ar testa vielu apstrādā vismaz četras nedēļas, kā rādītāju var izmantot arī tādu nobriedušu (normāli hromatisku) eritrocītu skaitu no eritrocītu kopējā skaita perifērajās asinīs, kas satur mikrokodolus.
Mikrokodolu in vivo tests grauzējiem ir īpaši piemērots, lai novērtētu mutagenitātes risku, jo tas ļauj novērtēt in vivo metabolisma faktorus, farmakokinētiku un DNS reparācijas procesus, lai gan ģenētiskie raksturlielumi dažādām sugām attiecīgajos audos var būt atšķirīgi. Testu in vivo var izmantot arī in vitro konstatētās mutagēnās iedarbības sīkākai izpētei.
Gadījumos, kad noskaidrots, ka testa viela vai tās reaģētspējīgs metabolisma produkts mērķaudos nenonāk, šo testu neizmanto.
Skatīt arī vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Centromērs (kinetohors): hromosomas reģions(-i), ar kuru(-iem) šūnas dalīšanās laikā saistās vārpstiņas šķiedras, nodrošinot secīgu meitashromosomu pārvietošanos uz meitasšūnu poliem.
Mikrokodoli: mazi kodoli, kas papildus šūnu galvenajiem kodoliem mitozes (mejozes) telofāzē atsevišķi izveidojas, salīpot hromosomu fragmentiem vai veselām hromosomām.
Normāli hromatisks eritrocīts: nobriedis eritrocīts, kam nav ribosomu un kuru var atšķirt no nenobriedušiem polihromatiskiem eritrocītiem ar ribosomu selektīvu krāsojumu.
Polihromatisks eritrocīts: nenobriedis eritrocīts attīstības vidējā posmā, kas vēl satur ribosomas un kuru tāpēc ar ribosomu selektīvu iekrāsojumu var atšķirt no nobriedušiem normāli hromatiskiem eritrocītiem.
1.3. TESTA METODES PRINCIPS
Piemērotā veidā izmēģinājuma dzīvniekus pakļauj testa vielas iedarbībai. Ja izmanto kaulu smadzenes, dzīvniekus pēc apstrādes noteiktos termiņos nogalina, izņem kaulu smadzenes, sagatavo un iekrāso to preparātus (1) (2) (3) (4) (5) (6) (7). Ja izmanto perifērās asinis, pēc apstrādes noteiktos termiņos ņem asinis, no kurām sagatavo un iekrāso uztriepes (4) (8) (9) (10). Izmēģinājumos, kuros izmanto perifērās asinis, starplaikam starp pēdējo pakļaušanu iedarbībai un šūnu ņemšanu jābūt iespējami mazam. Preparātos nosaka mikrokodolu klātbūtni.
1.4. TESTA METODES APRAKSTS
1.4.1. Sagatavošana
1.4.1.1. Dzīvnieku sugu izvēle
Izmantojot kaulu smadzenes, izmēģinājumiem parasti izvēlas žurkas, tomēr var izmantot jebkuras citas piemērotas sugas zīdītājus. Izmantojot perifērās asinis, ieteicams izmēģinājumiem ņemt peles. Var izmantot jebkuras citas piemērotas sugas zīdītājus ar nosacījumu, ka šīm sugām liesa neaizvāc mikrokodolu eritrocītus, vai sugas, kuras ir pietiekami jutīgas pret vielām, kas izraisa hromosomu struktūras vai skaita izmaiņas. Parasti izmanto jaunus, veselus, pieaugušus laboratorijas dzīvniekus. Izmēģinājuma sākumā dzīvnieku masas atšķirībām jābūt minimālām un tās nedrīkstētu pārsniegt ± 20 % no vidējās masas, kas noteikta katram dzimumam atsevišķi.
1.4.1.2. Turēšanas un barošanas nosacījumi
Piemēro vispārējos nosacījumus, kas minēti vispārīgā ievada B daļā, bet mitrumam vajadzētu būt 50–60 %.
1.4.1.3. Dzīvnieku sagatavošana
Veselus, jaunus, pieaugušus dzīvniekus pēc gadījuma izvēles principa sadala kontroles un apstrādes grupās. Katram dzīvniekam atsevišķi piešķir identifikāciju. Dzīvniekus laboratorijas apstākļiem aklimatizē vismaz piecas dienas. Būrus izvieto tā, lai iespējami samazinātu būru novietojuma varbūtējo ietekmi.
1.4.1.4. Devu sagatavošana
Pirms došanas dzīvniekiem cietas testa vielas vispirms izšķīdina vai suspendē piemērotos šķīdinātājos vai nesējos un, ja vajadzīgs, atšķaida. Šķidras testa vielas var dozēt tieši vai pirms dozēšanas atšķaidīt. Ja dati par testa vielu preparātu stabilitāti liecina, ka tos uzglabāt nevar, pārbaudēm izmanto svaigi pagatavotus preparātus.
1.4.2. Testa apstākļi
1.4.2.1. Šķīdinātājs/nesējs
Lietotajās devās šķīdinātājam vai nesējam nedrīkst būt toksiskas iedarbības, un tas nedrīkst būt reaģētspējīgs ar testa vielu. Izmantojot citus, mazāk izpētītus šķīdinātājus vai nesējus, jābūt datiem par to saderību. Vienmēr, kad tas iespējams, ieteicams vispirms izmantot ūdeni saturošus šķīdinātājus vai nesējus.
1.4.2.2. Kontroles
Visos izmēģinājumos katram dzīvnieku dzimumam līdztekus iekļauj pozitīvu un negatīvu (šķīdinātāja/nesēja) kontroli. Izņemot apstrādi ar testa vielu, ar kontrolgrupu dzīvniekiem rīkojas tieši tāpat kā ar apstrādes grupu dzīvniekiem.
Pozitīvā kontrolē iegūst mikrokodolus in vivo pie ekspozīcijas robežvērtībām, kas dod nosakāmu palielinājumu virs fona līmeņa. Pozitīvās kontroles vielu koncentrācijas izvēlas tā, lai to iedarbība būtu skaidri redzama, tomēr kodēto priekšmetstikliņu identitāti to nolasītājs nevarētu konstatēt uzreiz. Pieļaujams, ka pozitīvai kontrolei tiek izmantots cits iedarbības veids nekā testa vielai un paraugu ņem tikai vienreiz. Ja iespējams, kā pozitīvās kontroles vielas izmanto savienojumus, kas pieder pie atbilstošām ķīmisko vielu grupām. Pie pozitīvās kontroles vielām pieder:
|
Viela |
CAS Nr. |
Einecs Nr. |
|
etilmetānsulfonāts |
62-50-0 |
200-536-7 |
|
N-etil-N-nitrozourīnviela |
759-73-9 |
212-072-2 |
|
mitomicīns C |
50-07-7 |
200-008-6 |
|
ciklofosfamīds ciklofosfamīda monohidrāts |
50-18-0 6055-19-2 |
200-015-4 |
|
trietilēnmelamīns |
51-18-3 |
200-083-5 |
Ja nav pieņemamu vēsturisko datu par dzīvnieku savstarpējām atšķirībām un tādu šūnu parādīšanās biežumu, kurās ir mikrokodoli, katrā paraugu ņemšanas laikā iekļauj negatīvas kontroles dzīvniekus, uz kuriem iedarbojas tikai ar šķīdinātāju vai nesēju, bet citādi ar kontrolgrupu dzīvniekiem rīkojas tieši tāpat kā ar apstrādes grupu dzīvniekiem. Ja negatīvai kontrolei paraugus ņem tikai vienreiz, piemērotākais laiks ir pirmā paraugu ņemšanas reize. Turklāt jāizmanto arī tukšie mēģinājumi, izņemot gadījumus, kad ir iepriekš iegūti vēsturiski vai publicēti kontroldati, kas skaidri parāda, ka izvēlētajam šķīdinātājam/nesējam nav kaitīgas vai mutagēnas iedarbības.
Izmantojot perifērās asinis, kā negatīvo kontroli var izmantot neapstrādātus dzīvniekus gadījumos, kad perifērās asinis izmēģinājumiem ņem neilgu laiku (piemēram, pēc 1–3 apstrādēm ar testa vielu), un iegūtie rezultāti ir tādās pašās robežās kā vēsturiskie dati.
1.5. PROCEDŪRA
1.5.1. Dzīvnieku skaits un dzimums
Katrā apstrādes un kontroles grupā jāiekļauj vismaz pieci dzīvnieki no katra dzimuma (11). Ja izmēģinājuma veikšanas laikā ir pieejami citos izmēģinājumos iegūti dati par tās pašas sugas dzīvniekiem, kam izmantots tas pats iedarbības veids, un šie dati liecina, ka toksiskā iedarbība uz abu dzimumu indivīdiem būtiski neatšķiras, izmēģinājumam var izmantot tikai viena dzimuma dzīvniekus. Gadījumos, kad ķīmisko vielu iedarbība uz cilvēka organismu katram dzimumam var būt atšķirīga, piemēram, dažiem farmaceitiskajiem preparātiem, izmēģinājumu veic ar attiecīgā dzimuma dzīvniekiem.
1.5.2. Apstrādes shēma
Nav iespējams ieteikt kādu standarta apstrādes shēmu (piemēram, viena, divas vai vairākas devas ar 24 stundu intervālu). Var ņemt paraugus pēc paplašināta devu režīma, kamēr izmēģinājumā konstatē pozitīvu efektu, vai negatīvam izmēģinājumam – tikmēr, kamēr tiek konstatēts toksiskums vai tiek izmantota robeždeva, un dozēšanu turpina līdz paraugu ņemšanas laikam. Testa vielas devu var dot arī dalīti, t. i., divreiz vienā un tajā pašā dienā ik pēc dažām stundām, kas var būt vajadzīgs gadījumos, kad jādod liels vielas tilpums.
Testu var veikt divējādi:
a) ar testa vielu dzīvniekus apstrādā vienreiz. Kaulu smadzeņu paraugus ņem vismaz divreiz; pirmo reizi ne agrāk kā 24 stundas un ne vēlāk kā 48 stundas pēc apstrādes ar piemērotiem starplaikiem starp paraugu ņemšanas reizēm. Paraugu ņemšana agrāk par 24 stundām pēc apstrādes ir jāpamato. Perifēro asiņu paraugus ņem vismaz divreiz; pirmo reizi ne agrāk kā 36 stundas un ne vēlāk kā 48 stundas pēc apstrādes ar piemērotiem starplaikiem starp paraugu ņemšanas reizēm, bet nepārsniedzot 72 stundu starplaiku. Ja pozitīva reakcija konstatēta vienā paraugu ņemšanas reizē, papildu paraugi nav jāņem;
b) gadījumos, kad veic divas vai vairākas apstrādes (piemēram, divas vai vairākas apstrādes ar 24 stundu starplaiku), paraugus ņem vienreiz 18 līdz 24 stundu laikā pēc pēdējās apstrādes gadījumos, kad ņem kaulu smadzeņu paraugus, un 36 līdz 48 stundu laikā pēc pēdējās apstrādes gadījumos, kad ņem perifēro asiņu paraugus (12).
Gadījumos, kad tas vajadzīgs, var noteikt papildu paraugu ņemšanas laikus.
1.5.3. Devu lielums
Ja atbilstošu datu trūkuma dēļ vispirms veic orientējošu izmēģinājumu, tas jāizdara tajā pašā laboratorijā, kurā veiks galveno izmēģinājumu, izmantojot tās pašas sugas, līnijas un dzimuma dzīvniekus un ievērojot to pašu apstrādes režīmu (13). Ja viela ir toksiska, pirmajā paraugu ņemšanas reizē izmanto trīs devas. Šo devu intervālā ietver maksimāli toksiskās devas, kā arī vielas maztoksiskās vai netoksiskās devas. Vēlākajā paraugu ņemšanas laikā jāizmanto tikai lielākā deva. Kā lielāko nosaka devu, kurai ir tādas pašas toksiskās iedarbības pazīmes kā lielākajai devai, kam varētu būt letāla iedarbība pēc tāda paša devu režīma. Vielām ar specifisku bioloģisko aktivitāti maztoksiskās un netoksiskās devās (piemēram, hormoniem un mitogēniem) var būt citi devu noteikšanas kritēriji, ko katrā konkrētā gadījumā izvērtē atsevišķi. Kā lielāko var noteikt arī devu, kas liecina par toksisku iedarbību uz kaulu smadzenēm (piemēram, nenobriedušu eritrocītu skaita samazināšanās salīdzinājumā ar to kopējo skaitu kaulu smadzenēs vai perifērajās asinīs).
1.5.4. Iedarbības robežu tests
Ja testā ar vienu vielas devu, kas ir vismaz 2 000 mg/kg ķermeņa svara vienā paņēmienā vai divos paņēmienos vienā dienā, toksisku iedarbību nekonstatē un pēc datiem par struktūras ziņā līdzīgām vielām var pamatoti uzskatīt, ka tā nav genotoksiska, pilnīgus izmēģinājumus ar trim vielas devām var uzskatīt par nevajadzīgiem. Ilgstošākos izmēģinājumos – līdz 14 dienām – maksimālā dienas deva ir 2 000 mg/kg ķermeņa svara un 1 000 mg/kg ķermeņa svara apstrādei, kas pārsniedz 14 dienas. Paredzamā iedarbība uz cilvēku var norādīt uz to, ka devu iedarbības robežu pārbaudē jālieto lielāka deva.
1.5.5. Devu došana
Testa vielu parasti dod, mākslīgi barojot pa kuņģa caurulīti, piemērotu inkubācijas kanulu vai intraperitonālas injekcijas veidā. Var izmantot arī citus iedarbības veidus, ja šādai rīcībai ir pietiekams pamatojums. Maksimālais šķidruma tilpums, ko vienā paņēmienā var dot, mākslīgi barojot vai injicējot, ir atkarīgs no izmēģinājumu dzīvnieka lieluma. Tilpums nedrīkst pārsniegt 2 ml uz 100 g ķermeņa masas. Lielāka tilpuma lietošana par norādīto ir jāpamato. Izņemot kairinošas un kodīgas vielas, kuru iedarbība lielākās koncentrācijās parasti ir izteiktāka, izmēģinājumiem lietotā tilpuma mainības ietekmi samazina, koriģējot tilpumu tā, lai pie visām devām tas būtu vienāds.
1.5.6. Kaulu smadzeņu un asiņu sagatavošana
Kaulu smadzeņu šūnas parasti iegūst tūlīt pēc nogalināšanas no augšstilba kaula vai lielkaula. Visbiežāk no augšstilba kaula vai lielkaula iegūtās šūnas preparē un iekrāso ar tradicionālām metodēm. Perifērās asinis iegūst no astes vēnas vai cita piemērota asinsvada. Asins šūnas tūlīt supravitāli iekrāso (8) (9) (10) vai arī vispirms sagatavo uztriepes, ko iekrāso pēc tam. Lietojot DNS specifisku krāsvielu (piemēram, akridīnoranžo (14) vai Hoechst 33258 plus pironīnu-Y (15)), iespējams izvairīties no daļas artefaktu, kas saistīti ar DNS nespecifisku krāsvielu izmantošanu. Šīs priekšrocības neizslēdz parasto krāsvielu (piemēram, Giemsa) lietošanu. Var izmantot arī papildu sistēmas (piemēram, celulozes kolonnas to šūnu atdalīšanai, kurām ir kodoli (16)), ar nosacījumu, ka tās laboratorijā pareizi izmantojamas mikrokodolu preparātu sagatavošanai.
1.5.7. Analīze
Nenobriedušo eritrocītu skaita attiecību pret eritrocītu kopējo skaitu (nenobriedušie + nobriedušie) nosaka, saskaitot vismaz 200 eritrocītus no kaulu smadzenēm un vismaz 1 000 eritrocītus no perifērajām asinīm (17). Visus priekšmetstikliņus, arī pozitīvas un negatīvas kontroles priekšmetstikliņus, pirms mikroskopiskās analīzes kodē. Sastopot nenobriedušus eritrocītus ar mikrokodoliem, no katra dzīvnieka saskaita vismaz 2 000 nenobriedušu eritrocītu. Var iegūt papildu informāciju, saskaitot nobriedušus eritrocītus ar mikrokodoliem. Analizējot priekšmetstikliņus, nenobriedušo eritrocītu attiecība pret eritrocītu kopējo skaitu nedrīkst būt mazāka par 20 % no kontroles lieluma. Apstrādājot dzīvniekus pastāvīgi četras nedēļas vai ilgāk, uz katru dzīvnieku mikrokodolu sastopamības noteikšanai saskaita vismaz 2 000 nobriedušu eritrocītu. Ja automātiskās analīzes sistēmas (šūnu suspensiju attēlu analīze un plūsmas citometriskā analīze) ir pienācīgi kalibrētas un verificētas, tās ir pieņemama alternatīva manuālajām novērtēšanas metodēm.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Datus par katru dzīvnieku apkopo tabulas veidā. Eksperimenta vienība ir viens dzīvnieks. Katram analizējamajam dzīvniekam atsevišķi uzskaita nenobriedušos eritrocītus, nenobriedušos eritrocītus ar mikrokodoliem un nenobriedušo eritrocītu kopskaitu no visiem eritrocītiem. Ja dzīvniekus pastāvīgi apstrādā četras nedēļas vai ilgāk, jānorāda arī dati par nobriedušajiem eritrocītiem, ja tie tiek iegūti. Par katru dzīvnieku norāda nenobriedušo eritrocītu skaita attiecību pret eritrocītu kopskaitu un, ja tiek uzskatīts par vajadzīgu, arī to eritrocītu daļu, kuriem ir mikrokodoli. Ja nekas neliecina par vielas iedarbības atšķirībām atkarībā no dzīvnieku dzimuma, statistiskās analīzes veikšanai var apvienot datus, kas iegūti par abu dzimumu dzīvniekiem.
2.2. REZULTĀTU NOVĒRTĒŠANA UN INTERPRETĀCIJA
Pozitīvu rezultātu nosaka pēc vairākiem kritērijiem, piemēram, ar devu saistīta to šūnu skaita palielināšanās, kurām ir mikrokodoli, vai šādu šūnu skaita palielināšanās, pārbaudot vienu devu ar vienu paraugu ņemšanas laiku. Vispirms rezultātus izvērtē bioloģiski. Kā palīglīdzekli pārbaužu rezultātu izvērtēšanai var izmantot statistikas metodes (18) (19). Statistiskais nozīmīgums nedrīkst būt vienīgais faktors, pēc kura nosaka pozitīvu atbildes reakciju. Apšaubāmus rezultātus pārbauda, veicot testu atkārtoti, turklāt vēlams mainīt eksperimenta apstākļus.
Uzskata, ka testa vielas mutagēnās īpašības nav konstatētas, ja tās testa rezultāti neatbilst iepriekšminētajiem kritērijiem.
Lai gan lielākajā daļā eksperimentu iegūst nepārprotami pozitīvus vai negatīvus rezultātus, tomēr dažkārt pēc iegūtajiem datiem nevar noteikti spriest par testa vielas aktivitāti. Turklāt rezultāti var būt nedroši vai apšaubāmi arī neatkarīgi no eksperimenta atkārtojumu skaita.
Pozitīvi mikrokodolu testa rezultāti liecina, ka testa vielas ietekmē hromosomu bojājumu vai mitotiskā aparāta bojājumu rezultātā izmēģinājumiem izmantotās sugas dzīvnieku eritroblastos veidojas mikrokodoli. Negatīvi rezultāti liecina, ka izmēģinājuma apstākļos testa viela izmēģinājumu dzīvnieku sugai nenobriedušos eritrocītos neizsauc mikrokodolu veidošanos.
Jāizvērtē iespējamība, ka testa viela vai tās metabolīti sasniedz centrālās asinsrites sistēmu un jo īpaši mērķaudus (piemēram, sistēmiska toksicitāte).
3. ZIŅOJUMU SASTĀDĪŠANA
TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
Šķīdinātājs/nesējs:
— nesēja izvēles pamatojums,
— testa vielas šķīdība un stabilitāte šķīdinātājā/nesējā, ja tā ir zināma.
Testa dzīvnieki:
— izmantotā suga/līnija,
— dzīvnieku skaits, vecums un dzimums,
— izcelsme, turēšanas apstākļi, barība u. c.,
— dzīvnieku masa izmēģinājuma sākumā, katrā grupā norādot robežas, vidējo lielumu un standartnovirzi.
Testa apstākļi:
— pozitīvas un negatīvas (nesēja/šķīdinātāja) kontroles dati,
— devu intervāla noteikšanas izmēģinājuma rezultāti gadījumos, kad tas veikts,
— devu izvēles pamatojums,
— informācija par testa vielas sagatavošanu,
— informācija par testa vielas došanu,
— iedarbības veida izvēles pamatojums,
— metodes, ar kurām nosaka, ka testa viela nonākusi centrālajā asinsritē vai mērķaudos gadījumos, kad tas nepieciešams,
— testa vielas koncentrācijas (ppm) barībā vai dzeramajā ūdenī pārrēķins faktiskajā dienas devā (mg/kg ķermeņa masas) gadījumos, kad tas nepieciešams,
— sīkas ziņas par barības un ūdens kvalitāti,
— sīks apstrādes un paraugu ņemšanas shēmas apraksts,
— priekšmetstikliņu sagatavošanas metodes,
— toksicitātes novērtēšanas metodes,
— kritēriji, pēc kuriem uzskaita nenobriedušus eritrocītus ar mikrokodoliem,
— analizēto šūnu skaits no viena dzīvnieka,
— kritēriji, pēc kuriem novērtē, vai testa rezultāts ir pozitīvs, negatīvs vai neskaidrs.
Rezultāti:
— toksicitātes pazīmes,
— nenobriedušu eritrocītu skaits no eritrocītu kopējā skaita,
— nenobriedušu eritrocītu skaits ar mikrokodoliem, norāda katram dzīvniekam atsevišķi,
— nenobriedušu eritrocītu ar mikrokodoliem vidējais skaits ± standartnovirze katrā izmēģinājuma dzīvnieku grupā,
— ja iespējams, reakcijas uz devu novērtējums,
— statistiskās analīzes rezultāti, ja tā veikta,
— līdztekus iegūtie un vēsturiskie negatīvie rezultāti,
— līdztekus veiktās pozitīvās kontroles dati.
— Rezultātu izvērtējums.
— Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Heddle, J.A. (1973). A Rapid In Vivo Test for Chromosomal Damage, Mutation Res., 18, p. 187–190.
(2) Schmid, W. (1975). The Micronucleus Test, Mutation Res., 31, p. 9–15.
(3) Heddle, J.A., Salamone, M.F., Hite, M., Kirkhart, B., Mavournin, K., MacGregor, J.G. and Newell, G.W. (1983). The Induction of Micronuclei as a Measure of Genotoxicity. Mutation Res., 123, p. 61–118.
(4) Mavournin, K.H., Blakey, D.H., Cimino, M.C., Salamone, M.F. and Heddle, J.A. (1990). The In Vivo Micronucleus Assay in Mammalian Bone Marrow and Peripheral Blood. A report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 239, p. 29–80.
(5) MacGregor, J.T., Schlegel, R. Choy, W.N., and Wehr, C.M. (1983). Micronuclei in Circulating Erythrocytes: A Rapid Screen for Chromosomal Damage During Routine Toxicity Testing in Mice. in: “Developments in Science and Practice of Toxicology”, Ed. A.W. Hayes, R.C. Schnell and T.S. Miya, Elsevier, Amsterdam, p. 555–558.
(6) MacGregor, J.T., Heddle, J.A. Hite, M., Margolin, G.H., Ramel, C., Salamone, M.F., Tice, R.R., and Wild, D. (1987) Guidelines for the Conduct of Micronucleus Assays in Mammalian Bone Marrow Erytrocytes. Mutation Res., 189, p. 103–112.
(7) MacGregor, J.T., Wehr, C.M., Henika, P.R., and Shelby, M.E. (1990). The in vivo Erythrocyte Micronucleus Test: Measurement at Steady State Increases Assay Efficiency and Permits Integration with Toxicity Studies. Fund. Appl. Toxicol., 14, p. 513–522.
(8) Hayashi, M., Morita, T., Kodama, Y., Sofuni, T. and Ishidate, M. Jr. (1990). The Micronucleus Assay with Mouse Peripheral Blood Reticulocytes Using Acridine Orange-Coated Slides. Mutation Res., 245, p. 245–249.
(9) The Collaborative Study Group for the Micronucleus Test (1992). Micronucleus Test with Mouse Peripheral Blood Erythrocytes by Acridine Orange Supravital Staining: The Summary Report of the 5th Collaborative Study by CSGMT/JEMMS. MMS. Mutation Res., 278, p. 83–98.
(10) The Collaborative Study Group for the Micronucleus Test (CSGMT/JEMMS. MMS: The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan) (1995). Protocol recommended for the short-term mouse peripheral blood micronucleus test. Mutagenesis, 10, p. 153–159.
(11) Hayashi, M., Tice, R.R., MacGregor, J.T., Anderson, D., Blackey, D.H., Kirsch-Volders, M., Oleson, Jr.F.B., Pacchierotti, F., Romagna, F., Shimada, H., Sutou, S. and Vannier, B. (1994). In Vivo Rodent Erythrocyte Micronucleus Assay. Mutation Res., 312, p. 293–304.
(12) Higashikuni, N. and Sutou, S. (1995). An optimal, generalized sampling time of 30 ± 6 h after double dosing in the mouse peripheral blood micronucleus test. Mutagenesis, 10, p. 313–319.
(13) Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Rochold, M. (1992). Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose Setting in In Vivo Mutagenicity Assays. Mutagenesis, 7, p. 313–319.
(14) Hayashi, M., Sofuni, T. and Ishidate, M. Jr. (1983). An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test. Mutation Res., 120, p. 241–247.
(15) MacGregor, J.T., Wehr, C.M. and Langlois, R.G. (1983). A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyronin Y. Mutation Res., 120, p. 269–275.
(16) Romagna, F. and Staniforth, C.D. (1989). The automated bone marrow micronucleus test. Mutation Res., 213, p. 91–104.
(17) Gollapudi, B. and McFadden, L.G. (1995). Sample size for the estimation of polychromatic to normochromatic erythrocyte ratio in the bone marrow micronucleus test. Mutation Res., 347, p. 97–99.
(18) Richold, M., Ashby, J., Bootman, J., Chandley, A., Gatehouse, D.G. and Henderson, L. (1990). In Vivo Cytogenetics Assay. In: D.J. Kirkland (Ed.) Basic Mutagenicity tests. UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part I, revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, p. 115–141.
(19) Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K. (1989). Statistical Analysis of In Vivo Cytogenetic Assays. In: D.J. Kirkland (Ed.) Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part III. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, p. 184–232.
B.13./14. MUTAGENITĀTE – BAKTĒRIJU REVERSĀS MUTĀCIJAS
1. METODE
Šī metode ir ESAO TG 471 metodes “Baktēriju reversās mutācijas tests” (1997) kopija.
1.1. IEVADS
Baktēriju reversās mutācijas testā, lai noteiktu konkrētas mutācijas, pie kurām pieder vienas vai vairāku DNS bāzu pāru aizstāšana, pievienošana vai izslēgšana, izmanto Salmonella typhimurium un Escherichia coli celmus, kam vajadzīgas aminoskābes (1) (2) (3). Šā baktēriju reversās mutācijas testa princips ir tāds, ka ar to nosaka mutācijas, kas izlabo testam izmantojamo celmu mutācijas un atjauno baktēriju funkcionālās spējas sintezēt neaizstājamās aminoskābes. Reversās baktērijas nosaka pēc to augšanas spējas bez aminoskābēm, kas vajadzīgas mātes kontrolcelmam.
Noteiktas mutācijas ir daudzu cilvēka ģenētisko slimību cēlonis, turklāt ir pierādīts, ka tās somatiskajās šūnās rada onkogēnu un tumorsupresoro gēnu izmaiņas, izraisot vēzi cilvēkiem un izmēģinājumu dzīvniekiem. Baktēriju reversās mutācijas tests ir ātrs, lēts un diezgan vienkāršs. Daudziem kontrolcelmiem ir vairākas īpatnības, kuru dēļ tie ir jutīgāki mutāciju noteikšanai, ieskaitot atbilstošus DNS posmus reversijas vietās, lielu molekulu caurlaidības palielināšanos šūnās un DNS reparācijas sistēmu izslēgšanu vai nejaušas DNS pasivitātes pastiprināšanās procesus. Kontrolcelmu specifiskās īpašības var sniegt noderīgu informāciju par mutāciju veidiem, ko izraisa genotoksiskas vielas. Ļoti plaša datubāze ir uzkrāta par baktēriju reversās mutācijas testu rezultātiem daudzām un dažādām struktūrām, un ir labi izstrādātas metodikas ķīmisko vielu pārbaudēm ar dažādām fizikāli ķīmiskajām īpašībām, ieskaitot viegli gaistošus savienojumus.
Skatīt arī vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Reversās mutācijas testā ar Salmonella typhimurium vai Escherichia coli nosaka tāda celma mutāciju, kam vajadzīga aminoskābe (attiecīgi – histidīns vai triptofāns), par celmu, kam nav vajadzīga aminoskābe no ārēja avota.
Mutagēni, kas izraisa bāzu pāra aizvietošanu: vielas, kuras izraisa DNS bāzu izmaiņas. Reversijas testā šīs mutācijas var notikt sākotnējās mutācijas vietā vai bakteriālā genoma citā vietā.
Mutagēni, kas izraisa olbaltuma sintēzes nolasīšanas fāzes nobīdi: vielas, kuras izraisa DNS viena vai vairāku bāzu pāru pievienošanu vai izslēgšanu, tādējādi izmainot RNS nolasīšanu.
1.3. SĀKOTNĒJI APSVĒRUMI
Baktēriju reversās mutācijas testā izmanto prokariotu šūnas, kas atšķiras no zīdītāju šūnām pēc tādiem faktoriem kā izmantošana, metabolisms, hromosomu struktūra un DNS reparācijas procesi. Testiem, ko izdara in vitro, metaboliskai aktivācijai parasti jāizmanto eksogēns avots. Šāda metaboliskas aktivācijas sistēma nevar pilnībā imitēt apstākļus zīdītāju organismā in vivo. Tāpēc tests nedod tiešu informāciju par mutagēnu un kancerogēnu iedarbību uz zīdītājiem.
Baktēriju reversās mutācijas testu parasti izmanto vielas sākotnējai genotoksiskas aktivitātes novērtēšanai, un jo īpaši noteiktu mutāciju izraisīšanas aktivitātes noteikšanai. Plaša datubāze liecina, ka daudzas šajā testā pozitīvas ķīmiskās vielas uzrāda mutagēnu aktivitāti arī citos testos. Tomēr ir gadījumi, kad šajā testā netiek konstatēts, ka vielai ir mutagēnas īpašības; šā trūkuma iemesli saistāmi ar nosakāmā parametra īpašo raksturu, kā arī metabolisma aktivācijas vai bioloģiskās pieejamības atšķirībām. Savukārt faktori, kas palielina baktēriju reversās mutācijas testa jutību, var veicināt vielu mutagēnās aktivitātes pārvērtēšanu.
Baktēriju reversās mutācijas tests var nebūt piemērots noteiktām ķīmisko vielu grupām piederīgu savienojumu novērtēšanai, piemēram, tādu savienojumu mutagēnās aktivitātes novērtēšanai, kuriem ir izteikti baktericīdas īpašības (piemēram, dažas antibiotiskās vielas), kā arī savienojumiem, par kuriem ir pamats uzskatīt (vai ir noskaidrots), ka tie ietekmē tikai zīdītāju šūnu replikācijas sistēmu (piemēram, daži topoizomerāzes inhibitori un nukleozīdu analogi). Šādos gadījumos piemērotāki ir mutācijas testi, kuriem izmanto zīdītāju šūnas.
Lai gan daudzi savienojumi, kam šis tests ir pozitīvs, ir zīdītājiem kancerogēni, tomēr šī korelācija nav absolūta. Tā atkarīga no ķīmisko vielu grupas, pie kuras pieder pārbaudāmais savienojums, un ir kancerogēni, ko šajā testā noteikt nevar, jo to iedarbībai ir cits mehānisms, kas nav saistīts ar genotoksicitāti un kura nav baktēriju šūnās.
1.4. TESTA METODES PRINCIPS
Baktēriju šūnu suspensijas pakļauj testa vielas iedarbībai gan piemērotas metabolisma aktivācijas sistēmas klātbūtnē, gan bez tās. Ar ietveršanas metodi platē šīs suspensijas sajauc ar augšējā slāņa agaru, ar ko nekavējoties pārklāj nelielu barotnes daudzumu. Ar preinkubācijas metodi apstrādēs maisījumu inkubē un pēc tam sajauc ar augšējā slāņa agaru, ar ko pārklāj nelielu barotnes daudzumu. Pēc divas vai trīs dienas ilgas inkubācijas saskaņā ar abām metodēm revertantās kolonijas skaita un salīdzina ar to revertanto koloniju skaitu, kas spontāni izveidojušās uz šķīdinātāja kontrolplatēm.
Aprakstītas vairākas baktēriju reversās mutācijas testa procedūras. Pie plašāk izmantotajām pieder ietveršanas metode platē (1) (2) (3) (4), preinkubācijas metode (2) (3) (5) (6) (7) (8), fluktuācijas metode (9) (10) un suspensijas metode (11). Aprakstītas metodes modifikācijas gāzveida vai gaistošu vielu testēšanai (12).
Metodē aprakstītās procedūras pirmām kārtām attiecas uz platē ietveršanas un preinkubācijas metodēm. Tās abas ir piemērotas izmēģinājumiem gan ar metabolisma aktivāciju, gan bez tās. Daļu vielu var labāk noteikt ar preinkubācijas metodi. Šie savienojumi pieder pie tādām ķīmisko vielu grupām kā alifātiskie nitrozoamīni ar īsu ķēdi, divvērtīgie metāli, aldehīdi, azokrāsvielas un diazosavienojumi, pirolizidīna alkaloīdi, alilsavienojumi un nitrosavienojumi (3). Atzīts arī, ka dažas mutagēnu klases ne vienmēr var atklāt, izmantojot standarta procedūras, piemēram, ietveršanas metodi platē vai preinkubācijas metodi. Tās būtu uzskatāmas par “īpašiem gadījumiem”, un to atklāšanai noteikti jāizmanto citas alternatīvas procedūras. Var izdalīt šādus “īpašus gadījumus” (kopā ar procedūrām, ko var izmantot to atklāšanai): azokrāsvielas un diazosavienojumi (3) (5) (6) (13), gāzveida un gaistošas vielas (12) (14) (15) (16) un glikozīdi (17) (18). Atkāpes no standarta procedūras zinātniski jāpamato.
1.5. TESTA METODES APRAKSTS
1.5.1. Sagatavošana
1.5.1.1. Baktērijas
Svaigas baktēriju kultūras izaudzē līdz eksponenciālās fāzes beigām vai stacionārās fāzes sākumam (aptuveni 109 šūnas mililitrā). Neizmanto kultūras, kas ir stacionārās fāzes beigās. Būtiski, lai izmēģinājumiem izmantojamajām kultūrām būtu augsts dzīvotspējīgo baktēriju titrs. Titru var novērtēt pēc vēsturiskajiem kontroles datiem par augšanas līknēm vai katrā analīzē nosakot dzīvotspējīgo šūnu skaitu ar pārklāšanas eksperimentu.
Ieteicamā inkubēšanas temperatūra ir 37 oC.
Izmanto vismaz piecus baktērijas celmus. No tiem četriem jābūt S. typhimurium (TA 1535; TA 1537; TA97a vai TA97; TA98; un TA100), jo pierādīts, ka ar tiem iegūst drošus un dažādās laboratorijās atkārtojamus rezultātus. Šiem četriem S. typhimurium celmiem primārās reversijas vietā ir GC bāzu pāri, un noskaidrots, ka ar tiem nevar atklāt dažus oksidējošus mutagēnus, sašūtus aģentus un hidrazīnus. Šīs vielas var detektēt ar E. coli WP2 celmiem vai S. typhimurium TA 102 (19), kuriem primārās reversijas vietā ir AT bāzu pāris. Tāpēc ieteicamā izmantojamo celmu kombinācija ir:
— S. typhimurium TA1535 un
— S. typhimurium TA1537 vai TA97, vai TA97a, un
— S. typhimurium TA98, un
— S. typhimurium TA100, un
— E. coli WP2 uvrA vai E. coli WP2 uvrA (pKM101), vai S. typhimurium TA102.
Oksidējošu mutagēnu atklāšanai var būt vēlams izmantot TA102 vai pievienot kādu DNS reparācijas E. coli celmu (piemēram, E. coli WP2 vai E. coli WP2 (pKM101)).
Rezerves kultūru pagatavošanai, marķeru verificēšanai un glabāšanai izmanto labi izstrādātas procedūras. Aminoskābju nepieciešamība augšanai jāparāda katrai saldētajai rezerves kultūrai (triptofāna vajadzību S. typhimurium celmiem, bet E coli celmiem triptofāna vajadzību). Līdzīgi pārbauda arī citas fenotipa īpašības, proti, gadījumos, kad tas ir vajadzīgs, R-faktora plazmīdu klātbūtni vai trūkumu (t. i., rezistenci pret ampicilīnu TA98, TA100 un TA97a vai TA97, WP2 uvrA un WP2 uvrA (pKM101) celmiem, bet rezistenci pret ampicilīnu un tetraciklīnu TA102 celmam); raksturīgās mutācijas (t. i., rfa mutāciju S. typhimurium pēc jutības uz kristālvioleto un uvrA mutāciju E. coli vai uvrB mutāciju S. typhimurium pēc jutības uz ultravioleto gaismu) (2) (3). Celmiem jādod arī revertantās kolonijas ar parādīšanās biežumu, kas atbilst laboratorijas vēsturiskajiem kontroles datiem, un vēlams, lai tas būtu literatūrā minētajās robežās.
1.5.1.2. Barotne
Izmanto piemērotu minimālo agaru (kas satur, piemēram, Fogeļa–Bonera (Vogel-Bonner) minimālo barotni E un glikozi) un augšējā slāņa agaru, kas satur histidīnu un biotīnu vai triptofānu dažiem šūnu dalīšanās cikliem vajadzīgajā daudzumā (1) (2) (9).
1.5.1.3. Metabolisma aktivācija
Baktērijas pakļauj testa vielas iedarbībai gan piemērotas metabolisma aktivācijas sistēmas klātbūtnē, gan bez tās. Plašāk izmantojamā aktivācijas sistēma ir ar kofaktoru papildināta pēcmitohondriskā frakcija (S9), ko pagatavo no grauzēju aknām, kas apstrādātas ar enzīmstimulējošām vielām, piemēram, Aroclor 1254 (1) (2), vai fenobarbitona un β-naftoflavona maisījumu (18) (20) (21). Pēcmitahondrālo frakciju parasti izmanto S9 maisījumā koncentrācijā no 5 līdz 30 tilp. %. Metabolisma aktivācijas sistēmas izvēle var būt atkarīga no ķimikāliju grupas, pie kuras pieder testa viela. Dažos gadījumos pēcmitohondriskā frakcija var būt jālieto vairākās koncentrācijās. Azokrāsvielu un diazosavienojumu pārbaudēm var būt piemērotāka metabolisma aktivācijas sistēma ar reducējošām īpašībām (6) (13).
1.5.1.4. Testa viela/preparāts
Pirms baktēriju apstrādes ar cietām testa vielām, tās vispirms izšķīdina vai suspendē piemērotos šķīdinātājos vai nesējos un, ja vajadzīgs, atšķaida. Šķidras testa vielas var tieši pievienot testa sistēmā un/vai pirms šūnu apstrādes atšķaidīt. Ja dati par testa vielu preparātu stabilitāti liecina, ka tos uzglabāt nevar, izmanto svaigi pagatavotus preparātus.
Šķīdinātājs vai nesējs nedrīkst būt reaģētspējīgs ar testa vielu, un tas nedrīkst nelabvēlīgi ietekmēt baktēriju dzīvotspēju un S9 aktivitāti (22). Izmantojot citus, mazāk izpētītus šķīdinātājus vai nesējus, jābūt datiem par to saderību. Vienmēr, kad tas iespējams, ieteicams vispirms izmantot ūdeni saturošus šķīdinātājus vai nesējus. Pārbaudot ūdens vidē nestabilas vielas, izmanto bezūdens organiskos šķīdinātājus.
1.5.2. Testa apstākļi
1.5.2.1. Testam izmantojamie celmi (skatīt 1.5.1.1.)
1.5.2.2. Pārbaudāmās koncentrācijas
Viens no kritērijiem, kas jāņem vērā, nosakot lielāko izmantojamās testa vielas daudzumu, ir tās citotoksicitāte un šķīdība galīgajā apstrādes maisījumā.
Var būt lietderīgi iepriekšējā eksperimentā noteikt vielas toksicitāti un šķīdību. Citotoksicitāti var noteikt pēc revertanto koloniju skaita samazināšanās, fona pazušanas vai samazināšanās vai pēc apstrādāto kultūru izdzīvošanas pakāpes. Vielas citotoksicitāte var mainīties metabolisma aktivācijas sistēmu klātbūtnē. To, ka viela ir nešķīstoša, novērtē pēc tās izgulsnēšanās, kas redzama ar neapbruņotu aci, galīgajā maisījumā testa faktiskajos apstākļos.
Ieteicamā maksimālā testa koncentrācija vielām, kas nav citotoksiskas, ir 5 mg uz plati vai 5 μl uz plati. Vielām, kas nav citotoksiskas un nav šķīstošas – 5 mg uz plati vai 5 μl uz plati, vienā vai vairākās pārbaudāmajās koncentrācijās jābūt nešķīstošām galīgajā apstrādes maisījumā. Testa vielas, kas ir citotoksiskas jau zem 5 mg uz plati vai 5 μl uz plati, pārbauda koncentrācijās, kas ir mazākas par citotoksisko koncentrāciju. Neizšķīdušas vielas klātbūtne nedrīkst traucēt skaitīšanu.
Sākotnējā izmēģinājumā vielu pārbauda vismaz piecās analizējamās koncentrācijās ar apmēram puslogaritmiskiem (t. i., maksimāli √10 reizes) intervāliem starp testa punktiem. Var izmantot mazākus koncentrāciju intervālus gadījumos, kad pēta koncentrāciju ietekmi. Var veikt izmēģinājumus ar koncentrācijām, kas pārsniedz 5 mg vai 5 μl uz plati gadījumos, kad testa viela ievērojamā daudzumā satur potenciāli mutagēnus piemaisījumus.
1.5.2.3. Negatīvas un pozitīvas kontroles
Katrā eksperimentā gan ar metabolisma aktivāciju, gan bez tās vienlaicīgi iekļauj celmam piemērotas pozitīvas un negatīvas (šķīdinātāja vai nesēja) kontroles. Pozitīvai kontrolei izvēlas koncentrācijas, kas ir efektīvas visos izmēģinājumos.
Izmēģinājumos, kuros izmanto metabolisma aktivācijas sistēmas, standartvielu(-as) pozitīvai kontrolei jāizvēlas atbilstīgi lietoto baktēriju celma tipam.
Izmēģinājumos ar metabolisma aktivāciju pozitīvai kontrolei ir piemērotas šādas vielas:
|
CAS Nr. |
Einecs Nr. |
Viela |
|
781-43-1 |
212-308-4 |
9,10-dimetilantracēns |
|
57-97-6 |
200-359-5 |
7,12-dimetilbenzantracēns |
|
50-32-8 |
200-028-5 |
benzopirēns |
|
613-13-8 |
210-330-9 |
2-aminoantracēns |
|
50-18-0 |
ciklofosfamīds |
|
|
6055-19-2 |
200-015-4 |
ciklofosfamīda monohidrāts |
Izmēģinājumiem ar reducējošās metabolisma aktivācijas metodi pozitīvai kontrolei ir piemērota šāda viela:
|
CAS Nr. |
Einecs Nr. |
Viela |
|
573-58-0 |
209-358-4 |
Kongo sarkanais |
Kā vienīgo S9 maisījuma iedarbības indikatoru nevar izmantot 2-aminoantracēnu. Gadījumos, kad izmanto 2-aminoantracēnu, katrs S9 paraugs jāraksturo arī ar mutagēnu, kam vajadzīga metabolisma aktivācija ar mikrosomu fermentiem, piemēram, ar benzopirēnu vai dimetilbenzantracēnu.
Izmēģinājumos bez eksogēnas metabolisma aktivācijas sistēmas celmam specifiskai pozitīvai kontrolei ir piemērotas šādas vielas:
|
CAS Nr. |
Einecs Nr. |
Viela |
Celms |
|
26628-22-8 |
247-852-1 |
nātrija azīds |
TA 1535 un TA 100 |
|
607-57-8 |
210-138-5 |
2- nitrofluorēns |
TA 98 |
|
90-45-9 |
201-995-6 |
9-aminoakridīns |
TA 1537, TA 97 un TA 97a |
|
17070-45-0 |
241-129-4 |
ICR 191 |
TA 1537, TA 97 un TA 97a |
|
80-15-9 |
201-254-7 |
kumola hidroperoksīds |
TA 102 |
|
50-07-7 |
200-008-6 |
mitomicīns C |
WP2 uvrA un TA102 |
|
70-25-7 |
200-730-1 |
N-etil-N-nitro-N-nitrozoguanidīns |
WP2, WP2uvrA un WP2uvrA (pKM101) |
|
56-57-5 |
200-281-1 |
4-nitrohinolīn-1-oksīds |
WP2, WP2uvrA un WP2uvrA (pKM101) |
|
3688-53-7 |
furilfuramīds (AF2) |
Plazmīdus saturoši celmi |
Pozitīvai kontrolei var izmantot arī citas piemērotas standartvielas. Ja iespējams, kā pozitīvās kontroles vielas jāizmanto ķīmiskas vielas, kas pieder pie atbilstošām vielu grupām.
Jāiekļauj negatīvas kontroles, kurās ietilpst tikai šķīdinātājs vai nesējs un kurās nav testa vielu; ar tām rīkojas tieši tāpat kā ar apstrādes grupām. Turklāt jāizmanto arī tukšie mēģinājumi, izņemot gadījumus, kad ir iepriekš iegūti vēsturiski kontroldati, kas skaidri parāda, ka izvēlētajam šķīdinātājam nav kaitīgas mutagēnas iedarbības.
1.5.3. Procedūra
Pēc iekļaušanas platē metodes (1) (2) (3) (4) bez metabolisma aktivācijas parasti ņem 0,05 ml vai 0,1 ml testa vielas šķīduma, 0,1 ml svaigas baktēriju kultūras (kurā ir apmēram 108 dzīvotspējīgas šūnas) un 0,5 ml sterila buferšķīduma, ko sajauc ar 2,0 ml augšējā slāņa agara. Izmēģinājumiem ar metabolisma aktivāciju parasti ņem 0,5 ml metabolisma aktivācijas maisījuma, kurā ir vajadzīgais daudzums pēcmitohondriskās frakcijas (metabolisma aktivācijas maisījumā koncentrācijā no 5 līdz 30 tilp. %), ko kopā ar baktērijām un testa vielu vai tās šķīdumu sajauc ar augšējā slāņa agaru (2,0 ml). Mēģeņu saturu sajauc un izlej mazās agara platēs. Pirms inkubācijas augšējā slāņa agaram ļauj sacietēt.
Ar preinkubācijas metodes (2) (3) (5) (6) testa vielu vai tās šķīdumu parasti vispirms vismaz 20 minūtes inkubē 30–37 oC temperatūrā kopā ar testam izmantojamo celmu (kas satur apmēram 108 dzīvotspējīgas šūnas) un sterilu buferšķīdumu vai metabolisma aktivācijas sistēmu (0,5 ml), ko pēc tam sajauc ar augšējā slāņa agaru un izlej mazās agara platēs. Parasti 2,0 ml augšējā slāņa agara sajauc ar 0,05 vai 0,1ml testa vielas vai testa šķīduma, 0,1 ml baktēriju un 0,5 ml S9 maisījuma vai sterila buferšķīduma. Preinkubācijas laikā mēģenēm jāveic aerācija, lietojot kratītāju.
Pareizai variāciju novērtēšanai visas devas pārbauda trijos atkārtojumos. Izmēģinājumu var veikt divos atkārtojumos gadījumos, kad tam ir zinātnisks pamatojums. Kādas plates zaudējuma dēļ izmēģinājums nav uzskatāms par nederīgu.
Gāzveida un gaistošu vielu pārbaudēm izmanto atbilstošas metodes, piemēram, kultivēšanu hermētiski noslēgtos traukos (12) (14) (15) (16).
1.5.4. Inkubēšana
Visas viena izmēģinājuma plates inkubē 48–72 stundas 37 oC temperatūrā. Pēc inkubēšanas nosaka revertanto koloniju skaitu uz katras plates.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Rezultātus izsaka ar revertanto koloniju skaitu uz plati. Norāda arī revertanto koloniju skaitu gan uz negatīvās kontroles (uz šķīdinātāja kontroles un, ja izmantota, arī tukšā mēģinājuma), gan arī uz pozitīvās kontroles platēm. Testa vielai, pozitīvajai un negatīvajai (neapstrādātai un/vai šķīdinātāju) kontrolei norāda revertanto koloniju skaitu uz platēm, to vidējo skaitu un standartnovirzes.
Nav noteiktu prasību attiecībā uz pozitīvas reakcijas verificēšanu. Apšaubāmus rezultātus pārbauda, veicot atkārtoti pārbaudi, turklāt vēlams mainīt eksperimenta apstākļus. Negatīvi rezultāti katrā konkrētā gadījumā ir jāapstiprina. Gadījumos, kad negatīvu rezultātu apstiprināšanu uzskata par nevajadzīgu, tas ir jāpamato. Izmaiņas eksperimenta apstākļu parametros novērtē un nosaka papildu eksperimentos. Eksperimenta parametri, kurus var mainīt, ir pārbaudāmo koncentrāciju atšķirības, apstrādes metode (ietveršana platē vai šķidruma preinkubācija) un metabolisma aktivācijas apstākļi.
2.2. REZULTĀTU NOVĒRTĒŠANA UN INTERPRETĀCIJA
Pozitīvu rezultātu nosaka pēc vairākiem kritērijiem, piemēram, atkarībā no koncentrācijas – pēc revertanto koloniju skaita palielināšanās uz plati vai pēc vismaz viena celma revertanto koloniju skaita reproducējamas palielināšanās ar metabolisma aktivācijas sistēmu vai bez tās (23). Vispirms rezultātus izvērtē bioloģiski. Kā palīglīdzekli testu rezultātu izvērtēšanai var izmantot statistikas metodes (24). Tomēr statistiskais nozīmīgums nedrīkst būt vienīgais faktors, pēc kā nosaka pozitīvu atbildes reakciju.
Uzskata, ka testa vielas mutagēnās īpašības nav konstatētas, ja tās testa rezultāti neatbilst iepriekšminētajiem kritērijiem.
Lai gan lielākajā daļā eksperimentu iegūst nepārprotami pozitīvus vai negatīvus rezultātus, tomēr dažkārt pēc iegūtajiem datiem nevar noteikti spriest par testa vielas aktivitāti. Turklāt rezultāti var būt nedroši vai apšaubāmi arī neatkarīgi no eksperimenta atkārtojumu skaita.
Pozitīvi baktēriju reversās mutācijas testa rezultāti liecina, ka testa viela izraisa Salmonella typhimurium un/vai Escherichia coli noteiktas mutācijas ar bāzu aizvietošanu vai olbaltuma sintēzes nolasīšanas fāzes nobīdi genomā. Negatīvi rezultāti liecina, ka testa apstākļos testa viela neizraisa mutācijas pārbaudītajām sugām.
3. ZIŅOJUMU SASTĀDĪŠANA
TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
Šķīdinātājs/nesējs:
— šķīdinātāja/nesēja izvēles pamatojums,
— testa vielas šķīdība un stabilitāte šķīdinātājā/nesējā, ja tā ir zināma.
Celmi:
— izmantotie baktēriju celmi,
— šūnu skaits kultūrā,
— celmu raksturojums.
Testa apstākļi:
— testa vielas daudzums uz vienu plati (mg/platē vai μl/platē), pamatojot izvēlēto devu un vienas koncentrācijas pārbaudei ņemto plašu skaitu,
— izmantotā barotne,
— metabolisma aktivācijas sistēmas veids un sastāvs, norādot pieņemamības kritērijus,
— apstrādes procedūras.
Rezultāti:
— toksicitātes pazīmes,
— izgulsnēšanās pazīmes,
— koloniju skaits uz katras plates,
— vidējais revertanto koloniju skaits uz plati un standartnovirze,
— ja iespējams, reakcijas uz devu novērtējums,
— statistiskās analīzes rezultāti, ja tā veikta,
— līdztekus iegūtie negatīvas (šķīdinātāja/nesēja) un pozitīvas kontroles rezultāti, norādot robežas, vidējos lielumus un standartnovirzes,
— līdzšinējie vēsturiskie negatīvas (šķīdinātāja/nesēja) un pozitīvas kontroles rezultāti, norādot robežas, vidējos lielumus un standartnovirzes.
Rezultātu izvērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Ames, B.N., McCann, J. and Yamasaki E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test. Mutation Res., 31, p. 347–364.
(2) Maron, D.M. and Ames, B.N. (1983). Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, p. 173–215.
(3) Gatehouse, D., Haworth, S., Cebula, T., Gocke, E., Kier, L., Matsushima, T., Melcion, C., Nohmi, T., Venitt, S. and Zeiger, E. (1994). Recommendations for the Performance of Bacterial Mutation Assays. Mutation Res., 312, p. 217–233.
(4) Kier, L.D., Brusick D.J., Auletta, A.E., Von Halle, E.S., Brown, M.M., Simmon, V.F., Dunkel, V., McCann, J., Mortelmans, K., Prival, M., Rao, T.K. and Ray V. (1986). The Salmonella typhimurium/Mammalian Microsomal Assay: A Report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 168, p. 69–240.
(5) Yahagi, T., Degawa, M., Seino, Y.Y., Matsushima, T., Nagao, M., Sugimura, T. and Hashimoto, Y. (1975). Mutagenicity of Carcinogen Azo Dyes and their Derivatives, Cancer Letters, 1, p. 91–96.
(6) Matsushima, M., Sugimura, T., Nagao, M., Yahagi, T., Shirai, A. and Sawamura, M. (1980). Factors Modulating Mutagenicity Microbial Tests. In: Short-term Test Systems for Detecting Carcinogens. Ed. Norpoth K.H. and Garner, R.C., Springer, Berlin-Heidelberg-New York, p. 273–285.
(7) Gatehouse, D.G., Rowland, I.R., Wilcox, P., Callender, R.D. and Foster, R. (1980). Bacterial Mutation Assays. In: Basic Mutagenicity Tests: UKEMS Part 1 Revised. Ed. D.J. Kirkland, Cambridge University Press, p. 13–61.
(8) Aeschacher, H.U., Wolleb, U. and Porchet, L. (1987). Liquid Preincubation Mutagenicity Test for Foods. J. Food Safety, 8, p. 167–177.
(9) Green, M.H.L., Muriel, W.J. and Bridges, B.A. (1976). Use of a simplified fluctuation test to detect low levels of mutagens. Mutation Res., 38, p. 33–42.
(10) Hubbard, S.A., Green, M.H.L., Gatehouse, D. and J.W. Bridges (1984). The Fluctuation Test in Bacteria. In: Handbook of Mutagenicity Test Procedures. 2nd Edition. Ed. Kilbey, B.J., Legator, M., Nichols, W. and Ramel, C., Elsevier, Amsterdam-New York-Oxford, pp. 141–161.
(11) Thompson, E.D. and Melampy, P.J. (1981). An Examination of the Quantitative Suspension Assay for Mutagenesis with Strains of Salmonella typhimurium. Environmental Mutagenesis, 3, p. 453–465.
(12) Araki, A., Noguchi, T., Kato, F. and T. Matsushima (1994). Improved Method for Mutagenicity Testing of Gaseous Compounds by Using a Gas Sampling Bag. Mutation Res., 307, p. 335–344.
(13) Prival, M.J., Bell, S.J., Mitchell, V.D., Reipert, M.D. and Vaughn, V.L. (1984). Mutagenicity of Benzidine and Benzidine-Congener Dyes and Selected Monoazo Dyes in a Modified Salmonella Assay. Mutation Res., 136, p. 33–47.
(14) Zeiger, E., Anderson, B.E., Haworth, S., Lawlor, T. and Mortelmans, K. (1992). Salmonella Mutagenicity Tests. V. Results from the Testing of 311 Chemicals. Environ. Mol. Mutagen., 19, p. 2–141.
(15) Simmon, V., Kauhanen, K. and Tardiff, R.G. (1977). Mutagenic Activity of Chemicals Identified in Drinking Water. In Progress in Genetic Toxicology, D. Scott, B. Bridges and F. Sobels (Eds.) Elsevier, Amsterdam, p. 249–258.
(16) Hughes, T.J., Simmons, D.M., Monteith, I.G. and Claxton, L.D. (1987). Vaporisation Technique to Measure Mutagenic Activity of Volatile Organic Chemicals in the Ames/Salmonella Assay. Environmental Mutagenesis, 9, p. 421–441.
(17) Matsushima, T., Matsumoto, A., Shirai, M., Sawamura, M., and Sugimura, T. (1979). Mutagenicity of the Naturally Occurring Carcinogen Cycasin and Synthetic Methylazoxy Methane Conjugates in Salmonella typhimurium. Cancer Res., 39, p. 3780–3782.
(18) Tamura, G., Gold, C., Ferro-Luzzi, A. and Ames, B.N. (1980). Fecalase: A Model for Activation of Dietary Glycosides to Mutagens by Intestinal Flora. Proc. Natl. Acad. Sci. USA, 77, p. 4961–4965.
(19) Wilcox, P., Naidoo, A., Wedd, D.J. and Gatehouse, D.G. (1990). Comparison of Salmonella typhimurium TA 102 with Escherichia coli WP2 Tester strains. Mutagenesis, 5, p. 285–291.
(20) Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976). A Safe Substitute for Polychlorinated Biphenyls as an Inducer or Metabolic Activation Systems. In: “In Vitro metabolic Activation in Mutagenesis Testing” Eds. F.J. de Serres et al. Elsevier, North Holland, p. 85–88.
(21) Elliot, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992). Alternatives to Aroclor 1254-induced S9 in in Vitro Genotoxicity Assays. Mutagenesis, 7, p. 175–177.
(22) Maron, D., Katzenellenbogen, J. and Ames, B.N. (1981). Compatibility of Organic Solvents with the Salmonella/Microsome Test. Mutation Res., 88, p. 343–350.
(23) Claxton, L.D., Allen, J., Auletta, A., Mortelmans, K., Nestmann, E. and Zeiger, E. (1987). Guide for the Salmonella typhimurium/Mammalian Microsome Tests for Bacterial Mutagenicity. Mutation Res., 189, p. 83–91.
(24) Mahon, G.A.T., Green, M.H.L., Middleton, B., Mitchell, I., Robinson, W.D. and Tweats, D.J. (1989). Analysis of Data from Microbial Colony Assays. In: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Part II. Statistical Evaluation of Mutagenicity Test Data. Ed. Kirkland, D.J., Cambridge University Press, p. 28–65.
B.15. MUTAGENITĀTES NOTEIKŠANA KOPĀ AR KANCEROGENITĀTES PRIEKŠNOVĒRTĒJUMU GĒNU MUTĀCIJAS SACCHAROMYCES CEREVISIAE ŠŪNĀS
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJA
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Gēnu mutāciju noteikšanai, ko inducē ķīmiski aģenti pēc metaboliskās aktivācijas vai bez tās, var izmantot dažādus haploīdus un diploīdus rauga (Saccharomyces cerevisiae) celmus.
Šim nolūkam izmanto tādas haploīdu celmu mutāciju noteikšanas sistēmas, kas ļauj kvantitatīvi noteikt turpvērsto mutāciju no sarkaniem adenīnatkarīgiem mutantiem (ade-1, ade-2) uz divkārši adenīnatkarīgiem baltiem mutantiem, kā arī selektīvas sistēmas, piemēram, rezistences inducēšanu pret kanavanīnu un cikloheksimīdu.
Visplašāk pārbaudītā atpakaļvērsto mutāciju sistēma ir haploīdais celms XV 185-14C, kas satur ochre nonsensmutācijas ade 2-1, arg 4-17, lys 1-1 un trp 5-48, kuru reversiju var panākt ar bāzu nomaiņas mutagēniem, kas inducē sait-specifiskas mutācijas vai mutācijas ochre supresorgēnā. XV 185-14C satur arī ģenētisko marķieri his 1-7, kas ir misensmutācija, kuras reversiju var galvenokārt panākt ar mutāciju citā saitā, un iezīmētājgēnu hom 3-10, kas revertējams ar fāzes nobīdes mutagēniem.
No diploīdiem S. cerevisiae celmiem plaši izmanto tikai celmu D7, kas ir homozigots pēc ilv 1-92.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
Sagatavošanas darbi
Pārbaudāmo vielu un kontrolvielu šķīdumus attiecīgajā šķīdinātājā gatavo īsi pirms izmēģinājuma. Ja izmanto organiskos savienojumus, kas nešķīst ūdenī, tos izšķīdina tādā organiskā šķīdinātājā kā etanols, acetons vai dimetilsulfoksīds (DMSO), kuru koncentrācija nedrīkst pārsniegt 2 tilp. %. Šķīdinātājs galīgajā koncentrācijā nedrīkst ievērojami ietekmēt šūnu dzīvotspēju un vairošanos.
Šūnas pakļauj pārbaudāmās vielas iedarbībai, pievienojot tām piemērotu eksogēnu metaboliskās aktivācijas sistēmu, vai bez tās.
Visplašāk izmanto no grauzēju aknām iegūtu postmitohondriālo frakciju kopā ar kofaktoru, kas iepriekš apstrādāta ar fermentus inducējošiem aģentiem. Metabolisko aktivāciju var panākt, izmantojot arī citas sugas, audus, postmitohondriālās frakcijas vai metodes.
Testa apstākļi
Gēnu mutāciju pētījumos visbiežāk izmanto haploīdo celmu XV 185-14C un diploīdo celmu D7. Šim nolūkam der arī citi rauga celmi.
Izdzīvojušo un mutanto šūnu skaita noteikšanai izmanto piemērotas barotnes.
Vienlaikus jāizmanto pozitīvā kontrole, kontrole bez apstrādes un kontrole ar šķīdinātāju. Katras konkrētas mutācijas noteikšanai izmanto pozitīvo kontroli ar piemērotām vielām.
Pārbaudāmās vielas diapazons aptver vismaz piecas atšķirīgas koncentrācijas. Toksiskām vielām izvēlas tādu lielāko koncentrāciju, lai izdzīvotu vismaz 5–10 % šūnu. Vielas, kas samērā slikti šķīst ūdenī, pārbauda koncentrācijā, kas ir tuvu to šķīdības robežai, izmantojot piemērotu metodi. Netoksiskām vielām, kas pilnībā šķīst ūdenī, lielāko koncentrāciju nosaka katrā atsevišķā gadījumā.
Mikrobioloģiskās plates inkubē 4–7 dienas tumsā 28–30 oC temperatūrā.
Jāizmanto subkultūras, kam spontāno mutāciju biežums nepārsniedz pieņemto normu.
Reģistrējot prototrofus, kas radušies gēnu mutāciju rezultātā, katras koncentrācijas pārbaudei un šūnu dzīvotspējas noteikšanai izmanto vismaz trīs replikātus. Ja izmēģinājumā izmanto tādu ģenētisko marķieri kā hom 3–10, kam ir pazemināts mutāciju biežums, plašu skaits ir jāpalielina, lai iegūtu statistiski nozīmīgus datus.
Testa norise
S. cerevisiae celmu apstrādi parasti veic šķidrā barotnē, kad šūnas atrodas stacionārajā fāzē vai vairošanās fāzē. Sākotnēji izmēģinājumus veic ar šūnām vairošanās fāzē (1–5 × 107 šūnu/ml): uz ne vairāk kā 18 stundām tās pakļauj pārbaudāmās vielas iedarbībai 28–37 oC temperatūrā, pastāvīgi kratot; šajā laikā atkarībā no apstākļiem tām var vajadzīgā daudzumā pievienot metaboliskās aktivācijas sistēmu. Pēc apstrādes šūnas centrifugē, skalo un iesēj piemērotā barotnē. Pēc inkubācijas pārbauda izdzīvojušo šūnu skaitu un inducēto gēnu mutāciju biežumu. Ja pirmajā izmēģinājumā iegūst negatīvus rezultātus, tad izmēģinājums jāatkārto ar šūnām stacionārajā fāzē. Ja pirmajā izmēģinājumā iegūst pozitīvus rezultātus, tie jāapstiprina vēl vienā neatkarīgā izmēģinājumā.
2. DATI
Dati jāapkopo tabulā, norādot reģistrēto koloniju skaitu, mutantu skaitu, šūnu dzīvotspēju un mutācijas biežumu. Visi šie rezultāti jāapstiprina neatkarīgā izmēģinājumā. Iegūtie dati jāizvērtē, izmantojot piemērotas statistikas metodes.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— izmantotais mikroorganismu celms,
— testa apstākļi (šūnas stacionārajā fāzē vai vairošanās fāzē, barotņu sastāvs, inkubācijas temperatūra un ilgums, metaboliskās aktivācijas sistēma),
— aplikācijas shēma (izmantotās koncentrācijas, norise un ilgums, temperatūra, pozitīvā un negatīvā kontrole),
— reģistrēto koloniju skaits, mutantu skaits, šūnu dzīvotspēja un mutāciju biežums, vajadzības gadījumā devas/iedarbības attiecība, datu statistiskais novērtējums,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.16. MITOTISKĀ REKOMBINĀCIJA – SACCHAROMYCES CEREVISIAE ŠŪNĀS
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJA
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Mitotisko rekombināciju Saccharomyces cerevisiae šūnās var novērot gan starp gēniem (vai visbiežāk starp gēnu un centromēru), gan viena gēna ietvaros. Pirmajā gadījumā to dēvē par mitotisko krustmiju un tās rezultātā rodas reciprokie produkti, bet otrajā gadījumā šis process nav reciprokāls un to dēvē par gēnu konversiju. Par krustmiju parasti liecina tas, ka heterozigotiem celmiem rodas recesīvas homozigotas kolonijas vai sektori, savukārt uz gēnu konversiju norāda prototrofu revertantu parādīšanās auksotrofos heteroalēlos celmos, kas vienā gēnā satur divas dažādas bojātas alēles. Mitotiskās gēnu konversijas noteikšanai visplašāk izmanto tādus rauga celmus kā D4 (kas ir heteroalēls pēc ade 2 un trp 5), D7 (heteroalēls pēc trp 5), BZ34 (heteroalēls pēc arg 4) un JD1 (heteroalēls pēc his 4 un trp 5). Mitotisko krustmiju, kuras rezultātā rodas sarkani vai rozā sektori, var noteikt rauga celmam D5 vai D7 (tos izmanto arī mitotiskās gēnu konversijas un atgriezenisko mutāciju noteikšanai ilv 1-92 gēnā); abi šie celmi ir heteroalēli pēc komplementējošajām ade 2 alēlēm.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
Sagatavošanas darbi
Pārbaudāmo vielu un kontrolvielu vai standartvielu šķīdumus piemērotā šķīdinātājā gatavo īsi pirms izmēģinājuma. Ja izmanto organiskos savienojumus, kas nešķīst ūdenī, tos izšķīdina tādā organiskā šķīdinātājā kā etanols, acetons vai dimetilsulfoksīds (DMSO), kuru koncentrācija nedrīkst pārsniegt 2 tilp. %. Šķīdinātājs galīgajā koncentrācijā nedrīkst ievērojami ietekmēt šūnu dzīvotspēju un vairošanos.
Šūnas pakļauj pārbaudāmās vielas iedarbībai, gan pievienojot tām piemērotu eksogēnu metaboliskās aktivācijas sistēmu, gan bez tās. Visplašāk izmanto no grauzēju aknām iegūtu postmitohondriālo frakciju kopā ar kofaktoru, kas iepriekš apstrādāta ar fermentus inducējošiem aģentiem. Metabolisko aktivāciju var panākt, izmantojot arī citas sugas, audus, pēcmitohondriālās frakcijas vai metodes.
Testa apstākļi
Visplašāk izmanto diploīdos celmus D4, D5, D7 un JD1. Šim nolūkam var izmantot arī citus rauga celmus.
Izdzīvojušo šūnu skaita un mitotiskās rekombinācijas biežuma noteikšanai izmanto piemērotas barotnes.
Vienlaikus jāizmanto pozitīvā kontrole, kontrole bez apstrādes un kontrole ar šķīdinātāju. Katras konkrētas rekombinācijas noteikšanai izmanto pozitīvo kontroli ar piemērotām vielām.
Pārbaudāmās vielas diapazons aptver vismaz piecas atšķirīgas koncentrācijas. Cita starpā jāņem vērā tādi faktori kā citotoksicitāte un šķīdība. Viela vismazākajā koncentrācijā nedrīkst nomākt šūnu dzīvotspēju. Toksiskām vielām izvēlas tādu lielāko koncentrāciju, lai izdzīvotu vismaz 5–10 % šūnu. Vielas, kas samērā slikti šķīst ūdenī, pārbauda koncentrācijā, kas ir tuvu to šķīdības robežai, izmantojot piemērotu metodi. Netoksiskām vielām, kas pilnībā šķīst ūdenī, lielāko koncentrāciju nosaka katrā atsevišķā gadījumā.
Pārbaudāmās vielas iedarbībai, kas ilgst līdz 18 stundām, var pakļaut šūnas stacionārajā fāzē vai vairošanās fāzē. Bet, ja izmanto garāku ekspozīcijas laiku, mikroskopiski jāpārbauda, vai rauga kultūrās neveidojas sporas, jo tad izmēģinājuma rezultāti būs nederīgi.
Mikrobioloģiskās plates inkubē 4–7 dienas tumsā 28–30 oC temperatūrā. Plates, ko izmanto sarkano un rozā homozigoto sektoru noteikšanai, kuri veidojas krustmijas rezultātā, pirms to skaitīšanas vēl vienu vai divas dienas glabā ledusskapī (ap 4 oC), ļaujot attīstīties attiecīgās krāsas kolonijām.
Jāizmanto subkultūras, kurām spontānās mitotiskās rekombinācijas biežums nepārsniedz pieņemto normu.
Reģistrējot prototrofus, kas radušies mitotiskās gēnu konversijas rezultātā, katras koncentrācijas pārbaudei un šūnu dzīvotspējas noteikšanai izmanto vismaz trīs replikātus. Reģistrējot recesīvo homozigotismu pēc mitotiskās krustmijas, izmantoto plašu skaits ir jāpalielina, lai sasniegtu vajadzīgo koloniju daudzumu.
Testa norise
S. cerevisiae celmu apstrādi parasti veic šķidrā barotnē, kad šūnas atrodas stacionārajā fāzē vai vairošanās fāzē. Pirmos izmēģinājumus veic ar šūnām vairošanās fāzē. 1–5 × 107 šūnu/ml uz ne ilgāk kā 18 stundām pakļauj pārbaudāmās vielas iedarbībai 28–37 oC temperatūrā, pastāvīgi kratot; šajā laikā, atkarībā no apstākļiem, tām var vajadzīgā daudzumā pievienot metaboliskās aktivācijas sistēmu.
Pēc apstrādes šūnas centrifugē, skalo un iesēj piemērotā barotnē. Pēc inkubācijas pārbauda izdzīvojušo šūnu skaitu un inducētās mitotiskās rekombinācijas biežumu.
Ja pirmajā izmēģinājumā iegūst negatīvus rezultātus, tad izmēģinājums jāatkārto ar šūnām stacionārajā fāzē. Ja pirmajā izmēģinājumā iegūst pozitīvus rezultātus, tie jāapstiprina neatkarīgā izmēģinājumā.
2. DATI
Dati jāapkopo tabulā, norādot reģistrēto koloniju skaitu, rekombinantu skaitu, izdzīvojušo šūnu skaitu un rekombinācijas biežumu.
Šie rezultāti jāapstiprina neatkarīgā izmēģinājumā.
Iegūtie dati jāizvērtē ar piemērotu statistikas metodi.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— izmantotais mikroorganismu celms,
— testa apstākļi (šūnas stacionārajā fāzē vai vairošanās fāzē, barotņu sastāvs, inkubācijas temperatūra un ilgums, metaboliskās aktivācijas sistēma),
— aplikācijas shēma (izmantotās koncentrācijas, norise un ilgums, temperatūra, pozitīvā un negatīvā kontrole),
— reģistrēto koloniju skaits, rekombinantu skaits, izdzīvojušo šūnu skaits un rekombinācijas biežums, vajadzības gadījumā devas/iedarbības attiecība, datu statistiskais novērtējums,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.17. MUTAGENITĀTE – ZĪDĪTĀJU ŠŪNU GĒNU MUTĀCIJU TESTS IN VITRO
1. METODE
Šī metode ir ESAO TG 476 metodes “Zīdītāju šūnu gēnu mutāciju tests in vitro” (1997) kopija.
1.1. IEVADS
Zīdītāju šūnu gēnu mutāciju testu in vitro var izmantot ķīmisko vielu izraisīto gēnu mutāciju noteikšanai. Pie šim nolūkam piemērotām šūnu līnijām pieder L5178Y peļu limfomas šūnas, CHO, CHO-AS52 un V79 līniju Ķīnas kāmju šūnas, un TK6 cilvēku limfoblastoīdās šūnas (1). Šīm šūnu līnijām parasti nosaka tādus ģenētiskos raksturlielumus kā mutācija pie timidīnkināzes (TK) un hipoksantīna-guanīna fosforiboziltransferāzes (HPRT), kā arī ksantīna-guanīna fosforiboziltransferāzes (XPRT) transgēna. TK, HPRT un XPRT mutāciju testos nosaka dažādas ģenētiskās norises. Pēc TK un XPRT autosomu atrašanās vietas var noteikt tādas ģenētiskās pārmaiņas (piemēram, lielus izlaidumus), ko nevar noteikt HPRT gēna atrašanās vietā X hromosomās (2) (3) (4) (5) (6).
Zīdītāju šūnu gēnu mutāciju testam in vitro var izmantot izveidotas šūnu līnijas vai šūnu celmus. Testam izmatojamās šūnas izvēlas pēc to augšanas spējas kultūrā un spontāno mutāciju biežuma stabilitātes.
Testiem, ko izdara in vitro, metaboliskai aktivācijai parasti jāizmanto eksogēns avots. Šāda metaboliskas aktivācijas sistēma nevar pilnībā imitēt apstākļus zīdītāju organismā in vivo. Jāraugās, lai novērstu apstākļus, kuros iegūst rezultātus, kas neraksturo mutagenitāti. Pozitīvus rezultātus, kas neraksturo mutagenitāti, var iegūt no pH izmaiņām, osmozes vai vielu augstas citotoksicitātes dēļ (7).
Šo testu izmanto zīdītājiem potenciāli mutagēnu un kancerogēnu vielu skrīningam. Daudzi savienojumi, kam šis tests ir pozitīvs, ir zīdītājiem kancerogēni; tomēr pilnīga korelācija starp šo testu un kancerogenitāti nepastāv. Korelācija ir atkarīga no ķīmisko vielu grupas, pie kuras pieder pārbaudāmais savienojums, un ir arvien vairāk pierādījumu, ka ir kancerogēni, ko ar šo testu noteikt nevar, jo to iedarbībai ir cits mehānisms, kas ar genotoksiskumu nesaistīts vai kura nav baktēriju šūnās (6).
Skatīt arī vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Tieša mutācija: gēna mutācija no vecāku tipa mutanta formas, ko rada iekodētā proteīna enzīma funkcijas aktivācijas izmaņas vai zudums.
Bāzu pāra aizstājēji mutagēni: vielas, kas izraisa viena vai vairāku DNS bāzu pāru aizstāšanu.
Mutagēni, kas izraisa olbaltuma sintēzes nolasīšanas fāzes nobīdi: vielas, kas DNS molekulā izraisa viena vai vairāku bāzu pāru pievienošanu vai izdzēšanu.
Fenotipa izpausmes laiks: periods, kura laikā neizmainīti gēnu produkti tiek izspiesti no šūnām, kurās notikušas mutācijas.
Mutāciju biežums: mutanto šūnu skaits, ko novēro attiecībā pret dzīvotspējīgo šūnu skaitu.
Relatīvais kopējais pieaugums: šūnu skaita palielināšanās laikā salīdzinājumā ar šūnu kontroles populāciju, ko aprēķina, reizinot suspensijas pieauguma attiecību pret negatīvo kontroli ar klonēšanas efektivitātes attiecību pret negatīvo kontroli.
Relatīvais suspensijas pieaugums: šūnu skaita palielināšanās izpausmes perioda laikā attiecībā pret negatīvo kontroli.
Dzīvotspēja: apstrādāto šūnu klonēšanas efektivitāte laikā, kad pēc izpausmes laika perioda beigām tās novieto uz plates selektīvos apstākļos.
Izdzīvošana: pēc apstrādes perioda beigām uz plates novietotu apstrādātu šūnu klonēšanas efektivitāte; izdzīvošanu parasti izsaka attiecībā pret kontrolšūnu populācijas izdzīvošanu.
1.3. TESTA METODES PRINCIPS
Šūnas ar timidīnkināzes (TK) deficītu mutācijas TK+/- → TK-/- dēļ ir rezistentas pret pirimidīna analoga trifluortimidīna (TFT) citotoksisko iedarbību. Timidīnkināzes kompetentās šūnas ir jutīgas pret TFT, kas izraisa šūnu metabolisma inhibēšanu un aptur šūnu turpmāko dalīšanos. Tādējādi mutantās šūnas var vairoties TFT klātbūtnē, bet normālām šūnām, kas satur timidīnkināzi, tas nav iespējams. Līdzīgi šūnas, kurās trūkst HPRT vai XPRT, izvēlas pēc rezistences pret 6-tioguanīnu (TG) vai 8-azaguanīnu (AG). Gadījumos, kad bāzes analogu vai savienojumu, kas saistīts ar selektīvo vielu, pēta kādā no zīdītāju šūnu gēnu mutācijas testiem, rūpīgi jāizvērtē testa vielas īpašības. Piemēram, jāizpēta testa vielas iespējamais selektīvais toksiskums gan mutantajām, gan nemutantajām šūnām. Tā jāapstiprina selekcijas sistēmas/vielas īpašības gadījumos, kad pārbauda ķīmiskās vielas, kuru struktūra ir līdzīga selektīvās vielas struktūrai (8).
Šūnas suspensijā vai vienslāņa kultūrā noteiktu laiku pakļauj testa vielas iedarbībai gan metabolisma aktivācijas sistēmas klātbūtnē, gan bez tās un pēc tam subkultivē, lai pirms mutanta selekcijas noteiktu citotoksicitāti un izpaustos fenotipiskās īpašības (9) (10) (11) (12) (13). Citotoksicitāti parasti nosaka, novērtējot kultūru relatīvo klonēšanas efektivitāti (izdzīvošanu) vai relatīvo kopējo pieaugumu pēc apstrādes perioda. Apstrādātās kultūras uztur augšanas vidē pietiekami ilgu laiku, kas ir raksturīgs katrai izvēlētajai gēna atrašanās vietai hromosomā un šūnas tipam, un gandrīz optimāli ļauj izpausties izraisīto mutāciju fenotipiskajām īpašībām. Mutāciju biežumu nosaka, izsējot noteiktu skaitu šūnu barotnē, kas satur selektīvo vielu mutanto šūnu noteikšanai, un barotnē bez selektīvās vielas, kurā nosaka klonēšanas efektivitāti (dzīvotspēju). Pēc atbilstoša inkubēšanas perioda saskaita kolonijas. Mutāciju biežumu aprēķina pēc mutanto koloniju skaita selektīvajā vidē un koloniju skaita neselektīvajā vidē.
1.4. TESTA METODES APRAKSTS
1.4.1. Sagatavošana
1.4.1.1. Šūnas
Šim testam var izmantot dažādu tipu šūnas, ieskaitot L5171Y, CHO, CHO-AS52, V79 vai TK6 šūnu subklonus. Šūnu tipiem, ko izmanto šim testam, jābūt jutīgiem pret ķīmiskajiem mutagēniem, ar augstu klonēšanas efektivitāti un stabilu spontāno mutāciju biežumu. Šūnām jābūt ar pārbaudītu mikoplazmas piesārņojumu, un piesārņotas šūnas testam nav izmantojamas.
Testam jābūt iepriekš noteiktai jutībai un pakāpei. Izmanto šūnu skaitu, kultūras un testa vielas koncentrācijas, kas atbilst šiem noteiktajiem parametriem (14). Minimālo dzīvotspējīgo šūnu skaitu, kas izdzīvo pēc apstrādes un ko izmanto katrā testa posmā, nosaka pēc spontāno mutāciju biežuma. Vispārīgs norādījums ir izmantot šūnu skaitu, kas ir vismaz 10 reizes lielāks par spontāno mutāciju biežumam apgriezto skaitli. Tomēr ieteicams izmantot vismaz 106 šūnas. Lai testam noteiktu konsekventus veiktspējas rādītājus, vajadzīgi pietiekami vēsturiskie dati par šūnu sistēmu.
1.4.1.2. Barotnes un kultivēšanas apstākļi
Izmanto piemērotu kultivēšanas barotni, ievērojot attiecīgus inkubēšanas apstākļus (kultivēšanas trauki, temperatūra, CO2 koncentrācija un mitrums). Barotni izvēlas atbilstoši testā izmantojamajām selektīvajām sistēmām un šūnu tipam. Īpaši svarīgi ir izvēlēties tādus kultivēšanas apstākļus, kuros tiek nodrošināta optimāla augšana izpausmes perioda laikā, un koloniju veidošanas spēja gan mutantajām, gan nemutantajām šūnām.
1.4.1.3. Kultūru sagatavošana
Šūnas pavairo no rezerves kultūrām, tās izsējot kultivēšanas barotnē un inkubējot 37 oC temperatūrā. Pirms izmantošanas testam, kultūras var būt jāattīra no tajās esošajām mutantajām šūnām.
1.4.1.4. Metabolisma aktivācija
Šūnas pakļauj testa vielas iedarbībai gan piemērotas metabolisma aktivācijas sistēmas klātbūtnē, gan bez tās. Plašāk izmantojamā aktivācijas sistēma ir ar kofaktoru papildināta pēcmitohondriskā frakcija (S9), ko pagatavo no grauzēju aknām, kas apstrādātas ar enzīmstimulējošām vielām, piemēram, Aroclor 1254 (15) (16) (17) (18) vai fenobarbitona un β-naftoflavona maisījumu (19) (20).
Pēcmitohondrisko frakciju parasti izmanto galīgā testa barotnē koncentrācijā no 1 līdz 10 tilp. %. Metabolisma aktivācijas sistēmas izvēle var būt atkarīga no savienojumu grupas, pie kuras pieder testa viela. Dažos gadījumos pēcmitohondriskā frakcija var būt jālieto vairākās koncentrācijās.
Endogēnai aktivācijai var izmantot dažādus paņēmienus, arī ar gēnu inženierijas metodēm iegūtas šūnu līnijas, kas izdala specifiskus aktivācijas enzīmus. Izmantojamo šūnu līniju izvēlei jābūt zinātniski pamatotai (piemēram, ar citohroma P450 izoenzīma nepieciešamību testa vielas metabolismam).
1.4.1.5. Testa vielas sagatavošana
Pirms šūnu apstrādes ar cietām testa vielām tās vispirms izšķīdina vai suspendē piemērotos šķīdinātājos vai nesējos un, ja vajadzīgs, atšķaida. Šķidras testa vielas var tieši pievienot testa sistēmā un/vai pirms šūnu apstrādes atšķaidīt. Ja dati par testa vielu preparātu stabilitāti liecina, ka tos uzglabāt nevar, izmanto svaigi pagatavotus preparātus.
1.4.2. Testa apstākļi
1.4.2.1. Šķīdinātājs/nesējs
Šķīdinātājs vai nesējs nedrīkst būt reaģētspējīgs ar testa vielu, un tas nedrīkst nelabvēlīgi ietekmēt šūnu dzīvotspēju un S9 aktivitāti. Izmantojot citus, mazāk izpētītus šķīdinātājus vai nesējus, jābūt datiem par to saderību. Vienmēr, kad tas iespējams, ieteicams vispirms izmantot ūdeni saturošus šķīdinātājus vai nesējus. Pārbaudot ūdens vidē nestabilas vielas, izmanto bezūdens organiskos šķīdinātājus. Ūdeni var atdalīt, pievienojot molekulāros sietus.
1.4.2.2. Pārbaudāmās koncentrācijas
Starp kritērijiem, kas jāņem vērā, nosakot testa vielas lielāko koncentrāciju, ir tās citotoksikums, šķīdība testa sistēmā, kā arī ietekme uz pH izmaiņām vai osmoze.
Citotoksicitāte jānosaka galvenajā eksperimentā ar metabolisma aktivāciju un bez tās, izmantojot piemērotus šūnu integritātes un augšanas rādītājus, piemēram, klonēšanas relatīvo efektivitāti (izdzīvošanu) vai relatīvo kopējo pieaugumu. Var būt lietderīgi iepriekš orientējošā eksperimentā noteikt vielas citotoksicitāti un šķīdību.
Būtu jāizmanto vismaz trīs analizējamas koncentrācijas. Ja viela ir citotoksiska, koncentrāciju intervālā jāietver maksimāli toksiskās koncentrācijas, kā arī vielas maztoksiskās vai netoksiskās koncentrācijas. Parasti tas nozīmē, ka koncentrācijas nedrīkst atšķirties vairāk kā 2 līdz 10 reizes. Ja maksimālo koncentrāciju nosaka pēc citotoksicitātes, tad tai jābūt aptuveni 10–20 % (bet ne mazāk par 10 %) no relatīvās izdzīvošanas (relatīvās klonēšanas efektivitātes) vai relatīvā kopējā pieauguma. Vielām ar relatīvi nelielu citotoksicitāti maksimālajai testa koncentrācijai vajadzētu būt 5 mg/ml, 5 μl/ml vai 1,01 M, no kurām izvēlas mazāko.
Relatīvi nešķīstošas vielas pārbauda zem vai virs tās šķīdības robežas kultūras apstākļos. Nešķīdību nosaka galīgajā apstrādes barotnē, kurā šūnas pakļauj testa vielas iedarbībai. Var būt lietderīgi novērtēt vielas šķīdību apstrādes sākumā un beigās, jo šķīdība var mainīties testa sistēmas ietekmē šūnu, S9, seruma un citu faktoru klātbūtnē. Neizšķīdušas vielas klātbūtni var noteikt vizuāli ar neapbruņotu aci. Neizšķīdušas vielas klātbūtne nedrīkst traucēt skaitīšanu.
1.4.2.3. Kontroles
Katrā eksperimentā gan ar metabolisma aktivāciju, gan bez tās vienlaicīgi iekļauj pozitīvas un negatīvas (šķīdinātāja vai nesēja) kontroles. Izmantojot metabolisma aktivāciju, pozitīvas kontroles vielas mutagēnai iedarbībai ir vajadzīga aktivācija.
Pie pozitīvās kontroles vielām pieder:
|
Metabolisma aktivācijas apstākļi |
Gēna atrašanās vieta hromosomā |
Viela |
CAS Nr. |
Einecs Nr. |
|
Bez eksogēnas metabolisma aktivācijas |
HPRT |
Etilmetānsulfonāts |
62-50-0 |
200-536-7 |
|
Nitrozoetilurīnviela |
759-73-9 |
212-072-2 |
||
|
TK (mazām un lielām kolonijām) |
Metilmetānsulfonāts |
66-27-3 |
200-625-0 |
|
|
XPRT |
Etilmetānsulfonāts |
62-50-0 |
200-536-7 |
|
|
Nitrozoetilurīnviela |
759-73-9 |
212-072-2 |
||
|
Ar eksogēnu metabolisma aktivāciju |
HPRT |
3-Metilholantrēns |
56-49-5 |
200-276-4 |
|
N-Nitrozodimetilamīns |
62-75-9 |
200-549-8 |
||
|
7,12-Dimetilbenzantracēns |
57-97-6 |
200-359-5 |
||
|
TK (mazām un lielām kolonijām) |
Ciklofosfamīds |
50-18-0 |
200-015-4 |
|
|
Ciklofosfamīda monohidrāts |
6055-19-2 |
|||
|
Benzopirēns |
50-32-8 |
200-028-5 |
||
|
3-Metilholantrēns |
56-49-5 |
200-276-5 |
||
|
XPRT |
N-Nitrozodimetilamīns (augstiem S9 līmeņiem) |
62-75-9 |
200-549-8 |
|
|
Benzopirēns |
50-32-8 |
200-028-5 |
Pozitīvai kontrolei var izmantot citas piemērotas standartvielas, piemēram, ja laboratorijā ir vēsturisko datu bāze par 5-brom-2′-dezoksiuridīnu (CAS Nr. 59-14-3, Einecs Nr. 200-415-9) var izmantot arī šo standartvielu. Ja iespējams, kā pozitīvās kontroles vielas izmanto savienojumus, kas pieder pie atbilstošām vielu grupām.
Iekļauj arī negatīvu kontroli, kad apstrādes barotnē ietilpst tikai šķīdinātājs vai nesējs, un ar to rīkojas tieši tāpat kā ar apstrādes grupām. Turklāt jāizmanto arī tukšie mēģinājumi, izņemot gadījumus, kad ir iepriekš iegūti vēsturiskie dati, kas skaidri parāda, ka izvēlētajam šķīdinātājam nav kaitīgas vai mutagēnas iedarbības.
1.4.3. Procedūra
1.4.3.1. Iedarbība ar testa vielu
Ar metabolisku aktivāciju un bez tās uz augošām šūnu kultūrām iedarbojas ar testa vielu. Uz šūnām iedarbojas noteiktu laiku (parasti 3–6 stundas). Iedarbības laiku var pagarināt līdz vienam vai vairākiem šūnu cikliem.
Pie katras pārbaudāmās koncentrācijas izmanto vienu vai divas apstrādātas kultūras. Izmantojot vienu kultūru, palielina pārbaudāmo koncentrāciju skaitu, tādējādi nodrošinot pietiekamu analizējamo kultūru skaitu (piemēram, vismaz astoņas analizējamas koncentrācijas). Izmanto dublikātu negatīvās (šķīdinātāja) kontrolkultūras.
Gāzveida un gaistošu vielu pārbaudēm jāizmanto atbilstošas metodes, piemēram, kultivēšana hermētiski noslēgtos traukos (21) (22).
1.4.3.2. Izdzīvošanas, dzīvotspējas un mutāciju biežuma noteikšana
Pēc iedarbības perioda ar testa vielu, šūnas mazgā un kultivē, lai noteiktu izdzīvošanu un izpaustos mutanto šūnu fenotipa īpašības. Citotoksicitāti parasti nosaka, novērtējot kultūru relatīvo klonēšanas efektivitāti (izdzīvošanu) vai relatīvo kopējo pieaugumu pēc apstrādes perioda.
Katrai gēna atrašanās vietai hromosomā ir noteikts minimālais laiks, kurā iespējami optimāli izpaužas no jauna izraisīto mutantu fenotipa īpašības (HPRT un XPRT vajadzīgas vismaz 6–8 dienas, bet TK – vismaz divas dienas). Lai noteiktu mutantu skaitu un klonēšanas efektivitāti, šūnas audzē attiecīgās barotnēs, kam pievienotas selektīvās vielas, un bez tām. Dzīvotspējas noteikšanu (ko izmanto mutāciju biežuma aprēķināšanai) sāk fenotipa īpašību izpausmes perioda beigās, tās izsējot neselektīvā barotnē.
Ja L5178Y TK+/- testā pārbaudāmā viela ir pozitīva, vismaz vienai no testa kultūrām (ar lielāko pozitīvo koncentrāciju), kā arī negatīvā un pozitīvā kontrolē nosaka koloniju lielumu. Ja L5178Y TK+/- testā pārbaudāmā viela ir negatīva, koloniju lielumu nosaka negatīvā un pozitīvā kontrolē. Koloniju lielumu var noteikt arī izmēģinājumos, kuriem izmanto TK6TK+/- testu.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Rezultātos ietilpst citotoksicitātes un dzīvotspējas noteikšana, koloniju skaits un mutāciju biežums apstrādātajās un kontroles kultūrās. Ja L5178Y TK+/- tests ir pozitīvs, pie vienas testa vielas koncentrācijas (lielākās pozitīvās koncentrācijas), kā arī negatīvajā un pozitīvajā kontrolē nosaka lielu un mazu koloniju skaitu. Sīki izpēta lielo un mazo koloniju mutantu molekulārās un citoģenētiskās īpašības (23) (24). TK+/- testā kolonijas uzskaita pēc tādiem kritērijiem kā normāla auguma (lielās) un lēni augošas (mazās) kolonijas (25). Mutantu šūnām ar lielākajiem ģenētiskajiem bojājumiem ir ilgāks skaita dubultošanās laiks, un tāpēc tās veido mazas kolonijas. Šie bojājumi parasti ir no vesela gēna zuduma līdz kariotipā redzamām hromosomu izmaiņām. Mazas kolonijas veidojošu mutantu šūnu rašanās saistāma ar vielām, kuras izraisa ievērojamas hromosomu izmaiņas (26). Mazāk bojātu mutantu šūnu augšanas ātrums ir līdzīgs mātesšūnu augšanas ātrumam, un tās veido lielas kolonijas.
Būtu jānorāda arī šūnu izdzīvošana (relatīvā klonēšanas efektivitāte) vai relatīvais kopējais pieaugums. Mutāciju biežumu izsaka ar mutantu šūnu skaita attiecību pret izdzīvojušo šūnu skaitu.
Norāda datus par atsevišķām kultūrām. Bez tam visus datus apkopo tabulas veidā.
Attiecībā uz pozitīvas reakcijas verificēšanu nav noteiktu prasību. Apšaubāmus rezultātus pārbauda, veicot atkārtotu testu, turklāt vēlams mainīt eksperimenta apstākļus. Negatīvi rezultāti katrā konkrētā gadījumā ir jāapstiprina. Gadījumos, kad negatīvu rezultātu apstiprināšanu uzskata par nevajadzīgu, tas ir jāpamato. Iegūstot apšaubāmus vai negatīvus rezultātus, izmēģinājuma parametru izmaiņas novērtē un nosaka kontroles eksperimentos. Izmēģinājuma parametri, kurus var mainīt, ir pārbaudāmo koncentrāciju atšķirības un metabolisma aktivācijas apstākļi.
2.2. REZULTĀTU NOVĒRTĒŠANA UN INTERPRETĀCIJA
Pozitīvu rezultātu nosaka pēc vairākiem kritērijiem, tādiem kā ar koncentrācijas izmaiņām saistītā mutāciju biežuma vai reproducējamā biežuma palielināšanās. Vispirms rezultātus izvērtē bioloģiski. Kā palīglīdzekli pārbaužu rezultātu izvērtēšanai var izmantot statistikas metodes. Statistiskais nozīmīgums nedrīkst būt vienīgais faktors, pēc kā nosaka pozitīvu atbildes reakciju.
Gadījumos, kad testu rezultāti neatbilst minētajiem kritērijiem, uzskata, ka testa viela šajā sistēmā nav mutagēna.
Lai gan lielākajā daļā eksperimentu iegūst nepārprotami pozitīvus vai negatīvus rezultātus, tomēr dažkārt pēc iegūtajiem datiem nevar noteikti spriest par testa vielas aktivitāti. Turklāt rezultāti var būt nedroši vai apšaubāmi arī neatkarīgi no izmēģinājuma atkārtojumu skaita.
Zīdītāju šūnu gēnu mutāciju testā in vitro iegūti pozitīvi rezultāti liecina, ka testa viela izraisa izmantoto zīdītāju šūnu kultūru gēnu mutācijas. Lielāka nozīme ir reproducējamam mutāciju skaita pieaugumam, palielinoties testa vielas koncentrācijai. Negatīvi rezultāti liecina, ka izmēģinājuma apstākļos testa viela neizraisa izmantoto zīdītāju šūnu kultūru gēnu mutācijas.
3. ZIŅOJUMU SASTĀDĪŠANA
TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
Šķīdinātājs/nesējs:
— šķīdinātāja/nesēja izvēles pamatojums,
— testa vielas šķīdība un stabilitāte šķīdinātājā/nesējā, ja tā ir zināma.
Šūnas:
— šūnu veids un izcelsme,
— šūnu kultūru skaits,
— pārneses reižu skaits, ja vajadzīgs,
— šūnu kultūru uzturēšanas metodes, ja vajadzīgs,
— mikoplazmas trūkums.
Testa apstākļi:
— vielas koncentrāciju un šūnu kultūru skaita izvēles pamatojums, piemēram, dati par citotoksiskajām īpašībām un šķīdības robežām, ja tie ir pieejami,
— barotnes sastāvs, CO2 koncentrācija,
— testa vielas koncentrācija,
— pievienotā nesēja un testa vielas tilpums,
— inkubēšanas temperatūra,
— inkubēšanas ilgums,
— apstrādes ilgums ar testa vielu,
— šūnu blīvums apstrādes laikā,
— metabolisma aktivācijas sistēmas veids un sastāvs, norādot pieņemamības kritērijus,
— pozitīvas un negatīvas kontroles,
— fenotipa īpašību izpausmes periods (norādot izsēto šūnu skaitu un subkultūras, barošanas grafiku, ja ir),
— selektīvie aģenti,
— kritēriji, pēc kuriem novērtē, vai testa rezultāts ir pozitīvs, negatīvs vai neskaidrs,
— dzīvotspējīgo šūnu un mutantu šūnu skaita noteikšanas metodes,
— uzskaitīto koloniju lielums un veids (pēc vajadzības norādot kritērijus, pēc kuriem nosaka lielas vai mazas kolonijas).
Rezultāti:
— toksicitātes pazīmes,
— izgulsnēšanās pazīmes,
— dati par pārbaudes barotnes pH un osmozi iedarbības laikā ar testa vielu, ja tie noteikti,
— koloniju lielums, ja tas noteikts vismaz negatīvajā un pozitīvajā kontrolē,
— laboratorijas iespējas noteikt mazas kolonijas veidojošas mutantu šūnas ar L5178Y TK+/- sistēmu gadījumā, ja tas ir vajadzīgs,
— ja iespējams, reakcijas uz devu novērtējums,
— statistiskās analīzes rezultāti, ja tā veikta,
— līdztekus iegūtie negatīvas (šķīdinātāja/nesēja) un pozitīvas kontroles rezultāti,
— līdzšinējie vēsturiskie negatīvas (šķīdinātāja/nesēja) un pozitīvas kontroles rezultāti, norādot robežas, vidējos lielumus un standartnovirzes,
— mutāciju biežums.
Rezultātu izvērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Moore, M.M., DeMarini, D.M., DeSerres, F.J. and Tindall, K.R. (Eds.) (1987). Banbury Report 28: Mammalian Cell Mutagenesis, Cold Spring Harbor Laboratory, New York.
(2) Chu, E.H.Y. and Malling, H.V. (1968). Mammalian Cell Genetics. II. Chemical Induction of Specific Locus Mutations in Chinese Hamster Cells In Vitro, Proc. Natl. Acad. Sci., USA, 61, p. 1306–1312.
(3) Liber, H.L. and Thilly, W.G. (1982). Mutation Assay at the Thymidine Kinase Locus in Diploid Human Lymphoblasts. Mutation Res., 94, p. 467–485.
(4) Moore, M.M., Harington-Brock, K., Doerr, C.L. and Dearfield, K.L. (1989). Differential Mutant Quantitation at the Mouse Lymphoma TK and CHO HGPRT Loci. Mutagenesis, 4, p. 394–403.
(5) Aaron, C.S. and Stankowski, Jr.L.F. (1989). Comparison of the AS52/XPRT and the CHO/HPRT Assays: Evaluation of Six Drug Candidates. Mutation Res., 223, p. 121–128.
(6) Aaron, C.S., Bolcsfoldi, G., Glatt, H.R., Moore, M., Nishi, Y., Stankowski, Jr.L.F., Theiss, J. and Thompson, E. (1994). Mammalian Cell Gene Mutation Assays Working Group Report. Report of the International Workshop on Standardisation of Genotoxicity Test Procedures. Mutation Res., 312, p. 235–239.
(7) Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M., Brusick, D., Ashby, J. and Myhr, B.C. (1991). Genotoxicity Under Extreme Culture Conditions. A report from ICPEMC Task Group 9. Mutation Res., 257, p. 147–204.
(8) Clive, D., McCuen, R., Spector, J.F.S., Piper, C. and Mavournin, K.H. (1983). Specific Gene Mutations in L5178Y Cells in Culture. A Report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 115, p. 225–251.
(9) Li, A.P., Gupta, R.S., Heflich, R.H. and Wasson, J.S. (1988). A Review and Analysis of the Chinese Hamster Ovary/Hypoxanthine Guanine Phosphoribosyl Transferase System to Determine the Mutagenicity of Chemical Agents: A Report of Phase III of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 196, p. 17–36.
(10) Li, A.P., Carver, J.H., Choy, W.N., Hsie, A.W., Gupta, R.S., Loveday, K.S., O’Neill, J.P., Riddle, J.C., Stankowski, L.F. Jr. and Yang, L.L. (1987). A Guide for the Performance of the Chinese Hamster Ovary Cell/Hypoxanthine-Guanine Phosphoribosyl Transferase Gene Mutation Assay. Mutation Res., 189, p. 135–141.
(11) Liber, H.L., Yandell, D.W and Little, J.B. (1989). A Comparison of Mutation Induction at the TK and HPRT Loci in Human Lymphoblastoid Cells: Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK Locus. Mutation Res., 216, p. 9–17.
(12) Stankowski, L.F. Jr., Tindall, K.R. and Hsie, A.W. (1986). Quantitative and Molecular Analyses of Ethyl Methanosulphonate –and ICR 191– Induced Molecular Analyses of Ethyl Methanosulphonate –and ICR 191–Induced Mutation in AS52 Cells. Mutation Res., 160, p. 133–147.
(13) Turner, N.T., Batson, A.G. and Clive, D. (1984). Procedures for the L5178Y/TK+/- – TK+/- Mouse Lymphoma Cell Mutagenicity Assay. In: Kilbey, B.J. et al (eds.) Handbook of Mutagenicity Test Procedures, Elsevier Science Publishers, New York, p. 239–268.
(14) Arlett, C.F., Smith, D.M., Clarke, G.M., Green, M.H.L., Cole, J., McGregor, D.B. and Asquith, J.C. (1989). Mammalian Cell Gene Mutation Assays Based upon Colony Formation. In: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D.J., Ed., Cambridge University Press, p. 66–101.
(15) Abbondandolo, A., Bonatti, S., Corti, G., Fiorio, R., Loprieno, N. and Mazzaccaro, A. (1977). Induction of 6-Thioguanine-Resistant Mutants in V79 Chinese Hamster Cells by Mouse-Liver Microsome-Activated Dimethylnitrosamine. Mutation Res., 46, p. 365–373.
(16) Ames, B.N., McCann, J. and Yamasaki, E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test. Mutation Res., 31, p. 347–364.
(17) Clive, D., Johnson, K.O., Spector, J.F.S., Batson, A.G. and Brown M.M.M. (1979). Validation and Characterization of the L5178Y/TK+/- Mouse Lymphoma Mutagen Assay System. Mutat. Res., 59, p. 61–108.
(18) Maron, D.M. and Ames, B.N. (1983). Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, p. 173–215.
(19) Elliott, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992). Alternatives to Aroclor 1254-Induced S9 in In Vitro Genotoxicity Assays. Mutagenesis, 7, p. 175–177.
(20) Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976). A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. In: In Vitro Metabolic Activation in Mutagenesis Testing, de Serres, F.J., Fouts, J.R., Bend, J.R. and Philpot, R.M. (eds), Elsevier, North-Holland, p. 85–88.
(21) Krahn, D.F., Barsky, F.C. and McCooey, K.T. (1982). CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. In: Tice, R.R., Costa, D.L., Schaich, K.M. (eds). Genotoxic Effects of Airborne Agents. New York, Plenum, p. 91–103.
(22) Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983). Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environmental Mutagenesis, 5, p. 795–801.
(23) Applegate, M.L., Moore, M.M., Broder, C.B., Burrell, A. and Hozier, J.C. (1990). Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells. Proc. Natl. Acad. Sci. USA, 87, p. 51–55.
(24) Moore, M.M., Clive, D., Hozier, J.C., Howard, B.E., Batson, A.G., Turner, N.T. and Sawyer, J. (1985). Analysis of Trifluorothymidine-Resistant (TFTr) Mutants of L5178Y/TK+/- Mouse Lymphoma Cells. Mutation Res., 151, p. 161–174.
(25) Yandell, D.W., Dryja, T.P. and Little, J.B. (1990). Molecular Genetic Analysis of Recessive Mutations at a Heterozygous Autosomal Locus in Human Cells. Mutation Res., 229, p. 89–102.
(26) Moore, M.M. and Doerr, C.L. (1990). Comparison of Chromosome Aberration Frequency and Small-Colony TK-Deficient Mutant Frequency in L5178Y/TK+/- - 3.7.2C Mouse Lymphoma Cells. Mutagenesis, 5, p. 609–614.
B.18. DNS BOJĀJUMI UN TO REPARĀCIJA – DNS ĀRPUSFĀZES SINTĒZE – ZĪDĪTĀJU ŠŪNAS IN VITRO
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJA
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES PRINCIPS
Ar šo metodi DNS ārpusfāzes sintēzes (DĀS) noteikšanai pēta DNS reparatīvo sintēzi pēc tam, kad no DNS ir izgriezts un izņemts fragments, kas satur ķīmisku vai fizikālu aģentu inducētus bojājumus. Šim nolūkam izmanto ar tritiju iezīmētu timidīnu (3H-TdR), kas iekļaujas DNS struktūrā zīdītāju šūnās, kuras tajā brīdī atrodas ārpus šūnas cikla S fāzes. DNS molekulās uzņemto 3H-TdR apstrādātajās šūnās var noteikt, izmantojot autoradiogrāfiju vai šķidrumscintilāciju metodi (ŠSM). Zīdītāju šūnu kultūras, ja tie nav primārie žurku hepatocīti, apstrādā ar pārbaudāmo vielu, gan pievienojot tām eksogēno metaboliskās aktivācijas sistēmu, gan bez tās. DĀS mērījumiem var izmantot arī in vivo sistēmas.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
Sagatavošanas darbi
Pārbaudāmās vielas un kontroles vai standartvielas pievieno barotnei vai izšķīdina/suspendē piemērotā šķīdinātājā/vidē un tad atšķaida ar barotni tālākai izmantošanai izmēģinājumā. Šķīdinātājs galīgajā koncentrācijā nedrīkst nomākt šūnu dzīvotspēju.
Šim nolūkam var izmantot primārās žurku hepatocītu un cilvēku limfocītu kultūras vai pastāvīgās šūnu līnijas (piemēram, cilvēku diploīdos fibroblastus).
Šūnas pakļauj pārbaudāmās vielas iedarbībai, gan pievienojot tām piemērotu metaboliskās aktivācijas sistēmu, gan bez tās.
Testa apstākļi
Katra līknes punkta iegūšanai autoradiogrāfijas vajadzībām izmanto vismaz divas šūnu kultūras un sešas kultūras (vai mazāk, ja to var zinātniski pamatot) DĀS noteikšanai ar ŠSM.
Katrā izmēģinājumā, gan veicot metabolisko aktivāciju, gan bez tās, vienlaikus jāparedz pozitīvā un negatīvā (bez pārbaudāmās vielas un/vai ar šķīdinātāju) kontrole.
Kā pozitīvās kontroles piemēru žurku hepatocītu kultūrā var minēt 7,12-dimetilbenzantracēnu (7,12-DMBA) vai 2-acetilaminofluorēnu (2-AAF). Ja izmanto pastāvīgās šūnu līnijas, kā pozitīvās kontroles paraugu gan autoradiogrāfijas, gan ŠSM pētījumiem bez metaboliskās aktivācijas var minēt 4-nitrohinolīn-N-oksīdu (4-NHO); ja izmanto metaboliskās aktivācijas sistēmas, šādas pozitīvās kontroles piemērs ir N-dimetilnitrozamīns.
Pārbaudāmā viela jāizmanto tādā koncentrāciju diapazonā, kas ļautu veikt vajadzīgos mērījumus. Vielai lielākajā koncentrācijā jāuzrāda citotoksiska iedarbība. Savienojumus, kas samērā slikti šķīst ūdenī, pārbauda koncentrācijā, kas ir tuvu to šķīdības robežai. Netoksiskām ķīmiskām vielām, kas pilnībā šķīst ūdenī, lielāko pārbaudāmo koncentrāciju nosaka katrā atsevišķā gadījumā.
Šūnu kultūras kultivē piemērotā barotnē, nodrošinot vajadzīgo CO2 koncentrāciju, temperatūru un mitrumu. Pastāvīgās šūnu līnijas regulāri pārbauda, lai nodrošinātos pret mikoplazmas kontamināciju.
Metaboliskās aktivācijas sistēmu neizmanto ar primāro hepatocītu kultūrām. Pastāvīgās šūnu līnijas pakļauj pārbaudāmās vielas iedarbībai, gan pievienojot tām piemērotu metaboliskās aktivācijas sistēmu, gan bez tās.
Testa norise
Pastāvīgās šūnu līnijas iegūst no pamatkultūrām (piemēram, tripsinizējot vai nokratot šūnas), kuras iesēj inkubācijas traukos vajadzīgā blīvumā un kultivē 37 oC temperatūrā.
Īslaicīgas žurku hepatocītu kultūras iegūst, ļaujot tikko izdalītiem hepatocītiem piemērotā barotnē piestiprināties pie substrāta.
Cilvēka limfocītu kultūras iegūst, izmantojot attiecīgās metodes.
Tikko izdalītiem žurku hepatocītiem uz noteiktu laiku pievieno pārbaudāmo vielu kopā ar barotni, kas satur 3H-TdR. Beidzoties ekspozīcijas laikam, barotni nolej, bet šūnas skalo, apstrādā ar fiksatoru un žāvē. Priekšmetstikliņus iemērc autoradiogrāfijas emulsijā (var izmantot arī “novelkamo emulsijas kārtu”), eksponē, attīsta, krāso un novērtē.
Autoradiogrāfijas metodes. Vajadzīgo laika sprīdi šūnu kultūras pakļauj pārbaudāmās vielas iedarbībai un pēc tam apstrādā ar 3H-TdR. Ekspozīcijas laiks ir atkarīgs no vielas īpašībām, metabolisko sistēmu aktivitātes un šūnu tipa. Lai noteiktu DĀS maksimumu, 3H-TdR pievieno reizē ar pārbaudāmo vielu vai dažas minūtes vēlāk, sākoties ekspozīcijas laikam. Kuru no divām iespējām izvēlēties, ir atkarīgs no tā, vai pārbaudāmā viela mijiedarbojas ar 3H-TdR. Lai varētu atšķirt DĀS no DNS puskonservatīvās replikācijas, pēdējo var nomākt, piemēram, izmantojot bezarginīna barotni ar zemu seruma saturu vai pievienojot barotnei oksiurīnvielu.
DĀS mērījumi ar ŠSM. Pirms pievienot pārbaudāmo vielu, ir jābloķē šūnu pāreja S fāzē, kā tas aprakstīts iepriekš, un tad šūnas pakļauj pārbaudāmās vielas iedarbībai, kā norādīts autoradiogrāfijas metodes aprakstā. Beidzoties inkubācijas laikam, no šūnām izdala DNS un nosaka kopējo DNS saturu, kā arī uzņemtā 3H-TdR daudzumu.
Jāpatur prātā, ka, ja saskaņā ar iepriekš minēto metodi izmanto cilvēka limfocītus bez stimulācijas, DNS puskonservatīvā replikācija nav jānomāc.
Analīze
Nosakot DĀS šūnu kultūrā, neņem vērā šūnu kodolus S fāzē. Pārbaudot katru vielas koncentrāciju, veic vismaz 50 šūnu analīzi. Priekšmetstikliņus pirms skaitīšanas apzīmē ar šifru. Katram priekšmetstikliņam pēc nejaušības principa izskata vairākus citu no cita tālu esošus laukumus. Citoplazmā uzņemtā 3H-TdR daudzumu nosaka, katras saskaitītās šūnas citoplazmā pārbaudot trīs laukumus, kuri pēc lieluma līdzinās šūnas kodolam.
Veicot DĀS noteikšanu ar ŠSM, katras koncentrācijas pārbaudei un kontroles grupā izmanto pietiekamu šūnu kultūru skaitu.
Visi šie rezultāti jāapstiprina neatkarīgā izmēģinājumā.
2. DATI
Iegūtie dati jāapkopo tabulā.
2.1. NOTEIKŠANA AR AUDIORADIOGRĀFIJAS METODI
Atsevišķi jāreģistrē citoplazmā iekļautā 3H-TdR daudzums un graudiņu skaits virs šūnas kodola.
Citoplazmā ietvertā 3H-TdR daudzuma sadalījumu un graudiņu skaita sadalījumu uz vienu kodolu var raksturot ar vidējās, mediālās un modālās vērtības palīdzību.
2.2. NOTEIKŠANA AR SŠM
Veicot noteikšanu ar ŠSM, uzņemtā 3H-TdR daudzumu norāda kā dpm/μg DNS. Uzņemtās radioaktivitātes sadalījumu var raksturot ar dpm/μg DNS vidējo vērtību kopā ar standartnovirzi.
Dati jāizvērtē ar piemērotām statistikas metodēm.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— izmantotās šūnas, šūnu slāņa blīvums un pasāžu skaits ekspozīcijas brīdī, šūnu kultūru skaits,
— šūnu kultivēšanas metodes, norādot barotni, temperatūru un CO2 koncentrāciju,
— pārbaudāmā viela, šķīdinātājs, to koncentrācija un pamatojums eksperimentā izmantoto koncentrāciju izvēlei,
— metaboliskās aktivācijas sistēmu raksturojums,
— ekspozīcijas shēma,
— pozitīvā un negatīvā kontrole,
— izmantotā autoradiogrāfijas metode,
— paņēmiens, kas izmantots, lai bloķētu šūnu pāreju S fāzē,
— metodes, kas izmantotas DNS izdalīšanai un DNS kopējā satura noteikšanai ar ŠSM,
— ja iespējams, iedarbības atkarība no devas,
— statistiskais novērtējums,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.19. MĀSHROMATĪDU APMAIŅAS NOTEIKŠANA IN VITRO
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJA
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Metode māshromatīdu apmaiņas (MHA) noteikšanai ļauj īsā laikā reģistrēt DNS reciproko apmaiņu starp divām replicējošās hromosomas māshromatīdām. MHA laikā notiek DNS replikācijas produktu savstarpējā apmaiņa, kas skar acīmredzami homologos lokusus. Apmaiņas process, iespējams, noris, DNS molekulai pārtrūkstot un atkal savienojoties, lai gan tā molekulārais mehānisms ir maz izpētīts. Lai konstatētu MHA, jārod veids, kā atšķirīgi iezīmēt māshromatīdas; to var panākt, divu šūnas ciklu laikā ļaujot šūnām uzņemt bromdezoksiuridīnu (BrdU) hromosomālajā DNS.
Zīdītāju šūnas in vitro pakļauj pārbaudāmās vielas iedarbībai, vajadzības gadījumā vienlaikus pievienojot zīdītāju izcelsmes eksogēnu metaboliskās aktivācijas sistēmu un divu replikācijas ciklu laikā kultivējot tās BrdU saturošā barotnē. Pēc apstrādes ar vārpstveida inhibitoru (piemēram, kolhicīnu), kas ļauj uzkrāt šūnas mitozes metafāzei līdzīgā stadijā (c- jeb k-metafāze), šūnas savāc un gatavo hromosomu preparātus.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
1.6.1. Sagatavošanas darbi
— Šim nolūkam var izmantot primārās kultūras (piemēram, cilvēka limfocītus) vai pastāvīgās šūnu līnijas (piemēram, Ķīnas kāmja olnīcu šūnas). Šūnu līnijas jāpārbauda, lai nodrošinātos pret mikoplazmas kontamināciju.
— Izmanto piemērotas barotnes un ievēro inkubācijas apstākļus (piemēram, temperatūru, inkubācijas traukus, CO2 koncentrāciju un gaisa mitrumu).
— Pārbaudāmās vielas pirms ekspozīcijas var pievienot barotnei vai izšķīdināt/suspendēt piemērotā šķīdinātajā/nesējvielā. Šķīdinātājs/nesējviela galīgajā koncentrācijā nedrīkst ievērojami nomākt šūnu dzīvotspēju vai vairošanās ātrumu inkubācijas sistēmā, tā ietekmi uz MHA biežumu pārbauda, izmantojot kontroli ar šķīdinātāju.
— Šūnas pakļauj pārbaudāmās vielas iedarbībai, gan pievienojot tām piemērotu eksogēnu metaboliskās aktivācijas sistēmu, gan bez tās. Savukārt, ja izmanto šūnu tipus, kam piemīt iekšējā metaboliskā aktivitāte, šīs metaboliskās sistēmas aktivitātei un īpašībām jābūt saderīgām ar pārbaudāmās ķīmiskās vielas klasi.
1.6.2. Testa apstākļi
Viena līknes punkta iegūšanai izmanto vismaz divus šūnu kultūras paraugus.
Katrā eksperimentā jāparedz pozitīvā kontrole, gan izmantojot savienojumu, kam nav vajadzīga metaboliskā aktivācija, gan tādu, kam šāda aktivācija ir vajadzīga; vienlaikus jāizmanto negatīvā kontrole (ar šķīdinātāju).
Šeit ir minētas vielas, kuras var izmantot kā pozitīvo kontroli:
— viela, kurai nav vajadzīga aktivācija:
—— etilmetānsulfonāts,
— viela, kurai vajadzīga aktivācija:
—— ciklofosfamīds.
Vajadzības gadījumā kā papildu pozitīvo kontroli var izmantot vielu no tās pašas ķīmiskās klases, pie kuras pieder pārbaudāmā viela.
Pārbaudāmās vielas diapazons aptver vismaz trīs atšķirīgas koncentrācijas. Vielai lielākajā koncentrācijā jābūt ievērojami toksiskai, bet tā nedrīkst nomākt šūnu replikāciju. Vielas, kas samērā slikti šķīst ūdenī, pārbauda koncentrācijā, kas ir tuvu to šķīdības robežai, izmantojot piemērotu metodi. Netoksiskām vielām, kas pilnībā šķīst ūdenī, lielāko pārbaudāmo koncentrāciju nosaka katrā atsevišķā gadījumā.
1.6.3. Testa norise
Pastāvīgās šūnu līnijas iegūst no pamatkultūrām (piemēram, tripsinizējot vai nokratot šūnas), tās iesēj inkubācijas traukos vajadzīgā blīvumā un kultivē 37 oC temperatūrā. Ja izmanto vienslāņa kultūras, šūnu skaitam katrā inkubācijas traukā jābūt tādam, lai šūnu savākšanas brīdī vienlaidu [šūnu] slānis aizņemtu ne vairāk kā 50 % kultūras platības. Pastāv arī iespēja izmantot suspendētu šūnu kultūras. Cilvēka limfocītu kultūras, izmantojot piemērotas metodes, iegūst no asinīm, kam pievienots heparīns, un inkubē 37 oC temperatūrā.
Šūnas eksponenciālajā vairošanās fāzē pakļauj pārbaudāmās vielas iedarbībai attiecīgajā ekspozīcijas laikā; parasti pietiek ar 1–2 stundām, lai gan atsevišķos gadījumos ekspozīcijas laiku var pagarināt līdz diviem pilniem šūnas cikliem. Šūnām, kurām nepiemīt pietiekama metaboliskā aktivitāte, pārbaudāmo vielu pievieno gan kopā ar piemērotu metabolisma aktivācijas sistēmu, gan bez tās. Beidzoties ekspozīcijas laikam, šūnas skalo, lai tiktu vaļā no pārbaudāmās vielas, un divu replikācijas ciklu garumā tās kultivē BrdU klātbūtnē. Pastāv iespēja šūnas vienlaicīgi pakļaut pārbaudāmās vielas un BrdU iedarbībai divu pilnu šūnas ciklu laikā.
Cilvēka limfocītu kultūras apstrādā, kamēr tās atrodas pussinhronā stāvoklī.
Šūnas analizē otrās dalīšanās laikā pēc ekspozīcijas, gādājot par to, lai visjutīgākajās šūnas cikla stadijās tās būtu pakļautas vielas iedarbībai. Kamēr šūnas nav savāktas, visas darbības ar šūnu kultūrām, kurām pievienots BrdU, jāveic tumsā vai nespodrā kvēlspuldžu gaismā, lai mazinātu BrdU saturošās DNS fotolīzi.
Šūnu kultūras apstrādā ar vārpstveida inhibitoru (piemēram, kolhicīnu) 1–4 stundas pirms to savākšanas. Katru šūnu kultūru atsevišķi savāc un apstrādā, lai vēlāk sagatavotu hromosomu preparātus.
Hromosomu preparātus gatavo pēc citoģenētikas standartmetodēm. Priekšmetstikliņus MHA noteikšanai var krāsot, izmantojot dažādas metodes (piemēram, fluorescences metodi kopā ar Gīmsa metodi).
Analizējamo šūnu skaits ir atkarīgs no spontānās MHA biežuma kontroles šūnās. Parasti MHA noteikšanai analizē vismaz 25 labi izkliedētas metafāzes no katras šūnu kultūras. Priekšmetstikliņus pirms analīzes apzīmē ar šifru. Kas attiecas uz cilvēka limfocītiem, analizē tikai tās metafāzes, kurās ir 46 centromēras. Pastāvīgo šūnu līniju preparātos analizē tikai metafāzes, kurās centromēru skaits atbilst modālajam skaitam ± 2 centromēras. Jānorāda, vai marķējuma izmaiņas ap centromēru ir uzskatāmas par MHA. Iegūtie rezultāti jāapstiprina neatkarīgā eksperimentā.
2. DATI
Dati jāapkopo tabulā. Visām apstrādātām šūnu kultūrām un kontroles kultūrām atsevišķi jānorāda MHA biežums katrā metafāzē un MHA biežums uz vienu hromosomu katrā metafāzē.
Iegūtie dati jāizvērtē ar piemērotām statistikas metodēm.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— izmantotās šūnas, šūnu kultivēšanas paņēmieni,
— testa apstākļi (barotņu sastāvs, CO2 koncentrācija, pārbaudāmās vielas koncentrācija, izmantotais šķīdinātājs, inkubācijas temperatūra, ekspozīcijas ilgums, izmantotais vārpstas inhibitors, tā koncentrācija un apstrādes ilgums, izmantotā zīdītāju izcelsmes metaboliskās aktivācijas sistēma, pozitīvā un negatīvā kontrole),
— šūnu kultūru skaits uz vienu eksperimentālās līknes punktu,
— hromosomu preparātu izgatavošanas apraksts,
— analizēto metafāžu skaits (atsevišķi dati par katru šūnu kultūru),
— MHA vidējais biežums uz vienu šūnu un uz vienu hromosomu (atsevišķi dati par katru šūnu kultūru),
— MHA uzskaites kritēriji,
— devu izvēles pamatojums,
— vajadzības gadījumā – iedarbības atkarība no devas,
— statistiskais novērtējums,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.20. AR DZIMUMU SAISTĪTO RECESĪVO LETĀLO MUTĀCIJU NOTEIKŠANA (DROSOPHILA MELANOGASTER)
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJA
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Metode ar dzimumu saistīto recesīvo letālo mutāciju noteikšanai (SLRL tests) ļauj reģistrēt mutāciju (gan punktmutāciju, gan nelielu delēciju) parādīšanos Drosophila melanogaster dzimumšūnās. Šim nolūkam pārbauda turpvērstās mutācijas, kas var skart vienu no aptuveni 800 X hromosomas lokusiem, kuri veido gandrīz 80 % no to kopējā skaita X hromosomās. X hromosomā atrodas apmēram piektā daļa no visa haploīdā genoma.
Mutācijas Drosophila melanogaster X hromosomā fenotipiski izpaužas tēviņos, kuri ir mutantā gēna nesēji. Ja mutācija ir letāla hemizigotajā stāvoklī, par tās klātbūtni var spriest pēc tā, ka novēro tikai vienu no divām vīrišķo pēcnācēju klasēm, kuras parasti iegūst no heterozigotas mātītes. Uz šiem atzinumiem balstās SLRL tests, kurā izmanto īpaši marķētas un pārveidotas hromosomas.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
Sagatavošanas darbi
Šim nolūkam der tēviņi no labi izpētītas savvaļas tipa populācijas un mātītes no populācijas Muller-5. Var izmantot arī citas attiecīgi marķētas mātīšu populācijas, kuru X hromosomas satur vairākas inversijas.
Pārbaudāmās vielas izšķīdina ūdenī. Vielas, kas nešķīst ūdeni, var izšķīdināt vai suspendēt piemērotā šķīdinātājā/nesējvielā (piemēram, etilspirta un Tween 60 vai Tween 80 maisījumā), un tad pirms ievadīšanas tās atšķaida ar ūdeni vai fizioloģisko šķīdumu; šim nolūkam nebūtu ieteicams izmantot dimetilsulfoksīdu (DMSO).
Pirms izmēģinājuma jau iepriekš jānosaka tā precizitāte un ticamības pakāpe. Hromosomu skaits, kas jāanalizē pēc vielas aplikācijas, ir lielā mērā atkarīgs no spontāno mutāciju biežuma, ko novēro kontroles grupā.
Vielu var ievadīt perorāli, injekcijas veidā vai izmantot gāzes vai tvaikus. Pārbaudāmo vielu var iebarot kopā ar cukura šķīdumu. Vajadzības gadījumā vielas var izšķīdināt 0,7 % NaCl šķīdumā un injicēt tās krūšu vai vēdera apvidū.
Jāizmanto negatīvā (ar šķīdinātāju) un pozitīvā kontrole. Taču, ja attiecīgie kontroles dati jau iegūti iepriekš, var iztikt bez kontroles izmēģinājumiem.
Jāizmanto trīs dažādas koncentrācijas. Iepriekšējai novērtēšanai var izmantot vienu pārbaudāmās vielas koncentrāciju, izvēloties maksimāli pieļaujamo koncentrāciju vai tādu koncentrāciju, kas izraisa toksicitātes simptomus. Ja vielas nav toksiskas, tās izmanto pēc iespējas lielākā koncentrācijā.
Savvaļas tipa tēviņus (3 līdz 5 dienas vecus) pakļauj pārbaudāmās vielas iedarbībai un katru atsevišķi sapāro ar vairākām neapaugļotām mātītēm no Muller-5 populācijas vai no citas attiecīgi marķētas (X hromosomas satur vairākas inversijas) populācijas. Mātītes ik pēc 2–3 dienām aizstāj ar citām neapaugļotām mātītēm, lai būtu aptverts viss dzimumšūnu attīstības cikls. Šo mātīšu pēcnācējiem reģistrē to letāļu biežumu, kuras radušās pēc iedarbības uz nobriedušiem spermatozoīdiem, vidējās vai vēlīnās attīstības stadijas spermatīdiem, agrīnajiem spermatīdiem, spermatocītiem un spermatogonijiem.
Heterozigotās F1 mātītes, kas iegūtas pēc iepriekš minētās krustošanas, katru atsevišķi (proti, vienā stobriņā pa vienai mātītei) sapāro ar saviem brāļiem. Katru F2 paaudzes kultūru pārbauda, vai tajā atrodami savvaļas tipa tēviņi. Ja atklājas, ka kultūra radusies no F1 mātītes, kuras tēvišķajā X hromosomā ir letālais gēns (proti, tajā nenovēro tēviņus ar savvaļas tipa hromosomu), ir jāpārbauda šīs mātītes meitas ar tādu pašu genotipu, lai noskaidrotu letalitātes parādīšanos nākamajās paaudzēs.
2. DATI
Dati jāapkopo tabulā, norādot pārbaudīto X hromosomu skaitu, neauglīgo tēviņu skaitu un letālo mutāciju skaitu pēc katras koncentrācijas iedarbības, kuras novērotas katram apstrādātajam tēviņam pēc katras pārošanās reizes. Norāda arī dažāda lieluma klasteru skaitu uz vienu tēviņu. Šie rezultāti jāapstiprina neatkarīgā eksperimentā.
SLRL testa rezultāti jāizvērtē ar piemērotu statistikas metodi. Jāizpēta un piemērotā veidā statistiski jāizvērtē tādu recesīvo letālo mutāciju klasteru veidošanās, kas nāk no viena un tā paša tēviņa.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— ģenētiskais materiāls (izmantotās Drosophila populācijas vai līnijas, mušiņu vecums, apstrādāto tēviņu skaits, sterilo tēviņu skaits, iegūto F2 kultūru skaits, F2 kultūru skaits, kam nav pēcnācēju, hromosomu skaits ar letālajām mutācijām, kas reģistrētas katrā dzimumšūnu attīstības stadijā),
— kritēriji, pēc kuriem nosaka apstrādāto grupu lielumu,
— testa apstākļi (sīks apstrādes un paraugu ņemšanas shēmas apraksts, izmantotās koncentrācijas, toksicitātes dati, negatīvā (ar šķīdinātāju) un pozitīvā kontrole, ja izmanto),
— letālo mutāciju uzskaites kritēriji,
— ja iespējams, jānorāda iedarbības atkarība no devas,
— datu izvērtējums,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.21. ZĪDĪTĀJU ŠŪNU TRANSFORMĀCIJA IN VITRO
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJA
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Zīdītāju šūnu kultūras in vitro var izmantot ķīmiski inducētu fenotipisko izmaiņu noteikšanai, kuras saista ar ļaundabīgu transformāciju in vivo. Šim nolūkam plaši izmanto tādas šūnas kā CH310T ½, SHE, Fišera žurku šūnas, pētot izmaiņas šūnu morfoloģijā, transformācijas perēkļu veidošanos vai spēju vairoties mīkstajā agarā. Retāk izmanto tādas sistēmas, kas ļauj reģistrēt citas fizioloģiskas vai morfoloģiskas izmaiņas pēc ķīmisku kancerogēnu iedarbības. Nevienam in vitro pētāmajam parametram nav pierādīta cēloniska sakarība ar vēzi. Dažas eksperimentālās sistēmas var izmantot audzēju promotoru noteikšanai. Par citotoksicitāti var spriest pēc pārbaudāmās vielas ietekmes uz koloniju veidošanos (klonēšanas efektivitāti) šūnu kultūrās vai to vairošanās ātrumu. Citotoksicitātes mērījumi ļauj secināt, ka pārbaudāmās vielas iedarbība ir toksikoloģiski determinēta, taču to nevar visos gadījumos izmantot transformācijas biežuma aprēķināšanai, jo tas dažreiz paredz ilgāku inkubāciju un/vai šūnu atkārtotu izsēšanu.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
Sagatavošanas darbi
Atkarībā no transformācijas noteikšanas metodes var izmantot dažādas šūnu līnijas vai primārās šūnu kultūras. Jāpārliecinās, ka izmēģinājumā izmantotās šūnas ļauj novērot noteiktas fenotipiskās izmaiņas pēc zināmu kancerogēnu iedarbības un ka laboratorijā izmantotā metode ir dokumentāri pierādīta par derīgu un uzticamu.
Jāizmanto tādas barotnes un izmēģinājuma apstākļi, kas ir saderīgi ar transformācijas noteikšanas metodi.
Pārbaudāmās vielas pirms šūnu apstrādes var pievienot barotnei vai izšķīdināt/suspendēt piemērotā šķīdinātājā/nesējvielā. Šķīdinātājs/nesējviela galīgajā koncentrācijā nedrīkst nomākt šūnu dzīvotspēju, vairošanās ātrumu vai transformācijas biežumu.
Šūnas pakļauj pārbaudāmās vielas iedarbībai gan kopā ar piemērotu metaboliskās aktivācijas sistēmu, gan bez tās. Turpretī, ja izmanto šūnu tipus, kam piemīt iekšējā metaboliskā aktivitāte, šīs metaboliskās sistēmas aktivitātei un īpašībām jābūt saderīgām ar pārbaudāmās ķīmiskās vielas klasi.
Testa apstākļi
Katrā eksperimentā jāparedz pozitīvā kontrole, gan izmantojot savienojumu, kam nav vajadzīga iepriekšējā metaboliskā aktivācija, gan tādu, kam tā ir vajadzīga; tāpat jāizmanto negatīvā kontrole (ar šķīdinātāju/nesējvielu).
Šeit ir minētas vielas, kuras var izmantot kā pozitīvo kontroli:
— vielas, kurām nav vajadzīga aktivācija:
—— etilmetānsulfonāts,
— β-propiolaktons,
— savienojumi, kam ir vajadzīga metaboliskā aktivācija:
—— 2-acetilaminofluorēns,
— 4-dimetilaminoazobenzols,
— 7,12-dimetilbenzantracēns.
Ja iespējams, kā papildu pozitīvā kontrole jāizmanto viela no tās pašas ķīmiskās klases, pie kuras pieder pārbaudāmā viela.
Pārbaudāmā viela jāizmanto vairāku koncentrāciju diapazonā. Vielai šajā koncentrāciju diapazonā jāuzrāda toksicitāte, kas ir atkarīga no koncentrācijas, turklāt lielākās koncentrācijas ietekmē šūnu izdzīvošanai jābūt zemai, bet mazākās koncentrācijas ietekmē tai jābūt apmēram tādai pašai kā negatīvajā kontrolē. Vielas, kas samērā slikti šķīst ūdenī, pārbauda koncentrācijā, kas ir tuvu to šķīdības robežai, izmantojot piemērotu metodi. Netoksiskām vielām, kas pilnībā šķīst ūdenī, lielāko pārbaudāmo koncentrāciju nosaka katrā atsevišķā gadījumā.
Testa norise
Vajadzīgajā laika sprīdī, kas atkarīgs no izmantotās eksperimentālās sistēmas, šūnas pakļauj vielas iedarbībai un, ja izmanto garāku ekspozīcijas laiku, vielu var ievadīt atkārtoti, vienlaikus apmainot barotni (un vajadzības gadījumā arī metaboliskās aktivācijas sistēmu). Šūnām, kuru iekšējā metaboliskā aktivitāte nav pietiekami augsta, pārbaudāmo vielu pievieno gan kopā ar nepieciešamo metaboliskās aktivācijas sistēmu, gan bez tās. Beidzoties ekspozīcijas laikam, šūnas skalo, lai atbrīvotos no pārbaudāmās vielas, un, ievērojot apstākļus, kas ļauj izpausties transformēto šūnu fenotipam, kultivē tālāk, reģistrējot transformācijas biežumu. Visi iegūtie rezultāti jāapstiprina neatkarīgā eksperimentā.
2. DATI
Dati jāapkopo tabulā atkarībā no izmantotās metodes, piemēram, norādot plašu skaitu, plates, kurās novērota transformācija, vai transformēto šūnu skaitu. Vajadzības gadījumā izdzīvojušo šūnu skaitu norāda procentos no attiecīgā skaita kontroles kultūrās un transformācijas biežumu aprēķina kā transformēto šūnu skaitu attiecībā pret izdzīvojušo šūnu skaitu. Dati jāizvērtē ar piemērotām statistikas metodēm.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— izmantotais šūnu tips, šūnu kultūru skaits, šūnu kultivēšanas paņēmieni,
— testa apstākļi (pārbaudāmās vielas koncentrācija, izmantotais šķīdinātājs/nesējviela, inkubācijas ilgums, ekspozīcijas ilgums un biežums, šūnu slāņa blīvums apstrādes laikā, izmantotās eksogēnās metaboliskās aktivācijas sistēmas tips, pozitīvā un negatīvā kontrole, kontrolējamā fenotipa raksturojums, selektīvā sistēma (ja izmanto), izvēlēto devu pamatojums),
— izmantotā dzīvotspējīgu un transformētu šūnu uzskaites metode,
— statistiskais novērtējums,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.22. DOMINANTO LETĀĻU NOTEIKŠANA GRAUZĒJIEM
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJA
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Dominantās letāles izraisa embriju vai augļu bojāeju. Dominanto letāļu indukcija ķīmiskas vielas ietekmē norāda uz to, ka šī viela iedarbojas uz izmēģinājumu dzīvnieku ģeneratīvajiem audiem. Parasti uzskata, ka dominantās letāles rodas hromosomu bojājumu (strukturālu un skaitlisku anomāliju) rezultātā. Mātītēm pēc vielas iedarbības embriju bojāeja var iestāties arī toksicitātes ietekmē.
Parasti tēviņus pakļauj pārbaudāmās vielas iedarbībai un tad sapāro ar neapaugļotām mātītēm. Izmantojot secīgus pārošanas intervālus, var atsevišķi pārbaudīt [vielas ietekmi uz] katru dzimumšūnu attīstības stadiju. Par mirstību pēc implantācijas var secināt, ja aprēķina nedzīvo implantu skaita pieaugumu uz vienu mātīti apstrādātajā grupā attiecībā pret šo skaitu kontroles grupā. Mirstību pirms implantācijas var aplēst pēc dzelteno ķermeņu skaita vai salīdzinot implantu kopējo skaitu uz vienu mātīti apstrādes un kontroles grupā. Dominanto letāļu kopējo skaitu veido kopējā mirstība pirms un pēc implantācijas. Aprēķinot dominanto letāļu kopējo skaitu, salīdzina dzīvo implantu skaitu uz vienu mātīti izmēģinājumu grupā ar dzīvo implantu skaitu uz vienu mātīti kontroles grupā. Implantu skaita samazināšanās dažās grupās pēc pārošanās var būt izskaidrojama ar šūnu (t. i., spermatocītu un/vai spermatogoniju) bojāeju.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
Sagatavošanas darbi
Pārbaudāmās vielas, ja iespējams, izšķīdina vai suspendē izotoniskā sāls šķīdumā. Ķīmiskas vielas, kas nešķīst ūdenī, var izšķīdināt vai suspendēt piemērotā šķīdinātājā. Izmantotais šķīdinātājs nedrīkst ietekmēt pārbaudāmās vielas iedarbību vai būt toksisks. Izmanto tikko pagatavotus pārbaudāmās vielas šķīdumus vai suspensijas.
Testa apstākļi
Parasti pārbaudāmo vielu ievada tikai vienreiz. Pamatojoties uz toksikoloģijas datiem, var veikt atkārtotu apstrādi. Parasti izmanto perorālu intubāciju vai intraperitoniālu injekciju. Var izmantot arī citus aplikācijas veidus.
Izmēģinājumos ieteicams izmantot žurkas vai peles. Veselus dzīvniekus, kas pilnībā sasnieguši dzimumgatavību, pēc nejaušības principa sadala kontroles un apstrādes grupās.
Apstrādāto tēviņu skaits ir atkarīgs no analizējamās bioloģiskās pazīmes spontānās mainības biežuma. Izvēloties dzīvnieku skaitu, jau iepriekš jāapsver izmantotās metodes precizitāte un ticamības pakāpe. Piemēram, uzsākot eksperimentu, katrā dzīvnieku grupā, kas saņem vienādu devu, parasti jābūt tādam tēviņu skaitam, lai vienā pārošanās periodā varētu iegūt 30 līdz 50 grūsnu mātīšu.
Parasti katrā izmēģinājumā vienlaikus jāparedz pozitīvā un negatīvā (ar šķīdinātāju) kontrole. Ja tajā pašā laboratorijā nesen iegūti apmierinoši pozitīvās kontroles rezultāti, tos var izmantot jaunajā eksperimentā pozitīvās kontroles vietā. Pozitīvās kontroles vielas ievada samērā nelielā devā (piemēram, MMS, intraperitoniāli, 10 mg/kg), lai noteiktu metodes precizitāti.
Parasti izmanto trīs dažādas devas. Jāizvēlas tāda lielākā deva, kas ir toksiska vai kuras ietekmē samazinās dzīvnieku auglība. Atsevišķos gadījumos var pietikt ar vienu lielu devu.
Netoksisku vielu testēšanai izmanto 5 g/kg devu, ja to ievada vienreiz, vai 1 g/kg/dienā, ja to ievada atkārtoti.
Testa norise
Pastāv vairākas aplikācijas shēmas. Visbiežāk pārbaudāmo vielu ievada tikai vienreiz. Var izmantot arī citas aplikācijas shēmas.
Katru atsevišķu tēviņu pēc apstrādes secīgi sapāro ar vienu vai divām neapaugļotām un neapstrādātām mātītēm, ievērojot vajadzīgos intervālus. Mātīte paliek kopā ar tēviņu vismaz vienu estrālo ciklu vai līdz brīdim, kad ir notikusi pārošanās, par ko liecina sperma vai embols makstī.
Pārošanās reižu skaits pēc apstrādes ir atkarīgs no aplikācijas shēmas, un tam jāaptver visas dzimumšūnu attīstības stadijas.
Mātītes nonāvē grūtniecības otrajā puslaikā un pārbauda dzemdes saturu, reģistrējot nedzīvo un dzīvo implantu skaitu. Dažreiz pārbauda olnīcas, lai noteiktu dzelteno ķermeņu skaitu.
2. DATI
Dati jāapkopo tabulā, norādot tēviņu skaitu, grūsno mātīšu skaitu, kā arī to mātīšu skaitu, kurām nav iestājusies grūtniecība. Atsevišķi jānorāda katras pārošanās rezultāti kopā ar katra tēviņa un mātītes raksturojumu. Katrai mātītei norāda pārošanās nedēļu, devu, ko saņēmis tēviņš, kā arī dzīvo un nedzīvo implantu skaitu.
Aprēķinot kopējo dominanto letāļu skaitu, salīdzina dzīvo implantu skaitu uz vienu mātīti izmēģinājuma grupā ar dzīvo implantu skaitu uz vienu mātīti kontroles grupā. Lai noteiktu mirstību pēc implantācijas, salīdzina un analizē dzīvo un nedzīvo implantu attiecību apstrādāto dzīvnieku grupā un kontroles grupā.
Ja atsevišķi reģistrē agrīnas un vēlīnas mirstības gadījumus, šie dati jāiekļauj tabulā. Ja ir aplēsta mirstība pirms implantācijas, tā jānorāda ziņojumā. Mirstību pirms implantācijas var aprēķināt pēc dzelteno ķermeņu un implantu skaita starpības vai pēc implantu vidējā skaita samazinājuma vienā dzemdē, salīdzinot ar kontroles dzīvnieku pārošanās rezultātiem.
Datus izvērtē ar piemērotām statistikas metodēm.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— izmantoto dzīvnieku suga, līnija, vecums un svars, dzīvnieku skaits izmēģinājumu un kontroles grupās pēc dzimuma,
— pārbaudāmā viela, šķīdinātājs, pārbaudītās devas un izvēlēto devu pamatojums, negatīvā un pozitīvā kontrole, toksicitātes dati,
— aplikācijas veids un shēma,
— pārošanās shēma,
— metode veiksmīgas pārošanās noteikšanai,
— dzīvnieku nokaušanas brīdis,
— dominanto letāļu uzskaites kritēriji,
— vajadzības gadījumā, iedarbības atkarība no devas,
— statistiskais novērtējums,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.23. ZĪDĪTĀJU SPERMATOGONĀLO HROMOSOMU IZMAIŅU TESTS
1. METODE
Šī metode ir ESAO TG 483 metodes “Zīdītāju spermatogonālo hromosomu izmaiņu tests” (1997) kopija.
1.1. IEVADS
Zīdītāju spermatogonālo hromosomu izmaiņu testā in vivo nosaka vielas, kas zīdītāju spermatogonālajās šūnās rada hromosomu struktūras izmaiņas (1) (2) (3) (4) (5). Struktūras izmaiņas var būt divu veidu – hromosomu izmaiņas vai hromatīdu izmaiņas. Lielākā daļa ķīmisko mutagēnu izraisa hromatīdu izmaiņas, tomēr notiek arī hromosomu izmaiņas. Šī metode nav paredzēta hromosomu skaita izmaiņu noteikšanai šūnās, un parasti to tādām vajadzībām neizmanto. Hromosomu mutācijas un ar tām saistītās ģenētiskās pārmaiņas ir cēlonis daudzām cilvēku ģenētiskajām slimībām.
Šajā testā nosaka hromosomu pārmaiņas spermatogonālajās dzimumšūnās, un tāpēc pēc tā rezultātiem var prognozēt pārmantojamu mutāciju izraisīšanu dzimumšūnās.
Šim testam parasti izmanto grauzējus. Šajā citoģenētiskajā testā in vivo nosaka hromosomu izmaiņas spermatogonālajās mitozēs. Šai metodei neizmanto citas mērķšūnas.
Lai noteiktu hromatīdu tipa izmaiņas spermatogonālajās šūnās, izpēta šūnu pirmo mitotisko dalīšanos, kura notiek pēc apstrādes ar testa vielu, pirms šie bojājumi netiek zaudēti turpmākajos šūnu dalīšanās ciklos. Papildu informāciju no apstrādātajām spermatogonālajām mātesšūnām var iegūt mejotisko hromosomu analīzē, nosakot hromosomu tipa izmaiņas diakinēzes metafāzē I, kad apstrādātās šūnas kļūst par spermatocītiem.
Šajā in vivo testā pēta, vai somatisko šūnu mutagēniem ir šāda veida iedarbība arī uz dzimumšūnām. Bez tam spermatogonālajā testā novērtē mutagenitātes risku, ņemot vērā in vivo metabolisma faktorus, farmakokinētiku un DNS reparācijas procesus.
Sēkliniekos ir vairākas spermatogonālo šūnu paaudzes ar atšķirīgu jutību uz apstrādi ar ķīmisko vielu. Tāpēc atklātās izmaiņas raksturo tādu apstrādātu sermatogonālo šūnu populācijas kopēju atbildes reakciju, kurā pārsvarā ir diferencētas spermatogonālās šūnas. Atkarībā no to atrašanās vietas sēkliniekā, fiziskās un fizioloģiskās Sertolli šūnu barjeras, kā arī asinsrites un sēklinieka barjeras dēļ uz dažādām spermatogonālo šūnu paaudzēm centrālā asinsrite var iedarboties vai arī neiedarboties.
Gadījumos, kad noskaidrots, ka testa viela vai tās reaģētspējīgs metabolisma produkts mērķaudos nenonāk, šo testu neizmanto.
Skatīt arī vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Hromatīdu tipa izmaiņas: hromosomas struktūras bojājumi, kas izpaužas kā atsevišķu hromatīdu pārrāvumi, vai hromatīdu pārrāvumi un to rekombinācija.
Hromosomu tipa izmaiņas: hromosomas struktūras bojājumi, kas izpaužas kā abu hromatīdu pārrāvums vai pārrāvums un rekombinācija vienā un tajā pašā vietā.
Pārrāvums: ahromatisks bojājums ar nelielu hromatīdu nobīdi, kas ir mazāks par viena hromatīda platumu.
Hromosomu skaita izmaiņas: testam izmantojamajiem dzīvniekiem raksturīgā parastā hromosomu skaita izmaiņas.
Poliploīdija: haploīda hromosomu skaita (n) daudzkārtnis, izņemot hromosomu diploīdu skaitu (t. i., 3n, 4n utt.).
Struktūras izmaiņas: hromosomu struktūras izmaiņas, kas redzamas mikroskopā šūnu dalīšanās metafāzē, ko novēro kā trūkstošus posmus, fragmentus, iekšējas vai savstarpējas rekombinācijas.
1.3. TESTA METODES PRINCIPS
Dzīvniekus pakļauj testa vielas iedarbībai, izmantojot piemērotu tās uzņemšanas veidu, un tad nogalina noteiktu laiku pēc apstrādes. Pirms nogalināšanas dzīvniekus apstrādā ar metafāzi apturošu vielu (piemēram, kolhicīnu vai Colcemid®). Tad no dzimumšūnām pagatavo hromosomu preparātus, ko iekrāso, un metafāzes šūnām nosaka hromosomu izmaiņas.
1.4. TESTA METODES APRAKSTS
1.4.1. Sagatavošana
1.4.1.1. Dzīvnieku sugu izvēle
Parasti izmanto Ķīnas kāmju vai peļu tēviņus. Tomēr var izmantot arī citu piemērotu zīdītāju sugu tēviņus. Parasti izmanto jaunus, veselus, pieaugušus laboratorijas dzīvniekus. Izmēģinājuma sākumā dzīvnieku masas atšķirībām jābūt minimālām un tās nedrīkstētu pārsniegt ± 20 % no vidējās masas.
1.4.1.2. Turēšanas un barošanas nosacījumi
Izmanto vispārējos nosacījumus, kas minēti vispārīgā ievada B daļā, bet mitrumam vajadzētu būt 50–60 %.
1.4.1.3. Dzīvnieku sagatavošana
Veselus, jaunus, pieaugušus tēviņus pēc gadījuma izvēles principa sadala kontroles un apstrādes grupās. Būrus izvieto tā, lai iespējami samazinātu būru novietojuma varbūtējo ietekmi. Katram dzīvniekam atsevišķi piešķir identifikāciju. Pirms izmēģinājumu sākuma dzīvniekus laboratorijas apstākļiem aklimatizē vismaz piecas dienas.
1.4.1.4. Devu sagatavošana
Pirms došanas dzīvniekiem cietas testa vielas vispirms izšķīdina vai suspendē piemērotos šķīdinātājos vai nesējos un, ja vajadzīgs, atšķaida. Šķidras testa vielas var dozēt tieši vai pirms dozēšanas atšķaidīt. Ja dati par testa vielu preparātu stabilitāti liecina, ka tos uzglabāt nevar, izmanto svaigi pagatavotus preparātus.
1.4.2. Testa apstākļi
1.4.2.1. Šķīdinātājs/nesējs
Lietotajās devās šķīdinātājam vai nesējam nedrīkst būt toksiskas iedarbības un tas nedrīkst būt reaģētspējīgs ar testa vielu. Izmantojot citus, mazāk izpētītus šķīdinātājus vai nesējus, jābūt datiem par to saderību. Vienmēr, kad tas iespējams, vispirms ieteicams izmantot ūdeni saturošus šķīdinātājus vai nesējus.
1.4.2.2. Kontrole
Visos testos līdztekus iekļauj pozitīvas un negatīvas (šķīdinātāja/nesēja) kontroles. Izņemot apstrādi ar testa vielu, ar kontroles grupu dzīvniekiem rīkojas tieši tāpat kā ar apstrādāto grupu dzīvniekiem.
Pozitīvā kontrolē iegūst spermatogonālo šūnu hromosomu struktūras izmaiņas in vivo pie ekspozīcijas robežvērtībām, kas dod nosakāmu palielinājumu virs fona līmeņa.
Pozitīvās kontroles vielu koncentrācijas izvēlas tā, lai to iedarbība būtu skaidri redzama, tomēr kodēto priekšmetstikliņu identitāti to nolasītājs nevarētu konstatēt uzreiz. Pieļaujams, ka pozitīvai kontrolei tiek izmantots cits iedarbības veids nekā testa vielai un paraugu ņem tikai vienreiz. Ja iespējams, kā pozitīvās kontroles vielas izmanto savienojumus, kas pieder pie atbilstošām vielu grupām. Pie pozitīvās kontroles vielām pieder:
|
Viela |
CAS Nr. |
Einecs Nr. |
|
ciklofosfamīds ciklofosfamīda monohidrāts |
50-18-0 6055-19-2 |
200-015-4 |
|
cikloheksilamīns |
108-91-8 |
203-629-0 |
|
mitomicīns C |
50-07-7 |
200-008-6 |
|
monomērs akrilamīds |
79-06-1 |
201-173-7 |
|
trietilēnmelamīns |
51-18-3 |
200-083-5 |
Ja nav pieņemamu vēsturisko kontroldatu par dzīvnieku savstarpējām atšķirībām un tādu šūnu parādīšanās biežumu, kurās ir hromosomu izmaiņas, katrā paraugu ņemšanas laikā iekļauj negatīvas kontroles dzīvniekus, ko apstrādā tikai ar šķīdinātāju vai nesēju, bet citādi ar kontroles grupu dzīvniekiem rīkojas tieši tāpat kā ar apstrādes grupu dzīvniekiem. Turklāt jāizmanto arī tukšie mēģinājumi, izņemot gadījumus, kad ir iepriekš iegūti vēsturiski vai publicēti kontroldati, kas skaidri parāda, ka izvēlētajam šķīdinātājam/nesējam nav kaitīgas vai mutagēnas iedarbības.
1.5. PROCEDŪRA
1.5.1. Dzīvnieku skaits
Apstrādes un kontroles grupās iekļauj vismaz piecus pārbaudāmus tēviņus.
1.5.2. Apstrādes shēma
Testa vielas vēlams ievadīt vienreiz vai divreiz (t. i., vienā paņēmienā vai divos paņēmienos). Testa vielas devu var dot arī dalīti, t. i., divreiz vienā un tajā pašā dienā ik pēc dažām stundām, kas var būt vajadzīgs gadījumos, kad jādod liels vielas tilpums. Citiem devu režīmiem jābūt zinātniski pamatotiem.
No grupas, kurā pārbauda lielāko devu, paraugus pēc apstrādes ar vielu ņem divos termiņos. Tā kā testa viela var ietekmēt šūnas cikla kinētiku, agrākais paraugu ņemšanas termiņš ir apmēram 24 stundas pēc iedarbības ar to, bet vēlākais termiņš – aptuveni 48 stundas pēc apstrādes. No pārējām grupām paraugu ņemšanas termiņš ir 24 stundas vai 1,5 šūnu cikli pēc apstrādes ar testa vielu, izņemot gadījumus, kad iedarbības noteikšanai ir zināms paraugu ņemšanai piemērotāks termiņš (6).
Paraugus papildus var ņemt arī citos termiņos. Piemēram, pārbaudot vielas, kas var izraisīt hromosomu aizturi vai no S-neatkarīgu iedarbību, paraugi var būt jāņem agrākos termiņos (1).
Vajadzību atkārtot apstrādes shēmu nosaka atsevišķi katram konkrētam gadījumam. Izvēloties apstrādes shēmu, pēc kuras ar testa vielu iedarbojas atkārtoti, dzīvniekus nogalina 24 stundas (1,5 šūnu ciklus) pēc pēdējās apstrādes ar to. Vajadzības gadījumos paraugus papildus var ņemt arī citos termiņos.
Pirms nogalināšanas dzīvniekiem intraperitoniāli injicē atbilstošu devu metafāzi apturošas vielas (piemēram, Colcemid® vai kolhicīnu). Pēc tam ar atbilstošiem intervāliem no dzīvniekiem ņem paraugus. Pelēm šis intervāls ir aptuveni 3–5 stundas, bet Ķīnas kāmjiem apmēram 4–5 stundas.
1.5.3. Devu lielums
Ja atbilstošu datu trūkuma dēļ vispirms veic orientējošu izmēģinājumu, tas jāizdara tajā pašā laboratorijā, kurā veiks galveno izmēģinājumu, izmantojot tās pašas sugas un līnijas dzīvniekus un ievērojot tādu pašu apstrādes režīmu (7). Ja viela ir toksiska, pirmajā paraugu ņemšanas reizē izmanto trīs devas. Šo devu intervālā ietver maksimāli toksiskās devas, kā arī vielas maztoksiskās vai netoksiskās devas. Vēlākajā paraugu ņemšanas laikā jāizmanto tikai lielākā deva. Kā lielāko nosaka devu, kurai ir tādas pašas toksiskās iedarbības pazīmes kā lielākajai devai, kam varētu būt letāla iedarbība pēc tāda paša devu režīma.
Vielām ar specifisku bioloģisko aktivitāti maztoksiskās un netoksiskās devās (piemēram, hormoniem un mitogēniem) var būt citi devu noteikšanas kritēriji, ko katrā konkrētā gadījumā izvērtē atsevišķi. Kā lielāko var noteikt arī devu, kas liecina par toksisku iedarbību uz spermatogonālajām šūnām (piemēram, lielāku par tādu devu, kas pirmajā un otrajā mejozes metafāzē izraisa spermatogonālās mitozes samazināšanos; tā nedrīkst pārsniegt 50 %).
1.5.4. Iedarbības robežu tests
Ja testā ar vienu vielas devu, kas ir vismaz 2 000 mg/kg ķermeņa svara, vienā paņēmienā vai divos paņēmienos vienā dienā toksisku iedarbību nekonstatē un pēc datiem par struktūras ziņā līdzīgām vielām var pamatoti uzskatīt, ka tā nav genotoksiska, pilnīgus izmēģinājumus ar trim vielas devām var uzskatīt par nevajadzīgiem. Paredzamā iedarbība uz cilvēku var norādīt uz to, ka devu iedarbības robežu pārbaudē jālieto lielāka deva.
1.5.5. Devu došana
Testa vielu parasti ievada ar mākslīgo barošanu, izmantojot kuņģa caurulīti, piemērotu inkubācijas kanulu vai intraperitonālas injekcijas veidā. Var izmantot arī citus iedarbības veidus, ja šādai rīcībai ir pietiekams pamatojums. Maksimālais šķidruma tilpums, ko vienā paņēmienā var dot, mākslīgi barojot vai injicējot, ir atkarīgs no izmēģinājumu dzīvnieka lieluma. Tilpums nedrīkst pārsniegt 2 ml uz 100 g ķermeņa masas. Lielāka tilpuma lietošana par šo ir jāpamato. Izņemot kairinošas un kodīgas vielas, kuru iedarbība lielākās koncentrācijās parasti ir izteiktāka, izmēģinājumiem lietotā tilpuma mainības ietekmi samazina, koriģējot tilpumu tā, lai pie visām devām tas būtu vienāds.
1.5.6. Hromosomu sagatavošana
Tūliņ pēc nogalināšanas no viena vai abiem sēkliniekiem iegūst šūnu suspensijas, ko apstrādā ar hipotonisku šķīdumu un fiksē. Tad šūnas uznes uz priekšmetstikliņiem un iekrāso.
1.5.7. Analīze
No katra dzīvnieka analizē vismaz 100 labi izveidojušās metafāzes (t. i., vismaz 500 metafāzes no grupas). Šo skaitli var samazināt gadījumos, kad novēro lielu skaitu hromosomu izmaiņu. Visus priekšmetstikliņus, arī pozitīvas un negatīvas kontroles priekšmetstikliņus, pirms mikroskopiskās analīzes kodē. Tā kā priekšmetstikliņu sagatavošanas procedūrā bieži tiek bojātas metafāzes šūnas, zaudējot hromosomas, uzskaitāmajās šūnās jābūt centromēru skaitam, kas vienāds ar 2n ± 2.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Datus par katru dzīvnieku apkopo tabulas veidā. Eksperimenta vienība ir viens dzīvnieks. Katram dzīvniekam nosaka šūnu skaitu, kurās ir hromosomu struktūras izmaiņas, kā arī hromosomu izmaiņu skaitu uz vienu šūnu. Uzskaita dažāda veida hromosomu struktūras izmaiņas, norādot to skaitu un biežumu gan apstrādātajām grupām, gan kontrolgrupām. Pārrāvumus uzskaita un norāda atsevišķi, bet kopējā izmaiņu biežumā tos parasti neiekļauj.
Ja novēro gan mitozi, gam mejozi, iespējamās citotoksiskās iedarbības novērtēšanai un citotoksiskuma raksturošanai visiem apstrādes un negatīvas kontroles dzīvniekiem no 100 šūnām, kas dalās, nosaka spermatogonālo mitožu skaita attiecību pret pirmo un otro mejotisko metafāžu skaitu. Gadījumos, kad novēro tikai mitozi, katram dzīvniekam no vismaz 1 000 šūnām nosaka mitotisko indeksu.
2.2. REZULTĀTU NOVĒRTĒŠANA UN INTERPRETĀCIJA
Pozitīvu rezultātu nosaka pēc vairākiem kritērijiem, piemēram, ar devu saistītu to šūnu daļas palielināšanos, kurās ir hromosomu struktūras izmaiņas, vai izmainītu šūnu skaita palielināšanos, pārbaudot vienu devu ar vienu paraugu ņemšanas laiku. Vispirms rezultātus izvērtē bioloģiski. Kā palīglīdzekli izmēģinājumu rezultātu novērtēšanai var izmantot statistikas metodes (8). Statistiskais svarīgums nedrīkst būt vienīgais faktors, pēc kā nosaka pozitīvu atbildes reakciju. Apšaubāmus rezultātus pārbauda, veicot atkārtotu testu, turklāt vēlams mainīt eksperimenta apstākļus.
Uzskata, ka testa vielas mutagēnās īpašības nav konstatētas, ja tās testa rezultāti neatbilst iepriekšminētajiem kritērijiem.
Lai gan lielākajā daļā eksperimentu iegūst nepārprotami pozitīvus vai negatīvus rezultātus, tomēr dažkārt pēc iegūtajiem datiem nevar noteikti spriest par testa vielas aktivitāti. Turklāt rezultāti var būt nedroši vai apšaubāmi arī neatkarīgi no eksperimenta atkārtojumu skaita.
Pozitīvi rezultāti spermatogonālo hromosomu izmaiņu testā in vivo liecina, ka testa viela izmēģinājumu dzīvnieku sugai izraisa hromosomu izmaiņas dzimumšūnās. Negatīvi rezultāti liecina, ka izmēģinājuma apstākļos testa viela izmēģinājumu dzīvnieku sugai nerada hromosomu izmaiņas dzimumšūnās.
Jāizvērtē iespējamība, ka testa viela vai tās metabolīti var sasniegt mērķaudus.
3. ZIŅOJUMU SASTĀDĪŠANA
TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
Šķīdinātājs/nesējs:
— nesēja izvēles pamatojums,
— testa vielas šķīdība un stabilitāte šķīdinātājā/nesējā, ja tā ir zināma.
Testa dzīvnieki:
— izmantotā suga/līnija,
— dzīvnieku skaits un vecums,
— izcelsme, turēšanas apstākļi, barība u. c.,
— dzīvnieku masa testa sākumā, katrā grupā norādot robežas, vidējo lielumu un standartnovirzi.
Testa apstākļi:
— devu intervāla noteikšanas izmēģinājuma rezultāti gadījumos, kad tas veikts,
— devu izvēles pamatojums,
— iedarbības veida izvēles pamatojums,
— informācija par testa vielas sagatavošanu,
— informācija par testa vielas ievadīšanu,
— nogalināšanas termiņu pamatojums,
— testa vielas koncentrācijas (ppm) barībā vai dzeramajā ūdenī pārrēķins faktiskajā dienas devā (mg/kg ķermeņa masas) gadījumos, kad tas nepieciešams,
— sīkas ziņas par barības un ūdens kvalitāti,
— sīks apstrādes un paraugu ņemšanas shēmas apraksts,
— toksicitātes novērtēšanas metodes,
— metafāzes apturēšanai izmantojamās vielas identifikācija, tās koncentrācija un apstrādes ilgums,
— priekšmetstikliņu sagatavošanas metodes,
— izmaiņu uzskaites kritēriji,
— analizēto šūnu skaits no viena dzīvnieka,
— kritēriji, pēc kuriem novērtē, vai testa rezultāts ir pozitīvs, negatīvs vai neskaidrs.
Rezultāti:
— toksicitātes pazīmes,
— mitotiskais indekss,
— spermatogonālās mitozes šūnu attiecība pret pirmās un otrās mejotiskās metafāzes šūnām,
— izmaiņu veids un skaits, ko norāda katram dzīvniekam atsevišķi,
— kopējais hromosomu izmaiņu skaits grupā,
— kopējais šūnu skaits ar hromosomu izmaiņām grupā,
— ja iespējams, reakcijas uz devu novērtējums,
— statistiskās analīzes rezultāti, ja tā veikta,
— līdztekus veiktās negatīvās kontroles dati,
— līdzšinējie vēsturiskie negatīvas kontroles dati, norādot robežas, vidējās vērtības un standartnovirzes,
— līdztekus veiktās pozitīvās kontroles dati,
— ploīdijas izmaiņas, ja tās tiek novērotas.
Rezultātu izvērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Adler, I.D. (1986). Clastogenic Potential in Mouse Spermatogonia of Chemical Mutagens Related to their Cell-Cycle Specifications. In: Genetic Toxicology of Environmental Chemicals, Part B: Genetic Effects and Applied Mutagenesis, Ramel, C., Lambert, B. and Magnusson, J. (Eds.) Liss, New York, p. 477–484.
(2) Adler, I.D., (1984). Cytogenetic tests in Mammals. In: Mutagenicity Testing: a Practical Approach. Ed. S. Venitt and J.M. Parry. IRL Press, Oxford, Washington DC, p. 275–306.
(3) Evans, E.P., Breckon, G. and Ford, C.E., (1964). An Air-Drying Method for Meiotic Preparations from Mammalian Testes. Cytogenetics and Cell Genetics, 3, p. 289–294.
(4) Richold, M., Ashby, J., Chandley, A., Gatehouse, D.G. and Henderson, L. (1990). In Vivo Cytogenetic Assays, In: D.J. Kirkland (Ed.) Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part I revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, p. 115–141.
(5) Yamamoto, K. and Kikuchi, Y. (1978). A New Method for Preparation of Mammalian Spermatogonial Chromosomes. Mutation Res., 52, p. 207–209.
(6) Adler, I.D., Shelby M.D., Bootman, J., Favor, J., Generoso, W., Pacchierotti, F., Shibuya, T. and Tanaka N. (1994). International Workshop on Standardisation of Genotoxicity Test Procedures. Summary Report of the Working Group on Mammalian Germ Cell Tests. Mutation Res., 312, p. 313–318.
(7) Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Richold, M. (1992). Report of British Toxicology Society/UK Environmental Mutagen Society Working group: Dose setting in In Vivo Mutagenicity Assays. Mutagenesis, 7, p. 313–319.
(8) Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K. (1989). Statistical Analysis of In Vivo Cytogenetic Assays In: D.J. Kirkland (Ed.) Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, report, Part III. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, p. 184–232.
B.24. PEĻU PLANKUMAINĪBAS TESTS
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada E daļu.
1.2. DEFINITION
Skatīt vispārīgā ievada E daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Ar šo in vivo metodi pēta ķīmisku vielu iedarbību uz peļu embrijiem, kas atrodas dažādās attīstības stadijās. Kā mērķšūnas izmanto embriju melanoblastus, kuru gēni kontrolē peļu apmatojuma krāsu. Augošie embriji ir heterozigoti pēc vairākiem gēniem, kas nosaka apmatojuma krāsu. Mutācija šāda gēna dominantajā alelē vai tās zudums melanoblastā (kam pamatā var būt dažādi ģenētiskie mehānismi) noved pie recesīvā fenotipa izpausmes pēcnācējšūnās, kas izpaužas kā atšķirīgas krāsas plankums piedzimušas peles apmatojumā. Šādu plankumainu pēcnācēju skaitu un mutāciju biežumu pēc vielas iedarbības salīdzina ar tiem pašiem rādītājiem pēcnācēju grupā pēc šķīdinātāja iedarbības. Peļu plankumainības tests ļauj noteikt varbūtējas somatiskās mutācijas augļa šūnās.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
Sagatavošanas darbi
Ja iespējams, pārbaudāmās vielas izšķīdina vai suspendē izotoniskā sāls šķīdumā. Ķīmiskas vielas, kas nešķīst ūdenī, izšķīdina vai suspendē piemērotā šķīdinātājā. Izmantotais šķīdinātājs nedrīkst ietekmēt pārbaudāmās vielas iedarbību vai būt toksisks. Izmanto tikko pagatavotus pārbaudāmās vielas šķīdumus vai suspensijas.
T līnijas peles (nonagouti, a/a; chinchilla, pink eye, cch p/cch p; brown, b/b; dilute, short ear, d se/d se; piebald spotting, s/s) sapāro ar HT līnijas (pallid, nonagouti, brachypody, pa a bp/pa a bp; leaden fuzzy, ln fz/ln fz; pearl pe/pe) vai C57 BL līnijas (nonagouti, a/a) pelēm. Var sakrustot arī citas piemērotas līnijas, piemēram, NMRI (nonagouti, a/a; albino, c/c) ar DBA (nonagouti, a/a; brown, b/b; dilute d/d), ja šādi var iegūt nonagouti pēcnācējus.
Jābūt tādam skaitam apstrādātu grūsnu mātīšu, kas ļauj pēc katras ievadītās devas iegūt dzīvus pēcnācējus pietiekamā daudzumā. Attiecīgā parauga lielums ir atkarīgs no plankumu skaita, ko novēro pelēm pēc aplikācijas, un no pieejamiem kontroles datiem. Negatīvs rezultāts apstiprināms tikai tad, ja ir pārbaudīti vismaz 300 pēcnācēji no mātītēm pēc lielākās devas iedarbības.
Vienlaikus jābūt kontroles datiem par pelēm, kas pakļautas tikai šķīdinātāja iedarbībai (negatīvā kontrole). Lai uzlabotu metodes precizitāti, var apkopot arī iepriekš tajā pašā laboratorijā iegūtus kontroles datus, ja tie nav pārāk izkliedēti. Ja pārbaudāmā viela neuzrāda mutagēnas īpašības, jāizmanto arī pozitīvās kontroles dati, kas nesen iegūti tajā pašā laboratorijā, ar šo pašu metodi pārbaudot kādu zināmu ķīmisko mutagēnu.
Vielas ievadīšanai grūsnām mātītēm parasti izmanto perorālu intubāciju vai intraperitoniālu injekciju. Vajadzības gadījumā var izmantot inhalāciju vai citu aplikācijas veidu.
Izmanto vismaz divas devas, no kurām vienai jābūt toksiskai vai tādai, kas samazina mazuļu skaitu metienā. Ja vielas nav toksiskas, tās jāizmanto pēc iespējas lielākā devā.
Testa norise
Parasti dzīvnieki saņem vienu devu 8., 9. vai 10. grūtniecības dienā, kā 1. dienu uzskatot dienu, kurā pirmoreiz novēro maksts embolu. Tas atbilst 7,25, 8,25 un 9,25 dienu termiņam pēc aizmešanās. Šajās dienās var ievadīt secīgas devas.
Pēcnācējus šifrē un, sākot no 3. nedēļas līdz 4. nedēļai pēc atnešanās, tiem reģistrē plankumus apmatojumā. Izšķir trīs dažādus plankumu veidus:
a) balti plankumi ne vairāk kā 5 mm attālumā no vēdera mediālās līnijas, kas, iespējams, radušies šūnu bojāejas rezultātā (WMVS);
b) dzelteni plankumi ap krūts dziedzeriem, dzimumorgāniem, uz kakla, padusēs un cirkšņos, kā arī pieres vidū, kas atgādina apmatojuma krāsu agouti un, iespējams, radušies traucētas diferenciācijas dēļ (MDS); un
c) izkaisīti krāsaini un balti apmatojuma plankumi, kas, iespējams, radušies somatisko mutāciju rezultātā (RS).
Reģistrē visus trīs plankumu veidus, bet tikai RS ir ģenētiski determinēti. Ja rodas grūtības atšķirt MDS no RS, tās var atrisināt, apskatot apmatojuma paraugus fluorescences mikroskopā.
Pēcnācējiem reģistrē izteiktas morfoloģiskas anomālijas.
2. DATI
Jānorāda kopējais analizēto pēcnācēju skaits un to dzīvnieku skaits, kam novērots viens vai vairāki plankumi, kuri, iespējams, radušies somatiskās mutācijas rezultātā. Ar piemērotām statistikas metodēm salīdzina datus par izmēģinājumu un kontroles dzīvniekiem. Datus atsevišķi apkopo arī par katru metienu.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— krustošanai izmantotās līnijas,
— grūsno mātīšu skaits izmēģinājumu un kontroles grupās,
— vidējais metiena lielums izmēģinājumu un kontroles grupās atnešanās un atšķiršanas brīdī,
— pārbaudāmās vielas deva(-as),
— izmantotais šķīdinātājs,
— grūtniecības diena, kurā ievadīta pārbaudāmā viela,
— ievadīšanas veids,
— analizēto pēcnācēju kopējais skaits un to dzīvnieku skaits izmēģinājumu un kontroles grupās, kam novēroti WMVS, MDS un RS,
— izteiktas morfoloģiskas anomālijas,
— ja iespējams, RS biežums atkarībā no devas,
— statistiskais novērtējums,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.25. PĀRMANTOJAMO TRANSLOKĀCIJU NOTEIKŠANA PELĒM
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJA
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Veicot pārmantojamo translokāciju noteikšanu pelēm, pirmās paaudzes pēcnācējiem reģistrē strukturālas un skaitliskas hromosomu izmaiņas zīdītāju dzimumšūnās. Novērotās hromosomu izmaiņas ietver reciprokās translokācijas un, ja analizē arī sievišķos pēcnācējus, X hromosomas zudumu. Hromosomu translokāciju nesējiem un XO mātītēm ir pazemināta auglība, ko izmanto, lai atlasītu F1 pēcnācējus citoģenētiskās analīzes veikšanai. Dažas translokācijas (starp X hromosomu un autosomu, kā arī starp centromēru un telomēru) izraisa pilnīgu sterilitāti. Translokāciju citoģenētiskajai analīzei izmanto vīrišķo īpatņu (F1 tēviņu vai F1 mātīšu vīrišķo pēcnācēju) šūnas mejozes ciklā, diakinēzes-metafāzes I laikā. XO mātītes var citoģenētiski atšķirt pēc tā, ka to kaula smadzeņu šūnās mitozes laikā parādās tikai 39 hromosomas.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
Sagatavošanas darbi
Pārbaudāmās vielas izšķīdina izotoniskā sāls šķīdumā. Ja vielas nešķīst ūdenī, tās izšķīdina vai suspendē piemērotā šķīdinātājā. Pārbaudāmās vielas šķīdumam jābūt tikko pagatavotam. Ja izmanto šķīdinātāju, kas atvieglo vajadzīgas devas ievadīšanu, tas nedrīkst reaģēt ar pārbaudāmo vielu vai būt toksisks.
Parasti izmanto perorālu intubāciju vai intraperitoniālu injekciju. Var izmantot arī citus aplikācijas veidus.
Šim nolūkam izmanto peles, jo to pavairošana un citoloģiskā izmeklēšana nerada īpašas grūtības. Var izmantot jebkuru peļu līniju. Tomēr ir svarīgi, lai vidēji katrā metienā būtu vairāk nekā astoņi mazuļi, un šim skaitam jābūt diezgan nemainīgam.
Izmanto veselus un dzimumgatavību sasniegušus dzīvniekus.
Dzīvnieku skaits ir atkarīgs no spontāno translokāciju biežuma un no minimālā inducēto translokāciju skaita, kas vajadzīgs, lai iegūtu pozitīvu rezultātu.
Parasti analizē vīrišķos F1 pēcnācējus. Katrā izmēģinājumu dzīvnieku grupā pārbauda vismaz 500 vīrišķo F1 pēcnācēju. Ja pārbauda arī sievišķos F1 pēcnācējus, ir jābūt 300 tēviņiem un 300 mātītēm.
Jābūt attiecīgiem kontroles datiem, kas iegūti tagad un iepriekšējos izmēģinājumos. Ja tajā pašā laboratorijā ir pieejami atbilstoši pozitīvās kontroles rezultāti, kas iegūti nesen veiktos eksperimentos, tos var izmantot tagadējās pozitīvās kontroles vietā.
Pārbauda vienu vielas devu, parasti tā ir lielākā deva, kurai novēro minimālu toksisku iedarbību un kura neietekmē dzīvnieku reproduktīvo uzvedību vai izdzīvošanu. Lai noteiktu, kā vielas iedarbība mainās atkarībā no devas, papildus jābūt divām mazākām devām. Ja vielas nav toksiskas, tās jāizmanto pēc iespējas lielākā devā.
Testa norise
Pastāv divas aplikācijas shēmas. Pārbaudāmo vielu visbiežāk ievada vienreiz. Pārbaudāmo vielu var arī ievadīt 7 dienas nedēļā 35 dienu laikā. Pārošanās reižu skaits pēc aplikācijas ir atkarīgs no aplikācijas shēmas, un tam jāaptver visas dzimumšūnu attīstības stadijas. Beidzoties pārošanās laikam, katru mātīti ievieto atsevišķā būrī. Pēc mātītes atnešanās reģistrē dienu, metiena lielumu un pēcnācēju dzimumu. Visus vīrišķos pēcnācējus atšķir no mātītes, bet sievišķos pēcnācējus tālāk neizmanto, ja nav paredzēts citādi.
Var izvēlēties vienu no diviem iespējamiem paņēmieniem:
— F1 pēcnācēju auglības tests un iespējamo translokāciju nesēju citoģenētiskā analīze,
— visu vīrišķo F1 pēcnācēju citoģenētiskā analīze bez iepriekšējas atlases pēc auglības.
a) Auglības tests
Par to, ka F1 īpatņa auglība ir pazemināta, var spriest pēc metiena lieluma un/vai dzemdes satura analīzes, ko veic mātītēm pēc pārošanās ar šo īpatni.
Izmantotajai peļu līnijai jānosaka normālas un pazeminātas auglības kritēriji.
Dati par metienu lielumu. F1 tēviņus katru atsevišķā būrī sapāro ar tajā pašā eksperimentā iegūtām mātītēm vai ar mātītēm no tās pašas dzīvnieku populācijas. Dzīvniekus apskata katru dienu, sākot no 18. dienas pēc pārošanās. Atnešanās brīdī reģistrē metiena lielumu un F2 pēcnācēju dzimumu, tie vairs netiek izmantoti. Jāpārbauda sievišķie F1 pēcnācēji, F2 pēcnācējus no maziem metieniem patur turpmākai analīzei. Sievišķos translokāciju nesējus identificē, veicot translokāciju citoģenētisko analīzi vismaz kādam no vīrišķajiem pēcnācējiem. XO mātītes var pazīt pēc tā, ka to pēcnācēju dzimumu (tēviņi: mātītes) skaitliskā attiecība mainās no 1:1 uz 1:2. Ja izmanto secīgo metodi, normālos F1 dzīvniekus tālāk nepārbauda, ja pirmais F2 metiens atbilst vai pārsniedz iepriekš noteikto normālo lielumu, pretējā gadījumā pārbauda otro vai trešo F2 metienu.
F1 dzīvniekus, kurus pat pēc triju F2 metienu novērošanas nevar atzīt par normāliem, pārbauda, veicot dzemdes satura analīzi ar tiem sapārotajām mātītēm, vai tiešā veidā, veicot tiem citoģenētisko analīzi.
Dzemdes satura pārbaude. Metienu lieluma samazināšanās dzīvniekiem ar translokācijām ir izskaidrojama ar embriju bojāeju, tādējādi liels nedzīvu implantu skaits norāda uz to, ka pārbaudāmais dzīvnieks ir translokācijas nesējs. Katru analizējamo F1 tēviņu sapāro ar divām vai trim mātītēm. Par aizmešanos liecina maksts embols, ja to konstatē, ik rītu apskatot dzīvniekus. Mātītes nokauj pēc 14–16 dienām un reģistrē dzemdē atrasto dzīvo un nedzīvo implantu skaitu.
b) Citoģenētiskā analīze
No sēkliniekiem izgatavo gaisā žāvētus preparātus. Translokāciju nesējus identificē pēc multivalentu konfigurācijām, ko novēro primārajos spermatocītos diakinēzes-metafāzes I laikā. Vismaz divas šūnas ar multivalentiem ir pietiekams pierādījums tam, ka analizējamais dzīvnieks ir translokācijas nesējs.
Ja dzīvnieku pavairošana noris bez atlases, citoģenētiski pārbauda visus F1 tēviņus. Katram tēviņam mikroskopiski izvērtē vismaz 25 šūnas, kas iegūtas diakinēzes-metafāzes I laikā. F1 tēviņiem, kam ir nelieli sēklinieki vai kam mejoze apstājusies pirms diakinēzes, kā arī F1 mātītēm, ja ir aizdomas, ka tām ir XO genotips, pārbauda spermatogoniju vai kaula smadzeņu šūnas mitozes metafāzē. Ja ikvienā no 10 šūnām novēro neierasti garu un/vai īsu hromosomu, tas norāda uz to, ka ir notikusi īpaša translokācija, kas izraisa vīrišķo sterilitāti (c/t translokācijas tips). Dažas translokācijas starp X hromosomu un autosomu, kas izraisa vīrišķo sterilitāti, var konstatēt tikai pēc mitotisko hromosomu diferenciālās krāsošanas. Ja ikvienā no 10 mitozēm novēro tikai 39 hromosomas, tas liecina par to, ka mātītei ir XO genotips.
2. DATI
Datus apkopo tabulā.
Ziņojumā norāda metienu vidējo lielumu un dzimumu skaitlisko attiecību atnešanās un mazuļu atšķiršanas brīdī, ko novēro katrā pārošanās termiņā.
Pēc F1 dzīvnieku auglības pārbaudes norāda metienu vidējo lielumu pēc katras normālas pārošanās un katra atsevišķa metiena lielumu F1 translokāciju nesējiem. Pēc dzemdes satura pārbaudes norāda dzīvo un nedzīvo implantu vidējo skaitu normāliem dzīvnieku pāriem un dzīvo un nedzīvo implantu skaitu pēc katras F1 translokāciju nesēju pārošanās.
Pēc diakinēzes-metafāzes I citoģenētiskās analīzes katram translokāciju nesējam norāda multivalentu konfigurāciju tipu skaitu un kopējo šūnu skaitu.
Steriliem F1 īpatņiem norāda kopējo pārošanās skaitu un pārošanās perioda ilgumu. Norāda arī sēklinieku svaru un pievieno citoģenētiskās analīzes aprakstu.
Ziņojumā iekļauj metienu vidējo lielumu XO mātītēm, F2 pēcnācēju dzimumu skaitlisko attiecību un citoģenētiskās analīzes rezultātus.
Ja iepriekš veic varbūtējo F1 translokāciju nesēju atlasi, izmantojot auglības pārbaudi, tabulās jāiekļauj ziņas par to, cik dzīvniekiem ir novērota translokācijas heterozigotāte.
Ziņojumā arī jāietver negatīvās un pozitīvās kontroles dati.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— izmantotā peļu līnija, dzīvnieku vecums, apstrādāto dzīvnieku svars,
— katra dzimuma vecākdzīvnieku skaits izmēģinājumu un kontroles grupās,
— testa apstākļi, aplikācijas shēma, izmantotās devas, šķīdinātāji, pārošanās shēma,
— katras mātītes pēcnācēju skaits un dzimums, to pēcnācēju skaits un dzimums, kam veikta translokāciju analīze,
— translokāciju analīzes termiņi un kritēriji,
— translokāciju nesēju skaits un padziļināts raksturojums, vajadzības gadījumā norādot datus par pārošanu un dzemdes satura pārbaudi,
— citoģenētikas metodes un sīks mikroskopiskās analīzes apraksts, vēlams, pievienojot attēlus,
— statistiskais novērtējums,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.26. SUBHRONISKĀS ORĀLĀS TOKSICITĀTES TESTS – ATKĀRTOTO DEVU 90 DIENU ORĀLĀS TOKSICITĀTES PĒTĪJUMS AR GRAUZĒJIEM
1. METODE
Šī subhroniskās orālās toksicitātes testa metode ir ESAO TG 408 (1998) kopija.
1.1. IEVADS
Pārbaudot un novērtējot ķimikālijas toksiskās īpašības, subhroniskās orālās toksicitātes noteikšanu, izmantojot atkārtotas devas, var izdarīt pēc tam, kad no akūtās vai atkārtotās devas 28 dienu toksicitātes testiem ir iegūta sākotnējā informācija. 90 dienu pētījums sniedz informāciju par iespējamo veselības apdraudējumu, kas varētu rasties no atkārtotas iedarbības ilgākā laika posmā, ietverot laiku pēc zīdīšanas pārtraukšanas līdz pieauguša dzīvnieka vecuma sasniegšanai. Pētījums sniegs informāciju par lielākajām toksiskajām ietekmēm, norādīs mērķa orgānus un akumulācijas iespēju, un tas var aptuveni novērtēt iedarbības līmeni, pie kura nav novērojama negatīva ietekme un kurš būtu izmantojams, izvēloties devu līmeņus hroniskās iedarbības pētījumiem un nosakot drošības kritērijus iedarbībai uz cilvēkiem.
Šī metode turklāt pievērš uzmanību neiroloģiskajiem galapunktiem un norāda uz imunoloģisko ietekmi un ietekmi uz reproduktīvo funkciju. Ir uzsvērta arī vajadzība izdarīt rūpīgus dzīvnieku klīniskos novērojumus, lai iegūtu iespējami vairāk informācijas. Šajā pētījumā būtu jāidentificē ķīmiskās vielas, kuras varētu izraisīt uz orgāniem neirotoksisku, imunoloģisku ietekmi vai ietekmi uz reproduktīvajiem orgāniem, kas varētu pamatot turpmākus padziļinātus pētījumus.
Skatīt arī vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Deva: ievadītais testa vielas daudzums. Devu izsaka kā svaru (g, mg) vai kā testa vielas svaru uz izmēģinājuma dzīvnieka svara vienību (piemēram, mg/kg), vai kā nemainīgu koncentrāciju barībā (milj. daļas).
Dozēšana: vispārējs termins, kas ietver devu, tās biežumu un došanas ilgumu.
NOAEL : saīsinājums devai, pie kuras nav novērojama negatīva ietekme, un tas ir lielākais devas līmenis, pie kura nav novērojami ar iedarbību saistīti negatīvi rezultāti.
1.3. TESTA METODES PRINCIPS
Testa vielu dažādu līmeņu devās katru dienu perorāli ievada vairākām eksperimenta dzīvnieku grupām, vienu devas līmeni katrai grupai 90 dienu ilgā laika posmā. Vielas ievadīšanas laikā rūpīgi novēro, vai dzīvniekiem neparādās toksicitātes pazīmes. Dzīvniekiem, kas testa laikā nobeidzas vai tiek nogalināti, izdara autopsiju, un testa beigās izdzīvojušos dzīvniekus arī nogalina, un tiem izdara autopsiju.
1.4. TESTA METODES APRAKSTS
1.4.1. Dzīvnieku sagatavošana
Būtu jāizmanto veseli dzīvnieki, kas ir aklimatizēti laboratorijas apstākļos vismaz piecas dienas un kas nav iepriekš pakļauti eksperimenta procedūrām. Būtu jāapraksta testa dzīvnieku suga, šķirne, izcelsme, dzimums, svars un/vai vecums. Dzīvnieki būtu jāiedala kontroles un vielas saņemšanas grupās pēc nejaušās izvēles. Būrus izvieto tā, lai iespējami samazinātu būru novietojuma varbūtējo ietekmi. Katram dzīvniekam piešķir individuālu identifikācijas numuru.
1.4.2. Devu sagatavošana
Testa vielu ievada, dzīvnieku mākslīgi barojot vai ar barību vai ar dzeramo ūdeni. Perorālās ievadīšanas metode ir atkarīga no pētījuma mērķa un testa materiāla fizikālajām/ķīmiskajām īpašībām.
Vajadzības gadījumā testa vielu šķīdina vai suspendē piemērotā nesējā. Ir ieteicams, ja vien iespējams, vispirms apsvērt ūdens šķīduma/suspensijas izmantošanu, pēc tam eļļas (piemēram, kukurūzas eļļas) šķīduma/suspensijas izmantošanu un pēc tam iespējamu šķīdināšanu citos nesējos. Ja nesējs nav ūdens, ir jāzina šā nesēja toksiskās īpašības. Jānosaka testa vielas stabilitāte ievadīšanas apstākļos.
1.4.3. Testa apstākļi
1.4.3.1. Izmēģinājuma dzīvnieki
Testos galvenokārt izmanto žurkas, lai gan var izmantot arī citas grauzēju sugas, piemēram, peles. Jāizmanto jauni, veseli, pieauguši parasti laboratorijās izmantojamu līniju dzīvnieki. Mātītēm jābūt nedzemdējušām un negrūsnām. Devu došana jāsāk iespējami ātrāk tūlīt pēc zīdīšanas izbeigšanas un katrā ziņā, pirms dzīvnieki sasniedz deviņu nedēļu vecumu. Pētījuma sākumā dzīvnieku masas atšķirībām jābūt minimālām un tās nedrīkstētu pārsniegt ± 20 % no vidējās masas, kas noteikta katram dzimumam atsevišķi. Ja pētījumu veic kā ilgtermiņa hroniskās toksicitātes pētījuma iepriekšēju pētījumu, abos pētījumos jāizmanto vienas līnijas un izcelsmes dzīvnieki.
1.4.3.2. Skaits un dzimums
Katrā devu līmenī jāizmanto vismaz 20 dzīvnieki (10 mātītes un 10 tēviņi). Ja ir plānota dzīvnieku nogalināšana testa laikā, kopējais dzīvnieku skaits ir jāpalielina par dzīvnieku skaitu, ko paredzēts nogalināt pirms pētījuma pabeigšanas. Pamatojoties uz iepriekšējām zināšanām par ķīmisko vielu vai tās tuvu analogu, būtu jāapsver papildu 10 dzīvnieku grupas (pa pieciem no katra dzimuma) iekļaušana kontroles grupā un vislielākās devas grupā toksisko ietekmju atgriezeniskuma vai noturības novērošanai pēc testa vielas saņemšanas laika posma. Šā novērošanas laika posma ilgums jānosaka atbilstīgi novērotajām ietekmēm.
1.4.3.3. Devu lielums
Izmanto vismaz trīs devu līmeņus un veic vienlaicīgu kontroles eksperimentu, izņemot gadījumu, kad veic pieļaujamā daudzuma testu (skatīt 1.4.3.4. punktu). Devu līmeņus var noteikt, pamatojoties uz atkārtotās devas vai diapazona atrašanas pētījumiem un ņemot vērā visus esošos toksikoloģiskos un toksikokinētiskos datus, kas ir pieejami par testa vielu vai radniecīgiem materiāliem. Ja vien lielāko devas līmeni neierobežo testa vielas fizikāli ķīmiskās īpašības vai bioloģiskā ietekme, šis līmenis jāizvēlas ar mērķi izraisīt toksicitāti, bet ne nāvi vai smagas ciešanas. Devu līmeņi samazināšanās secībā jāizvēlas tā, lai parādītu atbildes reakcijas atkarību no devu lieluma un lai mazākais līmenis būtu līmenis, pie kura nav novērojama negatīva ietekme (NOAEL). Lai noteiktu intervālus starp devu līmeņiem samazināšanās secībā, bieži optimāli ir izmantot koeficientu 2 līdz 4 un bieži ir labāk pievienot ceturto testa grupu nekā izmantot starp devu līmeņiem ļoti lielus intervālus (piemēram, koeficientu, kas lielāks par 6–10).
Kontroles grupa ir grupa, kas nesaņem testa vielu, vai grupa, kas saņem nesēju, ja testa vielas ievadīšanā izmanto nesēju. Izņemot testa vielas došanu, ar kontroles grupu dzīvniekiem rīkojas tieši tāpat kā ar testa vielu saņēmēju grupu dzīvniekiem. Ja izmanto nesēju, kontroles grupa saņem nesēju lielākajā izmantotajā tilpumā. Ja testa vielu ievada ar barību un viela izraisa samazinātu barības uzņemšanu, tad var būt noderīgas kontroles grupas, ko baro pa pāriem, lai izšķirtu, vai samazinājums ir saistīts ar garšas īpašībām vai ar toksikoloģiskajām pārmaiņām testa modelī.
Vērība būtu jāvelta šādām nesēja un attiecīgi citu piedevu īpašībām: ietekmēm uz uzsūkšanos, sadalījumu, vielmaiņu vai testa vielas aizturi; ietekmēm uz testa vielas ķīmiskajām īpašībām, kuras var mainīt tās toksiskās īpašības; un ietekmei uz barības un ūdens patēriņu vai dzīvnieku barojumu.
1.4.3.4. Pieļaujamā daudzuma tests
Ja testā ar vienu vielas devas līmeni, kas ir vismaz 1 000 mg/kg ķermeņa svara dienā, izmantojot šim pētījumam aprakstīto procedūru, nav novērota negatīva ietekme un ja, pamatojoties uz datiem par struktūras ziņā līdzīgām vielām, var pamatoti uzskatīt, ka viela nav toksiska, pilnu pētījumu ar trim devu līmeņiem var uzskatīt par nevajadzīgu. Pieļaujamā daudzuma tests ir izmantojams, izņemot gadījumus, kad vielas iedarbība uz cilvēku norāda, ka jālieto lielāks devas līmenis.
1.5. PROCEDŪRA
1.5.1. Devu ievadīšana
Dzīvniekiem testa vielu dod ik dienu septiņas dienas nedēļā 90 dienu ilgā laika posmā. Jebkuram citam devu došanas režīmam, piemēram, piecas dienas nedēļā, jābūt pamatotam. Ja testa vielu ievada ar barošanas zondi, tā ar kuņģa zondi vai piemērotu intubācijas cauruli dzīvniekiem jāievada vienā devā. Maksimālais šķidruma tilpums, ko vienā paņēmienā var ievadīt, ir atkarīgs no izmēģinājumu dzīvnieka lieluma. Šķīduma tilpumam nevajadzētu pārsniegt 1 ml uz 100 g ķermeņa svara, izņemot ūdens šķīduma gadījumus, kad var lietot 2 ml uz 100 g ķermeņa svara. Izņemot kairinošas un kodīgas vielas, kuru iedarbība lielākās koncentrācijās parasti ir izteiktāka, testa tilpuma mainība būtu jāsamazina līdz minimumam, pielāgojot koncentrāciju tā, lai pie visiem devu līmeņiem tilpums būtu vienāds.
Ir svarīgi nodrošināt, lai vielām, kuras ievada ar barību vai dzeramo ūdeni, testā iesaistītās vielas īpašības neizjauktu parasto barības vai ūdens līdzsvaru. Ja testa vielu ievada ar barību, var izmantot nemainīgu koncentrāciju barībā (milj. daļas) vai nemainīgu devas līmeni, ņemot vērā dzīvnieka ķermeņa svaru; ir jānorāda, kuru alternatīvu izmanto. Vielām, kuras ievada ar barošanas zondi, devas jādod vienā laikā katru dienu un pēc vajadzības jāpielāgo, lai saglabātu nemainīgu devas līmeni, ņemot vērā dzīvnieka ķermeņa svaru. Ja 90 dienu pētījumu veic kā iepriekšēju pētījumu ilgtermiņa hroniskās toksicitātes pētījumam, tad tāda pati barība būtu jāizmanto abos pētījumos.
1.5.2. Novērojumi
Novērošanas laika posmam būtu jābūt vismaz 90 dienu ilgam. Papildu grupas dzīvniekus, kuri paredzēti tālākai novērošanai, noteiktu laika posmu vajadzētu turēt bez vielas saņemšanas, lai noteiktu toksisko ietekmju noturību vai atveseļošanos no tām.
Jāizdara vispārēji klīniskie novērojumi vismaz reizi dienā, vēlams vienā(-os) laikā(-os) katru dienu, ņemot vērā gaidāmo ietekmju maksimuma laika posmu pēc došanas. Jāprotokolē dzīvnieku klīniskais stāvoklis. Vismaz divas reizes dienā, parasti dienas sākumā un beigās, ir jāpārbauda, vai dzīvniekiem neparādās nāves tuvošanās un nāves pazīmes.
Vismaz vienu reizi pirms pirmās pakļaušanas iedarbībai (lai varētu izdarīt salīdzināšanu vienam un tam pašam dzīvniekam) un pēc tam vienu reizi nedēļā jāveic detalizēti klīniskie novērojami visiem dzīvniekiem. Šie novērojumi būtu jāveic ārpus dzīvnieka turēšanas krātiņa, ieteicams – standartnožogojumā katru reizi vienā un tajā pašā laikā. Novērojumi rūpīgi jāprotokolē, vēlams izmantot vērtēšanas sistēmu, ko skaidri noteikusi testēšanas laboratorija. Ir jācenšas nodrošināt, lai pārmaiņas novērošanas apstākļos būtu minimālas. Protokolējamās pazīmēs būtu jāiekļauj pārmaiņas ādā, apmatojumā, acīs, gļotādā, sekrēcijas izdalīšanās un veģetatīvā aktivitāte (piemēram, asarošana, piloarekcija, acs zīlītes diametrs un neraksturīga elpošana), bet ar to nebūtu jāaprobežojas. Būtu jāprotokolē arī pārmaiņas gaitā, stājā un atbildes reakcijās uz manipulācijām, kā arī klonisko un tonisko kustību klātesamība, pārmaiņas stereotipos (piemēram, pārmērīga kopšanās, atkārtota riņķošana) vai savāda uzvedība (piemēram, sakropļošanās, staigāšana atmuguriski) (1).
Oftalmoloģiskā apskate, izmantojot oftalmoskopu vai līdzīgu piemērotu ierīci, jāveic pirms testa vielas ievadīšanas un pētījuma beigās, vēlams visiem dzīvniekiem, bet vismaz lielākās devas grupas un kontroles grupas dzīvniekiem. Ja atklāj pārmaiņas acīs, jāpārbauda visi dzīvnieki.
Uz iedarbības laika posma beigām un katrā ziņā ne vēlāk kā 11. nedēļā ir jāpārbauda sensorās reakcijas uz dažādu veidu kairinātājiem (1) (piemēram, uz dzirdes, redzes un proprioceptīvajiem kairinātājiem) (2) (3) (4), kā arī jānovērtē tvēriena stiprums (5) un motoriskā aktivitāte (6). Sīkāki dati par procedūrām, kuras var ieviest, ir doti attiecīgajās norādēs. Tomēr var izmantot arī alternatīvas procedūras, ne tikai tās, kuras minētas norādēs.
Funkcionālos novērojumus, kurus veic uz pētījuma beigām, var neveikt, ja funkcionālo novērojumu dati ir pieejami no citiem pētījumiem un katras dienas klīniskajos novērojumos nav atklāti nekādi funkcionāli trūkumi.
Izņēmuma gadījumos funkcionālos novērojumus var arī neveikt tām dzīvnieku grupām, kurām citādi atklātas toksicitātes pazīmes tādā mērā, kas ievērojami traucētu funkcionālā testa norisi.
1.5.2.1. Ķermeņa svars un barības/ūdens patēriņš
Visi dzīvnieki jānosver vismaz vienu reizi nedēļā. Barības patēriņa noteikšana jāizdara vismaz ik nedēļu. Ja testa vielu ievada ar dzeramo ūdeni, ūdens patēriņš arī jānosaka vismaz ik nedēļu. Ūdens patēriņu var ņemt vērā arī barošanas vai mākslīgās barošanas pētījumos, kuru laikā dzeršanas intensitāte var mainīties.
1.5.2.2. Hematoloģija un klīniskā bioķīmija
Asins paraugi jāņem no noteiktas vietas un vajadzības gadījumā jāglabā piemērotos apstākļos. Testa laika posma beigās paraugus noņem tieši pirms dzīvnieku nogalināšanas procedūras vai kā daļu no tās.
Testa laika posma beigās un tad, kad asins paraugus ņem testa laika posma vidū, jāizdara šādas hematoloģiskās analīzes: hematokrītu, hemoglobīna koncentrācijas, eritrocītu skaita, leikocītu skaita un leikocitārās formulas, trombocītu skaita un asins recēšanas laika/spējas noteikšana.
Klīniskās bioķīmijas noteikšana, lai izpētītu galvenās toksiskās ietekmes audos, un jo īpaši ietekmes uz nierēm un aknām, jāveic ar tiem asins paraugiem, kuri paņemti no katra dzīvnieka tieši pirms dzīvnieku nogalināšanas procedūras vai kā daļa no tās (tas neattiecas uz dzīvniekiem, kuri atrasti mirstoši un/vai nogalināti pētījuma vidū). Līdzīgi kā hematoloģiskos pētījumos paraugus klīniskajiem bioķīmijas testiem var ņemt arī testa laika posma vidū. Ir ieteicams nedot dzīvniekiem barību uz nakti pirms asins analīžu ņemšanas ( 17 ). Plazmā vai serumā jānosaka nātrijs, kālijs, glikoze, kopējais holesterīns, urīnviela, urīnvielas slāpeklis asinīs, kreatīns, kopējās olbaltumvielas un albumīns un vairāk par diviem fermentiem, kas norāda uz hepatocelulārajām ietekmēm (piemēram, alanīna aminotransferāze, aspartāta aminotransferāze, alkalīnfosfatāze, gamma glutamiltranspeptidāze un sorbīta dehidrogenāze). Var iekļaut arī papildu fermentu (aknu vai citas izcelsmes) un žultsskābju noteikšanu, kas varētu sniegt noderīgu informāciju pie dažiem nosacījumiem.
Pēc izvēles pēdējās pētījuma nedēļas laikā, izmantojot urīna tilpuma savākšanu noteiktā laikā, var veikt šādas urīna analīzes: izskata, daudzuma, osmolaritātes vai īpatnējā svara, pH, olbaltumvielu, glikozes un asins/asins šūnu analīzes.
Turklāt būtu jāapsver iespēja veikt vispārēju audu bojājumu seruma marķieru izpēti. Citas noteikšanas, kuras būtu jāveic, ja testa vielas zināmās īpašības ietekmē attiecīgās metaboliskās īpašības vai ja ir aizdomas par tādu ietekmi, iekļauj kalciju, fosforu, tukšas dūšas triglicerīdus, specifiskus hormonus, methemoglobīnu un holīnesterāzi. Šīs noteikšanas ir jāizdara, ja ķīmiskās vielas pieder pie dažām klasēm vai atkarībā no konkrētā gadījuma.
Visumā ir vajadzīga elastīga pieeja atkarībā no sugām un novērotām un/vai paredzamām attiecīgās vielas ietekmēm.
Ja vēsturiskie dati par normas robežām ir nepietiekami, būtu jāapsver, vai pirms pētījuma sākšanas nebūtu jānosaka hematoloģiskie un klīniskās bioķīmijas mainīgie lielumi; vispār šos datus iegūt pirms devu došanas nav ieteicams (7).
1.5.2.3. Autopsija
Pētījumā visus dzīvniekus pakļauj pilnai detalizētai autopsijai, kas iekļauj ķermeņa ārējās virsmas, visu atveru un galvaskausa dobuma, torakālā dobuma un vēdera dobuma un šo dobumu satura rūpīgu apskati. Visu dzīvnieku (tas neattiecas uz dzīvniekiem, kas atrasti mirstoši un/vai nogalināti pētījuma laikā) aknas, nieres, virsnieru dziedzeri, sēklinieki, dzemde, olnīcas, aizkrūts dziedzeris, liesa, smadzenes un sirds jāatbrīvo no attiecīgajiem apkārtējiem audiem un iespējami drīz pēc secēšanas jānosver, lai izvairītos no izžūšanas.
Šādi audi jāglabā vispiemērotākajā fiksācijas vidē audu veida izmeklēšanai un paredzētai vēlākai histopatoloģiskai izmeklēšanai: visi audi ar makroskopiskiem bojājumiem, smadzenes (reprezentatīvi apgabali, iekļaujot lielās smadzenes, smadzenītes un iegarenās smadzenes/smadzeņu tiltu), muguras smadzenes (trijos līmeņos: kakla daļā, torakālajā vidusdaļā un jostasvietas daļā), hipofīze, vairogdziedzeris, epitēlijķermenīši, aizkrūts dziedzeris, barības vads, siekalu dziedzeri, kuņģis, tievās un resnās zarnas (iekļaujot kopu limfātiskos jeb Peijera mezgliņus), aknas, aizkuņģa dziedzeris, nieres, virsnieru dziedzeri, liesa, sirds, traheja un plaušas (konservētas, piepūšot ar fiksatoru un pēc tam iegremdējot), aorta, dzimumdziedzeri, dzemde, akcesorie dzimumorgāni, piena dziedzeri, prostata, urīnpūslis, žultspūslis (pelēm), limfmezgli (vēlams – viens limfmezgls, kas ir uz ievadīšanas ceļa, un otrs, kas ir attālu no ievadīšanas ceļa, lai konstatētu sistēmiskās ietekmes), perifēriskais nervs (sēžas nervs vai tibiālais nervs), vēlams – tiešā muskuļa tuvumā, kaulu smadzeņu izgriezums (un/vai svaigs kaulu smadzeņu aspirāts), āda un acis (ja oftalmoloģiskās apskates laikā novērotas pārmaiņas). No klīniskajiem un citiem novērojumiem var rasties doma papildus izmeklēt citus audus. Jākonservē arī orgāni, ko uzskata par iespējamiem mērķa orgāniem, pamatojoties uz zināmām testa vielas īpašībām.
1.5.2.4. Histopatoloģija
Visu kontroles grupas un lielākās devas grupas dzīvnieku konservētajiem orgāniem un audiem jāizdara pilna histopatoloģiskā izmeklēšana. Ja lielākās devas grupā ir novērotas ar vielas saņemšanu saistītas pārmaiņas, minētā izmeklēšana jāpaplašina uz visu citu devu grupu dzīvniekiem.
1.5.2.5. Jāizmeklē visi makroskopiskie bojājumi.
Ja izmanto papildu grupu, histopatoloģiskā izmeklēšana jāizdara audiem un orgāniem, kuros ietekmes konstatētas vielu saņēmušajām grupām.
2. DATI UN TO NOFORMĒŠANA
2.1. DATI
Būtu jāsniedz dati par katru atsevišķu dzīvnieku. Turklāt visi dati jāapkopo tabulā, katrai testa grupai parādot dzīvnieku skaitu testa sākumā, dzīvnieku skaitu, kas testa laikā ir nobeigušies vai humānu apsvērumu dēļ nogalināti, un katras nobeigšanās vai humānas nogalināšanas laiku, dzīvnieku skaitu, kam novērotas toksicitātes pazīmes, novēroto toksicitātes pazīmju aprakstu, iekļaujot toksisko ietekmju sākuma laiku, ilgumu un smagumu, dzīvnieku skaitu, kam novēroti audu bojājumi, bojājumu veidus un to dzīvnieku procentuālo daudzumu, kuriem parādījušies katra tipa bojājumi.
Attiecīgā gadījumā skaitliskie rezultāti būtu jānovērtē ar piemērotu un vispārpieņemtu statistisko metodi. Statistiskās metodes un analizējamie dati būtu jāizvēlas, plānojot pētījumu.
2.2. TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
2.2.1. Testa viela:
— fizikālais stāvoklis, tīrība un fizikāli ķīmiskās īpašības,
— identificēšanas dati,
— nesējs (attiecīgā gadījumā): nesēja izvēles pamatojums, ja nesējs nav ūdens.
2.2.2. Testa suga:
— izmantotā suga un līnija,
— dzīvnieku skaits, vecums un dzimums,
— izcelsme, turēšanas apstākļi, barība utt.,
— atsevišķo dzīvnieku svars testa sākumā.
2.2.3. Testa apstākļi:
— devu izvēles pamatojums,
— sīki izstrādāts apraksts par testa vielas sagatavošanu/pievienošanu barībai, iegūto sagatavotā maisījuma koncentrāciju, stabilitāti un homogenitāti,
— sīki izstrādāts testa vielas ievadīšanas apraksts,
— testa vielas faktiskās devas (mg/kg ķermeņa masas dienā) un – attiecīgā gadījumā – koeficients, lai testa vielas koncentrāciju (milj. daļās) barībā/dzeramajā ūdenī pārrēķinātu faktiskajās devās,
— sīki izstrādāts barības un ūdens kvalitātes apraksts.
2.2.4. Rezultāti:
— ķermeņa svars un ķermeņa svara pārmaiņas,
— attiecīgā gadījumā – barības patēriņš un ūdens patēriņš,
— dati par jutību pret toksicitāti pēc dzimuma un devu līmeņa, iekļaujot toksicitātes pazīmes,
— klīnisko novērojumu būtība, smagums un ilgums (vai tie ir vai nav atgriezeniski),
— oftalmoloģiskās apskates rezultāti,
— sensorās aktivitātes, tvēriena stipruma un motoriskās aktivitātes novērtējums (attiecīgā gadījumā),
— hematoloģisko testu dati ar attiecīgajām normas robežām,
— klīniskās bioķīmijas testu dati ar attiecīgajām normas robežām,
— ķermeņa beigu svars, orgānu svars un orgānu/ķermeņa svara attiecība,
— autopsijas rezultāti,
— sīki izstrādāts visu histopatoloģijas rezultātu apraksts,
— absorbcijas dati, ja ir pieejami,
— attiecīgā gadījumā – statistiskās apstrādes rezultāti.
Rezultātu izvērtējums.
Secinājumi.
3. IZMANTOTĀ LITERATŪRA
(1) IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document No 60.
(2) Tupper, D.E., Wallace, R.B. (1980). Utility of the Neurologic Examination in Rats. Acta Neurobiol. Exp., 40, p. 999–1003.
(3) Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J.Toxicol. Environ. Health, 9, p. 691–704.
(4) Moser, V.C., Mc Daniel, K.M., Phillips, P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, p. 267–283.
(5) Meyer O.A., Tilson H.A., Byrd W.C., Riley M.T. (1979). A Method for the Routine Assesment of Fore- and Hind- limb grip Strength of Rats and Mice. Neurobehav. Toxivol., 1, p. 233–236.
(6) Crofton K.M., Howard J.L., Moser V.C., Gill M.W., Reiter L.W., Tilson H.A., MacPhail R.C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, p. 599–609.
(7) Weingand K., Brown G., Hall R. et al. (1996). “Harmonisation of Animal Clinic Pathology Testing in Toxicity and Safety Studies”, Fundam. & Appl. Toxicol., 29, p. 198–201.
B.27. SUBHRONISKĀS ORĀLĀS TOKSICITĀTES TESTS – ATKĀRTOTO DEVU 90 DIENU ORĀLĀS TOKSICITĀTES PĒTĪJUMS AR DZĪVNIEKIEM, KAS NAV GRAUZĒJI
1. METODE
Šī subhroniskās orālās toksicitātes testa metode ir ESAO TG 409 (1998) kopija.
1.1. IEVADS
Pārbaudot un novērtējot ķimikālijas toksiskās īpašības, subhroniskās orālās toksicitātes noteikšanu, izmantojot atkārtotas devas, var izdarīt pēc tam, kad no akūtās vai atkārtotās devas 28 dienu toksicitātes testiem ir iegūta sākotnējā informācija. 90 dienu pētījums sniedz informāciju par iespējamo veselības apdraudējumu, kas varētu rasties no atkārtotas iedarbības straujas augšanas laika posmā līdz jauna pieauguša dzīvnieka attīstības posma sasniegšanai. Pētījums sniegs informāciju par lielākajām toksiskajām ietekmēm, norādīs mērķa orgānus un akumulācijas iespēju, un tas var aptuveni novērtēt iedarbības līmeni, pie kura nav novērojama negatīva ietekme un kurš būtu izmantojams, izvēloties devu līmeņus hroniskās iedarbības pētījumiem un nosakot drošības kritērijus iedarbībai uz cilvēkiem.
Testa metode ļauj identificēt ķīmiskās iedarbības negatīvās ietekmes uz dzīvniekiem, kas nav grauzēji, un tā būtu jāizmanto vienīgi:
— ja citos pētījumos novērotās ietekmes norāda uz vajadzību tās noskaidrot/raksturot, izmantojot citu sugu, kas nav grauzēji, vai
— ja toksikokinētiskie pētījumi rāda, ka tādas sugas izmantošana, kas nav grauzēji, ir vispiemērotākā laboratorijas dzīvnieku izvēle, vai
— ja citi īpaši iemesli pamato tādas sugas izmantošanu, kas nav grauzēji.
Skatīt arī vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Deva: ievadītais testa vielas daudzums. Devu izsaka kā svaru (g, mg) vai kā testa vielas svaru uz izmēģinājuma dzīvnieka svara vienību (piemēram, mg/kg) vai kā nemainīgu koncentrāciju barībā (milj. daļas).
Dozēšana: vispārējs termins, kas ietver devu, tās biežumu un došanas ilgumu.
NOAEL : saīsinājums devai, pie kuras nav novērojama negatīva ietekme, un tas ir lielākais devas līmenis, pie kura nav novērojami negatīvi ar iedarbību saistīti rezultāti.
1.3. TESTA METODES PRINCIPS
Testa vielu dažādu līmeņu devās katru dienu perorāli ievada vairākām eksperimenta dzīvnieku grupām, vienu devas līmeni katrai grupai 90 dienu ilgā laikā. Vielas ievadīšanas laikā rūpīgi novēro, vai dzīvniekiem neparādās toksicitātes pazīmes. Dzīvniekiem, kas testa laikā nobeidzas vai tiek nogalināti, izdara autopsiju un, testu nobeidzot, izdzīvojušos dzīvniekus arī nogalina un tiem izdara autopsiju.
1.4. TESTA METODES APRAKSTS
1.4.1. Dzīvnieku sugu izvēle
Parasti izmantojamā tādu dzīvnieku suga, kas nav grauzēji, ir suņi, kam būtu jābūt noteiktas šķirnes; bieži izmanto bīglus. Var izmanto arī citas sugas, piemēram, cūkas, pundurcūkas. Izmantot primātus nav ieteicams, un to izmantošana būtu jāpamato. Jāizmanto jauni, veseli dzīvnieki, un suņu gadījumā devu došanu būtu vēlams sākt 4–6 mēnešu vecumā un ne vēlāk kā deviņu mēnešu vecumā. Ja pētījumu veic kā ilgtermiņa hroniskās toksicitātes pētījuma iepriekšēju pētījumu, abos pētījumos jāizmanto viena un tā pati suga/šķirne.
1.4.2. Dzīvnieku sagatavošana
Izmanto veselus, jaunus dzīvniekus, kas ir aklimatizēti laboratorijas apstākļos un kas nav iepriekš pakļauti eksperimenta procedūrām. Aklimatizācijas ilgums ir atkarīgs no izraudzītās testa sugas un dzīvnieku izcelsmes. Tas suņiem vai šim nolūkam audzētām cūkām no vietējas audzētavas ir ieteicams vismaz piecas dienas un šiem dzīvniekiem ar ārēju izcelsmi – vismaz divas nedēļas. Jāapraksta testa dzīvnieku suga, šķirne, izcelsme, dzimums, svars un/vai vecums. Dzīvnieki jāiedala kontroles un testa grupās pēc nejaušās izvēles. Būri jāizvieto tā, lai būru novietojuma varbūtējo ietekmi iespējami samazinātu. Katram dzīvniekam jāpiešķir individuāls identifikācijas numurs.
1.4.3. Devu sagatavošana
Testa vielu var ievadīt ar barību vai ar dzeramo ūdeni, caur kuņģa zondi vai kapsulās. Perorālās ievadīšanas metode ir atkarīga no pētījuma nolūka un testa materiāla fizikāli ķīmiskajām īpašībām.
Vajadzības gadījumā testa vielu šķīdina vai suspendē piemērotā nesējā. Ir ieteicams, ja vien iespējams, vispirms apsvērt ūdens šķīduma/suspensijas izmantošanu, pēc tam eļļas (piemēram, kukurūzas eļļas) šķīduma/suspensijas izmantošanu un pēc tam iespējamu šķīdināšanu citos nesējos. Ja nesējs nav ūdens, ir jāzina šā nesēja toksiskās īpašības. Jānosaka testa vielas stabilitāte ievadīšanas apstākļos.
1.5. PROCEDŪRA
1.5.1. Dzīvnieku skaits un dzimums
Katrā devu līmenī jāizmanto vismaz astoņi dzīvnieki (četras mātītes un četri tēviņi). Ja ir plānota dzīvnieku nogalināšana eksperimenta laikā, skaits jāpalielina par dzīvnieku skaitu, ko paredzēts nogalināt pirms pētījuma pabeigšanas. Dzīvnieku skaitam pētījuma beigās jābūt pietiekamam, lai statistiski nozīmīgi novērtētu toksiskās ietekmes. Pamatojoties uz iepriekšējām zināšanām par vielu vai tās tuvu analogu, būtu jāapsver papildu astoņu dzīvnieku grupas (pa četriem no katra dzimuma) iekļaušana kontroles un vislielākās devas grupā toksisko ietekmju atgriezeniskuma vai noturības novērošanai laika posmā pēc testa vielas saņemšanas. Šā novērošanas laika posma ilgumu nosaka atbilstīgi novērotajām ietekmēm.
1.5.2. Dozēšana
Izmanto vismaz trīs devu līmeņus un veic vienlaicīgu kontroles eksperimentu, izņemot gadījumu, kad veic pieļaujamā daudzuma testu (skatīt 1.5.3. punktu). Devu līmeņus var noteikt, pamatojoties uz atkārtotās devas vai diapazona atrašanas pētījumiem un ņemot vērā visus esošos toksikoloģiskos un toksikokinētiskos datus, kas ir pieejami par testa vielu vai radniecīgiem materiāliem. Ja vien lielāko devas līmeni neierobežo testa vielas fizikāli ķīmiskās īpašības vai bioloģiskā ietekme, šis līmenis jāizvēlas ar mērķi izraisīt toksicitāti, bet ne nāvi vai smagas ciešanas. Devu līmeņi samazināšanās secībā jāizvēlas tā, lai parādītu atbildes reakcijas atkarību no devu lielumiem un lai mazākais devas līmenis būtu līmenis, pie kura nav novērojama negatīva ietekme (NOAEL). Lai noteiktu intervālus starp devu līmeņiem samazināšanās secībā, bieži optimāli ir izmantot koeficientu 2 līdz 4 un bieži ir labāk pievienot ceturto testa grupu nekā izmantot starp devām ļoti lielus intervālus (piemēram, koeficientu, kas lielāks par 6–10).
Kontroles grupa ir grupa, kas nesaņem testa vielu, vai grupa, kas saņem nesēju, ja testa vielas ievadīšanā izmanto nesēju. Izņemot testa vielu došanu, ar kontroles grupas dzīvniekiem jārīkojas tieši tāpat kā ar testa grupu dzīvniekiem. Ja izmanto nesēju, kontroles grupa saņem lielāko izmantoto nesēja tilpumu. Ja testa vielu ievada ar barību un viela izraisa samazinātu barības uzņemšanu, tad var būt noderīgas kontroles grupas, ko baro pa pāriem, lai izšķirtu, vai samazinājums ir saistīts ar garšas īpašībām vai ar toksikoloģiskajām pārmaiņām testa modelī.
Jāņem vērā šādas nesēja un attiecīgi citu piedevu īpašības: ietekmes uz uzsūkšanos, sadalījumu, vielmaiņu vai testa vielas aizturi; ietekmes uz testa vielas ķīmiskajām īpašībām, kuras var mainīt tās toksiskās īpašības; un ietekme uz barības un ūdens patēriņu vai dzīvnieku barojumu.
1.5.3. Pieļaujamā daudzuma tests
Ja testā ar vienu vielas devas līmeni, kas ir vismaz 1 000 mg/kg ķermeņa svara dienā, izmantojot šim pētījumam aprakstīto procedūru, nav novērota negatīva ietekme un ja, pamatojoties uz datiem par struktūras ziņā līdzīgām vielām, var pamatoti uzskatīt, ka viela nav toksiska, pilnu pētījumu ar trim devu līmeņiem var uzskatīt par nevajadzīgu. Pieļaujamā daudzuma tests ir izmantojams, izņemot gadījumus, kad vielas iedarbība uz cilvēku norāda, ka jālieto lielāks devas līmenis.
1.5.4. Devu ievadīšana
Dzīvniekiem testa vielu dod ik dienu septiņas dienas nedēļā 90 dienu ilgā laika posmā. Jebkuram citam devu došanas režīmam, piemēram, piecas dienas nedēļā, jābūt pamatotam. Ja testa vielu ievada ar zondi, viela ar kuņģa zondi vai piemērotu intubācijas cauruli dzīvniekiem jāievada vienā devā. Maksimālais šķidruma tilpums, ko vienā paņēmienā var ievadīt, ir atkarīgs no izmēģinājumu dzīvnieka lieluma. Parasti tilpumam būtu jābūt iespējami mazam. Izņemot kairinošas un kodīgas vielas, kuru iedarbība lielākās koncentrācijās parasti ir izteiktāka, testos lietotā tilpuma mainības ietekmi samazina, koriģējot tilpumu tā, lai pie visām devām tas būtu vienāds.
Ir svarīgi nodrošināt, lai vielām, kuras ievada ar barību vai dzeramo ūdeni, testā iesaistītās vielas īpašības neizjauktu parasto barības vai ūdens līdzsvaru. Ja testa vielu ievada ar barību, var izmantot nemainīgu koncentrāciju barībā (milj. daļas) vai nemainīgu devas līmeni, ņemot vērā dzīvnieka ķermeņa svaru; ir jānorāda, kuru alternatīvu izmanto. Vielām, kuras ievada ar zondi vai ar kapsulu, devas jādod vienā laikā katru dienu un pēc vajadzības jāpielāgo, lai saglabātu nemainīgu devas līmeni, ņemot vērā dzīvnieka ķermeņa svaru. Ja 90 dienu pētījumu veic kā iepriekšēju pētījumu ilgtermiņa hroniskās toksicitātes pētījumam, tad tāda pati barība jāizmanto abos pētījumos.
1.5.5. Novērojumi
Novērošanas laika posmam būtu jābūt vismaz 90 dienu ilgam. Papildu grupas dzīvnieki, kuri paredzēti tālākai novērošanai, noteiktu laika posmu jātur bez vielas saņemšanas, lai noteiktu toksisko ietekmju noturību vai atveseļošanos no tām.
Jāizdara vispārēji klīniski novērojumi vismaz reizi dienā, vēlams vienā(-os) laikā(-os) katru dienu, ņemot vērā gaidāmo ietekmju maksimuma laika posmu pēc vielas došanas. Jāprotokolē dzīvnieku klīniskais stāvoklis. Vismaz divas reizes dienā, parasti dienas sākumā un beigās, ir jāpārbauda, vai dzīvniekiem neparādās nāves tuvošanās un nāves pazīmes.
Vismaz vienu reizi pirms pirmās pakļaušanas iedarbībai (lai varētu izdarīt salīdzināšanu vienam un tam pašam dzīvniekam) un pēc tam vienu reizi nedēļā jāveic detalizēti klīniskie novērojami visiem dzīvniekiem. Šie novērojumi, ja tas ir praktiski izdarāms, būtu jāveic ārpus dzīvnieka turēšanas krātiņa standartnožogojumā un, vēlams, katru reizi vienā un tajā pašā laikā. Ir jācenšas nodrošināt, lai pārmaiņas novērošanas apstākļos būtu minimālas. Toksicitātes pazīmes rūpīgi jāprotokolē, iekļaujot sākšanās laiku, smagumu un ilgumu. Novērojumos jāiekļauj pārmaiņas ādā, apmatojumā, acīs un gļotādās, sekrēcijas izdalīšanās un veģetatīvā aktivitāte (piemēram, asarošana, piloarekcija, acs zīlītes diametrs un neraksturīga elpošana), bet ar to nebūtu jāaprobežojas. Būtu jāprotokolē arī pārmaiņas gaitā, stājā un atbildes reakcijās uz rīkošanos, kā arī klonisko un tonisko kustību klātesamība, pārmaiņas stereotipos (piemēram, pārmērīga kopšanās, atkārtota riņķošana) vai savāda uzvedība.
Oftalmoloģiskā apskate, izmantojot oftalmoskopu vai līdzīgu piemērotu ierīci, jāveic pirms testējamās vielas ievadīšanas un pētījuma beigās, vēlams, visiem dzīvniekiem, bet vismaz lielākās devas grupas un kontroles grupas dzīvniekiem. Ja atklāj ar vielas saņemšanu saistītas pārmaiņas acīs, jāpārbauda visi dzīvnieki.
1.5.5.1. Ķermeņa svars un barības/ūdens patēriņš
Visi dzīvnieki jānosver vismaz vienu reizi nedēļā. Barības patēriņa mērījumi jāizdara vismaz ik nedēļu. Ja testa vielu ievada ar dzeramo ūdeni, ūdens patēriņš arī jāmēra vismaz ik nedēļu. Ūdens patēriņu var ņemt vērā arī barošanas vai mākslīgās barošanas pētījumos, kuru laikā dzeršanas aktivitāte var mainīties.
1.5.5.2. Hematoloģija un klīniskā bioķīmija
Asins paraugi būtu jāņem no noteiktas vietas un vajadzības gadījumā jāglabā piemērotos apstākļos. Testa laika posma beigās paraugus noņem tieši pirms dzīvnieku nogalināšanas procedūras vai kā daļu no tās.
Hematoloģiskās analīzes, iekļaujot hematokrītu, hemoglobīna koncentrācijas, eritrocītu skaita, leikocītu skaita un leikocitārās formulas, trombocītu skaita un asins recēšanas spējas, piemēram, recēšanas laika, protrombīna laika vai tromboplastīna laika noteikšanu, jāizdara pētījuma sākumā un pēc tam reizi mēnesī vai testa laika posma vidū un, beidzot, testa laika posma beigās.
Klīniskās bioķīmijas analīzes, lai izpētītu galvenās toksiskās ietekmes audos, un jo īpaši ietekmes uz nierēm un aknām, jāizdara asins paraugiem, kas iegūti no visiem dzīvniekiem, testa sākumā un pēc tam reizi mēnesī vai testa laika posma vidū un, beidzot, testa laika posma beigās. Testa jomas, kas būtu jāņem vērā, ir elektrolītu līdzsvars, ogļhidrātu vielmaiņa un aknu un nieru darbība. Konkrēto testu izvēli ietekmēs novērojumi par testa vielas iedarbības veidu. Pirms asins paraugu ņemšanas sugai atbilstīgā laika posmā dzīvniekiem nav jādod barība. Ieteicamās noteikšanas iekļauj kalcija, fosfora, hlorīda jonu, nātrija, kālija, glikozes tukšā dūšā, alanīna aminotransferāzes, aspartāta aminotransferāzes, ornitīna dekarboksilāzes, gamma glutamiltranspeptidāzes, urīnvielas slāpekļa, albumīna, asins kreatinīna, kopējā bilirubīna un kopējo serumolbaltumvielu mērījumus.
Urīna analīzes jāizdara vismaz testa sākumā, pēc tam testa laika posma vidū un, beidzot, testa laika posma beigās, savācot urīnu noteiktā laikā. Urīna analīze iekļauj izskata, tilpuma, osmolalitātes vai īpatnējā svara, pH, olbaltumvielu, glikozes un asins/asins šūnu noteikšanu. Vajadzības gadījumā, lai paplašinātu novēroto ietekmju izpēti, var izmantot papildu parametrus.
Turklāt būtu jāapsver iespēja veikt pētījumu, kurā izpētītu vispārēju audu bojājumu seruma marķierus. Citas noteikšanas, kas var būt vajadzīgas adekvātai toksikoloģiskai novērtēšanai, iekļauj tauku, hormonu, skābju/bāzu līdzsvara, methemoglobīna un holīnesterāzes inhibēšanas analīzes. Vajadzības gadījumā, lai paplašinātu novēroto ietekmju izpēti, var izmantot papildu klīniskās bioķīmijas analīzes. Šīs noteikšanas ir jāizdara, ja ķīmiskās vielas pieder dažām klasēm vai katrā konkrētā gadījumā.
Visumā ir vajadzīga elastīga pieeja atkarībā no sugām un novērotām un/vai paredzamām attiecīgās vielas ietekmēm.
1.5.5.3. Autopsija
Pētījumā visus dzīvniekus pakļauj pilnai detalizētai autopsijai, kas iekļauj ķermeņa ārējās virsmas, visu atveru un galvaskausa dobuma, torakālā dobuma, vēdera dobuma un šo dobumu satura rūpīgu apskati. Visu dzīvnieku (tas neattiecas uz dzīvniekiem, kas atrasti mirstoši un/vai nogalināti pētījuma laikā) aknas ar žultspūsli, nieres, virsnieru dziedzeri, sēklinieki, dzemde, olnīcas, vairogdziedzeris (ar epitēlijķermenīšiem), aizkrūts dziedzeris, liesa, smadzenes un sirds jāatbrīvo no attiecīgajiem apkārtējiem audiem un iespējami drīz pēc secēšanas jānosver, lai izvairītos no izžūšanas.
Šādi audi jāglabā vispiemērotākajā fiksācijas vidē audu veida izmeklēšanai un paredzētai vēlākai histopatoloģiskai izmeklēšanai: visi audi ar makroskopiskiem bojājumiem, smadzenes (reprezentatīvi apgabali, iekļaujot lielās smadzenes, smadzenītes un iegarenās smadzenes/smadzeņu tiltu), muguras smadzenes (trijos līmeņos: kakla daļā, torakālajā vidusdaļā un jostasvietas daļā), hipofīze, acis, vairogdziedzeris, epitēlijķermenīši, aizkrūts dziedzeris, barības vads, siekalu dziedzeri, kuņģis, tievās un resnās zarnas (iekļaujot kopu limfātiskos jeb Peijera mezgliņus), aknas, žultspūslis, aizkuņģa dziedzeris, nieres, virsnieru dziedzeri, liesa, sirds, traheja un plaušas, aorta, dzimumdziedzeri, dzemde, akcesorie dzimumorgāni, piena dziedzeri, prostata, urīnpūslis, limfmezgli (vēlams – viens limfmezgls, kas ir uz ievadīšanas ceļa, un otrs, kas ir attālu no ievadīšanas ceļa, lai konstatētu sistēmiskās ietekmes), perifērais nervs (sēžas nervs vai tibiālais nervs), vēlams – tiešā muskuļa tuvumā, kaulu smadzeņu izgriezums (un/vai svaigu kaulu smadzeņu aspirāts) un āda. Klīnisko un citu novērojumu dēļ var rasties doma papildus izmeklēt citus audus. Jāsaglabā arī orgāni, ko uzskata par iespējamiem mērķa orgāniem, pamatojoties uz zināmām testa vielas īpašībām.
1.5.5.4. Histopatoloģija
Vismaz visu kontroles grupas un lielākās devas grupas dzīvnieku konservētajiem orgāniem un audiem jāizdara pilna histopatoloģiska izmeklēšana. Ja lielākās devas grupā ir novērotas ar vielas saņemšanu saistītas pārmaiņas, minētās izmeklēšanas jāpaplašina uz visu citu dozēšanas grupu dzīvniekiem.
Jāizmeklē visi makroskopiskie bojājumi.
Ja izmanto papildu grupu, histopatoloģiskā izmeklēšana jāizdara audiem un orgāniem, kuros ietekmes konstatētas vielu saņēmušajām grupām.
2. DATI UN TO NOFORMĒŠANA
2.1. DATI
Jāsniedz dati par katru atsevišķu dzīvnieku. Turklāt visi dati jāapkopo tabulā, katrai testa grupai parādot dzīvnieku skaitu testa sākumā, dzīvnieku skaitu, kas testa laikā ir nobeigušies vai humānu apsvērumu dēļ nogalināti, un katras nobeigšanās vai humānas nogalināšanas laiku, dzīvnieku skaitu, kam novērotas toksicitātes pazīmes, novēroto toksicitātes pazīmju aprakstu, iekļaujot toksisko ietekmju sākuma laiku, ilgumu un smagumu, dzīvnieku skaitu, kam novēroti audu bojājumi, bojājumu veidus un to dzīvnieku procentuālo daudzumu, kuriem parādījušies katra tipa bojājumi.
Attiecīgā gadījumā skaitliskie rezultāti būtu jānovērtē ar piemērotu un vispārpieņemtu statistisko metodi. Statistiskās metodes un analizējamie dati būtu jāizvēlas, plānojot pētījumu.
2.2. TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
2.2.1. Testa viela:
— fizikālais stāvoklis, tīrība un fizikāli ķīmiskās īpašības,
— identificēšanas dati,
— nesējs (attiecīgā gadījumā): nesēja izvēles pamatojums, ja nesējs nav ūdens.
2.2.2. Testa suga:
— izmantotā suga un līnija,
— dzīvnieku skaits, vecums un dzimums,
— izcelsme, turēšanas apstākļi, barība u. c.,
— atsevišķo dzīvnieku svars testa sākumā.
2.2.3. Testa apstākļi:
— devu izvēles pamatojums,
— sīks apraksts par testa vielas sagatavošanu/pievienošanu barībai, iegūto sagatavotā maisījuma koncentrāciju, stabilitāti un homogenitāti,
— sīks testa vielas ievadīšanas apraksts,
— testa vielas faktiskās devas (mg/kg ķermeņa masas dienā) un – attiecīgā gadījumā – koeficients, lai testa vielas koncentrāciju (milj. daļās) barībā/dzeramajā ūdenī pārrēķinātu faktiskajās devās,
— sīkas ziņas par barības un ūdens kvalitāti.
2.2.4. Rezultāti:
— ķermeņa svars/ķermeņa svara pārmaiņas,
— attiecīgā gadījumā barības patēriņš un ūdens patēriņš,
— dati par toksisko iedarbību pēc dzimuma un devu līmeņa, iekļaujot toksicitātes pazīmes,
— klīnisko novērojumu būtība, smagums un ilgums (vai tie ir vai nav atgriezeniski),
— oftalmoloģiskās izmeklēšanas dati,
— hematoloģisko testu dati ar attiecīgajiem normas robežu lielumiem,
— klīniskās bioķīmijas testu dati ar attiecīgajiem normas robežu lielumiem,
— ķermeņa beigu svars, orgānu svars un orgānu/ķermeņa svara attiecība,
— autopsijas rezultāti,
— sīki izstrādāts visu histopatoloģijas rezultātu apraksts,
— dati par absorbciju, ja pieejami,
— attiecīgā gadījumā – statistiskās apstrādes rezultāti.
Rezultātu izvērtējums.
Secinājumi.
B.28. SUBHRONISKĀS TOKSICITĀTES NOTEIKŠANA PĒC ĀRĪGAS APLIKĀCIJAS – ATKĀRTOTA ĀRĪGA APLIKĀCIJA GRAUZĒJIEM (90 DIENAS)
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Pārbaudāmo vielu dažādās devās katru dienu 90 dienu laikā uztriepj uz ādas izmēģinājumu dzīvniekiem, kas sadalīti vairākās grupās, un vienas grupas dzīvnieki saņem vienādu devu. Aplikācijas laikā dzīvniekus katru dienu novēro un reģistrē toksiskuma pazīmes. Dzīvniekus, kas miruši izmēģinājuma laikā, secē un, beidzoties izmēģinājumam, secē arī izdzīvojušos dzīvniekus.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
1.6.1. Sagatavošanas darbi
Vismaz piecas dienas pirms izmēģinājuma dzīvniekus pieradina pie dzīvošanas un barošanas apstākļiem, kādi būs izmēģinājuma laikā. Veselus, jaunus dzīvniekus pirms izmēģinājuma pēc nejaušības principa sadala apstrādes un kontroles grupās. Neilgi pirms izmēģinājuma dzīvniekiem uz muguras nocērp apmatojumu. Ādu var arī noskūt, bet tas jādara 24 stundas pirms izmēģinājuma. Parasti ik pēc nedēļas cirpšanu vai skūšanu atkārto. Cērpot vai skujot apmatojumu, jāuzmanās, lai nenobrāztu ādu. Pārbaudāmās vielas aplikācijai jāsagatavo ne mazāk kā 10 % no ķermeņa virsmas. Lemjot par to, cik lielai ādas virsmai jābūt brīvai no apmatojuma, lai to apstrādātu ar vielu, ņem vērā dzīvnieku svaru. Pārbaudot cietas vielas, kuras vajadzības gadījumā var saberzt pulverī, pārbaudāmā viela jāsamitrina ar pietiekamu daudzumu ūdens vai, ja nepieciešams, ar piemērotu šķīdinātāju, lai tai būtu laba saskare ar ādu. Šķidrumus parasti pārbauda neatšķaidītā vaidā. Parasti aplikāciju veic vienreiz dienā piecas līdz septiņas dienas nedēļā.
1.6.2. Testa apstākļi
1.6.2.1.
Var izmantot pieaugušas žurkas, trušus vai jūrascūciņas. Var izmantot arī citas sugas dzīvniekus, bet tad šī izvēle ir jāpamato. Uzsākot izmēģinājumu, svara svārstību diapazonam jābūt ± 20 % no vidējā svara. Ja subhroniskās toksicitātes testu, izmantojot ārīgu aplikāciju, veic pirms ilglaicīga testa, abos pētījumos jāizmanto tās pašas sugas un līnijas dzīvnieki.
1.6.2.2.
Vienu un to pašu devu izmēģina vismaz uz 20 (10 sieviešu un 10 vīriešu kārtas) dzīvniekiem ar veselu ādu. Mātītes nedrīkst būt iepriekš dzemdējušas vai grūsnas. Ja dzīvnieku nonāvēšana paredzēta arī izmēģinājuma laikā, to skaits ir jāpalielina par to dzīvnieku skaitu, kuri tiks nokauti izmēģinājuma gaitā. Bez tam var izveidot papildu grupu no 20 dzīvniekiem (pa 10 no katra dzimuma), kas 90 dienas saņem lielāko devu, un 28 dienu laikā pēc aplikācijas novēro, vai toksiskie simptomi ir atgriezeniski, noturīgi vai novēloti.
1.6.2.3.
Jāizmanto vismaz trīs dažādas devas, kā arī jābūt kontroles grupai un, ja lieto šķīdinātāju, jābūt vēl vienai kontroles grupai, kurā dzīvnieki saņem tikai šķīdinātāju. Ekspozīcijas laiks ir vismaz sešas stundas dienā. Pārbaudāmās vielas aplikāciju katru dienu veic vienādā laikā, un vajadzīgais vielas daudzums ik pa laikam jāpielāgo (ik pēc nedēļas vai divām nedēļām), lai tās deva būtu nemainīga attiecībā pret dzīvnieku ķermeņa svaru. Ar kontroles grupas dzīvniekiem rīkojas tieši tāpat kā ar pārējiem dzīvniekiem, tie tikai nesaņem pārbaudāmo vielu. Ja izmanto šķīdinātāju, kas atvieglo pārbaudāmās vielas ievadīšanu vajadzīgajā devā, kontroles dzīvnieki saņem tādu pašu daudzumu šķīdinātāja kā dzīvnieki, kas saņem lielāko vielas devu. Jāizvēlas tāda lielākā deva, kas ir toksiska, bet kas neizraisa vai reti izraisa dzīvnieku nāvi. Vielas mazākā deva nedrīkst būt toksiska. Ja ir pieejami aptuveni dati par to, ar kādām devām saskaras cilvēki, vismazākajai devai jābūt lielākai par tām. Būtu vēlams, ka vidēji lielās devas toksiskums izpaužas minimāli. Ja izmanto vairākas vidējā intervāla devas, to toksiskajai iedarbībai jābūt manāmi atšķirīgai. To dzīvnieku grupās, kas saņem mazo un vidēji lielo devu, jābūt zemam mirstības līmenim, lai varētu statistiski izvērtēt rezultātus.
Ja pārbaudāmās vielas aplikācija izraisa smagu ādas iekaisumu, tās koncentrācija jāsamazina, un tādēļ var samazināties vai neizpausties citi toksicitātes simptomi, lietojot lielo devu. Ja ādai ir nopietni bojājumi, var gadīties, ka izmēģinājums ir jāpārtrauc, un jauna pārbaude jāveic ar mazāku koncentrāciju.
1.6.3.
Ja sākotnējā pārbaudē izmanto 1 000 mg/kg devu vai pat lielāku devu, kas atbilst devai, ar kādu parasti saskaras cilvēki (ja tā ir zināma), un tai nenovēro toksisku iedarbību, var uzskatīt, ka turpmāka testēšana nav nepieciešama.
1.6.4.
Izmēģinājumu dzīvniekiem katru dienu pārbauda toksiskuma pazīmes. Tiem reģistrē nāves iestāšanās brīdi, kā arī laiku, kad parādās vai izzūd toksiskuma pazīmes.
1.6.5.
Katru dzīvnieku tur atsevišķā būrī. Dzīvniekus parasti apstrādā ar pārbaudāmo vielu 7 dienas nedēļā 90 dienu laikā.
Dzīvnieki papildu grupās, kas paredzētas tālākai novērošanai, turpmākās 28 dienas nesaņem pārbaudāmo vielu, lai varētu izsekot, kā tie atveseļojas un cik ilgi saglabājas toksiskā iedarbība. Ekspozīcijas ilgums ir vismaz 6 stundas dienā.
Pārbaudāmā viela vienmērīgi jāuztriepj uz ādas virsmas, kas veido aptuveni 10 % no kopējās ķermeņa virsmas. Ja vielas ir ļoti toksiskas, apstrādājamo ādas virsmu var samazināt, bet tai vienalga jābūt pēc iespējas lielākai, un viela jāuztriepj cik iespējams plānāk un vienmērīgāk.
Pārbaudāmās vielas saskari ar ādu ekspozīcijas laikā nodrošina ar poraina marles pārsēja un nekairinoša plākstera palīdzību. Apstrādātā vieta vēl papildus pienācīgi jāpārklāj, lai nostiprinātu marles pārsēju ar pārbaudāmo vielu un lai dzīvnieki nevarētu norīt pārbaudāmo vielu. Lai pārbaudāmā viela nenonāktu barības vadā, var daļēji ierobežot dzīvnieku kustību, taču pilnīga imobilizācija nebūtu vēlama.
Beidzoties ekspozīcijas laikam, pārbaudāmās vielas atlikums no ādas jānoņem, ja iespējams, izmantojot ūdeni vai citu piemērotu ādas mazgāšanas līdzekli.
Dzīvniekus katru dienu novēro, reģistrējot toksiskuma pazīmes, kā arī to parādīšanās brīdi, pakāpi un ilgumu. Novērojot dzīvniekus, jāpievērš uzmanība izmaiņām, kas skar ādu, acis un gļotādas, kā arī elpošanas orgānus, asinsriti, veģetatīvo un centrālo nervu sistēmu, somatomotoriku un uzvedības reakcijas Katru nedēļu jānosaka barības patēriņš, un katru nedēļu dzīvnieki jānosver. Pastāvīga dzīvnieku novērošana ļauj novērst dzīvnieku zudumus izmēģinājuma laikā kanibālisma, audu autolīzes vai nepareizu turēšanas apstākļu dēļ. Beidzoties izmēģinājumam, visus izdzīvojušos dzīvniekus, izņemot papildu grupas dzīvniekus, secē. Pamanot mirstošus dzīvniekus, tos uzreiz nošķir no pārējiem un secē.
Visus dzīvniekus, tostarp arī kontroles dzīvniekus, parasti pakļauj šādām pārbaudēm:
a) pirms pārbaudāmās vielas aplikācijas un testa beigās jāveic ja ne visu dzīvnieku, tad vismaz to, kas ir saņēmuši lielāko devu, un kontroles dzīvnieku oftalmoloģiskā izmeklēšana, izmantojot oftalmoskopu vai piemērotu līdzvērtīgu aparātu. Ja novēro izmaiņas acīs, ir jāpārbauda visi dzīvnieki;
b) beidzoties izmēģinājumam, jāveic hematoloģiskā izmeklēšana, kas ietver hematokrīta, hemoglobīna koncentrācijas, eritrocītu skaita, leikocītu skaita un leikocītu formulas, kā arī asins recēšanas spēju, piemēram, recēšanas laika, protrombīna laika, tromboplastīna laika vai trombocītu skaita noteikšanu;
c) beidzoties izmēģinājumam, jāveic arī asins klīniskās bioķīmijas izmeklējumi. Šie izmeklējumi visos gadījumos attiecas uz elektrolītu sastāvu, ogļhidrātu metabolismu, aknu un nieru darbību. Atsevišķu analīžu izvēle ir atkarīga no konkrētās vielas iedarbības veida. Ieteiktās analīzes ietver kalcija, fosfora, hlorīdu, nātrija, kālija, glikozes pēc badošanās (badošanās ilgums ir atkarīgs no dzīvnieku sugas), seruma glutamātpiruvāttransamināzes ( 18 ), seruma glutamātoksalacetāttransamināzes ( 19 ), ornitīndekarboksilāzes, gamma-glutamiltranspeptidāzes, urīnvielas slāpekļa, albumīna, plazmas kreatinīna, kopējā bilirubīna un kopējo seruma olbaltumvielu noteikšanu. Citas analīzes, kas jāveic, lai gūtu vispusīgu toksikoloģisko novērtējumu, paredz lipīdu, hormonu, skābju/bāzu līdzsvara, methemoglobīna un holīnesterāzes aktivitātes noteikšanu. Vajadzības gadījumā var veikt arī citus klīniskās bioķīmijas izmeklējumus, lai padziļināti izpētītu vielas iedarbību;
d) urīnanalīze parasti nav jāveic, ja vien nepastāv varbūtība, ka viela var būt toksiska, vai to apstiprina novērojumi.
Ja agrāk iegūtie dati ir nepietiekami, pirms uzsākt izmēģinājumu, jāapsver iespēja jau iepriekš noteikt hematoloģiskos un klīniskās bioķīmijas rādītājus.
Visiem dzīvniekiem veic pilnu autopsiju, kas paredz ķermeņa ārējās virsmas, visu atveru, kā arī galvaskausa, krūškurvja un vēdera dobuma un to satura apskati. Aknas, nieres, virsnieru dziedzerus un sēkliniekus nosver uzreiz pēc sekcijas, kamēr tie ir mitri un nesažuvuši. Piemērotā vidē jāsaglabā šādi orgāni un audi, lai turpmāk būtu iespējama to histopatoloģiskā izmeklēšana: visi orgāni ar makroskopiskiem bojājumiem, smadzenes, ieskaitot iegarenās smadzenes/tiltu, smadzenīšu garozu un smadzeņu garozu, hipofīze, vairogdziedzeris/epitēlijķermenīši, aizkrūts dziedzera audi, (traheja), plaušas, sirds, aorta, siekalu dziedzeri, aknas, liesa, nieres, virsnieru dziedzeri, aizkuņģa dziedzeris, gonādas, dzemde, papildu dzimumorgāni, žultspūslis (ja ir), barības vads, kuņģis, divpadsmitpirkstu zarna, tukšā zarna, līkumainā zarna, aklā zarna, lokzarna, taisnā zarna, urīnpūslis, limfmezglu paraugi, (sievišķais piena dziedzeris), (augšstilba muskulatūra), perifērās nervu sistēmas nervi, (acis), (krūšu kauls ar kaula smadzenēm), (augšstilba kauls ar locītavas virsmu), (triju līmeņu muguras smadzenes – no kakla, vidējā torakālā un gurnu rajona) un (ārpusorbītas asaru dziedzeri). Iekavās iekļautie audi jāpārbauda tikai tad, ja novēro toksiskuma pazīmes vai viela iedarbojas tieši uz šo orgānu.
a) Vispusīgu normālas un apstrādātas ādas, orgānu un audu histopatoloģisko izmeklēšanu veic visiem kontroles dzīvniekiem un dzīvniekiem, kas ir saņēmuši lielāko devu.
b) Jāizpēta visi orgāni ar makroskopiskiem bojājumiem.
c) Jāizpēta iedarbības skartie orgāni arī pārējās dzīvnieku grupās.
d) Ja izmanto žurkas, histopatoloģiski jāizmeklē infekcijas klātbūtne dzīvnieku plaušās pēc mazās un vidēji lielās devas aplikācijas, jo šādi var ērti novērtēt dzīvnieku veselības stāvokli. Turpmāko histopatoloģisko izmeklēšanu šajās dzīvnieku grupās parasti neveic, bet to obligāti veic dzīvniekiem pēc lielās devas aplikācijas, un tā attiecas uz orgāniem, kuriem ir novēroti bojājumi.
e) Ja izmanto papildu grupu, histopatoloģiski jāizmeklē audi un orgāni, uz kuriem iedarbojas pārbaudāmā viela pēc aplikācijas pārējās grupās.
2. DATI
Dati jāapkopo tabulā, norādot dzīvnieku skaitu katrā izmēģinājumu grupā testa sākumā, to dzīvnieku skaitu, kam novēroti bojājumi, bojājumu tipus un dzīvnieku procentuālo īpatsvaru ar katru bojājuma tipu. Iegūtie rezultāti jānovērtē, izmantojot piemērotu statistikas metodi. Var izmantot jebkuru atzītu statistikas metodi.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— dzīvnieku suga, līnija, izcelsme, turēšanas apstākļi, uzturs,
— testa apstākļi,
— izmantotās devas (jānorāda arī šķīdinātājs, ja tādu izmanto) un koncentrācijas,
— toksiskās reakcijas atkarībā no dzimuma un devas,
— netoksiska deva, ja var noteikt,
— nāves iestāšanās brīdis izmēģinājuma laikā vai norāde, ka dzīvnieki ir izdzīvojuši,
— toksiskās iedarbības vai citas iedarbības raksturojums,
— atsevišķu saindēšanās simptomu parādīšanās brīdis un to tālākā attīstība,
— barības patēriņš un ķermeņa svara izmaiņas,
— oftalmoloģijas dati,
— hematoloģiskie izmeklējumi un to rezultāti,
— klīniskās bioķīmijas izmeklējumi un to rezultāti (arī urīnanalīzes rezultāti, ja tādi ir),
— autopsijas rezultāti,
— sīks histopatoloģisko izmeklējumu apraksts,
— rezultātu statistiskā apstrāde, ja iespējams,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.29. SUBHRONISKĀS TOKSICITĀTES NOTEIKŠANA PĒC INHALĀCIJAS – TOKSICITĀTES NOTEIKŠANA GRAUZĒJIEM PĒC ATKĀRTOTAS INHALĀCIJAS (90 DIENAS)
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Vairākas izmēģinājumu dzīvnieku grupas katru dienu noteiktā laika posmā pakļauj dažādu pārbaudāmās vielas koncentrāciju iedarbībai, kopumā 90 dienu garumā; vienas grupas dzīvnieki saņem vielu vienādā koncentrācijā. Ja lieto nesējvielu, kas palīdz iegūt vajadzīgu pārbaudāmās vielas koncentrāciju atmosfērā, jābūt kontroles grupai, kas saņem tikai nesējvielu. Ekspozīcijas laikā dzīvniekus katru dienu novēro un reģistrē toksiskuma pazīmes. Testa laikā mirušos dzīvniekus secē un, beidzoties testam, secē arī izdzīvojušos dzīvniekus.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
1.6.1. Sagatavošanas darbi
Vismaz piecas dienas iepriekš dzīvniekus pieradina pie dzīvošanas un barošanas apstākļiem, kādi būs izmēģinājuma laikā. Veselus, jaunus dzīvniekus pirms izmēģinājuma pēc nejaušības principa sadala apstrādes un kontroles grupās. Ja nepieciešams, pārbaudāmajai vielai var pievienot piemērotu šķīdinātāju, kas palīdz iegūt atbilstošu vielas koncentrāciju atmosfērā. Ja izmanto šķīdinātāju vai citas piedevas, kas atvieglo pārbaudāmās vielas ievadīšanu vajadzīgajā devā, ir jāpārliecinās, ka tās nav toksiskas. Vajadzības gadījumā var izmantot agrāk iegūtus datus.
1.6.2. Testa apstākļi
Ja nav kontrindikāciju, vēlams izmantot žurkas. Jāizmanto jauni un veseli dzīvnieki, kas pieder pie plaši izplatītajām laboratorijas dzīvnieku līnijām. Uzsākot izmēģinājumus, dzīvnieku ķermeņa svara svārstību diapazons nedrīkst pārsniegt ± 20 % no vidējā svara. Ja subhroniskās toksicitātes testu pēc inhalācijas veic pirms ilglaicīga testa, abos pētījumos jāizmanto tās pašas sugas un līnijas dzīvnieki.
Ekspozīcijas laikā vienu un to pašu devu saņem vismaz 20 dzīvnieki (10 mātītes un 10 tēviņi). Mātītes nedrīkst būt iepriekš dzemdējušas vai grūsnas. Ja dzīvnieku nonāvēšana paredzēta arī izmēģinājuma laikā, to skaits ir jāpalielina par to dzīvnieku skaitu, kuri tiks nokauti izmēģinājumu gaitā. Bez tam var izveidot papildu grupu no 20 dzīvniekiem (pa 10 no katra dzimuma), kas 90 dienas saņem lielāko koncentrāciju, un 28 dienu laikā pēc inhalācijas novēro, vai toksiskā iedarbība ir atgriezeniska, noturīga vai novēlota.
Jāizmanto vismaz trīs dažādas koncentrācijas, kā arī jābūt kontroles grupai, bet, ja izmanto nesējvielu, jābūt arī kontroles dzīvniekiem, kas saņem tikai nesējvielu tās lielākajā koncentrācijā. Ar kontroles dzīvniekiem rīkojas tāpat kā ar pārējiem dzīvniekiem, tie tikai nesaņem pārbaudāmo vielu. Jāizvēlas tāda lielākā koncentrācija, kas ir toksiska, bet kas neizraisa vai reti izraisa dzīvnieku nāvi. Ja ir pieejami aptuveni dati par to, ar kādām devām saskaras cilvēki, vismazākajai devai jābūt lielākai par tām. Būtu vēlams, ka vidēji lielās koncentrācijas toksicitāte izpaužas minimāli. Ja izmanto vairākas vidējā intervāla koncentrācijas, to toksiskajai iedarbībai jābūt manāmi atšķirīgai. Dzīvnieku grupās, kas saņem mazo un vidēji lielo devu, jābūt zemam mirstības līmenim, lai varētu statistiski izvērtēt rezultātus.
Katru dienu ekspozīcijas ilgums pēc līdzsvara iestāšanās inhalācijas kamerā ir sešas stundas. Var būt arī cits ekspozīcijas ilgums atkarībā no konkrētām prasībām.
Izmēģinājumos ar dzīvniekiem izmanto inhalācijas iekārtas, kas nodrošina dinamisku gaisa plūsmu (vismaz 12 gaisa maiņas stundā), pietiekamu skābekļa koncentrāciju un vienmērīgu atmosfēru ekspozīcijas laikā. Ja izmanto inhalācijas kameru, tās konstrukcijai jābūt tādai, kas neļauj dzīvniekiem drūzmēties un maksimāli nodrošina pārbaudāmās vielas iedarbību ekspozīcijas laikā. Lai kamerā būtu noturīga atmosfēra, izmēģinājumu dzīvnieku kopējais “tilpums” parasti nedrīkst pārsniegt 5 % no kameras tilpuma. Var izmantot kameras, kas nodrošina dzīvnieku mutes un deguna, galvas vai visa ķermeņa saskari ar vielu; pirmajā un otrajā gadījumā samazinās iespēja uzņemt vielu citādā veidā, nevis ieelpojot.
Visu ekspozīcijas un atveseļošanās laiku izmēģinājumu dzīvniekus katru dienu apskata un reģistrē toksiskuma pazīmes. Tiem reģistrē nāves iestāšanās brīdi, kā arī laiku, kad parādās vai izzūd toksiskuma pazīmes.
1.6.3. Testa norise
Dzīvniekus 90 dienu laikā katru dienu, 5–7 dienas nedēļā, pakļauj pārbaudāmās vielas iedarbībai. Dzīvnieki papildu grupās, kas paredzētas tālākai novērošanai, turpmākās 28 dienas nesaņem pārbaudāmo vielu, lai varētu izsekot, kā tie atveseļojas un cik ilgi saglabājas toksiskā iedarbība. Izmēģinājuma laikā jānodrošina 22 ± 3 oC temperatūra. Parasti jānodrošina 30–70 % relatīvais mitrums, lai gan atsevišķos gadījumos (piemēram, ja izmanto aerosolus) to nevar panākt. Ekspozīcijas laikā dzīvniekus nebaro un nedzirda.
Jāizmanto dinamiskā inhalācijas sistēma, kas nodrošina pienācīgu koncentrācijas kontroli. Lai noteiktu vajadzīgo pārbaudāmās vielas koncentrāciju, iesaka veikt priekšizpēti. Gaisa plūsma jānoregulē tā, lai visā inhalācijas kamerā būtu nodrošināti vienādi apstākļi. Sistēmai pēc iespējas ātrāk jānodrošina nemainīgi ekspozīcijas apstākļi.
Jāveic šādu parametru mērījumi un uzraudzība:
a) gaisa plūsmas ātrums (nepārtraukti);
b) pārbaudāmās vielas faktiskā koncentrācija inhalācijas zonā. Vielas koncentrācijas svārstības ekspozīcijas laikā nedrīkst pārsniegt ± 15 % no vidējās vērtības. Tomēr, ja izmanto putekļus un aerosolus, to nevar tik viegli panākt, un tad ir pieļaujams plašāks svārstību diapazons. Visā izmēģinājuma laikā katru dienu pēc iespējas jācenšas nodrošināt nemainīgu vielas koncentrāciju. Gatavojoties izmēģinājumam, jāveic daļiņu lieluma analīze, lai noteiktu aerosola koncentrācijas noturīgumu. Šī analīze ekspozīcijas laikā jāveic pēc iespējas biežāk, lai pārliecinātos, ka daļiņu sadalījums pēc lieluma paliek nemainīgs;
c) temperatūra un gaisa mitrums;
d) ekspozīcijas laikā un pēc tam regulāri veic novērojumus un tos reģistrē; jābūt atsevišķiem pierakstiem par katru dzīvnieku. Dzīvniekus novēro katru dienu, reģistrējot toksiskuma pazīmes, kā arī to parādīšanās brīdi, pakāpi un ilgumu. Novērojot dzīvniekus, jāpievērš uzmanība izmaiņām, kas skar ādu, acis, gļotādas, elpošanas orgānus, asinsriti, veģetatīvo un centrālo nervu sistēmu, somatomotoriku un uzvedības reakcijas. Katru nedēļu jānosaka barības patēriņš, un katru nedēļu dzīvnieki jānosver. Sistemātiska dzīvnieku novērošana ļauj novērst dzīvnieku zudumus izmēģinājuma laikā kanibālisma, audu autolīzes vai nepareizu turēšanas apstākļu dēļ. Beidzoties ekspozīcijas laikam, visus izdzīvojušos dzīvniekus secē. Pamanot mirstošus dzīvniekus, tos uzreiz nošķir no pārējiem un secē.
Visus dzīvniekus, arī kontroles dzīvniekus, parasti pakļauj šādām pārbaudēm:
a) pirms pārbaudāmās vielas aplikācijas un izmēģinājuma beigās jāveic ja ne visu dzīvnieku, tad vismaz to, kas saņēmuši lielāko devu, un kontroles dzīvnieku oftalmoloģiskā izmeklēšana, izmantojot oftalmoskopu vai piemērotu līdzvērtīgu aparātu. Ja novēro izmaiņas acīs, jāpārbauda visi dzīvnieki;
b) beidzoties izmēģinājumam, ir jāveic hematoloģiskā izmeklēšana, kas ietver hematokrīta, hemoglobīna koncentrācijas, eritrocītu skaita, leikocītu skaita un leikocītu formulas, kā arī asins recēšanas spēju, piemēram, recēšanas laika, protrombīna laika, tromboplastīna laika vai trombocītu skaita noteikšanu;
c) beidzoties izmēģinājumam, ir jāveic arī asins klīniskās bioķīmijas izmeklējumi. Šie izmeklējumi visos gadījumos attiecas uz elektrolītu sastāvu, ogļhidrātu metabolismu, aknu un nieru darbību. Atsevišķu analīžu izvēle ir atkarīga no konkrētās vielas iedarbības veida. Ieteiktās analīzes ietver kalcija, fosfora, hlorīdu, nātrija, kālija, glikozes pēc badošanās (badošanās ilgums ir atkarīgs no dzīvnieku sugas), seruma glutamātpiruvāttransamināzes (19) , seruma glutamātoksalacetāttransamināzes (19) , ornitīndekarboksilāzes, gamma-glutamiltranspeptidāzes, urīnvielas slāpekļa, albumīna, plazmas kreatinīna, kopējā bilirubīna un kopējo seruma olbaltumvielu noteikšanu. Citas analīzes, kas jāveic, lai gūtu vispusīgu toksikoloģisko novērtējumu, paredz lipīdu, hormonu, skābju/bāzu līdzsvara, methemoglobīna un holīnesterāzes aktivitātes noteikšanu. Vajadzības gadījumā var veikt arī citas klīniskās bioķīmijas analīzes, lai padziļināti izpētītu vielas iedarbību;
d) urīnanalīze parasti nav jāveic, ja vien nepastāv varbūtība, ka viela var būt toksiska, vai to apstiprina novērojumi.
Ja agrāk iegūtie dati ir nepietiekami, pirms uzsākt izmēģinājumu, jāapsver iespēja jau iepriekš noteikt hematoloģiskos un klīniskās bioķīmijas rādītājus.
Visiem dzīvniekiem veic pilnu autopsiju, kas paredz ķermeņa ārējās virsmas, visu atveru, kā arī galvaskausa, krūškurvja un vēdera dobumu un to satura apskati. Aknas, nieres, virsnieru dziedzerus un sēkliniekus nosver uzreiz pēc sekcijas, kamēr tie ir mitri un nesažuvuši. Piemērotā vidē jāsaglabā šādi orgāni un audi, lai turpmāk būtu iespējama to histopatoloģiskā izmeklēšana: visi orgāni ar makroskopiskiem bojājumiem, plaušas, kas jāizņem saudzīgi un pilnībā, jānosver un jāapstrādā ar piemērotu fiksatoru, šādi nodrošinot plaušu struktūras saglabāšanu (uzskata, ka plaušu perfūzija ar fiksatoru ir noderīgs paņēmiens), smadzenes, ieskaitot iegarenās smadzenes/tiltu, smadzenīšu garozu un smadzeņu garozu, hipofīze, vairogdziedzeris/epitēlijķermenīši, aizkrūts dziedzera audi, traheja, sirds, aorta, siekalu dziedzeri, aknas, liesa, nieres, virsnieru dziedzeri, aizkuņģa dziedzeris, gonādas, dzemde (papildu dzimumorgāni), (āda), žultspūslis (ja ir), barības vads, kuņģis, divpadsmitpirkstu zarna, tukšā zarna, līkumainā zarna, aklā zarna, lokzarna, taisnā zarna, urīnpūslis, limfmezglu paraugi, (sievišķais piena dziedzeris), (augšstilba muskulatūra), perifērās nervu sistēmas nervi, (acis), krūšu kauls ar kaula smadzenēm, (augšstilba kauls ar locītavas virsmu) un (triju līmeņu muguras smadzenes – no kakla, vidējā torakālā un gurnu rajona). Iekavās iekļautie audi jāpārbauda tikai tad, ja novēro toksiskuma pazīmes vai viela iedarbojas tieši uz šo orgānu.
a) Vispusīgu elpošanas orgānu un citu orgānu un audu histopatoloģisko izmeklēšanu veic visiem kontroles dzīvniekiem un dzīvniekiem, kas saņēmuši lielāko devu.
b) Jāizpēta visi orgāni ar makroskopiskiem bojājumiem.
c) Jāizpēta iedarbības skartie orgāni arī pārējās dzīvnieku grupās.
d) Histopatoloģiski jāizmeklē dzīvnieku plaušas pēc mazās un vidēji lielās devas aplikācijas, jo šādi var ērti novērtēt dzīvnieku veselības stāvokli. Turpmāko histopatoloģisko izmeklēšanu šo grupu dzīvniekiem parasti neveic, bet to obligāti veic dzīvniekiem pēc lielās devas aplikācijas, un tā attiecas uz orgāniem, kuriem ir novēroti bojājumi.
e) Ja izmanto papildu grupu, histopatoloģiski jāizmeklē audi un orgāni, uz kuriem iedarbojas pārbaudāmā viela, par ko liecina novērojumi citās dzīvnieku grupās.
2. DATI
Dati jāapkopo tabulā, norādot dzīvnieku skaitu katrā izmēģinājumu grupā testa sākumā, to dzīvnieku skaitu, kam ir novēroti bojājumi, bojājumu tipus un dzīvnieku procentuālo īpatsvaru ar katru bojājuma tipu. Iegūtie rezultāti jānovērtē, izmantojot piemērotu statistikas metodi. Var izmantot jebkuru atzītu statistikas metodi.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— dzīvnieku suga, līnija, izcelsme, turēšanas apstākļi, uzturs,
— testa apstākļi:
— inhalācijas iekārtas apraksts, norādot tās konstrukciju, modeli, izmērus, gaisa avotu, makrodaļiņu un aerosolu ģenerēšanas sistēmu, gaisa kondicionēšanas paņēmienu, izplūdes gaisa apstrādi un dzīvnieku turēšanas apstākļus izmēģinājumu kamerā, ja tādu izmanto. Jāapraksta ierīces temperatūras, gaisa mitruma un, vajadzības gadījumā, aerosolu koncentrācijas noturīguma vai daļiņu lieluma noteikšanai.
— Ekspozīcijas parametri, kas jāapkopo tabulā, norādot vidējās vērtības, kā arī svārstību diapazonu
— (piemēram, standartnovirzi) un minot arī:
—a) gaisa plūsmas ātrumu inhalācijas iekārtā;
b) gaisa temperatūru un mitrumu;
c) nominālo koncentrāciju (inhalācijas iekārtā ievadītais pārbaudāmās vielas kopējais daudzums, kas izdalīts ar gaisa daudzumu);
d) nesējvielas tipu, jā tādu izmanto;
e) faktisko vielas koncentrāciju inhalācijas zonā;
f) daļiņu vidējo lielumu (vajadzības gadījumā),
— dati par toksiskajām reakcijām atkarībā no dzimuma un koncentrācijas,
— netoksiska deva, ja var noteikt,
— nāves iestāšanās brīdis izmēģinājuma laikā vai norāde, ka dzīvnieki ir izdzīvojuši,
— toksiskās iedarbības vai citas iedarbības raksturojums,
— atsevišķu saindēšanās simptomu parādīšanās brīdis un to tālākā attīstība,
— barības patēriņš un ķermeņa svara izmaiņas,
— oftalmoloģijas dati,
— veiktie hematoloģiskie izmeklējumi un to rezultāti,
— klīniskās bioķīmijas izmeklējumi un to rezultāti (arī urīnanalīzes rezultāti, ja tādi ir),
— autopsijas rezultāti,
— sīks histopatoloģisko izmeklējumu apraksts,
— rezultātu statistiskā apstrāde, ja iespējams,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.30. HRONISKĀS TOKSICITĀTES NOTEIKŠANA
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Izmantojot attiecīgo aplikācijas veidu, pārbaudāmo vielu parasti ievada septiņas dienas nedēļā vairākām izmēģinājumu dzīvnieku grupām; katra grupa saņem vienādu devu, un ekspozīcijas laiks aptver ievērojamu mūža daļu. Pārbaudāmās vielas ekspozīcijas laikā un pēc tam izmēģinājumu dzīvniekus katru dienu novēro un reģistrē toksiskuma pazīmes.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
1.6.1. Sagatavošanas darbi
Vismaz piecas dienas pirms izmēģinājuma dzīvniekus pieradina pie dzīvošanas un barošanas apstākļiem, kādi būs izmēģinājuma laikā. Veselus, jaunus dzīvniekus pirms izmēģinājuma pēc nejaušības principa sadala apstrādes un kontroles grupās.
1.6.2. Testa apstākļi
Šim nolūkam ieteicams izmantot žurkas.
Atkarībā no iepriekš veikto pētījumu rezultātiem var izmantot arī citu sugu dzīvniekus (ne tikai grauzējus). Izmanto jaunus un veselus dzīvniekus, kas pieder pie plaši izplatītām laboratorijas dzīvnieku līnijām, un vielu sāk ievadīt uzreiz pēc atšķiršanas.
Uzsākot izmēģinājumus, dzīvnieku ķermeņa svara svārstības nedrīkst būt lielākas par ± 20 % no vidējā svara. Ja subhroniskās toksicitātes noteikšanu pēc perorālas aplikācijas veic pirms ilglaicīga testa, abos pētījumos jāizmanto tās pašas sugas/šķirnes un līnijas dzīvnieki.
Ja izmanto grauzējus, vienu un to pašu devu ievada vismaz 40 dzīvniekiem (20 mātītēm un 20 tēviņiem), vienlaikus jābūt arī kontroles grupai. Mātītes nedrīkst būt iepriekš dzemdējušas vai grūsnas. Ja dzīvnieku nonāvēšana paredzēta arī izmēģinājuma laikā, to skaits ir jāpalielina par to dzīvnieku skaitu, kuri tiks nokauti izmēģinājuma gaitā.
Ja izmantotie dzīvnieki nav grauzēji, ir pieļaujams mazāks dzīvnieku skaits, bet tāpat katrā grupā jābūt vismaz pa četriem katra dzimuma īpatņiem.
Jāizmanto vismaz trīs dažādas devas, un vienlaikus jābūt kontroles grupai. Vielas lielākajai devai jābūt izteikti toksiskai, neizraisot pārmērīgi augstu mirstību.
Viela vismazākajā devā nedrīkst būt toksiska.
Vidēji lielo(-ās) devu(-as) izvēlas pa vidu starp lielo un mazo devu.
Izvēloties šīs devas, jāņem vērā iepriekšējo toksicitātes testu un pētījumu rezultāti.
Parasti pārbaudāmo vielu ievada katru dienu. Ja vielu pievieno dzeramajam ūdenim vai uzturam, tai visu laiku jābūt pieejamai dzīvniekiem.
Vienlaikus jābūt kontroles dzīvniekiem, kas no pārējiem dzīvniekiem atšķiras tikai ar to, ka tie nesaņem pārbaudāmo vielu.
Atsevišķos gadījumos, piemēram, pēc aerosolu inhalācijas vai pēc perorālas aplikācijas, kad izmanto emulgatoru, kura bioloģiskā iedarbība nav zināma, vienlaikus jāizmanto negatīvā kontroles grupa. Negatīvās kontroles grupa atšķiras no pārējām grupām tikai ar to, ka šie dzīvnieki nesaņem pārbaudāmo vielu vai šķīdinātāju/nesējvielu.
Divi galvenie ievadīšanas veidi ir perorāla aplikācija un inhalācija. Ievadīšanas veida izvēle ir atkarīga no pārbaudāmās vielas fizikālajām un ķīmiskajām īpašībām, kā arī no tā, kādā veidā cilvēki parasti nonāk saskarē ar šo vielu.
Ārīga aplikācija var radīt nopietnas grūtības no praktiskā viedokļa. Par vispārējo hronisko toksicitāti, vielai uzsūcoties caur ādu, parasti spriež pēc rezultātiem, kas gūti pēc perorālas ievadīšanas, un pēc tā, cik lielā mērā tā uzsūcas caur ādu, par ko liecina iepriekš veiktie toksicitātes testi, izmantojot ārīgu aplikāciju.
Ja pārbaudāmā viela organismā nonāk caur kuņģa–zarnu traktu un ja tieši tādā veidā tā var apdraudēt cilvēkus, ieteicams izmantot perorālu aplikāciju, ja tam nav kontrindikāciju. Dzīvnieki var saņemt pārbaudāmo vielu kopā ar uzturu, dzeramo ūdeni vai kapsulās. Dzīvnieki parasti saņem vielas devu katru dienu septiņas dienas nedēļā, jo, ja vielu ievada tikai piecas dienas nedēļā, “tukšajā laikā” dzīvnieki var atkopties, toksicitātes simptomi iet mazumā, kas savukārt ietekmēs rezultātus un to novērtēšanu. Tomēr, galvenokārt aiz praktiskiem apsvērumiem, uzskata, ka ir arī pieļaujama vielas ievadīšana piecas dienas nedēļā.
Tā kā, veicot inhalācijas testus, rodas lielākas tehniskas grūtības nekā tad, kad izmanto citus aplikācijas veidus, šeit sniegti sīkāki norādījumi attiecībā uz šo testu izmantošanu. Turklāt jāpiezīmē, ka atsevišķos gadījumos kā veiksmīgu alternatīvu var izmantot intratraheālu instilāciju.
Izvēloties ilglaicīgu ekspozīciju, parasti ņem vērā cilvēku iespējamo saskari ar vielu, tālab dzīvniekus katru dienu piecas reizes nedēļā uz sešām stundām ievieto inhalācijas kamerā ar vienmērīgu vielas koncentrāciju (periodiskā ekspozīcija) vai, ņemot vērā iespējamo vielas klātbūtni apkārtējā vidē, tos katru dienu septiņas reizes nedēļā uz 22–24 stundām pakļauj vielas iedarbībai (nepārtrauktā ekspozīcija), katru dienu vienādā laikā paredzot vienu stundu dzīvnieku barošanai un inhalācijas kameras apkopšanai.
Parasti abos gadījumos dzīvnieki saņem pārbaudāmo vielu noteiktā koncentrācijā. Galvenā atšķirība starp periodisko un nepārtraukto ekspozīciju ir tā, ka pirmajā gadījumā, beidzoties iedarbībai, dzīvnieki var atkopties 17–18 stundu laikā, un nedēļas nogalē šis atkopšanās laiks ir vēl garāks.
Periodiskās vai nepārtrauktās ekspozīcijas izvēle ir atkarīga no pētījuma mērķiem un no izvēlētā modeļa, kas simulē apstākļus, kādos cilvēki nonāk saskarē ar vielu. Šeit tomēr jārēķinās ar dažām tehniskām grūtībām. Piemēram, nepārtrauktās ekspozīcijas priekšrocības, modelējot apkārtējas vides apstākļus, var mazināt tas, ka ekspozīcijas laikā dzīvnieki jābaro un jāizmanto daudz sarežģītākas (un precīzākas) aerosola un tvaika ģenerēšanas un kontroles metodes.
Izmēģinājumos ar dzīvniekiem izmanto inhalācijas kameras, kas nodrošina dinamisku gaisa plūsmu (vismaz 12 gaisa maiņas stundā), pietiekamu skābekļa koncentrāciju un vienmērīgu atmosfēru ekspozīcijas laikā. Kontroles un izmēģinājumu dzīvniekiem izmanto vienādas uzbūves un konstrukcijas inhalācijas kameras, kas nodrošina līdzvērtīgus ekspozīcijas apstākļus, izņemot pārbaudāmās vielas klātbūtni. Gaisa spiediens kamerā parasti ir nedaudz pazemināts, lai izvairītos no pārbaudāmās vielas izplūšanas apkārtējā vidē. Kamerās jābūt pietiekami daudz vietas izmēģinājumu dzīvniekiem. Parasti, lai kamerā būtu noturīga atmosfēra, izmēģinājumu dzīvnieku kopējais “tilpums” nedrīkst pārsniegt 5 % no kameras tilpuma.
Jāveic šādu parametru mērījumi un uzraudzība:
i) gaisa plūsma – ieteicams pastāvīgi kontrolēt gaisa plūsmas ātrumu kamerā;
ii) koncentrācija – pārbaudāmās vielas koncentrācijas svārstības ekspozīcijas laikā nedrīkst pārsniegt ± 15 % no tās vidējās vērtības;
iii) temperatūra un gaisa mitrums – ja izmanto grauzējus, temperatūrai jābūt 22 ± 2 oC, gaisa mitrumam kamerā jābūt 30–70 %, izņemot gadījumus, kad pārbaudāmās vielas suspendēšanai kameras atmosfērā izmanto ūdeni. Abi šie parametri nepārtraukti jāuzrauga;
iv) daļiņu lieluma mērījumi – ja izmanto šķidros vai cietos aerosolus, kameras atmosfērā jānosaka daļiņu sadalījums pēc lieluma. Aerosola daļiņām jābūt tādā lielumā, lai izmēģinājumu dzīvnieki tos varētu ieelpot. Kameras atmosfēras paraugi jāņem dzīvnieku inhalācijas zonā. Daļiņu sadalījumam gaisa paraugā jābūt tādam pašam kā gaisā, ko elpo dzīvnieki, un tam gravimetriski jāatbilst aerosola suspensijai kopumā pat tad, ja liela daļa aerosola nav ieelpojama. Gatavojot iekārtu izmēģinājumam, pietiekami bieži jāveic daļiņu lieluma analīze, lai pārliecinātos par aerosola noturīgumu; ekspozīcijas laikā tā jāveic tik bieži, lai pienācīgi noteiktu daļiņu sadalījuma nemainīgumu gaisā, ko ieelpo dzīvnieki.
Dzīvnieki saņem pārbaudāmo vielu vismaz 12 mēnešus.
1.6.3. Testa norise
Vismaz vienreiz dienā dzīvniekus pakļauj rūpīgai klīniskajai pārbaudei. Bez tam dzīvniekus katru dienu novēro un gādā par to, lai samazinātu to zudumus izmēģinājuma laikā, piemēram, secējot vai iesaldējot mirušos dzīvniekus un nošķirot vai nokaujot vārgus vai mirstošus īpatņus. Dzīvnieki rūpīgi jānovēro, reģistrējot jebkuru toksicitātes simptomu parādīšanos un tālāko attīstību, kā arī jāsamazina dzīvnieku zudumi slimību, autolīzes vai kanibālisma dēļ.
Visiem dzīvniekiem reģistrē klīniskos simptomus, tostarp neiroloģiskās izmaiņas un izmaiņas acīs, kā arī mirstību. Jāreģistrē toksisko reakciju parādīšanās un tālākā attīstība, arī aizdomīgu audzēju rašanās.
Pirmo 13 nedēļu laikā katram dzīvniekam vienreiz nedēļā reģistrē ķermeņa svaru, vēlāk to dara vismaz ik pēc četrām nedēļām. Pirmo 13 nedēļu laikā katru nedēļu nosaka barības patēriņu, bet vēlāk apmēram ik pēc trim mēnešiem, ja vien veselības stāvokļa vai ķermeņa svara izmaiņu dēļ tas nav jādara citādi.
Hematoloģiskā izmeklēšana (piemēram, hemoglobīna satura, hematokrīta skaitļa, kopējā eritrocītu skaita, kopējā leikocītu skaita, trombocītu un citu asins recēšanas rādītāju noteikšana) jāveic pēc trim mēnešiem, sešiem mēnešiem un tad apmēram ik pēc sešiem mēnešiem un vēl pēc izmēģinājuma beigām, ņemot asins paraugus no visiem katras grupas dzīvniekiem, ja tie nepieder pie grauzējiem, vai no 10 katra dzimuma žurkām. Ja iespējams, pēc katra laika intervāla paraugi jāņem no tām pašām žurkām. Bez tam, ja tie nav grauzēji, asins paraugs jāņem arī pirms izmēģinājuma.
Ja klīniskie novērojumi liecina par dzīvnieku veselības pasliktināšanos pētījuma laikā, šiem dzīvniekiem nosaka asins ainu.
Asins ainas noteikšanai izmanto asins paraugus no dzīvniekiem, kas saņēmuši augstāko devu, un no kontroles dzīvniekiem. Dzīvniekiem, kas saņem vielu mazākā devā(-ās), asins ainu nosaka tikai tad, ja starp dzīvniekiem, kas saņēmuši augstāko devu, un kontroles dzīvniekiem novēro lielas svārstības vai uz to norāda patoloģiskās izmaiņas.
Paraugus urīnanalīzei ņem no visiem katras grupas dzīvniekiem, ja tie nepieder pie grauzējiem, vai no 10 katra dzimuma žurkām, ja iespējams, no tām pašām žurkām un ar tādu pašu laika intervālu kā hematoloģiskajiem izmeklējumiem. Grauzējiem, katram dzīvniekam atsevišķi vai visiem viena dzimuma/grupas paraugiem kopumā, veic šādas analīzes:
— izskats – tilpums un īpatnējais blīvums, katram dzīvniekam,
— olbaltumvielas, glikoze, ketoni, asins (puskvantitatīvi) urīnā,
— nogulsnes (puskvantitatīvi).
Apmēram ik pēc sešiem mēnešiem un pēc izmēģinājuma beigām visiem katras grupas dzīvniekiem, ja tie nepieder pie grauzējiem, vai 10 katra dzimuma žurkām, ja iespējams, visos laika intervālos no tām pašām žurkām, ņem asins paraugus klīniskās bioķīmijas izmeklējumiem. Bez tam, ja tie nav grauzēji, asins paraugs jāņem arī pirms izmēģinājuma. No šiem paraugiem iegūst plazmu un veic šādas analīzes:
— kopējā olbaltumvielu koncentrācija,
— albumīna koncentrācija,
— aknu funkcionālā darbība (piemēram, sārmainās fosfatāzes aktivitāte, glutamātpiruvāttransamināzes (19) aktivitāte un glutamātoksalacetāttransamināzes (19) aktivitāte), gamma-glutamiltranspeptidāze, ornitīndekarboksilāze,
— ogļhidrātu metabolisms, piemēram, glikoze pēc badošanās,
— nieru funkcionālā darbība, piemēram, urīnvielas slāpeklis asinīs.
Visiem dzīvniekiem, arī tiem, kas miruši izmēģinājuma laikā vai nokauti veselības stāvokļa dēļ, jāveic pilna autopsija. Pirms nokaušanas dzīvniekiem ņem asins paraugu asins ainas noteikšanai. Jāsaglabā visi audi ar makroskopiskām izmaiņām, audzēji vai audzējiem līdzīgi veidojumi. Jāmēģina rast korelāciju starp autopsijas datiem un mikroskopijas rezultātiem.
Visi orgāni un audi jāsaglabā histopatoloģiskajai izmeklēšanai. Tas parasti attiecas uz šādiem orgāniem un audiem – smadzenēm ( 20 ) (iegarenās smadzenes/tilts, smadzenīšu garoza, smadzeņu garoza), hipofīzi, vairogdziedzeri (kopā ar epitēlijķermenīšiem), aizkrūts dziedzeri, plaušām (kopā ar traheju), sirdi, aortu, siekalu dziedzeriem, aknām (20) , liesu, nierēm (20) , virsnieru dziedzeriem (20) , barības vadu, kuņģi, divpadsmitpirkstu zarnu, tukšo zarnu, līkumaino zarnu, aklo zarnu, lokzarnu, taisno zarnu, dzemdi, urīnpūsli, limfmezgliem, aizkuņģa dziedzeri, gonādām (20) , papildu dzimumorgāniem, sievišķo piena dziedzeri, ādu, muskulatūru, perifērās nervu sistēmas nerviem, muguras smadzenēm (kakla, vidējais torakālais un gurnu rajons), krūškaulu ar kaula smadzenēm, augšstilba kaulu (kopā ar locītavu) un acīm. Vislabākais veids, kā saglabāt plaušu un urīnpūšļa audus, ir piepildīt šos orgānus ar fiksatoru; pienācīga plaušu histopatoloģiskā izmeklēšana pēc inhalācijas nav iespējama bez šādas apstrādes. Veicot īpašus klīniskos pētījumus, piemēram, pēc inhalācijas, jāpārbauda visi elpošanas orgāni, ieskaitot degunu, rīkli un balseni.
Ja ir veikti citi klīniskie izmeklējumi, tajos iegūtie dati jāapkopo pirms mikroskopiskās pārbaudes, jo tie var sniegt svarīgu informāciju patologam.
Mikroskopā jāpārbauda visas patoloģiskās izmaiņas, it īpaši audzēji un citi veidojumi jebkurā orgānā. Bez tam ir ieteicams veikt šeit norādītās procedūras:
a) visu uzglabāto orgānu un audu mikroskopiskā izpēte kopā ar vispusīgu pārskatu par visām patoloģiskajām izmaiņām, kas novērotas:
1) izmēģinājuma laikā mirušiem vai nokautiem dzīvniekiem;
2) dzīvniekiem, kuri saņēmuši lielāko devu, un kontroles dzīvniekiem;
b) jāpārbauda orgāni vai audi dzīvniekiem, kas saņēmuši mazāku pārbaudāmās vielas devu, un kuros, iespējams, vielas ietekmē, radušās anomālijas;
c) ja testa rezultāti liecina par to, ka parastais dzīvnieku mūža ilgums ir ievērojami samazinājies vai ka radušās sekas var ietekmēt toksisko reakciju, jāpārbauda dzīvnieki nākamajā devas grupā, kā tas norādīts iepriekš;
d) lai pienācīgi novērtētu izmaiņas, kas novērotas dzīvniekiem pēc vielas aplikācijas, jābūt informācijai par to, cik bieži izmantotās līnijas dzīvniekiem tādos pašos laboratorijas apstākļos reģistrē spontāni radušās anomālijas, proti, jābūt iepriekš iegūtiem datiem par kontroles dzīvniekiem.
2. DATI
Dati jāapkopo tabulā, norādot dzīvnieku skaitu katrā izmēģinājuma grupā testa sākumā, to dzīvnieku skaitu, kam novērotas izmaiņas, un katra izmaiņu tipa procentuālo īpatsvaru. Rezultāti jānovērtē, izmantojot piemērotu statistikas metodi. Var izmantot jebkuru atzītu statistikas metodi.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— dzīvnieku suga, līnija, izcelsme, turēšanas apstākļi, uzturs,
— testa apstākļi.
— 3.1.1. Inhalācijas iekārtas apraksts:
— iekļaujot tās konstrukciju, modeli, izmērus, gaisa avotu, makrodaļiņu un aerosolu ģenerēšanas sistēmu, gaisa kondicionēšanas paņēmienu, izplūdes gaisa apstrādi un dzīvnieku turēšanas apstākļus izmēģinājumu kamerā, ja tādu izmanto. Apraksta ierīces temperatūras, gaisa mitruma un, vajadzības gadījumā, aerosolu koncentrācijas noturīguma vai daļiņu lieluma noteikšanai.
— 3.1.2. Ekspozīcijas režīms:
— šie dati jāapkopo tabulā, norādot vidējās vērtības, kā arī svārstību diapazonu (piemēram, standartnovirzi) un, ja iespējams, minot arī:
—a) gaisa plūsmas ātrumu inhalācijas iekārtā;
b) gaisa temperatūru un mitrumu;
c) nominālo koncentrāciju (inhalācijas iekārtā ievadītais pārbaudāmās vielas kopējais daudzums, kas izdalīts ar gaisa daudzumu);
d) nesējvielas tipu, ja tādu izmanto;
e) faktisko vielas koncentrāciju inhalācijas zonā;
f) daļiņu vidējo lielumu (vajadzības gadījumā),
— izmantotās devas (jānorāda arī nesējviela, ja tādu izmanto) un koncentrācijas,
— dati par toksiskajām reakcijām atkarībā no dzimuma un devas,
— netoksiska deva,
— nāves iestāšanās brīdis izmēģinājuma laikā vai norāde, ka dzīvnieki ir izdzīvojuši,
— toksiskās iedarbības vai citas iedarbības raksturojums,
— atsevišķu saindēšanās simptomu parādīšanās brīdis un to tālākā attīstība,
— barības patēriņš un ķermeņa svara izmaiņas,
— oftalmoloģijas dati,
— hematoloģiskie izmeklējumi un to rezultāti,
— klīniskās bioķīmijas izmeklējumi un to rezultāti (arī urīnanalīzes rezultāti, ja tādi ir),
— autopsijas rezultāti,
— sīks histopatoloģisko izmeklējumu apraksts,
— rezultātu statistiskā apstrāde, ja iespējams,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.31. PRENATĀLĀS ONTOĢENĒZES TOKSICITĀTES PĒTĪJUMS
1. METODE
Šī metode ir ESAO 414. (2001) vadlīnijā noteiktās metodes kopija.
1.1. IEVADS
Šī ontoģenēzes toksicitātes testa metode ir paredzēta, lai sniegtu vispārīgo informāciju par pirmsdzemdību iedarbības ietekmi uz grūsnu testa dzīvnieku un uz attīstošos organismu in utero; tā var iekļaut vērtējumu par iedarbību uz māti, kā arī par augļa nāvi, strukturālajām anomālijām vai augšanas izmaiņām. Funkcionāli bojājumi, kaut arī tie ir svarīga attīstības daļa, nav šīs testa metodes sastāvdaļa. Tos var testēt atsevišķā pētījumā vai kā papildinājumu šim pētījumam, izmantojot attīstības neirotoksicitātes testa metodi. Informācija par funkcionālu bojājumu un citu postnatālo iedarbību testa metodi attiecīgi skatīt divu paaudžu reproduktīvās toksicitātes un attīstības neirotoksicitātes pētījumu testa metodē.
Šai testa metodei atsevišķos gadījumos var būt vajadzīga īpaša pielāgošana, pamatojoties uz konkrētām zināšanām, piemēram, par testējamās vielas fizikāli ķīmiskajām vai toksikoloģiskajām īpašībām. Tāda pielāgošana ir pieņemama, ja pārliecinoši zinātniski dati liecina, ka pielāgojumi testu padarīs informatīvāku. Tādā gadījumā pētījuma pārskatā minētie zinātniskie dati ir rūpīgi jādokumentē.
1.2. DEFINĪCIJAS
Ontoģenēzes toksikoloģija: pētījums par tādām blakusparādībām uz attīstošos organismu, kuras var izraisīt iedarbība pirms apaugļošanas, prenatālās attīstības laikā vai postnatāli līdz seksuālās nobriešanas laikam. Galvenās ontoģenēzes toksicitātes izpausmes iekļauj: 1) organisma nāvi, 2) strukturālas anomālijas, 3) izmainītu augšanu un 4) funkcionālus bojājumus. Ontoģenēzes toksikoloģiju agrāk bieži minēja kā teratoloģiju.
Kaitīga iedarbība: jebkura ar vielas ievadīšanu saistīta tāda izmaiņa pret bāzes līniju, kas samazina organisma spēju izdzīvot, vairoties vai pielāgoties videi. Kas attiecas uz ontoģenēzes toksikoloģiju plašākajā nozīmē, tā iekļauj visas iedarbības, kas traucē normālu apaugļošanas produkta attīstību gan pirms dzimšanas, gan pēc tās.
Izmainīta augšana: pēcnācēja orgāna vai ķermeņa svara vai lieluma izmaiņas.
Izmaiņas (anomālijas): attīstības strukturālas izmaiņas, kas iekļauj malformācijas un novirzes (28).
Malformācija/ievērojama anomālija: strukturāla izmaiņa, ko uzskata par dzīvniekam kaitīgu (var būt arī letāla) un kas parasti ir reti sastopama.
Novirze/neliela anomālija: strukturāla izmaiņa, ko uzskata par tādu, kam nav kaitīga iedarbība uz dzīvnieku; var būt pārejoša un kontroles populācijā var būt relatīvi bieži sastopama.
Apaugļošanas produkts: apaugļotas olšūnas atvasinājumu summa jebkurā attīstības pakāpē no apaugļošanas līdz dzimšanai, iekļaujot augļapvalkus, kā arī embriju vai augli.
Implantācija (nidācija): blastocistas piestiprināšanās dzemdes epiteliālajam izklājumam, iekļaujot tās iziešanu caur dzemdes epitēliju un implantāciju endometrijā.
Embrijs: organisma agrīnais vai attīstības posms, jo īpaši olšūnas apaugļošanās produkts, kas attīstās, pēc tam, kad parādījusies garenvirziena ass, un līdz laikam, kad izveidojušās visas galvenās struktūras.
Embriotoksicitāte: kaitīga embrija normālajai struktūrai, attīstībai, augšanai un/vai dzīvotspējai.
Auglis: nedzimis pēcnācējs pēcembrija laika posmā.
Fetotoksicitāte: kaitīga augļa normālajai struktūrai, attīstībai, augšanai un/vai dzīvotspējai.
Aborts: priekšlaicīga apaugļošanās produktu – embrija vai dzīvotnespējīga augļa – izgrūšana no dzemdes.
Resorbcija: apaugļošanas produkts, kas implantēts dzemdē, pēc tam miris un tiek resorbēts vai ir resorbēts.
Agrīna resorbcija: implantācijas pierādījumi bez identificējama embrija/augļa.
Vēla resorbcija: miris embrijs vai auglis ar ārējām deģeneratīvām izmaiņām.
NOAEL : saīsinājums no “nenovēro nelabvēlīgu ietekmes līmeni” (NOAEL) (līmenis, pie kura nav novērojama nevēlama ietekme), un tas ir lielākais devas vai iedarbības līmenis, pie kura nav novērojami ar vielas ievadīšanu saistīti nevēlami rezultāti.
1.3. STANDARTVIELA
Nav.
1.4. TESTA METODES PRINCIPS
Parasti testējamo vielu ievada grūsniem dzīvniekiem vismaz pēc implantācijas līdz vienai dienai pirms plānotās nogalināšanas, kurai jābūt iespējami tuvu parastajai dzemdību dienai, neriskējot zaudēt datus priekšlaicīgu dzemdību dēļ. Testa metode nav paredzēta, lai apskatītu tikai organoģenēzes posmu (piemēram, no 5. līdz 15. dienai grauzējiem un no 6. līdz 18. dienai trušiem), bet attiecīgā gadījumā arī iedarbību no preimplantācijas visā grūsnības periodā līdz dienai pirms ķeizargrieziena. Īsi pirms ķeizargrieziena mātītes nogalina, apskata dzemdes saturu un augļus novērtē attiecībā uz ārēji redzamām anomālijām un mīksto audu un skeleta izmaiņām.
1.5. TESTA METODES APRAKSTS
1.5.1. Dzīvnieku sugu izvēle
Ir ieteicams testēšanu izdarīt ar visatbilstošākajām sugām un tādām laboratorijas sugām un līnijām, ko parasti izmanto ontoģenēzes toksicitātes prenatālā testēšanā. Piemērotākā grauzēju suga ir žurka un piemērotākā suga, kas nav grauzēji, ir trusis. Ja izmanto citas sugas, jāsniedz pamatojums.
1.5.2. Turēšanas un barošanas nosacījumi
Eksperimentālo dzīvnieku telpā temperatūrai jābūt 22 oC (± 3o) žurkām un 18 oC (± 3o) trušiem. Lai gan, izņemot telpas tīrīšanas laiku, relatīvajam mitrumam jābūt vismaz 30 % un vēlams, lai tas nepārsniegtu 70 %, tas jāuztur 50–60 % robežās. Apgaismojumam jābūt mākslīgam, secība ir 12 stundas gaismas, 12 stundas tumsas. Attiecībā uz barošanu var izmantot parasto laboratorijas barību ar neierobežotu dzeramā ūdens piegādi. Pārošanas procedūras jāveic attiecīgajam nolūkam piemērotos būros. Priekšroka dodama sapāroto dzīvnieku atsevišķai turēšanai, pieņemama ir arī turēšana nelielās grupās.
1.5.3. Dzīvnieku sagatavošana
Jāizmanto veseli dzīvnieki, kas ir aklimatizēti laboratorijas apstākļos vismaz piecas dienas un ar kuriem iepriekš nav veiktas izmēģinājumu procedūras. Testa dzīvniekiem norāda sugu, līniju, dzimumu, svaru un/vai vecumu. Visiem dzīvniekiem vai testa grupām, cik vien tas praktiski iespējams, jābūt vienāda svara un vecuma. Pie katra devas līmeņa jāizmanto jauni negrūsni pieauguši sievišķā dzimuma dzīvnieki. Sievišķā dzimuma dzīvnieki jāpāro ar tās pašas sugas un līnijas vīrišķā dzimuma dzīvniekiem un ir jāizvairās no brāļu un māsu pārošanas. Žurkām grūsnības 0. diena ir diena, kad novērots vagīnas embols un/vai sperma; trušiem grūsnības 0. diena ir diena, kad noticis coitus vai mākslīgā apsēklošana, ja lieto minēto metodi. Sapārotie sievišķā dzimuma dzīvnieki pēc nejaušas izvēles jāiedala kontroles un vielas došanas grupā. Būri jāizvieto tā, lai iespējami samazinātu būru novietojuma varbūtējo iedarbību. Katram dzīvniekam piešķir unikālu identifikācijas numuru. Pārotie sievišķā dzimuma dzīvnieki pēc nejaušās izvēles jāiedala kontroles un vielas došanas grupā, un, ja sievišķā dzimuma dzīvnieki ir pāroti partijās, dzīvnieki ir vienmērīgi jāsadala katras partijas grupās. Līdzīgi vienmērīgās grupās ir jāsadala sievišķā dzimuma dzīvnieki, ko apsēklojis viens un tas pats vīrišķā dzimuma dzīvnieks.
1.6. PROCEDŪRA
1.6.1. Dzīvnieku skaits un dzimums
Katrā testa un kontroles grupā jābūt pietiekamam sievišķā dzimuma dzīvnieku skaitam, lai autopsijā būtu aptuveni 20 sievišķā dzimuma dzīvnieki ar implantācijas vietām. Grupas ar mazāk nekā 16 dzīvniekiem ar implantācijas vietām var būt neatbilstošas. Māšu mirstība obligāti nepadara pētījumu nederīgu ar nosacījumu, ka tā nepārsniedz aptuveni 10 %.
1.6.2. Devu sagatavošana
Ja dozēšanas atvieglošanai izmanto nesēju vai citu piedevu, jāņem vērā šādas īpašības – iedarbība uz testējamās vielas uzsūkšanos, sadalījumu, metabolismu un aizturi vai izdalīšanos; iedarbība uz testējamās vielas ķīmiskajām īpašībām, kas var mainīt tās toksiskās īpašības; iedarbība uz barības un ūdens patēriņu vai dzīvnieku barojuma stāvokli. Nesējs nedrīkst būt toksisks ontoģenēzē vai ietekmēt reproduktīvo funkciju.
1.6.3. Dozēšana
Parasti testējamo vielu ievada katru dienu no implantācijas (piemēram, piektajā dienā pēc pārošanas) līdz dienai, kas ir dienu pirms plānotā ķeizargrieziena. Ja pieejamie iepriekšējie pētījumi nenorāda uz augstu pirmsimplantācijas zudumu iespēju, vielas ievadīšanu var paildzināt, iekļaujot visu grūsnības periodu no pārošanas līdz dienai pirms plānotās nogalināšanas. Ir labi zināms, ka grūsnības laikā nepiemērota apiešanās vai stress var izraisīt prenatālus zudumus. Lai pasargātos no prenatāliem zudumiem, ko izraisa ar vielas ievadīšanu nesaistīti faktori, ir jāizvairās no nevajadzīgas rīkošanās ar grūsniem dzīvniekiem, kā arī no ārējo faktoru radīta stresa, piemēram, trokšņa.
Jāizmanto vismaz trīs dažādas devas, un jāpielieto vienlaicīga grupu kontrole. Veseli dzīvnieki pēc nejaušās izvēles jāiedala kontroles un vielas ievadīšanas grupā. Devu līmeņi jāizvieto tā, lai veidotos toksisko iedarbību gradācija. Ja testējamās vielas fizikālās/ķīmiskās īpašības vai bioloģiskās īpašības nav ierobežotas, lielākā deva jāizvēlas, lai izraisītu nelielu ontoģenēzes toksicitāti un/vai māšu toksicitāti (klīniskās pazīmes vai ķermeņa svara samazinājums), bet ne nāvi vai smagas ciešanas. Vismaz vienam vidēji lielās devas līmenim jāizraisa minimālā novērojamā toksiskā iedarbība. Vielas mazākā deva nedrīkst izraisīt mātes toksicitātes vai ontoģenēzes toksicitātes pazīmes. Devu līmeņi lejupejošā secībā jāizvēlas tā, lai parādītu visas ar dozēšanu saistītās atbildes reakcijas un nenovērotas nelabvēlīgas ietekmes līmeni (NOAEL). Lejupejošo devu līmeņu uzdošanai bieži optimāli ir divkārši līdz četrkārši starplaiki, un ceturtās testa grupas pievienošana bieži ir ieteicamāka par ļoti plašu (piemēram, vairāk par 10 reizēm) starplaiku izmantošanu starp dozēšanām. Kaut arī mērķis ir mātes NOAEL noteikšana, var būt pieņemami arī pētījumi, kas šādu līmeni nenosaka (1).
Devu līmeņi jāizvēlas, ņemot vērā esošos toksicitātes datus, kā arī papildu informāciju par testējamo vielu un ar to saistīto materiālu metabolismu un toksikokinētiku. Tāda informācija arī palīdzēs parādīt dozēšanas režīma atbilstību.
Jāizmanto vienlaicīgas kontroles grupa. Šai grupai jābūt placebo saņēmējai kontroles grupai vai nesēja kontroles grupai, ja testējamās vielas došanā izmanto nesēju. Visām grupām jādod tas pats testējamās vielas vai nesēja tilpums. Ar kontroles grupas(-u) dzīvniekiem jārīkojas tāpat kā ar testa grupas dzīvniekiem. Nesēja kontroles grupai nesējs jāsaņem lielākajā izmantotajā daudzumā (kā zemākajā vielas saņemšanas grupā).
1.6.4. Pieļaujamības tests
Ja testā pie viena devas līmeņa, kas ir vismaz 1 000 mg/kg ķermeņa svara dienā, ievadot perorāli un izmantojot šim pētījumam aprakstītās procedūras, nav izraisīta novērojama toksicitāte ne grūsnajiem dzīvniekiem, ne to pēcnācējiem un ja iedarbība nav sagaidāma, pamatojoties uz esošajiem datiem (piemēram, no struktūras ziņā un/vai metaboliski radniecīgiem savienojumiem), tad pilnu pētījumu ar trīs devu līmeņu izmantošanu nevar uzskatīt par vajadzīgu. Paredzamā iedarbība uz cilvēku var norādīt uz to, ka pieļaujamības testā jāizmanto lielāks perorālās devas līmenis. Citiem ievadīšanas veidiem, tādiem kā ieelpošana un pielietošana uz ādas, vielas fizikāli ķīmiskās īpašības bieži var norādīt un ierobežot maksimālo sasniedzamo iedarbības līmeni (piemēram, pielietošana uz ādas nedrīkstētu izraisīt smagu lokālu toksicitāti).
1.6.5. Devu ievadīšana
Testējamo vielu vai nesēju parasti ievada perorāli vai caur zondi. Ja izmanto citu ievadīšanas veidu, testa izpildītājam jāsniedz tā izvēles pamatojums un izskaidrojums, un var būt vajadzīgi attiecīgi grozījumi (2) (3) (4). Testējamo vielu katru dienu ievada aptuveni vienā laikā.
Atsevišķo dzīvnieku devām parasti jābūt pamatotām uz atsevišķo ķermeņa svaru jaunāko noteikšanu. Tomēr jābūt piesardzīgiem, pielāgojot devu grūsnības pēdējās trešdaļas laikā. Lai novērstu pārliecīgu mātes toksicitāti, devas izvēlei jāizmanto esošie dati. Tomēr, ja vielu saņēmušajām mātītēm ir novērojama pārliecīga toksicitāte, tādi dzīvnieki ir humāni jānogalina. Ja vairāki grūsni dzīvnieki uzrāda pārliecīgas toksicitātes pazīmes, ir jāapsver attiecīgās devas grupas likvidēšana. Ja testējamo vielu dzīvniekiem ievada ar mākslīgo barošanu, tas jāizdara vienā devā, izmantojot kuņģa zondi vai piemērotu intubācijas kanulu. Maksimālais šķidruma tilpums, ko vienā paņēmienā var ievadīt, ir atkarīgs no testa dzīvnieka lieluma. Tilpums nedrīkst pārsniegt 1 ml/100 g ķermeņa svara, izņemot ūdens šķīdumus, ko var ievadīt 2 ml/100 g uz ķermeņa svaru. Ja par nesēju izmanto kukurūzas eļļu, tilpums nedrīkst pārsniegt 0,4 ml/100 g ķermeņa svara. Testa tilpuma izmaiņas ir jāsamazina līdz minimumam, pielāgojot koncentrāciju, lai nodrošinātu nemainīgu tilpumu pie visiem devu līmeņiem.
1.6.6. Mātīšu novērošana
Klīniskie novērojumi jāizdara un tie jāreģistrē vismaz reizi dienā, vēlams katru dienu vienā(-os) laikā(-os) un ņemot vērā sagaidāmo iedarbību maksimuma laika posmu pēc dozēšanas. Dzīvnieku stāvoklis jāreģistrē, iekļaujot mirstību, mirstošos dzīvniekus, nepārejošas izturēšanās izmaiņas un visas atklātās toksicitātes pazīmes.
1.6.7. Ķermeņa svars un barības patēriņš
Dzīvnieki jānosver grūsnības 0. dienā vai vēlākais 3. grūtniecības dienā, ja sapārotos dzīvniekus ir piegādājis audzētājs no ārpuses, pirmajā dozēšanas dienā, vismaz reizi trīs dienās dozēšanas laika posmā un paredzētās nogalināšanas dienā.
Barības patēriņš ir jāreģistrē ik pēc trim dienām, un tam jāsakrīt ar ķermeņa svara noteikšanas dienām.
1.6.8. Pēcnāves pārbaude
Sievišķā dzimuma dzīvnieki jānogalina vienu dienu pirms sagaidāmās dzemdību dienas. Sievišķā dzimuma dzīvnieki, kuriem novēro aborta vai priekšlaicīgu dzemdību pazīmes, jānogalina un jāizdara to rūpīga makroskopiskā pārbaude.
Tūlīt pēc nogalināšanas vai nāves pētījuma laikā mātīte makroskopiski jāpārbauda attiecībā uz strukturālām anomālijām vai patoloģiskām izmaiņām. Mātīšu vērtēšana ķeizargrieziena laikā un turpmākās augļu analīzes jāveic, vēlams, bez zināšanām par vielas saņemšanas grupu, lai līdz minimumam samazinātu neobjektivitāti.
1.6.9. Dzemdes satura apskate
Tūlīt pēc nogalināšanas vai iespējami drīz pēc nāves dzemdes ir jāizņem un jāpārliecinās par dzīvnieku grūsnības statusu. Dzemdes, kas šķiet negravīdas, ir jāpārbauda turpmāk (piemēram, izmantojot amonija sulfīda iekrāsošanos grauzējiem un Salevska iekrāsošanos vai piemērotu alternatīvu metodi trušiem), lai apstiprinātu negrūsnības statusu (5).
Gravīdas dzemdes, iekļaujot dzemdes kaklu, ir jānosver. Gravīdas dzemdes svars nav jāiegūst no dzīvniekiem, kas pētījuma laikā atrasti nobeigušies.
Grūsniem dzīvniekiem jānosaka corpora lutea skaits.
Dzemdes saturs ir jāpārbauda, lai noteiktu nobeigušos embriju vai augļu skaitu un dzīvotspējīgo augļu skaitu. Lai noteiktu apaugļošanas produkta relatīvo nobeigšanās laiku, ir jāapraksta resorbcijas pakāpe (skatīt 1.2. punktu).
1.6.10. Augļu pārbaude
Jānosaka katra augļa dzimums un ķermeņa svars.
Katrs auglis jāpārbauda attiecībā uz ārējām izmaiņām (6).
Augļi jāapskata attiecībā uz skeleta un mīksto audu izmaiņām (piemēram, novirzēm un malformācijām jeb anomālijām) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24). Augļu izmaiņu iedalīšana kategorijās ir vēlama, bet nav nepieciešama. Ja iedalīšanu kategorijās veic, ir skaidri jānorāda katras kategorijas noteikšanas kritēriji. Īpaša uzmanība jāvelta reproduktīvajam traktam, kas ir jāpārbauda attiecībā uz izmainītas attīstības pazīmēm.
Attiecībā uz grauzējiem aptuveni puse no katra metiena ir jāpreparē un jāpārbauda attiecībā uz skeleta izmaiņām. Atlikusī puse jāpreparē un jāpārbauda attiecībā uz mīksto audu izmaiņām, izmantojot pieņemtas vai piemērotas sēriju sekcijas metodes vai uzmanīgu makroskopiskās secēšanas paņēmienu.
Dzīvniekiem, kas nav grauzēji, piemēram, trušiem, visi augļi ir jāpārbauda attiecībā gan uz mīksto audu, gan skeleta izmaiņām. Šo augļu ķermeņus vērtē, attiecībā uz mīksto audu izmaiņām izdarot rūpīgu sekciju, kas var iekļaut procedūras tālākai sirds iekšējās struktūras novērtēšanai (25). Pusei no tā apskatītajiem augļiem ir jānoņem galvas un jāapstrādā mīksto audu izmaiņu novērtēšanai (iekļaujot acis, smadzenes, deguna ejas un mēli), izmantojot standarta sēriju secēšanas metodes (26) vai tikpat jutīgu metodi. Minēto augļu ķermeņi un atlikušie neskartie augļi ir jāapstrādā un jāpārbauda attiecībā uz skeleta izmaiņām, izmantojot tās pašas metodes, kas aprakstītas saistībā ar grauzējiem.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Datus reģistrē atsevišķi mātītēm, kā arī to pēcnācējiem un apvieno tabulas veidā, katrai testa grupai un katrai paaudzei parādot dzīvnieku skaitu testa sākumā, testa laikā atrasto nobeigušos vai humānu iemeslu dēļ nogalināto dzīvnieku skaitu, katras nobeigšanās vai humānās nogalināšanas laiku, grūsno sievišķā dzimuma dzīvnieku skaitu, toksicitātes pazīmes uzrādījušo dzīvnieku skaitu, novēroto toksicitātes pazīmju aprakstu, iekļaujot toksisko iedarbību parādīšanās brīdi, ilgumu un smagumu, embriju/augļu novērojumu veidu un visus attiecīgos datus par metienu.
Skaitliskie rezultāti ir jānovērtē ar piemērotu statistikas metodi, izmantojot metienu kā datu analīzes vienību. Jāizmanto vispāratzīta statistikas metode; statistikas metodes ir jāizvēlas kā daļa no pētījuma projekta un jāpamato. Jāreģistrē arī dati par dzīvniekiem, kas nav izdzīvojuši līdz paredzētajai nogalināšanai. Attiecīgā gadījumā minētos datus var iekļaut grupas vidējos lielumos. No tādiem dzīvniekiem iegūto datu relevance un tātad to iekļaušana vai neiekļaušana grupas vidējā(-os) lielumā(-os) ir jāpamato un jāizspriež katrā atsevišķā gadījumā.
2.2. REZULTĀTU IZVĒRTĒŠANA
Prenatālās ontoģenēzes toksicitātes dati ir jānovērtē novērotās iedarbības izteiksmē. Vērtējumā ir šāda informācija:
— mātes un embriju/augļu testa rezultāti, iekļaujot sakarības novērtējumu vai tās trūkumu starp testējamās vielas iedarbību uz dzīvniekiem un visu konstatāciju biežumu un smagumu,
— augļu ārējo, mīksto audu un skeleta izmaiņu iedalīšanai kategorijās izmantotie kritēriji, ja iedalīšana kategorijās ir veikta,
— attiecīgā gadījumā vēsturiskie kontroles dati, lai veicinātu pētījuma rezultātu interpretāciju,
— visā procentuālā daudzuma vai koeficientu aprēķināšanā izmantotie skaitļi,
— attiecīgā gadījumā pētījuma rezultātu atbilstoša statistiskā analīze, kurā jāiekļauj pietiekama informācija par analīzes metodi, tā, lai neatkarīgs recenzents/statistiķis varētu atkārtoti novērtēt un rekonstruēt analīzi.
Katrā pētījumā, kas rāda, ka toksiskās iedarbības nav, ir jāapsver turpmākie pētījumi, lai noteiktu testējamās vielas uzsūkšanos un bioloģisko pieejamību.
2.3. REZULTĀTU INTERPRETĒŠANA
Prenatālā ontoģenēzes toksicitāte sniedz informāciju par vielas atkārtotas iedarbības ietekmi grūsnības laikā uz mātītēm un uz to pēcnācēju intrauterīno attīstību. Pētījuma rezultāti ir jāinterpretē kopā ar subhronisko, reprodukcijas, toksikokinētisko un citu pētījumu datiem. Tā kā tiek uzsvērta vispārējā toksicitāte mātes toksicitātes un ontoģenēzes toksicitātes beigu punktu izteiksmē, pētījuma rezultāti zināmā mērā ļauj atšķirt iedarbību uz attīstību, kas sastopama, nepastāvot vispārējai toksicitātei, un iedarbību uz attīstību, ko izraisa tikai līmeņi, kas ir toksiski arī mātesdzīvniekam (27).
3. PĀRSKATA SAGATAVOŠANA
3.1. PĀRSKATS PAR TESTU
Pārskatā par testu jāiekļauj šāda informācija.
Testējamā viela:
— fizikālās īpašības un attiecīgā gadījumā fizikāli ķīmiskās īpašības,
— identifikācija, iekļaujot CAS numuru, ja tas ir zināms/noteikts,
— tīrība.
Nesējs (attiecīgā gadījumā):
— nesēja izvēles pamatojums, ja nesējs nav ūdens.
Testa dzīvnieki:
— izmantotā suga un līnija,
— dzīvnieku skaits un vecums,
— izcelsme, turēšanas apstākļi, barība u. c.,
— atsevišķo dzīvnieku svars testa sākumā.
Testa apstākļi:
— devu līmeņa izvēles pamatojums,
— sīkas ziņas par testējamās vielas preparāta/barības sagatavošanu, iegūto koncentrāciju, stabilitāti un homogenitāti,
— sīkas ziņas par testējamās vielas ievadīšanu,
— testējamās vielas koncentrācijas (milj. daļas) barībā vai dzeramajā ūdenī pārrēķins faktiskajā dienas devā (mg/kg ķermeņa svara dienā) attiecīgā gadījumā,
— vides apstākļi,
— sīkas ziņas par barības un ūdens kvalitāti.
Rezultāti
Dati par mātes toksisko atbildes reakciju uz devu iekļaujot, bet neaprobežojoties ar:
— dzīvnieku skaitu testa sākumā, izdzīvojušo dzīvnieku skaitu, grūsno dzīvnieku skaitu, abortu skaitu, priekšlaicīgu dzemdību skaitu,
— nāves iestāšanās dienu testa laikā vai norādi, ka dzīvnieki ir izdzīvojuši,
— dati par dzīvniekiem, kas nav izdzīvojuši līdz plānotajai nogalināšanai, ir jāreģistrē, bet nav jāiekļauj starpgrupu statistiskajos salīdzinājumos,
— katra anomāla klīniskā simptoma novērošanas diena un tālākā attīstība,
— ķermeņa svars, ķermeņa svara izmaiņas un gravīdās dzemdes svars, neobligāti iekļaujot ķermeņa svara izmaiņas, kas koriģētas uz gravīdās dzemdes svaru,
— barības patēriņš un ūdens patēriņš, ja tas ir mērīts,
— autopsijas konstatācijas, iekļaujot dzemdes svaru,
— ir jāreģistrē iedarbības uz māti un attīstību NOAEL vērtības.
Attīstības beigu punkti attiecībā uz devu, metieniem ar implantāciju, iekļaujot:
— corpora lutea skaitu,
— implantāciju skaitu, dzīvo un mirušo augļu un resorbciju skaitu un procentuālo daudzumu,
— pre- un postimplantācijas zudumu skaitu un procentuālo daudzumu.
Attīstības beigu punkti attiecībā uz devu metieniem ar dzīviem augļiem, iekļaujot:
— dzīvu pēcnācēju skaitu un procentuālo daudzumu,
— dzimumu attiecību,
— augļu ķermeņa svaru, vēlams pēc dzimumiem un dzimumiem kopā,
— ārējas, mīksto audu un skeleta malformācijas un citas attiecīgās izmaiņas,
— attiecīgā gadījumā kritērijus iedalīšanai kategorijās,
— augļu un metienu kopējo skaitu un procentuālo daudzumu ar ārējām, mīksto audu un skeleta izmaiņās, kā arī individuālu anomāliju un citu attiecīgu izmaiņu veidus un biežumu.
Rezultātu apspriešana.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Kavlock R.J. et al. (1996) A Simulation Study of the Influence of Study Design on the Estimation of Benchmark Doses for Developmental Toxicity. Risk Analysis 16; p. 399–410.
(2) Kimmel, C.A. and Francis, E.Z. (1990) Proceedings of the Workshop on the Acceptability and Interpretation of Dermal Developmental Toxicity Studies. Fundamental and Applied Toxicology 14; p. 386–398.
(3) Wong, B.A., et al. (1997) Developing Specialised Inhalation Exposure Systems to Address Toxicological Problems. CIIT Activities 17; p. 1–8.
(4) US Environmental Protection Agency (1985) Subpart E-Specific Organ/Tissue Toxicity, 40 CFR 798.4350: Inhalation Developmental Toxicity Study.
(5) Salewski, E. (1964) Faerbermethode zum Makroskopischen Nachweis von Implantations Stellen am Uterusder Ratte. Naunyn-Schmeidebergs Archiv fur Pharmakologie und Experimentelle Pathologie 247:367.
(6) Edwards, J.A. (1968) The external Development of the Rabbit and Rat Embryo. In Advances in Teratology. D.H.M. Woolam (ed.) Vol. 3. Academic Press, NY.
(7) Inouye, M. (1976) Differential Staining of Cartilage and Bone in Fetal Mouse Skeleton by Alcian Blue and Alizarin Red S. Congenital Anomalies 16; p. 171–173.
(8) Igarashi, E. et al. (1992) Frequency Of Spontaneous Axial Skeletal Variations Detected by the Double Staining Techniquefor Ossified and Cartilaginous Skeleton in Rat Foetuses. Congenital Anomalies 32; p. 381–391.
(9) Kimmel, C.A. et al. (1993) Skeletal Development Following Heat Exposure in the Rat. Teratology 47; p. 229–242.
(10) Marr, M.C. et al. (1988) Comparison of Single and Double Staining for Evaluation of Skeletal Development: The Effects of Ethylene Glycol (EG) in CD Rats. Teratology 37; p. 476.
(11) Barrow, M.V. and Taylor, W.J. (1969) A Rapid Method for Detecting Malformations in Rat Foetuses. Journal of Morphology 127:291–306.
(12) Fritz, H. (1974) Prenatal Ossification in Rabbits ss Indicative of Foetal Maturity. Teratology 11; p. 313–320.
(13) Gibson, J.P. et al. (1966) Use of the Rabbit in Teratogenicity Studies. Toxicology and Applied Pharmacology 9; p. 398–408.
(14) Kimmel, C.A. and Wilson, J.G. (1973) Skeletal Deviation in Rats: Malformations or Variations? Teratology 8; p. 309–316.
(15) Marr, M.C. et al. (1992) Developmental Stages of the CD (Sprague-Dawley) Rat Skeleton after Maternal Exposure to Ethylene Glycol. Teratology 46; p. 169–181.
(16) Monie, I.W. et al. (1965) Dissection Procedures for Rat Foetuses Permitting Alizarin Red Staining of Skeleton and Histological Study of Viscera. Supplement to Teratology Workshop Manual, p. 163–173.
(17) Spark, C. and Dawson, A.B. (1928) The Order and Time of appearance of Centers of Ossification in the Fore and Hind Limbs of the Albino Rat, with Special Reference to the Possible Influence of the Sex Factor. American Journal of Anatomy 41; p. 411–445.
(18) Staples, R.E. and Schnell, V.L. (1964) Refinements in Rapid Clearing Technique in the KOH-Alizarin Red S Method for Fetal Bone. Stain Technology 39; p. 61–63.
(19) Strong, R.M. (1928) The Order Time and Rate of Ossification of the Albino Rat (Mus Norvegicus Albinus) Skeleton. American Journal of Anatomy 36; p. 313–355.
(20) Stuckhardt, J.L. and Poppe, S.M. (1984) Fresh Visceral Examination of Rat and Rabbit Foetuses Used in Teratogenicity Testing. Teratogenesis, Carcinogenesis, and Mutagenesis 4; p. 181–188.
(21) Walker, D.G. and Wirtschafter, Z.T. (1957) The Genesis of the Rat Skeleton. Thomas, Springfield, IL.
(22) Wilson, J.G. (1965) Embryological Considerations in Teratology. In Teratology: Principles and Techniques, Wilson J.G. and Warkany J. (eds). University of Chicago, Chicago, IL, p. 251–277.
(23) Wilson, J.G. and Fraser, F.C. (eds). (1977) Handbook of Teratology, Vol. 4. Plenum, NY.
(24) Varnagy, L. (1980) Use of Recent Fetal Bone Staining Techniques in the Evaluation of Pesticide Teratogenicity. Acta Vet. Acad. Sci. Hung. 28; p. 233–239.
(25) Staples, R.E. (1974) Detection of visceral Alterations in Mammalian Foetuses. Teratology 9; p. 37–38.
(26) Van Julsingha, E.B. and C.G. Bennett (1977) A Dissecting Procedure for the Detection of Anomalies in the Rabbit Foetal Head. In: Methods in Prenatal Toxicology Neubert, D., Merker, H.J. and Kwasigroch, T.E. (eds.). University of Chicago, Chicago, IL, p. 126–144.
(27) US Environmental Protection Agency (1991) Guidelines for Developmental Toxicity Risk Assessment. Federal Register 56; 63798–63826.
(28) Wise, D.L. et al. (1997) Terminology of Developmental Abnormalities in Common Laboratory Mammals (Version 1) Teratology 55; p. 249–292.
B.32. KANCEROGENITĀTES NOTEIKŠANA
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Izmantojot attiecīgo aplikācijas veidu, pārbaudāmo vielu parasti ievada septiņas dienas nedēļā vairākām izmēģinājumu dzīvnieku grupām; katra grupa saņem vienādu devu, un ekspozīcijas laiks aptver ievērojamu mūža daļu. Ekspozīcijas laikā un arī vēlāk izmēģinājumu dzīvniekus katru dienu novēro un reģistrē toksiskuma pazīmes, jo īpaši audzēju rašanos.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
Vismaz piecas dienas pirms izmēģinājuma dzīvniekus pieradina pie dzīvošanas un barošanas apstākļiem, kādi būs izmēģinājuma laikā. Veselus, jaunus dzīvniekus pirms izmēģinājuma pēc nejaušības principa sadala apstrādes un kontroles grupās.
1.6.1.
Atkarībā no iepriekš veikto pētījumu rezultātiem var izmantot arī citu sugu dzīvniekus (ne tikai grauzējus). Izmanto jaunus un veselus dzīvniekus, kas pieder pie plaši izplatītām laboratorijas dzīvnieku līnijām, un vielu sāk ievadīt uzreiz pēc atšķiršanas.
Uzsākot izmēģinājumus, dzīvnieku ķermeņa svara svārstības nedrīkst būt lielākas par ± 20 % no vidējā svara. Ja subhroniskās toksicitātes noteikšanu pēc perorālas aplikācijas veic pirms ilglaicīga testa, abos pētījumos jāizmanto tās pašas sugas/šķirnes un līnijas dzīvnieki.
1.6.2.
Ja izmanto grauzējus, vienu un to pašu devu ievada vismaz 100 dzīvniekiem (50 mātītēm un 50 tēviņiem), un vienlaikus jābūt arī kontroles grupai. Mātītes nedrīkst būt iepriekš dzemdējušas vai grūsnas. Ja dzīvnieku nonāvēšana paredzēta arī izmēģinājuma laikā, to skaits ir jāpalielina par to dzīvnieku skaitu, kuri tiks nokauti izmēģinājuma gaitā.
1.6.3.
Jāizmanto vismaz trīs dažādas devas, un vienlaikus jābūt kontroles grupai. Jāizvēlas tāda augstākā deva, kas izraisa nenozīmīgas toksiskuma pazīmes, piemēram, nelielus ķermeņa svara zudumus (līdz 10 %), un ievērojami neietekmē dzīvnieku mūža garumu, ja vien tas nav saistīts ar audzēju rašanos.
Vielas vismazākā devā nedrīkst traucēt dzīvnieku normālo augšanu, attīstību un mūža ilgumu vai izraisīt jebkādus toksicitātes simptomus. Parasti tai vajadzētu sasniegt vismaz 10 % no lielās devas.
Vidēji liel(-ās) devu(-as) izvēlas pa vidu starp lielo un mazo devu.
Izvēloties šīs devas, jāņem vērā iepriekšējo toksicitātes testu un pētījumu rezultāti.
Parasti pārbaudāmo vielu ievada katru dienu. Ja to pievieno dzeramajam ūdenim vai uzturam, tai visu laiku jābūt pieejamai dzīvniekiem.
1.6.4.
Vienlaikus jābūt kontroles dzīvniekiem, kas no pārējiem dzīvniekiem atšķiras tikai ar to, ka tie nesaņem pārbaudāmo vielu.
Īpašos gadījumos, piemēram, ja izmanto inhalācijas testu ar aerosolu vai perorālu aplikāciju ar emulgatoru, kura bioloģiskā aktivitāte nav zināma, papildus jābūt negatīvās kontroles grupai, kas nesaņem nesējvielu.
1.6.5.
Trīs galvenie ievadīšanas veidi ir perorāla vai ārīga aplikācija un inhalācija. Ievadīšanas veida izvēle ir atkarīga no pārbaudāmās vielas fizikālajām un ķīmiskajām īpašībām, kā arī no tā, kādā veidā cilvēki parasti nonāk saskarē ar šo vielu.
1.6.5.1. Perorāla aplikācija
Ja pārbaudāmā viela organismā nonāk caur kuņģa–zarnu traktu un ja tieši tādā veidā tā var apdraudēt cilvēkus, ieteicams izmantot perorālu aplikāciju, ja tam nav kontrindikāciju. Dzīvnieki var saņemt pārbaudāmo vielu kopā ar uzturu, dzeramo ūdeni vai kapsulās.
Dzīvnieki parasti saņem vielas devu katru dienu septiņas dienas nedēļā, jo, ja vielu ievada tikai piecas dienas nedēļā, “tukšajā laikā” dzīvnieki var atkopties, toksicitātes simptomi iet mazumā, kas savukārt ietekmē rezultātus un to novērtēšanu. Tomēr galvenokārt aiz praktiskiem apsvērumiem uzskata, ka ir arī pieļaujama vielas ievadīšana piecas dienas nedēļā.
1.6.5.2. Ārīga aplikācija
Ārīgu aplikāciju, uztriepjot vielu uz ādas, var izvēlēties tad, ja simulē vienu no galvenajiem veidiem, kā viela iekļūst cilvēku organismā, un kā modeli ādas bojājumu inducēšanai.
1.6.5.3. Inhalācijas tests
Tā kā, veicot inhalācijas testus, rodas lielākas tehniskas grūtības nekā tad, kad izmanto citus aplikācijas veidus, šeit sniegti sīkāki norādījumi attiecībā uz šo testu izmantošanu. Jāpiezīmē, ka atsevišķos gadījumos kā veiksmīgu alternatīvu var izmantot intratraheālu instilāciju.
Izvēloties ilglaicīgu ekspozīciju, parasti ņem vērā cilvēku iespējamo saskari ar vielu, tālab dzīvniekus katru dienu piecas reizes nedēļā uz sešām stundām ievieto inhalācijas kamerā ar vienmērīgu vielas koncentrāciju (periodiskā ekspozīcija) vai, ņemot vērā iespējamo vielas klātbūtni apkārtējā vidē, tos katru dienu septiņas dienas nedēļā uz 22–24 stundām pakļauj vielas iedarbībai (nepārtrauktā ekspozīcija), katru dienu vienādā laikā paredzot vienu stundu dzīvnieku barošanai un inhalācijas kameras apkopšanai. Parasti abos gadījumos dzīvnieki saņem pārbaudāmo vielu noteiktā koncentrācijā.
Galvenā atšķirība starp periodisko un nepārtraukto ekspozīciju ir tā, ka pirmajā gadījumā, beidzoties iedarbībai, dzīvnieki var atkopties 17–18 stundu laikā, un nedēļas nogalē šis atkopšanās laiks ir vēl garāks.
Periodiskās vai nepārtrauktās ekspozīcijas izvēle ir atkarīga no pētījuma mērķiem un no izvēlētā modeļa, kas simulē apstākļus, kādos cilvēki nonāk saskarē ar vielu. Šeit tomēr jārēķinās ar dažām tehniskām grūtībām. Piemēram, nepārtrauktās ekspozīcijas priekšrocības, modelējot apkārtējas vides apstākļus, var mazināt tas, ka ekspozīcijas laikā dzīvnieki jābaro un jāizmanto daudz sarežģītākas (un precīzākas) aerosola un tvaika ģenerēšanas un kontroles metodes.
1.6.6.
Izmēģinājumos ar dzīvniekiem izmanto inhalācijas kameras, kas nodrošina dinamisku gaisa plūsmu (vismaz 12 gaisa maiņas stundā), pietiekamu skābekļa koncentrāciju un vienmērīgu atmosfēru ekspozīcijas laikā. Kontroles un izmēģinājumu dzīvniekiem izmanto vienādas uzbūves un konstrukcijas inhalācijas kameras, kas nodrošina līdzvērtīgus ekspozīcijas apstākļus, izņemot pārbaudāmās vielas klātbūtni. Gaisa spiediens kamerā parasti ir nedaudz pazemināts, lai izvairītos no pārbaudāmās vielas izplūšanas apkārtējā vidē. Kamerās jābūt pietiekami daudz vietas izmēģinājumu dzīvniekiem. Parasti, lai kamerā būtu noturīga atmosfēra, izmēģinājumu dzīvnieku kopējais “tilpums” nedrīkst pārsniegt 5 % no kameras tilpuma.
Jāveic šādu parametru mērījumi un uzraudzība:
i) gaisa plūsma – ieteicams pastāvīgi kontrolēt gaisa plūsmas ātrumu kamerā;
ii) koncentrācija – ikdienas ekspozīcijas laikā pārbaudāmās vielas koncentrācijas svārstības nedrīkst pārsniegt ± 15 % no tās vidējās vērtības. Visā izmēģinājuma laikā katru dienu pēc iespējas jācenšas nodrošināt nemainīgu vielas koncentrāciju;
iii) temperatūra un gaisa mitrums – ja izmanto grauzējus, temperatūrai jābūt 22 ± 2 oC, gaisa mitrumam kamerā jābūt 30–70 %, izņemot gadījumus, kad pārbaudāmās vielas suspendēšanai kameras atmosfērā izmanto ūdeni. Abi šie parametri nepārtraukti jāuzrauga;
iv) daļiņu lieluma mērījumi – ja izmanto šķidros vai cietos aerosolus, kameras atmosfērā jānosaka daļiņu sadalījums pēc lieluma. Aerosola daļiņām jābūt tādā lielumā, lai izmēģinājumu dzīvnieki tās varētu ieelpot. Kameras atmosfēras paraugi jāņem dzīvnieku inhalācijas zonā. Daļiņu sadalījumam gaisa paraugā jābūt tādam pašam kā gaisā, ko elpo dzīvnieki, un tam gravimetriski jāatbilst aerosola suspensijai kopumā pat tad, ja liela daļa aerosola nav ieelpojama. Gatavojot iekārtu izmēģinājumam, pietiekami bieži jāveic daļiņu lieluma analīze, lai pārliecinātos par aerosola noturīgumu; ekspozīcijas laikā tā jāveic tik bieži, lai pienācīgi noteiktu daļiņu sadalījuma nemainīgumu gaisā, ko ieelpo dzīvnieki.
1.6.7.
Kancerogenitātes pētījumi aptver izmēģinājumu dzīvnieku parastā mūža ilguma lielāko daļu. Pētījumi ar pelēm un kāmjiem ilgst 18 mēnešus, ar žurkām – 24 mēnešus, taču, ja izmanto dažas dzīvnieku līnijas, kam ir garāks mūža ilgums un/vai retāk reģistrē spontāni radušos audzējus, to ilgumu pelēm un kāmjiem pagarina līdz 24 mēnešiem, bet žurkām – līdz 30 mēnešiem. Tomēr šādus pagarinātos pētījumus var pārtraukt, ja izdzīvojušo dzīvnieku skaits pēc mazākās devas aplikācijas vai kontroles grupā ir sasniedzis 25 %. Ja pētījuma beigās atklājas, ka atkarībā no dzimuma dzīvnieki reaģē krasi atšķirīgi, datus par katru dzimumu apkopo atsevišķi. Ja priekšlaicīgi mirst tikai dzīvnieki, kas saņēmuši lielo devu, jo tā ir izteikti toksiska, pētījumi nav jāpārtrauc, ja vien citās dzīvnieku grupās nerodas problēmas toksicitātes dēļ. Negatīvs testa iznākums ir atzīstams par vērā ņemamu, ja dzīvnieku zudumi izmēģinājuma laikā autolīzes, kanibālisma vai tehnisku problēmu dēļ nepārsniedz 10 % un visās grupās ne mazāk kā 50 % dzīvnieku ir izdzīvojuši pēc 18 mēnešiem, ja tās ir peles, un pēc 24 mēnešiem, ja tās ir žurkas.
1.6.8. Testa norise
1.6.8.1.
Novērojot dzīvniekus, katru dienu jāpievērš uzmanība izmaiņām, kas skar ādu, acis un gļotādas, kā arī elpošanas orgānus, asinsriti, veģetatīvo un centrālo nervu sistēmu, somatomotoriku un uzvedības reakcijas
Pastāvīga dzīvnieku novērošana ļauj iespēju robežās samazināt dzīvnieku zudumus izmēģinājuma laikā kanibālisma, audu autolīzes vai nepiemērotu turēšanas apstākļu dēļ. Pamanot mirstošus dzīvniekus, tos uzreiz nošķir no pārējiem un secē.
Visiem dzīvniekiem reģistrē klīniskās pazīmes un nāves iestāšanos. Īpaši uzmanīgi jāseko audzēju attīstībai, reģistrējot katra skaidri saskatāma vai sataustāma audzēja parādīšanās brīdi, atrašanās vietu, izmērus, izskatu un tālāko attīstību.
Izmēģinājuma pirmo 13 nedēļu laikā barības patēriņš (un ūdens patēriņš, ja pārbaudāmā viela pievienota dzeramajam ūdenim) jānosaka katru nedēļu un pēc tam apmēram ik pēc trim mēnešiem, ja vien veselības stāvokļa vai ķermeņa svara izmaiņu dēļ nav jārīkojas citādi.
Izmēģinājuma pirmo 13 nedēļu laikā vienreiz nedēļā jāreģistrē katra dzīvnieka ķermeņa svars, bet vēlāk to dara vismaz ik pēc četrām nedēļām.
1.6.8.2.
Ja dzīvnieku novērojumi izmēģinājuma gaitā liecina par veselības stāvokļa pasliktināšanos, šiem dzīvniekiem pārbauda asins ainu.
Pēc 12 mēnešiem, 18 mēnešiem un pirms nokaušanas visiem dzīvniekiem ņem asinis un gatavo uztriepes. Asins ainas noteikšanai izmanto asins paraugus no dzīvniekiem pēc lielās devas aplikācijas un no kontroles dzīvniekiem. Ja šie dati, it īpaši tie, kas iegūti pirms nokaušanas, kā arī autopsijas rezultāti norāda uz tādu vajadzību, asins ainu pārbauda arī nākamās(-o) grupas(-u) dzīvniekiem, kas saņēmuši mazāku(-as) devu(-as).
Visiem dzīvniekiem, arī tiem, kas miruši izmēģinājuma laikā vai nokauti veselības stāvokļa dēļ, veic pilnu autopsiju. Jāsaglabā visi skaidri saredzami audzēji vai audi ar patoloģiskām izmaiņām un audzējiem līdzīgi veidojumi.
Piemērotā vidē jāsaglabā šādi orgāni un audi, lai turpmāk būtu iespējama to histopatoloģiskā izmeklēšana: smadzenes (ieskaitot iegareno smadzeņu/tilta audu paraugus, smadzenīšu garozu, smadzeņu garozu), hipofīze, vairogdziedzeris/epitēlijķermenīši, aizkrūts dziedzera audi, traheja un plaušas, sirds, aorta, siekalu dziedzeri, aknas, liesa, nieres, virsnieru dziedzeri, aizkuņģa dziedzeris, gonādas, dzemde, papildu dzimumorgāni, āda, barības vads, kuņģis, divpadsmitpirkstu zarna, tukšā zarna, līkumainā zarna, aklā zarna, lokzarna, taisnā zarna, urīnpūslis, limfmezglu paraugi, sievišķais piena dziedzeris, augšstilba muskulatūra, perifērās nervu sistēmas nervi, krūškauls ar kaula smadzenēm, augšstilba kauls (ar locītavu), triju līmeņu muguras smadzenes (no kakla, vidējā torakālā un gurnu rajona) un acis.
Vislabākais veids, kā saglabāt plaušu un urīnpūšļa audus, ir piepildīt šos orgānus ar fiksatoru; pienācīga plaušu histopatoloģiskā izmeklēšana pēc inhalācijas nav iespējama bez šādas apstrādes. Pēc inhalācijas testa jāsaglabā visi elpošanas orgāni, ieskaitot deguna dobumu, rīkli un balseni.
a) Orgānu un audu pilnu histopatoloģisko izmeklēšanu veic visiem pārbaudes laikā mirušiem vai nokautiem dzīvniekiem, kā arī visiem kontroles dzīvniekiem un dzīvniekiem pēc lielo devu aplikācijas.
b) Visu grupu dzīvniekiem mikroskopiski pārbauda visus skaidri saredzamus audzējus vai audzējam līdzīgus veidojumus.
c) Ja jaunveidojumu biežums dzīvnieku grupā pēc lielākās devas iedarbības un kontroles grupā ievērojami atšķiras, arī pārējās grupās jāveic šā konkrētā orgāna vai audu histopatoloģiskā izmeklēšana.
d) Ja mirstība dzīvnieku grupā pēc lielākās devas iedarbības ir ievērojami lielāka nekā kontroles grupā, vispusīgi jāpārbauda nākamās grupas dzīvnieki, kas saņēmuši mazāku devu.
e) Ja pēc lielās devas aplikācijas novēro toksicitāti vai citus simptomus, kas var ietekmēt audzēju rašanos, vispusīgi jāpārbauda nākamās grupas dzīvnieki, kas saņēmuši mazāku devu.
2. DATI
Dati jāapkopo tabulā, norādot dzīvnieku skaitu katrā izmēģinājumu grupā testa sākumā, to dzīvnieku skaitu, kam izmēģinājuma laikā novēroti audzēji, novērošanas brīdi un to dzīvnieku skaitu, kam audzēji atklāti pēc nokaušanas. Rezultāti jānovērtē, izmantojot piemērotu statistikas metodi. Var izmantot jebkuru atzītu statistikas metodi.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— dzīvnieku suga, līnija, izcelsme, turēšanas apstākļi, uzturs,
— testa apstākļi:
— 3.1.1. Inhalācijas iekārtas apraksts:
— norādot konstrukciju, modeli, izmērus, gaisa avotu, makrodaļiņu un aerosolu ģenerēšanas sistēmu, gaisa kondicionēšanas paņēmienu, izplūdes gaisa apstrādi un dzīvnieku turēšanas apstākļus izmēģinājumu kamerā, ja tādu izmanto. Jāapraksta ierīces temperatūras, gaisa mitruma un, vajadzības gadījumā, aerosolu koncentrācijas noturīguma vai daļiņu lieluma noteikšanai.
— 3.1.2. Ekspozīcijas režīms:
— šie dati jāapkopo tabulā, norādot vidējās vērtības, kā arī svārstību diapazonu (piemēram, standartnovirzi) un, ja iespējams, minot arī:
—a) gaisa plūsmas ātrumu inhalācijas iekārtā;
b) gaisa temperatūru un mitrumu;
c) nominālo koncentrāciju (inhalācijas iekārtā ievadītais pārbaudāmās vielas kopējais daudzums, kas izdalīts ar gaisa daudzumu);
d) nesējvielas tipu, ja tādu izmanto;
e) faktisko vielas koncentrāciju inhalācijas zonā;
f) daļiņu vidējo lielumu (vajadzības gadījumā),
— izmantotās devas (jānorāda arī nesējviela, ja tādu izmanto) un koncentrācijas,
— dati par audzēju biežumu atkarībā no dzimuma, devas un audzēju tipa,
— nāves iestāšanās brīdis izmēģinājuma laikā vai norāde, ka dzīvnieki ir izdzīvojuši,
— dati par toksiskajām reakcijām atkarībā no dzimuma un devas,
— toksiskās iedarbības vai citas iedarbības raksturojums,
— atsevišķu saindēšanās simptomu parādīšanās brīdis un to tālākā attīstība,
— dati par barības patēriņu un ķermeņa svaru,
— hematoloģiskie izmeklējumi un to rezultāti,
— autopsijas rezultāti,
— sīks histopatoloģisko izmeklējumu apraksts,
— rezultātu statistiskā apstrāde un izmantotās metodes,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.33. VIENLAICĪGA HRONISKĀS TOKSICITĀTES UN KANCEROGENITĀTES NOTEIKŠANA
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Vienlaicīga hroniskās toksicitātes un kancerogenitātes noteikšana ļauj pārbaudīt vielas hronisko un kancerogēno iedarbību uz zīdītājiem pēc ilgstošas ekspozīcijas.
Tādēļ kancerogenitātes noteikšanai izmanto vismaz vēl vienu papildu grupu, kas saņem pārbaudāmo vielu, un papildu kontroles grupu. Deva, ko saņem papildu grupas dzīvnieki, var būt lielāka par lielāko devu, ko izmanto kancerogenitātes testam. Dzīvniekiem, ko izmanto kancerogenitātes noteikšanai, pārbauda gan vispārējo toksicitāti, gan audzēju rašanos. Papildu grupas dzīvniekiem pēc vielas aplikācijas pārbauda vispārējo toksicitāti.
Izmantojot attiecīgo aplikācijas veidu, pārbaudāmo vielu parasti ievada septiņas dienas nedēļā vairāku izmēģinājumu grupu dzīvniekiem; katra grupa saņem vienādu devu, un ekspozīcijas laiks aptver ievērojamu mūža daļu. Ekspozīcijas laikā un arī vēlāk izmēģinājumu dzīvniekus katru dienu novēro un reģistrē toksiskuma pazīmes un audzēju rašanos.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
Vismaz piecas dienas pirms izmēģinājuma dzīvniekus pieradina pie dzīvošanas un barošanas apstākļiem, kādi būs izmēģinājuma laikā. Veselus, jaunus dzīvniekus pirms izmēģinājuma pēc nejaušības principa sadala apstrādes un kontroles grupās.
1.6.1.
Šim nolūkam ieteicams izmantot žurkas. Pamatojoties uz iepriekšējo testu rezultātiem, var izmantot arī citu sugu dzīvniekus (ne tikai grauzējus). Izmanto jaunus un veselus dzīvniekus, kas pieder pie plaši izplatītām laboratorijas dzīvnieku līnijām, un vielu sāk ievadīt uzreiz pēc atšķiršanas.
Uzsākot testu, dzīvnieku ķermeņa svara svārstības nedrīkst pārsniegt ± 20 % no vidējā svara. Ja subhroniskās toksicitātes testu pēc perorālas aplikācijas veic pirms ilglaicīga testa, abos pētījumos jāizmanto tās pašas sugas un šķirnes/līnijas dzīvnieki.
1.6.2.
Ja izmanto grauzējus, vienu un to pašu devu ievada vismaz 100 dzīvniekiem (50 mātītēm un 50 tēviņiem), vienlaikus jābūt arī kontroles grupai. Mātītes nedrīkst būt iepriekš dzemdējušas vai grūsnas. Ja dzīvnieku nonāvēšana paredzēta arī izmēģinājuma laikā, to skaits ir jāpalielina par to dzīvnieku skaitu, kuri tiks nokauti izmēģinājuma gaitā.
Papildu grupā(-ās), kurā(-ās) dzīvniekiem pēc vielas iedarbības pārbauda patoloģiskas izmaiņas, izņemot audzējus, jābūt pa 20 abu dzimumu īpatņiem, bet kontroles grupā pa 10 abu dzimumu īpatņiem.
1.6.3.
Kancerogenitātes noteikšanai izmanto vismaz trīs dažādas devas, un vienlaikus jābūt arī kontroles grupai. Jāizvēlas tāda lielākā deva, kas izraisa nenozīmīgas toksiskuma pazīmes, piemēram, nelielus ķermeņa svara zudumus (līdz 10 %), un ievērojami neietekmē dzīvnieku mūža garumu, ja vien tas nav saistīts ar audzēju rašanos.
Viela vismazākajā devā nedrīkst traucēt dzīvnieku normālo augšanu, attīstību un mūža ilgumu vai izraisīt jebkādus toksicitātes simptomus. Parasti tai vajadzētu sasniegt vismaz 10 % no lielās devas.
Vidēji lielo(-ās) devu(-as) izvēlas pa vidu starp lielo un mazo devu.
Izvēloties šīs devas, jāņem vērā iepriekšējo toksicitātes testu un pētījumu rezultāti.
Hroniskās toksicitātes noteikšanai izmanto papildu grupas, kurās dzīvnieki saņem pārbaudāmo vielu, un vienlaikus jābūt arī papildu kontroles grupai. Vielas lielākajai devai, ko saņem papildu grupas dzīvnieki, jābūt izteikti toksiskai.
Pārbaudāmo vielu parasti ievada katru dienu.
Ja vielu pievieno dzeramajam ūdenim vai uzturam, tai visu laiku jābūt pieejamai dzīvniekiem.
1.6.4.
Vienlaikus jābūt kontroles dzīvniekiem, kas atšķiras no pārējiem dzīvniekiem tikai ar to, ka nesaņem pārbaudāmo vielu.
Īpašos gadījumos, piemēram, ja izmanto inhalācijas testu ar aerosolu vai perorālu aplikāciju ar emulgatoru, kura bioloģiskā aktivitāte nav zināma, papildus jābūt negatīvās kontroles grupai, kas nesaņem šķīdinātāju/nesējvielu.
1.6.5.
Trīs galvenie ievadīšanas veidi ir perorāla vai ārīga aplikācija un inhalācija. Ievadīšanas veida izvēle ir atkarīga no pārbaudāmās vielas fizikālajām un ķīmiskajām īpašībām, kā arī no tā, kādā veidā cilvēki parasti nonāk saskarē ar šo vielu.
1.6.5.1.
Ja pārbaudāmā viela organismā nonāk caur kuņģa–zarnu traktu un ja tieši tādā veidā tā var apdraudēt cilvēkus, ieteicams izmantot perorālu aplikāciju, ja tam nav kontrindikāciju. Dzīvnieki var saņemt pārbaudāmo vielu kopā ar uzturu, dzeramo ūdeni vai kapsulās.
Dzīvnieki parasti saņem vielas devu katru dienu septiņas dienas nedēļā, jo, ja vielu ievada tikai piecas dienas nedēļā, “tukšajā laikā” dzīvnieki var atkopties, toksicitātes simptomi iet mazumā, kas savukārt ietekmē rezultātus un to novērtēšanu. Tomēr, galvenokārt pamatojoties uz praktiskiem apsvērumiem, uzskata, ka ir arī pieļaujama vielas ievadīšana piecas dienas nedēļā.
1.6.5.2. Ārīga aplikācija
Ārīgu aplikāciju, uztriepjot vielu uz ādas, var izvēlēties tad, ja simulē vienu no galvenajiem veidiem, kā viela iekļūst cilvēku organismā, un ja to izmanto kā modeli ādas bojājumu inducēšanai.
1.6.5.3. Inhalācijas tests
Tā kā, veicot inhalācijas testu, rodas lielākas tehniskas grūtības nekā tad, kad izmanto citus aplikācijas veidus, šeit sniegti sīkāki norādījumi attiecībā uz šā testa izmantošanu. Jāpiezīmē, ka atsevišķos gadījumos kā veiksmīgu alternatīvu var izmantot intratraheālu instilāciju.
Izvēloties ilglaicīgu ekspozīciju, parasti ņem vērā cilvēku iespējamo saskari ar vielu, tālab dzīvniekus katru dienu piecas reizes nedēļā uz sešām stundām ievieto inhalācijas kamerā ar vienmērīgu vielas koncentrāciju (periodiskā ekspozīcija) vai, ņemot vērā iespējamo vielas klātbūtni apkārtējā vidē, tos katru dienu septiņas dienas nedēļā uz 22–24 stundām pakļauj vielas iedarbībai (nepārtrauktā ekspozīcija), katru dienu vienādā laikā paredzot vienu stundu dzīvnieku barošanai un inhalācijas kameras apkopšanai. Parasti abos gadījumos dzīvnieki saņem pārbaudāmo vielu noteiktā koncentrācijā. Galvenā atšķirība starp periodisko un nepārtraukto ekspozīciju ir tā, ka pirmajā gadījumā, beidzoties iedarbībai, dzīvnieki var atkopties 17–18 stundu laikā un nedēļas nogalē šis atkopšanās laiks ir vēl garāks.
Periodiskās vai nepārtrauktās ekspozīcijas izvēle ir atkarīga no pētījuma mērķiem un no izvēlētā modeļa, kas simulē apstākļus, kādos cilvēki nonāk saskarē ar šo vielu. Šeit tomēr jārēķinās ar dažām tehniskām grūtībām. Piemēram, nepārtrauktās ekspozīcijas priekšrocības, modelējot apkārtējās vides apstākļus, var mazināt tas, ka ekspozīcijas laikā dzīvnieki jābaro un ir jāizmanto daudz sarežģītākas (un precīzākas) aerosola un tvaika ģenerēšanas un kontroles metodes.
1.6.6.
Izmēģinājumos ar dzīvniekiem izmanto inhalācijas kameras, kas nodrošina dinamisku gaisa plūsmu (vismaz 12 gaisa maiņas stundā), pietiekamu skābekļa koncentrāciju un vienmērīgu atmosfēru ekspozīcijas laikā. Kontroles un izmēģinājumu dzīvniekiem izmanto vienādas uzbūves un konstrukcijas inhalācijas kameras, kas nodrošina līdzvērtīgus ekspozīcijas apstākļus, izņemot pārbaudāmās vielas klātbūtni. Gaisa spiediens kamerā parasti ir nedaudz pazemināts, lai izvairītos no pārbaudāmās vielas izplūšanas apkārtējā vidē. Kamerās jābūt pietiekami daudz vietas izmēģinājumu dzīvniekiem. Parasti, lai kamerā būtu noturīga atmosfēra, izmēģinājumu dzīvnieku kopējais “tilpums” nedrīkst pārsniegt 5 % no kameras tilpuma.
Jāveic šādu parametru mērījumi un uzraudzība:
i) gaisa plūsma – vēlams pastāvīgi kontrolēt gaisa plūsmas ātrumu kamerā;
ii) vielas koncentrācijas svārstības ekspozīcijas laikā nedrīkst pārsniegt ± 15 % no vidējās vērtības. Visā izmēģinājuma laikā katru dienu pēc iespējas jācenšas nodrošināt nemainīgu vielas koncentrāciju;
iii) temperatūra un gaisa mitrums – ja izmanto grauzējus, temperatūrai jābūt 22 ± 2 oC, gaisa mitrumam kamerā jābūt 30–70 %, izņemot gadījumus, kad pārbaudāmās vielas suspendēšanai kameras atmosfērā izmanto ūdeni. Abi šie parametri nepārtraukti jāuzrauga;
iv) daļiņu lieluma mērījumi – ja izmanto šķidros vai cietos aerosolus, kameras atmosfērā jānosaka daļiņu sadalījums pēc lieluma. Aerosola daļiņām jābūt tādā lielumā, lai izmēģinājumu dzīvnieki tās varētu ieelpot. Kameras atmosfēras paraugi jāņem dzīvnieku inhalācijas zonā. Daļiņu sadalījumam gaisa paraugā jābūt tādam pašam kā gaisā, ko elpo dzīvnieki, un tam gravimetriski jāatbilst aerosola suspensijai kopumā pat tad, ja liela daļa aerosola nav ieelpojama. Gatavojot iekārtu izmēģinājumam, pietiekami bieži jāveic daļiņu lieluma analīze, lai pārliecinātos par aerosola noturīgumu; ekspozīcijas laikā tā jāveic tik bieži, lai pienācīgi noteiktu daļiņu sadalījuma nemainīgumu gaisā, ko elpo dzīvnieki.
1.6.7.
Tieši kancerogenitātes noteikšana aizņem izmēģinājumu dzīvnieku mūža ilguma lielāko daļu. Pētījumi ar pelēm un kāmjiem ilgst 18 mēnešus, ar žurkām – 24 mēnešus, taču, ja izmanto dažas dzīvnieku līnijas, kam ir garāks mūža ilgums un/vai kam retāk reģistrē spontāni radušos audzējus, to ilgumu pelēm un kāmjiem pagarina līdz 24 mēnešiem, bet žurkām – līdz 30 mēnešiem. Tomēr šos pagarinātos pētījumus var pārtraukt, ja izdzīvojušo dzīvnieku skaits pēc mazākās devas aplikācijas vai kontroles grupā ir sasniedzis 25 %. Ja pētījuma beigās atklājas, ka atkarībā no dzimuma dzīvnieki reaģē krasi atšķirīgi, datus par katru dzimumu apkopo atsevišķi. Ja priekšlaicīgi mirst tikai dzīvnieki, kas saņēmuši lielo devu, jo tā ir izteikti toksiska, pētījumi nav jāpārtrauc, ja vien citās dzīvnieku grupās nerodas problēmas toksicitātes dēļ. Negatīvs pētījumu iznākums atzīstams par vērā ņemamu, ja dzīvnieku zudumi izmēģinājumā laikā autolīzes, kanibālisma vai tehnisku problēmu dēļ visās grupās nepārsniedz 10 % un visās grupās ne mazāk kā 50 % dzīvnieku ir izdzīvojuši pēc 18 mēnešiem, ja tās ir peles, un pēc 24 mēnešiem, ja tās ir žurkas.
Papildu grupas, kurās ir pa 20 katra dzimuma dzīvniekiem, un attiecīgie kontroles dzīvnieki (pa 10 no katra dzimuma), kam pārbauda hronisko toksicitāti, jāsaglabā vismaz 12 mēnešus. Šos dzīvniekus paredzēts secēt, lai pārbaudītu vielas izraisītās patoloģiskās izmaiņas, kuras nav radušās novecošanas gaitā.
1.6.8.
1.6.8.1. Dzīvnieku novērošana
Novērojot dzīvniekus, katru dienu jāpievērš uzmanība izmaiņām, kas skar ādu, acis un gļotādas, kā arī elpošanas orgānus, asinsriti, veģetatīvo un centrālo nervu sistēmu, somatomotoriku un uzvedības reakcijas.
Papildu grupas(-u) dzīvniekus, kas saņem pārbaudāmo vielu, pēc attiecīgiem laika intervāliem pakļauj klīniskajai izmeklēšanai.
Pastāvīga dzīvnieku novērošana ļauj iespēju robežās pārliecināties, ka nerodas dzīvnieku zudumi kanibālisma, audu autolīzes vai nepareizu turēšanas apstākļu dēļ. Pamanot mirstošus dzīvniekus, tos uzreiz nošķir no pārējiem un secē.
Visiem dzīvniekiem reģistrē klīniskos simptomus, tostarp neiroloģiskās izmaiņas un izmaiņas acīs, kā arī nāves iestāšanos. Īpaši uzmanīgi jāseko audzēju attīstībai, reģistrējot katra skaidri saskatāma vai sataustāma audzēja parādīšanās brīdi, atrašanās vietu, izmērus, izskatu un tālāko attīstību. Jāreģistrē toksicitātes simptomu parādīšanās brīdis un to tālākā attīstība.
Izmēģinājuma pirmo 13 nedēļu laikā barības patēriņš (un ūdens patēriņš, ja pārbaudāmā viela pievienota dzeramajam ūdenim) jānosaka katru nedēļu un pēc tam apmēram ik pēc trim mēnešiem, ja vien veselības stāvokļa vai ķermeņa svara izmaiņu dēļ nav jārīkojas citādi.
Izmēģinājuma pirmo 13 nedēļu laikā vienreiz nedēļā jāreģistrē katra dzīvnieka ķermeņa svars, bet vēlāk to dara vismaz ik pēc četrām nedēļām.
1.6.8.2. Klīniskās pārbaudes
Hematoloģiskā izmeklēšana (piemēram, hemoglobīna satura, hematokrīta skaitļa, kopējā eritrocītu skaita, kopējā leikocītu skaita, trombocītu un citu asins recēšanas rādītāju noteikšana) jāveic pēc trim mēnešiem, sešiem mēnešiem, tad apmēram ik pēc sešiem mēnešiem un vēl izmēģinājuma beigās, ņemot asins paraugus no 10 katra dzimuma žurkām visās dzīvnieku grupās. Ja iespējams, pēc katra laika intervāla paraugi jāņem no tām pašām žurkām. Ja dzīvnieku novērojumi liecina par veselības stāvokļa pasliktināšanos izmēģinājuma gaitā, tiem jāpārbauda asins aina.
Asins ainas noteikšanai izmanto asins paraugus no dzīvniekiem, kas saņēmuši lielāko devu, un no kontroles dzīvniekiem. Dzīvniekiem, kas saņēmuši vielu mazākā(-ās) devā(-ās), asins ainu nosaka tikai tad, ja starp dzīvniekiem, kas saņēmuši lielāko devu, un kontroles dzīvniekiem novēro lielas svārstības vai ja tas izriet no autopsijas rezultātiem.
Paraugus urīnanalīzei ņem no 10 katra dzimuma žurkām visās grupās, ja iespējams, no tām pašām žurkām un ar tādiem pašiem laika intervāliem kā hematoloģiskajiem izmeklējumiem. Ja izmanto grauzējus, katram dzīvniekam atsevišķi vai visiem viena dzimuma/grupas paraugiem kopumā veic šādas analīzes:
— izskats – tilpums un īpatnējais blīvums katram dzīvniekam,
— olbaltumvielas, glikoze, ketoni, asins (puskvantitatīvi) urīnā,
— nogulsnes (puskvantitatīvi).
Apmēram ik pēc sešiem mēnešiem un izmēģinājuma beigās visiem dzīvniekiem, kas nepieder pie grauzējiem, un 10 katra dzimuma žurkām visās grupās, ja iespējams, pēc katra laika intervāla no tām pašām žurkām, ņem asins paraugus klīniskās bioķīmijas izmeklējumiem. Bez tam, ja tie nav grauzēji, asins paraugs jāņem arī pirms izmēģinājuma. No šiem paraugiem iegūst plazmu un tajā nosaka:
— olbaltumvielu kopējo koncentrāciju,
— albumīna koncentrāciju,
— aknu funkcionālo darbību (piemēram, sārmainās fosfatāzes aktivitāti, glutamātpiruvāttransamināzes (20) aktivitāti un glutamātoksalacetāttransamināzes (20) aktivitāti), gamma-glutamiltranspeptidāzi, ornitīndekarboksilāzi,
— ogļhidrātu metabolismu, piemēram, glikozi pēc badošanās,
— nieru funkcionālo darbību, piemēram, urīnvielas slāpekli asinīs.
Visiem dzīvniekiem, arī tiem, kas miruši izmēģinājuma laikā vai nokauti veselības stāvokļa dēļ, veic pilnu autopsiju. Pirms nokaušanas dzīvniekiem ņem asins paraugu asins ainas noteikšanai. Jāsaglabā visi skaidri saredzami audzēji vai audzējiem līdzīgi veidojumi. Jāmēģina rast korelāciju starp autopsijas datiem un mikroskopijas rezultātiem.
Visi orgāni un audi jāsaglabā histopatoloģiskajai izmeklēšanai. Tas parasti attiecas uz šādiem orgāniem un audiem – smadzenēm ( 21 ) (iegarenās smadzenes/tilts, smadzenīšu garoza, smadzeņu garoza), hipofīzi, vairogdziedzeri (kopā ar epitēlijķermenīšiem), aizkrūts dziedzeri, plaušām (kopā ar traheju), sirdi, aortu, siekalu dziedzeriem, aknām (21) , liesu, nierēm (21) , virsnieru dziedzeriem (21) , barības vadu, kuņģi, divpadsmitpirkstu zarnu, tukšo zarnu, līkumaino zarnu, aklo zarnu, lokzarnu, taisno zarnu, dzemdi, urīnpūsli, limfmezgliem, aizkuņģa dziedzeri, gonādām (21) , papildu dzimumorgāniem, sievišķo piena dziedzeri, ādu, muskulatūru, perifērās nervu sistēmas nerviem, muguras smadzenēm (kakla, vidējais torakālais un gurnu rajons), krūšu kaulu ar kaula smadzenēm, augšstilba kaulu (kopā ar locītavu) un acīm.
Vislabākais veids, kā saglabāt plaušu un urīnpūšļa audus, ir piepildīt šos orgānus ar fiksatoru; pienācīga plaušu histopatoloģiskā izmeklēšana pēc inhalācijas nav iedomājama bez šādas apstrādes. Veicot īpašus klīniskos pētījumus, piemēram, pēc inhalācijas, jāpārbauda visi elpošanas orgāni, ieskaitot degunu, rīkli un balseni.
Ja ir veikti citi klīniskie izmeklējumi, tajos iegūtie dati jāapkopo pirms mikroskopiskās pārbaudes, jo tie var sniegt svarīgu informāciju patologam.
Hroniskās toksicitātes noteikšanai:
rūpīgi jāizmeklē visi uzglabātie orgāni, kas paņemti no katra dzīvnieka papildu grupā pēc lielākās devas aplikācijas un kontroles grupā. Ja papildu grupas dzīvniekiem pēc lielākās devas aplikācijas konstatē patoloģiskas izmaiņas, ko izraisījusi pārbaudāmā viela, visiem pārējiem dzīvniekiem visās papildu grupās pēc vielas iedarbības, kā arī dzīvnieku grupās, kurām ievadīta viela kancerogenitātes testa laikā, veic iedarbības skarto orgānu vispusīgu un padziļinātu histoloģisko izmeklēšanu.
Kancerogenitātes noteikšanai:
a) orgānu un audu pilnu histopatoloģisko izmeklēšanu veic visiem testa laikā mirušiem vai nokautiem dzīvniekiem, kā arī visiem kontroles dzīvniekiem un dzīvniekiem pēc lielākās devas aplikācijas;
b) visās grupās mikroskopiski pārbauda visus skaidri saredzamus audzējus vai audzējam līdzīgus veidojumus neatkarīgi no orgāna;
c) ja jaunveidojumu biežums dzīvnieku grupā pēc lielākās devas aplikācijas un kontroles grupā ievērojami atšķiras, arī pārējās grupās jāveic šā konkrētā orgāna vai audu histopatoloģiskā izmeklēšana;
d) ja mirstība dzīvnieku grupā pēc lielākās devas aplikācijas ir ievērojami lielāka nekā kontroles grupā, vispusīgi jāpārbauda nākamās grupas dzīvnieki, kas saņēmuši mazāku devu;
e) ja pēc lielās devas aplikācijas novēro toksicitāti vai citus simptomus, kas var ietekmēt audzēju rašanos, vispusīgi jāpārbauda nākamās grupas dzīvnieki, kas saņēmuši mazāku devu.
2. DATI
Dati jāapkopo tabulā, norādot dzīvnieku skaitu katrā izmēģinājumu grupā testa sākumā, to dzīvnieku skaitu, kam izmēģinājuma laikā novēroti audzēji vai toksicitātes simptomi, novērošanas brīdī un to dzīvnieku skaitu, kam audzēji atklāti pēc nokaušanas. Rezultāti jānovērtē, izmantojot piemērotu statistikas metodi. Var izmantot jebkuru atzītu statistikas metodi.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— dzīvnieku suga, līnija/celms, izcelsme, turēšanas apstākļi, barība utt.,
— testa apstākļi:
— 3.1.1. Inhalācijas iekārtas apraksts:
— norādot tās konstrukciju, modeli, izmērus, gaisa avotu, makrodaļiņu un aerosolu ģenerēšanas sistēmu, gaisa kondicionēšanas paņēmienu, izplūdes gaisa apstrādi un dzīvnieku turēšanas apstākļus izmēģinājumu kamerā, ja tādu izmanto. Jāapraksta ierīces temperatūras, gaisa mitruma un, vajadzības gadījumā, aerosolu koncentrācijas noturīguma vai daļiņu lieluma noteikšanai.
— 3.1.2. Ekspozīcijas režīms:
— šie dati jāapkopo tabulā, norādot vidējās vērtības, kā arī svārstību diapazonu (piemēram, standartnovirzi) un, ja iespējams, minot arī:
—a) gaisa plūsmas ātrumu inhalācijas iekārtā;
b) gaisa temperatūru un mitrumu;
c) nominālo koncentrāciju (inhalācijas iekārtā ievadītais pārbaudāmās vielas kopējais daudzums, kas izdalīts ar gaisa daudzumu);
d) nesējvielas tipu, ja tādu izmanto;
e) faktisko vielas koncentrāciju inhalācijas zonā;
f) daļiņu vidējo lielumu (vajadzības gadījumā),
— izmantotās devas (jānorāda arī nesējviela, ja tādu izmanto) un koncentrācijas,
— dati par audzēju biežumu atkarībā no dzimuma, devas un audzēju tipa,
— nāves iestāšanās brīdis izmēģinājuma laikā vai norāde, ka dzīvnieki ir izdzīvojuši; tas attiecas arī uz papildu grupu,
— dati par toksiskajām reakcijām atkarībā no dzimuma un devas,
— toksiskās iedarbības vai citas iedarbības raksturojums,
— atsevišķu saindēšanās simptomu parādīšanās brīdis un to tālākā attīstība,
— oftalmoloģijas dati,
— barības patēriņš un ķermeņa svara izmaiņas,
— hematoloģiskie izmeklējumi un to rezultāti,
— klīniskās bioķīmijas izmeklējumi un to rezultāti (arī urīnanalīzes rezultāti, ja tādi ir),
— autopsijas rezultāti,
— sīks histopatoloģisko izmeklējumu apraksts,
— rezultātu statistiskā apstrāde un izmantotās metodes,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B. 34. TOKSICITĀTES IETEKME UZ VIENAS PAAUDZES REPRODUKTĪVO FUNKCIJU
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Vairākas grupas vīriešu un sieviešu kārtas dzīvnieku saņem pārbaudāmo vielu dažādās devās. Tēviņi to saņem augšanas stadijā un vismaz viena pilna spermatoģenēzes cikla laikā (kas pelēm ilgst apmēram 56 dienas un žurkām – 70 dienas), lai noskaidrotu pārbaudāmās vielas kaitīgo ietekmi uz spermatoģenēzi.
Vecākpaaudzes (P) mātītes to saņem vismaz divu pilnu estrālo ciklu laikā, lai noskaidrotu pārbaudāmās vielas kaitīgo ietekmi uz šo ciklu. Tad dzīvniekus pāro. Pārbaudāmo vielu pārošanās laikā saņem abu dzimumu dzīvnieki, bet vēlāk to saņem tikai mātītes grūtniecības un zīdīšanas laikā. Ja izmanto inhalācijas testu, metodei būs vajadzīgi pielāgojumi.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
1.6.1. Sagatavošanas darbi
Veselus un jaunus pieaugušus dzīvniekus pirms izmēģinājuma pēc nejaušības principa sadala apstrādes un kontroles grupās. Vismaz piecas dienas pirms izmēģinājuma dzīvniekus pieradina pie dzīvošanas un barošanas apstākļiem, kādi būs izmēģinājuma laikā. Pārbaudāmo vielu ieteicams pievienot barībai vai dzeramajam ūdenim. Var izmantot arī citus aplikācijas veidus. Pārbaudāmo vielu izmēģinājuma laikā visi dzīvnieki saņem pēc vienādas shēmas. Ja izmanto šķīdinātāju vai citas piedevas, kas atvieglo pārbaudāmās vielas ievadīšanu vajadzīgajā devā, ir jāpārliecinās, ka tie nav toksiski.
1.6.2. Izmēģinājumu dzīvnieki
Dzīvnieku sugas izvēle
Parasti priekšroku dod žurkām vai pelēm. Izmanto veselus dzīvniekus, ar kuriem iepriekš nav veikti nekādi izmēģinājumi. Šim nolūkam neder dzīvnieku līnijas ar pazeminātu vaislību. Izmēģinājumu dzīvniekiem norāda sugu, līniju, dzimumu, svaru un/vai vecumu.
Pienācīgai reproduktīvo spēju novērtēšanai jāveic pētījumi ar abu dzimumu dzīvniekiem. Visus izmēģinājumu un kontroles dzīvniekus izmanto pēc atšķiršanas no mātes.
Katrā apstrādes un kontroles grupā jābūt pietiekamam dzīvnieku skaitam, lai iegūtu ap 20 grūsnām mātītēm pirmsatnešanās stadijā.
Šādā veidā var nodrošināt pietiekamā daudzumā grūsnas mātītes un mazuļus, lai varētu statistiski novērtēt vielas ietekmi uz P paaudzes dzīvnieku reproduktīvajām spējām, grūsnību un mātišķo dzīvnieku uzvedību, kā arī uz F1 pēcnācēju zīšanu, augšanu un attīstību no aizmešanās līdz atšķiršanai.
1.6.3.
Barību un ūdeni dzīvnieki saņem ad libitum. Grūsnas mātītes īsi pirms atnešanās ievieto atsevišķos šim nolūkam paredzētos būros, vajadzības gadījumā nodrošina materiālu midzeņa ierīkošanai.
1.6.3.1.
Jābūt vismaz trim izmēģinājumu grupām un vienai kontroles grupai. Ja pārbaudāmo vielu ievada kopā ar šķīdinātāju, kontroles dzīvnieki saņem maksimālo izmantoto šķīdinātāja daudzumu. Ja pārbaudāmās vielas ietekmē samazinās uztura patēriņš vai tā uzņemšana organismā, var ieviest kontroles grupu, kas saņem līdzīgu uztura daudzumu. Ja to pieļauj pārbaudāmās vielas fizikālās/ķīmiskās vai bioloģiskās īpašības, jāizvēlas tāda lielākā deva, kas ir toksiska vecākdzīvniekiem (P), bet kas neveicina mirstību. Jāizvēlas tāda(-as) vidēji lielā(-ās) deva(-as), lai pārbaudāmās vielas izraisītā toksicitāte būtu minimāla, un tāda mazākā deva, lai tās kaitīgā ietekme uz vecākdzīvniekiem un pēcnācējiem nebūtu pamanāma. Ja pārbaudāmo vielu ievada ar zondes palīdzību vai kapsulās, tās deva jāizvēlas atkarībā no katra dzīvnieka ķermeņa svara un to katru nedēļu pielāgo ķermeņa svara izmaiņām. Devas, ko saņem mātītes grūsnības laikā, var aprēķināt pēc to ķermeņa svara tieši pirms izmēģinājuma vai grūsnības sestajā dienā.
1.6.3.2.
Ja maztoksiska viela, kuras deva ir vismaz 1 000 mg/kg, nekādi neiespaido dzīvnieku reproduktīvās spējas, tās turpmāka pārbaude, izmantojot citas devas, nav vajadzīga. Ja iepriekšējie pētījumi rāda, ka lielākā deva izteikti toksiski iedarbojas uz mātītēm, bet negatīvi neietekmē auglību, tās turpmāka pārbaude, izmantojot citas devas, nav vajadzīga.
1.6.3.3. Testa norise
Vecākpaaudzes (P) tēviņi sāk katru dienu saņemt pārbaudāmo vielu pēc atšķiršanas un vismaz pēc piecu dienu aklimatizēšanās, kad tie ir aptuveni 5–9 nedēļas veci. Žurkas turpina saņemt vielu 10 nedēļu laikā pirms pārošanās (peles – 8 nedēļas). Tēviņus nokauj un izmeklē tūlīt pēc pārošanās perioda beigām vai arī turpina tiem dot pārbaudāmo vielu, lai vajadzības gadījumā no tiem iegūtu vēl vienu metienu; tādā gadījumā tos nokauj un izmeklē īsi pirms izmēģinājuma beigām. Vecākpaaudzes (P) mātītes sāk saņemt pārbaudāmo vielu pēc vismaz piecu dienu aklimatizēšanās un turpina to saņemt vēl vismaz divas nedēļas pirms pārošanās. P mātītes turpina katru dienu saņemt vielu visā trīs nedēļu garajā pārošanās laikā, grūsnības laikā un vēlāk līdz F1 pēcteču atšķiršanai. Vielas ievadīšanas shēmu var koriģēt, ja ir pieejama papildu informācija par pārbaudāmo vielu, piemēram, par tās metabolisko aktivāciju vai bioakumulāciju.
Pētot toksicitātes ietekmi uz reproduktīvo funkciju, var izmantot pārošanas shēmu 1:1 (viens tēviņš un viena mātīte) vai 1:2 (viens tēviņš un divas mātītes).
Ja izmanto shēmu 1:1, mātīte paliek kopā ar tēviņu, līdz tā kļūst grūsna vai kamēr nav pagājušas trīs nedēļas. Katru rītu mātītēm pārbauda spermas vai embola klātbūtni makstī. Grūtniecību sāk skaitīt no dienas, kad mātītei makstī konstatē embolu vai spermu.
Ja pārošanās neizdodas, dzīvniekus pārbauda, lai noteiktu varbūtējās neauglības cēloņus.
Var izmēģināt papildu pārošanos ar citu tēviņu, kura vaislība ir pierādīta, veikt reproduktīvo orgānu mikroskopisko izmeklēšanu, kā arī pārbaudīt estrālo ciklu vai spermatoģenēzi.
Pētot auglību pēc pārbaudāmās vielas aplikācijas, dzīvniekiem ļauj netraucēti laist pasaulē pēcnācējus un tos audzināt līdz atšķiršanas brīdim.
Ja tomēr jāsamazina mazuļu skaits metienā, to iesaka veikt šādi. Starp pirmo un ceturto dienu pēc atnešanās mazuļu skaitu katrā metienā var samazināt, pēc iespējas atstājot tajā četrus vīrišķos un četrus sievišķos mazuļus.
Ja vīrišķo un sievišķo mazuļu skaits neļauj atstāt pa četriem katra dzimuma īpatņiem katrā metienā, to var samazināt daļēji (piemēram, atstājot piecus tēviņus un trīs mātītes). Mazuļu skaitu nevar samazināt, ja metienā ir mazāk par astoņiem mazuļiem.
1.6.4.
Visu izmēģinājuma laiku katru dzīvnieku vismaz vienreiz dienā novēro. Reģistrē acīm redzamas izmaiņas uzvedībā, grūtas vai novēlotas atnešanās gadījumus un toksiskuma pazīmes, kā arī nāves gadījumus. Pirms pārošanās un pārošanās laikā katru dienu var noteikt barības patēriņu. Pēc atnešanās, kā arī zīdīšanas laikā barības patēriņš (un ūdens patēriņš, ja pārbaudāmo vielu pievieno dzeramajam ūdenim) ir jānosaka tajā pašā dienā, kad nosaka metiena svaru. P tēviņi un mātītes jānosver pirmajā vielas aplikācijas dienā un tad ik pēc nedēļas. Novērojumu rezultātus protokolē atsevišķi par katru pieaugušo dzīvnieku.
Grūtniecības ilgumu skaita no grūtniecības “nulles dienas”. Katru metienu, tiklīdz iespējams, apskata uzreiz pēc atnešanās, reģistrējot mazuļu skaitu un dzimumu, nedzīvi piedzimušos, dzīvi piedzimušos un acīm redzamas anomālijas.
Nedzīvos mazuļus un mazuļus, kas nokauti ceturtajā dienā, uzglabā un pārbauda tiem iespējamos defektus. Dzīvos mazuļus pārskaita un visu metienu kopā, kā arī katru mazuli atsevišķi nosver nākamajā rītā pēc atnešanās, tad ceturtajā un septītajā dienā, bet vēlāk ik pēc nedēļas, kamēr turpinās izmēģinājums.
Mātītei un pēcnācējiem reģistrē visas novērotās kroplības vai uzvedības traucējumus.
1.6.5. Patoloģiskas izmaiņas
1.6.5.1.
P paaudzes dzīvnieki pēc nokaušanas vai pēc nāves izmēģinājuma laikā makroskopiski jāizmeklē, reģistrējot jebkuras anatomiskas anomālijas vai patoloģiskas izmaiņas, īpašu uzmanību pievēršot reproduktīvās sistēmas orgāniem. Defektus meklē arī mirušiem un mirstošiem mazuļiem.
1.6.5.2.
Visiem P dzīvniekiem izņem un uzglabā olnīcas, dzemdi, maksti, sēkliniekus, sēklinieku piedēkļus, sēklas pūslīšus, priekšdziedzeri, koagulācijas dziedzeri, hipofīzi un mērķorgānu(-us) tālākai izmeklēšanai ar mikroskopu. Ja šie orgāni nav iepriekš izpētīti pēc vairākkārtējas devas ievadīšanas, tos mikroskopiski izmeklē visiem dzīvniekiem pēc lielākās devas aplikācijas un kontroles dzīvniekiem, kā arī izmēģinājuma laikā mirušiem dzīvniekiem, ja to var izdarīt.
Orgānus, kuros šiem dzīvniekiem novēro patoloģiskas izmaiņas, pārbauda arī visiem pārējiem P dzīvniekiem. Šajā gadījumā mikroskopiski jāizmeklē visi audi ar acīm redzamām patoloģiskām izmaiņām. Kā jau minēts iedaļā par dzīvnieku pārošanu, mikroskopiski var izmeklēt arī reproduktīvās sistēmas orgānus tiem dzīvniekiem, kuru auglība ir apšaubīta.
2. DATI
Datus var apkopot tabulā, norādot dzīvnieku skaitu katrā izmēģinājumu grupā testa sākumā, auglīgo tēviņu skaitu, grūsno mātīšu skaitu, patoloģisko izmaiņu tipus un dzīvnieku procentuālo īpatsvaru ar katra tipa izmaiņām.
Ja iespējams, visi skaitliskie rezultāti jāizvērtē ar piemērotu statistikas metodi. Var izmantot jebkuru vispāratzītu statistikas metodi.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, jānorāda šādas ziņas:
— izmantotā suga/līnija,
— dati par toksiskajām reakcijām atkarībā no dzimuma un devas, arī par reproduktīvajām spējām, grūtniecību un dzīvotspēju,
— nāves iestāšanās brīdis izmēģinājuma laikā vai norāde, ka dzīvnieki ir izdzīvojuši līdz paredzētajam nokaušanas brīdim vai līdz izmēģinājuma beigām,
— tabula, kurā norādīts katra metiena svars, mazuļu vidējais svars un atsevišķu mazuļu svars izmēģinājuma beigās,
— toksiska vai cita iedarbība uz reproduktīvajām spējām, pēcnācējiem un postnatālo attīstību,
— atsevišķu saindēšanās simptomu parādīšanās brīdis un to tālākā attīstība,
— dati par P dzīvnieku ķermeņa svaru,
— autopsijas rezultāti,
— sīks histopatoloģisko izmeklējumu apraksts,
— rezultātu statistiskā apstrāde, ja iespējams,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.35. DIVU PAAUDŽU REPRODUKTĪVĀS TOKSICITĀTES PĒTĪJUMS
1. METODE
Šī metode ir ESAO 416. (2001) vadlīnijā noteiktās metodes kopija.
1.1. IEVADS
Šī divu paaudžu reprodukcijas testēšanas metode ir paredzēta vispārējās informācijas sniegšanai par testējamās vielas iedarbību uz vīrišķā un sievišķās reproduktīvās sistēmas integritāti un darbību, iekļaujot gonādu funkciju, estrālo ciklu, pārošanās uzvedību, apaugļošanos, grūsnību, dzemdības, laktāciju un zīdīšanas pārtraukšanu, un pēcnācēju augšanu un attīstību. Pētījums var arī sniegt informāciju par testējamās vielas iedarbību uz jaundzimušo saslimstību un mirstību un provizoriskus datus par prenatālo un postnatālo ontoģenēzes toksicitāti un būt par metodisku līdzekli turpmākajos testos. Papildu F1 paaudzes augšanas un attīstības pētīšanai šī testa metode ir arī paredzēta vīrišķās un sievišķās reproduktīvās sistēmas integritātes un darbības, kā arī F2 paaudzes augšanas un attīstības novērtēšanai. Papildu informāciju par ontoģenēzes toksicitāti un funkcionāliem trūkumiem vai arī papildu pētījumu segmentus var iekļaut šajā protokolā, attiecīgi ievērojot ontoģenēzes toksicitātes un/vai ontoģenēzes neirotoksicitātes metodes, vai arī minētos beigu punktus var pētīt atsevišķos pētījumos, izmantojot piemērotas testu metodes.
1.2. TESTA METODES PRINCIPS
Testējamo vielu pakāpeniskās devās saņem vairākas grupas vīrišķā un sievišķā dzimuma dzīvnieku. P paaudzes vīrišķā dzimuma dzīvniekiem devas jāsaņem augšanas posmā un vismaz viena pilna spermatoģenēzes cikla laikā (kas pelēm ilgst apmēram 56 dienas un žurkām – 70 dienas), lai noskaidrotu pārbaudāmās vielas kaitīgo iedarbību uz spermatoģenēzi. Iedarbību uz spermu nosaka ar vairākiem spermas rādītājiem (piemēram, spermas morfoloģiju un kustīgumu) un audu preparātā un sīki izstrādātā histopatoloģijā. Ja ir pieejami spermatoģenēzes dati no pietiekami ilga, piemēram, 90 dienu, iepriekšējā atkārtotās devas pētījuma, tad P paaudzes vīrišķā dzimuma dzīvnieki nav jāiekļauj vērtējumā. Tomēr ir ieteicams saglabāt P paaudzes spermas paraugus vai digitālos ierakstus, lai varētu novērtēt turpmāk. Lai varētu konstatēt kaitīgo iedarbību uz estrālā cikla normalitāti, P paaudzes sievišķā dzimuma dzīvniekiem testējamās vielas devas jāsaņem augšanas laikā un vairāku estrālo ciklu laikā. Testējamo vielu ievada vecāku (P) dzīvniekiem pārošanās laikā, radušās grūsnības laikā un līdz F1 pēcnācēju zīdīšanas pārtraukšanai. F1 pēcnācēji pēc zīdīšanas pārtraukšanas turpina saņemt testējamo vielu visu laiku, kamēr tie aug, pārojas un rada F2 pēcnācējus, līdz F2 pēcnācēju zīdīšanas pārtraukšanai.
Klīniskos novērojumus un patoloģiskās apskates visiem dzīvniekiem veic attiecībā uz toksiskuma pazīmēm ar īpašu uzsvaru uz iedarbību saistībā ar vīrišķās un sievišķās reproduktīvās sistēmas integritāti un darbību un uz pēcnācēju augšanu un attīstību.
1.3. TESTA METODES APRAKSTS
1.3.1. Dzīvnieku sugu izvēle
Žurka ir vēlamākā testa suga. Ja izmanto citas sugas, ir jāsniedz pamatojums un ir nepieciešami attiecīgi pārlabojumi. Nav jāizmanto līnijas ar mazu auglību vai attīstības defektu labi zināmu lielu sastopamību. Izmēģinājuma sākumā dzīvnieku svara atšķirībām jābūt minimālām un tās nedrīkst pārsniegt 20 % no vidējās svara, kas noteikta katram dzimumam atsevišķi.
1.3.2. Turēšanas un barošanas nosacījumi
Eksperimenta dzīvnieku telpas temperatūrai jābūt 22 oC (± 30). Kaut arī relatīvajam mitrumam jābūt vismaz 30 % un tam nav vēlams pārsniegt 70 %, izņemot telpas tīrīšanas laiku, mērķim jābūt 50–60 %. Apgaismojumam jābūt mākslīgam, secība ir 12 stundas gaismas, 12 stundas tumsas. Attiecībā uz barošanu var izmantot parasto laboratorijas barību ar neierobežotu dzeramā ūdens piegādi. Barības izvēli var ietekmēt vajadzība nodrošināt piemērotu testējamās vielas piejaukšanu, ja vielu ievada ar šo metodi.
Dzīvniekus būros var turēt atsevišķi vai nelielās viena dzimuma dzīvnieku grupās. Pārošanas procedūras jāveic attiecīgajam nolūkam piemērotos būros. Pārotās mātītes pēc kopulācijas fakta būros tur atsevišķi dzemdību vai maternitātes būros. Pārotās žurkas var turēt arī mazās grupās un nošķirt vienu vai vairākas dienas pirms dzemdībām. Tuvojoties dzemdībām, pārotajiem dzīvniekiem nodrošina piemērotu un noteiktu migas veidošanas materiālu.
1.3.3. Dzīvnieku sagatavošana
Jāizmanto veseli, jauni dzīvnieki, kas ir aklimatizēti laboratorijas apstākļos vismaz piecas dienas un ar kuriem iepriekš nav veiktas izmēģinājuma procedūras. Testa dzīvniekiem norāda sugu, līniju, izcelsmi, dzimumu, svaru un/vai vecumu. Ir jābūt zināmai brāļu un māsu radniecībai starp dzīvniekiem tā, lai izvairītos no brāļu un māsu pārošanas. Dzīvnieki pēc nejaušās izvēles ir jāiedala kontroles un vielas saņemšanas grupās (ieteicama stratifikācija pēc ķermeņa svara). Būrus izvieto tā, lai iespējami samazinātu būru novietojuma varbūtējo iedarbību. Katram dzīvniekam piešķir unikālu identifikācijas numuru. Ar P paaudzi tas ir jāizdara pirms dozēšanas sākuma. Ar F1 paaudzes dzīvniekiem, kas atlasīti pārošanai, tas ir jāizdara pēc zīdīšanas pārtraukšanas. Reģistrācija, kas norāda izcelsmes metienu, ir jāizdara par visiem atlasītajiem F1 dzīvniekiem. Turklāt ir ieteicams iespējami drīz pēc dzimšanas mazuļus individuāli identificēt, ja apsver mazuļu individuālu svēršanu vai funkcionālos testus.
Dozēšanas sākumā vecāku (P) dzīvnieki ir aptuveni piecas līdz deviņas nedēļas veci. Visu testa grupu dzīvnieki, cik tas praktiski iespējams, ir viena svara un vecuma.
1.4. PROCEDŪRA
1.4.1. Dzīvnieku skaits un dzimums
Katrā testa un kontroles grupā jābūt pietiekamam skaitam dzīvnieku, lai, vēlams, dzemdībās vai īsi pirms dzemdībām būtu vismaz 20 grūsni sievišķā dzimuma dzīvnieki. Ar vielām, kas izraisa nevēlamas ar vielas došanu saistītas iedarbības (piemēram, sterilitāti, pārlieku lielu toksicitāti pie lielas devas), tas varbūt nav iespējams. Mērķis ir nodrošināt pietiekamā daudzumā grūsnas mātītes, lai varētu statistiski novērtēt vielas spēju iedarboties uz auglību, grūsnību un mātišķo dzīvnieku uzvedību, kā arī F1 pēcnācēju zīšanu, augšanu un attīstību no apaugļošanās brīža līdz dzimumgatavībai un to pēcnācēju (F2) attīstību līdz zīdīšanas pārtraukšanai. Tādēļ nespēja iegūt grūsnu dzīvnieku pietiekamu skaitu (t. i., 20) obligāti nepadara pētījumu nederīgu un tas jāvērtē katrā gadījumā atsevišķi.
1.4.2. Devu sagatavošana
Ir ieteicams testējamo vielu ievadīt perorāli (ar barību, dzeramo ūdeni vai mākslīgi barojot), ja vien cits ievadīšanas veids (piemēram, caur ādu vai ieelpojot) nav uzskatāms par lietderīgāku.
Vajadzības gadījumā testējamo vielu izšķīdina vai suspendē piemērotā nesējā. Ir ieteicams, ja vien iespējams, vispirms apsvērt ūdens šķīduma/suspensijas izmantošanu, pēc tam apsvērt eļļas (piemēram, kukurūzas eļļas) šķīdumu/emulsiju un pēc tam iespējamu šķīdināšanu citos nesējos. Ir jābūt zināmām nesēju, kas nav ūdens, toksiskajām īpašībām. Ir jānosaka testējamās vielas stabilitāte nesējā.
1.4.3. Dozēšana
Izmanto vismaz trīs devu līmeņus un vienlaicīgu kontroli. Ja testējamās vielas fizikāli ķīmiskās īpašības vai bioloģiskā iedarbība neierobežo, lielākās devas līmenis jāizvēlas ar nolūku izraisīt toksicitāti, bet ne nāvi vai smagas ciešanas. Negaidītas mirstības gadījumā vēl ir pieņemami pētījumi ar vecāku (P) dzīvnieku mirstību mazāku par aptuveni 10 procentiem. Lejupejoša devu līmeņu secība ir jāizraugās, lai parādītu ar dozēšanu saistīto iedarbību un nenovērojamas nelabvēlīgas ietekmes līmeni (NOAEL). Lejupejošo devu līmeņu noteikšanai bieži optimāli ir divkārši līdz četrkārši starplaiki, un ceturtās testa grupas pievienošana bieži ir vēlamāka nekā ļoti plašu starplaiku (piemēram, vairāk nekā 10 reizes) izmantošana starp dozēšanām. Barības pētījumos devu starplaikam jābūt ne lielākam par trīskāršu. Devu līmeņi jāizvēlas, ņemot vērā esošos toksicitātes datus, jo īpaši atkārtotās devas pētījumu rezultātus. Jāņem vērā arī pieejamā informācija par testa savienojuma vai saistīto materiālu metabolismu un kinētiku. Turklāt minētā informācija arī palīdzēs parādīt dozēšanas režīma piemērotību.
Kontroles grupa ir vielu nesaņēmusi grupa vai nesēja kontroles grupa, ja testējamās vielas ievadīšanā izmanto nesēju. Ar kontroles dzīvniekiem jārīkojas tāpat kā ar pārējiem dzīvniekiem, tie tikai nesaņem testējamo vielu. Ja izmanto nesēju, kontroles grupa saņem lielāko izmantojamo nesēja tilpumu. Ja testējamo vielu ievada barībā un tā izraisa samazinātu barības uzņemšanu vai izmantošanu, tad var uzskatīt par vajadzīgu izmantot identiski barotu kontroles grupu. Vienlaicīgas identiski barotas kontroles grupas vietā var izmantot alternatīvus datus no kontrolētiem pētījumiem, kas paredzēti samazināta barības patēriņa iedarbībai uz reproduktīvajiem rādītājiem.
Jāņem vērā šādas nesēja un citu piedevu īpašības – iedarbība uz testējamās vielas uzsūkšanos, sadalījumu, metabolismu vai aizturi; iedarbība uz testējamās vielas ķīmiskajām īpašībām, kas var mainīt tās toksiskās īpašības; iedarbība uz dzīvnieku barības un ūdens patēriņu vai uz to barojuma statusu.
1.4.4. Pieļaujamības tests
Ja orālajā testā pie viena devas līmeņa, kas ir vismaz 1 000 mg/kg ķermeņa svara dienā, vai, ievadot ar barību vai dzeramo ūdeni, līdzvērtīgs procentuālais daudzums barībā vai dzeramajā ūdenī, izmantojot šajā pētījumā aprakstītās procedūras, nerodas novērojamas toksiskās iedarbības vecākiem vai to pēcnācējiem un ja toksicitāte nav sagaidāma, pamatojoties uz datiem par struktūras ziņā un/vai metaboliski radniecīgiem savienojumiem, tad pilnu pētījumu, izmantojot vairākus devu līmeņus var neuzskatīt par vajadzīgu. Pieļaujamības testu piemēro, izņemot gadījumu, ja iedarbība uz cilvēku rāda, ka jāizmanto augstāks orālās devas līmenis. Citiem ievadīšanas veidiem, tādiem kā inhalācija vai pielietošana uz ādas, fizikālās īpašības, tādas kā šķīdība, bieži var norādīt un ierobežot maksimālo sasniedzamo iedarbības līmeni.
1.4.5. Devu ievadīšana
Dzīvniekiem testējamā viela jādod septiņas dienas nedēļā. Vēlamākais ir perorālais ievadīšanas veids (barība, dzeramais ūdens vai mākslīgā barošana). Ja izmanto citu ievadīšanas veidu, jāsniedz pamatojums un var būt vajadzīgas attiecīgas izmaiņas. Visiem dzīvniekiem attiecīgā eksperimenta periodā devu dod ar vienu un to pašu metodi. Ja testējamo vielu ievada ar mākslīgo barošanu, tas jādara, izmantojot kuņģa zondi. Vienā reizē ievadītā šķidruma tilpums nedrīkst pārsniegt 1 ml/100 g ķermeņa svara (0,4 ml/100 g ir maksimums kukurūzas eļļai), izņemot ūdens šķīdumus, kad var izmantot 2 ml/100 g ķermeņa svara. Izņemot kairinošas vai kodīgas vielas, kam parasti ir saasinājuma iedarbība augstākās koncentrācijās, testa tilpuma izmaiņas ir jāsamazina līdz minimumam, pielāgojot koncentrāciju, lai nodrošinātu nemainīgu tilpumu visos devu līmeņos. Mākslīgās barošanas pētījumos mazuļi parasti testējamo vielu saņem tikai netieši ar pienu, līdz tiešā dozēšana sākas, izbeidzot zīdīšanu. Barības vai dzeramā ūdens pētījumos mazuļi papildus saņem testējamo vielu tieši, kad tie sāk paši ēst laktācijas perioda pēdējās nedēļas laikā.
Vielām, ko ievada ar barību vai dzeramo ūdeni, ir svarīgi nodrošināt, lai iesaistītie testējamās vielas daudzumi netraucētu normālo barības vai ūdens līdzsvaru. Ievadot testējamo vielu barībā var izmantot nemainīgu barības koncentrāciju (milj. daļas) vai nemainīgu devas līmeni attiecībā uz ķermeņa svaru; izmantotā alternatīva ir jānorāda. Ievadot vielu ar mākslīgo barošanu, deva jādod katru dienu tajā pašā laikā un jāpielāgo vismaz reizi nedēļā, lai uzturētu nemainīgu devas līmeni attiecībā uz dzīvnieka ķermeņa svaru. Pielāgojot mākslīgās barošanas devu, kas pamatojas uz ķermeņa svaru, ir jāņem vērā informācija par sadalījumu placentā.
1.4.6. Eksperimenta grafiki
Ikdienas dozēšana vecāku (P) tēviņiem un mātītēm sākas, kad tie ir piecas līdz deviņas dienas veci. Ikdienas dozēšana F1 tēviņiem un mātītēm sākas, izbeidzot zīdīšanu; jāievēro, ka testējamo vielu ievadot ar barību vai dzeramo ūdeni, testējamās vielas tieša iedarbība uz F1 mazuļiem var notikt jau laktācijas periodā. Dozēšanu abiem dzimumiem (P un F1) turpina vismaz 10 nedēļas pirms pārošanās perioda. Dozēšanu abiem dzimumiem turpina divas nedēļas pārošanās perioda laikā. Ja tēviņi vairs nav vajadzīgi reproduktīvo iedarbību vērtēšanai, tie humāni jānogalina un jāizpēta. Vecāku (P) mātītēm dozēšana jāturpina grūsnības laikā un līdz F1 pēcnācēju zīdīšanas pārtraukšanai. Jāapsver izmaiņas dozēšanas grafikā, pamatojoties uz pieejamo informāciju par testējamo vielu, iekļaujot esošos toksicitātes datus, metabolisma indukciju vai bioloģisko uzkrāšanos. Katra dzīvnieka deva parasti pamatojas uz jaunāko individuālā ķermeņa svara noteikšanu. Tomēr jābūt piesardzīgam, pielāgojot devu grūsnības pēdējā trešdaļā.
Devu došana P un F1 tēviņiem un mātītēm turpinās līdz eksperimenta izbeigšanai. Visi pieaugušie P un F1 tēviņi un mātītes humāni jānogalina, ja tie vairs nav vajadzīgi reproduktīvo iedarbību vērtēšanai. Pārošanai neizraudzītie F1 pēcnācēji un visi F2 pēcnācēji humāni jānogalina pēc zīdīšanas izbeigšanas.
1.4.7. Pārošanas procedūra
1.4.7.1. Vecāku (P) pārošana
Katrai pārošanai katru mātīti novieto ar viena un tā paša devas līmeņa tēviņu (1:1 pārošana), līdz notiek kopulācija vai ir pagājušas divas nedēļas. Katru dienu mātītes apskata attiecībā uz spermas vai vagīnas embolu klātbūtni. Grūsnības 0. diena ir diena, kad konstatē vagīnas embolu vai spermu. Ja pārošanās ir neveiksmīga, var apsvērt mātīšu atkārtotu pārošanu ar tās pašas grupas pārbaudītiem tēviņiem. Pāri skaidri jānorāda datos. Jāizvairās no brāļu un māsu pārošanas.
1.4.7.2. F1 pārošana
Lai radītu F2 paaudzi, no F1 pēcnācējiem pārošanai jāizvēlas, pārtraucot zīdīšanu, vismaz viens tēviņš un viena mātīte no katra metiena, lai pārotu ar citiem tā paša devas līmeņa, bet cita metiena mazuļiem. Ja metiena dzīvnieku nozīmīgas ķermeņa svara vai izskata atšķirības nav novērojamas, mazuļu izvēlei no katra metiena jābūt pēc nejaušās izvēles. Ja ir novērojamas atšķirības, jāizvēlas katra metiena labākie pārstāvji. Pragmatiski to vislabāk ir izdarīt, pamatojoties uz ķermeņa svaru, bet var būt lietderīgāk pamatoties uz izskatu. F1 pēcnācēji nav jāpāro, līdz tie sasnieguši pilnīgu seksuālo briedumu
Pāri bez pēcnācējiem ir jānovērtē, lai noteiktu neauglības cēloni. Tas var iekļaut tādas procedūras kā papildu pārošana ar citu pārbaudītu tēviņu vai mātīti, reproduktīvo orgānu mikroskopisko izmeklēšanu, kā arī estrālā cikla vai spermatoģenēzes pārbaudi.
1.4.7.3. Otrā pārošana
Dažos gadījumos, tādos kā ar vielas došanu saistītas metiena lieluma izmaiņas vai neskaidrs efekts pirmajā pārošanā, ir ieteicams P vai F1 pieaugušos dzīvniekus pārot vēlreiz, lai radītu otro metienu. Ir ieteicams mātītes vai tēviņus, kas nav radījuši metienu, atkārtoti pārot ar pretējā dzimuma pārbaudītiem vaislas dzīvniekiem. Ja otrā metiena radīšanu uzskata par nepieciešamu jebkurā paaudzē, dzīvnieki ir atkārtoti jāpāro vienu nedēļu pēc pēdējā metiena zīdīšanas pārtraukšanas.
1.4.7.4. Metiena lielums
Dzīvniekiem ļauj normāli dzemdēt un savus pēcnācējus audzināt līdz zīdīšanas pārtraukšanai. Metiena lielumu standartizēšana nav obligāta. Ja veic standartizāciju, izmantotā metode ir sīki jāapraksta.
1.5. NOVĒROJUMI
1.5.1. Klīniskie novērojumi
Vispārējie klīniskie novērojumi jāveic katru dienu un dozēšanas ar mākslīgo barošanu gadījumā novērojumu grafikā jāņem vērā iedarbību paredzamais maksimuma periods pēc dozēšanas. Jāreģistrē uzvedības izmaiņas, grūtu vai ilgu dzemdību pazīmes un visas toksicitātes pazīmes. Katra dzīvnieka papildu sīkāka apskate ir jāveic vismaz reizi nedēļā, un to ērti var izdarīt, kad dzīvnieku sver. Divreiz dienā un nedēļas nogalē attiecīgi vienreiz dienā visi dzīvnieki jānovēro attiecībā uz saslimstību un mirstību.
1.5.2. Vecāku dzīvnieku ķermeņa svars un barības/ūdens patēriņš
Vecāku dzīvniekus (P un F1) nosver pirmajā dozēšanas dienā un pēc tam reizi nedēļā. Vecāku sieviešu dzimuma dzīvniekus (P un F1) nosver vismaz grūsnības 0, 7., 14. un 20. vai 21. dienā un laktācijas laikā tajās pašās dienās, kad sver metienu, un dzīvnieku nogalināšanas dienā. Novērojumu rezultātus reģistrē atsevišķi par katru pieaugušo dzīvnieku. Pirmspārošanas un grūsnības periodā barības patēriņu mēra vismaz reizi nedēļā. Ja testējamo vielu ievada ar ūdeni, ūdens patēriņu mēra vismaz reizi nedēļā.
1.5.3. Meklēšanās cikls
Meklēšanās cikla ilgumu un normālību P un F1 mātītēm novērtē pēc vaginālajām iztriepēm pirms pārošanas un pēc izvēles pārošanās laikā, līdz ir atrastas pārošanās pazīmes. Iegūstot vagīnas/dzemdes kakla šūnas, jāpievērš uzmanība, lai izvairītos no gļotādas bojāšanas un sekojošas pseidogrūsnības ierosināšanas (1).
1.5.4. Spermas rādītāji
Visu P un F1 tēviņu sēklinieku un sēklinieku piedēkļu svaru reģistrē nogalinot un no katra orgāna vienu atstāj histopatoloģiskai izmeklēšanai (skatīt 1.5.7., 1.5.8.1. punktu). Katras P un F1 grupas tēviņu apakšgrupai, kurā ir vismaz desmit katras grupas tēviņu, atlikušie sēklinieki un sēklinieku piedēkļi ir attiecīgi jāizmanto pret homogenizāciju rezistento spermatīdu un cauda epididymal spermas rezervju skaitīšanai. Tai pašai tēviņu apakšgrupai sperma no cauda epididymides vai vas deferens jāsavāc spermas kustīguma un spermas morfoloģijas novērtēšanai. Ja ir novērota ar vielas došanu saistīta iedarbība vai ja ir citu pētījumu pierādījumi par iespējamo iedarbību uz spermatoģenēzi, spermas vērtēšana jāveic visiem tēviņiem katrā devas grupā; pretējā gadījumā skaitīšanu var ierobežot ar kontroles grupas un lielās devas P un F.1 tēviņiem.
Pret homogenizāciju rezistentās sēklinieku spermatīdas un cauda epididymal sperma ir jāskaita (2) (3). Cauda spermas rezerves var atvasināt no spermas koncentrācijas un tilpuma suspensijā, ko izmanto kvalitatīvo vērtējumu izdarīšanai, un no sekojošā atlikušo cauda audu malšanā un/vai homogenizācijā reģenerētās spermas skaita. Skaitīšanu izdara izraudzītajai visu devu grupu tēviņu apakšgrupai tūlīt pēc dzīvnieku nogalināšanas, ja vien netiek veikti video vai digitālie ieraksti vai paraugi nav sasaldējami un analizējami turpmāk. Tādos gadījumos kontroles grupu un lielākās devas grupu var analizēt pirmo. Ja nav novērojamas ar vielas došanu saistītas iedarbības (piemēram, iedarbība uz spermas skaitu, kustīgumu vai morfoloģiju), pārējo devu grupas nav jāanalizē. Ja lielākās devas grupā ir novērojamas ar vielas došanu saistītas iedarbības, ir jāvērtē arī mazāko devu grupas.
Epididimālās (vai ductus deferens) spermas kustīgums ir jānovērtē vai jāieraksta video tūlīt pēc nogalināšanas. Sperma jāreģenerē, samazinot bojājumus līdz minimumam, un jāatšķaida kustīguma analīzei, izmantojot pieņemamas metodes (4). Pieaugoši kustīgās spermas procentuālais daudzums jānosaka subjektīvi vai objektīvi. Ja veic kustīguma analīzi, izmantojot datoru (5) (6) (7) (8) (9) (10), pieaugošā kustīguma atvasināšana pamatojas uz lietotāja noteiktiem vidējā attāluma ātruma sliekšņiem un taisnumu vai lineāru koeficientu. Ja paraugus uzņem video (11) vai attēlus citādi reģistrē autopsijas laikā, var veikt vienīgi kontroles grupas un lielākās devas P un F.1 tēviņu analīzi, ja nav novērojamas ar vielas došanu saistītas iedarbības, pretējā gadījumā ir jāvērtē arī mazāko devu grupas. Ja nav videoattēla vai digitālā attēla, visi paraugi visās grupās ir jāanalizē autopsijā.
Jāizdara epididimālās (vai vas deferens) spermas morfoloģiskā vērtēšana. Sperma (vismaz 200 uz paraugu) ir jāapskata kā fiksēti mitri preparāti (12) un jāklasificē kā normāla vai nenormāla. Spermas morfoloģisko nenormālību piemēri iekļauj saplūšanu, izolētas galviņas un kroplīgas galviņas un/vai astes. Vērtēšana jāveic visu devu grupu izraudzītai tēviņu apakšgrupai tieši pēc nogalināšanas vai, pamatojoties uz video un digitālajiem ierakstiem, vēlāk. Iztriepes, kad tās ir fiksētas, arī var izskatīt vēlāk. Tādos gadījumos kontroles grupu un lielākās devas grupu var analizēt pirmo. Ja nav novērojamas ar vielas došanu saistītas iedarbības (piemēram, iedarbība uz spermas morfoloģiju), pārējo devu grupas nav jāanalizē. Ja lielākās devas grupā ir novērojamas ar vielas došanu saistītas iedarbības, ir jāvērtē arī mazāko devu grupas.
Ja kāds no iepriekš minētajiem spermas vērtēšanas rādītājiem jau ir apskatīts kā vismaz 90 dienu sistēmiskās toksicitātes pētījuma daļa, tie nav obligāti jāatkārto divu paaudžu pētījumā. Tomēr ir ieteicams saglabāt P paaudzes spermas paraugus vai digitālos ierakstus, lai vajadzības gadījumā veiktu turpmāku vērtēšanu.
1.5.5. Pēcnācēji
Katrs metiens ir jāapskata iespējami drīz pēc dzemdībām (0. laktācijas diena), lai konstatētu mazuļu skaitu un dzimumu, nedzīvi dzimušos, dzīvi dzimušos un makroskopisku anomāliju pastāvēšanu. Mazuļi, kas atrasti miruši 0. dienā, ja nav izmērcēti, vēlams, jāapskata attiecībā uz iespējamiem defektiem un nāves cēloni un jāsaglabā. Dzīvie mazuļi ir jāsaskaita un atsevišķi jānosver pēc dzimšanas (laktācijas 0. diena) vai 1. dienā un kārtējās svēršanas dienās pēc tam, piemēram, 4., 7., 14. un 21. laktācijas dienā. Mātītei un pēcnācējiem reģistrē visas novērotās fiziskās kroplības un uzvedības traucējumus.
Pēcnācēju fiziskā attīstība jāreģistrē galvenokārt pēc ķermeņa svara pieauguma. Citi fiziskie rādītāji (piemēram, ausu un acu atvēršanās, zobu parādīšanās, apmatojuma augšana) var dot papildu informāciju, bet minētos datus būtu vēlams vērtēt seksuālās nobriešanas kontekstā (piemēram, vecums un ķermeņa svars pie vagīnas atvēršanās vai balano–preputiālās atdalīšanās) (13). Ir ieteicami F1 pēcnācēju funkcionālie izmeklējumi (piemēram, kustību aktivitāte, sensorā funkcija, refleksu ontoģenēze) pirms un/vai pēc zīdīšanas pārtraukšanas, jo īpaši tie, kas saistās ar seksuālo nobriešanu, ja tādi izmeklējumi nav iekļauti atsevišķos pētījumos. Vecums, kad notiek vagīnas atvēršanās un preputiālā atdalīšanās, ir jānosaka no mātes nošķirtajiem F1 pēcnācējiem, kas izraudzīti pārošanai. Pēcdzemdību 0 dienā F2 mazuļiem ir jāmēra anogenitālais atstatums, ja mainījusies F1 dzimumu attiecība vai seksuālās nobriešanas laika iestāšanās.
Funkcionālos novērojumus var neizdarīt grupās, kas citādi uzrāda skaidras kaitīgo iedarbību pazīmes (piemēram, ievērojamu svara pieauguma samazināšanos utt.). Ja funkcionālos izmeklējumus izdara, tie nav jāizdara ar mazuļiem, kas izraudzīti pārošanai.
1.5.6. Makroskopiskā autopsija
Nogalināšanas vai nāves laikā pētījumā visus vecāku dzīvniekus (P un F1), visus mazuļus ar ārējām anomālijām vai klīniskām pazīmēm, kā arī vienu mazuli/dzimumu/metienu pēc nejaušās izvēles no F1 un F2 paaudzes apskata makroskopiski attiecībā uz strukturālām anomālijām vai patoloģiskām izmaiņām. Īpaša uzmanība jāpievērš reproduktīvās sistēmas orgāniem. Mazuļi, kas ir humāni nogalināti mirstošā stāvoklī, un mirušie mazuļi, ja nav izmērcēti, ir jāapskata attiecībā uz iespējamiem defektiem un/vai nāves cēloni un jāsaglabā.
Visu pirmoreiz dzemdējušo mātīšu dzemdes ir jāapskata veidā, kas netraucē histopatoloģisko vērtēšanu, attiecībā uz implantācijas vietu klātbūtni un skaitu.
1.5.7. Orgānu svars
Nogalināšanas laikā visiem P un F1 vecāku dzīvniekiem jānosaka ķermeņa svars un jānosver šādi orgāni (pāru orgāni jānosver atsevišķi):
— dzemde, olnīcas,
— sēklinieki, epididymides (kopā un cauda),
— prostata,
— sēklas pūslīši ar koagulācijas dziedzeriem un to šķidrumiem un prostatu (kā viena vienība),
— smadzenes, aknas, nieres, liesa, hipofīze, vairogdziedzeris un virsnieru dziedzeris un zināmie mērķa orgāni.
Ķermeņa svars pēc nogalināšanas jānosaka F1 un F2 mazuļiem, kas ir izraudzīti autopsijai. Jāsver šādi orgāni no viena nejauši izvēlēta mazuļa/dzimuma/metiena (skatīt 1.5.6. punktu) – smadzenes, liesa un timuss.
Makroskopiskās autopsijas un orgānu svara rezultāti jānovērtē kontekstā ar citu atkārtotās devas pētījumu rezultātiem, ja tādi ir pieejami.
1.5.8. Histopatoloģija
1.5.8.1. Vecāku dzīvnieki
Šādi vecāku dzīvnieku (P un F1) orgāni un audi vai to reprezentatīvi paraugi ir fiksējami un glabājami piemērotā vidē histopatoloģiskai apskatei:
— vagīna, dzemde ar kakliņu un olnīcām (glabājama piemērotā fiksatīvā),
— viens sēklinieks (glabājams Buina vai salīdzināmā fiksatīvā), viens epididymis, sēklas pūslīši, prostata un koagulācijas dziedzeris,
— iepriekš identificēts(-i) mērķa orgāns(-i) no visiem pārošanai izraudzītiem P un F1 dzīvniekiem.
Iepriekš uzskaitīto saglabāto orgānu un audu pilna histopatoloģiskā analīze jāizdara visiem lielākās devas un kontroles grupas P un F1 dzīvniekiem, kas izraudzīti pārošanai. P dzīvnieku olnīcu apskate nav obligāta. Orgāni, kuros parādās ar vielas došanu saistītas izmaiņas, ir jāapskata arī mazās un vidējās devas grupās, lai palīdzētu NOAEL noskaidrošanā. Turklāt histopatoloģisko novērtēšanu veic mazas un vidējas devas dzīvniekiem, kuriem ir domājama samazināta auglība, piemēram, tādiem, kas nav pārojušies, apaugļojušies, radījuši pēcnācējus vai dzemdējuši veselus pēcnācējus vai kuriem ir ietekmēts meklēšanās cikls vai spermas skaits, kustīgums vai morfoloģija. Jāapskata visi makroskopiskie bojājumi, tādi kā atrofija vai audzēji.
Lai identificētu ar vielas došanu saistītas iedarbības, tādas kā saglabātas spermatīdas, trūkstoši dīgļa šūnu slāņi vai tipi, daudzkodolu gigantiskās šūnas vai spermatogēno šūnu nekrotizēšanās lūmenā, ir jāveic sīka sēklinieku histopatoloģiskā apskate (piemēram, izmantojot Buina fiksatīvu, iegremdēšanu parafīnā un 4–5 μm biezus šķērsvirziena griezumus) (14). Neskarta epididymis apskatē jāiekļauj caput, corpus un cauda, apskati var izdarīt, novērtējot garengriezumu. Epididymis jānovērtē attiecībā uz leikocītu infiltrāciju, pārsvarā esošo šūnu tipu izmaiņām, šūnu tipiem ar novirzēm no normas un spermas fagocitozi. Tēviņu reproduktīvo orgānu izmeklēšanai var izmantot perjodskābes Šifa reakciju un iekrāsošanu ar hematoksilīnu.
Pēclaktācijas olnīcām jāsatur aizmetņu un augošas olšūnas, kā arī lieli laktācijas corpora lutea. Histopatoloģiskajai apskatei jākonstatē aizmetņu olšūnu populācijas kvalitatīva sarukšana. Aizmetņu olšūnu kvantitatīvu novērtēšanu veic F1 mātītēm; dzīvnieku skaitam, olnīcu griezumu izvēlei un autopsijas parauga lielumam jābūt statistiski atbilstošam izmantojamai vērtēšanas procedūrai. Apskatē jāiekļauj aizmetņu olšūnu skaitīšana, tās var apvienot ar mazām augošām olšūnām vielu saņēmušo un kontroles grupas olšūnu salīdzināšanai (15) (16), (17) (18) (19).
1.5.8.2. No mātes atšķirtie mazuļi
Makroskopiski nenormālus audus un mērķa orgānus no visiem mazuļiem ar ārējām anomālijām vai klīniskajām pazīmēm, kā arī no viena pēc nejaušās izvēles izraudzīta mazuļa/dzimuma/metiena no F1 un F2 paaudzes, kas nav bijis izraudzīts pārošanai, fiksē un glabā piemērotā vidē histopatoloģiskai apskatei. Saglabāto audu pilna histopatoloģiskā raksturošana jāizdara ar īpašu uzsvaru uz reproduktīvās sistēmas orgāniem.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Par katru testa grupu un katru paaudzi datus reģistrē atsevišķi un apkopotus tabulas veidā – parādot dzīvnieku skaitu testa sākumā, dzīvnieku skaitu, kas atrasti miruši testa laikā vai nogalināti humānu apsvērumu dēļ, katras nāves vai humānās nogalināšanas laiku, auglīgo dzīvnieku skaitu, grūsno mātīšu skaitu, dzīvnieku skaitu, kam ir toksicitātes pazīmes, novēroto toksicitātes pazīmju aprakstu, iekļaujot toksisko iedarbību sākuma laiku, ilgumu un stiprumu, vecāku un pēcnācēju novērojumu veidu, histopatoloģisko izmaiņu veidu un visus attiecīgos metienu datus.
Skaitliskie rezultāti jānovērtē ar piemērotu vispārpieņemtu statistikas metodi, statistikas metodes jāizvēlas kā daļa no pētījuma projekta un ir jāpamato. Datu analīzei var būt noderīgi devas–atbildes reakcijas statistiskie modeļi. Pārskatā jāiekļauj pietiekami daudz informācijas par izmantoto analīzes metodi un datorprogrammu tā, lai neatkarīgs pārbaudītājs/statistiķis varētu no jauna novērtēt un atjaunot analīzi.
2.2. REZULTĀTU NOVĒRTĒŠANA
Šā divu paaudžu reproduktīvās toksicitātes pētījuma konstatācijas jānovērtē novēroto iedarbību izteiksmē, iekļaujot autopsiju un mikroskopiskos izmeklējumus. Vērtējumā iekļauj testējamās vielas devas saistība ar anomāliju – iekļaujot makroskopiskos bojājumus, identificētos mērķa orgānus, ietekmēto auglību, klīniskās anomālijas, ietekmēto reproduktīvo un metiena rezultātu, ķermeņa svara izmaiņas, iedarbību uz mirstību un citas toksiskās iedarbības – to klātbūtni vai to neparādīšanos, biežumu un smagumu. Novērtējot testa rezultātus, jāņem vērā testējamās vielas fizikāli ķīmiskās īpašības un toksikokinētiskie dati, ja tie pieejami.
Pareizi veiktam reproduktīvās toksicitātes testam jādod apmierinošs nenovērojamas kaitīgas iedarbības līmeņa novērtējums un izpratne par kaitīgām iedarbībām uz vairošanos, dzemdībām, laktāciju, postnatālo attīstību, iekļaujot augšanu un seksuālo attīstību.
2.3. REZULTĀTU INTERPRETĀCIJA
Divu paaudžu reproduktīvās toksicitātes pētījums sniedz informāciju par vielas atkārtotas iedarbības ietekmi visās reproduktīvā cikla fāzēs. Jo īpaši pētījums sniedz informāciju par reproduktīvajiem rādītājiem un par pēcnācēju attīstību, augšanu, briedumu un izdzīvošanu. Pētījuma rezultāti jāinterpretē saistībā ar subhronisko, prenatālās attīstības, toksikokinētisko un citu pieejamo pētījumu rezultātiem. Šā pētījuma rezultātus var izmantot, novērtējot ķīmiskās vielas turpmāku pētījumu vajadzību. Rezultātu ekstrapolācija uz cilvēka pētījumu ir derīga ierobežotā veidā. Tie vislabāk izmantojami, lai sniegtu informāciju par nelabvēlīgas ietekmes līmeņiem un pieļaujamo iedarbību uz cilvēku (20) (21) (22) (23).
3. PĀRSKATA SAGATAVOŠANA
3.1. PĀRSKATS PAR TESTU
Pārskatā par testu jāiekļauj šāda informācija.
Testējamā viela:
— fizikālās īpašības un attiecīgā gadījumā fizikāli ķīmiskās īpašības,
— identifikācijas dati,
— tīrība.
Nesējs (attiecīgā gadījumā):
— nesēja izvēles pamatojums, ja nesējs nav ūdens.
Testa dzīvnieki:
— izmantotā suga/līnija,
— dzīvnieku skaits, vecums un dzimums,
— izcelsme, turēšanas apstākļi, barība, materiāls migas ierīkošanai utt.,
— dzīvnieku individuālais svars testa sākumā.
Testa apstākļi:
— devu līmeņa izvēles pamatojums,
— sīki dati par testējamās vielas preparāta/barības pagatavošanu, sasniegtās koncentrācijas,
— preparāta stabilitāte un viendabīgums,
— sīki dati par testējamās vielas ievadīšanu,
— attiecīgā gadījumā testējamās vielas koncentrācijas (milj. daļas) barībā/dzeramajā ūdenī pārvēršana sasniegtajā devā (mg/kg ķermeņa svara dienā),
— sīkas ziņas par barības un ūdens kvalitāti.
Rezultāti:
— barības patēriņš un, ja pieejams, ūdens patēriņš, barības efektivitāte (ķermeņa svara palielinājums uz patērētās barības gramu) un testējamā materiāla patēriņš P un F1 dzīvniekiem, izņemot kopā turēšanas periodu un vismaz laktācijas pēdējo trešdaļu,
— uzsūkšanās dati (ja pieejami),
— pārošanai izraudzīto P un F1 dzīvnieku ķermeņa svara dati,
— metiena un mazuļu svara dati,
— ķermeņa svars nogalinot, un vecāku dzīvnieku absolūtā un relatīvā svara dati,
— klīnisko pazīmju veids, smagums un ilgums (atgriezeniskas vai neatgriezeniskas),
— nāves laiks pētījuma laikā vai arī dzīvnieki izdzīvojuši līdz nogalināšanai,
— toksiskās atbildes reakcijas dati pēc dzimuma un devas, iekļaujot pārošanās, auglības, grūsnības, dzimšanas, dzīvotspējas un laktācijas indeksus; pārskatā jānorāda skaitļi, kas izmantoti minēto indeksu aprēķināšanā,
— toksiskās vai citas iedarbības uz reproduktīvo funkciju, pēcnācējiem, postnatālo augšanu utt.,
— autopsijas konstatācijas,
— visu histopatoloģisko konstatāciju sīki izstrādāts apraksts,
— P un F1 mātīšu skaits, kurām ir normāls cikls un cikla ilgums,
— kopējais cauda epididymal spermas skaits, pieaugoši kustīgās spermas procentuālais daudzums, morfoloģiski normālās spermas procentuālais daudzums un spermas ar katru identificētu nenormālību procentuālais daudzums,
— laiks līdz pārošanai, iekļaujot dienu skaitu līdz pārošanai,
— grūsnības ilgums,
— implantāciju un corpora lutea skaits, metiena lielums,
— dzīvi dzimušo skaits un pēcimplantācijas zudumi,
— mazuļu skaits ar makroskopiski redzamām anomālijām, ja ir noteikts nīkuļu skaits, kuri jāreģistrē,
— dati par mazuļu fiziskām atšķirības iezīmēm un citi postnatālās attīstības dati; novērtētas fiziskās atšķirības iezīmes ir jāpamato,
— funkcionālo novērojumu dati attiecīgi par mazuļiem un pieaugušajiem,
— attiecīgā gadījumā statistiskās apstrādes rezultāti.
Rezultātu apspriešana.
Secinājumi, iekļaujot NOAEL vērtības ietekmes uz māti un pēcnācējiem.
4. IZMANTOTĀ LITERATŪRA
(1) Sadleir, R.M.F.S. (1979). Cycles and Seasons, In: Reproduction in Mammals: I. Germ Cells and Fertilization, C.R. Auston and R.V. Short (eds.), Cambridge, New York.
(2) Gray, L.E. et al., (1989). A Dose-Response Analysis of Methoxychlor-Induced Alterations of Reproductive Development and Function in the Rat. Fundamental and Applied Toxicology 12:92–108.
(3) Robb, G.W. et al., (1978). Daily Sperm Production and Epididymal Sperm Reserves of Pubertal and Adult Rats. Journal of Reproduction and Fertility 54:103–107.
(4) Klinefelter, G.R. et al., (1991). The Method of Sperm Collection Significantly Influences Sperm Motion Parameters Following Ethane Dimethanesulfonate Administration in the Rat. Reproductive Toxicology 5:39; p. 44.
(5) Seed, J. et al. (1996). Methods for Assessing Sperm Motility, Morphology, and Counts in the Rat, Rabbit, and Dog: a Consensus Report. Reproductive Toxicology 10(3):237–244.
(6) Chapin, R.E. et al., (1992).Methods for Assessing Rat Sperm Motility. Reproductive Toxicology 6:267-273.
(7) Klinefelter, G.R. et al., (1992). Direct Effects of Ethane Dimethanesulphonate on Epididymal Function in Adult Rats: an In Vitro Demonstration. Journal of Andrology 13:409–421.
(8) Slott, V.L. et al., (1991). Rat Sperm Motility Analysis: Methodologic Considerations. Reproductive Toxicology 5:449–458.
(9) Slott, V.L. and Perreault, S.D., (1993). Computer-Assisted Sperm Analysis of Rodent Epididymal Sperm Motility Using the Hamilton-Thorn Motility Analyzer. In: Methods in Toxicology, Part A., Academic, Orlando, Florida, p. 319–333.
(10) Toth, G.P. et al. (1989). The Automated Analysis of Rat Sperm Motility Following Subchronic Epichlorhydrin Administration: Methodologic and Statistical Considerations. Journal of Andrology 10: 401–415.
(11) Working, P.K. and M. Hurtt, (1987). Computerised Videomicrographic Analysis of Rat Sperm Motility. Journal of Andrology 8:330–337.
(12) Linder, R.E. et al., (1992). Endpoints of Spermatoxicity in the Rat After Short Duration Exposures to Fourteen Reproductive Toxicants. Reproductive Toxicology 6:491–505.
(13) Korenbrot, C.C. et al., (1977). Preputial Separation as an External Sign of Pubertal Development in the Male Rat. Biological Reproduction 17:298303.
(14) Russell, L.D. et al., (1990). Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, Florida.
(15) Heindel, J.J. and R.E. Chapin, (eds.) (1993). Part B. Female Reproductive Systems, Methods in Toxicology, Academic, Orlando, Florida.
(16) Heindel, J.J. et al., (1989) Histological Assessment of Ovarian Follicle Number in Mice As a Screen of Ovarian Toxicity. In: Growth Factors and the Ovary, A.N. Hirshfield (ed.), Plenum, New York, p. 421–426.
(17) Manson, J.M. and Y.J. Kang, (1989). Test Methods for Assessing Female Reproductive and Developmental Toxicology. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven, New York.
(18) Smith, B.J. et al,. (1991). Comparison of Random and Serial Sections in Assessment of Ovarian Toxicity. Reproductive Toxicology 5:379–383.
(19) Heindel, J.J. (1999). Oocyte Quantitation and Ovarian Histology. In: An Evaluation and Interpretation of Reproductive Endpoints for Human Health Risk Assessment, G. Daston,. and C.A. Kimmel, (eds.), ILSI Press, Washington, DC.
(20) Thomas, J. A. (1991). Toxic Responses of the Reproductive System. In: Casarett and Doull’s Toxicology, M.O. Amdur, J. Doull, and C.D. Klaassen (eds.), Pergamon, New York.
(21) Zenick, H. and E.D. Clegg, (1989). Assessment of Male Reproductive Toxicity: A Risk Assessment Approach. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven Press, New York.
(22) Palmer, A.K. (1981). In: Developmental Toxicology, Kimmel, C.A. and J. Buelke-Sam (eds.), Raven Press, New York.
(23) Palmer, A.K. (1978). In Handbook of Teratology, Vol. 4, J.G. Wilson and F.C. Fraser (eds.), Plenum Press, New York.
B. 36. TOKSIKOKINĒTIKA
1. METODE
1.1. IEVADS
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Skatīt vispārīgā ievada B daļu.
1.3. STANDARTVIELAS
Nav.
1.4. METODES BŪTĪBA
Pārbaudāmo vielu ievada, izmantojot attiecīgo aplikācijas veidu. Atkarībā no pētījuma mērķa šo vielu noteiktā laikā posmā var ievadīt vienreiz vai atkārtoti vienai vai vairākām izmēģinājumu dzīvnieku grupām. Pēc tam atkarībā no pētījuma veida pārbaudāmo vielu un/vai tās metabolītus nosaka ķermeņa šķidrumos, audos un/vai izdalījumos.
Pētījumus var veikt, izmantojot “iezīmētu” vai “neiezīmētu” testa vielu. Ja izmanto iezīmētu pārbaudāmo vielu, tā jāiezīmē tā, lai iegūtu pēc iespējas vairāk informācijas par savienojuma pārvērtību gaitu.
1.5. KVALITĀTES KRITĒRIJI
Nav.
1.6. METODES APRAKSTS
Sagatavošanas darbi
Veselus un jaunus pieaugušos dzīvniekus vismaz piecas dienas pirms izmēģinājuma sāk pieradināt pie laboratorijas apstākļiem. Dzīvniekus pirms izmēģinājuma pēc nejaušības principa sadala apstrādes grupās. Īpašos gadījumos izmanto pavisam jaunus, grūsnus vai jau iepriekš apstrādātus dzīvniekus.
Testa apstākļi
Toksikokinētikas izpēti var veikt ar vienu vai vairākām piemērotām dzīvnieku sugām, ņemot vērā to, kādu sugu dzīvnieki jau ir izmantoti vai tiks izmantoti citos toksikoloģiskajos pētījumos ar šo vielu. Ja izmanto grauzējus, to svara svārstības izmēģinājuma laikā nedrīkst pārsniegt ± 20 % no vidējā svara.
Pārbaudot vielas absorbciju un ekskrēciju, katrā grupā, kas saņem vienādu devu, sākotnēji jābūt četriem dzīvniekiem. Dzīvnieku dzimumam nav lielas nozīmes, lai gan atsevišķos gadījumos jāpārbauda abu dzimumu dzīvnieki. Ja reakcija atšķiras atkarībā no dzimuma, tad jāpārbauda pa četriem katra dzimuma dzīvniekiem. Ja pētījumos neizmanto grauzējus, dzīvnieku skaits var būt mazāks. Pētot vielas izplatīšanos audos, sākotnējais grupas lielums ir atkarīgs no tā, cik dzīvnieku jānokauj katrā konkrētā laika sprīdī un cik bieži tas jādara.
Pētot vielas metabolismu, dzīvnieku skaits ir atkarīgs no konkrēta pētījuma mērķiem. Izmantojot vairākkārtējas devas un dažādus termiņus, grupas lielums ir atkarīgs no termiņu skaita un no tā, cik bieži dzīvnieki jānokauj; jebkurā gadījumā grupā nevar būt mazāk par diviem dzīvniekiem. Jābūt pietiekamam dzīvnieku skaitam, lai atkarībā no apstākļiem varētu pienācīgi noteikt pārbaudāmās vielas un/vai tās metabolītu koncentrācijas pieaugumu, stabilizēšanos un/vai sarukšanu.
Ja vielu ievada tikai vienreiz, jābūt vismaz divām dažādām devām. Jāizvēlas tāda mazākā deva, kas nav toksiska, un tāda lielākā deva, kas ietekmē toksikokinētikas parametrus vai kurai piemīt toksiska iedarbība.
Ja vielu ievada atkārtoti, parasti pietiek ar mazāko devu, lai gan dažreiz nākas izmantot arī lielāko devu.
Toksikokinētikas pētījumos izmanto to pašu aplikācijas veidu un, attiecīgi, to pašu šķīdinātāju, kas jau bijis vai tiks izmantots citos toksicitātes pētījumos. Parasti pārbaudāmo vielu noteiktā laika posmā ievada vairākām izmēģinājumu dzīvnieku grupām perorāli, ar zondes palīdzību, pievieno uzturam, uztriepj uz ādas vai izmanto inhalācijas testu. Pārbaudāmo vielu var ievadīt arī intravenozi, lai salīdzinātu tās absorbcijas ātrumu atkarībā no aplikācijas veida. Turklāt šādi var iegūt noderīgu informāciju par vielas izplatīšanos organismā tūlīt pēc intravenozās ievadīšanas.
Jāpatur prātā šķīdinātāja un pārbaudāmās vielas mijiedarbības iespējamība. Jāpievērš uzmanība tam, ka pārbaudāmās vielas absorbcija, to ievadot caur zondi vai kopā ar uzturu, var atšķirties, kā arī tam, ka tās deva rūpīgi jāizvēlas, it īpaši tad, ja pārbaudāmo vielu pievieno uzturam.
Dzīvniekus katru dienu novēro un reģistrē toksiskuma pazīmes un citus svarīgus klīniskos simptomus, arī to parādīšanās laiku, smaguma pakāpi un ilgumu.
Testa norise
Pēc izmēģinājumu dzīvnieku nosvēršanas tiem attiecīgā veidā ievada pārbaudāmo vielu. Vajadzības gadījumā pārbaudāmo vielu dzīvniekiem ievada pēc badošanās.
Ievadītās vielas absorbcijas ātrumu un apmērus var noteikt ar dažādām metodēm, arī izmantojot etalongrupas ( 22 ), piemēram:
— nosakot pārbaudāmās vielas un/vai tās metabolītu daudzumu izdalījumos, proti, urīnā, fekālijās, izelpotā gaisā, un to atlikumu ķermenī,
— salīdzinot bioloģisko iedarbību (piemēram, akūtās toksicitātes noteikšana) uz izmēģinājumu, kontroles un/vai etalongrupas dzīvniekiem,
— salīdzinot nieru izvadītās vielas un/vai tās metabolītu daudzumu izmēģinājumu grupās un etalongrupās,
— aprēķinot platību zem līknes, kas raksturo pārbaudāmās vielas un/vai tās metabolītu koncentrāciju plazmā atkarībā no laika, un salīdzinot to ar etalongrupas datiem.
Pašlaik pastāv divi paņēmieni, kā var analizēt vielas izplatīšanos organismā, kuri ir izmantojami arī abi reizē:
— noderīgus kvalitatīvus datus var iegūt, izmantojot visa ķermeņa autoradiogrāfiju,
— kvantitatīvus datus var iegūt, nokaujot dzīvniekus dažādos termiņos pēc vielas aplikācijas un nosakot pārbaudāmās vielas un/vai tās metabolītu koncentrāciju un daudzumu audos un orgānos.
Pētot vielas izvadīšanu no organisma, ņem urīna, fekāliju un izelpotā gaisa paraugus, bet atsevišķos gadījumos arī žulti. Pārbaudāmās vielas un/vai tās metabolītu daudzumu šajos izdalījumos nosaka dažādos laikos pēc aplikācijas, kamēr tiks izvadīti 95 % no ievadītās devas, bet ne ilgāk kā septiņas dienas.
Īpašos gadījumos izmēģinājumu dzīvniekiem zīdīšanas laikā nosaka pārbaudāmās vielas koncentrāciju pienā.
Lai noteiktu vielas metabolisma intensitāti un īpatnības, ar piemērotām metodēm analizē bioloģiskus paraugus. Jānoskaidro metabolītu struktūra, un jānorāda attiecīgie vielmaiņas ceļi, ja iepriekšējos toksikoloģiskajos pētījumos nav rastas atbildes uz šiem jautājumiem. Vielmaiņas ceļu noskaidrošanai var lieti noderēt izmēģinājumi in vitro.
Sīkāku informāciju par vielas toksicitātes saistību ar tās metabolismu var iegūt no bioķīmijas pētījumiem, piemēram, pētot tās ietekmi uz metabolisko fermentu sistēmām, endogēno neolbaltumvielu sulfhidrila savienojumu deplēciju un vielas saistīšanos ar makromolekulām.
2. DATI
Iegūtos datus atkarībā no pētījuma veida apkopo tabulā, vajadzības gadījumā pievienojot arī grafikus un diagrammas. Ja vajadzīgs, katrai izmēģinājumu grupai norāda vidējās vērtības un statistiskās svārstības atkarībā no laika, devas, audiem un orgāniem. Ar attiecīgām metodēm nosaka absorbcijas pakāpi, kā arī izvadītās vielas daudzumu un izvadīšanas ātrumu. Pēc vielas metabolisma izpētes ir jānorāda identificēto metabolītu struktūra un iespējamie vielmaiņas ceļi.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Atkarībā no pētījuma veida testa ziņojumā, ja iespējams, jāiekļauj šādas ziņas:
— informācija,
— dzīvnieku suga, līnija, izcelsme, turēšanas apstākļi, uzturs,
— iezīmēto vielu raksturojums, ja tās izmanto,
— izmantotās devas un laika intervāls starp devām,
— aplikācijas veids(-i) un izmantotie šķīdinātāji,
— toksiska iedarbība un citi novērotie iedarbības veidi,
— metodes pārbaudāmās vielas un/vai tās metabolītu noteikšanai bioloģiskos paraugos,
— izelpotais gaiss,
— tabulā(-ās) apkopoti mērījumu rezultāti atkarībā no devas, ievadīšanas režīma, laika, audiem un orgāniem,
— dati par vielas absorbciju un izvadīšanu laika gaitā,
— metodes vielas metabolītu raksturošanai un noteikšanai bioloģiskos paraugos,
— bioķīmiskās metodes vielas metabolisma noteikšanai,
— iespējamie vielmaiņas ceļi,
— rezultātu iztirzājums,
— rezultātu interpretācija.
3.2. IZVĒRTĒJUMS UN INTERPRETĀCIJA
Skatīt vispārīgā ievada B daļu.
4. IZMANTOTĀ LITERATŪRA
Skatīt vispārīgā ievada B daļu.
B.37. FOSFORORGANISKO VIELU AIZKAVĒTĀ NEIROTOKSICITĀTE PĒC AKŪTAS IEDARBĪBAS
1. METODE
1.1. IEVADS
Novērtējot vielu toksisko ietekmi, ir svarīgi ņemt vērā, ka dažu klašu vielas spēj izraisīt īpaša veida neirotoksicitāti, ko nevar noteikt citos toksicitātes pētījumos. Ir novērots, ka dažas fosfororganiskās vielas izraisa aizkavētu neirotoksicitāti, un tās ir jāuzskata par kandidātēm vērtēšanai.
Lai identificētu vielas, kas var izraisīt aizkavēto polineiropātiju, var izmantot in vitro skrīninga testus, tomēr negatīvi in vitro rezultāti nav pierādījums, ka testa viela nav neirotoksiska.
Skatīt vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Fosfororganiskas vielas iekļauj organofosforskābes, organofosfonskābes vai organofosforamīdskābes vai radniecīgus tiofosforskābes, tiofosfonskābes vai tiofosforamīdskābes nelādētus fosfororganiskos esterus, tioesterus vai anhidrīdus, vai citas vielas, kas var izraisīt aizkavētu neirotoksicitāti, kura dažreiz ir novērojama šajā vielu klasē.
Aizkavēta neirotoksicitāte ir sindroms, kas saistīts ar paildzinātu, aizkavētu ataksijas parādīšanos, muguras smadzeņu un perifērā nerva distālām aksonopātijām un ar neiropātiju saistītās esterāzes (NTE) kavēšanu un novecošanu nervu audos.
1.3. STANDARTVIELAS
Standartvielu var pārbaudīt ar pozitīvu kontroles grupu kā līdzekli, lai parādītu, ka laboratorijas testa apstākļos testa sugas atbildes reakcijas nav ievērojami mainījušās.
Plaši lietotas neirotoksiskas vielas piemērs ir tri-o-tolilfosfāts (CAS 78-30-8, Einecs 201-103-5, CAS nomenklatūra: fosforskābes tris(2-metilfenil)esteris, pazīstams arī kā tris-o-krezilfosfāts.
1.4. TESTA METODES PRINCIPS
Testa vielu ievada perorāli vienā devā mājas vistām, kas attiecīgā gadījumā ir aizsargātas no akūtas holīnerģiskas ietekmes. Dzīvniekus novēro 21 dienu, vai neparādās izturēšanās anomālijas, ataksija un paralīze. Pēc nejaušas izvēles no katras grupas izraudzītām vistām izdara bioķīmiskos mērījumus, jo īpaši ar neiropātiju saistītās esterāzes (NTE) kavēšanu, parasti 24 un 48 stundas pēc dozēšanas. 21 dienu pēc iedarbības atlikušās vistas nogalina un izdara izraudzītu nervu audu histopatoloģiskos izmeklējumus.
1.5. TESTA METODES APRAKSTS
1.5.1. Sagatavošanās
Jaunas veselas pieaugušas vistas, kam nav traucējošu vīrusu slimību un kas nesaņem medikamentus, un kam nav nenormāla gaita, pēc nejaušās izvēles iedala vielas saņemšanas un kontroles grupās un aklimatizē laboratorijas apstākļos vismaz piecas dienas pirms pētījuma sākšanas.
Jāizmanto būri vai norobežojumi, kas ir pietiekami plaši, lai vistas varētu brīvi kustēties un to gaita būtu viegli novērojama.
Testa vielu parasti dozē perorāli, izmantojot mākslīgo barošanu, želatīna kapsulas vai līdzīgu metodi. Šķidrumus var dot neatšķaidītus vai izšķīdinātus piemērotā nesējā, piemēram, kukurūzas eļļā; cietas vielas, ja iespējams, ir jāizšķīdina, jo lielas cietu vielu devas želatīna kapsulās var efektīvi neuzsūkties. Ir jāzina neūdens nesēju toksiskās īpašības un, ja tās nav zināmas, tad jānosaka pirms testa.
1.5.2. Testa apstākļi
1.5.2.1. Testa dzīvnieki
Ir ieteicams izmantot jaunas pieaugušas mājas dējējvistas (Gallus gallus domesticus), 8 līdz 12 mēnešus vecas. Ir jāizmanto standartlieluma šķirnes un līnijas, un vistām parasti jābūt izaudzētām apstākļos, kas ļauj brīvi kustēties.
1.5.2.2. Skaits un dzimums
Papildus vielas saņemšanas grupai ir jāizmanto nesēja kontroles grupa un pozitīvā kontroles grupa. Ar nesēja kontroles grupu ir jārīkojas tāpat kā ar vielas saņemšanas grupu, izņemot to, ka netiek ievadīta testa viela.
Katrā vistu grupā ir jāizmanto pietiekams putnu skaits tā, lai vismaz sešus putnus varētu nogalināt bioķīmiskajām noteikšanām (trīs katrā no diviem laika punktiem) un seši varētu izdzīvot 21 dienu ilgā pataloģiju novērošanas laikposmā.
Pozitīvo kontroles grupu var testēt vienlaikus vai arī tā var būt nesena agrākā kontroles grupa. Tajā ir jābūt vismaz sešām vistām, kas saņēmušas zināmu aizkavētas iedarbības neirotoksisku vielu, trim vistām bioķīmiskajiem izmeklējumiem un trim vistām patoloģiju izmeklējumiem. Ir ieteicams regulāri atjaunināt agrākos datus. Ir jāizveido jauni pozitīvas kontroles dati, ja testēšanas laboratorijā ir mainījusies kāda būtiska testa izdarīšanas sastāvdaļa (piemēram, līnija, barība, turēšanas apstākļi).
1.5.2.3. Devu līmeņi
Lai noteiktu galvenajā pētījumā izmantojamo līmeni, ir jāizdara iepriekšējs pētījums, izmantojot grupas ar piemērotu vistu skaitu un devu līmeņiem. Šajā iepriekšējā pētījumā parasti ir vajadzīga neliela letalitāte, lai noteiktu galvenajam pētījumam piemērotu devu. Tomēr, lai novērstu nobeigšanos akūtu holīnerģisku ietekmju dēļ, var izmantot atropīnu vai citu aizsargājošu līdzekli, par ko ir zināms, ka tas netraucē aizkavētas neirotoksiskas atbildes reakcijas. Lai novērtētu maksimālo neletālo testa vielas devu, var izmantot dažādas testa metodes (skatīt B.1.a metodi). Devas izvēlē noderīgi var būt arī agrākie dati par vistām vai cita toksikoloģijas informācija.
Testa vielas devas līmenim galvenajā pētījumā jābūt iespējami augstam, ņemot vērā devas izvēles iepriekšējā pētījuma rezultātus un augšējo robežas devu 2 000 mg/kg ķermeņa svara. Mirstība, kas var būt sastopama, nedrīkst izjaukt pietiekama skaita dzīvnieku izdzīvošanu bioķīmiskajām analīzēm (seši) un histoloģiskajām analīzēm (seši) 21 dienas laikā. Tomēr, lai novērstu nobeigšanos akūtu holīnerģisku ietekmju dēļ, var izmantot atropīnu vai citu aizsargājošu līdzekli, par ko ir zināms, ka tas netraucē aizkavētas neirotoksiskas atbildes reakcijas.
1.5.2.4. Pieļaujamā daudzuma tests
Ja novērojamu toksisku ietekmi neizraisa tests ar devas līmeni vismaz 2 000 mg/kg ķermeņa svara dienā, izmantojot procedūras, kas aprakstītas šā pētījuma izdarīšanai, un ja toksicitāte nav sagaidāma, pamatojoties uz datiem par struktūras ziņā līdzīgām vielām, tad pētījumu ar lielāku devu var uzskatīt par nevajadzīgu. Pieļaujamā daudzuma testu pielieto, izņemot gadījumus, ja iedarbība uz cilvēkiem norāda, ka ir jāizmanto augstāks devas līmenis.
1.5.3. Novērošanas laikposms
Novērošanas laikposms ir 21 diena.
1.5.4. Procedūra
Pēc aizsargājoša līdzekļa ievadīšanas, lai novērstu nobeigšanos akūtas holīnerģiskas ietekmes dēļ, vienā devā ievada testa vielu.
Novērošana jāuzsāk tūlīt pēc pakļaušanas iedarbībai. Pirmo divu dienu laikā visas vistas ir rūpīgi jānovēro vairākas reizes un pēc tam vismaz reizi dienā 21 dienu laika posmā līdz plānotajai nogalināšanai. Ir jāprotokolē visas toksicitātes pazīmes, iekļaujot nenormālas izturēšanās parādīšanos, veidu, smagumu un ilgumu. Ataksija ir jānovērtē, izmantojot kārtas gradāciju skalu, kas sastāv no vismaz četriem līmeņiem, un jādokumentē paralīze. Vismaz divreiz nedēļā vistas, kas atlasītas patoloģiju pētījumiem, ir jāizņem no būriem un jāpakļauj pastiprinātas kustību aktivitātes laika posmam, piemēram, kāpšanai pa kāpnēm, lai atvieglotu minimālu toksisko ietekmju novērošanu. Mirstoši dzīvnieki un dzīvnieki, kam ir smagas ciešanas, ja tie ievēroti, ir jāizņem, humāni jānogalina un jāizdara autopsija.
Visas vistas ir jānosver tieši pirms testa vielas ievadīšanas un vismaz reizi nedēļā pēc tam.
Pēc nejaušās izvēles izraudzītas sešas vistas no vielas saņemšanas grupas un sešas vistas no nesēja kontroles grupas, un trīs vistas no pozitīvās kontroles grupas (ja šo grupu pēta paralēli) jānogalina dažas dienas pēc dozēšanas, un galvas smadzenes un muguras smadzenes jāsagatavo un jāanalizē, lai noteiktu ar neiropātiju saistītās esterāzes kavēšanas aktivitāti. Turklāt var arī būt noderīgi sagatavot un analizēt sēžas nerva audus, lai noteiktu ar neiropātiju saistītās esterāzes kavēšanas aktivitāti. Parasti trīs putnus no kontroles grupas un no katras vielas saņemšanas grupas nogalina pēc 24 stundām un trīs pēc 48 stundām, bet trīs pozitīvās kontroles grupas vistas nogalina pēc 24 stundām. Ja intoksikācijas klīnisko pazīmju novērošana (tās bieži var novērtēt, novērojot holīnerģisko pazīmju parādīšanās laiku) norāda, ka toksiskā viela var izdalīties ļoti lēni, tad var būt vēlams ņemt audu paraugus no trim putniem divos citos laikos starp 24 un 72 stundām pēc dozēšanas.
Šiem paraugiem var izdarīt arī acetilholīnesterāzes (AchE) analīzes, ja to uzskata par lietderīgu. Tomēr in vivo var notikt spontāna AchE reaktivācija, un tādēļ vielas spēju kavēt AchE var novērtēt par zemu.
Visu dzīvnieku (plānoti nogalināto un mirstošo nogalināto) autopsijā ir jāiekļauj galvas smadzeņu un muguras smadzeņu izskata novērojumi.
Novērošanas laika posmā izdzīvojušo un bioķīmiskos pētījumos neizmantoto dzīvnieku nervu audi ir jāizmeklē mikroskopā. Audi ir jāfiksē in situ, izmantojot perfūzijas metodi. Audu griezumos jāiekļauj cerebellum (vidus garengriezuma līmenī), medulla oblongata, muguras smadzenes un perifērie nervi. Muguras smadzeņu griezumi ir jāņem no augšējā kakla daļas segmenta, torakālās vidusdaļas un jostasvietas daļas. Ir jāņem griezumi no tibiālā nerva un tā atzaru uz musculus gastrocnemius distālās daļas un no sēžas nerva. Griezumi ir jāiekrāso ar piemērotām mielīnam un aksoniem specifiskām krāsvielām.
2. DATI
Ja šajā metodē izraudzītajos beigu punktos (bioķīmijas, histopatoloģijas un izturēšanās novērojumos) ir iegūti negatīvi rezultāti, parasti nav vajadzīga turpmāka testēšana attiecībā uz aizkavētu neirotoksicitāti. Neviennozīmīgu vai neskaidru rezultātu gadījumā attiecībā uz šiem beigu punktiem var būt vajadzīga turpmāka izvērtēšana.
Norāda datus par atsevišķiem dzīvniekiem. Turklāt visi dati ir jāapkopo tabulas veidā, kurā katrai testa grupai parādīts dzīvnieku skaits testa sākumā, dzīvnieku skaits, kam novēroti audu bojājumi, ietekmes uz izturēšanos vai bioķīmiskas ietekmes, minēto audu bojājumu vai ietekmju veids un ilgums un dzīvnieku procentuālais daudzums atbilstīgi katra bojājuma vai ietekmes veidam un smagumam.
Šā pētījuma rezultāti ir jāvērtē, ņemot vērā izturēšanās, bioķīmisko un histopatoloģisko ietekmju un citu novēroto ietekmju biežumu, smagumu un korelācijas vielu saņēmušajās un kontroles grupās.
Skaitliskie rezultāti ir jānovērtē ar piemērotām un vispāratzītām statistikas metodēm. Izmantojamās statistikas metodes jāizvēlas, plānojot pētījumu.
3. ZIŅOJUMU SASTĀDĪŠANA
TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, iekļauj šādu informāciju.
3.1. Testa dzīvnieki:
— izmantotā līnija,
— dzīvnieku skaits un vecums,
— izcelsme, turēšanas apstākļi u. c.,
— atsevišķo dzīvnieku svars testa sākumā.
3.2. Testa apstākļi:
— sīkas ziņas par testa vielas sagatavošanu, stabilitāti un homogēniskumu; attiecīgā gadījumā,
— nesēja izvēles pamatojums,
— sīkas ziņas par testa vielas ievadīšanu,
— sīkas ziņas par barības un ūdens kvalitāti,
— devu izvēles pamatojums,
— ievadīto devu specifikācija, iekļaujot sīkas ziņas par ievadītā materiāla nesēju, tilpumu un fizikālo formu,
— aizsargājošā aģenta identifikācija un sīkas ziņas par tā ievadīšanu.
3.3. Rezultāti:
— dati par ķermeņa svaru,
— toksiskās atbildes reakcijas dati pa grupām, iekļaujot mirstību,
— klīniski novēroto pazīmju specifika, smagums un ilgums (atgriezenība vai neatgriezenība),
— bioķīmisko metožu un konstatāciju sīki izstrādāts apraksts,
— autopsijas konstatācijas,
— visu histopatoloģisko konstatāciju sīki izstrādāts apraksts,
— attiecīgā gadījumā rezultātu statistiskā apstrāde.
Rezultātu izvērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
Šī metode ir analoga ESAO TG 418.
B.38. FOSFORORGANISKO VIELU AIZKAVĒTĀS NEIROTOKSICITĀTES 28 DIENU VAIRĀKKĀRTĒJAS DEVAS PĒTĪJUMS
1. METODE
1.1. IEVADS
Vērtējot vielu toksisko ietekmi, ir svarīgi ņemt vērā, ka dažu klašu vielas spēj izraisīt īpaša veida neirotoksicitāti, ko nevar noteikt citos toksicitātes pētījumos. Ir novērots, ka dažas fosfororganiskās vielas izraisa aizkavētu neirotoksicitāti, un tās ir jāuzskata par kandidātēm vērtēšanai.
Lai identificētu tās vielas, kas var izraisīt aizkavētu polineiropātiju, var izmantot in vitro skrīninga testus; tomēr in vitro pētījumu negatīvie rezultāti nav pierādījums, ka testa viela nav neirotoksiska.
Šis 28 dienu aizkavētās neirotoksicitātes tests sniedz informāciju par iespējamu veselības apdraudējumu, ko, sagaidāms, var radīt atkārtota iedarbība ierobežotā laika posmā. Tas sniedz informāciju par devas sakarību ar atbildes reakciju, un tajā var novērtēt nenovērotas nelabvēlīgas ietekmes līmeni, kas var būt noderīgs, lai noteiktu iedarbības drošības kritērijus.
Skatīt arī vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Fosfororganiskas vielas iekļauj organofosforskābes, organofosfonskābes vai organofosforamīdskābes vai radniecīgus tiofosforskābes, tiofosfonskābes vai tiofosforamīdskābes nelādētus fosfororganiskos esterus, tioesterus vai anhidrīdus vai citas vielas, kas var izraisīt aizkavētu neirotoksicitāti, kura dažreiz ir novērojama šai vielu klasei.
Aizkavēta neirotoksicitāte ir sindroms, kas saistīts ar paildzinātu, aizkavētu ataksijas parādīšanos, muguras smadzeņu un perifērā nerva distālām aksonopātijām un ar neiropātiju saistītās esterāzes (NTE) kavēšanu un novecošanu audos.
1.3. TESTA METODES PRINCIPS
Testa vielas dienas devas perorāli ievada mājas vistām 28 dienas. Dzīvniekus novēro vismaz reizi dienā attiecībā uz izturēšanās anomālijām, ataksiju un paralīzi laikā līdz 14 dienām pēc pēdējās devas. Pēc nejaušas izvēles no katras grupas izraudzītām vistām izdara bioķīmiskos mērījumus, jo īpaši ar neiropātiju saistītās esterāzes (NTE) kavēšanu, parasti 24 un 48 stundas pēc pēdējās devas. Divas nedēļas pēc pēdējās devas atlikušās vistas nogalina un izdara izraudzītu nervu audu histopatoloģiskos izmeklējumus.
1.4. TESTA METODES APRAKSTS
1.4.1. Sagatavošanās
Jaunas veselas pieaugušas vistas, kam nav traucējošu vīrusu slimību un kas nesaņem medikamentus, un kam nav nenormāla gaita, pēc nejaušās izvēles iedala vielas saņemšanas un kontroles grupās un aklimatizē laboratorijas apstākļos vismaz piecas dienas pirms pētījuma sākšanas.
Jāizmanto būri vai norobežojumi, kas ir pietiekami plaši, lai vistas varētu brīvi kustēties un to gaita būtu viegli novērojama.
Katru dienu septiņas dienas nedēļā ir jāizdara perorāla dozēšana, vēlams, ar mākslīgo barošanu vai ievadot želatīna kapsulas. Šķidrumus var dot neatšķaidītus vai izšķīdinātus piemērotā nesējā, piemēram, kukurūzas eļļā; cietas vielas, ja iespējams, ir jāizšķīdina, jo lielas cietu vielu devas želatīna kapsulās var efektīvi neuzsūkties. Ir jāzina neūdens nesēju toksiskās īpašības, un, ja tās nav zināmas, tad jānosaka pirms testa.
1.4.2. Testa apstākļi
Ir ieteicams izmantot jaunas pieaugušas mājas dējējvistas (Gallus gallus domesticus), 8 līdz 12 mēnešus vecas. Ir ieteicams izmantot standartlielumu, šķirnes un līnijas, un vistām parasti jābūt izaudzētām apstākļos, kas ļauj brīvi kustēties.
Parasti jāizmanto vismaz trīs testa grupas un nesēja kontroles grupa. Ar nesēja kontroles grupu ir jārīkojas tāpat kā ar vielas saņemšanas grupu, izņemot testa vielas ievadīšanu.
Katrā putnu grupā ir jāizmanto pietiekams vistu skaits tā, lai vismaz sešus putnus varētu nogalināt bioķīmiskajām noteikšanām (trīs katrā no diviem laika punktiem) un seši putni varētu izdzīvot 14 dienu ilgā patoloģiju novērošanas laikposmā pēc vielas došanas.
Devu līmeņi jāizvēlas, ņemot vērā trīs aizkavētās neirotoksicitātes akūtā testa rezultātus vai par testa savienojumu pieejamos kinētikas datus. Augstākais devas līmenis ir jāizvēlas ar mērķi izraisīt toksiskas ietekmes, vēlams, aizkavēto neirotoksicitāti, bet ne nobeigšanos vai acīm redzamas ciešanas. Pēc tam jāizvēlas devu līmeņi lejupejošā secībā, lai parādītu visas ar devām saistītās atbildes reakcijas un lai zemākais devas līmenis būtu nenovērotas nelabvēlīgas ietekmes līmenis.
Ja novērojamu toksisku iedarbību neizraisa tests ar devas līmeni vismaz 1 000 mg/kg ķermeņa svara dienā, izmantojot procedūras, kas aprakstītas šā pētījuma izdarīšanai, un ja toksicitāte nav sagaidāma, pamatojoties uz datiem par struktūras ziņā līdzīgām vielām, tad pētījumu ar lielāku devu var uzskatīt par nevajadzīgu. Pieļaujamā daudzuma testu pielieto, izņemot gadījumus, ja iedarbība uz cilvēkiem norāda, ka ir jāizmanto augstāks devas līmenis.
Visi dzīvnieki ir jānovēro vismaz reizi dienā pakļaušanas iedarbībai laikposmā un 14 dienas pēc tā, izņemot plānoto autopsiju.
1.4.3. Procedūra
Dzīvniekiem testa vielu ievada katru dienu septiņas dienas nedēļā 28 dienu laikposmā.
Novērošana jāuzsāk tūlīt pēc vielas ievadīšanas sākuma. Visas vistas ir rūpīgi jānovēro vismaz reizi dienā katrā no 28 dozēšanas dienām un 14 dienas pēc dozēšanas vai līdz plānotai nogalināšanai. Ir jāprotokolē visas toksicitātes pazīmes, iekļaujot to parādīšanās laiku, veidu, smagumu un ilgumu. Novērojumos ir jāiekļauj izturēšanās anomālijas, bet ar tām nav jāierobežojas. Ataksija ir jānovērtē, izmantojot kārtas gradāciju skalu, kas sastāv no vismaz četriem līmeņiem, un jādokumentē paralīze. Vismaz divreiz nedēļā vistas ir jāizņem no būriem un jāpakļauj pastiprinātas kustību aktivitātes laika posmam, piemēram, kāpšanai pa kāpnēm, lai atvieglotu minimālu toksisko ietekmju novērošanu. Mirstoši dzīvnieki un dzīvnieki, kam ir smaga briesmu sajūta vai ciešanas, ja tie ievēroti, ir jāizņem, humāni jānogalina un jāizdara autopsija.
Visas vistas ir jānosver tieši pirms testa vielas pirmās ievadīšanas un vismaz reizi nedēļā pēc tam.
Pēc nejaušās izvēles izraudzītas sešas vistas no vielas saņemšanas grupas un sešas vistas no nesēja kontroles grupas jānogalina dažas dienas pēc pēdējās devas, jāpreparē galvas smadzenes un muguras smadzenes, un tajās jāanalizē ar neiropātiju saistītās esterāzes (NTE) kavēšanas aktivitāte. Turklāt var arī būt noderīgi sagatavot un analizēt sēžas nerva audus, lai noteiktu ar neiropātiju saistītās esterāzes (NTE) kavēšanas aktivitāti. Parasti pa trim putniem no kontroles grupas un no katras vielas saņemšanas grupas nogalina pēc 24 stundām un pa trim putniem pēc 48 stundām pēc pēdējās devas. Ja akūtā pētījuma vai citu pētījumu (piemēram, toksikokinētikas) dati norāda, ka vēlami ir citi nogalināšanas laiki pēc pēdējās dozēšanas, tad šie laiki ir jālieto, un pamatojums jādokumentē.
Šiem paraugiem var izdarīt arī acetilholīnesterāzes (AchE) analīzes, ja to uzskata par lietderīgu. Tomēr in vivo var notikt spontāna AchE reaktivācija, un tādēļ vielas spēju kavēt AchE var novērtēt par zemu.
Visu dzīvnieku (plānoti nogalināto un mirstošo nogalināto) autopsijā ir jāiekļauj galvas smadzeņu un muguras smadzeņu izskata novērojumi.
Novērošanas laika posmā izdzīvojušo un bioķīmiskos pētījumos neizmantoto dzīvnieku nervu audi ir jāizmeklē mikroskopā. Audi ir jāfiksē in situ, izmantojot perfūzijas metodi. Audu griezumos jāiekļauj cerebellum (vidus garengriezuma līmenī), medulla oblongata, muguras smadzenes un perifērie nervi. Muguras smadzeņu griezumi ir jāņem no augšējā kakla daļas segmenta, torakālās vidusdaļas un jostasvietas daļas. Ir jāņem griezumi no tibiālā nerva un tā atzaru uz musculus gastrocnemius distālās daļas un no sēžas nerva. Griezumi ir jāiekrāso ar piemērotām mielīnam un aksoniem specifiskām krāsvielām. Sākotnēji visu kontroles grupas un lielākās devas grupas dzīvnieku konservētajiem audiem jāizdara mikroskopiskā izmeklēšana. Ja lielākās devas grupā ir ietekmes pierādījumi, ir jāizdara mikroskopiskā izmeklēšana arī vidējās un zemākās devas grupu vistām.
2. DATI
Ja šajā metodē izraudzītajos beigu punktos (bioķīmijas, histopatoloģijas un izturēšanās novērojumos) ir iegūti negatīvi rezultāti, parasti nav vajadzīga turpmāka testēšana attiecībā uz aizkavēto neirotoksicitāti. Neviennozīmīgu vai neskaidru rezultātu gadījumā attiecībā uz šiem beigu punktiem var būt vajadzīga turpmāka izvērtēšana.
Jānorāda dati par atsevišķiem dzīvniekiem. Turklāt visi dati ir jāapkopo tabulas veidā, kurā katrai testa grupai parādīts dzīvnieku skaits testa sākumā, dzīvnieku skaits, kam novēroti audu bojājumi, ietekmes uz izturēšanos vai bioķīmiskas ietekmes, minēto audu bojājumu vai ietekmju veids un ilgums un dzīvnieku procentuālais daudzums atbilstīgi katra bojājuma vai ietekmes veidam un smagumam.
Šā pētījuma rezultāti ir jāvērtē, ņemot vērā izturēšanās, bioķīmisko un histopatoloģisko ietekmju un citu novēroto ietekmju biežumu, smagumu un korelācijas katrā vielu saņēmušajā grupā un kontroles grupā.
Skaitliskie rezultāti ir jānovērtē ar piemērotām un vispāratzītām statistikas metodēm. Statistikas metodes jāizvēlas, plānojot pētījumu.
3. ZIŅOJUMU SASTĀDĪŠANA
TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, iekļauj šādu informāciju.
3.1. Testa dzīvnieki:
— izmantotā līnija,
— dzīvnieku skaits un vecums,
— izcelsme, turēšanas apstākļi u. c.,
— atsevišķo dzīvnieku svars testa sākumā.
3.2. Testa apstākļi:
— sīkas ziņas par testa vielas sagatavošanu, stabilitāti un homogēniskumu attiecīgā gadījumā,
— nesēja izvēles pamatojums,
— sīkas ziņas par testa vielas ievadīšanu,
— sīkas ziņas par barības un ūdens kvalitāti,
— devu izvēles pamatojums,
— devu specifikācija, iekļaujot sīkas ziņas par ievadītā materiāla nesēju, tilpumu un fizikālo formu,
— citu laiku izvēles pamatojums bioķīmiskajām noteikšanām, ja tie nav 24 un 48 stundas.
3.3. Rezultāti:
— dati par ķermeņa svaru,
— toksiskās atbildes reakcijas dati pa devu līmeņiem, iekļaujot mirstību,
— nenovērojamas nelabvēlīgas ietekmes līmenis,
— klīnisko novērojumu specifika, smagums un ilgums (atgriezenība vai neatgriezenība),
— bioķīmisko metožu un konstatāciju sīki izstrādāts apraksts,
— autopsijas konstatācijas,
— visu histopatoloģisko konstatāciju sīki izstrādāts apraksts,
— attiecīgā gadījumā rezultātu statistiskā apstrāde.
Rezultātu izvērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
Šī metode ir analoga ESAO TG 419.
B.39. NEPROGRAMMĒTAS DNS SINTĒZES (UDS) TESTS AR ZĪDĪTĀJU AKNU ŠŪNĀM IN VIVO
1. METODE
Šī metode ir ESAO TG 486 metodes “Neprogrammētas DNS sintēzes (UDS) tests ar zīdītāju aknu šūnām in vivo” (1997) kopija.
1.1. IEVADS
Neprogrammētas DNS sintēzes (UDS) testā ar zīdītāju aknu šūnām in vivo identificē testa vielas, kas izraisa DNS reparācijas ar tām apstrādāto dzīvnieku aknu šūnās (1) (2) (3) (4).
Šis in vivo tests ir metode vielu genotoksiskās iedarbības pētīšanai aknās. Testā noteiktais rādītājs liecina par DNS bojājumiem un tiem sekojošām reparācijām aknu šūnās. Aknas parasti ir galvenā vieta, kurā notiek uzņemto vielu metabolisms. Tādējādi tā ir piemērota vieta DNS bojājumu noteikšanai in vivo.
Gadījumos, kad noskaidrots, ka testa viela mērķaudos nenonāk, šo testu neizmanto.
Neprogrammētu DNS sintēzi (UDS) novērtē, nosakot iezīmētu nukleozīdu uzņemšanu šūnās, kurās nenotiek programmēta (S-fāzes) DNS sintēze. Plašāk izmanto ar tritiju iezīmēta timidīna (3H-TdR) uzņemšanas noteikšanu ar autoradiogrāfijas metodi. Neprogrammētas DNS sintēzes in vivo testam piemērotākās ir žurku aknas. Var izmantot arī citu orgānu audus, kas nav šīs metodes objekts.
Neprogrammētas DNS testa atbildes reakcijas noteikšana ir atkarīga no bojājuma vietā izgriezto un ievietoto DNS bāzu skaita. Tāpēc neprogrammētas DNS sintēzes tests ir īpaši noderīgs ķīmisko vielu izraisītu liela garuma reparāciju (no 20 līdz 30 bāzes) noteikšanai. Savukārt maza garuma reparāciju (viena līdz trīs bāzes) noteikšanas jutība ir ievērojami zemāka. Turklāt mutācijas var notikt tādēļ, ka DNS bojājumu vietās reparācija nenotiek, tā notiek nepareizi, vai arī nepareizas replikācijas dēļ. Neprogrammētas DNS sintēzes testa atbildes reakcija neliecina par reparācijas procesa pareizību. Turklāt ir iespējams, ka mutagēns reaģē ar DNS, bet DNS bojājums izgriešanas reparācijas procesā izlabots netiek. Specifiskas informācijas trūkumu par neprogrammētas DNS sintēzes testā noteikto mutagēno aktivitāti kompensē šā rādītāja jutība, jo to nosaka visā genomā.
Skatīt arī vispārīgā ievada B daļu.
1.2. DEFINĪCIJAS
Šūnas, kas atrodas reparācijas procesā: kopējā kodola graudainība, kura lielāka par iepriekšnoteikto, kas jāpamato laboratorijai, kura veic testu.
Kopējā kodola graudainība (NNG): šūnu neprogrammētas DNS sintēzes kvantitatīvs novērtējums autoradiogrāfiskos UDS testos, ko aprēķina, no kodola graudu skaita (NG) atņemot citoplazmas graudu skaitu kodoliem ekvivalentās citoplazmas zonās (CG): NNG = NG – CG. NNG skaitu aprēķina atsevišķām šūnām, ko pēc tam pārrēķina uz visām šūnām kultūrā, paralēlās kultūrās u. c.
Neprogrammēta DNS sintēze (UDS): DNS reparācijas sintēze pēc tāda DNS fragmenta izgriešanas un aizvadīšanas, kurā ir bojājums, kas radies ķīmiska vai fizikāla faktora iedarbības rezultātā.
1.3. TESTA METODES PRINCIPS
Neprogrammētas DNS sintēzes testā ar zīdītāju aknu šūnām in vivo indicē DNS reparācijas sintēzi pēc tāda DNS fragmenta izgriešanas un aizvadīšanas, kurā ir bojājums, kas radies ķīmiska vai fizikāla faktora iedarbības rezultātā. Testā parasti izmanto 3H-TdR iekļaušanu aknu šūnu DNS, jo tām šūnu ciklā ir maz šūnu S-fāzē. Parasti 3H-TdR uzņemšanu nosaka ar autogrāfiju, jo to mazāk traucē S-fāzes šūnas nekā, piemēram, šķidro scintilāciju skaitīšanu.
1.4. TESTA METODES APRAKSTS
1.4.1. Sagatavošana
1.4.1.1. Dzīvnieku sugu izvēle
Parasti izmanto žurkas, tomēr var izmantot jebkuras piemērotas sugas zīdītājus. Parasti izmanto jaunus, veselus, pieaugušus laboratorijas dzīvniekus. Izmēģinājuma sākumā dzīvnieku masas atšķirībām jābūt minimālām un tās nedrīkstētu pārsniegt ± 20 % no vidējās masas, kas noteikta katram dzimumam atsevišķi.
1.4.1.2. Turēšanas un barošanas nosacījumi
Izmanto vispārējos nosacījumus, kas minēti vispārīgā ievada B daļā, bet mitrumam vajadzētu būt 50 līdz 60 %.
1.4.1.3. Dzīvnieku sagatavošana
Veselus, jaunus, pieaugušus dzīvniekus pēc gadījuma izvēles principa sadala kontroles un apstrādes grupās. Būrus izvieto tā, lai iespējami samazinātu būru novietojuma varbūtējo ietekmi. Dzīvniekiem piešķir īpašu identifikāciju un līdz izmēģinājumu sākumam tos vismaz piecas dienas tur būros aklimatizācijai laboratorijas apstākļiem.
1.4.1.4. Testa viela/preparāts
Pirms došanas dzīvniekiem cietas testa vielas vispirms izšķīdina vai suspendē piemērotos šķīdinātājos vai nesējos un, ja vajadzīgs, atšķaida. Šķidras testa vielas var dozēt tieši vai pirms dozēšanas atšķaidīt. Ja dati par testa vielu preparātu stabilitāti liecina, ka tos uzglabāt nevar, izmanto svaigi pagatavotus preparātus.
1.4.2. Testa apstākļi
1.4.2.1. Šķīdinātājs/nesējs
Lietotajās devās šķīdinātājam vai nesējam nedrīkst būt toksiskas iedarbības un tas nedrīkst būt reaģētspējīgs ar testa vielu. Izmantojot citus, mazāk izpētītus šķīdinātājus vai nesējus, jābūt datiem par to saderību. Vienmēr, kad tas iespējams, vispirms ieteicams izmantot ūdeni saturošus šķīdinātājus vai nesējus.
1.4.2.2. Kontroles
Visās testu neatkarīgajās daļās līdztekus iekļauj pozitīvas un negatīvas (šķīdinātāja/nesēja) kontroles. Izņemot apstrādi ar testa vielu, ar kontrolgrupu dzīvniekiem rīkojas tieši tāpat kā ar apstrādāto grupu dzīvniekiem.
Pozitīvai kontrolei izmanto vielas, kuras izraisa neprogrammētu DNS sintēzi pie ekspozīcijas robežvērtībām, kas dod nosakāmu palielinājumu virs fona līmeņa. Pozitīvas kontroles vielas, kam vajadzīga metabolisma aktivācija, izmanto devās, kurām ir mērena atbildes reakcija (4). Pozitīvās kontroles vielu koncentrācijas izvēlas tā, lai to iedarbība būtu skaidri redzama, tomēr kodēto priekšmetstikliņu identitāti to nolasītājs nevarētu konstatēt uzreiz. Pie pozitīvās kontroles vielām pieder:
|
Paraugu ņemšanas laiks |
Viela |
CAS Nr. |
Einecs Nr. |
|
Agrīniem paraugu ņemšanas termiņiem (2 līdz 4 stundas) |
N-nitrozodimetilamīns |
62-75-9 |
200-249-8 |
|
Vēlīniem paraugu ņemšanas termiņiem (12 līdz 16 stundas) |
N-2-fluorēnilacetamīds (2-AAF) |
53-96-3 |
200-188-6 |
Var izmantot arī citas piemērotas pozitīvas kontroles vielas. Pieļaujams, ka pozitīvai kontrolei tiek izmantots cits iedarbības veids nekā testa vielai.
1.5. PROCEDŪRA
1.5.1. Dzīvnieku skaits un dzimums
Ņemot vērā dabiskās bioloģiskās reakcijas atšķirības uz testu, izmanto pietiekamu skaitu dzīvnieku. Katrā grupā jābūt vismaz trim analizējamiem dzīvniekiem. Gadījumos, kad uzkrāta ievērojama vēsturisko datu bāze, pozitīvās un negatīvās kontroles grupās var iekļaut tikai vienu vai divus dzīvniekus.
Ja izmēģinājuma veikšanas laikā ir pieejami citos izmēģinājumos iegūti dati par tās pašas sugas dzīvniekiem, kam izmantots tas pats iedarbības veids, un šie dati liecina, ka toksiskā iedarbība uz abu dzimumu īpatņiem būtiski neatšķiras, izmēģinājumam var izmantot tikai viena dzimuma dzīvniekus, vēlams – tēviņus. Gadījumos, kad kaitīgā iedarbība uz cilvēka organismu katram dzimumam var būt atšķirīga, piemēram, dažiem farmaceitiskajiem preparātiem, izmēģinājumu veic ar attiecīgā dzimuma dzīvniekiem.
1.5.2. Apstrādes shēma
Ar testa vielām parasti veic vienreizēju apstrādi.
1.5.3. Devu lielums
Parasti lieto vismaz divas devas. Kā lielāko nosaka devu, kurai ir tādas pašas toksiskās iedarbības pazīmes kā lielākajai devai, kam varētu būt letāla iedarbība pēc tāda paša devu režīma. Parasti mazākā deva ir 50 % līdz 25 % no lielākas devas.
Vielām ar specifisku bioloģisko aktivitāti maztoksiskās un netoksiskās devās (piemēram, hormoniem un mitogēniem) var būt citi devu noteikšanas kritēriji, ko katrā konkrētā gadījumā izvērtē atsevišķi. Ja atbilstošu datu trūkuma dēļ vispirms veic orientējošu izmēģinājumu, tas jāizdara tajā pašā laboratorijā, kurā veiks galveno izmēģinājumu, izmantojot tās pašas sugas un dzimuma dzīvniekus un ievērojot tādu pašu apstrādes režīmu.
Kā lielāko var noteikt arī devu, kas liecina par toksisku iedarbību uz aknām (piemēram, piknotiskajiem kodoliem).
1.5.4. Iedarbības robežu tests
Ja testā ar vienu vielas devu, kas ir vismaz 2 000 mg/kg ķermeņa svara, vienā vai divos paņēmienos vienā dienā toksisku iedarbību nekonstatē un pēc datiem par struktūras ziņā līdzīgām vielām var pamatoti uzskatīt, ka tā nav genotoksiska, pilnīgi izmēģinājumi var būt nevajadzīgi. Paredzamā iedarbība uz cilvēku var norādīt uz to, ka devu iedarbības robežu pārbaudē jālieto lielāka deva.
1.5.5. Devu došana
Testa vielu parasti ievada ar mākslīgo barošanu, izmantojot kuņģa caurulīti vai piemērotu intubācijas kanulu. Var izmantot arī citus iedarbības veidus, ja šādai rīcībai ir pietiekams pamatojums. Taču nav ieteicams intraperitoniāls iedarbības veids, jo tādējādi aknas testa vielas iedarbībai var tikt pakļautas tieši, nevis caur centrālās asinsrites sistēmu. Maksimālais šķidruma tilpums, ko vienā paņēmienā var dot, mākslīgi barojot vai injicējot, ir atkarīgs no izmēģinājumu dzīvnieka lieluma. Tilpums nedrīkst pārsniegt 2 ml uz 100 g ķermeņa masas. Lielāka tilpuma lietošana par norādīto ir jāpamato. Izņemot kairinošas un kodīgas vielas, kuru iedarbība lielākās koncentrācijās parasti ir izteiktāka, izmēģinājumiem lietotā tilpuma mainības ietekmi samazina, koriģējot tilpumu tā, lai pie visām devām tas būtu vienāds.
1.5.6. Aknu šūnu sagatavošana
Parasti aknu šūnas no apstrādātajiem dzīvniekiem sagatavo 12 līdz 16 stundu laikā pēc testa vielas ievadīšanas. Gadījumos, kad pēc 12 līdz 16 stundām netiek konstatēta acīm redzama pozitīva atbildes reakcija, var būt nepieciešama papildu paraugu ņemšana agrīnākos termiņos (parasti divas līdz četras stundas pēc apstrādes). Paraugus var ņemt citos termiņos gadījumos, kad tie ir pamatoti ar toksikokinētiskajiem datiem.
Zīdītāju aknu šūnu īslaicīgas kultūras iegūst, aknas in situ apstrādājot ar kolagenāzi un tikko disociējušajām aknu šūnām ļaujot nostiprināties uz piemērotas virsmas. No negatīvās kontroles dzīvniekiem iegūto aknu šūnu dzīvotspējai (5) jābūt vismaz 50 %.
1.5.7. Neprogrammētas DNS sintēzes noteikšana
Tikko izolētas zīdītāju aknu šūnas noteiktu laiku, piemēram, trīs līdz astoņas stundas, parasti inkubē barotnē, kas satur 3H-TdR. Inkubēšanas perioda beigās barotni atdala no šūnām, kuras pēc tam var inkubēt barotnē, kas nesaistītas radioaktivitātes samazināšanai satur neiezīmētu timidīnu. Tad šūnas skalo, fiksē un žāvē. Ja inkubēšanas laiks ir ilgāks, nesaistītas radioaktivitātes samazināšana var nebūt vajadzīga. Priekšmetstikliņus iemērc autoradiogrāfijas emulsijā, tumsā eksponē (piemēram, 7 līdz 14 dienas ledusskapī), attīsta, iekrāso un saskaita eksponētos sudraba graudiņus. No katra dzīvnieka sagatavo divus vai trīs priekšmetstikliņus.
1.5.8. Analīze
Pareizai neprogrammētas DNS sintēzes novērtēšanai uz priekšmetstikliņiem sagatavotajos preparātos jābūt pietiekamam morfoloģiski normālu šūnu skaitam. Preparātos mikroskopiski nosaka acīmredzamas citotoksicitātes pazīmes (piemēram, piknozi, pazeminātu radioaktīvas iezīmēšanas līmeni).
Priekšmetstikliņus pirms graudiņu skaitīšanas kodē. Parasti no viena dzīvnieka uz vismaz diviem priekšmetstikliņiem uzskaita 100 šūnas; skaits, kas mazāks par 100 šūnām no viena dzīvnieka, ir jāpamato. Graudiņus neskaita S-fāzes kodolos, bet var atzīmēt S-fāzes šūnu daļu.
Ar piemērotām metodēm pēc sudraba graudiņu izgulsnēšanās nosaka morfoloģiski normālu šūnu kodolos un citoplazmā ietvertā 3H-TdR daudzumu.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Atsevišķi norāda datus par katru priekšmetstikliņu un dzīvnieku. Turklāt visus datus apkopo tabulas veidā. Katrai šūnai, katram dzīvniekam un katrai testa vielas devai atsevišķi aprēķina kopējo kodola graudainību (NNG), no kodola graudu skaita (NG) atņemot citoplazmas graudu skaitu kodoliem ekvivalentās citoplazmas zonās (CG). Gadījumos, kad uzskaita šūnas ar reparācijām, pamato to noteikšanas kritērijus, izmantojot iepriekš iegūtus vēsturiskos datus vai līdztekus veiktas negatīvas kontroles rezultātus. Skaitlisko rezultātu izvērtēšanai var izmantot statistikas metodes. Gadījumos, kad izmanto statistiskos testus, tos izvēlas un pamato pirms izmēģinājuma veikšanas.
2.2. REZULTĀTU NOVĒRTĒŠANA UN INTERPRETĀCIJA
Pozitīvas un negatīvas atbildes reakcijas noteikšanas kritēriji ir:
|
tests ir pozitīvs, ja |
i) |
kopējā kodola graudainība (NNG) pārsniedz pēc laboratorijas vēsturiskajiem datiem iepriekš noteikto robežvērtību; vai |
|
ii) |
kopējā kodola graudainība (NNG) ir būtiski lielāka par vienlaicīgā kontrolē noteikto vērtību; |
|
|
tests ir negatīvs, ja |
i) |
kopējā kodola graudainība (NNG) nepārsniedz pēc laboratorijas vēsturiskajiem datiem iepriekš noteikto robežvērtību; vai |
|
ii) |
kopējā kodola graudainība (NNG) nav būtiski lielāka par vienlaicīgā kontrolē noteikto vērtību. |
Iegūtos rezultātus izvērtē no bioloģiskā viedokļa, t. i., to variācijas starp atsevišķiem dzīvniekiem, ņemot vērā devu ietekmi uz citotoksiskajām īpašībām. Kā palīglīdzekli testa rezultātu izvērtēšanai var izmantot statistikas metodes. Statistiskais svarīgums nedrīkst būt vienīgais faktors, pēc kā nosaka pozitīvu atbildes reakciju.
Lai gan lielākajā daļā eksperimentu iegūst nepārprotami pozitīvus vai negatīvus rezultātus, tomēr dažkārt pēc iegūtajiem datiem nevar noteikti spriest par testa vielas aktivitāti. Turklāt rezultāti var būt nedroši vai apšaubāmi arī neatkarīgi no eksperimenta atkārtojumu skaita.
Pozitīvs rezultāts neprogrammētas DNS sintēzes testā ar zīdītāju aknu šūnām in vivo norāda, ka testa viela izraisa tādus DNS bojājumus zīdītāju aknu šūnās in vivo, ko var reparēt neprogrammētā DNS sintēzē in vitro. Negatīvi rezultāti liecina, ka izmēģinājuma apstākļos testa viela neizraisa šajā testā nosakāmus DNS bojājumus.
Jāizvērtē iespējamība, ka testa viela sasniedz centrālās asinsrites sistēmu un jo īpaši mērķaudus (piemēram, sistēmiska toksicitāte).
3. ZIŅOJUMU SASTĀDĪŠANA
TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
Šķīdinātājs/nesējs:
— nesēja izvēles pamatojums,
— testa vielas šķīdība un stabilitāte šķīdinātājā/nesējā, ja tā ir zināma.
Testa dzīvnieki:
— izmantotā suga/līnija,
— dzīvnieku skaits, vecums un dzimums,
— izcelsme, turēšanas apstākļi, barība u. c.,
— dzīvnieku masa testa sākumā, katrā grupā norādot robežas, vidējo lielumu un standartnovirzi.
Testa apstākļi:
— pozitīvas un negatīvas (nesēja/šķīdinātāja) kontroles,
— devu intervāla noteikšanas testa rezultāti gadījumos, kad tas veikts,
— devu izvēles pamatojums,
— informācija par testa vielas sagatavošanu,
— informācija par testa vielas došanu,
— iedarbības veida izvēles pamatojums,
— metodes, ar kurām nosaka, ka testa viela nonākusi centrālajā asinsritē vai mērķaudos gadījumos, kad tas nepieciešams,
— testa vielas koncentrācijas (ppm) barībā vai dzeramajā ūdenī pārrēķins faktiskajā dienas devā (mg/kg ķermeņa masas) gadījumos, kad tas nepieciešams,
— sīkas ziņas par barības un ūdens kvalitāti,
— sīks apstrādes un paraugu ņemšanas shēmas apraksts,
— toksicitātes novērtēšanas metodes,
— aknu šūnu preparātu un kultūru sagatavošanas metode,
— izmantotā autoradiogrāfiskā metode,
— sagatavoto priekšmetstikliņu un uzskaitīto šūnu skaits,
— novērtējuma kritēriji,
— kritēriji, pēc kuriem novērtē, vai testa rezultāts ir pozitīvs, negatīvs vai neskaidrs.
Rezultāti:
— kodolu graudainības, citoplazmas graudainības un kopējās kodola graudainības vidējie rādītāji atsevišķiem priekšmetstikliņiem, dzīvniekiem un grupām,
— ja iespējams, reakcijas uz devu novērtējums,
— statistiskās analīzes rezultāti, ja tā veikta,
— toksicitātes pazīmes,
— līdztekus iegūtie negatīvas (šķīdinātāja/nesēja) un pozitīvas kontroles rezultāti,
— līdzšinējie vēsturiskie negatīvas (šķīdinātāja/nesēja) un pozitīvas kontroles rezultāti, norādot robežas, vidējos lielumus un standartnovirzes,
— reparācijas šūnu skaits, ja ir noteikts,
— S-fāzes šūnu skaits, ja ir noteikts,
— šūnu dzīvotspēja.
Rezultātu izvērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Ashby, J., Lefevre, P.A., Burlinson, B. and Penman, M.G. (1985). An Assessment of the In Vivo Rat Hepatocyte DNA Repair Assay. Mutation Res., 156, p. 1–18.
(2) Butterworth, B.E., Ashby, J., Bermudez, E., Casciano, D., Mirsalis, J., Probst, G. and Williams, G. (1987). A Protocol and Guide for the In Vivo Rat Hepatocyte DNA-Repair Assay. Mutation Res. 189, p. 123–133.
(3) Kennelly, J.C., Waters, R., Ashby, J., Lefevre, P.A., Burlinson, B., Benford, D.J., Dean, S.W. and Mitchell, I. de G. (1993). In Vivo Rat Liver UDS Assay. In: Kirkland D.J. and Fox M., (Eds) Supplementary Mutagenicity Tests: UKEM Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part II revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, p. 52–77.
(4) Madle, S., Dean, S.W., Andrae, U., Brambilla, G., Burlinson, B., Doolittle, D.J., Furihata, C., Hertner, T., McQueen, C.A. and Mori, H. (1993). Recommendations for the Performance of UDS Tests In Vitro and In Vivo. Mutation Res., 312, p. 263–285.
(5) Fautz, R., Hussain, B., Efstathiou, E. and Hechenberger-Freudl, C. (1993). Assessment of the Relation Between the Initial Viability and the Attachment of Freshly Isolated Rat Hepatocytes Used for the In Vivo/In Vitro DNA Repair Assay (UDS). Mutation Res., 291, p. 21–27.
(6) Mirsalis, J.C., Tyson, C.K. and Butterworth, B.E. (1982). Detection of Genotoxic Carcinogens in the In Vivo/In Vitro Hepatocyte DNA Repair Assay. Environ. Mutagen, 4, p. 553–562.
B.40. IN VITRO ĀDAS EROZIJA: TRANSKUTĀNĀS ELEKTRISKĀS PRETESTĪBAS (TEP) TESTS
1. METODE
Šī testēšanas metode ir ekvivalenta ESAO TG 430 (2004) metodei.
1.1. IEVADS
Ādas erozija izpaužas kā neatgriezenisku audu bojājumu veidošanās ādā pēc testējamā materiāla aplicēšanas (kā definēts Globālajā harmonizētajā sistēmā (GHS) ķīmisko vielu un maisījumu klasifikācijai un marķēšanai (1)). Šajā metodē noteikta procedūra erozijas novērtēšanai, neizmantojot dzīvus dzīvniekus.
Ādas erozijas novērtēšanai parasti izmanto laboratorijas dzīvniekus (2). Šajā procedūrā izmantojamo dzīvnieku sāpes un ciešanas ņemtas vērā, pārskatot B.4. testēšanas metodi, kas ļauj ādas eroziju noteikt, izmantojot alternatīvas in vitro metodes.
Pirmais solis tādu alternatīvu testu noteikšanai, ko varētu lietot ādas erozijas testēšanai normatīvās regulēšanas nolūkiem, bija validēšanas priekšizpēte (3). Pēc tam tika veikta formāla ādas erozijas in vitro metožu (4) (5) validācija (6) (7) (8). Šo pētījumu un citu publikāciju rezultāts bija ieteikums par to, ka ādas erozijas in vivo novērtēšanai var izmantot šādus testus (9) (10) (11): cilvēka ādas modeļa testu (skatīt testēšanas metodi B.40.a un transkutānās elektriskās pretestības testu (šo metodi)).
Validācija un citi publicēti pētījumi parādīja, ka žurku ādas transkutānās elektriskās pretestības (TEP) noteikšana (12) (13) ļauj droši atšķirt vielas, kas rada ādas eroziju, no vielām, kas ādas eroziju nerada (5) (9).
Šajā metodē aprakstītais tests ļauj identificēt kodīgas vielas un vielu maisījumus. Bez tam šis tests ļauj identificēt kodīgās vielas un maisījumus, ja par to liecina cita informācija (piemēram, pH, struktūras un aktivitātes sakarība, dati par iedarbību uz cilvēka un dzīvnieku organismu) (1) (2) (11) (14). Tas atšķirībā no Globālās harmonizētās klasifikācijas sistēmas (GHS) (1) nesniedz informāciju par ādas eroziju un nedod iespējas kodīgās vielas sīkāk iedalīt apakškategorijās.
Lai pilnīgi novērtētu lokālo iedarbību uz ādu pēc vienas ekspozīcijas, ieteicams ievērot pakāpeniskas testēšanas stratēģiju, kas pievienota testēšanas metodei B.4 (2) un ir paredzēta Globālajā harmonizētajā sistēmā (1). Šī testēšanas stratēģija pirms izmēģinājumiem ar dzīviem dzīvniekiem paredz veikt in vitro testu ādas erozijas noteikšanai (kā aprakstīts šajā metodē) un testu ādas kairinājuma noteikšanai.
1.2. DEFINĪCIJA
Ādas erozija in vivo : neatgriezeniska ādas bojājuma veidošanās, konkrēti – saskatāma nekroze no epidermas dermā pēc testējamās vielas aplicēšanas uz laiku līdz četrām stundām. Kairinošās reakcijas konstatē pēc čūlām, asiņošanas, asiņojošiem kraupjiem un pēc ādas atkrāsošanās lobīšanās dēļ zonām bez apmatojuma un rētām 14 dienu ilga novērošanas perioda beigās. Neskaidrību gadījumos bojājumu novērtēšanai jāizmanto histopatoloģijas metodes.
Transkutānā elektriskā pretestība (TEP): ādas elektriskās pretestības rādītājs, kas izteikts kiloomos (kΩ). Vienkārša un droša metode barjeras funkcijas novērtēšanai, lai reģistrētu jonu pāreju caur ādu, izmantojot Vitstona tiltu.
1.3. STANDARTVIELAS
1. tabula
Standartvielas
|
Nosaukums |
Einecs Nr. |
CAS Nr. |
|
|
1,2-diaminopropāns |
201-155-9 |
78-90-0 |
ļoti kodīga |
|
akrilskābe |
201-177-9 |
79-10-7 |
ļoti kodīga |
|
2-terc-butilfenols |
201-807-2 |
88-18-6 |
kodīga |
|
kālija hidroksīds (10 %) |
215-181-3 |
1310-58-3 |
kodīga |
|
sērskābe (10 %) |
231-639-5 |
7664-93-9 |
kodīga |
|
oktānskābe (kaprilskābe) |
204-677-5 |
124-07-02 |
kodīga |
|
4-amino-1,2,4-triazols |
209-533-5 |
584-13-4 |
nav kodīga |
|
eigenols |
202-589-1 |
97-53-0 |
nav kodīga |
|
fenetilbromīds |
203-130-8 |
103-63-9 |
nav kodīga |
|
tetrahloretilēns |
204-825-9 |
27-18-4 |
nav kodīga |
|
izostearīnskābe |
250-178-0 |
30399-84-9 |
nav kodīga |
|
4-(metiltio)-benzaldehīds |
222-365-7 |
3446-89-7 |
nav kodīga |
Lielākā daļa no minētajām vielām ņemta no ķīmisko vielu saraksta, kuras tika izraudzītas ECVAM starptautiskajai validācijai (4). Izvēle pamatojas uz šādiem kritērijiem:
i) vienāds kodīgu un nekodīgu vielu skaits;
ii) ir tirdzniecībā pieejamas vielas, kas pārstāv lielāko daļu no attiecīgām ķīmisko vielu klasēm;
iii) ļoti kodīgu, kā arī mazāk kodīgu vielu iekļaušana, lai nodrošinātu atšķiršanu, pamatojoties uz kodīgumu;
iv) tādu ķīmisko vielu izvēle, ar kādām varētu strādāt laboratorijā, papildus kodīgumam nepakļaujoties citam nopietnākam riskam.
1.4. TESTĒŠANAS METODES PRINCIPS
Testējamo vielu aplicē uz laiku līdz 24 stundām ādas disku epidermas virsmai testēšanas iekārtā ar diviem nodalījumiem, kurā ādas diski veido nodalījumu starpsienu. Ādu diskiem ņem no 28–30 dienas vecām humāni nobeigtām žurkām. Kodīgus materiālus identificē pēc to spējas izraisīt stratum corneum normālas integritātes un barjeras funkcijas zudumu, ko novērtē kā TEP pazemināšanos zem sliekšņa līmeņa (12). Žurku TEP gadījumā izraudzītā sliekšņa vērtība ir 5 kΩ, pamatojoties uz plašiem datiem par lielu ķīmisko vielu klāstu, kurā lielākā vērtību daļa ir vai nu neapšaubāmi un ievērojami lielāka (bieži > 10 kΩ), vai ievērojami zemāka (parasti < 3 kΩ) par šo vērtību (12). Parasti materiāli, kas dzīvniekiem nerada ādas eroziju, bet ir ar kairinošu iedarbību vai bez tās, nesamazina TEP zemāk par šo sliekšņa vērtību. Bez tam ādas preparātu vai citas aparatūras izmantošana var mainīt sliekšņa vērtību un tāpēc var būt vajadzīga papildu validācija.
Krāsvielas saistīšanas posms tiek iekļauts testa procedūrā, lai apstiprinātu TEP pozitīvos rezultātus, ieskaitot vērtības, kas ir tuvu 5 kΩ. Krāsvielas saistīšanas posmā nosaka, vai jonu caurlaidības palielinājumu izraisījusi stratum corneum fiziska noārdīšanās. Pierādīts, ka TEP metode, izmantojot žurkas ādu, ļauj prognozēt in vivo kodīgumu, ko nosaka trušiem pēc B.4. testēšanas metodes (2). Jāatzīmē, ka salīdzinājumā ar cilvēka ādas strēmelīšu testu (15) in vivo tests trušiem ir ļoti konservatīvs attiecībā uz kodīguma un ādas kairinājuma noteikšanu.
1.5. TESTĒŠANAS METODES APRAKSTS
1.5.1. Dzīvnieki
Piemērotākā izmēģinājuma dzīvnieku suga ir žurkas, jo ir pierādīta to ādas jutība pret ķīmiskajām vielām šajā testā (10). Žurku vecums (laikā, kad ņem ādu) un līnija ir sevišķi svarīgi, lai būtu nodrošināts, ka apmatojuma folikulas ir snaudas fāzē pirms pieauguša dzīvnieka apmatojuma augšanas sākuma.
Jauniem, aptuveni 22 dienu veciem (Wistar vai līdzīgas līnijas) žurku vīrišķā vai sievišķā dzimuma īpatņiem uzmanīgi nocērp muguras un sānu apmatojumu. Pēc tam dzīvniekus mazgā, rūpīgi berzējot, cirpto vietu iemērcot antibiotiskas vielas šķīdumā (kas satur, piemēram, streptomicīnu, penicilīnu, hloramfenikolu un amfotericīnu koncentrācijā, kura nodrošina baktēriju augšanas novēršanu). Dzīvniekus mazgā ar antibiotikām trešajā vai ceturtajā dienā pēc pirmās mazgāšanas un izmanto trīs dienu laikā pēc otrās mazgāšanas, kad pēc apmatojuma noņemšanas stratum corneum ir atjaunojies.
1.5.2. Ādas disku sagatavošana
Dzīvniekus 28–30 dienu vecumā humāni nonāvē; vecumam ir noteicoša nozīme. Tad ņem katra dzīvnieka muguras un sānu ādu, no kuras atdala zemādas taukus, tos uzmanīgi atslāņojot. Izgriež apm. 20 mm diametra ādas diskus. Ādu var glabāt līdz disku izmantošanai, ja tiek pierādīts, ka pozitīvo un negatīvo kontroļu dati ir līdzvērtīgi datiem, kas iegūti, izmantojot svaigu ādu.
Ādas disku novieto uz viena PTFE (politetrafluoretilēna) caurulītes gala tā, lai epidermas virsma būtu kontaktā ar caurulīti. Uzmauc gumijas gredzenu, lai ādu piestiprinātu caurulītes galā, un nogriež liekos audus. Caurulītes un gredzena izmēri norādīti 2. attēlā. Pēc tam gumijas gredzena piestiprinājuma vietu PTFE caurulītei hermetizē, rūpīgi apziežot ar vazelīnu. Caurulīti nostiprina ar atsperīgu spaili receptora kamerā, kurā ir MgSO4 šķīdums (154 mM) (1. attēls). Ādas diskam jābūt pilnīgi iegremdētam MgSO4 šķīdumā. No vienas žurkas ādas var iegūt 10–15 ādas diskus.
Pirms testēšanas izmēra divu ādas disku elektrisko pretestību, lai pārbaudītu katra dzīvnieka ādas kvalitāti. Lai pārējos diskus varētu izmantot testēšanai, abu disku pretestībai jābūt lielākai par 10 kΩ. Ja pretestība ir mazāka par 10 kΩ, visi pārējie diski no šīs ādas mērījumu veikšanai nav derīgi.
1.5.3. Testējamās vielas un kontroles vielas aplicēšana
Visos eksperimentos jāizmanto paralēlas pozitīvās un negatīvās kontroles, lai nodrošinātu adekvātu eksperimentālā modeļa darbību. Jāizmanto diski no viena dzīvnieka ādas. Pozitīvai un negatīvai kontrolei ieteicams izmantot attiecīgi 10 M sālsskābi un ūdeni.
Testējamās vielas, kas ir šķidrumi (150 μl) aplicē vienmērīgi uz epidermas virsmas caurulītes iekšpusē. Testējot cietvielu materiālus, pietiekamu materiāla daudzumu uzklāj uz ādas diska vienmērīgi, lai pārklātu visu epidermas virsmu. Dejonizētu ūdeni (150 μl) pievieno uz cietā materiāla virsmas un cauruli viegli sakrata. Lai nodrošinātu maksimālu kontaktu ar ādu, var rasties nepieciešamība uzsildīt līdz 30 oC, lai testējamo vielu izkausētu vai padarītu mīkstāku, vai sasmalcināt, iegūstot materiālu graudiņu vai pulvera veidā.
Katrai testējamajai un kontroles vielai izmanto trīs ādas diskus. Testējamās vielas aplicē 24 stundas 20–23 oC temperatūrā. Testējamo vielu noņem, skalojot ar ūdensvada ūdens strūklu līdz 30 oC temperatūrā, kamēr materiāls pilnīgi nomazgāts.
1.5.4. TEP mērīšana
Ādas pretestību kā TEP mēra, izmantojot zemsprieguma maiņstrāvas Vitstona tiltu (13). Tilta pamatparametri ir darba spriegums 1–3 V, sinusoīda vai taisnstūrveida maiņstrāva ar frekvenci 50–1 000 Hz un mērījumu diapazons vismaz 0,1–30 kΩ. Ar validēšanai izmantoto mērtiltu virknes vai paralēlajā slēgumā mēra induktivitāti, kapacitāti un pretestību attiecīgi līdz 2 000 H, 2 000 μF un 2 MΩ pie frekvences 100 Hz vai 1 kHz. TEP testa nolūkiem mērījumi tiek veikti virknes slēgumā kā pretestība pie frekvences 100 Hz. Pirms elektriskās pretestības mērīšanas samazina ādas virsmas spraigumu, pievienojot tik daudz 70 % etanola, lai pārklātu epidermu. Pēc dažām sekundēm etanolu no caurulītes izlej un audus hidratē, pievienojot 3 mL MgSO4 šķīduma (154 mM). Tilta elektrodus novieto abās ādas diska pusēs, lai izmērītu ādas disku pretestību kΩ (1. attēls). Elektroda izmēri un elektroda daļas garums zem turētāja spailes norādīts 2. attēlā. Iekšējā elektroda turētāja spaile pretestības mērīšanas laikā balstās uz PTFE caurules, lai nodrošinātu, ka MgSO4 šķīdumā būtu iegremdēts vienāds elektroda garums. Ārējais elektrods tiek ievietots receptora kamerā tādā veidā, ka elektrods balstās pret kameras dibenu. Attālumam starp atsperes spaili un PTFE caurulītes apakšu jābūt nemainīgam (2. attēls), jo šis attālums ietekmē izmērītās pretestības vērtību. Tādējādi attālumam starp iekšējo elektrodu un ādas disku jābūt pastāvīgam un iespējami mazam (1–2 mm).
Ja izmērītā pretestības vērtība ir lielāka par 20 kΩ, tas varētu būt saistīts ar testējamās vielas paliekām uz ādas diska epidermas virsmas. Var vēlreiz mēģināt noņemt šīs vielas atliekas, piemēram, PTFE caurulītes galu noslēdzot ar cimdotu īkšķi un kratot aptuveni 10 sekundes; MgSO4 šķīdumu izlej un pretestības mērīšanu atkārto ar svaigu MgSO4 šķīdumu.
Testēšanai izmantotās aparatūras raksturlielumi, izmēri un eksperimenta procedūra var ietekmēt iegūstamās TEP vērtības. Kodīguma slieksnis 5 kΩ tika noteikts pēc datiem, kas iegūti ar šajā metodē aprakstīto speciālo aparatūru un procedūru. Citas sliekšņa un kontroles vērtības var izrādīties piemērotas citos testa apstākļos vai izmantojot citu aparatūru. Tādējādi metodika un pretestības sliekšņa vērtība jākalibrē, testējot standartvielas, kuras izvēlas no validācijai izmantotā ķīmisko vielu klāsta (4) (5) vai pētāmajām vielām līdzīgu ķīmisko klašu vielām. Vairākas piemērotas standartvielas norādītas 1. tabulā.
1.5.5. Krāsvielu saistīšanas metodes
Dažu nekodīgu materiālu iedarbībā pretestība var samazināties zem sliekšņa vērtības 5 kΩ, joniem pārejot caur stratum corneum un rezultātā samazinot elektrisko pretestību (5). Piemēram, neitrālas organiskās vielas un virsmaktīvas vielas (deterģenti, emulgatori u. c.) var noņemt ādas lipīdus, palielinot membrānas jonu caurlaidību. Tāpēc, ja testējamās vielas TEP vērtība ir ap 5 kΩ vai ir mazāka, bet saskatāma ādas bojājuma nav, jāveic krāsvielas penetrācijas noteikšana kontroles un apstrādātajos audos, lai noteiktu, vai iegūtās TEP vērtības ir ādas caurlaidības paaugstināšanās vai vielas kodīguma rezultāts (3) (5). Pēdējā gadījumā, kad stratum corneum ir pārrāvumi, krāsviela sulforodamīns B, aplicējot uz ādas, ātri penetrē audu slānī un to nokrāso. Minētā krāsviela ir stabila pret ļoti daudzu ķīmisko vielu iedarbību, kā arī turpmāk aprakstīto ekstrakcijas procedūru.
1.5.5.1. Sulforodamīna B krāsvielas aplicēšana un noņemšana
Pēc TEP noteikšanas no caurulītes izlej magnija sulfāta šķīdumu un uzmanīgi apskata ādu, vai tai nav acīm redzamu bojājumu. Ja lielu acīm redzamu bojājumu nav, uz divām stundām visiem ādas diskiem epidermas virsmai aplicē sulforodamīna B krāsvielas (Acid Red 52; C.I. 45100; Einecs Nr. 222-529-8; CAS Nr. 3520-42-1), 150 μL 10 % šķīdumu destilētā ūdenī. Pēc tam šos ādas diskus aptuveni 10 sekundes skalo ar istabas temperatūras ūdensvada ūdeni, lai noņemtu visu lieko/nesaistīto krāsvielu. Katru ādas disku piesardzīgi izņem no PTFE caurules un ievieto mēģenē (piemēram, 20 mL stikla scintilācijas mēģenē) ar dejonizētu ūdeni (8 ml). Mēģenes uzmanīgi 5 minūtes maisa, lai atdalītu nesaistīto krāsvielu. Pēc tam atkārto skalošanas operāciju, tad ādas diskus izņem un ievieto mēģenēs ar 5 ml nātrija dodecilsulfāta (NDS) 30 % šķīdumu destilētā ūdenī un inkubē 60 oC temperatūrā līdz nākamajai dienai.
Pēc inkubācijas katru ādas disku izņem un turpmāk neizmanto, bet šķīdumu centrifugē 8 minūtes 21 oC temperatūrā (relatīvais centrbēdzes spēks ~ 175 × g). Dzidrā šķīduma 1 mL atšķaida 5 reizes (t. i., 1 mL + 4 mL) ar 30 % NDS šķīdumu destilētā ūdenī. Šķīduma optisko blīvumu (D) mēra pie 565 nm.
1.5.5.2. Krāsvielas satura aprēķināšana
Sulforodamīna B krāsvielas saturu diskā aprēķina pēc D vērtībām (5) (sulforodamīna B krāsvielas molārās ekstinkcijas koeficients pie 565 nm = 8,7 × l04; molekulmasa = 580). Krāsvielas saturu nosaka katram ādas diskam, izmantojot attiecīgo kalibrēšanas līkni, un pēc tam atkārtojumiem aprēķina krāsvielas vidējo saturu.
2. DATI
Pretestības vērtības (kΩ) un krāsvielas vidējā satura vērtības (μg/disks) gadījumos, kad to nosaka, testējamajam materiālam, kā arī pozitīvajām un negatīvajām kontrolēm apkopo tabulā (atsevišķo eksperimentu dati un vidējā vērtība ± standartnovirze), ieskaitot datus par atkārtojumiem/atkārtotiem eksperimentiem, vidējām un atsevišķo atkārtojumu vērtībām.
2.1. REZULTĀTU INTERPRETĀCIJA
Vidējie TEP rezultāti ir derīgi, ja paralēlās pozitīvās un negatīvās kontroles vērtības atbilst diapazoniem, kas ir pieņemami metodei testēšanas laboratorijā. Pieņemamie pretestības diapazoni, izmantojot iepriekš aprakstīto metodoloģiju un aparātu, ir minēti tabulā:
|
Kontrole |
Viela |
Pretestības diapazons (Kω) |
|
Pozitīvā |
10 M sālsskābe |
0,5–1,0 |
|
Negatīvā |
Destilēts ūdens |
10–25 |
Vidējie krāsvielas saistīšanas rezultāti derīgi ar nosacījumu, ka paralēlās kontroles vērtības atbilst diapazonam, kas ir pieņemams šai metodei. Ieteicamie pieņemamie krāsvielas satura diapazoni kontroles vielām, kas atbilst iepriekš aprakstītajai metodoloģijai un aparatūrai, norādīti tabulā:
|
Kontrole |
Viela |
Krāsvielas satura diapazons (μg/disks) |
|
Pozitīvā |
10 M sālsskābe |
40–100 |
|
Negatīvā |
Destilēts ūdens |
15–35 |
Uzskatāms, ka testējamā viela nav kodīga, nokļūstot uz ādas:
i) ja testējamajai vielai noteiktā vidējā TEP vērtība ir lielāka par 5 kΩ, vai
ii) vidējā TEP vērtība ir mazāka par vai vienāda ar 5 kΩ, un
— ādas disks nav acīm redzami erodēts, un
— vidējais krāsvielas saturs diskā ir ievērojami zemāks par vidējo krāsvielas saturu paralēlajā 10 M HCl pozitīvajā kontrolē.
Uzskatāms, ka testējamā viela ir kodīga, nokļūstot uz ādas:
i) ja vidējā TEP vērtība ir mazāka par vai vienāda ar 5 kΩ un ādas disks ir acīm redzami erodēts, vai
ii) vidējā TEP vērtība ir mazāka par vai vienāda ar 5 kΩ, un
— ādas disks nav acīm redzami erodēts, tomēr
— vidējais krāsvielas saturs diskā ir lielāks par vai vienāds ar vidējo krāsvielas saturu paralēlajā 10 M HCl pozitīvajā kontrolē.
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatos jāiekļauj šāda informācija.
Testējamā viela un kontroles vielas:
— ķīmiskais nosaukums, piemēram, IUPAC vai CAS nosaukums, un CAS numurs, ja zināms,
— vielas vai preparāta tīrības pakāpe, sastāvs (masas procentos) un izskats,
— fizikāli ķīmiskās īpašības, kas saistītas ar testēšanu, piemēram, fizikālais stāvoklis, pH, stabilitāte, šķīdība ūdenī,
— testējamās/kontroles vielas sagatavošana testēšanai, ja tiek veikta (piemēram, sildīšana, sasmalcināšana),
— stabilitāte, ja zināma.
Izmēģinājumu dzīvnieki:
— izmantotā līnija un dzimums,
— dzīvnieku vecums, kad tie tika izmantoti kā donordzīvnieki,
— avots, turēšanas apstākļi, barošana u. c.,
— informācija par ādas sagatavošanu.
Testēšanas apstākļi:
— testēšanas iekārtu kalibrēšanas līknes,
— krāsvielas saistīšanas testa kalibrēšanas līknes,
— informācija par TEP mērīšanai izmantoto testēšanas procedūru,
— informācija par krāsvielas saistīšanas noteikšanai izmantoto procedūru, ja vajadzīgs,
— testēšanas procedūras iespējamo modifikāciju apraksts,
— izmantoto novērtējuma kritēriju apraksts.
Rezultāti:
— TEP un krāsvielas saistīšanas (ja šī veikta) noteikšanas rezultātu dati tabulas veidā atsevišķi par katru eksperimenta dzīvnieku un ādas paraugu,
— novērojumu apraksts.
Rezultātu novērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6.
(2) Testing Method B.4. Acute Toxicity: Dermal Irritation/Corrosion.
(3) Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report and recommendations of ECVAM Workshop 6. ATLA 23, p. 219–255.
(4) Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxicology In Vitro 12, p. 471–482.
(5) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhütter, H.-G., and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology In Vitro 12, p. 483–524.
(6) OECD (1996). Final Report of the OECD Workshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, p. 62.
(7) Balls, M., Blaauboer, B.J., Fentem. J.H., Bruner. L., Combes, R.D., Ekwall, B., Fielder. R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski. D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. The report and recommendations of ECVAM workshops. ATLA 23, p. 129–147.
(8) ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf.
(9) ECVAM (1998). ECVAM News & Views. ATLA 26, 275–280.
(10) ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods) (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf.
(11) OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st –2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat.
(12) Oliver, G.J.A., Pemberton, M.A., and Rhodes, C. (1986). An in vitro skin corrosivity test – modificationsand validation. Fd. Chem. Toxicol. 24, p. 507–512.
(13) Botham, P.A., Hall, T.J., Dennett, R., McCall, J.C., Basketter, D.A., Whittle, E., Cheeseman, M., Esdaile, D.J., and Gardner, J. (1992). The skin corrosivity test in vitro: results of an interlaboratory trial. Toxicology In Vitro 6, p. 191–194.
(14) Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709–720.
(15) Basketter, D.A., Chamberlain, M., Griffiths, H.A., Rowson, M., Whittle, E., York, M. (1997). The classification of skin irritants by human patch test. Fd. Chem. Toxicol. 35, p. 845–852.
(16) Oliver G.J.A, Pemberton M.A and Rhodes C. (1988). An In Vitro model for identifying skin-corrosive chemicals. I. Initial Validation. Toxicology In Vitro. 2, p. 7–17.
1. attēls
Aparāts žurku ādas TEP noteikšanai
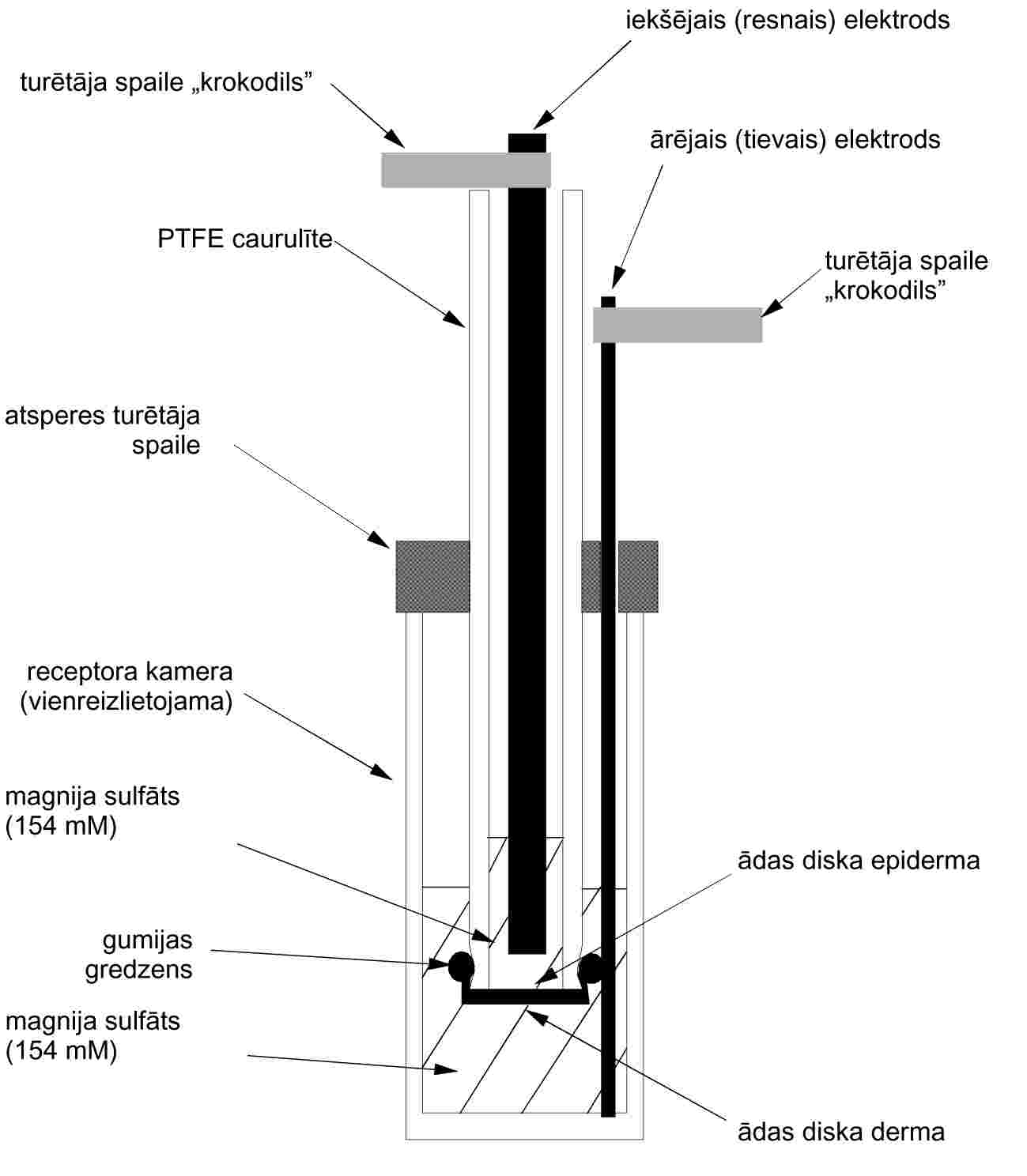
2. attēls
Politetrafluoretilēna (PFTE) caurulītes, receptora un elektrodu izmēri
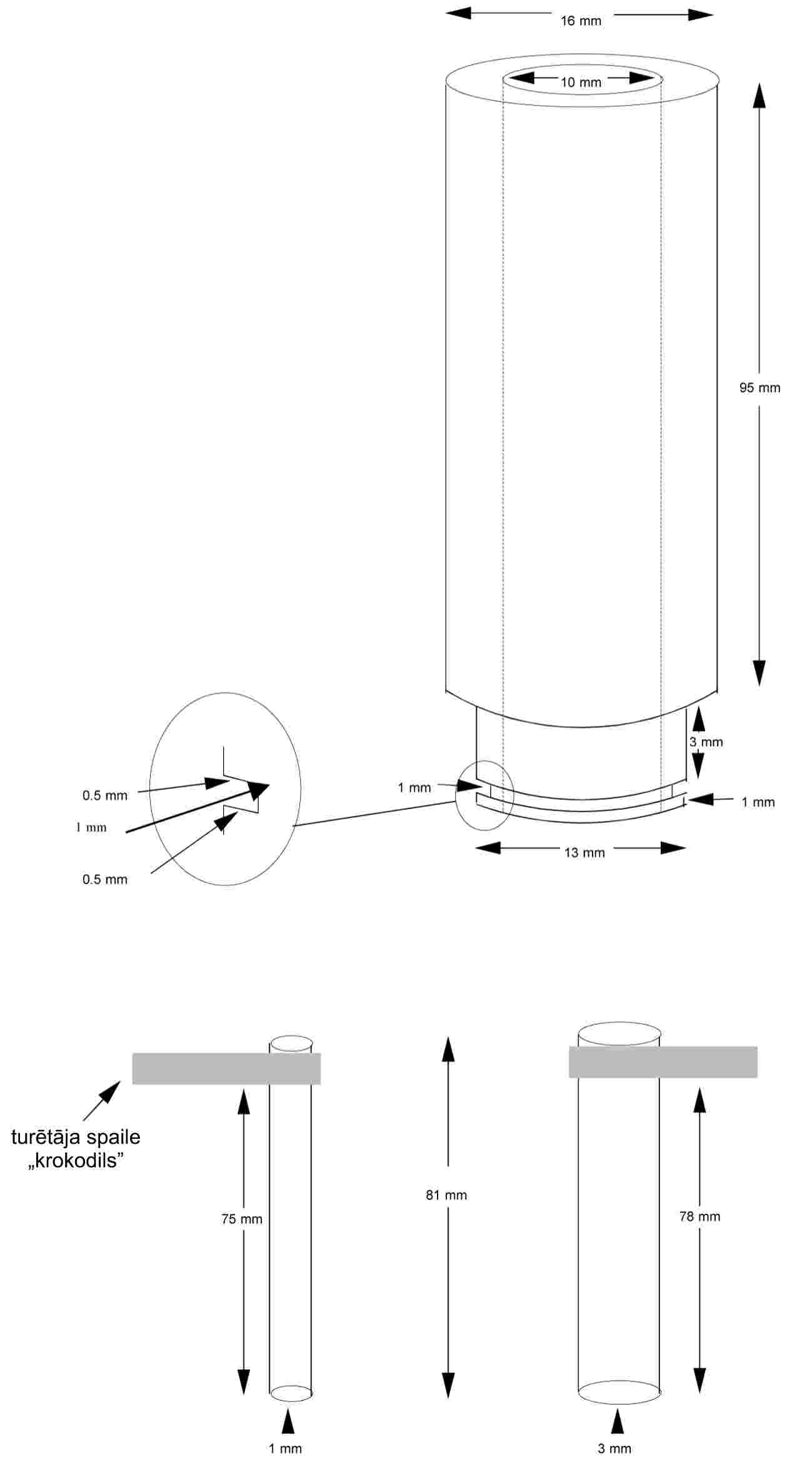
Attēlā parādītā aparāta darbībai svarīgākie faktori:
— PTFE caurulītes iekšējais diametrs,
— elektrodu garumam attiecībā pret PTFE caurulīti un receptora kameru jābūt tādam, lai elektrodi nepieskartos ādas diskam, un kontaktā ar MgSO4 šķīdumu būtu vienāds elektroda standarta garums,
— MgSO4 šķīduma līmenim receptora kamerā un PTFE caurulītē jābūt 1. attēlā norādītajā augstumā,
— lai elektriskā pretestība būtu ticams ādas īpašību rādītājs, ādas diskam jābūt pareizi fiksētam uz PTFE caurulītes.
B.40.a ĀDAS EROZIJAS IN VITRO TESTS: CILVĒKA ĀDAS MODEĻA TESTS
1. METODE
Šī testēšanas metode ir ekvivalenta ESAO TG 431 (2004) metodei.
1.1. IEVADS
Ādas erozija ir neatgriezeniska audu bojājuma veidošanās ādā pēc testējamā materiāla aplicēšanas (saskaņā ar ķīmisko vielu un maisījumu klasifikācijas Globālo harmonizēto sistēmu (GHS)) (1). Ādas erozijas novērtēšanai pēc šīs testēšanas metodes nav jāizmanto dzīvu dzīvnieku audi.
Kodīgas iedarbības uz ādu noteikšanai līdz šīm parasti izmantoja laboratorijas dzīvniekus (2). Ar šo testēšanas procedūru saistītās dzīvnieku sāpes un ciešanas ņemtas vērā un novērstas B.4. testēšanas metodes jaunajā redakcijā, kas dod iespējas kodīgo iedarbību uz ādu novērtēt, izmantojot alternatīvas in vitro metodes.
Pirmais solis, izstrādājot alternatīvas metodes, kuras varētu izmantot kodīgas iedarbības uz ādu testēšanai normatīvas regulēšanas nolūkiem, bija validācijas priekšizpēte (3). Pēc tam tika veikti in vitro metožu formālas validācijas pētījumi (6) (7) (8) kodīgas iedarbības uz ādu noteikšanai (4) (5). Šo pētījumu un citas publicētas literatūras (9) rezultātā izstrādāts ieteikums kodīgas iedarbības uz ādu novērtēšanai in vivo (10) (11) (12) (13) izmantot šādus testus: cilvēka ādas modeļa testu (šī metode) un transkutānās pretestības testu (skatīt B.40. testēšanas metodi).
Validācijas pētījumi liecina, ka testi, izmantojot cilvēka ādas modeli (3) (4) (5) (9), ļauj ticami atšķirt vielas ar zināmu kodīgu iedarbību uz ādu no vielām, kurām tās nav. Testēšanas protokols dod iespējas atšķirt vielas ar ļoti spēcīgu kodīgu iedarbību uz ādu no vielām, kurām tā nav tik spēcīga.
Šajā metodē aprakstītais tests ļauj identificēt kodīgas ķīmiskās vielas un maisījumus. Bez tam tas ļauj identificēt nekodīgas vielas un maisījumus, ja šā testa rezultātus papildina ar liecībām, kas iegūtas no citas jau esošas informācijas (piemēram, pH, struktūras un aktivitātes savstarpēja sakarība, dati par iedarbību uz cilvēka un/vai dzīvnieka organismu) (1) (2) (13) (14). Parasti tas nesniedz adekvātu informāciju par ādas kairinājumu, kā arī nedod iespējas kodīgās vielas sīkāk iedalīt apakškategorijās atšķirībā no Globālās harmonizētās klasifikācijas sistēmas (GHS) (1)
Lai pilnībā novērtētu lokālu iedarbību uz ādas pēc vienas ekspozīcijas, ieteicams ievērot pakāpeniskas testēšanas stratēģiju saskaņā ar B.4. testēšanas metodi (2), kas paredzēta Globālajā harmonizētajā sistēmā (GHS) (1). Minētā testēšanas stratēģija pirms dzīvu dzīvnieku izmantošanas izmēģinājumiem vispirms paredz kodīgas iedarbības uz ādu un ādas kairinājuma noteikšanu in vitro.
1.2. DEFINĪCIJAS
Ādas erozija in vivo : ir neatgriezeniska bojājuma veidošanās ādā, konkrēti – saskatāma nekroze no epidermas dermā pēc testējamās vielas aplicēšanas uz laiku līdz četrām stundām. Kodīgo iedarbību konstatē pēc čūlām, asiņošanas, asiņojošiem kraupjiem un – novērošanas beigās pēc 14 dienām – pēc ādas atkrāsošanās zonām ar izkritušu apmatojumu un rētām. Neskaidros gadījumos bojājums jānovērtē ar histopatoloģijas metodēm.
Šūnu dzīvotspēja: parametrs raksturo šūnu populācijas kopējo aktivitāti (piemēram, šūnu mitohondriju dehidrogenāžu spēju reducēt vitālo krāsvielu MTT), kas atkarībā no mērījumu beigu punkta un izmantotās testēšanas shēmas korelē ar šūnu kopējo skaitu un/vai vitalitāti.
1.3. STANDARTVIELAS
1. tabula
Standartvielas
|
Nosaukums |
Einecs Nr. |
CAS Nr. |
|
|
1,2-diaminopropāns |
201-155-9 |
78-90-0 |
ļoti kodīga |
|
akrilskābe |
201-177-9 |
79-10-7 |
ļoti kodīga |
|
2-terc-butilfenols |
201-807-2 |
88-18-6 |
kodīga |
|
kālija hidroksīds (10 %) |
215-181-3 |
1310-58-3 |
kodīga |
|
sērskābe (10 %) |
231-639-5 |
7664-93-9 |
kodīga |
|
oktānskābe (kaprilskābe) |
204-677-5 |
124-07-02 |
kodīga |
|
4-amino-1,2,4-triazols |
209-533-5 |
584-13-4 |
nav kodīga |
|
eigenols |
202-589-1 |
97-53-0 |
nav kodīga |
|
fenetilbromīds |
203-130-8 |
103-63-9 |
nav kodīga |
|
tetrahloretilēns |
204-825-9 |
27-18-4 |
nav kodīga |
|
izostearīnskābe |
250-178-0 |
30399-84-9 |
nav kodīga |
|
4-(metiltio)-benzaldehīds |
222-365-7 |
3446-89-7 |
nav kodīga |
Lielākā daļa no minētajām vielām ņemta no ķīmisko vielu saraksta, kuras tika izraudzītas ECVAM starptautiskajai validācijai (4). Izvēle pamatojas uz šādiem kritērijiem:
i) vienāds kodīgu un nekodīgu vielu skaits;
ii) ir tirdzniecībā pieejamas vielas, kas pārstāv lielāko daļu no attiecīgām ķīmisko vielu klasēm;
iii) gan ļoti kodīgu, gan arī mazāk kodīgu vielu iekļaušana, lai nodrošinātu atšķiršanu, pamatojoties uz kodīgumu;
iv) tādu ķīmisko vielu izvēle, ar kādām varētu strādāt laboratorijā, papildus kodīgumam nepakļaujoties citam nopietnākam riskam.
1.4. TESTĒŠANAS METODES PRINCIPS
Testējamo materiālu topikāli aplicē uz cilvēka ādas trīsdimensiju modeļa, kas satur vismaz atjaunotu epidermu ar funkcionālu stratum corneum. Kodīgus materiālus identificē pēc to spējas izraisīt šūnu dzīvotspējas samazināšanos (ko nosaka, piemēram, ar MTT samazināšanās testu (15)) zem noteiktiem sliekšņa līmeņiem pēc ekspozīcijas. Cilvēka ādas modeļa princips pamatojas uz hipotēzi, ka kairinošās ķīmiskās vielas spēj penetrēt stratum corneum difūzijas vai erozijas ceļā un ir dziļākiem šūnu slāņiem citotoksiskas.
1.4.1. Procedūra
1.4.1.1. Cilvēka ādas modelis
Cilvēka ādas modeli var izveidot vai nopirkt (piemēram, EpiDermTM un EPISKINTM modeļi) (16) (17) (18) (19), vai arī izstrādāt vai izveidot testēšanas laboratorijā (20) (21). Atzīts, ka uz cilvēka ādas izmantošanu attiecas ētiski apsvērumi, kā arī valstu un starptautiskie noteikumi. Jauni modeļi jāvalidē (vismaz 1.4.1.1.2. punktā noteiktajā apmērā). Šajā testā izmantojamajiem cilvēka ādas modeļiem jāatbilst šādām prasībām:
1.4.1.1.1.
Epitēlija izveidošanai jāizmanto cilvēka keratinocīti. Zem funkcionējoša stratum corneum jābūt vairākiem dzīvotspējīgu epitēlija šūnu slāņiem. Ādas modelim var būt arī stromas komponenta slānis. Stratum corneum jāsastāv no daudziem slāņiem ar nepieciešamo profilu, lai izveidotu funkcionālo barjeru, kas spēj novērst ātru citotoksisko marķieru penetrāciju. Modelim jābūt izveidotam tā, lai tiktu novērsta materiāla, kas atrodas ap stratum corneum, pāreja dzīvotspējīgajos audos. Ja testējamās vielas, kas atrodas ap stratum corneum, tajos pāriet, iedarbība uz ādu tiks modelēta slikti. Ādas modelim jābūt bez bakteriālā piesārņojuma (ieskaitot mikoplazmu) un brīvam no sēnītēm.
1.4.1.1.2.
Dzīvotspēju kvantitatīvi parasti nosaka pēc MTT vai citām metaboliski pārveidojamām vitālajām krāsvielām. Šajos gadījumos no negatīvās kontroles audiem ekstrahētās (izšķīdušās) krāsvielas optiskajam blīvumam (D) jābūt vismaz 20 reizes lielākam par optisko blīvumu tīram šķīdinātājam, kas izmantots ekstrakcijai (skatīt (22)). Negatīvās kontroles audiem jābūt stabiliem kultūrā (jābūt līdzīgai dzīvotspējai) testa ekspozīcijas periodā. Stratum corneum jābūt pietiekami noturīgam, lai pretotos ātrai noteikto citotoksisko marķieru (piemēram, 1 % Triton X-100) penetrācijai. Šo īpašību var novērtēt pēc ekspozīcijas laika, kas nepieciešams, lai šūnu dzīvotspēja samazinātos par 50 % (ET50) (piemēram, EpiDermTM un EPISKINTM modeļiem tas ir > 2 stundas). Audiem jābūt reproducējamiem laikā un, vēlams, arī laboratoriju starpā. Bez tam pēc izraudzītā testēšanas protokola ar audiem jābūt iespējamam pareizi noteikt standartvielu kodīgumu (skatīt 1. tabulu).
1.4.1.2. Testējamās vielas un kontroles vielu aplicēšana
Katram testēšanas variantam (ekspozīcijas laikam), kā arī kontrolei izmanto audu paraugus divos atkārtojumos. Šķidru materiālu gadījumā aplicē ādas virsmas vienmērīgai pārklāšanai pietiekamu testējamās vielas daudzumu, vismaz 25 μL/cm2. Cietvielu gadījumā pietiekamu testējamās vielas daudzumu aplicē, vienmērīgi pārklājot ādu, un, lai nodrošinātu labu saskari, to samitrina ar dejonizētu vai destilētu ūdeni. Ja nepieciešams, cietvielas pirms aplicēšanas jāsasmalcina pulverī. Aplicēšanas metodei jāatbilst testējamajai vielai (skatīt, piemēram, (5)). Ekspozīcijas perioda beigās testējamais materiāls rūpīgi jānomazgā no ādas virsmas ar piemērotu buferšķīdumu vai 0,9 % NaCl šķīdumu.
Paralēlas pozitīvās un negatīvās kontroles jāizmanto katram pētījumam, lai nodrošinātu adekvātu eksperimentālā modeļa darbību. Ieteicamās pozitīvās kontroles vielas ir ledus etiķskābe vai 8N KOH šķīdums. Ieteicamās negatīvās kontroles vielas ir 0,9 % NaCl šķīdums vai ūdens.
1.4.1.3. Šūnu dzīvotspējas noteikšana
Šūnu dzīvotspējas noteikšanai var izmantot tikai validētas kvantitatīvās metodes. Bez tam dzīvotspējas rādītājam jābūt trīsdimensiju audu modelim atbilstošam. Dzīvotspējas noteikšanu nedrīkst traucēt nespecifiska krāsvielas saistīšana. Tāpēc nav piemērotas krāsvielas, kuras saista olbaltumvielas vai metaboliski nepārveidojas (piemēram, neitrālā sarkanā). Visplašāk pielietojamā metode ir MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolija bromīds, tiazolilzilais: Einecs Nr. 206-069-5, CAS Nr. 298-93-1)) reducēšana – pierādīts, ka pēc šīs metodes iegūst precīzus un reproducējamus rezultātus (5), bet var izmantot arī citas metodes. Ādas paraugu uz trīs stundām ievieto zināmas koncentrācijas (piemēram, 0,3–1 mg/mL) MTT šķīdumā ar attiecīgu inkubācijas temperatūru. Nogulsnējušos zilu formazāna produktu pēc tam ekstrahē ar šķīdinātāju (izopropanolu) un mēra formazāna koncentrāciju, nosakot optisko blīvumu pie viļņa garuma no 540 līdz 595 nm.
Testējamā materiāla iedarbība uz vitālo krāsvielu var šķietami liecināt par šūnu metabolismu, un tādējādi dzīvotspēju var noteikt nepareizi. Pierādīts, ka tā notiek, ja testējamais materiāls skalojot netiek pilnīgi noņemts no ādas (9). Ja testējamais materiāls tieši iedarbojas uz vitālo krāsvielu, jāizmanto papildu kontroles, lai noteiktu testējamās vielas traucējošo ietekmi uz dzīvotspējas mērījumiem un veiktu to rezultātu korekcijas (9) (23).
2. DATI
Par katru audu paraugu atsevišķi tabulā jāapkopo optiskā blīvuma vērtības un testējamajam materiālam aprēķinātā šūnu dzīvotspēja procentos, pozitīvās un negatīvās kontroles, ieskaitot datus atsevišķi pa atkārtojumiem vai atkārtotiem eksperimentiem, un to vidējās vērtības.
2.1. REZULTĀTU INTERPRETĀCIJA
Katram testējamajam paraugam iegūtās optiskā blīvuma vērtības var izmantot dzīvotspējas aprēķināšanai procentos salīdzinājumā ar negatīvo kontroli, kurā to pieņem par 100 %. Šūnu dzīvotspējas sliekšņa robežvērtība procentos, kas atšķir kodīgus testējamajos materiālus no nekodīgiem (vai pēc kuras izšķir dažādas kodīguma klases), rezultātu novērtēšanai un kodīgo materiālu identificēšanai izmantotā(-as) matemātiskās statistiskas procedūra(-as) precīzi jādefinē un jādokumentē, kā arī jāparāda to piemērotība. Parasti šīs sliekšņa robežvērtības nosaka testēšanas optimizācijas laikā, pārbaudot iepriekšējas validācijas posmā un apstiprinot ar validācijas pētījumiem. Piemēram, ar EpiDerm™ modeli saistītā kodīgās iedarbības prognoze ir šāda (9):
Uzskatāms, ka testējamā viela ir kodīga iedarbībā uz ādu:
i) ja dzīvotspēja pēc 3 min ekspozīcijas ir mazāka par 50 % vai
ii) ja dzīvotspēja pēc 3 min ekspozīcijas ir lielāka vai vienāda ar 50 %, un dzīvotspēja pēc 1 stundas ekspozīcijas ir mazāka par 15 %.
Uzskatāms, ka testējamā viela nav kodīga iedarbībā uz ādu:
i) ja dzīvotspēja pēc 3 min ekspozīcijas ir lielāka vai vienāda ar 50 %, un dzīvotspēja pēc 1 stundas ekspozīcijas ir lielāka vai vienāda ar 15 %.
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jāiekļauj šāda informācija.
Testējamā viela un kontroles viela:
— ķīmiskais nosaukums, piemēram, IUPAC vai CAS nosaukums un CAS numurs, ja zināms,
— vielas vai preparāta tīrības pakāpe un sastāvs (masas procentos),
— fizikāli ķīmiskās īpašības, kas attiecas uz noteikšanu, piemēram, fizikālais stāvoklis, pH, stabilitāte, šķīdība ūdenī,
— testējamo un kontroles vielu sagatavošana testēšanai, ja veikta (piemēram, sildīšana, sasmalcināšana),
— stabilitāte, ja zināma.
Izmantotā ādas modeļa un protokola pamatojums.
Testēšanas apstākļi:
— izmantotā šūnu sistēma,
— šūnu dzīvotspējas mērīšanai izmantotās mērīšanas iekārtas (piemēram, spektrofotometra) kalibrēšanas dati,
— pilnīga papildinformācija par konkrēto izmantoto ādas modeli, ieskaitot ziņas par tā piemērotību,
— informācija par izmantoto testēšanas procedūru,
— testējamās devas,
— testēšanas procedūras iespējamo izmaiņu apraksts,
— atsauce uz iepriekšējiem vēsturiskajiem datiem par modeli,
— izmantoto novērtējuma kritēriju apraksts.
Rezultāti:
— tabulas veidā apkopoti dati par testējamajiem paraugiem,
— novērojumu apraksts.
Rezultātu novērtējums.
Secinājums.
4. IZMANTOTĀ LITERATŪRA
(1) OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6.
(2) Testing Method B.4. Acute Toxicity: Dermal Irritation/Corrosion.
(3) Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report recommendations of ECVAM Workshop 6 ATLA 23, p. 219–255.
(4) Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxicology In Vitro 12, p. 471–482.
(5) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. In Vitro 12, p. 483–524.
(6) OECD (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, p. 62.
(7) Balls, M., Blaauboer, B.J., Fentem, J.H., Bruner, L., Combes, R.D., Ekwall, B., Fielder, R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski, D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. Test report and recommendations of ECVAM workshops. ATLA 23, p. 129–147.
(8) ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf.
(9) Liebsch, M., Traue, D., Barrabas, C., Spielmann, H., Uphill, P., Wilkins, S., McPherson, J.P., Wiemann, C., Kaufmann, T., Remmele, M. and Holzhutter, H.G. (2000). The ECVAM prevalidation study on the use of EpiDerm for skin Corrosivity testing. ATLA 28, p. 371–401.
(10) ECVAM (1998). ECVAM News & Views. ATLA 26, p. 275–280.
(11) ECVAM (2000). ECVAM News & Views. ATLA 28, p. 365–67.
(12) ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods) (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf.
(13) OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st–2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat.
(14) Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709–720.
(15) Mosmann, T. (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity asssays. J.Immunol. Meth. 65, p. 55–63.
(16) Cannon, C.L., Neal, P.J., Southee, J.A., Kubilus, J., and Klausner, M., 1994. New epidermal model for dermal irritancy testing. Toxicology In Vitro 8, p. 889–891.
(17) Ponec, M., Boelsma, E., Weerheim, A., Mulder, A., Boutwstra, J., and Mommaas, M., 2000. Lipid and ultrastructural characterisation of reconstructed skin models. International Journal of Pharmaceutics. 203, p. 211–225.
(18) Tinois E, Gaetani Q, Gayraud B, Dupont D, Rougier A, Pouradier DX (1994). The Episkin model: Successful reconstruction of human epidermis in vitro. In In vitro Skin Toxicology. Edited by A Rougier, AM Goldberg and HI Maibach: 133–140.
(19) Tinois E, Tiollier J, Gaucherand M, Dumas H, Tardy M, Thivolet J (1991). In vitro and post –transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute. Experimental Cell Research 193: 310–319.
(20) Parentau, N.L., Bilbo, P., Molte, C.J., Mason, V.S., and Rosenberg, H. (1992). The organotypic culture of human skin keratinocytes and fibroblasts to achieve form and function. Cytotechnology 9, p. 163–171.
(21) Wilkins, L.M., Watson, S.R., Prosky, S.J., Meunier, S.F., Parentau, N.L. (1994). Development of a bilayered living skin construct for clinical applications. Biotechnology and Bioengineering 43/8, p. 747–756.
(22) Marshall, N.J., Goodwin, C.J., Holt, S.J. (1995). A critical assessment of the use of microculture tetrazolium assays to measure cell growth and function. Growth Regulation 5, p. 69–84.
(23) Fentem, J.H., Briggs, D., Chesne’, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Rouget, R., and van de Sandt, J.J.M., and Botham, P.A. (2001). A prevalidation study on in vitro tests for acute skin irritation: results and evaluation by the Management Team. Toxicology In Vitro 15, p. 57–93.
B.41. FOTOTOKSICITĀTES IN VITRO 3T3 NRU TESTS
1. METODE
Šī metode ir ekvivalenta ESAO TG 432 (2004) metodei.
1.1. IEVADS
Fototoksicitāte ir organisma toksiska reakcija uz vielu, kas parādās vai pastiprinās (pie zemākām devām) gaismas iedarbībā vai ko izraisa ādas apstarošana pēc sistemātiskas vielas lietošanas.
Fototoksicitātes in vitro 3T3 NRU testu izmanto vielas fototoksicitātes potenciāla noteikšanai, ko izraisa gaismas iedarbībā ierosināts ķīmiskais savienojums. Testā novērtē fotocitotoksicitāti, pamatojoties uz ķīmiskā savienojuma iedarbībai pakļauto šūnu dzīvotspējas relatīvo samazināšanos gaismas klātbūtnē, salīdzinot ar tumsu. Uzskatāms, ka šajā testā identificētās vielas ir fototoksiskas in vivo pēc sistemātiskas lietošanas un izkliedēšanas uz ādas vai arī pēc lokālas aplicēšanas uz ādas.
Daudzām ķīmisko vielu klasēm aprakstīta to spēja izraisīt fototoksisku iedarbību (1) (2) (3) (4). Šīm vielām piemīt spēja absorbēt gaismas staru enerģiju redzamās gaismas diapazonā. Saskaņā ar pirmo fotoķīmijas likumu (Grothusa-Drapera [Grotthaus-Draper] likums), lai notiktu fotoķīmiska reakcija, ir jāabsorbē noteikts gaismas kvantu daudzums. Tādējādi pirms bioloģiskā testa veikšanas jānosaka testējamās vielas UV un redzamās gaismas absorbcijas spektrs saskaņā ar ESAO TG 101 metodi. Uzskata, ka gadījumos, kad vielas molārās ekstinkcijas/absorbcijas koeficients ir mazāks par 10 l × mol-1 × cm-1, mazvarbūtīgi, ka viela ir fotoreaktīva. Šādai vielai var nebūt nepieciešams veikt fototoksicitātes in vitro 3T3 NRU testu vai kādu citu bioloģisko testu, lai noteiktu tās fotoķīmisko kaitīgumu (1) (5). Skatīt arī 1. papildinājumu.
Fototoksicitātes in vitro 3T3 NRU testa drošuma un piemērotības novērtējums nesen aprakstīts (6) (7) (8) (9). Tika pierādīts, ka fototoksicitātes in vitro 3T3 NRU tests ļauj prognozēt fototoksicitāti dzīvniekiem un cilvēkiem in vivo. Tests nav paredzēts tādas citu veidu kaitīgas iedarbības prognozēšanai, kuru varētu izraisīt ķīmisko vielu un gaismas kopēja iedarbība, piemēram, tas nav attiecināms uz fotogenotoksicitāti, fotoalerģiskumu vai fotokancerogenitāti, kā arī nedod iespējas novērtēt fototoksiskās iedarbības spēku. Bez tam tests nav paredzēts netiešo fototoksicitātes mehānismu, testējamās vielas metabolītu un maisījumu kaitīgās iedarbības pētīšanai.
Metabolizējošu sistēmu izmantošana ir vispārīga prasība visiem in vitro testiem genotoksicitātes un kancerogenitātes potenciāla prognozēšanai, tomēr līdz šim fototoksikoloģijā var minēt tikai dažus piemērus, kad vielas metaboliska transformācija ir nepieciešama, lai tā darbotos kā fototoksīns in vivo vai in vitro. Tādējādi metaboliskās aktivācijas sistēmas izmantošana šim testam netiek uzskatīta par nepieciešamu vai par zinātniski pamatotu.
1.2. DEFINĪCIJAS
Starojums: uz virsmu krītošas ultravioletās (UV) vai redzamās gaismas intensitāte, ko izsaka W/m2 vai mW/cm2.
Gaismas doza: uz virsmas krītošas ultravioletās vai redzamās gaismas starojuma enerģija (= intensitāte × laiks), izsakot džoulos (= W × s) uz laukuma vienību, piemēram, J/m2 vai J/cm2.
UV staru viļņu garums: CIE (Commission Internationale de l ’ Eclairage) ieteiktie diapazonu apzīmējumi ir šādi: UVA (315–400 nm), UVB (280–315 nm) un UVC (100–280 nm). Var izmantot arī citus diapazonu apzīmējumus; par UVB un UVA robežu parasti pieņem viļņa garumu 320 nm, un UVA var iedalīt UV-A1 un UV-A2, par robežu pieņemot aptuveni pie 340 nm.
Šūnu dzīvotspēja: parametrs, kas mēra šūnu populācijas kopējo aktivitāti (piemēram, vitālās krāsvielas Neutral Red uzņemšanu šūnu liposomās), kas atkarībā no mērīšanas beigu punkta un testēšanas plāna korelē ar šūnu kopējo skaitu un/vai šūnu dzīvotspēju.
Relatīvā šūnu dzīvotspēja: šūnu dzīvotspēja, kas izteikta attiecībā pret šķīdinātāja (negatīvo) kontroli visā testēšanas laikā (ar apstarošanu vai bez tās), bet neiedarbojoties ar testējamo vielu.
PIF ( Photo-Irritation-Factor) fotokairinājuma koeficients): šo koeficientu iegūst, salīdzinot divas citotoksiskas testējamās vielas koncentrācijas (IC50) ar vienādu efektivitāti, apstarojot ar UVA/redzamo gaismu (+Irr) un bez apstarošanas (–Irr).
IC 50 : testējamās vielas koncentrācija, pie kuras šūnu dzīvotspēja samazinās par 50 %.
MPE ( Mean-Photo-Effect) vidējais fotoefekts: nosakāmā vērtība, ko iegūst koncentrācijas reakcijas līkņu matemātiskā analīzē, salīdzinot līknes, kas iegūtas, apstarojot (+Irr) ar necitotoksisku UVA/redzamo gaismu un bez apstarošanas (–Irr).
Fototoksicitāte: akūta toksiska reakcija, kas rodas, uz ādu iedarbojoties ar konkrētu ķīmisku vielu un pēc tam iedarbojoties ar gaismu, vai arī iedarbība, kura tiek izraisīta līdzīgā veidā, ādu apstarojot pēc sistemātiskas ķīmiskas vielas lietošanas.
1.3. TESTĒŠANAS METODES PRINCIPS
Fototoksicitātes in vitro 3T3 NRU tests pamatojas uz ķīmiskās vielas citotoksicitātes salīdzinājumu, ja testu veic, apstarojot ar mākslīgas dienasgaismas devu, kas nav citotoksiska, un bez apstarošanas. Citotoksicitāti šajā testā izsaka kā vitālās krāsvielas Neutral Red (NR) uzsūkšanas samazināšanos 24 stundas pēc iedarbības ar testējamo vielu un apstarošanas, kas ir atkarīga no koncentrācijas (10). NR ir vāja katjonu krāsviela, kas nedifundējot viegli penetrē šūnu membrānās, šūnā uzkrājoties lizosomās. Jutīgas lizosomu membrānas šūnu virsmas izmaiņas rezultāts ir lizosomu bojājumi un citas izmaiņas, kas pakāpeniski kļūst neatgriezeniskas. Šo izmaiņu rezultāts, ko izraisa ksenobiotiku iedarbība, ir NR uzsūkšanas un saistīšanas samazināšanās. Līdz ar to ir iespējams atšķirt dzīvotspējīgas, bojātas vai nedzīvas šūnas, kas ir šā testa pamatuzdevums.
Balb/c 3T3 šūnas uztur kultūrā 24 stundas, lai izveidotos monoslāņi. Divas katrai testējamai vielai paredzētas 96 bedrīšu plates vispirms vienu stundu inkubē ar astoņām dažādām testa vielas koncentrācijām. Pēc tam vienu plati apstaro ar lielāko necitotoksisko starojuma devu, bet otru plati tur tumsā. Tad uz abām platēm iedarbības barotni nomaina ar kultivēšanas barotni un pēc 24 stundu inkubācijas nosaka šūnu dzīvotspēju, pamatojoties uz krāsvielas Neutral Red uzsūkšanu. Šūnu dzīvotspēju izsaka procentos salīdzinājumā ar šķīdinātāja kontroli bez testējamās vielas, un aprēķina atsevišķi katrai testējamajai koncentrācijai. Lai prognozētu fototoksisko potenciālu, jāsalīdzina koncentrācijas reakcijas ar apstarošanu un bez tās, parasti pie IC50 līmeņa, t. i., pie koncentrācijas, kas šūnu dzīvotspēju samazina līdz 50 % salīdzinājumā ar kontroli.
1.4. TESTA METODES APRAKSTS
1.4.1. Preparāti
1.4.1.1. Šūnas
Validācijas pētījumiem tika izmantota pastāvīgā peļu fibroblasta šūnu līnija, Balb/c 3T3, klons 31, no American Type Culture Collection (ATCC), Manassas, VA, USA, un no Eiropas Šūnu kultūru kolekcijas European Collection of Cell Cultures (ECACC), Salisbury, Wiltshire, UK, un tāpēc ieteicams šūnas ņemt no atzītiem šūnu depozitārijiem. Testēšanai pēc šīs pašas procedūras var izmantot citas kultūras, attiecīgi pielāgojot kultivēšanas apstākļus, tomēr ir jāpierāda ekvivalence.
Šūnas regulāri jāpārbauda, vai tās nav piesārņotas ar mikoplazmu, un tās var izmantot tikai tad, ja šis piesārņojums nav konstatēts (11).
Svarīga ir regulāra šūnu jutības pārbaude pret UV staru iedarbību saskaņā ar kvalitātes kontroles procedūru, kas aprakstīta šajā metodē. Sakarā ar to, ka šūnu UVA jutība var palielināties atkarībā no pārsējumu skaita, jāizmanto Balb/c 373 šūnu kultūras ar iespējami zemāko pārsējumu skaitu, ieteicams mazāku par 100. (Skatīt 1.4.2.2.2. punktu un 2. papildinājumu.)
1.4.1.2. Barotnes un kultivēšanas apstākļi
Piemērotas kultūru barotnes un inkubācijas apstākļi jāizmanto šūnu pārsēšanai un testēšanas procedūrai, piemēram, Balb/c 373 šūnām šie apstākļi ir DMEM (pēc Dīlbeko [Dulbecco] modificēta Īgla [Eagle] barotne), kas papildināta ar 10 % jaundzimuša teļa serumu, 4 mM glutamīnu, penicilīnu (100 IV) un streptomicīnu (100 μg/mL), un inkubācija pie 37 oC mitrā vidē 5–7,5 % CO2 atkarībā no buferšķīduma (skatīt 1.4.1.4. punkta otro daļu). Īpaši svarīgi, lai šūnu kultūras apstākļi nodrošinātu šūnu cikla ilgumu, kas ir izmantojamās šūnu kultūras vai šūnu līnijas līdzšinējo vēsturisko datu intervālā.
1.4.1.3. Kultūru sagatavošana
Šūnas no sasaldētās rezerves kultūras ar atbilstošu blīvumu izsēj kultivēšanas barotnē un pirms izmantošanas fototoksicitātes in vitro 3T3 NRU testam vismaz vienu reizi pārsēj.
Fototoksicitātes testā izmantojamās šūnas ar atbilstošu blīvumu izsēj kultivēšanas barotnē tā, lai tās nesaplūstu testa beigās, t. i., kad nosaka šūnu dzīvotspēju 48 stundas pēc sēšanas. Ja Balb/c 373 šūnu kultūru audzē 96 bedrīšu platē, ieteicamais šūnu sēšanas blīvums ir 1 × 104 šūnu vienā bedrītē.
Šūnas katrai testējamajai vielai sēj līdzīgā veidā divās atsevišķās 96 bedrīšu platēs, kuras pēc tam izmanto paralēli visā testa procedūras laikā pie identiskiem kultūras apstākļiem, izņemot laiku, kurā vienu plati apstaro (+Irr), bet otru atstāj tumsā (–Irr).
1.4.1.4. Tesējamās vielas sagatavošana
Testējamajai vielai jābūt svaigi sagatavotai tieši pirms testēšanas, ja nav datu, kas liecina par stabilitāti glabāšanas laikā. Visu šūnu ķīmisko apstrādi un sākotnējo sagatavošanu ieteicams veikt tādā apgaismojumā, kurā nenotiek testējamās vielas fotoaktivācija vai noārdīšanās vēl pirms apstarošanas.
Testa vielas jāizšķīdina sāļu buferšķīdumā, piemēram, Ērla izotoniskajā sāļu šķīdumā (Earl ’ s Balanced Salt Solution) vai citā fizioloģiskā buferšķīdumā, kas nesatur olbaltumvielas un gaismu absorbējošas vielas (piemēram, pH indikatora krāsvielas vai vitamīnus), lai novērstu to radītos traucējumus apstarošanas laikā. Sakarā ar to, ka apstarošanas laikā šūnas tiek turētas ārpus CO2 inkubatora aptuveni 50 minūtes, jānodrošina alkalizācijas novēršana. Ja izmanto vāju buferšķīdumu, piemēram, EBSS, to nodrošina, inkubējot šūnas pie 7,5 % CO2. Ja šūnas tiek inkubētas tikai pie 5 % CO2, būtu jāizvēlas stiprāks buferšķīdums.
Testējamās vielas ar ierobežotu šķīdību ūdenī jāizšķīdina piemērotā šķīdinātājā. Ja izmanto šķīdinātāju, tam jābūt vienādā daudzumā visās kultūrās, t. i., negatīvajās (šķīdinātāja) kontrolēs, kā arī pie visām testējamās vielas koncentrācijām, un šādā koncentrācijā tas nedrīkst būt citotoksisks. Testējamās vielas koncentrācijas jāizvēlas tā, lai šķīdumos neveidotos nogulsnes vai tie kļūtu nedzidri.
Ieteicamie šķīdinātāji ir dimetilsulfoksīds (DMSO) un etanols (ETOH). Var izmantot arī citus šķīdinātājus, kuriem ir neliela citotoksicitāte. Pirms izmantošanas jānovērtē katra šķīdinātāja īpašības, piemēram, reaģētspēja ar testējamo vielu, tās fototoksiskā efekta samazināšana, radikāļu saistīšanas spēja un/vai ķīmiskā stabilitāte šķīdinātājā.
Testējamās vielas šķīšanas veicināšanai var izmantot maisīšanu ar vorteksu, apstrādi ar ultraskaņu un/vai sildīšanu līdz atbilstošai temperatūrai, ja tādējādi netiek ietekmēta testējamās vielas stabilitāte.
1.4.1.5. Apstarošanas apstākļi
1.4.1.5.1.
Pareiza gaismas avota un filtru izvēle ir noteicošs fototoksicitātes testa faktors. UVA un redzamās gaismas starojums parasti saistāms ar fototoksiskajām reakcijām in vivo (3) (12), turpretī UVM vairāk saistāms ar lielu citotoksicitāti, kas palielinās 1 000 reizes, viļņa garumam samazinoties no 313 līdz 280 nm (13). Piemērota gaismas avota izvēles kritērijos jāiekļauj prasība par to, ka gaismas avotam jāizstaro viļņa garumi, kurus absorbē testējamā viela (absorbcijas spektrs), un gaismas starojuma devai (kas sasniedzama saprātīga ilguma apstarošanas laikā) jābūt pietiekamai zināmo fotocitotoksisko ķīmisko vielu detektēšanai. Bez tam izmantojamie viļņu garumi un devas nedrīkst pārmērīgi kaitēt testēšanas sistēmai, piemēram, emitējot siltumstarojumu (spektra infrasarkanajā reģionā).
Saules gaismas modelēšana ar saules imitatoriem ir uzskatāma par optimālu mākslīgā apgaismojuma avotu. Filtrētā saules imitatora starojuma enerģijas izkliedei jābūt tuvai dabīgās gaismas izkliedei, kas norādīta (14). Saules imitatoros izmanto gan ksenona, gan (ierosināta) dzīvsudraba-metāla halogenīda loka starojumu (15). Ierosināta dzīvsudraba-metāla halogenīda loka starojuma priekšrocība ir tā, kas tas emitē mazāk siltuma un ir lētāks, tomēr atbilstība saules gaismai nav tik precīza ka ksenona lokam. Visi saules gaismas imitatori izstaro ievērojamu UVB daudzumu, tāpēc tie jāaprīko ar filtriem, lai aizturētu ļoti citotoksiskos UVB viļņa garumus. Sakarā ar to, ka šūnu kultūru plastmasas materiāli satur UV stabilizatorus, spektrs jāmēra caur tā paša tipa 96 bedrīšu plates vāku, kāds tiks izmantots eksperimentā. Neskatoties uz pasākumiem, kas veikti, lai aizturētu spektra daļas filtrējot vai uz neizbēgamiem filtra efektiem, ko rada iekārta, spektrs, kas reģistrēts zem šiem filtriem, nedrīkst atšķirties no standartizētās dabīgās dienasgaismas (14). Fototoksicitātes in vitro 3T3 NRU testa validācijas pētījumos izmantotā saules gaismas imitatora filtrētā starojuma spektra sadalījums dots (8) (16). Skatīt arī 1. attēlu 2. papildinājumā.
1.4.1.5.2.
Gaismas starojuma intensitāte (starojums) jāpārbauda regulāri pirms katra fototoksicitātes testa, izmantojot piemērotu platjoslas UV-metru. Intensitāte jāmēra caur tā paša tipa 96 bedrīšu plates vāku, ko izmanto eksperimentā. UV-spektrometram jābūt kalibrētam pēc avota. UV-metra darbība jāpārbauda ar, ieteicams, tāda paša tipa identiski kalibrētu UV-metru, ko izmanto par etalonu. Ideālā gadījumā lielākos laika intervālos būtu jāizmanto spektroradiometrs gaismas avota filtrētā starojuma spektra mērīšanai un UV-metra kalibrēšanas pārbaudei.
Noskaidrots, ka starojuma doza 5 J/cm2 (UVA diapazonā) nav citotoksiska Balb/c 373 šūnām, bet ir pietiekama, lai ķīmiskās vielas ierosinātu līdz fototoksisko reakciju izraisīšanas stāvoklim (6) (17), piemēram, lai 50 minūšu laikā sasniegtu 5 J/cm2, apstarojums tika noregulēts uz 1,7 mW/cm2. Skatīt 2. attēlu 2. papildinājumā. Ja izmanto citu šūnu līniju vai gaismas avotu, apstarojuma doza būtu, iespējams, jākalibrē tā, lai varētu izvēlēties tādu dozas režīmu, kas šūnām nekaitē, bet ir pietiekama standarta fototoksīnu ierosināšanai. Apstarošanas laiku aprēķina pēc šādas formulas:
|
|
(1J = 1 Wsec) |
1.4.2. Testēšanas apstākļi
1.4.2.1. Testējamās vielas koncentrācijas
Jānosaka attiecīgie apstarošanai ar gaismu pakļautās (+Irr) un tumsā turētās (–Irr) testējamās vielas koncentrāciju diapazoni, veicot dozu diapazonu noteikšanas eksperimentus. Varētu būt lietderīgi novērtēt sākotnējo šķīdību un pēc 60 minūtēm (vai jebkāda cita iedarbības laika), jo šķīdība var mainīties gan ar laiku, gan apstarošanas iedarbībā. Lai novērstu toksicitāti, kas rodas nepareizu kultivēšanas apstākļu dēļ, vai testējot ļoti skābas vai sārmainas vielas, šūnu kultūrā ar pievienotu testējamo vielu jābūt pH 6,5–7,8.
Lielākajai testējamās vielas koncentrācijai jābūt fizioloģiskajiem testēšanas apstākļiem atbilstošiem, piemēram, tā nedrīkst radīt osmozes vai pH izraisītu stresu. Ņemot vērā testējamās vielas īpašības, kā faktori var būt jāņem vērā arī citas fizikāli ķīmiskās īpašības, kas ierobežo tās koncentrāciju. Relatīvi mazšķīstošām vielām, kuras nav toksiskas koncentrācijās, kas zemākas par piesātināta šķīduma koncentrāciju, testēšana jāveic pie lielākās sasniedzamās koncentrācijas. Vispār, pie koncentrācijām, kādās veic testēšanu, nedrīkst veidoties nogulsnes. Ieteicams, lai testējamās vielas maksimālā koncentrācija nepārsniegtu 1 000 μg/mL, bet osmotiskais spiediens nebūtu lielāks par 10 mmolar. Jāizmanto astoņas testējamās vielas koncentrācijas, kas mainās ģeometriskā progresijā ar pastāvīgu atšķaidījuma koeficientu (skatīt 2.1. punkta otro daļu).
Ja diapazona noteikšanas eksperimentā iegūta informācija, ka testējamā viela nav citotoksiska līdz pat robežkoncentrācijai, veicot eksperimentu tumsā (–Irr), bet ir ļoti citotoksiska apstarojot (+Irr), tad koncentrācijas diapazoni, kuri būtu jāizvēlas (+Irr) eksperimentam, var atšķirties no (–Irr) izvēlētajiem diapazoniem, lai ievērotu prasību par atbilstošas kvalitātes datiem.
1.4.2.2. Kontroles
1.4.2.2.1.
Šūnām regulāri (apmēram katram piektajam pārsējumam) jāpārbauda jutība pret gaismas avotu, novērtējot šūnu dzīvotspēju pēc apstarošanas ar pieaugošām starojuma devām. Veicot šo novērtēšanu, jāizmanto vairākas apstarojuma dozas, ieskaitot līmeņus, kas būtiski pārsniedz fototoksicitātes 3T3 NRU testam izmantotos līmeņus. Vienkāršākais šo dozu kvantitatīvās noteikšanas veids ir gaismas avota UV spektra daļu mērījumi. Šūnas tiek izsētas ar blīvumu, kādu izmanto fototoksicitātes in vitro 3T3 NRU testā, un tās nākamajā dienā apstaro. Tad šūnu dzīvotspēju nosaka pēc vienas dienas, pamatojoties uz Neutral Red uzsūkšanu. Jāparāda, ka noteiktā lielākā netoksiskā deva (piemēram, validācijas pētījumā 5 J/cm2 [UVA]) ir pietiekama, lai pareizi klasificētu standartvielas (1. tabula).
1.4.2.2.2.
Tests atbilst kvalitātes kritērijiem, ja apstarotās negatīvās/šķīdinātāja kontrolēs salīdzinājumā ar neapstarotajiem negatīvajām/šķīdinātāja kontrolēm šūnu dzīvotspēja ir lielāka par 80 %.
1.4.2.2.3.
No šķīdinātāja kontrolēm ekstrahētās Neutral Red absolūtais optiskais blīvums (D540 NRU) parāda, vai vienā bedrītē izsētās 1 × 104 šūnas divās eksperimenta dienās augušas ar parasto dubultošanās laiku. Tests atbilst pieņemamības kritērijiem, ja vidējais neapstrādāto kontroļu D540 NRU ≥ 0,4 (t. i., aptuveni divdesmit reizes lielāks par šķīdinātāja fona absorbciju).
1.4.2.2.4.
Zināma fototoksiskā viela jāpārbauda paralēli katram fototoksicitātes in vitro 3T3 NRU testam. Ieteicams izmantot hlorpromazīnu (HPZ). Pēc standarta noteikumiem testētajam HPZ fototoksicitātes 3T3 NRU testā tika noteikti šādi testa pieņemamības kritēriji: apstarotajam (+Irr) HPZ: IC50 = 0,1 līdz 2,0 μg/ml, neapstarotajam HPZ (–Irr): IC50 = 7,0 līdz 90,0 μg/mL. Fotokairinājuma koeficientam (PIF) jābūt > 6. Jāseko iepriekšējām pozitīvās kontroles izmaiņām pēc datu vēstures.
Citas fototoksiskās vielas, kas atbilst pārbaudāmās vielas ķīmiskajai klasei vai šķīdībai, var izmantot kā paralēlās pozitīvās kontroles hlorpromazīna vietā.
1.4.3. Testēšanas procedūra (6) (7) (8) (16) (17)
1.4.3.1. 1. dienā
100 μL kultivēšanas barotnes pārnes 96 bedrīšu audu kultūras mikrotitra plates malējās bedrītēs (= tukšie paraugi). Pārējās bedrītēs pārnes pa 100 μL suspensijas 1 × l05 šūnu/mL šūnu barotnē (= 1 × 104 šūnu/bedrītē). Katrai testējamās vielas koncentrāciju sērijai un šķīdinātāja un pozitīvajām kontrolēm jāsagatavo divas plates.
Šūnas jāiztur inkubatorā 24 stundas (skatīt 1.4.1.2. punktu), kamēr izveidojas daļēji saplūdis monoslānis. Šis inkubācijas laiks nodrošina šūnu atjaunošanos, savienošanos un eksponenciālu augšanu.
1.4.3.2. 2. dienā
Pabeidzot inkubāciju, kultivēšanas barotni dekantē no šūnām un tās uzmanīgi skalo ar 150 μL buferšķīduma, kas tika izmantots inkubācijai. Pievieno 100 μL buferšķīduma, kas satur atbilstošu testējamās vielas vai šķīdinātāja (šķīdinātāja kontroļu) koncentrāciju. Jābūt astoņām dažādām testējamās vielas koncentrācijām. Šūnas inkubē ar testējamo vielu tumsā 60 minūtes (skatīt 1.4.1.2. punktu un 1.4.1.4. punkta otro daļu).
No divām platēm, kas tika sagatavotas katrai testējamās vielas koncentrāciju sērijai un kontrolēm, jāizvēlas, parasti pēc nejaušības principa, viena plate citotoksicitātes noteikšanai (–Irr) (t. i., kontroles plate) un viena (apstrādājamā plate) – fotocitotoksicitātes noteikšanai (+Irr).
Veicot +Irr apstarošanu, šūnas apstaro pie istabas temperatūras 50 minūtes caur 96 bedrīšu plates vāku ar lielāko no starojuma dozām, kas nav citotoksiska (skatīt arī 2. papildinājumu). Neapstarotā plate (–Irr) jāiztur istabas temperatūrā tumšā kamerā 50 minūtes (= apstarošanas ar gaismu laiks).
Testējamo šķīdumu dekantē un uzmanīgi divas reizes skalo ar 150 μL buferšķīduma, kas tika izmantots inkubācijai, bet nesatur testējamo materiālu. Buferšķīdumu aizstāj ar kultivēšanas barotni un inkubē (skatīt 1.4.1.2. punktu) līdz nākamajai dienai (18–22 stundas).
1.4.3.3. 3. dienā
1.4.3.3.1.
Jānosaka šūnu augšana, morfoloģija un monoslāņa integritāte ar fāzu kontrastmikroskopu. Reģistrē šūnu morfoloģijas izmaiņas un ietekmi uz šūnu augšanu.
1.4.3.3.2.
Šūnas jānoskalo ar 150 μL iepriekš sasildīta buferšķīduma. Skalojamais šķīdums jāatdala, uzmanīgi nolejot. Pievieno 100 μL Neutral Red (NR) (3-amino-7-dimetilamino-2-metilfenazīna hidrohlorīda, Einecs Nr. 209-035-8; CAS Nr. 553-24-2; C.I. 50040), kura koncentrācija ir 50 μg/mL barotnē bez seruma (16), un trīs stundas inkubē, kā aprakstīts 1.4.1.2. punktā.
Pēc inkubācijas atdala barotni ar NR un šūnas noskalo ar 150 μL buferšķīduma. Lieko buferšķīdumu dekantē un atdala ar iesūcināšanu vai centrifugēšanu.
Desorbētajai NR pievieno precīzi 150 μL svaigi pagatavota šķīduma ar šādu sastāvu: 49 daļas ūdens + 50 daļas etanola + 1 daļa etiķskābes.
Mikrotitra plati uzmanīgi krata (mikrotitra plašu kratītājā) 10 minūtes, kamēr NR tiek ekstrahēts no šūnām un izveidojas viendabīgs šķīdums.
Mēra NR ekstrakta optisko blīvumu pie 540 nm spektrofotometrā, kā etalonu izmantojot tukšo paraugu. Dati jāglabā atbilstošā formāta failā turpmākai analīzei.
2. DATI
2.1. DATU KVALITĀTE UN APJOMS
Testēšanas datiem jānodrošina apstarotās un neapstarotās koncentrācijas atbildes reakcijas ticamas analīzes iespējas un, ja iespējams, arī tās testa vielas koncentrācijas analīze, pie kuras šūnu dzīvotspēja samazinās līdz 50 % (IC50). Ja konstatēta citotoksicitāte, jānosaka gan koncentrācijas diapazons, gan atsevišķo koncentrāciju līkņu krustošanās ar ordinātu asi tā, lai varētu konstruēt līkni pēc eksperimenta datiem.
Ja rezultāti ir skaidri pozitīvi vai skaidri negatīvi (skatīt 2.3. punkta pirmo daļu), tad varētu pietikt ar sākotnējo eksperimentu, ko papildina ar vienu vai vairākiem orientējošiem dozu diapazona noteikšanas izmēģinājumiem.
Neviennozīmīgi, robežai tuvi vai neskaidri rezultāti jāprecizē, veicot papildu eksperimentus (skatīt 2.4. punkta otro daļu). Šādos gadījumos jāizskata eksperimenta apstākļu modificēšanas iespēja. Eksperimenta apstākļi, kurus varētu modificēt, ir koncentrāciju diapazons vai intervāls koncentrāciju starpā, iepriekšējās inkubācijas un apstarošanas laiks. Apstarošanas laiku var saīsināt, testējot ūdens šķīdumā nestabilas vielas.
2.2. REZULTĀTU NOVĒRTĒŠANA
Lai varētu novērtēt datus, jāaprēķina fotokairinājuma koeficients (PIF) vai vidējais fotoefekts (MPE).
Fotocitotoksicitāti aprēķina (skatīt turpmāk), atsevišķās koncentrācijas un atbildes reakcijas vērtības aproksimējot ar nepārtrauktu koncentrācijas un atbildes reakcijas sakarības līkni (modeli). Līknes izlīdzināšanu pēc iegūtajiem datiem parasti veic ar nelineārās regresijas metodi (18). Lai novērtētu datu mainīguma ietekmi uz izlīdzināto līkni, ieteicams izmantot paškorelācijas (bootstrap) metodi.
Fotokairinājuma koeficientu (PIF) aprēķina pēc šādas formulas:
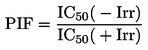
Ja IC50 gaismas klātbūtnē vai tumsā nav iespējams aprēķināt, tad nevar noteikt testējamā materiāla PIF.
Vidējais fotoefekts (MPE) pamatojas uz koncentrācijas atbildes līkņu pilnu salīdzinājumu (19). To nosaka kā reprezentatīvā fotoefekta vērtību kopas vidējo svērto lielumu:

Fotoefektu PEc pie jebkuras koncentrācijas C nosaka kā atbildes efekta REc un dozas efekta DEc reizinājumu, t. i., PEc = REc × DEc. Atbildes efekts REc ir gaismā un tumsā novērojamo atbildes reakciju starpība, t. i., REc = Rc (–Irr) – Rc (+Irr). Dozas efektu aprēķina pēc formulas:

kur C* ir ekvivalences koncentrācija, t. i., koncentrācija, pie kuras +Irr atbildes reakcija ir vienāda ar –Irr atbildes reakciju pie koncentrācijas C. Ja C* nevar noteikt, jo +Irr līknes atbildes vērtības ir sistemātiski augstākas vai zemākas par RC (–Irr), tad dozas efektu pieņem par 1. Iesvara koeficientus wi dod lielākā atbildes reakcijas vērtība, t. i., wi = MAX {Ri (+Irr), Ri (–Irr)}. Koncentrācijas tīklu Ci izvēlas tādu, lai to pašu punktu skaitu iekļautu katrā koncentrāciju intervālā, kas noteikts ar eksperimentā izmantotajām koncentrācijām. MPE aprēķina tikai maksimālās koncentrācijas vērtībai, pie kuras vismaz viena no divām līknēm joprojām parāda atbildes reakcijas vērtību vismaz 10 %. Ja šī maksimālā koncentrācija pārsniedz lielāko no koncentrācijām, kas tika izmantotas +Irr eksperimentā, tad pārējai +Irr līknes daļai pieņem atbildes reakcijas vērtību “0”. Atkarībā no tā, vai MPE vērtība pārsniedz izraudzīto sliekšņa vērtību (MPEc = 0,15), viela tiek vai netiek klasificēta kā fototoksiska.
Pieejama programmatūra PIF un MPE aprēķināšanai (20).
2.3. REZULTĀTU INTERPRETĀCIJA
Pamatojoties uz validācijas pētījumu (8), ja testējamās vielas PIF < 2 vai MPE < 0, tad var pieņemt, ka: “fototoksicitātes nav”. Ja 2 < PIF < 5 vai 0,1 < MPE < 0,15, tad prognozē: “fototoksicitāte iespējama”, un, ja PIF > 5 vai MPE > 0,15, tad prognozē: “fototoksicitāte ir”.
Katrai laboratorijai, kas pirmo reizi ievieš šo testēšanas metodi, pirms nezināmu vielu testēšanas to fototoksicitātes noteikšanai jāanalizē 1. tabulā minētās standartvielas. Noteiktajām PIF vai MPE vērtībām jābūt tuvām 1. tabulā minētajām vērtībām.
1. tabula
|
Ķīmiskais nosaukums |
Einecs Nr. |
CAS Nr. |
PIF |
MPE |
Absorbcijas maksimums |
Šķīdinātājs (1) |
|
Amiodarona hidrohlorīds |
243-293-2 |
[19774-82-4] |
> 3,25 |
0,27–0,54 |
242 nm 300 nm (plecs) |
etanols |
|
Hlorpromazīna hidrohlorīds |
200-701-3 |
[69-09-0] |
> 14,4 |
0,33–0,63 |
309 nm |
etanols |
|
Norfloksacīns |
274-614-4 |
[70458-96-7] |
> 71,6 |
0,34–0,90 |
316 nm |
acetonitrils |
|
Antracēns |
204-371-1 |
[120-12-7] |
> 18,5 |
0,19–0,81 |
356 nm |
acetonitrils |
|
Dinātrija protoporfirīns IX |
256-815-9 |
[50865-01-5] |
> 45,3 |
0,54–0,74 |
402 nm |
etanols |
|
L-histidīns |
[7006-35-1] |
no PIF |
0,05–0,10 |
211 nm |
ūdens |
|
|
Heksahlorofēns |
200-733-8 |
[70-30-4] |
1,1–1,7 |
0,00–0,05 |
299 nm 317 nm (plecs) |
etanols |
|
Nātrija laurilsulfāts |
205-788-1 |
[151-21-3] |
1,0–1,9 |
0,00–0,05 |
adsorbcijas nav |
ūdens |
|
(1) Absorbcijjas mērīšanai izmantotais šķīdinātājs. |
||||||
2.4. DATU INTERPRETĀCIJA
Ja fototoksisku iedarbību novēro tikai augstākajām testējamās vielas koncentrācijām (īpaši ūdenī šķīstošajām vielām), var rasties nepieciešamība pēc papildu apsvērumiem, novērtējot risku. Šie apsvērumi var iekļaut sevī datus par absorbciju un ķīmisko vielu uzkrāšanos ādā un/vai citos testos iegūtus datus, piemēram, ķīmisko vielu testēšanā ar dzīvnieku vai cilvēka ādu vai ādas modeļiem in vitro iegūtos rezultātus.
Ja toksicitāte netika konstatēta (+Irr un –Irr) un ja zemas šķīdības dēļ ir testējamo koncentrāciju ierobežojumi, testēšanas rezultāti var būt apšaubāmi un papildus jāveic apstiprinošs tests, piemēram, izmantojot citu modeli.
3. PĀRSKATS
TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jāiekļauj vismaz šāda informācija.
Testējamā viela:
— identifikācijas dati, nosaukumi un IUPAC un CAS numurs, ja zināms,
— fizikālās īpašības un tīrības pakāpe,
— fizikāli ķīmiskās īpašības, kas attiecas uz testēšanu,
— UV/redzamās gaismas absorbcijas spektrs,
— stabilitāte un fotostabilitāte, ja zināma.
Šķīdinātājs:
— šķīdinātāja izvēles pamatojums,
— testējamās vielas šķīdība šķīdinātājā,
— šķīdinātāja saturs procentos iedarbības barotnē.
Šūnas:
— šūnu tips un avots,
— norāde, ka nav mikoplazmas,
— šūnu pārsējumu skaits, ja zināms,
— šūnu jutība pret apstarojumu, kas noteikta ar fototoksicitātes in vitro 3T3 NRU testam izmantoto iekārtu.
Testēšanas apstākļi (1); inkubācija pirms un pēc apstrādes:
— kultivēšanas barotnes tips un sastāvs,
— inkubācijas apstākļi (CO2 koncentrācija; temperatūra; mitrums),
— inkubācijas ilgums (pirms apstrādes; pēc apstrādes).
Testēšanas apstākļi (2); apstrāde ar testējamo vielu:
— testēšanai izmantojamo vielas koncentrāciju izvēles pamatojums testam ar apstarošanu un bez tās,
— testējamās vielas ierobežotas šķīdības gadījumā un ja nav konstatēta citotoksicitāte: augstākās testējamās koncentrācijas izvēles pamatojums,
— apstrādei izmantotās barotnes tips un sastāvs (sāļu buferšķīdums),
— ķīmiskās iedarbības ilgums.
Testēšanas apstākļi (3); apstarojums:
— izmantotā gaismas avota izvēles pamatojums,
— gaismas avota un radiometra ražotājs un tips,
— gaismas avota starojuma spektra raksturlielumi,
— izmantoto filtru caurlaidības un absorbcijas raksturlielumi,
— radiometra raksturlielumi un kalibrēšanas dati,
— gaismas avota attālums no testējamās sistēmas,
— UVA starojums šajā attālumā, izsakot mW/cm2,
— apstarošanas ilgums ar UV/redzamo gaismu,
— UVA doza (starojums × laiks), izsakot J/cm2,
— šūnu kultūru temperatūra apstarošanas laikā un paralēlo šūnu kultūru temperatūra, kuras iztur tumsā.
Testēšanas apstākļi (4); šūnu dzīvotspējas tests ar Neutral Red:
— iedarbībai ar Neutral Red paredzētās barotnes sastāvs,
— Neutral Red inkubācijas ilgums,
— inkubācijas apstākļi (CO2 koncentrācija; temperatūra; mitrums),
— Neutral Red ekstrakcijas apstākļi (ekstrahents; ilgums),
— viļņa garums, pie kura spektrofotometriski nosaka Neutral Red optisko blīvumu,
— otrs (references) viļņa garums, ja izmanto,
— spektrofotometriskā tukšā parauga sastāvs, ja izmanto.
Rezultāti:
— šūnu vidējā dzīvotspēja visās testējamās vielas koncentrācijās, procentos no dzīvotspējas paralēlajās šķīdinātāja kontrolēs,
— koncentrācijas un atbildes reakcijas līknes (testējamās vielas koncentrācijas šūnu relatīvās dzīvotspējas sakarība), kas iegūtas paralēlajos +Irr un –Irr eksperimentos,
— koncentrācijas un atbildes reakcijas līkņu analīze: ja iespējams, IC50 (+Irr) un IC50 (-Irr) datoraprēķins/aprēķins,
— divu koncentrācijas un atbildes reakcijas līkņu salīdzinājums, kas iegūtas apstarojot un neapstarojot, – aprēķinot fotokairinājuma koeficientu (PIF) vai aprēķinot vidējo fotoefektu (MPE),
— testa pieņemamības kritēriji; paralēlā šķīdinātāja kontrole,
— apstaroto un neapstaroto šūnu absolūtā dzīvotspēja (Neutral Red ekstrakta optiskais blīvums),
— vēsturiskie dati par negatīvajām un šķīdinātāja kontrolēm; vidējās vērtības un standartnovirzes,
— testa pieņemamības kritēriji; paralēlā pozitīvā kontrole,
— pozitīvās kontroles vielas IC50 (+Irr) un IC50 (–Irr) un PIF/MPE,
— vēsturiskie dati par pozitīvās kontroles vielu: IC50 (+Irr) un IC50 (–Irr) un PIF/MPE; vidējās vērtības un standartnovirzes.
Rezultātu novērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Lovell W.W. (1993). A scheme for in vitro screening of substances for photoallergenic potential. Toxicology In Vitro 7: p. 95–102.
(2) Santamaria, L. and Prino, G. (1972). List of the photodynamic substances. In “Research Progress in Organic, Biological and Medicinal Chemistry” Vol. 3 part 1. North Holland Publishing Co. Amsterdam. P. XI–XXXV.
(3) Spielmann, H., Lovell, W.W., Hölzle, E., Johnson, B.E., Maurer, T., Miranda, M.A., Pape, W.J.W., Sapora, O., and Sladowski, D. (1994). In vitro phototoxicity testing: The report and recommendations of ECVAM Workshop 2. ATLA, 22, p. 314–348.
(4) Spikes, J.D. (1989). Photosensitisation. In “The science of Photobiology” Edited by K.C. Smith. Plenum Press, New York. 2nd edition, p. 79–110.
(5) OECD (1997) Environmental Health and Safety Publications, Series on Testing and Assessment No 7 “Guidance Document On Direct Phototransformation Of Chemicals In Water” Environment Directorate, OECD, Paris.
(6) Spielmann, H., Balls, M., Döring, B., Holzhütter, H.G., Kalweit, S., Klecak, G., L’Eplattenier, H., Liebsch, M., Lovell, W.W., Maurer, T., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W., and Willshaw, A. (1994). EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay. Toxicology In Vitro 8, p. 793–796.
(7) Anon (1998). Statement on the scientific validity of the 3T3 NRU PT test (an in vitro test for phototoxicity), European Commission, Joint Research Centre: ECVAM and DGXI/E/2, 3 November 1997, ATLA, 26, p. 7–8.
(8) Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., Pechovitch, G. De Silva, O., Holzhütter, H.G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W.W., Maurer, T., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W., and Brantom, P. (1998). The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test. Toxicology In Vitro 12, p. 305–327.
(9) OECD (2002) Extended Expert Consultation Meeting on The In Vitro 3T3 NRU Phototoxicity Test Guideline Proposal, Berlin, 30th-31th October 2001, Secretariat’s Final Summary Report, 15th March 2002, OECD ENV/EHS, available upon request from the Secretariat.
(10) Borenfreund, E., and Puerner, J.A. (1985). Toxicity determination in vitro by morphological alterations and neutral red absorption. Toxicology Lett., 24, p. 119–124.
(11) Hay, R.J. (1988). The seed stock concept and quality control for cell lines. Analytical Biochemistry 171, p. 225–237.
(12) Lambert L.A, Warner W.G., and Kornhauser A. (1996) Animal models for phototoxicity testing. In “Dermatotoxicology”, edited by F.N. Marzulli and H.I. Maibach. Taylor & Francis, Washington DC. 5th Edition, p. 515–530.
(13) Tyrrell R.M., Pidoux M (1987). Action spectra for human skin cells: estimates of the relative cytotoxicity of the middle ultraviolet, near ultraviolet and violet regions of sunlight on epidermal keratinocytes. Cancer Res., 47, p. 1825–1829.
(14) ISO 1097 (1993). Photography – Processed photographic colour films and paper prints – Methods for measuring image stability.
(15) Sunscreen Testing (UV.B) TECHNICALREPORT, CIE, International Commission on Illumnation, Publication No 90, Vienna, 1993, ISBN 3 900 734 275.
(16) ZEBET/ECVAM/COLIPA – Standard Operating Procedure: In Vitro 3T3 NRU Phototoxicity Test. Final Version, 7 September, 1998. 18 pgs.
(17) Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., De Silva, O., Holzhütter, H.G., Gerberick, F., Liebsch, M., Lovell, W.W., and Pfannenbecker, U. (1998) A study on UV filter chemicals from Annex VII of the European Union Directive 76/768/EEC, in the in vitro 3T3 NRU phototoxicity test. ATLA 26, p. 679–708.
(18) Holzhütter, H.G., and Quedenau, J. (1995) Mathematical modeling of cellular responses to external signals. J. Biol. Systems 3, p. 127–138.
(19) Holzhütter, H.G. (1997). A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals. ATLA, 25, p. 445–462.
(20) http://www.oecd.org/document/55/0,2340,en_2649_34377_2349687_1_1_1_1,00.html.
1. PAPILDINĀJUMS
Fototoksicitātes in vitro 3T3 NRU testa izmantošana saskaņā ar ķīmisko vielu fototoksicitātes pakāpeniskas testēšanas pieeju
2. PAPILDINĀJUMS
1. attēls
Saules gaismas imitatora filtrēta starojuma spektrālās jaudas sadalījums

(skatīt 1.4.1.5. punkta otro daļu)
1. attēlā parādīts filtrētā saules imitatora pieņemamās spektrālās jaudas sadalījums. Tas noteikts aktivēta metāla halogenīda avotam, kas tika izmantots fototoksicitātes 3T3 NRU testa validēšanas izmēģinājumos (6) (8) (17). Attēlā parādīti divu dažādu filtru un 96 bedrīšu kultivācijas plates vāka papildu filtrēšanas efekti. H2 filtrs tika izmantots tikai testēšanas sistēmām, kas spēj izturēt lielāku UVB daudzumu (ādas modeļa tests un sarkano asinsķermenīšu fotohemolīzes tests). Fototoksicitātes 3T3 NRU testā tika izmantots H1 filtrs. Attēlā parādītais plates vāka papildu filtrēšanas efekts novērojams galvenokārt UVB diapazonā un atstāj tādu UVB daudzumu starojuma spektrā, kas ir pietiekams, lai ierosinātu ķīmiskās vielas, kurām piemīt absorbcija UVB diapazonā, piemēram, amiodarons (skatīt 1. tabulu).
2. attēls
Balb/c 3T3 šūnu jutība pret apstarošanu (UVA diapazonā)
Šūnu dzīvotspēja (Neutral Red uzsūkšana aptumšotajās kontrolēs, %)

(skatīt 1.4.1.5.2. punkta otro daļu; 1.4.2.2.1., 1.4.2.2.2. punktu)
Balb/c 3T3 šūnu jutība pret fototoksicitātes 3T3 NRU testa validācijas izmēģinājumā izmantotā saules imitatora starojumu, mērot UVA diapazonā. Attēlā parādīti validēšanas priekšizpētes rezultāti no septiņām dažādām laboratorijām (1). Divas līknes ar gaišiem punktiem tika iegūtas ar vecām šūnu kultūrām (liels pārsējumu skaits), kuras bija jānomaina ar jaunām, bet līknes ar tumšiem punktiem parāda šūnas ar pieņemamu jutību pret starojumu.
Pēc šiem datiem tika noteikta lielākā necitotoksiskā starojuma doza: 5 J/cm2 (vertikālā punktētā līnija). Horizontālā punktētā līnija parāda arī maksimālo pieņemamo apstarojuma efektu, kas minēts 1.4.2.2. punktā.
B.42. ĀDAS SENSIBILIZĀCIJA: LOKĀLO LIMFMEZGLU NOTEIKŠANA (LLNA)
IEVADS
1. ESAO ķīmisko vielu testēšanas vadlīnijas un uz tām pamatotās ES testēšanas metodes tiek regulāri pārskatītas, ņemot vērā tehnikas attīstību, regulatīvo prasību izmaiņas un dzīvnieku labturības apsvērumus. Sākotnējā, jau apstiprinātā testēšanas metode (TM) ādas sensibilizācijas noteikšanai pelēm ir lokālo limfmezglu noteikšanas metode (LLNA; ESAO 429. testēšanas vadlīnijas; šā pielikuma B.42. nodaļa) (1). Ir publicēti LLNA validācijas un ar to saistītā darba pārskati (2) (3) (4) (5) (6) (7) (8) (9) (10) (11). Atjauninātās LLNA pamatā ir praktiskās pieredzes un zinātnisko datu izvērtējums (12). Šī ir otrā no divām TM, kas izstrādājamas, lai novērtētu ķīmiskām vielām vai to maisījumiem piemītošo ādas sensibilizācijas potenciālu (dzīvniekiem). Pirmajā TM (ESAO 406. testēšanas vadlīnijas; šā pielikuma B.6. nodaļa) izmanto testēšanu ar jūrascūciņām, proti, maksimizācijas testu jūrascūciņām un Bīlera testu (13). Salīdzinot ar B.6 un EASO 406. testēšanas vadlīnijām (13), LLNA ir pārāka dzīvnieku labturības ziņā. Šī atjauninātā LLNA TM ietver veiktspējas standartus (PS) (1. papildinājums), kurus var izmantot, lai novērtētu tādu jaunu un/vai pārveidotu testēšanas metožu validācijas statusu, kuras ir funkcionalitātes vai noteikšanas mehānisma ziņā līdzīgas LLNA, saskaņā ar ESAO Vadlīniju dokumentā Nr. 34 izklāstītajiem principiem (14).
2. LLNA pēta ādas sensibilizācijas indukcijas fāzi un sniedz kvantitatīvus datus, kas piemēroti atbildes reakcijas uz devu novērtēšanai. Turklāt jānorāda, ka vieglas/vidējas iedarbības sensibilizatori, kas ir ieteikti kā piemērotas pozitīvās kontroles vielas (PC) jūrascūciņu testa metodēm (B.6; EASO 406. testēšanas vadlīnijas) (13), ir piemēroti arī lietošanai ar LLNA (6) (8) (15). Kā viena no iespējamām pieejām šajā TM aprakstīta reducētā LLNA (rLLNA), kura ļauj maksimāli par 40 % samazināt izmantoto dzīvnieku skaitu (16) (17) (18). rLLNA var izmantot, ja ir regulatīva vajadzība apstiprināt negatīvu ādas sensibilizācijas potenciāla prognozi un ar nosacījumu, ka tiek ievērotas visas pārējās šajā TM aprakstītās LLNA protokola specifikācijas. Negatīvai ādas sensibilizācijas potenciāla prognozei būtu jābalstās uz visu pieejamo informāciju, kā aprakstīts 4. punktā. Lai varētu piemērot rLLNA pieeju, vajadzīgs skaidrs pamatojums un zinātniski argumenti. Ja pretēji gaidītajam ar rLLNA tiek iegūts pozitīvs vai neskaidrs rezultāts, var būt jāturpina testēšana, lai interpretētu vai precizētu minēto rezultātu. rLLNA nebūtu izmantojama ādu sensibilizējošu testējamo vielu bīstamības noteikšanai gadījumos, kad jānovērtē reakcija uz devu, piemēram, nosakot apakškategorijas atbilstīgi Regulai (EK) Nr. 1272/2008 par vielu un maisījumu klasificēšanu, marķēšanu un iepakošanu un ANO Globāli harmonizētajai ķīmisko vielu klasifikācijas un marķēšanas sistēmai.
DEFINĪCIJAS
3. Definīcijas skatīt 2. papildinājumā.
SĀKOTNĒJIE APSVĒRUMI UN IEROBEŽOJUMI
4. LLNA ir viena no alternatīvām, kuras var izmantot ķīmisko vielu – potenciālu ādas sensibilizatoru noteikšanā. Tas nenozīmē, ka visos gadījumos LLNA būtu jālieto jūrascūciņu testa vietā (B.6; ESAO 406. testēšanas vadlīnijas) (13), bet gan to, ka šī noteikšana ir minētajam testam līdzvērtīga un to var izmantot kā alternatīvu, kuras pozitīvajam vai negatīvajam rezultātam vairs nav vajadzīgs papildu apstiprinājums. Pirms uzsākt pētījumus, testēšanas laboratorijai jāņem vērā visa par testējamo vielu pieejamā informācija. Pie šādas informācijas pieder tās identifikācija un ķīmiskā struktūra, fizikāli ķīmiskās īpašības, citu in vitro vai in vivo veikto toksicitātes testu rezultāti un toksikoloģiskie dati par struktūras ziņā saistītām vielām. Šī informācija jāizvērtē, lai noteiktu LLNA piemērotību konkrētajai vielai (ņemot vērā atsevišķu veidu vielu nesaderību ar LLNA; skatīt 5. punktu) un lai izraudzītos pareizu testējamās vielas devu.
5. LLNA ir in vivo metode un kā tāda paredz dzīvnieku izmantošanu alerģiskās kontakta sensibilizējošās aktivitātes novērtējumā. Tomēr šim mērķim vajadzīgo dzīvnieku skaits var būt mazāks nekā parasti. Turklāt LLNA piedāvā būtiski uzlabot veidu, kādā dzīvnieki tiek izmantoti alerģiskās kontakta sensibilizācijas testēšanā (mazāk sāpju un ciešanu). LLNA pamatojas uz to imunoloģisko gadījumu izskatīšanu, kurus ķīmiskās vielas stimulē sensibilizācijas indukcijas fāzē. Atšķirībā no testiem ar jūrascūciņām (B.6; ESAO 406. testēšanas vadlīnijas) (13) ar LLNA nav jānoskaidro provocētās–inducētās ādas hipersensibilizācijas reakcijas. Turklāt LLNA nav jāizmanto palīgviela, kā tas ir jūrascūciņu maksimizācijas testā (13). Tādā veidā LLNA mazina dzīvnieku sāpes un ciešanas. Neraugoties uz LLNA priekšrocībām salīdzinājumā ar B.6 un ESAO 406. testēšanas vadlīnijām, ir jāatzīst, ka ir daži ierobežojumi, kas var radīt nepieciešamību izmantot B.6 un ESAO 406. testēšanas vadlīnijas (13) (piemēram, ar LLNA noteikti šķietami negatīvi dažiem metāliem, šķietami pozitīvi dažiem ādas kairinātājiem [tādiem kā atsevišķas surfaktantu tipa ķīmiskās vielas] (19) (20), vai testējamās vielas šķīdība). Turklāt vajadzība pēc jūrascūciņu testiem (B.6 un ESAO 406. testēšanas vadlīnijas) (21) var saglabāties attiecībā uz ķīmisko vielu klasēm vai vielām, kuru sastāvā ir funkcionālās grupas, par kurām ir pierādīts, ka tās darbojas kā potenciāli sajaucējfaktori (13). Bez tam, pamatojoties uz ierobežoto validācijas datubāzi, kas sastāvēja pārsvarā no pesticīdu preparātiem, attiecībā uz šāda tipa testējamām vielām (22) drīzāk LLNA, nevis jūrascūciņu tests dos pozitīvu rezultātu. Tomēr, testējot preparātus, varētu līdztekus testēt arī salīdzināšanas vielas (līdzīgas vielas, kuru reakcija ir zināma), lai pierādītu, ka LLNA darbojas pienācīgi (skatīt 16. punktu). Izņemot šādus minētos ierobežojumus, LLNA jāvar izmantot jebkuras vielas testēšanai, ja vien testējamai vielai nav tādu īpašību, kas varētu ietekmēt LLNA precizitāti.
METODES PRINCIPS
6. LLNA pamatprincips ir tāds, ka sensibilizatori inducē limfocītu savairošanos limfmezglos, kuri drenē testējamās vielas saņemšanas vietu. Šī savairošanās ir proporcionāla devai un alergēna iedarbīgumam un ir vienkāršs paņēmiens, lai iegūtu kvantitatīvu sensitivitātes mērījumu. Savairošanās pakāpi nosaka, vidējo savairošanos katrā testējamās vielas grupā salīdzinot ar vidējo savairošanos kontroles grupā, kas saņēmusi tikai nesēju (VC). Nosaka attiecību starp vidējo progresiju grupās, kas saņēmušas pētāmo vielu, un progresiju VC grupā; tas ir stimulācijas indekss (SI). Lai testējamo vielu pamatoti klasificētu kā potenciālu ādas sensibilizatoru, SI vērtībai jābūt ≥ 3. Šeit aprakstīto procedūru pamatā ir in vivo veikta radioaktīvā iezīmēšana šūnu savairošanās izmērīšanai aurikulārajos limfmezglos. Tomēr šūnu savairošanās vērtēšanai var izmantot citus beigu punktus ar nosacījumu, ka pilnībā tiek ievēroti PS (1. papildinājums).
METODES APRAKSTS
Dzīvnieku sugas izvēle
7. Šim testam izvēlētā suga ir peles. Izmanto jaunas, pieaugušas CBA/Ca vai CBA/J līnijas sievišķā dzimuma peles, kas nav dzemdējušas un nav grūsnas. Pētījuma sākumā dzīvniekiem jābūt 8–12 nedēļu veciem, dzīvnieku masas atšķirībām jābūt minimālām un ne lielākām par 20 % no vidējās masas. Citas līnijas un vīrišķā dzimuma dzīvniekus var izmantot, ja ir iegūts pietiekami daudz datu, lai parādītu, ka LLNA atbildes reakcijā nav nozīmīgu atšķirību, kas specifiskas līnijai un/vai dzimumam.
Turēšanas un barošanas apstākļi
8. Ja nav zinātniska pamatojuma, kāpēc peles būtu turamas katra atsevišķi, peles izmitina grupā (23). Telpā, kurā tur izmēģinājumu dzīvniekus, jābūt 22 ± 3 °C temperatūrai. Lai gan, izņemot telpu uzkopšanas laiku, relatīvajam mitrumam jābūt vismaz 30 % un vēlams ne vairāk kā 70 %, tas jāuztur 50-60 % robežās. Apgaismojumam jābūt mākslīgam atbilstoši secībai 12 stundas gaišas, 12 stundas tumšas. Barošanai var izmantot parasto laboratorijas barību ar neierobežotu dzeramā ūdens daudzumu.
Dzīvnieku sagatavošana
9. Dzīvniekus izvēlas pēc nejaušības principa, marķē individuālai identificēšanai (bet nekādā veidā nemarķē ausis) un tur būros vismaz piecas dienas pirms testa sākuma, lai tos aklimatizētu laboratorijas apstākļos. Pirms apstrādes uzsākšanas visus dzīvniekus apskata, lai pārliecinātos, ka tiem nav novērojami ādas bojājumi.
Testa šķīdumu sagatavošana
10. Cietas ķīmiskās vielas pirms peļu ausu apstrādes izšķīdina vai suspendē, izmantojot šķīdinātājus vai nesējus, un vajadzības gadījumā atšķaida. Šķidras ķīmiskās vielas var izmantot gan atšķaidītas, gan neatšķaidītas. Nešķīstošas ķīmiskās vielas (kādas parasti izmanto medicīnas iekārtās) pirms peļu ausu apstrādes ekstrahē piemērotā šķīdinātājā, lai visas ekstrahējamās sastāvdaļas būtu pieejamas testēšanai. Ja dati par testējamo vielu stabilitāti liecina, ka tās uzglabāt nevar, katru dienu sagatavo svaigas testējamās vielas.
Ticamības pārbaude
11. Metodes veiktspējas pienācīgumu parāda ar pozitīvās kontroles vielu (PC) palīdzību, kas ar adekvātu un reproducējamu sensibilitāti reaģē kā sensibilizējošas testēšanas vielas, kuru reakcijas intensitāte ir sīki aprakstīta. Ieteicams paredzēt vienlaicīgu PC, jo tādā veidā var pierādīt laboratorijas spēju atkārtoti un sekmīgi īstenot noteikšanu, kā arī novērtēt iekšlaboratorijas un starplaboratoriju reproducējamību un rezultātu salīdzināmību. Pirms LLNA ieteicams lietotājiem konsultēties ar atbildīgajām iestādēm, jo dažas regulatīvās iestādes pieprasa PC izmantošanu katrā individuālā pētījumā. Attiecīgi labāk ir ikreiz izmantot vienlaicīgu PC, jo tas ļauj neveikt papildu testēšanu ar dzīvniekiem, lai izpildītu prasības, kuras var izrietēt no PC periodiskas izmantošanas (skatīt 12. punktu). PC jādod pozitīva LLNA atbildes reakcija tādā iedarbības līmenī, kurā ir sagaidāms stimulācijas indekss (SI) > 3, salīdzinot ar negatīvās kontroles vielu (NC) grupu. PC deva jāizvēlas tā, lai neizraisītu pārmērīgu ādas kairinājumu vai sistēmisku toksicitāti un lai indukcija būtu atkārtojama, taču ne pārmērīga (tā ir pārmērīga, piemēram, ja SI > 20). Ieteicamākās PC ir 25 % heksilkanēļskābes aldehīds (CAS Nr. 101-86-0) ar acetonu/olīveļļu (4:1 tilp./tilp.) un 5 % merkaptobenzotiazols (CAS No. 149-30-4) ar N,N-dimetilformamīdu (skatīt 1 papildinājuma 1. tabulu). Var būt apstākļi, kad ar pienācīgu pamatojumu var izmantot citas PC, kas atbilst iepriekš minētajiem kritērijiem.
12. Lai gan vienlaicīgas PC grupas izmantošana ir ieteicama, var būt situācijas, kad laboratorijās, kurās LLNA veic regulāri (t. i., vismaz reizi mēnesī) un kurās tāpēc ir vēsturiska PC datubāze, kas pierāda laboratorijas spēju ar PC iegūt reproducējamus un pareizus rezultātus, adekvātāka var izrādīties periodiska PC izmantošana (t. i., vismaz reizi 6 mēnešos). LLNA metodes adekvātu pārzināšanu var sekmīgi pierādīt, ar PC iegūstot konsekventus pozitīvus rezultātus vismaz 10 neatkarīgās testēšanas reizēs, kuras veiktas samērīgā laika periodā (t. i., ne ilgāk kā gada laikā).
13. Vienlaicīga PC grupa noteikti jāiekļauj, kad LLNA notiek procedurālas izmaiņas (piemēram, augsti kvalificēta personāla nomaiņa, testēšanas metodes materiālu un/vai reaģentu nomaiņa, cits izmēģinājumu dzīvnieku piegādātājs), un šādas izmaiņas pienācīgi jādokumentē laboratorijas pārskatos. Jānovērtē šādu izmaiņu ietekme uz iepriekš izveidotās vēsturiskās datubāzes adekvātumu un tas, vai vajag veidot jaunu vēsturisku datubāzi, lai dokumentētu ar PC iegūtu rezultātu konsekvenci.
14. Pētniekiem jāapzinās, ka lēmums par periodisku, nevis vienlaicīgu PC izmantošanu ietekmēs to, kādā mērā par adekvātiem un pieņemamiem varēs uzskatīt negatīvos pētījumu rezultātus, kas bez vienlaicīgas PC iegūti periodiskās PC izmantošanas starplaikos. Piemēram, ja ar periodisko PC pētījumu iegūst šķietami negatīvu rezultātu, var apšaubīt negatīvu testējamās vielas rezultātu, kas iegūts iepriekšējā pieņemamā periodiskā PC pētījuma un nepieņemamā periodiskā PC pētījuma starplaikā. Tāpēc rūpīgi jāizvērtē, vai izmantot vienlaicīgu vai periodisku PC. Tāpat jāizvērtē, kādas ir iespējas vienlaicīgās PC grupā izmantot mazāk dzīvnieku, ja to var zinātniski pamatot un ja laboratorija ar saviem specifiskajiem vēsturiskajiem datiem var pierādīt, ka ir iespējams izmantot mazāk peļu (12).
15. Kaut arī PC jātestē nesējā, par kuru ir zināms, ka tas izrāda viendabīgu atbildes reakciju (piemēram, acetons/olīveļļa; 4:1 tilp./tilp.), var būt dažas reglamentējošas situācijas, kurās būs nepieciešama arī testēšana nestandarta nesējā (klīniski/ķīmiski piederīgs sastāvs) (24). Ja vienlaicīgo PC testē ar citu nesēju nekā testējamo vielu, vienlaicīgās PC vajadzībām jāparedz atsevišķs VC.
16. Ja vērtē testējamās vielas, kas pieder konkrētai ķīmisko vielu klasei vai kas dod noteikta diapazona reakciju, var izmantot salīdzināšanas vielas, kuras noder, lai parādītu, ka testēšanas metode darbojas un pienācīgi nosaka šā tipa testējamām vielām piemītošo ādas sensibilizācijas potenciālu. Pienācīgām salīdzināšanas vielām ir jāpiemīt šādām īpašībām:
— strukturāla un funkcionāla līdzība ar testējamās vielas klases vielām;
— labi zināmas fizikālās un ķīmiskās īpašības;
— papildinoši dati no LLNA;
— papildinoši dati saistībā ar citiem dzīvniekiem un/vai cilvēku.
TESTA PROCEDŪRA
Dzīvnieku skaits un devu līmeņi
17. Uz devas grupu ar vismaz trim testējamās vielas koncentrācijām izmanto vismaz četrus dzīvniekus un vienlaicīgas NC grupu, kas saņem tikai testējamās vielas nesēju, un PC grupu (vienlaicīgu vai nesenu atkarībā no laboratorijas prakses un saistībā ar 11.–15. punktu). Jāapsver iespēja testēt vairākas PC devas, īpaši tad, ja PC testēšana ir periodiska. Izņemot apstrādi ar testējamo vielu, ar kontroles grupu dzīvniekiem rīkojas tieši tāpat kā ar apstrādāto grupu dzīvniekiem.
18. Devu un nesēja izvēlei jāpamatojas uz atsaucē (3) un (5) sniegtajiem ieteikumiem. Secīgas devas parasti izraugās no atbilstošas koncentrāciju rindas, kā 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 %, u. c. Koncentrāciju rindas izvēlei jābūt ar adekvātu zinātnisku pamatojumu. Jāizvērtē visa esošā toksikoloģiskā (piemēram, akūta toksicitāte un dermālais kairinājums) un struktūras un fizikālķīmiskā informācija par attiecīgo testējamo vielu (un/vai par struktūras ziņā saistītām vielām), ja tāda ir, un trīs secīgās koncentrācijas jāizraugās tā, lai augstākā no tām izraisītu stiprāko iedarbību, kura vēl nerada sistēmisku toksicitāti un/vai pārmērīgu lokālu ādas kairinājumu (3) (25). Ja šādas informācijas nav, sākumā var būt jāveic priekšskrīninga tests (skatīt 21.–24. punktu).
19. Nesējs nedrīkst pārmainīt vai maskēt testēšanas rezultātus, un tas jāizraugās tāds, lai šķīdība būtu iespējami lielāka, tā ļaujot iegūt augstāko reāli sasniedzamo koncentrāciju un iegūstot šķīdumu/suspensiju, kas būtu derīga testējamās vielas pielietošanai. Ieteicamie nesēji ir acetons/olīveļļa (4:1 tilp./tilp.), N,N-dimetilformamīds, metiletilketons, propilēnglikols un dimetilsulfoksīds (19), bet var izmantot arī citus, ja tam ir pietiekams zinātniskais pamatojums. Dažos gadījumos papildu kontrolei jāizmanto klīniski atbilstošs šķīdinātājs vai tirdzniecības preparāts, kura sastāvā testējamo vielu tirgo. Īpaši jārūpējas, lai nodrošinātu to, ka hidrofīlas testējamās vielas ir iekļautas nesēja sistēmā, kas mitrina ādu un tūlīt nenotek, un jāizmanto pienācīgi šķīdinātāji (piemēram, 1 % Pluronic® L92). Tādēļ ir jāizvairās no nesējiem, kas satur vienīgi ūdeni.
20. Izpētot no individuālām pelēm iegūtus limfmezglus, var novērtēt dzīvnieku savstarpējās atšķirības un iegūt testējamās vielas grupas un VC grupas mērījumu statistisku salīdzinājumu (skatīt 35. punktu). Turklāt PC grupas peļu skaita iespējamā samazinājuma izvērtējumam jēga ir tad, ja dati ir par individuāliem dzīvniekiem (12). Dažas regulatīvās iestādes prasa, lai dati būtu par individuāliem dzīvniekiem. Citas turpretim par pieņemamiem var uzskatīt arī datus par apstrādes dzīvnieku grupām, un šādā situācijā lietotājiem ir izvēle starp individuālu un grupas datu vākšanu.
Priekšskrīninga tests
21. Ja nav informācijas, lai noteiktu augstāko testējamo devu (skatīt 18. punktu), jāveic priekšskrīninga tests, lai definētu ar LLNA testējamo atbilstošo devas līmeni. Priekšskrīninga testa mērķis ir būt par orientieri ar LLNA testējamā maksimālā devas līmeņa izvēlē, ja nav informācijas par koncentrāciju, kādā testējamā viela izraisa sistēmisku toksicitāti (skatīt 24. punktu) un/vai pārmērīgu lokālu ādas kairinājumu (skatīt 23. punktu). Maksimālajam testējamās vielas devas līmenim vajadzētu būt 100 % (šķidrumiem) un augstākajai iespējamajai koncentrācijai (cietām vielām un suspensijām).
22. Priekšskrīninga testa apstākļi ir identiski pamata LLNA apstākļiem, izņemot to, ka nevērtē progresiju limfmezglos un ka devas grupā var izmantot mazāku skaitu dzīvnieku. Ieteicamais skaits ir viens vai divi dzīvnieki katrā devas grupā. Visām pelēm ik dienas pārbauda to, vai apstrādes vietā nav klīnisku pazīmju, kas liecinātu par sistēmisku toksicitāti vai lokālu kairinājumu. Pirms testa un tā beigās (6. diena) reģistrē dzīvnieku ķermeņa masu. Katrai peles apskata abas ausis, un iespējamo apsārtumu novērtē pēc 1. tabulas punktu skalas (25). Auss biezumu mēra ar piemērotu mērierīci (piemēram, digitālo mikrometru vai “Peacock” tipa biezuma mērierīci) 1. dienā (pirms devas), 3. dienā (aptuveni 48 stundas pēc pirmās devas) un 6. dienā. Turklāt 6. dienā auss biezumu var mērīt ar auss caursišanas paņēmienu pēc tam, kad dzīvnieki ir humāni nonāvēti. Lokālu ādas kairinājumu uzskata par pārmērīgu tad, ja jebkurā mērījumu dienā apsārtuma novērtējums pēc punktu skalas ir ≥ 3 un/vai auss biezums ir palielinājies par ≥ 25 % (26) (27). Lielākā deva, kas izmantojama LLNA pamata testā, ir otrā zemākā deva priekšskrīninga koncentrāciju rindā (skatīt 18. punktu), kas neizraisa sistēmisku toksicitāti un/vai pārmērīgu lokālu ādas kairinājumu.
1. tabula
Apsārtuma (eritēmas) skala
|
Pazīmes |
Punktu skaits |
|
Apsārtuma nav |
0 |
|
Vāji izteikts (gandrīz nemanāms) apsārtums |
1 |
|
Izteikts apsārtums |
2 |
|
Vidēji stiprs un ļoti stiprs apsārtums |
3 |
|
Ļoti stiprs apsārtums (biešu sarkans) un kreveles, kas apsārtuma novērtēšanu padara neiespējamu |
4 |
23. Papildus auss biezuma 25 % pieaugumam (26) (27) kairinātāju identificēšanai LLNA izmanto arī statistiski nozīmīgus auss biezuma pieauguma rādītājus apstrādātajām pelēm salīdzinājumā ar kontroles grupas pelēm (28) (29) (30) (31) (32) (33) (34). Tomēr, lai gan statistiski nozīmīgs pieaugums var arī nesasniegt 25 % robežu, šādu pieaugumu neuzskata par pārmērīga kairinājuma izpausmi (30) (32) (33) (34).
24. Turpmāk uzskaitītie klīniskie novērojumi, ja tie ir novērtējuma neatņemama daļa, var liecināt par sistēmisku toksicitāti (35) (36), un tāpēc var parādīt, kāds būs LLNA pamata testā izmantojamais maksimālais devas līmenis: nervu sistēmas darbības traucējumi (piemēram, piloarekcija, ataksija, drebuļi un krampji); uzvedības traucējumi (piemēram, agresivitāte, ar personīgo higiēnu saistītās uzvedības maiņa, jūtams aktivitātes samazinājums vai pieaugums); neraksturīga elpošana (piemēram, elpas vilcienu biežuma un intensitātes maiņa, kā apgrūtināta vai spazmatiska elpošana, trokšņi plaušās) un pārmaiņas barības un ūdens uzņemšanā. Turklāt novērtējumā jāņem vērā letarģijas pazīmes un/vai reakcijas samazināšanās un visas klīniskās pazīmes, kas liecina par vairāk nekā mirklīgām sāpēm un ciešanām, vai ķermeņa masas samazinājums par vairāk nekā 5 % laikā no 1. dienas līdz 6. dienai, kā arī mirstības rādītāji. Mirstoši dzīvnieki vai dzīvnieki, kuriem acīmredzami sāp vai kuri smagi un ilgstoši cieš, ir humāni jānonāvē (37).
Eksperimenta grafiks pamata pētījuma laikā
25. Eksperimenta grafiks ir šāds:
|
— |
1. diena : Individuāli nosaka un reģistrē katra dzīvnieka masu, izdara un reģistrē klīniskos novērojumus. Katras auss aizmugures virsmu apstrādā ar 25 μl atšķaidījuma, kurš satur attiecīgo testējamo vielu, tikai nesēju vai PC (vienlaicīgu vai nesenu atkarībā no laboratorijas prakses un saistībā ar 11.–15. punktu). |
|
— |
2. un 3. diena : Atkārto 1. dienā veikto apstrādi. |
|
— |
4. un 5. diena : Apstrāde nenotiek. |
|
— |
6. diena : Reģistrē katra dzīvnieka masu. Visām testa un kontroles pelēm astes vēnā injicē 250 μl sterila fosfāta bufera fizioloģiskā šķīduma (PBS), kas satur 20 μCi (7,4 × 105 Bq) tritiāta (3H)-metiltimidīna. Alternatīvi visām pelēm astes vēnā injicē 250 μl sterila PBS, kas satur 2 μCi (7.4 × 104 Bq) 125I–joddeoksiuridīna un 10–5Μ fluordeoksiuridīna. Pēc piecām stundām (5 h) visus dzīvniekus humāni nonāvē. Pelēm izgriež aurikulāros limfmezglus un ievieto PBS katram dzīvniekam atsevišķi (individuālo dzīvnieku pieeja); alternatīvi izgriež visus aurikulāros limfmezglus un ievieto PBS katrai eksperimenta grupai kopā (apstrādes grupas pieeja). Sīkus datus un diagrammas par limfmezglu identificēšanu un izgriešanu skatīt atsaucēs (12). Eksperimenta protokolā var iekļaut papildu parametrus, kas raksturo turpmāku ādas lokālo reakciju pamata pētījuma laikā, piemēram, auss apsārtuma novērtējumu pēc punktu skalas vai auss biezuma mērījumus (nosaka ar mērierīci vai ar auss caursišanas paņēmienu autopsijā). |
Šūnu suspensiju sagatavošana
26. No abās pusēs izgrieztām limfmezglu šūnām (LNC) iegūtu atsevišķu šūnu suspensiju no atsevišķiem dzīvniekiem vai no apstrādes grupas pagatavo, šūnas saudzīgi mehāniski sadalot caur nerūsējošā tērauda sietu ar 200 μm acu izmēru vai izmantojot citu paņēmienu, kas ir derīgs atsevišķu šūnu suspensiju ieguvei. LNC divreiz mazgā lielā daudzumā PBS, un DNS izgulsnē ar 5 % trihloretiķskābi (TCA) 4 °C temperatūrā 18 stundu laikā (3). Plāksnītes vai nu vēlreiz suspendē 1 ml TCA un pārnes scintilācijas stobriņos, kas satur 10 ml 3H skaitīšanas scintilācijas šķidruma, vai tieši pārnes gamma skaitīšanas caurulītēs 125I skaitīšanai.
Šūnu savairošanās noteikšana (inkorporētā radioaktivitāte)
27. 3H-metiltimidīna inkorporēšanos mēra ar β-scintilāciju skaitīšanu kā sadalīšanās skaitu minūtē (DPM). 125I-joddeoksiuridīna inkorporēšanos mēra ar 125I skaitīšanu un arī izsaka kā DPM. Atkarībā no izmantotās pieejas inkorporēšanos izsaka kā DPM katrai pelei (individuālā pieeja) vai DPM apstrādes grupai (apstrādes grupas pieeja).
Reducētā LLNA
28. Atsevišķos gadījumos, ja ir regulatīva vajadzība apstiprināt negatīvu ādas sensibilizācijas potenciāla prognozi un ar nosacījumu, ka tiek ievērotas visas pārējās šajā TM aprakstītās LLNA protokola specifikācijas, var izmantot fakultatīvu, rLLNA protokolu (16) (17) (18), kuram vajadzīgs mazāk izmēģinājuma dzīvnieku. Lai varētu piemērot rLLNA pieeju, vajadzīgs skaidrs pamatojums un zinātniski argumenti. Ja iegūtais rezultāts ir pozitīvs vai neskaidrs, var būt jāturpina testēšana, lai interpretētu vai precizētu minēto rezultātu.
29. Devas grupu skaita samazinājums ir vienīgā atšķirība starp LLNA un rLLNA testēšanas metožu protokoliem, un tāpēc ar rLLNA neiegūst datus par devas un atbildes reakcijas mijiedarbību. Tātad rLLNA neizmanto gadījumos, kad minētā informācija ir vajadzīga. Tāpat kā daudzdevu LLNA gadījumā, testējamās vielas koncentrācijai, kuru vērtē ar rLLNA, jābūt augstākajai koncentrācijai, kura vēl nerada acīmredzamu sistēmisku toksicitāti un/vai pārmērīgu lokālu ādas kairinājumu pelēm (skatīt 18. punktu).
NOVĒROJUMI
Klīniskie novērojumi
30. Ikviena pele vismaz reizi dienā ir rūpīgi jānovēro attiecībā uz vietēju kairinājumu apstrādes vietā vai sistēmiskas toksicitātes klīniskajām pazīmēm. Visus novērojumus sistemātiski reģistrē, par katru peli izdarot individuālu ierakstu. Novērošanas plānā jāiekļauj kritēriji, kas ļauj tūlīt identificēt peles, kurām ir sistēmiskas toksicitātes, pārmērīga lokāla ādas kairinājuma vai ādas korozijas pazīmes, lai tām veiktu eitanāziju (37).
Ķermeņa masa
31. Kā norādīts 25. punktā, individuālu dzīvnieku ķermeņa masa ir jānosaka testa sākumā un pirms plānotās humānās nonāvēšanas.
REZULTĀTU APRĒĶINĀŠANA
32. Katras apstrādes grupas rezultātu izsaka ar SI. Ja izmanto individuālo pieeju, SI iegūst, DPM vidējo lielumu katrai pelei katrā testējamās vielas grupā un PC grupā dalot ar DPM vidējo lielumu katrai pelei šķīdinātāja/VC grupā. Tā VC grupās vidējais SI ir 1. Ja izmanto apstrādes grupas pieeju, SI iegūst, dalot katras apstrādes grupas apvienoto radioaktīvo inkorporāciju ar apvienotās VC grupas inkorporāciju; rezultāts ir vidējais SI.
33. Lēmumu pieņemšanas procesā rezultātu uzskata par pozitīvu, ja SI ≥ 3. Tomēr, nosakot, vai neitrālam tuvu rezultātu varētu uzskatīt par pozitīvu, var ņemt vērā arī devas un atbildes reakcijas stiprumu un šķīdinātāja/nesēja un PC reakcijas statistisko nozīmīgumu un konsekvenci (4) (5) (6).
34. Ja nepieciešams paskaidrot iegūtos rezultātus, jāņem vērā testējamās vielas dažādās īpašības, tostarp tas, vai tā strukturāli līdzinās jau zināmiem ādas sensibilizatoriem, vai tā izraisa pārmērīgu lokālu ādas kairinājumu pelēm un kāda veida atbildes reakcija uz devu ir novērota. Šie un citi apsvērumi sīkāk iztirzāti citur (7).
35. Radioaktivitātes datu vākšana par individuālām pelēm pavērs iespējas statistiskai analīzei par devas un atbildes reakcijas mijiedarbības esību un tās pakāpi šajos datos. Jebkurš statistisks novērtējums var ietvert devas un atbildes reakcijas mijiedarbības novērtējumu, kā arī pienācīgi koriģētus testējamo grupu salīdzinājumus (piemēram, devu pāri grupā un šīs grupas salīdzinājums ar vienlaicīgu VC grupu). Statistiskā analīze var ietvert, piemēram, lineāro regresiju jeb Viljama [William’s] testu, ar ko analizē devas un atbildes reakcijas mijiedarbību tendences, un Daneta [Dunnett] testu, lai salīdzinātu devu pārus. Izvēloties attiecīgu statistiskās analīzes metodi, pētniekam jāapzinās iespējamās mainīgo lielumu nevienādības un citas ar to saistītās problēmas, kuru dēļ var būt nepieciešama datu pārveidošana vai neparametriskā statistiskā analīze. Visādā ziņā iespējams, ka pētniekam SI būs jāaprēķina un statistiskā analīze jāveic gan ar, gan bez dažiem punktveida datiem (respektīvi, neņemot vērā galējības jeb rupjas kļūdas).
DATI UN TESTĒŠANAS PĀRSKATS
Dati
36. Dati jāapkopo tabulā. Individuālu dzīvnieku apstrādes gadījumā jānorāda indivīdu DPM vērtības, grupas vidējā DPM vērtība uz dzīvnieku, attiecīgais kļūdas apzīmējums (piem., SD, SEM) un vidējais SI katrai devas grupai salīdzinājumā ar kontroles VC grupu. Dzīvnieku grupas apstrādes gadījumā jānorāda vidējais DPM un vidējais SI katrai devas grupai salīdzinājumā ar kontroles VC grupu.
Testēšanas pārskats
37. Testēšanas pārskatā jābūt iekļautai šādai informācijai:
Testējamā viela un kontroles vielas:
— identifikācijas dati (piemēram, CAS un EK numurs (ja ir); avots; tīrība; zināmie piemaisījumi; partijas numurs),
— fizikālās un fizikāli ķīmiskās īpašības (piemēram, gaistamība, stabilitāte, šķīdība),
— maisījuma gadījumā: sastāvs un sastāvdaļu relatīvais procentuālais daudzums.
Šķīdinātājs/nesējs:
— identifikācijas dati (tīrība; koncentrācija (attiecīgā gadījumā); izmantotais tilpums),
— nesēja izvēles pamatojums.
Izmēģinājumu dzīvnieki:
— CBA peļu avots,
— dzīvnieku mikrobioloģiskais statuss, ja tas zināms,
— dzīvnieku skaits un vecums,
— dzīvnieku avots, turēšanas un barošanas apstākļi utt.
Testēšanas apstākļi:
— sīkas ziņas par testējamās vielas sagatavošanu un pielietošanu,
— devu izvēles pamatojums, attiecīgā gadījumā iekļaujot priekšskrīninga testa rezultātus,
— izmantotās nesēja un testējamās vielas koncentrācijas un pielietotās testējamās vielas kopējais daudzums,
— sīkas ziņas par barības un ūdens kvalitāti (iekļaujot barības veidu/izcelsmi, ūdens izcelsmi),
— sīks apstrādes un paraugu ņemšanas shēmas apraksts,
— toksicitātes novērtēšanas metodes,
— kritēriji, pēc kuriem testa rezultātu klasificē kā pozitīvu vai negatīvu,
— sīkas ziņas par novirzēm no protokola un paskaidrojums par to, kādā veidā šī novirze ietekmē pētījuma plānu un rezultātus.
Ticamības pārbaude:
— jaunākās ticamības pārbaudes rezultātu kopsavilkums, iekļaujot informāciju par testējamo vielu, tās koncentrāciju un nesēju,
— vienlaicīgas un/vai vēsturiskas PC un vienlaicīgas NC dati no testēšanas laboratorijas,
— ja vienlaicīga PC nav paredzēta: datums un laboratorijas pārskats par nesenāko kārtējo PC un pārskats par agrāko PC datiem konkrētajā laboratorijā, kuri pamato vienlaicīgas PC neveikšanu.
Rezultāti:
— individuālu peļu masa dozēšanas sākumā un veicot plānoto nonāvēšanu; vidējās vērtības un attiecīgais kļūdas apzīmējums (piem., SD, SEM) katrai apstrādes grupai,
— toksicitātes parādīšanās gaita un pazīmes, iekļaujot ādas kairinājumu ievadīšanas vietā, ja tāds ir, katram dzīvniekam,
— tabulā apkopoti dati par individuālu peļu (individuālu dzīvnieku pieeja) vai vidējām (apstrādes grupu pieeja) DPM vērtībām un SI vērtībām katrai apstrādes grupai,
— vidējās vērtības un attiecīgais kļūdas apzīmējums (piem., SD, SEM) par DPM katrai pelei katrā apstrādes grupā un galējību jeb rupju kļūdu analīze katrā apstrādes grupā, ja izmanto individuālu dzīvnieku pieeju,
— aprēķinātais SI un attiecīgs mainības mērs, kas ņem vērā to, ka ne testējamās vielas grupā, ne kontroles grupā dzīvnieki nav identiski (ja izmanto individuālu dzīvnieku pieeju),
— devas un atbildes reakcijas sakarības,
— attiecīgā gadījumā, statistiskā analīze.
Rezultātu izvērtējums:
— īss komentārs par rezultātiem, atbildes reakcijas uz devu analīzi un, attiecīgā gadījumā, statistisko analīzi ar secinājumu, vai testējamā viela jāuzskata par ādas sensibilizatoru.
IZMANTOTĀ LITERATŪRA
1) OECD (2002), Skin Sensitisation: Local Lymph Node Assay. OECD Guideline for the Testing of Chemicals No 429, Paris. Available at: [http://www.oecd.org/env/testguidelines]
2) Kimber, I. and Basketter, D.A. (1992), The murine local lymph node assay; collaborative studies and new directions: A commentary, Food Chem. Toxicol., 30, 165-169.
3) Kimber, I., Dearman, R.J., Scholes, E.W. and Basketter, D.A. (1994), The local lymph node assay: developments and applications, Toxicol., 93, 13-31.
4) Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E. and Hastings, K.L. (1998), Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise, J. Toxicol. Environ. Health, 53, 563-79.
5) Chamberlain, M. and Basketter, D.A. (1996), The local lymph node assay: status of validation, Food Chem. Toxicol., 34, 999-1002.
6) Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E. (1996), The local lymph node assay: A viable alternative to currently accepted skin sensitisation tests, Food Chem. Toxicol., 34, 985-997.
7) Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998), Strategies for identifying false positive responses in predictive sensitisation tests, Food Chem. Toxicol., 36, 327-33.
8) Van Och, F.M.M., Slob, W., De Jong, W.H., Vandebriel, R.J. and Van Loveren, H. (2000), A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employment of a regression method that includes determination of uncertainty margins, Toxicol., 146, 49-59.
9) Dean, J.H., Twerdok, L.E., Tice, R.R., Sailstad, D.M., Hattan, D.G., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: II. Conclusions and recommendations of an independent scientific peer review panel, Reg. Toxicol. Pharmacol, 34: 258-273.
10) Haneke, K.E., Tice, R.R., Carson, B.L., Margolin, B.H., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: III. Data analyses completed by the national toxicology program interagency center for the evaluation of alternative toxicological methods, Reg. Toxicol. Pharmacol, 34, 274-286.
11) Sailstad, D.M., Hattan, D., Hill, R.N., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: I. The ICCVAM review process, Reg. Toxicol. Pharmacol, 34: 249-257.
12) ICCVAM (2009), Recommended Performance Standards: Murine Local Lymph Node Assay, NIH Publication Number 09-7357, Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna-ps/LLNAPerfStds.pdf]
13) OECD (1992), Skin Sensitisation. OECD Guideline for Testing of Chemicals No 406, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
14) OECD (2005), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, Environment, Health and Safety Monograph, Series on Testing and Assessment No. 34, ENV/JM/MONO(2005)14, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
15) Dearman, R.J., Hilton, J., Evans, P., Harvey, P., Basketter, D.A. and Kimber, I. (1998), Temporal stability of local lymph node assay responses to hexyl cinnamic aldehyde, J. Appl. Toxicol., 18, 281-284.
16) Kimber, I., Dearman, R.J., Betts, C.J., Gerberick, G.F., Ryan, C.A., Kern, P.S., Patlewicz, G.Y. and Basketter, D.A. (2006), The local lymph node assay and skin sensitisation: a cut-down screen to reduce animal requirements? Contact Dermatitis, 54, 181-185.
17) ESAC (2007), Statement on the Reduced Local Lymph Node Assay (rLLNA), European Commission Directorate General, Joint Research Centre, Institute for Health and Consumer Protection, European Centre for the Validation of Alternative Methods, April 2007. Available at: [http://ecvam.jrc.it/ft_doc/ESAC26_statement_rLLNA_20070525-1.pdf]
18) ICCVAM (2009), The Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) Test Method Evaluation Report. The Reduced Murine Local Lymph Node Assay: An Alternative Test Method Using Fewer Animals to Assess the Allergic Contact Dermatitis Potential of Chemicals and Products, NIH Publication Number 09-6439, Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/]
19) ICCVAM (1999), The Murine Local Lymph Node Assay: A Test Method for Assessing the Allergic Contact Dermatitis Potential of Chemicals/Compounds, The Results of an Independent Peer Review Evaluation Coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM), NIH Publication No. 99-4494, Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna/llnarep.pdf]
20) Kreiling, R., Hollnagel, H.M., Hareng, L., Eigler, L., Lee, M.S., Griem, P., Dreessen, B., Kleber, M., Albrecht, A., Garcia, C. and Wendel, A. (2008), Comparison of the skin sensitising potential of unsaturated compounds as assessed by the murine local lymph node assay (LLNA) and the guinea pig maximization test (GPMT), Food Chem. Toxicol., 46, 1896-1904.
21) Basketter, D., Ball, N., Cagen, S., Carrilo, J.C., Certa, H., Eigler, D., Garcia, C., Esch, H., Graham, C., Haux, C., Kreiling, R. and Mehling, A. (2009), Application of a weight of evidence approach to assessing discordant sensitisation datasets: implications for REACH, Reg. Toxicol. Pharmacol., 55, 90-96.
22) ICCVAM (2009), ICCVAM Test Method Evaluation Report. Assessment of the Validity of the LLNA for Testing Pesticide Formulations and Other Products, Metals, and Substances in Aqueous Solutions, NIH Publication Number 10-7512, Research Triangle Park, NC: National Institute of Environmental Health Sciences, Available at: [http://iccvam.niehs.nih.gov/]
23) ILAR (1996), Institute of Laboratory Animal Research (ILAR) Guide for the Care and Use of Laboratory Animals, 7th ed. Washington, DC: National Academies Press.
24) McGarry, H.F. (2007), The murine local lymph node assay: regulatory and potency considerations under REACH, Toxicol., 238, 71-89.
25) OECD (2002), Acute Dermal Irritation/Corrosion. OECD Guideline for Testing of Chemicals No. 404, Paris, France. Available at: http://www.oecd.org/document/40/0,3343,en_2649_34377_37051368_1_1_1_1,00.html]
26) Reeder, M.K., Broomhead, Y.L., DiDonato, L. and DeGeorge, G.L. (2007), Use of an enhanced local lymph node assay to correctly classify irritants and false positive substances, Toxicologist, 96, 235.
27) ICCVAM (2009), Non-radioactive Murine Local Lymph Node Assay: Flow Cytometry Test Method Protocol (LLNA: BrdU-FC) Revised Draft Background Review Document, Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/methods/immunotox/fcLLNA/BRDcomplete.pdf]
28) Hayes, B.B., Gerber, P.C., Griffey, S.S. and Meade, B.J. (1998), Contact hypersensitivity to dicyclohexylcarbodiimide and diisopropylcarbodiimide in female B6C3F1 mice, Drug. Chem. Toxicol., 21, 195-206.
29) Homey, B., von Schilling, C., Blumel, J., Schuppe, H.C., Ruzicka, T., Ahr, H.J., Lehmann, P. and Vohr, V.W. (1998), An integrated model for the differentiation of chemical-induced allergic and irritant skin reactions, Toxicol. Appl. Pharmacol., 153, 83-94.
30) Woolhiser, M.R., Hayes, B.B. and Meade, B.J. (1998), A combined murine local lymph node and irritancy assay to predict sensitisation and irritancy potential of chemicals, Toxicol. Meth., 8, 245-256.
31) Hayes, B.B. and Meade, B.J. (1999), Contact sensitivity to selected acrylate compounds in B6C3F1 mice: relative potency, cross reactivity, and comparison of test methods, Drug. Chem. Toxicol., 22, 491-506.
32) Ehling, G., Hecht, M., Heusener, A., Huesler, J., Gamer, A.O., van Loveren, H., Maurer, T., Riecke, K., Ullmann, L., Ulrich, P., Vandebriel, R. and Vohr, H.W. (2005), A European inter-laboratory validation of alternative endpoints of the murine local lymph node assay: first round. Toxicol., 212, 60-68.
33) Vohr, H.W. and Ahr, H.J. (2005), The local lymph node assay being too sensitive? Arch. Toxicol., 79, 721-728.
34) Patterson, R.M., Noga, E. and Germolec, D. (2007), Lack of evidence for contact sensitisation by Pfiesteria extract, Environ. Health Perspect., 115, 1023-1028.
35) OECD (1987), Acute Dermal Toxicity, OECD Guideline for Testing of Chemicals No 402, Paris, France. Available at: [http://www.oecd.org/env/testguidelines]
36) ICCVAM (2009), Report on the ICCVAM-NICEATM/ECVAM/JaCVAM Scientific Workshop on Acute Chemical Safety Testing: Advancing In Vitro Approaches and Humane Endpoints for Systemic Toxicity Evaluations. Research Triangle Park, NC: National Institute of Environmental Health Sciences, Available at: http://iccvam.niehs.nih.gov/methods/acutetox/Tox_workshop.htm]
37) OECD (2000), Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation, Environmental Health and Safety Monograph, Series on Testing and Assessment No. 19, ENV/JM/MONO(2000)7, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
1. papildinājums
Veiktspējas standarti, pēc kuriem vērtējamas ierosinātās līdzīgās vai modificētās metodes ādas sensibilizācijas testēšanai ar LLNA
IEVADS
1. Veiktspējas standartu (PS) izstrādes mērķis ir izveidot pamatu, kuram pielīdzināt jaunas testēšanas metodes – gan aizsargātas (t. i., ar autortiesībām, tirdzniecības zīmēm, reģistrāciju), gan neaizsargātas –, lai noteiktu, vai konkrētajām testēšanas vajadzībām tās ir pietiekami pareizas un ticamas. Šos PS, kuru pamatā ir validētas un pieņemtas testēšanas metodes, var izmantot, lai izvērtētu, cik ticamas un pareizas ir citas, līdzīgas metodes (ikdienā dēvētas par me-too jeb atdarinājuma testiem), kuru pamatā ir līdzīgi zinātniski principi un ar kurām mēra vai prognozē tā paša veida bioloģisko vai toksisko iedarbību (14).
2. Pirms pieņemt modificētas metodes (t. i., ierosinātos potenciālos uzlabojumus jau apstiprinātā testēšanas metodē), jāveic novērtējums, kurā jānosaka ierosināto izmaiņu ietekme uz testa veiktspēju un pakāpe, kādā šīs izmaiņas ietekmē informāciju, kas pieejama par citiem validēšanas procesa komponentiem. Atkarībā no ierosināto izmaiņu daudzuma un rakstura, datiem, ko tās ģenerē, un papildu dokumentācijas šīs metodes vai nu jāvalidē tādā procesā, kāds paredzēts jaunām testēšanas metodēm, vai (ja tas ir pamatoti) ierobežotā apjomā, izmantojot esošos PS, jānovērtē to ticamība un piemērotība (14).
3. Izmantojot ķīmiskās vielas, kas aptver visu ādas reakcijas klasifikācijas LLNA skalu, jānosaka ticamība un precizitāte visām līdzīgajām vai modificētajām metodēm, kuras izmanto saskaņā ar šo TM. Lai novērstu dzīvnieku neattaisnotu izmantošanu, modeļu izstrādātājiem, pirms uzsākt validācijas pētījumus saskaņā ar šajā TM sniegtajiem PS un testēšanas vadlīnijām, stingri ieteicams konsultēties ar attiecīgajām iestādēm.
4. Attiecībā uz līdzīgu vai modificētu LLNA versiju validitātes novērtēšanu šo PS pamatā ir ASV US-ICCVAM, Eiropas EC-ECVAM un Japānas JaCVAM harmonizētie PS (12). PS veidojošie elementi ir būtiskie testēšanas metodes komponenti, ieteicamās references vielas un pareizības un ticamības standarti, kas ierosinātajai metodei jāsasniedz vai jāpārsniedz.
I. Testēšanas metodes būtiskie komponenti
5. Lai nodrošinātu to, ka LLNA līdzīgā vai modificētā metode funkcionalitātes ziņā vai pēc noteikšanas mehānisma ir analoga LLNA un mēra to pašu bioloģisko iedarbību, testēšanas metodes protokolā jāiekļauj šādi komponenti:
— testējamā ķīmiskā viela topikāli jāaplicē uz abām peles ausīm,
— limfocītu savairošanās jāmēra limfmezglos, kuri drenē testējamās ķīmiskās vielas aplicēšanas vietu,
— limfocītu savairošanās jāmēra ādas sensibilizācijas indukcijas fāzē,
— testējamām vielām: lielākajai izraudzītajai devai jāatbilst augstākajai koncentrācijai, kura vēl nerada acīmredzamu sistēmisku toksicitāti un/vai pārmērīgu lokālu ādas kairinājumu pelēm; pozitīvām references vielām: lielākajai devai jābūt vismaz tikpat lielai kā LLNA EC3 vērtībām atbilstošajām references vielām (skatīt 1. tabulu), vēl neradot sistēmisku toksicitāti un/vai pārmērīgu lokālu ādas kairinājumu pelēm,
— katrā pētījumā jāparedz kontroles VC grupa un, attiecīgā gadījumā, arī vienlaicīga PC grupa,
— jāizmanto vismaz četri dzīvnieki katrā devas grupā,
— drīkst vākt datus tiklab par individuāliem dzīvniekiem kā par dzīvnieku grupām.
Ja minētie kritēriji nav pilnībā izpildīti, šos PS nevar izmantot līdzīgas vai modificētas metodes validēšanai.
II. References vielu obligātais minimums
6. ASV US-ICCVAM, Eiropas EC-ECVAM un Japānas JaCVAM harmonizētajos PS (12) identificētas 18 obligāti izmantojamas references vielas un 4 fakultatīvas references vielas (t. i., vielas, kas LLNA uzrāda šķietami pozitīvu vai šķietami negatīvu rezultātu salīdzinājumā ar cilvēka un jūrascūciņu materiāla testēšanas rezultātiem (B.6; ESAO 406. testēšanas vadlīnijas) (13) un tāpēc dod iespēju demonstrēt LLNA līdzvērtīgu vai par to labāku veiktspēju), un tās visas ir iekļautas LLNA PS. Minēto ķīmisko vielu identificēšanai izmantotie atlases kritēriji ir šādi:
— sarakstā iekļautās references vielas pārstāv tādu veidu vielas, kurām parasti testē ādas sensibilizācijas potenciālu, un reakciju diapazonu, ko ir iespējams izmērīt vai prognozēt ar LLNA,
— tās ir ar precīzi noteiktu ķīmisko struktūru,
— par katru no šīm vielām ir pieejami LLNA dati no jūrascūciņu testa (B.6; ESAO 406. testēšanas vadlīnijas) (13) un, attiecīgā gadījumā, cilvēka materiāla testēšanas rezultāti,
— vielas ir brīvi pieejamas no komerciāliem avotiem.
Ieteicamās references vielas uzskaitītas 1. tabulā. Pētījumi, kuros izmantotas ieteiktās references vielas, jāvērtē, izmantojot tām atbilstošo 1. tabulā norādīto nesēju. Ja tabulā norādīta viela nav pieejama, ar pienācīgu pamatojumu drīkst izmantot citas vielas, kas atbilst iepriekš minētajiem atlases kritērijiem.
1. tabula
LLNA PS ieteicamās references vielas
|
Nr. |
Ķīmiskā viela (3) |
CAS Nr. |
Veids |
Veh (4) |
EC3 % (5) |
N (6) |
0,5x – 2,0x EC3 |
Faktiskais EC3 diapazons |
LLNA vs. jūrasc. |
LLNA vs. cilv. |
|
1 |
5-hlor-2-metil-4-izotiazolīn-3-ons (CMI)/2-metil-4-izotiazolīn-3-ons (MI) (7) |
26172-55-4/2682-20-4 |
Liq |
DMF |
0,009 |
1 |
0,0045-0,018 |
NC |
+/+ |
+/+ |
|
2 |
DNCB |
97-00-7 |
Sol |
AOO |
0,049 |
15 |
0,025-0,099 |
0,02-0,094 |
+/+ |
+/+ |
|
3 |
4-fenilēndiamīns |
106-50-3 |
Sol |
AOO |
0,11 |
6 |
0,055-0,22 |
0,07-0,16 |
+/+ |
+/+ |
|
4 |
Kobalta hlorīds |
7646-79-9 |
Sol |
DMSO |
0,6 |
2 |
0,3-1,2 |
0,4-0,8 |
+/+ |
+/+ |
|
5 |
Izoeigenols |
97-54-1 |
Liq |
AOO |
1,5 |
47 |
0,77-3,1 |
0,5-3,3 |
+/+ |
+/+ |
|
6 |
2-merkaptobenztiazols |
149-30-4 |
Sol |
DMF |
1,7 |
1 |
0,85-3,4 |
NC |
+/+ |
+/+ |
|
7 |
Citrāls |
5392-40-5 |
Liq |
AOO |
9,2 |
6 |
4,6-18,3 |
5,1-13 |
+/+ |
+/+ |
|
8 |
HCA |
101-86-0 |
Liq |
AOO |
9,7 |
21 |
4,8-19,5 |
4,4-14,7 |
+/+ |
+/+ |
|
9 |
Eigenols |
97-53-0 |
Liq |
AOO |
10,1 |
11 |
5,05-20,2 |
4,9-15 |
+/+ |
+/+ |
|
10 |
Fenilbenzoāts |
93-99-2 |
Sol |
AOO |
13,6 |
3 |
6,8-27,2 |
1,2-20 |
+/+ |
+/+ |
|
11 |
Kanēļskābes spirts |
104-54-1 |
Sol |
AOO |
21 |
1 |
10,5-42 |
NC |
+/+ |
+/+ |
|
12 |
Urīnvielas imidazolidinils |
39236-46-9 |
Sol |
DMF |
24 |
1 |
12-48 |
NC |
+/+ |
+/+ |
|
13 |
Metilmetakrilāts |
80-62-6 |
Liq |
AOO |
90 |
1 |
45-100 |
NC |
+/+ |
+/+ |
|
14 |
Hlorbenzols |
108-90-7 |
Liq |
AOO |
25 |
1 |
NA |
NA |
–/– |
–/ (1) |
|
15 |
Izopropanols |
67-63-0 |
Liq |
AOO |
50 |
1 |
NA |
NA |
–/– |
–/+ |
|
16 |
Pienskābe |
50-21-5 |
Liq |
DMSO |
25 |
1 |
NA |
NA |
–/– |
–/ (1) |
|
17 |
Metilsalicilāts |
119-36-8 |
Liq |
AOO |
20 |
9 |
NA |
NA |
–/– |
–/– |
|
18 |
Salicilskābe |
69-72-7 |
Sol |
AOO |
25 |
1 |
NA |
NA |
–/– |
–/– |
|
Vielas, kuru lietojums par LLNA labākas veiktspējas demonstrēšanai ir fakultatīvs |
||||||||||
|
19 |
Nātrija laurilsulfāts |
151-21-3 |
Sol |
DMF |
8,1 |
5 |
4,05-16,2 |
1,5-17,1 |
+/– |
+/– |
|
20 |
Etilēnglikola dimetakrilāts |
97-90-5 |
Liq |
MEK |
28 |
1 |
14-56 |
NC |
+/– |
+/+ |
|
21 |
Ksilols |
1330-20-7 |
Liq |
AOO |
95,8 |
1 |
47,9-100 |
NC |
+/ (2) |
+/– |
|
22 |
Niķeļa hlorīds |
7718-54-9 |
Sol |
DMSO |
5 |
2 |
NA |
NA |
–/+ |
–/+ |
|
(1) Tiek uzskatīta par cilvēka ādu nesensibilizējošu vielu, jo: nav zināmi klīniski ādas strēmelīšu testa rezultāti; viela nav ādas strēmelīšu testa komplektā iekļauts alergēns; nav zināmi cilvēka ādas sensibilizācijas gadījumi. (2) GP dati nav pieejami. (3) Ja dati par testējamo vielu stabilitāti liecina, ka tās uzglabāt nevar, katru dienu sagatavo svaigas testējamās ķīmiskās vielas. (4) Dažādi nesēji var dažādi ietekmēt LLNA veiktspēju, tāpēc ar katru references vielu jālieto tai ieteicamais nesējs (24)(32). (5) Ja pieejama vairāk nekā viena EC3 vērtība, norādīta vidējā vērtība. Vielām ar negatīvu reakciju (t. i., stimulācijas indekss < 3) norādīta augstākā testētā koncentrācija. (6) LLNA pētījumu skaits, no kuriem iegūti dati. (7) Komerciāli pieejams ar nosaukumu katons CG (CAS Nr. 55965-84-9); CMI un MI maisījums attiecībā 3:1. Katra komponenta relatīvā koncentrācija ir no 1,1 % līdz 1,25 % (CMI) un no 0,3 % līdz 0,45 % (MI). Neaktīvie komponenti ir magnija sāļi (21,5 % līdz 24 %) un vara nitrāts (0,15 % līdz 0,17 %), atlikusī preparāta daļa ir 74 % līdz 77 % ūdens. Katons CG ir brīvi pieejams no tādiem komerciāliem avotiem kā Sigma-Aldrich un Rohm and Haas (tagad Dow Chemical Corporation). Saīsinājumi: AOO = acetons/olīveļļa (4:1, tilp./tilp.); CAS Nr. = Ķīmiskā informatīvā dienesta [Chemical Abstracts Service] numurs; DMF = N,N-dimetilformamīds; DMSO = dimetilsulfoksīds; DNCB = 2,4-dinitrohlorbenzols; EC3 = koncentrācija, kurā stimulācijas indeksa vērtība ir 3; GP = jūrascūciņu testa rezultāts (B.6; ESAO 406. testēšanas vadlīnijas) (13); HCA = heksilkanēļskābes aldehīds; Liq = šķidrums; LLNA = peļu lokālo limfmezglu noteikšanas rezultāts (B.42; ESAO 429. testēšanas vadlīnijas) (1); MEK = metiletilketons; NA = nepiemēro, jo stimulācijas indekss < 3; NC = nav aprēķināts, jo dati pieejami tikai no viena pētījuma; Sol = cieta viela; Veh = nesējs. |
||||||||||
III. Definētie ticamības un pareizības standarti
7. Vērtējot ar 18 obligāti izmantojamajām references vielām, līdzīgas vai modificētas LLNA metodes pareizībai jābūt tādai pašai, kā paredz LLNA PS, vai lielākai. Jaunajai vai modificētajai metodei jānodrošina pareiza klasifikācija “jā/nē” līmenī. Tomēr ar jauno vai modificēto metodi var neizdoties pareizi klasificēt visas obligāti izmantojamās references vielas. Ja, piemēram, nepareizi klasificēts kāds no vājajiem sensibilizatoriem, bet tiek sniegts nepareizās klasifikācijas izskaidrojums un attiecīgi papildu dati (piemēram, testēšanas rezultāti, kuros pareizi klasificētas citas vielas, kam piemītošās fizikālās, ķīmiskās un sensibilizējošās īpašības ir līdzīgas nepareizi klasificētās references vielas īpašībām), to var uzskatīt par līdzvērtīgas veiktspējas pierādījumu. Šādos apstākļos jaunās vai modificētās LLNA testēšanas metodes validācijas statusu novērtē katrā gadījumā atsevišķi.
8. Lai noteiktu iekšlaboratorijas reproducējamības pakāpi, jaunā vai modificētā LLNA metode jāvērtē, izmantojot sensibilizējošu vielu, kura ar LLNA jau ir labi izpētīta. Tāpēc LLNA PS pamatā ir rezultātu variācija atkārtotos testos ar heksilkanēļskābes aldehīdu (HCA). Lai novērtētu iekšlaboratorijas reproducējamību, novērtētā koncentrācijas sliekšņa (ECt) vērtības ar HCA jāiegūst četrās atsevišķās testēšanas reizēs, testējot ar vismaz nedēļu ilgiem starplaikiem. Iekšlaboratorijas reproducējamības pakāpe ir pieņemama tad, ja laboratorija katrā HCA testēšanā iegūst ECt vērtības robežās no 5 % līdz 20 %, kas atbilst diapazonā 0,5–2,0 esoša skaitļa reizinājumam ar vidējo EC3 vērtību, kas attiecībā uz HCA (10 %) norādīta LLNA (skatīt 1. tabulu).
9. Starplaboratoriju reproducējamības pakāpi jaunai vai modificētai LLNA metodei jāvērtē, izmantojot divas sensibilizējošas vielas, kuras ar LLNA jau ir labi izpētītas. LLNA PS pamatā ir rezultātu variācija testos ar HCA un 2,4-dinitrohlorbenzolu (DNCB) dažādās laboratorijās. ECt vērtības jāiegūst neatkarīgā veidā un no viena pētījuma, kas veikts vismaz trijās atsevišķās laboratorijās. Starplaboratoriju reproducējamības pakāpe ir pieņemama tad, ja katras laboratorijas iegūtās ECt vērtības ir no 5 % līdz 20 % HCA gadījumā un 0,025 % līdz 0,1 % DNCB gadījumā, kas atbilst diapazonā 0,5–2,0 esoša skaitļa reizinājumam ar vidējo EC3 vērtību, kas attiecībā uz HCA (10 %) un DNCB (0,05 %) norādīta LLNA (skatīt 1. tabulu).
2. papildinājums
Definīcijas
Pareizība : pēc testēšanas metodes iegūto mērījumu rezultātu sakritības pakāpe ar pieņemtajām references vērtībām. Tas ir testēšanas metodes veiktspējas raksturlielums un viens no tās piemērotības aspektiem. Šo terminu bieži izmanto “atbilstības” vietā, ar to apzīmējot pēc testēšanas metodes iegūto pareizo rezultātu daļu (14).
Salīdzināšanas viela : sensibilizējoša vai nesensibilizējoša viela, ko izmanto par standartu salīdzināšanai ar testējamo vielu. Salīdzināšanas vielai ir jābūt: (i) pastāvīgam un drošam ieguves avotam; (ii) struktūras un funkciju līdzībai ar testējamo vielu klases vielām; (iii) zināmām fizikāli ķīmiskajām īpašībām; (iv) papildu datiem par zināmajiem iedarbības veidiem; (v) vielas zināmajam iedarbības stiprumam jāatbilst vēlamās reakcijas intensitātes diapazonam.
Novērtētais koncentrācijas slieksnis (ECt) : novērtētā zemākā testējamās vielas koncentrācija, kurā stimulācijas indekss liecina par pozitīvu reakciju.
Novērtētā koncentrācija-3 (EC3) : novērtētā testējamās vielas koncentrācija, kurā stimulācijas indekss ir 3.
Šķietams negatīvs : testējamā viela, kurai ar testēšanas metodi kļūdaini identificēta negatīva vai neaktīva reakcija, lai gan faktiski tā ir pozitīva vai aktīva.
Šķietams pozitīvs : testējamā viela, kurai ar testēšanas metodi kļūdaini identificēta pozitīva vai aktīva reakcija, lai gan faktiski tā ir negatīva vai neaktīva.
Bīstamība : potenciālā spēja kaitēt veselībai vai videi. Kaitīgā iedarbība kļūst nosakāma tikai tad, ja iedarbības intensitāte ir pietiekami liela.
Starplaboratoriju reproducējamība : lielums, kas raksturo, kādā mērā vairākas kvalificētas laboratorijas spēj iegūt kvalitatīvi un kvantitatīvi līdzīgus rezultātus, ja tās izmanto vienu un to pašu protokolu un vienas un tās pašas testējamās vielas. Starplaboratoriju reproducējamību (saukta arī par interlaboratoriju reproducējamību) nosaka prevalidēšanas un validēšanas procesā, un šis lielums rāda, cik lielā mērā testēšanu vienlīdz sekmīgi iespējams veikt dažādās laboratorijās (14).
Iekšlaboratorijas reproducējamība : lielums, kas raksturo, kādā mērā vienā laboratorijā strādājoši kvalificēti darbinieki spēj sekmīgi atkārtot iepriekš iegūtus rezultātus, ja to pašu protokolu izmanto citā laikā. Saukts arī par intralaboratoriju reproducējamību (14).
Atdarinājuma (me-too) tests : sadzīvisks apzīmējums testēšanas metodei, kura ir noteikšanas mehānisma vai funkcionalitātes ziņā līdzīga validētai un pieņemtai testēšanas references metodei. Šāda testēšanas metode varētu kandidēt uz vēlāku validēšanu. Brīvi aizstājama ar tai līdzīgu testēšanas metodi (14).
Galējība jeb rupja kļūda : novērojums, kuru raksturo izteikta novirze no pārējām vērtībām populācijas paraugā, kurš atlasīts pēc nejaušības principa.
Veiktspējas standarti (PS) : saskaņā ar validētu testēšanas metodi noteikti standarti, pēc kuriem novērtē funkcionalitātes ziņā vai pēc noteikšanas mehānisma līdzīgu testēšanas metožu salīdzināmību. Šeit iekļauti: i) testēšanas metodes būtiskie komponenti; ii) obligāti izmantojamās references vielas, kas izraudzītas no tām ķīmiskajām vielām, kuras izmantotas, lai pierādītu attiecīgās validētās testēšanas metodes veiktspējas pieņemamību; iii) līdzīgie pareizības un ticamības līmeņi, kuru pamatā ir attiecīgajai validētajai testēšanas metodei noteiktie konkrētie līmeņi un kuru nodrošināšanu ar novērtējamo testēšanas metodi var pierādīt ar obligāti izmantojamajām references vielām (14).
Aizsargāta testēšanas metode : testēšanas metode, ar kuru saistīto ražošanu un izplatīšanu ierobežo patentu tiesības, autortiesības, tirdzniecības zīmes u. c.
Kvalitātes nodrošināšana : pārvaldības process, kurā laboratorijas testēšanas standartu, prasību un pierakstu uzturēšanas procedūru ievērošanu un datu pārneses pareizību novērtē no testēšanas veicējiem neatkarīgas personas.
References vielas : ķīmiskas vielas, kas izraudzītas izmantošanai validēšanas procesā un kuru reakcija in vitro vai in vivo testēšanas standartsistēmā vai pētāmajās sugās ir jau zināma. Šīm ķīmiskajām vielām jābūt reprezentatīvām attiecībā uz to ķīmisko vielu klasi, kuras testē ar attiecīgo metodi, un jāaptver testējamo ķīmisko vielu iespējamo reakciju diapazons (izteikta reakcija, vāja reakcija, nav reakcijas). Dažādos validēšanas procesa posmos var būt vajadzīgas dažādas references vielas; tas pats attiecas uz testēšanas metodēm un to lietojumiem (14).
Piemērotība : testa raksturojums no tā lietderīguma viedokļa; vai tas ir piemērots un izmantojams kādam konkrētam mērķim. Pakāpe, kādā ar minēto testu iespējams pareizi izmērīt vai prognozēt pētāmo bioloģisko ietekmi. Piemērotība ietver arī testēšanas metodes pareizības (atbilstības) aspektu (14).
Ticamība : parametrs, ar kuru mēra pakāpi, kādā tajā pašā vai citā laboratorijā ilgākā laikā, izmantojot to pašu protokolu, var iegūt reproducējamus rezultātus. To novērtē, aprēķinot iekšlaboratorijas un starplaboratoriju reproducējamību (14).
Ādas sensibilizācija : imunoloģisks process, kurš norisinās, ja uz uzņemtspējīgu organismu ārēji iedarbojas stimulējošs ķīmisks alergēns, kas izraisa ādas imūnreakciju, kuras rezultāts var būt kontaktsensibilizācija.
Stimulācijas indekss (SI) : vērtība, ko aprēķina, lai novērtētu testējamai vielai piemītošo ādas sensibilizācijas potenciālu; to izsaka kā attiecību starp progresiju grupās, kas saņēmušas pētāmo vielu, un progresiju kontroles grupā, kas saņēmusi tikai nesēju.
Testējamā viela (arī testējamā ķīmiskā viela) : viela vai vielu maisījums, kuru testē ar šo TM.
Validēta testēšanas metode : testēšanas metode, par kuru ir pabeigti validācijas pētījumi, lai noteiktu metodes piemērotību noteiktam nolūkam (tostarp pareizību) un ticamību. Jāievēro, ka validētas testēšanas metodes veiktspēja pareizības un ticamības ziņā var nebūt pietiekama, lai to izmantotu paredzētajam nolūkam (14).
B.43. ŽURKU NEIROTOKSICITĀTES PĒTĪJUMS
1. METODE
Šī metode ir līdzvērtīga ESAO 424 (1997) vadlīnijā noteiktajai metodei.
Šī testa metode ir paredzēta, lai iegūtu informāciju, kas nepieciešama ķīmisko vielu potenciālās neirotoksicitātes apstiprināšanai vai turpmākai raksturošanai pieaugušos dzīvniekos. To var apvienot ar esošajām atkārtotas devas toksicitātes pētījumu testu metodēm vai veikt kā atsevišķu pētījumu. Ir ieteicams iepazīties ar ESAO Pamatnostādnēm par neirotoksicitātes testēšanas stratēģijām un metodēm (OECD Guidance Document on Neurotoxicity Testing Strategies and Methods) (1), kas palīdzēs veikt pētījumus, kuru pamatā ir šī testa metode. Tas ir īpaši svarīgi, apsverot pārlabojumus novērošanā un testa procedūrās, kas ieteiktas šīs metodes parastajai izmantošanai. Pamatnostādnes ir sagatavotas, lai atvieglotu citu testa procedūru izvēli izmantošanai konkrētos apstākļos.
Attīstības neirotoksicitātes novērtēšana nav šīs metodes temats.
1.1. IEVADS
Pārbaudot un novērtējot ķīmisko vielu toksiskās īpašības, ir svarīgi ņemt vērā neirotoksiskās iedarbības potenciālu. Jau atkārtotās devas sistēmiskās toksicitātes testa metode iekļauj novērojumus potenciālās neirotoksicitātes skrīninga veikšanai. Šo testa metodi var izmantot pētījuma veikšanai, lai iegūtu vairāk informācijas par atkārtotās devas sistēmiskās toksicitātes pētījumos novēroto neirotoksisko iedarbību vai to apstiprinātu. Tomēr apsvērumi par dažu klašu ķīmisko vielu potenciālo neirotoksicitāti var vedināt uz domām, ka tās var atbilstošāk novērtēt, izmantojot šo metodi, bez potenciālās neirotoksicitātes iepriekšējām norādēm no atkārtotās devas sistēmiskās toksicitātes pētījumiem. Piemēram, šādos apsvērumos jāiekļauj:
— neiroloģisko pazīmju vai neiropatoloģisko bojājumu novērojumi toksicitātes pētījumos, kas nav atkārtotās devas sistēmiskās toksicitātes pētījumi, vai
— struktūras radniecība vai citu informācija, kas tās saista ar zināmām neirotoksiskām vielām.
Turklāt var būt citi gadījumi, kad ir lietderīgi izmantot šo testa metodi; sīkākus datus skatīt (1).
Šī metode ir izveidota tā, lai to varētu pielāgot konkrētu vajadzību apmierināšanai, lai apstiprinātu ķīmiskās vielas konkrētu histopatoloģisko un izturēšanās neirotoksicitāti, kā arī sniegtu neirotoksisko atbildes reakciju raksturojumu un kvantitatīvu novērtējumu.
Agrāk neirotoksicitāti pielīdzināja neiropātijai, kas iekļauj neiropatoloģiskos bojājumus vai neiroloģiskas disfunkcijas – krampji, paralīze vai drebēšana. Lai gan neiropātija ir svarīga neirotoksicitātes izpausme, tagad ir skaidrs, ka ir daudzas citas nervu sistēmas toksicitātes pazīmes (piemēram, kustību koordinācijas zudums, jutības deficīts, mācīšanās un atmiņas disfunkcijas), kas var neatspoguļoties neiropātijas vai citu veidu pētījumos.
Šī neirotoksicitātes testa metode ir izstrādāta, lai konstatētu lielākās neiroizturēšanās un neiropatoloģiskās iedarbības pieaugušiem grauzējiem. Kaut arī izturēšanās, pat nepastāvot morfoloģiskām izmaiņām, var atspoguļot blakusparādības uz organismu, ne visas izturēšanās izmaiņas ir specifiskas nervu sistēmai. Tādēļ novērotās izmaiņas ir jānovērtē saistībā ar korelatīviem histopatoloģijas, hematoloģijas vai bioķīmijas datiem, kā arī ar citu veidu sistēmiskās toksicitātes datiem. Testēšana, kas šajā metodē vajadzīga, lai nodrošinātu neirotoksisko atbildes reakciju raksturojumu un kvantitatīvo izvērtējumu, iekļauj īpašas histopatoloģiskas un izturēšanās procedūras, ko turpmāk var papildināt ar elektrofizioloģiskiem vai bioķīmiskiem pētījumiem (1) (2) (3) (4).
Neirotoksiskās vielas nervu sistēmā var iedarboties uz vairākiem mērķiem un atbilstoši dažādiem mehānismiem. Tā kā neviena atsevišķa testu kopa nevar rūpīgi novērtēt visu vielu neirotoksisko potenciālu, var būt nepieciešams izmantot citus in vitro un in vivo testus, kas specifiski novērotajam vai sagaidāmajam neirotoksicitātes veidam.
Šo testa metodi var izmantot arī saistībā ar norādījumu kopu, kas izklāstīta ESAO Pamatnostādnēs par neirotoksicitātes testēšanas stratēģijām un metodēm (1), lai plānotu pētījumus, kas paredzēti, lai turpmāk raksturotu vai palielinātu atbildes reakcijas uz devu kvantitatīvās novērtēšanas jutību labākai nenovērotas nelabvēlīgas ietekmes līmeņa noteikšanai vai ķīmiskās vielas zināmās vai paredzamās bīstamības pamatošanai. Piemēram, var plānot pētījumus neirotoksisko mehānismu identificēšanai un novērtēšanai vai datu papildināšanai, kas jau pieejami no neiroizturēšanās un neiropatoloģisko pamatnovērojumu procedūru izmantošanas. Tādos pētījumos nav jākopē dati, kas iegūti, izmantojot šajā metodē ieteiktās standartprocedūras, ja tādi dati jau ir pieejami un netiek uzskatīti par nepieciešamiem pētījuma rezultātu interpretācijai.
Šis neirotoksicitātes pētījums, izmantots atsevišķi vai apvienojumā, nodrošina informāciju, kas var:
— identificēt, vai testējamā ķīmiskā viela ir neatgriezeniski vai atgriezeniski iedarbojusies uz nervu sistēmu,
— dot ieguldījumu ar ķīmiskās vielas iedarbību saistīto nervu sistēmas izmaiņu raksturošanā un pamatā esošā mehānisma izpratnē,
— noteikt atbildes reakcijas sakarību ar devu un laiku, lai novērtētu nenovērotās nelabvēlīgas ietekmes līmeni (ko var izmantot ķīmiskās vielas drošības kritēriju noteikšanai).
Šajā testa metodē izmanto perorālo testējamās vielas ievadīšanu. Var būt piemērotāki citi ievadīšanas veidi (piemēram, caur ādu vai ieelpojot), un var būt vajadzīga ieteikto procedūru pārveidošana. Apsvērumi par ievadīšanas veida izvēli ir atkarīgi no iedarbības veida uz cilvēku un pieejamās toksikoloģiskās vai kinētiskās informācijas.
1.2. DEFINĪCIJAS
Kaitīgā iedarbība: tādas ar vielas ievadīšanu saistītas izmaiņas attiecībā pret bāzes līniju, kuras samazina organisma spēju izdzīvot, vairoties vai pielāgoties videi.
Deva: ievadītās testējamās vielas daudzums. Devu izsaka kā svaru (g/mg) vai kā testējamās vielas svaru uz testa dzīvnieka svara vienību (piemēram, mg/kg), vai kā nemainīgu koncentrāciju barībā (milj. daļas).
Dozēšana: vispārīgs termins, kas iekļauj devu, tās biežumu un ievadīšanas ilgumu.
Neirotoksicitāte: nervu sistēmas struktūras vai funkciju nevēlamas izmaiņas, ko rada ķīmiska, bioloģiska vai fizikāla aģenta iedarbība.
Neirotoksiska viela: ķīmisks, bioloģisks vai fizikāls aģents, kuram ir neirotoksicitātes izraisīšanas spēja.
NOAEL : saīsinājums no “no observed adverse effect level” (nenovērojamas nelabvēlīgas ietekmes līmenis), un tas ir lielākais devas līmenis, pie kura nav novērojami ar vielas ievadīšanu saistīti nevēlami rezultāti.
1.3. TESTA METODES PRINCIPS
Testējamo vielu ievada orāli devu diapazonā vairākām laboratorijas grauzēju grupām. Parasti ir vajadzīgas atkārtotās devas, un dozēšanas režīms var būt 28 dienas, subhronisks (90 dienas) vai hronisks (1 gads vai ilgāk). Šajā testa metodē izklāstītās procedūras var izmantot arī akūtās neirotoksicitātes pētījumā. Dzīvniekus testē, lai varētu konstatēt vai raksturot izturēšanos un/vai neiroloģiskās anomālijas. Katrā novērošanas laika posmā vērtē izturēšanās veidus, ko varētu ietekmēt neirotoksiskās vielas. Testa beigās katra dzimuma dzīvnieku apakškopai no katras grupas izdara perfūziju in situ, kā arī sagatavo un apskata galvas un muguras smadzeņu un perifēro nervu griezumus.
Ja pētījumu veic kā atsevišķu pētījumu neirotoksicitātes skrīninga izdarīšanai vai neirotoksisko iedarbību raksturošanai, katras grupas dzīvniekus, ko neizmanto perfūzijai un vēlākai histopatoloģijai (skatīt 1. tabulu), var izmantot specifiskām neiroizturēšanās, neiropatoloģiskām, neiroķīmiskām vai elektrofizioloģiskām procedūrām, kuras var papildināt datus, kas iegūti no šai metodei vajadzīgajiem standarta izmeklējumiem (1). Minētās papildu procedūras var būt īpaši noderīgas, ja empīriskie novērojumi vai sagaidāmās iedarbības norāda uz ķīmiskās vielas neirotoksicitātes konkrētu veidu vai mērķi. Alternatīvi – atlikušos dzīvniekus var izmantot tādiem novērtējumiem, kas vajadzīgi atkārtotās devas toksicitātes testu metodēm pētījumos ar grauzējiem.
Ja šīs testa metodes procedūras apvieno ar citu testu metožu procedūrām, ir vajadzīgs pietiekams dzīvnieku skaits, lai izpildītu novērojumu prasības abiem pētījumiem.
1.4. TESTA METODES APRAKSTS
1.4.1. Dzīvnieku sugu izvēle
Ieteicamākā grauzēju suga ir žurkas, kaut arī, sniedzot pamatojumu, var izmantot citas grauzēju sugas. Ir jāizmanto jauni, veseli, pieauguši parasti izmantojamo laboratorijas līniju dzīvnieki. Mātītes nedrīkst būt iepriekš dzemdējušas vai grūsnas. Dozēšana parasti jāuzsāk iespējami drīz pēc atšķiršanas no mātes, vēlams, ne vēlāk kā sešu nedēļu veciem dzīvniekiem un katrā ziņā pirms dzīvnieki ir deviņas nedēļas veci. Tomēr, ja šo pētījumu apvieno ar citiem pētījumiem, šai vecuma prasībai var būt vajadzīga pielāgošana. Pētījuma sākumā dzīvnieku masas atšķirībām jābūt minimālām un tās nedrīkstētu pārsniegt ± 20 % no katra dzimuma dzīvnieku vidējā svara. Ja atkārtotās devas īslaicīgu pētījumu izdara kā ilgtermiņa pētījuma iepriekšēju pētījumu, ir ieteicams abos pētījumos izmantot vienas līnijas un izcelsmes dzīvniekus.
1.4.2. Turēšanas un barošanas nosacījumi
Eksperimenta dzīvnieku telpas temperatūrai jābūt 22 oC (± 3 oC). Kaut arī relatīvajam mitrumam jābūt vismaz 30 % un, vēlams, nav jāpārsniedz 70 %, izņemot telpu tīrīšanas laiku, mērķim jābūt 50–60 %. Apgaismojumam jābūt mākslīgam, secība ir 12 stundas gaismas, 12 stundas tumsas. Skaļš, neregulārs troksnis iespējami jāsamazina. Barošanai var izmantot parasto laboratorijas barību ar neierobežotu dzeramā ūdens piegādi. Barības izvēli var ietekmēt vajadzība nodrošināt piemērotu testējamās vielas piejaukšanu, ja vielu ievada ar šo metodi. Dzīvniekus var turēt atsevišķi vai būros nelielās tā paša dzimuma dzīvnieku grupās.
1.4.3. Dzīvnieku sagatavošana
Veselus, jaunus dzīvniekus pēc nejaušās izvēles principa sadala kontroles un vielas saņemšanas grupās. Būrus izvieto tā, lai iespējami samazinātu būru novietojuma varbūtējo iedarbību. Dzīvniekiem piešķir unikālu identifikāciju, un līdz izmēģinājumu sākumam vismaz piecas dienas tur būros, lai tie aklimatizētos laboratorijas apstākļos.
1.4.4. Ievadīšanas veids un devu sagatavošana
Šajā testa metodē izmanto perorālo testējamās vielas ievadīšanu. Perorālā ievadīšana var notikt ar mākslīgo barošanu, barībā, dzeramajā ūdenī vai ar kapsulām. Var izmantot citus ievadīšanas veidus (piemēram, caur ādu vai ieelpojot), bet var būt vajadzīga ieteikto procedūru pārveidošana. Apsvērumi par ievadīšanas veida izvēli ir atkarīgi no iedarbības rakstura uz cilvēku un pieejamās toksikoloģiskās vai kinētiskās informācijas. Ievadīšanas veida izvēles motīvi, kā arī izrietošie šīs testa metodes procedūru pārlabojumi ir jānorāda.
Vajadzības gadījumā testējamo vielu izšķīdina vai suspendē piemērotā nesējā. Ir ieteicams vispirms apsvērt ūdens šķīduma/suspensijas lietošanu, pēc tam apsvērt eļļas (piemēram, kukurūzas eļļas) šķīduma/suspensijas lietošanu un pēc tam iespējamu šķīdumu/suspensiju citā nesējā. Nesēja toksiskajām īpašībām jābūt zināmām. Turklāt jāņem vērā šādas nesēja īpašības – nesēja iedarbība uz testējamās vielas uzsūkšanos, sadalījumu, metabolismu vai aizturi, kas var mainīt testējamās vielas toksiskās īpašības, un barības un ūdens patēriņa iedarbību uz dzīvnieku barojuma stāvokli.
1.5. PROCEDŪRAS
1.5.1. Dzīvnieku skaits un dzimums
Ja pētījumu veic kā atsevišķu pētījumu, sīki izstrādātu klīnisko un funkcionālo novērojumu izvērtēšanai katrā devas un kontroles grupā ir jāizmanto vismaz 20 dzīvnieki (10 tēviņi un 10 mātītes). Vismaz pieciem tēviņiem un piecām mātītēm, kas izraudzīti no minētajiem 10 tēviņiem un 10 mātītēm, ir jāizdara perfūzija in situ, un tie jāizmanto sīki izstrādātai neirohistopatoloģijai pētījuma beigās. Ja konkrētā devas grupā attiecībā uz neirotoksiskajām iedarbībām tiek novērots tikai ierobežots dzīvnieku skaits, jāapsver šo dzīvnieku iekļaušana perfūzijas izdarīšanai izraudzītajos dzīvniekos. Ja pētījumu veic apvienojumā ar atkārtotās devas toksicitātes pētījumu, ir jāizmanto pietiekams dzīvnieku skaits, lai atbilstu abu pētījumu mērķiem. Minimālais dzīvnieku skaits grupā dažādiem pētījumu apvienojumiem ir norādīts 1. tabulā. Ja plāno starpposmu nogalināšanas vai atveseļošanās grupas, lai novērotu toksiskās iedarbības atgriezeniskumu, noturīgumu vai aizkavētu parādīšanos pēc vielas saņemšanas, vai ja ir apsvērtas papildu novērošanas, tad dzīvnieku skaits ir jāpalielina, lai nodrošinātu, ka ir pieejams novērojumiem un histopatoloģijai vajadzīgais dzīvnieku skaits.
1.5.2. Vielas saņemšanas un kontroles grupa
Parasti jāizmanto vismaz trīs devu grupas un kontroles grupa, bet, ja no citu datu izvērtēšanas nav sagaidāma iedarbība pie atkārtotās devas 1 000 mg/kg ķermeņa svara dienā, tad var izdarīt pieļaujamības testu. Ja piemēroti dati nav pieejami, var izdarīt diapazona atrašanas pētījumu, kas palīdzētu noteikt izmantojamās devas. Ar kontroles dzīvniekiem jārīkojas tāpat kā ar testa grupu dzīvniekiem, tie tikai nesaņem testējamo vielu. Ja testējamo vielu ievada kopā ar nesēju, kontroles dzīvnieki saņem maksimālo izmantojamo nesēja daudzumu.
1.5.3. Ticamības pārbaude
Pētījuma veicējai laboratorijai ir jāuzrāda dati, kas parāda tās spēju veikt pētījumu un izmantojamo procedūru jutību. Tādiem datiem jāsniedz pierādījumi par spēju dažādos novērošanai ieteiktos beigu punktos attiecīgi konstatēt un kvantitatīvi noteikt izmaiņas, tādas kā veģetatīvās pazīmes, sensoro reaktivitāte, ekstremitāšu satvēriena stiprums un kustību aktivitāte. Informācija par ķīmiskajām vielām, kas izraisa dažādu veidu neirotoksiskās atbildes reakcijas un ir izmantojamas kā pozitīvās kontroles vielas, ir atrodama 2.–9. norādē. Var izmantot iepriekšējos datus, ja eksperimenta procedūru būtiskie aspekti paliek tie paši. Ir ieteicams regulāri atjaunināt vēsturiskos datus. Ja pētījuma veicēja laboratorija ir mainījusi kādu testa vai procedūru nozīmīgu sastāvdaļu, ir jāiegūst jauni dati, kas parāda procedūru saglabātu jutību.
1.5.4. Devu izvēle
Devu līmeņi jāizvēlas, ņemot vērā iepriekš novērotos toksicitātes un kinētikas datus, kas ir pieejami par testējamo vielu vai ar to saistītiem materiāliem. Augstākais devas līmenis ir jāizvēlas ar mērķi izraisīt neirotoksiskas iedarbības vai skaidras sistēmiskas toksiskas iedarbības. Pēc tam jāizvēlas devu līmeņi lejupejošā secībā, lai parādītu visas ar devām saistītās atbildes reakcijas un lai zemākajā devas līmenī nenovēro nelabvēlīgas ietekmes līmeni (NOAEL). Principā devu līmeņi ir jāizvēlas tā, lai primārā toksiskā iedarbība uz nervu sistēmu būtu atšķirama no iedarbības, kas saistīta ar sistēmisko toksicitāti. Bieži optimāli ir divi līdz trīs starplaiki, un ceturtās testa grupas pievienošana bieži ir vēlamāka par ļoti lielu starplaiku (piemēram, ar koeficientu, lielāku par 10) izmantošanu starp dozēšanām. Ja ir pamatots iedarbības uz cilvēku vērtējums, arī tas jāņem vērā.
1.5.5. Pieļaujamības tests
Ja novērojamu neirotoksisku iedarbību neizraisa tests ar devas līmeni vismaz 1 000 mg/kg ķermeņa svara dienā, izmantojot aprakstītās procedūras, un ja toksicitāte nav sagaidāma, pamatojoties uz datiem par struktūras ziņā saistītām vielām, tad pētījumu ar trim devu līmeņiem var uzskatīt par nevajadzīgu. Paredzamā iedarbība uz cilvēku var norādīt, ka pieļaujamības testā jālieto lielāka perorālā deva. Citiem ievadīšanas veidiem, tādiem kā ieelpošana vai ievadīšana caur ādu, maksimālo sasniedzamo iedarbības līmeni bieži var diktēt testējamās vielas fizikāli ķīmiskās īpašības. Perorāla akūtā pētījuma veikšanai pieļaujamības testa devai jābūt vismaz 2 000 mg/kg.
1.5.6. Devu ievadīšana
Dzīvniekiem testējamo vielu dozē katru dienu septiņas dienas nedēļā vismaz 28 dienu laika posmā; piecu dienu dozēšanas režīms vai īsāks iedarbības laika posms ir jāpamato. Ja testējamo vielu dzīvniekiem ievada ar mākslīgo barošanu, tas jāizdara vienā devā, izmantojot kuņģa zondi vai piemērotu intubācijas kanulu. Maksimālais šķidruma tilpums, ko vienā paņēmienā var ievadīt, ir atkarīgs no testa dzīvnieka lieluma. Tilpums nedrīkst pārsniegt 1 ml uz 100 g ķermeņa svara. Tomēr ūdens šķīdumu gadījumā var apsvērt līdz 2 ml/100 g ķermeņa svara izmantošanu. Izņemot kairinošas vai kodīgas vielas, kuru iedarbība lielākās koncentrācijās parasti ir izteiktāka, testiem lietotā tilpuma mainības iedarbība ir jāsamazina līdz minimumam, koriģējot koncentrāciju tā, lai pie visām devām tilpums būtu vienāds.
Vielām, ko ievada ar barību vai dzeramo ūdeni, ir svarīgi nodrošināt, lai iesaistītie testējamās vielas daudzumi netraucētu normālu barības vai ūdens līdzsvaru. Ja testējamo vielu ievada ar barību, var izmantot nemainīgu koncentrāciju barībā (milj. daļas) vai nemainīgu devas līmeni attiecībā pret dzīvnieka ķermeņa svaru; jebkura atkāpe no šīs shēmas ir jāpamato. Ja vielu ievada, mākslīgi barojot, deva katru dienu jāievada vienā laikā un pēc vajadzības jākoriģē, lai uzturētu nemainīgu devas līmeni attiecībā pret dzīvnieka ķermeņa svaru. Ja atkārtotās devas pētījumu izmanto kā ilgtermiņa pētījuma iepriekšēju pētījumu, abos pētījumos jāizmanto līdzīga veida barība. Akūtos pētījumos, ja nav iespējams uzreiz ievadīt visu devu, to sadala un ievada pa daļām laika posmā, kas nepārsniedz 24 stundas.
1.6. NOVĒROŠANA
1.6.1. Novērošanas un testu biežums
Atkārtotās devas pētījumos novērošanas laika posmam jāietver dozēšanas laika posms. Akūtajos pētījumos ir jāievēro 14 dienu laika posms pēc vielas ievadīšanas. Bez vielas iedarbības turēto satelītgrupu dzīvnieku novērošanā arī jāiekļauj šis laika posms pēc vielas ievadīšanas.
Novērojumi jāizdara pietiekami bieži, lai iespējami palielinātu izturēšanās un/vai neiroloģisko anomāliju konstatēšanas iespēju. Novērojumi, vēlams, jāveic katru dienu vienos un tajos pašos laikos, ņemot vērā sagaidāmo iedarbību maksimuma periodu pēc dozēšanas. Klīnisko novērojumu un funkcionālo testu biežums ir apkopots 2. tabulā. Ja iepriekšējos pētījumos iegūtie kinētiskie vai citi dati norāda uz vajadzību pēc novērojumiem, testiem vai pēcnovērojumu periodiem izmantot atšķirīgus laika punktus, ir jāpieņem alternatīvs grafiks, lai iegūtu maksimālo informāciju. Ir jāsniedz grafika izmaiņu motīvi.
1.6.1.1. Vispārējā veselības stāvokļa novērojumi un mirstība/saslimstība
Visi dzīvnieki ir rūpīgi jānovēro vismaz vienreiz dienā attiecībā uz to veselības stāvokli, kā arī vismaz divreiz dienā attiecībā uz saslimstību un mirstību.
1.6.1.2. Sīki izstrādāti klīniskie novērojumi
Sīki izstrādāti klīniskie novērojumi jāveic attiecībā uz visiem šim nolūkam izraudzītajiem dzīvniekiem (skatīt 1. tabulu) vienreiz pirms pirmās iedarbības (lai varētu izdarīt individuāla pētījuma objekta stāvokļu salīdzinājumus) un pēc tam dažādos starplaikos atkarībā no pētījuma ilguma (skatīt 2. tabulu). Atveseļošanās perioda beigās jāveic sīki izstrādāti atveseļošanās satelītgrupas klīniskie novērojumi. Sīki klīniskie novērojumi jāveic ārpus turēšanas būra standartnožogojumā. Tie rūpīgi jāreģistrē, izmantojot punktu sistēmas, kas iekļauj katra novērojumu mērījuma kritērijus vai punktu skalas. Testēšanas laboratorijai skaidri jānosaka kritēriji vai skalas. Ir jācenšas nodrošināt, lai izmaiņas testa apstākļos būtu minimālas (nebūtu sistemātiski saistītas ar vielas ievadīšanu) un lai novērošanu izdarītu apmācīti novērotāji, kas nav informēti par vielas ievadīšanu.
Novērojumus ieteicams izdarīt strukturētā veidā, katram dzīvniekam katrā novērošanas laikā sistemātiski pielietojot skaidri noteiktus kritērijus (iekļaujot “parastā diapazona” definīciju). “Parastais diapazons” ir atbilstoši jādokumentē. Visas novērotās pazīmes ir jāreģistrē. Kad vien tas īstenojams, ir jāreģistrē arī novēroto pazīmju lielums. Klīniskajos novērojumos jāiekļauj izmaiņas ādā, apmatojumā, acīs, gļotādās, sekrēcijas un izdalījumi un veģetatīvā aktivitāte (piemēram, asarošana, piloerekcija, acs zīlītes lielums, neparasts elpošanas raksturs un/vai elpošana caur muti, neparastas urinācijas vai defekācijas pazīmes un izmainītas krāsas urīns), bet nav jāaprobežojas ar tiem.
Jāatzīmē arī neparastas atbildes reakcijas attiecībā uz ķermeņa stāvokli, aktivitātes līmeni (piemēram, samazināta vai pastiprināta standartiežogojuma pētīšana) un kustību koordināciju. Jāreģistrē izmaiņas gaitā (piemēram, gāzelēšanās, ataksija), stājā (piemēram, sakumpusi mugura) un reaģēšanā uz manipulācijām, novietošanu vai citiem vides stimuliem, kā arī klonisko vai tonisko kustību esamība, krampji vai drebēšana, stereotipi (piemēram, pārmērīga kopšanās, neparastas galvas kustības, atkārtota griešanās) vai dīvaina izturēšanās (piemēram, košana vai pārmērīga laizīšana, pašsakropļošanās, staigāšana atpakaļvirzienā, skaņu izdošana) vai agresija.
1.6.1.3. Funkcionālie testi
Tāpat kā sīki klīniskie novērojumi arī funkcionālie testi ir jāizdara vienreiz pirms iedarbības un bieži pēc tās visiem dzīvniekiem, kas šim nolūkam izraudzīti (skatīt 1. tabulu). Funkcionālās testēšanas biežums arī ir atkarīgs no pētījuma ilguma (skatīt 2. tabulu). Papildus novērošanas periodiem, kas norādīti 2. tabulā, funkcionālie atveseļošanās satelītgrupu novērojumi arī jāveic iespējami tuvu nogalināšanas laikam. Funkcionālajiem testiem jāiekļauj sensorā reaktivitāte uz dažādu modalitāšu stimuliem (piemēram, dzirdes, redzes un proprioceptīvajiem stimuliem (5) (6) (7)), ekstremitāšu tvērējstipruma vērtējums (8) un kustību aktivitātes vērtējums (9). Kustību aktivitāte jāmēra ar automatizētu ierīci, kas var konstatēt aktivitātes palielinājumus un samazinājumus. Ja izmanto citu noteiktu sistēmu, tai jābūt kvantitatīvai un ir jāparāda tās jutība un ticamība. Katra ierīce ir jātestē, lai nodrošinātu tās ticamību laika gaitā un atbilstību starp ierīcēm. Sīkāki dati par procedūrām, kuras var izmantot, ir sniegti attiecīgajā literatūras sarakstā. Ja nav datu (piemēram, struktūras–aktivitātes dati, epidemioloģiskie dati, citi toksikoloģiskie pētījumi), kas norādītu uz potenciālām neirotoksiskām iedarbībām, ir jāapsver specializētāku sensorās un kustību funkcijas vai mācīšanās un atmiņas testu iekļaušana, lai iespējamās iedarbības izpētītu sīkāk. Vairāk informācijas par specializētiem testiem un to izmantošanu ir sniegts literatūras sarakstā (1).
Izņēmuma gadījumā dzīvniekiem, kas uzrāda toksicitātes pazīmes tādā mērā, kas būtiski traucē funkcionālo testu, attiecīgo testu var neizdarīt. Dzīvnieku izslēgšana no funkcionālā testa ir jāpamato.
1.6.2. Ķermeņa svars un barības/ūdens patēriņš
Līdz 90 dienu ilgos pētījumos dzīvnieki jāsver vismaz reizi nedēļā un vismaz reizi nedēļā ir jāmēra barības patēriņš (ja testējamo vielu ievada ar ūdeni, jāmēra ūdens patēriņš). Ilgtermiņa pētījumos visi dzīvnieki pirmo 13 nedēļu laikā ir jāsver vismaz reizi nedēļā un pēc tam vismaz vienreiz katrās četrās nedēļās. Izmēģinājuma pirmo 13 nedēļu laikā barības patēriņš (ūdens patēriņš, ja testējamo vielu ievada ar dzeramo ūdeni) jāmēra vismaz katru nedēļu un pēc tam apmēram ik pēc trim mēnešiem, ja vien veselības stāvokļa vai ķermeņa svara izmaiņu dēļ nav jārīkojas citādi.
1.6.3. Oftalmoloģija
Pētījumos, kas ilgāki par 28 dienām, pirms testējamās vielas ievadīšanas un pētījuma beigās jāveic, ja ne visu dzīvnieku, tad vismaz to, kas saņēmuši lielāko devu, un kontroles dzīvnieku oftalmoloģiskā izmeklēšana, izmantojot oftalmoskopu vai piemērotu līdzvērtīgu aparātu. Ja konstatē izmaiņas acīs vai ja klīnisko pazīmju dēļ ir vajadzīgs, jāizmeklē visi dzīvnieki. Ilgtermiņa pētījumos arī oftalmoloģiskā izmeklēšana jāveic ar 13 nedēļu starplaikiem. Oftalmoloģiskā izmeklēšana nav jāizdara, ja attiecīgie dati jau ir pieejami no citiem līdzīga ilguma un līdzīgu devu līmeņu pētījumiem.
1.6.4. Hematoloģija un klīniskā bioķīmija
Ja neirotoksicitātes pētījumu veic apvienojumā ar atkārtotās devas sistēmiskās toksicitātes pētījumu, hematoloģiskie izmeklējumi un klīniskās bioķīmijas noteikšana ir jāizdara, kā norādīts sistēmiskās toksicitātes pētījuma attiecīgajā metodē. Paraugu vākšana ir jāizdara tā, lai iespējami samazinātu potenciālo iedarbību uz neiroizturēšanos.
1.6.5. Histopatoloģija
Neiropatoloģiskā apskate ir jāplāno, lai papildinātu un paplašinātu pētījuma in vivo fāzes laikā izdarītos novērojumus. Audi no vismaz pieciem dzīvniekiem uz dzimumu katrā grupā (skatīt 1. tabulu un nākamo daļu) ir jāfiksē in situ, izmantojot vispāratzītas perfūzijas un fiksācijas metodes (skatīt literatūras saraksta (3) 5. nodaļu un literatūras saraksta (4) 50. nodaļu). Jāreģistrē novērotās makroskopiskās izmaiņas. Ja pētījumu veic kā atsevišķu skrīninga pētījumu attiecībā uz neirotoksicitāti vai lai raksturotu neirotoksiskās iedarbības, atlikušos dzīvniekus var izmantot specifiskiem neiroizturēšanās (10) (11), neiropatoloģiskām (10) (11) (12) (13), neiroķīmiskām (10) (11) (14) (15) vai elektrofizioloģiskām (10) (11) (16) (17) procedūrām, kas var papildināt šeit aprakstītās procedūras un izmeklējumus, vai arī palielināt histopatoloģiski apskatīto dzīvnieku skaitu. Papildu procedūras ir īpaši noderīgas, ja empīriskie novērojumi vai sagaidāmās iedarbības norāda uz ķīmiskās vielas neirotoksicitātes konkrētu veidu vai mērķi (2) (3). Alternatīvi atlikušos dzīvniekus var izmantot arī parastai patoloģijas novērtēšanai, kā aprakstīts atkārtotās devas pētījumu metodē.
Vispārējas iekrāsošanas procedūra, piemēram, ar hematoksilīnu un eozīnu (H&E), ir jāizdara visiem audu paraugiem, kas aplieti ar parafīnu, un jāizdara apskate mikroskopā. Ja ir novērotas perifērās neiropātijas pazīmes vai par tām ir aizdomas, ir jāizdara ar plastmasu pārklātu perifēro nervu paraugu izmeklēšana. Klīniskās pazīmes var rosināt izmeklēt arī citas vietas vai izmantot īpašas iekrāsošanas procedūras. Norādījumus par izmeklējamām papildu vietām var atrast (3) (4). Lai parādītu konkrētus patoloģisko izmaiņu veidus, var būt noderīgi arī atbilstoši īpaši iekrāsojumi (18).
Histoloģiski jāizmeklē reprezentatīvas centrālās un perifērās nervu sistēmas daļas (skatīt literatūras saraksta (3) 5. nodaļu un literatūras saraksta (4) 50. nodaļu). Izmeklējamo vietu skaitā parasti jāiekļauj – priekšējās smadzenes, lielo smadzeņu centrs, iekļaujot griezumu caur hipokampu, vidējās smadzenes, smadzenītes, tilts, garenās smadzenes, acs ar acs nervu un tīkleni, muguras smadzenes kakla un muguras paresninājumos, dorsālās saknītes gangliji, dorsālās un vēdera saknes šķiedras, proksimālais sēžas nervs, proksimālais tibiālais nervs (pie ceļa) un tibiālā nerva apakšstilba muskuļa zari. Muguras smadzeņu un perifēro nervu griezumiem jāiekļauj šķērsgriezums un garengriezums. Jāpievērš uzmanība nervu sistēmas asinsvadu tīklam. Jāapskata arī skeleta muskuļa, jo īpaši apakšstilba muskuļa paraugs. Īpaša uzmanība jāpievērš vietām ar šūnu un šķiedru struktūru un īpašībām centrālajā nervu sistēmā un perifērajā nervu sistēmā, kas ir zināmas kā īpaši iedarbīgas uz neirotoksiskām vielām.
Norādījumi par neiropatoloģiskām izmaiņām, ko parasti rada toksisko vielu iedarbība, ir atrodami literatūras sarakstā (3) (4). Ir ieteicama audu paraugu pakāpeniska apskate, kurā griezumus no lielākās devas grupas vispirms salīdzina ar kontroles grupas griezumiem. Ja paraugos no šīm grupām neiropatoloģiskas izmaiņas nav novērojamas, turpmāka analīze nav vajadzīga. Ja lielākās devas grupā novērotas neiropatoloģiskas izmaiņas, potenciāli ietekmēto audu paraugi no vidējās un mazākās devas grupām ir jākodē un secīgi jāizmeklē.
Ja kvalitatīvajā izmeklēšanā ir atrasti neiropatoloģisku izmaiņu pierādījumi, jāveic otra izmeklēšana visos nervu sistēmas apvidos, kuros parādījušās izmaiņas. Griezumus no katra potenciāli cietušā apvidus visās devu grupās ir jākodē un jāizmeklē pēc nejaušās izvēles, nezinot kodu. Katra bojājuma biežums un smagums ir jāreģistrē. Pēc tam, kad visi apvidi no visām devu grupām ir novērtēti, kodu var atklāt un izdarīt statistisko analīzi, lai novērtētu devas sakarību ar atbildes reakciju. Jāapraksta katra bojājuma dažādās smaguma pakāpes.
Neiropatoloģiskie rezultāti jānovērtē izturēšanās novērojumu un mērījumu, kā arī citu datu no iepriekšējiem un vienlaicīgiem sistēmiskās toksicitātes pētījumiem kontekstā.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Jānorāda dati par atsevišķiem dzīvniekiem. Turklāt visi dati jāapkopo tabulas veidā, katrai testa vai kontroles grupai parādot dzīvnieku skaitu testa sākumā, dzīvnieku skaitu, kas testa laikā ir nobeigušies vai humānu apsvērumu dēļ nogalināti, un katras nobeigšanās vai humānas nogalināšanas laiku, dzīvnieku skaitu, kam novērotas toksicitātes pazīmes, novēroto toksicitātes pazīmju aprakstu, iekļaujot toksisko iedarbību sākuma laiku, ilgumu un smagumu, dzīvnieku skaitu, kam novēroti audu bojājumi, iekļaujot bojājumu veidus un smagumu.
2.2. REZULTĀTU NOVĒRTĒŠANA UN INTERPRETĀCIJA
Pētījuma rezultāti jāvērtē neiroizturēšanās un neiropatoloģisko iedarbību (arī neiroķīmisko vai elektrofizoloģisko iedarbību, ja ir iekļauti papildu izmeklējumi), kā arī citu novēroto kaitīgo iedarbību biežuma, smaguma un korelāciju izteiksmē. Ja iespējams, skaitliskie rezultāti jānovērtē ar piemērotu un vispārpieņemtu statistikas metodi. Statistikas metodes jāizvēlas, plānojot pētījumu.
3. PĀRSKATA SAGATAVOŠANA
3.1. PĀRSKATS PAR TESTU
Pārskatā par testu jābūt iekļautai šādai informācijai.
Testējamā viela:
— fizikālās īpašības (iekļaujot izomērismu, tīrību un fizikāli ķīmiskās īpašības),
— identifikācijas dati.
Nesējs (attiecīgā gadījumā):
— nesēja izvēles pamatojums.
Testa dzīvnieki:
— izmantotā suga/līnija,
— dzīvnieku skaits, vecums un dzimums,
— izcelsme, turēšanas apstākļi, aklimatizācija, barība utt.,
— atsevišķo dzīvnieku svars testa sākumā.
Testa apstākļi:
— sīkas ziņas par testējamās vielas preparāta/barības sagatavošanu, iegūto koncentrāciju, stabilitāti un homogenitāti,
— ievadīto devu specifikācija, iekļaujot sīkas ziņas par ievadītā materiāla nesēju, tilpumu un fizikālo formu,
— sīkas ziņas par testējamās vielas ievadīšanu,
— izraudzīto devu līmeņu pamatojums,
— iedarbības veida un ilguma pamatojums,
— testējamās vielas koncentrācijas (milj. daļas) barībā vai dzeramajā ūdenī pārrēķins faktiskajā dienas devā (mg/kg ķermeņa svara dienā) attiecīgā gadījumā,
— sīkas ziņas par barības un ūdens kvalitāti.
Novērojumu un testa procedūras:
— sīki dati par katras grupas dzīvnieku iedalīšanu perfūzijas apakšgrupās,
— sīki dati par vērtēšanas sistēmām, iekļaujot katra mērījuma kritērijus un vērtēšanas skalas sīki izstrādātos klīniskajos novērojumos,
— sīki funkcionālo testu dati par sensoro reaktivitāti uz dažādu modalitāšu stimuliem (piemēram, dzirdes, redzes un proprioceptīvajiem stimuliem); par ekstremitāšu tvēriena stipruma novērtējumu; par kustību aktivitātes vērtējumu (iekļaujot sīkus aktivitātes konstatēšanas automātisko ierīču datus); citas izmantotās procedūras,
— sīki oftalmoloģisko izmeklējumu dati un attiecīgā gadījumā hematoloģiskie izmeklējumi un klīniskās bioķīmijas testi ar attiecīgām bāzes līnijas vērtībām,
— sīki dati par konkrētām neiroizturēšanās, neiropatoloģijas, neiroķīmiskām vai elektrofizioloģiskām procedūrām.
Rezultāti:
— ķermeņa svars/ķermeņa svara izmaiņas, iekļaujot ķermeņa svaru pie nogalināšanas,
— barības patēriņš un attiecīgā gadījumā ūdens patēriņš,
— dati par toksisko atbildes reakciju pa dzimumiem un devu līmeņiem, iekļaujot toksicitātes pazīmes vai mirstību,
— sīki izstrādātu klīnisko novērojumu (atgriezenisku vai neatgriezenisku) raksturs, smagums un ilgums (parādīšanās laiks un turpmākā gaita),
— visu funkcionālo testu rezultātu sīks apraksts,
— autopsijas rezultāti,
— visu neiroizturēšanās, neiropatoloģijas un neiroķīmisko vai elektrofizioloģisko rezultātu sīks apraksts, ja tie pieejami,
— uzsūkšanās un metabolisma dati, ja tie ir pieejami,
— rezultātu statistiskā apstrāde attiecīgā gadījumā.
Rezultātu izvērtējums:
— informācija par atbildes reakciju uz devu,
— citu toksisko iedarbību sakarība ar secinājumu par testējamās ķīmiskās vielas neirotoksisko potenciālu,
— nenovērojamas nelabvēlīgas ietekmes līmenis.
Secinājumi:
— ir vēlams konkrēts paziņojums par testējamās ķīmiskās vielas vispārējo neirotoksicitāti.
4. IZMANTOTĀ LITERATŪRA
(1) OECD Giudance Document on Neurotoxicity Testing Strategies and Test Methods. OECD, Paris, In Preparation.
(2) Test Guideline for a Developmental Neurotoxicity Study, OECD Guidelines for the Testing of Chemicals. In preparation.
(3) World Health Organisation (WHO) (1986). Environmental Health Criteria document 60: Principles and Methods for the Assessment of Neurotoxicity associated with Exposure to Chemicals.
(4) Spencer, P.S. and Schaumburg, H.H. (1980). Experimental and Clinical Neurotoxicology. Eds. Spencer, P.S. and Schaumburg, H.H. eds. Williams and Wilkins, Baltimore/London.
(5) Tupper, D.E. and Wallace, R.B. (1980). Utility of the Neurological Examination in Rats. Acta Neurobiol. Exp., 40, p. 999–1003.
(6) Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, p. 691–704.
(7) Moser, V.C., McDaniel, K.M. and Phillips, P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of amitraz. Toxic. Appl. Pharmacol., 108, p. 267–283.
(8) Meyer, O.A., Tilson, H.A., Byrd, W.C. and Riley, M.T. (1979). A Method for the Routine Assessment of Fore- and Hind- limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, p. 233–236.
(9) Crofton, K.M., Haward, J.L., Moser, V.C., Gill, M.W., Reirer, L.W., Tilson, H.A. and MacPhail, R.C. (1991) Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, p. 599–609.
(10) Tilson, H.A., and Mitchell, C.L. eds. (1992). Neurotoxicology Target Organ Toxicology Series. Raven Press, New York.
(11) Chang, L.W., ed. (1995). Principles of Neurotoxicology. Marcel Dekker, New York.
(12) Broxup, B. (1991). Neuopathology as a screen for Neurotoxicity Assessment. J. Amer. Coll. Toxicol., 10, p. 689–695.
(13) Moser, V.C., Anthony, D.C., Sette, W.F. and MacPhail, R.C. (1992). Comparison of Subchronic Neurotoxicity of 2-Hydroxyethyl Acrylate and Acrylamide in Rats. Fund. Appl.Toxicol., 18, 343–352.
(14) O'Callaghan, J.P. (1988). Neurotypic and Gliotypic Proteins as Biochemical Markers of Neurotoxicity. Eurotoxicol. Teratol., 10, p. 445–452.
(15) O'Callaghan J.P. and Miller, D.B. (1988). Acute Exposure of the Neonatal Rat to Triethyltin Results in Persistent Changes in Neurotypic and Gliotypic Proteins. J. Pharmacol. Exp. Ther., 244, p. 368–378.
(16) Fox. D.A., Lowndes, H.E. and Birkamper, G.G. (1982). Electrophysiological Techniques in Neurotoxicology. In: Nervous System Toxicology. Mitchell, C.L. ed. Raven Press, New York, p. 299–335.
(17) Johnson, B.L. (1980). Electrophysiological Methods in neurotoxicity Testing. In: Experimental and Clinical Neurotoxicology. Spencer, P.S. and Schaumburg, H.H. eds., Williams and Wilkins Co.,. Baltimore/London, p. 726–742.
(18) Bancroft, J.D. and Steven A. (1990). Theory and Pratice of Histological Techniques. Chapter 17, Neuropathological Techniques. Lowe, James and Cox, Gordon eds. Churchill Livingstone.
1. tabula
Minimālais grupā vajadzīgais dzīvnieku skaits, ja neirotoksicitātes pētījumu veic atsevišķi vai apvienojumā ar citiem pētījumiem
|
NEIROTOKSICITĀTES PĒTĪJUMU VEIC KĀ |
||||
|
atsevišķu pētījumu |
apvienotu pētījumu ar 28 dienu pētījumu |
apvienotu pētījumu ar 90 dienu pētījumu |
apvienotu pētījumu ar hroniskās toksicitātes pētījumu |
|
|
Kopējais dzīvnieku skaits grupā |
10 sievišķā un 10 vīrišķā dzimuma dzīvnieki |
10 sievišķā un 10 vīrišķā dzimuma dzīvnieki |
15 sievišķā un 15 vīrišķā dzimuma dzīvnieki |
25 sievišķā un 25 vīrišķā dzimuma dzīvnieki |
|
Dzīvnieku skaits, kas izraudzīts funkcionālajai testēšanai, iekļaujot sīki izstrādātus klīniskos novērojumus |
10 sievišķā un 10 vīrišķā dzimuma dzīvnieki |
10 sievišķā un 10 vīrišķā dzimuma dzīvnieki |
10 sievišķā un 10 vīrišķā dzimuma dzīvnieki |
10 sievišķā un 10 vīrišķā dzimuma dzīvnieki |
|
Dzīvnieku skaits, kas izraudzīts perfūzijai in situ un neirohistopatoloģijai |
5 sievišķā un 5 vīrišķā dzimuma dzīvnieki |
5 sievišķā un 5 vīrišķā dzimuma dzīvnieki |
5 sievišķā un 5 vīrišķā dzimuma dzīvnieki |
5 sievišķā un 5 vīrišķā dzimuma dzīvnieki |
|
Dzīvnieku skaits, kas izraudzīts atkārtotās devas/subhroniskās/hroniskās toksicitātes novērojumiem, hematoloģijai, klīniskajai bioķīmijai, histopatoloģijai utt., kā norādīts attiecīgajos Norādījumos |
5 sievišķā un 5 vīrišķā dzimuma dzīvnieki |
|||
|
Papildu novērojumi attiecīgā gadījumā |
5 sievišķā un 5 vīrišķā dzimuma dzīvnieki |
|||
|
† – Iekļauj piecus dzīvniekus, kas izraudzīti funkcionālajai testēšanai un sīki izstrādātiem klīniskajiem novērojumiem kā daļa no neirotoksicitātes pētījuma. |
||||
2. tabula
Klīnisko novērojumu un funkcionālo testu biežums
|
Novērojumu veids |
Pētījuma ilgums |
||||
|
Akūts |
28 dienas |
90 dienas |
Hronisks |
||
|
Visiem dzīvniekiem |
Vispārējais veselības stāvoklis |
katru dienu |
katru dienu |
katru dienu |
katru dienu |
|
Mirstība/saslimstība |
divreiz dienā |
divreiz dienā |
divreiz dienā |
divreiz dienā |
|
|
Dzīvniekiem, kas izraudzīti funkcionālajiem novērojumiem |
Sīki izstrādāti klīniskie novērojumi |
— pirms pirmās iedarbības — 8 stundu laikā pēc dozēšanas aplēstajā maksimālā efekta laikā — 7. un 14. dienā pēc dozēšanas |
— pirms pirmās iedarbības — pēc tam reizi nedēļā |
— pirms pirmās iedarbības — vienreiz iedarbības pirmās vai otrās nedēļas laikā — pēc tam reizi mēnesī |
— pirms pirmās iedarbības — vienreiz iedarbības pirmā mēneša laikā — pēc tam reizi trijos mēnešos |
|
Funkcionalitātes testi |
— pirms pirmās iedarbības — 8 stundu laikā pēc dozēšanas aplēstajā maksimālā efekta laikā — 7. un 14. dienā pēc dozēšanas |
— pirms pirmās iedarbības — vielas saņemšanas ceturtās nedēļas laikā iespējami tuvu iedarbības laika posma beigām |
— pirms pirmās iedarbības — vienreiz iedarbības pirmās vai otrās nedēļas laikā — pēc tam reizi mēnesī |
— pirms pirmās iedarbības — vienreiz iedarbības pirmā mēneša laikā — pēc tam reizi trijos mēnešos |
|
B.44. ABSORBCIJA ĀDĀ: IN VIVO METODE
1. METODE
Šī testēšanas metode ir ekvivalenta ESAO TG 427 (2004) metodei.
1.1. IEVADS
Daudzu ķīmisko vielu iedarbība notiek, uzsūcoties galvenokārt caur ādu, tomēr toksikoloģijas pētījumos ar laboratorijas dzīvniekiem tās ievada orāli. Perkutānās absorbcijas in vivo izmēģinājumā saskaņā ar šiem norādījumiem nodrošina sakarību, kas nepieciešama to rezultātu ekstrapolācijai, kas iegūti izmēģinājumos, ievadot orāli, lai novērtētu vielas drošumu, tai nokļūstot uz ādas.
Vielai jāiziet cauri daudziem ādas šūnu slāņiem, tikai pēc tam tā sasniedz asinsriti. Lielākajai daļai vielu uzsūkšanās ātrumu nosaka stratum corneum, kas sastāv no nedzīvām šūnām. Ādas caurlaidība ir atkarīga gan no ķīmiskās vielas lipofilajām īpašībām un ārējā epidermas slāņa biezuma, gan no tādiem faktoriem kā vielas molekulmasa un tās koncentrācija. Parasti žurku un trušu ādai ir lielāka caurlaidība salīdzinājumā ar cilvēka ādu, bet jūrascūciņu un pērtiķu āda ir vairāk līdzīga cilvēka ādai.
Perkutānās absorbcijas noteikšanas metodes var iedalīt divās grupās: izmēģinājumi in vivo un in vitro. Pēc in vivo metodēm var iegūt ticamu informāciju par absorbciju caur dažādu laboratorijas dzīvnieku sugu ādu. Par tām jaunākas ir in vitro metodes. Pēc šīm metodēm nosaka vielas pārnesi caur pilna vai daļēja biezuma dzīvnieka vai cilvēka ādu uz šķidruma savācēju. In vitro metode ir aprakstīta kā atsevišķa testēšanas metode (1). Izvēloties metodi, kas būtu konkrētajai situācijai piemērotākā, ieteicams izmantot ESAO Norādījumus par izmēģinājumu veikšanu vielu absorbcijas ādā noteikšanai (2), jo šajā dokumentā ir sīkāka informācija par in vivo un in vitro metožu piemērotību.
Pēc šeit aprakstītās in vivo metodes iespējams noteikt testējamās vielas penetrāciju caur ādu uz testa sistēmas savācēju. Metodika tika plaši izmantota daudzus gadus (3) (4) (5) (6) (7). Kaut gan perkutānās absorbcijas in vitro izmēģinājumus var izmantot daudzos gadījumos, tomēr iespējamas arī situācijas, kurās nepieciešamo informāciju var iegūt tikai izmēģinājumos in vivo.
Šīs in vivo metodes priekšrocība ir tāda, ka izmanto fizioloģiski un metaboliski neskartu sistēmu, izmēģinājumus veic ar tādu sugu dzīvniekiem, kuras izmanto daudzos toksicitātes pētījumos, un to var pielāgot citu sugu izmantošanai. Metodes trūkumi ir dzīvu dzīvnieku izmantošana, nepieciešamība izmantot ar radioizotopiem iezīmētus materiālus ticamu rezultātu iegūšanai, grūtības noteikt absorbcijas sākumu, kā arī izmēģinājumos visvairāk izmantojamās sugas dzīvnieku (žurkas) un cilvēka ādas caurlaidības atšķirības. Dzīvnieka ādai parasti ir lielāka caurlaidība, tāpēc tādā veidā noteikta cilvēka ādas perkutānā absorbcija var tikt novērtēta par augstu (6) (8) (9). Kodīgu/erozīvu vielu testēšanu nedrīkst veikt izmēģinājumos ar dzīviem dzīvniekiem.
1.2. DEFINĪCIJAS
Neabsorbētā deva: vielas daudzums, kas nomazgāts no ādas virsmas pēc ekspozīcijas, vielas daudzums uz neokluzīvā pārklājuma, kā arī daudzums, kas, kā pierāda mērījumi, iztvaiko no ādas ekspozīcijas laikā.
Absorbētā deva (in vivo ): vielas kopējais daudzums dzīvnieka urīnā, būra mazgājamā ūdenī, ekskrementos, izelpotajā gaisā (ja to mēra), asinīs, audos (ja tos ievāc) un ķermenī pēc aplicēšanas vietas ādas noņemšanas.
Absorbējamā deva: vielas daudzums, kas paliek uz ādas vai ādā pēc nomazgāšanas.
1.3. TESTĒŠANAS METODES PRINCIPS
Testējamo vielu, ko vēlams iezīmēt ar radioizotopiem, aplicē uz dzīvnieku ādas, no kuras nocirpta spalva, vienā vai vairākos atbilstošos devu līmeņos veidā, kas ir “lietošanā esošam” preparātam reprezentatīvs. Testējamo preparātu noteiktu laika periodu iztur kontaktā ar ādu ar piemērotu pārklājumu (neokluzīvs, pusokluzīvs vai okluzīvs), lai nepieļautu tā nolaizīšanu. Beidzoties ekspozīcijas laikam, pārklājumu noņem un ādu notīra ar piemērotu tīrāmo vielu, bet pārklājumu un tīrāmos materiālus saglabā analīzei un uzliek jaunu pārklājumu. Pirms ekspozīcijas, tās laikā un pēc tam dzīvniekus tur individuālos metabolisma pētīšanas būros, un šajos termiņos analīzēm ņem ekskrementu un izelpotā gaisa paraugus. Izelpotā gaisa paraugus var neņemt, ja ir pietiekama informācija, ka veidojas maz radioaktīvā metabolīta vai tas neveidojas vispār. Katrā eksperimentā parasti jāizmanto vairākas dzīvnieku grupas, kuras pakļauj testējamā preparāta iedarbībai. Vienas grupas dzīvniekus pēc vielas ekspozīcijas nogalina. Pārējo grupu dzīvniekus nogalina noteiktos termiņos pēc tam (2). Beidzoties paraugu ņemšanas laikam, nogalina pārējos dzīvniekus, ņem asinis analīzēm, atdala aplicēšanas vietu analīzēm un analizē ķermeni, lai noteiktu neizdalītā materiāla daudzumu. Paraugus analizē ar piemērotiem līdzekļiem un nosaka perkutānās absorbcijas līmeni (6) (8) (9).
1.4. METODES APRAKSTS
1.4.1. Dzīvnieku sugas izvēle
Žurkas ir visplašāk izmantojamā suga, bet var izmantot arī līnijas un sugas, kurām nav apmatojuma, jo to absorbcijas raksturlielumi ir līdzīgāki cilvēka ādai (3) (6) (7) (8) (9). Jāizmanto jauni pieauguši veselīgi viena dzimuma (parasti vīrišķā) dzīvnieki no parasti izmantojamām laboratorijas līnijām. Uzsākot eksperimentu, atsevišķo dzīvnieku ķermeņa masai jābūt ± 20 % no vidējās masas. Piemēram, var izmantot vīrišķā dzimuma žurkas, kuru ķermeņa masa ir 200–250 g, it sevišķi šā diapazona augšgalā.
1.4.2. Dzīvnieku skaits un dzimums
Katra testējamā preparāta testēšanai vienam paraugu ņemšanas termiņam, kurā dzīvniekus nogalina, jāizmanto vismaz četru viena dzimuma dzīvnieku grupa. Katras grupas dzīvniekus nogalina pēc cita laika intervāla, piemēram, ekspozīcijas perioda beigās (parasti pēc 6 vai 24 stundām) un vēlāk (piemēram, pēc 48 un 72 stundām). Ja ir informācija, kas liecina par toksicitātes būtiskām atšķirībām vīrišķā un sievišķā dzimuma īpatņu starpā, jāizvēlas jutīgākais dzimums. Ja šādas informācijas nav, izmēģinājumiem var izmantot jebkura viena dzimuma dzīvniekus.
1.4.3. Turēšanas un barošanas apstākļi
Gaisa temperatūrai telpās, kurās tur izmēģinājuma dzīvniekus, jābūt 22 oC (± 3 oC). Lai gan gaisa relatīvajam mitrumam jābūt vismaz 30 % un, ieteicams, ne vairāk kā 70 %, izņemot uzkopšanas laiku, relatīvā mitruma mērķa vērtība ir 50–60 %. Dzīvniekus 12 stundas diennaktī tur mākslīgā apgaismojumā, bet 12 stundas tumsā. Barošanai var izmantot parasto laboratorijas dzīvnieku barību, tai un dzeramajam ūdenim bez ierobežojumiem jābūt brīvi pieejamai. Izmēģinājuma laikā un, vēlams, arī aklimatizācijas laikā dzīvniekus tur atsevišķos, metabolisma pētīšanai paredzētos būros. Barības izmētāšana un ūdens izliešana ietekmē izmēģinājuma rezultātus, tāpēc tā iespējami jānovērš.
1.4.4. Dzīvnieku sagatavošana
Dzīvniekus marķē, lai nodrošinātu to identifikāciju, un aklimatizācijai laboratorijas apstākļiem tur būros vismaz piecas dienas pirms izmēģinājuma sākšanas.
Pēc aklimatizācijas perioda un aptuveni 24 stundas pirms devas aplicēšanas katram dzīvniekam ķermeņa plecu un muguras daļā jābūt nocirptam apmatojumam. Bojātas ādas caurlaidības īpašības atšķiras no nebojātas ādas īpašībām, tāpēc jāuzmanās, lai ādu nenobrāztu. Pēc cirpšanas un aptuveni 24 stundas pirms testējamās vielas aplicēšanas (skatīt 1.4.7. punktu) ādas virsma jānoslauka ar acetonu, lai noņemtu tauku dziedzeru izdalījumus. Papildu mazgāšana ar ziepēm un ūdeni nav ieteicama, jo ziepju paliekas var veicināt testējamās vielas absorbciju. Vietai jābūt pietiekami lielai, lai iegūtu ticamus rezultātus, aprēķinot absorbēto testējamās vielas daudzumu uz 1 cm2 ādas, ieteicamā platība ir vismaz 10 cm2. Šāda platība ir iespējama, ja izmanto žurkas ar ķermeņa masu 200–250 g. Pēc sagatavošanas dzīvniekus atkal ievieto metabolisma pētīšanas būros.
1.4.5. Testējamā viela
Testējamā viela ir materiāls, kura penetrācijas raksturlielumi jāizpēta. Ideālā gadījumā testējamajai vielai jābūt iezīmētai ar radioizotopiem.
1.4.6. Testējamās vielas sagatavošana
Testējamās vielas preparātam (piemēram, tīram, atšķaidītam vai salikta sastāva materiālam, kas satur testējamo vielu un tiek aplicēts uz ādas) jābūt tam pašam (vai faktiski tādam pašam), kura iedarbībai var tikt pakļauti cilvēki vai, iespējams, citas mērķa sugas. Jebkādas atkāpes no izmantojamā “lietošanā esošā” preparāta jāpamato. Ja vajadzīgs, testējamo vielu izšķīdina vai suspendē piemērotā nesējā. Ja izmanto nevis ūdeni, bet citus nesējus, jābūt zināmiem to uzsūkšanās raksturlielumiem un datiem par iespējamo savstarpējo iedarbību ar testējamo vielu.
1.4.7. Aplicēšana uz ādas
Uz ādas virsmas izvēlas attiecīgas platības aplicēšanas vietu. Zināmu testējamā preparāta daudzumu vienmērīgi uzklāj attiecīgajā vietā. Šim daudzumam jāatveido potenciālais cilvēka lietojamais daudzums, parasti 1–5 mg/cm2 cietai vielai vai līdz 10 μl/cm2 šķidrumiem. Jebkāds cits daudzums jāpamato ar sagaidāmiem lietošanas apstākļiem, eksperimenta mērķiem vai testējamā preparāta fizikālajām īpašībām. Pēc vielas aplicēšanas apstrādātā vieta jāaizsargā pret nolaizīšanu. Tipisks līdzeklis ir parādīts 1. attēlā. Parasti aplicēšanas vietu aizsargā ar neokluzīvu pārklājumu (piemēram, ar gaisu caurlaidīgu pārklājumu no neilona sietiņa). Tomēr ilgstošas aplicēšanas gadījumā aplicēšanas vieta jāaizsargā ar okluzīvu līdzekli. Ja daļēji gaistošas testējamās vielas iztvaikošanas rezultātā testējamās vielas atgūstamība samazinās zemāk par pieņemamo līmeni (skatīt arī 1.4.10. punkta pirmo daļu), iztvaikojusī viela jāuztver ar ogles filtru uz aplicēšanas ierīces (skatīt 1. attēlu). Svarīgi, lai šīs ierīces nebojātu ādu, neabsorbētu testējamo preparātu un ar to nereaģētu. Dzīvniekus atkal ieliek individuālajos metabolisma pētīšanas būros, lai savāktu ekskrētus.
1.4.8. Ekspozīcijas ilgums un paraugu ņemšana
Ekspozīcijas ilgums ir laika periods starp aplicēšanu un testējamā preparāta noņemšanu, skalojot ādu. Jāpielieto attiecīgais ekspozīcijas periods (parasti 6 vai 24 stundas), pamatojoties uz sagaidāmo ekspozīcijas ilgumu cilvēkam. Pēc ekspozīcijas laika beigām dzīvniekus tur metabolisma būros līdz noteiktajam paraugu ņemšanas termiņam, kad tos nogalina. Dzīvnieki jānovēro, lai konstatētu toksicitātes/uzvedības anomāliju pazīmes regulāros intervālos visā izmēģinājuma laikā. Ekspozīcijas perioda beigās apstrādātā āda jānovēro, vai nav redzamu kairinājuma pazīmju.
Metabolisma pētīšanas būriem jābūt tādiem, lai varētu atsevišķi savākt urīnu un ekskrementus visā eksperimenta laikā. Būru konstrukcijai jānodrošina iespējas uztvert ar 14C izotopu iezīmētu oglekļa dioksīdu un 14C gaistošos oglekļa savienojumus, kuri jāanalizē, ja tie veidojas zināmā daudzumā (> 5 %). Urīns, ekskrementi un uztveramās vielas (piemēram, ar 14C izotopu iezīmēts oglekļa dioksīds un 14C gaistošie oglekļa savienojumi) jāsavāc atsevišķi no katras grupas katrā paraugu ņemšanas reizē. Ja ir pietiekama informācija par to, ka radioaktīvais metabolīts veidojas maz vai neveidojas vispār, tad var izmantot vaļējus būrus.
Ekskrētus savāc ekspozīcijas laikā pēc 24 stundām no sākotnējā kontakta ar ādu un pēc tam katru dienu līdz izmēģinājuma beigām. Parasti pietiek ar trijiem ekskrētu savākšanas intervāliem, tomēr, ņemot vērā paredzēto testējamā preparāta lietojumu vai esošos datus par kinētiku, eksperimentam var noteikt piemērotākos vai papildu laika intervālus.
Ekspozīcijas laika beigās aizsargpārklājumu no dzīvnieka noņem un katru atsevišķi glabā analīzei. Visu dzīvnieku apstrādātā āda jānoskalo vismaz trīs reizes ar tīrāmo līdzekli un piemērotiem tamponiem. Jāievēro piesardzība, lai neaiztiktu pārējās ķermeņa daļas. Tīrīšanas līdzeklim jāatbilst parastai higiēnas praksei, piemēram, jāizmanto ziepju ūdens šķīdums. Beigās āda jānosusina. Visi tamponi un nomazgājumi jāsaglabā analīzei. Pirms dzīvnieka novietošanas atpakaļ būrī uz ādas jāuzliek jauns pārklājums, lai aizsargātu to dzīvnieku apstrādātās vietas, kuri ir iekļauti vēlāku termiņu grupās.
1.4.9. Beigu procedūras
Pēc noteikta termiņa attiecīgās grupas dzīvnieki jānogalina un jāņem asinis analīzei. Aizsargpārklājums jānoņem analīzei. Āda no aplicēšanas vietas un tai piegulošajām neapstrādātajām apcirptajām vietām jānoņem no katra dzīvnieka atsevišķai analīzei. Aplicēšanas vieta jāfrakcionē, atdalot stratum corneum no zem tā esošās epidermas, lai iegūtu vairāk informācijas par testējamās vielas uzsūkšanos. Nosakot uzsūkšanos laikā pēc ekspozīcijas perioda, var iegūt zināmus norādījumus par to, kas notiek ar testējamo vielu, tai nokļūstot stratum corneum. Lai vienkāršotu ādas frakcionēšanu (pēc pēdējās ādas mazgāšanas un dzīvnieka nogalināšanas), jānoņem visi aizsargpārklājumi. Ādu no aplicēšanas vietas kopā ar tai piegulošās ādas gredzenu izgriež no žurkas ķermeņa un piestiprina uz plāksnītes. Uz ādas virsmas piestiprina līmlentes strēmelīti, viegli piespiežot, un līmlenti noņem kopā ar stratum corneum daļu. Šo operāciju atkārto, kamēr strēmelīte vairs nelīp pie ādas virsmas un viss stratum corneum ir noņemts. Atsevišķajam dzīvniekam izmantotās lentes strēmelītes var apvienot vienā traukā ar līdzekli audu mineralizācijai, lai izšķīdinātu stratum corneum. Visus iespējamos mērķa audus var atdalīt atsevišķai analīzei pirms pārējā ķermeņa analīzes, lai noteiktu ķermenī absorbēto devu. Atsevišķo dzīvnieku ķermeņi jāsaglabā analīzei. Parasti veic tikai kopējā satura analīzi. Mērķa orgānus var izņemt atsevišķai analīzei (ja par šādu nepieciešamību liecina citi pētījumi). Urīns, kas atrodas urīnpūslī noteiktajā paraugu ņemšanas laikā, kad dzīvnieku nogalina, jāpievieno iepriekš savāktajam urīnam. Pēc ekskrētu savākšanas metabolisma būris, būri un to uztvērēji pēc paraugu ņemšanas termiņa, kad dzīvniekus nogalina, jāmazgā ar piemērotu šķīdinātāju. Līdzīgā veidā jāizanalizē citas iespējami piesārņotas ierīces.
1.4.10. Analīze
Visos eksperimentos jāpanāk adekvāta atgūstamība (t. i., vidēji 100 ± 10 % no radioaktivitātes). Atgūstamība, kas ir ārpus šā diapazona, ir jāizskaidro. Lietotās devas daudzuma analīze katrā paraugā jāveic pēc attiecīgi validētām procedūrām.
Statistikas rādītājos jāiekļauj visu aplikāciju atsevišķo atkārtojumu rezultātu izkliede.
2. DATI
Visiem dzīvniekiem un katram paraugu ņemšanas laikam jāveic šādi testējamās vielas un/vai metabolītu mērījumi. Šiem individuālajiem datiem papildus jāsniedz apkopoti dati vidējo vērtību veidā pa paraugu ņemšanas laikiem:
— daudzums, kas saistīts ar aizsargpārklājuma ierīcēm,
— daudzums, kuru var noņemt no ādas,
— daudzums uz ādas/ādā, kuru nevar nomazgāt no ādas,
— daudzums asinīs,
— daudzums ekskrementos un izelpotajā gaisā (ja vajadzīgs),
— ķermenī un atsevišķām analīzēm izņemtajos orgānos palikušais daudzums.
Testējamās vielas un/vai metabolīta daudzums ekskrētos, izelpotajā gaisā, asinīs un ķermenī ļauj noteikt kopējo daudzumu, kas tika absorbēts katrā laika periodā. Var aprēķināt arī testējamās vielas daudzumu, kuru absorbē 1 cm2 ādas, kas tika pakļauta testējamās vielas iedarbībai ekspozīcijas laikā.
3. ZIŅOJUMS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jāiekļauj protokolā noteiktās prasības, ieskaitot izmantotās testēšanas sistēmas pamatojumu, un jānorāda turpmāk minētais.
Testējamā viela:
— identifikācijas dati (piemēram, CAS Nr., ja ir; avots; tīrības pakāpe (radioķīmiskā tīrība); zināmie piemaisījumi; ražošanas partijas numurs),
— fizikālais stāvoklis, fizikāli ķīmiskās īpašības (piemēram, pH, gaistamība, šķīdība, stabilitāte, molekulmasa un log Pow).
Testējamais preparāts:
— sastāvs un izmantošanas pamatojums,
— sīkāka informācija par testējamo preparātu, lietoto daudzumu, sasniegto koncentrāciju, nesēju, stabilitāti un homogenitāti.
Izmēģinājuma dzīvnieki:
— izmantotās sugas/līnijas,
— dzīvnieku skaits, vecums un dzimums,
— dzīvnieku izcelsmes avots, turēšanas apstākļi, barošana u. c.,
— katra dzīvnieka ķermeņa masa testēšanas sākumā.
Testa apstākļi:
— informācija par testējamā preparāta lietošanu (aplicēšanas vieta, noteikšanas metodes, (ar oklūziju/bez oklūzijas, apjoms, ekstrakcija, detektēšana),
— barības un ūdens kvalitātātes dati.
Rezultāti
— toksicitātes pazīmes,
— tabulā apkopoti dati par absorbciju (izsakot kā ātrumu, daudzumu vai daļu procentos),
— kopējā atgūstamība eksperimentā,
— rezultātu interpretācija, salīdzinājums ar citiem datiem par testējamā savienojuma perkutānu absorbciju.
Rezultātu novērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Testing Method B.45. Skin Absorption: In vitro Method.
(2) OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris.
(3) ECETOC (1993) Percutaneous Absorption. European Centre for Ecotoxicology and Toxicology of Chemicals, Monograph No 20.
(4) Zendzian RP (1989) Skin Penetration Method suggested for Environmental Protection Agency Requirements. J. Am. Coll. Toxicol. 8(5), p. 829–835.
(5) Kemppainen BW, Reifenrath WG (1990) Methods for skin absorption. CRC Press Boca Raton, FL, USA.
(6) EPA (1992) Dermal Exposure Assessment: Principles and Applications. Exposure Assessment Group, Office of Health and Environmental Assessment.
(7) EPA (1998) Health Effects Test Guidelines, OPPTS 870-7600, Dermal Penetration. Office of Prevention, Pedsticides and Toxic Substances.
(8) Bronaugh RL, Wester RC, Bucks D, Maibach HI and Sarason R (1990) In vivo percutaneous absorption of fragrance ingredients in reshus monkeys and humans. Fd. Chem. Toxic. 28, 369–373.
(9) Feldman RJ and Maibach HI (1970) Absorption of some organic compounds through the skin in man. J. Invest Dermatol. 54, p. 399–404.
1. attēls
Parasti izmantotās ierīces konstrukcija aplicēšanas vietas aprobežošanai un aizsardzībai perkutānas absorbcijas in vivo izmēģinājumos
B.45. ABSORBCIJA ĀDĀ: IN VITRO METODE
1. METODE
Šī testēšanas metode ir ekvivalenta ESAO TG 428 (2004) metodei.
1.1. IEVADS
Šī metode paredzēta informācijas iegūšanai par testējamās vielas absorbciju, to aplicējot uz izgrieztas ādas. Šo metodi var izmantot atsevišķi vai kopā ar in vivo testēšanas metodi (1). Plānojot eksperimentus, kurā tiek izmatota šī metode, ieteicams izmantot ESAO Norādījumus par izmēģinājumu veikšanu vielu absorbcijas ādā noteikšanai (2). Norādījumu dokuments sagatavots, lai atvieglotu konkrētiem apstākļiem piemērotāko in vitro procedūru izvēli un nodrošinātu ticamu rezultātu iegūšanu ar šo metodi.
Absorbcijas ādā un iedarbības caur ādu noteikšanai izmantojamās metodes iedalāmas divās grupās – in vivo un in vitro metodes. In vivo metodes absorbcijas ādā noteikšanai tiek plaši pielietotas un sniedz farmakokinētisko informāciju par vairākām dzīvnieku sugām. In vivo metode ir aprakstīta atsevišķi (1). Arī in vitro metodes daudzus gadus tika pielietotas absorbcijas ādā noteikšanai. Kaut gan šajā testēšanas metodē minēto in vitro metožu formālās validācijas pētījumi netika veikti, ESAO eksperti 1999. gadā ir vienojušies, ka par in vitro metodēm ir pietiekami daudz izvērtētas informācijas, kas tās apstiprina (3). Sīkāka informācija par to, ieskaitot daudzos in vitro un in vivo metožu tiešos salīdzinājumus, ir minēta Norādījumu dokumentā (2). Šis temats apskatīts vairākās monogrāfijās, kurās labi pamatota in vitro metodes izmantošana (4) (5) (6) (7) (8) (9) (10) (11) (12). Pēc in vitro metodēm nosaka ķīmiskās vielas difūziju ādā un cauri ādai uz šķīduma savācēju, izmantojot nedzīvu ādu, lai mērītu tikai difūziju, vai svaigus, metaboliski aktīvus ādas audus, lai vienlaicīgi mērītu difūziju un ādas metabolismu. Šīs metodes izmanto, lai salīdzinātu dažāda sastāva preparātu ķīmisko vielu iedarbību uz ādu un caur to un lai iegūtu datus, kas izmantojami perkutānās absorbcijas modelēšanai cilvēka organismā.
Iespējams, ka in vitro metode nav pielietojama visās situācijās un visām ķīmisko vielu klasēm. In vitro testēšanas metodi varētu pielietot, lai veiktu penetrācijas ādā sākotnējo kvalitatīvo novērtēšanu. Noteiktos gadījumos var rasties nepieciešamība pielietot to in vivo datiem. Par situācijām, kādās varētu būt piemērotāka in vitro metode, norādījumus skatīt dokumentā (2). Pieņemot lēmumu, var izmantot sīkāku papildu informāciju, kas minēta (3).
Šī metode nosaka vispārējos principus absorbcijas ādā un testējamās vielas pārvietošanās noteikšanai izgrieztā ādā. Var izmantot daudzu zīdītāju, arī cilvēka, ādu. Ādas caurlaidības īpašības saglabājas pēc izgriešanas no ķermeņa, jo galvenā difūzijas barjera ir nedzīvs stratum corneum; aktīva ķīmisko vielu pārnese caur ādu nav konstatēta. Tika pierādīts, ka āda spēj metabolizēt dažas ķīmiskās vielas perkutānās absorbcijas laikā (6), bet šis process nav ātrumu ierobežojošs, ņemot vērā faktisko absorbēto devu, kaut gan var ietekmēt iedarbības īpašības, vielai nokļūstot asinsritē.
1.2 DEFINĪCIJAS
Neabsorbētā deva: vielas daudzums, kas nomazgāts no ādas virsmas pēc ekspozīcijas, vielas daudzums uz neokluzīvā pārklājuma, kā arī daudzums, kas, kā pierāda mērījumi, iztvaiko no ādas ekspozīcijas laikā.
Absorbētā deva (in vitro ): vielas kopējais daudzums, kas noteiktā laikā nonāk šķīduma uztvērējā vai cirkulācijas sistēmā.
Absorbējamā deva: vielas daudzums, kas paliek uz ādas vai ādā pēc nomazgāšanas.
1.3. METODES PRINCIPS
Testējamo vielu, kas var būt iezīmēta ar radioizotopiem, aplicē uz ādas parauga virsmas, ar kuru nodala divas difūzijas šūnas kameras. Viela noteiktu laiku noteiktos apstākļos atrodas uz ādas, pēc tam vielu noņem ar piemērotām tīrīšanas procedūrām. Paraugus no šķīduma uztvērēja ņem noteiktos laika intervālos eksperimenta gaitā un analizē, nosakot testējamo vielu un/vai metabolītus.
Ja tiek izmantotas metaboliski aktīvas sistēmas, testējamās vielas metabolītus var analizēt ar piemērotām metodēm. Eksperimenta beigās attiecīgos gadījumos testējamās vielas un tās metabolītu sadalījumu nosaka kvantitatīvi.
Šajā metodē un norādījumu dokumentā (2) aprakstītajos apstākļos nosaka testējamās vielas absorbciju noteiktā laikā, analizējot šķīdumu uztvērējā un apstrādāto ādu. Uz ādas palikusī testējamā viela jāuzskata par absorbētu, izņemot gadījumus, kad var pierādīt, ka absorbciju var noteikt, tikai analizējot šķīdumu uztvērējā. Pārējo daļu (no ādas noskalotā un ādas slāņos palikušā materiāla) analīze ļauj veikt turpmāko datu novērtēšanu, ieskaitot kopējo testējamās vielas pārvietošanos un atgūstamību.
Lai kontrolētu testēšanas sistēmas darbību un attiecīgajā laboratorijā iegūto rezultātu ticamību, jāizmanto standartvielas, ar kurām iegūtie rezultāti atbilst par attiecīgo metodi publicētajiem datiem. Šo prasību var izpildīt, attiecīgo standartvielu (ieteicams, lai tai būtu testējamajai vielai līdzīgas lipofilās īpašības) testējot paralēli ar testējamo vielu, vai sniedzot adekvātus iepriekšējos vēsturiskos datus par vairākām standartvielām ar dažādām lipofilajām īpašībām (piemēram, kofeīnu, benzoskābi un testosteronu).
1.4. TESTĒŠANAS METODES APRAKSTS
1.4.1. Difūzijas šūna
Difūzijas šūna sastāv no donorkameras un receptorkameras, to starpā novieto ādu (tipiskas konstrukcijas piemērs parādīts 1. attēlā). Šūnai labi jāpieguļ ādai, paraugu ņemšanai jābūt vienkāršai, ar labu uztvērēja šķīduma, kas kontaktē ar ādas apakšpusi, maisīšanu un ar šūnas un tās satura temperatūras regulāciju. Var izmantot gan statiskās, gan caurplūdes difūzijas šūnas. Parasti donorkamera ekspozīcijas laikā paliek nenoslēgta, ja lieto fiksētu testējamā preparāta devu. Tomēr dažiem nefiksētas aplicēšanas vai fiksēto devu testēšanas scenārijiem donorkamera var būt slēgta.
1.4.2. Uztvērēja šķīdums
Jādod priekšroka fizioloģiskam uztvērēja šķīdumam ar vadītspēju, kaut gan var lietot arī citādu, ja tas ir pamatoti. Jānosaka precīzs uztvērēja šķīduma sastāvs. Jāpārliecinās, ka testējamajai vielai ir pietiekama šķīdība uztvērēja šķīdumā un ka šis šķīdums nedarbojas kā absorbcijas barjera. Bez tam uztvērēja šķīdums nedrīkst ietekmēt ādas parauga integritāti. Izmantojot caurplūdes sistēmu, caurplūdes ātrums nedrīkst kavēt testējamās vielas difūziju uztvērēja šķīdumā. Izmantojot statiskās difūzijas šūnu, šķīdums pastāvīgi jāmaisa un regulāri jāņem paraugi. Ja pēta metabolismu, uztvērēja šķīdumam eksperimenta laikā jāuztur ādas dzīvotspēja.
1.4.3. Ādas preparāti
Var izmantot cilvēka vai dzīvnieku ādu. Vispāratzīts, ka cilvēka ādas izmantošanai jāatbilst valsts un starptautiskajām ētikas normām un noteikumiem. Kaut gan priekšroka jādod dzīvotspējīgai ādai, var izmantot arī nedzīvu ādu ar nosacījumu, ka var pierādīt ādas integritāti. Var izmantot epidermas membrānas (atdalot enzimātiski, termiski vai ķīmiski) vai slāņos sadalītu (parasti 200–400 μm biezu) ādu, kas sagatavota ar dermatomu. Var izmantot arī pilna biezuma ādu, bet tai nevajadzētu būt pārlieku biezai (> 1 mm), ja tas nav īpaši nepieciešams testējamās vielas noteikšanai ādas slāņos. Sugas, anatomiskās vietas un sagatavošanas veids jāpamato. Par katru testējamo preparātu jāiegūst pieņemami dati vismaz četros atkārtojumos.
1.4.4. Ādas preparāta integritāte
Ļoti svarīga ir pareiza ādas sagatavošana. Nepareizi rīkojoties, var rasties stratum corneum bojājums, tāpēc sagatavotā ādas parauga integritāte ir jāpārbauda. Ja pēta ādas metabolismu, jāizmanto svaigi izgriezta āda, ciktāl tas iespējams, un testēšana jāveic apstākļos, par kuriem zināms, ka tajos notiek metaboliska aktivitāte. Vispārīgs norādījums ir tāds, ka svaigi izgriezta āda jāizmanto 24 stundu laikā, bet ādas glabāšanas ilgums var būt atšķirīgs atkarībā no metabolizācijā iesaistītās enzīmu sistēmas un glabāšanas temperatūras (13). Ja ādas preparāti tika uzglabāti pirms izmantošanas, jāiegūst liecības par barjeras funkcijas saglabāšanos.
1.4.5. Testējamā viela
Testējamā viela ir materiāls, kuram jānosaka penetrācijas raksturlielumi. Ideālā gadījumā testējamajai vielai vajadzētu būt iezīmētai ar radioizotopiem.
1.4.6 Testējamais preparāts
Testējamās vielas preparātam (piemēram, tīram, atšķaidītam vai salikta sastāva materiālam, kas satur testējamo vielu un tiek aplicēts uz ādas) jābūt tam pašam (vai faktiski tādam pašam), kura iedarbībai var tikt pakļauti cilvēki vai, iespējams, citas mērķa sugas. Jebkādas atkāpes no izmantojamā “lietošanā esošā” preparāta jāpamato.
1.4.7. Testējamo vielu koncentrācijas un sastāvs
Parasti izmēģinājumus veic ar vairākām testējamās vielas koncentrācijām, sasniedzot lielāko no potenciālajām koncentrācijām, kuru iedarbībai var tikt pakļauti cilvēki. Līdzīgā veidā jānosaka tipisko sastāvu testēšanas diapazons.
1.4.8. Aplicēšana uz ādas
Parastos apstākļos cilvēks var tikt pakļauts fiksētu ķīmisko vielu devu iedarbībai. Tāpēc jāizmanto devas, kas atbilst iespējamajai iedarbībai uz cilvēku, parasti 1–5 mg/cm2 ādas cietām vielām un līdz 10 μl/cm2 šķīdumiem. Daudzums jāpamato ar sagaidāmiem lietošanas apstākļiem, pētījumu mērķiem vai testējamā preparāta fizikālajiem raksturlielumiem. Piemēram, aplicēšana uz ādas virsmas varētu būt nedozēta, ja tiek aplicēti lieli apjomi uz virsmas vienību.
1.4.9. Temperatūra
Ķīmisko vielu pasīvo difūziju (un tātad to absorbciju ādā) ietekmē temperatūra. Difūzijas kamerā un ādā jāuztur pastāvīga temperatūra, kas ir tuva normālai ādas temperatūrai 32 ±1 oC. Dažādām testēšanas šūnu konstrukcijām vajadzīga atšķirīga ūdens vannas vai sildīšanas bloka temperatūra, lai nodrošinātu, ka tā uztvērējā/ādā atbilst fizioloģiskajai normai. Relatīvajam mitrumam jābūt no 30 līdz 70 %.
1.4.10. Ekspozīcijas ilgums un paraugu ņemšana
Testējamā preparāta iedarbība uz ādu var ilgt visu izmēģinājuma laiku vai īsāku termiņu (piemēram, modelējot īpašu iedarbības veidu uz cilvēka organismu). No ādas jānomazgā liekais testējamais preparāts, izmantojot piemērotu tīrīšanas līdzekli, un noskalojumi jāsavāc analīzei. Testējamā preparāta nomazgāšanas procedūra ir atkarīga no paredzētajā lietojumā esošajiem izmantošanas apstākļiem, un tā jāpamato. Parasti paraugi jāņem pēc 24 stundām, lai nodrošinātu adekvātus absorbcijas gaitas novērojumus. Pēc 24 stundām ādas integritāte var sākt pasliktināties, tāpēc paraugu ņemšanas laiks parasti nedrīkst būt ilgāks par 24 stundām. Ja testējamā viela ātri iesūcas ādā, varētu būt, ka tas nav nepieciešams, bet ja testējamā viela ādā iesūcas lēni, varētu būt vajadzīgs ilgāks laiks. Paraugu ņemšanas biežumam no uztvērēja šķīduma jānodrošina datu iegūšana testējamās vielas absorbcijas gaitas attēlošanai grafiski.
1.4.11. Beigu procedūras
Visas testējamās sistēmas sastāvdaļas jāanalizē, un jānosaka atgūstamība. Minētais attiecas uz donorkameru, mazgāšanas šķīdumu pēc ādas skalošanas, ādas preparātu un uztvērēja šķīdumu/kameru. Zināmos gadījumos ādu varētu sadalīt un iegūt eksponēto ādas vietu, ādas daļu zem difūzijas šūnas malām un stratum corneum, ko izmanto epidermas un dermas frakcijas atsevišķām analīzēm.
1.4.12. Analīze
Visos izmēģinājumos jāpanāk adekvāta atgūstamība (mērķa vērtība vidēji 100 ±10 % no radioaktivitātes, iespējamās novirzes pamatojot). Testējamās vielas daudzums uztvērēja šķīdumā, ādas preparātā, uz ādas virsmas un aparatūras skalošanas šķīdumā jāanalizē pēc attiecīgi piemērotas metodes.
2. DATI
Jānorāda uztvērēja šķīduma sastāva izmaiņas, testējamās ķīmiskās vielas sadalījums testēšanas sistēmā un absorbcijas gaita atkarībā no laika. Ja ekspozīcijai pielieto fiksētas devas, jāaprēķina no ādas noskalotais, ar ādu saistītais (kā arī dažādos ādas slāņos esošais daudzums, ja to analizē) un uztvērēja šķīdumā esošais daudzums (ātrums un daudzums vai aplicētās devas daļa procentos). Dažkārt absorbciju ādā var izteikt tikai ar datiem par uztvērēja šķīdumu. Tomēr, ja testējamā viela paliek ādā izmēģinājuma beigās, tā var būt jāiekļauj kopējā absorbētajā daudzumā (skatīt (3) 66. punktā). Ja ekspozīcijai nelieto fiksētas devas, pēc iegūtajiem datiem var aprēķināt caurlaidības konstanti (Kp). Minētajos apstākļos absorbēto daļu procentos nenosaka.
3. REZULTĀTI
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jāiekļauj protokolā noteiktās prasības, ieskaitot izmantojamās testēšanas sistēmas pamatojumu, kā arī šāda informācija.
Testējamā viela:
— fizikālais stāvoklis, fizikāli ķīmiskās īpašības (vismaz molekulmasa un log Pow), tīrība (radioķīmiskā tīrība),
— identifikācijas informācija (piemēram, ražošanas partijas numurs),
— šķīdība uztvērēja šķīdumā.
Testējamais preparāts:
— sastāvs un lietošanas pamatojums,
— homogenitāte.
Testēšanas apstākļi:
— ādas avoti un ņemšanas vieta, sagatavošanas metode, glabāšanas apstākļi pirms izmantošanas, pirmapstrāde (tīrīšana, apstrāde ar antibiotikām u. c.), ādas integritātes mērījumi, metaboliskais statuss, lietošanas pamatojums,
— testēšanas šūnas konstrukcija, uztvērēja šķīduma sastāvs, uztvērēja šķīduma caurplūdes ātrums vai paraugu ņemšanas laiki un procedūras,
— informācija par testējamā preparāta aplicēšanu un lietoto devu noteikšanu,
— ekspozīcijas ilgums,
— informācija par testējamā preparāta noņemšanu no ādas, piemēram, par ādas skalošanu,
— informācija par ādas analīzi un visām frakcionēšanas metodēm, kas tika izmantotas, lai noteiktu sadalījumu ādā,
— testēšanas šūnas un iekārtas skalošanas metodes,
— analīžu metodes, ekstrakcijas paņēmieni, dati par analītisko metožu noteikšanas robežām un validācijas dati.
Rezultāti:
— kopējā atgūstamība eksperimentā (lietotā deva ≡ noskalojumi no ādas + āda + uztvērēja šķīdums + testēšanas šūnas skalošanas šķīdums),
— tabulā apkopoti atsevišķo šūnu atgūstamības dati katrā nodalījumā,
— absorbcijas gaita,
— tabulā apkopoti dati par absorbciju (izsakot kā ātrumu, daudzumu vai daļu procentos).
Rezultātu novērtējums.
Secinājumi.
4. IZMANTOTĀ LITERATŪRA
(1) Testing Method B.44. Skin Absorption: In Vivo Method.
(2) OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris.
(3) OECD (2000). Report of the Meeting of the OECD Extended Steering Committee for Percutaneous Absorption Testing, Annex 1 to ENV/JM/TG(2000)5. OECD, Paris.
(4) Kemppainen BW and Reifenrath WG. (1990). Methods for skin absorption. CRC Press, Boca Raton.
(5) Bronaugh R.L. and Collier, SW. (1991). Protocol for In vitro Percutaneous Absorption Studies, in In vitro Percutaneous Absorption: Principles, Fundamentals and Applications, RL Bronaugh and HI Maibach, Eds., CRC Press, Boca Raton, pp. 237–241.
(6) Bronaugh RL and Maibach HI. (1991). In vitro Percutaneous Absorption: Principles, Fundamentals and Applications. CRC Press, Boca Raton.
(7) European Centre for Ecotoxicology and Toxicology of Chemicals (1993). Monograph No 20, Percutaneous Absorption, ECETOC, Brussels.
(8) Diembeck W, Beck H, Benech-Kieffer F, Courtellemont P, Dupuis J, Lovell W, Paye M, Spengler J, Steiling W (1999). Test Guidelines for In Vitro Assessment of Dermal Absorption and Percutaneous Penetration of Cosmetic Ingredients, Fd Chem Tox, 37, p. 191–205.
(9) Recommended Protocol for In vitro Percutaneous Absorption Rate Studies (1996). US Federal Register, Vol. 61, No 65.
(10) Howes D, Guy R, Hadgraft J, Heylings JR et al. (1996). Methods for assessing Percutaneous absorption. ECVAM Workshop Report ATLA 24, 81 R10.
(11) Schaefer H and Redelmeier TE. (1996). Skin barrier: principles of percutaneous absorption. Karger, Basel.
(12) Roberts MS and Walters KA. (1998). Dermal absorption and toxicity assessment. Marcel Dekker, New York.
(13) Jewell, C., Heylings, JR., Clowes, HM. and Williams, FM. (2000). Percutaneous absorption and metabolism of dinitrochlorobenzene in vitro. Arch Toxicol 74: p. 356–365.
1. attēls
Tipiska statiskās difūzijas šūnas konstrukcija perkutānas absorbcijas in vitro pētījumiem

B.46. ĀDAS KAIRINĀJUMA NOTEIKŠANA AR CILVĒKA EPIDERMAS REKONSTRUKCIJAS MODEĻA IN VITRO TESTU
IEVADS
1. Ādas kairinājums ir atgriezeniska audu bojājuma veidošanās ādā ne ilgāk kā 4 stundas pēc testējamās vielas aplicēšanas [saskaņā ar Apvienoto Nāciju Organizācijas (ANO) vielu klasificēšanas un marķēšanas globāli harmonizēto sistēmu (GHS) un Eiropas Parlamenta un Padomes 2008. gada 16. decembra Regulu (EK) Nr. 1272/2008 par vielu un maisījumu klasificēšanu, marķēšanu un iepakošanu (1) (3)]. Šajā testēšanas metodē (TM) aprakstīta in vitro noteikšanas procedūra, kuru var izmantot kairinošu ķīmisku vielu (substanču un maisījumu) bīstamības identificēšanai saskaņā ar 2. kategoriju ANO GHS un ES CLP regulā (1) (2) (3). ES un citos reģionos, kas nav pieņēmuši fakultatīvo ANO GHS 3. kategoriju (vājš kairinātājs), šo TM var izmantot arī neklasificētu ķīmisko vielu identificēšanai, t. i., ANO GHS un ES CLP“neklasificētām” vielām (1) (3). Šo TM var izmantot kā atsevišķu aizstājējtestu, lai noteiktu ādas kairināmību ar ķīmiskām vielām in vivo ādas kairināmības testēšanā ar pakāpeniskas testēšanas stratēģiju (4; šā pielikuma B.4. nodaļa).
2. Ādas kairinājuma novērtēšanai parasti veic laboratorijas izmēģinājumus ar dzīvniekiem [ESAO 404. testēšanas vadlīnijas; šā pielikuma B.4. nodaļa] (4). Ņemot vērā dzīvnieku labturības apsvērumus, 2004. gadā pārskatīja B.4. metodi, ar ko nosaka ādas kairinājumu/kodīgu jeb korozīvu iedarbību uz ādu pēc pakāpeniskas testēšanas stratēģijas, izmantojot validētas in vitro vai ex vivo metodes un tādā veidā neradot dzīvniekiem sāpes un ciešanas. Trīs validētas in vitro testēšanas metodes ir pieņemtas kā ESAO 430., 431. un 435. testēšanas vadlīnijas (5) (6) (7) un divas no tām kā šā pielikuma B.40. un B.40.a nodaļas, kas izmantojamas korozīvās iedarbības noteikšanai ar pakāpeniskas testēšanas stratēģiju, kā paredz B.4 un ESAO 404. testēšanas vadlīnijas (4).
3. Šī TM ir par cilvēka veselības beigu punktam atbilstošo ādas kairinājumu. Šajā TM izmanto cilvēka epidermas rekonstrukcijas modeļus (RhE) (kuriem par šūnu avotu izmanto nepārveidotus cilvēka epidermas keratinocītus, ādai reprezentatīvu audu un citoloģisko arhitektūru), kuru bioķīmiskās un fizioloģiskās īpašības kopumā ir ļoti līdzīgas cilvēka ādas virsējās daļas, t. i., epidermas, īpašībām. Šajā TM ietverti arī veiktspējas standarti (PS) (2. papildinājums), kas ļauj novērtēt līdzīgas un modificētas RhE tipa metodes, kuras izstrādājusi EC-ECVAM (8) saskaņā ar ESAO vadlīniju dokumentu Nr. 34 (9).
4. Eksistē trīs validētas metodes, kuras līdzinās šai TM. Prevalidēšanas, optimizēšanas un validēšanas pētījumi jau pabeigti in vitro metodei (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20), kurā izmanto RhE modeli; komerciāli tā pieejama ar nosaukumu EpiSkinTM (validēta references metode – VRM). Divas pārējās komerciāli pieejamās in vitro ādas kairinājuma RhE metodes, validējot ar PS (21), uzrāda VRM līdzīgus rezultātus; tās ir EpiDermTM SIT (EPI-200) un SkinEthicTM RhE metode (22).
5. Pirms tādu ierosinātu līdzīgu vai modificētu in vitro RhE metožu, kas nav VRM, EpiDermTM SIT (EPI-200) vai SkinEthicTM RhE metode, izmantošanas regulatīviem mērķiem ir jānosaka šādu metožu ticamība, piemērotība (pareizība) un ierosinātā izmantojuma limiti, tādējādi nodrošinot, ka attiecīgo metodi var uzskatīt par līdzīgu VRM atbilstīgi PS prasībām, kas noteiktas šajā TM (2. papildinājums). Pirms līdzīgas vai modificētas in vitro RhE metodes izstrādes un validēšanas un iesniegšanas regulatīvai apstiprināšanai (23) turklāt ieteicams iepazīties ar ESAO paskaidrojošo pamatdokumentu par in vitro ādas kairinājuma testēšanu.
DEFINĪCIJAS
6. Definīcijas skatīt 1. papildinājumā.
SĀKOTNĒJIE APSVĒRUMI UN IEROBEŽOJUMI
7. Saskaņā ar validācijas pētījumu (16) šīs TM iespējas ir ierobežotas tādā ziņā, ka ar šo metodi nevar ķīmiskās vielas klasificēt kā fakultatīvās ANO GHS 3. kategorijas vielas (vāji kairinātāji) (1). Ja metodi izmanto kā daļēju aizstājējtestu, var būt jāveic turpmāka in vivo testēšana, lai pilnībā aprakstītu vielas spēju izraisīt ādas kairinājumu (4; šā pielikuma B.4. nodaļa). Ir atzīts, ka cilvēka ādas izmantošanai jāatbilst nacionālām un starptautiskām ētiskajām normām un nosacījumiem.
8. Ar šo TM in vitro tiek analizēts ādas kairinātāja komponents pakāpeniskās testēšanas stratēģijā B.4 (ESAO 404. testēšanas vadlīnijas) par ādas koroziju/kairinājumu (4). Lai arī ar šo TM nevar iegūt adekvātus datus par ādas koroziju, jāatzīmē, ka B.40.a (ESAO 431. testēšanas vadlīnijas) par ādas koroziju pamatojas uz tādu pašu RhE testēšanas sistēmu, bet izmanto citu protokolu (B.40.a nodaļa). Šīs metodes pamatā ir RhE modeļi, kuros izmanto cilvēka keratinocītus un kuri tādējādi in vitro pārstāv attiecīgās sugas mērķorgānu. Tā turklāt tiešā veidā aptver iekaisuma kaskādes/mehānisma sākotnējo posmu norisēs (šūnu bojājumi un audu bojājumi, kuru rezultāts ir lokalizēta trauma), kuras notiek, kairinājumam rodoties in vivo. Ar šo TM saistītajā validēšanas procesā ir testēts plašs ķīmisko vielu spektrs, un validācijas pētījuma empīriskā datubāze aptver kopumā 58 ķīmiskas vielas (16)(18)(23). Metode ir derīga cietām vielām, šķidrumiem, puscietām vielām un vaskiem. Šķidrumi var būt ūdens vai neūdens šķīdumu veidā; cietas vielas var būt gan ūdenī šķīstošas, gan nešķīstošas. Ja nepieciešams, cietās vielas pirms aplicēšanas jāsamaļ pulverī; nekāda cita iepriekšēja apstrāde paraugam nav vajadzīga. Validācijas pētījumā vēl nav novērtētas gāzes un aerosoli (24). Kaut arī jādomā, ka vispār ir iespējams tos testēt ar RhE tehnoloģiju, ar pašreizējo TM gāzes un aerosolus testēt nevar. Jāatzīmē arī tas, ka ķīmiskās vielas, kurām ir spilgta krāsa, var ietekmēt šūnu dzīvotspējas mērījumus, un tas jālabo ar pielāgotu kontroli (skatīt 24.–26. punktu).
9. Vienai atsevišķai testēšanas reizei ar trim audu atkārtojumiem jābūt pietiekamai gadījumos, kad testējamās ķīmiskās vielas klasifikācija ir nepārprotama. Tomēr neskaidros gadījumos, kā nesakritīgi mērījumu rezultāti atkārtojumos un/vai vidējā procentuālā dzīvotspēja 50 ± 5 %, jāapsver vajadzība pēc otrās vai pat pēc trešās testēšanas reizes, ja nesakrīt abu pirmo divu testēšanas reižu rezultāti.
METODES PRINCIPS
10. Testējamo ķīmisko vielu topikāli aplicē uz trīsdimensiju RhE modeļa, kuru veido nepārveidoti cilvēka epidermas keratinocīti, kultivēti tā, lai veidotos labi diferencētas daudzslāņu cilvēka epidermas modelis. Tam ir bazālais, spinālais un granulārais slānis, daudzslāņu stratum corneum ar lamelāriem lipīdu starpšūnu slāņiem, kuru uzbūve ir reprezentatīva galvenajām lipīdu klasēm in vivo.
11. Ķīmisku vielu izraisīts ādas kairinājums, kas izpaužas kā apsārtums un pietūkums, ir notikumu kaskādes rezultāts, kuras sākums ir iespiešanās stratum corneum un bojājumi zem tā esošajos keratinocītu slāņos. Mirstošās keratinocītu šūnas izdala mediatorus, kas sāk iekaisuma kaskādes norises, kuras ietekmē dermis esošās šūnas, jo sevišķi stromālās un endoteliālās šūnas. Novēroto apsārtumu un pietūkumu izraisa endoteliālo šūnu dilatācija un pieaugošā caurlaidība (24). RhE izmantojošās metodes mēra notikumu kaskādes sākuma norises.
12. Šūnu dzīvotspēju RhE modeļos mēra pēc vitālās krāsvielas MTT [3 (4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijbromīds, tiazolilzilais; CAS Nr. 298-93-1)] konversijas ar enzīmu par zilas krāsas formazāna sāli, kura daudzumu audu ekstraktā nosaka kvantitatīvi (25). Kairinošas ķīmiskās vielas tiek klasificētas pēc šūnu dzīvotspējas samazināšanās zemāk par kādu noteiktu iepriekš pieņemtu robežvērtību (t. i., ≤ 50 %, ANO GHS/ES CLP 2. kat. kairinošās vielas). Atkarībā no regulatīvās sistēmas, kurā izmanto šīs TM rezultātus, ķīmiskās vielas, ar kurām šūnu dzīvotspēja ir augstāka par noteikto robežvērtību, var uzskatīt par kairinājumu neizraisošām (t. i., > 50 %, neklasificētas vielas).
PRASMES DEMONSTRĒŠANA
13. Pirms sākt plaši izmantot kādu no trijām ar šo TM saistītajām validētajām testēšanas metodēm, tehniskās prasmes uzskatāmai parādīšanai laboratorijām jāizmanto desmit references vielas, kas norādītas 1. tabulā. Attiecībā uz līdzīgām metodēm, kas izstrādātas saskaņā ar šo TM, vai uz kādas no triju validēto metožu modifikācijām, pirms sākt attiecīgās metodes izmantošanu regulatīvās testēšanas vajadzībām, jābūt izpildītām šai TM noteikto veiktspējas standartu (PS) prasībām, kas aprakstītas 2. papildinājumā.
14. Ieteicams, lai prasmes demonstrēšanas ietvaros lietotājs pēc audu saņemšanas verificētu šo audu barjeras funkcijas, kā precizējis RhE modeļa ražotājs. Īpaši svarīgi tas ir tad, ja audu sūtījums veicis tālu ceļu vai aizņēmis ilgu laiku. Kad metode ir sekmīgi apgūta un tās izmantošanas prasme uzskatāmi parādīta, šādu verifikāciju vairs nav nepieciešams veikt katru reizi. Tomēr, ja metodi izmanto parastajā praksē, ir ieteicams turpināt regulāri novērtēt šīs barjeras funkcijas.
1. tabula
References vielas (1)
|
Ķīmiskā viela |
CAS Nr. |
In vivo punkti (2) |
Fizikālais stāvoklis |
ANO GHS/ES CLP kategorija |
|
Naftalīnetiķskābe |
86-87-3 |
0 |
Cietas vielas |
Neklas. |
|
Izopropanols |
67-63-0 |
0,3 |
Šķidrums |
Neklas. |
|
Metilstearāts |
112-61-8 |
1 |
Cietas vielas |
Neklas. |
|
Heptilbutirāts |
5870-93-9 |
1,7 |
Šķidrums |
Neklas. |
|
Heksilsalicilāts |
6259-76-3 |
2 |
Šķidrums |
Neklas. |
|
Ciklamenaldehīds |
103-95-7 |
2,3 |
Šķidrums |
2. kat. |
|
1-bromheksāns |
111-25-1 |
2,7 |
Šķidrums |
2. kat. |
|
Kālija hidroksīds (5 % ūd.) |
1310-58-3 |
3 |
Šķidrums |
2. kat. |
|
1-metil-3-fenil-1-piperazīns |
5271-27-2 |
3,3 |
Cietas vielas |
2. kat. |
|
Heptanāls |
111-71-7 |
3,4 |
Šķidrums |
2. kat. |
|
(1) Šīs references vielas ir daļa no validācijas pētījumā izmantotā references vielu kopuma. (2) In vivo punkti saskaņā ar B.4 un ESAO 404. testēšanas vadlīnijām (4). (3) Pēc šīs testēšanas metodes atsevišķi neklasificē vielas, ko var klasificēt ANO GHS 3. kategorijā (vāji kairinātāji). (4) ANO GHS fakultatīvo 3. kategoriju ES CLP regulā nepiemēro. |
||||
PROCEDŪRA
15. Turpmāk aprakstīti ādas kairinājuma noteikšanai izmantojamās RhE metodes komponenti un procedūras. Jārekonstruē RhE modelis, kuru sagatavo laboratorijā vai iegūst no komerciāliem avotiem. Par EpiSkinTM, EpiDermTM SIT (EPI-200) un SkinEthicTM RhE ir pieejamas standartoperāciju procedūras (SOP) (26)(27)(28). Testēšana jāveic, ievērojot turpmāk aprakstītos noteikumus.
RhE Testēšanas Metodes Komponenti
Vispārīgi nosacījumi
16. Epitēlija rekonstruēšanai jāizmanto nepārveidoti cilvēka keratinocīti. Zem funkcionāla stratum corneum jābūt vairākiem dzīvotspējīgu epitēlija šūnu slāņiem (bazālajam slānim, stratum spinosum, stratum granulosum). Stratum corneum jābūt daudzslāņu, ar raksturīgo lipīdu profilu, kas izveido funkcionālo barjeru, kura novērš citotoksisko marķieru, piemēram, nātrija dodecilsulfāta (SDS) vai Triton X-100, ātru penetrāciju. Barjeras funkcija jānovērtē, nosakot koncentrāciju, pie kuras ķīmiskais marķieris pēc noteikta ekspozīcijas laika samazina audu dzīvotspēju par 50 % (IC50), vai nosakot ekspozīcijas laiku, pēc kura noteiktas fiksētas koncentrācijas ķīmiskā marķiera iedarbībā audu dzīvotspēja samazinās par 50 % (ET50). RhE modeļa aizturēšanas īpašībām jānovērš ap stratum corneum esošā materiāla pāreja dzīvotspējīgos audos, kuras dēļ var tikt nepareizi modelēta faktiskā iedarbība uz ādu. RhE modelis nedrīkst būt kontaminēts ar baktērijām, vīrusiem, mikoplazmu un sēnītēm.
Funkcionāli nosacījumi
17. Metode dzīvotspējas noteikšanai ir MTT metode (25). RhE modeļa lietotājiem jānodrošina, ka visas izmantotās RhE modeļa partijas atbilst negatīvās kontroles (NC) vajadzībām definētajiem kritērijiem. Ekstrakcijas šķīduma optiskajam blīvumam (OD) jābūt pietiekami zemam, t. i., OD< 0,1. Pieņemamības diapazonu (augšējā un apakšējā robeža) negatīvās kontroles OD vērtībām (resp., ādas kairinājuma testēšanas metodes apstākļus) nosaka RhE modeļa izstrādātājs/piegādātājs; pieņemamības diapazons trijām validētajām metodēm ir norādīts 2. tabulā. Jādokumentē ar NC apstrādāto audu stabilitāte kultūrā (jābūt ar salīdzināmiem dzīvotspējas rādītājiem) visas testa ekspozīcijas laikā.
2. tabula
Pieņemamības diapazons negatīvās kontroles OD vērtībām
|
Apakšējā pieņemamības robežvērtība |
Augšējā pieņemamības robežvērtība |
|
|
EpiSkinTM (SM) |
≥ 0,6 |
≤ 1,5 |
|
EpiDermTM SIT (EPI-200) |
≥ 1,0 |
≤ 2,5 |
|
SkinEthicTM RhE |
≥ 1,2 |
≤ 2,5 |
18. Stratum corneum un tā lipīdu sastāvam jābūt tādam, lai aizturētu citotoksisku ķīmisko marķieru, piemēram, SDS vai Triton X-100, ātru penetrāciju, ko nosaka pēc IC50 vai ET50 (3. tabula).
19. Jāveic RhE modeļa histoloģiski izmeklējumi, lai demonstrētu modeļa līdzību cilvēka epidermas struktūrai (ieskaitot daudzslāņu stratum corneum).
20. Ar pozitīvās kontroles (PC) ķīmisko vielu un negatīvo kontroli (NC) iegūtajiem testēšanas metodes rezultātiem uzskatāmi jāparāda to reproducējamība laikā.
21. RhE modeļa izstrādātājam/piegādātājam jānodrošina un uzskatāmi jāparāda, ka visas izmantotās RhE modeļa partijas atbilst definētajiem produkcijas pieņemamības kritērijiem, kuru vidū piemērotākie ir dzīvotspēja (17. punkts), barjeras funkcija (18. punkts) un morfoloģija (19. punkts). Šie dati jādara pieejami metodes lietotājiem, lai tie šo informāciju iekļautu testēšanas pārskatā. RhE modeļa izstrādātājam/piegādātājam (vai pašiem testētājiem gadījumos, kad izmanto pašizgatavotus modeļus) jānosaka IC50 vai ET50 vērtību pieņemamības intervāls (augšējā un apakšējā robeža). Kairinātāja klasifikācijas prognozēšanai ir derīgi tikai ar prasībām atbilstošiem audu modeļiem noteiktie rezultāti. Kā piemērs 3. tabulā norādīti trijām validētajām metodēm noteiktie pieņemamības intervāli.
3. tabula
Partiju QC pieņemamības intervāli
|
Apakšējā pieņemamības robežvērtība |
Augšējā pieņemamības robežvērtība |
|
|
EpiSkinTM (SM) (18 stundu apstrāde ar SDS)(26) |
IC50 = 1,0 mg/ml |
IC50 = 3,0 mg/ml |
|
EpiDermTM SIT (EPI-200) (1 % Triton X-100)(27) |
ET50 = 4,8 h |
ET50 = 8,7 h |
|
SkinEthicTM RhE (1 % Triton X-100)(28) |
ET50 = 4,0 h |
ET50 = 9,0 h |
Testējamās vielas un kontrolvielas aplicēšana
22. Katrai testējamai ķīmiskajai vielai un kontroles vielai katrā testēšanas reizē vajadzīgi vismaz trīs atkārtojumi. Testējamās ķīmiskās vielas, kas ir šķidras vai cietas vielas, uz epidermas virsmas vienmērīgā slānī jāaplicē pietiekamā daudzumā, t. i., minimāli 25 μl/cm2 vai 25 mg/cm2, raugoties, lai netiktu testēta nefiksēta deva. Testējot cietas vielas, lai nodrošinātu iespējami labāku testējamās vielas un epidermas virsmas kontaktu, pirms to aplicēšanas epidermas virsma jāsamitrina ar dejonizētu vai destilētu ūdeni. Ja iespējams, cietas vielas jātestē smalka pulvera veidā. Ekspozīcijas perioda beigās testējamā ķīmiskā viela no epidermas virsmas rūpīgi jānoskalo ar piemērotu buferšķīdumu vai 0,9 % NaCl. Atkarībā no lietotā RhE modeļa (validēti ir trīs modeļi) ekspozīcijas laiks var būt no 15 līdz 60 minūtēm, bet inkubēšanas temperatūra no 20 līdz 37 °C. Ekspozīcijas periodus un temperatūras optimizē katrai RhE metodei atsevišķi, un tie kļūst par konkrētajai metodei raksturīgajām iezīmēm; metodes sīkāk skatīt standartoperāciju procedūrās (SOP) (26) (27) (28).
23. Katrā testēšanas reizē jāizmanto paralēlas NC un PC, lai uzskatāmi parādītu, ka šūnu dzīvotspēja (ar NC), barjeras funkcija un audu jutība (ar PC) ir iepriekš noteiktajā vērtību pieņemamības intervālā. Ieteicamā PC ir nātrija dodecilsulfāta 5 % šķīdums ūdenī. Ieteicamās NC ķīmiskās vielas ir ūdens vai fizioloģiskais šķīdums ar fosfātbuferi (PBS).
Šūnu dzīvotspējas noteikšana
24. Testēšanas procedūras svarīgākais elements ir ievērot, ka dzīvotspējas mērījumus nedrīkst veikt tūlīt pēc testējamo vielu ekspozīcijas un ka noskalotajiem audiem jaunā barotnē ir vajadzīgs pietiekami ilgs pēcekspozīcijas inkubēšanas laiks. Šajā laikā izzūd vājas citotoksiskas iedarbības pazīmes un parādās nepārprotamas citotoksiskas iedarbības izpausmes. Testa optimizācijas posms (11) (12) (13) (14) (15) parādīja, ka optimāls ir 42 stundu ilgs pēcekspozīcijas inkubēšanas laiks.
25. Šūnu dzīvotspējas mērīšanai ar šo TM izmantojamā validētā kvantitatīvā metode ir MTT noteikšana. Tā ir audu trīsdimensiju modelim piemērota metode. Audu paraugu uz 3 stundām pārnes atbilstošas koncentrācijas (piemēram, 0,3-1 mg/ml) MTT šķīdumā. Pēc tam veic nogulsnētā zilas krāsas formazāna produkta ekstrakciju ar šķīdinātāju (piemēram, izopropanolu vai paskābinātu izopropanolu) un nosaka formazāna koncentrāciju, mērot optisko blīvumu pie viļņa garuma 570 nm ± 30 nm.
26. Testējamās ķīmiskās vielas optiskās īpašības vai ķīmiskās reakcijas ar MTT var traucēt noteikšanu, un tāpēc dzīvotspēja var būt noteikta nepareizi (jo testējamā ķīmiskā viela var gan kavēt, gan veicināt krāsas veidošanos vai atkrāsošanos). Tas var notikt gadījumos, kad testējamo ķīmisko vielu pilnībā nenoskalo no audiem vai tad, ja tā iespiežas epidermā. Ja testējamā ķīmiskā viela tieši iedarbojas uz vitālo krāsvielu MTT (MTT reducētājs), tai ir krāsa vai krāsa izveidojas ekspozīcijas laikā, testējamo ķīmisko vielu radīto dzīvotspējas mērījumu traucējumu noteikšanai un korekcijām jāizmanto papildu kontroles. SOP par trijām validētajām metodēm ir pieejams sīks apraksts par to, kā koriģēt tiešo MTT redukciju un traucējumus, ko rada vielas, kam ir krāsa (26) (27) (28).
Pieņemamības kritēriji
27. Katrai metodei, kurā izmanto testēšanai derīgas RhE modeļu partijas (sk. 21. punktu) ar NC vielu apstrādātajiem audiem noteiktajām optiskā blīvuma vērtībām jāraksturo šo audu kvalitāte visos nosūtīšanas un saņemšanas cikla posmos un visos protokola procesos. Optiskā blīvuma kontrolvērtības nedrīkst būt zemākas par vēsturiski noteiktajām robežvērtībām. Arī datiem par audiem, kas apstrādāti ar PC vielu, t. i., nātrija dodecilsulfāta (SDS) 5 % šķīdumu ūdenī, jāraksturo audiem saglabājusies spēja reaģēt uz ķīmisko kairināju TM apstākļos (26) (27) (28). Jānosaka attiecīgi kritēriji par audu testēšanas atkārtojumos noteikto rezultātu pieļaujamo mainību (piemēram, ja par šādu kritēriju izmanto standartnovirzi (SD), tai jāiekļaujas vienpusējā 95 % pielaides intervālā, kas aprēķināts pēc vēsturiskiem datiem; VRM SD < 18 %).
Rezultātu interpretēšana un prognozes modelis
28. Katrai testējamajai ķīmiskajai vielai iegūtās optiskā blīvuma vērtības var izmantot dzīvotspējīgo šūnu daļas aprēķināšanai salīdzinājumā ar NC, kuru pieņem par 100 %. Precīzi jānosaka un jādokumentē šūnu dzīvotspējas robežvērtība, pēc kuras identificē un atšķir testējamās kairinošās ķīmiskās vielas no šādi neklasificētajām ķīmiskajām vielām, kā arī testēšanas rezultātu izvērtēšanai izmantotās statistiskās procedūras, un uzskatāmi jāparāda to piemērotība. Kairināmības prognozēšanas robežvērtības ir šādas:
— ja audu šūnu dzīvotspēja pēc ekspozīcijas un pēcapstrādes inkubēšanas laika ir mazāka vai vienāda ar (≤) 50 %, uzskata, ka testējamā ķīmiskā viela izraisa tādu ādas kairinājumu, ka tā jāklasificē ANO GHS/ES CLP 2. kategorijā,
— ja audu šūnu dzīvotspēja pēc ekspozīcijas un pēcapstrādes inkubēšanas laika ir lielāka par (>) 50 %, atkarībā no regulatīvās sistēmas, kurā izmanto šīs TM rezultātus, var uzskatīt, ka testējamā ķīmiskā viela neizraisa ādas kairinājumu un ANO GHS/ES CLP sistēmā ir neklasificēta viela.
DATI UN TESTĒŠANAS PĀRSKATS
Dati
29. Par katru noteikšanas reizi, arī par atkārtotiem eksperimentiem, ja tos veic, tabulas veidā apkopo visus datus par visiem testējamo audu atkārtojumiem (piemēram, optiskā blīvuma vērtības, datus par testējamās vielas ietekmi uz šūnu dzīvotspēju un tās klasifikācijas datus). Par katru noteikšanas reizi jānorāda rezultāta vidējā vērtība ± standartnovirze. Par katru testējamo vielu jādokumentē novērotā iedarbība ar MTT reaģentu un testējamo ķīmisko vielu, kurai ir krāsa.
Testēšanas pārskats
30. Testēšanas pārskatā jābūt iekļautai šādai informācijai:
Testējamā un kontroles viela:
— ķīmiskais nosaukums, piemēram, CAS nosaukums un numurs, EK nosaukums un numurs, ja zināms,
— ķīmiskās vielas tīrība un sastāvs (masas procentos),
— fizikāli ķīmiskās īpašības, kas attiecas uz testēšanu (piemēram, fizikālais stāvoklis, stabilitāte un iztvaikošanas spēja, pH, šķīdība ūdenī, ja tās ir zināmas),
— testējamo/kontroles ķīmisko vielu sagatavošana pirms testēšanas, ja tā ir veikta (piem., uzsildīšana, malšana),
— uzglabāšanas nosacījumi.
RhE modeļa un testēšanas protokola izmantošanas pamatojums
Testēšanas apstākļi:
— izmantotā šūnu sistēma,
— pietiekama papildinformācija par izmantoto RhE modeli un tā veiktspējas raksturlielumiem. No tiem jānorāda vismaz:
—i) šūnu dzīvotspēja;
ii) barjeras funkcija;
iii) morfoloģija;
iv) rezultātu reproducējamība un ticamības raksturlielumi;
v) modeļa kvalitātes kontrole (QC),
— informācija par izmantoto testēšanas procedūru;
— testēšanai lietotās devas, ekspozīcijas laiks un pēcekspozīcijas inkubēšanas laiks,
— testēšanas procedūras iespējamo modifikāciju apraksts,
— vēsturiskie dati par modeli. No tiem jānorāda vismaz:
—i) kvalitātes kontroles datu pieņemamība saskaņā ar vēsturiskajiem datiem par partiju kontroles rezultātiem;
ii) pozitīvās un negatīvās kontroles datu pieņemamība, ņemot vērā pozitīvās un negatīvās kontroles vidējās vērtības un vērtību intervālus,
— izmantotie novērtēšanas kritēriji un iedarbības prognozes modelim izraudzīto robežvērtību pamatojums,
— vēsturiskie kontroles dati.
Rezultāti:
— tabulā apkopoti dati par katru testējamo ķīmisko vielu visās noteikšanas reizēs un visos atkārtojumos,
— kontrole, kas izmantota tiešajiem MTT reducētājiem un/vai testējamām ķīmiskām vielām, kurām ir krāsa,
— citi novērojumi.
Rezultātu apspriešana
Secinājumi
IZMANTOTĀ LITERATŪRA
1) UN (2009), United Nations Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Third revised edition, UN New York and Geneva. Available at: [http://www.unece.org/trans/danger/publi/ghs/ghs_rev03/03files_e.html]
2) EC-ECVAM (2009), Statement on the “Performance under UN GHS of three in vitro assays for skin irritation testing and the adaptation of the Reference Chemicals and Defined Accuracy Values of the ECVAM skin irritation Performance Standards”, issued by the ECVAM Scientific Advisory Committee (ESAC30), 9 April 2009. Available at: [http://ecvam.jrc.ec.europa.eu]
3) Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directives 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006. OV L 353, 31.12.2008., 1. lpp.
4) OECD (2004), Acute Dermal Irritation/Corrosion, OECD Guideline for the Testing of Chemicals No. 404, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
5) OECD (2004), In Vitro Skin Corrosion: Transcutaneous Electrical Resistance (TER), OECD Guideline for the Testing of Chemicals No. 430, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
6) OECD (2004), In Vitro Skin Corrosion: Human Skin Model Test, OECD Guideline for the Testing of Chemicals No. 431, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
7) OECD (2006), In Vitro Membrane Barrier Test Method for Skin Corrosion, OECD Guideline for the Testing of Chemicals No. 435, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
8) EC-ECVAM (2009), Performance Standards for in vitro skin irritation test methods based on Reconstructed human Epidermis (RhE)? Available at: [http://ecvam.jrc.ec.europa.eu]
9) OECD (2005), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, OECD Series on Testing and Assessment No. 34, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
10) Fentem, J.H., Briggs, D., Chesné, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Roguet, R., van de Sandt, J.J. M. and Botham, P. (2001), A prevalidation study on in vitro tests for acute skin irritation, Results and evaluation by the Management Team, Toxicol. in Vitro 15, 57-93.
11) Portes, P., Grandidier, M.-H., Cohen, C. and Roguet, R. (2002), Refinement of the EPISKIN protocol for the assessment of acute skin irritation of chemicals: follow-up to the ECVAM prevalidation study, Toxicol. in Vitro 16, 765–770.
12) Kandárová, H., Liebsch, M., Genschow, E., Gerner, I., Traue, D., Slawik, B. and Spielmann, H. (2004), Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests, ALTEX 21, 107–114.
13) Kandárová, H., Liebsch, M., Gerner, I., Schmidt, E., Genschow, E., Traue, D. and Spielmann, H. (2005), The EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests – An assessment of the performance of the optimised test, ATLA 33, 351-367.
14) Cotovio, J., Grandidier, M.-H., Portes, P., Roguet, R. and Rubinsteen, G. (2005), The in vitro acute skin irritation of chemicals: optimisation of the EPISKIN prediction model within the framework of the ECVAM validation process, ATLA 33, 329-349.
15) Zuang, V., Balls, M., Botham, P.A., Coquette, A., Corsini, E., Curren, R.D., Elliot, G.R., Fentem, J.H., Heylings, J.R., Liebsch, M., Medina, J., Roguet, R., van De Sandt, J.J.M., Wiemann, C. and Worth, A. (2002), Follow-up to the ECVAM prevalidation study on in vitro tests for acute skin irritation, The European Centre for the Validation of Alternative Methods Skin Irritation Task Force report 2, ATLA 30, 109-129.
16) Spielmann, H., mailto:Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovio, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., mailto:Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007), The ECVAM international validation study on in vitro tests for acute skin irritation: Report on the validity of the EPISKIN and EpiDerm assays and on the skin integrity function test, ATLA 35, 559-601.
17) Hoffmann, S. (2006), ECVAM skin irritation validation study phase II: Analysis of the primary endpoint MTT and the secondary endpoint IL1-α. Available at: [http://ecvam.jrc.ec.europa.eu]
18) Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. and Zuang, V. (2007), The ECVAM international validation study on in vitro tests for acute skin irritation: selection of test chemicals, ATLA 35, 603-619.
19) Cotovio, J., Grandidier, M.-H., Lelièvre, D., Roguet, R., Tinois-Tessonneaud, E. and Leclaire, J. (2007), In vitro acute skin irritancy of chemicals using the validated EPISKIN model in a tiered strategy - Results and performances with 184 cosmetic ingredients, AATEX, 14, 351-358.
20) EC-ECVAM (2007), Statement on the validity of in vitro tests for skin irritation, issued by the ECVAM Scientific Advisory Committee (ESAC26), 27 April 2007. Available at: [http://ecvam.jrc.ec.europa.eu]
21) EC-ECVAM (2007), Performance Standards for applying human skin models to in vitro skin irritation testing. Available at: [http://ecvam.jrc.ec.europa.eu]
22) EC-ECVAM (2008), Statement on the scientific validity of in vitro tests for skin irritation testing, issued by the ECVAM Scientific Advisory Committee (ESAC29), 5 November 2008. Available at: [http://ecvam.jrc.ec.europa.eu]
23) OECD (2010), Explanatory background document to the OECD draft Test Guideline on in vitro skin irritation testing. OECD Series on Testing and Assessment, No. 137, OECD, Paris. Available at: [http://www.oecd.org/document/24/0,3746,en_2649_34377_47858904_1_1_1_1,00.html]
24) Welss, T., Basketter, D.A. and Schröder, K.R. (2004), In vitro skin irritation: fact and future. State of the art review of mechanisms and models, Toxicol. in Vitro 18, 231-243.
25) Mosmann, T. (1983), Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays, J. Immunol. Methods 65, 55-63.
26) EpiSkinTM SOP, Version 1.8 (February 2009), ECVAM Skin Irritation Validation Study: Validation of the EpiSkinTM test method 15 min - 42 hours for the prediction of acute skin irritation of chemicals. Available at: [http://ecvam.jrc.ec.europa.eu]
27) EpiDermTM SOP, Version 7.0 (Revised March 2009), Protocol for: In vitro EpiDermTM skin irritation test (EPI-200-SIT), For use with MatTek Corporation’s reconstructed human epidermal model EpiDerm (EPI-200). Available at: [http://ecvam.jrc.ec.europa.eu]
28) SkinEthicTM RHE SOP, Version 2.0 (February 2009), SkinEthic skin irritation test-42bis test method for the prediction of acute skin irritation of chemicals: 42 minutes application + 42 hours post-incubation. Available at: [http://ecvam.jrc.ec.europa.eu]
29) Harvell, J.D., Lamminstausta, K., and Maibach, H.I. (1995), Irritant contact dermatitis, In: Practical Contact Dermatitis, pp 7-18, (Ed. Guin J. D.). Mc Graw-Hill, New York.
30) Commission Directive 2001/59/EC of 6 August 2001 adapting to technical progress for the 28th time Council Directive 67/548/EEC on the approximation of laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances, OV L 225, 21.8.2001., 1. lpp.
31) Basketter, D.A., York, M., McFadden, J.P. and Robinson, M.K. (2004), Determination of skin irritation potential in the human 4-h patch test. Contact Dermatitis 51, 1-4.
32) Jirova, D., Liebsch, M., Basketter, D., Spiller, E., Kejlova, K., Bendova, H., Marriott, M. and Kandarova, H. (2007), Comparison of human skin irritation and photo-irritation patch test data with cellular in vitro assays and animal in vivo data, ALTEX, 14, 359-365.
33) Jírová, D., Basketter, D., Liebsch, M., Bendová, H., Kejlová, K., Marriott, M. and Kandárová, H. (2010), Comparison of human skin irritation patch test data with in vitro skin irritation assays and animal data, Contact Dermatitis, 62, 109-116.
1. papildinājums
Definīcijas
Pareizība : pēc testēšanas metodes iegūto mērījumu rezultātu sakritības pakāpe ar pieņemtajām references vērtībām. Tas ir testēšanas metodes veiktspējas raksturlielums un viens no tās piemērotības aspektiem. Šo terminu bieži izmanto “atbilstības” vietā, ar to apzīmējot pēc testēšanas metodes iegūto pareizo rezultātu daļu (9).
Šūnu dzīvotspēja : parametrs, ar kuru mēra šūnu populācijas kopējo aktivitāti, piemēram, šūnu mitohondriju dehidrogenāžu spēju reducēt vitālo krāsvielu MTT (3–(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijbromīds, tiazolilzilais), kas atkarībā no nosakāmā testēšanas beigu punkta un izmantotā testēšanas plāna korelē ar dzīvo šūnu kopējo skaitu un/vai dzīvotspēju.
Sakritība : parametrs, ar kuru mēra to testēšanas metožu veiktspēju, ar kurām iegūst nepārprotami skaidrus rezultātus, un viens no piemērotības aspektiem. Šo terminu var lietot arī pareizības nozīmē, un to definē kā visu to testēto ķīmisko vielu proporcionālo daļu, kuras pareizi klasificētas kā tādas, kurām ir pozitīva vai negatīva reakcija (9).
ET50 : parametrs, ko var aprēķināt pēc ekspozīcijas laika, kas pēc noteiktas koncentrācijas ķīmiskā marķiera aplicēšanas nepieciešams šūnu dzīvotspējas samazināšanai par 50 % (sk. arī IC50).
ES CLP regula (Eiropas Parlamenta un Padomes 2008. gada 16. decembra Regula (EK) Nr. 1272/2008 par vielu un maisījumu klasificēšanu, marķēšanu un iepakošanu) : Eiropas Savienībā (ES) īsteno ANO GHS sistēmu ķīmisko vielu (substanču un to maisījumu) klasificēšanai un marķēšanai (3).
GHS (ANO Ķīmisko vielu klasificēšanas un marķēšanas Globāli harmonizētā sistēma) : sistēma, saskaņā ar kuru ķīmiskās vielas (kā substances un maisījumos) klasificē pēc standartizētiem kaitīgās iedarbības veidiem un to intensitātes uz cilvēka veselību un vidi, kā arī paredz atbilstošu saziņas elementu izmantošanu, piemēram, piktogrammas, signālvārdus, bīstamības apzīmējumus, piesardzības apzīmējumus un drošības datu lapas, kuru mērķis ir sniegt informāciju, kas nepieciešama cilvēku (tostarp darba devēju, strādājošo, transporta darbinieku, patērētāju un avārijas dienestu darbinieku) un vides aizsardzībai pret to kaitīgo iedarbību (1).
IC50 : parametrs, ko var aprēķināt pēc ķīmiskā marķiera koncentrācijas, kurā audu dzīvotspēja pēc noteikta ekspozīcijas laika samazinās par 50 % (IC50) (sk. arī ET50).
Nefiksēta deva : uz ādas epidermas aplicētais testējamās ķīmiskās vielas daudzums, kas ir lielāks par ādas epidermas pilnīgai un vienmērīgai pārklāšanai nepieciešamo daudzumu.
Atdarinājuma (me-too) tests : sadzīvisks apzīmējums testēšanas metodei, kura ir noteikšanas mehānisma vai funkcionalitātes ziņā līdzīga validētai un pieņemtai testēšanas references metodei. Šāda testēšanas metode varētu pretendēt uz vēlāku validēšanu. Brīvi aizstājama ar tai līdzīgu testēšanas metodi (9).
Veiktspējas standarti (PS) : saskaņā ar validētu testēšanas metodi noteikti standarti, pēc kuriem novērtē noteikšanas mehānisma vai funkcionalitātes ziņā līdzīgu testēšanas metožu salīdzināmību. Šeit iekļauti: i) testēšanas metodes būtiskie komponenti; ii) obligāti izmantojamās references vielas, kas izraudzītas no tām ķīmiskajām vielām, kuras izmantotas, lai pierādītu attiecīgās validētās testēšanas metodes veiktspējas pieņemamību; iii) salīdzināmie pareizības un ticamības līmeņi, kuru pamatā ir attiecīgajai validētajai testēšanas metodei noteiktie konkrētie līmeņi un kuru nodrošināšanu ar novērtējamo testēšanas metodi var pierādīt ar obligāti izmantojamajām references vielām (9).
References vielas : ķīmiskas vielas, kas izraudzītas izmantošanai validēšanas procesā un kuru reakcija in vitro vai in vivo testēšanas standartsistēmā vai pētāmajās sugās ir jau zināma. Šīm ķīmiskajām vielām jābūt reprezentatīvām attiecībā uz to ķīmisko vielu klasi, kuras testē ar attiecīgo metodi, un jāaptver testējamo ķīmisko vielu iespējamo reakciju diapazons (izteikta reakcija, vāja reakcija, nav reakcijas). Dažādos validēšanas procesa posmos var būt vajadzīgas dažādas references vielas; tas pats attiecas uz testēšanas metodēm un to lietojumiem (9).
Piemērotība : testa raksturojums no tā lietderīguma viedokļa; vai tas ir piemērots un izmantojams kādam konkrētam mērķim. Pakāpe, kādā ar minēto testu iespējams pareizi izmērīt vai prognozēt pētāmo bioloģisko ietekmi. Piemērotība ietver arī testēšanas metodes pareizības (atbilstības) aspektu (9).
Ticamība : parametrs, ar kuru mēra pakāpi, kādā tajā pašā vai citā laboratorijā ilgākā laikā, izmantojot to pašu protokolu, var iegūt reproducējamus rezultātus. To novērtē, aprēķinot iekšlaboratorijas un starplaboratoriju reproducējamību (9).
Aizstājējtests : ikdienā lietota testa aizstāšanai paredzēts tests, kuru pieņemts izmantot bīstamības identificēšanai un/vai riska novērtēšanai, ar pierādītu spēju ekvivalentā vai labākā veidā, salīdzinot ar pieņemto testu, nodrošināt (pēc vajadzības) cilvēka un dzīvnieku veselības vai vides aizsardzību; attiecas uz visām iespējamām testēšanas situācijām un ķīmiskajām vielām (9).
Jutība : ar konkrēto testēšanas metodi pareizi klasificēto pozitīvo/aktīvo testējamo ķīmisko vielu daļa, kurām ir attiecīgā veida iedarbība. Jutība ir testēšanas metodes precizitātes mērs, kādā iegūst nepārprotami skaidrus rezultātus, un tā ir svarīgs faktors, kas jāņem vērā, novērtējot testēšanas metodes piemērotību (9).
Ādas kairinājums : atgriezeniska audu bojājuma veidošanās ādā ne ilgāk kā 4 stundas pēc testējamās ķīmiskās vielas aplicēšanas. Ādas kairinājums ir vietēja ar imūnsistēmu nesaistīta reakcija, kas parādās neilgi pēc kairinātāja iedarbības (29). Tās svarīgākā iezīme ir atgriezeniskums, kas saistīts ar iekaisuma reakcijām un ar iekaisuma procesu saistītā kairinājuma raksturīgo klīnisko pazīmju (ādas apsarkums, pietūkums, niezēšana un sāpes) lielāko daļu.
Specifiskums : ar konkrēto testēšanas metodi pareizi klasificēto negatīvo/neaktīvo testējamo ķīmisko vielu daļa. Specifiskums ir testēšanas metodes precizitātes mērs, kādā iegūst nepārprotami skaidrus rezultātus, un tā ir svarīgs faktors, kas jāņem vērā, novērtējot testēšanas metodes piemērotību (9).
Pakāpeniskas testēšanas stratēģija : testēšana, kurā secīgi izmanto vairākas metodes; nākamajā testēšanas posmā izmantojamo metodi izraugās atkarībā no iepriekšējā testēšanas posma rezultātiem (9).
Testējamā ķīmiskā viela (arī testējamā viela) : viela vai vielu maisījums, kuru testē ar šo TM.
2. papildinājums
Veiktspējas standarti, pēc kuriem vērtējamas ierosinātās līdzīgās vai modificētās in vitro metodes ādas kairinājuma testēšanai ar cilvēka epidermas rekonstrukcijas modeļiem (RhE)
IEVADS
1. Veiktspējas standartu (PS) izstrādes mērķis ir izveidot pamatu, kuram pielīdzināt jaunas metodes – gan aizsargātas (t. i., ar autortiesībām, tirdzniecības zīmēm, reģistrāciju), gan neaizsargātas –, lai noteiktu, vai konkrētajām testēšanas vajadzībām tās ir pietiekami pareizas un ticamas. Šos PS, kuru pamatā ir validētas un pieņemtas metodes, var izmantot, lai izvērtētu, cik ticamas un pareizas ir citas, analogas metodes (ikdienā dēvētas par me-too jeb atdarinājuma testiem), kuru pamatā ir līdzīgi zinātniski principi un ar kurām mēra vai prognozē tā paša veida bioloģisko vai toksisko iedarbību (9).
2. Pirms pieņemt modificētas metodes (t. i., ierosinātos potenciālos uzlabojumus jau apstiprinātā metodē), jāveic novērtējums, kurā jānosaka ierosināto izmaiņu ietekme uz testa veiktspēju un pakāpe, kādā šīs izmaiņas ietekmē informāciju, kas pieejama par citiem validēšanas procesa komponentiem. Atkarībā no ierosināto izmaiņu daudzuma un rakstura, datiem, ko tās ģenerē, un papildu dokumentācijas šīs metodes vai nu jāvalidē tādā procesā, kāds paredzēts jaunām testēšanas metodēm, vai (ja tas ir pamatoti) ierobežotā apjomā, izmantojot esošos PS, jānovērtē to ticamība un piemērotība (9).
3. Līdzīgas (atdarinājuma jeb me-too) vai modificētas metodes, kas radniecīgas kādai no trijām validētajām metodēm [EpiSkin™ (validētā references metode – VRM), EpiDerm™ SIT (EPI-200) un SkinEthic™ RHE] un kas ierosinātas izmantošanai šajā TM, jānovērtē, lai noteiktu to ticamību un pareizību, un šajā procesā jāizmanto tādas ķīmiskās vielas, kas ir reprezentatīvas visam Dreiza [Draize] ādas kairinājuma reakcijas intervālam. Novērtētām pēc PS ar 20 ieteicamajām references vielām (1. tabula), ierosinātajām līdzīgajām vai modificētajām metodēm jābūt ar tādiem ticamības un pareizības rādītājiem, kas ir salīdzināmi ar VRM noteiktajiem vai labāki par tiem (2. tabula) (2) (16). Ticamības un pareizības vērtības, kuras jāsasniedz, norādītas šā papildinājuma 8. līdz 12. punktā. Jāiekļauj neklasificētas (ANO GHS/ES CLP“Neklas.”) un klasificētas (ANO GHS/ES CLP 2. kat.) (1) ķīmiskās vielas, kas pārstāv dažādas ķīmisko vielu klases, lai ierosinātās metodes ticamību un pareizību (jutība, specifiskums un kopējā precizitāte) varētu salīdzināt ar attiecīgajiem VRM rādītājiem. Pirms metodi izmantot jaunu testējamo ķīmisko vielu testēšanai, jānosaka metodes ticamība un tās spēja pareizi identificēt ANO GHS/ES CLP 2. kategorijas kairinošās ķīmiskās vielas un (atkarībā no regulatīvās sistēmas, kurai dati sagatavoti) arī spēja pareizi identificēt ANO GHS/ES CLP neklasificētās ķīmiskās vielas.
4. Šo PS pamatā ir EC-ECVAM PS (8), kas atjaunināti saskaņā ar ANO GHS un ES CLP sistēmu par klasifikāciju un marķēšanu (1) (3). Sākotnējos PS definēja pēc validācijas pētījuma (21) pabeigšanas, un to pamatā bija ES klasifikācijas sistēma, kas noteikta ar Komisijas 2001. gada 6. augusta Direktīvu 2001/59/EEK, ar ko divdesmit astoto reizi tehnikas attīstībai pielāgo Padomes Direktīvu 67/548/EEK par normatīvo un administratīvo aktu tuvināšanu attiecībā uz bīstamu vielu klasifikāciju, iepakošanu un marķēšanu ( 23 ). Laika posmā pēc validācijas pētījuma beigām un pirms šīs TM izstrādes pabeigšanas ANO GHS sistēma par klasifikāciju un marķēšanu tika pieņemta izmantošanai ES (ES CLP) (3), un tāpēc PS tika atjaunināti (8). Atjauninājumi attiecas pārsvarā uz: (i) PS references vielu kopumu; (ii) definētajām ticamības un pareizības vērtībām (2) (23).
VEIKTSPĒJAS STANDARTI IN VITRO RhE TESTĒŠANAS METODĒM ĀDAS KAIRINĀJUMA NOTEIKŠANAI
5. PS ir šādi trīs elementi (9):
I) Testēšanas metodes būtiskie komponenti
II) References vielu obligātais minimums
III) Definētās ticamības un pareizības vērtības
I. Testēšanas metodes būtiskie komponenti
6. Tie ir būtiski svarīgi validētas metodes struktūras, funkcionalitātes un procedūras elementi, kuri jāiekļauj ierosinātas, pēc noteikšanas mehānisma vai funkcionalitātes ziņā līdzīgas vai modificētas metodes protokolā. Šie komponenti ietver metodes unikālos raksturlielumus, kritiski svarīgas procedurālas iezīmes un kvalitātes kontroles pasākumus. Būtiski svarīgo testēšanas metodes komponentu ievērošana palīdzēs nodrošināt to, ka līdzīgas vai modificētas ierosinātās metodes koncepcija būs tāda pati kā atbilstošajai VRM (9). Būtiskie testēšanas metodes komponenti sīki aprakstīti TM 16. līdz 21. punktā, un testēšana jāveic saskaņā ar turpmāk minētajiem punktiem:
— Vispārīgi nosacījumi (16. punkts)
— Funkcionālie nosacījumi, tostarp:
—— šūnu dzīvotspēja (17. punkts),
— barjeras funkcija (18. punkts),
— morfoloģija (19. punkts),
— reproducējamība (20. punkts),
— kvalitātes kontrole (21. punkts).
II. References vielu obligātais minimums
7. References vielas izmanto, lai noteiktu, vai ierosināta vai modificēta metode, kura, kā pierādīts, strukturāli un funkcionāli ir pietiekami līdzīga VRM vai kura būtībā ir viena no trijām validētajām metodēm, tikai nedaudz modificētā veidā, ticamības un pareizības ziņā ir salīdzināma ar VRM vai ir labāka par to (2) (8) (16) (23). Ieteicamās 20 references vielas, kas uzskaitītas 1. tabulā, aptver dažādas ķīmisko vielu klases (t. i., ķīmisko vielu kategorijas atkarībā no to funkcionālajām grupām) un tās ir visam Dreiza [Draize] ādas kairinājuma reakcijas intervālam reprezentatīvas (no nekairinošām līdz stipri kairinošām). Minētajā sarakstā ir 10 ANO GHS/ES CLP 2. kategorijas ķīmiskās vielas un 10 neklasificētas ķīmiskās vielas, no kurām 3 ir fakultatīvās ANO GHS 3. kategorijas ķīmiskās vielas. Pēc šīs testēšanas metodes atsevišķi neklasificē vielas, ko var klasificēt ANO GHS 3. kategorijā. 1. tabulā uzskaitītās ķīmiskās vielas ir atlasītas no vielām, kuras izmantotas prevalidēšanai sekojošajā optimizācijas fāzē un VRM validēšanas pētījumā, ievērojot šo vielu funkcionālās īpašības un fizikālo stāvokli (14) (18). Šīs references vielas ir minimālais ķīmisko vielu daudzums, kas izmantojams, lai novērtētu ierosinātas līdzīgas vai modificētas metodes pareizību un ticamību, taču tās nav jāizmanto jaunu metožu izstrādē. Gadījumos, kad kāda no norādītajām ķīmiskajām vielām nav pieejama, var izmantot citas ķīmiskās vielas, par kurām ir pieejami atbilstoši references dati, kas iegūti in vivo izmēģinājumos, priekšroku dodot vielām, kuras izmantotas prevalidēšanai sekojošajā optimizācijas fāzē vai VRM validēšanas pētījumā. Ja nepieciešams, ierosinātās metodes pareizības tālākai novērtēšanai papildus obligātajam references vielu kopumam var izmantot citām ķīmisko vielu klasēm piederošas vielas, par kurām ir pieejami atbilstoši references dati, kas iegūti in vivo izmēģinājumos.
1. tabula
Obligātās references vielas pareizības un ticamības vērtību noteikšanai līdzīgām vai modificētām RhE ādas kairinājuma noteikšanas metodēm (1)
|
Ķīmiskā viela |
CAS Nr. |
Fizikālais stāvoklis |
In vivo reakcija |
VRM in vitro kat. |
ANO GHS/ES CLP in vivo kat. |
|
1-brom-4-hlorbutāns |
6940-78-9 |
Šķidr. |
0 |
2. kat. |
Neklas. |
|
dietilftalāts |
84-66-2 |
Šķidr. |
0 |
Neklas. |
Neklas. |
|
naftalīnetiķskābe |
86-87-3 |
Cietv. |
0 |
Neklas. |
Neklas. |
|
alilfenoksiacetāts |
7493-74-5 |
Šķidr. |
0,3 |
Neklas. |
Neklas. |
|
izopropanols |
67-63-0 |
Šķidr. |
0,3 |
Neklas. |
Neklas. |
|
4-metiltiobenzaldehīds |
3446-89-7 |
Šķidr. |
1 |
2. kat. |
Neklas. |
|
metilstearāts |
112-61-8 |
Cietv. |
1 |
Neklas. |
Neklas. |
|
heptilbutirāts |
5870-93-9 |
Šķidr. |
1,7 |
Neklas. |
Neklas. |
|
heksilsalicilāts |
6259-76-3 |
Šķidr. |
2 |
Neklas. |
Neklas. |
|
kanēļskābes aldehīds |
104-55-2 |
Šķidr. |
2 |
2. kat. |
Neklas. (Fakult. 3. kat.) (3) |
|
1-dekanols (2) |
112-30-1 |
Šķidr. |
2,3 |
2. kat. |
2. kat. |
|
ciklamenaldehīds |
103-95-7 |
Šķidr. |
2,3 |
2. kat. |
2. kat. |
|
1-bromheksāns |
111-25-1 |
Šķidr. |
2,7 |
2. kat. |
2. kat. |
|
2-hlormetil-3,5-dimetil-4-metoksipiridīna hidrohlorīds |
86604-75-3 |
Cietv. |
2,7 |
2. kat. |
2. kat. |
|
di-n-propildisulfīds (2) |
629-19-6 |
Šķidr. |
3 |
Neklas. |
2. kat. |
|
kālija hidroksīds (5 % ūd.) |
1310-58-3 |
Šķidr. |
3 |
2. kat. |
2. kat. |
|
5-(1,1-dimetiletil)-2-metilbenzotiols |
7340-90-1 |
Šķidr. |
3,3 |
2. kat. |
2. kat. |
|
1-metil-3-fenil-1-piperazīns |
5271-27-2 |
Cietv. |
3,3 |
2. kat. |
2. kat. |
|
heptanāls |
111-71-7 |
Šķidr. |
3,4 |
2. kat. |
2. kat. |
|
tetrahloretilēns |
127-18-4 |
Šķidr. |
4 |
2. kat. |
2. kat. |
|
(1) Ķīmisko vielu izvēles pamatā ir šādi kritēriji: (i) vielas ir nopērkamas, (ii) tās ir visam Dreiza [Draize] ādas kairinājuma reakcijas intervālam reprezentatīvas (no nekairinošām līdz stipri kairinošām), (iii) tās ir ar precīzi noteiktu ķīmisko struktūru, (iv) vielas ir reprezentatīvas validācijas procesā izmantotajām ķīmiskajām funkcijām, (v) tās nav ekstrēmi toksiskas (piemēram, kancerogēnas vai reproduktīvajai sistēmai toksiskas), un to lietošana nav saistīta ar pārlieku augstām atkritumu apsaimniekošanas izmaksām. (2) Ādu kairinoša iedarbība uz trušiem, bet ir ticami pierādījumi, ka iedarbība uz cilvēku nav kairinoša (31) (32) (33). (3) Saskaņā ar ANO GHS, bet ne ar ES CLP. |
|||||
III. Definētās ticamības un pareizības vērtības
8. Lai noteiktu ierosināto līdzīgo vai modificēto metožu ticamību un piemērotību starplaboratoriskai izmantošanai, vismaz trijās laboratorijās jānotestē visas 20 references vielas, kas uzskaitītas 1. tabulā. Tomēr, ja ierosināto metodi izmantos tikai vienā laboratorijā, testēšana daudzās laboratorijās šīs metodes validēšanai nav nepieciešama. Būtiski svarīgi tomēr ir tas, lai šādus validācijas pētījumus saskaņā ar starptautiskām vadlīnijām izvērtētu neatkarīgas, starptautiski atzītas validācijas struktūras (9). Katrā laboratorijā visas 20 references vielas jātestē trijās neatkarīgās testēšanas sērijās, kuras veic ar atšķirīgu partiju audiem un ar pietiekami ilgstošiem starplaikiem. Katrā sērijā vienlaikus jātestē vismaz trīs audu paraugu atkārtojumi katrai testējamai vielai, NC un PC.
9. Lai nodrošinātu to, ka ticamības un piemērotības vērtības tiek aprēķinātas iepriekš noteiktā un konsekventā veidā, ierosinātās metodes ticamību un pareizumu aprēķina, ņemot vērā visus četrus turpmāk minētos kritērijus kopā:
1. Iekšlaboratorijas un starplaboratoriju variāciju un prognozēšanas spējas (pareizības) aprēķināšanai izmantojami tikai dati no pilnīgām testēšanas sērijām.
2. Katras references vielas galīgo klasifikāciju katrā attiecīgajā laboratorijā nosaka pēc šūnu dzīvotspējas vidējās vērtības, kas noteikta vairākām testējamo paraugu sērijām pilnīgā testēšanas sērijā.
3. Lai aprēķinātu metodes starplaboratoriju variāciju, izmantojami tikai dati par vielām, kurām visās attiecīgajās laboratorijās veiktas pilnīgas testēšanas sērijas.
4. Pareizības vērtības aprēķina, pamatojoties uz individuālu laboratoriju prognozi par visām 20 references vielām, kura izveidota dažādās attiecīgajās laboratorijās.
Šajā kontekstā testēšanas sērija ir trīs neatkarīgas testēšanas reizes, ko vienā laboratorijā veic vienai testējamai ķīmiskai vielai. Pilnīga testēšanas sērija ir testēšanas sērija, kuru vienā laboratorijā veic vienai testējamai ķīmiskai vielai un kurā visās trijās testēšanas reizēs iegūts derīgs rezultāts. Tas nozīmē, ka viena testēšanas reize, kurā iegūts nederīgs rezultāts, padara nederīgu visu testēšanas sēriju, kas sastāv no trijām testēšanas reizēm.
10. Iekšlaboratorijas reproducējamībai jābūt tādai, ka pēc vienā laboratorijā dažādās neatkarīgās 20 references vielu testēšanas sērijās iegūtajiem rezultātiem noteiktās vielu klasifikācijas (ANO GHS/ES CLP 2. kat./neklas.) sakritība ir vienāda vai lielāka (≥) par 90 %.
11. Starplaboratoriju reproducējamībai nav būtiskas nozīmes gadījumos, kad attiecīgo metodi paredzēts izmantot tikai vienā laboratorijā. Metodēm, kuras paredzēts izmantot vairākās laboratorijās, starplaboratoriju reproducējamībai ir jābūt tādai, ka pēc vismaz trijās laboratorijās dažādās neatkarīgās 20 references vielu testēšanas sērijās iegūtajiem rezultātiem noteiktās vielu klasifikācijas (ANO GHS/ES CLP 2. kat./neklas.) sakritība ir vienāda vai lielāka (≥) par 80 %.
12. Ierosinātās līdzīgās vai modificētās metodes precizitātei (jutība, specifiskums un kopējā pareizība) jābūt tādai pašai vai labākai nekā VRM, ņemot vērā papildu informāciju par metodes piemērotību pētāmajai sugai (2. tabula). Jutībai jābūt vienādai vai lielākai (≥) par 80 % (2) (8) (23). Tomēr pastāv vēl viens konkrēts ierobežojums attiecībā uz ierosinātās in vitro metodes jutību, proti, tikai divas in vivo 2. kategorijas ķīmiskās vielas, 1-dekanols un di-n-propildisulfīds, drīkst tikt kļūdaini identificētas kā neklasificētas vielas vairāk nekā vienā attiecīgajā laboratorijā. Specifiskumam jābūt vienādam vai lielākam (≥) par 70 % (2) (8) (23). Citu ierobežojumu attiecībā uz ierosinātās in vitro metodes specifiskumu nav, t. i., attiecīgā laboratorija drīkst kļūdaini identificēt in vivo neklasificētu ķīmisku vielu, kamēr vien testēšanas metodes specifiskuma galīgā vērtība paliek pieņemamajā diapazonā. Kopējai pareizībai jābūt vienādai vai lielākai (≥) par 75 % (2) (8) (23). Kaut arī VRM jutība, kas aprēķināta 20 references vielām, kuras uzskaitītas 1. tabulā, ir 90 %, definētā minimālās jutības vērtība, lai līdzīgu vai modificētu metodi uzskatītu par derīgu, ir 80 %, jo ir zināms, ka gan 1-dekanols (robežai tuvs rezultāts), gan di-n-propildisulfīds (šķietams negatīvs VRM) cilvēkam nav kairinoši (31) (32) (33), toties testēšanā ar trušiem tie identificēti kā kairinošas vielas. Tā kā RhE modeļos izmanto cilvēka izcelsmes šūnas, ar tiem var prognozēt šo ķīmisko vielu nekairinošo iedabu (ANO GHS/ES CLP neklas.).
2. tabula
Prasītās jutības, specifiskuma un kopējās pareizības prognozētspējas vērtības, lai līdzīgu vai modificētu metodi uzskatītu par derīgu
|
Jutība |
Specifiskums |
Kopējā pareizība |
|
≥ 80 % |
≥ 70 % |
≥ 75 % |
13. Iespējams, ka vienā vai vairākos testos ar vienu vai vairākām testējamām vielām tiek/netiek izpildīti testēšanas pieņemamības kritēriji testējamām un kontroles vielām vai ka šie testi ir/nav pieņemami citu iemeslu dēļ. Lai iegūtu trūkstošos datus, pieļaujams katru testējamo vielu testēt ne vairāk kā vēl divas reizes (“atkārtota testēšana”). Precīzāk, tā kā atkārtotas testēšanas gadījumā vienlaikus jātestē arī PC un NC, katrai testējamai vielai maksimāli pieļaujamas divas papildu testēšanas sērijas.
14. Jādomā, ka pat pēc atkārtotas testēšanas var būt tā, ka nevar katrai testējamai vielai nodrošināt prasītās trīs derīgās testēšanas sērijas ar katru references vielu katrā attiecīgajā laboratorijā, un rezultāts ir nepilnīga datu matrica. Šādos gadījumos datu kopas uzskata par pieņemamām tad, ja ir izpildīti visi trīs turpmāk minētie kritēriji.
1. Par katru no 20 references vielām jābūt vismaz vienai pilnīgai testēšanas sērijai.
2. Katrā no vismaz trim attiecīgajām laboratorijām jānodrošina, ka vismaz 85 % testēšanas sēriju ir pilnīgas (20 ķīmiskām vielām, t. i., vienā laboratorijā nederīgas drīkst būt trīs testēšanas sērijas).
3. Vismaz 90 % visu iespējamo testēšanas sēriju no vismaz trim laboratorijām jābūt pilnīgām (20 ķīmiskām vielām, kas testētas trijās laboratorijās, t. i., nederīgas drīkst būt kopumā sešas testēšanas sērijas).;
B. 47 LIELLOPU RADZENES DUĻĶOŠANĀS UN CAURLAIDĪBAS TESTĒŠANAS METODE NOPIETNUS ACU BOJĀJUMUS VAI NOPIETNU KAIRINĀJUMU IZRAISĪTĀJU VIELU IDENTIFICĒŠANAI
IEVADS
1. Liellopu radzenes duļķošanās un caurlaidības (BCOP) testēšanas metode in vitro ir noteikšanas metode, ko konkrētos apstākļos un ar noteiktiem ierobežojumiem var izmantot, lai vielas un to maisījumus klasificētu kā “nopietnus acu bojājumus vai nopietnu kairinājumu” izraisītājus (1) (2) (3). Šajā testēšanas metodē nopietnu kairinājumu izraisošām uzskata vielas, kas trušiem rada acu bojājumus, kuri neizzūd vismaz 21 dienas laikā pēc iedarbības. Kaut gan netiek uzskatīts, ka ar BCOP var pilnībā aizstāt iedarbības testu uz acīm in vivo ar trušiem, BCOP iesaka izmantot daudzpakāpju testēšanas stratēģijā, lai īpašas lietošanas jomā veiktu normatīvajos aktos reglamentēto klasifikāciju un marķēšanu (4) (5). Testējamās vielas un maisījumus (6) var klasificēt kā nopietnus acu bojājumus vai nopietnu kairinājumu izraisošas, neveicot papildu testēšanu ar trušiem. Ar vielām, kuru testēšanas rezultāts ir negatīvs, jāveic izmēģinājumi izmantojot trušus pēc pakāpeniskas loģiski secīgas testēšanas stratēģijas saskaņā ar ESAO testēšanas norādījumiem OECD Test Guideline 405 (7) (šī pielikuma B. 5. nodaļa).
2. Šajā testēšanas metodē aprakstītas procedūras, ko izmanto, lai vērtētu testējamās vielas potenciālo nopietnus bojājumus vai nopietnu kairinājumu izraisošo iedarbību uz acīm, ko mēra ar tās spēju izraisīt izolētas liellopu acs radzenes duļķošanos un palielināt tās caurlaidību. Toksisko iedarbību uz radzeni mēra ar šādiem parametriem: (i) gaismas caurlaidības samazināšanās (duļķošanās), (ii) krāsvielas fluoresceīna nātrija sāls caurlaidības palielināšanās (caurlaidība). Radzenes duļķošanās un caurlaidības vērtējumu pēc testējamās vielas iedarbības apvieno, lai noteiktu kairinājuma rādītāju in vitro (IVIS), ko izmanto testējamās vielas radītā kairinājuma pakāpes klasificēšanai.
3. Pēc BCOP testēšanas metodes ir testētas arī tāda acu kairinājuma izraisošas vielas, kura radītie bojājumi izzūd drīzāk nekā 21 dienas laikā, gan arī vielas, kurām nav kairinājumu izraisošas iedarbības. Tomēr BCOP testēšanas metodes pareizība un rezultātu ticamība šo kategoriju vielām nav formāli novērtēta.
4. Definīcijas sk. 1. papildinājumā.
SĀKOTNĒJIE APSVĒRUMI UN IEROBEŽOJUMI
5. Šīs testēšanas metodes pamatā ir Alternatīvo metožu validēšanas starpaģentūru koordinācijas komitejas (ICCVAM) BCOP testēšanas metodes protokols (8), kas tika izstrādāts pēc starptautiska validācijas pētījuma (4)(5)(9), kurā piedalījās Eiropas Alternatīvo metožu validēšanas centrs (ECVAM) un Japānas Alternatīvo metožu validēšanas centrs (JaCVAM). Protokola pamatā ir informācija, kas iegūta no In vitro pētījumu institūta (IIVS) un INVITTOX protokola Nr. 124 (10), kurš atbilst Eiropas Kopienas sponsorētā 1997.-1998. gadā veiktā BCOP testa iepriekšējas validācijas pētījumā izmantotajam protokolam. Abu protokolu pamatā ir BCOP testēšanas metodika, ko pirmoreiz aprakstījuši Gautheron et al. (11).
6. Šīs testēšanas metodes apzinātie ierobežojumi ir lielais kļūdaini pozitīvo rezultātu procents spirtiem un ketoniem un lielais kļūdaini negatīvo rezultātu procents cietvielām validācijas datubāzē (sk. 44. punktu) (5). Ja no datubāzes izslēdz vielas, kas ietilpst šajās fizikālo un ķīmisko īpašību klasēs, BCOP precizitāte ES, EPA un GHS klasifikācijas sistēmās ievērojami uzlabojas (5). Pamatojoties uz šā testa nolūku (t.i., identificēt tikai nopietnus acu bojājumus / nopietnu kairinājumu izraisošas vielas), kļūdaini negatīvo rezultātu procentam nav būtiskas nozīmes, jo šādas vielas pēc tam tiktu testētas izmēģinājumos ar trušiem vai izmantojot citus pietiekami validētus in vitro testus atkarībā no normatīvajos aktos noteiktajām prasībām, izmantojot secīgas testēšanas stratēģiju un citus attiecīgus datus. Turklāt patlaban esošā validācijas datubāze nedod iespējas pienācīgi novērtēt dažas ķīmisko vielu un produktu klases (piemēram, maisījumus). Taču var mēģināt izmantot šo testēšanas metodi visu veidu testējamajiem materiāliem (tostarp maisījumiem), ja pozitīvs rezultāts var būt pieņemams kā norāde par nopietnus acu bojājumus vai nopietnu kairinājumu izraisošu iedarbību. Taču par spirtiem un ketoniem iegūtie pozitīvie rezultāti jāinterpretē piesardzīgi pārvērtēšanas riska dēļ.
7. Visās procedūrās ar liellopu acīm un liellopu radzenēm testēšanas iestādēm jāievēro piemērojamie noteikumi un procedūras darbībām ar dzīvnieku izcelsmes materiāliem, pie kuriem pieder arī audi un audu šķidrumi. Bez tam ieteicams ievērot vispārējos piesardzības pasākumus darbam laboratorijā (12).
8. Lai gan testēšanas metodē tiek ņemti vērā daži iedarbības veidi uz acīm, kas tiek novērtēti truša acs kairinājuma testa metodē un zināmā mērā to smagums, tajā netiek ņemti vērā konjunktīvas un varavīksnenes bojājumi, kas ir šīs metodes ierobežojums. Kaut gan radzenes bojājumu atgriezeniskumu per se nevar novērtēt izmantojot BCOP testa metodi, pamatojoties uz izmēģinājumu rezultātiem ar trušiem, ierosināts neatgriezeniskas un atgriezeniskas iedarbības nošķiršanai izmantot radzenes bojājuma sākotnējā dziļuma novērtējumu (13). Visbeidzot, izmantojot BCOP metodi, nevar novērtēt ar iedarbību uz acīm saistītās sistēmiskās toksicitātes potenciālu.
9. Patlaban notiek darbs pie precīzāku raksturlielumu izstrādes BCOP metodes izmantošanas iespēju un ierobežojumu noteikšanā kairinājumu izraisošu un kairinājumu neizraisošu vielu identificēšanai (sk. arī 45. punktu). BCOP testēšanas metodes formālai novērtēšanai un iespējamo izmantošanas veidu noteikšanai, tostarp kairinājumu izraisošu un kairinājumu neizraisošu vielu identificēšanai, tās lietotāji tiek aicināti iesniegt validācijas organizācijām paraugus un/vai sniegt datus.
10. Laboratorijām, kas sāk lietot šo testēšanas metodi, jāizmanto 2. papildinājumā norādītās standartvielas. Laboratorija šīs vielas var izmantot BCOP testēšanas metodes izpildes tehniskās kompetences demonstrēšanai pirms BCOP testēšanas rezultātu datu iesniegšanas izmantošanai normatīvajos aktos reglamentētajai bīstamības klasifikācijai.
METODES PRINCIPS
11. BCOP testēšanas metode ir orgāntipisks modelis, kas īslaicīgi nodrošina iespēju saglabāt liellopu acs radzenes normālas fizioloģiskas un bioķīmiskas funkcijas in vitro. Šajā testēšanas metodē testējamās vielas radītos bojājumus novērtē, veicot radzenes duļķošanās un gaismas caurlaidības izmaiņu kvantitatīvus mērījumus attiecīgi ar opacitometru un redzamās gaismas spektrofotometru. Abus mērījumus izmanto IVIS aprēķināšanai, pēc kura nosaka kairinājuma izraisīšanas bīstamības klasifikācijas kategoriju in vitro, ko izmanto testējamās vielas acu kairinājumu izraisīšanas potenciāla in vivo prognozei (sk. sadaļu “Lēmuma pieņemšanas kritēriji”).
12. BCOP testēšanas metodē tiek izmantotas tikko kautu liellopu acs izolētas radzenes. Radzenes duļķošanos mēra kvantitatīvi kā radzenes gaismas caurlaidību. Radzenes caurlaidību mēra kvantitatīvi kā krāsvielas fluoresceīna nātrija sāls daudzumu, kas iziet cauri visam radzenes slānim un ko nosaka aizmugurējā nodalījuma vidē. Testējamo vielu aplicē uz radzenes epitēlija virsmas, to iepildot radzenes turētāja priekšējā kamerā. 3. papildinājumā dots BCOP metodē izmantojamā radzenes turētāja apraksts un shēma. Radzenes turētāji ir gatavi nopērkami no dažādiem piegādātājiem, tos var izgatavot pašu spēkiem.
Liellopu acu iegūšanai izmantojamo dzīvnieku šķirnes un vecums
13. Uz kautuvēm nosūtītos liellopus parasti kauj izmantošanai patēriņam cilvēku pārtikā vai citām vajadzībām. Par cilvēkiem paredzētas pārtikai piemērotiem uzskata tikai veselīgus dzīvniekus, ko izmanto arī BCOP testā vajadzīgo radzeņu iegūšanai. Liellopu dzīvsvars atkarībā no šķirnes, vecuma un dzimuma var ievērojami atšķirties, tāpēc netiek noteikts ieteicamais dzīvnieka dzīvsvars kaušanas laikā.
14. Ja tiek izmantotas dažāda vecuma dzīvnieku acis, to radzeņu izmēri var atšķirties. No liellopiem, kas vecāki par astoņiem gadiem, parasti iegūst radzenes, kuru diametrs horizontāli ir > 30,5 mm un kuru biezums centrā (CCT) ir ≥ 1 100 μm, savukārt no liellopiem, kas ir jaunāki par pieciem gadiem, iegūst radzenes ar diametru horizontāli < 28,5 mm un CCT < 900 μm (14). Šā iemesla dēļ tāpēc parasti neizmanto par 60 mēnešiem vecāku liellopu acis. Parasti neizmanto arī par 12 mēnešiem jaunāku liellopu acis, jo tās vēl attīstās un radzenes biezums un diametrs ir ievērojami mazāki nekā pieaugušu liellopu acīm. Taču jaunlopu (t.i., 6 līdz 12 mēnešus vecu) radzenes ir pieļaujams izmantot, jo tām ir dažas priekšrocības, piemēram, lielāka pieejamība, mazs vecuma diapazons un mazāks darbinieku iespējamas saskares risks ar liellopu sūkļveida encefalopātiju (15). Tā kā būtu lietderīgi sīkāk novērtēt, kā radzenes lielums un biezums ietekmē tās reakciju uz nopietnus acu bojājumus/ nopietnu acu kairinājumu izraisītāju vielu iedarbību, lietotāji tiek rosināti norādīt to dzīvnieku aptuveno vecumu un/vai dzīvsvaru, no kuriem ņemtas testēšanai izmantotās radzenes.
Acu ņemšana un nogādāšana laboratorijā
15. Acis ņem kautuvju darbinieki. Lai pēc iespējas samazinātu acu mehāniskos un cita veida bojājumus, acis izņem iespējami drīz pēc dzīvnieka nonāvēšanas. Lai novērstu kairinājumu iespējami izraisošu vielu iedarbību uz acīm, dzīvnieka galvas skalošanai nedrīkst izmantot detergentus.
16. Piemērota izmēra konteinerā acis pilnībā iegremdē Henksa šķīdumā (Hanks’ Balanced Salt Solution, HBSS) un nogādā laboratorijā tā, lai pēc iespējas samazinātu to bojāšanos un/vai bakteriālo kontamināciju. Tā kā acis tiek ņemtas kaušanas laikā, tās var būt pakļautas asiņu un citu bioloģisko materiālu, kā arī baktēriju u.c. mikroorganismu iedarbībai. Tāpēc ir svarīgi iespējami samazināt kontaminācijas risku (piemēram, turot konteineru ar acīm uz kūstoša ledus, un Henksa šķīdumam (HBSS), kurā acis atrodas transportēšanas laikā, pievienojot antibiotikas [piemēram, penicilīnu koncentrācijā 100 IU/mL un streptomicīnu koncentrācijā 100 μg/mL]).
17. Pēc iespējas samazina laiku no acu ņemšanas līdz radzeņu izmantošanai BCOP testā (parasti ņem un izmanto tajā pašā dienā), un uzskatāmi parāda, ka tam nav ietekmes uz testēšanas rezultātiem. Šo rezultātu pamatā ir acu izvēles kritēriji, kā arī atbildes reakcijas pozitīvajā un negatīvajā kontrolē. Visām testēšanā izmantotajām acīm ir jābūt no vienas noteiktā dienā ņemto acu grupas.
BCOP testam izmantojamo acu izvēles kritēriji
18. Pēc acu nogādāšanas laboratorijā uzmanīgi pārbauda, vai tām nav bojājumu, tostarp pārmērīgas duļķošanās, skrambu vai neovaskularizācijas. Jāizmanto tikai tādu acu radzenes, kam nav šo bojājumu.
19. Vēlāk testēšanas procesā novērtē arī katras radzenes kvalitāti. Nav derīgas radzenes, kuru duļķošanās rādītājs pēc sākotnējās vienas stundas līdzsvarošanas perioda ir lielāks par septiņām duļķošanās vienībām (PIEZĪME: opacitometrs jākalibrē ar duļķainības kalibratoriem standartiem, kurus izmanto duļķošanās vienību noteikšanai, sk. 3. papildinājumu).
20. Katrā paraugu grupā (testējamā viela, paralēlas negatīvās un pozitīvās kontroles) jābūt vismaz trīs acīm. BCOP testa negatīvajai kontrolei izmanto trīs radzenes. Tā kā visas radzenes tiek izņemtas no acs ābola un iemontētas radzeņu kamerās, ir iespējami atsevišķu radzeņu duļķošanās un caurlaidības rādītāju artefakti (tostarp negatīvajā kontrolē). Turklāt, veicot IVIS aprēķinus, radzeņu, kam veic negatīvo kontroli, duļķošanās un caurlaidības vērtības tiek izmantotas to radzeņu duļķošanās un caurlaidības vērtību korekcijai, uz kurām iedarbojas ar testējamo vielu un izmanto pozitīvajai kontrolei.
PROCEDŪRA
Acu sagatavošana
21. Nebojātas radzenes izpreparē kopā ar 2–3 mm platu cīpslenes daļu, lai atvieglotu turpmākās operācijas un nebojātu radzenes epitēliju un endotēliju. Izolētās radzenes nostiprina šim nolūkam paredzētos radzeņu turētājos, kas sastāv no priekšējā un aizmugurējā nodalījuma, kuri saskaras attiecīgi ar radzenes epitēlija un endotēlija virsmu. Abas kameras (vispirms aizmugurējo kameru) tā, lai neveidotos burbuļi, pilnībā piepilda ar siltu Īgla barotni (Eagle's Minimum Essential Medium, EMEM). Pēc tam vismaz vienu stundu ierīci iztur pie 32 ± 1 °C, lai stabilizētu tās temperatūru un radzene būtu līdzsvarā ar apkārtējo vidi, iespējami nodrošinot normālu metabolisko aktivitāti (radzenes virsmas temperatūra in vivo ir apmēram 32 °C).
22. Pēc līdzsvarošanas abās kamerās iepilda svaigu siltu EMEM, un katrai radzenei nolasa sākotnējās duļķošanās rādījumus. Radzenes, kam tiek konstatēti makroskopiski audu bojājumi (piemēram, skrambas, pigmentācija, neovaskularizācija) vai kuru duļķošanās rādītājs ir lielāks par 7 duļķošanās vienībām, nav derīgas. Aprēķina visu to radzeņu vidējo duļķošanos, kam veikta līdzsvarošana. Vismaz trīs radzenes, kuru duļķošanās vērtības ir tuvu visu radzeņu vidējai duļķošanās vērtībai, izmanto negatīvajai (jeb šķīdinātāju) kontrolei. Pārējās radzenes iedala testa un pozitīvās kontroles grupās.
23. Tā kā ūdens siltumietilpība ir lielāka par gaisa siltumietilpību, ūdens nodrošina stabilākus temperatūras apstākļus inkubācijai. Tāpēc radzenes turētāja un tā satura uzturēšanai 32 ± 1 °C temperatūrā ieteicams izmantot ūdens vannu. Taču var izmantot arī inkubatorus ar gaisu, ja tiek veikti temperatūras stabilitātes uzturēšanai vajadzīgie pasākumi (piemēram, iepriekš sasildot turētājus un barotni).
Testējamās vielas aplicēšana
24. Izmanto divus dažādus apstrādes protokolus, vienu šķidrumiem un virsmaktīvām vielām (cietvielām vai šķidrumiem), bet otru cietvielām, kas nav virsmaktīvas.
25. Šķidrumu iedarbību testē neatšķaidot, bet virsmaktīvās vielas testē 10 % (masas) koncentrācijā 0,9 % nātrija hlorīda šķīduma, destilēta ūdens vai cita šķīdinātāja šķīdumā, par kuriem ir iegūtas liecības, ka tiem nav nevēlamas ietekmes uz testēšanas sistēmu. Pusšķidrus, krēmveida un vaskveida materiālus parasti testē šķīdumu veidā. Ja izmanto citu atšķaidīšanas koncentrāciju, tas ir attiecīgi jāpamato. Šķidrumu un virsmaktīvo vielu iedarbībai radzenes pakļauj 10 min. Ja izmanto citu iedarbības laiku, tam jāsniedz pienācīgs zinātnisks pamatojums.
26. Cietvielas, kas nav virsmaktīvas, parasti testē šķīdumu vai suspensiju veidā 20 % koncentrācijā 0,9 % nātrija hlorīda šķīduma, destilēta ūdens vai cita šķīdinātāja šķīdumā, par kuriem ir iegūtas liecības, ka tiem nav nevēlamas ietekmes uz testēšanas sistēmu. Zināmos apstākļos ar pienācīgu zinātnisku pamatojumu cietvielas var testēt tīrā veidā, izmantojot vaļējās kameras metodi (sk. 29. punktu), tās tieši aplicējot uz radzenes virsmas. Cietvielu iedarbībai radzenes pakļauj četras stundas, taču, tāpat kā šķidrumu un virsmaktīvu vielu gadījumā, ar pienācīgu zinātnisku pamatojumu drīkst izmantot citu iedarbības laiku.
27. Atkarībā no testējamās vielas fizikālajām un ķīmiskajām īpašībām (piemēram, cietvielas, šķidrumi, viskozi un neviskozi šķidrumi) var izmantot dažādas aplicēšanas metodes. Galvenais ir nodrošināt, lai testējamā viela pienācīgi pārklātu epitēlija virsmu, un skalojot tā tiktu pienācīgi noskalota. Slēgtās kameras metodi parasti izmanto neviskozām vai nedaudz viskozām testējamām vielām, kas ir šķidrumi, bet vaļējās kameras metodi parasti izmanto daļēji viskozām un viskozām testējamajām vielām un cietvielām tīrā veidā.
28. Izmantojot slēgtās kameras metodi, pietiekamu daudzumu testējamās vielas (750 μL), ar ko var pārklāt radzenes epitēlija virsmu, ievieto priekšējā kamerā pa dozēšanas atverēm kameras augšpusē un atveres pēc tam uz iedarbības laiku noslēdz ar kameras aizbāžņiem. Svarīgi ir nodrošināt, lai katra radzene tiktu pakļauta testējamās vielas iedarbībai uz atbilstošu laiku.
29. Izmantojot vaļējās kameras metodi, pirms aplicēšanas noņem loga slēggredzenu un priekšējās kameras stikla lodziņu. Kontroles vai testējamo vielu (750 μL vai tādu testējamās vielas daudzumu, ar ko var pilnībā noklāt radzeni) aplicē tieši uz radzenes epitēlija virsmas ar mikropipeti. Ja testējamās vielas dozēšana ar pipeti ir apgrūtināta, to var zem spiediena iepildīt virzuļpipetē, lai atvieglotu dozēšanu. Virzuļpipetes uzgali ievieto šļirces dozēšanas uzgalī, lai materiālu spiediena iedarbības rezultātā varētu iespiest dozēšanas uzgalī. Vienlaikus, pipetes virzulim pārvietojoties augšup, tiek spiests šļirces virzulis. Ja pipetes uzgalī parādās gaisa burbuļi, testējamo materiālu izņem (izspiež) un procesu atkārto, kamēr uzgalis ir pilns un tajā nav gaisa burbuļu. Ja vajadzīgs, var izmantot parastu šļirci (bez adatas), jo ar to var izmērīt precīzu testējamās vielas tilpumu, un vielu ir vieglāk uzklāt radzenes epitēlija virsmai. Pēc aplicēšanas priekšējai kamerai ieliek stikla lodziņu, lai atkal izveidotu noslēgtu sistēmu.
Inkubēšana pēc iedarbības
30. Pēc iedarbības perioda testējamo, negatīvās kontroles vai pozitīvās kontroles vielu izņem no priekšējās kameras un epitēliju vismaz trīs reizes (vai kamēr vairs nav vizuāli novērojamas testējamās vielas paliekas) nomazgā ar EMEM (kas satur fenolsarkano). Barotni, kurā ir fenolsarkanais, izmanto skalošanai, jo fenolsarkanā krāsas izmaiņas var novērot, lai noteiktu skābu vai sārmainu materiālu noskalošanas efektivitāti. Radzenes mazgā vairāk nekā trīs reizes, ja fenolsarkanais nekrāsojas sarkans (ir dzeltenā vai violetā krāsā) vai ja ir redzamas testējamā materiāla atliekas. Kad barotnē vairs nav testējamās vielas, radzenes pēdējo reizi noskalo ar EMEM (bez fenolsarkanā). Pēdējā skalošanas reizē izmanto EMEM (bez fenolsarkanā), lai noskalotu fenolsarkano no priekšējās kameras pirms duļķošanās mērīšanas. Pēc tam priekšējo kameru no jauna piepilda ar svaigu EMEM, kas nesatur fenolsarkano.
31. Testējot šķidrumus vai virsmaktīvas vielas, pēc skalošanas radzenes inkubē vēl divas stundas 32 ± 1 °C temperatūrā. Zināmos apstākļos var būt noderīgs ilgāks pēciedarbības laiks, kas jāņem vērā konkrētos gadījumos. Ar cietvielām apstrādātas radzenes pēc četru stundu ilgā iedarbības perioda beigām rūpīgi noskalo, bet tām nav vajadzīga papildu inkubācija.
32. Pēc šķidrumu un virsmaktīvo vielu iedarbības paredzētā inkubācijas perioda beigām un, izņemot virsmaktīvās vielas, pēc četru stundu ilgas cietvielu iedarbības novēro katras radzenes duļķošanos un caurlaidību. Katru radzeni apskata un reģistrē novērojumus (piemēram, audu nolobīšanās, testējamā materiāla atliekas, nevienmērīgas duļķošanās pazīmes). Šie novērojumi var būt svarīgi, jo ar tiem var būt izskaidrojamas opacitometra rādījumu atšķirības.
Kontroles vielas
33. Katrā eksperimentā iekļauj paralēlas negatīvās vai šķīdinātāja/nesēja kontroles un pozitīvās kontroles.
34. Testējot vielu, kas ir šķidrums ar 100 % koncentrāciju, BCOP testēšanas metodē iekļauj paralēlu negatīvo kontroli (piemēram, 0,9 % nātrija hlorīda šķīdumu vai destilētu ūdeni), lai varētu konstatēt neraksturīgas testēšanas sistēmas izmaiņas un testējamajiem beigu punktiem noteiktu sākotnējās vērtības. Tādējādi tiek arī nodrošināts, lai testēšanas apstākļu dēļ kā atbildes reakcija nepareizi netiktu konstatēts kairinājums.
35. Testējot atšķaidītu vielu, kas ir šķidrums, virsmaktīvo vielu vai cietvielu, BCOP testēšanas metodē iekļauj paralēlu šķīdinātāja/nesēja kontroles grupu, lai varētu konstatēt neraksturīgas testēšanas sistēmas izmaiņas un noteiktu mērāmo parametru sākotnējās vērtības. Drīkst izmantot tikai tādu šķīdinātāju/nesēju, par kuru iegūtas liecības, ka tam nav nevēlamas ietekmes uz testēšanas sistēmu.
36. Katrā eksperimentā kā paralēlu pozitīvo kontroli iekļauj testu ar acu kairinājumu izraisošu vielu, lai pārliecinātos, ka atbildes reakcija ir atbilstoša. Tā kā šajā testēšanas metodē BCOP tests tiek izmantots, lai identificētu acu nopietnus bojājumus vai nopietnu kairinājumu izraisītājas vielas, ideālā gadījumā pozitīvajai kontroles vielai būtu jābūt standartvielai, kas šajā testēšanas metodē izraisa spēcīgu reakciju. Tomēr, lai nodrošinātu iespēju novērtēt pozitīvās kontroles reakcijas mainību laikā, kairinājuma reakcijas intensitāte nedrīkstētu būt pārmērīgi liela.
37. Pozitīvās kontroles piemēri testējamajām vielām, kas ir šķidrumi, ir dimetilformamīds vai 1 % nātrija hidroksīda šķīdums. Pozitīvās kontroles piemērs testējamajām cietvielām ir 20 % (masas) imidazola šķīdums 0,9 % nātrija hlorīda šķīdumā.
38. Salīdzināšanas vielas ir lietderīgi izmantot, lai novērtētu noteiktas nezināmu ķīmisko ielu vai produktu kategorijas potenciālu izraisīt acu kairinājumu vai novērtētu acu kairinājumu izraisošas vielas salīdzinošo spēju izraisīt noteiktas intensitātes kairinājuma reakcijas.
Mērāmie beigu punkti
39. Duļķošanos nosaka pēc radzenes gaismas caurlaidības. Radzenes duļķošanos mēra kvantitatīvi ar opacitometru, rezultātā iegūstot duļķošanās vērtības, kas ir nepārtraukti lielumi.
40. Caurlaidību nosaka pēc krāsvielas fluoresceīna nātrija sāls daudzuma, kas iziet cauri visiem radzenes šūnu slāņiem (t.i., no epitēlija uz radzenes ārējās virsmas līdz endotēlijam uz radzenes iekšējās virsmas). Radzenes turētāja priekšējo kamerā, kas saskaras ar radzenes epitēlija virsmu, iepilda 1 mL fluoresceīna nātrija sāls šķīduma (attiecīgi 4 vai 5 mg/mL, testējot šķidrumus un virsmaktīvās vielas vai cietvielas, kas nav virsmaktīvas), savukārt aizmugurējo kameru, kas saskaras ar radzenes endotēlija virsmu, piepilda ar svaigu EMEM. Pēc tam turētāju horizontālā stāvoklī 90 ± 5 min inkubē 32 ± 1 °C temperatūrā. Izmantojot UV/VIS spektrofotometriju, kvantitatīvi izmēra fluoresceīna nātrija sāls daudzumu, kas nonāk aizmugurējā kamerā. Spektrofotometriskos mērījumus veic pie 490 nm, reģistrē kā optiskā blīvuma (OD490) vai absorbcijas vērtības, ko mēra kā nepārtrauktu lielumu. Fluoresceīna caurlaidības vērtības nosaka, izmantojot OD490 vērtības, izmantojot redzamās gaismas spektrofotometru ar standarta 1 cm optiskā ceļa garumu.
41. Var izmantot arī 96 iedobju mikrotitrēšanas plati, ja (i) var noteikt fluoresceīna OD490 vērtību noteikšanai izmantotās plates lasītāja lineāro diapazonu un (ii) lai iegūtu OD490 vērtības, kas ekvivalentas standarta 1 cm optiskā ceļa garumam, 96 iedobju platē tiek izmantoti pareiza tilpuma fluoresceīna paraugi (tam vajadzīga pilnībā pilna iedobe [parasti 360 μL]).
DATI UN TESTĒŠANAS PĀRSKATS
Datu novērtēšana
42. Pēc duļķošanās un vidējās caurlaidības (OD490) vērtību korekcijas, ņemot vērā fona duļķošanos un negatīvās kontroles caurlaidības OD490 vērtības, lai katrai testējamo paraugu grupai aprēķinātu in vitro kairinājuma rādītāju (IVIS) katras testējamās paraugu grupas vidējās duļķošanās un caurlaidības OD490 vērtības apvieno, izmantojot šādu empīrisku formulu:
IVIS = vidējā duļķošanās vērtība + (15 × vidējā caurlaidības OD490 vērtība)
Sina et al. (16) norāda, ka šī formula ir iegūta iekšlaboratoriju un starplaboratoriju pētījumos. Datiem, kas, izmantojot 36 savienojumus, iegūti vairāku laboratoriju veiktā pētījumā, tika veikta daudzfaktoru analīze, lai iegūtu vienādojumu, kas vislabāk apraksta in vivo un in vitro datu savstarpējo sakarību. Šo analīzi veica divas atsevišķas zinātnieku grupas, iegūstot gandrīz identiskus vienādojumus.
43. Duļķošanās un caurlaidības vērtības jānovērtē arī neatkarīgi viena no otras, lai noteiktu, vai testējamā viela izraisījusi nopietnus acu bojājumus vai nopietnu kairinājumu tikai kāda viena testēšanas beigu punkta vai to abu dēļ (sk. sadaļu “Lēmuma pieņemšanas kritēriji”).
Lēmuma pieņemšanas kritēriji
44. Vielu uzskata par nopietnus acu bojājumus vai nopietnu kairinājumu izraisošu, ja tās iedarbības rezultātā izmērītais IVIS ir ≥ 55,1. Kā noteikts 1. punktā, ja testējamā viela netiek identificēta kā nopietnus acu bojājumus vai nopietnu kairinājumu izraisoša, tās klasifikācijai un marķēšanai ir jāveic papildu testēšana. BCOP testēšanas metodes pareizība ir 79 % (113/143) līdz 81 % (119/147), kļūdaini pozitīvo rezultātu daļa ir no 19 % (20/103) līdz 21 % (22/103) un kļūdaini negatīvo rezultātu daļa ir no 16 % (7/43) līdz 25 % (10/40), salīdzinot ar datiem, kas iegūti pēc truša acu testēšanas metodes in vivo, kas klasificēti atbilstīgi EPA (1), ES (2) vai GHS (3) klasifikācijas sistēmai. Ja noteiktu ķīmisko (t.i., spirti, ketoni) vai fizikālo (t.i., cietvielas) īpašību grupas vielas izslēdz no datubāzes, BCOP pareizība ES, EPA un GHS klasifikācijas sistēmā ir no 87 % (72/83) līdz 92 % (78/85), kļūdaini pozitīvo rezultātu daļa ir no 12 % (7/58) līdz 16 % (9/56) un kļūdaini negatīvo rezultātu daļa ir no 0 % (0/27) līdz 12 % (3/26).
45. Ja testējamo vielu neklasificē kā nopietnus acu bojājumus vai nopietnu kairinājumu izraisošu, kopā ar truša acu testa in vivo vai cita atbilstīgi validēta in vitro testa datiem BCOP dati var būt noderīgi, lai turpmāk novērtētu BCOP testēšanas metodes piemērotību un ierobežojumus acu kairinājumu izraisošu un acu kairinājumu neizraisošu vielu testēšanai (patlaban tiek izstrādāts norādījumu dokuments par in vitro testēšanas metodēm, lai noteiktu toksicitāti acīm).
Testa rezultātu pieņemamības kritēriji
46. Testēšanas rezultātu uzskata par pieņemamu, ja pozitīvajā kontrolē tiek iegūta IVIS vērtība, kas divkāršas standartnovirzes robežās sakrīt ar tādas pašreizējo iepriekš iegūto vēsturisko datu vidējo vērtību, kura tiek atjaunināta vismaz reizi trīs mēnešos vai ikreiz, kad veic pieņemamu testu laboratorijās, kurās testēšanu izdara reti (t.i., retāk nekā reizi mēnesī). Negatīvās vai šķīdinātāja/nesēja kontroles rezultātā jāiegūst tādas duļķošanās un caurlaidības vērtības, kas ir mazākas nekā liellopu radzenēm sākotnēji noteiktās fona duļķošanās un caurlaidības augstākās vērtības attiecīgajā negatīvajā vai šķīdinātāja/nesēja kontrolē.
Testēšanas pārskats
47. Testēšanas pārskatā jāiekļauj šāda informācija, kas attiecas uz konkrēto noteikšanu:
Testējamās vielas un kontrolvielas
Ķīmiskais nosaukums(-i), piemēram, ķīmijas analītisko apskatu indeksā (Chemical Abstracts Service, CAS) izmantotais nosaukums, pēc tam citi nosaukumi, ja tādi ir zināmi;
CAS reģistra numurs, ja tas ir zināms;
vielas vai maisījuma tīrība un sastāvs (masas procentos), ciktāl šī informācija ir pieejama;
fizikāli ķīmiskās īpašības, kas attiecas uz pētījuma veikšanu, piemēram, fizikālais stāvoklis, gaistamība, pH, stabilitāte, vielas ķīmiskā klase, šķīdība ūdenī;
testējamās/kontroles vielu sagatavošana testēšanai, ja tiek veikta (piemēram, sildīšana, sasmalcināšana);
stabilitāte, ja zināma.
Informācija par sponsoru un testēšanas iestādi
Sponsora, testēšanas iestādes nosaukums, pētījuma vadītāja uzvārds un adrese;
norāde par acu ņemšanas vietu (t.i., iestāde, kur tās ņemtas);
Acu glabāšanas un transportēšanas apstākļi (piemēram, acu ņemšanas datums un laiks, līdz testēšanas sākumam pagājušais laiks, transportēšanas un temperatūras apstākļi, izmantotās antibiotikas);
īpašas to dzīvnieku pazīmes, no kuriem ņemtas acis, ja tādas ir pieejamas (piemēram, donordzīvnieka vecums, dzimums, svars).
Izmantotās testēšanas metodes un protokola pamatojums
Testēšanas metodes integritāte
Procedūra, ko izmanto, lai nodrošinātu testēšanas metodes integritāti (t.i., pareizību un ticamību) laikā (piemēram, periodiska standartvielu testēšana, iepriekš iegūto vēsturisko negatīvās un pozitīvās kontroles datu izmantošana).
Testa apstiprināšanas kritēriji
Pieņemams paralēlo pozitīvo un negatīvo kontroļu rezultātu diapazons, pamatojoties uz iepriekš iegūtajiem vēsturiskajiem datiem;
ja vajadzīgs, pieņemami paralēlo standarta kontroļu diapazoni, pamatojoties uz iepriekš iegūtajiem vēsturiskajiem datiem.
Testēšanas apstākļi
Izmantotās testēšanas sistēmas apraksts;
izmantotā radzenes turētāja tips;
informācija par duļķošanās un caurlaidības mērierīču (piemēram, opacitometra un spektrofotometra) kalibrēšanu;
informācija par izmantotajām liellopu radzenēm, tostarp liecības par to kvalitāti;
sīkas ziņas par izmantoto testēšanas procedūru;
testējamās vielas koncentrācija(-s);
testēšanas procedūras iespējamo modifikāciju apraksts;
atsauce uz vēsturiskajiem datiem par modeli (piemēram, negatīvās un pozitīvās kontroles, standartvielas, salīdzināšanas vielas);
izmantoto novērtējuma kritēriju apraksts.
Rezultāti
Tabulas veidā apkopoti dati par katru testējamo paraugu (piemēram, duļķošanās un OD490 vērtības un aprēķinātais testējamās vielas IVIS, un pozitīvās, negatīvās un salīdzināšanas kontroles [ja paredzētas], pēc vajadzības iekļaujot datus no atkārtotiem eksperimentiem, un katrā eksperimentā iegūtā vidējā vērtība ± standartnovirze);
Novērojumu apraksts.
Rezultātu novērtējums
Secinājums
LITERATŪRA
(1) U.S. EPA (1996). Label Review Manual: 2nd Edition. EPA737-B-96-001. Washington, DC: U.S. Environmental Protection Agency.
(2) Eiropas Parlamenta un Padomes 2008. gada 16. decembra Regula (EK) Nr. 1272/2008 par vielu un maisījumu klasificēšanu, marķēšanu un iepakošanu un ar ko groza un atceļ Direktīvas 67/548/EEK un 1999/45/EK un groza Regulu (EK) Nr. 1907/2006. OV L 353, 31.12.2008., 1. lpp.
(3) UN (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Second revised edition, New York & Geneva: United Nations Publications, 2007. Pieejams:
[http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html]
(4) ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Pieejams:
[http://ecvam.jrc.it/index.htm]
(5) ICCVAM (2007). Test Method Evaluation Report - In vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Centre for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Pieejams:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(6) Eiropas Parlamenta un Padomes 2006. gada 18. decembra Regula (EK) Nr. 1907/2006, kas attiecas uz ķimikāliju reģistrēšanu, vērtēšanu, licencēšanu un ierobežošanu (REACH), un ar kuru izveido Eiropas Ķimikāliju aģentūru, groza Direktīvu 1999/45/EK un atceļ Padomes Regulu (EEK) Nr. 793/93 un Komisijas Regulu (EK) Nr. 1488/94, kā arī Padomes Direktīvu 76/769/EEK un Komisijas Direktīvu 91/155/EEK, 93/67/EEK, 93/105/EK un 2000/21/EK. OV L 396, 30.12.2006., 1. lpp.
(7) OECD (2002). Test Guideline 405. OECD Guideline for Testing of Chemicals. Acute eye irritation/corrosion. Pieejams:
[http://www.oecd.org/document/40/0,2340,en_2649_34377_37051368_1_1_1_1,00.html]
(8) ICCVAM (2007). ICCVAM Recommended BCOP Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Centre for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Pieejams:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(9) ICCVAM. (2006). Current Status of In vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability Test Method. NIH Publication No.: 06-4512. Research Triangle Park: National Toxicology Program. Pieejams:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_ice.htm]
(10) INVITTOX (1999). Protocol 124: Bovine Corneal Opacity and Permeability Assay – SOP of Microbiological Associates Ltd. Ispra, Italy: European Centre for the Validation of Alternative Methods (ECVAM).
(11) Gautheron, P., Dukic, M., Alix, D. and Sina, J.F. (1992). Bovine corneal opacity and permeability test: An in vitro assay of ocular irritancy. Fundam. Appl. Toxicol. 18:442-449.
(12) Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Pieejams:
[http://www.cdc.gov/ncidod/dhqp/pdf].
(13) Maurer, J.K., Parker, R.D. and Jester, J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
(14) Doughty, M.J., Petrou, S. and Macmillan, H. (1995). Anatomy and morphology of the cornea of bovine eyes from a slaughterhouse. Can. J. Zool. 73:2159-2165.
(15) Collee, J. and Bradley, R. (1997). BSE: A decade on - Part I. The Lancet 349:636-641.
(16) Sina, J.F., Galer, D.M., Sussman, R.S., Gautheron, P.D., Sargent, E.V., Leong, B., Shah, P.V., Curren, R.D., and Miller, K. (1995). A collaborative evaluation of seven alternatives to the Draize eye irritation test using pharmaceutical intermediates. Fundam Appl Toxicol 26:20-31.
(17) ICCVAM (2006). Background review document, Current Status of In vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Pieejams:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
(18) ICCVAM (2006). Background review document, Current Status of In vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye (ICE) Test Method. Pieejams:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
1. papildinājums
DEFINĪCIJAS
Pareizība : pēc testēšanas metodes iegūto mērījumu rezultātu sakritības pakāpe ar attiecīgajām references vērtībām. Tas ir testēšanas metodes veiktspējas raksturlielums un viens no tās piemērotības aspektiem. Šo terminu bieži izmanto ar nozīmi “sakritība” vai atbilstība, ar to domājot pareizo rezultātu daļu, ko iegūst pēc testēšanas metodes.
Salīdzināšanas viela : viela, ko izmanto kā standartu salīdzināšanai ar testējamo vielu. Salīdzināšanas vielai ir jābūt šādām īpašībām: (i) pastāvīgs un uzticams ieguves avots, (ii) struktūras un funkciju līdzība ar testējamo vielu klases vielām, (iii) zināmas fizikālās/ķīmiskās īpašības; (iv) papildu dati par zināmajiem iedarbības veidiem un (v) vielas zināmais iedarbības stiprums atbilst vēlamās reakcijas intensitātes diapazonam.
Radzene : acs ābola priekšējā caurspīdīgā daļa, kas pārklāj varavīksneni un zīlīti un ielaiž acī gaismu.
Radzenes duļķošanās : izmērītā radzenes duļķošanās pakāpe pēc testējamās vielas iedarbības. Radzenes duļķošanās palielināšanās norāda uz radzenes bojājumiem. Duļķošanos var novērtēt subjektīvi kā Dreizes (Draize) truša acu testā vai objektīvi, izmantojot instrumentu, piemēram, opacitometru.
Radzenes caurlaidība : kvantitatīvs radzenes epitēlija bojājumu mērījums, nosakot krāsvielas fluoresceīna nātrija sāls daudzumu, kas iziet cauri visām radzenes šūnu kārtām.
EPA 1. kategorija : nopietns acu bojājums (acs audu neatgriezeniska noārdīšana), radzenes bojājums vai izraisīts kairinājums, kas saglabājas ilgāk par 21 dienu (1).
ES R41 kategorija : acs audu bojājums vai nopietni fiziski redzes traucējumi, kas rodas pēc testējamās vielas aplicēšanas uz acs priekšējās virsmas un nav pilnīgi atgriezeniski 21 dienas laikā pēc aplicēšanas (2).
Kļūdaini negatīvo rezultātu daļa : visu to pozitīvo vielu daļa ar attiecīgu iedarbību, kas, izmantojot konkrēto testēšanas metodi, nepareizi identificēta kā negatīva viela, kurai šādas iedarbības nav. Tas ir viens no testēšanas metodes veiktspējas raksturlielumiem.
Kļūdaini pozitīvo rezultātu daļa : visu to visu to negatīvo vielu daļa bez attiecīgas iedarbības, kas, izmantojot konkrēto testēšanas metodi, nepareizi identificētas kā pozitīvas vielas ar šādu iedarbību. Tas ir viens no testēšanas metodes veiktspējas raksturlielumiem.
GHS (Globāli harmonizētā ķīmisko vielu klasifikācijas un marķēšanas sistēma) : sistēma, saskaņā ar kuru ķimikālijas (vielas un maisījumus) klasificē pēc standartizētiem kaitīgās iedarbības veidiem un to intensitātes uz cilvēka veselību un vidi, kā arī paredz atbilstošu saziņas elementu izmantošanu, piemēram, piktogrammas, signālvārdus, bīstamības apzīmējumus, piesardzības apzīmējumus un drošības datu lapas, kuru mērķis ir sniegt informāciju, kas nepieciešama cilvēku (tostarp darba devēju, strādājošo, transporta darbinieku, patērētāju un avārijas dienestu darbinieku) un vides aizsardzībai pret to kaitīgo iedarbību (3).
GHS 1. kategorija : acs audu bojājums vai nopietni fiziski redzes traucējumi, kas rodas pēc testējamās vielas aplicēšanas un kas nav pilnīgi atgriezeniski ilgāk par 21 dienu pēc vielas aplicēšanas (3).
Bīstamība : aģentam vai situācijai piemītoša īpašība, kas šā aģenta iedarbības rezultātā var radīt nevēlamu ietekmi uz attiecīgo organismu, sistēmu vai (sub)populāciju.
In vitro kairinājuma rādītājs (IVIS) : pēc empīriskas formulas aprēķināts rādītājs, ko izmanto BCOP testā un kurā tiek apvienota katras paraugu grupas vidējā duļķošanās un vidējā caurlaidības vērtība, lai katrai grupai iegūtu vienu rezultātu in vitro. IVIS = vidējā duļķošanās vērtība + (15 x vidējā caurlaidības vērtība).
Negatīvā kontrole : ar testējamo vielu neapstrādāts atkārtojums, kurā ir visi pārējie testēšanas sistēmas komponenti. Šo paraugu testē kopā ar paraugiem, uz kuriem aplicēta testējamā viela, un citiem kontroles paraugiem, lai noteiktu, vai šķīdinātājam ir mijiedarbība ar testēšanas sistēmu.
Kairinājumu neizraisoša viela : viela, kas netiek klasificēta kā EPA I, II vai III kategorijas, ES R41 vai R36 kategorijas, vai GHS 1., 2.A vai 2.B kategorijas acu kairinājumu izraisītāja viela.
Nopietnus acu bojājumus izraisoša viela : (a) viela, kas rada acs audu neatgriezenisku bojājumu; (b) viela, kas tiek klasificēta kā GHS 1. kategorijas, EPA I kategorijas vai ES R41 kategorijas acu kairinājumu izraisītāja viela (1) (2) (3).
Acu kairinājumu izraisoša viela : (a) viela, kas pēc aplicēšanas uz acs priekšējās virsmas izraisa acī atgriezeniskas izmaiņas, (b) viela, kas tiek klasificēta kā EPA II vai III kategorijas, ES R36 kategorijas vai GHS 2.A vai 2.B kategorijas acu kairinājumu izraisītāja viela (1) (2) (3).
Nopietnu acu kairinājumu izraisoša viela : (a) viela, kas pēc aplicēšanas uz acs priekšējās virsmas izraisa acs audu bojājumus, kas ir neatgriezeniski ilgāk par 21 dienu pēc aplicēšanas vai kas izraisa nopietnus fiziskus redzes traucējumus; (b) viela, kas tiek klasificēta kā GHS 1. kategorijas, EPA I kategorijas vai ES R41 kategorijas acu kairinājumu izraisītāja viela (1) (2) (3).
Opacitometrs : instruments, ko lieto, lai mērītu “radzenes duļķošanos”, radzenes gaismas caurlaidības kvantitatīvai noteikšanai. Instrumentam parasti ir divi nodalījumi, katram savs gaismas avots un fotoelements. Vienā nodalījumā ievieto apstrādāto radzeni, bet otru izmanto instrumenta kalibrēšanai un nulles vērtību iestatīšanai. Halogēnlampas gaisma iet cauri kontroles nodalījumam (tukša kamera bez logiem un šķidruma) krītot uz fotoelementu, un tiek salīdzināta ar gaismu, kas krīt uz fotoelementu izejot cauri nodalījumam, kurā ir kamera ar radzeni. Tiek salīdzināta abu fotoelementu uztvertās gaismas caurlaidības vērtību starpība, un uz ciparu displeja tiek izvadīta duļķošanās skaitliskā vērtība.
Pozitīvā kontrole : atkārtojums, kurā ir visi testēšanas sistēmas komponenti, un kuram veikta apstrāde ar vielu, par ko ir zināms, ka tā izraisa attiecīgo atbildes reakciju. Lai nodrošinātu iespēju novērtēt pozitīvās kontroles atbildes reakcijas mainību laikā, nopietnu kairinājumu izraisošās reakcijas intensitāte nedrīkst būt pārlieku liela.
Ticamība : lielums, kas raksturo, kādā mērā tajā pašā vai citā laboratorijā ilgākā laikā, izmantojot to pašu protokolu, var izpildīt testēšanas metodi atkārtoti. To novērtē, aprēķinot metodes reproducējamību dažādās laboratorijās un atkārtojamību tajā pašā laboratorijā.
Šķīdinātāja/nesēja kontrole : ar testējamo vielu neapstrādāts paraugs, kurā ir visi testēšanas sistēmas komponenti, tostarp šķīdinātājs vai nesējs, ko izmanto testējamās vielas un citos kontroles paraugos, lai noteiktu attiecīgā šķīdinātājā vai nesējā izšķīdināto ar testējamo vielu apstrādāto paraugu sākotnējo atbildes reakciju. Testējot kopā ar paralēlu negatīvo kontroli, šis paraugs parāda arī, vai šķīdinātājam vai nesējam ir mijiedarbība ar testēšanas sistēmu.
Daudzpakāpju testēšana : pakāpeniskas testēšanas stratēģija, kurā noteiktā secībā pārskata visu esošo informāciju par testējamo vielu, katrā pakāpē izmantojot datu svarīguma pieeju, lai pirms pārejas uz nākamo pakāpi noteiktu, vai ir pieejams pietiekami daudz informācijas, lai pieņemtu lēmumu par bīstamības klasifikāciju. Ja testējamās vielas kairinājuma izraisīšanas potenciālu var noteikt, pamatojoties uz esošo informāciju, papildus testēšana nav jāveic. Ja, pamatojoties uz esošo informāciju, testējamās vielas kairinājuma izraisīšanas potenciālu nevar noteikt, veic pakāpenisku secīgu testēšanas procedūru ar dzīvniekiem, līdz var viennozīmīgi pieņemt lēmumu par klasifikāciju.
Validēta testēšanas metode : testēšanas metode, kurai ir veikti validācijas pētījumi, lai noteiktu metodes piemērotību noteiktam nolūkam (tostarp pareizību) un ticamību. Jāievēro, ka validētas testēšanas metodes veiktspēja pareizības un ticamības ziņā var nebūt pietiekama, lai to izmantotu paredzētajam nolūkam.
Pierādījumu vērtēšana : process, kurā tiek apsvērtas dažādu datu priekšrocības un trūkumi, lai pieņemtu un pamatotu secinājumu par vielas potenciālo bīstamību.
2. papildinājums
BCOP testēšanas metodes standartvielas
Pirms šai testēšanas metodikai atbilstīgas testēšanas metodes regulāras izmantošanas laboratorijas var uzskatāmi apliecināt savu tehnisko prasmi, pareizi nosakot klasifikāciju 1. tabulā ieteiktajām 10 vielām, kas izraisa nopietnus acu bojājumus. Šīs vielas ir izraudzītas, lai raksturotu nopietnus acu bojājumus/ nopietnu acu kairinājumu izraisītāju vielu lokālas iedarbības diapazonu, kura pamatā ir in vivo truša acu testa rezultāti (TG 405) (t.i., 1., 2.A, 2.B kategorija, vai netiek klasificēta un marķēta saskaņā ar ANO GHS (3) (7). Taču, ņemot vērā šo testu validēto noderīgumu (t.i., nopietnus acu bojājumus vai nopietnu kairinājumu izraisītāju vielu identificēšanai), lai pierādītu prasmi, var iegūt tikai divus klasificējamus testa rezultātus (izraisa nopietnus acu bojājumus/ nopietnu acu kairinājumu vai neizraisa nopietnus acu bojājumus/ nopietnu acu kairinājumu). Citi izvēles kritēriji ir vielu pieejamība tirgū, lai būtu pieejami ļoti kvalitatīvi in vivo atsauces dati un lai būtu pieejami ļoti kvalitatīvi dati par divām in vitro metodēm, kurām tiek izstrādāti testēšanas norādījumi. Šī iemesla dēļ tika izraudzītas nopietnus acu bojājumus izraisošās vielas no ICCVAM ieteiktā 122 standartvielu saraksta in vitro acīm toksisko īpašību noteikšanas testa metožu validēšanai (sk. H papildinājumu. ICCVAM ieteiktās atsauces vielas) (5). Atsauces dati ir pieejami ICCVAM papildinformācijas pārskata dokumentos par BCOP metodi un izolētas vistas acs (ICE) testēšanas metodi (17) (18).
1. tabula.
Ieteicamās vielas tehniskās prasmes apliecināšanai testēšanai pēc BCOP
|
Viela |
CAS Nr. |
Ķīmiskā klase (1) |
Agregātstāvoklis |
In vivo klasifikācija (2) |
In vitro klasifikācija (3) |
|
Benzalkonija hlorīds (5 %) |
8001-54-5 |
Onija savienojums |
Šķidrums |
1. kategorija |
Izraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Hlorheksidīns |
55-56-1 |
Amīns, amidīns |
Cietviela |
1. kategorija |
Izraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Dibenzoil-L-vīnskābe |
2743-38-6 |
Karbonskābes esteris |
Cietviela |
1. kategorija |
Izraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Imidazols |
288-32-4 |
Heterociklisks savienojums |
Cietviela |
1. kategorija |
Izraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Trihloretiķskābe (30 %) |
76-03-9 |
Karbonskābe |
Šķidrums |
1. kategorija |
Izraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
2,6-Dihlorbenzoil hlorīds |
4659-45-4 |
Acilhalogenīds |
Šķidrums |
2.A kategorija |
Neizraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Etil-2-metilaceto-acetāts |
609-14-3 |
Ketonesteris |
Šķidrums |
2.B kategorija |
Neizraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Amonija nitrāts |
6484-52-2 |
Neorganiskais sāls |
Cietviela |
2.A kategorija |
Neizraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Glicerīns |
56-81-5 |
Spirts |
Šķidrums |
Netiek marķēta |
Neizraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
n-heksāns |
110-54-3 |
Ogļūdeņradis (acikliskais) |
Šķidrums |
Netiek marķēta |
Neizraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
(1) Ķīmiskās klases katrai testējamai vielai piešķirtas, izmantojot standarta klasifikācijas shēmu, kuras pamatā ir National Library of Medicine Medical Subject Headings (MeSH) klasifikācijas sistēma (pieejama http://www.nlm.nih.gov/mesh). (2) Pamatojoties uz in vivo truša acu testa rezultātiem (ESAO TG 405) un izmantojot ANO GHS sistēmu (3)(7). (3) Pamatojoties uz BCOP un ICE testēšanas metožu rezultātiem. Saīsinājumi: CAS Nr. = Ķīmijas analītisko apskatu indeksa reģistra numurs |
|||||
3. papildinājums
BCOP RADZENES TURĒTĀJS
1. BCOP radzeņu turētāji ir izgatavoti no inerta materiāla (piemēram, polipropilēna). Turētājs sastāv no divām pusēm (priekšējā un aizmugurējā kamera), un tam ir divas līdzīgas cilindriskas iekšējās kameras. Katras kameras tilpums ir 5 mL, un tās galā ir stikla disks, caur kuru reģistrē duļķošanās mērījumus. Katras iekšējās kameras diametrs ir 1,7 cm, un augstums 2,2 cm ( 24 ). Lai nepieļautu noplūdes, aizmugurējā kamerā ievieto blīvi. Radzenes novieto ar endotēlija virsmu uz leju pret aizmugurējās kameras blīvi, un priekšējo kameru novieto uz radzenes epitēlija virsmas. Kameras notur vietā trīs nerūsējošas skrūves kameras ārmalā. Lai nodrošinātu vieglu piekļuvi radzenei, katras kameras galā ir noņemams stikla disks. Arī starp stikla disku un kameru ir blīve, lai nepieļautu noplūdes. Barotnes un testējamās vielas ievadīšanai un izvadīšanai ir paredzētas divas atveres katras kameras augšpusē. Iedarbības un inkubācijas perioda laikā tās noslēdz ar gumijas vāciņiem.
Paskaidrojumi
Glass disc : Stikla disks
PTFE-O-ring : PTFE blīve
Refill : Iepildīšana
Hanger : Piestiprinājums
Cap : Vāciņš
Nut : Uzgrieznis
O-ring : Blīve
Posterior compartment : Aizmugurējā kamera
Anterior compartment : Priekšējā kamera
Fixing screws : Savienošanas skrūves
OPACITOMETRS
2. Opacitometrs ir gaismas caurlaidības mērierīce. Halogēnlampas gaisma iet cauri kontroles nodalījumam (tukša kamera bez logiem un šķidruma) krītot uz fotoelementu, un tiek salīdzināta ar gaismu, kas krīt uz fotoelementu izejot cauri nodalījumam, kurā ir kamera ar radzeni. Tiek salīdzināta fotoelementu uztvertā gaismas starojuma starpība, un uz ciparu displeja tiek izvadīta duļķošanās skaitliskā vērtība.
3. Opacitometra rādījumiem visā mērījumu diapazonā jābūt lineārai sakarībai līdz pat prognozes modelī aprakstīto dažādo klasifikāciju robežvērtībām (t.i., līdz robežvērtībai, kas atbilst nopietnus acu bojājumus/nopietnu acu kairinājumu izraisītāju vielu klasifikācijai). Lai nodrošinātu lineārus un precīzus rādījumus līdz 75-80 duļķošanās vienībām, opacitometrs ir jākalibrē ar vairākiem kalibratoriem. Kalibratorus (puscaurspīdīgas poliestera loksnes) novieto kalibrēšanas kamerā (radzenes kamera, kas paredzēta kalibrēšanas līdzekļu turēšanai) un nolasa opacitometra rādījumu. Kalibrēšanas kamera ir izveidota tā, lai kalibrators atrastos apmēram tādā pašā attālumā no gaismas un fotoelementa, kādā duļķošanās mērījumu laikā būtu novietota radzene. Opacitometru vispirms iestata uz 0 duļķošanās vienībām bez kalibratora kalibrēšanas kamerā. Pēc tam pārmaiņus pa vienam kalibrēšanas kamerā ievieto trīs dažādus kalibratorus un mēra duļķošanos. Duļķošanās rādījumiem 1., 2. un 3. kalibratoram jābūt attiecīgi 75, 150 un 225 duļķošanās vienības ± 5 %.
B.48 IZOLĒTAS VISTAS ACS TESTĒŠANAS METODE NOPIETNUS ACU BOJĀJUMUS VAI NOPIETNU KAIRINĀJUMU IZRAISĪTĀJU VIELU IDENTIFICĒŠANAI
IEVADS
1. Izolētas vistas acs (ICE) testēšanas metode in vitro ir noteikšanas metode, ko konkrētos apstākļos un ar noteiktiem ierobežojumiem var izmantot, lai vielas un to maisījumus klasificētu kā “nopietnus acu bojājumus vai nopietnu kairinājumu” izraisītājus (1) (2) (3). Šajā testēšanas metodē par nopietnu kairinājumu izraisošām uzskata vielas, kas trušiem rada acu bojājumus, kuri neizzūd vismaz 21 dienas laikā pēc iedarbības. Kaut gan netiek uzskatīts, ka ar ICE var pilnībā aizstāt iedarbības testu uz acīm in vivo ar trušiem, ICE iesaka izmantot daudzpakāpju testēšanas stratēģijā, lai īpašas lietošanas jomā veiktu normatīvajos aktos reglamentēto klasifikāciju un marķēšanu (4) (5). Testējamās vielas (6) var klasificēt kā nopietnus acu bojājumus vai nopietnu kairinājumu izraisošas, neveicot papildu testēšanu ar trušiem. Ar vielām, kuru testēšanas rezultāts ir negatīvs, jāveic izmēģinājumi, izmantojot trušus, pēc pakāpeniskas loģiski secīgas testēšanas stratēģiju saskaņā ar ESAO testēšanas norādījumiem OECD Test Guideline 405 (7) (šī pielikuma B. 5. nodaļa).
2. Šajā testēšanas metodē aprakstītas procedūras, ko izmanto, lai vērtētu testējamās vielas potenciālo nopietnus bojājumus vai nopietnu kairinājumu izraisošo iedarbību uz acīm, ko mēra ar tās spēju izraisīt toksisku iedarbību uz izolētu vistas aci. Toksisko iedarbību uz radzeni mēra ar šādiem parametriem: (i) kvalitatīvs duļķošanās novērtējums, (ii) kvalitatīvs epitēlija bojājumu novērtējums, pamatojoties uz fluoresceīna aplicēšanu acij (fluoresceīna aizturēšana), (iii) kvantitatīvs biezuma palielināšanās (uzbrieduma) novērtējums un (iv) kvalitatīvs makroskopisko morfoloģisko virsmai radīto bojājumu novērtējums. Radzenes duļķošanās, uzbrieduma un bojājumu novērtējumu pēc testējamās vielas iedarbības novērtē atsevišķi un pēc tam apvieno, lai noteiktu acu kairinājuma klasifikāciju.
3. Izmantojot ICE testēšanas metodi, ir testētas arī acu kairinājumu izraisošas vielas, kas rada bojājumus, kuri izzūd drīzāk nekā 21 dienā, un vielas, kam nav kairinājumu izraisošas iedarbības. Taču ICE testēšanas metodes pareizība un ticamība šo kategoriju vielām nav formāli novērtēta.
4. Definīcijas sk. 1. papildinājumā.
SĀKOTNĒJIE APSVĒRUMI UN IEROBEŽOJUMI
5. Šīs testēšanas metodes pamatā ir Alternatīvo metožu validēšanas starpaģentūru koordinācijas komitejas (ICCVAM) ICE testēšanas metodes protokols (8), kas tika izstrādāts pēc starptautiska validācijas pētījuma (4) (5) (9), kurā piedalījās Eiropas Alternatīvo metožu validēšanas centrs, Japānas Alternatīvo metožu validēšanas centrs un TNO Dzīves kvalitātes nodaļas toksikoloģijas un praktiskās farmakoloģijas departaments (Nīderlande). Protokola pamatā ir informācija, kas iegūta no publicētiem protokoliem, kā arī TNO pašlaik izmantotā protokola (10) (11) (12) (13) (14).
6. Šīs metodes apzinātie ierobežojumi ir lielais kļūdaini pozitīvo rezultātu procents spirtiem un lielais kļūdaini negatīvo rezultātu procents cietvielām un virsmaktīvām vielām (sk. 47. punktu) (4). Ja no datubāzes izslēdz vielas, kas ietilpst šajās ķīmisko un fizikālo īpašību klasēs, ICE precizitāte ES, EPA un GHS klasifikācijas sistēmās ievērojami uzlabojas (4). Pamatojoties uz šīs testēšanas mērķi (t.i., identificēt tikai nopietnus acu bojājumus / nopietnu kairinājumu izraisošas vielas), kļūdaini negatīvo rezultātu procentam nav būtiskas nozīmes, jo šādas vielas pēc tam tiktu testētas izmēģinājumos ar trušiem vai citus pietiekami validētus in vitro testus, atkarībā no normatīvo aktu prasībām, izmantojot secīgas testēšanas stratēģiju un datu nozīmīguma pieeju. Turklāt, izmantojot līdzšinējo validācijas datubāzi, nevarēja pienācīgi novērtēt dažas ķīmisko vielu vai produktu klases (piemēram, maisījumus). Taču var apsvērt iespējas izmantot šo testēšanas metodi visu veidu testējamajiem materiāliem (tostarp maisījumiem), ja pozitīvs rezultāts var būt pieņemams kā norāde par nopietnus acu bojājumus vai nopietnu kairinājumu izraisošu iedarbību. Taču spirtu testēšanā iegūti pozitīvi rezultāti jāinterpretē piesardzīgi pārvērtēšanas riska dēļ.
7. Visās procedūrās ar vistu acīm testēšanas iestādēm jāievēro piemērojamie noteikumi un procedūras darbībām ar cilvēku vai dzīvnieku izcelsmes materiāliem, pie kuriem pieder arī audi un audu šķidrumi. Bez tam ieteicams ievērot vispārējos piesardzības pasākumus darbam laboratorijā (15).
8. Testēšanas metodē netiek ņemti vērā konjunktīvas un varavīksnenes bojājumi, kas ir tās ierobežojums, tomēr tajā tiek ņemti vērā daži iedarbības veidi uz aci, kas tiek novērtēti truša acs kairinājuma testa metodē, un zināmā mērā to smagums. Kaut gan radzenes bojājumu atgriezeniskumu nevar novērtēt, izmantojot ICE testēšanas metodi, pamatojoties uz trušu acu pētījumiem, ir ierosināts, ka, lai nošķirtu neatgriezenisku un atgriezenisku iedarbību, var izmantot radzenes bojājuma sākotnējā dziļuma novērtējumu (16). Visbeidzot, izmantojot ICE testēšanas metodi, nevar novērtēt sistēmiskas toksicitātes potenciālu saistībā ar iedarbību uz acīm.
9. Patlaban notiek darbs pie precīzāku raksturlielumu izstrādes ICE testēšanas metodes noderīgumam un ierobežojumiem tādu vielu identificēšanai, kas nerada nopietnus acu bojājumus vai nopietnu acu kairinājumu (sk. arī 48. punktu). Lietotāji tiek aicināti iesniegt validācijas organizācijām paraugus un/vai datus, lai tās formāli novērtētu ICE testēšanas metodes turpmākos lietošanas veidus, tostarp nopietna acu kairinājuma izraisošu un acu kairinājumu neizraisošu vielu identificēšanai.
10. Laboratorijām, kas sāk lietot šo testēšanas metodi, jāizmanto 2. papildinājumā norādītās standartvielas. Laboratorija šīs vielas var izmantot ICE testēšanas metodes izpildes tehniskās kompetences demonstrēšanai pirms ICE testēšanas rezultātu datu iesniegšanas izmantošanai normatīvajos aktos reglamentētajai bīstamības klasifikācijai.
METODES PRINCIPS
11. ICE testēšanas metode ir orgāntipisks modelis, kas īslaicīgi nodrošina iespēju saglabāt vistas aci in vitro. Šajā testēšanas metodē testējamās vielas radītos bojājumus novērtē, nosakot radzenes uzbriedumu, duļķošanos un fluoresceīna aizturi. Divi pēdējie parametri tiek novērtēti kvalitatīvi, bet radzenes uzbrieduma noteikšana ir kvantitatīva. Katru novērtējumu pārvērš kvantitatīvā rezultātā, ko izmanto, lai aprēķinātu kopējo kairinājuma rādītāju, vai tam piešķir kvalitatīvu kategoriju, ko izmanto, lai in vitro noteiktu nopietnus acu bojājumus vai nopietnu kairinājumu izraisītāju iedarbības klasifikāciju. Abus rezultātus var izmantot, lai prognozētu testējamās vielas potenciālo in vivo nopietnus acu bojājumus vai nopietnu kairinājumu izraisītāju iedarbību (sk. sadaļu “Lēmuma pieņemšanas kritēriji”).
Vistu acu iegūšanai izmantojamo dzīvnieku avots un vecums
12. Parasti šajā testā izmanto acis, kas ņemtas no kautuvē cilvēku patēriņam pārtikai kautām vistām, tāpēc laboratorijas dzīvnieki nav jāizmanto. Izmanto tikai veselīgu dzīvnieku acis, kurus uzskata par piemērotiem cilvēkiem paredzētas pārtikas apritei.
13. Kaut gan vistu optimālā vecuma novērtēšanai nav veikts īpašs pētījums, šajā testēšanas metodē ierasti izmanto pavasara cāļus, kurus parasti apstrādā putnu kautuvē (t.i., aptuveni 7 nedēļas vecus, 1,5–2,5 kg).
Acu ņemšana un nogādāšana laboratorijā
14. Galvas atdala tūlīt pēc vistu apdullināšanas, parasti ar elektriskās strāvas triecienu, un asiņu nolaišanas pa griezumu kaklā. Jāizvēlas vietējs vistu sagādes avots, kas atrodas iespējami tuvu laboratorijai, lai vistu galvas no kautuves varētu nogādāt laboratorijā, iespējami samazinot to bojāšanos un/vai bakteriālo kontamināciju. Laiks no vistu galvu ņemšanas līdz acu izmantošanai ICE testam ir iespējami jāsamazina (parasti divu stundu laikā), un uzskatāmi jāparāda, ka tam nav nevēlamas ietekmes uz noteikšanas rezultātiem. Šo rezultātu pamatā ir acu izvēles kritēriji, kā arī pozitīvās un negatīvās kontroles reakcijas. Visām testēšanai izmantotajām acīm ir jābūt no vienas noteiktā dienā ņemtu acu grupas.
15. Tā kā acis laboratorijā tiek preparētas, galvas no kautuves transportē pie apkārtējās vides temperatūras plastmasas kārbās, kurās mitrumu uztur ar sāls izotoniskā šķīdumā samitrinātiem dvieļiem.
ICE testam izmantojamo acu izvēles kritēriji
16. Izbrāķē acis, kurām pēc izņemšanas ir augsts fluoresceīna sākotnējais saistīšanas rādītājs (t.i., > 0,5) vai radzenes duļķošanās rādītājs (t.i., > 0,5).
17. Katrā paraugu grupā un paralēlajā pozitīvajā kontrolē testē vismaz trīs acis. Negatīvās kontroles grupā vai šķīdinātāja kontrolē (ja izmanto šķīdinātāju, izņemot sāls šķīdumu) ir jābūt vismaz vienai acij.
PROCEDŪRA
Acu sagatavošana
18. Uzmanīgi noņem plakstiņus, nebojājot radzeni. Radzenes integritāti ātri novērtē, uz dažām sekundēm uzpilinot tās virsmai 2 % (masas) fluoresceīna nātrija sāls šķīdumu, ko pēc tam noskalo ar sāls izotonisko šķīdumu. Pēc tam ar fluoresceīnu apstrādātas acis pārbauda ar spraugas lampas mikroskopu, lai pārliecinātos, vai radzene nav bojāta (t.i., ja fluoresceīna aiztures un radzenes duļķošanās rādītāji ir ≤ 0,5).
19. Ja acs nav bojāta, to uzmanīgi, nebojājot radzeni, izpreparē galvaskausa. Acs ābolu izvelk no dobuma, stingri pieturot mirkšķināšanas membrānu ar ķirurģiskajām knaiblēm, un acs muskuļus pārgriež ar liektām šķērēm ar noapaļotiem galiem. Svarīgi ir nepieļaut radzenes bojājumus pārmērīga spiediena dēļ (t.i., saspiešanas artefakti).
20. Kad acs ir izņemta no dobuma, pie tās atstāj redzamu daļu redzes nerva. Pēc izņemšanas no dobuma aci novieto uz absorbējoša paliktņa un nogriež mirkšķināšanas membrānu un citus saistaudus.
21. Izņemto aci ar radzeni vertikālā stāvoklī iestiprina nerūsējošā tērauda skavā. Skavu pēc tam ievieto mitrināšanas aparāta kamerā (16). Skavas mitrināšanas aparātā ievieto tā, lai izotoniskā sāls šķīduma pilieni mitrinātu visu radzeni. Mitrināšanas aparāta kamerā jāuztur 32 ± 1,5 °C temperatūra. Tipisku mitrināšanas aparāta (ko var iegādāties vai izgatavot) un acu stiprinājuma skavu shēmu sk. 3. papildinājumā. Aparātu var pārveidot atbilstoši konkrētās laboratorijas vajadzībām (piemēram, lai izmantotu atšķirīgu acu skaitu).
22. Pēc ievietošanas mitrināšanas aparātā acis vēlreiz apskata ar spraugas lampas mikroskopu, lai pārliecinātos, ka preparēšanas procedūrā tās nav bojātas. Izmēra radzenes biezumu radzenes virsotnē, izmantojot spraugas lampas mikroskopa dziļuma mērīšanas ierīci. Nomaina visas acis, (i) kuru fluoresceīna aiztures rezultāts ir > 0,5, (ii) kuru radzenes duļķošanās rādītājs ir > 0,5 vai (iii) kam ir jebkuras citas bojājumu pazīmes. No tām acīm, kas netiek izbrāķētas neviena šī kritērija dēļ, izbrāķē tās, kuru radzenes biezums atšķiras no visu acu radzenes vidējā biezuma rādītāja par vairāk nekā 10 %. Lietotājiem jāņem vērā, ka, izmantojot spraugas lampas mikroskopu, ar dažādu spraugas platumu radzenes biezuma mērījumu rezultāti var būt atšķirīgi. Spraugas platums jāiestata 0,095 mm.
23. Kad visas acis ir pārbaudītas un atzītas par derīgām, acis apmēram 45 līdz 60 min inkubē, lai pirms aplicēšanas tās līdzsvarotu ar testēšanas sistēmu. Pēc līdzsvarošanas reģistrē radzenes biezuma un duļķošanās nulles sākotnējos mērījumu, ko izmanto kā sākuma punktu (t.i., laiks = 0). Šim testēšanas beigu punktam kā sākotnējās atskaites punktu izmanto fluoresceīna aiztures rādītāju, kas noteikts acs preparēšanas laikā.
Testējamās vielas aplicēšana
24. Tūlīt pēc nulles sākotnējiem mērījumiem (turētājā ievietotu) aci izņem no mitrināšanas aparāta, novieto horizontāli un uz radzenes aplicē testējamo vielu.
25. Testējamās vielas, kas ir šķidrumi, parasti testē neatšķaidītas, taču tās var atšķaidīt, ja tas tiek uzskatīts par vajadzīgu (piemēram, plānojot pētījumu). Atšķaidīšanai ieteicams izmantot sāls fizioloģisko šķīdumu. Kontrolētos apstākļos var izmantot arī citus šķīdinātājus, taču, izņemot sāls fizioloģisko šķīdumu, citu šķīdinātāju piemērotība ir uzskatāmi jāparāda.
26. Testējamās vielas, kas ir šķidrumi, uz radzenes aplicē tā, lai pilnībā visa radzenes virsma tiktu vienmērīgi noklāta ar testējamo vielu; standarta tilpums ir 0,03 mL.
27. Cietvielas iespējami sīki jāsasmalcina piestā, vai izmantojot līdzvērtīgu smalcināšanas ierīci. Pulveri aplicē uz radzenes tā, lai virsmu vienmērīgi pārklātu ar testējamo vielu; standarta daudzums ir 0,03 g.
28. Testējamo vielu (šķidruma vai cietvielas veidā) aplicē uz 10 sek un pēc tam noskalo no acs ar istabas temperatūras sāls izotonisko šķīdumu (apmēram 20 mL). Pēc tam aci (ievietotu turētājā) atkal ievieto mitrināšanas aparātā sākotnējā vertikālajā stāvoklī.
Kontroles vielas
29. Katrā eksperimentā iekļauj paralēlas negatīvās vai šķīdinātāja/nesēja kontroles un pozitīvās kontroles.
30. Testējot šķidrumus 100 % koncentrācijā vai cietvielas, ICE testēšanas metodē izmanto paralēlu negatīvo kontroli ar sāls fizioloģisko šķīdumu, lai konstatētu neraksturīgas testēšanas sistēmas izmaiņas un nodrošinātu, ka noteikšanas apstākļu dēļ netiek konstatēta kairinājumu izraisoša reakcija.
31. Testējot atšķaidītus šķīdumus, testēšanas metodē iekļauj paralēlu šķīdinātāja/nesēja kontroles grupu, lai konstatētu neraksturīgas testēšanas sistēmas izmaiņas un nodrošinātu, ka testēšanas apstākļu dēļ kairinājumu izraisoša reakcija netiek konstatēta. Kā noteikts 25. punktā, drīkst izmantot tikai tādu šķīdinātāju/nesēju, par kuru ir liecības, ka tam nav nelabvēlīgas ietekmes uz testēšanas sistēmu.
32. Katrā eksperimentā kā paralēlu pozitīvo kontroli iekļauj testu ar zināmu acu kairinājumu izraisošu vielu, lai pārliecinātos, ka izraisītā atbildes reakcija ir atbilstoša. Tā kā šajā testēšanas metodē ICE tests tiek izmantots nopietnus acu bojājumus vai nopietnu kairinājumu izraisītāju vielu identificēšanai, pozitīvās kontroles vielai jābūt standartvielai, kas šajā testēšanas metodē izraisa spēcīgu reakciju. Tomēr, lai nodrošinātu iespēju novērtēt pozitīvās kontroles reakcijas mainību laikā, spēcīgās reakcijas intensitāte nedrīkst būt pārmērīgi liela. Pozitīvās kontroles vajadzībām jāiegūst pietiekami daudz in vitro datu, lai varētu aprēķināt statistiski noteiktu pozitīvajai kontrolei pieņemamo vērtību intervālu. Ja pozitīvajai kontrolei nav pieejams pietiekams daudzums iepriekš iegūtu vēsturisko ICE testēšanas metodes datu, iespējams, jāveic pētījumi, lai šo informāciju iegūtu.
33. Pozitīvās kontroles piemēri testējamajām vielām, kas ir šķidrumi, ir 10 % etiķskābe vai 5 % benzalkonija hlorīds, bet pozitīvās kontroles testējamām cietvielām ir nātrija hidroksīds vai imidazols.
34. Salīdzināšanas vielas ir lietderīgi izmantot, lai novērtētu nezināmu noteiktas ķīmisko vielu vai produktu kategorijas spēju izraisīt acu kairinājumu, vai arī, lai novērtētu acu kairinājumu izraisošas vielas salīdzinošo spēju izraisīt noteiktas intensitātes atbildes reakciju uz kairinājumu.
Mērāmie beigu punkti
35. Apstrādātās radzenes novērtē pirms aplicēšanas un 30, 75, 120, 180 un 240 min (± 5 min) pēc skalošanas apstrādes beigās. Ar šiem laika intervāliem pietiek, lai četru stundu ilgajā iedarbības periodā veiktu pietiekamu skaitu mērījumu un starp mērījumiem būtu pietiekami ilgs laiks visu vajadzīgo novērojumu veikšanai.
36. Novērtē šādus parametrus: radzenes duļķošanās, uzbriedums, fluoresceīna aizture un morfoloģiskās izmaiņas (piemēram, epitēlija izdrupšana vai atslābšana). Visus parametrus, izņemot fluoresceīna aizturi (ko nosaka tikai pirms aplicēšanas un 30 min pēc testējamās vielas iedarbības), nosaka katrā no iepriekš minētajiem laika intervāliem.
37. Radzenes duļķošanās, fluoresceīna aiztures, morfoloģisko izmaiņu un histopatoloģisko izmaiņu, ja tās tiek noteiktas, dokumentēšanai ieteicams izmantot fotogrāfijas.
38. Pēc pēdējās noteikšanas četru stundu perioda beigās lietotājiem ieteicams saglabāt acis piemērotā fiksatīvā (piemēram, neitrālā buferētā formalīnā) iespējamai histopatoloģiskai izmeklēšanai.
39. Radzenes uzbriedumu nosaka no radzenes biezuma mērījumiem ar spraugas lampas mikroskopa optisko pahimetru. To izsaka procentos un aprēķina saskaņā ar radzeņu biezuma mērījumiem saskaņā ar šādu formulu:

40. Visiem novērojumu laika intervāliem aprēķina visu testējamo acu radzeņu vidējo uzbriedumu procentos. Pamatojoties uz augstāko radzeņu uzbrieduma vidējo rādītāju, kas novērots jebkurā laika intervālā, katrai testējamai vielai piešķir kopējo kategorijas rezultātu.
41. Radzenes duļķošanos aprēķina pēc tās radzenes daļas, kurai noteikts skaitliski lielākais duļķošanās rādītājs. Visām testējamajām acīm visos novērojumu laika intervālos aprēķina radzeņu duļķošanās vidējo rādītāju. Pamatojoties uz jebkurā laika intervālā novērotās radzeņu duļķošanās augstāko vidējo rādītāju, katrai testējamai vielai piešķir kopējo kategorijas rezultātu (1. tabula).
1. tabula
Radzenes duļķošanās rādītājs
|
Rādītājs |
Novērojums |
|
0 |
Nav duļķošanās |
|
0,5 |
Ļoti vāja duļķošanās |
|
1 |
Izkaisītas vai difūzas zonas, labi redzamas varavīksnenes daļas |
|
2 |
Labi izšķirama caurspīdīgā daļa, varavīksnenes daļas redzamas nedaudz neskaidri |
|
3 |
Liela radzenes duļķošanās, atsevišķas varavīksnenes daļas nav redzamas, acs zīlītes izmērs tikko saskatāms |
|
4 |
Pilnīga radzenes duļķošanās, varavīksnene nav saskatāma |
42. Vidējo fluoresceīna aiztures vērtību visām testējamām acīm aprēķina tikai 30 min novērošanas intervālam un izmanto, lai piešķirtu katrai testējamai vielai kopējo kategorijas rezultātu (2. tabula).
2. tabula
Fluoresceīna aiztures rādītājs
|
Rezultāts |
Novērojums |
|
0 |
Nav fluoresceīna aiztures |
|
0,5 |
Ļoti neliela atsevišķu šūnu iekrāsošanās |
|
1 |
Neregulāra atsevišķu šūnu iekrāsošanās visā apstrādātajā radzenes daļā |
|
2 |
Koncentrēta vai saplūstoša blīva atsevišķu šūnu iekrāsošanās |
|
3 |
Lielas, saplūstošas radzenes daļas iekrāsošanās ar fluoresceīnu |
43. Morfoloģisko izmaiņu veidi ir radzenes epitēlija šūnu “izdrupšana”, epitēlija “atslābšana”, “nelīdzenumu veidošanās” radzenes virsmā un testējamās vielas “pielipšana” pie radzenes. Šo bojājumu smaguma pakāpe var atšķirties, un vairākas šīs pazīmes var konstatēt vienlaicīgi. Atkarībā no testēšanas veicēja interpretācijas šo bojājumu klasifikācija ir subjektīva.
DATI UN TESTĒŠANAS PĀRSKATS
Datu novērtēšana
44. Radzenes duļķošanās, uzbrieduma un fluoresceīna aiztures rezultāti jānovērtē atsevišķi, lai katram beigu punktam iegūtu ICE klasi. Pēc tam attiecīgās testējamās vielas izraisītā kairinājuma klasifikācijas iegūšanai apvieno visiem beigu punktiem noteiktās ICE klases.
Lēmuma pieņemšanas kritēriji
45. Pēc visu beigu punktu novērtēšanas var piešķirt ICE klases, pamatojoties uz iepriekš noteiktiem rādītāju vērtību intervāliem. Radzenes biezumu (3. tabula), duļķošanos (4. tabula) un fluoresceīna aizturi (5. tabula) atbilstoši četrām ICE klasēm interpretē šādi.
3. tabula
ICE radzenes biezuma klasifikācijas kritēriji
|
Vidējais radzenes uzbriedums (%) (1) |
ICE klase |
|
0 līdz 5 |
I |
|
> 5 līdz 12 |
II |
|
> 12 līdz 18 (> 75 min pēc aplicēšanas) |
II |
|
> 12 līdz 18 (≤ 75 min pēc aplicēšanas) |
III |
|
> 18 līdz 26 |
III |
|
> 26 līdz 32 (> 75 min pēc aplicēšanas) |
III |
|
> 26 līdz 32 (≤ 75 min pēc aplicēšanas) |
IV |
|
> 32 |
IV |
|
(1) Radzenes uzbrieduma rādītājus izmanto tikai tad, ja biezums ir mērīts ar Haag-Streit BP900 spraugas lampas mikroskopu, izmantojot dziļuma mērīšanas ierīci Nr. I un spraugas platuma iestatījuma vērtību 9½, kas vienāda ar 0,095 mm. Lietotājiem jāņem vērā, ka, izmantojot spraugas lampas mikroskopu, ar dažādu spraugas platumu var iegūt atšķirīgus radzenes biezuma mērījumu rezultātus. |
|
4. tabula
ICE klasifikācijas kritēriji duļķošanās novērtēšanai
|
Lielākais vidējais duļķošanās rādītājs (1) |
ICE klase |
|
0,0-0,5 |
I |
|
0,6-1,5 |
II |
|
1,6-2,5 |
III |
|
2,6-4,0 |
IV |
|
(1) Skatīt 1. tabulu. |
|
46. Kopējo testējamās vielas in vitro kairinājuma klasifikācijas kategoriju nosaka atbilstīgi kairinājuma klasifikācijai, kas atbilst radzenes uzbrieduma, radzenes duļķošanās un fluoresceīna aiztures rādītāju kombinācijai, izmantojot 6. tabulā noteikto shēmu.
6. tabula
Kopējās in vitro kairinājuma klasifikācijas
|
Klasifikācija |
3 parametru rādītāju kombinācija |
|
Izraisa nopietnus acu bojājumus/ nopietnu acu kairinājumu |
3 × IV 2 × IV, 1 × III 2 × IV, 1 × II (1) 2 × IV, 1 × I (1) Radzenes duļķošanās ≥ 3 pēc 30 min (vismaz 2 acīm) Radzenes duļķošanās = 4 jebkurā laika intervālā (vismaz 2 acīm) Ievērojama epitēlija atslābšana (vismaz 1 acij) |
|
(1) Mazāk ticama kombinācija. |
|
47. Kā noteikts 1. punktā, gadījumos, kad testējamā viela netiek identificēta kā nopietnus acu bojājumus vai nopietnu kairinājumu izraisītāja, klasifikācijas un marķēšanas nolūkā ir jāveic papildu testēšana. Nopietnus acu bojājumus vai nopietnu kairinājumu izraisītāju vielu identificēšanas kopējā pareizība pēc ICE testēšanas metodes ir no 83 % (120/144) līdz 87 % (134/154), kļūdaini pozitīvo rezultātu daļa ir no 6 % (7/122) līdz 8 % (9/116) un kļūdaini negatīvo rezultātu daļa ir no 41 % (13/32) līdz 50 % (15/30), salīdzinot ar izmēģinājumu rezultātiem ar trušu acīm in vivo atbilstīgi EPA (1), ES (2) vai GHS (3) klasifikācijas sistēmai. Ja noteiktas ķīmisko (t.i., spirti un virsmaktīvās vielas) un fizikālo īpašību (t.i., cietvielas) grupas vielas izslēdz no datubāzes, ICE pareizība ES, EPA un GHS klasifikācijas sistēmā ir no 91 % (75/82) līdz 92 % (69/75), kļūdaini pozitīvo rezultātu daļa ir no 5 % (4/73) līdz 6 % (4/70) un kļūdaini negatīvo rezultātu daļa ir no 29 % (2/7) līdz 33 % (3/9) (4).
48. Ja testējamā viela netiek klasificēta kā nopietnus acu bojājumus vai nopietnu kairinājumu izraisītāja, kopā ar in vivo truša acu testa vai cita atbilstīgi validēta in vitro testa datiem ICE dati var būt noderīgi, lai turpmāk novērtētu ICE testēšanas metodes piemērotību un ierobežojumus kā nopietnus acu bojājumus vai nopietnu kairinājumu neizraisošu vielu identificēšanai (tiek izstrādāts norādījumu dokuments par in vitro testēšanas metodēm, lai noteiktu toksicitāti acīm).
Testa rezultātu pieņemamības kritēriji
49. Testēšanas rezultātu uzskata par pieņemamu, ja paralēlajā negatīvajā vai nesēja/šķīdinātāja kontrolē un paralēlajā pozitīvajā kontrolē tiek noteikta kairinājuma klasifikācija, kas atbilst attiecīgi kairinājumu izraisošu un nopietnus acu bojājumus vai nopietnu kairinājumu izraisošu vielu klasifikācijai.
Testēšanas pārskats
50. Testēšanas pārskatā jāiekļauj šāda informācija, kas attiecas uz konkrēto noteikšanu.
Testējamās vielas un kontrolvielas
Ķīmiskais nosaukums(-i), piemēram, ķīmijas analītisko apskatu indeksā (Chemical Abstracts Service, CAS) izmantotais nosaukums, pēc tam citi nosaukumi, ja tādi ir zināmi;
CAS reģistra numurs, ja tas ir zināms;
vielas vai maisījuma tīrība un sastāvs (masas procentos), ciktāl šī informācija ir pieejama;
fizikāli ķīmiskās īpašības, kas attiecas uz pētījuma veikšanu, piemēram, fizikālais stāvoklis, gaistamība, pH, stabilitāte, vielas ķīmiskā klase, šķīdība ūdenī;
testējamās/kontroles vielas sagatavošana testēšanai, ja tiek veikta (piemēram, sildīšana, sasmalcināšana);
stabilitāte, ja zināma.
Informācija par sponsoru un testēšanas iestādi
Sponsora, testēšanas iestādes nosaukums, pētījuma vadītāja uzvārds un adrese;
norāde par acu ņemšanas vietu (t.i., iestāde, kur tās ņemtas);
Acu glabāšanas un transportēšanas apstākļi (piemēram, acu ņemšanas datums un laiks, līdz testēšanas sākumam pagājušais laiks);
īpašas to dzīvnieku pazīmes, no kuriem ņemtas acis, ja tādas ir pieejamas (piemēram, donordzīvnieka vecums, dzimums, dzīvsvars).
Izmantotās testēšanas metodes un protokola pamatojums
Testēšanas metodes integritāte
Procedūra, ko izmanto, lai nodrošinātu testēšanas metodes integritāti (t.i., pareizību un ticamību) laikā (piemēram, periodiska standartvielu testēšana, iepriekš iegūto vēsturisko negatīvo un pozitīvo kontroles datu izmantošana).
Testa apstiprināšanas kritēriji
ja vajadzīgs, pieņemami paralēlo standarta kontroļu diapazoni, pamatojoties uz iepriekš iegūtajiem vēsturiskajiem datiem.
Testēšanas apstākļi
Izmantotās testēšanas sistēmas apraksts;
izmantotais spraugas lampas mikroskops (piemēram, modelis);
izmantotā spraugas lampas mikroskopa instrumentu iestatījumi;
informācija par izmantotajām vistu acīm, tostarp to kvalitātes apliecinājumi;
sīkas ziņas par izmantoto testēšanas procedūru;
izmantotā(-s) testējamās vielas koncentrācija(s-),
testēšanas procedūras iespējamo modifikāciju apraksts;
atsauce uz vēsturiskajiem datiem par modeli (piemēram, negatīvās un pozitīvās kontroles, standartvielas, salīdzināšanas vielas);
izmantoto novērtējuma kritēriju apraksts.
Rezultāti
Novērojumu apraksts;
attiecīgos gadījumos acs fotogrāfijas;
Rezultātu novērtējums
Secinājums
LITERATŪRA
(1) U.S. EPA (1996). Label Review Manual: 2nd Edition. EPA737-B-96-001. Washington, DC: U.S. Environmental Protection Agency.
(2) Eiropas Parlamenta un Padomes 2008. gada 16. decembra Regula (EK) Nr. 1272/2008 par vielu un maisījumu klasificēšanu, marķēšanu un iepakošanu un ar ko groza un atceļ Direktīvas 67/548/EEK un 1999/45/EK un groza Regulu (EK) Nr. 1907/2006. OV L 353, 31.12.2008., 1. lpp.
(3) United nations (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Second revised edition, UN New York and Geneva, 2007. Pieejams:
[http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html]
(4) ICCVAM (2007). Test Method Evaluation Report - In vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Pieejams:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(5) ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Pieejams:
[http://ecvam.jrc.it/index.htm]
(6) Eiropas Parlamenta un Padomes 2006. gada 18. decembra Regula (EK) Nr. 1907/2006, kas attiecas uz ķimikāliju reģistrēšanu, vērtēšanu, licencēšanu un ierobežošanu (REACH), un ar kuru izveido Eiropas Ķimikāliju aģentūru, groza Direktīvu 1999/45/EK un atceļ Padomes Regulu (EEK) Nr. 793/93 un Komisijas Regulu (EK) Nr. 1488/94, kā arī Padomes Direktīvu 76/769/EEK un Komisijas Direktīvu 91/155/EEK, 93/67/EEK, 93/105/EK un 2000/21/EK. OV L 396, 30.12.2006., 1. lpp.
(7) OECD (2002). Test Guideline 405. OECD Guideline for Testing of Chemicals. Acute eye irritation/corrosion. Pieejams:
[http://www.oecd.org/document/40/0,2340,en_2649_34377_37051368_1_1_1_1,00.html]
(8) ICCVAM (2007). ICCVAM Recommended ICE Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Pieejams:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm]
(9) ICCVAM. (2006). Current Status of In vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye Test Method. NIH Publication No.: 06-4513. Research Triangle Park: National Toxicology Program. Pieejams:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_ice.htm]
(10) Prinsen, M.K. and Koëter, B.W.M. (1993). Justification of the enucleated eye test with eyes of slaughterhouse animals as an alternative to the Draize eye irritation test with rabbits. Fd. Chem. Toxicol. 31:69-76.
(11) INVITTOX (1994). Protocol 80: Chicken enucleated eye test (CEET). Pieejams:
[http://ecvam.jrc.it/index.htm].
(12) Balls, M., Botham, P.A., Bruner, L.H. and Spielmann H. (1995). The EC/HO international validation study on alternatives to the Draize eye irritation test. Toxicol. In vitro 9:871-929.
(13) Prinsen, M.K. (1996). The chicken enucleated eye test (CEET): A practical (pre)screen for the assessment of eye irritation/corrosion potential of test materials. Food Chem. Toxicol. 34:291-296.
(14) Chamberlain, M., Gad, S.C., Gautheron, P. and Prinsen, M.K. (1997). IRAG Working Group I: Organotypic models for the assessment/prediction of ocular irritation. Food Chem. Toxicol. 35:23-37.
(15) Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Pieejams:
[http://www.cdc.gov/ncidod/dhqp/pdf/isolation2007.pdf].
(16) Maurer, J.K., Parker, R.D. and Jester J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
(17) Burton, A.B.G., M. York and R.S. Lawrence (1981). The in vitro assessment of severe irritants. Fd. Cosmet.- Toxicol.- 19, 471-480.
(18) ICCVAM (2006). Background review document, Current Status of In vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Pieejams:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
(19) ICCVAM (2006). Background review document, Current Status of In vitro Test Methods for Identifying Ocular Corrosives and Severe IrritantsIsolated Chicken Eye (ICE) Test Method. Pieejams:
[http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm]
1. papildinājums
DEFINĪCIJAS
Pareizība : pēc testēšanas metodes iegūto mērījumu rezultātu sakritības pakāpe ar attiecīgajām references vērtībām. Tas ir testēšanas metodes veiktspējas raksturlielums un viens no tās piemērotības aspektiem. Šo terminu bieži izmanto ar nozīmi “sakritība” vai atbilstība, ar to domājot pareizo rezultātu daļu, ko iegūst pēc testēšanas metodes.
Salīdzināšanas viela : viela, ko izmanto kā standartu salīdzināšanai ar testējamo vielu. Salīdzināšanas vielai ir jābūt šādām īpašībām: (i) pastāvīgs un uzticams ieguves avots, (ii) struktūras un funkciju līdzība ar testējamo vielu klases vielām, (iii) zināmas fizikālās/ķīmiskās īpašības; (iv) papildu dati par zināmajiem iedarbības veidiem un (v) vielas zināmais iedarbības stiprums atbilst vēlamās reakcijas intensitātes diapazonam.
Radzene : acs ābola priekšējā caurspīdīgā daļa, kas pārklāj varavīksneni un zīlīti un ielaiž acī gaismu.
Radzenes duļķošanās : izmērītā radzenes duļķošanās pakāpe pēc testējamās vielas iedarbības. Radzenes duļķošanās palielināšanās norāda uz radzenes bojājumiem.
Radzenes uzbriedums : objektīvs ICE testa mērījums, kas norāda, kādā mērā radzene pēc testējamās vielas iedarbības ir uzbriedusi. To izsaka procentos un aprēķina no radzenes sākotnējā (pirms aplicēšanas) biezuma mērījuma un biezuma, kas pēc testēšanas materiāla iedarbības saskaņā ar ICE testēšanas metodi reģistrēts ar regulāriem intervāliem. Radzenes uzbrieduma pakāpe norāda uz radzenes bojājumiem.
EPA 1. kategorija : nopietns acu bojājums (acs audu neatgriezeniska noārdīšana), radzenes bojājums vai izraisīts kairinājums, kas saglabājas ilgāk par 21 dienu (1).
ES R41 kategorija : acs audu bojājums vai nopietni fiziski redzes traucējumi, kas rodas pēc testējamās vielas aplicēšanas uz acs priekšējās virsmas un nav pilnīgi atgriezeniski 21 dienas laikā pēc aplicēšanas (2).
Kļūdaini negatīvo rezultātu daļa : visu to pozitīvo vielu daļa ar attiecīgu iedarbību, kas, izmantojot konkrēto testēšanas metodi, nepareizi identificētas kā negatīvas vielas, kurai šādas iedarbības nav. Tas ir viens no testēšanas metodes veiktspējas raksturlielumiem.
Kļūdaini pozitīvo rezultātu daļa : visu to visu to negatīvo vielu daļa bez attiecīgas iedarbības, kas, izmantojot konkrēto testēšanas metodi, nepareizi identificētas kā pozitīvas vielas ar šādu iedarbību. Tas ir viens no testēšanas metodes veiktspējas raksturlielumiem.
Fluoresceīna aizture : subjektīvs ICE testa mērījums, kas norāda, kādā mērā radzenes epitēlija šūnas pēc testējamās vielas iedarbības aiztur fluoresceīna nātrija sāli. Fluoresceīna aiztures pakāpe norāda uz radzenes epitēlija bojājumiem.
GHS (Globāli harmonizētā ķīmisko vielu klasifikācijas un marķēšanas sistēma) : sistēma, saskaņā ar kuru ķimikālijas (vielas un maisījumus) klasificē pēc standartizētiem kaitīgās iedarbības veidiem un to intensitātes uz cilvēka veselību un vidi, kā arī paredz atbilstošu saziņas elementu izmantošanu, piemēram, piktogrammas, signālvārdus, bīstamības apzīmējumus, piesardzības apzīmējumus un drošības datu lapas, kuru mērķis ir sniegt informāciju, kas nepieciešama cilvēku (tostarp darba devēju, strādājošo, transporta darbinieku, patērētāju un avārijas dienestu darbinieku) un vides aizsardzībai pret to kaitīgo iedarbību (3).
GHS 1. kategorija : acs audu bojājums vai nopietni fiziski redzes traucējumi, kas rodas pēc testējamās vielas aplicēšanas un kas nav pilnīgi atgriezeniski ilgāk par 21 dienu pēc vielas aplicēšanas (3).
Bīstamība : aģentam vai situācijai piemītoša īpašība, kas šā aģenta iedarbības rezultātā var radīt nevēlamu ietekmi uz attiecīgo organismu, sistēmu vai (sub)populāciju.
Negatīvā kontrole : ar testējamo vielu neapstrādāts atkārtojums, kurā ir visi pārējie testēšanas sistēmas komponenti. Šo paraugu testē kopā ar paraugiem, uz kuriem aplicēta testējamā viela, un citiem kontroles paraugiem, lai noteiktu, vai šķīdinātājam ir mijiedarbība ar testēšanas sistēmu.
Kairinājumu neizraisoša viela : viela, kas netiek klasificēta kā EPA I, II vai III kategorijas, ES R41 vai R36 kategorijas, vai GHS 1., 2.A vai 2.B kategorijas acu kairinājumu izraisītāja viela (1)(2)(3).
Nopietnus acu bojājumus izraisoša viela : (a) viela, kas rada acs audu neatgriezenisku bojājumu; (b) viela, kas tiek klasificēta kā GHS 1. kategorijas, EPA I kategorijas vai ES R41 kategorijas acu kairinājumu izraisītāja viela (1) (2) (3).
Acu kairinājumu izraisoša viela : (a) viela, kas pēc aplicēšanas uz acs priekšējās virsmas izraisa acī atgriezeniskas izmaiņas, (b) viela, kas tiek klasificēta kā EPA II vai III kategorijas, ES R36 kategorijas vai GHS 2.A vai 2.B kategorijas acu kairinājumu izraisītāja viela (1) (2) (3).
Nopietnu acu kairinājumu izraisoša viela : (a) viela, kas pēc aplicēšanas uz acs priekšējās virsmas izraisa acs audu bojājumus, kas ir neatgriezeniski ilgāk par 21 dienu pēc aplicēšanas vai kas izraisa nopietnus fiziskus redzes traucējumus; (b) viela, kas tiek klasificēta kā GHS 1. kategorijas, EPA I kategorijas vai ES R41 kategorijas acu kairinājumu izraisītāja viela (1)(2)(3).
Pozitīvā kontrole : atkārtojums, kurā ir visi testēšanas sistēmas komponenti, un kuram veikta apstrāde ar vielu, par ko ir zināms, ka tā izraisa attiecīgo atbildes reakciju. Lai nodrošinātu iespēju novērtēt pozitīvās kontroles atbildes reakcijas mainību laikā, nopietnu kairinājumu izraisošās reakcijas intensitāte nedrīkst būt pārlieku liela.
Ticamība : lielums, kas raksturo, kādā mērā tajā pašā vai citā laboratorijā ilgākā laikā, izmantojot to pašu protokolu, var izpildīt testēšanas metodi atkārtoti. To novērtē, aprēķinot metodes reproducējamību dažādās laboratorijās un atkārtojamību tajā pašā laboratorijā.
Spraugas lampas mikroskops : instruments, ko izmanto acs apskatīšanai binokulārā mikroskopa palielinājumā, izveidojot stereoskopisku, stāvus novietotu attēlu. ICE testēšanas metodē šo instrumentu izmanto, lai apskatītu vistas acs priekšējās struktūras, kā arī objektīvi izmērītu radzenes biezumu ar dziļuma mērīšanai paredzētu palīgierīci.
Šķīdinātāja/nesēja kontrole : ar testējamo vielu neapstrādāts paraugs, kurā ir visi testēšanas sistēmas komponenti, tostarp šķīdinātājs vai nesējs, ko izmanto testējamās vielas un citos kontroles paraugos, lai noteiktu attiecīgā šķīdinātājā vai nesējā izšķīdināto ar testējamo vielu apstrādāto paraugu sākotnējo atbildes reakciju. Testējot kopā ar paralēlu negatīvo kontroli, šis paraugs parāda arī, vai šķīdinātājam vai nesējam ir mijiedarbība ar testēšanas sistēmu.
Daudzpakāpju testēšana : pakāpeniskas testēšanas stratēģija, kurā noteiktā secībā pārskata visu esošo informāciju par testējamo vielu, katrā pakāpē izmantojot datu svarīguma pieeju, lai pirms pārejas uz nākamo pakāpi noteiktu, vai ir pieejams pietiekami daudz informācijas, lai pieņemtu lēmumu par bīstamības klasifikāciju. Ja testējamās vielas kairinājuma izraisīšanas potenciālu var noteikt, pamatojoties uz esošo informāciju, papildus testēšana nav jāveic. Ja, pamatojoties uz esošo informāciju, testējamās vielas kairinājuma izraisīšanas potenciālu nevar noteikt, veic pakāpenisku secīgu testēšanas procedūru ar dzīvniekiem, līdz var viennozīmīgi pieņemt lēmumu par klasifikāciju.
Validēta testēšanas metode : testēšanas metode, kurai ir veikti validācijas pētījumi, lai noteiktu metodes piemērotību noteiktam nolūkam (tostarp pareizību) un ticamību. Jāievēro, ka validētas testēšanas metodes veiktspēja pareizības un ticamības ziņā var nebūt pietiekama, lai to izmantotu paredzētajam nolūkam.
Pierādījumu vērtēšana : process, kurā tiek apsvērtas dažādu datu priekšrocības un trūkumi, lai pieņemtu un pamatotu secinājumu par vielas potenciālo bīstamību.
2. papildinājums
ICE TESTĒŠANAS METODES STANDARTVIELAS
Pirms šai testēšanas metodikai atbilstīgas testēšanas metodes regulāras izmantošanas laboratorijas var uzskatāmi apliecināt savu tehnisko prasmi, pareizi nosakot klasifikāciju 1. tabulā ieteiktajām 10 vielām, kas izraisa nopietnus acu bojājumus. Šīs vielas ir izraudzītas, lai raksturotu acu vietēju bojājumu/kairinājuma izraisīšanas diapazonu, kura pamatā ir in vivo truša acu testa rezultāti (TG 405) (t. i., 1., 2.A, 2.B kategorija, vai netiek klasificēta un marķēta saskaņā ar ANO GHS (3) (7). Taču, ņemot vērā šo testu validēto noderīgumu (t. i., tikai nopietnus acu bojājumus / acu kairinājumu izraisītāju vielu identificēšanai), prasmes aplicināšanai var iegūt tikai divus klasificējamus testa rezultātus (nopietnus acu bojājumus vai nopietnu kairinājumu izraisītāja viela, vai acu bojājumus / acs kairinājumu neizraisoša viela). Citi izvēles kritēriji ir vielu pieejamība tirgū, lai būtu pieejami ļoti kvalitatīvi in vivo atsauces dati un lai būtu pieejami ļoti kvalitatīvi dati par divām in vitro metodēm, kurām tiek izstrādāti testēšanas norādījumi. Šī iemesla dēļ tika izraudzītas nopietnus acu bojājumus izraisītājas vielas no ICCVAM ieteiktā 122 standartvielu saraksta in vitro acīm toksisko īpašību noteikšanas testa metožu validēšanai (sk. H papildinājumu. ICCVAM ieteiktās atsauces vielas (4). Atsauces dati ir pieejami ICCVAM papildinformācijas pārskata dokumentos par liellopu radzenes duļķošanās un caurlaidības (BCOP) un ICE testēšanas metodi (18) (19).
1. tabula
Ieteicamās vielas ICE metodes izpildes tehniskā prasmīguma pierādīšanai
|
Ķimikālija |
CAS Nr. |
Ķīmiskā klase (1) |
Agregātstāvoklis |
In vivo klasifikācija (2) |
In vitro klasifikācija (3) |
|
Benzalkonija hlorīds (5 %) |
8001-54-5 |
Onija savienojums |
Šķidrums |
1. kategorija |
Izraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Hlorheksidīns |
55-56-1 |
Amīns, amidīns |
Cietviela |
1. kategorija |
Izraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Dibenzoil-L-vīnskābe |
2743-38-6 |
Karbonskābes esteris |
Cietviela |
1. kategorija |
Izraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Imidazols |
288-32-4 |
Heterociklisks savienojums |
Cietviela |
1. kategorija |
Izraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Trihloretiķskābe (30 %) |
76-03-9 |
Karbonskābe |
Šķidrums |
1. kategorija |
Izraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
2,6-Dihlorbenzoil hlorīds |
4659-45-4 |
Acilhalogenīds |
Šķidrums |
2.A kategorija |
Neizraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Etil-2-metilaceto-acetāts |
609-14-3 |
Ketonesteris |
Šķidrums |
2.B kategorija |
Neizraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Amonija nitrāts |
6484-52-2 |
Neorganiskais sāls |
Cieta viela |
2.A kategorija |
Neizraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
Glicerīns |
56-81-5 |
Spirts |
Šķidrums |
Netiek marķēta |
Neizraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
n-heksāns |
110-54-3 |
Ogļūdeņradis (acikliskais) |
Šķidrums |
Netiek marķēta |
Neizraisa nopietnus acu bojājumus/nopietnu acu kairinājumu |
|
(1) Ķīmiskās klases katrai testējamai vielai piešķirtas, izmantojot standarta klasifikācijas shēmu, kuras pamatā ir National Library of Medicine Medical Subject Headings (MeSH) klasifikācijas sistēma (pieejama http://www.nlm.nih.gov/mesh). (2) Pamatojoties uz in vivo truša acu testa rezultātiem (ESAO TG 405) un izmantojot ANO GHS sistēmu (3)(7). (3) Pamatojoties uz BCOP un ICE testēšanas metožu rezultātiem. Saīsinājumi: CAS Nr. = Ķīmijas analītisko apskatu indeksa reģistra numurs |
|||||
3. papildinājums
ICE mitrināšanas aparāta un acu skavu shēmas
(Mitrināšanas aparāta un acs turētāja skavas pilnīgāku aprakstu sk. Burton et al. (17))

B.49. IN VITRO ZĪDĪTĀJU ŠŪNU MIKROKODOLU TESTS
IEVADS
1. In vitro mikrokodolu (MNvit) noteikšana ir genotoksicitātes tests mikrokodolu (MN) noteikšanai starpfāzu šūnu citoplazmā. Mikrokodoli var būt no acentriskiem hromosomu fragmentiem (t. i., tādiem, kuriem nav centromēra) vai no veselām hromosomām, kuras šūnu dalīšanās anafāzē nespēj atvirzīties uz šūnas poliem. Noteikšanā reģistrē klastogēno un aneigēno ķīmisko vielu (substanču un maisījumu) (1) (2) aktivitāti šūnās, kurās testējamās vielas iedarbības laikā vai pēc tās ir notikusi šūnu dalīšanās. Šī testēšanas metode (TM) ļauj izmantot testēšanas protokolu ar aktīna polimerizācijas inhibitoru citotalazīnu B (cytoB) vai bez tā. CytoB pievienošana pirms mērķmitozes ļauj identificēt un selektīvi analizēt mikrokodolu sastopamību šūnās, kurās noslēdzies viens mitozes cikls (jo šādās šūnās ir divi kodoli) (3) (4). Turklāt, ja ir pierādījumi tam, ka analizējamā šūnu populācijā ir notikusi mitoze, šī TM ļauj izmantot testēšanas protokolus, kuri neparedz citokinēzes bloķēšanu.
2. Papildus MNvit noteikšanas izmantojumam mikrokodolus inducējošu ķīmisku vielu (substanču un maisījumu) identificēšanai ir vēl citi noderīgi paņēmieni, kā iegūt informāciju par hromosomu bojājumu mehānismiem un mikrokodolu veidošanos, piemēram, citokinēzes bloķēšana, kinetohoru imūnķīmiskā iezīmēšana vai hibridizēšana ar centromēru/telomēru zondēm (fluorescenta in situ hibridizēšana, FISH) (5) (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16). Iezīmēšanas un hibridizēšanas procedūras var izmantot, ja pastiprinās mikrokodolu veidošanās un pētnieks vēlas noskaidrot, vai šā pastiprinājuma izraisītāja iedaba ir klastogēna un/vai aneigēna.
3. Mikrokodoli reprezentē meitasšūnām nodotos bojājumus, bet metafāzes šūnās uzskaitītās hromosomu aberācijas tālāk nodotas netiek. Tā kā mikrokodolu novērtējums interfāzes šūnās var būt relatīvi objektīvs, laboratorijas personāla vienīgais uzdevums ir noteikt, vai šūnās ir notikusi dalīšanās un cik daudz ir šūnu, kas satur mikrokodolu. Rezultātā uzskaiti preparātos iespējams paveikt relatīvi ātri, un analīzi var automatizēt. Tāpēc ir praktiski iespējams vienā apstrādes reizē uzskaitīt tūkstošiem, nevis simtiem šūnu un tādā veidā palielināt noteikšanas nozīmību. Visbeidzot, tā kā mikrokodoli var izveidoties no salīpošām hromosomām, ar šo metodi potenciāli var detektēt aneiploīdiju ierosinošos aģentus, kurus ir sarežģīti pētīt ar parastajiem hromosomu aberācijas testiem (piemēram, ESAO 473. testēšanas vadlīnijas; šā pielikuma B.10. nodaļa) (17). Tomēr ar MNvit noteikšanu, ja neizmanto tādus īpašus paņēmienus kā 2. punktā aprakstītais FISH, nav iespējams diferencēt poliploīdiju un klastogenitāti inducējošas ķīmiskas vielas.
4. MNvit noteikšana ir in vitro metode, kurā parasti izmanto cilvēka vai grauzēju šūnu kultūras. Tā dod visaptverošu pamatu hromosomu bojājumu potenciāla izpētei in vitro, jo ļauj detektēt gan aneigēnus, gan klastogēnus.
5. MNvit noteikšana ir noturīga un efektīva dažādu tipu šūnās, ar cytoB vai bez tā. Bagātīgs datu klāsts apstiprina MNvit noteikšanas derīgumu dažādās grauzēju šūnu līnijās (CHO, V79, CHL/IU un L5178Y) un cilvēka limfocītos (18) (19) (20) (21) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31). Īpaši jāatzīmē starptautiskie validācijas pētījumi, kuru norisi koordinējusi Francijas Genotoksikoloģijas biedrība [Société Française de Toxicologie Génétique] (SFTG) (18) (19) (20) (21) (22), un Starptautiskā Genotoksikoloģijas darbsemināra materiāli (4) (16). Veicot retrospektīvu validācijas pētījumu, pieejamos datus turklāt pēc zinātnisko pierādījumu nozīmīguma principa atkārtoti izvērtējis Eiropas Komisijas izveidotais Eiropas Alternatīvo metožu validēšanas centrs (ECVAM), un ECVAM zinātniskā padomdevēja komiteja (ESAC) šo testēšanas metodi ir akceptējusi kā zinātniski derīgu (32) (33) (34). Aprakstīta arī cilvēka TK6 limfoblastoīdo šūnu līnijas (35) HepG2 šūnu (36) (37) un Sīrijas kāmja embrija primāro šūnu (38) izmantošana, taču par tām nav bijis validācijas pētījumu.
DEFINĪCIJAS
6. Definīcijas skatīt 1. papildinājumā.
SĀKOTNĒJI APSVĒRUMI
7. In vitro testos parasti jāizmanto metaboliskajai aktivācijai eksogēns avots, izņemot ja šūnas attiecībā uz testējamām vielām ir metaboliski kompetentas. Eksogēnā metaboliskās aktivācijas sistēma nav pilnībā identiska in vivo apstākļiem. Jāpievērš uzmanība tam, lai novērstu apstākļus, kuros iegūst šķietami pozitīvus rezultātus, kas neliecina par testējamai vielai piemītošu mutagenitāti, bet kuru cēlonis ir vērā ņemamas izmaiņas pH vai osmozē vai paaugstināta citotoksicitāte (39) (40) (41). Ja testējamā viela tās pievienošanas laikā izmaina barotnes pH, tas jākoriģē, ieteicams, ar buferšķīdumu, ko pievieno izejas standartšķīdumam, lai pH visos tilpumos, koncentrācijās un barotnēs būtu vienāds.
8. Mikrokodolu indukcijas analīzē izšķiroša nozīme ir tam, lai apstrādātajās un neapstrādātajās kultūrās būtu notikusi mitoze. Mikrokodolu uzskaitei labākais laiks ir tad, kad testējamās vielas pievienošanas laikā vai pēc tam šūnās ir noslēgusies viena mitoze.
METODES PRINCIPS
9. Uz cilvēka vai zīdītāju izcelsmes šūnu kultūrām iedarbojas ar testējamo vielu, izmantojot eksogēnu metaboliskās aktivācijas avotu un arī bez tā, izņemot ja lieto šūnas ar adekvātu metabolisko kapacitāti. Visos testos izmanto vienlaicīgas šķīdinātāja/nesēja kontroles (VC) un pozitīvās kontroles (PC) ķīmiskās vielas.
10. Uz šūnām iedarbojas ar testējamo vielu, un iedarbības laikā vai pēc tās šūnas kultivē pietiekami ilgu laiku, lai hromosomu vai vārpstiņas bojājumi izraisītu mikrokodolu veidošanos starpfāzu šūnās. Lai inducētu aneiploīdiju, parasti mitozei jānotiek testējamās vielas klātbūtnē. Savāktās un iekrāsotās starpfāzu šūnas analizē, lai tajās noteiktu mikrokodolu esību. Ideālā gadījumā mikrokodoli jāuzskaita tikai tajās šūnās, kurās mitoze noslēgusies testējamās vielas iedarbības laikā vai pēciedarbības periodā, ja tāds ir. Ar citokinēzes bloķētāju apstrādātās kultūrās uzskaita tikai divkodolu šūnas. Ja citokinēzes bloķētājs nav lietots, ir svarīgi parādīt, ka analizētajās šūnās, visticamāk, ir notikusi šūnu dalīšanās testējamās vielas iedarbības laikā vai pēc tās. Attiecībā uz visiem protokoliem ir svarīgi parādīt, ka šūnu savairošanās ir notikusi gan kontroles, gan apstrādātajā kultūrā; kultūrās, kurās uzskaita mikrokodolus (vai paralēlajās kultūrās), jānovērtē testējamās vielas inducētās citotoksicitātes vai citostāzes pakāpe.
METODES APRAKSTS
Preparāti
11. Var izmantot kultivētus primāros cilvēka perifēro asinsvadu limfocītus (5) (19) (42) (43) un vairākas grauzēju šūnu līnijas, piemēram, CHO, V79, CHL/IU, un L5178Y šūnas (18) (19) (20) (21) (22) (25) (26) (27) (28) (30). Ja izmanto citas šūnu līnijas un tipus, tas jāpamato ar uzskatāmi parādītu veiktspēju, kā aprakstīts iedaļā par pieņemamības kritērijiem. Mikrokodolu sastopamības biežums ietekmēs testa jutību, un tāpēc ieteicams izmantot šūnu tipus ar zemiem, stabiliem mikrokodolu veidošanās biežuma rādītājiem.
12. Cilvēka perifēro asinsvadu limfocīti jāiegūst no jauniem cilvēkiem (aptuveni 18–35 gadus veciem), kas ir veselīgi, nesmēķētāji un nav nesen bijuši saskarē ar genotoksisku ķīmisku vielu vai starojumu. Ja izmanto šūnas no vairāk nekā viena donora, jānorāda donoru skaits. Mikrokodolu sastopamības biežums palielinās līdz ar vecumu, un šī tendence ir izteiktāka sievietēm nekā vīriešiem (44); tas jāņem vērā, izvēloties grupējamās donoru šūnas.
Barotne un kultivēšanas apstākļi
13. Kultūru uzturēšanai lieto piemērotas barotnes un ievēro atbilstošus kultivēšanas apstākļus (trauki kultūrām, CO2 koncentrācija, temperatūra un mitrums). Stabilām šūnu līnijām un celmiem regulāri jāpārbauda modālo hromosomu skaita stabilitāte un mikoplazmas neesība, un tos nedrīkst izmantot, ja konstatē mikoplazmu vai ja modālo hromosomu skaits ir mainījies. Jāzina, kāds ir normālais šūnas cikla laiks kultivēšanas apstākļos, ko izmanto testēšanas laboratorijā. Ja izmanto citokinēzes bloķēšanas paņēmienu, citokinēzes inhibitora koncentrācija jāoptimizē konkrētajam šūnu tipam un jāizraugās tāda, par kuru zināms, ka uzskaites vajadzībām tā dod labu divkodolu šūnu iznākumu.
Šūnu kultūru sagatavošana
14. Stabilas šūnu līnijas un celmi: šūnas pavairo no pamatkultūrām, izsēj barotnē tādā blīvumā, lai kultūras nesaplūstu monoslānī un lai suspensiju kultūras nesasniegtu pārmērīgu blīvumu pirms šūnu savākšanas, un inkubē 37 °C temperatūrā.
15. Limfocīti: pilnu asins sastāvu, kas apstrādāts ar antikoagulantu (piemēram, heparīnu), vai tikai limfocītus kultivē, klātesot mitogēnam, piemēram, fitohemaglutinīnam (PHA), un tad uz to iedarbojas ar testējamo vielu un ar cytoB.
Metaboliskā aktivācija
16. Ja izmanto šūnas ar nepietiekamu endogēno metabolisko kapacitāti, jālieto eksogēnas metabolizējošās sistēmas. Plašāk izmantojamā aktivācijas sistēma ir ar kofaktoru papildināta pēcmitohondriskā frakcija (S9), ko pagatavo no grauzēju aknām, kas apstrādātas ar enzīmstimulējošām vielām, piemēram, Aroclor 1254 (45) (46) vai fenobarbitona un β-naftoflavona maisījumu (46) (47) (48) (49). Pēdējā minētā kombinācija nav pretrunā ar Stokholmas Konvenciju par noturīgiem organiskajiem piesārņotājiem (50) un Regulu (EK) Nr. 850/2004 par noturīgiem organiskajiem piesārņotājiem (66) un jauktas funkcijas oksidāžu inducēšanā izrādījusies tikpat efektīva kā Aroclor 1254 (46) (47) (48) (49). S9 frakciju parasti izmanto koncentrācijā 1–10 % (tilp./tilp.) galīgajā testa barotnē. Metaboliskās aktivācijas sistēmas stāvoklis var būt atkarīgs no testējamo ķīmisko vielu klases, un dažos gadījumos var būt lietderīgi izmantot vairāk nekā vienu S9 koncentrāciju.
17. Ar gēnu inženierijas metodēm iegūtas šūnu līnijas, kas izteic specifiskos cilvēka vai grauzēju enzīmus, var atbrīvot no vajadzības pēc eksogēnas metaboliskās aktivācijas sistēmas, un tās var izmantot kā testa šūnas. Šādos gadījumos izmantojamo šūnu līniju izvēlei jābūt zinātniski pamatotai, piemēram, ar jauktas funkcijas oksidāžu atbilstību testējamās vielas metabolismam (51) un ar to reaģētspēju uz zināmiem klastogēniem un aneigēniem (skatīt daļu par pieņemamības kritērijiem). Jāatzīst, ka testējamo vielu nedrīkst metabolizēt ar izteiktām jauktas funkcijas oksidāzēm; šajā gadījumā negatīvs rezultāts neliecina, ka testējamā viela nespēj inducēt mikrokodolus.
Testējamās vielas sagatavošana
18. Cietas ķīmiskās vielas jāizšķīdina atbilstošos šķīdinātājos vai nesējos un, ja vajadzīgs, pirms šūnu apstrādes jāatšķaida. Šķidras ķīmiskās vielas var tieši pievienot testēšanas sistēmā un/vai pirms šūnu apstrādes atšķaidīt. Gāzes vai gaistošas vielas jātestē ar attiecīgām standarta protokolu modifikācijām, piemēram, apstrādi veicot hermētiski noslēgtā traukā (52) (53). Ja dati par testējamo vielu preparātu stabilitāti liecina, ka tos uzglabāt nevar, izmanto svaigi pagatavotus preparātus.
Testēšanas apstākļi
Šķīdinātāji/nesēji
19. Šķīdinātājs vai nesējs nedrīkst reaģēt ar testējamo vielu vai nebūt saderīgs ar šūnu dzīvotspēju vai ar S9 aktivitātes uzturēšanu izmantotajās koncentrācijās. Ja nelieto labi zināmu šķīdinātāju/nesēju (piemēram, ūdeni, šūnu kultūras barotni, dimetilsulfoksīdu), lietojums jāpamato ar datiem par tā saderību ar testējamo vielu un to, ka izmantotais šķīdinātājs/nesējs nav genotoksisks. Vienmēr, kad tas iespējams, vispirms ieteicams izmantot ūdeni saturošus šķīdinātājus vai nesējus.
CytoB kā citokinēzes bloķētājs
20. Viens no svarīgākajiem apsvērumiem MNvit metodes veiktspējas nodrošināšanā ir tāds, ka uzskaitītajām šūnām apstrādes laikā vai pēcapstrādes inkubēšanas laikā (ja tāds ir) ir jābūt pabeigušām mitozi. CytoB ir aģents, ko ļoti plaši izmanto kā citokinēzes bloķētāju, jo tas inhibē aktīna veidošanos un tādējādi neļauj meitasšūnām atdalīties pēc mitozes; rezultātā rodas divkodolu šūnas (5) (54), (55). Mikrokodolu uzskaiti tāpēc var veikt tikai tajās šūnās, kurās apstrādes laikā vai pēc tās ir beigusies mitoze. Vienlaikus var izmērīt testējamās vielas ietekmi uz šūnu savairošanās kinētiku. CytoB ieteicams izmantot kā citokinēzes bloķētāju cilvēka limfocītos, jo šūnu cikla ilgumi dažādās kultūrās un dažādiem donoriem atšķirsies un ne visi limfocīti reaģē uz PHA. Šūnu līniju testēšanā, lai noteiktu, vai uzskaites šūnas ir sadalījušās, izmanto citas metodes; tās ir apskatītas turpmāk (skatīt 26. punktu).
21. Laboratorijai jānosaka atbilstoša cytoB koncentrācija katram šūnu tipam, lai sasniegtu optimālu divkodolu šūnu sastopamību šķīdinātāja/nesēja kontroles kultūrās. Atbilstošas koncentrācijas cytoB parasti ir starp 3 un 6 μg/ml.
Šūnu savairošanās un citotoksicitātes mērīšana un iedarbības koncentrācijas izvēle
22. Nosakot augstāko testējamās vielas koncentrāciju, kas jātestē, neizvēlas koncentrācijas, kas spēj radīt šķietami pozitīvas atbildes reakcijas, piemēram, tādas koncentrācijas, kas izraisa pārmērīgu citotoksicitāti, nogulsnes barotnē vai manāmi izmaina pH vai osmozi (39) (40) (41).
23. Mēra šūnu savairošanos, lai nodrošinātu, ka apstrādātajās šūnās testēšanas laikā ir beigusies mitoze un ka apstrāde tiek veikta attiecīgā citotoksicitātes līmenī (skatīt 29. punktu). Citotoksicitāti ar metabolisma aktivāciju un bez tās nosaka šūnās, kam vajadzīga metaboliskā aktivācija, izmantojot šūnu skaita relatīvo pieaugumu (RICC) vai populācijas relatīvo divkāršošanos (RPD) (formulas skatīt 2. papildinājumā), ja vien neizmanto cytoB. Ja izmanto cytoB, citotoksicitāti var noteikt, izmantojot replicēšanās indeksu (RI) (formulas skatīt 2. papildinājumā).
24. Kultūru apstrāde ar cytoB un vienkodola, divkodolu un daudzkodolu šūnu relatīvā sastopamības biežuma noteikšana kultūrā ir laba metode, kā kvantitatīvi izteikt ietekmi uz šūnu savairošanos un apstrādes citotoksisko vai citostatisko darbību (5), un nodrošina, ka uzskaitītas tiek tikai šūnas, kas apstrādes laikā vai pēc tās ir dalījušās.
25. Pētījumos ar cytoB citostāzi/citotoksicitāti var kvantitatīvi izteikt ar savairošanās indeksu pēc citokinēzes blokādes (CBPI) (5) (26) (56) vai tās var iegūt no RI, kas raksturo vismaz 500 šūnas vienā kultūrā (formulas skatīt 2. papildinājumā). Ja cytoB izmanto, lai novērtētu šūnu savairošanās pakāpi, CBPI vai RI jānosaka vismaz 500 šūnām vienā kultūrā. Šos mērījumus, cita starpā, var izmantot, lai noteiktu citotoksicitāti, salīdzinot vērtības apstrādātajās un kontroles kultūrās. Noderīgu informāciju var dot citu citotoksicitātes marķieru (piemēram, šūnu saplūšanas, šūnu skaita, apoptozes, nekrozes, metafāzes uzskaites) novērtēšana.
26. Pētījumos bez cytoB ir uzskatāmi jāparāda, ka kultūrā uzskaitītās šūnas ir beigušas dalīties apstrādes laikā vai pēc apstrādes ar testējamo vielu, citādi var iegūt šķietami negatīvu rezultātu. Metodes, kas izmantotas, lai nodrošinātu, ka uzskaitītas tiek dalīšanos beigušās šūnas, paredz iekļaut un pēc tam detektēt bromdeoksiuridīnu (BRDU), lai identificētu replicējušās šūnas (57), klonu veidošanos, kad šūnas no pastāvīgās šūnu līnijas apstrādā un uzskaita in situ uz mikroskopa priekšmetstikliņa (savairošanās indekss (PI)) (25) (26) (27) (28), vai arī populācijas relatīvās divkāršošanās (RPD) vai šūnu skaita relatīvā pieauguma (RICC) noteikšanu vai citas pārbaudītas metodes (16) (56) (58) (59) (formulas skatīt 2. papildinājumā). Noderīgu informāciju var dot citu citotoksicitātes vai citostāzes marķieru (piemēram, šūnu saplūšanas, šūnu skaita, apoptozes, nekrozes, metafāzes uzskaites) novērtēšana.
27. Jāizvērtē vismaz trīs analizējamas testējamās koncentrācijas. Lai to panāktu, var būt nepieciešams veikt eksperimentu, izmantojot lielāku skaitu savstarpēji tuvu esošu koncentrāciju un analizēt mikrokodolu veidošanos tādās koncentrācijās, kas nodrošina piemērotu citotoksicitāšu diapazonu. Alternatīva stratēģija ir veikt iepriekšēju citotoksicitātes testēšanu, lai galīgajā testā vajadzētu pētīt mazāku skaitu koncentrāciju.
28. Augstākajai koncentrācijai jārada 55 ± 5 % citotoksicitāte. Augstākās koncentrācijās kā sekundāra citotoksicitātes ietekme var rasties hromosomu bojājumi (60). Ja konstatē citotoksicitāti, izraudzītajām testējamām koncentrācijām jābūt diapazonā no koncentrācijas, kas rada 55 ± 5 % citotoksicitāti, līdz koncentrācijai, kas rada nelielu citotoksicitāti vai to nerada nemaz.
29. Ja citotoksiskums vai nogulsnes nav novērotas, augstākajai testējamai koncentrācijai jāatbilst 0,01 M, 5 mg/ml vai 5 μl/ml atkarībā no tā, kura ir mazākā. Analīzei atlasītajām koncentrācijām parasti jāatšķiras par ne vairāk kā 10 vienībām. Testējamām vielām, kam koncentrācijas–atbildes reakcijas līknes ir stāvas, var būt jātestē savstarpēji mazāk atšķirīgas koncentrācijas, lai uzskaiti varētu veikt arī kultūrās ar vidēju un zemu toksicitātes diapazonu.
30. Ja ierobežojošais faktors ir šķīdība, maksimālā koncentrācija (ja to neierobežo citotoksicitāte) ir zemākā koncentrācija, kurā kultūrās ir saredzamas minimālas nogulsnes, ar nosacījumu, ka tas netraucē uzskaitei. Nogulsnes jāvērtē ar tādām metodēm kā gaismas mikroskopija un kultivēšanas gaitā neizzūdošu vai (līdz apstrādes beigām) parādošos nogulšņu konstatēšana.
Kontroles
31. Katrā eksperimentā jāiekļauj vienlaicīgas pozitīvās un šķīdinātāja/nesēja kontroles, ar metabolisma aktivāciju vai bez tās.
32. PC ir vajadzīga, lai pierādītu izmantoto šūnu spēju un testa protokola derīgumu klastogēnu un aneigēnu identificēšanai un apliecinātu S9 preparāta metabolisko kapacitāti. Ar PC būtu jāizmanto zināmi mikrokodolu veidošanās inducētāji tādās koncentrācijās, kurās sagaidāms neliels, bet reproducējams palielinājums salīdzinājumā ar fona līmeni, un tiek uzskatāmi parādīta testēšanas sistēmas jutība. PC vielu koncentrācijas izvēlas tā, lai to iedarbība būtu skaidri redzama, tomēr lai kodēto priekšmetstikliņu identitāti to nolasītājs nevarētu konstatēt uzreiz.
33. Lai uzskatāmi parādītu testēšanas sistēmas metabolisko kompetenci un spēju detektēt klastogēnus, jāizmanto klastogēns, kuram vajadzīga metabolisma aktivācija (piemēram, ciklofosfamīds vai benz[a]pirēns). Ja tas ir pamatoti, var lietot citas PC. Dažas PC, kam vajadzīga metabolisma aktivācija, noteiktos apstrādes apstākļos vai noteiktās šūnu līnijās var būt aktīvas bez eksogēnas metabolisma aktivācijas, un tāpēc izraudzītajā šūnu līnijā un izraudzītajās koncentrācijās jātestē vajadzība pēc metaboliskās aktivācijas un S9 preparāta aktivitāte.
34. Patlaban nav zināms neviens aneigēns, kam vajadzīga metaboliska aktivācija, lai tas kļūtu genotoksiski aktīvs (16). Aneigēnās aktivitātes jomā patlaban pieņemtās PC ir, piemēram, kolhicīns un vinblastīns. Var izmantot citas ķīmiskas vielas, ja tās inducē mikrokodolu veidošanos vienīgi vai galvenokārt aneigēnas aktivitātes rezultātā. Lai novērstu vajadzību pēc divām PC (klastogenicitātei un aneigenicitātei) bez metaboliskās aktivācijas, aneigenicitātes kontroli var izmantot par PC bez S9 un klastogenicitātes kontroli var lietot, lai testētu izmantotās metabolisma aktivācijas sistēmas piemērotību. Klastogenicitātes un aneigenicitātes PC jāizmanto šūnās, kurām nav vajadzīga S9. Ieteicamās PC norādītas 3. papildinājumā.
35. Ja ir pieejamas piemērotas ķīmiskās vielas, var apsvērt ar ķīmiskās vielas klasi saistītas PC izmantošanu. Visām izmantotajām PC jābūt piemērotām attiecīgajam šūnu tipam un aktivācijas apstākļiem.
36. Visās šūnu savākšanas reizēs jāparedz šķīdinātāja/nesēja kontroles izmantošana. Turklāt jāizmanto arī neapstrādāta NC (bez šķīdinātāja/nesēja), ja vien nav publicētu vai laboratorijā pieejamu vēsturisko kontroles datu, kas uzskatāmi parāda, ka izraudzītajam šķīdinātājam šādā koncentrācijā nav genotoksiskas vai citas kaitīgas iedarbības.
TESTA PROCEDŪRA
Apstrādes kārtība
37. Lai palielinātu varbūtību, ka aneigēns vai klastogēns tiek detektēts brīdī, kad tas ir aktīvs kādā konkrētā šūnas cikla posmā, ir svarīgi ar testējamo vielu apstrādāt pietiekamu skaitu šūnu visos to šūnas cikla posmos. Tādēļ šūnu līniju un primāro šūnu kultūru apstrādes kārtība var nedaudz atšķirties no limfocītu apstrādes, kam vajadzīga mitogēnā stimulācija, lai sāktos šūnas cikls; tas apskatīts 41.–43. punktā (16).
38. Teorētiski apsvērumi, kā arī publicētie dati (18), rāda, ka lielākā daļa aneigēnu un klastogēnu tiks detektēti īsā 3–6 stundu apstrādes periodā ar S9 vai bez tā, un turpinājumā sekos testējamās vielas noņemšana un augšanas periods 1,5–2,0 šūnas ciklu garumā (6). Šūnu paraugus ņem pēc laika perioda, kas atbilst aptuveni 1,5–2,0 parastajiem (t. i., neapstrādātu šūnu) šūnas cikliem, apstrādes sākumā vai beigās (skatīt 1. tabulu). Paraugu ņemšanas vai atveseļošanās laiku var pagarināt, ja ir zināms vai domājams, ka testējamā viela ietekmē šūnas cikla ilgumu (piemēram, ja testē nukleozīdu analogus).
39. Ņemot vērā S9 preparātu potenciālo citotoksicitāti kultivētās zīdītāju šūnās, apstrādi ar paildzinātu iedarbību 1,5–2,0 normālos šūnas ciklos veic tikai bez S9. Paildzinātā apstrādē ir iespējas šūnu apstrādi ar testējamo vielu veikt cytoB klātbūtnē vai bez tās. Šīs iespējas attiecas uz situācijām, kurās var būt bažas par iespējamo mijiedarbību starp testējamo vielu un cytoB.
40. Ierosinātā šūnu apstrādes kārtība ir parādīta 1. tabulā. Šo vispārīgo apstrādes kārtību var modificēt atkarībā no testējamās vielas stabilitātes vai reaģētspējas vai no konkrētām izmantoto šūnu augšanas īpatnībām. Visos variantos apstrādei jāsākas un jābeidzas, kad šūnu augšana ir eksponenciāla. Apstrādes kārtība sīkāk izklāstīta 41.–47. punktā.
1. tabula
Šūnu apstrādes un savākšanas laiks MNvit noteikšanā
|
Limfocīti, primārās šūnas un šūnu līnijas ar cytoB |
+ S9 |
3–6 stundas apstrādā S9 klātbūtnē; aizvāc S9 un apstrādes barotni; pievieno jaunu barotni un cytoB; šūnas savāc pēc 1,5–2,0 normāliem šūnas cikliem. |
|
– S9 Īslaicīga iedarbība |
Apstrādā 3–6 stundas; aizvāc apstrādes barotni; pievieno jaunu barotni un cytoB; šūnas savāc pēc 1,5–2,0 normāliem šūnas cikliem. |
|
|
– S9 Ilgstoša iedarbība |
A variants. 1,5–2 normālu šūnas ciklu laikā apstrādā cytoB klātbūtnē; savāc iedarbības laika beigās. B variants. apstrādā 1,5–2 normālu šūnas ciklu laikā; aizvāc testējamo vielu; pievieno jaunu barotni un cytoB; šūnas savāc pēc 1,5–2,0 normāliem šūnas cikliem. |
|
|
Šūnu līnijas bez cytoB (Apstrāde identiska iepriekš aprakstītajai, taču bez cytoB pievienošanas.) |
||
Limfocīti, primārās šūnas un šūnu līnijas ar cytoB
41. Limfocītiem visefektīvākā pieeja ir sākt testējamās vielas iedarbību 44–48 stundas pēc stimulēšanas ar PHA, kad cikla sinhronizācija būs zudusi (5). Sākotnējā noteikšanā šūnas 3–6 stundas apstrādā ar testējamo vielu S9 klātbūtnē vai bez tās. Apstrādes barotni aizvāc un aizstāj ar svaigu barotni, kas satur cytoB, un pēc 1,5–2,0 normāliem šūnas cikliem šūnas savāc.
42. Ja abās sākotnējās noteikšanās ar īslaicīgu (3–6 stundu) apstrādi rezultāts ir negatīvs vai neskaidrs, nākamo apstrādi veic ar ilgstošāku iedarbību bez S9. Pieejami divi vienlīdz pieņemami apstrādes varianti. Tomēr iespējams, A variants ir labāks stimulētiem limfocītiem, jo eksponenciālā augšana 96 stundas pēc stimulēšanas sākuma var mazināties. Turklāt B variantā līdz galīgajam paraugu ņemšanas laikam šūnu kultūras nebūtu saplūdušas.
— A variants. Šūnas apstrādā ar testējamo vielu 1,5–2,0 normālu šūnas ciklu laikā un apstrādes laika beigās šūnas savāc.
— B variants. Šūnas apstrādā ar testējamo vielu 1,5–2,0 normālu šūnas ciklu laikā. Apstrādes barotni aizvāc un aizstāj ar svaigu barotni, un šūnas savāc pēc tam, kad beigušies vēl 1,5–2,0 normāli šūnas cikli.
43. Primārās šūnas un šūnu līnijas jāapstrādā līdzīgi kā limfocītus, izņemot to, ka nav nepieciešams tos 44–48 stundas stimulēt ar PHA. Uz šūnām, kas nav limfocīti, iedarbojas tā, ka pētījuma beigās šūnas joprojām atrodas logaritmiskajā augšanas posmā.
Šūnu līnijas bez cytoB
44. Šūnas 3–6 stundas apstrādā S9 klātbūtnē vai bez tās. Apstrādes barotni aizvāc un aizstāj ar svaigu barotni, un pēc 1,5–2,0 normāliem šūnas cikliem šūnas savāc.
45. Ja abās sākotnējās noteikšanās ar īslaicīgu (3–6 stundu) apstrādi rezultāts ir negatīvs vai neskaidrs, nākamo apstrādi veic ar ilgstošāku iedarbību. Pieejami divi vienlīdz pieņemami apstrādes varianti.
— A variants. Šūnas apstrādā ar testējamo vielu 1,5–2,0 normālu šūnas ciklu laikā un apstrādes laika beigās šūnas savāc.
— B variants. Šūnas apstrādā ar testējamo vielu 1,5–2,0 normālu šūnas ciklu laikā. Apstrādes barotni aizvāc un aizstāj ar svaigu barotni, un šūnas savāc pēc tam, kad beigušies vēl 1,5–2,0 normāli šūnas cikli.
46. Monoslāņa kultūrās 3–6 stundu apstrādes beigās vēl var būt mitotiskās šūnas (identificējamas kā apaļas un tādas, kas atdalās no virsmas). Tā kā mitotiskās šūnas viegli atdalās, tās var tikt aizvāktas kopā ar testējamo vielu saturošo barotni. Šīs šūnas jāsavāc, kad kultūras mazgā, un jāievieto atpakaļ kultūrā, lai šūnu savākšanas laikā nebūtu mitotiski dalošos šūnu un mikrokodolu zuduma.
Šūnu kultūru skaits
47. Dublikātu kultūras jāizmanto katrai testējamās vielas koncentrācijai un nesēja/šķīdinātāja un NC kultūrām. Ja dublikātu kultūru variācija ir minimāla, ko pierāda ar vēsturiskiem laboratorijas datiem, ir pieņemami izmantot tikai vienu kultūru. Ja izmanto tikai vienu kultūru, ieteicams analizēt lielāku koncentrāciju skaitu.
Šūnu savākšana un priekšmetstikliņu sagatavošana
48. Šūnas no katras kultūras savāc un apstrādā atsevišķi. Šūnu preparātu sagatavošana var ietvert hipotonisku apstrādi, bet tā nav nepieciešama, ja atbilstošu šūnu izklājumu panāk citā veidā. Var izmantot dažādus priekšmetstikliņu sagatavošanas paņēmienus, ja vien uzskaites vajadzībām tiek iegūti augstas kvalitātes šūnu preparāti. Šūnu citoplazma jāsaglabā, lai detektētu mikrokodolus un (ar citokinēzes bloķēšanas metodi) ticami identificētu divkodolu šūnas.
49. Priekšmetstikliņus iekrāsot var ar dažādām metodēm, piemēram, Giemsa vai luminiscences DNS specifiskām krāsvielām (59). Lietojot DNS specifisku krāsvielu (piemēram, akridīnoranžo (61) vai Hoechst 33258 ar pironīnu-Y (62)), iespējams izvairīties no daļas artefaktu, kas saistīti ar DNS nespecifisku krāsvielu izmantošanu. Antikinetohoru antivielas, FISH ar pancentromēriskām DNS zondēm vai in situ iezīmēšanu ar pancentromēriem specifiskām gruntskrāsām, kā arī atbilstošu DNS iekrāsošanu, var izmantot, lai identificētu mikrokodolu saturu (hromosomas/hromosomu fragmentus), ja vajadzīga informācija par to veidošanās mehāniku (15) (16). Citas metodes un diferenciāciju starp klastogēniem un aneigēniem var izmantot tad, ja pagātnē tā ir izrādījusies efektīva.
Analīze
50. Visus priekšmetstikliņus, tostarp šķīdinātāja/nesēja un kontroles priekšmetstikliņus, pirms mikroskopiskās analīzes kodē. Alternatīvi, kodētus paraugus var analizēt, izmantojot validētas, automatizētas plūsmas citometriskā vai attēlu analīzes sistēmā.
51. Ar cytoB apstrādātās kultūrās mikrokodolu sastopamība jāanalizē vismaz 2 000 divkodolu šūnām vienā koncentrācijā (vismaz 1 000 divkodolu šūnās vienā kultūrā; divas kultūras vienā koncentrācijā). Ja izmanto tikai vienu kultūru, tajā jāuzskaita vismaz 2 000 divkodolu šūnu no katras koncentrācijas. Ja katrā koncentrācijā uzskaitei ir pieejamas ievērojami mazāk nekā 1 000 divkodolu šūnu katrā kultūrā vai 2 000 divkodolu šūnu, ja izmanto tikai vienu kultūru, un ja nav detektējams ievērojams mikrokodolu skaita pieaugums, testēšana jāatkārto ar lielāku daudzumu šūnu vai ar mazāk toksiskām koncentrācijām atkarībā no tā, kas ir piemērotāk. Jāraugās, lai neuzskaitītu divkodolu šūnas ar neregulāru formu vai tādas, kuru abi kodoli ir ļoti nevienādi; tāpat nevajag sajaukt divkodolu šūnas un nevienmērīgā izklājumā esošas daudzkodolu šūnas. Šūnās, kas satur vairāk nekā divus galvenos kodolus, mikrokodoli nav jāanalizē, jo šajās šūnās mikrokodolu vidējā izplatība var būt augstāka (63), (64). Vienkodola šūnu uzskaite ir pieņemama tad, ja ir pierādīts, ka testējamā vielas maina cytoB aktivitāti.
52. Ar cytoB neapstrādātās šūnu līnijās mikrokodoli jāuzskaita vismaz 2 000 šūnām vienā koncentrācijā (vismaz 1 000 šūnu vienā kultūrā; divas kultūras vienā koncentrācijā). Ja izmanto tikai vienu kultūru katrai koncentrācijai, no šīs kultūras jāuzskaita vismaz 2 000 šūnu.
53. Ja lieto cytoB, jānosaka CBPI vai RI, lai novērtētu šūnu savairošanos (skatīt 2. papildinājumu), izmantojot vismaz 500 šūnas katrā kultūrā. Ja apstrādi veic bez cytoB, ir būtiski sniegt uzskaitīto šūnu savairošanās pierādījumus, kā aprakstīts 24.–27. punktā.
Pieņemamības kritēriji
54. Laboratorijai, kas ierosina izmantot MNvit noteikšanu, kas aprakstīta šajā TM, jāpierāda tās spēja ticami un pareizi detektēt ķīmiskās vielas ar zināmu aneigēnu un klastogēnu aktivitāti, ar metabolisko aktivāciju un bez tās, kā arī detektēt zināmas, negatīvi reaģējošas ķīmiskās vielas, izmantojot references vielas, kas uzskaitītas 3. papildinājumā. Kā pierādījumu savai spējai pareizi veikt šo TM laboratorijai jāsniedz pierādījumi par to, ka šūnās, kurās uzskaita mikrokodolu veidošanos, ir beigusies viena kodolu dalīšanās, ja testēšanu veic bez cytoB.
55. Ieteicamās references vielas ir ķīmiskās vielas, kas uzskaitītas 3. papildinājumā. Šo sarakstu var papildināt un tajā iekļautās ķīmiskās vielas aizstāt ar citām, ja šo ķīmisko vielu aktivitāte ir zināma un ja mikrokodolus tās inducē ar vienādiem darbības mehānismiem, un ja ir pierādīts, ka tās ir piemērotas ķīmiskajām vielām, kuras tiks testētas, izmantojot MNvit procedūru. Pamatojums var būt validācijas pētījums, kurš aptver daudzas un dažādas vai arī tikai dažas vielas, kas izvēlētas, ņemot vērā testējamās vielas ķīmisko klasi vai bojājumu rašanās mehānismu, kuru pēta.
56. Šķīdinātāja/nesēja kontrolei un neapstrādātām kultūrām būtu jāuzrāda reproducējami zema un stabila mikrokodolu sastopamība (parasti 5–25 mikrokodoli uz 1 000 šūnām visiem šūnu tipiem, kas minēti 11. punktā). Citiem šūnu tipiem var būt dažādi reakciju diapazoni, kas jānosaka, kad tos validē izmantošanai MNvit noteikšanā. Vēsturiskos kontroles diapazonus veido no datiem par negatīvo kontroli, šķīdinātāju un PC. Šīs vērtības jāizmanto, lemjot par to, vai eksperimentā izmantot vienlaicīgu NC/PC.
57. Ja noteikšanas vajadzībām ierosinātas sīkas izmaiņas testēšanas protokolā (piemēram, automatizēta, nevis manuāla uzskaite; jauns šūnu tips), šo izmaiņu efektivitāte jāpierāda, pirms modificēto protokolu var uzskatīt par pieņemamu izmantošanai. Efektivitātes pierādīšana ietver demonstrēšanu, ka ir iespējams detektēt hromosomu pārrāvumu un papildinājumu vai zaudējumu galvenos mehānismus un ka var iegūt atbilstošu pozitīvu un negatīvu rezultātu attiecībā uz atsevišķās vielas klasi vai daudzām dažādām vielām, kuras paredzēts testēt.
DATI UN TESTĒŠANAS PĀRSKATS
Rezultātu apstrāde
58. Ja izmanto citokinēzes bloķēšanas paņēmienu, mikrokodolu indukcijas novērtēšanai izmanto tikai divkodolu šūnas ar mikrokodoliem (neatkarīgi no mikrokodolu skaita šūnā). Atsevišķi uzskaitot šūnas ar vienu, diviem vai vairākiem mikrokodoliem, var iegūt noderīgu informāciju, bet tā nav obligāta.
59. Jānosaka vienlaicīgie citotoksiskuma un/vai citostāzes pasākumi visām apstrādātajām kultūrām un šķīdinātāja/nesēja kontroles kultūrām (58). Jāaprēķina CBPI vai RI visām apstrādātajām un kontroles kultūrām, to izsakot kā šūnas cikla kavēšanās mērījumus gadījumā, ja izmanto citokinēzes bloķēšanas paņēmienu. Ja nav cytoB, izmanto RPD vai RICC, vai PI (skatīt 2. papildinājumu).
60. Norāda datus par atsevišķām kultūrām. Turklāt visus datus apkopo tabulas veidā.
61. Ķīmiskās vielas var inducēt mikrokodolu veidošanos MNvit tāpēc, ka tās inducē hromosomu pārrāvumu, hromosomu zaudējumu vai abus kopā. Var veikt papildu analīzi ar antikinetohoru antivielām vai centromēriem specifiskām in situ zondēm vai izmantot citas metodes, lai noteiktu, vai mikrokodolu inducēšanas mehānisms ir saistīts ar klastogēnu un/vai ar aneigēnu aktivitāti.
Rezultātu izvērtējums un interpretācija
62. Nav prasības veikt verifikāciju, papildus testējot izteikti pozitīvu vai negatīvu reakciju. Neskaidri rezultāti jāprecizē, analizējot vēl 1 000 šūnu no visām kultūrām, lai saglabātu aklā nolasījuma principu. Ja šī pieeja nedod rezultātu, testēšanu turpina. Turpmākajā testēšanā jāapsver pētījuma parametru modifikācija pēc vajadzības plašākā vai šaurākā diapazonā. Pētījuma parametri, kurus varētu modificēt, ir testējamo koncentrāciju atšķirības, apstrādes un šūnu savākšanas laiks un/vai metabolisma aktivācijas apstākļi.
63. Ir vairāki pozitīva rezultāta kritēriji, kā, piemēram, mikrokodolus saturošo šūnu skaita pieaugums atkarībā no koncentrācijas vai statistiski nozīmīgs pieaugums. Vispirms rezultātus izvērtē no bioloģiskā skatpunkta. Apsverot, vai novērotās vērtības ir vēsturiskā kontroles diapazona robežās vai ārpus tām, var iegūt pieturas punktus, lai novērtētu reakcijas bioloģisko nozīmīgumu. Kā palīglīdzekli izmēģinājumu rezultātu novērtēšanai var izmantot piemērotas statistikas metodes (65). Tomēr statistiskās testēšanas rezultāti jānovērtē attiecībā uz devas un reakcijas mijiedarbību. Jāņem vērā arī reproducējamība un vēsturiskie dati.
64. Lai gan lielākajā daļā eksperimentu iegūst nepārprotami pozitīvus vai negatīvus rezultātus, tomēr dažkārt pēc iegūtajiem datiem nevar skaidri spriest par testējamās vielas aktivitāti. Šīs neviennozīmīgās vai apšaubāmās reakcijas var rasties neatkarīgi no tā, cik reizes eksperimentu atkārto.
65. Pozitīvs MNvit noteikšanas rezultāts liecina, ka testējamās vielas inducē hromosomu pārrāvumu vai hromosomu zaudējumu kultivētās zīdītāju šūnās. Negatīvs rezultāts liecina, ka konkrētajos testēšanas apstākļos testējamā viela nerada hromosomu pārrāvumu un/vai papildinājumu vai zaudējumu kultivētās zīdītāju šūnās.
Testēšanas pārskats
66. Testēšanas pārskatā jāiekļauj vismaz šāda informācija, ja tā attiecas uz konkrēto noteikšanu.
Testējamā ķīmiskā viela:
— identifikācijas dati, CAS numurs un EK numurs,
— fizikālās īpašības un tīrības pakāpe,
— fizikāli ķīmiskās īpašības, kas attiecas uz testa veikšanu,
— testējamās ķīmiskās vielas reaģētspēja ar šķīdinātāju/nesēju vai šūnu kultūras barotni.
Šķīdinātājs/nesējs:
— šķīdinātāja/nesēja izvēles pamatojums,
— testējamās vielas šķīdība un stabilitāte šķīdinātājā/nesējā.
Šūnas:
— izmantoto šūnu tips un avots,
— izmantotā šūnu tipa piemērotība,
— mikoplazmas neesība (attiecīgā gadījumā),
— informācija par šūnu cikla ilgumu, šūnu skaita divkāršošanās laiks vai savairošanās indekss,
— ja izmanto limfocītus: asins donoru dzimums, vecums un skaits (attiecīgā gadījumā),
— ja izmanto limfocītus: vai iedarbojas uz pilnu asins sastāvu vai tikai uz atsevišķi izdalītiem limfocītiem,
— pārneses reižu skaits (attiecīgā gadījumā),
— šūnu kultūru uzturēšanas metodes (attiecīgā gadījumā),
— hromosomu modālais skaits,
— normālais šūnas cikla ilgums (negatīvā kontrole).
Testēšanas apstākļi:
— ja izmanto citokinēzes bloķētāju (piemēram, cytoB): vielas identitāte, koncentrācija un laika periods, kurā notiek iedarbība uz šūnām,
— vielas koncentrāciju un šūnu kultūru skaita izvēles pamatojums, piemēram, dati par citotoksiskajām īpašībām un šķīdības robežām, ja tie ir pieejami,
— barotnes sastāvs, CO2 koncentrācija (attiecīgā gadījumā),
— testējamās vielas koncentrācijas,
— pievienotā nesēja un testējamās vielas koncentrācija (un/vai tilpums),
— inkubācijas temperatūra un ilgums,
— apstrādes ar testējamo vielu ilgums,
— šūnu savākšanas ilgums pēc apstrādes,
— šūnu blīvums to izsējas laikā (attiecīgā gadījumā),
— metabolisma aktivācijas sistēmas veids un sastāvs, norādot pieņemamības kritērijus,
— pozitīvās kontroles ķīmiskā viela un negatīvā kontrole,
— priekšmetstikliņu sagatavošanas metodes un izmantotais šūnu iekrāsošanas paņēmiens,
— mikrokodolu identifikācijas kritēriji,
— analizēto šūnu skaits,
— citotoksicitātes mērīšanas metodes,
— ar citotoksicitāti saistīta papildu informācija,
— kritēriji, pēc kuriem novērtē, vai testēšanas rezultāts ir pozitīvs, negatīvs vai neskaidrs,
— izmantotā statistiskās analīzes metode vai metodes,
— metodes (piemēram, tādas kā kinetohoru antivielas izmantošana), lai noskaidrotu, vai mikrokodoli satur veselas vai fragmentētas hromosomas (attiecīgā gadījumā).
Rezultāti:
— citotoksicitātes mērīšanas veids, piemēram, CBPI vai RI, ja izmanto citokinēzes bloķēšanas paņēmienu; RICC, RPD vai PI, ja citokinēzes bloķēšanas paņēmienu neizmanto; citi novērojumi (attiecīgā gadījumā), piemēram, šūnu saplūšana, apoptoze, nekroze, metafāzu skaits, divkodolu šūnu sastopamības biežums,
— izgulsnēšanās pazīmes,
— dati par apstrādes barotnes pH un osmozi, ja tie noteikti,
— analīzei pieņemamu šūnu definīcija,
— vienkodola, divkodolu un daudzkodolu šūnu sastopamība, ja izmanto citokinēzes bloķēšanas metodi,
— katrai apstrādātajai un kontroles kultūrai atsevišķi norādīts to šūnu skaits, kurām ir mikrokodoli, un norādīts, vai mikrokodoli ir no divkodolu vai no vienkodola šūnām (attiecīgā gadījumā),
— ja iespējams, reakcijas uz koncentrāciju novērtējums,
— vienlaicīgas negatīvās (šķīdinātāja/nesēja) un pozitīvās kontroles ķīmiskie dati (koncentrācijas un šķīdinātāji),
— vēsturiskie negatīvās (šķīdinātāja/nesēja) un pozitīvās kontroles ķīmiskie dati, norādot diapazonus, vidējās vērtības un standartnovirzes un ticamības intervālu (piemēram, 95 %),
— statistiskā analīze; p-vērtības (attiecīgā gadījumā).
Rezultātu apspriešana
Secinājumi
IZMANTOTĀ LITERATŪRA
1) Kirsch-Volders, M. (1997), Towards a validation of the micronucleus test. Mutation Res., 392, 1-4.
2) Parry, J.M. and Sors, A. (1993), The detection and assessment of the aneugenic potential of environmental chemicals: the European Community aneuploidy project, Mutation Res., 287, 3-15.
3) Fenech, M. and Morley, A.A. (1985), Solutions to the kinetic problem in the micronucleus assay, Cytobios., 43, 233-246.
4) Kirsch-Volders, M., Sofuni, T., Aardema, M., Albertini, S., Eastmond, D., Fenech, M., Ishidate, M. Jr, Lorge, E., Norppa, H., Surralles, J., von der Hude, W. and Wakata, A. (2000), Report from the In Vitro Micronucleus Assay Working Group, Environ. Mol. Mutagen., 35, 167-172.
5) Fenech, M. (2007), Cytokinesis-block micronucleus cytome assay, Nature Protocols, 2(5), 1084-1104.
6) Fenech, M. and Morley, A.A. (1986), Cytokinesis-block micronucleus method in human lymphocytes: effect of in-vivo ageing and low dose X-irradiation, Mutation Res., 161, 193-198.
7) Eastmond, D.A. and Tucker, J.D. (1989), Identification of aneuploidy-inducing agents using cytokinesis-blocked human lymphocytes and an antikinetochore antibody, Environ. Mol. Mutagen., 13, 34-43.
8) Eastmond, D.A. and Pinkel, D. (1990), Detection of aneuploidy and aneuploidy-inducing agents in human lymphocytes using fluorescence in-situ hybridisation with chromosome-specific DNA probes, Mutation Res., 234, 9-20.
9) Miller, B.M., Zitzelsberger, H.F., Weier, H.U. and Adler, I.D. (1991), Classification of micronuclei in murine erythrocytes: immunofluorescent staining using CREST antibodies compared to in situ hybridization with biotinylated gamma satellite DNA, Mutagenesis, 6, 297-302.
10) Farooqi, Z., Darroudi, F. and Natarajan, A.T. (1993), The use of fluorescence in-situ hybridisation for the detection of aneugens in cytokinesis-blocked mouse splenocytes, Mutagenesis, 8, 329-334.
11) Migliore, L., Bocciardi, R., Macri, C. and Lo Jacono, F. (1993), Cytogenetic damage induced in human lymphocytes by four vanadium compounds and micronucleus analysis by fluorescence in situ hybridization with a centromeric probe, Mutation Res., 319, 205-213.
12) Norppa, H., Renzi, L. and Lindholm, C. (1993), Detection of whole chromosomes in micronuclei of cytokinesis-blocked human lymphocytes by antikinetochore staining and in situ hybridization, Mutagenesis, 8, 519-525.
13) Eastmond, D.A, Rupa, D.S. and Hasegawa, L.S. (1994), Detection of hyperdiploidy and chromosome breakage in interphase human lymphocytes following exposure to the benzene metabolite hydroquinone using multicolor fluorescence in situ hybridization with DNA probes, Mutation Res., 322, 9-20.
14) Marshall, R.R., Murphy, M., Kirkland, D.J. and Bentley, K.S. (1996), Fluorescence in situ hybridisation (FISH) with chromosome-specific centromeric probes: a sensitive method to detect aneuploidy, Mutation Res., 372, 233-245.
15) Zijno, P., Leopardi, F., Marcon, R. and Crebelli, R. (1996), Analysis of chromosome segregation by means of fluorescence in situ hybridization: application to cytokinesis-blocked human lymphocytes, Mutation Res., 372, 211-219.
16) Kirsch-Volders, M., Sofuni, T., Aardema, M., Albertini, S., Eastmond, D., Fenech, M., Ishidate Jr., M., Lorge, E., Norppa, H., Surrallés, J., von der Hude, W. and Wakata, A. (2003), Report from the in vitro micronucleus assay working group. Mutation Res., 540, 153-163.
17) OECD (1997), In Vitro Mammalian Chromosome Aberration Test, Test Guideline No. 473, OECD Guidelines for Testing of Chemicals, OECD, Paris. Available at: [www.oecd.org/env/testguidelines]
18) Lorge, E., Thybaud, V., Aardema, M.J., Oliver, J., Wakata, A., Lorenzon G. and Marzin, D. (2006), SFTG International collaborative Study on in vitro micronucleus test. I. General conditions and overall conclusions of the study, Mutation Res., 607, 13-36.
19) Clare, G., Lorenzon, G., Akhurst, L.C., Marzin, D., van Delft, J., Montero, R., Botta, A., Bertens, A., Cinelli, S., Thybaud, V. and Lorge, E. (2006), SFTG International collaborative study on the in vitro micronucleus test. II. Using human lymphocytes, Mutation Res., 607, 37-60.
20) Aardema, M.J., Snyder, R.D., Spicer, C., Divi, K., Morita, T., Mauthe, R.J., Gibson, D.P., Soelter, S., Curry, P.T., Thybaud, V., Lorenzon, G., Marzin, D. and Lorge, E. (2006), SFTG International collaborative study on the in vitro micronucleus test, III. Using CHO cells, Mutation Res., 607, 61-87.
21) Wakata, A., Matsuoka, A., Yamakage, K., Yoshida, J., Kubo, K., Kobayashi, K., Senjyu, N., Itoh, S., Miyajima, H., Hamada, S., Nishida, S., Araki, H., Yamamura, E., Matsui, A., Thybaud, V., Lorenzon, G., Marzin, D. and Lorge, E. (2006), SFTG International collaborative study on the in vitro micronucleus test, IV. Using CHO/IU cells, Mutation Res., 607, 88-124.
22) Oliver, J., Meunier, J.-R., Awogi, T., Elhajouji, A., Ouldelhkim, M.-C., Bichet, N., Thybaud, V., Lorenzon, G., Marzin, D. and Lorge, E. (2006), SFTG International collaborative study on the in vitro micronucleus test, V. Using L5178Y cells, Mutation Res., 607, 125-152.
23) Albertini, S., Miller, B., Chetelat, A.A. and Locher, F. (1997), Detailed data on in vitro MNT and in vitro CA: industrial experience, Mutation Res., 392, 187-208.
24) Miller, B., Albertini, S., Locher, F., Thybaud, V. and Lorge, E. (1997), Comparative evaluation of the in vitro micronucleus test and the in vitro chromosome aberration test: industrial experience, Mutation Res., 392, 45-59.
25) Miller, B., Potter-Locher, F., Seelbach, A., Stopper, H., Utesch, D. and Madle, S. (1998), Evaluation of the in vitro micronucleus test as an alternative to the in vitro chromosomal aberration assay: position of the GUM Working Group on the in vitro micronucleus test. Gesellschaft fur Umwelt-Mutations-forschung, Mutation Res., 410, 81-116.
26) Kalweit, S., Utesch, U., von der Hude, W. and Madle, S. (1999), Chemically induced micronucleus formation in V79 cells – comparison of three different test approaches, Mutation Res. 439, 183-190.
27) Kersten, B., Zhang, J., Brendler Schwaab, S.Y., Kasper, P. and Müller, L. (1999), The application of the micronucleus test in Chinese hamster V79 cells to detect drug-induced photogenotoxicity, Mutation Res. 445, 55-71.
28) von der Hude, W., Kalweit, S., Engelhardt, G., McKiernan, S., Kasper, P., Slacik-Erben, R., Miltenburger, H.G., Honarvar, N., Fahrig, R., Gorlitz, B., Albertini, S., Kirchner, S., Utesch, D., Potter-Locher, F., Stopper, H. and Madle, S. (2000), In vitro micronucleus assay with Chinese hamster V79 cells - results of a collaborative study with in situ exposure to 26 chemical substances, Mutation Res., 468, 137-163.
29) Garriott, M.L., Phelps, J.B. and Hoffman, W.P. (2002), A protocol for the in vitro micronucleus test, I. Contributions to the development of a protocol suitable for regulatory submissions from an examination of 16 chemicals with different mechanisms of action and different levels of activity, Mutation Res., 517, 123-134.
30) Matsushima, T., Hayashi, M., Matsuoka, A., Ishidate, M. Jr., Miura, K.F., Shimizu, H., Suzuki, Y., Morimoto, K., Ogura, H., Mure, K., Koshi, K. and Sofuni, T. (1999), Validation study of the in vitro micronucleus test in a Chinese hamster lung cell line (CHL/IU), Mutagenesis, 14, 569-580.
31) Elhajouji, A., and Lorge, E. (2006), Special Issue: SFTG International collaborative study on in vitro micronucleus test, Mutation Res., 607, 1-152.
32) ECVAM (2006), Statement by the European Centre for the Validation of Alternative Methods (ECVAM) Scientific Advisory Committee (ESAC) on the scientific validity of the in vitro micronucleus test as an alternative to the in vitro chromosome aberration assay for genotoxicity testing. ESAC 25th meeting, 16-17 November, 2006, Available at: [http://ecvam.jrc.it/index.htm]
33) ESAC (2006), ECVAM Scientific Advisory Committee (ESAC) Peer Review, Retrospective Validation of the In Vitro Micronucleus Test, Summary and Conclusions of the Peer Review Panel, Available at: [http://ecvam.jrc.it/index.htm]
34) Corvi, R., Albertini, S., Hartung, T., Hoffmann, S., Maurici, D., Pfuhler, S, van Benthem, J., Vanparys P. (2008), ECVAM Retrospective Validation of in vitro Micronucleus Test (MNT), Mutagenesis, 23, 271-283.
35) Zhang, L.S., Honma, M., Hayashi, M., Suzuki, T., Matsuoka, A. and Sofuni, T. (1995), A comparative study of TK6 human lymphoblastoid and L5178Y mouse lymphoma cell lines in the in vitro micronucleus test, Mutation Res., 347, 105-115.
36) Ehrlich, V., Darroudi, F., Uhl, M., Steinkellner, S., Zsivkovits, M. and Knasmeuller, S. (2002), Fumonisin B1 is genotoxic in human derived hepatoma (HepG2) cells, Mutagenesis, 17, 257-260.
37) Knasmüller, S., Mersch-Sundermann, V., Kevekordes, S., Darroudi, F., Huber, W.W., Hoelzl, C., Bichler, J. and Majer, B.J. (2004), Use of human-derived liver cell lines for the detection of environmental and dietary genotoxicants; current state of knowledge, Toxicol., 198, 315-328.
38) Gibson, D.P., Brauninger, R., Shaffi, H.S., Kerckaert, G.A., LeBoeuf, R.A., Isfort, R.J. and Aardema, M.J. (1997), Induction of micronuclei in Syrian hamster embryo cells: comparison to results in the SHE cell transformation assay for National Toxicology Program test chemicals, Mutation Res., 392, 61-70.
39) Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M. Jr., Brusick, D., Ashby, J. and Myhr, B.C. (1991), International Commission for Protection Against Environmental Mutagens and Carcinogens, Genotoxicity under extreme culture conditions. A report from ICPEMC Task Group 9, Mutation Res., 257, 147-205.
40) Morita, T., Nagaki, T., Fukuda, I. and Okumura, K. (1992), Clastogenicity of low pH to various cultured mammalian cells, Mutation Res., 268, 297-305.
41) Brusick, D. (1986), Genotoxic effects in cultured mammalian cells produced by low pH treatment conditions and increased ion concentrations, Environ. Mutagen., 8, 789-886.
42) Fenech, M. and Morley, A.A. (1985), Measurement of micronuclei in lymphocytes, Mutation Res., 147, 29-36.
43) Fenech, M. (1997), The advantages and disadvantages of cytokinesis-blood micronucleus method, Mutation Res., 392, 11-18.
44) Bonassi, S., Fenech, M., Lando, C., Lin, Y.P., Ceppi, M., Chang, W.P., Holland, N., Kirsch-Volders, M., Zeiger, E., Ban, S., Barale, R., Bigatti, M.P., Bolognesi, C., Jia, C., Di Giorgio, M., Ferguson, L.R., Fucic, A., Lima, O.G., Hrelia, P., Krishnaja, A.P., Lee, T.K., Migliore, L., Mikhalevich, L., Mirkova, E., Mosesso, P., Muller, W.U., Odagiri, Y., Scarffi, M.R., Szabova, E., Vorobtsova, I., Vral, A. and Zijno, A. (2001), HUman MicroNucleus Project: international database comparison for results with the cytokinesis-block micronucleus assay in human lymphocytes, I. Effect of laboratory protocol, scoring criteria and host factors on the frequency of micronuclei, Environ. Mol. Mutagen. 37, 31-45.
45) Maron, D.M. and Ames, B.N. (1983), Revised methods for the Salmonella mutagenicity test, Mutation Res., 113, 173-215.
46) Ong, T.-m., Mukhtar, M., Wolf, C.R. and Zeiger, E. (1980), Differential effects of cytochrome P450-inducers on promutagen activation capabilities and enzymatic activities of S-9 from rat liver, J. Environ. Pathol. Toxicol., 4, 55-65.
47) Elliott, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992), Alternatives to Aroclor 1254-induced S9 in in-vitro genotoxicity assays. Mutagenesis, 7, 175-177.
48) Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A safe substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems, In: de Serres, F.J., Fouts, J. R., Bend, J.R. and Philpot, R.M. (eds), In Vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, 85. – 88. lpp.
49) Johnson, T.E., Umbenhauer, D.R. and Galloway, S.M. (1996), Human liver S-9 metabolic activation: proficiency in cytogenetic assays and comparison with phenobarbital/beta-naphthoflavone or Aroclor 1254 induced rat S-9, Environ. Mol. Mutagen., 28, 51-59.
50) UNEP (2001), Stockholm Convention on Persistent Organic Pollutants, United Nations Environment Programme (UNEP). Available at: [http://www.pops.int/]
51) Doherty, A.T., Ellard, S., Parry, E.M. and Parry, J.M. (1996), An investigation into the activation and deactivation of chlorinated hydrocarbons to genotoxins in metabolically competent human cells, Mutagenesis, 11, 247-274.
52) Krahn, D.F., Barsky, F.C. and McCooey, K.T. (1982), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, In: Tice, R.R., Costa, D.L. and Schaich, K.M. (eds), Genotoxic Effects of Airborne Agents. New York, Plenum, 91. – 103. lpp.
53) Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983), Evaluation of an exposure system using cells grown on collagen gels for detecting highly volatile mutagens in the CHO/HGPRT mutation assay, Environ. Mutagenesis 5, 795-801.
54) Fenech, M. (1993), The cytokinesis-block micronucleus technique: a detailed description of the method and its application to genotoxicity studies in human populations, Mutation Res., 285, 35-44.
55) Phelps, J.B., Garriott, M.L., and Hoffman, W.P. (2002), A protocol for the in vitro micronucleus test. II. Contributions to the validation of a protocol suitable for regulatory submissions from an examination of 10 chemicals with different mechanisms of action and different levels of activity, Mutation Res., 521, 103-112.
56) Kirsch-Volders, M., Sofuni, T., Aardema, M., Albertini, S., Eastmond, D., Fenech, M., Ishidate, M. Jr., Kirchner, S., Lorge, E., Morita, T., Norppa, H., Surralles, J., Vanhauwaert, A. and Wakata, A. (2004), Corrigendum to “Report from the in vitro micronucleus assay working group”, Mutation Res., 564, 97-100.
57) Pincu, M., Bass, D. and Norman, A. (1984), An improved micronuclear assay in lymphocytes, Mutation Res., 139, 61-65.
58) Lorge, E., Hayashi, M., Albertini, S. and Kirkland, D. (2008), Comparison of different methods for an accurate assessment of cytotoxicity in the in vitro micronucleus test. I. Theoretical aspects, Mutation Res., 655, 1-3.
59) Surralles, J., Xamena, N., Creus, A., Catalan, J., Norppa, H. and Marcos, R. (1995), Induction of micronuclei by five pyrethroid insecticides in whole-blood and isolated human lymphocyte cultures, Mutation Res., 341, 169-184.
60) Galloway, S. (2000), Cytotoxicity and chromosome aberrations in vitro: Experience in industry and the case for an upper limit on toxicity in the aberration assay, Environ. Molec. Mutagenesis 35, 191-201.
61) Hayashi, M., Sofuni, T., and Ishidate, M. Jr. (1983), An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test, Mutation Res., 120, 241-247.
62) MacGregor, J. T., Wehr, C. M., and Langlois, R. G. (1983), A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyronin Y, Mutation Res., 120, 269-275.
63) Hayashi, M., Sofuni, T. and Ishidate, M. Jr. (1983), An application of acridine orange fluorescent staining to the micronucleus test, Mutation Res., 120, 241-247.
64) Fenech, M., Chang, W.P., Kirsch-Volders, M., Holland, N., Bonassi, S. and Zeiger, E. (2003), HUMN project: detailed description of the scoring criteria for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures, Mutation Res., 534, 65-75.
65) Hoffman, W.P., Garriott, M.L. and Lee, C. (2003), In vitro micronucleus test, In: Encyclopedia of Biopharmaceutical Statistics, Second edition. S. Chow (ed.), Marcel Dekker, Inc. New York, NY, 463.–467. lpp.
66) Regulation (EC) No 850/2004 of the European Parliament and of the Council of 29 April 2004 on persistent organic pollutants and amending Directive 79/117/EEC, OV L 229, 30.4.2004., 5. lpp.
1. papildinājums
Definīcijas
Aneigēns : viela vai process, kas mijiedarbībā ar mitotiskā un mejotiskā šūnu dalīšanās cikla komponentiem izraisa šūnu vai organismu aneiploīdiju.
Aneiploīdija : novirze no normālā diploīdā (vai haploīdā) hromosomu skaita par vienu vai vairākām atsevišķām hromosomām, bet ne par hromosomu pāri vai pāriem (poliploīdija).
Apoptoze : programmēta šūnu nāve, ko raksturo virkne posmu, kuru rezultātā šūnas sabrūk, bet saglabā membrānu integritāti, un veidojas apoptotiskie ķermenīši, kurus iznīcina fagocīti vai kuri tiek fiziski izvadīti.
Šūnu savairošanās : šūnu skaita pieaugums šūnu mitotiskās dalīšanās rezultātā.
Centromērs : hromosomas DNS reģions, kurā abas hromatīdas ir saistītas un uz kura sānu pie sāna piestiprinājušās abas kinetohoras.
Klastogēns : viela vai process, kas izraisa strukturālu hromosomālu aberāciju (novirzīšanos no normāltipa) šūnu vai organismu populācijās.
Citokinēze : šūnas dalīšanās process, kas notiek tūlīt pēc mitozes un kura rezultātā izveidojas divas meitšūnas, katra ar savu kodolu.
Savairošanās indekss pēc citokinēzes blokādes (CBPI) : otrā dalīšanās viļņa šūnu proporcionālā daļa populācijās, kas saņēmušas pētāmo vielu, salīdzinājumā ar pētāmo vielu nesaņēmušo kontroles populāciju (formulu skatīt 2. papildinājumā).
Citostāze : šūnu augšanas kavēšana (formulu skatīt 2. papildinājumā).
Citotoksicitāte : šūnas nāvi izraisoša kaitīga ietekme uz šūnas struktūru vai funkcionalitāti.
Genotoksisks : vispārīgs termins, kas aptver visu veidu bojājumus DNS vai hromosomās, tostarp sekvences pārtraukumus, pārkārtojumus, mutācijas, hromosomu aberācijas un aneiploīdiju. Ne visas genotoksiskās ietekmes rada mutācijas vai pastāvīgus hromosomu bojājumus.
Starpfāzu šūnas : šūnas, kas neatrodas mitotiskajā stadijā.
Kinetohora : proteīnus saturoša struktūra, kas sagrupējas pie centromēra hromosomā, ar kuru šūnas dalīšanās laikā saistās vārpstiņas šķiedras, nodrošinot secīgu meitashromosomu pārvietošanos uz meitasšūnu poliem.
Mikrokodoli : mazi kodoli, kas papildus šūnu galvenajiem kodoliem mitozes vai mejozes telofāzē atsevišķi izveidojas, salīpot hromosomu fragmentiem vai veselām hromosomām.
Mitoze : šūnas kodola dalīšanās process, kuru parasti sīkāk iedala šādās stadijās: profāze, prometafāze, metafāze, anafāze un telofāze.
Mitotiskais indekss : metafāzē esošu šūnu skaita attiecība pret šūnu kopējo skaitu populācijā; raksturo šūnu savairošanās pakāpi šajā populācijā.
Mutagēns : faktors, kas izraisa pārmantojamas DNS bāzu pāru sekvences vai sekvenču izmaiņas gēnos vai hromosomu struktūrā (hromosomu aberācijas).
Neatdalīšanās : māshromatīdu neatdalīšanās, kas meitšūnu veidošanās procesā neļauj māshromatīdām pienācīgi atvirzīties vienai no otras un kuras rezultātā hromosomu skaits meitšūnās nav normāls.
Poliploīdija : vienu vai vairākus hromosomu komplektus ietverošas skaitliskas hromosomu aberācijas šūnās vai organismos (pretstatā aneiploīdijai, kas skar vienu vai vairākas atsevišķas hromosomas).
Savairošanās indekss (PI) : citotoksicitātes mērīšanas paņēmiens, ja neizmanto cytoB (formulu skatīt 2. papildinājumā).
Šūnu skaita relatīvais pieaugums (RICC) : citotoksicitātes mērīšanas paņēmiens, ja neizmanto cytoB (formulu skatīt 2. papildinājumā).
Populācijas relatīvā divkāršošanās (RPD) : citotoksicitātes mērīšanas paņēmiens, ja neizmanto cytoB (formulu skatīt 2. papildinājumā).
Replicēšanās indekss (RI) : pabeigtu [šūnu dalīšanās] ciklu proporcionālā daļa kultūrā, kas saņēmusi pētāmo vielu, ekspozīcijas un atveseļošanās laikā salīdzinājumā ar pētāmo vielu nesaņēmušo kontroles kultūru (formulu skatīt 2. papildinājumā).
Testējamā ķīmiskā viela (arī testējama viela) : viela vai vielu maisījums, kuru testē ar šo TM.
2. papildinājums
Citotoksicitātes novērtējuma formulas
1. Ja izmanto cytoB, citotoksicitātes novērtējuma pamatā ir savairošanās indekss pēc citokinēzes blokādes (CBPI) vai replicēšanās indekss (RI) (16) (58). CBPI rāda šūnas ciklu vidējo skaitu vienai šūnai laikā, kamēr uz to iedarbojas cytoB, un šo indeksu var izmantot, lai aprēķinātu šūnu savairošanos. RI rāda kodolu relatīvo skaitu apstrādātajās kultūrās salīdzinājumā ar kontroles kultūrām, un ar to var procentos (%) izteikt citostāzi:
% citostāze = 100 – 100{(CBPIT – 1) ÷ (CBPIC – 1)}
un:
|
T |
= |
ar testējamo ķīmisko vielu apstrādātā kultūra |
|
C |
= |
nesēju saņēmusī kontroles kultūra |
kur:
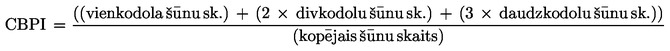
Tādā veidā CBPI ar vērtību 1 (visas šūnas ir vienkodola šūnas) ir līdzvērtīgs 100 % citostāzei.
Citostāze = 100 – RI
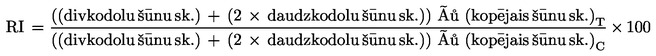
|
T |
= |
apstrādātās kultūras |
|
C |
= |
kontroles kultūras |
2. Tādā veidā, ja RI ir 53 %, tas nozīmē, ka, salīdzinot ar kontroles kultūras šūnu skaitu, kuras dalījušās, izveidojot divkodolu un daudzkodolu šūnas, apstrādātajā kultūrā šādi dalījušies tikai 53 % no tāda paša šūnu skaita, t. i., ir 47 % citostāze.
3. Ja cytoBneizmanto, citotoksicitātes novērtējuma pamatā ieteicams likt šūnu skaita relatīvā pieauguma (RICC) vai populācijas relatīvās divkāršošanās (RPD) rādītājus (58), jo tie abi ņem vērā to šūnu populācijas daļu, kura ir dalījusies.


kur:
Populācijas divkāršošanās = [log (šūnu skaits pēc apstrādes ÷ šūnu skaits sākumā)] ÷ log 2
4. Tādā veidā, ja RICC vai RPD ir 53 %, tas uzrāda 47 % citotoksicitāti/citostāzi.
5. Ar savairošanās indeksu (PI) citotoksicitāti var novērtēt, saskaitot klonus, ko veido 1 šūna (cl1), 2 šūnas (cl2), 3 līdz 4 šūnas (cl4) un 5 līdz 8 šūnas (cl8).

6. PI ir ticis izmantots kā noderīgs un ticams citotoksicitātes parametrs arī bez cytoB iedarbības in situ kultivētām šūnu līnijām (25) (26) (27) (28).
3. papildinājums
Veiktspējas novērtēšanai ieteicamās references vielas (1)
|
Kategorija |
Ķīmiskā viela |
CAS Nr. |
EK Nr. |
|
1. Klastogēni, kuriem metabolisma aktivācija nav vajadzīga |
|||
|
Citozīnarabinozīds |
147-94-4 |
205-705-9 |
|
|
Mitomicīns C |
50-07-7 |
200-008-6 |
|
|
2. Klastogēni, kam ir vajadzīga metabolisma aktivācija |
|||
|
Benz(a)pirēns |
50-32-8 |
200-028-5 |
|
|
Ciklofosfamīds |
50-18-0 |
200-015-4 |
|
|
3. Aneigēni |
|||
|
Kolhicīns |
64-86-8 |
200-598-5 |
|
|
Vinblastīns |
143-67-9 |
205-606-0 |
|
|
4. Negatīvās vielas |
|||
|
Di-(2-etilheksil)ftalāts |
117-81-7 |
204-211-0 |
|
|
Nalidiksskābe |
389-08-2 |
206-864-7 |
|
|
Pirēns |
129-00-0 |
204-927-3 |
|
|
Nātrija hlorīds |
7647-14-5 |
231-598-3 |
|
|
(1) References vielas ir lietošanai ieteicamās ķīmiskās vielas. References vielu sarakstu var papildināt un tajās iekļautās ķīmiskās vielas aizstāt ar citām, ja šo ķīmisko vielu aktivitāte ir zināma un ja mikrokodolus tās inducē ar vienādiem darbības mehānismiem, un ja ir pierādīts, ka tās ir piemērotas ķīmiskajām vielām, kuras tiks testētas, izmantojot MNvit procedūru. Atkarībā no testēšanas mērķa pamatojums var būt arī validācijas pētījums, kurš aptver daudzas un dažādas vai arī tikai dažas vielas, kas izvēlētas, ņemot vērā testējamās vielas ķīmisko klasi vai bojājumu rašanās mehānismu, kuru pēta. |
|||
B.50. ĀDAS SENSIBILIZĀCIJA: LOKĀLO LIMFMEZGLU NOTEIKŠANA (LLNA:DA)
IEVADS
1. ESAO ķīmisko vielu testēšanas vadlīnijas un ES testēšanas metodes tiek regulāri pārskatītas, ņemot vērā tehnikas attīstību, regulatīvo prasību izmaiņas un dzīvnieku labturības apsvērumus. Ir pārskatīta B.42 – pirmā no testēšanas metodēm (TM) ādas sensibilizācijas noteikšanai pelēm jeb lokālo limfmezglu noteikšanas metode (LLNA; ESAO 429. testēšanas vadlīnijas) (1). Ir publicēti LLNA validācijas un ar to saistītā darba pārskati (2) (3) (4) (5) (6) (7) (8) (9). Lai mērītu limfocītu savairošanos, LLNA izmanto radioizotopisko timidīnu vai jodīnu, un tāpēc šīs metodes pielietošana ir ierobežota gadījumos, kad radioaktīvo komponentu iegāde, izmantošana vai apglabāšana ir problemātiska. LLNA:DA (izstrādātājs: Daicel Chemical Industies Ltd.) ir modificēta LLNA, kurā nav radioaktīvo komponentu un ar kuru kvantitatīvi nosaka adenozīntrifosfāta (ATP) saturu, par limfocītu savairošanās indikatoru izmantojot bioluminiscenci. LLNA:DA testēšanas metode ir validēta, to ir pārskatījusi starptautiska salīdzinošās izvērtēšanas komisija un ir rekomendējusi šo metodi kā tādu, kas ar dažiem ierobežojumiem uzskatāma par noderīgu ādu sensibilizējošu un nesensibilizējošu ķīmisku vielu identificēšanai (10) (11) (12) (13). Šī TM ir izstrādāta, lai novērtētu ķīmiskām vielām vai to maisījumiem piemītošo ādas sensibilizācijas potenciālu (dzīvniekiem). Šā pielikuma B.6. nodaļā un ESAO 406. testēšanas vadlīnijās aprakstītā metode izmanto testēšanu ar jūrascūciņām, proti, maksimizācijas testu jūrascūciņām un Bīlera testu (14). LLNA (šā pielikuma B.42. nodaļa; ESAO 429. testēšanas vadlīnijas) un abas šīs metodes modifikācijas, kurās nav radioaktīvo komponentu, proti, LLNA:DA (šā pielikuma B.50. nodaļa; ESAO 442.a testēšanas vadlīnijas) un LLNA:BrdU-ELISA (šā pielikuma B.51. nodaļa; ESAO 442.b testēšanas vadlīnijas), visas ir pārākas par testēšanas metodēm ar jūrascūciņām, kas aprakstītas B.6 un ESAO 406. testēšanas vadlīnijās (14), dzīvnieku skaita samazinājuma un labāka izmantojuma ziņā.
2. Līdzīgi kā LLNA, ar LLNA:DA pēta ādas sensibilizācijas indukcijas fāzi un sniedz kvantitatīvus datus, kas piemēroti atbildes reakcijas uz devu novērtēšanai. Turklāt iespēja noteikt ādas sensibilizatorus, neizmantojot radioaktīvus DNS marķierus, atbrīvo no vajadzības risināt arodapstarošanas un radioaktīvo atkritumu apglabāšanas jautājumus. Tas savukārt ļauj ādas sensibilizatoru noteikšanai biežāk izmantot peles un turpināt samazināt jūrascūciņu izmantošanu ādas sensibilizācijas potenciāla testēšanā (t. i., B.6; ESAO 406. testēšanas vadlīnijas) (14).
DEFINĪCIJAS
3. Definīcijas skatīt 1. papildinājumā.
SĀKOTNĒJIE APSVĒRUMI UN IEROBEŽOJUMI
4. LLNA:DA metode ir modificēta LLNA, kura paredzēta ķīmisko vielu – potenciālu ādas sensibilizatoru identificēšanai un kurai ir zināmi ierobežojumi. Tas nenozīmē, ka visos gadījumos LLNA:DA būtu jālieto LLNA vai jūrascūciņu testa vietā (B.6; ESAO 406. testēšanas vadlīnijas) (14), bet gan to, ka šī noteikšana ir minētajam testam līdzvērtīga un to var izmantot kā alternatīvu, kuras pozitīvajam vai negatīvajam rezultātam vairs nav vajadzīgs papildu apstiprinājums (10) (11). Pirms uzsākt pētījumus, testēšanas laboratorijai jāņem vērā visa par testējamo vielu pieejamā informācija. Pie šādas informācijas pieder testējamās vielas identifikācija un ķīmiskā struktūra, fizikāli ķīmiskās īpašības, citu in vitro vai in vivo veikto toksicitātes testu rezultāti un toksikoloģiskie dati par struktūras ziņā saistītām vielām. Šī informācija jāizvērtē, lai noteiktu LLNA:DA piemērotību konkrētajai testējamai vielai (ņemot vērā atsevišķu veidu vielu nesaderību ar LLNA:DA; skatīt 5. punktu) un lai izraudzītos pareizu testējamās vielas devu.
5. LLNA:DA ir in vivo metode un kā tāda paredz dzīvnieku izmantošanu alerģiskās kontakta sensibilizējošās aktivitātes novērtējumā. Tomēr salīdzinājumā ar testēšanas metodēm, kurās izmanto jūrascūciņas (B.6; ESAO 406. testēšanas metode), tajā iespējams izmantot mazāku skaitu dzīvnieku (14). LLNA:DA turklāt piedāvā būtisku uzlabojumu (mazāk sāpju un ciešanu) dzīvnieku izmantojumā alerģiskās kontakta sensibilizējošās testēšanas vajadzībām, jo (atšķirībā no B.6 un ESAO 406. testēšanas vadlīnijām) LLNA:DA nav jānoskaidro provocētās–inducētās ādas hipersensibilizācijas reakcijas. Neraugoties uz LLNA:DA priekšrocībām salīdzinājumā ar B.6 un ESAO 406. testēšanas vadlīnijām (14), šai metodei ir daži ierobežojumi, kuru dēļ tomēr jāizmanto B.6 vai ESAO 406. testēšanas vadlīniju metode (piemēram, dažu metālu testēšanā, šķietami pozitīva rezultāta konstatēšanas gadījumā dažiem ādas sensibilizatoriem [kā, piemēram, atsevišķām surfaktantu tipa vielām] (6) (1; šā pielikuma B.42. nodaļa) vai testējamās vielas šķīdības labad). Turklāt vajadzība pēc jūrascūciņu testiem (B.6 un ESAO 406. testēšanas vadlīnijas (14)) var saglabāties attiecībā uz ķīmisko vielu klasēm vai vielām, kuru sastāvā ir funkcionālās grupas, par kurām ir pierādīts, ka tās darbojas kā potenciāli sajaucējfaktori (16). Ierobežojumus, kuri konstatēti LLNA gadījumā (1; šā pielikuma B.42. nodaļa) ieteicams attiecināt arī uz LLNA:DA (10). Turklāt LLNA:DA var nebūt piemērotākā metode tādu vielu testēšanai, kas ietekmē ATP koncentrācijas (piemēram, vielas, kam ir ATP inhibējoša iedarbība) vai kas ietekmē starpšūnu ATP mērījumu precizitāti (piemēram, ATP degradējošu enzīmu klātbūtne, ārpusšūnu ATP klātbūtne limfmezglā). Izņemot šādus minētos ierobežojumus, LLNA:DA jāvar izmantot jebkuras vielas testēšanai, ja vien testējamai vielai nav tādu īpašību, kas varētu ietekmēt LLNA:DA precizitāti. Ja stimulācijas indeksa (SI) vērtība ir robežās no 1,8 līdz 2,5, jāapsver neitrālam tuva pozitīva rezultāta iespējamība (skatīt 31.–32. punktu). Šā apgalvojuma pamatā ir validēšanas datubāze, kuru veido 44 vielas ar SI ≥ 1,8 (skatīt 6. punktu); LLNA:DA pareizi identificēja visus 32 LLNA sensibilizatorus, bet kļūdaini identificēja trīs no 12 LLNA nesensibilizējošajām vielām, kuru SI vērtības bija robežās no 1,8 līdz 2,5 (t. i., pozitīvs neitrālam tuvs rezultāts) (10). Tomēr, tā kā SI vērtību noteikšanai un testēšanas metodes prognozēšanas spējas aprēķināšanai tika izmantota viena un tā pati datu kopa, minētie rezultāti var būt pārāk augsts reālās prognozēšanas spējas novērtējums.
TESTĒŠANAS METODES PRINCIPS
6. LLNA:DA pamatprincips ir tāds, ka sensibilizatori inducē limfocītu savairošanos limfmezglos, kuri drenē testējamās vielas saņemšanas vietu. Šī savairošanās ir proporcionāla devai un alergēna iedarbīgumam un ir vienkāršs paņēmiens, lai iegūtu kvantitatīvu sensitivitātes mērījumu. Savairošanās pakāpi nosaka, vidējo savairošanos katrā testējamās vielas grupā salīdzinot ar vidējo savairošanos kontroles grupā, kas saņēmusi tikai nesēju (VC). Nosaka attiecību starp vidējo progresiju grupās, kas saņēmušas pētāmo vielu, un progresiju VC grupā; tas ir stimulācijas indekss (SI). Lai testējamo vielu pamatoti turpinātu vērtēt kā potenciālu ādas sensibilizatoru, SI vērtībai jābūt ≥ 1,8. Šeit aprakstītās procedūras pamatā ir adenozīntrifosfāta (ATP) satura mērīšana ar bioluminiscenci (zināms, ka tas korelē ar dzīvo šūnu skaitu) (17), lai indicētu vairojošos šūnu skaita pieaugumu aurikulārajos limfmezglos (18) (19). Biolumuniscences metodē izmanto luciferāzi (enzīms), lai katalizētu gaismas rašanos no ATP un luciferīna šādā reakcijā:
ATP + Luciferīns + O
2
![]() Oksiluciferīns + AMP + PPi
+ CO
2 + Gaisma
Oksiluciferīns + AMP + PPi
+ CO
2 + Gaisma
Emitētās gaismas intensitāte ir lineārā sakarībā ar ATP koncentrāciju, un to mēra ar luminometru. Luciferīna–luciferāzes noteikšana ir jutīga metode ATP kvantitatīvai noteikšanai, kam ir plašs lietojumu spektrs (20).
METODES APRAKSTS
Dzīvnieku sugas izvēle
7. Šim testam izvēlētā suga ir peles. LLNA:DA validēšanas pētījumi ir veikti vienīgi ar CBA/J līnijas dzīvniekiem, un tāpēc to uzskata par ieteicamo līniju (12) (13). Izmanto jaunas, pieaugušas sievišķā dzimuma peles, kas nav dzemdējušas un nav grūsnas. Pētījuma sākumā dzīvniekiem jābūt 8–12 nedēļu veciem, dzīvnieku masas atšķirībām jābūt minimālām un ne lielākām par 20 % no vidējās masas. Citas līnijas un vīrišķā dzimuma dzīvniekus var izmantot, ja ir iegūts pietiekami daudz datu, lai parādītu, ka LLNA:DA atbildes reakcijā nav nozīmīgu atšķirību, kas specifiskas līnijai un/vai dzimumam.
Turēšanas un barošanas apstākļi
8. Ja nav zinātniska pamatojuma, kāpēc peles būtu turamas katra atsevišķi, peles izmitina grupā (21). Telpā, kurā tur izmēģinājumu dzīvniekus, jābūt 22 ± 3 °C temperatūrai. Lai gan, izņemot telpu uzkopšanas laiku, relatīvajam mitrumam jābūt vismaz 30 % un vēlams ne vairāk kā 70 %, tas jāuztur 50–60 % robežās. Apgaismojumam jābūt mākslīgam atbilstoši secībai 12 stundas gaišas, 12 stundas tumšas. Barošanai var izmantot parasto laboratorijas barību ar neierobežotu dzeramā ūdens daudzumu.
Dzīvnieku sagatavošana
9. Dzīvniekus izvēlas pēc nejaušības principa, marķē individuālai identificēšanai (bet nekādā veidā nemarķē ausis) un tur būros vismaz piecas dienas pirms testa sākuma, lai tos aklimatizētu laboratorijas apstākļos. Pirms apstrādes uzsākšanas visus dzīvniekus apskata, lai pārliecinātos, ka tiem nav novērojami ādas bojājumi.
Testa šķīdumu sagatavošana
10. Cietas ķīmiskās vielas pirms peļu ausu apstrādes izšķīdina vai suspendē, izmantojot šķīdinātājus vai nesējus, un vajadzības gadījumā atšķaida. Šķidras ķīmiskās vielas var izmantot gan atšķaidītas, gan neatšķaidītas. Nešķīstošas ķīmiskās vielas (kādas parasti izmanto medicīnas iekārtās) pirms peļu ausu apstrādes ekstrahē piemērotā šķīdinātājā, lai visas ekstrahējamās sastāvdaļas būtu pieejamas testēšanai. Ja dati par testējamo vielu stabilitāti liecina, ka tās uzglabāt nevar, katru dienu sagatavo svaigas testējamās vielas.
Ticamības pārbaude
11. Metodes veiktspējas pienācīgumu parāda ar pozitīvās kontroles vielu (PC) palīdzību, kuras ar adekvātu un reproducējamu sensibilitāti reaģē uz sensibilizējošām testēšanas vielām un kuru reakcijas intensitāte ir sīki aprakstīta. Ieteicams paredzēt vienlaicīgu PC, jo tādā veidā var pierādīt laboratorijas spēju atkārtoti un sekmīgi īstenot noteikšanu, kā arī novērtēt iekšlaboratorijas un starplaboratoriju reproducējamību un rezultātu salīdzināmību. Pirms LLNA:DA ieteicams lietotājiem konsultēties ar atbildīgajām iestādēm, jo dažas regulatīvās iestādes pieprasa PC izmantošanu katrā individuālā pētījumā. Attiecīgi labāk ir ikreiz izmantot vienlaicīgu PC, jo tas ļauj neveikt papildu testēšanu ar dzīvniekiem, lai izpildītu prasības, kuras var izrietēt no PC neregulāras izmantošanas (skatīt 12. punktu). PC jādod pozitīva LLNA:DA atbildes reakcija tādā iedarbības līmenī, kurā ir sagaidāms stimulācijas indekss (SI) ≥ 1,8, salīdzinot ar negatīvās kontroles vielu (NC) grupu. PC deva jāizvēlas tā, lai neizraisītu pārmērīgu ādas kairinājumu vai sistēmisku toksicitāti un lai indukcija būtu atkārtojama, taču ne pārmērīga (piemēram, SI > 10 uzskata par pārmērīgu). Ieteicamākās PC ir 25 % heksilkanēļskābes aldehīds (Chemical Abstracts Service [CAS] Nr. 101-86-0) un 25 % eigenols (CAS Nr. 97-53-0) ar acetonu/olīveļļu (4:1 tilp./tilp.). Var būt apstākļi, kad ar pienācīgu pamatojumu var izmantot citas PC, kas atbilst iepriekš minētajiem kritērijiem.
12. Lai gan vienlaicīgas PC grupas izmantošana ir ieteicama, var būt situācijas, kad laboratorijās, kurās LLNA:DA veic regulāri (t. i., vismaz reizi mēnesī) un kurās tāpēc ir vēsturiska PC datubāze, kas pierāda laboratorijas spēju ar PC iegūt reproducējamus un pareizus rezultātus, piemērotāka var izrādīties periodiska PC izmantošana (t. i., vismaz reizi 6 mēnešos). LLNA:DA metodes adekvātu pārzināšanu var sekmīgi pierādīt, ar PC iegūstot konsekventus pozitīvus rezultātus vismaz 10 neatkarīgās testēšanas reizēs, kuras veiktas samērīgā laika periodā (t. i., ne ilgāk kā gada laikā).
13. Vienlaicīga PC grupa noteikti jāiekļauj, kad LLNA:DA notiek procedurālas izmaiņas (piemēram, augsti kvalificēta personāla nomaiņa, testēšanas metodes materiālu un/vai reaģentu nomaiņa, cits izmēģinājumu dzīvnieku piegādātājs), un šādas izmaiņas pienācīgi jādokumentē laboratorijas pārskatos. Jānovērtē šādu izmaiņu ietekme uz iepriekš izveidotās vēsturiskās datubāzes adekvātumu un tas, vai vajag veidot jaunu vēsturisku datubāzi, lai dokumentētu ar PC iegūtu rezultātu konsekvenci.
14. Pētniekiem jāapzinās, ka lēmums par periodisku, nevis vienlaicīgu PC izmantošanu ietekmēs to, kādā mērā par adekvātiem un pieņemamiem varēs uzskatīt negatīvos pētījumu rezultātus, kas bez vienlaicīgas PC iegūti periodiskās PC izmantošanas starplaikos. Piemēram, ja ar periodisko PC pētījumu iegūst šķietami negatīvu rezultātu, var apšaubīt negatīvu testējamās vielas rezultātu, kas iegūts iepriekšējā pieņemamā periodiskā PC pētījuma un nepieņemamā periodiskā PC pētījuma starplaikā. Tāpēc rūpīgi jāizvērtē, vai izmantot vienlaicīgu vai periodisku PC. Tāpat jāizvērtē, kādas ir iespējas vienlaicīgās PC grupā izmantot mazāk dzīvnieku, ja to var zinātniski pamatot un ja laboratorija ar saviem specifiskajiem vēsturiskajiem datiem var pierādīt, ka ir iespējams izmantot mazāk peļu (22).
15. Kaut arī PC jātestē nesējā, par kuru ir zināms, ka tas izrāda viendabīgu atbildes reakciju (piemēram, acetons/olīveļļa; 4:1 tilp./tilp.), var būt dažas reglamentējošas situācijas, kurās būs nepieciešama arī testēšana nestandarta nesējā (klīniski/ķīmiski piederīgs sastāvs) (23). Ja vienlaicīgo PC testē ar citu nesēju nekā testējamo vielu, vienlaicīgās PC vajadzībām jāparedz atsevišķs VC.
16. Ja vērtē vielas, kas pieder konkrētai ķīmisko vielu klasei vai kas dod noteikta diapazona reakciju, var izmantot salīdzināšanas vielas, kuras noder, lai parādītu, ka testēšanas metode darbojas un pienācīgi nosaka šā tipa vielām piemītošo ādas sensibilizācijas potenciālu. Pienācīgām salīdzināšanas vielām ir jāpiemīt šādām īpašībām:
— strukturāla un funkcionāla līdzība ar testējamās vielas klases vielām,
— labi zināmas fizikālās un ķīmiskās īpašības,
— papildinoši dati no LLNA:DA,
— papildinoši dati saistībā ar citiem dzīvniekiem un/vai cilvēku.
TESTA PROCEDŪRA
Dzīvnieku skaits un devu līmeņi
17. Uz devas grupu ar vismaz trim testējamās vielas koncentrācijām izmanto vismaz četrus dzīvniekus un vienlaicīgas NC grupu, kas saņem tikai testējamās vielas nesēju, un PC grupu (vienlaicīgu vai nesenu atkarībā no laboratorijas prakses un saistībā ar 11.–15. punktu). Jāapsver iespēja testēt vairākas PC devas, īpaši tad, ja PC testēšana ir periodiska. Izņemot apstrādi ar testējamo vielu, ar kontroles grupu dzīvniekiem rīkojas tieši tāpat kā ar apstrādāto grupu dzīvniekiem.
18. Devu un nesēja izvēlei jāpamatojas uz atsaucē (2) un (24) sniegtajiem ieteikumiem. Secīgas devas parasti izraugās no atbilstošas koncentrāciju rindas, kā 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 %, u. c. Koncentrāciju rindas izvēlei jābūt ar adekvātu zinātnisku pamatojumu. Jāizvērtē visa esošā toksikoloģiskā (piemēram, akūta toksicitāte un dermālais kairinājums) un struktūras un fizikālķīmiskā informācija par attiecīgo testējamo vielu (un/vai par struktūras ziņā saistītām vielām), ja tāda ir, un trīs secīgās koncentrācijas jāizraugās tā, lai augstākā no tām izraisītu stiprāko iedarbību, kura vēl nerada sistēmisku toksicitāti un/vai pārmērīgu lokālu ādas kairinājumu (24) (25). Ja šādas informācijas nav, sākumā var būt jāveic priekšskrīninga tests (skatīt 21.–24. punktu).
19. Nesējs nedrīkst pārmainīt vai maskēt testēšanas rezultātus, un tas jāizraugās tāds, lai šķīdība būtu iespējami lielāka, tā ļaujot iegūt augstāko reāli sasniedzamo koncentrāciju un iegūstot šķīdumu/suspensiju, kas būtu derīga testējamās vielas pielietošanai. Ieteicamie nesēji ir acetons/olīveļļa (4:1 tilp./tilp.), N,N-dimetilformamīds, metiletilketons, propilēnglikols un dimetilsulfoksīds (6), bet var izmantot arī citus, ja tam ir pietiekams zinātniskais pamatojums. Dažos gadījumos papildu kontrolei jāizmanto klīniski atbilstošs šķīdinātājs vai tirdzniecības preparāts, kura sastāvā testējamo vielu tirgo. Īpaši jārūpējas, lai nodrošinātu to, ka hidrofīlas vielas ir iekļautas nesēja sistēmā, kas mitrina ādu un tūlīt nenotek, un jāizmanto pienācīgi šķīdinātāji (piemēram, 1 % Pluronic® L92). Tādēļ ir jāizvairās no nesējiem, kas satur vienīgi ūdeni.
20. Izpētot no individuālām pelēm iegūtus limfmezglus, var novērtēt dzīvnieku savstarpējās atšķirības un iegūt testējamās vielas grupas un VC grupas mērījumu statistisku salīdzinājumu (skatīt 33. punktu). Turklāt PC grupas peļu skaita iespējamā samazinājuma izvērtējumam jēga ir vienīgi tad, ja dati ir par individuāliem dzīvniekiem (22). Dažas regulatīvās iestādes prasa, lai dati būtu par individuāliem dzīvniekiem. Regulāra datu vākšana par individuāliem dzīvniekiem dod priekšrocības dzīvnieku labturības ziņā, jo ļauj izvairīties no atkārtotas testēšanas gadījumā, ja vielas testēšanas rezultātus sākotnēji apkopo vienā veidā (piemēram, par apstrādes grupu), bet regulatīvās iestādes vēlāk izvirza citas prasības (piemēram, pieprasa datus par individuāliem dzīvniekiem).
Priekšskrīninga tests
21. Ja nav informācijas, lai noteiktu augstāko testējamo devu (skatīt 18. punktu), jāveic priekšskrīninga tests, lai definētu ar LLNA:DA testējamo atbilstošo devas līmeni. Priekšskrīninga testa mērķis ir būt par orientieri ar LLNA:DA testējamā maksimālā devas līmeņa izvēlē, ja nav informācijas par koncentrāciju, kādā testējamā viela izraisa sistēmisku toksicitāti (skatīt 24. punktu) un/vai pārmērīgu lokālu ādas kairinājumu (skatīt 23. punktu). Maksimālajam testējamās vielas devas līmenim vajadzētu būt 100 % (šķidrumiem) un augstākajai iespējamajai koncentrācijai (cietām vielām un suspensijām).
22. Priekšskrīninga testa apstākļi ir identiski pamata LLNA:DA apstākļiem, izņemot to, ka nevērtē progresiju limfmezglos un ka devas grupā var izmantot mazāku skaitu dzīvnieku. Ieteicamais skaits ir viens vai divi dzīvnieki katrā devas grupā. Visām pelēm ik dienas pārbauda to, vai apstrādes vietā nav klīnisku pazīmju, kas liecinātu par sistēmisku toksicitāti vai lokālu kairinājumu. Pirms testa un tā beigās (8. diena) reģistrē dzīvnieku ķermeņa masu. Katrai peles apskata abas ausis, un iespējamo apsārtumu novērtē pēc 1. tabulas punktu skalas (25). Auss biezumu mēra ar piemērotu mērierīci (piemēram, digitālo mikrometru vai “Peacock” tipa biezuma mērierīci) 1. dienā (pirms devas), 3. dienā (aptuveni 48 stundas pēc pirmās devas), 7. dienā (24 stundas pirms testēšanas beigām) un 8. dienā. Turklāt 8. dienā auss biezumu var mērīt ar auss caursišanas paņēmienu pēc tam, kad dzīvnieki ir humāni nonāvēti. Lokālu kairinājumu uzskata par pārmērīgu tad, ja jebkurā mērījumu dienā apsārtuma novērtējums pēc punktu skalas ir ≥ 3 un/vai auss biezums ≥ 25 % (26) (27). Lielākā deva, kas izmantojama LLNA:DA pamata testā, ir otrā zemākā deva priekšskrīninga koncentrāciju rindā (skatīt 18. punktu), kas neizraisa sistēmisku toksicitāti un/vai pārmērīgu lokālu ādas kairinājumu.
1. tabula
Apsārtuma (eritēmas) skala
|
Pazīmes |
Punktu skaits |
|
Apsārtuma nav |
0 |
|
Vāji izteikts (gandrīz nemanāms) apsārtums |
1 |
|
Izteikts apsārtums |
2 |
|
Vidēji stiprs un ļoti stiprs apsārtums |
3 |
|
Ļoti stiprs apsārtums (biešu sarkans) un kreveles, kas apsārtuma novērtēšanu padara neiespējamu |
4 |
23. Papildus auss biezuma 25 % pieaugumam (26) (27) kairinātāju identificēšanai LLNA izmanto arī statistiski nozīmīgus auss biezuma pieauguma rādītājus apstrādātajām pelēm salīdzinājumā ar kontroles grupas pelēm (28) (29) (30) (31) (32) (33) (34). Tomēr, lai gan statistiski nozīmīgs pieaugums var arī nesasniegt 25 % robežu, šādu pieaugumu neuzskata par pārmērīga kairinājuma izpausmi (30) (31) (32) (33) (34).
24. Turpmāk uzskaitītie klīniskie novērojumi, ja tie ir novērtējuma neatņemama daļa, var liecināt par sistēmisku toksicitāti (35), un tāpēc var parādīt, kāds būs LLNA:DA pamata testā izmantojamais maksimālais devas līmenis: nervu sistēmas darbības traucējumi (piemēram, piloarekcija, ataksija, drebuļi un krampji); uzvedības traucējumi (piemēram, agresivitāte, ar personīgo higiēnu saistītās uzvedības maiņa, jūtams aktivitātes samazinājums vai pieaugums); neraksturīga elpošana (piemēram, elpas vilcienu biežuma un intensitātes maiņa, kā apgrūtināta vai spazmatiska elpošana, trokšņi plaušās) un pārmaiņas barības un ūdens uzņemšanā. Turklāt novērtējumā jāņem vērā letarģijas pazīmes un/vai reakcijas samazināšanās un visas klīniskās pazīmes, kas liecina par vairāk nekā mirklīgām sāpēm un ciešanām, vai ķermeņa masas samazinājums par vairāk nekā 5 % laikā no 1. dienas līdz 8. dienai, kā arī mirstības rādītāji. Mirstoši dzīvnieki vai dzīvnieki, kuri uzrāda stipru sāpju un ciešanu pazīmes, ir humāni jānonāvē (36).
Eksperimenta grafiks pamata pētījuma laikā
25. Eksperimenta grafiks ir šāds:
|
— |
1. diena : individuāli nosaka un reģistrē katra dzīvnieka masu, reģistrē klīniskos novērojumus. Izmantojot SLS šķīdumā iemērktu otiņu un katras auss aizmugures virsmu noklājot četros līdz piecos triepienos, uzliek 1 % nātrija laurilsulfāta (SLS) šķīdumu ūdenī. Stundu pēc apstrādes ar SLS katras auss aizmugures virsmu apstrādā ar 25 μl atšķaidījuma, kurš satur attiecīgo testējamo vielu, tikai nesēju vai PC (vienlaicīgu vai nesenu atkarībā no laboratorijas prakses un saistībā ar 11.–15. punktu). |
|
— |
2., 3. un 7. diena : atkārto priekšapstrādi ar 1 % SLS šķīdumu ūdenī un testējamās vielas uzlikšanu kā 1. dienā. |
|
— |
4., 5. un 6. diena : apstrāde nenotiek. |
|
— |
8. diena : reģistrē katra dzīvnieka masu un klīniskos novērojumus. Aptuveni 24 līdz 30 stundas pēc tam, kad 7. dienā sākta vielas uzlikšana, dzīvniekus humāni nonāvē. No katras auss izgriež aurikulāros limfmezglus, kurus katrai pelei atsevišķi apstrādā fizioloģiskajā šķīdumā ar fosfātbuferi (PBS). Sīkus datus un diagrammas par limfmezglu identificēšanu un izgriešanu skatīt atsaucēs (22). Eksperimenta protokolā var iekļaut papildu parametrus, kas raksturo turpmāku ādas lokālo reakciju pamata pētījuma laikā, piemēram, auss apsārtuma novērtējumu pēc punktu skalas vai auss biezuma mērījumus (nosaka ar mērierīci vai ar auss caursišanas paņēmienu autopsijā). |
Šūnu suspensiju sagatavošana
26. No katrai pelei abās pusēs izgrieztām limfmezglu šūnām (LNC) sagatavo atsevišķu šūnu suspensiju; to dara, limfmezglus novietojot starp diviem priekšmetstikliņiem un viegli uzspiežot, lai tie pārplīstu. Kad audi vienmērīgi un plānā kārtā izlīdzinājušies, priekšmetstikliņus atdala vienu no otra. Uz abiem priekšmetstikliņiem esošos audus suspendē ar PBS, priekšmetstikliņu slīpā leņķī turot virs Petri trauciņa un skalojot ar PBS, un vienlaikus ar šūnu skrāpi tīrot priekšmetstikliņu no audiem. Tā kā NC dzīvnieku limfmezgli ir mazi, tie jāapstrādā ar sevišķu rūpību, lai novērstu SI vērtību izkropļojumus. Abu priekšmetstikliņu noskalošanai jāizmanto kopā 1 mL PBS. Petri trauciņā atrodošos LNC suspensiju homogenizē, nedaudz apmaisot ar šūnu skrāpi. Ar mikropipeti savāc 20 μL LNC suspensijas alikvotas, neskarot ar aci saredzamo membrānu, un pagatavo tās maisījumu ar 1,98 mL PBS, rezultātā iegūstot 2 mL paraugu. Pēc šīs pašas procedūras sagatavo otru 2 mL paraugu; tādā veidā no katra dzīvnieka iegūst divus paraugus.
Šūnu savairošanās noteikšana (limfocītu ATP satura mērīšana)
27. ATP satura pieaugumu limfmezglos mēra ar luciferīna/luciferāzes metodi, izmantojot ATP mērīšanas komplektu, kas mēra bioluminiscenci, to izsakot relatīvās luminiscences vienībās (RLU). Noteikšanas laikam, kas aizrit no dzīvnieka nonāvēšanas brīža līdz ATP satura izmērīšanai, katra individuāla dzīvnieka gadījumā jābūt iespējami vienādākam un jāiekļaujas apmēram 30 minūtēs, jo uzskata, ka ATP saturs pēc dzīvnieka nonāvēšanas pakāpeniski samazinās (12). Tāpēc procedūru virkne, no aurikulāro limfmezglu izgriešanas līdz ATP izmērīšanai, jāpabeidz 20 minūtēs, ievērojot iepriekš noteiktu grafiku, kas visiem dzīvniekiem ir vienāds. ATP luminiscence jāmēra katrā 2 mL paraugā, tādā veidā no katra dzīvnieka iegūstot divus ATP mērījumu rezultātus. Turpmāko aprēķinu vajadzībām nosaka un izmanto vidējo ATP luminiscences rādītāju (skatīt 30. punktu).
NOVĒROJUMI
Klīniskie novērojumi
28. Ikviena pele vismaz reizi dienā ir rūpīgi jānovēro attiecībā uz vietēju kairinājumu apstrādes vietā vai sistēmiskas toksicitātes klīniskajām pazīmēm. Visus novērojumus sistemātiski reģistrē, par katru peli izdarot individuālu ierakstu. Novērošanas plānā jāiekļauj kritēriji, kas ļauj tūlīt identificēt peles, kurām ir sistēmiskas toksicitātes, pārmērīga lokāla ādas kairinājuma vai ādas korozijas pazīmes, lai tām veiktu eitanāziju (36).
Ķermeņa masa
29. Kā norādīts 25. punktā, individuālu dzīvnieku ķermeņa masa ir jānosaka testa sākumā un pirms plānotās humānās nonāvēšanas.
REZULTĀTU APRĒĶINĀŠANA
30. Katras apstrādes grupas rezultātu izsaka ar vidējo SI. SI iegūst, vidējo RLU vērtību katrai pelei katrā testējamās vielas grupā un PC grupā dalot ar vidējo RLU vērtību katrai pelei šķīdinātāja/VC grupā. Tā VC grupās vidējais SI ir 1.
31. Lēmumu pieņemšanas procesā rezultātu uzskata par pozitīvu, ja SI ≥ 1,8 (10). Tomēr, nosakot, vai neitrālam tuvu rezultātu (t. i., ar SI vērtību robežās no 1,8 līdz 2,5) varētu uzskatīt par pozitīvu, var ņemt vērā arī devas un atbildes reakcijas stiprumu un šķīdinātāja/nesēja un PC reakcijas statistisko nozīmīgumu un konsekvenci (2) (3) (37).
32. Attiecībā uz neitrālam tuvu pozitīvu rezultātu ar SI vērtību robežās no 1,8 līdz 2,5, pirms apstiprināt, ka šis rezultāts ir pozitīvs, lietotāji var izvērtēt tādu papildu informāciju kā devas un atbildes reakcijas mijiedarbība, sistēmiskas toksicitātes vai pārmērīga kairinājuma pazīmes un, attiecīgā gadījumā, statistiskais nozīmīgums apvienojumā ar SI vērtībām (10). Jāņem vērā arī testējamās vielas dažādās īpašības, tostarp tas, vai tā strukturāli līdzinās jau zināmiem ādas sensibilizatoriem, vai tā izraisa pārmērīgu ādas kairinājumu pelēm un kāda veida atbildes reakcija uz devu ir novērota. Šie un citi apsvērumi sīkāk iztirzāti citur (4).
33. Datu vākšana par individuālām pelēm pavērs iespējas statistiskai analīzei par devas un atbildes reakcijas mijiedarbības esību un tās pakāpi šajos datos. Jebkurš statistisks novērtējums var ietvert devas un atbildes reakcijas mijiedarbības novērtējumu, kā arī pienācīgi koriģētus testējamo grupu salīdzinājumus (piemēram, devu pāri grupā un šīs grupas salīdzinājums ar vienlaicīgu šķīdinātāja/kontroles grupu). Statistiskā analīze var ietvert, piemēram, lineāro regresiju jeb Viljamsa [William’s] testu, ar ko analizē devas un atbildes reakcijas mijiedarbību tendences, un Daneta [Dunnett] testu, lai salīdzinātu devu pārus. Izvēloties attiecīgu statistiskās analīzes metodi, pētniekam jāapzinās iespējamās mainīgo lielumu nevienādības un citas ar to saistītās problēmas, kuru dēļ var būt nepieciešama datu pārveidošana vai neparametriskā statistiskā analīze. Visādā ziņā iespējams, ka pētniekam SI būs jāaprēķina un statistiskā analīze jāveic gan ar, gan bez dažiem punktveida datiem (respektīvi, neņemot vērā galējības jeb rupjas kļūdas).
DATI UN TESTĒŠANAS PĀRSKATS
Dati
34. Dati jāapkopo tabulā, uzrādot indivīdu RLU vērtības, grupas vidējo RLU vērtību uz dzīvnieku, attiecīgo kļūdas apzīmējumu (piem., SD, SEM) un vidējo SI katrai devas grupai salīdzinājumā ar vienlaicīgo šķīdinātāja/kontroles grupu.
Testēšanas pārskats
35. Testēšanas pārskatā jābūt iekļautai šādai informācijai:
Testējamā un kontroles viela:
— identifikācijas dati (piemēram, CAS un EK numurs (ja ir); avots; tīrība; zināmie piemaisījumi; partijas numurs),
— fizikālās un fizikāli ķīmiskās īpašības (piemēram, gaistamība, stabilitāte, šķīdība),
— maisījuma gadījumā: sastāvs un sastāvdaļu relatīvais procentuālais daudzums.
Šķīdinātājs/nesējs:
— identifikācijas dati (tīrība; koncentrācija (attiecīgā gadījumā); izmantotais tilpums),
— nesēja izvēles pamatojums.
Izmēģinājumu dzīvnieki:
— CBA peļu avots,
— dzīvnieku mikrobioloģiskais statuss, ja tas zināms,
— dzīvnieku skaits un vecums,
— dzīvnieku avots, turēšanas un barošanas apstākļi utt.
Testēšanas apstākļi:
— ATP komplekta avots, partijas numurs un ražotāja kvalitātes nodrošinājuma/kvalitātes kontroles dati,
— sīkas ziņas par testējamās vielas sagatavošanu un pielietošanu,
— devu izvēles pamatojums, attiecīgā gadījumā iekļaujot priekšskrīninga testa rezultātus,
— izmantotās nesēja un testējamās vielas koncentrācijas un pielietotās testējamās vielas kopējais daudzums,
— sīkas ziņas par barības un ūdens kvalitāti (iekļaujot barības veidu/izcelsmi, ūdens izcelsmi),
— sīks apstrādes un paraugu ņemšanas shēmas apraksts,
— toksicitātes novērtēšanas metodes,
— kritēriji, pēc kuriem testa rezultātu klasificē kā pozitīvu vai negatīvu,
— sīkas ziņas par novirzēm no protokola un paskaidrojums par to, kādā veidā šī novirze ietekmē pētījuma plānu un rezultātus.
Ticamības pārbaude:
— jaunākās ticamības pārbaudes rezultātu kopsavilkums, iekļaujot informāciju par testējamo vielu, tās koncentrāciju un nesēju,
— vienlaicīgi un/vai vēsturiski PC un vienlaicīgi negatīvās (šķīdinātājs/nesējs) kontroles dati no testēšanas laboratorijas,
— ja vienlaicīga PC nav paredzēta: datums un laboratorijas pārskats par nesenāko kārtējo PC un pārskats par agrāko PC datiem konkrētajā laboratorijā, kuri pamato vienlaicīgas PC neveikšanu.
Rezultāti:
— individuālu peļu masa dozēšanas sākumā un veicot plānoto nonāvēšanu; vidējās vērtības un attiecīgais kļūdas apzīmējums (piem., SD, SEM) katrai apstrādes grupai,
— toksicitātes parādīšanās gaita un pazīmes, iekļaujot ādas kairinājumu ievadīšanas vietā, ja tāds ir, katram dzīvniekam,
— dzīvnieka nonāvēšanas laiks un ATP mērījuma laiks katram dzīvniekam,
— tabula ar individuālu peļu RLU vērtībām un SI vērtībām visām devām katrā apstrādes grupā,
— vidējās vērtības un attiecīgais kļūdas apzīmējums (piem., SD, SEM) par RLU katrai pelei katrā apstrādes grupā un galējību jeb rupju kļūdu analīze katrā apstrādes grupā,
— aprēķinātais SI un attiecīgs mainības mērs, kas ņem vērā to, ka ne testējamās vielas grupā, ne kontroles grupā dzīvnieki nav identiski,
— devas un atbildes reakcijas sakarības,
— attiecīgā gadījumā, statistiskā analīze.
Rezultātu izvērtējums:
— īss komentārs par rezultātiem, atbildes reakcijas uz devu analīzi un, attiecīgā gadījumā, statistisko analīzi ar secinājumu, vai testējamā viela jāuzskata par ādas sensibilizatoru.
IZMANTOTĀ LITERATŪRA
1) OECD (2010), Skin Sensitisation: Local Lymph Node Assay, Test Guideline No. 429, Guidelines for the Testing of Chemicals, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
2) Chamberlain, M. and Basketter, D.A. (1996), The local lymph node assay: status of validation. Food Chem, Toxicol., 34, 999-1002.
3) Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E. (1996), The local lymph node assay: A viable alternative to currently accepted skin sensitisation tests. Food Chem, Toxicol., 34, 985-997.
4) Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998), Strategies for identifying false positive responses in predictive sensitisation tests. Food Chem. Toxicol., 36, 327-333.
5) Van Och, F.M.M., Slob, W., De Jong, W.H., Vandebriel, R.J. and Van Loveren, H. (2000), A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employment of a regression method that includes determination of uncertainty margins. Toxicol., 146, 49-59.
6) ICCVAM (1999), The murine local lymph node Assay: A test method for assessing the allergic contact dermatitis potential of chemicals/compounds: The results of an independent peer review evaluation coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494. Research Triangle Park, N.C. Available at: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna/llnarep.pdf]
7) Dean, J.H., Twerdok, L.E., Tice, R.R., Sailstad, D.M., Hattan, D.G., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: II. Conclusions and recommendations of an independent scientific peer review panel. Reg. Toxicol. Pharmacol. 34, 258-273.
8) Haneke, K.E., Tice, R.R., Carson, B.L., Margolin, B.H., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: III. Data analyses completed by the national toxicology program interagency center for the evaluation of alternative toxicological methods. Reg. Toxicol. Pharmacol. 34, 274-286.
9) Sailstad, D.M., Hattan, D., Hill, R.N., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: I. The ICCVAM review process.Reg. Toxicol. Pharmacol. 34, 249-257.
10) ICCVAM (2010), ICCVAM Test Method Evaluation Report. Nonradioactive local lymph node assay: modified by Daicel Chemical Industries, Ltd., based on ATP content test method protocol (LLNA: DA). NIH Publication No. 10-7551A/B. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/methods/immunotox/llna-DA/TMER.htm]
11) ICCVAM (2009), Independent Scientific Peer Review Panel Report: Updated validation status of new versions and applications of the murine local lymph node assay: a test method for assessing the allergic contact dermatitis potential of chemicals and products. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/LLNAPRPRept2009.pdf].
12) Idehara, K., Yamagishi, G., Yamashita, K. and Ito, M. (2008), Characterization and evaluation of a modified local lymph node assay using ATP content as a non-radio isotopic endpoint.J. Pharmacol. Toxicol. Meth., 58, 1-10.
13) Omori, T., Idehara, K., Kojima, H., Sozu, T., Arima, K., Goto, H., Hanada, T., Ikarashi, Y., Inoda, T., Kanazawa, Y., Kosaka, T., Maki, E., Morimoto, T., Shinoda, S., Shinoda, N., Takeyoshi, M., Tanaka, M., Uratani, M., Usami, M., Yamanaka, A., Yoneda, T., Yoshimura, I. and Yuasa, A. (2008), Interlaboratory validation of the modified murine local lymph node assay based on adenosine triphosphate measurement. J. Pharmacol. Toxicol. Meth., 58, 11-26.
14) OECD (1992), Skin Sensitisation, Test Guideline No. 406, Guidelines for Testing of Chemicals, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
15) Kreiling, R., Hollnagel, H.M., Hareng, L., Eigler, L., Lee, M.S., Griem, P., Dreessen, B., Kleber, M., Albrecht, A., Garcia, C. and Wendel, A. (2008), Comparison of the skin sensitising potential of unsaturated compounds as assessed by the murine local lymph node assay (LLNA) and the guinea pig maximization test (GPMT). Food Chem. Toxicol., 46, 1896-1904.
16) Basketter, D., Ball, N., Cagen, S., Carrillo, J.C., Certa, H., Eigler, D., Garcia, C., Esch, H., Graham, C., Haux, C., Kreiling, R. and Mehling, A. (2009), Application of a weight of evidence approach to assessing discordant sensitisation datasets: implications for REACH. Reg. Toxicol. Pharmacol., 55, 90-96.
17) Crouch, S.P., Kozlowski, R., Slater, K.J. and Fletcher J. (1993), The use of ATP bioluminescence as a measure of cell proliferation and cytotoxicity. J. Immunol. Meth., 160, 81-88.
18) Ishizaka, A., Tono-oka, T. and Matsumoto, S. (1984), Evaluation of the proliferative response of lymphocytes by measurement of intracellular ATP. J. Immunol. Meth., 72, 127-132.
19) Dexter, S.J., Cámara, M., Davies, M. and Shakesheff, K.M. (2003), Development of a bioluminescent ATP assay to quantify mammalian and bacterial cell number from a mixed population. Biomat., 24, 27-34.
20) Lundin A. (2000), Use of firefly luciferase in ATP-related assays of biomass, enzymes, and metabolites. Meth. Enzymol., 305, 346-370.
21) ILAR (1996), Institute of Laboratory Animal Research (ILAR) Guide for the Care and Use of Laboratory Animals. 7th ed. Washington, DC: National Academies Press.
22) ICCVAM (2009), Recommended Performance Standards: Murine Local Lymph Node Assay, NIH Publication Number 09-7357, Research Triangle Park, NC: National Institute of Environmental Health Science. Available at: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna-ps/LLNAPerfStds.pdf]
23) McGarry, H.F. (2007), The murine local lymph node assay: regulatory and potency considerations under REACH. Toxicol., 238, 71-89.
24) Kimber, I., Dearman, R.J., Scholes E.W. and Basketter, D.A. (1994), The local lymph node assay: developments and applications. Toxicol., 93, 13-31.
25) OECD (2002), Acute Dermal Irritation/Corrosion, Test Guideline No. 404, Guidelines for Testing of Chemicals, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
26) Reeder, M.K., Broomhead, Y.L., DiDonato, L. and DeGeorge, G.L. (2007), Use of an enhanced local lymph node assay to correctly classify irritants and false positive substances. Toxicologist, 96, 235.
27) ICCVAM (2009), Nonradioactive Murine Local Lymph Node Assay: Flow Cytometry Test Method Protocol (LLNA: BrdU-FC) Revised Draft Background Review Document. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/methods/immunotox/fcLLNA/BRDcomplete.pdf].
28) Hayes, B.B., Gerber, P.C., Griffey, S.S. and Meade, B.J. (1998), Contact hypersensitivity to dicyclohexylcarbodiimide and diisopropylcarbodiimide in female B6C3F1 mice. Drug. Chem. Toxicol., 21, 195-206.
29) Homey, B., von Schilling, C., Blumel, J., Schuppe, H.C., Ruzicka, T., Ahr, H.J., Lehmann, P. and Vohr, V.W. (1998), An integrated model for the differentiation of chemical-induced allergic and irritant skin reactions. Toxicol. Appl. Pharmacol., 153, 83-94.
30) Woolhiser, M.R., Hayes, B.B. and Meade, B.J. (1998), A combined murine local lymph node and irritancy assay to predict sensitisation and irritancy potential of chemicals. Toxicol. Meth., 8, 245-256.
31) Hayes, B.B. and Meade, B.J. (1999), Contact sensitivity to selected acrylate compounds in B6C3F1 mice: relative potency, cross reactivity, and comparison of test methods. Drug Chem. Toxicol., 22, 491-506.
32) Ehling, G., Hecht, M., Heusener, A., Huesler, J., Gamer, A.O., van Loveren, H., Maurer, T., Riecke, K., Ullmann, L., Ulrich, P., Vandebriel, R. and Vohr, H.W. (2005), A European inter-laboratory validation of alternative endpoints of the murine local lymph node assay: first round. Toxicol., 212, 60-68.
33) Vohr, H.W. and Ahr, H.J. (2005), The local lymph node assay being too sensitive? Arch. Toxicol., 79, 721-728.
34) Patterson, R.M., Noga, E. and Germolec, D. (2007), Lack of evidence for contact sensitisation by Pfiesteria extract. Environ. Health Perspect., 115, 1023-1028.
35) ICCVAM (2009), Report on the ICCVAM-NICEATM/ECVAM/JaCVAM Scientific Workshop on Acute Chemical Safety Testing: Advancing In Vitro Approaches and Humane Endpoints for Systemic Toxicity Evaluations. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/methods/acutetox/Tox_workshop.htm]
36) OECD (2000), Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation, Environmental Health and Safety Monograph Series on Testing and Assessment No. 19, ENV/JM/MONO(2000)7, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
37) Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E. and Hastings, K.L. (1998), Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. J. Toxicol. Environ. Health, 53 563-79.
38) OECD (2005), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, Environment, Health and Safety Monograph Series on Testing and Assessment No. 34, ENV/JM/MONO(2005)14, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
1. papildinājums
DEFINĪCIJAS
Pareizība : pēc testēšanas metodes iegūto mērījumu rezultātu sakritības pakāpe ar pieņemtajām references vērtībām. Tas ir testēšanas metodes veiktspējas raksturlielums un viens no tās piemērotības aspektiem. Šo terminu bieži izmanto “atbilstības” vietā, ar to apzīmējot pēc testēšanas metodes iegūto pareizo rezultātu daļu (38).
Salīdzināšanas viela : sensibilizējoša vai nesensibilizējoša viela, ko izmanto par standartu salīdzināšanai ar testējamo vielu. Salīdzināšanas vielai ir jābūt: (i) pastāvīgs un uzticams ieguves avots; (ii) struktūras un funkciju līdzība ar testējamo vielu klases vielām; (iii) zināmas fizikāli ķīmiskās īpašības; (iv) papildu datiem par zināmajiem iedarbības veidiem; (v) vielas zināmajam iedarbības stiprumam jāatbilst vēlamās reakcijas intensitātes diapazonam.
Šķietams negatīvs : viela, kurai ar testēšanas metodi kļūdaini noteikta negatīva vai neaktīva reakcija, lai gan faktiski tā ir pozitīva vai aktīva.
Šķietams pozitīvs : viela, kurai ar testēšanas metodi kļūdaini noteikta pozitīva vai aktīva reakcija, lai gan faktiski tā ir negatīva vai neaktīva.
Bīstamība : potenciālā spēja kaitēt veselībai vai videi. Kaitīgā iedarbība kļūst nosakāma tikai tad, ja iedarbības intensitāte ir pietiekami liela.
Starplaboratoriju reproducējamība : lielums, kas raksturo, kādā mērā vairākas kvalificētas laboratorijas spēj iegūt kvalitatīvi un kvantitatīvi līdzīgus rezultātus, ja tās izmanto vienu un to pašu protokolu un vienas un tās pašas testējamās vielas. Starplaboratoriju reproducējamību (saukta arī par interlaboratoriju reproducējamību) nosaka prevalidēšanas un validēšanas procesā, un šis lielums rāda, cik lielā mērā testēšanu vienlīdz sekmīgi iespējams veikt dažādās laboratorijās (38).
Iekšlaboratorijas reproducējamība : lielums, kas raksturo, kādā mērā vienā laboratorijā strādājoši kvalificēti darbinieki spēj sekmīgi atkārtot iepriekš iegūtus rezultātus, ja to pašu protokolu izmanto citā laikā. Saukts arī par intralaboratoriju reproducējamību (38).
Galējība jeb rupja kļūda : novērojums, kuru raksturo izteikta novirze no pārējām vērtībām populācijas paraugā, kurš atlasīts pēc nejaušības principa.
Kvalitātes nodrošināšana : pārvaldības process, kurā laboratorijas testēšanas standartu, prasību un pierakstu uzturēšanas procedūru ievērošanu un datu pārneses pareizību novērtē no testēšanas veicējiem neatkarīgas personas.
Ticamība : parametrs, ar kuru mēra pakāpi, kādā tajā pašā vai citā laboratorijā ilgākā laikā, izmantojot to pašu protokolu, var iegūt reproducējamus rezultātus. To novērtē, aprēķinot iekšlaboratorijas un starplaboratoriju reproducējamību (38).
Ādas sensibilizācija : imunoloģisks process, kurš norisinās, ja uz uzņemtspējīgu organismu ārēji iedarbojas stimulējošs ķīmisks alergēns, kas izraisa ādas imūnreakciju, kuras rezultāts var būt kontaktsensibilizācija.
Stimulācijas indekss (SI) : vērtība, ko aprēķina, lai novērtētu testējamai vielai piemītošo ādas sensibilizācijas potenciālu; to izsaka kā attiecību starp progresiju grupās, kas saņēmušas pētāmo vielu, un progresiju kontroles grupā, kas saņēmusi tikai nesēju.
Testējamā viela (arī testējamā ķīmiskā viela) : viela vai vielu maisījums, kuru testē ar šo TM.
B.51. ĀDAS SENSIBILIZĀCIJA: LOKĀLO LIMFMEZGLU NOTEIKŠANA (LLNA:BrdU-ELISA)
IEVADS
1. ESAO ķīmisko vielu testēšanas vadlīnijas un ES testēšanas metodes tiek regulāri pārskatītas, ņemot vērā tehnikas attīstību, regulatīvo prasību izmaiņas un dzīvnieku labturības apsvērumus. Ir pārskatīta B.42 – pirmā no testēšanas metodēm (TM) ādas sensibilizācijas noteikšanai pelēm jeb lokālo limfmezglu noteikšanas metode (LLNA; ESAO 429. testēšanas vadlīnijas) (1; šā pielikuma B.42. nodaļa). Ir publicēti sīki dati par LLNA validāciju un pārskats par saistītajiem darbiem (2) (3) (4) (5) (6) (7) (8) (9). Lai mērītu limfocītu savairošanos, LLNA izmanto radioizotopisko timidīnu vai jodīnu, un tāpēc šīs metodes pielietošana ir ierobežota gadījumos, kad radioaktīvo komponentu iegāde, izmantošana vai apglabāšana ir problemātiska. LLNA:BrdU-ELISA [Enzyme-Linked Immunosorbent Assay, konkurējošā imūnfermentācijas analīze] ir modificēta LLNA, kurā nav radioaktīvo komponentu un kurā izmanto ar radioaktīvajiem izotopiem neiezīmētu 5-brom-2-deoksiuridīnu (BrdU) (Chemical Abstracts Service [CAS] Nr. 59-14-3), lai ar testēšanas sistēmu, kuras pamatā ir ELISA metode, mērītu limfocītu savairošanos. LLNA:BrdU-ELISA testēšanas metode ir validēta, to ir pārskatījusi starptautiska neatkarīga salīdzinošās zinātniskās izvērtēšanas komisija un ir rekomendējusi šo metodi kā tādu, kas ar dažiem ierobežojumiem uzskatāma par noderīgu ādu sensibilizējošu un nesensibilizējošu ķīmisku vielu identificēšanai (10) (11) (12). Šī TM ir izstrādāta, lai novērtētu ķīmiskām vielām vai to maisījumiem piemītošo ādas sensibilizācijas potenciālu (dzīvniekiem). Šā pielikuma B.6. nodaļā un ESAO 406. testēšanas vadlīnijās aprakstītā metode izmanto testēšanu ar jūrascūciņām, proti, maksimizācijas testu jūrascūciņām un Bīlera testu (13). LLNA (šā pielikuma B.42. nodaļa; ESAO 429. testēšanas vadlīnijas) un abas šīs metodes modifikācijas, kurās nav radioaktīvo komponentu, proti, LLNA:BrdU-ELISA (šā pielikuma B.51. nodaļa; ESAO 442.b testēšanas vadlīnijas) un LLNA:DA (šā pielikuma B.50. nodaļa; ESAO 442.a testēšanas vadlīnijas), visas ir pārākas par testēšanas metodēm ar jūrascūciņām, kas aprakstītas B.6 un ESAO 406. testēšanas vadlīnijās (13), dzīvnieku skaita samazinājuma un labāka izmantojuma ziņā.
2. Līdzīgi kā LLNA, ar LLNA:BrdU-ELISA pēta ādas sensibilizācijas indukcijas fāzi un sniedz kvantitatīvus datus, kas piemēroti atbildes reakcijas uz devu novērtēšanai. Turklāt iespēja noteikt ādas sensibilizatorus, neizmantojot radioaktīvus DNS marķierus, atbrīvo no vajadzības risināt arodapstarošanas un radioaktīvo atkritumu apglabāšanas jautājumus. Tas savukārt ļauj ādas sensibilizatoru noteikšanai biežāk izmantot peles un turpināt samazināt jūrascūciņu izmantošanu ādas sensibilizācijas potenciāla testēšanā (t. i., B.6; ESAO 406. testēšanas vadlīnijas) (13).
DEFINĪCIJAS
3. Definīcijas skatīt 1. papildinājumā.
SĀKOTNĒJIE APSVĒRUMI UN IEROBEŽOJUMI
4. LLNA:BrdU-ELISA metode ir modificēta LLNA, kura paredzēta ķīmisko vielu – potenciālu ādas sensibilizatoru identificēšanai un kurai ir zināmi ierobežojumi. Tas nenozīmē, ka visos gadījumos LLNA:BrdU-ELISA būtu jālieto LLNA vai jūrascūciņu testa vietā (B.6; ESAO 406. testēšanas vadlīnijas) (13), bet gan to, ka šī noteikšana ir minētajam testam līdzvērtīga un to var izmantot kā alternatīvu, kuras pozitīvajam vai negatīvajam rezultātam vairs nav vajadzīgs papildu apstiprinājums (10) (11). Pirms uzsākt pētījumus, testēšanas laboratorijai jāņem vērā visa par testējamo vielu pieejamā informācija. Pie šādas informācijas pieder tās identifikācija un ķīmiskā struktūra, fizikāli ķīmiskās īpašības, citu in vitro vai in vivo veikto toksicitātes testu rezultāti un toksikoloģiskie dati par struktūras ziņā saistītām vielām. Šī informācija jāizvērtē, lai noteiktu LLNA:BrdU-ELISA piemērotību konkrētajai testējamai vielai (ņemot vērā atsevišķu veidu vielu nesaderību ar LLNA:BrdU-ELISA; skatīt 5. punktu) un lai izraudzītos pareizu testējamās vielas devu.
5. LLNA:BrdU-ELISA ir in vivo metode un kā tāda paredz dzīvnieku izmantošanu alerģiskās kontakta sensibilizējošās aktivitātes novērtējumā. Tomēr salīdzinājumā ar testēšanas metodēm, kurās izmanto jūrascūciņas (B.6; ESAO 406. testēšanas metode), tajā iespējams izmantot mazāku skaitu dzīvnieku (13). LLNA:BrdU-ELISA turklāt piedāvā būtisku uzlabojumu dzīvnieku izmantojumā alerģiskās kontakta sensibilizējošās testēšanas vajadzībām, jo (atšķirībā no B.6 un ESAO 406. testēšanas vadlīnijām) LLNA:BrdU-ELISA nav jānoskaidro provocētās–inducētās ādas hipersensibilizācijas reakcijas. Turklāt LLNA:BrdU-ELISA nav jāizmanto palīgviela, kā tas ir jūrascūciņu maksimizācijas testā (šā pielikuma B.6. nodaļa; 13). Tādā veidā LLNA:BrdU-ELISA samazina dzīvnieku ciešanas. Neraugoties uz LLNA:BrdU-ELISA priekšrocībām salīdzinājumā ar B.6 un ESAO 406. testēšanas vadlīnijām (13), šai metodei ir daži ierobežojumi, kuru dēļ tomēr jāizmanto B.6 vai ESAO 406. testēšanas vadlīniju metode (piemēram, dažu metālu testēšanā, šķietami pozitīva rezultāta konstatēšanas gadījumā dažiem ādas sensibilizatoriem [kā, piemēram, atsevišķām surfaktantu tipa vielām] (6) (1; šā pielikuma B.42. nodaļa) vai testējamās vielas šķīdības labad). Turklāt vajadzība pēc jūrascūciņu testiem (B.6 un ESAO 406. testēšanas vadlīnijas) (13) var saglabāties attiecībā uz ķīmisko vielu klasēm vai vielām, kuru sastāvā ir funkcionālās grupas, par kurām ir pierādīts, ka tās darbojas kā potenciāli sajaucējfaktori (15). Ierobežojumus, kuri konstatēti LLNA gadījumā (1; šā pielikuma B.42. nodaļa) ieteicams attiecināt arī uz LLNA:BrdU-ELISA (10). Izņemot šādus minētos ierobežojumus, LLNA:BrdU-ELISA jāvar izmantot jebkuras ķīmiskas vielas testēšanai, ja vien testējamai ķīmiskajai vielai nav tādu īpašību, kas varētu ietekmēt LLNA:BrdU-ELISA precizitāti. Ja stimulācijas indeksa (SI) vērtība ir robežās no 1,6 līdz 1,9, jāapsver neitrālam tuva pozitīva rezultāta iespējamība (skatīt 31.–32. punktu). Šā apgalvojuma pamatā ir validēšanas datubāze, kuru veido 43 vielas ar SI ≥ 1,6 (skatīt 6. punktu); LLNA:BrdU-ELISA pareizi identificēja visus 32 LLNA sensibilizatorus, bet kļūdaini identificēja divus no 11 LLNA nesensibilizējošajām vielām, kuru SI vērtības bija robežās no 1,6 līdz 1,9 (t. i., pozitīvs neitrālam tuvs rezultāts) (10). Tomēr, tā kā SI vērtību noteikšanai un testēšanas metodes prognozēšanas spējas aprēķināšanai tika izmantota viena un tā pati datu kopa, minētie rezultāti var būt pārāk augsts reālās prognozēšanas spējas novērtējums.
TESTĒŠANAS METODES PRINCIPS
6. LLNA:BrdU-ELISA pamatprincips ir tāds, ka sensibilizatori inducē limfocītu savairošanos limfmezglos, kuri drenē testējamās vielas saņemšanas vietu. Šī savairošanās ir proporcionāla devai un alergēna iedarbīgumam un ir vienkāršs paņēmiens, lai iegūtu kvantitatīvu sensitivitātes mērījumu. Savairošanās pakāpi nosaka, vidējo savairošanos katrā testējamās vielas grupā salīdzinot ar vidējo savairošanos kontroles grupā, kas saņēmusi tikai nesēju (VC). Nosaka attiecību starp vidējo progresiju grupās, kas saņēmušas pētāmo vielu, un progresiju VC grupā; tas ir stimulācijas indekss (SI). Lai testējamo vielu pamatoti turpinātu vērtēt kā potenciālu ādas sensibilizatoru, SI vērtībai jābūt ≥ 1,6. Šeit aprakstīto procedūru pamatā ir BrdU satura noteikšana šūnu savairošanās izmērīšanai aurikulārajos limfmezglos. BrdU ir timidīna analogs un vairojošos šūnu DNS sastāvā iekļaujas līdzīgā veidā. BrdU iekļaušanās pakāpi mēra ar ELISA metodi, kurā lieto BrdU specifisku antivielu, kas turklāt iezīmēta ar peroksidāzi. Kad pievieno substrātu, peroksidāze ar to reaģē, un reakcijas produktam ir krāsa; reakcijas produkta daudzumu mēra noteiktā absorbcijas režīmā, izmantojot mikrotitrēšanas plati.
METODES APRAKSTS
Dzīvnieku sugas izvēle
7. Šim testam izvēlētā suga ir peles. LLNA:BrdU-ELISA validēšanas pētījumi ir veikti vienīgi ar CBA/JN līnijas dzīvniekiem, un tāpēc to uzskata par ieteicamo līniju (10) (12). Izmanto jaunas, pieaugušas sievišķā dzimuma peles, kas nav dzemdējušas un nav grūsnas. Pētījuma sākumā dzīvniekiem jābūt 8–12 nedēļu veciem, dzīvnieku masas atšķirībām jābūt minimālām un ne lielākām par 20 % no vidējās masas. Citas līnijas un vīrišķā dzimuma dzīvniekus var izmantot, ja ir iegūts pietiekami daudz datu, lai parādītu, ka LLNA:BrdU-ELISA atbildes reakcijā nav nozīmīgu atšķirību, kas specifiskas līnijai un/vai dzimumam.
Turēšanas un barošanas apstākļi
8. Ja nav zinātniska pamatojuma, kāpēc peles būtu turamas katra atsevišķi, peles izmitina grupā (16). Telpā, kurā tur izmēģinājumu dzīvniekus, jābūt 22 ± 3 °C temperatūrai. Lai gan, izņemot telpu uzkopšanas laiku, relatīvajam mitrumam jābūt vismaz 30 % un vēlams ne vairāk kā 70 %, tas jāuztur 50-60 % robežās. Apgaismojumam jābūt mākslīgam atbilstoši secībai 12 stundas gaišas, 12 stundas tumšas. Barošanai var izmantot parasto laboratorijas barību ar neierobežotu dzeramā ūdens daudzumu.
Dzīvnieku sagatavošana
9. Dzīvniekus izvēlas pēc nejaušības principa, marķē individuālai identificēšanai (bet nekādā veidā nemarķē ausis) un tur būros vismaz piecas dienas pirms testa sākuma, lai tos aklimatizētu laboratorijas apstākļos. Pirms apstrādes uzsākšanas visus dzīvniekus apskata, lai pārliecinātos, ka tiem nav novērojami ādas bojājumi.
Testa šķīdumu sagatavošana
10. Cietas ķīmiskās vielas pirms peļu ausu apstrādes izšķīdina vai suspendē, izmantojot šķīdinātājus vai nesējus, un vajadzības gadījumā atšķaida. Šķidras ķīmiskās vielas var izmantot gan atšķaidītas, gan neatšķaidītas. Nešķīstošas ķīmiskās vielas (kādas parasti izmanto medicīnas iekārtās) pirms peļu ausu apstrādes ekstrahē piemērotā šķīdinātājā, lai visas ekstrahējamās sastāvdaļas būtu pieejamas testēšanai. Ja dati par testējamo vielu stabilitāti liecina, ka tās uzglabāt nevar, katru dienu sagatavo svaigas testējamās vielas.
Ticamības pārbaude
11. Metodes veiktspējas pienācīgumu parāda ar pozitīvās kontroles vielu (PC) palīdzību, kas ar adekvātu un reproducējamu sensibilitāti reaģē kā sensibilizējošas testēšanas vielas, kuru reakcijas intensitāte ir sīki aprakstīta. Ieteicams paredzēt vienlaicīgu PC, jo tādā veidā var pierādīt laboratorijas spēju atkārtoti un sekmīgi īstenot noteikšanu, kā arī novērtēt iekšlaboratorijas un starplaboratoriju reproducējamību un rezultātu salīdzināmību. Pirms LLNA:BrdU-ELISA ieteicams lietotājiem konsultēties ar atbildīgajām iestādēm, jo dažas regulatīvās iestādes pieprasa PC izmantošanu katrā individuālā pētījumā. Attiecīgi labāk ir ikreiz izmantot vienlaicīgu PC, jo tas ļauj neveikt papildu testēšanu ar dzīvniekiem, lai izpildītu prasības, kuras var izrietēt no PC neregulāras izmantošanas (skatīt 12. punktu). PC jādod pozitīva LLNA:BrdU-ELISA atbildes reakcija tādā iedarbības līmenī, kurā ir sagaidāms stimulācijas indekss (SI) ≥ 1,6, salīdzinot ar negatīvās kontroles vielu (NC) grupu. PC deva jāizvēlas tā, lai neizraisītu pārmērīgu ādas kairinājumu vai sistēmisku toksicitāti un lai indukcija būtu atkārtojama, taču ne pārmērīga (piemēram, SI > 14 uzskata par pārmērīgu). Ieteicamākās PC ir 25 % heksilkanēļskābes aldehīds (CAS Nr. 101-86-0) un 25 % eigenols (CAS Nr. 97-53-0) ar acetonu/olīveļļu (4:1 tilp./tilp.). Var būt apstākļi, kad ar pienācīgu pamatojumu var izmantot citas PC, kas atbilst iepriekš minētajiem kritērijiem.
12. Lai gan vienlaicīgas PC grupas izmantošana ir ieteicama, var būt situācijas, kad laboratorijās, kurās LLNA:BrdU-ELISA veic regulāri (t. i., vismaz reizi mēnesī) un kurās tāpēc ir vēsturiska PC datubāze, kas pierāda laboratorijas spēju ar PC iegūt reproducējamus un pareizus rezultātus, piemērotāka var izrādīties periodiska PC izmantošana (t. i., vismaz reizi 6 mēnešos). LLNA:BrdU-ELISA metodes adekvātu pārzināšanu var sekmīgi pierādīt, ar PC iegūstot konsekventus pozitīvus rezultātus vismaz 10 neatkarīgās testēšanas reizēs, kuras veiktas samērīgā laika periodā (t. i., ne ilgāk kā gada laikā).
13. Vienlaicīga PC grupa noteikti jāiekļauj, kad LLNA:BrdU-ELISA notiek procedurālas izmaiņas (piemēram, augsti kvalificēta personāla nomaiņa, testēšanas metodes materiālu un/vai reaģentu nomaiņa, cits izmēģinājumu dzīvnieku piegādātājs), un šādas izmaiņas pienācīgi jādokumentē laboratorijas pārskatos. Jānovērtē šādu izmaiņu ietekme uz iepriekš izveidotās vēsturiskās datubāzes adekvātumu un tas, vai vajag veidot jaunu vēsturisku datubāzi, lai dokumentētu ar PC iegūtu rezultātu konsekvenci.
14. Pētniekiem jāapzinās, ka lēmums par periodisku, nevis vienlaicīgu PC izmantošanu ietekmēs to, kādā mērā par adekvātiem un pieņemamiem varēs uzskatīt negatīvos pētījumu rezultātus, kas bez vienlaicīgas PC iegūti periodiskās PC izmantošanas starplaikos. Piemēram, ja ar periodisko PC pētījumu iegūst šķietami negatīvu rezultātu, var apšaubīt negatīvu testējamās vielas rezultātu, kas iegūts iepriekšējā pieņemamā periodiskā PC pētījuma un nepieņemamā periodiskā PC pētījuma starplaikā. Tāpēc rūpīgi jāizvērtē, vai izmantot vienlaicīgu vai periodisku PC. Tāpat jāizvērtē, kādas ir iespējas vienlaicīgās PC grupā izmantot mazāk dzīvnieku, ja to var zinātniski pamatot un ja laboratorija ar saviem specifiskajiem vēsturiskajiem datiem var pierādīt, ka ir iespējams izmantot mazāk peļu (17).
15. Kaut arī PC jātestē nesējā, par kuru ir zināms, ka tas izrāda viendabīgu atbildes reakciju (piemēram, acetons/olīveļļa; 4:1 tilp./tilp.), var būt dažas reglamentējošas situācijas, kurās būs nepieciešama arī testēšana nestandarta nesējā (klīniski/ķīmiski piederīgs sastāvs) (18). Ja vienlaicīgo PC testē ar citu nesēju nekā testējamo vielu, vienlaicīgās PC vajadzībām jāparedz atsevišķs VC.
16. Ja vērtē testējamās vielas, kas pieder konkrētai ķīmisko vielu klasei vai kas dod noteikta diapazona reakciju, var izmantot salīdzināšanas vielas, kuras noder, lai parādītu, ka testēšanas metode darbojas un pienācīgi nosaka šā tipa testējamām vielām piemītošo ādas sensibilizācijas potenciālu. Pienācīgām salīdzināšanas vielām ir jāpiemīt šādām īpašībām:
— strukturāla un funkcionāla līdzība ar testējamās vielas klases vielām,
— labi zināmas fizikālās un ķīmiskās īpašības,
— papildinoši dati no LLNA:BrdU-ELISA,
— papildinoši dati saistībā ar citiem dzīvniekiem un/vai cilvēku.
TESTA PROCEDŪRA
Dzīvnieku skaits un devu līmeņi
17. Uz devas grupu ar vismaz trim testējamās vielas koncentrācijām izmanto vismaz četrus dzīvniekus un vienlaicīgas NC grupu, kas saņem tikai testējamās vielas nesēju, un PC grupu (vienlaicīgu vai nesenu atkarībā no laboratorijas prakses un saistībā ar 11.–15. punktu). Jāapsver iespēja testēt vairākas PC devas, īpaši tad, ja PC testēšana ir periodiska. Izņemot apstrādi ar testējamo vielu, ar kontroles grupu dzīvniekiem rīkojas tieši tāpat kā ar apstrādāto grupu dzīvniekiem.
18. Devu un nesēja izvēlei jāpamatojas uz atsaucē (2) un (19) sniegtajiem ieteikumiem. Secīgas devas parasti izraugās no atbilstošas koncentrāciju rindas, kā 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 %, u. c. Koncentrāciju rindas izvēlei jābūt ar adekvātu zinātnisku pamatojumu. Jāizvērtē visa esošā toksikoloģiskā (piemēram, akūta toksicitāte un dermālais kairinājums) un struktūras un fizikālķīmiskā informācija par attiecīgo testējamo vielu (un/vai par struktūras ziņā saistītām vielām), ja tāda ir, un trīs secīgās koncentrācijas jāizraugās tā, lai augstākā no tām izraisītu stiprāko iedarbību, kura vēl nerada sistēmisku toksicitāti un/vai pārmērīgu lokālu ādas kairinājumu (19) (20 un šā pielikuma B.4. nodaļa). Ja šādas informācijas nav, sākumā var būt jāveic priekšskrīninga tests (skatīt 21.–24. punktu).
19. Nesējs nedrīkst pārmainīt vai maskēt testēšanas rezultātus, un tas jāizraugās tāds, lai šķīdība būtu iespējami lielāka, tā ļaujot iegūt augstāko reāli sasniedzamo koncentrāciju un iegūstot šķīdumu/suspensiju, kas būtu derīga testējamās vielas pielietošanai. Ieteicamie nesēji ir acetons/olīveļļa (4:1 tilp./tilp.), N,N-dimetilformamīds, metiletilketons, propilēnglikols un dimetilsulfoksīds (6), bet var izmantot arī citus, ja tam ir pietiekams zinātniskais pamatojums. Dažos gadījumos papildu kontrolei jāizmanto klīniski atbilstošs šķīdinātājs vai tirdzniecības preparāts, kura sastāvā testējamo vielu tirgo. Īpaši jārūpējas, lai nodrošinātu to, ka hidrofīlas testējamās vielas ir iekļautas nesēja sistēmā, kas mitrina ādu un tūlīt nenotek, un jāizmanto pienācīgi šķīdinātāji (piemēram, 1 % Pluronic® L92). Tādēļ ir jāizvairās no nesējiem, kas satur vienīgi ūdeni.
20. Izpētot no individuālām pelēm iegūtus limfmezglus, var novērtēt dzīvnieku savstarpējās atšķirības un iegūt testējamās vielas grupas un VC grupas mērījumu statistisku salīdzinājumu (skatīt 33. punktu). Turklāt PC grupas peļu skaita iespējamā samazinājuma izvērtējumam jēga ir vienīgi tad, ja dati ir par individuāliem dzīvniekiem (17). Dažas regulatīvās iestādes prasa, lai dati būtu par individuāliem dzīvniekiem. Regulāra datu vākšana par individuāliem dzīvniekiem dod priekšrocības dzīvnieku labturības ziņā, jo ļauj izvairīties no atkārtotas testēšanas gadījumā, ja vielas testēšanas rezultātus sākotnēji apkopo vienā veidā (piemēram, par apstrādes grupu), bet regulatīvās iestādes vēlāk izvirza citas prasības (piemēram, pieprasa datus par individuāliem dzīvniekiem).
Priekšskrīninga tests
21. Ja nav informācijas, lai noteiktu augstāko testējamo devu (skatīt 18. punktu), jāveic priekšskrīninga tests, lai definētu ar LLNA:BrdU-ELISA testējamo atbilstošo devas līmeni. Priekšskrīninga testa mērķis ir būt par orientieri ar LLNA:BrdU-ELISA testējamā maksimālā devas līmeņa izvēlē, ja nav informācijas par koncentrāciju, kādā testējamā viela izraisa sistēmisku toksicitāti (skatīt 24. punktu) un/vai pārmērīgu lokālu ādas kairinājumu (skatīt 23. punktu). Maksimālajai testējamās vielas devas koncentrācijai vajadzētu būt 100 % (šķidrumiem) un augstākajai iespējamajai koncentrācijai (cietām vielām un suspensijām).
22. Priekšskrīninga testa apstākļi ir identiski pamata LLNA:BrdU-ELISA apstākļiem, izņemot to, ka nevērtē progresiju limfmezglos un ka devas grupā var izmantot mazāku skaitu dzīvnieku. Ieteicamais skaits ir viens vai divi dzīvnieki katrā devas grupā. Visām pelēm ik dienas pārbauda to, vai apstrādes vietā nav klīnisku pazīmju, kas liecinātu par sistēmisku toksicitāti vai lokālu kairinājumu. Pirms testa un tā beigās (6. diena) reģistrē dzīvnieku ķermeņa masu. Katrai peles apskata abas ausis, un iespējamo apsārtumu novērtē pēc 1. tabulas punktu skalas (20; šā pielikuma B.4. nodaļa). Auss biezumu mēra ar piemērotu mērierīci (piemēram, digitālo mikrometru vai “Peacock” tipa biezuma mērierīci) 1. dienā (pirms devas), 3. dienā (aptuveni 48 stundas pēc pirmās devas) un 6. dienā. Turklāt 6. dienā auss biezumu var mērīt ar auss caursišanas paņēmienu pēc tam, kad dzīvnieki ir humāni nonāvēti. Lokālu kairinājumu uzskata par pārmērīgu tad, ja jebkurā mērījumu dienā apsārtuma novērtējums pēc punktu skalas ir ≥ 3 un/vai auss biezums ≥ 25 % (21) (22). Lielākā deva, kas izmantojama LLNA:BrdU-ELISA pamata testā, ir otrā zemākā deva priekšskrīninga koncentrāciju rindā (skatīt 18. punktu), kas neizraisa sistēmisku toksicitāti un/vai pārmērīgu lokālu ādas kairinājumu.
1. tabula
Apsārtuma (eritēmas) skala
|
Pazīmes |
Punktu skaits |
|
Apsārtuma nav |
0 |
|
Vāji izteikts (gandrīz nemanāms) apsārtums |
1 |
|
Izteikts apsārtums |
2 |
|
Vidēji stiprs un ļoti stiprs apsārtums |
3 |
|
Ļoti stiprs apsārtums (biešu sarkans) un kreveles, kas apsārtuma novērtēšanu padara neiespējamu |
4 |
23. Papildus auss biezuma 25 % pieaugumam (21) (22) kairinātāju identificēšanai LLNA izmanto arī statistiski nozīmīgus auss biezuma pieauguma rādītājus apstrādātajām pelēm salīdzinājumā ar kontroles grupas pelēm (22) (23) (24) (25) (26) (27) (28). Tomēr, lai gan statistiski nozīmīgs pieaugums var arī nesasniegt 25 % robežu, šādu pieaugumu neuzskata par pārmērīga kairinājuma izpausmi (25) (26) (27) (28) (29).
24. Turpmāk uzskaitītie klīniskie novērojumi, ja tie ir novērtējuma neatņemama daļa, var liecināt par sistēmisku toksicitāti (30), un tāpēc var parādīt, kāds būs LLNA:BrdU-ELISA pamata testā izmantojamais maksimālais devas līmenis: nervu sistēmas darbības traucējumi (piemēram, piloarekcija, ataksija, drebuļi un krampji); uzvedības traucējumi (piemēram, agresivitāte, ar personīgo higiēnu saistītās uzvedības maiņa, jūtams aktivitātes samazinājums vai pieaugums); neraksturīga elpošana (piemēram, elpas vilcienu biežuma un intensitātes maiņa, kā apgrūtināta vai spazmatiska elpošana, trokšņi plaušās) un pārmaiņas barības un ūdens uzņemšanā. Turklāt novērtējumā jāņem vērā letarģijas pazīmes un/vai reakcijas samazināšanās un visas klīniskās pazīmes, kas liecina par vairāk nekā mirklīgām sāpēm un ciešanām, vai ķermeņa masas samazinājums par vairāk nekā 5 % laikā no 1. dienas līdz 6. dienai, kā arī mirstības rādītāji. Mirstoši dzīvnieki vai dzīvnieki, kuri uzrāda stipru sāpju un ciešanu pazīmes, ir humāni jānonāvē (31).
Eksperimenta grafiks pamata pētījuma laikā
25. Eksperimenta grafiks ir šāds:
|
— |
1. diena : individuāli nosaka un reģistrē katra dzīvnieka masu, reģistrē klīniskos novērojumus. Katras auss aizmugures virsmu apstrādā ar 25 μl atšķaidījuma, kurš satur attiecīgo testējamo vielu, tikai nesēju vai PC (vienlaicīgu vai nesenu atkarībā no laboratorijas prakses un saistībā ar 11.–15. punktu). |
|
— |
2. un 3. diena : atkārto 1. dienā veikto apstrādi. |
|
— |
4. diena : apstrāde nenotiek. |
|
— |
5. diena : intraperitoneāli injicē 0,5 mL (5 mg uz peli) BrdU (10 mg/mL) šķīduma. |
|
— |
6. diena : reģistrē katra dzīvnieka masu un klīniskos novērojumus. Aptuveni 24 stundas (24 h) pēc BrdU injicēšanas dzīvniekus humāni nonāvē. No katras auss izgriež aurikulāros limfmezglus, kurus katrai pelei atsevišķi apstrādā fizioloģiskajā šķīdumā ar fosfātbuferi (PBS). Sīkus datus un diagrammas par limfmezglu identificēšanu un izgriešanu skatīt atsaucēs (17). Eksperimenta protokolā var iekļaut papildu parametrus, kas raksturo turpmāku ādas lokālo reakciju pamata pētījuma laikā, piemēram, auss apsārtuma novērtējumu pēc punktu skalas vai auss biezuma mērījumus (nosaka ar mērierīci vai ar auss caursišanas paņēmienu autopsijā). |
Šūnu suspensiju sagatavošana
26. No katrai pelei abās pusēs izgrieztām limfmezglu šūnām (LNC) sagatavo atsevišķu šūnu suspensiju, šūnas saudzīgi mehāniski sadalot caur nerūsējošā tērauda sietu ar 200 μm acu izmēru vai izmantojot citu paņēmienu, kas ir derīgs atsevišķu šūnu suspensiju ieguvei (piemēram, vienreizlietojamā plastmasas piestā saberžot limfmezglus un pēc tam tos filtrējot caur #70 neilona filtru). Šajā testā LNC suspensijas pareizai sagatavošanai ir izšķiroša nozīme, un tāpēc tās gatavotājam jābūt pieredzējušam un prasmīgam. Tā kā NC dzīvnieku limfmezgli ir mazi, tie jāapstrādā ar sevišķu rūpību, lai novērstu SI vērtību izkropļojumus. Visos gadījumos LNC suspensijas mērķtilpums jākoriģē līdz noteiktam optimizētam tilpumam (aptuveni 15 mL). Optimizētā tilpuma vērtību izraugās tā, lai NC grupas vidējās absorbcijas vērtība būtu 0,1–0,2 robežās.
Šūnu savairošanās noteikšana (BrdU satura mērīšana limfocītu DNS)
27. BrdU mēra ar ELISA metodi, izmantojot komerciāli pieejamu testēšanas komplektu (piemēram, Roche Applied Science, Manheima, Vācija, kataloga nr. 11 647 229 001). Īsumā, 100 μL LNC suspensijas trīskāršā atkārtojumā pārnes plakandibena mikroplates bedrītēs. Pēc LNC fiksācijas un denaturācijas katrā bedrītē pievieno anti-BrdU antivielu un ļauj, lai notiek reakcija. Pēc tam mazgājot atdala anti-BrdU antivielu, pievieno substrāta šķīdumu un ļauj, lai rodas hromogēns. Pēc tam mēra absorbciju pie 370 nm, par references viļņa garumu izmantojot 492 nm. Visos gadījumos testēšanas apstākļi jāoptimizē (skatīt 26. punktu).
NOVĒROJUMI
Klīniskie novērojumi
28. Ikviena pele vismaz reizi dienā ir rūpīgi jānovēro attiecībā uz vietēju kairinājumu apstrādes vietā vai sistēmiskas toksicitātes klīniskajām pazīmēm. Visus novērojumus sistemātiski reģistrē, par katru peli izdarot individuālu ierakstu. Novērošanas plānā jāiekļauj kritēriji, kas ļauj tūlīt identificēt peles, kurām ir sistēmiskas toksicitātes, pārmērīga lokāla ādas kairinājuma vai ādas korozijas pazīmes, lai tām veiktu eitanāziju (31).
Ķermeņa masa
29. Kā norādīts 25. punktā, individuālu dzīvnieku ķermeņa masa ir jānosaka testa sākumā un pirms plānotās humānās nonāvēšanas.
REZULTĀTU APRĒĶINĀŠANA
30. Katras apstrādes grupas rezultātu izsaka ar vidējo SI. SI iegūst, vidējo BrdU iezīmēšanas indeksa vērtību katrai pelei katrā testējamās vielas grupā un PC grupā dalot ar vidējo BrdU iezīmēšanas indeksa vērtību šķīdinātāja/VC grupā. Tā VC grupās vidējais SI ir 1.
BrdU iezīmēšanas indeksu definē šādi:
BrdU iezīmēšanas indekss = (ABSem – ABS tukšaisem) – (ABSref – ABS tukšaisref)
kur: “em” ir emisijas viļņa garums un “ref” ir references viļņa garums.
31. Lēmumu pieņemšanas procesā rezultātu uzskata par pozitīvu, ja SI ≥ 1,6 (10). Tomēr, nosakot, vai neitrālam tuvu rezultātu (t. i., ar SI vērtību robežās no 1,6 līdz 1,9) varētu uzskatīt par pozitīvu, var ņemt vērā arī devas un atbildes reakcijas stiprumu un šķīdinātāja/nesēja un PC reakcijas statistisko nozīmīgumu un konsekvenci (3) (6) (32).
32. Attiecībā uz neitrālam tuvu pozitīvu rezultātu ar SI vērtību robežās no 1,6 līdz 1,9, pirms apstiprināt, ka šis rezultāts ir pozitīvs, lietotāji var izvērtēt tādu papildu informāciju kā devas un atbildes reakcijas mijiedarbība, sistēmiskas toksicitātes vai pārmērīga kairinājuma pazīmes un, attiecīgā gadījumā, statistiskais nozīmīgums apvienojumā ar SI vērtībām (10). Jāņem vērā arī testējamās vielas dažādās īpašības, tostarp tas, vai tā strukturāli līdzinās jau zināmiem ādas sensibilizatoriem, vai tā izraisa pārmērīgu ādas kairinājumu pelēm un kāda veida atbildes reakcija uz devu ir novērota. Šie un citi apsvērumi turpmāk iztirzāti sīkāk (4).
33. Datu vākšana par individuālām pelēm pavērs iespējas statistiskai analīzei par devas un atbildes reakcijas mijiedarbības esību un tās pakāpi šajos datos. Jebkurš statistisks novērtējums var ietvert devas un atbildes reakcijas mijiedarbības novērtējumu, kā arī pienācīgi koriģētus testējamo grupu salīdzinājumus (piemēram, devu pāri grupā un šīs grupas salīdzinājums ar vienlaicīgu šķīdinātāja/kontroles grupu). Statistiskā analīze var ietvert, piemēram, lineāro regresiju jeb Viljamsa [William’s] testu, ar ko analizē devas un atbildes reakcijas mijiedarbību tendences, un Daneta [Dunnett] testu, lai salīdzinātu devu pārus. Izvēloties attiecīgu statistiskās analīzes metodi, pētniekam jāapzinās iespējamās mainīgo lielumu nevienādības un citas ar to saistītās problēmas, kuru dēļ var būt nepieciešama datu pārveidošana vai neparametriskā statistiskā analīze. Visādā ziņā iespējams, ka pētniekam SI būs jāaprēķina un statistiskā analīze jāveic gan ar, gan bez dažiem punktveida datiem (respektīvi, neņemot vērā galējības jeb rupjas kļūdas).
DATI UN TESTĒŠANAS PĀRSKATS
Dati
34. Dati jāapkopo tabulā, uzrādot indivīdu BrdU iezīmēšanas indeksa vērtības, grupas vidējo BrdU iezīmēšanas indeksa vērtību uz dzīvnieku, attiecīgo kļūdas apzīmējumu (piem., SD, SEM) un vidējo SI katrai devas grupai salīdzinājumā ar vienlaicīgo šķīdinātāja/kontroles grupu.
Testēšanas pārskats
35. Testēšanas pārskatā jābūt iekļautai šādai informācijai:
Testējamā un kontroles viela:
— identifikācijas dati (piemēram, CAS un EK numurs (ja ir); avots; tīrība; zināmie piemaisījumi; partijas numurs),
— fizikālās un fizikāli ķīmiskās īpašības (piemēram, gaistamība, stabilitāte, šķīdība),
— maisījuma gadījumā: sastāvs un sastāvdaļu relatīvais procentuālais daudzums.
Šķīdinātājs/nesējs:
— identifikācijas dati (tīrība; koncentrācija (attiecīgā gadījumā); izmantotais tilpums),
— nesēja izvēles pamatojums.
Izmēģinājumu dzīvnieki:
— CBA peļu avots,
— dzīvnieku mikrobioloģiskais statuss, ja tas zināms,
— dzīvnieku skaits un vecums,
— dzīvnieku avots, turēšanas un barošanas apstākļi utt.
Testēšanas apstākļi:
— ELISA komplekta avots, partijas numurs un ražotāja kvalitātes nodrošinājuma/kvalitātes kontroles dati (jutība pret antivielām, specifiskums un detekcijas limits),
— sīkas ziņas par testējamās vielas sagatavošanu un pielietošanu,
— devu izvēles pamatojums, attiecīgā gadījumā iekļaujot priekšskrīninga testa rezultātus,
— izmantotās nesēja un testējamās vielas koncentrācijas un pielietotās testējamās vielas kopējais daudzums,
— sīkas ziņas par barības un ūdens kvalitāti (iekļaujot barības veidu/izcelsmi, ūdens izcelsmi),
— sīks apstrādes un paraugu ņemšanas shēmas apraksts,
— toksicitātes novērtēšanas metodes,
— kritēriji, pēc kuriem testa rezultātu klasificē kā pozitīvu vai negatīvu,
— sīkas ziņas par novirzēm no protokola un paskaidrojums par to, kādā veidā šī novirze ietekmē pētījuma plānu un rezultātus.
Ticamības pārbaude:
— jaunākās ticamības pārbaudes rezultātu kopsavilkums, iekļaujot informāciju par testējamo vielu, tās koncentrāciju un nesēju,
— vienlaicīgi un/vai vēsturiski PC un vienlaicīgi negatīvās (šķīdinātājs/nesējs) kontroles dati no testēšanas laboratorijas,
— ja vienlaicīga PC nav paredzēta: datums un laboratorijas pārskats par nesenāko kārtējo PC un pārskats par agrāko PC datiem konkrētajā laboratorijā, kuri pamato vienlaicīgas PC neveikšanu.
Rezultāti:
— individuālu peļu masa dozēšanas sākumā un veicot plānoto humāno nonāvēšanu; vidējās vērtības un attiecīgais kļūdas apzīmējums (piem., SD, SEM) katrai apstrādes grupai,
— toksicitātes parādīšanās gaita un pazīmes, iekļaujot ādas kairinājumu ievadīšanas vietā, ja tāds ir, katram dzīvniekam,
— tabula ar individuālu peļu BrdU iezīmēšanas indeksa un SI vērtībām katrā apstrādes grupā,
— vidējās vērtības un attiecīgais kļūdas apzīmējums (piem., SD, SEM) par BrdU iezīmēšanas indeksu katrai pelei katrā apstrādes grupā un galējību jeb rupju kļūdu analīze katrā apstrādes grupā,
— aprēķinātais SI un attiecīgs mainības mērs, kas ņem vērā to, ka ne testējamās vielas grupā, ne kontroles grupā dzīvnieki nav identiski,
— devas un atbildes reakcijas sakarības,
— attiecīgā gadījumā, statistiskā analīze.
Rezultātu izvērtējums:
— īss komentārs par rezultātiem, atbildes reakcijas uz devu analīzi un, attiecīgā gadījumā, statistisko analīzi ar secinājumu, vai testējamā viela jāuzskata par ādas sensibilizatoru.
IZMANTOTĀ LITERATŪRA
1) OECD (2010), Skin Sensitisation: Local Lymph Node Assay, Test Guideline No. 429, Guidelines for the Testing of Chemicals, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
2) Chamberlain, M. and Basketter, D.A. (1996), The local lymph node assay: status of validation. Food Chem. Toxicol., 34, 999-1002.
3) Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E. (1996), The local lymph node assay: A viable alternative to currently accepted skin sensitisation tests. Food Chem. Toxicol., 34, 985-997.
4) Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998), Strategies for identifying false positive responses in predictive sensitisation tests. Food Chem. Toxicol., 36, 327-33.
5) Van Och, F.M.M., Slob, W., De Jong, W.H., Vandebriel, R.J. and Van Loveren, H. (2000), A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employment of a regression method that includes determination of uncertainty margins. Toxicol., 146, 49-59.
6) ICCVAM (1999), The murine local lymph node Assay: A test method for assessing the allergic contact dermatitis potential of chemicals/compounds: The results of an independent peer review evaluation coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494. Research Triangle Park, N.C. Available at: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna/llnarep.pdf]
7) Dean, J.H., Twerdok, L.E., Tice, R.R., Sailstad, D.M., Hattan, D.G., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: II. Conclusions and recommendations of an independent scientific peer review panel. Reg. Toxicol. Pharmacol., 34(3), 258-273.
8) Haneke, K.E., Tice, R.R., Carson, B.L., Margolin, B.H., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: III. Data analyses completed by the national toxicology program interagency center for the evaluation of alternative toxicological methods. Reg. Toxicol. Pharmacol., 34(3), 274-286.
9) Sailstad, D.M., Hattan, D., Hill, R.N., Stokes, W.S. (2001), ICCVAM evaluation of the murine local lymph node assay: I. The ICCVAM review process. Reg. Toxicol. Pharmacol., 34(3), 249-257.
10) ICCVAM (2010), ICCVAM Test Method Evaluation Report. Nonradioactive local lymph node assay: BrdU-ELISA Test Method Protocol (LLNA: BrdU-ELISA). NIH Publication No. 10-7552A/B. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/methods/immunotox/llna-ELISA/TMER.htm]
11) ICCVAM (2009), Independent Scientific Peer Review Panel Report: Updated validation status of new versions and applications of the murine local lymph node assay: a test method for assessing the allergic contact dermatitis potential of chemicals and products. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/LLNAPRPRept2009.pdf]
12) Takeyoshi, M., Iida, K., Shiraishi, K. and Hoshuyama, S. (2005), Novel approach for classifying chemicals according to skin sensitising potency by non-radioisotopic modification of the local lymph node assay. J. Appl. Toxicol., 25, 129-134.
13) OECD (1992), Skin Sensitisation, Test Guideline No. 406, Guidelines for Testing of Chemicals, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
14) Kreiling, R., Hollnagel, H.M., Hareng, L., Eigler, L., Lee, M.S., Griem, P., Dreessen, B., Kleber, M., Albrecht, A., Garcia, C. and Wendel, A. (2008), Comparison of the skin sensitising potential of unsaturated compounds as assessed by the murine local lymph node assay (LLNA) and the guinea pig maximization test (GPMT). Food Chem. Toxicol., 46, 1896-1904.
15) Basketter, D., Ball, N., Cagen, S., Carrilo, J.C., Certa, H., Eigler, D., Garcia, C., Esch, H., Graham, C., Haux, C., Kreiling, R. and Mehling, A. (2009), Application of a weight of evidence approach to assessing discordant sensitisation datasets: implications for REACH. Reg. Toxicol. Pharmacol., 55, 90-96.
16) ILAR (1996), Institute of Laboratory Animal Research (ILAR) Guide for the Care and Use of Laboratory Animals. 7th ed. Washington, DC: National Academies Press.
17) ICCVAM (2009), Recommended Performance Standards: Murine Local Lymph Node Assay. NIH Publication Number 09-7357. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/docs/immunotox_docs/llna-ps/LLNAPerfStds.pdf]
18) McGarry, H.F. (2007), The murine local lymph node assay: regulatory and potency considerations under REACH. Toxicol., 238, 71-89.
19) Kimber, I., Dearman, R.J., Scholes E.W. and Basketter, D.A. (1994), The local lymph node assay: developments and applications. Toxicol., 93, 13-31.
20) OECD (2002), Acute Dermal Irritation/Corrosion, Test Guideline No. 404, Guidelines for Testing of Chemicals, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
21) Reeder, M.K., Broomhead, Y.L., DiDonato, L. and DeGeorge, G.L. (2007), Use of an enhanced local lymph node assay to correctly classify irritants and false positive substances. Toxicologist, 96, 235.
22) ICCVAM (2009), Nonradioactive Murine Local Lymph Node Assay: Flow Cytometry Test Method Protocol (LLNA: BrdU-FC) Revised Draft Background Review Document. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/methods/immunotox/fcLLNA/BRDcomplete.pdf].
23) Hayes, B.B., Gerber, P.C., Griffey, S.S. and Meade, B.J. (1998), Contact hypersensitivity to dicyclohexylcarbodiimide and diisopropylcarbodiimide in female B6C3F1 mice. Drug Chem. Toxicol., 21, 195-206.
24) Homey, B., von Schilling, C., Blumel, J., Schuppe, H.C., Ruzicka, T., Ahr, H.J., Lehmann, P. and Vohr, V.W. (1998), An integrated model for the differentiation of chemical-induced allergic and irritant skin reactions. Toxicol. Appl. Pharmacol., 153, 83-94.
25) Woolhiser, M.R., Hayes, B.B. and Meade, B.J. (1998), A combined murine local lymph node and irritancy assay to predict sensitisation and irritancy potential of chemicals. Toxicol. Meth., 8, 245-256.
26) Hayes, B.B. and Meade, B.J. (1999), Contact sensitivity to selected acrylate compounds in B6C3F1 mice: relative potency, cross reactivity, and comparison of test methods. Drug. Chem. Toxicol., 22, 491-506.
27) Ehling, G., Hecht, M., Heusener, A., Huesler, J., Gamer, A.O., van Loveren, H., Maurer, T., Riecke, K., Ullmann, L., Ulrich, P., Vandebriel, R. and Vohr, H.W. (2005), A European inter- laboratory validation of alternative endpoints of the murine local lymph node assay: first round. Toxicol., 212, 60-68.
28) Vohr, H.W. and Ahr, H.J. (2005), The local lymph node assay being too sensitive? Arch. Toxicol., 79, 721-728.
29) Patterson, R.M., Noga, E. and Germolec D. (2007), Lack of evidence for contact sensitisation by Pfiesteria extract. Environ. Health Perspect., 115, 1023-1028.
30) ICCVAM (2009), Report on the ICCVAM-NICEATM/ECVAM/JaCVAM Scientific Workshop on Acute Chemical Safety Testing: Advancing In Vitro Approaches and Humane Endpoints for Systemic Toxicity Evaluations. Research Triangle Park, NC: National Institute of Environmental Health Sciences. Available at: [http://iccvam.niehs.nih.gov/methods/acutetox/Tox_workshop.htm].
31) OECD (2000), Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation, Environmental Health and Safety Monograph Series on Testing and Assessment No. 19, ENV/JM/MONO(2000)7, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
32) Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E. and Hastings, K.L. (1998), Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. J. Toxicol. Environ.l Health, 53, 563-79.
33) OECD (2005), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, Environment, Health and Safety Monograph Series on Testing and Assessment No. 34, ENV/JM/MONO(2005)14, OECD, Paris. Available at: [http://www.oecd.org/env/testguidelines]
1. papildinājums
DEFINĪCIJAS
Pareizība : pēc testēšanas metodes iegūto mērījumu rezultātu sakritības pakāpe ar pieņemtajām references vērtībām. Tas ir testēšanas metodes veiktspējas raksturlielums un viens no tās piemērotības aspektiem. Šo terminu bieži izmanto “atbilstības” vietā, ar to apzīmējot pēc testēšanas metodes iegūto pareizo rezultātu daļu (33).
Salīdzināšanas viela : sensibilizējoša vai nesensibilizējoša viela, ko izmanto par standartu salīdzināšanai ar testējamo vielu. Salīdzināšanas vielai ir jāpiemīt šādām īpašībām: (i) pastāvīgs un uzticams ieguves avots, (ii) struktūras un funkciju līdzība ar testējamo vielu klases vielām, (iii) zināmas fizikālās/ķīmiskās īpašības; (iv) papildu dati par zināmajiem iedarbības veidiem; (v) vielas zināmais iedarbības stiprums atbilst vēlamās reakcijas intensitātes diapazonam.
Šķietams negatīvs : testējamā viela, kurai ar testēšanas metodi kļūdaini noteikta negatīva vai neaktīva reakcija, lai gan faktiski tā ir pozitīva vai aktīva (33).
Šķietams pozitīvs : testējamā viela, kurai ar testēšanas metodi kļūdaini noteikta pozitīva vai aktīva reakcija, lai gan faktiski tā ir negatīva vai neaktīva (33).
Bīstamība : potenciālā spēja kaitēt veselībai vai videi. Kaitīgā iedarbība kļūst nosakāma tikai tad, ja iedarbības intensitāte ir pietiekami liela.
Starplaboratoriju reproducējamība : lielums, kas raksturo, kādā mērā vairākas kvalificētas laboratorijas spēj iegūt kvalitatīvi un kvantitatīvi līdzīgus rezultātus, ja tās izmanto vienu un to pašu protokolu un vienas un tās pašas testējamās vielas. Starplaboratoriju reproducējamību (saukta arī par interlaboratoriju reproducējamību) nosaka prevalidēšanas un validēšanas procesā, un šis lielums rāda, cik lielā mērā testēšanu vienlīdz sekmīgi iespējams veikt dažādās laboratorijās (33).
Iekšlaboratorijas reproducējamība : lielums, kas raksturo, kādā mērā vienā laboratorijā strādājoši kvalificēti darbinieki spēj sekmīgi atkārtot iepriekš iegūtus rezultātus, ja to pašu protokolu izmanto citā laikā. Saukts arī par intralaboratoriju reproducējamību (33).
Galējība jeb rupja kļūda : novērojums, kuru raksturo izteikta novirze no pārējām vērtībām populācijas paraugā, kurš atlasīts pēc nejaušības principa.
Kvalitātes nodrošināšana : pārvaldības process, kurā laboratorijas testēšanas standartu, prasību un pierakstu uzturēšanas procedūru ievērošanu un datu pārneses pareizību novērtē no testēšanas veicējiem neatkarīgas personas.
Ticamība : parametrs, ar kuru mēra pakāpi, kādā tajā pašā vai citā laboratorijā ilgākā laikā, izmantojot to pašu protokolu, var iegūt reproducējamus rezultātus. To novērtē, aprēķinot iekšlaboratorijas un starplaboratoriju reproducējamību (33).
Ādas sensibilizācija : imunoloģisks process, kurš norisinās, ja uz uzņemtspējīgu organismu ārēji iedarbojas stimulējošs ķīmisks alergēns, kas izraisa ādas imūnreakciju, kuras rezultāts var būt kontaktsensibilizācija.
Stimulācijas indekss (SI) : vērtība, ko aprēķina, lai novērtētu testējamai vielai piemītošo ādas sensibilizācijas potenciālu; to izsaka kā attiecību starp progresiju grupās, kas saņēmušas pētāmo vielu, un progresiju kontroles grupā, kas saņēmusi tikai nesēju.
Testējamā viela (arī testējamā ķīmiskā viela) : viela vai vielu maisījums, kuru testē ar šo TM.
C DAĻA: METODES EKOTOKSICITĀTES NOTEIKŠANAI
|
SATURS |
|
|
C.1. |
AKŪTĀ TOKSICITĀTE ZIVĪM |
|
C.2. |
AKŪTĀ TOKSICITĀTE DAFNIJĀM |
|
C.3. |
SALDŪDENS AĻĢU UN CIĀNBAKTĒRIJU (ZILAĻĢU) AUGŠANAS INHIBĒŠANAS TESTS |
|
C.4. |
“VIEGLAS” BIOLOĢISKĀS NOĀRDĪŠANĀS SPĒJAS NOTEIKŠANA |
|
I DAĻA. |
VISPĀRĪGI APSVĒRUMI |
|
II DAĻA. |
IOO ATKRĀSOŠANĀS TESTS (C.4.-A metode) |
|
III DAĻA. |
MODIFICĒTĀ ESAO SKRĪNINGA METODE (C.4.-B metode) |
|
IV DAĻA. |
CO2 IZDALĪŠANĀS TESTS (C.4.-C metode) |
|
V DAĻA. |
MANOMETRISKĀ RESPIROMETRIJA (C.4.-D metode) |
|
VI DAĻA. |
SLĒGTO PUDEĻU METODE (C.4.-E metode) |
|
VII DAĻA. |
MITI METODE (C.4.-F metode) |
|
C.5. |
DEGRADĀCIJA – BIOĶĪMISKAIS SKĀBEKĻA PATĒRIŅŠ |
|
C.6. |
DEGRADĀCIJA – ĶĪMISKAIS SKĀBEKĻA PATĒRIŅŠ |
|
C.7. |
NOĀRDĪŠANĀS – ABIOTISKA NOĀRDĪŠANĀS: HIDROLĪZE ATKARĪBĀ NO pH |
|
C.8. |
TOKSICITĀTES NOTEIKŠANA SLIEKĀM |
|
C.9. |
BIODEGRADĀCIJA – CĀNA-VELLENA TESTS |
|
C.10. |
BIODEGRADĀCIJA – AKTĪVO DŪŅU IMITĀCIJAS TESTI |
|
C.11. |
BIODEGRADĀCIJA – AKTĪVO DŪŅU RESPIRĀCIJAS INHIBĪCIJAS TESTS |
|
C.12. |
BIODEGRADĀCIJA – MODIFICĒTS SCAS TESTS |
|
C.13. |
BIOKONCENTRĀCIJA – ZIVJU ANALĪZE CAURPLŪDES APSTĀKĻOS |
|
C.14. |
ZIVJU MAZUĻU AUGŠANAS TESTS |
|
C.15. |
ĪSTERMIŅA TOKSICITĀTES TESTS ZIVĪM EMBRIJA UN DZELTENUMMAISA ATTĪSTĪBAS POSMOS |
|
C.16. |
MĀJAS BITES – AKŪTAS ORĀLĀS TOKSICITĀTES TESTS |
|
C.17. |
MĀJAS BITES – AKŪTAS KONTAKTA TOKSICITĀTES TESTS |
|
C.18. |
ADSORBCIJA/DESORBCIJA AR KRATĪŠANAS METODI |
|
C.19. |
ADSORBCIJAS KOEFICIENTA (KOC ) NOTEIKŠANA UZ AUGSNES UN UZ KANALIZĀCIJAS NOSĒDUMIEM AR AUGSTAS IZŠĶIRŠANAS ŠĶIDRUMA HROMATOGRĀFIJU (HPLC) |
|
C.20. |
DAPHNIA MAGNA VAIROŠANĀS TESTS |
|
C.21. |
AUGSNES MIKROORGANISMI – SLĀPEKĻA TRANSFORMĀCIJAS TESTS |
|
C.22. |
AUGSNES MIKROORGANISMI – OGLEKĻA TRANSFORMĀCIJAS TESTS |
|
C.23. |
AEROBĀ UN ANAEROBĀ TRANSFORMĀCIJA AUGSNĒ |
|
C.24. |
AEROBĀ UN ANAEROBĀ TRANSFORMĀCIJA ŪDENS NOSĒDUMU SISTĒMĀS |
|
C.25. |
AEROBĀ MINERALIZĀCIJA VIRSZEMES ŪDENĪ – BIOLOĢISKĀS NOĀRDĪŠANĀS IMITĀCIJAS TESTS |
|
C.26. |
LEMNA SP. AUGŠANAS INHIBĒŠANAS TESTS |
C.1. AKŪTĀ TOKSICITĀTE ZIVĪM
1. METODE
1.1. IEVADS
Šā testa nolūks ir noteikt vielas akūto letālo toksicitāti zivīm saldūdenī. Iespēju robežās ir jānodrošinās ar datiem par testa vielas šķīdību ūdenī, tvaika spiedienu, ķīmisko noturīgumu, disociācijas konstantēm un biosadalīšanos, kas var palīdzēt izvēlēties vispiemērotāko (statisko, pusstatisko vai caurplūdes) testa metodi un panākt pietiekami nemainīgu testa vielas koncentrāciju testu laikā.
Cita informācija (piemēram, struktūrformula, tīrības pakāpe, galveno piemaisījumu īpašības un procentuālais īpatsvars, piedevu daudzums un sadalījuma koeficients sistēmā n-oktanols/ūdens) jāņem vērā, plānojot testus un analizējot iegūtos rezultātus.
1.2. DEFINĪCIJAS UN MĒRVIENVIENĪBAS
Akūtā toksicitāte ir redzamā kaitīgā ietekme, kas izraisīta organismā pēc vielas īslaicīgas (dažu dienu) iedarbības. Šajā testā akūtā toksicitāte ir izteikta kā vidējā letālā koncentrācija (LC50), kas atbilst tādai vielas koncentrācijai ūdenī, kura norādītajā ilgstošas iedarbības laikā izraisa 50 % zivju nāvi testa grupā.
Visas testa vielas koncentrācijas ir izteiktas kā svars tilpuma vienībā (miligrami litrā). Tās var izteikt arī kā svaru uz svara vienību (mg.kg-1).
1.3. STANDARTVIELAS
Standartvielas izmantošana ļauj pārliecināties, ka pārbaudāmās sugas reakcija laboratorijas testa apstākļos nav būtiski mainījusies.
Šim testam standartvielas vēl nav noteiktas.
1.4. TESTA METODES PRINCIPS
Pieļaujamības testu var izdarīt ar koncentrāciju 100 mg litrā, lai parādītu, ka LC50 ir lielāks par minēto koncentrāciju.
Uz zivīm 96 stundas iedarbojas ar testa vielu, kas pievienota ūdenim koncentrāciju diapazonā. Vismaz ik pēc 24 stundām reģistrē zivju mirstību un, ja iespējams, aprēķina koncentrāciju, kas izraisa 50 % zivju nāvi (LC50) katrā novērošanas termiņā.
1.5. KVALITĀTES KRITĒRIJI
Kvalitātes kritērijus piemēro pieļaujamības testam, kā arī visai testa metodei.
Kontroles grupas mirstība testa beigās nedrīkst pārsniegt 10 % (vai vienu zivi, ja izmanto mazāk par desmit zivīm).
Izšķīdušā skābekļa koncentrācijai visu laiku jābūt lielākai par 60 % no gaisa piesātinājuma koncentrācijas.
Testa vielas koncentrācijas visā testa laikā saglabā 80 % robežās no sākuma koncentrācijas.
Vielām, kas viegli šķīst testa vidē, veidojot stabilus šķīdumus, t. i., tādus, kas nekādā jūtamā veidā neiztvaiko, nenoārdās, nehidrolizējas vai neadsorbējas, sākuma koncentrāciju var uzskatīt par vienādu ar nominālo koncentrāciju. Jāsniedz dati, ka koncentrācija ir saglabāta visā testa laikā un ka kvalitātes kritēriji ir izpildīti.
Vielām, kas:
i) slikti šķīst testa vidē;
ii) spēj veidot stabilas emulsijas vai dispersijas vai
iii) nav stabilas ūdens šķīdumos,
par sākuma koncentrāciju pieņem šķīdumā izmērīto koncentrāciju (vai, ja tas tehniski ir iespējams, ūdens kolonnā izmērīto koncentrāciju) testa sākumā. Koncentrāciju nosaka pēc līdzsvara sasniegšanas laika posma, bet pirms testa zivju ielaišanas.
Katrā no šiem gadījumiem testa laikā jāizdara turpmāki mērījumi, lai apstiprinātu faktiskās iedarbīgās koncentrācijas vai atbilstību kvalitātes kritērijiem.
pH nedrīkst atšķirties vairāk par 1 vienību.
1.6. TESTA METODES APRAKSTS
Var izmantot trīs dažādas procedūras.
Statiskais tests:
toksicitātes tests, kurā nav testa šķīduma plūsmas. (Šķīdumi paliek nemainīti visā testa laikā.)
Pusstatiskais tests:
testa laikā šķīduma plūsma netiek nodrošināta, bet ilgākā laika posmā (piemēram, pēc 24 stundām) testa šķīdumu periodiski apmaina.
Tests caurplūdes apstākļos:
toksicitāti nosaka testa kamerās, kurās pastāvīgi atjauno ūdeni, un testa vielu pievieno ūdenim, ar kuru atjauno testa vidi.
1.6.1. Reaģenti
1.6.1.1. Testa vielu šķīdumi
Vajadzīgās koncentrācijas izejas standartšķīdumus gatavo, izšķīdinot vielu dejonizētā ūdenī vai ūdenī, kas iegūts saskaņā ar 1.6.1.2. punktu.
Testam vajadzīgo koncentrāciju iegūst, atšķaidot izejas standartšķīdumu. Ja pārbauda lielāku koncentrāciju, vielu var izšķīdināt tieši ūdenī, ko lieto atšķaidīšanai.
Vielas parasti jāpārbauda tikai līdz šķīdības robežai. Attiecībā uz dažām vielām (piemēram, vielām, kam ir maza šķīdība ūdenī vai liels Pow, vai tām, kas ūdenī veido drīzāk stabilu dispersiju nekā īstu šķīdumu) ir pieņemams testa koncentrāciju palielināt virs vielas šķīdības robežas, lai nodrošinātu, ka ir iegūta maksimālās šķīdības koncentrācija/maksimālā stabilā koncentrācija. Tomēr ir svarīgi, lai minētā koncentrācija citādi neizjauktu testa sistēmu (piemēram, vielas plēve uz ūdens virsmas, kas kavē ūdens piesātināšanu ar skābekli, utt.).
Kā palīglīdzekli ūdenī slikti šķīstošu vielu izejas standartšķīdumu pagatavošanai vai minēto vielu disperģēšanai testa vidē var izmantot dispersiju ar ultraskaņu, organiskos šķīdinātājus, emulgatorus vai disperģētājus. Ja izmanto tādas palīgvielas, visām testa koncentrācijām jāsatur viens un tas pats palīgvielas daudzums, un papildu kontroles zivs ir jāpakļauj tādai pašai palīgvielas koncentrācijai, kādu izmanto testa sērijā. Palīgvielu koncentrācijai jābūt iespējami mazai, un nekādā ziņā tā nedrīkst pārsniegt 100 mg litrā testa vides.
Tests jāveic bez pH korekcijas. Ja novēro krasas pH izmaiņas, testu ieteicams atkārtot, veicot pH korekciju, un rezultāti jāprotokolē. Šajā gadījumā izejas standartšķīduma pH koriģē līdz pH līmenim, kāds ir ūdenim, ko izmanto atšķaidīšanai, ja nav īpašu iemeslu rīkoties citādi. Šim nolūkam vēlams izmantot HCl un NaOH. pH līmenis jākoriģē tā, lai būtiski neietekmētu testa vielas koncentrāciju izejas standartšķīdumā. Ja šāda korekcija izraisa ķīmisku reakciju vai testa vielas nogulsnēšanos, tas jāreģistrē.
1.6.1.2. Ūdens atšķaidīšanai un zivju turēšanai
Var izmantot dzeramo ūdeni (kas nesatur hloru, smagos metālus vai citas nevēlamas vielas bīstamā koncentrācijā), labas kvalitātes dabīgo ūdeni vai “atjaunotu” ūdeni (skatīt 1. papildinājumu). Ieteicams izmantot ūdeni, kura kopējā cietība ir 10 līdz 250 mg/l (pēc CaCO3) un pH līmenis 6,0–8,5.
1.6.2. Aprīkojums
Visam aprīkojumam jābūt no ķīmiski inerta materiāla.
— automātiskā atšķaidīšanas iekārta (caurplūdes testam),
— skābekļa mērītājs,
— iekārta ūdens cietības noteikšanai,
— piemērota temperatūras regulēšanas ierīce,
— pH metrs.
1.6.3. Testa zivis
Zivis nedrīkst būt slimas vai ar izteiktām kroplības pazīmēm.
Izmantojamā suga jāizvēlas, pamatojoties uz praktiskiem kritērijiem, tādiem kā viegla pieejamība visu gadu, turēšanas vieglums, ērtums testēšanai, relatīvā jutība pret ķīmiskām vielām un ekonomiskie, bioloģiskie vai ekoloģiskie faktori, kas uz to attiecas. Izvēloties zivju sugu, ir jāņem vērā arī iegūto datu salīdzināmība un esošā starptautiskā saskaņošana (1. atsauce).
Šā testa veikšanai ieteicamo zivju sugu saraksts ir norādīts 2. papildinājumā; ieteicamākās sugas ir Danio zebras zivs un varavīksnes forele.
1.6.3.1. Turēšanas apstākļi
Ieteicams izmantot līdzīga garuma un vecuma zivis no viena sūtījuma. Vismaz 12 dienas zivis tur šeit norādītajos apstākļos:
Zivju daudzums:
atkarībā no izmantotās sistēmas (recirkulācija vai caurplūde) un zivju sugas.
Ūdens:
skatīt 1.6.1.2. punktu.
Apgaismojums:
ikdienas apgaismojums 12 līdz 16 stundas.
Skābekļa koncentrācija ūdenī:
vismaz 80 % no gaisa piesātinājuma koncentrācijas.
Barošana:
trīsreiz nedēļā vai katru dienu, to pārtrauc 24 stundas pirms testa.
1.6.3.2. Mirstība
Beidzoties 48 stundu pierašanas laikam, reģistrē mirstību, ievērojot šādus kritērijus:
— lielāka par 10 % no populācijas septiņās dienās –
— izbrāķē visu partiju,
— 5 līdz 10 % no populācijas –
— turēšanas laiku turpina septiņas papildu dienas.
— Ja turpmāk mirstības gadījumus nenovēro, partija der izmēģinājumiem, pretējā gadījumā to izbrāķē,
— mazāk par 5 % no populācijas –
— partiju pieņem.
1.6.4. Pielāgošanās
Vismaz septiņas dienas pirms testa visas zivis jātur tādas pašas kvalitātes un temperatūras ūdenī, kādu izmantos pārbaudes laikā.
1.6.5. Testa procedūra
Pirms testa uzsākšanas var veikt priekšizmēģinājumu, lai noskaidrotu, kāds koncentrācijas diapazons būtu izmantojams testa laikā.
Papildus testa sērijai izdara vienu kontroles izmēģinājumu bez testa vielas un attiecīgā gadījumā vienu kontroles izmēģinājumu ar palīgvielu.
Atkarībā no testa vielas fizikālajām un ķīmiskajām īpašībām attiecīgi izvēlas statisko, pusstatisko vai caurplūdes modeli, lai atbilstu kvalitātes kritērijiem.
Zivis pakļauj vielas iedarbībai, ievērojot šādus nosacījumus:
— ilgums – 96 stundas,
— dzīvnieku skaits – vismaz septiņi uz katru vielas koncentrāciju,
— rezervuāri – kuru tilpums atbilst ieteiktajam zivju skaitam,
— zivju daudzums – maksimālais ieteicamais zivju daudzums statiskos un pusstatiskos testos ir 1g litrā; caurplūdes sistēmās ir pieņemams lielāks zivju daudzums,
— testa koncentrācija – vismaz piecas koncentrācijas, kas atšķiras ar nemainīgu koeficientu, ne lielāku par 2,2, un kas cik iespējams ietver diapazonu no 0 līdz 100 % mirstībai,
— ūdens – skatīt 1.6.1.2. punktu,
— apgaismojums – ikdienas apgaismojums 12 līdz 16 stundas,
— temperatūra – atkarībā no zivju sugas (2. papildinājums), bet kuras svārstības testa laikā nepārsniedz ±1 oC,
— skābekļa koncentrācija ūdenī – vismaz 60 % no gaisa piesātinājuma koncentrācijas izvēlētajā temperatūrā,
— barošana – nebaro.
Zivis pirmoreiz apskata pēc 2–4 stundām un vēlāk vismaz ik pēc 24 stundām. Uzskata, ka zivs ir nedzīva, ja, pieskaroties tās astei, tā neizrāda nekādu reakciju un elpošanas kustības. Pamanītas nedzīvas zivis izņem un reģistrē to nāvi. Reģistrē arī citas redzamas anomālijas (piemēram, līdzsvara zudumu, peldēšanas, elpošanas, pigmentācijas izmaiņas u. tml.).
Katru dienu veic pH, ūdenī izšķīdušā skābekļa un temperatūras mērījumus.
Izmantojot šajā testa metodē aprakstītās procedūras, pieļaujamības testu var izdarīt ar koncentrāciju 100 mg litrā, lai parādītu, ka LC50 ir lielāks par minēto koncentrāciju.
Ja vielas īpašības ir tādas, ka koncentrāciju 100 mg litrā ūdens nevar iegūt, pieļaujamības tests jāveic pie koncentrācijas, kas ir vienāda ar vielas šķīdību (vai pie maksimālās koncentrācijas, kurā veidojas stabila dispersija) izmantotajā vidē (skatīt arī 1.6.1.1. punktu).
Pieļaujamības tests jāveic, izmantojot 7 līdz 10 zivis, ar tādu pašu kontroles zivju skaitu. (Binomiālā teorija nosaka, ka, izmantojot 10 zivis, pie nulles mirstības ir 99,9 % ticamība, ka LC50 ir lielāks par pieļaujamības testā izmantoto koncentrāciju. Izmantojot 7, 8 vai 9 zivis, nulles mirstība sniedz vismaz 99 % ticamību, ka LC50 ir lielāks par izmantoto koncentrāciju.)
Ja mirstība pastāv, ir jāizdara pilns pētījums. Ja ir novērotas subletālas ietekmes, tās ir jāreģistrē.
2. DATI UN TO IZVĒRTĒŠANA
Par katru laika posmu, kad ir reģistrēti novērojumi (24, 48, 72 un 96 stundas), mirstību, kas izteikta procentos katrā ieteicamajā iedarbības laika posmā, atliek pret koncentrāciju logaritmiskajā/varbūtības diagrammā.
Ja ir iespējams, izmantojot standarta procedūras, katram novērošanas laikam ir jānovērtē LC50 un ticamības robežas (p = 0,05); šie lielumi jānoapaļo līdz vienam vai, lielākais, līdz diviem nozīmīgiem cipariem (noapaļošanas līdz diviem cipariem piemēri: 173,5 noapaļo līdz 170; 0,127 noapaļo līdz 0,13; 1,21 noapaļo līdz 1,2).
Ja koncentrācijas/atbildes reakcijas procentu līkne ir pārāk stāva, lai aprēķinātu LC50 vērtību, pietiek ar tās grafiski iegūto aptuveno vērtību.
Ja divas secīgas koncentrācijas, kas viena no otras atšķiras 2,2 reizes, izraisa tikai 0 un 100 % mirstību, ar to pietiek, lai norādītu diapazonu, kurā ietilpst LC50.
Ja ir novērots, ka nevar nodrošināt testa vielas stabilitāti vai viendabīgumu, tas jāreģistrē un jāievēro piesardzība, interpretējot rezultātus.
3. ZIŅOJUMA SAGATAVOŠANA
Testa ziņojumā, ja iespējams, jānorāda šāda informācija:
— dati par testa zivīm (zinātniskais nosaukums, līnija, piegādātājs, pirmapstrāde, izmēri un skaits katrai testa koncentrācijai),
— norāde, kur ņem ūdeni atšķaidīšanai, un tā galvenās ķīmiskās īpašības (pH, cietība, temperatūra),
— ja viela slikti šķīst ūdenī, izejas standartšķīduma un testā izmantoto šķīdumu sagatavošanas paņēmiens,
— palīgvielu koncentrācija,
— izmantoto koncentrāciju saraksts un jebkuri pieejamie dati par testa vielas stabilitāti pārbaudāmajā koncentrācijā,
— ja veic ķīmiskās analīzes, izmantotās metodes un rezultāti,
— pieļaujamības testa rezultāti, ja tāds izdarīts,
— izvēlētās testa procedūras pamatojums un apraksts (piemēram, statiskā vai pusstatiskā metode, dozēšanas ātrums, caurplūdes ātrums, aerācijas nodrošinājums, zivju daudzums utt.),
— aprīkojuma apraksts,
— apgaismojuma režīms,
— skābekļa koncentrācija ūdenī, testā izmantoto šķīdumu pH vērtība un temperatūra ik pēc 24 stundām,
— kvalitātes kritēriju izpildes pierādījums,
— tabula, kurā parādīta kumulatīvā mirstība katrā koncentrācijā un kontroles grupā (un kontroles grupā ar palīgvielu, ja tā vajadzīga) katrā no ieteiktajiem novērošanas laikiem,
— testa beigās iegūtās koncentrācijas/atbildes reakcijas līknes grafiskais attēls,
— LC50 katrā ieteiktajā novērošanas termiņā (norādot 95 % ticamības robežas), ja iespējams,
— statistikas metodes LC50 noteikšanai,
— rezultāti, kas iegūti ar standartvielu, ja tādu izmanto,
— lielākā testa koncentrācija, kas neizraisa mirstību testa laikā,
— mazākā testa koncentrācija, kas izraisa 100 % mirstību testa laikā.
4. IZMANTOTĀ LITERATŪRA
(1) OECD, Paris, 1981, Test Guideline 203, Decision of the Council C(81) 30 final and updates.
(2) AFNOR – Determination of the acute toxicity of a substance to Brachydanio rerio –Static and Flow Through methods -NFT 90-303 June 1985.
(3) AFNOR – Determination of the acute toxicity of a substance to Salmo gairdneri –Static and Flow – Through methods -NFT 90-305 June 1985.
(4) ISO 7346/1,/2 and/3 – Water Quality – Determination of the acute lethal toxicity of substances to a fresh water fish (Brachydanio rerio Hamilton-Buchanan -Teleostei, Cyprinidae). Part 1: Static method. Part 2: Semi-static method. Part 3: Flow-through method.
(5) Eidgenössisches Department des Innern, Schweiz: Richtlinien fur Probenahme und Normung von Wasseruntersuchungsmethoden – Part II 1974.
(6) DIN Testverfahren mit Wasserorganismen, 38 412 (11) und 1 (15).
(7) JIS K 0102, Acute toxicity test for fish.
(8) NEN 6506- Water -Bepaling van de akute toxiciteit met behulp van Poecilia reticulata, 1980.
(9) Environmental Protection Agency, Methods for the acute toxicity tests with fish, macroinvertebrates and amphibians. The Committee on Methods for Toxicity Tests with Aquatic Organisms, Ecological Research Series EPA-660-75-009, 1975.
(10) Environmental Protection Agency, Environmental monitoring and support laboratory, Office of Research and Development, EPA-600/4-78-012, January 1978.
(11) Environmental Protection Agency, Toxic Substance Control, Part IV, 16 March 1979.
(12) Standard methods for the examination of water and wastewater, fourteen edition, APHA-AWWA-WPCF,1975.
(13) Commission of the European Communities, Inter-laboratory test programme concerning the study of the ecotoxicityof a chemical substance with respect to the fish. EEC Study D.8368, 22 March 1979.
(14) Verfahrensvorschlag des Umweltbundesamtes zum akuten Fisch-Test. Rudolph, P. und Boje, R. Okotoxikologie, Grundlagen fur die okotoxikologische Bewertung von Umweltchemikalien nach dem Chemikaliengesetz, ecomed 1986.
(15) Litchfield, J. T. and Wilcoxon, F., A simplified method for evaluating dose effects experiments, J. Pharm, tExp. Therap., 1949, vol. 96, p. 99.
(16) Finney, D.J. Statistical Methods in Biological Assay. Griffin, Weycombe, U.K., 1978.
(17) Sprague, J.B. Measurement of pollutant toxicity to fish. Bioassay methods for acute toxicity. Water Res., 1969, Vol. 3, p. 793–821.
(18) Sprague, J.B. Measurement of pollutant toxicity to fish. II Utilising and applying bioassay results. Water Res. 1970, Vol. 4, p. 3–32.
(19) Stephan, C.E. Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). American Society for Testing and Materials, ASTM STP 634, 1977, 65–84.
(20) Stephan, C.E., Busch, K.A., Smith, R., Burke, J. and Andrews, R.W. A computer program for calculating an LC50. US EPA.
1. papildinājums
Atjaunotais ūdens
Atšķaidīšanai piemērots ūdens (paraugs)
Visām ķīmiskajām vielām jābūt analītiski tīrām.
Jāizmanto ļoti kvalitatīvs vai dejonizēts ūdens, kura vadītspēja ir zemāka par 5 μScm-1.
Ūdens destilācija aparāts nedrīkst saturēt vara detaļas.
Pamatšķīdumi
|
CaCI2. 2H2O (kalcija hlorīda dihidrāts): izšķīdina ūdenī, lai kopējais tilpums būtu 1 litrs. |
11,76 g |
|
MgSO4. 7H2O (magnija sulfāta heptahidrāts): izšķīdina ūdenī, lai kopējais tilpums būtu 1 litrs. |
4,93 g |
|
NaHCO3 (nātrija hidrogēnkarbonāts): izšķīdina ūdenī, lai kopējais tilpums būtu 1 litrs. |
2,59 g |
|
KCl (kālija hlorīds): izšķīdina ūdenī, lai kopējais tilpums būtu 1 litrs. |
0,23 g |
Atjaunotais ūdens atšķaidīšanai
No visiem četriem izejas standartšķīdumiem ņem pa 25 ml, sajauc kopā un pievieno ūdeni līdz 1 litram.
Veic aerāciju, līdz skābekļa koncentrācija ūdenī sasniedz gaisa piesātinājuma līmeni.
pH līmenim jābūt 7,8 ± 0,2.
Vajadzības gadījumā pH līmeni koriģē ar NaOH (nātrija hidroksīds) vai HCI (sālsskābe).
Šādi iegūto ūdeni atšķaidīšanai atstāj apmēram uz 12 stundām, aerācija vairs nav vajadzīga.
Kopējā Ca un Mg jonu koncentrācija šķīdumā ir 2,5 mmol litrā. Ca:Mg jonu attiecība ir 4:1, un Na:K jonu attiecība ir 10:1. Šā šķīduma kopējā sārmainība ir 0,8 mmol litrā.
Gatavojot ūdeni atšķaidīšanai, atkāpes no metodikas ir pieļaujamas, ja tās neietekmē ūdens sastāvu vai īpašības.
2. papildinājums
Ieteicamās zivju sugas
|
Ieteicamās sugas |
Ieteicamais temperatūru diapazons ( oC) |
Ieteicamais kopējais testa dzīvnieka garums (cm) |
|
Brachydanio rerio (Teleostei, Cyprinidae) (Hamilton-Buchanan) Danio zebras zivs |
20 līdz 24 |
3,0 ± 0,5 |
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) melnā platgalve |
20 līdz 24 |
5,0 ± 2,5 |
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linneaus 1758) parastā karpa |
20 līdz 24 |
6,0 ± 2,0 |
|
Oryzias latipes (Teleostei, Poeciliidae) Cyprinodontidae (Tomminck and Schlege 1850) Japānas orīzija |
20 līdz 24 |
3,0 ± 1,0 |
|
Poecilia reticulata (Teleostei, Poeciliidae) (Peters 1859) gupija |
20 līdz 24 |
3,0 ± 1,0 |
|
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque Linneaus 1758) zilais saulesasaris |
20 līdz 24 |
5,0 ± 2,0 |
|
Onchorhynchus mykiss (Teleostei, Salmonidae) (Walbaum 1988) varavīksnes forele |
12 līdz 17 |
6,0 ± 2,0 |
|
Leuciscus idus (Teleostei, Cyprinidae) (Linneaus 1758) ālants, šķaunacis |
20 līdz 24 |
6,0 ± 2,0 |
Zivju iegūšana
Iepriekš minētās zivis ir viegli audzējamas un plaši pieejamas visu gadu. Tās var pavairot un audzēt zivjaudzētavās vai laboratorijās, kas ļauj tās pasargāt no slimībām un parazītiem, tādējādi iegūstot veselas zivis, kuru izcelsme ir zināma. Šīs zivis pieejamas daudzās pasaules vietās.
3. papildinājums
Koncentrācijas piemērs – mirstības procentuālais īpatsvars
C.2. AKŪTĀ TOKSICITĀTE DAFNIJĀM
1. METODE
Akūtas imobilizācijas testēšanas metode ir ekvivalenta ESAO TG 202 (2004) metodei.
1.1. IEVADS
Šajā metodē noteikts akūtās toksicitātes tests ķīmisko vielu iedarbības novērtēšanai uz dafnijām. Iespēju robežās izmantotas esošās metodes (1) (2) (3).
1.2. DEFINĪCIJAS
Šīs metodes kontekstā izmantoti šādi termini:
EC 50 : koncentrācija, kurā noteiktā ekspozīcijas laikā tiek imobilizēti 50 % dafniju. Ja tiek izmantota cita definīcija, tā jānorāda kopā ar attiecīgo atsauci.
Imobilizācija: par imobilizētām tiek uzskatītas dafnijas, kas 15 sekundes pēc testēšanas trauka satura uzmanīgas samaisīšanas nespēj peldēt (pat ja tās vēl kustina viciņas).
1.3. TESTA METODES PRINCIPS
Jaunas dafnijas, kuru vecums nepārsniedz 24 stundas testēšanas sākumā, 48 stundu laikā pakļauj testējamās vielas dažādu koncentrāciju iedarbībai. Imobilizāciju nosaka pēc 24 un 48 stundām, salīdzinot ar kontroli. Rezultātus analizē, lai aprēķinātu EC50 pēc 48 stundām (skatīt 1.2. punktā minētās definīcijas). EC50 noteikšanu pēc 24 stundām veic pēc izvēles.
1.4. INFORMĀCIJA PAR TESTA VIELU
Jābūt zināmai testējamās vielas šķīdībai ūdenī un tvaika spiedienam, un drošai testējamo šķīdumu analīzes metodei vielas daudzuma noteikšanai ar zināmu atgūstamību un kvantitatīvās noteikšanas robežu. Lietderīga ir informācija par vielas struktūru, tīrības pakāpi, stabilitāti ūdenī un gaismā, Pow un vieglas bioloģiskās noārdīšanās spējas testēšanas rezultātiem (skatīt metodi C.4).
Piezīme: norādījumi par vielu testēšanu gadījumos, kad šo vielu fizikāli ķīmisko īpašību dēļ testēšana ir sarežģīta, atrodami (4).
1.5. STANDARTVIELAS
Standartvielu EC50 testēšanu var izmantot par līdzekli testēšanas apstākļu piemērotības apstiprināšanai. Šim nolūkam ieteicams lietot toksiskās vielas, kas tika vairākkārt izmantotas starptautiskās salīdzināšanas testēšanā ( 25 ) (1) (5). Standartvielas testēšanu ieteicams veikt vismaz reizi mēnesī vai vismaz divas reizes gadā.
1.6. KVALITĀTES KRITĒRIJI
Lai testa rezultāti būtu derīgi, jāievēro šādi kritēriji:
— kontrolēs, ieskaitot kontroli ar solubilizācijas aģentu, ne vairāk kā 10 % no dafnijām jābūt imobilizētām,
— izšķīdušā skābekļa koncentrācijai testa beigās jābūt ≥ 3 mg/l kontroles un testa traukos.
Piezīme: pirmajam kritērijam ne vairāk kā 10 % no kontroles dafnijām jābūt novērojamai imobilizācijai vai citām slimību un stresa pazīmēm, piemēram, krāsas zaudēšanai un tādai neparastai uzvedībai kā aizturēšanās uz ūdens virsmas.
1.7. TESTA METODES APRAKSTS
1.7.1. Aprīkojums
Testēšanas traukiem un citai aparatūrai, kas nonāk saskarē ar testējamajiem šķīdumiem, jābūt izgatavotiem no stikla vai cita ķīmiski inerta materiāla. Parasti testēšanai izmanto stikla mēģenes un vārglāzes; pirms katras lietošanas testēšanas trauki jāmazgā saskaņā ar laboratorijas standartprocedūrām. Testēšanas trauki jānosedz, lai samazinātu ūdens zudumus iztvaikošanas dēļ, un jānovērš putekļu iekļūšana šķīdumos. Gaistošas vielas jātestē pilnīgi piepildītos noslēgtos traukos, un tiem jābūt pietiekami lieliem, lai novērstu iespēju, ka ir par maz skābekļa vai tas kļūst par ierobežojošo faktoru (skatīt 1.6. punktu un 1.8.3. punkta pirmo daļu).
Papildus izmanto šādas iekārtas: oksimetru (ar mikroelektrodu vai citu ierīci, kas piemērota izšķīdušā skābekļa mērīšanai maza apjoma paraugos); pH-metru; piemērotu temperatūras regulēšanas ierīcu; iekārtu kopējā organiskā oglekļa koncentrācijas (TOC) noteikšanai; iekārtu ķīmiskā skābekļa patēriņa (ĶSP – COD) noteikšanai, iekārtu cietības noteikšanai u. c.
1.7.2. Testa organismi
Priekšroka dodama dafniju sugai Daphnia magna Straus, tomēr šim testam var izmantot citas piemērotas Daphnia sugas (piemēram, Daphnia pulex). Testa sākumā dzīvnieku vecumam jābūt mazākam par 24 stundām, bet rezultātu izkliedes samazināšanai noteikti ieteicams, lai tie nebūtu pirmās paaudzes pēcnācēji. To izcelsmei jābūt no veselīgas populācijas (t. i., nav pieļaujamas tādas stresa pazīmes kā liela mirstība, tēviņu un efipiju klātbūtne, pirmās paaudzes producēšanas kavējums, krāsu zaudējuši dzīvnieki u. c.). Visu konkrētam testam izmantoto organismu izcelsmei jābūt no kultūrām, kas iegūtas no vienas dafniju rezerves kultūras. Dzīvnieku rezerves kultūra jāuztur tādos apstākļos (gaisma, temperatūra, barotne), kas līdzīgi testēšanas apstākļiem. Ja dafniju kultūras barotne, kas paredzēta izmantošanai testēšanā, atšķiras no barotnes, kas izmantota rutīnas dafniju kultūrai, būtu ieteicams pirms testēšanas paredzēt aklimatizācijas periodu. Šajā nolūkā dafnijas jāiztur atšķaidīšanai izmantojamajā ūdenī testēšanas temperatūrā vismaz 48 stundas pirms testēšanas sākuma.
1.7.3. Ūdens atšķaidīšanai un zivju turēšanai
Dabīgs ūdens (virszemes vai gruntsūdens), rekonstituēts ūdens vai ūdensvada ūdens, no kura attīrīts hlors, ir izmantojams turēšanai un atšķaidīšanai, ja dafnijas tajā bez stresa pazīmēm izdzīvo kultivēšanas, aklimatizācijas un testēšanas laikā. Jebkurš ūdens, kas atbilst atšķaidīšanas ūdenim 1. papildinājumā noteiktajiem ķīmiskajiem raksturlielumiem, ir piemērots testēšanai. Šim ūdenim jābūt pastāvīgai kvalitātei testēšanas laikā. Rekonstituētu ūdeni var sagatavot, pievienojot noteiktos atzītas analītiskās tīrības klases reaģentu daudzumus dejonizētam vai destilētam ūdenim. Rekonstituēta ūdens piemēri ir minēti (1) (6) un 2. papildinājumā. Jāņem vērā, ka barotnes, kas satur helātveidotājus, piemēram, 2. papildinājumā minētās M4 un M7 barotnes, nav piemērotas metālus saturošu vielu testēšanai. Vides reakcijai pH jābūt diapazonā no 6 līdz 9. Cietība no 140 un 250 mg/l (izsakot CaCO3) ir ieteicama, izmantojot Daphnia magna, zemāka cietība var būt piemērota arī citām Daphnia sugām. Atšķaidīšanas ūdeni var aerēt pirms izmantošanas testēšanai tā, lai izšķīdušā skābekļa koncentrācija atbilstu piesātinājuma stāvoklim.
Ja lieto dabīgu ūdeni, kvalitātes parametrs jāmēra vismaz divas reizes gadā vai katru reizi, kad ir aizdomas, ka kvalitātes rādītāji ir ievērojami mainīgi (skatīt iepriekšējo daļu un 1. papildinājumu). Jānosaka arī smagie metāli (piemēram, Cu, Pb, Zn, Hg, Cd, Ni). Ja izmanto ūdensvada ūdeni, no kura attīrīts hlors, vēlams katru dienu veikt hlora analīzi. Ja atšķaidīšanas ūdens ir virszemes ūdens vai gruntsūdens, jāmēra tā vadītspēja un jānosaka kopējais organiskā oglekļa saturs (TOC), vai ķīmiskais skābekļa patēriņš (ĶSP).
1.7.4. Testējamie šķīdumi
Vajadzīgās koncentrācijas testējamos šķīdumus parasti pagatavo, atšķaidot rezerves šķīdumu. Rezerves šķīdumus ieteicams gatavot, izšķīdinot testējamo vielu atšķaidīšanai paredzētajā ūdenī. Ciktāl tas iespējams, jāizvairās no šķīdinātāju, emulgatoru vai disperģētāju pielietošanas. Tomēr noteiktos gadījumos šīs vielas var izrādīties nepieciešamas, lai iegūtu attiecīgas koncentrācijas rezerves šķīdumu. Norādījumi par piemērotiem šķīdinātājiem, emulgatoriem un disperģētājiem ir minēti (4). Testējamās vielas daudzums testējamos šķīdumos nedrīkst pārsniegt šķīdības robežu atšķaidīšanas ūdenī.
Tests jāveic bez pH korekcijas. Ja pH nepaliek 6–9 diapazonā, tad jāveic vēl viens tests, rezerves šķīduma pH koriģējot līdz atšķaidīšanas ūdens reakcijas līmenim pirms testējamās vielas pievienošanas. pH koriģēšana jāveic tādā veidā, lai ievērojami nemainītos rezerves šķīduma koncentrācija un lai nenotiktu nekādas ķīmiskās reakcijas ar testējamo vielu, vai lai tā neizgulsnētos. Korekcijai vēlams izmantot HCl un NaOH.
1.8. PROCEDŪRA
1.8.1. Ekspozīcijas apstākļi
1.8.1.1. Testa grupas un kontroles
Testēšanas traukos iepilda attiecīgos atšķaidīšanas ūdens un testējamās vielas šķīdumu daudzumus. Gaisa/ūdens attiecībai traukā testējamajā un kontroles grupā jābūt vienādai. Pēc tam testēšanas traukos ievieto dafnijas. Katrai testējamajai koncentrācijai un kontrolei jāizmanto vismaz 20 dafnijas, kuras ieteicams iedalīt četrās grupās pa pieciem īpatņiem katrā. Katrai dafnijai jāparedz vismaz 2 ml testējamā šķīduma (t. i., 10 ml piecām dafnijām katrā testēšanas traukā). Testu var veikt, izmantojot pusstatisko atjaunošanu vai caurplūdes sistēmu, ja testējamās vielas koncentrācija nav stabila.
Papildus apstrādājamai sērijai jābūt vienai atšķaidāmā ūdens kontroles sērijai, kā arī, ja tas piemērojams, vienai kontroles sērijai ar solubilizācijas aģentu.
1.8.1.2. Testējamās koncentrācijas
Var veikt diapazona noteikšanas testu, lai noteiktu pašam testam paredzēto koncentrācijas diapazonu, ja nav informācijas par testējamās vielas toksicitāti. Šajā nolūkā dafnijas pakļauj ievērojami atšķirīgu testējamās vielas koncentrāciju iedarbībai. Piecas dafnijas pakļauj katras testējamās koncentrācijas iedarbībai 48 stundas vai mazāk, turklāt nav nepieciešami atkārtojumi. Iedarbības laiku var saīsināt (piemēram, līdz 24 stundām vai mazāk), ja diapazona noteikšanas testam paredzētos datus var iegūt īsākā laikā.
Jāizmanto vismaz piecas testējamās koncentrācijas. Koncentrācijām jāmainās ģeometriskā progresijā ar koeficientu, kas, vēlams, nepārsniedz 2,2. Jāsniedz pamatojums, ja izmanto mazāk nekā piecas koncentrācijas. Lielākās testa koncentrācijas rezultātam jābūt 100 % imobilizācijai, bet zemākās testa koncentrācijas rezultātam vajadzētu būt jebkādas novērojamas iedarbības trūkumam.
1.8.1.3. Inkubācijas apstākļi
Temperatūrai jābūt no 18 oC līdz 22 oC, un katrā atsevišķā testā tai jābūt nemainīgai ± 1 oC robežās. Ieteicams izmantot ciklu, kurā 16 stundas pavada ar apgaismojumu un 8 stundas tumsā. Testēšanu var veikt arī pilnīgā tumsā, īpaši gaismā nestabilām vielām.
Testēšanas laikā testēšanas traukos jānodrošina aerācija. Testu veic, nekoriģējot pH. Testēšanas laikā dafnijas nav jābaro.
1.8.1.4. Ilgums
Testēšanas ilgums ir 48 stundas.
1.8.2. Novērojumi
Katrs testēšanas trauks jāpārbauda, lai konstatētu imobilizētas dafnijas 24 un 48 stundas pēc testēšanas sākuma (definīciju skatīt 1.2. punktā). Bez imobilitātes jāfiksē arī uzvedības vai izskata anomālijas.
1.8.3. Analītiskie mērījumi
Izšķīdušo skābekli un pH mēra testēšanas sākumā un beigās kontroles variantā un pie lielākās testējamās vielas koncentrācijas. Kontrolē esošajai izšķīdinātā skābekļa koncentrācijai jāatbilst pieņemamības kritērijam (skatīt 1.6. punktu). Parasti pH nemainās vairāk par 1,5 vienībām. Temperatūru parasti mēra kontroles traukos vai telpā; temperatūra jāreģistrē visā testēšanas laikā vai vismaz testa sākumā un beigās.
Testējamās vielas koncentrāciju ieteicams mērīt vismaz lielākajai un mazākajai testa koncentrācijai testa sākumā un beigās (4). Rezultātiem ieteicams izmantot izmērītās koncentrācijas. Tomēr, ja ir liecības, ka visā testēšanas laikā testējamās vielas koncentrācija visumā atbilst nominālajai vai izmērītajai sākotnējai koncentrācijai ± 20 %, rezultātiem var izmantot nominālās vai izmērītās sākotnējās vērtības.
1.9. LIMITA TESTS
Izmantojot šajā metodē aprakstītās procedūras, varētu veikt limita testu pie 100 mg/l testējamās vielas vai līdz tās šķīdībai testējamajā šķīdumā (atkarībā no tā, kura no minētajām koncentrācijām ir zemāka), lai pierādītu, vai EC50 ir lielāka par šo koncentrāciju. Limita testu ieteicams veikt, izmantojot 20 dafnijas (tās ieteicams iedalīt četrās grupās pa pieciem īpatņiem) ar tādu pašu kontroļu skaitu. Ja notiek imobilizācija, jāveic testēšana pilnā apmērā. Jebkāda anomāla uzvedība jāreģistrē.
2. DATI
Dati jāapkopo tabulā, katram izmēģinājuma variantam un kontrolei norādot izmantoto dafniju skaitu un katrā atkārtojumā novēroto imobilizāciju. Procentos izteiktu imobilizēto dafniju skaitu, kas konstatēts pēc 24 un 48 stundām, attēlo grafiski atkarībā no testējamās vielas koncentrācijas. Datus analizē ar piemērotām statistikas metodēm (piemēram, probitu analīze, u. c.), lai aprēķinātu līkņu virziena koeficientus un EC50 ar 95 % ticamību (p = 0,05) (7) (8).
Ja EC50 aprēķināšanas standartmetodes iegūto datu apstrādei nav piemērojamas, augstākā koncentrācija, kas neizraisa nekādu imobilizāciju, un zemākā koncentrācija, pie kuras notiek 100 % imobilizācija, jāizmanto EC50 (par kuru pieņem šo divu koncentrāciju vidējo ģeometrisko vērtību) aptuvenai noteikšanai.
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jāiekļauj vismaz šāda informācija.
Testējamā viela:
— fiziskais sastāvs un attiecīgās fizikāli ķīmiskās īpašības,
— ķīmiskās identifikācijas dati, ieskaitot tīrības pakāpi.
Testa suga:
— Daphnia avots un suga, avota piegādātājs (ja zināms) un pielietotie kultūras apstākļi (ieskaitot barības avotu, veidu un daudzumu, barošanas biežumu).
Testēšanas apstākļi:
— testēšanas trauku apraksts: trauku tips, šķīduma tilpums, dafniju skaits vienā testēšanas traukā, katras koncentrācijas testēšanas trauku (atkārtojumu) skaits,
— rezerves šķīduma un testējamo šķīdumu sagatavošanas metodes, ieskaitot iespējamu šķīdinātāja vai disperģētāja lietošanu, testēšanai izmantotās koncentrācijas,
— informācija par atšķaidīšanas ūdeni: ūdens avots un kvalitātes rādītāji (pH, cietība, Ca/Mg attiecība, Na/K attiecība, bāziskums, vadītspēja u. c.); rekonstituētā ūdens sastāvs, ja izmanto šādu ūdeni,
— inkubācijas apstākļi: temperatūra, gaismas intensitāte un apgaismošanas periodiskums, izšķīdušā skābekļa saturs, pH u. c.
Rezultāti:
— to dafniju skaits un daļa procentos, kuras tika imobilizētas vai izrādīja jebkādus nelabvēlīgus efektus (ieskaitot anomālu uzvedību), kontrolē un visos variantos katrā novērojuma laikā, kā arī novēroto efektu būtības apraksts,
— ar standartvielu veiktās testēšanas rezultāti un datums, ja tiek veikta,
— nominālās testējamās koncentrācijas un visu analīžu rezultāti, nosakot testējamās vielas koncentrāciju testēšanas traukos; jānorāda arī metodes atgūstamība un kvantitatīvās noteikšanas robeža,
— visi testēšanas laikā veiktie fizikālie un ķīmiskie temperatūras, pH un izšķīdušā skābekļa mērījumu rezultāti,
— EC50 pēc 48 h imobilizācijai ar ticamības intervāliem un modeļu grafikiem, kas tika izmantoti to aprēķinam, devas atbildes reakcijas līkņu virziena koeficients un standartnovirze; statistiskās procedūras, kas izmantotas EC50 noteikšanai (jānorāda arī šie dati, kas iegūti pēc 24 stundām, ja tie tika mērīti),
— paskaidrojums par jebkādu atkāpi no testēšanas metodes un par to, vai atkāpe ir ietekmējusi testa rezultātus.
4. IZMANTOTĀ LITERATŪRA
(1) ISO 6341 (1996). Water quality – Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) – Acute toxicity test. Third edition, 1996.
(2) EPA OPPTS 850.1010. (1996). Ecological Effects Test Guidelines – Aquatic Invertebrate Acute Toxicity Test, Freshwater Daphnids.
(3) Environment Canada (1996). Biological test method. Acute Lethality Test Using Daphnia spp. EPS 1/RM/11. Environment Canada, Ottawa, Ontario, Canada.
(4) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publication. Series on Testing and Assessment. No. 23. Paris 2000.
(5) Commission of the European Communities. Study D8369 (1979). Inter-laboratory Test Programme concerning the study of the ecotoxicity of a chemical substance with respect to Daphnia.
(6) OECD Guidelines for the Testing of Chemicals. Guideline 211: Daphnia magna Reproduction Test, adopted September 1998.
(7) Stephan C.E. (1977). Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). ASTM STP 634 – American Society for Testing and Materials. p. 65–84.
(8) Finney D.J. (1978). Statistical Methods in Biological Assay. 3rd ed. London. Griffin, Weycombe, UK.
1. PAPILDINĀJUMS
DAŽI ATŠĶAIDĪŠANAI PIEMĒROTA ŪDENS ĶĪMISKIE RAKSTURLIELUMI
|
Viela |
Koncentrācijas |
|
Daļiņas |
< 20 mg/l |
|
Kopējais organiskais ogleklis |
< 2 mg/l |
|
Nejonizēts amonjaks |
< 1 μg/l |
|
Atlikušais hlors |
< 10 μg/l |
|
Fosfororganisko pesticīdu kop. saturs |
< 50 ng/l |
|
Hlororganisko pesticīdu un polhlorbifenīlu kop. saturs |
< 50 ng/l |
|
Kopējais organiskā hlora saturs |
< 25 ng/l |
2. PAPILDINĀJUMS
PIEMĒROTA REKONSTITUĒTĀ TESTĒŠANAS ŪDENS PIEMĒRI
ISO testa ūdens (1)
|
Rezerves šķīdumi (atsevišķu vielu) |
Gatavojot rekonstituēto ūdeni, 1 l ūdens jāpievieno šāds rezerves šķīdumu tilpums (1) |
|
|
Viela |
Daudzums, kas pievienots 1 l ūdens (1) |
|
|
Kalcija hlorīds CaCl2, 2H2O |
11,76 g |
25 ml |
|
Magnija sulfāts MgSO4, 7H2O |
4,93 g |
25 ml |
|
Nātrija bikarbonāts NaHCO3 |
2,59 g |
25 ml |
|
Kālija hlorīds KCl |
0,23 g |
25 ml |
|
(1) Piemērotas tīrības ūdens, piemēram, dejonizēts, destilēts vai ar apgriezto osmozi iegūtā ūdenī, kura vēlamā vadītspēja nepārsniedz 10 μS.cm-1. |
||
Elendta M7 un M4 barotne
Aklimatizācija Elendta M7 un M4 barotnē
Dažām laboratorijām bija grūtības, dafnijas pārnesot tieši M4 un M7 barotnē. Tomēr zināmā mērā sekmīga var būt pakāpeniska aklimatizācija, t. i., pārnesot no dabīgās vides vispirms 30 %, pēc tam 60 % un visbeidzot 100 % Elendta barotnē. Aklimatizācija var ilgt līdz pat vienam mēnesim.
Sagatavošana
Vispirms piemērotas tīrības ūdenī, t. i., dejonizētā, destilētā vai ar apgriezto osmozi iegūtā ūdenī pagatavo atsevišķu pēdu elementu atsevišķus izejas šķīdumus (I). No šiem dažādajiem izejas šķīdumiem (I) pagatavo vienu izejas šķīdumu (II), kas satur visus pēdu elementus (apvienoto šķīdumu), t. i.:
|
Rezerves šķīdums(I) (atsevišķu vielu šķīdums) |
Daudzums, kas pievienots ūdenim (mg/l) |
Koncentrācija (attiecībā pret M4 barotni) |
Lai pagatavotu apvienoto izejas šķīdumu II, ūdenim pievieno šādu daudzumu izejas šķīduma I (ml/l) |
|
|
M4 |
M7 |
|||
|
H3BO3 |
57 190 |
20 000 reizes |
1,0 |
0,25 |
|
MnCl2.4H2O |
7 210 |
20 000 reizes |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000 reizes |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000 reizes |
1,0 |
0,25 |
|
SrCl2·6H2OSrCl2.6H2O |
3 040 |
20 000 reizes |
1,0 |
0,25 |
|
NaBr |
320 |
20 000 reizes |
1,0 |
0,25 |
|
4·Na2 MoO4·2H2OMoO4.2H2O |
1 230 |
20 000 reizes |
1,0 |
0,25 |
|
CuCl2·2H2OCuCl2.2H2O |
335 |
20 000 reizes |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000 reizes |
1,0 |
1,0 |
|
CoCl2.6H2O |
200 |
20 000 reizes |
1,0 |
1,0 |
|
KI |
65 |
20 000 reizes |
1,0 |
1,0 |
|
Na2 SeO3 |
43,8 |
20 000 reizes |
1,0 |
1,0 |
|
NH4 VO3 |
11,5 |
20 000 reizes |
1,0 |
1,0 |
|
Na2 EDTA· 2H2OED-2OEDTA.2H2O |
5 000 |
2 000 reizes |
— |
— |
|
FeSO4·7H2OFeSO4.7H2O |
1 991 |
2 000 reizes |
— |
— |
|
Na 2 EDTA un FeSO4 šķīdumus pagatavo atsevišķi, apvieno un tūlīt ievieto autoklāvā. |
||||
|
Tā iegūst: |
||||
|
2 l Fe-EDTA šķīdums |
1 000 |
20,0 |
5,0 |
|
M4 un M7 vidi pagatavo, izmantojot rezerves šķīdumu II, barības makroelementus un vitamīnus, šādi:
|
Ūdenim pievienotais daudzums (mg/l) |
Koncentrācija (attiecībā pret M4 vidi) |
Rezerves šķīduma II daudzums, kas pievienots, gatavojot barotni (ml/l) |
||
|
M4 |
M7 |
|||
|
Rezerves šķīdums II (mikroelementu maisījums) |
20 reizes |
50 |
50 |
|
|
Barības makroelementu rezerves šķīdumi (atsevišķas vielas) |
||||
|
CaCl2 · 2H20 |
293 800 |
1 000 reizes |
1,0 |
1,0 |
|
MgSO4 · 7H2O |
246 600 |
2 000 reizes |
0,5 |
0,5 |
|
KCl |
58 000 |
10 000 reizes |
0,1 |
0,1 |
|
NaHCO3 |
64 800 |
1 000 reizes |
1,0 |
1,0 |
|
Na2 SiO3 · 9H2O |
50 000 |
5 000 reizes |
0,2 |
0,2 |
|
NaNO3 |
2 740 |
10 000 reizes |
0,1 |
0,1 |
|
KH2 PO4 |
1 430 |
10 000 reizes |
0,1 |
0,1 |
|
K2HPO4 |
1 840 |
10 000 reizes |
0,1 |
0,1 |
|
Kombinētais vitamīnu pamatšķīdums |
— |
10 000 reizes |
0,1 |
0,1 |
|
Vitamīnu maisījuma rezerves šķīdumu gatavo, pievienojot šādus trīs veidu vitamīnus 1 l ūdens: |
||||
|
Tiamīna hidrohlorīds |
750 |
10 000 |
||
|
Ciānkobalamīns (B12) |
10 |
10 000 |
||
|
Biotīns |
7,5 |
10 000 |
||
Vitamīnu maisījuma rezerves šķīdumu glabā sasaldētu mazās alikvotās. Vitamīnus barotnei pievieno neilgi pirms izmantošanas.
|
N. B. |
: |
Lai novērstu sāļu izgulsnēšanos, gatavojot barotni, rezerves šķīdumu alikvotas jāpievieno pie aptuveni 500–800 ml dejonizēta ūdens un pēc tam jāatšķaida līdz 1 litram. |
|
N. B. |
: |
Pirmā publikācija par M4 barotni ir: Elendt, B. P. (1990). Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, p. 25–33. |
C.3. SALDŪDENS AĻĢU UN CIĀNBAKTĒRIJU (ZILAĻĢU) AUGŠANAS INHIBĒŠANAS TESTS
1. METODE
Šī metode ir ekvivalenta OECD TG 201 (2006).
1.1. IEVADS
Testēšanas metodes periodiski pārskata un pilnveido, ņemot vērā zinātnes attīstību. C.3. testēšanas metode bija jāpārstrādā, iekļaujot papildu sugas un izpildot noteiktās prasības par bīstamības novērtējumu un vielu klasifikāciju. Metode pārstrādāta, ņemot vērā plašo praktisko pieredzi, jaunākās zinātniskās atziņas pētījumos par toksisko iedarbību uz aļģēm un izmantošanas pieredzi reglamentēšanas jomā, kas iegūta kopš sākotnējās pieņemšanas.
1.2. DEFINĪCIJAS
Šajā testēšanas metodē ir izmantotas šādas definīcijas un saīsinājumi:
Biomasa: ir populācijas dzīvās vielas sausais svars (sausna), kas izteikts noteiktā tilpuma vienībā; piemēram, mg aļģu sausnas/litrā testa šķīduma. Parasti “biomasa” tiek definēta kā masa, taču šajā testēšanas metodes aprakstā šis vārds tiek lietots, lai apzīmētu masu tilpuma vienībā. Bez tam šajā testā parasti mēra biomasas aizstājējparametrus, tādus kā šūnu skaitu, fluorescenci utt., un lietotais termins “biomasa” līdz ar to attiecas arī uz šiem aizstājējparametru mērījumiem.
Variācijas koeficients: ir parametra mainības bezdimensijas mērs, ko nosaka kā standartnovirzes attiecību pret vidējo vērtību. Šo koeficientu var izteikt arī procentos. Kontroles kultūru atkārtojumu vidējā īpatnējā augšanas ātruma vidējo variācijas koeficientu aprēķina šādi:
1. Izmantojot konkrētā atkārtojuma ikdienas / katras sekcijas augšanas ātrumus, aprēķina vidējā īpatnējā augšanas ātruma variācijas koeficientu procentos.
2. Lai iegūtu kontroles kultūru atkārtojumu ikdienas / katras sekcijas īpatnējā augšanas ātruma vidējo variācijas koeficientu, aprēķina visu 1. punktā noteikto vērtību vidējo lielumu.
ECx : ir testa barotnē izšķīdinātās testējamās vielas koncentrācija, kas noteiktajā iedarbības periodā izraisa testa organisma x % (piemēram, 50 %) augšanas inhibēšanu (periodu norāda, ja tas atšķiras no pilna vai normālā testēšanas laika). Lai nepārprotami norādītu efektīvās koncentrācijas EC vērtību, kas iegūta no augšanas ātruma vai arī iznākuma, izmanto attiecīgi simbolus “ErC” un “EyC”.
Audzēšanas barotne: ir pilnvērtīga sintētiska barotne, kurā aug testa aļģes, kad tās pakļauj testējamās vielas iedarbībai. Testējamā viela parasti tiek izšķīdināta barotnē.
Augšanas ātrums (vidējais īpatnējais augšanas ātrums): ir biomasas pieauguma logaritms iedarbības laikā.
Zemākā novērojamās ietekmes koncentrācija (LOEC): ir zemākā pārbaudītā koncentrācija, kādā testējamā viela noteiktajā iedarbības laikā statistiski nozīmīgā līmenī, salīdzinot ar kontroli, samazina augšanu (pie p < 0,05). Tomēr visām koncentrācijām, kas pārsniedz LOEC, ir jārada tikpat kaitīga vai kaitīgāka iedarbība, kā LOEC. Ja abus nosacījumus izpildīt nav iespējams, ir rūpīgi jāizskaidro, kā tika izvēlēta LOEC (un līdz ar to arī NOEC).
Nenovērojamās ietekmes koncentrācija (NOEC): ir testējamā koncentrācija tieši zem LOEC.
Atbildes reakcijas mainīgais lielums: toksiskuma rādītājs, ko ar dažādu aprēķina metožu palīdzību iegūst no jebkura mērītā parametra, kas apraksta biomasu. Šajā metodē atbildes reakcijas mainīgie ir augšanas ātrums un iznākums, ko iegūst tieši, mērot biomasu vai izmantojot kādu no minētajiem aizstājējparametri.
Īpatnējais augšanas ātrums: ir atbildes reakcijas mainīgais, ko definē kā novērojamā parametra (šajā testēšanas metodē – biomasas) naturālo logaritmu starpību attiecīgā laika periodā.
Iznākums: ir mērāmā mainīgā vērtība iedarbības perioda beigās, no kuras ir atņemta mērāmā mainīgā vērtība iedarbības perioda sākumā, t. i., biomasas pieaugums testēšanas laikā.
1.3. TESTA PIELIETOJUMS
Šī testēšanas metode ir vieglāk izmantojama ūdenī šķīstošām vielām, kas testa apstākļos, visticamāk, paliks ūdens šķīdumā. Testējot gaistošas, izteikti adsorbējošas, krāsainas vielas, kā arī tādas vielas, kas slikti šķīst ūdenī, vai arī vielas, kas var ietekmēt barības vielu vai minerālvielu pieejamību barotnē, var būt nepieciešamas aprakstītā procesa modifikācijas (piemēram, noslēgta sistēma, testa trauku kondicionēšana). Norādījumi par dažām izmantojamajām modifikācijām ir sniegti (2)(3) un (4).
1.4. METODES PRINCIPS
Šī testa mērķis ir noteikt, kā viela ietekmē saldūdens mikroaļģu un/vai ciānbaktēriju augšanu. Eksponenciāli augošus testa organismus periodiski audzētās kultūrās pakļauj testējamās vielas iedarbībai laika posmā, kas parasti ilgst 72 stundas. Lai gan tests ir diezgan īslaicīgs, tas ļauj izvērtēt iedarbību uz vairākām paaudzēm.
Sistēmas atbildes reakcija ir dažādu testējamās vielas koncentrāciju iedarbībai pakļauto aļģu kultūru sēriju (testa vienības) augšanas samazināšanās. Atbildes reakciju vērtē kā iedarbības koncentrāciju funkciju, salīdzinot ar atkārtojumu, iedarbībai nepakļauto kontroles kultūru, vidējo augšanu. Lai pilnībā izpaustos sistēmas reakcija uz toksisko iedarbību (optimālā jutība), kultūrām ļauj neierobežoti eksponenciāli augt, nodrošinot pietiekami daudz barības vielu un nepārtrauktu gaismu pietiekami ilgu laiku, lai varētu izmērīt īpatnējā augšanas ātruma samazināšanos.
Augšanu un augšanas inhibēšanu skaitliski nosaka, izmērot aļģu biomasu kā laika funkciju. Aļģu biomasu definē kā sausnas masu tilpuma vienībā, tas ir, mg aļģu litrā testa šķīduma. Tomēr sausnas masa ir grūti mērāma, tāpēc tiek izmantoti aizstājējparametri. Visbiežāk izmantotais no šiem aizstājējiem parametriem ir šūnu skaits. Citi aizstājējparametri ir šūnu tilpums, fluorescence, optiskais blīvums, u. c. Jānosaka pārrēķināšanas koeficients attiecīgā aizstājējparametra pārvēršanai biomasā.
Testa mērķis ir augšanas inhibēšana, ko izsaka kā biomasas logaritmisko pieaugumu (vidējais īpatnējais augšanas ātrums) iedarbības perioda laikā. Izmantojot testējamajos šķīdumos noteiktos vidējos īpatnējos augšanas ātrumus, aprēķina koncentrāciju, kas izraisa augšanas ātruma konkrēto x % inhibēšanu (piemēram, 50 %), un izsaka kā ErCx (piemēram, ErC50).
Šīs metodes veikšanai ES noteiktajos ietvaros rezultātu aprēķināšana vajadzētu būt balstītai uz vidējo specifisko augšanas ātrumu apstākļiem, kas aprakstīti zemāk 2.2. sadaļā. Šajā testēšanas metodē izmantotais atbildes reakcijas papildu mainīgais ir iznākums, kas var būt nepieciešams, lai izpildītu dažu valstu specifiskas reglamentējošas prasības. To definē kā biomasu iedarbības perioda beigās, no kura atņem biomasu iedarbības perioda sākumā. Izmantojot testējamo šķīdumu sērijās noteikto iznākumu, aprēķina koncentrāciju, kas izraisa iznākuma konkrēto x % inhibēšanu (piemēram, 50 %) un izsaka kā EyCx (piem., EyC50).
Turklāt zemāko novērojamās ietekmes koncentrāciju (LOEC) un koncentrāciju, pie kuras ietekme nav novērojama (NOEC), var noteikt statistiski.
1.5. INFORMĀCIJA PAR TESTĒJAMO VIELU
Testēšanas apstākļu noteikšanai var būt noderīga informācija par testējamās vielas struktūrformulu, tīrības pakāpi, stabilitāti gaismā, stabilitāti testēšanas apstākļos, gaismu absorbējošajām īpašībām, pKa, kā arī transformācijas pētījumu rezultātiem, ieskaitot bioloģiskās noārdīšanas spēju ūdenī.
Jāzina pārbaudāmās vielas šķīdība ūdenī, sadalījuma koeficients sistēmā oktanols/ūdens (Pow) un tvaika spiediens, un jābūt pieejamai validētai metodei vielas daudzuma noteikšanai pārbaudāmajā šķīdumā ar zināmu atgūstamību un kvalitatīvās noteikšanas robežu.
1.6. STANDARTVIELA
Standartvielas, piemēram, 3,5-dihidrofenolu, ko izmanto starptautiskajās starplaboratoriju salīdzinošās testēšanas programmās (4), var lietot testēšanas procedūras pārbaudei. Zaļaļģēm par standartvielu var izmantot kālija dihromātu. Testēšanu ar standartvielām vēlams veikt vismaz divas reizes gadā.
1.7. TESTA DERĪGUMS
Lai tests būtu derīgs, ir jāizpilda šādi veiktspējas kritēriji:
— Kontroles kultūru biomasai 72 stundu laikā ir jāpieaug eksponenciāli, vismaz 16-kārtīgi. Tas atbilst īpatnējam augšanas ātrumam 0,92 dienā–1. Biežāk izmantotajām sugām augšanas ātrums ir būtiski lielāks (skatīt I pielikumu). Šo kritēriju var neizpildīt, ja izmanto sugas, kas aug lēnāk par I pielikumā norādītajām. Tādā gadījumā testēšanas laiks jāpagarina, lai iegūtu vismaz 16-kārtīgu kontroles kultūru pieaugumu, visu testa laiku saglabājot eksponenciālu augšanu. Testa laiku var saīsināt līdz vismaz 48 stundām, lai testa laikā saglabātu neierobežotu eksponenciālu augšanu, kamēr ir sasniegts minimālais pieauguma koeficients 16.
— Katras sekcijas īpatnējo augšanas ātrumu vidējais variācijas koeficients (0.–1. diena, 1.–2. diena un 2.–3. diena 72 stundu testam) kontroles kultūrās (sk. “Variācijas koeficients” sadaļu 1.2) nedrīkst pārsniegt 35 %. Par katras sekcijas īpatnējā augšanas ātruma aprēķināšanu sk. 2.2.1 otrajā daļā. Šis kritērijs attiecas uz kontroles kultūru atkārtojumu variācijas koeficientu vidējo vērtību.
— Testa laikā kontroles kultūru atkārtojumu vidējo īpatnējo augšanas ātrumu variācijas koeficients testos ar Pseudokirchneriella subcapitata un Desmodesmus subspicatus nedrīkst pārsniegt 7 %. Mazāk analizētām sugām šai vērtībai nevajadzētu pārsniegt 10 %.
1.8. METODES APRAKSTS
1.8.1. Aparatūra
Traukiem un citai aparatūrai, kas saskaras ar testa šķīdumiem, jābūt no stikla vai cita ķīmiski inerta materiāla. Priekšmeti ir rūpīgi jāmazgā, lai novērstu iespējamo organisko vai neorganisko piesārņotāju ietekmi uz aļģu augšanu vai testēajmo šķīdumu sastāvu.
Testēšanai izmantojamie trauki parasti ir stikla kolbas, kurām jābūt pietiekami lielām, lai nodrošinātu kultūras tilpumu, kas nepieciešams mērījumiem testa laikā, kā arī atbilstošai CO2 masas pārnesei no atmosfēras (sk. 1.8.9. otro daļu). Jāņem vērā, ka šķidruma tilpumam jābūt analītiskajām noteikšanām pietiekami lielam (sk. 1.8.11 piekto daļu).
Turklāt nepieciešama kāda no šīm iekārtām vai tās visas:
— iekārta kultūras audzēšanai: ir ieteicams izmantot skapi vai kameru, kurā vajadzīgo inkubācijas temperatūru var uzturēt ar precizitāti ± 2 °C,
— instrumenti apgaismojuma mērīšanai: jāuzsver, ka mērījuma rezultātu ietekmē gaismas intensitātes mērīšanas metode un īpaši uztvērēja (kolektora) tips. Mērījumus ieteicams veikt, izmantojot sfērisku (4π) uztvērēju, kas reaģē uz tiešo un atstaroto gaismu visos leņķos virs mērījuma plaknes un zem tās, vai 2 π uztvērēju, kas reaģē uz visu gaismu virs mērījumu plaknes,
— iekārtas aļģu biomasas noteikšanai. Šūnu skaitu, kas ir biežāk izmantotais aļģu biomasas aizstājējparametrs, var noteikt, izmantojot daļiņu elektronisko skaitītāju, mikroskopu ar skaitīšanas kameru vai arī plūsmas citometru. Citus biomasas aizstājējparametrus var mērīt, izmantojot plūsmas citometru, fluorimetru, spektrofotometru vai kolorimetru. Aprēķinos ieteicams izmantot pārrēķināšanas koeficientu šūnu skaita pārvēršanai sausnas masā. Lai ar spektrofotometru iegūtu derīgus mērījumus pie zemas biomasas koncentrācijas, var būt nepieciešams izmantot kivetes ar optisko ceļu vismaz 4 cm.
1.8.2. Testa organismi
Var izmantot vairākas brīvi dzīvojošu mikroaļģu un zilaļģu sugas. 1. pielikumā uzskaitītie celmi ir pierādījuši savu piemērotību izmantošanai šajā testēšanas metodē izklāstītajai procedūrai.
Izmantojot citas sugas, jānorāda celms un/vai izcelsme. Ir jāapstiprina, ka izvēlēto testa aļģu eksponenciālo augšanu, saglabājot noteiktos apstākļus, ir iespējams nodrošināt visu testa laiku.
1.8.3. Audzēšanas barotne
Ieteicams izmantot divas alternatīvas barotnes: OECD un AAP barotnes. Šo barotņu sastāvs norādīts 2. pielikumā. Jāievēro, ka sākotnējais pH un buferietilpība (spēja uzturēt nemainīgu pH) abām barotnēm ir atšķirīga. Tāpēc testēšanas rezultāti atkarībā no izmantotās barotnes var būt dažādi, īpaši analizējot vielas, kas jonizējas.
Barotnes var būt nepieciešams modificēt noteiktiem mērķiem, piemēram, analizējot metālus vai helātus veidojošas vielas, vai arī veicot testēšanu pie dažādām pH vērtībām. Modificētas barotnes izmantošana ir sīki jāapraksta un jāpamato (2)(3).
1.8.4. Biomasas sākotnējā koncentrācija
Testa kultūru sākotnējai biomasai ir jābūt vienādai visās testa kultūrās un pietiekami mazai, lai kultūra visu inkubācijas periodu varētu augt eksponenciāli, neiztērējot barības vielas. Sākotnējā biomasa nedrīkst pārsniegt 0,5 mg/l sausnas masas. Šīs ir ieteiktās sākotnējās šūnu koncentrācijas:
|
Pseudokirchneriella subcapitata: |
5 × 103-104 |
šūnas/ml |
|
Desmodesmus subspicatus |
2–5 × 103 |
šūnas/ml |
|
Navicula pelliculosa |
104 |
šūnas/ml |
|
Anabaena flos-aquae |
104 |
šūnas/ml |
|
Synechococcus leopoliensis |
5 × 104-105 |
šūnas/ml |
1.8.5. Testējamās vielas koncentrācija
Koncentrāciju intervālu, kurā iespējama iedarbība, var noteikt, ņemot vērā intervāla noteikšanas testu rezultātus. Galīgajam definitīvajam testam ir jāizvēlas vismaz piecas koncentrācijas, kas veido ģeometrisko progresiju ar kāpinātāju, kas nepārsniedz 3,2. Testējamajām vielām ar lēzenu koncentrācijas atbildes reakcijas līkni, iespējams, ir jāizmanto lielākas kāpinātāja vērtības. Koncentrāciju sērijām būtu jānodrošina 5–75 % aļģu augšanas ātruma inhibēšana.
1.8.6. Atkārtojumi un kontroles
Testēšanas plānā jāparedz trīs atkārtojumi katram testējamās koncentrācijas variantam. Ja NOEC noteikt nav nepieciešams, testēšanas plānu var mainīt, palielinot koncentrāciju skaitu un samazinot katras koncentrācijas atkārtojumu skaitu. Kontrolei nepieciešami vismaz trīs atkārtojumi, bet ideāli to skaitam ir jābūt divas reizes lielākam par katra testējamās koncentrācijas varianta atkārtojumu skaitu.
Testējamās vielas koncentrācijas analītiskai noteikšanai var sagatavot atsevišķus testējamos šķīdumus (sk. 1.8.11. ceturto un sesto daļu).
Ja testējamās vielas šķīdināšanai izmanto šķīdinātāju, testēšanas plānā jāiekļauj papildu kontroles, kas satur šķīdinātāju tādā pašā koncentrācijā, kādā tas izmantots testa kultūrām.
1.8.7. Inokulācijas kultūras sagatavošana
Lai pielāgotu testa aļģes testēšanas apstākļiem un nodrošinātu, ka testējamo šķīdumu inokulācijai izmantotās aļģes atrodas eksponenciālās augšanas fāzē, 2–4 dienas pirms testa sākuma sagatavo inokulācijas kultūru. Aļģu biomasa ir jākoriģē, lai līdz testa sākumam inokulācijas kultūrā dominētu eksponenciālā augšana. Inokulācijas kultūru inkubē tādos pašos apstākļos kā testa kultūras. Lai pārliecinātos, ka testa celms kultivēšanas apstākļos aug normāli, nosaka inokulācijas kultūras biomasas pieaugumu. Aļģu kultūru audzēšanas piemērs izklāstīts 3. pielikumā. Lai novērstu šūnu sinhronu dalīšanos testa laikā, inokulācijas kultūra, iespējams, būs jāpārsēj atkārtoti.
1.8.8. Testa šķīdumu sagatavošana
Visos testējamajos šķīdumos jābūt vienādai barotnes koncentrācijai un testa aļģu sākotnējai biomasai. Izvēlētās koncentrācijas testa šķīdumus parasti sagatavo, samaisot testējamās vielas izejas šķīdumu ar barotni un inokulācijas kultūru. Izejas šķīdumu parasti sagatavo, izšķīdinot vielu testa vidē.
Lai testa videi pievienotu vielas ar zemu šķīdību ūdenī, kā nesējus var izmantot šķīdinātājus, piemēram, acetonu, t-butilspirtu un dimetilformamīdu (1)(2). Šķīdinātāja koncentrācija nedrīkst pārsniegt 100 μl/l, un visām testa sērijas kultūrām (ieskaitot kontroles) šķīdinātājs jāpievieno vienādā koncentrācijā.
1.8.9. Inkubācija
Testa traukus noslēdz ar gaisu caurlaidīgiem aizbāžņiem. Traukus sakrata un ievieto kultivēšanas aparātā. Testa laikā aļģes nepieciešams turēt suspensijas stāvoklī un veicināt CO2 pārnesi. Šim nolūkam izmanto pastāvīgu kratīšanu vai maisīšanu. Kultūras ir audzē temperatūrā no 21 līdz 24 °C, ko uztur ar ± 2 °C precizitāti. Sugām, kas nav minētās 1. pielikumā, piemēram, tropiskajām sugām, var būt piemērotas augstākas temperatūras ar nosacījumu, ka iespējams izpildīt derīguma kritērijus. Kolbas ir ieteicams izvietot nejaušā secībā un katru dienu mainīt to stāvokli inkubatorā.
Kontroles barotnes pH testa laikā nedrīkst palielināties vairāk par 1,5 vienībām. Lai iegūtu reproducējamus un precīzi definētus rezultātus metāliem un savienojumiem, kas testa pH atbilstošā ūdeņraža jonu koncentrācijā daļēji jonizējas, var būt jāierobežo pH izmaiņas. Tehniski iespējams panākt par 0,5 pH vienībām mazākas izmaiņas, kas sasniedzams, nodrošinot adekvātu CO2 masas pārnesi no apkārtējā gaisa testa šķīdumā, piemēram, palielinot kratīšanas ātrumu. Tāpat, samazinot sākotnējo biomasu vai arī testa ilgumu, var samazināt kultūras CO2 vajadzību.
Virsmai, uz kuras tiek inkubētas kultūras, jāsaņem pastāvīgs, viendabīgi fluorescējošs, piemēram, “vēsi baltās” vai “dienasgaismas” tipa apgaismojums. Aļģu un ciānbaktēriju gaismas prasības ir atšķirīgas. Gaismas intensitāte ir jāizvēlas atbilstoši izmantotajam testa organismam. Ieteicamajām zaļaļģu sugām gaismas intensitāte šķīdumu līmenī ir jāizvēlas intervālā 60–120 μE·m–2·s–1, ar atbilstošu uztvērēju mērot pie fotosintētiski efektīvo viļņu garuma, t. i., 400–700 nm. Dažas sugas, īpaši Anabaena flos-aquae, labi aug zemākas intensitātes gaismā un var tikt bojātas, ja gaismas intensitāte ir augsta. Šādām sugām vidējā gaismas intensitāte ir jāizvēlas intervālā 40–60 μE·m–2·s–1. (Apgaismojuma mērīšanas instrumentiem, kas ir kalibrēti luksos, ekvivalents 4 440–8 880 lx aukstās baltās gaismas intervāls aptuveni atbilst ieteiktajai gaismas intensitātei 60–120 μE·m–2·s–1). Gaismas intensitāte no vidējās gaismas intensitātes virs inkubācijas virsmas nedrīkst atšķirties vairāk par ± 15 %.
1.8.10. Testa ilgums
Tests parasti ilgst 72 stundas. Tomēr var izmantot īslaicīgākus vai ilglaicīgākus testus ar nosacījumu, ka tiek ievēroti 1.7. sadaļā minētie derīguma kritēriji.
1.8.11. Mērījumi un noteikšanas analīzes
Aļģu biomasa katrā kolbā testēšanas laikā jānosaka vismaz vienu reizi dienā. Ja mērījumus veic, izmantojot ar pipeti no testa šķīduma ņemtus nelielus tilpumus, tos nedrīkst aizstāt.
Biomasu mēra, skaitot šūnas ar mikroskopu vai izmantojot daļiņu elektronisko skaitītāju (pēc šūnu skaita un/vai bioloģiskā tilpuma). Citas metodes, piemēram, plūsmas citometriju, in vitro vai in vivo hlorofila fluorescences (6)(7) vai optiskā blīvuma mērījumi ir izmantojami ar nosacījumu, ka var demonstrēt testēšanas apstākļos iegūstamās biomasas pietiekami ciešu korelāciju ar šādu alternatīvu parametru.
Testa sākumā un beigās jānosaka šķīdumu pH.
Ja izmantoto koncentrāciju diapazonā pieejama analītiska procedūra testējamās vielas noteikšanai, testa šķīdumi jāanalizē, lai apstiprinātu sākotnējās koncentrācijas un iedarbības koncentrāciju saglabāšanos visā testēšanas laikā.
Ja sagaidās, ka iedarbības koncentrāciju nominālās vērtības testēšanas laikā mainīsies ne vairāk par 20 %, iespējams, ka pietiks noteikt testējamās vielas koncentrāciju zemas un augstas koncentrācijas variantos testa sākumā un beigās, kā arī koncentrāciju, kas aptuveni atbilst EC50. Ja koncentrācijas, visticamāk, nesaglabāsies 80–120 % robežās no nominālās koncentrācijas, ieteicams analizēt visas pārbaudāmās koncentrācijas testa sākumā un beigās. Lai precīzāk noteiktu gaistošu, nestabilu vai izteikti adsorbējošu testējamo vielu zudumus, iedarbības laikā ar 24 stundu intervālu laikā ieteicams ņemt analīzēm papildu testējamās vielas paraugus. Šīm vielām būs nepieciešami papildu atkārtojumi. Visos gadījumos testējamās vielas koncentrācijas ir jānosaka tikai no viena katras pārbaudāmās koncentrācijas atkārtojuma (vai arī vairākos vienā atkārtojumā apvienotos traukos).
Iedarbības koncentrāciju analīzei testa laikā īpaši sagatavotās barotnes jāapstrādā identiski testā izmantotajām, t. i., tās jāinokulē ar aļģēm un jāinkubē identiskos apstākļos. Ja jānosaka izšķīdušās testējamās vielas koncentrācija, iespējams, ka aļģes jāatdala no barotnes. Atdalīšanu ieteicams veikt centrifūgā pie relatīvi neliela centrbēdzes spēka, kas ir pietiekams aļģu izgulsnēšanai.
Konstatējot, ka testējamās vielas koncentrācija visa testa laikā ir saglabājusies ± 20 % no nominālās vai noteiktās sākotnējās koncentrācijas, rezultātu analīzei var izmantot nominālās vai noteiktās sākotnējās vērtības. Ja novirze no nominālās vai arī noteiktās sākotnējās koncentrācijas pārsniedz ± 20 %, rezultātu analīzei jāizmanto vidējā ģeometriskā koncentrācija iedarbības laikā, vai arī modeļi, kas apraksta pārbaudāmās vielas koncentrācijas samazināšanos (3)(8).
Aļģu augšanas inhibēšanas tests ir dinamiskāka testa sistēma nekā lielākā daļa citu īslaicīgo testu, ko izmanto toksiskuma noteikšanai ūdens vidē. Līdz ar to faktiskās koncentrācijas var būt grūti nosakāmas, īpaši adsorbējošām vielām zemās koncentrācijās. Šādos gadījumos vielas izzušana no šķīduma, adsorbējoties uz pieaugošās aļģu biomasas nenozīmē, ka tās testa sistēmā vairs nav. Analizējot testēšanas rezultātus jāpārbauda, vai līdz ar testējamās vielas koncentrācijas samazināšanos testa laikā samazinās arī augšanas inhibēšana. Ja tā notiek, var apsvērt iespējas izmantot piemērotu modeli testējamās vielas koncentrācijas samazināšanās (8) aprakstīšanai. Ja nē, rezultātu analīzei var izmantot sākotnējās (nominālās vai izmērītās) koncentrācijas.
1.8.12. Citi novērojumi
Lai pārliecinātos par inokulējamās kultūras normālu un veselīgu izskatu, kā arī konstatētu visas aļģu anomālijas (ko var izraisīt testējamās vielas iedarbība), testa beigās jāveic mikroskopiski izmeklējumi.
1.8.13. Robežvērtību tests
Dažos gadījumos, piemēram, ja iepriekšējais tests norāda, ka testējamās vielas koncentrācijām līdz 100 mg·l–1 vai arī līdz šķīdības robežai testa vidē (atkarībā no tā, kura no vērtībām ir mazāka) nav toksiskas iedarbības, var veikt robežvērtību testu, kurā salīdzina reakciju kontroles grupā un vienā apstrādes varianta grupā (100 mg·l–1 vai koncentrācijā, kas atbilst šķīdības robežai). To ieteicams papildināt ar iedarbības koncentrācijas analīzi. Uz robežvērtības testu attiecas visi iepriekš aprakstītie testa nosacījumi un derīguma kritēriji, izņemot to, ka nepieciešami vismaz seši katra apstrādes varianta atkārtojumi. Reakcijas mainīgos kontroles grupā un apstrādes grupā var analizēt, izmantojot statistisku testu vidējo vērtību salīdzināšanai, piemēram, Stjūdenta t-testu. Ja abu grupu dispersija nav vienāda, jāveic nevienādām dispersijām pielāgots t-tests.
1.8.14. Modifikācijas stripri krāsainām vielām
Iradiācijai (vieglas intensitātes) vajadzētu būt augstākai diapazona beigās, kā aprakstīts šajā testēšanas metodē: 120μE m-2 s-1 vai augstāk.
Gaismas ceļam vajadzētu būt īsākam pie testa šķīduma tilpuma samazināšanas (diapazonā 5–25 ml).
Pietiekamu sakratīšanu (piemēram, mērenu sakratīšanu) vajadzētu veikt, lai iegūtu augstas iedarbības biežumu uz aļģēm un augstu irridāciju uz kultūras virsmu.
2. DATI
2.1. AUGŠANAS GRAFIKI
Biomasu testa traukos var izteikt mērījumam izmantotā aizstājējparametra vienībās (piemēram, šūnu skaits, fluorescence).
Lai konstruētu augšanas grafikus, tabulas veidā apkopo datus par biomasas koncentrācijām testa kultūrās un kontrolēs un testējamās vielas koncentrācijām un mērījumu termiņiem, ko reģistrē ar precizitāti vismaz līdz veselām stundām. Šajā pirmajā posmā var izmantot gan logaritmisko, gan lineāro mērogu, taču logaritmisko skalu izmantot ir obligāti, un tā kopumā labāk attēlo augšanas izmaiņas testēšanas laikā. Jāņem vērā, ka eksponenciālo augšanu logaritmisko koordinātu sistēmā attēlo ar taisnu līniju, un līnijas virziena koeficients (slīpums) raksturo īpatnējo augšanas ātrumu.
Izmantojot grafikus, pārbauda, vai kontroles kultūras testa laikā aug eksponenciāli un paredzamajā ātrumā. Kritiski izvērtē visus datu punktus un grafiku veidu, kā arī pārbauda izejas datus un procedūras, vai tajos nav kļūdu. Īpašu uzmanību pievērš visiem datiem, kas, kā šķiet, atšķiras par sistemātisku kļūdu. Ja dati norāda uz kļūdām procedūrā un tās ir/vai var tikt uzskatītas par ļoti ticamām, attiecīgo datu punktu atzīmē kā izkrītošu un neiekļauj turpmākajā statistiskajā analīzē. (Ja aļģu koncentrācija vienā no diviem vai trim varianta atkārtojumu traukiem atbilst nullei, tas, iespējams, norāda, ka trauki nav pareizi inokulēti vai pietiekami tīri). Iemesli, kāpēc datu punkts tika atzīts par izkrītošu, ir skaidri jānorāda testēšanas pārskatā. Pieņemamie iemesli ir tikai (reti) kļūdas procedūrā un nevis vienkārši zema precizitāte. Statistiskās procedūras izkritušo vērtību identificēšanai šī tipa problēmām ir izmantojamas ierobežoti, un tās nevar aizstāt eksperta vērtējumu. Izkritušās vērtības (atbilstoši identificētas) ieteicams atstāt starp grafikos vai tabulās attēlotajiem datu punktiem.
2.2. ATBILDES REAKCIJAS MAINĪGIE
Šī testa mērķis ir noteikt, kā testējamā viela ietekmē aļģu augšanu. Šajā testēšanas metodē aprakstīti divi atbildes reakcijas mainīgie, jo dalībvalstīm ir atšķirīga to izvēle un dažādas ar reglamentāciju saistītās vajadzības. Lai testa rezultāti tiktu atzīti visās dalībvalstīs, efekti ir jāizvērtē, izmantojot abus reakcijas mainīgos (a) un (b), kas aprakstīti turpmāk.
(a) Vidējais īpatnējais augšanas ātrums: šo reakcijas mainīgo aprēķina, pēc testa laikā konstatētā biomasas logaritmiskā pieauguma, ko izsaka vieni dienai.
(b) Iznākums: šis reakcijas mainīgais ir biomasa testa beigās, no kuras atņem biomasu testa sākumā.
Šīs metodes veikšanai ES noteiktajos ietvaros, rezultātu aprēķināšanai vajadzētu būt balstītai uz vidējo specifisko augšanas ātrumu apstākļiem, kas aprakstīti zemāk. Jāatzīmē, ka toksiskās iedarbības aprēķinu rezultāts ir atkarīgs no izmantotā atbildes reakcijas mainīgā, kas nav salīdzināmi, un šīs atšķirības jāņem vērā, izmantojot testa rezultātus. Ņemot vērā katras pieejas matemātisko bāzi un stingri ievērojot šajā metodē noteiktos testēšanas apstākļus, uz vidējo īpatnējo augšanas ātrumu (ErCx) balstītās ECx vērtības kopumā būs augstākas par rezultātiem, kas aprēķināti pēc iznākuma (EyCx). To nevar interpretēt kā abu atbildes reakcijas mainīgo jutības atšķirības, jo šīs vērtības ir matemātiski dažādas. Vidējā īpatnējā augšanas ātruma koncepcija ir balstīta uz aļģu vispārējā eksponenciālās augšanas modeļa neierobežotās kultūrās, kurās toksisko iedarbību vērtē, ņemot vērā ietekmi uz augšanas ātrumu, neatkarīgi no kontroles kultūras absolūtā īpatnējā augšanas ātruma, koncentrācijas un atbildes reakcijas grafika slīpuma vai testēšanas ilguma. Pretēji tam uz iznākumu balstītie rezultāti ir atkarīgi no visiem šiem mainīgajiem. EyCx ir atkarīgs no katrā testā izmantoto aļģu sugu īpatnējā augšanas ātruma un maksimālā īpatnējā augšanas ātruma, kas dažādām sugām un pat atšķirīgiem aļģu celmiem var būt dažāds. Šo reakcijas mainīgo nevar izmantot, lai salīdzinātu dažādu aļģu sugu vai pat atšķirīgu celmu jutību pret toksiskajām vielām. Lai gan vidējā īpatnējā augšanas ātruma izmantošanai toksiskās iedarbības novērtēšanā no zinātniskā viedokļa būtu dodama priekšroka, dažās valstīs spēkā esošo reglamentējošo prasību izpildei šajā testa metodē ir iekļauts arī uz iznākumu balstīts toksiskās iedarbības novērtējums.
2.2.1. Vidējais augšanas ātrums
Katram kontroles un apstrādes varianta traukam vidējo īpatnējo augšanas ātrumu noteiktam periodam aprēķina kā biomasas logaritmisko pieaugumu saskaņā ar vienādojumu:

kur:
|
μ i–j - |
ir vidējais īpatnējais augšanas ātrums no laika i līdz j; |
|
X i - |
ir biomasa laikā i; |
|
X j - |
ir biomasa laikā j. |
Katrā apstrādes varianta grupā un kontroles grupā aprēķina vidējo augšanas ātrumu un tā dispersiju.
Aprēķina vidējo īpatnējo augšanas ātrumu visā testa laikā (parasti 0–3 dienās), par sākuma vērtību izmantojot nomināli inokulēto biomasu, nevis noteikto sākuma vērtību, jo šādā veidā parasti var sasniegt lielāku precizitāti. Ja biomasas mērīšanā izmantotās iekārtas ļauj pietiekami precīzi noteikt zemu inokulētās kultūras biomasu (piemēram, plūsmas citometrs), tad var izmantot noteikto sākotnējo biomasas koncentrāciju. Tāpat izvērtē katras sekcijas augšanas ātrums, ko aprēķina kā katras testa dienas (0.–1. diena, 1.–2. diena un 2.–3. diena) īpatnējo augšanas ātrumu un pārbauda, vai kontroles augšanas laiks ir pastāvīgs (sk. derīguma kritērijus 1.7. sadaļā). Par vidējo kopējo īpatnējo augšanas ātrumu būtiski zemāks īpatnējais augšanas ātrums pirmajā dienā var liecināt par kultūras atrašanos kavēšanās fāzē, kurā tā attīstās lēni. Lai gan kavēšanās fāzi kontroles kultūrās var līdz minimumam samazināt un praktiski novērst, atbilstoši pavairojot pirmskultūru, kavēšanās fāze apstrādes variantu kultūrās var liecināt par kultūras atveseļošanos pēc sākotnējā toksiskā stresa, vai par sākotnēji samazinātu iedarbību testējamās vielas zudumu dēļ (ieskaitot sorbciju aļģu biomasā). Līdz ar to, lai izvērtētu testa vielas ietekmi visas iedarbības laikā, var noteikt katras sekcijas augšanas ātrumu. Būtiska atšķirība starp katras sekcijas augšanas ātrumu un vidējo augšanas ātrumu norāda uz novirzi no pastāvīgas eksponenciālas augšanas un liecina par nepieciešamību sīkāk izpētīt augšanas līknes.
Augšanas ātruma inhibēšanu procentos katram apstrādes atkārtojumam aprēķina šādi:
![]()
kur:
|
%Ir: |
vidējā īpatnējā augšanas ātruma inhibēšana procentos; |
|
μC: |
kontroles grupas vidējais īpatnējais augšanas ātrums (μ); |
|
μT: |
apstrādes varianta atkārtojumu vidējais īpatnējais augšanas ātrums. |
Ja testējamo šķīdumu gatavošanai lieto šķīdinātājus, inhibēšanas procentu aprēķināšanā jāizmanto nevis kontroles bez šķīdinātājiem, bet gan kontroles ar šķīdinātājiem.
2.2.2. Iznākums
Iznākumu aprēķina no katra kontroles trauka un apstrādes varianta trauka biomasas testa beigās, atņemot biomasu testa sākumā. Katrai testējamajai koncentrācijai un kontrolei aprēķina vidējo iznākumu un tā dispersiju. Iznākuma inhibēšanu procentos (%Iy) katram atkārtojumam var aprēķināt:
![]()
kur:
|
% Iy: |
iznākuma inhibēšana procentos |
|
YC: |
iznākuma vidējā vērtība kontroles grupā |
|
YT: |
apstrādes varianta atkārtojumu iznākuma vērtība |
2.3. KONCENTRĀCIJAS-ATBILDES REAKCIJAS GRAFIKS
Inhibēšanas vērtības procentos atkarībā no testējamās vielas koncentrācijas logaritma atliek uz grafika, neņemot vērā punktus, kas atzīti par izkritušiem testēšanas pirmajā posmā. Ar roku vai izmantojot datorizētu interpolāciju, starp datu punktiem izvelk gludu līniju, lai iegūtu pirmo iespaidu par koncentrācijas-atbildes reakcijas sakarību, tad turpina, lietojot precīzāku metodi, ieteicams, datorizētu statistisku metodi. Atkarībā no plānotā datu izmantošanas veida, to kvalitātes (precizitātes) un apjoma, kā arī datu analīzes instrumentu pieejamības, var pieņemt lēmumu (un dažreiz tas ir pamatoti) pārtraukt datu analīzi šajā posmā, un no grafika vienkārši nolasīt galvenos parametrus EC50 un EC10 (un/vai EC20) (sk. arī sadaļu par veicinošu iedarbību turpinājumā). Iemesli, kas attaisno statistiskās metodes neizmantošanu:
— Dati nav piemēroti datorizētām metodēm, lai iegūtu drošākus rezultātus par tiem, ko var iegūt ar eksperta vērtējumu – šajās situācijās ar dažām datorprogrammām, iespējams, pat nevarēs iegūt risinājumu (iterācijas var nekonverģēt, u. c.).
— Lietojot pieejamās datora programmas, nav iespējams adekvāti izmantot datus par augšanas stimulāciju (sk. turpmāk).
2.4. STATISTISKĀS PROCEDŪRAS
Mērķis – izmantojot regresijas analīzi, iegūt kvantitatīvu koncentrācijas-atbildes reakcijas sakarību. Lai gan pēc atbildes reakcijas datu lineāras transformēšanas iespējams izmantot svērto lineāro regresiju, piemēram, probit vai logit, vai Weibull vienībās (9), tomēr ieteicams izmantot nelineārās regresijas metodes, kas labāk apraksta neizbēgamās datu kļūdas un novirzes no nesimetriskajiem sadalījumiem. Tuvojoties nullei vai pilnīgai inhibēšanai, šādas novirzes var palielināt analīzi apgrūtinošā transformācija (9). Jāņem vērā, ka analīžu standartmetodes, kas izmanto probit, logit vai Weibull pārveidojumus, ir paredzētas tādu datu analīzei, kas ir galīgi lielumi (piemēram, mirstības vai izdzīvošanas datiem), un tās jāmodificē, piemērojot augšanas vai biomasas datiem, kas ir nepārtraukti gadījuma lielumi. Īpašas procedūras ECx vērtību noteikšanai, izmantojot datus, kas ir nepārtraukti lielumi, ir aprakstītas (10),(11) un (12). Nelineārās regresijas analīze sīkāk aprakstīta 4. pielikumā.
Lai izskaitļotu punktu ECx vērtības, katram analizējamajam reakcijas mainīgajam izmanto koncentrācijas-atbildes reakcijas sakarību. Ja iespējams, katrai vērtībai jānosaka 95 % ticamības līmeņi. Atbildes reakcijas datu atbilstība regresijas modelim jāizvērtē vai nu grafiski, vai statistiski. Regresijas analīze jāveic, izmantojot nevis apstrādes variantu grupu vidējos rādītājus, bet atsevišķu atkārtojumu atbildes reakcijas. Ja tomēr nelineāra grafika izmantošana ir grūti īstenojama datu lielās izkliedes dēļ, problēmu var apiet, veicot regresiju grupas vidējām vērtībām, jo tā ir praktiska iespēja, kā samazināt iespējamo izkritušo vērtību ietekmi. Ja atsevišķie atkārtojumi nedod labu rezultātu, par šīs iespējas izmantošanu kā par novirzi no parastās procedūrasa jānorāda testēšanas pārskatā.
Ja pieejamie regresijas modeļi/metodes datiem nav piemēroti, EC50 vērtības un ticamības līmeņus var iegūt arī, izmantojot lineāro interpolāciju ar bootstrapping – statistisku metodi datu kopas pārbaudei, izveidojot to pseidoatkārtojumus pēc gadījuma izvēles principa (13).
Lai izvērtētu LOEC un līdz ar to arī NOEC, kā arī testējamās vielas ietekmi uz augšanas ātrumu, izmantojot dispersijas analīzes metodes, jāsalīdzina ar to apstrādes variantu grupu vidējās vērtības. Katras koncentrācijas vidējā vērtība pēc tam, izmantojot atbilstošu daudzkārtīgu salīdzinājumu vai trenda testa metodes, ir jāsalīdzina ar kontroles vidējo vērtību. Iespējams, būs noderīgs Dunnett vai Williams tests (14)(15)(16)(17)(18). Jānovērtē, vai ir spēkā pieņēmums par dispersijas homogenitāti. Šo izvērtējumu var veikt grafiski vai arī izmantojot formālu testu (18). Piemēroti ir Levene vai Bartlett testi. Dispersijas nehomogenitāti dažreiz var koriģēt ar datu logaritmisko transformāciju. Tomēr, ja dispersijas heterogenitāte ir ļoti liela un to nav iespējams novērst ar transformāciju, būtu jālemj par tādu metožu kā Jonkheere trenda testa izmantošanu. Sīkāki norādījumi par NOEC noteikšanu aprakstīti (12).
Zinātnes jaunākās atziņas ir pamatā ieteikumam atteikties no NOEC jēdziena, tās vietā izmantojot ECx vērtības, ko nosaka ar regresijas analīzi. Šim aļģu testam nav noteikta piemērota x vērtība. Piemērotākais acīmredzot ir 10 līdz 20 % intervāls, (atkarībā no izvēlētā reakcijas mainīgā), un testēšanas pārskatā vēlams norādīt EC10 un EC20 vērtības.
2.5. AUGŠANAS VEICINĀŠANA
Dažkārt zemās koncentrācijās novēro augšanas veicināšanu (negatīvo inhibēšanu). Tā iemesls ir vai nu hormēzes parādība (“toksiskā stimulācija”), vai arī augšanu veicinošu faktoru pievienošana izmantotajai minimālajai barotnei ar testējamo vielu. Jāņem vērā, ka neorganisko barības vielu pievienošanai nedrīkstētu būt tiešas ietekmes uz attīstību, jo testa vidē visā tā laikā ir jābūt barības vielu pārākumam. Aprēķinot EC50, zemu devu stimulācijas efektu parasti var neņemt vērā, ja vien tā nav ekstrēmi liela. Tomēr, ja tā ir ekstrēmi liela vai arī ECx vērtība jāaprēķina pie maziem x, var būt nepieciešamas īpašas procedūras. Ja iespējams, no datu analīzes nevajadzētu izslēgt veicinošas reakcijas, un, ja ar izmantojamo grafiku veidošanas programmatūru nav iespējams akceptēt nelielu stimulāciju, var izmantot lineāro interpolāciju ar bootstrapping, lai izdarītu secinājumus par pārējiem datiem. Ekstrēmas stimulācijas gadījumā, iespējams, ka var būt jāizmanto hormēzes modelis (19).
2.6. NETOKSISKA AUGŠANAS INHIBĒŠANA
Gaismu absorbējošas testējamās vielas var samazināt augšanas ātrumu, jo noēnojums samazina pieejamās gaismas daudzumu. Šāda fiziskā iedarbība, modificējot testa apstākļus, ir jānodala no toksiskās iedarbības, un fiziskā iedarbība ir jānorāda atsevišķi. Norādes ir pieejamas (2) un (3).
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jāiekļauj šāda informācija:
Testējamā viela:
— fizikālais stāvoklis un būtiskās fizikāli ķīmiskās īpašības, ieskaitot šķīdību ūdeni,
— ķīmiskās identifikācijas dati, ieskaitot tīrību.
Testa sugas:
— celms, piegādātājs vai izcelsmes avots un izmantotie kultivēšanas apstākļi.
Testēšanas apstākļi:
— testēšanas sākuma datums un ilgums,
— testēšanas plāna apraksts: testa trauki, kultūras tilpumi, biomasas blīvums testa sākumā,
— barotnes sastāvs,
— testējamās koncentrācijas un atkārtojumi (piemēram, atkārtojumu skaits, testējamo koncentrāciju variantu skaits un izmantotā ģeometriskā progresija),
— testa šķīdumu sagatavošanas apraksts, ieskaitot šķīdinātāju izmantošanu, u. c.,
— kultivēšanai izmantotā aparatūra,
— gaismas intensitāte un kvalitāte (avots, homogenitāte),
— temperatūra,
— testējamās koncentrācijas: nominālās testējamās koncentrācijas un visi rezultāti, kas iegūti analīzēs ar mērķi noteikt testējamās vielas koncentrāciju testa traukos. Pārskatā jānorāda testējamās vielas atgūstamība un kvantitatīvās noteikšanas robeža testa matricā,
— visas novirzes no šīs testēšanas metodes,
— biomasas noteikšanas metode un noteiktā parametra korelācijas pierādījumi ar sausnas masu.
Rezultāti:
— pH vērtības testa sākumā un beigās visos izmēģinājuma variantos,
— katras kolbas biomasa visos mērījumu punktos un biomasas mērīšanas metode,
— augšanas grafiki (biomasas izmaiņas laikā),
— katra varianta atkārtojumam aprēķinātie atbildes reakcijas mainīgie ar vidējām vērtībām un variācijas koeficientiem atkārtojumos,
— koncentrācijas/iedarbības sakarības grafiskais attēlojums,
— atbildes reakcijas mainīgo toksiskās iedarbības rādītāju piemēram, EC50, EC10, EC20 aprēķinātās vērtības un to ticamības intervāli. Ja aprēķina, arī LOEC un NOEC vērtības, jānorāda to noteikšanai izmantotās statistiskās metodes,
— ja izmanto dispersijas analīzi, nosakāmās iedarbības apjoms (piemēram, mazākā būtiskā starpība),
— jebkāda augšanas veicināšana, kas konstatēta kādā no variantiem,
— citi novērojumi, piemēram, aļģu morfoloģiskās izmaiņas,
— rezultātu izvērtējums, norādot arī atkāpes no šīs testēšanas metodes, kurām varētu būt ietekme uz testēšanas rezultātiem.
4. LITERATŪRA
(1) OECD TG 201 (2006) Freshwater Alga and Cyanobacteria, Growth Inhibition Test
(2) ISO 1998: Water quality – Guidance for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waster water. ISO/DIS 14442
(3) OECD 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, no. 23.
(4) ISO 1998: Water quality – Sampling – Part 16: General Guidance for Biotesting. ISO 5667–16.
(5) ISO 1993: Water quality – Algal growth inhibition test. ISO 8692
(6) Mayer, P., Cuhel, R. and Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525–2531.
(7) Slovacey, R.E. and Hanna, P. J. In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22,5 (1977), pp.919–925
(8) Simpson, S.L., Roland, M.G.E., Stauber, J.L. and Batley, G. E. (2003) Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem 22, 2073–2079.
(9) Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718.
(10) Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E. R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167.
(11) Bruce, R.D., and Versteeg, D. J. (1992). A statistical procedure for modelling continuous toxicity data. Env. Toxicol. Chem. 11:1485–1494.
(12) OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
(13) Norberg-King T. J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN.
(14) Dunnett, C. W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096–1121
(15) Dunnett, C. W. (1964) New tables for multiple comparisons with a control. Biometrics 20: 482–491.
(16) Williams, D. A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103–117.
(17) Williams, D. A. (1972) The comparison of several dose levels with a zero dose control. Biometrics 28: 510–531.
(18) Draper, N.R. and Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York.
(19) Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Water Research, 29, 93–96.
1. papildinājums
Metodei piemērotie celmi
Zaļaļģes
— Pseudokirchneriella subcapitata, (agrāk pazīstama kā Selenastrum capricornutum), ATCC 22662, CCAP 278/4, 61.81 SAG
— Desmodesmus subspicatus (agrāk pazīstama kā Scenedesmus subspicatus) 86.81 SAG
Diatomejas
— Navicula pelliculosa, UTEX 664
Zilaļģes
— Anabaena flos-aquae, UTEX 1444, ATCC 29413, CCAP 1403/13A
— Synechococcus leopoliensis, UTEX 625, CCAP 1405/1
Celmu avoti
Ieteiktie celmi ir pieejami kā aļģu tīrkultūras no šādām kolekcijām (alfabētiskā secībā):
ATCC: American Type Culture Collection
10801 University Boulevard
Manassas, Virginia 20110–2209
ASV
CCAP, Culture Collection of Algae and Protozoa
Institute of Freshwater Ecology,
Windermere Laboratory
Far Sawrey, Amblerside
Cumbria
LA22 0LP
Apvienotā Karaliste
Sammlung von Algenkulturen
Albrecht-von-Haller-Institut
Universität Göttingen
Nikloausberger Weg 18
D-37073 Göttingen
VĀCIJA
UTEX Culture Collection of Algae
Section of Molecular, Cellular and Developmental Biology
School of Biological Sciences
the University of Texas at Austin
Austin, Texas 78712
ASV
Ieteikto sugu izskats un īpašības
|
P. subcapitata |
D. subspicatus |
N. pelliculosa |
Anabaena flos-aquae |
S. leopoliensis |
|
|
Izskats |
Izliektas, savītas atsevišķas šūnas |
Ovālas, parasti atsevišķas šūnas |
Nūjiņas |
Ovālu šūnu ķēdes |
Nūjiņas |
|
Izmērs (L × W) μm |
8–14 × 2–3 |
7–15 × 3–12 |
7,1 × 3,7 |
4,5 × 3 |
6 × 1 |
|
Šūnu tilpums (μm3/šūna) |
40–60 (1) |
60–80 (1) |
40–50 (1) |
30–40 (1) |
2,5 (2) |
|
Šūnas sausnas masa (mg/šūna) |
2–3 × 10–8 |
3–4 × 10–8 |
3–4 × 10–8 |
1–2 × 10–8 |
2–3 × 10–9 |
|
Augšanas ātrums (3) (diena–1) |
1,5–1,7 |
1,2–1,5 |
1,4 |
1,1–1,4 |
2,0–2,4 |
|
(1) Noteikts, izmantojot daļiņu elektronisko skaitītāju (2) Aprēķināts, ņemot vērā izmēru (3) Parasti novērojamie augšanas ātrumi OECD barotnē, pie gaismas intensitātes aptuveni 70 μE·m–2·s–1 un 21 °C temperatūrā. |
|||||
Norādījumi par ieteicamo testa sugu kultivēšanu un uzturēšanu
Pseudokirchneriella subcapitata un Desmodesmus subspicatus
Šīs zaļaļģes kopumā ir viegli audzējamas dažādās barotnēs. Informācija par piemērotām barotnēm ir pieejama kultūras kolekcijās. Šūnas parasti attīstās atsevišķi, un šūnu blīvumu var viegli izmērīt ar daļiņu elektronisko skaitītāju vai mikroskopu.
Anabaena flos-aquae
Rezerves kultūras uzturēšanai var izmantot dažādas barotnes. Īpaši svarīgi ir neļaut periodiski audzētajai kultūrai atjaunojoties pāriet no augšanas kavēšanās fāzes nākamajā augšanas fāzē, jo tas apgrūtina kultūras ataudzēšanu.
Anabaena flos-aquae veido cieši saistītu šūnu ķēdes. Šo agregātu izmēri atkarībā no kultivēšanas apstākļiem var atšķirties. Lai biomasas noteikšanā izmantotu mikroskopu vai daļiņu elektronisko skaitītāju, šie agregāti, iespējams, būs jāsadala.
Lai samazinātu skaitīšanas rezultātu mainību, ķēdes var izjaukt, apstrādājot ar ultraskaņu. Ultraskaņas iedarbība, kuras ilgums pārsniedz ķēžu izjaukšanai nepieciešamo, var iznīcināt šūnas. Visi varianti ir jāapstrādā ar ultraskaņu vienādi ilgi.
Lai kompensētu mainīgumu, ir jāizskaita pietiekami daudz lauciņu uz hemocitometra (vismaz 400 šūnas). Tas uzlabo mikroskopiskās noteikšanas ticamību.
Lai noteiktu kopējo Anabaena šūnu tilpumu, pēc šūnu atdalīšanas ar saudzīgu sonifikāciju var izmantot daļiņu elektronisko skaitītāju. Sonifikācijas enerģijai ir jābūt tādai, lai nesagrautu šūnas.
Lai testa trauku inokulācijā izmantotā aļģu suspensija būtu labi sajaukta un homogēna, maisīšanai izmanto vorteksu.
Testa trauki ir jānovieto uz kratītāja platformas, kas izdara orbitālas vai turp/atpakaļ svārstības apm. 150 reizes minūtē. Lai samazinātu Anabaena tieksmi veidot pikas, var veikt maisīšanu ar pārtraukumiem. Ja ir izveidojušās pikas, jāpievērš uzmanība reprezentatīvu paraugu iegūšanai biomasas mērījumiem. Lai izjauktu aļģu pikas, pirms paraugu ņemšanas var būt nepieciešama enerģiska kratīšana.
Synechococcus leopoliensis
Pamatkultūras uzturēšanai var izmantot dažādas barotnes. Informācija par piemērotām barotnēm ir pieejama kultūras kolekcijās.
Synechococcus leopoliensis attīstās kā atsevišķas nūjiņveida šūnas. Šūnas ir ļoti sīkas, kas apgrūtina biomasas mērījumus, skaitīšanai izmantojot mikroskopu. Ieteicams izmantot elektroniskos daļiņu skaitītājus, kas ir aprīkoti, lai skaitītu pat apmēram 1 μm lielas daļiņas. Var izmantot arī in vitro fluorometriskos mērījumus.
Navicula pelliculosa
Pamatkultūras uzturēšanai var izmantot dažādas barotnes. Informācija par piemērotām barotnēm ir pieejama kultūras kolekcijās. Jāievēro, ka barotnei jāpievieno silikāts.
Navicula pelliculosa noteiktos augšanas apstākļos var veidot agregātus. Izdaloties lipīdiem, aļģu šūnas dažkārt var veidot plēvi uz virsmas. Šajos apstākļos ir jāveic īpaši pasākumi, lai iegūtu reprezentatīvu paraugu, ņemot paraugus biomasas noteikšanai. Iespējams, būs nepieciešama intensīva kratīšana, piemēram, izmantojot vorteksu.
2. papildinājums
Barotnes
Var izmantot kādu no šīm divām barotnēm:
OECD barotne: Sākotnējā OECD TG 201 barotne, arī saskaņā ar ISO 8692
ASV. EPA barotne AAP, arī saskaņā ar ASTM.
Sagatavojot šīs barotnes, jāizmanto reaģenta vai analītiskās tīrības pakāpes vielas un dejonizēts ūdens.
AAP barotnes (ASV EPA) un OECD TG 201 barotnes sastāvs
|
Sastāvdaļa |
EPA |
OECD |
||
|
mg/l |
mM |
mg/l |
mM |
|
|
NaHCO3 |
15,0 |
0,179 |
50,0 |
0,595 |
|
NaNO3 |
25,5 |
0,300 |
||
|
NH4Cl |
15,0 |
0,280 |
||
|
MgCl2·6(H2O) |
12,16 |
0,0598 |
12,0 |
0,0590 |
|
CaCl2·2(H2O) |
4,41 |
0,0300 |
18,0 |
0,122 |
|
MgSO4·7(H2O) |
14,6 |
0,0592 |
15,0 |
0,0609 |
|
K2HPO4 |
1,044 |
0,00599 |
||
|
KH2PO4 |
1,60 |
0,00919 |
||
|
FeCl3·6(H2O) |
0,160 |
0,000591 |
0,0640 |
0,000237 |
|
Na2EDTA·2(H2O) |
0,300 |
0,000806 |
0,100 |
0,000269 (1) |
|
H3BO3 |
0,186 |
0,00300 |
0,185 |
0,00299 |
|
MnCl2·4(H2O) |
0,415 |
0,00201 |
0,415 |
0,00210 |
|
ZnCl2 |
0,00327 |
0,000024 |
0,00300 |
0,0000220 |
|
CoCl2·6(H2O) |
0,00143 |
0,000006 |
0,00150 |
0,00000630 |
|
Na2MoO4·2(H2O) |
0,00726 |
0,000030 |
0,00700 |
0,0000289 |
|
CuCl2.2(H2O) |
0,000012 |
0,00000007 |
0,00001 |
0,00000006 |
|
pH |
7,5 |
8,1 |
||
|
(1) EDTA molārā attiecība pret dzelzi nedaudz pārsniedz stehiometrisko. Tādējādi novērš dzelzs izgulsnēšanos, vienlaikus līdz minimumam samazinot smago metālu jonu helātu veidošanos. |
||||
Testā ar diatomejām Navicula pelliculosa abas barotnes jāpapildina ar Na2SiO3·9H20, lai iegūtu 1,4 mg Si/l.
Barotnes pH iegūst, karbonātu sistēmai vidē līdzsvarojoties ar CO2 parciālo spiedienu atmosfēras gaisā. Aptuvena attiecība starp pH 25 °C temperatūrā un bikarbonāta molāro koncentrāciju ir:
pHeq = 11,30 + log [HCO3]
Ar 15 mg/l NaHCO3, pHeq = 7,5 (ASV EPA barotne), un ar 50 mg/l NaHCO3, pHeq = 8,1 (OECD barotne).
Testa barotnes elementu sastāvs
|
Elements |
EPA |
OECD |
|
mg/l |
mg/l |
|
|
C |
2,144 |
7,148 |
|
N |
4,202 |
3,927 |
|
P |
0,186 |
0,285 |
|
K |
0,469 |
0,459 |
|
Na |
11,044 |
13,704 |
|
Ca |
1,202 |
4,905 |
|
Mg |
2,909 |
2,913 |
|
Fe |
0,033 |
0,017 |
|
Mn |
0,115 |
0,115 |
OECD barotnes sagatavošana
|
Barības viela |
Koncentrācija izejas šķīdumā |
|
Izejas šķīdums Nr. 1: makroelementi |
|
|
NH4Cl MgCl2·6H2O CaCl2·2H2O MgSO4·7H2O KH2PO4 |
1,5 g·l–1 1,2 g·l–1 1,8 g·l–1 1,5 g·l–1 0,16 g·l–1 |
|
Izejas šķīdums Nr. 2: dzelzs |
|
|
FeCl3·6H2O Na2EDTA·2H2O |
64 mg·l–1 100 mg·l–1 |
|
Izejas šķīdums Nr. 3: mikroelementi |
|
|
H3BO3 MnCl2·4H2O ZnCl2 CoCl2·6H2O CuCl2·2H2O Na2MoO4·2H2O |
185 mg·l–1 415 mg·l–1 3 mg·l–1 1,5 mg·l–1 0,01 mg·l–1 7 mg·l–1 |
|
Izejas šķīdums Nr. 4: bikarbonāts |
|
|
NaHCO3 |
50 g·l–1 |
|
Na2SiO3·9H20 |
|
Izejas šķīdumus sterilizē, izmantojot membrānu filtrāciju (vidējais poru diametrs 0,2 μm) vai arī autoklāvā (120 °C, 15 min). Šķīdumus glabā tumsā 4 °C temperatūrā.
Izejas šķīdumus Nr. 2 un Nr. 4 neapstrādā autoklāvā, bet sterilizē, izmantojot membrānu filtrāciju.
Barotni sagatavo, ūdenim pievienojot atbilstošu 1.–4. izejas šķīduma tilpumu:
Apm. 500 ml sterila ūdens pievieno:
— 10 ml izejas šķīduma Nr. 1
— 1 ml izejas šķīduma Nr. 2
— 1 ml izejas šķīduma Nr. 3
— 1 ml izejas šķīduma Nr. 4
Ar sterilu ūdeni uzpilda līdz 1 000 ml tilpumam
Atvēl pietiekami daudz laika, lai barotne varētu līdzsvaroties ar atmosfēras CO2, ja nepieciešams, dažas stundas barbotējot sterilu filtrētu gaisu.
AAP barotnes sagatavošana
A1.1. Pa 1 ml no katra A1.2.1-A1.2.7 minētā izejas šķīduma pievieno apm. 900 ml dejonizēta vai destilēta ūdens un tad atšķaida līdz 1 litram.
A1.2. Makroelementu izejas šķīdumus gatavo, 500 ml dejonizēta vai destilēta ūdens izšķīdinot turpmāk minētās vielas. Reaģentus A1.2.1, A1.2.2, A1.2.3, un A1.2.4 var apvienot vienā izejas šķīdumā.
A1.2.1. NaNO3 – 12,750 g
A1.2.2. MgCl2·6H2O – 6,082 g
A1.2.3. CaCl2·2H2O – 2,205 g
A1.2.4. Mikroelementu izejas šķīdums (sk. A1.3.)
A1.2.5. MgSO4·7H2O – 7,350 g
A1.2.6. K2HPO4 – 0,522 g
A1.2.7. NaHCO3 – 7,500 g
A1.2.8. Na2SiO3·9H2O (sk. A1.1 piezīmi)
A1.1 piezīme. Izmantot tikai diatomeju sugām: var pievienot tieši (204,4 mg) vai arī izmantojot izejas šķīdumu, lai Si galīgā koncentrācija barotnē būtu 20 mg/l.
A1.3. Mikroelementu izejas šķīdumu sagatavo, 500 ml dejonizētā vai destilētā ūdenī izšķīdinot:
A1.3.1. H3BO3 – 92,760 mg
A1.3.2. MnCl2·4H2O – 207,690 mg
A1.3.3. ZnCl2 – 1,635 mg
A1.3.4. FeCl3·6H2O – 79,880 mg
A1.3.5. CoCl2·6H2O – 0,714 mg
A1.3.6. Na2MoO4·2H2O – 3,630 mg
A1.3.7. CuCl2·2H2O – 0,006 mg
A1.3.8. Na2EDTA·2H2O – 150,000 mg
[etilēndiamīntetraetiķskābes dinātrija sāls]
A1.3.9. Na2SeO4·5H2O – 0,005 mg (sk. A1.2 piezīmi)
A1.2 piezīme. Izmantot tikai diatomeju rezerves kultūrām paredzētām barotnēm.
A1.4. izmantojot 0,1 N vai 1,0 N NaOH vai HCl, koriģē pH līdz 7,5 ± 0,1.
A1.5. Barotni filtrē sterilā traukā caur 0,22-μm membrānas filtru, ja izmanto daļiņu skaitītāju, vai 0,45-μm filtru, ja daļiņu skaitītāju neizmanto.
A1.6. Līdz lietošanai barotni glabā tumsā apmēram 4 °C temperatūrā.
3. papildinājums
Aļģu kultivēšanas piemērs
Vispārīgas piezīmes
Kultivēšanas mērķis šajā gadījumā ir iegūt aļģu kultūras toksiskās iedarbības noteikšanai.
Jāizmanto piemērotas metodes, kas nodrošina, ka aļģu kultūras nav inficētas ar baktērijām. Iespējams, būs vēlamas no citiem organismiem brīvas kultūras, taču ir nepieciešams izveidot un izmantot aļģu tīrkultūras.
Visas darbības ir jāveic sterilos apstākļos, lai izvairītos no piesārņošanas ar baktērijām vai citām aļģēm.
Iekārtas un materiāli
Skatīt “Testa metode”: Aparatūra.
Aļģu kultūru iegūšanas procedūras
Barības vielu šķīdumu (barotņu) sagatavošana:
Visi barotnē esošo barības vielu sāļi tiek sagatavoti koncentrētu izejas šķīdumu veidā, ko glabā tumšā un vēsā vietā. Šos šķīdumus sterilizē filtrējot vai autoklavējot.
Barotni sagatavo, atbilstošu izejas šķīduma tilpumu pievienojot sterilam destilētam ūdenim tā, lai novērstu inficēšanos. Lai iegūtu cieto barotni, pievieno 0,8 procentus agara.
Pamatkultūra:
Pamatkultūras ir nelielas aļģu kultūras, ko regulāri pārnes svaigā barotnē izmantošanai par testa sākotnējo materiālu. Ja kultūras neizmanto regulāri, tās sēj mēģenēs uz slīpagara. Pārsēj svaigā barotnē vismaz reizi divos mēnešos.
Pamatkultūras audzē koniskās kolbās, kas satur atbilstošo barotni (tilpums apmēram 100 ml). Aļģes inkubējot 20 °C temperatūrā pastāvīgā apgaismojumā, tās ir jāpārsēj katru nedēļu.
Pārsēšanas laikā daļu “vecās” kultūras ar sterilām pipetēm pārnes kolbā ar svaigu barotni tā, lai strauji augošām sugām sākotnējā koncentrācija būtu apmēram 100 reižu mazāka nekā vecajā kultūrā.
Sugas augšanas ātrumu var noteikt, izmantojot augšanas grafiku. Ja tas ir zināms, var noteikt blīvumu, pie kura kultūra ir jāpārnes uz jaunu barotni. Tas jādara, pirms kultūra sasniegusi bojāejas fāzi.
Pirmskultūra:
Pirmskultūrā jāiegūst testa kultūru inokulācijai piemērots aļģu daudzums. Pirmskultūru inkubē testa apstākļos un izmanto tās eksponenciālās augšanas fāzē, parasti pēc 2–4 dienu ilgas inkubācijas. Ja aļģu kultūras satur deformētas vai nenormālas šūnas, tās neizmanto.
4. papildinājums
Datu analīze, izmantojot nelineāro regresiju
Vispārīgi apsvērumi
Atbildes reakcija aļģu un citu mikroorganismu augšanas testos – dabiskā biomasas augšana, to raksturojot ar procesa ātrumu, ir nepārtraukts vai metriskais mainīgais lielums, un tā integrālis laikā, ja izmanto biomasu. Tie abi ir saistīti ar atbilstošo vidējo atbildes reakciju, kas kontroles atkārtojumos uzrāda maksimālo vērtību, reaģējot testēšanas apstākļiem, no kuriem aļģu testā noteicošie faktori ir gaisma un temperatūra. Sistēmai ir normālais sadalījums vai tā ir homogēna, un biomasu var uzskatīt par nepārtrauktu lielumu, neņemot vērā atsevišķās šūnas. Šādas sistēmas reakcijas mainība ir atkarīga tikai no eksperimentāliem faktoriem (ko parasti apraksta log-normālais vai normālais kļūdas sadalījums). Tas atšķiras no tipiskām bioloģiskā testa reakcijām, ko raksturo dati, kas ir diskrēti lielumi, kuriem bieži par galveno mainīgo komponentu uzskata atsevišķu organismu toleranci (kam parasti ir binominālais sadalījums). Kontroles atbildes reakcijas šajā gadījumā atbilst nullei vai fona līmenim.
Parasti normalizēta vai relatīva reakcija r monotoni samazinās no 1 (nulles inhibēšana) līdz 0 (100-procentīga inhibēšana). Ņemot vērā, ka visām reakcijām piemīt ar tām saistītās kļūdas, aprēķinātā šķietami negatīvā inhibēšana izskaidrojama tikai ar gadījuma kļūdu.
Regresijas analīze
Modeļi
Regresijas analīzes mērķis ir kvantitatīvi aprakstīt reakciju atkarībā no koncentrācijas, izmantojot matemātisku regresijas funkciju Y = f (C) vai arī biežāk F (Z), kur Z = log C. Izmantojot apgriezto funkciju C = f–1 (Y), var aprēķināt ECx, ieskaitot EC50, EC10 un EC20, kā arī to 95 % ticamības līmeņus. Vairākas vienkāršas matemātiskas funkcijas labi apraksta aļģu augšanas inhibēšanas testos iegūto koncentrācijas-reakcijas sakarību. Šādas funkcijas ir, piemēram, loģistiskais vienādojums, nesimetriskais Weibull vienādojums un log-normālā sadalījuma funkcija, kas visas ir sigmoīdas līknes, kuras asimptotiski tiecas uz vērtību viens, ja C → 0, un uz nulli, ja C → ∞ (bezgalību).
Nepārtrauktu sliekšņa funkciju modeļu izmantošana (piemēram, Koimana [Koyman] modelis “populācijas augšanas inhibēšanai”, Kooijman et al. 1996.) ir nesen ieteikts vai alternatīvs asimptotiskajiem modeļiem. Šajā modelī pieņem, ka nav nekādas iedarbības pie koncentrācijām, kas mazākas par noteiktu slieksni EC0+, ko nosaka, ekstrapolējot reakcijas un koncentrācijas sakarību, un nosakot tās krustošanās punktu ar koncentrāciju asi, izmantojot vienkāršu nepārtrauktu funkciju, kas koordinātu sākuma punktā nav diferencējama.
Jāņem vērā, ka analīze var būt vienkārša atlikuma kvadrātu summas samazināšana (pieņemot pastāvīgu dispersiju) vai arī svērto kvadrātu summa, ja dispersijas heterogenitāte ir kompensēta.
Procedūra
Procedūra kopumā ir šāda: izvēlas atbilstošu funkciju Y = f (C), ko, izmantojot nelineāru regresiju, piemēro datiem. Lai no datiem iegūtu iespējami vairāk informācijas, ieteicams izmantot katra atsevišķa atkārtojuma mērījumus, nevis atkārtojumu vidējās vērtības. No otras puses, ja datu izliede ir liela, praktiskā pieredze liecina, ka atkārtojumu vidējās vērtības var nodrošināt daudz robustāku matemātisko novērtējumu, jo, lai gan satur sistemātisko kļūdu, tās mazāk ietekmē gadījuma kļūdas, nekā tas notiktu, saglabājot katru individuālo datu punktu.
Izveido atbilstošu grafiku, atliek izmērītos datus un pārbauda grafika atbilstību. Šajā nolūkā īpaši noderīga var būt atlikuma dispersijas analīze. Ja koncentrācijas un reakcijas sakarības izteikšanai izraudzītā funkcionālā sakarība pietiekami labi neapraksta visu līkni vai tās būtisku daļu, piemēram, atbildes reakciju zemās koncentrācijās, simetriska grafika vietā izvēlas citu iespēju, piemēram, nesimetrisku grafiku, tādu kā Weibull funkcija. Inhibēšanas negatīvas vērtības var būt problemātiskas, piemēram, izmantojot log-normālā sadalījuma funkciju, un attiecīgi arī nosakot vajadzību izmantot citu regresijas funkciju. Šādām negatīvām atbildes reakcijām nav ieteicams piešķirt nulles vai nelielu pozitīvu vērtību, jo tādējādi rodas kļūdas sadalījuma kropļojumi. Iespējams, lai novērtētu EClow x, dažas grafika daļas, piemēram, zemas inhibēšanas daļu, būs nepieciešamas atsevišķas līknes. Izmantojot attiecīgo vienādojumu (“apgriezto funkciju”), aprēķina C = f–1 (Y), raksturīgo punktu vērtības ECx, un testēšanas pārskatā norāda vismaz EC50 un vienu vai divas EClow x vērtības. Veiktajos testos iegūtā pieredze liek secināt, ka aļģu testa precizitāte parasti ļauj pietiekami adekvāti novērtēt 10 % inhibēšanu, ja datu punktu skaits ir pietiekams, ja vien zemas koncentrācijas neveicina augšanu, līdz ar to apgrūtinot vērtēšanu. Tā kā EC20 parasti atrodas uz koncentrācijas-atbildes reakcijas līknes centrālās daļas, kas ir aptuveni lineāra, tās noteikšanas precizitāte bieži ir daudz augstāka par EC10, noteikšanas precizitāti. Dažreiz EC10 var būt grūti interpretēt augšanas stimulācijas dēļ. Tāpēc, lai arī parasti EC10 vērtību var noteikt pietiekami precīzi, pārskatā vienmēr ieteicams norādīt arī EC20.
Iesvara koeficienti
Eksperimenta dispersija parasti nav konstanta, un tajā ietilpst proporcionālitātes komponents, līdz ar to parasti izdevīgāk veikt svērto regresiju. Šajā analīzē iesvara koeficientus parasti uzskata par apgriezti proporcionāliem dispersijai:
Wi = 1/Var(ri)
Daudzas regresijas programmas ļauj veikt svērto regresijas analīzi ar tabulā norādītajiem iesvara koeficientiem. Ērtības labad iesvara koeficientus normalizē, tos reizinot ar n/Σ w (n ir datu punktu skaits), tā, lai to summa būtu viens.
Normalizētās atbildes reakcijas
Normalizēšana, izmantojot vidējo kontroles reakciju, rada dažas principiālas problēmas un diezgan komplicētu dispersijas struktūru. Dalot atbildes reakcijas ar vidējo kontroles reakciju inhibēšanas procenta iegūšanai, ievieš papildu neprecizitāti, ko rada kontroles vidējās vērtības kļūda. Ja vien kļūda nav nenozīmīgi maza, regresijas un ticamības līmeņu iesvara koeficienti jākoriģē, ņemot vērā kovariāciju ar kontroli (17). Jāievēro, ka kontroles vidējās reakcijas augsta precizitāte ir svarīga, lai samazinātu relatīvās atbildes reakcijas kopējo dispersiju. Šī dispersija ir šāda:
apakšējais indekss i attiecas uz koncentrācijas līmeni i un apakšējais indekss 0 attiecas uz kontrolēm)
Yi = relatīvā atbildes reakcija = ri/r0 = 1 – I = f (Ci)
ar dispersiju:
Var (Yi) = Var (ri/r0) ≅ (∂Yi / ∂ ri)2·Var(ri) + (∂ Yi/ ∂ r0)2·Var (r0)
un tā kā
(∂Yi/ ∂ ri) = 1/r0 un (∂ Yi / ∂ r0) = ri/r0 2
datiem ar normālu sadalījumu, kā arī mi un m0 atkārtojumiem:
Var(ri) = σ2/mi
līdz ar to relatīvās atbildes reakcijas kopējā dispersija Yi ir:
Var(Yi) = σ2/(r0 2 mi) + ri 2·σ2/r0 4 m0
Kontroles vidējās vērtības kļūda ir apgriezti proporcionāla kontroles atkārtojumu vidējā skaita kvadrātsaknei, un dažreiz ir vēlams iekļaut vēsturiskos datus, tādējādi būtiski samazinot kļūdu. Alternatīva procedūra ir datu normalizāciju neveikt un izmantot atbildes reakcijas un arī kontroles reakcijas datu absolūtās vērtības, taču ieviešot kontroles reakcijas vērtības kā papildu parametru, kura vērtības nosaka ar nelineāru regresiju. Izmantojot parasto divu parametru regresijas vienādojumu, pēc šīs metodes jāizmanto trīs parametri, līdz ar to vajadzīgs arī vairāk datu punktu, nekā veicot nelineāro regresiju datiem, ko normalizē, izmantojot iepriekš noteiktu kontroles atbildes reakciju.
Ticamības intervālu apgrieztās vērtības
Nelineāras regresijas ticamības intervālu izskaitļošana, izmantojot apgrieztās vērtības, ir diezgan sarežģīta un nav pieejama parastajās datorprogrammu paketēs, ko izmanto statistisko aprēķinu veikšanai. Aptuvenus ticamības līmeņus var iegūt, izmantojot standarta nelineāras regresijas programmas ar atkārtotu parametrizāciju (Bruce and Versteeg, 1992), kas paredz pārveidot matemātisko vienādojumu, izmantojot nepieciešamo punktu vērtības, piemēram, EC10 un EC50 kā nosakāmos parametrus. (Šī funkcija ir I = f (α, β koncentrācija), un nepieciešams izmantot definīcijas sakarības f (α, β, EC10) = 0,1 un f (α, β, EC50) = 0,5, lai f ((α, β koncentrācija) aizstātu ar ekvivalentu funkciju g (EC10, EC50, koncentrācija).
Tiešāks aprēķins (Andersen et al, 1998.) ir izmantot sākotnējo vienādojumu kopā ar Teilora ekspansiju ap vidējām ri un r0 vērtībām.
Nesen popularitāti ir ieguvušas bootstrap metodes. Šajās metodēs dispersijas empīriskā sadalījuma noteikšanai izmanto eksperimentālos datus, no kuriem izveido pseidoatkārtojumus pēc gadījuma izvēles principa, izmantojot nejaušo skaitļu ģeneratoru.
Literatūra
Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): No-effect concentrations in algal growth inhibition tests. Water Research, 30, 1625–1632.
Bruce, R.D. and Versteeg, D. J. (1992) A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Env. Toxicol. Chem.11, 1485–1494
Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A. & Nyholm, N. (1998): Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405–420.
C.4. “VIEGLAS” BIOLOĢISKĀS NOĀRDĪŠANĀS SPĒJAS NOTEIKŠANA
I DAĻA. VISPĀRĪGI APSVĒRUMI
I.1. IEVADS
Aprakstītas sešas testēšanas metodes ķīmisko vielu bioloģiskās vieglas noārdīšanās spējas novērtēšanai aerobos apstākļos ūdens vidē:
a) izšķīdušā organiskā oglekļa (IOO) noteikšana. Atkrāsošanās (C.4.-A metode);
b) modificētā ESAO metode – IOO atkrāsošanās (C.4.-B metode);
c) oglekļa dioksīda (CO2) izdalīšanās (modificēta Sturma metode) (C.4.-C metode);
d) manometriskā respirometrija (C.4.-D metode);
e) slēgto pudeļu (C.4.-E metode);
f) MITI (Japānas Ārējās tirdzniecības un rūpniecības ministrijas metode) (C.4.-F metode).
Par visām sešām metodēm to izmantošanas vispārīgie un kopīgie apsvērumi izklāstīti attiecīgās metodes I daļā. Konkrētie jautājumi, kas attiecas uz katru metodi atsevišķi, aprakstīti II līdz VII daļā. Papildinājumos pievienotas definīcijas, formulas un norādījumi.
Pēc šīm metodēm iegūst salīdzināmus rezultātus, par ko liecina ESAO 1988. gadā veiktās starplaboratoriju salīdzinošās testēšanas rezultāti. Tomēr atkarībā no testējamās vielas fizikālajām īpašībām kādai no metodēm var būt dodama priekšroka.
I.2. PIEMĒROTĀKĀS METODES IZVĒLE
Lai izraudzītos piemērotāko metodi, ir svarīgi iegūt informāciju par attiecīgās vielas šķīdību, tvaika spiedienu un adsorbcijas īpašībām. Teorētisko vērtību aprēķināšanai un izmērīto parametru vērtību pārbaudei, piemēram, TSP, TCO2, IOO, TOC, ĶSP (skatīt 1. un 2. papildinājumu), jāzina vielas ķīmiskā struktūra vai sastāvs.
Ķīmiskās vielas, kuru šķīdība ūdenī ir vismaz 100 mg/l, ja tās nav gaistošas un neadsorbējas, var novērtēt pēc visām metodēm. Vielām, kuras slikti šķīst ūdenī, ir gaistošas vai adsorbējas, piemērotākās metodes norādītas 1. tabulā. Kā pārbaudīt ūdenī slikti šķīstošas vielas un gaistošas vielas, aprakstīts 3 papildinājumā. Vielas ar vidēju gaistamību var pārbaudīt pēc IOO atkrāsošanās metodes, ja testēšanas traukos (kuriem jābūt noslēdzamiem ar piemērotiem līdzekļiem) ir pietiekams tilpums gāzēm. Šādā gadījumā fizisko zudumu noteikšanai jāizveido abiotiska kontrole.
1.tabula
Testēšanas metožu piemērotība
|
Tests |
Analīzes metode |
Piemērotība vielām, kuras ir: |
||
|
slikti šķīstošas |
gaistošas |
adsorbējas |
||
|
IOO atkrāsošanas |
izšķīdušais organiskais ogleklis |
— |
— |
+/- |
|
Modif. ESAO atkrāsošanās metode |
izšķīdušais organiskais ogleklis |
— |
— |
+/- |
|
CO2 izdalīšanās |
respirometrija: CO2 izdalīšanās |
+ |
— |
+ |
|
Manometriskā respirometrija |
manometriskā respirometrija: skābekļa patēriņš |
+ |
+/- |
+ |
|
Slēgto pudeļu |
respirometrija: izšķīdušais skābeklis |
+/- |
+ |
+ |
|
MITI |
respirometrija: skābekļa patēriņš |
+ |
+/- |
+ |
Iegūto rezultātu interpretēšanai vajadzīga informācija par testējamā materiāla tīrību vai galveno sastāvdaļu saturu, īpaši gadījumos, kad rezultātu skaitliskās vērtības ir nelielas vai minimālas.
Piemērotāko pārbaudāmo koncentrāciju izvēlei var būt noderīga informācija par pārbaudāmās vielas toksisko iedarbību uz baktērijām (4. papildinājums), un tā var būt ļoti svarīga bioloģiskās degradācijas spējas zemu vērtību pareizai interpretēšanai.
I.3. STANDARTVIELAS
Procedūras pārbaudei paralēli parastajām testējamo vielu pārbaužu sērijām veic izmēģinājumus ar standartvielām, kuras atbilst vieglas bioloģiskās noārdīšanās spējas kritērijiem.
Piemērotas standartvielas ir anilīns (svaigi pārdestilēts), nātrija acetāts un nātrija benzoāts. Minētās standartvielas pēc šīm metodēm noārdās pat tad, ja netiek pievienots sējmateriāls.
Izteikts priekšlikums atrast tādu standartvielu, kura gan ir viegli bioloģiski noārdāma, taču šim nolūkam ir noteikti nepieciešams pievienot sējmateriālu. Tāpēc tika ieteikts izmantot kālija hidrogēnftalātu, taču, pirms šo vielu var pieņemt par standartvielu, par to ir jāiegūst vairāk attiecīgas informācijas.
Respirometriskos mērījumos skābekļa uzņemšanu nitrifikācijas dēļ var ietekmēt slāpekli saturoši savienojumi (skatīt 2. un 5. papildinājumu).
I.4. NOTEIKŠANAS METOŽU PRINCIPS
Testējamās vielas šķīdumu vai suspensiju minerālbarotnē inokulē un inkubē aerobos apstākļos tumsā vai izkliedētā gaismā. Ar sējmateriālu saistītais izšķīdušais organiskais ogleklis (IOO) jāuztur iespējami zemā līmenī salīdzinājumā ar IOO no testējamās vielas. Izdara sējmateriāla endogenās aktivitātes korekciju, paralēli veicot izmēģinājumus ar tukšo paraugu ar sējmateriālu, bet bez pārbaudāmās vielas, lai gan šūnu endogenā aktivitāte vielas klātbūtnē precīzi neatbilst aktivitātei endogenajā kontrolē. Paralēli veiktspējas pārbaudei veic testēšanu, izmantojot standartvielu.
Parasti degradācija notiek pēc tādu parametru kā IOO, CO2 veidošana un skābekļa uzņemšana, un, lai noteiktu biodegradācijas sākumu un beigas, mērījumus veic pietiekami bieži. Ar automātiskajiem respirometriem mērījumus veic nepārtraukti. Dažkārt papildus citiem parametriem papildus nosaka IOO, bet parasti to dara tikai testēšanas sākumā un beigās. Īpašas ķīmiskās analīzes var veikt pārbaudāmās vielas primārās degradācijas novērtēšanai un lai noteiktu tās laikā veidojošos starpproduktu koncentrāciju (obligāti jāveic pēc MITI metodes).
Parasti izmēģinājumi ilgst 28 dienas. Tomēr to var izbeigt arī drīzāk nekā pēc 28 dienām, piemēram, tiklīdz biodegradācijas līkne sasniegusi plato vismaz trīs analīzēs. Izmēģinājumus var turpināt arī ilgāk nekā 28 dienas, ja līkne liecina par to, ka biodegradācija ir sākusies, taču 28 dienu laikā nav sasniegts tās plato.
I.5. KVALITĀTES KRITĒRIJI
I.5.1. Reproducējamība
Biodegradācijas īpatnību dēļ un gadījumos, kad par sējmateriālu tiek izmantotas jauktas baktēriju populācijas, noteikšana jāveic vismaz divos atkārtojumos.
Parasti, jo augstāka ir sākotnēji pievienoto mikroorganismu koncentrācija, jo mazākas ir atšķirības starp atkārtojumiem. Veiktās starplaboratoriju salīdzinošās testēšanas rezultāti liecina arī, ka dažādās laboratorijās iegūtie rezultāti var būt ievērojami atšķirīgi, taču laba sakritība tiek iegūta ar vielām, kas viegli bioloģiski noārdās.
I.5.2. Testa rezultātu derīgums
Izmēģinājuma rezultāti uzskatāmi par derīgiem, ja atkārtojumos iegūto rezultātu maksimālo vērtību starpība pēc vielas izdalīšanas plato izmēģinājuma beigās vai 10 dienu intervāla beigās attiecīgi nepārsniedz 20 % un ja standartvielas degradācijas procents sasniedzis vieglas bioloģiskās noārdīšanas spējai vajadzīgo līmeni 14 dienu laikā. Ja kāds no šiem nosacījumiem nav ievērots, noteikšana jāveic atkārtoti. Metožu stingrības dēļ zemas noteiktās vērtības nebūt nenozīmē, ka testējamā viela vides apstākļos bioloģiski nenoārdās, tomēr liecina, ka biodegradācijas noteikšanai jāveic papildu darbs.
Ja toksiskuma izmēģinājumos ar testējamo vielu un standartvielu degradācijas pakāpe (pēc TOC) nepārsniedz 35 % vai ir mazāka par 25 % (pēc TSP vai TCO2) 14 dienu laikā, uzskata, ka pārbaudāmajām ķīmiskajām vielām ir inhibējošas īpašības (skatīt arī 4. papildinājumu). Testēšana jāatkārto, ja iespējams izmantot pārbaudāmo vielu zemākā koncentrācijā un/vai sējmateriālu augstākā koncentrācijā, bet ne vairāk kā 30 mg cietvielu daļiņu litrā.
I.6. VISPĀRĪGAS PROCEDŪRAS UN SAGATAVOŠANA
Vispārīgi noteikumi par izmēģinājumu veikšanu apkopoti 2. tabulā. Aparatūra un citi eksperimentālie apstākļi, kas konkrēti attiecas uz katru metodi, aprakstīti turpmāk attiecīgajās iedaļās.
1. tabula
Pārbaudes apstākļi
|
Tests |
IOO atkrāsošanas |
CO2 izdalīšanās |
Manometriskā respirometrija |
Modificētā ESAO skrīninga |
Slēgto pudeļu |
MITI (I) |
|
Testējamās vielas koncentrācija |
||||||
|
mg/1 |
100 |
2–10 |
100 |
|||
|
mg IOO/1 |
10–40 |
10–20 |
10–40 |
|||
|
mg TSP/1 |
50–100 |
5–10 |
||||
|
Sējmateriāla koncentrācija (šūnu/1, aptuveni) |
≤ 30 mg/1 SS vai ≤ 100ml efluenta/1 (107–108) |
0,5ml sekundārā efluenta/1 (105) |
≤ 5 ml efluenta/1 (104–106) |
30 mg/1 SS (107–108) |
||
|
Elementu koncentrācija minerālbarotnē (mg/1) |
||||||
|
P |
116 |
11,6 |
29 |
|||
|
N |
1,3 |
0,13 |
1,3 |
|||
|
Na |
86 |
8,6 |
17,2 |
|||
|
K |
122 |
12,2 |
36,5 |
|||
|
Mg |
2,2 |
2,2 |
6,6 |
|||
|
Ca |
9,9 |
9,9 |
29,7 |
|||
|
Fe |
0,05 - 0,1 |
0,05 - 0,1 |
0,15 |
|||
|
pH |
7,4 ± 0,2 |
vēlams 7,0 |
||||
|
Temperatūra |
22 ± 2 oC |
25 ± 1 oC |
||||
|
IOO = izšķīdušais organiskais ogleklis |
TSP = teorētiskais skābekļa patēriņš |
SS = suspendētās daļiņas |
||||
I.6.1. Ūdens atšķaidīšanai
Izmanto dejonizētu vai destilētu ūdeni, kas augšanu kavējošās koncentrācijās nesatur toksiskas vielas (piemēram, Cu++ jonus). Tajā nedrīkst būt vairāk par 10 % organiskā oglekļa no daudzuma, kas tiek ievadīts ar pārbaudāmo vielu. Ūdenim jābūt ļoti tīram, lai nebūtu lielas tukšajam paraugam noteiktās vērtības. Kontamināciju var radīt gan raksturīgi piemaisījumi, jonu apmaiņas sveķi, gan arī baktēriju un aļģu sadalīšanās produkti. Katrai izmēģinājumu sērijai izmanto ūdeni no vienas partijas, kas iepriekš pārbaudīts, veicot IOO analīzi. Šāda pārbaude nav vajadzīga noslēgto pudeļu testam, taču tad ūdenim jābūt ar zemu skābekļa patēriņu.
I.6.2. Minerālvielu rezerves šķīdumi
Testējamos šķīdumus pagatavo, no iepriekš sagatavotiem minerālvielu rezerves šķīdumiem. Var izmantot šādus rezerves šķīdumus (ar dažādiem atšķaidījuma koeficientiem) IOO atkrāsošanas, modificētajai ESAO skrīninga, CO2 izdalīšanās, manometriskās respirometrijas, slēgto pudeļu metodēm.
Atšķaidījuma koeficienti un minerālbarotnes MITI metodei norādīti pie attiecīgajām metodēm.
No analītiski tīriem reaģentiem pagatavo šādus rezerves šķīdumus:
|
a) |
Monokālija dihidrogēnortofosfāts, KH2PO4 |
8,50 g |
|
Dikālija monohidrogēnortofosfāts, K2HPO4 |
21,75 g |
|
|
Dinātrija monohidrogēnortofosfāta dihidrāts Na2HPO4. 2 H2O |
33,40 g |
|
|
Amonija hlorīds, NH4Cl |
0,50 g |
|
|
Izšķīdina ūdenī un atšķaida līdz 1 litram. Šķīduma pH jābūt 7,4. |
||
|
b) |
Kalcija hlorīds, bezūdens, CaCl2 |
27,50 g |
|
vai kalcija hlorīda dihidrāts, CaCl2, 2 H2O |
36,40 g |
|
|
Izšķīdina ūdenī un atšķaida līdz 1 litram |
||
|
c) |
Magnija sulfāta heptahidrāts, MgSO4. 7 H2O |
22,50 g |
|
Izšķīdina ūdenī un atšķaida līdz 1 litram. |
||
|
d) |
Dzelzs(III) hlorīda heksahidrāts, FeC13. 6H2O |
0,25 g |
|
Izšķīdina ūdenī un atšķaida līdz 1 litram. |
Piezīme: lai šķīdums nebūtu jāgatavo tieši pirms lietošanas, uz tā vienu litru pievieno vienu pilienu konc. HCl vai 0,4 g etilēndiamīntetraetiķskābes dinātrija sāls (EDTA).
I.6.3. Ķīmisko vielu rezerves šķīdumi
Piemēram, izšķīdina 1 līdz 10 g pārbaudāmās vielas vai standartvielas dejonizētā ūdenī un atšķaida līdz vienam litram, ja šķīdība ir lielāka par 1 g/l. Rezerves šķīdumus var pagatavot minerālbarotnē vai pievienot vielu tieši barotnei. Par mazāk šķīstošām vielām skatīt 3. papildinājumu, bet MITI metodē (C.4.-F metode) neizmanto nekādus šķīdinātājus vai emulgatorus.
I.6.4. Sējmateriāls
Sējmateriālu var iegūt dažādi: no aktīvajām dūņām, (nehlorētiem) attīrītiem notekūdeņiem, virszemes ūdeņiem, augsnes vai minēto materiālu maisījuma. Ja izmanto aktīvās dūņas IOO atkrāsošanās metodei, CO2 izdalīšanās metodei un manometriskajām respirometrijas metodēm, tās jāņem no attīrīšanas iekārtām vai laboratorijas ierīces, uz kurām galvenokārt novada sadzīves notekūdeņus. Noskaidrots, ka, izmantojot citu sējmateriālu, rezultātiem ir lielāka izkliede. Modificētajai ESAO metodei un slēgto pudeļu metodei vajadzīgs vairāk atšķaidīts sējmateriāls bez aktīvo dūņu daļiņām, tāpēc tā piemērotākais avots ir attīrīti notekūdeņi no sadzīves notekūdeņu attīrīšanas iekārtas vai attiecīgas laboratorijas iekārtas. MITI metodei sējmateriāls ir maisījums no dažādiem avotiem, un metodes aprakstā tas aprakstīts atsevišķā iedaļā.
I.6.4.1. Sējmateriāls no aktīvajām dūņām
Ņem svaigu aktīvo dūņu paraugu no aerācijas tvertnes notekūdeņu attīrīšanas iekārtās vai laboratorijas iekārtās, kurās galvenokārt attīra sadzīves notekūdeņus. Ja vajadzīgs, atdala rupjās daļiņas, filtrējot caur smalku sietu, un pēc tam dūņas glabā aerobos apstākļos.
Pēc rupjo daļiņu atdalīšanas nostādina vai centrifugē (piemēram, 10 min pie 100 g). Dzidro šķīdumu izlej. Dūņas var skalot ar minerālbarotni. Koncentrētās dūņas suspendē minerālbarotnē, lai iegūtu suspendēto daļiņu koncentrāciju 3–5 g suspendēto daļiņu/l un līdz lietošanai aerē.
Dūņas jāņem no parastām attīrīšanas iekārtām, kas darbojas pienācīgi. Ja dūņas jāņem no attīrīšanas iekārtām, kas darbojas ar pilnu jaudu, vai tās var saturēt inhibitorus, tās ir jāmazgā. Pēc rūpīgas sajaukšanas atkārtoti suspendētās dūņas nostādina vai centrifugē, dzidro šķīdumu nolej un izmazgātās nogulsnes suspendē minerālbarotnē. Šo procedūru atkārto, līdz dūņas uzskatāmas par attīrītām no substrāta pārākuma vai inhibitora.
Pēc dūņu attīrīšanas vai arī no neattīrītām dūņām ņem paraugu tieši pirms lietošanas suspendēto daļiņu satura noteikšanai.
Otra alternatīva ir aktīvās dūņas homogenizēt (3–5 g suspendēto daļiņu/l). Dūņas mehāniskajā maisītājā 2 min sajauc ar vidēju ātrumu. Sajauktās dūņas 30 min vai, ja vajadzīgs, ilgāk nostādina un šķidrumu dekantē izmantošanai par sējmateriālu 10 ml/l minerālbarotnes.
I.6.4.2. Citi sējmateriāla avoti
To var iegūt no attīrītiem notekūdeņiem, kurus aizvada no attīrīšanas iekārtām vai laboratorijas iekārtām, kurās galvenokārt attīra sadzīves notekūdeņus. Ņem svaigu paraugu un transportēšanas laikā tur aerobos apstākļos. Nostādina vienu stundu vai filtrē caur papīra filtru ar rupjām porām, un dekantātu vai filtrātu līdz lietošanai glabā aerobos apstākļos. Uz litru barotnes izmanto līdz 100 ml šāda sējmateriāla.
Vēl cits sējmateriāla avots ir virszemes ūdeņi. Šādā gadījumā ņem piemērota virszemes ūdens paraugu, piemēram, upes vai ezera ūdeni, un līdz lietošanai glabā aerobos apstākļos. Ja vajadzīgs, sējmateriālu koncentrē filtrējot vai centrifugējot.
I.6.5. Sējmateriāla iepriekšēja kondicionēšana
Sējmateriālu var iepriekš kondicionēt, bet ne pieradināt eksperimenta apstākļiem. Kondicionēšanu veic, aktīvās dūņas aerējot minerālbarotnē vai attīrītā notekūdenī 5–7 dienas izmēģinājuma vides temperatūrā. Iepriekšēja kondicionēšana dažkārt uzlabo noteikšanas metožu precizitāti, samazinot tukšajam paraugam noteiktās vērtības. Neuzskata par nepieciešamu kondicionēt sējmateriālu, veicot noteikšanu pēc MITI metodes.
I.6.6. Abiotiskā kontrole
Vajadzības gadījumos pārbauda testējamās vielas iespējamo abiotisko degradāciju, nosakot izdalīto IOO, skābekļa uzņemšanu vai oglekļa dioksīda izdalīšanos sterilā kontrolē bez sējmateriāla. Sterilizē ar membrānfiltrāciju (0,2-0,45 mikrometri) vai vajadzīgajā koncentrācijā pievienojot piemērotu toksisku vielu. Ja izmanto membrānfiltrāciju, sterilitātes saglabāšanai paraugus ņem aseptiskos apstākļos. Ja iespējama pārbaudāmās vielas adsorbcija, bioloģiskās noārdīšanās spēju nosakot pēc IOO izdalīšanās, īpaši tad, ja par sējmateriālu izmanto aktīvās dūņas, jāiekļauj arī abiotiskā kontrole ar sējmateriālu, kas ir noindēts.
I.6.7. Kolbu skaits
Izmēģinājumu sērijai parasti izmantojamo kolbu skaits noteikts katras metodes aprakstā.
Var izmantot šādas kolbas:
— testa suspensija: satur testējamo vielu un sējmateriālu,
— sējmateriāla tukšais paraugs: satur tikai sējmateriālu,
— noteikšanas kontrole: satur standartvielu un sējmateriālu,
— abiotiskā sterilā kontrole: sterila, satur pārbaudāmo vielu (skatīt I.6.6. punktu),
— adsorbcijas kontrole: satur pārbaudāmo vielu, sējmateriālu un sterilizējošo vielu,
— toksicitātes kontrole: satur testējamo vielu, standartvielu un sējmateriālu.
Paralēli noteikti jānosaka testa suspensija un sējmateriāla tukšais paraugs. Ieteicams paralēli veikt noteikšanu arī citās kolbās.
Tomēr tas ne vienmēr ir iespējams. Jānodrošina, ka paraugs ir tik liels, lai varētu veikt noteikšanu vai nolasījumus 10 dienu intervālā.
I.7. DATI UN IZVĒRTĒŠANA
Aprēķinot degradācijas procentu Dt, izmanto attiecīgā parametra vidējās vērtības, kas noteiktas pēc diviem atkārtojumiem testa suspensijai un sējmateriāla tukšajam paraugam. Formulas dotas turpmāk attiecīgo metožu aprakstos. Degradācijas procesu attēlo grafiski un norāda 10 dienu intervālu. Aprēķina izdalīšanās procentu 10 dienu intervāla beigās vai vajadzības gadījumā vērtību, kādu sasniedz noteikšanas beigās.
Respirometriskos mērījumos skābekļa uzņemšanu nitrifikācijas dēļ var ietekmēt slāpekli saturoši savienojumi (skatīt 2. un 5. papildinājumu).
I.7.1. Degradācija, ko mēra, nosakot IOO
Degradācijas procentu Dt katram parauga ņemšanas laikam aprēķina atsevišķi kolbām ar testējamo vielu, izmantojot IOO mērījumu vidējās vērtības, kuras noteiktas pēc diviem atkārtojumiem, lai varētu novērtēt testa derīgumu (skatīt I.5.2. punktu). To aprēķina pēc šāda vienādojuma:
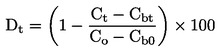
kur:
|
Dt |
= |
degradācijas % laikā t, |
|
Co |
= |
IOO vidējā sākuma koncentrācija barotnē ar sējmateriālu, kas satur testējamo vielu (mg IOO/1), |
|
Ct |
= |
IOO vidējā koncentrācija barotnē ar sējmateriālu, kas satur testējamo vielu laikā t (mg IOO/1), |
|
Cbo |
= |
IOO vidējā sākuma koncentrācija tukšajā paraugā ar sējmateriālu minerālbarotnē (mg IOO/l), |
|
Cbt |
= |
IOO vidējā koncentrācija tukšajā paraugā ar sējmateriālu minerālbarotnē laikā t (mg IOO/1). |
Visas koncentrācijas nosaka eksperimentāli.
I.7.2. Degradācija, ko mēra ar īpašām analīzēm
Ja ir pieejami īpaši analītiskie dati, aprēķina primāro biodegradāciju no:
![]()
kur:
|
Dt |
= |
degradācijas % laikā t, parasti 28 dienās, |
|
Sa |
= |
testējamās vielas atlikušais daudzums barotnē ar sējmateriālu noteikšanas beigās (mg), |
|
Sb |
= |
testējamās vielas atlikušais daudzums tukšajā paraugā ar ūdeni/barotni, kam pievienota tikai testējamā viela (mg). |
1.7.3. Abiotiskā degradācija
Gadījumos, kad izmanto abiotisko sterilo kontroli, aprēķina abiotiskās degradācijas procentu pēc formulas:
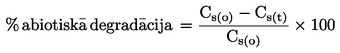
kur:
|
Cs(o) |
= |
IOO koncentrācija sterilajā kontrolē 0. dienā, |
|
C s(t) |
= |
IOO koncentrācija sterilajā kontrolē t dienā. |
I.8. PĀRSKATS
Testēšanas pārskatā, ja iespējams, jānorāda:
— nosakāmā viela, standartvielas, to tīrība,
— testēšanas apstākļi,
— sējmateriāls: īpašības un ņemšanas vieta(-as), koncentrācija un iepriekšēja kondicionēšana, ja tā veikta,
— rūpniecisko notekūdeņu sastāvs un daļa notekūdeņos, ja tie zināmi,
— testēšanas ilgums un temperatūra,
— par grūti šķīstošam vielām to apstrāde,
— izmantotā testēšanas metode; par visām noteikšanas procedūru izmaiņām jādod zinātnisks pamatojums,
— drošības datu lapa,
— novērotās inhibēšanas parādības,
— novērotā abiotiskā degradācija,
— ķīmisko analīžu dati, ja ir pieejami,
— starpproduktu analīžu dati, ja pieejami,
— degradācijas procents atkarībā no laika testējamajai vielai un standartvielai diagrammas veidā; precīzi jānorāda kavējuma fāze, degradācijas fāze, 10 dienu intervāls un virziena koeficients (1. papildinājums). Ja tests veikts saskaņā ar derīguma kritērijiem, degradācijas procenta vidējās vērtības kolbām ar pārbaudāmo vielu var izmantot attēlošanai,
— izdalīšanās procents pēc 10 dienu intervāla, sasniedzot plato vai testēšanas beigās.
II DAĻA. IOO ATKRĀSOŠANĀS TESTS (C.4.-A metode)
II.1. METODES PRINCIPS
Noteiktu tilpumu minerālās barotnes ar sējmateriālu, kas kā vienīgo oglekļa avotu satur zināmu testējamās vielas koncentrāciju (10–40 mg IOO/l) 22 ± 2 oC temperatūrā aerē tumsā vai izkliedētā apgaismojumā.
Pēc degradācijas 28 dienu periodā veic biežas IOO analīzes. Biodegradācijas pakāpi aprēķina pēc izdalītā IOO koncentrācijas (kas koriģēta pēc sējmateriāla tukšā parauga kontroles), ko izsaka procentos attiecībā pret sākuma koncentrāciju. Primārās biodegradācijas pakāpi var aprēķināt pēc inkubācijas sākumā un beigās veikto papildu ķīmisko analīžu rezultātiem.
II.2. TESTA METODES APRAKSTS
II.2.1. Iekārta
a) Koniskās kolbas, piemēram, 250 ml līdz 2 1 tilpuma, atkarībā no IOO analīzei vajadzīgā tilpuma;
b) mehāniskais kratītājs koniskajām kolbām, ar automātisku temperatūras regulēšanu vai izmantošanai pastāvīgā telpas temperatūrā, ar pietiekamu jaudu aerobu apstākļu uzturēšanai visās kolbās;
c) filtrēšanas iekārta ar piemērotām membrānām;
d) IOO analizators;
e) aparāts izšķīdušā skābekļa noteikšanai;
f) centrifūga.
II.2.2. Minerālbarotņu sagatavošana
Rezerves šķīdumu sagatavošanu skatīt I.6.2. punktā.
Sajauc 10 ml šķīduma a) ar 800 ml ūdens atšķaidīšanai, pievieno pa 1 ml b) līdz d) šķīduma un uzpilda līdz 1 l ar ūdeni atšķaidīšanai.
II.2.3. Sējmateriāla sagatavošana un iepriekšēja kondicionēšana
Sējmateriālu var iegūt dažādi: no aktīvajām dūņām; attīrītiem notekūdeņiem; virszemes ūdeņiem; augsnēm vai iepriekšminēto maisījuma.
Skatīt I.6.4., I.6.4.1., I.6.4.2. un I.6.5. punktu.
II.2.4. Kolbu sagatavošana
Piemēram, 2 l tilpuma koniskajās kolbās pārnes pa 800 ml minerālbarotnes un pievieno pietiekamus tilpumus testējamās vielas un standartvielas rezerves šķīdumu atsevišķās kolbās, lai iegūtu ķīmisko vielu koncentrāciju, kas ekvivalenta 10–40 mg IOO/1. Pārbauda pH vērtības, kuras, ja vajadzīgs, noregulē līdz 7,4. Kolbās iesēj aktīvās dūņas vai sējmateriālu no cita avota (skatīt I.6.4. punktu), lai iegūtu galīgo koncentrāciju, kas nepārsniedz 30 mg suspendēto daļiņu/l. Sagatavo arī sējmateriāla kontroli minerālbarotnē bez testējamās vielas vai standartvielas.
Ja vajadzīgs, vienu kolbu izmanto testējamās vielas iespējamās inhibitora iedarbības pārbaudei, apsējot šķīdumu, kurā minerālbarotnē ir salīdzināmas testējamās vielas un standartvielas koncentrācijas.
Ja vajadzīgs, vēl vienā sterilā kolbā, izmantojot ķīmisko vielu bez sējmateriāla (skatīt I.6.6. punktu) pārbauda, vai notiek ķīmiskās vielas abiotiskā degradācija.
Ja testējamā viela varētu tikt ievērojamā daudzumā adsorbēta uz stikla, dūņām u. c., papildus veic orientējošu novērtējumu, lai noteiktu iespējamo adsorbcijas pakāpi un tādējādi testa piemērotību konkrētajai vielai (skatīt 1. tabulu). Vienā kolbā, kas satur testējamo vielu, pievieno sējmateriālu un sterilizējošu vielu.
Visās kolbās uzpilda kopējo tilpumu līdz 1 l ar minerālbarotni un pēc samaisīšanas no katras kolbas ņem paraugu IOO sākuma koncentrācijas noteikšanai (skatīt 2.4. papildinājumu). Kolbas noslēdz, piemēram, ar alumīnija foliju tā, lai notiktu kolbas satura gaisa apmaiņa ar apkārtējo atmosfēru. tad kolbas ievieto kratītājā un sāk testēšanu.
II.2.5. Kolbu skaits parastā sērijā
1. un 2. kolba: testa suspensija
3. un 4. kolba: sējmateriāla tukšais paraugs
5. kolba: noteikšanas kontrole
Vēlams, kā arī gadījumos, kad tas vajadzīgs:
6. kolba: abiotiskā sterilā kontrole
7. kolba: adsorbcijas kontrole
8. kolba: toksicitātes kontrole
Skatīt arī I.6.7. punktu.
II.2.6. Darba gaita
Visā testēšanas laikā divos atkārtojumos katrā kolbā nosaka IOO koncentrācijas pēc noteiktiem intervāliem pietiekami bieži, lai varētu noteikt 10 dienu intervāla sākumu un izdalīšanās procentu 10 dienu intervāla beigās. Katrai noteikšanai ņem minimāli nepieciešamo suspensijas daudzumu.
Pirms paraugu ņemšanas, ja vajadzīgs, kompensē iztvaikošanas zudumus, vajadzīgajā daudzumā pievienojot ūdeni atšķaidīšanai (skatīt I.6.1. punktu). Barotni pirms parauga ņemšanas rūpīgi samaisa un raugās, lai kolbu sienām pielipušais materiāls tiktu izšķīdināts vai suspendēts. Paraugu tūlīt filtrē caur membrānfiltru vai centrifugē (skatīt 2.4. papildinājumu). Ja filtrētos vai centrifugētos paraugus neanalizē tajā paša dienā, 2–4 oC temperatūrā tos var glabāt līdz 48 stundām, bet –18 oC un zemākā temperatūrā – arī ilgāku laiku.
II.3. DATI UN PĀRSKATS
II.3.1. Rezultātu apstrāde
Saskaņā ar I.7.1. punktu (IOO noteikšana) aprēķina degradācijas procentu laikā t un fakultatīvi arī saskaņā ar I.7.2. punktu (īpašas analīzes).
Visus rezultātus reģistrē noteiktajās datu lapās.
II.3.2. Rezultātu derīgums
Skatīt I.5.2. punktu.
II.3.3. Pārskats
Skatīt I.8. punktu.
II.4. DATU LAPA
Turpmāk dots datu lapas paraugs.
IOO ATKRĀSOŠANĀS TESTS
1. LABORATORIJA
2. TESTĒŠANAS SĀKUMA DATUMS
3. TESTĒJAMĀ VIELA
Nosaukums:
Rezerves šķīduma koncentrācija: mg/l vielas veidā
Sākuma koncentrācija barotnē, t0: mg/l vielas veidā
4. SĒJMATERIĀLS
Avots:
Attīrīšana:
Iepriekšēja kondicionēšana, ja veikta:
Suspendēto vielu koncentrācija reakcijas maisījumā: mg/1
5. OGLEKĻA NOTEIKŠANA
Oglekļa analizators:
|
Kolbas Nr. |
IOO pēc n dienām (mg/1) |
||||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Testējamā viela plus sējmateriāls |
1 |
a1 |
|||||
|
a2 |
|||||||
|
a, vid. Ca(t) |
|||||||
|
2 |
b1 |
||||||
|
b2 |
|||||||
|
b, vid. Cb(t) |
|||||||
|
Sējmateriāla tukšais paraugs bez testējamās vielas |
3 |
c1 |
|||||
|
c2 |
|||||||
|
c, vid. Cc(t) |
|||||||
|
4 |
d1 |
||||||
|
d2 |
|||||||
|
d, vid. Cd(t) |
|||||||
|
|
|||||||
6. IZEJAS DATU NOVĒRTĒŠANA
|
Kolbas nr. |
degradācijas % pēc n dienām |
|||||
|
0 |
n1 |
n2 |
n3 |
nx |
||
|
1 |
|
0 |
||||
|
2 |
|
0 |
||||
|
Vidējā vērtība (1) |
|
0 |
||||
|
(1) D1 un D2 nevar aprēķināt vidējo vērtību, ja tie ir ievērojami atšķirīgi. |
||||||
Piezīme: līdzīgus formātus var izmantot arī standartvielai un toksicitātes kontrolei.
7. ABIOTISKĀ KONTROLE (fakultatīvi)
|
Laiks (dienas) |
||
|
0 |
t |
|
|
IOO konc. (mg/1) sterilajā kontrolē |
Cs(o) |
Cs(t) |
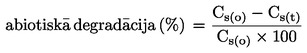
8. SPECIFISKAS ĶĪMISKĀS ANALĪZES (fakultatīvi)
|
Testējamās vielas atlikušais daudzums testēšanas beigās (mg/l) |
Primārā degradācija (%) |
|
|
Sterilā kontrole |
Sb |
|
|
Testa barotne ar sējmateriālu |
Sa |
|
III DAĻA. MODIFICĒTĀ ESAO SKRĪNINGA METODE (C.4.-B metode)
III.1. METODES PRINCIPS
Noteiktu tilpumu minerālās barotnes, kas kā vienīgo oglekļa avotu satur zināmu testējamās vielas koncentrāciju (10–40 mg IOO/l) apsēj ar 0,5 ml attīrītu notekūdeņu uz litru barotnes. Maisījumu aerē tumsā vai izkliedētā apgaismojumā 22 ± 2 oC temperatūrā.
Pēc degradācijas 28 dienu periodā veic biežas IOO analīzes. Biodegradācijas pakāpi aprēķina pēc izdalītā IOO koncentrācijas (ko koriģē pēc sējmateriāla tukšā parauga kontroles), ko izsaka procentos attiecībā pret sākuma koncentrāciju. Primārās biodegradācijas pakāpi var aprēķināt pēc papildus inkubācijas sākumā un beigās veikto papildus ķīmisko analīžu rezultātiem.
III.2. TESTA METODES APRAKSTS
III.2.1. Aprīkojums
a) Koniskās kolbas, piemēram, no 250 ml līdz 2 1 tilpuma, atkarībā no IOO analīzei vajadzīgā tilpuma;
b) mehāniskais kratītājs koniskajām kolbām, ar automātisku temperatūras regulēšanu vai izmantošanai pastāvīgā telpas temperatūrā, ar pietiekamu jaudu aerobu apstākļu uzturēšanai visās kolbās;
c) filtrēšanas iekārta ar piemērotām membrānām;
d) IOO analizators;
e) aparāts izšķīdušā skābekļa noteikšanai;
f) centrifūga.
III.2.2. Minerālbarotņu sagatavošana
Rezerves šķīdumu sagatavošanu skatīt I.6.2. punktu.
Sajauc 10 ml šķīduma a) ar 80 ml ūdens atšķaidīšanai, pievieno pa 1 ml b) līdz d) šķīduma un uzpilda līdz 1 litram ar ūdeni atšķaidīšanai.
Pēc šīs metodes par sējmateriālu izmanto tikai 0,5 ml attīrītu notekūdeņu/l, un tāpēc barotne var būt jāpastiprina ar mikroelementiem un augšanas stimulatoriem. To dara, uz litru gatavas barotnes pievienojot pa 1 ml šādu šķīdumu:
Mikroelementu šķīdums:
|
Mangāna sulfāta tetrahidrāts, MnSO4. 4H2O |
39,9 mg |
|
Borskābe, H3BO3 |
57,2 mg |
|
Cinka sulfāta heptahidrāts, ZnSO4. 7H2O |
42,8 mg |
|
Amonija heptamolibdāts (NH4)6 Mo7O24 |
34,7 mg |
|
Fe helāts (FeCl3 ethilēndiamīntetraetiķskābe) |
100,0 mg |
|
Izšķīdina ūdenī un atšķaida līdz 1 000 ml |
|
|
Vitamīnu šķīdums: |
|
|
Rauga ekstrakts |
15,0 mg |
Rauga ekstraktu izšķīdina 100 ml ūdens. Sterilizē, filtrējot caur 0,2 mikronu membrānas filtru, vai gatavo svaigu.
III.2.3. Sējmateriāla sagatavošana un iepriekšēja kondicionēšana
To var iegūt no attīrītiem notekūdeņiem, kurus aizvada no attīrīšanas iekārtām vai laboratorijas iekārtām, kurās galvenokārt attīra sadzīves notekūdeņus. Skatīt I.6.4.2. un I.6.5. punktu.
Izmanto 0,5 ml uz litru barotnes.
III.2.4. Kolbu sagatavošana
Piemēram, 2 l tilpuma koniskajās kolbās pārnes pa 800 ml minerālbarotnes un pievieno pietiekamus tilpumus testējamās vielas un standartvielas rezerves šķīdumu atsevišķās kolbās, lai iegūtu ķīmisko vielu koncentrāciju, kas ekvivalenta 10–40 mg IOO/1. Pārbauda pH vērtības, kuras, ja vajadzīgs, noregulē līdz 7,4. Kolbas apsēj ar attīrītiem notekūdeņiem 0,5 ml/l (skatīt I.6.4.2. punktu). Sagatavo arī sējmateriāla kontroli minerālbarotnē bez testējamās vielas vai standartvielas.
Ja vajadzīgs, vienu kolbu izmanto testējamās vielas iespējamās inhibitora iedarbības pārbaudei, apsējot šķīdumu, kurā minerālbarotnē ir salīdzināmas testējamās vielas un standartvielas koncentrācijas.
Ja vajadzīgs, vēl vienā sterilā kolbā, izmantojot ķīmisko vielu bez sējmateriāla (skatīt I.6.6. punktu) pārbauda, vai notiek ķīmiskās vielas abiotiskā degradācija.
Ja testējamā viela varētu tikt ievērojamā daudzumā adsorbēta uz stikla, dūņām u. c., papildus veic orientējošu novērtējumu, lai noteiktu iespējamo adsorbcijas pakāpi un tādējādi testa piemērotību konkrētajai vielai (skatīt 1. tabulu). Vienā kolbā, kas satur testējamo vielu, pievieno sējmateriālu un sterilizējošu vielu.
Visās kolbās uzpilda kopējo tilpumu līdz 1 litram ar minerālbarotni, un pēc samaisīšanas no katras kolbas ņem paraugu IOO sākuma koncentrācijas noteikšanai (skatīt 2.4. papildinājumu). Kolbas noslēdz, piemēram, ar alumīnija foliju tā, lai notiktu kolbas satura gaisa apmaiņa ar apkārtējo atmosfēru. Tad kolbas ievieto kratītājā un sāk testēšanu.
III.2.5. Kolbu skaits parastā sērijā
1. un 2. kolba: testa suspensija
3. un 4. kolba: sējmateriāla tukšais paraugs
5. kolba: noteikšanas kontrole
Vēlams, kā arī gadījumos, kad tas vajadzīgs:
6. kolba: abiotiskā sterilā kontrole
7. kolba: adsorbcijas kontrole
8. kolba: toksicitātes kontrole
Skatīt arī I.6.7. punktu.
III.2.6. Testa gaita
Visā testēšanas laikā divos atkārtojumos katrā kolbā nosaka IOO koncentrācijas pēc noteiktiem intervāliem pietiekami bieži, lai varētu noteikt 10 dienu intervāla sākumu un izdalīšanās procentu 10 dienu intervāla beigās. Katrai noteikšanai ņem minimāli nepieciešamo suspensijas daudzumu.
Pirms paraugu ņemšanas, ja vajadzīgs, kompensē iztvaikošanas zudumus, vajadzīgajā daudzumā pievienojot ūdeni atšķaidīšanai. Barotni pirms parauga ņemšanas rūpīgi samaisa un raugās, lai kolbu sienām pielipušais materiāls tiktu izšķīdināts vai suspendēts. Paraugu tūlīt filtrē caur membrānfiltru vai centrifugē (skatīt 2.4. papildinājumu). Ja filtrētos vai centrifugētos paraugus neanalizē tajā paša dienā, 2–4 oC temperatūrā tos var glabāt līdz 48 stundām, bet –18 oC un zemākā temperatūrā – arī ilgāku laiku.
III.3. DATI UN PĀRSKATS
III.3.1. Rezultātu apstrāde
Saskaņā ar I.7.1. punktu (IOO noteikšana) aprēķina degradācijas procentu laikā t un fakultatīvi arī saskaņā ar I.7.2. punktu (īpašas analīzes).
Visus rezultātus reģistrē noteiktajās datu lapās.
III.3.2. Rezultātu derīgums
Skatīt I.5.2. punktu.
III.3.3. Pārskats
Skatīt I.8. punktu.
III.4. DATU LAPA
Turpmāk dots datu lapas paraugs.
MODIFICĒTS ESAO SKRĪNINGA TESTS
1. LABORATORIJA
2. TESTĒŠANAS SĀKUMA DATUMS
3. TESTĒJAMĀ VIELA
Nosaukums:
Rezerves šķīduma koncentrācija: mg/l vielas veidā
Sākuma koncentrācija barotnē, t0: mg/l vielas veidā
4. SĒJMATERIĀLS
Avots:
Attīrīšana:
Iepriekšēja kondicionēšana, ja veikta:
Suspendēto vielu koncentrācija reakcijas maisījumā: mg/l
5. OGLEKĻA NOTEIKŠANA
Oglekļa analizators:
|
Kolbas nr. |
IOO pēc n dienām (mg/1) |
||||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Testējamā viela un sējmateriāls |
1 |
a1 |
|||||
|
a2 |
|||||||
|
a, vid. Ca(t) |
|||||||
|
2 |
b1 |
||||||
|
b2 |
|||||||
|
b, vid. Cb(t) |
|||||||
|
Sējmateriāla tukšais paraugs bez testējamās vielas |
3 |
c1 |
|||||
|
c2 |
|||||||
|
c, vid. Cc(t) |
|||||||
|
4 |
d1 |
||||||
|
d2 |
|||||||
|
d, vid. Cd(t) |
|||||||
|
|
|||||||
6. IZEJAS DATU NOVĒRTĒŠANA
|
Kolbas nr. |
degradācijas % pēc n dienām |
|||||
|
0 |
n1 |
n2 |
n3 |
nx |
||
|
1 |
|
0 |
||||
|
2 |
|
0 |
||||
|
Vidējā vērtība (1) |
|
0 |
||||
|
(1) Pēc D1 un D2 nevar aprēķināt vidējo vērtību, ja tie ir ievērojami atšķirīgi. |
||||||
Piezīme: līdzīgus formātus var izmantot arī standartvielai un toksicitātes kontrolei.
7. ABIOTISKĀ KONTROLE (fakultatīvi)
|
Laiks (dienas) |
||
|
0 |
t |
|
|
IOO konc. (mg/1) sterilajā kontrolē |
Cs(o) |
Cs(t) |

8. SPECIFISKAS ĶĪMISKĀS ANALĪZES (pēc izvēles)
|
Testējamās vielas atlikušais daudzums testēšanas beigās (mg/l) |
Primārā degradācija (%) |
|
|
Sterilā kontrole |
Sb |
|
|
Testa barotne ar sējmateriālu |
Sa |
|
IV DAĻA. CO2 IZDALĪŠANĀS TESTS (C.4.-C metode)
IV.1. METODES PRINCIPS
Noteiktu tilpumu minerālās barotnes ar sējmateriālu, kas kā vienīgo oglekļa avotu satur zināmu testējamās vielas koncentrāciju (10–20 mg IOO vai TOC/l) 22 ± 2 oC temperatūrā aerē tumsā vai izkliedētā apgaismojumā. Degradācija notiek 28 dienas, nosakot izdalīto oglekļa dioksīdu, ko uztver bārija vai nātrija hidroksīdā un kuru nosaka, attitrējot hidroksīda pārākumu vai neorganiskā oglekļa veidā. No testējamās vielas izdalījušos oglekļa dioksīdu (kas koriģēts pēc sējmateriāla tukšā parauga) izsaka procentos TCO2. Primārās biodegradācijas pakāpi var aprēķināt pēc inkubācijas sākumā un beigās veikto papildu IOO analīžu rezultātiem.
IV.2. TESTA METODES APRAKSTS
IV.2.1. Aprīkojums
a) Kolbas, 2–5 l tilpuma ar aerācijas cauruli, kas iet gandrīz līdz kolbas dibenam un izplūdi;
b) magnētiskie maisītāji gadījumos, kad testē mazšķīstošas vielas;
c) gāzu absorbcijas pudeles;
d) ierīce gaisa plūsmas regulēšanai un mērīšanai;
e) aparāts oglekļa dioksīda saistīšanai, ko izmanto tāda gaisa sagatavošanai, no kura izdalīts oglekļa dioksīds; var izmantot arī no CO2 attīrīta skābekļa un slāpekļa maisījumu no gāzes baloniem pareizās attiecībās (20 % O2:80 % N2);
f) oglekļa dioksīda noteikšanas ierīce titrimetriski vai neorganiskā oglekļa analizatora veidā;
g) membrānfiltrēšanas ierīce (fakultatīvi);
h) IOO analizators (fakultatīvi).
IV.2.2. Minerālbarotņu sagatavošana
Rezerves šķīdumu sagatavošanu skatīt I.6.2. punktu.
Sajauc 10 ml šķīduma a) ar 800 ml ūdens atšķaidīšanai, pievieno pa 1 ml b) līdz d) šķīduma un uzpilda līdz 1 litram ar ūdeni atšķaidīšanai.
IV.2.3. Sējmateriāla sagatavošana un iepriekšēja kondicionēšana
Sējmateriālu var iegūt dažādi: no aktīvajām dūņām; attīrītiem notekūdeņiem; virszemes ūdeņiem; augsnēm vai iepriekšminēto maisījuma.
Skatīt I.6.4., I.6.4.1., I.6.4.2. un I.6.5. punktu.
IV.2.4. Kolbu sagatavošana
Piemēra veidā turpmāk norādīti tilpumi un svērumi 5 l tilpuma kolbām, kurās ir 3 l suspensijas. Ja izmanto mazākus tilpumus, skaitļus attiecīgi modificē, taču nodrošina, lai varētu precīzi izmērīt izdalījušos oglekļa dioksīda daudzumu.
Katrā 5 l tilpuma kolbā pārnes 2 400 ml minerālbarotnes. Pievieno attiecīgu daudzumu sagatavoto aktīvo dūņu (skatīt I.6.4.1. un I.6.5. punktu) tā, lai suspendēto daļiņu saturs galīgajos 3 l maisījuma ar sējmateriāla nepārsniegtu 30 mg/l. Sagatavotās dūņas var arī vispirms atšķaidīt, iegūstot 500–1 000 mg/l suspensijai minerālbarotnē, un tās alikvotu pievienot 5 l tilpuma kolbas saturam, lai iegūtu koncentrāciju 30 mg/l; tādējādi tiek nodrošināta lielāka precizitāte. Var izmantot citus sējmateriāla avotus (skatīt I.6.4.2. punktu).
Apsētos maisījumus līdz nākamajai dienai aerē ar gaisu, no kura attīrīts CO2, lai no sistēmas aizvadītu oglekļa dioksīdu.
Pievieno testējamo vielu un atsevišķi standartvielu noteikta rezerves šķīduma tilpuma veidā, lai pievienotās vielas nodrošinātu 10 līdz 20 mg IOO vai TOC/l; dažās kolbās ķīmiskās vielas nepievieno sējmateriāla kontrolei. Mazšķīstošas testējamās vielas kolbās tieši pievieno pēc svara vai tilpuma vai rīkojas, kā aprakstīts 3. papildinājumā.
Ja vajadzīgs, vienu kolbu izmanto, lai pārbadītu testējamās vielas iespējamo inhibējošo iedarbību, gan testējamo vielu, gan standartvielu pievienojot tādās pašās koncentrācijās kā pārējās kolbās.
Ja vajadzīgs, vēl vienā sterilā kolbā, izmantojot ķīmisko vielu bez sējmateriāla (skatīt I.6.6. punktu) pārbauda, vai notiek ķīmiskās vielas abiotiska degradācija. Sterilizē, vajadzīgajā koncentrācijā pievienojot toksisku vielu.
Visās kolbās suspensijas atšķaida līdz 3 l, pievienojot minerālbarotni, kas pirms tam aerēta ar gaisu, kas attīrīts no CO2. Ja vajadzīgs, var ņemt paraugus IOO analīzei (skatīt 2.4. papildinājumu) un/vai kādu īpašu analīzi. Gaisa izplūdē no kolbām pievieno absorbcijas pudeles.
Ja izmanto bārija hidroksīdu, visām 5 l kolbām virknē pievieno trīs absorbcijas pudeles, kurās katrā ir 100 ml 0,0125 M bārija hidroksīda šķīduma. Šķīdumā nedrīkst būt sulfātu un karbonātu nogulšņu, un tā koncentrācija jānosaka tieši pirms lietošanas. Izmantojot nātrija hidroksīdu, pievieno divus uztvērējus, no kuriem otrais tiek izmantots kontrolei, lai pārliecinātos, ka viss oglekļa dioksīds ir absorbēts pirmajā. Var izmantot ar seruma pudeļu aizbāžņiem aprīkotas absorbcijas pudeles. Katrā pudelē pārnes 200 ml 0,05 M nātrija hidroksīda šķīduma, kas ir pietiekami visa izdalītā oglekļa dioksīda daudzuma absorbēšanai, testējamajai vielai pilnīgi noārdoties. Arī tikko pagatavots nātrija hidroksīda šķīdums nelielā daudzumā satur karbonātus; to koriģē, atņemot karbonātu saturu tukšajā paraugā.
IV.2.5. Kolbu skaits parastā sērijā
1. un 2. kolba: testa suspensija
3. un 4. kolba: sējmateriāla tukšais paraugs
5. kolba: noteikšanas kontrole
Vēlams, kā arī gadījumos, kad tas vajadzīgs:
6. kolba: abiotiskā sterilā kontrole
7. kolba: toksicitātes kontrole
Skatīt arī I.6.7. punktu.
IV.2.6. Testa gaita
Testēšanu sāk, caur suspensiju ar ātrumu 30–100 ml/min barbotējot no CO2 attīrītu gaisu. Periodiski CO2 satura noteikšanai ņem absorbenta paraugus. Pirmo 10 dienu laikā ieteicams analīzes izdarīt katru otro vai trešo dienu, pēc tam līdz 28. dienai katru piekto dienu tā, lai varētu noteikt 10 dienu intervālu.
Ņem paraugus 28. dienā IOO un/vai specifiskām analīzēm, mēra suspensijas pH un katrā kolbā pievieno 1 ml koncentrētas hlorūdeņražskābes; kolbas līdz nākamajai dienai aerē, lai no testējamajām suspensijām aizvadītu oglekļa dioksīdu. Pēdējo izdalītā oglekļa dioksīda analīzi veic 29. dienā.
Dienās, kad nosaka CO2, atvieno kolbai tuvāko absorberu ar bārija hidroksīdu, un hidroksīda šķīdumu titrē ar 0,05 M HCl, par indikatoru izmantojot fenolftaleīnu. Palikušos absorberus pārvieto par vienu vietu tuvāk kolbai un galā pievieno jaunu absorberu, kurā ir 100 ml svaiga 0,0125 M bārija hidroksīda. Pēc vajadzības veic titrēšanu, piemēram, gadījumos, kad pirmajā uztvērējā ievērojamā daudzumā veidojas nogulsnes un pirms tās rodas otrajā uztvērējā, vai vismaz reizi nedēļā. Ja par absorbentu izmanto NaOH, ar šļirci ņem nelielu paraugu (atkarībā no izmantotā oglekļa analizatora parametriem) nātrija hidroksīda no kolbai tuvākā absorbera. Paraugu injicē oglekļa analizatora 1.C daļā izdalījušās oglekļa dioksīda tiešai noteikšanai.
Otrā uztvērēja saturu analizē tikai testēšanas beigās, lai noteiktu oglekļa dioksīda pārneses korekciju.
IV.3. DATI UN PĀRSKATS
IV.3.1. Rezultātu apstrāde
Absorberā uztvertā CO2 daudzumu pēc titrēšanas aprēķina šādi:
mgCO2 = (100 × CB – 0,5 × V × CA) × 44
kur:
|
V |
= |
100 ml absorberā esošā tilpuma titrēšanai izmantotā HC1 daudzums (ml), |
|
CB |
= |
bārija hidroksīda šķīduma koncentrācija (M), |
|
CA |
= |
hlorūdeņražskābes šķīduma koncentrācija (M), |
ja CB ir 0,0125 M un CA ir 0,05 M, 100 ml bārija hidroksīda titrēšanai patērē 50 ml, un CO2 aprēķina šādi:
![]()
Tādējādi šajā gadījumā titrēšanai izlietoto HCl tilpumu pārvērš mg izdalītā CO2, to reizinot ar koeficientu 1,1.
Izmantojot attiecīgos titrēšanas rezultātus, aprēķina sējmateriāla un sējmateriāla kopā ar testējamo vielu izdalītā CO2 daudzumus, kuru starpība ir ķīmiskās vielas izdalītā CO2 daudzums.
Piemēram, ja sējmateriāla titrēšanai patērē 48 ml, bet sējmateriāla kopā ar testējamo vielu titrēšanai – 45 ml,
CO2 daudzums no sējmateriāla = 1,1 × (50 – 48) = 2,2 mg
CO2 daudzums no sējmateriāla kopā ar testējamo vielu = 1,1 × (50 – 45) = 5,5 mg
un tādējādi testējamās vielas izdalītā CO2 masa ir 3,3 mg.
Biodegradāciju procentos aprēķina:
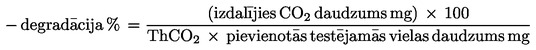
vai

kur 3,67 pārrēķina koeficients oglekļa izteikšanai oglekļa dioksīdā (44/12).
Degradācijas procentu konkrētā laika periodā nosaka, saskaitot katrai tā dienai aprēķinātās TCO2 vērtības līdz termiņam, kuram to nosaka.
Nātrija hidroksīda absorberiem aprēķina izdalīto oglekļa dioksīda daudzumu, ko izsaka IC (mg), reizinot IC koncentrāciju absorbentā ar absorbenta tilpumu.
Degradācijas procentu aprēķina pēc formulas:

Pēc apraksta I.7. punktā aprēķina IOO izdalīšanos (nav obligāti). Šos un visus pārējos rezultātus reģistrē noteiktajās datu lapās.
IV.3.2. Rezultātu derīgums
Testējamās vielas suspensijas koncentrācija minerālbarotnē testēšanas sākumā nedrīkst būt zemāka par 5 % TC, un no sējmateriāla tukšā parauga kopējam izdalītajam CO2 daudzumam testēšanas beigās parasti nevajadzētu pārsniegt 40 mg/l barotnes. Ja tiek noteiktas par 70 mg CO2/l lielākas vērtības, kritiski jāizvērtē gan iegūtie dati, gan izraudzītā noteikšanas metode.
Skatīt arī I.5.2. punktu.
IV.3.3. Pārskats
Skatīt I.8. punktu.
IV.4. DATU LAPA
Turpmāk dots datu lapas paraugs.
OGLEKĻA DIOKSĪDA IZDALĪŠANĀS TESTS
1. LABORATORIJA
2. TESTĒŠANAS SĀKUMA DATUMS
3. TESTĒJAMĀ VIELA
Nosaukums:
Rezerves šķīduma koncentrācija: mg/l vielas veidā
Sākuma koncentrācija barotnē: mg/l vielas veidā
Kolbā pievienotais kopīgais C daudzums: mg C
TCO2: mg CO2
4. SĒJMATERIĀLS
Avots:
Attīrīšana:
Iepriekšēja kondicionēšana, ja veikta:
Suspendēto vielu koncentrācija reakcijas maisījumā: mg/l
5. OGLEKĻA DIOKSĪDA PRODUCĒŠANA UN BIODEGRADĒJAMĪBA
Metode: Ba(OH)2/NaOH/cita
|
Laiks (dienas) |
CO2 veidošanās no testējamā parauga (mg) |
CO2 veidošanās no tukšā parauga (mg) |
CO2 veidošanās kumulatīvi (mg) (testējamā parauga un tukšā parauga starpība vidēji) |
TCO2 kumulatīvais
|
|||||
|
1 2 |
vidējā vērtība |
3 4 |
vidējā vērtība |
1 |
2 |
1 |
2 |
vidējā vērtība |
|
|
0 |
|||||||||
|
n1 |
|||||||||
|
n2 |
|||||||||
|
n3 |
|||||||||
|
28 |
|||||||||
Piezīme: līdzīgus formātus var izmantot arī standartvielai un toksicitātes kontrolei.
6. OGLEKĻA ANALĪZE (fakultatīvi)
Oglekļa analizators:
|
Laiks (dienas) |
Tukšais paraugs (mg/l) |
Testējamā viela (mg/l) |
|
0 |
Cb(o) |
C0 |
|
28 (1) |
Cb(t) |
Ct |
|
(1) Vai inkubēšanas beigās. |
||
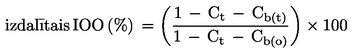
7. ABIOTISKĀ DEGRADĀCIJA (nav obligāti)
sterilajā kolbā pēc 28 dienām izveidojušos CO2 daudzumu miligramos dala ar TCO2:

V DAĻA. MANOMETRISKĀ RESPIROMETRIJA (C.4.-D metode)
V.1. METODES PRINCIPS
Noteiktu tilpumu apsētas minerālbarotnes, kura satur zināmu koncentrāciju testējamās vielas (100 mg/l testējamās vielas, kas rada vismaz 50–100 mg TSP/l) kā nomināli vienīgo organiskā oglekļa avotu, līdz 28 dienām maisa noslēgtā kolbā pastāvīgā temperatūrā (± 1 oC). Skābekļa patēriņu nosaka, mērot (elektrolītiski izdalītā) skābekļa daudzumu, kas vajadzīgs gāzes pastāvīga tilpuma uzturēšanai respirometra kolbā, vai pēc tilpuma vai spiediena (vai to abu) izmaiņām aparātā. Izdalījušos oglekļa dioksīdu absorbē kālija hidroksīda šķīdumā vai ar kādu citu šim nolūkam piemērotu absorbentu. Testējamās ķīmiskās vielas patērēto skābekļa daudzumu (ko koriģē pēc paralēli noteiktā tukšā parauga šķīduma patērētā daudzuma) izsaka kā TSP vai ĶSP daļu procentos. Primārās biodegradācijas pakāpi var aprēķināt arī pēc inkubācijas sākumā un beigās veikto papildu specifisko analīžu rezultātiem, bet kopējo biodegradāciju – pēc IOO analīzes rezultātiem.
V.2. METODES APRAKSTS
V.2.1. Iekārta
a) Piemērots respirometrs;
b) temperatūras regulēšanas ierīce, kas uztur temperatūru vismaz ± 1 oC robežās vai precīzāk;
c) membrānfiltrēšanas ierīce (fakultatīvi);
d) oglekļa analizators (fakultatīvi).
V.2.2. Minerālbarotņu sagatavošana
Rezerves šķīdumu sagatavošanu skatīt I.6.2. punktā.
Sajauc 10 ml šķīduma a) ar 800 ml ūdens atšķaidīšanai, pievieno pa 1 ml b) līdz d) šķīduma un uzpilda līdz 1 litram ar ūdeni atšķaidīšanai.
V.2.3. Sējmateriāla sagatavošana un iepriekšēja kondicionēšana
Sējmateriālu var iegūt dažādi: no aktīvajām dūņām; attīrītiem notekūdeņiem; virszemes ūdeņiem un augsnēm vai iepriekšminēto maisījuma.
Skatīt I.6.4., I.6.4.1., I.6.4.2. un I.6.5. punktu.
V.2.4. Kolbu sagatavošana
Atsevišķās sērijās no rezerves šķīdumiem sagatavo testējamās vielas un standartvielas šķīdumus minerālbarotnē, parasti 100 mg vielas litrā (kas dod vismaz 50–100 mg TSP/l).
Ja nav sagaidāma nitrifikācija, kad attiecīgos aprēķinus izdara pēc nitrātu veidošanās, TSP vērtību aprēķina, veidojoties amonija sāļiem (skatīt 2.2. papildinājumu).
Pārbauda pH vērtības, kuras, ja vajadzīgs, noregulē līdz 7,4 ± 0,2.
Mazšķīstošas vielas pievieno vēlāk (skatīt turpmāk).
Ja jānosaka testējamās vielas toksicitāte, pagatavo vēl vienu šķīdumu minerālbarotnē, kas satur testējamo vielu un standartvielu tādās pašās koncentrācijās kā to atsevišķi pagatavotie šķīdumi.
Ja jāveic skābekļa fizikāli ķīmiskā patēriņa mērījumi, sagatavo testējamās vielas šķīdumu, parasti ar koncentrāciju 100 mg TSP/l, kas sterilizēts, pievienojot piemērotu toksisku vielu (skatīt I.6.6. punktu).
Kolbās vismaz divos atkārtojumos pārnes attiecīgos testējamās vielas un standartvielas šķīdumu daudzumus. Pārējās kolbās pārnes tikai minerālbarotni (sējmateriāla kontrolei) un, ja vajadzīgs, testējamās vielas un standartvielas jaukto šķīdumu, un sterilo šķīdumu.
Ja testējamā viela ir mazšķīstoša, šajā noteikšanas posmā to tieši pievieno pēc svara vai tilpuma vai rīkojas, kā aprakstīts 3. papildinājumā. CO2 absorberā iepilda kālija hidroksīdu, nātronkaļķus vai citu absorbentu.
V.2.5. Kolbu skaits parastā sērijā
1. un 2. kolba: testa suspensija
3. un 4. kolba: sējmateriāla tukšais paraugs
5. kolba: noteikšanas kontrole
Vēlams, kā arī gadījumos, kad tas vajadzīgs:
6. kolba: sterilā kontrole
7. kolba: toksicitātes kontrole
Skatīt arī I.6.7. punktu.
V.2.6. Testa gaita
Kolbas iztur vajadzīgajā temperatūrā un tās, kuras vajadzīgs, apsēj ar aktīvajām dūņām vai citu sējmateriālu tā, lai suspendēto vielu koncentrācija nepārsniegtu 30 mg/l. Iekārtu samontē, iedarbina maisītāju, pārbauda aparāta hermētiskumu un sāk skābekļa patēriņa mērījumus. Parasti aparāts var darboties bez pastāvīgas uzraudzības un var veikt tikai nolasījumus un ikdienas pārbaudes, lai pārliecinātos, ka tiek uzturēts pareizs temperatūras un maisīšanas režīms.
Pēc regulāri un bieži veikto nolasījumu rezultātiem ar iekārtas ražotāja norādītajām metodēm aprēķina patērēto skābekļa daudzumu. Inkubēšanas beigās, kas parasti ir pēc 28 dienām, izmēra kolbu satura pH, īpaši tad, ja skābekļa patēriņš ir zems vai arī tas ir lielāks par TSPNH4 (slāpekļa savienojumiem).
Ja vajadzīgs, sākumā un beigās no respirometra kolbām ņem paraugus IOO vai attiecīgās ķīmiskās vielas noteikšanai (skatīt 2.4. papildinājumu). Ņemot paraugu pirmoreiz, jārīkojas tā, lai būtu zināms kolbā palikušās suspensijas daudzums. Ja skābekli patērē testējamā viela, kuras sastāvā ir slāpeklis, nosaka nitrītu un nitrātu satura palielināšanos 28 dienu laikā un aprēķina nitrifikācijai patērētā skābekļa daudzuma korekciju (5. papildinājums).
V.3. DATI UN PĀRSKATS
V.3.1. Rezultātu apstrāde
Testējamās vielas skābekļa patēriņu (mg) pēc noteikta laika (kas koriģēts pēc sējmateriāla tukšā parauga patēriņu tajā pašā laikā) dala ar izmantotās testējamās vielas daudzumu. Tādējādi aprēķina BSP (BOD), kas izteikts mg skābekļa/mg testējamās vielas, t. i.,
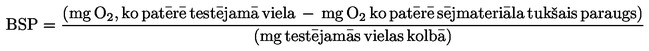
= mg O2 uz mg testējamās vielas
degradācijas procentu aprēķina pēc formulas:

vai

Jāpiezīmē, ka pēc šīm abām metodēm iegūto rezultātu skaitliskās vērtības ne vienmēr ir vienādas; ieteicams izmantot šo otru metodi.
Testējamajām vielām, kuras satur slāpekli, atkarībā no tā, kas ir sagaidāms vai zināms attiecībā uz nitrifikāciju, izmanto attiecīgo TSP (NH4 vai NO3) vērtību (2.2. papildinājums). Ja nitrifikācija notiek, taču ne pilnīgi, pēc nitrītjonu un nitrātjonu koncentrāciju izmaiņām aprēķina korekciju skābeklim, kas patērēts nitrifikācijai (5. papildinājums).
Ja fakultatīvi nosaka arī organiskā oglekļa un/vai attiecīgās vielas saturu, degradācijas procentu aprēķina saskaņā ar I.7. punktu.
Visus rezultātus reģistrē pievienotajās datu lapās.
V.3.2. Rezultātu derīgums
Sējmateriāla tukšā parauga skābekļa patēriņš parasti ir 20–30 mg O2/l, un 28 dienās tas nedrīkst pārsniegt 60 mg/l. Ja tā vērtības pārsniedz 60 mg/l, kritiski jāizvērtē eksperimentālie dati un to iegūšanas metodes. Ja pH vērtība nav robežās no 6 līdz 8,5 un testējamās vielas skābekļa patēriņš nepārsniedz 60 %, noteikšana jāatkārto ar testējamo vielu zemākā koncentrācijā.
Skatīt arī I.5.2. punktu.
V.3.3. Pārskats
Skatīt I.8. punktu.
V.4. DATU LAPA
Turpmāk dots datu lapas paraugs.
MANOMETRISKĀS RESPIROMETRIJAS METODE
1. LABORATORIJA
2. TESTĒŠANAS SĀKUMA DATUMS
3. TESTĒJAMĀ VIELA
Nosaukums:
Rezerves šķīduma koncentrācija: mg/l
Sākuma koncentrācija barotnē, C0: mg/l
Testa kolbas tilpums (V): ml
TSP vai ĶSP: mg O2/mg testējamās vielas (NH4 vai NO3)
4. SĒJMATERIĀLS
Avots:
Attīrīšana:
Iepriekšēja kondicionēšana, ja veikta:
Suspendēto vielu koncentrācija reakcijas maisījumā: mg/1
5. SKĀBEKĻA PATĒRIŅŠ: BIOLOĢISKĀS NOĀRDĪŠANĀS SPĒJA
|
Laiks (dienas) |
|||||||||||||
|
0 |
7 |
14 |
21 |
28 |
|||||||||
|
Testējamās vielas O2 patēriņš (mg) |
1 |
||||||||||||
|
2 |
|||||||||||||
|
a, vidēji |
|||||||||||||
|
Tukšā parauga O2 patēriņš (mg) |
3 |
||||||||||||
|
4 |
|||||||||||||
|
b, vidēji |
|||||||||||||
|
Koriģētais BSP (mg) |
(a1- bm) |
||||||||||||
|
(a2- bm) |
|||||||||||||
|
BSP uz mg testējamās vielas |
|
||||||||||||
|
|
|||||||||||||
|
degradācija %
|
D1 (a1) |
||||||||||||
|
D2 (a2) |
|||||||||||||
|
Vidējā vērtība (1) |
|||||||||||||
|
(1) Pēc D1 un D2 nevar aprēķināt vidējo vērtību, ja tie ir ievērojami atšķirīgi. V = barotnes tilpums testa kolbā. |
|||||||||||||
N. B. Līdzīgus formātus var izmantot arī standartvielai un toksicitātes kontrolei.
6. NITRIFIKĀCIJAS KOREKCIJA (skatīt 5. papildinājumu)
|
Diena |
0 |
28 |
Starpība |
|
i) nitrātjonu koncentrācija (mg N/l) |
N |
||
|
ii) skābekļa ekvivalents (4,57 × N × V) (mg) |
— |
— |
|
|
iii) nitrītjonu koncentrācija (mg N/l) |
N |
||
|
iv) skābekļa ekvivalents (3,43 × N × V) (mg) |
— |
— |
|
|
ii)+ iv) kopīgais skābekļa ekvivalents |
— |
— |
7. OGLEKĻA ANALĪZE (nav obligāti)
Oglekļa analizators:
|
Laiks (dienas) |
Tukšais paraugs (mg/l) |
Testējamā viela (mg/l) |
|
0 |
(Cblo) |
(C0) |
|
28 (1) |
(Cbit) |
(Ct) |
|
(1) Vai inkubēšanas beigās. |
||

8. KONKRĒTĀ VIELA (fakultatīvi)
|
Sb |
= |
koncentrācija fizikāli ķīmiskajā (sterilajā) kontrolē pēc 28 dienām |
|
Sa |
= |
koncentrācija kolbā ar sējmateriālu pēc 28 dienām, |
![]()
9. ABIOTISKĀ DEGRADĀCIJA (fakultatīvi)
|
a |
= |
skābekļa patēriņš sterilajās kolbās pēc 28 dienām, (mg) |
![]()
(skatīt 1. un 3. iedaļu)
![]()
VI DAĻA. SLĒGTO PUDEĻU METODE (C.4.-E metode)
VI.1. METODES PRINCIPS
Testējamās vielas šķīdumu minerālbarotnē, parasti 2–5 mg/l, apsēj ar relatīvi nelielu jauktas populācijas sējmateriāla daudzumu un pilnīgi piepildītas noslēgtās pudeles iztur tumšā vietā pastāvīgā temperatūrā. Pēc degradācijas 28 dienu periodā veic izšķīdušā skābekļa analīzes. Testējamās ķīmiskās vielas patērēto skābekļa daudzumu, ko koriģē pēc paralēli noteiktā tukšā parauga šķīduma patērētā daudzuma, izsaka kā TSP vai ĶSP daļu procentos.
VI.2. METODES APRAKSTS
VI.2.1. Iekārta
a) BSP noteikšanas pudeles ar stikla aizbāžņiem, piemēram, 250–300 ml;
b) ūdens vanna vai termostats, kurā pudeles iztur tumsā nemainīgā temperatūrā (± 1 oC vai precīzāk);
c) liela tilpuma (2–5 l) stikla pudeles barotņu gatavošanai un BSP pudeļu pildīšanai;
d) skābekļa elektrods un oksimetrs vai iekārtas un reaģenti titrēšanai pēc Vinklera.
VI.2.2. Minerālbarotņu sagatavošana
Rezerves šķīdumu sagatavošanu skatīt I.6.2. punktā.
Sajauc pa 1 (vienam) mililitram a) līdz d) šķīduma un ar destilētu ūdeni atšķaida līdz 1 litram.
VI.2.3. Sējmateriāla sagatavošana
Sējmateriālu parasti iegūst no attīrītiem notekūdeņiem, kurus aizvada no attīrīšanas iekārtām vai laboratorijas iekārtām, kurās galvenokārt attīra sadzīves notekūdeņus. Vēl cits sējmateriāla avots ir virszemes ūdeņi. Parasti uz litru barotnes ņem no viena piliena (0,05 ml) līdz 5 ml filtrāta; var būt jāveic izmēģinājumi optimālā konkrēto attīrīto notekūdeņu tilpuma noteikšanai (skatīt I.6.4.2. un I.6.5. punktu).
VI.2.4. Kolbu sagatavošana
Minerālbarotni intensīvi aerē vismaz 20 min. Visai paraugu sērijai izmanto minerālbarotni no vienas ražošanas partijas. Parasti barotne ir lietošanai gatava pēc 20 h stāvēšanas noteikšanas temperatūrā. Kontroles nolūkā nosaka izšķīdušā skābekļa saturu; 20 oC temperatūrā tam jābūt apmēram 9 mg/l. Visas ar gaisu piesātinātās barotnes pārnešanas un uzpildīšanas operācijas veic tā, lai neveidotos burbuļi, piemēram, izmantojot sifonus.
Vienlaicīgai noteikšanai sagatavo paralēlas BSP pudeļu sērijas ar testējamo vielu un standartvielu. BSP pudelēm, ieskaitot sējmateriāla tukšo paraugu pudeles, jābūt pietiekamā daudzumā, lai ar vajadzīgajiem intervāliem, piemēram, pēc 0, 7, 14, 21 un 28 dienām, skābekļa patēriņu varētu mērīt vismaz divos atkārtojumos. Lai būtu iespējams noteikt 10 dienu intervālu, var būt vajadzīgs vēl lielāks skaits pudeļu.
Lielajās pudelēs apmēram līdz vienai trešdaļai to tilpuma pārnes ar gaisu pilnīgi piesātinātu minerālbarotni. Tad atsevišķās lielajās pudelēs vajadzīgajā daudzumā pievieno testējamās vielas un standartvielas rezerves šķīdumus, parasti tik daudz, lai vielu galīgā koncentrācija nepārsniegtu 10 mg/l. Lielajā pudelē, kurā ir barotne tukšā parauga kontrolei, nekādas ķīmiskās vielas nepievieno.
Lai nodrošinātu, ka netiek ierobežota sējmateriāla aktivitāte, izšķīdušā skābekļa koncentrācija BSP pudelēs drīkst pazemināties ne vairāk kā līdz 0,5 mg/l. Tāpēc testējamās vielas koncentrācija nedrīkst pārsniegt apmēram 2 mg/l. Tomēr grūti noārdāmas vielas un vielas ar zemu TSP vērtību var izmantot koncentrācijas no 5 līdz 10 mg/l. Dažkārt var būt ieteicams izveidot testējamās vielas paralēlas izmēģinājumu sērijas ar divām dažādām koncentrācijām, piemēram, 2 un 5 mg/l. Parasti aprēķina TSP vērtību, kāda ir, veidojoties amonija sāļiem, bet, ja var notikt nitrifikācija vai ir zināms, ka tā notiek, TSP aprēķina, ņemot vērā nitrātu veidošanos (TSPNO3: skatīt 2.2. papildinājumu). Taču, ja nitrifikācija nenotiek līdz galam vai nenotiek pavisam, veic korekciju pēc analītiski noteiktajām nitrītjonu un nitrātjonu koncentrāciju izmaiņām (skatīt 5. papildinājumu).
Ja jāpēta testējamās vielas toksiskā iedarbība (piemēram, gadījumos, kad sākotnēji tiek konstatēts, ka tās bioloģiskās noārdīšanās spēja ir zema), ir vajadzīgas citas pudeļu sērijas.
Citā lielajā kolbā sagatavo ar gaisu piesātinātu minerālbarotni (apmēram trešdaļu tās tilpuma), pievieno testējamo vielu un standartvielu galīgajās koncentrācijas, kas parasti ir tādas pašas kā pārējās lielajās pudelēs.
Šķīdumus lielajās pudelēs apsēj ar attīrītu notekūdeni (no viena piliena vai apmēram 0,05 ml līdz apmēram 5 ml uz litru) vai ar sējmateriālu no cita avota, piemēram, upes ūdeni (skatīt I.6.4.2. punktu). Tad šķīdumus atšķaida ar aerētu minerālbarotni un sajauc, izmantojot šļūteni, kas sniedzas līdz pudeles dibenam.
VI.2.5. Kolbu skaits parastā sērijā
Parastā sērijā izmanto šādas kolbas:
— vismaz 10 kolbas, kurās ir testējamā viela un sējmateriāls (testa suspensija),
— vismaz 10 pudeles, kurās ir tikai sējmateriāls (sējmateriāla tukšais paraugs),
— vismaz 10 kolbas, kurās ir standartviela un sējmateriāls (metodes kontrole),
— un vajadzības gadījumos sešas pudeles, kurās ir testējamā viela, standartviela un sējmateriāls (toksicitātes kontrole). Lai būtu iespējams noteikt 10 dienu intervālu, var būt vajadzīgs apmēram divreiz lielāks skaits pudeļu.
VI.2.6. Testa gaita
Sagatavotos šķīdumus nekavējoties iepilda attiecīgajās BSP pudeļu grupās caur šļūteni no lielās pudeles apakšējās ceturtdaļas (nevis no apakšas) tā, lai visas BSP pudeles tiktu pilnīgi piepildītas. Uzmanīgi noslēdz, izspiežot gaisa burbuļus. Sākuma – nulles laika – paraugos tūlīt nosaka izšķīdušo skābekli pēc Vinklera vai elektrodu metodes. Pudeļu saturu var iekonservēt, lai analīzes veiktu vēlāk pēc Vinklera metodes, pievienojot mangāna(II) sulfātu un nātrija hidroksīdu (Vinklera pirmo reaģentu). Pirms veikt nākamos analīzes posmus pēc Vinklera metodes, glabā cieši noslēgtās pudelēs, kas satur brūna mangāna(III) hidroksīda veidā fiksētu skābekli, tumšā vietā 10–20 oC temperatūrā ne ilgāk kā 24 stundas. Pārējās atkārtojumu pudeles noslēdz tā, lai tajās nebūtu gaisa burbuļu, un inkubē 20 oC temperatūrā tumsā. Visām sērijām jābūt paralēlām sērijām sējmateriāla tukšā parauga noteikšanai. Izšķīdušā skābekļa analīzēm ar noteiktiem intervāliem (ne retāk kā reizi nedēļā) 28 dienu inkubēšanas perioda laikā ņem pudeles vismaz divos atkārtojumos.
Iknedēļas paraugi dod iespējas noteikt izdalīšanās procentu 14 dienu intervālā, bet paraugu ņemšana ik pēc 3–4 dienām nodrošina iespējas noteikt 10 dienu intervālu, kam var būt vajadzīgs apmēram divreiz vairāk pudeļu.
Testējamajām vielām, kas satur slāpekli, jāveic nitrifikācijai patērētā skābekļa korekcija. Šim nolūkam izšķīdušā skābekļa koncentrāciju nosaka pēc skābekļa elektroda metodes un pēc tam no BSP pudeles ņem paraugu nitrītjonu un nitrātjonu satura noteikšanai. Pēc nitrītu un nitrātu koncentrācijas izmaiņām aprēķina nitrifikācijai patērētā skābekļa daudzumu (skatīt 5. papildinājumu).
VI.3. DATI UN PĀRSKATS
VI.3.1. Rezultātu apstrāde
Vispirms aprēķina BSP katra perioda beigās, atņemot skābekļa patēriņu (mg O2/l) sējmateriāla tukšajā paraugā no testējamās vielas skābekļa patēriņa. Īpatnējo BSP miligramos skābekļa uz miligramu testējamās vielas aprēķina, šo koriģēto samazinājumu dalot ar testējamās vielas koncentrāciju (mg/l). Aprēķina biodegradācijas procentu, īpatnējo BSP ar īpatnējo TSP (kuru aprēķina saskaņā ar 2.2. papildinājumu) vai ar ĶSP (ko nosaka analītiski, skatīt 2.3. papildinājumu) šādi:

= mg O2 uz mg testējamās vielas

vai

Jāpiezīmē, ka pēc šīm abām metodēm iegūto rezultātu skaitliskās vērtības ne vienmēr ir vienādas; ieteicams izmantot šo otru metodi.
Testējamajām vielām, kuras satur slāpekli, atkarībā no tā, kas ir sagaidāms vai zināms par nitrifikāciju, izmanto attiecīgo TSP (NH4 vai NO3) vērtību (2.2. papildinājums). Ja nitrifikācija notiek, taču ne pilnīgi, pēc nitrītjonu un nitrātjonu koncentrāciju izmaiņām aprēķina korekciju skābeklim, kas patērēts nitrifikācijai (5. papildinājums).
VI.3.2. Rezultātu derīgums
Skābekļa satura samazinājums pēc 28 dienām sējmateriāla tukšajā paraugā nedrīkst pārsniegt 1,5 mg izšķīdušā skābekļa/l. Ja iegūst par minēto augstākas vērtības, jāpārbauda eksperimenta metodes. Atlikusī skābekļa koncentrācija testa pudelēs nedrīkst būt mazāka par 0,5 mg/l. Tik zemas skābekļa koncentrācijas uzskatāmas par ticamām tikai tad, ja ar izmantoto izšķīdušā skābekļa satura noteikšanas metodi tās iespējams izmērīt precīzi.
Skatīt arī I.5.2. punktu.
VI.3.3. Pārskats
Skatīt I.8. punktu.
VI.4. DATU LAPA
Turpmāk dots datu lapas paraugs.
SLĒGTO PUDEĻU METODE
1. LABORATORIJA
2. TESTĒŠANAS SĀKUMA DATUMS
3. TESTĒJAMĀ VIELA
Nosaukums:
Rezerves šķīduma koncentrācija: mg/l
Sākuma koncentrācija pudelē: mg/l
TSP vai ĶSP: mg O2/mg testējamās vielas
4. SĒJMATERIĀLS
Avots:
Attīrīšana:
Iepriekšēja kondicionēšana, ja veikta:
Reakcijas maisījuma koncentrācija: mg/l
5. IZŠĶĪDUŠĀ SKĀBEKĻA SATURA NOTEIKŠANA
Metode: Vinklera/elektroda
Kolbu analīzes
|
Inkubēšanas laiks (dienas) |
Izšķīdušais skābeklis (mg/l) |
|||||
|
0 |
n1 |
n2 |
||||
|
Tukšais paraugs (bez vielas) |
1 |
C1 |
||||
|
2 |
C2 |
|||||
|
Vidējais |
|
|||||
|
Testējamā viela |
1 |
a1 |
||||
|
2 |
a2 |
|||||
|
Vidējais |
|
|||||
Piezīme: līdzīgus formātus var izmantot arī standartvielai un toksicitātes kontrolei.
6. NITRIFIKĀCIJAS KOREKCIJA (skatīt 5. papildinājumu)
|
Inkubēšanas laiks (dienas) |
0 |
n1 |
n2 |
n3 |
|
i) nitrātjonu koncentrācija (mg N/l) |
||||
|
ii) nitrātjonu koncentrācija (mg N/l) |
— |
|||
|
iii) skābekļa ekvivalents (mg/l) |
— |
|||
|
iv) nitrītjonu koncentrācija (mg N/l) |
||||
|
v) nitrītjonu koncentrācijas izmaiņas (mg N/l) |
— |
|||
|
vi) skābekļa ekvivalents (mg/l) |
— |
|||
|
iii)+ vi) kopējais skābekļa ekvivalents (mg/l) |
— |
7. IZŠĶĪDUŠĀ SKĀBEKĻA SATURA SAMAZINĀŠANĀS: DEGRADĀCIJA %
|
Samazinājums pēc n dienām (mg/1) |
||||
|
n1 |
n2 |
n3 |
||
|
1. KOLBA: (mto – mtx) – (mbo – mbx) |
||||
|
2. KOLBA: (mto – mtx) – (mbo – mbx) |
||||
|
1. KOLBA:
|
||||
|
2. KOLBA:
|
||||
|
% D vid. (1) =
|
||||
|
(1) Vidējo vērtību neaprēķina, ja atkārtojumos iegūtie rezultāti ir ievērojami atšķirīgi. |
||||
|
mto |
= |
vērtība testa kolbā laikā 0 |
|
mtx |
= |
vērtība testa kolbā laikā x |
|
mbo |
= |
tukšā parauga vērtība laikā 0 |
|
mbx |
= |
tukšā parauga vērtība laikā x |
Aprēķina arī nitrifikācijas korekciju iii + vi no 6. iedaļas.
8. TUKŠĀ PARAUGA IZŠĶĪDUŠĀ SKĀBEKĻA SATURA SAMAZINĀŠANĀS
Tukšā parauga skābekļa patēriņš: (mbo – mb28) mg/l. Pēc šā patēriņa nosaka testēšanas rezultātu derīgumu. Tam jābūt mazākam par 1,5 mg/l.
VII DAĻA. MITI METODE (C.4.-F metode)
VII.1. METODES PRINCIPS
Automātiski 28 dienas aptumšotā noslēgtā respirometrā 25 ± 1 oC temperatūrā maisot mēra skābekļa patēriņu testējamās vielas šķīdumā vai suspensijā minerālbarotnē, kas apsēta ar īpaši izaudzētiem neadaptētiem mikroorganismiem. Izdalījušos oglekļa dioksīdu absorbē ar nātronkaļķiem. Biodegradāciju izsaka skābekļa patēriņa procentos (ar tukšā parauga korekciju) no teorētiskā skābekļa patēriņa (TSP). Primārās biodegradācijas pakāpi var aprēķināt arī pēc inkubācijas sākumā un beigās veikto papildu specifisko analīžu rezultātiem vai pēc IOO analīzes rezultātiem.
VII.2. TESTA METODES APRAKSTS
VII.2.1. Aprīkojums
a) Automātiskā elektrolītiskā BSP mērīšanas ierīce vai respirometrs, kas parasti aprīkots ar sešām pudelēm, kuru tilpums ir 300 ml, ar vāciņu CO2 absorbentam;
b) termostatējama kamera un/vai ūdens vanna ar 25 ± 1 oC vai precīzāk;
c) membrānfiltrēšanas ierīce (fakultatīvi);
d) oglekļa analizators (nav obligāti).
VII.2.2. Minerālbarotņu sagatavošana
No analītiski tīriem reaģentiem pagatavo šādus rezerves šķīdumus (I.6.1. punkts):
|
a) |
monokālija dihidrogenortofosfāts, KH2PO4 |
8,50 g |
|
dikālija monohidrogenortofosfāts, K2HPO4 |
21,75 g |
|
|
dinātrija monohidrogenortofosfāta dodekahidrāts Na2HPO4 12 H2O |
44,60 g |
|
|
amonija hlorīds, NH4Cl |
1,70 g |
|
|
Izšķīdina ūdenī un atšķaida līdz 1 litram. |
||
|
Šķīduma pH jābūt 7,2. |
||
|
b) |
magnija sulfāta heptahidrāts, MgSO4 7 H2O |
22,50 g |
|
Izšķīdina ūdenī un atšķaida līdz 1 litram |
||
|
c) |
kalcija hlorīds, bezūdens, CaCl2 |
27,50 g |
|
Izšķīdina ūdenī un atšķaida līdz 1 litram |
||
|
d) |
dzelzs(III) hlorīda heksahidrāts, FeCl3 6 H2O |
0,25 g |
|
Izšķīdina ūdenī un atšķaida līdz 1 litram. |
Ņem pa 3 ml no šķīdumiem a), b), c) un d) un atšķaida līdz 1 litram.
VII.2.3. Sējmateriāla sagatavošana
Ņem svaigus paraugus no vismaz desmit vietām, galvenokārt teritorijās, kur lietotas un izplūdušas dažādas ķīmiskās vielas. No tādām vietām kā notekūdeņu attīrīšanas iekārtas, ražošanas notekūdeņu attīrīšanas iekārtas, upes, ezeri, jūras, ņem 1 l dūņu, augsnes virskārtas, ūdens u. c. un rūpīgi sajauc. Pēc peldošo daļiņu atdalīšanas un nostādināšanas ar nātrija hidroksīdu vai fosforskābi noregulē dzidrā šķīduma pH līdz 7 ± 1.
Ar dzidro šķīdumu pilnīgi piepilda aktīvo dūņu trauku un šķidrumu aerē apmēram 23 1/2/h. 30 minūtes pēc aerācijas pārtraukšanas izlej apmēram trešdaļu no visa dzidrā šķīduma daudzuma un nostādinātajam materiālam pievieno tikpat daudz šķīduma (pH 7), kas satur pa 0,1 % glikozes, peptona un monokālija ortofosfāta, un atsāk aerāciju. Šo procedūru atkārto vienreiz dienā. Aktīvo dūņu iekārtas jāekspluatē saskaņā ar labu praksi: attīrītajiem notekūdeņiem jābūt dzidriem, to temperatūrai 25 ± 2 oC, vides reakcijai pH 7 ± 1, dūņām viegli jānogulsnējas, ar pietiekamu aerāciju maisījumam pastāvīgi jānodrošina aerobi apstākļi, tajās jābūt vienšūņiem, un dūņu aktivitāte vismaz reizi trijos mēnešos jāpārbauda ar standartvielu. Par sējmateriālu neizmanto dūņas, ja iekārta darbojas mazāk nekā mēnesi vai ilgāk par četriem mēnešiem. Pēc tam ar regulāriem intervāliem reizi trijos mēnešos ņem paraugus no vismaz desmit vietām.
Lai uzturētu svaigo un veco dūņu aktivitāti vienā līmenī, sajauc vienādus tilpumus filtrētā dzidrā šķīduma no lietošanā esošajām aktīvajām dūņām un filtrētā dzidrā šķīduma no desmit vietām paņemtā maisījuma un maisījumu kultivē, kā noteikts iepriekš. Dūņas lietošanai par sējmateriālu ņem 18–24 h pēc iekārtas palaišanas.
VII.2.4. Kolbu sagatavošana
Sagatavo šādas sešas kolbas:
Nr. 1: testējamā viela ūdens šķīdumā koncentrācijā 100 mg/l,
Nr. 2, 3 un 4: testējamā viela minerālbarotnē koncentrācijā 100 mg/l,
Nr. 5: standartviela (piemēram, anilīns) minerālbarotnē koncentrācijā 100 mg/l,
Nr. 6: tikai minerālbarotne.
Mazšķīstošas testējamās vielas pievieno tieši pēc masas vai tilpuma vai ar tām rīkojas, kā aprakstīts 3. papildinājumā, tomēr nedrīkst lietot ne šķīdinātājus, ne emulgatorus. Visām kolbām speciālajos aizbāžņos ievieto CO2 absorbentu. Kolbās Nr. 2, 3 un 4 noregulē pH līdz 7,0.
VII.2.5. Testa gaita
Apsēj kolbas Nr. 2, 3, un 4 (testējamās suspensijas), Nr. 5 (aktivitātes kontrole) un Nr. 6 (sējmateriāla tukšais paraugs) ar nelielu daudzumu sējmateriāla, lai iegūtu koncentrāciju 30 mg/l suspendēto vielu. Sējmateriālu nepievieno kolbā Nr. 1, ko izmanto par abiotisko kontroli. Iekārtu samontē, pārbauda aparāta hermētiskumu, iedarbina maisītāju un sāk skābekļa patēriņa mērījumus tumsas apstākļos. Katru dienu pārbauda temperatūru, maisītāja un skābekļa patēriņa kulonometriskās reģistrēšanas ierīces darbību un novēro kolbu satura krāsas izmaiņas. Nolasa skābekļa patēriņu sešās kolbās, izmantojot piemērotu tiešo mērījumu metodi, piemēram, no sešpunktu pašrakstītāja diagrammas, kas zīmē BSP patēriņa līkni. Inkubēšanas beigās, parasti pēc 28 dienām, mēra kolbu satura pH un nosaka testējamās vielas atlikuma un no tiem veidojušos starpproduktu koncentrāciju, IOO koncentrāciju (2.4. papildinājums). Īpaši uzmanīgi strādā ar gaistošām vielām. Ja sagaidāms, ka notiks nitrifikācijas process, ja iespējams, nosaka nitrātjonu un nitrītjonu koncentrāciju.
VII.3. DATI UN PĀRSKATS
VII.3.1. Rezultātu apstrāde
Testējamās vielas skābekļa patēriņu (mg) pēc noteikta laika, kas koriģēts pēc sējmateriāla tukšā parauga patēriņa tajā pašā laikā, dala ar izmantotās testējamās vielas daudzumu. Tādējādi aprēķina BSP, kas izteikts mg skābekļa/mg testējamās vielas, t. i.:

= mg O2 uz mg testējamās vielas
Biodegradāciju procentos aprēķina šādi:
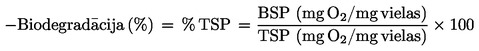
Maisījumiem TSP aprēķina pēc elementanalīzes rezultātiem tāpat kā individuālām vielām. Izmanto attiecīgo TSP (TSPNH4 vai TSPNO3) atkarībā no tā, vai nitrifikācija nenotiek vai norit līdz galam (2.2. papildinājums). Ja nitrifikācija notiek, taču ne pilnīgi, pēc nitrītjonu un nitrātjonu koncentrāciju izmaiņām aprēķina korekciju skābeklim, kas patērēts nitrifikācijai (5. papildinājums).
Primāro degradāciju procentos aprēķina pēc konkrētās (sākotnējās) vielas zudumiem (skatīt I.7.2. punktu).
![]()
Ja testējamās vielas zudumi konstatēti kolbā Nr. 1, kurā mēra fizikāli ķīmisko izdalīšanos, to reģistrē un testējamās vielas koncentrāciju (Sb) šajā kolbā pēc 28 dienām izmanto biodegradācijas procentu aprēķināšanai.
Ja veic IOO noteikšanu (fakultatīvi), aprēķina kopējo biodegradāciju no:
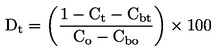
kā aprakstīts I.7.1. punktā. Ja kolbā Nr. 1 ir samazinājies IOO, mērot fizikāli ķīmisko izdalīšanos, biodegradācijas procenta aprēķināšanai izmanto IOO koncentrāciju šajā kolbā.
Visus rezultātus reģistrē pievienotajās datu lapās.
VII.3.2. Rezultātu derīgums
Sējmateriāla tukšā parauga skābekļa patēriņš parasti ir 20–30 mg O2/l, un 28 dienās tas nedrīkst pārsniegt 60 mg/l. Ja tā vērtības pārsniedz 60 mg/l, kritiski jāizvērtē eksperimentālie dati un to iegūšanas metodes. Ja pH vērtība nav robežās no 6 līdz 8,5 un testējamās vielas skābekļa patēriņš nepārsniedz 60 %, noteikšana jāatkārto ar testējamo vielu zemākā koncentrācijā.
Skatīt arī I.5.2. punktu.
Ja anilīna degradācijas procents, kas aprēķināts pēc skābekļa patēriņa, pēc septiņām dienām nepārsniedz 40 %, bet pēc 14 dienām 65 %, iegūtie rezultāti uzskatāmi par nederīgiem.
VII.3.3. Pārskats
Skatīt I.8. punktu.
VII.4. DATU LAPA
Turpmāk dots datu lapas paraugs.
MITI (I) METODE
1. LABORATORIJA
2. TESTĒŠANAS SĀKUMA DATUMS
3. TESTĒJAMĀ VIELA
Nosaukums:
Rezerves šķīduma koncentrācija: mg/l vielas veidā
Sākuma koncentrācija barotnē, C0: mg/l vielas veidā
Reakcijas maisījums, V: ml
TSP: mg O2/1
4. SĒJMATERIĀLS
Dūņu paraugu ņemšanas vietas:
|
1) … |
6) … |
|
2) … |
7) … |
|
3) … |
8) … |
|
4) … |
9) … |
|
5) … |
10) … |
Suspendēto vielu koncentrācija aktīvajās dūņās pēc aklimatizācijas sintētiskajā notekūdenī = … mg/1
Aktīvo dūņu tilpums uz litru gatavas barotnes = … ml
Dūņu koncentrācija gatavajā barotnē = …mg/1
5. SKĀBEKĻA PATĒRIŅŠ: BIOLOĢISKĀS NOĀRDĪŠANĀS SPĒJA
Izmantotā respirometra veids:
|
Laiks (dienas) |
|||||||
|
0 |
7 |
14 |
21 |
28 |
|||
|
Testējamās vielas O2 patēriņš (mg) |
al |
||||||
|
a2 |
|||||||
|
a3 |
|||||||
|
Tukšā parauga O2 patēriņš (mg) |
b |
||||||
|
Koriģētais O2 patēriņš (mg) |
(a1 – b) (a2 – b) (a3 – b) |
||||||
|
BSP uz mg testējamās vielas |
|
1. kolba |
|||||
|
2. kolba |
|||||||
|
3. kolba |
|||||||
|
degradācija %
|
1 |
||||||
|
2 |
|||||||
|
3 |
|||||||
|
vidējā vērtība (1) |
|||||||
|
(1) Vidējo vērtību neaprēķina, ja atkārtojumos iegūtie rezultāti ir ievērojami atšķirīgi. |
|||||||
N. B.! Līdzīgas formas tabulu var izmantot standartvielai.
6. OGLEKĻA ANALĪZE (fakultatīvi)
Oglekļa analizators:
|
Flakons/kolba |
IOO |
Izdalītais IOO % |
Vidējais |
|||
|
mērītā vērtība |
koriģētā vērtība |
|||||
|
Ūdens + testējamā viela |
a |
— |
— |
|||
|
Dūņas + testējamā viela |
b1 |
b1 – c |
||||
|
Dūņas + testējamā viela |
b2 |
b2 – c |
||||
|
Dūņas + testējamā viela |
b3 |
b3 – c |
||||
|
Tukšā parauga kontrole |
c |
— |
— |
— |
||
![]()
7. ĪPAŠU ĶĪMISKO ANALĪŽU DATI
|
Testējamās vielas atlikušais daudzums testēšanas beigās (mg/l) |
degradācija % |
|
|
Tukšais paraugs ar ūdeni |
Sb |
|
|
Barotne ar sējmateriālu |
Sa1 |
|
|
Sa2 |
||
|
S a3 |
![]()
Attiecīgi kolbām a1, a2 un a3 aprēķina degradācijas %.
8. PIEZĪMES
Ja iespējams, jāpievieno BSP izmaiņu līkne laikā.
I PAPILDINĀJUMS
SAĪSINĀJUMI UN DEFINĪCIJAS
|
DO |
: |
izšķīdušais skābeklis ir ūdens paraugā izšķīdušā skābekļa koncentrācija (mg/l). |
|
BSP (BOD) |
: |
bioķīmiskais skābekļa patēriņš ir skābekļa daudzums (g), ko mikroorganismi patērē testējamā savienojuma metabolizēšanai; izsaka arī kā skābekļa uzņemšanu uz 1 g testējamā savienojuma. (Skatīt C.5. metodi.) |
|
ĶSP (COD) |
: |
ķīmiskais skābekļa patēriņš ir testējamā savienojuma oksidēšanai ar kālija dihromātu vidē patērētais skābekļa daudzums (g); tas ir oksidējamas vielas daudzuma mērs; izsaka arī kā skābekļa patēriņu uz 1g testējamā savienojuma. (Skatīt C.6. metodi.) |
|
IOO (DOC) |
: |
izšķīdušais organiskais ogleklis ir organisko savienojumu veidā saistītā oglekļa saturs ūdens šķīdumā vai iziet cauru 0,45 mikrometru filtram vai paliek centrifugātā pēc centrifugēšanas 15 min 40 000 m.s-2 (± 4 000 g). |
|
TSP (ThOD) |
: |
teorētiskais skābekļa patēriņš ir kopējais skābekļa patēriņš (mg), kas vajadzīgs ķīmiskās vielas pilnīgai oksidēšanai; to aprēķina pēc ķīmiskās formulas (skatīt 2.2. papildinājumu) un to arī izsaka mg skābekļa, ko patērē uz miligramu testējamā savienojuma. |
|
TCO2 |
: |
teorētiskais oglekļa dioksīds ir aprēķinātais oglekļa dioksīda daudzums (mg), kuram jāveidojas no zināma vai izmērīta oglekļa daudzuma, kas ir testējamā savienojuma sastāvā, to pilnīgi mineralizējot; izsaka arī miligramos oglekļa dioksīda, kas izdalās uz miligramu testējamā savienojuma. |
|
TOC |
: |
kopējais organiskais ogleklis ir summārais oglekļa saturs paraugā, kas ir šķīdumā un suspensijā esošā organiskā oglekļa summa. |
|
IC |
: |
neorganiskais ogleklis. |
|
TC |
: |
kopējais ogleklis ir organisko un neorganisko savienojumu veidā saistītais ogleklis, kuru satur paraugs. |
Primārā biodegradācija:
ir vielas ķīmiskās struktūras izmaiņas, bioloģiskas iedarbības rezultātā tai zaudējot specifiskās īpašības.
Pilnīga biodegradācija (aerobos apstākļos):
ir degradācijas līmenis, kādā testējamo savienojumu pilnībā izmanto mikroorganismi, izdalot oglekļa dioksīdu, ūdeni, minerālsāļus un jaunas mikroorganismu šūnu sastāvdaļas (biomasu).
Viegli bioloģiski noārdāmi:
noteiktas drošības pārbaudes uz pilnīgu biodegradāciju izgājušu ķīmisko vielu pieņemta klasifikācija; šīs pārbaudes ir tik stingras, ka var pieņemt, ka aerobos apstākļos ūdens vidē šie savienojumi noārdīsies ātri un pilnīgi.
Būtībā bioloģiski noārdāmi:
tādu ķīmisko vielu klasifikācija, par kurām ar atzītām bioloģiskās noārdīšanās spējas noteikšanas metodēm ir iegūtas neapšaubāmas liecības par to (primāru vai pilnīgu) biodegradāciju.
Attīrāmība:
iespējas savienojumus atdalīt notekūdeņu bioloģiskās attīrīšanas procesā, nelabvēlīgi neietekmējot attīrīšanas procesu darbību. Parasti attīrāmi ir viegli bioloģiski noārdāmi savienojumi, taču ne vienmēr attīrāmi ir visi būtībā bioloģiski noārdāmie savienojumi. Var izmantot arī abiotiskus procesus.
Kavējuma laiks:
ir laiks no inokulācijas atkrāsošanas testā līdz vismaz 10 % degradācijai. Kavējuma laiks parasti ir ļoti mainīgs rādītājs, kuram ir slikta reproducējamība.
Degradācijas laiks:
ir periods no kavējuma laika beigām līdz laikam, kamēr tiek sasniegti 90 % no maksimālā degradācijas līmeņa.
10 dienu intervāls:
10 dienas tieši pēc 10 % degradācijas sasniegšanas.
II PAPILDINĀJUMS
PIEMĒROTU SUMMĀRO PARAMETRU NOTEIKŠANA UN APRĒĶINĀŠANA
Atkarībā no izraudzītās metodes var būt vajadzīgi kādi summārie parametri. Turpmāk aprakstīta šo vērtību noteikšanas kārtība. Šo parametru izmantošana noteikta attiecīgo metožu aprakstos.
1. Oglekļa saturs
Testējamās vielas oglekļa saturu aprēķina pēc tās elementu sastāva vai nosaka ar elementanalīzi.
2. Teorētiskais skābekļa patēriņš (TSP)
Teorētisko skābekļa patēriņu (TSP) var aprēķināt, ja ir zināms elementu sastāvs vai tas noteikts ar elementanalīzi. Savienojumam
CcHhClclNnNanaOoPpSs
bez nitrifikācijas,
![]()
mg/mg
vai ar nitrifikāciju
![]()
mg/mg
3. Ķīmiskais skābekļa patēriņš (ĶSP)
Ķīmisko skābekļa patēriņu nosaka pēc C.6. metodes.
4. Izšķīdušais organiskais ogleklis (IOO)
Pēc definīcijas izšķīdušais organiskais ogleklis ir ķīmiskās vielas vai vielu maisījuma ūdenī esošais organiskais ogleklis, kas iziet caur filtru ar poru izmēru 0,45 mikrometri.
Paraugus no testēšanas traukiem izlej un nekavējoties filtrē filtrācijas aparātā, izmantojot piemērotu membrānas filtru. Filtrāta pirmos 20 ml (daudzumu var samazināt, izmantojot mazus filtrus) izlej. Oglekļa analīzei saglabā 10–20 ml tilpuma vai mazāk, ja injicē (tilpums atkarīgs no oglekļa analizatoram vajadzīgā daudzuma). IOO koncentrāciju nosaka ar organiskā oglekļa satura analizatoru, ar kuru iespējams noteikt oglekļa koncentrāciju, kas ir vienāds vai mazāks par 10 % no sākotnējās noteikšanai izmantotās IOO koncentrācijas.
Nofiltrētos paraugus, kurus nav iespējams izanalizēt tajā pašā darba dienā, var 48 stundas uzglabāt 2–4 °C temperatūrā vai –18 °C temperatūrā ilgāku laiku.
Piezīmes
Membrānfiltru hidrofilizēšanai tos parasti piesūcina ar virsmaktīvām vielām. Tāpēc filtrs var saturēt vairākus miligramus šķīstoša organiska oglekļa, kas var traucēt bioloģiskās noārdīšanas spējas noteikšanai. Virsmaktīvās vielas un citus šķīstošus organiskos savienojumus no filtriem izdala, tos trīs reizes pa vienai stundai vārot dejonizētā ūdenī. Pēc tam filtrus vienu nedēļu var glabāt ūdenī. Ja izmanto vienreizlietojamās filtrpatronas, katra to partija ir jāpārbauda, lai pārliecinātos, vai no tiem neizdalās šķīstošais organiskais ogleklis.
Atkarībā no membrānfiltra veida pārbaudāmā viela uz tās var tikt saistīta absorbcijas rezultātā. Tāpēc var būt vēlams nodrošināt, lai testējamā viela netiktu adsorbēta uz filtra.
Filtrācijas vietā IOO atdalīšanai no TOC var izmantot 15 minūtes ilgu centrifugēšanu 40 000 m.sec-2 (4 000 g). Metode nav droša, ja sākuma koncentrācija ir < 10 mg IOO/l, jo netiek atdalītas visas baktērijas vai arī atkārtoti izšķīst ogleklis, ko satur baktēriju plazma.
BIBLIOGRĀFIJA
— Standard Methods for the Examination of Water and Wastewater, 12th ed, Am. Pub. Hlth. Ass., Am. Wat. Poll. Control Fed., Oxygen Demand, 1965, p. 65.
— Wagner, R., Von Wasser, 1976, Vol. 46, p. 139.
— DIN-Entwurf 38 409 Teil 41 Deutsche Einheitsverfahren zur Wasser-, Abwasser- und Schlammuntersuchung, Summarische Wirkungs- und Stoffkenngrößen (Gruppe H). Bestimmung des Chemischen Sauerstoffbedarfs (CSB) (H 41), Normenausschuß Wasserwesen (NAW) in DIN Deutsches Institut für Normung e. V.
— Gerike, P., The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, Vol. 13 (1), p. 169.
III PAPILDINĀJUMS
SLIKTI ŠĶĪSTOŠU VIELU BIOLOĢISKĀS NOĀRDĪŠANAS SPĒJAS NOTEIKŠANA
Nosakot bioloģiskās noārdīšanas spēju grūti šķīstošām vielām, īpaša vērība jāveltī šādiem aspektiem.
Viendabīgi parasti nerada ar paraugu ņemšanu saistītas problēmas, taču, lai izvairītos no noteikšanas kļūdām, kas saistītas ar paraugu neviendabīgumu, cietvielas ir ieteicams homogenizēt ar attiecīgi piemērotām metodēm. Īpaši uzmanība tam jāveltī, ja vajadzīgi tikai dažus miligramus lieli paraugi no vielām vai vielu maisījumiem ar augstu piemaisījumu saturu.
Noteikšanas laikā var izmantot dažādu veidu maisīšanu. Jāmaisa tikai tik daudz, lai viela būtu disperģētā stāvoklī, taču tā nekarstu, pārlieku neputotos un uz to neiedarbotos pārāk lieli bīdes spēki.
Vielas stabilas dispersijas veidošanai var izmantot emulgatoru. Testēšanas apstākļos tas nedrīkst būt baktērijām toksisks, bioloģiski degradēties vai veicināt putu veidošanos.
Uz šķīdinātājiem attiecas tādi paši kritēriji kā uz emulgatoriem.
Pārbaudāmām cietvielām nav ieteicams izmantot cietus nesējus, lai gan šādi nesēji var būt piemēroti eļļainām vielām.
Gadījumos, kad izmanto tādas palīgvielas kā emulgatori, šķīdinātāji vai nesēji, jāveic attiecīgo palīgvielu saturoša tukšā parauga analīze.
Slikti šķīstošu vielu bioloģiskās degradācijas noteikšanai var izmantot CO2, BSP, MITI respirometriskās metodes.
BIBLIOGRĀFIJA
— de Morsier, A. et al., Biodegradation tests for poorly soluble compounds. Chemosphere, 1987, Vol. 16, 833.
— Gerike, P., The Biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, Vol. 13, 169.
IV PAPILDINĀJUMS
BIOLOĢISKĀS NOĀRDĪŠANĀS SPĒJAS NOVĒRTĒŠANA ĶĪMISKAJĀM VIELĀM, KURAS VARĒTU BŪT SĒJMATERIĀLAM TOKSISKAS
Ja, nosakot, vai ķīmiskā viela ir bioloģiski viegli noārdāma, izrādās, ka tā nav bioloģiski degradējama, ieteicams izmantot šādu procedūru, ja jāizšķir, vai tā nenoārdās vai arī kavē aļģu augšanu (Reynolds et al., 1987).
Jāizmanto līdzīgs vai tāds pats sējmateriāls, kā nosakot toksiskumu vai bioloģiskās noārdīšanas spēju.
Lai novērtētu ķīmisko vielu toksiskumu, kurām jau veikta bioloģiskās noārdīšanas spējas noteikšana, var būt jāizmanto dūņu respirācijas ātruma (aktīvo dūņu respirācijas inhibēšanas – Direktīva 88/302/EEK), BSP un/vai augšanas kavēšanas noteikšanas metodes vai to kombinācija.
Ja jānovērš ar toksiskumu saistītā augšanas kavēšana, testējamās vielas pārbaudāmās koncentrācijas, kuras izmanto bioloģiskās degradācijas spējas noteikšanai, nedrīkstētu būt lielākas par 1/10 no EC50 vērtības (mazākas par EC20 vērtībām), kuras noteiktas, novērtējot attiecīgās vielas toksicitāti. Savienojumiem, kuru EC50 vērtība pārsniedz 300 mg/l, vieglas bioloģiskās noārdīšanās spējas izmēģinājumos parasti toksisku iedarbību nenovēro.
Ja EC50 vērtības mazākas par 20 mg/l, tās turpmākajos izmēģinājumos var radīt nopietnas problēmas. Izmēģinājumiem izmanto vielas zemās koncentrācijas, kuras nosaka nepieciešamību precīzo un jutīgo noslēgto pudeļu testu vai ar 14C iezīmētu materiālu. Var lietot arī aklimatizēti sējmateriālu, kas var paciest augstāku testējamās vielas koncentrāciju iedarbību. Šādā gadījumā tomēr tiek zaudēts vieglas bioloģiskās noārdīšanas spējas kritērijs.
BIBLIOGRĀFIJA
Reynolds, L. et al., Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 1987, Vol. 16, 2259.
V PAPILDINĀJUMS
AR NITRIFIKĀCIJAS RADĪTAJIEM TRAUCĒJUMIEM SAISTĪTĀ SKĀBEKĻA PATĒRIŅA KOREKCIJA
Novērtējot skābekļa uzņemšanu, nosakot pārbaudāmās vielas bioloģiskās degradācijas spēju, bet neņemot vērā nitrifikāciju, vielām, kuras nesatur slāpekli, ar to saistītās kļūdas ir nelielas (līdz 5 %) arī tad, ja amonija slāpekļa oksidēšana vidē notiek kļūdas dēļ, sajaucot testa un tukšā mēģinājuma traukus. Tomēr testējamajām vielām, kuras satur slāpekli, var rasties nopietnas kļūdas.
Ja nitrifikācija ir notikusi, bet šis process nav beidzies, reakcijas maisījumā novēroto skābekļa uzņemšanu var koriģēt par skābekļa daudzumu, kas patērēts amonija jonu oksidēšanai līdz nitrītam un nitrātam gadījumos, kad inkubācijas laikā noteiktas nitrīta un nitrāta koncentrācijas izmaiņās pēc šādiem vienādojumiem:
|
2 NH4Cl + 3O2 = 2 HN O2 + 2 HCI + 2 H2O |
(1) |
|
2 HNO2 + O2 = 2 HNO3 |
(2) |
|
Summārais vienādojums: |
|
|
2 NH4Cl + 4 O2 = 2 HNO3 + 2 HCl + 2 H2O |
(3) |
Pēc vienādojuma (1) 28 g slāpekļa amonija hlorīda (NH4C1) veidā, oksidējoties par nitrātu, saista 96 g skābekļa, t. i., koeficients ir 3,43 (96/28). Tādā pašā veidā pēc vienādojuma (3) 28 g slāpekļa, oksidējoties par nitrātu, saista 128 g skābekļa, t. i., koeficients ir 4,57 (128/28).
Tā kā šīs reakcijas ir secīgas un notiek ar noteiktām un dažādām baktēriju sugām, nitrītu koncentrācijai ir iespējas gan paaugstināties, gan pazemināties; pēdējā gadījumā būtu jāveidojas ekvivalentai nitrātu koncentrācijai. Tādējādi skābeklis, kas patērēts nitrātu veidošanai, ir nitrātu koncentrācijas palielinājuma reizinājums ar 4,57, bet ar nitrītu veidošanos saistāmā slāpekļa patēriņš ir 3,43, reizināts ar nitrītu koncentrācijas pieaugumu vai, tā koncentrācijai samazinoties, skābekļa zudumi ir – 3,43, reizināts ar koncentrācijas samazinājumu.
Tas ir:
|
O2, kas patērēts nitrātu veidošanai = 4,57 × nitrātu koncentrācijas pieaugums |
(4) |
|
un |
|
|
O2, kas patērēts nitrītu veidošanai = 3,43 × nitrītu koncentrācijas pieaugums |
(5) |
|
un |
|
|
O2, kas zaudēts, nitrītiem samazinoties = - 3,43 × nitrītu koncentrācijas samazinājums |
(6) |
|
Tātad |
|
|
O2 patēriņš nitrifikācijas dēļ = ± 3,43 × nitrītjona koncentrācijas izmaiņas + 4,57 × nitrātjonu koncentrācijas pieaugums |
(7) |
|
un tādējādi |
|
|
O2 patēriņš C oksidēšanai = kopējais novērotais patēriņš – patēriņš nitrifikācijas dēļ |
(8) |
Ja nosaka tikai oksidēto N, nitrifikācijai patērētā skābekļa daudzumu pirmajā tuvinājumā aprēķina kā 4,75 × oksidētā n satura palielinājums.
C oksidēšanai koriģēto vērtību tad salīdzina ar TSPNH3, ko aprēķina saskaņā ar 2. papildinājumu.
C.5. DEGRADĀCIJA – BIOĶĪMISKAIS SKĀBEKĻA PATĒRIŅŠ
1. METODE
1.1. IEVADS
Ar šo metodi nosaka cietu vai šķidru organisko vielu bioķīmisko skābekļa patēriņu (BSP).
Pēc šīs metodes iegūtie dati attiecas uz ūdenī šķīstošām vielām; taču vismaz principā pēc tās var testēt arī gaistošas un mazšķīstošas vielas.
Šī metode izmantojama tikai tādu organisko vielu testēšanai, kurām šim nolūkam izmantotajā koncentrācijā nav inhibējošas iedarbības uz baktērijām. Ja pārbaudāmā viela nešķīst līdz testējamajai koncentrācijai, jāveic īpaši pasākumi, piemēram, testējamās vielas disperģēšanai jāizmanto ultraskaņa.
Informācija par toksiskumu attiecībā pret mikroorganismiem var noderēt, izvērtējot neviennozīmīgus rezultātus un izvēloties vajadzīgo koncentrācijas diapazonu.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Ar BSP saprot izšķīdušā skābekļa masu, kas konkrētos apstākļos nepieciešama noteikta tilpuma vielas šķīduma bioķīmiskās oksidēšanās procesa nodrošināšanai.
Iegūtos rezultātus norāda BSP gramos uz vienu gramu pārbaudītās vielas.
1.3. STANDARTVIELAS
Sējmateriāla aktivitātes pārbaudei ieteicams izmantot piemērotu standartvielu.
1.4. METODES PRINCIPS
Iepriekš noteiktu vielas daudzumu, kas izšķīdināts vai disperģēts piemērotā un labi aerētā barotnē, kas apsēta ar mikroorganismu sējmateriālu, inkubē tumsā nemainīgā apkārtējā temperatūrā.
BSP nosaka pēc izšķīdušā skābekļa koncentrācijas starpības testēšanas sākumā un beigās. Noteikšanas ilgums ir vismaz piecas dienas, bet ne vairāk par 28 dienām.
Vienlaikus paralēli jāveic tukšā parauga analīze, kurā nav pārbaudāmās vielas.
1.5. KVALITĀTES KRITĒRIJI
BSP noteikšanu nevar uzskatīt par pilnīgi drošu vielas biosadalīšanās rādītāju. Tā ir izmantojama tikai kā iepriekšēja pārbaude.
1.6. METODES APRAKSTS
Pārbaudāmo vielu iepriekš izšķīdina ūdenī vai disperģē, lai iegūtu BSP noteikšanai vajadzīgo koncentrāciju. Nosaka BSP pēc jebkuras piemērotas valsts vai starptautiskas standartmetodes.
2. DATI UN IZVĒRTĒŠANA
BSP sākotnējā šķīdumā aprēķina pēc izvēlētās standartmetodes un norāda BSP gramos uz vienu testējamās vielas gramu.
3. PĀRSKATS
Jānorāda izmantotā metode.
Bioķīmiskais skābekļa patēriņš ir vidējais rādītājs, kas iegūts vismaz no trim derīgiem mērījumiem.
Pārskatā jāiekļauj visa informācija un piezīmes, kas attiecas uz rezultātu interpretāciju, jo īpaši par testējamās vielas piemaisījumiem, agregātstāvokli, toksisko iedarbību un sastāvu, kas var ietekmēt rezultātus.
Ja izmanto piedevu, kas inhibē bioloģisko nitrifikāciju, tas jānorāda.
4. IZMANTOTĀ LITERATŪRA
Standartmetožu saraksts, piemēram:
NF T 90-103: Bioķīmiskā skābekļa patēriņa noteikšana.
NBN 407: Bioķīmiskais skābekļa patēriņš.
NEN 32355.4: Bepaling van het biochemish zuurstofverbruik (BZV).
The determination of biochemical oxygen demand, Methods for the examination of water and associated materials, HMSO, London.
ISO 5815: Bioloģiskā skābekļa patēriņa noteikšana pēc n dienām.
C.6. DEGRADĀCIJA – ĶĪMISKAIS SKĀBEKĻA PATĒRIŅŠ
1. METODE
1.1. IEVADS
Pēc šīs metodes nosaka cietu vai šķidru organisko vielu ķīmisko skābekļa patēriņu (ĶSP) iepriekš noteiktos, standartizētos laboratorijas apstākļos.
Testēšanai un rezultātu interpretācijai var būt noderīga informācija par vielas sastāvu (piemēram, organisko savienojumu halogēnsāļi, dzelzs sāļi, hlororganiskie savienojumi).
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Ķīmiskais skābekļa patēriņš raksturo vielas oksidējamību, kas ir ekvivalenta oksidējošā reaģenta skābekļa daudzumam, kuru noteiktos laboratorijas apstākļos patērē pārbaudāmā viela.
Iegūtos rezultātus norāda ĶSP gramos uz vienu gramu pārbaudītās vielas.
1.3. STANDARTVIELAS
Pārbaudot jaunu vielu, ne visos gadījumos jāizmanto standartvielas. Tās galvenokārt izmanto metožu periodiskai kalibrēšanai un dod iespēju salīdzināt pēc citas metodes iegūtus rezultātus.
1.4. METODES PRINCIPS
Iepriekš noteiktu vielas daudzumu, kas izšķīdināts vai disperģēts ūdenī, oksidē ar kālija dihromātu, divas stundas vārot koncentrētā sērskābes vidē ar atteci, par katalizatoru izmantojot sudraba sulfātu. Dihromāta atlikumu nosaka, titrējot ar standartizētu dzelzs (II) amonija sulfātu.
Testējot hloru saturošas vielas, hlorīdu traucējošās ietekmes samazināšanai pievieno dzīvsudraba sulfātu ( 26 ).
1.5. KVALITĀTES KRITĒRIJI
ĶSP tā noteikšanas veida dēļ ir oksidēšanās spējas rādītājs, un kā tādu to var izmantot kā praktisku paņēmienu organiskās vielas daudzuma noteikšanai.
Noteikšanu var traucēt hlorīdjoni; ĶSP noteikšanu var traucēt arī neorganiskas vielas ar reducētāju vai oksidētāju īpašībām.
Daļa ciklisko savienojumu un gaistošu vielu (piemēram, zemākās taukskābes) šīs metodes apstākļos pilnībā neoksidējas.
1.6. METODES APRAKSTS
Pārbaudāmo vielu izšķīdina vai disperģē, lai ĶSP būtu 250–600 mg/l.
Piezīmes
Mazšķīstošas un grūti disperģējamas vielas smalki saberzta pulvera vai šķidruma veidā daudzumā, kas atbilst apmēram 5 mg ĶSP, nosver un pārnes noteikšanas iekārtā ar ūdeni.
Bieži vien ķīmisko skābekļa patēriņu (ĶSP), jo īpaši mazšķīstošām vielām, ērtāk noteikt pēc metodes varianta, t. i., slēgtā sistēmā ar spiediena izlīdzināšanas ierīci (H. Kelkenberg, 1975). Bieži vien pēc šīs modifikācijas var iegūt labus rezultātus tādiem savienojumiem, piemēram, etiķskābei, kas pēc parastās metodes ir grūti analizējami. Tomēr šī metode neder piridīnam. Ja (1) noteikto kālija dihromāta koncentrāciju paaugstina līdz 0,25 N (0,0416 M), var izmantot tiešu 5–10 mg iesvaru, kas ir būtiski ūdenī mazšķīstošu vielu ĶSP noteikšanai (skatīt (2)).
Pārējos gadījumos ĶSP nosaka pēc jebkuras piemērotas valsts vai starptautiskas standartmetodes.
2. DATU IZVĒRTĒŠANA
Pārbaudes laikā kolbā novēroto ĶSP aprēķina pēc izvēlētās standartmetodes un norāda ĶSP gramos uz vienu testējamās vielas gramu.
3. PĀRSKATS
Jānorāda izmantotā standartmetode.
Ķīmiskais skābekļa patēriņš ir vidējais rādītājs, kas iegūts vismaz no trim mērījumiem. Pārskatā jāiekļauj visa informācija un piezīmes, kas attiecas uz rezultātu interpretāciju, jo īpaši – par testējamās vielas piemaisījumiem, agregātstāvokli un īpašībām (ja tādas ir zināmas), kas var ietekmēt noteikšanas rezultātus.
Ja hlorīdjonu traucējošās ietekmes samazināšanai izmanto dzīvsudraba sulfātu, tas ir jānorāda.
4. IZMANTOTĀ LITERATŪRA
(1) Kelkenberg, H.,Z. von Wasser und Abwasserforschung, 1975, Vol. 8, p. 146.
(2) Gerike, P. The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, Vol. 13, p. 169.
Standartmetožu saraksts, piemēram:
NBN T 91-201: Ķīmiskā skābekļa patēriņa noteikšana.
ISBN O 11 7512494: Piesārņotu ūdeņu un notekūdeņu ķīmiskais skābekļa patēriņš (dihromāta skaitlis).
NF T 90-101: Ķīmiskā skābekļa patēriņa noteikšana.
DS 217 = ūdens analīze: Ķīmiskā skābekļa patēriņa noteikšana.
DIN 38409-H-41: Ķīmiskā skābekļa patēriņa (ĶSP) noteikšana virs 15 mg litrā.
NEN 3235 5.3: Bepaling van het chemisch zuurstofverbruik.
ISO 6060 Ūdens kvalitāte: Ķīmiskā skābekļa patēriņa noteikšanas dihromāta metodes.
C.7. NOĀRDĪŠANĀS – ABIOTISKA NOĀRDĪŠANĀS: HIDROLĪZE ATKARĪBĀ NO pH
1. METODE
Šī testēšanas metode ir ekvivalenta ESAO TG 111 (2004) metodei.
1.1. IEVADS
Ķīmiskās vielas var iekļūt virszemes ūdeņos to tiešas lietošanas vai izsmidzināšanas kļūdas dēļ, no atkritumiem, ar virszemes noteci un drenu noteci, notekūdeņiem, ražošanas, sadzīves un lauksaimniecības notekūdeņiem, kā arī no atmosfēras, un minētās vielas šajos ūdeņos var pārveidoties ķīmiskos (piemēram, hidrolīze, oksidēšanās), fotoķīmiskos procesos un/vai mikroorganismu iedarbībā. Šajos norādījumos ir aprakstīta laboratorijas testēšanas metode ķīmisko vielu abiotisku hidrolītisku pārvērtību noteikšanai ūdens vidē parasti sastopamo pH vērtību intervālā (pH 4–9), un šie norādījumi pamatojas uz attiecīgajiem norādījumiem par testēšanu, kas minēti (1), (2), (3), (4), (5), (6), (7).
Eksperimentāli nosaka: i) testējamās vielas hidrolīzes ātrumu atkarībā no pH, un ii) to hidrolīzes produktu identitāti vai īpašības, veidošanās un noārdīšanās ātrumu, kuru iedarbībai var tikt pakļauti organismi. Šie pētījumi var būt nepieciešami par ķīmiskajām vielām, kuras tiek ievadītas tieši ūdenī, vai arī ir iespējams, ka tās nokļūst vidē kādā citā no iepriekš minētajiem veidiem.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Skatīt 2. papildinājumu.
1.3. METODES PIEMĒROTĪBA
Metode ir vispār piemērota ķīmiskajām vielām (ar radioizotopiem iezīmētām un neiezīmētām), kuru noteikšanai ir piemērota analītiska metode, kas nodrošina pietiekamu pareizību un jutību. Šī testēšanas metode ir izmantojama nedaudz gaistošiem un negaistošiem savienojumiem ar pietiekamu šķīdību ūdenī. Testēšanas metodi nav ieteicams izmantot ķīmiskajām vielām, kurām ir liela gaistamība no ūdens (t. i., fumiganti, organiskie šķīdinātāji), un tāpēc šīs vielas eksperimenta apstākļos nevar aizturēt šķīdumā. Var gadīties, ka testēšana būs apgrūtināta, ja vielai ir minimāla šķīdība ūdenī (8).
1.4. METODES PRINCIPS
Steriliem ūdens buferšķīdumiem ar atšķirīgu pH vērtību (pH 4, 7 un 9) pievieno testējamo vielu un iztur tumsā kontrolējamos laboratorijas apstākļos (pastāvīgā temperatūrā). Pēc noteiktiem laika intervāliem buferšķīdumus analizē, nosakot attiecīgās testējamās vielas un to hidrolīzes produktu saturu. Testējamo vielu iezīmējot ar radioizotopu (piemēram, 14C), var vienkāršāk noteikt masas bilanci.
Šajā testēšanas metodē paredzēts izmantot pakāpeniskas testēšanas pieeju, tā ir norādīta un izskaidrota 1. papildinājumā. Katrā nākamajā testēšanas posmā izmanto iepriekšējā posmā iegūtos rezultātus.
1.5. INFORMĀCIJA PAR TESTĒJAMO VIELU
Hidrolīzes ātruma noteikšanai var izmantot neiezīmētu vai ar radioizotopiem iezīmētu testējamo vielu. Iezīmētā viela parasti būtu jāizvēlas, pētot hidrolīzes gaitu un nosakot masas bilanci; tomēr īpašos gadījumos varētu būt, ka iezīmēšana nav absolūti nepieciešama. Ieteicams iezīmēšanai izmantot 14C izotopu, bet var būt lietderīgi izmantot arī citus radioizotopus, piemēram, 13C, 15N, 3H. Ja iespējams, jāiezīmē molekulas stabilākās daļas. Piemēram, ja testējamās vielas struktūrā ir viens aromātiskais gredzens, jāiezīmē šis gredzens; ja ir divi vai vairāki šādi gredzeni, tad iespējams, ka vajadzēs atsevišķi pētīt katra iezīmētā aromātiskā gredzena pārvērtības, lai iegūtu attiecīgo informāciju par hidrolīzes produktu veidošanos. Testējamās vielas tīrības pakāpei jābūt vismaz 95 %.
Pirms hidrolīzes testa par testējamo vielu jāiegūst šāda informācija:
a) šķīdība ūdenī (A.6. testēšanas metode);
b) šķīdība organiskajos šķīdinātājos;
c) tvaika spiediens (A.4. testēšanas metode) un/vai Henrija konstante;
d) sadalījuma koeficients n-oktanolā/ūdenī (A.8. testēšanas metode);
e) disociācijas konstante (pKa) (ESAO TG 112 metode) (9);
f) tiešās un netiešās fotolīzes ātrums ūdenī, kur nepieciešams.
Jābūt izmantojamām analītiskām metodēm testējamās vielas un, attiecīgos gadījumos, tās hidrolīzes produktu kvantitatīvai noteikšanai un identifikācijai ūdens šķīdumos (skatīt arī 1.7.2. punktu).
1.6. STANDARTVIELAS
Ja iespējams, standartvielas jāizmanto hidrolīzes produktu identifikācijai un kvantitatīvai noteikšanai ar spektroskopijas un hromatogrāfijas metodēm vai citām metodēm ar pietiekamu jutību.
1.7. KVALITĀTES KRITĒRIJI
1.7.1. Atgūstamība
Vismaz divu buferšķīduma vai to ekstrakta šķīduma analīze divos atkārtojumos tūlīt pēc testējamās vielas pievienošanas dod pirmās liecības par analītiskās metodes atkārtojamību un attiecīgās procedūras vienveidību. Atgūstamību nākamajiem testēšanas posmiem nosaka pēc attiecīgajām masas bilancēm (ja lieto iezīmētu vielu). Gan iezīmētām, gan neiezīmētām vielām atgūstamībai jābūt no 90 % līdz 110 % (7). Ja tehnisku iemeslu dēļ to panākt grūti, neiezīmētām vielām pieņemama arī atgūstamība 70 % līmenī, bet tas jāpamato.
1.7.2. Analītiskās metodes atkārtojamība un jutība
Testējamās vielas un tās hidrolīzes produktu kvantitatīvai noteikšanai izmantojamās analītiskās metodes atkārtojamību var pārbaudīt ar to pašu buferšķīdumu (vai to ekstraktu) dublikātu paraugu analīzi pēc tam, kad hidrolīzes produkti ir izveidojušies kvantitatīvai noteikšanai pietiekamā daudzumā.
Analītiskajai metodei jābūt pietiekami jutīgai, lai noteiktu testa vielas koncentrācijas līdz pat 10 % vai mazāk no sākotnējās koncentrācijas. Ja vajadzīgs, analītiskajām metodēm jābūt arī pietiekami jutīgām, lai noteiktu hidrolīzes produktu daudzumā 10 % vai vairāk no lietotā daudzuma (jebkurā momentā eksperimenta gaitā) līdz pat 25 % vai mazāk no tā maksimālās koncentrācijas.
1.7.3. Hidrolīzes kinētikas datu ticamības intervāli
Ticamības intervāli jāaprēķina un jānorāda visiem regresijas koeficientiem, ātruma konstantēm, pussadalīšanās laikiem un citiem kinētikas datiem (piemēram, DT50).
1.8. TESTĒŠANAS METODES APRAKSTS
1.8.1. Iekārtas un aparatūra
Pētījumi jāveic stikla traukos (piemēram, mēģenēs, nelielās kolbās), ja nepieciešams, tumsā sterilos apstākļos, izņemot gadījumus, kad iepriekšējie dati (piemēram, sadalījuma koeficients n-oktanolā–ūdenī) nenorāda, ka testējamā viela var pielipt pie stikla. Šādos gadījumos jāapsver citu materiālu (piemēram, teflona) izmantošana. Iespējams, ka pielipšanas problēmu varētu novērst, izmantojot kādu vai vairākas šādas metodes:
— uz testēšanas trauka sieniņām adsorbētās testējamās vielas un hidrolīzes produktu masas noteikšana,
— ultraskaņas vannas izmantošana,
— visu stikla trauku mazgāšana ar šķīdinātāju pēc katras paraugu ņemšanas reizes,
— preparātu izmantošana,
— palielināta papildšķīdinātāja daudzuma izmantošana testējamās vielas ievadīšanai sistēmā; ja izmanto papildšķīdinātāju, tas nedrīkst izraisīt testējamās vielas hidrolīzi.
Parasti ir nepieciešami ūdens vannas kratītāji ar temperatūras regulēšanu vai termostati dažādu testējamo šķīdumu inkubācijai.
Nepieciešamas standarta laboratorijas iekārtas, ieskaitot šādas:
— pH-metrs,
— tādi analītiskie instrumenti kā gāzes hromatogrāfijas, HPLC hromatogrāfijas, plānslāņa hromatogrāfijas iekārta, ieskaitot detektēšanas iekārtu, kas piemērota ar radioizotopiem iezīmēto un neiezīmēto materiālu analīzei vai inversajai izotopu atšķaidīšanas metodei,
— instrumenti identifikācijai (piemēram, MS, GC-MS, HPLC-MS, KMR u. c.),
— šķidruma scintilācijas skaitītājs,
— šķirpiltuves šķidrumu ekstrakcijai,
— aparatūra šķīdumu un ekstraktu koncentrēšanai (piemēram, rotācijas iztvaicētājs),
— iekārta ar temperatūras kontroli (piemēram, ūdens vanna).
Pie nepieciešamajiem ķīmiskajiem reaģentiem pieder, piemēram:
— analītiskās tīrības organiskie šķīdinātāji, piemēram, heksāns, dihlormetāns u. c.,
— scintilācijas šķidrums,
— buferšķīdumi (sīkāk skatīt 1.8.3. punktā).
Visi hidrolīzes testā izmantojamie stikla trauki, analītiski tīrs ūdens un buferšķīdumi jāsterilizē.
1.8.2. Testējamās vielas pievienošana
Testējamā viela buferšķīdumiem (skatīt 3. papildinājumu) jāpievieno ūdens šķīdumu veidā. Ja nepieciešams, testējamās vielas pilnīgai izšķīdināšanai un sajaukšanai nelielā daudzumā var izmantot šķīdinātājus, kas sajaucas ar ūdeni (piemēram, acetonitrilu, acetonu, etanolu), parasti to tilpuma daļai nepārsniedzot 1 %. Ja jāizmanto šķīdinātāji augstākās koncentrācijās (piemēram, ja testējamā viela ir mazšķīstoša), tas pieļaujams tikai tad, ja var uzskatāmi parādīt, ka šķīdinātājam nav nekādas ietekmes uz testējamo vielu hidrolīzi.
Produkta preparātus parasti nav ieteicams izmantot, jo nevar izslēgt, ka to sastāvdaļas neietekmē hidrolīzes procesu. Tomēr, ja testējamā viela slikti šķīst ūdenī vai pielīp pie stikla (skatīt 1.8.1. punktu), preparāta izmantošana varētu būt pieņemama alternatīva.
Jāizmanto viena testējamās vielas koncentrācija; šī koncentrācija nedrīkst pārsniegt 0,01 M vai pusi no piesātināta šķīduma koncentrācijas (skatīt 1. papildinājumu).
1.8.3. Buferšķīdumi
Hidrolīzes tests jāveic pie pH vērtībām 4, 7 un 9. Šim nolūkam jāgatavo buferšķīdumi no analīžu veikšanai piemērotas tīrības klases vielām (reagent grade) un ūdens. Dažas ieteicamās bufersistēmas ir minētas 3. papildinājumā. Jāņem vērā, ka izmantotais buferšķīdums var ietekmēt hidrolīzes ātrumu, un šādos gadījumos jālieto cits buferšķīdums.
Buferšķīdumu pH jāmēra, izmantojot kalibrētu pH-metru, ar precizitāti vismaz 0,1 nepieciešamajā temperatūrā.
1.8.4. Testēšanas apstākļi
1.8.4.1. Testēšanas temperatūra
Hidrolīzes pētījumi jāveic pastāvīgā temperatūrā. Ekstrapolācijai ir svarīgi temperatūru uzturēt ar precizitāti vismaz ± 0,5oC.
Iepriekšējais tests (1. posms) jāveic 50 oC temperatūrā, ja testējamās vielas hidrolīzes raksturlielumi nav zināmi. Nākamo posmu kinētiskie testi jāveic vismaz trijās temperatūrās (ieskaitot 50 oC temperatūru), izņemot gadījumus, kad testējamā viela saskaņā ar testēšanas pirmajā posmā iegūtajiem rezultātiem ir stabila pret hidrolīzi. Ieteicamais temperatūras diapazons ir 10–70 oC (turklāt ieteicams, lai vismaz viena no izmantotajām temperatūrām būtu zemāka par 25 oC), iekļaujot pārskatā norādāmo standarta apstākļu temperatūru 25 oC un vidē sastopamo temperatūru intervāla lielāko daļu.
1.8.4.2. Gaisma un skābeklis
Veicot hidrolīzes testus, ar jebkādu piemērotu metodi jānovērš iespējamā fotolīze. Jāveic arī visi iespējamie pasākumi skābekļa iedarbības novēršanai (piemēram, 5 min barbotējot hēliju, slāpekli vai argonu pirms šķīduma sagatavošanas).
1.8.4.3. Testēšanas ilgums
Orientējošais tests jāveic piecas dienas, bet nākamajos posmos testi jāveic, līdz hidrolizējas 90 % testējamās vielas, vai 30 dienas atkarībā no tā, kurš no šiem laika periodiem ir īsāks.
1.8.5. Testēšanas veikšana
1.8.5.1. Orientējošais tests (1. posms)
Orientējošo testu veic 50 ± 0,5oC temperatūrā pie pH 4, 7 un 9. Ja pēc piecām dienām (t0,5 25 o C > 1 gads) hidrolizējušies mazāk nekā 10 % vielas, testējamā viela uzskatāma par hidrolītiski stabilu un turpmāku testēšanu parasti nav nepieciešams veikt. Ja ir zināms, ka testējamā viela ir nestabila vidē sastopamās temperatūrās, orientējošais tests nav jāveic. Analītiskajai metodei jābūt ar pietiekamu precizitāti un jutību, lai varētu konstatēt sākotnējās koncentrācijas samazinājumu par 10 %.
1.8.5.2. Nestabilu vielu hidrolīze (2. posms)
Nākamajā posmā testēšana jāveic pie tām pH vērtībām, kurās iepriekš orientējošā testā konstatēta testējamās vielas nestabilitāte. Testējamās vielas buferšķīdumi jāiztur termostatā izraudzītajās temperatūrās. Lai noteiktu pirmās kārtas reakcijas, visi šķīdumi jāanalizē laika intervālos, kas nodrošina vismaz sešus attālinātus datu punktus, parasti no 10 % līdz 90 % no testējamās vielas hidrolīzes. Atsevišķie atkārtojumi (minimālais atkārtojumu skaits ir divi paraugi atsevišķos reakcijas traukos) jāņem un saturs jāizanalizē pēc katra no vismaz sešiem paraugu ņemšanas laikiem (iegūstot vismaz divpadsmit atkārtojumu datu punktus). Viena apvienota parauga izmantošana, no kura katrā paraugu ņemšanas termiņā ņem atsevišķas pārbaudāmā šķīduma alikvotas, uzskatāma par neatbilstošu paņēmienu, jo tādējādi nav iespējams veikt datu izkliedes analīzi un var rasties problēmas, kas saistītas ar testējamā šķīduma kontamināciju. Sterilitātes apstiprināšanas testi jāveic pēdējā posma testa beigās (t. i., pie 90 % hidrolīzes vai pēc 30 dienām). Tomēr, ja netiek novērota vielas noārdīšanās (t. i., pārveidošanās), sterilitātes testi nav uzskatāmi par nepieciešamiem.
1.8.5.3. Hidrolīzes produktu identifikācija (3. posms)
Jebkādi nozīmīgāki hidrolīzes produkti, vismaz tie, kas reprezentē > 10 % no lietotās devas, jāidentificē ar piemērotām analītiskajām metodēm.
1.8.5.4. Fakultatīvie testi
Papildu testi pie citām pH vērtībām, izņemot 4, 7 un 9, var būt jāveic gadījumos, kad testējamā viela ir hidrolītiski nestabila. Piemēram, fizioloģijā var būt jāveic testēšana skābākā vidē (piemēram, pie pH 1,2) vienā fizioloģiskajiem procesiem atbilstošajā temperatūrā (37 oC).
2. DATI
Ja nepieciešams, testējamās vielas un hidrolīzes produktu daudzumi jānorāda procentos no lietotās sākotnējās koncentrācijas un, ieteicams, koncentrāciju (mg/L) veidā katram paraugu ņemšanas termiņam, pH un testēšanas temperatūrai. Bez tam jānorāda masas bilance procentos no lietotās sākotnējās koncentrācijas, ja testējamā viela iezīmēta ar izotopiem.
Datiem par testējamās vielas koncentrācijas izmaiņām laikā jāveic logaritmiskie pārveidojumi, un tie jāattēlo grafiski atkarībā no laika. Jāidentificē nozīmīgākie hidrolīzes produkti, vismaz tie, kas reprezentē > 10 % no lietotās devas, un to koncentrācijas pēc logaritmiskiem pārveidojumiem arī jāattēlo grafiski līdzīgā veidā kā par testējamo vielu, lai parādītu to veidošanās un noārdīšanās ātrumus.
2.1. REZULTĀTU APSTRĀDE
Precīzākas pussadalīšanās vai DT50 vērtības jāiegūst, izdarot aprēķinus pēc atbilstoša kinētiskā modeļa. Pussadalīšanās un/vai DT50 vērtības (kopā ar ticamības līmeņiem) jānorāda visām pH un temperatūras vērtībām kopā ar izmantotā modeļa aprakstu, kinētikas kārtu un determinācijas koeficientu (r2). Ja vajadzīgs, aprēķini jāveic arī par hidrolīzes produktiem.
Ja hidrolīzes ātrumu nosaka dažādās temperatūrās, šķietamās pirmās kārtas hidrolīzes ātruma konstantes (kobs) jānosaka kā temperatūras funkcija. Aprēķinam jāpamatojas gan uz kobs sadalīšanu ātruma konstantēs skābes katalizētai hidrolīzei, hidrolīzei neitrālā vidē un bāzes katalizētai hidrolīzei (attiecīgi kH, kneutral, un kOH), gan uz Areniusa vienādojumu:
![]()
kur Ai un Bi ir attiecīgi regresijas vienādojuma brīvais loceklis un virziena koeficients ln ki lineārajai regresijai atkarībā no absolūtās temperatūras kelvinos (K) apgrieztās vērtības. Izmantojot Areniusa vienādojumu skābes katalizētai hidrolīzei, hidrolīzei neitrālā vidē un bāzes katalizētai hidrolīzei, var aprēķināt šķietamās pirmās kārtas hidrolīzes reakcijas ātruma konstantes un tādējādi – arī pussadalīšanās laikus citās temperatūrās, kurām ātruma konstantes eksperimentāli noteikt nav iespējams (10).
2.2. REZULTĀTU NOVĒRTĒŠANA UN INTERPRETĀCIJA
Vairums hidrolīzes reakciju norisinās ar šķietamās pirmās kārtas reakciju ātrumu, un tāpēc pussadalīšanās laiks nav atkarīgs no koncentrācijas (skatīt 4. vienādojumu 2. papildinājumā). Tas parasti ļauj rezultātus, kas iegūti laboratorijā koncentrācijām no 10-2 līdz 10-3 M, attiecināt uz vides apstākļiem (≤ 10-6 M) (10). Ja nosaka gan pH, gan temperatūru, vairākus piemērus tam, ka pastāv laba sakritība hidrolīzes ātrumiem, kas noteikti tīrā un dabiskā ūdenī, par daudzām ķīmiskajām vielām aprakstījuši Mabey un Mill (11).
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jāiekļauj vismaz šāda informācija.
Testējamā viela:
— ikdienas nosaukums, ķīmiskais nosaukums, CAS numurs, struktūrformula (norādot iezīmēto vietu, ja lieto ar radioizotopu iezīmētu vielu) un attiecīgās fizikāli ķīmiskās īpašības (skatīt 1.5. punktu),
— testējamās vielas tīrība (piemaisījumi),
— iezīmētās vielas iezīmes tīrība un molārā aktivitāte (kur piemērojams).
— Buferšķīdumi:
— gatavošanas datumi un ziņas par pagatavošanu,
— izmantotās bufervielas un ūdens,
— buferšķīdumu molārā koncentrācija un pH.
Testēšanas apstākļi:
— pētījumu veikšanas datumi,
— izmantotais testējamās vielas daudzums,
— testējamās vielas lietošanai izmantotā metode un šķīdinātāji (veids un daudzums),
— inkubēto testējamās vielas buferšķīdumu tilpums,
— izmantotās inkubācijas sistēmas apraksts,
— pH un temperatūra pētījuma laikā,
— paraugu ņemšanas laiki,
— ekstrakcijas metodes,
— testējamās vielas un tās hidrolīzes produktu daudzuma noteikšanas un identifikācijas metodes buferšķīdumos,
— atkārtojumu skaits.
Rezultāti:
— izmantoto analītisko metožu atkārtojamība un jutība,
— atgūstamība (% vērtības derīgiem pētījumu rezultātiem norādītas 1.7.1. punktā),
— tabulā apkopoti dati par atkārtojumiem un to vidējās vērtības,
— masas bilance pētījuma laikā un pētījuma beigās (ja lieto iezīmētu testējamo vielu),
— orientējošā pētījuma rezultāti,
— rezultātu novērtējums un interpretācija,
— visi oriģinālie dati un skaitļi.
Ja nosaka hidrolīzes ātrumu, ir nepieciešama tikai šāda informācija:
— koncentrācijas grafiki atkarībā no laika (testējamajām vielām un, attiecīgos gadījumos, hidrolīzes produktiem) pie katras pH vērtības un temperatūras,
— Areniusa vienādojuma rezultātu tabulas temperatūrai 20 oC/25 oC, norādot pH, ātruma konstanti (h-1 vai dienā-1), pussadalīšanās laiku vai DT50, temperatūras ( oC), ieskaitot ticamības līmeņus un determinācijas koeficientus (r2), vai citu līdzīgu informāciju,
— iespējamā hidrolīzes gaita.
4. IZMANTOTĀ LITERATŪRA
(1) OECD (1981). Hydrolysis as a Function of pH. OECD Guideline for Testing of Chemicals Nr. 111, adopted 12 May 1981.
(2) US-Environmental Protection Agency (1982). 40 CFR 796.3500, Hydrolysis as a Function of pH at 25 oC. Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
(3) Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
(4) European Union (EU) (1995). Commission Directive 95/36/EC amending Council Directive 91/414/EEC concerning the placing of plant protection products on the market. Annex V: Fate and Behaviour in the Environment.
(5) Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
(6) BBA (1980). Merkblatt Nr. 55, Teil I und II: Prüfung des Verhaltens von Pflanzenbehandlungsmitteln im Wasser (October 1980).
(7) SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
(8) OECD (2000). Guidance document on aquatic toxicity testing of difficult substances and mixtures, OECD Environmental Health and Safety Publications Series on Testing and Assessment Nr. 23.
(9) OECD (1993). Guidelines for the Testing of Chemicals. Paris. OECD (1994–2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
(10) Nelson, H, Laskowski D, Thermes S, and Hendley P. (1997) Recommended changes in pesticide fate study guidelines for improving input to computer models. (Text version of oral presentation at the 14th Annual Meeting of the Society of Environmental Toxicology and Chemistry, Dallas TX, November 1993).
(11) Mabey, W. and Mill, T. (1978). Critical review of hydrolysis of organic compounds in water under environmental conditions. J. Phys. Chem. Ref. Data 7, p. 383–415.
1. PAPILDINĀJUMS
Hidrolīzes pakāpeniskas testēšanas shēma
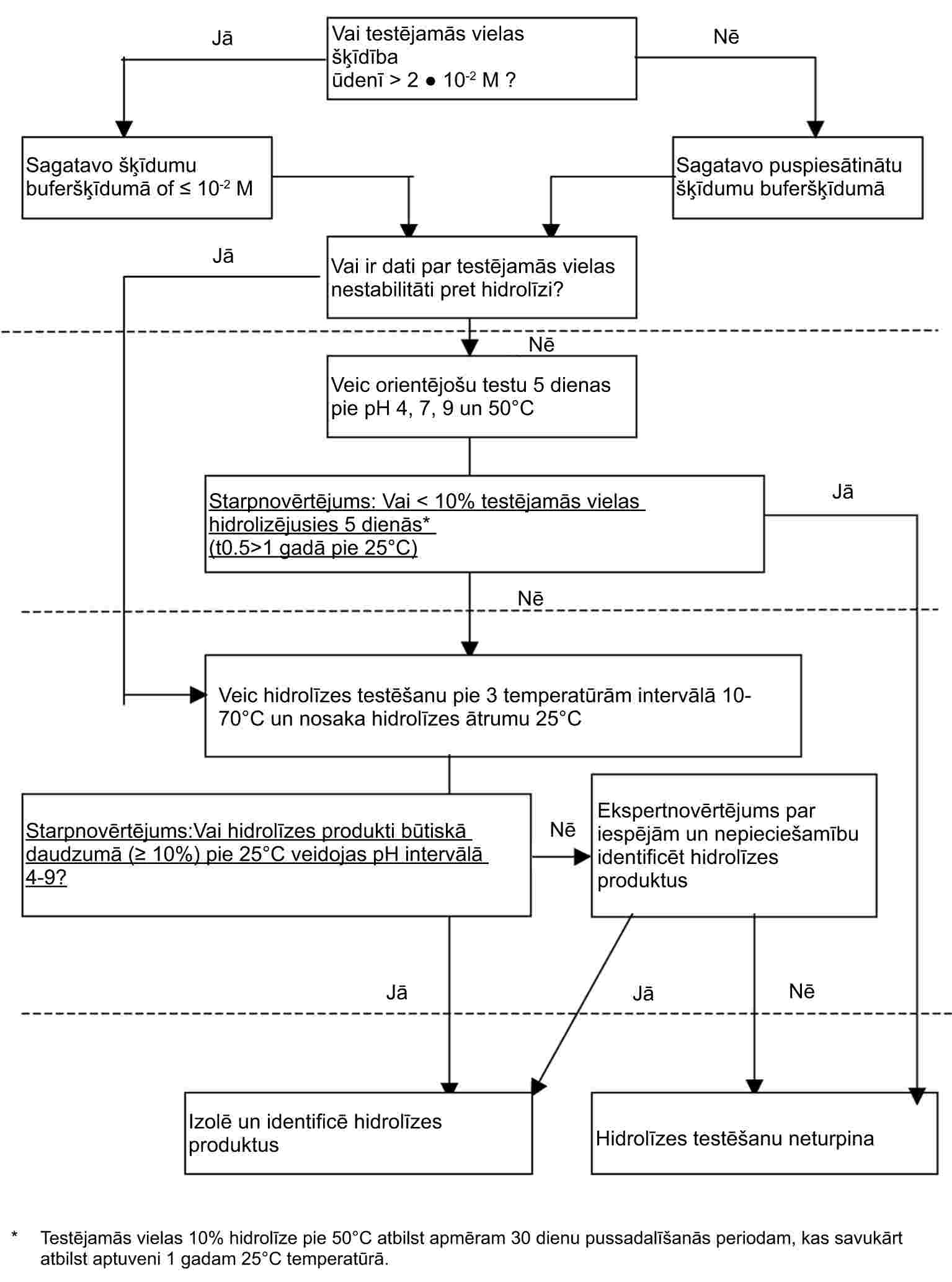
2. PAPILDINAJUMS
Definīcijas un mērvienības
Jāizmanto tikai standarta starptautiskās sistēmas mērvienības (SI).
Testējamā viela: viela, sākotnējais savienojums vai tās transformācijas produkti.
Pārveidošanās produkti: visas vielas, kas rodas testējamās vielas biotiskas vai abiotiskas transformācijas rezultātā.
Hidrolīzes produkti: visas vielas, kas rodas testējamās vielas hidrolītiskas transformācijas reakcijās.
Hidrolīze: testējamās vielas RX reakcija ar ūdeni, kurā notiek X- grupas apmaiņas reakcija OH- grupu reakcijas centrā:
|
RX + HOH → ROH + HX |
[1] |
Ātrumu, pie kura RX koncentrācija samazinās šajā vienkāršotajā procesā, apraksta
|
ātrums = k [H2O] [RX] |
otrās kārtas reakcijām |
|
vai |
|
|
ātrums = k [RX] |
pirmās kārtas reakcijām |
atkarībā no ātruma noteikšanas posma. Ūdens ir lielā pārākumā salīdzinājumā ar testējamo vielu, tāpēc šā tipa reakcijas parasti apraksta kā šķietamās pirmās kārtas reakcijas, kurām novēroto ātruma konstanti apraksta sakarība
|
kobs = k [H2O] |
[2] |
un to var aprēķināt pēc šāda vienādojuma
|
|
[3] |
kur
t = laiks
un Co, Ct = RX koncentrācijas laikā 0 un t.
Šīs konstantes mērvienības ir (laiks)-1, un reakcijas pussadalīšanās laiku (laiks, kas nepieciešams, lai izreaģētu 50 % no RX daudzuma) apraksta ar vienādojumu
|
|
[4] |
Pussadalīšanās laiks: (t0,5) ir laiks, kas nepieciešams, lai hidrolizētos 50 % no testējamās vielas daudzuma, ja reakciju var aprakstīt ar pirmās kārtas kinētiku; tas nav atkarīgs no koncentrācijas.
DT 50 (izzušanas laiks 50): laiks, kurā testējamās vielas koncentrācija samazināts par 50 %; tas atšķiras no pussadalīšanās laika t0,5, ja reakcija nenotiek atbilstoši pirmās kārtas reakciju kinētikai.
Ātruma konstantes k noteikšana dažādās temperatūrās
Ja ātruma konstantes ir zināmas divām temperatūrām, tad ātruma konstantes citās temperatūrās var aprēķināt pēc Areniusa vienādojuma:
![]()
vai
![]()
ln k grafiks atkarībā no 1/T ir taisne ar virziena koeficientu – E/R
kur:
|
k |
= |
ātruma konstante dažādās temperatūrās, |
|
E |
= |
aktivācijas enerģija (kJ/mol), |
|
T |
= |
absolūtā temperatūra (K), |
|
R |
= |
universālā gāzu konstante (8,314 J/mol.K). |
Aktivācijas enerģiju nosaka ar regresijas analīzi vai aprēķina pēc šāda vienādojuma:

kur: T2 > T1.
3. PAPILDINĀJUMS
Bufersistēmas
A. CLARK un LUBS:
KLĀRKA un LUBSA bufermaisījumi ( 27 )
|
Sastāvs |
pH |
|
0,2 N HCl UN 0,2 N KCl 20 oC TEMPERATŪRĀ |
|
|
47,5 ml HCl + 25 ml KCl, atšķaida līdz 100 ml |
1,0 |
|
32,25 ml HCl + 25 ml KCl, atšķaida līdz 100 ml |
1,2 |
|
20,75 ml HCl + 25 ml KCl, atšķaida līdz 100 ml |
1,4 |
|
13,15 ml HCl + 25 ml KCl, atšķaida līdz 100 ml |
1,6 |
|
8,3 ml HCl + 25 ml KCl, atšķaida līdz 100 ml |
1,8 |
|
5,3 ml HCl + 25 ml KCl, atšķaida līdz 100 ml |
2,0 |
|
3,35 ml HCl + 25 ml KCl, atšķaida līdz 100 ml |
2,2 |
|
0,1 M kālija biftalāts + 0,1 N HCl 20 oC TEMPERATŪRĀ |
|
|
46,70 ml 0,1 N HCl + 50 ml biftalāta, atšķaida līdz 100 ml |
2,2 |
|
39,60 ml 0,1 N HCl + 50 ml biftalāta, atšķaida līdz 100 ml |
2,4 |
|
32,95 ml 0,1 N HCl + 50 ml biftalāta, atšķaida līdz 100 ml |
2,6 |
|
26,42 ml 0,1 N HCl + 50 ml biftalāta, atšķaida līdz 100 ml |
2,8 |
|
20,32 ml 0,1 N HCl + 50 ml biftalāta, atšķaida līdz 100 ml |
3,0 |
|
14,70 ml 0,1 N HCl + 50 ml biftalāta, atšķaida līdz 100 ml |
3,2 |
|
9,90 ml 0,1 N HCl + 50 ml biftalāta, atšķaida līdz 100 ml |
3,4 |
|
5,97 ml 0,1 N HCl + 50 ml biftalāta, atšķaida līdz 100 ml |
3,6 |
|
2,63 ml 0,1 N HCl + 50 ml biftalāta, atšķaida līdz 100 ml |
3,8 |
|
0,1 M kālija biftalāts + 0,1 N NaOH 20 oC TEMPERATŪRĀ |
|
|
0,40 ml 0,1 N NaOH + 50 ml biftalāta, atšķaida līdz 100 ml |
4,0 |
|
3,70 ml 0,1 N NaOH + 50 ml biftalāta, atšķaida līdz 100 ml |
4,2 |
|
7,50 ml 0,1 N NaOH + 50 ml biftalāta, atšķaida līdz 100 ml |
4,4 |
|
12,15 ml 0,1 N NaOH + 50 ml biftalāta, atšķaida līdz 100 ml |
4,6 |
|
17,70 ml 0,1 N NaOH + 50 ml biftalāta, atšķaida līdz 100 ml |
4,8 |
|
23,85 ml 0,1 N NaOH + 50 ml biftalāta, atšķaida līdz 100 ml |
5,0 |
|
29,95 ml 0,1 N NaOH + 50 ml biftalāta, atšķaida līdz 100 ml |
5,2 |
|
35,45 ml 0,1 N NaOH + 50 ml biftalāta, atšķaida līdz 100 ml |
5,4 |
|
39,85 ml 0,1 N NaOH + 50 ml biftalāta, atšķaida līdz 100 ml |
5,6 |
|
43,00 ml 0,1 N NaOH + 50 ml biftalāta, atšķaida līdz 100 ml |
5,8 |
|
45,45 ml 0,1 N NaOH + 50 ml biftalāta, atšķaida līdz 100 ml |
6,0 |
KLĀRKA un LUBSA bufermaisījumi (turpinājums)
|
0,1 M monokālija fosfāts + 0,1 N NaOH 20 oC TEMPERATŪRĀ |
|
|
5,70 ml 0,1 N NaOH + 50 ml fosfāta, atšķaida līdz 100 ml |
6,0 |
|
8,60 ml 0,1 N NaOH + 50 ml fosfāta, atšķaida līdz 100 ml |
6,2 |
|
12,60 ml 0,1 N NaOH + 50 ml fosfāta, atšķaida līdz 100 ml |
6,4 |
|
17,80 ml 0,1 N NaOH + 50 ml fosfāta, atšķaida līdz 100 ml |
6,6 |
|
23,45 ml 0,1 N NaOH + 50 ml fosfāta, atšķaida līdz 100 ml |
6,8 |
|
29,63 ml 0,1 N NaOH + 50 ml fosfāta, atšķaida līdz 100 ml |
7,0 |
|
35,00 ml 0,1 N NaOH + 50 ml fosfāta, atšķaida līdz 100 ml |
7,2 |
|
39,50 ml 0,1 N NaOH + 50 ml fosfāta, atšķaida līdz 100 ml |
7,4 |
|
42,80 ml 0,1 N NaOH + 50 ml fosfāta, atšķaida līdz 100 ml |
7,6 |
|
45,20 ml 0,1 N NaOH + 50 ml fosfāta, atšķaida līdz 100 ml |
7,8 |
|
46,80 ml 0,1 N NaOH + 50 ml fosfāta, atšķaida līdz 100 ml |
8,0 |
|
0,1 M H3B030,1 M KCl šķīdumā + 0,1 N NaOH 20 oC TEMPERATŪRĀ |
|
|
2,61 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
7,8 |
|
3,97 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
8,0 |
|
5,90 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
8,2 |
|
8,50 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
8,4 |
|
12,00 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
8,6 |
|
16,30 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
8,8 |
|
21,30 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
9,0 |
|
26,70 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
9,2 |
|
32,00 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
9,4 |
|
36,85 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
9,6 |
|
40,80 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
9,8 |
|
43,90 ml 0,1 N NaOH + 50 ml borskābes, atšķaida līdz 100 ml |
10,0 |
B. KOLTHOFF un VLEESCHHOUWER:
KOLTHOFA un FLEŠHAUVERA citrāta buferšķīdumi
|
Sastāvs |
pH |
|
0,1 M monokālija citrāta un 0,1 N HCl 18 oC temperatūrā |
|
|
49,7 ml 0,1 N HCl + 50 ml citrāta, atšķaida līdz 100 ml |
2,2 |
|
43,4 ml 0,1 N HCl + 50 ml citrāta, atšķaida līdz 100 ml |
2,4 |
|
36,8 ml 0,1 N HCl + 50 ml citrāta, atšķaida līdz 100 ml |
2,6 |
|
30,2 ml 0,1 N HCl + 50 ml citrāta, atšķaida līdz 100 ml |
2,8 |
|
23,6 ml 0,1 N HCl + 50 ml citrāta, atšķaida līdz 100 ml |
3,0 |
|
17,2 ml 0,1 N HCl + 50 ml citrāta, atšķaida līdz 100 ml |
3,2 |
|
10,7 ml 0,1 N HCl + 50 ml citrāta, atšķaida līdz 100 ml |
3,4 |
|
4,2 ml 0,1 N HCl + 50 ml citrāta, atšķaida līdz 100 ml |
3,6 |
|
0,1 M monokālija citrāta un 0,1 N NaOH 18 oC temperatūrā |
|
|
2,0 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
3,8 |
|
9,0 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
4,0 |
|
16,3 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
4,2 |
|
23,7 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
4,4 |
|
31,5 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
4,6 |
|
39,2 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
4,8 |
|
46,7 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
5,0 |
|
54,2 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
5,2 |
|
61,0 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
5,4 |
|
68,0 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
5,6 |
|
74,4 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
5,8 |
|
81,2 ml 0,1 N NaOH + 50 ml citrāta, atšķaida līdz 100 ml |
6,0 |
C. SÖRENSEN:
SĒRENSENA borāta maisījumi
|
Sastāvs |
Sörensen 18 oC |
Walbum, pH |
|||
|
ml, boraka |
HCl/NaOH |
10 oC |
40 oC |
70 oC |
|
|
0,05 M boraks + 0,1 N HCl |
|||||
|
5,25 |
4,75 |
7,62 |
7,64 |
7,55 |
7,47 |
|
5,50 |
4,50 |
7,94 |
7,98 |
7,86 |
7,76 |
|
5,75 |
4,25 |
8,14 |
8,17 |
8,06 |
7,95 |
|
6,00 |
4,00 |
8,29 |
8,32 |
8,19 |
8,08 |
|
6,50 |
3,50 |
8,51 |
8,54 |
8,40 |
8,28 |
|
7,00 |
3,00 |
8,08 |
8,72 |
8,56 |
8,40 |
|
7,50 |
2,50 |
8,80 |
8,84 |
8,67 |
8,50 |
|
8,00 |
2,00 |
8,91 |
8,96 |
8,77 |
8,59 |
|
8,50 |
1,50 |
9,01 |
9,06 |
8,86 |
8,67 |
|
9,00 |
1,00 |
9,09 |
9,14 |
8,94 |
8,74 |
|
9,50 |
0,50 |
9,17 |
9,22 |
9,01 |
8,80 |
|
10,00 |
0,00 |
9,24 |
9,30 |
9,08 |
8,86 |
|
0,05 M boraks + 0,1 N NaOH |
|||||
|
10,0 |
0,0 |
9,24 |
9,30 |
9,08 |
8,86 |
|
9,0 |
1,0 |
9,36 |
9,42 |
9,18 |
8,94 |
|
8,0 |
2,0 |
9,50 |
9,57 |
9,30 |
9,02 |
|
7,0 |
3,0 |
9,68 |
9,76 |
9,44 |
9,12 |
|
6,0 |
4,0 |
9,97 |
10,06 |
9,67 |
9,28 |
SĒRENSENA fosfātu maisījumi
|
Sastāvs |
pH |
|
0,0667 M monokālija fosfāts + 0,0667 M dinātrija fosfāts 20 oC temperatūrā |
|
|
99,2 ml KH2PO4 + 0,8 ml Na2HPO4 |
5,0 |
|
98,4 ml KH2PO4 + 1,6 ml Na2HPO4 |
5,2 |
|
97,3 ml KH2PO4 + 2,7 ml Na2HPO4 |
5,4 |
|
95,5 ml KH2PO4 + 4,5 ml Na2HPO4 |
5,6 |
|
92,8 ml KH2PO4 + 7,2 ml Na2HPO4 |
5,8 |
|
88,9 ml KH2PO4 + 11,1 ml Na2HPO4 |
6,0 |
|
83,0 ml KH2PO4 + 17,0 ml Na2HPO4 |
6,2 |
|
75,4 ml KH2PO4 + 24,6 ml Na2HPO4 |
6,4 |
|
65,3 ml KH2PO4 + 34,7 ml Na2HPO4 |
6,6 |
|
53,4 ml KH2PO4 + 46,6 ml Na2HPO4 |
6,8 |
|
41,3 ml KH2PO4 + 58,7 ml Na2HPO4 |
7,0 |
|
29,6 ml KH2PO4 + 70,4 ml Na2HPO4 |
7,2 |
|
19,7 ml KH2PO4 + 80,3 ml Na2HPO4 |
7,4 |
|
12,8 ml KH2PO4 + 87,2 ml Na2HPO4 |
7,6 |
|
7,4 ml KH2PO4 + 92,6 ml Na2HPO4 |
7,8 |
|
3,7 ml KH2PO4 + 96,3 ml Na2HPO4 |
8,0 |
C.8. TOKSICITĀTES NOTEIKŠANA SLIEKĀM
MĀKSLĪGĀS AUGSNES TESTS
1. METODE
1.1. IEVADS
Šajā laboratoriskajā pārbaudē pārbaudāmo vielu pievieno mākslīgai augsnei, kurā uz 14 dienām ievieto sliekas. Pēc šā laika posma (un vajadzības gadījumā pēc septiņām dienām) pēta attiecīgās vielas nāvējošo ietekmi uz sliekām. Ar šā testa metodi var relatīvi īsā laikā izpētīt ķimikāliju ietekmi uz sliekām saistībā ar šo vielu uzņemšanu caur ādu un ar barību.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
LC50 (vidējā letālā koncentrācija): vielas koncentrācija, kas testa laikā nogalina 50 % testa dzīvnieku.
1.3. STANDARTVIELA
Standartvielu izmanto regulāri, lai parādītu, ka testa sistēmas jutība nav būtiski mainījusies.
Ieteicamā standartviela ir analītiski tīrs hloracetamīds.
1.4. TESTA PRINCIPS
Augsne ir mainīga vide, tādēļ šajā testā izmanto smilšmālu, kura sastāvs ir rūpīgi definēts. Pieaugušas Eisenia foetida sugas sliekas (skatīt piezīmi papildinājumā) tur noteiktā mākslīgajā augsnē, kuru apstrādā ar pārbaudāmo vielu dažādās koncentrācijās. Konteineru saturu 14 dienas (un vajadzības gadījumā septiņas dienas) pēc testa sākuma izklāj uz paplātes un saskaita izdzīvojušās sliekas pie katras koncentrācijas.
1.5. KVALITĀTES KRITĒRIJI
Tests izstrādāts tā, lai tas būtu pēc iespējas precīzāk reproducējams testa substrāta un testa organismu ziņā. Mirstība kontrolsubstrātā testa beigās nedrīkst pārsniegt 10 %, citādi testa rezultāti ir nederīgi.
1.6. TESTA METODES APRAKSTS
1.6.1. Materiāli
1.6.1.1.
Testa pamatsubstrāts ir mākslīgā augsne ar noteiktu sastāvu.
a) Pamatsubstrāts (norādīts sausnas procentuālais sastāvs)
— 10 % sfagnu kūdras (pēc iespējas tuvāk pH vērtībai robežās no 5,5 līdz 6,0, bez redzamām augu atliekām, smalka maluma),
— 20 % kaolinīta māla, kura sastāvā, vēlams, ir vairāk nekā 50 % kaolinīta,
— apmēram 69 % rūpniecisko kvarca smilšu (pārsvarā smalkā smilts, kurā vairāk nekā 50 % daļiņu ir izmērā no 0,05 līdz 0,2 mm). Ja vielas dispersija ūdenī ir nepietiekoša, uz katru testa konteineru vajadzētu būt pieejamiem 10 g vielas, kas paredzēti vēlākai iejaukšanai pārbaudāmā vielā,
— apmēram 1 % kalcija karbonāta (CaCO3), kas ir pulverizēts, ķīmiski tīrs un pievienots, lai pH vērtība būtu 6,0 ± 0,5.
b) Testa substrāts
Testa substrāta sastāvā ir pamatsubstrāts, pārbaudāmā viela un dejonizēts ūdens.
Ūdens saturs ir apmēram 25 līdz 42 % no pamatsubstrāta sausnas. Substrāta ūdens saturu nosaka, izžāvējot paraugu līdz nemainīgam svaram 105 oC temperatūrā. Galvenais kritērijs mākslīgās augsnes samitrināšanā ir tāds, ka samitrinātajā augsnē nav stāvoša ūdens. Maisot jānodrošina pārbaudāmās vielas vienmērīga izplatība substrātā. Jānorāda, kāds paņēmiens izmantots, lai pārbaudāmo vielu iemaisītu substrātā.
c) Kontrolsubstrāts
Kontrolsubstrāts sastāv no pamatsubstrāta un ūdens. Ja izmanto kādu piedevu, tad jābūt papildu kontrolsubstrātam, kura sastāvā ir tāds pats daudzums minētās piedevas.
1.6.1.2.
Stikla konteineri ar tilpību aptuveni viens litrs (pienācīgi nosegti ar plastmasas vākiem, šķīvjiem vai plastmasas plēvi, kurā ir caurumi ventilācijai), piepildīti ar tādu mitra testa substrāta vai kontrolsubstrāta daudzumu, kas ir līdzvērtīgs 500 g substrāta sausnas.
1.6.2. Testa apstākļi
Konteineri jātur klimata kontroles kamerā 20 ± 2 oC temperatūrā un pastāvīgā apgaismojumā. Gaismas intensitātei jābūt no 400 līdz 800 luksiem.
Testa ilgums ir 14 dienas, bet vajadzības gadījumā mirstību var novērtēt arī septiņas dienas pēc testa sākuma.
1.6.3. Testa metode
Pārbaudāmās vielas koncentrāciju izsaka ar vielas svaru uz pamatsubstrāta sausnas vienību (mg/kg).
To koncentrāciju diapazonu, kas izraisa mirstību 0 līdz 100 % apmērā, var noskaidrot ar iedarbības diapazona noteikšanas testu, šādi iegūstot informāciju par galīgajā testā izmantojamo koncentrāciju diapazonu.
Viela jātestē šādās koncentrācijās: 1 000; 100; 10; 1; 0,1 mg vielas uz kilogramu testa substrāta (sausna).
Ja paredzēts veikt pilnīgu galīgo testu, tad iedarbības diapazona noteikšanas testā pietiek ar vienu testa partiju katrai koncentrācijai un vienu neapstrādātu kontrolpartiju, kur katrā partijā ir 10 sliekas.
Iedarbības diapazona noteikšanas testa rezultātus izmanto, lai atlasītu vismaz piecas ģeometrisku sēriju veidojošas koncentrācijas, kas izraisa mirstību 0 līdz 100 % apmērā un viena no otras atšķiras ar nemainīga lieluma faktoru, kurš nepārsniedz 1,8.
Ar testiem, kuros izmanto šādas koncentrāciju sērijas, vajadzētu spēt noteikt LC50 vērtību un tās ticamības robežas tik precīzi, cik vien tas iespējams.
Galīgajā testā izmanto vismaz četras testa partijas katrai koncentrācijai un četras neapstrādātas kontrolpartijas, kur katrā ir 10 sliekas. No šīm partijām iegūtos rezultātus uzrāda kā vidējo vērtību un standartnovirzi.
Ja divas secīgas koncentrācijas, kuru attiecība ir 1,8, izraisa tikai 0 % un 100 % mirstību, tad pietiek ar šīm divām vērtībām, lai noteiktu diapazonu, kam atbilst LC50 vērtība.
Testa substrātu, ja iespējams, sagatavo, neizmantojot papildu aktīvās vielas, bet tikai ūdeni. Tieši pirms testa sākuma pārbaudāmās vielas emulsiju vai dispersiju dejonizētā ūdenī vai citā šķīdinātājā iemaisa testa pamatsubstrātā vai vienmērīgi izsmidzina uz tā virsmas, izmantojot smalku hromatogrāfisku vai tamlīdzīgu smidzinātāju.
Ja pārbaudāmā viela nešķīst ūdenī, to var izšķīdināt pēc iespējas mazākā tilpumā piemērota organiska šķīdinātāja (piemēram, heksāna, acetona vai hloroforma).
Pārbaudāmās vielas šķīdināšanai, disperģēšanai vai emulģēšanai drīkst izmantot tikai tādas aktīvās vielas, kas tūlīt izgaist. Testa substrāts pirms izmantošanas jāventilē. Iztvaikojušā ūdens daudzums jāaizstāj. Ja izmanto papildu aktīvās vielas, tad kontrolpartijā tām jābūt tikpat lielā daudzumā.
Ja pārbaudāmā viela nav izšķīdināma, disperģējama vai emulģējama organiskos šķīdinātājos, tad 10 g maisījuma, kas sastāv no smalkas kvarca smilts un tāda pārbaudāmās vielas daudzuma, kas vajadzīgs, lai apstrādātu 500 g mākslīgās augsnes sausnas, samaisa ar 490 g testa substrāta sausnas.
Testa partiju veido, ievietojot stikla konteinerā tādu daudzumu mitra testa substrāta, kas atbilst 500 g sausnas, un uz šā testa substrāta virsmas uzliekot 10 sliekas, kuras 24 stundas ir kondicionētas līdzvērtīgā mitrā pamatsubstrātā un pēc tam ātri nomazgātas, pirms slieku izmantošanas lieko ūdeni nosusinot ar filtrpapīru.
Konteinerus pārsedz ar perforētiem plastmasas vākiem, šķīvjiem vai plēvi, lai novērstu substrāta izžūšanu, un tos 14 dienas tur testa apstākļos.
Novērtējums jāveic 14 dienas (un vajadzības gadījumā septiņas dienas) pēc testa sākuma. Substrātu izlīdzina uz stikla vai nerūsējošā tērauda plāksnes. Apskata sliekas un nosaka izdzīvojušo slieku skaitu. Slieku uzskata par nedzīvu, ja tā nereaģē uz vieglu mehānisku kairinājumu priekšgalā.
Ja mirstību pārbauda pēc septiņām dienām, tad pēc pārbaudes konteineru atkal piepilda ar to pašu testa substrātu un izdzīvojušās sliekas novieto uz šā substrāta virsmas.
1.6.4. Testa organismi
Testa organismi ir pieauguši Eisenia foetida īpatņi (skatīt piezīmi papildinājumā) (vismaz divus mēnešus veci, ar jostiņu), kuru svars ir no 300 līdz 600 mg. (Pavairošanas metodi skatīt papildinājumā.)
2. DATI
2.1. REZULTĀTU APSTRĀDE UN NOVĒRTĒŠANA
Testētās vielas koncentrācijas norāda kopā ar atsauci uz atbilstošajiem bojāgājušo slieku procentuālajiem daudzumiem.
Ja dati ir adekvāti, tad LC50 vērtību un ticamības robežas (p = 0,05) nosaka ar standartmetodēm (Ličfīlds un Vilkoksons, 1949, vai līdzvērtīga metode). LC50 vērtību izsaka miligramos pārbaudāmās vielas uz kilogramu testa substrāta (sausna).
Ja koncentrācijas līknes slīpums ir pārāk stāvs, lai varētu aprēķināt LC50 vērtību, pietiek ar šīs vērtības grafisku novērtējumu.
Ja divas secīgas koncentrācijas, kuru attiecība ir 1,8, izraisa tikai 0 % un 100 % mirstību, tad pietiek ar šīm divām vērtībām, lai noteiktu diapazonu, kam atbilst LC50 vērtība.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, ietver šādu informāciju:
— apgalvojums, ka tests ir veikts saskaņā ar iepriekšminētajiem kvalitātes kritērijiem,
— testa veids (iedarbības diapazona noteikšanas tests un/vai galīgais tests),
— precīzs testa apstākļu apraksts vai apgalvojums, ka tests ir veikts saskaņā ar attiecīgo metodi,
— jānorāda visas atkāpes, precīzs tā paņēmiena apraksts, kas izmantots, lai pārbaudāmo vielu iemaisītu testa pamatsubstrātā,
— informācija par testa organismiem (suga, vecums, vidējais svars un svara diapazons, turēšanas un pavairošanas apstākļi, piegādātājs),
— LC50 noteikšanas metode,
— testa rezultāti, kā arī visi izmantotie dati,
— novēroto simptomu vai testa organismu uzvedības izmaiņu apraksts,
— mirstība kontrolsubstrātā,
— LC50 vai augstākā testētā koncentrācija bez mirstības un zemākā testētā koncentrācija ar 100 % mirstību 14 dienas (un, ja vajadzīgs, septiņas dienas) pēc testa sākuma,
— koncentrācijas/ietekmes līkne,
— ar standartvielu iegūtie rezultāti, kas var būt saistīti ar konkrēto testu vai ar agrākiem kvalitātes kontroles pasākumiem.
4. IZMANTOTĀ LITERATŪRA
(1) OECD, Paris, 1981, Test Guideline 207, Decision of the Council C(81)30 final.
(2) Edwards, C. A. and Lofty, J.R., 1977, Biology of Earthworms, Chapman and Hall, London, p. 331.
(3) Bouche. M. B., 1972, Lombriciens de France, Ecologie et Systematique, Institut National de la Recherche Agronomique, p. 671.
(4) Litchfield, J. T. andWilcoxon, F., A simplified method of evaluation dose effect experiments. I. Pharm. Exp. Therap., vol. 96, 1949, p. 99.
(5) Commission of the European Communities, Development of a standardised laboratory method for assessing the toxicity of chemical substances to earthworms, Report EUR 8714 EN, 1983.
(6) Umweltbundesamt/Biologische Bundesanstalt für land- und Forstwirtschaft, Berlin, 1984, Verfahrensvorschlag “Toxizitätstest am Regenwurm Eisenia foetida in künstlichem Boden”, in: Rudolph/Boje, Ökotoxikologie, ecomed, Landsberg, 1986.
Papildinājums
Slieku pavairošana un turēšana pirms testēšanas
Slieku pavairošanas nolūkā 30 līdz 50 pieaugušas sliekas ievieto pavairošanas kastē ar svaigu substrātu un pēc 14 dienām izņem no tās. Šos dzīvniekus var izmantot tālākai pavairošanai. No kokoniem izšķīlušās sliekas testēšanai izmanto, kad tās ir sasniegušas briedumu (saskaņā ar paredzētajiem apstākļiem – pēc diviem vai trim mēnešiem).
Turēšanas un pavairošanas apstākļi
|
Klimata kontroles kamera |
: |
temperatūra 20 ± 2 oC, vēlams pastāvīgs apgaismojums (intensitāte no 400 līdz 800 luksiem). |
|
Pavairošanas kastes |
: |
piemēroti, sekli konteineri, kuru tilpums ir no 10 līdz 20 l. |
|
Substrāts |
: |
Eisenia foetida var pavairot dažādu dzīvnieku ekskrementos. Ieteicams par pavairošanas substrātu izmantot maisījumu, kurā 50 % tilpuma ir kūdra un 50 % – liellopu vai zirgu mēsli. pH vērtībai šajā substrātā jābūt apmēram 6 līdz 7 (to regulē ar kalcija karbonātu), un substrātam jābūt ar zemu jonu vadītspēju (mazāk nekā 6 mmhos vai 0,5 % sāls koncentrācijas). Substrātam jābūt mitram, bet ne pārāk slapjam. Bez iepriekš aprakstītās metodes var izmantot arī citus sekmīgi lietotus paņēmienus. |
Piezīme: ir divas Eisenia foetida pasugas, kuras daži taksonomisti nodala kā atsevišķas sugas (Bušs, 1972). Morfoloģiski tās ir līdzīgas, bet vienai, Eisenia foetida foetida, raksturīgs šķērsenisks segmentu iesvītrojums, kamēr otrai, Eisenia foetida andrei, tāda nav, toties novērojams daudzveidīgs iesarkans krāsojums. Ja iespējams, jāizmanto Eisenia foetida andrei. Citas sugas var izmantot tad, ja ir pieejama vajadzīgā metodoloģija.
C.9. BIODEGRADĀCIJA
CĀNA-VELLENA TESTS
1. METODE
1.1. IEVADS
Šīs metodes mērķis ir statiskā testā izvērtēt ūdenī šķīstošu, negaistošu organisku vielu maksimālo iespējamo bioloģiskās noārdīšanās spēju apstākļos, kad tās pakļauj relatīvi augstā koncentrācijā esošu mikroorganismu iedarbībai.
Interpretējot rezultātus (skatīt 3.2. punktu), jāņem vērā tas, ka ir iespējama fizikāli ķīmiskā adsorbcija uz suspendētajām daļiņām.
Pētāmās vielas izmanto koncentrācijās, kas atbilst IOO vērtībām diapazonā no 50 līdz 400 mg/l vai ĶSP vērtībām diapazonā no 100 līdz 1 000 mg/l (IOO = izšķīdis organiskais ogleklis; ĶSP = ķīmiskais skābekļa patēriņš). Šīs koncentrācijas, lai arī relatīvi augstas, ir analītiski ticamas. Savienojumi ar toksiskām īpašībām var novilcināt vai kavēt noārdīšanās procesu.
Šajā metodē pārbaudāmās vielas maksimālās bioloģiskās noārdīšanās spējas novērtēšanai izmanto izšķīdušā organiskā oglekļa koncentrācijas vai ķīmiskā skābekļa patēriņa mērījumus.
Ja vienlaikus izmanto kādu īpašu analīzes metodi, ir iespējams novērtēt vielas pirmējo biodegradāciju (sākotnējās ķīmiskās struktūras izzušanu).
Šī metode piemērojama tikai tādām organiskām pārbaudāmām vielām, kurām testā izmantotajā koncentrācijā ir šādas īpašības:
— testa apstākļos tās ir ūdenī šķīstošas,
— testa apstākļos tām ir neliels tvaika spiediens,
— nav inhibējošas ietekmes uz baktērijām,
— testa sistēma tās adsorbē tikai ierobežotā apmērā,
— tās neizdalās no testa šķīduma putošanas dēļ.
Iegūto rezultātu interpretēšanā noder informācija par pārbaudāmā materiāla galveno sastāvdaļu relatīvo īpatsvaru, sevišķi tajos gadījumos, kad rezultāti ir skaitliski nelieli vai tuvi kritiskajai robežai.
Skaitliski nelielu rezultātu interpretēšanā un piemērotu testa koncentrāciju izvēlē vēlams izmantot informāciju par attiecīgās vielas toksicitāti mikroorganismiem.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Testa beigās sasniegto noārdīšanās pakāpi sauc par “biodegradāciju Cāna-Vellena testā”:

kur:
|
DT |
= |
biodegradācija (%) laikā T, |
|
CA |
= |
IOO (vai ĶSP) vērtības testa maisījumā, mērītas trīs stundas pēc testa sākuma (mg/l) (IOO izšķīdis organiskais ogleklis; ĶSP = ķīmiskais skābekļa patēriņš), |
|
CT |
= |
IOO vai ĶSP vērtības testa maisījumā parauga ņemšanas laikā (mg/l), |
|
CB |
= |
IOO vai ĶSP vērtība tukšajā analīzē parauga ņemšanas laikā (mg/l), |
|
CBA |
= |
IOO vai ĶSP vērtība tukšajā analīzē, mērīta trīs stundas pēc testa sākuma (mg/l). |
Noārdīšanās pakāpes vērtību noapaļo līdz tuvākajam veselajam skaitlim.
Noārdīšanās procentuālo apjomu izsaka ar IOO (vai ĶSP) procentuālo daudzumu, kas raksturo testētās vielas noārdīšanu.
Trīs stundas pēc testa sākuma izmērītās vērtības un aprēķinātās vai, vēlams, izmērītās sākotnējās vērtības starpība var sniegt noderīgu informāciju par testētās vielas noārdīšanu (skatīt 3.2. punktu “Rezultātu interpretēšana”).
1.3. STANDARTVIELAS
Dažos gadījumos, kad notiek jaunu vielu izpēte, var būt lietderīgi izmantot standartvielas, tomēr ieteikt konkrētas standartvielas pagaidām nevar.
1.4. TESTA METODES PRINCIPS
Aktīvās dūņas, barības minerālvielas un pārbaudāmo materiālu kā vienīgo oglekļa avotu ūdens šķīdumā visus kopā ievieto viena līdz četru litru tilpuma stikla traukā, kas aprīkots ar maisītāju un aeratoru. Maisījumu līdz 28 dienas ilgā laika posmā maisa un aerē 20–25 oC temperatūrā izkliedētā apgaismojumā vai tumšā telpā. Noārdīšanās procesu novēro, reizi dienā vai citā piemērotā un regulārā laika intervālā nosakot IOO (vai ĶSP) vērtības filtrētajā šķīdumā. Pēc katra laika intervāla izdalītā IOO (vai ĶSP) un trīs stundas pēc testa sākuma izmērītās vērtības attiecību izsaka kā biodegradācijas procentuālo apmēru un ar šo attiecību raksturo noārdīšanās pakāpi konkrētajā laika posmā. Rezultātu atliek diagrammā attiecībā pret laiku, tā iegūstot biodegradācijas līkni.
Ja izmanto kādu īpašu analīzes metodi, var mērīt biodegradācijas izraisītās izmaiņas sākotnējo molekulu koncentrācijā (pirmējā biodegradācija).
1.5. KVALITĀTES KRITĒRIJI
Gredzena testā šā testa reproducējamība ir atzīta par apmierinošu.
Metodes jutību lielā mērā nosaka tukšās analīzes mainīgums un – mazākā mērā – izšķīdušā organiskā oglekļa un maisījumā esošā pārbaudāmā savienojuma koncentrācijas noteikšanas precizitāte.
1.6. TESTA METODES APRAKSTS
1.6.1. Sagatavošanās testam
1.6.1.1.
Testa ūdens: dzeramais ūdens, kurā organiskā oglekļa saturs ir mazāks par 5 mg/l. Kalcija un magnija jonu kopējā koncentrācija nedrīkst pārsniegt 2,7 mmol/l; pretējā gadījumā jāizmanto atbilstīgs atšķaidījums ar dejonizētu vai destilētu ūdeni.
|
Sērskābe, analītiskais reaģents (A. R.): |
50 g/l |
|
Nātrija hidroksīda šķīduma A. R.: |
40 g/l |
|
Barības minerālvielu šķīdums; izšķīdināt vienā litrā dejonizēta ūdens: |
|
|
amonija hlorīds, NH4Cl, A. R.: |
38,5 g |
|
nātrija dihidrogēnfosfāts, NaH2PO4.2H2O, A. R.: |
33,4 g |
|
kālija dihidrogēnfosfāts, KH2PO4, A. R.: |
8,5 g |
|
dikālija monohidrogēnfosfāts, K2HPO4, A. R.: |
21,75 g |
Maisījums izmantojams gan kā barības viela, gan kā bufersistēma.
1.6.1.2.
Stikla trauki, kuru tilpums ir viens līdz četri litri (piemēram, cilindriski trauki).
Maisītājs ar stikla vai metāla maisītājierīci, kas uzmontēta uz piemērotas vārpstas (maisītājierīcei jārotē apmēram 5–10 cm virs trauka dibena). Tās vietā var izmantot magnētisku maisītājierīci ar 7–10 cm garu stienīti.
Stikla caurulīte, kuras iekšējais diametrs ir 2–4 mm un kura paredzēta gaisa pievadei. Caurulītes atverei jāatrodas aptuveni 1 cm virs trauka dibena.
Centrifūga (aptuveni 3 550 g).
pH mērierīce.
Izšķīdušā skābekļa mērierīce.
Papīra filtri.
Membrānfiltrācijas iekārta.
Membrānfiltri, poru izmērs 0,45 μn. Membrānfiltri ir derīgi tad, ja tie visos filtrēšanas etapos nodrošina oglekļa necaurlaidību un neabsorbē pārbaudāmo vielu.
Analītiskās iekārtas organiskā oglekļa satura un ķīmiskā skābekļa patēriņa noteikšanai.
1.6.1.3.
Aktīvās dūņas no bioloģiskajām attīrīšanas iekārtām mazgā, tās (atkārtoti) centrifugējot vai izgulsnējot testa ūdenī (skatīt iepriekš).
Aktīvajām dūņām jābūt atbilstošā stāvoklī. Šādas dūņas ir pieejamas pienācīgi strādājošās notekūdeņu attīrīšanas iekārtās. Lai iegūtu pēc iespējas vairāk dažādu baktēriju sugu vai celmu, var pagatavot inokulātu maisījumu no dažādiem avotiem (piemēram, dažādas attīrīšanas iekārtas, augsnes ekstrakti, upes ūdeņi u. c.). Šis maisījums jāapstrādā, kā aprakstīts iepriekš.
Informācijai par aktīvo dūņu aktivitātes testu skatīt punktu “Funkcionalitātes kontrole” turpmāk.
1.6.1.4.
Testa traukā ievieto 500 ml testa ūdens, 2,5 ml/l barības minerālvielu šķīduma un aktīvās dūņas tādā daudzumā, kas atbilst no 0,2 līdz 1,0 g/l sausnas galīgajā maisījumā. Pievieno pietiekamu daudzumu pārbaudāmās vielas standartšķīduma, lai galīgajā maisījumā IOO koncentrācija būtu no 50 līdz 400 mg/l. Atbilstošā ĶSP vērtība ir no 100 līdz 1 000 mg/l. Maisījumu uzpilda ar testa ūdeni tā, lai kopējais tilpums būtu no viena līdz četriem litriem. Kopējais tilpums, kas jāizvēlas, ir atkarīgs no to paraugu skaita, kurus paredzēts ņemt, lai noteiktu IOO vai ĶSP, un no tilpumiem, kas vajadzīgi analītiskās procedūras mērķiem.
Parasti pietiek ar divu litru tilpumu. Katrā testa sērijā līdz ar citiem uzstāda vismaz vienu kontroltrauku (tukšā analīze); tajā ir tikai aktīvās dūņas un barības minerālvielu šķīdums, kas uzpildīts ar testa ūdeni līdz tādam pašam kopējam tilpumam, kāds ir testa traukos.
1.6.2. Testa veikšana
Testa trauku saturu 20–25 oC temperatūrā un izkliedētā apgaismojumā vai tumšā telpā maisa ar magnētiskām maisītājierīcēm vai ar dzenskrūvēm. Aerāciju veic ar saspiestu gaisu, ko attīra ar kokvilnas filtru un vajadzības gadījumā ar skalotni. Jānodrošina, lai dūņas neizgulsnējas un lai skābekļa koncentrācija nenoslīd zem 2 mg/l.
Regulāri (piemēram, katru dienu) jāpārbauda pH vērtība un vajadzības gadījumā tā jākoriģē, lai pH vērtība būtu 7–8.
Iztvaikošanas radītos zudumus kompensē, tieši pirms katras paraugu ņemšanas pievienojot nepieciešamo daudzumu dejonizēta vai destilēta ūdens. Laba prakse ir pirms testa sākuma uz trauka atzīmēt šķidruma līmeni. Pēc katras paraugu ņemšanas reizes (bez aerācijas un maisīšanas) izdara jaunas atzīmes. Pirmos paraugus vienmēr ņem trīs stundas pēc testa sākuma, lai šādi noteiktu aktīvo dūņu adsorbētā pārbaudāmā materiāla daudzumu.
Pārbaudāmā materiāla noārdīšanu novēro, katru dienu vai kādā citā regulārā intervālā veicot IOO vai ĶSP noteikšanu. No testa trauka un tukšās analīzes ņemtos paraugus filtrē caur rūpīgi mazgātu papīra filtru. Pirmos 5 ml testa šķīduma filtrāta izlej. Grūti filtrējamas dūņas var iepriekš atdalīt, paraugu 10 minūtes centrifugējot. IOO un ĶSP ikreiz nosaka vismaz divos atkārtojumos. Maksimālais testa ilgums ir 28 dienas.
Piezīme: duļķainos paraugus filtrē caur membrānfiltriem. Membrānfiltri nedrīkst laist cauri vai adsorbēt nekādu organisku materiālu.
Katrā testa sērijā līdz ar citiem jāuzstāda arī trauks, kurā atrodas zināma viela, lai šādi pārbaudītu aktīvo dūņu darbspēju. Šim nolūkam labi der dietilēnglikols.
Ja analīzes veic ar relatīvi īsām laika atstarpēm (piemēram, katru dienu), tad noārdīšanās līknē (skatīt 2. attēlu) pielāgojumi ir skaidri redzami. Tādēļ testu nevajadzētu sākt tieši pirms iknedēļas brīvdienām.
Ja pielāgošana notiek testa beigās, tad testu var paildzināt, kamēr noārdīšanās beidzas.
Piezīme: ja vajadzīgas sīkākas ziņas par pielāgoto dūņu dzīvības procesiem, tad tās pašas aktīvās dūņas vēlreiz ievieto tajā pašā pārbaudāmā materiālā saskaņā ar šādu procedūru.
Izslēdz maisītāju un aeratoru un ļauj aktīvajām dūņām nogulsnēties. Nosmeļ šķidruma virsslāni, uzpilda to ar testa ūdeni līdz divu litru tilpumam, maisa 15 minūtes un atkal ļauj nogulsnēties. Vēlreiz nosmeļ šķidruma virsslāni un, izmantojot atlikušās dūņas, atkārto testu ar to pašu materiālu, kā aprakstīts iepriekš 1.6.1.4. un 1.6.2. punktā. Aktīvās dūņas var atdalīt arī centrifugējot, nevis izgulsnējot.
Pielāgotās dūņas var samaisīt ar svaigām dūņām, lai koncentrācija būtu 0,2–1 g sausnas uz litru.
Parasti paraugus filtrē caur rūpīgi mazgātu papīra filtru (mazgāšanai izmanto dejonizētu ūdeni).
Duļķainos paraugus filtrē caur membrānfiltriem (0,45 μm).
Izmantojot kopējā organiskā oglekļa (TOC) rādītāju, divos atkārtojumos nosaka IOO koncentrāciju paraugu filtrātos (pirmos 5 ml izlej). Ja filtrātu nav iespējams analizēt tajā pašā dienā, tad līdz nākamajai dienai tas jāuzglabā ledusskapī. Ilgāka uzglabāšana nav ieteicama.
ĶSP koncentrāciju nosaka paraugu filtrātos ar ĶSP analītisko gatavību un saskaņā ar izmantotās literatūras sarakstā (2) aprakstīto metodi.
2. DATI UN TO NOVĒRTĒŠANA
IOO un/vai ĶSP koncentrācijas paraugos nosaka vismaz divos atkārtojumos, kā aprakstīts iepriekš 1.6.2. punktā. Noārdīšanos laikā T aprēķina pēc formulas (pie definīcijām), kā norādīts iepriekš 1.2. punktā.
Noārdīšanās pakāpes vērtību noapaļo līdz tuvākajam veselajam skaitlim. Testa beigās sasniegto noārdīšanās pakāpi sauc par “biodegradāciju Cāna-Vellena testā”.
Piezīme: ja pilnīga noārdīšanās notikusi pirms testam atvēlētā laika beigām un ja šo rezultātu apstiprina nākamajā dienā veikta otra analīze, tad testu var beigt.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, ietver šādu informāciju:
— vielas sākotnējā koncentrācija,
— visa pārējā informācija un eksperimentālie rezultāti, kas attiecas uz testēto vielu, standartvielu, ja tāda ir izmantota, un tukšo analīzi,
— vielas koncentrācija pēc trim stundām,
— biodegradācijas līkne un tās apraksts,
— testa organismu ievākšanas datums un vieta, pielāgotības statuss, izmantotā koncentrācija u. c.,
— zinātnisks pamatojums visām testa metodes izmaiņām.
3.2. REZULTĀTU INTERPRETĀCIJA
IOO (ĶSP) samazināšanās, kas notiek pakāpeniski vairāku dienu vai nedēļu laikā, norāda uz to, ka pārbaudāmā viela tiek bioloģiski noārdīta.
Tomēr dažos gadījumos var izpausties fizikālķīmiskā adsorbcija, un uz to norāda pilnīga vai daļēja vielas izzušana jau no paša sākuma, pirmo trīs stundu laikā, kā arī tas, ka kontrolmaisījuma un testa maisījuma virsslāņu kvalitatīvā atšķirība saglabājas negaidīti maza.
Lai nodalītu biodegradāciju (vai daļēju biodegradāciju) no adsorbcijas, jāveic turpmāki testi.
To var veikt vairākos veidos, bet vispārliecinošākais ir izmantot šķīduma virsslāni vai dūņas par inokulātu galvenajā sarakstā iekļautā testā (vēlams – respirometriskā testā).
Pārbaudāmās vielas, kam šajā testā raksturīga stipra neadsorbējoša IOO (ĶSP) samazināšanās, uzskatāmas par potenciāli bioloģiski noārdāmām. Daļēja neadsorbējoša samazināšanās norāda uz to, ka ķīmiskā viela vismaz daļēji ir bioloģiski noārdāma. Vāju IOO (ĶSP) samazināšanos vai tās trūkumu var būt izraisījusi pārbaudāmās vielas inhibējošā iedarbība uz mikroorganismiem, uz ko norāda arī līze un dūņu zudums, kā rezultātā šķīduma virsslānis ir duļķains. Tests jāatkārto ar zemāku pārbaudāmās vielas koncentrāciju.
Lielāku jutību iespējams sasniegt, izmantojot savienojumam specifisku analīzes metodi vai ar radioaktīvo oglekli 14C marķētu pārbaudāmo vielu. Ar 14C marķēta pārbaudāmā savienojuma gadījumā to, ka ir notikusi biodegradācija, apstiprina 14CO2 atgūšana.
Ja rezultāti raksturo pirmējo biodegradāciju, tad iespēju robežās jāizskaidro ķīmiskās struktūras izmaiņas, kas izraisa reakcijas zudumu sākotnējā pārbaudāmā vielā.
Analīzes metodes validācija jāsniedz kopā ar tukšajā analīzē iegūto rezultātu.
4. IZMANTOTĀ LITERATŪRA
(1) OECD, Paris, 1981, Test Guideline 302 B, Decision of the Council C(81) 30 final.
(2) Pielikums V C.9 “Sadalīšanās – ķīmiskais skābekļa patēriņš”, Komisijas Direktīva 84/449/EEK (OV L 251, 19.9.1984., 1. lpp.).
Papildinājums
NOVĒRTĒJUMA PIEMĒRS
|
Organiskais savienojums: |
4-etoksibenzoskābe |
|
Teorētiskā testa koncentrācija |
600 mg/1 |
|
Teorētiskais IOO |
390 mg/l |
|
Inokulāts: |
... notekūdeņu attīrīšanas iekārtas |
|
Koncentrācija: |
1 grams sausnas uz litru |
|
Pielāgotības statuss |
nav pielāgots |
|
Analīze: |
IOO noteikšana |
|
Parauga apjoms: |
3 ml |
|
Kontrolviela: |
dietilēnglikols |
|
Savienojuma toksicitāte: |
koncentrācijā zem 1 000 mg/l toksiskas iedarbības nav Izmantotais tests: fermentācijas tests ar stobriņu metodi |
|
Testa laiks |
Kontrolviela |
Pārbaudāmā viela |
|||||
|
Tukšā analīze, IOO (1), mg/l |
IOO (1), mg/l |
IOO, tīrais, mg/l |
Noārdīšanās % |
IOO (1), mg/l |
IOO, tīrais, mg/l |
Noārdīšanās % |
|
|
0 |
— |
— |
300,0 |
— |
— |
390,0 |
— |
|
3 stundas |
4,0 |
298,0 |
294,0 |
2 |
371,6 |
367,6 |
6 |
|
1 diena |
6,1 |
288,3 |
282,2 |
6 |
373,3 |
367,2 |
6 |
|
2 dienas |
5,0 |
281,2 |
276,2 |
8 |
360,0 |
355,0 |
9 |
|
5 dienas |
6,3 |
270,5 |
264,2 |
12 |
193,8 |
187,5 |
52 |
|
6 dienas |
7,4 |
253,3 |
245,9 |
18 |
143,9 |
136,5 |
65 |
|
7 dienas |
11,3 |
212,5 |
201,2 |
33 |
104,5 |
93,2 |
76 |
|
8 dienas |
7,8 |
142,5 |
134,7 |
55 |
58,9 |
51,1 |
87 |
|
9 dienas |
7,0 |
35,0 |
28,0 |
91 |
18,1 |
11,1 |
97 |
|
10 dienas |
18,0 |
37,0 |
19,0 |
94 |
20,0 |
2,0 |
99 |
|
(1) Trīskāršu atkārtojumu vidējās vērtības. |
|||||||
1. attēls
Biodegradācijas līkņu piemēri

2. attēls
Dūņu pielāgošanas piemēri

C.10. BIODEGRADĀCIJA
AKTĪVO DŪŅU IMITĀCIJAS TESTI
1. METODE
1.1. IEVADS
1.1.1. Vispārīgas piezīmes
Šī metode piemērojama tikai tādām organiskām vielām, kurām testā izmantotajā koncentrācijā ir šādas īpašības:
— tās šķīst ūdenī tiktāl, cik vajadzīgs testa šķīdumu sagatavošanai,
— testa apstākļos tām ir neliels tvaika spiediens,
— tām nav inhibējošas ietekmes uz baktērijām.
Iegūto rezultātu interpretēšanā noder informācija par pārbaudāmā materiāla galveno sastāvdaļu relatīvo īpatsvaru, sevišķi tajos gadījumos, kad rezultāti ir skaitliski nelieli vai tuvi kritiskajai robežai.
Skaitliski nelielu rezultātu interpretēšanā un piemērotu testa koncentrāciju izvēlē vēlams izmantot informāciju par attiecīgās vielas toksicitāti mikroorganismiem.
1.1.2. Maksimālās bioloģiskās noārdīšanās spējas noteikšana (IOO/ĶSP analīze)
Šīs metodes mērķis ir noteikt maksimālo bioloģiskās noārdīšanās spēju, mērot attiecīgās vielas izzušanu un visus metabolītus aktīvo dūņu iekārtas modelī, kur pārbaudāmās vielas koncentrācija atbilst > 12 mg IOO uz litru (jeb aptuveni 40 mg ĶSP uz litru); optimālā koncentrācija varētu būt 20 mg IOO uz litru. (IOO = izšķīdis organiskais ogleklis; ĶSP = ķīmiskais skābekļa patēriņš.)
Pārbaudāmā materiālā jānosaka organiskā oglekļa saturs (vai ķīmiskais skābekļa patēriņš).
1.1.3. Pirmējās biodegradācijas noteikšana (īpašā analīze)
Šīs metodes mērķis ir pirmējās biodegradācijas noteikšana aktīvo dūņu iekārtas modelī ar pārbaudāmās vielas koncentrāciju aptuveni 20 mg/l, izmantojot īpašu analīzes metodi (ja analīzes metode un ar toksicitāti saistīti apsvērumi to pieļauj, var izmantot zemāku vai augstāku koncentrāciju). Tas ļauj novērtēt vielas pirmējo biodegradāciju (sākotnējās ķīmiskās struktūras izzušanu).
Šīs metodes mērķis nav testētās vielas mineralizācijas pakāpes noteikšana.
Jābūt pieejamai atbilstošai analīzes metodei, lai varētu noteikt testēto vielu.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
1.2.1. IOO/ĶSP analīze
Attiecīgās vielas noārdīšanās pakāpi nosaka pēc šādas formulas:
|
|
(1. a)) |
kur:
|
DR |
= |
pārbaudāmā materiāla noārdīšanās pakāpe procentos no IOO (vai ĶSP) dotajā vidējā izdalīšanas laikā, |
|
T |
= |
pārbaudāmā materiāla koncentrācija ieplūdē, mg IOO/l (vai mg ĶSP/l), |
|
E |
= |
IOO (vai ĶSP) koncentrācija izplūdē no testa vienības, mg IOO/l (vai mg ĶSP/l), |
|
Eo |
= |
IOO (vai ĶSP) koncentrācija izplūdē no tukšās vienības, mg IOO/l (vai mg ĶSP/l). |
Noārdīšanos izsaka ar procentuālo IOO (vai ĶSP) samazinājumu dotajā izdalīšanas laikā attiecībā uz pārbaudāmo materiālu.
1.2.2. Īpašā analīze
Pārbaudāmās vielas izzušanu no ūdens fāzes (Rw) dotajā vidējā izdalīšanas laikā procentuāli aprēķina pēc šādas formulas:
|
|
(1. b)) |
kur:
|
CI |
= |
vielas koncentrācija testa vienības ieplūdē (mg vielas uz litru; vērtību nosaka īpašā analīzē), |
|
Co |
= |
vielas koncentrācija izplūdē no testa vienības (mg vielas uz litru; vērtību nosaka īpašā analīzē). |
1.3. STANDARTVIELAS
Dažos gadījumos, kad notiek jaunu vielu izpēte, var būt lietderīgi izmantot standartvielas, tomēr ieteikt konkrētas standartvielas pagaidām nevar.
1.4. TESTA METOŽU PRINCIPS
Lai noteiktu maksimālo bioloģiskās noārdīšanās spēju, vienlaikus darbina divas aktīvo dūņu eksperimentālās vienības (ESAO apstiprinošā testa vai porainā tīģeļa vienības). Pārbaudāmo vielu pievieno ieplūdei (sintētiskie vai sadzīves notekūdeņi) vienā no vienībām, kamēr otrā vienībā ieplūst tikai notekūdeņi. Pirmējās biodegradācijas noteikšanai ar īpašu ieplūdes un izplūdes analīzes metodi izmanto tikai vienu vienību.
IOO (vai ĶSP) koncentrāciju mēra izplūdē vai arī pārbaudāmās vielas koncentrāciju nosaka īpašā analīzē.
Pārbaudāmā materiāla radīto IOO nemēra, bet vienkārši novērtē.
Veicot IOO (vai ĶSP) mērījumus, pieņem, ka testa un tukšās vienības izplūdēs vidējo koncentrāciju starpību rada nenoārdītais pārbaudāmais materiāls.
Veicot īpašās analīzes, var mērīt sākotnējo molekulu koncentrācijas izmaiņas (pirmējā biodegradācija).
Vienības var darbināt ar transinokulācijas metodi “savienoto vienību režīmā”.
1.5. KVALITĀTES KRITĒRIJI
Vielas sākuma koncentrācija ir atkarīga no veiktās analīzes veida un atbilstošajiem ierobežojumiem.
1.6. TESTA METODES APRAKSTS
1.6.1. Sagatavošanās testam
1.6.1.1.
Ja neveic īpašas analīzes, tad vajadzīgas divas vienveida vienības. Var izmantot šādu divu veidu ierīces.
ESAO apstiprinošais tests
Iekārta (1. papildinājums) sastāv no sintētisko notekūdeņu glabāšanas trauka (A), dozētājsūkņa (B), aerācijas trauka (C), nostādināšanas trauka (D), saspiesta gaisa sūkņa (E) aktīvo dūņu atkārtotai apstrādei un trauka (F) apstrādāto notekūdeņu savākšanai.
Traukiem (A) un (F) jābūt no stikla vai piemērotas plastmasas un ar vismaz 24 litru tilpumu. Sūknim (B) jānodrošina sintētisko notekūdeņu nemainīga plūsma uz aerācijas trauku; var izmantot jebkuru piemērotu sistēmu, ja vien tā nodrošina vajadzīgo ievades plūsmu un koncentrāciju. Normālos darbības apstākļos nostādināšanas trauka (D) augstums ir tāds, lai aerācijas traukā ietilptu trīs litri maisījuma. Traukā (C) konusa galotnē ir iekārts poraina stikla aerācijas kubs (G). Caur aeratoru izpūstā gaisa daudzumu var mērīt ar caurplūduma mērītāju.
Saspiesta gaisa sūkni (E) uzstāda tā, lai aktīvās dūņas no nostādināšanas trauka pastāvīgi un atkārtoti novadītu uz aerācijas trauku (C).
“Porainais tīģelis”
Poraino tīģeli darina no poraina polietilēna (biezums 2 mm, maksimālais poru izmērs 95 μn) loksnes, izveidojot no tās cilindru ar 14 cm diametru un ar konisku pamatni, kuras leņķis ir 45o (2. papildinājuma 1. un 2. attēls). Poraino tīģeli ievieto tādā necaurlaidīgā traukā no piemērotas plastmasas, kura diametrs ir 15 cm un kura cilindriskajā daļā 17,2 cm augstumā atrodas atvere, ar ko ierobežo tīģelī esošā šķidruma tilpumu (3 litri). Iekšējā trauka augšmalu apjož ciets balstošs gredzens no piemērotas plastmasas, lai veidotos 0,5 cm plata sprauga starp iekšējo un ārējo trauku.
Poraino tīģeli var uzstādīt termoregulējamā ūdens vannā. Jānodrošina gaisa piegāde iekšējā trauka pamatnē, uz kuras novieto piemērotu difuzoru.
Traukiem (A) un (E) jābūt no stikla vai piemērotas plastmasas un ar vismaz 24 litru tilpumu. Sūknim (B) jānodrošina sintētisko notekūdeņu nemainīga plūsma uz aerācijas trauku; var izmantot jebkuru piemērotu sistēmu, ja vien tā nodrošina vajadzīgo ievades plūsmu un koncentrāciju.
Jāsagādā poraino tīģeļu rezerves, lai varētu aizstāt lietošanas laikā aizsprostojušos tīģeļus; aizsprostojušos tīģeļus tīra, tos uz 24 stundām iemērcot hipohlorīta šķīdumā un pēc tam rūpīgi noskalojot ar krāna ūdeni.
1.6.1.2.
Membrānfiltrācijas iekārta un membrānfiltri ar poru izmēru 0,45 μn. Membrānfiltri ir derīgi tad, ja tie visos filtrēšanas etapos nodrošina oglekļa necaurlaidību un neadsorbē pārbaudāmo vielu.
1.6.1.3.
Var izmantot vai nu atbilstošu sintētisku materiālu, vai sadzīves notekūdeņus.
Sintētiska materiāla piemērs
Jāšķīdina litrā krāna ūdens:
|
Peptons: |
160 mg, |
|
Gaļas ekstrakts: |
10 mg, |
|
Urīnviela: |
30 mg, |
|
NaCl: |
7 mg, |
|
CaCl2 . 2H2O: |
4 mg, |
|
MgSO4 . 7H2O: |
2 mg, |
|
K2HPO4: |
28 mg. |
Sadzīves notekūdeņi
Katru dienu jāievāc svaigi no pārplūdes pirmējās nostādināšanas tvertnē attīrīšanas iekārtās, kurās attīra galvenokārt sadzīves notekūdeņus.
1.6.1.4.
Jāsagatavo pārbaudāmā materiāla šķīdums (piemēram, 1 %), ko pievieno testa vienībai. Jānosaka materiāla koncentrācija, lai zinātu, kāds tilpums jāpievieno notekūdeņiem, vai arī, izmantojot otru sūkni, jāievada tieši testa vienībā ar nolūku iegūt testam vajadzīgo koncentrāciju.
1.6.1.5.
Piezīme: ja izmanto sadzīves notekūdeņus, nav jēgas lietot inokulātu, kurā ir zema baktēriju koncentrācija, bet tā vietā var izmantot aktīvās dūņas.
Var izmantot dažādus inokulātus.
Turpmāk sniegti trīs atbilstošu inokulātu piemēri.
a) No otrējās izplūdes iegūts inokulāts
Inokulātu iegūst no labas kvalitātes otrējās izplūdes, ko ievāc attīrīšanas iekārtās, kurās apstrādā galvenokārt sadzīves notekūdeņus. Parauga ievākšanas un izmantošanas starplaikā izplūde jāuzglabā aerobos apstākļos. Lai iegūtu inokulātu, paraugu filtrē caur rupju filtru; pirmos 200 ml filtrāta neizmanto. Līdz izmantošanai filtrātu glabā aerobos apstākļos. Inokulāts jāizlieto tā ieguves dienā. Inokulācijai jāizmanto vismaz 3 ml.
b) Jaukts inokulāts
No otrējās izplūdes iegūts inokulāts:
Skatīt aprakstu iepriekšējā daļā.
No augsnes iegūts inokulāts:
100 g dārza augsnes (auglīgas, nesterilizētas) suspendē 1 000 ml nehlorēta dzeramā ūdens. (Augsnes, kurās ir pārlieku daudz māla, smilts vai humusa, nav derīgas.) Pēc samaisīšanas suspensijai ļauj 30 minūtes nogulsnēties. Virsslāni filtrē caur rupju filtru; pirmos 200 ml filtrāta neizmanto. Filtrātu tūlīt sāk aerēt, un to turpina līdz filtrāta izmantošanai. Inokulāts jāizlieto tā ieguves dienā.
No virszemes ūdeņiem iegūts inokulāts:
Vēl citu inokulāta daļu iegūst no mezosaprobiskiem virszemes ūdeņiem. Paraugu filtrē caur rupju papīra filtru; pirmos 200 ml filtrāta neizmanto. Līdz izmantošanai filtrātu glabā aerobos apstākļos. Inokulāts jāizlieto tā ieguves dienā.
Triju inokulāta daļu paraugus vienādos daudzumos salej kopā un labi samaisa, un no šā maisījuma iegūst galīgo inokulātu. Inokulācijai jāizmanto vismaz 3 ml.
c) No aktīvajām dūņām iegūts inokulāts
Par inokulātu var izmantot aktīvo dūņu (suspendēto daļiņu saturs līdz 2,5 g/l) tilpumu (ne vairāk kā 3 l), kas ņemts no aerācijas tvertnes iekārtās, kurās attīra galvenokārt sadzīves notekūdeņus.
1.6.2. Procedūra
Testu veic istabas temperatūrā; tai jābūt robežās no 18 līdz 25 oC.
Ja tas ir lietderīgi, tad testu var veikt zemākā temperatūrā (līdz 10 oC); ja viela ir noārdījusies, tad parasti turpmāka darbība nav nepieciešama. Ja tomēr viela nav noārdījusies, tad tests jāveic pastāvīgā temperatūrā, kuras diapazons ir no 18 līdz 25 oC.
1.6.2.1.
Dūņu augšanas/stabilizācijas periods ir laiks, kurā aktīvajās dūņās suspendēto daļiņu koncentrācija un vienību darbība konkrētajos apstākļos sasniedz stabilu stāvokli.
Piestrādes laiks ir periods, kas sākas ar brīdi, kad pārbaudāmo vielu pievieno pirmoreiz, un beidzas tad, kad šīs vielas noārdīšanās stabilizējas (sasniedz relatīvi nemainīgu vērtību). Šis laiks nedrīkst pārsniegt sešas nedēļas.
Novērtēšanas laiks ilgst trīs nedēļas, un tas sākas trīs nedēļas pēc tam, kad pārbaudāmās vielas noārdīšanās sasniedz relatīvi nemainīgu vērtību, kas parasti ir augsta. Tām vielām, kas pirmajās sešās nedēļās noārdās tikai nedaudz vai nenoārdās nemaz, novērtēšanas laiks ir vēl nākamās trīs nedēļas.
Sākotnēji uzpilda viena testa veikšanai vajadzīgās vienības ar inokulātu, kas samaisīts ar ieplūdi.
Pēc tam iedarbina aeratoru (ESAO apstiprinošā testa vienību gadījumā – arī saspiestā gaisa sūkni (E)) un dozētājierīci (B).
Pārbaudāmo vielu nesaturošas ieplūdes caurplūdei aerācijas traukā (C) jābūt vai nu vienam litram stundā, vai puslitram stundā; tas nodrošina trīs vai sešu stundu ilgu vidējo izdalīšanas laiku.
Aerācijas ātrums jāregulē tā, lai trauka (C) saturs visu laiku būtu suspendētā stāvoklī un lai izšķīdušā skābekļa saturs būtu vismaz 2 mg/l.
Ar piemērotiem līdzekļiem jānovērš putošana. Nedrīkst izmantot tādus pretputošanas līdzekļus, kam ir inhibējoša ietekme uz aktīvajām dūņām.
Dūņas, kas uzkrājušās ap aerācijas trauka (C) augšdaļu (ESAO apstiprinošā testa vienību gadījumā – arī nostādināšanas trauka (D) pamatnē un cirkulācijas sistēmā), ar suku vai ar citiem piemērotiem līdzekļiem vismaz reizi dienā jānogādā atpakaļ šķīduma maisījumā.
Ja dūņas nenogulsnējas, tad to blīvumu var palielināt, pēc vajadzības atkārtoti pievienojot 5 % trīsvērtīgās dzelzs hlorīdu porcijās pa 2 ml.
Izplūdi savāc traukā (E vai F) 20 līdz 24 stundu ilgā laikposmā un pēc trauka satura rūpīgas samaisīšanas ņem paraugu. Trauks (E vai F) ir rūpīgi jāiztīra.
Lai uzraudzītu un kontrolētu procesa efektivitāti, ķīmisko skābekļa patēriņu (ĶSP) vai izšķīdušo organisko oglekli (IOO) uzkrātās izplūdes filtrātā mēra vismaz divreiz nedēļā, un šo pašu noteikumu attiecina arī uz filtrēto ieplūdi (filtrē ar membrānfiltru, kura poru izmērs ir 0,45 μm; filtrāta pirmos (aptuveni) 20 ml neizmanto).
ĶSP vai IOO samazinājumam būtu jāizlīdzinās pēc tam, kad vienas dienas laikā notikušās noārdīšanās apjoms daudzmaz stabilizējas.
Aktīvo dūņu sausnas saturs aerācijas tvertnē jānosaka divreiz nedēļā (g/l). Vienības var darbināt vienā no šādiem diviem veidiem: vai nu aktīvo dūņu sausnas saturu nosaka divreiz nedēļā un, ja tas pārsniedz 2,5 g/l, tad aktīvo dūņu pārpalikumu aizvāc, vai arī no katra trauka ik dienas atlej 500 ml šķīduma maisījuma, lai šādi nodrošinātu vidēji sešas dienas ilgu dūņu izdalīšanas laiku.
Kad izmērītie un aptuveni novērtētie rādītāji (procesa efektivitāte (ĶSP vai IOO samazinājums), dūņu koncentrācija, dūņu nogulsnēšanās, izplūdes duļķainums u. c.) abās vienībās ir pietiekami stabili, vienas vienības ieplūdei pievieno pārbaudāmo vielu atbilstīgi 1.6.2.2. punktam.
Cita iespēja ir pievienot pārbaudāmo vielu dūņu augšanas perioda (1.6.2.1. punkts) sākumā, jo īpaši tādā gadījumā, ja dūņas pievieno kā inokulātu.
1.6.2.2.
Saglabā piestrādes laikā uzturētos darbības apstākļus, un testa vienības ieplūdei pievieno atbilstošu daudzumu pārbaudāmā materiāla standartšķīduma (aptuveni 1 %), lai iegūtu vēlamo pārbaudāmā materiāla koncentrāciju notekūdeņos (aptuveni 10 līdz 20 mg IOO/l vai 40 mg ĶSP/l). To var darīt, katru dienu iemaisot standartšķīdumu notekūdeņos vai izmantojot atsevišķu sūknēšanas sistēmu. Minēto koncentrāciju drīkst sasniegt pakāpeniski. Ja pārbaudāmās vielas ietekme uz aktīvajām dūņām nav toksiska, tad vielu var testēt arī augstākā koncentrācijā.
Tukšās analīzes vienībā pievieno tikai tādu ieplūdi, kuras sastāvā nav nekādas papildu vielas. Analīzes vajadzībām ņem attiecīgus izplūdes daudzumus, ko filtrē caur membrānfiltriem (0,45 μm), bet filtrāta pirmos (aptuveni) 20 ml neizmanto.
Filtrēto paraugu analīze jāveic tajā pašā dienā, pretējā gadījumā tie jāuzglabā, izmantojot piemērotu metodi, piemēram, pievienojot 0,05 ml 1 % dzīvsudraba hlorīda (HgCl2) šķīduma uz katriem 10 ml filtrāta vai uzglabājot šos paraugus līdz 24 stundām 2 līdz 4 oC temperatūrā vai ilgāku laiku –18 oC un zemākā temperatūrā.
Piestrādes laiks kopā ar pārbaudāmās vielas pievienošanas laiku nedrīkst būt ilgāks par sešām nedēļām, un novērtēšanas laiks nedrīkst būt īsāks par trim nedēļām, t. i., galīgais rezultāts jāaprēķina, pamatojoties uz aptuveni 14 līdz 20 noteikšanas reizēm.
Savienoto vienību režīms
Vienību savienošanu panāk, reizi dienā divās vienībās veicot apmaiņu ar 1,5 litriem šķīduma maisījuma (tostarp dūņām) no aktīvo dūņu aerācijas traukiem. Izteikti absorbējošu pārbaudāmo materiālu gadījumā šos 1,5 litrus ņem tikai no šķīduma virsslāņa nostādināšanas traukā un pārlej otrās vienības aktīvo dūņu traukā.
1.6.2.3.
Lai novērotu vielas pārmaiņas, var veikt divu veidu analīzes:
IOO un ĶSP
IOO koncentrācijas nosaka divkārt, izmantojot oglekļa analizatoru un/vai ĶSP vērtības atbilstīgi izmantotajai literatūrai (2).
Īpašā analīze
Testētās vielas koncentrācijas nosaka ar piemērotu analīzes metodi. Ja iespējams, jāveic dūņu absorbētās vielas īpaša noteikšana.
2. DATI UN TO NOVĒRTĒŠANA
2.1. SAVIENOTO VIENĪBU REŽĪMS
Izmantojot “savienoto vienību režīmu”, vienā dienā notikušā samazinājuma pakāpi DR aprēķina saskaņā ar 1.2.1. punktu.
Šo vienā dienā notikušā samazinājuma pakāpi DR koriģē līdz vērtībai DRc, kurā atspoguļo transinokulācijas dēļ radušos materiāla pārnesi un kuru trīs stundu ilgam vidējam izdalīšanas laikam precizē ar 2. vienādību, bet sešu stundu ilgam vidējam izdalīšanas laikam – ar 3. vienādību:
|
|
(2) |
|
|
(3) |
Aprēķina DRC vērtību sērijas vidējo vērtību, kā arī standartnovirzi atbilstīgi 4. vienādībai
|
|
(4) |
kur:
|
SDRc |
= |
DRc vērtību sērijas standartnovirze, |
|
|
= |
DRc vērtības vidējā vērtība, |
|
n |
= |
noteikšanas reižu skaits. |
Netipisko datu kopas DRc sērijās izslēdz saskaņā ar atbilstīgu statistikas procedūru, piemēram, Naļimova metodi (6), ar 95 % varbūtību un vēlreiz aprēķina vidējo vērtību un standartnovirzi DRc datu kopai, no kuras izslēgti netipiskie dati.
Pēc tam aprēķina galīgo rezultātu saskaņā ar 5. vienādību.
|
|
(5) |
kur:
|
tn-1; α |
= |
tabulā nolasāmā t vērtība attiecībā pret n pāriem E un E0 vērtību un statistisko ticamību P (P = 1 – α), kur P ir 95 % (1). |
Rezultātu norāda kā vidējo vērtību ar pielaides robežu 95 % varbūtības līmenī, attiecīgo standartnovirzi un datu daudzumu DRc datu kopā bez netipisko datu kopām, un netipisko datu kopu daudzumu, piemēram:
|
DRc |
= |
98,6 ± 2,3 % izdalītā IOO, |
|
s |
= |
4,65 % izdalītā IOO, |
|
n |
= |
18, |
|
x |
= |
netipisko datu kopu daudzums. |
2.2. NESAVIENOTO VIENĪBU REŽĪMS
Šo vienību darbību var pārbaudīt šādi:
![]()
Šos vienā dienā notikušos samazinājumus var attēlot grafiski, lai noteiktu tendences, piemēram, aklimatizācijā.
2.2.1. ĶSP/IOO noteikšanas izmantošana
Vienā dienā notikušā samazinājuma pakāpi DR aprēķina saskaņā ar 1.2.1. punktu.
Aprēķina DR vērtību sērijas vidējo vērtību; bez tam aprēķina tās standartnovirzi pēc formulas:
|
|
(6) |
kur:
|
sDR |
= |
DRi vērtību sērijas standartnovirze, |
|
|
= |
DRi vērtību vidējā vērtība, |
|
n |
= |
noteikšanas reižu skaits. |
Netipisko datu kopas DR sērijās izslēdz saskaņā ar atbilstīgu statistikas procedūru, piemēram, Naļimova metodi (6), ar 95 % varbūtību un vēlreiz aprēķina vidējo vērtību un standartnovirzi DR datu kopai, no kuras izslēgti netipiskie dati.
Pēc tam aprēķina galīgo rezultātu saskaņā ar 7. vienādību:
|
|
(7) |
kur:
|
tn-1;α |
= |
tabulā nolasāmā t vērtība attiecībā pret n pāriem E un E0 vērtību un statistisko ticamību P (P = 1 – α), kur P ir 95 % (1). |
Rezultātu norāda kā vidējo vērtību ar pielaides robežu 95 % varbūtības līmenī, attiecīgo standartnovirzi un datu daudzumu DR datu kopā bez netipisko datu kopām, un netipisko datu kopu daudzumu, piemēram:
|
DR |
= |
(98,6 ± 2,3) % izdalītā IOO, |
|
s |
= |
4,65 % izdalītā IOO, |
|
n |
= |
18, |
|
x |
= |
netipisko datu kopu daudzums. |
2.2.2. Īpašas analīzes izmantošana
Pārbaudāmās vielas procentuālo zudumu ūdens fāzē (Rw) aprēķina saskaņā ar 1.2.2. punktu.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, ietver šādu informāciju:
— veidlapa, kura pievienota 3. papildinājumā un kurā norāda testa norises apstākļus,
— testa iekārta (ESAO apstiprinošā testa iekārta vai porainais tīģelis),
— ekspluatācijas metode: savienoto vienību režīms vai cits režīms,
— notekūdeņi: sintētiskie vai sadzīves; sadzīves notekūdeņu gadījumā jānorāda parauga ņemšanas datums un vieta,
— inokulāta veids, norādot parauga ņemšanas datumu un vietu,
— paziņojums un analīzes metodes apraksts, ja tikušas veiktas kādas īpašas analīzes,
— diagramma, kurā attēlota IOO vai ĶSP samazināšanās atkarībā no laika, kā arī norādīts piestrādes laiks un novērtēšanas laiks,
— pārbaudāmās vielas analītiska atgūšana IOO vai ĶSP veidā standartšķīdumā,
— īpašu analīžu veikšanas gadījumā – diagramma, kurā procentuāli ataino testētās vielas izzušanu ūdens fāzē atkarībā no laika (piestrādes un novērtēšanas laiks),
— pārbaudāmās vielas IOO vai ĶSP vidējo samazinājumu un standartnovirzi aprēķina pēc novērtēšanas laika rezultātiem, t. i., pēc datiem, kas iegūti pārbaudāmā materiāla stabilas izdalīšanas posmā vai arī stabilas darbības posmā,
— diagramma, kurā ataino aktīvo dūņu koncentrāciju atkarībā no laika,
— piezīmes par aktīvajām dūņām (dūņu atlikuma izņemšana, apjoma palielināšanās, FeCl3 u. c.), ja šādas piezīmes ir,
— testā izmantotā vielas koncentrācija,
— dūņu analīzes rezultāti, ja tādi ir,
— visa informācija un eksperimentālie rezultāti attiecībā uz testēto vielu un standartvielu, ja tāda ir izmantota,
— zinātnisks pamatojums visām izmantotās metodes izmaiņām.
3.2. REZULTĀTU INTERPRETĀCIJA
Vāju testētās vielas samazināšanos ūdens fāzē var būt izraisījusi šīs vielas inhibējošā iedarbība uz mikroorganismiem. Uz to var norādīt arī līze un dūņu zudums, kā rezultātā šķīduma virsslānis ir duļķains, un IOO (vai ĶSP) samazinājuma efektivitātes mazināšanās eksperimentālajā iekārtā.
Dažreiz var izpausties fizikālķīmiskā adsorbcija. Molekulārā līmenī notikušas bioloģiskās iedarbības un fizikālķīmiskās adsorbcijas ietekmi var nošķirt, analizējot dūņas pēc atbilstīgas to desorbcijas.
Lai nodalītu biodegradāciju (vai daļēju biodegradāciju) no adsorbcijas, jāveic turpmāki testi.
To var veikt vairākos veidos, bet vispārliecinošākais ir izmantot šķīduma virsslāni par inokulātu galvenajā sarakstā iekļautā testā (vēlams – respirometriskā testā).
Ja novēro stipru IOO vai ĶSP samazinājumu, tad tas ir biodegradācijas dēļ, bet vāja samazinājuma gadījumā biodegradāciju nav iespējams atšķirt no vielas izdalīšanas. Piemēram, ja šķīstošam savienojumam ir augsta adsorbcijas konstante – 98 % un dūņu atlikuma zudums ir 10 % dienā, tad ir iespējama vielas izdalīšana līdz 40 % apmērā; ja dūņu atlikuma zudums ir 30 %, tad vielas izdalīšana dēļ adsorbcijas uz atlikušajām dūņām vai dēļ izvadīšanas kopā ar atlikušajām dūņām var sasniegt 65 % (4).
Veicot īpašu analīzi, jāpievērš uzmanība vielas struktūras un izmantotās īpašās analīzes metodes saistībai. Šajā gadījumā novēroto parādību nevar interpretēt kā vielas mineralizāciju.
4. IZMANTOTĀ LITERATŪRA
(1) OECD, Paris, 1981, Test Guideline 303 A, Decision of the Council C(81) 30 final.
(2) Pielikums V C.9 “Sadalīšanās tests – ķīmiskais skābekļa patēriņš”, Komisijas Direktīva 84/449/EEK (OV L 251, 19.9.1984., 1. lpp.).
(3) Painter, H. A., King, E. F., WRC Porous-Pot method for assessing biodegradability, Technical Report TR70, June 1978, Water Research Centre, United Kingdom.
(4) Wierich, P., Gerike, P., The fate of soluble, recalcitrant, and adsorbing compounds in activated sludge plants, Ecotoxicology and Environmental Safety, vol. 5, No 2, June 1981, pp. 161–171.
(5) Padomes Direktīvas 82/242/EEK un 82/243/EEK (OV L 109, 22.4.1982., 1. lpp.), ar ko groza Padomes Direktīvas 73/404/EEK un 73/405/EEK par mazgāšanas līdzekļu bioloģiskās noārdīšanās spēju (OV L 347, 17.12.1973., 51. lpp.).
(6) Streuli, H., Fehlerhafte Interpretation und Anwendung von Ausreßertests, insbesondere bei Ringversuchen zur Oberprüfung analytisch-chemischer Untersuchungsmethoden, Fresenius-Zeitschrift für Analytische Chemie, 303 (1980), pp. 406–408.
1. papildinājums
1. attēls

2. attēls

2. papildinājums
1. attēls
Iekārta bioloģiskās noārdīšanās spējas novērtēšanai

2. attēls
Trīslitru porainā tīģeļa aerācijas trauka daļas

3. papildinājums
Aktīvo dūņu imitācijas testa norises apstākļi
Pārbauda katrā grupā
Iekārta
|
ESAO apstiprinājums |
|
|
Porainais tīģelis |
Norises veids
|
Atsevišķa vienība |
|
|
Savienotās vienības |
|
|
Nesavienotās vienības |
Transinokulācija
|
Nav |
|
|
Aktīvās dūņas |
|
|
Šķīduma virsslānis |
Vidējais izdalīšanās laiks
|
Trīs stundas |
|
|
Sešas stundas |
Barības vielu bāze
|
Sadzīves notekūdeņi |
|
|
Sintētiskie notekūdeņi |
Inokulāts
|
Otrējā izplūde |
|
|
Jaukts |
|
|
Aktīvās dūņas |
Testa materiāla pievienošana
|
No sākuma |
|
|
Pakāpeniska palienāšana |
|
|
Pēc dūņu izveidošanās |
Analīze
|
Īpaša |
|
|
ĶSP |
|
|
IOO |
C.11. BIODEGRADĀCIJA
AKTĪVO DŪŅU RESPIRĀCIJAS INHIBĪCIJAS TESTS
1. METODE
1.1. IEVADS
Ar šo metodi novērtē pārbaudāmās vielas ietekmi uz mikroorganismiem, noteiktos apstākļos mērot to elpošanas intensitāti dažādās pārbaudāmās vielas koncentrācijās.
Šīs metodes mērķis ir nodrošināt ātras analīzes metodi, ar ko iespējams identificēt vielas, kuras var kaitīgi ietekmēt aerobos organismus mikrobioloģiskajās attīrīšanas iekārtās, un noteikt neinhibējošas pārbaudāmo vielu koncentrācijas izmantošanai biodegradācijas testos.
Pirms galīgā testa veikšanas var noteikt iedarbības diapazonu. Šādi iegūst informāciju par pamata testā izmantojamo koncentrāciju diapazonu.
Plānojot testu, testa sēriju sākumā un beigās paredz pa vienai kontrolanalīzei, kurā nav pārbaudāmās vielas. Visas aktīvo dūņu partijas turklāt jāpārbauda ar standartvielu.
Šo metodi visērtāk ir piemērot ūdenī šķīstošām un slikti gaistošām vielām, kuras paliek ūdenī.
Iespējams, ka vielām, kuru šķīdība testa vidē ir ierobežota, nevarēs noteikt EC50.
Ja pārbaudāmai vielai raksturīga oksidatīvās fosforilācijas atvienošana, tad rezultāti, kas pamatoti ar skābekļa uzņemšanu, var radīt kļūdainus secinājumus.
Testa veikšanas nolūkā ir lietderīgi ievākt šādu informāciju par pārbaudāmo vielu:
— šķīdība ūdenī,
— tvaika spiediens,
— struktūrformula,
— tīrība.
Ieteikums
Aktīvo dūņu sastāvā var būt patogēni mikroorganismi, un tāpēc ar tām jārīkojas uzmanīgi.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Elpošanas intensitāte ir aerobās dūņās esošo notekūdeņu mikroorganismu skābekļa patēriņš, ko parasti izsaka kā mg O2 uz mg dūņu stundā.
Lai aprēķinātu pārbaudāmās vielas inhibējošo ietekmi kādā konkrētā koncentrācijā, elpošanas intensitāti izsaka procentuāli no abās kontrolanalīzēs reģistrētās elpošanas intensitātes vidējās vērtības:

kur:
|
Rs |
= |
skābekļa patēriņa intensitāte tajā pārbaudāmās vielas koncentrācijā, kuru pārbauda, |
|
Rc1 |
= |
skābekļa patēriņa intensitāte, 1. kontrolanalīze, |
|
Rc2 |
= |
skābekļa patēriņa intensitāte, 2. kontrolanalīze. |
Šajā metodē EC50 ir pārbaudāmās vielas koncentrācija, pie kuras elpošanas intensitāte ir 50 % no tās, ko šajā metodē aprakstītajos apstākļos reģistrē kontrolanalīzē.
1.3. STANDARTVIELAS
Ieteicams par standartvielu izmantot 3,5-dihlorfenolu, kas ir plaši zināms elpošanas inhibitors, un ar to noteikt EC50 visās aktīvo dūņu partijās, lai šādi pārbaudītu, vai dūņu jutība ir normas robežās.
1.4. TESTA METODES PRINCIPS
Standartdaudzumā sintētisko notekūdeņu barotnes ievietotu aktīvo dūņu elpošanas intensitāti mēra pēc 30 minūšu vai trīs stundu ilga saskares laika vai abos šajos laikos. Turklāt elpošanas intensitāti vienām un tām pašām aktīvajām dūņām mēra identiskos apstākļos, bet dažādās pārbaudāmās vielas koncentrācijās. Noteiktā koncentrācijā esošas pārbaudāmās vielas inhibējošo ietekmi izsaka procentuāli no abās kontrolanalīzēs reģistrētās elpošanas intensitātes vidējās vērtības. Izmantojot dažādās koncentrācijās iegūtās vērtības, aprēķina EC50 vērtību.
1.5. KVALITĀTES KRITĒRIJI
Testa rezultāti ir derīgi, ja:
— elpošanas intensitātes vērtības abās kontrolanalīzēs neatšķiras par vairāk kā 15 %,
— EC50 vērtība (pēc 30 minūtēm un/vai trim stundām) 3,5-dihlorfenolam ir pieļaujamajā diapazonā no 5 līdz 30 mg/l.
1.6. TESTA METODES APRAKSTS
1.6.1. Reaģenti
1.6.1.1.
Pārbaudāmās vielas šķīdumus gatavo tieši pirms testa, izmantojot standartšķīdumu. Ja izmanto turpmāk ieteikto metodi, tad piemērota standartšķīduma koncentrācija ir 0,5 g/l.
1.6.1.2.
3,5-dihlorfenola šķīdumu var sagatavot, piemēram, izšķīdinot 0,5 g 3,5-dihlorfenola 10 mililitros 1M NaOH, šķīdumu uzpildot ar destilētu ūdeni līdz aptuveni 30 ml tilpumam, tajā iemaisot tik daudz 0,5M H2SO4, ka sāk izkrist nogulsnes, – vajadzēs apmēram 8 mililitrus 0,5M H2SO4 – un visbeidzot šo maisījumu uzpildot ar destilētu ūdeni līdz viena litra tilpumam. Iegūtā šķīduma pH vajadzētu būt diapazonā no 7 līdz 8.
1.6.1.3.
Sintētisko notekūdeņu barotni gatavo, vienā litrā ūdens izšķīdinot šādus vielas daudzumus:
— 16 g peptona,
— 11 g gaļas ekstrakta,
— 3 g urīnvielas,
— 0,7 g NaCl,
— 0,4 g CaCl2.2H2O,
— 0,2 g MgSO4.7H2O,
— 2,8 g K2HPO4.
1. Piezīme: šie sintētiskie notekūdeņi ir simtkāršs to notekūdeņu koncentrāts, kas aprakstīti ESAO tehniskajā ziņojumā “Ieteicamā metode sintētiskajos mazgāšanas līdzekļos izmantoto virsmas aktīvo vielu bioloģiskās noārdīšanās spējas noteikšanai” (1976. gada 11. jūnijs) un kam pievienots dikālija hidrogēnfosfāts.
2. Piezīme: ja sagatavoto barotni neizmanto tūlīt, tad to uzglabā tumšā vietā 0 līdz 4 oC temperatūrā ne ilgāk kā vienu nedēļu un tādos apstākļos, kas neizraisa nekādas izmaiņas barotnes sastāvā. Pirms novietošanas glabāšanā barotni turklāt var sterilizēt, vai arī peptonu un gaļas ekstraktu var pievienot tieši pirms testa sākuma. Pirms lietošanas barotni rūpīgi samaisa un koriģē pH.
1.6.2. Iekārta
Mēriekārta: nav būtiski lietot noteiktas konstrukcijas mēriekārtu. Tomēr tai jābūt ar augšējo tilpumu un aizbāznim cieši jāpieguļ mērkolbas kakliņam.
Vajadzīgs parastais laboratorijas aprīkojums, un jo īpaši:
— mēriekārta,
— aerācijas ierīce,
— pH elektrods un mēraparatūra,
— O2 elektrods.
1.6.3. Inokulāta sagatavošana
Šajā testā par mikrobiālo inokulātu izmanto aktīvās dūņas no notekūdeņu attīrīšanas iekārtām, kurās attīra galvenokārt sadzīves notekūdeņus.
Vajadzības gadījumā pēc dūņu nogādāšanas laboratorijā no tām var atdalīt rupjās daļiņas, ļaujot dūņām neilgu laiku, piemēram, 15 minūtes, izgulsnēties un tad nolejot augšējo slāni ar smalkākajām daļiņām. Cita iespēja ir dūņas dažas sekundes maisīt ar elektrisko maisītāju.
Turklāt, ja ir pamats uzskatīt, ka dūņu sastāvā ir inhibējošs materiāls, tad tās jāmazgā krāna ūdenī vai izotoniskā šķīdumā. Pēc izgulsnēšanas ar centrifūgu nolej virsējo slāni (procedūru atkārto trīs reizes).
Nosver un izkaltē nelielu daudzumu minēto dūņu. Pamatojoties uz šo rezultātu, var aprēķināt mitro dūņu daudzumu, kas jāsuspendē ūdenī, lai iegūtu aktīvās dūņas, kuru maisījumā suspendēto daļiņu daudzums ir no 2 līdz 4 g/l. Šādi iegūtā koncentrācija testa barotnē ir no 0,8 līdz 1,6 g/l, ja izmanto turpmāk ieteikto metodi.
Ja dūņas nevar izmantot to ievākšanas dienā, tad uz katru litru aktīvo dūņu, kas sagatavotas, kā aprakstīts iepriekš, pievieno 50 ml sintētisko notekūdeņu; tad maisījumu vienu nakti aerē 20 ± 2 oC temperatūrā. Pēc tam to turpina aerēt, lai izmantotu tajā pašā dienā. Pirms lietošanas pārbauda pH un vajadzības gadījumā to koriģē līdz pH vērtībai 6–8. Maisījumā suspendēto daļiņu daudzumu jānosaka, kā aprakstīts šā punkta iepriekšējā daļā.
Ja nepieciešams turpmākajās (ne vairāk kā četrās) dienās izmantot to pašu dūņu partiju, tad katras darba dienas beigās pievieno vēl 50 ml sintētisko notekūdeņu barotnes uz litru dūņu.
1.6.4. Testa veikšana
|
Ilgums/saskares laiks: |
30 minūtes un/vai trīs stundas, kuru laikā veic aerāciju |
|
Ūdens: |
dzeramais ūdens (vajadzības gadījumā dehlorēts) |
|
Gaisa piegāde: |
tīrs gaiss bez naftas produktu piejaukuma. Gaisa plūsmai jābūt no 0,5 līdz 1 l/min |
|
Mēriekārta: |
kolba ar plakanu dibenu, piemēram, BSP kolba |
|
Skābekļa mērītājs: |
piemērots skābekļa elektrods ar pašrakstītāju |
|
Barības vielu šķīdums: |
sintētiskie notekūdeņi (skatīt iepriekš) |
|
Pārbaudāmā viela: |
pārbaudāmo šķīdumu gatavo tieši pirms testa sākuma |
|
Standartviela: |
piemēram, 3,5-dihlorfenols (vismaz trīs koncentrācijas) |
|
Kontrolanalīze: |
inokulēts paraugs bez pārbaudāmās vielas |
|
Temperatūra: |
20 ± 2 oC. |
Ieteicamā eksperimentālā metode, ko var piemērot gan pārbaudāmai vielai, gan standartvielai trīs stundu ilgajā saskares laikā, ir izklāstīta turpmāk.
Izmanto vairākus traukus (piemēram, vārglāzes ar 1 litra tilpumu).
Jāizmanto vismaz piecas koncentrācijas, kuru izkliedes faktors ir nemainīgs un, vēlams, ne lielāks par 3,2.
Laikā “0” 16 mililitrus sintētisko notekūdeņu barotnes uzpilda ar ūdeni līdz 300 ml tilpumam. Pievieno 200 ml mikrobiālā inokulāta un visu maisījumu (500 ml) pārlej pirmajā traukā (pirmā kontrolanalīze C1).
Testa traukus vajag pastāvīgi aerēt, lai nodrošinātu, ka izšķīdušā O2 koncentrācija ir ne mazāka par 2,5 mg/l un ka tieši pirms elpošanas intensitātes mērījuma nolasīšanas O2 koncentrācija ir aptuveni 6,5 mg/l.
Laikā “15 minūtes” (15 minūtes ir brīvi noteikts, taču ērts laika intervāls) atkārto iepriekš aprakstīto procedūru, mainās tikai tas, ka 16 mililitriem sintētisko notekūdeņu vispirms pievieno 100 ml pārbaudāmās vielas standartšķīduma un tad šķīdumu uzpilda ar ūdeni līdz 300 ml tilpumam un pievieno mikrobiālo inokulātu, kopā iegūstot 500 ml tilpumu. Pēc tam šo maisījumu pārlej otrajā traukā un aerē, kā aprakstīts iepriekš. Šo procesu atkārto ik pēc 15 minūtēm, izmantojot dažādus pārbaudāmās vielas standartšķīduma tilpumus, lai iegūtu virkni trauku, kuros pārbaudāmā viela ir dažādās koncentrācijās. Visbeidzot sagatavo otro kontrolanalīzi (C2).
Pēc trim stundām nosaka pH, labi samaisa pirmā trauka saturu un tā paraugu ielej mērierīcē, un līdz 10 minūšu ilgā laika posmā mēra elpošanas intensitāti.
Šo noteikšanu atkārto ar katra trauka saturu, ievērojot 15 minūšu intervālu, un tā, lai katrā traukā saskares laiks būtu trīs stundas.
Tādā pašā veidā pārbauda standartvielu visās mikrobiālā inokulāta partijās.
Ja mērījumi jāveic pēc 30 saskares minūtēm, tad vajadzīgs cits režīms (piemēram, vairāk nekā viens skābekļa mērītājs).
Ja nepieciešams veikt ķīmiskā skābekļa patēriņa mērījumus, tad sagatavo vēl citus traukus ar pārbaudāmo vielu, sintētisko notekūdeņu barotni un ūdeni, bet bez aktīvajām dūņām. Skābekļa patēriņu mēra un reģistrē pēc 30 minūšu un/vai trīs stundu ilgas aerēšanas (saskares laiks).
2. DATI UN TO NOVĒRTĒŠANA
Elpošanas intensitāti aprēķina pēc pašrakstītāja zīmēm, kas atbilst koncentrācijai no aptuveni 6,5 mg O2/l līdz 2,5 mg O2/l, vai pēc 10 minūšu ilga laika posma, kurā elpošanas intensitāte ir zema. Tai elpošanas līknes daļai, pēc kuras mēra elpošanas intensitāti, jābūt lineārai.
Ja elpošanas intensitātes vērtības abās kontrolanalīzēs atšķiras par vairāk nekā 15 % vai ja standartvielas EC50 (30 minūtes un/vai trīs stundas) vērtība ir ārpus pieņemtā diapazona (3,5-dihlorfenolam tas ir 5 līdz 30 mg/l), tad tests nav derīgs un tas ir jāatkārto.
Inhibīcijas procentuālo daudzumu aprēķina katrai testa koncentrācijai (skatīt 1.2. punktu). Inhibīcijas procentuālo daudzumu attiecībā pret koncentrāciju atliek logaritmiski normālā (vai logaritmiski varbūtīgā) diagrammā un no tās nosaka EC50 vērtību.
95 % ticamības robežas EC50 vērtībām var noteikt ar standartmetodēm.
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, ietver šādu informāciju:
— pārbaudāmā viela: ķīmiskās identifikācijas dati,
— testa sistēma: aktīvo dūņu avots, koncentrācija un pirmapstrāde, ja tāda ir veikta,
— testa apstākļi:
—— reakcijas maisījuma pH pirms elpošanas intensitātes mērījuma,
— testa temperatūra,
— testa ilgums,
— standartviela un izmērītā EC50 vērtība šai vielai,
— abiotiskais skābekļa patēriņš (ja ir),
— rezultāti:
—— visi mērījumu dati,
— inhibīcijas līkne un EC50 aprēķina metode,
— EC50 un, ja iespējams, 95 % ticamības robežas, EK20 un EK80,
— visi novērojumi un tās atkāpes no šīs testa metodes, kuras var būt ietekmējušas rezultātu.
3.2. DATU INTERPRETĀCIJA
EC50 vērtība jāuztver vienīgi kā norāde uz pārbaudāmās vielas iespējamo toksicitāti attiecībā pret notekūdeņu attīrīšanas iekārtu aktīvajām dūņām vai pret notekūdeņu mikroorganismiem, jo laboratorijas apstākļos nav iespējams precīzi imitēt dabīgajā vidē notiekošās sarežģītās mijiedarbības. Turklāt pārbaudāmās vielas, kuru iedarbība uz amonjaka oksidēšanos var būt inhibējoša, var veidot arī netipiskas inhibīcijas līknes. Attiecīgi šādu līkņu interpretēšanā jāievēro piesardzība.
4. IZMANTOTĀ LITERATŪRA
(1) Starptautiskais standarts ISO 8192-1986.
(2) Broecker, B., Zahn, R., Water Research 11, 1977, p. 165.
(3) Brown, D., Hitz, H. R., Schaefer, L., Chemosphere 10, 1981, p. 245.
(4) ETAD (Ecological and Tox.icological Association of Dyestuffs Manufacturing Industries), Ieteicama metode Nr. 103, kas arī aprakstīta:
(5) Robra, B., Wasserl Abwasser 117, 1976, p. 80.
(6) Schefer, W., Textilveredlung 6, 1977, p. 247.
(7) OECD, Paris, 1981, Test Guideline 209, Decision of the Council C(84) 30 final.
C.12. BIODEGRADĀCIJA
MODIFICĒTS SCAS TESTS
1. METODE
1.1. IEVADS
Šīs metodes mērķis ir ilgstošā laikposmā izvērtēt ūdenī šķīstošu, negaistošu organisku vielu maksimālo iespējamo bioloģiskās noārdīšanās spēju apstākļos, kad tās pakļauj relatīvi augstā koncentrācijā esošu mikroorganismu iedarbībai. Šajā laikā mikroorganismu dzīvotspēju uztur, ik dienas pievienojot to barotnei izgulsnētus notekūdeņus. (Iknedēļas brīvdienu laikā notekūdeņus var uzglabāt 4 oC temperatūrā. Cita iespēja ir izmantot sintētiskos notekūdeņus no ESAO apstiprinošā testa.)
Interpretējot rezultātus (skatīt 3.2. punktu), jāņem vērā tas, ka ir iespējama fizikālķīmiskā adsorbcija uz suspendētajām daļiņām.
Ilgstošā šķidrās fāzes aizturēšanas perioda (36 stundas) un nepastāvīgās barības vielu pievienošanas dēļ šajā testā netiek imitēti notekūdeņu attīrīšanas iekārtās esošie apstākļi. Ar dažādām testētajām vielām iegūtie rezultāti liecina par to, ka šim testam ir augsts biodegradācijas potenciāls.
Testa apstākļi ir ļoti labvēlīgi tādu mikroorganismu atlasei un/vai pielāgošanai, kas spēj noārdīt pārbaudāmo savienojumu. (Šo metodi var izmantot arī citiem testiem paredzētu aklimatizētu inokulātu ieguvei.)
Šajā metodē pārbaudāmo vielu maksimālās bioloģiskās noārdīšanās spējas novērtēšanai izmanto izšķīdušā organiskā oglekļa koncentrācijas mērījumus. Ieteicams IOO noteikt pēc paskābināšanas un izpūšanas, nevis kā kopējā un neorganiskā oglekļa starpību.
Vienlaikus izmantojot īpašu analīzes metodi, ir iespējams novērtēt vielas pirmējo noārdīšanos (sākotnējās ķīmiskās struktūras izzušanu).
Šī metode piemērojama tikai tādām organiskām pārbaudāmām vielām, kam testā izmantotajā koncentrācijā ir šādas īpašības:
— tās ir ūdenī šķīstošas (vismaz 20 mg izšķīdušā organiskā oglekļa uz litru),
— tām ir neliels tvaika spiediens,
— nav inhibējošas ietekmes uz baktērijām,
— to adsorbcija testa sistēmā ir nebūtiska,
— tās neizdalās no testa šķīduma putošanas dēļ.
Pārbaudāmā materiālā jānosaka organiskā oglekļa saturs.
Iegūto rezultātu interpretēšanā noder informācija par pārbaudāmā materiāla galveno sastāvdaļu relatīvo īpatsvaru, sevišķi tajos gadījumos, kad rezultāti ir skaitliski nelieli vai tuvi kritiskajai robežai.
Skaitliski nelielu rezultātu interpretēšanā un piemērotas testa koncentrācijas izvēlē var noderēt informācija par pārbaudāmās vielas toksicitāti mikroorganismiem.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
|
CT |
= |
pārbaudāmās vielas koncentrācija, izteikta ar esošā vai pievienotā organiskā oglekļa saturu izgulsnējušos notekūdeņos aerācijas perioda sākumā (mg/l), |
|
Ct |
= |
testa šķīduma virsslānī esošā izšķīdušā organiskā oglekļa koncentrācija aerācijas perioda beigās (mg/l), |
|
Cc |
= |
kontrolanalīzes šķīduma virsslānī esošā izšķīdušā organiskā oglekļa koncentrācija aerācijas perioda beigās (mg/l). |
Šajā metodē ar biodegradāciju saprot organiskā oglekļa izzušanu. Biodegradāciju var izteikt šādi.
1. Vienā dienā pievienotā vielas daudzuma procentuālais zudums Dda:
|
|
(1) |
kur
|
Dda |
= |
vienā dienā pievienotā daudzuma noārdīšanās pakāpe. |
2. Dienas sākumā esošā vielas kopējā daudzuma procentuālais zudums Dssd:
|
|
(2. a)) |
|
|
(2. b)) |
kur
|
Dssd |
= |
dienas sākumā esošā vielas kopējā daudzuma noārdīšanās pakāpe; |
ar indeksiem i un (i + 1) norāda mērījuma veikšanas dienu.
2. a) vienādība ieteicama tad, ja izplūdes IOO vērtība katru dienu ir citāda, bet 2. b) vienādību var izmantot tad, ja izplūdes IOO vērtība dažādās dienās ir relatīvi nemainīga.
1.3. STANDARTVIELAS
Dažos gadījumos, kad notiek jaunu vielu izpēte, var būt lietderīgi izmantot standartvielas, tomēr ieteikt konkrētu standartvielu nevar.
Dati par vairākiem gredzena testos vērtētiem savienojumiem (skatīt 1. papildinājumu) sniegti galvenokārt tādēļ, lai varētu regulāri veikt metodes kalibrēšanu un lai citas metodes izmantošanas gadījumā iegūtu salīdzināmus rezultātus.
1.4. TESTA METODES PRINCIPS
No notekūdeņu attīrīšanas iekārtām ņemtās aktīvās dūņas ievieto puspārtrauktās aktīvo dūņu darbības (SCAS) vienībā. Pievieno pārbaudāmo savienojumu un izgulsnētus sadzīves notekūdeņus un maisījumu aerē 23 stundas. Tad aerāciju pārtrauc, ļauj dūņām izgulsnēties un nolej šķīduma virsslāni.
Pēc tam aerācijas kamerā atlikušās dūņas sajauc ar nākamo pārbaudāmā savienojuma un notekūdeņu alikvoto daļu un atkārto visu ciklu.
Biodegradāciju vērtē, nosakot izšķīdušā organiskā oglekļa koncentrāciju šķīduma virsslānī. Šo vērtību salīdzina ar to, kas iegūta, analizējot šķīdumu no kontrolanalīzes, kurā iepildīti tikai izgulsnētie notekūdeņi.
Ja izmanto kādu īpašu analītisku metodi, var mērīt biodegradācijas izraisītās izmaiņas sākotnējo molekulu koncentrācijā (pirmējā biodegradācija).
1.5. KVALITĀTES KRITĒRIJI
Šīs uz izšķīdušā organiskā oglekļa izzušanu balstītās metodes reproducējamība vēl nav noteikta. (Ir iegūti ļoti precīzi dati par stipri noārdāmu materiālu pirmējo biodegradāciju.)
Metodes jutību lielā mērā ietekmē tukšās analīzes mainīgums un – mazākā mērā – precizitāte, ar kādu katra cikla sākumā nosaka izšķīdušā organiskā oglekļa un šķīdumā esošā pārbaudāmā savienojuma koncentrāciju.
1.6. TESTA METODES APRAKSTS
1.6.1. Sagatavošanās testam
Uzstāda atbilstīgu daudzumu tīru aerācijas vienību – var izmantot arī oriģinālo 1,5 litru SCAS testa vienību – un gaisa pievades caurulītes (1. attēls) katrai pārbaudāmai vielai un kontrolanalīzei. Testa vienībās piegādātajam saspiestajam gaisam, kuru attīra ar kokvilnas filtru, jābūt bez organiskā oglekļa piemaisījumiem un iepriekš piesātinātam ar ūdeni, lai mazinātu iztvaikošanas radītos zudumus.
Šķīduma maisījuma paraugu ar suspendēto daļiņu koncentrāciju no 1 līdz 4 g/l ņem no aktīvo dūņu iekārtām, kurās attīra galvenokārt sadzīves notekūdeņus. Katrai aerācijas vienībai vajadzīgi apmēram 150 ml šķīduma maisījuma.
Destilētā ūdenī sagatavo pārbaudāmās vielas standartšķīdumus; vajadzīgā organiskā oglekļa koncentrācija parasti ir 400 mg/l, un tas pārbaudāmā savienojumā nodrošina oglekļa koncentrāciju 20 mg/l katra aerācijas cikla sākumā, ja vien nenotiek biodegradācija.
Ja vielas toksicitāte attiecībā pret mikroorganismiem to ļauj, var izmantot augstākas koncentrācijas.
Izmēra organiskā oglekļa koncentrāciju standartšķīdumos.
1.6.2. Testa apstākļi
Tests jāveic no 20 līdz 25 oC temperatūrā.
Izmanto aerobos mikroorganismus augstā koncentrācijā (suspendēto daļiņu koncentrācija no 1 līdz 4 g/l), un efektīvais aiztures laiks ir 36 stundas. Oglekli saturošais materiāls notekūdeņu barotnē ekstensīvi oksidējas, un parasti tas notiek astoņu stundu laikā pēc katra aerācijas cikla sākuma. Pēc tam atlikušajā aerācijas periodā dūņas endogēni elpo, un šajā laikā vienīgais pieejamais substrāts ir pārbaudāmais savienojums, ja vien arī tas nav viegli metabolizējams. Šīs iezīmes apvienojumā ar ik dienas atkārtotu inokulāciju, ko veic tad, ja par barotni izmanto sadzīves notekūdeņus, nodrošina ļoti labvēlīgus apstākļus gan aklimatizācijai, gan ekstensīvai biodegradācijai.
1.6.3. Testa veikšana
Ņem aktīvo dūņu šķīduma maisījuma paraugu no piemērotām attīrīšanas iekārtām, kurās apstrādā galvenokārt sadzīves notekūdeņus, un līdz izmantošanai laboratorijā to tur aerobos apstākļos. Visas aerācijas vienības, kā arī kontrolvienību uzpilda ar 150 ml šķīduma maisījuma (ja izmanto oriģinālo SCAS testa vienību, tad šeit norādītie tilpumi jāreizina ar 10) un sāk aerāciju. Pēc 23 stundām aerāciju pārtrauc un ļauj dūņām 45 minūtes nogulsnēties. Pēc kārtas atver katra trauka krānu un nolej pa 100 ml šķīduma virsslāņa. Tieši pirms izmantošanas ņem izgulsnējušos sadzīves notekūdeņu paraugu un katrā aerācijas vienībā atlikušajām dūņām pievieno pa 100 ml no šā parauga. Atsāk aerāciju. Šajā stadijā pārbaudāmos materiālus nepievieno un vienības ik dienu papildina ar sadzīves notekūdeņu devu, kamēr šķīduma virsslānis pēc izgulsnēšanās kļūst dzidrs. Parasti tas aizņem ne vairāk kā divas nedēļas, un līdz šim laikam šķīduma virsslānī izšķīdušā organiskā oglekļa koncentrācija katra aerācijas cikla beigās stabilizējas konkrētā līmenī.
Minētā laika posma beigās atsevišķajos traukos izgulsnējušās dūņas samaisa un katrā vienībā pievieno 50 ml no šādi iegūtā dūņu maisījuma.
Kontrolvienībās pievieno 95 ml izgulsnējušos notekūdeņu un 5 ml ūdens un testa vienībās pievieno 95 ml izgulsnējušos notekūdeņu un 5 ml attiecīgā pārbaudāmā savienojuma standartšķīduma (400 mg/l). Atsāk aerāciju, kuru turpina 23 stundas. Pēc tam ļauj dūņām 45 minūtes nogulsnēties, nolej šķīduma virsslāni un tajā nosaka izšķīdušā organiskā oglekļa koncentrāciju.
Iepriekš aprakstīto uzpildīšanas un noliešanas procedūru atkārto katru dienu visā testa laikā.
Pirms izgulsnēšanas var būt vajadzīgs notīrīt vienību sienas, lai novērstu cieto daļiņu uzkrāšanos virs šķidruma līmeņa. Lai novērstu nevēlamu savstarpēju sajaukšanos, katrai vienībai lieto savu skrāpi vai suku.
Ideālā gadījumā izšķīdušo organisko oglekli šķīduma virsslānī nosaka katru dienu, lai arī ir pieļaujams veikt ne tik biežas analīzes. Pirms analizēšanas šķīdumus izfiltrē caur mazgātiem 0,45 μn membrānfiltriem vai centrifugē. Membrānfiltri ir derīgi tad, ja tie visos filtrēšanas etapos nodrošina slāpekļa necaurlaidību un neabsorbē pārbaudāmo vielu. Parauga temperatūra centrifugēšanas laikā nedrīkst pārsniegt 40 oC.
Testa ilgums attiecībā uz savienojumiem, kuru bioloģiskā degradācija ir slikta vai kuri bioloģiski nenoārdās nemaz, nav noteikts, taču pieredze liecina, ka parasti tam vajadzētu ilgt vismaz 12 nedēļas un tomēr ne vairāk kā 26 nedēļas.
2. DATI UN TO NOVĒRTĒŠANA
Testa vienību un kontrolanalīžu vienību šķīdumu virsslānī esošā izšķīdušā organiskā oglekļa vērtības attēlo grafiski attiecībā pret laiku.
Biodegradācijas gadījumā vielas koncentrācija testa vienībā tuvinās vielas koncentrācijai kontrolanalīzē. Pēc tam, kad abu minēto koncentrāciju starpība trijos secīgos mērījumos ir palikusi nemainīga, veic vēl tik daudz turpmāku mērījumu, cik vajadzīgs datu statistiskai apstrādei, un aprēķina pārbaudāmās vielas procentuālo biodegradāciju (Dda vai Dssd, skatīt 1.2. punktu).
3. ZIŅOJUMA SAGATAVOŠANA
3.1. TESTA ZIŅOJUMS
Testa ziņojumā, ja iespējams, ietver šādu informāciju:
— visas ziņas par notekūdeņu veidu, izmantoto vienību veidu un eksperimentālajiem rezultātiem attiecībā uz testēto vielu, standartvielu, ja tāda ir izmantota, un tukšo analīzi,
— temperatūra,
— degradācijas līkne ar aprakstu, aprēķina veids (skatīt 1.2. punktu),
— aktīvo dūņu un notekūdeņu ievākšanas datums un vieta, pielāgojumu statuss, koncentrācija u. c.,
— zinātnisks pamatojums visām testa metodes izmaiņām,
— paraksts un datums.
3.2. REZULTĀTU INTERPRETĀCIJA
Tā kā ar šo metodi pārbaudāmās vielas nav viegli biodegradējamas, tad tas IOO samazinājums, kas noticis vienīgi biodegradācijas dēļ, parasti izpaužas pakāpeniski, vairāku dienu vai nedēļu laikā, izņemot gadījumus, kad aklimatizācija ir pēkšņa, uz ko norāda krass koncentrācijas samazinājums pēc dažām nedēļām.
Tomēr dažreiz var manāmi izpausties fizikālķīmiskā adsorbcija; par to liecina pilnīga vai daļēja pievienotā IOO izzušana jau pašā sākumā. Turpmāk notiekošais ir atkarīgs no tādiem faktoriem kā izplūdē esošo suspendēto daļiņu adsorbcijas pakāpe un koncentrācija. Parasti IOO koncentrāciju starpība kontrolanalīzes un pārbaudāmās vielas šķīduma virsslānī, salīdzinot ar sākotnējo zemo vērtību, pakāpeniski pieaug un pēc tam šī starpība saglabājas nemainīga visu atlikušo eksperimenta laiku, ja vien nenotiek aklimatizācija.
Lai nodalītu biodegradāciju (vai daļēju biodegradāciju) no adsorbcijas, jāveic turpmāki testi. To var veikt vairākos veidos, bet vispārliecinošākais ir izmantot šķīduma virsslāni vai dūņas par inokulātu galvenajā sarakstā iekļautā testā (vēlams – respirometriskā testā).
Pārbaudāmās vielas, kam šajā testā raksturīga augsta, neadsorbējoša IOO samazināšanās, uzskatāmas par potenciāli bioloģiski noārdāmām. Daļēja neadsorbējoša samazināšanās norāda uz to, ka ķīmiskā viela vismaz daļēji ir bioloģiski noārdāma.
Vāju IOO samazināšanos vai tās trūkumu var būt izraisījusi pārbaudāmās vielas inhibējošā iedarbība uz mikroorganismiem, un to var atklāt arī līze un dūņu zudums, kā rezultātā šķīduma virsslānis ir duļķains. Tests jāatkārto ar zemāku pārbaudāmās vielas koncentrāciju.
Lielāku jutību iespējams sasniegt, izmantojot savienojumam specifisku analīzes metodi vai ar radioaktīvo oglekli 14C marķētu pārbaudāmo vielu. Ar 14C marķēta pārbaudāmā savienojuma gadījumā to, ka ir notikusi biodegradācija, apstiprina 14CO2 atgūšana.
Ja rezultāti raksturo arī primāro biodegradāciju, tad iespēju robežās jāizskaidro ķīmiskās struktūras izmaiņas, kas izraisa reakcijas zudumu sākotnējā pārbaudāmā vielā.
Analīzes metodes validācija jānorāda kopā ar tukšajā analīzē iegūto rezultātu.
4. IZMANTOTĀ LITERATŪRA
(1) OECD, Paris, 1981, Test Guideline 302 A, Decision of the Council C(81) 30 final.
1. papildinājums
SCAS tests: rezultātu piemērs
|
Viela |
CT (mg/l) |
Ct – Cc (mg/l) |
Biodegradācijas procentuālais daudzums, Dda |
Testa ilgums (dienas) |
|
4-acetilaminobenzolsulfonāts |
17,2 |
2,0 |
85 |
40 |
|
Tetrapropilēnbenzolsulfonāts |
17,3 |
8,4 |
51,4 |
40 |
|
4-nitrofenols |
16,9 |
0,8 |
95,3 |
40 |
|
Dietilēnglikols |
16,5 |
0,2 |
98,8 |
40 |
|
Anilīns |
16,9 |
1,7 |
95,9 |
40 |
|
Ciklopentāntetrakarboksilāts |
17,9 |
3,2 |
81,1 |
120 |
2. Papildinājums
Testa iekārtas piemērs
1. attēls
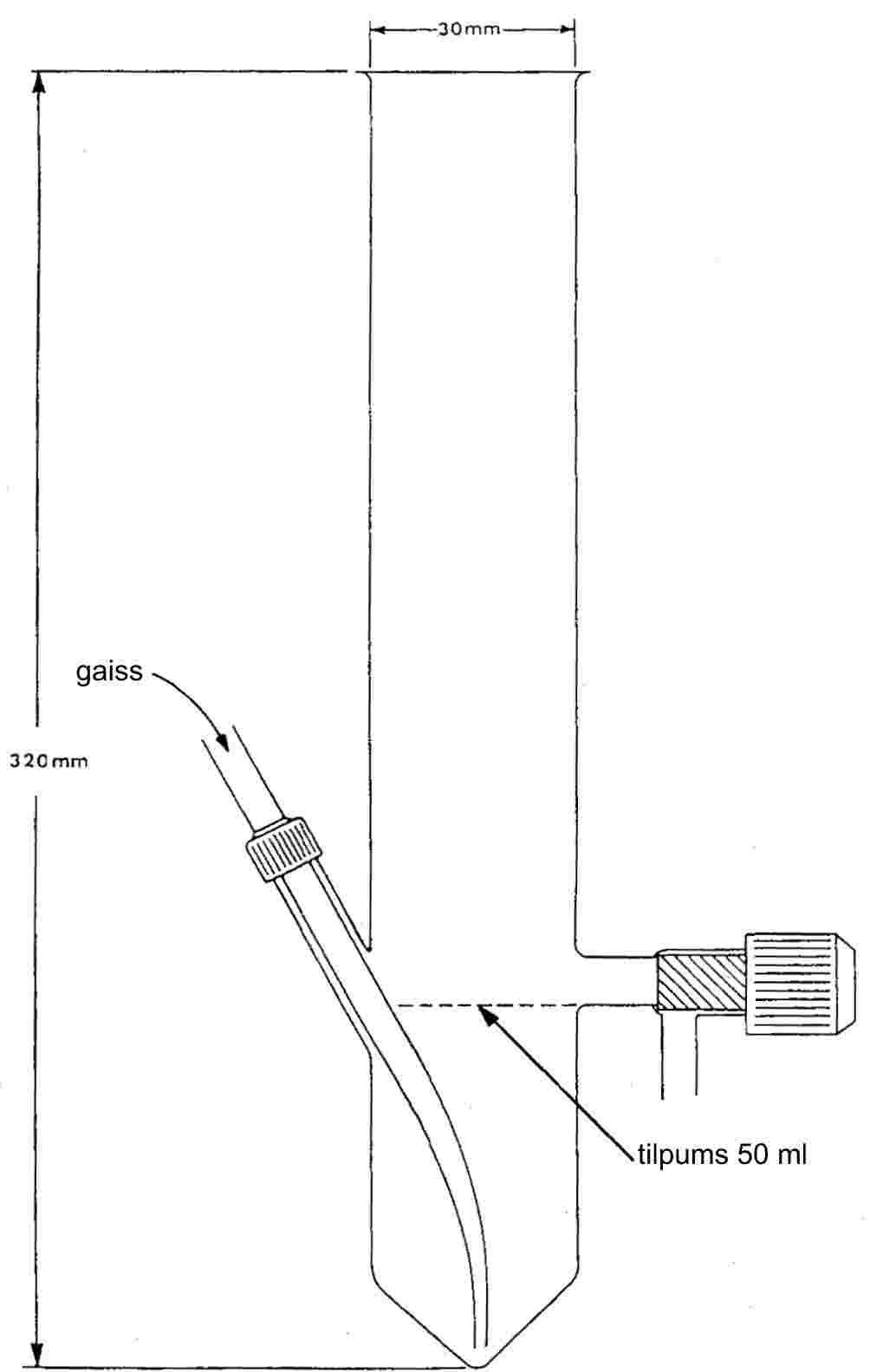
C.13. BIOKONCENTRĀCIJA – ZIVJU ANALĪZE CAURPLŪDES APSTĀKĻOS
1. METODE
Biokoncentrācijas metode ir OECD TG 305 (1996) kopija.
1.1. IEVADS
Šī metode apraksta procedūru vielu biokoncentrēšanas potenciāla raksturošanai zivīs caurplūdes apstākļos. Kaut arī caurplūdes testu režīmam noteikti jādod priekšroka, pieļaujami ir arī pusstatiski režīmi ar noteikumu, ka ir izpildīti ticamības kritēriji.
Metode ir pietiekami detalizēta, lai veiktu testus, tomēr dodot pietiekamu brīvību, lai eksperimenta plānu piemērotu konkrētu laboratoriju apstākļiem un pārbaudāmo vielu raksturīgo īpašību dažādībai. Visticamāk ir, ja to izmanto stabilām organiskām vielām ar log Pow lielumiem starp 1,5 un 6,0 (1), bet to var izmantot arī superlipofīlām vielām (ar log Pow > 6,0). Biokoncentrācijas koeficienta (BCF – bioconcentration factor) iepriekšēja novērtēšana dažkārt norāda, ka KB šādām superlipofīlām vielām, iespējams, ir lielāks nekā stacionāra stāvokļa biokoncentrācijas koeficienta (BCFSS) lielums, kas ir sagaidāms no laboratorijas eksperimentiem. Iepriekšēju biokoncentrācijas koeficienta novērtējumu organiskām vielām ar log Pow vērtībām ap 9,0 var iegūt, izmantojot Binteina vienādojumu (2). Parametri, kas raksturo biokoncentrēšanas potenciālu, ir uzņemšanas ātruma konstante (k1), attīrīšanās ātruma konstante (k2) un BCFSS.
Ūdens un zivju paraugu analīzi var atvieglot ar radioaktīviem izotopiem iezīmētas pārbaudāmās vielas un tās var izmantot, lai noteiktu, vai jāizdara degradācijas identifikācija un kvantitatīvā noteikšana. Ja mēra kopējo radioaktīvo atlikumu (piemēram, sadedzinot vai solubilizējot audus), tad BCF pamatojas uz izejas savienojumu, aizturētiem metabolītiem un arī uz asimilēto oglekli. BCFS pamatojas uz kopējo radioaktīvo atlikumu, tādēļ to nevar tieši salīdzināt ar BCF, kas ir iegūts vienīgi izejas savienojuma specifiskā ķīmiskā analīzē.
Lai noteiktu BCF, pamatojoties uz izejas savienojumu, pētījumos ar radioaktīvi iezīmētām vielām var izmantot zivju attīrīšanās procedūras un vajadzības gadījumā var raksturot galvenos metabolītus. Analizējot un identificējot atlikumu audos, ir iespējams arī apvienot zivju metabolisma pētījumus ar biokoncentrēšanas pētījumiem.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Biokoncentrēšana/bioakumulēšana: pārbaudāmās vielas koncentrācijas pieaugums organismā/uz tā (tā noteiktos audos) attiecībā pret pārbaudāmās vielas koncentrāciju apkārtējā vidē.
Biokoncentrēšanas koeficients (BCF jeb KB) jebkurā laikā šīs akumulēšanas testa uzņemšanas fāzē: pārbaudāmās vielas koncentrācija zivī vai uz tās, vai noteiktos tās audos (Cf kā μg/g (ppm)), dalīta ar šīs vielas koncentrāciju apkārtējā vidē (Cw kā μg/g (ppm)).
Stacionāra stāvokļa biokoncentrēšanas koeficients (BCFSS jeb KB) būtiski nemainās ilgākā laikā, ja pārbaudāmās vielas koncentrācija apkārtējā vidē šajā laikā ir konstanta.
Stacionāra stāvokļa plato ir sasniegts tad, (ja atliek grafikā pārbaudāmās vielas koncentrāciju zivīs (Cf) pret laiku) kad līkne kļūst paralēla laika asij un trīs secīgas Cf analīzes paraugiem, kas ņemti vismaz divu dienu intervālos, savā starpā sakrīt vismaz ± 20 % robežās un starp trim paraugu ņemšanas posmiem nav būtisku atšķirību. Analizējot apvienotus paraugus, ir vajadzīgas vismaz četras sekojošas analīzes. Pārbaudāmajām vielām, ko uzņem lēni, piemērotāki intervāli ir septiņas dienas.
Biokoncentrēšanas koeficienti, kas aprēķināti tieši no kinētiskajām ātruma konstantēm (k1/k2), tiek saukti par kinētiskajiem koncentrēšanas koeficientiem, BCFk.
Oktanola-ūdens sadalījuma koeficients (Pow) ir ķīmiskā savienojuma šķīdības oktanolā attiecība pret tā šķīdību ūdenī līdzsvara stāvoklī (A.8. metode), ko apzīmē arī ar Kow. Logaritmu no Pow izmanto kā ķīmiskās vielas biokoncentrēšanas ūdens organismos potenciāla rādītāju.
Iedarbības jeb uzņemšanas fāze ir laiks, kad zivis ir pakļautas ķīmiskās vielas iedarbībai.
Uzņemšanas ātruma konstante (k1) ir skaitlisks lielums, kas uzrāda pārbaudāmās vielas koncentrācijas palielinājuma ātrumu zivīs vai uz tām (vai specifiskos to audos), ja zivis ir pakļautas šīs ķīmiskās vielas iedarbībai (k1 izsaka dienās-1).
Pēciedarbības jeb attīrīšanās (zušanas) fāze ir laiks pēc pārbaudāmo zivju pārnešanas no vides, kas satur pārbaudāmo vielu, vidē, kas to nesatur; šajā laikā tiek pētīta zivju attīrīšanās no vielas (jeb tīrais vielas zudums).
Attīrīšanās (zuduma) ātruma konstante (k2) ir skaitlisks lielums, kas rāda pārbaudāmās vielas koncentrācijas samazināšanos pārbaudāmajās zivīs (vai specifiskos to audos) pēc pārbaudāmo zivju pārnešanas no vides, kas satur pārbaudāmo vielu, vidē, kas to nesatur (k2 izsaka dienās-1).
1.3. TESTA METODES PRINCIPS
Tests sastāv no divām fāzēm: iedarbības (uzņemšanas) un pēciedarbības (attīrīšanās) fāzes. Uzņemšanas fāzes laikā uz vienas sugas atsevišķām zivju grupām iedarbojas vismaz ar divām pārbaudāmās vielas koncentrācijām. Pēc tam zivis pārnes vidē, kas nesatur pārbaudāmo vielu, lai notiktu attīrīšanās fāze. Attīrīšanās fāze ir vienmēr vajadzīga vienmēr, izņemot, ja uzņemšanas fāze ir bijusi nenozīmīga (piemēram, BCF ir mazāks par 10). Pārbaudāmās vielas koncentrāciju zivīs/uz tām (vai specifiskos to audos) kontrolē abās pārbaudes fāzēs. Papildus divām pārbaudes koncentrācijām identiskos apstākļos, izņemot, to, ka nav klāt pārbaudāmā viela, tur zivju kontroles grupu, lai iespējamās negatīvās ietekmes, kas novērojamas biokoncentrēšanas testā, attiecinātu uz attiecīgo kontroles grupu un iegūtu pārbaudāmās vielas fona koncentrācijas.
Uzņemšanas fāzi turpina 28 dienas, ja vien netiek parādīts, ka līdzsvars ir sasniegts agrāk. Uzņemšanas fāzes ilgumu un laiku līdz stacionāram stāvoklim var paredzēt, izmantojot vienādojumu 3. papildinājumā. Attīrīšanās periods sākas pēc tam, kad zivis pārnestas citā tīrā traukā tajā pašā vidē, bet bez pārbaudāmās vielas. Ja iespējams, biokoncentrēšanas koeficientu vislabāk aprēķina gan kā attiecību (BCFSS) koncentrācijai zivīs (Cf) pret koncentrāciju ūdenī (Cw) šķietami stacionārā stāvoklī, gan kā kinētisko biokoncentrēšanas koeficientu (BCFk) kā uzņemšanas ātruma konstantes (k1) attiecību pret attīrīšanās ātruma konstanti (k2), pieņemot, ka reakcijas kinētika ir pirmās kārtas. Ja kinētika acīmredzami nav pirmās kārtas, tad jāizmanto sarežģītāki modeļi (5. papildinājums).
Ja stacionārs stāvoklis nav sasniegts 28 dienās, uzņemšanas fāze jāpagarina līdz stacionāra stāvokļa sasniegšanai vai līdz 60 dienām, līdz notikumam, kurš no abiem minētajiem notiek ātrāk. Pēc tam uzsāk attīrīšanas fāzi.
Uzņemšanas ātruma konstanti, attīrīšanās (zuduma) ātruma konstanti (vai konstantes, ja iesaistīti sarežģītāki modeļi), biokoncentrēšanas koeficientu un, ja iespējams, ticamības robežas katram no šiem parametriem aprēķina, izmantojot modeli, kas vislabāk apraksta pārbaudāmās vielas izmērītās koncentrācijas zivīs un ūdenī.
BCF izsaka kā funkciju no zivju kopējā slapjā svara. Tomēr īpašiem mērķiem var izmantot specifiskus audus vai orgānus (piemēram, muskuļus, aknas), ja zivis ir pietiekami lielas vai arī ja zivis var sadalīt ēdamajā (fileja) un neēdamajā (iekšējie orgāni) daļā. Tā kā daudzām organiskām vielām ir skaidri izteikta sakarība starp biokoncentrēšanas potenciālu un lipofilitāti, pastāv arī atbilstoša sakarība starp tauku saturu analizējamās zivīs un novēroto šādu vielu biokoncentrēšanu. Tādēļ, lai samazinātu pārbaudes rezultātu mainīgumu vielām ar augstu lipofilitāti (piemēram, ar log Pow > 3), biokoncentrēšana būtu jāizsaka attiecībā pret tauku saturu papildus attiecināšanai pret visa ķermeņa masu.
Tauku saturs būtu jānosaka tam pašam bioloģiskajam materiālam, ko izmanto pārbaudāmās vielas koncentrācijas noteikšanai, ja tas ir iespējams.
1.4. INFORMĀCIJA PAR PĀRBAUDĀMO VIELU
Pirms biokoncentrēšanas testa veikšanas būtu jāzina šāda informācija par pārbaudāmo vielu:
— šķīdība ūdenī,
— oktanola-ūdens sadalījuma koeficients Pow (apzīmē arī kā Kow, ko nosaka ar HPLC A.8. metodi),
— hidrolīze,
— fotopārvērtības ūdenī, ko nosaka saules starojuma vai mākslīga saules starojuma ietekmē un tādos starojuma apstākļos, kādos tiek veikts biokoncentrācijas tests (3),
— virsmas spraigums (t. i., vielām, kam nevar noteikt Pow),
— tvaika spiediens,
— biodegradēšanās iespēja (ja vajadzīgs).
Cita vajadzīga informācija ir toksicitāte attiecībā uz testā izmantojamām zivju sugām, vislabāk – asimptotiskais LC50 (t. i., no laika neatkarīgs). Lai kvantitatīvi noteiktu pārbaudāmo vielu šķīdumos un bioloģiskajā materiālā, jābūt pieejamai piemērotai analītiskai metodei ar zināmu precizitāti un jutību, kā arī informācijai par paraugu sagatavošanu un glabāšanu. Jābūt zināmai arī pārbaudāmās vielas analītiskās noteikšanas robežai kā ūdenī, tā zivju audos. Ja lieto ar 14C iezīmētu pārbaudāmo vielu, tad jāzina arī radioaktivitāte procentos, kas saistīta ar piemaisījumiem.
1.5. TESTA DERĪGUMS
Lai pārbaude būtu derīgs, jāievēro šādi apstākļi:
— temperatūras svārstības ir mazākas par ± 2 oC,
— izšķīdušā skābekļa koncentrācija nav mazāka par 60 % no piesātinājuma,
— pārbaudāmās vielas koncentrāciju nodalījumos uztur ± 20 % robežās no vidējās izmērītās vērtības uzņemšanas fāzes laikā,
— mirstība un citas negatīvas ietekmes/saslimšanas kā kontroles, tā eksperimenta grupā testa beigās ir mazākas par 10 %; ja šis tests turpinās vairākas nedēļas vai mēnešus, tad mirstībai vai citām negatīvām ietekmēm abās zivju grupās būtu jābūt mazākai par 5 % mēnesī un kopumā nebūtu jāpārsniedz 30 %.
1.6. STANDARTVIELAS
Standartvielu ar zināmu biokoncentrēšanas potenciālu izmantošana būtu noderīga eksperimentālās procedūras pārbaudei, ja vajadzīgs. Tomēr specifiskas vielas vēl nevar ieteikt.
1.7. TESTA METODES APRAKSTS
1.7.1. Aprīkojums
Jāpievērš vērība, lai visās iekārtas daļās izvairītos izmantot materiālus, kas varētu šķīst, sorbēties vai ekstrahēties un kam varētu būt negatīva ietekme uz zivīm. Var izmantot no ķīmiski inerta materiāla izgatavotus proporcionāli ievietojamam zivju daudzumam piemērotas ietilpības standarta taisnstūrainus vai cilindriskus baseinus. Plastmasas caurules jāizmanto minimāli. Priekšroka ir Teflon®, nerūsējošā tērauda un/vai stikla cauruļu izmantošanai. Pieredze rāda, ka vielām ar augstiem absorbcijas koeficientiem, tādām kā sintētiskie piretroīdi, var būt vajadzīgs kvarca stikls. Tādos gadījumos iekārta pēc izmantošanas jāizmet.
1.7.2. Ūdens
Testos parasti lieto parasto ūdeni un tā ieguves avotam jābūt nepiesārņotam un nemainīgas kvalitātes. Atšķaidīšanā lietotajam ūdenim jābūt tādas kvalitātes, kas ļauj izvēlētās sugas zivīm izdzīvot aklimatizācijas un testa laikā normālā izskatā un ar normālu izturēšanos. Ideālā gadījumā būtu jāparāda, ka testā izmantotās sugas atšķaidīšanai izmantotajā ūdenī var dzīvot, augt un vairoties (piemēram, laboratorijas kultūrā vai dzīves cikla toksicitātes testā). Ūdens būtu jāraksturo vismaz ar pH, cietumu, kopējo cieto vielu saturu, kopējo organisko oglekli un vēlams arī amoniju, nitrītiem un bāziskumu un – jūras dzīvniekiem – sāļumu. Parametri, kas ir svarīgi optimāliem zivju eksistences apstākļiem, ir pilnībā zināmi, bet 1. papildinājumā ir dotas ieteicamās maksimālās koncentrācijas testos lietojamā saldūdens un jūras ūdens vairākiem parametriem.
Ūdens kvalitātei testa laikā jābūt konstantai. pH vērtībai jābūt starp 6,0 un 8,5, bet viena testa laikā tam jābūt ± 0,5 pH vienību robežās. Lai nodrošinātu, ka atšķaidīšanas ūdens nevajadzīgi neietekmē testa rezultātu (piemēram, veidojot kompleksus ar pārbaudes vielu) vai negatīvi neietekmē zivju partijas uzvedību, laiku pa laikam jāņem paraugi analīzei. Ja ir zināms, ka ūdens kvalitāte ir relatīvi nemainīga, tad, piemēram, reizi trijos mēnešos būtu jāveic smago metālu (piemēram, Cu, Pb, Zn, Hg, Cd, Ni), biežāk sastopamo anjonu un katjonu (piemēram, Ca, Mg, Na, K, Cl, SO4), pesticīdu (piemēram, kopējo hlororganisko un fosfororganisko pesticīdu), kopējā organiskā oglekļa un suspendēto cieto daļiņu analīze. Ja ir parādīts, ka ūdens kvalitāte ir nemainīga ilgāk par vienu gadu, tad noteikšanas var veikt retāk un intervālus pagarināt (piemēram, reizi sešos mēnešos).
Dabīgajam daļiņu saturam un kopējam organiskajam ogleklim (TOC) atšķaidīšanas ūdenī būtu jābūt iespējami mazākam, lai izvairītos no tā, ka pārbaudāmās vielas absorbcija uz organiskā materiāla varētu samazināt vielas biopieejamību (4). Maksimāli pieļaujamais lielums ir 5 mg/l konkrētam materiālam (sauss materiāls, kas neiziet caur 0,45 μm filtru) un 2 mg/l kopējam organiskajam ogleklim (skatīt 1. papildinājumu). Vajadzības gadījumā ūdens pirms lietošanas jāfiltrē. Organiskā oglekļa daļai ūdenī no pārbaudes zivīm (ekskrementi) un no barības pārpalikuma jābūt iespējami mazai. Visā testa laikā organiskā oglekļa koncentrācijai testa baseinā nevajadzēt vairāk nekā par 10 mg/l (± 20 %) pārsniegt to organiskā oglekļa koncentrāciju, kas rodas no pārbaudāmās vielas un šķīdību veicinošā aģenta, ja tādu izmanto.
1.7.3. Testa šķīdumi
Sagatavo pārbaudāmās vielas piemērotas koncentrācijas darba šķīdumu. Darba šķīdumu vislabāk pagatavot, vienkārši maisot vai kratot pārbaudāmo vielu atšķaidīšanas ūdenī. Šķīdinātāju vai disperģējošu vielu (šķīdību veicinošu reaģentu) lietošana nav ieteicama; tomēr dažos gadījumos tos var izmantot, lai pagatavotu piemērotas koncentrācijas darba šķīdumu. Šķīdinātāji, ko var lietot, ir etanols, metanols, etilenglikola monometilēteris, etilenglikola dimetilēteris, dimetilformamīds un trietilenglikols. Disperģējošas vielas, ko var lietot, ir Cremophor RH40, Tween 80, 0,01 % metilceluloze un HCO-40. Jābūt uzmanīgiem, ja lieto viegli biodegradējamus reaģentus, jo tie var radīt problēmas ar baktēriju augšanu caurplūdes testos. Pārbaudāmā viela var būt radioaktīvi iezīmēta, un tai būtu jābūt augstas tīrības pakāpes (piemēram, vēlams > 98 %).
Caurplūdes testiem ir vajadzīga sistēma, kas nepārtraukti padod un atšķaida pārbaudāmās vielas darba šķīdumu (piemēram, dozējošs sūknis, proporcionāls atšķaidītājs, sistēma piesātināšanai ar gaisu), lai padotu pārbaudāmās koncentrācijas šķīdumu testa nodalījumos. Caur katru testa nodalījumu dienā vislabāk ir izdarīt vismaz piecas tilpuma nomaiņas. Priekšroka ir caurplūdes režīmam, bet, ja tas nav iespējams (piemēram, ja tas negatīvi ietekmē pārbaudes organismus), var izmantot pusstatisku tehniku ar noteikumu, ka ir izpildīti ticamības kritēriji. Darba šķīdumu plūsmas ātrumi jākontrolē 48 stundas pirms testa un pēc tam testa laikā vismaz katru dienu. Šajā kontrolē ir ietverta plūsmas ātruma kontrole caur katru testa nodalījumu un jānodrošina, ka plūsmas ātrums nemainās vairāk par 20 % katrā nodalījumā un vairāk arī neatšķiras starp nodalījumiem.
1.7.4. Sugu izvēle
Sugu izvēlē svarīgs kritērijs ir tas, vai tās ir viegli pieejamas, vai tās var iegūt piemērotos lielumos un vai tās var apmierinoši turēt laboratorijā. Citi kritēriji zivju sugu izvēlei ietver atlabšanas, komerciālo, ekoloģisko svarīgumu, kā arī salīdzināmu jutīgumu, veiksmīgo izmantošanu iepriekš utt.
Iesakāmās sugas pārbaudēm ir uzskaitītas 2. papildinājumā. Citas sugas var izmantot, bet testa procedūru vajadzētu tām piemērot, lai nodrošinātu piemērotus pārbaudes apstākļus. Šajā gadījumā jādod pamatojums sugas izvēlei un izvēlētā eksperimenta metode.
1.7.5. Zivju turēšana
Zivju partijas populāciju vismaz divas nedēļas aklimatizē testa temperatūras ūdenī un visu laiku baro ar pietiekamu diētu, kas ir tāda pati, kādu izmantos testa laikā.
Pēc 48 stundu sākumposma reģistrē mirstību un piemēro šādus kritērijus:
— mirstība septiņās dienās lielāka par 10 % no populācijas: izbrāķē visu grupu,
— mirstība starp 5 un 10 % no populācijas septiņās dienās: aklimatizē septiņas papildu dienas,
— mirstība mazāka par 5 % no populācijas septiņās dienās: pieņem partiju, bet, ja mirstība nākošo septiņu dienu laikā ir lielāka par 5 %, izbrāķē visu partiju.
Nodrošina, lai testiem izmantojamām zivīm nebūtu redzamas saslimšanas vai nenormālības. Zivīm nebūtu jāsaņem ārstēšana divu nedēļu laikā pirms testiem vai testu laikā.
1.8. TESTU VEIKŠANA
1.8.1. Iepriekšējs tests
Var būt noderīgi izdarīt iepriekšēju eksperimentu, lai optimizētu testa veikšanu, piemēram, pārbaudāmās vielas koncentrācijas (koncentrāciju) izvēli, uzņemšanas un attīrīšanas fāzes ilgumu.
1.8.2. Uzņemšanas fāzes apstākļi
1.8.2.1.
Uzņemšanas fāzes ilgumu var paredzēt pēc praktiskās pieredzes (piemēram, no iepriekšējiem pētījumiem vai līdzīgas ķīmiskas vielas uzkrāšanās) vai no noteiktām empīriskām sakarībām, kur izmantotas zināšanas vai nu par pārbaudāmās vielas šķīdību ūdenī, vai par oktanola/ūdens sadalījuma koeficientu (skatīt 3. papildinājumu).
Uzņemšanas fāze būtu jāturpina 28 dienas, ja vien nevar parādīt, ka līdzsvars ir sasniegts agrāk. Ja stacionārs stāvoklis nav sasniegts 28 dienās, uzņemšanas fāze būtu jāpagarina līdz stacionāra stāvokļa sasniegšanai vai līdz 60 dienām, kurš no abiem notikumiem iestājas drīzāk.
1.8.2.2.
Parasti puse no uzņemšanas fāzes ilguma ir pietiekama, lai notiktu atbilstoša (piemēram, 95 %) ķermenī uzņemtās vielas samazināšanās (noteikšanas paskaidrojumus skatīt 3. papildinājumā). Ja laiks 95 % sasniegšanai ir nerealizējami ilgs, piemēram, ja tas divreiz pārsniedz parasto uzņemšanas fāzes ilgumu (t. i., vairāk par 56 dienām), tad var izmantot īsāku laiku (t. i., līdz pārbaudāmās vielas koncentrācija ir mazāka par 10 % no stacionārā stāvokļa koncentrācijas). Tomēr vielām, kurām ir sarežģītāks uzņemšanas un attīrīšanās raksturs, nekā attēlo viena zivju nodalījuma modelis, kas uzrāda pirmās kārtas kinētiku, jāļauj ilgākas attīrīšanās fāzes, lai noteiktu zuduma ātruma konstantes. Šo laika posmu tomēr nosaka laika posms, kurā pārbaudāmās vielas koncentrācija zivīs paliek virs analītiskās noteikšanas robežas.
1.8.2.3.
Zivju skaitu uz testa koncentrāciju izvēlas tādu, lai katrā paraugā būtu pieejamas vismaz četras zivis. Ja ir vajadzīga lielāka statistiska nozīmība, ir vajadzīgs lielāks zivju skaits paraugā.
Ja izmanto pieaugušas zivis, ziņo, vai tās ir tēviņi vai mātītes, vai eksperimentā izmanto abus dzimumus. Ja izmanto abus dzimumus, jādokumentē tauku satura atšķirības starp dzimumiem, kam pirms pakļaušanas vielu iedarbībai būtu jābūt nenozīmīgām; var būt vajadzīga visu tēviņu un mātīšu apvienošana paraugā.
Ikvienā atsevišķā testā izvēlas zivis ar līdzīgu masu tā, lai mazākā nebūtu vieglāka par divām trešdaļām no lielākās svara. Visām būtu jābūt vienas vecuma klases un jābūt iegūtām no viena avota. Tā kā zivju masai un vecumam dažreiz, izrādās, ir nozīme BCF lielumos (1), šīs detaļas precīzi jāprotokolē. Ir iesakāms pirms testa nosvērt nelielu zivju partijas parauga daļu, lai noteiktu vidējo svaru.
1.8.2.4.
Lai Cw samazināšanās, ko rada zivju ievietošana testa sākumā, būtu iespējami maza un arī lai izvairītos no izšķīdušā skābekļa koncentrācijas samazināšanās, izmanto augstu ūdens/zivju attiecību. Ir svarīgi, lai ievietošanas ātrums būtu piemērots testā izmantojamām zivju sugām. Katrā ziņā parastais iesakāmais ievietošanas ātrums ir 0,1 līdz 1 g zivs (slapjais svars) uz litru ūdens dienā. Lielus ievietošanas ātrumus var lietot, ja ir parādīts, ka pārbaudāmās vielas koncentrāciju var uzturēt ± 20 % robežās un izšķīdušā skābekļa koncentrācija nesamazinās zem 60 % no piesātinājuma.
Izvēloties piemērotu ievietošanas režīmu, jāņem vērā zivju parastā dabiskā vide. Piemēram, zivīm, kas dzīvo ūdens tilpnes dibenā, var vajadzēt lielāku akvārija dibena laukumu uz to pašu ūdens tilpumu nekā tuvu ūdens virsmai dzīvojošām zivju sugām.
1.8.2.5.
Aklimatizācijas un testa laikā zivis baro ar piemērotu diētu, kurai ir zināms tauku un kopējo olbaltumvielu saturs, pietiekamā daudzumā, lai tās uzturētu veselas un saglabātu ķermeņa svaru. Aklimatizācijas un testa laikā zivis baro katru dienu aptuveni 1 līdz 2 % no ķermeņa masas apmērā; tas uztur tauku koncentrāciju vairumam zivju sugu testa laikā relatīvi nemainīgā līmenī. Barojuma līmeni jāpārrēķina, piemēram, reizi nedēļā, lai uzturētu nemainīgu ķermeņa masu un tauku saturu. Šim aprēķinam zivju masu katrā testa nodalījumā var novērtēt no zivs, kas visnesenāk ir paņemta paraugam šajā nodalījumā. Nodalījumā palikušās zivis nesver.
Neapēsto barību un izkārnījumus no testa nodalījuma atsūc ar sifonu katru dienu īsu laiku pēc barošanas (no 30 minūtēm līdz vienai stundai). Testa laikā nodalījumus tur iespējami tīrus, lai organiskā materiāla koncentrācija būtu pēc iespējas mazāka, jo organiskā oglekļa klātbūtne var ierobežot pārbaudāmās vielas biopieejamību (1).
Tā kā daudzu veidu zivju barība ir izveidota no zivju miltiem, barībā jānosaka pārbaudāmās vielas saturs. Ir vēlams barību analizēt arī uz pesticīdiem un smagajiem metāliem.
1.8.2.6.
Fotoperiods parasti ilgst 12 līdz 16 stundas, un temperatūrai (± 2 oC) jābūt piemērotai pētāmo zivju sugai (skatīt 2. papildinājumu). Apgaismojuma tipam un raksturojumam būtu jābūt zināmam. Uzmanība jāpievērš pārbaudāmās vielas iespējamām fotopārvērtībām pētījuma starojuma apstākļos. Jāizmanto piemērots apgaismojums, lai izvairītos no zivju pakļaušanas nedabīgu fotoproduktu iedarbībai. Dažos gadījumos var būt atbilstoši izmantot filtru, lai ekranētu UV starojumu ar viļņa garumu zem 290 nm.
1.8.2.7.
Caurplūdes apstākļos zivis pakļauj vismaz divu koncentrāciju pārbaudāmās vielas ūdens šķīduma iedarbībai. Parasti augsto (vai augstāko) pārbaudāmās vielas koncentrāciju izvēlas apmēram 1 % līmenī no akūtas asimptotiskas LC50 lieluma, un tai jābūt vismaz desmit reižu augstākai par vielas noteikšanas robežu ūdenī ar izmantojamo analītisko metodi.
Augstāko testa koncentrāciju var noteikt arī, dalot akūto 96 stundu LC50 ar piemērotu akūto/hronisko attiecību (piemērotas attiecības dažām ķīmiskām vielām var būt starp 3 un 100). Ja iespējams, izvēlas citu koncentrāciju(-as) tā, lai tās atšķirtos viena no otras ar koeficientu 10. Ja tas nav iespējams 1 % no LC50 kritērija dēļ un analītiskās robežas dēļ, tad var lietot mazāku koeficientu vai jāapsver ar 14C iezīmētas pārbaudāmās vielas lietošana. Neviena izmantojamā koncentrācija nevar būt lielāka par pārbaudāmās vielas šķīdību.
Ja lieto šķīdību veicinošu reaģentu, tā koncentrācijai jābūt mazākai par 0,1 ml/l un tai jābūt vienādai visos mēģinājumu akvārijos. Būtu jāzina kopējais reaģenta un pārbaudāmās vielas ieguldījums kopējā organiskā oglekļa saturā testā izmantojamā ūdenī. Tomēr jāpieliek visas pūles, lai izvairītos no tādu reaģentu izmantošanas.
1.8.2.8.
Bez testa sērijām jāizdara viena atšķaidīšanas ūdens analīze kontroles grupai vai, ja tas ir būtiski, jāizdara viena analīze ūdenim, kas satur šķīdību veicinošo reaģentu, ar noteikumu, ka ir noskaidrots, ka reaģents neietekmē zivis. Ja tā nav, jāveic abas kontroles.
1.8.3. Ūdens kvalitātes mērījumu biežums
Testa laikā visos akvārijos jāmēra izšķīdušais skābeklis, TOC, pH un temperatūra. Kopējais cietums un sāļums, ja tas ir būtiski, jāmēra kontroles mēģinājumā un vienā traukā ar augstāku (vai visaugstāko) koncentrāciju. Izšķīdušais skābeklis un sāļums, ja tas ir nozīmīgs, jāmēra minimāli trīs reizes – uzņemšanas posma sākumā, apmēram vidū un beigās – un reizi nedēļā attīrīšanās posma laikā. TOC būtu jāmēra testa sākumā (24 stundas un 48 stundas pirms uzņemšanas fāzes uzsākšanas) pirms zivju ielaišanas un vismaz reizi nedēļā uzņemšanas un attīrīšanās fāžu laikā. Temperatūra jāmēra katru dienu, pH katra posma sākumā un beigās un cietība – vienreiz katrā testā. Temperatūra vislabāk jāpārrauga visu laiku vismaz vienā traukā.
1.8.4. Zivju un ūdens paraugu ņemšana un analīze
1.8.4.1.
Ūdeni no testa nodalījumiem pārbaudāmās vielas koncentrācijas noteikšanai ņem pirms zivju ielaišanas un kā uzņemšanas, tā arī attīrīšanās fāžu laikā. Kā minimumu ūdens paraugus ņem tajā pašā laikā, kad zivju paraugus, un pirms barošanas. Uzņemšanas fāzes laikā pārbaudāmās vielas koncentrāciju nosaka, lai pārbaudītu atbilstību ticamības kritērijiem.
Zivju paraugus ņem vismaz piecas reizes uzņemšanas fāzes laikā un vismaz četras reizes attīrīšanās fāzes laikā. Tā kā dažos gadījumos ir grūti ar pieņemamu precizitāti izrēķināt aptuveno BCF vērtību, pamatojoties uz šo paraugu skaitu, jo īpaši, ja ir norādījumi, ka attīrīšanās kinētika nav vienkārša pirmās kārtas kinētika, tad var būt ieteicams paraugus abās fāzēs ņemt biežāk (skatīt 4. papildinājumu). Papildu paraugus uzglabā un analizē tikai tad, ja pirmā cikla analīzes izrādās neadekvātas, lai ar vēlamo precizitāti aprēķinātu BCF.
Pieņemama paraugu ņemšanas grafika paraugs ir 4. papildinājumā. Citus grafikus var viegli izrēķināt, izmantojot citas pieņemtas Pow vērtības, lai aprēķinātu zivju pakļaušanas ķimikālijas iedarbībai laiku 95 % uzņemšanai.
Paraugu ņemšanu turpina uzņemšanas fāzes laikā, līdz konstatē stacionāru stāvokli, vai 28 dienas – kas no abiem notiek drīzāk. Ja stacionārs stāvoklis nav sasniegts 28 dienās, paraugu ņemšana turpinās līdz stacionāra stāvokļa sasniegšanai vai 60 dienas – kas no abiem notiek drīzāk. Pirms attīrīšanās fāzes sākuma zivis pārvieto tīros akvārijos.
1.8.4.2.
Ūdens paraugus analīzei iegūst, piemēram, sifonējot caur inerta materiāla cauruli no testa nodalījuma viduspunkta. Tā kā ne filtrēšana, ne centrifugēšana vienmēr neatdala pārbaudāmās vielas bionepieejamo frakciju no tās, kas ir biopieejama (īpaši superlipofīlām vielām, t. i., ķīmiskām vielām ar log Pow > 5) (1) (5), paraugus var nepakļaut šādai apstrādei.
Tā vietā būtu jāveic pasākumi, lai uzturētu baseinus iespējami tīrus, un kopējā organiskā oglekļa saturs jākontrolē gan uzņemšanas, gan attīrīšanās fāzes laikā.
Katrā paraugu ņemšanas reizē no testa nodalījumiem izņem piemērotu skaitu zivju (parasti minimālais daudzums ir četras). Paraugam ņemtās zivis ātri noskalo ar ūdeni, nosusina “sausas”, uzreiz nogalina, izmantojot vispiemērotāko un humānāko metodi, un pēc tam nosver.
Vislabāk ir analizēt zivis un ūdeni tūlīt pēc paraugu noņemšanas, lai novērstu sadalīšanos un citus zudumus un lai izrēķinātu aptuvenos uzņemšanas un attīrīšanās ātrumus, kamēr tests turpinās. Tūlītēja analīze arī palīdz izvairīties no aizkavēšanās, nosakot laiku, kad ir sasniegts līknes plato.
Ja analīzi neveic tūlīt, paraugus glabā, izmantojot piemērotu metodi. Pirms sākt pētījumus, iegūst informāciju par konkrētai pārbaudāmai vielai piemērotu glabāšanas metodi – piemēram, dziļo saldēšanu, turēšanu 4 oC temperatūrā, ekstrakciju utt.
1.8.4.3.
Tā kā visu procedūru pēc būtības nosaka pārbaudāmajai vielai izmantojamās analītiskās metodes precizitāte, pareizība un jutība, eksperimentāli jāpārbauda, vai ķīmiskās analīzes precizitāte un atkārtojamība, kā arī pārbaudāmās vielas atpakaļiegūšana gan no ūdens, gan no zivīm ar konkrēto metodi ir apmierinoša. Pārbauda arī, vai pārbaudāmā viela nav konstatējama atšķaidīšanai izmantojamā ūdenī.
Ja vajadzīgs, no testa iegūtās Cw un Cf vērtības koriģē uz atgūstamo vielu un kontroles mēģinājuma fona vērtībām. Zivju un ūdens paraugus visu laiku apstrādā tā, lai līdz minimumam samazinātu piesārņojumu un zudumus (piemēram, tos, kas rodas no adsorbcijas uz parauga ņemšanas ierīces).
1.8.4.4.
Ja testā izmanto radioaktīvi iezīmētus materiālus, iespējams analītiski noteikt kopējo radioaktīvo iezīmi (t. i., izejas savienojumam kopā ar metabolītiem) vai arī paraugi ir tā jātīra, lai izejas savienojumu varētu analizēt atsevišķi. Galvenos metabolītus var raksturot arī stacionārā stāvoklī vai uzņemšanas fāzes beigās – kurš no abiem iestājas ātrāk. Ja BCF kopējo radioaktīvi iezīmēto atlikumvielu izteiksmē ir ≥ 1 000 %, tad var būt ieteicams un dažu kategoriju ķīmiskām vielām, piemēram, pesticīdiem, pat stingri ieteicams identificēt un kvantitatīvi noteikt noārdīšanas produktus, kas veido ≥ 10 % no kopējā vielu atlikuma zivju audos stacionārā stāvoklī. Ja noārdīšanās produkti, kas veido ≥ 10 % no kopējā radioaktīvi iezīmētā vielu atlikuma zivju audos, ir identificēti un kvantitatīvi noteikti, tad ir arī iesakāms identificēt un kvantitatīvi noteikt noārdīšanās produktus testa ūdenī.
Pārbaudāmās vielas koncentrācija parasti būtu jānosaka katrā nosvērtā atsevišķā zivī. Ja tas nav iespējams, var veikt paraugu apvienošanu katram paraugu ņemšanas gadījumam, bet apvienošana noteikti ierobežo statistikas procedūras, ko var piemērot datiem. Ja specifiska statistikas procedūra un nozīmīgums ir svarīgi apsvērumi, testā jāietver atbilstošs skaits zivju, lai pielāgotu vēlamo apvienošanas procedūru un statistisko nozīmīgumu (6) (7).
BCF jāizsaka kā kopējā svara funkcija un lipofīlām vielām arī kā tauku satura funkcija. Tauku saturu zivīs nosaka katrā paraugu ņemšanas reizē, ja tas ir iespējams. Tauku satura noteikšanai jālieto piemērotas metodes ((8) un (2) 3. papildinājumā). Kā standartmetodi var ieteikt hloroforma/metanola ekstrakcijas metodi (9). Dažādas metodes nedod identas vērtības (10), tādēļ ir svarīgi uzrādīt izmantotās metodes detaļas. Ja iespējams, tauku analīze jāveic tam pašam ekstraktam, kas sagatavots pārbaudāmās vielas analīzei, jo tauki bieži jāizdala no šķīduma, pirms to var analizēt hromatogrāfiski. Tauku saturam zivīs (mg/kg slapja svara) eksperimenta beigās nebūtu jāatšķiras no tauku satura eksperimenta sākumā vairāk kā par ± 25 %. Cieto vielu saturs audos arī būtu jāprotokolē, lai varētu pārrēķināt tauku koncentrāciju no mitriem audiem uz sausiem.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Pārbaudāmās vielas uzņemšanas līkni iegūst, atliekot vielas koncentrāciju zivīs/uz zivīm (vai konkrētos audos) uzņemšanas fāzē pret laiku aritmētiskā skalā. Ja līkne ir sasniegusi plato, tas ir, līkne ir aptuveni asimptotiska laika asij, tad stacionāra stāvokļa BCFSS aprēķina kā dalījumu:
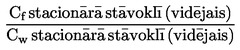
Ja stacionārs stāvoklis nav sasniegts, var būt iespējams aprēķināt BCFSS ar pietiekamu precizitāti nedrošam novērtējumam no “stacionāra stāvokļa” pie 80 % (1,6/k2) vai 95 % (3,0/k2) no līdzsvara koncentrācijas.
Koncentrācijas koeficientu (BCFk) nosaka kā attiecību k1/k2 starp divām pirmās kārtas reakciju kinētiskajām konstantēm. Attīrīšanās ātruma konstanti (k2) parasti nosaka no attīrīšanās līknes (t. i., pārbaudāmās vielas koncentrācijas samazināšanos zivīs atliekot pret laiku). Uzņemšanas ātruma konstanti (k1) pēc tam izrēķina no dotās k2 vērtības un Cf vērtības, ko iegūst no uzņemšanas līknes (skatīt arī 5. papildinājumu). Labākā metode BCFk un konstanšu k1 un k2 iegūšanai ir nelineāru parametru novērtēšanas metožu izmantošana aprēķinos ar datoru (11). Citādi k1 un k2 aprēķiniem var izmantot arī grafiskas metodes. Ja attīrīšanās līkne acīmredzami nav pirmās kārtas, tad būtu jāizmanto sarežģītāki modeļi (skatīt izmantoto literatūru 3. papildinājumā) un jālūdz biostatistikas speciālista padoms.
2.2. REZULTĀTU INTERPRETĀCIJA
Ja izmērītās pārbaudāmo šķīdumu koncentrācijas ir tuvas noteikšanas robežai, rezultāti jāinterpretē piesardzīgi.
Skaidri definētas uzņemšanas un zuduma līknes norāda uz labas kvalitātes biokoncentrēšanas datiem. Divu testa šķīdumu uzņemšanas/attīrīšanās konstanšu atšķirībām būtu jābūt mazākām par 20 %. Novērotas nozīmīgas atšķirības starp uzņemšanas/attīrīšanās ātrumiem divām pielietotām testa koncentrācijām būtu jāprotokolē un jādod iespējamais izskaidrojums. Parasti BCFS ticamības robeža labi izveidotos pētījumos ir tuva ± 20 %.
3. PROTOKOLĒŠANA
Testa ziņojumā jābūt šādai informācijai:
3.1. PĀRBAUDĀMĀ VIELA:
— fizikālās īpašības un, ja būtiski, fizikāli ķīmiskās īpašības,
— ķīmiskās identifikācijas dati (ieskaitot organiskā oglekļa saturu, ja vajadzīgs),
— ja viela ir radioaktīvi iezīmēta, iezīmēto atomu (iezīmētā atoma) precīzs stāvoklis un radioaktivitāte, kas saistīta ar piemaisījumiem.
3.2. TESTOS IZMANTOJAMĀS SUGAS
— zinātniskais nosaukums, dzimta, avots, iepriekšējā apstrāde, aklimatizācija, vecums, lielums utt.
3.3. TESTA APSTĀKĻI:
— izmantotā testa procedūra (piemēram, caurplūdes vai pusstatiskā),
— izmantotā apgaismojuma veids un raksturlielumi un fotoperiods(-i),
— testa projekts (piemēram, testa nodalījumu skaits un lielums, ūdens nomaiņas ātrums, atkārtojumu skaits, zivju skaits uz atkārtojumu, pārbaudāmo koncentrāciju skaits, uzņemšanas un attīrīšanās fāžu ilgums, paraugu ņemšanas biežums zivju un ūdens paraugiem),
— darba šķīdumu pagatavošanas metode un atjaunošanas biežums (šķīdību veicinošais reaģents, ja tādu lieto, jādod tā koncentrācija un ieguldījums testā lietojamā ūdens kopējā oglekļa saturā),
— nominālā pārbaudāmā koncentrācija, izmērītie vidējie lielumi un to standartnovirzes testa traukos, un metode, ar kādu tās izrēķinātas,
— atšķaidīšanas ūdens avots, priekšapstrādes apraksts, zivju dzīvotspējas testa rezultāti šajā ūdenī un ūdens raksturojums: pH, cietība, temperatūra, izšķīdušā skābekļa koncentrācija, atlikuma hlora līmenis (ja ir mērīts), kopējais organiskais ogleklis, suspendētas cietas daļiņas, testa vides sāļums (ja vajadzīgs) un jebkuri citi veikti mērījumi,
— ūdens kvalitāte testa traukos, pH, cietība, TOC, temperatūra un izšķīdušā skābekļa koncentrācija,
— sīka informācija par barošanu (piemēram, barības tips, avots, sastāvs, vismaz tauku un olbaltumvielu saturs, ja iespējams, izēdinātais daudzums un barošanas biežums),
— informācija par zivju un ūdens paraugu apstrādi, ieskaitot detaļas par sagatavošanu, glabāšanu, ekstrakciju un analītiskām procedūrām (un precizitāti) pārbaudāmajai vielai un tauku saturam (ja tas ir mērīts).
3.4. REZULTĀTI:
— jebkura iepriekš veikta pētījuma rezultāti,
— kontroles grupas zivju mirstība un zivju mirstība katrā nodalījumā, un jebkura novērota nenormāla uzvedība,
— tauku saturs zivīs (ja noteikts testa gadījumā),
— līknes (ieskaitot visus mērījumu datus), kas rāda pārbaudāmās vielas uzņemšanu un attīrīšanos zivīs, laiku līdz stacionāra stāvokļa sasniegšanai,
— Cf un CW (ar standartnovirzēm un diapazonu, ja vajadzīgs) visiem paraugu ņemšanas laikiem (Cf izsaka μg/g visa ķermeņa vai konkrētu tā audu (piemēram, tauku) slapja svara (ppm) un Cw izsaka μg/ml (ppm). Protokolā ieraksta Cw vērtības arī kontroles sērijai (protokolē arī fona lielumus),
— stacionāra stāvokļa biokoncentrācijas koeficients (BCFSS) un/vai kinētiskās koncentrācijas koeficients (BCFk), un vajadzības gadījumā 95 % ticamības robežas uzņemšanas un attīrīšanās ātrumu konstantēm (visas izsaka attiecībā uz visa ķermeņa masu un dzīvnieka vai tā specifisku audu kopējo tauku saturu, ja tas ir izmērīts), ticamības robežas un standartnovirzes (ja tās ir pieejamas) un aprēķinu metodes/datu analīzi izmantotās pārbaudāmās vielas katrai koncentrācijai,
— ja izmanto radioaktīvi iezīmētas vielas un ja tas ir vajadzīgs, var uzrādīt detektēto metabolītu uzkrāšanos,
— viss neparastais attiecībā uz testu, visas novirzes no šīm procedūrām un jebkura cita būtiska informācija.
tādus rezultātus kā “noteikšanas robežās nav konstatēts” samazina līdz minimumam, attīstot pirmstesta metodes un eksperimenta plānu, jo tādus rezultātus nevar izmantot ātruma konstanšu aprēķinos.
4. IZMANTOTĀ LITERATŪRA
(1) Connell D.W. (1988). Bioaccumulation behaviour of persistent chemicals with aquatic organisms. Rev. Environ. Contam. Toxicol. 102, p. 117–156.
(2) Bintein S., Devillers J. and Karcher W. (1993). Nonlinear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR and QSAR in Environmental Research, 1, p. 29-390.
(3) OECD, Paris (1996). Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals. No. 3.
(4) Kristensen P. (1991) Bioconcentration in fish: Comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
(5) US EPA 822-R-94-002 (1994) Great Lake Water Quality Initiative Technical Support Document for the Procedure to Determine Bioaccumulation Factors. July 1994.
(6) US FDA, (Food and Drug Administration) Revision. Pesticide analytical manual, 1, 5 600 Fisher’s Lane, Rockville, MD 20852, July 1975.
(7) US EPA (1974). Section 5, A(1) Analysis of Human or Animal Adipose Tissue, in Analysis of Pesticide Residues in Human and Environmental Samples, Thompson J.F. (ed.) Research Triangle Park, N.C. 27711.
(8) Compaan H. (1980) in “The determination of the possible effects of chemicals and wastes on the aquatic environment: degradation, toxicity, bioaccumulation” Ch. 2.3, Part II. Government Publishing Office, The Hague, The Netherlands.
(9) Gardner et al, (1995) Limn. & Oceanogr. 30, p. 1099–1105.
(10) Randall R.C., Lee H., Ozretich R.J., Lake J.L. and Pruell R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Toxicol. Chem. 10, pp. 1431–1436.
(11) CEC, Bioconcentration of chemical substances in fish: the flow-through method-Ring Test Programme, 1984 to 1985. Final report March 1987. Authors: P. Kristensen and N. Nyholm.
(12) ASTM E-1022-84 (Reapproved 1988) Standard Practice for conducting Bioconcentration Tests with Fishes and Saltwater Bivalve Molluscs.
1. PAPILDINĀJUMS
Pieņemama atšķaidīšanas ūdens ķīmiskie raksturlielumi
|
VIELA |
ROBEŽKONCENTRĀCIJA |
|
|
1. |
Daļiņas |
5 mg/l |
|
2. |
Kopējais organiskais ogleklis |
2 mg/l |
|
3. |
Nejonizēts amonjaks |
1 μg/l |
|
4. |
Nogulšņu hlors |
10 μg/l |
|
5. |
Kopējie fosfororganiskie pesticīdi |
50 ng/l |
|
6. |
Kopējie hlororganiskie pesticīdi un polihlorbifenīli |
50 ng/l |
|
7. |
Kopējais organiskais hlors |
25 ng/l |
|
8. |
Alumīnijs |
1μg/l |
|
9. |
Arsēns |
1μg/l |
|
10. |
Hroms |
1 μ g/l |
|
11. |
Kobalts |
1 μ g/l |
|
12. |
Varš |
1 μ g/l |
|
13. |
Dzelzs |
1 μ g/l |
|
14. |
Svins |
1 μ g/l |
|
15. |
Niķelis |
1 μ g/l |
|
16. |
Cinks |
1 μ g/l |
|
17. |
Kadmijs |
100 ng/l |
|
18. |
Dzīvsudrabs |
100 ng/l |
|
19. |
Sudrabs |
100 ng/l |
2. PAPILDINĀJUMS
Pārbaudēm ieteicamās zivju sugas
|
Ieteicamās sugas |
Ieteicamais pārbaudes temperatūru diapazons ( oC) |
Ieteicamais kopējais pārbaudes dzīvnieku garums (cm) |
|
|
1. |
Danio rerio (1) (Teleostei, Cyprinidae) (Hamilton-Buchanan) |
20–25 |
3,0 ± 0,5 |
|
2. |
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) |
20–25 |
5,0 ± 2,0 |
|
3. |
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) |
20–25 |
5,0 ± 3,0 |
|
4. |
Oryzias latipes (Teleostei, Poeciliidae) (Temminck and Schlegel) |
20–25 |
4,0 ± 1,0 |
|
5. |
Poecilia reticulata (Teleostei, Poeciliidae) (Peters) |
20–25 |
3,0 ± 1,0 |
|
6. |
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque) |
20–25 |
5,0 ± 2,0 |
|
7. |
Oncorhynchus mykiss (Teleostei, Salmonidae) (Walbaum) |
13–17 |
8,0 ± 4,0 |
|
8. |
Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) |
18–20 |
3,0 ± 1,0 |
|
(1) Meyer A., Orti G. (1993) Proc. Royal Society of London, Series B., Vol. 252, p. 231. |
|||
Dažādās valstīs izmanto dažādas upju grīvu un jūras sugas, piemēram:
|
Spots |
Leiostomus xanthurus |
|
Lāsumainais jūrasgrundulis |
Cyprinodon variegatus |
|
Saldūdens menīdija |
Menidia beryllina |
|
Zeltainais jūrasasaris |
Cymatogaster aggregata |
|
Kalifornijas jūrasmēle |
Parophrys vetulus |
|
Ziemeļatlantijas ragainā buļļzivs |
Leptocottus armatus |
|
Trīsadatu stagars |
Gasterosteus aculeatus |
|
Labraks |
Dicentracus labrax |
|
Vīķe |
Alburnus alburnus |
Savākšana
Tabulā minētās saldūdens zivis ir viegli audzējamas un/vai viegli pieejamas visu gadu, kamēr jūras un upju grīvu zivis daļēji ir saistītas ar attiecīgām valstīm. Tās var audzēt un kultivēt vai nu zivjaudzētavās, vai laboratorijā slimību un parazītu kontroles apstākļos tā, lai pētījumu dzīvnieki būtu veseli un ar zināmu izcelsmi. Šīs zivis ir pieejamas daudzās vietās pasaulē.
3. PAPILDINĀJUMS
Uzņemšanas un attīrīšanās fāzes ilguma iepriekšnoteikšana
1. Uzņemšanas fāzes iepriekšnoteikšana
Pirms pārbaudes veikšanas no empīriskām sakarībām starp k2 un n-oktanola/ūdens sadalījuma koeficienta (Pow) vai no k2 un šķīdības ūdenī (s) var novērtēt k2 un no šejienes aptuvenu laiku procentos, kas ir vajadzīgs, lai sasniegtu stacionāru stāvokli.
Aptuvenu k2 (dienas-1) vērtību var iegūt, piemēram, no šīs empīriskās sakarības (1):
|
log10 k2 = 0,414 log10(Pow) + 1,47(r2= 0,95) |
(1. vienādojums) |
Par citām sakarībām skatīt (2).
Ja sadalījuma koeficients (Pow) nav zināms, novērtēt var (3), zinot vielas šķīdību un izmantojot šādu sakarību:
|
log10 (Pow) = 0,862 log10(s) + 0,710 (r2 = 0,994) |
(2. vienādojums) |
kur
s = šķīdība (moli/l): (n=36)
Šīs sakarības ir pielietojamas vienīgi vielām ar log Pow vērtībām starp 2 un 6,5 (4).
Laiku, kas vajadzīgs, lai sasniegtu noteiktus procentus no stacionārā stāvokļa, var izrēķināt, izmantojot aptuveno k2, no vispārējā kinētikas vienādojuma, kas apraksta uzņemšanu un attīrīšanos (pirmās kārtas kinētika):
![]()
vai, ja Cw ir konstanta:
|
|
(3. vienādojums) |
Ja tuvojas stacionāram stāvoklim (t- → ∞), 3. vienādojumu var vienkāršot (5) (6) šādi:
![]()
Tad k1/k2 · Cw ir tuvinājums koncentrācijai zivīs “stacionārā stāvoklī” (Cfs).
3. vienādojumu var pārveidot:
|
|
(4. vienādojums) |
Izmantojot 4.vienādojumu, var iepriekšnovērtēt laiku, kas vajadzīgs, lai sasniegtu noteiktus procentus no stacionāra stāvokļa, ja k2 iepriekš novērtē, izmantojot 1. vai 2. vienādojumu.
Kā orientieris, statistiski optimāls uzņemšanas fāzes ilgums statistiski pieņemamu datu sniegšanai (BCFk) ir laika posms, kas vajadzīgs, lai pārbaudāmās vielas koncentrācijas zivīs logaritmiskā līkne, kas atlikta pret lineāro laiku, sasniegtu viduspunktu jeb 1,6/k2, jeb 80 % no stacionārā stāvokļa, bet ne vairāk par 3,0/k2 jeb 95 % no stacionārā stāvokļa (7).
Laiks, lai sasniegtu 80 % no stacionārā stāvokļa ir (4. vienādojums):
|
|
(5. vienādojums) |
Līdzīgi – 95 % no stacionāra stāvokļa ir:
|
|
(6. vienādojums) |
Piemēram, uzņemšanas fāzes ilguma (uzņ.) pārbaudāmajai vielai ar log Pow = 4 būtu (izmantojot 1., 5. un 6. vienādojumu):
|
log10k2 = - 0,414.(4) + 1,47 |
k2 = 0,652 dienas-1 |
uzņ. (80 %) = 1,6/0,652, t. i., 2,45 dienas (59 stundas)
vai uzņ. (95 %) = 3,0/0,652, t. i., 4,60 dienas (110 stundas)
Līdzīgi – pārbaudāmai vielai ar s = 10-5 mol/l (log(s) = 5,0) uzņemšanas ilgums būtu (izmantojot 1., 2., 5. un 6. vienādojumu):
log10 (Pow) = 0,862 (- 5,0) + 0,710 = 5,02
log10 K2 = 0,414 (5,02) + 1,47
k2 = 0,246 dienas-1
uzņ. (80 %) = 1,6/0,246, t. i., 6,5 dienas (156 stundas)
vai uzņ. (95 %) = 3,0/0,246, t. i., 12,2 dienas (293 stundas)
Alternatīvi, lai aprēķinātu laiku, kas vajadzīgs stacionārā stāvokļa sasniegšanai (4), var izmantot izteiksmi:
teq= 6,54 × 10 = 3 Pow + 55,31 (stundas)
2. Attīrīšanās fāzes iepriekšnoteikšana
Iepriekš noteikt laiku, kas vajadzīgs, lai samazinātu ķermeņa uzņemto vielu līdz noteiktiem sākotnējās koncentrācijas procentiem, var arī, izmantojot vispārēju vienādojumu, kas apraksta uzņemšanu un attīrīšanos (pirmās kārtas kinētika) (1) (8).
Attīrīšanās fāzei pieņem, ka Cw ir vienāda ar nulli. Vienādojumu var vienkāršot līdz:
![]()
vai
![]()
kur Cf, o ir koncentrācija attīrīšanās posma sākumā. 50 % attīrīšanos sasniedz laikā (t50):

vai
![]()
Līdzīgi – 95 % attīrīšanās laiks ir:
![]()
Ja pirmajā posmā izmanto 80 % uzņemšanu (1,6/k 2) un attīrīšanās fāzē 95 % zudumu (3,0/k 2), tad attīrīšanās fāze ir aptuveni divreiz ilgāka par uzņemšanas fāzi.
Ir svarīgi atzīmēt, ka novērtējumi tomēr pamatojas uz pieņēmumu, ka uzņemšana un attīrīšanās notiek pēc pirmās kārtas kinētikas. Ja pirmās kārtas kinētika acīmredzami nav spēkā, būtu jāizmanto sarežģītāki modeļi (piemēram, (1)).
Literatūra (3. papildinājumam)
(1) Spacie A. and Hamelink J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. and Chem. 1, p. 309–320.
(2) Kristensen P. (1991). Bioconcentration in fish: comparison of BCF’s derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute.
(3) Chiou C.T. and Schmedding D.W. (1982). Partitioning of organic compounds in octanol-water systems. Environ. Sci. Technol. 16 (1), p. 4–10.
(4) Hawker D.W. and Connell D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22 (6), p. 701–707.
(5) Branson D.R., Blau G.E., Alexander H.C. and Neely W.B. (1975). Transactions of the American Fisheries Society, 104 (4), p. 785–792.
(6) Ernst W. (1985). Accumulation in Aquatic organisms. In: Appraisal of tests to predict the environmental behaviour of chemicals. Ed. by Sheehman P., Korte F., Klein W. and Bourdeau P.H. Part 4.4 p. 243–255. SCOPE, 1985, John Wiley & Sons Ltd. N.Y.
(7) Reilly P.M., Bajramovic R., Blau G.E., Branson D.R. and Sauerhoff M.W. (1977). Guidelines for the optimal design of experiments to estimate parameters in first order kinetic models, Can. J. Chem. Eng. 55, p. 614–622.
(8) Könemann H. and Van Leeuwen K. (1980). Toxicokinetics in fish: Accumulation and Elimination of six Chlorobenzenes by Guppies. Chemosphere, 9, p. 3–19.
4. PAPILDINĀJUMS
Biokoncentrāciju pārbaužu paraugu ņemšanas teorētisks piemērs vielām ar log pOw = 4
|
Zivju paraugu ņemšana |
Paraugu ņemšanas laika grafiks |
Ūdens paraugu skaits |
Zivju skaits paraugā |
|
|
Minimālais vajadzīgais biežums (dienas) |
Papildu paraugu ņemšana |
|||
|
Uzņemšanas fāze |
-1 0 |
2 (1) 2 |
Pievieno 45–80 zivis |
|
|
Pirmā |
0,3 |
0,4 |
2 (2) |
4 (4) |
|
Otrā |
0,6 |
0,9 |
2 (2) |
4 (4) |
|
Trešā |
1,2 |
1,7 |
2 (2) |
4 (4) |
|
Ceturtā |
2,4 |
3,3 |
2 (2) |
4 (4) |
|
Piektā |
4,7 |
2 |
6 |
|
|
Attīrīšanās fāze |
Zivis pārvieto ūdenī, kas nesatur pārbaudāmo vielu |
|||
|
Sestā |
5,0 |
5,3 |
4 (4) |
|
|
Septītā |
5,9 |
7,0 |
4 (4) |
|
|
Astotā |
9,3 |
11,2 |
4 (4) |
|
|
Devītā |
14,0 |
17,5 |
6 (4) |
|
|
(1) Ūdens paraugu ņem pēc tam, kad pievadīti minimums trīs “nodalījuma tilpumi” ūdens. Skaitļi iekavās ir paraugu skaits (ūdenim, zivīm), kas jāņem, ja ņem papildu paraugus. Piezīme: pirmspārbaudes aptuvenais k2 pie log Pow lieluma 4,0 ir 0,652 dienas-1. Kopējais eksperimenta ilgums ir noteikts 3 × uzņ. = 3 × 4,6 dienas, t. i., 14 dienas. Aptuveno “uzņ.” novērtēšanu skatīt 3. papildinājumā. |
||||
5. PAPILDINĀJUMS
Modeļa izvēle
Uzskata, ka lielāko daļu biokoncentrācijas datu “pietiekami labi” apraksta vienkāršs divu nodalījumu/divu parametru modelis, kā rāda rektilineārā līkne, kas attīrīšanās fāzē tuvojas punktiem, kas atbilst koncentrācijām zivīs, ja šos punktus atliek puslogaritmiskā grafikā. (Ja šos punktus nevar aprakstīt ar rektilineāru līkni, tad jāizmanto sarežģītāks modelis, skatīt, piemēram, Spacie un Hamelink, 3. papildinājuma (1)).
Attīrīšanās (zuduma) ātruma konstantes k2 noteikšanas grafiskā metode
Pārbaudāmās vielas koncentrāciju, kas atrasta katrā zivju paraugā, atliek puslogaritmiskā grafikā pret parauga ņemšanas laiku. Šīs līknes slīpums ir k2.
![]()
Ievērojiet, ka novirzes no taisnas līnijas var norādīt uz sarežģītāku attīrīšanās raksturu nekā pirmās kārtas kinētika. Lai noskaidrotu attīrīšanās tipus, kas atšķiras no pirmās kārtas kinētikas, var izmantot grafisko metodi.
Uzņemšanas ātruma konstantes k1 noteikšanas grafiskā metode
Pie dotās k2 šādi aprēķina k1:
|
|
(1. vienādojums) |
Cf vērtību nolasa līdzenās uzņemšanas līknes viduspunktā, līkni iegūst no datiem, atliekot koncentrācijas log pret laiku (lineārā skalā).
Uzņemšanas un attīrīšanās (zuduma) ātruma konstanšu aprēķins ar datoru
Labākais veids, kā aprēķināt biokoncentrēšanas koeficientu un ātruma konstantes k1 un k2, ir izmantot datoru nelineāru parametru novērtēšanai. Datoru programmas aprēķina k1 un k2 lielumus dotajam datu kopumam, kurā ir secīgas koncentrācijas un attiecīgie laika posmi, izmantojot modeli:
|
|
(2. vienādojums) |
|
|
(3. vienādojums) |
kur tc ir laiks uzņemšanas fāzes beigās.
Šī pieeja dod standartnoviržu aptuvenos lielumus k1 un k2.
Tā kā k2 vairumā gadījumu var noteikt no attīrīšanās līknes ar relatīvi augstu precizitāti un tā kā starp abiem parametriem k1 un k2 ir stingra korelācija, ja tie ir noteikti vienlaicīgi, ir ieteicams vispirms izrēķināt k2 tikai no attīrīšanās datiem un pēc tam izrēķināt k1 no uzņemšanas datiem, izmantojot nelineāro regresiju.
C.14. ZIVJU MAZUĻU AUGŠANAS TESTS
1. METODE
Šī augšanas toksicitātes testa metode ir ESAO TG 215 (2000) kopija.
1.1. IEVADS
Šis tests ir paredzēts, lai novērtētu ilgstošas ķimikāliju iedarbības ietekmi uz zivju mazuļu augšanu. Tas pamatojas uz metodi, kas izveidota un kam izdarīts gredzena tests (1) (2) Eiropas Savienībā un kas paredzēta ķimikāliju ietekmes novērtēšanai uz varavīksnes foreļu (Oncorynchus mykiss) mazuļu augšanu caurplūdes apstākļos. Var izmantot citas labi dokumentētas sugas. Piemēram, pieredze ir iegūta zebras zivs (Danio rerio) ( 28 ) (3) (4) un rīsa zivs (medaka, Oryzias latipes) (5) (6) (7) augšanas testos.
Skatīt arī vispārīgā ievada C daļu.
1.2. DEFINĪCIJAS
Mazākās novērojamās ietekmes koncentrācija (LOEC ): testa vielas mazākā testētā koncentrācija, pie kuras ir novērots, ka vielai ir nozīmīga ietekme (pie p < 0,05), salīdzinot ar kontroli. Tomēr pie visām testa koncentrācijām, kas lielākas par LOEC, ir jābūt negatīvai ietekmei, kas ir vienāda ar vai lielāka par negatīvo ietekmi, kas novērota pie LOEC.
Nenovērojamas ietekmes koncentrācija (NOEC ): testa koncentrācija tieši zem LOEC.
EC x : šajā testa metodē tā ir testa vielas koncentrācija, kas izraisa x % pārmaiņas zivju augšanas ātrumā, salīdzinot ar kontroli.
Noslogojums: zivju mitrais svars ūdens tilpuma vienībā.
Apdzīvotības blīvums: zivju skaits ūdens tilpuma vienībā.
Atsevišķas zivs īpatnējais augšanas ātrums: izsaka viena īpatņa augšanas ātrumu, pamatojoties uz tā sākotnējo svaru.
Vidējais īpatnējais augšanas ātrums tvertnē: izsaka tvertnes īpatņu kopskaita vidējo augšanas ātrumu vienā koncentrācijā.
Pseidoīpatnējais augšanas ātrums: izsaka individuālo augšanas ātrumu salīdzinājumā ar tvertnes īpatņu kopskaita vidējo sākuma svaru.
1.3. TESTA METODES PRINCIPS
Zivju mazuļus eksponenciālajā augšanas fāzē pēc nosvēršanas ievieto testa tvertnēs un pakļauj ūdenī izšķīdinātas testa vielas iedarbībai subletālu koncentrāciju diapazonā, vēlams, caurplūdes apstākļos vai, ja tas nav iespējams, piemērotos pusstatiskos (statiskos ar atjaunošanu) apstākļos. Testa ilgums ir 28 dienas. Zivis baro katru dienu. Barības deva pamatojas uz zivju sākotnējiem svariem, un to var pārrēķināt pēc 14 dienām. Testa beigās zivis vēlreiz nosver. Ietekmi uz augšanas ātrumu analizē, izmantojot regresijas modeli, lai novērtētu koncentrāciju, kas izraisa augšanas ātruma pārmaiņu par x %, t. i., ECx (piemēram, EC10, EC20, vai EC30). Alternatīvi datus var salīdzināt ar kontroles lielumiem, lai noteiktu mazākās novērojamās ietekmes koncentrāciju (LOEC) un no tās – nenovērojamas ietekmes koncentrāciju (NOEC).
1.4. INFORMĀCIJA PAR TESTA VIELU
Būtu jābūt pieejamiem akūtās toksicitātes testa (skatīt C.1. testa metodi) rezultātiem, kas, vēlams, iegūti ar šim testam izraudzīto sugu. Tas nozīmē, ka testa vielas šķīdība ūdenī un tvaika spiediens ir zināms un ka vielas daudzuma kvantitatīvai noteikšanai testa šķīdumos ir pieejama droša analītiska metode ar zināmu precizitāti un atklāšanas robežu.
Noderīga informācija iekļauj struktūras formulu, vielas tīrības pakāpi, stabilitāti ūdenī un gaismā, pKa, Pow un vieglas bionoārdīšanās testa rezultātus (skatīt testa C.4. metodi).
1.5. TESTA DERĪGUMS
Lai tests būtu derīgs, piemēro šādus nosacījumus:
— kontroles grupā kopējā dzīvnieku mirstība testa beigās nedrīkst pārsniegt 10 %,
— kontroles grupā zivju vidējā svara palielinājumam jābūt pietiekami lielam, lai varētu noteikt vismazākās augšanas ātruma pārmaiņas, ko uzskata par nozīmīgām. Gredzena tests (2) ir parādījis, ka varavīksnes forelei kontroles grupā vidējam svaram 28 dienās ir jāpalielinās vismaz uz pusi (t. i., par 50 %); piemēram, sākotnējais svars: 1 g uz zivi (= 100 %), beigu svars pēc 28 dienām: = 1,5 g uz zivi (≥ 150 %),
— izšķīdušā skābekļa koncentrācijai visā testa laikā jābūt vismaz 60 % no piesātināšanas ar gaisu lieluma,
— ūdens temperatūra jebkurā testa laika mirklī nedrīkst starp testa tvertnēm atšķirties vairāk par ± 1 oC, un tā būtu jāuztur 2 oC diapazonā temperatūru intervālos, kas norādīti testa sugām (1. papildinājums).
1.6. TESTA METODES APRAKSTS
1.6.1. Iekārta
Parastais laboratorijas aprīkojums un jo īpaši:
— skābekļa mērīšanas iekārtas un pHmetri,
— aprīkojums ūdens cietības un sārmainības noteikšanai,
— atbilstīga aparatūra temperatūras regulēšanai un, vēlams, nepārtrauktai uzraudzībai,
— ķīmiski inerta materiāla tvertnes ar piemērotu ietilpību attiecībā pret ieteicamo noslogojumu un apdzīvotības blīvumu (skatīt 1.8.5. punktu un 1. papildinājumu),
— pietiekami precīzi svari (t. i., ar precizitāti ± 0,5 %).
1.6.2. Ūdens
Par testa ūdeni var izmantot jebkādu ūdeni, kurā testa sugas uzrāda pietiekamu ilgtermiņa izdzīvotību un augšanu. Tā kvalitātei testa laika posmā jābūt nemainīgai. Ūdens pH jābūt diapazonā no 6,5 līdz 8,5, bet konkrētā testā tam jābūt ± 0,5 pH vienību diapazonā. Cietība ir ieteicama lielāka par 140 mg/l (rēķinot uz CaCO3). Lai nodrošinātu, ka atšķaidīšanas ūdens pārāk neietekmē testa rezultātu (piemēram, veidojot kompleksus ar testa vielu), noteiktos intervālos jāņem paraugi analīzei. Smago metālu (piemēram, Cu, Pb, Zn, Hg, Cd un Ni), galveno anjonu un katjonu (piemēram, Ca, Mg, Na, K, Cl un SO4), pesticīdu (piemēram, kopējo fosfororganisko pesticīdu un kopējo hlororganisko pesticīdu), kopējā organiskā oglekļa un suspendētu cietu vielu mērījumus, piemēram, jāveic reizi trijos mēnešos, ja ir zināms, ka atšķaidīšanas ūdens kvalitāte ir relatīvi nemainīga. Ja ir parādīts, ka ūdens kvalitāte ir nemainīga vismaz viena gada laikā, mērījumi var būt retāki un intervāli var būt garāki (piemēram, reizi sešos mēnešos). Daži pieņemama atšķaidīšanas ūdens ķīmiskie parametri ir uzskaitīti 2. papildinājumā.
1.6.3. Testa šķīdumi
Izraudzītās koncentrācijas testa šķīdumus parasti gatavo, atšķaidot izejas šķīdumu.
Izejas šķīdumu vēlams pagatavot, vienkārši maisot vai kratot testa vielu ar atšķaidīšanas ūdeni, izmantojot mehāniskus līdzekļus (piemēram, kratītāju vai ultraskaņu). Piemērota koncentrēta izejas šķīduma iegūšanai var izmantot piesātināšanas kolonnas (šķīdības kolonnas).
Dažos gadījumos, lai iegūtu piemērotas koncentrācijas izejas šķīdumu, var būt jālieto šķīdinātāji vai disperģējošas vielas (šķīdību veicinošas vielas). Piemērotu šķīdinātāju piemēri ir acetons, etilspirts, metilspirts, dimetilsulfoksīds, dimetilformamīds un trietilēnglikols. Piemērotu disperģējošu vielu piemēri ir Cremophor RH40, Tween 80, 0,01 % metilceluloze un HCO-40. Ir jābūt uzmanīgam, lietojot viegli bionoārdāmas vielas (piemēram, acetonu) un/vai viegli gaistošus savienojumus, jo tie var radīt problēmas ar baktēriju augšanu caurplūdes testos. Ja lieto šķīdību veicinošu vielu, tā nedrīkst jūtami ietekmēt zivju augšanu un redzami negatīvi ietekmēt mazuļus, ko var novērot kontroles mēģinājumā, kuru izdara ar šķīdinātāju vien.
Caurplūdes testos ir vajadzīga sistēma, kas nepārtraukti piegādā un atšķaida testa vielas izejas šķīdumu (piemēram, dozējošais sūknis, proporcionālais atšķaidītājs, piesātināšanas sistēma), lai testa tvertnēm piegādātu virkni koncentrāciju. Izejas šķīdumu un atšķaidīšanas ūdens plūsmas ātrumi testa laikā jāpārbauda noteiktos intervālos, vēlams, reizi dienā, un tie testa laikā nedrīkst mainīties vairāk kā par 10 %. Gredzena testā (2) ir parādīts, ka testa laikā varavīksnes forelēm ūdens aizvadīšana 6 litri uz zivs gramu dienā ir pieņemams daudzums (skatīt 1.8.2.2. punktu).
Pusstatiskajiem (atjaunošanas) testiem vides atjaunošanas biežums ir atkarīgs no testa vielas stabilitātes, bet ir ieteicams ūdeni atjaunot katru dienu. Ja no iepriekšējiem stabilitātes testiem (skatīt 1.4. punktu) ir zināms, ka testa vielas koncentrācija nav stabila (t. i., ārpus 80–120 % diapazona no nominālās koncentrācijas vai mazāka par 80 % no izmērītās sākotnējās koncentrācijas) atjaunošanas laika posmā, tad jāapsver caurplūdes testa izmantošana.
1.6.4. Sugu izvēle
Šim testam ieteicama suga ir varavīksnes forele (Oncorhynchus mykiss), jo pieredzes lielākā daļa ir iegūta gredzena testā ar šo sugu (1) (2). Tomēr var izmantot citas labi dokumentētas sugas, bet var būt vajadzīga testa procedūras pielāgošana, lai nodrošinātu piemērotus testa apstākļus. Piemēram, pieredze ir pieejama arī ar zebras zivi (Danio rerio) (3) (4) un rīsu zivi (medaka, Oryzias latipes) (5) (6) (7). Tādā gadījumā ir jāprotokolē sugas izvēles pamatojums un eksperimenta metode.
1.6.5. Zivju turēšana
Testa zivis izvēlas no viena bara populācijas, vēlams no viena un tā paša nārsta, kas vismaz divas nedēļas pirms testa ir turēts ūdens kvalitātes un apgaismojuma apstākļos, kuri līdzīgi testa apstākļiem. Tās jābaro ar barības devu, mazākais, 2 % no ķermeņa svara dienā un, vēlams, 4 % no ķermeņa svara dienā visā turēšanas laika posmā un testa laikā.
Pēc 48 stundu ievietošanas laika posma reģistrē mirstību un piemēro šādus kritērijus:
— mirstība septiņās dienās ir lielāka par 10 % no populācijas: izbrāķē visu partiju,
— mirstība starp 5 % un 10 % no populācijas: aklimatizācija septiņu papildu dienu laikā; ja mirstība otru septiņu dienu laikā ir lielāka par 5 %, izbrāķē visu partiju,
— mirstība septiņās dienās ir mazāka par 5 % no populācijas: partiju pieņem.
Zivis nevajadzētu ārstēt no slimībām divu nedēļu laikā pirms testa vai testa laikā.
1.7. TESTA PLĀNS
Testa plāns attiecas uz testa koncentrāciju skaita un intervālu izvēli, tvertņu skaitu katram koncentrācijas līmenim un zivju skaitu tvertnē. Ideālā gadījumā testa plāns būtu jāizvēlas, ņemot vērā:
— pētījuma mērķi,
— statistiskās analīzes metodi, ko izmantos,
— eksperimenta resursu pieejamību un izmaksas.
Mērķu izklāstā, ja iespējams, būtu jākonkretizē statistiskā selektivitāte, kas vajadzīga, lai noteiktu attiecīgo atšķirības lielumu (piemēram, augšanas ātruma atšķirību) vai, alternatīvi, precizitāte, ar kuru ir jānovērtē ECx (piemēram, x = 10, 20, vai 30 un, vēlams, ne mazāk par 10). Bez tā nav iespējams dot stingru priekšrakstu par pētījuma lielumu.
Ir svarīgi saprast, ka plāns, kas ir optimāls (vislabākā veidā izmanto resursus) lietošanai ar vienu statistiskās analīzes metodi, nav katrā ziņā optimāls ar citu metodi. Ieteicamais plāns LOEC/NOEC novērtēšanai tātad nav tas pats, kas ieteicams regresijas analīzei.
Lielākajā daļā gadījumu regresijas analīze ir jāuzskata par labāku nekā dispersiju analīze Stefena un Rodžersa apspriesto iemeslu dēļ (8). Tomēr, ja nav atrasts piemērots regresijas modelis (r2 < 0,9), būtu jāizmanto NOEC/LOEC.
1.7.1. Regresijas analīzes plāns
Ar regresiju analizējama testa plānā ir svarīgi ņemt vērā:
— testā izmantotajām koncentrācijām noteikti ir jāaptver efektīvā koncentrācija (piemēram, EC10, 20, 30) un koncentrāciju diapazons, kurā ir interese par testa vielas ietekmi. Precizitāte, ar kuru var novērtēt efektīvās koncentrācijas, ir vislielākā, ja efektīvā koncentrācija ir testēto koncentrāciju diapazona vidū. Izraugoties piemērotas testa koncentrācijas, noderīgs var būt diapazona atrašanas priekšmēģinājums.
— Lai nodrošinātu apmierinošu statistisko modelēšanu, testā būtu jāiekļauj vismaz viena kontroles tvertne un piecas papildu tvertnes ar dažādām koncentrācijām. Attiecīgā gadījumā, ja lieto šķīdību veicinošu vielu, papildus testa rindai būtu jāizdara kontroles mēģinājums, kas satur šķīdību veicinošo vielu augstākajā testētajā koncentrācijā (skatīt 1.8.3. un 1.8.4. punktu).
— Var izmantot piemērotu ģeometrisko rindu vai logaritmisko rindu (9) (skatīt 3. papildinājumu). Priekšroka ir jādod testa koncentrāciju logaritmiskiem intervāliem.
— Ja ir pieejamas vairāk nekā sešas tvertnes, papildu tvertnes būtu jāizmanto paralēliem mēģinājumiem vai arī jāizdala pa koncentrāciju diapazonu, lai nodrošinātu mazākus intervālus starp līmeņiem. Abi šie pasākumi ir vienlīdz vēlami.
1.7.2. NOEC/LOEC novērtēšanas plāns, izmantojot dispersiju analīzi (ANOVA)
Vēlams, lai katrai koncentrācijai būtu paralēlo mēģinājumu tvertnes un statistisko analīzi izdarītu atsevišķām tvertnēm (10). Bez paralēlo mēģinājumu tvertnēm nav iespējams ņemt vērā mainīgumu starp tvertnēm, ārpus tā, kas pastāv starp atsevišķām zivīm. Tomēr pieredze ir parādījusi (11), ka aplūkotajā gadījumā mainīgums starp tvertnēm ir ļoti mazs, salīdzinot ar mainīgumu tvertnē (t. i., starp zivīm). Tādēļ relatīvi pieņemama alternatīva ir izdarīt statistisko analīzi atsevišķu zivju līmenī.
Parasti izmanto vismaz piecas testa koncentrācijas ģeometriskā rindā ar koeficientu, kas, vēlams, nav lielāks par 3,2.
Parasti, ja testus izdara ar paralēlo mēģinājumu tvertnēm, paralēlo mēģinājumu kontroles tvertņu skaitam un tātad arī zivju skaitam būtu jābūt divreiz lielākam par skaitu katrā testa koncentrācijā, kurās zivju skaitam vienmēr būtu jābūt vienādam (12) (13) (14). Pretēji, ja nav paralēlo mēģinājumu tvertņu, zivju skaitam kontroles grupā būtu jābūt tādam pašam kā zivju skaitam katrā testa koncentrācijā.
Ja ANOVA pamatojas uz tvertnēm, nevis uz atsevišķām zivīm (kam būtu vajadzīgs individuāli marķēt zivis vai izmantot “pseidoīpatnējos” augšanas ātrumus (skatīt 2.1.2. punktu)), ir vajadzīgas pietiekami daudzas paralēlo mēģinājumu tvertnes, lai varētu noteikt standarta novirzes “tvertnēm ar vienu koncentrāciju”. Tas nozīmē, ka kļūdas brīvības pakāpēm dispersiju analīzē būtu jābūt vismaz 5 (10). Ja paralēlos mēģinājumus izdara tikai kontroles mēģinājumiem, pastāv risks, ka kļūdas mainīgums būs neobjektīvs, jo tas var palielināties ar attiecīgā augšanas ātruma vidējo lielumu. Tā kā, palielinoties koncentrācijai, augšanas ātrums, sagaidāms, samazināsies, radīsies tendence mainīgumu novērtēt par augstu.
1.8. PROCEDŪRA
1.8.1. Testa zivju izvēle un svēršana
Ir svarīgi testa sākumā līdz minimumam samazināt zivju svara atšķirības. Piemērots lielumu diapazons dažādām sugām, kas ir ieteicamas izmantošanai šajā testā, ir norādīts 1. papildinājumā. Visai testā izmantotajai zivju partijai atsevišķo eksemplāru svaru diapazonam ideālā gadījumā būtu jābūt ± 10 % no aritmētiskā vidējā svara, un katrā ziņā tam nevajadzētu pārsniegt 25 %. Ir ieteicams pirms testa nosvērt zivju kopējā parauga daļu, lai novērtētu vidējo svaru.
Pirms testa sākuma bara populāciju 24 stundas nedrīkstētu barot. Pēc tam zivis jāizvēlas pēc nejaušās izvēles. Lietojot vispārējas anestēzijas līdzekli (piemēram, 100 mg/l trikaīna metānsulfonāta (MS 222) ūdens šķīdumu, kas neitralizēts, pievienojot divas daļas nātrija bikarbonāta uz vienu daļu MS 222), zivis būtu atsevišķi mitras (nosusinātas) jānosver ar 1. papildinājumā norādīto precizitāti. Tās zivis, kuru svars ir paredzētajā intervālā, būtu jāpatur un pēc nejaušās izvēles jāizvieto pa testa traukiem. Kopējais zivju mitrais svars katrā testa traukā būtu jāprotokolē. Anestēzijas līdzekļu lietošana, tāpat kā rīkošanās ar zivīm (iekļaujot susināšanu un svēršanu) var zivju mazuļiem radīt stresu un savainojumus, jo īpaši maza lieluma sugām. Tādēļ ar zivju mazuļiem ir jārīkojas ar vislielāko rūpību, lai testa dzīvniekiem neradītu stresu un tos neievainotu.
Zivis vēlreiz nosver testa 28. dienā (skatīt 1.8.6. punktu). Tomēr, ja uzskata par vajadzīgu pārrēķināt barības devu, zivis var nosvērt vēlreiz testa 14. dienā (skatīt 1.8.2.3. punktu). Lai noteiktu zivju lieluma pārmaiņas, uz kurām pamatojoties var pielāgot barības devas, var izmantot citu metodi, piemēram, fotogrāfisko metodi.
1.8.2. Iedarbības apstākļi
1.8.2.1. Ilgums
Testa ilgums ir ≥ 28 dienas.
1.8.2.2. Noslogojums un apdzīvotības blīvums
Ir svarīgi, lai noslogojums un apdzīvotības blīvums būtu piemērots izmantojamai testa sugai (skatīt 1. papildinājumu). Ja apdzīvotības blīvums ir pārāk liels, tad rodas pārapdzīvotības stress, kas izraisa augšanas ātruma samazinājumu un, iespējams, slimību. Ja tas ir pārāk mazs, tas var ierosināt tādu teritoriālu uzvedību, kas arī var ietekmēt augšanu. Katrā ziņā noslogojumam jābūt pietiekami mazam, lai bez aerācijas varētu uzturēt izšķīdušā skābekļa koncentrāciju vismaz 60 % no piesātinājuma lieluma. Gredzena testā (2) ir parādīts, ka varavīksnes forelēm ir pieņemams noslogojums 16 foreles ar svaru 3–5 g 40 litru tilpumā. Ir ieteicams testa laikā nomainīt 6 litrus ūdens uz gramu zivs dienā.
1.8.2.3. Barošana
Zivis jābaro ar piemērotu barību (1. papildinājums) pietiekamā daudzumā, lai izraisītu pieņemamu augšanas ātrumu. Jāpievērš vērība, lai izvairītos no mikrobu augšanas un ūdens duļķainības. Varavīksnes forelēm barības daudzums 4 % no ķermeņa svara dienā varētu atbilst šiem nosacījumiem (2) (15) (16) (17). Dienas devu var sadalīt divās vienādās daļās un dienā dot zivīm divās barošanas reizēs, ko atdala vismaz piecas stundas. Deva pamatojas uz zivju sākotnējo svaru katrā testa traukā. Ja zivis vēlreiz sver 14. dienā, devu pēc tam pārrēķina. Zivīm nedod barību 24 stundas pirms svēršanas.
Neapēstā barība un fekālais materiāls no testa traukiem jāaizvāc katru dienu, ar atsūkšanu rūpīgi iztīrot katras tvertnes dibenu.
1.8.2.4. Gaisma un temperatūra
Fotoperiods un ūdens temperatūra jāpiemēro testa sugai (1. papildinājums).
1.8.3. Testa koncentrācijas
Parasti ir vajadzīgas piecas testa vielas koncentrācijas neatkarīgi no testa plāna (skatīt 1.7.2. punktu). Priekšzināšanas par testa vielas toksicitāti (piemēram, no akūtās toksicitātes testa un/vai no diapazona atrašanas pētījuma) būtu noderīgas piemērotu testa apstākļu izvēlei. Ja izmanto mazāk par piecām koncentrācijām, tas jāpamato. Lielākā testētā koncentrācija nedrīkstētu pārsniegt vielas šķīdības robežu ūdenī.
Ja izejas šķīduma pagatavošanā izmanto šķīdību veicinošu vielu, tās galakoncentrācijai nevajadzētu būt lielākai par 0,1 ml/l un tai, vēlams, būtu jābūt vienādai visos testa traukos (skatīt 1.6.3. punktu). Tomēr jāpieliek visas pūles, lai izvairītos no šādu vielu lietošanas.
1.8.4. Kontroles mēģinājumi
Atšķaidīšanas ūdens kontroles mēģinājumu skaits ir atkarīgs no testa plāna (skatīt 1.7. līdz 1.7.2. punktu). Ja izmanto šķīdību veicinošu vielu, tad arī šķīdību veicinošai vielai jāiekļauj tāds pats kontroles mēģinājumu skaits kā atšķaidīšanas ūdenim.
1.8.5. Analītisko noteikšanu un mērījumu biežums
Testa laikā testa vielas koncentrācijas nosaka regulāros intervālos (skatīt turpmāk).
Caurplūdes testos atšķaidīšanas ūdens un toksiskā izejas šķīduma plūsmas ātrums jāpārbauda regulāros intervālos, vēlams, ik dienas, un tas testa laikā nedrīkst mainīties vairāk kā par 10 %. Ja ir sagaidāms, ka testa vielas koncentrācijas būs ± 20 % no nominālajiem lielumiem (t. i., 80–120 % diapazonā, skatīt 1.6.2 un 1.6.3 punktu), ir ieteicams vismaz lielāko un mazāko testa koncentrāciju analizēt testa sākumā un reizi nedēļā pēc tam. Ja ir sagaidāms, ka testa vielas koncentrācija testā nesaglabāsies ± 20 % no nominālā lieluma (pamatojoties uz testa vielas stabilitātes datiem), ir jāanalizē visas testa koncentrācijas, bet jāievēro tas pats režīms.
Pusstatiskajos (atjaunošanas) testos, ja ir sagaidāms, ka testa vielas koncentrācija saglabāsies ± 20 % no nominālā lieluma, ir ieteicams vismaz lielāko un mazāko testa koncentrāciju analizēt svaigi pagatavotu un tieši pirms atjaunošanas pētījuma sākumā un pēc tam katru nedēļu. Ja ir sagaidāms, ka testa vielas koncentrācija testā nesaglabāsies ± 20 % no nominālā lieluma, visas testa koncentrācijas ir jāanalizē, ievērojot to pašu režīmu, kāds ir stabilākām vielām.
Ir ieteicams rezultātu aprēķinā pamatoties uz izmērītajām koncentrācijām. Tomēr, ja ir pieejami dati, kas rāda, ka testa vielas koncentrācija šķīdumā visā testa laikā ir apmierinoši saglabājusies ± 20 % no nominālā lieluma vai no izmērītās sākuma koncentrācijas, tad rezultātu aprēķins var pamatoties uz nominālajiem vai izmērītajiem lielumiem.
Paraugi var būt jāfiltrē (piemēram, izmantojot 0,45 μm poru lielumu) vai jācentrifugē. Ieteicamā procedūra ir centrifugēšana. Tomēr arī filtrēšana var būt pieņemama, ja testa materiāls neadsorbējas uz filtra.
Testa laikā visos testa traukos ir jāmēra izšķīdušais skābeklis, pH un temperatūra. Kopējā cietība, sārmainība un sāļums (attiecīgā gadījumā) jāmēra kontroles mēģinājumos un vienā traukā ar lielāko koncentrāciju. Izšķīdušais skābeklis un sāļums (attiecīgā gadījumā) jāmēra trīs reizes (testa sākumā, vidū un beigās). Pusstatiskajos testos ir ieteicams izšķīdušo skābekli mērīt biežāk, vēlams, pirms katras ūdens atjaunošanas un pēc tās vai vismaz reizi nedēļā. pH jāmēra katras ūdens atjaunošanas sākumā un beigās statiskajos atjaunošanas testos un vismaz reizi nedēļā caurplūdes testos. Cietība un sārmainība jāmēra katrā testā vienu reizi. Temperatūru vēlams uzraudzīt nepārtraukti vismaz vienā testa traukā.
1.8.6. Novērojumi
Svars: testa beigās visas izdzīvojušās zivis ir jānosver mitras (nosusinātas) vai nu grupās atbilstīgi testa traukam, vai atsevišķi. Dzīvnieku svēršanai atbilstīgi testa traukam ir priekšroka pret individuālu svēršanu, kurai zivis ir individuāli jāmarķē. Individuālas svēršanas gadījumā, lai noteiktu atsevišķu zivju īpatnējo augšanas ātrumu, izvēlētajai marķēšanas tehnikai būtu jāizvairās radīt dzīvniekiem stresu (piemērotas būtu alternatīvas marķēšanai ar saldēšanu, piemēram, krāsainas smalkas makšķerauklas lietošana).
Zivis testa laika posmā jāapskata katru dienu un jāatzīmē visas ārējās anomālijas (piemēram, asiņošana, krāsas zudums) un anomāla izturēšanās. Jāreģistrē mirstība un nedzīvās zivis jāaizvāc iespējami drīz. Nedzīvās zivis neaizstāj, noslogojums ir pietiekams, lai izvairītos no ietekmes uz augšanu, ko rada zivju skaita maiņa tvertnē. Tomēr ir jāpielāgo barības daudzums.
2. DATI UN TO NOFORMĒŠANA
2.1. REZULTĀTU APSTRĀDE
Ir ieteicams testa plānošanā un analīzē iesaistīt statistiķi, jo testa metode ļauj ievērojami mainīt eksperimenta plānu, piemēram, testa trauku skaitu, testa koncentrāciju skaitu, zivju skaitu utt. Ņemot vērā testa plānā pieejamās izvēles iespējas, šeit nav doti konkrēti norādījumi par statistisko procedūru.
Augšanas ātrumi nav jāaprēķina testa traukiem, kuros mirstība pārsniedz 10 %. Tomēr mirstība jānorāda visām testa koncentrācijām.
Neatkarīgi no tā, kādu metodi izmanto datu analīzē, centrālais jēdziens ir īpatnējais augšanas ātrums r starp momentu t1 un momentu t2. To var definēt vairākos veidos atkarībā no tā, vai zivis ir vai nav individuāli marķētas un vai ir jāizmanto vidējais lielums tvertnē.
![]()
![]()
![]()
kur:
|
r1 |
= |
atsevišķas zivs īpatnējais augšanas ātrums, |
|
r2 |
= |
vidējais īpatnējais augšanas ātrums tvertnē, |
|
r3 |
= |
“pseidoīpatnējais” augšanas ātrums, |
|
w1, w2 |
= |
konkrētas zivs svars attiecīgi laika punktā t1 un t2, |
|
loge w1 |
= |
atsevišķas zivs svara logaritms pētījuma laika posma sākumā, |
|
loge w2 |
= |
atsevišķas zivs svara logaritms pētījuma laika posma beigās, |
|
loge W1 |
= |
lielumu w1 logaritmu vidējais lielums zivīm tvertnē pētījuma laika posma sākumā, |
|
loge W2 |
= |
lielumu w2 logaritmu vidējais lielums zivīm tvertnē pētījuma laika posma beigās, |
|
t1, t2 |
= |
laiks (dienās) pētījuma laika posma sākumā un beigās, |
r1, r2, r3 var aprēķināt 0–28 dienu laika posmam un attiecīgā gadījumā (t. i., ja ir izdarīti mērījumi 14. dienā) 0–14 un 14–28 dienu laika posmiem.
2.1.1. Rezultātu analīze ar regresiju (koncentrācijas–iedarbības modelēšanu)
Šī analīzes metode pielāgo piemērotu matemātisku sakarību starp īpatnējo augšanas ātrumu un koncentrāciju un no šīs sakarības dod iespēju novērtēt ECx, t. i., jebkuru vajadzīgo EC lielumu. Izmantojot šo metodi, r aprēķins atsevišķām zivīm (r1) nav vajadzīgs, un tā vietā analīze var balstīties uz tvertnei vidējo r lielumu (r2). Šī pēdējā metode ir atzīstama par labāku. Tā ir arī piemērotāka ļoti mazu zivju izmantošanas gadījumā.
Lai aplūkotu koncentrācijas sakarību ar iedarbību, tvertnei vidējie īpatnējie augšanas ātrumi (r2) būtu grafiski jāatliek pret koncentrāciju.
Lai izteiktu sakarību starp r2 un koncentrāciju, jāizvēlas piemērots modelis, un tā izvēle ir attiecīgi jāpamato.
Ja katrā tvertnē izdzīvojušo zivju skaits nav vienāds, tad neatkarīgi no tā, vai modelis ir vienkāršs vai nelineārs, modeļa pielāgošanas procesā jānosaka svērtie lielumi, lai ņemtu vērā grupu nevienādos lielumus.
Modeļa pielāgošanas metodei ir jānodrošina, piemēram, EC20 un tās izkliedes novērtējums (standarta kļūda vai ticamības intervāls). Pielāgotā modeļa grafiskais attēls jāparāda attiecībā uz datiem, tā lai būtu redzama modeļa pielāgošanas atbilstība (8) (18) (19) (20).
2.1.2. LOEC novērtēšanas rezultātu analīze
Ja testā ir iekļautas paralēlo mēģinājumu tvertnes visiem koncentrāciju līmeņiem, LOEC novērtēšana var pamatoties uz tvertnei vidējā īpatnējā augšanas ātruma dispersiju analīzi (ANOVA) (skatīt 2.1. punktu), pēc tam izmantojot piemērotu metodi (piemēram, Daneta vai Viljamsa testu (12) (13) (14) (21)) katras koncentrācijas vidējā r salīdzināšanai ar kontroles mēģinājuma vidējo r, lai noskaidrotu mazāko koncentrāciju, kurai atšķirība ir nozīmīga 0,05 varbūtības līmenī. Ja parametriskajām metodēm vajadzīgie pieņēmumi nav atbilstoši – nenormāls sadalījums (piemēram, Šapiro-Vilksa tests) vai heterogēnas dispersijas (Bartleta tests), tad dispersiju homogenizēšanai būtu jāapsver datu pārveidošana pirms ANOVA izdarīšanas vai jāizdara svērta ANOVA.
Ja paralēlo mēģinājumu tvertnes katrai koncentrācijai testā nav iekļautas, ANOVA, kas pamatojas uz tvertnēm, būs bez jēgas vai neiespējama. Šajā gadījumā pieņemams kompromiss ir ANOVA izdarīšana, balstoties uz atsevišķu zivju “pseidoīpatnējo” augšanas ātrumu r3.
Katras testa koncentrācijas vidējo r3 pēc tam var salīdzināt ar kontroles grupas vidējo r3. Pēc tam tāpat kā iepriekš var noskaidrot LOEC. Ir jāievēro, ka šī metode neņem vērā mainīgumu starp tvertnēm vairāk, kā tā ievēro mainīgumu starp atsevišķām zivīm, un šajā ziņā nedod nekādu aizsardzību. Tomēr pieredze ir parādījusi (8), ka mainīgums starp tvertnēm ir ļoti mazs, salīdzinot ar mainīgumu tvertnē (t. i., starp zivīm). Ja analīzē atsevišķas zivis neiekļauj, ir jāparedz nejaušo kļūdu identifikācijas metode un tās izmantošanas pamatojums.
2.2. REZULTĀTU INTERPRETĀCIJA
Rezultāti būtu jāinterpretē piesardzīgi, ja izmērītās toksiskās vielas koncentrāciju līmeņi testa šķīdumos ir tuvi analītiskās metodes atklāšanas robežai vai ja pusstatiskajos testos testa vielas koncentrācija samazinās starp brīdi, kad šķīdums ir svaigi pagatavots, un brīdi pirms atjaunošanas.
2.3. TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
2.3.1. Testa viela:
— fizikālais stāvoklis un attiecīgās fizikāli ķīmiskās īpašības,
— ķīmiskās identificēšanas dati, iekļaujot tīrību un attiecīgā gadījumā testa vielas kvantitatīvās noteikšanas analītisko metodi.
2.3.2. Testa suga:
— zinātniskais nosaukums, ja iespējams,
— līnija, lielums, piegādātājs, iepriekšēja apstrāde utt.
2.3.3. Testa apstākļi:
— izmantotā testa procedūra (piemēram, pusstatiskā/atjaunošanas, caurplūdes, noslogojums, apdzīvotības blīvums utt.),
— testa plāns (piemēram, testa trauku skaits, testa koncentrācijas un paralēlie testi, zivju skaits uz trauku),
— izejas šķīduma pagatavošanas metode un atjaunošanas biežums (ir jānorāda šķīšanu veicinošā viela, ja to lieto, un tās koncentrācija),
— nominālās testa koncentrācijas, izmērīto lielumu vidējie lielumi un to standartnovirzes testa traukos un metode, ar kādu novirzes iegūtas, un pierādījumi, ka mērījumi attiecas uz testa vielas koncentrācijām īstā šķīdumā,
— atšķaidīšanas ūdens parametri: testa vides pH, cietība, sārmainība, temperatūra, izšķīdušā skābekļa koncentrācija, atlikumu hlora līmeņi (ja mērīti), kopējais organiskais ogleklis, suspendētās cietās daļiņas, sāļums (ja mērīts) un citi izdarītie mērījumi,
— ūdens kvalitāte testa traukos: pH, cietība, temperatūra un izšķīdušā skābekļa koncentrācija,
— sīka informācija par barošanu (piemēram, barības veids(-i), avots, dotais daudzums un biežums).
2.3.4. Rezultāti:
— pierādījumi, ka kontroles grupa atbilst derīguma kritērijiem attiecībā uz izdzīvotību, un dati par mirstību katrā no testa koncentrācijām,
— izmantotā statistiskās analīzes metode, statistika, kas pamatojas uz paralēlajiem mēģinājumiem vai atsevišķām zivīm, datu apstrāde un lietotās metodes pamatojums,
— tabulas dati par atsevišķo zivju svaru un zivju vidējo svaru 0., 14. (ja ir izdarīti mērījumi) un 28. dienā, tvertnei vidējie īpatnējie augšanas ātrumi vai pseidoīpatnējie augšanas ātrumi (attiecīgā gadījumā) 0–28 dienu laika posmā vai, iespējams, 0–14 un 14–28 dienu laika posmā,
— statistiskās analīzes rezultāti (t. i., regresijas analīze vai ANOVA), vēlams, tabulas vai grafikas veidā, un LOEC (p = 0,05) un NOEC vai ECx, attiecīgā gadījumā, ja iespējams, standarta kļūdas,
— zivju neparastu reakciju biežums un testa vielas radītā redzamā ietekme.
3. IZMANTOTĀ LITERATŪRA
(1) Solbe J. F. de LG (1987). Environmental Effects of Chemicals (CFM 9350 SLD). Report on a UK Ring Test of a Method for Studying the Effects of Chemicals on the Growth Rate of Fish. WRc Report No PRD 1388-M/2.
(2) Ashley S., Mallett M. J. and Grandy N. J. (1990). EEK Ring Test of a Method for Determining the Effects of Chemicals on the Growth Rate of Fish. Final Report to the Commission of the European Communities. WRc Report No EEK 2600-M.
(3) Crossland N. O. (1985). A method to evaluate effects of toxic chemicals on fish growth. Chemosphere, 14, p. 1855–1870.
(4) Nagel R., Bresh H., Caspers N., Hansen P. D., Market M., Munk R., Scholz N. and H fte B. B. (1991). Effect of 3,4-dichloroaniline on the early life stages of the Zebrafish (Brachydanio rerio): results of a comparative laboratory study. Ecotox. Environ. Safety, 21, p. 157–164.
(5) Yamamoto, Tokio. (1975). Series of stock cultures in biological field. Medaka (killifish) biology and strains. Keigaku Publish. Tokio, Japan.
(6) Holcombe, G. W., Benoit D. A., Hammermeister, D. E., Leonard, E. N. and Johnson, R. D. (1995). Acute and long-term effects of nine chemicals on the Japanese medaka (Oryzias latipes). Arch. Environ. Conta. Toxicol. 28, p. 287–297.
(7) Benoit, D. A., Holcombe, G. W. and Spehar, R. L. (1991). Guidelines for conducting early life toxicity tests with Japanese medaka (Oryzias latipes). Ecological Research Series EPA-600/3–91–063. US Environmental Protection Agency, Duluth, Minnesota.
(8) Stephan C. E. and Rogers J. W. (1985). Advantages of using regression analysis to calculate results of chronic toxicity tests. Aquatic Toxicology and Hazard Assessment: Eighth Symposium, ASTM STP 891, R. C. Bahner and D. J. Hansen, eds., American Society for Testing and Materials, Philadelphia, p. 328–338.
(9) Environment Canada (1992). Biological test method: toxicity tests using early life stages of salmonid fish (rainbow trout, coho salmon, or Atlantic salmon). Conservation and Protection, Ontario, Report EPS 1/RM/28, p. 81.
(10) Cox D. R. (1958). Planning of experiments. Wiley Edt.
(11) Pack S. (1991). Statistical issues concerning the design of tests for determining the effects of chemicals on the growth rate of fish. Room Document 4, OECD Ad Hoc Meeting of Experts on Aquatic Toxicology, WRc Medmenham, UK, 10–12 December 1991.
(12) Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control, J. Amer. Statist. Assoc., 50, p. 1096–1121.
(13) Dunnett C. W. (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482–491.
(14) Williams D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, p. 103–117.
(15) Johnston, W. L., Atkinson, J. L., Glanville N. T. (1994). A technique using sequential feedings of different coloured food to determine food intake by individual rainbow trout, Oncorhynchus mykiss: effect of feeding level. Aquaculture 120, p. 123–133.
(16) Quinton, J. C. and Blake, R. W. (1990). The effect of feed cycling and ration level on the compensatory growth response in rainbow trout, Oncorhynchus mykiss. Journal of Fish Biology, 37, p. 33–41.
(17) Post, G. (1987). Nutrition and Nutritional Diseases of Fish. Chapter IX in Testbook of Fish Health. T. F. H. Publications, Inc. Neptune City, New Jersey, USA. p. 288.
(18) Bruce, R. D. and Versteeg D. J. (1992). A statistical procedure for modelling continuous toxicity data. Environ. Toxicol. Chem. 11, p. 1485–1494.
(19) DeGraeve, G. M., Cooney, J. M., Pollock, T. L., Reichenbach, J. H., Dean, Marcus, M. D. and McIntyre, D. O. (1989). Precision of EPA seven-day fathead minnow larval survival and growth test; intra and interlaboratory study. Report EA-6189 (American Petroleum Institute Publication, No 4468). Electric Power Research Institute, Palo Alto, CA.
(20) Norbert-King T. J. (1988). An interpolation estimate for chronic toxicity: the ICp approach. US Environmental Protection Agency. Environmental Research Lab., Duluth, Minnesota. Tech. Rep. No 05-88 of National Effluent Toxicity Assesment Center. Sept. 1988. p. 12.
(21) Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, p. 510–531.
1. PAPILDINĀJUMS
TESTĒŠANAI ETEICAMĀS ZIVJU SUGAS UN PIEMĒROTIE TESTA APSTĀKĻI
|
Suga |
Ieteicamais testa temperatūru diapazons ( oC) |
Fotoperiods (stundas) |
Ieteicamais zivju sākotnējā svara diapazons (g) |
Vajadzīgā mērījumu precizitāte |
Noslogojums (g/l) |
Apdzīvotības blīvums (litrā) |
Barība |
Testa ilgums (dienas) |
|
Ieteicamās sugas: |
||||||||
|
Oncorhynchus mykiss Varavīksnes forele |
12,5—16,0 |
12–16 |
1–5 |
Līdz tuvākajiem 100 mg |
1,2—2,0 |
4 |
Sausā patentētā lašu dzimtas zivju mazuļu barība |
≥ 28 |
|
Citas labi dokumentētas sugas: |
||||||||
|
Danio rerio Zebras zivs |
21–25 |
12–16 |
0,050—0,100 |
Līdz tuvākajam 1 mg |
0,2—1,0 |
5–10 |
Dzīva barība (Brachionus Artemia) |
≥ 28 |
|
Oryzias latipes Rīsa zivs (Medaka) |
21–25 |
12–16 |
0,050—0,100 |
Līdz tuvākajam 1 mg |
0,2—1,0 |
5–20 |
Dzīva barība (Brachionus Artemia) |
≥ 28 |
2. PAPILDINĀJUMS
DAŽAS PIEŅEMAMA ATŠĶAIDĪŠANAS ŪDENS ĶĪMISKĀS ĪPAŠĪBAS
|
Viela |
Koncentrācijas |
|
Daļiņas |
< 20 mg/l |
|
Kopējais organiskais ogleklis |
< 2 mg/l |
|
Nejonizēts amonjaks |
< 1 μg/l |
|
Atlikumu hlors |
< 10 μg/l |
|
Kopējie fosfororganiskie pesticīdi |
< 50 ng/l |
|
Kopējie hlororganiskie pesticīdi un polihlorbifenīli |
< 50 ng/l |
|
Kopējais organiskais hlors |
< 25 ng/l |
3. PAPILDINĀJUMS
Koncentrāciju logaritmiskās rindas, kas piemērotas toksicitātes testam (9)
|
Aile (koncentrāciju skaits starp 100 un 10 vai starp 10 un 1) (1) |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
32 |
46 |
56 |
63 |
68 |
72 |
75 |
|
10 |
22 |
32 |
40 |
46 |
52 |
56 |
|
3,2 |
10 |
18 |
25 |
32 |
37 |
42 |
|
1,0 |
4,6 |
10 |
16 |
22 |
27 |
32 |
|
2,2 |
5,6 |
10 |
15 |
19 |
24 |
|
|
1,0 |
3,2 |
6,3 |
10 |
14 |
18 |
|
|
1,8 |
4,0 |
6,8 |
10 |
13 |
||
|
1,0 |
2,5 |
4,6 |
7,2 |
10 |
||
|
1,6 |
3,2 |
5,2 |
7,5 |
|||
|
1,0 |
2,2 |
3,7 |
5,6 |
|||
|
1,5 |
2,7 |
4,2 |
||||
|
1,0 |
1,9 |
3,2 |
||||
|
1,4 |
2,4 |
|||||
|
1,0 |
1,8 |
|||||
|
13 |
||||||
|
1,0 |
||||||
|
(1) No ailes var izvēlēties piecu (vai vairāku) secīgu koncentrāciju rindu. Viduspunkti starp koncentrācijām ailē x ir atrodami ailē 2x+1. Uzskaitītie lielumi var pārstāvēt koncentrācijas, kas izteiktas tilpuma vai svara procentos (mg/l vai μg/l). Lielumus attiecīgā gadījumā var reizināt vai dalīt ar jebkuru skaitļa 10. pakāpi. 1. aili var izmantot, ja ir ievērojama nenoteiktība par toksicitātes līmeni. |
||||||
C.15. ĪSTERMIŅA TOKSICITĀTES TESTS ZIVĪM EMBRIJA UN DZELTENUMMAISA ATTĪSTĪBAS POSMOS
1. METODE
Šī akūtās toksicitātes testa metode ir ESAO TG 212 (1998) kopija.
1.1. IEVADS
Šis īstermiņa toksicitātes tests zivīm embrija un dzeltenummaisa attīstības posmos ir īstermiņa tests, kurā tās pakļauj iedarbībai dzīves posmos no tikko apaugļotas oliņas līdz dzeltenummaisa posma beigām. Embrija un dzeltenummaisa posma testā barošana nav paredzēta, un tātad tests būtu jāpabeidz, kamēr zivju mazuļi dzeltenummaisa attīstības posmā vēl barojas no dzeltenummaisa.
Tests ir paredzēts, lai noteiktu ķimikāliju letālo un, ierobežotā mērā, subletālo ietekmi uz testētajām konkrētajām attīstības stadijām un sugām. Testam būtu jāsniedz noderīga informācija, kas varētu a) veidot tiltu starp letāliem un subletāliem testiem, b) tikt izmantota kā skrīninga tests pilnīgam dzīves sākumposmu testam vai hroniskās toksicitātes testam un c) tikt izmantota sugu testēšanai, ja audzēšanas metodes nav pietiekami pavirzījušās, lai ietvertu pārejas laika posmu no endogēnas barošanas uz eksogēnu.
Būtu jāpatur prātā, ka tikai testi, kas iekļauj visus zivju dzīves cikla posmus, parasti var sniegt precīzu vērtējumu par ķimikāliju hronisko toksicitāti zivīm un ka jebkura samazināta iedarbība attiecībā uz dzīves posmiem var samazināt jutību un tādā veidā hroniskā toksicitāte var tikt novērtēta par zemu. Tādēļ ir sagaidāms, ka embrija un dzeltenummaisa posma tests būs mazāk jutīgs nekā pilns dzīves sākumposmu tests, jo īpaši attiecībā uz ļoti lipofīlām ķimikālijām (log Pow > 4) un ķimikālijām ar specifisku toksiskās iedarbības veidu. Tomēr mazākas atšķirības jutībā starp diviem testiem būtu sagaidāmas ķimikālijām ar nespecifisku narkotisku darbības veidu (1).
Pirms šā testa publicēšanas lielākā daļa pieredzes ar šo embrija un dzeltenummaisa testu ir bijusi iegūta ar saldūdens zivi Danio rerio Hamilton-Buchanan (Teleostei, Cyprinidae ar parasto nosaukumu zebras zivs). Tādēļ sīkāk izstrādāti norādījumi par testa izdarīšanu ar šīm sugām ir sniegti 1. papildinājumā. Tas neizslēdz iespēju izmantot citas sugas, par kurām arī ir pieejama pieredze (1. tabula).
1.2. DEFINĪCIJAS
Mazākā novērojamas ietekmes koncentrācija (LOEC ): testa vielas mazākā testētā koncentrācija, pie kuras ir novērots, ka vielai ir nozīmīga ietekme (pie p < 0,05), salīdzinot ar kontroles testu. Tomēr pie visām testa koncentrācijām, kas lielākas par LOEC, ir jābūt negatīvai ietekmei, kura ir vienāda vai lielāka par negatīvo ietekmi, kas novērota pie LOEC.
Nenovērojamas ietekmes koncentrācija (NOEC ): ir testa koncentrācija tieši zem LOEC.
1.3. TESTA PRINCIPS
Zivis embrija un dzeltenummaisa attīstības posmos pakļauj ūdenī izšķīdinātai testa vielai koncentrāciju diapazonā. Atbilstīgi ziņojumam ir iespējams izvēlēties starp pusstatisko un caurplūdes procedūru. Izvēle ir atkarīga no testa vielas īpašībām. Testu sāk, ievietojot apaugļotas oliņas testa tvertnēs, un beidz tieši pirms tam, kad kāda kāpura dzeltenummaiss jebkurā no testa tvertnēm ir pilnīgi uzsūcies, vai pirms kontroles grupā sākas mirstība bada dēļ. Letālo un subletālo ietekmi novērtē un salīdzina ar lielumiem kontroles grupā, lai noteiktu mazākās novērojamās ietekmes koncentrāciju un no tās noteiktu nenovērojamas ietekmes koncentrāciju. Alternatīvi šīs ietekmes var analizēt, izmantojot regresijas modeli, lai novērtētu koncentrāciju, kas izraisa doto procentuālo ietekmi (t. i., LC/ECx, kur x ir noteikta ietekme procentos).
1.4. INFORMĀCIJA PAR TESTA VIELU
Būtu jābūt pieejamiem akūtās toksicitātes testa (skatīt C.1. metodi) rezultātiem, kas, vēlams, iegūti ar šim testam izraudzīto sugu. Rezultāti var būt noderīgi, izvēloties dzīves sākumposmu testiem piemērotu koncentrāciju diapazonu. Jāzina testa vielas šķīdība ūdenī (iekļaujot šķīdību testā izmantojamā ūdenī) un tvaika spiediens. Jābūt pieejamai ticamai analītiskai metodei vielas kvantitatīvai noteikšanai testa šķīdumos, kuras precizitāte un atklāšanas robeža ir zināma un norādīta ziņojumā.
Informācija, kas var būt noderīga, izstrādājot testa apstākļus, iekļauj testa vielas struktūrformulu, tīrību, stabilitāti gaismas ietekmē, stabilitāti testa apstākļos, pKa, Pow un vieglas bionoārdīšanās testa rezultātus (skatīt C.4. metodi).
1.5. TESTA DERĪGUMS
Lai tests būtu derīgs, piemēro šādus nosacījumus:
— apaugļoto oliņu kopējai izdzīvotībai kontroles grupā un attiecīgā gadījumā traukos, kuros ir tikai šķīdinātājs, ir jābūt lielākai vai vienādai ar 2. un 3. papildinājumā norādītajiem robežlielumiem,
— izšķīdušā skābekļa koncentrācijai visā testa laikā jābūt starp 60 un 100 % no piesātināšanas ar gaisu lieluma,
— ūdens temperatūra nedrīkst vairāk par ± 1,5oC atšķirties starp testa tvertnēm vai starp secīgām dienām jebkurā brīdī testa laikā, un tai jābūt temperatūru intervālā, kas norādīts attiecīgajai testa sugai (2. un 3. papildinājums).
1.6. TESTA METODES APRAKSTS
1.6.1. Testa tvertnes
Var izmantot jebkurus stikla vai cita ķīmiski inerta materiāla traukus. Trauku izmēriem jābūt pietiekami lieliem, lai tie atbilstu noslogojumam (skatīt 1.7.1.2. punktu). Ir ieteicams testa tvertnes izvietot testa izpildes vietā pēc nejaušās izvēles. Pēc nejaušas izvēles izvietotu bloku plāns, kur katrā blokā ir pārstāvēta katra veida apstrāde, ir vēlamāks par pilnīgi nejaušas izvēles izvietojuma plānu, ja laboratorijā ir sistemātiskas ietekmes, ko var kontrolēt, izmantojot izvietojumu pa blokiem. Izvietošana pa blokiem, ja to lieto, jāņem vērā turpmākajā datu analīzē. Testa tvertnes jāaizsargā no nevēlamiem traucējumiem.
1.6.2. Zivju sugu izvēle
Ieteicamās zivju sugas ir norādītas 1.A tabulā. Tas neizslēdz citu sugu izmantošanu (piemēri ir 1.B tabulā), bet testa procedūra var būt jāpielāgo, lai nodrošinātu piemērotus testa apstākļus. Tādā gadījumā jāprotokolē sugas izvēles pamatojums un eksperimenta metode.
1.6.3. Vaislas zivju turēšana
Dati par vaislas zivju turēšanu piemērotos apstākļos ir atrodami ESAO TG 210 ( 29 ) un (2), (3), (4), (5), (6).
1.6.4. Rīkošanās ar embrijiem un kāpuriem
Embrijus un kāpurus galvenās tvertnes iekšpusē var pakļaut iedarbībai, ievietotus mazākos traukos, kuru sāni vai gali veidoti no sieta, lai testa šķīdums varētu plūst cauri traukiem. Neturbulentu plūsmu caur šiem mazajiem traukiem var izraisīt, tos piekarot turētājam, kas tos kustina augšup un lejup, tā, lai organismi visu laiku būtu iegremdēti. Var izmantot arī sifona skalošanas sistēmu. Lašu dzimtas zivju apaugļotas oliņas var balstīties uz paliktņiem vai sietiem ar pietiekami lielām atverēm, lai kāpuri pēc izšķilšanās varētu tām izkrist cauri. Lai pusstatiskajos testos ar pilnīgu atjaunošanu ik dienas embrijus un kāpurus izņemtu, ir piemēroti lietot Pastēra pipetes (skatīt 1.6.6. punktu).
Ja oliņu turēšanai galvenajā testa traukā ir izmantoti oliņu turētāji, režģi vai sieti, šie šķēršļi pēc kāpuru izšķilšanās (29) jāaizvāc, izņemot gadījumu, ja sieti jāsaglabā, lai novērstu zivju izkļūšanu. Ja kāpuri ir jāpārvieto, tos nedrīkstētu pakļaut gaisa iedarbībai un zivju izņemšanai no oliņu traukiem nedrīkst izmantot tīkliņus (tādu piesardzību var neievērot ar dažām mazāk vārīgām sugām, piemēram, karpām). Šo pārvietošanu grafiks mainās atkarībā no sugas, un pārvietošana var nebūt vienmēr vajadzīga. Pusstatiskajai metodei var izmantot vārglāzes vai seklus traukus un vajadzības gadījumā tos aprīkot ar sietu, kas nedaudz pacelts virs vārglāzes dibena. Ja šo trauku tilpums ir pietiekams, lai atbilstu noslogojuma prasībām, (skatīt 1.7.1.2. punktu) embriju vai kāpuru pārnešana var nebūt vajadzīga.
1.6.5. Ūdens
Jebkurš ūdens, kas atbilst 4. papildinājumā uzskaitītajām pieņemama atšķaidīšanas ūdens ķīmiskajām īpašībām un kurā testa suga kontroles mēģinājumā uzrāda izdzīvotību, kas ir vismaz tikpat laba kā 2. un 3. papildinājumā aprakstītā, ir piemērots testa ūdens. Tā kvalitātei testa laika posmā jābūt nemainīgai. pH būtu jābūt nemainīgam ± 0,5 pH vienību diapazonā. Lai nodrošinātu, ka atšķaidīšanas ūdens pārāk neietekmē testa rezultātu (piemēram, veidojot kompleksus ar testa vielu) vai negatīvi neietekmē vaislas zivju darbību, noteiktos intervālos jāņem paraugi analīzei. Smago metālu (piemēram, Cu, Pb, Zn, Hg, Cd un Ni), galveno anjonu un katjonu (piemēram, Ca, Mg, Na, K, Cl un SO4), pesticīdu (piemēram, kopējo fosfororganisko pesticīdu un kopējo hlororganisko pesticīdu), kopējā organiskā oglekļa un suspendētu cietu vielu mērījumi, piemēram, būtu jāveic reizi trijos mēnešos, ja ir zināms, ka atšķaidīšanas ūdens kvalitāte ir relatīvi nemainīga. Ja ir parādīts, ka ūdens kvalitāte ir nemainīga vismaz viena gada laikā, noteikšanas var būt retākas un intervāli var būt garāki (piemēram, reizi sešos mēnešos).
1.6.6. Testa šķīdumi
Izraudzītās koncentrācijas testa šķīdumus parasti gatavo, atšķaidot izejas šķīdumu.
Izejas šķīdumu vēlams pagatavot, vienkārši maisot vai kratot testa vielu ar atšķaidīšanas ūdeni, izmantojot mehāniskus līdzekļus (piemēram, kratītāju vai ultraskaņu). Piemērota koncentrēta izejas šķīduma iegūšanai var izmantot piesātināšanas kolonnas (šķīdības kolonnas). Cik vien iespējams, būtu jāizvairās izmantot šķīdinātājus vai disperģējošas vielas (šķīdību veicinošas vielas); tomēr dažos gadījumos šādi savienojumi var būt vajadzīgi, lai iegūtu piemērotas koncentrācijas izejas šķīdumu. Piemērotu šķīdinātāju piemēri ir acetons, etilspirts, metilspirts, dimetilformamīds un trietilēnglikols. Piemērotu disperģējošu vielu piemēri ir Cremophor RH40, Tween 80, 0,01 % metilceluloze un HCO-40. Ir jābūt uzmanīgam, lietojot viegli bionoārdāmas vielas (piemēram, acetonu) un/vai viegli gaistošus savienojumus, jo tie var radīt problēmas ar baktēriju augšanu caurplūdes testos. Ja lieto šķīdību veicinošu vielu, tā nedrīkst jūtami ietekmēt izdzīvotību vai redzami negatīvi ietekmēt attīstības sākumstadijas, ko var atklāt kontroles mēģinājumā, kuru izdara ar šķīdinātāju vien. Tomēr būtu jāpieliek visas pūles, lai izvairītos no šādu vielu lietošanas.
Lietojot pusstatisko metodi, var izmantot divas atšķirīgas atjaunošanas procedūras: i) tīros traukos sagatavo jaunus testa šķīdumus un izdzīvojušās oliņas un kāpurus uzmanīgi pārnes jaunajos traukos nelielā vecā šķīduma tilpumā, izvairoties pakļaut gaisa iedarbībai vai ii) testa organismus atstāj traukos, kamēr apmaina daļu (vismaz trīs ceturtdaļas) no testa ūdens. Vides atjaunošanas biežums ir atkarīgs no testa vielas stabilitātes, bet ir ieteicams ūdeni atjaunot katru dienu. Ja no iepriekšējiem stabilitātes testiem (skatīt 1.4. punktu) ir zināms, ka testa vielas koncentrācija atjaunošanas laika posmā nav stabila (t. i., ārpus 80–120 % diapazona no nominālās koncentrācijas vai zem 80 % no izmērītās sākotnējās koncentrācijas), tad jāapsver caurplūdes testa izmantošana. Katrā ziņā jārūpējas, lai izvairītos no stresa radīšanas kāpuriem ūdens atjaunošanas laikā.
Lai piegādātu testa tvertnēm rindu koncentrāciju, caurplūdes testos ir vajadzīga sistēma, kas nepārtraukti piegādā un atšķaida testa vielas izejas šķīdumu (piemēram, dozējošais sūknis, proporcionālas atšķaidīšanas ierīce, piesātinātāja sistēma). Izejas šķīdumu un atšķaidīšanas ūdens plūsmas ātrumi testa laikā jāpārbauda noteiktos intervālos, vēlams, reizi dienā, un tie testa laikā nedrīkst mainīties vairāk kā par 10 %. Par piemērotu ir atzīts plūsmas ātrums, kas līdzvērtīgs vismaz pieciem testa tvertnes tilpumiem 24 stundās (2).
1.7. PROCEDŪRA
Noderīga informācija par zivju embriju un dzeltenummaisa attīstības posma toksicitātes testu izdarīšanu ir pieejama literatūrā, kuras daži piemēri ir iekļauti šā teksta literatūras sarakstā (7) (8) (9).
1.7.1. Iedarbības apstākļi
1.7.1.1. Ilgums
Testu vēlams sākt 30 minūšu laikā pēc oliņu apaugļošanas. Embrijus iegremdē testa šķīdumā pirms blastodiska dalīšanās stadijas sākuma vai iespējami drīz pēc tam un katrā ziņā pirms gastrulas stadijas sākuma. Oliņām, kas iegūtas no komercpiegādātāja, var nebūt iespējams testu sākt tieši pēc apaugļošanas. Tā kā testa jutību var ievērojami ietekmēt testa sākuma aizkavēšanās, tests būtu jāsāk astoņu stundu laikā pēc apaugļošanas. Tā kā vielas iedarbības laika posmā kāpurus nebaro, tests būtu jābeidz, tieši pirms kāda kāpura dzeltenummaiss jebkurā testa traukā ir pilnīgi uzsūcies vai pirms kontroles grupā sākas mirstība bada dēļ. Ilgums būs atkarīgs no izmantotās sugas. Daži ieteicamie ilgumi ir 2. un 3. papildinājumā.
1.7.1.2. Noslogojums
Apaugļoto oliņu skaitam testa sākumā būtu jābūt pietiekamam, lai atbilstu statistikas prasībām. Oliņas jāsadala starp apstrādes veidiem pēc nejaušās izvēles, un katrai koncentrācijai jāizmanto vismaz 30 apaugļotas oliņas, sadalot vienādi (vai iespējami vienādi, jo, izmantojot dažas sugas, var būt grūti iegūt vienādas partijas) starp vismaz trim paralēlo testu traukiem. Noslogojumam (biomasai testa šķīduma tilpuma vienībā) jābūt pietiekami mazam, lai bez aerācijas varētu uzturēt izšķīdušā skābekļa koncentrāciju vismaz 60 % no piesātinājuma lieluma. Caurplūdes testiem ir ieteikts noslogojums, kas nav lielāks par 0,5 g/l 24 stundās un nav lielāks par 5 g/l šķīduma jebkurā laikā (2).
1.7.1.3. Gaisma un temperatūra
Fotoperiods un ūdens temperatūra jāpiemēro testa sugai (2. un 3. papildinājums). Temperatūras uzraudzības nolūkiem var būt lietderīgi izmantot papildu testa trauku.
1.7.2. Testa koncentrācijas
Parasti ir vajadzīgas piecas testa vielas koncentrācijas, kas atšķiras ar nemainīgu koeficientu, ne lielāku par 3,2. Izvēloties testa koncentrāciju diapazonu, būtu jāņem vērā līkne, kas attēlo LC50 atkarību no iedarbības laika akūtās toksicitātes pētījumā. Dažos gadījumos var būt lietderīgi izmantot mazāk nekā piecas koncentrācijas, piemēram, pieļaujamā daudzuma testos, un šaurāku koncentrāciju intervālu. Ja izmanto mazāk par piecām koncentrācijām, tas būtu jāpamato. Vielas koncentrācijas, kas lielākas par 96 stundu LC50 vai 100 mg/l, izvēloties no abiem mazāko lielumu, nav jātestē. Vielas nebūtu jātestē virs to šķīdības robežas testa ūdenī.
Ja izmanto šķīdību veicinošu vielu, lai vieglāk pagatavotu testa šķīdumus (skatīt 1.6.6. punktu), tās galakoncentrācija testa traukos nedrīkst būt lielāka par 0,1 ml/l, un tai jābūt vienādai visos testa traukos.
1.7.3. Kontroles mēģinājumi
Papildus testa sērijai vajadzētu izdarīt vienu kontroles mēģinājumu ar atšķaidīšanas ūdeni (attiecīgā gadījumā izdarot paralēlos mēģinājumus) un arī attiecīgā gadījumā vienu kontroles mēģinājumu ar šķīdību veicinošo vielu (attiecīgā gadījumā izdarot paralēlos mēģinājumus).
1.7.4. Analītisko noteikšanu un mērījumu biežums
Testa laikā testa vielas koncentrācijas nosaka regulāros intervālos.
Pusstatiskajos testos, ja testa vielas koncentrācija, sagaidāms, paliks ± 20 % no nominālās (t. i., 80–120 % diapazonā; skatīt 1.4. un 1.6.6. punktu), ir ieteicams vismaz lielāko un mazāko testa koncentrāciju analizēt svaigi pagatavotu un tieši pirms atjaunošanas vismaz trijos laika punktos, kas vienmērīgi izvietoti testa laikā (t. i., analīzes būtu jāveic tā paša šķīduma paraugam, kas ir svaigi pagatavots un pie atjaunošanas).
Ja nav sagaidāms, ka testa vielas koncentrācija testā saglabāsies ± 20 % no nominālā lieluma (pamatojoties uz testa vielas stabilitātes datiem), ir jāanalizē visas testa koncentrācijas, svaigi pagatavotas un pie atjaunošanas, bet jāievēro tas pats režīms (t. i., vismaz trijos laika punktos, kas vienmērīgi izvietoti testa laikā). Testa vielas koncentrāciju noteikšana pirms atjaunošanas ir jāizdara tikai vienā paralēlā mēģinājuma traukā katrai testa koncentrācijai. Noteikšanas jāizdara ne retāk par septiņām dienām. Ir ieteicams rezultātu aprēķinā pamatoties uz izmērītajām koncentrācijām. Tomēr, ja ir pieejami dati, kas rāda, ka testa vielas koncentrācija šķīdumā visā testa laikā ir apmierinoši saglabājusies ± 20 % no nominālā lieluma vai no izmērītās sākuma koncentrācijas, tad rezultātu aprēķins var pamatoties uz nominālajiem vai izmērītajiem sākotnējiem lielumiem.
Ja izmanto caurplūdes testu, ir piemērots paraugu ņemšanas režīms, kas ir līdzīgs režīmam, kurš aprakstīts pusstatiskajiem testiem (bet šajā gadījumā nav piemērojama “veco” šķīdumu mērīšana). Tomēr, ja testa ilgums ir lielāks par septiņām dienām, var būt ieteicams pirmajā nedēļā palielināt paraugu ņemšanas reižu skaitu (piemēram, trīs mērījumu komplekti), lai nodrošinātu, ka testa koncentrācijas paliek stabilas.
Paraugi var būt jāfiltrē (piemēram, izmantojot 0,45 μm poru lielumu) vai jācentrifugē. Tomēr, tā kā ne centrifugēšana, ne filtrēšana vienmēr neatdala testa vielas bionepieejamo frakciju no tās, kas ir biopieejama, paraugus minētajai apstrādei var nepakļaut.
Testa laikā visos testa traukos jāmēra izšķīdušais skābeklis, pH un temperatūra. Kopējā cietība un sāļums (attiecīgā gadījumā) jāmēra kontroles mēģinājumos un vienā traukā ar lielāko koncentrāciju. Izšķīdušais skābeklis un sāļums (attiecīgā gadījumā) būtu jāmēra vismaz trīs reizes (testa sākumā, vidū un beigās). Pusstatiskajos testos ir ieteicams izšķīdušo skābekli mērīt biežāk, vēlams, pirms katras ūdens atjaunošanas un pēc tās vai vismaz vienreiz nedēļā. pH jāmēra katras ūdens atjaunošanas sākumā un beigās pusstatiskajos testos un vismaz reizi nedēļā caurplūdes testos. Cietība jāmēra katrā testā vienu reizi. Temperatūra jāmēra katru dienu, un to būtu vēlams nepārtraukti uzraudzīt vismaz vienā testa traukā.
1.7.5. Novērojumi
1.7.5.1. Embrionālās attīstības stadijas
Embrionālā stadija (t. i., gastrulas stadija) testa vielas iedarbības sākumā jāpārbauda iespējami precīzi. To var izdarīt, izmantojot pienācīgi saglabātu un notīrītu oliņu raksturīgu paraugu. Embrionālās attīstības stadiju apraksts un ilustrācijas ir atrodamas arī literatūrā (2) (5) (10) (11).
1.7.5.2. Izšķilšanās un izdzīvotība
Novērojumi par izšķilšanos un izdzīvotību jāizdara vismaz reizi dienā, un skaits jāprotokolē. Var būt vēlams testa sākumā izdarīt biežākus novērojumus (piemēram, reizi 30 minūtēs pirmo trīs stundu laikā), jo dažos gadījumos izdzīvotības laiki var būt nozīmīgāki nekā nāves gadījumu skaits vien (piemēram, ja ir akūta toksiska ietekme). Nedzīvie embriji un kāpuri būtu jāizņem, tikko tie pamanīti, jo tie var strauji sadalīties. Nedzīvos īpatņus izņemot, būtu ārkārtīgi jāuzmanās, lai nepiedurtos tuvu esošajām oliņām/kāpuriem vai tos fiziski netraumētu, jo tie ir ārkārtīgi vārīgi un jutīgi. Nāves kritēriji atšķiras atkarībā no dzīves posma:
— oliņām: jo īpaši agrīnās stadijās, izteikts gaismas caurlaidības zudums un krāsas maiņa, ko rada olbaltumvielu koagulācija un/vai izgulsnēšanās, kas ir balta necaurredzama izskata cēlonis,
— embrijiem: ķermeņa kustību trūkums un/vai sirds pulsāciju trūkums, un/vai bezkrāsas blāvums sugām, kuru embriji parasti ir gaismu caurlaidīgi,
— kāpuriem: nekustīgums un/vai elpošanas kustību trūkums, un/vai sirds pulsāciju trūkums, un/vai centrālās nervu sistēmas balti blāvs krāsojums, un/vai atbildes reakcijas trūkums uz mehānisku kairinājumu.
1.7.5.3. Nenormāls izskats
Kāpuru skaits, kam ir nenormāla ķermeņa forma un/vai pigmentācija, un dzeltenummaisa uzsūkšanās stadija, būtu jāprotokolē adekvātos intervālos atkarībā no testa ilguma un aprakstītās nenormālības rakstura. Jāņem vērā, ka nenormāli embriji un kāpuri ir sastopami dabā un dažām sugām kontroles grupā(-ās) to kārtas lielums var būt daži procenti. Nenormālie dzīvnieki no testa traukiem jāizņem tikai tad, kad tie ir nobeigušies.
1.7.5.4. Nenormāla uzvedība
Nenormālības, piemēram, hiperventilācija, nekoordinēta peldēšana un netipisks miera stāvoklis jāprotokolē atbilstošos intervālos atkarībā no testa ilguma. Šīs ietekmes, kaut arī grūti izsakāmas kvantitatīvi, var, ja tās novērotas, palīdzēt interpretēt mirstības datus, t. i., sniegt informāciju par vielas toksiskās darbības veidu.
1.7.5.5. Garums
Testa beigās ir ieteicams izmērīt individuālos garumus; var izmantot standarta garumu, garumu pēc Smita vai kopējo garumu. Tomēr, ja astes spura pūst vai spura erodē, jāizmanto standarta garumi. Parasti labi izdarītā testā garumu variācijas koeficientam starp paralēlajiem mēģinājumiem kontroles grupās jābūt ≤ 20 %.
1.7.5.6. Svars
Testa beigās var nosvērt atsevišķos dzīvniekus; sausais svars (24 stundas pie 60 oC) ir vēlamāks par mitro svaru (zivis nosusinātas sausas). Parasti labi izdarītā testā svara variācijas koeficientam starp paralēlajiem mēģinājumiem kontroles grupās jābūt ≤ 20 %.
Šo novērojumu rezultātā statistiskajai analīzei būs pieejami šādi dati vai daļa no tiem:
— kumulatīvā mirstība,
— veselu kāpuru skaits testa beigās,
— šķilšanās sākuma laiks un beigu laiks (t. i., 90 % izšķilšanās katrā paralēlajā mēģinājumā),
— katru dienu izšķīlušos kāpuru skaits,
— testa beigās izdzīvojušo dzīvnieku garums (un svars),
— kāpuru skaits, kas ir deformēti vai kam ir nenormāls izskats,
— kāpuru skaits, kam ir nenormāla uzvedība.
2. DATI UN TO NOFORMĒŠANA
2.1 REZULTĀTU APSTRĀDE
Ir ieteicams gan testa plānošanā, gan analīzē iekļaut statistiķi, jo metode ļauj ievērojami mainīt eksperimenta plānu, piemēram, testa tvertņu skaitu, testa koncentrāciju skaitu, apaugļoto oliņu sākuma skaitu un mērāmos parametrus. Ņemot vērā testa plānā pieejamās izvēles iespējas, konkrēti norādījumi par statistisko procedūru šeit nav doti.
Ja ir jānovērtē LOEC/NOEC, ir jāanalizē variācijas katrā paralēlo mēģinājumu kopā, izmantojot dispersiju analīzi (ANOVA) vai saistību tabulas procedūru. Lai vairākkārtīgi salīdzinātu atsevišķām koncentrācijām iegūtos rezultātus ar kontroles mēģinājumu rezultātiem, noderīga var būt Daneta metode (12) (13). Ir pieejami arī citi noderīgi piemēri (14) (15). Būtu jāaprēķina un jāprotokolē ietekmes lielums, kas ir nosakāms, izmantojot ANOVA vai citas procedūras (t. i., testa iespējas). Būtu jāatzīmē, ka ne visi 1.7.5.6. punktā uzskaitītie novērojumi ir piemēroti statistiskai analīzei, izmantojot ANOVA. Piemēram, kumulatīvo mirstību un veselīgu kāpuru skaitu testa beigās varētu analizēt, izmantojot varbūtības vienības metodes.
Ja ir jānovērtē LC/ECx, interesējošajiem datiem jāpielāgo piemērota(-as) līkne(-es), piemēram, loģistiskā līkne, izmantojot tādu statistisko metodi kā mazāko kvadrātu metode vai nelineāro mazāko kvadrātu metode. Līkne(-es) jāparametrizē tā, lai interesējošo LC/ECx un tās standartkļūdu varētu noteikt tieši. Tas ļoti atvieglo ticamības robežu aprēķinu ap LC/ECx. Ja vien nav laba pamatojuma dot priekšroku atšķirīgiem ticamības līmeņiem, būtu jāizvēlas 95 % divpusējas ticamības robežas. Pielāgošanas procedūrai, vēlams, būtu jādod līdzeklis novērtēt, cik nozīmīgs ir pielāgotības trūkums. Līkņu pielāgošanai var izmantot grafiskās metodes. Regresijas analīze ir piemērota visiem novērojumiem, kas uzskaitīti 1.7.5.6. punktā.
2.2. REZULTĀTU INTERPRETĀCIJA
Ja izmērītās toksisko vielu koncentrācijas testa šķīdumos ir tuvas analītiskās metodes atklāšanas robežai, tad rezultāti būtu jāinterpretē piesardzīgi. Rezultātu interpretācija koncentrācijām, kas lielākas par vielas šķīdību ūdenī, arī būtu jāizdara piesardzīgi.
2.3. TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
2.3.1. Testa viela:
— fizikālais stāvoklis un attiecīgās fizikāli ķīmiskās īpašības,
— ķīmiskās identificēšanas dati, iekļaujot tīrību un attiecīgā gadījumā testa vielas kvantitatīvās noteikšanas analītisko metodi.
2.3.2. Testa suga:
— vaislas zivju zinātniskais nosaukums, līnija, skaits (t. i., cik mātīšu ir izmantots vajadzīgā oliņu skaita nodrošināšanai testā), izcelsme un apaugļoto oliņu savākšanas metode un turpmāka rīkošanās ar tām.
2.3.3. Testa apstākļi:
— izmantotā testa procedūra (piemēram, pusstatiskā vai caurplūdes, laika posms no apaugļošanas līdz testa sākumam, noslogojums utt.),
— fotoperiods(-i),
— testa plāns (piemēram, testa tvertņu un paralēlo mēģinājumu skaits, embriju skaits uz paralēlo mēģinājumu),
— izejas šķīduma pagatavošanas metode un atjaunošanas biežums (ir jānorāda šķīšanu veicinošā viela, ja to lieto, un tās koncentrācija),
— nominālās testa koncentrācijas, izmērītie lielumi, to vidējās novirzes un standartnovirzes testa traukos un metode, ar ko šie dati iegūti, un, ja testa viela šķīst ūdenī koncentrācijās, kas ir mazākas par testētajām, būtu jāsniedz pierādījumi, ka mērījumi attiecas uz testa vielas koncentrācijām šķīdumā,
— atšķaidīšanas ūdens raksturlielumi: testa vides pH, cietība, temperatūra, izšķīdušā skābekļa koncentrācija, atlikumu hlora līmeņi (ja mērīti), kopējais organiskais ogleklis, suspendētās cietās daļiņas, sāļums (ja mērīts) un citi izdarītie mērījumi,
— ūdens kvalitāte testa traukos: pH, cietība, temperatūra un izšķīdušā skābekļa koncentrācija.
2.3.4. Rezultāti:
— priekšmēģinājumu rezultāti par testa vielas stabilitāti,
— pierādījumi, ka kontroles grupa atbilst testa sugas vispārējam izdzīvotības pieņemamības standartam (2. un 3. papildinājums),
— dati par mirstību/izdzīvotību embrija un kāpura stadijās un vispārējo mirstību/izdzīvotību,
— izšķilšanās dienas un izšķīlušos kāpuru skaits,
— dati par garumu (un svaru),
— morfoloģisko anomāliju biežums un apraksts, ja tādas ir,
— ietekmju uz izturēšanos biežums un apraksts, ja tādas ir,
— datu statistiskā analīze un apstrāde
— testiem, kas analizēti, izmantojot ANOVA, mazākās novērojamās ietekmes koncentrācija (LOEC) pie p = 0,05 un nenovērojamās ietekmes koncentrācija (NOEC) katrai novērtētajai atbildes reakcijai, iekļaujot izmantoto statistisko procedūru aprakstu un norādi, kāda lieluma ietekmi var noteikt,
— testiem, kas analizēti, izmantojot regresijas metodi, LC/ECx un ticamības intervāli un tās aprēķinā izmantotā pielāgotā modeļa grafika,
— paskaidrojums par atkāpēm no šīs testa metodes.
3. IZMANTOTĀ LITERATŪRA
(1) Kristensen P. (1990). Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, p. 60. June 1990.
(2) ASTM (1988). Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. p. 26.
(3) Brauhn J. L. and Schoettger R. A. (1975). Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. p. 54, Ecological Research Series, EPA-660/3–75–011, Duluth, Minnesota.
(4) Brungs W. A. and Jones B. R. (1977). Temperature Criteria for Freshwater Fish: Protocol and Procedures. p. 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota.
(5) Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Biol. 10, p. 121–173.
(6) Legault R. (1958). A Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, p. 328–330.
(7) Dave G., Damgaard B., Grande M., Martelin J. E., Rosander B. and Viktor T. (1987). Ring Test of an Embryo-larval Toxicity Test with Zebrafish (Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, p. 61–71.
(8) Birge J. W., Black J. A. and Westerman A. G. (1985). Short-term Fish and Amphibian Embryo-larval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, p. 807–821.
(9) Van Leeuwen C. J., Espeldoorn A. and Mol F. (1986). Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. III. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, p. 129–145.
(10) Kirchen R. V. and W. R. West (1969). Teleostean Development. Carolina Tips 32(4): 1-4. Carolina Biological Supply Company.
(11) Kirchen R. V. and W. R. West (1976). The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina. p. 36.
(12) Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc., 50, p. 1096–1121.
(13) Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, p. 482–491.
(14) Mc Clave J. T., Sullivan J. H. and Pearson J. G. (1980). Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia.
(15) Van Leeuwen C. J., Adema D. M. M. and Hermes J. (1990). Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, p. 321–334.
(16) Environment Canada (1992). Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS 1/RM/28, December 1992, p. 81.
(17) Dave G. and Xiu R. (1991). Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio rerio. Arch. of Environmental Contamination and Toxicology, 21, p. 126–134.
(18) Meyer A., Bierman C. H. and Orti G. (1993). The phylogenetic position of the Zebrafish (Danio rerio), a model system in developmental biology ó an invitation to the comparative methods. Proc. Royal Society of London, Series B, 252: p. 231–236.
(19) Ghillebaert F., Chaillou C., Deschamps F. and Roubaud P. (1995). Toxic Effects, at Three pH Levels, of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, p. 19–28.
(20) US EPA, (1991). Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPA report EPA/600/3–91/064, Dec. 1991, EPA, Duluth.
(21) US EPA, (1991). Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Oryzias latipes). EPA report EPA/600/3–91/063, Dec. 1991, EPA, Duluth.
(22) De Graeve G. M., Cooney J. D., McIntyre D. O., Poccocic T. L., Reichenbach N. G., Dean J. H. and Marcus M. D. (1991). Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, p. 1189–1203.
(23) Calow P. (1993). Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, Chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish.
(24) Balon E. K. (1985). Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, p. 280.
(25) Blaxter J. H. S. (1988). Pattern and variety in development, in: W. S. Hoar and D. J. Randall eds., Fish Physiology, Vol. XIA, Academic press, p. 1–58.
1.A tabula
Testēšanai ieteicamās zivju sugas
|
SALDŪDENS |
|
Oncorhynchus mykiss Varavīksnes forele (9) (16) |
|
Danio rerio Zebras zivs (7) (17) (18) |
|
Cyprinus caprio Karpa (8) (19) |
|
Oryzias latipes Rīsa zivs/medaka (20) (21) |
|
Pimephales promelas Resngalvas mailīte (8) (22) |
1.B tabula
Citu labi dokumentētu sugu piemēri, ko var izmantot
|
SALDŪDENS |
SĀLSŪDENS |
|
Carassius auratus Sudrabainā karūsa (8) |
Menidia peninsulae Alterīnveidīgo zivju suga (23) (24) (25) |
|
Lepomis macrochirus Asarveidīgo zivju suga (8) |
Clupea harengus Atlantijas siļķe (24) (25) |
|
Gadus morhua Menca (24) (25) |
|
|
Cyprinodon variegatus Karpzobveidīgo zivju suga (23) (24) (25) |
1. PAPILDINĀJUMS
NORĀDĪJUMI PAR TOKSICITĀTES TESTA IZDARĪŠANU AR ZEBRAS ZIVS (Brachydanio rerio) EMBRIJIEM UN MAZUĻIEM DZELTENUMMAISA ATTĪSTĪBAS STADIJĀ
IEVADS
Zebras zivs izcelsme ir Indijas Koromandelas piekrastē, kur tā dzīvo strauji tekošās straumēs. Tā ir parasta karpu dzimtas akvārija zivs, un informācija par tās kopšanu un audzēšanu ir atrodama standarta rokasgrāmatās par tropu zivīm. Tās bioloģiju un izmantošanu ar zvejniecību saistītos pētījumos ir apskatījis Lāle (1).
Šī zivs reti ir garāka par 45 mm. Ķermenis ir cilindrisks ar 7–9 tumši zilām horizontālām sudrabotām svītrām. Svītras iesniedzas astes spurā un anālajā spurā. Mugura ir olīvzaļa. Tēviņi ir slaidāki par mātītēm. Mātītes ir sudrabainākas, un vēderiņš ir izpleties, jo īpaši pirms nārstošanas.
Pieaugušas zivis spēj paciest lielas ūdens temperatūras, pH un cietības svārstības. Tomēr, lai iegūtu veselīgas zivis, kas rada labas kvalitātes oliņas, jānodrošina optimāli apstākļi.
Nārsta laikā tēviņš seko mātītei un to grūsta ar galvu un, kad oliņas ir izstumtas, tās apaugļo. Oliņas, kas ir caurspīdīgas un nelīpošas, nokrīt dibenā, kur tās var apēst vecāki. Nārstošanu ietekmē apgaismojums. Ja rīta gaisma ir atbilstoša, zivs parasti nārsto agrīnās stundās pēc rītausmas.
Mātīte var radīt vairāku simtu oliņu partijas nedēļas intervālos.
VAISLAS ZIVJU VAIROŠANĀS UN DZĪVES SĀKUMSTADIJU APSTĀKĻI
Izvēlas piemērotu skaitu veselu zivju un tās tur piemērotā ūdenī (skatīt, piemēram, 4. papildinājumu) vismaz divas nedēļas pirms paredzētā nārsta. Zivju grupai jāļauj vairoties vismaz vienu reizi pirms oliņu partijas veidošanas, ko izmanto testā. Zivju blīvums minētajā laika posmā nedrīkstētu pārsniegt 1 gramu zivju litrā. Regulāra ūdens maiņa vai tīrīšanas sistēmu izmantošana ļauj blīvumu palielināt. Temperatūrai turēšanas tvertnēs jābūt 25 ± 2 oC. Zivīm jānodrošina dažāda barība, kas var sastāvēt, piemēram, no atbilstošas pārdodamas sausās barības, dzīviem, tikko noķertiem bezčaulvēžiem, trīsuļodiem, dafnijām, sīksliekām (Enchytraeids).
Turpmāk ir galvenajos vilcienos aprakstītas divas procedūras, kas praksē ir ļāvušas iegūt pietiekami lielu partiju veselīgu apaugļotu oliņu veicamajam testam:
Astoņas mātītes un 16 tēviņus ievieto tvertnē, kas satur 50 litrus atšķaidīšanas ūdens un kas aizsargāta no tiešas gaismas, un atstāj, iespējami maz traucējot, vismaz 48 stundas. Pēcpusdienā pirms testa sākšanas akvārija dibenā novieto nārstošanas paplāti. Nārstošanas paplāte sastāv no 5–7 cm augsta rāmja (organiskā stikla vai cita piemērota materiāla), kam virspusē piestiprināts rupjš tīkls ar 2–5 mm acīm, bet apakšā smalks tīkls ar 10–30 μm acīm. Rāmja rupjajam tīklam ir piestiprināta rinda “nārsta koku”, kas sastāv no nešķetinātām neilona auklām. Pēc tam, kad zivis ir atstātas tumsā 12 stundas, ieslēdz vāju apgaismojumu, kurš ierosina nārstošanu. Divas līdz četras stundas pēc nārstošanas paplāti izņem un oliņas savāc. Nārstošanas paplāte neļauj oliņas apēst zivīm un vienlaikus ļauj viegli savākt oliņas. Zivju grupai jābūt nārstojušai vismaz vienreiz pirms nārsta, no kura oliņas izmanto testā.
5–10 zivju tēviņus un mātītes tur atsevišķi vismaz divas nedēļas pirms paredzētā nārsta. Pēc 5–10 dienām mātīšu vēderiņi izstiepsies un kļūs redzamas ģenitālās kārpiņas. Zivju tēviņiem kārpiņu nav. Nārstošanu izdara nārstošanas tvertnēs, kas aprīkotas ar neīstu tīkla dibenu (kā aprakstīts iepriekš). Tvertne ir piepildīta ar atšķaidīšanas ūdeni tā, lai ūdens līmenis virs tīkla būtu 5–10 cm. Dienu pirms paredzētā nārsta vienu mātīti un divus tēviņus ievieto tvertnē. Ūdens temperatūru pakāpeniski paceļ vienu grādu augstāk par aklimatizācijas temperatūru. Gaismu izslēdz un tvertni atstāj cik iespējams netraucējot. No rīta ieslēdz vāju apgaismojumu, kas ierosina nārstošanu. Pēc 2–4 stundām zivis izņem un savāc oliņas. Ja vajadzīgas lielākas oliņu partijas, nekā var iegūt no vienas mātītes, tad paralēli var iekārtot pietiekami lielu nārstošanas tvertņu skaitu. Ja protokolē atsevišķu mātīšu vairošanās rezultātus pirms testa (partijas lielumu un kvalitāti), tad pavairošanai var izvēlēties mātītes ar labākajiem vairošanās rezultātiem.
Oliņas jāpārvieto testa traukos, izmantojot stikla caurulītes (iekšējais diametrs nav mazāks par 4 mm), kas aprīkotas ar lokanu sūkšanas baloniņu. Ūdens daudzumam, kas ir kopā ar oliņām, tās pārvietojot, jābūt iespējami mazam. Oliņas ir smagākas par ūdeni, un tās izplūst no caurulītes. Jāpievērš vērība, lai oliņas (un kāpuri) nesaskartos ar gaisu. Jāizdara partijas(-u) parauga(-u) apskate mikroskopā, lai pārliecinātos, ka pirmās attīstības stadijas norit normāli. Oliņu dezinfekcija nav atļauta.
Oliņu visaugstākā mirstība ir 24 pirmajās stundās pēc apaugļošanas. Minētajā laika posmā bieži ir novērojama 5–40 % mirstība. Oliņas deģenerējas neveiksmīgas apaugļošanas vai attīstības traucējumu dēļ. Šķiet, ka oliņu partijas kvalitāte ir atkarīga no mātītes, jo dažas mātītes pastāvīgi rada labas kvalitātes oliņas, bet citas nekad nerada. Arī attīstības un šķilšanās ātrums mainās no vienas partijas uz citu. Veiksmīgi apaugļotas oliņas un kāpuri dzeltenummaisa stadijā izdzīvo labi, parasti ap 90 %. 25 oC temperatūrā oliņas izšķilsies 3–5 dienas pēc apaugļošanas un dzeltenummaiss uzsūksies aptuveni 13 dienas pēc apaugļošanas.
Embrionālo attīstību labi ir raksturojis Hisaoka un Betls (2). Oliņu un izšķīlušos kāpuru caurspīdīguma dēļ var sekot zivju attīstībai un konstatēt attīstības defektus. Aptuveni četras stundas pēc nārsta neapaugļotās oliņas var atšķirt no apaugļotajām (3). Lai izdarītu šo apskati, oliņas un kāpurus ievieto maza tilpuma testa traukos un aplūko mikroskopā.
Testa apstākļi, kas izmantojami attīstības sākumstadijās, ir uzskaitīti 2. papildinājumā. Optimālie pH un atšķaidīšanas ūdens cietības lielumi attiecīgi ir 7,8 un 250 mg CaCO3/l.
APRĒĶINI UN STATISTIKA
Tiek piedāvāta divpakāpju pieeja. Vispirms statistiski analizē datus par mirstību, anomālu attīstību un izšķilšanās laiku. Pēc tam koncentrācijām, kurās nav konstatēta negatīva ietekme uz kādu no minētajiem parametriem, statistiski novērtē ķermeņa garumu. Šī pieeja ir ieteicama, jo toksiskā viela var selektīvi nogalināt mazākas zivis, aizkavēt šķilšanās laiku un izraisīt attīstības defektus, tā radot neobjektīvus garuma mērījumus. Turklāt būs aptuveni tas pats mērāmo zivju skaits uz vienu apstrādi, kas nodrošinās testa statistisko derīgumu.
LC50 UN EC50 NOTEIKŠANA
Tiek piedāvāta divpakāpju pieeja. Vispirms statistiski uz kontroles mēģinājuma mirstību saskaņā ar Ebota formulu (4):

kur:
|
P |
= |
koriģētais izdzīvotības %, |
|
P' |
= |
testa koncentrācijā novērotais izdzīvotības %, |
|
C |
= |
izdzīvotības % kontroles mēģinājumā. |
Ja iespējams, LC50 ar piemērotu metodi nosaka testa beigās.
Ja ir vēlams EC50 statistikā iekļaut morfoloģiskās anomālijas, norādījumus skatīt (5).
LOEC UN NOEC NOVĒRTĒŠANA
Oliņu un dzeltenummaisa stadijas testa mērķis ir salīdzināt koncentrācijas, kas nav nulles koncentrācijas, ar kontroli, t. i., noteikt LOEC. Tādēļ būtu jāizmanto vairākkārtīgas salīdzināšanas procedūras (6) (7) (8) (9) (10).
IZMANTOTĀ LITERATŪRA
(1) Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Fish Biol. 10, p. 121–173.
(2) Hisaoka K. K. and Battle H. I. (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio (Hamilton-Buchanan) J. Morph., 102, p. 311.
(3) Nagel R. (1986). Untersuchungen zur Eiproduktion beim Zebrab rbling (Brachydanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, p. 173–181.
(4) Finney D. J. (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, p. 1–333.
(5) Stephan C. E. (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment: Fifth Conference, ASTM STP 766, J. G. Pearson, R. B. Foster and W. E. Bishop, Eds., American Society for Testing and Materials, pp. 69–81.
(6) Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc., 50, p. 1096–1121.
(7) Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, p. 482–491.
(8) Williams D. A. (1971). A Test for Differences Between Treatment Means when Several Dose Levels are Compared with a Zero Dose Control. Biometrics, 27, p. 103–117.
(9) Williams D. A. (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, p. 519–531.
(10) Sokal R. R. and Rohlf F. J. (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W. H. Freeman and Co., San Francisco.
2. PAPILDINĀJUMS
TESTA APSTĀKĻI, ILGUMS UN IZDZĪVOTĪBAS KRITĒRIJI IETEICAMAJĀM SUGĀM
|
Sugas |
Temperatūra ( oC) |
Sāļums (0/00) |
Fotoperiods (stundas) |
Stadiju ilgums (dienas) |
Parastais testa ilgums |
Kontroles grupas izdzīvotība (minimālie %) |
||
|
embrija |
dzeltenummaisa |
izšķilšanās rezultāts |
pēc izšķilšanās |
|||||
|
SALDŪDENS |
||||||||
|
Brachydanio rerio Zebras zivs |
25 ± 1 |
— |
12–16 |
3–5 |
8–10 |
Iespējami drīz pēc apaugļošanas (gastrulas stadijas sākumā) līdz 5 dienām pēc izšķilšanās (8–10 dienas) |
80 |
90 |
|
Oncorhynchus mykiss Varavīksnes forele |
10 ± 1 (1) 12 ± 1 (2) |
— |
0 () |
30–35 |
25–30 |
Iespējami drīz pēc apaugļošanas (gastrulas stadijas sākumā) līdz 20 dienām pēc izšķilšanās (50–55 dienas) |
66 |
70 |
|
Cyprinus carpio Karpa |
21–25 |
— |
12–16 |
5 |
> 4 |
Iespējami drīz pēc apaugļošanas (gastrulas stadijas sākumā) līdz 4 dienām pēc izšķilšanās (8–9 dienas) |
80 |
75 |
|
Oryzias latipes Rīsa zivs/medaka |
24 ± 1 (1) 23 ± 1 (2) |
— |
12–16 |
8–11 |
4–8 |
Iespējami drīz pēc apaugļošanas (gastrulas stadijas sākumā) līdz 5 dienām pēc izšķilšanās (13–16 dienas) |
80 |
80 |
|
Pimephales promelas Resngalvas mailīte |
25 ± 2 |
— |
16 |
4–5 |
5 |
Iespējami drīz pēc apaugļošanas (gastrulas stadijas sākumā) līdz 4 dienām pēc izšķilšanās (8–9 dienas) |
60 |
70 |
|
(1) Embrijiem. (2) Kāpuriem. (3) Tumsa embrijiem un kāpuriem līdz vienai nedēļai pēc izšķilšanās, izņemot laiku, kad tos apskata. Pēc tam vājš apgaismojums visā testa laikā. |
||||||||
3. PAPILDINĀJUMS
Testa apstākļi, ilgums un izdzīvotības kritēriji citām labi dokumentētām sugām
|
SUGAS |
TEMPERATŪRA ( oC) |
SĀĻUMS (0/00) |
FOTOPERIODS (stundas) |
STADIJU ILGUMS (dienas) |
PARASTAIS TESTA ILGUMS EMBRIJIEM UN DZELTENUMMAISAM |
KONTROLES GRUPAS IZDZĪVOTĪBA (minimālie %) |
||
|
embrija |
dzeltenummaisa |
izšķilšanās rezultāts |
pēc izšķilšanās |
|||||
|
SALDŪDENS |
||||||||
|
Carassius auratus Sudrabainā karūsa |
24 ± 1 |
— |
— |
3–4 |
> 4 |
Iespējami drīz pēc apaugļošanas (gastrulas stadijas sākumā) līdz 4 dienām pēc izšķilšanās (7 dienas) |
— |
80 |
|
Leopomis macrochirus Asarveidīgo zivju suga |
21 ± 1 |
— |
16 |
3 |
> 4 |
Iespējami drīz pēc apaugļošanas (gastrulas stadijas sākumā) līdz 4 dienām pēc izšķilšanās (7 dienas) |
— |
75 |
|
SĀĻŪDENS |
||||||||
|
Menidia peninsulae Aterīnveidīgo zivju suga |
22–25 |
15–22 |
12 |
1,5 |
10 |
Iespējami drīz pēc apaugļošanas (gastrulas stadijas sākumā) līdz 5 dienām pēc izšķilšanās (6–7 dienas) |
80 |
60 |
|
Clupea harengus Atlantijas siļķe |
10 ± 1 |
8–15 |
12 |
20–25 |
3–5 |
Iespējami drīz pēc apaugļošanas (gastrulas stadijas sākumā) līdz 3 dienām pēc izšķilšanās (23–27 dienas) |
60 |
80 |
|
Gadus morhua Menca |
5 ± 1 |
5–30 |
12 |
14–16 |
3–5 |
Iespējami drīz pēc apaugļošanas (gastrulas stadijas sākumā) līdz 3 dienām pēc izšķilšanās (18 dienas) |
60 |
80 |
|
Cyprinodon variegatus Karpzobveidīgo zivju suga |
25 ± 1 |
15–30 |
12 |
— |
— |
Iespējami drīz pēc apaugļošanas (gastrulas stadijas sākumā) līdz 4/7 dienām pēc izšķilšanās (28 dienas) |
> 75 |
80 |
4. PAPILDINĀJUMS
PIEŅEMAMA ATŠĶAIDĪŠANAS ŪDENS DAŽAS ĶĪMISKĀS ĪPAŠĪBAS
|
VIELA |
KONCENTRĀCIJAS |
|
Daļiņas |
< 20 mg/l |
|
Kopējais organiskais ogleklis |
< 2 mg/l |
|
Nejonizēts amonjaks |
< 1 μg/l |
|
Atlikumu hlors |
< 10 μg/l |
|
Kopējie fosfororganiskie pesticīdi |
< 50 ng/l |
|
Kopējie hlororganiskie pesticīdi un polihlorbifenili |
< 50 ng/l |
|
Kopējais organiskais hlors |
< 25 ng/l |
C.16. MĀJAS BITES – AKŪTAS ORĀLĀS TOKSICITĀTES TESTS
1. METODE
Šis akūtās toksicitātes tests ir ESAO TG 213 (1998) kopija.
1.1. IEVADS
Šis toksicitātes tests ir laboratorijas metode, kas paredzēta augu aizsardzības līdzekļu un citu ķimikāliju orālās akūtās toksicitātes novērtēšanai pieaugušām darba mājas bitēm.
Vielu toksisko īpašību pārbaudei un novērtēšanai var būt vajadzīga akūtās orālās toksicitātes noteikšana mājas bitēm, piemēram, ja ir sagaidāma attiecīgās ķimikālijas iedarbība uz bitēm. Akūtās orālās toksicitātes testu izdara, lai noteiktu pesticīdu un citu ķimikāliju raksturīgo toksicitāti bitēm. Šā testa rezultāti būtu jāizmanto, lai noskaidrotu turpmākas izvērtēšanas vajadzību. Jo īpaši šo metodi var izmantot pakāpeniskās programmās, lai novērtētu pesticīdu apdraudējumu bitēm, pamatojoties uz secīgu virzību no toksicitātes testiem laboratorijā uz eksperimentiem daļējos lauka apstākļos un lauka apstākļos (1). Pesticīdus var testēt kā aktīvās vielas (a.v.) vai kā preparātus.
Lai pārbaudītu bišu jutību un testa procedūras precizitāti, jālieto toksicitātes standarts.
1.2. DEFINĪCIJAS
Akūtā orālā toksicitāte: negatīvās ietekmes, kas rodas, ilgākais, 96 stundu (h) laika posmā pēc testa vielas vienas devas perorālas ievadīšanas.
Deva: testa vielas patērētais daudzums. Devu izsaka kā testa vielas masu (μg) uz testa dzīvnieku (μg uz biti). Reālo devu katrai bitei nevar aprēķināt, jo bites baro kolektīvi, bet vidējo devu var novērtēt (kopā patērētā testa viela/testa bišu skaits vienā sprostā).
LD 50 (vidējā letālā deva), orālā: a statistiski aprēķināta vienreizēja vielas deva, kas, perorāli ievadot, var izraisīt 50 % dzīvnieku nāvi. LD50 lielumu izsaka testa vielas μg uz biti. Pesticīdiem testa viela var būt aktīvā viela (a.v.) vai preparāts, kas satur vienu vai vairākas aktīvās vielas.
Mirstība: dzīvnieku reģistrē kā mirušu, ja tas ir pilnīgi nekustīgs.
1.3. TESTA METODES PRINCIPS
Pieaugušas darba mājas bites (Apis mellifera) pakļauj saharozes šķīdumā disperģētas testa vielas devām noteiktā diapazonā. Pēc tam bites baro ar to pašu barību, kurā testa vielas nav. Mirstību protokolē reizi dienā vismaz 48 stundu laikā un salīdzina ar kontroles lielumiem. Ja mirstība starp 24. stundu un 48. stundu palielinās, bet kontroles grupā mirstība paliek pieņemamā līmenī, t. i., ≤ 10 %, ir lietderīgi pagarināt testa ilgumu maksimāli līdz 96 stundām. Rezultātus analizē, lai aprēķinātu LD50 24 stundās un 48 stundās un, ja pētījumu pagarina, 72 stundās un 96 stundās.
1.4. TESTA DERĪGUMS
Lai tests būtu derīgs, piemēro šādus nosacījumus:
— kontroles mēģinājuma kopējā dzīvnieku skaita vidējā mirstība testa beigās nedrīkst pārsniegt 10 %,
— toksicitātes standarta LD50 iekļaujas noteiktajā diapazonā.
1.5. TESTA METODES APRAKSTS
1.5.1. Bišu savākšana
Būtu jāizmanto jaunas, pieaugušas vienas rases darba bites, t. i., viena vecuma, vienāda barojuma utt. bites. Bites būtu jāiegūst no atbilstīgi barotas, veselīgas, iespējami brīvas no slimībām saimes, kurā ir bišu māte un kuras vēsture un fizioloģiskais stāvoklis ir zināms. Bites var savākt izmantošanas rītā vai pirmstesta vakarā un turēt testa apstākļos līdz nākamai dienai. Bites, kas savāktas no rāmīšiem bez periem, ir piemērotas. Būtu jāizvairās bites vākt agrā pavasarī vai vēlā rudenī, jo tajā laikā bišu fizioloģija ir mainījusies. Ja testi ir jāizdara agrā pavasarī vai vēlā rudenī, bites var izperināt inkubatorā un vienu nedēļu audzēt ar “bišu maizi” (ziedputekšņiem, kas savākti no kārēm) un saharozes šķīdumu. Bites, kas apstrādātas ar ķīmiskām vielām, piemēram, antibiotikām, pretvarozes preparātiem utt., nedrīkstētu izmantot toksicitātes testā četras nedēļas pēc pēdējās apstrādes beigām.
1.5.2. Turēšanas un barošanas apstākļi
Izmanto viegli tīrāmus un labi vēdināmus sprostus. Var izmantot jebkuru piemērotu materiālu, piemēram, nerūsējošo tēraudu, stiepļu sietu, plastmasas vai iznīcināmus koka sprostus utt. Vēlamas ir grupas pa 10 bitēm sprostā. Testa sprostu lielums būtu jāpiemēro bišu skaitam, t. i., jānodrošina pietiekami daudz vietas.
Bites eksperimenta telpā būtu jātur tumsā 25 ± 2 oC temperatūrā. Visā testa laikā būtu jāprotokolē relatīvais mitrums, normāli tas ir ap 50–70 %. Darbības ar bitēm, iekļaujot apstrādi un novērošanu, var izdarīt (dienas) gaismā. Barībai izmanto saharozes šķīdumu ūdenī ar galīgo koncentrāciju 500 g/l (50 % svars/tilpums). Pēc testa devu iedošanas barība būtu jāsniedz ad libitum. Barošanas sistēmai būtu jārada iespēja protokolēt barības patēriņu katrā sprostā (skatīt 1.6.3.1. pantu). Var izmantot stikla caurulīti (aptuveni 50 mm garu un 10 mm platu, kam vaļējais gals sašaurināts līdz apmēram 2 mm diametram).
1.5.3. Bišu sagatavošana
Savāktās bites pēc nejaušās izvēles izvieto testa sprostos, ko pēc nejaušās izvēles novieto eksperimenta telpā.
Pirms testa uzsākšanas bitēm var nedot barību līdz divām stundām. Ir ieteicams pirms vielas došanas bitēm nedot barību, lai testa sākumā visas bites būtu vienādas zarnu satura ziņā. Mirstošas bites pirms testa uzsākšanas būtu jābrāķē un jāaizstāj ar veselām.
1.5.4. Devu sagatavošana
Ja testa viela jaucas ar ūdeni, to var tieši izšķīdināt 50 % saharozes šķīdumā. Tehniskiem produktiem un vielām, kas slikti šķīst ūdenī, var izmanto tādus nesējus kā organisks šķīdinātājs, emulgatori vai disperģējošas vielas, kas ir maz toksiskas bitēm (piemēram, acetonu, dimetilformamīdu, dimetilsulfoksīdu). Nesēja koncentrācija ir atkarīga no testa vielas šķīdības, un palīglīdzekļa koncentrācijai jābūt vienādai visās testa koncentrācijās. Tomēr piemērota nesēja koncentrācija parasti ir 1 %, un to nedrīkstētu pārsniegt.
Jāpagatavo attiecīgi kontroles šķīdumi, t. i., ja testa vielas šķīdināšanai lieto šķīdinātāju vai disperģējošu vielu, jāizmanto divas atsevišķas kontroles šķīdumu grupas: šķīdums ūdenī un saharozes šķīdums ar šķīdinātāju/nesēju tādā pašā koncentrācijā kā testa šķīdumos.
1.6. PROCEDŪRA
1.6.1. Testa un kontroles grupas
Testēto devu un paralēlo mēģinājumu skaitam jāatbilst statistikas prasībām, lai noteiktu LD50 ar 95 % ticamības robežu. Parasti testam ir vajadzīgas piecas devas ģeometriskā rindā ar koeficientu, ne lielāku par 2,2, rindā iekļaujot LD50. Tomēr atšķaidīšanas koeficients un koncentrāciju skaits dozēšanai ir jānosaka attiecībā pret toksicitātes līknes slīpumu (deva pret mirstību) un jāņem vērā statistiskā metode, kas ir izraudzīta rezultātu analīzei. Izraudzīties dozēšanai piemērotas koncentrācijas var, izmantojot diapazona atrašanas testu.
Katra testa koncentrācija jādod vismaz trim paralēlām testa grupām ar 10 bitēm katrā grupā. Papildus testa rindām jāizdara mēģinājumi vismaz ar trim kontroles partijām pa 10 bitēm katrā. Kontroles partijas jāiekļauj arī lietotajiem šķīdinātājiem/nesējiem (skatīt 1.5.4. punktu).
1.6.2. Toksicitātes standarts
Testa rindā jāiekļauj toksicitātes standarts. Jāizvēlas vismaz trīs devas, iekļaujot sagaidāmo LD50 lielumu. Katrai testa devai jāizmanto vismaz trīs paralēlo mēģinājumu sprosti, katrs ar 10 bitēm. Vēlamais toksicitātes standarts ir dimetoāts, kuram protokolētā orālā LD50 – 24 h ir diapazonā 0,10–0,35 μg a.v. uz biti (2). Tomēr ir pieņemami citi toksicitātes standarti, ja pastāv pietiekams daudzums datu, lai pārbaudītu sagaidāmo devas/atbildes reakcijas sakarību (piemēram, parations).
1.6.3. Pakļaušana iedarbībai
1.6.3.1. Devu ievadīšana
Katrai testa bišu grupai jādod 100–200 μl 50 % saharozes šķīduma ūdenī, kas satur testa vielu attiecīgā koncentrācijā. Maz šķīstoši, maz toksiski izstrādājumi vai tādi, kas preparātā ir nelielā koncentrācijā, ir jādod lielākā tilpumā, jo ir jālieto lielāka daļa saharozes šķīduma. Apstrādātās barības daudzums, ko grupa patērējusi, pastāvīgi jāprotokolē. Pēc patērēšanas (parasti pēc 3–4 stundām) barošanas ierīce no sprosta jāaizvāc un jāaizstāj ar tādu, kas satur tikai saharozes šķīdumu. Saharozes šķīdumu pēc tam dod ad libitum. Dažu savienojumu gadījumā bites var atteikties no testa devas lielākām koncentrācijām, barību patērējot maz vai vispār nepatērējot. Vēlākais pēc sešām stundām nepatērētā apstrādātā barība jāaizstāj ar tīru saharozes šķīdumu. Patērētais apstrādātās barības daudzums jānovērtē (piemēram, izmērot palikušās apstrādātās barības tilpumu/svaru).
1.6.3.2. Ilgums
Vēlamais testa ilgums ir 48 stundas pēc testa šķīduma aizstāšanas ar tīru saharozes šķīdumu. Ja mirstība pēc pirmajām 24 stundām turpina palielināties vairāk nekā par 10 %, testa ilgums jāpagarina, ilgākais, līdz 96 stundām ar nosacījumu, ka kontroles grupas mirstība nepārsniedz 10 %.
1.6.4. Novērojumi
Mirstību protokolē četras stundas pēc testa sākuma un pēc tam pēc 24 un 48 stundām (t. i., pēc devas došanas). Ja ir vajadzīgs pagarināts novērošanas laika posms, turpmāki novērtējumi jāizdara 24 stundu intervālos ilgākais līdz 96 stundām ar nosacījumu, ka kontroles grupā mirstība nepārsniedz 10 %.
Jānovērtē grupas patērētās barības daudzums. Apstrādātās un neapstrādātās barības patēriņa salīdzinājums sešu stundu laikā var sniegt informāciju par apstrādātās barības garšīgumu.
Testa laikā novērota anomāla izturēšanās būtu jāprotokolē.
1.6.5. Pieļaujamā daudzuma tests
Dažos gadījumos (piemēram, ja ir sagaidāms, ka testa vielai būs neliela toksicitāte) var izdarīt pieļaujamā daudzuma testu, izmantojot 100 μg a.v. uz biti, lai parādītu, ka LD50 pārsniedz šo lielumu. Jāizmanto tā pati procedūra, iekļaujot trīs paralēlu testu grupas uz testa devu, attiecīgu kontroles mēģinājumu, patērētās apstrādātās barības daudzuma novērtēšanu un toksicitātes standarta izmantošanu. Ja mirstība parādās, jāizdara pilns pētījums. Ja novēro subletālas ietekmes (skatīt 1.6.4. punktu), tās jāprotokolē.
2. DATI UN TO NOFORMĒŠANA
2.1. DATI
Dati jāapkopo tabulā, katrai apstrādātai grupai, kā arī kontroles un toksicitātes standarta grupām parādot izmantoto bišu skaitu, mirstību katrā novērojumu izdarīšanas brīdī un bišu skaitu ar anomālu izturēšanos. Mirstības datus analizē ar piemērotām statistiskajām metodēm (piemēram, varbūtības vienību analīzi, slīdošo vidējo, binomiālo varbūtību) (3) (4). Grafiski atliek devas/atbildes reakcijas līknes katrā ieteicamajā novērojumu izdarīšanas brīdī un aprēķina līkņu slīpumus un vidējo letālo devu (LD50) ar 95 % ticamības robežu. Korekcijas uz kontroles grupas mirstību var izdarīt, izmantojot Ebota korekciju (4) (5). Ja apstrādātā barība nav pilnībā patērēta, jānosaka uz grupu patērētā testa vielas deva. LD50 jāizsaka testa vielas mikrogramos uz biti.
2.2. TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
2.2.1. Testa viela:
— fizikālais stāvoklis un attiecīgās fizikāli ķīmiskās īpašības (piemēram, stabilitāte ūdenī, tvaika spiediens),
— ķīmiskās identifikācijas dati, iekļaujot struktūrformulu, tīrību (t. i., pesticīdiem aktīvās(-o) vielas(-u) identitāti un koncentrāciju(-as)).
2.2.2. Testa suga:
— zinātniskais nosaukums, rase, aptuvens vecums (nedēļās), savākšanas metode, savākšanas datums,
— informācija par testa bišu savākšanai izmantotajām kolonijām, iekļaujot veselību, pieaugušo bišu slimības, iepriekšējo apstrādi utt.
2.2.3. Testa apstākļi:
— eksperimenta telpas temperatūra un relatīvais mitrums,
— turēšanas apstākļi, iekļaujot sprostu tipu, lielumu un materiālu,
— izejas šķīduma un testa šķīdumu pagatavošanas metode (ir jānorāda šķīdinātājs, ja to lieto, un tā koncentrācija),
— testa plāns, piemēram, izmantoto testa šķīdumu skaits un koncentrācijas, kontroles mēģinājumu skaits; katrai testa koncentrācijai un kontrolei – paralēlo mēģinājumu sprostu skaits un bišu skaits uz sprostu,
— testa datums.
2.2.4. Rezultāti:
— diapazona atrašanas priekšmēģinājuma rezultāti, ja tas izdarīts,
— izejas dati: mirstība pie katras testētās devas katrā novērojumu izdarīšanas brīdī,
— devas/atbildes reakcijas līknes grafiks testa beigās,
— LD50 lielumi ar 95 % ticamības robežu katrā no ieteicamajiem novērojumu izdarīšanas brīžiem testa vielai un toksicitātes standartam,
— statistiskās procedūras, kas izmantotas LD50 noteikšanai,
— mirstība kontroles mēģinājumos,
— citas novērotas vai izmērītas bioloģiskās ietekmes, piemēram, anomāla bišu izturēšanās (iekļaujot atteikšanos no testa devas), patērētās barības daudzums apstrādātās un neapstrādātās grupās,
— novirzes no šeit aprakstītās testa procedūras un cita būtiska informācija.
3. IZMANTOTĀ LITERATŪRA
(1) EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products – Honeybees. EPPO Bulletin, Vol. 23, N.1, p. 151–165. March 1993.
(2) Gough, H. J., McIndoe, E. C., Lewis, G. B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.) 1981-1992. Journal of Apicultural Research, 22,pp. 119–125.
(3) Litchfield, J. T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, p. 99–113.
(4) Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
(5) Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol., 18, p. 265–267.
C.17. MĀJAS BITES – AKŪTAS KONTAKTA TOKSICITĀTES TESTS
1. METODE
Šī akūtās toksicitātes testa metode ir ESAO TG 214 (1998) kopija.
1.1. IEVADS
Šis toksicitātes tests ir laboratorijas metode, kas paredzēta, lai novērtētu augu aizsardzības līdzekļu un citu ķimikāliju akūto kontakta toksicitāti pieaugušām darba bitēm.
Vielu toksisko īpašību pārbaudei un novērtēšanai var būt vajadzīga akūtās kontakta toksicitātes noteikšana mājas bitēm, piemēram, ja ir sagaidāma attiecīgās ķimikālijas iedarbība uz bitēm. Akūtās kontakta toksicitātes testu izdara, lai noteiktu pesticīdiem un citām ķimikālijām piemītošo toksicitāti bitēm. Šā testa rezultāti būtu jāizmanto, lai noskaidrotu, vai ir vajadzīga turpmāka izvērtēšana. Jo īpaši šo metodi var izmantot pakāpeniskās programmās, lai novērtētu pesticīdu apdraudējumu bitēm, pamatojoties uz secīgu virzību no toksicitātes testiem laboratorijā uz eksperimentiem daļējos lauka apstākļos un lauka apstākļos (1). Pesticīdus var testēt kā aktīvās vielas (a.v.) vai kā preparātus.
Lai pārbaudītu bišu jutību un testa procedūras precizitāti, jālieto toksicitātes standarts.
1.2. DEFINĪCIJAS
Akūta orālā toksicitāte: negatīvās ietekmes, kas rodas, ilgākais, 96 stundu laika posmā pēc testa vielas vienas devas lokālas pielietošanas.
Deva: testa vielas lietotais daudzums. Devu izsaka kā testa vielas masu (μg) uz testa dzīvnieku (μg uz biti).
LD 50 (vidējā letālā deva), kontakta: statistiski aprēķināta vienreizēja vielas deva, kas, kontakta ceļā ievadot, var izraisīt 50 % dzīvnieku nāvi. LD50 lielumu izsaka testa vielas μg uz biti. Pesticīdiem testa viela var būt aktīvā viela (a.v.) vai preparāts, kas satur vienu vai vairākas aktīvās vielas.
Mirstība: dzīvnieku protokolē kā mirušu, ja tas ir pilnīgi nekustīgs.
1.3. TESTA METODES PRINCIPS
Pieaugušas darba mājas bites (Apis mellifera) pakļauj piemērotā nesējā izšķīdinātas testa vielas iedarbībai, tieši pielietojot uz torakālās daļas (pilieniņu veidā). Testa ilgums ir 48 stundas. Ja mirstība palielinās starp 24 stundām un 48 stundām, bet kontroles mēģinājumā mirstība saglabājas pieņemamā līmenī, t. i., ≤ 10 %, ir lietderīgi paildzināt testu maksimāli līdz 96 stundām. Mirstību protokolē ik dienas un salīdzina ar lielumiem kontroles mēģinājumā. Rezultātus analizē, lai aprēķinātu LD50 pēc 24 stundām un pēc 48 stundām un paildzināta pētījuma gadījumā pēc 72 stundām un 96 stundām.
1.4. TESTA DERĪGUMS
Lai tests būtu derīgs, piemēro šādus nosacījumus:
— kontroles mēģinājuma kopējā dzīvnieku skaita vidējā mirstība testa beigās nedrīkst pārsniegt 10 %,
— toksicitātes standarta LD50 iekļaujas noteiktajā diapazonā.
1.5. TESTA METODES APRAKSTS
1.5.1. Bišu savākšana
Jāizmanto jaunas, pieaugušas darba bites, t. i., viena vecuma, vienāda barojuma, vienas rases utt. bites. Bites jāiegūst no atbilstīgi barotas, veselīgas, iespējami brīvas no slimībām saimes, kurā ir bišu māte un kuras vēsture un fizioloģiskais stāvoklis ir zināms. Bites var savākt izmantošanas rītā vai pirmstesta vakarā un turēt testa apstākļos līdz nākamajai dienai. Bites, kas savāktas no rāmīšiem bez periem, ir piemērotas. Jāizvairās bites vākt agrā pavasarī vai vēlā rudenī, jo tajā laika posmā bišu fizioloģija ir mainījusies. Ja testi ir jāizdara agrā pavasarī vai vēlā rudenī, bites var izperināt inkubatorā un vienu nedēļu audzēt ar “bišu maizi” (ziedputekšņiem, kas savākti no kārēm) un saharozes šķīdumu. Bites, kas apstrādātas ar ķīmiskām vielām, piemēram, antibiotikām, pretvarozes preparātiem utt., nedrīkst izmantot toksicitātes testā četras nedēļas pēc pēdējās apstrādes beigām.
1.5.2. Turēšanas un barošanas apstākļi
Izmanto viegli tīrāmus un labi vēdināmus sprostus. Var izmantot jebkuru piemērotu materiālu, piemēram, nerūsošo tēraudu, stiepļu sietu, plastmasu, iznīcināmus koka sprostus utt. Testa sprostiem būtu jābūt piemērotiem bišu skaitam, t.i., jānodrošina pietiekami daudz vietas. Vēlamas ir grupas pa 10 bitēm sprostā.
Bites eksperimenta telpā jātur tumsā 25 ± 2 oC temperatūrā. Visā testa laikā jāprotokolē relatīvais mitrums, normāli tas ir ap 50–70 %. Darbības ar bitēm, iekļaujot apstrādi un novērošanu, var izdarīt (dienas) gaismā. Barībai izmanto saharozes šķīdumu ūdenī ar galīgo koncentrāciju 500 g/l (50 % svars/tilpums) un testa laikā to nodrošina ad libitum, izmantojot bišu barošanas ierīci. Tā var būt stikla caurulīte (aptuveni 50 mm gara un 10 mm plata, kuras vaļējais gals ir sašaurināts līdz apmēram 2 mm diametrā).
1.5.3. Bišu sagatavošana
Lai pielietotu testa vielu, savāktajām bitēm var izdarīt anestēziju ar oglekļa dioksīdu vai slāpekli. Anestēzijas līdzekļa daudzumam un iedarbības laikam jābūt iespējami mazam. Mirstošas bites pirms testa sākšanas jābrāķē un jāaizstāj ar veselām.
1.5.4. Devu sagatavošana
Testa viela ir jādod bitēm nesējā, t. i., organiskā šķīdinātājā vai ūdens šķīdumā ar mitrinošu vielu. Kā organisks šķīdinātājs ir vēlams acetons, bet var lietot arī citus organiskos šķīdinātājus, kas bitēm ir maztoksiski (piemēram, dimetilformamīdu, dimetilsulfoksīdu). Ūdenī disperģētu preparātu un organiskajos šķīdinātājos nesējos nešķīstošu ļoti polāru organisko vielu šķīdumus var būt vieglāk lietot, ja tie ir sagatavoti komerciāla mitrinoša preparāta (piemēram, Agral, Cittowett, Lubrol, Triton, Tween) atšķaidītā šķīdumā.
Jāpagatavo attiecīgi kontroles šķīdumi, t. i., ja testa vielas šķīdināšanai lieto šķīdinātāju vai disperģējošu vielu, jāizmanto divas atsevišķas kontroles šķīdumu grupas, no kurām vienu apstrādā ar ūdeni un otru apstrādā ar šķīdinātāju/disperģētāju.
1.6. PROCEDŪRA
1.6.1. Testa un kontroles grupas
Testēto devu un paralēlo mēģinājumu skaitam jāatbilst statistikas prasībām, lai noteiktu LD50 ar 95 % ticamības robežu. Parasti testam ir vajadzīgas piecas devas ģeometriskā rindā ar koeficientu, ne lielāku par 2,2, iekļaujot LD50 diapazonu. Tomēr devu skaits ir jānosaka attiecībā pret toksicitātes līknes slīpumu (deva pret mirstību) un jāņem vērā statistiskā metode, kas ir izraudzīta rezultātu analīzei. Izraudzīties dozēšanai piemērotas koncentrācijas var, izmantojot diapazona atrašanas testu.
Katra testa koncentrācija jādod vismaz trim paralēlām testa grupām ar 10 bitēm katrā grupā.
Papildus testa rindām jāizdara mēģinājumi vismaz ar trim kontroles partijām pa 10 bitēm katrā. Ja lieto organisko šķīdinātāju vai mitrinošo vielu, ir jāiekļauj trīs papildu kontroles partijas pa 10 bitēm katrā – šķīdinātājam vai mitrinošajai vielai.
1.6.2. Toksicitātes standarts
Testa rindā ir jāiekļauj toksicitātes standarts. Jāizvēlas vismaz trīs devas, lai iekļautu sagaidāmo LD50 lielumu. Katrai testa devai jāizmanto vismaz trīs paralēlo mēģinājumu sprosti, no kuriem katrā ir 10 bites. Vēlamais toksicitātes standarts ir dimetoāts, kuram protokolētā kontakta LD50 – 24 h ir diapazonā 0,10–0,30 μg a.v. uz biti (2). Tomēr ir pieņemami citi toksicitātes standarti, ja pastāv pietiekams daudzums datu, lai pārbaudītu sagaidāmo devas sakarību ar atbildes reakciju (piemēram, parations).
1.6.3. Pakļaušana iedarbībai
1.6.3.1. Devu ievadīšana
Anestezētas bites apstrādā atsevišķi, vielu lietojot vietēji. Bitēm pēc nejaušās izvēles nozīmē dažādas testa devas un kontroli. Attiecīgas koncentrācijas šķīduma 1 μl ar mikroaplikatoru uzliek katras bites torakālās daļas muguras pusei. Ja tas ir pamatoti, var lietot citus tilpumus. Pēc šķīduma uzlikšanas bites ievieto testa sprostos un tām piegādā saharozes šķīdumus.
1.6.3.2. Ilgums
Vēlamais testa ilgums ir 48 stundas. Ja starp 24 stundām un 48 stundām mirstība palielinās vairāk nekā par 10 %, testa ilgums būtu jāpalielina līdz maksimāli 96 stundām ar nosacījumu, ka kontroles grupā mirstība nepārsniedz 10 %.
1.6.4. Novērojumi
Mirstību protokolē četras stundas pēc devas došanas un pēc tam 24 stundas un 48 stundas. Ja ir vajadzīgs pagarināts novērojumu laika posms, turpmāki novērtējumi jāizdara 24 stundu intervālos maksimāli līdz 96 stundām ar nosacījumu, ka kontroles grupā mirstība nav lielāka par 10 %.
Testa laikā novērota anomāla izturēšanās jāprotokolē.
1.6.5. Pieļaujamā daudzuma tests
Dažos gadījumos (piemēram, ja ir sagaidāms, ka testa vielai būs neliela toksicitāte) var izdarīt pieļaujamā daudzuma testu, izmantojot 100 μg a.v. uz biti, lai parādītu, ka LD50 pārsniedz šo lielumu. Jālieto tā pati procedūra, iekļaujot trīs paralēlas testa grupas testa devai, attiecīgo kontroles mēģinājumu un toksicitātes standartu. Ja mirstība parādās, jāizdara pilns pētījums. Ja novēro subletālas ietekmes (skatīt 1.6.4. punktu), tās jāprotokolē.
2. DATI UN TO NOFORMĒŠANA
2.1. DATI
Dati jāapkopo tabulā, parādot katrai apstrādātai grupai, kā arī kontroles un toksicitātes standarta grupām izmantoto bišu skaitu, mirstību katrā novērojumu izdarīšanas brīdī un bišu skaitu ar anomālu izturēšanos. Mirstības datus analizē ar piemērotām statistikas metodēm (piemēram, varbūtības vienības analīzi, slīdošo vidējo, binomiālo varbūtību) (3) (4). Katram ieteicamajam novērojumu izdarīšanas brīdim (t. i., 24 stundas, 48 stundas un attiecīgā gadījumā 72 stundas, 96 stundas) grafiski atliek devas attiecības pret atbildes reakciju līknes un aprēķina līkņu slīpumus un vidējo letālo devu (LD50) ar 95 % ticamības robežu. Korekcijas uz kontroles grupas mirstību var izdarīt, izmantojot Ebota korekciju (4) (5). LD50 jāizsaka testa vielas μg uz biti.
2.2. TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
2.2.1. Testa viela:
— fizikālais stāvoklis un fizikāli ķīmiskās īpašības (piemēram, stabilitāte ūdenī, tvaika spiediens),
— ķīmiskās identifikācijas dati, iekļaujot struktūrformulu, tīrību (t. i., pesticīdiem aktīvās(-o) vielas(-u) identitāti un koncentrāciju(-as)).
2.2.2. Testa suga:
— zinātniskais nosaukums, rase, aptuvens vecums (nedēļās), savākšanas metode, savākšanas datums,
— informācija par testa bišu savākšanai izmantotajām kolonijām, iekļaujot veselību, pieaugušo bišu slimības, iepriekšējo apstrādi utt.
2.2.3. Testa apstākļi:
— eksperimenta telpas temperatūra un relatīvais mitrums,
— turēšanas apstākļi, iekļaujot sprostu tipu, lielumu un materiālu,
— testa vielas lietošanas metodes, piemēram, lietotais nesējšķīdinātājs, bitei uzliktais testa šķīduma tilpums, lietotais anestēzijas līdzeklis,
— testa plāns, piemēram, izmantoto testa devu skaits un koncentrācijas, kontroles mēģinājumu skaits; katrai testa koncentrācijai un kontrolei paralēlo mēģinājumu sprostu skaits un bišu skaits sprostā,
— testa datums.
2.2.4. Rezultāti:
— diapazona atrašanas priekšmēģinājuma rezultāti, ja tas izdarīts,
— izejas dati: mirstība pie katras testētās koncentrācijas katrā novērojumu izdarīšanas brīdī,
— devas/atbildes reakcijas līknes grafika testa beigās,
— LD50 lielumi ar 95 % ticamības robežu katrā no ieteicamajiem novērojumu izdarīšanas brīžiem testa vielai un toksicitātes standartam,
— statistiskās procedūras, kas izmantotas LD50 noteikšanai,
— mirstība kontroles mēģinājumos,
— citas novērotas vai izmērītas bioloģiskas ietekmes un anomālas bišu atbildes reakcijas,
— novirzes no šeit aprakstītās testa procedūras un cita būtiska informācija.
3. IZMANTOTĀ LITERATŪRA
(1) EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products – Honeybees. EPPO bulletin, Vol. 23, N.1, p. 151–165. March 1993.
(2) Gough, H. J., McIndoe, E. C., Lewis, G. B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.), 1981–1992. Journal of Apicultural Research 22, p. 119–125.
(3) Litchfield, J. T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, p. 99–113.
(4) Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
(5) Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol. 18, p. 265–267.
C.18. ADSORBCIJA/DESORBCIJA AR KRATĪŠANAS METODI
1. METODE
Šī metode ir ESAO TG 106 kopija augsnes adsorbcijas/desorbcijas noteikšanai, izmantojot kratīšanas metodi (Batch Equilibrium Method) (2000).
1.1. IEVADS
Metode ņem vērā gredzena testu un semināru augsnes izvēlei adsorbcijas testa izveidei (1) (2) (3) (4) un arī esošās valsts līmeņa pamatnostādnes (5) (6) (7) (8) (9) (10) (11).
Adsorbcijas/desorbcijas pētījumi ir noderīgi būtiskas informācijas iegūšanai par ķimikāliju kustīgumu un sadalījumu augsnē, ūdenī un biosfēras gaisa nodalījumos (12) (13) (14) (15) (16) (17) (18) (19) (20) (21). Informāciju var izmantot, piemēram, lai paredzētu vai novērtētu ķimikālijas pieejamību noārdīšanai (22) (23), pārveidošanai un uzņemšanai organismos (24); izsālīšanai cauri augsnes profilam (16) (18) (19) (21) (25) (26) (27) (28); gaistamībai no augsnes (21) (29) (30); aizplūšanai no zemes virsmas dabiskajos ūdeņos (18) (31) (32). Adsorbcijas datus var izmantot salīdzināšanai un modelēšanai (19) (33) (34) (35).
Ķimikāliju sadalījuma veidošanās starp augsnes un ūdens fāzēm ir sarežģīts process, kas ir atkarīgs no vairākiem atšķirīgiem faktoriem: no vielas ķīmiskajām īpašībām (12) (36) (37) (38) (39) (40), augsnes īpašībām (4) (12) (13) (14) (41) (42) (43) (44) (45) (46) (47) (48) (49) un klimata faktoriem, piemēram, lietus, temperatūras, saules gaismas un vēja. Tādā kārtā daudzās parādības un mehānismi, kas ir iesaistīti ķimikālijas adsorbcijas procesos augsnē, nav pilnībā noskaidrojami ar vienkāršotu laboratorijas modeli, piemēram, ar šeit aprakstīto metodi. Tomēr, pat ja šo mēģinājumu nevar attiecināt uz visiem vidē iespējamiem gadījumiem, tas sniedz vērtīgu informāciju par vides saistību ar kādas ķimikālijas adsorbciju.
Skatīt arī vispārīgo ievadu.
1.2. DARBĪBAS JOMA
Metodes uzdevums ir noskaidrot vielas adsorbcijas/desorbcijas izturēšanos augsnē. Mērķis ir iegūt sorbcijas lielumu, ko varētu izmantot, lai paredzētu sadalījumu augsnē pie dažādiem vides apstākļiem; šajā nolūkā nosaka ķimikālijas līdzsvara adsorbcijas koeficientus dažādās augsnēs kā augsnes raksturlielumu (piemēram, organiskā oglekļa satura, mālu satura un augsnes struktūras un pH) funkciju. Lai iespējami plašāk ietvertu attiecīgās vielas savstarpējo iedarbību ar dabā sastopamajām augsnēm, ir jāizmanto dažādu tipu augsnes.
Šajā metodē adsorbcija ir ķimikālijas saistīšanās procesi ar augšņu virsmu; metode neatšķir dažādus adsorbcijas procesus (fizikālo un ķīmisko adsorbciju) un tādus procesus kā virsmas katalizēta noārdīšanās, adsorbcija tilpumā vai ķīmiskā reakcija. Adsorbciju, kas notiek uz augsnes veidotajām koloidālajām daļiņām (diametrs < 0,2 μm), neņem vērā.
Augsnes parametri, ko uzskata par adsorbcijai vissvarīgākajiem, ir: organiskā oglekļa saturs (3) (4) (12) (13) (14) (41) (43) (44) (45) (46) (47) (48); mālu saturs un augsnes struktūra (3) (4) (41) (42) (43) (44) (45) (46) (47) (48) un pH jonizējamiem savienojumiem (3) (4) (42). Citi augsnes parametri, kuri var ietekmēt konkrētas vielas adsorbciju/desorbciju, ir efektīvā katjonu apmaiņas spēja (EKAS), amorfo dzelzs un alumīnija oksīdu saturs, jo īpaši vulkāniskajās un tropu augsnēs, kā arī īpatnējā virsma (49).
Tests ir izstrādāts, lai novērtētu ķimikālijas adsorbciju uz dažādu tipu augsnēm ar dažādu organiskā oglekļa saturu, mālu saturu, augsnes struktūru un pH. Tas iekļauj trīs posmus.
1. posms: iepriekšēja izpēte, lai noteiktu:
— augsnes/šķīduma attiecību,
— adsorbcijas līdzsvara iestāšanās laiku un līdzsvara stāvoklī adsorbēto testa vielas daudzumu,
— testa vielas adsorbciju uz testa trauku virsmām un testa vielas stabilitāti testa laikā.
2. posms: skrīninga tests – adsorbciju pēta pieciem dažādiem augsnes tipiem ar adsorbcijas kinētiku vienai koncentrācijai un nosaka sadalījuma koeficientu Kd un Koc.
3. posms: Freindliha adsorbcijas izotermas noteikšana, lai noteiktu, kā koncentrācija ietekmē adsorbcijas pakāpi uz augsnēm.
Desorbcijas pētījums ar desorbcijas kinētikas/Freindliha desorbcijas izotermas noteikšanu (1. papildinājums).
1.3. DEFINĪCIJAS UN MĒRVIENĪBAS
|
Simbols |
Definīcija |
Vienības |
|
|
adsorbcijas procentuālais daudzums laika punktā ti |
% |
|
Aeq |
adsorbcijas procentuālais daudzums adsorbcijas līdzsvara stāvoklī |
% |
|
|
uz augsnes adsorbētās testa vielas masa laika punktā ti |
μg |
|
|
uz augsnes adsorbētās testa vielas masa laika intervālā Δti |
μg |
|
|
uz augsnes adsorbētās testa vielas masa adsorbcijas līdzsvara stāvoklī |
μg |
|
m0 |
testa vielas masa mēģenē adsorbcijas testa sākumā |
μg |
|
|
testa vielas masa alikvotā (
|
μg |
|
|
vielas masa šķīdumā adsorbcijas līdzsvara stāvoklī |
μg |
|
msoil |
augsnes fāzes daudzums, izteikts kā augsnes sausā masa |
g |
|
Cst |
vielas izejas šķīduma masas koncentrācija |
μg cm-3 |
|
C0 |
testa šķīduma sākotnējā masas koncentrācija saskarē ar augsni |
μg cm-3 |
|
|
vielas masas koncentrācija ūdens fāzē laika punktā ti, kad veic analīzi |
μg cm-3 |
|
|
uz augsnes adsorbētās vielas saturs adsorbcijas līdzsvara stāvoklī |
μg g-1 |
|
|
vielas masas koncentrācija ūdens fāzē adsorbcijas līdzsvara stāvoklī |
μg cm-3 |
|
V0 |
sākotnējais tilpums ūdens fāzei, kas adsorbcijas testa laikā saskaras ar augsni |
cm3 |
|
|
alikvota tilpums, kurā mēra testa vielu |
cm3 |
|
Kd |
adsorbcijas sadalījuma koeficients |
cm3 g-1 |
|
Koc |
organiskā oglekļa normalizētais adsorbcijas koeficients |
cm3 g-1 |
|
Kom |
organiskās vielas normalizētais sadalījuma koeficients |
cm3 g-1 |
|
|
Freindliha adsorbcijas koeficients |
μg 1-1/n (cm3) 1/n g-1 |
|
1/n |
Freindliha pakāpes rādītājs |
|
|
|
desorbcijas procentuālais daudzums laika punktā ti |
% |
|
|
desorbcijas procentuālais daudzums laika intervālā Δti |
% |
|
Kdes |
šķietamais desorbcijas koeficients |
cm3 g-1 |
|
|
Freindliha desorbcijas koeficients |
μg 1-1/n (cm3) 1/n g-1 |
|
|
no augsnes desorbētās testa vielas masa laika punktā ti |
μg |
|
|
no augsnes desorbētās testa vielas masa laika intervālā Δti |
μg |
|
|
analītiski noteiktā vielas masa ūdens fāzē desorbcijas līdzsvara stāvoklī |
μg |
|
|
testa vielas desorbētā kopējā masa līdzsvara stāvoklī |
μg |
|
|
testa vielas masa, kas palikusi adsorbēta uz augsnes pēc laika intervāla Δti |
μg |
|
|
vielas masa, kas nepilnīgas tilpuma aizvietošanas dēļ palikusi pēc adsorbcijas līdzsvara sasniegšanas |
μg |
|
|
testa vielas saturs, kas palikusi adsorbēta uz augsnes desorbcijas līdzsvara stāvoklī |
μg g-1 |
|
|
testa vielas masas koncentrācija ūdens fāzē desorbcijas līdzsvara stāvoklī |
μg cm-3 |
|
VT |
tilpums ūdens fāzei, kas saskaras ar augsni desorbcijas kinētikas eksperimenta laikā, ko izdara ar virknes metodi |
cm3 |
|
VR |
supernatanta tilpums, kas aizvadīts no mēģenes pēc adsorbcijas līdzsvara sasniegšanas un aizvietots ar tādu pašu 0,01 M CaCl2 tilpumu |
cm3 |
|
|
alikvota tilpums, kas desorbcijas eksperimenta laikā, kuru izdara ar virknes metodi, ņemts analīzei no laika punkta (i) |
cm3 |
|
|
Šķīduma tilpums, kas ņemts no mēģenes (i) testa vielas mērījumam desorbcijas kinētikas eksperimentā (paralēlā metode) |
cm3 |
|
|
šķīduma tilpums, kas ņemts no mēģenes testa vielas mērījumam desorbcijas līdzsvara stāvoklī |
cm3 |
|
MB |
masas bilance |
% |
|
mE |
testa vielas kopējā masa, kas ekstrahēta no augsnes un no testa trauka sieniņām divos posmos |
μg |
|
Vrec |
pēc adsorbcijas līdzsvara atgūtais supernatanta tilpums |
cm3 |
|
Pow |
sadalījuma koeficients sistēmā oktanols/ūdens |
|
|
pKa |
disociācijas konstante |
|
|
Sw |
šķīdība ūdenī |
g l-1 |
1.4. TESTA METODES PRINCIPS
Neiezīmētas vai radioaktīvi iezīmētas testa vielas šķīdumu 0,01 M kalcija hlorīdā zināmus tilpumus ar zināmām koncentrācijām pievieno augsnes paraugiem, kam ir zināma sausā masa un kas iepriekš ir sasnieguši līdzsvara stāvokli 0,01 M kalcija hlorīdā. Maisījumu atbilstīgu laiku krata. Augsnes suspensijas pēc tam atdala centrifugējot un, ja vēlas, filtrē un analizē ūdens fāzi. Uz augsnes parauga adsorbēto testa vielas daudzumu aprēķina kā starpību starp šķīdumā sākotnēji esošo testa vielas daudzumu un eksperimenta beigās palikušo daudzumu (netiešā metode).
Pēc izvēles adsorbēto testa vielas daudzumu var noteikt arī tiešā augsnes analīzē (tiešā metode). Pēdējā minētā procedūra, kas ietver ekstrakciju vairākos posmos ar atbilstīgu šķīdinātāju, ir ieteicama gadījumos, kad vielas šķīdumu koncentrāciju starpību nevar precīzi noteikt. Šādi gadījumi ir, piemēram: testa vielas adsorbcija uz testa trauku virsmas, testa vielas nestabilitāte eksperimenta laikā, vāja adsorbcija, kas noved tikai pie niecīgas šķīduma koncentrācijas maiņas; un stipra adsorbcija, kas noved pie mazas koncentrācijas, ko nevar precīzi noteikt. Ja izmanto radioaktīvi iezīmētu vielu, no augsnes ekstrahēšanas var izvairīties, pārpelnojot augsnes fāzi un analizējot ar šķidruma scintilācijas skaitītāju. Tomēr šķidruma scintilācijas skaitīšana ir nespecifiska metode, kas nevar atšķirt sākumproduktus un pārveidošanās produktus; tādēļ tā būtu jāizmanto tikai tad, ja testa ķimikālija ir stabila pētījuma laikā.
1.5. INFORMĀCIJA PAR TESTA VIELU
Reaktīviem jābūt analītiskas tīrības pakāpes. Ir ieteicams lietot neiezīmētās testa vielas ar zināmu uzbūvi un vēlams vismaz 95 % tīrību vai radioaktīvi iezīmētas testa vielas ar zināmu uzbūvi un radioaktīvi tīras. Marķiervielām ar īsu pussabrukšanas periodu jāpielieto korekcijas uz sabrukšanu.
Pirms adsorbcijas/desorbcijas testu izdarīšanas vajadzīga šāda informācija par testa vielu:
a) šķīdība ūdenī (A.6);
b) tvaika spiediens (A.4) vai Henrija likuma konstante;
c) abiotiska noārdīšanās: hidrolīze kā pH funkcija (C.7);
d) sadalījuma koeficients (A.8);
e) vieglā bionoārdīšanās (C.4), t. i., aerobā un anaerobā pārvēršanās augsnē;
f) jonizējamo vielu pKa;
g) tiešā fotolīze ūdenī (t. i., UV-Vis absorbcijas spektri ūdenī, kvantu iznākums) un fotonoārdīšanās uz augsnes.
1.6. TESTA PIEMĒROJAMĪBA
Tests ir piemērojams ķīmiskām vielām, kurām ir pieejama analītiska metode ar pietiekamu precizitāti. Svarīgs parametrs, kas var ietekmēt rezultātu ticamību, īpaši, ja rīkojas pēc netiešās metodes, ir testa vielas stabilitāte testa laika mērogā. Tāpēc priekšmēģinājumā ir obligāti jāpārbauda vielas stabilitāte; ja ir novērojama pārveidošanās testa laika mērogā, ir ieteicams galveno pētījumu veikt, analizējot gan augsnes, gan ūdens fāzes.
Grūtības var rasties, izdarot šo testu vielām ar mazu šķīdību ūdenī (Sw < 10–4 g l–1), kā arī stipri lādētām vielām, tādēļ, ka koncentrāciju ūdens fāzē nevar izmērīt ar pietiekamu analītisku precizitāti. Tādos gadījumos ir jāveic papildu pasākumi. Pamatnostādnes, kā rīkoties minēto problēmu gadījumā, ir dotas šīs metodes attiecīgās iedaļās.
Analizējot gaistošas vielas, ir jāpievērš uzmanība, lai izvairītos no zudumiem pētījuma laikā.
1.7. METODES APRAKSTS
1.7.1. Aprīkojums un ķīmiskie reaģenti
Laboratorijas standartaprīkojums, īpaši šāds:
a) mēģenes vai trauki eksperimentu veikšanai. Ir svarīgi, lai attiecīgās mēģenes vai trauki:
— precīzi atbilstu centrifūgai, lai samazinātu manipulāciju un pārneses kļūdas,
— būtu izgatavoti no inerta materiāla, kas līdz minimumam samazinātu testa vielas adsorbciju uz virsmas;
b) kratīšanas ierīce: vertikālais kratītājs vai līdzvērtīgs aprīkojums; kratīšanas ierīcei kratīšanas laikā jānotur augsne suspendētā stāvoklī;
c) centrifūga: vēlams, liela ātruma, piemēram, ar centrbēdzes spēku > 3 000 g, ar kontrolējamu temperatūru, tāda, kas var no ūdens šķīduma atdalīt daļiņas, kuru diametrs ir lielāks par 0,2 mikrometriem. Trauki kratīšanas un centrifugēšanas laikā jānoslēdz ar uzmavām, lai izvairītos no izgaišanas un ūdens zudumiem; lai līdz minimumam samazinātu adsorbciju uz uzmavām, jālieto deaktivētas uzmavas, piemēram, ar teflonu klātas uzskrūvējamas uzmavas;
d) nav obligāti: filtrēšanas ierīce; filtri ar 0,2 μm porainību, sterili, vienreizējas lietošanas. Īpaši jāpievērš uzmanība filtru materiāla izvēlei, lai izvairītos no testa vielas zudumiem uz tā; slikti šķīstošām testa vielām organiska materiāla filtri nav ieteicami;
e) analītiskie instrumenti, piemēroti testa ķimikālijas koncentrācijas mērīšanai;
f) žāvēšanas skapis, kas var uzturēt temperatūru 103 oC līdz 110 oC intervālā.
1.7.2. Augšņu raksturošana un izvēle
Augsnes jāraksturo ar trim parametriem, ko uzskata par tādiem, no kā lielā mērā atkarīga adsorbcijas spēja: organiskais ogleklis, mālu saturs un augsnes struktūra, pH. Kā jau minēts (skatīt “Darbības jomu”), citas augsnes fizikāli ķīmiskās īpašības var ietekmēt konkrētas vielas adsorbciju/desorbciju, un šādos gadījumos tās jāņem vērā.
Augsnes raksturošanai izmantojamās metodes ir ļoti svarīgas, un tās var ļoti nozīmīgi ietekmēt rezultātus. Tādēļ ir ieteicams augsnes pH mērīt 0,01 M CaCl2 šķīdumā (tas ir šķīdums, ko izmanto adsorbcijas/desorbcijas testos) saskaņā ar atbilstošo ISO metodi (ISO-10390-1). Ir arī ieteicams citas attiecīgās augsnes īpašības noteikt saskaņā ar standartmetodēm (piemēram, ISO Handbook of Soil Analysis); tas ļauj sorbcijas datu analīzi pamatot ar starptautiski standartizētiem augsnes parametriem. Dažas pamatnostādnes esošajām augsnes analīzes un raksturošanas standartmetodēm ir dotas (50)–(52). Augsnes testu metožu kalibrēšanai ir ieteicams izmanot standarta augsnes.
Pamatnostādnes adsorbcijas/desorbcijas eksperimentu augšņu izvēlei ir dotas 1. tabulā. Septiņas izraudzītās augsnes iekļauj augšņu tipus, kas ir sastopami mērenajās ģeogrāfiskajās joslās. Augsnēm, kas izraudzītas jonizējamām testa vielām, būtu jāiekļauj plašs pH diapazons, lai varētu novērtēt vielas adsorbciju jonizētajā un nejonizētajā formā. Pamatnostādnes, cik daudzas dažādas augsnes lietot dažādos testa posmos, ir dotas 1.9. punktā “Testa izpildīšana”.
Ja priekšroku dod citiem augšņu tipiem, tās jāraksturo ar vieniem un tiem pašiem parametriem un to īpašībām jāmainās līdzīgi, kā aprakstīts 1. tabulā, pat ja tās precīzi neatbilst attiecīgajiem kritērijiem.
1. tabula
Pamatnostādnes augsnes paraugu izvēlei adsorbcijai/desorbcijai
|
Augsnes tips |
pH diapazons (0,01 M CaCl2 šķīdumā) |
Organiskā oglekļa saturs (%) |
Mālu saturs (%) |
Augsnes struktūra (1) |
|
1 |
4,5—5,5 |
1,0—2,0 |
65–80 |
māli |
|
2 |
> 7,5 |
3,5—5,0 |
20–40 |
viegls māls |
|
3 |
5,5—7,0 |
1,5—3,0 |
15–25 |
viegls smilšmāls |
|
4 |
4,0—5,5 |
3,0—4,0 |
15–30 |
smilšmāls |
|
5 |
< 4,0—6,0 (2) |
< 10–15 (2) |
mālsmilts |
|
|
6 |
> 7,0 |
40–65 |
viegls māls/māls |
|
|
7 |
< 4,5 |
> 10 |
< 10 |
smilts/mālsmilts |
|
(1) Saskaņā ar FAO un ASV sistēmu (85). (2) Attiecīgos mainīgos lielumus būtu vēlams iekļaut norādītajā diapazonā. Ja tomēr rodas grūtības atrast piemērotu augsnes materiālu, ir pieļaujami lielumi, kas mazāki par norādīto minimumu. (3) Augsnes, kurās ir mazāk par 0,3 % organiskā oglekļa, var deformēt korelāciju starp organisko vielu saturu un adsorbciju. Tādēļ ir ieteicams izmantot augsnes ar minimālo organiskā oglekļa saturu 0,3 %. |
||||
1.7.3. Augsnes paraugu savākšana un glabāšana
1.7.3.1. Savākšana
Īpaša paraugu ņemšanas metode vai rīki nav ieteikti; paraugu ņemšanas metode ir atkarīga no pētījuma mērķa (53) (54) (55) (56) (57) (58).
Jāņem vērā sekojošais:
a) ir vajadzīga sīka informācija par lauka vēsturi; tā ietver atrašanās vietu, augu segu, apstrādi ar pesticīdiem un/vai mēslošanas līdzekļiem, bioloģiskās piedevas vai nejaušu piesārņojumu. Attiecībā uz paraugu ņemšanas vietu jāievēro ISO standarta par augsnes paraugu ņemšanu ieteikumi (ISO 10381-6);
b) paraugu ņemšanas vieta jādefinē ar UTM (Universal Transversal Mercator-Projection/European Horizontal Datum) koordinātām vai ģeogrāfiskajām koordinātām; tas varētu dot iespēju nākotnē no jauna savākt konkrētu augsni vai varētu palīdzēt definēt augsni atšķirīgās klasifikācijas sistēmās, ko lieto dažādās valstīs. Turklāt ir jāvāc tika A horizonts līdz 20 cm maksimālajam dziļumam. Īpaši ja Nr. 7 tipa augsnē kā augsnes daļa ir klāt horizonts Oh, tas jāiekļauj paraugā.
Augsnes paraugi jātransportē tādās tvertnēs un temperatūras apstākļos, kas garantē, ka augsnes sākotnējās īpašības jūtami nemainās.
1.7.3.2. Glabāšana
Priekšroka dodama augsnēm, kas tikko ņemtas no lauka. Vienīgi, ja tas nav iespējams, augsnes var glabāt apkārtējās vides temperatūrā, un tās jāglabā gaisa sausas. Glabāšanas laika ierobežojumi nav ieteikti, bet augsnes, kas glabātas ilgāk par trim gadiem, pirms lietošanas jāanalizē no jauna attiecībā uz organiskā oglekļa saturu, pH un katjonapmaiņas spēju.
1.7.3.3. Augsnes paraugu apstrāde un sagatavošana testam
Augsnes izžāvē gaisa sausas apkārtējās vides temperatūrā (vēlams 20–25 oC). Irdināšana jāizdara ar minimālu spēku, lai augsnes sākotnējā struktūra mainītos iespējami mazāk. Augsnes izsijā līdz daļiņu lielumam ≤ 2 mm. Attiecībā uz sijāšanas procesu jāievēro ISO standarta par augsnes paraugu ņemšanu ieteikumi (ISO 10381-6). Ir ieteicams augsni rūpīgi homogenizēt, jo tas uzlabo rezultātu atkārtojamību. Katras augsnes mitruma saturu nosaka trim alikvotiem, sildot 105 oC temperatūrā, līdz nemainīgam svaram (aptuveni 12 stundas). Visos aprēķinos augsnes masa attiecināma uz žāvēšanas skapī izžāvētu sausu masu, t. i., augsnes svaru koriģē uz mitruma saturu.
1.7.4. Testa vielas sagatavošana piemērošanai augsnē
Testa vielu izšķīdina 0,01 M CaCl2 šķīdumā destilētā vai dejonizētā ūdenī; CaCl2 šķīdumu izmanto kā ūdens šķīdinātāja fāzi, lai uzlabotu centrifugēšanu un līdz minimumam samazinātu katjonapmaiņu. Izejas šķīduma koncentrācijai vēlams būt par trim kārtas lielumiem lielākai par izmantojamās analītiskās metodes atklāšanas robežu. Šis slieksnis nodrošina precīzus mērījumus attiecībā uz šajā metodē izmantoto metodiku; turklāt izejas šķīduma koncentrācijai jābūt mazākai par testa vielas šķīdību ūdenī.
Izejas šķīdumu vēlams pagatavot tieši pirms lietošanas uz augsnes paraugiem, un tas jāglabā noslēgtā traukā tumsā 4 oC temperatūrā. Glabāšanas ilgums ir atkarīgs no testa vielas stabilitātes un tās koncentrācijas šķīdumā.
Vienīgi slikti šķīstošām vielām (Sw < 10–4 g l–1) var būt vajadzīgs piemērots šķīdību palielinošs reaģents, ja ir grūti izšķīdināt testa vielu. Šķīdību palielinošajam reaģentam: a) jājaucas ar ūdeni, piemēram, tas var būt metanols vai acetonitrils; b) tā daudzums nedrīkst būt lielāks par 1 % no izejas šķīduma kopējā tilpuma, un tam jāveido vēl mazāka daļa testa vielas šķīdumā, kurš saskarsies ar augsni (vēlams mazāk par 0,1 %); un c) nav jābūt virsmas aktīvam vai jāreaģē ar testa ķimikāliju solvolīzes reakcijās. Šķīdību palielinošā reaģenta izmantošana ir jāizvirza un jāpamato darba protokolā.
Cita alternatīva slikti šķīstošām vielām ir pievienot testa vielu testa sistēmai ar palīgšķīdinātāju: testa vielu izšķīdina organiskā šķīdinātājā, kura alikvotu pievieno sistēmai, ko veido augsne un 0,01 M CaCl2 šķīdums destilētā vai dejonizētā ūdenī. Organiskā šķīdinātāja saturam ūdens fāzē jābūt iespējami mazam, parasti ne lielākam par 0,1 %. Organiskā šķīduma piejaukšana var radīt sliktu tilpuma atkārtojamību. Tā var rasties papildu kļūda, jo testa vielas un palīgšķīdinātāja koncentrācija visos testos nebūs vienāda.
1.8. ADSORBCIJAS/DESORBCIJAS TESTA IZDARĪŠANAS PRIEKŠNOTEIKUMI
1.8.1. Analītiskā metode
Galvenie parametri, kas var ietekmēt sorbcijas mērījumu precizitāti, ir analītiskās metodes precizitāte šķīduma un adsorbētās fāzes analīzē, testa vielas stabilitāte un tīrība, sorbcijas līdzsvara sasniegšana, šķīduma koncentrācijas maiņas lielums, augsnes/šķīduma attiecība un augsnes struktūras pārmaiņas līdzsvara iestāšanās procesa laikā (35) (59)–(62). Daži piemēri, kas attiecas uz precizitātes jautājumiem, ir doti 2. papildinājumā.
Izmantojamās analītiskās metodes ticamība ir jāpārbauda koncentrāciju diapazonā, kāds sagaidāms testa laikā. Eksperimentators var brīvi izveidot piemērotu metodi ar piemērotu pareizību, precizitāti, atkārtojamību, atklāšanas robežām un nosakāmo daudzumu. Pamatnostādnes, kā izdarīt šādu testu, ir dotas turpmāk aprakstītajā eksperimentā.
Piemērotu 0,01 M CaCl2 tilpumu, piemēram, 100 cm3, krata četras stundas ar tādas augsnes iesvaru, piemēram, 20 g, kurai ir liela adsorbcijas spēja, t. i., liels organiskā oglekļa un mālu saturs; iesvarus un tilpumus var mainīt atkarībā no analītiskajām vajadzībām, bet augsnes/šķīduma attiecība 1:5 ir ērts sākuma punkts. Maisījumu centrifugē un ūdens fāzi var nofiltrēt. Ūdens fāzei pievieno noteiktu testa vielas izejas šķīduma tilpumu, lai sasniegtu nominālo koncentrāciju tajā koncentrāciju diapazonā, kāds sagaidāms testa laikā. Minētais tilpums nedrīkst pārsniegt 10 % no ūdens fāzes galīgā tilpuma, lai iespējami mazāk mainītu pirmslīdzsvara stāvokļa šķīduma īpašības. Šķīdumu analizē.
Lai izslēgtu metodes nejaušās kļūdas un augsnes radītos matricas efektus, ir jāiekļauj viens tukšais mēģinājums, kas sastāv no sistēmas: augsne + CaCl2 šķīdums (bez testa vielas).
Analītiskās metodes, ko var izmantot sorbcijas mērījumiem, iekļauj gāzu šķidruma hromatogrāfiju (GLC), augstas izšķiršanas šķidrumu hromatogrāfiju (HPLC), spektrometriju (piemēram, GC/masspektrometriju, HPLC/masspektrometriju) un šķidrumu scintilācijas skaitīšanu (radioaktīvi iezīmētām vielām). Neatkarīgi no izmantotās analītiskās metodes to uzskata par piemērotu, ja atgūtais daudzums ir starp 90 % un 110 % no nomināllieluma. Lai varētu izdarīt kvantitatīvo noteikšanu un novērtēšanu pēc sadalīšanas, analītiskās metodes atklāšanas robežām jābūt vismaz par diviem kārtas lielumiem mazākām par nominālo koncentrāciju.
Adsorbcijas pētījumiem pieejamās analītiskās metodes parametriem un atklāšanas robežām ir svarīga loma testa apstākļu definēšanā un visā testa eksperimenta izpildē. Šeit piedāvātā metode izklāsta vispārīgo eksperimenta gaitu un sniedz ieteikumus un pamatnostādnes alternatīviem risinājumiem, ja analītiskā metode un laboratorijas aprīkojums varētu uzlikt ierobežojumus.
1.8.2. Optimālas augsnes/šķīduma attiecības izvēle
Piemērotas augsnes attiecības pret šķīdumu izvēle sorbcijas pētījumiem ir atkarīga no sadalījuma koeficienta Kd un vēlamās relatīvās adsorbcijas pakāpes. Vielas koncentrācijas pārmaiņas šķīdumā nosaka mērījumu statistisko pareizību, kas pamatojas uz adsorbcijas vienādojuma formu un analītiskās metodikas robežām ķimikālijas koncentrāciju noteikšanā šķīdumā. Tāpēc vispārējā praksē ir lietderīgi noteikt dažas nemainīgas attiecības, kurām adsorbētais procentuālais daudzums ir virs 20 % un, vēlams, > 50 % (62), ievērojot, ka testa vielas koncentrācijai ūdens fāzē jābūt pietiekami augstai, lai to varētu precīzi izmērīt. Tas ir jo īpaši nozīmīgi liela adsorbcijas procentuālā daudzuma gadījumā.
Ērta pieeja piemērotas augsnes/ūdens attiecības izvēlei pamatojas uz Kd lielumu, kas noteikts priekšmēģinājumā vai ar izveidotu noteikšanas metodi (3. papildinājums). Piemērotu augsnes/ūdens attiecību pēc tam var izvēlēties no grafika, ko iegūst, atliekot augsnes/ūdens attiecību atkarībā no Kd konkrētiem adsorbcijas procentuālajiem daudzumiem (1. attēls). Šajā grafikā pieņem, ka adsorbcijas vienādojums ir lineārs ( 30 ). Pielietojamo sakarību iegūst, pārveidojot Kd 4. vienādojumu 1. vienādojuma veidā:
|
|
(1) |
vai logaritmiskā formā, pieņemot, ka R = msoil/V0 and Aeq %/100 =
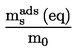
|
|
(2) |
1. attēls. Augsnes/šķīduma attiecības sakarība ar Kd pie dažādiem adsorbētās testa vielas procentuālajiem daudzumiem
1. attēls rāda vajadzīgās augsnes/šķīduma attiecības kā Kd funkciju dažādiem adsorbcijas līmeņiem. Piemēram, pie augsnes/šķīduma attiecības 1:5 un Kd = 20 adsorbēti ir aptuveni 80 %. Lai iegūtu 50 % adsorbciju pie tā paša Kd, ir jālieto 1:25 attiecība. Šī pieeja piemērotas augsnes/šķīduma attiecības izvēlei dod pētniekam iespēju elastīgi piemēroties eksperimenta vajadzībām.
Lielākas grūtības rodas, ja ķimikālijas adsorbējas stipri vai ļoti nedaudz. Ja adsorbcija ir niecīga, ir ieteicams izmantot augsnes/šķīduma attiecību 1:1, kaut arī dažiem ļoti organisku augšņu tipiem var būt vajadzīga mazāka attiecība, lai izveidotos dubļu putriņa. Jābūt uzmanīgiem ar analīzes metodiku, mērot mazas šķīduma koncentrācijas pārmaiņas; citādi adsorbcijas mērījumi būs nepareizi. No otras puses, pie ļoti lieliem sadalījuma koeficientiem Kd augsnes/šķīduma attiecību var palielināt līdz 1:100, lai šķīdumā paliktu nozīmīgs ķimikālijas daudzums. Tomēr jāpievērš uzmanība labas sajaukšanas nodrošināšanai un jādod sistēmai pietiekams laiks līdzsvara sasniegšanai. Alternatīva pieeja šiem galējiem gadījumiem, ja nav piemērotas analīzes metodikas, ir iepriekš novērtēt Kd lielumu, izmantojot aptuvenas novērtēšanas metodes, kas balstās, piemēram, uz Pow lielumiem (3. papildinājums). Tas jo īpaši var noderēt maz adsorbētām/polārām ķimikālijām ar Pow < 20 un lipofīlām/stipri adsorbējamām vielām ar Pow > 104.
1.9. TESTA IZPILDĪŠANA
1.9.1. Testa apstākļi
Visus eksperimentus izdara apkārtējās vides temperatūrā un, ja iespējams, nemainīgā temperatūrā starp 20 oC un 25 oC.
Centrifugēšanas apstākļiem jābūt tādiem, lai varētu atdalīt no šķīduma daļiņas, lielākas par 0,2 μm. Šis lielums atbilst mazākajai daļiņai, ko uzskata par cietu daļiņu, un tā ir robeža starp cietu un koloidālu daļiņu. Pamatnostādnes, kā noteikt centrifugēšanas apstākļus, ir dotas 4. papildinājumā.
Ja centrifugēšanas aprīkojums nevar nodrošināt atdalīšanu daļiņām, kas ir lielākas par 0,2 μm, var izmantot centrifugēšanas apvienojumu ar 0,2 μm filtriem. Filtriem jābūt izgatavotiem no piemērota inerta materiāla, lai izvairītos no testa vielas zudumiem uz filtriem. Katrā ziņā būtu jāpārbauda, vai filtrējot nerodas testa vielas zudumi.
1.9.2. Testa 1. posms – priekšmēģinājumi
Priekšmēģinājumu izdarīšanas mērķis jau ir dots iedaļā “Darbības joma”. Pamatnostādnes šāda testa izveidošanai ir dotas turpmāk piedāvātajā eksperimentā.
1.9.2.1. Optimālas augsnes/šķīduma attiecības izvēle
Izmanto divu tipu augsnes un trīs augsnes/šķīduma attiecības (seši eksperimenti). Viena tipa augsnē ir liels organiskā oglekļa saturs un mazs mālu saturs, un otrā augsnē ir mazs organiskā oglekļa saturs un liels mālu saturs. Ir ieteicamas šādas augsnes/šķīduma attiecības:
— 50 g augsnes un 50 cm3 testa vielas šķīduma ūdenī (attiecība 1:1),
— 10 g augsnes un 50 cm3 testa vielas šķīduma ūdenī (attiecība 1:5),
— 2 g augsnes un 50 cm3 testa vielas šķīduma ūdenī (attiecība 1:25),
Minimālais augsnes daudzums, ar ko var izdarīt eksperimentu, ir atkarīgs no laboratorijas aprīkojuma un izmantoto analītisko metožu efektivitātes. Tomēr ir ieteicams izmantot vismaz 1 g un, vēlams, 2 g, lai iegūtu ticamus testa rezultātus.
Vienu kontroles paraugu, kas satur tikai testa vielu 0,01 M CaCl2 šķīdumā (bez augsnes) pakļauj precīzi tiem pašiem posmiem kā testa sistēmas, lai pārbaudītu testa vielas stabilitāti CaCl2 šķīdumā un tās iespējamo adsorbciju uz testa trauku virsmām.
Tai pašai testa procedūrai pakļauj augsnes tukšo mēģinājumu ar to pašu augsnes daudzumu un 0,01 M CaCl2 šķīduma 50 cm3 kopējo tilpumu (bez testa vielas). Tas analīzē kalpo kā fona kontrole, lai noteiktu traucējošās vielas vai piesārņotas augsnes.
Visi eksperimenti, iekļaujot kontroles mēģinājumus un tukšos mēģinājumus, jāveic vismaz divas reizes. Pētījumam sagatavojamo paraugu kopējo skaitu var aprēķināt attiecībā uz izmantojamo metodiku.
Priekšmēģinājumu un galvenā pētījuma metodes pamatā ir vienas un tās pašas, izņēmumi attiecīgā gadījumā ir minēti.
Gaisa sausiem augsnes paraugiem ļauj sasniegt līdzsvara stāvokli, pirms eksperimenta dienas kratot visu nakti (12 stundas) ar vismaz 45 cm30,01 M CaCl2. Pēc tam pievieno testa vielas izejas šķīduma tilpumu, kāds vajadzīgs, lai sasniegtu galīgo tilpumu 50 cm3. Šis izejas šķīdumam pievienotais tilpums: a) nepārsniedz 10 % no ūdens fāzes 50 cm3 galīgā tilpuma, lai iespējami mazāk mainītu pirmslīdzsvara stāvokļa šķīduma īpašības; b) vēlams dot testa vielas, kas ir saskarē ar augsni, sākotnējo koncentrāciju (C0), kas ir vismaz par diviem kārtas lielumiem lielāka nekā analītiskās metodes atklāšanas robeža; šis ierobežojums nodrošina iespēju veikt pareizus mērījumus, pat ja notiek stipra adsorbcija (> 90 %), un vēlāk noteikt adsorbcijas izotermas. Ir arī ieteicams, ja tas ir iespējams, lai sākotnējā koncentrācija (C0) nepārsniegtu pusi no vielas šķīdības robežas.
Piemērs, kā aprēķināt izejas šķīduma koncentrāciju (Cst), ir dots turpmāk. Pieņem, ka atklāšanas robeža ir 0,01 μg cm–3 un adsorbcija 90 %; tādā veidā ar augsni saskarē esošās testa vielas sākotnējai koncentrācijai, vēlams būt 1 μg cm–3 (divus kārtas lielumus lielākai par atklāšanas robežu). Pieņemot, ka ir pievienots maksimālais ieteicamais izejas šķīduma tilpums, t. i., 5 cm3 pie 45 cm30,01 M CaCl2 šķīduma (= 10 % no izejas šķīduma 50 cm3 kopējā ūdens fāzes tilpuma), izejas šķīduma koncentrācijai jābūt 10 μg cm–3; tas ir par trim kārtas lielumiem vairāk par analītiskās metodes atklāšanas robežu.
Ūdens fāzes pH jāmēra pirms saskares ar augsni un pēc tam, jo tam ir liela nozīme visā adsorbcijas procesā, jo īpaši jonizējamām vielām.
Maisījumu krata, līdz ir sasniegts adsorbcijas līdzsvars. Līdzsvara iestāšanās laiks augsnēs ir ļoti atšķirīgs atkarībā no ķimikālijas un augsnes; 24 stundu laika posms parasti ir pietiekami ilgs (77). Priekšmēģinājumā paraugus var ņemt secīgi 48 maisīšanas stundu laikā (piemēram, pēc 4, 8, 24, 48 stundām). Tomēr analīzes laiks būtu jāapsver elastīgi, ievērojot laboratorijas darba grafiku.
Ir divas iespējas analizēt testa vielas ūdens šķīdumu: a) paralēlā metode un b) virknes metode. Ir jāuzsver, ka, kaut arī paralēlā metode eksperimentāli ir laika ietilpīgāka, rezultātu matemātiskā apstrāde ir vienkāršāka (5. papildinājums). Tomēr metodikas izvēle ir atstājama eksperimentatoram, kuram ir jāņem vērā laboratorijas aprīkojums un resursi.
a) Paralēlā metode: sagatavo tik daudz paraugus ar vienu un to pašu augsnes/šķīduma attiecību, cik ir laika intervālu, kuros vēlas pētīt adsorbcijas kinētiku. Pēc centrifugēšanas un, ja vēlas, filtrēšanas pirmās mēģenes ūdens fāzi iespējami pilnīgi atgūst un izmēra, piemēram, pēc 4 stundām, ar otrās mēģenes ūdens fāzi to dara pēc 8 stundām, ar trešās – pēc 24 stundām utt.;
b) virknes metode: katrai augsnes/šķīduma attiecībai sagatavo tikai vienu paraugu divos eksemplāros. Noteiktos laika intervālos maisījumu centrifugē, lai atdalītu fāzes. Nelielā ūdens fāzes alikvotā daļā tūlīt analizē testa vielu; pēc tam eksperimentu turpina ar sākotnējo maisījumu. Ja pēc centrifugēšanas izdara filtrēšanu, laboratorijai ir vajadzīgs aprīkojums mazu ūdens alikvotu filtrēšanai. Ir ieteicams, ka ņemto alikvotu tilpums kopā nepārsniedz 1 % no šķīduma kopējā tilpuma, lai būtiski nemainītos augsnes/šķīduma attiecība un lai nesamazinātu izšķīdušās vielas masu, kas testa laikā pieejama adsorbcijai.
Adsorbcijas procentuālo daudzumu
![]()
![]()
1.9.2.2. Adsorbcijas līdzsvara iestāšanās laika un līdzsvara stāvoklī adsorbētās testa vielas daudzuma noteikšana
Kā jau minēts,
![]()
vai
![]()
atkarības no laika grafiskais attēlojums ļauj noteikt adsorbcijas līdzsvara sasniegšanu un līdzsvara stāvoklī adsorbēto testa vielas daudzumu. 5. papildinājuma 1. un 2. attēls rāda šādu grafiku piemērus. Līdzsvara iestāšanās laiks ir laiks, kas sistēmai vajadzīgs, lai sasniegtu līdzsvaru.
Ja konkrētai augsnei nav konstatējams plato, bet vienmērīgs palielinājums, tā cēlonis var būt komplicējoši faktori, piemēram, bionoārdīšanās vai lēna difūzija. Bionoārdīšanos var pierādīt, atkārtojot eksperimentu ar sterilizētu augsnes paraugu. Ja pat šajā gadījumā nav sasniegts plato, eksperimentatoram būtu jāmeklē citas parādības, kas varētu būt iesaistītas konkrētajā pētījumā; to var izdarīt attiecīgi mainot eksperimenta apstākļus (temperatūru, kratīšanas laiku, augsnes/šķīduma attiecības). Eksperimentatoram ir jāizlemj, vai turpināt testa procedūru, neraugoties uz to, ka līdzsvara stāvokli, iespējams, nevarēs sasniegt.
1.9.2.3. Adsorbcija uz testa trauka virsmas un testa vielas stabilitāte
Daļēju informāciju par testa vielas adsorbciju uz testa trauku virsmas, kā arī par testa vielas stabilitāti var iegūt, analizējot kontroles paraugus. Ja ir novērojams samazinājums, lielāks par analītiskās metodes standarta kļūdu, varētu būt iesaistīta abiotiska noārdīšanās un/vai adsorbcija uz testa trauka virsmas. Abas šīs parādības var atšķirt, ja rūpīgi nomazgā trauka sienas ar zināmu tilpumu piemērota šķīdinātāja un mazgāšanas šķīdumā analizē testa vielu. Ja adsorbcija uz testa trauka virsmas nav novērota, samazinājums rāda testa vielas abiotisko nestabilitāti. Ja ir konstatēta adsorbēšanās, ir jāmaina testa trauku materiāls. Tomēr šajā eksperimentā iegūtos datus par adsorbciju uz testa trauku virsmas nevar tieši ekstrapolēt uz augsnes/šķīduma eksperimentu. Augsnes klātbūtne ietekmē šo adsorbciju.
Papildu informāciju par testa vielas stabilitāti var iegūt, nosakot masas bilanci atkarībā no laika. Tas nozīmē, ka testa vielu analizē ūdens fāzē, augsnes ekstraktos un uz testa trauku sienām. Starpība starp pievienotās testa vielas masu un testa vielas masu summu ūdens fāzē, augsnes ekstraktos un uz testa trauka sienām ir vienāda ar sadalījušās un/vai izgaisušās un/vai neekstrahētās vielas masu. Lai noteiktu masas bilanci, eksperimenta laikā jāsasniedz adsorbcijas līdzsvars.
Masas bilanci nosaka gan augsnēm, gan vienai augsnes/šķīduma attiecībai katrai augsnei, kas līdzsvara stāvoklī dod samazinājumu virs 20 % un, vēlams, > 50 %. Kad ar pēdējā ūdens fāzes parauga analīzi pēc 48 stundām ir pabeigts attiecības atrašanas eksperiments, fāzes atdala centrifugējot un, ja vēlas, filtrējot. Ūdens fāzi atgūst iespējami pilnīgi un augsnei pievieno piemērotu ekstrahēšanas šķīdinātāju (ekstrakcijas koeficients vismaz 95 %). Ieteicams izdarīt vismaz divas secīgas ekstrahēšanas. Nosaka testa vielas daudzumu augsnē un testa trauka ekstraktos un aprēķina masas bilanci (Dati un to noformēšana, vienādojums (10)). Ja tā ir mazāka par 90 %, uzskata, ka testa viela nav stabila testa laika mērogā. Tomēr pētījumu var turpināt, ja testa vielas nestabilitāti ņem vērā; šajā gadījumā ir ieteicams abas fāzes analizēt galvenajā pētījumā.
1.9.2.4. 2. posms – adsorbcijas kinētika pie vienas testa vielas koncentrācijas
Izmanto no 1. tabulas izraudzītas piecas augsnes. Ir izdevīgi šajās piecās augsnēs iekļaut dažas vai visas augsnes, kas attiecīgi izmantotas priekšmēģinājumos. Tādā gadījumā 2. posms nav jāatkārto augsnēm, kas izmantotas priekšmēģinājumos.
Līdzsvara iestāšanās laiku, augsnes/šķīduma attiecību, augsnes parauga svaru, ūdens fāzes, kas saskaras ar augsni, tilpumu un testa vielas koncentrāciju šķīdumā izvēlas, pamatojoties uz priekšmēģinājumu rezultātiem. Analīzi būtu vēlams izdarīt aptuveni pēc 2, 4, 6, 8 (ja iespējams, arī pēc 10) un 24 stundām saskares laika; kratīšanas laiku var pagarināt maksimāli līdz 48 stundām gadījumā, ja ķimikālijai vajadzīgs ilgāks laiks līdzsvara sasniegšanai, lai varētu iegūt attiecības noteikšanas rezultātus. Tomēr analīzes laiku var noteikt elastīgi.
Katru eksperimentu (viena augsne un viens šķīdums) izdara vismaz divos eksemplāros, lai varētu noteikt rezultātu dispersiju. Katrā eksperimentā izdara vienu tukšo mēģinājumu. Tas sastāv no augsnes un 0,01 M CaCl2 šķīduma bez testa vielas, un attiecīgais svars un tilpums ir identisks eksperimentā izmantotajam svaram un tilpumam. To pašu testa procedūru izdara ar testa vielu 0,01 M CaCl2 šķīdumā (bez augsnes), lai nodrošinātos pret nejaušību.
Adsorbcijas procentuālo daudzumu aprēķina katrā laika punktā
![]()
![]()
Adsorbcijas kinētikas testa rezultāti
Lineārais Kd lielums parasti ir precīzs sorbcijas aprakstīšanai augsnē (35) (78), un tas raksturo ķimikālijām piemītošo kustīgumu augsnē. Piemēram, parasti ķimikālijas ar Kd ≤ 1 cm3 g-1 uzskata par kvalitatīvi kustīgām. Līdzīgi kustīguma klasifikācijas shēmu, kas pamatojas uz Koc lielumiem, ir izveidojis Makols et al. (16). Turklāt pastāv izskalošanas klasifikācijas shēmas, kas pamatojas uz attiecību starp Koc un DT-50 ( 32 ) (32) (79).
Saskaņā ar kļūdu analīzes pētījumu (61) Kd lielumus, kas ir mazāki par 0,3 cm3 g–1, no koncentrācijas samazinājuma ūdens fāzē pareizi noteikt nevar, pat ja izmanto vislabāko (no rezultātu precizitātes viedokļa) augsnes/šķīduma attiecību, t. i., 1:1. Tādā gadījumā ir ieteicams analizēt abas fāzes – augsni un šķīdumu.
Attiecībā uz iepriekšminētajām piezīmēm ir ieteicams turpināt ķimikālijas adsorbcijas augsnē un ķimikālijas potenciālā kustīguma pētījumu, nosakot Freindliha adsorbcijas izotermas tām sistēmām, kurām ir iespējams pareizi noteikt Kd, ievērojot šīs testa metodes eksperimenta protokolu. Pareiza noteikšana ir iespējama, ja Kd reizinājuma ar augsnes/šķīduma attiecību lielums ir > 0,3 gadījumā, ja mērījumi pamatojas uz koncentrācijas samazināšanos ūdens fāzē (netiešā metode), vai reizinājuma lielums ir > 0,1 gadījumā, ja analizē abas fāzes (tiešā metode) (61).
1.9.2.5. Testa 3. posms – adsorbcijas izotermas un desorbcijas kinētika/desorbcijas izotermas
1.9.2.5.1.
Izmanto piecas testa vielas koncentrācijas, kas, vēlams, iekļauj divus kārtas lielumus; izvēloties šīs koncentrācijas, ir jāņem vērā vielas šķīdība ūdenī un no tās izrietošās ūdens šķīduma koncentrācijas līdzsvara stāvoklī. Visā pētījumā jāsaglabā viena un tā pati augsnes/šķīduma attiecība katrai augsnei. Adsorbcijas testu izdara, kā aprakstīts iepriekš, vienīgā atšķirība ir, ka ūdens fāze ir 2. posmā. Nosaka līdzsvara koncentrācijas šķīdumā un adsorbēto daudzumu aprēķina no testa vielas samazinājuma šķīdumā vai ar tiešo metodi. Adsorbēto masu uz augsnes masas vienību atliek grafiski kā testa vielas līdzsvara koncentrācijas funkciju (skatīt “Dati un to noformēšana”).
Adsorbcijas izotermu eksperimenta rezultāti
No matemātiskajiem adsorbcijas modeļiem, kas līdz šim ir piedāvāti, Freindliha adsorbcijas izotermu adsorbcijas procesa aprakstīšanai lieto visbiežāk. Sīkāk izstrādāta informācija par adsorbcijas modeļu interpretāciju un to svarīgumu ir sniegta (41), (45), (80), (81), (82).
Piezīme: jāuzsver, ka KF (Freindliha adsorbcijas koeficientu) lielumu salīdzināšana dažādām vielām ir iespējama tikai tad, ja KF lielumi ir izteikti vienās un tajās pašās vienībās (83).
1.9.2.5.2.
Šā eksperimenta mērķis ir izpētīt, vai ķimikālija uz augsnes adsorbējas atgriezeniski vai neatgriezeniski. Šī informācija ir svarīga, jo desorbcijas procesam arī ir liela nozīme attiecībā uz ķimikālijas izturēšanos augsnē lauka apstākļos. Turklāt desorbcijas dati ir noderīgi ieejas dati izskalošanās modelēšanā ar datoru un izšķīdušās vielas aizplūšanas simulēšanā ar datoru. Ja vēlas izdarīt desorbcijas pētījumu, ir ieteicams turpmāk aprakstīto pētījumu izdarīt katrai sistēmai, kurai iepriekšējā adsorbcijas kinētikas eksperimentā ir bijusi iespējama pareiza Kd noteikšana.
Tāpat kā adsorbcijas kinētikas pētījumā ir divas iespējas izdarīt arī desorbcijas kinētikas eksperimentu: a) paralēlā metode un b) virknes metode. Tomēr metodikas izvēle ir atstājama eksperimentatoram, kuram ir jāņem vērā pieejamais laboratorijas aprīkojums un resursi.
a) Paralēlā metode: katrai augsnei, kas ir izraudzīta desorbcijas pētījuma veikšanai, sagatavo tik daudzus paraugus ar vienu un to pašu augsnes/šķīduma attiecību, cik ir laika intervālu, kuros grib pētīt desorbcijas kinētiku. Vēlams izmanto tos pašus laika intervālus kā adsorbcijas kinētikas eksperimentā; tomēr kopējo laiku var pēc vajadzības pagarināt, lai sistēma sasniegtu desorbcijas līdzsvaru. Katrā eksperimentā (viena augsne, viens šķīdums) izdara tukšo mēģinājumu. Tas sastāv no augsnes un 0,01 M CaCl2 šķīduma bez testa vielas, un attiecīgais svars un tilpums ir identisks eksperimentā izmantotajam svaram un tilpumam. Ar testa vielu 0,01 M CaCl2 šķīdumā (bez augsnes) kā ar kontroles paraugu izdara to pašu testa procedūru. Visus augsnes maisījumus ar šķīdumu krata līdz adsorbcijas līdzsvara sasniegšanai (kā noteikts iepriekš 2. posmā). Pēc tam fāzes atdala centrifugējot un ūdens fāzes, cik iespējams, aizvada. Aizvadīto šķīduma tilpumu aizvieto ar tādu pašu 0,01 M CaCl2 tilpumu bez testa vielas un jaunos maisījumus atkal krata. Pirmās mēģenes ūdens fāzi iespējami pilnīgi atgūst un izmēra, piemēram, pēc divām stundām, otrās mēģenes ūdens fāzi – pēc četrām stundām, trešās – pēc sešām stundām utt., līdz ir sasniegts desorbcijas līdzsvars.
b) Virknes metode: pēc adsorbcijas kinētikas eksperimenta maisījumu centrifugē un ūdens fāzi iespējami pilnīgi aizvada. Aizvadīto šķīduma tilpumu aizvieto ar tādu pašu 0,01 M CaCl2 šķīduma tilpumu bez testa vielas. Jauno maisījumu krata, līdz ir sasniegts desorbcijas līdzsvars. Šajā laika posmā noteiktos laika intervālos maisījumu centrifugē, lai atdalītu fāzes. Nelielā ūdens fāzes alikvotā tūlīt analizē testa vielu; pēc tam eksperimentu turpina ar sākotnējo maisījumu. Katra atsevišķā alikvota tilpumam jābūt mazākam par 1 % no kopējā tilpuma. Lai saglabātu to pašu augsnes/šķīduma attiecību, maisījumam pievieno tādu pašu daudzumu svaiga 0,01 M CaCl2 šķīduma un turpina kratīt līdz nākošajam laika intervālam.
Desorbcijas procentuālo daudzumu aprēķina katrā laika punktā
![]()
![]()
Desorbcijas kinētikas eksperimenta rezultāti
Kopējā grafikā atlikts desorbcijas procentuālais daudzums
![]()
un adsorbcijas procentuālais daudzums
![]()
atkarībā no laika ļauj novērtēt adsorbcijas procesa atgriezeniskumu. Ja desorbcijas līdzsvars tiek sasniegts pat divreiz ilgākā laikā nekā adsorbcijas līdzsvars un ja kopējā desorbcija ir vairāk par 75 % no adsorbētā daudzuma, adsorbciju uzskata par atgriezenisku.
1.9.2.5.3.
Freindliha desorbcijas izotermas nosaka augsnēm, kas izmantotas adsorbcijas izotermu eksperimentā. Desorbcijas testu izdara, kā aprakstīts iedaļā “Desorbcijas kinētika” ar vienīgo atšķirību, ka ūdens fāzi analizē tikai vienreiz desorbcijas līdzsvara stāvoklī. Aprēķina desorbētās testa vielas daudzumu. Testa vielas saturu, kas palicis adsorbēts uz augsnes desorbcijas līdzsvara stāvoklī, atliek grafikā kā testa vielas līdzsvara koncentrācijas šķīdumā funkciju (skatīt “Dati un to noformēšana” un 5. papildinājumu).
2. DATI UN TO NOFORMĒŠANA
Analīzes datus noformē tabulas veidā (skatīt 6. papildinājumu). Uzdod atsevišķus mērījumus un aprēķinātos vidējos lielumus. Adsorbcijas izotermas sniedz grafikas noformējumā. Aprēķinus izdara, kā aprakstīts turpmāk.
Testa nolūkiem uzskata, ka 1 cm3 ūdens šķīduma masa ir 1 g. Augsnes/šķīduma attiecību svars/svars vai svars/tilpums vienībās var izteikt ar vienu un to pašu skaitli.
2.1. ADSORBCIJA
Adsorbciju
![]()
![]()
|
|
(3) |
kur:
|
|
= |
adsorbcijas procentuālais daudzums laika punktā ti (%), |
|
|
= |
uz augsnes adsorbētās testa vielas masa laika punktā ti (μg), |
|
m0 |
= |
testa vielas masa mēģenē testa sākumā (μg). |
Sīkāk izstrādāta informācija, kā aprēķināt adsorbcijas procentuālo daudzumu
![]()
paralēlajai un virknes metodei, ir dota 5. papildinājumā.
Sadalījuma koeficients Kd ir attiecība starp vielas saturu augsnes fāzē un vielas masas koncentrāciju ūdens šķīdumā testa apstākļos, kad sasniegts adsorbcijas līdzsvars.
|
|
(4) |
kur:
|
|
= |
uz augsnes adsorbētās vielas saturs adsorbcijas līdzsvara stāvoklī (μg g-1), |
|
|
= |
vielas masas koncentrācija ūdens fāzē adsorbcijas līdzsvara stāvoklī (μg cm-3). Koncentrāciju analītiski nosaka, ņemot vērā tukšajos mēģinājumos iegūtos lielumus; |
|
|
= |
uz augsnes adsorbētās vielas masa adsorbcijas līdzsvara stāvoklī (μg), |
|
|
= |
vielas masa šķīdumā adsorbcijas līdzsvara stāvoklī (μg), |
|
msoil |
= |
augsnes fāzes daudzums, izteikts kā augsnes sausā masa (g), |
|
V0 |
= |
ūdens fāzes sākotnējais tilpums (cm3), kas saskaras ar augsni. |
Sakarību starp Aeq un Kd izrēķina no vienādojuma:
|
|
(5) |
kur:
|
Aeq |
= |
adsorbcijas procentuālais daudzums adsorbcijas līdzsvara stāvoklī %. |
Organiskā oglekļa normalizētais adsorbcijas koeficients Koc saista sadalījuma koeficientu Kd ar organiskā oglekļa saturu augsnes paraugā
|
|
(6) |
kur:
|
%OC |
= |
organiskā oglekļa procentuālais daudzums augsnes paraugā (g g-1). |
Koeficients Koc ir vienīgas lielums, kas raksturo galvenokārt nepolāru organisko ķimikāliju sadalījumu starp organisko oglekli augsnē vai nogulumos un ūdenī. Šo ķimikāliju adsorbcijas korelē ar sorbējošās cietās vielas organisko vielu saturu (7); tādējādi Koc lielumi ir atkarīgi no specifiskajām īpašībām, kas piemīt humusa frakcijām, kuru sorbcijas spēja izcelsmes, izveidošanās u. c. atšķirību dēļ ir ievērojami atšķirīga.
2.1.1. Adsorbcijas izotermas
Freindliha adsorbcijas izotermas vienādojums saista testa vielas adsorbēto daudzumu ar testa vielas koncentrāciju šķīdumā līdzsvara stāvoklī (8. vienādojums).
Datus apstrādā, kā aprakstīts iedaļā “Adsorbcija”, un katrai mēģenei aprēķina testa vielas daudzumu, kas adsorbēts uz augsnes pēc adsorbcijas testa (
![]()
, citur apzīmēts kā x/m). Pieņem, ka līdzsvars ir sasniegts un ka
![]()
ir lielums līdzsvara stāvoklī:
|
|
(7) |
Freindliha adsorbcijas vienādojums ir 8. vienādojums:
|
|
(8) |
vai lineārā veidā:
|
|
(9) |
kur:
|
|
= |
Freindliha adsorbcijas koeficients; tā dimensija ir cm3 g-1 tikai, ja 1/n = 1; visos citos gadījumos dimensijā
|
|
n |
= |
regresijas konstante; 1/n parasti ir diapazonā no 0,7 līdz 1,0, kas norāda, ka sorbcijas dati bieži ir nedaudz nelineāri. |
8. un 9. vienādojumu attēlo grafiski un, izmantojot 9. vienādojumu, ar regresijas analīzi aprēķina
![]()

2. attēls. Freindliha adsorbcijas grafiskais attēls, parastais un linearizētais
2.1.2. Masas bilance
Masas bilanci (MB) definē kā vielas procentuālo daudzumu, ko var analītiski atgūt pēc adsorbcijas testa, attiecībā pret vielas nominālo daudzumu testa sākumā.
Datu apstrāde ir atšķirīga, ja šķīdinātājs pilnībā jaucas ar ūdeni. Ja šķīdinātājs jaucas ar ūdeni, var izmantot datu apstrādi, kas aprakstīta iedaļā “Desorbcija”, lai noteiktu ar šķīdinātāja ekstrahēšanu atgūto vielas daudzumu. Ja šķīdinātājs mazāk jaucas ar ūdeni, atgūtais daudzums ir jānosaka.
Adsorbcijas masas bilanci MB aprēķina šādi: pieņem, ka apzīmējums (mE) atbilst no augsnes un no testa trauka virsmas ar organisko šķīdinātāju ekstrahētās testa ķimikālijas masu summai
|
|
(10) |
kur:
|
MB |
= |
masas bilance (%), |
|
mE |
= |
testa vielas kopējā masa, kas ekstrahēta no augsnes un no testa trauka sienām divos posmos (μg), |
|
C0 |
= |
testa šķīduma, kas saskaras ar augsni, sākotnējā masas koncentrācija (μg cm-3), |
|
Vrec |
= |
pēc adsorbcijas līdzsvara iestāšanās atgūtais supernatanta tilpums (cm-3). |
2.2. DESORBCIJA
Desorbcija (D) definēta kā desorbētais testa vielas procentuālais daudzums attiecībā pret iepriekš adsorbēto vielas daudzumu testa apstākļos:
|
|
(11) |
kur:
|
|
= |
desorbcijas procentuālais daudzums laika punktā ti (%), |
|
|
= |
no augsnes desorbētās testa vielas masa laika punktā ti (μg), |
|
|
= |
no augsnes desorbētās vielas masa adsorbcijas līdzsvara stāvoklī (μg). |
Sīkāk izstrādāta informācija, kā aprēķināt desorbcijas procentuālo daudzumu
![]()
paralēlajai un virknes metodei, ir dota 5. papildinājumā.
Šķietamais desorbcijas koeficients Kdes ir attiecība starp augsnes fāzē palikušās vielas saturu un desorbētās vielas masas koncentrāciju ūdens šķīdumā, kad sasniegts desorbcijas līdzsvars:
|
|
(12) |
kur:
|
Kdes |
= |
desorbcijas koeficients (cm3 g-1), |
|
|
= |
no augsnes desorbētās testa vielas kopējā masa desorbcijas līdzsvara stāvoklī (μg), |
|
VT |
= |
kopējais tilpums ūdens fāzei, kas desorbcijas kinētikas testa laikā saskaras ar augsni (cm3). |
Pamatnostādnes
![]()
aprēķināšanai ir dotas 5. papildinājumā iedaļā “Desorbcija”.
Piezīme
Ja iepriekš izdarītais adsorbcijas tests ir bijis veikts ar paralēlo metodi, uzskata, ka 12. vienādojumā tilpums VT ir vienāds ar V0.
2.2.1. Desorbcijas izotermas
Freindliha desorbcijas izotermas vienādojums saista testa vielas daudzumu, kas palicis adsorbēts uz augsnes, ar testa vielas koncentrāciju šķīdumā desorbcijas līdzsvara stāvoklī (16. vienādojums).
Katrai mēģenei vielas saturu, kas palicis adsorbēts uz augsnes desorbcijas līdzsvara stāvoklī, aprēķina šādi:
|
|
(13) |
![]()
definē kā:
|
|
(14) |
kur:
|
|
= |
testa vielas saturs, kas palicis adsorbēts uz augsnes desorbcijas līdzsvara stāvoklī (μg g-1), |
|
|
= |
analītiski noteiktā vielas masa ūdens fāzē desorbcijas līdzsvara stāvoklī (μg), |
|
|
= |
testa vielas masa, kas palikusi pēc adsorbcijas līdzsvara sasniegšanas nepilnīgas tilpuma aizstāšanas dēļ (μg), |
|
|
= |
vielas masa šķīdumā adsorbcijas līdzsvara stāvoklī (μg); |
|
|
(15) |
|
|
= |
šķīduma tilpums, kas ņemts no mēģenes testa vielas mērījumam desorbcijas līdzsvara stāvoklī (cm3), |
|
VR |
= |
supernatanta tilpums, kas aizvadīts no mēģenes pēc adsorbcijas līdzsvara sasniegšanas un aizvietots ar tādu pašu 0,01 M CaCl2 tilpumu (cm3); |
Freindliha desorbcijas vienādojums ir 16. vienādojums:
|
|
(16) |
vai lineārā veidā:
|
|
(17) |
kur:
|
|
= |
Freindliha desorbcijas koeficients, |
|
n |
= |
regresijas konstante, |
|
|
= |
vielas masas koncentrācija ūdens fāzē desorbcijas līdzsvara stāvoklī (μg cm-3). |
16. un 17. vienādojumu var attēlot grafikā un, izmantojot 17. vienādojumu, ar regresijas analīzi aprēķināt
![]()
un 1/n lielumu.
Piezīme
Ja Freindliha adsorbcijas vai desorbcijas pakāpes rādītājs 1/n ir vienāds ar 1, Freindliha adsorbcijas vai desorbcijas konstante (
![]()
![]()
2.2.2. Testa ziņojums
Testa ziņojumā ir šāda informācija:
— Izmantoto augsnes paraugu pilnīga identifikācija, kurā iekļauta:
— ģeogrāfiskā vietas norāde (ģeogrāfiskais platums un garums),
— paraugu ņemšanas datums,
— izmantošanas veids (piemēram, lauksaimniecības augsne, meža augsne utt.),
— parauga ņemšanas dziļums,
— smilts/sanesu/mālu saturs,
— pH lielumi (0,01 M CaCl2 šķīdumā),
— organiskā oglekļa saturs,
— organiskās vielas saturs,
— slāpekļa saturs,
— C/N attiecība,
— katjonu apmaiņas spēja (mmoli/kg),
— visa informācija attiecībā uz augsnes paraugu savākšanu un uzglabāšanu,
— attiecīgā gadījumā – visa informācija, kas attiecas uz testa vielas adsorbcijas/desorbcijas interpretāciju,
— uz metodēm, kas izmantotas katra parametra noteikšanai,
— attiecīgā informācija par testa vielu,
— eksperimenta temperatūra,
— centrifugēšanas apstākļi,
— testa vielas analīzē izmantotā analītiskā procedūra,
— šķīdību palielinoša reaģenta izmantošanas pamatojums testa vielas izejas šķīduma pagatavošanai,
— attiecīgā gadījumā aprēķinos izdarīto korekciju izskaidrojums,
— dati saskaņā ar veidlapu (6. papildinājums) un grafiskais attēlojums,
— visa informācija un novērojumi, kas ir noderīgi testa rezultātu interpretācijai.
3. IZMANTOTĀ LITERATŪRA
(1) Kukowski H. and Brümmer G., (1987). Investigations on the Adsorption and Desorption of Selected Chemicals in Soils. UBA Report 106 02 045, Part II.
(2) Fränzle O., Kuhnt G. and Vetter L., (1987). Selection of Representative Soils in the EC-Territory. UBA Report 106 02 045, Part I.
(3) Kuhnt G. and Muntau H. (Eds.) EURO-Soils: Identification, Collection, Treatment, Characterisation. Special Publication No. 1.94.60, Joint Research Centre. European Commission, ISPRA, December 1994.
(4) OECD Test Guidelines Programme, Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995 (June 1995).
(5) US-Environment Protection Agency: Pesticide Assessment Guidelines, Subdivision N, Chemistry: Environmental Fate, Series 163-1, Leaching and Adsorption/Desorption Studies, Addendum 6 on Data Reporting, 540/09-88-096, Date: 1/1988.
(6) US-Environment Protection Agency: Prevention, Pesticides and Toxic Substances, OPPTS Harmonized Test Guidelines, Series 835-Fate, Transport and Transformation Test Guidelines, 0PPTS No: 835.1220 Sediment and Soil Adsorption/Desorption Isotherm. EPA No: 712-C-96-048, April 1996.
(7) ASTM Standards, E 1195-85, Standard Test Method for Determining a Sorption Constant (Koc) for an Organic Chemical in Soil and Sediments.
(8) Agriculture Canada: Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada, 15 July 1987.
(9) Netherlands Commission Registration Pesticides (1995): Application for registration of a pesticide. Section G. Behaviour of the product and its metabolites in soil, water and air.
(10) Danish National Agency of Environmental Protection (October 1988): Criteria for registration of pesticides as especially dangerous to health or especially harmful to the environment.
(11) BBA (1990), Guidelines for the Official Testing of Plant Protection Products, Biological Research Centre for Agriculture and Forestry, Braunschweig, Germany.
(12) Calvet R., (1989), “Evaluation of adsorption coefficients and the prediction of the mobilities of pesticides in soils”, in Methodological Aspects of the Study of Pesticide Behaviour in Soil (ed. P. Jamet), INRA, Paris, (Review).
(13) Calvet R., (1980) “Adsorption-Desorption Phenomena” in Interactions between herbicides and the soil. (R.J. Hance ed.), Academic Press, London, p. 83–122.
(14) Hasset J.J., and Banwart W.L., (1989), “The sorption of nonpolar organics by soils and sediments” in Reactions and Movement of Organic Chemicals in Soils. Soil Science Society of America (S.S.S.A), Special Publication No. 22, p. 31–44.
(15) Van Genuchten M. Th., Davidson J.M., and Wierenga P.J., (1974), “An evaluation of kinetic and equilibrium equations for the prediction of pesticide movement through porous media”. Soil Sci. Soc. Am. Proc., Vol. 38(1), p. 29–35.
(16) McCall P.J., Laskowski D.A., Swann R.L., and Dishburger H.J., (1981), “Measurement of sorption coefficients of organic chemicals and their use, in environmental fate analysis”, in Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington DC.
(17) Lambert S.M., Porter P.E., and Schieferrstein R.H., (1965), “Movement and sorption of chemicals applied to the soil”. Weeds, 13, p. 185–190.
(18) Rhodes R.C., Belasco I.J., and Pease H.L., (1970) “Determination of mobility and adsorption of agrochemicals in soils”. J.Agric.Food Chem., 18, p. 524–528.
(19) Russell M.H., (1995), “Recommended approaches to assess pesticide mobility in soil” in Environmental Behavior of Agrochemicals (ed. T.R. Roberts and P.C. Kearney). John Wiley & Sons Ltd.
(20) Esser H.O., Hemingway R.J., Klein W., Sharp D.B., Vonk J.W. and Holland P.T., (1988), “Recommended approach to the evaluation of the environmental behavior of pesticides”, IUPAC Reports on Pesticides (24). Pure Appl. Chem., 60, p. 901–932.
(21) Guth J.A., Burkhard N., and D.O. Eberle, (1976), “Experimental models for studying the persistence of pesticides in soils”. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, pp 137-157, BCPC, Surrey, UK.
(22) Furminge C.G.L., and Osgerby J.M., (1967), “Persistence of herbicides in soil”. J. Sci. Fd Agric., 18, p. 269–273.
(23) Burkhard N., and Guth J.A., (1981), “Chemical hydrolysis of 2-Chloro-4,6-bis(alkylamino)-1,3,5-triazine herbicides and their breakdown in soil under the influence of adsorption”. Pestic. Sci. 12, p. 45–52.
(24) Guth J.A., Gerber H.R., and Schlaepfer T., (1977). “Effect of adsorption, movement and persistence on the biological availability of soil-applied pesticides”. Proc. Br. Crop Prot. Conf., 3, p. 961–971.
(25) Osgerby J.M., (1973), “Process affecting herbicide action in soil”. Pestic. Sci., 4, p. 247–258.
(26) Guth J.A., (1972), “Adsorptions- und Einwascheverhalten von Pflanzenschutzmitteln in Böden”. Schr. Reihe Ver. Wass. -Boden-Lufthyg. Berlin-Dahlem, Heft 37, p. 143–154.
(27) Hamaker J.W., (1975), “The interpretation of soil leaching experiments”, in Environmental Dynamics of Pesticides (eds R. Haque and V.H. freed), pp. 135–172, Plenum Press, NY.
(28) Helling C.S., (1971), “Pesticide mobility in soils”. Soil Sci. Soc. Amer. Proc., 35, p. 732–210.
(29) Hamaker J.W., (1972), “Diffusion and volatilization” in Organic chemicals in the soil environment (C.A.I. Goring and J.W. Hamaker eds), Vol. I, p. 49–143.
(30) Burkhard N. and Guth J.A., (1981), “Rate of volatilisation of pesticides from soil surfaces; Comparison of calculated results with those determined in a laboratory model system”. Pestic. Sci. 12, p. 37–44.
(31) Cohen S.Z., Creeger S.M., Carsel R.F., and Enfield C.G., (1984), “Potential pesticide contamination of groundwater from agricultural uses”, in Treatment and Disposal of Pesticide Wastes, pp. 297-325, Acs Symp. Ser. 259, American Chemical Society, Washington, DC.
(32) Gustafson D.I., (1989), “Groundwater ubiquity score: a simple method for assessing pesticide leachability”. J. Environ. Toxic. Chem., 8(4), p. 339–357.
(33) Leistra M., and Dekkers W.A., (1976). “Computed effects of adsorption kinetics on pesticide movement in soils”. J. of Soil Sci., 28, p. 340–350.
(34) Bromilov R.H., and Leistra M., (1980), “Measured and simulated behavior of aldicarb and its oxydation products in fallow soils”. Pest. Sci., 11, p. 389–395.
(35) Green R.E., and Karickoff S.W., (1990), “Sorption estimates for modeling”, in Pesticides in the Soil Environment: Process, Impacts and Modeling (ed. H.H. Cheng). Soil Sci. Soc. Am., Book Series no. 2, p.80–101,
(36) Lambert S.M., (1967), “Functional relationship between sorption in soil and chemical structure”. J. Agri. Food Chem., 15, p. 572–576.
(37) Hance R.J., (1969), “An empirical relationship between chemical structure and the sorption of some herbicides by soils”. J. Agri. Food Chem., 17, p. 667–668.
(38) Briggs G.G. (1969), “Molecular structure of herbicides and their sorption by soils”. Nature, 223, p. 1288.
(39) Briggs G.G. (1981). “Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor”. J. Agric. Food Chem., 29, p. 1050–1059.
(40) Sabljic A., (1984), “Predictions of the nature and strength of soil sorption of organic polutance by molecular topology”. J. Agric. Food Chem., 32, p. 243–246.
(41) Bailey G.W., and White J.L., (1970), “Factors influencing the adsorption, desorption, and movement of pesticides in soil”. Residue Rev., 32, p. 29–92.
(42) Bailey G.W., J.L. White and Y. Rothberg., (1968), “Adsorption of organic herbicides by montomorillonite: Role of pH and chemical character of adsorbate”. Soil Sci. Soc. Amer. Proc. 32:222-234.
(43) Karickhoff S.W., (1981) “Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils”. Chemosphere 10, p. 833–846.
(44) Paya-Perez A., Riaz M. and Larsen B., (1989), “Soil Sorption of 6 Chlorobenzenes and 20 PCB Congeners”. Environ. Toxicol. Safety 21, p. 1–17.
(45) Hamaker J.W., and Thompson J.M., (1972). “Adsorption in organic chemicals” in Organic Chemicals in the Soil Environment (Goring C.A.I. and Hamaker J.W., eds), Vol I and II, Marcel Dekker, Inc., New York, NY, 1972, p. 49–143.
(46) Deli J., and Warren G.F., 1971, “Adsorption, desorption and leaching of diphenamid in soils”. Weed Sci. 19:67-69.
(47) Chu-Huang Wu, Buehring N., Davinson J.M. and Santelmann, (1975), “Napropamide Adsorption, desorption and Movement in soils”. Weed Science, Vol. 23, p. 454–457.
(48) Haues M.H.B., Stacey M., and Thompson J.M., (1968) “Adsorption of s-triazine herbicides by soil organic preparations” in Isotopes and Radiation in Soil Organic Studies, p. 75, International. Atomic Energy Agency, Vienna.
(49) Pionke H.B., and Deangelis R.J., (1980), “Methods for distributing pesticide loss in field run-off between the solution and adsorbed phase”, CREAMS, in A Field Scale Model for Chemicals, Run-off and Erosion from Agricultural Management Systems, Chapter 19, Vol. III: Supporting Documentation, USDA Conservation Research report.
(50) ISO Standard Compendium Environment: Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition (1994).
(51) Scheffer F., and Schachtschabel, Lehrbuch der Bodenkunde, F. Enke Verlag, Stuttgart (1982), 11th edition.
(52) Black, Evans D.D., White J.L., Ensminger L.E., and Clark F.E., eds. “Methods of Soil Analysis”, Vol. 1 and 2, American Society of Agronomy, Madison, WI, 1982.
(53) ISO/DIS 10381-1 Soil Quality – Sampling – Part 1: Guidance on the design of sampling programmes.
(54) ISO/DIS 10381-2 Soil Quality – Sampling – Part 2: Guidance on sampling techniques.
(55) ISO/DIS 10381-3 Soil Quality – Sampling – Part 3: Guidance on safety of sampling.
(56) ISO/DIS 10381-4 Soil Quality – Sampling – Part 4: Guidance on the investigation of natural and cultivated soils.
(57) ISO/DIS 10381-5 Soil Quality – Sampling – Part 5: Guidance on the investigation of soil contamination of urban and industrial sites.
(58) ISO 10381-6, 1993: Soil Quality – Sampling – Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
(59) Green R.E., and Yamane V.K., (1970) “Precision in pesticide adsorption measurements”. Soil Sci. Am. Proc., 34, p. 353–354.
(60) Grover R., and Hance R.J. (1970), “Effect of ratio of soil to water on adsorption of linuron and atrazine”. Soil Sci., p. 109–138.
(61) Boesten, J.J.T.I, “Influence of soil/liquid ratio on the experimental error of sorption coefficients in pesticide/soil system”. Pest. Sci. 1990, 30, p. 31–41.
(62) Boesten, J.J.T.I. “Influence of soil/liquid ratio on the experimental error of sorption coefficients in relation to OECD guideline 106” Proceedings of 5th international workshop on environmental behaviour of pesticides and regulatory aspects, Brussels, 26–29 April 1994.
(63) Bastide J., Cantier J.M., et Coste C., (1980), “Comportement de substances herbicides dans le sol en fonction de leur structure chimique”. Weed Res. 21, p. 227–231.
(64) Brown D.S., and Flagg E.W., (1981), “Empirical prediction of organic pollutants sorption in natural sediments”. J. Environ.Qual., 10(3), p. 382–386.
(65) Chiou C.T., Porter P.E., and Schmedding D.W., (1983), “Partition equilibria of non-ionic organic compounds between soil organic matter and water”. Environ. Sci. Technol., 17(4), p. 227–231.
(66) Gerstl Z., and Mingelgrin U., (1984), “Sorption of organic substances by soils and sediments”. J. Environm. Sci. Health, B19 (3), p. 297–312.
(67) Vowles P.D., and Mantoura R.F.C., (1987), “Sediment-water partition coefficient and HPLC retention factors of aromatic hydrocarbons”. Chemosphere, 16(1), p. 109–116.
(68) Lyman W.J., Reehl W.F.and Rosenblatt D.H. (1990). Handbook of Chemical Property Estimation Methods. Environmental Behaviour of Organic Compounds. American Chemical Society, Washington DC.
(69) Keniga E.E., and Goring, C.A.I. (1980). “Relationship between water solubility, soil sorption, octanol-water partitioning and concentration of chemicals in the biota” in Aquatic Toxicology (eds J.G. Eaton, et al.), pp.78-115, ASTM STP 707, Philadelphia.
(70) Chiou C.T., Peters L.J., and Freed V.H., (“1979), A physical concept of soil-water equilibria for non-ionic organic compounds”. Science, Vol. 206, p. 831–832.
(71) Hassett J.J., Banwart W.I., Wood S.G., and Means J.C., (1981), “Sorption of/-Naphtol: implications concerning the limits of hydrophobic sorption”. Soil Sci. Soc. Am. J. 45, p. 38–42.
(72) Karickhoff S.W., (1981), “Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils”. Chemosphere, Vol. 10(8), p. 833–846.
(73) Moreale A., van Bladel R., (1981), “Adsorption de 13 herbicides et insecticides par le sol. Relation solubilité – reactivité. Revue de l’Agric., 34 (4), p. 319–322.
(74) Müller M., Kördel W. (1996), “Comparison of screening methods for the determination/estimation of adsorption coefficients on soil”. Chemosphere, 32(12), p. 2493–2504.
(75) Kördel W., Kotthoff G., Müller M. (1995), “HPLC – screening method for the determination of the adsorption coefficient on soil – results of a ring test”. Chemosphere 30 (7), p. 1373–1384.
(76) Kördel W., Stutte J., Kotthoff G. (1993), “HPLC – screening method for the determination of the adsorption coefficient on soil – comparison of different stationary phases. Chemosphere 27 (12), p. 2341–2352.
(77) Hance, R.J., (1967), “The speed of Attainment of Sorption Equilibria in Some Systems Involving Herbicides”. Weed Research, Vol. 7, p. 29–36.
(78) Koskinen W.C., and Harper S.S., (1990), “The retention processes: mechanisms” in Pesticides in the Soil Environment: Processes, Impacts and Modelling (ed. H.H. Cheng). Soil Sci. Soc. Am. Book Series, No. 2, Madison, Wisconsin.
(79) Cohen S.Z., Creeger S.M., Carsel R.F., and Enfield C.G. (1984), “Potential pesticide contamination of groundwater from agricultural uses”, in Treatment and Disposal of Pesticide Wastes, p.297–325, ACS Symp. Ser. 259, American Chemical Society, Washington, DC.
(80) Giles C.H., (1970), “Interpretation and use of sorption isotherms” in Sorption and Transport Processes in Soils. S.C.I. Monograph No. 37, p. 14–32.
(81) Giles, C.H.; McEwan J.H.; Nakhwa, S.N. and Smith, D, (1960), “Studies in adsorption: XI. A system of classification of solution adsorption isotherms and its use in the diagnosis of adsorption mechanisms and in measurements of pesticides surface areas of soils”. J. Chem. Soc., p. 3973-93.
(82) Calvet R., Tercé M., and Arvien J.C., (1980), “Adsorption des pesticides par les sols et leurs constituants: 3. Caractéristiques générales de l’adsorption”. Ann. Agron. 31, p. 239–251.
(83) Bedbur E., (1996), “Anomalies in the Freundlich equation”, Proc. COST 66 Workshop, Pesticides in soil and the environment, 13-15 May 1996, Stratford-upon-Avon, U.K.
(84) Guth, J.A., (1985), “Adsorption/desorption”, in Joint International Symposium, Physicochemical Properties and their Role in Environmental Hazard Assessment, July 1–3, Canterbury, UK.
(85) Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
1. PAPILDINĀJUMS
Testēšanas shēma

2. PAPILDINĀJUMS
KONCENTRĀCIJAS MAIŅAS UN ANALĪTISKĀS METODES PRECIZITĀTES IETEKME UZ ADSORBCIJAS REZULTĀTU PRECIZITĀTI
No turpmāk dotās tabulas (84) ir redzams – ja starpība starp testa vielas sākuma masu šķīdumā (m0 = 110 μg) un līdzsvara stāvokļa masu šķīdumā (
![]()
![]()
|
Augsnes daudzums |
msoil |
= 10 g |
|
Šķīduma tilpums |
V0 |
= 100 cm3 |
|
(μg) |
(μg cm-3) |
R |
(μg) |
(μg g-1) |
R‡ |
Kd* |
R‡ |
|
|
A = 9 % |
||||||||
|
m0 = 110 μg vai C0=1.100 μg/cm3 |
100 |
1,000 |
patiesais lielums |
10 |
1,00 |
patiesais lielums |
1 |
|
|
101 |
1,010 |
1 % |
9 |
0,90 |
10 % |
0,891 |
10,9 % |
|
|
105 |
1,050 |
5 % |
5 |
0,50 |
50 % |
0,476 |
52,4 % |
|
|
109 |
1,090 |
9 % |
1 |
0,10 |
90 % |
0,092 |
90,8 % |
|
|
A = 55 % |
||||||||
|
m0= 110 μg vai C0=1.100μg/cm3 |
50,0 |
0,500 |
patiesais lielums |
60,0 |
6,00 |
patiesais lielums |
12,00 |
|
|
50,5 |
0,505 |
1 % |
59,5 |
5,95 |
0,8 % |
11,78 |
1,8 % |
|
|
52,5 |
0,525 |
5 % |
57,5 |
5,75 |
4,0 % |
10,95 |
8,8 % |
|
|
55,0 |
0,550 |
10 % |
55,0 |
5,50 |
8,3 % |
10,00 |
16,7 % |
|
|
A = 99 % |
||||||||
|
m0 = 110 μg vai C0=1.100 μg/cm3 |
1,100 |
0,011 |
patiesais lielums |
108,9 |
10,89 |
patiesais lielums |
990 |
|
|
1,111 |
0,01111 |
1 % |
108,889 |
10,8889 |
0,01 % |
980 |
1,0 % |
|
|
1,155 |
0,01155 |
5 % |
108,845 |
10,8845 |
0,05 % |
942 |
4,8 % |
|
|
1,21 |
0,0121 |
10 % |
108,790 |
10,8790 |
0,10 % |
899 |
9,2 % |
|
|
|
= |
|
|
|
= |
testa vielas masa augsnes fāzē līdzsvara stāvoklī, μg, |
|
|
= |
testa vielas masa ūdens fāzē līdzsvara stāvoklī, μg, |
|
|
= |
testa vielas saturs augsnes fāzē līdzsvara stāvoklī, μg g-1, |
|
|
= |
testa vielas masas koncentrācija ūdens fāzē līdzsvara stāvoklī, μg cm-3, |
|
R |
= |
|
|
R‡ |
= |
aprēķina kļūda, kas radusies analītiskās kļūdas R dēļ. |
3. PAPILDINĀJUMS
KD NOVĒRTĒŠANAS METODES
1. Novērtēšanas metodes ļauj paredzēt Kd, pamatojoties uz korelācijām, piemēram, ar Pow lielumiem (12) (39) (63)–(68), šķīdības ūdenī datiem (12) (19) (21) (39) (68)–(73) vai polaritātes datiem, kas iegūti, izmantojot apgrieztās fāzes HPLC (74)–(76). Kā parādīts 1. un 2. tabulā, Koc vai Kom aprēķina no šiem vienādojumiem, un pēc tam netieši aprēķina Kd no šādiem vienādojumiem:
|
|
|
2. Šīs korelācijas pamatojas uz diviem pieņēmumiem: 1) tieši augsnes organiskās sastāvdaļas visvairāk ietekmē vielas adsorbciju; un 2) iesaistītās savstarpējās iedarbības galvenokārt ir nepolāras. Tādēļ attiecīgās korelācijas: 1) nav piemērojamas polārām vielām vai ir tām piemērojamas tikai kaut kādā mērā un 2) nav piemērojamas, ja organisko sastāvdaļu saturs augsnē ir ļoti mazs (12). Turklāt, kaut arī ir atrastas apmierinošas korelācijas starp Pow un adsorbciju (19), to pašu nevar teikt par sakarību starp šķīdību ūdenī un adsorbciju (19) (21); pagaidām pētījumi ir ļoti pretrunīgi.
3. Daži korelāciju piemēri starp adsorbcijas koeficientu un sadalījuma koeficientu sistēmā oktanols–ūdens, kā arī starp adsorbcijas koeficientu un šķīdību ūdenī ir sniegti attiecīgi 1. un 2. tabulā.
1. tabula
Korelāciju piemēri starp adsorbcijas sadalījuma koeficientu un sadalījuma koeficientu sistēmā oktanols–ūdens; citus piemērus skatīt (12), (68).
|
Vielas |
Korelācijas |
Autori |
|
Urīnvielas atvasinājumi |
log Kom = 0,69 + 0,52 log Pow |
Briggs (1981) (39) |
|
Hlorētie aromātiskie savienojumi |
log Koc = - 0,779 + 0,904 log Pow |
Chiou et al. (1983) (65) |
|
Dažādi pesticīdi |
log Kom = 4,4 + 0,72 log Pow |
Gerstl and Mingelgrin (1984) (66) |
|
Aromātiskie ogļūdeņraži |
log Koc = - 2,53 + 1,15 log Pow |
Vowles and Mantoura (1987) (67) |
2. tabula
Korelāciju piemēri starp adsorbcijas sadalījuma koeficientu un šķīdību ūdenī; citus piemērus skatīt (68), (69).
|
Savienojumi |
Korelācijas |
Autori |
|
Dažādi pesticīdi |
log Kom = 3,8 - 0,561 log Sw |
Gerstl and Mingelgrin (1984) (66) |
|
Hlorētas alifātiskās un aromātiskās vielas |
log Kom = (4,040 +/- 0,038) – (0,557 +/- 0,012) log Sw |
Chiou et al. (1979) (70) |
|
α-naftols |
log Koc = 4,273 - 0,686 log Sw |
Hasset et al. (1981) (71) |
|
Cikliskas alifātiskās un aromātiskās vielas |
log Koc = - 1,405 - 0,921 log Sw - 0,00953 (mp-25) |
Karickhoff (1981) (72) |
|
Dažādi savienojumi |
log Kom = 2,75 - 0,45 log Sw |
Moreale van Blade (1982) (73) |
4. PAPILDINĀJUMS
APRĒĶINI CENTRIFUGĒŠANAS APSTĀKĻU DEFINĒŠANAI
1. Centrifugēšanas laiku apraksta šāda formula, pieņemot, ka daļiņas ir lodveida:
|
|
(1) |
Vienkāršības labad visi parametri ir aprakstīti vienībās, kas nav SI vienības (g, cm),
kur:
|
ω |
= |
griešanās ātrums (=2 π rpm/60), rad s-1, |
|
rpm |
= |
apgriezieni minūtē, |
|
η |
= |
šķīduma viskozitāte, g s-1 cm-1, |
|
rp |
= |
daļiņas rādiuss, cm, |
|
ρ s |
= |
augsnes blīvums, g cm-3, |
|
ρaq |
= |
šķīdums blīvums, g cm-3, |
|
Rt |
= |
atstatums no centrifūgas rotora centra līdz šķīduma augšpusei centrifūgas mēģenē, cm, |
|
Rb |
= |
atstatums no centrifūgas rotora centra līdz šķīduma apakšai centrifūgas mēģenē, cm, |
|
Rb-Rt |
= |
augsnes/šķīduma maisījuma augstums centrifūgas mēģenē, cm. |
Lai nodrošinātu pilnīgu atdalīšanu, parasti izmanto divreiz ilgāku laiku nekā aprēķinātais.
2. Vienādojumu (1) var vēl vairāk vienkāršot, ja uzskata, ka šķīduma viskozitāte (η) un blīvums (ρaq) ir vienāds ar ūdens viskozitāti un blīvumu 25 oC temperatūrā; tā, η = 8,95 × 10-3 g s-1 cm-1 un ρaq = 1,0 g × cm-3.
Tātad centrifugēšanas laiku apraksta vienādojums (2):
|
|
(2) |
3. No 2. vienādojuma ir redzams, ka centrifugēšanas apstākļu noteikšanā ir svarīgi divi parametri, t. i., laiks (t) un ātrums (apgr. min), lai sasniegtu daļiņu atdalīšanu ar konkrētu lielumu (mūsu gadījumā ar rādiusu 0,1 μm): 1) augsnes blīvums un 2) maisījuma augstums centrifūgas mēģenē (Rb-Rt), t. i., atstatums, ko aizņem augsnes daļiņas no šķīduma virsmas līdz mēģenes apakšai; acīmredzot, ja tilpums ir nemainīgs, maisījuma augstums mēģenē ir atkarīgs no mēģenes rādiusa kvadrāta.
4. Šā papildinājuma 1. attēlā attēlotas centrifugēšanas laika (t) pārmaiņas atkarībā no centrifugēšanas ātruma (apgr. min) dažādiem augsnes blīvumiem (ρs) (1.a attēls) un atkarībā no maisījuma augstuma centrifūgas mēģenēs (1.b attēls). 1.a attēlā ir acīmredzama augsnes blīvuma ietekme; piemēram, klasiskai centrifugēšanai ar 3000 apgr. min centrifugēšanas laiks ir aptuveni 240 min, ja augsnes blīvums ir 1,2 g cm3, bet tas ir tikai 50 min, ja augsnes blīvums ir 2,0 g cm3. Līdzīgi 1.b attēlā klasiskai centrifugēšanai ar 3000 apgr. min centrifugēšanas laiks ir aptuveni 50 min, ja maisījuma augstums ir 10 cm, un tikai 7 min, ja augstums ir 1 cm. Tomēr ir svarīgi atrast optimālu attiecību starp centrifugēšanu, kurai vajadzīgs iespējami mazāks augstums, un starp vieglāku eksperimentatora darbu, atdalot fāzes pēc centrifugēšanas.
5. Turklāt, nosakot eksperimenta apstākļus augsnes/šķīduma fāzu atdalīšanai, ir svarīgi ņemt vērā iespējamo trešās “pseidofāzes” – koloīdu – pastāvēšanu. Koloidālajām daļiņām, kuru lielums ir mazāks par 0,2 μm, var būt svarīga ietekme uz visu vielas adsorbcijas mehānismu augsnes suspensijā. Ja centrifugēšanu izdara, kā iepriekš aprakstīts, koloidālās daļiņas paliek ūdens fāzē un tās tiek pakļautas analīzei kopā ar ūdens fāzi. Tādā veidā informācija par to ietekmi ir zaudēta.
Ja analīžu izdarītājai laboratorijai ir ultracentrifugēšanas vai ultrafiltrēšanas iekārtas, vielas adsorbciju/desorbciju uz augsnes var pētīt dziļāk, iekļaujot arī informāciju par vielas adsorbciju uz koloidālām daļiņām. Tādā gadījumā, lai atdalītu visas trīs fāzes, jāizmanto ultracentrifugēšana ar 60 000 apgr. min vai ultrafiltrēšana ar filtra porainību 100 000 daltoni. Attiecīgi ir arī jāmaina testa ziņojums, lai visās trīs fāzēs izdarītu vielas analīzi.
1.a attēls.

Centrifugēšanas laika (t) pārmaiņas atkarībā un centrifugēšanas ātruma (apgr. min) dažādiem augsnes blīvumiem (ρs). Rt = 10 cm, Rb-Rt = 10 cm, η = 8,95 × 10-3 g s-1 cm-1 un ρaq = 1,0 g cm-3 pie 25 oC.
1.b attēls.

Centrifugēšanas laika (t) pārmaiņas atkarībā no centrifugēšanas ātruma (apgr. min) dažādiem maisījuma augstumiem centrifūgas mēģenē (Rb-Rt) = L; Rt = 10 cm, η = 8,95 × 10-3 g s-1 cm-1, ρaq = 1,0 g cm-3 pie 25 oC un ρs = 2,0 g cm-3.
5. PAPILDINĀJUMS
ADSORBCIJAS A ( %) UN DESORBCIJAS D ( %) APRĒĶINS
Procedūras laika grafiks ir:
Visos aprēķinos ir pieņemts, ka testa viela ir stabila un ievērojami neadsorbējas uz trauka sienām.
ADSORBCIJA A (A %)
a) Paralēlā metode
Adsorbcijas procentuālo daudzumu aprēķina katrai mēģenei (i) katrā laika punktā (ti) saskaņā ar vienādojumu:
|
|
(1) |
Šā vienādojuma locekļus var aprēķināt šādi:
|
m0 = C0 · V0 (μg) |
(2) |
|
|
(3) |
kur:
|
|
= |
adsorbcijas procentuālais daudzums ( %) laika punktā ti, |
|
|
= |
uz augsnes adsorbētās testa vielas masa analīzes izdarīšanas laika punktā (μg), |
|
m0 |
= |
testa vielas masa mēģenē testa sākumā (μg), |
|
C0 |
= |
ar augsni saskarē esošā testa šķīduma sākotnējā masas koncentrācija (μg cm-3), |
|
|
= |
vielas masas koncentrācija ūdens fāzē analīzes izdarīšanas laika punktā ti (μg cm-3); šo koncentrāciju analītiski nosaka, ņemot vērā tukšajos mēģinājumos iegūtos lielumus, |
|
V0 |
= |
ar augsni saskarē esošā testa šķīduma ūdens fāzes sākotnējais tilpums (cm3). |
Adsorbcijas procentuālā daudzuma
![]()
vai
![]()
lielumus atliek grafiski atkarībā no laika un nosaka laiku, kad ir sasniegts sorbcijas līdzsvars. Šādu grafiku piemēri attiecīgi ir doti 1. un 2. attēlā.

1. attēls.
Adsorbcijas līdzsvara grafiks.
2. attēls.
Testa vielas masas koncentrācija ūdens fāzē (Caq) atkarībā no laika.
b) Virknes metode
Turpmāk dotie vienādojumi ņem vērā, ka adsorbcijas procedūru izdara, noteiktos laika intervālos mērot testa vielu mazos ūdens fāzes alikvotos.
— Uz augsnes katrā laika intervālā adsorbēto vielas daudzumu aprēķina šādi:
—— pirmajam laika intervālam Δt1 = t1- t0
—
|
|
(4) |
— otrajam laika intervālam Dt2 = t2- t1
—
|
|
(5) |
— trešajam laika intervālam Dt3 = t3- t2
—
|
|
(6) |
— n-tajam laika intervālam Dtn = tn- tn-1
—
|
|
(7) |
— Adsorbcijas procentuālo daudzumu katrā laika intervālā
![]()
|
|
(8) |
— kur adsorbcijas procentuālo daudzumu
![]()
|
|
(9) |
— Adsorbcijas procentuālā daudzuma
![]()
![]()
— Līdzsvara sasniegšanas laikā teq:
—— uz augsnes adsorbētās testa vielas masa ir:
—
|
|
(10) |
— testa vielas masa šķīdumā ir
—
|
|
(11) |
— un adsorbcijas procentuālais daudzums līdzsvara stāvoklī ir:
—
|
|
(12) |
Iepriekš izmantotie parametri ir definēti kā:
|
|
= |
vielas masa, kas attiecīgi adsorbēta uz augsnes laika intervālos Δt1, Δt2,..., Δtn (mg), |
|
|
= |
vielas masa, kas attiecīgi izmērīta alikvotā
|
|
|
= |
uz augsnes adsorbētās vielas masa adsorbcijas līdzsvara stāvoklī (mg), |
|
|
= |
vielas masa šķīdumā adsorbcijas līdzsvara stāvoklī (mg), |
|
|
= |
alikvota tilpums, kurā mēra testa vielu (cm3), |
|
|
= |
adsorbcijas procentuālais daudzums, kas atbilst laika intervālam Δti (%), |
|
|
= |
adsorbcijas procentuālais daudzums adsorbcijas līdzsvara stāvoklī (%). |
DESORBCIJA D (%)
Par laiku t0, kad sākas desorbcijas kinētikas eksperiments, uzskata mirkli, kad testa vielas šķīduma maksimālais atgūtais tilpums (pēc adsorbcijas līdzsvara sasniegšanas) ir aizvietots ar vienādu 0,01 M CaCl2 šķīduma tilpumu.
a) Paralēlā metode
Laika punktā ti mēra testa vielu ūdens fāzē, kas ņemta no i-tās mēģenes (
![]()
), un desorbēto masu aprēķina saskaņā ar vienādojumu:
|
|
(13) |
Desorbcijas līdzsvara stāvoklī ti = teq Laika intervālā
![]()
![]()
(Δti) desorbēto testa vielas masu apraksta vienādojums:
|
|
(14) |
Aprēķina desorbcijas procentuālo daudzumu:
laika punktā ti no vienādojuma:
|
|
(15) |
un laika intervālā (Δti) no vienādojuma:
|
|
(16) |
kur:
|
|
= |
desorbcijas procentuālais daudzums laika punktā i (%), |
|
|
= |
desorbcijas procentuālais daudzums, kas atbilst laika intervālam Δti (%), |
|
|
= |
desorbētās testa vielas masa laika punktā ti, (μg)), |
|
|
= |
desorbētās testa vielas masa laika intervālā Δti (μg), |
|
|
= |
testa vielas masa, kas analītiski izmērīta laika punktā ti analīzei ņemtā šķīduma tilpumā
|
|
|
= |
testa vielas masa, kas palikusi pēc adsorbcijas līdzsvara sasniegšanas nepilnīgas tilpuma aizvietošanas dēļ (μg); |
|
|
(17) |
|
|
= |
testa vielas masa šķīdumā adsorbcijas līdzsvara stāvoklī (μg), |
|
VR |
= |
supernatanta tilpums, kas aizvadīts no mēģenes pēc adsorbcijas līdzsvara sasniegšanas un aizvietots ar tādu pašu 0,01 M CaCl2 tilpumu (cm3), |
|
|
= |
šķīduma tilpums, kas ņemts no i-tās mēģenes testa vielas mērījumam desorbcijas kinētikas eksperimentā (cm3). |
Desorbcijas procentuālā daudzuma
![]()
vai
![]()
(atkarībā no pētījuma vajadzībām) lielumus atliek grafiski atkarībā no laika un nosaka laiku, kad ir sasniegts desorbcijas līdzsvars.
b) Virknes metode
Turpmāk dotajos vienādojumos ir ņemts vērā, ka adsorbcijas procedūra, kas ir veikta iepriekš, ir izdarīta, mērot testa vielu mazos ūdens fāzes alikvotos
![]()
|
|
(18) |
Laika punktā ti:
— testa vielas masu mēra mazā alikvotā
![]()
|
|
(19) |
— Desorbcijas līdzsvara stāvoklī ti = teq un tādēļ
![]()
![]()
— Desorbcijas procentuālo daudzumu
![]()
|
|
(20) |
Laika intervālā (Δti):
Katrā laika intervālā desorbēto vielas daudzumu aprēķina šādi:
— pirmajam laika intervālam Δt1 = t1-t0
—
|
|
(21) |
— otrajam laika intervālam Δt2 = t2-t1
—
|
|
(22) |
— n-tajam intervālam Δtn = tn-tn-1
—
|
|
(23) |
Visbeidzot, desorbcijas procentuālo daudzumu katrā laika intervālā
![]()
aprēķina, izmantojot šādu vienādojumu:
|
|
(24) |
bet desorbcijas procentuālo daudzumu
![]()
|
|
(25) |
kur iepriekš izmantotie parametri ir definēti kā:
|
|
= |
vielas masa, kas palikusi adsorbēta uz augsnes attiecīgi pēc laika intervāliem Δt1, Δt2,..., Δtn (μg), |
|
|
= |
vielas masa, kas attiecīgi desorbēta laika intervālos Δt1, Δt2,..., Δtn (μg), |
|
|
= |
vielas masa, kas attiecīgi izmērīta alikvotā
|
|
VT |
= |
tilpums ūdens fāzei, kas saskaras ar augsni desorbcijas kinētikas eksperimentā, kuru izdara ar virknes metodi (cm3), |
|
|
= |
testa vielas masa, kas palikusi pēc adsorbcijas līdzsvara sasniegšanas nepilnīgas tilpuma aizvietošanas dēļ (μg),
|
|
VR |
= |
supernatanta tilpums, kas aizvadīts no mēģenes pēc adsorbcijas līdzsvara sasniegšanas un aizvietots ar to pašu 0,01 M CaCl2 šķīduma tilpumu (cm3), |
|
|
= |
alikvota tilpums, kas desorbcijas kinētikas eksperimentā, kuru izdara ar virknes metodi, ņemts analīzei no i-tās mēģenes (cm3),
|
6. PAPILDINĀJUMS
ADSORBCIJA/DESORBCIJA UZ AUGSNES: DATU NOFORMĒŠANAS PROTOKOLI
Testētā viela:
Testētā augsne:
Sausās masas saturs augsnē (105 oC, 12 h): … %
Temperatūra: … oC
Analītiskās metodes piemērotība
|
Nosvērtā augsne |
g |
|
|
Augsne: sausā masa |
g |
|
|
CaCl2 šķīduma tilpums |
cm3 |
|
|
Gala šķīduma nominālā koncentrācija |
μg cm-3 |
|
|
Gala šķīduma analītiskā koncentrācija |
μg cm-3 |
Izmantotās analītiskās metodes princips:
Analītiskās metodes kalibrēšana:
Testētā viela:
Testētā augsne:
Augsnes sausās masas saturs (105 oC, 12 h): … %
Temperatūra: … oC
|
Izmantotā analītiskā metodika: |
Netiešā |
|
Paralēlā |
|
Virknes |
|
|
Tiešā |
|
Adsorbcijas tests: testa paraugi
|
Simbols |
Vienības |
Līdzsvara iestāšanās laiks |
Līdzsvara iestāšanās laiks |
Līdzsvara iestāšanās laiks |
Līdzsvara iestāšanās laiks |
|||||
|
Mēģenes nr. |
||||||||||
|
Nosvērtā augsne |
— |
g |
||||||||
|
Augsne: sausā masa |
msoil |
g |
||||||||
|
Ūdens tilpums nosvērtajā augsnē (aprēķinātais) |
VWS |
cm3 |
||||||||
|
0,01 M CaCl2 šķīduma tilpums līdzsvara stāvokļa sasniegšanai augsnē |
cm3 |
|||||||||
|
Izejas šķīduma tilpums |
cm3 |
|||||||||
|
Kopējais tilpums ūdens fāzei, kas ir saskarē ar augsni |
V0 |
cm3 |
||||||||
|
Testa šķīduma sākotnējā koncentrācija |
C0 |
μg cm-3 |
||||||||
|
Testa vielas masa testa sākumā |
m o |
μg |
||||||||
|
Pēc kratīšanas un centrifugēšanas |
||||||||||
|
NETIEŠĀ METODE |
||||||||||
|
Paralēlā metode |
||||||||||
|
Testa vielas koncentrācija ūdens fāzē, iekļaujot korekciju uz tukšo mēģinājumu |
|
μg cm-3 |
||||||||
|
Virknes metode |
||||||||||
|
Testa vielas izmērītā masa alikvotā Va A |
|
μg |
||||||||
|
TIEŠĀ METODE |
||||||||||
|
Uz augsnes adsorbētā testa vielas masa |
|
μg |
||||||||
|
Adsorbcijas aprēķins |
||||||||||
|
Adsorbcija |
|
% |
||||||||
|
|
% |
|||||||||
|
Vidējā |
||||||||||
|
Adsorbcijas koeficients |
Kd |
cm3 g-1 |
||||||||
|
Vidējais |
||||||||||
|
Adsorbcijas koeficients |
Koc |
cm3 g-1 |
||||||||
|
Vidējais |
||||||||||
Testētā viela:
Testētā augsne:
Augsnes sausās masas saturs (105 …%
Temperatūra: … oC
Adsorbcijas tests: tukšais mēģinājums un kontroles mēģinājums
|
Simbols |
Vienības |
Tukšais mēģinājums |
Tukšais mēģinājums |
Kontroles mēģinājums |
||||
|
Mēģenes nr. |
||||||||
|
Nosvērtā augsne |
g |
0 |
0 |
|||||
|
Ūdens daudzums nosvērtajā augsnē (aprēķinātais) |
cm3 |
— |
— |
|||||
|
Pievienotais 0,01 M CaCl2 šķīduma tilpums |
cm3 |
|||||||
|
Pievienotais testa vielas izejas šķīduma tilpums |
cm3 |
0 |
0 |
|||||
|
Kopējais ūdens fāzes tilpums (aprēķinātais) |
cm3 |
— |
— |
|||||
|
Testa vielas sākotnējā koncentrācija ūdens fāzē |
μg cm-3 |
|||||||
|
Pēc kratīšanas un centrifugēšanas |
||||||||
|
Koncentrācija ūdens fāzē |
μg cm-3 |
|||||||
Piezīme: vajadzības gadījumā pievienojiet ailes.
Testētā viela:
Testētā augsne:
Augsnes sausās masas saturs (105 oC 12 h):… %
Temperatūra: … oC
Masas bilance
|
Simbols |
Vienības |
|||||
|
Mēģenes nr. |
||||||
|
Nosvērtā augsne |
— |
g |
||||
|
Augsne: sausā masa |
msoil |
g |
||||
|
Ūdens tilpums nosvērtajā augsnē (aprēķinātais) |
VWS |
ml |
||||
|
0,01 M CaCl2 šķīduma tilpums līdzsvara stāvokļa sasniegšanai augsnē |
ml |
|||||
|
Izejas šķīduma tilpums |
cm3 |
|||||
|
Kopējais tilpums ūdens fāzei, kas ir saskarē ar augsni |
V0 |
cm3 |
||||
|
Testa šķīduma sākotnējā koncentrācija |
C0 |
μg cm-3 |
||||
|
Līdzsvara iestāšanās laiks |
— |
h |
||||
|
Pēc kratīšanas un centrifugēšanas |
||||||
|
Testa vielas koncentrācija ūdens fāzē pie adsorbcijas, iekļaujot korekciju uz tukšo mēģinājumu līdzsvara stāvoklī |
|
μg cm-3 |
||||
|
Līdzsvara sasniegšanas laiks |
teq |
h |
||||
|
1. atšķaidījums ar šķīdinātāju |
||||||
|
Aizvadītais ūdens fāzes tilpums |
Vrec |
cm3 |
||||
|
Pievienotais šķīdinātāja tilpums |
ΔV |
cm3 |
||||
|
1. ekstrakcija ar šķīdinātāju |
||||||
|
Šķīdinātājā analizētais signāls |
SE1 |
var. |
||||
|
Testa vielas koncentrācija šķīdinātājā |
CE1 |
μg cm-3 |
||||
|
No augsnes un no trauka sienām ekstrahētā vielas masa |
mE1 |
μg |
||||
|
2. atšķaidījums ar šķīdinātāju |
||||||
|
Aizvadītais šķīdinātāja tilpums |
ΔVs |
cm3 |
||||
|
Pievienotais šķīdinātāja tilpums |
ΔV' |
cm3 |
||||
|
2. ekstrakcija ar šķīdinātāju |
||||||
|
Šķīdinātāja fāzē analizētais signāls |
SE2 |
var. |
||||
|
Testa vielas koncentrācija šķīdinātājā |
CE2 |
μg cm-3 |
||||
|
No augsnes un no trauka sienām ekstrahētā vielas masa |
mE2 |
μg |
||||
|
Divos posmos ekstrahētā kopējā testa vielas masa |
mE |
μg |
||||
|
Masas bilance |
MB |
% |
||||
Testētā viela:
Testētā augsne:
Augsnes sausās masas saturs (105 oC, 12 h):… %
Temperatūra: … oC
Adsorbcijas izotermas
|
Simbols |
Vienības |
|||||||||
|
Mēģene nr. |
||||||||||
|
Nosvērtā augsne |
— |
g |
||||||||
|
Augsne: sausā masa |
E |
g |
||||||||
|
Ūdens tilpums nosvērtajā augsnē (aprēķinātais) |
VWS |
cm3 |
||||||||
|
0,01 M CaCl2 šķīduma tilpums līdzsvara stāvokļa sasniegšanai augsnē |
cm3 |
|||||||||
|
Pievienotais izejas šķīduma tilpums |
cm3 |
|||||||||
|
Kopējais tilpums ūdens fāzei, kas ir saskarē ar augsni (aprēķinātais) |
V0 |
cm3 |
||||||||
|
Šķīduma koncentrācija |
C0 |
μg cm-3 |
||||||||
|
Līdzsvara sasniegšanas laiks |
— |
h |
||||||||
|
Pēc kratīšanas un centrifugēšanas |
||||||||||
|
Vielas koncentrācija ūdens fāzē, iekļaujot korekciju uz tukšo mēģinājumu |
|
μg cm-3 |
||||||||
|
Temperatūra |
oC |
|||||||||
|
Uz augsnes vienību adsorbētā masa |
|
μg g-1 |
||||||||
Regresijas analīze:
lielums KF ads:
l/n lielums:
regresijas koeficients r2:
Testētā viela:
Testētā augsne:
Augsnes sausās masas saturs (105 oC, 12 h):…………………………………………………..%
Temperatūra: … oC
|
Izmantotā analītiskā metodika: |
Netiešā |
|
Paralēlā |
|
Virknes |
|
Desorbcijas tests
|
Simbols |
Vienības |
Laika intervāls |
Laika intervāls |
Laika intervāls |
Laika intervāls |
||
|
Mēģenes nr., kurai izdarīts adsorbcijas posms |
|||||||
|
Uz augsnes adsorbētā vielas masa adsorbcijas līdzsvara stāvoklī |
|
μg |
|||||
|
Aizvadītais ūdens fāzes tilpums, kas aizstāts ar 0,01 M CaCl2 |
VR |
cm3 |
|||||
|
Kopējais tilpums ūdens fāzei kas ir saskarē ar augsni |
PM |
V0 |
cm3 |
||||
|
VM |
VT |
cm3 |
|||||
|
Testa vielas masa, kas ir palikusi pēc adsorbcijas līdzsvara iestāšanās nepilnīgas tilpuma aizvietošanas dēļ |
|
μg |
|||||
|
Desorbcijas kinētika |
|||||||
|
No augsnes laikā ti desorbētā izmērītā vielas masa |
|
μg |
|||||
|
Testa vielas mērīšanai no i-tās mēģenes ņemtais šķīduma tilpums |
PM |
Vf i |
cm3 |
||||
|
VM |
va D |
cm3 |
|||||
|
No augsnes laika punktā ti desorbētā vielas masa (aprēķinātā) |
|
μg |
|||||
|
No augsnes laika intervālā ti desorbētā vielas masa (aprēķinātā) |
|
μg |
|||||
|
Desorbcijas procentuālais daudzums |
|||||||
|
Desorbcija laika punktā ti |
Dti |
% |
|||||
|
Desorbcija laika intervālā ti |
|
% |
|||||
|
Šķietamais desorbcijas koeficients |
Kdes |
||||||
PM: paralēlā metode.
VM: virknes metode.
C.19. ADSORBCIJAS KOEFICIENTA (KOC ) NOTEIKŠANA UZ AUGSNES UN UZ KANALIZĀCIJAS NOSĒDUMIEM AR AUGSTAS IZŠĶIRŠANAS ŠĶIDRUMA HROMATOGRĀFIJU (HPLC)
1. METODE
Šī metode ir ESAO TG121 (2001) kopija.
1.1. IEVADS
Vielu sorbcijas izturēšanos uz augsnēm un uz kanalizācijas nosēdumiem var aprakstīt ar parametriem, ko eksperimentāli nosaka ar C.18. testa metodi. Svarīgs parametrs ir adsorbcijas koeficients, kas ir definēts kā attiecība starp vielas koncentrāciju uz augsnes/nosēdumiem un vielas koncentrāciju ūdens fāzē adsorbcijas līdzsvara stāvoklī. Adsorbcijas koeficients Koc, kas ir normalizēts attiecībā pret organiskā oglekļa saturu augsnē, ir noderīgs indikators attiecībā uz ķimikālijas saistīšanās spēju uz augsnes un uz kanalizācijas nosēdumu organiskās sastāvdaļas, un tas ļauj salīdzināt dažādas ķimikālijas. Šo parametru var novērtēt, izmantojot korelācijas ar šķīdību ūdenī un ar sadalījuma koeficientu sistēmā n-oktanols/ūdens (1) (2) (3) (4) (5) (6) (7).
Šajā testā aprakstītā eksperimenta metode adsorbcijas koeficienta Koc novērtēšanai uz augsnes un kanalizācijas nosēdumiem izmanto HPLC (8). Ar to novērtētie lielumi ir ticamāki nekā ar QSAR aprēķiniem iegūtie. Kā novērtēšanas metode tā nevar pilnībā aizstāt kratīšanas līdzsvara eksperimentus, kas izmantoti testa metodē C.18. Novērtētais Koc tomēr var būt noderīgs piemērotu testa parametru izvēlē adsorbcijas/desorbcijas pētījumiem saskaņā ar C.18. testa metodi, aprēķinot Kd (sadalījuma koeficientu) vai Kf (Freindliha adsorbcijas koeficientu) saskaņā ar vienādojumu (3) (skatīt 1.2. punktu).
1.2. DEFINĪCIJAS
K d : sadalījuma koeficients ir definēts kā izšķīdinātas testa vielas līdzsvara koncentrāciju attiecība divfāžu sistēmā, kas sastāv no sorbenta (augsnes vai kanalizācijas nosēdumiem) un ūdens fāzes; tas ir bezdimensiju lielums, ja koncentrācijas abās fāzēs izsaka kā masas/masas koncentrācijas. Ja ūdens fāzes koncentrācija ir dota kā masas/tilpuma koncentrācija, tad vienības ir ml. g–1. Kd var mainīties, mainoties sorbenta īpašībām, un var būt atkarīgs no koncentrācijas.
|
|
(1) |
kur:
|
Csoil |
= |
testa vielas koncentrācija uz augsnes līdzsvara stāvoklī (μg· g-1), |
|
Csludge |
= |
testa vielas koncentrācija uz nosēdumiem līdzsvara stāvoklī (μg· g-1), |
|
Caq |
= |
testa vielas koncentrācija ūdens fāzē līdzsvara stāvoklī (μg· g-1, μg· ml-1). |
K f : Freindliha adsorbcijas koeficients ir definēts kā testa vielas koncentrācija uz augsnes vai uz nosēdumiem (x/m), ja līdzsvara stāvokļa koncentrācija Caq ūdens fāzē ir vienāda ar vienu; vienības ir sorbenta μg. g–1. Lielums var mainīties, mainoties sorbenta īpašībām.
|
|
(1) |
kur:
|
x/m |
= |
testa vielas daudzums x (μg), kas adsorbēts uz sorbenta daudzuma m (g) līdzsvara stāvoklī, |
|
1/n |
= |
Freindliha adsorbcijas izotermas slīpums, |
|
Caq |
= |
testa vielas koncentrācija ūdens fāzē līdzsvara stāvoklī (μg· ml-1) |
At
![]()
K oc : Sadalījuma koeficients (Kd) vai Freindliha adsorbcijas koeficients (Kf), normalizēts attiecībā uz sorbenta organiskā oglekļa saturu (foc); jo īpaši nejonizētām ķimikālijām tas ir aptuvens indikators vielas adsorbcijas līmenim uz sorbenta un ļauj salīdzināt dažādas ķimikālijas. Atkarībā no Kd un Kf dimensijām Koc var būt bezdimensiju lielums vai arī tam var būt vienības ml. g-1 vai μg. g-1 organisko vielu.
|
|
(3) |
Sakarība starp Koc un Kd vienmēr nav lineāra, un Koc lielumi var mainīties no augsnes uz augsni, bet to mainīgums ir stipri mazāks, salīdzinot ar Kd vai Kf lielumiem.
Adsorbcijas koeficientu (Koc) iegūst no ietilpības koeficienta (k'), izmantojot ar izraudzītiem standartsavienojumiem konstruētu kalibrācijas grafiku log k' pret log Koc.
|
|
(4) |
kur:
|
tR |
= |
testa vielas un standartvielas HPLC aiztures laiks (minūtēs), |
|
t0 |
= |
HPLC“mirušais” laiks (minūtēs) (skatīt 1.8.2. punktu). |
P OW : sadalījuma koeficients sistēmā oktanols–ūdens ir definēts kā izšķīdušās vielas koncentrāciju attiecība n-oktanolā un ūdenī; tas ir bezdimensiju lielums.
|
|
(5) |
1.3. STANDARTVIELAS
Pirms metodes izmantošanas jāzina struktūrformula, tīrība un – attiecīgā gadījumā – disociācijas konstante. Noderīga ir informācija par šķīdību ūdenī un organiskajos šķīdinātājos, par sadalījuma koeficientu sistēmā oktanols–ūdens un par hidrolīzes īpašībām.
Lai korelētu testa vielas izmērītos HPLC aiztures laika datus ar adsorbcijas koeficientu Koc, ir jāizveido kalibrācijas grafika log Koc atkarībai no log k'. Jāizmanto vismaz seši kalibrācijas punkti, vismaz viens zem testa vielas sagaidāmā lieluma un vismaz viens virs šā lieluma. Metodes precizitāte ievērojami uzlabosies, ja izmantos standartvielas, kas ir strukturāli radniecīgas testa vielai. Ja tādi dati nav pieejami, tad piemērotas kalibrēšanas vielas izvēlas pēc lietotāja ieskatiem. Tādā gadījumā būtu jāizvēlas vispārīgāks strukturāli dažādu vielu kopums. Vielas un Koc lielumi, ko var izmantot, ir uzskaitīti papildinājuma 1. tabulā kanalizācijas nosēdumiem un 3. tabulā augsnei. Citu kalibrācijas vielu izvēle ir jāpamato.
1.4. TESTA METODES PRINCIPS
HPLC izdara ar analīzes kolonnām, kas pildītas ar tirdzniecībā pieejamu ciānpropila cieto fāzi, kura satur lipofīlas un polāras daļiņas. Izmanto vidēji polāru nekustīgo fāzi uz silikagēla matrices:
|
– O – Si |
– CH2 – CH2 – CH2 |
– CN |
|
silikagēls |
nepolāra atdalošā daļa |
polārā daļiņa |
Testa metodes princips ir līdzīgs A.8. testa metodei (sadalījuma koeficients, HPLC metode). Ejot cauri kolonnai kopā ar kustīgo fāzi, testa viela savstarpēji iedarbojas ar nekustīgo fāzi. Sadalīšanās dēļ starp kustīgo un nekustīgo fāzi testa viela aizkavējas. Nekustīgās fāzes struktūras divdabība ar polārām un nepolārām vietām ļauj tai savstarpēji sadarboties ar molekulas polārajām un nepolārajām grupām līdzīgi tam, kā notiek ar augsnes vai kanalizācijas nosēdumu matrices organiskajām sastāvdaļām. Tas dod iespēju noskaidrot sakarību starp aiztures laiku kolonnā un adsorbcijas koeficientu uz organiskās sastāvdaļas.
Sorbcijas izturēšanos lielā mērā ietekmē pH, jo īpaši polārām vielām. Lauksaimniecības augsnēs vai kanalizācijas ūdeņu attīrīšanas uzņēmumu tvertnēs pH parasti mainās no 5,5 līdz 7,5. Jonizējamām vielām būtu jāizdara divi testi gan ar jonizēto, gan ar nejonizēto formu piemērotos buferšķīdumos, bet tikai tad, ja vismaz 10 % testa vielas disociē pH intervālā no 5,5 līdz 7,5.
Tā kā novērtēšanai izmanto vienīgi sakarību starp aizturi HPLC kolonnā un adsorbcijas koeficientu, nav vajadzīga kvantitatīva analītiska metode un ir jānosaka tikai aiztures laiks. Ja ir pieejams piemērotu standartvielu kopums un var izmantot standarta eksperimentālos apstākļus, metode nodrošina ātru un efektīvu veidu adsorbcijas koeficienta Koc noteikšanai.
1.5. TESTA PIELIETOJAMĪBA
HPLC metode ir izmantojama ķīmiskām vielām (iezīmētām vai neiezīmētām), kurām ir pieejama piemērota noteikšanas sistēma (piemēram, spektrofotometrs, radioaktivitātes detektors) un kuras ir pietiekami stabilas eksperimenta laikā. Metode var būt jo īpaši noderīga ķimikālijām, ko ir grūti pētīt citās eksperimenta sistēmās (t. i., gaistošām vielām; vielām, kas nešķīst ūdenī koncentrācijās, kuras var analītiski mērīt; vielām, kurām ir liela tieksme attiecībā uz inkubācijas sistēmas virsmu). Metodi var izmantot maisījumiem, kas dod neizšķirtas eluēšanas joslas. Tādā gadījumā testa maisījuma savienojumiem ir jānosaka log Koc lielumu augšējā un apakšējā robeža.
Dažreiz HPLC rezultātu interpretācijā sarežģījumus var radīt piemaisījumi, bet tie ir mazsvarīgi, ja testa vielu var skaidri identificēt un atdalīt no piemaisījumiem.
Metodes pareizība ir pārbaudīta papildinājuma 1. tabulā uzskaitītajām vielām, un metode ir lietota arī dažādām citām ķimikālijām, kas pieder šādām ķīmisko savienojumu klasēm:
— aromātiskajiem amīniem (piemēram, trifluralīns, 4-hloranilīns, 3,5-dinitroanilīns, 4-metilanilīns, N-metilanilīns, 1-naftilamīns),
— aromātiskajiem karbonskābju esteriem (piemēram, benzoskābes metilesteris, 3,5-dinitrobenzoskābes etilesteris),
— aromātiskajiem ogļūdeņražiem (piemēram, toluols, ksilols, etilbenzols, nitrobenzols),
— ariloksifenoksipropionskābes esteriem (piemēram, diklofop-metils, fenoksaprop-etils, fenoksaprop-P-etils),
— benzimidazola un imidazola fungicīdiem (piemēram, karbendazims, fuberidazols, triazoksīds),
— karbonskābju amīdiem (piemēram, 2-hlorbenzamīds, N, N-dimetilbenzamīds, 3,5-dinitrobenzamīds, N-metilbenzamīds, 2-nitrobenzamīds, 3-nitrobenzamīds),
— hlorētajiem ogļūdeņražiem (piemēram, endosulfāns, DDT, heksahlorbenzols, kvintocēns, 1,2,3-trihlorbenzols),
— fosfororganiskajiem insekticīdiem (piemēram, azinfos-metils, disulfotons, fenamifoss, izofenfoss, pirazofoss, sulprofoss, triazofoss),
— fenoliem (piemēram, fenols, 2-nitrofenols, 4-nitrofenols, pentahlorfenols, 2,4,6-trihlorfenols, 1-naftols),
— fenilurīnvielas atvasinājumiem (piemēram, izoproturons, monolinurons, pensikurons),
— pigmenta krāsvielām (piemēram, Acid Yellow 219, Basic Blue 41, Direct Red 81),
— poliaromātiskajiem ogļūdeņražiem (piemēram, acenaftēns, naftalīns),
— 1,3,5-triazīna herbicīdiem (piemēram, prometrīns, propazīns, simazīns, terbutrīns),
— triazola atvasinājumiem (piemēram, tebukonazols, triadimefons, tradimenols, triapentenols).
Metode nav izmantojama vielām, kas reaģē ar eluentu vai ar nekustīgo fāzi. Tā nav izmantojama arī vielām, kas īpašā veidā iedarbojas ar neorganiskajām sastāvdaļām (piemēram, veido klasteru kompleksus ar mālu minerālvielām). Metode var nebūt derīga virsmas aktīvām vielām, neorganiskiem savienojumiem un vidēji stiprām vai stiprām organiskām skābēm un bāzēm. Var noteikt log Koc lielumus no 1,5 līdz 5,0. Jonizējamas vielas ir jāmēra, izmantojot buferētu kustīgo fāzi, bet ir jāpievērš uzmanība, lai neizgulsnētos bufera sastāvdaļas vai testa viela.
1.6. KVALITĀTES KRITĒRIJI
1.6.1 Precizitāte
Parasti testa vielas adsorbcijas koeficientu var noteikt ar precizitāti ± 0,5 logaritmiskās vienības no lieluma, kas noteikts ar kratīšanas metodi (skatīt papildinājuma 1. tabulu). Lielāku precizitāti var sasniegt, ja izmantotās standartvielas ir strukturāli radniecīgas testa vielai.
1.6.2. Atkārtojamība
Noteikšanas jāizdara vismaz divos eksemplāros. No atsevišķajiem mērījumiem iegūtajiem log Koc lielumiem jābūt 0,25 logaritmisko vienību diapazonā.
1.6.3 Reproducējamība
Pagaidām izmantošanā gūtā pieredze apstiprina metodes derīgumu. HPLC metodes pētījumā, izmantojot 48 vielas (galvenokārt pesticīdus), par kurām bija pieejami ticami Koc dati uz augsnēm, ir iegūts korelācijas koeficients R = 0,95 (10) (11).
Lai uzlabotu un pamatotu šo metodi, tika izdarīts starplaboratoriju salīdzinošs tests, kurā piedalījās 11 laboratorijas (12). Rezultāti ir papildinājuma 2. tabulā.
1.7. TESTA METODES APRAKSTS
1.7.1. Adsorbcijas koeficienta novērtēšanas priekšmēģinājums
Par indikatoriem adsorbcijas lielumam var izmantot sadalījuma koeficientu sistēmā oktanols–ūdens Pow (= Kow) un, zināmā mērā, šķīdību ūdenī, jo īpaši nejonizētām vielām, un tādā veidā tos var izmantot, lai iepriekš novērtētu diapazonu. Vairākām ķimikāliju grupām ir publicētas dažādas noderīgas korelācijas (1) (2) (3) (4) (5) (6) (7).
1.7.2. Iekārta
Šķidruma hromatogrāfs, aprīkots ar bezpulsāciju sūkni un piemērotu detektoru. Ir ieteicams izmantot injicēšanas ventili ar injekciju cilpu. Izmanto tirdzniecībā esošos ķīmiski piesaistītos ciānpropila sveķus uz silikagēla pamata (piemēram, Hypersil un Zorbax CN). Starp injekcijas sistēmu un analīzes kolonnu var ievietot tā paša materiāla priekškolonnu. Dažādu piegādātāju kolonnas var ievērojami atšķirties pēc sadalīšanas efektivitātes. Orientējoši vajadzētu sasniegt šādus ietilpības koeficientus k': log k' > 0,0, ja log Koc = 3,0 un log k' > 0,4, ja log K'oc = 2,0, izmantojot 55/45 % metanola/ūdens maisījumu par kustīgo fāzi.
1.7.3. Kustīgās fāzes
Ir testētas vairākas kustīgās fāzes, un ir ieteicamas šādas divas:
— metanols/ūdens (55/45 % tilp./tilp.),
— metanols/0,01M citrāta buferšķīdums pH 6,0 (55/45 % tilp./tilp.).
Lai pagatavotu eluentu, izmanto HPLC kvalitātes metanolu un destilētu ūdeni vai citrāta buferšķīdumu. Maisījumu pirms lietošanas atbrīvo no gāzēm. Jāizmanto izokrātiskā eluēšana. Ja metanola/ūdens maisījumi nav piemēroti, var izmēģināt citus organisko šķīdinātāju/ūdens maisījumus, piemēram, etanola/ūdens vai acetonitrila/ūdens maisījumus. Jonizējamiem savienojumiem ir ieteicams lietot buferšķīdumu, lai stabilizētu pH. Ir jāpievērš vērība, lai neizgulsnētu sāļus un nebojātu kolonnu, kas var notikt ar dažiem organiskās fāzes/buferšķīdumu maisījumiem.
Nedrīkst izmantot tādas piedevas kā jonu pāru reaģenti, jo tie var ietekmēt nekustīgās fāzes sorbcijas īpašības. Tādas nekustīgās fāzes pārmaiņas var būt neatgriezeniskas. Šā iemesla dēļ eksperimentus, kuros izmanto piedevas, izdara ar atsevišķām kolonnām.
1.7.4. Šķīdināmās vielas
Testa vielas un standartvielas jāizšķīdina kustīgajā fāzē.
1.8. TESTA VEIKŠANA
1.8.1. Testa apstākļi
Mērījumu laikā jāreģistrē temperatūra. Lai garantētu nemainīgus apstākļus kalibrēšanas gaitā un testa vielas vērtēšanas un mērīšanas gaitā, ir ļoti ieteicams izmantot kolonnas termostatu ar kontrolējamu temperatūru.
1.8.2. “Mirušā” laika to noteikšana
“Mirušā” laika to noteikšanai var izmantot divas atšķirīgas metodes (skatīt arī 1.2. punktu).
1.8.2.1. “Mirušā” laika to noteikšana ar homologu rindām
Ir pārbaudīts, ka šī procedūra dod ticamus un standartizētus to lielumus. Sīkāku informāciju skatīt A.8. testa metodē: Sadalījuma koeficients (n-oktanols/ūdens), HPLC metode.
1.8.2.2. “Mirušā” laika to noteikšana ar inertām vielām, ko neaiztur kolonna
Šī metode pamatojas uz formamīda, urīnvielas vai nātrija nitrāta šķīdumu injicēšanu. Noteikšanas jāizdara vismaz divos eksemplāros.
1.8.3. Aiztures laiku tR noteikšana
Standartvielas jāizraugās, kā aprakstīts 1.3. punktā. Lai noteiktu standartvielu aiztures laikus, tās var injicēt kā jauktu standartu ar nosacījumu, ka ir apstiprināts, ka katras standartvielas aiztures laiku neietekmē citu standartvielu klātbūtne. Kalibrēšana būtu jāizdara regulāri vismaz divreiz dienā, lai ņemtu vērā neparedzētas pārmaiņas kolonnas darbībā. Labākai praksei kalibrēšanas injekcijas būtu jāizdara pirms testa vielas injicēšanas un pēc tās, lai apstiprinātu, ka aiztures laiki nav nobīdījušies. Testa vielas injicē atsevišķi iespējami mazos daudzumos (lai novērstu kolonnas pārslodzi) un nosaka to aiztures laikus.
Lai palielinātu mērījumu ticamību, noteikšanas ir jāizdara vismaz divos eksemplāros. No atsevišķajiem mērījumiem iegūtajiem log Koc lielumiem jābūt 0,25 logaritmisko vienību diapazonā.
1.8.4. Novērtēšana
Izraudzītajām standartvielām no “mirušā” laika to un no aiztures laikiem tR aprēķina ietilpības koeficientus k' saskaņā ar vienādojumu (4) (skatīt 1.2. punktu). Standartvielu log k' pēc tam atliek grafiski pret standartvielu log Koc lielumiem, kas iegūti kratīšanas eksperimentos un doti papildinājuma 1. un 3. tabulā. Izmantojot minēto grafiku, no testa vielas log k' lieluma pēc tam nosaka tās log Koc lielumu. Ja faktiskais rezultāts rāda, ka testa vielas log Koc ir ārpus kalibrēšanas diapazona, tests ir jāatkārto, izmantojot citas, piemērotākas standartvielas.
2. DATI UN TO NOFORMĒŠANA
Ziņojumā jāiekļauj šāda informācija:
— testa vielu un standartvielu identifikācija un to tīrība, un attiecīgā gadījumā pKa lielumi,
— iekārtas un darba apstākļu apraksts, piemēram, analītiskās kolonnas (un priekškolonnas) tips un izmēri, detektors, kustīgā fāze (komponentu attiecība un pH), temperatūras diapazons mērījumu laikā,
— “mirušais” laiks un tā noteikšanas metode,
— kolonnā ievadītie testa vielas un standartvielu daudzumi,
— kalibrēšanā izmantoto standartvielu aiztures laiki,
— uzkonstruētās regresijas līnijas dati (log k' pret log Koc) un regresijas līnijas grafiks,
— testa savienojuma vidējie aiztures laika dati un noteiktais log Koc lielums,
— hromatogrammas.
3. IZMANTOTĀ LITERATŪRA
(1) W.J. Lyman, W.F. Reehl, D.H. Rosenblatt (ed). (1990). Handbook of chemical property estimation methods, chapt. 4, McGraw-Hill, New York.
(2) J. Hodson, N.A. Williams (1988). The estimation of the adsorption coefficient (Koc) for soils by HPLC. Chemosphere, 17, p. 67.
(3) G.G. Briggs (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem., 29, p.1050–1059.
(4) C.T. Chiou, P.E. Porter, D.W. Schmedding (1983). Partition equilibria of nonionic organic compounds between soil organic matter and water. Environ. Sci. Technol., 17, p. 227–231.
(5) Z. Gerstl, U. Mingelgrin (1984). Sorption of organic substances by soils and sediment. J. Environm. Sci. Health, B19, p. 297–312.
(6) C.T. Chiou, L.J. Peters, V. H. Freed (1979). A physical concept of soil water equilibria for nonionic organic compounds, Science, 106, p. 831–832.
(7) S.W. Karickhoff (1981). Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils. Chemosphere, 10, p. 833–846.
(8) W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), p. 121–128.
(9) M. Mueller, W. Kördel (1996). Comparison of screening methods for the estimation of adsorption coefficients on soil. Chemosphere, 32(12), p. 2493–2504.
(10) W. Kördel, J. Stutte, G. Kotthoff (1993). HPLC-screening method for the determination of the adsorption coefficient in soil-comparison of different stationary phases, Chemosphere, 27(12), p. 2341–2352.
(11) B. von Oepen, W. Kördel, W. Klein (1991). Sorption of nonpolar and polar compounds to soils: Processes, measurements and experience with the applicability of the modified OECD Guideline 106, Chemosphere, 22, p. 285–304.
(12) W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), p. 1373–1384.
PAPILDINĀJUMS
1. tabula
Koc lielumu salīdzinājums augsnēm un kanalizācijas nosēdumiem ar lielumiem, kas aprēķināti no HPLC skrīninga metodes (1) (2)
|
Viela |
CAS Nr. |
log Koc kanalizācijas nosēdumiem |
log Koc HPLC |
Δ |
log Koc augsnēm |
log Koc HPLC |
Δ |
|
Atrazīns |
1912-24-9 |
1,66 |
2,14 |
0,48 |
1,81 |
2,20 |
0,39 |
|
Linurons |
330-55-2 |
2,43 |
2,96 |
0,53 |
2,59 |
2,89 |
0,30 |
|
Fentions |
55-38-9 |
3,75 |
3,58 |
0,17 |
3,31 |
3,40 |
0,09 |
|
Monurons |
150-68-5 |
1,46 |
2,21 |
0,75 |
1,99 |
2,26 |
0,27 |
|
Fenantrēns |
85-01-8 |
4,35 |
3,72 |
0,63 |
4,09 |
3,52 |
0,57 |
|
Benzoskābes fenilesteris |
93-99-2 |
3,26 |
3,03 |
0,23 |
2,87 |
2,94 |
0,07 |
|
Benzamīds |
55-21-0 |
1,60 |
1,00 |
0,60 |
1,26 |
1,25 |
0,01 |
|
4-Nitrobenzamīds |
619-80-7 |
1,52 |
1,49 |
0,03 |
1,93 |
1,66 |
0,27 |
|
Acetanilīds |
103-84-4 |
1,52 |
1,53 |
0,01 |
1,26 |
1,69 |
0,08 |
|
Anilīns |
62-53-3 |
1,74 |
1,47 |
0,27 |
2,07 |
1,64 |
0,43 |
|
2,5-Dihloranilīns |
95-82-9 |
2,45 |
2,59 |
0,14 |
2,55 |
2,58 |
0,03 |
|
(1) W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), p. 121–128. (2) W. Kördel, D. Hennecke, C. Franke (1997). Determination of the adsorption-coefficients of organic substances on sewage sludges. Chemosphere, 35 (1/2), p. 107–119. |
|||||||
2. tabula
Starplaboratoriju salīdzinoša testa (piedalījušās 11 laboratorijas) rezultāti HPLC metodes uzlabošanai un novērtēšanai (1)
|
Substance |
CAS Nr. |
log Koc |
Koc |
log Koc |
|
[OECD 106] |
[HPLC metode] |
|||
|
Atrazīns |
1912-24-9 |
1,81 |
78 ± 16 |
1,89 |
|
Monurons |
150-68-5 |
1,99 |
100 ± 8 |
2,00 |
|
Triapentenols |
77608-88-3 |
2,37 |
292 ± 58 |
2,47 |
|
Linurons |
330-55-2 |
2,59 |
465 ± 62 |
2,67 |
|
Fentions |
55-38-9 |
3,31 |
2062 ± 648 |
3,31 |
|
(1) W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), p. 1373–1384. |
||||
3. tabula
Ieteicamās standartvielas HPLC skrīninga metodei, kas pamatojas uz datiem par adsorbciju uz augsnes.
|
Standartviela |
CAS Nr. |
Vidējie Koc lielumi no kratīšanas metodes |
Koc datu skaits |
log S.D. |
Avots |
|
Acetanilīds |
103-84-4 |
1,25 |
4 |
0,48 |
|
|
Fenols |
108-95-2 |
1,32 |
4 |
0,70 |
|
|
2-Nitrobenzamīds |
610-15-1 |
1,45 |
3 |
0,90 |
|
|
N.N-dimetilbenzamīds |
611-74-5 |
1,52 |
2 |
0,45 |
|
|
4-Metilbenzamīds |
619-55-6 |
1,78 |
3 |
1,76 |
|
|
Metilbenzoāts |
93-58-3 |
1,80 |
4 |
1,08 |
|
|
Atrazīns |
1912-24-9 |
1,81 |
3 |
1,08 |
|
|
Izoproturons |
34123-59-6 |
1,86 |
5 |
1,53 |
|
|
3-Nitrobenzamīds |
645-09-0 |
1,95 |
3 |
1,31 |
|
|
Anilīns |
62-53-3 |
2,07 |
4 |
1,73 |
|
|
3,5-Dinitrobenzamīds |
121-81-3 |
2,31 |
3 |
1,27 |
|
|
Karbendazīms |
10605-21-7 |
2,35 |
3 |
1,37 |
|
|
Triadimenols |
55219-65-3 |
2,40 |
3 |
1,85 |
|
|
Triazoksīds |
72459-58-6 |
2,44 |
3 |
1,66 |
|
|
Triazofoss |
24017-47-8 |
2,55 |
3 |
1,78 |
|
|
Linurons |
330-55-2 |
2,59 |
3 |
1,97 |
|
|
Naftalīns |
91-20-3 |
2,75 |
4 |
2,20 |
|
|
Endosulfāndiols |
2157-19-9 |
3,02 |
5 |
2,29 |
|
|
Metiokarbs |
2032-65-7 |
3,10 |
4 |
2,39 |
|
|
Acid Yellow 219 |
63405-85-6 |
3,16 |
4 |
2,83 |
|
|
1,2,3-Trihlorbenzols |
87-61-6 |
3,16 |
4 |
1,40 |
|
|
γ-HCH |
58-89-9 |
3,23 |
5 |
2,94 |
|
|
Fentions |
55-38-9 |
3,31 |
3 |
2,49 |
|
|
Direct Red |
2610-11-9 |
3,43 |
4 |
2,68 |
|
|
Pirazofoss |
13457-18-6 |
3,65 |
3 |
2,70 |
|
|
α-Endosulfans |
959-98-8 |
4,09 |
5 |
3,74 |
|
|
Diklofop-metils |
51338-27-3 |
4,20 |
3 |
3,77 |
|
|
Fenantrēns |
85-01-8 |
4,09 |
4 |
3,83 |
|
|
Basic Blue 41 (mix) |
26850-47-5 12270-13-2 |
4,89 |
4 |
4,46 |
|
|
DDT |
50-29-3 |
5,63 |
1 |
— |
|
|
(1) W. Kördel, J. Müller (1994). Bestimmung des Adsorptionskoeffizienten organischer Chemikalien mit der HPLC. UBA R & D Report No. 106 01 044 (1994). (2) B.V. Oepen, W. Kördel, W. Klein. (1991). Chemosphere, 22, p. 285–304. (3) Rūpniecības dati. |
|||||
C.20 DAPHNIA MAGNA VAIROŠANĀS TESTS
1. METODE
Šī vairošanās toksicitātes testa metode ir ESAO TG 211 (1998) kopija.
1.1. IEVADS
Testa galvenais mērķis ir novērtēt ķimikāliju ietekmi uz Daphnia magna vairošanās iznākumu.
1.2. DEFINĪCIJAS UN MĒRVIENĪBAS
Vecāki: dafniju mātītes, kuras ir, sākot testu, un kuru vairošanās iznākums ir pētījuma objekts.
Pēcnācēji: jaunās dafnijas, ko testa gaitā radījuši vecāki.
Mazākās novērojamās ietekmes koncentrācija (LOEC ): mazākā pārbaudītā koncentrācija, ar kuru noteiktā iedarbības laika posmā ir novērota statistiski nozīmīga vielas ietekme uz vairošanos un vecāku mirstību (pie p < 0,05), salīdzinot ar kontrolmēģinājumu. Tomēr ar visām testa koncentrācijām, kas lielākas par LOEC, ir jābūt negatīvai ietekmei, kas ir vienāda ar vai lielāka par to negatīvo ietekmi, kas novērota ar LOEC. Ja šos divus nosacījumus nevar izpildīt, ir jādod pilnīgs izskaidrojums, kā ir izraudzīta LOEC (un līdz ar to NOEC).
Nenovērojamās ietekmes koncentrācija (NOEC ): testa koncentrācija, kas ir tieši zemāka par LOEC un ar kuru, salīdzinot ar kontroles mēģinājumu, noteiktā iedarbības laika posmā nav statistiski nozīmīgas ietekmes (p < 0,05).
EC x : ūdenī izšķīdinātas testa vielas koncentrācija, kas noteiktā iedarbības laika posmā izraisa Daphnia magna vairošanās samazinājumu par x %.
Raksturīgais pieauguma ātrums: populācijas augšanas mērs, kas iekļauj vairošanās iznākumu un vecumam specifisko mirstību (20) (21) (22). Nemainīgai populācijai tas ir vienāds ar nulli. Augošai populācijai tas ir pozitīvs un populācijai, kas samazinās, tas ir negatīvs. Protams, pēdējā minētā nav noturīga un beidzot izzūd.
Atklāšanas robeža: mazākā koncentrācija, ko var atklāt, bet ne kvantitatīvi noteikt.
Noteikšanas robeža: mazākā koncentrācija, ko var kvantitatīvi izmērīt.
Mirstība: dzīvnieku reģistrē kā mirušu, ja tas ir nekustīgs, t. i., ja tas nespēj peldēt vai ja nav novērojamas piedēkļu vai vēderiņa aizmugures daļas kustības 15 sekunžu laikā pēc testa trauka vieglas pakratīšanas. (Ja izmanto citu definīciju, tā ir jāprotokolē kopā ar norādi uz to.)
1.3. TESTA METODES PRINCIPS
Uz jaunām dafniju mātītēm (vecākiem), kas testa sākumā ir jaunākas par 24 stundām, ļauj iedarboties ūdenī izšķīdinātai testa vielai, kura pievienota ūdenim koncentrāciju diapazonā. Testa ilgums ir 21 diena. Testa beigās novērtē kopējo dzīvo pēcnācēju skaitu, kas radies uz katru testa beigās dzīvu vecāku. Tas nozīmē, ka no aprēķiniem izslēdz jaunos dzīvniekus, kas radušies no pieaugušajiem dzīvniekiem, kuri vēlāk testa laikā miruši. Vecāku vairošanās iznākumu var izteikt citādi (piemēram, kā dzīvo pēcnācēju skaitu, kas radušies uz vienu dzīvnieku dienā, sākot no pirmās dienas, kad ir novērots, ka radies pēcnācējs), bet tie būtu jāprotokolē papildus kopējam jauno dzīvnieku skaitam, kas radušies, rēķinot uz testa beigās dzīvo vecāku. Testa vielas iedarbībai pakļauto dzīvnieku vairošanās iznākumu salīdzina ar vairošanās iznākumu kontroles mēģinājumā, lai noteiktu mazākās novērotās ietekmes koncentrāciju (LOEC) un līdz ar to nenovērojamas ietekmes koncentrāciju (NOEC). Turklāt, cik tas ir iespējams, datus analizē, izmantojot regresijas modeli, lai noteiktu koncentrāciju, kas izraisa vairošanās iznākuma samazinājumu par x % (t. i., EC50, EC20, vai EC10).
Ir jāprotokolē arī vecāku izdzīvošana un pirmo mazuļu rašanās laiks. Var aplūkot arī citas ar vielu saistītas ietekmes uz tādiem parametriem kā augšana (piemēram, garums) un varbūt raksturīgais pieauguma ātrums.
1.4. INFORMĀCIJA PAR TESTA VIELU
Jābūt pieejamiem ar Daphnia magna veiktā akūtās toksicitātes testa rezultātiem (skatīt I daļas C.2. metodi). Rezultāti var būt noderīgi, izvēloties vairošanās testiem piemērotu testa koncentrāciju diapazonu. Jāzina testa vielas šķīdība ūdenī un tvaika spiediens, un jābūt pieejamai drošai analītiskai metodei vielas daudzuma kvantitatīvai noteikšanai testa šķīdumos ar zināmu atgūšanas efektivitāti un noteikšanas robežu.
Informācija, kas var būt noderīga, izstrādājot testa apstākļus, iekļauj testa vielas struktūrformulu, tīrību, stabilitāti gaismas ietekmē, stabilitāti testa apstākļos, pKa, Pow un vieglas bionoārdīšanās testa rezultātus (skatīt C.4. metodi).
1.5. TESTA DERĪGUMS
Lai tests būtu derīgs, kontroles mēģinājumā(-os) tam jāatbilst šādiem izpildes kritērijiem:
— vecāku (dafniju mātīšu) mirstība testa beigās nepārsniedz 20 %,
— dzīvu pēcnācēju, kas radušies uz vienu vecāku, vidējais skaits testa beigās ir ≥ 60.
1.6. TESTA METODES APRAKSTS
1.6.1. Iekārtas
Testa traukiem un citām iekārtām, kas saskaras ar testa šķīdumiem, jābūt pilnībā izgatavotiem no stikla vai cita ķīmiski inerta materiāla. Testa trauki parasti ir stikla vārglāzes.
Turklāt ir vajadzīgs šāds aprīkojums vai daļa no tā:
— iekārta skābekļa koncentrācijas mērīšanai (ar mikroelektrodu vai citu piemērotu aprīkojumu izšķīdušā skābekļa mērīšanai maza tilpuma paraugos),
— piemērots termostats,
— pHmetrs,
— iekārta ūdens cietības noteikšanai,
— iekārta ūdens kopējā organiskā oglekļa koncentrācijas (TOC) noteikšanai vai iekārta skābekļa ķīmiskā patēriņa (COD) noteikšanai,
— piemērota iekārta apgaismojuma režīma kontrolei un gaismas intensitātes mērīšanai.
1.6.2. Testa organisms
Testā izmantojamā suga ir Daphnia magna Straus. Var izmantot citas Daphnia sugas ar nosacījumu, ka tās atbilst attiecīgiem derīguma kritērijiem (derīguma kritērijam, kas attiecas uz vairošanās iznākumu kontroles testā, jābūt raksturīgam Daphnia sugām). Ja izmanto citas Daphnia sugas, tām jābūt skaidri identificētām un to izmantošana jāpamato.
Vēlams klonu identificēt, nosakot genotipu. Pētījumā (1) ir parādīts, ka klons A (kura izcelsme ir IRCHA Francijā) (3) konsekventi atbilst derīguma kritērijam par vidēji ≥ 60 izdzīvojušiem pēctečiem, rēķinot uz vienu vecāku, ja tos audzē šajā metodē aprakstītajos apstākļos. Tomēr ir pieņemami citi kloni ar nosacījumu, ka ir parādīts, ka dafniju audzēšana atbilst testa derīguma kritērijiem.
Testu uzsākot, dzīvniekiem jābūt mazāk nekā 24 stundas veciem, un tie nedrīkst būt tiešie pēcteči no pirmā nārsta. To izcelsmei jābūt no veselīga bara (t. i., kas neuzrāda tādas stresa pazīmes kā liela mirstība, tēviņu un efipiju klātbūtne, pirmā nārsta aizkavēšanās, krāsu zaudējuši dzīvnieki utt.). Bara dzīvnieki jātur tādos audzēšanas apstākļos (gaisma, temperatūra, vide, barošana un dzīvnieku skaits tilpuma vienībā), kas ir līdzīgi testā izmantojamiem apstākļiem. Ja dafniju audzēšanas vide, ko izmanto testā, atšķiras no vides, ko izmanto parastā dafniju audzēšanā, laba prakse ir iekļaut pirmstesta aklimatizācijas posmu, kas parasti ir aptuveni trīs nedēļas (t. i., viena paaudze), lai izvairītos no vecāku stresa.
1.6.3. Testa vide
Ir ieteicams šajā testā izmantot pilnībā definētu vidi. Tā var izvairīties no grūti raksturojamu piedevu (piemēram, jūraszāļu, augsnes ekstrakta utt.) izmantošanas un tātad uzlabot standartizācijas iespējas starp laboratorijām. Šīm mērķim par piemērotām ir atrastas Elendt M44 un M7 vides (skatīt 1. papildinājumu). Tomēr ir pieņemamas citas vides (piemēram, (5) (6)) ar nosacījumu, ka ir parādīts, ka dafniju audzēšana atbilst testa derīguma kritērijiem.
Ja izmanto vidi, kas iekļauj nedefinētas piedevas, šādas piedevas skaidri jānorāda un testa ziņojumā jāsniedz informācija par sastāvu, jo īpaši attiecībā uz oglekļa saturu, tādēļ, ka tas var dot ieguldījumu paredzētajā dietā. Ir ieteicams noteikt kopējo organisko oglekli (TOC) un/vai skābekļa ķīmisko patēriņu (COD) organiskās piedevas izejas preparātā un novērtēt ieguldījumu attiecībā uz TOC/COD pagatavotajā testa vidē. Ir ieteicams, lai vides TOC līmenis (t. i., pirms aļģu pievienošanas) būtu mazāks par 2 mg/l (7).
Ja testa vielas satur metālus, ir svarīgi apzināties, ka testa vides īpašības (piemēram, cietība, helātu veidošanas spēja) var ietekmēt testa vielas toksicitāti. Šā iemesla dēļ ir vēlama pilnībā definēta vide. Tomēr pašlaik vienīgās pilnībā definētās vides, kas ir pazīstamas kā piemērotas Daphnia magna ilgtermiņa audzēšanai, ir Elendt M4 un M7. Abas vides satur helātus veidojošo reaģentu EDTA. Pētījumā (2) ir parādīts, ka kadmija “šķietamā toksicitāte” parasti ir mazāka, ja vairošanās testu izdara M4 un M7 vidē, nekā, ja to izdara vidē, kas nesatur EDTA. Tādēļ M4 un M7 nav ieteicamas, lai testētu metālus saturošas vielas, un jāizvairās arī lietot citas vides, kas satur zināmus helātus veidojošus reaģentus. Metālus saturošām vielām var būt ieteicams izmantot alternatīvu vidi, piemēram, pēc ASTM metodes atjaunotu cietu saldūdeni (7), kas nesatur EDTA, ar pievienotu jūraszāļu ekstraktu (8). Minētais pēc ASTM metodes atjaunotā cietā saldūdens apvienojums ar jūraszāļu ekstraktu ir piemērots arī Daphnia magna ilgtermiņa audzēšanai un testēšanai (2), kaut arī tam tomēr piemīt neliela helātu veidošanas spēja pievienotā jūraszāļu ekstrakta organisko sastāvdaļu dēļ.
Izšķīdušā skābekļa koncentrācijai testa sākumā un tā laikā jābūt lielākai par 3 mg/l. pH jābūt diapazonā no 6 līdz 9, un parasti tas vienā testā nedrīkst mainīties vairāk kā par 1,5 vienībām. Cietība ir ieteicama lielāka par 140 mg/l (rēķinot uz CaCO3). Testi šajā cietības līmenī un virs tā ir parādījuši vairošanās spēju, kas atbilst derīguma kritērijiem (9) (10).
1.6.4. Testa šķīdumi
Izraudzītās koncentrācijas testa šķīdumus parasti gatavo, atšķaidot izejas šķīdumu. Izejas šķīdumu vēlams gatavot, izšķīdinot vielu testa vidē.
Lai iegūtu piemērotas koncentrācijas izejas šķīdumu, dažos gadījumos var vajadzēt izmantot organiskos šķīdinātājus vai disperģētājas vielas, bet šādus materiālus izmantot ir jāizvairās, cik vien iespējams. Piemērotu šķīdinātāju piemēri ir acetons, etilspirts, metilspirts, dimetilformamīds un trietilēnglikols. Piemērotu disperģētāju vielu piemēri ir Cremophor RH40, 0,01 % metilceluloze un HCO-40. Katrā ziņā testa viela testa šķīdumos nedrīkst pārsniegt šķīdības robežu testa vidē.
Šķīdinātājus izmanto, lai iegūtu izejas šķīdumu, ko precīzi varētu dozēt ūdenī. Pie galīgajā testa vidē ieteicamās šķīdinātāja koncentrācijas (t. i., ≤ 0,1 ml/l) iepriekš uzskaitītie šķīdinātāji nav toksiski un nepalielina vielas šķīdību ūdenī.
Disperģētājas vielas var atvieglot precīzu dozēšanu un disperģēšanu. Pie galīgajā testa vidē ieteicamās šķīdinātāja koncentrācijas (≤ 0,1 ml/l) iepriekš uzskaitītās disperģētājas vielas nav toksiskas un nepalielina vielas šķīdību ūdenī.
1.7. TESTA PLĀNS
Apstrāde būtu jāizdara testa traukos, un visas turpmākās darbības ar testa traukiem būtu jāveic pēc nejaušās izvēles. Ja tā nedara, tas var radīt neobjektivitāti, ko varētu uzskatīt par koncentrācijas ietekmi. Jo īpaši, ja ar eksperimenta vienībām rīkojas apstrādes vai koncentrācijas secībā, tad dažas ar laiku saistītas ietekmes, piemēram, eksperimentatora nogurums vai cita kļūda, var radīt lielāku ietekmi lielākās koncentrācijās. Turklāt, ja testa rezultātus varētu ietekmēt testa sākotnējie vai apkārtējie apstākļi, piemēram, novietojums laboratorijā, tad būtu jāapsver testa bloķēšana.
1.8. PROCEDŪRA
1.8.1. Iedarbības apstākļi
1.8.1.1. Ilgums
Testa ilgums ir 21 diena.
1.8.1.2. Ievietošana
Vecākus tur atsevišķi, katrā testa traukā vienu ar 50–100 ml vides katrā traukā.
Lai atbilstu lietojamai analītiskajai procedūrai, ko izmanto testa vielas koncentrācijas noteikšanai, dažreiz var būt vajadzīgi lielāki tilpumi, kaut arī ir pieļaujams apvienot vienādas koncentrācijas trauku saturu, lai izdarītu ķīmisko analīzi. Ja izmanto tilpumus, kas lielāki par 100 ml, var vajadzēt palielināt dafnijām doto barības daudzumu, lai nodrošinātu atbilstīgu barības pieejamību un atbilstību derīguma kritērijiem. Caurplūdes testiem tehnisku iemeslu dēļ var izskatīt alternatīvus projektus (piemēram, četras 10 dzīvnieku grupas lielākā testa tilpumā), bet pārmaiņas testa plānā būtu jāprotokolē.
1.8.1.3. Dzīvnieku skaits
Pusstatiskos testos vismaz 10 dzīvniekus tur atsevišķi katrā testa koncentrācijā un vismaz 10 dzīvniekus tur atsevišķi kontroles sērijā.
Caurplūsmas testos (1) ir parādīts, ka ir piemēroti 40 dzīvniekus sadalīt četrās grupās pa 10 dzīvniekiem katrā testa koncentrācijā. Var izmantot mazāku testa organismu skaitu un ir ieteicams vismaz 20 dzīvnieku uz koncentrāciju, sadalot divos vai vairākos atkārtojumos ar vienādu dzīvnieku skaitu (piemēram, četri atkārtojumi ar piecām dafnijām katrā). Ievērojiet, ka testos, kur dzīvnieki tiek turēti grupās, nebūs iespējams izteikt vairošanās iznākumu kā dzīvo pēcteču skaitu uz vienu vecāku, kas ir dzīvs testa beigās, ja vecāki nomirs. Šādos gadījumos vairošanās iznākums būtu jāizsaka kā “dzīvo pēcteču kopējais skaits, kas radies uz katru testa sākumā esošo vecāku”.
1.8.1.4. Barošana
Pusstatiskos testos barošanu vēlams izdarīt reizi dienā, bet vismaz trīs reizes nedēļā (t. i. atbilstīgi vides pārmaiņām). Atkāpes no tā (piemēram, caurplūdes testos) būtu jāprotokolē.
Testa laikā vecāku diētai vēlamas dzīvas vienas vai vairāku šādu sugu aļģu šūnas: Chlorella sp., Selenastrum capricornutum (tagad Pseudokirchneriella subcapitata (11)) un Scenedesmus subspicatus. Piegādātajai diētai jāpamatojas uz katram vecākam piegādātā organiskā oglekļa (C) daudzumu. Pētījumā (12) ir parādīts, ka Daphnia magna gadījumā barības līmeņi starp 0,1 un 0,2 mg C uz dafniju dienā ir pietiekami, lai sasniegtu vajadzīgo pēcnācēju skaitu atbilstīgi testa derīguma kritērijiem. Barību var piegādāt vai nu nemainīgā daudzumā visā testa laikā, vai, ja vēlas, sākumā var piegādāt mazāku daudzumu un pēc tam testa laikā to palielināt, lai ņemtu vērā vecāku augšanu. Šādā gadījumā barībai tomēr būtu visu laiku jāpaliek ieteicamajā diapazonā 0,1–0,2 mg C uz dafniju dienā.
Ja vajadzīgā barības daudzuma izbarošanai ir jāizmanto tādi aizvietotāji mērījumi kā aļģu šūnu skaits vai gaismas absorbcija (t. i., ērtībai, jo oglekļa satura mērījumi ir laikietilpīgi), tad katrai laboratorijai ir jāizveido savas nomogrammas, kas saista aizvietotāju mērījumu ar aļģu kultūras oglekļa saturu (padomu par nomogrammu izveidi skatīt 2. papildinājumā). Nomogrammas būtu jāpārbauda vismaz reizi gadā, un tas jādara biežāk, ja ir mainījušies aļģu kultūras apstākļi. Ir konstatēts, ka gaismas absorbcija ir labāks aizvietotājs oglekļa satura mērījumiem nekā šūnu skaits (13).
Lai samazinātu līdz minimumam aļģu kultūras vides tilpumu, ko pārnes testa traukos, dafnijām būtu jāizbaro koncentrēta aļģu suspensija. Aļģu koncentrēšanu var sasniegt centrifugējot, kam seko suspendēšana no jauna destilētā ūdenī, dejonizētā ūdenī vai dafnijuaudzēšanas vidē.
1.8.1.5. Gaisma
16 stundu gaismas ar intensitāti, kas nav lielāka par 15–20 μE. m–2. s– 1.
1.8.1.6. Temperatūra
Testa vides temperatūrai būtu jābūt 18–22 oC diapazonā. Tomēr katrā atsevišķā testā temperatūra, ja iespējams, šajās robežās nedrīkstētu mainīties vairāk kā par 2 oC (piemēram, 18–20, 19–21 vai 20–22 oC). Var būt lietderīgi izmantot papildu testa trauku temperatūras uzraudzīšanas mērķiem.
1.8.1.7. Piesātināšana ar gaisu
Testa laikā testa traukus nedrīkst piesātināt ar gaisu.
1.8.2. Testa koncentrācija
Parasti būtu jābūt vismaz piecām testa koncentrācijām, kas sakārtotas ģeometriskā rindā un atšķiras ar koeficientu, kas, vēlams, nav lielāks par 3,2, un būtu jāizmanto piemērots skaits atkārtojumu katrai testa koncentrācijai (skatīt 1.8.1.3. punktu). Ja izmanto mazāk par piecām koncentrācijām, tas būtu jāpamato. Vielas nedrīkstētu testēt virs to šķīdības robežas testa vidē.
Nosakot koncentrāciju diapazonu, būtu jāņem vērā:
ja mērķis ir iegūt LOEC/NOEC, mazākajai testa koncentrācijai ir jābūt pietiekami mazai, lai vairošanās šajā koncentrācijā nebūtu ievērojami mazāka par vairošanos kontroles testā. Ja tā nav, tests ir jāatkārto ar samazinātu mazāko koncentrāciju;
ja mērķis ir iegūt LOEC/NOEC, lielākajai testa koncentrācijai ir jābūt pietiekami lielai, lai vairošanās šajā koncentrācijā būtu ievērojami mazāka par vairošanos kontroles testā. Ja tā nav, tests ir jāatkārto ar palielinātu lielāko koncentrāciju;
ja novērtē ECX ietekmi uz vairošanos, ir ieteicams izmantot pietiekami lielas koncentrācijas, lai definētu ECX ar atbilstīgu ticamības līmeni. Ja novērtē EC50 ietekmi uz vairošanos, ir ieteicams, lai lielākā testa koncentrācija būtu lielāka par attiecīgo EC50. Pretējā gadījumā, kaut arī EC50 vēl ir iespējams novērtēt, EC50 ticamības intervāls ir ļoti plašs, un var būt neiespējami apmierinoši novērtēt pieskaņotā modeļa atbilstību;
testa koncentrācijas diapazonā vēlams neiekļaut koncentrācijas, kurām ir statistiski nozīmīga ietekme uz pieaugušo dzīvnieku izdzīvošanu, jo tas mainītu testa būtību no vienkārša vairošanās testa un apvienotu vairošanās un mirstības testu, kam ir vajadzīga daudz sarežģītāka statistiskā analīze.
Priekšzināšanas par testa vielas toksicitāti (piemēram, no akūtās toksicitātes testa un/vai no diapazona atrašanas pētījuma) būtu noderīgas piemērotu testa apstākļu izvēlei.
Ja izmanto šķīdinātāju vai disperģētāju vielu, lai vieglāk pagatavotu testa šķīdumus (skatīt 1.6.4. punktu), tās galakoncentrācija testa traukos nedrīkstētu būt lielāka par 0,1 ml/l, un tai vajadzētu būt vienādai visos testa traukos.
1.8.3. Kontroles testi
Būtu jāizdara viena testa vides kontroles testu sērija un attiecīgā gadījumā arī viena kontroles testu sērija ar šķīdinātāju vai disperģētāju vielu. Ja izmanto šķīdinātāju vai disperģētāju vielu, koncentrācijai būtu jābūt tādai pašai, kādu izmanto traukos, kuros ir testa viela. Būtu jāizmanto piemērots atkārtojumu skaits (skatīt 1.8.1.3. punktu).
Parasti labi izdarītā testā variāciju koeficientam ap dzīvo pēcteču vidējo skaitu uz vienu vecāku kontroles testā būtu jābūt ≤ 25 %, un tas būtu jāprotokolē testa plānā, kurā izmanto atsevišķi turētus dzīvniekus.
1.8.4. Testa vides atjaunošana
Vides atjaunošanas biežums ir atkarīgs no testa vielas stabilitātes, bet vide būtu jāatjauno vismaz trīs reizes nedēļā. Ja no iepriekšējiem stabilitātes testiem (skatīt 1.4. punktu) ir zināms, ka testa vielas koncentrācija nav stabila (t. i., ārpus 80–120 % diapazona no nominālās koncentrācijas vai zem 80 % no izmērītās sākotnējās koncentrācijas maksimālajā atjaunošanas laika posmā (t. i., trīs dienās), tad jāapsver biežāka vides atjaunošana vai caurplūdes testa izmantošana.
Ja vidi atjauno pusstatiskos testos, sagatavo otru testa trauku sēriju un vecākus pārvieto uz tiem, piemēram, ar piemērota diametra stikla pipeti. Vides tilpumam, kas pārnests kopā ar dafnijām, jābūt iespējami mazam.
1.8.5. Novērojumi
Testa laikā izdarīto novērojumu rezultāti jāprotokolē datu lapās (skatīt piemērus pielikuma 3. un 4. papildinājumā). Ja ir vajadzīgi citi mērījumi (skatīt 1.3. un 1.8.8. punktu), var būt vajadzīgi papildu novērojumi.
1.8.6. Pēcnācēji
Pēcnācējus, kas radušies no katra vecāka, sākot no pirmā nārsta parādīšanās, vēlams katru dienu izņemt un saskaitīt, lai tie nevarētu patērēt barību, kas paredzēta pieaugušajam dzīvniekam. Šā pētījuma mērķiem ir jāskaita ne vien dzīvie pēcnācēji, bet jāprotokolē arī nepilnīgi attīstītās oliņas un nedzīvie pēcnācēji.
1.8.7. Mirstība
Vecāku mirstību būtu vēlams protokolēt katru dienu, vismaz tajos pašos laikos, kad skaita pēcnācējus.
1.8.8. Citi parametri
Kaut arī šī metode ir galvenokārt paredzēta, lai novērtētu ietekmi uz vairošanos, ir iespējams, ka arī citas ietekmes var novērtēt pietiekami kvantitatīvi, lai varētu izdarīt statistisko analīzi. Augšanas mērījumi ir ļoti vēlami, jo tie sniedz informāciju par iespējamām subletālām ietekmēm, kas var būt noderīgākas nekā vairošanās mērījumi vien; testa beigās ir ieteicams izmērīt vecāku garumu (t. i., ķermeņa garumu, neiekļaujot postabdomena nagu). Citi parametri, ko var izmērīt vai aprēķināt, iekļauj laiku līdz pirmajam nārstam (un turpmākajiem nārstiem), nārstu skaitu un lielumu uz vienu dzīvnieku, nepilnīgi attīstīto oliņu skaitu, tēviņu vai efipiju klātbūtni un populācijas palielināšanās raksturīgo ātrumu.
1.8.9. Analītisko noteikšanu un mērījumu biežums
Skābekļa koncentrācija, temperatūra, ūdens cietība un pH lielums būtu jāmēra vismaz ik nedēļas svaigā un vecā vidē, kontroles testos un lielākajā testa vielas koncentrācijā.
Testa laikā testa vielas koncentrācijas nosaka regulāros intervālos.
Pusstatiskos testos, ja ir sagaidāms, ka testa vielas koncentrācija saglabāsies ± 20 % robežās no nominālā lieluma (t. i., 80–120 % diapazonā – skatīt 1.4. un 1.8.4. punktu), ir ieteicams vismaz lielākās un mazākās testa koncentrācijas analizēt svaigi pagatavotas un atjaunošanas laikā vienreiz testa pirmās nedēļas laikā (t. i., analīzes būtu jāizdara paraugam no tā paša šķīduma – svaigi pagatavotam un pie atjaunošanas). Šīs noteikšanas pēc tam būtu jāatkārto vismaz ik nedēļas.
Ja testā ir sagaidāms, ka testa vielas koncentrācija nesaglabāsies ± 20 % robežās no nominālā lieluma, ir jāanalizē visas testa koncentrācijas, svaigi pagatavotas un pie atjaunošanas. Tomēr tajos testos, kuros izmērītā testa vielas sākotnējā koncentrācija nav ± 20 % robežās no nominālās, bet kuros var sniegt pietiekamus pierādījumus, ka sākotnējās koncentrācijas ir atkārtojamas un stabilas (t. i., 80–120 % diapazonā no sākotnējām koncentrācijām), ķīmiskās noteikšanas var 2. un 3. nedēļā ierobežot līdz lielākajai un mazākajai testa koncentrācijai. Visos gadījumos testa vielas koncentrāciju noteikšana pirms atjaunošanas ir jāizdara tikai viena atkārtojuma traukā katrai testa koncentrācijai.
Ja izmanto caurplūdes testu, ir izmantojams paraugu ņemšanas režīms, kas ir līdzīgs režīmam, kurš aprakstīts pusstatiskajiem testiem (bet šajā gadījumā nav piemērojama “veco” šķīdumu mērīšana). Tomēr var būt ieteicams pirmajā nedēļā palielināt paraugu ņemšanas reižu skaitu (piemēram, trīs mērījumu komplekti), lai nodrošinātu, ka testa koncentrācijas paliek stabilas. Šā veida testos atšķaidītāja un testa vielas plūsmas ātrums būtu jāpārbauda ik dienas.
Ja ir pierādījumi, ka testējamās vielas koncentrācija ir apmierinoši saglabāta ± 20 % robežās no nominālās vai izmērītās koncentrācijas testa laikā, tad rezultāti var pamatoties uz nominālajiem vai izmērītajiem sākotnējiem lielumiem. Ja atkāpes no nominālās vai izmērītās sākotnējās koncentrācijas ir lielākas par ± 20 %, rezultāti būtu jāizsaka kā laikā svērtais vidējais lielums (skatīt pielikuma 5. papildinājumu).
2. DATI UN TO NOFORMĒŠANA
2.1. REZULTĀTU APSTRĀDE
Testa nolūks ir noteikt testa vielas ietekmi uz dzīvu pēcnācēju kopskaitu, kas radušies uz vienu testa beigās dzīvu vecāku. Pēcnācēju kopskaits uz vienu vecāku būtu jāaprēķina katram testa traukam (t. i., atkārtojumam). Ja kādā no atkārtojumiem vecāks mirst testa laikā vai izrādās tēviņš, tad atkārtojumu no analīzes izslēdz. Analīze tādā gadījumā pamatojas uz samazinātu atkārtojumu skaitu.
Lai ķimikālijas ietekmei uz vairošanās iznākumu novērtētu LOEC un no tā NOEC, ir jāaprēķina vidējais vairošanās iznākums pa katras koncentrācijas atkārtojumiem un apvienotā atlikuma standartnovirze, un to var izdarīt, izmantojot dispersiju analīzi (ANOVA). Katras koncentrācijas vidējais lielums pēc tam ir jāsalīdzina ar kontroles testa vidējo lielumu, izmantojot piemērotu daudzkārtējas salīdzināšanas metodi. Var būt noderīgi Daneta vai Viljamsas testi (14) (15) (16) (17). Ir jāpārbauda, vai ir izpildīts ANOVA pieņēmums par dispersiju homogenitāti. Ir ieteicams to izdarīt grafiski, nevis ar formālu nozīmīguma testu (18); piemērota alternatīva ir izdarīt Bartleta testu. Ja šis pieņēmums nav izpildīts, tad jāapsver datu pārveidošana, lai homogenizētu dispersijas pirms ANOVA veikšanas, vai jāapsver svērta ANOVA veikšana. Būtu jāaprēķina un jāprotokolē ietekmes lielums, kas ir atklājams, izmantojot ANOVA (t. i., mazākā nozīmīgā starpība).
Lai novērtētu koncentrāciju, kas par 50 % samazina vairošanās iznākumu (t. i., EC50), datiem būtu jāpielāgo piemērota līkne, piemēram, logaritmiskā līkne, izmantojot statistikas metodi, piemēram, mazāko kvadrātu metodi. Līkni var parametrizēt tā, lai EC50 un tās standartkļūdu varētu noteikt tieši. Tas ļoti atvieglo EC50 ticamības robežu aprēķinu. Ja vien nav laba pamatojuma dot priekšroku atšķirīgiem ticamības līmeņiem, būtu jāizvēlas 95 % divpusējas ticamības robežas. Pielāgošanas procedūrai, vēlams, būtu jādod iespēja novērtēt, cik nozīmīgs ir atbilstības trūkums. To var izdarīt grafiski vai sadalot atlikuma kvadrātu summu “atbilstības trūkuma” un “tīras kļūdas komponentos” un izdarot nozīmīguma testu atbilstības trūkumam. Tā kā apstrādei, kas noved pie lielas auglības, ir sagaidāmas radušos jauno dzīvnieku skaita lielākas dispersijas nekā apstrādei, kas noved pie nelielas auglības, būtu jāapsver novēroto lielumu svēršana, lai atspoguļotu atšķirīgās dispersijas atšķirīgas apstrādes grupās (pamatojuma informāciju skatīt (18)).
Analizējot galīgā gredzena testa datus (2), logaritmiskā līkne bija pielāgota, izmantojot šādu modeli, kaut arī var izmantot citus piemērotus modeļus:
kur:
|
Y: |
= |
kopējais jauno dzīvnieku skaits uz vienu testa beigās dzīvu vecāku (aprēķināts katram traukam), |
|
x: |
= |
vielas koncentrācija, |
|
c: |
= |
sagaidāmais jauno dzīvnieku skaits, ja x = 0, |
|
x0: |
= |
populācijas EC50, |
|
b: |
= |
slīpuma parametrs. |
Šis modelis, sagaidāms, ir adekvāts lielā skaitā situāciju, bet ir testi, kuriem tas nav piemērots. Modeļa derīgums būtu jāpārbauda, kā piedāvāts iepriekš. Dažos gadījumos var būt piemērots hormezes modelis, saskaņā ar kuru mazām koncentrācijām atbilst liela ietekme (19).
Var novērtēt arī citas ietekmes koncentrācijas, tādas kā EC10 vai EC20, kaut arī var būt ieteicamāk izmantot citu parametru modeli, kas nav izmantots EC50 novērtēšanai.
2.2. TESTA ZIŅOJUMS
Testa ziņojumā jābūt šādai informācijai.
2.2.1. Testa viela:
— fizikālais stāvoklis un attiecīgās fizikāli ķīmiskās īpašības,
— ķīmiskās identificēšanas dati, iekļaujot tīrību.
2.2.2. Testa suga:
— klons (vai tam ir ģenētiski noteikts tips), piegādātājs vai avots (ja tas ir zināms) un izmantotie audzēšanas apstākļi. Ja ir izmantotas dažādas Daphnia magna sugas, tas ir jāprotokolē un jāpamato.
2.2.3. Testa apstākļi:
— izmantotā testa procedūra (t. i., pusstatiskā vai caurplūdes, tilpums, ievietoto Daphnia skaits uz litru),
— apgaismojuma ilgums un gaismas intensitāte,
— testa plāns (piemēram, paralēlo mēģinājumu skaits, vecāku skaits uz paralēlo mēģinājumu),
— dati par izmantoto audzēšanas vidi,
— organiskā materiāla piedevas, ja tādas ir lietotas, iekļaujot to sastāvu, avotu, sagatavošanas metodi, izejas preparātu TOC/COD, testa vidē iegūtā TOC/COD novērtējums,
— sīki izstrādāta informācija par barošanu, iekļaujot daudzumu (mg C/dafnija/dienā) un plānu (piemēram, barības veidu, attiecībā uz aļģēm iekļaujot specifisko (sugas) nosaukumu un, ja zināms, līniju un audzēšanas apstākļus),
— izejas šķīduma pagatavošanas metode un atjaunošanas biežums (ir jānorāda šķīdinātājs vai disperģētāja viela, ja to lieto, un tās koncentrācija).
2.2.4. Rezultāti:
— priekšmēģinājumu rezultāti par testa vielas stabilitāti:
— nominālās testa koncentrācijas un visu analīžu rezultāti testa vielas koncentrāciju noteikšanai testa traukos (skatīt paraugu datu lapās 4. papildinājumā); jāprotokolē arī metodes atgūšanas efektivitāte un noteikšanas robeža,
— ūdens kvalitāte testa traukos (t. i., pH, temperatūra un izšķīdušā skābekļa koncentrācija, un TOC un/vai COD, un attiecīgā gadījumā cietība) (skatīt piemēru datu lapā 3. papildinājumā),
— pilnīgs protokols par katra vecāka dzīvajiem pēcnācējiem (skatīt datu lapas paraugu 3. papildinājumā),
— vecāku nāves gadījumu skaits un diena, kad tas noticis (skatīt datu lapas paraugu pielikuma 3. papildinājumā),
— auglības kontroles mēģinājumu variāciju koeficients (pamatojoties uz dzīvo pēcnācēju kopējo skaitu uz vienu testa beigās dzīvu vecāku),
— grafiks dzīvo pēcnācēju kopējā skaita uz vienu testa beigās dzīvu vecāku (katram paralēlam mēģinājumam) sakarībai ar testa vielas koncentrāciju,
— mazākās novērojamās ietekmes koncentrācija (LOEC) attiecībā uz vairošanos, iekļaujot izmantoto statistisko procedūru aprakstu un norādi, kāda lieluma ietekmi var atklāt, un nenovērojamās ietekmes koncentrācija (NOEC) attiecībā uz vairošanos; attiecīgā gadījumā jāprotokolē arī LOEC/NOEC attiecībā uz vecāku mirstību,
— attiecīgā gadījumā ECx attiecībā uz vairošanos un ticamības intervāli un tās aprēķināšanai pielāgotā modeļa grafiks, devas – atbildes reakcijas līknes slīpums un tās standartkļūda,
— citi novēroti bioloģiskie efekti vai mērījumi: ziņojumi par citiem bioloģiskiem efektiem, kas ir novēroti vai mērīti (piemēram, vecāku augšana), iekļaujot attiecīgu pamatojumu,
— paskaidrojums par atkāpēm no testa metodes.
3. IZMANTOTĀ LITERATŪRA
(1) OECD Test Guideline Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20-21 March 1993.
(2) OECD Environmental Health and Safety Publications. Series on Testing and Assessment No.6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997.
(3) Baird D.J., Barber J., Bradley M.C., Soares A.M.V.M. and Calow P. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, p. 257–265.
(4) Elendt B.P., (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, p. 25–33.
(5) EPA (1993). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohio.
(6) Vigano L., (1991) Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol.,47, p. 775–782.
(7) ASTM (1988). Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P.A., p. 20.
(8) Baird D.J., Soares A.M.V.M., Girling A., Barber J., Bradley M.C. and Calow P. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H.Løkke, H. Tyle & F. Bro-Rasmussen. Eds.) p. 144–148.
(9) Parkhurst B.R., Forte J.L. and Wright G.P. (1981). Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, p. 1–8.
(10) Cowgill U.M. and Milazzo D.P. (1990). The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), p. 185–196.
(11) Korshikov (1990). Pseudokirchneriella subcapitata Hindak, F-1990. Biologice Prace, 36, 209.
(12) Sims I.R., Watson S. and Holmes D. (1993). Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, 2053–2058.
(13) Sims I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, p. 459–466.
(14) Dunnett C.W., (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, p. 1096–1121.
(15) Dunnett C.W., (1964). New tables for multiple comparisons with a control. Biometrics, 20, p. 482–491.
(16) Williams D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, p. 103–117.
(17) Williams D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, p. 510–531.
(18) Draper N.R. and Smith H. (1981). Applied Regression Analysis, second edition, Wiley, N.Y.
(19) Brain P. and Cousens R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, p. 93–96.
(20) Wilson E.O. and Bossert, W.H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers.
(21) Poole R.W. (1974). An Introduction to quantitative Ecology. Mc Graw Hill Series in Population Biology, New York, p. 532.
(22) Meyer J.S., Ingersoll C.G., McDonald L.L. and Boyce M.S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, p.1156–1166.
1. PAPILDINĀJUMS
PILNĪGI DEFINĒTAS ELENDT M7 UN M4 VIDES PAGATAVOŠANA
Aklimatizācija Elendt M7 un M4 vidē
Dažām laboratorijām ir bijušas grūtības, dafnijas tieši pārnesot M41 un M7 vidē. Tomēr ar pakāpenisku aklimatizāciju, t. i., pārnesot no savas vides 30 % Elendt vidē, pēc tam 60 % Elendt vidē un pēc tam 100 % Elendt vidē, ir sasniegti zināmi panākumi. Aklimatizācijas laika posmi var būt vajadzīgi pat vienu mēnesi ilgi.
PAGATAVOŠANA
Pēdu elementi
Vispirms piemērotas tīrības ūdenī, t. i., dejonizētā, destilētā vai ar apgriezto osmozi iegūtā ūdenī pagatavo atsevišķu pēdu elementu atsevišķus izejas šķīdumus (I). No šiem dažādajiem izejas šķīdumiem (I) pagatavo vienu izejas šķīdumu (II), kas satur visus pēdu elementus (apvienoto šķīdumu), t. i.:
|
Izejas šķīdumi(-i) I (viena viela) |
Ūdenim pievienotais daudzums (mg/l) |
Koncentrācija (attiecībā uz vidi M4); daudzkārtnis |
Lai pagatavotu apvienoto izejas šķīdumu II, ūdenim pievieno šādu daudzumu izejas šķīduma I (ml/l) |
|
|
M 4 |
M 7 |
|||
|
H3BO3 |
57 190 |
20 000 |
1,0 |
0,25 |
|
MnCl2 * 4 H2O |
7 210 |
20 000 |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000 |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000 |
1,0 |
0,25 |
|
SrCl2 * 6 H2O |
3 040 |
20 000 |
1,0 |
0,25 |
|
NaBr |
320 |
20 000 |
1,0 |
0,25 |
|
Na2MoO4 * 2 H2O |
1 260 |
20 000 |
1,0 |
0,25 |
|
CuCl2 * 2 H2O |
335 |
20 000 |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000 |
1,0 |
1,0 |
|
CoCl2 * 6 H2O |
200 |
20 000 |
1,0 |
1,0 |
|
KI |
65 |
20 000 |
1,0 |
1,0 |
|
Na2SeO3 |
43,8 |
20 000 |
1,0 |
1,0 |
|
NH4VO3 |
11,5 |
20 000 |
1,0 |
1,0 |
|
Na2EDTA * 2 H2O |
5 000 |
2 000 |
— |
— |
|
FeSO4 * 7 H2O |
1 991 |
2 000 |
— |
— |
|
Na2EDTA un FeSO4 šķīdumus pagatavo atsevišķi, salej kopā un tūlīt liek autoklāvā. No tā rodas: |
||||
|
21 Fe-EDTA šķīdums |
1 000 |
20,0 |
5,0 |
|
M4 and M7 vide
M4 un M7 vidi pagatavo, izmantojot izejas šķīdumu II, makrobarības vielas un vitamīnus, šādi:
|
Ūdenim pievienotais daudzums (mg/l) |
Koncentrācija (attiecībā uz vidi M4) (daudzkārtnis) |
Vides pagatavošanai pievienotais izejas šķīdums II daudzums (ml/l) |
||
|
M 4 |
M 7 |
|||
|
Apvienotais pēdu elementu izejas šķīdums II |
20 |
50 |
50 |
|
|
Makrobarības vielu izejas šķīdumi (viena viela) |
||||
|
CaCl2 * 2 H2O |
293 800 |
1 000 |
1,0 |
1,0 |
|
MgSO4 * 7 H2O |
246 600 |
2 000 |
0,5 |
0,5 |
|
KCl |
58 000 |
10 000 |
0,1 |
0,1 |
|
NaHCO3 |
64 800 |
1 000 |
1,0 |
1,0 |
|
Na2SiO3 * 9 H2O |
50 000 |
5 000 |
0,2 |
0,2 |
|
NaNO3 |
2 740 |
10 000 |
0,1 |
0,1 |
|
KH2PO4 |
1 430 |
10 000 |
0,1 |
0,1 |
|
K2HPO4 |
1 840 |
10 000 |
0,1 |
0,1 |
|
Kompleksais vitamīnu pamatšķīdums |
— |
10 000 |
0,1 |
0,1 |
|
Apvienotu vitamīnu izejas šķīdumu pagatavo, pievienojot 3 vitamīnus 1 litram ūdens, kā parādīts turpmāk: |
||||
|
Tiamīna hidrohlorīds |
750 |
10 000 |
— |
— |
|
Ciānkobalamīns (B12) |
10 |
10 000 |
— |
— |
|
Biotīns |
7,5 |
10 000 |
— |
— |
|
Apvienoto vitamīnu izejas šķīdumu glabā sasaldētu mazos alikvotos. Vitamīnus pievieno videi īsu laiku pirms lietošanas. N.B. Lai izvairītos no sāļu izgulsnēšanās, gatavojot pilnu vidi, izejas šķīdumu alikvotus pievieno apmēram 500–800 mililitriem dejonizēta ūdens un pēc tam uzpilda līdz 1 litram. N.N.B. Pirmā publikācija par M4 vidi ir: Elendt, B. P. (1990). Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, p. 25–33. |
||||
2. PAPILDINĀJUMS
KOPĒJĀ ORGANISKĀ OGLEKĻA (TOC) ANALĪZE UN NOMOGRAMMAS IZVEIDE TOC SATURAM AĻĢES SATUROŠĀ BARĪBĀ
Ir atzīts, ka oglekļa saturu aļģes saturošā barībā parasti nemēra tieši, bet no korelācijām (t. i., nomogrammām) ar aizstājējiem mērījumiem, piemēram, korelācijām ar aļģu šūnu skaitu vai gaismas absorbciju).
TOC jāmēra ar augsttemperatūras oksidācijas metodi, nevis ar UV vai persulfāta metodi. (Skatīt: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB.)
Nomogrammas izveidošanai aļģes atdala no augšanas vides centrifugējot, pēc tam vēlreiz suspendējot destilētā ūdenī. Katra parauga aizvietotāju parametru un TOC koncentrāciju mēra trijos paralēlos mērījumos. Destilēta ūdens tukšos mēģinājumus analizē un TOC koncentrāciju atņem no TOC koncentrācijas aļģu paraugos.
Vajadzīgajā oglekļa koncentrāciju diapazonā nomogrammai būtu jābūt lineārai. Piemēri ir parādīti turpmāk.
N. B.! Šie piemēri nav izmantojami aprēķiniem; ir būtiski svarīgi, lai pašas laboratorijas sagatavotu savas nomogrammas.

3. PAPILDINĀJUMS
DATU LAPAS PARAUGS, KURĀ PROTOKOLĒTA VIDES ATJAUNOŠANA, FIZIKĀLI ĶĪMISKĀS MONITORĒŠANAS DATI, BAROŠANA, DAFNIJU VAIROŠANĀS UN PIEAUGUŠO DAFNIJU MIRSTĪBA
|
Eksperimenta nr: |
Sākšanas datums: |
Klons: |
Vide: |
Barības veids: |
Testa viela: |
Nominālā koncentrācija: |
||||||||||||||||||
|
Diena |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
||
|
Vides atjaunošana (atzīme) |
||||||||||||||||||||||||
|
PH (1) |
jauns |
|||||||||||||||||||||||
|
vecs |
||||||||||||||||||||||||
|
O2 mg/l (1) |
jauns |
|||||||||||||||||||||||
|
vecs |
||||||||||||||||||||||||
|
Temp. ( oC) (1) |
jauns |
|||||||||||||||||||||||
|
vecs |
||||||||||||||||||||||||
|
Dota barība (atzīme) |
||||||||||||||||||||||||
|
Dzīvu pēcnācēju nav (2) |
Kopā |
|||||||||||||||||||||||
|
1.trauks |
||||||||||||||||||||||||
|
2. |
||||||||||||||||||||||||
|
3. |
||||||||||||||||||||||||
|
4. |
||||||||||||||||||||||||
|
5. |
||||||||||||||||||||||||
|
6. |
||||||||||||||||||||||||
|
7. |
||||||||||||||||||||||||
|
8. |
||||||||||||||||||||||||
|
9. |
||||||||||||||||||||||||
|
10. |
||||||||||||||||||||||||
|
Kopā |
||||||||||||||||||||||||
|
Kumulatīvā pieaugušo mirstība (3) |
||||||||||||||||||||||||
|
(1) Norādīt, kurš trauks izmantots eksperimentam. (2) Pieaugušu dzīvnieku mirstību reģistrē, atbilstošā lodziņā ierakstot “M”. (3) Nepilnīgi attīstītās oliņas reģistrē, atbilstošā lodziņā ierakstot “NAO” |
||||||||||||||||||||||||
4. PAPILDINĀJUMS
DATU LAPAS PARAUGS ĶĪMISKĀS ANALĪZES REZULTĀTU PROTOKOLĒŠANAI
a) Izmērītās koncentrācijas
|
Nominālā konc. |
1. nedēļas paraugs |
2. nedēļas paraugs |
3. nedēļas paraugs |
|||
|
Svaigs |
Vecs |
Svaigs |
Vecs |
Svaigs |
Vecs |
|
b) Izmērītās koncentrācijas kā nominālās koncentrācijas procentuālais daudzums
|
Nominālā konc. |
1. nedēļas paraugs |
2. nedēļas paraugs |
3. nedēļas paraugs |
|||
|
Svaigs |
Vecs |
Svaigs |
Vecs |
Svaigs |
Vecs |
|
5. PAPILDINĀJUMS
LAIKĀ SVĒRTĀ VIDĒJĀ LIELUMA APRĒĶINS
Laikā svērtais vidējais lielums
Ja testa vielas koncentrācija var samazināties laika posmā starp vides atjaunošanas reizēm, tad ir jāapsver, kādu koncentrāciju izvēlēties kā tādu, kas pārstāv koncentrāciju diapazonu, kuram pakļauj Daphnia vecākus. Izvēlei būtu jāpamatojas uz bioloģiskiem apsvērumiem, kā arī statistikas apsvērumiem. Piemēram, ja uzskata, ka vairošanos visvairāk ietekmē maksimālā koncentrācija, kam pakļauj Daphnia, tad būtu jālieto maksimālā koncentrācija. Tomēr, ja uzskata, ka svarīgāka ir toksiskās vielas akumulētā vai hroniskā ietekme, tad atbilstošāka ir vidējā koncentrācija. Tādā gadījumā izmantošanai piemērots vidējais lielums ir laikā svērtā vidējā koncentrācija, jo tā ņem vērā koncentrācijas pārmaiņas laikā.
1. attēls:
Laikā svērtā vidējā lieluma piemērs

1. attēlā rādīts (vienkāršota) testa piemērs, testam turpinoties septiņas dienas ar vides atjaunošanu 0., 2. un 4. dienā.
Tievā zigzaglīnija attēlo koncentrāciju katrā laika punktā. Pieņem, ka koncentrācija samazinās eksponenciāli.
Seši grafikā atliktie punkti attēlo novērotās koncentrācijas, kas izmērītas katra atjaunošanas laika posma sākumā un beigās.
Resnā nepārtrauktā līnija rāda laikā svērtā vidējā lieluma novietojumu.
Laikā svērtais vidējais lielums ir aprēķināts tā, lai laukums zem laikā svērtā vidējā lieluma būtu vienāds ar laukumu zem koncentrācijas līknes. Iepriekš attēlotā piemēra aprēķins ir parādīts 1. tabulā.
1. tabula
Laikā svērtā vidējā lieluma aprēķins
|
Atjaunošana Nr. |
Dienas |
Conc0 |
Conc1 |
ln(Conc0) |
ln(Conc1) |
Laukums |
|
1. |
2 |
10,000 |
4,493 |
2,303 |
1,503 |
13,767 |
|
2. |
2 |
11,000 |
6,037 |
2,398 |
1,798 |
16,544 |
|
3. |
3 |
10,000 |
4,066 |
2,303 |
1,403 |
19,781 |
|
Dienas kopā: 7 |
Laukums kopā |
50,091 |
||||
|
TW vidējais |
7,156 |
|||||
|
“Dienas” ir dienu skaits atjaunošanas laika posmā. “Conc0” ir katra atjaunošanas laika posma sākumā izmērītā koncentrācija. “Conc1” ir katra atjaunošanas laika posma beigās izmērītā koncentrācija. “ln(Conc0)” ir Konc0 naturālais logaritms. “ln(Conc1)” ir Konc1 naturālais logaritms. “Laukums” ir laukums zem katra atjaunošanas laika posma eksponenciālās līknes. To aprēķina no:
|
||||||
Laikā svērtais vidējais lielums (“TW vidējais”) ir “Laukums kopā” dalīts ar “Dienas kopā”.
Protams, dafniju vairošanās testa tabula ir jāpagarina, lai tā ietvertu 21 dienu.
Ir skaidrs – ja novērojumus izdara tikai katra atjaunošanas laika posma sākumā un beigās, nav iespējams apstiprināt, ka koncentrācijas samazināšanās process patiešām ir eksponenciāls. Citādai līknei būtu citāds laukuma aprēķins. Tomēr eksponenciāls samazināšanās process ir ļoti ticams, un eksponenciāla līkne, ļoti iespējams, ir labākā līkne izmantošanai, ja nav citas informācijas.
Tomēr ir jābūt piesardzīgam, ja ķīmiskā analīze atjaunošanas perioda beigās neuzrāda nemaz vielas. Ja vien nav iespējams novērtēt, cik drīz viela pazūd no šķīduma, nav iespējams iegūt īstenībai atbilstošu laukumu zem līknes un tātad ir neiespējami iegūt pamatotu laikā svērto vidējo lielumu.
C.21. AUGSNES MIKROORGANISMI – SLĀPEKĻA TRANSFORMĀCIJAS TESTS
1. METODE
Šī testa metode ir ESAO 216 (2000) vadlīnijā noteiktās metodes kopija.
1.1. IEVADS
Šī testa metode apraksta laboratorijas metodi, kas izveidota ķīmisko vielu ilgtermiņa iedarbību izpētei uz augsnes mikroorganismu slāpekļa transformācijas aktivitāti pēc vienreizējas iedarbības. Tests galvenokārt pamatojas uz Eiropas un Vidusjūras Augu aizsardzības organizācijas ieteikumiem (1). Tomēr ir ņemti vērā arī citi norādījumi, iekļaujot Vācijas Federatīvās bioloģijas iestādes (2), ASV Vides aizsardzības aģentūras (3), Vides toksikoloģijas un ķīmijas savienības (4) un Starptautiskās Standartizācijas organizācijas (5) norādījumus. ESAO seminārā par augsnes/nogulumu atlasi, kas 1995. gadā notika Beldžiratē, Itālijā (6), vienojās par šajā testā izmantojamo augšņu skaitu un tipu. Ieteikumi par augsnes paraugu vākšanu, apstrādi un glabāšanu pamatojas uz ISO pamatnostādnēm (7) un Beldžirates semināra ieteikumiem. Pārbaudot un vērtējot testējamo vielu toksiskās īpašības, var būt jānosaka ietekmes uz augsnes mikrobu aktivitāti, piemēram, ja vajadzīgi dati par kultūraugu aizsardzības līdzekļu iespējamām blakusiedarbībām uz augsnes mikrofloru vai ja ir sagaidāma ķīmisko vielu, kas nav kultūraugu aizsardzības līdzekļi, iedarbība uz augsnes mikroorganismiem. Slāpekļa transformācijas testu izdara, lai noteiktu šādu ķīmisku vielu iedarbību uz augsnes mikrofloru. Ja agroķīmiskās vielas (piemēram, kultūraugu aizsardzības līdzekļus, mēslošanas līdzekļus, mežsaimniecības ķīmiskās vielas) pārbauda, tiek veikti slāpekļa transformācijas un oglekļa transformācijas testi. Ja pārbauda ķīmiskās vielas, kas nav agroķīmiskās vielas, pietiek ar slāpekļa transformācijas testu. Tomēr, ja EC50 vērtības šādu ķīmisko vielu slāpekļa transformācijas testā ir diapazonā, kas atrasts tirdzniecībā pieejamiem nitrifikācijas inhibitoriem (piemēram, nitrapirīnam), var izdarīt oglekļa transformācijas testu, lai iegūtu papildu informāciju.
Augsnes sastāv no dzīviem un nedzīviem komponentiem, kas ir sarežģītos un neviendabīgos maisījumos. Mikroorganismiem ir svarīga loma organisko vielu noārdīšanā un transformācijā auglīgās augsnēs, kurās daudzas sugas dod ieguldījumu dažādos augsnes auglības aspektos. Jebkura ilgtermiņa iejaukšanās minētajos bioķīmiskajos procesos var potenciāli iejaukties barības vielu apritē, un tas var mainīt augsnes auglību. Oglekļa un slāpekļa transformācija notiek visās auglīgās augsnēs. Kaut arī par šiem procesiem atbildīgās mikrobu kopas atšķiras starp augsnēm, transformācijas ceļi būtībā ir vieni un tie paši.
Šī aprakstītā testēšanas metode ir izveidota, lai noskaidrotu vielas ilgtermiņa kaitīgo iedarbību uz slāpekļa transformācijas procesu aerobās virsmas augsnēs. Testa metode ļauj noteikt arī vielu iedarbību uz augsnes mikrofloras veikto oglekļa transformāciju. Nitrātu veidošanās notiek pēc oglekļa–slāpekļa saišu noārdīšanas. Tātad, ja apstrādātajās un kontroles augsnēs ir konstatēti vienādi nitrātu veidošanās ātrumi, ir liela varbūtība, ka galvenie oglekļa noārdīšanās ceļi ir neskarti un funkcionāli. Testam izraudzītajam substrātam (lucernas miltu pulverim) ir labvēlīga oglekļa attiecība pret slāpekli (parasti starp 12/1 un 16/1). Tādēļ testa laikā ir samazināts oglekļa trūkums un, ja ķīmiskā viela sabojā mikrobu kopas, tās var atveseļoties 100 dienu laikā.
Testi, no kuriem ir izstrādāta šī testa metode, sākotnēji bija paredzēti vielām, kurām var noteikt augsnē nokļūstošo daudzumu. Tā tas, piemēram, ir ar kultūraugu aizsardzības līdzekļiem, kuru lietojuma deva praksē ir zināma. Agroķīmiskajām vielām ir pietiekami testēt divas devas, kas saistītas ar sagaidāmo vai paredzamo lietojuma devu. Agroķīmiskās vielas var testēt kā aktīvās sastāvdaļas (a.s.) vai kā preparātus. Tomēr tests nav ierobežots ar agroķīmiskajām vielām. Mainot augsnē lietojamās testējamās vielas daudzumu un datu novērtēšanas veidu, testu var izmantot arī ķīmiskajām vielām, kurām nav zināms sagaidāmais augsnē nokļūstošais daudzums. Tā var noteikt koncentrāciju rindas iedarbību uz slāpekļa transformāciju vielām, kas nav agroķīmiskās vielas. Šo testu datus izmanto devas–atbildes reakcijas līknes sagatavošanai un ECx vērtību aprēķināšanai, kur x ir definēts kā iedarbības %.
1.2. DEFINĪCIJAS
Slāpekļa transformācija: mikroorganismu veikta slāpekli saturošu organisko vielu galīgā noārdīšana amonificēšanas un nitrificēšanas procesos līdz attiecīgajam neorganiskajam galaproduktam – nitrātam.
EC X (efektīvā koncentrācija): testējamās vielas koncentrācija augsnē, kas izraisa slāpekļa transformācijas par nitrātu kavēšanu par x procentiem.
EC 50 (vidējā efektīvā koncentrācija): testējamās vielas koncentrācija augsnē, kas izraisa slāpekļa transformācijas par nitrātu kavēšanu par 50 procentiem (50 %).
1.3. STANDARTVIELAS
Nav.
1.4. TESTA METODES BŪTĪBA
Izsijātu augsni uzlabo ar augu miltu pulveri un vai nu apstrādā ar testējamo vielu, vai atstāj neapstrādātu (kontrole). Ja testē agroķīmiskas vielas, ir ieteicamas vismaz divas testa koncentrācijas, un tās jāizvēlas saistībā ar praksē sagaidāmo augstāko koncentrāciju. Pēc 0, 7, 14 un 28 inkubācijas dienām apstrādātās un kontroles augsnes paraugus ekstrahē ar piemērotu šķīdinātāju un ekstraktos nosaka nitrāta daudzumus. Nitrātu veidošanās ātrumu apstrādātajos paraugos salīdzina ar ātrumu kontroles paraugā un aprēķina apstrādāto paraugu procentuālās novirzes no kontroles parauga. Visus testus izdara vismaz 28 dienas. Ja 28. dienā apstrādātā un neapstrādātā parauga atšķirība ir vienāda vai lielāka par 25 %, mērījumus turpina ne vairāk kā līdz 100 dienām. Ja testē vielas, kas nav agroķīmiskās vielas, testējamās vielas koncentrāciju rindu pievieno augsnes paraugiem un apstrādātajos paraugos un kontroles paraugā izveidojušos nitrāta daudzumus mēra pēc 28 inkubācijas dienām. Testu ar daudzkāršotām koncentrācijām rezultātus analizē, izmantojot regresijas modeli un aprēķina ECx vērtības (t. i., EC50, EC25 un/vai EC10). Skatīt definīcijas.
1.5. TESTA DERĪGUMS
Testa ar agroķīmiskām vielām rezultātu izvērtēšana pamatojas uz relatīvi mazām atšķirībām (t. i., vidējo vērtību ± 25 %) starp nitrāta koncentrācijām kontroles un apstrādātas augsnes paraugos, tādēļ lielas kontroles mēģinājumu izmaiņas var izraisīt nepareizus rezultātus. Tādēļ izmaiņām starp kontroles paraugu atkārtojumiem jābūt mazākām par ± 15 %.
1.6. TESTA METODES APRAKSTS
1.6.1. Aprīkojmus
Izmanto ķīmiski inerta materiāla testa tvertnes. To tilpumam jāatbilst augšņu inkubācijai izmantojamām procedūrām, t. i., inkubācijai kopā vai atsevišķu augsnes paraugu virknē (skatīt 1.7.1.2. punktu). Jārūpējas, lai testa laikā iespējami samazinātu ūdens zudumu un nodrošinātu gāzu apmaiņu (piemēram, testa tvertnes var pārklāt ar perforētu polietilēna plēvi). Testējot gaistošas vielas, ir jāizmanto graduētas un gāzu necaurlaidīgas tvertnes. Tām jābūt tik lielām, lai ar augsnes paraugu būtu pildīta aptuveni viena ceturtdaļa tilpuma.
Izmanto standarta laboratorijas aprīkojumu, kurā iekļauts:
— kratīšanas ierīce – mehāniskais kratītājs vai līdzvērtīgs aprīkojums,
— centrifūga (3 000 g) vai filtrēšanas ierīce (kurā izmanto nitrātus nesaturošu filtrpapīru),
— atbilstošas jutības un atkārtojamības instruments nitrāta analīzei.
1.6.2. Augšņu izraudzīšanās un skaits
Izmanto vienu augsni. Ieteicamie augsnes rādītāji ir šādi:
— smilšu saturs – ne mazāks kā 50 % un ne lielāks kā 75 %,
— pH līmenis – 5,5–7,5,
— organiskā oglekļa saturs – 0,5–1,5 %,
— mikrobu biomasa ir jāizmēra (8) (9), un tās oglekļa saturam jābūt vismaz 1 % no kopējā augsnes organiskā oglekļa.
Vairumā gadījumu augsne ar šādiem rādītājiem pārstāv sliktākā gadījuma situāciju, jo testējamās ķīmiskās vielas adsorbcija ir minimāla un tās pieejamība mikroflorai ir maksimāla. Tādēļ testi ar citām augsnēm parasti nav vajadzīgi. Tomēr dažos apstākļos, piemēram, ja testējamās vielas sagaidāmā galvenā izmantošana ir īpašās augsnēs, tādās kā skābas meža augsnes, vai elektrostatiski uzlādētām ķīmiskām vielām, var būt vajadzīga papildu augsnes izmantošana.
1.6.3. Augsnes paraugu vākšana un glabāšana
1.6.3.1. Vākšana
Ir jābūt pieejamiem sīkiem datiem par tās vietas vēsturi, no kuras savākta testējamā augsne. Dati iekļauj precīzu atrašanās vietu, zemsedzi, datus par apstrādi ar kultūraugu aizsardzības līdzekļiem, bioloģisko materiālu piedevām vai nejaušiem piesārņojumiem. Augsnes savākšanai izraudzītajai vietai jābūt ilgstoši izmantojamai. Piemērotas ir ganības, lauki ar viengadīgām graudaugu kultūrām (izņemot kukurūzu) vai blīvi apsēts zaļmēslojums. Izraudzītā paraugu ņemšanas vieta nedrīkst būt apstrādāta ar kultūraugu aizsardzības līdzekļiem vismaz vienu gadu pirms paraugu ņemšanas. Arī organiskie mēslošanas līdzekļi nedrīkst būt pielietoti vismaz sešus mēnešus. Minerālmēslu izmantošana ir pieņemama tikai saskaņā ar kultūraugu prasībām, un augsnes paraugus nedrīkst ņemt vismaz trīs mēnešu laikā pēc mēslošanas līdzekļa pielietošanas. Ir jāizvairās izmantot augsni, kas apstrādāta ar mēslošanas līdzekļiem ar zināmu biocīdu iedarbību (piemēram, kalcija ciānamīds).
Jāizvairās ņemt paraugus tieši pēc ilgiem sausuma vai pārplūšanas laika posmiem (ilgākiem par 30 dienām). Aramzemju paraugi jāņem no 0 līdz 20 cm dziļuma. Pļavu (ganību) vai citās augsnēs, kur aršana nenotiek ilgākos laika posmos (vismaz vienu augšanas periodu), maksimālais paraugu ņemšanas dziļums var būt nedaudz lielāks par 20 cm (piemēram, līdz 25 cm).
Augsnes paraugi ir pārvedami, izmantojot tvertnes un temperatūras apstākļos, kas garantē, ka augsnes sākotnējās īpašības nav ievērojami mainījušās.
1.6.3.2. Glabāšana
Vēlams izmantot augsnes, kas ir svaigi savāktas no lauka. Ja nevar izvairīties no glabāšanas laboratorijā, augsnes var glabāt tumsā 4 ± 2 oC temperatūrā ilgākais trīs mēnešus. Augšņu glabāšanas laikā jānodrošina aerobi apstākļi. Ja augsnes vāc vietās, kur tās ir sasalušas vismaz trīs mēnešus gadā, var apsvērt sešus mēnešus ilgu glabāšanu mīnus 18 oC līdz mīnus 22 oC temperatūrā. Pirms katra eksperimenta izmēra glabāto augšņu mikrobu biomasu, un oglekļa saturam biomasā jābūt vismaz 1 % no kopējā augsnes oglekļa satura (skatīt 1.6.2. punktu).
1.6.4. Rīkošanās ar augsni un tās sagatavošana testam
1.6.4.1. Priekšinkubācija
Ja augsne ir glabāta (skatīt 1.6.3.2. punktu), ir ieteicama 2 līdz 28 dienu ilga priekšinkubācija. Priekšinkubācijas laikā augsnes temperatūrai un mitruma saturam jābūt līdzvērtīgam testā izmantotajai temperatūrai un mitruma saturam (skatīt 1.6.4.2. un 1.7.1.3. punktu).
1.6.4.2. Fizikāli ķīmiskās īpašības
Augsni ar rokām attīra no lieliem priekšmetiem (piemēram, akmeņiem, augu daļām utt.) un pēc tam mitru sijā, pārmērīgi neizžāvējot, līdz daļiņu lielumam mazākam vai vienādam ar 2 mm. Augsnes mitruma saturs ir jākoriģē ar destilētu vai dejonizētu ūdeni līdz vērtībai no 40 % līdz 60 % no maksimālās ūdens saturēšanas spējas.
1.6.4.3. Uzlabošana ar organisku substrātu
Augsne ir jāuzlabo ar piemērotu organisku substrātu, piemēram, lucernas zāles zaļajiem miltiem (galvenā sastāvdaļa – Medicago sativa) ar C/N attiecību no 12/1 līdz 16/1. Ieteicamā lucernas attiecība pret augsni ir 5 g lucernas uz kilogramu augsnes (sausais svars).
1.6.5. Testējamās vielas sagatavošana pielietošanai augsnē
Testējamo vielu parasti pielieto, izmantojot nesēju. Nesējs var būt ūdens (ūdenī šķīstošām vielām) vai inerta cieta viela, tāda kā smalkas kvarca smiltis (daļiņu lielums 0,1–0,5 mm). Lietot šķidrus nesējus, izņemot ūdeni (piemēram, organiskos šķīdinātājus, tādus kā acetons, hloroforms), ir jāizvairās, jo tie var kaitēt mikroflorai. Ja par nesēju izmanto smiltis, tās var pārklāt ar testējamo vielu, kas izšķīdināta vai suspendēta piemērotā šķīdinātājā. Tādos gadījumos pirms sajaukšanas ar augsni šķīdinātājs jāaizvada iztvaicējot. Optimālam testējamās vielas sadalījumam augsnē ir ieteicama attiecība 10 g smilšu uz kilogramu augsnes (sauss svars). Kontroles paraugus apstrādā tikai ar tādu pašu daudzumu ūdens un/vai kvarca smilšu.
Testējot gaistošas ķīmiskās vielas, apstrādes laikā ir iespējami jāizvairās no zudumiem un jācenšas nodrošināt viendabīgu sadalījumu augsnē (piemēram, testējamā viela ir jāinjicē augsnē vairākās vietās).
1.6.6. Testa koncentrācijas
Ja testē agroķīmiskas vielas, ir jāizmanto vismaz divas koncentrācijas. Mazākajai koncentrācijai jāatspoguļo vismaz maksimālais daudzums, kas prakses apstākļos, sagaidāms, nokļūs augsnē, bet lielākajai koncentrācijai jābūt mazākās koncentrācijas daudzkārtnim. Augsnei pievienojamās testējamās vielas koncentrācijas aprēķina, pieņemot, ka viela ir vienmērīgi iekļauta 5 cm dziļumā un augsnes bēruma blīvums ir 1,5. Agroķīmiskām vielām, ko pielieto tieši augsnē, vai ķīmiskām vielām, kuru augsnē nokļuvušo daudzumu var paredzēt, ieteicamās koncentrācijas ir maksimālā paredzamā koncentrācija vidē (PEC) un par to piecreiz lielāka koncentrācija. Vielas, ko paredzēts pielietot augsnēm vairākas reizes vienā sezonā, ir jātestē koncentrācijās, kas atvasinātas, reizinot PEC ar maksimālo sagaidāmo pielietošanas reižu skaitu. Lielākā testētā koncentrācija tomēr nedrīkst pārsniegt desmitkāršotu maksimālo viena lietojuma devu. Ja testē vielas, kas nav agroķīmiskas vielas, izmanto vismaz piecu koncentrāciju ģeometrisko rindu. Testētajām koncentrācijām ir jāiekļauj ECx vērtības noteikšanai vajadzīgo koncentrāciju diapazons.
1.7. TESTA IZPILDE
1.7.1. Iedarbības apstākļi
1.7.1.1. Apstrāde un kontrole
Ja testē agroķīmiskas vielas, augsni sadala trijās vienāda svara daļās. Divas daļas sajauc ar nesēju, kas satur vielu, un trešo sajauc ar nesēju bez vielas (kontrole). Ir ieteicami vismaz trīs atkārtojumi gan apstrādātai, gan neapstrādātai augsnei. Ja testē vielas, kas nav agroķīmiskas vielas, augsni sadala sešās vienāda svara daļās. Piecus no paraugiem sajauc ar nesēju, kas satur testējamo vielu, un sesto paraugu sajauc ar nesēju bez vielas. Ir ieteicami trīs atkārtojumi gan apstrādei, gan kontrolei. Jārūpējas, lai nodrošinātu viendabīgu testējamās vielas sadalījumu apstrādātajos augsnes paraugos. Jaukšanas laikā jāizvairās augsni sablīvēt vai savelt.
1.7.1.2. Augsnes paraugu inkubācija
Augsnes paraugu inkubāciju var izdarīt divos veidos – inkubēt katras apstrādātās un neapstrādātās augsnes kopējos paraugus vai katras apstrādātās un neapstrādātās augsnes atsevišķu un vienāda lieluma apakšparaugu rindas. Tomēr, ja testē gaistošas vielas, tests jāizdara tikai ar atsevišķu paraugu rindām. Ja augsnes inkubē kopējā paraugā, sagatavo lielus katras apstrādātās un neapstrādātās augsnes daudzumus un ņem analizējamos paraugus, kā testa laikā vajadzīgs. Katrai apstrādei un kontrolei sākotnēji sagatavojamais daudzums ir atkarīgs no apakšparaugu lieluma, analīzē izmantoto atkārtojumu skaita un sagaidāmā paraugu ņemšanas reižu maksimālā skaita. Kopējā paraugā inkubētās augsnes pirms apakšparaugu ņemšanas ir rūpīgi jāsajauc. Ja augsnes inkubē kā atsevišķu augsnes paraugu rindu, katru apstrādāto un neapstrādāto kopējo augsnes paraugu sadala vajadzīgajā skaitā apakšparaugu, un tos izmanto pēc vajadzības. Eksperimentos, kuros sagaidāmas vairāk par divām paraugu ņemšanas reizēm, ir jāsagatavo pietiekami daudz apakšparaugu, ņemot vērā visus atkārtojumus un visas paraugu ņemšanas reizes. Vismaz trīs testa augsnes atkārtojumu paraugi ir jāinkubē aerobos apstākļos (skatīt 1.7.1.1. punktu). Lai izvairītos no anaerobu apstākļu izveidošanās, visos testos jāizmanto piemērotas tvertnes ar pietiekamu telpu virs ūdens. Ja testē gaistošas vielas, tests jāizdara tikai ar atsevišķu paraugu rindām.
1.7.1.3. Testa apstākļi un ilgums
Testu izdara tumsā, istabas temperatūrā 20 ± 2 oC. Augsnes paraugu mitruma saturs testa laikā jāsaglabā no 40 % līdz 60 % no augsnes maksimālās ūdens saturēšanas spējas (skatīt 1.6.4.2. punktu) ± 5 % diapazonā. Pēc vajadzības var pievienot destilētu, dejonizētu ūdeni.
Minimālais testa ilgums ir 28 dienas. Ja testē agroķīmiskas vielas, salīdzina nitrātu veidošanās ātrumu apstrādātajos un kontroles paraugos. Ja tie 28. dienā atšķiras vairāk nekā par 25 %, testu turpina, līdz atšķirība ir vienāda ar 25 % vai mazāka par to vai maksimāli 100 dienas, atkarībā no tā, kurš no šiem lielumiem ir mazāks. Vielām, kas nav agroķīmiskas vielas, testu beidz pēc 28 dienām. Divdesmit astotajā dienā nosaka nitrātu daudzumu apstrādātajā un kontroles augsnes paraugā un aprēķina ECX vērtības.
1.7.2. Augsnes paraugu ņemšana un analīze
1.7.2.1. Augsnes paraugu ņemšanas grafiks
Ja testē agroķīmiskas vielas, augsnes paraugus analizē attiecībā uz nitrātiem 0., 7., 14. un 28. dienā. Ja vajadzīgs paildzināts tests, turpmākos mērījumus veic 14 dienu starplaikos pēc 28. dienas.
Ja testu veic vielām, kas nav agroķīmiskas vielas, izmanto vismaz piecas testa koncentrācijas un augsnes paraugus analizē attiecībā uz nitrātiem iedarbības perioda sākumā (0. dienā) un beigās (28. dienā). Ja uzskata par vajadzīgu, var pievienot starpmērījumu, piemēram, 7. dienā. Datus, kas iegūti 28. dienā, izmanto ECX vērtības noteikšanai. Ja vēlas, 0. dienas kontroles parauga datus var izmantot, lai reģistrētu nitrātu sākotnējo saturu augsnē.
1.7.2.2. Augsnes paraugu analīze
Katrā apstrādātajā un kontroles atkārtojumā izveidojušos nitrātu daudzumu nosaka katrā paraugu ņemšanas reizē. Nitrātu ekstrahē no augsnes, kratot paraugus ar piemērotu ekstrakcijas šķīdinātāju, piemēram, 0,1 M nātrija hlorīda šķīdumu. Ir ieteicama attiecība 5 ml KCl šķīduma uz gramu augsnes sausā svara ekvivalenta. Lai optimizētu ekstrakciju, tvertnes, kurās ir augsne un ekstrakcijas šķīdums, nedrīkst būt pilnākas par pusi. Maisījumus krata pie 150 apgr./min 60 minūtes. Maisījumus centrifugē vai filtrē un šķidro fāzi analizē attiecībā uz nitrātu. Daļiņas nesaturošus šķidros ekstraktus var pirms analīzes glabāt mīnus 20 ± 5 oC temperatūrā līdz sešiem mēnešiem.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Ja testus izdara ar agroķīmiskām vielām, katrā augsnes parauga atkārtojumā radies nitrāta daudzums jāreģistrē un visu atkārtojumu vidējās vērtības jāsniedz tabulas veidā. Slāpekļa transformācijas ātrumi ir jānovērtē ar piemērotām un vispārpieņemtām statistikas metodēm (piemēram, F-tests, 5 % nozīmības līmenis). Nitrāta daudzumus izsaka mg nitrāta/kg augsnes sausā svara dienā. Nitrāta veidošanās ātrumu katrā apstrādē salīdzina ar nitrāta veidošanās ātrumu kontrolē un aprēķina procentuālo novirzi no kontroles.
Ja testus izdara ar vielām, kas nav agroķīmiskas vielas, nosaka katrā atkārtojumā radušos nitrāta daudzumu un ECX vērtības novērtēšanai sagatavo devas–atbildes reakcijas līkni. Nitrāta daudzumus (t. i., mg nitrāta/kg augsnes sausā svara dienā), kas atrasti apstrādātajos paraugos pēc 28 dienām, salīdzina ar kontroles paraugā atrasto. No šiem datiem izrēķina kavēšanas vērtību procentos katrai testa koncentrācijai. Attiecīgos procentus atliek pret koncentrāciju un pēc tam izmanto statistikas procedūrās, lai aprēķinātu ECx vērtības. Izmantojot standarta procedūras (10) (11) (12), nosaka arī aprēķinātās ECx ticamības robežas (p = 0,95).
Testējamās vielas, kurās ir daudz slāpekļa, var dot ieguldījumu nitrāta daudzumā, kas radies testa laikā. Ja minētās vielas testē lielā koncentrācijā (piemēram, ķīmiskās vielas, kuras paredzēts pielietot atkārtoti), testā ir jāiekļauj attiecīga kontrole (t. i., augsne plus testējamā viela, bet bez augu miltiem). Minētās kontroles dati jāņem vērā ECx aprēķinos.
2.2. REZULTĀTU INTERPRETĀCIJA
Ja vērtē testu rezultātus ar agroķīmiskām vielām un ja starpība nitrātu veidošanās ātrumā starp mazāko apstrādi (t. i., maksimālo paredzēto koncentrāciju) un kontroli ir vienāda ar 25 % vai mazāka par to jebkurā paraugu ņemšanas laikā pēc 28. dienas, ražojumu novērtēt kā tādu, kam nav ilgtermiņa iedarbības uz slāpekļa transformāciju augsnēs. Ja vērtē testu rezultātus ar vielām, kas nav agroķīmiskas vielas, izmanto EC50, EC25 un/vai EC10 vērtības.
3. PĀRSKATA SAGATAVOŠANA
Pārskatā par testu jāiekļauj šāda informācija.
Pilnīga izmantotās augsnes identifikācija, kurā ietverta:
— vietas ģeogrāfiskā norāde (platums, garums),
— informācija par vietas vēsturi (t. i., augsega, apstrāde ar kultūraugu aizsardzības līdzekļiem, apstrāde ar mēslošanas līdzekļiem, nejaušs piesārņojums utt.),
— izmantošanas veids (piemēram, lauksaimniecības zeme, mežs utt.),
— paraugu ņemšanas dziļums (cm),
— smilšu/sanesu/māla saturs (% no sausa svara),
— pH (ūdenī),
— organiskā oglekļa saturs (% no sausa svara),
— slāpekļa saturs (% no sausa svara),
— sākotnējā nitrāta koncentrācija (mg nitrāta/kg sausa svara),
— katjonu apmaiņas spēja (mmol/kg),
— mikrobu biomasa procentos no kopējā organiskā oglekļa,
— norāde par katra rādītāja noteikšanā izmantotajām metodēm,
— visa informācija par augsnes paraugu vākšanu un glabāšanu,
— sīki dati par augsnes priekšinkubāciju, ja tā bijusi.
Testējamā viela:
— fizikālās īpašības un attiecīgā gadījumā fizikāli ķīmiskās īpašības,
— ķīmiskās identifikācijas dati, attiecīgā gadījumā iekļaujot struktūrformulu, tīrību (t. i., kultūraugu aizsardzības līdzekļiem aktīvās sastāvdaļas procentuālo daudzumu), slāpekļa saturu.
Substrāts:
— substrāta izcelsme,
— sastāvs (t. i., lucernas milti, lucernas zāles zaļie milti),
— oglekļa, slāpekļa saturs (% no sausa svara),
— sieta acu lielums (mm).
Testa apstākļi:
— sīki dati par augsnes uzlabošanu ar organisko substrātu,
— izmantotās testējamās ķīmiskās vielas koncentrāciju skaits un attiecīgā gadījumā izraudzīto koncentrāciju pamatojums,
— sīki dati par testējamās vielas pielietošanu augsnē,
— inkubēšanas temperatūra,
— augsnes mitruma saturs testa sākumā un testa laikā,
— izmantotā augsnes inkubēšanas metode (t. i., kopējā parauga vai atsevišķu apakšparaugu rindas),
— atkārtojumu skaits,
— paraugu ņemšanas reizes,
— nitrāta ekstrahēšanai no augsnes izmantotā metode.
Rezultāti:
— nitrāta analizēšanai izmantotā analītiskā procedūra un iekārta,
— dati, kas ierakstīti tabulā, iekļaujot nitrāta mērījumu atsevišķās un vidējās vērtības,
— atšķirības starp atkārtojumiem apstrādātajos un kontroles paraugos,
— attiecīgā gadījumā aprēķinos izdarīto korekciju skaidrojums,
— nitrātu veidošanās ātrumu procentuālās atšķirības katrā paraugu ņemšanas reizē vai attiecīgā gadījumā EC50 vērtība ar 95 procentu ticamības robežu, pārējās ECx (t. i., EC25 vai EC10) ar ticamības starplaikiem un devas–atbildes reakcijas līknes grafiku,
— rezultātu statistiskā apstrāde,
— visa informācija un novērojumi, kas noderīgi rezultātu interpretācijai.
4. IZMANTOTĀ LITERATŪRA
(1) EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1–16, 1994.
(2) BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990).
(3) EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
(4) SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brussels.
(5) ISO/DIS 14238 (1995). Soil Quality – Determination of Nitrogen Mineralisation and Nitrification in Soils and the Influence of Chemicals on these Processes. Technical Committee ISO/TC 190/SC 4: Soil Quality – Biological Methods.
(6) OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18–20 January 1995.
(7) ISO 10381-6 (1993). Soil quality – Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
(8) ISO 14240-1 (1997). Soil quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method.
(9) ISO 14240-2 (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method.
(10) Litchfield, J.T. and Wilcoxon F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, p. 99–113.
(11) Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York.
(12) Finney, D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK.
C.22. AUGSNES MIKROORGANISMI – OGLEKĻA TRANSFORMĀCIJAS TESTS
1. METODE
Šī metode ir ESAO 217 (2000) vadlīnijā noteiktās metodes kopija.
1.1. IEVADS
Šī testa metode apraksta laboratorijas metodi, kas paredzēta, lai izpētītu kultūraugu aizsardzības līdzekļu un, iespējams, citu ķīmisko vielu potenciālo iedarbību uz augsnes mikroorganismu oglekļa transformācijas aktivitāti pēc vienas iedarbības reizes. Tests galvenokārt pamatojas uz Eiropas un Vidusjūras Augu aizsardzības organizācijas ieteikumiem (1). Tomēr ir ņemtas vērā arī citas pamatnostādnes, iekļaujot Vācijas Federatīvās bioloģijas iestādes (2), ASV Vides aizsardzības aģentūras (3) un Starptautiskās Standartizācijas organizācijas (4) pamatnostādnes. ESAO seminārā par augsnes/nosēdumu atlasi, kas 1995. gadā notika Beldžiratē, Itālijā (5), vienojās par šajā testā izmantojamo augšņu skaitu un tipu. Ieteikumi par augsnes paraugu vākšanu, apstrādi un glabāšanu pamatojas uz ISO pamatnostādņu dokumentu (6) un Beldžirates semināra ieteikumiem.
Pārbaudot un vērtējot testējamo vielu toksiskās īpašības, var būt jānosaka iedarbības uz augsnes mikrobu aktivitāti, piemēram, ja vajadzīgi dati par augu aizsardzības līdzekļu iespējamām blakusiedarbībām uz augsnes mikrofloru vai ja ir sagaidāma ķīmisko vielu, kas nav augu aizsardzības līdzekļi, iedarbība uz augsnes mikroorganismiem. Oglekļa transformācijas testu izdara, lai noteiktu tādu ķīmisku vielu iedarbību uz augsnes mikrofloru. Ja pārbauda agroķīmiskās vielas (piemēram, kultūraugu aizsardzības līdzekļus, mēslošanas līdzekļus, mežsaimniecības ķīmiskās vielas), tiek veikti oglekļa transformācijas un slāpekļa transformācijas testi. Ja pārbauda ķīmiskās vielas, kas nav agroķīmiskās vielas, pietiek ar slāpekļa transformācijas testu. Tomēr, ja EC50 vērtības šādu ķīmisko vielu slāpekļa transformācijas testā ir diapazonā, kas atrasts tirdzniecībā pieejamiem nitrifikācijas inhibitoriem (piemēram, nitrapirīnam), var izdarīt oglekļa transformācijas testu, lai iegūtu papildu informāciju.
Augsnes sastāv no dzīviem un nedzīviem komponentiem, kas pastāv sarežģītos un neviendabīgos maisījumos. Mikroorganismiem ir svarīga loma organisko vielu noārdīšanā un transformācijā auglīgās augsnēs, kurās daudzas sugas dod ieguldījumu dažādos augsnes auglības aspektos. Jebkura ilgtermiņa iejaukšanās minētajos bioķīmiskajos procesos var potenciāli iejaukties barības vielu apritē, un tas var mainīt augsnes auglību. Oglekļa un slāpekļa transformācija notiek visās auglīgās augsnēs. Kaut arī par šiem procesiem atbildīgās mikrobu kopas atšķiras starp augsnēm, transformācijas ceļi būtībā ir vieni un tie paši.
Šī testa metode ir izveidota, lai noskaidrotu vielas ilgtermiņa kaitīgo iedarbību uz oglekļa transformācijas procesu aerobās virsmas augsnēs. Tests ir jutīgs pret to mikrobu kopu lieluma un aktivitātes izmaiņām, kuras ir atbildīgas par oglekļa transformāciju, jo minētās kopas testā tiek pakļautas ķīmiskai spriedzei un oglekļa trūkumam. Izmanto smilšainu augsni ar mazu organisko vielu saturu. Attiecīgo augsni apstrādā ar testējamo vielu un inkubē apstākļos, kuros var notikt ātrs mikrobiāls metabolisms. Minētajos apstākļos viegli pieejama oglekļa avoti augsnē drīz izsīkst. Tas izraisa oglekļa trūkumu, kas nonāvē mikrobu šūnas un izraisa miera stāvokli un/vai sporu veidošanos. Ja tests ir ilgāks par 28 dienām, minēto reakciju summu var izmērīt (neapstrādātā augsnē) kontrolē kā metaboliski aktīvo mikrobu biomasas pieaugošu zudumu (7). Ja testa apstākļos ķīmiska viela iedarbojas uz biomasu augsnē, kurā ir oglekļa spriedze, biomasa var neatgriezties līdz tam pašam līmenim kā kontrole. Šā iemesla dēļ traucējumi, ko testējamā viela izraisījusi jebkurā testa laikā, bieži paliek līdz testa beigām.
Testi, no kuriem ir izveidota šī testa metode, sākotnēji bija izveidoti vielām, kurām var paredzēt augsnē nokļūstošo daudzumu. Tā tas, piemēram, ir ar kultūraugu aizsardzības līdzekļiem, kuru lietojuma deva praksē ir zināma. Agroķīmiskajām vielām ir pietiekami testēt divas devas, kas saistītas ar sagaidāmo vai paredzamo lietojuma devu. Agroķīmiskās vielas var testēt kā aktīvās sastāvdaļas (a.s.) vai kā preparātus. Tomēr tests nav ierobežots ar ķīmiskajām vielām, kuru koncentrācija vidē ir paredzama. Mainot augsnē lietojamās testējamās vielas daudzumu un datu novērtēšanas veidu, testu var izmantot arī ķīmiskajām vielām, kurām nav zināms sagaidāmais augsnē nokļuvušais daudzums. Tā nosaka koncentrāciju rindas iedarbību uz oglekļa transformāciju vielām, kas nav agroķīmiskās vielas. Šo testu datus izmanto devas–atbildes reakcijas līknes sagatavošanai un ECx vērtību aprēķināšanai, kur x ir noteikts kā iedarbības %.
1.2. DEFINĪCIJAS
Oglekļa transformācija: mikroorganismu veikta organisko vielu noārdīšana, veidojoties neorganiskam galaproduktam – oglekļa dioksīdam.
EC X (efektīvā koncentrācija): testējamās vielas koncentrācija augsnē, kas izraisa oglekļa transformācijas par oglekļa dioksīdu x procentu kavēšanu.
EC 50 (vidējā efektīvā koncentrācija): testējamās vielas koncentrācija augsnē, kas izraisa oglekļa transformācijas par oglekļa dioksīdu 50 procentu kavēšanu.
1.3. STANDARTVIELAS
Nav.
1.4. TESTA METODES PRINCIPS
Izsijātu augsni apstrādā ar testējamo vielu vai atstāj neapstrādātu (kontrole). Ja testē agroķīmiskas vielas, ir ieteicamas vismaz divas testa koncentrācijas, un tās jāizvēlas saistībā ar praksē sagaidāmo augstāko koncentrāciju. Pēc 0, 7, 14 un 28 inkubācijas dienām apstrādātās un kontroles augsnes paraugus sajauc ar glikozi un 12 secīgu stundu laikā mēra glikozes inducētos elpošanas ātrumus. Elpošanas ātrumus izsaka kā izdalīto oglekļa dioksīdu (mg oglekļa dioksīda/kg sausas augsnes/h) vai patērēto skābekli (mg skābekļa/kg augsnes/h). Vidējo elpošanas ātrumu apstrādātas augsnes paraugos salīdzina ar vidējo elpošanas ātrumu kontrolei un aprēķina apstrādātā parauga procentuālo atšķirību no kontroles. Visus testus turpina vismaz 28 dienas. Ja 28. dienā apstrādātā un neapstrādātā parauga atšķirība ir vienāda ar 25 % vai lielāka par to, mērījumus turpina 14 dienu starplaikos ne vairāk kā līdz 100 dienām. Ja testē vielas, kas nav agroķīmiskās vielas, testējamās vielas koncentrāciju rindu pievieno augsnes paraugiem, un glikozes inducētos elpošanas ātrumus (t. i., vidējos radušos oglekļa dioksīda vai patērētā skābekļa daudzumus) mēra pēc 28 dienām. Testu ar koncentrāciju rindu rezultātus analizē, izmantojot regresijas modeli, un aprēķina ECx vērtības (t. i., EC50, EC25 un/vai EC10). Skatīt definīcijas.
1.5. TESTA DERĪGUMS
Testa ar agroķīmiskām vielām rezultātu izvērtēšana pamatojas uz relatīvi mazām atšķirībām (t. i., vidējo vērtību ± 25 %) starp izdalīto oglekļa dioksīdu vai patērēto skābekli kontroles un apstrādātas augsnes paraugos, tādēļ lielas izmaiņas kontrolē var izraisīt nepareizus rezultātus. Tādēļ izmaiņām starp kontroles paraugu atkārtojumiem jābūt mazākām par ± 15 %.
1.6. TESTA METODES APRAKSTS
1.6.1. Aprīkojums
Izmanto ķīmiski inerta materiāla testa tvertnes. To tilpumam jāatbilst augšņu inkubācijā izmantojamām procedūrām, t. i., inkubācijai kopā vai atsevišķu augsnes paraugu virknē (skatīt 1.7.1.2. punktu). Jārūpējas, lai testa laikā iespējami samazinātu ūdens zudumu un nodrošinātu gāzu apmaiņu (piemēram, testa tvertnes var pārklāt ar perforētu polietilēna plēvi). Testējot gaistošas vielas, ir jāizmanto graduētas un gāzu necaurlaidīgas tvertnes. Tām jābūt tik lielām, lai ar augsnes paraugu būtu pildīta aptuveni viena ceturtdaļa tilpuma.
Glikozes inducētas elpošanas noteikšanai ir vajadzīgas inkubācijas sistēmas un oglekļa dioksīda veidošanās vai skābekļa patēriņa mērīšanas instrumenti. Šādu sistēmu un instrumentu piemēri ir atrodami literatūras sarakstā (8) (9) (10) (11).
1.6.2. Augšņu izvēle un skaits
Izmanto vienu augsni. Ieteicamie augsnes rādītāji ir šādi:
— smilšu saturs – ne mazāks kā 50 % un ne lielāks kā 75 %,
— pH līmenis – 5,5–7,5,
— organiskā oglekļa saturs – 0,5–1,5 %,
— mikrobu biomasa ir jāizmēra (12) (13), un tās oglekļa saturam jābūt vismaz 1 % no kopējā augsnes organiskā oglekļa.
Vairumā gadījumu augsne ar šādiem rādītājiem pārstāv sliktākā gadījuma situāciju, jo testējamās ķīmiskās vielas adsorbcija ir minimāla un tās pieejamība mikroflorai ir maksimāla. Tādēļ testi ar citām augsnēm parasti nav vajadzīgi. Tomēr dažos apstākļos, piemēram, ja testējamās vielas sagaidāmā galvenā izmantošana ir īpašās augsnēs, tādās kā skābas meža augsnes, vai ja ķīmiskās vielas ir elektrostatiski uzlādētas, var būt vajadzīga papildu augsnes izmantošana.
1.6.3. Augsnes paraugu savākšana un glabāšana
1.6.3.1. Savākšana
Ir jābūt pieejamai sīkai informācijai par tās vietas vēsturi, no kuras savākta testa augsne. Dati iekļauj precīzu atrašanās vietu, zemsedzi, datus par apstrādi ar kultūraugu aizsardzības līdzekļiem, bioloģisko materiālu piedevām vai nejaušiem piesārņojumiem. Augsnes savākšanai izraudzītajai vietai jābūt ilgstoši izmantojamai. Piemērotas ir ganības, lauki ar viengadīgām graudaugu kultūrām (izņemot kukurūzu) vai blīvi apsēts zaļmēslojums. Izraudzītā paraugu ņemšanas vieta nedrīkst būt apstrādāta ar kultūraugu aizsardzības līdzekļiem vismaz vienu gadu pirms paraugu ņemšanas. Arī organiskie mēslošanas līdzekļi nedrīkst būt pielietoti vismaz sešus mēnešus. Minerālmēslu izmantošana ir pieņemama tikai saskaņā ar kultūraugu prasībām, un augsnes paraugus nedrīkst ņemt vismaz trīs mēnešu laikā pēc mēslošanas līdzekļa pielietošanas. Ir jāizvairās izmantot augsni, kas apstrādāta ar mēslošanas līdzekļiem ar zināmu biocīdu iedarbību (piemēram, kalcija ciānamīds).
Jāizvairās ņemt paraugus tieši pēc ilgiem sausuma vai pārplūšanas laika posmiem (ilgākiem par 30 dienām). Aramzemju paraugi jāņem no 0 līdz 20 cm dziļuma. Pļavu (ganību) vai citām augsnēs, kur aršana nenotiek ilgākos laika posmos (vismaz vienu augšanas periodu), maksimālais paraugu ņemšanas dziļums var būt nedaudz lielāks par 20 cm (piemēram, līdz 25 cm). Augsnes paraugi jāpārvadā, izmantojot tvertnes un temperatūras apstākļos, kas garantē, ka augsnes sākotnējās īpašības nav ievērojami mainījušās.
1.6.3.2. Glabāšana
Vēlams izmantot augsnes, kas ir svaigi savāktas no lauka. Ja nevar izvairīties no glabāšanas laboratorijā, augsnes var glabāt tumsā 4 ± 2 oC temperatūrā ilgākais trīs mēnešus. Augšņu glabāšanas laikā jānodrošina aerobi apstākļi. Ja augsnes vāc vietās, kur tās ir sasalušas vismaz trīs mēnešus gadā, var apsvērt sešus mēnešus ilgu glabāšanu mīnus 18 oC temperatūrā. Pirms katra eksperimenta izmērī glabāto augšņu mikrobu biomasu, un oglekļa saturam biomasā jābūt vismaz 1 % no kopējā augsnes oglekļa satura (skatīt 1.6.2. punktu).
1.6.4. Augsnes apstrāde un tās sagatavošana testam
1.6.4.1. Priekšinkubācija
Ja augsne ir glabāta (skatīt 1.6.4.2. un 1.7.1.3. punktu), ir ieteicama 2 līdz 28 dienu ilga priekšinkubācija. Priekšinkubācijas laikā augsnes temperatūrai un mitruma saturam jābūt līdzīgam testā izmantotajai temperatūrai un mitruma saturam (skatīt 1.6.4.2. un 1.7.1.3. punktu).
1.6.4.2. Fizikāli ķīmiskās īpašības
Augsni ar rokām attīra no lieliem priekšmetiem (piemēram, akmeņiem, augu daļām utt.) un pēc tam mitru sijā, pārmērīgi neizžāvējot, līdz daļiņu lielumam, mazākam vai vienādam ar 2 mm. Augsnes mitruma saturs ir jākoriģē ar destilētu vai dejonizētu ūdeni līdz vērtībai no 40 % līdz 60 % no maksimālās ūdens saturēšanas spējas.
1.6.5. Testējamās vielas sagatavošana pielietošanai augsnē
Testējamo vielu parasti pielieto, izmantojot nesēju. Nesējs var būt ūdens (ūdenī šķīstošām vielām) vai inerta cieta viela, tāda kā smalkas kvarca smiltis (daļiņu lielums – 0,1–0,5 mm). Lietot šķidrus nesējus, izņemot ūdeni (piemēram, organiskos šķīdinātājus, tādus kā acetons, hloroforms), ir jāizvairās, jo tie var kaitēt mikroflorai. Ja par nesēju izmanto smiltis, tās var pārklāt ar testējamo vielu, kas izšķīdināta vai suspendēta piemērotā šķīdinātājā. Tādos gadījumos pirms sajaukšanas ar augsni šķīdinātājs jāaizvada iztvaicējot. Optimālam testējamās vielas sadalījumam augsnē ir ieteicama attiecība 10 g smilšu uz kilogramu augsnes (sauss svars). Kontroles paraugus apstrādā tikai ar tādu pašu daudzumu ūdens un/vai kvarca smilšu.
Testējot gaistošas ķīmiskās vielas, apstrādes laikā ir iespējami jāizvairās no zudumiem un jācenšas nodrošināt viendabīgu sadalījumu augsnē (piemēram, testējamā viela ir jāinjicē augsnē vairākās vietās).
1.6.6. Testa koncentrācijas
Ja testē kultūraugu aizsardzības produktus vai citas ķīmiskās vielas ar paredzamām koncentrācijām vidē, ir jāizmanto vismaz divas koncentrācijas. Mazākajai koncentrācijai jāatspoguļo vismaz maksimālais daudzums, kas praktiskos apstākļos, sagaidāms, nokļūs augsnē, bet lielākajai koncentrācijai jābūt mazākās koncentrācijas daudzkārtnim. Augsnei pievienotās testējamās vielas koncentrācijas aprēķina, pieņemot, ka viela ir vienmērīgi iestrādāta 5 cm dziļumā un augsnes bēruma blīvums ir 1,5. Agroķīmiskām vielām, ko pielieto tieši augsnē, vai ķīmiskām vielām, kuru augsnē nokļuvušo daudzumu var paredzēt, ieteicamās koncentrācijas ir paredzamā koncentrācija vidē (PEC) un par to piecreiz lielāka koncentrācija. Vielas, ko paredzēts pielietot augsnēm vairākas reizes vienā sezonā, ir jātestē koncentrācijās, kas atvasinātas, reizinot PEC ar maksimālo sagaidāmo pielietošanas reižu skaitu. Lielākā testētā koncentrācija tomēr nedrīkst pārsniegt desmitkāršotu maksimālo viena lietojuma devu.
Ja testē vielas, kas nav agroķīmiskas vielas, izmanto vismaz piecu koncentrāciju ģeometrisko rindu. Testētajām koncentrācijām ir jāiekļauj ECx vērtības noteikšanai vajadzīgo koncentrāciju diapazons.
1.7. TESTA NORISE
1.7.1. Iedarbības apstākļi
1.7.1.1. Iedarbības apstākļi
Ja testē agroķīmiskas vielas, augsni sadala trijās vienāda svara daļās. Divas daļas sajauc ar nesēju, kas satur vielu, un trešo sajauc ar nesēju bez vielas (kontrole). Ir ieteicami vismaz trīs atkārtojumi gan apstrādātai, gan neapstrādātai augsnei. Ja testē vielas, kas nav agroķīmiskas vielas, augsni sadala sešās vienāda svara daļās. Piecus no paraugiem sajauc ar nesēju, kas satur testējamo vielu, un sesto paraugu sajauc ar nesēju bez vielas. Ir ieteicami trīs atkārtojumi gan apstrādei, gan kontrolei. Jārūpējas, lai nodrošinātu vienmērīgu testējamās vielas sadalījumu apstrādātajos augsnes paraugos. Jaukšanas laikā jāizvairās augsni sablīvēt vai savelt.
1.7.1.2. Augsnes paraugu inkubācija
Augsnes paraugu inkubāciju var izdarīt divos veidos – katras apstrādātās un neapstrādātās augsnes kopējiem paraugiem vai katras apstrādātās un neapstrādātās augsnes atsevišķu un vienāda lieluma apakšparaugu rindām. Tomēr, ja testē gaistošas vielas, tests jāizdara tikai ar atsevišķu paraugu rindām. Ja augsnes inkubē kopējā paraugā, sagatavo lielus katras apstrādātās un neapstrādātās augsnes daudzumus un ņem analizējamos paraugus, kā testa laikā vajadzīgs. Katrai apstrādei un kontrolei sākotnēji sagatavojamais daudzums ir atkarīgs no apakšparaugu lieluma, analīzē izmantoto atkārtojumu skaita un sagaidāmā paraugu ņemšanas reižu maksimālā skaita. Kopējā paraugā inkubētās augsnes pirms apakšparaugu ņemšanas ir rūpīgi jāsajauc. Ja augsnes inkubē kā atsevišķu augsnes paraugu rindu, katru apstrādāto un neapstrādāto kopējo augsnes paraugu sadala vajadzīgajā skaitā apakšparaugu un tos izmanto pēc vajadzības. Eksperimentos, kuros sagaidāmas vairāk par divām paraugu ņemšanas reizēm, ir jāsagatavo pietiekami daudz apakšparaugu, ņemot vērā visus atkārtojumus un visas paraugu ņemšanas reizes. Vismaz trīs testa augsnes atkārtojumu paraugi ir jāinkubē aerobos apstākļos (skatīt 1.7.1.1. punktu). Lai izvairītos no anaerobu apstākļu izveidošanās, visos testos jāizmanto piemērotas tvertnes ar pietiekamu tukšo telpu. Ja testē gaistošas vielas, tests jāizdara tikai ar atsevišķu paraugu rindām.
1.7.1.3. Testa apstākļi un ilgums
Testu izdara tumsā, istabas temperatūrā 20 ± 2 oC. Augsnes paraugu mitruma saturs testa laikā jāsaglabā no 40 % līdz 60 % no augsnes maksimālās ūdens saturēšanas spējas (skatīt 1.6.4.2. punktu) ± 5 % diapazonā. Pēc vajadzības var pievienot destilētu, dejonizētu ūdeni.
Minimālais testa ilgums ir 28 dienas. Ja testē agroķīmiskas vielas, salīdzina izdalītā oglekļa dioksīda vai patērētā skābekļa daudzumus apstrādātajos un kontroles paraugos. Ja tie 28. dienā atšķiras vairāk nekā par 25 %, testu turpina, līdz atšķirība ir vienāda ar 25 % vai mazāka par to vai maksimāli 100 dienas, atkarībā no tā, kurš no šiem lielumiem ir mazāks. Vielām, kas nav agroķīmiskas vielas, testu beidz pēc 28 dienām. 28. dienā nosaka izdalītā oglekļa dioksīda vai patērētā skābekļa daudzumu apstrādātajā un kontroles augsnes paraugā un aprēķina ECX vērtības.
1.7.2. Augsnes paraugu ņemšana un analīze
1.7.2.1. Augsnes paraugu ņemšanas grafiks
Ja testē agroķīmiskas vielas, augsnes paraugus analizē attiecībā uz glikozes inducētas elpošanas ātrumiem 0., 7., 14. un 28. dienā. Ja vajadzīgs paildzināts tests, turpmākos mērījumus veic 14 dienu starplaikos pēc 28. dienas.
Ja testu veic vielām, kas nav agroķīmiskas vielas, izmanto vismaz piecas testa koncentrācijas un augsnes paraugus analizē attiecībā uz glikozes inducētas elpošanas ātrumiem iedarbības perioda sākumā (0. dienā) un beigās (28. dienā). Ja uzskata par vajadzīgu, var pievienot starpmērījumu, piemēram, 7. dienā. Datus, kas iegūti 28. dienā, izmanto ECx vērtības noteikšanai. Ja vēlas, 0. dienas kontroles parauga datus var izmantot, lai noteiktu metaboliski aktīvu mikrobu biomasas sākotnējo saturu augsnē (12).
1.7.2.2. Glikozes inducētas elpošanas ātrumu mērīšana
Katrā apstrādātajā un kontroles atkārtojumā glikozes inducētas elpošanas ātrumu nosaka katrā paraugu ņemšanas reizē. Augsnes paraugus sajauc ar pietiekamu daudzumu glikozes, lai izraisītu maksimālo elpošanas atbildes reakciju. Glikozes daudzumu, kas vajadzīgs maksimālās elpošanas atbildes reakcijas izraisīšanai no konkrētās augsnes, var noteikt priekštestā, izmantojot glikozes koncentrāciju rindu (14). Tomēr smilšainām augsnēm ar 0,5–1,5 % organiskā oglekļa parasti pietiek 2 000 mg līdz 4 000 mg glikozes uz kg augsnes sausā svara. Glikozi var samalt pulverī ar tīrām kvarca smiltīm (10 g smilšu/kg augsnes sausā svara) un vienmērīgi sajaukt ar augsni.
Ar glikozi uzlabotus augsnes paraugus 20 ± 2 oC temperatūrā inkubē aparātā, kas piemērots elpošanas ātrumu mērīšanai nepārtraukti, katru stundu vai katras divas stundas (skatīt 1.6.1. punktu). Izdalīto oglekļa dioksīdu vai patērēto skābekli mēra 12 secīgas stundas, un mērījumi jāuzsāk iespējami drīz, t. i., 1 līdz 2 stundas pēc glikozes pievienošanas. Mēra kopējo izdalītā oglekļa dioksīda vai patērētā skābekļa daudzumu 12 stundu laikā un nosaka vidējos elpošanas ātrumus.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Ja testus izdara ar agroķīmiskām vielām, katrā augsnes parauga atkārtojumā izdalītā oglekļa dioksīda vai patērētā skābekļa daudzums jāreģistrē, un visu atkārtojumu vidējās vērtības jāsniedz tabulas veidā. Rezultāti ir jānovērtē ar piemērotām un vispārpieņemtām statistikas metodēm (piemēram, F-testu, 5 % nozīmības līmeni). Glikozes inducētās elpošanas ātrumus izsaka mg oglekļa dioksīda/kg augsnes sausā svara/h. Vidējo oglekļa dioksīda izdalīšanās vai skābekļa patēriņa ātrumu katrā apstrādē salīdzina ar oglekļa dioksīda izdalīšanās vai skābekļa patēriņa ātrumu kontrolē un aprēķina procentuālo novirzi no kontroles.
Ja testus izdara ar vielām, kas nav agroķīmiskas vielas, nosaka katrā atkārtojumā izdalīto oglekļa dioksīda vai patērēto skābekļa daudzumu un ECx vērtības novērtēšanai sagatavo devas–atbildes reakcijas līkni. Glikozes inducētās elpošanas ātrumus (t. i., mg oglekļa dioksīda/kg sausā svara augsnes/h vai mg skābekļa/kg sausā svara augsnes/h), kas konstatēti apstrādātajiem paraugiem pēc 28 dienām, salīdzina ar kontrolē konstatētajiem. No šiem datiem izrēķina kavēšanas vērtību procentos katrai testa koncentrācijai. Attiecīgos procentus atliek pret koncentrāciju un izmanto statistikas procedūras, lai aprēķinātu ECx vērtības. Izmantojot standarta procedūras (15) (16) (17), nosaka arī aprēķinātās ECx ticamības robežas (p = 0,95).
2.2. REZULTĀTU INTERPRETĀCIJA
Ja vērtē testu rezultātus ar agroķīmiskām vielām un ja starpība elpošanas ātrumā starp mazāko apstrādi (t. i., maksimālo paredzēto koncentrāciju) un kontroli ir vienāda ar 25 % vai mazāka par to jebkurā paraugu ņemšanas laikā pēc 28. dienas, var novērtēt, ka ražojumam nav ilgtermiņa ietekmes uz oglekļa transformāciju augsnēs. Ja vērtē testu rezultātus ar vielām, kas nav agroķīmiskas vielas, izmanto EC50, EC25 un/vai EC10 vērtības.
3. PĀRSKATA SAGATAVOŠANA
PĀRSKATS PAR TESTU
Pārskatā par testu jābūt iekļautai šādai informācijai.
Pilnīga izmantotās augsnes identifikācija, kurā iekļauta:
— vietas ģeogrāfiskā norāde (garums, platums),
— informācija par vietas vēsturi (t. i., augsega, apstrāde ar kultūraugu aizsardzības līdzekļiem, apstrāde ar mēslošanas līdzekļiem, nejaušs piesārņojums utt.),
— izmantošanas veids (piemēram, lauksaimniecības zeme, mežs utt.),
— paraugu ņemšanas dziļums (cm),
— smilšu/sanesu/māla saturs (% no sausa svara),
— pH (ūdenī),
— organiskā oglekļa saturs (% no sausa svara),
— slāpekļa saturs (% no sausa svara),
— katjonu apmaiņas spēja (mmol/kg),
— sākotnējā mikrobu biomasa procentos no kopējā organiskā oglekļa,
— norāde par katra rādītāja noteikšanā izmantotajām metodēm,
— visa informācija par augsnes paraugu vākšanu un glabāšanu,
— sīki dati par augsnes priekšinkubāciju, ja tā bijusi.
Testējamā viela:
— fizikālās īpašības un attiecīgā gadījumā fizikāli ķīmiskās īpašības,
— ķīmiskās identifikācijas dati, attiecīgā gadījumā iekļaujot struktūras formulu, tīrību (t. i., kultūraugu aizsardzības līdzekļiem aktīvās sastāvdaļas procentuālo daudzumu), slāpekļa saturu.
Testa apstākļi:
— sīki dati par augsnes uzlabošanu ar organisko substrātu,
— izmantotās testējamās ķīmiskās vielas koncentrāciju skaits un attiecīgā gadījumā izraudzīto koncentrāciju pamatojums,
— sīki dati par testējamās vielas pielietošanu augsnē,
— inkubācijas temperatūra,
— augsnes mitruma saturs testa sākumā un testa laikā,
— izmantotā augsnes inkubācijas metode (t. i., kopējam paraugam vai atsevišķu apakšparaugu rindai),
— atkārtojumu skaits,
— paraugu ņemšanas reizes.
Rezultāti:
— elpošanas ātruma mērīšanai izmantotā metode un iekārta,
— tabulas veidā apkopoti dati, iekļaujot oglekļa dioksīda vai skābekļa daudzumu atsevišķās un vidējās vērtības,
— atšķirības starp atkārtojumiem apstrādātajos un kontroles paraugos,
— attiecīgā gadījumā aprēķinos izdarīto korekciju skaidrojums,
— glikozes inducētās elpošanas ātrumu procentuālās atšķirības katrā paraugu ņemšanas reizē vai attiecīgā gadījumā EC50 vērtība ar 95 procentu ticamības robežu, pārējās ECx (t. i., EC25 vai EC10) ar ticamības starplaikiem un devas–atbildes reakcijas līknes grafika,
— rezultātu statistiskā apstrāde, ja iespējams,
— visa informācija un novērojumi, kas noderīgi rezultātu interpretācijai.
4. IZMANTOTĀ LITERATŪRA
(1) EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1–16, 1994.
(2) BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990).
(3) EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
(4) SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brussels.
(5) OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995.
(6) ISO 10381-6 (1993). Soil quality – Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
(7) Anderson, J.P.E. (1987). Handling and Storage of Soils for Pesticide Experiments, in “Pesticide Effects on Soil Microflora”. Eds. L. Somerville and M.P. Greaves, Chap. 3: 45–60.
(8) Anderson, J.P.E. (1982). Soil Respiration, in “Methods of Soil Analysis – Part 2: Chemical and Microbiological Properties”. Agronomy Monograph No 9. Eds. A.L. Page, R.H. Miller and D.R. Keeney. 41: 831–871.
(9) ISO 11266-1. (1993). Soil Quality – Guidance on Laboratory Tests for Biodegradation in Soil: Part 1. Aerobic Conditions.
(10) ISO 14239 (1997E). Soil Quality – Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions.
(11) Heinemeyer, O., Insam, H., Kaiser, E.A, and Walenzik, G. (1989). Soil microbial biomass and respiration measurements; an automated technique based on infrared gas analyses. Plant and Soil, 116: 77–81.
(12) ISO 14240-1 (1997). Soil quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method.
(13) ISO 14240-2 (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method.
(14) Malkomes, H.-P. (1986). Einfluß von Glukosemenge auf die Reaktion der Kurzzeit-Atmung im Boden Gegenüber Pflanzenschutzmitteln, Dargestellt am Beispiel eines Herbizide. (Influence of the Amount of Glucose Added to the Soil on the Effect of Pesticides in Short-Term Respiration, using a Herbicide as an Example). Nachrichtenbl. Deut. Pflanzenschutzd., Braunschweig, 38: 113–120.
(15) Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, p. 99–113.
(16) Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York.
(17) Finney D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK.
C.23. AEROBĀ UN ANAEROBĀ TRANSFORMĀCIJA AUGSNĒ
1. METODE
Šī testa metode ir ESAO 307 (2002) vadlīnijā noteiktās metodes kopija.
1.1. IEVADS
Šī testa metode pamatojas uz esošajām pamatnostādnēm (1) (2) (3) (4) (5) (6) (7) (8) (9). Šajā testa metodē aprakstītā metode ir paredzēta ķīmisko vielu aerobās un anaerobās transformācijas augsnē novērtēšanai. Eksperimentus veic, lai noteiktu – i) testējamās vielas transformācijas ātrumu un ii) transformācijas produktu, kas var iedarboties uz augiem un augsnes organismiem, īpašības un veidošanās un samazināšanās ātrumu. Tādi pētījumi ir vajadzīgi par ķīmiskajām vielām, ko tieši pielieto augsnē vai kas varētu nokļūt augsnes vidē. Tādus laboratorijas pētījumu rezultātus var arī izmantot, lai izveidotu paraugu ņemšanas un analīzes protokolus ar pētījumiem saistītās jomās.
Lai novērtētu transformācijas ceļus, parasti pietiek ar aerobiem un anaerobiem pētījumiem ar vienu augsnes tipu (8) (10) (11). Transformācijas ātrumi ir jānosaka vismaz trīs papildu augsnēs (8) (10).
ESAO seminārā par augsnes un nosēdumu atlasi, kas 1995. gadā notika Beldžiratē, Itālijā (10), vienojās jo īpaši par šajā testā izmantojamo augšņu skaitu un tipu. Testēto augšņu tipiem jābūt reprezentatīviem attiecībā uz vides apstākļiem, kuros notiek izmantošana vai izlaišana. Piemēram, ķīmiskās vielas, ko var izlaist subtropiskajā vai tropiskajā klimatā, ir jātestē ar Ferrasols vai Nitosols (FAO sistēma). Seminārs arī sniedza ieteikumus attiecībā uz augsnes paraugu vākšanu, apstrādi un glabāšanu, pamatojoties uz ISO pamatnostādnēm (15). Šajā metodē ir apsvērta arī rīsa augšņu izmantošana.
1.2. DEFINĪCIJAS
Testējamā viela: jebkura viela, gan izejas savienojums, gan attiecīgie transformācijas produkti.
Transformācijas produkti: visas vielas, kas rodas testējamās vielas biotiskās vai abiotiskās transformācijas reakcijās, iekļaujot CO2 un produktus, kas ir saistītās nogulsnēs.
Saistītās nogulsnes: “saistītās nogulsnes” ir vielas augsnē, augos vai dzīvniekos, kuras ir noturīgas matricā izejas savienojuma vai tā metabolītu/transformācijas produktu veidā pēc ekstrakcijas. Ekstrakcijas metode nedrīkst būtiski mainīt pašus savienojumus vai matricas struktūru. Saistības veidu var noskaidrot daļēji ar matricu mainošām ekstrakcijas metodēm un sarežģītām analīzes metodēm. Līdz šim, piemēram, šādā veidā ir identificētas kovalentās, jonu un sorbcijas saites, kā arī ieslēgumi. Parasti saistīto nogulšņu veidošanās ievērojami samazina bioloģisko pieejamību un bioloģiski pieejamo daudzumu (12) (Starptautiskā Teorētiskās un lietišķās ķīmijas savienība – modificēts 1984. gadā (13)).
Aerobā transformācija: reakcijas, kas notiek molekulārā skābekļa klātbūtnē (14).
Anaerobā transformācija: reakcijas, kas notiek, izslēdzot molekulārā skābekļa klātbūtni.
Augsne: mazu organismu (galvenokārt mikroorganismu) apdzīvots neorganisku un organisku ķīmisko sastāvdaļu maisījums, pēdējās minētās satur savienojumus ar lielu oglekļa un slāpekļa saturu un lielu molekulsvaru. Ar augsni var rīkoties divos stāvokļos:
a) neskartu, kā tā laika gaitā ir izveidojusies raksturīgos dažādu augšņu tipu slāņos;
b) skartu, kā tā parasti ir atrodama aramzemē vai kā tas notiek, ja rokot vāc paraugus un izmanto šajā testa metodē (14).
Mineralizācija: pilnīga organisko savienojumu noārdīšana līdz CO2 un H2O aerobos apstākļos un līdz CH4, CO2 un H2O anaerobos apstākļos. Šīs testa metodes kontekstā, ja izmanto ar 14C marķētu savienojumu, mineralizācija nozīmē intensīvu noārdīšanos, kuras laikā marķētā oglekļa atomi oksidējas, izdalot attiecīgu daudzumu 14CO2 (14).
Pussabrukšanas periods: t0,5 ir laiks, kas vajadzīgs, lai transformētu 50 % testējamās vielas, ja transformāciju var aprakstīt pirmās kārtas kinētika; tas nav atkarīgs no koncentrācijas.
DT 50 (izzušanas laiks 50): laiks, kurā testējamās vielas koncentrācija samazinās par 50 %; tas ir atšķirīgs no pussabrukšanas perioda t0,5, ja transformācija nenotiek saskaņā ar pirmās kārtas kinētiku.
DT 75 (izzušanas laiks 75): laiks, kurā testējamās vielas koncentrācija samazinās par 75 %.
DT 90 (izzušanas laiks 90): laiks, kurā testējamās vielas koncentrācija samazinās par 90 %.
1.3. STANDARTVIELAS
Standartvielas jāizmanto transformācijas produktu raksturošanai un/vai identifikācijai ar spektroskopijas un hromatogrāfijas metodēm.
1.4. TESTA PIEMĒROJAMĪBA
Metode ir derīga visām ķīmiskajām vielām (nemarķētām vai radioaktīvi marķētām), kurām ir pieejama pietiekami precīza un jutīga analīzes metode. Tā ir derīga nedaudz gaistošiem, negaistošiem, ūdenī šķīstošiem vai ūdenī nešķīstošiem savienojumiem. Tests nav jāpielieto ķīmiskajām vielām, kas ir ļoti gaistošas no augsnes (piemēram, fumigantiem, organiskajiem šķīdinātājiem), un tādēļ šā testa eksperimenta apstākļos nav saglabājamas augsnē.
1.5. INFORMĀCIJA PAR TESTĒJAMO VIELU
Transformācijas ātruma mērīšanai var izmantot nemarķētas vai marķētas vielas. Marķēts materiāls ir vajadzīgs, lai pētītu transformācijas ceļu un noteiktu masas bilanci. Ir ieteicama marķēšana ar 14C, bet noderīga var būt arī citu izotopu, tādu kā 13C, 15N, 3H, 32P izmantošana. Cik iespējams, marķējums jānovieto molekulas stabilākajā(-ās) daļā(-ās). Testējamās vielas tīrībai jābūt vismaz 95 %.
Pirms aerobās un anaerobās transformācijas augsnē testa izdarīšanas vajadzīga šāda informācija par testējamo vielu:
a) šķīdība ūdenī (A.6. metode);
b) šķīdība organiskajos šķīdinātājos;
c) tvaika spiediens (A.4. metode) un Henrija likuma konstante;
d) sadalījuma koeficients sistēmā n-oktanols/ūdens (A.8. metode);
e) ķīmiskā stabilitāte tumsā (hidrolīze) (C.7. metode);
f) pKa, ja molekula protonējas vai deprotonējas (ESAO 112. vadlīnija) (16).
Citā noderīgā informācijā var iekļaut datus par testējamās vielas toksicitāti attiecībā uz augsnes mikroorganismiem (C.21. un C.22. testa metode) (16).
Jābūt pieejamām analīzes metodēm (iekļaujot ekstrakciju un attīrīšanas metodes) testējamās vielas un tās transformācijas produktu kvantitatīvai noteikšanai un identifikācijai.
1.6. TESTA METODES PRINCIPS
Augsnes paraugus apstrādā ar testējamo vielu un inkubē tumsā biometra veida kolbās vai caurplūdes sistēmās kontrolētos laboratorijas apstākļos (nemainīgā temperatūrā un augsnes mitrumā). Piemērotos starplaikos augsnes paraugus ekstrahē un analizē attiecībā uz izejas savienojumu un transformācijas produktiem. Analīzei savāc arī gaistošos produktus, izmantojot piemērotas absorbcijas ierīces. Izmantojot ar 14C marķētu materiālu, var izmērīt dažādus testējamās vielas mineralizācijas ātrumus, uztverot radušos 14CO2, un noteikt masas bilanci, iekļaujot augsnes saistītās nogulsnes.
1.7. KVALITĀTES KRITĒRIJI
1.7.1. Atgūstamība
Vismaz divu paralēlu augsnes paraugu ekstrahēšana un analīze tieši pēc testējamās vielas pievienošanas dod pirmo norādi par analīzes metodes atkārtojamību un pielietojamās procedūras vienādību testējamai vielai. Atgūstamību eksperimentu vēlākiem posmiem iegūst no attiecīgajām masas bilancēm. Atgūstamībai jābūt diapazonā no 90 % līdz 110 % marķētām ķīmiskām vielām (8) un no 70 % līdz 110 % nemarķētām ķīmiskām vielām (3).
1.7.2. Analīzes metodes atkārtojamība un jutība
Analīzes metodes atkārtojamību (izņemot sākotnējās ekstrahēšanas efektivitāti), kvantitatīvi nosakot testējamās vielas un transformācijas produktu, var pārbaudīt, veicot divas paralēlas analīzes vienam un tam pašam augsnes ekstraktam, kas ir pietiekami inkubēts, lai veidotos transformācijas produkts.
Analītiskās metodes kvalitatīvās noteikšanas robežai (KNR) attiecībā uz testējamo vielu un transformācijas produktiem jābūt vismaz 0,01 mg.kg-1 augsnes (kā testējamai vielai) vai 1 % no pielietotās devas, atkarībā no tā, kurš lielums ir mazāks. Ir jānorāda arī kvantitatīvās noteikšanas robeža (LOQ).
1.7.3. Transformācijas datu precizitāte
Testējamās vielas koncentrācijas kā laika funkcijas regresijas analīze sniedz attiecīgu informāciju par transformācijas līknes ticamību un ļauj aprēķināt pussabrukšanas perioda ticamības robežas (pseido pirmās kārtas kinētikas gadījumā) vai DT50 vērtības un attiecīgā gadījumā DT75 un DT90 vērtības.
1.8. TESTA METODES APRAKSTS
1.8.1. Aprīkojums un ķīmiskie reaģenti
Inkubācijas sistēmas sastāv no statiskām noslēgtām sistēmām vai piemērotām caurplūdes sistēmām (7) (17). Piemērotu caurplūdes augsnes inkubācijas aparātu un biometra tipa kolbu piemēri ir attiecīgi parādīti 1. un 2. attēlā. Abu veidu inkubācijas sistēmām ir priekšrocības un ierobežojumi (7) (17).
Ir vajadzīgs laboratorijas standartaprīkojums, un jo īpaši šāds aprīkojums:
— analīzes iekārtas, tādas kā GŠH, HPLC, TLC aprīkojums, iekļaujot attiecīgās atklāšanas sistēmas radioaktīvi marķētu un nemarķētu vielu analīzei vai apgrieztajai izotopu atšķaidīš metodei,
— aparāti identifikācijas nolūkiem (piemēram, MS, GC-MS, HPLC-MS, KMR utt.),
— šķidruma scintilāciju skaitītājs,
— oksidēšanas iekārta radioaktīvā materiāla sadedzināšanai,
— centrifūga,
— ekstrahēšanas aparāts (piemēram, centrifūgas mēģenes aukstajai ekstrahēšanai un Soksleta aparāts nepārtrauktai ekstrahēšanai ar atteci),
— aprīkojums šķīdumu un ekstraktu koncentrēšanai (piemēram, rotācijas iztvaicētājs),
— ūdens vanna,
— mehāniskais maisītājs (piemēram, mīcītājs, rotācijas maisītājs).
Izmantojamie ķīmiskie reaģenti, piemēram, ir:
— NaOH, analītiski tīrs, 2 mol· dm-3, vai cita piemērota bāze (piemēram, KOH, etanolamīns),
— H2SO4, analītiski tīrs, 0,05 mol· dm-3,
— etilēnglikols, analītiski tīrs,
— cieti absorbcijas materiāli, tādi kā natronkaļķi un poliuretāna aizbāžņi,
— organiskie šķīdinātāji, analītiski tīri, tādi kā acetons, metanols utt.,
— scintilācijas šķidrums.
1.8.2. Testējamās vielas pielietošana
Testējamo vielu pielietošanai un sadalīšanai augsnē var izšķīdināt ūdenī (dejonizētā vai destilētā) vai vajadzības gadījumā niecīgos daudzumos acetonā vai citos organiskajos šķīdinātājos (6), kuros testējamā viela ir pietiekami šķīstoša un stabila. Tomēr izraudzītā šķīdinātāja daudzums nedrīkst ievērojami ietekmēt augsnes mikrobu aktivitāti (skatīt 1.5. un 1.9.2.–1.9.3. punktu). Ir jāizvairās lietot šķīdinātājus, kas kavē mikrobu aktivitāti, piemēram, hloroformu, dihlormetānu un citus halogenētus šķīdinātājus.
Testējamo vielu var arī pievienot kā cietu vielu, piemēram, sajauktu ar kvarca smiltīm (6) vai testa augsnes, kas ir izžāvēta gaisā, sausa un sterilizēta, nelielā apakšparaugā. Ja testējamo vielu pievieno, izmantojot šķīdinātāju, ir jāļauj šķīdinātājam iztvaikot, pirms apakšparaugu ar piejaukumu pievieno oriģinālajam nesterilajam augsnes paraugam.
Parastajām ķīmiskajām vielām, kuru galvenais iekļūšanas veids augsnē ir caur notekūdeņu dūņām/pielietošanu lauksaimniecībā, testējamā viela ir vispirms jāpievieno dūņām, ko pēc tam ievada augsnes paraugā (skatīt 1.9.2. un 1.9.3. punktu).
Izmantot preparātus parasti nav ieteicams. Tomēr, piemēram, slikti šķīstošām testējamām vielām preparātu izmantošana var būt piemērota alternatīva.
1.8.3. Augsnes
1.8.3.1. Augšņu atlase
Lai noteiktu transformācijas ceļu, var lietot reprezentatīvu augsni; ir ieteicams smilšains smilšmāls vai sanešu smilšmāls, vai smilšmāls, vai smilšmālaina smilts (saskaņā ar FAO un USDA klasifikāciju (18)) ar pH 5,5–8,0, organiskā oglekļa saturu 0,5–2,5 % un mikrobu biomasu vismaz 1 % no kopējā organiskā oglekļa (10).
Transformācijas ātruma pētījumos jāizmanto vismaz trīs papildu augsnes, kas pārstāv attiecīgo augšņu diapazonu. Augsnēm jāatšķiras pēc oglekļa satura, pH, mālu satura un mikrobu biomasas (10).
Visas augsnes jāraksturo vismaz attiecībā uz struktūru (% smilšu, % sanešu, % mālu) (saskaņā ar FAO un USDA klasifikāciju (18)), pH, katjonu apmaiņas spēju, organisko oglekli, bēruma blīvumu, ūdens aiztures īpašībām un mikrobu biomasu (tikai aerobiem pētījumiem). Rezultātu interpretēšanā var būt noderīga papildu informācija par augsnes īpašībām. Augsnes īpašību noteikšanai var izmantot literatūras sarakstā (19) (20) (21) (22) (23) ieteiktās metodes. Mikrobu masa ir jānosaka, izmantojot substrāta inducētās elpošanas (SIR) metodi (25) (26) vai alternatīvas metodes (20).
1.8.3.2. Augšņu vākšana, apstrāde un glabāšana
Ir jābūt pieejamai sīkai informācijai par tās vietas vēsturi, no kuras savākta testa augsne. Dati iekļauj precīzu atrašanās vietu, zemsedzi, datus par apstrādi ar ķīmiskām vielām, apstrādi ar organiskajiem un neorganiskajiem mēslošanas līdzekļiem, bioloģisko materiālu piedevām vai citiem piesārņojumiem. Ja augsnes iepriekšējos četros gados ir apstrādātas ar testējamo vielu vai tās struktūras analogiem, tās nav jāizmanto transformācijas pētījumos (10) (15).
Augsnei jābūt tikko savāktai no lauka (no A horizonta vai no augsnes augšējā 20 cm biezā slāņa) ar augsnes ūdens saturu, kas atvieglo sijāšanu. Augsnēm, kas nav rīsa lauku augsnes, no paraugu ņemšanas jāizvairās ilgu (> 30 dienu) sausuma, sasaluma vai pārplūšanas periodu laikā vai tūlīt pēc tiem (14). Paraugi ir jāpārved tādā veidā, kas iespējami samazina augsnes ūdens satura izmaiņas, un, cik iespējams, jātur tumsā, brīvi piekļūstot gaisam. Šajā nolūkā parasti ir piemērots vaļīgi aizsiets polietilēna maiss.
Augsne jāapstrādā iespējami drīz pēc paraugu ņemšanas. Veģetācija, lielāka augsnes fauna un akmeņi ir jāizņem, pirms augsni izsijā caur 2 mm sietu, kas atdala mazus akmeņus, faunu un augu atliekas. Jāizvairās no augsnes intensīvas žāvēšanas un drupināšanas pirms sijāšanas (15).
Ja ziemā paraugu ņemšana laukā ir apgrūtināta (augsne sasalusi vai pārklāta ar sniega slāni), to var ņemt no augsnes krājuma, ko glabā siltumnīcā zem zemsedzes (piemēram, zāles vai zāles un āboliņa maisījumiem). Pētījumiem ar tikko no lauka savāktu augsni noteikti ir priekšroka, bet, ja savāktā un apstrādātā augsne ir jāglabā pirms pētījuma sākšanas, glabāšanas apstākļiem jābūt atbilstošiem un tikai uz ierobežotu laiku (4 ± 2 oC temperatūrā maksimāli uz trim mēnešiem), lai saglabātos mikrobu aktivitāte. Sīki izstrādātas instrukcijas par biotransformācijas eksperimentos izmantojamo augšņu vākšanu, apstrādi un glabāšanu ir atrodamas literatūras sarakstā (8) (10) (15) (26) (27).
Pirms apstrādāto augsni izmanto šajā testā, tai izdara priekšinkubāciju, lai izdiedzētu un atdalītu sēklas un lai atjaunotu mikrobu metabolisma līdzsvaru pēc izmaiņām no paraugu ņemšanas vai glabāšanas apstākļiem uz inkubācijas apstākļiem. Parasti ir piemērots 2 līdz 28 dienu priekšinkubācijas periods aptuvenos faktiskā testa temperatūras un mitruma apstākļos. Glabāšanas un priekšinkubācijas laikam kopā nav jāpārsniedz trīs mēneši.
1.9. TESTA NORISE
1.9.1. Testa apstākļi
1.9.1.1. Testa temperatūra
Visā testa laikā augsnes ir jāinkubē tumsā, nemainīgā temperatūrā, kas ir reprezentatīva klimata apstākļiem, kuros notiks vielas izmantošana vai izlaišana. Ieteicama 20 ± 2 oC temperatūra visām testējamām vielām, kas var nokļūt augsnē mērenā klimatā. Temperatūra ir jāpārrauga.
Attiecībā uz ķīmiskām vielām, ko pielieto vai izlaiž aukstākā klimatā (piemēram, ziemeļu valstīs, rudens/ziemas periodos), ir jāinkubē papildu augsnes paraugi, bet zemākā temperatūrā (piemēram, 10 ± 2 oC).
1.9.1.2. Mitruma saturs
Transformācijas testiem aerobos apstākļos augsnes mitruma saturs jākoriģē un jāuztur pie pF no 2,0 līdz 2,5 (3). Augsnes mitruma saturu izsaka kā ūdens masu uz sausas augsnes masu, un tas ir regulāri jākontrolē (piemēram, divu nedēļu starplaikos), sverot inkubācijas kolbas un kompensējot ūdens zudumus ar ūdens (vēlams, sterili filtrēta krāna ūdens) pievienošanu. Jārūpējas, lai novērstu vai iespējami samazinātu testējamās vielas un/vai transformācijas produktu zudumus iztvaikošanas un/vai fotonoārdīšanās (ja tā notiek) veidā mitruma papildināšanas laikā.
Transformācijas testiem anaerobos un rīsa lauku apstākļos augsne ir piesātināta ar ūdeni appludinot.
1.9.1.3. Aerobas inkubācijas apstākļi
Caurplūdes sistēmās aerobos apstākļus uztur, ar pārtraukumiem appludinot vai nepārtraukti vēdinot ar mitrinātu gaisu. Biometra kolbās gaisa apmaiņu uztur ar difūziju.
1.9.1.4. Sterili aerobi apstākļi
Lai iegūtu informāciju par testējamās vielas abiotiskās transformācijas nozīmīgumu, augsnes paraugus var sterilizēt (sterilizācijas metodes skatīt (16) un (29)), apstrādāt ar sterilu testējamo vielu (piemēram, pievienot šķīdumu caur sterilu filtru) un aerēt ar mitrinātu sterilu gaisu, kā aprakstīts 1.9.1.3. punktā. Rīsa lauku augsne un ūdens jāsterilizē un inkubācija jāizdara, kā aprakstīts 1.9.1.6. punktā.
1.9.1.5. Anaerobas inkubācijas apstākļi
Lai izveidotu un uzturētu anaerobus apstākļus, ar testējamo vielu apstrādātu un 30 dienas vai vienu pussabrukšanas periodu, vai DT50 (atkarībā no tā, kurš ir īsāks) aerobos apstākļos inkubētu augsni pēc tam pārklāj ar ūdeni (1–3 cm biezu ūdens slāni) un inkubācijas sistēmu applūdina ar inertu gāzi (piemēram, slāpekli vai argonu). Testa sistēmā jāvar izdarīt mērījumus, tādus kā pH, skābekļa koncentrācija un redokspotenciāls, un jāiekļauj gaistošo produktu uztveršanas ierīces. Biometra veida sistēmai jābūt noslēgtai, lai izvairītos no gaisa iekļūšanas difundējot.
1.9.1.6. Rīsa lauka inkubācijas apstākļi
Lai pētītu transformāciju rīsu lauku augsnēs, augsni applūdina ar apmēram 1–5 cm biezu ūdens slāni un testējamo vielu pielieto ūdens fāzei (9). Ieteicamais augsnes dziļums ir vismaz 5 cm. Sistēmu vēdina ar gaisu tāpat kā aerobos apstākļos. Jāpārrauga un jāreģistrē ūdens slāņa pH, skābekļa koncentrācija un redokspotenciāls. Pirms transformācijas pētījumu uzsākšanas ir nepieciešams vismaz divas nedēļas ilgs pirmsinkubācijas laika posms (skatīt 1.8.3.2. punktu).
1.9.1.7. Testa ilgums
Ātruma un noārdīšanās ceļa pētījumiem parasti nav jāpārsniedz 120 dienas (3) (6) (8), jo pēc tam mākslīgā laboratorijas sistēmā, kas izolēta no dabiskās papildināšanās, ir sagaidāma augsnes mikrobu aktivitātes samazināšanās. Ja ir jāraksturo testējamās vielas samazinājums un galveno transformācijas produktu veidošanās un samazinājums, pētījumu var turpināt ilgākā laika posmā (piemēram, 6 vai 12 mēnešus) (8). Ilgāki inkubācijas periodi ir jāpamato pārskatā par testu, un tiem jābūt kopā ar biomasas mērījumiem minēto periodu laikā un to beigās.
1.9.2. Testa norise
Aptuveni 50 līdz 200 g augsnes (pamatojoties uz sausu svaru) ievieto katrā inkubācijas kolbā (skatīt 3. papildinājuma 1. un 2. attēlu) un augsni apstrādā ar testējamo vielu, izmantojot vienu no 1.8.2. punktā aprakstītajām metodēm. Ja testējamās vielas pielietošanai izmanto organiskos šķīdinātājus, tie ir jāaizvada no augsnes iztvaicējot. Pēc tam augsni rūpīgi sajauc ar lāpstiņu un/vai kratot kolbu. Ja pētījumu veic rīsa lauka apstākļos, augsne un ūdens pēc testējamās vielas pielietošanas ir rūpīgi jāsajauc. Apstrādātās augsnes mazi alikvoti (piemēram, 1 g) ir jāanalizē attiecībā uz testējamo vielu, lai pārbaudītu tās vienmērīgu sadalījumu. Alternatīvu metodi skatīt turpmāk.
Apstrādes devai jāatbilst lietošanas pamācībās ieteiktajai augstākajai kultūraugu aizsardzības līdzekļa devai un jābūt vienmērīgi iestrādātai atbilstoši dziļumam laukā (piemēram, augsnes augšējā 10 cm biezā slānī ( 33 ). Piemēram, ķīmiskajām vielām, ko bez iestrādāšanas pielieto uz lapām vai augsnes, atbilstošais dziļums izskaitļošanai, cik daudz ķīmiskās vielas ir jāpievieno katrā kolbā, ir 2,5 cm. Augsnē iestrādātām ķīmiskajām vielām atbilstošais dziļums ir lietošanas pamācībās norādītais iestrādāšanas dziļums. Vispārējām ķīmiskajām vielām lietojuma deva jāaplēš, pamatojoties uz visatbilstošāko ievadīšanas veidu; piemēram, ja galvenais ievadīšanas veids augsnē ir caur notekūdeņu dūņām, ķīmiskā viela ir jādozē dūņās koncentrācijā, kas atspoguļo sagaidāmo koncentrāciju dūņās, un augsnei pievienoto dūņu daudzumam jāatspoguļo parastā dūņu slodze uz lauksaimniecības augsnēm. Ja attiecīgā koncentrācija nav pietiekami liela galveno transformācijas produktu identificēšanai, var būt noderīgi inkubēt atsevišķus augsnes paraugus, kas satur lielākas devas, bet ir jāizvairās no pārlieku lielām devām, kas ietekmē augsnes mikrobu funkcijas (skatīt 1.5. un 1.8.2. punktu).
Alternatīvi – ar testējamo vielu var apstrādāt lielāku augsnes partiju (t. i., 1 līdz 2 kg), kas rūpīgi sajaukta piemērotā maisītājā un pēc tam mazās 50 līdz 200 g daļās pārnesta inkubācijas kolbās (piemēram, izmantojot parauga dalītājus). Apstrādātās augsnes partijas mazi alikvoti (piemēram, 1 g) ir jāanalizē attiecībā uz testējamo vielu, lai pārbaudītu tās vienmērīgu sadalījumu. Tādai procedūrai ir priekšroka, jo tā ļauj vienmērīgāk sadalīt testējamo vielu augsnē.
Neapstrādātās augsnes paraugus arī inkubē tādos pašos apstākļos (aerobos) kā paraugus, kas apstrādāti ar testējamo vielu. Minētos paraugus izmanto biomasas mērījumiem pētījuma laikā un tā beigās.
Ja augsnē pielieto organiskajā(-os) šķīdinātājā(-os) izšķīdinātu testējamo vielu, augsnes paraugus, kas apstrādāti ar to pašu šķīdinātāja(-u) daudzumu, inkubē tādos pašos apstākļos (aerobos) kā ar testējamo vielu apstrādātos paraugus. Minētos paraugus izmanto biomasas mērījumiem sākumā, pētījuma laikā un beigās, lai pārbaudītu šķīdinātāja(-u) iedarbību uz mikrobu biomasu.
Kolbas, kas satur apstrādāto augsni, vai nu pievieno 1. attēlā parādītajai caurplūdes sistēmai, vai arī noslēdz ar 2. attēlā parādīto absorbcijas kolonnu (skatīt 3. papildinājumu).
1.9.3. Paraugu ņemšana un mērīšana
Dublikātu inkubācijas kolbas atbilstošos starplaikos izņem un augsnes paraugus ekstrahē ar piemērotiem dažādas polaritātes šķīdinātājiem un analizē attiecībā uz testējamo vielu un/vai transformācijas produktiem. Labi izplānots pētījums iekļauj pietiekami daudz kolbu tā, lai katrā paraugu ņemšanas reizē izmantotu divas kolbas. Arī absorbcijas šķīdumus vai cietos absorbcijas materiālus izņem dažādos starplaikos (7 dienu starplaikos pirmā mēneša laikā un pēc viena mēneša 17 dienu starplaikos) katra augsnes parauga inkubācijas laikā un beigās un analizē attiecībā uz gaistošajiem produktiem. Bez augsnes parauga, ko ņem tieši pēc pielietošanas (0. dienas paraugs), jāiekļauj vismaz piecu papildu paraugu ņemšanas punkti. Starplaiki jāizvēlas tā, lai varētu izveidot testējamās vielas samazināšanās modeli un transformācijas produktu veidošanās un samazināšanās modeli (piemēram, 0, 1, 3, 7 dienas; 2, 3 nedēļas; 1, 2, 3 mēneši utt.).
Izmantojot ar 14C marķētu testējamo vielu, neekstrahējamo radioaktivitāti kvantitatīvi nosaka sadedzinot un katram paraugu ņemšanas starplaikam aprēķina masas bilanci.
Anaerobās un rīsa lauka inkubācijas gadījumā augsnes un ūdens fāzes analizē kopā attiecībā uz testējamo vielu un transformācijas produktiem vai arī pirms ekstrakcijas un analīzes atdala filtrējot vai centrifugējot.
1.9.4. Neobligātie testi
Aerobi, nesterili pētījumi papildu temperatūrās un pie papildu augsnes mitrumiem var būt noderīgi, lai noteiktu temperatūras un augsnes mitruma ietekmi uz testējamās vielas transformācijas ātrumiem un/vai tās transformācijas produktiem augsnē.
Var mēģināt papildus raksturot neekstrahējamo radioaktivitāti, izmantojot, piemēram, superkritiskā šķidruma ekstrakciju.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Testējamās vielas daudzumi, transformācijas produkti, gaistošās vielas (tikai %) un neekstrahējamās vielas jāsniedz kā pielietotās sākuma koncentrācijas % un attiecīgā gadījumā kā mg· kg-1 augsnes (pamatojoties uz augsnes sauso svaru) katrā paraugu ņemšanas starplaikā. Masas bilance jāsniedz kā pielietotās sākotnējās koncentrācijas procentuālais daudzums katrā paraugu ņemšanas starplaikā. Testējamās vielas koncentrāciju grafiskais attēlojums attiecībā pret laiku ļauj novērtēt tās transformācijas pussabrukšanas periodu vai DT50. Galvenie transformācijas produkti ir jāidentificē un to koncentrācijas arī jāatliek pret laiku, lai parādītu to veidošanās un samazināšanās ātrumus. Galvenais transformācijas produkts ir jebkurš produkts, kas pārstāv ≥ 10 % no pielietotās devas jebkurā pētījuma laika brīdī.
Uztvertie gaistošie produkti sniedz norādi uz testējamās vielas un tās transformācijas produktu gaistamības potenciālu no augsnes.
Precīzākas pussabrukšanas perioda vai DT50 vērtības un attiecīgā gadījumā DT75 un DT90 vērtības ir jāiegūst, pielietojot atbilstošus kinētiskā modeļa aprēķinus. Pussabrukšanas perioda un DT50 vērtības jāreģistrē kopā ar izmantotā modeļa aprakstu, kinētikas kārtu un noteikšanas koeficientu (r2). Priekšroka ir pirmās kārtas kinētikai, ja vien r2 < 0,7. Attiecīgā gadījumā aprēķini jāpielieto arī galvenajiem transformācijas produktiem. Piemērotu modeļu piemēri ir aprakstīti literatūras sarakstā (31)–(35).
Dažādās temperatūrās izdarītos ātruma pētījumos transformācijas ātrumi eksperimenta temperatūru diapazonā ir jāapraksta kā temperatūras funkcija, izmantojot Arrēniusa sakarību formā:
![]()
or
![]()
,
kur ln A un B ir regresijas konstantes attiecīgi no koordinātu ass nogriežņa un slīpuma leņķa vislabāk atbilstošajai taisnei, kas izveidota, atliekot ln k pret 1/T, k ir ātruma konstante temperatūrā T un T ir temperatūra Kelvina grādos. Jāpievērš uzmanība ierobežotajam temperatūras diapazonam, kurā Arreniusa sakarība ir derīga, ja transformāciju ietekmē mikrobu darbība.
2.2. REZULTĀTU NOVĒRTĒŠANA UN INTERPRETĀCIJA
Kaut arī pētījumu veic mākslīgā laboratorijas sistēmā, rezultāti ļauj novērtēt testējamās vielas transformācijas ātrumu un arī transformācijas produktu veidošanās un samazināšanās ātrumu lauka apstākļos (36) (37).
Testējamās vielas transformācijas ceļu pētījums sniedz informāciju par veidu, kā pielietotās vielas struktūra augsnē mainās ķīmiskās un mikrobu reakcijās.
3. PĀRSKATA SAGATAVOŠANA
PĀRSKATS PAR TESTU
Pārskatā par testu jāiekļauj:
Testējamā viela:
— vispārpieņemtais nosaukums, ķīmiskais nosaukums, CAS numurs, struktūrformula (norādot marķētā(-o) atoma(-u) stāvokli, ja izmanto radioaktīvi marķētu materiālu) un attiecīgās fizikāli ķīmiskās īpašības (skatīt 1.5. punktu),
— testējamās vielas tīrība (piemaisījumi),
— marķēto ķīmisko vielu radioķīmiskā tīrība un īpatnējā aktivitāte (attiecīgā gadījumā).
Standartvielas:
— transformācijas produktu raksturošanai un/vai identifikācijai izmantoto standartvielu ķīmiskais nosaukums un struktūra.
Testa augsnes:
— sīki dati par vākšanas vietu,
— augsnes paraugu ņemšanas datums un procedūra,
— augšņu īpašības, piemēram, pH, organiskā oglekļa saturs, struktūra (% smilšu, % sanešu, % mālu) katjonu apmaiņas spēja, bēruma blīvums, ūdens aiztures raksturojums un mikrobu biomasa,
— augsnes glabāšanas ilgums un glabāšanas apstākļi (ja augsne glabāta).
Testa apstākļi:
— pētījuma norises datumi,
— pielietotās testējamās vielas daudzums,
— testējamās vielas pielietošanas metode un izmantotie šķīdinātāji,
— sākotnēji apstrādātās augsnes svars un katrā analīzes starplaikā ņemto paraugu svars,
— izmantotās inkubācijas sistēmas apraksts,
— gaisa plūsmas ātrumi (tikai caurplūdes sistēmām),
— eksperimentālā veidojuma temperatūra,
— augsnes mitruma saturs inkubācijas laikā,
— mikrobu biomasa aerobā pētījuma sākumā, tā laikā un beigās,
— pH, skābekļa koncentrācija un redokspotenciāls anaerobā un rīsa lauka pētījuma sākumā, tā laikā un beigās,
— ekstrahēšanas metode(-es),
— testējamās vielas un galveno transformācijas produktu kvantitatīvās noteikšanas un identifikācijas metodes augsnē un absorbcijas materiālos,
— atkārtojumu skaits un kontroles mēģinājumu skaits.
Rezultāti:
— mikrobu aktivitātes noteikšanas rezultāts,
— izmantoto analīzes metožu atkārtojamība un jutība,
— atgūstamība (% vērtības derīgam pētījumam ir sniegtas 1.7.1. punktā),
— tabulas ar rezultātiem, kas izteikti kā pielietotās sākuma devas % un attiecīgā gadījumā kā mg.kg–1 augsnes (pamatojoties uz sausu svaru),
— masas bilance pētījuma laikā un beigās,
— neekstrahējamās (saistītās) radioaktivitātes vai atlieku raksturojums augsnē,
— izdalītās CO2 un citu gaistošo savienojumu kvantitatīvā noteikšana,
— testējamās vielas un attiecīgā gadījumā galveno transformācijas produktu koncentrācijas grafika attiecība pret laiku,
— testējamās vielas un attiecīgā gadījumā galveno transformācijas produktu pussabrukšanas periods vai DT50, DT75 un DT90, iekļaujot ticamības robežas,
— abiotiskās noārdīšanās ātruma novērtējums sterilos apstākļos,
— testējamās vielas un attiecīgā gadījumā galveno transformācijas produktu transformācijas kinētikas novērtējums,
— ierosinātie transformācijas ceļi attiecīgā gadījumā,
— rezultātu apspriešana un interpretācija,
— izejas dati (t. i., paraugu hromatogrammas, paraugu transformācijas ātrumu aprēķini un transformācijas produktu identifikācijai izmantotie līdzekļi).
4. IZMANTOTĀ LITERATŪRA
(1) US- Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
(2) Agriculture Canada (1987). Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada.
(3) European Union (EU) (1995). Commission Directive 95/36/EC of 14 July 1995 amending Council Directive 91/414/EEC concerning the placing of plant protection products on the market. Annex II, Part A and Annex III, Part A: Fate and Behaviour in the Environment.
(4) Dutch Commission for Registration of Pesticides (1995). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
(5) BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-1. Verbleib von Pflanzenschutzmitteln im Boden – Abbau, Umwandlung und Metabolismus.
(6) ISO/DIS 11266-1 (1994). Soil Quality – Guidance on laboratory tests for biodegradation of organic chemicals in soil – Part 1: Aerobic conditions.
(7) ISO 14239 (1997). Soil Quality – Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions.
(8) SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
(9) MAFF – Japan 2000 – Draft Guidelines for transformation studies of pesticides in soil – Aerobic metabolism study in soil under paddy field conditions (flooded).
(10) OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995.
(11) Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123–157.
(12) DFG: Pesticide Bound Residues in Soil. Wiley – VCH (1998).
(13) T.R. Roberts: Non-extractable pesticide residue in soils and plants. Pure Appl. Chem. 56, 945–956 (IUPAC 1984).
(14) OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981).
(15) ISO 10381-6 (1993). Soil Quality – Sampling – Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
(16) Annex V to Directive 67/548/EEC.
(17) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, p. 85–114.
(18) Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962).
(19) Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods. A. Klute, Ed.) Agronomy Series No 9, 2nd Edition.
(20) Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties. A.L. Page, R.H. Miller and D.R. Kelney, Eds. Agronomy Series No 9, 2nd Edition.
(21) ISO Standard Compendium Environment (1994). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
(22) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
(23) Scheffer, F., Schachtschabel, P. (1975). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
(24) Anderson, J.P.E., Domsch, K.H. (1978) A physiological method for the quantitative measurement of microbial biomass in soils. Soil Biol. Biochem. 10, p. 215–221.
(25) ISO 14240-1 and 2 (1997). Soil Quality – Determination of soil microbial biomass – Part 1: Substrate-induced respiration method. Part 2: fumigation-extraction method.
(26) Anderson, J.P.E. (1987). Handling and storage of soils for pesticide experiments. In Pesticide Effects on Soil Microflora. L. Somerville, M.P. Greaves, Eds. Taylor & Francis, 45–60.
(27) Kato, Yasuhiro. (1998). Mechanism of pesticide transformation in the environment: Aerobic and bio-transformation of pesticides in aqueous environment. Proceedings of the 16th Symposium on Environmental Science of Pesticide, p. 105–120.
(28) Keuken O., Anderson J.P.E. (1996). Influence of storage on biochemical processes in soil. In Pesticides, Soil Microbiology and Soil Quality, p. 59–63 (SETAC-Europe).
(29) Stenberg B., Johansson M., Pell M., Sjödahl-Svensson K., Stenström J., Torstensson L. (1996). Effect of freeze and cold storage of soil on microbial activities and biomass. In Pesticides, Soil Microbiology and Soil Quality, p. 68–69 (SETAC-Europe).
(30) Gennari, M., Negre, M., Ambrosoli, R. (1987). Effects of ethylene oxide on soil microbial content and some chemical characteristics. Plant and Soil 102, p. 197–200.
(31) Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, p. 141–146.
(32) Hamaker, J.W. (1976). The application of mathematical modelling to the soil persistence and accumulation of pesticides. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, p. 181–199.
(33) Goring, C.A.I., Laskowski, D.A., Hamaker, J.W., Meikle, R.W. (1975). Principles of pesticide degradation in soil. In “Environmental Dynamics of Pesticides”. R. Haque and V.H. Freed, Eds., p. 135–172.
(34) Timme, G., Frehse, H., Laska, V. (1986). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. II. Pflanzenschutz – Nachrichten Bayer 39, p. 188–204.
(35) Timme, G., Frehse, H. (1980). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. I. Pflanzenschutz – Nachrichten Bayer 33, p. 47–60.
(36) Gustafson D.I., Holden L.R. (1990). Non-linear pesticide dissipation in soil; a new model based on spatial variability. Environm. Sci. Technol. 24, p. 1032–1041.
(37) Hurle K., Walker A. (1980). Persistence and its prediction. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, p. 83–122.
1.PAPILDINĀJUMS
ŪDENS SPRIEGUMS, LAUKA IETILPĪBA (FC) UN ŪDENSIETILPĪBA (WHC) ( 34 )
|
Ūdens staba augstums (cm) |
pF () |
bar () |
Komentāri |
||
|
107 |
7 |
104 |
Sausa augsne |
||
|
1,6 · 104 |
4,2 |
16 |
Vīšanas punkts |
||
|
104 |
4 |
10 |
|||
|
103 |
3 |
1 |
|||
|
6· 102 |
2,8 |
0,6 |
|||
|
3,3 · 102 |
2,5 |
0,33 () |
|
||
|
102 |
2 |
0,1 |
|||
|
60 |
1,8 |
0,06 |
|||
|
33 |
1,5 |
0,033 |
|||
|
10 |
1 |
0,01 |
WHC (tuvinājums) |
||
|
1 |
0 |
0,001 |
Ūdens piesātināta augsne |
||
|
(1) pF = log no ūdens staba cm. (2) 1 bar = 105 Pa. (3) Atbilst aptuvenam ūdens saturam 10 % smiltī, 35 % mālsmiltī un 45 % mālā. (4) Lauka ietilpība nav nemainīga, bet atkarībā no augsnes tipa mainās pF no 1,5 un 2,5. |
|||||
Ūdens spraigumu mēra ūdens staba centimetros vai bāros. Uzsūkšanas spraiguma lielā diapazona dēļ to izsaka vienkārši kā pF vērtību, kas ir līdzvērtīga ūdens staba centimetru logaritmam.
Lauka ietilpību nosaka kā ūdens daudzumu, ko dabiska augsne var saglabāt pretī smaguma spēkam divas dienas pēc ilga lietus perioda vai pēc pietiekamas apūdeņošanas. To nosaka neskartā augsnē in situ laukā. Mērīšana tādēļ nav pielietojama skartiem laboratorijas augsnes paraugiem. Lauka ietilpības (FC) vērtības, kas noteiktas skartās augsnēs, var uzrādīt lielas sistemātiskas atkāpes.
Ūdensietilpību (WHC) nosaka laboratorijā neskartai un skartai augsnei, piesātinot ar ūdeni augsnes kolonnu ar kapilāro pārnesi. Tā ir īpaši noderīga skartām augsnēm, un tā var būt līdz 30 % lielāka par lauka ietilpību (1). Arī eksperimentāli to ir vieglāk noteikt nekā ticamas FC vērtības.
Piezīmes
2. PAPILDINĀJUMS
AUGSNES MITRUMA SATURS (g ūdens un 100 g sausas augsnes) DAŽĀDIEM AUGŠŅU TIPIEM NO DAŽĀDĀM VALSTĪM
|
Mitruma saturs |
||||
|
Augsnes tips |
Valsts |
|||
|
WHC (1) |
pF = 1,8 |
pF = 2,5 |
||
|
Smilts |
Vācija |
28,7 |
8,8 |
3,9 |
|
Smilšmālaina smilts |
Vācija |
50,4 |
17,9 |
12,1 |
|
Smilšmālaina smilts |
Šveice |
44,0 |
35,3 |
9,2 |
|
Sanešu smilšmāls |
Šveice |
72,8 |
56,6 |
28,4 |
|
Mālains smilšmāls |
Brazīlija |
69,7 |
38,4 |
27,3 |
|
Mālains smilšmāls |
Japāna |
74,4 |
57,8 |
31,4 |
|
Smilšains smilšmāls |
Japāna |
82,4 |
59,2 |
36,0 |
|
Sanešu smilšmāls |
ASV |
47,2 |
33,2 |
18,8 |
|
Smilšains smilšmāls |
ASV |
40,4 |
25,2 |
13,3 |
|
(1) Ūdensietilpība. |
||||
3. PAPILDINĀJUMS
1. attēls
Caurplūdes aparāta piemērs ķīmisko vielu transformācijas augsnē pētījumiem ( 35 ) ( 36 )

2. attēls
Biometra tipa kolbas piemērs ķīmisko vielu transformācijas pētījumiem augsnē ( 37 )

C.24. AEROBĀ UN ANAEROBĀ TRANSFORMĀCIJA ŪDENS NOSĒDUMU SISTĒMĀS
1. METODE
Šī testa metode ir ESAO 308 (2002) vadlīnijā noteiktās metodes kopija.
1.1. IEVADS
Ķīmiskās vielas var iekļūt seklos vai dziļos virsmas ūdeņos ar tādiem ievadīšanas veidiem kā tiešā pielietošana, aerosolu pārvietošanās, noplūde, nosusināšana, atkritumu apglabāšana, rūpniecības, mājsaimniecības vai lauksaimniecības notekūdeņi un izgulsnēšanās no atmosfēras. Šī testa metode apraksta laboratorijas metodi organisko ķīmisko vielu aerobās un anaerobās transformācijas novērtēšanai ūdens nosēdumu sistēmās. Tā pamatojas uz esošajām pamatnostādnēm (1) (2) (3) (4) (5) (6). ESAO seminārā par augsnes un nosēdumu atlasi, kas 1995. gadā notika Beldžiratē, Itālijā (7), vienojās jo īpaši par šajā testā izmantojamo augšņu skaitu un tipu. Seminārs arī sniedza ieteikumus attiecībā uz nosēdumu paraugu vākšanu, apstrādi un glabāšanu, pamatojoties uz ISO pamatnostādnēm (8). Tādi pētījumi ir vajadzīgi par ķīmiskajām vielām, ko tieši pielieto ūdenī vai kas varētu nokļūt ūdens vidē iepriekš aprakstītajā veidā.
Dabīgo ūdens nosēdumu sistēmas augšējā ūdens fāzē bieži ir aerobas. Nosēdumu virsmas slānis var būt aerobs vai anaerobs, bet dziļākie nosēdumi parasti ir anaerobi. Lai ietvertu visas minētās iespējas, šajā dokumentā ir aprakstīti gan aerobi, gan anaerobi testi. Aerobais tests simulē aerobu ūdens kolonnu virs aeroba nosēdumu slāņa, zem kura ir anaerobs gradients. Anaerobs tests simulē pilnīgi anaerobu ūdens–nosēdumu sistēmu. Ja apstākļi rāda, ka ir ievērojami jāatkāpjas no šiem ieteikumiem, piemēram, izmantojot neskartas nosēdumu serdes vai nosēdumus, uz ko varētu būt iedarbojusies testējamā viela, attiecīgajam nolūkam ir pieejamas citas metodes (9).
1.2. DEFINĪCIJAS
Visos gadījumos jālieto starptautiskās mērvienību sistēmas (SI) vienības.
Testējamā viela: jebkura viela, vai nu izejas savienojums, vai arī attiecīgie transformācijas produkti.
Transformācijas produkti: visas vielas, kas rodas testējamās vielas biotiskās vai abiotiskās transformācijas reakcijās, iekļaujot CO2 un saistītās nogulsnes.
Saistītās nogulsnes: “saistītās nogulsnes” ir vielas augsnē, augos vai dzīvniekos, kuras ir noturīgas matricā izejas savienojuma vai tā metabolītu veidā pēc ekstrakcijas. Ekstrakcijas metode nedrīkst būtiski mainīt pašus savienojumus vai matricas struktūru. Saistības veidu var noskaidrot daļēji ar matricu mainošām ekstrakcijas metodēm un sarežģītām analīzes metodēm. Līdz šim, piemēram, šādā veidā ir identificētas kovalentās, jonu un sorbcijas saites, kā arī ieslēgumi. Parasti saistīto nogulšņu veidošanās ievērojami samazina bioloģisko pieejamību un bioloģiski pieejamo daudzumu (10) (Starptautiskā Teorētiskās un lietišķās ķīmijas savienība – modificēts 1984. gadā (11)).
Aerobā transformācija: (oksidējošā) – reakcijas, kas notiek molekulārā skābekļa klātbūtnē (12).
Anaerobā transformācija: (reducējošā) – reakcijas, kas notiek, izslēdzot molekulārā skābekļa klātbūtni (12).
Dabīgie ūdeņi: virsmas ūdeņi, iegūti no dīķiem, upēm, strautiem utt.
Nosēdumi: neorganisku un organisku ķīmisko sastāvdaļu maisījums, pēdējās minētās satur savienojumus ar lielu oglekļa un slāpekļa saturu un lielu molekulsvaru. Tos izgulsnē dabīgie ūdeņi, un tie veido saskari ar attiecīgo ūdeni.
Mineralizācija: pilnīga organisko savienojumu noārdīšanās līdz CO2 un H2O aerobos apstākļos un līdz CH4, CO2 un H2O anaerobos apstākļos. Šīs testa metodes kontekstā, ja izmanto radioaktīvi marķētu savienojumu, mineralizācija nozīmē intensīvu molekulas noārdīšanos, kuras laikā marķētā oglekļa atomi kvantitatīvi oksidējas vai reducējas, izdalot attiecīgu daudzumu 14CO2 vai 14CH4.
Pussabrukšanas periods, t0,5: laiks, kas vajadzīgs, lai transformētu 50 % testējamās vielas, ja transformāciju var aprakstīt pirmās kārtas kinētika; tas nav atkarīgs no sākotnējās koncentrācijas.
DT 50 (izzušanas laiks 50): laiks, kurā testējamās vielas sākotnējā koncentrācija samazinās par 50 %.
DT 75 (izzušanas laiks 75): laiks, kurā testējamās vielas sākotnējā koncentrācija samazinās par 75 %.
DT 90 (izzušanas laiks 90): laiks, kurā testējamās vielas sākotnējā koncentrācija samazinās par 90 %.
1.3. STANDARTVIELAS
Standartvielas jāizmanto transformācijas produktu identifikācijai un kvantitatīvai noteikšanai ar spektroskopijas un hromatogrāfijas metodēm.
1.4. INFORMĀCIJA PAR TESTĒJAMO VIELU
Transformācijas ātruma mērīšanai var izmantot nemarķētas vai ar izotopiem marķētas vielas, kaut arī priekšroka ir marķētam materiālam. Marķēts materiāls ir vajadzīgs, lai pētītu transformācijas ceļu un noteiktu masas bilanci. Ir ieteicama marķēšana ar 14C, bet noderīga var būt arī citu izotopu, tādu kā 13C, 15N, 3H, 32P, izmantošana. Cik iespējams, marķējums jānovieto molekulas stabilākajā(-ās) daļā(-ās). Testējamās vielas ķīmiskajai un/vai radioķīmiskajai tīrībai jābūt vismaz 95 %.
Pirms testa izdarīšanas ir vajadzīga šāda informācija par testējamo vielu:
a) šķīdība ūdenī (A.6. metode);
b) šķīdība organiskajos šķīdinātājos;
c) tvaika spiediens (A.4. metode) un Henrija likuma konstante;
d) sadalījuma koeficients sistēmā n-oktanols/ūdens (A.8. metode);
e) adsorbcijas koeficients (attiecīgā gadījumā Kd, Kf vai Koc) (C.18. metode);
f) hidrolīze (C.7. metode);
g) disociācijas konstante (pKa) (ESAO 112. vadlīnija) (13);
h) testējamās vielas ķīmiskā struktūra un attiecīgā gadījumā marķētā(-o) izotopa(-u) vieta(-as).
Piezīme: ir jāreģistrē temperatūra, kādā minētie mērījumi izdarīti.
Cita noderīga informācija var iekļaut datus par testējamās vielas toksicitāti mikroorganismiem, datus par vieglu un/vai potenciālu bioloģisko noārdīšanos un aerobu un anaerobu transformāciju augsnē.
Jābūt pieejamām analīzes metodēm (iekļaujot ekstrakciju un attīrīšanas metodes) testējamās vielas un tās transformācijas produktu kvantitatīvai noteikšanai un identifikācijai ūdenī un nosēdumos (skatīt 1.7.2. punktu).
1.5. TESTA METODES PRINCIPS
Šajā testā aprakstītā metode izmanto aerobu un anaerobu ūdens nosēdumu sistēmu (skatīt 1. papildinājumu), kas ļauj:
— mērīt testējamās vielas transformācijas ātrumu ūdens–nosēdumu sistēmā,
— mērīt testējamās vielas transformācijas ātrumu nosēdumos,
— mērīt testējamās vielas un/vai tās transformācijas produktu mineralizācijas ātrumu (ja izmanto ar 14C marķētu testējamo vielu),
— identificēt un kvantitatīvi noteikt transformācijas produktus ūdens un nosēdumu fāzē, iekļaujot masas bilanci (ja izmanto ar 14C marķētu testējamo vielu),
— mērīt testējamās vielas un tās transformācijas produktu sadalījumu starp abām fāzēm inkubācijas perioda laikā tumsā (lai izvairītos, piemēram, no aļģu ziedēšanas) nemainīgā temperatūrā. Ja dati atļauj, nosaka pussabrukšanas periodus, DT50, DT75 un DT90 vērtības, bet tās nedrīkst ekstrapolēt tālu aiz eksperimenta laika posma (skatīt 1.2. punktu).
Vismaz divi nosēdumi un ar tiem saistītie ūdeņi ir vajadzīgi attiecīgi aerobajam un anaerobajam pētījumam (7). Tomēr var būt gadījumi, kad jāizmanto vairāk par diviem ūdens nosēdumiem, piemēram, ķīmiskai vielai, kas var būt klāt saldūdens un/vai jūras vidē.
1.6. TESTA DERĪGUMS
Metode parasti ir derīga ķīmiskajām vielām (nemarķētām vai radioaktīvi marķētām), kurām ir pieejama pietiekami precīza un jutīga analīzes metode. Tā ir derīga nedaudz gaistošiem, negaistošiem, ūdenī šķīstošiem vai ūdenī slikti šķīstošiem savienojumiem. Tests nav jāpielieto ķīmiskajām vielām, kas ir ļoti gaistošas attiecībā uz ūdeni (piemēram, fumigantiem, organiskajiem šķīdinātājiem) un tādēļ šā testa eksperimenta apstākļos nav saglabājamas ūdenī un/vai nosēdumos.
Metode līdz šim ir pielietota ķīmisko vielu transformācijas pētījumiem saldūdeņos un nosēdumos, bet principā to var pielietot arī grīvas/jūras sistēmām. Tā nav piemērota, lai simulētu apstākļus tekošā ūdenī (piemēram, upēs) vai atklātā jūrā.
1.7. KVALITĀTES KRITĒRIJI
1.7.1. Atgūstamība
Vismaz ūdens un nosēdumu paraugu dublikātu ekstrahēšana un analīze tieši pēc testējamās vielas pievienošanas dod pirmo norādi par analīzes metodes atkārtojamību un pielietojamās procedūras vienādību testējamai vielai. Atgūstamību eksperimentu vēlākiem posmiem iegūst no attiecīgajām masas bilancēm (ja izmanto marķētu materiālu). Atgūstamībai jābūt diapazonā no 90 % līdz 110 % marķētām ķīmiskām vielām (6) un no 70 % līdz 110 % nemarķētām ķīmiskām vielām.
1.7.2. Analīzes metodes atkārtojamība un jutība
Analīzes metodes atkārtojamību (izņemot sākotnējās ekstrahēšanas efektivitāti) testējamās vielas un transformācijas produktu kvantitatīvā noteikšanā var pārbaudīt ar transformācijas produktu veidošanai pietiekami ilgi inkubēta viena un tā paša ūdens vai nosēdumu parauga ekstrakta dublikātu analīzēm.
Analītiskās metodes kvalitatīvās noteikšanas robežai (KNR) attiecībā uz testējamo vielu un transformācijas produktiem jābūt vismaz 0,01 mg· kg-1 ūdenī vai nosēdumos (kā testējamai vielai) vai 1 % no testa sistēmai pielietotās devas, atkarībā no tā, kurš lielums ir mazāks. Ir jānorāda arī kvantitatīvās noteikšanas robeža (LOQ).
1.7.3. Transformācijas datu precizitāte
Testējamās vielas koncentrācijas kā laika funkcijas regresijas analīze sniedz attiecīgu informāciju par transformācijas līknes precizitāti un ļauj aprēķināt pussabrukšanas perioda ticamības robežas (pseido pirmās kārtas kinētikas gadījumā) vai DT50 vērtības un attiecīgā gadījumā DT75 un DT90 vērtības.
1.8. METODES APRAKSTS
1.8.1. Testa sistēma un aparatūra
Pētījums jāizdara stikla tvertnēs (piemēram, pudelēs, centrifūgas stobriņos), ja vien iepriekšējā informācija (tāda kā sadalījuma koeficients sistēmā n-oktanols-ūdens, sorbcijas dati utt.) nenorāda, ka testējamā viela var pielipt stiklam, tādā gadījumā var apsvērt alternatīva materiāla (tāda kā teflons) izmantošana. Ja ir zināms, ka testējamā viela pielīp stiklam, var būt iespējams šo problēmu samazināt, izmantojot vienu no šādām metodēm:
— noteikt uz stikla sorbēto testējamās vielas un transformācijas produktu masu,
— nodrošināt visu stikla priekšmetu mazgāšanu ar šķīdinātāju testa beigās,
— izmantot preparātus (skatīt arī 1.9.2. punktu),
— testējamās vielas pievienošanai sistēmā izmantot palielinātu daudzumu palīgšķīdinātāja; ja izmanto palīgšķīdinātāju, tam jābūt tādam, kas neizraisa testējamās vielas solvolīzi.
Parasto testa aparātu piemēri, t. i., gāzes plūsmas un biometra tipa sistēmas, attiecīgi ir parādīti 2. un 3. papildinājumā (14). Citas noderīgas inkubācijas sistēmas ir aprakstītas (15). Eksperimentālā aparāta konstrukcijai ir jāļauj apmainīties gaisam vai slāpeklim un uztvert gaistošos produktus. Aparāta izmēriem jābūt tādiem, lai tie atbilstu testa prasībām (skatīt 1.9.1. punktu). Vēdināšanu var nodrošināt, lēni burbuļojot vai laižot pāri ūdens virsmai gaisu vai slāpekli. Pēdējā minētā gadījumā, lai būtu labāks skābekļa vai slāpekļa sadalījums, var ieteikt no augšas lēni maisīt ūdeni. Nav jāizmanto CO2 nesaturošs gaiss, jo tas var izraisīt ūdens pH palielinājumu. Katrā gadījumā nosēdumu traucēšana ir nevēlama un no tās iespējami jāizvairās. Nedaudz gaistošas ķīmiskās vielas ir jātestē biometra tipa sistēmā, lēni maisot ūdens virsmu. Var izmantot arī noslēgtas tvertnes, kuru brīvajā telpā ir atmosfēras gaiss vai slāpeklis un iekšējie stobriņi gaistošo produktu uztveršanai (16). Aerobā testā ir regulāri jāapmaina brīvās telpas gāze, lai kompensētu biomasas patērēto skābekli.
Piemēroti uztvērēji gaistošo transformācijas produktu savākšanai iekļauj 1 mol· dm-3 kālija hidroksīda vai nātrija hidroksīda šķīdumus oglekļa dioksīdam un etilēnglikolu, etanolamīnu vai 2 % parafīnu ksilolā organiskajiem savienojumiem, bet ar to nav ierobežoti. Anaerobos apstākļos radušās gaistošās vielas, tādas kā metāns, var savākt, piemēram, ar molekulārajiem sietiem. Tādas vielas var sadedzināt, piemēram, līdz CO2, laižot gāzi 900 oC temperatūrā caur kvarca cauruli, kas pildīta ar CuO, un uztverot radušos CO2 absorberā ar sārmu (17).
Testējamās vielas un transformācijas produktu ķīmiskajai analīzei ir vajadzīgas laboratorijas iekārtas (piemēram, gāzu–šķidruma hromatogrāfija (GŠH), augstas izšķirtspējas šķidruma hromatogrāfija (HPLC), plānslāņa hromatogrāfija (TLC), masspektrosmetrija (MS), šķidruma hromatogrāfija–masspektrometrija (LC–MS), kodolmagnētiskā rezonanse (KMR) utt.), attiecīgā gadījumā iekļaujot atklāšanas sistēmas radioaktīvi marķētām vai nemarķētām ķīmiskām vielām. Ja izmanto radioaktīvi marķētu materiālu, vajadzīgs ir arī šķidruma scintilāciju skaitītājs un sadegšanas oksidēšanas iekārta (nosēdumu paraugu sadedzināšanai pirms radioaktivitātes analīzes).
Attiecīgā gadījumā ir vajadzīgs cits standarta laboratorijas aprīkojums fizikāli ķīmiskajām un bioloģiskajām noteikšanām (skatīt 1.8.2.2. punkta 1. tabulu), stikla priekšmeti, ķīmiskās vielas un reaģenti.
1.8.2. Ūdens nosēdumu atlase un skaits
Paraugu ņemšanas vietas izraugās saskaņā ar testa nolūku konkrētajā situācijā. Izraugoties paraugu ņemšanas vietas, jāņem vērā iespējamie agrākie lauksaimniecības, rūpniecības un mājsaimniecības ieguldījumi ieplūdes vietā un augstāk pa straumi. Nosēdumi nav jāizmanto, ja tie ar testējamo vielu vai tās struktūras analogiem ir bijuši piesārņoti iepriekšējo četru gadu laikā.
1.8.2.1. Nosēdumu atlase
Aerobiem pētījumiem parasti izmanto divus nosēdumus (7). Abiem atlasītajiem nosēdumiem jāatšķiras attiecībā uz organiskā oglekļa saturu un struktūru. Vienam no nosēdumiem jābūt ar lielu organiskā oglekļa saturu (2,5–7,5 %) un smalku struktūru, otram jābūt ar mazu organiskā oglekļa saturu (0,5–2,5 %) un rupju struktūru. Organiskā oglekļa saturu atšķirībai parasti jābūt vismaz 2 %. “Smalka struktūra” ir noteikta kā (mālu + sanesu) saturs > 50 % un “rupja struktūra” ir noteikta kā (mālu + sanesu) saturs < 50 %. Abu nosēdumu (mālu + sanesu) satura atšķirībai parasti jābūt vismaz 20 %. Ja ķīmiskā viela var nokļūt arī jūras ūdenī, vismaz vienai ūdens–nosēdumu sistēmai jābūt jūras izcelsmes.
Stingri anaerobā pētījumā divi nosēdumi (iekļaujot ar tiem saistītos ūdeņus) ir jāņem no virsmas ūdeņu anaerobajām zonām (7). Ar nosēdumu un ūdens fāzēm jārīkojas un tās jāpārved uzmanīgi, izslēdzot skābekļa piekļuvi.
Nosēdumu atlasē var būt svarīgi citi rādītāji, un tie jāapsver katrā atsevišķā gadījumā. Piemēram, nosēdumu pH diapazons ir svarīgs, testējot ķīmiskās vielas, kuru transformācija un/vai sorbcija var būt atkarīga no pH. Sorbcijas atkarība no pH var atspoguļoties testējamās vielas pKa.
1.8.2.2. Ūdens–nosēdumu paraugu raksturošana
Galvenie rādītāji, kas jāmēra un jāreģistrē (norādot izmantoto metodi) par ūdeni un nosēdumiem, un testa posms, kurā attiecīgie rādītāji ir jānosaka, ir apkopoti turpmākajā tabulā. Informācijai – attiecīgo rādītāju noteikšanas metodes ir iekļautas literatūras sarakstā (18) (19) (20) (21).
Turklāt katrā atsevišķā gadījumā var būt jāmēra un jāreģistrē citi rādītāji (piemēram, saldūdenim – daļiņas, sārmainība, cietība, vadītspēja, NO3/PO4 (attiecība un individuālās vērtības); nosēdumiem – katjonu apmaiņas spēja, ūdensietilpība, karbonāts, kopējais slāpeklis un fosfors; jūras sistēmām – sāļums). Arī nitrāta, sulfāta, bioloģiski pieejamās dzelzs un, iespējams, citu elektronakceptoru analīze nosēdumos un ūdenī var būt noderīga, novērtējot redoksapstākļus, jo īpaši saistībā ar anaerobo transformāciju.
Rādītāju mērīšana ūdens–nosēdumu paraugu raksturošanai (7) (22) (23)
|
Parametrs |
Testa procedūras posms |
|||||
|
paraugu ņemšana laukā |
pēcapstrāde |
aklimatizācijas sākums |
testa sākums |
testa laikā |
testa beigas |
|
|
Ūdens |
||||||
|
Izcelsme/avots |
x |
|||||
|
Temperatūra |
x |
|||||
|
pH |
x |
x |
x |
x |
x |
|
|
Kopējais organiskais ogleklis (TOC) |
x |
x |
x |
|||
|
O2 koncentrācija (2) |
x |
x |
x |
x |
x |
|
|
Redokspotenciāls (2) |
x |
x |
x |
x |
||
|
Nosēdumi |
||||||
|
Izcelsme/avots |
x |
|||||
|
Slāņa dziļums |
x |
|||||
|
pH |
x |
x |
x |
x |
x |
|
|
Daļiņu lieluma sadalījums |
x |
|||||
|
Kopējais organiskais ogleklis (TOC) |
x |
x |
x |
x |
||
|
Mikrobu biomasa (1) |
x |
x |
x |
|||
|
Redokspotenciāls (2) |
Novērojumi (krāsa/smarža) |
x |
x |
x |
x |
|
|
(1) Mikrobu elpošanas ātruma metode (26), fumigācijas metode (27) vai dzīvotspējīgo mikroorganismu (piemēram, baktēriju, aktinomicešu, sēnīšu un koloniju kopā) skaita novērtējums aerobiem pētījumiem; metānoģenēzes ātrums anaerobiem pētījumiem. (2) Jaunāko pētījumu rezultāti ir parādījuši, ka skābekļa koncentrāciju ūdenī mērījumiem un ūdens redokspotenciālu mērījumiem nav mehāniska vai iepriekš paredzama vērtība, ciktāl tas attiecas uz mikrobu populāciju augšanu un attīstību virsmas ūdeņos (24) (25). Bioķīmiskā skābekļa patēriņa (BSP, paraugus ņemot laukā, testa sākumā un beigās) un mikro/makro barības vielu Ca, Mg un Mn (testa sākumā un beigās) noteikšana un kopējā N un P mērīšana nosēdumos (paraugus ņemot laukā un testa beigās) var būt labāki rīki aerobās biotransformācijas ātrumu un ceļu interpretācijai un novērtēšanai. |
||||||
1.8.3. Savākšana, apstrāde un glabāšana
1.8.3.1. Savākšana
Nosēdumu savākšanā jāizmanto ISO pamatnostādņu projekts par nosēdumu paraugu vākšanu (8). Nosēdumu paraugi jāņem no visa augšējā 5 līdz 10 cm bieza nosēdumu slāņa. Saistītais ūdens jāvāc no tās pašas vietas un tajā pašā laikā kā nosēdumi. Anaerobam pētījumam nosēdumi un saistītais ūdens jāņem un jāpārved, izslēdzot skābekļa piekļuvi (28) (skatīt 1.8.2.1. punktu). Dažas paraugu ņemšanas ierīces ir aprakstītas literatūras sarakstā (8) (23).
1.8.3.2. Apstrāde
Nosēdumus filtrējot atdala no ūdens, un nosēdumus mitrus sijā caur 2 mm sietu, izmantojot no tās pašas vietas ņemtā ūdens pārākumu, ko pēc tam izlej. Pēc tam nosēdumu un ūdens zināmus daudzumus sajauc vēlamajā attiecībā (skatīt 1.9.1. punktu) inkubācijas kolbās un sagatavo aklimatizācijas periodam (skatīt 1.8.4. punktu). Anaerobā pētījumā visi apstrādes posmi jāveic, izslēdzot skābekļa piekļuvi (29) (30) (31) (32) (33).
1.8.3.3. Glabāšana
Ir ļoti ieteicami izmantot svaigi ņemtus nosēdumu un ūdens paraugus, bet, ja glabāt ir nepieciešami, nosēdumi un ūdens ir jāizlaiž caur sietu, kā aprakstīts iepriekš, un jāglabā kopā piesātināti ar ūdeni (6–10 cm biezs ūdens slānis) tumsā, 4 ± 2 oC4 temperatūrā maksimāli četras nedēļas (7) (8) (23). Aerobos pētījumos izmantojamie paraugi jāglabā ar brīvu gaisa piekļuvi (piemēram, vaļējās tvertnēs), bet anaerobos pētījumos izmantojamie paraugi jāglabā, izslēdzot gaisa piekļuvi. Pārvadāšanas un glabāšanas laikā nosēdumi un ūdens nedrīkst sasalt un izžūt.
1.8.4. Nosēdumu/ūdens paraugu sagatavošana testam
Pirms testējamās vielas pievienošanas jābūt aklimatizācijas periodam, kad katrs nosēdumu/ūdens paraugs ir ievietots inkubācijas tvertnē, ko izmantos galvenajā testā, un aklimatizācija jāveic tieši tādos pašos apstākļos kā testa inkubēšana (skatīt 1.9.1. punktu). Aklimatizācijas periods ir laiks, kas vajadzīgs sistēmas pieņemamas stabilitātes sasniegšanai, ko atspoguļo pH, skābekļa koncentrācija ūdenī, nosēdumu un ūdens redokspotenciāls un fāzu makroskopiskā atdalīšanās. Parasti aklimatizācijas periodam jāilgst no vienas līdz divām nedēļām, un tas nedrīkst pārsniegt četras nedēļas. Minētā perioda laikā veikto noteikšanu rezultāti ir jāreģistrē.
1.9. TESTA NORISE
1.9.1. Testa apstākļi
Tests jāizdara inkubēšanas aparātā (skatīt 1.8.1. punktu) ar ūdens–nosēdumu tilpuma attiecību no 3:1 līdz 4:1 un ar 2,5 cm (± 0,5 cm) biezu nosēdumu slāni. Minimālais ieteicamais nosēdumu daudzums uz inkubēšanas tvertnes ir 50 g (pamatojoties uz sausu svaru).
Tests jāizdara tumsā nemainīgā temperatūrā no 10 līdz 30 oC diapazonā. Piemērota temperatūra ir (20 ± 2) oC. Attiecīgā gadījumā var apsvērt papildu zemāku temperatūru (piemēram, 10 oC) katrā atsevišķā gadījumā atkarībā no informācijas, kas jāiegūst testā. Inkubēšanas temperatūra ir jāuzrauga un jāreģistrē.
1.9.2. Testējamās vielas apstrāde un pielietošana
Izmanto vienu ķīmiskās vielas testa koncentrāciju ( 38 ) 9. Kultūraugu aizsardzības ķīmiskajām vielām, ko tieši pielieto ūdens struktūrās, maksimālā deva, kas ir uz etiķetes, jāuzskata par maksimālo lietojuma devu, ko aprēķina, pamatojoties uz ūdens virsmas laukumu testa tvertnē. Visos citos gadījumos izmantojamā koncentrācija jāpamato uz prognozēm no emisijām vidē. Jāpievērš vērība, lai nodrošinātu, ka tiek pielietota atbilstoša testējamās vielas koncentrācija transformācijas ceļu un transformācijas produktu veidošanās un samazināšanās raksturošanai. Var būt nepieciešams pielietot lielākas devas (piemēram, 10 reižu) situācijās, kad testējamās vielas koncentrācijas ir tuvas noteikšanas robežai pētījuma sākumā un/vai kad galvenos transformācijas produktus nevar viegli noteikt, kaut arī to daļa ir 10 % no testējamās vielas lietojuma devas. Tomēr, ja izmanto lielākas testa koncentrācijas, tām nedrīkst būt ievērojama kaitīga iedarbība uz ūdens–nosēdumu sistēmas mikrobu aktivitāti. Lai sasniegtu nemainīgu testējamās vielas koncentrāciju dažādu izmēru tvertnēs, var apsvērt, vai nav lietderīgi pielietojamā materiāla daudzumu koriģēt, pamatojoties uz ūdens staba dziļumu tvertnē attiecībā pret ūdens dziļumu laukā (ko pieņem par 100 cm, bet var izmantot citu dziļumu). Aprēķina piemēru skatīt 4. papildinājumā.
Ideālā gadījumā testējamā viela jāpielieto kā ūdens šķīdums testa sistēmas ūdens fāzē. Ja no tā nevar izvairīties, testējamās vielas pielietošanai un izplatīšanai ir atļauts lietot mazus daudzumus ar ūdeni sajaucamu šķīdinātāju (tādu kā acetons, etanols), bet tie nedrīkst pārsniegt 1 % tilp./tilp. un tiem nedrīkst būt kaitīga iedarbība uz testa sistēmas mikrobu aktivitāti. Jārīkojas uzmanīgi, veidojot testējamās vielas ūdens šķīdumu – var būt piemēroti izmantot šķīduma veidošanas kolonnas un iepriekšēju maisīšanu, lai nodrošinātu pilnīgu viendabīgumu. Pēc ūdens šķīduma pievienošanas testa sistēmai ir ieteicams uzmanīgi maisīt ūdens fāzi, iespējami maz skarot nosēdumus.
Preparātu izmantošana parasti nav ieteicama, jo preparāta sastāvdaļas var ietekmēt testējamās vielas un/vai transformācijas produktu sadalījumu starp ūdens un nosēdumu fāzēm. Tomēr slikti šķīstošām testējamām vielām preparātu izmantošana var būt piemērota alternatīva.
Inkubācijas tvertņu skaits ir atkarīgs no paraugu ņemšanas reižu skaita (skatīt 1.9.3. punktu). Ir jāiekļauj pietiekams testa sistēmu skaits, lai katrā paraugu ņemšanas reizē varētu iztērēt divas sistēmas. Izmantojot katras ūdens nosēdumu sistēmas kontroles vienības, tās nav jāapstrādā ar testējamo vielu. Kontroles vienības var izmantot, lai noteiktu nosēdumu mikrobu biomasu un ūdens un nosēdumu kopējo organisko oglekli pētījuma beigās. Divas no kontroles vienībām (t. i., vienu kontroles vienību katram ūdens nosēdumam) var izmantot, lai pārraudzītu vajadzīgos rādītājus nosēdumos un ūdenī aklimatizācijas periodā (skatīt tabulu 1.8.2.2. punktā). Divas papildu kontroles vienības ir jāiekļauj, ja testējamo vielu pielieto, izmantojot šķīdinātāju, lai izmērītu kaitīgo iedarbību uz testa sistēmas mikrobu aktivitāti.
1.9.3. Testa ilgums un paraugu ņemšana
Eksperimenta ilgumam parasti nav jāpārsniedz 100 dienas (6), un tam jāturpinās, līdz ir noskaidrots noārdīšanās ceļš un sadalījuma modelis sistēmā ūdens–nosēdumi vai kad 90 % testējamās vielas ir izkliedēti transformējoties un/vai gaistot. Paraugu ņemšanas reizēm jābūt vismaz sešām (iekļaujot nulles reizi) ar neobligātu priekšpētījumu (skatīt 1.9.4. punktu), ko izmanto piemērota paraugu ņemšanas režīma un testa ilguma izveidošanai, ja vien pietiekami dati par testējamo vielu nav pieejami no iepriekšējiem pētījumiem. Hidrofobām testējamām vielām pētījuma sākumposmā var būt vajadzīgas papildu paraugu ņemšanas reizes, lai noteiktu sadalījuma attiecību starp ūdens un nosēdumu fāzēm.
Piemērotās paraugu ņemšanas reizēs analīzei izņem visu inkubācijas tvertņu (ar atkārtojuma tvertni). Nosēdumus un virs tiem esošo ūdeni analizē atsevišķi ( 39 ) 0. Virsmas ūdens ir uzmanīgi jāatdala, iespējami maz skarot nosēdumus. Testējamās vielas un transformācijas produktu ekstrakcija un raksturošana jāizdara, ievērojot atbilstošās analīzes procedūras. Jārūpējas, lai noņemtu materiālu, kas varētu būt adsorbējies uz inkubācijas tvertnes vai uz savienotājiem cauruļvadiem, kurus izmanto gaistošo vielu uztveršanai.
1.9.4. Neobligāts iepriekšējais tests
Ja ilgumu un paraugu ņemšanas režīmu nevar novērtēt no citiem attiecīgajiem pētījumiem ar testējamo vielu, var uzskatīt par atbilstošu neobligātu iepriekšējo testu, kas jāizdara tādos pašos testa apstākļos kā galīgajam pētījumam paredzētie. Īsi jāreģistrē attiecīgie iepriekšējā testa eksperimenta apstākļi un rezultāti, ja veic iepriekšējo testu.
1.9.5. Mērījumi un analīze
Katrā paraugu ņemšanas reizē ir jāmēra un jāreģistrē testējamās vielas un transformācijas produktu koncentrācija (kā pielietotā koncentrācija un kā procentuālais daudzums). Parasti ir jāidentificē transformācijas produkti, kas konstatēti pie ≥ 10 % no pielietotās radioaktivitātes kopējā ūdens–nosēdumu sistēmā jebkurā paraugu ņemšanas reizē, ja nav pienācīgi pamatots citādi. Jāapsver arī to transformācijas produktu identificēšana, kuru koncentrācija pētījuma laikā nepārtraukti palielinās, pat ja to koncentrācijas nepārsniedz iepriekš norādītās robežas, jo tas var norādīt uz noturību. Pēdējā minētā jāapsver katrā atsevišķā gadījumā, pārskatā sniedzot pamatojumu.
Katrā paraugu ņemšanas reizē ir jāreģistrē gāzu/gaistošo vielu (CO2 un citu, t. i., gaistošo organisko savienojumu) uztveršanas sistēmu rezultāti Jāreģistrē mineralizācijas ātrumi. Katrā paraugu ņemšanas reizē jāreģistrē neekstrahējamās (saistītās) nogulsnes nosēdumos.
2. DATI
2.1. REZULTĀTU APSTRĀDE
Katrā paraugu ņemšanas reizē jāaprēķina kopējā masas bilance vai pievienotās radioaktivitātes atgūstamība (skatīt 1.7.1. punktu). Rezultāti jāreģistrē kā pievienotās radioaktivitātes procenti. Katrā paraugu ņemšanas reizē jāreģistrē radioaktivitātes sadalījums starp ūdeni un nosēdumiem kā koncentrācija un procentuālais daudzums.
Jāaprēķina testējamās vielas pussabrukšanas periods, DT50 un attiecīgā gadījumā DT75 un DT90 ar to ticamības robežām (skatīt 1.7.3. punktu). Informāciju par testējamās vielas izkliedēšanās ātrumu ūdenī un nosēdumos var iegūt, izmantojot attiecīgus vērtēšanas rīkus. Tie var būt diapazonā no pseido pirmās kārtas kinētikas pielietošanas, empīriskas līknes pielāgošanas metodes, kas izmanto grafiskus vai skaitliskus risinājumus, līdz sarežģītākiem pieņēmumiem, kas izmanto, piemēram, viena vai vairāku nodalījumu modeļus. Sīkākus datus var iegūt attiecīgajā literatūras sarakstā (35) (36) (37).
Visām pieejām ir stiprās un vājās puses un ievērojamas atšķirības sarežģītībā. Pieņēmums par pirmās kārtas kinētiku var būt noārdīšanās un sadalījuma procesu pārāk liels vienkāršojums, bet, ja iespējams, sniedz terminu (ātruma konstanti vai pussabrukšanas periodu), kas ir viegli saprotams un vērtīgs simulācijas modelēšanā un paredzamo vides koncentrāciju aprēķinos. Empīriskās pieejas vai lineārās transformācijas var sniegt labāku līkņu atbilstību datiem un tādēļ dot iespēju labāk novērtēt pussabrukšanas periodus, DT50 un attiecīgā gadījumā DT75 un DT90 vērtības. Atvasināto konstanšu lietojums tomēr ir ierobežots. Ar nodalījumu modeļiem var iegūt riska novērtēšanai vairākas noderīgas konstantes, kas apraksta noārdīšanās ātrumu dažādos nodalījumos un ķīmiskās vielas sadalījumu. Tie arī jāizmanto galveno transformācijas produktu rašanās un noārdīšanās ātruma konstanšu noteikšanai. Visos gadījumos izraudzītā metode ir jāpamato, un eksperimentatoram grafiski un/vai statistiski jāparāda, cik labi tā piemērota.
3. PĀRSKATA SAGATAVOŠANA
3.1. PĀRSKATS PAR TESTU
Pārskatā jāiekļauj šāda informācija.
Testējamā viela:
— vispārpieņemtais nosaukums, ķīmiskais nosaukums, CAS numurs, struktūrformula (norādot marķējuma(-u) vietu, ja izmanto radioaktīvi marķētu materiālu) un attiecīgās fizikāli ķīmiskās īpašības,
— testējamās vielas tīrība (piemaisījumi),
— marķēto ķīmisko vielu radioķīmiskā tīrība un īpatnējā aktivitāte (attiecīgā gadījumā).
Standartvielas:
— transformācijas produktu raksturošanai un/vai identifikācijai izmantoto standartvielu ķīmiskais nosaukums un struktūra.
Testa nosēdumi un ūdeņi:
— ūdens nosēdumu paraugu ņemšanas vietas(-u) atrašanās un apraksts, iekļaujot, ja iespējams, piesārņošanas vēsturi,
— visa informācija par ūdens–nosēdumu sistēmas vākšanu, glabāšanu (ja tā notikusi) un aklimatizāciju;
— ūdens–nosēdumu paraugu raksturojums, kā uzskaitīts 1.8.2.2. punkta tabulā.
Testa apstākļi:
— izmantotā testa sistēma (piemēram, caurplūdes, biometra, ventilācijas veids, kratīšanas metode, ūdens tilpums, nosēdumu masa, ūdens slāņa un nosēdumu slāņa biezums, testa tvertņu izmēri utt.),
— testējamās vielas pielietošana testa sistēmā – izmantotā testa koncentrācija, atkārtojumu un kontroles mēģinājumu skaits, testējamās vielas pielietošanas veids (piemēram, šķīdinātāja izmantošana, ja to izmanto) utt.,
— inkubēšanas temperatūra,
— paraugu ņemšanas reizes,
— ekstrakcijas metodes un to efektivitāte, kā arī analīzes metodes un noteikšanas robežas,
— transformācijas produktu raksturošanas/identifikācijas metodes,
— novirzes no testa protokola vai testa apstākļiem pētījuma laikā.
Rezultāti:
— reprezentatīvu analīžu izejas dati skaitļos (visi izejas dati jāglabā labas laboratorijas prakses arhīvā),
— izmantoto analīzes metožu atkārtojamība un jutība,
— atgūstamība (% vērtības derīgam pētījumam ir sniegtas 1.7.1. punktā),
— tabulas ar rezultātiem, kas izteikti kā pielietotās devas % un kā mg.kg–1 ūdenī, nosēdumos un visā sistēmā (tikai %) testējamai vielai un attiecīgā gadījumā transformācijas produktiem un neekstrahējamai radioaktivitātei,
— masas bilance pētījuma laikā un beigās,
— transformācijas grafiskais attēlojums ūdens un nosēdumu frakcijās un visā sistēmā (iekļaujot mineralizāciju),
— mineralizācijas ātrumi,
— testējamās vielas un attiecīgā gadījumā galveno transformācijas produktu pussabrukšanas periods, DT50 un attiecīgā gadījumā DT75 un DT90 vērtības ūdenī, nosēdumos un visā sistēmā, iekļaujot ticamības robežas,
— testējamās vielas un attiecīgā gadījumā galveno transformācijas produktu transformācijas kinētikas novērtējums,
— ierosinātie transformācijas ceļi attiecīgā gadījumā,
— rezultātu apspriešana.
4. IZMANTOTĀ LITERATŪRA
(1) BBA-Guidelines for the examination of plant protectors in the registration process. (1990). Part IV, Section 5-1: Degradability and fate of plant protectors in the water/sediment system. Germany.
(2) Commission for registration of pesticides: Application for registration of a pesticide. (1991). Part G. Behaviour of the product and its metabolites in soil, water and air, Section G.2.1 (a). The Netherlands.
(3) MAFF Pesticides Safety Directorate. (1992). Preliminary guideline for the conduct of biodegradability tests on pesticides in natural sediment/water systems. Ref No SC 9046. United-Kingdom.
(4) Agriculture Canada: Environmental chemistry and fate (1987). Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) – Anaerobic and aerobic. Canada. Pp. 35–37.
(5) US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982). Section 162-3, Anaerobic aquatic metabolism.
(6) SETAC-Europe publication. (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides. Ed. Dr Mark R. Lynch. SETAC-Europe, Brussels.
(7) OECD Test Guidelines Programme. (1995). Final Report of the OECD Workshop on Selection of Soils/sediments, Belgirate, Italy, 18–20 January 1995.
(8) ISO/DIS 5667-12. (1994). Water quality – Sampling – Part 12: Guidance on sampling of bottom sediments.
(9) US-EPA (1998a). Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPA 712-C-98-080.
(10) DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998).
(11) T.R. Roberts: Non-extractable pesticide residues in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984).
(12) OECD Test Guideline 304A: Inherent Biodegradability in Soil (adopted 12 May 1981).
(13) OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
(14) Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic model ecosystem. BCPC – Pests and Diseases, 3B-4, 149-158.
(15) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D.H. Hutson, T.R. Roberts, Eds.), Vol. 1, 85–114. J. Wiley & Sons.
(16) Madsen, T., Kristensen, P. (1997). Effects of bacterial inoculation and non-ionic surfactants on degradation of polycyclic aromatic hydrocarbons in soil. Environ. Toxicol. Chem. 16, p. 631–637.
(17) Steber, J., Wierich, P. (1987). The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with 14C-labelled model surfactants. Water Research 21, p. 661–667.
(18) Black, C.A. (1965). Methods of Soil Analysis. Agronomy Monograph No. 9. American Society of Agronomy, Madison.
(19) APHA (1989). Standard Methods for Examination of Water and Wastewater (17th edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C.
(20) Rowell, D.L. (1994). Soil Science Methods and Applications. Longman.
(21) Light, T.S. (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, p. 1038–1039.
(22) SETAC-Europe publication (1991). Guidance document on testing procedures for pesticides in freshwater mesocosms. From the Workshop “A Meeting of Experts on Guidelines for Static Field Mesocosms Tests”, 3–4 July 1991.
(23) SETAC-Europe publication. (1993). Guidance document on sediment toxicity tests and bioassays for freshwater and marine environments. From the Workshop On Sediment Toxicity Assessment (WOSTA), 8–10 November 1993. Eds.: I.R. Hill, P. Matthiessen and F. Heimbach.
(24) Vink, J.P.M., van der Zee, S.E.A.T.M. (1997). Pesticide biotransformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, p. 2858–2868.
(25) Vink, J.P.M., Schraa, G., van der Zee, S.E.A.T.M. (1999). Nutrient effects on microbial transformation of pesticides in nitrifying waters. Environ. Toxicol, p. 329–338.
(26) Anderson, T.H., Domsch, K.H. (1985). Maintenance carbon requirements of actively-metabolising microbial populations under in-situ conditions. Soil Biol. Biochem. 17, p. 197–203.
(27) ISO-14240-2. (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method.
(28) Beelen, P. Van and F. Van Keulen. (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), p. 13–21.
(29) Shelton, D.R. and Tiedje, J.M. (1984). General method for determining anaerobic biodegradation potential. App. Environ. Microbiol. 47, p. 850–857.
(30) Birch, R.R., Biver, C., Campagna, R., Gledhill, W.E., Pagga, U., Steber, J., Reust, H. and Bontinck, W.J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, p. 1527–1550.
(31) Pagga, U. and Beimborn, D.B. (1993). Anaerobic biodegradation tests for organic compounds. Chemoshpere 27, p. 1499–1509.
(32) Nuck, B.A. and Federle, T.W. (1986). A batch test for assessing the mineralisation of 14C-radiolabelled compounds under realistic anaerobic conditions. Environ. Sci. Technol. 30, p. 3597–3603.
(33) US-EPA (1998b). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPA 712-C-98-090.
(34) Sijm, Haller and Schrap (1997). Influence of storage on sediment characteristics and drying sediment on sorption coefficients of organic contaminants. Bulletin Environ. Contam. Toxicol. 58, p. 961–968.
(35) Timme, G., Frehse H. and Laska V. (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues II. Pflanzenschutz – Nachrichten Bayer, 39, p. 187–203.
(36) Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues I. Pflanzenschutz – Nachrichten Bayer, 33, p. 47–60.
(37) Carlton, R.R. and Allen, R. (1994). The use of a compartment model for evaluating the fate of pesticides in sediment/water systems. Brighton Crop Protection Conference – Pest and Diseases, p. 1349–1354.
1. PAPILDINĀJUMS
NORĀDĪJUMI PAR AEROBĀM UN ANAEROBĀM TESTA SISTĒMĀM
Aerobā testa sistēma
Šajā testa metodē aprakstītā aerobā testa sistēmas sastāv no aeroba ūdens slāņa (parastais skābekļa koncentrāciju diapazons no 7 līdz 10 mg· 1-1) un nosēdumu slāņa, kas ir aerobs pie virsmas un anaerobs zem virsmas (parastais vidējā redokspotenciāla (Eh) diapazons nosēdumu anaerobajā zonā ir –80 līdz –190 mV). Katrā inkubācijas vienībā pāri ūdens virsmai laiž samitrinātu gaisu, lai uzturētu pietiekamu skābekļa daudzumu brīvajā telpā.
Anaerobā testa sistēma
Anaerobā testa sistēmai testa procedūra ir faktiski tā pati, kas izklāstīta attiecībā uz aerobo sistēmu, izņemot to, ka pāri ūdens virsmai katrā inkubācijas vienībā laiž mitru slāpekli, lai saglabātu slāpekli brīvajā telpā. Nosēdumus un ūdeni uzskata par anaerobu, ja redokspotenciāls (Eh) ir zemāks par –100 mV.
Anaerobajā testā mineralizācijas novērtējums iekļauj izdalītā oglekļa dioksīda un metāna mērīšanu.
2. PAPILDINĀJUMS
GĀZES CAURPLŪDES APARĀTA PIEMĒRS

3. PAPILDINĀJUMS
EXAMPLE OF A BIOMETER APPARATUS

4. PAPILDINĀJUMS
LIETOJUMA DEVAS APRĒĶINA PIEMĒRRS TESTA TVERTNĒM
|
Cilindra iekšējais diametrs: |
= 8 cm |
|
Ūdens staba augstums, neiekļaujot nosēdumus: |
= 12 cm |
|
Virsmas laukums: 3,142 × 42 |
= 50,3 cm2 |
|
Lietojuma deva – 500 g testējamās vielas/ha atbilst 5 μg/cm2 |
|
|
Kopā μg: 5 × 50,3 |
= 251,5 μg |
|
Koriģējiet daudzumu attiecībā uz 100 cm dziļumu: 12 × 251,5 ÷ 100 |
= 30,18 μg |
|
Ūdens staba tilpums: 50,3 × 12 |
= 603 ml |
|
Koncentrācija ūdenī: 30,18 ÷ 603 |
= 0,050 μg/ml vai 50 μg/l |
C.25. AEROBĀ MINERALIZĀCIJA VIRSZEMES ŪDENĪ – BIOLOĢISKĀS NOĀRDĪŠANĀS IMITĀCIJAS TESTS
1. METODE
Šī metode ir līdzvērtīga metodei OECD TG 309 (2004) (1)
1.1. IEVADS
Pēc šīs metodes nosaka testējamās vielas bioloģiskās noārdīšanās gaitu mazās koncentrācijās aerobos apstākļos dabīgā ūdenī, un novērojumus kvantitatīvi izsaka ar kinētisko ātrumu. Šis imitācijas tests ir laboratorijas metode, izmantojot paraugu sēriju kratīšanu kolbās, lai noteiktu organisko vielu aerobās bioloģiskās noārdīšanās ātrumu dabīgā virszemes ūdens (saldūdens, sāļūdens vai jūras ūdens) paraugos. Tās pamatā ir ISO/DIS 14592–1 (2), iekļaujot arī C.23. un C.24. testēšanas metodes (3)(4) elementus. Lai novērstu testa mikrovides bojāšanos ilgstošas testēšanas laikā, darbības ar paraugu sērijām var aizstāt ar pusnepārtraukto paņēmienu. Imitācijas testa galvenais mērķis ir noteikt testējamās vielas mineralizāciju virszemes ūdenī, un noārdīšanās kinētiku izsaka pēc mineralizācijas. Otrs sekundārais mērķis ir iegūt informāciju par primāro noārdīšanos un galveno pārveidošanās produktu veidošanos. Pārveidošanās produktu identificēšana un, ja iespējams, to koncentrāciju kvantitatīva noteikšana ir īpaši svarīga vielām, kas mineralizējas ļoti lēni (piemēram, vielām, kuru kopējā atlikuma 14C sadalīšanās pusperiods pārsniedz 60 dienas). Galveno pārveidošanās produktu identificēšanai analītisko ierobežojumu dēļ parasti ir jāizmanto lielākas testējamās vielas koncentrācijas (piemēram, > 100 μg/l).
Zema koncentrācija šajā metodē nozīmē koncentrāciju (piemēram, mazāku par 1 μg/l līdz 100 μg/l), kas ir pietiekami maza, lai nodrošinātu, ka testēšanas apstākļos noteiktā bioloģiskās noārdīšanās kinētika raksturo dabas vidē sagaidāmo. Salīdzinājumā ar bioloģiski noārdāmu oglekli saturošo vielu kopējo masu, ko satur testā izmantojamais dabīgais ūdens, testējamā viela mazā koncentrācijā kalpo kā sekundārais substrāts. Tas nozīmē, ka sagaidāmās bioloģiskās noārdīšanās reakciju kinētika ir pirmās kārtas (“neaugoša” kinētika) un ka testējamā viela var noārdīties “kometabolisma” procesā. Pirmās kārtas noārdīšanās reakcijās noārdīšanās ātrums (mg/l/dienā) ir proporcionāls substrāta koncentrācijai, kura samazinās laikā. Īstas pirmās kārtas kinētikas gadījumā īpatnējā noārdīšanās ātruma konstante k nav atkarīga no laika un koncentrācijas. Tas ir, k ievērojami nemainās eksperimenta laikā un nemainās, palielinot koncentrāciju citā eksperimentā. Pēc definīcijas īpatnējā noārdīšanās ātruma konstante ir vienāda ar koncentrācijas relatīvajām izmaiņām laikā: k = (1/C) · (dC/dt). Kaut arī šeit norādītajos apstākļos parasti ir sagaidāma pirmās kārtas kinētika, var būt gadījumi, kad procesu labāk apraksta citi kinētisko reakciju mehānismi. Novirzes no pirmās kārtas kinētikas var būt novērojamas, piemēram, ja bioloģiskās pārveidošanās ātrumu ierobežo nevis pašu bioloģisko reakciju ātrums, bet ar masas pārneses procesiem saistītās parādības, piemēram, difūzijas ātrums. Tomēr datus gandrīz vienmēr var aprakstīt ar pseidopirmās kārtas kinētiku, izmantojot no koncentrācijas atkarīgu reakcijas ātruma konstanti.
Lai atvieglotu eksperimenta plānošanu un rezultātu interpretāciju, pirms testa jābūt pieejamai informācijai par testējamās vielas bioloģisko noārdīšanos lielākās koncentrācijās (piemērm, no standarta skrīninga testiem), kā arī informācijai par abiotisko noārdīšanos, pārveidošanās produktiem un attiecīgajām fizikāli ķīmiskajām īpašībām. Ar 14C iezīmētu testējamo vielu izmantošana un 14C fāzu sadalījuma noteikšana testēšanas beigās dod iespējas noteikt galīgo bioloģisko noārdīšanos. Ja izmanto ar izotopiem neiezīmētu testējamo vielu, galīgo bioloģisko noārdīšanos var noteikt, tikai testējot to augstākās koncentrācijās, un ja ir zināmi visi tās svarīgākie pārveidošanās produkti.
1.2. DEFINĪCIJAS
Primārā bioloģiskā noārdīšanās: vielas struktūras izmaiņas (pārveidošanās) mikroorganismu iedarbībā, kuru dēļ zūd tās ķīmiskā identitāte.
Funkcionālā bioloģiskā noārdīšanās: vielas struktūras izmaiņas (pārveidošanās) mikroorganismu iedarbībā, kuru dēļ zūd kāda tās specifiska īpašība.
Galīgā aerobā bioloģiskā noārdīšanās: vielas noārdīšanās skābekļa klātbūtnē līdz oglekļa dioksīdam, ūdenim un citu klātesošo elementu minerālsāļiem (mineralizācija) mikroorganismu iedarbībā, veidojoties jaunai biomasai un jaunām organiskām vielām, kas ir mikrobu biosintēzes produkti.
Mineralizācija: vielas noārdīšanās skābekļa klātbūtnē līdz oglekļa dioksīdam, ūdenim un citu klātesošo elementu minerālsāļiem mikroorganismu iedarbībā.
Kavēšanās fāze: laiks no testēšanas sākuma līdz noārdošo mikroorganismu adaptācijai, kurā vielas vai organiskā materiāla bioloģiskās noārdīšanās pakāpe ir sasniegusi nosakāmu līmeni (piemēram, 10 % no maksimālās teorētiskās vai mazāk, atkarībā no noteikšanas metodes precizitātes).
Bioloģiskās noārdīšanās maksimālais līmenis: vielas vai organiskā materiāla procentos izteikta bioloģiskās noārdīšanās pakāpe testa apstākļos, virs kuras testēšanas laikā turpmāka bioloģiskā noārdīšanās nenotiek.
Primārais substrāts: dabīgā oglekļa un enerģijas avotu kopums, kas nodrošina mikrobu biomasas augšanu un uzturēšanu.
Sekundārais substrāts: komponents, kas substrātā ir tik zemā koncentrācijā, ka tam noārdoties, aktīvajiem mikroorganismiem tiek piegādāti tikai nenozīmīgi oglekļa un enerģijas daudzumi, salīdzinot ar galveno substrāta komponentu (primāro substrātu) noārdīšanā piegādāto oglekli un enerģiju.
Noārdīšanās ātruma konstante: pirmās kārtas vai pseidopirmās kārtas kinētiskās reakcijas ātruma konstante k (d–1), kas raksturo noārdīšanās procesu ātrumu. Eksperimentāli k nosaka no noārdīšanās līknes sākuma daļas, ko iegūst pēc kavēšanās fāzes beigām.
Pussadalīšanās periods, t1/2 (d): termins, ko izmanto, lai raksturotu pirmās kārtas reakcijas ātrumu. Tas ir laika intervāls, kurā koncentrācija samazinās 2 reizes. Pussadalīšanās perioda un noārdīšanās ātruma konstantes savstarpējo sakarību izsaka ar vienādojumu t1/2 = ln2/k.
Pusnoārdīšanās laiks, DT50 (d): termins, ko izmanto, lai kvantitatīvi izteiktu bioloģiskās noārdīšanās testēšanas rezultātus. Tas ir laika intervāls, iekļaujot kavēšanās fāzi, kas vajadzīgs, lai bioloģiskās noārdīšanās pakāpe sasniegtu 50 %.
Noteikšanas robeža (LOD) un kvantitatīvās noteikšanas robeža (LOQ): kvalitatīvās noteikšanas robeža ( LOD ) ir vielas koncentrācija, zem kuras vielas identitāte nav atšķirama no analītiskiem artefaktiem. Kvantitatīvās noteikšanas robeža (LOQ) ir vielas koncentrācija, zem kuras tā nav nosakāma ar pieņemamu precizitāti.
Izšķīdušais organiskais ogleklis (DOC): ūdens paraugā esošā tā organiskā oglekļa daļa, ko nevar atdalīt ar norādīto fāzu atdalīšanu, piemēram, ar centrifugēšanu pie 40 000 ms–2 15 min vai ar membrānas filtrāciju, izmantojot membrānas ar porām 0,2 μm–0,45 μm diametrā.
Kopējā organiskā 14C aktivitāte (TOA): kopējā 14C aktivitāte, kas saistīta ar organisko oglekli.
Izšķīdušā organiskā 14C aktivitāte (DOA): kopējā 14C aktivitāte, kas saistīta ar izšķīdušo organisko oglekli.
Daļiņu organiskā 14C aktivitāte (POA): kopējā 14C aktivitāte, kas saistīta ar daļiņu organisko oglekli.
1.3. TESTA PIELIETOJAMĪBA
Šis imitācijas tests ir pielietojams negaistošām vai maz gaistošām organiskām vielām, ko testē mazās koncentrācijās. Lietojot kolbas, kurās var piekļūt atmosfēras gaiss (piemēram, ar vates aizbāžņiem), vielas, kuru ar Henrija konstante ir mazāka par aptuveni 1 Pa·m3/mol (apm. 10–5 atm·m3/mol), var uzskatīt par praktiski negaistošām. Lietojot noslēgtas kolbas ar augšpusē tukšu telpu, ir iespējams bez zudumiem no testēšanas sistēmas testēt maz gaistošas vielas (Henrija konstante < 100 Pa·m3/mol jeb < 10 3 atm·m3/mol). Var notikt ar 14C iezīmēto vielu zudums, ja neveic pasākumus ar CO2 izdalīšanos saistīto zudumu novēršanai. Tādā situācija var būt nepieciešams uztvert CO2 iekšējā absorberā ar sārmu vai izmantot ārējo CO2 absorbcijas sistēmu (tieša 14CO2 noteikšana, sk. 3. pielikumu). Bioloģiskās noārdīšanās kinētikas noteikšanai testējamās vielas koncentrācijām jābūt mazākām par tās šķīdību ūdenī. Tomēr jāatzīmē, ka šķīdība ūdenī pēc literatūras datiem var būt ievērojami augstāka par testējamās vielas šķīdību dabīgajos ūdeņos. Īpaši slikti šķīstošu testējamo vielu šķīdību var noteikt, izmantojot testam lietojamos dabīgos ūdeņus.
Metodi var izmantot bioloģiskās noārdīšanās imitācijai virszemes ūdenī, kurā nav rupju daļiņu (pelaģiskais tests) vai duļķainā virszemes ūdenī, piemēram, ūdenī tuvu ūdens/nosēdumu robežvirsmai (suspendēto nosēdumu tests).
1.4. TESTA PRINCIPS
Testu veic sēriju veidā, inkubējot testējamo vielu tikai ar virszemes ūdeni (pelaģiskais tests) vai ar virszemes ūdeni, kam pievienotas suspendētas cietās daļiņas/sedimenti 0,01 līdz 1 g/l sausnas masas (suspendēto sedimentu tests), lai imitētu ūdeni ar suspendētām cietām daļiņām vai atkārtoti suspendētiem sedimentiem. Suspendēto cieto daļiņu/sedimentu koncentrācija minētā intervāla zemākajā daļā ir tipiska lielākajai daļai virszemes ūdeņu. Testa kolbas inkubē tumsā apkārtējās vides temperatūrā aerobos apstākļos kratot. Lai noteiktu noārdīšanās kinētiku, ir jāizmanto vismaz divas dažādas testējamās vielas koncentrācijas. Koncentrācijām savā starpā ir jāatšķiras 5 līdz 10 reizes, un jāatbilst vides apstākļos sagaidāmajam koncentrāciju diapazonam. Testējamās vielas maksimālā koncentrācija nedrīkst pārsniegt 100 μg/l, bet vēlama ir maksimālā testējamās vielas koncentrācija 10 μg/l vai mazāka, lai nodrošinātu, ka bioloģiskā noārdīšanās notiek atbilstoši pirmās kārtas kinētikai. Mazākā koncentrācija nedrīkst pārsniegt 10 μg/l, bet vēlamā mazākās testējamās vielas koncentrācijas ir 1–2 μg/l, vai mazākas par 1 μg/l. Parasti šādas mazas koncentrācijas var pareizi noteikt, izmantojot komerciāli pieejamas ar 14C izotopu iezīmētas vielas. Analītisko ierobežojumu dēļ bieži nav iespējams izmērīt testa vielas koncentrāciju ar vajadzīgo precizitāti, ja testējamās vielas koncentrācija ≤ 100 μg/l (sk. 1.7.2. iedaļas otro rindkopu). Lielākas testējamās vielas koncentrācijas (> 100 μg/l un dažreiz > 1 mg/l) var izmantot galveno pārveidošanās produktu identificēšanai un kvantitatīvai noteikšanai vai gadījumā, ja nav pieejama specifiska analīzes metode ar pietiekami zemu noteikšanas robežu. Ja testējamās vielas koncentrācija ir augsta, iegūtie rezultāti var nebūt izmantojami pirmās kārtas noārdīšanās reakcijas konstantes un pussadalīšanās perioda noteikšanai, jo noārdīšanās, iespējams, var neatbilst pirmās kārtas kinētikai.
Noārdīšanās procesu kontrolē piemērotos laika intervālos, mērot atlikušā 14C izotopa vai testējamās vielas atlikušo koncentrāciju, ja izmanto specifisku ķīmisko analīzi. Molekulas stabilākās daļas iezīmēšana ar 14C nodrošina kopējās mineralizācijas noteikšanu, bet mazāk stabilās molekulas daļas iezīmēšana ar 14C, kā arī specifiskas analīzes izmantošana dod iespēju novērtēt tikai primāro bioloģisko noārdīšanos. Tomēr stabilākā daļa ne vienmēr iekļauj molekulas attiecīgo funkcionālo grupu (kura var būt saistīta ar specifisku īpašību, tādu kā toksiskums, bioakumulācija, u. c.). Tādā gadījumā, lai izsekotu specifiskas īpašības zušanu, var būt lietderīgi izmantot funkcionālajā daļā ar 14C izotopu iezīmētu testējamo vielu.
1.5. INFORMĀCIJA PAR TESTĒJAMO VIELU
Šajā testā var izmantot gan ar radioaktīvajiem izotopiem iezīmētas, gan neiezīmētas vielas. Ieteicams izmantot iezīmēšanas metodi ar 14C, un marķierim parasti jābūt molekulas stabilākajā(-ās) daļā(-ās) (sk. arī 1.4. iedaļu). Vielām, kas satur vairākus aromātiskos gredzenus, vēlams ar 14C iezīmēt vismaz vienu oglekļa atomu katrā gredzenā. Turklāt ir vēlams ar 14C iezīmēt vienu vai vairākus oglekļa atomus abās pusēs no viegli noārdāmām saitēm. Testējamās vielas ķīmiskajai un/vai radioķīmiskajai tīrībai jābūt > 95 %. Ar radioaktīvajiem izotopiem iezīmētām vielām vēlamā īpatnējā aktivitāte ir aptuveni 50 μCi/mg (1,85 MBq) vai augstāka, lai atvieglotu 14C mērījumus testos, ko izdara ar mazām sākotnējām koncentrācijām. Par testējamo vielu jābūt pieejamai šādai informācijai:
— šķīdība ūdenī [A.6. metode],
— šķīdība organiskos šķīdinātājos (vielām, kuras pielieto ar šķīdinātāju vai kuras slikti šķīst ūdenī),
— disociācijas konstante (pKa), ja vielai ir tieksme pievienot vai zaudēt protonus [OECD TG 112] (5),
— tvaika spiediens [A.4. metode] un Henrija konstante,
— ķīmiskā stabilitāte ūdenī un tumsā (hidrolīze) [C.7. metode].
Ja ūdenī slikti šķīstošas vielas testē jūras ūdenī, var būt noderīgi arī zināt izsālīšanās konstanti (jeb Sečenova konstanti) Ks, ko aprēķina pēc vienādojuma: log (S/S') = Ks Cm, kur S un S' attiecīgi ir vielas šķīdība saldūdenī un jūras ūdenī un Cm ir sāls molārā koncentrācija.
Ja testēšanu veic “suspendēto sedimentu testa” veidā, jābūt pieejamai arī šādai informācijai:
— sadalījuma koeficients sistēmā n-oktanols/ūdens [A.8. metode],
— adsorbcijas koeficients [C.18. metode].
Cita noderīga informācija var būt:
— koncentrācija vidē, ja tā ir noteikta vai aprēķināta,
— testējamās vielas toksiskums mikroorganismiem [C.11. metode],
— bioloģiskās noārdīšanās spēja un/vai potenciālā bioloģiskā noārdāmība [metodes C.4 A–F, C.12, C.9, OECD TG 302 (5)],
— bioloģiskās noārdīšanās spēja augsnē aerobos vai anaerobos apstākļos un sedimentu/ūdens transformācijas pētījumi [C.23., C.24. metode].
1.6. STANDARTVIELAS
Par standartvielu jāizmanto viela, kas parasti viegli noārdās aerobos apstākļos (piemēram, anilīns vai nātrija benzoāts). Sagaidāmais anilīna un nātrija benzoāta noārdīšanās laika intervāls parasti ir mazāks par 2 nedēļām. Standartvielu izmantošanas nolūks ir nodrošināt, ka testa ūdens mikrobu aktivitāte ir zināmās robežās, t. i., ka ūdens satur aktīvu mikrobu populāciju.
1.7. KVALITĀTES KRITĒRIJI
1.7.1. Atgūstamība
Tūlīt pēc testējamās vielas pievienošanas katra sākotnējā testējamā koncentrācija ir jāpārbauda, mērot 14C aktivitāti, vai veicot neiezīmētu vielu ķīmisko analīzi vismaz dublikātu paraugiem. Tas sniedz informāciju par analītiskās metodes pielietojamību, par tās atkārtojamību un par testējamās vielas sadalījuma viendabīgumu. Parasti izmērīto sākotnējo 14C aktivitāti vai testējamās vielas faktisko koncentrāciju – un nevis nominālo koncentrāciju – izmanto turpmākajai datu analīzei, jo ar to kompensē sorbcijas radītos zudumus un dozēšanas kļūdas. Ar 14C iezīmētas testējamās vielas atgūstamību eksperimenta beigās nosaka pēc masas bilances (sk. 1.8.9.4. iedaļas pēdējo rindkopu). Ideālā gadījumā ar radioaktīvo izotopu iezīmētas vielas masas bilancei jābūt diapazonā no 90 % līdz 110 %, ievērojot, ka neiezīmētu testa vielu analītiskajai precizitātei jānodrošina sākotnējā atgūstamība 70 % līdz 110 %. Norādītie diapazoni uzskatāmi par mērķa vērtībām, un tie nav jāizmanto kā testēšanas rezultātu pieņemamības kritēriji. Analītisko precizitāti testējamai vielai var noteikt pie zemākas koncentrācijas nekā sākotnējā koncentrācija, vai arī to noteikt svarīgākajiem pārveidošanās produktiem.
1.7.2. Analītiskās metodes atkārtojamība un jutība
Analītiskās metodes atkārtojamība (arī sākotnējās ekstrakcijas efektivitāte) testējamās vielas vai attiecīgos gadījumos svarīgāko pārveidošanās produktu kvantitatīvai noteikšanai jāpārbauda ar virszemes ūdens piecu atsevišķu ekstraktu atkārtotām analīzēm.
Testējamās vielas un pārveidošanās produktu analītiskās metodes kvalitatīvās noteikšanas robežai (LOD), ja iespējams, jābūt vismaz 1 % no testēšanas sistēmā pievienotā sākotnējā daudzuma. Kvantitatīvās noteikšanas robežai (LOQ) jābūt vienādai vai mazākai par 10 % no izmantotās koncentrācijas. Daudzu organisko vielu un to pārveidošanās produktu ķīmiskajai analīzei bieži nepieciešams, lai testējamās vielas koncentrācija būtu relatīvi augsta, t. i., > 100 μg/l.
1.8. TESTĒŠANAS METODES APRAKSTS
1.8.1. Aparatūra
Testu var veikt piemērota tilpuma (piemēram 0,5 vai 1,0 l) koniskajās vai cilindriskajās kolbās, kas noslēgtas ar silikona vai gumijas aizbāžņiem, vai seruma kolbās ar CO2 necaurlaidīgiem vāciņiem (piemēram, ar butilkaučuka blīvēm). Testu var veikt arī ar vairākām kolbām vienam variantam, un analīzei ņem visas kolbas saturu, katrā paraugu intervālā vismaz divos atkārtojumos (sk. 1.8.9.1. iedaļas pēdējo rindkopu). Negaistošām testējamajām vielām, kas nav iezīmētas ar radioaktīvajiem izotopiem, gāzi necaurlaidīgi aizbāžņi vai vāciņi nav vajadzīgi, un ir piemēroti vaļīgi vates aizbāžņi, kas novērš piesārņošanos no gaisa (sk. 1.8.9.1. iedaļas otro rindkopu). Maz gaistošas vielas jātestē biometra tipa sistēmā, uzmanīgi maisot ūdens virsmu. Lai būtu droši, ka nenotiek bakteriālā piesārņošanās, traukus pirms lietošanas var sterilizēt karsējot vai apstrādājot autoklāvā. Turklāt tiek izmantots šāds standarta laboratorijas aprīkojums:
— kratītājs vai magnētiskie maisītāji testa kolbu nepārtrauktai maisīšanai,
— centrifūga,
— pH metrs,
— turbidimetrs nefelometriskiem duļķainības mērījumiem,
— žāvējamais skapis vai mikroviļņu krāsns sausnas masas noteikšanai,
— membrānfiltrācijas aparāts,
— autoklāvs vai skapis stikla trauku termiskai sterilizēšanai,
— ierīces darbam ar 14C iezīmētām vielām,
— aprīkojums 14C aktivitātes kvantitatīvai noteikšanai CO2 absorbcijas šķīdumu paraugos un vajadzības gadījumā sedimentu paraugos,
— analītiskais aprīkojums testējamās vielas (un standartvielas) noteikšanai, ja izmanto specifisku ķīmisko analīzi (piemēram, gāzu hromatogrāfu, augstspiediena šķidruma hromatogrāfu).
1.8.2. Testējamās vielas izejas standartšķīdums
Testējamās vielas un standartvielas izejas standartšķīdumu gatavošanai izmanto dejonizētu ūdeni (sk. 1.8.7. iedaļas pirmo rindkopu). Dejonizētajā ūdenī nedrīkst būt mikroorganismiem toksisku vielu, un izšķīdušajam organiskajam ogleklim (DOC) jābūt ne vairāk par 1 mg/l (6).
1.8.3. Virszemes ūdens paraugu ņemšana un transportēšana
Paraugu ņemšanas vieta virszemes ūdens savākšanai katrā konkrētajā situācijā jāizraugās atbilstoši testēšanas nolūkam. Izraugoties paraugu ņemšanas vietas, jāņem vērā iespējamo lauksaimniecības, rūpniecības vai mājsaimniecības vielu ievadīšanas vēsture. Ja zināms, ka ūdens vide iepriekšējo četru gadu laikā ir piesārņota ar testējamo vielu vai tās struktūras analogiem, testējamā ūdens paraugus no tās neņem, izņemot gadījumus, kad izpētes mērķis ir noskaidrot noārdīšanās ātrumu tās iedarbībai pakļautajās vietās. Parauga ņemšanas laikā jāizmēra ūdens pH un temperatūra. Turklāt ir jāatzīmē paraugu ņemšanas dziļums un ūdens paraugu izskats (piemēram, krāsa un duļķainība) (sk. 3. iedaļu). Lai parādītu, ka apstākļi ir aerobi – ja vien tas nav acīmredzami, spriežot pēc ārējām pazīmēm un vietas vēstures, jāmēra skābekļa koncentrācija un/vai redokspotenciāls ūdenī un nosēdumu virsmas slānī. Virszemes ūdens jātransportē pilnīgi tīrā konteinerā. Parauga temperatūra transportēšanas laikā nedrīkst ievērojami pārsniegt temperatūru testēšanas laikā. Ja transportēšanas laiks ir ilgāks par 2 līdz 3 stundām, ūdens paraugu ieteicams atdzesēt līdz 4 oC temperatūrai. Ūdens paraugu nedrīkst sasaldēt.
1.8.4. Virszemes ūdensparaugu glabāšana un sagatavošana testēšanai
Testēšanu vēlams sākt vienas dienas laikā pēc paraugu ņemšanas. Ja paraugi jāglabā, glabāšanas laikam jābūt iespējami īsam, un tas nedrīkst pārsniegt 4 nedēļas. Līdz lietošanai ūdens paraugs jāglabā 4 °C temperatūrā aerējot. Pirms izmantošanas jāatdala rupjās daļiņas, piemēram, filtrējot caur neilona filtru ar aptuveni 100 μm acu izmēru vai caur rupju papīra filtru, vai nostādinot.
1.8.5. Ar sedimentiem papildināta ūdens sagatavošana (neobligāti)
Suspendēto sedimentu testam kolbās, kas satur dabīgo ūdeni (filtrētu, lai atdalītu rupjās daļiņas, kā aprakstīts 1.8.4. iedaļā), pievieno sedimenta virskārtu suspensijas iegūšanai; suspendēto cieto vielu koncentrācijai jābūt no 0,01 līdz 1 g/l. Sedimenta virskārtu ņem no tās pašas vietas, kur ņemts ūdens paraugs. Atkarībā no konkrētās ūdens vides sedimentiem var būt raksturīgs liels organiskā oglekļa saturs (2,5–7,5 %) un smalka tekstūra vai mazs organiskā oglekļa saturs (0,5–2,5 %) un rupja tekstūra (3). Sedimenta virskārtas paraugu var sagatavot šādi: lietojot caurspīdīgu plastmasa cauruli, izņem vairākus sedimenta griezumus, nekavējoties atdala augšējos aerobos slāņus (no virsmas līdz maksimāli 5 mm dziļumam) un tos apvieno. Tādā veidā izveidotais apvienotais sedimentu paraugs jātransportē konteinerā ar plašu gaisa telpu, lai sedimentus uzglabātu aerobos apstākļos (atdzesēt līdz 4 °C, ja transportēšanas ilgums pārsniedz 2–3 stundas). Sedimentu paraugs jāsuspendē testa ūdenī attiecībā 1:10 un līdz lietošanai jāglabā 4 °C temperatūrā aerējot. Ja sedimenti jāglabā, glabāšanas laikam jābūt iespējami īsam, un tas nedrīkst pārsniegt 4 nedēļas.
1.8.6. Pusnepārtrauktā procedūra (neobligāti)
Ilgstoša inkubēšana (vairākus mēnešus) var būt nepieciešama, ja, pirms var izmērīt testējamās vielas ievērojamu noārdīšanos, ir ilgs kavēšanās laiks. Ja tas ir zināms no vielas līdzšinējās testēšanas pieredzes, testu var sākt, izmantojot pusnepārtraukto procedūru, kas ļauj periodiski atjaunot daļu testējamā ūdens prauga vai suspensijas (sk. 2. pielikumu). Parasto sēriju testu var pārveidot par pusnepārtraukto testu, ja, izmantojot sēriju procedūru, aptuveni 60 dienu laikā nav novērojama vielas bioloģiskā noārdīšanās (sk. 1.8.8.3. iedaļas otro rindkopu).
1.8.7. Testējamās vielas (vai standartvielas) pievienošana
Vielām, kas labi šķīst ūdenī (> 1 mg/l) un ir maz gaistošas (Henrija konstantes < 1 Pa·m3/mol jeb < 10–5 atm·m3/mol), izejas standartšķīdumu var sagatavot dejonizētā ūdenī (sk 1.8.2. iedaļu); lai sasniegtu vajadzīgo koncentrāciju, atbilstošu izejas standartšķīduma tilpumu pievieno testa traukos. Pievienotais izejas standartšķīduma tilpums nedrīkst pārsniegt praktisko minimumu (ja iespējams, < 10 % no galīgā šķidruma tilpuma). Par organisko šķīdinātāju lietošanas alternatīvu var uzskatīt arī testējamās vielas šķīdināšanu lielākā testa ūdens tilpumā.
Negaistošu vielu ar mazu šķīdību ūdenī izejas standartšķīdumi jāgatavo, izmantojot organisku šķīdinātāju, ja no tā nevar izvairīties, bet testējamai sistēmai pievienotā šķīdinātāja daudzums nedrīkst pārsniegt 1 % tilp., un tas nedrīkst nevēlami ietekmēt mikrobu aktivitāti. Šķīdinātājs nedrīkst ietekmēt testējamās vielas stabilitāti ūdenī. Šķīdinātājs jālieto niecīgā daudzumā, tā, lai tas ievērojami nepalielinātu testa ūdens vai suspensijas izšķīdušā organiskā oglekļa (DOC) koncentrāciju. Tas jāpārbauda ar vielai specifisku analīzi vai, ja iespējams, DOC analīzi (6). Jāraugās, lai pārnestā šķīdinātāja daudzums nepārsniegtu absolūti nepieciešamo, un testējamās vielas daudzums izšķīstu testa ūdens galīgajā tilpumā. Var izmantot citas metodes testējamās vielas ievadīšanai testa traukos, kā aprakstīts (7) un (8). Ja testējamās vielas pievienošanai izmanto organisko šķīdinātāju, tad līdzīgi kā ar aktīvā testa traukiem, kuros pievienota testa viela ar šķīdinātāju kā nesēju, ir jārīkojas ar kontroles traukiem, kas satur testa ūdeni (bez pievienotām vielu piedevām) un testa ūdeni ar pievienotu standartvielu. Šķīdinātāja kontrole vajadzīga, lai konstatētu iespējamo šķidinātāja nevēlamo iedarbību uz mikrobu populāciju, par ko liecina standartvielas noārdīšanās.
1.8.8. Testēšanas apstākļi
1.8.8.1. Testēšanas temperatūra
Inkubācijai jānotiek tumsā (vēlams) vai izkliedētā apgaismojumā temperatūrā, ko uztur ar precizitāti ± 2 °C, un var būt apkārtējā temperatūra vai standarta temperatūra 20–25 °C. Apkārtējā temperatūra var būt parauga faktiskā temperatūra parauga ņemšanas laikā vai vidējā temperatūra parauga ņemšanas vietā.
1.8.8.2. Maisīšana
Maisīšana ar nepārtrauktu kratīšanu vai maisīšanu jāveic, lai daļiņas un mikroorganismi visu laiku būtu suspensijā. Maisīšana arī atvieglo skābekļa pārnesi no virsējās tukšās telpas šķidrumā tā, lai varētu uzturēt aerobus apstākļus. Kolbas novieto kratītājā (aptuveni 100 apgr./min kratīšana) vai izmanto magnētisko maisītāju. Maisīšanai jābūt nepārtrauktai. Kratīšanai vai maisīšanai jābūt iespējami saudzīgai, kas tomēr saglabā homogēnu suspensiju.
1.8.8.3. Testēšanas ilgums
Testēšanas laiks parasti nedrīkst pārsniegt 60 dienas, ja neizmanto pusnepārtraukto procedūru ar testa suspensijas periodisku atjaunošanu (sk. 1.8.6. iedaļu un 2. pielikumu). Tomēr testēšanas ilgumu sēriju testā var paildzināt maksimāli līdz 90 dienām, ja testējamās vielas noārdīšanās ir sākusies pirmo 60 dienu laikā. Noārdīšanos piemērotos laika intervālos kontrolē, nosakot atlikušā 14C aktivitāti vai izdalījušos 14CO2 (sk. 1.8.9.4. iedaļu) un/vai ar ķīmisko analīzi (1.8.9.5. iedaļa). Lai novērtētu noārdīšanās procesu, inkubācijas laikam jābūt pietiekami ilgam. Vēlams, lai noārdīšanās pakāpe būtu lielāka par 50 %; vielām, kas noārdās lēni, noārdīšanās pakāpei jābūt pietiekami lielai (parasti lielākai par 20 %), lai varētu noteikt noārdīšanās kinētiskā ātruma konstanti.
Jāveic regulāri pH un skābekļa koncentrācijas mērījumi, izņemot gadījumus, kad pieredze ar tajā pašā vietā ņemtiem ūdens un nosēdumu paraugiem liecina, ka šādi mērījumi nav vajadzīgi. Dažkārt primāro substrātu metabolisms daudz lielākās koncentrācijās ar ūdeni un nosēdumiem var izraisīt pietiekamu CO2 veidošanos un skābekļa patēriņu, kas ievērojami atšķiras no eksperimenta apstākļiem testēšanas laikā.
1.8.9. Procedūra
1.8.9.1. Kolbu sagatavošana pelaģiskajam testam
Piemērotu testa ūdens tilpumu pārnes testa kolbās apmēram līdz vienai trešdaļai no kolbas tilpuma, bet ne mazāk par 100 ml. Ja izmanto vairākas kolbas (lai varētu izmantot visas kolbas saturu katrā parauga ņemšanas laikā), piemērotākais testa ūdens tilpums arī ir ap 100 ml, jo mazi paraugu tilpumi var ietekmēt kavēšanās fāzes ilgumu. Testējamo vielu pievieno no izejas standartšķīduma, kā aprakstīts 1.8.2. un 1.8.7. iedaļā. Lai noteiktu noārdīšanās kinētiku un aprēķinātu noārdīšanās kinētisko ātruma konstanti, jāizmanto vismaz divas testējamās vielas koncentrācijas, kas atšķiras 5 līdz 10 reizes. Abām izraudzītajām koncentrācijām jābūt mazākām par 100 μg/l un vēlams diapazonā < 1–10 μg/l.
Kolbas noslēdz ar gaisu un CO2 necaurlaidīgiem aizbāžņiem vai vāciņiem. Ar 14C neiezīmētām negaistošām testa vielām ieteicams izmantot vaļīgus vates aizbāžņus, kas novērš piesārņošanos no gaisa (sk. 1.8.1. iedaļu), ja galvenie noārdīšanās produkti ir negaistoši un CO2 nosaka netieši (sk. 3. pielikumu).
Kolbas inkubē izraudzītajā temperatūrā (sk. 1.8.8.1. iedaļu). Paraugus ķīmiskajai analīzei vai 14C mērījumiem ņem testēšanas sākumā (t. i., pirms sākusies bioloģiskā noārdīšanās, sk. 1.7.1. iedaļu) un pēc tam piemērotos laika intervālos testēšanas laikā. Paraugus var ņemt, ņemot apakšparaugus (piemēram, 5 ml alikvotas) no katra atkārtojuma, vai izmantojot visas kolbas saturu katrā parauga ņemšanas reizē. Testa vielas mineralizāciju var noteikt tieši vai netieši (sk. 3. pielikumu). Parasti noārdīšanās fāzes laikā (t. i., pēc kavēšanās fāzes) ir vajadzīgi vismaz pieci paraugu ņemšanas punkti, lai ticami noteiktu ātruma konstanti, ja vien nav ietiekama pamatojuma uzskatīt, ka trīs paraugu ņemšanas punkti ir pietiekami vielām, kuras ātri noārdās. Vielām, kas nenoārdās ātri, noārdīšanās fāzē viegli var izdarīt vairākus mērījumus, un tāpēc konstantes noteikšanai jāizmanto vairāk datu punktu. Paraugu ņemšanai fiksētu grafiku nevar noteikt, jo bioloģiskās noārdīšanās ātrums ir katrai vielai atšķirīgs, tomēr ieteicams ņemt paraugus reizi nedēļā, ja noārdīšanās notiek lēni. Ja testējamā viela noārdās ātri, paraugi jāņem trīs dienas pēc kārtas vienreiz dienā, un pēc tam katru otro vai trešo dienu. Dažos gadījumos, piemēram, ar vielām, kas ļoti ātri hidrolizējas, paraugi var būt jāņem ar dažu stundu intervālu. Pirms testēšanas ieteicams veikt orientējošu pētījumu, lai noteiktu piemērotākos paraugu ņemšanas intervālus. Ja paraugi nepieciešami turpmākām analīzēm, ieteicams ņemt vairāk paraugu un pēc tam izvēlēties tos, kas analizējami eksperimenta beigās saskaņā ar atpakaļgaitas stratēģiju, t. i., pēdējos paraugus analizē vispirms (sk. norādījumus par paraugu stabilitāti glabāšanas laikā 1.8.9.5. iedaļas otrajā rindkopā).
1.8.9.2. Kolbu un paraugu skaits
Nokomplektē pietiekamu testa kolbu skaitu, lai būtu:
— testa kolbas, katrai testējamās vielas koncentrācijai vismaz divos atkārtojumos (vēlams vismaz 3), vai vairāk, ja katrā paraugu ņemšanas reizē izmanto visu kolbas saturu (apzīmē ar FT),
— testa kolbas masas bilances aprēķināšanai katrai testa vielas koncentrācijai vismaz divas kolbas (apzīmē ar FM),
— tukšais mēģinājums bez testējamās vielas, vismaz viena testa kolba, kura satur tikai testa ūdeni (apzīmē ar FB),
— standartvielas kontroles mēģinājums; divas kolbas ar standartvielu (piemēram, anilīnu vai nātrija benzoātu 10 μg/l) (apzīmē ar FC). Standartvielas kontroles nolūks ir apstiprināt mikrobu aktivitātes minimumu. Ja iespējams, var izmantot ar radioaktīvo izotopu iezīmētu standartvielu arī tad, ja testējamās vielas noārdīšanos kontrolē ar ķīmiskajām analīzēm,
— sterilā kontrole; viena vai divas kolbas, kas satur sterilizētu testa ūdeni, lai konstatētu iespējamu abiotisku noārdīšanos vai citādu ar bioloģiskiem procesiem nesaistītu testējamās vielas izmantošanu (apzīmē ar FS). Bioloģisko aktivitāti var apturēt, testa ūdeni sterilizējot autoklāvā (121 °C; 20 min) vai pievienojot toksisku vielu (piemēram, nātrija azīdu (NaN3) 10–20 g/l, dzīvsudraba hlorīdu (HgCl2) 100 mg/l vai formalīnu 100 mg/l), vai apstarojot ar gamma stariem. Ja izmanto HgCl2, tas testa ūdens jālikvidē kā toksiskie atkritumi. Ūdenim ar lielu pievienoto sedimenta daudzumu sterilitāti panākt nav viegli, tādā gadījumā ieteicama atkārtota apstrāde autoklāvā (piemēram, trīs reizes). Jāņem vērā, ka sterilizācija autoklāvā var mainīt sedimentu sorbcijas īpašības,
— šķīdinātāja kontrole; satur testa ūdeni un testa ūdeni ar standartvielu; divas kolbas, ar to pašu šķīdinātāja daudzumu un izmantojot to pašu procedūru kā testējamajai vielai. Nolūks ir konstatēt iespējamo nevēlamo šķīdinātāja ietekmi, nosakot standartvielas noārdīšanos.
Testēšanas plānā jāņem vērā, vai svarīgāk palielināt atkārtojumu skaitu, vai arī ņemšanas laiku skaitu. Precīzs vajadzīgo kolbu skaits ir atkarīgs no noārdīšanās mērījumiem izmantojamās metodes (sk. 1.8.9.1. iedaļas trešo rindkopu, 1.8.9.4. iedaļu un 3. pielikumu).
No katras kolbas katrā paraugu ņemšanas laikā jāņem divi apakšparaugi (piemēram, 5 ml alikvotas). Ja vienam variantam izmanto vairākas kolbas, lai varētu izmantot visu kolbas saturu, katram paraugu ņemšanas laikam jāizmanto vismaz divas kolbas (sk. 1.8.9.1. iedaļas pirmo rindkopu).
1.8.9.3. Kolbu sagatavošana suspendēto nosēdumu testam [neobligāti]
Iepilda vajadzīgos testa ūdens un, ja vajadzīgs, sedimentu tilpumus testa traukos (sk. 1.8.5. iedaļu). Kolbu sagatavošana suspendēto sedimentu testam ir tāda pati kā pelaģiskajam testam (sk. 1.8.9.1. un 1.8.9.2. iedaļu). Izmanto, vēlams, seruma pudeles vai līdzīgas formas kolbas. Noslēgtas kolbas horizontāli novieto uz kratītāja platformas. Acīmredzot, atvērtas kolbas ar 14C neiezīmētām negaistošām vielām ir jānovieto vertikāli, tādā gadījumā ieteicams izmantot magnētisko maisītāju un magnētiskos stienīšus ar stikla pārklājumu. Aerobus apstākļu nodrošināšanai veic pudeļu satura aerāciju.
1.8.9.4. Radioķīmiskās noteikšanas metodes
Izdalījušos 14CO2 daudzumu nosaka tiešos vai netiešos mērījumos (sk. 3. pielikumu). Netieši 14CO2 nosaka pēc starpības starp sākotnējo 14C aktivitāti testa ūdenī vai suspensijā un kopējo atlikuma aktivitāti parauga ņemšanas laikā, mērot pēc parauga paskābināšanas līdz pH 2–3 un CO2 izdalīšanas. Tādā veidā tiek aizvadīts neorganiskais ogleklis, un izmērītā atlikuma aktivitāte attiecināma uz organisko vielu. Netiešu 14CO2 noteikšanu neizmanto, ja testējamās vielas noārdīšanās laikā radušies svarīgākie pārveidošanās produkti ir gaistoši (sk. 3. pielikumu). Ja iespējams, 14CO2 izdalīšanās jāmēra tieši (sk. 3. pielikumu) katrā paraugu ņemšanas laikā vismaz vienā testa kolbā; šī procedūra rada iespējas kontrolēt gan masas bilanci, gan bioloģiskās noārdīšanās procesu, taču metodi var izmantot tikai testiem, ko veic ar noslēgtām kolbām.
Ja radušos 14CO2 mēra tieši testa laikā, šajā nolūkā testa sākumā jāsagatavo vairāk kolbu. Tiešu 14CO2 noteikšanu veikt ir ieteicams, ja testējamās vielas pārveidošanās laikā radušies svarīgākie pārveidošanās produkti ir gaistoši. Katrā mērījumu punktā testa papildu kolbas paskābina līdz pH 2–3 un 14CO2 uztver iekšējā vai ārējā absorberā (sk. 3. pielikumu).
Pēc izvēles ar 14C izotopu iezīmētu testējamo vielu un to galveno pārveidošanās produktu koncentrāciju var noteikt ar radiohromatogrāfiju (piemēram, plānslāņa hromatogrāfiju, RAD-TLC) vai HPLC ar radioķīmisko detektēšanu.
Pēc izvēles var noteikt atlikuma radioaktivitātes fāzu sadalījumu (sk. 1. pielikumu), un testējamās vielas nesadalījušos atlikumu vai tās pārveidošanās produktus.
Testēšanas beigās tiešos 14CO2 mērījumos nosaka masas bilanci, izmantojot atsevišķas testa kolbas, no kurām testēšanas laikā netika ņemti paraugi (sk. 3. pielikumu).
1.8.9.5. Ķīmisko analīžu metodes
Ja ir iespējams izmantot jutīgu analīzes metodi, primāro bioloģisko noārdīšanos var novērtēt, izmērot testējamās vielas atlikuma kopējo koncentrāciju bez iezīmēšanas a radioaktīvo izotopu. Ja izmanto ar radioaktīvu izotopu iezīmētu testējamo vielu (lai noteiktu kopējo mineralizāciju), paralēli var izdarīt specifisku ķīmisko analīzi, lai sniegtu noderīgu papildu informāciju un kontrolētu procedūru. Specifiskas ķīmiskās analīzes var izmantot arī, lai mērītu pārveidošanās produktus, kas veidojas testa vielas noārdīšanās laikā, un tas ir ieteicams vielām, kuru mineralizēšanās pusperiods ir lielāks par 60 dienām. Katram parauga ņemšanas laikam jāmēra un jāreģistrē testējamās vielas un pārveidošanās produktu koncentrācija (koncentrācijas veidā un kā procentuālais daudzums no lietotās). Vispār ir jāidentificē pārveidošanās produkti, kas ir detektēti pie ≥ 10 % no lietotās koncentrācijas katrā parauga ņemšanas reizē, ja nav pienācīgi pamatots citādi. Jāapsver arī tādu pārveidošanās produktu identifikācijas nepieciešamība, kuru koncentrācija pastāvīgi palielinās, pat ja to koncentrācija nepārsniedz iepriekš norādīto robežu, jo tas var norādīt uz noturīgumu. Jāapsver pārveidošanās produktu analizēšanas nepieciešamība sterilajā kontrolē ja uzskata, ka iespējama testējamās vielas ātra abiotiska pārveidošanās (piemēram, hidrolīze). Vajadzība identificēt un kvantitatīvi noteikt pārveidošanās produktus jāapsver, katru gadījumu izskatot atsevišķi, un tās pamatojumu sniedzot testēšanas pārskatā. Ekstrakcijas metodes ar organisku šķīdinātāju jāizmanto saskaņā ar attiecīgās analītiskās procedūras aprakstā sniegtajiem norādījumiem.
Visi paraugi jāglabā 2–4 °C temperatūrā un bez gaisa piekļuves, ja analīzi veic 24 stundu laikā (vēlams). Ilgākai glabāšanai paraugi ir jāsasaldē zem – 18 °C vai ķīmiski jākonservē. Paraugu konservēšanai paskābināšana nav ieteicama, jo paskābināti paraugi var būt nestabili. Ja paraugus neanalizē 24 stundu laikā un tie tiek glabāti ilgāk, ir jāveic pētījums par stabilitāti glabājot, lai parādītu, ka nosakāmā viela, glabājot – 18 °C temperatūrā vai konservēšanas apstākļos ir stabila. Ja analītiskajā metodē ietilpst ekstrakcija ar šķīdinātāju vai cietās fāzes ekstrakciju (CFE), ekstrakcija jāveic tūlīt pēc paraugu ņemšanas vai pēc glabāšanas vēsumā ne ilgāk par 24 stundām.
Atkarībā no analītiskās metodes jutības var būt vajadzīgi lielāki parauga tilpumi nekā norādīts 1.8.1. iedaļā. Testēšana ērti izdarāma ar viena litra paraugiem 2–3 litru tilpuma kolbās, kas dod iespējas analīzēm ņemt apmēram 100 ml tilpuma paraugus.
2. DATI UN TESTĒŠANAS PĀRSKATS
2.1. REZULTĀTU APSTRĀDE
2.1.1. Datu atlikšana
Paraugu ņemšanas laiku noapaļo līdz veselām stundām (ja vien viela ievērojami nenoārdās minūšu līdz dažu stundu laikā), bet nevis līdz veselam skaitam dienu. Testējamās vielas atlikuma aktivitāti (ar 14C iezīmētām vielām) vai atlikuma koncentrāciju (neiezīmētām vielām) atkarībā no laika atliek uz grafika lineārās un puslogaritmiskās koordinātēs (sk. 1.a, 1.b attēlu). Ja ir notikusi noārdīšanās, salīdzina rezultātus no kolbām FT ar rezultātiem no kolbām FS. Ja rezultātu vidējie lielumi no kolbām ar testējamo vielu (FT) un no sterilajām kolbām (FS) atšķiras mazāk par 10 %, var pieņemt, ka novērotā noārdīšanās galvenokārt ir abiotiska. Ja noārdīšanās kolbās FS ir mazāka, skaitļus var izmantot, lai koriģētu tos, kas iegūti ar kolbām FT (atņemot) novērtētu bioloģiskās noārdīšanās pakāpi. Ja veic svarīgāko pārveidošanās produktu analīzes, to veidošanās un samazināšanās grafiki ir jāsniedz papildus testējamās vielas daudzuma samazināšanās grafikam.
Pēc noārdīšanās līknes (puslogaritmiskais grafiks) nosaka kavēšanās fāzes ilgumu tL, ekstrapolējot tās lineāro daļu uz nulles noārdīšanos vai nosakot laiku, kurā noārdījušies aptuveni 10 % vielas (sk. 1.a un 1.b att.). No puslogaritmiskā grafika novērtē pirmās kārtas ātruma konstanti k un tās standartkļūdu pēc naturālā logaritma ln lineārās regresijas (14C atlikuma aktivitātei vai testa vielas atlikuma koncentrācijai) atkarībā no laika. Jo īpaši ar 14C mērījumiem izmanto tikai datus, kas piederīgi līknes sākotnējai lineārajai daļai pēc kavēšanās fāzes beigām, un dod priekšroku dažu reprezentatīvu datu izvēlei, nevis lielāka skaita mazāk drošu datu izvēlei. Nenoteiktība šajā gadījumā iekļauj kļūdas, kas piemīt ieteicamajai izmērīto 14C atlikuma aktivitāšu izmantošanai (sk. turpmāk). Dažkārt var būt jāaprēķina divas dažādas ātruma konstantes, ja noārdīšanās notiek divās fāzēs. Šajā nolūkā definē divas atšķirīgas noārdīšanās līknes fāzes. Ātruma konstanti k un pussadalīšanās periodu t½ = ln2/k aprēķina katram atkārtojumam, ja apakšparaugus ņem no vienas kolbas, vai izmantojot vidējās vērtības, ja katrā parauga ņemšanas laikā izmanto visu vienas kolbas saturu (sk. 1.8.9.2. iedaļas pēdējo rindkopu). Pirmajā gadījumā ātruma konstante un pussadalīšanās periods jānorāda katram atkārtojumam atsevišķi, to vidējā vērtība ar standartkļūdu. Ja ir izmantotas lielas testējamās vielas koncentrācijas, noārdīšanās līkne var ievērojami atšķirties no taisnes (puslogaritmiskais grafiks), un pirmās kārtas kinētika var nebūt spēkā. Tāpēc nav nozīmes noteikt pussadalīšanās periodu. Tomēr ierobežotā datu diapazonā var izmantot pseidopirmās kārtas kinētiku un noteikt pusnoārdīšanās laiku DT50 (laiku, kurā sasniedz 50 % noārdīšanos). Tomēr jāievēro, ka noārdīšanās gaitu ārpus izraudzītajam datu diapazonam pēc DT50 nevar prognozēt, un ka apraksta tikai konkrēto datu kopumu. Pieejamas datu analīzes metodes statistikas aprēķinu veikšanai un līknes aproksimācijai, un šim nolūkam ieteicams izmantot minētā veida programmatūru.
Ja veic specifiskas ķīmiskās analīzes, primārās noārdīšanās ātruma konstantes un pussadalīšanās periodus nosaka kopējai mineralizācijai, kā norādīts iepriekš. Ja limitējošais process ir primārā noārdīšanās, var izmantot datu punktus no visas noārdīšanās gaitas. Tā tas ir tāpēc, ka mērījumi ir tieši, pretstatā 14C aktivitātes mērījumiem.
Ja izmanto ar 14C izotopu iezīmētas vielas, masas bilanci izsaka procentos no lietotās sākotnējās koncentrācijas vismaz testa beigās.
2.1.2. Atlikuma aktivitāte
Ja noārdās ar 14C iezīmētā organiskās vielas daļa, lielākā 14C daļa pārvēršas par 14CO2, bet otra daļa tiek izmantota biomasas pieaugumam un/vai ārpusšūnu metabolītu sintēzei. Tāpēc pilnīgā “galīgā” vielas bioloģiskā noārdīšanās nenotiek tās oglekļa 100 % pārvēršanās par 14CO2. Biosintēzes produktos saistītais 14C turpmāk lēni izdalās 14CO2 veidā “sekundārās mineralizācijas” dēļ. Šo iemeslu dēļ organiskā 14C atlikuma aktivitātes (mērītas pēc CO2 izdalīšanās) vai 14CO2 atlikuma aktivitāte atkarībā no laika, uzrāda “astes” pēc noārdīšanās beigām. Tas apgrūtina kinētikas interpretāciju, un tāpēc noārdīšanās ātruma konstantes noteikšanai parasti izmanto tikai līknes sākuma daļu (pēc kavēšanās fāzes beigām un pirms ir sasniegta apm. 50 % noārdīšanās). Noārdīšanās procesa laikā kopējā atlikuma organiskā 14C aktivitāte vienmēr ir lielāka par 14C aktivitāti, kas saistīta ar vēl nenoārdījušos testējamo vielu. Ja testējamās vielas noārdīšanās notiek pēc pirmās kārtas reakcijas mehānisma un konstanta daļa α mineralizējas par CO2, 14C noārdīšanās līknes sākotnējais virziena koeficients – slīpums (kopējā organiskā 14C attiecība pret laiku) ir α reizinājums ar atbilstošās testējamās vielas (vai precīzāk ar 14C iezīmētās testējamās vielas daļas) koncentrācijas līknes virziena koeficientu. Ja izmanto nekoriģētus kopējās organiskā 14C aktivitātes mērījumus, aprēķinātā sadalīšanās ātruma konstante tāpēc būs konservatīvs lielums. Literatūrā aprakstītas procedūras testējamās vielas koncentrācijas aprēķināšanai pēc izmērītām radioķīmiskām aktivitātēm, pamatojoties uz dažādiem vienkāršojošiem pieņēmumiem (2)(9)(10)(11). Tādas procedūras vienkāršāk izmantojamas vielām, kas ātri noārdās.
2.2. REZULTĀTU INTERPRETĀCIJA
Ja tiek konstatēts, ka k nav atkarīga no pievienotās koncentrācijas (t. i., ja aprēķinātā k vērtība ir aptuveni vienāda pie dažādām testējamās vielas koncentrācijām), var pieņemt, ka izmantotajiem testēšanas apstākļiem, t. i., testējamajai vielai, ūdens paraugam un testa temperatūrai, reprezentatīva ir pirmās kārtas reakcijas ātruma konstante. Ciktāl rezultātus var vispārināt vai ekstrapolēt uz citām sistēmām, ir jānovērtē eksperta slēdzienā. Ja izmanto lielu testējamās vielas koncentrāciju un tāpēc noārdīšanās nenotiek atbilstoši pirmās kārtas kinētikai, datus nevar izmantot pirmās kārtas reakcijas ātruma konstantes vai atbilstošā pussadalīšanās perioda tiešai aprēķināšanai. Tomēr datus, kas iegūti testā ar augstu testējamās vielas koncentrāciju, var izmantot, lai novērtētu kopējo mineralizācijas pakāpi un/vai identificētu un kvantitatīvi noteiktu pārveidošanās produktus.
Ja ir zināmi citu noārdīšanās procesu ātrumi, kas nav bioloģiskā noārdīšanās, (piemēram, hidrolīzes vai iztvaikošanas) ātrumi, aptuvenai bioloģiskās noārdīšanās ātruma aprēķināšanai tos var atņemt no testa laikā novērotā kopējā noārdīšanās ātruma. Hidrolīzes datus var, piemēram, iegūt no sterilās kontroles vai no paralēla testa, kurā izmanto lielāku testējamās vielas koncentrāciju.
Netiešo un tiešo 14CO2 noteikšanu (1.8.9.4. iedaļa un 3. pielikums) var izmantot tikai, lai izmērītu testa vielas mineralizāciju līdz CO2. Radiohromatogrāfiju (RAD-TLC) vai HPLC var izmantot, lai analizētu ar 14C iezīmētas testa vielas koncentrāciju un galveno pārveidošanās produktu veidošanos (1.8.9.4. iedaļas trešā rindkopa). Lai varētu tieši novērtēt pussadalīšanās periodu, ir nepieciešams, lai klāt nebūtu svarīgākie pārveidošanās produkti (definēti kā ≥ 10 % no pievienotās testējamās vielas daudzuma). Ja tā definētie galvenie pārveidošanās produkti ir klāt, nepieciešams sīks datu novērtējums. Šim nolūkam var veikt atkārtotu testēšanu un/vai pārveidošanās produktu identificēšanu (sk. 1.8.9.5. iedaļas pirmo rindkopu), ja vien pārveidošanās produktu rezultātu nevar pamatoti novērtēt no pieredzes (piemēram, no informācijas par noārdīšanās ceļiem). Tā kā testējamās vielas oglekļa daļa, kas pārvēršas par CO2, mainās (galvenokārt atkarībā no testējamās vielas koncentrācijas un citiem pieejamiem substrātiem, testēšanas apstākļiem un mikroorganismu kopuma), šis tests neļauj tieši novērtēt galīgo bioloģisko noārdīšanos, kā tas ir DOC izzušanas testā, bet rezultāts ir līdzīgs respirometrijas testā iegūtajam rezultātam. Mineralizācijas pakāpe tāpēc ir mazāka vai vienāda ar galīgās bioloģiskās noārdīšanās minimālo līmeni. Lai iegūtu pilnīgāku ainu par galīgo bioloģisko noārdīšanos (mineralizāciju un izmantošanu biomasas veidošanai), testa beigās jāveic 14C fāzu sadalījuma analīze (sk. 1. pielikumu). Cieto daļiņu masā esošais 14C daudzums sastāv no baktēriju biomasā ietvertā 14C, un no 14C, ko ir sorbējušas organiskās daļiņas.
2.3. TESTĒŠANAS METODES VALIDĀCIJA
Ja standartviela sagaidāmajā laika intervālā nenoārdās (anilīns un nātrija benzoāts parasti noārdās mazāk nekā divās nedēļās), iegūtie testēšanas rezultāti ir apšaubāmi, un tie ir jāverificē vai testēšana jāatkārto ar jaunu ūdens paraugu. Pēc ISO metodes veiktā starplaboratoriju salīdzinošajā testēšanā, kurā piedalījās septiņas Eiropas laboratorijas, noteiktās koriģētās anilīna noārdīšanās ātruma konstantes bija diapazonā no 0,3 līdz 1,7 dienas–1 ar vidējo vērtību 0,8 d–1 20 oC temperatūrā un ar standartkļūdu ± 0,4 d–1 (t½ = 0,9 dienas). Parastie kavēšanās laiki bija 1 līdz 7 dienas. Analizētajos ūdens paraugos baktēriju biomasas daudzums atbilda 103-104 kolonijas veidojošām vienībām (KVV) vienā mililitrā. Noārdīšanās ātrumi ar barības vielām bagātos Eiropas vidienes ūdeņos bija lielāki nekā Ziemeļu oligotrofajos ūdeņos, kas varētu būt izskaidrojams ar trofiskā režīma atšķirībām vai ar vielu iepriekšēju iedarbību.
Kopējai atgūstamībai (masas bilancei) testa beigās jābūt no 90 % līdz 110 % ar radioaktīvo izotopu iezīmētām vielām, bet neiezīmēto vielu sākotnējai atgūstamībai eksperimenta sākumā jābūt no 70 % līdz 110 %. Tomēr norādītie diapazoni jāinterpretē tikai kā mērķa vērtības, un tie nav jāizmanto par testēšanas rezultātu pieņemamības kritērijiem.
3. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā skaidri jānorāda testēšanas paņēmiens, t. i., pelaģiskais vai suspendētu sedimentu tests, un testēšanas pārskatā jābūt arī vismaz šādai informācijai.
Testējamās vielas un standartvielas:
— vispārējie nosaukumi, ķīmiskie nosaukumi (ieteicams izmantot IUPAC un/vai CAS nosaukumu), CAS numuri, struktūrformulas (norādot 14C vietu, ja izmanto ar radioaktīvo izotopu iezīmētu vielu), un testējamās vielas un standartvielas attiecīgās fizikāli ķīmiskās īpašības (sk. 1.5. un 1.6. iedaļu),
— ķīmiskie nosaukumi, CAS numuri, struktūrformulas (norādot 14C vietu, ja izmanto radioaktīvi iezīmētu vielu) un attiecīgās fizikāli ķīmiskās īpašības vielām, ko izmanto par standartiem pārveidošanās produktu identificēšanai un kvantitatīvai noteikšanai,
— testējamās vielas un standartvielu tīrība (piemaisījumi),
— iezīmētās vielas radioķīmiskā tīrība un īpatnējā aktivitāte (attiecīgā gadījumā).
Virszemes ūdens:
Par ņemto ūdens paraugu jāsniedz vismaz šāda informācija:
— parauga ņemšanas vietas atrašanās un apraksts, iekļaujot, ja iespējams, piesārņojuma vēsturi,
— parauga ņemšanas datums un laiks,
— barības vielas (kopējais N, amonijs, nitrīti, nitrāti, kopējais P, šķīstošie ortofosfāti),
— ņemšanas dziļums,
— parauga izskats (piemēram, krāsa un duļķainība),
— DOC un TOC,
— bioloģiskais skābekļa patēriņš (BSP),
— temperatūra un pH ņemšanas vietā un laikā,
— skābekļa saturs, vai redokspotenciāls (obligāti tikai, ja apstākļi nav acīmredzami aerobi),
— sāļu saturs vai elektrovadītspēja (jūras ūdens un sāļūdens gadījumā),
— suspendēto vielu saturs (ja paraugs ir duļķains),
— iespējama cita veida informācija par parauga ņemšanas vietu parauga ņemšanas laikā (piemēram, pašreizējie vai vēsturiskie dati par upju vai jūras straumju plūsmas ātrumu, tuvējām lielām izplūdēm un izplūžu veidu, laika apstākļiem pirms parauga ņemšanas laika).
Un neobligāti:
— mikrobu biomasa (piemēram, kolonijas veidojošo vienību skaits vai tiešā šūnu skaitīšana mikroskopā, izmantojot akridīnoranžo),
— neorganiskā oglekļa saturs,
— Hlorofila-a koncentrācija kā aļģu biomasas specifisks rādītājs.
Ja veic suspendēto sedimentu testu, papildus jāsniedz šāda informācija par sedimentiem:
— sedimentu ņemšanas dziļums,
— sedimentu izskats (piemēram, krāsaini, dūņaini, mālaini vai smilšaini),
— tekstūra (piemēram, rupju smilšu, smalku smilšu, sanesu un mālu %),
— suspendēto cieto vielu sausnas masa g/l, TOC koncentrācija vai masas zudums izkvēlinot kā organisko vielu satura mērs,
— pH,
— skābekļa saturs vai redokspotenciāls (obligāti tikai tad, ja apstākļi nav acīmredzami aerobi).
Testēšanas apstākļi:
— paraugu glabāšanas ilgums no paraugu ņemšanas laika līdz testēšanai laboratorijā, parauga glabāšana un tā sagatavošana, testēšanas datumi,
— pielietotais testējamās vielas daudzums, testējamā koncentrācija un izmantotā standartviela,
— testējamās vielas lietošanas metode, iekļaujot šķīdinātāju izmantošanu,
— lietotā virszemes ūdens un nosēdumu (ja tos lieto) tilpums un katrā paraugu ņemšanas laikā analīzei ņemtā parauga tilpums,
— izmantotās testēšanas sistēmas apraksts.
Ja testēšana nav jāveic tumsā, informācija par “izkliedētā apgaismojuma” apstākļiem:
— informācija par metodi(-ēm), kas lietota(-as) sterilai kontrolei (piemēram, autoklavēšanas temperatūra, ilgums un skaits),
— inkubācijas temperatūra,
— informācija par analītiskajām metodēm un par metodēm, kas izmantotas radioķīmiskajos mērījumos, masas bilances noteikšanai, un fāzu sadalījuma mērījumos (ja tie veikti),
— atkārtojumu skaits.
Rezultāti:
— atgūstamība procentos (sk. 1.7.1. iedaļu);
— izmantoto analītisko metožu atkārtojamība un jutība, iekļaujot noteikšanas robežu (LOD) un kvantitatīvās noteikšanas robežu (LOQ) (sk. 1.7.2. iedaļu);
— visi mērījumu dati (iekļaujot paraugu ņemšanas laikus) un aprēķinātās vērtības tabulas veidā, un noārdīšanās līknes; katrai testa koncentrācijai un katra atkārtojuma kolbai pārskatā norāda logaritmiskā grafika slīpuma virziena lineārās korelācijas koeficientu, aprēķināto kavēšanās fāzes ilgumu un pirmās kārtas vai pseidopirmās kārtas ātruma konstanti (ja iespējams) un atbilstošo pusnoārdīšanās periodu (vai pusperiodu t50);
— attiecīgās vērtības norāda kā atsevišķos atkārtojumos novēroto rezultātu – piemēram, kavēšanās fāzes ilguma, noārdīšanās ātruma konstantes un pusnoārdīšanās perioda (vai t50) – vidējās vērtības;
— sistēmas klasifikāciju kā neadaptētu vai adaptētu, spriežot no noārdīšanās līknes rakstura un testējamās koncentrācijas iespējamās ietekmes;
— galīgās masas bilances pārbaudes rezultāti un fāzu sadalījuma mērījumu rezultāti (ja tādi ir);
— mineralizētā 14C daļa un, ja ir izmantotas specifiskas analīzes, primārās noārdīšanās galīgais līmenis;
— lietotās vielas un attiecīgā gadījumā svarīgāko pārvēršanās produktu identifikācija, molārā koncentrācija un procenti (sk. 1.8.9.5. iedaļas pirmo rindkopu);
— ja vajadzīgs, iespējamais pārveidošanās mehānisms;
— rezultātu izvērtējums.
4. LITERATŪRA
1. OECD TG 309 (2004) Aerobic Mineralisation in surface water – Simulation Biodegradation Test
2. ISO/DIS 14592–1 (1999) Water quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations – Part 1: Shake flask batch test with surface water or surface water/sediment suspensions.
3. Testing Method C.23. Aerobic and anaerobic transformation in soil.
4. Testing Method C.24. Aerobic and anaerobic transformation in aquatic sediments.
5. OECD (1993). Guidelines for the Testing of Chemicals. OECD, Paris.
6. ISO 8245 (1999). Water quality – Guidelines on the determination of total organic carbon (TOC) and dissolved organic carbon (DOC).
7. ISO 10634 (1995). Water quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
8. OECD draft (2000). Guidance Document on aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 22
9. Simkins, S. and Alexander, M. (1984). Models for mineralization kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol.47, 394–401.
10. Ingerslev, F. and N. Nyholm. (2000). Shake-flask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, 274–283.
11. ISO/CD 14592–1 (1999). Ring test report: Water Quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1 – report of 1998/1999 ring-test. Shake flask batch test with surface water or surface water/sediment suspensions.
1. papildinājums
14 C fāzu sadalījums
Lai pārbaudītu procedūru, atlikuma kopējo organiskā 14C aktivitāti (TOA) parastajiem mērījumiem papildus jāveic masas bilances mērījumi, kurā ietilpst izdalītā 14CO2 tieša noteikšana pēc uztveršanas absorberā (sk. 3. pielikumu). Pati par sevi pozitīva 14CO2 veidošanās bilance ir tiešs pierādījums par bioloģisko noārdīšanos pretstatā abiotiskās noārdīšanās vai citiem zudumu mehānismiem, piemēram, iztvaikošanai vai sorbcijai. Noderīgu papildu informāciju, kas raksturo bioloģisko noārdīšano, var iegūt no TOA sadalījuma mērījumiem starp izšķīdušo stāvokli (izšķīdušā organiskā 14C aktivitāte, DOA) un stāvokli cieto daļiņu veidā (daļiņu organiskā 14C aktivitāte, POA) pēc daļiņu atdalīšanas ar membrānfiltrāciju vai centrifugēšanu. POA sastāv no testa vielas, kas sorbēta uz mikrobu biomasas un uz citām daļiņām, papildus testa vielas ogleklim, kas ir izmantots jauna šūnu materiāla sintēzei un tādējādi iekļauts daļiņu biomasas frakcijā. Izšķīdušā 14C organiskā materiāla veidošanos var novērtēt kā DOA bioloģiskās noārdīšanās beigās (līknes plato daļa noārdīšanās izmaiņu laika grafikā).
Atlikuma 14C fāzu sadalījumu paraugos novērtē, tos filtrējot caur 0,22 μm vai 0,45 μm membrānas filtru no materiāla, kas neadsorbē ievērojamus testējamās vielas daudzumus (piemēroti var būt polikarbonāta filtri). Ja testa vielas sorbcija uz filtra ir pārāk liela, lai to varētu neņemt vērā (jāpārbauda pirms eksperimenta), filtrēšanas vietā var izmantot ultracentrifugēšanu (2 000 g; 10 min).
Ar filtrātu vai centrifugātu rīkojas, kā 3. pielikumā aprakstīts par nefiltrētiem paraugiem. Membrānas filtrus izšķīdina piemērotā scintilāciju šķidrumā un skata, kā parasts, parasti izmantojot tikai ārējā standarta koeficienta metodi, lai koriģētu vājinājumu, vai lieto parauga oksidētāju. Ja ir izmantota centrifugēšana, no daļiņu frakcijas izveidojušos granulu atkārtoti suspendē 1–2 ml destilēta ūdens, un mazgāšanas ūdeni pārnes scintilāciju stobriņā. Pēc tam divas reizes skalo ar 1 ml destilēta ūdens un mazgāšanas ūdeni pārnes stobriņā. Vajadzības gadījumā suspensiju var iekļaut gelā šķidruma scintilāciju skaitīšanai.
2. papildinājums
Pusnepārtrauktā procedūra
Lai panāktu grūti noārdāmu vielu pietiekamu noārdīšanos, inkubācija var būt jāveic vairākus mēnešus. Testēšanas ilgums parasti nedrīkst pārsniegt 60 dienas, ja vien sākotnējā ūdens parauga īpašības netiek saglabātas, atjaunojot testa suspensiju. Ja suspensiju neatjaunojot testējamās vielas noārdīšanās ir sākusies pirmo 60 dienu laikā, testēšanas laiku var paildzināt ne vairāk kā līdz 90 dienām.
Ilgstošas inkubācijas laikā dažādu zudumu veidošanās mehānismu dēļ un ūdens paraugā samazinoties galveno barības vielu saturam un izsīkstot primārajiem oglekļa substrātiem, var samazināties mikroorganismu daudzveidība. Tāpēc, lai pareizi noteiktu lēni noārdošos vielu noārdīšanās ātrumu, ir ieteicams izmantot pusnepārtraukto testu. Tests jāuzsāk, izmantojot pusnepārtraukto procedūru, ja, pamatojoties uz iepriekšējo pieredzi, ir sagaidāms, ka 20 % vielas noārdīšanās sasniegšanai būs trīs mēnešu ilgs inkubācijas periods. Var arī parasto sēriju testu var nomainīt ar pusnepārtraukto testu, ja sēriju procedūrā aptuveni 60 dienās testējamās vielas noārdīšanās nav novērota. Pusnepārtraukto procedūru var izbeigt un testēšanu turpināt kā sēriju testu gadījumos, kad tiek novērota nozīmīga noārdīšanās (piemēram, > 20 %).
Pusnepārtrauktajā testā ik pēc divām nedēļām aptuveni vienu trešdaļu no testējamās suspensijas tilpuma aizstāj ar svaigi ņemtu ūdeni, kam sākotnējā koncentrācijā pievienota testējamā viela. Ja veic suspendēto sedimenta testu, kas nav neobligāti, aizstāšanas ūdenim tāpat pievieno arī sedimentus sākotnējā koncentrācijā (no 0,01 līdz 1 g/l). Veicot testu ar suspendētām sedimentu cietām vielām, ir svarīgi, lai testējamā sistēma tiktu uzturēta pilnīgi suspendētā stāvoklī arī ūdens atjaunošanas laikā, un lai uzturēšanās laiks sistēmā cietajām vielām un ūdenim būtu identisks, citādi var zust paredzētā līdzība ar homogēnu ūdens sistēmu bez fiksētām fāzēm. Šo iemeslu dēļ, ja izmanto pusnepārtraukto procedūru, vēlama ir suspendēto sedimentu koncentrācija norādītā intervāla mazākajā daļā.
Testējamās vielas pievienošana nozīmē, ka testējamās vielas sākotnējā koncentrācija ar testa suspensijas daļējo atjaunošanu netiek pārsniegta un tādējādi tiek novērsta adaptācija, kas bieži novērojama pie lielām testējamo vielu koncentrācijām. Tā kā procedūrā ietilpst atkārtota inokulācija un noplicināto barības vielu un primāro substrātu kompensācija, mikroorganismu sākotnējā daudzveidība tiek atjaunota, un testēšanas ilgumu principā var pagarināt bezgalīgi. Ja izmanto pusnepārtraukto procedūru, ir svarīgi atzīmēt, ka testējamās vielas atlikuma koncentrācija ir jākoriģē, ņemot vērā testējamās vielas daudzumus, ko katrā atjaunošanas procedūrā pievieno un aizvada. Savienojumiem, kas sorbējas maz, savstarpēji aizstājamas koncentrācijas ir testējamās vielas kopējā un izšķīdušās daļas koncentrācija. Sorbcija ir nenozīmīga (< 5 %) norādītajos apstākļos (0,1 1 g cietas vielas/l) vielām, kurām log Kow < 3 (spēkā neitrāliem lipofīliem savienojumiem). To raksturo šāds aprēķina piemērs. 0,1 g/l cietu vielu aptuveni atbilst 10 mg oglekļa litrā (oglekļa daļa fC = 0,01). Pieņemot, ka
log Kow (testējamai vielai) = 3
Koc = 0,42 × Kow
sadalījuma koeficients Kd = fC × Koc
tādā gadījumā izšķīdusī daļa no kopējās koncentrācijas (C-ūdens (Cw)/C-kopējā (Ct) ir:
Cw/Ct = 1/(1 + Kd × SS) = 1(1 + Koc × fC × SS) = 1/(1 + 0,42 × 103 × 0,01 × 0,1 x 10–3) = 0,999
3. papildinājums
14CO2 noteikšana
14CO2 netieša noteikšana
Rutīnas mērījumiem netiešā metode parasti ir mazāk laikietilpīga un ir pati precīzākā, ja testējamā viela ir negaistoša un tās pārveidošanās produkti nav gaistoši. Nefiltrētus paraugus, piemēram, 5 ml tilpuma paraugus, pārnes scintilāciju stobriņos. Piemērota paraugu sākotnējā aktivitāte ir 5 000 dpm-10 000 dpm (80–170 Bq), bet minimālā sākotnējā aktivitāte ir aptuveni 1 000 dpm. Pēc paskābināšanas līdz pH 2–3 ar 1–2 pilieniem koncentrētas H3PO4 vai HCl ir jāizdala CO2. CO2 var aizvadīt, barbotējot cauri gaisu aptuveni ½–1 stundu. Otra iespēja ir 1–2 stundas stobriņus intensīvi kratīt (piemēram, uz mikroplašu kratītāja), vai maisot ne tik intensīvi, atstāt līdz nākamajai dienai. CO2 izdalīšanas efektivitāte ir jāpārbauda (paildzinot aerēšanas vai kratīšanas laiku). Pēc tam jāpievieno scintilāciju šķidrums, kas piemērots skaitīšanai ūdens paraugos, paraugs jāhomogenizē vorteksā, un ar šķidruma scintilāciju skaitīšanu jānosaka radioaktivitāte, atņemot fona aktivitāti, kas noteikta tukšajiem paraugiem (FB). Ja testa ūdens nav ļoti krāsains vai nesatur cietās daļiņas lielā koncentrācijā, paraugi parasti uzrāda vienādu dzēšanu, un ir pietiekami izdarīt dzēšanas koriģēšanu, izmantojot ārējo standartu. Ja testa ūdens ir stipri krāsains, var būt nepieciešama dzēšanas korekcija, izmantojot iekšējo standartu. Ja daļiņu koncentrācija ir ļoti liela, var nebūt iespējams iegūt homogēnu šķīdumu vai gelu, vai arī dzišanas atšķirības starp paraugiem var būt lielas. Tādā gadījumā testa maisījumam var izmantot turpinājumā aprakstīto skaitīšanas metodi. Ja testu izdara kā suspendētu sedimentu testu, 14CO2 mērījumus var izdarīt netieši – ņemt homogēnu 10 ml testa ūdens/suspensijas paraugu un atdalīt fāzes, centrifugējot ar piemērotu ātrumu (piemēram, 40 000 m/s2 15 min). Pēc tam ar ūdens fāzi rīkojas, kā aprakstīts iepriekš. Cieto daļiņu fāzē (POA) 14C aktivitāte jānosaka, sedimentus atkārtoti suspendējot nelielā daudzumā destilēta ūdens, pārnesot scintilāciju stobriņos un pievienojot scintilāciju šķidrumu, lai veidotos gels (šim nolūkam ir pieejami īpaši scintilāciju šķidrumi). Atkarībā no daļiņu īpašībām (piemēram, organiskās vielas satura) var būt lietderīgi paraugu līdz nākamajai dienai atstāt iedarboties ar audus šķīdinošu vielu, un tad pirms scintilāciju šķidruma pievienošanas homogenizēt ar vorteksu. Cita POA noteikšanas metode ir sadedzināšana skābekļa pārākumā, izmantojot parauga oksidētāju. Skaitīšanai noteikti jāizmanto iekšējie standarti, un var būt javeic dzēšanas korekcijas, pievienojot iekšējo standartu katram atsevišķajam paraugam.
14CO2 tiešā noteikšana
Ja 14CO2 izdalīšanos mēra tieši, tas ir jādara, sakomplektējot testa sākumā vairāk kolbu, un katrā mērīšanas punktā izlietojot visu testa kolbu saturu, ko paskābina līdz pH 2–3 un uztverot 14CO2 iekšējā (kas testa sākumā ievietots katrā testa kolbā) vai ārējā absorbentā. Par absorbējošo vidi var izmantot sārmu (piemēram, 1 N NaOH šķīdumu vai NaOH granulas), etanolamīnu vai tirdzniecībā pieejamus absorbentus uz etanolamīna bāzes. Lai tieši noteiktu 14CO2, kolbas jānoslēdz, piemēram, ar butilkaučuka membrānām.
1a. attēls
Datu aritmētiskas atlikšanas piemērs (atlikuma aktivitāte atkarībā no laika)

1b. attēls
Puslogaritmiskās datu atlikšanas piemērs (atlikuma aktivitātes ln atkarībā no laika)
C.26. LEMNA SP. AUGŠANAS INHIBĒŠANAS TESTS
1. METODE
Šī metode ir līdzvērtīga OECD TG 221 (2006) (1). Panākta plaša vienošanās starp ES iestādēm, ka Lemna tests ir piemērota alternatīva alģu testam stipri krāsainām vielām (2)(3).
1.1. IEVADS
Šī testēšanas metode paredzēta vielu toksiskās iedarbības novērtēšanai uz Lemna jeb ūdensziedu ģints saldūdens augiem. Tās pamatā ir esošās metodes (4, 5, 6, 7, 8, 9), taču šeit aprakstītās metodes modificētas saskaņā ar jaunākajiem pētījumiem un konsultācijām par vairākiem būtiskiem jautājumiem. Piedāvātā metode validēta starptautiskā starplaboratoriju salīdzinošā testēšanā (10).
Šajā testēšanas metodē aprakstīta toksiskuma noteikšana, izmantojot Lemna gibba un Lemna minor; abas sugas ir plaši pētītas un izmantotas par objektu iepriekš minētajos standartos. Lemna ģints taksonomija ir sarežģīta, jo sastopami daudzveidīgi fenotipi. Toksisko vielu ietekmē var parādīties Lemna ģenētiskā dažādība. Attiecībā uz ģenētisko dažādību pašlaik nav pietiekami daudz datu, lai ieteiktu konkrētu klonu izmantošanai šajā testēšanas metodē. Jāatzīmē, ka testu neveic aksēniskā jeb sterilā kultūrā, taču testa norises laikā zināmos posmos veic pasākumus, lai kontaminācija ar citiem organismiem būtu minimāla.
Sniegta informācija par testēšanas norisi gan ar šķīduma atjaunošanu (pusstatiskā metode un caurplūdes metode), gan arī bez šķīduma atjaunošanas (statiskā metode). Atkarībā no testēšanas mērķiem un reglamentējošām prasībām ieteicams apsvērt pusstatiskās metodes un caurplūdes metodes lietošanu, piemēram, vielām, kas ātri izdalās no šķīduma iztvaikošanas, fotoķīmiskās sadalīšanās, izgulsnēšanās vai bioloģiskās noārdīšanās rezultātā. Papildu norādījumi sniegti literatūrā (11).
1.2. DEFINĪCIJAS
Šajā testēšanas metodē lietotas turpmāk dotās definīcijas un saīsinājumi.
Biomasa. Populācijas dzīvās vielas sausnas masa. Šajā testā parasti biomasu aizvieto ar tādu parametru mērījumiem kā ūdensziedu plātnīšu skaits vai plātnīšu zonas platība; termins “biomasa” attiecas arī uz šiem aizstājējparametriem.
Hloroze. Ūdensziedu plātnīšu audu dzeltēšana.
Klons. Organisms vai šūna, kas cēlusies no atsevišķa indivīda (īpatņa, eksemplāra) veģetatīvās vairošanās ceļā. Viena un tā paša klona indivīdi tāpēc ir ģenētiski vienādi.
Kolonija. Agregāts, kas veidojas no savstarpēji sasaistītām ūdensziedu mātes un meitas plātnītēm (parasti 2–4). To dažkārt sauc par augu.
ECx Testa vidē izšķīdinātās testējamās vielas koncentrācija, kuras iedarbībā par x % (piemēram, par 50 %) samazinās Lemna augšana noteiktā laika posmā (skaidri norādot, ja ir novirzes no pilna vai normāla testēšanas ilguma). Lai nepārprotami norādītu, ka minētā EC vērtība iegūta no augšanas ātruma vai biomasas iznākuma, saistībā ar augšanas ātrumu jālieto simbols “ErC” un saistībā ar biomasas iznākumu jālieto “EyC”, t. i., vadoties pēc mērāmā mainīgā parametra, piemēram, ErC (plātnīšu skaits).
Caurplūde. Tests, kurā notiek testa šķīdumu nepārtraukta apmaiņa.
Plātnīte. Ūdenszieda atsevišķa struktūrvienība, pēc ārējā izskata lapveidīga. Tā ir ūdenszieda mazākā vienība, kas spējīga vairoties.
Kumpainība. Ūdenszieda plātnītes, kas izskatās kumpainas vai uzpūtušās.
Augšana. Mainīgā lieluma mērāmās vērtības palielināšanās, piemēram, ūdensziedu plātnīšu skaita, sausnas, dabīgi mitrās masas vai plātnīšu zonas palielināšanās testa periodā.
Augšanas ātrums (vidējais īpatnējais augšanas ātrums). Logaritmiskais biomasas pieaugums iedarbības periodā.
Zemākā novērojamās ietekmes koncentrācija (LOEC). Mazākā pārbaudītā koncentrācija, pie kuras novērota statistiski nozīmīga vielas kavējošā ietekme uz augšanu (pie p < 0,05) salīdzinājumā ar kontroli noteiktā iedarbības laikā. Tomēr visām testa koncentrācijām, kas pārsniedz LOEC, jāuzrāda kaitīga iedarbība, kura ir vienāda vai lielāka par to, kas novērojama pie LOEC. Ja ir neiespējami nodrošināt šos abus nosacījumus, jāsniedz izsmeļošs izskaidrojums, kāpēc šāds LOEC (un tādējādi NOEC) izvēlēts.
Mērāmie parametri jeb mainīgie lielumi. Parametri, kas tiek mērīti, lai izteiktu testēšanas beigu rezultātu ar vienu vai vairākiem citiem atšķirīgiem parametriem. Šajā metodē mērāmie parametri ir ūdensziedu plātnīšu skaits, plātnīšu zonas platība, dabīgi mitrā masa un sausna.
Monokultūra. Vienas sugas augu kultūra.
Nekroze. Nedzīvi (t. i., balti vai ūdenī izmirkuši) plātnīšu audi.
Nenovērojamas ietekmes koncentrācija (NOEC). Testa koncentrācija, kuras skaitliskā vērtība ir nākamā zemākā tieši zem LOEC.
Fenotips. Organisma morfoloģisko un fizioloģisko pazīmju kopums, ko nosaka tā gēnu un vides savstarpējā mijiedarbība.
Iegūtie parametri jeb mainīgie lielumi. Toksiskuma noteikšanas parametri, kas atvasināti no mērāmiem parametriem un raksturo biomasu ar dažādu aprēķina metožu izmantojumu. Šajā metodē iegūtie parametri ir augšanas ātrums un biomasas iznākums, kas atvasināti no tādiem mērāmiem parametriem kā ūdensziedu plātnīšu skaits, plātnīšu zonas platība, dabīgi mitrā masa un sausna.
Pusstatiskais tests. Tests, kurā testa šķīdumu periodiski maina ar noteiktu regularitāti testa gaitā.
Statiskais tests. Testa metode, kurā šķīdumu testa gaitā nemaina.
Testa beigu rezultāts. Galvenais faktors, kas mainās testējamās vielas ietekmē salīdzinājumā ar kontroli un ir testēšanas mērķis. Šajā metodē testa beigu rezultāts ir augšanas kavēšana, ko var izteikt ar dažādiem iegūtiem raksturlielumiem, kas pamatoti ar vienu vai vairākiem mērāmiem parametriem.
Testa barotne. Pilnvērtīga sintētiskā barotne testa augu kultivēšanai, kurai pievienota testējamā viela. Testējamā viela parasti ir izšķīdināta testa barotnē.
Iznākums. Mērāmā parametra vērtība, kas raksturo biomasas daudzumu iedarbības perioda beigās, no kura atņemts attiecīgā parametra vērtība iedarbības perioda sākumā.
1.3. METODES PRINCIPS
Eksponenciāli augošām Lemna ģints monokultūrām pievieno testējamo vielu dažādās koncentrācijās un kultivē septiņas dienas. Šī testa mērķis ir kvantitatīvi noteikt testējamās vielas ietekmi uz augu veģetatīvo augšanu konkrētā periodā, izvērtējot izvēlētos mērāmos parametrus. Ūdensziedu plātnīšu skaits ir primārais mērāmais parametrs. Jāmēra vēl vismaz viens cits parametrs (kopējā plātnīšu zonas platība, dabīgi mitrā masa vai sausna), tāpēc ka dažas vielas citus mērāmos parametrus var ietekmēt vairāk nekā plātnīšu skaitu. Lai kvantitatīvi noteiktu testējamās vielas ietekmi, augšanu testa šķīdumos salīdzina ar augšanu kontrolšķīdumos un atrod koncentrāciju, kas izraisa noteiktu x % augšanas kavēšanu (piemēram, 50 %), ko izsaka kā ECx (piemēram, EC50).
Testa beigu rezultāts ir augšanas kavēšana, kas izteikta kā mērāmā parametra (vidējā īpatnējā augšanas ātruma) logaritmiskais pieaugums testējamās vielas iedarbības jeb iedarbības periodā. No vidējā īpatnējā augšanas ātruma skaitliskajām vērtībām, ko iegūst testa šķīdumu rindā, atrod koncentrāciju, kas izraisa noteiktu x % augšanas kavēšanu (piemēram, 50 %), ko izsaka kā ErCx (piemēram, ErC50).
Papildu parametrs, ko izmanto šajā testa metodē, ir biomasas iznākums, kas nepieciešams dažās valstīs atbilstoši īpašām normatīvām prasībām. Tas definēts kā mērāmais parametrs iedarbības perioda beigās, no kura atņemts attiecīgs iedarbības perioda sākumā izmērīts parametrs. No biomasas iznākuma skaitliskajām vērtībām, ko iegūst testa šķīdumu rindā, atrod koncentrāciju, kas izraisa noteiktu x % biomasas iznākuma samazināšanos (piemēram, 50 %), ko izsaka kā EyCx (piemēram, EyC50).
Turklāt statistiski jānosaka mazākā novērojamās iedarbības koncentrācija (LOEC) un nenovērojamas iedarbības koncentrācija (NOEC).
1.4. INFORMĀCIJA PAR TESTĒJAMO VIELU
Jābūt pieejamai pietiekami jutīgai analīzes metodei vielas kvantitatīvai noteikšanai testa barotnē.
Nosakot testēšanas apstākļus, var noderēt informācija par testējamo vielu – struktūrformula, tīrības pakāpe, stabilitāte ūdenī un gaismā, pKa, Kow, tvaika spiediens un bioloģiskās noārdīšanās spēja. Šķīdību ūdenī un tvaika spiedienu var izmantot, lai aprēķinātu Henrija konstanti un novērtētu, vai testa periodā iespējami būtiski testējamās vielas zudumi. Tā iespējams gūt norādījumus, vai jāveic īpaši pasākumi šādu zudumu kontrolei. Ja informācija par testējamās vielas šķīdību un stabilitāti ir neprecīza, ieteicams to novērtēt testa apstākļos, t. i., ar barotni, temperatūru, apgaismojuma režīmu, ko izmantos testa laikā.
Ja īpaši svarīga ir testa vides pH kontrole, piemēram, ja testējamie metāli vai vielas ir hidrolītiski nestabilas, barotnei ieteicams pievienot buferšķīdumu (sk. 1.7.4. iedaļas pirmo rindkopu). Papildu norādījumi par testiem ar tādām vielām, kas grūti testējamas to fizikāli ķīmisko īpašību dēļ, atrodami (11).
1.5. STANDARTVIELA
Standartvielu(-as), piemēram, 3,5-dihlorfenolu, ko lieto starptautiskā starplaboratoriju salīdzinošā testēšanā (10), var izmantot par testēšanas procedūras pārbaudes līdzekli. Ieteicams testēt standartvielu vismaz divas reizes gadā vai arī, ja testēšana notiek retāk, veikt to paralēli ar testējamās vielas toksiskuma noteikšanu.
1.6. TESTĒŠANAS REZULTĀTU VALIDĀCIJA
Lai testēšanas rezultātus atzītu par derīgiem, plātnīšu skaita divkāršošanās laikam kontrolē jābūt mazākam par 2,5 dienām (60 h), kas atbilst aptuveni septiņkārtīgam pieaugumam septiņās dienās un vidējam īpatnējam augšanas ātrumam 0,275 d–1. Izmantojot šajā testēšanas metodē aprakstītās barotnes un pārbaudes apstākļus, šo kritēriju var sasniegt statiskā testa režīmā (8). Tāpat sagaidāms, ka šo kritēriju var sasniegt, izmantojot testā pusstatisko metodi un caurplūdes metodi. Divkāršošanās laika aprēķināšana norādīta 2.1. iedaļā.
1.7. METODES APRAKSTS
1.7.1. Aparatūra
Visām iekārtām, kas ir saskarē ar testa vidi, jābūt izgatavotām no stikla vai cita ķīmiski inerta materiāla. Stikla traukiem, kas paredzēti kultivēšanai un testēšanai, jāattīra no ķīmiska piesārņojuma, kas varētu iekļūt testa vidē, un tiem jābūt steriliem. Testa traukiem jābūt pietiekami lieliem, lai kolonijas kontroles traukos varētu brīvi augt, testa beigās nepārklājoties cita citai. Nav būtiski, ja saknītes pieskaras testa trauka dibenam, tomēr visiem testa traukiem ieteicamais minimālais dziļums ir 20 mm un minimālais tilpums 100 ml. Testa trauku izvēlei nav citas būtiskas nozīmes, ja vien tiek izpildītas minētās prasības. Par piemērotām atzītas arī atbilstoša izmēra stikla vārglāzes, kristalizatori vai Petri trauki no stikla. Testa traukiem jābūt apsegtiem, lai līdz minimumam samazinātu iztvaikošanu un nejauša piesārņojuma iespēju, vienlaikus nodrošinot nepieciešamo gaisa apmaiņu. Piemēroti ir tādi testa trauki un it īpaši to pārsegums, kas nenoēno augus vai nerada gaismas spektra izmaiņas.
Kultūras un testa traukus nedrīkst izvietot vienkopu. Šī prasība labāk izpildāma, izmantojot atsevišķas audzēšanas kameras, inkubatorus vai skapjus. Apgaismojums un temperatūra jākontrolē un jāuztur nemainīgā līmenī (sk. 1.7.8. iedaļu).
1.7.2. Testa organismi
Šajā testā izmantojamie organismi ir Lemna gibba vai Lemna minor. Toksiskuma noteikšanai izmantojamo ūdensziedu sugu īss apraksts dots 1. pielikumā. Augu materiāls jāsaņem no kultūru kolekcijas, no citas laboratorijas vai jāievāc lauka apstākļos. Lauka apstākļos ievākti augi vismaz 8 nedēļas pirms izmantošanas jāuztur kultūrā tieši tādā barotnē, kādu izmanto testēšanai. Vietām uz lauka, kur ievāc sākotnējo kultūras sējmateriālu, jābūt bez redzamiem piesārņojuma avotiem. Ja augu materiāls saņemts no citas laboratorijas vai no kultūru kolekcijas, tas jāuztur līdzīgi vismaz 3 nedēļas. Visos gadījumos jānorāda testā izmantojamā augu materiāla izcelsmes avots, suga un klons (ja zināms).
Jāizmanto monokultūras, kas redzami nav piesārņotas ar aļģēm un vienšūņiem. Veselīgi L. minor augi sastāv no kolonijām, ko veido 2–5 plātnītes, bet veselīgā L. gibba kolonijā var būt pat 7 plātnītes.
Testā izmantojamo augu kvalitāte un viendabīgums būtiski ietekmē testa rezultātus, tāpēc tie jāizraugās rūpīgi. Jāizmanto jauni, ātri augoši augi bez redzamiem bojājumiem vai krāsas izmaiņām (hlorozes). Labas kvalitātes kultūras pazīme ir daudz koloniju, kas sastāv no vismaz 2 plātnītēm. Liels atsevišķu plātnīšu skaits liecina par vides stresu, piemēram, barības vielu nepietiekamību, un testēšanai sējmateriālu no šādām augu kultūrām izmantot nedrīkst.
1.7.3. Audzēšana
Lai manipulācijas kultūras uzturēšanai varētu veikt retāk (piemētam, ja Lemna testi tuvākajā laikā nav plānoti), kultūras glabā samazināta apgaismojuma apstākļos pazeminātā temperatūrā (4–10 °C). Sīkāka informācija par kultūru uzturēšanu dota 2. pielikumā. Ja novērojamas aļģu vai citu organismu kontaminācijas pazīmes, jāņem Lemna plātnīšu izlases paraugs, jāveic tā virsmas sterilizācija un pēc tam jāpārnes svaigā barotnē (sk. 2. pielikumu). Šādā gadījumā atlikusī kontaminētā kultūra jālikvidē.
Vismaz 7 dienas pirms testēšanas sākuma pietiekamu daudzumu koloniju aseptiski pārvieto svaigā barotnē un 7–10 dienas kultivē testa apstākļos.
1.7.4. Testa barotne
Turpmāk minētas vairākas barotnes, kas ieteicamas Lemna minor un Lemna gibba kultivēšanai. Rūpīgi jāapsver pH buferšķīduma pievienošana barotnēm (4-morfolīnpropānsulfonskābe; CAS Nr.1132–61–2; EINECS Nr.214–478–5 Lemna gibba barotnei un NaHCO3 Lemna minor barotnei), ja iespējams, ka tas varētu reaģēt ar testējamo vielu un ietekmēt tās toksiskumu. Var izmantot arī Steinberga barotni (12), ja tā atbilst ticamības kritērijiem.
Arī modificēta Zviedrijas standartos (SIS) minētā Lemna barotne ieteicama kultivēšanai un testēšanai ar L. minor. Šīs barotnes sastāvs dots 3. pielikumā.
Barotne 20X – AAP, kas aprakstīta 3. pielikumā, ieteicama kultivēšanai un pārbaudēm ar L. gibba.
Steinberga barotne, kas aprakstīta 3. pielikumā, arī ir piemērota L. minor, un ja tā atbilst derīguma kritērijiem, izmantojama arī L. gibba kultivēšanai.
1.7.5. Testa šķīdumi
Testa šķīdumus parasti gatavo, atšķaidot pamatšķīdumu. Testējamās vielas pamatšķīdumu parasti gatavo, izšķīdinot vielu barotnē.
Lielākā testējamā koncentrācija parasti nav augstāka par vielas šķīdību ūdenī testa apstākļos. Jānorāda, ka Lemna ūdensziedi peld barotnes virspusē un uz tiem var iedarboties vielas, kas uzkrājas ūdens un gaisa saskares zonā (piemēram, ūdenī slikti šķīstošas vai hidrofobas vielas, vai virsmaktīvās vielas). Tādos apstākļos iedarbību var radīt viela, kura atrodas ārpus šķīduma, un atkarībā no testējamās vielas īpašībām testa koncentrācijas var pārsniegt tās šķīdību ūdenī. No slikti šķīstošām testējamajām vielām var būt jāgatavo koncentrēti pamatšķīdumi vai dispersijas, izmantojot organiskos šķīdinātājus vai disperģētājvielas, lai atvieglotu vielas disperģēšanu un šķīdināšanu, dodot iespējas paaugstināt testējamās vielas dozēšanas precizitāti testa barotnē. Tomēr jādara viss iespējamais, lai izvairītos no šādu materiālu lietošanas. Šīs palīgvielas – šķīdinātāji vai disperģētājvielas – nedrīkst būt fitotoksiskas. Piemēram, parasti izmantojamie šķīdinātāji, kas nav fitotoksiski koncentrācijā virs 100 μl/l, ir acetons un dimetilformamīds. Ja lieto šķīdinātājus vai disperģētājvielas, jānorāda šo vielu gala koncentrācija un tā jāuztur minimālā līmenī (≤ 100 μl/l), un visos variantos – testējamās vielas un kontroles traukos – šķīdinātājam vai disperģētājvielai jābūt vienādā koncentrācijā. Papildu norādījumi par disperģētājvielu lietošanu atrodami literatūrā (11).
1.7.6. Testa un kontroles grupas
Piemērotu testējamo koncentrāciju izvēlei ieteicams iegūt priekšzināšanas par testējamās vielas toksiskumu Lemna ūdensziediem, piemēram, veicot orientējošu izmēģinājumu vielas koncentrāciju diapazona noteikšanai. Galīgajā toksiskuma testā parasti jābūt vismaz piecām testējamo koncentrāciju variantiem sērijā, kas palielinās ģeometriskā progresijā. Vēlams, lai sadalījuma koeficients starp testa koncentrācijām nepārsniegtu 3,2; lielāku vērtību var izmantot tad, ja koncentrācijas–iedarbības līkne ir lēzena. Ja testē mazāk nekā piecas koncentrācijas, tas ir jāpamato. Katram testējamās koncentrācijas variantam jābūt vismaz trijos atkārtojumos.
Nosakot testējamo koncentrāciju diapazonu (orientējošam izmēģinājumam un/vai galīgajam toksiskuma testam), jāņem vērā šādi apsvērumi.
— ECx, noteikšanā testa koncentrācijām jāietver ECx, vērtība, lai nodrošinātu atbilstošu ticamību. Piemēram, nosakot EC50, augstākajai testētajai koncentrācijai jābūt lielākai par EC50 vērtību. Ja EC50 vērtība atrodas ārpus testa koncentrāciju diapazona, attiecīgie ticamības intervāli ir lieli, un nebūs iespējama modeļa statistiskā derīguma korekta novērtēšana.
— Ja mērķis ir noteikt LOEC/NOEC, zemākajai testa koncentrācijai jābūt pietiekami mazai, tā, lai augšana nebūtu ievērojami lēnāka kā kontrolē. Pie tam augstākajai testa koncentrācijai jābūt pietiekami lielai, tā, lai augšana būtu ievērojami lēnāka nekā kontrolē. Ja tā nav, testēšana jāatkārto, izmantojot citādu koncentrāciju diapazonu (ja vien lielākā koncentrācija nav tuvu šķīdības robežai vai maksimāli pieļaujamajai robežkoncentrācijai, piemēram, 100 mg/l).
Katram testam jāiekļauj kontrole, kurā ir tā pati barotne, vienāds plātnīšu un koloniju skaits, vides apstākļi, manipulācijas kā testa traukos, bet bez testējamās vielas. Ja lieto palīgšķīdinātāju vai disperģētājvielu, kontrolei papildus jāpievieno tas pats šķīdinātājs/disperģētājviela tieši tādā koncentrācijā kā testa traukos. Atkārtojumu skaitam kontroles traukiem (arī traukiem ar šķīdinātāju, ja to lieto) jābūt vismaz tādam pašam kā trauku skaitam katrai testējamās koncentrācijas variantam, ideālā gadījumā divreiz lielākam par to.
Ja nav nepieciešams noteikt NOEC, eksperimenta plānu var mainīt, palielinot testējamo koncentrāciju skaitu un samazinot katras koncentrācijas atkārtojumu skaitu. Taču kontrolei jābūt vismaz 3 atkārtojumiem.
1.7.7. Iedarbība
Kolonijas, kas sastāv no 2–4 saredzamām plātnītēm, no inokulāta kultūras aseptiskos apstākļos pārsēj testa traukos, sadalot pēc gadījuma principa. Katrā testa traukā jāatrodas pavisam 9–12 plātnītēm. Plātnīšu un koloniju skaitam visos testa traukos jābūt vienādam. Šīs metodes izmantošanas pieredze un starplaboratoriju salīdzinošās testēšanas dati liecina, ka trīs atkārtojumi katram testa traukam, kur sākumā iesētas 9–12 plātnītes, ir pietiekami, lai starp testa traukiem konstatētu augšanas atšķirības pie aptuveni 4–7 % inhibēšanas, kas aprēķināta pēc augšanas ātruma (10–15 %, ja aprēķināta pēc biomasas iznākuma) (10).
Testa trauki inkubatorā jāizvieto pēc gadījuma principa, lai iespējami samazinātu telpiskās atšķirības gaismas intensitātes vai temperatūras ziņā. Nepieciešams arī bloka plānojums vai trauku pārvietošana pēc gadījuma izvēles principa pēc tam, kad izdarīti novērojumi (vai arī trauku pārvietošana jāveic biežāk).
Ja orientējošā izmēģinājumā konstatē, ka testa periodā (7 dienas) testējamās vielas koncentrāciju nav iespējams uzturēt (t. i., izmērītā koncentrācija ir mazāka par 80 % no sākotnējās koncentrācijas), ieteicams izmantot pusstatisko metodi. Šādā gadījumā kolonijas jāiesēj svaigi sagatavotā testēšanas barotnē un kontrolšķīdumos vismaz divas reizes testa laikā (t. i., 3. un 5. dienā). Pārsēšanas biežums svaigā barotnē atkarīgs no testējamās vielas stabilitātes; parasti tā var būt vajadzīga, lai ļoti nestabilām un gaistošām vielām uzturētu iespējami nemainīgu koncentrāciju. Dažkārt var būt jāizmanto caurplūdes metode (11, 13).
Iedarbības modeļi, testējamo vielu izsmidzinot uz auga lapām, šajā testēšanas metodē nav aprakstīti, bet ir atrodami literatūrā (14).
1.7.8. Inkubācijas apstākļi
Pastāvīgas silti vai vēsi baltas dienasgaismas avots, kas nodrošina apgaismojuma intensitāti diapazonā 85–135 μE·m–2·s–1, mērot fotosintēzes aktivitātei atbilstošā spektra daļā (400–700 nm) tādā pašā attālumā no gaismas avota, kādā atrodas Lemna plātnītes (ekvivalents 6 500–10 000 lux). Jebkuras novirzes no izraudzītās apgaismojuma intensitātes testa zonā nedrīkst pārsniegt ± 15 %. Apgaismojuma noteikšanas un mērīšanas metodes, it īpaši sensora veids, var ietekmēt izmērītās vērtības. Par labākiem atzīstami sfēriskie sensori (reaģē uz gaismu visos leņķos virs mērījumu plaknes un zem tās) un “kosinusa” sensori (reaģē uz gaismu visos leņķos virs mērījumu plaknes) salīdzinājumā ar vienvirziena sensoriem, un var iegūt augstākus nolasījumus no šeit aprakstītā veida daudzpunktu gaismas avota.
Temperatūrai testa traukos jābūt 24±2 °C. Kontroles barotnē testēšanas laikā pH nedrīkst mainīties vairāk kā par 1,5 vienībām. Tomēr noviržu dēļ, kas pārsniedz 1,5 vienības, testēšanas rezultāti nav uzskatāmi par nederīgiem, ja tas atbilst derīguma kritērijiem. Papildu uzraudzība pH novirzēm vajadzīga īpašos gadījumos – ja jātestē nestabilas vielas vai metāli. Sīkākus norādījumus sk. literatūrā (11).
1.7.9. Ilgums
Testu beidz 7 dienas pēc augu iesēšanas testa traukos.
1.7.10. Mērījumi un analītiskā noteikšana
Testēšanas sākumā jānosaka un jāreģistrē plātnīšu skaits testa traukos, pārliecinoties, ka tiek uzskaitītas uz āru izvirzītas, skaidri saskatāmas plātnītes. Plātnīšu skaits jānosaka testa sākumā, tad vismaz vienu reizi 3 dienās iedarbības periodā (t. i., vismaz 2 reizes 7 dienu periodā) un testa beigās, uzskaitot gan normālās, gan anomālās plātnītes. Jāievēro augu attīstības izmaiņas, t. i., plātnīšu lielums, ārējais izskats, nekrozes pazīmes, hloroze, kumpainība, koloniju sadalīšanās, peldspējas zudums, kā arī saknīšu garums un izskats. Jānovēro arī barotnes izmaiņu pazīmes (t. i., neizšķīdušas vielas, aļģu augšana testa traukā).
Papildus plātnīšu skaita noteikšanai testēšanas laikā jānovērtē arī testējamās vielas ietekme uz vienu (vai vairākiem) šādiem mērāmajiem parametriem:
i) kopējā plātnīšu zonas platība;
ii) sausna;
iii) dabīgi mitrā masa.
Kopējās plātnīšu zonas platības noteikšanai ir tāda priekšrocība, ka to var noteikt katram testējamā varianta un kontroles traukam testa sākumā, norises gaitā un testa beigās. Sausna vai dabīgi mitrā masa jānosaka reprezentatīvā paraugā testa sākumā no inokulāta kultūras, kuru lietos par sējmateriālu testa sākšanai, kā arī testa beigās augu materiālā no katra testējamā varianta un kontroles trauka. Ja plātnīšu zonas platība netiek mērīta, vēlams noteikt sausnu, nevis dabīgi mitro masu.
Kopējo plātnīšu zonas platību, sausnu un dabīgi mitro masu var noteikt šādi:
i) Kopējā plātnīšu zonas platība. Kopējo visu koloniju zonas platību var noteikt ar attēlu analīzi. Testa trauka un augu siluetus var fiksēt ar videokameru (t. i., novietojot trauku uz gaismas kameras), un iegūto attēlu digitalizēt. Ja kalibrēšanu veic ar plakanas formas modeļiem, var noteikt kopējo plātnīšu zonas platību testa traukā. Jāraugās, lai nebūtu traucējumu, ko rada testa trauka malas. Alternatīva, bet darbietilpīgāka metode ir fotografēt testa traukus un augus, izgriezt iegūto koloniju siluetu un izmērīt to laukumu, izmantojot lapu virsmas platības analizatoru vai milimetrpapīru. Piemērotas ir arī citas metodes (piemēram, izmantojot papīru, var noteikt papīra masas attiecību starp koloniju silueta laukumu un laukuma vienību).
ii) Sausna. No katra testa trauka ievāc visas kolonijas un skalo ar destilētu vai dejonizētu ūdeni. Nosusina, lai atbrīvotos no liekā ūdens un 60 °C temperatūrā žāvē līdz nemainīgai masai. Jāņem arī saknīšu fragmenti. Sausna jānosaka vismaz ar 0,1 mg precizitāti.
iii) Dabīgi mitrā masa. Visas kolonijas pārvieto iepriekš nosvērtās polistirola (vai cita inerta materiāla) mēģenēs ar noapaļotu apakšdaļu un sīkām (1 mm) atverēm. Mēģenes 10 minūtes istabas temperatūrā centrifugē ar ātrumu 3 000 apgr./min. Mēģenes ar nosusinātajām kolonijām atkal nosver un aprēķina dabīgi mitro masu, atņemot tukšas mēģenes masu.
1.7.10.1. Mērījumu un analītiskās noteikšanas biežums
Izmantojot statisko metodi, pH jāmēra katrā testēšanas traukā testa sākumā un beigās. Pusstatiskās metodes gadījumā pH jāmēra katrā “svaigā” testa šķīduma porcijā pirms šķīduma nomaiņas, kā arī attiecīgajās “izlietoto” šķīdumu porcijās.
Apgaismojuma intensitāte jāmēra audzēšanas kamerā, inkubatorā vai skapī tādā pašā attālumā no gaismas avota, kādā atrodas Lemna plātnītes. Mērījumi jāveic vismaz vienreiz testēšanas laikā. Barotnes temperatūras mērīšanu veic aizvietotājtraukā, kas novietots identiskos apstākļos audzēšanas kamerā, inkubatorā vai skapī, un tā jāmēra vismaz vienreiz dienā.
Testa laikā testējamās vielas koncentrāciju nosaka atbilstošos intervālos. Statiskajos testos minimālā prasība ir noteikt koncentrāciju testēšanas sākumā un beigās.
Pusstatiskajos testos, kad sagaidāms, ka testējamās vielas koncentrācija saglabāsies ± 20 % robežās no nominālās koncentrācijas, jāanalizē visi no jauna pagatavotie testa šķīdumi, kā arī tie paši šķīdumi pirms katras ievadīšanas testa traukos (sk. 1.7.7. iedaļas trešo punktu). Tomēr tādos testos, kur testējamās vielas izmērītā sākotnējā koncentrācija nav ± 20 % no nominālās koncentrācijas, bet pietiekami pierādījumi liecina, ka sākotnējā koncentrācija ir atkārtojama un stabila (t. i., 80–120 % no sākotnējās koncentrācijas), ķīmiskās analīzes var veikt tikai pie pašām lielākajām un mazākajām testējamajām koncentrācijām. Visos gadījumos testējamās vielas koncentrācija jānosaka pirms svaiga šķīduma pievienošanas – tikai no viena atkārtojuma (trauka) katrai koncentrācijai (var apvienot paraugus no visiem atkārtojumiem).
Ja izmanto caurplūdes metodi, paraugus ņem līdzīgā režīmā, kā aprakstīts pusstatiskās metodes gadījumā, tajā skaitā ņem analīzes testēšanas sākumā, vidusposmā un beigās; veikt mērījumus “izlietotajos” šķīdumos nav lietderīgi. Šajā testā šķīdinātāja un testējamās vielas vai testējamās vielas pamatšķīduma plūsmas ātrums jāpārbauda katru dienu.
Ja ir liecības, ka testējamās vielas koncentrācija testa gaitā ir pietiekami nemainīga ± 20 % robežās no nominālās vai izmērītās sākotnējās koncentrācijas, rezultātu analīzi var veikt, pamatojoties uz sākotnējām nominālām vai izmērītām vērtībām. Ja novirzes no nominālās vai izmērītās sākotnējās koncentrācijas ir lielākas par ± 20 %, rezultātu analīzei jāpamatojas uz vidējo ģeometrisko koncentrāciju iedarbības periodā vai arī uz modeļiem, kas apraksta testējamās vielas koncentrācijas samazināšanos (11).
1.7.11. Robežkoncentrācijas tests
Atsevišķos gadījumos, piemēram, ja orientējošā izmēģinājumā redzams, ka testējamā viela nav toksiska koncentrācijā līdz 100 mg/l vai līdz tās šķīdības robežai testa barotnē (atkarībā no tā, kura ir mazāka), var veikt robežkoncentrācijas testu, kurā salīdzina kontroles grupas un apstrādes grupas reakciju (100 mg/l vai koncentrācijā, kas vienāda ar šķīdību). Noteikti ieteicams to apstiprināt, analizējot koncentrācijas, ar kādām apstrādā paraugus. Iepriekš aprakstītie testa apstākļi un derīguma kritēriji attiecas uz robežkoncentrācijas testu, izņemot to, ka katras koncentrācijas atkārtojumu skaits jādubulto. Augšanu kontroles grupā un apstrādes grupā var analizēt, izmantojot statistikas metodes, piemēram, Stjūdenta kritēriju.
2. DATI UN TESTĒŠANAS PĀRSKATS
2.1. DIVKĀRŠOŠANĀS LAIKS
Lai noteiktu ūdensziedu plātnīšu skaita divkāršošanās laiku (Td) un pētījuma atbilstību šim derīguma kritērijam (1.6. iedaļa), aprēķiniem ar kontroles traukos iegūtiem datiem izmanto šādu formulu:
Td = ln 2/μ
kur μ ir vidējais īpatnējais augšanas ātrums, ko nosaka, kā aprakstīts 2.2.1. iedaļas pirmajā un otrajā rindkopā.
2.2. ATBILDES REAKCIJAS MAINĪGIE RAKSTURLIELUMI
Testēšanas mērķis ir noteikt testējamās vielas ietekmi uz Lemna veģetatīvo augšanu. Šajā testēšanas metodē aprakstīti divi raksturlielumi, jo dalībvalstīm ir dažādas preferences un reglamentējošās prasības. Lai testa rezultāti būtu pieņemami visās dalībvalstīs, vielu iedarbību var vērtēt pēc abiem turpmāk a) un b) apakšpunktā minētajiem parametriem.
a) Vidējais īpatnējais augšanas ātrums. Šis atbildes reakcijas rādītājs aprēķināts, pamatojoties uz plātnīšu skaita logaritma izmaiņām un pamatojoties uz vēl cita mērāmā parametra (kopējās plātnīšu zonas platības, dabīgi mitrās masas vai sausnas) logaritma izmaiņām laikā (izteikts dienās) kontrolē un katrā testējamās koncentrācijas variantā. To dažreiz apzīmē par relatīvo augšanas ātrumu (15).
b) Biomasas iznākums. Šis atbildes reakcijas rādītājs aprēķināts, pamatojoties uz plātnīšu skaita izmaiņām un uz vēl kāda cita mērāma parametra (kopējās plātnīšu zonas platības, dabīgi mitrās masas vai sausnas) izmaiņām kontrolēs un katrā apstrādes varianta grupā periodā līdz testēšanas beigām.
Jāatzīmē, ka toksiskuma rādītāji, kas aprēķināti, izmantojot šos abus atbildes reakcijas rādītājus, nav savstarpēji salīdzināmi, un šī atšķirība jāapzinās, izmantojot testa rezultātus. Ja šīs testa metodes noteikumi ir ievēroti, matemātiskās pieejas atšķirību dēļ ECx vērtība, kas noteikta pēc vidējā īpatnējā augšanas ātruma (ErCx), parasti ir augstāka salīdzinājumā ar rezultātiem, kas iegūti, pamatojoties uz biomasas iznākumu (EyCx). To nedrīkst interpretēt kā šo abu iegūto parametru jutības atšķirību, gluži vienkārši, šie lielumi matemātiski ir dažādi. Vidējā īpatnējā augšanas ātruma koncepcijas pamatā ir ūdensziedu kultūras neierobežota eksponenciāla augšana, toksiskumu nosakot pēc ietekmes uz augšanas ātrumu neatkarīgi no kontroles īpatnējā augšanas ātruma absolūtā lieluma, koncentrācijas-iedarbības līknes slīpuma vai no testa ilguma. Pretstatā tam rezultāti, kas balstās uz biomasas iznākumu kā iegūto mainīgo atbildes reakcijas rādītāju, ir atkarīgi no visiem citiem minētajiem parametriem. ErCx ir atkarīgs no konkrētās testā izmantojamās ūdensziedu sugas īpatnējā augšanas ātruma un no maksimālā īpatnējā augšanas ātruma, kas dažādām sugām un pat dažādiem kloniem var būt aršķirīgs. Pēc šā rādītāja nevar savstarpēji salīdzināt ūdensziedu sugu un pat dažādu klonu jutību pret toksiskām vielām. Kaut gan no zinātniskā viedokļa labāk ir toksiskuma noteikšanai izmantot vidējo īpatnējo augšanas ātrumu, šajā testēšanas metodē iekļauta arī toksiskuma noteikšana, kas pamatojas uz biomasas iznākumu, ievērojot pašlaik vairākās valstīs spēkā esošās normatīvās prasības.
Toksiskuma noteikšanai jāpamatojas uz plātnīšu skaitu un vēl vismaz vienu citu mērāmo parametru (plātnīšu zonas kopējā platība, sausna vai dabīgi mitrā masa), tā kā dažas vielas var ietekmēt citus mērāmos lielumus vairāk nekā plātnīšu skaitu. Šo iedarbību nevar noteikt, aprēķinot tikai plātnīšu skaitu.
Plātnīšu skaits, kā arī jebkurš cits iegūtais mērāmais parametrs, t. i., plātnīšu zonas kopējā platība, sausna vai dabīgi mitrā masa, jāapkopo tabulā kopā ar testējamās vielas koncentrāciju katrā mērījumu termiņā. Turpmāko datu analīzei, piemēram, lai noteiktu LOEC, NOEC vai ECx, jāpamatojas uz katrā atsevišķā atkārtojumā iegūtām vērtībām, nevis katram nosakāmajam variantam aprēķināto vidējo vērtību.
2.2.1. Vidējais īpatnējais augšanas ātrums
Vidējo īpatnējo augšanas ātrumu noteiktā laika posmā aprēķina kā plātnīšu skaita un vēl cita mērāmā lieluma (kopējās plātnīšu zonas platības, dabīgi mitrās masas vai sausnas) logaritmisko pieaugumu katram atkārtojumam kontroles un apstrādes variantu grupās, izmantojot formulu:
![]()
kur:
|
μi–j: |
vidējais īpatnējais augšanas ātrums laika posmā no i līdz j |
|
Ni: |
mērāmais lielums testa vai kontroltraukā laika punktā i |
|
Nj: |
mērāmais lielums testējamās koncentrācijas vai kontroles traukā laika punktā j |
|
t: |
laika posms no i līdz j |
Katra apstrādes varianta atkārtojumu grupai un kontroles grupai aprēķina augšanas ātruma vidējo vērtību un dispersiju.
Vidējais īpatnējais augšanas ātrums jāaprēķina visam testa periodam (laika punkts “i” ir testa sākums, un laika punkts “j” ir testa beigas). Katrai apstrādes varianta atkārtojumu grupai un kontroles grupai aprēķina vidējā īpatnējā augšanas ātruma vidējo vērtību un dispersiju. Bez tam jānosaka augšanas ātrums pa posmiem, lai novērtētu testējamās vielas iedarbības parādīšanos apstrādes periodā (piemēram, pārbaudot logaritmiskās augšanas līknes). Augšanas līknes ir noteikti jāanalizē, jo vidējā augšanas ātruma būtiskas atšķirības no augšanas ātruma starpposmos liecina par novirzi no konstantas eksponenciālas augšanas. Šajā gadījumā konservatīva pieeja būtu salīdzināt apstrādāto kultūru īpatnējo augšanas ātrumu maksimālās kavēšanas periodā ar kontroles kultūrām tajā pašā laika periodā.
Procentuālo augšanas ātruma kavēšanu (Lr) katrai testējamajai koncentrācijai (apstrādes grupai) aprēķina pēc šādas formulas:
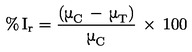
kur:
|
% Ir: |
vidējā īpatnējā augšanas ātruma procentuālās kavēšanas vērtība |
|
μC: |
μ vidējā vērtība kontrolē |
|
μT: |
μ vidējā vērtība apstrādes grupā. |
2.2.2. Biomasas iznākums
Ietekmi uz biomasas iznākumu nosaka, pamatojoties uz diviem mērāmajiem parametriem, – plātnīšu skaitu un vēl kādu citu mērāmo lielumu (kopējo plātnīšu zonas platību, dabīgi mitro masu vai sausnu) katrā testa traukā testēšanas sākumā un beigās. Sākotnējās biomasas sausnu vai dabīgi mitro masu nosaka, ņemot plātnīšu paraugus no tās pašas partijas, ko izmanto sēšanai testa traukos (sk. 1.7.3. iedaļas otro rindkopu). Katrai apstrādes grupai un kontroles grupai aprēķina vidējā īpatnējā augšanas ātruma vidējo vērtību un dispersiju. Vidējo biomasas iznākuma kavēšanas procentuālo vērtību (% Iy) katrai apstrādes grupai aprēķina šādi:
![]()
kur:
|
% Iy: |
biomasas iznākuma samazināšanās procentuālā vērtība |
|
bC: |
kontroles grupas biomasa testa beigās, no kuras atņemta biomasa testa sākumā |
|
bT: |
apstrādes grupas biomasa testa beigās, no kuras atņemta biomasa testa sākumā |
2.2.3. Koncentrācijas-iedarbības līkņu konstruēšana
Koncentrācijas-iedarbības līknes konstruē, saistot atbildes reakcijas rādītāju vidējo inhibēšanu procentos (Ir un Iy aprēķina, kā noteikts 2.2.1. iedaļas pēdējā rindkopā vai 2.2.2. iedaļā) atkarībā no testējamās vielas koncentrācijas logaritma.
2.2.4. ECx noteikšana
ECx (piemēram, EC50) aprēķina pēc vidējā īpatnējā augšanas ātruma (ErCx) un biomasas iznākuma (EyCx), kurus savukārt nosaka pēc plātnīšu skaita un izmantojot vēl kādu citu mērāmo lielumu (kopējo plātnīšu zonas platību, dabīgi mitro masu vai sausnu). Tas ir tāpēc, ka ir testējamās vielas, kas atšķirīgi ietekmē plātnīšu skaitu un citus mērāmos parametrus. Vēlamie toksiskuma rādītāji tāpēc ir četras dažādas ECx vērtības katram inhibēšanas līmenim x: ErCx (plātnīšu skaits); ErCx (kopējā plātnīšu zonas platība, dabīgi mitrā masa vai sausna); EyCx (plātnīšu skaits); un EyCx (kopējā plātnīšu zonas platība, dabīgi mitrā masa vai sausna).
2.3. STATISTIKAS PROCEDŪRAS
Datu statistiskās analīzes mērķis ir ar regresijas analīzes palīdzību iegūt koncentrācijas-iedarbības kvantitatīvās attiecības. Var izmantot svērto lineāro regresiju pēc tam, kad veikta iegūto datu lineārā transformācija, piemēram, probit vai logit, vai arī Weibull vienībās (16), taču vēlams izmantot augstākas kārtas regresiju, kas ir piemērotāka gadījumos ar nenovēršamām datu kļūdām un novirzēm no varbūtību vienmērīga sadalījuma. Tuvojoties nulles inhibēšanai vai pilnīgai inhibēšanai, transformācija šādas novirzes var palielināt, traucējot analīzi (16). Jānorāda, ka analīzes standarta metodes, kurās izmanto probit, logit, vai Weibull pārveidojumus, paredzētas datiem, ko izsaka ar galīgu skaitli (piemēram, mirstība vai izdzīvotība) un tās jāmodificē, lai pielāgotu augšanas ātruma vai biomasas iznākuma datiem. Īpašas procedūras ECx vērtību noteikšanai datiem, kas ir nepārtraukti gadījuma lielumi, aprakstītas literatūrā (17, 18, 19).
ECx vērtību aprēķiniem konkrētos punktos katram analizējamajam atbildes reakcijas rādītājam izmanto koncentrācijas-iedarbības sakarības kvantitatīvās attiecības. Ja iespējams, jānosaka katra aprēķinātā lieluma 95 % ticamības robežas. Iegūto datu atbilstība regresijas modelim jāpārbauda grafiski vai statistiski. Regresijas analīze jāveic, izmantojot katrā atsevišķā atkārtojumā iegūtās vērtības, nevis apstrādes variantu grupu vidējās vērtības.
Gadījumos, kad pieejamie regresijas modeļi/metodes nav piemēroti iegūtajiem datiem, EC50 vērtības var aprēķināt un ticamības robežas noteikt arī, izmantojot lineāro interpolāciju ar bootstrapping (20) – statistisku metodi datu kopas pārbaudei, izveidojot to pseidoatkārtojumus pēc gadījuma izvēles principa.
Lai noteiktu LOEC un līdz ar to NOEC, jāsalīdzina apstrādes variantu vidējās vērtības, izmantojot dispersijas analīzi. Katras koncentrācijas vidējais lielums jāsalīdzina ar kontroles vidējo lielumu, izmantojot atbilstošu multiplās salīdzināšanas vai trenda testa metodi. Noderīgi var būt Daneta (Dunnett) vai Viljamsa (Williams) testi (21, 22, 23, 24). Jāpārbauda, vai ir spēkā pieņēmums par dispersijas homogenitāti, kas ir dispersijas analīzes pamatā. Šo pārbaudi var veikt grafiski vai formālā testā (25). Piemēroti testi ir Levena (Levene) vai Bārtleta (Bartlett) testi. Ja nav izpildīts pieņēmums attiecībā uz dispersijas homogenitāti, to dažreiz var labot, veicot datu logaritmisku transformāciju. Ja dispersijas heterogenitāte ir pārlieku liela un to nevar koriģēt ar transformāciju, jāveic analīze ar tādām metodēm kā pamazinošā soļa Jonkēra (Jonkheere) trenda tests. Papildu norādījumi par NOEC noteikšanu sniegti literatūrā (19).
Ar jaunākajām zinātnes atziņām pamatots ieteikums atteikties no NOEC koncepcijas, tās vietā izmantojot ECx, ko aprēķina pēc attiecīgajiiem regresijas vienādojumiem. Ieteicamākā x vērtība šim Lemna testam nav konstatēta. Taču noskaidrots, ka ir piemērots 10–20 % diapazons (atkarībā no izmantojamā atbildes reakcijas rādītāja), un vēlams norādīt gan EC10, gan EC20.
3. PĀRSKATS
3.1. TESTĒŠANAS PĀRSKATS
Testēšanas pārskatā jābūt šādai informācijai:
Testējamā viela:
— fizikālās īpašības un fizikāli ķīmiskās īpašības, t.sk. šķīdība ūdenī,
— ķīmiskās identifikācijas dati (piemēram, CAS numurs), tostarp tīrības pakāpe.
Testa sugas:
— zinātniskais nosaukums, klons (ja zināms) un izcelsmes avots.
Testa apstākļi:
— izvēlētā testēšanas procedūra (statiskā, pusstatiskā vai caurplūdes metode),
— testa sākuma un beigu datums un tā ilgums,
— barotne,
— eksperimentālā plāna apraksts: testa trauki un pārsegums, šķīdumu tilpums, plātnīšu un koloniju skaits katrā testa traukā testa sākumā,
— izraudzītās testējamās koncentrācijas (nominālās un izmērītās, pēc vajadzības) un katra koncentrācijas varianta atkārtojumu skaits,
— pamatšķīdumu un testa šķīdumu pagatavošanas metodes, tostarp šķīdinātāju vai disperģētājvielu izmantošana,
— temperatūra testēšanas laikā,
— gaismas avots, gaismas intensitāte un homogenitāte,
— pH vērtības testējamiem un kontroles šķīdumiem,
— testējamās vielas koncentrācija un analīzes metode ar attiecīgiem kvalitātes novērtēšanas datiem (analīžu validācijas pētījumi, standartnovirzes vai ticamības robežas),
— metodes plātnīšu skaita un citu mērāmo parametru, piemēram, sausnas, dabīgi mitrās masas vai plātnīšu zonas kopējās platības noteikšanai,
— visas atkāpes no šīs testēšanas metodes.
Rezultāti:
— izejas dati: plātnīšu skaits un citi mērāmie parametri – no katra testējamā un kontroles trauka visos novērojumu vai analīžu termiņos,
— katra mērāmā lieluma vidējās vērtības un standartnovirzes,
— augšanas līknes katrai koncentrācijai (ieteicams ar logaritmiski pārveidotu mērāmo parametru, sk. 2.2.1. iedaļas otro rindkopu),
— divkāršošanās laiks/augšanas ātrums kontrolē, kas aprēķināts pēc plātnīšu skaita,
— aprēķinātie atbildes reakcijas rādītāji visiem testē'jamo variantu atkārtojumiem, to vidējās vērtības un atkārtojumu variācijas koeficienti,
— koncentrācijas un tās ietekmes savstarpējās sakarības grafisks attēlojums,
— iegūto parametru toksiskumu raksturojošo beigu punktu aprēķini, piemēram, EC50, EC10, EC20 un saistītie ticamības intervāli; LOEC un/vai NOEC; ja tās ir aprēķinātas, un to noteikšanai izmantotās statistikas metodes,
— ja izmanto dispersijas analīzi, iedarbības apmērs, ko iespējams konstatēt (piemēram, mazākā būtiskā starpība),
— apstrādes variantos konstatētā augšanas stimulēšana,
— fitotoksiskuma vizuālas pazīmes, kā arī testējamo šķīdumu novērojumi,
— rezultātu novērtējums un ziņas par atkāpēm no šīs testēšanas metodes, kuras ietekmējušas noteikšanas rezultātus.
4. LITERATŪRA
(1) OECD TG 221 (2006) Lemna Sp. Growth Inhibition Test
(2) The use of Lemna studies for coloured substances is detailed in Section 13.5.3 of the EU Manual of Decisions dated July 2006, at http://ecb.jrc.ec.europa.eu/new-chemicals
(3) Guidance on information requirements and chemical safety assessment – Chapter R.7b: Endpoint specific guidance; Table 7.8.3 Summary of difficult substance testing issues, available at
http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1234958685#A
(4) ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742. In, Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA.
(5) USEPA – United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., “Public draft”. EPA 712-C-96–156. 8pp.
(6) AFNOR – Association Française de Normalisation. (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
(7) SSI – Swedish Standards Institute. (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (in Swedish).
(8) Environment Canada. (1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37–120 pp
(9) Environment Canada. (1993) Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Canadian Wildlife Service, Technical Report Series No. 145.
(10) Sims I., Whitehouse P., and Lacey R. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency.
(11) OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No.23.
(12) ISO DIS 20079. Water Quality – Determination of the Toxic Effect of Water Constituents and Waste Water to Duckweed (Lemna minor) – Duckweed Growth Inhibition Test.
(13) Walbridge C. T. (1977). A flow-through testing procedure with duckweed (Lemna minor L.). Environmental Research Laboratory – Duluth, Minnesota 55804. US EPA Report No. EPA-600/3–77 108. September 1977.
(14) Lockhart W. L., Billeck B. N. and Baron C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353–359.
(15) Huebert, D.B. and Shay J.M. (1993) Considerations in the assessment of toxicity using duckweeds. Environmental Toxicology and Chemistry, 12, 481–483.
(16) Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718.
(17) Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167.
(18) Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485–1494.
(19) OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
(20) Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN.
(21) Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096–1121.
(22) Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics, 20, 482–491.
(23) Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103–117.
(24) Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28: 510–531.
(25) Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93–96.
1. papildinājums
Lemna spp. apraksts
Ūdensaugs Lemna, kuru parasti sauc par ūdensziediem, pieder Lemnaceae dzimtai, kas ietver četras Lemna ģintis ar daudzām pasaulē plaši izplatītām sugām. Šo augu ārējais izskats un taksonomija ir izsmeļoši aprakstīta (1, 2). Lemna gibba un L. minor ir raksturīgas mērenā klimata joslu sugas, un tās parasti izmanto toksiskuma pārbaudēs. Abām sugām raksturīgas ūdenī brīvi peldošas vai iegrimušas diskveida plātnītes ar sīku pavedienveida saknīti katras plātnītes apakšpuses vidusdaļā. Lemna sugām ziedi veidojas reti; šie augi vairojas veģetatīvi, attīstoties jaunām plātnītēm (3). Salīdzinājumā ar vecākiem eksemplāriem jaunie augi ir bālāki, ar īsākām saknēm, un tie veidoti no divām vai trim dažāda lieluma plātnītēm. Lemna ģints augiem raksturīgs mazs izmērs, vienkārša uzbūve, veģetatīva vairošanās un īss ģenerāciju (paaudžu maiņas) laiks, tāpēc šīs ģints augi ir ļoti piemēroti laboratorijas testiem (4, 5).
Tā kā iespējama jutības starpsugu mainība, ticams ir vienīgi jutības salīdzinājums vienas sugas robežās.
Testēšanai izmantoto Lemna sugu piemēri. Sugu norādes
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2. Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys. Chem., 29: 935–941.
Lemna minor: United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., “Public draft”. EPA 712-C-96–156. 8pp.
Association Française de Normalisation (AFNOR). (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
Swedish Standards Institute (SIS). (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (in Swedish).
Lemna gibba: ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742.
United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., “Public draft”. EPA 712-C-96–156. 8pp.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch. Environ. Contam. Toxicol., 10:1959–1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol. Environ. Saf., 5:87–96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481–483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds. Verh.-Int. Ver. Limnol., 19:2102–2111.
Lemna sugu kolekcijas
University of Toronto Culture Collection of Algae and Cyanobacteria
Department of Botany, University of Toronto
Toronto, Ontario, Kanāda, M5S 3 B2
Tel: +1–416–978–3641
Fakss:+1–416–978–5878
e-pasts: jacreman@botany.utoronto.ca
http://www.botany.utoronto.ca/utcc
North Carolina State University
Forestry Dept
Duckweed Culture Collection
Campus Box 8002
Raleigh, NC 27695–8002
Amerikas Savienotās Valstis
Tel: 001 (919) 515–7572
astomp@unity.ncsu.edu
Institute of Applied Environmental Research (ITM) Stockholm University
SE-106 91 STOCKHOLM
ZVIEDRIJA
Tel: +46 8 674 7240
Fakss: +46 8 674 7636
Federal Environmental Agency (UBA)
FG III 3.4
Schichauweg 58
12307 Berlin
Vācija
e-pasts: Lemna@uba.de
http://www.umweltbundesamt.de/contact.htm
Literatūra
1) Hillman, W.S. (1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221–287.
2) Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanischen Inst. ETH, Stiftung Rubel, Zürich, Switzerland.
3) Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82–991150–0–0. The Agricultural Research Council of Norway, University of Oslo.
4) Wang, W. (1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1–14.
5) Wang, W. (1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7–22.
2. papildinājums
Pamatkultūras uzturēšana
Pamatkultūras pazeminātā temperatūrā (4–10 °C) var uzturēt, ilgāku laiku neatjaunojot. Lemna kultivēšanai var izmantot to pašu barotni, ko lieto testēšanai, bet pamatkultūrai var lietot citu ar barības vielām bagātu barotni.
Periodiski vairākus jaunus, gaiši zaļas krāsas augus aseptiski pārnes kultivēšanas traukos ar svaigu barotni. Uzglabājot kultūru šeit ieteiktajā temperatūras režīmā, pārsēšanas intervāls var būt līdz trim nedēļām.
Jālieto ķīmiski tīri (mazgāti ar skābi) un sterili stikla kultivēšanas trauki, un manipulācijas jāveic aseptiski. Pamatkultūras kontaminācijas gadījumā, piemēram, ar aļģēm vai sēnēm, jāveic pasākumi kontaminējošo organismu likvidēšanā. Aļģes un vairākus citus kontaminējošos organismus iespējams likvidēt, sterilizējot virsmu. Ņem kontaminētā augu materiāla paraugu un nogriež saknītes. Materiālu enerģiski krata tīrā ūdenī, pēc tam iegremdē 0,5 % (tilp. %) nātrija hipohlorīta šķīdumā uz laiku no 30 sekundēm līdz 5 minūtēm. Augu materiālu pēc tam skalo ar sterilu ūdeni un vairākās porcijās pārvieto kultivēšanas traukos ar svaigu barotni. Daudzas plātnītes šīs apstrādes rezultātā iet bojā, it īpaši, ja iedarbības periods ir ilgāks; izdzīvojušie eksemplāri parasti ir attīrīti no kontaminācijas. Tos var izmantot pārsēšanai jaunā kultūrā.
3. papildinājums
Barotnes
L. minor un L. gibba kultivēšanai ieteicamas dažādas barotnes. L. minor kultivēšanai ieteicama modificēta Zviedrijas standartos (SIS) minētā barotne, bet L. gibba ieteicama 20X AAP barotne. Abu barotņu sastāvs norādīts turpmāk. Gatavojot šīs barotnes, jālieto ķīmiski tīras vai analītiski tīras vielas un dejonizēts ūdens.
Zviedrijas standarta (Swedish Standard, SIS) Lemna barotne
— Pamatšķīdumus I–V sterilizē autoklāvā (120 °C, 15 min) vai ar mebrānfiltrāciju (poru izmērs aptuveni 0,2 μm).
— Pamatšķīdumu VI (vai VII) sterilizē tikai ar mebrānfiltrāciju; tos nedrīkst sterilizēt autoklāvā.
— Sterilie pamatšķīdumi jāuzglabā vēsā un tumšā vietā. Pamatšķīdumi I–V derīgi sešus mēnešus, bet pamatšķīdumam VI (vai VII) derīguma termiņš ir viens mēnesis.
—
|
Pamatšķīdums Nr. |
Viela |
Koncentrācija pamatšķīdumā (g/l) |
Koncentrācija gatavajā šķīdumā(mg/l) |
Gatavais šķīdums |
|
|
Elements |
Koncentrācija (mg/l) |
||||
|
I |
NaNO3 KH2PO4 |
8,50 1,34 |
85 13,4 |
Na; N K; P |
32; 14 6,0; 2,4 |
|
II |
MgSO4 · 7H2O |
15 |
75 |
Mg; S |
7,4; 9,8 |
|
III |
CaCl2 · 2H2O |
7,2 |
36 |
Ca; Cl |
9,8; 17,5 |
|
IV |
Na2CO3 |
4,0 |
20 |
C |
2,3 |
|
V |
H3BO3 MnCl2 · 4H2O Na2MoO4 · 2H2O ZnSO4·7H2O CuSO4·5H2O Co(NO3)2·6H2O |
1,0 0,20 0,010 0,050 0,0050 0,010 |
1,00 0,20 0,010 0,050 0,0050 0,010 |
B Mn Mo Zn Cu Co |
0,17 0,056 0,0040 0,011 0,0013 0,0020 |
|
VI |
FeCl3·6H2O Na2-EDTA·2H2O |
0,17 0,28 |
0,84 1,4 |
Fe — |
0,17 — |
|
VII |
MOPS (buferšķīdums) |
490 |
490 |
— |
— |
— Lai pagatavotu vienu litru SIS barotnes, 900 ml dejonizēta ūdens pievieno pamatšķīdumus:
—— 10 ml pamatšķīduma I
— 5 ml pamatšķīduma II
— 5 ml pamatšķīduma III
— 5 ml pamatšķīduma IV
— 1 ml pamatšķīduma V
— 5 ml pamatšķīduma VI
— 1 ml pamatšķīdumaVII (pēc vajadzības)
—
Piezīme: papildu pamatšķīdums VII (MOPS buferšķīdums) var būt vajadzīgs dažām testa vielām (sk. 1.4. iedaļas pēdējo rindkopu).
— Noregulē pH 6,5 ± 0,2 ar 0,1 M vai 1 M HCl vai NaOH šķīdumu, tilpumu uzpilda līdz vienam litram ar dejonizētu ūdeni.
20X AAP barotne
Pamatšķīdumus gatavo sterilā destilētā vai dejonizētā ūdenī.
Sterilie pamatšķīdumi jāglabā tumšā vēsā vietā. Šādos apstākļos glabājot, pamatšķīdumu derīguma termiņš ir vismaz 6–8 nedēļas.
20X – AAP barotnei gatavo piecus barības vielu pamatšķīdumus (A1, A2, A3, B un C), izmantojot ķīmiski tīras vielas. Barotni pagatavo aptuveni 850 ml dejonizēta ūdens pievienojot 20 ml katra barības vielu pamatšķīduma. Noregulē pH 7,5 ± 0,1 ar 0,1 M vai 1 M HCl vai NaOH šķīdumu, un tilpumu uzpilda līdz vienam litram ar dejonizētu ūdeni. Barotni filtrē caur 0,2 μm (aptuveni) membrānfiltru sterilā traukā.
Lai stabilizētos testēšanai izmantojamās barotnes pH, to pagatavo 1–2 dienas pirms lietošanas. Barotnes pH pirms lietošanas jāpārbauda un, ja nepieciešams, noregulē ar 0,1 M vai 1 M HCl vai NaOH šķīdumu, kā minēts iepriekš.
|
Pamatšķīdums Nr. |
Viela |
Koncentrācija pamatšķīdumā (g/l) (1) |
Koncentrācija gatavā barotnē (mg/l) (1) |
Gatavā barotne |
|
|
Elements |
Koncentrācija (mg/l) (1) |
||||
|
A1 |
NaNO3 MgCl2·6H2O CaCl2·2H2O |
26 12 4,4 |
510 240 90 |
Na; N Mg Ca |
190; 84 58,08 24,04 |
|
A2 |
MgSO4·7H2O |
15 |
290 |
S |
38,22 |
|
A3 |
K2HPO4·3H2O |
1,4 |
30 |
K; P |
9,4; 3,7 |
|
B |
H3BO3 MnCl2·4H2O FeCl3·6H2O Na2EDTA·2H2O ZnCl2 CoCl2·6H2O Na2MoO4·2H2O CuCl2·2H2O |
0,19 0,42 0,16 0,30 3,3 mg·l–1 1,4 mg·l–1 7,3 mg·l–1 0,012 mg·l–1 |
3,7 8,3 3,2 6,0 66 μg·l–1 29 μg·l–1 145 μg·l–1 0,24 μg·l–1 |
B Mn Fe — Zn Co Mo Cu |
0,65 2,3 0,66 — 31 μg·l–1 7,1 μg·l–1 58 μg·l–1 0,080 μg·l–1 |
|
C |
NaHCO3 |
15 |
300 |
Na; C |
220; 43 |
|
(1) Ja nav norādīts citādi. |
|||||
Piezīme. Teorētiski atbilstošā bikarbonātu galīgā koncentrācija (kad iespējams iztikt bez vērā ņemamas pH līmeņa regulēšanas) ir 15 mg/l, nevis 300 mg/l. Tomēr vēsturiski, tajā skaitā starplaboratoriju salīdzinošajā testēšanā, 20X – AAP barotnē lietotā koncentrācija ir 300 mg/l (I. Sims, P. Whitehouse and R. Lacey. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency).
Steinberga barotne (ISO 20079)
Koncentrācijas un pamatšķīdumi
— Modificēto Steinberga barotni saskaņā ar ISO 20079 izmanto tikai Lemna minor kultivēšanai (tā kā pēc šīs metodes atļauta vienīgi Lemna minor), taču testos gūtā pieredze liecina, ka labi rezultāti sasniedzami arī ar Lemna gibba.
— Gatavojot šo barotni, jālieto ķīmiski tīras vai analītiski tīras vielas un dejonizēts ūdens.
— Barotni gatavo no pamatšķīdumiem vai no desmitkārtīgas koncentrācijas barotnes; tā ir barotnes maksimālā koncentrācija, kas iespējama bez vielu izgulsnēšanās.
1. tabula
Steinberga barotne ar stabilizētu pH (modificēta pēc Altenburgera)
|
Viela |
Barotne |
||
|
Makroelementi |
Molekulmasa |
mg/l |
mmol/l |
|
KNO3 |
101,12 |
350,00 |
3,46 |
|
Ca(NO3)2 · 4H2O |
236,15 |
295,00 |
1,25 |
|
KH2PO4 |
136,09 |
90,00 |
0,66 |
|
K2HPO4 |
174,18 |
12,60 |
0,072 |
|
MgSO4 · 7H2O |
246,37 |
100,00 |
0,41 |
|
Mikroelementi |
Molekulmasa |
μg/l |
μmol/l |
|
H3BO3 |
61,83 |
120,00 |
1,94 |
|
ZnSO4·7H2O |
287,43 |
180,00 |
0,63 |
|
Na2MoO4·2H2O |
241,92 |
44,00 |
0,18 |
|
MnCl2·4H2O |
197,84 |
180,00 |
0,91 |
|
FeCl3·6H2O |
270,21 |
760,00 |
2,81 |
|
EDTA-dinātrija dihidrāts |
372,24 |
1 500,00 |
4,03 |
2. tabula
Pamatšķīdumi (makroelementi)
|
1. Makroelementi (×50 koncentrēti) |
g/l |
|
1. pamatšķīdums: |
|
|
KNO3 |
17,50 |
|
KH2PO4 |
4,5 |
|
K2HPO4 |
0,63 |
|
2. pamatšķīdums: |
|
|
MgSO4 · 7H2O |
5,00 |
|
3. pamatšķīdums: |
|
|
Ca(NO3)2·4H2O |
14,75 |
3. tabula
Pamatšķīdumi (mikroelementi)
|
2. Mikroelementi (×1 000 koncentrēti) |
mg/l |
|
4. pamatšķīdums: |
|
|
H3BO3 |
120,0 |
|
5. pamatšķīdums: |
|
|
ZnSO4·7H2O |
180,0 |
|
6. pamatšķīdums: |
|
|
Na2MoO4·2H2O |
44,0 |
|
7. pamatšķīdums: |
|
|
MnCl2·4H2O |
180,0 |
|
8. pamatšķīdums: |
|
|
FeCl3·6H2O |
760,00 |
|
EDTA dinātrija dihidrāts |
1 500,00 |
— Vienā šķīdumā var apvienot 2. un 3. pamatšķīdumu, un atsevišķi 4. līdz 7. (ņemot vērā nepieciešamās koncentrācijas).
— Ilgākai glabāšanai pamatšķīdumus sterilizē autoklāvā pie 121 °C, 20 min, vai kā alternatīvu izmanto sterilo filtrēšanu (0,2 μm). Stingri jāievēro, ka 8. pamatšķīdumu sterilizē ar filtrēšanu (0,2 μm).
Modificētās Steinberga barotnes pagatavošana galīgajā koncentrācijā
— Aptuveni 900 ml dejonizēta ūdens pievieno pa 20 ml 1., 2. un 3.pamatšķīduma (sk. 2. tab.), lai nenotiktu izgulsnēšanās.
— Pievieno pa 1,0 ml 4., 5., 6. 7. un 8. pamatšķīduma (sk. 3. tab.).
— pH jābūt 5,5 ± 0,2 (noregulē, pievienojot pēc iespējas mazāku tilpumu NaOH šķīduma vai HCl).
— Uzpilda ar ūdeni līdz 1 000 ml.
— Ja pamatšķīdumus sterilizē un tiek lietots piemērots ūdens, gatavā barotne nav jāsterilizē. Ja barotni sterilizē tās galīgajā koncentrācijā, 8. pamatšķīdums jāpievieno pēc autoklavēšanas (121 °C, 20 min).
Koncentrētas (×10) modificētās Steinberga barotnes pagatavošana pagaidu uzglabāšanai
— Lai nenotiktu izgulsnēšanās, pie aptuveni 30 ml dejonizēta ūdens pievieno pa 20 ml 1., 2. un 3.pamatšķīduma (sk.2. tab.).
— Pievieno 1,0 ml 4., 5., 6. 7. un 8. pamatšķīduma (sk. 3.tab.). Uzpilda ar ūdeni līdz 100 ml.
— Ja pamatšķīdumus sterilizē un tiek lietots piemērots ūdens, gatavā barotne nav jāsterilizē. Ja barotni sterilizē tās galīgajā koncentrācijā, 8. pamatšķīdums jāpievieno pēc autoklavēšanas (121 °C, 20 min).
— Barotnes pH (galīgajā koncentrācijā) jābūt 5,5 ± 0,2.
( 1 ) OV L 396, 30.12.2006., 1. lpp. Labota ar OV L 136, 29.5.2007., 3. lpp.
( 2 ) OV 196, 16.8.1967., 1. lpp. Direktīvā jaunākie grozījumi izdarīti ar Eiropas Parlamenta un Padomes Direktīvu 2006/121/EK (OV L 396, 30.12.2006., 850. lpp., labota ar OV L 136, 29.5.2007., 281. lpp.) – jāpapildina ar attiecīgajām norādēm pēc 30. pielāgojumu publikācijas.
( 3 ) Piemēram, ANO transporta noteikumu satvarā.
( 4 ) Skābe pirms testēšanas jātitrē, lai apstiprinātu tās koncentrāciju.
( 5 ) Piemēram, literatūras sarakstā (1) izmantoti 50 masas % perhlorskābes un 40 masas % nātrija hlorāta šķīdumi.
( 6 ) Piemēram, Vatmaņa celulozes pulveris kolonnu hromatogrāfijai CF 11, kataloga Nr. 4021 050.
( 7 ) Apstiprina, piemēram, titrējot pēc Fišera metodes.
( 8 ) Šādu ūdens saturu var panākt arī, piemēram, 24 h karsējot 105 oC temperatūrā vakuumā.
( 9 ) Oksidētāju maisījumi ar celulozi jāuzskata par potenciāli sprādzienbīstamiem, un ar tiem jāstrādā, ievērojot attiecīgus piesardzības pasākumus.
( 10 ) Praktiski to var izdarīt, sagatavojot testējamā šķidruma 1:1 maisījumu ar celulozi lielākā daudzumā, nekā izmēģinājumiem vajadzīgs, un pārnesot 5 ± 0,1 g spiedtvertnē. Katram izmēģinājumam jāsagatavo jauns maisījums.
( 11 ) Jo īpaši nedrīkst saskarties spirāles blakus vijumi.
( 12 ) Izmantojot vairākas standartvielas, par rezultātu interpretāciju saskaņā ar ANO transporta noteikumiem skatīt izmantotās literatūras sarakstā (1).
( 13 ) Šī palielinājuma vērtība norādīta 3 μm šķiedrām, 6 μm šķiedrām būtu piemērotāks × 5 000 palielinājums.
( 14 ) Attiecībā uz 3 μm šķiedrām, skatīt iepriekšējo piezīmi.
( 15 ) Jānorāda radzenes duļķošanās platība.
( 16 ) Vairākiem mērījumiem serumā un plazmā, jo īpaši glikozes mērījumiem, vēlams nedot barību uz nakti. Galvenais iemesls, kādēļ tas ir vēlams, ir palielināta izkliede, ko neizbēgami rada barības došana un kas tiecas maskēt smalkākās ietekmes un padara grūtāku interpretāciju. No otras puses, barības nedošana uz nakti tomēr var traucēt dzīvnieku vispārējo metabolismu un jo īpaši barošanas pētījumos var traucēt pakļaušanu testa vielas ikdienas iedarbībai. Ja ir pieņemta barības nedošana uz nakti, klīniski bioloģiskās noteikšanas jāizdara pēc funkcionālo novērojumu veikšanas pētījuma ceturtajā nedēļā.
( 17 ) Dažiem mērījumiem serumā un plazmā, jo īpaši glikozes mērījumiem, ir vēlams dzīvniekiem pirms asins ņemšanas uz nakti nedot barību. Tas ir vēlams galvenokārt tāpēc, ka barības uzņemšana neizbēgami izraisītu palielinātu datu izkliedi, kam būtu tendence maskēt smalkas ietekmes un kas padarītu interpretāciju grūtu. No otras puses, barības nedošana uz nakti var traucēt dzīvnieku vispārējo vielmaiņu un – jo īpaši barošanas pētījumos – var izjaukt testa vielas ikdienas iedarbību. Ja ir pieņemta barības nedošana uz nakti, klīniskie bioķīmiskie mērījumi jāveic pēc pētījuma funkcionālo novērojumu izdarīšanas.
( 18 ) Pašreizējais nosaukums – seruma alanīnaminotransferāze.
( 19 ) Pašreizējais nosaukums – seruma aspartāmaminotransferāze.
( 20 ) Šie orgāni, kas iegūti no 10 katra dzimuma grauzējiem katrā grupā (ja tie ir grauzēji), kā arī vairogdziedzeris (kopā ar epitēlijķermenīšiem), kas izņemts visiem dzīvniekiem (ja tie nav grauzēji), ir jānosver.
( 21 ) Šie orgāni, kas iegūti no 10 katra dzimuma grauzējiem visās grupās, ir jānosver.
( 22 ) Etalongrupa ir dzīvnieku grupa, kam pārbaudāmo vielu ievada citādā veidā, kas nodrošina devas pilnīgu bioloģisko pieejamību.
( 23 ) OV L 225, 21.8.2001., 1. lpp.
( 24 ) Norādītie izmēri attiecas uz radzenes turētāju, kas paredzēts 12 līdz 60 mēnešus vecu govju acīm. Ja izmanto 6 līdz 12 mēnešus vecu dzīvnieku acis, abu turētāja kameru tilpumam jābūt 4 mL, bet abu iekšējo kameru diametram 1,5 cm un augstumam 2,2 cm. Katra jaunas konstrukcijas radzenes turētāja gadījumā ir ļoti svarīgi, lai iedarbībai pakļautā radzenes virsmas laukuma attiecība pret aizmugurējās kameras tilpumu būtu tāda pati kā standarta radzenes turētājam. Šī prasība ir vajadzīga, lai pareizi noteiktu caurlaidības vērtības IVIS aprēķināšanai saskaņā ar norādīto formulu.
( 25 ) Saskaņā ar šo starplaboratoriju salīdzināšanas testu rezultātiem un standarta ISO 6341 Tehnisko labojumu, kālija bihromātam (K2Cr2O7) noteiktā EC50 vērtība pēc 24 stundām ir no 0,6 mg/l līdz 1,7 mg/l.
( 26 ) Lai novērstu dzīvsudraba izplūdes vidē, šķīdumus, kuri satur dzīvsudraba sāļus, pēc lietošanas attīra.
( 27 ) Šajās tabulās minētie pH lielumi ir aprēķināti no iespējamo vērtību mērījumiem, izmantojot Sērensena standarta vienādojumu (1909). Atbilstošās pH vērtības ir par 0,04 vienībām augstākas par tabulā norādītajām vērtībām.
( 28 ) Meyer, A., Bierman, C. H. and Orti, G. (1993). The phylogenetic position of the zebrafish (Danio rerio), a model system in developmental biology: an invitation to the comparative method. Proc. R. Soc. Lond. B. 252, pp. 231–236.
( 29 ) OECD, Paris (1992). Test Guideline 210, “Fish, Early-life Stage Toxicity Test”.
( 30 )
![]()
( 31 ) Lai noteiktu līdzsvara plato, var izmantot arī grafiku, kas attēlo testa vielas koncentrācijas ūdens fāzē
![]()
( 32 ) DT50: laiks, kurā noārdās 50 % no testa vielas.
( 33 ) Sākotnējo koncentrāciju, pamatojoties uz platību, aprēķina, izmantojot šādu vienādojumu:

|
Csoil |
= |
sākotnējā koncentrācija augsnē, |
|
A |
= |
lietojuma deva [kg· ha-1]; 1 = augsnes slāņa biezums laukā [m]; d = sausais augsnes bēruma blīvums [kg· m-3]. |
Aptuveni rēķinot, lietojuma deva 1 kg· ha-1 dod augsnes koncentrāciju aptuveni 1 mg· kg-1 10 cm biezā slānī (pieņemot, ka bēruma blīvums ir 1 g· cm-3).
( 34 ) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
( 35 ) Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, p. 123–157.
( 36 ) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol. 1, p. 85–114.
( 37 ) Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, p. 141–146.
( 38 ) Tests ar otru koncentrāciju var būt noderīgs attiecībā uz ķīmiskajām vielām, kas sasniedz ūdens virsmu dažādos veidos, kādēļ rodas ievērojami atšķirīgas koncentrācijas, ciktāl mazāko koncentrāciju var analizēt ar pietiekamu precizitāti.
( 39 ) Ja viegli var notikt anaerobās transformācijas produktu ātra reoksidācija, anaerobi apstākļi ir jāsaglabā paraugu ņemšanas un analīzes laikā.