ISSN 1977-0707
Gazzetta ufficiale
dell'Unione europea
L 128

Edizione in lingua italiana
Legislazione
60° anno
19 maggio 2017
|
ISSN 1977-0707 |
||
|
Gazzetta ufficiale dell'Unione europea |
L 128 |
|

|
||
|
Edizione in lingua italiana |
Legislazione |
60° anno |
|
|
|
|
|
(1) Testo rilevante ai fini del SEE. |
|
IT |
Gli atti i cui titoli sono stampati in caratteri chiari appartengono alla gestione corrente. Essi sono adottati nel quadro della politica agricola ed hanno generalmente una durata di validità limitata. I titoli degli altri atti sono stampati in grassetto e preceduti da un asterisco. |
II Atti non legislativi
ACCORDI INTERNAZIONALI
|
19.5.2017 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 128/1 |
ACCORDO
a norma del regolamento (UE) 2015/1017 del Parlamento europeo e del Consiglio, del 25 giugno 2015, relativo al Fondo europeo per gli investimenti strategici, al polo europeo di consulenza sugli investimenti e al portale dei progetti di investimento europei e che modifica i regolamenti (UE) n. 1291/2013 e (UE) n. 1316/2013 — il Fondo europeo per gli investimenti strategici
IL PARLAMENTO EUROPEO E LA BANCA EUROPEA PER GLI INVESTIMENTI (le «Parti»),
|
— |
visto il trattato sull'Unione europea, in particolare l'articolo 14, |
|
— |
visto il trattato sul funzionamento dell'Unione europea, e in particolare gli articoli 15, 16, 232, 308, 309 e 339, |
|
— |
visto lo statuto della Banca europea per gli investimenti (BEI), e in particolare l'articolo 11, paragrafo 7, e gli articoli 16 e 18, |
|
— |
visto il regolamento (UE) 2015/1017 del Parlamento europeo e del Consiglio, del 25 giugno 2015, relativo al Fondo europeo per gli investimenti strategici, al polo europeo di consulenza sugli investimenti e al portale dei progetti di investimento europei e che modifica i regolamenti (UE) n. 1291/2013 e (UE) n. 1316/2013 — il Fondo europeo per gli investimenti strategici (1) (il «regolamento FEIS»), e in particolare l'articolo 17, paragrafo 5, |
|
— |
visto il regolamento (CE) n. 45/2001 del Parlamento europeo e del Consiglio, del 18 dicembre 2000, concernente la tutela delle persone fisiche in relazione al trattamento dei dati personali da parte delle istituzioni e degli organismi comunitari, nonché la libera circolazione di tali dati (2), |
|
— |
visto il regolamento (CE) n. 1049/2001 del Parlamento europeo e del Consiglio, del 30 maggio 2001, relativo all'accesso del pubblico ai documenti del Parlamento europeo, del Consiglio e della Commissione (3), |
|
A. |
considerando che il regolamento FEIS istituisce il Fondo europeo per gli investimenti strategici (FEIS), una garanzia dell'Unione, un fondo di garanzia dell'Unione, un polo europeo di consulenza sugli investimenti (PECI) e un portale dei progetti di investimento europei; |
|
B. |
considerando che, mettendo capacità di rischio a disposizione della BEI, il FEIS intende sostenere nell'Unione:
|
|
C. |
considerando che il regolamento FEIS prevede che il FEIS sia istituito quale meccanismo distinto, chiaramente identificabile e trasparente gestito dalla BEI, le cui operazioni dovrebbero essere chiaramente distinte dalle altre operazioni della BEI; |
|
D. |
considerando che, ai fini dell'assolvimento dell'obbligo di rendiconto nei confronti dei cittadini europei, la BEI dovrebbe riferire periodicamente al Parlamento europeo e al Consiglio circa l'evoluzione del FEIS, gli effetti da esso prodotti e le operazioni condotte nel suo ambito, in particolare per quanto riguarda l'addizionalità delle operazioni realizzate a titolo del FEIS rispetto alle operazioni ordinarie della BEI, comprese le attività speciali, e che a tale fine dovrebbero essere adottate disposizioni adeguate; |
|
E. |
considerando che, in conformità dell'articolo 17, paragrafo 5, del regolamento FEIS, il Parlamento europeo e la BEI devono concludere un accordo sulle modalità dettagliate dello scambio di informazioni tra il Parlamento europeo e la BEI a norma del regolamento FEIS, compresa la procedura di selezione del direttore generale e del vicedirettore generale del FEIS; |
|
F. |
considerando che l'articolo 7, paragrafo 6, del regolamento FEIS prevede che, a seguito di una procedura di selezione aperta e trasparente conforme alle procedure della BEI, il comitato direttivo debba selezionare un candidato per la posizione di direttore generale e un candidato per la posizione di vicedirettore generale e stabilisce che il Parlamento europeo e il Consiglio debbano essere debitamente informati, in maniera tempestiva, in tutte le fasi della procedura di selezione, nel rispetto di rigorosi obblighi di riservatezza. A seguito dell'audizione del candidato selezionato per ciascuna posizione e una volta ottenuta l'approvazione del Parlamento europeo, il presidente della BEI deve nominare il direttore generale e il vicedirettore generale per un mandato di tre anni rinnovabile una sola volta; |
|
G. |
considerando che l'articolo 16, paragrafo 2, del regolamento FEIS prevede che la BEI, se del caso in cooperazione con il Fondo europeo per gli investimenti (FEI), debba presentare al Parlamento europeo e al Consiglio una relazione annuale sulle sue operazioni di finanziamento e di investimento disciplinate dal regolamento FEIS. Tale relazione annuale, che deve contenere informazioni operative e finanziarie come ulteriormente specificato all'articolo 16, paragrafo 2, del regolamento FEIS, deve essere resa pubblica; |
|
H. |
considerando che l'articolo 17, paragrafo 1, del regolamento FEIS prevede che, su richiesta del Parlamento europeo o del Consiglio, il presidente del comitato direttivo e il direttore generale devono riferire sulle prestazioni del FEIS all'istituzione richiedente, anche partecipando a un'audizione dinanzi al Parlamento europeo; |
|
I. |
considerando che l'articolo 17, paragrafo 2, del regolamento FEIS dispone altresì che il presidente del comitato direttivo e il direttore generale debbano rispondere oralmente o per iscritto alle interrogazioni rivolte al FEIS dal Parlamento europeo o dal Consiglio entro cinque settimane dalla data di ricevimento dell'interrogazione; |
|
J. |
considerando che l'articolo 17, paragrafo 4, del regolamento FEIS prevede che, su richiesta del Parlamento europeo, il presidente della BEI debba partecipare a un'audizione del Parlamento europeo dedicata alle operazioni di finanziamento e di investimento della BEI disciplinate dal regolamento FEIS. Il presidente della BEI deve rispondere oralmente o per iscritto, entro cinque settimane dalla data del loro ricevimento, alle interrogazioni rivolte alla BEI dal Parlamento europeo o dal Consiglio riguardanti le operazioni di finanziamento e di investimento della BEI disciplinate dal regolamento FEIS; |
|
K. |
considerando che l'articolo 18, paragrafo 1, del regolamento FEIS stabilisce che la BEI debba valutare il funzionamento del FEIS entro il 5 gennaio 2017; che la BEI debba trasmettere la sua valutazione al Parlamento europeo, al Consiglio e alla Commissione; |
|
L. |
considerando che il presente accordo non pregiudica l'accordo tripartito tra la Commissione europea, la Corte dei conti europea e la Banca europea per gli investimenti del 27 ottobre 2003; |
CONVENGONO QUANTO SEGUE:
Articolo 1
Scopo e ambito di applicazione
Il presente accordo definisce le modalità dettagliate dello scambio di informazioni tra il Parlamento europeo e la BEI a norma del regolamento FEIS, inclusa la procedura di selezione del direttore generale e del vice direttore generale.
SEZIONE I
ACCESSO ALL'INFORMAZIONE
Articolo 2
Relazioni periodiche
2.1. In conformità dell'articolo 14, paragrafo 9, del regolamento FEIS, la BEI presenta al Parlamento europeo, al Consiglio e alla Commissione una relazione annuale sui servizi forniti dal PECI e sull'esecuzione del suo bilancio, incluse informazioni sui diritti riscossi e sul loro utilizzo (la «relazione sul PECI»).
La BEI prepara la relazione sul PECI facendo riferimento al periodo che termina il 31 dicembre di ogni anno e la presenta entro il 1o settembre dell'anno successivo.
2.2. In conformità dell'articolo 16, paragrafo 2, del regolamento FEIS, la BEI, se del caso in cooperazione con il FEI, presenta al Parlamento europeo e al Consiglio una relazione annuale sulle operazioni di finanziamento e di investimento della BEI disciplinate dal regolamento FEIS (la «relazione sul FEIS»). La relazione sul FEIS include:
|
a) |
una valutazione delle operazioni di finanziamento e di investimento della BEI a livello di operazione, settore, paese e regione, con esame della relativa conformità al regolamento FEIS, in particolare con il criterio di assicurare addizionalità, unitamente alla valutazione della ripartizione delle operazioni di finanziamento e di investimento della BEI tra gli obiettivi generali del FEIS; |
|
b) |
una valutazione, in termini aggregati, del valore aggiunto, della mobilitazione di risorse del settore privato, dei risultati stimati ed effettivi e delle realizzazioni e dei risultati e degli impatti delle operazioni di finanziamento e di investimento della BEI, incluso l'impatto sulla creazione di posti di lavoro; |
|
c) |
una valutazione della misura in cui le operazioni disciplinate dal regolamento FEIS contribuiscono al conseguimento degli obiettivi generali del FEIS, inclusa una valutazione del livello degli investimenti FEIS nei settori della ricerca, dello sviluppo e dell'innovazione, dei trasporti (tra cui RTE-T e mobilità urbana), delle telecomunicazioni, dell'infrastruttura energetica e dell'efficienza energetica; |
|
d) |
una valutazione del rispetto delle condizioni per l'impiego della garanzia dell'Unione e degli indicatori fondamentali di rendimento; |
|
e) |
una valutazione dell'effetto leva ottenuto mediante i progetti sostenuti dal FEIS; |
|
f) |
una descrizione dei progetti per i quali il sostegno dei fondi strutturali e di investimento europei si combina con il sostegno del FEIS e l'importo totale dei contributi provenienti da ciascuna fonte; |
|
g) |
l'importo finanziario trasferito ai beneficiari e una valutazione, in termini aggregati, delle operazioni di finanziamento e di investimento della BEI; |
|
h) |
una valutazione del valore aggiunto delle operazioni di finanziamento e di investimento della BEI e del rischio aggregato associato a dette operazioni; |
|
i) |
informazioni particolareggiate sulle attivazioni della garanzia dell'Unione, sulle perdite, sui rendimenti, sugli importi recuperati e su eventuali altri pagamenti ricevuti; |
|
j) |
le relazioni finanziarie sulle operazioni finanziarie e di investimento realizzate dalla BEI disciplinate dal regolamento FEIS sottoposte a revisione contabile da parte di un revisore esterno indipendente. |
La BEI prepara la relazione sul FEIS facendo riferimento al periodo che termina il 31 dicembre di ogni anno e la presenta entro il 31 maggio dell'anno successivo. Fatte salve le disposizioni del primo comma, la BEI trasmette al Parlamento europeo i dati grezzi nello stesso formato ed entro il medesimo termine (ossia non oltre il 31 marzo dell'anno in cui deve essere presentata la corrispondente relazione sul FEIS) in cui sono trasmessi alla Commissione.
2.3. La lingua della relazione sul PECI e della relazione sul FEIS è l'inglese.
Articolo 3
Relazioni di valutazione del FEIS
3.1. In conformità dell'articolo 18, paragrafo 1, del regolamento FEIS, entro il 5 gennaio 2017 la BEI valuta il funzionamento del FEIS e trasmette la sua valutazione al Parlamento europeo.
3.2. In conformità dell'articolo 18, paragrafo 3, del regolamento FEIS, entro il 30 giugno 2018, e successivamente con cadenza triennale, la BEI pubblica una relazione completa sul funzionamento del FEIS che comprende una valutazione dell'impatto del FEIS sugli investimenti nell'Unione, sulla creazione di occupazione e sull'accesso ai finanziamenti per le PMI e per le imprese a media capitalizzazione.
3.3. In conformità dell'articolo 18, paragrafo 5, del regolamento FEIS, la BEI trasmette in tempo utile al Parlamento europeo, e si assicura che il FEI faccia altrettanto, le sue relazioni di valutazione indipendenti, vertenti sull'impatto e sui risultati pratici delle rispettive attività specifiche della BEI e del FEI condotte a norma del regolamento FEIS.
Spetta interamente alla BEI o al FEI, a seconda dei casi, valutare la necessità di procedere a tali valutazioni indipendenti, in aggiunta a quelle di cui all'articolo 3, paragrafi 1 e 2, e decidere i tempi di tali suddette valutazioni indipendenti.
3.4. Le relazioni di valutazione di cui al presente articolo sono trasmesse senza indugio al Parlamento europeo non appena approvate dalla BEI o dal FEI, a seconda dei casi.
3.5. La lingua delle relazioni di valutazione di cui al presente articolo è l'inglese.
Articolo 4
Informazioni sulle modifiche dell'accordo FEIS
In conformità dell'articolo 4, paragrafo 2, lettera i), del regolamento FEIS, l'accordo concluso tra la Commissione e la BEI per la gestione del FEIS e la concessione della garanzia dell'Unione («l'accordo FEIS») include l'obbligo per tali parti di riferire al Parlamento europeo in merito alle modifiche all'accordo FEIS.
Articolo 5
Decisioni del comitato per gli investimenti
5.1. In conformità dell'articolo 7, paragrafo 12, terzo comma, del regolamento FEIS, la BEI trasmette al Parlamento europeo l'elenco di tutte le decisioni del comitato per gli investimenti con le quali viene negato l'impiego della garanzia dell'Unione.
5.2. La BEI trasmette due volte l'anno al Parlamento europeo, rispettivamente entro il 31 marzo ed entro il 30 settembre, l'elenco di cui all'articolo 5, paragrafo 1.
5.3. Le informazioni fornite dalla BEI al Parlamento europeo a norma dell'articolo 5, paragrafo 1, sono soggette a rigorosi obblighi di riservatezza e sono trattate dal Parlamento europeo conformemente al disposto dell'articolo 10.
5.4. Fatto salvo il paragrafo 3 del presente articolo, la BEI trasmette al Parlamento europeo tutte le decisioni del comitato per gli investimenti del FEIS sull'impiego della garanzia non appena esse sono disponibili. Ove del caso, la BEI include nell'elenco delle decisioni che autorizzano l'impiego della garanzia dell'Unione informazioni sulle operazioni, in particolare la loro descrizione, l'indicazione del promotore o dell'intermediario finanziario e gli obiettivi del progetto sostenuto dalla BEI nel quadro del FEIS. Nel caso di decisioni sensibili sul piano commerciale, la BEI trasmette le decisioni stesse e le informazioni concernenti i promotori o gli intermediari finanziari alla data in cui si conclude il finanziamento o a qualsiasi data anteriore in cui venga meno il loro carattere sensibile sul piano commerciale.
5.5. In conformità dell'articolo 7, paragrafo 12, secondo comma, del regolamento FEIS, le decisioni del comitato per gli investimenti del FEIS che autorizzano l'impiego della garanzia dell'Unione sono pubbliche e accessibili.
Articolo 6
Modifiche ai limiti di concentrazione settoriale o geografica del portafoglio del FEIS
6.1. In conformità dell'allegato II, punto 8, al regolamento FEIS, se il comitato direttivo del FEIS decide di modificare i limiti indicativi di concentrazione settoriale o geografica stabiliti per il portafoglio del FEIS, illustra la propria decisione in merito al Parlamento europeo.
6.2. In conformità dell'articolo 7, paragrafo 3, secondo comma, del regolamento FEIS, i processi verbali delle riunioni del comitato direttivo sono pubblicati non appena approvati da quest'ultimo. Tali processi verbali, insieme alla motivazione scritta del comitato direttivo in merito alle eventuali modifiche di cui all'articolo 6, paragrafo 1, sono trasmessi al Parlamento europeo non appena disponibili e in ogni caso al più tardi contestualmente alla pubblicazione dei processi verbali.
SEZIONE II
INFORMAZIONE AD HOC E RISPOSTE A INTERROGAZIONI
Articolo 7
Informazione ad hoc, audizioni e altre riunioni
7.1. In conformità dell'articolo 17, paragrafo 4, del regolamento FEIS, su richiesta delle commissioni competenti del Parlamento europeo, il presidente della BEI partecipa ad almeno un'audizione dinanzi al Parlamento europeo dedicata a questioni relative alle operazioni di finanziamento e di investimento della BEI disciplinate dal regolamento FEIS. Le commissioni competenti del Parlamento europeo e la BEI stabiliscono di comune accordo la data di tale audizione da tenersi nel corso dell'anno successivo.
7.2. A seguito di interrogazioni rivolte dal Parlamento europeo alla BEI su questioni relative alle operazioni di finanziamento e di investimento della BEI disciplinate dal regolamento FEIS, le commissioni competenti del Parlamento europeo possono invitare il presidente della BEI ad ulteriori riunioni ad hoc su tali questioni.
Le commissioni competenti del Parlamento europeo e la BEI si accordano sulla data di tali riunioni ad hoc, che dovranno tenersi non appena possibile e comunque entro cinque settimane dalla data della richiesta delle commissioni competenti del Parlamento europeo.
Conformemente alle pertinenti disposizioni del regolamento del Parlamento europeo, tali audizioni e riunioni ad hoc possono essere riservate.
7.3. Su richiesta del presidente della BEI o del presidente della commissione competente del Parlamento europeo, e di comune accordo, il personale dirigente della BEI o del FEI può partecipare alle audizioni e alle riunioni ad hoc, incluse le riunioni riservate di cui ai paragrafi 1 e 2 del presente articolo.
7.4. Su richiesta del presidente della commissione competente del Parlamento europeo, a seguito di interrogazioni rivolte dal Parlamento europeo su questioni relative alle operazioni di finanziamento e di investimento della BEI disciplinate dal regolamento FEIS, le commissioni competenti del Parlamento europeo possono invitare il personale dirigente della BEI a scambi di opinioni ad hoc su tali questioni, a una data stabilita di comune accordo.
Conformemente alle pertinenti disposizioni del regolamento del Parlamento europeo, tali scambi di opinioni ad hoc possono essere riservati.
7.5. In conformità dell'articolo 17, paragrafo 1, del regolamento FEIS, su richiesta delle commissioni competenti del Parlamento europeo, il direttore generale del FEIS riferisce sulle prestazioni del FEIS, anche partecipando ad audizioni dinanzi al Parlamento europeo.
Le commissioni competenti del Parlamento europeo e il direttore generale del FEIS si accordano sulla data di tali audizioni, che dovranno tenersi non appena possibile e comunque entro cinque settimane dalla data della richiesta delle commissioni competenti del Parlamento europeo.
Tale resoconto al Parlamento europeo da parte del direttore generale del FEIS sulla prestazioni del FEIS può assumere la forma di riunioni ad hoc con le commissioni competenti del Parlamento europeo, da organizzarsi su richiesta di tali commissioni competenti a una data stabilita di comune accordo.
Conformemente alle pertinenti disposizioni del regolamento del Parlamento europeo, tali audizioni e riunioni ad hoc possono essere riservate.
7.6. Su richiesta motivata del direttore generale del FEIS o del presidente della commissione competente del Parlamento europeo, e di comune accordo, il personale dirigente della BEI e del FEI può partecipare alle audizioni e alle riunioni ad hoc, incluse le riunioni riservate, di cui all'articolo 7, paragrafo 5.
Articolo 8
Risposta alle interrogazioni
8.1. In conformità dell'articolo 17, paragrafo 4, del regolamento FEIS, su richiesta delle commissioni competenti del Parlamento europeo, il presidente della BEI risponde oralmente o per iscritto alle interrogazioni rivolte alla BEI dal Parlamento europeo riguardanti le operazioni di finanziamento e di investimento della BEI disciplinate dal regolamento FEIS.
8.2. In conformità dell'articolo 17, paragrafo 2, del regolamento FEIS, il direttore generale del FEIS risponde oralmente o per iscritto alle interrogazioni rivolte al FEIS dal Parlamento europeo.
8.3. Il Parlamento europeo può formulare tutte le interrogazioni al presidente della BEI a norma del paragrafo 1 del presente articolo attraverso il presidente della commissione competente del Parlamento europeo. Il Parlamento europeo può formulare tutte le interrogazioni al direttore generale del FEIS a norma del paragrafo 2 del presente articolo attraverso il presidente della commissione competente del Parlamento europeo e la segreteria del FEIS.
8.4. A tutte le interrogazioni rivolte dal Parlamento europeo al presidente della BEI a norma del paragrafo 1 del presente articolo, o al direttore generale del FEIS a norma del paragrafo 2 del presente articolo, è data risposta il più rapidamente possibile e comunque entro cinque settimane dalla data del ricevimento dell'interrogazione.
Le risposte orali alle interrogazioni rivolte dal Parlamento europeo al presidente della BEI a norma del paragrafo 1 del presente articolo, o al direttore generale del FEIS a norma del paragrafo 2 del presente articolo, possono assumere la forma di riunioni ad hoc, come previsto, rispettivamente, dall'articolo 7, paragrafo 2, e dall'articolo 7, paragrafo 5, terzo comma.
SEZIONE III
PROCEDURE DI SELEZIONE
Articolo 9
Procedura di selezione del direttore generale e del vicedirettore generale
9.1. La BEI stabilisce i criteri di selezione del direttore generale e del vicedirettore generale del FEIS in conformità del regolamento FEIS, compreso l'equilibrio necessario tra competenze, conoscenze ed esperienza, cercando di promuovere gli standard più elevati e garantire la diversità, inclusa quella di genere.
9.2. La BEI informa le commissioni pertinenti del Parlamento europeo di un posto vacante due settimane prima della pubblicazione del relativo posto vacante, fornendo i dettagli della procedura di selezione aperta che la BEI seguirà.
9.3. La BEI informa le commissioni pertinenti del Parlamento europeo in merito alla composizione del gruppo di candidati (numero di candidature, combinazione di capacità professionali, equilibrio di genere e nazionalità), nonché al metodo utilizzato per valutare i candidati al fine di stilare un elenco ristretto di almeno due candidati potenziali proposti dalla BEI al comitato direttivo.
9.4. La BEI trasmette alle commissioni competenti del Parlamento europeo l'elenco ristretto dei candidati selezionati. La BEI fornisce tale elenco almeno tre settimane prima della selezione del candidato finale da parte del comitato direttivo.
9.5. Le commissioni competenti del Parlamento europeo possono presentare interrogazioni concernenti i criteri di selezione o l'elenco ristretto, o entrambi, entro una settimana dal ricevimento dell'elenco ristretto dei candidati. La BEI risponde per iscritto entro due settimane.
9.6. La procedura di approvazione comprende le fasi seguenti:
|
a) |
la BEI comunica al Parlamento europeo le proposte di nomina per l'incarico di direttore generale e vice direttore generale, corredate di un'esposizione scritta dei motivi alla base di tale selezione; |
|
b) |
il Parlamento europeo organizza quanto prima, e al massimo entro quattro settimane, l'audizione del candidato a ciascuna posizione; |
|
c) |
il Parlamento europeo decide in merito all'approvazione della nomina delle proposte mediante una votazione in seno ad ogni commissione pertinente su un progetto di risoluzione, seguita da una votazione di approvazione o reiezione di tale risoluzione, da tenersi entro sei settimane dalle proposte. |
9.7. In seguito all'approvazione del Parlamento europeo, il presidente della BEI nomina il direttore generale e il vicedirettore generale conformemente alle disposizioni del regolamento FEIS.
9.8. Se il Parlamento europeo non approva la proposta della BEI, la BEI può attingere dall'elenco di candidati esistenti o ripetere la procedura di selezione.
9.9. La BEI comunica senza indebito ritardo al Parlamento europeo qualsiasi dimissione, revoca, sostituzione temporanea o posto vacante all'interno della struttura di governance del FEIS.
SEZIONE IV
DISPOSIZIONI GENERALI
Articolo 10
Riservatezza
10.1. Tenuto conto del fatto che alcune delle informazioni scambiate nel contesto del presente accordo possono essere riservate o sensibili sotto il profilo commerciale, le parti s'impegnano a evitare la comunicazione, senza il previo consenso scritto dell'altra parte, di qualsiasi informazione riservata da loro ricevuta in tale contesto.
Detto impegno lascia tuttavia impregiudicate le comunicazioni di informazioni stabilite per legge, regolamento, trattato o per ordine di un tribunale competente a statuire in materia e non pregiudica le pertinenti disposizioni del regolamento FEIS in materia di trasparenza e di pubblicazione delle informazioni.
Ai fini del presente accordo, per «informazioni riservate» si intende qualsiasi informazione in forma scritta o in qualsiasi altra forma permanente (anche elettronica) che è chiaramente indicata come riservata.
Nel qualificare le informazioni come riservate, la BEI rispetta la sua politica di trasparenza, nella versione pubblicata sul suo sito web nel momento in cui tali informazioni sono fornite al Parlamento europeo.
10.2. Il Parlamento europeo gestisce e protegge qualsiasi informazione riservata fornita dalla BEI nell'ambito del presente accordo in conformità delle pertinenti disposizioni del regolamento del Parlamento europeo, e in particolare dell'articolo 210 bis (Procedura da applicare per la consultazione da parte di una commissione delle informazioni confidenziali ricevute dal Parlamento) e della Decisione dell'Ufficio di presidenza del Parlamento europeo, del 15 aprile 2013, sulla regolamentazione relativa al trattamento delle informazioni riservate da parte del Parlamento europeo (4), conformemente alle «altre informazioni riservate» (quali ivi definite).
10.3. In conformità delle pertinenti disposizioni del suo regolamento, il Parlamento europeo tiene un elenco delle persone che gestiscono le informazioni riservate.
10.4. Il Parlamento e la BEI si tengono reciprocamente informati in merito all'avvio e all'esito di un eventuale procedimento giudiziario, amministrativo o di altro tipo, in cui una terza parte richieda l'accesso a informazioni riservate fornite dalla BEI al Parlamento europeo.
Articolo 11
Riunioni tecniche preparatorie
11.1. Al fine di preparare gli scambi di opinioni, le audizioni o altre forme di interazione previste dal presente accordo, sono organizzate riunioni tecniche su richiesta del Parlamento europeo o della BEI.
11.2. Le riunioni tecniche si tengono almeno una settimana prima dello scambio di opinioni, dell'audizione o di qualsiasi altra forma di interazione a cui fanno riferimento.
Articolo 12
Regime linguistico
Qualsiasi richiesta presentata dal Parlamento europeo e a norma del presente accordo può essere trasmessa alla BEI in qualunque lingua ufficiale dell'Unione. Le risposte della BEI sono redatte in inglese.
Articolo 13
Disposizioni finali
13.1. Le parti procedono regolarmente a una valutazione dell'attuazione pratica del presente accordo ed effettuano un riesame appena entra in vigore il regolamento di proroga del FEIS e, successivamente, entro il 30 giugno 2019, alla luce dell'esperienza pratica di attuazione.
13.2. Il presente accordo entra in vigore il giorno successivo alla sua firma.
13.3. Il presente accordo è pubblicato nella Gazzetta ufficiale dell'Unione europea.
Fatto a Bruxelles, il 2 maggio 2017
Per il Parlamento europeo
Il presidente
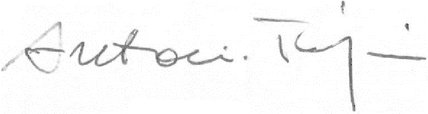
A. TAJANI
Fatto a Lussemburgo, il 3 aprile 2017
Per la Banca europea per gli investimenti
Il presidente
![]()
W. HOYER
(1) GU L 169 dell'1.7.2015, pag. 1.
(2) GU L 8 del 12.1.2001, pag. 1.
(3) GU L 145 del 31.5.2001, pag. 43.
(4) GU C 96 dell'1.4.2014, pag. 1.
REGOLAMENTI
|
19.5.2017 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 128/9 |
REGOLAMENTO DI ESECUZIONE (UE) 2017/854 DELLA COMMISSIONE
del 18 maggio 2017
che conferisce la protezione di cui all'articolo 99 del regolamento (UE) n. 1308/2013 del Parlamento europeo e del Consiglio alla denominazione Darnibole (DOP)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (UE) n. 1308/2013 del Parlamento europeo e del Consiglio, del 17 dicembre 2013, recante organizzazione comune dei mercati dei prodotti agricoli e che abroga i regolamenti (CEE) n. 922/72, (CEE) n. 234/79, (CE) n. 1037/2001 e (CE) n. 1234/2007 del Consiglio (1), in particolare l'articolo 99,
considerando quanto segue:
|
(1) |
Ai sensi dell'articolo 97, paragrafi 2 e 3, del regolamento (UE) n. 1308/2013, la domanda di registrazione della denominazione «Darnibole» presentata dal Regno Unito è stata esaminata dalla Commissione e successivamente pubblicata nella Gazzetta ufficiale dell'Unione europea (2). |
|
(2) |
Alla Commissione non è stata notificata alcuna dichiarazione di opposizione ai sensi dell'articolo 98 del regolamento (UE) n. 1308/2013. |
|
(3) |
Ai sensi dell'articolo 99 del regolamento (UE) n. 1308/2013 la denominazione «Darnibole» dovrebbe essere protetta e registrata nel registro di cui all'articolo 104 dello stesso regolamento. |
|
(4) |
Le misure di cui al presente regolamento sono conformi al parere del comitato per l'organizzazione comune dei mercati agricoli, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
La denominazione «Darnibole» (DOP) è protetta.
Articolo 2
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 18 maggio 2017
Per la Commissione
Il presidente
Jean-Claude JUNCKER
(1) GU L 347 del 20.12.2013, pag. 671.
(2) GU C 457 dell'8.12.2016, pag. 3.
|
19.5.2017 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 128/10 |
REGOLAMENTO DI ESECUZIONE (UE) 2017/855 DELLA COMMISSIONE
del 18 maggio 2017
che modifica il regolamento di esecuzione (UE) n. 540/2011 per quanto riguarda le condizioni di approvazione della sostanza attiva diflubenzurone
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1107/2009 del Parlamento europeo e del Consiglio, del 21 ottobre 2009, relativo all'immissione sul mercato dei prodotti fitosanitari e che abroga le direttive del Consiglio 79/117/CEE e 91/414/CEE (1), in particolare la prima alternativa di cui all'articolo 21, paragrafo 3, e l'articolo 78, paragrafo 2,
considerando quanto segue:
|
(1) |
La direttiva 2008/69/CE della Commissione (2) ha iscritto il diflubenzurone come sostanza attiva nell'allegato I della direttiva 91/414/CEE del Consiglio (3). |
|
(2) |
Le sostanze attive iscritte nell'allegato I della direttiva 91/414/CEE sono considerate approvate a norma del regolamento (CE) n. 1107/2009 e sono elencate nella parte A dell'allegato del regolamento di esecuzione (UE) n. 540/2011 della Commissione (4). |
|
(3) |
Conformemente alla direttiva 2010/39/UE della Commissione (5) il richiedente, a seguito della cui domanda il diflubenzurone è stato iscritto nell'allegato I della direttiva 91/414/CEE del Consiglio, era tenuto a fornire informazioni di conferma relative alla potenziale rilevanza tossicologica dell'impurità e del metabolita 4-cloroanilina (PCA). |
|
(4) |
Il richiedente ha presentato tali informazioni allo Stato membro relatore, la Svezia, entro il termine previsto a tale scopo. |
|
(5) |
La Svezia ha valutato le informazioni presentate dal richiedente e il 20 dicembre 2011 ha presentato la propria valutazione, sotto forma di addendum al progetto di rapporto di valutazione, agli altri Stati membri, alla Commissione e all'Autorità europea per la sicurezza alimentare (nel seguito «l'Autorità»). |
|
(6) |
La Commissione ha consultato l'Autorità, che il 7 settembre 2012 ha presentato le sue conclusioni sulla valutazione del rischio delle informazioni di conferma per il diflubenzurone (6). L'Autorità ha trasmesso le sue osservazioni sul diflubenzurone al richiedente, che è stato invitato dalla Commissione a presentare le sue osservazioni in merito alla relazione di esame. Il progetto di rapporto di valutazione, l'addendum e le conclusioni dell'Autorità sono stati esaminati dagli Stati membri e dalla Commissione nell'ambito del comitato permanente per la catena alimentare e la salute degli animali e adottati il 16 luglio 2013 sotto forma di relazione di esame della Commissione sul diflubenzurone. |
|
(7) |
Sebbene i risultati degli studi di genotossicità abbiano indicato che il PCA, oltre a essere un agente cancerogeno, è un agente genotossico in vivo, non è stato osservato alcun potenziale genotossico e cancerogeno negli studi condotti con un modello animale adeguato per l'esposizione umana al diflubenzurone e quindi al PCA quale metabolita e impurità. Alla luce delle informazioni presentate dal richiedente la Commissione ha ritenuto che le informazioni di conferma richieste fossero state fornite. |
|
(8) |
Date le proprietà genotossiche del PCA, individuate sulla base delle informazioni di conferma, considerate le sue proprietà genotossiche e vista l'assenza di una soglia di esposizione accettabile, nelle sue conclusioni l'Autorità ha tuttavia individuato un nuovo motivo di preoccupazione relativo alla potenziale esposizione al PCA quale residuo. |
|
(9) |
La Commissione ha avviato un riesame dell'approvazione della sostanza attiva diflubenzurone. La Commissione ha ritenuto che, alla luce delle nuove conoscenze scientifiche e tecniche di cui sopra, vi fossero indicazioni del fatto che l'approvazione della sostanza attiva diflubenzurone non soddisfacesse più i criteri di approvazione previsti all'articolo 4 del regolamento (CE) n. 1107/2009 riguardo al suo potenziale effetto nocivo sulla salute umana attraverso l'esposizione al PCA quale residuo. Essa ha invitato il richiedente a presentare informazioni per quanto riguarda la potenziale esposizione al PCA quale residuo e, qualora tale esposizione sia confermata, l'esame della potenziale rilevanza tossicologica. |
|
(10) |
Il richiedente ha presentato tali informazioni alla Svezia entro il termine previsto a tale scopo. |
|
(11) |
La Svezia ha valutato le informazioni presentate dal richiedente e il 23 luglio 2014 e ha presentato la propria valutazione, sotto forma di addendum al progetto di rapporto di valutazione, agli altri Stati membri, alla Commissione e all'Autorità europea per la sicurezza alimentare. |
|
(12) |
La Commissione ha consultato l'Autorità, che l'11 dicembre 2015 ha presentato le sue conclusioni sulla valutazione del rischio in base ai dati presentati per il riesame dell'approvazione del diflubenzurone (7). L'Autorità ha comunicato al richiedente le sue osservazioni sul diflubenzurone. |
|
(13) |
La Commissione ritiene che le informazioni presentate nell'ambito del processo di riesame non dimostrino che il rischio derivante dalla potenziale esposizione dei consumatori al PCA quale residuo è accettabile. In particolare, la presenza del PCA nella via metabolica è stata dimostrata in alcune piante e in alcuni animali d'allevamento e non ha potuto essere esclusa in altre piante o in altri animali. Gli studi hanno inoltre evidenziato una trasformazione significativa dei residui di diflubenzurone in PCA in condizioni simili o uguali a quelle dei processi di sterilizzazione degli alimenti; tale trasformazione non ha potuto essere esclusa per le pratiche di trattamento domestiche. |
|
(14) |
Considerate le proprietà genotossiche e cancerogene del PCA e l'assenza di una soglia di esposizione accettabile, non è stato dimostrato che l'esposizione dei consumatori al PCA quale residuo, derivante da un'applicazione conforme alle buone pratiche fitosanitarie, non ha effetti nocivi. Poiché i valori di riferimento tossicologici per il PCA non possono essere fissati e non possono pertanto essere individuati livelli di residui sicuri, l'eventuale esposizione dei consumatori al PCA dovrebbe essere evitata. |
|
(15) |
La Commissione ha invitato il richiedente a presentare le proprie osservazioni in merito alla relazione di esame. Le osservazioni del richiedente non hanno dissipato le criticità in materia di sicurezza dei consumatori legate all'esposizione al PCA. |
|
(16) |
Il progetto di rapporto di valutazione, l'addendum e le conclusioni dell'Autorità sono stati esaminati dagli Stati membri e dalla Commissione nell'ambito del comitato permanente per le piante, gli animali, gli alimenti e i mangimi e adottati il 23 marzo 2017 sotto forma di relazione di esame della Commissione sul diflubenzurone. |
|
(17) |
La Commissione ha concluso che l'esposizione dei consumatori al PCA non può essere esclusa se non attraverso l'introduzione di ulteriori restrizioni. In particolare, l'impiego del diflubenzuron dovrebbe essere limitato alle colture non commestibili, e le colture trattate con diflubenzurone non dovrebbero entrare nella catena alimentare umana e animale. Al fine di ridurre al minimo l'esposizione dei consumatori al PCA è pertanto opportuno modificare le condizioni d'impiego del diflubenzuron. |
|
(18) |
L'allegato del regolamento di esecuzione (UE) n. 540/2011 dovrebbe pertanto essere modificato di conseguenza. |
|
(19) |
È opportuno concedere agli Stati membri il tempo necessario per modificare o revocare le autorizzazioni dei prodotti fitosanitari contenenti diflubenzurone. |
|
(20) |
Per quanto concerne i prodotti fitosanitari contenenti diflubenzurone, laddove gli Stati membri concedano un periodo di tolleranza a norma dell'articolo 46 del regolamento (CE) n. 1107/2009, tale periodo dovrebbe terminare non oltre 15 mesi dall'entrata in vigore del presente regolamento. |
|
(21) |
Le misure di cui al presente regolamento sono conformi al parere del Comitato permanente per le piante, gli animali, gli alimenti e i mangimi, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
Modifica del regolamento di esecuzione (UE) n. 540/2011
Nella settima colonna «Disposizioni specifiche» della voce numero 174 sul diflubenzurone, nella parte A dell'allegato del regolamento (UE) n. 540/2011, il testo è sostituito dal seguente:
«Possono essere autorizzati solo gli usi nelle colture non commestibili.
Per l'applicazione dei principi uniformi di cui all'articolo 29, paragrafo 6, del regolamento (CE) n. 1107/2009, si deve tener conto delle conclusioni della relazione di esame sul diflubenzurone, in particolare delle relative appendici I e II, nella versione modificata il 23 marzo 2017 dal comitato permanente per le piante, gli animali, gli alimenti e i mangimi.
Ai fini di tale valutazione generale gli Stati membri devono prestare particolare attenzione:
|
— |
alle specifiche del materiale tecnico prodotto commercialmente, che devono essere confermate e corredate da adeguati dati analitici. Il materiale di prova utilizzato nei fascicoli sulla tossicità deve essere comparato e verificato a fronte delle specifiche del materiale tecnico, |
|
— |
alla protezione degli organismi acquatici, degli organismi terrestri e degli artropodi non bersaglio, api comprese, |
|
— |
alla potenziale esposizione involontaria al diflubenzurone di colture alimentari e foraggere derivante dall'impiego su colture non commestibili (ad esempio tramite dispersione aerea), |
|
— |
alla protezione dei lavoratori, dei residenti e degli astanti. |
Gli Stati membri provvedono affinché le colture trattate con diflubenzurone non entrino nella catena alimentare umana e animale.
Le condizioni d'impiego devono comprendere, se del caso, adeguate misure di attenuazione dei rischi.»
Articolo 2
Misure transitorie
Conformemente al regolamento (CE) n. 1107/2009 gli Stati membri modificano o revocano all'occorrenza le autorizzazioni esistenti per i prodotti fitosanitari contenenti la sostanza attiva diflubenzurone entro l'8 settembre 2017.
Articolo 3
Periodo di tolleranza
L'eventuale periodo di tolleranza concesso dagli Stati membri a norma dell'articolo 46 del regolamento (CE) n. 1107/2009 è il più breve possibile e termina entro il l'8 settembre 2018.
Articolo 4
Entrata in vigore
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 18 maggio 2017
Per la Commissione
Il presidente
Jean-Claude JUNCKER
(1) GU L 309 del 24.11.2009, pag. 1.
(2) Direttiva 2008/69/CE della Commissione, del 1o luglio 2008, che modifica la direttiva 91/414/CEE del Consiglio con l'iscrizione delle sostanze attive clofentezina, dicamba, difenoconazolo, diflubenzurone, imazaquin, lenacil, ossadiazone, picloram e piriprossifen (GU L 172 del 2.7.2008, pag. 9).
(3) Direttiva 91/414/CEE del Consiglio, del 15 luglio 1991, relativa all'immissione in commercio dei prodotti fitosanitari (GU L 230 del 19.8.1991, pag. 1).
(4) Regolamento di esecuzione (UE) n. 540/2011 della Commissione, del 25 maggio 2011, recante disposizioni di attuazione del regolamento (CE) n. 1107/2009 del Parlamento europeo e del Consiglio per quanto riguarda l'elenco delle sostanze attive approvate (GU L 153 dell'11.6.2011, pag. 1).
(5) Direttiva 2010/39/UE della Commissione, del 22 giugno 2010, che modifica l'allegato I della direttiva 91/414/CEE del Consiglio per quanto riguarda le disposizioni specifiche relative alle sostanze attive clofentezina, diflubenzurone, lenacil, ossadiazone, picloram e piriprossifen (GU L 156 del 23.6.2010, pag. 7).
(6) Autorità europea per la sicurezza alimentare; Conclusion on the peer review of the pesticide risk assessment of confirmatory data submitted for the active substance diflubenzuron (Conclusioni sulla revisione tra pari della valutazione del rischio in base ai dati di conferma presentati per la sostanza attiva diflubenzurone come antiparassitario). EFSA Journal 2012; 10(9):2870. 26 pagg. doi:10.2903/j.efsa.2012.2870. Disponibile online all'indirizzo: www.efsa.europa.eu/efsajournal.htm
(7) Autorità europea per la sicurezza alimentare; Conclusion on the peer review on the review of the approval of the active substance diflubenzuron regarding the metabolite PCA (Conclusioni sulla revisione tra pari del riesame dell'approvazione della sostanza attiva diflubenzurone con riguardo al metabolita PCA). EFSA Journal 2015; 13(8):4222. 30 pagg. doi:10.2903/j.efsa.2015.4222. Disponibile online all'indirizzo: www.efsa.europa.eu/efsajournal.htm
|
19.5.2017 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 128/14 |
REGOLAMENTO DI ESECUZIONE (UE) 2017/856 DELLA COMMISSIONE
del 18 maggio 2017
che modifica il regolamento di esecuzione (UE) n. 540/2011 per quanto riguarda le condizioni di approvazione della sostanza attiva flurossipir
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (CE) n. 1107/2009 del Parlamento europeo e del Consiglio, del 21 ottobre 2009, relativo all'immissione sul mercato dei prodotti fitosanitari e che abroga le direttive del Consiglio 79/117/CEE e 91/414/CEE (1), in particolare la seconda alternativa di cui all'articolo 21, paragrafo 3, e l'articolo 78, paragrafo 2,
considerando quanto segue:
|
(1) |
Il regolamento di esecuzione (UE) n. 736/2011 della Commissione (2) ha approvato il flurossipir come sostanza attiva conformemente al regolamento (CE) n. 1107/2009 nel rispetto di determinate condizioni che richiedono agli Stati membri interessati di garantire che il richiedente a seguito della cui domanda il flurossipir è stato approvato fornisca ulteriori informazioni di conferma in merito a sei punti, uno dei quali riguarda la rilevanza delle impurezze presenti nelle specifiche tecniche. |
|
(2) |
Il 25 giugno 2012 e il 5 settembre 2013 il richiedente ha presentato allo Stato membro relatore, l'Irlanda, informazioni supplementari per rispondere alla richiesta di dati di conferma entro il termine previsto a tale scopo. |
|
(3) |
L'Irlanda ha valutato tali informazioni supplementari fornite dal richiedente e il 22 dicembre 2014 ha presentato la propria valutazione, sotto forma di addendum al progetto di rapporto di valutazione, agli altri Stati membri, alla Commissione e all'Autorità europea per la sicurezza alimentare (di seguito «l'Autorità»), invitandoli a formulare osservazioni in merito. |
|
(4) |
Il 22 luglio 2015 l'Autorità ha pubblicato una relazione tecnica (3) che sintetizza i risultati di tale consultazione per il flurossipir. |
|
(5) |
Il progetto di rapporto di valutazione, l'addendum e la relazione tecnica dell'Autorità sono stati riesaminati dagli Stati membri e dalla Commissione in seno al comitato permanente per le piante, gli animali, gli alimenti e i mangimi e adottati il 23 marzo 2017 sotto forma di rapporto di riesame della Commissione relativo al flurossipir. |
|
(6) |
La Commissione ha invitato il richiedente a presentare le sue osservazioni in merito a tale rapporto di riesame relativo al flurossipir. |
|
(7) |
La sostanza N-metil-2-pirrolidone (NMP) è classificata nel regolamento (CE) n. 1272/2008 del Parlamento europeo e del Consiglio (4) come tossica per la riproduzione, categoria 1B, con un limite di concentrazione generale dello 0,3 %. È altamente improbabile che una presenza di NMP nel materiale tecnico inferiore a 3 g/kg ponga un rischio per i consumatori. La Commissione ha pertanto concluso che le informazioni supplementari fornite mostrano che dovrebbe essere stabilito un livello massimo di impurezze tossicologicamente rilevante per l'NMP inferiore a 3 g/kg (< 0,3 %) nel materiale tecnico. |
|
(8) |
Al fine di garantire un elevato livello di protezione dei consumatori è pertanto opportuno stabilire un livello massimo di tali impurezze nella sostanza attiva fabbricata commercialmente. |
|
(9) |
L'allegato del regolamento di esecuzione (UE) n. 540/2011 della Commissione (5) dovrebbe pertanto essere modificato di conseguenza. |
|
(10) |
È opportuno concedere agli Stati membri un periodo di tempo sufficiente per modificare o revocare le autorizzazioni dei prodotti fitosanitari contenenti flurossipir. |
|
(11) |
Laddove gli Stati membri concedano un periodo di tolleranza a norma dell'articolo 46 del regolamento (CE) n. 1107/2009, nel caso di prodotti fitosanitari contenenti flurossipir tale periodo dovrebbe terminare al più tardi l'8 settembre 2018. |
|
(12) |
Le misure di cui al presente regolamento sono conformi al parere del comitato permanente per le piante, gli animali, gli alimenti e i mangimi, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
Modifica del regolamento di esecuzione (UE) n. 540/2011
L'allegato del regolamento di esecuzione (UE) n. 540/2011 è modificato conformemente all'allegato del presente regolamento.
Articolo 2
Misure transitorie
In conformità al regolamento (CE) n. 1107/2009 gli Stati membri modificano o revocano all'occorrenza le autorizzazioni esistenti per i prodotti fitosanitari contenenti la sostanza attiva flurossipir entro l'8 settembre 2017.
Articolo 3
Periodo di tolleranza
L'eventuale periodo di tolleranza concesso dagli Stati membri a norma dell'articolo 46 del regolamento (CE) n. 1107/2009 è il più breve possibile e termina al più tardi l'8 settembre 2018.
Articolo 4
Entrata in vigore
Il presente regolamento entra in vigore il ventesimo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 18 maggio 2017
Per la Commissione
Il presidente
Jean-Claude JUNCKER
(1) GU L 309 del 24.11.2009, pag. 1.
(2) Regolamento di esecuzione (UE) n. 736/2011 della Commissione, del 26 luglio 2011, che approva la sostanza attiva flurossipir a norma del regolamento (CE) n. 1107/2009 del Parlamento europeo e del Consiglio relativo all'immissione sul mercato dei prodotti fitosanitari e che modifica l'allegato del regolamento di esecuzione (UE) n. 540/2011 della Commissione (GU L 195 del 27.7.2011, pag. 37).
(3) EFSA (Autorità europea per la sicurezza alimentare), 2015. Technical report on the outcome of the consultation with Member States, the applicant and EFSA on the pesticide risk assessment for fluroxypyr in light of confirmatory data (Relazione tecnica sui risultati della consultazione con gli Stati membri, il richiedente e l'EFSA sulla valutazione del rischio sulla base dei dati di conferma forniti per il flurossipir come antiparassitario). Pubblicazione di supporto dell'EFSA 2015:EN-857. 43 pagg.
(4) Regolamento (CE) n. 1272/2008 del Parlamento europeo e del Consiglio, del 16 dicembre 2008, relativo alla classificazione, all'etichettatura e all'imballaggio delle sostanze e delle miscele che modifica e abroga le direttive 67/548/CEE e 1999/45/CE e che reca modifica al regolamento (CE) n. 1907/2006 (GU L 353 del 31.12.2008, pag. 1).
(5) Regolamento di esecuzione (UE) n. 540/2011 della Commissione, del 25 maggio 2011, recante disposizioni di attuazione del regolamento (CE) n. 1107/2009 del Parlamento europeo e del Consiglio per quanto riguarda l'elenco delle sostanze attive approvate (GU L 153 dell'11.6.2011, pag. 1).
ALLEGATO
Nella parte B dell'allegato del regolamento di esecuzione (UE) n. 540/2011, il testo della colonna «Purezza» della riga 9, Flurossipir, è sostituito dal seguente:
«≥ 950 g/kg (fluroxypyr-meptyl)
La seguente impurezza di fabbricazione presenta rischi tossicologici e non deve superare il seguente livello nel materiale tecnico:
N-metil-2-pirrolidone (NMP): < 3 g/kg»
Nella parte B dell'allegato del regolamento di esecuzione (UE) n. 540/2011, il testo della colonna «Disposizioni specifiche» della riga 9, flurossipir, è sostituito dal seguente:
«PARTE A
Possono essere autorizzati solo gli usi come erbicida.
PARTE B
Per l'applicazione dei principi uniformi di cui all'articolo 29, paragrafo 6, del regolamento (CE) n. 1107/2009 si deve tener conto delle conclusioni del rapporto di riesame sulla sostanza flurossipir, in particolare delle relative appendici I e II, nella versione definitiva adottata il 23 marzo 2017 dal comitato permanente per le piante, gli animali, gli alimenti e i mangimi.
Nell'ambito di questa valutazione generale, gli Stati membri devono prestare particolare attenzione:
|
— |
alla potenziale contaminazione delle acque sotterranee da parte del metabolita piridinolo del flurossipir quando tale sostanza attiva viene impiegata in regioni dal suolo alcalino o vulnerabile o esposte a condizioni climatiche vulnerabili; |
|
— |
al rischio per gli organismi acquatici. |
Le condizioni di autorizzazione devono comprendere, se del caso, misure di attenuazione dei rischi.»
|
19.5.2017 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 128/17 |
REGOLAMENTO DI ESECUZIONE (UE) 2017/857 DELLA COMMISSIONE
del 18 maggio 2017
recante fissazione dei valori forfettari all'importazione ai fini della determinazione del prezzo di entrata di taluni ortofrutticoli
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (UE) n. 1308/2013 del Parlamento europeo e del Consiglio, del 17 dicembre 2013, recante organizzazione comune dei mercati dei prodotti agricoli e che abroga i regolamenti (CEE) n. 922/72, (CEE) n. 234/79, (CE) n. 1037/2001 e (CE) n. 1234/2007 del Consiglio (1),
visto il regolamento di esecuzione (UE) n. 543/2011 della Commissione, del 7 giugno 2011, recante modalità di applicazione del regolamento (CE) n. 1234/2007 del Consiglio nei settori degli ortofrutticoli freschi e degli ortofrutticoli trasformati (2), in particolare l'articolo 136, paragrafo 1,
considerando quanto segue:
|
(1) |
Il regolamento di esecuzione (UE) n. 543/2011 prevede, in applicazione dei risultati dei negoziati commerciali multilaterali dell'Uruguay round, i criteri per la fissazione da parte della Commissione dei valori forfettari all'importazione dai paesi terzi, per i prodotti e i periodi indicati nell'allegato XVI, parte A, del medesimo regolamento. |
|
(2) |
Il valore forfettario all'importazione è calcolato ciascun giorno feriale, in conformità dell'articolo 136, paragrafo 1, del regolamento di esecuzione (UE) n. 543/2011, tenendo conto di dati giornalieri variabili. Pertanto il presente regolamento entra in vigore il giorno della pubblicazione nella Gazzetta ufficiale dell'Unione europea, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
I valori forfettari all'importazione di cui all'articolo 136 del regolamento di esecuzione (UE) n. 543/2011 sono quelli fissati nell'allegato del presente regolamento.
Articolo 2
Il presente regolamento entra in vigore il giorno della pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 18 maggio 2017
Per la Commissione,
a nome del presidente
Jerzy PLEWA
Direttore generale
Direzione generale dell'Agricoltura e dello sviluppo rurale
(1) GU L 347 del 20.12.2013, pag. 671.
(2) GU L 157 del 15.6.2011, pag. 1.
ALLEGATO
Valori forfettari all'importazione ai fini della determinazione del prezzo di entrata di taluni ortofrutticoli
|
(EUR/100 kg) |
||
|
Codice NC |
Codice dei paesi terzi (1) |
Valore forfettario all'importazione |
|
0702 00 00 |
MA |
104,0 |
|
TN |
158,2 |
|
|
TR |
94,0 |
|
|
ZZ |
118,7 |
|
|
0709 93 10 |
TR |
132,4 |
|
ZZ |
132,4 |
|
|
0805 10 22 , 0805 10 24 , 0805 10 28 |
EG |
49,9 |
|
MA |
59,7 |
|
|
TR |
41,8 |
|
|
ZA |
88,5 |
|
|
ZZ |
60,0 |
|
|
0805 50 10 |
AR |
123,2 |
|
TR |
65,0 |
|
|
ZA |
207,1 |
|
|
ZZ |
131,8 |
|
|
0808 10 80 |
AR |
118,7 |
|
BR |
119,2 |
|
|
CL |
133,7 |
|
|
CN |
130,6 |
|
|
NZ |
152,0 |
|
|
US |
107,1 |
|
|
ZA |
99,8 |
|
|
ZZ |
123,0 |
|
(1) Nomenclatura dei paesi stabilita dal Regolamento (UE) n. 1106/2012 della Commissione, del 27 novembre 2012, che attua il regolamento (CE) n. 471/2009 del Parlamento europeo e del Consiglio, relativo alle statistiche comunitarie del commercio estero con i paesi terzi, per quanto riguarda l'aggiornamento della nomenclatura dei paesi e territori (GU L 328 del 28.11.2012, pag. 7). Il codice «ZZ» corrisponde a «altre origini».
|
19.5.2017 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 128/19 |
REGOLAMENTO DI ESECUZIONE (UE) 2017/858 DELLA COMMISSIONE
del 18 maggio 2017
recante fissazione del prezzo minimo di vendita di latte scremato in polvere per la nona gara parziale nell'ambito della gara aperta dal regolamento di esecuzione (UE) 2016/2080
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
visto il regolamento (UE) n. 1308/2013 del Parlamento europeo e del Consiglio, del 17 dicembre 2013, recante organizzazione comune dei mercati dei prodotti agricoli e che abroga i regolamenti (CEE) n. 922/72, (CEE) n. 234/79, (CE) n. 1037/2001 e (CE) n. 1234/2007 del Consiglio (1),
visto il regolamento di esecuzione (UE) 2016/1240 della Commissione, del 18 maggio 2016, recante modalità di applicazione del regolamento (UE) n. 1308/2013 del Parlamento europeo e del Consiglio per quanto riguarda l'intervento pubblico e l'aiuto all'ammasso privato (2), in particolare l'articolo 32,
considerando quanto segue:
|
(1) |
Il regolamento di esecuzione (UE) 2016/2080 della Commissione (3) ha aperto la gara per la vendita di latte scremato in polvere. |
|
(2) |
Sulla base delle offerte ricevute per la nona gara parziale, non occorre fissare un prezzo minimo di vendita. |
|
(3) |
Le misure di cui al presente regolamento sono conformi al parere del Comitato per l'organizzazione comune dei mercati agricoli, |
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
Per la nona gara parziale per la vendita di latte scremato in polvere nell'ambito della procedura di gara aperta dal regolamento (UE) 2016/2080, per la quale il termine entro cui le offerte dovevano essere presentate è scaduto il 16 maggio 2017, non è fissato un prezzo minimo di vendita.
Articolo 2
Il presente regolamento entra in vigore il giorno della pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 18 maggio 2017
Per la Commissione,
a nome del presidente
Jerzy PLEWA
Direttore generale
Direzione generale dell'Agricoltura e dello sviluppo rurale
(1) GU L 347 del 20.12.2013, pag. 671.
(2) GU L 206 del 30.7.2016, pag. 71.
(3) Regolamento di esecuzione (UE) 2016/2080 della Commissione, del 25 novembre 2016, recante apertura di una gara per la vendita di latte scremato in polvere (GU L 321 del 29.11.2016, pag. 45).
DECISIONI
|
19.5.2017 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 128/20 |
DECISIONE (UE) 2017/859 DEL CONSIGLIO
dell'11 maggio 2017
relativa alla posizione che deve essere adottata, a nome dell'Unione europea, in sede di Comitato misto SEE in merito a una modifica del protocollo 31 dell'accordo SEE sulla cooperazione in settori specifici al di fuori delle quattro libertà (linee di bilancio 02.03.01 «Mercato interno» e 02.03.04 «Strumento per la gestione del mercato interno»)
IL CONSIGLIO DELL'UNIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea, in particolare l'articolo 114, in combinato disposto con l'articolo 218, paragrafo 9,
visto il regolamento (CE) n. 2894/94 del Consiglio, del 28 novembre 1994, relativo ad alcune modalità di applicazione dell'accordo sullo Spazio economico europeo (1), in particolare l'articolo 1, paragrafo 3,
vista la proposta della Commissione europea,
considerando quanto segue:
|
(1) |
L'accordo sullo Spazio economico europeo (2) («accordo SEE») è entrato in vigore il 1o gennaio 1994. |
|
(2) |
A norma dell'articolo 98 dell'accordo SEE, il Comitato misto SEE può decidere di modificare, tra l'altro, il protocollo 31 dell'accordo SEE. |
|
(3) |
Il protocollo 31 dell'accordo SEE contiene disposizioni sulla cooperazione in settori specifici al di fuori delle quattro libertà. |
|
(4) |
È opportuno proseguire la cooperazione delle parti contraenti dell'accordo SEE nelle azioni dell'Unione finanziate dal bilancio generale dell'Unione europea relative al funzionamento e allo sviluppo del mercato interno per beni e servizi. |
|
(5) |
Inoltre, la cooperazione delle parti contraenti dell'accordo SEE dovrebbe essere estesa alle azioni dell'Unione finanziate dal bilancio generale dell'Unione europea riguardanti lo strumento per la gestione del mercato interno. |
|
(6) |
È opportuno pertanto modificare il protocollo 31 dell'accordo SEE per far sì che la cooperazione estesa possa iniziare dal 1o gennaio 2017. |
|
(7) |
La posizione dell'Unione in sede di Comitato misto SEE dovrebbe pertanto basarsi sul progetto di decisione accluso, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
La posizione che deve essere adottata a nome dell'Unione in sede di Comitato misto SEE in merito alla modifica proposta del protocollo 31 dell'accordo SEE sulla cooperazione in settori specifici al di fuori delle quattro libertà si basa sul progetto di decisione del Comitato misto SEE accluso alla presente decisione.
Articolo 2
La presente decisione entra in vigore il giorno dell'adozione.
Fatto a Bruxelles, l'11 maggio 2017
Per il Consiglio
Il presidente
R. GALDES
(1) GU L 305 del 30.11.1994, pag. 6.
(2) GU L 1 del 3.1.1994, pag. 3.
PROGETTO
DECISIONE DEL COMITATO MISTO SEE N. …/2017
del …
che modifica il protocollo 31 dell'accordo SEE sulla cooperazione in settori specifici al di fuori delle quattro libertà
IL COMITATO MISTO SEE,
visto l'accordo sullo Spazio economico europeo («accordo SEE»), in particolare gli articoli 86 e 98,
considerando quanto segue:
|
(1) |
È opportuno proseguire la cooperazione tra le parti contraenti dell'accordo SEE per quanto riguarda le azioni dell'Unione finanziate dal bilancio generale dell'Unione europea relative al funzionamento e allo sviluppo del mercato interno per beni e servizi. |
|
(2) |
Inoltre, la cooperazione delle parti contraenti dell'accordo SEE dovrebbe essere estesa alle azioni dell'Unione finanziate dal bilancio generale dell'Unione europea riguardanti lo strumento per la gestione del mercato interno. |
|
(3) |
È opportuno pertanto modificare il protocollo 31 dell'accordo SEE per far sì che la cooperazione estesa possa iniziare dal 1o gennaio 2017, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
L'articolo 7 del protocollo 31 dell'accordo SEE è così modificato:
|
1. |
Al paragrafo 12, le parole «l'esercizio finanziario 2016» sono sostituite da «gli esercizi finanziari 2016 e 2017». |
|
2. |
È aggiunto il paragrafo seguente:
|
Articolo 2
La presente decisione entra in vigore il giorno successivo all'ultima notifica a norma dell'articolo 103, paragrafo 1, dell'accordo SEE (*1).
Essa si applica a decorrere dal 1o gennaio 2017.
Articolo 3
La presente decisione è pubblicata nella sezione SEE e nel supplemento SEE della Gazzetta ufficiale dell'Unione europea.
Fatto a Bruxelles, il
Per il Comitato misto SEE
Il presidente
I segretari del Comitato misto SEE
(*1) [Non è stata comunicata l'esistenza di obblighi costituzionali.] [Comunicata l'esistenza di obblighi costituzionali.]
|
19.5.2017 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 128/23 |
DECISIONE (UE) 2017/860 DEL CONSIGLIO
dell'11 maggio 2017
relativa alla posizione da adottare, a nome dell'Unione europea, in sede di Comitato misto SEE con riguardo a una modifica del protocollo 31 dell'accordo SEE, sulla cooperazione in settori specifici al di fuori delle quattro libertà (linea di bilancio 33.02.03.01)
Il CONSIGLIO DELL'UNIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea, in particolare l'articolo 114, in combinato disposto con l'articolo 218, paragrafo 9,
visto il regolamento (CE) n. 2894/94 del Consiglio, del 28 novembre 1994, relativo ad alcune modalità di applicazione dell'accordo sullo Spazio economico europeo (1), in particolare l'articolo 1, paragrafo 3,
vista la proposta della Commissione europea,
considerando quanto segue:
|
(1) |
L'accordo sullo Spazio economico europeo (2) («accordo SEE») è entrato in vigore il 1o gennaio 1994. |
|
(2) |
A norma dell'articolo 98 dell'accordo SEE, il Comitato misto SEE può decidere di modificare, tra l'altro, il protocollo 31 dell'accordo SEE. |
|
(3) |
Il protocollo 31 dell'accordo SEE contiene disposizioni sulla cooperazione in settori specifici al di fuori delle quattro libertà. |
|
(4) |
È opportuno proseguire la cooperazione tra le parti contraenti dell'accordo SEE per quanto riguarda le azioni dell'Unione finanziate dal bilancio generale dell'Unione europea relative al diritto societario. |
|
(5) |
È opportuno pertanto modificare il protocollo 31 dell'accordo SEE per far sì che tale cooperazione estesa possa iniziare dal 1o gennaio 2017. |
|
(6) |
L'Unione dovrebbe adottare in sede di Comitato misto SEE la posizione di cui al progetto di decisione accluso, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
La posizione da adottare, a nome dell'Unione, in sede di Comitato misto SEE in merito alla modifica proposta del protocollo 31 dell'accordo SEE, sulla cooperazione in settori specifici al di fuori delle quattro libertà, è basata sul progetto di decisione del Comitato misto SEE accluso alla presente decisione.
Articolo 2
La presente decisione entra in vigore il giorno dell'adozione.
Fatto a Bruxelles, l'11 maggio 2017
Per il Consiglio
Il presidente
R. GALDES
(1) GU L 305 del 30.11.1994, pag. 6.
(2) GU L 1 del 3.1.1994, pag. 3.
PROGETTO
DECISIONE DEL COMITATO MISTO SEE N. …/2017
del …
che modifica il protocollo 31 dell'accordo SEE, sulla cooperazione in settori specifici al di fuori delle quattro libertà
IL COMITATO MISTO SEE,
visto l'accordo sullo Spazio economico europeo («accordo SEE»), in particolare gli articoli 86 e 98,
considerando quanto segue:
|
(1) |
È opportuno proseguire la cooperazione tra le parti contraenti dell'accordo SEE per quanto riguarda le azioni dell'Unione finanziate dal bilancio generale dell'Unione europea relative al diritto societario. |
|
(2) |
È opportuno pertanto modificare il protocollo 31 dell'accordo SEE per far sì che tale cooperazione estesa possa iniziare dal 1o gennaio 2017, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
All'articolo 7, paragrafo 13, del protocollo 31 dell'accordo SEE, le parole «l'esercizio finanziario 2016» sono sostituite dalle parole «gli esercizi finanziari 2016 e 2017».
Articolo 2
La presente decisione entra in vigore il giorno successivo all'ultima notifica a norma dell'articolo 103, paragrafo 1, dell'accordo SEE (1).
Essa si applica a decorrere dal 1o gennaio 2017.
Articolo 3
La presente decisione è pubblicata nella sezione SEE e nel supplemento SEE della Gazzetta ufficiale dell'Unione europea.
Fatto a Bruxelles, il
Per il comitato misto SEE
Il presidente
I segretari del comitato misto SEE
(1) [Non è stata comunicata l'esistenza di obblighi costituzionali.] [Comunicata l'esistenza di obblighi costituzionali.]
|
19.5.2017 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 128/25 |
DECISIONE (UE) 2017/861 DEL CONSIGLIO
dell'11 maggio 2017
relativa alla posizione che deve essere adottata, a nome dell'Unione europea, in sede di comitato misto SEE in merito a una modifica del protocollo 3 dell'accordo SEE sui prodotti di cui all'articolo 8, paragrafo 3, lettera b), dell'accordo
IL CONSIGLIO DELL'UNIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea, in particolare l'articolo 114, in combinato disposto con l'articolo 218, paragrafo 9,
visto il regolamento (CE) n. 2894/94 del Consiglio, del 28 novembre 1994, relativo ad alcune modalità di applicazione dell'accordo sullo Spazio economico europeo (1), in particolare l'articolo 1, paragrafo 3,
vista la proposta della Commissione europea,
considerando quanto segue:
|
(1) |
L'accordo sullo Spazio economico europeo (2) («accordo SEE») è entrato in vigore il 1o gennaio 1994. |
|
(2) |
A norma dell'articolo 98 dell'accordo SEE, il comitato misto SEE può decidere di modificare, tra l'altro, il protocollo 3 dell'accordo SEE. Tale protocollo stabilisce un regime di scambi specifico tra le parti contraenti per taluni prodotti agricoli e prodotti agricoli trasformati. |
|
(3) |
L'articolo 2, paragrafo 2, del protocollo 3 dell'accordo SEE stabilisce che i dazi doganali figuranti negli allegati della tabella I del medesimo protocollo possono essere adeguati dal comitato misto SEE in seguito a concessioni reciproche. L'Islanda e l'Unione europea hanno convenuto di abolire i dazi doganali per taluni prodotti elencati nel protocollo 3 dell'accordo SEE. Tali concessioni si applicheranno unicamente ai prodotti originari rispettivamente dell'Unione europea e dell'Islanda, ai sensi della convenzione regionale sulle norme di origine preferenziali paneuromediterranee. |
|
(4) |
È opportuno pertanto modificare di conseguenza il protocollo 3 dell'accordo SEE. |
|
(5) |
La posizione dell'Unione in sede di comitato misto SEE dovrebbe pertanto basarsi sul progetto di decisione accluso, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
La posizione che deve essere adottata, a nome dell'Unione, in sede di comitato misto SEE in merito alla proposta di modifica del protocollo 3 dell'accordo SEE sui prodotti di cui all'articolo 8, paragrafo 3, lettera b), dell'accordo, si basa sul progetto di decisione del comitato misto SEE accluso alla presente decisione.
Articolo 2
La presente decisione entra in vigore il giorno dell'adozione.
Fatto a Bruxelles, l'11 maggio 2017
Per il Consiglio
Il presidente
R. GALDES
(1) GU L 305 del 30.11.1994, pag. 6.
(2) GU L 1 del 3.1.1994, pag. 3.
PROGETTO
DECISIONE DEL COMITATO MISTO SEE N. …/2017
del …
che modifica il protocollo 3 dell'accordo SEE sui prodotti di cui all'articolo 8, paragrafo 3, lettera b), dell'accordo
IL COMITATO MISTO SEE,
visto l'accordo sullo Spazio economico europeo («accordo SEE»), in particolare l'articolo 98,
considerando quanto segue:
|
(1) |
Il protocollo 3 dell'accordo SEE stabilisce un regime di scambi specifico tra le parti contraenti per taluni prodotti agricoli e prodotti agricoli trasformati. |
|
(2) |
L'articolo 2, paragrafo 2, del protocollo 3 dell'accordo SEE stabilisce che i dazi doganali figuranti negli allegati della tabella I del protocollo 3 dell'accordo SEE possono essere adeguati dal comitato misto SEE in seguito a concessioni reciproche. L'Islanda e l'Unione europea hanno convenuto di abolire i dazi per taluni prodotti elencati nel protocollo 3 dell'accordo SEE. Tali concessioni si applicheranno unicamente ai prodotti originari rispettivamente dell'Unione europea e dell'Islanda, ai sensi della convenzione regionale sulle norme di origine preferenziali paneuromediterranee. |
|
(3) |
È opportuno pertanto modificare di conseguenza il protocollo 3 dell'accordo SEE, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Il protocollo 3 dell'accordo SEE è così modificato:
|
1. |
All'articolo 2, alla fine del paragrafo 1 è aggiunto il seguente comma: «I prodotti di cui alla tabella I originari dell'Islanda o dell'Unione europea, conformemente alle disposizioni della convenzione regionale sulle norme di origine preferenziali paneuromediterranee, sono soggetti ai dazi doganali indicati, rispettivamente, al punto 4 bis dell'allegato I della tabella I e al punto 1 bis dell'allegato II della tabella I.». |
|
2. |
L'allegato I della tabella I è modificato conformemente all'allegato I della presente decisione. |
|
3. |
L'allegato II della tabella I è modificato conformemente all'allegato II della presente decisione. |
Articolo 2
La presente decisione entra in vigore il … a condizione che siano state effettuate tutte le notifiche previste dall'articolo 103, paragrafo 1, dell'accordo SEE (*1) o, se posteriore, lo stesso giorno dell'entrata in vigore dell'accordo in forma di scambio di lettere tra l'Unione europea e l'Islanda relativo alla concessione di preferenze commerciali supplementari per i prodotti agricoli (1).
Articolo 3
La presente decisione è pubblicata nella sezione SEE e nel supplemento SEE della Gazzetta ufficiale dell'Unione europea.
Fatto a Bruxelles, il
Per il comitato misto SEE
Il presidente
I segretari del comitato misto SEE
(*1) [Non è stata comunicata l'esistenza di obblighi costituzionali.] [Comunicata l'esistenza di obblighi costituzionali.]
(1) GU …
ALLEGATO I
L'allegato I della tabella I del protocollo 3 dell'accordo è modificato come segue:
|
1) |
dopo il paragrafo 4 è inserito il seguente paragrafo:
|
|
2) |
Il paragrafo 8 è sostituito dal seguente:
|
ALLEGATO II
L'allegato II della tabella I del protocollo 3 dell'accordo è modificato come segue:
|
1) |
dopo il paragrafo 1 è inserito il seguente paragrafo:
|
|
2) |
il paragrafo 2 è sostituito dal seguente:
|
|
19.5.2017 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 128/55 |
DECISIONE DI ESECUZIONE (UE) 2017/862 DELLA COMMISSIONE
del 17 maggio 2017
che stabilisce le condizioni di polizia sanitaria e di certificazione veterinaria cui è subordinata la reintroduzione di cavalli registrati per competizioni dopo un'esportazione temporanea in Turkmenistan, che modifica l'allegato I della decisione 93/195/CEE per quanto concerne la voce relativa al Turkmenistan e l'allegato I della decisione 2004/211/CE per quanto concerne la voce relativa al Turkmenistan nell'elenco dei paesi terzi e delle parti di paesi terzi da cui sono autorizzate le importazioni nell'Unione di equidi vivi nonché di sperma, ovuli ed embrioni della specie equina
[notificata con il numero C(2017) 3207]
(Testo rilevante ai fini del SEE)
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
vista la direttiva 2009/156/CE del Consiglio, del 30 novembre 2009, relativa alle condizioni di polizia sanitaria che disciplinano i movimenti di equidi e le importazioni di equidi in provenienza dai paesi terzi (1), in particolare l'articolo 12, paragrafi 1 e 4, l'articolo 16, paragrafo 2 e l'articolo 19, lettere a) e b),
considerando quanto segue:
|
(1) |
La direttiva 2009/156/CE stabilisce le condizioni di polizia sanitaria che disciplinano le importazioni di equidi vivi nell'Unione. Essa dispone che le importazioni di equidi nell'Unione siano autorizzate unicamente in provenienza dai paesi terzi che soddisfano determinate condizioni di polizia sanitaria. |
|
(2) |
L'allegato I della decisione 93/195/CEE della Commissione (2) stabilisce elenchi di paesi terzi assegnati ai gruppi sanitari da A a E. L'allegato VII della medesima decisione contiene, tra l'altro, un modello di certificato sanitario da usare per la reintroduzione di cavalli registrati dopo esportazione temporanea di meno di 60 giorni ai fini della partecipazione alle manifestazioni equestri degli Asian Games o l'Endurance World Cup. |
|
(3) |
Le manifestazioni equestri dell'edizione 2017 degli Asian Indoor and Martial Arts Games avranno luogo ad Ashgabat, Turkmenistan, dal 17 al 27 settembre 2017 con il patrocinio della Fédération Equestre Internationale. |
|
(4) |
Al fine di autorizzare la reintroduzione nell'Unione di cavalli registrati per competizioni dopo un'esportazione temporanea al fine di partecipare alle manifestazioni degli Asian Indoor and Martial Arts Games e al fine di stabilire un modello di certificato sanitario destinato ad accompagnare tali cavalli registrati, è necessario inserire il Turkmenistan nel gruppo sanitario adeguato nell'allegato I di detta decisione e stabilire che tali cavalli possono rientrare nell'Unione solo se accompagnati da un certificato sanitario redatto secondo il modello di cui all'allegato VII della decisione 93/195/CEE. |
|
(5) |
La decisione 93/195/CEE dovrebbe pertanto essere modificata di conseguenza. |
|
(6) |
L'allegato I della decisione 2004/211/CE della Commissione (3) stabilisce l'elenco dei paesi terzi, o delle loro parti ove si applichi la regionalizzazione, da cui gli Stati membri autorizzano l'importazione di equidi e sperma, ovuli ed embrioni della specie equina, nonché le condizioni applicabili a tali importazioni. |
|
(7) |
Al fine di ospitare le manifestazioni equestri dell'edizione 2017 degli Asian Indoor and Martial Arts Games, le autorità competenti del Turkmenistan hanno chiesto che una parte del territorio di tale paese, la parte meridionale della regione di Ahal, sia riconosciuta come zona indenne dalle malattie degli equini per un periodo di tempo limitato. |
|
(8) |
Nel febbraio 2017 i servizi della Commissione hanno partecipato a una missione svolta dall'Organizzazione mondiale per la salute animale (OIE) in Turkmenistan al fine di assistere il paese nel completare l'istituzione della zona indenne dalle malattie degli equini, che consiste in una zona centrale inserita in una zona di sorveglianza. |
|
(9) |
Le autorità competenti del Turkmenistan hanno fornito una serie di garanzie, in particolare per quanto riguarda l'obbligo di denuncia delle malattie di cui all'allegato I della direttiva 2009/156/CE nel loro paese e l'impegno a rispettare integralmente l'articolo 12, paragrafo 2, lettera f), della medesima direttiva per quanto concerne la denuncia immediata della malattia alla Commissione e agli Stati membri. |
|
(10) |
Nel Turkmenistan non sono mai stati riscontrati focolai di peste equina, encefalomielite equina venezuelana e stomatite vescicolosa. L'ultimo caso di durina segnalato all'OIE risale al 2010. Non è stato segnalato alcun caso di morva per almeno tre anni, come richiesto dall'OIE affinché un paese possa chiedere la qualifica di paese indenne da tale malattia. |
|
(11) |
Il Turkmenistan ha svolto un'ampia indagine sierologica sulla popolazione equina del paese, in particolare nella zona di sorveglianza della zona indenne dalle malattie degli equini, con esito negativo in tutti i casi per quanto riguarda la peste equina, la morva e la durina. Per un periodo di sei mesi, che avrà formalmente inizio il 15 marzo 2017, nella zona centrale non saranno presenti equini fino all'introduzione dei cavalli partecipanti alle manifestazioni secondo il protocollo di quarantena concordato. |
|
(12) |
Al fine di garantire la protezione sostenibile della situazione sanitaria della popolazione equina all'interno della zona indenne dalle malattie degli equini, le autorità del Turkmenistan si sono impegnate a gestire una struttura di quarantena di nuova costruzione situata in posizione direttamente adiacente alla zona indenne dalle malattie degli equini per controllare l'ingresso di equidi provenienti da allevamenti di altre parti del Turkmenistan e da alcuni paesi terzi non elencati nell'allegato I della decisione 2004/211/CE. Durante la quarantena che precede l'ingresso, gli animali vengono sottoposti a test zoosanitari che soddisfano le condizioni dell'Unione per le importazioni. |
|
(13) |
Considerando l'esito soddisfacente della succitata missione e le informazioni e garanzie fornite dal Turkmenistan, detto paese dovrebbe essere incluso nell'elenco dei paesi terzi di cui all'allegato I della decisione 2004/211/CE per la reintroduzione di cavalli registrati durante il periodo compreso tra il 10 settembre e il 10 ottobre 2017. Allo stesso tempo il Turkmenistan dovrebbe essere regionalizzato per talune malattie degli equini. Da un punto di vista epidemiologico la zona indenne dalle malattie degli equini del Turkmenistan dovrebbe essere assegnata al gruppo sanitario B dell'elenco di cui all'allegato I della decisione 2004/211/CE. |
|
(14) |
La decisione 2004/211/CE dovrebbe pertanto essere modificata di conseguenza. |
|
(15) |
Le misure di cui alla presente decisione sono conformi al parere del Comitato permanente per le piante, gli animali, gli alimenti e i mangimi, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Gli Stati membri autorizzano la reintroduzione di cavalli registrati per competizioni dopo un'esportazione temporanea nella parte del territorio del Turkmenistan regionalizzata per la partecipazione all'edizione 2017 degli Asian Indoor and Martial Arts Games di Ashgabat, a condizione che siano accompagnati da un certificato sanitario redatto secondo il modello di cui all'allegato VII della decisione 93/195/CEE, debitamente compilato entro il termine di cui all'allegato I della decisione 2004/211/CE.
Articolo 2
L'allegato I della decisione 93/195/CEE è modificato conformemente all'allegato I della presente decisione.
Articolo 3
L'allegato I della decisione 2004/211/CE è modificato conformemente all'allegato II della presente decisione.
Articolo 4
Gli Stati membri sono destinatari della presente decisione.
Essa si applica fino al 31 ottobre 2017.
Fatto a Bruxelles, il 17 maggio 2017
Per la Commissione
Vytenis ANDRIUKAITIS
Membro della Commissione
(1) GU L 192 del 23.7.2010, pag. 1.
(2) Decisione 93/195/CEE della Commissione, del 2 febbraio 1993, relativa alle condizioni di polizia sanitaria e alla certificazione veterinaria cui è subordinata la reintroduzione di cavalli registrati per corse, competizioni e manifestazioni culturali dopo un'esportazione temporanea (GU L 86 del 6.4.1993, pag. 1).
(3) Decisione 2004/211/CE della Commissione, del 6 gennaio 2004, che stabilisce l'elenco dei paesi terzi e delle parti di territorio dei paesi terzi da cui gli Stati membri autorizzano le importazioni di equidi vivi nonché di sperma, ovuli ed embrioni della specie equina e che modifica le decisioni 93/195/CEE e 94/63/CE (GU L 73 dell'11.3.2004, pag. 1).
ALLEGATO I
L'allegato I della decisione 93/195/CEE è così modificato:
|
1) |
l'elenco dei paesi terzi del gruppo sanitario B è sostituito dall'elenco seguente: «Australia (AU), Bielorussia (BY), Montenegro (ME), ex Repubblica iugoslava di Macedonia (2) (MK), Nuova Zelanda (NZ), Serbia (RS), Russia (3) (RU), Turkmenistan (3) (5) (TM), Ucraina (UA)»; |
|
2) |
il testo della nota 3 è sostituito dal seguente:
|
|
3) |
è aggiunta la seguente nota 5:
|
ALLEGATO II
L'allegato I della decisione 2004/211/CE è così modificato:
|
1) |
nella tabella, la seguente voce relativa al Turkmenistan è inserita, secondo l'ordine alfabetico del codice ISO, tra la voce relativa alla Thailandia e quella relativa alla Tunisia:
|
|
2) |
è aggiunto il seguente riquadro 8:
|
||||||||||||
|
19.5.2017 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 128/59 |
DECISIONE DI ESECUZIONE (UE) 2017/863 DELLA COMMISSIONE
del 18 maggio 2017
che aggiorna la licenza EUPL per il software con codice sorgente aperto per agevolare ulteriormente la condivisione e il riutilizzo del software sviluppato dalle pubbliche amministrazioni
LA COMMISSIONE EUROPEA,
visto il trattato sul funzionamento dell'Unione europea,
considerando quanto segue:
|
(1) |
La Commissione ha approvato la Licenza Pubblica dell'Unione europea (EUPL) v.1.0 con decisione C(2006) 7108 del 9 gennaio 2007. |
|
(2) |
Con decisione C(2007) 6774 l'EUPL v.1.0 è stata convalidata in tutte le lingue ufficiali dell'Unione europea. |
|
(3) |
Con decisione C(2008) 8911 la Commissione europea ha adottato una versione riveduta della licenza (EUPL v. 1.1) e l'ha convalidata in tutte le lingue ufficiali. |
|
(4) |
Al fine di agevolare ulteriormente la condivisione e il riutilizzo del software sviluppato dalle pubbliche amministrazioni in relazione all'uso di una licenza per il software con codice sorgente aperto, dovrebbe essere adottata una nuova versione della licenza EUPL (EUPL v. 1.2). |
|
(5) |
Sono necessarie riformulazioni e semplificazioni per uniformare la licenza alle denominazioni ufficiali, consentire un campo di applicazione più ampio, dare alle parti una misura di flessibilità per quanto riguarda il diritto applicabile e chiarire la competenza della Corte di giustizia conformemente al trattato sul funzionamento dell'Unione europea. |
|
(6) |
L'EUPL include un'appendice che elenca le «licenze compatibili» che forniscono l'interoperabilità con un elenco di altre licenze con clausola SA (Share-Alike); sono pertanto necessari alcuni aggiornamenti per tener conto delle licenze pertinenti più recenti. |
|
(7) |
Di conseguenza è stata sviluppata una versione aggiornata dell'EUPL, la versione 1.2, il cui testo dovrebbe essere presentato in forma consolidata ai fini della chiarezza e della razionalità, |
DECIDE:
Articolo unico
È rilasciata una nuova versione della European Union Public Licence (EUPL), la versione 1.2, nei termini di cui all'allegato della presente decisione.
Fatto a Bruxelles, il 18 maggio 2017
Per la Commissione
Günther OETTINGER
Membro della Commissione
ALLEGATO
LICENZA PUBBLICA DELL'UNIONE EUROPEA v. 1.2
EUPL © Unione europea 2007, 2016
La presente Licenza Pubblica dell'Unione europea («EUPL») si applica a tutte le opere, come definite di seguito, fornite alle condizioni di cui alla presente licenza. È vietata l'utilizzazione dell'opera in forme diverse da quelle autorizzate dalla presente licenza (nella misura in cui tale utilizzazione sia riservata in via esclusiva al titolare dei diritti d'autore sull'opera).
L'opera è fornita alle condizioni della presente licenza se il licenziante (come definito di seguito) ha posto la seguente dicitura immediatamente dopo l'avviso sui diritti d'autore sull'opera:
Concesso in licenza a norma dell'EUPL
o ha espresso con qualunque altro mezzo la propria volontà di cederla in licenza alle condizioni dell'EUPL.
1 Definizioni
Nella presente licenza i seguenti termini sono così definiti:
— Licenza : la presente licenza.
— Opera originaria : l'opera o il software distribuiti o comunicati dal licenziante alle condizioni della presente licenza, disponibile sotto forma di codice sorgente e, a seconda dei casi, anche sotto forma di codice eseguibile.
— Opere derivate : le opere o il software che possono essere creati dal licenziatario sulla base dell'opera originaria o di una sua modificazione. La presente licenza non definisce quale grado di modificazione o di dipendenza rispetto all'opera originaria sia prescritto per caratterizzare un'opera come opera derivata; tale questione è disciplinata dalla legge sul diritto d'autore applicabile nel paese indicato all'articolo 15.
— Opera : l'opera originaria o le opere da essa derivate.
— Codice sorgente : forma leggibile dell'opera che risulta la più appropriata per essere studiata e modificata dall'uomo.
— Codice eseguibile : il codice che in genere è stato compilato e che è destinato a essere eseguito come programma da un computer.
— Licenziante : la persona fisica o giuridica che distribuisce o comunica l'opera secondo i termini della licenza.
— Contributore/i : la persona fisica o giuridica che modifica l'opera secondo i termini della licenza o altrimenti contribuisce alla creazione di un'opera derivata.
— Licenziatario : la persona fisica o giuridica che fa uso del programma secondo i termini della licenza.
— Distribuzione o comunicazione : la vendita, la cessione a titolo gratuito, il prestito, la locazione, la distribuzione, la comunicazione, la trasmissione o qualsiasi altro atto finalizzato a mettere copie dell'opera a disposizione di altre persone fisiche o giuridiche, o fornire loro accesso alle sue funzionalità essenziali, online o offline.
2 Estensione dei diritti concessi dalla licenza
Il licenziante concede al licenziatario, per tutta la durata del diritto d'autore sull'opera originaria, una licenza mondiale, gratuita, non esclusiva, a sua volta cedibile in sublicenza, che conferisce il diritto di compiere gli atti seguenti:
|
— |
utilizzare l'opera in qualsiasi circostanza e per ogni utilizzo, |
|
— |
riprodurre l'opera, |
|
— |
modificare l'opera e creare opere derivate basate su di essa, |
|
— |
comunicare al pubblico, anche mediante messa a disposizione o esposizione dell'opera o di copie della stessa e, a seconda dei casi, rappresentare l'opera in forma pubblica, |
|
— |
distribuire l'opera o copie della stessa, |
|
— |
cedere in prestito e in locazione l'opera o copie della stessa, |
|
— |
concedere in sublicenza i diritti sull'opera o copie della stessa. |
I diritti suddetti possono essere esercitati con qualsiasi mezzo di comunicazione, su qualsiasi supporto e in qualsiasi formato, attualmente noto o che sarà successivamente inventato, nella misura consentita dal diritto applicabile.
Nei paesi in cui si applicano i diritti morali di autore, il licenziante rinuncia al diritto di esercitare i suoi diritti morali nella misura consentita dalla legge affinché la cessione in licenza dei diritti patrimoniali sopra indicati possa produrre tutti i suoi effetti.
Il licenziante concede al licenziatario, a titolo gratuito e non esclusivo, il diritto di utilizzare qualsiasi brevetto detenuto dal licenziante, nella misura necessaria all'esercizio dei diritti di utilizzazione dell'opera concessi dalla presente licenza.
3 Comunicazione del codice sorgente
Il licenziante può fornire l'opera o sotto forma di codice sorgente o come codice eseguibile. Se l'opera è fornita come codice eseguibile, il licenziante fornisce, in aggiunta, una copia leggibile dall'elaboratore del codice sorgente dell'opera a corredo di ogni copia dell'opera da lui distribuita oppure indica, in un avviso che segue l'avviso sui diritti d'autore apposto sull'opera, un archivio in cui il codice sorgente è facilmente e gratuitamente accessibile per tutto il periodo in cui il licenziante distribuisce o comunica l'opera.
4 Limitazioni del diritto d'autore
Nessuna clausola della presente licenza è finalizzata a impedire al licenziatario di beneficiare di tutte le eccezioni o limitazioni applicabili ai diritti esclusivi dei titolari dei diritti sull'opera, dell'esaurimento di tali diritti o di qualsiasi altra limitazione applicabile.
5 Obblighi del licenziatario
La concessione dei diritti sopra indicati è soggetta ad alcune restrizioni e obblighi in capo al licenziatario. Gli obblighi sono i seguenti:
|
|
Diritto di attribuzione: il licenziatario lascia intatti tutti gli avvisi relativi ai diritti d'autore, ai brevetti o ai marchi e tutte le indicazioni che fanno riferimento alla licenza e all'esclusione della garanzia. Ogni copia dell'opera che il licenziatario distribuisce o comunica deve essere corredata di una copia di tali avvisi e di una copia della licenza. Su tutte le opere derivate il licenziatario deve apporre o far apporre avvisi ben visibili indicanti che l'opera è stata modificata e la data della modificazione. |
|
|
Clausola «copyleft»: se il licenziatario distribuisce o comunica copie delle opere originarie o delle opere derivate, la distribuzione o comunicazione ha luogo nell'osservanza delle clausole della presente licenza o di una sua versione successiva a meno che l'opera originaria venga esplicitamente distribuita solo nel quadro della presente versione della licenza, ad esempio mediante la comunicazione «solo EUPL v. 1.2». Il licenziatario (che in tal caso diventa licenziante) non può offrire né imporre termini o condizioni ulteriori sull'opera o sulle opere derivate che alterino o restringano le condizioni della licenza. |
|
|
Clausola di compatibilità: se il licenziatario distribuisce o comunica le opere derivate o copie delle opere derivate basate sull'opera e su un'altra opera concessa in licenza secondo le condizioni di una licenza compatibile, la distribuzione o comunicazione può avvenire nell'osservanza delle clausole della licenza compatibile. Ai fini dell'applicazione della presente clausola, l'espressione «licenza compatibile» si riferisce alle licenze enumerate nell'allegato della presente licenza. In caso di conflitto tra gli obblighi del licenziatario a norma della licenza compatibile e i suoi obblighi a norma della presente licenza, prevalgono gli obblighi prescritti dalla licenza compatibile. |
|
|
Fornitura del codice sorgente: se distribuisce o comunica copie dell'opera, il licenziatario fornirà copia del codice sorgente in formato leggibile dall'elaboratore oppure indicherà un archivio in cui tale codice sorgente è facilmente e liberamente accessibile, per tutto il tempo in cui distribuisce o comunica l'opera. |
|
|
Tutela dei diritti: la presente licenza non autorizza a fare uso di nomi commerciali, di marchi distintivi di prodotti o servizi o dei nomi dei licenzianti, se non nei limiti necessari ad una utilizzazione ragionevole e conforme agli usi per descrivere l'origine dell'opera e riprodurre il contenuto dell'avviso relativo al diritto d'autore. |
6 Autori e contributori
Il licenziante originario garantisce che i diritti d'autore sull'opera originaria concessi a norma della presente licenza sono di sua proprietà ovvero gli sono concessi in licenza e che dispone del diritto e del potere di concedere la licenza.
Ciascun contributore garantisce che i diritti d'autore sulle modifiche che egli apporta all'opera sono di sua proprietà o che gli sono concessi in licenza e che dispone del diritto e del potere di concedere la licenza.
Ogni volta che il licenziatario accetta la licenza, il licenziante originario e i contributori successivi concedono al licenziatario una licenza sui loro contributi all'opera, secondo le condizioni della presente licenza.
7 Esclusione della garanzia
L'opera è un'opera in divenire, che viene costantemente migliorata grazie all'apporto di diversi contributori. Non si tratta di un'opera finita e può pertanto contenere difetti o errori inerenti a questo tipo di sviluppo.
Per tale ragione, l'opera è concessa in licenza «così com'è» e senza garanzie di alcun genere, ivi incluse, tra le altre, quelle relative all'utilizzazione commerciale, all'idoneità a soddisfare una determinata funzione, all'assenza di difetti o errori, all'accuratezza, all'efficacia, alla non violazione di diritti di proprietà intellettuale diversi dal diritto d'autore come indicato all'articolo 6 della presente licenza.
La presente esclusione di garanzia costituisce parte integrante della licenza e condizione per la concessione di qualsiasi diritto sull'opera.
8 Esclusione di responsabilità
Salvi i casi di comportamenti dolosi o di danni direttamente arrecati a persone fisiche, in nessun caso il licenziante può essere ritenuto responsabile per i danni, di qualsiasi natura, diretti o indiretti, materiali o morali, derivanti dalla licenza o dall'utilizzazione dell'opera, ivi inclusi, tra gli altri, i danni per perdita di avviamento, interruzione del lavoro, guasto o malfunzionamento del computer, perdita di dati e qualsiasi danno commerciale, anche nel caso in cui il licenziante fosse stato informato che tali danni avrebbero potuto verificarsi. Tuttavia, il licenziante sarà ritenuto responsabile a norma delle leggi sulla responsabilità da prodotto in quanto applicabili all'opera.
9 Altre pattuizioni
All'atto della distribuzione dell'opera, il licenziatario ha facoltà di stipulare pattuizioni aggiuntive, definendo gli obblighi o i servizi compatibili con la presente licenza. Tuttavia, nell'accettare tali obblighi, il licenziatario agisce esclusivamente in nome proprio e sotto propria esclusiva responsabilità, e non in nome del licenziante originario o di qualsiasi altro contributore, e solo subordinatamente all'assunzione dell'impegno a risarcire, difendere e tenere indenne ciascun contributore da eventuali responsabilità o richieste risarcitorie rivolte allo stesso contributore in conseguenza delle garanzie o responsabilità aggiuntive assunte dal licenziatario.
10 Accettazione della licenza
Le clausole della presente licenza possono essere accettate cliccando sull'icona «Accetto» posta sotto una finestra che fa apparire il testo della presente licenza o prestando consenso in qualsiasi altro modo simile, conformemente alle disposizioni di legge applicabili. Cliccando su tale icona il licenziatario manifesta la chiara e irrevocabile accettazione della presente licenza e di tutti i suoi termini e condizioni.
Analogamente accetta irrevocabilmente la presente licenza e tutti i suoi termini e condizioni esercitando i diritti concessi dall'articolo 2 della presente Licenza, quali l'utilizzazione dell'opera, la creazione di un'opera derivata o la distribuzione o comunicazione dell'opera o di copie della stessa.
11 Informazione del pubblico
Se il licenziatario procede alla distribuzione o comunicazione dell'opera mediante strumenti di comunicazione elettronica (ad esempio, offrendo di scaricare l'opera da un luogo remoto), il canale di distribuzione o i mezzi di comunicazione (ad esempio un sito web) dovranno fornire al pubblico come minimo le informazioni prescritte dalla normativa applicabile in relazione al licenziante, alla licenza e al modo in cui essa può essere resa accessibile, accettata, conservata e riprodotta da parte del licenziatario.
12 Cessazione della licenza
La licenza e i diritti da essa concessi cesseranno automaticamente di avere effetto ove il licenziatario violi una qualsiasi delle condizioni previste dalla licenza.
Tale cessazione non comporterà cessazione delle licenze concesse a persone che abbiano ricevuto l'opera dal licenziatario a norma della licenza, sempreché tali persone ottemperino integralmente alle clausole della licenza stessa.
13 Varie
Ferme restando le disposizioni dell'articolo 9, la licenza costituisce l'accordo integrale tra le parti in merito all'opera.
Le clausole della licenza che risultino nulle o non possano essere fatte valere in base alla normativa applicabile non incideranno sulla validità o sull'applicabilità della licenza nel suo complesso. Le clausole in questione saranno interpretate o modificate nella misura necessaria a renderle valide e applicabili.
La Commissione europea può pubblicare altre versioni linguistiche o nuove versioni della presente licenza o versioni aggiornate dell'Appendice, nella misura in cui ciò sia necessario e ragionevole, senza ridurre la portata dei diritti accordati dalla licenza. Le nuove versioni della licenza saranno pubblicate con un numero di versione univoco.
Tutte le versioni linguistiche della presente licenza, approvate dalla Commissione europea, hanno valore identico. Le parti possono utilizzare la versione linguistica di loro scelta.
14 Competenza giurisdizionale
Fatti salvi accordi specifici tra le parti:
|
— |
per qualsiasi controversia in ordine all'interpretazione della presente licenza che insorga tra le istituzioni, gli organismi, gli uffici e le agenzie dell'Unione, nella qualità di licenziante, e il licenziatario è competente la Corte di giustizia dell'Unione europea, a norma dell'articolo 272 del trattato sul funzionamento dell'Unione europea; |
|
— |
per qualsiasi controversia che insorga tra altre parti in ordine all'interpretazione della presente licenza è esclusivamente competente il tribunale del luogo in cui il licenziante risiede o esercita la sua attività principale. |
15 Legge applicabile
Fatti salvi accordi specifici tra le parti:
|
— |
la presente Licenza è disciplinata dalla legge dello Stato membro dell'Unione europea nel quale il licenziante è stabilito, risiede o ha la propria sede sociale; |
|
— |
la presente licenza è disciplinata dalla legge belga ove il licenziante non sia stabilito, non risieda o non abbia la propria sede sociale in uno Stato membro dell'Unione europea. |
Appendice
«Licenze compatibili» ai sensi dell'articolo 5 EUPL sono le seguenti:
|
— |
GNU General Public License (GPL) v. 2, v. 3 |
|
— |
GNU Affero General Public License (AGPL) v. 3 |
|
— |
Open Software License (OSL) v. 2.1, v. 3.0 |
|
— |
Eclipse Public License (EPL) v. 1.0 |
|
— |
CeCILL v. 2.0, v. 2.1 |
|
— |
Mozilla Public Licence (MPL) v. 2 |
|
— |
GNU Lesser General Public Licence (LGPL) v. 2.1, v. 3 |
|
— |
Creative Commons Attribution-ShareAlike v. 3.0 Unported (CC BY-SA 3.0) per le opere diverse dal software |
|
— |
European Union Public Licence (EUPL) v. 1.1, v. 1.2 |
|
— |
Québec Free and Open-Source Licence — Reciprocity (LiLiQ-R) or Strong Reciprocity (LiLiQ-R+) |
|
— |
La Commissione può aggiornare la presente Appendice per tener conto delle versioni più recenti delle licenze summenzionate senza produrre una nuova versione dell'EUPL, purché esse garantiscano i diritti concessi dall'articolo 2 della presente licenza e proteggano il codice sorgente coperto dall'appropriazione esclusiva. |
|
— |
Tutte le altre modifiche o aggiunte a tale Appendice richiedono la produzione di una nuova versione dell'EUPL. |