ALLEGATO
Nell'allegato V del regolamento (CE) n. 152/2009, la parte B «DETERMINAZIONE DEI LIVELLI DI DIOSSINE (PCDD/PCDF) E PCB» è sostituita dalla seguente:
«B. DETERMINAZIONE DEI LIVELLI DI DIOSSINE (PCDD/PCDF) E PCB
CAPO I
Metodi di campionamento e interpretazione dei risultati analitici
1. Finalità e campo d'applicazione
I campioni destinati al controllo ufficiale dei livelli di policlorodibenzo-p-diossine (PCDD), policlorodibenzofurani (PCDF), policlorobifenili (PCB) diossina-simili (1) e PCB non diossina-simili negli alimenti per animali sono prelevati secondo le disposizioni dell'allegato I. Si applicano le prescrizioni quantitative relative al controllo delle sostanze o dei prodotti ripartiti in modo uniforme negli alimenti per animali di cui al punto 5.1 dell'allegato I. I campioni globali così ottenuti sono considerati rappresentativi delle partite o sottopartite da cui sono prelevati. Il rispetto dei livelli massimi fissati nella direttiva 2002/32/CE è accertato in base ai livelli determinati nei campioni di laboratorio.
Ai fini della presente parte B, si applicano le definizioni di cui all'allegato I della decisione 2002/657/CE (2) della Commissione.
In aggiunta a tali definizioni, i fini della presente parte B si applicano inoltre le seguenti definizioni:
|
|
“Metodi di screening”: i metodi impiegati per la selezione di campioni con livelli di PCDD/PCDF e di PCB diossina-simili superiori ai livelli massimi o alle soglie di intervento. Essi consentono un alto throughput di campioni a costi commisurati all'efficacia, in modo da aumentare la possibilità di scoprire nuovi incidenti caratterizzati da alta esposizione e rischi per la salute dei consumatori. I metodi di screening si basano su metodi bioanalitici o GC-MS. I risultati derivanti da campioni che superano il valore di cut-off relativamente al controllo di conformità con il livello massimo vanno verificati mediante una nuova analisi completa del campione originale avvalendosi di un metodo di conferma. |
|
|
“Metodi di conferma”: metodi che forniscono informazioni complete o complementari che permettono di identificare e di quantificare in modo inequivoco i PCDD/PCDF e i PCB diossina-simili al livello massimo o, se del caso, alla soglia di intervento. Tali metodi utilizzano la gascromatografia/spettrometria di massa ad alta risoluzione (GC-HRMS) o la gascromatografia/spettrometria di massa tandem (GC-MS/MS). |
2. Conformità della partita o sottopartita al livello massimo
2.1. PCB non diossina-simili
La partita è conforme al livello massimo se il risultato analitico non supera il livello massimo di PCB non diossina-simili fissato dalla direttiva 2002/32/CE, tenendo conto dell'incertezza di misura.
La partita non è conforme al livello massimo se il risultato analitico upperbound (3), confermato da una doppia analisi (4), supera il livello massimo fissato dalla direttiva 2002/32/CE, tenendo conto dell'incertezza di misura. Per verificare la conformità è utilizzata la media delle due determinazioni tenendo conto dell'incertezza di misura.
Può tenersi conto dell'incertezza di misura in uno dei seguenti modi:
|
— |
calcolando l'incertezza estesa per mezzo di un fattore di copertura 2 corrispondente ad un livello di fiducia del 95 % circa. Una partita o sottopartita non è conforme se il valore misurato meno U supera il livello massimo, |
|
— |
stabilendo il limite di decisione (CCα) come indicato al punto 3.1.2.5 dell'allegato I della decisione 2002/657/CE. Una partita o sottopartita non è conforme se il valore misurato è pari o superiore al CCα. |
I paragrafi 1, 2 e 3 si applicano al risultato analitico ottenuto sul campione utilizzato per il controllo ufficiale. Per le analisi effettuate nel quadro di procedure di ricorso o di arbitrato valgono le norme nazionali.
2.2. PCDD/PCDF e PCB diossina-simili
La partita è conforme ai livelli massimi se il risultato di una singola analisi,
|
— |
eseguita con un metodo di screening, il cui tasso di falsi conformi è inferiore al 5 %, indica che il livello non supera i livelli massimi fissati dalla direttiva 2002/32/CE rispettivamente per PCDD/PCDF e per la somma di PCDD/PCDF e PCB diossina-simili, |
|
— |
eseguita con un metodo di conferma, non supera i livelli massimi fissati dalla direttiva 2002/32/CE rispettivamente per PCDD/PCDF e per la somma di PCDD/PCDF e PCB diossina-simili tenendo conto dell'incertezza di misura. |
Per i dosaggi di screening è stabilito un valore di cut-off per le decisioni sulla conformità del campione ai livelli massimi stabiliti rispettivamente per PCDD/PCDF o per la somma di PCDD/PCDF e PCB diossina-simili.
La partita non è conforme al livello massimo se il risultato analitico upperbound (5) ottenuto con un metodo di conferma e confermato da una doppia analisi supera il livello massimo fissato dalla direttiva 2002/32/CE tenendo conto dell'incertezza di misura (6). Per verificare la conformità è utilizzata la media delle due determinazioni tenendo conto dell'incertezza di misura.
Può tenersi conto dell'incertezza di misura in uno dei seguenti modi:
|
— |
calcolando l'incertezza estesa per mezzo di un fattore di copertura 2 corrispondente ad un livello di fiducia del 95 % circa. Una partita o sottopartita non è conforme se il valore misurato meno U supera il livello massimo. Nel caso di una determinazione separata di PCDD/PCDF e PCB diossina-simili, la somma dell'incertezza estesa stimata dei risultati analitici separati di PCDD/PCDF e PCB diossina-simili è utilizzata per la somma di PCDD/PCDF e PCB diossina-simili, |
|
— |
stabilendo il limite di decisione (CCα) come indicato al punto 3.1.2.5 dell'allegato I della decisione 2002/657/CE. Una partita o sottopartita non è conforme se il valore misurato è pari o superiore al CCα. |
I paragrafi da 1 a 4 si applicano al risultato analitico ottenuto sul campione utilizzato per il controllo ufficiale. Per le analisi effettuate nel quadro di procedure di ricorso o di arbitrato valgono le norme nazionali.
3. Risultati eccedenti le soglie d'intervento di cui all'allegato II della direttiva 2002/32/CE
Le soglie di intervento fungono da strumento per la selezione dei campioni nei casi in cui è necessario identificare una fonte di contaminazione e prendere provvedimenti per la sua riduzione o eliminazione. I metodi di screening stabiliscono appropriati valori di cut-off per la selezione di tali campioni. Qualora siano necessarie azioni significative per identificare una fonte e ridurre o eliminare la contaminazione può essere opportuno confermare il superamento delle soglie di intervento mediante una doppia analisi eseguita con un metodo di conferma e tenendo conto dell'incertezza di misura (7).
CAPO II
Preparazione dei campioni e prescrizioni per i metodi di analisi impiegati nel controllo ufficiale dei livelli di diossine (PCDD/PCDF) e di PCB diossina-simili negli alimenti per animali
1. Campo d'applicazione
Le prescrizioni di cui al presente capo si applicano alle analisi dei prodotti destinati all'alimentazione degli animali effettuate ai fini del controllo ufficiale dei livelli di policlorodibenzo-p-diossine (PCDD) e policlorodibenzofurani (PCDF) 2,3,7,8-sostituiti e di policlorobifenili diossina-simili (PCB diossina-simili) e per altre finalità di legge.
Il monitoraggio della presenza di PCDD/PCDF e di PCB diossina-simili negli alimenti per animali può essere effettuato con due differenti tipologie di metodi analitici:
|
a) |
Metodi di screening L'obiettivo dei metodi di screening è selezionare i campioni con livelli di PCDD/PCDF e PCB diossina-simili superiori ai livelli massimi o alle soglie di intervento. I metodi di screening dovrebbero consentire un alto throughput di campioni a costi commisurati all'efficacia, in modo da accrescere la possibilità di scoprire nuovi incidenti con alta esposizione e rischi per la salute dei consumatori. La loro applicazione ha lo scopo di evitare i risultati falsi conformi. I metodi di screening possono comprendere metodi bioanalitici e metodi GC-MS. I metodi di screening confrontano il risultato analitico con un valore di cut-off e danno una decisione sì/no indicativa del possibile superamento del livello massimo o della soglia di intervento. La concentrazione di PCDD/PCDF e la somma di PCDD/PCDF e PCB diossina-simili nei campioni che si sospetta non siano conformi al livello massimo deve essere determinata/confermata mediante un metodo di conferma. I metodi di screening possono inoltre fornire un'indicazione dei livelli di PCDD/PCDF e di PCB diossina-simili presenti nel campione. In caso di applicazione di metodi di screening bioanalitici il risultato è espresso in equivalenti bioanalitici (BEQ), mentre in caso di applicazione di metodi fisico-chimici GC-MS tale risultato è espresso in equivalenti tossici (TEQ). I risultati numerici dei metodi di screening sono atti a dimostrare la conformità o la sospetta non conformità delle soglie di intervento nonché il loro superamento; forniscono inoltre un'indicazione del range dei livelli in caso di follow-up con metodi di conferma. Non sono idonei per attività quali la valutazione dei livelli di background, la stima dell'assunzione, il monitoraggio delle tendenze nel tempo dei livelli o la ri-valutazione dei livelli massimi e delle soglie di intervento. |
|
b) |
Metodi di conferma I metodi di conferma consentono di identificare e di quantificare in modo inequivoco i PCDD/PCDF e i PCB diossina-simili presenti in un campione e forniscono informazioni complete a livello di congeneri. Questi metodi permettono pertanto di controllare i livelli massimi e le soglie di intervento, compresa la conferma dei risultati ottenuti con i metodi di screening. I risultati possono inoltre essere utilizzati per altri scopi quali la determinazione dei livelli di background bassi nel controllo degli alimenti per animali, il monitoraggio delle tendenze nel tempo, la valutazione dell'esposizione e la creazione di una base di dati per l'eventuale ri-valutazione dei livelli massimi e delle soglie di intervento. Essi sono importanti anche per stabilire pattern di congeneri al fine di identificare la fonte di una eventuale contaminazione. Tali metodi impiegano la GC-HRMS. Al fine di confermare la conformità o la non conformità con il livello massimo può essere impiegata anche la GC-MS/MS. |
2. Premessa
Per il calcolo delle concentrazioni di equivalenti tossici (TEQ), le concentrazioni delle singole sostanze in un dato campione sono moltiplicate per il rispettivo fattore di equivalenza tossica (TEF) [cfr. nota (1)* al Capo I] e quindi sommate per ottenere la concentrazione totale di composti diossina-simili espressa in TEQ.
Ai fini della presente parte B, il limite di quantificazione specifico accettato di un singolo congenere è il tenore più basso dell'analita che può essere misurato con ragionevole certezza statistica nel rispetto dei criteri di identificazione definiti in norme internazionalmente riconosciute quali, ad esempio, la norma EN 16215:2012 (Alimenti per animali — Determinazione di diossine e PCB diossina-simili mediante GC-HRMS e di PCB indicatori mediante GC-HRMS) e/o nei metodi EPA 1613 e 1688 riveduti.
Il limite di quantificazione di un singolo congenere può essere identificato come:
|
a) |
la concentrazione di un analita nell'estratto di un campione che produce una risposta strumentale a due diversi ioni da monitorare con un rapporto S/R (segnale/rumore) di 3:1 per il segnale meno intenso dei dati grezzi; o |
|
b) |
il punto di concentrazione più basso su una curva di calibrazione che produce una deviazione accettabile (≤ 30 %) e coerente (misurata almeno all'inizio e alla fine della serie analitica di campioni) rispetto al fattore di risposta relativo medio calcolato per tutti i punti sulla curva di calibrazione per ciascuna serie di campioni se per motivi tecnici il calcolo del rapporto segnale/rumore non fornisce risultati affidabili. Il limite di quantificazione è calcolato a partire dal punto di concentrazione più basso, tenendo conto del recupero degli standard interni e delle grandezze dei campioni. |
I metodi di screening bioanalitici non danno risultati al livello del congenere, ma solo un'indicazione (8) del livello di TEQ espresso in equivalenti bioanalitici (BEQ), in considerazione del fatto che non tutti i composti presenti in un estratto di campione che produce una risposta nel test possono soddisfare tutte le prescrizioni del principio di TEQ.
I metodi di screening e di conferma possono essere applicati per il controllo di una determinata matrice solo se sono sufficientemente sensibili per rilevare i livelli in modo attendibile alla soglia d'intervento o al livello massimo.
3. Prescrizioni di garanzia della qualità
3.1. Devono essere adottate misure per evitare contaminazioni incrociate durante ogni fase del campionamento e dell'analisi.
3.2. I campioni devono essere conservati e trasportati in contenitori di vetro, alluminio, polipropilene o polietilene, che ne permettano la conservazione senza influenzare i livelli di PCDD/PCDF e di PCB diossina-simili. Le tracce di polvere di carta devono essere rimosse dal contenitore.
3.3. La conservazione e il trasporto deve avvenire in modo da preservare l'integrità del campione di alimenti per animali.
3.4. Se del caso, macinare finemente e mescolare accuratamente ogni campione di laboratorio utilizzando un metodo che garantisca una completa omogeneizzazione (ad esempio, macinazione che consenta il passaggio attraverso un setaccio a maglie di 1 mm); prima della macinazione, i campioni devono essere asciugati, qualora il tenore di umidità sia troppo elevato.
3.5. I reagenti, la vetreria e le apparecchiature sono sottoposti a controlli per evitare che influenzino i risultati espressi in TEQ o BEQ.
3.6. È effettuata un'analisi in bianco, eseguendo l'intera procedura analitica senza il campione.
3.7. Per i metodi bioanalitici occorre verificare che la vetreria e i solventi utilizzati nell'analisi siano esenti da composti che interferiscono con la rilevazione dei composti bersaglio nel working range. La vetreria deve essere risciacquata con solventi o riscaldata a temperature che consentano di eliminare dalla superficie le tracce di PCDD/PCDF, composti diossina-simili e composti interferenti.
3.8. La quantità del campione utilizzato per l'estrazione deve essere sufficiente a permettere la conformità alle prescrizioni in relazione ad un working range sufficientemente basso comprendente le concentrazioni di livelli massimi o della soglia d'intervento.
3.9. Le procedure specifiche di preparazione dei campioni utilizzate per i prodotti considerati sono conformi a linee guida internazionalmente accettate.
4. Prescrizioni per i laboratori
4.1. Come prescritto dal regolamento (CE) n. 882/2004, i laboratori sono accreditati da un organismo riconosciuto operante in conformità alla Guida ISO 58, per garantire che applichino alle loro analisi le procedure di assicurazione qualità. I laboratori devono essere accreditati in base alla norma EN ISO/IEC 17025.
4.2. La competenza del laboratorio è dimostrata dalla partecipazione regolare ed efficace a studi condotti in collaborazione con altri laboratori per la determinazione di PCDD/PCDF e di PCB diossina-simili nelle matrici di alimenti per animali e nei range di concentrazioni corrispondenti.
4.3. I laboratori che applicano metodi di screening per il controllo di routine dei campioni instaurano una stretta cooperazione con i laboratori che applicano il metodo di conferma per il controllo della qualità e per la conferma del risultato analitico di campioni sospetti.
5. Prescrizioni di base per la procedura di analisi per le diossine (PCDD/PCDF) e i PCB diossina-simili
5.1. Working range e limiti di quantificazione bassi
Per i PCDD/PCDF le quantità rilevabili devono situarsi nel range superiore del femtogrammo (10-15 g), data l'estrema tossicità di alcuni di questi composti. Per la maggior parte dei congeneri dei PCB è già sufficiente il limite di quantificazione dell'ordine del nanogrammo (10-9 g). Per la misura dei congeneri più tossici dei PCB diossina-simili (in particolare i congeneri non orto-sostituiti) il limite inferiore del working range deve raggiungere i livelli bassi del picogrammo (10-12 g). Per tutti gli altri congeneri dei PCB è sufficiente un limite di quantificazione dell'ordine del nanogrammo (10-9 g).
5.2. Alta selettività (specificità)
5.2.1. Occorre distinguere tra PCDD/PCDF e PCB diossina-simili e una moltitudine di altri composti coestratti che possono generare un'interferenza, presenti anche in concentrazioni superiori di vari ordini di grandezza rispetto a quelle degli analiti di interesse. Per i metodi GC-MS è necessaria una differenziazione tra i vari congeneri, in particolare tra quelli tossici (ad esempio, i diciassette PCDD/PCDF 2,3,7,8-sostituiti e i dodici PCB diossina-simili) e gli altri congeneri.
5.2.2. I metodi bioanalitici permettono di rilevare i composti bersaglio come somma di PCDD/PCDF e/o PCB diossina-simili. Il clean-up del campione ha lo scopo di eliminare i composti che causano risultati falsi non conformi o che possono diminuire la risposta, causando risultati falsi conformi.
5.3. Alta accuratezza (esattezza e precisione, recupero apparente del biodosaggio)
5.3.1. Per i metodi GC-MS la determinazione fornisce una stima valida dell'esatta concentrazione in un campione. È necessaria un'alta accuratezza per evitare che il risultato dell'analisi di un campione sia respinto a causa della scarsa affidabilità del livello di TEQ determinato. L'accuratezza è espressa come esattezza (differenza tra il valore medio misurato per un analita in un materiale certificato e il suo valore certificato, espressa in percentuale di tale valore) e precisione (deviazione standard relativa RSDR calcolata in base a risultati ottenuti in condizioni di riproducibilità).
5.3.2. Per i metodi bioanalitici è determinato il recupero apparente del biodosaggio. Il recupero apparente del biodosaggio è il livello di BEQ calcolato a partire dalla curva di calibrazione della TCDD o del PCB 126 corretto del bianco e poi diviso per il livello TEQ determinato dal metodo di conferma. Mira a correggere fattori quali la perdita di PCDD/PCDF e composti diossina-simili durante le fasi di estrazione e clean-up, composti coestratti che aumentano o diminuiscono la risposta (effetti agonistici e antagonistici), la qualità del fit della curva o le differenze tra i valori TEF (fattore di equivalenza tossica) e REP (potenzialità relativa). Il recupero apparente del biodosaggio è calcolato a partire da idonei campioni di riferimento con pattern di congeneri rappresentativi attorno al livello di interesse.
5.4. Validazione nel range del livello massimo e misure generali di controllo della qualità
5.4.1. I laboratori dimostrano la performance di un metodo nel range del livello massimo, ad esempio 0,5 ×, 1 × e 2 × il livello massimo con un coefficiente di variazione accettabile per le analisi ripetute, durante la procedura di validazione e durante le analisi di routine.
5.4.2. Controlli regolari in bianco ed esperimenti spiking o analisi di campioni di controllo (di preferenza, se disponibile, materiale di riferimento certificato) sono effettuati come misure interne di controllo della qualità. Per i controlli in bianco, gli esperimenti spiking o le analisi dei campioni di controllo, sono registrati e verificati diagrammi di controllo qualità per assicurare che la performance analitica sia conforme alle prescrizioni.
5.5. Limite di quantificazione
5.5.1. Per un metodo di screening bioanalitico non è indispensabile fissare il limite di quantificazione, ma il metodo deve dimostrare di poter differenziare tra il valore bianco e il valore di cut-off. Quando è fornito un livello BEQ, è fissato un livello di reporting per trattare i campioni che presentano una risposta al di sotto di tale livello. Il livello di reporting è dimostrato diverso dai campioni bianchi di procedura almeno di un fattore tre, con una risposta al di sotto del working range. È quindi calcolato a partire da campioni contenenti i composti bersaglio attorno al livello minimo richiesto, e non da un rapporto S/R o un dosaggio bianco.
5.5.2. Il limite di quantificazione per un metodo di conferma è dell'ordine di circa un quinto del livello massimo.
5.6. Criteri analitici
Affinché i metodi di conferma o di screening diano risultati affidabili, devono essere soddisfatti i seguenti criteri nel range del livello massimo o della soglia di intervento rispettivamente per il valore TEQ o BEQ, determinati come TEQ totale (somma di PCDD/PCDF e PCB diossina-simili) o separatamente per PCDD/PCDF e PCB diossina-simili.
|
|
Screening con metodi bioanalitici o fisico-chimici |
Metodi di conferma |
|
Tasso di falsi conformi (9) |
< 5 % |
|
|
Esattezza |
|
da – 20 % a + 20 % |
|
Ripetibilità (RSDr) |
< 20 % |
|
|
Riproducibilità in laboratorio (RSDR) |
< 25 % |
< 15 % |
5.7. Prescrizioni specifiche per i metodi di screening
5.7.1. Per lo screening possono essere utilizzati metodi GC-MS e metodi bioanalitici. Per i metodi GC-MS valgono le prescrizioni indicate al punto 6. Per i metodi bioanalitici cellulari valgono le prescrizioni specifiche indicate al punto 7.
5.7.2. I laboratori che applicano metodi di screening per il controllo di routine dei campioni instaurano una stretta cooperazione con i laboratori che applicano il metodo di conferma.
5.7.3. Durante l'analisi di routine la performance del metodo di screening deve essere verificata mediante un controllo della qualità analitica e una validazione del metodo on-going. È necessario un programma continuo per il controllo dei risultati conformi.
5.7.4. Controllo dell'eventuale soppressione della risposta cellulare e della citotossicità:
Il 20 % degli estratti del campione è misurato in screening di routine senza e con aggiunta di 2,3,7,8-TCDD corrispondente al livello massimo o alla soglia di intervento, per verificare se la risposta è soppressa da sostanze interferenti presenti nell'estratto del campione. La concentrazione misurata del campione spiked è comparata con la somma della concentrazione dell'estratto unspiked e della concentrazione dello spiking. Se la concentrazione misurata è inferiore di più del 25 % alla concentrazione (somma) calcolata, si ha un'indicazione di una potenziale soppressione del segnale e il rispettivo campione deve essere sottoposto ad analisi di conferma GC-HRMS. I risultati sono monitorati in diagrammi di controllo qualità.
5.7.5. Controllo di qualità sui campioni conformi:
Sono confermati mediante GC-HRMS dal 2 al 10 % circa dei campioni conformi, secondo la matrice del campione e l'esperienza di laboratorio.
5.7.6. Determinazione dei tassi di falsi conformi a partire dai dati di controllo di qualità:
È determinato il tasso dei risultati falsi conformi dello screening di campioni al di sotto e al di sopra del livello massimo o della soglia di intervento. I tassi reali di falsi conformi sono inferiori al 5 %. Se si dispone di un minimo di 20 risultati confermati per matrice/gruppo di matrici dal controllo di qualità dei campioni conformi, da questa base di dati sono tratte conclusioni sul tasso di falsi conformi. I risultati dei campioni analizzati in ring trial o durante incidenti di contaminazione, che coprono un range di concentrazione fino a per esempio 2 × il livello massimo (LM), possono essere inclusi nel minimo dei 20 risultati richiesti per la valutazione del tasso di falsi conformi. I campioni coprono i pattern di congeneri più frequenti, rappresentanti varie fonti.
Anche se i dosaggi di screening sono diretti principalmente a individuare campioni che superano la soglia d'intervento, il criterio per la determinazione dei tassi di falsi conformi è il livello massimo, tenendo conto dell'incertezza di misura del metodo di conferma.
5.7.7. I campioni dello screening potenzialmente non conformi sono sempre verificati con una nuova analisi completa del campione originale mediante un metodo analitico di conferma. Questi campioni possono anche essere utilizzati per valutare il tasso di risultati falsi non conformi. Per i metodi di screening, il tasso di risultati falsi non conformi è la frazione dei risultati confermati conformi dall'analisi di conferma, quando nello screening precedente il campione è stato dichiarato potenzialmente non conforme. La valutazione della vantaggiosità del metodo di screening si basa sul confronto dei campioni falsi non conformi con il numero totale di campioni controllati. Tale tasso deve essere sufficientemente basso da rendere vantaggioso l'uso di uno strumento di screening.
5.7.8. Almeno in condizioni di validazione, i metodi bioanalitici forniscono una valida indicazione del livello di TEQ, calcolato ed espresso in BEQ.
Anche per i metodi bioanalitici applicati in condizioni di ripetibilità, la RSDr intralaboratorio è di norma inferiore alla riproducibilità RSDR.
6. Prescrizioni specifiche per i metodi GC-MS da rispettare a fini di screening o di conferma
6.1. Differenze accettabili tra i risultati OMS-TEQ upperbound e lowerbound
La differenza tra il livello upperbound e il livello lowerbound non deve essere superiore al 20 % per la conferma del superamento dei livelli massimi o, ove opportuno, delle soglie di intervento.
6.2. Controllo dei recuperi
6.2.1. All'inizio del metodo d'analisi, ad esempio prima dell'estrazione, devono essere aggiunti standard interni di PCDD/PCDF 2,3,7,8-clorosostituiti e marcati con 13C e standard interni di PCB diossina-simili marcati con 13C per convalidare la procedura d'analisi. Deve essere aggiunto almeno un congenere per ciascuno dei gruppi omologhi da tetra a octaclorati di PCDD/PCDF e almeno un congenere per ciascuno dei gruppi omologhi di PCB diossina-simili (in alternativa, almeno un congenere per ciascuna funzione di registrazione di ioni selezionati tramite spettrometria di massa utilizzata per il monitoraggio di PCDD/PCDF e PCB diossina-simili). Nel caso dei metodi di conferma, sono utilizzati tutti i 17 standard interni di PCDD/PCDF 2,3,7,8-sostituiti marcati con 13C e tutti i 12 standard interni di PCB diossina-simili marcati con 13C.
6.2.2. Sono inoltre determinati i fattori di risposta relativa per i congeneri ai quali non è aggiunto alcun analogo marcato con 13C, utilizzando appropriate soluzioni di calibrazione.
6.2.3. Per gli alimenti per animali di origine vegetale e per gli alimenti per animali di origine animale con tenore di grassi inferiore al 10 %, l'aggiunta di standard interni prima dell'estrazione è obbligatoria. Per gli alimenti per animali di origine animale con tenore di grassi superiore al 10 %, gli standard interni possono essere aggiunti prima o dopo l'estrazione dei grassi. È effettuata un'appropriata validazione dell'efficienza dell'estrazione, a seconda della fase in cui sono introdotti gli standard interni e del modo in cui i risultati sono espressi (sulla base del prodotto o dei grassi).
6.2.4. Prima dell'analisi GC-MS sono aggiunti 1 o 2 standard di recupero (surrogato).
6.2.5. È necessario il controllo del recupero. Per i metodi di conferma, i recuperi dei singoli standard interni sono compresi tra il 60 % e il 120 %. Recuperi inferiori o superiori per singoli congeneri, in particolare per alcune dibenzo-p-diossine e alcuni dibenzofurani epta e octaclorati, sono accettabili, purché il loro contributo al valore TEQ non superi il 10 % del valore totale TEQ (in base alla somma di PCDD/PCDF e PCB diossina-simili). Per i metodi di screening GC-MS i recuperi sono compresi tra il 30 % e il 140 %.
6.3. Rimozione delle sostanze interferenti
|
— |
La separazione di PCDD/PCDF dai composti clorurati interferenti, quali i PCB non diossina-simili e gli eteri clorurati di difenile, è effettuata mediante appropriate tecniche cromatografiche (di preferenza con una colonna di florisil, d'allumina e/o di carbone). |
|
— |
La separazione gascromatografica degli isomeri è < 25 % da picco a picco tra 1,2,3,4,7,8-HxCDF e 1,2,3,6,7,8-HxCDF. |
6.4. Calibrazione con curva standard
Il range della curva di calibrazione copre il corrispondente range del livello massimo o delle soglie d'intervento.
6.5. Criteri specifici per i metodi di conferma
|
— |
Per la GC-HRMS:
|
|
— |
Per la GC-MS/MS:
|
7. Prescrizioni specifiche per i metodi bioanalitici
I metodi bioanalitici sono metodi basati su principi biologici come i dosaggi cellulari, i dosaggi di recettori o gli immunodosaggi. Le prescrizioni figuranti in questo punto 7 si riferiscono ai metodi bioanalitici in generale.
Un metodo di screening classifica in via di principio un campione come conforme o sospetto non conforme. Per questo, il livello di BEQ calcolato è comparato al valore di cut-off (cfr. 7.3). I campioni al di sotto del valore di cut-off sono dichiarati conformi, i campioni uguali o superiori al valore di cut-off sono dichiarati sospetti non conformi e devono essere analizzati con un metodo di conferma. In pratica, un livello di BEQ corrispondente a 2/3 del livello massimo può servire come valore di cut-off purché si garantisca un tasso di falsi conformi inferiore al 5 % e un tasso accettabile di risultati falsi non conformi. Con livelli massimi distinti per PCDD/PCDF e per la somma di PCDD/PCDF e PCB diossina-simili, il controllo della conformità dei campioni senza frazionamento richiede appropriati valori di cut-off dei biodosaggi per i PCDD/PCDF. Per il controllo dei campioni che superano le soglie d'intervento una percentuale appropriata della rispettiva soglia d'intervento può fungere da valore di cut-off.
Inoltre, nel caso di alcuni metodi bioanalitici, un livello indicativo espresso in BEQ può essere dato per i campioni compresi nel working range e che superano il limite di reporting (cfr. 7.1.1 e 7.1.6).
7.1. Valutazione della risposta al test
7.1.1. Prescrizioni generali
|
— |
Nel calcolo delle concentrazioni a partire da una curva di calibrazione della TCDD, i valori agli estremi inferiore e superiore della curva presenteranno una forte variazione [coefficiente di variazione (CV) elevato]. Il working range è costituito dalla zona in cui il CV è inferiore al 15 %. L'estremo inferiore del working range (limite di reporting) deve inoltre essere fissato al di sopra dei bianchi di procedura almeno di un fattore tre. L'estremo superiore del working range è di norma rappresentato dal valore EC70 (70 % della concentrazione effettiva massima), ma è più basso se il CV è superiore al 15 % in questo range. Il working range è stabilito durante la validazione. I valori di cut-off (cfr. punto 7.3) devono situarsi entro il working range. |
|
— |
Le soluzioni standard e gli estratti dei campioni sono testati almeno in doppio. Nel caso di uso di doppi, una soluzione standard o un estratto di controllo testati in 4-6 pozzetti distribuiti sulla piastra producono una risposta o una concentrazione (possibile solo nel working range) in base a un CV < 15 %. |
7.1.2. Calibrazione
7.1.2.1. Calibrazione con curva standard
|
— |
I livelli nei campioni sono stimati comparando la risposta al test a una curva di calibrazione della TCDD (o del PCB 126 o di una miscela standard PCDD/PCDF/PCB diossina-simili) per calcolare il livello BEQ nell'estratto e poi nel campione. |
|
— |
Le curve di calibrazione contengono da 8 a 12 concentrazioni (almeno in doppio) con concentrazioni sufficienti nella parte inferiore della curva (working range). Particolare attenzione è prestata alla qualità del fit della curva nel working range. Il valore R2, come tale, è di scarsa o nessuna utilità nella stima della bontà del fit in regressione non lineare. Un migliore fit è ottenuto minimizzando la differenza tra i livelli calcolati e osservati nel working range della curva, ad esempio diminuendo la somma dei quadrati residui. |
|
— |
Il livello stimato nell'estratto del campione è quindi corretto del livello BEQ calcolato per un campione bianco di matrice/solvente (per tener conto delle impurità provenienti dai solventi e dalle sostanze chimiche utilizzate) e del recupero apparente (calcolato a partire dal livello BEQ di idonei campioni di riferimento con pattern di congeneri rappresentativi attorno al livello massimo o alla soglia di intervento). Per effettuare una correzione del recupero, il recupero apparente deve situarsi entro il range richiesto (cfr. punto 7.1.4). I campioni di riferimento utilizzati per la correzione del recupero devono essere conformi alle prescrizioni di cui al punto 7.2. |
7.1.2.2. Calibrazione con campioni di riferimento
In alternativa, può essere utilizzata una curva di calibrazione preparata a partire da almeno 4 campioni di riferimento (cfr. punto 7.2.4: un bianco matrice, più tre campioni di riferimento a 0,5 ×, 1,0 × e 2,0 × il livello massimo o la soglia di intervento), il che rende superflua la correzione del bianco e del recupero. In tal caso, la risposta al test corrispondente a 2/3 del livello massimo (cfr. punto 7.3) può essere calcolata direttamente a partire da questi campioni e utilizzata come valore di cut-off. Per il controllo dei campioni che superano le soglie d'intervento, il valore di cut-off può essere costituito da una percentuale appropriata di queste soglie d'intervento.
7.1.3. Determinazione separata di PCDD/PCDF e PCB diossina-simili
Gli estratti possono essere suddivisi in frazioni contenenti PCDD/PCDF e PCB diossina-simili, il che permette un'identificazione separata dei livelli TEQ (in BEQ) di PCDD/PCDF e PCB diossina-simili. Per valutare i risultati per la frazione contenente PCB diossina-simili è da utilizzarsi di preferenza una curva di calibrazione standard del PCB 126.
7.1.4. Recuperi apparenti del biodosaggio
Il “recupero apparente del biodosaggio” è calcolato a partire da idonei campioni di riferimento con pattern di congeneri rappresentativi attorno al livello massimo o alla soglia di intervento ed espresso in percentuale del livello BEQ rispetto al livello TEQ. A seconda del tipo di dosaggio e di TEF (10) utilizzati, le differenze tra fattori TEF e REP per i PCB diossina-simili possono causare per i PCB diossina-simili recuperi apparenti bassi rispetto ai PCDD/PCDF. Pertanto, se è eseguita una determinazione separata di PCDD/PCDF e PCB diossina-simili, i recuperi apparenti del biodosaggio sono: per i PCB diossina-simili dal 20 % al 60 %, per i PCDD/PCDF dal 50 % al 130 % (i range valgono per la curva di calibrazione della TCDD). Poiché il contributo dei PCB diossina-simili alla somma di PCDD/PCDF e PCB diossina-simili può variare secondo le matrici e i campioni, i recuperi apparenti del biodosaggio per la somma di PCDD/PCDF e PCB diossina-simili riflettono questi range e sono compresi tra il 30 % e il 130 %. Ogni modifica sostanziale dei valori di TEF per PCDD/PCDF e PCB diossina-simili nella legislazione dell'Unione richiede la revisione di questi range.
7.1.5. Controllo dei recuperi per il clean-up
La perdita di composti durante il clean-up è verificata durante la validazione. Un campione bianco spiked con una miscela dei diversi congeneri è sottoposto a clean-up (almeno n = 3) e il recupero e la variabilità sono verificati mediante un metodo di conferma. Il recupero è compreso tra 60 % e 120 %, in particolare per i congeneri che contribuiscono per più del 10 % al livello di TEQ presente in varie miscele.
7.1.6. Limite di reporting
Per i livelli BEQ un limite di reporting è determinato a partire dai corrispondenti campioni matrice implicanti pattern di congeneri tipici, ma non dalla curva di calibrazione degli standard, data la scarsa precisione nel range inferiore della curva. Occorre tenere conto degli effetti dell'estrazione e del clean-up. Il limite di reporting è fissato al di sopra dei bianchi di procedura di almeno un fattore tre.
7.2. Uso di campioni di riferimento
7.2.1. I campioni di riferimento rappresentano la matrice campione, i pattern di congeneri e i range di concentrazione per PCDD/PCDF e PCB diossina-simili attorno al livello massimo o alla soglia di intervento.
7.2.2. Un bianco matrice e, se questo non è possibile, un bianco di procedura e un campione di riferimento al livello massimo o alla soglia di intervento sono inclusi in ciascuna serie di test. Questi campioni sono estratti e testati nello stesso momento in condizioni identiche. Il campione di riferimento presenta una risposta notevolmente più elevata del campione in bianco, in modo da garantire l'idoneità del test. Questi campioni possono essere utilizzati per le correzioni del bianco e del recupero.
7.2.3. I campioni di riferimento scelti per effettuare una correzione del recupero sono rappresentativi dei campioni da analizzare, il che significa che i pattern di congeneri non possono portare a una sottostima dei livelli.
7.2.4. Campioni di riferimento supplementari, per esempio a 0,5 × e 2 × il livello massimo o la soglia di intervento possono essere inclusi per dimostrare la performance adeguata del test nel range di interesse per il controllo del livello massimo o della soglia di intervento. Combinati, questi campioni possono essere utilizzati per calcolare i livelli BEQ nei campioni da analizzare (cfr. punto 7.1.2.2).
7.3. Determinazione dei valori di cut-off
È stabilito il rapporto tra i risultati bioanalitici in BEQ e i risultati del metodo di conferma in TEQ, ad esempio mediante esperimenti di calibrazione matrix-matched, con campioni di riferimento spiked a 0, 0,5 ×, 1 × e 2 × il livello massimo (LM), con 6 ripetizioni ad ogni livello (n = 24). I fattori di correzione (bianco e recupero) possono essere stimati in base a questo rapporto, ma sono controllati come stabilito al punto 7.2.2.
Sono stabiliti valori di cut-off per la decisione sulla conformità del campione ai livelli massimi o per il controllo delle soglie d'intervento, se pertinente, con i rispettivi livelli massimi o le rispettive soglie di intervento fissati singolarmente per PCDD/PCDF e PCB diossina-simili o per la somma di PCDD/PCDF e PCB diossina-simili. Essi sono rappresentati dall'endpoint inferiore della distribuzione dei risultati bioanalitici (corretti del bianco e del recupero) corrispondente al limite di decisione del metodo di conferma in base ad un livello di fiducia del 95 %, implicante un tasso di falsi conformi < 5 % e a una RSDR < 25 %. Il limite di decisione del metodo di conferma è il livello massimo, tenendo conto dell'incertezza di misura.
Il valore di cut-off (in BEQ) può essere calcolato in uno dei modi indicati ai punti 7.3.1, 7.3.2 e 7.3.3. (cfr. figura 1):
7.3.1. Uso della banda inferiore dell'intervallo di predizione del 95 % al limite di decisione del metodo di conferma.

dove:
|
BEQDL |
BEQ corrispondente al limite di decisione del metodo di conferma, ossia al livello massimo compresa l'incertezza di misura |
|
sy,x |
deviazione standard residua |
|
t α,f = m-2 |
fattore di Student (α = 5 %, f = gradi di libertà, un lato) |
|
m |
numero totale dei punti di calibrazione (indice j) |
|
n |
numero di ripetizioni ad ogni livello |
|
xi |
concentrazione del campione (in TEQ) del punto di calibrazione i determinato con un metodo di conferma |
|
|
media delle concentrazioni (in TEQ) di tutti i campioni di calibrazione |
|
|
Qxx = parametro somma dei quadrati, i = indice per il punto di calibrazione i |
7.3.2. Calcolo a partire dai risultati bioanalitici (corretti del bianco e del recupero) di analisi multiple di campioni (n ≥ 6) contaminati al limite di decisione del metodo di conferma, come endpoint inferiore della distribuzione dei dati al corrispondente valore BEQ medio
Valore di cut-off = BEQDL – 1.64xSDR
dove:
|
SDR |
deviazione standard dei risultati del biodosaggio a BEQDL, misurata in condizioni di riproducibilità in laboratorio |
7.3.3. Calcolo come valore medio dei risultati bioanalitici (in BEQ, corretto del bianco e del recupero) a partire dall'analisi multipla di campioni (n ≥ 6) contaminati a 2/3 del livello massimo o della soglia di intervento, sulla base dell'osservazione che questo livello sarà prossimo al valore di cut-off determinato come indicato ai punti 7.3.1 o 7.3.2.
Figura 1
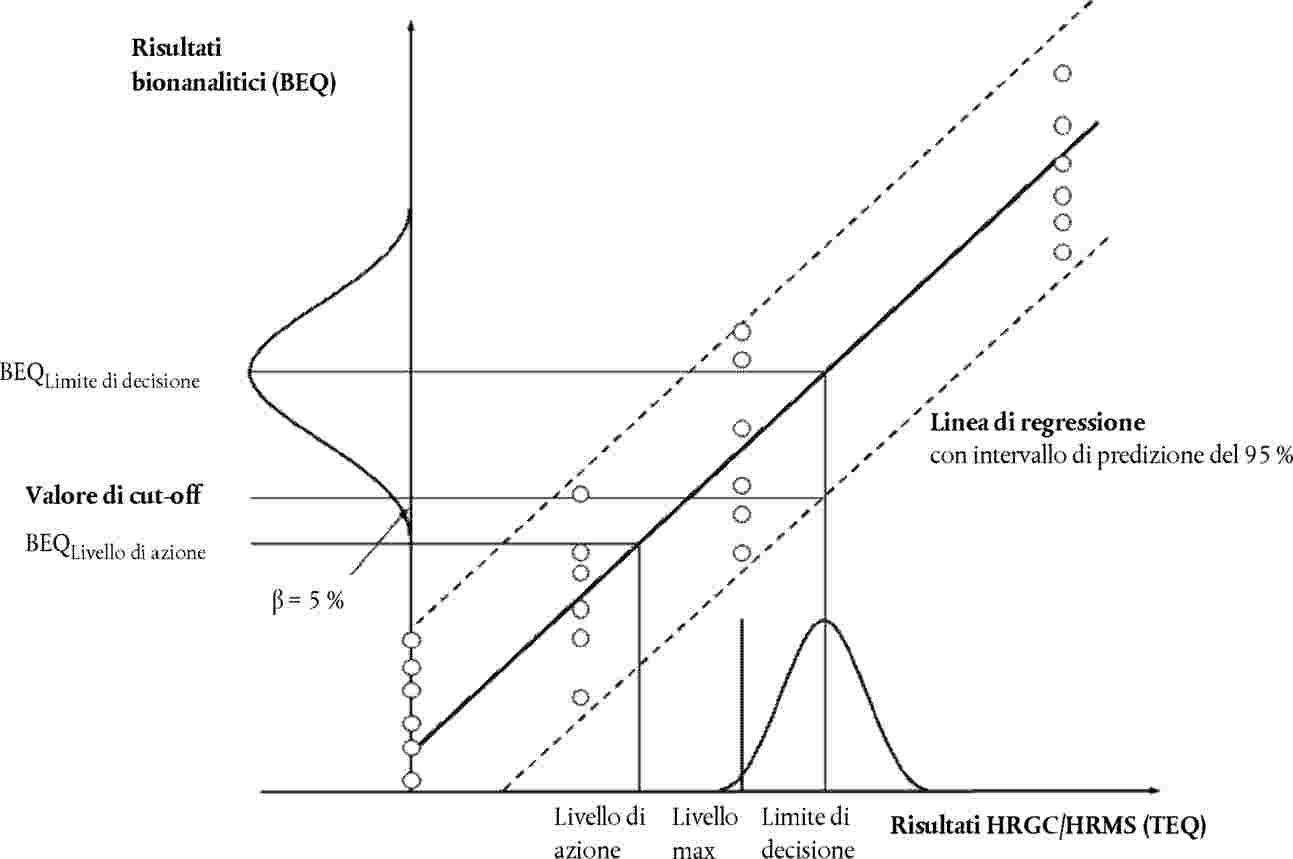
Figura 1 Calcolo dei valori di cut-off in base a un livello di fiducia del 95 % implicante un tasso di falsi conformi < 5 %, e una RSDR < 25 %:
|
1. |
a partire dalla banda inferiore dell'intervallo di predizione del 95 % al limite di decisione del metodo di conferma, |
|
2. |
a partire dall'analisi multipla di campioni (n ≥ 6) contaminati al limite di decisione del metodo di conferma, come endpoint inferiore della distribuzione dei dati (rappresentata nella figura da una curva a campana) al corrispondente valore BEQ medio. |
7.3.4. Restrizioni dei valori di cut-off
I valori di cut-off espressi in BEQ calcolati a partire dalla RSDR ottenuta durante la validazione utilizzando un numero limitato di campioni con differenti matrici/pattern di congeneri possono essere superiori ai livelli massimi o alle soglie di intervento espressi in TEQ in quanto la precisione è maggiore di quella raggiungibile in routine quando deve essere controllato uno spettro sconosciuto di possibili pattern di congeneri. In tali casi, i valori di cut-off sono calcolati a partire da una RSDR = 25 %, o sono preferiti i due terzi del livello massimo o della soglia di intervento.
7.4. Caratteristiche di performance
7.4.1. Poiché nei metodi bioanalitici non possono essere utilizzati standard interni, sono eseguiti test di ripetibilità dei metodi bioanalitici per ottenere informazioni sulla deviazione standard nelle e tra le serie di test. La ripetibilità è inferiore al 20 %, la riproducibilità in laboratorio inferiore al 25 %, in base ai livelli calcolati in BEQ dopo correzione del bianco e del recupero.
7.4.2. Nel processo di validazione il test deve permettere di distinguere tra un campione in bianco e un livello al valore di cut-off, consentendo l'identificazione dei campioni al di sopra del corrispondente valore di cut-off (cfr. punto 7.1.2).
7.4.3. Sono definiti i composti bersaglio, le possibili interferenze e i livelli massimi tollerabili di bianco.
7.4.4. La deviazione standard percentuale nella risposta o nella concentrazione calcolata a partire dalla risposta (possibile solo nel working range) di una determinazione triplice di un estratto del campione non può essere superiore al 15 %.
7.4.5. I risultati non corretti dei campioni di riferimento espressi in BEQ (bianco e al livello massimo o alla soglia di intervento) sono utilizzati per valutare la performance del metodo bioanalitico su un periodo di tempo costante.
7.4.6. I diagrammi di controllo qualità per i bianchi di procedura e ciascun tipo di campione di riferimento sono registrati e controllati per assicurare che la performance analitica sia conforme alle prescrizioni, in particolare per i bianchi di procedura per quanto concerne la differenza minima richiesta rispetto all'estremo inferiore del working range e per i campioni di riferimento per quanto riguarda la riproducibilità in laboratorio. I bianchi di procedura sono controllati in modo da evitare risultati falsi conformi quando sono sottratti.
7.4.7. I risultati dei campioni sospetti, ottenuti con i metodi di conferma, e del 2-10 % dei campioni conformi (minimo di 20 campioni per matrice) sono raccolti e utilizzati per valutare la performance del metodo di screening e il rapporto tra BEQ e TEQ. Questa base di dati può essere utilizzata per la rivalutazione dei valori di cut-off applicabili ai campioni di routine per le matrici validate.
7.4.8. La buona performance del metodo può essere dimostrata anche con la partecipazione a ring trial. Anche i risultati dei campioni analizzati in ring trial, che coprano un range di concentrazione fino a, per esempio, due volte il limite massimo, possono essere inclusi nella valutazione del tasso di falsi conformi, se il laboratorio è in grado di dimostrare la sua buona performance. I campioni coprono i pattern di congeneri più frequenti, rappresentanti varie fonti.
7.4.9. Durante gli incidenti, i valori di cut-off possono essere rivalutati, tenendo conto della matrice e dei pattern di congeneri specifici del singolo incidente.
8. Reporting dei risultati
8.1. Metodi di conferma
8.1.1. Se la procedura analitica impiegata lo consente, i risultati dell'analisi contengono i livelli dei singoli congeneri di PCDD/PCDF e PCB diossina-simili e sono espressi come lowerbound, upperbound e mediumbound, per includere un massimo di informazione nel reporting dei risultati e permettere così l'interpretazione dei risultati secondo prescrizioni specifiche.
8.1.2. Il rapporto comprende anche il metodo utilizzato per l'estrazione di PCDD/PCDF e PCB diossina-simili.
8.1.3. I recuperi dei singoli standard interni sono indicati se si situano al di fuori del range menzionato al punto 6.2.5, se il livello massimo è superato (in questo caso, i recuperi per una delle due doppie analisi) e in altri casi su richiesta.
8.1.4. Poiché nel decidere della conformità di un campione occorre tener conto dell'incertezza di misura, deve essere indicato anche questo parametro. I risultati analitici sono pertanto espressi come x +/- U, dove x è il risultato analitico e U l'incertezza di misura estesa, calcolata per mezzo di un fattore di copertura 2 che dà un livello di fiducia del 95 % circa. Nel caso di una determinazione separata di PCDD/PCDF e PCB diossina-simili, la somma dell'incertezza estesa stimata dei risultati analitici separati di PCDD/PCDF e PCB diossina-simili è utilizzata per la somma di PCDD/PCDF e PCB diossina-simili.
8.1.5. Se si tiene conto dell'incertezza di misura applicando il CCα (come descritto nella presente parte B, capo I, punto 2.2) questo parametro è indicato.
8.1.6. I risultati sono espressi nelle stesse unità e con almeno lo stesso numero di cifre significative dei livelli massimi stabiliti dalla direttiva 2002/32/CE.
8.2. Metodi di screening bioanalitici
8.2.1. Il risultato dello screening è espresso come “conforme” o “sospetto non conforme” (“sospetto”).
8.2.2. Inoltre, per PCDD/PCDF e/o PCB diossina-simili può essere dato un risultato espresso in BEQ e non in TEQ.
8.2.3. I campioni con una risposta al di sotto del limite di reporting sono espressi come “inferiori al limite di reporting”.
8.2.4. Per ciascun tipo di matrice del campione il rapporto menziona il livello massimo o la soglia di intervento su cui si basa la valutazione.
8.2.5. Il rapporto menziona il tipo di test applicato, il principio base del test e il tipo di calibrazione.
8.2.6. Il rapporto indica il metodo utilizzato per l'estrazione di PCDD/PCDF e PCB diossina-simili.
8.2.7. In caso di campioni sospetti non conformi, il rapporto deve includere una nota sulle azioni da intraprendere. La concentrazione di PCDD/PCDF e la somma di PCDD/PCDF e PCB diossina-simili nei campioni con livelli elevati deve essere determinata/confermata mediante un metodo di conferma.
CAPO III
Preparazione dei campioni e prescrizioni per i metodi di analisi impiegati nel controllo ufficiale dei livelli di PCB non diossina-simili (PCB # 28, 52, 101, 138, 153, 180)
1. Campo d'applicazione
Le prescrizioni di cui al presente capo si applicano alle analisi degli alimenti per animali eseguite per il controllo ufficiale dei livelli di policlorobifenili non diossina-simili (PCB non diossina-simili) e per altre finalità di legge.
2. Metodi di rilevazione applicabili
Gascromatografia con rilevazione a cattura di elettroni (GC-ECD), GC-LRMS, GC-MS/MS, GC-HRMS o metodi equivalenti.
3. Identificazione e conferma degli analiti di interesse
3.1. Tempo di ritenzione relativo rispetto agli standard interni o agli standard di riferimento (deviazione accettabile di +/- 0,25 %).
3.2. Separazione gascromatografica dei sei PCB indicatori (PCB 28, PCB 52, PCB 101, PCB 138, PCB 153 e PCB 180) dalle sostanze interferenti, specie PCB coeluenti, in particolare se i livelli dei campioni si situano entro i limiti legali e la non conformità deve essere confermata.
[I congeneri che spesso coeluiscono sono per esempio PCB 28/31, PCB 52/69 e PCB 138/163/164. Per la GC-MS sono considerate anche le possibili interferenze di frammenti di congeneri più altamente clorurati.]
3.3. Prescrizioni per le tecniche GC-MS
Monitoraggio di almeno:
|
a) |
due ioni specifici per HRMS; |
|
b) |
due ioni specifici di m/z > 200 o tre ioni specifici di m/z > 100 per LRMS; |
|
c) |
1 precursore e 2 ioni prodotti per MS-MS. |
Tolleranze massime ammesse per i rapporti di abbondanza per i frammenti di massa selezionati:
Deviazione relativa del rapporto di abbondanza dei frammenti di massa selezionati rispetto all'abbondanza teorica o standard di calibrazione per lo ione bersaglio (lo ione monitorato più abbondante) e gli ioni qualificatori:
|
Intensità relativa degli ioni qualificatori rispetto allo ione bersaglio |
GC-EI-MS (deviazione relativa) |
GC-CI-MS, GC-MSn (deviazione relativa) |
|
> 50 % |
± 10 % |
± 20 % |
|
da > 20 % a 50 % |
± 15 % |
± 25 % |
|
da > 10 % a 20 % |
± 20 % |
± 30 % |
|
≤ 10 % |
± 50 % (11) |
± 50 % (11) |
3.4. Prescrizioni per le tecniche di GC-ECD
Conferma dei risultati che oltrepassano la tolleranza con due colonne GC con fasi stazionarie di diversa polarità.
4. Dimostrazione della performance del metodo
La performance del metodo è validata nel range del livello massimo (da 0,5 a 2 volte il livello massimo) con un coefficiente di variazione accettabile per le analisi ripetute (cfr. prescrizioni per la precisione intermedia al punto 9).
5. Limite di quantificazione
I valori del bianco non sono superiori al 30 % del livello di contaminazione corrispondente al livello massimo (12).
6. Controllo di qualità
Controlli in bianco regolari, analisi di campioni spiked, campioni di controllo di qualità, partecipazione a studi interlaboratorio su matrici rilevanti.
7. Controllo dei recuperi
7.1. Sono utilizzati idonei standard interni con proprietà fisico-chimiche comparabili agli analiti di interesse.
7.2. Aggiunta di standard interni:
Aggiunta ai prodotti (prima dell'estrazione e del processo di clean-up).
7.3. Prescrizioni per i metodi che utilizzano tutti i sei congeneri di PCB indicatori marcati con isotopi:
|
a) |
correzione dei risultati in funzione dei recuperi degli standard interni; |
|
b) |
recuperi degli standard interni marcati con isotopi compresi tra il 50 % e il 120 %; |
|
c) |
recuperi inferiori o superiori per i singoli congeneri con un contributo alla somma dei sei PCB indicatori inferiore al 10 % sono accettabili. |
7.4. Prescrizioni per i metodi che non utilizzano tutti i sei standard interni marcati con isotopi o utilizzano altri standard interni:
|
a) |
controllo del recupero degli standard interni per ogni campione; |
|
b) |
recuperi degli standard interni compresi tra il 60 % e il 120 %; |
|
c) |
correzione dei risultati in funzione dei recuperi degli standard interni. |
7.5. I recuperi dei congeneri non marcati sono controllati per mezzo di campioni spiked o campioni di controllo qualità con concentrazioni nel range del livello massimo. I recuperi per questi congeneri sono considerati accettabili se sono compresi tra il 70 % e il 120 %.
8. Prescrizioni per i laboratori
Come prescritto dal regolamento (CE) n. 882/2004, i laboratori devono essere accreditati da un organismo riconosciuto operante in conformità alla Guida ISO 58, per garantire che alle loro analisi sia applicata l'assicurazione qualità. I laboratori devono essere accreditati in base alla norma EN ISO/IEC 17025.
9. Caratteristiche di performance: criteri per la somma dei sei PCB indicatori al livello massimo
|
Esattezza |
da – 30 a + 30 % |
|
Precisione intermedia (RSD%) |
≤ 20 % |
|
Differenza tra calcolo upperbound e lowerbound |
≤ 20 % |
10. Reporting dei risultati
10.1. Se la procedura analitica impiegata lo consente, i risultati dell'analisi contengono i livelli dei singoli congeneri di PCB e sono espressi come lowerbound, upperbound e mediumbound, per includere un massimo di informazione nel reporting dei risultati e permettere così l'interpretazione dei risultati secondo prescrizioni specifiche.
10.2. Il rapporto indica il metodo utilizzato per l'estrazione di PCB e lipidi.
10.3. I recuperi dei singoli standard interni sono indicati se si situano al di fuori del range menzionato al punto 7, se il livello massimo è superato e in altri casi su richiesta.
10.4. Poiché nel decidere della conformità di un campione occorre tener conto dell'incertezza di misura, deve essere indicato anche questo parametro. I risultati analitici sono pertanto espressi come x +/- U, dove x è il risultato analitico e U l'incertezza di misura estesa, calcolata per mezzo di un fattore di copertura 2 che dà un livello di fiducia del 95 % circa.
10.5. Se si tiene conto dell'incertezza di misura applicando il CCα (come descritto al punto 2.1 del capo I) questo parametro è indicato.
10.6. I risultati sono espressi nelle stesse unità e con almeno lo stesso numero di cifre significative dei livelli massimi stabiliti dalla direttiva 2002/32/CE.
(9) rispetto ai livelli massimi.
(11) Essendo disponibile un numero sufficiente di frammenti di massa con intensità relativa > 10 %, non è raccomandato l'uso di ioni qualificatori con intensità relativa inferiore al 10 % rispetto allo ione bersaglio.
