|
21.7.2007
|
IT
|
Gazzetta ufficiale dell’Unione europea
|
L 191/1
|
REGOLAMENTO (CE) N. 829/2007 DELLA COMMISSIONE
del 28 giugno 2007
che modifica gli allegati I, II, VII, VIII, X e XI del regolamento (CE) n. 1774/2002 del Parlamento europeo e del Consiglio per quanto riguarda l'immissione sul mercato di taluni sottoprodotti di origine animale
(Testo rilevante ai fini del SEE)
LA COMMISSIONE DELLE COMUNITÀ EUROPEE,
visto il trattato che istituisce la Comunità europea,
visto il regolamento (CE) n. 1774/2002 del Parlamento europeo e del Consiglio, del 3 ottobre 2002, recante norme sanitarie relative ai sottoprodotti di origine animale non destinati al consumo umano (1), in particolare l'articolo 28, paragrafo 2, l'articolo 29, paragrafo 3, e l'articolo 32, paragrafo 1,
considerando quanto segue:
|
(1)
|
Il regolamento (CE) n. 1774/2002 fissa le norme sanitarie e di polizia sanitaria applicabili all'importazione e al transito nella Comunità di taluni sottoprodotti di origine animale e di prodotti da essi derivati. Il regolamento fissa le esigenze generali in materia di igiene applicabili alla trasformazione dei materiali di categoria 1, 2 e 3 e le condizioni di immissione sul mercato di tali sottoprodotti di origine animale e di prodotti da essi derivati, nonché i modelli di certificati sanitari che debbono accompagnarli all'atto della loro importazione nella Comunità.
|
|
(2)
|
A motivo del rischio di introduzione del piccolo scarabeo dell'alveare nella Comunità, attualmente indenne da tale parassita, occorre fissare le prescrizioni per l'importazione della cera d'api destinata ad usi tecnici e modificare la definizione dei prodotti apicoli di cui all'allegato I del regolamento (CE) n. 1774/2002. Occorre quindi modificare di conseguenza la definizione di cui all'allegato I del regolamento, le condizioni di importazione di cui all'allegato VIII, capitolo IX, e il modello di certificato sanitario di cui all'allegato X, capitolo 13, del regolamento in questione.
|
|
(3)
|
L'allegato II, capitolo X, del regolamento (CE) n. 1774/2002 stabilisce che durante il trasporto i sottoprodotti di origine animale e i prodotti trasformati devono essere accompagnati da un documento commerciale. Per migliorare la rintracciabilità delle pelli durante il trasporto, occorre modificare il modello di tale documento. Occorre quindi modificare di conseguenza l'allegato II del regolamento.
|
|
(4)
|
Il regolamento (CE) n. 999/2001 del Parlamento europeo e del Consiglio, del 22 maggio 2001, recante disposizioni per la prevenzione, il controllo e l'eradicazione di alcune encefalopatie spongiformi trasmissibili (2), si applica alla produzione e all'immissione sul mercato di animali vivi e di prodotti di origine animale. Il regolamento vieta la somministrazione di proteine animali trasformate ad animali d'allevamento che sono tenuti, ingrassati o allevati per la produzione di alimenti.
|
|
(5)
|
Fatto salvo il divieto del regolamento (CE) n. 999/2001, occorre che condizioni di trasformazione meno rigorose del metodo attuale di trasformazione n. 1, come previsto nell'allegato VII, capitolo II, del regolamento (CE) n. 1774/2002 si applichino alle proteine animali trasformate derivate da sangue di suini, in quanto il rischio di trasmissione di EST da parte dei suini non ha riscontro in alcun dato scientifico. Per motivi di salute pubblica e animale è necessario peraltro introdurre una condizione di temperatura minima per quanto riguarda la trasformazione del sangue di suini. Occorre pertanto modificare di conseguenza l’allegato VII, capitolo II, del regolamento (CE) n. 1774/2002.
|
|
(6)
|
L'allegato VIII, capitolo II, punto A.1, del regolamento (CE) n. 1774/2002 autorizza l'utilizzazione di parti di animali macellati adatte al consumo umano, ma non destinate al consumo umano per motivi commerciali nella produzione di alimenti greggi per animali da compagnia all'interno della Comunità. Sembra che parti di tali animali dichiarati inadatti al consumo umano, ma esenti da qualsiasi segno di malattia trasmissibile agli esseri umani o agli animali, possono anch'essi essere utilizzati senza rischi negli alimenti per animali da compagnia. Occore quindi modificare di conseguenza il capitolo II, punto A.1, e il capitolo XI dell'allegato VIII del regolamento, quest'ultimo riguardante le disposizioni per l'importazione nella Comunità.
|
|
(7)
|
È necessario modificare i modelli esistenti di certificati sanitari relativi all'importazione di pelli nella Comunità al fine di apportare una serie di modifiche tecniche. A fini di chiarezza occorre quindi modificare di conseguenza le prescrizioni applicabili a tali prodotti figuranti al capitolo VI dell'allegato VIII nonché i modelli di certificati sanitari di cui ai capitoli 5 A, 5 B e 5 C dell'allegato X del regolamento (CE) n. 1774/2002.
|
|
(8)
|
Nel suo Parere scientifico sugli effetti dell'influenza aviaria sulla salute e il benessere degli animali, adottato il 13 e 14 settembre 2005, l'Autorità europea per la sicurezza alimentare (EFSA) è giunta alla conclusione che le piume debbano essere trattate prima di essere commercializzate, per ridurre il rischio di propagazione dell'influenza aviaria. Il capitolo VIII dell'allegato VIII del regolamento (CE) n. 1774/2002 fissa le misure comunitarie permanenti relative all'immissione sul mercato e all'importazione di piume. Alla luce del parere summenzionato e dell'attuale situazione epidemiologica mondiale nei confronti dell'influenza aviaria, occorre modificare le pertinenti misure comunitarie per l'importazione e il trattamento di piume prima dell'importazione. Occorre quindi modificare di conseguenza l'allegato VIII del regolamento.
|
|
(9)
|
Per prevedere possibilità di trasformazione equivalenti per i paesi terzi e per la Comunità, occorre modificare di conseguenza il certificato sanitario di cui all'allegato X, capitolo 1, del regolamento (CE) n. 1774/2002 relativo alle importazioni nella Comunità di proteine animali trasformate non destinate al consumo umano e di prodotti diversi dagli alimenti per animali da compagnia contenenti tali proteine. È necessario modificare conseguentemente l'allegato X, capitolo I, del regolamento (CE) n. 1774/2002.
|
|
(10)
|
Il capitolo 3 B dell'allegato X del regolamento (CE) n. 1774/2002 contiene il modello di certificato sanitario relativo alle importazioni nella Comunità di alimenti trasformati per animali da compagnia diversi da quelli in conserva. Sembra che gli alimenti trasformati per animali da compagnia siano sempre più prodotti in paesi terzi tramite la miscela di ingredienti già trasformati che sono stati trattati individualmente conformemente alle disposizioni del regolamento. Il trattamento termico di tali ingredienti può alterare le loro qualità nutrizionali. Occorre quindi che l'importazione nella Comunità di alimenti trasformati per animali da compagnia costituiti da tali ingredienti sicuri sia autorizzata e che il modello di certificato sanitario di cui al capitolo 3 B dell'allegato X del regolamento (CE) n. 1774/2002 sia modificato di conseguenza.
|
|
(11)
|
Il regolamento (CE) n. 1774/2002 prevede l'importazione nella Comunità di taluni sottoprodotti di origine animale destinati alla produzione di alimenti per animali da compagnia contenenti sostanze provenienti da animali trattati con talune sostanze vietate. Peraltro è attualmente vietata l'importazione nella Comunità di alimenti trasformati per animali da compagnia, di articoli da masticare e di interiora aromatizzanti contenenti tali sostanze. Dal momento che l'importazione di tali materie prime per la produzione di alimenti per animali da compagnia nella Comunità non presenta rischi sanitari più gravi di quelli inerenti all'importazione di tali materie prime sotto forma di ingredienti di alimenti trasformati per animali da compagnia, di articoli da masticare e di interiora aromatizzanti importate, occorre autorizzare altresì l'importazione nella Comunità di tali prodotti trasformati contenenti le materia prime in questione. Occorre quindi modificare di conseguenza i modelli di certificati sanitari di cui ai capitoli 3 A, 3 B, 3 C e 3 E dell'allegato X del regolamento (CE) n. 1774/2002.
|
|
(12)
|
Il capitolo 3 B dell'allegato X del regolamento (CE) n. 1774/2002 prevede che il certificato sanitario per gli alimenti trasformati per animali da compagnia diversi dagli alimenti in conserva comporti un attestato con la precisazione che gli alimenti per animali da compagnia sono stati confezionati in imballaggi nuovi recanti un'etichetta con l'indicazione «Non destinati al consumo umano». La direttiva 79/373/CEE del Consiglio, del 2 aprile 1979, relativa alla commercializzazione degli alimenti composti per gli animali (3), contiene già le disposizioni equivalenti in materia di marcatura miranti a prevenire un'utilizzazione accidentale o per negligenza di tali prodotti per il consumo umano. Occorre quindi modificare di conseguenza i modelli di certificati sanitari di cui al capitolo 3 B dell'allegato X del regolamento (CE) n. 1774/2002.
|
|
(13)
|
L'allegato VIII del regolamento (CE) n. 1774/2002 fissa i requisiti applicabili all'immissione sul mercato e all'importazione nella Comunità di alimenti per animali da compagnia, di articoli da masticare e di prodotti tecnici. Il capitolo II, punto B.4, dell'allegato prevede che gli articoli da masticare debbano essere sottoposti, durante la trasformazione, ad un trattamento termico sufficiente a distruggere gli organismi patogeni. Vari Stati membri hanno chiesto l'autorizzazione, durante la trasformazione degli articoli da masticare, di altri procedimenti in grado di offrire garanzie di sicurezza equivalenti. Occorre quindi modificare di conseguenza il capitolo II, punto B.4, dell'allegato VIII del regolamento (CE) n. 1774/2002.
|
|
(14)
|
Il capitolo 3 C dell'allegato X del regolamento (CE) n. 1774/2002 riporta il modello di certificato sanitario relativo alle importazioni nella Comunità di articoli da masticare. Dal momento che trattamenti diversi da quello termico saranno autorizzati per la trasformazione di articoli da masticare nella Comunità, tali diversi trattamenti debbono anch'essi essere autorizzati per gli articoli da masticare importati. Taluni articoli da masticare sono prodotti secondo metodi tradizionali a partire da pesci. La protezione della salute degli animali non richiede che un trattamento termico sia applicato in casi simili. Occorre quindi modificare di conseguenza il modello di certificato sanitario di cui al capitolo 3 C dell'allegato X del regolamento in questione.
|
|
(15)
|
L'allegato VIII, capitolo II, punto B.6, del regolamento (CE) n. 1774/2002 fissa le norme microbiologiche applicabili agli alimenti grezzi per animali da compagnia prodotti nella Comunità. Tali norme debbono essere altresì applicate agli alimenti grezzi per animali da compagnia importati nella Comunità e destinati alla vendita diretta nonché ai sottoprodotti di origine animale destinati all'alimentazione degli animali d'allevamento da pelliccia, destinati ad essere spediti verso la Comunità. Occorre quindi modificare di conseguenza il capitolo 3 D dell'allegato X del regolamento in questione.
|
|
(16)
|
L'allegato XI del regolamento (CE) n. 1774/2002 contiene gli elenchi dei paesi terzi dai quali gli Stati membri possono autorizzare le importazioni di sottoprodotti di origine animale non destinati al consumo umano. La parte XIII di tale allegato contiene un elenco di paesi terzi in provenienza dei quali gli Stati membri possono autorizzare le importazioni di siero di equidi. Conformemente a tale parte XIII, l'elenco comprende i paesi terzi di cui all'allegato I della decisione 2004/211/CE della Commissione, del 6 gennaio 2004, che stabilisce l'elenco dei paesi terzi e delle parti di territorio dei paesi terzi da cui gli Stati membri autorizzano le importazioni di equidi vivi nonché di sperma, ovuli ed embrioni della specie equina e che modifica le decisioni 93/195/CEE e 94/63/CE (4), in provenienza dei quali è autorizzata l'importazione di equidi destinati al macello.
|
|
(17)
|
Il siero di equidi può tuttavia essere prelevato su animali vivi. Per questo motivo la situazione zoosanitaria che consente ad un paese terzo di essere incluso nell'elenco di paesi terzi in provenienza dei quali è permessa l'importazione di equidi per allevamento e produzione dovrà essere sufficiente a determinare se il siero di equidi può essere importato da tali paesi terzi. Ciò consentirebbe, in particolare, l'autorizzazione all'importazione di siero di equidi dal Messico. Occorre pertanto modificare di conseguenza l’allegato XI, parte XIII, del regolamento (CE) n. 1774/2002.
|
|
(18)
|
I certificati veterinari sono elaborati nel formato previsto dalla decisione 2007/240/CE della Commissione (5) relativa all'adozione di nuovi modelli armonizzati di certificati veterinari relativi all'importazione nella Comunità europea di animali vivi e di prodotti di origine animale. Occorre quindi modificare di conseguenza l'allegato II, capitolo X, del regolamento (CE) n. 1774/2002 e i modelli di certificati sanitari di cui all'allegato X del regolamento in questione.
|
|
(19)
|
Occorre prevedere un periodo transitorio dopo la data di entrata in vigore del presente regolamento, al fine di consentire l'importazione ininterrotta nella Comunità dei sottoprodotti di origine animale e dei prodotti da essi derivati di cui al regolamento (CE) n. 1774/2002 e accompagnati dai certificati sanitari conformi a tale regolamento.
|
|
(20)
|
Le misure previste nel presente regolamento sono conformi al parere del comitato permanente per la catena alimentare e la salute degli animali,
|
HA ADOTTATO IL PRESENTE REGOLAMENTO:
Articolo 1
Gli allegati I, II, VII, VIII, X e XI del regolamento (CE) n. 1774/2002 sono modificati conformemente all'allegato del presente regolamento.
Articolo 2
Per un periodo transitorio di sei mesi dalla data d'entrata in vigore del presente regolamento, il documento commerciale di cui all'allegato II del regolamento (CE) n. 1774/2002 e i modelli di certificati sanitari di cui all'allegato X del regolamento in questione, compilati conformemente alle disposizioni applicabili prima della data d'entrata in vigore del presente regolamento, possono continuare ad accompagnare i prodotti cui si riferiscono.
Articolo 3
Il presente regolamento entra in vigore il terzo giorno successivo alla pubblicazione nella Gazzetta ufficiale dell'Unione europea.
Il presente regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Fatto a Bruxelles, il 28 giugno 2007.
Per la Commissione
Markos KYPRIANOU
Membro della Commissione
(1) GU L 273 del 10.10.2002, pag. 1. Regolamento modificato da ultimo dal regolamento (CE) n. 2007/2006 della Commissione (GU L 379 del 28.12.2006, pag. 98).
(2) GU L 147 del 31.5.2001, pag. 1. Regolamento modificato da ultimo dal regolamento (CE) n. 1923/2006 della Commissione (GU L 404 del 30.12.2006, pag. 1).
(3) GU L 86 del 6.4.1979, pag. 30. Direttiva modificata da ultimo dal regolamento (CE) n. 807/2003 (GU L 122 del 16.5.2003, pag. 36).
(4) GU L 73 dell’11.3.2004, pag. 1. Decisione modificata dal regolamento (CE) n. 1792/2006 (GU L 362 del 20.12.2006, pag. 1).
(5) GU L 104 del 21.4.2007, pag. 37.
ALLEGATO
Gli allegati del regolamento (CE) n. 1774/2002 sono modificati come segue.
|
1)
|
L'allegato I è modificato come segue:
|
a)
|
il punto 1 è sostituito dal seguente:
|
«1.
|
“sottoprodotti apicoli”: miele, cera d'api, pappa reale, propoli o polline non destinati al consumo umano»;
|
|
|
b)
|
il punto 42 è sostituito dal seguente:
|
«42.
|
Proteine animali trasformate: proteine animali ottenute interamente da materiali di categoria 3 e trattate, conformemente al capitolo II dell'allegato VII del presente regolamento, in modo da renderle adatte all'utilizzazione diretta come materie prime per mangimi o a qualsiasi altra utilizzazione negli alimenti per animali, compresi quelli per animali da compagnia, o all'utilizzazione in fertilizzanti organici o ammendanti; non comprendono i prodotti sanguigni, il latte, i prodotti a base di latte, il colostro, la gelatina, le proteine idrolizzate e il fosfato bicalcico, le uova e i prodotti a base di uova, il fosfato tricalcico e il collagene.»
|
|
|
|
2)
|
All'allegato II, il testo del capitolo X è sostituito dal seguente:
«CAPITOLO X
Documento commerciale
|
1.
|
Durante il trasporto i sottoprodotti di origine animale e i prodotti trasformati sono accompagnati dal seguente documento commerciale. Peraltro gli Stati membri possono optare per un documento commerciale diverso, su supporto cartaceo o in forma elettronica, per sottoprodotti di origine animale e prodotti trasformati trasportati all'interno di uno stesso Stato membro, a condizione che tale documento commerciale soddisfi le prescrizioni di cui al capitolo III, punto 2.
|
|
2.
|
Quando intervengono più trasportatori, ciascuno di essi compila la dichiarazione di cui al punto 7 del documento commerciale, che ne costituisce parte integrante.
|
MODELLO DI DOCUMENTO COMMERCIALE PER IL TRASPORTO ALL'INTERNO DELLA COMUNITÀ DI SOTTOPRODOTTI DI ORIGINE ANIMALE E DI PRODOTTI TRASFORMATI
Osservazioni
|
a)
|
Il documento commerciale è compilato seguendo il modello che figura nel presente allegato. Esso contiene, nell'ordine di numerazione figurante nel modello, gli attestati richiesti per il trasporto di sottoprodotti di origine animale e di prodotti trasformati da essi derivati.
|
|
b)
|
Il documento commerciale è redatto in una delle lingue ufficiali dello Stato membro di origine o dello Stato membro di destinazione, a seconda dei casi. Tuttavia, può anche essere redatto in altre lingue ufficiali comunitarie, purché sia allegata una traduzione ufficiale o previo accordo dell’autorità competente dello Stato membro di destinazione.
|
|
c)
|
Il documento commerciale deve essere prodotto in almeno tre esemplari (un originale e due copie). L'originale deve accompagnare la spedizione fino al luogo di destinazione finale. Il ricevente deve conservarlo. Il produttore e il trasportatore devono conservare ciascuno una delle copie.
|
|
d)
|
L'originale di ciascun documento commerciale deve essere composto da un unico foglio scritto su entrambi i lati oppure, nei casi in cui occorrano più pagine, deve essere costituito in modo tale che i fogli formino un tutto unico e indivisibile.
|
|
e)
|
Se, per motivi legati all'identificazione degli elementi della partita, al documento commerciale sono aggiunte pagine supplementari, anche tali pagine sono considerate parte integrante dell'originale del documento e su ciascuna di esse è apposta la firma della persona responsabile.
|
|
f)
|
Se il documento commerciale, comprese le pagine supplementari di cui alla lettera e), si compone di più pagine, ciascuna di esse deve recare, in basso, una numerazione del tipo “(numero della pagina)/(numero totale di pagine)” e, in alto, il numero di codice del documento che è stato assegnato dalla persona responsabile.
|
|
g)
|
L’originale del documento commerciale deve essere compilato e firmato dal responsabile. che si accerta che siano rispettati i principi di documentazione enunciati nell’allegato II, capitolo III, del regolamento (CE) n. 1774/2002. Il documento commerciale deve specificare:
|
i)
|
la data in cui i materiali sono stati prelevati dallo stabilimento;
|
|
ii)
|
la descrizione dei materiali, compresa la loro identificazione, le specie animali per i materiali di categoria 3 e i prodotti trasformati da essi derivati destinati ad essere utilizzati come materie prime per mangimi e, se del caso, il numero del marchio auricolare dell'animale;
|
|
iii)
|
la quantità dei materiali;
|
|
iv)
|
il luogo di origine dei materiali;
|
|
v)
|
il nome e l'indirizzo del trasportatore dei materiali;
|
|
vi)
|
il nome, l'indirizzo e, se del caso, il numero di riconoscimento del destinatario; nonché
|
|
vii)
|
se del caso, il numero di riconoscimento dell'impianto di origine e la natura e i metodi del trattamento.
|
|
|
h)
|
Il colore della firma della persona responsabile deve essere diverso da quello del testo stampato.
|
|
i)
|
Il documento commerciale deve essere conservato per un periodo di almeno due anni ai fini della sua presentazione all'autorità competente per la verifica dei registri di cui all'articolo 9 del regolamento (CE) n. 1774/2002.
|
|
j)
|
Ove gli Stati membri decidano di utilizzare un documento commerciale elettronico, le prescrizioni di cui ai punti da a) a i) debbono essere rispettate adeguatamente a tale formato elettronico.
|



|
|
3)
|
All'allegato VII, capitolo II, punto A.1, il testo del primo comma è sostituito dal seguente:
«Le proteine animali trasformate derivanti da mammiferi devono essere state sottoposte al metodo di trasformazione 1. Peraltro, il sangue di suini può essere trattato con qualsiasi metodo di trasformazione tra quelli figuranti da 1 a 5, o al metodo di trasformazione 7, a condizione che, in caso di applicazione di quest'ultimo, venga applicato un trattamento termico nel corso del quale è stata raggiunta la temperatura di almeno 80 °C in tutta la massa.»
|
|
4)
|
L'allegato VIII è modificato come segue:
|
a)
|
il capitolo II è modificato come segue:
|
i)
|
il punto A.1 è sostituito dal seguente:
|
«1.
|
Gli unici sottoprodotti di origine animale che possono essere utilizzati per produrre alimenti per animali da compagnia e articoli da masticare sono quelli di cui all'articolo 6, paragrafo 1, lettere da a) a j). Tuttavia, gli alimenti greggi per animali da compagnia possono essere ricavati esclusivamente dai sottoprodotti di origine animale di cui all'articolo 6, paragrafo 1, lettera a), o all'articolo 6, paragrafo 1, lettera b).»;
|
|
|
ii)
|
il punto B.4 è sostituito dal seguente:
|
«4.
|
Gli articoli da masticare devono essere sottoposti, durante la trasformazione, a un trattamento in grado di distruggere gli organismi patogeni (inclusa la salmonella).
Dopo il trattamento, devono essere adottate tutte le precauzioni atte ad evitare la contaminazione del prodotto. I prodotti devono essere confezionati in imballaggi nuovi.»;
|
|
|
|
b)
|
il capitolo III è modificato come segue:
|
i)
|
il punto I.A.3 è sostituito dal seguente:
|
«3.
|
Lo stallatico non trasformato di equidi che viene commercializzato non può provenire da un'azienda sottoposta a restrizioni di polizia sanitaria riguardanti morva, stomatite vescicolosa, carbonchio o rabbia conformemente all'articolo 4, paragrafo 5, della direttiva 90/426/CEE.»;
|
|
|
ii)
|
il punto I.B.4 è sostituito dal seguente:
|
«4.
|
L'importazione di stallatico non trasformato è vietata.»;
|
|
|
iii)
|
al punto II.B.6, la lettera d) è sostituita dalla seguente:
|
«d)
|
se i prodotti sono accompagnati da un certificato sanitario conforme al modello stabilito nel capitolo 17 dell'allegato X.»;
|
|
|
|
c)
|
il capitolo VI è modificato come segue:
|
i)
|
al punto A.1, la lettera a) è sostituita dalla seguente:
|
«a)
|
alle pelli di ungulati che soddisfano le disposizioni del regolamento (CE) n. 853/2004 del Parlamento europeo e del Consiglio, del 29 aprile 2004, che stabilisce norme specifiche in materia di igiene per gli alimenti di origine animale (1).
|
|
|
ii)
|
il punto B.3 è sostituito dal seguente:
|
«3.
|
Gli scambi di pelli fresche o refrigerate sono soggetti alle stesse condizioni sanitarie di quelle applicabili alle carni fresche conformemente alla direttiva 2002/99/CE del Consiglio, del 16 dicembre 2002, che stabilisce norme di polizia sanitaria per la produzione, la trasformazione, la distribuzione e l'introduzione di prodotti di origine animale destinati al consumo umano (2).
|
|
|
iii)
|
al punto C.5, nella lettera b) la frase introduttiva è sostituita dalla seguente:
|
«b)
|
sono originarie di un paese terzo, oppure, in caso di regionalizzazione operata ai sensi della normativa comunitaria, di una parte di un paese terzo, figurante nell'elenco di cui alla parte XIV, lettera A, dell'allegato XI e che, a seconda della specie interessata:»;
|
|
|
iv)
|
al punto C.6, le lettere b) ed e) sono sostituite dalle seguenti:
|
«b)
|
provengono:
|
i)
|
da un paese terzo o, in caso di regionalizzazione ufficiale conformemente alla legislazione comunitaria, da una parte di un paese terzo che figura nell'elenco di cui all'allegato XI, parte XIV, lettera B, in provenienza del quale le importazioni di carni fresche delle specie corrispondenti sono autorizzate e sono state trattate conformemente ai punti A.2.a), A.2.b) e A.2.c); o
|
|
ii)
|
da un paese terzo che figura nell'elenco di cui all'allegato XI, parte XIV, lettera B, e sono state trattate conformemente ai punti A.2.c) o A.2. d); o
|
|
iii)
|
da equidi o ruminanti provenienti da un paese terzo figurante nell'elenco di cui all'allegato XI, parte XIV, lettera C, che sono stati trattati conformemente ai punti A.2.a), A.2.b) e A.2.c) e che dopo il trattamento sono stati isolati per almeno 21 giorni;
|
|
|
c)
|
nel caso di pelli salate trasportate per nave, esse sono state trattate conformemente ai punti A.2.b) o A.2.c) e sono state isolate dopo il trattamento durante il trasporto per almeno 14 giorni nel caso del punto A.2.b) o 7 giorni nel caso del punto A.2.c) prima della loro importazione; il certificato sanitario che accompagna la spedizione indica il trattamento applicato e la durata del trasporto; nonché
|
|
d)
|
sono accompagnate da un certificato sanitario conforme al modello di certificato sanitario di cui all'allegato X, capitolo 5 B, o, nel caso di pelli di cui al punto C.6.b).iii) del presente allegato, da una dichiarazione ufficiale conforme al modello di cui all'allegato X, capitolo 5 C.»;
|
|
|
|
d)
|
il capitolo VIII è modificato come segue:
|
i)
|
al punto 4.B, la frase introduttiva è sostituita dalla seguente:
«Gli Stati membri debbono autorizzare l'importazione della lana e dei peli non trasformati se essi:»;
|
|
ii)
|
dopo il punto B.4 è aggiunto il seguente punto:
|
«5.
|
È vietata l'importazione di piume e parti di piume non trasformate.
Gli Stati membri debbono autorizzare l'importazione di piume e di parti di piume trasformate purché:
|
a)
|
si tratti di piume ornamentali trattate, di piume trattate trasportate dai viaggiatori per uso privato o di lotti di piume trattate spediti a singoli per usi non industriali; o
|
|
b)
|
siano accompagnate da un documento commerciale attestante che le piume o le parti di piume sono state trattate per getto di vapore o qualsiasi altro metodo atto a garantire l'inattivazione di agenti patogeni e siano state confezionate allo stato secco in modo sicuro in imballaggi.»;
|
|
|
|
|
e)
|
il capitolo IX è modificato come segue:
|
i)
|
al punto 1.A, la frase introduttiva è sostituita dalla seguente:
|
«1.
|
I sottoprodotti apicoli destinati ad essere utilizzati esclusivamente nell'apicoltura devono:»;
|
|
|
ii)
|
il punto B.3 è sostituito dal seguente:
|
«3.
|
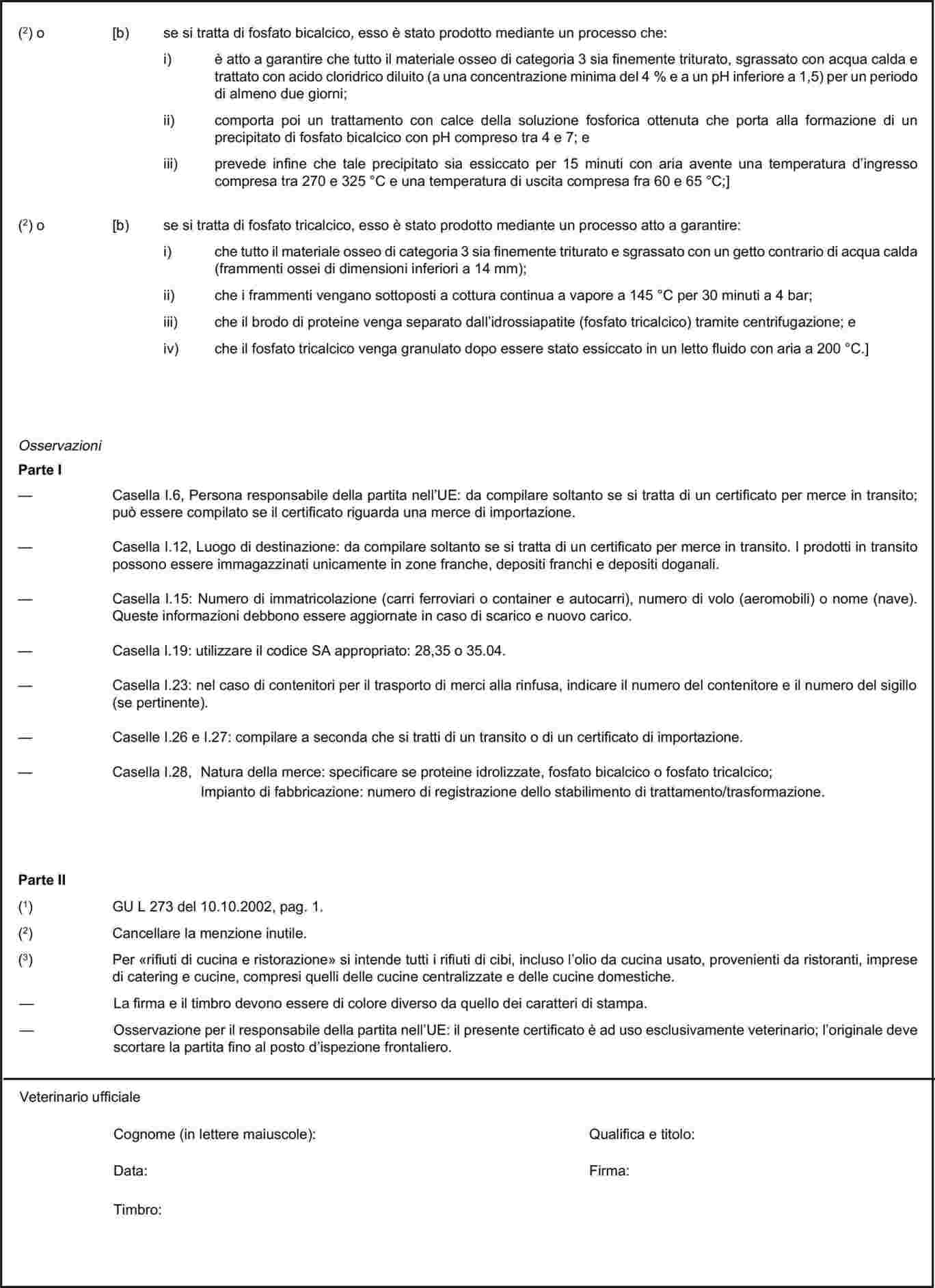
Gli Stati membri debbono autorizzare l'importazione di sottoprodotti apicoli, diversi dalla cera d'api sotto forma di favi, destinati ad essere utilizzati nell'apicolture, purché essi:
|
a)
|
provengano da paesi terzi figuranti nell'elenco di cui all'allegato XI, parte XII;
|
|
b)
|
o:
|
i)
|
siano stati sottoposti a una temperatura di –12 °C o inferiore per almeno 24 ore; o
|
|
ii)
|
nel caso della cera, il materiale sia stato raffinato o trasformato prima dell'importazione; nonché
|
|
|
c)
|
siano accompagnati da un certificato sanitario conforme al modello di cui al capitolo 13 dell'allegato X.»;
|
|
|
|
iii)
|
al punto B sono aggiunti i seguenti punti 4 e 5:
|
«4.
|
Gli Stati membri debbono autorizzare l'importazione, per scopi tecnici di cera d'api diversa dalla cera d'api sotto forma di favi purché:
|
a)
|
sia stata raffinata o fusa prima dell'importazione; nonché
|
|
b)
|
sia accompagnata da un documento commerciale che attesti tale raffinamento o fusione.
|
|
|
5.
|
È vietata l'importazione di cera d'api sotto forma di favi.»;
|
|
|
|
f)
|
il capitolo XI è modificato come segue:
|
i)
|
al punto 2, il secondo comma è sostituito dal seguente:
«tuttavia, i sottoprodotti di origine animale da usare per l'alimentazione degli animali da pelliccia o per alimenti greggi per animali da compagnia devono essere soltanto quelli di cui all'articolo 6, paragrafo 1, lettere a) e b);»
|
|
ii)
|
il punto 6 è sostituito dal seguente:
|
«6.
|
siano accompagnati da un certificato conforme a uno dei modelli di cui all'allegato X, capitolo 3 D, capitolo 3 F o capitolo 8.»
|
|
|
|
|
5)
|
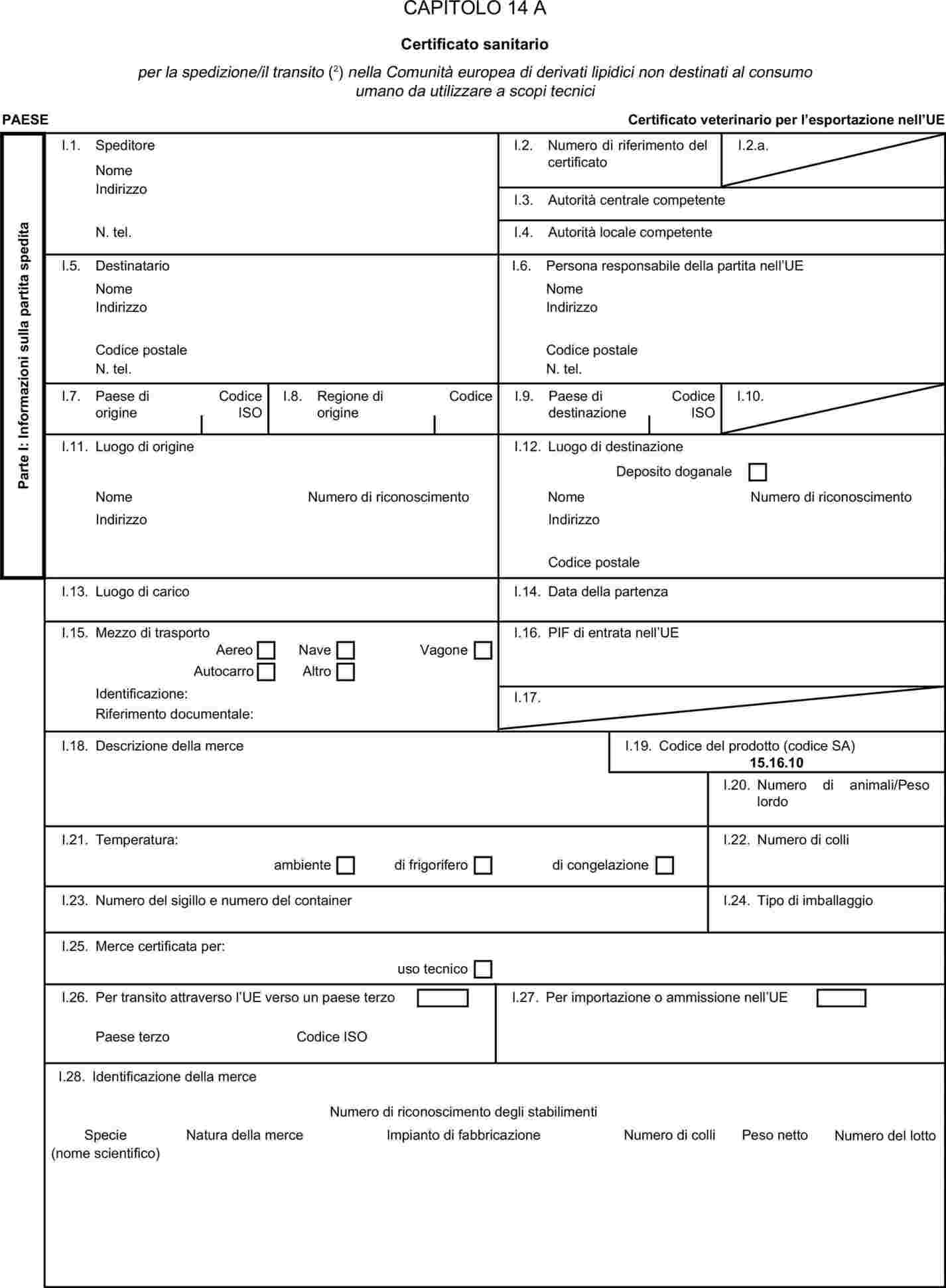
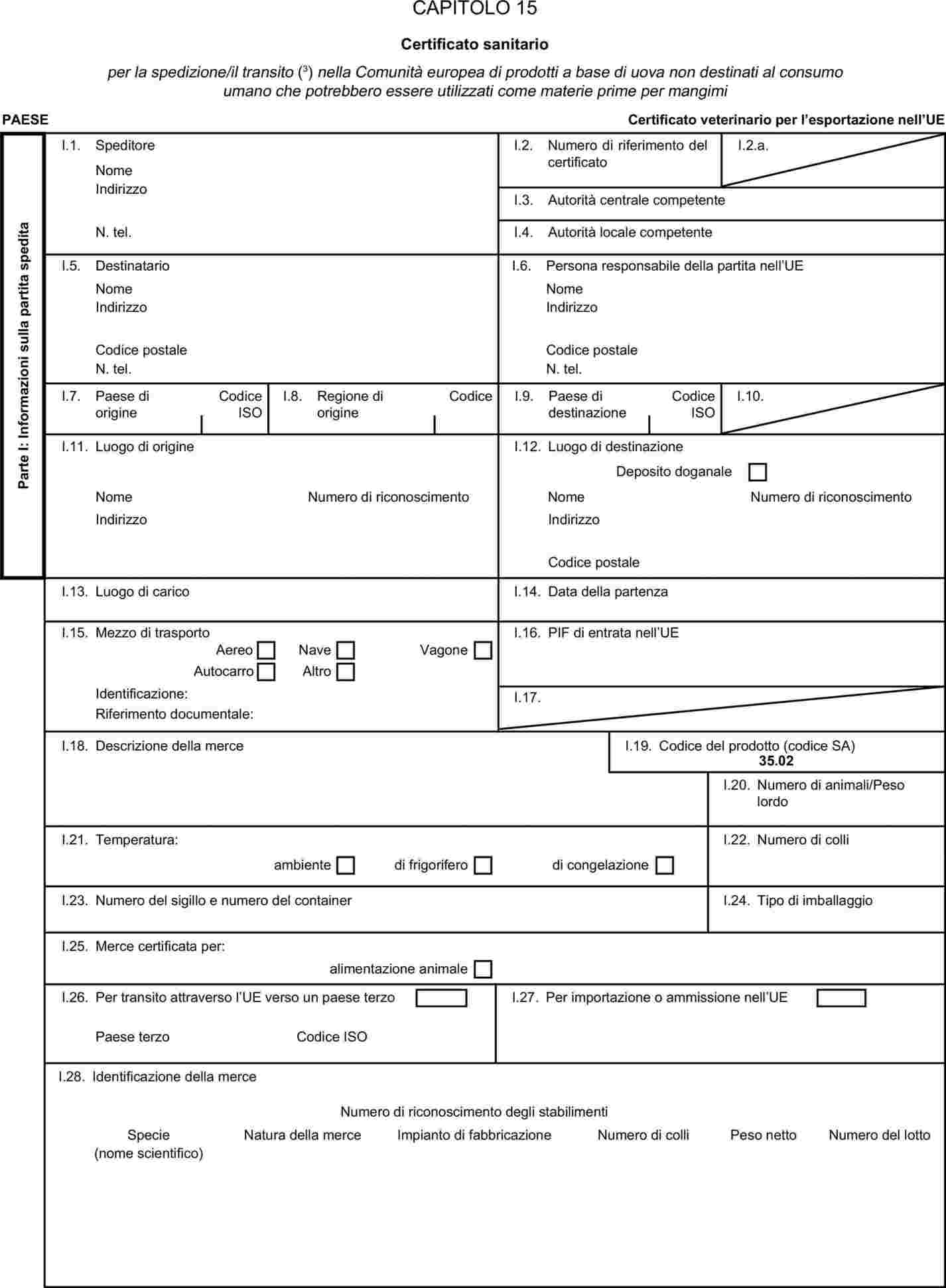
L'allegato X è sostituito dal seguente:
«ALLEGATO X
MODELLI DI CERTIFICATI SANITARI PER L'IMPORTAZIONE DA PAESI TERZI E PER IL TRANSITO NELLA COMUNITÀ EUROPEA DI ALCUNI SOTTOPRODOTTI DI ORIGINE ANIMALE E PRODOTTI DA ESSI DERIVATI
Osservazioni
|
a)
|
I certificati veterinari devono essere rilasciati dal paese esportatore, sulla base dei modelli riportati nel presente allegato X, secondo il formato del modello relativo ai sottoprodotti di origine animale corrispondenti. Essi devono contenere, seguendo la numerazione che figura nel modello, gli attestati richiesti per ciascun paese terzo e, se del caso, le garanzie supplementari richieste per il paese terzo esportatore o parte di esso.
|
|
b)
|
L'originale di ciascun certificato deve essere composto da un unico foglio scritto su entrambi i lati oppure, nei casi in cui occorrano più pagine, deve essere costituito in modo tale che i fogli formino un tutto unico e indivisibile.
|
|
c)
|
Il certificato deve essere redatto in almeno una delle lingue ufficiali dello Stato membro in cui verrà svolta l'ispezione frontaliera e dello Stato membro di destinazione. Tali Stati membri possono tuttavia consentire, se necessario, l'uso di altre lingue accompagnate da una traduzione ufficiale.
|
|
d)
|
Se, per motivi legati all'identificazione degli elementi della partita, al certificato vengono aggiunte pagine supplementari, anche tali pagine costituiranno parte integrante del certificato originale mediante l'apposizione, su ciascuna di esse, della firma e del timbro del veterinario ufficiale responsabile della certificazione.
|
|
e)
|
Se il certificato, comprese le schede supplementari di cui alla lettera d), è formato da più di una pagina, ciascuna pagina deve recare, in basso, una numerazione del tipo “(numero di pagina)/(numero totale delle pagine)” e, in alto, il numero di codice del certificato assegnato dall'autorità competente.
|
|
f)
|
L'originale del certificato deve essere compilato e firmato da un veterinario ufficiale. Le autorità competenti del paese esportatore accertano che siano applicati criteri di certificazione equivalenti a quelli previsti dalla direttiva 96/93/CE del Consiglio.
|
|
g)
|
La firma deve essere di colore diverso da quello del testo stampato. La stessa norma si applica ai timbri diversi da quelli a secco o in filigrana.
|
|
h)
|
L'originale del certificato deve accompagnare la partita fino al posto d'ispezione frontaliero dell'UE.
|
|
i)
|
Ove i certificati sanitari siano utilizzati per partite in transito, la casella I.5 (“Destinatario”) del certificato sanitario va completata con il nome e l'indirizzo del posto di ispezione frontaliera attraverso il quale la partita deve lasciare la Comunità europea.
|






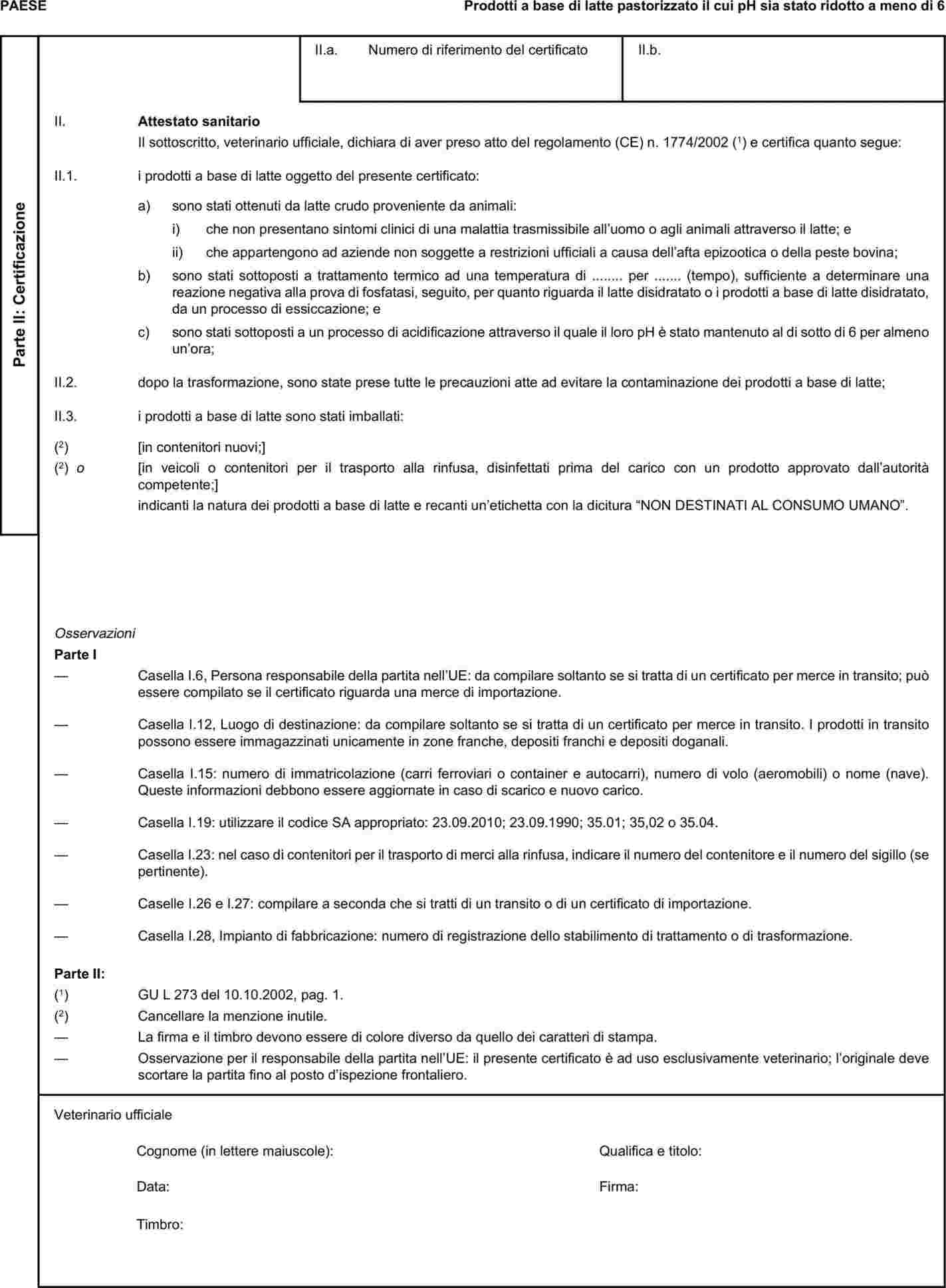

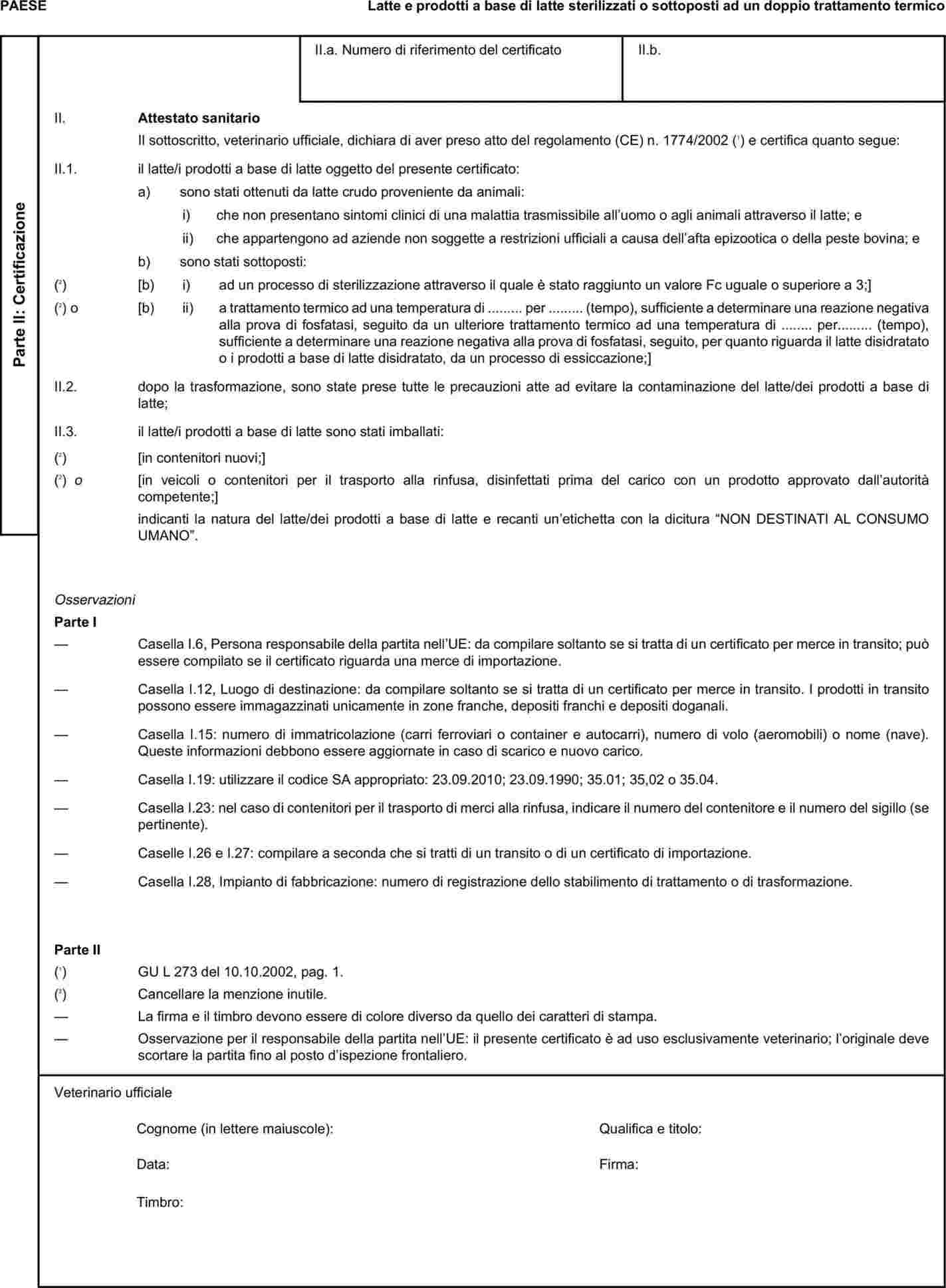























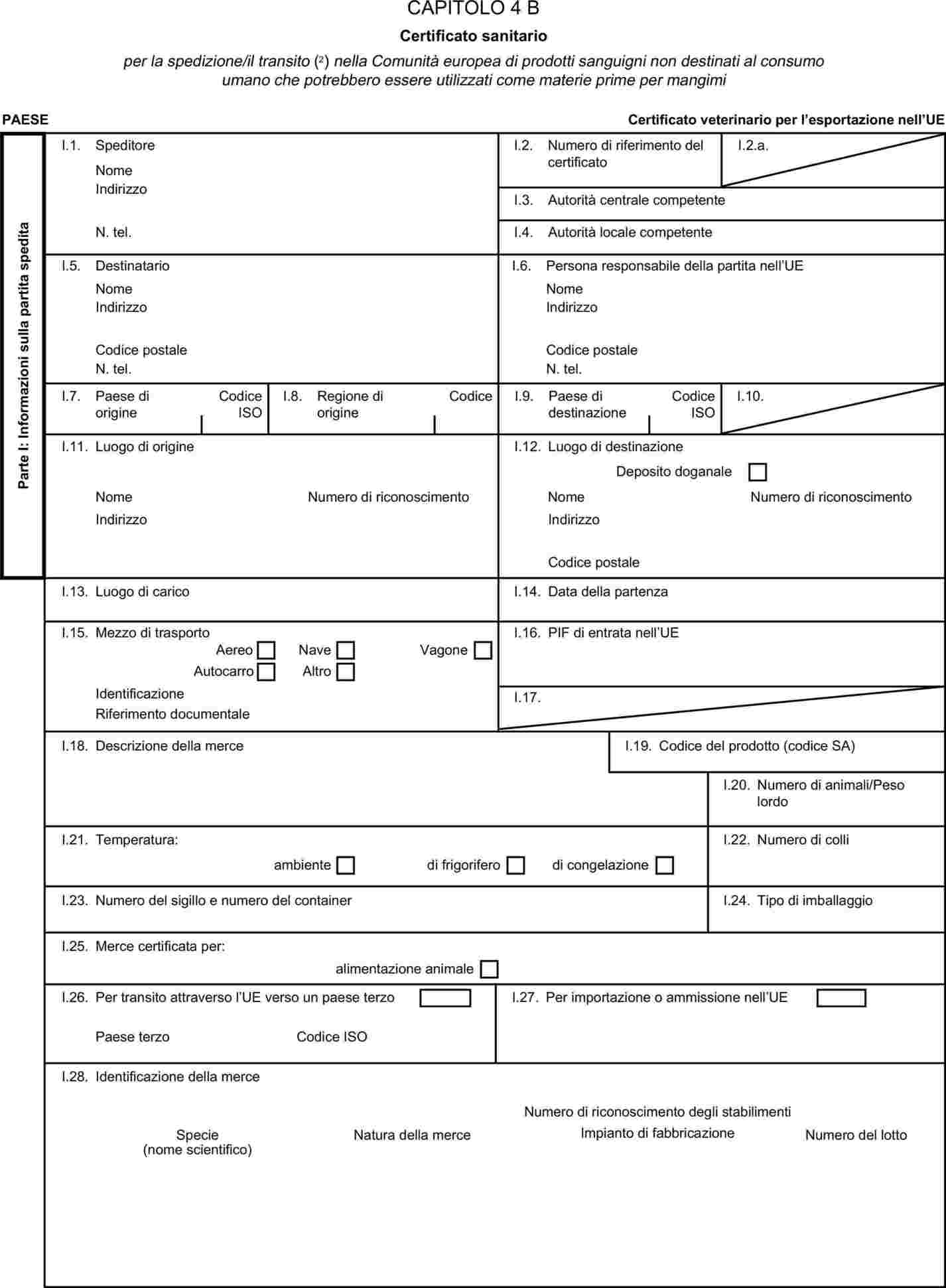

































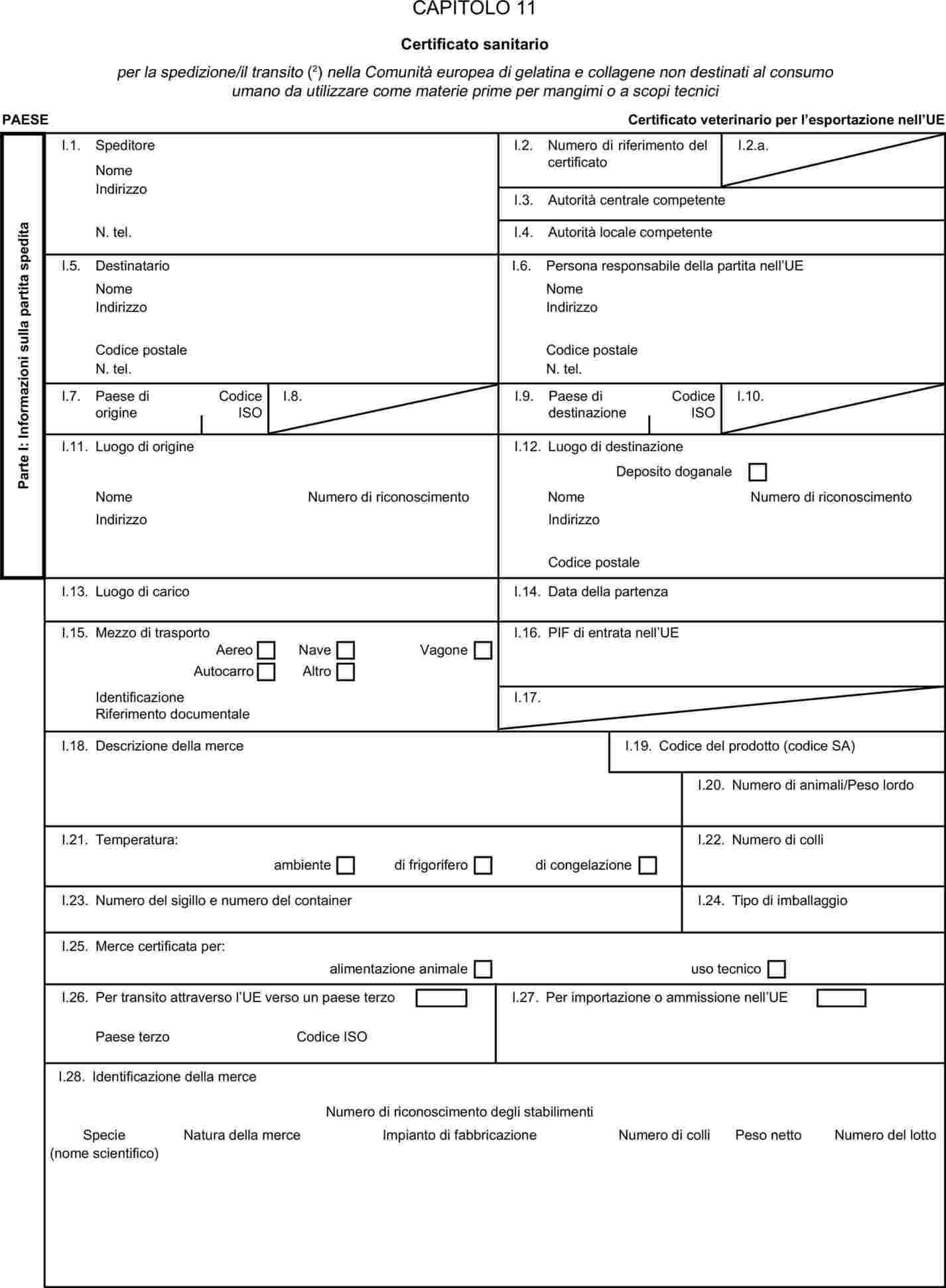


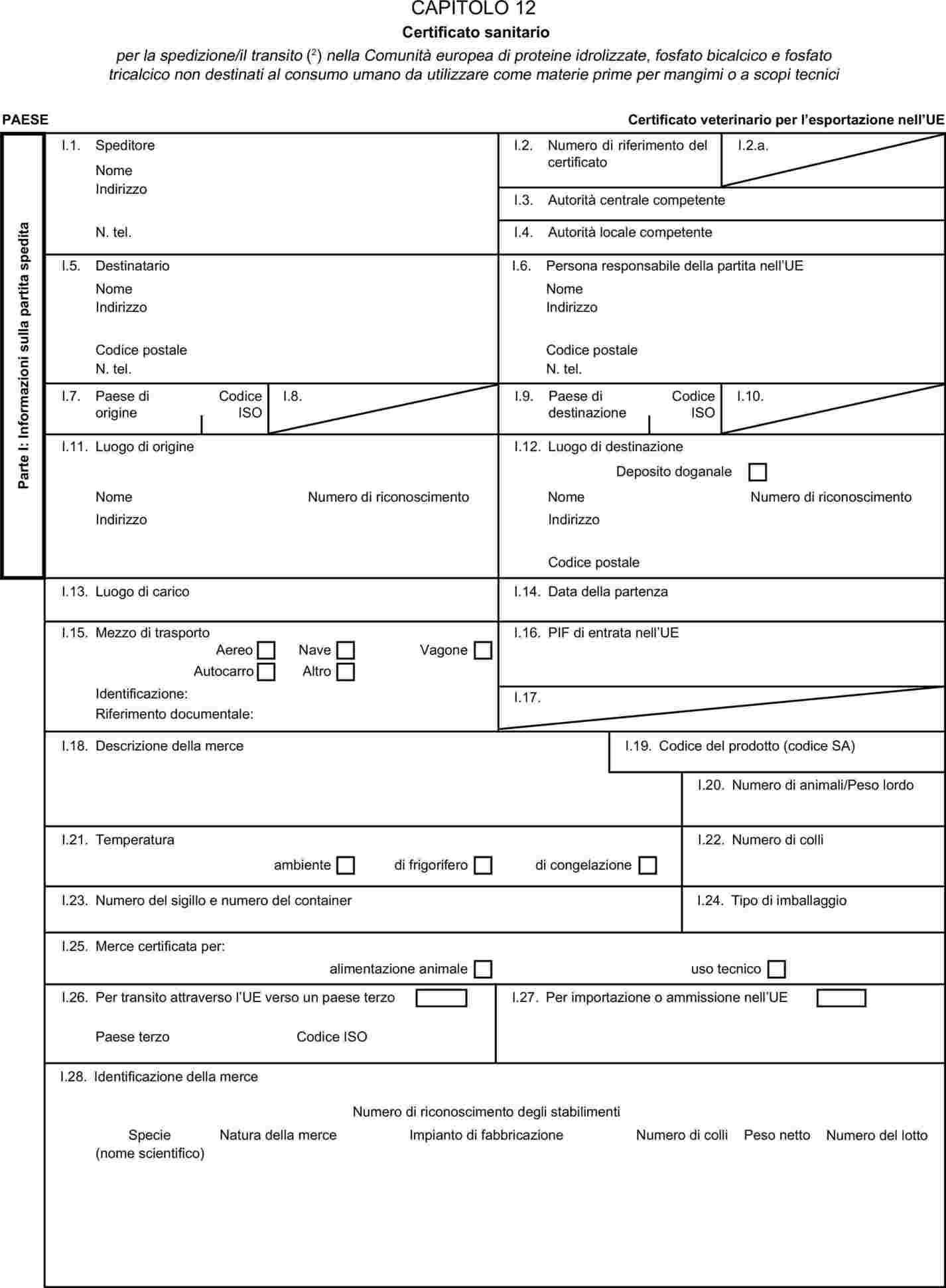












|
|
6)
|
L'allegato XI è modificato come segue:
|
a)
|
il titolo della parte VI è sostituito dal seguente:
«PARTE VI
Elenco dei paesi terzi in provenienza dai quali gli Stati membri possono autorizzare le importazioni di prodotti sanguigni (non provenienti da equidi) destinati a uso tecnico e farmaceutico (certificati sanitari di cui ai capitoli 4 C e 8)»;
|
|
b)
|
nella parte VII il titolo e il punto A sono sostituiti dal testo seguente:
«PARTE VII A
Elenco dei paesi terzi in provenienza dai quali gli Stati membri possono autorizzare l'importazione di sottoprodotti di origine animale destinati alla fabbricazione di alimenti trasformati per animali da compagnia (certificati sanitari di cui ai capitoli 3 B e 3 F)
|
A.
|
Sottoprodotti di origine animale ottenuti da bovini, ovini, caprini, suini ed equini allevati o selvatici:
i paesi terzi e le parti di paesi terzi elencati nella parte I dell'allegato II della decisione 79/542/CEE del Consiglio, in provenienza dai quali è autorizzata l'importazione di tale categoria di carni fresche delle specie corrispondenti, nonché, per quanto riguarda i sottoprodotti specificati, i seguenti paesi:
carni maturate e disossate (compreso il diaframma) e/o frattaglie rifilate maturate di bovini, caprini, ovini o selvaggina (anche allevata) provenienti da paesi dell’America del sud e dell’Africa del sud, o parti di tali paesi, in cui sono autorizzate le carni maturate e disossate delle specie corrispondenti.»;
|
|
|
c)
|
la parte IX è sostituita dalla seguente:
«PARTE IX
Elenco dei paesi terzi in provenienza dai quali gli Stati membri possono autorizzare le importazioni di stallatico trasformato e di prodotti trasformati a base di stallatico per il trattamento del suolo (certificato sanitario di cui al capitolo 17)
Per lo stallatico trasformato e i prodotti trasformati a base di stallatico i paesi elencati nei seguenti atti:
|
a)
|
allegato II, parte 1, della decisione 79/542/CEE del Consiglio;
|
|
b)
|
allegato I della decisione 2004/211/CE della Commissione; o
|
|
|
d)
|
la parte XIII è sostituita dalla seguente:
«PARTE XIII
Elenco dei paesi terzi in provenienza dai quali gli Stati membri possono autorizzare le importazione di siero di equidi (certificato sanitario di cui al capitolo 4 A)
I paesi terzi o le parti di paesi terzi elencati nell'allegato I della decisione 2004/211/CE della Commissione (8), in provenienza dai quali è consentita l'importazione di cavalli destinati all'allevamento o alla produzione.»
|
|
(1) GU L 139 del 30.4.2004, pag. 55; rettifica nella GU L 226 del 25.6.2004, pag. 22.»;
(2) GU L 18 del 23.1.2003, pag. 11.»;
























































































