1992L0065 — HU — 03.07.2004 — 007.002
Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért
Módosította:
Módosította:
|
►A1
|
Ausztria, Finnország és Svédország csatlakozási okmánya
|
C 241
|
21
|
29.8.1994
|
|
►A2
|
Okmány a Cseh Köztársaság, az Észt Köztársaság, a Ciprusi Köztársaság, a Lett Köztársaság, a Litván Köztársaság, a Magyar Köztársaság, a Máltai Köztársaság, a Lengyel Köztársaság, a Szlovén Köztársaság és a Szlovák Köztársaság csatlakozásának feltételeiről, valamint az Európai Unió alapját képező szerződések kiigazításáról szóló
|
L 236
|
33
|
23.9.2003
|
▼B
A TANÁCS 92/65/EGK IRÁNYELVE
(1992. július 13.)
a 90/425/EGK irányelv A. mellékletének I. pontjában felsorolt külön közösségi szabályokban megállapított állat-egészségügyi követelmények hatálya alá nem tartozó állatok, spermák, petesejtek és embriók Közösségen belüli kereskedelmére és a Közösségbe történő behozatalára irányadó állat-egészségügyi követelmények megállapításáról
AZ EURÓPAI KÖZÖSSÉGEK TANÁCSA,
tekintettel az Európai Gazdasági Közösséget létrehozó szerződésre és különösen annak 43. cikkére,
tekintettel a Bizottság javaslatára (
1
),
tekintettel az Európai Parlament véleményére (
2
),
tekintettel a Gazdasági és Szociális Bizottság véleményére (
3
),
mivel az élő állatok és állati eredetű termékek a Szerződés II. mellékletének terméklistáján szerepelnek; mivel az ilyen állatok és termékek forgalomba hozatala a mezőgazdasági gazdálkodók jövedelmének forrásául szolgál;
mivel az ágazat ésszerű fejlődése és termelékenységének növelése érdekében az állatokra és termékekre vonatkozó állat-egészségügyi szabályozást közösségi szinten kell megállapítani;
mivel a Közösségnek el kell fogadnia a belső piac 1992. december 31-éig történő fokozatos létrehozására szolgáló intézkedéseket;
mivel a fent említett célok megvalósításának érdekében a Tanács állat-egészségügyi előírásokat állapított meg a szarvasmarhákra, sertésekre, juhokra és kecskékre, lófélékre, baromfira és keltetőtojásokra, halakra és halászati termékekre, kagylókra, szarvasmarha- és sertésspermákra, szarvasmarha-embriókra, nyers húsra, baromfihúsra, hústermékekre, vad- és nyúlhúsra vonatkozóan;
mivel a fent említett előírások hatálya alá nem tartozó állatok és állati eredetű termékek forgalomba hozatalához állat-egészségügyi előírások elfogadására van szükség;
mivel rendelkezéseket kell hozni – a veszélyeztetett vadon élő állat- és növényfajok nemzetközi kereskedelméről szóló, 1982. december 3-i 3626/82/EGK tanácsi rendelet (
4
) sérelme nélkül – ezen irányelv alkalmazására vonatkozóan;
mivel bizonyos technikai vonatkozásokban hivatkozni kell a szarvasmarhafélék és a sertések Közösségen belüli kereskedelmét érintő állat-egészségügyi problémákról szóló, 1964. június 26-i 64/432/EGK tanácsi irányelvre (
5
), továbbá a száj- és körömfájás elleni védekezésre irányuló közösségi intézkedések bevezetéséről szóló, 1985. november 18-i 85/511/EGK tanácsi irányelvre (
6
);
mivel az ellenőrzések végrehajtása és az azt követő védőintézkedések tekintetében hivatkozni kell a belső piac megvalósításának céljával meghatározott élőállatok és állati termékek Közösségen belüli kereskedelmében alkalmazható állat-egészségügyi és tenyésztéstechnikai ellenőrzésekről szóló, 1990. június 26-i 90/425/EGK tanácsi irányelvben (
7
) megállapított általános előírásokra;
mivel – ha másképp nem szabályozták – az állatok és az állati eredetű termékek kereskedelmét a lehetséges védőintézkedések alkalmazásának sérelme nélkül liberalizálni kell;
mivel az állatbetegségek terjedésének jelentős kockázata miatt bizonyos állatokra és állati eredetű termékekre vonatkozóan különleges követelményeket kell meghatározni arra az esetre, amikor kereskedelmi célból forgalomba hozatalra kerülnek, különösen ha kiváló állat-egészségügyi helyzetű térségbe szánják;
mivel az Egyesült Királyság és Észak-Írország, illetve Írország különleges elszigetelt helyzetéből következően, illetve abból a tényből adódóan, hogy jelentős ideje veszettségtől mentes területnek számítanak, különleges intézkedések meghozatala szükséges annak megakadályozására, hogy a más országokból származó kutyák és macskák az Egyesült Királyságban, illetve Írországban történő forgalomba hozatala során ne veszélyeztessék a veszettség behurcolásával ezen országokat. Mindazonáltal ezen intézkedések nem érintik a tagállamok határain történő állat-egészségügyi ellenőrzések megszüntetését;
mivel e követelmények teljesítésének biztosítására és ellenőrzésére a legmegfelelőbb módszer az egészségügyi bizonyítvány;
mivel a Közösség egészségügyi állapotának fenntartása érdekében az ezen irányelvben említett állatoknak és állati eredetű termékeknek forgalomba hozataluk esetén eleget kell tenniük a kereskedelemre vonatkozó alapvető követelményeknek, amelyek ellenőrzése a harmadik országokból a Közösségbe behozott termékek állat-egészségügyi ellenőrzésére irányadó elvek megállapításáról szóló, 1990. december 10-i 90/675/EGK tanácsi irányelv (
8
) alapelvei és előírásai szerint történik;
mivel intézkedések szükségesek olyan eljárás megalkotására, amely biztosítja az Állat-egészségügyi Állandó Bizottság keretén belül a tagállamok és a Bizottság közötti szoros együttműködést;
mivel az egyes államok nemzeti jogrendjébe illesztésének a 29. cikk által 1994. január 1-jében megállapított határideje nem befolyásolhatja a határokon történő állat-egészségügyi ellenőrzések eltörlését, amelynek határideje 1993. január 1-je,
ELFOGADTA EZT AZ IRÁNYELVET:
ELSŐ FEJEZET
Általános rendelkezések
1. cikk
▼M7
Ezen irányelv azon állatok, spermák, petesejtek és embriók Közösségen belüli kereskedelmére és a Közösségbe történő behozatalára irányadó állat-egészségügyi követelményeket állapítja meg, amelyek nem tartoznak az F mellékletben meghatározott közösségi jogszabályokban megállapított állat-egészségügyi követelmények hatálya alá.
▼B
Ezen irányelvet a 3626/82/EGK rendelet alapján hozott rendelkezések sérelme nélkül kell alkalmazni.
Ezen irányelv nem érinti a kedvtelésből tartott állatokra vonatkozó nemzeti szintű szabályokat, mindazonáltal ez utóbbi szabályok változatlanul hagyása nem veszélyeztetheti a tagállamok közös határain történő állat-egészségügyi vizsgálatok eltörlését.
2. cikk
(1) Ezen irányelv alkalmazásában:
a) „kereskedelem”: a 90/425/EGK irányelv 2. cikkének 3. pontjában meghatározott kereskedelem;
b) „állatok”: a 64/432/EGK, 90/426/EGK (
9
) 90/539/EGK (
10
), 91/67/EGK (
11
), 91/68/EGK (
12
), 91/492/EGK (
13
) és 91/493/EGK (
14
) irányelvekben foglalt fajoktól eltérő állatfajok egyedei;
c) „engedélyezett szervezet, intézmény vagy központ”: a 13. cikkel összhangban engedélyezett valamennyi állandó, földrajzilag behatárolt területen lévő létesítmény, amelyben egy vagy több állatfaj rendszeres tartása vagy tenyésztése folyik kereskedelmi célból vagy anélkül, illetve kizárólagosan az alábbiakban felsorolt célok legalább egyikéből:
— állatok bemutatása és oktatási célok,
— alap vagy alkalmazott tudományos kutatás, vagy ilyen jellegű kutatás céljából történő tenyésztés;
d) „bejelentési kötelezettség alá tartozó betegségek”: az A. mellékletben felsorolt betegségek.
(2) Továbbá – az engedélyezett központokra és szervezetekre vonatkozó meghatározások kivételével – a 64/432/EGK, 91/67/EGK és a 90/539/EGK irányelv 2. cikke fogalommeghatározásait értelemszerűen kell alkalmazni.
MÁSODIK FEJEZET
A kereskedelemre vonatkozó előírások
3. cikk
A tagállamok biztosítják, hogy az 1. cikk első bekezdésében említett kereskedelem kizárólag az ezen irányelv alkalmazásából vagy más közösségi törvényekből, különösen az alkalmazott védőintézkedésekből fakadó állat-egészségügyi okok miatt nem tiltott vagy korlátozott.
▼A1
A vonatkozó közösségi rendelkezések meghozataláig Svédország az Svédországba szállítandó kígyók és más hüllők vonatkozásában saját nemzeti rendelkezéseit alkalmazhatja.
▼B
4. cikk
A tagállamok megteszik a megfelelő intézkedéseket annak érdekében, hogy a 90/425/EGK irányelv 4. cikke 1. pontja a) alpontjának alkalmazása céljából az irányelv 5–10. cikkében említett állatok – a 13. cikk és a 24. cikk végrehajtásához meghozandó különös intézkedések sérelme nélkül – abban az estben képezzék kereskedelem tárgyát, ha eleget tesznek az 5–10. cikkben meghatározott előírásoknak, valamint ha az irányelv 12. cikke (1) és (3) bekezdésében említett olyan gazdaságokból vagy üzleti tevékenységekből származnak, amelyeket az illetékes hatóság nyilvántartásba vett és az alábbi feltéteknek is megfelelnek:
— az állatok a 90/425/EGK irányelv 3. cikke (3) bekezdésének megfelelően rendszeres vizsgálaton esnek át,
— a bejelentési kötelezettség alá tartozó betegségeken kívül azon, a B. mellékletben említett betegségek fellépését, amelyekre vonatkozóan az érintett tagállamok védekezési vagy ellenőrző programot indítottak be, jelentik az illetékes hatóságnak,
— eleget tesznek azon, az egyes betegségekkel szembeni védekezésre vonatkozó, egyedi nemzeti szintű előírásoknak, amelyek az adott tagállam szempontjából különös jelentőséggel bírnak, és amelyekre a 14. cikknek vagy a 15. cikk (2) bekezdése szerinti határozatnak megfelelően programot hoztak létre,
— csak olyan állatokat hoznak kereskedelmi célból forgalomba, amelyek betegség jelét nem mutatják, illetve olyan gazdaságokból vagy területekről származnak, amelyekben állat-egészségügyi okokra visszavezethető tilalom nincs érvényben; továbbá abban az esetben, ha az állatok az 5–11. cikk szerinti egészségügyi bizonyítvánnyal vagy kereskedelmi okmánnyal nem rendelkeznek, az állattartónak kell nyilatkozatot tennie arról, hogy az érintett egyedek a szállítás kezdetekor betegségnek semmilyen egyértelmű jelét nem mutatták, illetve hogy a létesítménye semmilyen állat-egészségügyi korlátozás alá nem esik,
— megfelel az állatjóléti követelményeknek.
5. cikk
(1) A tagállamok biztosítják, hogy a majmok és félmajmok csak akkor kerülnek kereskedelmi forgalomba, ha az adott tagállam illetékes hatóságai által a 13. cikk értelmében engedélyezett szervezetekből, intézményekből vagy központokból származnak, továbbá ezek az állatok rendelkeznek az E. melléklet szerinti állat-egészségügyi bizonyítvánnyal, amelyet az állat származási helye szerinti szervezet, intézmény vagy központ hatósági állatorvosa állít ki, igazolva az állat egészséges állapotát.
(2) A tagállam illetékes hatósága – az (1) bekezdéstől eltérve – jóváhagyhatja egy engedélyezett szervezetnek, intézetnek vagy központnak a majmok és félmajmok magánszemélytől történő beszerzését.
6. cikk
A. A tagállamok biztosítják, hogy – a 14. és a 15. cikk sérelme nélkül – a 64/432/EGK, 90/426/EGK és 91/68/EGK irányelvben nem szereplő patás állatfajok kereskedelmi forgalomba csak akkor kerülnek, ha azok a következő követelményeknek eleget tesznek:
1. általános érvénnyel:
a) azonosításuknak a 90/425/EGK irányelv 3. cikke (1) bekezdésének c) pontja szerint kell történnie;
b) nem lehetnek fertőző betegség felszámolása céljából létrehozott program alapján vágóhídra szánt állatok;
c) azokat ragadós száj- és körömfájás ellen nem vakcinázták, és eleget kell tenniük a 85/511/EGK irányelv és a 64/432/EGK irányelv 4a. cikkének vonatkozó követelményeinek;
d) a 64/432/EGK irányelv 3. cikke (2) bekezdése b) és c) pontjában említett gazdaságból kell származniuk, amely nem tartozik állat-egészségügyi intézkedések, különösen a 85/511/EGK, 80/217/EGK (
15
) és a 91/68/EGK irányelv szerint hozott intézkedések hatálya alá; és az állatokat születésüktől fogva, de legalább szállításuk előtt harminc nappal folyamatosan e gazdaságban tartották;
▼M7
e) csatolni kell az E melléklet 1. részében megadott mintának megfelelő bizonyítványt, amely tartalmazza az alábbi nyilatkozatot:

▼M7 —————
▼B
2. kérődzők esetében:
a) a 64/432/EGK vagy a 91/68/EGK irányelvvel összhangban csak hatóságilag elismerten gümőkórtól és brucellózistól mentes állományból származhatnak, továbbá eleget kell tenniük a 91/68/EGK irányelv 3. cikke vagy a 64/432/EGK irányelv 3. cikke (2) bekezdésének c), d), f), g) és h) pontjában a kérődzőkre vonatkozó állat-egészségügyi előírásoknak;
▼M7
b) amennyiben nem olyan állományból érkeznek, amely megfelel az a) pont követelményeinek, akkor olyan állományból kell érkezniük, amelyben az állatok berakodását megelőző 42 napban nem észleltek brucellózisos vagy gümőkóros esetet, és amelyben a kérődzők a berakodást megelőző 30 napban negatív eredménnyel mentek át brucellózis- és gümőkór vizsgálaton;
▼A1
c) a 26. cikkben megállapított eljárásnak megfelelően rendelkezések fogadható el a leukózisra vonatkozóan.
▼B
3. sertésfélék esetében:
a) nem származhatnak olyan területről, amely a 64/432/EGK irányelv 9a. cikkének megfelelően, afrikai sertéspestis előfordulása miatt korlátozások alatt áll;
b) csak olyan gazdaságból származhatnak, amelyet klasszikus sertéspestis következtében a 80/217/EGK irányelvben meghatározott korlátozások nem sújtanak;
c) csak a 64/432/EGK irányelvnek megfelelő brucellózistól mentes gazdaságból származhatnak és az állatoknak a 64/432/EGK sertésre vonatkozó állat-egészségügyi követelményeknek is meg kell felelniük;
d) amennyiben a c) pontban leírt követelményeknek meg nem felelő állományból származnak, az állatokat a szállítást megelőző harminc napon belül alá kell vetni egy brucellózis elleni ellenanyag kimutatására irányuló vizsgálaton, amely negatív eredménnyel zárul.
▼M7 —————
▼M7
4. az e cikkben említett vizsgálati követelményeket és szempontokat a 26. cikkben megállapított eljárásnak megfelelően lehet meghatározni. E határozatoknak figyelembe kell venniük a Közösség sarkköri régióiban tenyésztett kérődzők esetét.
Az előző albekezdésben előírt határozatok meghozataláig a nemzeti jogszabályokat kell alkalmazni.
▼B
B. A 64/432/EGK irányelv a következőképpen módosul:
1. a 2. cikk b) és c) pontjában a „szarvasmarhák” helyébe a „szarvasmarhafélékhez tartozó fajok egyedei (beleértve a Bubalus bubalus-t)” lép;
2. a következő cikkel egészül ki:
„10a. cikk
A 12. cikkben meghatározott eljárásnak megfelelően az F. mellékletben szereplő egészségügyi bizonyítvány módosítható vagy kiegészíthető, különösen a 92/65/EGK irányelv 6. cikkében meghatározott követelmények figyelembevétele céljából.”
7. cikk
A. A tagállamok biztosítják, hogy a 90/539/EGK irányelv hatálya alá nem tartozó madárfajok kereskedelmi forgalomba csak akkor kerülhetnek, ha azok megfelelnek az alábbi követelményeknek:
1. általános érvénnyel:
a) csak olyan gazdaságból származhatnak, amelyben madárinfluenza a szállítást megelőző harminc napban nem fordult elő;
b) csak olyan gazdaságból vagy területről származnak, amelyben Newcastle-betegség leküzdésére szolgáló korlátozó intézkedéseket nem vezettek be.
A 90/539/EGK irányelv 19. cikkében említett közösségi intézkedések végrehajtásáig – a Szerződés általános rendelkezéseinek megfelelően – a Newcastle-betegség leküzdésére irányuló nemzeti szintű előírások maradnak továbbra is érvényben;
c) a 91/496/EGK irányelv 10. cikk (1) bekezdése harmadik francia bekezdésével összhangban – amennyiben harmadik országból származnak – a Közösség területén lévő gazdaságban, amelyben a behozatalt követően a felvétel megtörtént, karanténba kell hogy kerüljenek;
2. továbbá, a papagájfélékre vonatkozóan:
a) nem származhatnak olyan gazdaságból, illetve nem érintkezhettek olyan gazdaság egyedeivel, ahol psittacosist (Chlamydia psittaci) állapítottak meg.
Az utolsó regisztrált esettől számított tilalom és az állatorvosi felügyelet mellett történő – a 26. cikkben előírt eljárásnak megfelelően végrehajtott – gyógykezelés ideje legalább 2 hónap;
b) azonosításuk a 90/425/EGK irányelv 3. cikke (1) bekezdésének c) pontja szerint történik.
A papagájfélék – különösen a beteg papagájfélék – azonosítási módszerének meghatározása a 26. cikkben leírt eljárás szerint történik;
c) az állatokat a származási gazdaság vagy vállalkozás szerint illetékes, az illetékes hatóság által e jogokkal felruházott állatorvos vagy hatósági állatorvos által kiállított kereskedelmi okmány kíséri.
B. A nyúlhús és a tenyésztettvad-hús előállítását és forgalomba hozatalát érintő közegészségügyi és állat-egészségügyi problémákról szóló, 1990. november 27-i 91/495/EGK tanácsi irányelv (
16
) 2. cikke (2) bekezdésének második albekezdésében az ötödik sorban lévő „90/539/EGK irányelvben említett fajok” kifejezés az „és a laposmellű futómadarak (Ratitae)” szavakkal egészül ki.
A baromfi és a keltetőtojás Közösségen belüli kereskedelmére és harmadik országból történő behozatalára irányadó állat-egészségügyi feltételekről szóló, 1990. október 15-i 90/539/EGK tanácsi irányelv (
17
) 2. cikke (2) bekezdésének 1. pontja az „és fogoly” kifejezés az „és laposmellű futómadár (Ratitae)” kifejezéssel egészül ki.
8. cikk
A tagállamok biztosítják, hogy a méhek (Apis melifera) csak akkor kerülhetnek kereskedelmi forgalomba, ha megfelelnek az alábbi feltételeknek:
a) származási területükön nincsenek mézelő méhek nyúlós költésrothadása miatt bevezetett tilalmi intézkedések;
A tilalom az utolsó regisztrált esettől számítva, illetve attól az időponttól számítva legalább 30 napig tart, amikor az illetékes hatóság három kilométer sugarú körzetben minden kaptárt ellenőrzött, és minden fertőzött kaptárt elégettek, vagy a fent említett illetékes hatóság egyetértésével kezeltek és megvizsgáltak;
A méhekre (Apis melifera) alkalmazott követelményeket vagy azokkal egyenértékű követelményeket a 26. cikkben foglalt eljárással összhangban – az Állat-egészségügyi Tudományos Bizottsággal való egyeztetést követően – alkalmazni lehet a poszméhek esetében is;
b) az E. mellékletben található mintának megfelelő egészségügyi bizonyítvány kíséri az állatokat, amelyben az illetékes hatóság igazolja, hogy az állatok az a) pontban leírt követelményeknek eleget tesznek.
9. cikk
(1) A tagállamok biztosítják, hogy nyúlalakúak csak akkor kerülhetnek kereskedelmi forgalomba, ha eleget tesznek az alábbi követelményeknek:
a) nem származhatnak olyan gazdaságból, vagy nem érintkezhettek olyan gazdaságból származó állatokkal, amelyen veszettség jelentkezett, illetve az elmúlt egy hónapban ennek gyanúja fennállt;
b) csak olyan gazdaságból származhatnak, amelyben egy állaton sem láthatóak a myxomatózis klinikai tünetei.
(2) A nyúlalakúak országon belüli szállításához egészségügyi bizonyítvány használatát előíró tagállamok megkövetelhetik, hogy a hozzájuk szánt állatokat az E. mellékletben szereplő mintának megfelelő egészségügyi bizonyítvány kísérje a következő nyilatkozattal kiegészítve:
„Alulírott, … igazolom, hogy a szállítmány eleget tett a 92/65/EGK irányelv 9. cikkében leírt követelményeknek, és az állatok a vizsgálat során semmilyen betegség klinikai tünetét nem mutatták.”
E bizonyítványt csak a származási gazdaság szerint illetékes, az illetékes hatóság által e jogokkal felruházott állatorvos vagy hatósági állatorvos, nyúlalakúak üzletszerű tenyésztése esetén a hatósági állatorvos állíthatja ki. Azon tagállamok, amelyek élni kívánnak e lehetőséggel, értesítik a Bizottságot, amelynek kötelessége biztosítani az első albekezdésben foglalt követelmények teljesítését.
(3) Írország és az Egyesült Királyság megkövetelheti az (1) bekezdés a) pontjában meghatározott követelmények teljesítését biztosító egészségügyi bizonyítvány benyújtását.
10. cikk
(1) A tagállamok biztosítják, hogy a
►M5
————— ◄ nyérc és róka kereskedelmét megtiltják, amennyiben ezen állatok olyan gazdaságból származnak vagy érintkezhettek olyan gazdaságból származó állatokkal, amelyen veszettség jelentkezett, illetve az elmúlt hat hónapban ennek gyanúja fennállt, amíg rendszeres vakcinázási programot nem alkalmaznak.
▼M5
(2) A kereskedelmi forgalomba kerülés érdekében a kutyáknak, macskáknak és görényeknek eleget kell tenniük a kedvtelésből tartott állatok nem kereskedelmi célú mozgására vonatkozó állat-egészségügyi követelményekről és a 92/65/EGK tanácsi irányelv módosításáról szóló, 2003. május 26-i 998/2003/EK európai parlamenti és tanácsi rendelet (
18
) 5. és 16. cikkében megállapított követelményeknek.
Az állatokat kísérő bizonyítványnak igazolnia kell azt is, hogy az állatok feladása előtt 24 órával az illetékes hatóság által felhatalmazott állatorvos klinikai vizsgálatot végzett, amely azt mutatta, hogy az állatok jó egészségi állapotban vannak, és kibírják a rendeltetési helyükig történő szállítást.
(3) A (2) bekezdéstől eltérően – amennyiben a kereskedelem Írországba, az Egyesült Királyságba vagy Svédországba irányul – a kutyáknak, macskáknak és görényeknek a 998/2003/EK rendelet 6. és 16. cikkében megállapított feltételeknek kell megfelelniük.
Az állatokat kísérő bizonyítványnak igazolnia kell azt is, hogy az állatok feladása előtt 24 órával az illetékes hatóság által felhatalmazott állatorvos klinikai vizsgálatot végzett, amely azt mutatta, hogy az állatok jó egészségi állapotban vannak, és kibírják a rendeltetési helyükig történő szállítást.
▼A2
(4) A (2) és (3) bekezdés sérelme nélkül, Írország, Ciprus, Málta és az Egyesült Királyság fenntarthatja az azokra a húsevőkre,
►M5
a (2) és (3) bekezdésben említett fajok kivételével, ◄ főemlősökre, denevérekre és az ezen irányelv hatálya alá tartozó egyéb veszettségre fogékony állatokra vonatkozó nemzeti karanténelőírásait, amelyek esetében nem bizonyítható, hogy a származási telepen születtek, és hogy születésük óta fogságban voltak, ugyanakkor ezen előírások fenntartása nem veszélyeztetheti a tagállamok közötti határokon végzett állat-egészségügyi ellenőrzések eltörlését.
▼B
(5) A 90/638/EGK határozat a következőképpen módosul:
1. az 1. cikk a következő francia bekezdéssel egészül ki:
„– veszettség leküzdésére irányuló programok: a III. mellékletben megállapított követelmények”
;
2. a következő melléklet került beszúrásra:
„III. MELLÉKLET
A veszettség leküzdésére irányuló programok követelményei
A veszettség leküzdésére irányuló programoknak legalább a következőket kell tartalmazniuk:
a) az I. melléklet 1–7. pontjában említett követelmények;
b) azon terület vagy területek részletes leírása – a természetes határokat is beleértve – amelyeken rókák szájon át történő immunizálása folyik. E terület vagy területek nagyságának legalább 6 000 km2-nek kell lennie, illetve kiterjedhet a tagállam teljes területére, valamint Közösségen kívüli állam szomszédos területét is magában foglalhatja;
c) az alkalmazandó oltóanyagok részletes leírása, a csalétek-kihelyezés rendszere, sűrűsége és gyakorisága;
d) adott esetben, a projekt területén működő önkéntes szervezetek a növény- és állatfajok megőrzése, megóvása érdekében végzett tevékenységeinek részletes leírása, célja és költségei.”
(6) A Tanács – a Bizottság javaslatára – minősített többséggel kijelöl egy speciális intézményt a szerológiai tesztek szabványosításához szükséges ismérvek megalkotásának céljából, továbbá dönt annak kötelezettségeiről.
(7) A tagállamok biztosítják, hogy a szerológiai tesztek során felmerülő költségek az importőröket terhelik.
▼M5 —————
▼A1
10a. cikk
A veszettség tekintetében és a 26. cikkben megállapított eljárásnak megfelelően, a megfelelő bizonyítékok bemutatása után a 9. és 10. cikket úgy kell módosítani, hogy az figyelembe vegye a finnországi és svédországi helyzetet annak érdekében, hogy rájuk ugyanazokat a rendelkezéseket legyenek alkalmazandók, mint a velük megegyező helyzetben lévő tagállamokban.
▼B
11. cikk
(1) A tagállamok biztosítják, hogy – a 21. és 23. cikk végrehajtása során hozott határozatok sérelme nélkül – csak a (2), (3) és (4) bekezdésben megállapított feltételeknek megfelelő sperma, petesejt és embrió kerülhet kereskedelmi forgalomba.
(2) A juh, kecske és lófajok spermájának – a bizonyos különös fajták törzskönyvébe történő felvétele során betartandó követelmények sérelme nélkül – az alábbi feltételeknek kell megfelelnie:
— mesterséges termékenyítés céljára történő gyűjtése és előkészítése egészségügyi szempontok alapján a D. melléklet I. fejezetének megfelelően engedélyezett központban történt, vagy – juh és kecske esetében – a fentiektől eltérően, a 91/68/EGK irányelv követelményeinek megfelelő gazdaságban,
— a D. melléklet II. fejezetében leírt feltételeknek megfelelő állatoktól származik (bebocsátás és rutin vizsgálatok),
— gyűjtése, előkészítése és tartósítása a D. melléklet III. fejezetének megfelelően történt,
— egy másik tagállamba történő szállítás során a 26. cikk szerinti eljárás alapján megállapított mintának megfelelő egészségügyi bizonyítvány kíséri.
(3) Juh-/kecskefélék, lófélék és sertések petesejtjei, illetve embrióinak az alábbi feltételeknek kell megfelelnie:
— azokat az érintett tagállam illetékes hatósága által engedélyezett gyűjtő csoport távolította el, továbbá előállításuk megfelelően felszerelt laboratóriumban, a D. melléklet IV. fejezetében leírt feltételeknek megfelelő donor állatokból történt,
— kezelése és tárolása a D. melléklet III. fejezetének megfelelően történt,
— egy másik tagállamba történő szállítás során a 26. cikk szerinti eljárás alapján megállapított mintának megfelelő egészségügyi bizonyítvány kíséri.
A donor nőstényállatok inszeminálásához használt juh-, kecske- és lóspermának meg kell felelnie a (2) bekezdés előírásainak, illetve – a sertések estében – a 90/429/EGK irányelvnek. A 26. cikkben leírt eljárásnak megfelelően egyéb kiegészítő biztosítékokat is meg lehet határozni.
(4) A Bizottság 1997. december 31-ét megelőzően jelentést tesz e cikk végrehajtásáról szóló javaslatokkal együttesen, különös tekintettel a tudomány és a technika fejlődésére.
12. cikk
(1) A 90/425/EGK irányelv által megállapított, ellenőrzésekre vonatkozó szabályokat az elvégzendő vizsgálatok végrehajtására és az azt követő intézkedésekre vonatkozóan az egészségügyi bizonyítvánnyal ellátott, ezen irányelv hatálya alá tartozó állatok, spermák, petesejtek és embriók tekintetében alkalmazni kell. Az egyéb állatoknak – a származási és a rendeltetési helyen végzett ellenőrzések tekintetében – a hivatkozott irányelv alapszabályainak hatálya alá tartozó gazdaságból kell származniuk.
(2) A 90/425/EGK irányelv 10. cikkét alkalmazni kell az ezen irányelv hatálya alá tartozó állatokra, spermára, petesejtekre és embriókra.
(3) Kereskedelmi célokból a 90/425/EGK irányelv 12. cikkének előírásait kiterjesztik azon kereskedőkre, akik állandó vagy ideiglenes jelleggel a 7., 9. és 10. cikkben leírt állatokat tartanak.
(4) A rendeltetési hely tájékoztatása – a 90/425/EGK irányelv 4. cikk (2) bekezdése szerint – az ezen irányelvvel összhangban egészségügyi bizonyítvánnyal kísért állatok, spermák, petesejtek és embriók tekintetében az Animo-rendszeren keresztül történik.
(5) Ezen irányelv különös rendelkezéseinek sérelme nélkül, az illetékes hatóság ezen irányelv előírásai megsértésének gyanúja esetén vagy – amennyiben az 1. cikkben említett állatok és spermák, petesejtek és embriók minősége kétséges – valamennyi szükséges vizsgálatot elvégzi.
(6) A tagállamok ezen irányelv megsértésének szankcionálása érdekében megteszik a megfelelő közigazgatási vagy büntető intézkedéseket, különösen ha az 1. cikkben említett állatok valós állapota nem egyezik meg a bizonyítványokban vagy okmányokban leírtakkal, továbbá ha az állatok azonosítása vagy az érintett spermák, petesejtek és embriók jelölése nem felel meg ezen irányelvnek, vagy az érintett állatok vagy termékek az ezen irányelvben leírt ellenőrzéseken nem estek át.
13. cikk
(1) Az A. és B. mellékletben leírt betegségre fogékony állatok kereskedelméhez – amennyiben a rendeltetési tagállamban érvényesek a 14. és l5. cikkben leírt biztosítékok – és az ilyen állatok spermájának, petesejtjeinek és embrióinak kereskedelméhez, amely a C. melléklet szerint engedélyezett szervezetek, intézmények vagy központok között bonyolódik le, az E. mellékletben meghatározott mintának megfelelő szállítási okmány használata szükséges. Ezen – a származási szervezet, intézmény vagy központ szerint illetékes állatorvos által kiállítandó – okmányban igazolni kell, hogy az állatok, spermák, petesejtek vagy embriók olyan szervezetből, intézményből vagy központból származnak, amelyet a C. mellékletnek megfelelően engedélyeztek; az okmánynak az állatokat és termékeket a szállítás során végig kísérnie kell.
(2)
a) Az engedélyezés érdekében a szervezetek, intézmények és központok a bejelentési kötelezettség alá tartozó betegségek tekintetében a tagállam illetékes hatóságának valamennyi, a C. melléklet követelményeivel összefüggésben lévő igazoló okmányt benyújtják.
b) Az engedélyezés kérvényezéséhez vagy megújításához benyújtott iratok megérkezésekor az illetékes hatóság azt a benne foglalt információk alapján és – adott esetben – a helyszíni vizsgálatok eredményeinek figyelembevételével megvizsgálja.
c) Az illetékes hatóság, a C. melléklet 3. pontjának megfelelően az engedélyezést visszavonhatja.
d) Minden tagállam benyújtja a Bizottságnak az engedélyezett szervezetek, intézmények és központok jegyzékét a változások feltüntetésével. A Bizottság ezen adatokat továbbítja a többi tagállamnak.
▼A1
e) Svédországnak a csatlakozási szerződés hatálybalépésének időpontjától számítva két év áll rendelkezésére a szervezetek, intézetek és központok tekintetében előírt intézkedések végrehajtására.
▼B
14. cikk
(1) Amennyiben a tagállam közvetlenül vagy az állattartókon keresztül önkéntes vagy kötelező jellegű programot állít vagy állított fel a B. mellékletben említett betegségek leküzdésére, benyújthatja a programot a Bizottságnak, különös tekintettel a következőkre:
— a betegség elterjedtsége a területén,
— az adott betegség bejelentési kötelezettség alá tartozik-e,
— a program beindításának okai, figyelembe véve a program költség-haszon viszonyait és a betegség jelentőségét,
— a földrajzi terület, ahol a programot végrehajtják,
— a létesítményekre alkalmazott minősítési kategóriák, valamennyi, a gazdaságba kerülő állatfajra vonatkozó követelmények és az alkalmazandó vizsgálati eljárások,
— a program ellenőrző eljárása, beleértve az állattartók szerepének mértékét a végrehajtás során,
— a foganatosítandó intézkedések ismertetése, amennyiben valamely okból egy gazdaság elveszti a minősítését,
— a program folyamán végzett vizsgálatok pozitív eredménye esetén végrehajtandó intézkedések,
— az érintett tagállam területén történő és a Közösségen belüli kereskedelem közötti megkülönböztetés hiánya.
(2) A Bizottság megvizsgálja a tagállamok benyújtott programjait. A programokat a 26. cikkben leírt eljárásnak megfelelően, az (1) bekezdésben foglalt ismérvek teljesítése mellett hagyhatják jóvá. Ugyanezen eljárás keretében további, általános vagy korlátozott érvényű, a kereskedelemben esetleg szükséges biztosítékok kerülhetnek meghatározásra a programok bemutatásával egyidejűleg vagy azt követően legkésőbb három hónapon belül. E biztosítékok nem haladhatják meg a tagállamok által nemzeti szinten alkalmazott biztosítékok mértékét.
(3) A tagállamok által benyújtott programokat a 26. cikkben leírt eljárásnak megfelelően lehet módosítani vagy kiegészíteni. Ugyanezen eljárás keretében a (2) bekezdésben említett biztosítékok is módosíthatók.
15. cikk
(1) Amennyiben egy tagállam véleménye szerint területe vagy területének egy része mentes a B. mellékletben felsorolt olyan betegségek egyikétől, amelyre az ezen irányelv hatálya alá tartozó állatok fogékonyak, igazoló dokumentációt nyújt be a Bizottságnak, különös tekintettel az alábbiakra:
— a betegség jellege és előfordulásának gyakorisága az adott területen,
— a szerológiai, mikrobiológiai, patológiai vagy járványügyi vizsgálatok alapján végzett ellenőrző tesztek eredményei,
— az az időpont, amióta a betegség bejelentési kötelezettség alá tartozik az illetékes hatóság felé,
— a végrehajtott ellenőrzés időtartama,
— adott esetben az az időszak, amíg a betegség elleni védőoltás tiltott volt és a tilalom hatálya alá eső földrajzi terület,
— annak igazolására vonatkozó rendelkezések, hogy a betegség nem fordul elő.
(2) A Bizottság megvizsgálja az (1) bekezdés által előírt dokumentációt, és a tagállam tervét jóváhagyás vagy elutasítás céljából benyújtja az Állat-egészségügyi Állandó Bizottságnak. Amennyiben a tervet jóváhagyják, a 26. cikkben leírt eljárás szerint további, általános vagy korlátozott érvényű, a kereskedelemben esetleg szükséges biztosítékok kerülnek meghatározásra. E biztosítékok nem haladhatják meg a tagállamok által nemzeti szinten alkalmazott biztosítékok mértékét.
A döntés meghozataláig az érintett tagállam továbbra is fenntarthatja kereskedelmében a minősítésének megtartása érdekében szükséges követelményeket.
(3) Az érintett tagállam jelenti a Bizottságnak az (1) bekezdésben meghatározott adatokkal kapcsolatban bekövetkezett valamennyi változást. A (2) bekezdéssel összhangban meghatározott biztosítékokat – a fent említett bejelentés alapján – a 26. cikkben leírt eljárásnak megfelelően módosítani lehet vagy vissza lehet vonni.
III. FEJEZET
A Közösségbe irányuló behozatalra vonatkozó előírások
16. cikk
Az irányelv hatálya alá tartozó állatok, spermák, petesejtek és embriók behozatalára vonatkozó feltételeknek a II. fejezetben megállapítottakkal legalább egyenértékűnek kell lenniük.
▼M5
A macskák, kutyák, és görények tekintetében a behozatali feltételeknek a 998/2003/EK rendelet III. fejezetének feltételeivel legalább egyenértékűnek kell lenniük.
Az állatokat kísérő bizonyítványnak igazolnia kell azt is, hogy az állatok feladása előtt 24 órával az illetékes hatóság által felhatalmazott állatorvos klinikai vizsgálatot végzett, amely azt mutatta, hogy az állatok jó egészségi állapotban vannak, és kibírják a rendeltetési helyükig történő szállítást.
▼B
17. cikk
(1) A 16. cikk egységes alkalmazásának érdekében a következő bekezdésekben foglaltak érvényesek.
(2) Az 1. cikkben említett állatok, spermák, petesejtek és embriók csak abban az esetben képezhetik a Közösségbe irányuló behozatal tárgyát, amennyiben megfelelnek az alábbi követelményeknek:
a) a (3) bekezdés a) pontjával összhangban összeállított jegyzékben szereplő harmadik országból kell származniuk;
b) a 26. cikkben leírt eljárással megállapított mintának megfelelő egészségügyi bizonyítvánnyal kell rendelkezniük, amelyet az exportáló állam illetékes hatósága aláírt, igazolva, hogy az állatok, spermák, petesejtek és embriók megfelelnek a kiegészítő feltételeknek vagy a (4) bekezdésben említettekkel egyenértékű biztosítékokat nyújtanak és ilyen biztosítékokat nyújtó, engedélyezett központokból, szervezetekből, intézményekből vagy olyan gyűjtőközpontokból származnak.
(3) A 26. cikk által leírt eljárásnak megfelelően a következőket állapítják meg:
▼M7
a) azon harmadik országok vagy harmadik országok azon részeinek jegyzéke, amelyek a II. fejezetben meghatározottakkal egyenértékű biztosítékokat képesek nyújtani a tagállamoknak és a Bizottságnak az állatok, spermák, petesejtek és embriók vonatkozásában,
valamint
b) a tagállamok által a juh- és kecske-, valamint lófélék spermájának, petesejtjeinek és embrióinak, továbbá sertésfélék (
19
) petesejtjeinek és embrióinak behozatalára feljogosított harmadik országok ideiglenes jegyzékének megállapításáról szóló, 1994. január 31-i 94/63/EK bizottsági határozat sérelme nélkül azon gyűjtőközpontok jegyzéke, ahová e harmadik országok beadhatják a 11. cikkben meghatározott biztosítékokat.
A Bizottság tájékoztatja a tagállamokat a központok jegyzékének bármely előterjesztett módosításáról, és a tagállamoknak az előterjesztett módosítások kézhezvételének időpontjától számítva 10 munkanap áll rendelkezésükre ahhoz, hogy észrevételeiket írásban elküldjék a Bizottsághoz.
Amennyiben 10 munkanapon belül nem érkezik írásos észrevétel a tagállamoktól, az előterjesztett módosításokat a tagállamok által elfogadottnak kell tekinteni és a behozatal a módosított jegyzékeknek megfelelően engedélyezett, amikor a Bizottság értesíti a tagállamok, illetve az érintett harmadik országok illetékes hatóságait arról, hogy a módosításokat közzétette a Bizottság honlapján.
Amennyiben 10 munkanapon belül legalább egy tagállamtól írásos észrevétel érkezik, a Bizottság tájékoztatja a tagállamokat és felkéri az Élelmiszerlánc- és Állat-egészségügyi Állandó Bizottságot, hogy következő ülésén fogadjon el határozatot a 26. cikk második albekezdésében megállapított eljárásnak megfelelően.
▼B
c) a különös állat-egészségügyi követelmények – különös tekintettel a Közösségnek az egyes, egzotikusnak számító betegségektől történő védelmére – vagy az irányelv által leírtakkal egyenértékű biztosítékok;
A harmadik országok részére megállapított különös követelmények és egyenértékű garanciák nem lehetnek kevésbé szigorúak a II. fejezetben előírtaknál.
(4) A (3) bekezdésben előírt jegyzéken csak olyan harmadik országok vagy országrészek szerepelhetnek:
a) amelyekből történő behozatal nem tiltott:
— az A. mellékletben említett vagy más, a Közösségben egzotikusnak számító betegségek előfordulása miatt,
— a 72/462/EGK irányelv 6., 7. és 14. cikke, a 91/495/EGK irányelv és a 71/118/EGK irányelv (
20
) 17. cikke értelmében, vagy ezen irányelv hatálya alá tartozó egyéb állatok esetében a 26. cikkben leírt eljárásnak megfelelően hozott határozat alapján, figyelembe véve az egészségügyi helyzetüket;
b) amelyeket jogrendjük, állat-egészségügyi és ellenőrző szolgálatuk szervezete és e szolgálat jogköre és – a 72/462/EGK irányelv 3. cikkének (2) bekezdésével összhangban – felügyelete tekintetében, elismertek arra, hogy biztosítani tudják hatályos jogszabályaik végrehajtását;
c) amelyek állat-egészségügyi szolgálata a II. fejezetben leírtakkal legalább egyenértékű egészségügyi követelményeket tud biztosítani.
(5) A Bizottság és a tagállamok szakértői helyszíni vizsgálatokat végeznek annak ellenőrzésére, hogy az érintett harmadik ország által nyújtott, a termelés és értékesítés feltételeire vonatkozó biztosítékok egyenértékűnek tekinthetők-e a Közösségben alkalmazottakéval.
A tagállamok ellenőrzéssel megbízott szakértőit a tagállamok javaslata alapján, a Bizottság nevezi ki.
A Közösség nevében végrehajtott ellenőrzések költségeit a Közösség fedezi.
(6) Az (5) bekezdésben említett ellenőrzések megszervezéséig a harmadik országokban végzendő ellenőrzésre továbbra is a nemzeti szintű szabályokat kell alkalmazni, amennyiben a fent említett ellenőrzések során kiderül, hogy a (3) bekezdésnek megfelelően nyújtott biztosítékok nem teljesülnek, ezt az Állat-egészségügyi Állandó Bizottságon keresztül jelenteni kell.
18. cikk
(1) A tagállamok biztosítják, hogy ezen irányelv hatálya alá tartozó állatok, spermák, petesejtek és embriók akkor hozhatók be a Közösségbe, ha:
— hatósági állatorvos által kiállított egészségügyi bizonyítvánnyal rendelkeznek.
— A bizonyítvány mintáját – az adott állatfajnak megfelelően – a 26. cikkben leírt eljárás szerint kell megállapítani,
— a 90/675/EGK és a 91/496/EGK (
21
) irányelv által előírt ellenőrzéseknek megfeleltek,
— a Közösség területére szállítást megelőzően hatósági állatorvos megvizsgálta azokat, hogy megbizonyosodjon arról, hogy a 91/628/EGK irányelvben (
22
) részletezett – különösen az itatásra és etetésre vonatkozó – szállítási feltételek teljesülnek.
— az 5–10. cikkben említett állatok az értékesítés előtt átestek a 26. cikkben leírt eljárással összhangban megállapított, részletes szabályozás szerinti karanténozáson.
(2) E cikk végrehajtási szabályainak megalkotásáig a harmadik országokból történő behozatalra vonatkozó nemzeti szintű szabályok maradnak érvényben azon országok esetében, amelyekre vonatkozóan még nem fogadtak el közösségi szintű előírásokat, amennyiben azok nem kevésbé szigorúak a II. fejezetben leírtaknál.
19. cikk
A 26. cikkben leírt eljárásnak megfelelően a következőket határozzák meg:
a) az állatkertbe, cirkuszba, vidámparkokba vagy kísérleti laboratóriumokba szánt állatok esetében a Közösségbe irányuló behozatalhoz szükséges, különleges állat-egészségügyi követelmények és a kísérő okmányok természete és tartalma;
b) az érintett közösségi fajok védelme érdekében, az irányelv hatálya alá tartozó különféle állatfajok tekintetében alkalmazott kiegészítő biztosítékok.
20. cikk
A 90/675/EGK irányelvben megállapított alapelveket és szabályokat kell alkalmazni, különös tekintettel a tagállamok által elvégzendő ellenőrzések, az ellenőrzéseket követő intézkedések és védőintézkedések végrehajtására.
A 91/496/EGK irányelv 30. cikkében és 8. cikke 3. pontjában előírt határozatok alkalmazásáig – ezen irányelv (1) bekezdésében említett szabályok és alapelvek sérelme nélkül – továbbra is a fent említett irányelv 8. cikke (1) és (2) bekezdésének végrehajtására vonatkozó nemzeti szintű jogszabályok maradnak érvényben.
IV. FEJEZET
Közös záró rendelkezések
21. cikk
Az 5–11. cikkben nem említett állatok, spermák, petesejtek és embriók kereskedelmére vonatkozó állat-egészségügyi feltételek és a kereskedelmi bizonyítványok mintái – szükség szerint – a 26. cikk szerinti eljárás keretében kerülnek meghatározásra.
22. cikk
Ezen irányelv mellékletei – szükség szerint – a 26. cikk szerinti eljárás keretében módosíthatók.
▼A1
A B. mellékletet a csatlakozási szerződés hatálybalépését megelőzően felül kell vizsgálni, különösen annak érdekében, hogy a betegségek listáját kiegészítsék azokkal a betegségekkel, amelyekre a kérődzők és sertésfélék fogékonyak, valamint azokkal, amelyek a juhfélék spermáján, petesejtjein és embrióin keresztül terjednek.
▼B
23. cikk
A cirkuszi és mutatványos állatok szállítására és az állatkertbe szánt állatok, spermák, petesejtek és embriók kereskedelmére vonatkozó különös feltételek a 26. cikk szerinti eljárással – a II. fejezet
►M7
————— ◄ eltérve – határozhatók meg.
24. cikk
(1) A tagállamokat feljogosíthatják arra, hogy az ezen irányelvben említett – egy harmadik ország területén áthaladó – olyan állatok (beleértve a kalitkában tartott madarakat), spermák, petesejtek és embriók területükön történő áthaladását olyan egészségügyi bizonyítvány bemutatásához kössék, amely ezen irányelv rendelkezéseinek betartását igazolja.
(2) Amennyiben a tagállamok az első bekezdésben megállapított lehetőséget igénybe vették, erről a Bizottságot és a többi tagállamot az Állat-egészségügyi Állandó Bizottságon keresztül értesítik.
25. cikk
A 90/425/EGK irányelv A. melléklete a következőkkel egészül ki:
„A Tanács 1992. július 13-i 92/65/EGK irányelve a 90/425/EGK irányelv A. mellékletének I. pontjában felsorolt külön közösségi szabályokban megállapított állat-egészségügyi követelmények hatálya alá nem tartozó állatok, spermák, petesejtek és embriók Közösségen belüli kereskedelmére és a Közösségbe történő behozatalára irányadó állat-egészségügyi követelmények megállapításáról (HL L 268., 1992.9.14., 54. o.).”
▼M7
26. cikk
(1) A Bizottságot a 178/2002/EK tanácsi rendelet 58. cikkével létrehozott Élelmiszerlánc- és Állat-egészségügyi Állandó Bizottság segíti (
23
).
(2) E bekezdésre történő hivatkozáskor az 1999/468/EK (
24
) tanácsi határozat 5. és 7. cikke irányadó.
Az 1999/468/EK határozat 5. cikkének (6) bekezdésében meghatározott időtartam 15 napban kerül meghatározásra.
(3) A bizottság fogadja el eljárási Szabályzatát.
▼B
27. cikk
Azon tagállamok, amelyek az ezen irányelvben meghatározottakkal egyenértékű biztosítékokat nyújtó ellenőrző rendszert alkalmaznak az irányelv hatálya alá tartozó állatok, spermák, petesejtek embriók területükön történő szállításának tekintetében, viszonossági alapon eltérhetnek a 6. cikk A. bekezdése 1. pontjának f) alpontjától, a 8. cikk b) pontjától és a 11. cikk (1) bekezdésének d) pontjától.
28. cikk
A 26. cikkben leírt eljárás szerint – 3 éves időszakra – átmeneti intézkedéseket lehet elfogadni, az új, ezen irányelvben létrehozott rendelkezésekre való áttérés megkönnyítése érdekében.
29. cikk
(1) A tagállamok hatályba léptetik azokat a törvényi, rendeleti és közigazgatási rendelkezéseket, amelyek ahhoz szükségesek, hogy ennek az irányelvnek 1994. január 1-ig megfeleljenek. Erről haladéktalanul tájékoztatják a Bizottságot.
Amikor a tagállamok elfogadják ezeket az intézkedéseket, azokban hivatkozni kell erre az irányelvre vagy azokhoz hivatalos kihirdetésük alkalmával kell ilyen hivatkozást fűzni. A hivatkozás módját a tagállamok határozzák meg.
(2) A tagállamok közlik a Bizottsággal nemzeti joguknak azokat a főbb rendelkezéseit, amelyeket az ezen irányelv által szabályozott területen fogadtak el.
(3) A nemzeti szintű jogrendbe történő átültetés határidejének 1994. január 1-jére történő megállapítása nem sérti a 89/662/EGK és 90/425/EGK irányelv által előírt határokon történő állat-egészségügyi vizsgálatok eltörlését.
30. cikk
Ennek az irányelvnek a tagállamok a címzettjei.
▼M6
A. MELLÉKLET
BEJELENTÉSI KÖTELEZETTSÉG ALÁ TARTÓZÓ BETEGSÉGEK EZEN IRÁNYELVVEL ÖSSZEFÜGGÉSBEN
|
Betegség
|
Elsődlegesen érintett rend/család/faj
|
|
Afrikai lópestis
|
Equidae
|
|
Afrikai sertéspestis
|
Suidae és Tayassuidae
|
|
Madárinfluenza
|
Aves
|
|
Mézelő méhek nyúlós költésrothadása
|
Apis
|
|
Lépfene
|
Bovidae, Camelidae, Cervicae, Elephantidae, Equidae és Hippopotamidae
|
|
Kéknyelv betegség
|
Antilocapridae, Bovidae, Cervidae, Giraffidae és Rhinocerotidae
|
|
Brucella abortus
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae és Tragulidae
|
|
Brucella melitensis
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae és Tragulidae
|
|
Brucella ovis
|
Camelidae, Tragulidae, Cervidae, Giraffidae, Bovidae és Antilocapridae
|
|
Brucella suis
|
Cervidae, Leporidae, Ovibos moschatus, Suidae és Tayassuidae
|
|
Klasszikus sertéspestis
|
Suidae és Tayassuidae
|
|
Szarvasmarhák ragadós tüdőlobja
|
Szarvasmarhafélék (beleértve a zebut, bivalyt, bölényt és jakot)
|
|
Ebola
|
Nem emberi főemlősök
|
|
Ragadós száj- és körömfájás
|
Artiodactyla és ázsiai elefántok
|
|
Pisztrángfélék fertőző vérképzőszervi elhalása
|
Salmonidae
|
|
Bőrcsomósodáskór
|
Bovidae és Giraffidae
|
|
Majomhimlő
|
Rodentiaés nem emberi főemlősök
|
|
Mycobacterium bovis
|
Mammalia, különösen Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae és Tragulidae
|
|
Newcastle-betegség
|
Aves
|
|
Kiskérődzők pestise
|
Bovidae és Suidae
|
|
Fertőző sertésbénulás
|
Suidae
|
|
Psitacosis
|
Psittaciformes
|
|
Veszettség
|
Carnivora és Chiroptera
|
|
Rift-völgyi láz
|
Bovidae, Camelus fajok és Rhinocerotidae
|
|
Keleti marhavész
|
Artiodactyla
|
|
Kis méhkas bogár (Aethina tumida)
|
Apis és Bombus
|
|
Juh- és kecskehimlő
|
Bovidae
|
|
Sertések hólyagos betegsége
|
Suidae és Tayassuidae
|
|
Tropilaelaps atka (Tropilaelaps spp.)
|
Apis
|
|
Hólyagos szájgyulladás
|
Artiodactyla és Equidae
|
|
TSE
|
Bovidae, Cervidae, Felidae és Musteidae
|
▼B
B. MELLÉKLET
AZON BETEGSÉGEK JEGYZÉKE, AMELYEKRE IRÁNYULÓ NEMZETI PROGRAMOK EZEN IRÁNYELV ALAPJÁN ELISMERHETŐK
|
nyérc
|
vírusos bélgyulladás
aleuti betegség
|
|
méhek
|
mézelő méhek enyhébb (európai) költésrothadása
varroa atkakór és légcsőatkakór
|
|
főemlősök és macskafélék
|
gümőkór
|
|
kérődzők
|
gümőkór
|
|
nyúlalakúak
|
myxomatózis
nyulak vérzéses betegsége
tularémia
|
▼M3
C. MELLÉKLET
A SZERVEZETEK, INTÉZMÉNYEK VAGY KÖZPONTOK ENGEDÉLYEZÉSÉT SZABÁLYOZÓ FELTÉTELEK
1. A 2. cikk (1) bekezdésének c) pontjában meghatározott szervezetnek, intézménynek vagy központnak a 13. cikk (2) bekezdése szerinti hatósági engedélyezéséhez az alábbi feltételeknek kell megfelelnie:
a) környezetétől egyértelműen elhatárolt és elkülönített, vagy az állatokat úgy zárták el vagy helyezték el, hogy azok a mezőgazdasági telepek egészségügyi állapotára kockázatot ne jelentsenek;
b) megfelelő eszközökkel rendelkezik az állatok befogására, elzárására és elkülönítésére, valamint megfelelő karanténlétesítményekkel és engedélyezett eljárásokkal rendelkezik a nem engedélyezett helyekről származó állatokhoz;
c) mentes az A. mellékletben és a B. mellékletben felsorolt betegségektől, amennyiben az érintett ország a 14. cikk szerinti programmal rendelkezik. Ahhoz, hogy egy szervezetet, intézményt vagy központot az ilyen betegségektől mentesnek lehessen nyilvánítani, az illetékes hatóság értékeli e szervezetek, intézmények vagy központok állat-egészségügyi állapotról szóló, legalább a megelőző három évre vonatkozó feljegyzéseit, valamint a szervezetben, intézményben vagy központban levő állatokon végzett klinikai vagy laboratóriumi vizsgálatok eredményeit. E követelménytől eltérve azonban az új szervezeteket, intézményeket vagy központokat is engedélyezni kell, amennyiben az állományt képező állatok engedélyezett szervetekből, intézményekből vagy központokból származnak;
d) naprakész feljegyzéseket vezetnek a következőkről:
i. a létesítményben jelen levő valamennyi fajhoz tartozó állatok száma és azonosítása (életkor, ivar, faj, és – adott esetben – egyedi azonosítás);
ii. a létesítménybe érkező vagy az azt elhagyó állatok száma és azonosítása (életkor, ivar, faj, és – adott esetben – egyedi azonosítás) a származásukra vagy rendeltetésükre, a be- vagy kiszállításra és az állatok egészségügyi állapotára vonatkozó információkkal együtt;
iii. a vérvizsgálatok vagy egyéb diagnosztikai eljárások eredményei;
iv. a betegségek előfordulásai, és – adott esetben – az alkalmazott kezelések;
v. a létesítményben elhullott állatok post mortem vizsgálatainak eredményei, beleértve a halva született állatokat;
vi. az elkülönítés vagy karantén ideje alatt tett megfigyelések;
e) vagy megállapodnak egy illetékes laboratóriummal a post mortem vizsgálatok elvégzéséről, vagy rendelkeznek egy vagy több megfelelő létesítménnyel, amelyekben egy illetékes személy a feljogosított állatorvos felügyelete alatt elvégezheti e vizsgálatokat;
f) vagy megfelelő megállapodásokkal, vagy helyszíni eszközökkel rendelkeznek a betegségben elhullott vagy emiatt leölt állatok tetemeinek megfelelő ártalmatlanítására;
g) szerződésekkel vagy egyéb jogi eszközökkel biztosítják egy, az illetékes hatóság által feljogosított és annak ellenőrzése alatt álló állatorvos szolgálatát, aki:
i. értelemszerűen megfelel a 64/432/EGK irányelv 14. cikke (3) bekezdésének B. pontjában említett követelményeknek;
ii. biztosítja az érintett ország járványügyi helyzetének megfelelő, az illetékes hatóság által engedélyezett, valamint a szervezet, intézmény vagy központ által alkalmazott megfelelő járványügyi és ellenőrzési intézkedéseket. Az ilyen intézkedések a következőket foglalják magukban:
— éves járványfelügyeleti terv, amely magában foglalja az állatok megfelelő ellenőrzését a zoonózisok szempontjából,
— a fertőző betegségekre gyanús állatok klinikai, laboratóriumi és post mortem vizsgálata,
— adott esetben a fogékony állatok vakcinázása a fertőző betegségekkel szemben, kizárólag a közösségi jogszabályokkal összhangban;
iii. biztosítja, hogy haladéktalanul jelentsenek az illetékes hatóságnak minden gyanús elhullást és minden olyan tünet megjelenését, amely arra utal, hogy az állatok az A. és B. mellékletben említett egy vagy több betegséggel fertőződtek, amennyiben az érintett betegség az érintett tagállamban bejelentési kötelezettség alá tartozik;
iv. biztosítja, hogy a beérkező állatokat szükség szerint elkülönítsék ezen irányelv követelményeivel és – ha rendelkezésre áll – az illetékes hatóság utasításaival összhangban;
v. felelős ezen irányelv állat-egészségügyi követelményeinek, valamint az állatok szállítás alatti védelmére és az állati hulladékok ártalmatlanítására vonatkozó közösségi jogszabályok folyamatos betartásáért;
h) ha kísérleteket végző laboratóriumok számára tart állatokat, megfelel a 86/609/EGK irányelv 5. cikke rendelkezéseinek.
2. Az engedélyt fenn kell tartani, ha teljesülnek a következő követelmények:
a) a létesítmények az illetékes hatóság hatósági állatorvosának ellenőrzése alatt állnak, aki:
i. legalább évente egyszer látogatást tesz a szervezet, intézmény vagy központ létesítményeiben;
ii. ellenőrzi a feljogosított állatorvos tevékenységét és az éves járványfelügyeleti terv végrehajtását;
iii. biztosítja ezen irányelv rendelkezéseinek betartását;
b) csak más engedélyezett szervezetből, intézményből vagy központból érkező állatok vihetők be a létesítménybe ezen irányelv rendelkezéseivel összhangban;
c) a hatósági állatorvos igazolja, hogy:
— teljesítették ezen irányelv rendelkezéseit;
— az állatok klinikai, post mortem és laboratóriumi vizsgálatainak eredményei nem mutatták ki az A. és B. mellékletben említett betegségek előfordulását;
d) a szervezet, intézmény vagy központ az engedélyezést követően legalább tíz évig megőrzi az 1. d) pontban említett feljegyzéseket.
3. Ezen irányelv 5. cikkének (1) bekezdésétől és e melléklet 2. b) pontjától eltérve, a nem engedélyezett szervezetekből, intézményekből vagy központokból származó állatokat, beleértve a majmokat (Simiae és Prosimiae), be lehet vinni egy engedélyezett szervezetbe, intézménybe vagy központba, amennyiben ezen állatokat az állományba történő bevezetést megelőzően az illetékes hatóságok utasításaival összhangban hatósági felügyelet alatt álló karanténozásnak vetik alá.
A majmok (Simiae és Prosimiae) tekintetében be kell tartani az OIE Nemzetközi Egészségügyi Szabályzatában (2.10.1. fejezet és 3.5.1. melléklet) megállapított, karanténra vonatkozó követelményeket.
Az egyéb, e melléklet 2. b) pontjával összhangban karanténozott állatok esetében a karantén időtartama az A. mellékletben felsorolt betegségek tekintetében legalább 30 nap.
4. Az engedélyezett szervezetben, intézményben vagy központban tartott állatok csak abban az esetben hagyhatják el a létesítményt, ha azokat más engedélyezett szervezetbe, intézménybe vagy központba szánják az érintett vagy egy másik tagállamban; ha azonban azokat nem engedélyezett szervezetbe, intézménybe vagy központba szánják, csak az illetékes hatóság által a betegség elterjedésének megakadályozása érdekében hozott követelményekkel összhangban hagyhatják el a létesítményt.
5. Ha egy tagállam a közösségi jogszabályok szerint kiegészítő biztosítékokat követelhet, további megfelelő követelményeket és bizonyítványokat kérhet a fogékony fajok engedélyezett szervezetekbe, intézményekbe vagy központokba történő bevitelét megelőzően.
6. Az engedélyezés részleges vagy teljes felfüggesztésére, visszavonására vagy visszaállítására vonatkozó eljárás a következő:
a) amennyiben az illetékes hatóság azt állapítja meg, hogy a 2. pont követelményei nem teljesültek, vagy a felhasználás céljára már nem vonatkozik ezen irányelv 2. cikke, az engedélyt fel kell függeszteni vagy vissza kell vonni;
b) amennyiben az A. vagy B. mellékletben említett valamely betegség gyanúját jelentették, az illetékes hatóság felfüggeszti a szervezet, intézmény vagy központ engedélyét, amíg hivatalosan ki nem zárják a gyanút. Az érintett betegségtől és a betegség terjesztésének kockázatától függően a felfüggesztés vonatkozhat a létesítmény egészére vagy csak az érintett betegségre fogékony állatok bizonyos kategóriáira. Az illetékes hatóság biztosítja, hogy megtegyék valamennyi, a gyanú megerősítéséhez vagy kizárásához, valamint a betegség elterjedésének megelőzéséhez szükséges intézkedést az érintett betegség elleni intézkedésekre és az állatok kereskedelmére vonatkozó közösségi jogszabályokkal összhangban;
c) amennyiben a betegség gyanúját megerősítik, a szervezetet, intézményt vagy központot csak akkor lehet újra engedélyezni, ha a létesítményekben a betegség és a fertőzés forrásának felszámolása után – beleértve a megfelelő tisztítást és fertőtlenítést – újra teljesülnek az e melléklet 1. pontjában megállapított feltételek, az 1. c) pont kivételével;
d) az illetékes hatóság tájékoztatja a Bizottságot egy szervezet, intézmény vagy központ engedélyezésének felfüggesztéséről, visszavonásáról vagy annak visszaállításáról.
▼B
D. MELLÉKLET
▼M1
I. FEJEZET
I. A spermagyűjtő központok és állomások engedélyezésére vonatkozó feltételek
A spermagyűjtő központoknak és állomásoknak:
1. a „központ állatorvosának” felügyelete alatt kell állniuk;
2. legalább a következőkkel kell rendelkezniük:
a) egy zárható helyiséggel az állatok elszállásolására, valamint szükség esetén a lófélék számára egy olyan futtató területtel, amelyet fizikailag elválasztottak a spermagyűjtő, -feldolgozó és -tároló helyiségektől;
b) olyan elkülönítő helyiségekkel, amelyeknek nincs közvetlen összeköttetésük az állatok szokásos szálláshelyével;
c) egy spermagyűjtő létesítménnyel, amely magában foglal egy külön helyiséget az eszközök tisztítására és fertőtlenítésére vagy sterilizálására;
d) egy, a spermagyűjtő létesítménytől különálló spermafeldolgozó helyiséggel, amely nem feltétlenül ugyanazon a telepen található;
e) egy spermatároló helyiséggel, amely nem feltétlenül ugyanazon a telepen található;
3. oly módon épültnek és elzártnak kell lenniük, hogy a központon kívüli állatokkal történő érintkezés megakadályozható legyen;
4. olyan építésűnek kell lenniük, hogy az irodák kivételével az egész központ és – lófélék esetében – a futtató terület könnyen tisztítható és fertőtleníthető legyen.
II. A spermagyűjtő központok és állomások felügyeletére vonatkozó feltételek
A spermagyűjtő központokat és állomásokat:
1. felügyelni kell annak biztosítása céljából, hogy ott csak olyan fajokba tartozó állatok forduljanak elő, amelyek spermáját gyűjtik.
Más háziállatokat is be lehet azonban bocsátani a központokba, amennyiben azok nem jelentenek fertőzésveszélyt azokra az állatfajokra, amelyek spermáját a központban gyűjtik, és ha azok megfelelnek a központ állatorvosa által meghatározott feltételeknek.
Ha lófélék esetében a gyűjtőközpont egy telepen található egy mesterséges termékenyítő vagy fedeztető központtal, akkor kancákat, próbaméneket és természetes fedeztetésre szánt fedezőméneket be lehet oda bocsátani, amennyiben azok megfelelnek a D. melléklet II. fejezete A. bekezdésének 1., 2., 3. és 4. pontjában szereplő követelményeknek;
2. ellenőrizni kell annak biztosítására, hogy olyan feljegyzéseket vezetnek, amelyek feltüntetik:
— a központban vagy állomáson jelen lévő minden egyes állat faját, fajtáját, születési idejét és azonosító adatait,
— a központba vagy állomásra belépő vagy azt elhagyó állatok minden mozgását,
— a központban vagy állomáson tartott állatok egészségügyi előtörténetét, összes diagnosztikai vizsgálatait és azok eredményeit, valamint az ott tartott állatokon végrehajtott kezeléseket és vakcinázásokat,
— a sperma gyűjtésének és feldolgozásának dátumát,
— a sperma rendeltetését,
3. szezonális szaporodású állatok esetében a tenyészidőszak során évente legalább egyszer, nem szezonális szaporodású állatok esetében pedig évente kétszer meg kell szemlélnie egy hatósági állatorvosnak az engedélyezés és a felügyelet feltételeire vonatkozó összes szempont vizsgálata és igazolása céljából;
4. olyan módon kell felügyelni, amely alkalmas az illetéktelen személyek bejutásának megakadályozására. Az engedéllyel rendelkező látogatóktól meg kell követelni, hogy tartsák be a központ állatorvosa által meghatározott feltételeket;
5. felkészült személyzettel kell ellátni, akik megfelelő képzésben részesültek a betegségek terjedésének megelőzését célzó fertőtlenítési és higiéniás eljárások tekintetében;
6. ellenőrizni kell annak biztosítására, hogy:
— a központban vagy állomáson tartott állatok egyikét se használják természetes fedeztetésre az első spermavétel előtti legalább 30 napos időszakban és a spermagyűjtési időszak során,
— a sperma gyűjtését, feldolgozását és tárolását kizárólag az e célokra fenntartott helyiségekben végezzék,
— a gyűjtés vagy a feldolgozás során a spermával vagy a donor állattal érintkezésbe kerülő, valamennyi eszközt használat előtt megfelelően fertőtlenítsék vagy sterilizálják, vagy új, egyszer használatos eszközöket használjanak és azokat használat után dobják el,
— Ha lófélék esetében a gyűjtőközpont egy telepen található egy mesterséges termékenyítő vagy fedeztető központtal, szigorúan el kell különíteni a mesterséges termékenyítésre vagy természetes fedeztetésre használt felszereléseket és eszközöket a donor állatokkal vagy a gyűjtőközpontban vagy -gyűjtőállomáson tartott más állatokkal és a spermával érintkezésbe kerülő felszerelésektől és eszközöktől,
— csak olyan állati eredetű termékeket, pl. hígítókat, adalékokat vagy spermahígítókat használjanak a sperma feldolgozása során, amelyek nem jelentenek állat-egészségügyi veszélyt, vagy amelyek az ilyen veszély kizárása céljából előzetes kezelésen estek át,
— mélyhűtött vagy hűtött sperma esetében olyan hűtőközegeket használjanak, amelyeket előzőleg más állati eredetű termékekhez nem használtak,
— a sperma tárolására vagy szállítására használt minden gyűjtőedényt használat előtt megfelelően fertőtlenítsenek vagy sterilizáljanak, vagy új, egyszer használatos gyűjtőedényeket használjanak és azokat használat után dobják el;
7. a spermagyűjtő központoknak vagy állomásoknak biztosítaniuk kell a sperma minden egyes adagjának eltávolíthatatlan módon történő azonosítását úgy, hogy a származási tagállamot, a gyűjtés dátumát, a donor állat faját, fajtáját és azonosító adatait, valamint a spermát gyűjtő engedélyezett központ nevét és/vagy számát meg lehessen állapítani.
▼B
II. FEJEZET
A gyűjtőközpontokra és -állomásokra vonatkozó feltételek
A hímivarú donor állatok felvételére vonatkozó követelmények
▼M1
A. MÉNEK
Sperma nyerésére csak olyan mént szabad használni, amely a központ állatorvosa szerint megfelel a következő követelményeknek:
1. a központba vagy állomásra való belépéskor és a spermavétel napján nem mutathatja fertőző vagy ragályos betegség semmilyen tünetét;
2. olyan tagállam vagy harmadik ország területéről vagy – régiókra osztás esetén – a tagállam vagy harmadik ország olyan részéről és olyan állatorvosi felügyelet alatti állományból kell származnia, amelyek mindegyike megfelel a 90/426/EGK tanácsi irányelvben meghatározott követelményeknek;
3. a spermavételt megelőző 30 nap során olyan gazdaságban kellett tartózkodnia, amelyben abban az időszakban egyetlen ló sem mutatta a ló fertőző arteritisének semmilyen klinikai tünetét;
4. a spermavételt megelőző 60 nap során olyan gazdaságban kellett tartózkodnia, amelyben abban az időszakban egyetlen ló sem mutatta a ló ragályos méhgyulladásának semmilyen klinikai tünetét;
5. az első spermavételt megelőző 30 napban és a spermagyűjtési időszakban tilos természetes fedeztetésre használni;
6. az illetékes hatóság által elismert laboratóriumban a 7. pontban meghatározott program szerint végrehajtott és tanúsított alábbi vizsgálatoknak kell alávetni:
i. a ló fertőző kevésvérűségének kimutatására irányuló agargél-immundiffúziós próba (Coggins-próba), negatív eredménnyel;
ii. a ló fertőző arteritisére irányuló vírusneutralizációs próba. Hacsak a próba 1:4-es hígításban negatív eredményt nem ad, vírusizolálási vizsgálatot kell végezni a donor mén teljes spermájának azonos térfogategységnyi mennyiségén, negatív eredménnyel;
iii. a ló ragályos méhgyulladására irányuló, hétnapos időközzel két alkalommal végzett, a Taylorella equigenitalis -nak a pre-ejakulációs folyadékból vagy egy spermamintából, illetve a legalább a hímvessző tasakjából, a húgycsőből és a húgycsőüregből vett genitális tamponmintákból történő izolálását célzó vizsgálat, minden esetben negatív eredménnyel;
7. át kellett esnie az alábbi vizsgálati programok egyikén:
i. Ha a spermát friss vagy hűtött állapotban való forgalmazás céljából veszik:
— és a donor mén az első spermavétel előtti legalább 30 napos időszakban és a gyűjtési időszakban folyamatosan a spermagyűjtő központban vagy állomáson tartózkodik, és a gyűjtőközpontban vagy -állomáson tartott lófélék nem kerülnek közvetlen érintkezésbe a donor mén egészségügyi állapotánál kedvezőtlenebb egészségügyi állapotú lófélékkel, a fenti tartózkodási időszak kezdete után legalább 14 nappal és legalább évente egyszer, a tenyészidőszak kezdetén el kell végezni a 6. pont i., ii. és iii. alpontjában előírt vizsgálatokat,
— és a donor mén nem tartózkodik folyamatosan a spermagyűjtő központban vagy állomáson, és/vagy a gyűjtőközpontban vagy gyűjtőállomáson tartott más lófélék nem kerülnek közvetlen érintkezésbe kedvezőtlenebb egészségügyi állapotú lófélékkel, az első spermavétel előtti 14 napos időszakban és legalább évente egyszer, a tenyészidőszak kezdetén el kell végezni a 6. pont i., ii. és iii. alpontjában előírt vizsgálatokat. A 6. pont i. alpontjában előírt vizsgálatot továbbá a spermagyűjtési időszak során legalább 120 naponta meg kell ismételni. A 6. pont ii. alpontjában előírt vizsgálatot minden spermavétel előtt nem több mint 30 nappal el kell végezni, hacsak a ló fertőző arteritisére szeropozitív mén nem vírusürítő állapotát az évente elvégzendő vírusizolálási vizsgálat nem igazolja;
ii. Amennyiben a spermát fagyasztott állapotban való forgalmazás céljából gyűjtik, a 7. pont i. alpontja első és második francia bekezdésében leírt vizsgálati programokat kell alkalmazni, illetve – vagylagosan – a 6. pont i., ii. és iii. alpontjában előírt vizsgálatokat kell elvégezni a sperma kötelező 30 napos tárolási időszakában és nem kevesebb mint 14 nappal a sperma vétele után, a mén tartózkodási hely szerinti helyzetétől függetlenül.
▼B
B. JUH- ÉS KECSKEFÉLÉK
1. Csak azok a – központból, állomásról vagy gazdaságból származó – juh- és kecskefélék használhatók spermagyűjtésre, amelyek a hatósági állatorvos megelégedésére az alábbi követelményeknek megfelelnek:
a) a spermavétel időpontjában jó egészségi állapotúak;
b) a Közösségen belüli kereskedelemre vonatkozó, 91/68/EGK irányelv 4., 5. és 6. cikkében megállapított követelményeknek megfelelnek.
Továbbá a donor állatoknak át kell esniük – negatív eredménnyel – a levétel előtti harminc nap folyamán:
— a 91/68/EGK irányelv C. mellékletével összhangban a brucellózis (B. melitensis) kimutatására szolgáló vizsgálaton,
— a 91/68/EGK irányelv C. mellékletével összhangban a kosok fertőző mellékhere- és heregyulladásának (B. ovis) kimutatatására szolgáló vizsgálaton,
— a „Border disease” vírusára irányuló vizsgálaton;
c) átestek a vonatkozó vizsgálatokon és teszteken, amelyek biztosítják a fenti a) és b) pontban kikötött követelményeknek történő megfelelést.
2. Az első pontban említett vizsgálatokat a tagállam által engedélyezett laboratórium végzi.
▼M1
|
C.
|
Amennyiben az A. vagy a B. részben említett vizsgálatok bármelyike pozitív eredményt ad, a pozitív állatot el kell különíteni, és az attól a legutóbbi negatív eredményű vizsgálat óta eltelt időben vett spermát nem szabad forgalomba hozni. Ugyanez vonatkozik arra a spermára is, amelyet a pozitív eredményű vizsgálat végrehajtása óta eltelt időben vettek a gazdaságban vagy a gyűjtőközpontban vagy gyűjtőállomáson az adott betegségre fogékony többi állattól. A forgalmazást addig nem szabad újraindítani, amíg a központ egészségügyi helyzetét vissza nem állították.
|
III. FEJEZET
Spermákra, petesejtekre és embriókra vonatkozó feltételek
A spermákat, a petesejteket és az embriókat az alábbi elveknek megfelelően kell gyűjteni, feldolgozni és tartósítani:
a) A petesejtek és az embriók mosással való kinyerését lófélék esetében is a 26. cikkben meghatározott eljárással összhangban megállapítandó feltételeknek megfelelően kell végezni. E feltételek elfogadásáig a nemzetközi szabványokat kell alkalmazni.
A petesejtek és az embriók zona pellucida részének a mosás előtt és után is sértetlennek kell maradnia.
Egyidejűleg csak azonos donortól származó petesejteket és embriókat szabad mosni.
A mosás után minden petesejt vagy embrió zona pellucidájának teljes felületét meg kell vizsgálni legalább 50-szeres nagyítással, és igazolni kell, hogy az sértetlen és mentes minden hozzátapadt anyagtól;
b) A petesejtek és embriók gyűjtésére, feldolgozására (vizsgálat, mosás és kezelés), tartósítására vagy fagyasztására használt közeget és oldatokat jóváhagyott módszerekkel kell sterilizálni, és oly módon kell kezelni, hogy azok sterilek maradjanak.
A petesejtek és embriók gyűjtésére, mosására és tartósítására használt közegekhez és a spermahígítókhoz antibiotikumokat kell adni. Ha szükséges, a részletes szabályokat a 26. cikkben előírt eljárás szerint kell meghatározni;
c) A spermák, petesejtek és embriók gyűjtésére, feldolgozására, tartósítására vagy fagyasztására használt minden anyagot használat előtt vagy megfelelő módon fertőtleníteni vagy sterilizálni kell, vagy új, egyszer használatos anyagokat kell alkalmazni és azokat használat után el kell dobni;
d) A 26. cikkben előírt eljárás alapján – különösen a mosófolyadékok gyűjtésére vonatkozóan – további vizsgálatokat lehet bevezetni annak bizonyítására, hogy kórokozók nincsenek jelen;
e) Az a) pontban előírt vizsgálaton sikeresen átesett petesejteket és embriókat és a spermákat steril tartályokba kell helyezni, amelyeket megfelelően azonosítottak, kizárólag egy hím- vagy nőivarú donor állattól származó terméket tartalmaznak, és azonnal lezárásra kerülnek.
A tartály – 26. cikkben előírt eljárás szerint meghatározott – azonosításának biztosítania kell, hogy legalább a származási ország, a gyűjtés időpontja, a donor állat faja, fajtája és azonossága, és/vagy a gyűjtőközpont/csoport száma megállapítható legyen;
f) A fagyasztott spermákat, petesejteket és embriókat folyékony nitrogént tartalmazó steril tartályokba kell helyezni, amelyek semmilyen szennyezési veszélyt nem jelentenek a termékre;
g) A fagyasztott spermákat, petesejteket és embriókat a feladás előtt legalább 30 napig engedélyezett tárolási feltételek mellett kell tárolni;
h) A spermákat, petesejteket és embriókat olyan tartályokban kell szállítani, amelyeket használat előtt vagy megfelelően megtisztítottak, fertőtlenítettek vagy sterilizáltak, vagy pedig új, egyszer használatos tartályokat kell használni és azokat a használat után el kell dobni.
IV. FEJEZET
Nőivarú donor állatok
Nőivarú állatokat csak akkor szabad embriók vagy petesejtek nyerésére felhasználni, ha azok és származási állományaik a hatósági állatorvos szerint megfelelnek az adott állatfajba tartozó, tenyésztésre és termelésre szánt élőállatok Közösségen belüli kereskedelmére vonatkozó irányelvekben előírt követelményeknek.
Sertésekre a 64/432/EGK tanácsi irányelv rendelkezései, a juh- és kecskefélékre pedig a 91/68/EGK tanácsi irányelv rendelkezései vonatkoznak.
A 90/426/EGK tanácsi irányelv által bevezetett követelményeken túlmenően a lóféléket a petesejtek vagy embriók gyűjtése előtt legalább 60 napon át a ló ragályos méhgyulladásának klinikai tüneteitől mentes gazdaságokban kell tartani. A petesejtek vagy embriók gyűjtése előtti 30 napos időszakban azokat természetes fedeztetésre nem szabad használni.
▼M3
E. MELLÉKLET
1. rész
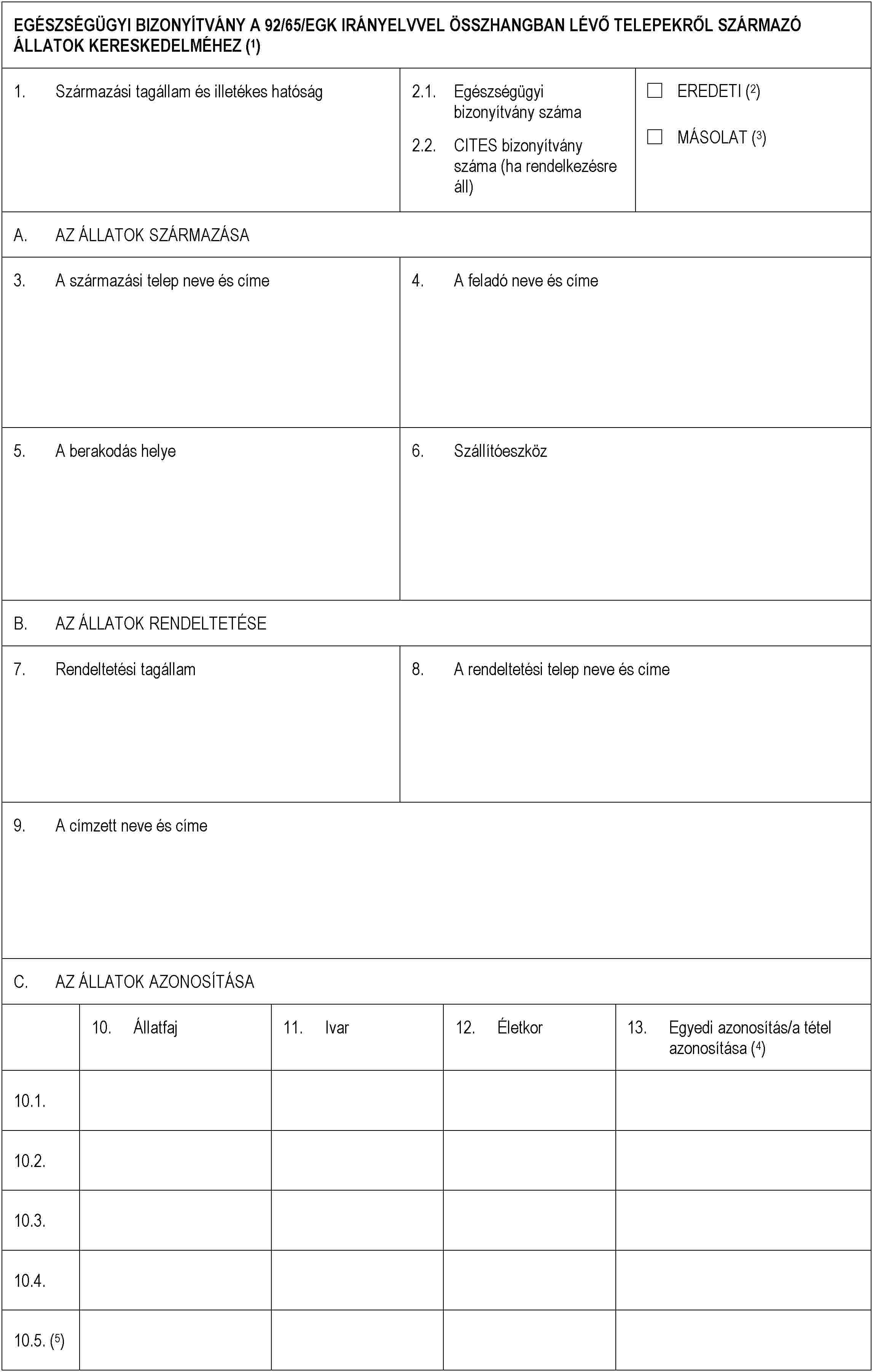

2. rész


3. rész


▼M7
F. MELLÉKLET
A szarvasmarhafélék és a sertések Közösségen belüli kereskedelmét érintő állat-egészségügyi problémákról szóló, 1964. június 26-i 64/432/EGK tanácsi irányelve
A szarvasmarhafajba tartozó háziasított állatok spermájának Közösségen belüli kereskedelmére és behozatalára alkalmazandó állat-egészségügyi követelmények megállapításáról szóló, 1988. június 14-i 88/407/EGK tanácsi irányelv
A szarvasmarhafajba tartozó háziasított állatok embrióinak Közösségen belüli kereskedelmét és harmadik országokból történő behozatalát szabályozó állat-egészségügyi feltételekről szóló, 1989. szeptember 25-i 89/556/EK tanácsi irányelv
A lófélék mozgására és harmadik országból történő behozatalára irányadó állat-egészségügyi feltételekről szóló, 1990. június 26-i 90/426/EGK tanácsi irányelv
A sertéssperma Közösségen belüli kereskedelmére és behozatalára alkalmazandó állat-egészségügyi követelmények megállapításáról szóló, 1990. június 26-i 90/429/EGK tanácsi irányelv
A baromfi és a keltetőtojás Közösségen belüli kereskedelmére és harmadik országból történő behozatalára irányadó állat-egészségügyi feltételekről szóló, 1990. október 15-i 90/539/EGK tanácsi irányelv
A tenyésztett víziállatok és az akvakultúra-termékek forgalomba hozatalára irányadó állat-egészségügyi feltételekről szóló, 1991. január 28-i 91/67/EGK tanácsi irányelv
A juh- és kecskefélék Közösségen belüli kereskedelmére irányadó állat-egészségügyi feltételekről szóló, 1991. január 28-i 91/68/EGK tanácsi irányelv
Az egyes élő patás állatok Közösségbe történő behozatalára, valamint a Közösségen történő átszállítására vonatkozó állat-egészségügyi szabályok megállapításáról, a 90/426/EGK és 92/65/EGK irányelv módosításáról, valamint a 72/462/EGK irányelv hatályon kívül helyezéséről szóló, 2004. április 26-i 2004/68/EK tanácsi irányelv.






