EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32008R0440
Council Regulation (EC) No 440/2008 of 30 May 2008 laying down test methods pursuant to Regulation (EC) No 1907/2006 of the European Parliament and of the Council on the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) (Text with EEA relevance)
A Bizottság 440/2008/EK rendelete ( 2008. május 30.) a vegyi anyagok regisztrálásáról, értékeléséről, engedélyezéséről és korlátozásáról (REACH) szóló 1907/2006/EK európai parlamenti és a tanácsi rendelet értelmében alkalmazandó vizsgálati módszerek megállapításáról (EGT-vonatkozású szöveg)
A Bizottság 440/2008/EK rendelete ( 2008. május 30.) a vegyi anyagok regisztrálásáról, értékeléséről, engedélyezéséről és korlátozásáról (REACH) szóló 1907/2006/EK európai parlamenti és a tanácsi rendelet értelmében alkalmazandó vizsgálati módszerek megállapításáról (EGT-vonatkozású szöveg)
OJ L 142, 31.5.2008, p. 1–739
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
Special edition in Croatian: Chapter 13 Volume 033 P. 3 - 741
 In force: This act has been changed. Current consolidated version: 26/03/2023
In force: This act has been changed. Current consolidated version: 26/03/2023
|
31.5.2008 |
HU |
Az Európai Unió Hivatalos Lapja |
L 142/1 |
A BIZOTTSÁG 440/2008/EK RENDELETE
(2008. május 30.)
a vegyi anyagok regisztrálásáról, értékeléséről, engedélyezéséről és korlátozásáról (REACH) szóló 1907/2006/EK európai parlamenti és a tanácsi rendelet értelmében alkalmazandó vizsgálati módszerek megállapításáról
(EGT-vonatkozású szöveg)
AZ EURÓPAI KÖZÖSSÉGEK BIZOTTSÁGA,
tekintettel az Európai Közösséget létrehozó szerződésre,
tekintettel a vegyi anyagok regisztrálásáról, értékeléséről, engedélyezéséről és korlátozásáról (REACH), az Európai Vegyianyag-ügynökség létrehozásáról, az 1999/45/EK irányelv módosításáról, valamint a 793/93/EGK tanácsi rendelet, az 1488/94/EK bizottsági rendelet, a 76/769/EGK tanácsi irányelv, a 91/155/EGK, a 93/67/EGK, a 93/105/EK és a 2000/21/EK bizottsági irányelv hatályon kívül helyezéséről szóló, 2006. december 18-i 1907/2006/EK európai parlamenti és tanácsi rendeletre (1) és különösen annak 13. cikke (3) bekezdésére,
mivel:
|
(1) |
Az 1907/2006/EK rendelet értelmében közösségi szinten vizsgálati módszereket kell elfogadni olyan vizsgálatokat illetően, amelyek szükségesek az egyes anyagok lényegi tulajdonságaira vonatkozó információk megszerzéséhez. |
|
(2) |
A veszélyes anyagok osztályozására, csomagolására és címkézésére vonatkozó törvényi, rendeleti és közigazgatási rendelkezések közelítéséről szóló 67/548/EGK tanácsi irányelv (2) V. melléklete megállapította az anyagok és készítmények fizikai és kémiai tulajdonságainak, toxicitásának, valamint ökotoxicitásának meghatározására szolgáló módszereket. A 2006/121/EK európai parlamenti és tanácsi irányelv 2008. január 1-jei hatállyal törölte a 67/548/EGK rendelet V. mellékletét. |
|
(3) |
A 67/548/EGK rendelet V. mellékletében szereplő vizsgálati módszereket bele kell foglalni ebbe a rendeletbe. |
|
(4) |
E rendelet nem zárja ki más vizsgálati módszerek használatát, feltéve hogy alkalmazásuk összhangban van az 1907/2006/EK rendelet 13. cikkének (3) bekezdésével. |
|
(5) |
A vizsgálati eljárások során az állatok helyettesítésére, illetve a felhasználásuk csökkentésére és finomítására vonatkozó elveket teljes mértékben figyelembe kell venni a vizsgálati módszerek kidolgozásakor, különösen akkor, ha az állatkísérletek kiváltására, számának csökkentésére vagy finomítására alkalmas, hitelesített módszerek rendelkezésre állnak. |
|
(6) |
E rendelet rendelkezései összhangban vannak az 1907/2006/EK rendelet 133. cikkével létrehozott bizottság véleményével, |
ELFOGADTA EZT A RENDELETET:
1. cikk
Az 1907/2006/EK rendelet céljából alkalmazandó vizsgálati módszereket e rendelet melléklete állapítja meg.
2. cikk
A Bizottság szükség esetén felülvizsgálja az e rendeletben foglalt vizsgálati módszereket a gerinces állatokon végzett kísérletek helyettesítése, számának csökkentése és finomítása érdekében.
3. cikk
A 67/548/EGK irányelv V. mellékletére történő hivatkozásokat az e rendeletre való hivatkozásként kell értelmezni.
4. cikk
Ez a rendelet az Európai Unió Hivatalos Lapjában történő kihirdetését követő napon lép hatályba.
Rendelkezéseit 2008. június 1-jétől kell alkalmazni.
Kelt Brüsszelben, 2008. május 30-án.
a Bizottság részéről
Stavros DIMAS
a Bizottság tagja
(1) HL L 396., 2006.12.30., 1. o., helyesbítve: HL L 136., 2007.5.29., 3. o.
(2) HL 196., 1967.8.16., 1. o. A legutóbb a 2006/121/EK európai parlamenti és tanácsi irányelvvel (HL L 396., 2006.12.30., 850. o., helyesbítve: HL L 136., 2007.5.29., 281. o.) módosított irányelv – frissítésre kerül a megfelelő hivatkozásokkal, amint közzéteszik a műszaki fejlődéshez történő 30. hozzáigazításról szóló dokumentumot.
MELLÉKLET
A. RÉSZ: A FIZIKAI-KÉMIAI TULAJDONSÁGOK MEGHATÁROZÁSÁNAK MÓDSZEREI
TARTALOMJEGYZÉK
|
A.1. |
OLVADÁSPONT/FAGYÁSPONT |
|
A.2. |
FORRÁSPONT |
|
A.3. |
RELATÍV SŰRŰSÉG |
|
A.4. |
GŐZNYOMÁS |
|
A.5. |
FELÜLETI FESZÜLTSÉG |
|
A.6. |
OLDHATÓSÁG VÍZBEN |
|
A.8. |
MEGOSZLÁSI HÁNYADOS |
|
A.9. |
LOBBANÁSPONT |
|
A.10. |
TŰZVESZÉLYESSÉG (SZILÁRD ANYAGOK) |
|
A.11. |
TŰZVESZÉLYESSÉG (GÁZOK) |
|
A.12. |
TŰZVESZÉLYESSÉG (ÉRINTKEZÉS VÍZZEL) |
|
A.13. |
SZILÁRD ANYAGOK ÉS FOLYADÉKOK ÖNGYULLADÁSI KÉPESSÉGE |
|
A.14. |
ROBBANÁSI TULAJDONSÁGOK |
|
A.15. |
ÖNGYULLADÁSI HŐMÉRSÉKLET (FOLYADÉKOK ÉS GÁZOK) |
|
A.16. |
SZILÁRD ANYAGOK RELATÍV ÖNGYULLADÁSI HŐMÉRSÉKLETE |
|
A.17. |
OXIDÁLÓ TULAJDONSÁGOK (SZILÁRD ANYAGOK) |
|
A.18. |
A POLIMEREK SZÁMÁTLAG SZERINTI MOLEKULATÖMEGE ÉS MOLEKULATÖMEG-ELOSZLÁSA |
|
A.19. |
POLIMEREK KIS MOLEKULATÖMEG-TARTALMA |
|
A.20. |
POLIMEREK OLDÓDÁS/EXTRAKCIÓ VISELKEDÉSE VÍZBEN |
|
A.21. |
OXIDÁLÓ TULAJDONSÁGOK (FOLYADÉKOK) |
A.1. OLVADÁSPONT/FAGYÁSPONT
1. MÓDSZER
A leírt módszerek többsége az 1. OECD vizsgálati irányelven alapul. Az alapelveket a (2) és (3) szakirodalom ismerteti.
1.1. BEVEZETÉS
Az anyagok olvadáspontjának meghatározásához a leírt módszereket és eszközöket kell alkalmazni az anyagok tisztasági fokára vonatkozó mindenfajta korlátozás nélkül.
A módszer kiválasztása a vizsgálni kívánt anyag természetétől függ. Ennek következtében a korlátozó tényező attól függ, hogy könnyen, nehezen vagy egyáltalán nem porítható az anyag.
Néhány anyag esetében a fagyáspont vagy dermedési pont meghatározása a megfelelőbb, és az ezek meghatározására vonatkozó szabványok is szerepelnek ebben a módszerben.
Ahol az anyag különleges tulajdonságai miatt a fenti paraméterek közül egyik sem mérhető nehézség nélkül, a dermedéspont lehet megfelelő.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Az olvadáspont az a hőmérséklet, amelynél légköri nyomáson létrejön a fázisátmenet a szilárd halmazállapotból folyékony halmazállapotba, és ez a hőmérséklet ideális esetben megegyezik a fagyásponttal.
Mivel sok anyag fázisátmenete bizonyos hőmérséklet-tartományban jön létre, ezért ezt gyakran olvadási tartományként írják le.
Mértékegységek átszámítása (K-ről oC-ra)
t = T – 273,15
|
t |
: |
Celsius-skála szerinti hőmérséklet, Celsius-fok ( oC) |
|
T |
: |
termodinamikai hőmérséklet, Kelvin (K) |
1.3. REFERENCIAANYAGOK
Nem kell minden új anyag vizsgálatakor referenciaanyagot használni. Ezeknek elsősorban arra kell szolgálniuk, hogy időnként ellenőrizzék a módszer megfelelőségét, és lehetővé tegyék az összehasonlítást más módszerekkel kapott eredményekkel.
Néhány kalibrációs anyagot a (4) szakirodalom sorol fel.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Meghatározza a szilárd halmazállapotból folyékony halmazállapotba vagy folyékony halmazállapotból szilárd halmazállapotba történő fázisátmenet hőmérsékletét (hőmérséklettartományát). A gyakorlatban a vizsgált anyag mintájának légköri nyomáson végrehajtott melegítése/hűtése során az olvadás/fagyás kezdetének és az olvadás/fagyás befejezésének hőmérsékletét határozzák meg. A leírás öt módszert ismertet, nevezetesen a kapilláris módszert, a fűtőasztalos módszereket, a fagyáspont-meghatározásokat, a termikus analízis módszerét és a dermedéspont meghatározását (ahogyan ezt az ásványolajokhoz kifejlesztették).
Bizonyos esetekben megfelelő lehet a fagyáspont mérése az olvadáspont mérése helyett.
1.4.1. Kapilláris módszer
1.4.1.1. Olvadáspontmérő készülékek folyadékfürdővel
Kis mennyiségű, finomra őrölt anyagot helyeznek el egy kapilláris csőben, és szorosan tömörítik. Ezután felmelegítik a csövet egy hőmérővel együtt, és a hőmérséklet-emelkedést 1 K/perc körüli értéknél kisebbre állítják be a tényleges olvasztás során. Meghatározzák az olvadás kezdő és végső hőmérsékletét.
1.4.1.2. Olvadáspontmérő készülékek fémblokkos eszközzel
Megegyezik az 1.4.1.1. pontban ismertetett eljárással, azzal a kivétellel, hogy melegített fémblokkban helyezik el a kapilláris csövet és a hőmérőt, és ezek a blokkban kialakított nyílásokon keresztül figyelhetők.
1.4.1.3. Fotocellás meghatározás
A kapilláris csőben elhelyezett mintát automatikusan melegítik egy fémhengerben. Fénysugarat irányítanak az anyagon keresztül a hengerben kialakított nyílás segítségével egy pontosan kalibrált fotocellához. A legtöbb anyag optikai tulajdonságai opálosról átlátszóra változnak a hevítés során. A fotocellát elérő fény intenzitása megnövekszik, és stop jelet küld a digitális jelzőkészüléknek, amely a fűtőkamrában elhelyezett platina ellenállás-hőmérő hőmérsékletét jelzi. Ez a módszer nem alkalmas néhány, erősen színezett anyaghoz.
1.4.2. Fűtőasztalok
1.4.2.1. Kofler-féle fűtőasztal
A Kofler-féle fűtőasztal két, különböző hővezető képességű, elektromosan melegített fémből áll, ahol a fűtőasztalt úgy tervezték, hogy a hosszúsága mentén a hőmérséklet-gradiens majdnem lineáris legyen. A fűtőasztal hőmérséklete 283-tól 573 K-ig változhat. A fűtőasztalt egy, a fűtőasztalhoz tervezett skálával és mutatót tartalmazó különleges hőmérsékletjelző készülékkel látták el. Az olvadáspont meghatározására az anyagot vékony rétegben közvetlenül a fűtőasztal felületére helyezik. Néhány másodpercen belül éles elválasztó vonal alakul ki a folyékony és szilárd fázis között. Ekkor a mutatót a vonal hátralévő részéhez állítva leolvassák az elválasztó vonalnál kapott hőmérsékletet.
1.4.2.2. Olvadásvizsgáló mikroszkóp
Többféle, mikroszkóppal végrehajtott fűtőasztal-vizsgálat alkalmas a kis mennyiségű anyag olvadáspontjának meghatározására. A fűtőasztalok többségében a hőmérsékletet érzékeny termoelemmel mérik, de esetenként higanyhőmérőt használnak. Egy jellegzetes mikroszkópos, fűtőasztalos olvadáspontvizsgáló-készülék olyan, fémlemezt tartalmazó hevítőkamrával rendelkezik, amelyre a mintát egy tárgylemezen helyezik el. A fémlemez közepén lévő nyílás lehetővé teszi, hogy bejusson a fény a mikroszkóp megvilágító tükréről. Használat közben üveglappal fedik le a kamrát annak érdekében, hogy a vizsgált területről kizárják a levegőt.
A minta hevítését reosztát szabályozza. Optikailag anizotróp anyagokon történő nagyon pontos mérések végrehajtásához polarizált fény használható.
1.4.2.3. Meniszkusz-módszer
Ezt a módszert kifejezetten poliamidokhoz használják.
Vizuálisan meghatározzák azt a hőmérsékletet, amelynél egy fűtőasztal és egy, a poliamid próbadarab által tartott üvegfedél közé zárt szilikonolaj meniszkusza elmozdul.
1.4.3. Fagyáspont meghatározásának módszere
A mintát speciális kémcsőbe helyezik a fagyáspont meghatározására szolgáló készülékbe. A mintát óvatosan és folyamatosan keverik a hűtés során, és megfelelő időközönként megmérik a hőmérsékletét. Amikor a hőmérséklet néhány leolvasás során állandó marad, ezt a hőmérsékletet jegyzik fel (a hőmérő hibájának figyelembevételével) fagyáspontként.
A túlhűtést a szilárd és a folyékony fázisok közötti egyensúly fenntartásával kell elkerülni.
1.4.4. Termikus analízis
1.4.4.1. Differenciál-termoanalízis (DTA)
Ez a módszer az anyag és egy referenciaanyag közötti hőmérséklet-különbséget a hőmérséklet függvényében regisztrálja, miközben az anyagot és a referenciaanyagot ugyanazzal az irányított hőmérsékletprogrammal vizsgálják. Amikor a minta entalpiaváltozással járó fázisátalakuláson megy keresztül, ezt a változást a hőáramlási görbe alapvonalától való endoterm (olvadás) vagy exoterm (fagyás) eltérés jelzi.
1.4.4.2. Differenciál scanning kalorimetria (DSC)
Ez a módszer egy anyagba és a referenciaanyagba történő energiabevitelek közötti különbséget a hőmérséklet függvényében regisztrálja, miközben az anyagot és a referenciaanyagot ugyanolyan irányított hőmérsékletprogrammal vizsgálják. Ez az energia az anyag és a referenciaanyag közötti nulla hőmérséklet-különbség létrehozásához szükséges energia. Amikor a minta entalpiaváltozással járó fázisátalakuláson megy keresztül, ezt a változást a hőáramlási görbe alapvonalától való endoterm (olvadás) vagy exoterm (fagyás) eltérés jelzi.
1.4.5. Dermedéspont
Ezt a módszert ásványolajoknál történő használatra fejlesztették ki, és minden alacsony olvadáspontú, olajtartalmú anyaghoz használható.
Előzetes melegítés után a mintát meghatározott ütemben hűtik, és 3 K hőfokintervallumonként megvizsgálják a folyási jellemzőit. Dermedéspontként azt a legalacsonyabb hőmérsékletet jegyzik fel, amelynél még megfigyelhető az anyag mozgása.
1.5. MINŐSÉGI KÖVETELMÉNYEK
A következő táblázat sorolja fel az olvadáspont/olvadási tartomány meghatározásához használt különböző módszerek alkalmazhatóságát és pontosságát:
TÁBLÁZAT: A MÓDSZEREK ALKALMAZHATÓSÁGA
A. Kapilláris módszerek
|
Mérési módszer |
Azok az anyagok, amelyek poríthatók |
Azok az anyagok, amelyek nem poríthatók könnyen |
Hőmérséklet-tartomány |
Becsült pontosság (1) |
Meglévő szabvány |
|
Olvadáspontmérő készülékek folyadékfürdővel |
Igen |
Csak néhányhoz |
273-tól 573 K-ig |
±0,3K |
J1S K 0064 |
|
Olvadáspontmérő készülékek fémblokkal |
Igen |
Csak néhányhoz |
293-tól > 573 K-ig |
±0,5K |
ISO 1218 (E) |
|
Fotocellás meghatározás |
Igen |
Többféle Készülékkel, eszközzel |
253-tól 573 K-ig |
±0,5K |
|
B. Fűtőasztalok és fagyasztási módszerek
|
Mérési módszer |
Azok az anyagok, amelyek poríthatók |
Azok az anyagok, amelyek nem poríthatók könnyen |
Hőmérséklet-tartomány |
Becsült pontosság (2) |
Meglévő szabvány |
|
Kofler-féle fűtőasztal rúd |
Igen |
Nem |
283-tól > 573 K-ig |
±1,0 K |
ANSI/ASTMD 3451-76 |
|
Olvadást vizsgáló mikroszkóp |
Igen |
Csak néhányhoz |
273-tól > 573 K-ig |
±0,5K |
DIN 53736 |
|
Meniszkusz-módszer |
Nem |
Különösen poliamidokhoz |
293-tól > 573 K-ig |
±0,5K |
ISO 1218(E) |
|
Fagyáspont meghatározási módszer |
Igen |
Igen |
223-tól 573 K-ig |
±0,5 K |
pl. BS 4695 |
C. Termoanalízis
|
Mérési módszer |
Azok az anyagok, amelyek poríthatók |
Azok az anyagok, amelyek nem poríthatók könnyen |
Hőmérséklet-tartomány |
Becsült pontosság (3) |
Meglévő szabvány |
|
Differenciál-termoanalízis |
Igen |
Igen |
173-tól 1 273 K-ig |
600 K-ig ±0,5 K, 1 273 K-ig ±2,0 K |
ASTM E 537- 76 |
|
Differenciál scanning kalorimetria |
Igen |
Igen |
173-tól 1 273 K-ig |
600 K-ig ±0,5 K, 1 273 K-ig ±2,0 K |
ASTM E 537-76 |
D. Dermedéspont
|
Mérési módszer |
Azok az anyagok, amelyek poríthatok |
Azok az anyagok, amelyek nem poríthatók könnyen |
Hőmérséklet-tartomány |
Becsült pontosság (4) |
Meglévő szabvány |
|
Dermedéspont |
Ásványolajokhoz és olajtartalmú anyagokhoz |
Ásványolajokhoz és olajtartalmú anyagokhoz |
223-tól 323K-ig |
±3,0 K |
ASTM D 97-66 |
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
A nemzetközi és nemzeti szabványok csaknem minden vizsgálati módszert leírnak (lásd az 1. függeléket).
1.6.1. Módszerek kapilláris csővel
Lassú hőmérséklet-növelés esetén a finom porrá őrölt anyagok rendszerint az 1. ábrán látható olvadási szakaszokat mutatják.
1. ábra

Az olvadáspont meghatározása során az olvadás kezdeti és véghőmérsékletét jegyzik fel.
1.6.1.1. Olvadáspontmérő folyadékfürdő készülék
A 2. ábra egy szabványosított, üvegből készített olvadáspontmérő készüléktípust (JIS K 0064) mutat; minden méret milliméterben van megadva.
2. ábra
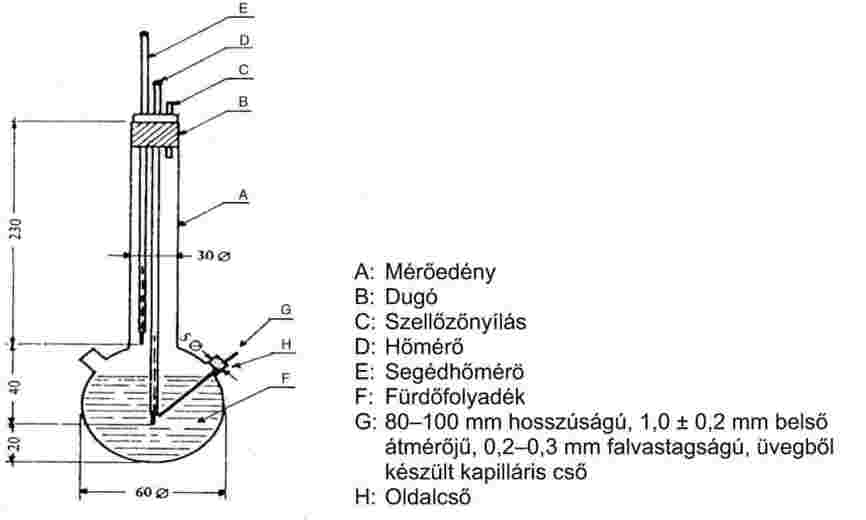
Fürdőfolyadék:
Megfelelő folyadékot kell választani. A folyadék kiválasztása a meghatározni kívánt olvadásponttól függ, például 473 K-nél nem magasabb olvadáspontokhoz folyékony paraffin, 573 K-nél nem magasabb olvadáspontokhoz szilikonolaj alkalmas.
523 K feletti olvadáspontokhoz három tömegrész kénsavból és két tömegrész káliumszulfátból álló keverék használható. Ennek használata esetén megfelelő óvintézkedéseket kell tenni.
Hőmérő:
Csak azok a hőmérők használhatók, amelyek megfelelnek az alábbi, vagy ezzel egyenértékű szabványok követelményeinek:
ASTM E 1-71, DIN 12770, JIS K 8001.
Eljárás:
A száraz anyagot dörzscsészében finom porrá őrlik, és behelyezik az egyik végén leforrasztott kapilláris csőbe úgy, hogy a töltési szint körülbelül 3 mm legyen szoros összetömörítés után. Az egységes tömörített minta eléréséhez a kapilláris csövet függőlegesen, üvegcsövön keresztül óraüvegre kell ejteni körülbelül 700 mm magasságból.
A megtöltött kapilláris csövet úgy kell a fürdőbe helyezni, hogy a hőmérő higanygömbjének középső része azon a helyen érintkezzen a kapilláris csővel, ahol az anyag található. A kapilláris csövet általában az olvadási hőmérsékletnél 10 K-nel alacsonyabb hőmérséklet mellett helyezik a készülékbe.
A folyadékfürdőt úgy melegítik, hogy a hőmérséklet-növekedés mértéke körülbelül 3 K/perc legyen. A folyadékot keverni kell. Körülbelül 10 K-nel a várt olvadáspont előtt a hőmérsékletnövekedési ütemet maximum 1 K/perc értékre kell módosítani.
Számítás:
Az olvadáspont számítása a következőképpen történik:
T = TD + 0,00016 (TD – TE) n
Ahol:
|
T |
= |
korrigált olvadáspont K-ben |
|
TD |
= |
a D hőmérő által mutatott hőmérsékletérték K-ben |
|
TE |
= |
az E hőmérő által mutatott hőmérsékletérték K-ben |
|
N |
= |
a D hőmérőn a folyadékfürdőből kiemelkedő részen a higanyoszlop fokbeosztásainak száma |
1.6.1.2. Olvadáspontmérő készülékek fémblokkal
Készülék:
A következőkből áll:
|
— |
hengeres fémblokk, amelynek a belső része üreges és kamrát alkot (lásd a 3. ábrát), |
|
— |
fémdugó, két vagy több furattal, amelynek segítségével csövek vezethetők a fémblokkba, |
|
— |
egy, a fémblokkhoz létrehozott fűtőrendszer, amelyet például a fémblokkhoz csatolt, zárt elektromos ellenállás biztosít, |
|
— |
reosztát az energiabevitel szabályozásához, elektromos fűtés használatakor, |
|
— |
a kamra oldalfalain négy, hőálló üvegből készült ablak, egymással szemben, derékszögben elhelyezve. Az egyik ablak elé nézőkét szereltek fel a kapilláris cső megfigyeléséhez. A többi három ablakot lámpák segítségével a burkolat belsejének megvilágítására használják, |
|
— |
egyik végén zárt, hőálló üvegből készült kapilláris cső (lásd az 1.6.1.1. pontot). |
Lásd az 1.6.1.1. pontban említett szabványokat. Hasonló pontosságú termoelektromos mérőkészülékek is alkalmazhatók.
3. ábra

1.6.1.3. Fotocellás meghatározás
Készülék és eljárás:
A készülék egy automatikus hűtőrendszerrel ellátott fémkamrából áll. Három kapilláris csövet töltenek meg az 1.6.1.1. pontnak megfelelően, és helyeznek a kemencébe.
Különböző lineáris hőmérséklet-növelési lehetőségek állnak rendelkezésre a készülék kalibrálásához, az alkalmas hőmérséklet-növekedés beállítása elektromosan történik egy előre kiválasztott konstans és lineáris értékre. Regisztráló készülékek mutatják a kemence tényleges hőmérsékletét és a kapilláris csövekben lévő anyag hőmérsékletét.
1.6.2. Fűtőasztalok
1.6.2.1. Kofler-féle fűtőasztal
Lásd a függeléket.
1.6.2.2. Olvadásvizsgáló mikroszkóp
Lásd a függeléket.
1.6.2.3. Meniszkusz-módszer (poliamidok)
Lásd a függeléket.
Az olvadásponton a hevítés sebességének 1 K/perc értéknél kisebbnek kell lennie.
1.6.3. A fagyáspont meghatározásának módszerei
Lásd a függeléket.
1.6.4. Termikus analízis
1.6.4.1. Differenciál-termoanalízis
Lásd a függeléket.
1.6.4.2. Differenciál scanning kalorimetria
Lásd a függeléket.
1.6.5. Dermedéspont meghatározása
Lásd a függeléket.
2. ADATOK
Néhány esetben a hőmérő helyesbítése szükséges.
3. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az alkalmazott módszert, |
|
— |
az anyag pontos leírását (azonosság és szennyeződések), és amennyiben volt ilyen, előzetes tisztítási fokának pontos ismertetését, |
|
— |
a pontosság becslését. |
Legalább két, a becsült pontossági tartományban lévő mért érték (lásd a táblázatokat) középértékét adják meg olvadáspontként.
Amennyiben az olvadás kezdetén és végső szakaszában mért hőmérséklet közötti különbség a módszer pontossági határai között van, az olvadás végső szakaszában mért hőmérsékletet kell olvadáspontnak tekinteni; egyébként meg kell adni mind a két hőmérsékletet.
Amennyiben az anyag elbomlik vagy szublimál az olvadáspont elérése előtt, meg kell adni azt a hőmérsékletet, amelynél ez a hatás megfigyelhető.
A vizsgálati jelentésben közölni kell minden, az eredmények értelmezése szempontjából lényeges információt és megjegyzést, különösen azokat, amelyek az anyag szennyeződéseivel és fizikai állapotával kapcsolatosak.
4. SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 102. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges. |
|
(2) |
IUPAC, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London, 1975, vol. II., 803–834. |
|
(3) |
R. Weissberger ed.: Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, vol. I, part I, chapter VII. |
|
(4) |
IUPAC, Physicochemical measurements: Catalogue of reference materials from national laboratories, Pure and applied chemistry, 1976, vol. 48, 505–515. |
Függelék
További technikai információt például a következő szabványok nyújthatnak.
1. Kapilláris módszerek
1.1. Olvadáspontmérő készülékek folyadékfürdővel
|
ASTM E 324-69 |
Standard test method for relatíve initial and final melting points and the melting range of organic chemicals |
|
BS 4634 |
Method for the determination of melting point and/or melting range |
|
DIN 53181 |
Bestimmung des Schmelzintervalles von Harzen nach Kapilarverfarehn |
|
JIS K 00-64 |
Testing methods for melting point of chemical products |
1.2. Olvadáspontmérő készülékek fémblokkal
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
|
ISO 1218 (E) |
Plastics – polyamides – determination of „melting point” |
2. Fűtőasztal
2.1. Kofler-féle fűtőasztal
|
ANSI/ASTM D 3451-76 |
Standard recommended practices for testing polymeric powder coatings |
2.2. Olvadáspont-vizsgáló mikroszkóp
|
DIN 53736 |
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen |
2.3. Meniszkusz-módszer (poliamidok)
|
ISO 1218 (E) |
Plastics – polyamides – determination of „melting point” |
|
ANSI/ASTM D 2133-66 |
Standard specification for acetal resin injection moulding and extrusion materials |
|
NF T 51-050 |
Résines de polyamides. Détermination du „point de fusion”. Méthode du ménisque |
3. Módszerek a fagyáspont meghatározására
|
BS 4633 |
Method for the determination of crystallizing point |
|
BS 4695 |
Method for Determination of Melting Point of petroleum wax (Cooling Curve) |
|
DIN 51421 |
Bestimmung des Gefrierpunktes von Flugkraftstoffen, Ottokraftstoffen und Motorenbenzolen |
|
ISO 2207 |
Cires de pétrole: détermination de la température de figeage |
|
DIN 53175 |
Bestimmung des Erstarrungspunktes von Fettsäuren |
|
NF T 60-114 |
Point de fusion des paraffines |
|
NF T 20-051 |
Méthode de détermination du point de cristallisation (point de congélation) |
|
ISO 1392 |
Method for the determination of the freezing point |
4. Termikus analízis
4.1. Differenciál termoanalízis
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
4.2. Differenciál scanning kalorimetria
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse, Begriffe |
5. Dermedéspont meghatározása
|
NBN 52014 |
Echantillonnage et analyse des produits du pétrole: Point de trouble et point d'écoulement limite – Monsterneming en ontleding van aardolieproducten: Troebelingspunt en vloeipunt |
|
ASTM D 97-66 |
Standard test method for pour point of petroleum oils |
|
ISO 3016 |
Petroleum oils – Determination of pour point |
A.2. FORRÁSPONT
1. MÓDSZER
A leírt módszerek többsége az OECD vizsgálati irányelveken (1) alapul. Az alapelveket a (2) és (3) szakirodalom ismerteti.
1.1. BEVEZETÉS
Az itt leírt módszerek és eszközök folyadékokhoz és alacsony olvadáspontú anyagokhoz alkalmazhatók, feltéve hogy azok a forráspont alatt nem mennek keresztül kémiai reakción (például autooxidáció, átrendeződés, bomlás stb.). A módszerek tiszta és szennyezett folyékony anyagokhoz alkalmazhatók.
A hangsúly a fotocellás meghatározást és a termikus analízist használó módszereken van, mivel ezek a módszerek lehetővé teszik az olvadás-, valamint a forráspontok meghatározását. Ezenkívül a mérések automatikusan hajthatók végre.
A „dinamikus módszernek” megvan az az előnye, hogy a gőznyomás meghatározásához is alkalmazható, és nincs szükség a forráspontnak a normál nyomásra (105,325 kPa) történő átszámítására, mivel a normál nyomás a mérés során manosztát segítségével beállítható.
Megjegyzések:
A szennyeződéseknek a forráspont meghatározására gyakorolt hatása nagymértékben függ a szennyezés természetétől. Amennyiben olyan illékony szennyezések vannak a mintában, amelyek befolyásolhatják az eredményt, az anyag még tisztítható lehet.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
A normál forráspont az a hőmérséklet, amelynél valamely folyadék gőznyomása 101,325 kPa.
Amennyiben a forráspontot nem normál légköri nyomáson mérik, a gőznyomásnak a hőmérséklettől való függése a Clausius–Clapeyron egyenlet segítségével írható le:

ahol:
|
p |
= |
az anyag gőznyomása Pascalban |
|
Hv |
= |
az anyag párolgási hője mol–1 mértékegységben |
|
R |
= |
általános moláris gázállandó = 8,314 J mol–1 K–1 |
|
T |
= |
termodinamikus hőmérséklet K-ben |
A forráspontot a mérés során észlelhető környezeti nyomás figyelembevételével adják meg.
Átszámítások
Nyomás (mértékegysége: kPa)
|
100 kPa |
= |
1 bar = 0,1 MPa (a „bar” még mindig megengedhető, de nem ajánlott) |
|
133 Pa |
= |
1 Hgmm = 1 Torr (a „Hgmm” és „Torr” mértékegységek nem megengedettek) |
|
1 atm |
= |
normál atmoszféra = 101 325 Pa (az „atm” mértékegység nem megengedett) |
Hőmérséklet (mértékegység: K)
t = T – 273,15
|
t |
: |
Celsius hőmérséklet, Celsius-fok ( oC) |
|
T |
: |
termodinamikus hőmérséklet, Kelvin (K) |
1.3. REFERENCIAANYAGOK
Nem kell minden új anyag vizsgálatakor referenciaanyagot használni. Ezeknek elsősorban arra kell szolgálniuk, hogy időnként ellenőrizzék a módszer megfelelőségét, és lehetővé tegyék az összehasonlítást más módszerekkel kapott eredményekkel.
Néhány kalibrációs anyag a függelékben felsorolt módszerek leírásában található.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A forráspont (forrásponttartomány) meghatározására szolgáló öt módszer a forráspont mérésén, míg két további módszer termikus analízisen alapul.
1.4.1. Meghatározás ebulliométer segítségével
Az ebulliométereket eredetileg a forráspont-növekedés alapján történő molekulasúlymeghatározáshoz fejlesztették ki, de pontos forráspontmérésekhez is alkalmasak. Az ASTM D 1120-72-es szabvány egy nagyon egyszerű készüléket ismertet (lásd a függeléket). A folyadékot ebben a készülékben egyensúlyi körülmények között, légköri nyomáson forrásig hevítik.
1.4.2. Dinamikus módszer
E módszerrel a gőz újrakondenzálódási hőmérsékletét mérik forráskor, megfelelő hőmérővel a refluxban. A módszerben a nyomás változtatható.
1.4.3. Desztillációs módszer forráspont meghatározására
Ez a módszer a folyadék desztillálását, a gőz kondenzációs hőmérsékletének mérését és a desztillátum mennyiségének meghatározását foglalja magában.
1.4.4. Siwoloboff-módszer
A mintát folyadékfürdőbe merített mintacsőben melegítik. A mintacsőbe bemerítenek egy, az alsó részében levegőbuborékot tartalmazó, az alján összeolvasztott hajszálcsövet.
1.4.5. Fotocellás meghatározás
A Siwoloboff-alapelvet követve automatikus fotoelektromos mérést hajtanak végre felszálló buborékok segítségével.
1.4.6. Differenciál-termoanalízis
Ez a módszer az anyag és egy referenciaanyag közötti hőmérséklet-különbséget a hőmérséklet függvényében regisztrálja, miközben az anyagot és a referenciaanyagot ugyanazzal az irányított hőmérsékletprogrammal vizsgálják. Amikor a minta entalpiaváltozással járó fázisátalakuláson megy át, ezt a változást a regisztrált hőmérsékleti görbe alapvonalától való endoterm eltérés (forrás) jelzi.
1.4.7. Differenciál scanning kalorimetria
Ez a módszer az anyagba és a referenciaanyagba történő energiabevitelek közötti különbséget regisztrálja a hőmérséklet függvényében, miközben az anyagot és a referenciaanyagot ugyanazzal az irányított hőmérsékletprogrammal vizsgálják. Ez az energia az anyag és a referenciaanyag közötti nulla hőmérséklet-különbség létrehozásához szükséges energia. Amikor a minta entalpiaváltozással járó fázisátalakuláson megy át, ezt a változást a hőáramlási görbe alapvonalától való endoterm eltérés (forrás) jelzi.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Az 1. táblázat sorolja fel a forráspont/forrástartomány meghatározásához használt különböző módszerek alkalmazhatóságát és pontosságát.
1. táblázat
A módszerek összehasonlítása
|
Mérési módszer |
Becsült pontosság |
Meglévő szabvány |
|
Ebulliométer |
ASTMD 1120-72 (5) |
|
|
Dinamikus módszer |
±0,5 K (600 K-ig) (6) |
|
|
Desztillációs folyamat (forrási tartomány) |
±0,5 K (600 K-ig) |
ISO/R 918, DIN 53171, BS 4591/71 |
|
Siwoloboff szerint |
± 2 K (600 K-ig) (6) |
|
|
Fotocellás meghatározás |
±0,3 K (373 K-ig) (6) |
|
|
Differenciál-termokalorimetria |
±0,5 K (600 K-ig) ±2,0 K (1 273 K-ig) |
ASTM E 537-76 |
|
Differenciál scanning kalorimetria |
±0,5 K (600 K-ig) ±2,0 K (1 273 K-ig) |
ASTM E 537-76 |
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
A nemzetközi és nemzeti szabványok (lásd a függeléket) csaknem minden vizsgálati módszert tartalmaznak.
1.6.1. Ebulliométer
Lásd a függeléket.
1.6.2. Dinamikus módszer
Lásd a gőznyomás meghatározására szolgáló A.4-es vizsgálati módszert.
Az észlelt forráspontot 101,325 kPa alkalmazott nyomás mellett adják meg.
1.6.3. Desztillációs folyamat (forrási tartomány)
Lásd a függeléket.
1.6.4. Siwoloboff-módszer
A mintát egy olvadáspontmérő készülékben, egy körülbelül 5 mm átmérőjű mintacsőben melegítik (1. ábra).
Az 1. ábra a szabványosított olvadás- és forráspontmérő készülékek egyik típusát (JIS K 0064) mutatja be (üvegből készült, minden méret milliméterben van megadva).
1. ábra

A mintacsőbe egy, az alsó vége fölött körülbelül 1 cm-rel leforrasztott kapilláris csövet helyeznek be (forrási kapilláris). A vizsgált anyagot addig töltik be, hogy a kapilláris leforrasztott szakasza a folyadék felszíne alatt legyen. A forrási kapillárist tartalmazó mintacsövet a hőmérőhöz rögzítik egy gumiszalaggal, vagy oldalról egy tartóval rögzítik (lásd a 2. ábrát):
|
2. ábra Müködési alapelv Siwoloboff szerint |
3. ábra Módosított alapelv |
|
|
|
A folyadékfürdőt a forráspontnak megfelelően választják ki. 573 K hőmérsékletig szilikonolaj használható. Paraffinolaj csak legfeljebb 473 K-ig használható. A fürdőben lévő folyadék melegítését először 3 K/perc hőmérséklet-növekedésre kell beállítani. A folyadékfürdőt keverni kell. A várt forráspont alatt körülbelül 10 K-nel csökkenteni kell a melegítést úgy, hogy a hőmérséklet-növekedés üteme 1 K/perc értéknél kisebb legyen. A forráspont megközelítésekor gyors ütemben buborékok kezdenek megjelenni a forraló kapillárisból.
A forráspont az a hőmérséklet, amelynél, további hűtéskor, megáll a buboréklánc, és hirtelen növekedni kezd a folyadékszint a kapillárisban. Az ennek megfelelő, a hőmérőn látható érték az anyag forráspontja.
A módosított alapelv esetében (3. ábra) a forráspontot egy olvadáspont mérésére szolgáló kapillárisban határozzák meg. Ezt a kapillárist megnyújtották hegyes csúcsúra körülbelül 2 cm hosszúságban (a), és ezzel kis mennyiségű mintát szívnak fel. A hegyes kapilláris cső nyitott végét összeolvasztással lezárják úgy, hogy a végén legyen egy kis légbuborék. Az olvadáspont meghatározására szolgáló készülék melegítésekor (b) kitágul a légbuborék. A forráspont annak a hőmérsékletnek felel meg, amelynél az anyagból álló dugó eléri a folyadékfürdő felületének szintjét (c).
1.6.5. Fotocellás meghatározás
A mintát egy fűtött fémblokkba helyezett kapilláris csőben melegítik.
A blokkban lévő alkalmas nyílásokon keresztül egy fénysugarat irányítanak az anyagon át egy pontosan kalibrált fotocellára.
A minta hőmérséklet-növekedése során egyenként légbuborékok jelennek meg a forrásban lévő anyagot tartalmazó kapillárisból. A forráspont elérésekor nagymértékben megnövekszik a buborékok száma. Ez változást hoz létre a fényerőben, amelyet egy fotocella regisztrál, és stopjelet ad a blokkban elhelyezett platina ellenállás-hőmérő hőmérsékletét jelző készüléknek.
A módszer különösen hasznos, mivel lehetővé teszi a szobahőmérséklet alatti meghatározásokat egészen 253,15 K-ig (–20 oC) anélkül, hogy bármilyen változtatást kellene végrehajtani a készülékben. A készüléket egyszerűen el kell helyezni egy hűtőfürdőben.
1.6.6. Termikus analízis
1.6.6.1. Differenciál-termoanalízis
Lásd a függeléket.
1.6.6.2. Differenciál scanning kalorimetria
Lásd a függeléket.
2. ADATOK
A normál nyomástól való kis eltéréseknél (max. ± 5 kPa) a forráspontokat Tn-re normalizálják az alábbi, Sidney Young-féle számértékegyenlet segítségével:
Tn = T + (fT x Δ p)
ahol:
|
Δ p |
= |
(101,325 – p) [figyeljen az előjelre] |
|
P |
= |
mért nyomás kPa mértékegységben |
|
fT |
= |
forráspontváltozás üteme a nyomás függvényében, K/kPa mértékegységben |
|
T |
= |
mért forráspont K-ben |
|
Tn |
= |
normál nyomásra korrigált forráspont K-ben |
Számos anyagra a hőmérséklet-korrekciós tényezőket, az fT-t, és a közelítő meghatározásokra szolgáló egyenleteket a fent említett nemzetközi és nemzeti szabványok tartalmazzák.
Például a DIN 53171-es módszer a festékekben lévő oldószerekhez a következő közelítő korrekciókat említi meg:
2. táblázat
Hőmerseklet-korrekcios tényezők, FT
|
Hőmérséklet, T (K) |
Korrekciós tényező, fT (K/kPa) |
|
323,15 |
0,26 |
|
348,15 |
0,28 |
|
373,15 |
0,31 |
|
398,15 |
0,33 |
|
423,15 |
0,35 |
|
448,15 |
0,37 |
|
473,15 |
0,39 |
|
498,15 |
0,41 |
|
523,15 |
0,44 |
|
548,15 |
0,45 |
|
573,15 |
0,47 |
3. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az alkalmazott módszert, |
|
— |
az anyag pontos leírását (azonosítás és szennyezések), és amennyiben van ilyen, az előzetes tisztítási fok pontos ismertetését, |
|
— |
a pontosság becslését. |
Legalább két, a becsült pontossági tartományban lévő mért érték (lásd az 1. táblázatot) középértékét adják meg olvadáspontként.
Meg kell adni a mért forráspontokat és azok középértékét, továbbá kPa-ban azt (azokat) a nyomást (nyomásokat), amelyeknél a méréseket végrehajtották. A nyomásnak lehetőleg a normál légköri nyomáshoz kell közel lennie.
Meg kell adni az eredmények értelmezéséhez lényeges valamennyi információt és megjegyzést, különösen azokat, amelyek az anyag szennyeződéseivel és fizikai állapotával kapcsolatosak.
4. SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, a 103. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges. |
|
(2) |
IUPAC, B. Le Neindre, B. Vodar, eds. Experimental thermodynamics, Butterworths, London, 1975, vol. II. |
|
(3) |
R. Weissberger ed.: Technique of organic chemistry, Physical methods of organic chemistry, Third Edition, Interscience Publications, New York, 1959, volume I, part I, Chapter VIII. |
Függelék
További technikai információt például a következő szabványok nyújthatnak:
1. Ebulliométer
|
1.1. |
Olvadáspontmérő készülékek folyadékfürdővel |
|
ASTM D 1120-72 |
Standard test method for boiling point of engine anti-freezes |
2. Desztillációs folyamat (forrási tartomány)
|
ISO/R 918 |
Test Method for Distillation (Distillation Yield and Distillation Range) |
|
BS 4349/68 |
Method for determination of distillation of petroleum products |
|
BS 4591/71 |
Method for the determination of distillation characteristics |
|
DIN 53171 |
Lösungsmittel für Anstrichstoffe, Bestimmung des Siedeverlaufes |
|
NF T 20-608 |
Distillation: détermination du rendement et de l'intervalle de distillation |
3. Differenciál-termoanalízis és differenciál scanning kalorimetria
|
ASTM E 537-76 |
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis |
|
ASTM E 473-85 |
Standard definitions of terms relating to thermal analysis |
|
ASTM E 472-86 |
Standard practice for reporting thermoanalytical data |
|
DIN 51005 |
Thermische Analyse: Begriffe |
A.3. RELATÍV SŰRŰSÉG
1. MÓDSZER
A leírt módszerek az OECD vizsgálati irányelveken (1) alapulnak. Az alapelveket a (2) szakirodalom ismerteti.
1.1. BEVEZETÉS
Az itt leírt, a relatív sűrűség meghatározására szolgáló módszerek szilárd és folyékony anyagokhoz alkalmazhatók, a tisztasági fokukra vonatkozó korlátozás nélkül. Az 1. táblázat sorolja fel a különböző alkalmazandó módszereket.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
A szilárd anyagok vagy folyadékok D20 4 relatív sűrűsége a vizsgált anyag 20 oC hőmérsékleten meghatározott térfogatának tömege és a 4 oC hőmérsékleten meghatározott ugyanolyan térfogatú víz tömege közötti arány.
A relatív sűrűség dimenzió nélküli szám.
Valamely anyag ρ sűrűsége az m tömegének és v térfogatának a hányadosa. A ρ sűrűség Sí-mértékegységben kg/m3 -ben van megadva.
1.3. REFERENCIAANYAGOK (1) (3)
Nem kell minden új anyag vizsgálatakor referenciaanyagot használni. Ezeknek elsősorban arra kell szolgálniuk, hogy időnként ellenőrizzék a módszer megfelelőségét, és lehetővé tegyék az összehasonlítást más módszerekkel nyert eredményekkel.
1.4. A MÓDSZEREK ALAPELVE
Négy különböző osztályba sorolt módszer használatos.
1.4.1. Felhajtóerőn alapuló módszer
1.4.1.1. Hidrométer (folyékony anyagokhoz)
Megfelelően pontos és gyors sűrűségmeghatározások érhetők el úszó hidrométerekkel, amelyek lehetővé teszik valamely folyadék sűrűségének meghatározását a merülési mélysége alapján, egy skála leolvasásával.
1.4.1.2. Hidrosztatikus mérleg (folyékony és szilárd anyagokhoz)
A levegőben és egy alkalmas folyadékban (például vízben) mért vizsgálati minta tömege közötti különbség használható a minta sűrűségének meghatározására.
Szilárd anyagok esetében a mért sűrűség csak az adott, méréshez használt minta sűrűségét reprezentálja. Folyadékok sűrűségének meghatározásához megmérik egy ismert v térfogatú test tömegét levegőben, majd a folyadékban.
1.4.1.3. Merülőtest-módszer (folyékony anyagokhoz) (4)
E módszerben valamely folyadék sűrűségét a vizsgált folyadékba ismert térfogatú test bemerítése előtt és után a folyadék tömegéből határozzák meg.
1.4.2. Piknométeres módszerek
Szilárd anyagokhoz vagy folyadékokhoz különböző alakú és ismert térfogatú piknométerek használhatók. A sűrűséget a megtöltött és üres piknométer tömege közötti különbségből és annak ismert térfogatából számítják ki.
1.4.3. Levegő-összehasonlítású piknométer (szilárd anyagokhoz)
A szilárd test sűrűsége, alakjától függetlenül, szobahőmérsékleten, gáz-összehasonlítású piknométerrel mérhető meg. Ehhez az anyag térfogatát levegőben vagy inert gázban egy állítható, kalibrált térfogatú hengerben mérik meg. A sűrűség számításához a térfogatmérés befejezését követően tömegmérést végeznek.
1.4.4. Oszcillációs sűrűségmérő (5) (6) (7)
Valamely folyadék sűrűsége megmérhető oszcillációs sűrűségmérővel. Egy U-cső alakban gyártott mechanikus oszcillátort rezegtetnek az oszcillátor tömegétől függő oszcillátor rezonanciafrekvenciáján, amely ennek tömegétől függ. A minta bevitele megváltoztatja az oszcillátor rezonanciafrekvenciáját. A készüléket két, ismert sűrűségű folyékony anyag segítségével kell kalibrálni. Ezeket az anyagokat lehetőleg úgy kell kiválasztani, hogy a sűrűségük lefedje a mérni kívánt tartományt.
1.5. MINŐSÉGI KÖVETELMÉNYEK
A relatív sűrűség meghatározására használt különböző módszerek alkalmazhatóságát a táblázat sorolja fel.
1.6. A MÓDSZEREK LEÍRÁSA
A függelék ismerteti azokat a példaként megadott szabványokat, amelyeket a további technikai részletek megismeréséhez tanulmányozni kell.
A vizsgálatokat 20 oC hőmérsékleten kell végrehajtani, és legalább két mérést kell elvégezni.
2. ADATOK
Lásd a szabványokat.
3. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, az alábbi információkat kell tartalmaznia:
|
— |
az alkalmazott módszert, |
|
— |
az anyag pontos leírását (azonosság és szennyeződések) és előzetes tisztítási foka, amennyiben van ilyen. |
A 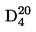 relatív sűrűséget az 1.2. pontban meghatározott módon kell megadni a mért anyag fizikai állapotával együtt.
relatív sűrűséget az 1.2. pontban meghatározott módon kell megadni a mért anyag fizikai állapotával együtt.
Meg kell adni az eredmények értelmezése szempontjából lényeges minden információt és megjegyzést, különösen azokat, amelyek az anyag szennyeződéseivel és fizikai állapotával kapcsolatosak.
Táblázat
A módszerek alkalmazhatósága
|
Mérési módszer |
Sűrűséget |
A leginkább lehetséges dinamikus viszkozitás |
Meglévő szabványok |
|||
|
Szilárd anyag |
Folyadék |
|||||
|
|
igen |
5 Pa s |
ISO 387, ISO 649-2, NF T 20-050 |
||
|
|
|
|
|
||
|
igen |
|
|
ISO 1183 (A) |
||
|
|
igen |
5 Pa s |
ISO 901 és 758 |
||
|
|
igen |
20 Pa s |
DIN 53217 |
||
|
|
|
|
ISO 3507 |
||
|
igen |
|
|
ISO 1183(B) NF T 20-053 |
||
|
|
igen |
500 Pa s |
ISO 758 |
||
|
igen |
|
|
DIN 55990 Teil 3. DIN 53243 |
||
|
|
igen |
5 Pa s |
|
||
4. SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 109. vizsgálati irányelv, a Tanács C(81) 30. határozata, végleges. |
|
(2) |
R. Weissberger ed, Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed, chapter IV, Interscience Publ., New York, 1959, vol. I, part 1. |
|
(3) |
IUPAC, Recommended reference materials for realization of physico-chemical properties, Pure and applied chemistry, 1976, vol. 48, 508. |
|
(4) |
Wagenbreth, H., Die Tauchkugel zur Bestimmung der Dichte von Flüssigkeiten, Technisches Messen tm, 1979, vol. 11, 427–430. |
|
(5) |
Leopold, H., Die digitale Messung von Flüssigkeiten, Elektronik, 1970, vol. 19., 297–302. |
|
(6) |
Baumgarten, D., Füllmengenkontrolle bei vorgepackten Erzeugnissen – Verfahren zur Dichtebestimmung bei flüssigen Produkten und ihre praktische Anwendung, Die Pharmazeutische Industrie, 1975, vol. 37, 717–726. |
|
(7) |
Riemann, J., Der Einsatz der digitalen Dichtemessung im Brauereilaboratorium, Brauwissenschaft, 1976, vol. 9, 253–255. |
Függelék
További technikai információt például a következő szabványok nyújtanak:
1. Felhajtóerőn alapuló módszer
1.1. Hidrométer
|
DIN 12790, ISO 387 |
Hydrometer; general instructions |
|
DIN 12791 |
Part I: Density hydrometers; construction, adjustment and use Part II: Density hydrometers; standardized sizes, designation Part III: Use and test |
|
ISO 649-2 |
Laboratory glassware: Density hydrometers for general purpose |
|
NF T 20-050 |
Chemical products for industrial use – Determination of density of liquids – Areometric method |
|
DIN 12793 |
Laboratory glassware: range find hydrometers |
1.2. Hidrosztatikus mérleg
Szilárd anyagokhoz
|
ISO 1183 |
Method A: Methods for determining the density and relative density of plastics excluding cellular plastics |
|
NF T 20-049 |
Chemical products for industrial use – Determination of the density of solids other than powders and cellular products – Hydrostatic balance method |
|
ASTM-D-792 |
Specific gravity and density of plastics by displacement |
|
DIN 53479 |
Testing of plastics and elastomers; determination of density |
Folyékony anyagokhoz
|
ISO 901 |
ISO 758 |
|
DIN 51757 |
Testing of mineral oils and related materials; determination of density |
|
ASTM D 941-55, ASTM D 1296-67 és ASTM D 1481-62 |
|
|
ASTM D 1298 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
|
BS 4714 |
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method |
1.3. Merülőtest-módszer
|
DIN 53217 |
Testing of paints, varnishes and similar coating materials; determination of density; immersed body method |
2. Piknométeres módszerek
2.1. Folyékony anyagokhoz
|
ISO 3507 |
Pycnometers |
|
ISO 758 |
Liquid chemical products; determination of density at 20 oC |
|
DIN 12797 |
Gay-Lussac pycnometer (for non-volatile liquids which are not too viscous) |
|
DIN 12798 |
Lipkin pycnometer (for liquids with a kinematic viscosity of less than 100 x l0–6 m2 s–1 at 15 oC) |
|
DIN 12800 |
Sprengel pycnometer (for liquids as DIN 12798) |
|
DIN 12801 |
Reischauer pycnometer (for liquids with a kinematic viscosity of less than 100 x 10–6 m2 s–1 at 20 oC, applicable in particular also to hydrocarbons and aqueous solutions as well as to liquids with higher vapour pressure, approximately 1 bar at 90 oC) |
|
DIN 12806 |
Hubbard pycnometer (for viscous liquids of all types which do not have too high a vapour pressure, in particular also for paints, varnishes and bitumen) |
|
DIN 12807 |
Bingham pycnometer (for liquids, as in DIN 12801) |
|
DIN 12808 |
Jaulmes pycnometer (in particular for ethanol – water mixture) |
|
DIN 12809 |
Pycnometer with ground-in thermometer and capillary side tube (for liquids which are not too viscous) |
|
DIN 53217 |
Testing of paints, varnishes and similar products; determination of density by pycnometer |
|
DIN 51757 |
Point 7: Testing of mineral oils and related materials; determination of density |
|
ASTM D 297 |
Section 15: Rubber products – chemical analysis |
|
ASTM D 2111 |
Method C: Halogenated organic compounds |
|
BS 4699 |
Method for determination of specific gravity and density of petroleum products (graduated bicapillary pycnometer method) |
|
BS 5903 |
Method for determination of relative density and density of petroleum products by the capillary-stoppered pycnometer method |
|
NF T 20-053 |
Chemical products for industrial use – Determination of density of solids in powder and liquids – Pycnometric method |
2.2. Szilárd anyagokhoz
|
ISO 1183 |
Method B: Methods for determining the density and relative density of plastics excluding cellular plastics |
|
NF T 20-053 |
Chemical products for industrial use – Determination of density of solids in powder and liquids – Pycnometric method |
|
DIN 19683 |
Determination of the density of soils |
3. Levegő-összehasonlítású piknométer
|
DIN 55990 |
Part 3: Prüfung von Anstrichstoffen und ähnlichen Beschichrungsstoffen; Pulverlack; Bestimmung der Dichte |
|
DIN 53243 |
Anstrichstoffe; Chlorhaltige Polymere; Prüfung |
A.4. GŐZNYOMÁS
1. MÓDSZER
A leírt módszerek többsége az OECD vizsgálati irányelveken (1) alapul. Az alapelveket a (2) és (3) szakirodalom ismerteti.
1.1. BEVEZETÉS
E vizsgálat végrehajtásához hasznos előzetes információkat szerezni az anyag szerkezetéről, olvadáspontjáról és forráspontjáról.
Nincs olyan mérési eljárás, amely a gőznyomások teljes tartományához alkalmazható. Ezért több módszer ajánlott a gőznyomás méréséhez < 10–4-től 105 Pa-ig.
A szennyeződések rendszerint befolyásolják a gőznyomást, amely nagymértékben függ a szennyeződés fajtájától.
Tisztítható az anyag, ahol illékony szennyeződések vannak jelen a mintában, amelyek hatással lehetnek az eredményre. Szükség lehet a technikai tisztaságú anyag gőznyomásának megadására.
Az itt leírt néhány módszer fém alkatrészekkel ellátott készüléket használ; ezt figyelembe kell venni a maró anyagok vizsgálatakor.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Valamely anyag gőznyomása a szilárd vagy folyékony anyag feletti telítettségi nyomás. Termodinamikai egyensúlyban valamely tiszta anyag gőznyomása kizárólag a hőmérséklet függvénye.
A nyomás alkalmazandó Sí-mértékegysége a pascal (Pa).
A korábban használt mértékegységek, átszámítási tényezőjükkel együtt, a következők:
|
1 Torr (≡ l Hgmm) |
= 1,333 × l02Pa |
|
1 atmoszféra |
= 1,013 × l05 Pa |
|
l bar |
= 105Pa |
A hőmérséklet Sí-mértékegysége a kelvin (K).
Az R általános moláris gázállandó értéke 8,314 J mol–1 K–1.
A gőznyomás hőmérsékletfüggését a Clausius–Clapeyron-egyenlet írja le:
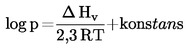
ahol:
|
p |
= |
az anyag gőznyomása pascalban |
|
Δ HV |
= |
a párolgási hője J mol–1 -ben |
|
R |
= |
általános moláris gázállandó J mol–1 K–1-ben |
|
T |
= |
termodinamikai hőmérséklet K-ben |
1.3. REFERENCIAANYAGOK
Nem kell minden új anyag vizsgálatakor referenciaanyagot használni. Ezeknek elsősorban arra kell szolgálniuk, hogy időnként ellenőrizzék a módszer megfelelőségét, és lehetővé tegyék az összehasonlítást más módszerekkel nyert eredményekkel.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A gőznyomás meghatározására hét, különböző gőznyomástartományokban alkalmazható módszer javasolt. Minden módszernél a gőznyomást különböző hőmérsékleteken határozzák meg. Korlátozott hőmérséklet-tartományban valamely tiszta anyag gőznyomásának logaritmusa a hőmérséklet inverzének lineáris függvénye.
1.4.1. Dinamikus módszer
A dinamikus módszer alkalmazásakor mérik az adott nyomáshoz tartozó forráspontot.
Ajánlott tartomány:
103-tól l05 Pa-ig.
E módszer a normál forráspont meghatározására is ajánlott, és e célra egészen 600 K-ig használható.
1.4.2. Statikus módszer
A statikus eljárásban, termodinamikai egyensúlynál meghatároznak egy zárt rendszerben létrejött gőznyomást adott hőmérsékleten. A módszer egykomponensű és többkomponensű szilárd anyagokhoz és folyadékokhoz alkalmas.
Ajánlott tartomány:
10-től 105 Pa-ig.
Ez a módszer 1–10 Pa tartományban is használható, feltéve hogy gondosan járnak el.
1.4.3. Izoteniszkóp
Ez a szabvány is statikus módszer, de rendszerint nem alkalmas többkomponensű rendszerekhez. További információt az ASTM módszer D-2879-86 leírása tartalmaz.
Ajánlott tartomány:
100-tól 105 Pa-ig.
1.4.4. Effúziós módszer: gőznyomás mérésére szolgáló mérleg
Vákuum alatt, egy cellából annak ismert méretű nyílásán keresztül, egységnyi idő alatt távozó anyag mennyisége úgy határozható meg, hogy elhanyagolható az anyag visszatérése a cellába (például egy érzékeny mérlegen a gőzlökéssel létrehozott impulzus mérésével, vagy a tömegveszteség mérésével).
Ajánlott tartomány:
10–3-tól 1 Pa-ig.
1.4.5. Effúziós módszer: tömegveszteséggel vagy az elpárolgott anyag leválasztásával
A módszer egy Knudsen-cellából (4), ultravákuum alatt, egy mikronyíláson keresztül, gőz formájában, egységnyi idő alatt kiáramló vizsgált anyag tömegének becslésén alapul. A kiáramló gőz tömege a cella tömegveszteségének meghatározásával, vagy a gőznek alacsony hőmérsékleten végrehajtott kondenzálásával és kromatográfiás analízis segítségével az elpárolgott anyag mennyiségének meghatározásával kapható meg. A gőznyomás a Hertz–Knudsen-féle összefüggés alkalmazásával számítható ki.
Ajánlott tartomány:
10–3-tól 1 Pa-ig.
1.4.6. Gázszaturációs módszer
Inert vivőgázáramot vezetnek az anyagon, hogy az telítetté váljon a gőzével. Valamely ismert mennyiségű vivőgáz által szállított anyagmennyiség egy alkalmas kondenzedényben való összegyűjtéssel, vagy „in-train” analitikai módszerrel mérhető. Ezután a módszer segítségével számítják ki a gőznyomást az adott hőmérsékleten.
Ajánlott tartomány:
10–4-től 1 Pa-ig.
Ez a módszer 1-től 10 Pa-ig terjedő tartományban is használható, feltéve hogy gondosan járnak el.
1.4.7. Forgó rotor
A forgó rotoros mérőeszközben a tényleges mérőelem egy mágneses térben felfüggesztett és nagyon gyorsan forgó kis acélgolyó. A gáznyomás az acélgolyó nyomástól függő lassulásából határozható meg.
Ajánlott tartomány:
10–4-től 0,5 Pa-ig.
1.5. MINŐSÉGI KÖVETELMÉNYEK
A gőznyomást meghatározó különböző módszerek az alkalmazás, ismételhetőség, reprodukálhatóság, mérési tartomány, meglévő szabvány tekintetében kerülnek összehasonlításra. Ezt az összehasonlítást a következő táblázat mutatja be.
|
Mérési módszer |
Anyagok |
Becsült ismételhetőség |
Becsült reprodukálhatóság |
Ajánlott tartomány |
Meglévő szabvány |
|||
|
Szilárd |
Folyékony |
|||||||
|
alacsony olvadáspontű |
igen |
25 %-ig |
25 %-ig |
103 Pa-tól 2x103 Pa-ig |
— |
||
|
|
|
|
1-től 5 %-ig |
1-től 5 %-ig |
2x103 Pa-tól 105 Pa-ig |
— |
||
|
igen |
igen |
5-től 10 %-ig |
5-től 10 %-ig |
10 Pa-tól 105 Pa-ig |
NFT 20-048 (5) |
||
|
igen |
igen |
5-től 10 %-ig |
5-től 10 %- |
102 Pa-tól 105 Pa-ig |
ASTM-D 2879-86 |
||
|
igen |
igen |
5-től 20 %-ig |
50 %-ig |
10–3 Pa-tól 1 Pa-ig |
NFT 20-047 (6) |
||
|
igen |
igen |
10-től 30 %-ig |
— |
10–3 Pa-tól 1 Pa-ig |
— |
||
|
igen |
igen |
10-től 30 %-ig |
— |
10–4 Pa-tól 1 Pa-ig |
— |
||
|
igen |
igen |
10-től 20 %-ig |
— |
10–4 Pa-tól 0,5 Pa-ig |
— |
||
1.6. A VIZSGALATI MÓDSZER LEÍRÁSA
1.6.1. Dinamikus mérés
1.6.1.1. Készülék
A mérőkészülék jellemzően egy csatlakoztatott, üvegből vagy fémből készült hűtővel ellátott forralóedényből (1. ábra), a hőmérséklet mérésére szolgáló eszközből és a nyomás szabályozására és mérésére használt berendezésből áll. A rajzon látható jellegzetes mérőkészülék hőálló üvegből készült, és öt részből tevődik össze:
A részben kettősfalú, nagy cső egy csiszolt köpenycsatlakozóból, hűtőből, hűtőedényből és egy bemeneti nyílásból áll.
Egy Cottrell-féle „szivattyúval” felszerelt üveghengert szereltek be a cső forraló szakaszába, amelynek zúzott üveggel létrehozott érdes felülete a forralási folyamat során a lökésszerű gőzképződés elkerülésére szolgál.
A hőmérsékletet egy alkalmas bevezető csőcsatlakozón (például csiszolt belső felületű csatlakozón) keresztül, a készülékbe a mérés helyéig bemerített alkalmas hőmérséklet-érzékelővel (például ellenállás-hőmérő, köpeny-termoelem) (5. számú tétel az 1. ábrán) mérik.
A nyomásszabályozóhoz és a mérőeszközhöz létre kell hozni a szükséges csatlakozásokat.
A gömblombikot, amely térfogat-kiegyenlítőként szolgál, egy kapilláris cső segítségével csatlakoztatják a mérőkészülékhez.
A forralóedényt az alulról az üvegkészülékbe behelyezett fűtőelem (például fűtőrúd) melegíti. A szükséges fűtőáram beállítása és szabályozása termoelem segítségével történik.
A szükséges, 102 Pa és körülbelül 105 Pa közötti vákuumot vákuumszivattyúval hozzák létre.
Egy alkalmas szelepet használnak nyomásszabályozáshoz a levegő vagy a nitrogén mérésére (mérési tartomány körülbelül 102–105 Pa) és légcserére.
A nyomást manométer méri.
1.6.1.2. Mérési eljárás
A gőznyomást közelítőleg 103 és 105 Pa között meghatározott nyomásérték mellett, a minta forráspontjának meghatározásával mérik. Állandó nyomás alatti, állandósult hőmérséklet azt jelzi, hogy elérték a forráspontot. Habzó anyagok nem mérhetők ennek a módszernek a segítségével.
Az anyagot a tiszta, száraz mintaedénybe helyezik. Problémák merülhetnek fel a nem por állagú szilárd anyagok esetében, de ezek esetenként megoldhatók a hűtőköpeny fűtésével. Az edény megtöltése után a készüléket a peremnél lezárják, és gáztalanítják az anyagot. Ezután beállítják a legalacsonyabb kívánt nyomást, és bekapcsolják a fűtést. Ezzel egyidejűleg regisztráló készülékhez csatlakoztatják a hőmérséklet-érzékelőt.
Egyensúlyi állapot akkor jön létre, amikor a regisztráló készülék állandó nyomáson állandó forráspontot mutat. Különös gonddal kell eljárni a forralás során a lökésszerű gőzképződés elkerülése érdekében. Ezenkívül teljes kondenzációnak kell létrejönnie a hűtőben. Alacsony olvadáspontú szilárd anyagok gőznyomásának meghatározásakor gondosan kell eljárni, ügyelve a kondenzátor eldugulásának elkerülésére.
Az egyensúlyi pont regisztrálása után magasabb nyomást állítanak be. Ez a folyamat az elmondottak szerint folytatódik 105 Pa eléréséig (összesen körülbelül 5–10 mérési pont). Ellenőrzésképpen meg kell ismételni az egyensúlyi pontokat csökkenő nyomások mellett.
1.6.2. Statikus mérés
1.6.2.1. Készülék
A készülék a minta hőmérsékletének szabályozására és a hőmérséklet mérésére egy mintatároló tartályból, valamint egy fűtő- és hűtőrendszerből áll. A készülék a nyomás beállítására és mérésére szolgáló eszközt is tartalmaz. A működési alapelveket a 2a. és 2b. ábra mutatja be.
A mintakamrát (2a. ábra) egyik oldalon vákuumszivattyú határolja. A másik oldalhoz manométer-folyadékot tartalmazó U-csövet csatlakoztattak. Az U-cső egyik vége a vákuumszivattyúhoz, a nitrogénpalackhoz vagy szellőztető szelephez és egy manométerhez ágazik el.
Az U-cső helyett nyomásjelzővel ellátott nyomásmérő is használható (2b. ábra).
A minta hőmérsékletének szabályozása érdekében a mintatartályt a vákuumcsővel és U-csővel vagy nyomásmérővel együtt állandó hőmérsékleten, ±0,2 K, tartott fürdőbe helyezik. A hőmérsékletméréseket a mintát tartalmazó tartály külső falán vagy magában a tartályban hajtják végre.
A készülék kiürítésére egy felszálló hűtött csapdával ellátott vákuumszivattyút használnak.
A 2a. módszer esetében közvetve, nullajelző segítségével mérik az anyag gőznyomását. E módszer figyelembe veszi azt a tényt, hogy a hőmérséklet-változás következtében változik a folyadék sűrűsége az U-csőben.
Az alábbi folyadékok alkalmasak az U-csőhöz nullajelzésként való használatra, a vizsgált anyag nyomástartományától és kémiai viselkedésétől függően: szilikonfolyadékok, fltalátok. A vizsgált anyagnak nem szabad észrevehetően feloldódnia az U-csőben lévő folyadékban, vagy ezzel reakcióba lépnie.
A manométerhez higany használható a normál légnyomástól 102 Pa-ig terjedő mérési tartományban, míg szilikonfolyadék és ftalát a 102 Pa-tól lefelé a 10 Pa-ig terjedő tartományban. Fűthető membrán manométerek 10-1 Pa alatt is használhatók. Léteznek más nyomásmérők is, amelyek 10 Pa alatt használhatók.
1.6.2.2. Mérési eljárás
Mérés előtt a 2. ábrán látható készülék valamennyi komponensét alaposan meg kell tisztítani, és meg kell szárítani.
A 2a. módszer esetében meg kell tölteni az U-csövet a választott folyadékkal, amelyet magas hőmérsékleten gáztalanítani kell az értékek leolvasása előtt.
A vizsgált anyagot a készülékbe helyezik, amit ezután lezárnak, és megfelelő mértékben csökkentik a hőmérsékletet a gáztalanításhoz. A hőmérsékletnek elegendően alacsonynak kell lennie a levegő eltávolításához, de – többkomponensű rendszer esetében – nem szabad megváltoztatnia az anyag összetételét. Szükség esetén keveréssel hozható létre gyorsabban az egyensúly.
A minta túlhűthető például folyékony hidrogénnel (ügyelve a levegő vagy hajtóközeg kondenzációjának elkerülésére), vagy etanol és szárazjég keverékével. Alacsony hőmérsékleten végzett méréshez ultra-kriomathoz csatlakoztatott, szabályozott hőmérsékletű fürdőt kell használni.
Miközben nyitva van a mintatartály fölötti szelep, szívással eltávolítják a levegőt. Ezután lezárják a szelepet, és lecsökkentik a minta hőmérsékletét a kívánt legalacsonyabb szintre. Ha szükséges, többször meg kell ismételni a gáztalanítást.
A minta melegítésekor növekszik a gőznyomás. Ez megváltoztatja a folyadék egyensúlyát az U-csőben. Ennek kiegyenlítésére nitrogént vagy levegőt engednek a készülékbe egy szelepen keresztül mindaddig, amíg a nyomásjelző folyadék nullát nem mutat. Az ehhez szükséges nyomás szobahőmérsékleten precíziós manométerről olvasható le. E nyomás az anyag gőznyomásának felel meg ezen a mérési hőmérsékleten.
A 2b. módszer ehhez hasonló, de a gőznyomást közvetlenül olvassák le.
A gőznyomás hőmérséklettől való függését megfelelően kis intervallumonként (körülbelül 5 – 10 mérési pont) határozzák meg egészen a kívánt maximumig. Ellenőrzésképpen meg kell ismételni az alacsony hőmérsékleten kapott értékek mérését.
Amennyiben az ismételt mérésekből kapott értékek nem esnek egybe a hőmérséklet növelése során kapott értékkel, ennek a következők valamelyike lehet az oka:
|
1. |
A minta még mindig tartalmaz levegőt (például nagy viszkozitású anyagok) vagy alacsony forráspontú anyagokat, amely(ek) a melegítés során szabadul(nak) fel, és további túlhűtést követően szívással eltávolítható(k). |
|
2. |
Nem elegendően alacsony a hűtési hőmérséklet. Ilyen esetben folyékony nitrogént használnak hűtőközegként. Amennyiben az 1. vagy a 2. esetről van szó, meg kell ismételni a méréseket. |
|
3. |
Az anyag kémiai reakción megy keresztül a vizsgált hőmérséklet-tartományban (például bomlás, polimerizáció). |
1.6.3. Izoteniszkóp
A módszer teljes leírása a 7. szakirodalomban található. A mérőkészülék működési elve a 3. ábrán látható. Az 1.6.2. pontban leírt statikus módszerhez hasonlóan az izoteniszkóp is megfelelő szilárd anyagok vagy folyadékok vizsgálatához.
Folyadékok esetében maga az anyag szolgál közegként a segédmanométerben. Az izoteniszkópba annyi folyadékot visznek be, amennyi elegendő a gömb és a manométer szakasz rövid ágának megtöltéséhez. Az izoteniszkópot vákuumrendszerhez csatlakoztatják és evakuálják, majd megtöltik nitrogénnel. A rendszer evakuálását és tisztítását kétszer ismétlik a maradék oxigén eltávolítására. A megtöltött izoteniszkópot vízszintes helyzetbe állítják úgy, hogy a minta vékony rétegben terjedjen szét a mintagömbben és a manométerszakaszban (U-rész). A rendszer nyomását 133 Pa-ra csökkentik, és óvatosan, lassan melegítik a mintát, amíg éppen forrni kezd (oldott, kötött gázok eltávolítása). Az izoteniszkópot ezután úgy helyezik el, hogy a minta visszatérjen a manométer rövid ágába és a gömbbe, úgy, hogy mind a kettő teljesen meg legyen töltve folyadékkal. A nyomást ugyanúgy tartják fenn, mint a gáztalanításkor; a mintagömb megnyújtott csúcsát kis lánggal melegítik, amíg a mintából felszabadult gőz elegendően ki nem tágul a minta egy részének kiszorítására a gömb és a manométer kar felső részéből az izoteniszkóp manométerszakaszába, gőzzel telt, nitrogénmentes teret létrehozva.
Az izoteniszkópot ezután állandó hőmérsékletű fürdőbe helyezik, és úgy állítják be a nitrogén nyomását, hogy az egyenlő legyen a minta nyomásával. A nyomásegyensúlyt az izoteniszkóp manométerszakasza jelzi. Egyensúlyi állapotban a nitrogén gőznyomása egyenlő az anyag gőznyomásával.
Szilárd anyagok esetében, a nyomás- és hőmérséklet-tartománytól függően, az 1.6.2.1. pontban felsorolt manométer-folyadékokat használják. A gáztalanított manométer-folyadékot az izoteniszkóp hosszú ágában lévő kiszélesedő részbe öntik. Ezután a gömbbe helyezik a vizsgálni kívánt szilárd anyagot, és magas hőmérsékleten gáztalanítják. Gáztalanítás után megdöntik az izoteniszkópot úgy, hogy a manométer-folyadék az U-csőbe folyhasson. A hőmérséklet függvényében a gőznyomás mérését az 1.6.2. pontnak megfelelően végzik el.
1.6.4. Effúziós módszer: Gőznyomásmérő mérleg
1.6.4.1. Készülék
Az (1) szakirodalomban megtalálható a készülék különböző típusainak leírása. Az itt leírt készülék az általános működési elvet mutatja be (4. ábra). A 4. ábra a készülék fő részeit mutatja, amelyek a következők: rozsdamentes acélból vagy üvegből készült vákuumtartály, a vákuum létrehozására és mérésére szolgáló berendezés, és a gőznyomás mérlegen történő mérésére szolgáló beépített komponensek. A készülék a következő beépített komponenseket tartalmazza:
|
— |
párologtató kemence peremmel és forgó bevezető csatlakozással. Az elpárologtató kemence például rézből vagy jó hővezető képességű, kémiailag ellenálló ötvözetből készült hengeres tartály. Rézfalú üvegedény is használható. A kemence átmérője körülbelül 3–5 cm, magassága 2–5 cm. A gőzáram számára 1–3 különböző méretű nyílást készítettek. A kemencét vagy egy alul elhelyezett fűtőlap, vagy a kívülre szerelt fűtőspirál segítségével fűtik. Annak megakadályozására, hogy a hő az alaplemezhez disszipálódjon, a fűtőkészüléket alacsony hővezető képességű fémmel (nikkel-ezüst vagy króm-nikkel acéllal) csatlakoztatják az alaplaphoz, ilyen például egy, a forgó bevezető csatlakozáshoz csatlakoztatott nikkel-ezüst cső többnyílású kemence esetében. Az elrendezésnek megvan az előnye, hogy lehetővé teszi egy rézrúd bevezetését. E megoldás lehetővé teszi a kívülről, hűtőfürdő segítségével történő hűtést, |
|
— |
amennyiben a réz kemencefedélnek három különböző átmérőjű nyílása van, és az átmérők egymással 90o-ot zárnak be, a teljes mérési tartományon belül különböző gőznyomás-tartományok mérhetők (körülbelül 0,30 és 4,50 mm átmérő közötti nyílások). A nagy nyílásokat alacsony gőznyomáshoz használják, és fordítva. A kemence forgatásával beállítható a kívánt nyílás vagy egy közbenső állás a gőzáramban (kemencenyílás – védőburok – mérlegserpenyő), és a molekulák áramlása szabaddá válik vagy eltérítésre kerül a kemencenyíláson keresztül a mérlegserpenyőhöz. Az anyag hőmérsékletének mérésére termoelemet vagy ellenállás-hőmérőt helyeznek el egy erre alkalmas helyen, |
|
— |
a védőburok fölött helyezkedik el egy precíziós mikromérleghez tartozó mérlegserpenyő (lásd lejjebb). A mérlegserpenyő körülbelül 30 mm átmérőjű. Ehhez aranybevonatú alumínium az alkalmas anyag, |
|
— |
a mérlegserpenyőt henger alakú sárgaréz vagy vörösréz hűtőtartály veszi körül. A hűtőtartály a mérleg típusától függően nyílásokat tartalmaz a mérlegrúd számára és egy védőburkolat-nyílást a molekulák áramlásához, továbbá biztosítja a gőz teljes kondenzációját a mérlegserpenyőn. A kifelé történő hődisszipációt például egy, a hűtőtartályhoz csatlakoztatott rézrúd biztosítja. A rudat az alaplemezen vezetik keresztül, és például egy króm-nikkel acélcsővel hőszigetelik. A rudat egy, az alaplemez alatt elhelyezett, folyékony nitrogént tartalmazó Dewar-edénybe merítik, vagy folyékony nitrogént keringtetnek a rúdon át. A hűtőtartályt így körülbelül –120 oC hőmérsékleten tartják. A mérlegserpenyőt kizárólag sugárzással hűtik, és ez megfelelő a vizsgálat alatt álló nyomástartományhoz (a mérés kezdete előtt körülbelül egy órával hűteni kell), |
|
— |
a mérleg a hűtőtartály fölött helyezkedik el. Alkalmas mérleg például egy nagy érzékenységű, kétkarú elektronikus mikromérleg (8), vagy nagy érzékenységű forgótekercses műszer (lásd az OECD 104. vizsgálati irányelvét 1981.5.12.), |
|
— |
az alaplemez elektromos csatlakozásokat is tartalmaz termoelemek (vagy ellenállás- hőmérők) és fűtőtekercsek csatlakoztatására, |
|
— |
a tartályban vákuumot hoznak létre egy részleges vákuumot biztosító szivattyú vagy nagyteljesítményű vákuumszivattyú segítségével (szükséges vákuum körülbelül 1–2 × 10–3 Pa, amelyet körülbelül 2 órás szivattyúzás után érnek el). A nyomást alkalmas ionizációs manométerrel szabályozzák. |
1.6.4.2. Mérési eljárás
A tartályt megtöltik a vizsgált anyaggal, és lezárják a fedelet. A védőburkolatot és a hűtőtartályt keresztülcsúsztatják a kemencén. A készüléket lezárják, és bekapcsolják a vákuumszivattyúkat. A mérések kezdete előtti névleges nyomásnak körülbelül 10–4 Pa-nak kell lennie. A hűtőtartály hűtése 10–2 Pa-nál kezdődik.
Amikor már elérték a szükséges vákuumot, elkezdik a kalibrációs műveletsorozatot a szükséges legalacsonyabb hőmérsékletnél. Beállítják a megfelelő nyílást a fedélen, a gőzáram keresztülhalad a védőburkolaton, közvetlenül a nyílás fölött, és a lehűtött mérlegserpenyőhöz ütközik. A mérlegserpenyőnek elegendően nagynak kell lennie annak biztosítására, hogy a védőburkolaton keresztülvezetett teljes gőzáram hozzáütközhessen. A gőzáram mozgásmennyisége erőként hat a mérlegserpenyőre, és a molekulák kondenzálódnak annak hideg felületén.
A mozgásmennyiség és az egyidejű kondenzáció jelet hoz létre a regisztráló készüléken. A jelek értékelése kétféle információt biztosít:
|
1. |
Az itt leírt készülékben a gőznyomást közvetlenül a mérlegserpenyőre ható mozgásmennyiségből határozzák meg [ehhez nem kell ismerni a molekulasúlyt (2)]. A geometriai tényezıket, ilyenek például a kemencenyílás és a molekula áramlási szöge, figyelembe kell venni a mért értékek értékelésénél. |
|
2. |
Ezzel egyidejőleg mérhetı a kondenzátum tömege, és ebbıl kiszámítható a párolgási sebesség. A gıznyomás a párolgási sebességbıl és a molekulatömegbıl is kiszámítható a Hertz-féle egyenlet (2) segítségével. |
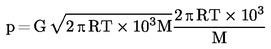
ahol:
|
G |
= |
párolgási sebesség (kg s–1m–2) |
|
M |
= |
molekulatömeg (g mol–1) |
|
T |
= |
hőmérséklet (K) |
|
R |
= |
általános moláris gázállandó (J mol–1K–1) |
|
p |
= |
gőznyomás (Pa) |
A szükséges vákuum elérése után elkezdődik a méréssorozat a legalacsonyabb kívánt mérési hőmérsékleten.
További mérések végrehajtásához a hőmérsékletet kis intervallumokban növelik a maximális kívánt hőmérséklet eléréséig. A mintát ezután újra lehűtik, és regisztrálható egy második gőznyomás görbe. Amennyiben a második mérési sorozat nincs összhangban az első sorozat eredményeivel, lehetséges, hogy az anyag lebomlott a mért hőmérséklet-tartományban.
1.6.5. Effúziós módszer – tömegveszteséggel
1.6.5.1. Készülék
Az effúziós készülék a következő alapalkatrészekből áll:
|
— |
szabályozható hőmérsékletű, légüres tartály, amelyben az effúziós cellákat elhelyezik, |
|
— |
nagy vákuumszivattyú (például diffúziós szivattyú vagy turbomolekuláris szivattyú) vákuum-manométerrel, |
|
— |
kondenzedény folyékony nitrogénnel vagy szárazjéggel. |
Az 5. ábrán példaként egy elektromosan fűtött, négy, rozsdamentes acél effúziós kamrával ellátott, alumínium vákuumtartály látható. A körülbelül 0,3 mm vastagságú rozsdamentes acél fóliának 0,2–1,0 mm átmérőjű effúziós nyílása van, és menetes fedéllel csatlakozik az effúziós cellához.
1.6.5.2. Mérési eljárás
Minden egyes effúziós cellába betöltik a referencia- és vizsgálati anyagokat, a menetes fedéllel rögzítik az átfolyó nyílással ellátott fémfóliát, majd megmérik minden egyes cella tömegét 0,1 mg-on belüli pontossággal. A kamrát elhelyezik a szabályozott hőmérsékletű készülékbe, amelyet ezután evakuálnak a várt nyomás egytizedénél kisebb nyomásig. 5-től 30 óráig terjedő meghatározott időközönként levegőt engednek be a készülékbe, és a tömege újbóli megmérésével meghatározzák az effúziós kamra tömegveszteségét.
Meghatározott időközönként újra megmérik a kamra tömegét, annak érdekében, hogy az eredményeket ne befolyásolják az illékony szennyeződések, legalább két ilyen időintervallumban ellenőrizve, hogy állandó-e a párolgási sebesség.
Az effúziós cellában a p gőznyomást a következő összefüggés adja meg:
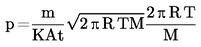
ahol:
|
p |
= |
gőznyomás (Pa) |
|
m |
= |
a cellát t idő alatt elhagyó anyag tömege (kg) |
|
t |
= |
idő (s) |
|
A |
= |
a furat területe (m2) |
|
K |
= |
korrekciós tényező |
|
R |
= |
= általános gázállandó (J mol–1K–1) |
|
T |
= |
hőmérséklet (K) |
|
M |
= |
molekulatömeg (kg mol–1) |
A K korrekciós tényező a hengeres átfolyó nyíláshosszúságától és a sugár arányától függ:
|
arány |
0,1 |
0,2 |
0,6 |
1,0 |
2,0 |
|
K |
0,952 |
0,909 |
0,771 |
0,672 |
0,514 |
A fenti egyenlet átírható:
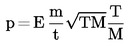
ahol  az effúziós cellaállandó.
az effúziós cellaállandó.
Ez az E effúziós cellaállandó referenciaanyagokkal (2,9) határozható meg a következő egyenlet segítségével:

ahol
|
p(r) |
= |
a referenciaanyag gőznyomása (Pa) |
|
M(r) |
= |
a referenciaanyag molekulatömege (kg x mol–1) |
1.6.6. Gázszaturációs módszer
1.6.6.1. Készülék
A vizsgálat végrehajtásához használt jellegzetes készülék a 6a. ábrán bemutatott és az alábbiakban leírt komponensből áll (1).
Inert gáz:
A vivőgáznak nem szabad kémiai reakcióba lépnie a vizsgált anyaggal. Erre a célra rendszerint megfelelő a nitrogén, de esetenként más gázokra lehet szükség (10). A használt gáznak száraznak kell lennie (lásd a 6a. ábrán a 4. tételt: a relatívpáratartalom-érzékelőt).
Áramlásszabályozás:
Alkalmas gázszabályozó rendszer szükséges egy telítőoszlopon keresztül az állandó és kiválasztott áramlásbiztosítására.
Kondenzedények gőz lecsapódásához:
Ezek az adott minta jellemzőitől és a kiválasztott analitikai módszertől függnek. A párát kvantitatív módon és olyan formában kell leválasztani, amely lehetővé teszi az ezt követő elemzést. Néhány vizsgálati anyag esetében folyadékokat, például hexánt vagy etilén-glikolt tartalmazó kondenzedények megfelelőek. Mások esetében szilárd abszorbensek lehetnek alkalmasak.
A gőzelválasztás és az ezt követő elemzés alternatívájaként „in-train” analitikai módszerek, például a kromatográfia használható ismert mennyiségű vivőgáz által szállított anyag mennyiségének kvantitatív meghatározására. Ezenkívül mérhető a minta tömegvesztesége is.
Hőcserélő:
A különböző hőmérsékleteken végrehajtott mérésekhez szükség lehet hőcserélő beépítésére a berendezésbe.
Szaturátoroszlop:
A vizsgálati anyag oldatát valamilyen alkalmas inert hordozóanyaghoz adagolják. Az átitatott hordozóanyagot a szaturátoroszlopba helyezik, amely méreteinek és átfolyási sebességének olyannak kell lennie, hogy biztosítva legyen a vivőgáz teljes szaturációja. A szaturátoroszlopnak szabályozott hőmérsékletűnek kell lennie. Szobahőmérséklet feletti mérésekhez a szaturátoroszlop és a kondenzedények közötti területet fűteni kell a vizsgált anyag kondenzációjának megakadályozására.
A diffúzióval létrejövő tömegtranszport csökkentésére kapilláris helyezhető el a szaturátoroszlop után (6b. ábra).
1.6.6.2. Mérési eljárás
A szaturátoroszlop előkészítése:
A vizsgált anyagnak erősen illékony oldószerben lévő oldatát megfelelő hordozóanyag-mennyiséghez adják hozzá. Elegendő vizsgált anyagot kell hozzáadni, hogy a vizsgálat során fennmaradjon a szaturáció. Az oldószert levegőben vagy forgó párologtatóban teljes mértékben elpárologtatják, és az alaposan megkevert anyagot hozzáadják a szaturátoroszlophoz. A minta hőmérsékletének szabályozása után száraz nitrogént vezetnek át a készüléken.
Mérés:
A kondenzedényeket vagy az „in-train” érzékelőt az oszlop kifolyó vezetékéhez csatlakoztatják, és feljegyzik ennek időpontját. A kísérlet kezdetén és a kísérlet során az áramlási sebességet gázbuborékos áramlásmérő segítségével (vagy folyamatosan egy tömegáramlás-mérővel) rendszeres időközönként ellenőrzik.
A szaturátoroszlop kilépő nyílásánál mérni kell a nyomást. Ez megtehető vagy:
|
a) |
a nyomásmérő beépítésével a szaturátoroszlop és a kondenzedények közé (ez elégtelen is lehet, mivel megnöveli a holtteret és az adszorpciós felületet); vagy |
|
b) |
egy külön kísérletben az adott, alkalmazott leválasztó rendszeren keresztül a nyomásesések meghatározásával az átfolyási sebesség függvényében, (ez elégtelen is lehet folyadékleválasztókhoz). |
A különböző analitikai módszerekhez szükséges vizsgált anyagmennyiség összegyűjtéséhez szükséges időt előzetes mérésekkel vagy becslésekkel határozzák meg. Az anyagnak további elemzéshez történő összegyűjtése alternatívájaként folyamatos („in-train”) kvantitatív analitikai módszer használható (például kromatográfia). Valamely adott hőmérséklet melletti gőznyomás kiszámítása előtt előzetes méréseket kell végrehajtani annak a maximális áramlási sebességnek a meghatározására, amely teljesen telíteni fogja a vivőgázt a vizsgált anyag gőzével. Ez biztosítva van, ha elegendően lassan vezetik keresztül a vivőgázt a szaturátoron úgy, hogy egy kisebb áramlási sebesség ne adjon nagyobb számított gőznyomást.
Az adott esetben alkalmazandó analitikai módszert (ilyen például a gázkromatográfia vagy a gravimetria) a vizsgált anyag természete határozza meg.
Az ismert térfogatú vivőgáz által szállított anyagmennyiség meghatározott.
1.6.6.3. A gőznyomás kiszámítása
A gőznyomást a W/V gőzsűrűségből számítják ki a következő egyenlettel:
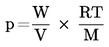
ahol:
|
p |
= |
gőznyomás (Pa) |
|
W |
= |
az elpárolgott vizsgált anyag tömege (g) |
|
V |
= |
szaturált gáz térfogata (m3) |
|
R |
= |
általános moláris gázállandó (J mol–1 K–1) |
|
T |
= |
hőmérséklet (K) |
|
M |
= |
vizsgált anyag molekulatömege (g mol–1) |
A mért térfogatokat helyesbíteni kell az áramlásmérő és a szabályozott hőmérsékletű szaturátor közötti nyomás- és hőmérséklet-különbségek figyelembevételével. Amennyiben az áramlásmérő a kondenzedény utáni szakaszban van, helyesbítések szükségesek a kondenzedényben lévő minden elpárolgott alkotóanyag figyelembevételével (1).
1.6.7. Forgó rotor (8, 11, 13)
1.6.7.1. Készülék
A forgó rotoros módszer a 8. ábrán bemutatott forgó rotoros viszkozitásmérő segítségével hajtható végre. A 7. ábrán látható a kísérleti berendezés vázlatos rajza.
A mérőkészülék általában egy szabályozott hőmérsékletű (0,1 oC-on belül szabályozott) tartályba helyezett forgó rotoros mérőfejből áll. A mintatartályt egy szabályozott hőmérsékletű (0,01 oC-on belül szabályozott) tartályba helyezik, és a berendezés minden további részét magasabb hőmérsékleten tartják a kondenzáció megakadályozására. A rendszerhez vákuumcsövek segítségével nagy vákuumszivattyút csatlakoztatnak.
A forgó rotoros mérőfej egy csőben elhelyezett (4–5 mm átmérőjű) acélgolyóból áll. A golyót mágneses térben függesztik fel és stabilizálják, általában állandó mágnesek és vezérlőtekercsek segítségével.
A golyót a tekercsek által létrehozott forgómágneses térrel pörgetik. A golyónak a mindig jelen lévő alacsony oldalirányú mágnesessége mérésére szolgáló felvevőtekercsek lehetővé teszik a golyó pörgési sebességének a mérését.
1.6.7.2. Mérési eljárás
Amikor a golyó már elért egy adott v(o) fordulatszámot (rendszerint körülbelül 400 fordulat/másodperc), a további energiaátadás megáll, és a gázok okozta súrlódás miatt lassulás jön létre.
A fordulatszám-csökkenést az idő függvényében mérik. Mivel a mágneses felfüggesztés okozta súrlódás elhanyagolható a gázok okozta súrlódással összehasonlítva, a p gáznyomást a következő egyenlet adja meg:
![]()
ahol:
|
|
= |
a gázmolekulák átlagos sebessége |
|
r |
= |
a golyó sugara |
|
p |
= |
a golyó tömegsürüsége |
|
o |
= |
a tangenciális impulzus átvitel együtthatója (E = 1, ha a golyó ideális gömbfelületű) |
|
t |
= |
idő |
|
v(t) |
= |
fordulatszám t idő után |
|
v(o) |
= |
kezdeti fordulatszám |
Ez az egyenlet a következőképpen is írható:
ahol tn, tn–1 adott N számú fordulathoz szükséges idő. Ezek a tn és tn–1 időintervallumok egymás után következnek, és tn > tn–1.
A gázmolekula átlagos 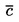 sebességét az alábbi egyenlet adja meg:
sebességét az alábbi egyenlet adja meg:

ahol:
|
T |
= |
hőmérséklet |
|
R |
= |
általános moláris gázállandó |
|
M |
= |
molekulatömeg. |
2. ADATOK
Az előző módszerek bármelyikéből kapott gőznyomást legalább két hőmérsékleten kell meghatározni. 0 és 50 oC közötti tartományban kedvezőbb, ha három vagy több mérést végeznek a gőznyomás görbe linearitásának ellenőrzésére.
3. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az alkalmazott módszert, |
|
— |
az anyag pontos leírását (azonosság és szennyeződések), és amennyiben vannak ilyenek, az előzetes tisztítási fok pontos ismertetését, |
|
— |
legalább két gőznyomás- és hőmérsékletértéket, lehetőleg 0 és 50 oC közötti tartományban, |
|
— |
valamennyi alapadatot, |
|
— |
l/T függvényében ábrázolt log p görbét, |
|
— |
a gőznyomás becsült értékét 20 vagy 25 oC-on. |
Amennyiben változás (állapotváltozás, bomlás) figyelhető meg, fel kell jegyezni a következő információkat:
|
— |
a változás jellege, |
|
— |
az a hőmérséklet, amelynél a változás légköri nyomáson bekövetkezik, |
|
— |
gőznyomás az átmeneti hőmérséklet alatt 10 és 20 oC-kal és e felett 10 és 20 oC-kal (kivéve, ha szilárdból gázra történt a halmazállapot-változás). |
A jelentésben szerepelnie kell az eredmények értelmezéséhez lényeges valamennyi információnak és megjegyzésnek, különösen azoknak, amelyek az anyag szennyeződéseivel és fizikai állapotával kapcsolatosak.
4. SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 104. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges. |
|
(2) |
Ambrose, D. in B. Le Neindre, B. Vodar, (Eds.): Experimental Thermodynamics, Butterworths, London, 1975, vol. II. |
|
(3) |
R. Weissberger ed.: Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Chapter IX, Interscience Publ., New York, 1959, vol. I, part I. |
|
(4) |
Knudsen, M. Ann. Phys. Lpz., 1909, vol. 29, 1979; 1911, vol. 34, 593. |
|
(5) |
NF T 20-048 AFNOR (Sept. 85). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within range from 10–1 to 10 Pa – Static method. |
|
(6) |
NF T 20-047 AFNOR (Sept. 85). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within range from 10–3 to 1 Pa – Vapour pressure balance method. |
|
(7) |
ASTM D 2879-86, Standard test method for vapour pressure – temperature relationship and initial decomposition temperature of liquids by isoteniscope. |
|
(8) |
G. Messer, P. Röhl, G. Grosse and W. Jitschin. J. Vas. Sci. Technol.(A), 1987, Vol. 5(4), 2440. |
|
(9) |
Ambrose, D.; Lawrenson, I.J.; Sprake, C.H.S. J. Chem. Thermodynamics 1975, vol. 7, 1173. |
|
(10) |
B.F. Rordorf. Thermochimica Acta, 1985, vol. 85, 435. |
|
(11) |
G. Comsa, J.K. Fremerey and B. Lindenau. J. Vac. Sci. Technol., 1980, vol. 17 (2), 642. |
|
(12) |
G. Reich. J. Vac. Sci. Technol. 1982, vol. 20 (4), 1148. |
|
(13) |
J.K. Fremerey. J. Vac. Sci. Technol.(A), 1985, vol. 3 (3), 1715. |
1. Függelék
Becslési módszer
BEVEZETÉS
A gőznyomás számított értékei a következőkhöz használhatók:
|
— |
annak eldöntésére, hogy melyik a megfelelő kísérleti módszer, |
|
— |
becslés vagy határérték biztosítására olyan esetben, ahol a kísérleti módszer nem alkalmazható technikai okok miatt (azt az esetet is beleértve, ahol nagyon alacsony a gőznyomás), |
|
— |
az olyan esetek meghatározására, ahol indokolt a kísérleti mérés elhagyása, mert környezeti hőmérsékleten a gőznyomás valószínűleg < 10–5 Pa. |
BECSLÉSI MÓDSZER
Folyadékok és szilárd anyagok gőznyomása a módosított Watson-korreláció (a) segítségével becsülhető meg. Az egyetlen kísérleti adat, amelyre szükség van, a normál forráspont. A módszer 105 Pa-tól 105 Pa-ig terjedő tartományban alkalmazható.
A módszerre vonatkozó részletes információkat a „Handbook of Chemical Property Estimation Methods” (b) című kiadvány ismerteti.
SZÁMÍTÁSI ELJÁRÁS
A (b)-nek megfelelően a következőképpen számítják a gőznyomást:
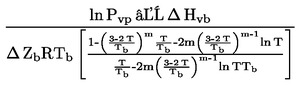
ahol:
|
T |
= az adott hőmérséklet |
|
Tb |
= normál forráspont |
|
Pvp |
= gőznyomás T hőmérsékleten |
|
ΔHvb |
= párolgáshő |
|
ΔZb |
= kompresszibilitási tényező (becslés szerint 0,97) |
|
m |
= az adott hőmérsékleten a fizikai állapottól függő empirikus tényező |
Ezenkívül

ahol KF az anyag polaritását figyelembe vevő empirikus tényező. A (b) szakirodalom néhány vegyülettípushoz felsorolja a hozzá tartozó KF tényezőt.
Nagyon gyakran előfordulhat, hogy valamilyen csökkentett nyomáshoz tartozó forráspont van megadva. Ilyen esetben, a (b) szakirodalomnak megfelelően, a gőznyomás a következőképpen számítható ki:

ahol T1 a forráspont a P1 csökkentett nyomáson.
JELENTÉS
A becslési módszer használatakor a jelentésnek tartalmaznia kell a számítás részletes dokumentálását.
SZAKIRODALOM
|
(a) |
K.M. Watson, Ind. Eng. Chem; 1943, vol. 35, 398. |
|
(b) |
W.J. Lyman, W.F. Reehl, D.H.Rosenblatt. Handbook of Chemical Property Estimation Methods, McGraw-Hill, 1982. |
2. Függelék
1. ábra
Készülék a gőznyomásgörbe meghatározására a dinamikus módszer szerint

2a. ábra
Készülék gőz nyomásgörbe meghatározására a statikus módszer szerint (U-csöves manométer segítségével)

2b. ábra
Készülék gőznyomásgörbe meghatározására statikus módszer szerint (nyomásjelző műszer segítségével)
3. ábra
Izoteniszkóp (lásd a 7. felhasznált irodalmat)

4. ábra
Készülék a gőznyomásgörbe meghatározására a gőznyomásmérő mérleg módszere szerint
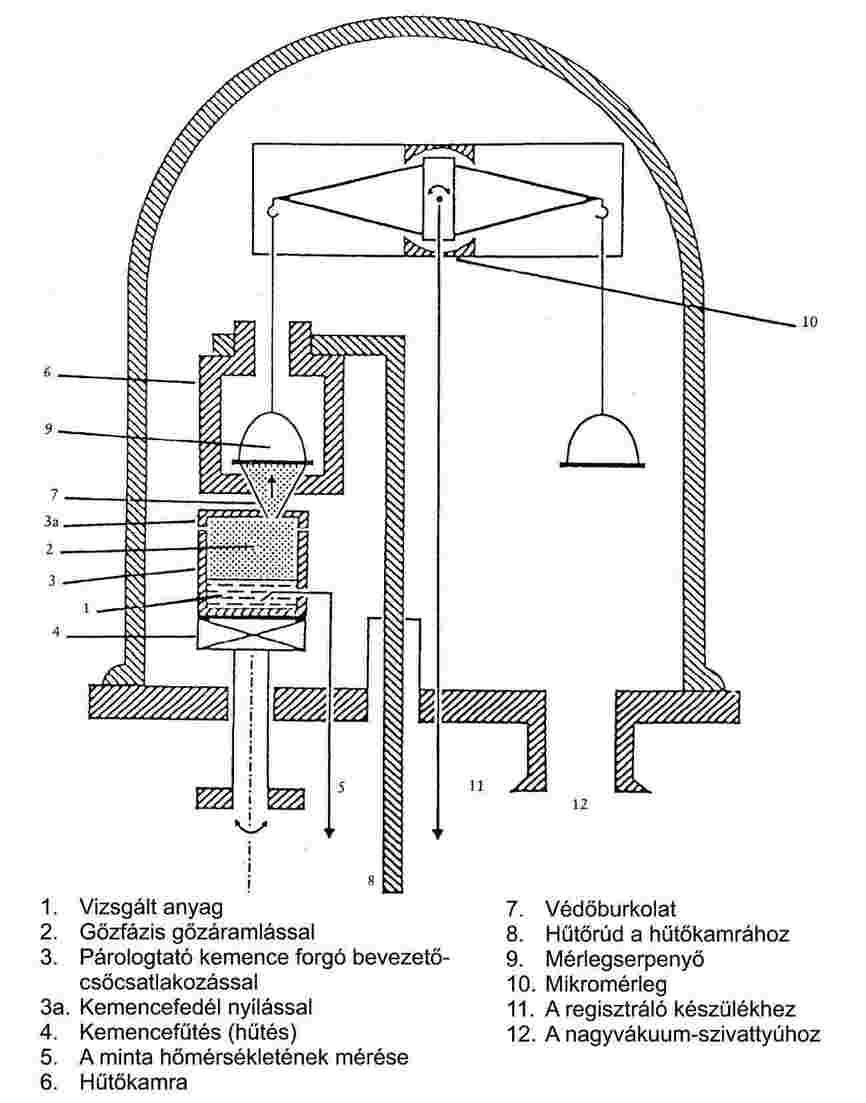
5. ábra
Példa alacsony nyomáson, effúziós módszerrel végrehajtott, párologtatásra szolgáló készülékre, 8 cm3-es effúziós cellatérfogattal

6a. ábra
Példa a gázszaturációs módszerrel a gőznyomás meghatározására szolgáló áramlási rendszerre
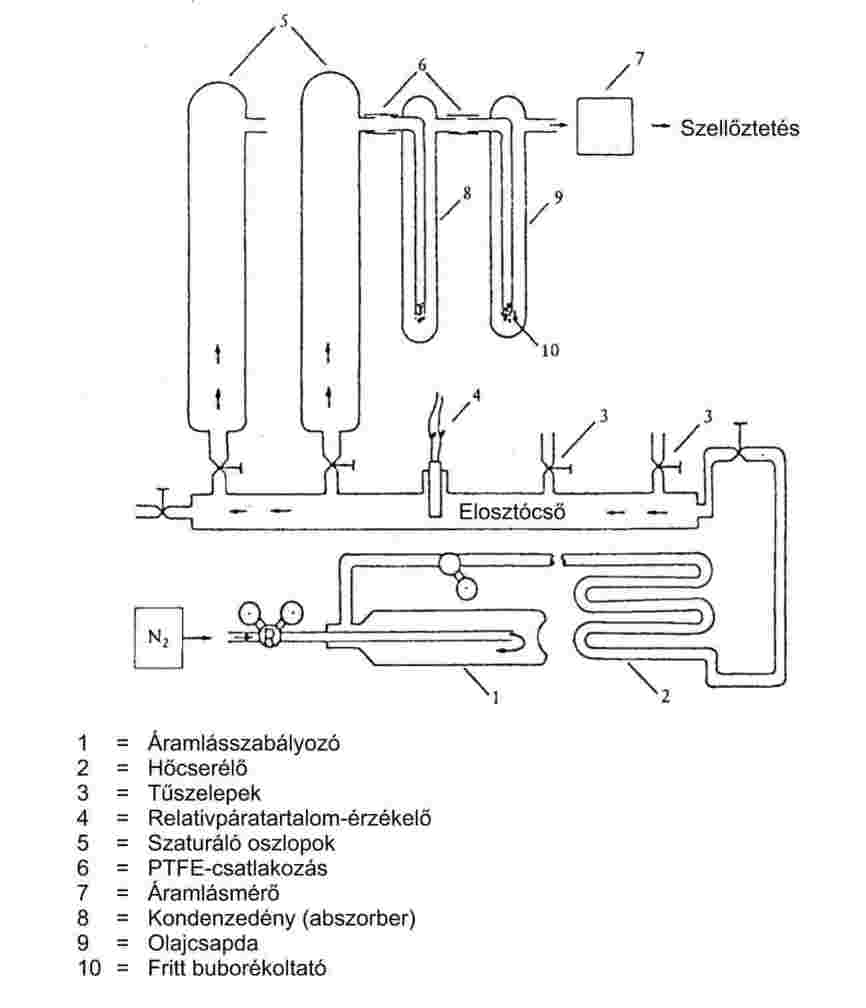
6b. ábra
Példa a gázszaturációs módszerrel a gőznyomás meghatározására szolgáló rendszerre, amelynél egy kapillárist helyeztek el a szaturációs kamra után

7. ábra
Példa a forgó rotoros módszerhez használt kísérleti berendezésre

8. ábra
Példa forgó rotor érzékelőfejre

A.5. FELÜLETI FESZÜLTSÉG
1. MÓDSZER
Az itt leírt módszerek az OECD vizsgálati irányelvén alapulnak. Az alapelveket a (2) szakirodalom ismerteti.
1.1. BEVEZETÉS
A leírt módszerek vizes oldatok felületi feszültségének méréséhez alkalmazhatók.
E vizsgálat végrehajtásához hasznos előzetes információkat szerezni az anyag vízben való oldhatóságáról, szerkezetéről, hidralizáló tulajdonságairól és a micellák képződése szempontjából kritikus koncentrációjáról.
A következő módszerek a legtöbb vegyi anyaghoz alkalmazhatók, tisztasági fokuktól függetlenül mindenfajta korlátozás nélkül.
A gyűrűs felületifeszültség-mérő módszerrel végrehajtott felületifeszültség-mérés körülbelül 200 mPa s-nél kisebb, dinamikus viszkozitású vizes oldatokra korlátozódik.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Az egységnyi területre vonatkoztatott szabad felületi entalpiát felületi feszültségnek nevezzük.
A felületi feszültséget a következőképpen adják meg:
N/m (SI-mértékegység); vagy
mN/m (SI-almértékegység);
1 N/m = 103 dyn/cm
1 mN/m = 1 dyn/cm az elavult CGS-rendszerben.
1.3. REFERENCIAANYAGOK
Nem kell minden új anyag vizsgálatakor referenciaanyagot használni. Ezeknek elsősorban arra kell szolgálniuk, hogy időnként ellenőrizzék a módszer megfelelőségét, és lehetővé tegyék az összehasonlítást más módszerekkel nyert eredményekkel.
Az 1. és 3. szakirodalom a felületi feszültségek széles tartományát felölelő referenciaanyagokat ismertet.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A módszerek annak a maximális erőnek a mérésén alapulnak, amelyet függőlegesen kell kifejteni egy mérőcsészébe elhelyezett vizsgálandó folyadék felületével érintkező mérőkengyelre vagy gyűrűre, annak e felülettől történő elválasztása érdekében, vagy egy lemezre, amelynek egyik széle érintkezik a felülettel, a kialakult film kiemelése érdekében.
Azokat az anyagokat, amelyek legalább 1 mg/l koncentrációban oldhatók vízben, vizes oldatban vizsgálják egyetlen koncentráció mellett.
1.5. MINŐSÉGI KÖVETELMÉNYEK
E módszerek nagyobb pontosságra képesek, mint amelyre a környezeti értékeléshez valószínűleg szükség van.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Elkészítik az anyag oldatát desztillált vízben. Az oldat koncentrációjának az anyag telített vizes oldatához tartozó koncentrációérték 90 %-ának kell lennie; ha ez a koncentráció meghaladja az 1 g/l értéket, 1 g/l koncentrációt használnak a vizsgálathoz. Nem kell megvizsgálni azokat az anyagokat, amelyek oldhatósága a vízben 1 mg/l-nél kisebb.
1.6.1. Lemezes módszer
Lásd az ISO 304 és NF T 73-060 szabványokat (Surface active agents – determination of surface tension by drawing up liquid films).
1.6.2. Kengyeles módszer
Lásd az ISO 304 és NF T 73-060 szabványokat (Surface active agents – determination of surface tension by drawing up liquid films).
1.6.3. Gyűrűs módszer
Lásd az ISO 304 és NF T 73-060 szabványokat (Surface active agents – determination of surface tension by drawing up liquid films).
1.6.4. Az OECD által harmonizált gyűrűs módszer
1.6.4.1. Készülék
E méréshez megfelelőek a kereskedelemben kapható felületifeszültség-mérők. Ezek a következő részekből állnak:
|
— |
mobil mintaasztal, |
|
— |
erőmérő rendszer, |
|
— |
mérőtest (gyűrű), |
|
— |
mérőtartály. |
1.6.4.1.1.
A mobil mintaasztalt a vizsgálandó folyadékot tartalmazó, szabályozott hőmérsékletű mérőtartály tartójaként használják. Az erőmérő rendszerrel együtt egy talpazatra kell felszerelni.
1.6.4.1.2.
Az erőmérő rendszer (lásd az ábrát) a mintaasztal fölött helyezkedik el. Az erőmérés hibájának nem szabad ± 10–6 N-nál nagyobbnak lennie, a tömegmérés ±0,1 mg hibahatárának megfelelően. A kereskedelemben kapható felületifeszültség-mérő mérőskálája legtöbbször mN/m-ben lett kalibrálva azért, hogy a felületi feszültség közvetlenül mN/m-ben legyen leolvasható, 0,1 mN/m pontossággal.
1.6.4.1.3.
A gyűrű rendszerint körülbelül 0,4 mm vastagságú és 60 mm átlagos átmérőjű, platinairídium huzalból készül. A huzalgyűrűt vízszintesen függesztik le egy fémtűről és egy huzalszerelő kengyelről az erőmérő rendszerhez történő csatlakozás létrehozása érdekében (lásd az ábrát).
Ábra
Mérőtest
(Minden méret mm-ben van megadva)

1.6.4.1.4.
A vizsgált oldatot tartalmazó mérőtartálynak szabályozott hőmérsékletű üvegtartálynak kell lennie. Úgy kell tervezni, hogy a mérés során a vizsgálandó oldat folyadékfázisának és a felszín feletti gázfázisnak a hőmérséklete állandó maradjon, és a minta ne párologhasson el. 45 mm-nél nem kisebb belső átmérőjű hengeres üvegtartályok elfogadhatók.
1.6.4.2. A készülék előkészítése
1.6.4.2.1.
Az üvegtartályokat gondosan meg kell tisztítani. Amennyiben szükséges, azokat forró króm-kénsavval és ezt követően tömény (83–98 tömegszázalékos H3PO4) foszforsavval kell mosni, alaposan le kell öblíteni csapvízben, és végül kétszer desztillált vízben kell mosni mindaddig, amíg semleges nem lesz, majd meg kell szárítani, és ki kell öblíteni a vizsgált folyadék egy részével.
A gyűrűt először minden vízben oldható anyag eltávolítása érdekében alaposan le kell öblíteni vízben, rövid időre be kell meríteni króm-kénsavba, le kell mosni kétszer desztillált vízzel, amíg semleges nem lesz, és végül rövid ideig melegíteni kell metanol láng fölött.
Megjegyzés:
Az olyan anyagokkal történő szennyezést, amelyek a króm-kénsavban vagy a foszforsavban nem oldódnak fel vagy nem bomlanak el – ilyenek például a szilikonok – alkalmas szerves oldószer segítségével kell eltávolítani.
1.6.4.2.2.
A készülék hitelesítése a nullapont ellenőrzéséből és ennek beállításából áll úgy, hogy a műszer jelzése mindig megbízható legyen mN/m-ben.
Összeszerelés:
A készüléket vízszintbe kell állítani, például a felületifeszültség-mérő alaptestére elhelyezett vízszintező segítségével, az alaplapon elhelyezett vízszintező csavarok állításával.
A nullapont beállítása:
A gyűrűnek a készülékre történő felszerelése után és a folyadékba bemerítés előtt a felületifeszültség-mérő által jelzett értéket nullára kell állítani, és ellenőrizni kell, hogy a gyűrű párhuzamos-e a folyadékfelülettel. Ehhez a folyadékfelszín tükörként használható.
Kalibráció:
A tényleges vizsgálati kalibrálás a következő két eljárás valamelyikének a segítségével hajtható végre:
|
a) |
Egy tömeg segítségével: ehhez az eljáráshoz 0,1 és 1,0 gramm közötti, ismert tömegű súlyokat helyeznek a gyűrűre. Ezt a Φa kalibrálási tényezőt, amellyel minden, a műszer által megadott értéket meg kell szorozni, a következő egyenletnek (1) megfelelően kell meghatározni:
ahol:
|
|
b) |
Víz segítségével: az eljárásnál tiszta vizet használnak, amelynek a felületi feszültsége, például 23 oC hőmérsékleten 72,3 mN/m. Az eljárás gyorsabb a súllyal történő kalibrációnál, de mindig fennáll az a veszély, hogy a víz felületi feszültségét meghamisítják a felületaktív anyagokkal történő szennyeződési nyomok. A Φb kalibrálási tényezőt, amellyel a műszer által mutatott minden értéket meg kell szorozni, a következő egyenletnek (2) megfelelően kell meghatározni:
ahol:
|
1.6.4.3. Minták előkészítése
A vizsgált anyagokból vizes oldatot kell készíteni a szükséges koncentrációk használatával, és ezeknek nem szabad tartalmazniuk nem oldott anyagot.
Az oldatot állandó hőmérsékleten (±0,5 oC) kell tartani. Mivel a mérőtartályban lévő oldat felületi feszültsége változik idővel, több mérést kell végrehajtani különböző időpontokban, és fel kell rajzolni egy görbét, amely a felületi feszültséget mutatja az idő függvényében. Amennyiben további változás nem jön létre, beáll az egyensúlyi állapot.
A mérést zavarják más anyagok por és gáznemű szennyeződései. Ezért a munkát védőburkolat alatt kell végrehajtani.
1.6.5. Vizsgálati körülmények
A mérést körülbelül 20 oC hőmérsékleten kell végrehajtani, és a hőmérsékletet ±0,5 oC-on belül kell szabályozni.
1.6.6. A vizsgálat végrehajtása
A mérendő oldatokat be kell vinni a gondosan megtisztított mérőtartályba, ügyelve a habosodás elkerülésére, és ezután a mérőtartályt rá kell helyezni a vizsgálókészülék asztalára. Az asztallapot a mérőtartállyal együtt meg kell emelni, amíg a gyűrű bele nem merül az oldatba. Ezután az asztallapot fokozatosan és egyenletesen süllyeszteni kell (körülbelül 0,5 cm/perc sebességgel) a gyűrűnek a felülettől történő elválasztása érdekében, egészen a maximális erő eléréséig. A gyűrűhöz tapadt folyadékrétegnek nem szabad leválnia a gyűrűről. A mérések elvégzése után a gyűrűt újra az oldatba kell meríteni, és a mérést meg kell ismételni, amíg a kapott felületi feszültség értéke állandó nem lesz. Az oldatnak a mérőtartályba helyezéséig eltelt időt fel kell jegyezni minden egyes meghatározáshoz. Az értékek leolvasását annál a maximális erőnél kell végrehajtani, amely ahhoz szükséges, hogy elválassza a gyűrűt a folyadékfelülettől.
2. ADATOK
A felületi feszültség kiszámításához a készüléken mN/m-ben leolvasott értéket először meg kell szorozni (az alkalmazott kalibrálási eljárástól függően) Φa vagy Φb kalibrálási tényezővel. Az így kapott érték csak közelítőleg érvényes, és ezért helyesbíteni kell.
Harkins és Jordan (4) kísérletileg helyesbítési tényezőket határoztak meg a gyűrű méreteitől, a folyadék sűrűségétől és ennek felületi feszültségétől függő gyűrűs módszer által mért felületifeszültség-értékekhez.
Mivel munkaigényes feladat a Harkins- és Jordan-táblázatokból minden egyes méréshez a helyesbítési tényező meghatározása, vizes oldatok felületi feszültségének kiszámításához használható az egyszerűsített eljárás, nevezetesen a helyesbített felületifeszültség-értékek közvetlen kiolvasása a táblázatból (interpolálni kell a táblázatban közölt értékek közé eső értékekhez).
Táblázat:
A mért felületi feszültség helyesbítése
Csak vizes oldatokhoz, ρ = 1 g/cm3
|
r |
= 9,55 mm (gyűrű átlagos sugara) |
|
r |
= 0,185 mm (gyűrű huzalának sugara) |
|
Kisérleti érték (mN/m) |
Helyesbített érték (mN/m) |
|
|
Kalibráció vízre (lásd az 1.6.4.2.2. pont a) alpontja alatt) |
Kalibráció vízre (lásd az 1.6.4.2.2. pont b) alpontja alatt) |
|
|
20 |
16,9 |
18,1 |
|
22 |
18,7 |
20,1 |
|
24 |
20,6 |
22,1 |
|
26 |
22,4 |
24,1 |
|
28 |
24,3 |
26,1 |
|
30 |
26,2 |
28,1 |
|
32 |
28,1 |
30,1 |
|
34 |
29,9 |
32,1 |
|
36 |
31,8 |
34,1 |
|
38 |
33,7 |
36,1 |
|
40 |
35,6 |
38,2 |
|
42 |
37,6 |
40,3 |
|
44 |
39,5 |
42,3 |
|
46 |
41,4 |
44,4 |
|
48 |
43,4 |
46,5 |
|
50 |
45,3 |
48,6 |
|
52 |
47,3 |
50,7 |
|
54 |
49,3 |
52,8 |
|
56 |
51,2 |
54,9 |
|
58 |
53,2 |
57,0 |
|
60 |
55,2 |
59,1 |
|
62 |
57,2 |
61,3 |
|
64 |
59,2 |
63,4 |
|
66 |
61,2 |
65,5 |
|
68 |
63,2 |
67,7 |
|
70 |
65,2 |
69,9 |
|
72 |
67,2 |
72,0 |
|
74 |
69,2 |
— |
|
76 |
71,2 |
— |
|
78 |
73,2 |
— |
Ezt a táblázatot a Harkins–Jordan-helyesbítés alapján állították össze. Hasonlít a DIN-szabványban (DIN 53914) lévő, vízre és vizes oldatokra (sűrűség, ρ = 1 g/cm3) vonatkozó táblázathoz, és az R = 9,55 mm (gyűrű átlagos sugara) és r = 0,185 mm (gyűrű huzalának sugara) méretekkel rendelkező, kereskedelmi forgalomban kapható gyűrűre érvényes. A táblázat tömeggel vagy vízzel végrehajtott kalibrálás után mért felületi feszültség értékek helyesbített értékeit adja meg.
Más lehetőségként, az előző kalibrálás nélkül, a felületi feszültség a következő képletnek megfelelően számítható ki:

ahol:
|
F |
= |
a film elszakadásakor a dinamométeren mért erő |
|
R |
= |
a gyűrű sugara |
|
f |
= |
a helyesbítési tényező (1) |
3. VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az alkalmazott módszert, |
|
— |
a vizsgálathoz használt víz vagy oldat típusát, |
|
— |
az anyag pontos leírását (azonosítás és szennyeződések), |
|
— |
a mérési eredményeket: felületi feszültség (leolvasott érték), megadva mind az egyes leolvasott értékeket, mind az adott számbeli középértéket, valamint a helyesbített középértéket (a berendezés tényezőjének és a helyesbítési táblázat figyelembevételével), |
|
— |
az oldat koncentrációját, |
|
— |
a vizsgálati hőmérsékletet, |
|
— |
a felhasznált oldat életkorát; különösen az oldat elkészítése és mérése közötti időt, |
|
— |
az oldatnak a mérőtartályba helyezése után a felületi feszültség időfüggésének leírását, |
|
— |
az eredmények értelmezéséhez szükséges minden információt és megjegyzést közölni kell, különösen azokat, amelyek az anyag szennyeződéseivel és fizikai állapotával kapcsolatosak. |
3.2. AZ EREDMÉNYEK ÉRTELMEZÉSE
Figyelembe véve, hogy a desztillált víz felületi feszültsége 72,75 mN/m 20 oC hőmérsékleten, azokat az anyagokat, amelyek 60 mN/m-nél kisebb felületi feszültséget mutatnak e módszer feltételei mellett, felületaktív anyagoknak kell tekinteni.
4. SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 115. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges. |
|
(2) |
R. Weissberger ed.: Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, vol. I, part I, chapter XIV. |
|
(3) |
Pure Appl. Chem., 1976, vol. 48, 511. |
|
(4) |
Harkins, W.D., Jordan, H.F., J. Amer. Chem. Soc, 1930, vol. 52, 1751. |
A.6. OLDHATÓSÁG VÍZBEN
1. MÓDSZER
A leírt módszerek az OECD vizsgálati irányelven (1) alapulnak.
1.1. BEVEZETÉS
E vizsgálat végrehajtásához hasznos előzetes információkat szerezni az anyag szerkezeti képletéről, gőznyomásáról, disszociációs állandójáról és hidrolíziséről (a pH függvényében).
Nincs olyan módszer, amely a vízoldékonyság teljes tartományát lefedné.
A következő leírásban ismertetett két vizsgálati módszer lefedi az oldhatóság teljes tartományát, de nem alkalmazható illékony anyagokhoz:
|
— |
az egyiket, amely kis oldhatóságú (< 10–2 gramm/liter) és vízben stabil, lényegében tiszta anyagokra alkalmazható, „oszlopelúciós módszernek” nevezik, |
|
— |
a másikat, amely nagyobb oldhatóságú (>10–2 gramm/liter) és vízben stabil, lényegében tiszta anyagokra alkalmazható, „lombikmódszernek” nevezik. |
A vizsgált anyag vízoldékonyságára jelentős hatással lehet a szennyeződések jelenléte.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Valamely anyag vízoldékonyságát az adott hőmérsékleten, az anyag vízben történő telítettségi tömegkoncentrációjával adják meg. A vízoldékonyságot tömeg/oldattérfogat egységekben fejezik ki. Az SI-mértékegység a kg/m3 (gramm/liter is használható).
1.3. REFERENCIAANYAGOK
Nem kell minden új anyag vizsgálatakor referenciaanyagot használni. Ezeknek elsősorban arra kell szolgálniuk, hogy időnként ellenőrizzék a módszer megfelelőségét, és lehetővé tegyék az összehasonlítást más módszerekkel nyert eredményekkel.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A minta mennyiségét közelítőleg, továbbá a telítési tömegkoncentráció eléréshez szükséges időt egyszerű elővizsgálattal kell meghatározni.
1.4.1. Oszlopelúciós módszer
Ez a módszer valamely vizsgált anyagnak vízzel, mikrooszlopból végrehajtott elúcióján alapul; az oszlop a vizsgált anyag feleslegével bevont inert hordozóanyaggal – mint például üveggyöngy vagy homok – van megtöltve. A vízoldékonyságot akkor határozzák meg, amikor az eluátum tömegkoncentrációja konstans. Ezt egy koncentrációplató mutatja az idő függvényében.
1.4.2. Lombikmódszer
E módszernél az anyagot (a szilárd anyagokat porítani kell) feloldják a vizsgálati hőmérsékletnél magasabb hőmérsékletű vízben. A telítés elérésekor lehűtik a keveréket, és a vizsgálati hőmérsékleten tartják, addig keverve, amíg az egyensúly be nem áll. Más megoldásként a mérés végrehajtható közvetlenül a vizsgálati hőmérsékleten, ha megfelelő mintavételezéssel meggyőződtek a telítettségi egyensúly eléréséről. Ezt követően alkalmas analitikai módszerrel meghatározzák az anyag tömegkoncentrációját olyan vizes oldatban, amely nem tartalmaz fel nem oldott részecskét.
1.5. MINŐSÉGI KÖVETELMÉNYEK
1.5.1. Ismételhetőség
Oszlopelúciós módszer esetében < 30 % érhető el; lombikmódszer esetén, < 15 %-nak kell megfigyelhetőnek lennie.
1.5.2. Érzékenység
Ez az elemzés módszerétől függ, de egészen 10–6 gramm/liter tömegkoncentráció meghatározások is végrehajthatók.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Vizsgálati körülmények
A vizsgálatot lehetőleg 20 ±0,5 oC hőmérsékleten kell végrehajtani. Amennyiben feltételezhető, hogy az oldhatóság függ a hőmérséklettől (> 3 %/ oC), két további hőmérsékletet, legalább 10 oC-kal az először kiválasztott hőmérséklet fölött és alatt, is használni kell. Ebben az esetben a hőmérséklet-szabályozásnak ±0,1 oC pontosságúnak kell lennie. A kiválasztott hőmérsékletet állandó értéken kell tartani a berendezés minden lényeges részében.
1.6.2. Előzetes vizsgálat
Egy csiszolt üvegdugójú, 10 ml-es mérőhengerben lévő, körülbelül 0,1 gramm mintához (szilárd anyagokat porítani kell) szobahőmérsékletű, egyre nagyobb térfogatú desztillált vizet adnak hozzá, az alábbi táblázatban látható lépéseknek megfelelően:
|
0,1 g oldható „x” ml vízben |
0,1 |
0,5 |
1 |
2 |
10 |
100 |
> 100 |
|
Oldhatóság közelítőleg (gramm/liter) |
> 1 000 |
1 000-től 200-ig |
200-tól 100-ig |
100-tól 50-ig |
50-től 10-ig |
10-től l-ig |
< 1 |
A jelzett vízmennyiség minden egyes hozzáadása után a keveréket erőteljesen rázzák 10 percig, és szemrevételezéssel ellenőrzik, hogy vannak-e a mintának fel nem oldott részei. Amennyiben 10 ml víz hozzáadása után a minta vagy annak részei nem oldódtak fel, a kísérletet nagyobb vízmennyiséggel meg kell ismételni egy 100 ml-es mérőhengerben. Alacsonyabb oldhatóságok esetében lényegesen hosszabb lehet az anyag feloldásához szükséges idő (legalább 24 órát kell engedélyezni). A közelítő oldhatóságot a táblázat mutatja az alatt a hozzáadott vízmennyiség alatt, amelyben létrejön a minta teljes feloldása. Amennyiben az anyag még mindig látszólag oldhatatlan, több mint 24 órát kell engedélyezni (maximum 96 órát), vagy további hígítást kell végrehajtani, hogy meggyőződjenek arról, hogy az oszlopelúciós vagy a lombikos oldhatósági módszert kell-e alkalmazni.
1.6.3. Oszlopelúciós módszer
1.6.3.1. Hordozóanyag, oldószer és eluáló anyag
Az oszlopelúciós módszerhez használt hordozóanyagnak inertnek kell lennie. Az alkalmazható lehetséges anyagok az üveggyöngy és a homok. Analitikai tisztaságú illékony oldószert kell használni a vizsgált anyag felvitelére a hordozóelemre. Üveg- vagy kvarckészülékben eluáló folyadékként kétszer desztillált vizet kell alkalmazni.
Megjegyzés:
Nem szabad közvetlenül valamilyen szerves ioncserélőből származó vizet használni.
1.6.3.2. A hordozóanyag telítése
Körülbelül 600 mg hordozóanyagot mérnek ki, és azt egy 50 ml-es gömblombikba töltik.
Alkalmas, kimért vizsgálati anyagot feloldanak a kiválasztott oldószerben. Ebből az oldatból megfelelő mennyiséget hozzáadnak a hordozóanyaghoz. Az oldószert teljesen el kell párologtatni, például forgó párologtatóval; egyébként nem érhető el a hordozóanyag vízzel történő telítése a hordozóanyag felületén a megoszlási hatások miatt.
A hordozóanyag megtöltése problémákat okozhat (hibás eredmények), ha a vizsgált anyag olajos vagy más kristályos fázisként leülepszik. A problémát kísérletileg kell megvizsgálni, és meg kell adni a részleteket.
Engedni kell, hogy a megtöltött hordozóanyag körülbelül két órán át álljon körülbelül 5 ml vízben, és ezután a szuszpenziót hozzá kell adni a mikrooszlophoz. Más megoldásként száraz megtöltött hordozóanyag önthető a mikro oszlopba, amelyet előzőleg vízzel feltöltöttek, és ezután körülbelül 2 óra alatt hozható egyensúlyba.
Vizsgálati eljárás:
A hordozóanyagból az anyag eluálása két különböző mód valamelyikével hajtható végre:
|
— |
újrakeringtető szivattyú (lásd az 1. ábrát), |
|
— |
kiegyenlítő tartály (lásd a 4. ábrát). |
1.6.3.3. Oszlopelúciós módszer újrakeringtető szivattyúval
Készülék
Az 1. ábra mutatja egy jellegzetes rendszer vázlatos elrendezését. A 2. ábrán egy alkalmas mikrooszlop látható, jóllehet bármilyen méret elfogadható, feltéve hogy megfelel a reprodukálhatósági és érzékenységi követelménynek. Az oszlopnak biztosítania kell legalább öt víztartály-térfogatnyi töltőteret, és legalább öt mintát kell tárolnia. Más megoldásként a méret csökkenthető, ha utántöltő oldószert alkalmaznak a szennyeződésekkel eltávolított, kezdeti öt tartálytérfogat pótlására.
Az oszlopot körülbelül 25 ml/óra áramlás szabályozására képes újrakeringtető szivattyúhoz kell csatlakoztatni. A szivattyút politetra-fluoretilén (P.T.F.E.) és/vagy üvegvezetékekkel csatlakoztatják. Az oszlopnak és a szivattyúnak, összeszerelt állapotban, biztosítania kell a mintavételt és a felső tér egyensúlyba hozását légköri nyomáson. Az oszlopanyagot egy kis (5 mm-es) üveggyapotdugó tartja, amely a részecskék kiszűrésére is szolgál. Az újrakeringtető szivattyú lehet például egy perisztaltikus szivattyú vagy membránszivattyú (biztosítani kell, hogy semmilyen szennyeződés és/vagy abszorpció ne jöjjön létre a cső anyagával).
Mérési eljárás
Elkezdődik az áramlás az oszlopon keresztül. Az áramlási sebesség 25ml/óra legyen (ez a leírt oszlop esetében 10 tartálytérfogat/órának felel meg). Az első öt tartálytérfogatot (minimum) nem használják fel annak érdekében, hogy eltávolítsák a vízben oldható szennyeződéseket. Ezt követően az egyensúlyi állapot létrejöttéig engedik működtetni az újrakeringtető szivattyút, öt olyan, egymást követő, véletlenül választott minta felhasználásával, amelyek koncentrációja nem tér el egymástól ± 30 %-nál nagyobb mértékben. Ezeket a mintákat legalább 10 tartálytérfogatnyi eluáló folyadék áthaladásának megfelelő időintervallummal kell elválasztani egymástól.
1.6.3.4. Oszlopelúciós módszer kiegyenlítő
tartállyal Készülék (lásd a 4. és 3. ábrát)
Kiegyenlítő tartály: a kiegyenlítő tartályhoz az összeköttetést egy csiszolt üvegből készült csatlakozó biztosítja, amelyet PTFE-csővezeték csatlakoztat. Körülbelül 25 ml/óra átfolyási sebesség használata ajánlott. Össze kell gyűjteni, és elemezni kell a kiválasztott módszerrel az egymást követő eluátumfrakciókat.
Mérési eljárás
Azokat a középső eluátumtartományból származó frakciókat használják a vízben oldhatóság meghatározására, ahol a koncentrációk állandóak (± 30 %) legalább öt egymást követő frakcióban.
Mindkét esetben (újrakeringtető szivattyút vagy kiegyenlítő tartályt használva) egy második méréssorozatot is végre kell hajtani az első áramlási sebességének felével. Amennyiben a két méréssorozat eredményei megegyeznek egymással, a vizsgálat kielégítő; ha a kisebb áramlási sebességgel nagyobb a látszólagos oldhatóság, akkor az áramlási sebesség felezését folytatni kell, amíg a két egymást követő méréssorozat azonos oldhatóságot nem ad.
Mindkét esetben (újrakeringtető szivattyú vagy kiegyenlítő tartály használatakor) ellenőrizni kell a frakciókat kolloidanyag jelenlétét keresve a Tyndall-jelenség (fényszóródás) előfordulásának vizsgálatával. Az ilyen részecskék jelenléte meghamisítja az eredményeket, és a vizsgálatot meg kell ismételni az oszlop szűrési hatásának javításaival.
Fel kell jegyezni minden egyes minta pH-ját. Végre kell hajtani egy másik méréssorozatot ugyanazon a hőmérsékleten.
1.6.4. Lombikmódszer
1.6.4.1. Készülék
A lombikmódszerhez a következő felszerelés szükséges:
|
— |
szokásos laboratóriumi üvegeszközök és műszerek, |
|
— |
oldatok szabályozott, állandó hőmérséklet melletti keverésére alkalmas készülék, |
|
— |
centrifuga (lehetőleg szabályozott hőmérsékletű), ha szükséges, emulziókkal, és |
|
— |
analitikai meghatározáshoz szükséges eszköz. |
1.6.4.2. Mérési eljárás
Becsléssel meghatározzák a kívánt vízmennyiség telítéséhez szükséges anyagmennyiséget az előzetes vizsgálat alapján. A szükséges vízmennyiség az analitikai módszertől és az oldhatósági tartománytól függ. A fent meghatározott anyagmennyiségnek körülbelül ötszörösét bemérik a három, becsiszolt üvegdugóval felszerelt üvegedénybe (például centrifuga-kémcsövek, lombikok). A kiválasztott vízmennyiséget betöltik az edényekbe, és szorosan ledugózzák. A lezárt edényeket ezután 30 oC hőmérsékleten összerázzák. (Olyan rázó- vagy keverőkészüléket kell használni, amely képes arra, hogy állandó hőmérsékleten működjön, ilyen például a mágneses keverőberendezés egy szabályozott hőmérsékletű vízfürdőben.) Egy nap eltelte után az egyik tartályt eltávolítják, és vizsgálati hőmérsékleten újra egyensúlyba hozzák 24 órára, esetenkénti rázással. A tartály tartalmát ezután vizsgálati hőmérsékleten centrifugálják, és valamilyen alkalmas analitikai módszerrel meghatározzák a vizsgált anyag koncentrációját a tiszta, átlátszó vizes fázisban. A másik két lombikot hasonlóan kezelik a kezdeti, 30 oC hőmérsékleten két, illetve három napon át végrehajtott egyensúlyba hozás után. Amennyiben legalább az utolsó két tartály vizsgálatából kapott koncentrációeredmények megegyeznek a szükséges reprodukálhatósággal, a vizsgálat kielégítő. A teljes vizsgálatot meg kell ismételni, hosszabb egyensúly-beállási idő alkalmazásával, ha az 1., 2. és 3. tartályokból kapott eredmények növekvő tedenciájúak.
A mérési eljárás 30 oC-on végrehajtott előzetes inkubáció nélkül is végrehajtható. A telítési egyensúly beállítása sebességének becsléséhez mintákat vesznek, amíg a keverési idő már nincs hatással a vizsgálandó oldat koncentrációjára.
Fel kell jegyezni minden egyes minta pH-ját.
1.6.5. Elemzés
Ezekhez a meghatározásokhoz előnyben részesítendő az anyagspecifikus analitikai módszer, mivel kis mennyiségekben jelen lévő oldható szennyeződések jelentős hibákat okozhatnak a mért oldhatóságban. Ilyen módszerekre példák: gáz vagy folyadékkromatográfia, titrálási módszerek, fotometrikus módszerek, voltametrikus módszerek.
2. ADATOK
2.1. OSZLOPELÚCIÓS MÓDSZER
Ki kell számítani minden egyes méréssorozatból a telítési plató legalább öt egymást követő mintájának középértékét, valamint a standard deviációt. Az eredményeket tömeg/oldattérfogat egységben kell megadni.
Összehasonlítják a különböző áramlási sebességgel végrehajtott két vizsgálatban kapott középértékeket, és ezek ismételhetőségének 30 %-nál kisebbnek kell lennie.
2.2. LOMBIKMÓDSZER
Az egyes eredményeket meg kell adni mindhárom lombik esetében, és a konstansnak tekintett eredményeket (15 %-nál kisebb ismételhetőség) átlagolni kell, és tömeg/oldattérfogat egységekben kell megadni. Ez szükségessé teheti a tömegegységek újbóli átszámítását térfogategységekre annak a sűrűségnek a használatával, amikor az oldhatóság nagyon nagy (> 100 gramm/liter).
3. VIZSGÁLATI JELENTÉS
3.1. OSZLOPELÚCIÓS MÓDSZER
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az előzetes vizsgálat eredményeit, |
|
— |
az anyag pontos leírását (azonosítás és szennyeződések), |
|
— |
minden egyes minta koncentrációját, áramlási sebességét és pH-ját, |
|
— |
minden egyes vizsgálatsorozat telítettségi platója legalább öt mintájának középértékeit és standard deviációját, |
|
— |
két egymást követő, elfogadható méréssorozat átlagát, |
|
— |
a víz hőmérsékletét a szaturációs folyamat során, |
|
— |
az alkalmazott elemzési módszert, |
|
— |
az alkalmazott hordozóanyag sajátosságát, |
|
— |
a hordozóanyag betöltését, |
|
— |
a felhasznált oldószert, |
|
— |
a vizsgálat során az anyag minden kémiai instabilitásának bizonyítékát és az alkalmazott módszert, |
|
— |
az eredmények értelmezése szempontjából lényeges minden információt, különösen az anyag szennyeződéseivel és fizikai állapotával kapcsolatosakat. |
3.2. LOMBIKMÓDSZER
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az elővizsgálat eredményeit, |
|
— |
az anyag pontos leírását (azonosság és szennyeződések), |
|
— |
a jellegzetes analitikai meghatározásokat és azok átlagait, ha egynél több értéket határoztak meg az egyes lombikokhoz, |
|
— |
minden minta pH-ját, |
|
— |
az egymással egyező, különböző lombikokból kapott értékek átlagát, |
|
— |
a vizsgálati hőmérsékletet, |
|
— |
az alkalmazott analitikai módszert, |
|
— |
a vizsgálat és az alkalmazott módszer során az anyag mindenfajta kémiai instabilitásának bizonyítékát, |
|
— |
az eredmények értelmezése szempontjából lényeges minden információt, különösen az anyag szennyeződéseivel és fizikai állapotával kapcsolatosakat. |
4. SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 105. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges. |
|
(2) |
NF T 20-045 (AFNOR) (Sept. 85). Chemical products for industrial use – Determination of water solubility of solids and liquids with low solubility – Column elution method. |
|
(3) |
NF T 20-046 (AFNOR) (Sept. 85). Chemical products for industrial use – Determination of water solubility of solids and liquids with high solubility – Flask method. |
Függelék
1. ábra
Oszlopelúciós módszer újrakeringtető szivattyúval

2. ábra
Jellegzetes mikrooszlop
(Minden méret mm-ben van megadva)
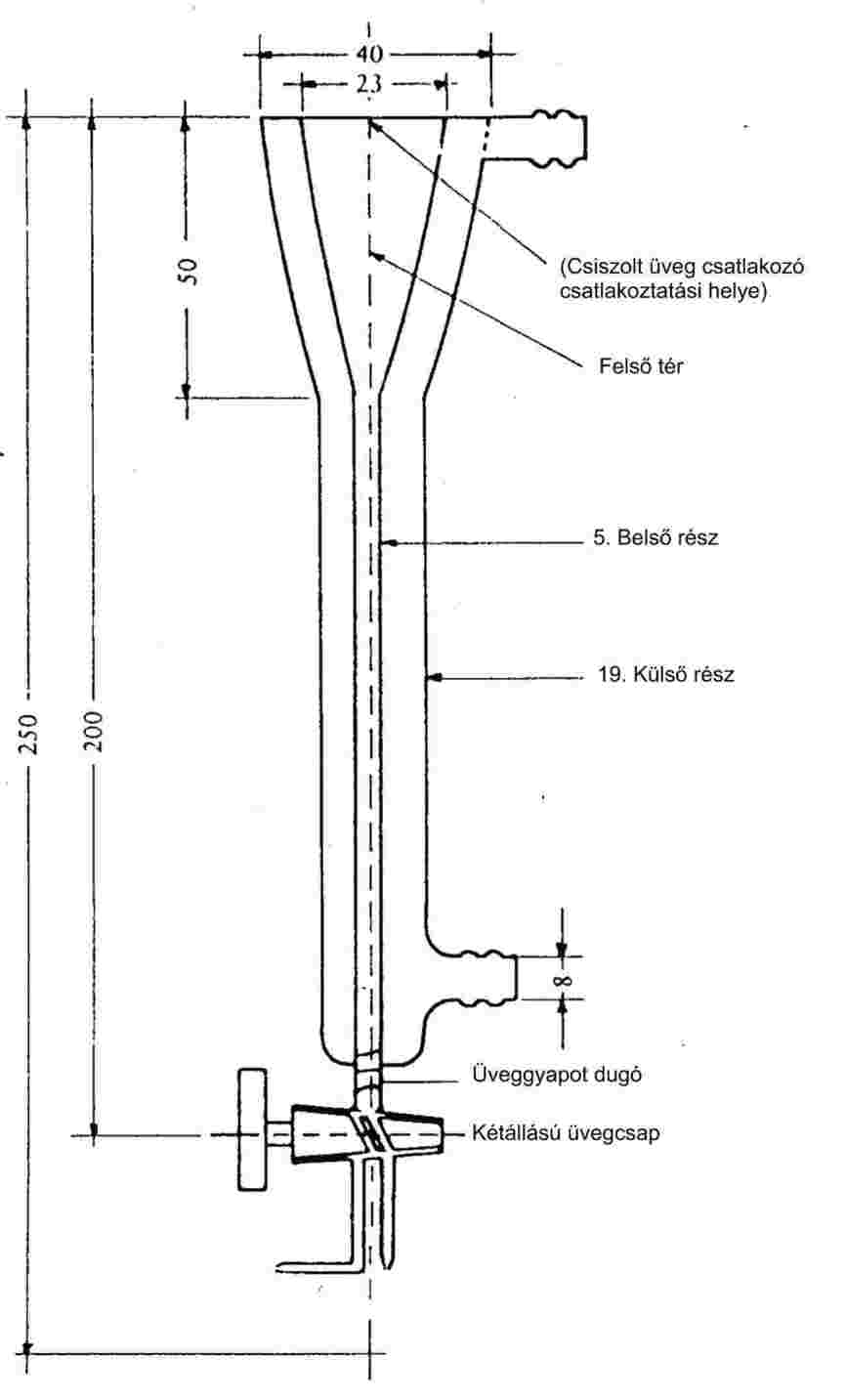
3. ábra
Jellegzetes mikrooszlop
(Minden méret mm-ben van megadva)
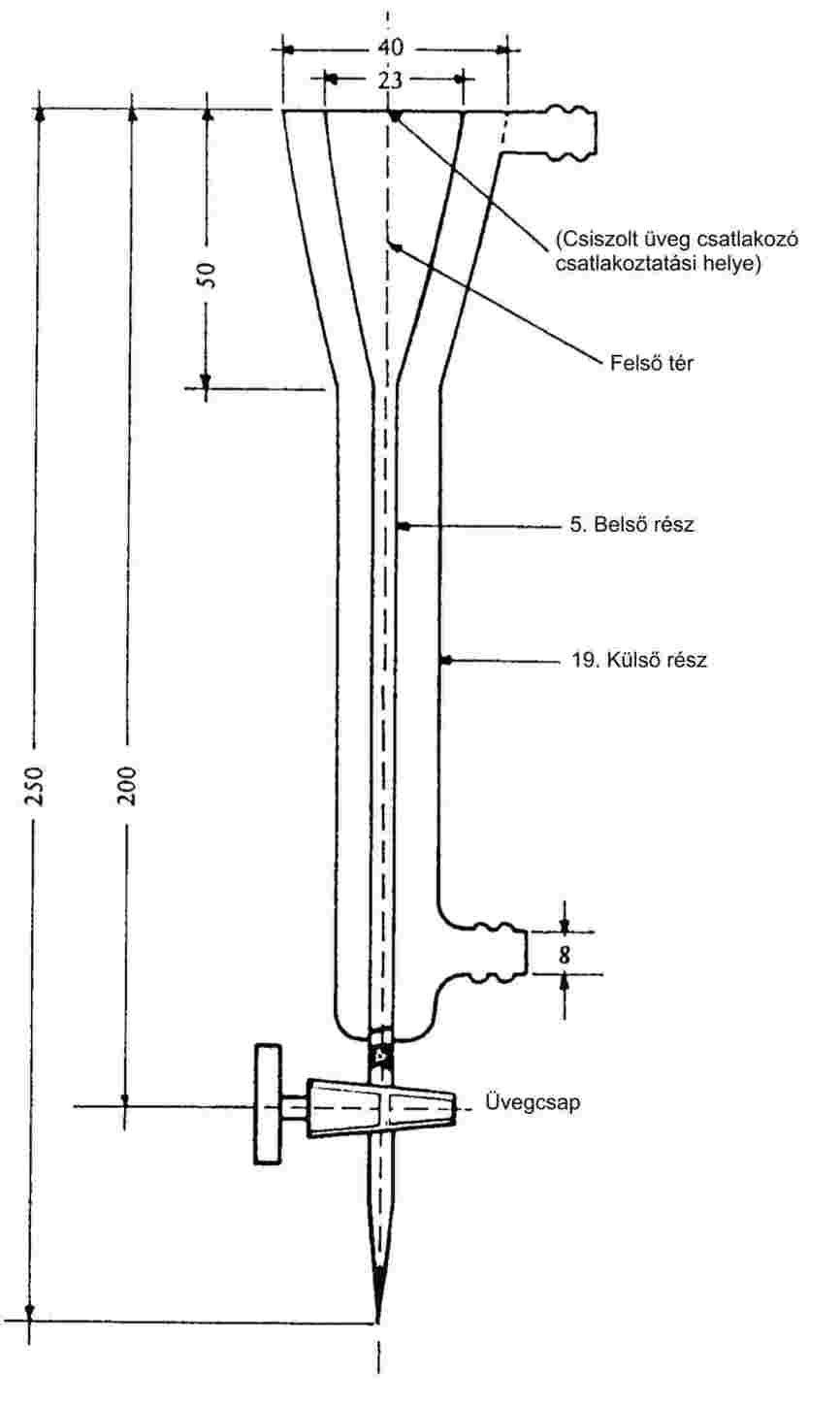
4. ábra
Oszlopelúciós módszer kiegyenlítő tartállyal

A.8. MEGOSZLÁSI HÁNYADOS
1. MÓDSZER
Az itt leírt „lombikrázásos” módszer az OECD vizsgálati irányelven (1) alapul.
1.1. BEVEZETÉS
E vizsgálat végrehajtásához hasznos előzetes információkat szerezni az anyag szerkezeti képletéről, disszociációs állandójáról, vízben oldhatóságáról, hidrolíziséről, n-oktanol oldhatóságáról és felületi feszültségéről.
Ionizálható anyagokon a méréseket csak nem ionos formájukban (szabad sav vagy szabad bázis) szabad végrehajtani, amelyet legalább egy pH-egységgel a pK alatti (szabad sav) vagy feletti (szabad bázis) pH-jú, megfelelő puffer használatával hoznak létre.
Ez a vizsgálati módszer két különálló eljárást foglal magában: a lombikrázásos módszert és a nagynyomású folyadékkromatográfiát („high performance liquid chromatography”, HPLC). Az előbbi akkor alkalmazható, amikor a P-érték (a meghatározásokat lásd lejjebb) a –2 és + 4 közötti tartományba, és az utóbbi a 0 és 6 közötti tartományba esik. A kísérleti eljárások közül bármelyik végrehajtása előtt először a megoszlási hányados előzetesen becsült értékét kell megállapítani.
A lombikrázásos módszer csak vízben és n-oktanolban oldható, lényegében tiszta anyagokhoz alkalmazható. Nem alkalmazható felületaktív anyagok esetében (amelyekhez biztosítani kell az egyedi n-oktanol- és vízoldékonyságon alapuló becsült vagy számított értéket).
A HLPC-módszer nem alkalmazható erős savak és lúgok, komplex fémvegyületek, felületaktív anyagok és olyan anyagok esetében, amelyek az eluáló anyagokkal reakcióba lépnek. Ezen anyagok esetében egyedi n-oktanol- és vízoldékonyságon alapuló, becsült vagy számított értéket kell biztosítani.
A HPLC-módszer kevésbé érzékeny a vizsgálandó vegyületben lévő szennyeződések jelenlétére, mint a lombikrázásos módszer. Ennek ellenére bizonyos esetekben a szennyeződések megnehezíthetik az eredmények értelmezését, mivel bizonytalanná válik a csúcs kijelölése. Olyan keverékek esetében, amelyek határozatlan sávot eredményeznek, meg kell adni a log P felső és alsó határát.
1.2. FOGALOMMEGHATÁROZÁS ÉS MÉRTÉKEGYSÉGEK
A megoszlási hányados (P) két, egymással nem elegyedő oldószerből álló, kétfázisú rendszerben feloldott anyag egyensúlyi koncentrációinak (ci) aránya. N-oktanol és víz esetében:

A megoszlási hányados (P) két koncentráció hányadosa, és rendszerint 10-es alapú logaritmus (log P) alakjában adják meg.
1.3. REFERENCIAANYAGOK
A lombikrázásos módszer
Nem kell minden új anyag vizsgálatakor referenciaanyagot használni. Ezeknek elsősorban arra kell szolgálniuk, hogy időnként ellenőrizzék a módszer megfelelőségét, és lehetővé tegyék az összehasonlítást más módszerekkel nyert eredményekkel.
A HPLC-módszer
Valamely vegyület mért HPLC-adata és annak P-értéke korrelációba állításához létre kell hozni a kromatográfiai adatok függvényében a log P kalibrációs görbéjét legalább 6 referenciapontot használva. A felhasználó feladata a megfelelő referenciaanyagok kiválasztása. Amikor csak lehetséges, legalább egy referenciavegyületnek a vizsgált anyag Pow-je fölötti, és egy másiknak a vizsgált anyag Pow-je alatti Pow-vel kell rendelkeznie. Négynél kisebb log P-értékek esetében a kalibráció a lombikrázásos módszerrel kapott adatokon alapulhat. Négynél nagyobb log P-értékekhez a kalibráció szakirodalmi értékeken alapulhat, amennyiben ezek összhangban vannak a számított értékekkel. Nagyobb pontosság elérésére előnyben kell részesíteni az olyan referenciavegyületeket, amelyek szerkezetileg kapcsolatban vannak a vizsgált anyaggal.
Sok vegyi anyagcsoport esetében a log Pow-értékek terjedelmes jegyzékei állnak rendelkezésre (2) (3). Amennyiben a szerkezetileg egymással összefüggésben lévő vegyületek megoszlási hányadosairól nem állnak rendelkezésre adatok, más referenciavegyületekkel végrehajtott általánosabb kalibrálás használható.
A javasolt referenciaanyagok és azok Pow-értékeinek jegyzékét a 2. függelék tartalmazza.
1.4. A VIZSGÁLATI MÓDSZER ELVE
1.4.1. A lombikrázásos módszer
A megoszlási hányados meghatározásához egyensúlyt kell teremteni a rendszer valamennyi, egymással kölcsönhatásban lévő komponense között, és meg kell határozni a két fázisban feloldott anyagok koncentrációit. Az ezzel a témakörrel foglalkozó szakirodalom vizsgálata azt jelzi, hogy többféle különböző módszer használható ennek a problémának a megoldására, azaz a két fázis alapos keverésére, amelyet a szétválasztásuk követ a vizsgált anyag egyensúlyi koncentrációjának meghatározására.
1.4.2. A HPLC-módszer
A HPLC-t olyan, a kereskedelemben kapható szilárd fázissal megtöltött analitikai oszlopokon hajtják végre, amely kémiailag kovasavhoz kötött hosszú szénhidrogénláncokat (például C8, C18) tartalmaz. Az oszlopba befecskendezett vegyi anyagok különböző sebességekkel mozognak az oszlop mentén a mozgó fázis és az álló szénhidrogénfázis közötti, különböző mértékű megoszlásuk miatt. A vegyi anyagok keverékei a víztaszító képességük sorrendjében eluálódnak, úgy, hogy először a vízben oldható vegyi anyagok eluálódnak, és utoljára az olajban oldható vegyi anyagok, a szénhidrogén-víz megoszlási hányadosukkal arányosan. Ez lehetővé teszi az ilyen (fordított fázisú) oszlopon a retenciós idő és az n-oktanol/víz megoszlási hányados közötti összefüggés meghatározását. A megoszlási hányados a következő kifejezés által megadott „k”kapacitási faktor segítségével határozható meg.
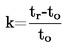
amelyben tr = a vizsgált anyag retenciós ideje, és t0 = az az átlagos idő, amelyre egy oldószer-molekulának szüksége van ahhoz, hogy keresztülhaladjon az oszlopon (holtidő).
Kvantitatív analitikai módszerek nem szükségesek, és csak az elúciós időket kell meghatározni.
1.5. MINŐSÉGI KÖVETELMÉNYEK
1.5.1. Ismételhetőség
A lombikrázásos módszer
A megoszlási hányados pontosságának biztosítása érdekében két meghatározást kell végrehajtani három különböző vizsgálati körülmény között, amelyek során változtatható az előírt anyagmennyiség, valamint az oldószertérfogatok aránya. A megoszlási hányados 10-es alapú logaritmusban kifejezett értékeinek ±0,3 logegység-tartományon belül kell lennie.
A HPLC-módszer
A mérés megbízhatóságának növelésére két meghatározást kell végrehajtani. Az egyes mérésekből meghatározott log P értékeknek ±0,1 logegység-tartományon belül kell lenniük.
1.5.2. Érzékenység
A lombikrázásos módszer
A módszer mérési tartományát az analitikai eljárás detektálási határa határozza meg. Ennek lehetővé kell tennie a –2 és + 4 (esetenként, amikor teljesülnek ennek a feltételei, ez a tartomány egészen 5-ös log Pow-re is kibővíthető) közötti tartományban lévő log Pow értékek kiértékelését, amennyiben az oldatban lévő anyag koncentrációja egyik fázisban sem több 0,01 mol/liternél.
A HPLC-módszer
A HPLC-módszer 0 és 6 közötti log Pow tartományban teszi lehetővé a megoszlási hányadosok becslését.
Általában valamely vegyület megoszlási hányadosa a lombikrázásos értéktől számított ± 1 logegységen belül becsülhető meg. A jellegzetes korrelációk megtalálhatók a szakirodalomban (4) (5) (6) (7) (8). Nagyobb pontosság rendszerint akkor érhető el, amikor a korrelációs görbék egymással szerkezetileg kapcsolatban lévő referenciavegyületeken alapulnak (9).
1.5.3. Alkalmazhatóság
A lombikrázásos módszer
A Nernst-féle megoszlási törvény csak állandó hőmérsékleten, nyomáson és pH mellett érvényes híg oldatokra. Szigorúan két tiszta oldószer között diszpergálódott tiszta anyagra érvényes. Amennyiben egyidejűleg több különböző oldott anyag van jelen egy vagy több fázisban, ez hatással lesz az eredményekre.
Az oldott molekulák disszociációja vagy asszociációja eltéréseket eredményez a Nernst-féle megoszlási törvénytől. Az ilyen eltéréseket az a tény jelzi, hogy a megoszlási hányados függővé válik az oldat koncentrációjától.
Mivel többszörös egyensúlyról van szó, ezt a módszert nem szabad alkalmazni ionizálható vegyületekre helyesbítés alkalmazása nélkül. Ilyen vegyületek esetében meg kell fontolni pufferoldatok használatát víz helyett; a puffer pH-jának legalább 1 pH-egységgel el kell térnie az anyag pKa-értékétől, és figyelembe kell venni ennek a pH-nak az összefüggését a környezettel.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. A megoszlási hányados előzetes becslése
A megoszlási hányados becslését lehetőleg számítási módszer (lásd az 1. függeléket) segítségével, vagy adott esetben a tiszta oldószerekben lévő vizsgált anyag oldhatóságainak arányából (10) kell végrehajtani.
1.6.2. A lombikrázásos módszer
1.6.2.1. Előkészület
n-oktanol: a megoszlási hányados meghatározását nagy tisztaságú, analitikai minőségű reagenssel kell végrehajtani.
Víz: üveg- vagy kvarckészülékben lévő desztillált vagy kétszer desztillált vizet kell használni. Ionizálható vegyületekhez víz helyett pufferoldatokat kell használni, amennyiben indokolt.
Megjegyzés:
Nem szabad közvetlenül valamilyen ioncserélőből vett vizet használni.
1.6.2.1.1.
Valamely megoszlási hányados meghatározása előtt kölcsönösen telítik az oldószerrendszer fázisait a kísérleti hőmérsékleten végrehajtott rázással. Ennek végrehajtásához célszerű 24 órán át egy mechanikus rázókészülékben nagy tisztaságú, analitikai minőségű n-oktanolt vagy vizet tartalmazó két olyan, nagy tárolópalackot rázni, amelyek közül mindkettő elegendő mennyiséget tartalmaz a másik oldószerből, és ezután ezeket addig kell alkalmazni, amíg a fázisok szétválnak, és bekövetkezik a telítettségi állapot.
1.6.2.1.2.
A kétfázisú rendszer teljes mennyiségének majdnem meg kell töltenie a vizsgálati tartályt. Ez segíteni fog az elillanás miatti anyagveszteség megakadályozásában. Az alkalmazandó térfogatarányt és anyagmennyiségeket a következők határozzák meg:
|
— |
a megoszlási hányados előzetes értékelése (lásd fent), |
|
— |
az analitikai eljáráshoz szükséges vizsgált anyag minimális mennyisége, és |
|
— |
a mindkét fázisban 0,01 mol/literes maximáliskoncentráció-korlátozás. |
Három vizsgálatot kell végezni. Az elsőben az n-oktanol és víz számított térfogatarányát használják; a másodikban ezt az arányt kettővel elosztják; és a harmadikban ezt az arányt kettővel megszorozzák (például, 1:1, 1:2, 2:1).
1.6.2.1.3.
Törzsoldatot készítenek vízzel előre telített n-oktanolban. Ennek a törzsoldatnak a koncentrációját pontosan meg kell határozni, mielőtt a megoszlási hányados meghatározásához használnánk. Ezt az oldatot olyan körülmények között kell tárolni, amely biztosítja annak stabilitását.
1.6.2.2. Vizsgálati körülmények
A vizsgálati hőmérsékletet állandó értéken (± 1 oC) kell tartani, és ennek a 20 és 25 oC közötti tartományban kell lennie.
1.6.2.3. Mérési eljárás
1.6.2.3.1.
Minden vizsgálati körülményhez elő kell készíteni a pontosan megmért két oldószermennyiséget, valamint a szükséges törzsoldatmennyiséget tartalmazó vizsgálati tartályt.
Az n-oktanol-fázisokat térfogat alapján kell mérni. A vizsgálati tartályokat vagy alkalmas rázókészülékbe kell helyezni, vagy kézzel kell keverni. Centrifugakémcső használatakor javasolt módszer a kémcső gyors forgatása 180 fokban a főtengelye mentén úgy, hogy minden oldott levegő távozzék a két fázisból. A tapasztalat azt mutatja, hogy 50 ilyen forgatás rendszerint elegendő a megoszlási egyensúly létrehozásához. Azért, hogy bizonyosan létrejöjjön az egyensúly, öt perc alatt 100 forgatás ajánlott.
1.6.2.3.2.
Adott esetben a fázisok elkülönítéséhez a keveréket centrifugálni kell. Ezt a műveletet szobahőmérsékleten, laboratóriumi centrifugában kell elvégezni, vagy ha nem szabályozott hőmérsékletű centrifugát használnak, a centrifugakémcsöveket az elemzés előtt legalább egy óra hosszat egyensúlyban kell tartani a vizsgálati hőmérsékleten.
1.6.2.4. Elemzés
A megoszlási hányados meghatározásához meg kell határozni a vizsgált anyag koncentrációját mindkét fázisban. Ez úgy tehető meg, hogy ki kell venni minden egyes vizsgálati körülményhez tartozó minden egyes kémcsőből mindkét fázis aliquot részét, és elemezni kell azokat a kiválasztott eljárással. Ezután ki kell számítani a mindkét fázisban jelen lévő teljes anyagmennyiséget, és ezt össze kell hasonlítani az eredetileg bevitt anyagmennyiséggel.
A vizes fázisból olyan eljárással kell mintát venni, amely minimálissá teszi az n-oktanol maradéka bevitelének veszélyét: a vizes fázisból a mintavételhez egy eltávolítható tűvel ellátott üvegfecskendő használható. A fecskendőt kiinduláskor részben meg kell tölteni levegővel. A levegőt óvatosan ki kell tolni, miközben a tűt behelyezik az n-oktanol-rétegen keresztül. Ezután megfelelő mennyiségű vizes fázist kell beszívni a fecskendőbe. A fecskendőt gyorsan el kell távolítani az oldatból, és le kell venni a tűt. A fecskendő tartalma ezután vizes mintaként használható. A két elkülönített fázisban a koncentrációt lehetőleg valamilyen, anyagra jellemző módszerrel kell meghatározni. A következő felsorolás példákat ad azokra az analitikai módszerekre, amelyek megfelelőnek bizonyulhatnak:
|
— |
fotometrikus módszerek, |
|
— |
gázkromatográfia, |
|
— |
nagy nyomású folyadékkromatográfia. |
1.6.3. A HPLC-módszer
1.6.3.1. Előkészület
Készülék
Impulzusmentes szivattyúval és alkalmas detektáló készülékkel felszerelt folyadékkromatográf szükséges. Injektáló hurkokkal rendelkező injektor használata ajánlatos. Álló fázisban poláros csoportok jelenléte nagymértékben károsíthatja a HPLC-oszlop megfelelő működését. Ezért az álló fázisnak minimális százalékban szabad csak tartalmaznia poláros csoportokat (11). A kereskedelemben kapható mikroszemcsés, reverz fázisú töltetek vagy előretöltött oszlopok is használhatók. Az injektáló rendszer és az analitikai oszlop közé védőoszlop helyezhető el.
Mobil fázis
Eluáló oldószer elkészítésére HPLC-minőségű metanolt és HPLC-minőségű vizet használnak, amelyet gáztalanítanak használat előtt. Izokratikus eluálást kell alkalmazni. Minimum 25 % víztartalmú metanol/víz arányt kell használni. Általában 3:1 (térfogat/térfogat) metanol-víz keverék megfelelő log P = 6 vegyületek 1 órán belüli eluálásához 1 ml/perc átfolyási sebesség mellett. Ha a vegyület log P-je nagy, szükségessé válik az elúciós idő lerövidítése (referenciavegyületeknél is) a mobil fázis polaritásának vagy az oszlop hosszúságának csökkentésével.
A n-oktanolban nagyon kis mértékben oldható anyagok hajlamosak arra, hogy rendkívül alacsony log Pow-értékeket adjanak a HPLC-módszerrel; az ilyen vegyületek csúcsai esetenként az oldószerfronttal együtt jelentkeznek. Ez valószínűleg annak tulajdonítható, hogy túl lassú a megoszlási folyamat ahhoz, hogy létrejöhessen az egyensúly az alatt az idő alatt, amíg általában egy HPLC-elválasztás tart. Az áramlási sebesség csökkentése vagy a metanol/víz arány csökkentése hatásos lehet abban, hogy reális értéket kapjanak.
A vizsgált, és a referenciavegyületeknek elegendő koncentrációkban oldhatóaknak kell lenniük a mobil fázisban ahhoz, hogy kimutathatók legyenek. Csak kivételes esetekben használhatók adalékanyagok a metanol/víz keverékhez, mivel az adalékanyagok megváltoztatják az oszlop tulajdonságait. Adalékanyagokkal rendelkező kromatogramokhoz kötelező az ugyanolyan típusú, külön oszlop használata. Amennyiben nem megfelelő a metanol-víz, más szerves oldószer-víz keverékek használhatók, például etanol-víz vagy aceto-nitril-víz.
Az eluáló folyadék pH-ja döntő fontosságú ionizálható vegyületek esetében. Ennek belül kell lennie az oszlop üzemi pH-tartományán, ami rendszerint 2 és 8 között van. Ajánlatos a pufferolás. El kell kerülni a só kicsapódását és az oszlop minőségromlását, amely bizonyos szerves fázis/puffer keverékek esetében megvalósulhat. Nem ajánlatos kovasav alapú, álló fázisú HPLC-berendezéssel pH 8 felett méréseket végrehajtani, mivel a lúgos mobil fázis használata gyors romlást okozhat az oszlop teljesítőképességében.
Oldott anyagok
A referenciavegyületeknek a lehető legtisztább vegyületeknek kell lenniük. A vizsgálatra vagy kalibrálásra szánt vegyületeket, amennyiben lehetséges, feloldják a mobil fázisban.
Vizsgálati körülmények
A mérések során a hőmérsékletnek nem szabad ± 2 K-nél nagyobb értékkel változnia.
1.6.3.2. Mérés
A t0 holtidő számítása
A t0 holtidő valamely homológ sor (például n-alkil-metil-ketonok) vagy kromatográffal nem késleltetett szerves vegyületek (például tiokarbamid vagy formamid) segítségével határozható meg. A t0 holtidőnek homológ sor segítségével végrehajtott számításához valamely homológ sornak legalább hét tagját fecskendezik be, és meghatározzák a megfelelő holtidőt. Felrajzolják a tr (n c + 1) alapretenciós időt a tr(n c) függvényében, és meghatározzák a következő regressziós egyenletet:
tr(nc + 1) = a + b tr(nc)
„a” metszéspontját és „b” meredekségét (n = szénatomok száma). A t0 holtidőt ekkor a következő összefüggés adja meg:
to = a/(1 - b)
Kalibrációs görbe
A következő lépés a log P függvényében a log k-értékek korrelációjának megállapítása megfelelő referenciaanyagok esetében. A gyakorlatban egyidejűleg fecskendeznek be 5–10 tagból álló standard referenciavegyületet, amelyek log P-értéke a várt tartomány körül van, és lehetőleg a detektáló rendszerhez kapcsolt regisztráló integrátoron meghatározzák a retenciós időket. Kiszámítják a kapacitástényezők megfelelő – k – logaritmusait, és felrajzolják a lombikrázásos módszerrel meghatározott log P függvényében. A kalibrálást rendszeres időközönként, naponta legalább egyszer elvégzik azért, hogy felismerjék az esetleges változásokat az oszlop viselkedésében.
A vizsgált anyag kapacitási tényezőjének meghatározása
A vizsgált anyagot a mobil fázis lehető legkisebb mennyiségében fecskendezik be. Meghatározzák (kétszer) a retenciós időt, amely lehetővé teszi a k kapacitástényező kiszámítását. A referenciavegyületek korrelációs görbéjéből interpolálható a vizsgált anyag megoszlási hányadosa. Nagyon kicsi és nagyon nagy megoszlási hányadosok esetében extrapoláció szükséges. Ilyen esetekben gondosan kell figyelembe venni a regressziós egyenes konfidenciahatárait.
2. ADATOK
Lombikrázásos módszer
A P meghatározott értékeinek megbízhatósága a párhuzamos meghatározások középértékeinek az általános középértékkel való összehasonlításával vizsgálható.
3. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az anyag pontos leírását (azonosság és szennyeződések), |
|
— |
amikor a módszerek nem alkalmazhatók (például felületaktív anyag), az egyes n-oktanol- és vízoldékonyságon alapuló valamilyen számított értéket vagy becslést kell megadni, |
|
— |
az eredmények értelmezése szempontjából lényeges valamennyi információt és megjegyzést, különösen azokat, amelyek az anyag szennyeződéseivel és fizikai állapotával kapcsolatosak. |
Lombikrázásos módszer esetében:
|
— |
adott esetben az előzetes becslés eredményeit, |
|
— |
azt a hőmérsékletet, amelyen a meghatározást mérték, |
|
— |
a koncentrációk meghatározásához használt analitikai eljárások adatait, |
|
— |
adott esetben a centrifugálás idejét és sebességét, |
|
— |
mindkét fázisban a mért koncentrációkat, minden egyes meghatározáshoz (ez azt jelenti, hogy összesen 12 koncentrációnak kell szerepelnie a jelentésben), |
|
— |
a vizsgált anyag súlyát, az egyes vizsgálati tartályokban alkalmazott minden egyes fázis térfogatát és egyensúlyba hozás után az egyes fázisokban jelen lévő vizsgált anyag teljes, számított mennyiségét, |
|
— |
a megoszlási hányados (P) számított értékeit, és minden vizsgálati körülmény esetében meg kell adni a középértéket, vagyis minden meghatározáshoz meg kell adni a középértéket. Amennyiben létezik javaslat a megoszlási hányados koncentrációfüggőségére, ezt is szerepeltetni kell a jelentésben, |
|
— |
meg kell adni az egyes P értékeknek a középérték körüli standard deviációját, |
|
— |
az összes meghatározásból megállapított átlagos P értéket 10-es alapú logaritmusaként is ki kell kifejezni, |
|
— |
a számított elméleti Pow-t, amikor ilyen értéket meghatároznak, vagy amikor a mért érték > 104, |
|
— |
a kísérlet során felhasznált víz és vizes fázis pH-ját, |
|
— |
víz helyett puffer használata esetén a pufferek használatának indoklását, a pufferek összetételét, koncentrációját és pH-ját, és a vizes fázis pH-ját a kísérlet előtt és után. |
A HPLC-módszer esetében:
|
— |
adott esetben az előzetes becslés eredményét, |
|
— |
a vizsgált és referenciaanyagokat és azok tisztaságát, |
|
— |
azt a hőmérséklet-tartományt, amelyben a meghatározások történtek, |
|
— |
azt a pH-t, amelyben a meghatározások történtek, |
|
— |
az analitikai és védőoszlop, a mobil fázis és a detektálásra szolgáló eszközök adatait, |
|
— |
a kalibrálás során használt referenciaanyagok regressziós adatait és a szakirodalomban közölt log P-értékeit, |
|
— |
az illesztett regressziós egyenes részleteit (log k a log P függvényében), |
|
— |
a vizsgált vegyület átlagos retenciós adatait és interpolált log P értékét, |
|
— |
a berendezés és a működési állapot leírását, |
|
— |
az elúciós profilokat, |
|
— |
az oszlopba bevitt vizsgált és referenciaanyagok mennyiségét, |
|
— |
a holtidőt, és mérésének módját. |
4. SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 107. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges. |
|
(2) |
C. Hansch and A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979. |
|
(3) |
Log P and Parameter Database, A tool for the quantitative prediction of bioactivity (C. Hansch, chairman, A.J. Leo, dir.) – A Pomona College Medical Chemistry Project 1982, Pomona College, Claremont, Kalifornia, 91711. címről szerezhető be. |
|
(4) |
L. Renberg, G. Sundström and K. Sundh-Nygärd, Chemosphere, 1980, vol. 80, 683. |
|
(5) |
H. Ellgehausen, C. D'Hondt and R. Fuerer, Pestic. Sci., 1981, vol. 12,219. (1981). |
|
(6) |
B. McDuffie, Chemosphere, 1981, vol. 10, 73. |
|
(7) |
W.E. Hammers et al., J. Chromatogr., 1982, vol. 247, 1. |
|
(8) |
J.E. Haky and A.M. Young, J. Liq. Chromat., 1984, vol. 7, 675. |
|
(9) |
S. Fujisawa and E. Masuhara, J. Biomed. Mat. Res., 1981, vol. 15, 787. |
|
(10) |
O. Jubermann, Verteilen und Extrahieren, in Methoden der Organischen Chemie (Houben Weyl), Allgemeine Laboratoriumpraxis (edited by E. Müller), Georg Thieme Verlag, Stuttgart, 1958, Band 1/1, 223–339. |
|
(11) |
R.F. Rekker and H.M. de Kort, Euro. J. Med. Chem., 1979, vol. 14, 479. |
|
(12) |
A. Leo, C. Hansch and D. Elkins, Partition coefficients and their uses. Chem. Rev., 971, vol. 71, 525. |
|
(13) |
R.F. Rekker, The Hydrophobic Fragmental Constant, Elsevier, Amsterdam, 1977. |
|
(14) |
NF T 20-043 AFNOR (1985). Chemical products for industrial use – Determination of partition coefficient – Flask shaking method. |
|
(15) |
C.V. Eadsforth and P. Moser, Chemosphere, 1983, vol. 12, 1459. |
|
(16) |
A. Leo, C. Hansch and D. Elkins, Chem. Rev., 1971, vol. 71, 525. |
|
(17) |
C. Hansch, A. Leo, S.H. Unger, K.H. Kim, D. Nikaitani and E.J. Lien, J. Med. Chem., 1973, vol. 16, 1207. |
|
(18) |
W.B. Neely, D.R. Branson and G.E. Blau, Environ. Sci. Technol., 1974, vol. 8, 1113. |
|
(19) |
D.S. Brown and E.W. Flagg, J. Environ, Qual., 1981, vol. 10, 382. |
|
(20) |
J.K. Seydel and K.J. Schaper, Chemische Struktur und biologische Aktivität von Wirkstoffen, Verlag Chemie, Weinheim, New York, 1979. |
|
(21) |
R. Franke, Theoretical Drug Design Methods, Elsevier, Amsterdam, 1984. |
|
(22) |
Y.C. Martin, Quantitative Drug Design, Marcel Dekker, New York, Basel, 1978. |
|
(23) |
N.S. Nirrlees, S.J. Noulton, C.T. Murphy, P.J. Taylor; J. Med. Chem., 1976, vol. 19, 615. |
1. Függelék
Számítási/becslési módszerek
BEVEZETÉS
A Handbook of Chemical Property Estimation Methods (a) című mű ismerteti a számítási módszerek, adatok és példák általános bevezetését.
A Pow számított értékei használhatók:
|
— |
annak eldöntésére, hogy a kísérleti módszerek közül melyik megfelelő (lombikrázási tartomány: log Pow: –2-től 4-ig, HPLC-tartomány: log Pow: 0-tól 6-ig), |
|
— |
a megfelelő vizsgálati körülmények kiválasztásához (például referenciaanyagok HPLC-eljárásokhoz, n-oktanol/víz térfogatarány lombikrázásos módszerhez), |
|
— |
a lehetséges kísérleti hibák belső laboratóriumi ellenőrzéséhez, |
|
— |
Pow becslés biztosítására, ahol a kísérleti módszerek technikai okok miatt nem alkalmazhatók. |
BECSLÉSI MÓDSZER
A megoszlási hányados előzetes becslése
A megoszlási hányados értéke a tiszta oldószerekben a vizsgálati anyag oldhatóságának segítségével becsülhető meg. Ehhez:
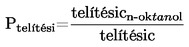
SZÁMÍTÁSI MÓDSZEREK
A számítási módszerek alapelve
Minden számítási módszer a molekulának olyan elemekre való formális lebomlásán alapul, amelyekhez ismertek megbízható log Pow értékek. Ekkor a teljes molekula log Pow értékét a megfelelő fragmentum összege plusz az intermolekuláris kölcsönhatásokhoz tartozó korrekciós kifejezések összege adja.
A fragmentumkonstansok és korrekciós kifejezések jegyzékei rendelkezésre állnak (b) (c) (d) (e). Néhányat közülük rendszeresen frissítenek (b).
Minőségi követelmények
Általában a számítási módszer megbízhatósága csökken a vizsgált vegyület növekvő bonyolultságával. Kis molekulasúlyú és egy- vagy kétfunkciós csoportú, egyszerű molekulák esetében a különböző fragmentálási módszerek eredményei és a mért érték között 0,1–0,3 log Pow eltérés várható. Összetettebb molekulák esetében a hibahatár nagyobb lehet. Ez a fragmentumkonstansok megbízhatóságától és rendelkezésre állásától, valamint az intramolekuláris kölcsönhatások (például hidrogénkötések) felismerhetőségétől és a korrekciós kifejezések pontos használatától függ (kisebb a probléma a CLOGP-3-as szoftverrel) (b). Ionizálható vegyületek esetében fontos a töltés vagy az ionizáció mértékének megfelelő figyelembevétele.
Számítási eljárások
Hansch-féle π-módszer
A Fujita és munkatársai (f) által bevezetett eredeti π hidrofób helyettesítő konstanst a következőképpen definiálták:
πX = log Pow (PhX) -log Pow (PhH)
ahol Pow (PhX) egy aromás származék megoszlási hányadosa és Pow (PhH) a kiindulási vegyület megoszlási hányadosa.
(például πCl = log Pow (C6H5C1) -log Pow(C6H6) = 2,84 – 2,13 = 0,71)
A definíció alapján a π-módszer általában aromás szubsztitúcióra alkalmazható. Nagy számú szubstituens π-értékeit (b) (c) (d) már táblázatba foglalták. Ezeket aromás molekulák vagy szubstruktúrák log Pow értékének kiszámításához használják.
A Rekker-féle módszer
Rekker szerint (g) a log Pow érték kiszámítása a következőképpen történik:

ahol fj a különböző molekuláris fragmentumkonstansok és ai ezeknek a vizsgált molekulában való előfordulási gyakorisága. A korrekciós kifejezések egyetlen Cm konstans (egy úgynevezett „magic constant”) egész számú többszöröseként fejezhetők ki. Az fj és Cm fragmentumkonstansokat egy 1 054 kísérleti Pow értéket (825 vegyület) tartalmazó jegyzékből határozták meg többszörös regresszióanalízis (c) (h) segítségével. A interakciós kifejezések meghatározását az (e) (h) (i) szakirodalomban leírt szabályoknak megfelelően hajtották végre.
A Hansch–Leo-féle módszer
Hansch és Leo (c) szerint a log Pow érték a következő összefüggésből számítható ki:

ahol fi a különböző molekularész állandói, Fj a korrekciós kifejezések és ai, bj a megfelelő előfordulási gyakoriság. Kísérleti Pow értékekből atomos és csoportfragmentálási értékek jegyzékét és Fj korrekciós kifejezések (úgynevezett „tényezők”) jegyzékét határozták meg a fokozatos megközelítés módszerével. A korrekciós kifejezéseket több különböző osztályba sorolták be (a) (c). Viszonylag bonyolult és időigényes minden szabály és korrekciós kifejezés figyelembevétele. Szoftvercsomagokat fejlesztettek ki (b).
Összetett módszer
Összetett molekulák log Pow értékének számítása lényegesen javítható, ha a molekula nagyobb szerkezeti elemekre bontható, amelyekhez rendelkezésre állnak megbízható log Pow értékek táblázatokból (b) (c), vagy saját mérésekből. Az ilyen részek (például heterociklusok, antrakinon, azobenzol) ezután kombinálhatók a Hansch-féle π-értékekkel, vagy a Rekker-vagy Leo-féle részállandókkal.
Megjegyzések
|
i. |
A számítási módszerek csak akkor alkalmazhatók részben vagy teljesen ionizált vegyületekhez, amikor lehetőség van a szükséges korrekciós tényező figyelembevételére. |
|
ii. |
Amennyiben intramolekuláris hidrogénkötések feltételezhetők, hozzá kell adni a megfelelő korrekciós tagot (körülbelül +0,6 és +1,0 közötti log Pow egységek) (a). Az ilyen kötések jelenlétét a molekula sztereomodelljei vagy spektroszkópikus adatai jelezhetik. |
|
iii. |
Amennyiben több tautomeralak lehetséges, a legvalószínűbb alakot kell használni számítási alapként. |
|
iv. |
A részkonstansok jegyzékeinek módosítását körültekintően kell végrehajtani. |
Vizsgálati jelentés
A számítási/becslési módszerek használatakor a vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az anyag leírását (keverék, szennyeződések stb.), |
|
— |
minden lehetséges intramolekuláris hidrogénkötés, disszociáció, töltés és minden egyéb szokatlan hatás (például tautoméria) jelzését, |
|
— |
a számítási módszer leírását, |
|
— |
az adatbázis azonosítását vagy a készlet ismertetését, |
|
— |
a részek kiválasztásának sajátosságait, |
|
— |
a számítás átfogó dokumentálását. |
SZAKIRODALOM
|
(a) |
W.J. Lyman, W.F. Reehl and D.H. Rosenblatt (ed.), Handbook of Chemical Property Estimation Methods, McGraw-Hill, New York, 1983. |
|
(b) |
Pomona College, Medicinal Chemistry Project, Claremont, Kalifornia 91711, USA, Log P Database and Med. Chem. Software (Program CLOGP-3) |
|
(c) |
C. Hansch, A.J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979. |
|
(d) |
A. Leo, C. Hansch, D. Elkins, Chem. Rev., 1971. vol. 71, 525. |
|
(e) |
R.F. Rekker, H.M. de Kort, Eur. J. Med. Chem. – Chim. Ther. 1979, vol. 14, 479. |
|
(f) |
T. Fujita, J. Iwasa and C. Hansch, J. Amer. Chem. Soc, 1964, vol. 86, 5175. |
|
(g) |
R.F. Rekker, The Hydrophobic Fragmental Constant, Pharmacochemistry Library, Elsevier, New York, 1977, vol. 1. |
|
(h) |
C.V. Eadsforth, P. Moser, Chemosphere, 1983, vol. 12, 1459. |
|
(i) |
R.A. Scherrer, ACS, American Chemical Society, Washington, D.C., 1984, Symposium Series 255, 225. |
2. Függelék
HPLC-Módszerhez Javasolt Referenciaanyagok
|
Szena |
Referenciaanyag |
log Pow |
pKa |
|
1 |
2-butanon |
0,3 |
|
|
2 |
4-Acetilpiridin |
0,5 |
|
|
3 |
Anilin |
0,9 |
|
|
4 |
Acetanilid |
1,0 |
|
|
5 |
Benzilalkohol |
1,1 |
|
|
6 |
p-Metoxifenol |
1,3 |
pKa = 10,26 |
|
7 |
Fenoxiecetsav |
1,4 |
pKa = 3,12 |
|
8 |
Fenol |
1,5 |
pKa = 9,92 |
|
9 |
2,4-Dinitrofenol |
1,5 |
pKa = 3,96 |
|
10 |
Benzonitril |
1,6 |
|
|
11 |
Fenilacetonitril |
1,6 |
|
|
12 |
4-Metilbenzil-alkohol |
1,6 |
|
|
13 |
Acetofenon |
1,7 |
|
|
14 |
2-Nitrofenol |
1,8 |
pKa = 7,17 |
|
15 |
3-Nitrobenzoesav |
1,8 |
pKa = 3,47 |
|
16 |
4-Klóranilin |
1,8 |
pKa = 4,15 |
|
17 |
Nitrobenzol |
1,9 |
|
|
18 |
Fahéj alkohol |
1,9 |
|
|
19 |
Benzoesav |
1,9 |
pKa = 4,19 |
|
20 |
p-Krezol |
1,9 |
pKa = 10,17 |
|
21 |
Fahéjsav |
2,1 |
pKa = 3,89 cis 4,44 trans |
|
22 |
Anizol |
2,1 |
|
|
23 |
Metilbenzoát |
2,1 |
|
|
24 |
Benzol |
2,1 |
|
|
25 |
3-Metilbenzoesav |
2,4 |
pKa = 4,27 |
|
26 |
4-Klórfenol |
2,4 |
pKa = 9,1 |
|
27 |
Triklóretilén |
2,4 |
|
|
28 |
Atrazin |
2,6 |
|
|
29 |
Etilbenzoát |
2,6 |
|
|
30 |
2,6-Diklórbenzonitril |
2,6 |
|
|
31 |
3-Klórbenzoesav |
2,7 |
pKa = 3,82 |
|
32 |
Toluol |
2,7 |
|
|
33 |
1-Naftol |
2,7 |
pKa = 9,34 |
|
34 |
2,3-Diklóranilin |
2,8 |
|
|
35 |
Klórbenzol |
2,8 |
|
|
36 |
Allil-feniléter |
2,9 |
|
|
37 |
Brómbenzol |
3,0 |
|
|
38 |
Etilbenzol |
3,2 |
|
|
39 |
Benzofenon |
3,2 |
|
|
40 |
4-Fenilfenol |
3,2 |
pKa = 9,54 |
|
41 |
Timol |
3,3 |
|
|
42 |
1,4-Diklórbenzol |
3,4 |
|
|
43 |
Difenilamin |
3,4 |
pKa = 0,79 |
|
44 |
Naftalin |
3,6 |
|
|
45 |
Fenilbenzoát |
3,6 |
|
|
46 |
Izopropilbenzol |
3,7 |
|
|
47 |
2,4,6-Triklórfenol |
3,7 |
pKa = 6 |
|
48 |
Bifenil |
4,0 |
|
|
49 |
Benzil-benzoát |
4,0 |
|
|
50 |
2,4-Dinitro-6-szekunder butilfenol |
4,1 |
|
|
51 |
1,2,4-Triklórbenzol |
4,2 |
|
|
52 |
Dedekánsav |
4,2 |
|
|
53 |
Difeniléter |
4,2 |
|
|
54 |
n-Butilbenzol |
4,5 |
|
|
55 |
Fenantrin |
4,5 |
|
|
56 |
Fluorantén |
4,7 |
|
|
57 |
Dibenzil |
4,8 |
|
|
58 |
2,6-Difenilpiridin |
4,9 |
|
|
59 |
Trifenil-amin |
5,7 |
|
|
60 |
DDT |
6,2 |
|
|
Egyéb, alacsony log Pow értékű referenciaanyagok |
|||
|
1 |
Nikotinsav |
-0,07 |
|
A.9. LOBBANÁSPONT
1. MÓDSZER
1.1. BEVEZETÉS
E vizsgálat végrehajtásához hasznos előzetes információkat szerezni az anyag lobbanékonyságáról. A vizsgálati eljárás olyan folyékony anyagokhoz alkalmazható, amelyek gőzeit meggyújthatják gyújtóforrások. A leírásban felsorolt vizsgálati módszerek csak az egyes módszereknél megadott lobbanáspont-tartományoknál megbízhatóak.
A használni kívánt módszer kiválasztásakor vizsgálni kell az anyag és a mintatartó közötti kémiai reakciók lehetőségét.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
A lobbanáspont az a 101,325 kPa nyomásra korrigált legalacsonyabb hőmérséklet, amelyen a vizsgálati módszerben meghatározott feltételek mellett valamely folyadék olyan mennyiségben fejleszt gőzt, hogy a vizsgálati tartályban meggyújtható gőz/levegő keverék jön létre.
Mértékegységek: oC
t = T – 273,15
(t oC-ban és T K-ben)
1.3. REFERENCIAANYAGOK
Nem kell minden új anyag vizsgálatakor referenciaanyagot használni. Ezeknek elsősorban arra kell szolgálniuk, hogy időnként ellenőrizzék a módszer megfelelőségét, és lehetővé tegyék az összehasonlítást más módszerekkel nyert eredményekkel.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Az anyagot vizsgálati tartályban helyezik el, és felmelegítik vagy lehűtik az egyes vizsgálati módszerekben leírt eljárásnak megfelelő vizsgálati hőmérsékletre. Gyújtási kísérleteket végeznek azért, hogy meggyőződjenek arról, fellobban-e vagy sem a minta a vizsgálati hőmérsékleten.
1.5. MINŐSÉGI KÖVETELMÉNYEK
1.5.1. Ismételhetőség
Az ismételhetőség a lobbanáspont-tartománynak és az alkalmazott vizsgálati módszernek megfelelően változik; maximum 2 oC.
1.5.2. Érzékenység
Az érzékenység az alkalmazott vizsgálati módszertől függ.
1.5.3. Alkalmazhatóság
Néhány vizsgálati módszer alkalmazhatósága bizonyos lobbanáspont-tartományokra korlátozódik, és az anyaggal kapcsolatos adatoktól (például magas viszkozitás) függ.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
A vizsgált anyagból vett mintát valamilyen vizsgáló készülékben helyezik el az 1.6.3.1. és/vagy 1.6.3.2. pontnak megfelelően.
Energiadús vagy toxikus anyagokhoz biztonsági okok miatt ajánlatos kis, körülbelül 2 cm3 mintaméretet használó módszert alkalmazni.
1.6.2. Vizsgálati körülmények
A készüléket, amennyiben ez biztonsági szempontból megfelel, huzatmentes helyre kell helyezni.
1.6.3. A vizsgálat végrehajtása
1.6.3.1. Egyensúlyi módszer
Lásd az ISO 1516, ISO 3680, ISO 1523, ISO 3679-es szabványt.
1.6.3.2. Nem egyensúlyi módszer
Ábel-féle készülék:
Lásd a BS 2000 170. részét, az NF M07-011, NF T66-009 szabványt.
Ábel–Pensky-féle készülék:
Lásd az EN 57, DIN 51755 1. részét (5-től 65 oC-ig terjedő hőmérsékletekhez), a DIN 51755 2. részét (5 oC alatti hőmérsékletekhez), az NF M07-036 szabványt.
Tag-féle készülék:
Lásd az ASTM D 56 szabványt.
Pensky-Martens-féle készülék:
Lásd az ISO 2719, EN 11, DIN 51758, ASTM D 93, BS 2000-34, NF M07-019 szabványt.
Megjegyzések:
Amennyiben az 1.6.3.2. pontban szereplő, nem egyensúlyi módszerrel meghatározott lobbanáspontról megállapítják, hogy az értéke 0 ± 2 oC, 21 ± 2 oC vagy 55 ± 2 oC, ezt az eredményt meg kell erősíteni az ugyanezt a készüléket használó valamilyen egyensúlyi módszerrel.
Bejelentéshez csak azok a módszerek használhatók, amelyek megadják a lobbanáspont hőmérsékletét.
Oldószereket tartalmazó, viszkózus folyadékok (festékek, ragasztóanyagok és ehhez hasonlóak) lobbanáspontjának meghatározásához csak viszkózus folyadékok lobbanáspontjának meghatározására alkalmas készülékek és vizsgálati módszerek használhatók.
Lásd az ISO 3679, ISO 3680, ISO 1523, DIN 53213 1. részét.
|
2. |
ADATOK |
3. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az anyag pontos leírását (azonosítás és szennyeződések), |
|
— |
meg kell adni az alkalmazott módszert, valamint minden esetleges eltérést, |
|
— |
az eredményeket és az eredmények értelmezése szempontjából lényeges minden további megjegyzést. |
4. SZAKIRODALOM
Nincs.
A.10. TŰZVESZÉLYESSÉG (SZILÁRD ANYAGOK)
1. MÓDSZER
1.1. BEVEZETÉS
E vizsgálat végrehajtásához hasznos előzetes információkat szerezni az anyag lehetséges robbanási tulajdonságairól.
Ezt a vizsgálatot csak porszerű, szemcsés vagy pasztaszerű anyagokhoz szabad alkalmazni.
Ahhoz, hogy ne vizsgáljanak minden meggyújtható anyagot, hanem csak azokat, amelyek hevesen égnek, vagy égési tulajdonságai valamilyen ok miatt különösen veszélyesek, csak azok az anyagok tekinthetők tűzveszélyesnek, amelyek égési sebessége meghalad egy bizonyos határértéket.
A tűz eloltásakor jelentkező nehézségek miatt különösen veszélyes lehet, ha a fémporban izzás terjed. A fémporokat tűzveszélyesnek kell tekinteni, ha az anyagban az izzás terjedése egy előírt időtartamon belül van.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Égési idő, másodpercben kifejezve.
1.3. REFERENCIAANYAGOK
Nincs megadva.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Az anyagot megszakítás nélküli, körülbelül 250 mm hosszú csíkba vagy porsávba rendezik, és előzetes vizsgálatot hajtanak végre annak meghatározására, hogy gázlánggal meggyújtva lánggal terjed-e vagy parázslik-e. Amennyiben az előírt időtartamon belül a porcsík 200 mm-es szakasza mentén bekövetkezik a terjedés, teljes vizsgálati programot hajtanak végre az égési sebesség meghatározása érdekében.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincs megadva.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előzetes screening vizsgálat
Az anyagot körülbelül 250 mm hosszú, 20 mm széles és 10 mm magas, megszakítás nélküli csíkba vagy porsávba rendezik egy nem éghető, nem porózus és alacsony hővezető-képességű alaplemezen. Egy (legalább 5 mm átmérőjű) gázégőből forró lángot bocsátanak a porcsík egyik végére mindaddig, amíg a por meg nem gyullad, vagy maximum 2 percig (fémek vagy fémötvözetek porai esetében 5 percig). Figyelni kell, hogy az égés tovaterjed-e a csík 200 mm-es szakasza mentén a 4 perces vizsgálati időtartamon belül (vagy fémporok esetében 40 perc alatt). Amennyiben az anyag nem gyullad meg, és lángolva vagy parázzsal nem továbbítja az égést a porcsík 200 mm-es szakasza mentén a 4 perces (vagy 40 perces) vizsgálati időtartamon belül, akkor az anyagot nem szabad tűzveszélyesnek tekinteni, és további vizsgálat nem szükséges. Amennyiben az anyag kevesebb mint 4 perc alatt vagy fémporok esetében kevesebb mint 40 perc alatt továbbítja az égést a porcsík 200 mm-es szakasza mentén, az alábbiakban (az 1.6.2. pontban és azt követően) leírt eljárást végre kell hajtani.
1.6.2. Égési sebesség vizsgálata
1.6.2.1. Előkészület
Egy 250 mm hosszú, háromszög keresztmetszetű, 10 mm belső magasságú és 20 mm szélességű formába lazán betöltik a porszerű vagy szemcsés anyagokat. A forma mindkét oldalán, hosszirányban, két fémlemezt helyeznek el oldalsó határoló felületként, amelyek 2 mm-rel túlnyúlnak a háromszög keresztmetszetű alakzat felső szélén (lásd az ábrát). A formát ezután háromszor leejtik 2 cm magasságból valamilyen szilárd felületre. Amennyiben szükséges, a formát újból feltöltik vizsgálati anyaggal. Az oldalhatárolókat ezután eltávolítják, és a felesleges anyagot lekaparják. Valamilyen nem éghető, nem porózus és alacsony hővezető-képességű alaplemezt helyeznek a forma tetejére, a készüléket megfordítják és a formát eltávolítják.
A pasztaszerű anyagokat nem éghető, nem porózus és kis hővezető-képességű alaplemezen terítik el 250 mm hosszúságú és körülbelül 1 cm2 keresztmetszetű kötél alakjában.
1.6.2.2. Vizsgálati körülmények
Nedvszívó anyag esetében a vizsgálatot az anyagnak a tartályból történt eltávolítása után a lehető leggyorsabban kell végrehajtani.
1.6.2.3. A vizsgálat végrehajtása
A halmot az elszívószekrény huzatába kell elhelyezni.
A levegősebességnek elegendőnek kell lennie ahhoz, hogy megakadályozza az égéstermékeknek a laboratóriumba szökését, és ezt nem szabad változtatni a vizsgálat során. Huzaternyőt kell felszerelni a készülék köré.
Gázégőből (legalább 5 mm átmérőjű) kibocsátott forró lángot használnak az anyaghalom egyik végén történő meggyújtására. Amikor a halom már 80 mm távolságig égett, megmérik az égési sebességet a következő 100 mm mentén.
A vizsgálatot hatszor hajtják végre, minden alkalommal tiszta, hideg lemezt használva, kivéve ha korábban pozitív eredményt kaptak.
2. ADATOK
Az értékeléshez az előzetes szűrővizsgálat (1.6.1.) során nyert égési idő és a legfeljebb hat vizsgálatban (1.6.2.3.) nyert legrövidebb égési idő kell.
3. VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az anyag pontos leírását (azonosítás és szennyeződések), |
|
— |
a vizsgált anyag leírását, ennek fizikai állapotát, beleértve a nedvességtartalmat, |
|
— |
az előzetes screening-vizsgálat és az égési sebesség vizsgálata során nyert eredményeket, amennyiben végeztek ilyen vizsgálatokat, |
|
— |
az eredmények értelmezése szempontjából lényeges minden további megjegyzést. |
3.2. AZ EREDMÉNYEK ÉRTELMEZÉSE
A porszerű, szemcsés vagy pasztaszerű anyagokat tűzveszélyesnek kell tekinteni, amennyiben az 1.6.2. pontban leírt vizsgálati eljárásnak megfelelően végrehajtott bármely vizsgálat során az égési idő kevesebb mint 45 másodperc. Fémek vagy fémötvözetek porait tűzveszélyesnek kell tekinteni, amennyiben meggyújthatók, és a láng vagy a reakciózóna 10 perc vagy ennél rövidebb idő alatt halad keresztül a teljes mintán.
4. FELHASZNÁLT IRODALOM
NF T 20-042 (SEPT 85). Chemical products for industrial use. Determination of the flammability of solids.
Függelék
Ábra
Forma és tartozékok a halom elkészítéséhez
(Minden métet mm-ben van megadva)

A.11. TŰZVESZÉLYESSÉG (GÁZOK)
1. MÓDSZER
1.1. BEVEZETÉS
A módszer lehetővé teszi annak meghatározását, hogy levegővel kevert, szobahőmérsékletű (körülbelül 20 oC-os) és légköri nyomású gázok tűzveszélyesek-e, és ha igen, milyen koncentrációtartományban. A vizsgálati gáz levegővel alkotott, egyre növekvő gázkoncentrációjú keverékeit elektromos szikra hatásának teszik ki, és figyelik, hogy előfordul-e gyulladás.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
A tűzveszélyességi tartomány az alsó és felső robbanási határ közötti koncentrációtartomány. Az alsó és felső robbanási határ a levegővel kevert, kismértékben tűzveszélyes gáznak azon koncentrációhatárai, amelyeknél nem jön létre lángterjedés.
1.3. REFERENCIAANYAGOK
Nincs megadva.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Lépésenként növelik a gázkoncentrációt a levegőben, és a keveréket minden egyes szakaszban elektromos szikra hatásának teszik ki.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincs megadva.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Készülék
A vizsgálati tartály egy függőleges, 50 mm minimális belső átmérőjű és 300 mm minimális magasságú üveghenger. A gyújtóelektródák 3–5 mm távolságra vannak egymástól, és a henger aljától 60 mm-re helyezkednek el. A hengert nyomásmentesítő nyílással szerelték fel. A készüléket védőburkolattal kell ellátni mindenféle robbanásveszély korlátozására.
Gyújtóforrásként 0,5 szekundum időtartamú, álló, indukciós szikrát használnak, amelyet 10– 15 kV kimeneti feszültségű (bemeneti teljesítmény maximum 300 W), nagyfeszültségű transzformátor hoz létre. A (2) szakirodalom az alkalmas készülék egy példáját írja le.
1.6.2. Vizsgálati körülmények
A vizsgálatot szobahőmérsékleten (körülbelül 20 oC) kell végrehajtani.
1.6.3. A vizsgálat végrehajtása
Adagoló szivattyúk segítségével ismert koncentrációjú, levegőbe kevert gázt visznek be az üveghengerbe. Szikrát vezetnek a keveréken keresztül, és megfigyelik, hogy elválik-e a láng a gyújtóforrástól és terjed-e önállóan. A gázkoncentrációt 1 térfogatszázalékos lépésekben változtatják, amíg be nem következik a gyulladás a fentieknek megfelelően.
Amennyiben a gáz kémiai szerkezete azt jelzi, hogy az valószínűleg nem tűzveszélyes, és kiszámítható a levegővel alkotott sztöchiometrikus keveréke, akkor csak a sztöchiometriai összetételnél 10 %-kal kisebb értékűtől a 10 %-kal nagyobb összetételig terjedő tartományban lévő keverékeket kell megvizsgálni 1 %-os lépésekben.
2. ADATOK
E tulajdonság meghatározásához a lángterjedés előfordulása az egyetlen lényeges információ.
3. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az anyag pontos leírását (azonosítás és szennyeződések), |
|
— |
a vizsgálathoz használt készülék leírását, a méreteivel együtt, |
|
— |
azt a hőmérsékletet, amelyen a vizsgálatot végrehajtották, |
|
— |
a vizsgált koncentrációkat és a kapott eredményeket, |
|
— |
a vizsgálat eredményét: nem tűzveszélyes gáz vagy tűzveszélyes gáz, |
|
— |
amennyiben arra a következtetésre jutottak, hogy a gáz nem tűzveszélyes, meg kell adni azt a koncentrációtartományt, amely felett 1 %-os lépésekben vizsgálták meg, |
|
— |
az eredmények értelmezéséhez szükséges minden információt és megjegyzést közölni kell. |
4. SZAKIRODALOM
|
(1) |
NF T 20-041 (SEPT 85). Chemical products for industrial use. Determination of the flammability of gases. |
|
(2) |
W. Berthold, D. Conrad, T. Grewer, H. Crosse-Wortmann, T. Redeker und H. Schacke. „Entwicklung einer Standard-Apparatur zur Messung von Explosionsgrenzen”. Chem.-Ing.-Tech. 1984, vol. 56, 2, 126-127. |
A.12. TŰZVESZÉLYESSÉG (ÉRINTKEZÉS VÍZZEL)
1. MÓDSZER
1.1. BEVEZETÉS
E vizsgálati módszer annak meghatározására használható, hogy valamely anyag vízzel vagy nedves levegővel létrejött reakciója olyan gáz vagy gázok fejlődéséhez vezet-e, amelyek tűzveszélyesek.
A vizsgálati módszer mind szilárd, mind folyékony anyagokhoz alkalmazható. E módszer nem alkalmazható olyan anyagoknál, amelyeknél öngyulladás lép fel, amikor levegővel érintkeznek.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Tűzveszélyesek: azok az anyagok, amelyek vízzel vagy nedves levegővel érintkezve veszélyes mennyiségben, minimum 1 liter/kg/óra ütemben fejlesztenek tűzveszélyes gázokat.
1.3. A VIZSGÁLATI MÓDSZER ELVE
Az anyagot az alábbi lépések sorrendjének megfelelően vizsgálják; amennyiben valamely lépésnél gyulladás következik be, további vizsgálat nem szükséges. Amennyiben ismert, hogy az anyag nem lép erőteljes reakcióba vízzel, tovább kell haladni a 4. lépéshez (1.3.4.).
1.3.1. 1. lépés
A vizsgált anyagot elhelyezik egy 20 oC-os hőmérsékletű desztillált vizet tartalmazó tálba, és figyelik, hogy a fejlődő gáz meggyullad-e.
1.3.2. 2. lépés
A vizsgált anyagot egy 20 oC-os hőmérsékletű desztillált vizet tartalmazó edény felületén lebegő szűrőpapírra helyezik, és figyelik, hogy a fejlődő gáz meggyullad-e. A szűrőpapír arra szolgál, hogy egy helyen tartsa az anyagot a gyulladás lehetőségének növelésére.
1.3.3. 3. lépés
A vizsgált anyagot egy körülbelül 2 cm magas és 3 cm átmérőjű halomba helyezik. Néhány csepp vizet adnak hozzá a halomhoz, és figyelik, hogy a fejlődő gáz meggyullad-e.
1.3.4. 4. lépés
A vizsgált anyagot 20 oC-os hőmérsékletű desztillált vízzel keverik, és a gázfejlődés sebességét 7 órán keresztül mérik, 1 órás időközönként. Amennyiben a gázfejlődés sebessége egyenetlen vagy növekszik, 7 óra után a mérési időt meg kell növelni maximum 5 napra. A vizsgálat megállítható, ha a sebesség bármikor az 1 liter/kg/órát meghaladja.
1.4. REFERENCIAANYAGOK
Nincs megadva.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincs megadva.
1.6. A VIZSGÁLATI MÓDSZEREK LEÍRÁSA
1.6.1. 1. lépés
1.6.1.1. Vizsgálati körülmények
A vizsgálatot szobahőmérsékleten (körülbelül 20 oC-on) hajtják végre.
1.6.1.2. A vizsgálat végrehajtása
Desztillált vizet tartalmazó tálba kismennyiségű (körülbelül 2 mm átmérőjű) vizsgált anyagot kell helyezni. Figyelni kell, hogy i) fejlődik-e gáz; és hogy ii) meggyullad-e a gáz. Amennyiben a gáz meggyullad, nincs szükség az anyag további vizsgálatára, mivel az anyagot veszélyesnek kell tekinteni.
1.6.2. 2. lépés
1.6.2.1. Készülék
Valamilyen alkalmas tartályban, például egy 100 mm átmérőjű lepárlóedényben lévő desztillált víz felszínén szűrőpapírt lebegtetnek.
1.6.2.2. Vizsgálati körülmények
A vizsgálatot szobahőmérsékleten (körülbelül 20 oC-on) hajtják végre.
1.6.2.3. A vizsgálat végrehajtása
A szűrőpapír közepére kismennyiségű (körülbelül 2 mm átmérőjű) vizsgált anyagot helyeznek. Figyelni kell, hogy i. fejlődik-e gáz; és hogy ii. meggyullad-e. Amennyiben a gáz meggyullad, nincs szükség az anyag további vizsgálatára, mivel az anyagot veszélyesnek kell tekinteni.
1.6.3. 3. lépés
1.6.3.1. Vizsgálati körülmények
A vizsgálatot szobahőmérsékleten (körülbelül 20 oC-on) hajtják végre.
1.6.3.2. A vizsgálat végrehajtása
A vizsgált anyagot körülbelül 2 cm magasságú és 3 cm átmérőjű, a tetején mélyedéssel ellátott halomba helyezik. Néhány csepp vizet adnak a bemélyedt részhez, és figyelik, hogy i. fejlődik-e gáz; és hogy ii. meggyullad-e. Amennyiben a gáz meggyullad, az anyag további vizsgálatára nincs szükség, mivel az anyagot veszélyesnek kell tekinteni.
1.6.4. 4. lépés
1.6.4.1. Készülék
A készülék felépítését az ábra mutatja.
1.6.4.2. Vizsgálati körülmények
Vizsgálni kell a vizsgált anyagot tartalmazó tartályt, hogy van-e benne 500 μm-nél kisebb (részecskeméretű) por. Amennyiben a por a teljes anyag több mint 1 tömegszázaléka, vagy ha a minta morzsálódik, akkor a teljes anyagot porrá kell őrölni vizsgálat előtt a tárolás és kezelés alatti részecskeméret csökkenésének figyelembevétele érdekében; egyébként az anyagot olyan állapotban kell megvizsgálni, ahogyan átvették. A vizsgálatot szobahőmérsékleten (körülbelül 20 oC-on) és légköri nyomáson kell végrehajtani.
1.6.4.3. A vizsgálat végrehajtása
10–20 ml vizet öntenek a készülék csepegtetőtölcsérébe, és 10 gramm anyagot helyeznek a kúp alakú lombikba. A fejlődő gáz térfogata bármilyen, erre alkalmas eszközzel mérhető. Kinyitják a csepegtetőtölcsér elzárócsapját, hogy beengedjék a vizet a kúp alakú lombikba, és elindítanak egy stopperórát. A gázfejlődést óránként mérik a 7 órás időtartam során. Amennyiben ez alatt az időtartam alatt a gázfejlődés egyenetlen, vagy ha az időtartam végén növekszik a gázfejlődés sebessége, a méréseket folytatni kell, legfeljebb öt napig. Amennyiben a mérés során bármikor a gázfejlődés sebessége meghaladja az 1 liter/kg/órát, a vizsgálat megszakítható. Ezt a vizsgálatot háromszor kell elvégezni.
Amennyiben ismeretlen a gáz kémiai összetétele, elemezni kell a gázt. Amennyiben a gáz tűzveszélyes komponenseket tartalmaz, és nem ismert, hogy a teljes keverék tűzveszélyes-e, vagy sem, ugyanolyan összetételű keveréket kell készíteni, és megvizsgálni az A. 11. módszernek megfelelően.
2. ADATOK
Az anyagot veszélyesnek kell tekinteni, ha:
|
— |
öngyulladás jön létre a vizsgálati eljárás bármelyik lépésében, vagy |
|
— |
1 liter/kg anyag/óránál nagyobb sebességgel fejlődik kismértékben tűzveszélyes gáz. |
3. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az anyag pontos leírását (azonosítás és szennyeződések), |
|
— |
a vizsgált anyag minden előkészítésének részleteit, |
|
— |
a vizsgálatok eredményeit (1., 2., 3. és 4. lépés), |
|
— |
a fejlődő gáz kémiai összetételét, |
|
— |
a gázfejlődés sebességét, ha a 4. lépést (1.6.4.) végrehajtják, |
|
— |
az eredmények értelmezéséhez lényeges minden további megjegyzést. |
4. SZAKIRODALOM
|
(1) |
Recommendation on the transport of dangerous goods, test and criteria, 1990, United Nations, New York. |
|
(2) |
NF T 20-040 (SEPT 85). Chemical products for industrial use. Determination of the flammability of gases formed by the hydrolysis of solid and liquid products. |
Függelék
Ábra
Készülék

A.13. SZILÁRD ANYAGOK ÉS FOLYADÉKOK ÖNGYULLADÁSI KÉPESSÉGE
1. MÓDSZER
1.1. BEVEZETÉS
A vizsgálati eljárás olyan szilárd vagy folyékony anyagoknál alkalmazható, amelyek kis mennyiségekben öngyulladással meggyulladnak rövid idővel azután, hogy érintkezésbe lépnek a szobahőmérsékletű (körülbelül 20 oC-os) levegővel.
Azokra az anyagokra, amelyeket a gyulladás bekövetkezése előtt órákon vagy napokon át szobahőmérséklet vagy magas hőmérséklet hatásának kell kitenni, e vizsgálati módszer nem vonatkozik.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Azok az anyagok tekinthetők pirofórosnak, amelyek meggyulladnak, vagy az 1.6. pontban leírt feltételek mellett szenesedést okoznak.
Folyadékoknál lehet, hogy az öngyulladást is meg kell vizsgálni az öngyulladási hőmérséklet (folyadékok és gázok) című A.15. módszer segítségével.
1.3. REFERENCIAANYAGOK
Nincs megadva.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A szilárd vagy folyékony anyagot hozzáadják egy inert hordozóanyaghoz, és környezeti hőmérsékleten érintkezésbe hozzák a levegővel 5 perces időtartamig. Amennyiben a folyékony anyagok nem gyulladnak meg ilyen körülmények között, azokat szűrőpapírral felitatják, és környezeti hőmérsékleten (körülbelül 20 oC-on) levegő hatásának teszik ki 5 percre. Amennyiben a szilárd vagy folyékony anyag meggyullad, vagy a folyékony anyag meggyújtja vagy elszenesíti a szűrőpapírt, akkor az anyagot pirofórosnak tekintik.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Ismételhetőség: a biztonsággal kapcsolatos jelentősége miatt egyetlen pozitív eredmény elegendő ahhoz, hogy az anyagot pirofórosnak tekintsék.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Készülék
Egy körülbelül 10 cm átmérőjű porceláncsészét szobahőmérsékleten (körülbelül 20 oC-on) megtöltenek kovafölddel körülbelül 5 mm magasságig.
Megjegyzés:
A kovaföldet vagy bármilyen más, ehhez hasonló inert anyagot, amely könnyen beszerezhető, úgy kell kiválasztani, hogy olyan talajra legyen reprezentatív, amelyre a vizsgált anyag baleset esetén kifolyhat.
Száraz szűrőpapír szükséges olyan folyadékok vizsgálatához, amelyek levegővel érintkezve nem gyulladnak meg inert hordozóanyaggal történő érintkezéskor.
1.6.2. A vizsgálat végrehajtása
a) Porszerű szilárd anyagok
A vizsgálandó porszerű anyagból 1–2 cm3-t kiöntenek körülbelül 1 méter magasságról egy nem éghető felületre, és figyelik, hogy meggyullad-e az anyag a leejtés során vagy az öntéstől számított 5 percen belül.
A vizsgálatot hat alkalommal hajtják végre, kivéve ha meggyullad az anyag.
b) Folyadékok
Körülbelül 5 cm3 vizsgált folyadékot öntenek az előkészített porceláncsészébe, és figyelik, hogy 5 percen belül meggyullad-e az anyag.
Amennyiben nem gyullad meg a hatszor elvégzett vizsgálat során, a következő vizsgálatokat hajtják végre:
Fecskendőből 0,5 ml vizsgált anyagot helyeznek egy bevagdosott szűrőpapírra, és figyelik, hogy megyullad-e, illetve elszenesedik-e a szűrőpapír a folyadék hozzáadásától számított 5 percen belül. A vizsgálatot háromszor hajtják végre, kivéve ha meggyullad vagy elszenesedik a szűrőpapír.
2. ADATOK
2.1. AZ EREDMÉNYEK KEZELÉSE
A vizsgálat abbahagyható, amennyiben valamelyik vizsgálat eredménye pozitív.
2.2. ÉRTÉKELÉS
Amennyiben valamely inert hordozóanyaghoz való hozzáadás és levegő hatásának való expozíció után az anyag 5 percen belül meggyullad, vagy valamely folyékony anyag a levegő hatásának való expozíció után 5 percen belül elszenesít vagy meggyújt egy szűrőpapírt, az anyagot pirofórosnak tekintik.
3. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az anyag pontos leírását (azonosítás és szennyeződések), |
|
— |
a vizsgálatok eredményeit, |
|
— |
az eredmények értelmezése szempontjából lényeges minden további megjegyzést. |
4. SZAKIRODALOM
|
(1) |
NF T 20-039 (SEPT 85). Chemical products for industrial use. Determination of the spontaneous flammability of solids and liquids. |
|
(2) |
Recommendations on the Transport of Dangerous Goods, Test and criteria, 1990, United Nations, New York. |
A.14. ROBBANÁSI TULAJDONSÁGOK
1. MÓDSZER
1.1. BEVEZETÉS
A módszer egy vizsgálatvázlatot ismertet annak meghatározására, hogy robbanásveszélyes-e valamely szilárd vagy pépes anyag, amikor láng (hőérzékenység), illetve ütés vagy súrlódás (mechanikai hatással szembeni érzékenység) hatásának van kitéve, és hogy robbanásveszélyes-e valamely folyékony anyag, amikor láng vagy ütés hatásának van kitéve.
A módszer három részből áll:
|
a) |
hőérzékenység vizsgálata (1); |
|
b) |
ütéssel kapcsolatos mechanikai hatással szembeni érzékenység vizsgálata (1); |
|
c) |
súrlódással kapcsolatos mechanikai hatással szembeni érzékenység vizsgálata (1). |
A módszer bizonyos általános határ segítségével adatokat ad meg a robbanás bekövetkezése valószínűségének meghatározására. A módszert nem annak megállapítására tervezték, hogy bizonyos körülmények között képes-e az anyag robbanásra.
A módszer alkalmas annak meghatározására, hogy az anyag robbanásveszélyes-e (hő- és mechanikai hatással szembeni érzékenység) az irányelvben előírt különleges körülmények között. A módszer alapja számos, nemzetközileg széles körben használt készüléktípus (1), amelyek rendszerint kielégítő eredményeket adnak. Ismert, hogy a módszer nem ad végleges eredményt. A megadott készülék helyett használható más készülék, feltéve hogy az nemzetközileg elismert, és hogy az eredmények összeegyeztethetők a megadott készülékkel kapott eredményekkel.
A vizsgálatokat nem kell végrehajtani, amikor a rendelkezésre álló termodinamikai információk (például képződéshő, bomláshő) és/vagy a szerkezeti képletben egyes reakcióképes csoportok hiánya (2) vitathatatlanul bizonyossá teszi, hogy az anyag nem képes gázképződéssel vagy hőfelszabadulással járó gyors bomlásra (vagyis az anyag nem jelent semmilyen robbanásveszélyt). Folyadékoknál nincs szükség súrlódással kapcsolatos mechanikai hatással szembeni érzékenységvizsgálatra.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Robbanásveszélyes:
Azok az anyagok, amelyek láng hatására robbanhatnak, vagy amelyek a megadott készülékben az ütésre vagy rázásra érzékenyek (vagy mechanikai hatással szemben érzékenyebbek, mint az 1,3-dinitro-benzol az alternatív készülékben).
1.3. REFERENCIAANYAGOK
1,3-dinitro-benzol, 0,5 mm-es szitán átszitált, rostált, kristályos technikai termék, a súrlódást és ütést vizsgáló módszerekhez.
Vizes ciklohexánonból átkristályosított, nedvesen szitált, 250 μm nyíláson átmenő és 150 μm nyílásméretű szitán visszamaradó, 103 ± 2 oC hőmérsékleten (4 órán át) szárított Perhidro-1,3,5-trinitro-1,3,5-triazin (RDX, hexogén, ciklonit – CAS 121-82-4) a második súrlódás- és ütésvizsgálat-sorozathoz.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Előzetes vizsgálatok szükségesek a három érzékenységvizsgálat végrehajtása érdekében a biztonságos körülmények létrehozásához.
1.4.1. Biztonság a kezelés során – vizsgálatok (3)
Biztonsági okok miatt a fő vizsgálatok végrehajtása előtt kismennyiségű (körülbelül 10 mg) anyagmintát – anélkül, hogy gázlángba beleérne – hevítenek, alkalmas formájú készülékben ütéssel, és egy üllőn fakalapács használatával vagy súrlódást létrehozó géppel súrlódás hatásának teszik ki. E vizsgálat célja meggyőződni arról, hogy érzékeny-e és robbanásveszélyes-e annyira az anyag, hogy az előírt érzékenységi vizsgálatokat, különösen a hőhatással szembeni érzékenységvizsgálatot, különleges óvintézkedések mellett kell-e végrehajtani a vizsgálatot végző személy sérülésének elkerülésére.
1.4.2. Hőérzékenység
A módszer magában foglalja az anyagnak a különböző nyílásátmérőjű mérőperemek által lezárt acélcsőben történő melegítését annak meghatározására, hogy hajlamos-e robbanásra az anyag erős hevítés és meghatározott mértékű fojtás mellett.
1.4.3. Mechanikai hatással szembeni érzékenység (ütés)
A módszer magában foglalja az anyag expozícióját olyan ütés hatásának, amelyet egy megadott magasságról leejtett, megadott tömeg hoz létre.
1.4.4. Mechanikai hatással szembeni érzékenység (súrlódás)
A módszer magában foglalja a szilárd vagy pépes anyagok expozícióját súrlódás hatásának, szabványosított felületek között, előírt terheléssel és relatív elmozdulással.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincs megadva.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Hőérzékenység (láng hatása)
1.6.1.1. Készülék
A készülék egy fűtő- és védőkészülékbe szerelt, újra fel nem használható acélcsőből, valamint annak újrahasználható zárószerkezetéből áll (1. ábra). Valamennyi cső acéllemezből, mélyhúzással készült (lásd a függeléket), 24 mm belső átmérőjű, 75 mm hosszúságú és 0,5 mm falvastagságú. A csövek a nyitott végükön peremmel vannak ellátva azért, hogy lezárhatók legyenek a zárólemez-szerkezettel. Ez egy központi furattal rendelkező, a csőhöz kétrészes csatlakozással (anya és menetes gyűrű) szorosan rögzített, nyomásálló zárólemezből áll. Az anya és a menetes gyűrű króm-mangán acélból készült (lásd a függeléket), amely egészen 800 oC hőmérsékletig szikramentes. A zárólemezek 6 mm vastagságú, hőálló acélból készültek (lásd a függeléket), és különböző nyílásátmérővel rendelkeznek.
1.6.1.2. Vizsgálati körülmények
Az anyagot az átvételkor rendszerint megvizsgálják, bizonyos esetekben, például préselt, öntött, vagy más módon tömörített anyagok esetében, szükség lehet az anyag aprítás utáni vizsgálatára.
Szilárd anyagok esetében az egyes vizsgálatok során használandó anyag mennyiségét kétszakaszos száraz futtatási eljárás segítségével határozzák meg. Egy kitáralt csövet, amelynek előzőleg megmérték az önsúlyát, megtöltenek 9 cm3 anyaggal, és az anyagot tömörítik a cső teljes keresztmetszetére ható 80 N erővel. Biztonsági okokból vagy olyan esetekben, ahol összenyomással változtatható a minta fizikai alakja, más töltési eljárások is használhatók; például ha az anyag nagyon érzékeny a súrlódásra, a tömörítés nem megfelelő. Amennyiben az anyag összenyomható, addig folytatják a további anyagbevitelt és tömörítést, amíg a cső felső vége alatt 55 mm-re van feltöltve. Meghatározzák a cső 55 mm-es szintjéig a feltöltéshez használt össztömeget, és hozzáadnak két további adagot, mindkettőt 80 N erővel tömörítve. Ezután szükség szerint, tömörítéssel hozzáadnak vagy kivesznek anyagot úgy, hogy a töltési szint a cső felső végétől 15 mm-re legyen. A második száraz futtatást, az első száraz futtatásban megállapított teljes tömeg egyharmadának tömörített mennyiségével kezdik el. Hozzáadnak két további ilyen adagot 80 N tömörítéssel, és a csőben az anyagszintet a cső felső végétől 15 mm-re állítják be, szükség szerint anyag hozzáadásával vagy elvételével. A második száraz futtatásban meghatározott anyagmennyiséget használják minden egyes vizsgálathoz; a megtöltést három egyenlő mennyiségben hajtják végre, mindegyiket 9 cm3-re sűrítik össze olyan erővel, amely ehhez szükséges. (Ez megkönnyíthető menetes gyűrűk segítségével.)
Folyadékokat és géleket 60 mm-es magasságig töltenek be a csőbe, a gélek esetében különös gondossággal kell eljárni annak megakadályozása érdekében, hogy üregek alakuljanak ki. A menetes gyűrűt alulról a csőre csúsztatják, behelyezik a megfelelő zárólemezt, és meghúzzák az anyát valamennyi molibdén-diszulfid bázisú kenőanyag felvitele után. Lényeges annak ellenőrzése, hogy nem került anyag a karima és a lemez közé vagy a menetekbe.
A hevítést nyomásszabályozóval (60–70 mbar) felszerelt ipari palackból egy áramlásmérőn átvezetett és a négy égőhöz elosztócsövön keresztül egyenletesen elosztott (amelyet az égőkből a lángok vizuális megfigyelése jelez) propán biztosítja. Az égőket az 1. ábrának megfelelően a vizsgálati kamra köré helyezték el. A négy gázégő együttes fogyasztása körülbelül 3,2 liter propán/perc. Használhatók más éghető gázok és égők, de a hevítési sebességnek a 3. ábrán megadottnak kell lennie. Minden készülék esetében a hevítési sebességet rendszeres időközönként ellenőrizni kell dibutil-ftaláttal megtöltött csövek segítségével a 3. ábrának megfelelően.
1.6.1.3. A vizsgálatok végrehajtása
Minden egyes vizsgálatot addig kell végezni, amíg a cső szét nem esik, vagy már 5 percig nem hevítették. Amennyiben a cső három vagy több darabra törik szét, amelyek néhány esetben a 2. ábrának megfelelően keskeny fémcsíkokkal összekapcsolhatók, ezt úgy értékelik, hogy robbanás történt. Az olyan vizsgálatokat, amelyeknél kevesebb töredék jön létre, vagy egyáltalán nem törik szét a cső, úgy tekintik, hogy nem eredményeznek robbanást.
Először egy három vizsgálatból álló vizsgálatsorozatot hajtanak végre 6,0 mm átmérőjű zárólemezzel, és ha nem történik robbanás, egy második, három vizsgálatból álló vizsgálatsorozat hajtanak végre 2,0 mm átmérőjű mérőperemmel. Amennyiben a két vizsgálatsorozat végrehajtása során valamelyiknél robbanás történik, nincs szükség további vizsgálatokra.
1.6.1.4. Kiértékelés
A vizsgálat eredményét pozitívnak tekintik, ha a fenti vizsgálatsorozatok valamelyikében robbanás történt.
1.6.2. Mechanikai hatással szembeni érzékenység (ütés)
1.6.2.1. Készülék (4. ábra)
Egy jellegzetes ejtőkalapácsos készülék lényeges részei egy alaplappal ellátott öntöttacél tömb, üllő, oszlop, vezetők, ejtősúlyok, kioldó készülék és egy mintatartó. A 100 mm (átmérőjű) × 70 mm (magasságú) acélüllőt a 450 mm (hosszúságú) × 450 mm (szélességű) × 60 mm (magasságú) öntött alaplappal ellátott, 230 mm (hosszúságú) × 250 mm (szélességű) × 200 mm (magasságú) acéltömb tetejéhez csavarozzák. Egy varratmentes húzott acélcsőből készült oszlopot rögzítettek az acéltömb hátsó részéhez csavarozott tartóba. Négy csavar rögzíti a készüléket egy tömör, 60 × 60 × 60 cm-es betontömbhöz úgy, hogy a vezető sínek tökéletesen függőlegesek, és az ejtősúly szabadon esik. A vizsgálathoz 5 és 10 kg-os, tömör acélból készült súlyokat alkalmaznak. Minden egyes súly ütőfeje HRC 60–63 keménységű és 25 mm-es minimális átmérőjű edzett acél.
A vizsgált mintát két koaxiális, egymás fölött elhelyezett, tömör acélhengerből álló ütőkészülékbe zárják egy hengeres acél vezetőgyűrű bemélyedésében. A tömör acélhengerek 10 (-0,003, -0,005) mm átmérőjűek és 10 mm magasságúak, és felületük csiszolt, szélük lekerekített (0,5 mm-es görbületi sugár), és HRC 58–65 keménységűek. A hengermélyedés külső átmérője 16 mm, magassága 13 mm, és egy 10 (+0,005, +0,010) mm-es csiszolt furattal kell rendelkeznie. Az ütőkészüléket acélból készült (26 mm átmérőjű és 26 mm magasságú), közbeeső üllőre szerelték, és egy, a füstgázok távozását lehetővé tevő, perforált gyűrűvel állítják középpontba.
1.6.2.2. Vizsgálati körülmények
A minta térfogata 40 mm3 vagy valamilyen alternatív készülékhez megfelelő térfogatú legyen. A szilárd anyagokat száraz állapotban kell vizsgálni, és a következőképpen kell előkészíteni:
|
a) |
a por alakú anyagokat szitálják (0,5 mm-es szitaméret); a szitán átjutó anyagot használják a vizsgálathoz; |
|
b) |
a préselt, öntött vagy más módon tömörített anyagokat kis darabokra törik és szitálják; a 0,5 és 1 mm közötti átmérőjű szitált frakciót használják a vizsgálathoz, a szitált frakciónak az eredeti anyagra reprezentatívnak kell lennie. |
Az általában pép formájában szállított anyagokat, amennyiben lehetséges, száraz állapotban, vagy minden esetben a lehető legnagyobb mennyiségű oldószer eltávolítását követően kell vizsgálni. A folyékony anyagokat a felső és alsó acélhengerek között 1 mm-es réssel vizsgálják.
1.6.2.3. A vizsgálatok végrehajtása
Hat vizsgálatból álló vizsgálatsorozatot hajtanak végre, a 10 kg-os tömeget 0,40 méterről (40 J) ejtik le. Amennyiben robbanás következik be a 40 J-lal végrehajtott hat vizsgálat valamelyike során, további hat vizsgálatból álló vizsgálatsorozatot kell végrehajtani, ahol 5 kg-os tömeget kell leejteni 0,15 méterről (7,5 J). Más készülékekben a mintát összehasonlítják a kiválasztott referenciaanyaggal egy meghatározott eljárás (például fel-le módszer stb.) segítségével.
1.6.2.4. Értékelés
A vizsgálat eredményét pozitívnak tekintik, ha az előírt ütőkészülékkel végrehajtott vizsgálatok bármelyikében legalább egyszer robbanás következik be (ezzel egyenértékű a lángba borulás és/vagy durranás), vagy a minta érzékenyebbnek bizonyul, mint az 1,3-dinitro-benzol vagy az RDX valamelyik alternatív ütésvizsgálatban.
1.6.3. Mechanikai hatással szembeni érzékenység (súrlódás)
1.6.3.1. Készülék (5. ábra)
A súrlódásérzékenységet vizsgáló berendezés egy öntöttacél alaplemezből áll, amelyre a súrlódási érzékenységet vizsgáló készüléket felszerelték. Ez a készülék egy rögzített porcelánhengerből és egy mozgó porcelánlapból áll. A porcelánlapot egy kocsin tartják, amely két csúszópályán fut. A kocsit hajtórúd, hüvelyvonó karom és alkalmas hajtómű csatlakoztatja a villamos motorhoz úgy, hogy a porcelánlap csak egyszer mozdul előre és hátra 10 mm-t a porcelánhenger alatt. A porcelánhenger terhelhető, például 120 vagy 360 newtonnal.
A porcelánlapok fehér ipari porcelánból (9–32 μm érdesség) készültek, és 25 mm (hosszúság) × 25 mm (szélesség) × 5 mm (magasság) méretűek. A porcelánhenger ugyancsak fehér ipari porcelánból készült, és ez 15 mm hosszú, 10 mm átmérőjű és 10 mm görbületi sugarú, érdesített gömbszeletekkel rendelkezik.
1.6.3.2. Vizsgálati körülmények
A minta térfogata 10 mm3 vagy az adott alternatív berendezésnek megfelelő térfogatú legyen.
A szilárd anyagokat száraz állapotban vizsgálják, és a következőképpen készítik elő:
|
a) |
a por alakú anyagokat szitálják (0,5 mm-es szitaméret); a szitán átjutó anyagot használják a vizsgálathoz; |
|
b) |
a préselt, öntött vagy más módon tömörített anyagokat darabokra törik és szitálják; a < 0,5 mm átmérőjű szitált frakciót használják vizsgálathoz. |
Az általában pép formában szállított anyagokat, amennyiben lehetséges, száraz állapotban kell megvizsgálni. Amennyiben az anyag száraz állapotban nem készíthető el, a pépet (a lehető legnagyobb oldószermennyiség eltávolítása után) egy formával készített, 0,5 mm vastag, 2 mm széles, 10 mm hosszú filmként vizsgálják.
1.6.3.3. A vizsgálatok végrehajtása
A porcelánhengert a vizsgált mintára helyezik, és ráadják a terhelést. A vizsgálat végrehajtásakor a porcelánlap porozitási jelzésének harántirányban kell állnia a mozgás irányával. Ügyelni kell arra, hogy amikor a hengert a mintára helyezik, elegendő vizsgált anyag legyen a henger alatt, és a lap megfelelően mozogjon a henger alatt. Pépes anyagokhoz egy 2 × 10 mm-es nyílású, 0,5 mm vastag mérőeszközt használnak az anyag lapra történő felvitelére. A porcelánlapnak 10 mm-t kell előre és visszafelé mozognia a porcelánhenger alatt 0,44 másodpercen belül. A lap és henger felületének minden részét csak egyszer szabad használni; a henger két vége két vizsgálathoz, a lap két felülete felületenként három vizsgálathoz használható.
Hat vizsgálatból álló vizsgálatsorozatot hajtanak végre 360 N terheléssel. Amennyiben pozitív eredményt kapnak ez alatt a hat vizsgálat alatt, további hat vizsgálatból álló vizsgálatsorozatot kell végrehajtani 120 N terheléssel. Egy másik készülékben a mintát összehasonlítják a kiválasztott referenciaanyaggal egy erre meghatározott eljárás (például fel-le módszer) segítségével.
1.6.3.4. Értékelés
A vizsgálati eredmény akkor tekinthető pozitívnak, ha az előírt súrlódási érzékenységet vizsgáló berendezéssel végrehajtott vizsgálatok valamelyikében legalább egyszer robbanás jön létre (a robbanással egyenértékű a sercegés és/vagy a csattanás vagy lángba borulás), vagy egy alternatív súrlódásvizsgálat során teljesül az ezzel egyenértékű követelmény.
2. ADATOK
Elvben az anyagot az irányelv értelmében robbanásveszélyesnek kell tekinteni, ha a hő, ütés vagy súrlódási érzékenység vizsgálata során pozitív eredményt kapnak.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
a vizsgált anyag azonosítását, összetételét, tisztaságát, nedvességtartalmát stb., |
|
— |
a minta fizikai jellemzőit, és annak feltüntetését, hogy őrölték, aprították és/vagy szitálták-e az anyagot, |
|
— |
a hőérzékenységi vizsgálatok során tett megfigyeléseket (például a minta tömege, száma stb.), |
|
— |
a mechanikai hatással szembeni érzékenységvizsgálatok során tett megfigyeléseket (például jelentős mennyiségű füst képződése vagy teljes elbomlás csattanás nélkül, lángok, szikra, csattanás, sistergés, ropogás stb.), |
|
— |
minden egyes típusú vizsgálat eredményét, |
|
— |
ha alternatív készüléket használtak, meg kell adni az adott készülékkel kapott eredmények és az egyenértékű készülékkel kapott eredmények közötti korreláció tudományos indoklását, valamint prioritását, |
|
— |
minden hasznos megjegyzést, ilyen például a hivatkozás a hasonló termékekkel végrehajtott vizsgálatokra, amely lényeges lehet az eredmények megfelelő értelmezéséhez, |
|
— |
az eredmények értelmezése szempontjából lényeges minden további megjegyzést. |
3.2. AZ EREDMÉNYEK ÉRTELMEZÉSE ÉS ÉRTÉKELÉSE
A vizsgálati jelentésnek tartalmaznia kell minden hamis, rendellenes, illetve nem jellemző eredményt. Amennyiben a vizsgálatok közül bármelyiket figyelmen kívül kell hagyni, meg kell adni annak magyarázatát és minden alternatív vagy kiegészítő vizsgálat eredményeit. A rendellenes eredményt el kell fogadni névértéken, és az anyagot ennek megfelelően osztályozni kell, kivéve ha az eredmény megmagyarázható.
4. SZAKIRODALOM
|
(1) |
Recommendations on the Transport of Dangerous Goods: Tests and criteria, 1990, United Nations, New York. |
|
(2) |
Bretherick, L., Handbook of Reactive Chemical Hazards, 4th edition, Butterworths, London, ISBN 0-750- 60103-5, 1990. |
|
(3) |
Koenen, H., Ide, K.H. and Swart, K.H. Explosivstoffe, 1961, vol. 3, 6–13 and 30–42. |
|
(4) |
NF T 20-038 (Sept. 85). Chemical products for industrial use – Determination of explosion risk. |
Függelék
Példa az anyag meghatározására a hőérzékenységvizsgálathoz (lásd a DIN 1623 szabványt)
|
(1) |
Cső: 1.0336.505 g számú anyagmeghatározás. |
|
(2) |
Zárólemez: 1.4873 számú anyagmeghatározás. |
|
(3) |
Menetes gyűrű és anya: 1.3817 számú anyagmeghatározás. |
1. ábra
Hőérzékenységet vizsgáló készülék
(minden méret mm-ben van megadva)

2. ábra
Hőérzékenység-vizsgálat
Példák a széttörésre
3. ábra
Hevítési sebesség kalibrációja a hőérzékenység-vizsgálathoz
Egy zárt (1,5 mm-es zárólemez) csőben 3,2 liter/perces áramlási sebességű propán segítségével dibutil-ftalát (27 cm3) melegítésekor kapott hőmérséklet/idő görbe. A hőmérsékletet egy 1 mm átmérőjű, középre, 43 mm-rel a cső pereme alá helyezett rozsdamentes acéllal bevont kromel/alumel termoelemmel mérik. 135 oC és 285 oC között a hevítési sebességnek 185 és 215 K/perc között kell lennie.
4. ábra
Ütési érzékenységet vizsgáló készülék
(minden méret mm-ben van megadva)

4. ábra
Folytatás
5. ábra
Súrlódási érzékenységet vizsgáló készülék
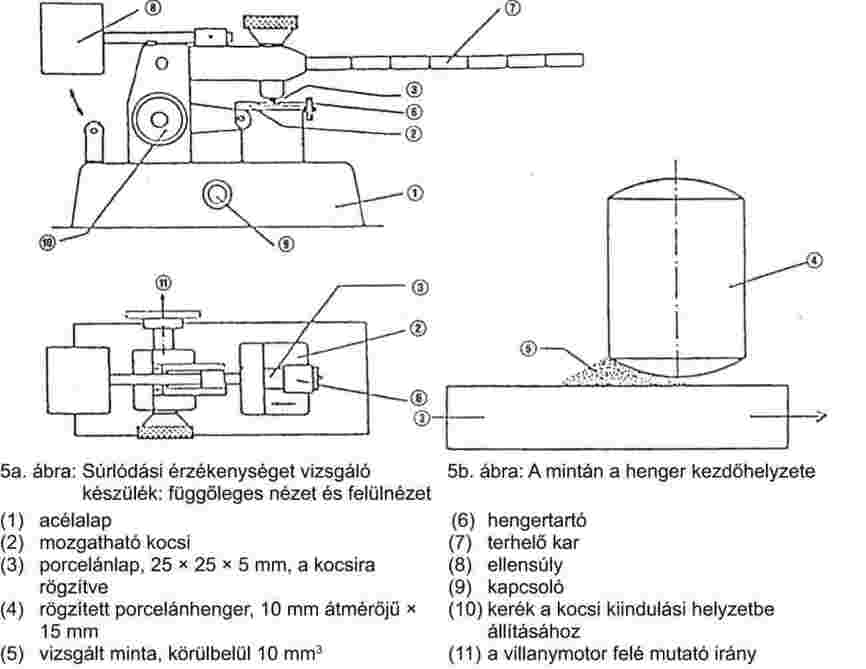
A.15. ÖNGYULLADÁSI HŐMÉRSÉKLET (FOLYADÉKOK ÉS GÁZOK)
1. MÓDSZER
1.1. BEVEZETÉS
Robbanásveszélyes és környezeti hőmérsékleten levegővel érintkezve öngyulladó anyagokat nem lehet ezen eljárással vizsgálni. A vizsgálati eljárás olyan gázokhoz, folyadékokhoz és gőzökhöz alkalmazható, amelyek forró felülettel érintkezve meggyulladhatnak.
Az öngyulladási hőmérsékletet jelentős mértékben csökkentheti a katalitikus szennyeződések jelenléte, a felület anyaga vagy a vizsgálati tartály nagyobb térfogata.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Az öngyulladási képesség mértéke az öngyulladási hőmérséklet segítségével fejezhető ki. Az öngyulladási hőmérséklet az a legalacsonyabb hőmérséklet, amelyen a vizsgált anyag levegővel keverve meggyullad a vizsgálati módszerben meghatározott körülmények között.
1.3. REFERENCIAANYAGOK
A szabványok tartalmazzák a referenciaanyagokat (lásd az 1.6.3. pontot). Ezeknek elsősorban a módszer megfelelőségének időnkénti ellenőrzésére és a más módszerekkel kapott eredményekkel való összehasonlítás lehetővé tételére kell szolgálniuk.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A módszer meghatározza valamely körülkerített tér belső felületének azt a minimális hőmérsékletét, amelynél meggyullad az e térbe fecskendezett gáz, gőz vagy folyadék.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Az ismételhetőség az öngyulladási hőmérsékletek tartományának és az alkalmazott vizsgálati módszernek megfelelően változik.
Az érzékenység és specifikusság az alkalmazott vizsgálati módszertől függ.
1.6. A MÓDSZER LEÍRÁSA
1.6.1. Készülék
A készüléket az 1.6.3. pontban említett módszer írja le.
1.6.2. Vizsgálati körülmények
A vizsgált anyagmintát az 1.6.3. pontban említett módszernek megfelelően vizsgálják.
1.6.3. A vizsgálat végrehajtása
Lásd az IEC 79-4, DIN 51794, ASTM-E 659-78, BS 4056, NF T 20-037 szabványokat.
2. ADATOK
Regisztrálni kell a vizsgálati hőmérsékletet, a légköri nyomást, a felhasznált minta mennyiségét és a gyulladás bekövetkezéséig eltelt holtidőt.
3. JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
az anyag pontos leírását (azonosítás és szennyeződések), |
|
— |
a felhasznált minta mennyiségét, a légköri nyomást, |
|
— |
a vizsgálathoz használt készüléket, |
|
— |
a mérések eredményeit (vizsgálati hőmérsékletek, gyulladással kapcsolatos eredmények, megfelelő holtidők), |
|
— |
az eredmények értelmezése szempontjából lényeges minden további megjegyzést. |
4. SZAKIRODALOM
Nincs.
A.16. SZILÁRD ANYAGOK RELATÍV ÖNGYULLADÁSI HŐMÉRSÉKLETE
1. MÓDSZER
1.1. BEVEZETÉS
Robbanásveszélyes és környezeti hőmérsékleten levegővel érintkezve öngyulladó anyagokat nem szabad alávetni ennek a vizsgálatnak.
A vizsgálat célja előzetes információk biztosítása szilárd anyagok magas hőmérsékleteken bekövetkező öngyulladásáról.
Amennyiben az anyagnak oxigénnel történő reakciója, vagy az exoterm bomlás során fejlődő hő nem elég gyorsan áramlik a környezetbe, öngyulladáshoz vezető önmelegedés jön létre. Az öngyulladás tehát akkor következik be, amikor a hőtermelés üteme meghaladja a hőveszteség ütemét.
A vizsgálati eljárás hasznos mint előzetes szűrővizsgálat szilárd anyagoknál. Tekintettel a szilárd anyagok gyulladásának és égésének bonyolult természetére, e vizsgálati módszernek megfelelően meghatározott öngyulladási hőmérsékletet csak összehasonlítási célokra szabad használni.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Az e módszerrel kapott öngyulladási hőmérséklet az a oC-ban kifejezett minimális környezeti hőmérséklet, amelynél meghatározott körülmények között meghatározott mennyiségű anyag meggyullad.
1.3 REFERENCIAANYAG
Nincs.
1.4 A VIZSGÁLATI MÓDSZER ELVE
Meghatározott térfogatú vizsgált anyagot szobahőmérsékletű kemencébe helyeznek; majd regisztrálják a minta közepére vonatkozó hőmérséklet/idő görbét, miközben a kemence hőmérsékletét 0,5 oC/perc sebességgel 400 oC-ra vagy olvadáspontra emelik, amennyiben az kisebb 400 oC-nál. E vizsgálat alkalmazásában öngyulladási hőmérséklet a kemencének az a hőmérséklete, amelynél a minta hőmérséklete önmelegedéssel eléri a 400 oC-t.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincs.
1.6. A MÓDSZER LEÍRÁSA
1.6.1. Készülék
1.6.1.1. Kemence
Természetes levegőkeringtetéssel és robbanás elleni szeleppel ellátott, hőmérsékletprogramozott laboratóriumi kemence (körülbelül 2 liter térfogatú). A lehetséges robbanásveszély elkerülése érdekében nem szabad engedni, hogy bármilyen gáz-halmazállapotú bomlástermék kapcsolatba lépjen az elektromos fűtőelemekkel.
1.6.1.2. Drótháló kocka
Az 1. ábrán látható mintának megfelelő 0,045 mm-es nyílásokkal rendelkező, rozsdamentes acél dróthálót kell kivágni. A hálót össze kell hajtogatni nyitott tetejű kockává, és huzallal rögzíteni kell.
1.6.1.3. Termoelemek
Alkalmas termoelemek.
1.6.1.4. Regisztráló készülék
Bármely, 0-tól 600 oC-ig vagy ennek megfelelő feszültségre kalibrált, kétcsatornás regisztráló készülék.
1.6.2. Vizsgálati körülmények
Az anyagokat az átvételüknek megfelelő állapotukban vizsgálják.
1.6.3. A vizsgálat végrehajtása
A kockát megtöltik a vizsgált anyaggal, és gyenge ütögetéssel tömörítik, majd további anyagot adnak hozzá, amíg teljesen meg nem telik a kocka. A kockát ezután szobahőmérsékleten felfüggesztik a kemence közepén. Az egyik termoelemet a kocka közepére helyezik, a másikat a kocka és a kemence fala közé a kemence hőmérsékletének regisztrálására.
A kemence és a minta hőmérsékletét folyamatosan regisztrálják, miközben 0,5 oC/perc sebességgel 400 oC-ra, vagy ha az olvadási pont ennél alacsonyabb, akkor az olvadási pontra növelik a kemence hőmérsékletét.
Amennyiben az anyag meggyullad, a mintában lévő termoelem nagyon hirtelen hőmérsékletnövekedést fog mutatni a kemence hőmérsékletéhez képest.
2. ADATOK
Az értékeléshez lényeges a kemencének az a hőmérséklete, amelynél a minta hőmérséklete önmelegedéssel eléri a 400 oC-ot (lásd a 2. ábrát).
3. JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
a vizsgált anyag leírását, |
|
— |
a mérés eredményeit, a hőmérséklet/idő görbét is ideértve, |
|
— |
az eredmények értelmezése szempontjából lényeges minden további megjegyzést. |
4. SZAKIRODALOM
NF T 20-036 (September 85). Chemical products for industrial use. Determination of the relative temperature of the spontaneous flammability of solids.
1. ábra
20 mm-es vizsgálati kocka sémája

2. ábra
Jellegzetes hőmérséklet/idő görbe
A.17. OXIDÁLÓ TULAJDONSÁGOK (SZILÁRD ANYAGOK)
1. MÓDSZER
1.1. BEVEZETÉS
E vizsgálat végrehajtásához hasznos előzetes információkat szerezni az anyag minden lehetséges robbanási tulajdonságáról.
Ez a vizsgálat nem alkalmazható folyadékokhoz, gázokhoz, robbanásveszélyes vagy tűzveszélyes anyagokhoz vagy szerves peroxidokhoz.
A vizsgálatot nem kell végrehajtani, ha a szerkezeti képlet vizsgálata minden kétség nélkül kimutatja, hogy az anyag nem képes exoterm reakcióba lépni éghető anyaggal.
Előzetes vizsgálatot kell végrehajtani annak megállapítására, hogy különleges óvintézkedésekkel kell-e végrehajtani a vizsgálatot.
1.2. FOGALOMMEGHATÁROZÁS ÉS MÉRTÉKEGYSÉGEK
Égési idő: az 1.6. pontban leírt eljárást követve, az a másodpercben meghatározott reakcióidő, amely alatt a reakciózónában az égés az anyagnyaláb mentén szétterjed.
Égési sebesség: milliméter/szekundumban kifejezve.
Maximális égési sebesség: 10–90 tömegszázalékban oxidálószert tartalmazó keverékekkel kapott égési sebességek közül a legnagyobb érték.
1.3. REFERENCIAANYAG
A vizsgálathoz és az előzetes vizsgálathoz referenciaanyagként (analitikai tisztaságú) bárium-nitrátot használnak.
A referenciakeverék az a bárium-nitrátnak cellulózporral alkotott, az 1.6. pontnak megfelelően elkészített (rendszerint 60 tömegszázalékos bárium-nitrátot tartalmazó) keveréke, amelynek maximális az égési sebessége.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Biztonsági okokból előzetes vizsgálatot hajtanak végre. Nincs szükség további vizsgálatra, amennyiben az előzetes vizsgálat világosan jelzi, hogy a vizsgált anyagnak oxidáló tulajdonságai vannak. Ellenkező esetben az anyagot teljes vizsgálatnak kell alávetni.
A teljes vizsgálat során a vizsgált anyag és valamilyen meghatározott éghető anyag különböző arányú keverékét kell alkalmazni. Ezután minden egyes keverékből kialakítanak egy halmot, és a halmot az egyik végén meggyújtják. A meghatározott maximális égési sebességet összehasonlítják a referenciakeverék maximális égési sebességével.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Amennyiben szükséges, az őrlés és keverés bármilyen módszere megfelel, feltéve hogy a hat különálló vizsgálatban a maximális égési sebesség 10 %-nál nem nagyobb mértékben tér el a számtani középértéktől.
1.6. A MÓDSZER LEÍRÁSA
1.6.1. Előkészítés
1.6.1.1. A vizsgált anyag
A vizsgált anyagot < 0,125 mm-es részecskeméretűre őrlik a következő eljárás segítségével: a vizsgált anyag szitálása, a visszamaradó anyag őrlése, az eljárás megismétlése, amíg a teljes vizsgált anyag keresztül nem halad a szitán.
A minőségi követelménynek megfelelő bármilyen őrlési és szitálási módszer használható.
A keverék előkészítése előtt az anyagot 105 oC hőmérsékleten súlyállandóságig szárítják. Amennyiben a vizsgált anyag bomlási hőmérséklete 105 oC alatt van, az anyagot alacsonyabb hőmérsékleten kell megszárítani.
1.6.1.2. Éghető anyag
Éghető anyagként por alakú cellulózt használnak. A cellulóznak vékonyfilm- vagy oszlopkromatográfiához használt típusúnak kell lennie. A szálhosszúság több mint 85 %-a 0,020 és 0,075 mm között legyen. A cellulózport egy 0,125 mm nyílásméretű szitán áttörik. Ugyanabból a gyártási sorozatból származó cellulózt kell használni a teljes vizsgálat során.
A keverék előkészítése előtt a porított cellulózt 105 oC-on súlyállandóságig szárítják.
Amennyiben falisztet használnak az előzetes vizsgálatnál, akkor puha falisztet kell készíteni, amely átmegy egy 1,6 mm nyílásméretű szitán, ezt alaposan meg kell keverni, majd 105 oC hőmérsékleten 4 órán át kell szárítani 25 mm-nél nem vastagabb rétegben. Ezután le kell hűteni, és amíg szükséges – legfeljebb a szárítástól számított 24 órán keresztül – légmentes tartályban kell tárolni, amelyet a lehető legjobban meg kell tölteni.
1.6.1.3. Gyújtóforrás
Gyújtóforrásként gázégőből (minimális átmérője 5 mm) kiáramló forró lángot kell használni. Amennyiben más gyújtóforrást használnak (például inert légkörben végrehajtott vizsgálatkor), a jelentésben meg kell adni annak leírását és indoklását.
1.6.2. A vizsgálat végrehajtása
Megjegyzés:
Az oxidálószereknek cellulózzal vagy faliszttel alkotott keverékeit robbanásveszélyesnek kell tekinteni, és kellő gondossággal kell kezelni.
1.6.2.1. Előzetes vizsgálat
A szárított anyagot alaposan összekeverik szárított cellulózzal vagy faliszttel 2 vizsgáltanyag-tömegrész – 1 cellulóz- vagy faliszt-tömegrész arányban, és a keveréket kis, kúp alakú, 3,5 cm (az alap átmérője) × 2,5 cm-es (magasság) halomba formálják egy kúp alakú forma (például lezárt szárú laboratóriumi üvegtölcsér) tömörítés nélküli megtöltésével.
A halmot egy hideg, nem éghető, nem porózus és alacsony hővezető-képességű alaplemezre helyezik. A vizsgálatot az 1.6.2.2. pontnak megfelelően füstszekrényben kell végrehajtani.
A gyújtóforrást érintkezésbe hozzák a kúppal. Megfigyelik és regisztrálják az ennek eredményeként létrejövő reakció erőteljességét és időtartamát.
Az anyagot oxidálónak kell tekinteni, ha erőteljes a reakció.
Minden esetben, ahol kételyek merülnek fel az eredménnyel kapcsolatban, végre kell hajtani az alábbiakban leírt teljes vizsgálatsorozatot.
1.6.2.2. Vizsgálatsorozat
10 %-os intervallumokban, 10–90 tömegszázalékban oxidálószert tartalmazó oxidálószer/cellulózkeverékeket készítenek. Határesetekhez közbenső oxidáló szer/cellulózkeverékeket kell használni azért, hogy pontosabb legyen a kapott maximális égési sebesség.
A halmot forma segítségével alakítják ki. A háromszög keresztmetszetű forma fémből készült, hossza 250 mm, belső magassága 10 mm és belső szélessége 20 mm. A forma mindkét oldalán hosszirányban két fémlemezt szereltek fel oldallapként, amelyek 2 mm-rel túlnyúlnak a háromszög alakú keresztmetszet felső szélén (lásd az ábrát). Ezt az eszközt lazán megtöltik a szükségesnél kissé több keverékkel. Miután a formát egyszer 2 cm-es magasságból szilárd felületre ejtették, a megmaradó felesleges anyagot lekaparják egy ferdén elhelyezett lappal. Az oldallapokat eltávolítják, és a megmaradt por felületét kisimítják egy henger segítségével. Ezután a forma tetejére nem éghető, nem porózus és alacsony hővezető-képességű alaplemezt helyeznek, a készüléket megfordítják, és eltávolítják a formát.
A halmot a füstszekrény huzatába helyezik.
A levegő sebességének elegendőnek kell lennie ahhoz, hogy megakadályozza az égéstermékek laboratóriumba szökését, és azt a vizsgálat során megváltoztatni nem szabad. A berendezés köré huzatellenzőt kell szerelni.
A cellulóz és néhány vizsgált anyag vízfelvevő képessége miatt a vizsgálatot a lehető leggyorsabban kell végrehajtani.
Meggyújtják a halom egyik végét úgy, hogy hozzáérintik a lángot.
A reakcióidőt 200 mm-es távolság mentén mérik, miután a reakciózóna már 30 mm távolságra terjedt.
A vizsgálatot a referenciaanyaggal és a vizsgált anyagnak a cellulózzal alkotott keverékei mindegyikével legalább egyszer végrehajtják.
Amennyiben megállapítják, hogy a maximális égési sebesség lényegesen nagyobb, mint amelyet a referenciakeverékből kaptak, a vizsgálat megszakítható; egyébként a vizsgálatot ötször meg kell ismételni a legnagyobb égési sebességet adó három keverék mindegyikével.
Amennyiben az eredmény gyaníthatóan hamis pozitív, a vizsgálatot meg kell ismételni cellulóz helyett ehhez hasonló részecskeméretű inert anyag, például kovaföld segítségével. Más megoldásként a legnagyobb égési sebességű vizsgált anyag/cellulózkeveréket újra meg kell vizsgálni inert légkörben (< 2 térfogatszázalék oxigéntartalom).
2. ADATOK
Biztonsági okokból a maximális égési sebességet – és nem a középértéket – kell a vizsgált anyag jellemző oxidáló tulajdonságának tekinteni.
Az értékeléshez adott keverék hat vizsgálatából álló vizsgálatsorozatán belül az égési sebesség legnagyobb értéke a fontos.
Fel kell rajzolni minden egyes keverék legnagyobb égési sebességének görbéjét az oxidálószer koncentrációja függvényében. A görbéből kell megállapítani a maximális égési sebességet.
A maximális égési sebességű keverék vizsgálatából kapott hat mért égési sebesség értékének nem szabad 10 %-nál nagyobb mértékben eltérnie a számtani középértéktől; ellenkező esetben javítani kell az őrlési és keverési módszereken.
Össze kell hasonlítani a kapott maximális égési sebességet a referenciaanyag maximális égési sebességével (lásd az 1.3. pontot).
Amennyiben a vizsgálatokat inert légkörben hajtják végre, a maximális reakciósebességet összehasonlítják a referenciakeverék inert légkörben kapott maximális reakciósebességével.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek, amennyiben lehetséges, a következő információkat kell tartalmaznia:
|
— |
a vizsgált anyag azonosságát, összetételét, tisztaságát, nedvességtartalmát stb., |
|
— |
a vizsgált minta minden kezelését (például őrlés, szárítás, …), |
|
— |
a vizsgálatok során használt gyújtóforrást, |
|
— |
a mérések eredményeit, |
|
— |
a reakció módját (például felvillanással égés a felületen, a teljes tömegen keresztüli égés, az égéstermékekre vonatkozó minden információ, …), |
|
— |
az eredmények értelmezése szempontjából lényeges minden további megjegyzést, ilyen például a hevesség (lángolás, szikrázás, füstölgés, lassú izzás stb.) leírása, és mind a vizsgált, mind a referenciaanyag előzetes biztonsági/szűrési vizsgálata során kapott közelítő időtartam, |
|
— |
inert anyaggal végrehajtott vizsgálatokból kapott eredményeket, amennyiben van ilyen, |
|
— |
inert légkörben végrehajtott vizsgálatokból kapott eredményeket, amennyiben van ilyen. |
3.2. AZ EREDMÉNY ÉRTELMEZÉSE
Valamely anyagot oxidáló anyagnak kell tekinteni, amikor:
|
a) |
az előzetes vizsgálat során erőteljes reakció jön létre; |
|
b) |
a teljes vizsgálat során a vizsgált keverékek maximális égési sebessége nagyobb vagy egyenlő, mint a cellulóz és a bárium-nitrát alkotta referenciakeverék maximális égési sebessége. |
A hamis pozitív eredmény elkerülése érdekében az inert anyaggal kevert anyag vizsgálatakor és/vagy inert légkörben végrehajtott vizsgálatkor kapott eredményeket figyelembe kell venni az eredmények értelmezésekor.
4. SZAKIRODALOM
NF T 20-035 (SEPT 85). Chemical products for industrial use. Determination of the oxidizing properties of solids.
Függelék
Ábra
Forma és tartozékok a halom elkészítéséhez
(Minden méret mm-ben van megadva)
A.18. A POLIMEREK SZÁMÁTLAG SZERINTI MOLEKULATÖMEGE ÉS MOLEKULATÖMEG-ELOSZLÁSA
1. MÓDSZER
E gél permeációs kromatográfiás módszer megfelel az OECD TG 118-nak (1996). Az alapelvek és további technikai információk az 1. hivatkozásban találhatók.
1.1. BEVEZETÉS
Mivel a polimerek tulajdonságai olyan változatosak, lehetetlen egyetlen módszert leírni, pontosan felsorolva az elválasztás és kiértékelés feltételeit, amelyek lefednek minden, a polimerek elválasztásánál előforduló eshetőséget és különlegességet. Különösen a komplexpolimer rendszereknél gyakran nem használható a gél permeációs kromatográfia (GPC). Amennyiben a GPC nem használható, a molekulatömeg más módszerekkel határozható meg (lásd a függeléket). Ilyen esetekben meg kell adni a használt módszer valamennyi részletét és igazolását.
A leírt módszer az 55672 DIN szabványon alapul (1). Ebben a DIN szabványban található részletes információ a kísérletek kivitelezéséről és az adatkiértékelésről. Amennyiben a kísérleti körülmények módosítása szükséges, a változtatásokat igazolni kell. Más szabvány is használható, amennyiben teljes körű hivatkozással rendelkezik. A leírt módszer kalibrációra ismert polidiszperzitású polisztirol mintákat használ, és esetleg módosítani kell, hogy megfelelő legyen bizonyos polimereknél, pl.: vízben oldható és hosszú láncú elágazó polimerek.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Az Mn számátlag molekulatömeget és az Mw tömegátlag molekulatömeget az alábbi egyenletekkel lehet meghatározni:
|
|
|
ahol
Hi a detektorjel szintje az alapvonaltól Vi retenciós térfogatra,
Mi a polimerfrakció molekulatömege Vi retenciós térfogatnál, és
n az adatpontok száma.
A molekulatömeg eloszlásának szélességét, ami a rendszer diszperzitásának mértéke, az Mw/Mn arány adja meg.
1.3. REFERENCIAANYAGOK
Kalibrációt kell készíteni, mert a GPC relatív módszer. Keskeny eloszlású, lineárisan felépített, ismert Mn és Mw átlagos molekulatömegű, és ismert molekulatömeg eloszlású polisztirol standardokat használnak e célra. Az ismeretlen minta molekulatömegének meghatározására a kalibrációs görbe csak akkor használható, amennyiben a minta és a standardok elválasztásának körülményei azonos módon lettek kiválasztva.
A molekulatömeg és az elúciós térfogat között meghatározott kapcsolat csak az adott kísérlet sajátos körülményei között érvényes. A körülmények magukban foglalják mindenek felett a hőmérsékletet, az oldószert (vagy oldószerkeveréket), a kromatográfiás feltételeket és az elválasztó oszlopot vagy oszlopokat.
A minta így meghatározott molekulatömegei relatív értékek és „polisztirol ekvivalens molekulatömeg”-ként írták le őket. Ez azt jelenti, hogy a minta és a standard szerkezeti és kémiai különbségeitől függően a molekulatömegek kisebb-nagyobb mértékben eltérhetnek az abszolút értéktől. Amennyiben más standardokat használtak, pl. polietilén-glikol, polietilén-oxid, polimetil-metakrilát, poliakrilsav, azt meg kell indokolni.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A minta molekulatömeg-eloszlása és az átlagos molekulatömegek (Mn, Mw) GPC-vel meghatározhatók. A GPC a folyékony kromatográfia speciális típusa, aminél a minta az egyes alkotók hidrodinamikai térfogata szerint választódik el (2).
Az elválasztás a minta porózus anyaggal, tipikusan szerves géllel töltött oszlopon való áthaladásakor valósul meg. Kis molekulák be tudnak hatolni a pórusokba, a nagy molekulák nem. A nagy molekulák útja ezért rövidebb, és elsőként eluálódnak. A közepes méretű molekulák a pórusok egy részébe behatolnak, és később eluálódnak. A legkisebb, a gél pórusainál kisebb átlagos hidrodinamikai sugarú molekulák minden pórusba be tudnak hatolni. Ezek eluálódnak utoljára.
Ideális helyzetben az elválasztást teljesen a molekulafajták mérete szabja meg, de a gyakorlatban nehéz elkerülni valamely abszorpciós hatás közrehatását. A nem egyenletes oszlopfeltöltés és a holttérfogat ronthatja a helyzetet (2).
A detektálás megvalósul pl. a törésmutatóval vagy az UV-elnyeléssel, és egyszerű eloszlási görbét eredményez. Azonban ahhoz, hogy a tényleges molekulatömeg-értékeket a görbéhez lehessen rendelni, az oszlopot kalibrálni kell ismert molekulatömegű és ideális esetben nagyjából hasonló szerkezetű polimerek, pl. különböző polisztirol standardok futtatásával. Tipikusan Gauss-görbe kapható, néha a kis molekulatömeg oldalán kis farokkal eltorzítva, a függőleges tengely a különböző eluált molekulafajták tömeg szerinti mennyiségét, a vízszintes tengely a molekulatömeg logaritmusát mutatja.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Az elúciós térfogat reprodukálhatósága (relatív standard deviáció, RSD) 0,3 %-nál jobb kell, hogy legyen. Az analízis megkövetelt reprodukálhatóságát belső standarddal való korrekcióval kell biztosítani, amennyiben a kromatogramot az idő függvényében értékelik ki, és nem felel meg a fent említett követelménynek (1). A polidiszperzitás függ a standardok molekulatömegétől. Polisztirol standardoknál a tipikus értékek:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw/Mn < 1,20 |
(Mp a standard molekulatömege a csúcsmaximumnál)
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. A standard polisztirol oldatok készítése
A polisztirol standardokat óvatosan keverve oldják fel a választott eluensben. A gyártó ajánlásait számításba kell venni az oldatok készítésénél.
A választott standardok koncentrációja különböző faktoroktól függ, pl. injektált térfogat, az oldat viszkozitása és az elemző detektor érzékenysége. A túltöltés elkerülése érdekében a maximális injektált térfogatot az oszlop hosszához kell igazítani. 30 cm × 7,8 mm-es oszlopú GPC-vel történő analitikai elválasztásoknál a jellemző injektált térfogat rendesen 40 és 100 μl között van. Nagyobb térfogat is elképzelhető, de nem lépheti túl a 250 μl-t. Az oszlop aktuális kalibrációja előtt meg kell határozni az injektált térfogat és a koncentráció optimális arányát.
1.6.2. A mintaoldat elkészítése
Elvben a mintaoldatok elkészítésére is ugyanezek a követelmények érvényesek. A mintát megfelelő oldószerben pl. tetrahidro-furán (THF) óvatos rázással oldják fel. Semmilyen körülmények között sem szabad ultrahangos fürdőben feloldani. Amennyiben szükséges, az oldat tisztítható 0,2–2 μm-es pórusméretű membránszűrővel.
A feloldatlan részecskék jelenlétét, amik nagy molekulatömegű fajták miatt fordulhatnak elő, fel kell jegyezni a végleges jelentésben. A feloldott részecskék tömegszázalékának meghatározására megfelelő módszert kell alkalmazni. Az oldatot 24 órán belül fel kell használni.
1.6.3. Készülék
|
— |
oldószertartály, |
|
— |
gáztalanító (szükség szerint), |
|
— |
pumpa, |
|
— |
rezgéscsillapító (szükség szerint), |
|
— |
injektáló rendszer, |
|
— |
kromatográfiás oszlopok, |
|
— |
detektor, |
|
— |
áramlásmérő (szükség szerint), |
|
— |
adat rögzítő-feldolgozó, |
|
— |
hulladéktároló. |
Biztosítani kell, hogy a GPC rendszer inert legyen a használt oldószerekkel szemben (pl. THF oldószernél acélkapillárisok használata).
1.6.4. Injektáló és oldószerszállító rendszer
A minta oldatának meghatározott térfogatát automataadagolóval vagy kézzel töltik az oszlopra egy pontosan meghatározott zónába. Amennyiben kézzel végzik, a fecskendő dugattyújának túl gyors benyomása vagy kihúzása a megfigyelt molekulatömeg-eloszlásban változásokat okozhat. Az oldószert szállító rendszernek, amennyire csak lehet, lüktetésmentesnek kell lenni, ideálisan rezgéscsillapítót magában foglalva. Az áramlási sebesség 1 ml/perc nagyságrendű.
1.6.5. Oszlop
A mintától függően a polimert egy egyszerű, vagy több, sorba kötött oszlopot használva jellemeznek. Számos meghatározott tulajdonságokkal (pl. pórusméret, szelektivitási határérték) rendelkező porózus oszlopanyag elérhető a kereskedelemben. Az elválasztó gél vagy az oszlophossz megválasztása a minta tulajdonságaitól (pl. hidrodinamikai térfogatok, molekulatömeg-eloszlás) és az elválasztás sajátos körülményeitől, pl. oldószer, hőmérséklet és áramlási sebesség is függ (1) (2) (3).
1.6.6. Elméleti tányérszám
Az elválasztásra használt oszlopot vagy oszlopkombinációt az elméleti tányérszámmal kell jellemezni. A THF eluáló oldószer esetében ez magában foglalja etil-benzol vagy más, megfelelő nem poláris oldat töltését ismert hosszúságú oszlopra. Az elméleti tányérszámot a következő egyenlet adja meg:
|
|
vagy |
|
ahol:
|
N |
= |
az elméleti tányérszám |
|
Ve |
= |
az elúciós térfogat a csúcsmaximumnál |
|
W |
= |
az alapvonal csúcsszélesség |
|
W1/2 |
= |
a csúcsszélesség félmagasságnál. |
1.6.7. Az elválasztás hatékonysága
Az elméleti tányérszámon kívül, ami a sávszélességet meghatározó mennyiség, az elválasztás hatékonyságának is van szerepe, amit a kalibrációs görbe meredeksége határoz meg. Egy oszlop elválasztási hatékonyságát a következő kapcsolat adja meg:
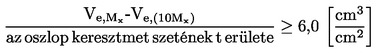
ahol:
|
Ve, Mx |
= |
az Mx molekulatömegű polisztirol elúciós térfogata |
|
Ve,(10.Mx) |
= |
a 10-szer nagyobb molekulatömegű polisztirol elúciós térfogata. |
A rendszer felbontása általában így definiált:
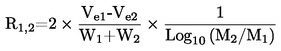
Ahol
|
Ve1, Ve2 |
= |
két polisztirol standard elúciós térfogata a csúcsmaximumnál |
|
W1, W2 |
= |
az alapvonal csúcsszélességei |
|
M1, M2 |
= |
a molekulatömegek a csúcsmaximumnál (10-es faktorral térjenek el). |
Az oszloprendszerre az R-értéknek nagyobbnak kell lennie mint 1,7 (4).
1.6.8. Oldószerek
Minden oldószernek nagy tisztaságúnak kell lennie (THF-ből 99,5 %-os tisztaságút használnak). Az oldószertartálynak (inertgáz-atmoszférában, amennyiben szükséges) elég nagynak kell lenni az oszlop kalibrálásához és néhány mintaanalízishez. Az oldószert gáztalanítani kell, mielőtt a pumpával az oszlopra juttatják.
1.6.9. Hőmérséklet-szabályozás
A kritikus belső komponensek (injektáló hurok, oszlopok, detektor, csövezés) hőmérsékletét állandó és az oldószerválasztásnak megfelelő értéken kell tartani.
1.6.10. Detektor
A detektor célja az oszlopról eluált minta koncentrációjának mennyiségi rögzítése. A csúcsok szükségtelen szélesedésének elkerülésére a detektorcella küvetta térfogatának a lehető legkisebbnek kell lenni. Nem lehet nagyobb 10 μl-nél, kivéve a fényszórási és viszkozitásdetektoroknál. A detektálásra differenciális törésmutató-mérést szokás használni. Azonban, ha a minta vagy az elúciós oldószer sajátos tulajdonságai megkövetelik, más detektortípusok is használhatók, pl. UV/látható fény, IR, viszkozitásdetektor stb.
2. ADATOK ÉS JELENTÉS
2.1. ADATOK
A DIN szabványra (1) kell hivatkozni a részletes értékelési követelménynél éppúgy, mint az adatgyűjtéssel és -feldolgozással kapcsolatos követelményeknél.
Minden mintánál két független kísérletet kell végezni. Külön-külön kell azokat elemezni.
Mn-t, Mw-t, Mw/Mn-t és Mp-t meg kell adni minden mérésnél. Fontos egyértelműen jelezni, hogy a mért értékek a használt standard molekulatömegével ekvivalens relatív értékek.
A retenciós térfogatok, vagy a retenciós idők (lehetőleg belső standardot használva korrigáltak) meghatározása után a log Mp értékek (Mp a kalibráló standard csúcsmaximuma) lesznek ábrázolva egyikük függvényében. Molekulatömeg-dekádonként legalább két kalibrációs pont szükséges, és legalább öt mérési pont kell a teljes görbéhez, aminek le kell fedni a minta becsült molekulatömegét. A kalibrációs görbe kis molekulatömegű végpontját n-hexil-benzol, vagy más megfelelő nem poláris oldott anyag definiálja. A számátlag és a tömegátlag molekulatömeget általában elektronikus adatfeldolgozással, az 1.2. pont képletei alapján határozzák meg. A kézi digitalizálás esetében az ASTM D 3536-91 használható (3).
Az eloszlási görbét táblázat vagy ábra (differenciális frekvencia, vagy összegszázalék a log M függvényében) formájában kell megadni. Grafikus ábrázolásnál egy molekulatömeg-dekádnak általában kb. 4 cm szélesnek kell lennie, a csúcsmaximumnak pedig kb. 8 cm magasnak kell lennie. Integrál eloszlási görbék esetében az ordinátában a különbségnek 0 és 100 % között kb. 10 cm-esnek kell lenni.
2.2. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek az alábbi információkat kell tartalmaznia:
2.2.1. Vizsgált anyag
|
— |
elérhető információk a vizsgált anyagról (azonosság, adalékanyag, szennyező anyag), |
|
— |
a mintakezelés, megfigyelések, problémák leírása. |
2.2.2. Műszerezettség
|
— |
eluens tartály, inert gáz, az eluens gáztalanítása, az eluens összetétele, szennyezők, |
|
— |
pumpa, rezgéscsillapító, injektáló rendszer, |
|
— |
elválasztó oszlopok (a gyártó, az oszlop jellemzőiről minden információ, mint pórusméret, az elválasztó anyag fajtája stb., a használt oszlopok száma, hossza és elrendezése), |
|
— |
az oszlop (vagy oszlopkombináció) elméleti tányérszáma, elválasztás hatékonysága (a rendszer felbontása), |
|
— |
információ a csúcsok szimmetriájáról, |
|
— |
oszlophőmérséklet, hőmérséklet-szabályozás módja, |
|
— |
detektor (mérési elv, típus, küvettatérfogat), |
|
— |
áramlásmérő, amennyiben használva lett (gyártó, mérési elv), |
|
— |
adatrögzítő és -feldolgozó rendszer (hardver és szoftver). |
2.2.3. A rendszer kalibrálása
|
— |
a kalibrációs görbék megalkotásához használt módszer részletes leírása, |
|
— |
információk a módszer minőségi követelményeiről (pl. korrelációs együttható, eltérés négyzetösszege stb.), |
|
— |
információk minden, a kísérleti eljárás és az adatok kiértékelése és feldolgozása során alkalmazott extrapolációról, feltételezésről és közelítésről, |
|
— |
a kalibrációs görbék megalkotásához használt minden mérést dokumentálni kell egy táblázatban, amely minden kalibrációs pont esetében az alábbiakat tartalmazza:
|
2.2.4. Kiértékelés:
|
— |
időn alapuló kiértékelés: a megkövetelt reprodukálhatóság biztosítására használt módszerek (korrekciós módszer, belső standard stb.), |
|
— |
információ arról, hogy a kiértékelés az elúciós térfogat vagy a retenciós idő alapján történt, |
|
— |
információ a kiértékelés korlátairól, amennyiben nem elemeztek egy csúcsot teljesen, |
|
— |
a kiegyenlítési módszerek leírása, amennyiben használva lettek, |
|
— |
minta-előállítási és -előkezelési eljárások, |
|
— |
feloldatlan részecskék jelenléte, amennyiben voltak, |
|
— |
injektálási térfogat (μl) és injektálási koncentráció (mg/ml), |
|
— |
az ideális GPC profiltól való eltéréshez vezető hatásokat jelző megfigyelések, |
|
— |
a vizsgálati eljárások minden módosításának részletes leírása, |
|
— |
a hibatartományok részletei, |
|
— |
az eredmények értelmezésére vonatkozó bármely egyéb információ és megfigyelés. |
3. IRODALOMJEGYZÉK
|
(1) |
DIN 55672 (1995). Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, 1. rész. |
|
(2) |
Yau, W. W., Kirkland, J. J., and Bly, D. D. eds, (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons. |
|
(3) |
ASTM D 3536-91, (1991). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
ASTM D 5296-92, (1992). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polistyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
Függelék
Példák polimerek számátlag molekulatömege (Mn) meghatározásának más módszereire
Mn meghatározására a gél permeációs kromatográfia (GPC) az előnyben részesített módszer, különösen, ha elérhető a polimeréhez hasonló szerkezetű standardkészlet. Azonban, ha gyakorlati nehézségekbe ütközik a GPC használata, vagy amennyiben számítani lehet arra, hogy nincs megfelelő érték az Mn számára (és ami igazolást igényel), alternatív módszerek alkalmazhatók, úgymint:
1. A kolligatív tulajdonságok felhasználása
|
1.1. |
Ebullioszkópia/krioszkópia: az oldószer polimer hozzáadásával kiváltott forráspont-emelkedésének (ebullioszkópia), vagy fagypont-csökkenésének (krioszkópia) mérése. A módszer azon a tényen alapul, hogy az oldott polimer hatása a folyadék forrás/fagypontjára a polimer molekulatömegétől függ (1) (2). Alkalmazhatóság: Mn < 20 000. |
|
1.2. |
Gőznyomás csökkentése: a kiválasztott referenciafolyadék gőznyomásának mérése ismert mennyiségű polimer hozzáadása előtt és után (1) (2). Alkalmazhatóság: Mn < 20 000 (elméletben; gyakorlatban azonban korlátozott értékű). |
|
1.3. |
Membrán ozmometria: az ozmózis elvén alapul, azaz, hogy az oldószer-molekulák hajlamosak híg oldatból a tömény oldatba átmenni egy félig áteresztő membránon keresztül, hogy egyensúly jöjjön létre. A vizsgálatnál a híg oldat nulla koncentrációjú, a tömény oldat pedig a polimert tartalmazza. Az oldószer átvándorlása a membránon keresztül nyomáskülönbséget okoz, amely az oldat koncentrációjától és a polimer molekulatömegétől függ (1) (3) (4). Alkalmazhatóság: Mn20 000–200 000 között. |
|
1.4. |
Gőzfázis ozmometria: tiszta oldószer aeroszol párolgási sebességének összehasonlítása legalább három eltérő koncentrációban polimert tartalmazó aeroszolhoz képest (1) (5) (6). Alkalmazhatóság: Mn < 20 000. |
2. Végcsoport analízis
A módszer alkalmazásához a polimer általános szerkezetének és a láncot lezáró végcsoportok szerkezetének (aminek a fő váztól pl. NMR-rel vagy titrálással/származékképzéssel megkülönböztethetőnek kell lenni) ismerete szükséges. A polimerben jelen lévő végcsoportok molekulakoncentrációjának meghatározása a molekulatömeg értékéhez vezethet (7) (8) (9).
Alkalmazhatóság: Mn50 000-ig (csökkenő megbízhatósággal).
3. Irodalomjegyzék
|
(1) |
Billmeyer, F. W. Jr., (1984). Textbook of Polymer Science, 3rd. Edn., John Wiley, New York. |
|
(2) |
Glover, C. A., (1975). Absolute Colligative Property Methods. Chapter 4. In: Polymer Molecular Weights, Part I, P. E. Slade, Jr. ed., Marcel Dekker, New York. |
|
(3) |
ASTM D 3750-79, (1979). Standard Practice for Determination of Number-Average Molecular Weight of Polymers by Membrane Osmometry. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
Coll, H. (1989). Membrane Osmometry. In: Determination of Molecular Weight, A. R. Copper ed., J. Wiley and Sons, pp. 25–52. |
|
(5) |
ASTM 3592-77, (1977). Standard Recommended Practice for Determination of Molecular Weight by Vapour Pressure, American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(6) |
Morris, C. E. M., (1989). Vapour Pressure Osmometry. In: Determination of Molecular Weight, A. R. Cooper ed., John Wiley and Sons. |
|
(7) |
Schröder, E., Müller, G., and Arndt, K-F., (1989). Polymer Characterisation, Carl Hanser Verlag, Munich. |
|
(8) |
Garmon, R. G., (1975). End-Group Determinations, Chapter 3. In: Polymer Molecular Weighs, Part I, P. E. Slade, Jr. ed. Marcel Dekker, New York. |
|
(9) |
Amiya S., et al. (1990). Pure and Applied Chemistry, 62, pp. 2139–2146. |
A.19. POLIMEREK KIS MOLEKULATÖMEG-TARTALMA
1. MÓDSZER
Ez a gél permeációs kromatográfiás módszer az OECD TG 119-nek megfelelője (1996). Az alapelvek és további technikai információk az 1. hivatkozásban találhatók.
1.1. BEVEZETÉS
Mivel a polimerek tulajdonságai olyan változatosak, lehetetlen egyetlen módszert leírni, pontosan felsorolva az elválasztás és kiértékelés feltételeit, amelyek lefednek minden, a polimerek elválasztásánál előforduló eshetőséget és különlegességet. Különösen a komplexpolimer rendszereknél gyakran nem használható a gél permeációs kromatográfia (GPC). Amennyiben a GPC nem használható, a molekulatömeg más módszerekkel határozható meg (lásd a függeléket). Ilyen esetekben meg kell adni a használt módszer valamennyi részletét és igazolását.
A leírt módszer az 55672 DIN szabványon alapul (1). Ebben a DIN szabványban található részletes információ a kísérletek kivitelezéséről és az adatkiértékelésről. Amennyiben a kísérleti körülmények módosítása szükséges, a változtatásokat igazolni kell. Más szabvány is használható, ha teljes körű hivatkozással rendelkezik. A leírt módszer ismert polidiszperzitású polisztirol kalibrációs mintákat használ, és esetleg módosítani kell, hogy megfelelő legyen bizonyos polimereknél, pl. vízben oldható és hosszú láncú elágazó polimerek.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
A kis molekulatömeget önkényesen 1 000 dalton alattiként definiálták.
Az Mn számátlag molekulatömeget és az Mw tömegátlag molekulatömeget a következő egyenletekkel lehet meghatározni:
|
|
|
ahol:
|
HI |
= |
a detektorjel szintje az alapvonaltól Vi retenciós térfogatra |
|
Mi |
= |
a polimerfrakció molekulatömege Vi retenciós térfogatnál, és n az adatpontok száma. |
A molekulatömeg eloszlásának szélességét, ami a rendszer diszperzitásának mértéke, az Mw/Mn arány adja meg.
1.3. REFERENCIAANYAGOK
Kalibrációt kell készíteni, mert a GPC relatív módszer. Keskeny eloszlású, lineárisan felépített, ismert Mn és Mw átlagos molekulatömegű, és ismert molekulatömeg eloszlású polisztirol standardokat használnak e célra. Az ismeretlen minta molekulatömegének meghatározására a kalibrációs görbe csak akkor használható, amennyiben a minta és a standardok elválasztásának körülményei azonos módon lettek kiválasztva.
A molekulatömeg és az elúciós térfogat között meghatározott kapcsolat csak az adott kísérlet sajátos körülményei között érvényes. A körülmények magukban foglalják mindenek felett a hőmérsékletet, az oldószert (vagy oldószerkeveréket), a kromatográfiás feltételeket és az elválasztó oszlopot vagy oszlopokat.
A minta így meghatározott molekulatömegei relatív értékek és „polisztirol ekvivalens molekulatömeg”-ként írták le őket. Ez azt jelenti, hogy a minta és a standard szerkezeti és kémiai különbségeitől függően a molekulatömegek kisebb-nagyobb mértékben eltérhetnek az abszolút értéktől. Amennyiben más standardokat használtak, pl. polietilén-glikol, polietilén-oxid, polimetil-metakrilát, poliakrilsav, azt meg kell indokolni.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A minta molekulatömeg-eloszlása és az átlagos molekulatömegek (Mn, Mw) GPC-vel meghatározhatók. A GPC a folyékony kromatográfia speciális típusa, aminél a minta az egyes alkotók hidrodinamikai térfogata szerint választódik el (2).
Az elválasztás a minta porózus anyaggal, tipikusan szerves géllel töltött oszlopon való áthaladásakor valósul meg. Kis molekulák be tudnak hatolni a pórusokba, a nagy molekulák nem. A nagy molekulák útja ezért rövidebb, és elsőként eluálódnak. A közepes méretű molekulák a pórusok egy részébe behatolnak, és később eluálódnak. A legkisebb, a gél pórusainál kisebb átlagos hidrodinamikai sugarú molekulák minden pórusba be tudnak hatolni. Ezek eluálódnak utoljára.
Ideális helyzetben az elválasztást teljesen a molekulafajták mérete szabja meg, de a gyakorlatban nehéz elkerülni valamely abszorpciós hatás közrehatását. A nem egyenletes oszlopfeltöltés és a holt térfogat ronthatja a helyzetet (2).
A detektálás megvalósul pl. a törésmutatóval vagy az UV-elnyeléssel, és egyszerű eloszlási görbét eredményez. Azonban ahhoz, hogy a tényleges molekulatömeg-értékeket a görbéhez lehessen rendelni, az oszlopot kalibrálni kell ismert molekulatömegű és ideális esetben nagyjából hasonló szerkezetű polimerek, pl. különböző polisztirol standardok futtatásával. Tipikusan Gauss-görbe kapható, néha a kis molekulatömeg oldalán kis farokkal eltorzítva, a függőleges tengely a különböző eluált molekulafajták tömeg szerinti mennyiségét mutatja, a vízszintes tengely a molekulatömeg logaritmusát.
A kis molekulatömeg-tartalmat ebből a görbéből származtatjuk. A számítás csak akkor lehet pontos, amennyiben az alacsony molekulatömegű fajták a polimerre, mint egészre ekvivalensen, tömeg szerinti alapon hatnak vissza.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Az elúciós térfogat reprodukálhatósága (relatív standard deviáció, RSD) 0,3 %-nál jobb kell, hogy legyen. Az analízis megkövetelt reprodukálhatóságát belső standarddal való korrekcióval kell biztosítani, amennyiben a kromatogramot az idő függvényében értékelik ki, és nem felel meg a fent említett követelménynek (1). A polidiszperzitás függ a standardok molekulatömegétől. Polisztirol standardoknál a tipikus értékek:
|
Mp < 2 000 |
Mw/Mn < 1,20 |
|
2 000 ≤ Mp ≤ 106 |
Mw/Mn < 1,05 |
|
Mp > 106 |
Mw/Mn < 1,20 |
(Mp a standard molekulatömege a csúcsmaximumnál)
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. A standard polisztirol oldatok készítése
A polisztirol standardokat óvatosan keverve oldják fel a választott eluensben. A gyártó ajánlásait számításba kell venni az oldatok készítésénél.
A választott standardok koncentrációja különböző faktoroktól függ, pl. injektált térfogat, az oldat viszkozitása, és az elemző detektor érzékenysége. A túltöltés elkerülése érdekében a maximális injektált térfogatot az oszlop hosszához kell igazítani. 30 cm × 7,8 mm-es oszlopú GPC-vel történő analitikai elválasztásoknál a jellemző injektált térfogat rendesen 40 és 100 μl között van. Nagyobb térfogat is elképzelhető, de nem lépheti túl a 250 μl-t. Az oszlop aktuális kalibrációja előtt meg kell határozni az injektált térfogat és a koncentráció optimális arányát.
1.6.2. A mintaoldat készítése
Elvben a mintaoldatok elkészítésére is ugyanezek a követelmények érvényesek. A mintát megfelelő oldószerben, pl. tetrahidro-furán (THF), óvatos rázással oldják fel. Semmilyen körülmények között sem szabad ultrahangos fürdőben feloldani. Amennyiben szükséges, az oldat tisztítható 0,2–2 μm-es pórusméretű membránszűrővel.
A feloldatlan részecskék jelenlétét, amik nagy molekulatömegű fajták miatt fordulhatnak elő, fel kell jegyezni a végleges jegyzőkönyvben. A feloldott részecskék tömegszázalékának meghatározására megfelelő módszert kell alkalmazni. Az oldatot 24 órán belül fel kell használni.
1.6.3. A szennyezőanyag- és adalékanyag-tartalom korrekciója
Rendszerint szükséges az M < 1 000 fajta tartalmának korrekciója a nem polimer fajtájú jelen lévő komponensek (pl. szennyező anyagok, és/vagy adalékanyagok) járulékára, kivéve ha a mért tartalom már < 1 %. Ezt a polimer oldat, vagy a GPC eluátum közvetlen analízisével érik el.
Amennyiben az oszlopon való áthaladás után az eluátum túl híg a további analízishez, töményíteni kell. Szükséges lehet az eluátum beszáradásig való párologtatása és újraoldása. Az eluátum töményítésének olyan körülmények között kell történnie, amelyek biztosítják, hogy az eluátumban nem történik változás. A GPC lépés utáni eluátumkezelés függ a mennyiségi meghatározás használt analitikus módszerétől.
1.6.4. Készülék
A GPC készülék a következő komponensekből áll:
|
— |
oldószertartály, |
|
— |
gáztalanító (szükség szerint), |
|
— |
pumpa, |
|
— |
rezgéscsillapító (szükség szerint), |
|
— |
injektáló rendszer, |
|
— |
kromatográfiás oszlopok, |
|
— |
detektor, |
|
— |
áramlásmérő (szükség szerint), |
|
— |
adatrögzítő, -feldolgozó, |
|
— |
hulladéktároló. |
Biztosítani kell, hogy a GPC rendszer inert legyen a használt oldószerekkel szemben (pl. THF oldószernél acélkapillárisok használata).
1.6.5. Injektáló és oldószerszállító rendszer
A minta oldatának meghatározott térfogatát automataadagolóval vagy kézzel töltik az oszlopra egy pontosan meghatározott zónába. Amennyiben kézzel végzik, a fecskendő dugattyújának túl gyors benyomása vagy kihúzása a megfigyelt molekulatömeg-eloszlásban változásokat okozhat. Az oldószert szállító rendszernek, amennyire csak lehet, lüktetésmentesnek kell lenni, ideálisan rezgéscsillapítót magában foglalva. Az áramlási sebesség 1 ml/perc nagyságrendű.
1.6.6. Oszlop
A mintától függően a polimert egy egyszerű, vagy több, sorba kötött oszlopot használva jellemeznek. Számos meghatározott tulajdonságokkal (pl. pórusméret, kizárási határérték) rendelkező porózus oszlopanyag elérhető a kereskedelemben. Az elválasztó gél vagy az oszlophossz megválasztása a minta tulajdonságaitól (pl. hidrodinamikai térfogatok, molekulatömeg-eloszlás) és az elválasztás sajátos körülményeitől, pl. oldószer, hőmérséklet és áramlási sebesség is függ (1) (2) (3).
1.6.7. Elméleti tányérszám
Az elválasztásra használt oszlopot vagy oszlopkombinációt az elméleti tányérszámmal kell jellemezni. A THF eluáló oldószer esetében ez magában foglalja etil-benzol, vagy más megfelelő nem poláris oldat töltését ismert hosszúságú oszlopra. Az elméleti tányérszámot a következő egyenlet adja meg:
|
|
vagy |
|
Ahol:
|
N |
= |
az elméleti tányérszám |
|
Ve |
= |
az elúciós térfogat a csúcsmaximumnál |
|
W |
= |
az alapvonal csúcsszélessége |
|
W1/2 |
= |
a csúcsszélesség félmagasságnál |
1.6.8. Az elválasztás hatékonysága
Az elméleti tányérszámon kívül, ami a sávszélességet meghatározó mennyiség, az elválasztás hatékonyságának is van szerepe, amit a kalibrációs görbe meredeksége határoz meg. Egy oszlop elválasztási hatékonyságát a következő kapcsolat adja meg:

ahol:
|
Ve, Mx |
= |
az Mx molekulatömegű polisztirol elúciós térfogata |
|
Ve,(10.Mx) |
= |
a 10-szer nagyobb molekulatömegű polisztirol elúciós térfogata |
A rendszer felbontása általában így definiált:
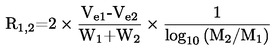
ahol:
|
Ve1, Ve2 |
= |
két polisztirol standard elúciós térfogata a csúcsmaximumnál |
|
W1, W2 |
= |
az alapvonal csúcsszélességei |
|
M1, M2 |
= |
a molekulatömegek a csúcsmaximumnál (10-es faktorral térjenek el). |
Az oszloprendszerre az R-értéknek nagyobbnak kell lennie mint 1,7 (4).
1.6.9. Oldószerek
Minden oldószernek nagy tisztaságúnak kell lennie (THF-ből 99,5 %-os tisztaságút használnak). Az oldószertartálynak (inertgáz-atmoszférában, amennyiben szükséges) elég nagynak kell lennie az oszlop kalibrálásához és néhány mintaanalízishez. Az oldószert gáztalanítani kell, mielőtt a pumpával az oszlopra juttatják.
1.6.10. Hőmérséklet-szabályozás
A kritikus belső komponensek (injektáló hurok, oszlopok, detektor, csövezés) hőmérsékletét állandó és az oldószerválasztásnak megfelelő értéken kell tartani.
1.6.11. Detektor
A detektor célja az oszlopról eluált minta koncentrációjának mennyiségi rögzítése. A csúcsok szükségtelen szélesedésének elkerülésére a detektorcella küvettatérfogatának a lehető legkisebbnek kell lenni. Nem lehet nagyobb 10 μl-nél, kivéve a fényszórási és viszkozitásdetektoroknál. A detektálásra differenciális törésmutató mérést szokás használni. Azonban, ha a minta vagy az elúciós oldószer sajátos tulajdonságai megkövetelik, más detektortípusok is használhatók, pl. UV/látható fény, IR, viszkozitásdetektor stb.
2. ADATOK ÉS JELENTÉS
2.1. ADATOK
A DIN szabványra (1) kell hivatkozni a részletes értékelési követelménynél éppúgy, mint az adatgyűjtéssel és -feldolgozással kapcsolatos követelményeknél.
Minden mintánál két független kísérletet kell végezni. Külön-külön kell azokat elemezni. Minden esetben elengedhetetlen a mintával azonos körülmények között kezelt vakpróbákból származó adatokat is meghatározni.
Fontos egyértelműen jelezni, hogy a mért értékek a használt standard molekulatömegével ekvivalens relatív értékek.
A retenciós térfogatok vagy a retenciós idők (lehetőleg belső standardot használva korrigáltak) meghatározása után a log Mp értékek (Mp a kalibráló standard csúcsmaximuma) lesznek ábrázolva egyikük függvényében. Molekulatömeg-dekádonként legalább két kalibrációs pont szükséges, és legalább öt mérési pont kell a teljes görbéhez, aminek le kell fedni a minta becsült molekulatömegét. A kalibrációs görbe kis molekulatömegű végpontját n-hexil-benzol, vagy más megfelelő nem poláris oldott anyag definiálja. A görbének az 1 000-nél kisebb molekulatömegeknek megfelelő részét a szennyező és adalékanyagoknak megfelelően határozták meg és korrigálták. Az elúciós görbéket általában elektronikus adatfeldolgozás útján értékelik ki. A kézi digitalizálás esetében az ASTM D 3536-91 használható (3).
Amennyiben az oszlopon visszamaradt bármilyen nem oldható polimer, molekulatömege valószínűleg nagyobb az oldható frakcióénál, és amennyiben ezt figyelmen kívül hagyják, az az alacsony molekulatömeg-tartalom túlbecsülését eredményezi. A kis molekulatömeg-tartalmú nem oldható polimer korrekciójára vonatkozó útmutatás a függelékben található.
Az eloszlási görbét táblázat vagy ábra (differenciális frekvencia vagy összegszázalék a log M függvényében) formájában kell megadni. Grafikus ábrázolásnál egy molekulatömeg-dekádnak általában kb. 4 cm szélesnek kell lennie, a csúcsmaximumnak pedig kb. 8 cm magasnak kell lenni. Integrális eloszlási görbék esetében az ordinátában a különbségnek 0 és 100 % között kb. 10 cm-esnek kell lenni.
2.2. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek az alábbi információkat kell tartalmaznia:
2.2.1. Vizsgált anyag
|
— |
elérhető információk a vizsgált anyagról (azonosság, adalékanyagok, szennyező anyagok), |
|
— |
a mintakezelés, megfigyelések, problémák leírása. |
2.2.2. Műszerezettség
|
— |
eluens tartály, inert gáz, az eluens gáztalanítása, az eluens összetétele, szennyezők, |
|
— |
pumpa, rezgéscsillapító, injektáló rendszer, |
|
— |
elválasztó oszlopok (a gyártó, az oszlop jellemzőiről minden információ, mint pórusméret, az elválasztó anyag fajtája stb., a használt oszlopok száma, hossza és elrendezése), |
|
— |
az oszlop (vagy oszlopkombináció) elméleti tányérszáma, elválasztás hatékonysága (a rendszer felbontása), |
|
— |
információ a csúcsok szimmetriájáról, |
|
— |
oszlophőmérséklet, hőmérséklet-szabályozás módja, |
|
— |
detektor (mérési elv, típus, küvettatérfogat), |
|
— |
áramlásmérő, amennyiben használva lett (gyártó, mérési elv), |
|
— |
adatrögzítő és -feldolgozó rendszer (hardver és szoftver). |
2.2.3. A rendszer kalibrálása
|
— |
a kalibrációs görbék megalkotásához használt módszer részletes leírása, |
|
— |
információk a módszer minőségi követelményeiről (pl. korrelációs együttható, eltérés négyzetösszege stb.), |
|
— |
információk minden, a kísérleti eljárás és az adatok kiértékelése és feldolgozása során alkalmazott extrapolációról, feltételezésről és közelítésről, |
|
— |
a kalibrációs görbék megalkotásához használt minden mérést dokumentálni kell egy táblázatban, amely minden kalibrációs pont esetében az alábbiakat tartalmazza:
|
2.2.4. Információ a kis molekulatömegű polimertartalomról
|
— |
az analízishez használt módszerek és a kísérletek kivitelezési módjának leírása, |
|
— |
információ a teljes mintára vonatkozó kis molekulatömegű frakciók százalékos (w/w) tartalmáról, |
|
— |
információ a teljes mintára vonatkozó szennyező, adalékanyagokról, és más nem polimer frakcióról, tömegszázalékban kifejezve. |
2.2.5. Kiértékelés:
|
— |
időn alapuló kiértékelés: a megkövetelt reprodukálhatóság biztosítására használt módszerek (korrekciós módszer, belső standard stb.), |
|
— |
információ arról, hogy a kiértékelés az elúciós térfogat vagy a retenciós idő alapján történt, |
|
— |
információ a kiértékelés korlátairól, amennyiben nem elemeztek egy csúcsot teljesen, |
|
— |
a kiegyenlítési módszerek leírása, amennyiben használva lettek, |
|
— |
minta-előállítási és minta-előkezelési eljárások, |
|
— |
feloldatlan részecskék jelenléte, amennyiben voltak, |
|
— |
injektálási térfogat (μl) és injektálási koncentráció (mg/ml), |
|
— |
az ideális GPC profiltól való eltéréshez vezető hatásokat jelző megfigyelések, |
|
— |
a vizsgálati eljárások minden módosításának részletes leírása, |
|
— |
a hibatartományok részletei, |
|
— |
az eredmények értelmezésre vonatkozó bármely egyéb információ és megfigyelés. |
3. IRODALOMJEGYZÉK
|
(1) |
DIN 55672 (1995). Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, 1. rész. |
|
(2) |
Yau, W. W., Kirkland, J. J., and Bly, D. D. eds, (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons. |
|
(3) |
ASTM D 3536-91, (1991). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania. |
|
(4) |
ASTM D 5296-92, (1992). Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania. |
Függelék
Útmutató a kis molekulatömeg-tartalom korrekciójához a nem oldható polimerfrakciók vonatkozásában
Amennyiben nem oldható polimer van jelen a mintában, tömegveszteséget okoz a GPC analízis során. A nem oldható polimer irreverzibilisen visszamarad az oszlopon vagy a mintaszűrőn, míg a minta oldható része áthalad az oszlopon. Amennyiben a polimer törésmutató növekedése (dn/dc) megbecsülhető vagy mérhető, meg lehet becsülni a minta tömegvesztését az oszlopon. Ekkor az ismert koncentrációjú standard anyagokkal való külső kalibrálás és a dn/dc használatával korrekciót alkalmaznak a refraktométer válaszának kalibrálására. Az alábbi példában poli(metil-metakrilát) (pMMA) standardot használtak.
Az akril polimerek analízisénél a külső kalibráció során ismert koncentrációjú tetrahidro-furánban oldott pMMA standardot analizálnak GPC-vel, és a kapott adatok használhatók a refraktométer-állandó megállapításához, a következő egyenlet szerint:
K = R/(C x V x dn/dc)
ahol
|
K |
= |
a refraktométer-állandó (mikrovoltszekundum/ml-ben), |
|
R |
= |
a pMMA standard válasza (mikrovoltszekundumban), |
|
C |
= |
a pMMA standard koncentrációja (mg/ml-ben), |
|
V |
= |
az injektált térfogat (ml-ben) és |
|
dn/dc |
= |
a törésmutató növekedése pMMA-ra tetrahidro-furánban (ml/mg-ban). |
A következő adatok tipikusak a pMMA standardra:
|
R |
= |
2 937 891 |
|
C |
= |
1,07 mg/ml |
|
V |
= |
0,1 ml |
|
dn/dc |
= |
9 x 10-5 ml/mg |
Az eredményül kapott K értéket (3,05 × 1011 ezután az elméleti detektorválasz kiszámítására lehet használni, amennyiben az injektált polimer 100 %-a eluálódott a detektoron.
A.20. POLIMEREK OLDÓDÁS/EXTRAKCIÓ VISELKEDÉSE VÍZBEN
1. MÓDSZER
A leírt módszer megfelel az OECD TG 120-nak (1997). Az alapelvek és további technikai információk az (1) hivatkozásban találhatók.
1.1. BEVEZETÉS
Bizonyos polimereknél, pl. emulziós polimereknél, kezdeti előkészítő munkára lehet szükség, mielőtt az alább leírt módszert használni lehetne. A módszer nem alkalmazható folyékony polimerek és a vizsgálati körülmények között vízzel reagáló polimerek esetében.
Amennyiben a módszer nem praktikus vagy nem lehetséges, az oldódási/extrakciós viselkedés más módszerekkel is vizsgálható. Ilyen esetben meg kell adni a használt módszer minden részletét és igazolását.
1.2 REFERENCIAANYAGOK
Nincsenek.
1.3 A VIZSGÁLATI MÓDSZER ELVE
A polimerek vizes közegben való oldódási/extrakciós viselkedése lombik módszerrel (ld. A.6 oldhatóság vízben, lombik módszer) határozható meg, az alább leírt módosításokkal.
1.4 MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.5 A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.5.1. Berendezés
A következő berendezés szükséges a módszerhez:
|
— |
aprítóeszköz, pl. őrlőmalom ismert méretű részecskék előállítására, |
|
— |
rázókészülék, hőmérséklet-szabályozási lehetőséggel, |
|
— |
membránszűrő-rendszer, |
|
— |
megfelelő analitikai berendezés, |
|
— |
standardizált szűrők. |
1.5.2 Mintakészítés
Egy reprezentatív mintát először 0,125 és 0,25 mm közötti részecske méretűre kell csökkenteni megfelelő szűrőket használva. A minta stabilitásához vagy az őrlési folyamatnál szükség lehet hűtésre. Gumiszerű anyagok folyékonynitrogén-hőmérsékleten apríthatók (1).
Amennyiben a megkövetelt részecskeméret-frakció nem érhető el, a részecskeméretet annyira le kell csökkenteni, amennyire csak lehetséges, és jegyzőkönyvezni kell az eredményt. A jegyzőkönyvben fel kell tüntetni az aprított minta vizsgálat előtti tárolási módját.
1.5.3. Eljárás
A vizsgált anyagból három 10 g-os mintát kell bemérni egyenként, három üvegdugós edénybe, és 1 000 ml vizet kell adni mindegyikhez. Amennyiben 10 g polimer kezelése kivihetetlen, a következő legnagyobb kezelhető mennyiséget kell használni, és a víz mennyiségét ehhez kell igazítani.
Az edényeket szorosan le kell zárni és 20 oC-on felrázni. Állandó hőmérsékleten működni képes rázó- vagy keverőeszközt kell használni. 24 órás időtartam elteltével az edények tartalmát centrifugálni vagy szűrni kell, és a polimer koncentrációját a tiszta vizes fázisban megfelelő analitikai módszerrel meg kell határozni. Amennyiben a vizes fázishoz nincs megfelelő analitikai módszer, a teljes oldhatóság/extrahálhatóság megbecsülhető a szűrési maradék vagy centrifugálási csapadék száraz tömegéből.
Rendszerint szükség van egyrészt a szennyező anyagok és az adalékanyagok, másrészt a kis molekulatömegű fajták közti mennyiségi megkülönböztetésre. Gravimetriás meghatározásnál vizsgált anyag használata nélküli vakpróba elvégzése is szükséges, hogy a kísérleti eljárásból származó maradékokkal is el lehessen számolni.
A polimerek oldódási/extrakciós viselkedésének meghatározása vízben 37 oC-on 2-es és 9-es pH-nál, a 20 oC-on történő kísérlet leírása szerint végezhető. A pH-értékek alkalmas pufferek vagy megfelelő savak és bázisok, mint sósav, ecetsav, analitikai tisztaságú nátrium-, vagy kálium-hidroxid, vagy NH3 hozzáadásával állíthatók be.
A használt analitikai módszertől függően egy vagy két vizsgálatot kell elvégezni. Amennyiben a vizes fázis polimertartalmának közvetlen analízisére megfelelő sajátos módszerek állnak rendelkezésre, egy, a fent leírtak szerinti vizsgálatnak kielégítőnek kell lenni. Amennyiben ilyen módszerek nem állnak rendelkezésre és a polimer oldódási/extrakciós viselkedésének meghatározása csak a vizes extraktum teljes szervesszéntartalmának (TOC) meghatározásával végzett közvetett analízisre korlátozott, még egy további vizsgálatot kell elvégezni. Ezt a további vizsgálatot is háromszor kell elvégezni, 10-szer kisebb polimermintákkal és az első vizsgálatban használttal azonos vízmennyiséggel.
1.5.4. Analízis
1.5.4.1. Egy mintamérettel végzett vizsgálat
A vizes fázisú polimer komponenseinek közvetlen analízisére módszerek állhatnak rendelkezésre. Alternatív lehetőségként megfontolható az oldott/extrahált polimerkomponensek közvetett analízise a teljes oldhatórész-tartalom meghatározásával és a nem polimerspecifikus komponensekre vonatkozó korrekcióval.
A vizes fázis analízise az összes polimerfajta esetében lehetséges:
vagy elegendően érzékeny módszerrel, pl.
|
— |
TOC, CO2-ot fejlesztő perszulfát vagy dikromát feltárással, amit IR-rel vagy kémiai analízissel történő becslés követ, |
|
— |
atomabszorpciós spektrometria (AAS), vagy induktív csatolású plazmaemissziós (ICP) ekvivalense szilícium- vagy fémtartalmú polimereknél, |
|
— |
UV abszorpció vagy spektrofluorimetria aril polimereknél, |
|
— |
LC-MS alacsony molekulatömegű mintáknál, |
vagy a vizes extraktum száradásig történő vákuumpárologtatásával és a maradék spektroszkópiás (IR, UV, stb.) vagy AAS/ICP analízisével.
Amennyiben a vizes fázis ily módon történő analízise nem kivitelezhető, a vizes kivonatot vízzel nem vegyíthető szerves oldószerrel, pl. klórozott szénhidrogénnel kell extrahálni. Az oldószert ezután el kell párologtatni, és a maradékot a fentiek szerint, a megadott polimertartalomnak megfelelően kell analizálni. Bármilyen szennyezőként vagy adalékként azonosított komponenst ebben a maradékban le kell vonni a polimerre magára jellemző oldódási/extrakciós fok meghatározásának céljából.
Amennyiben ezen anyagok viszonylag nagy mennyiségben vannak jelen, szükséges lehet a maradékot például HPLC- vagy GC-analízisnek alávetni annak érdekében, hogy megkülönbözethetők legyenek a szennyezők a jelen lévő monomer és monomerszármazék-fajtáktól, és így az utóbbiak valódi tartalma meghatározható legyen.
Néhány esetben elegendő lehet a szerves oldószer egyszerű száradásig történő elpárologtatása és a száraz maradék lemérése.
1.5.4.2. Két különböző mintamérettel végzett vizsgálat
Minden vizes extraktum TOC-ra nézve analizált.
A minta nem oldódott/nem extrahált részén gravimetriás meghatározást végeznek. Amennyiben az egyes edények tartalmának centrifugálása vagy szűrése után polimermaradékok maradnak az edény falához tapadva, az edényt a szűrlettel kell öblíteni, amíg az edény megtisztul minden látható maradéktól. Ezt követően a szűrletet újracentrifugálják, vagy szűrik. A szűrőn vagy a centrifugacsőben maradó maradékokat 40 oC-on vákuumban szárítják, és lemérik. A szárítást állandó tömeg eléréséig kell folytatni.
2. ADATOK
2.1. EGY MINTAMÉRETTEL VÉGZETT VIZSGÁLAT
Mind a három lombik eredményeit és az átlagértékeket is meg kell adni, és tömeg per az oldat térfogatban (tipikusan mg/l), vagy tömeg per polimerminta-tömegben (tipikusan mg/g) kell kifejezni. Továbbá a minta tömegvesztését (számítása: az oldott anyag tömege osztva a kiindulási minta tömegével) is meg kell adni. Ki kell számolni a relatív standard deviációkat (RSD). Egyedi számokat kell megadni a teljes anyagra (polimer + alapvető adalékok stb.) és csak a polimerre (azaz az ilyen adalékok levonása után).
2.2. KÉT KÜLÖNBÖZŐ MINTAMÉRETTEL VÉGZETT VIZSGÁLAT
Meg kell adni a két három párhuzamossal végzett kísérlet vizes extraktumainak egyedi TOC-értékeit és valamennyi kísérlet átlagértékét, tömeg per az oldat térfogata (tipikusan mgC/l) és tömeg per kiindulási mintatömeg (tipikusan mgC/g) egységekben is kifejezve.
Amennyiben nincs különbség a nagy és kis minta/víz arány eredményeiben, ez azt jelezheti, hogy valamennyi extrahálható komponens tényleg extrahálva lett. Ebben az esetben a közvetlen analízis általában nem szükséges.
A maradékok egyedi tömegeit meg kell adni, és a minták kiindulási tömegének százalékában kell kifejezni. Átlagokat kísérletenként kell számolni. A 100 és a talált százalék különbsége az eredeti mintában lévő oldható és extrahálható anyag százalékát képviseli.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésben az alábbi információkat kell tartalmazni:
3.1.1. Vizsgált anyag
|
— |
a vizsgált anyagról rendelkezésre álló információk (azonosság, adalékok, szennyezők, alacsony molekulatömegű fajok tartalma). |
3.1.2. Kísérleti körülmények
|
— |
a használt eljárások és kísérleti körülmények leírása, |
|
— |
az analitikai és detektálási módszerek leírása. |
3.1.3. Eredmények
|
— |
oldhatósági/extrahálhatósági eredmények mg/l-ben; a különböző oldatokbeli extrakciós tesztek egyedi és átlagértékei, polimertartalom és szennyező anyagok, adalékanyagok stb. szerint bontva, |
|
— |
oldhatósági/extrahálhatósági eredmények mg/polimer g-ban, |
|
— |
a vizes extraktumok TOC-értékei, az oldott anyag tömege és a számolt százalékok, amennyiben mérik, |
|
— |
az egyes minták pH-ja, |
|
— |
információ a vakpróbaértékekről, |
|
— |
irodalmi hivatkozások a vizsgált anyag kémiai instabilitásról a vizsgálati és az analitikai eljárás alatt, amennyiben szükséges, |
|
— |
valamennyi, az eredmények értelmezéséhez fontos információ. |
4. IRODALOMJEGYZÉK
DIN 5377 (1976) Zerkleinerung von Kunstofferzeugnissen für Prüfzwecke.
A.21. OXIDÁLÓ TULAJDONSÁGOK (FOLYADÉKOK)
1. MÓDSZER
1.1. BEVEZETÉS
Ezzel a vizsgálati módszerrel egy folyékony anyag azon képességét mérhetjük, hogy milyen mértékben képes egy éghető anyag égésének sebességét vagy intenzitását növelni, vagy olyan keveréket képezni egy éghető anyaggal, amely spontán öngyulladásra képes, ha a két anyagot alaposan összekeverik. A módszer az oxidáló folyadékok vizsgálatára szolgáló ENSZ-módszeren (1) alapul, illetve egyenértékű azzal. Mivel azonban az A21. módszer elsősorban arra szolgál, hogy kielégítse az 1907/2006 rendelet követelményeit, csak egyetlen referenciaanyaggal kell az összehasonlítást elvégezni. Más referenciaanyagok vizsgálatára és összehasonlítására akkor lehet szükség, ha a vizsgálatok eredményeit várhatóan más célokra használják fel (7).
Nem kell elvégezni ezt a vizsgálatot, ha a szerkezeti képlet alapján kétségkívül megállapítható, hogy az anyag nem képes exoterm reakcióba lépni egy éghető anyaggal.
Hasznos, ha a vizsgálat elvégzése előtt rendelkezünk előzetes információkkal az anyag potenciális robbanásveszélyességi tulajdonságairól.
Nem alkalmazható a vizsgálat szilárd anyagokra, gázokra, robbanásveszélyes vagy erősen tűzveszélyes anyagokra vagy szerves peroxidokra.
Előfordulhat, hogy nem kell elvégezni ezt a vizsgálatot, ha az oxidáló folyadékok vizsgálatára szolgáló ENSZ-módszerrel (1) már megvizsgálták az anyagot, és rendelkezésre állnak ennek eredményei.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS EGYSÉGEK
„Átlagos nyomásemelkedési idő”: az a mért átlagos idő, amely alatt a vizsgált keverék nyomása a légköri nyomás felett 690 kPa-ról 2 070 kPa-ra emelkedik.
1.3. REFERENCIAANYAG
Referenciaanyagként 65 tömegszázalékos vizes salétromsav (analitikai minőségű) szükséges (8).
Adott esetben, ha a vizsgáló előre tudja, hogy a vizsgálat eredményeit végül más célokra használhatják (7), célszerű lehet további referenciaanyagokat is megvizsgálni (9).
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgálandó folyadékot 1:1 tömegarányban összekeverjük rostos cellulózzal és nyomástartó edénybe tesszük. Ha a keverés vagy betöltés során spontán öngyulladás lép fel, nincs szükség további vizsgálatra.
Ha nem lép fel spontán öngyulladás, az egész vizsgálatot el kell végezni. A keveréket a nyomástartó edényben hevíteni kell, majd meg kell mérni, hogy átlagosan mennyi idő szükséges ahhoz, hogy a nyomás a légköri nyomás felett 690 kPa-ról 2 070 kPa-ra emelkedjen. Ezt kell azután összehasonlítani a referenciaanyag(ok) és cellulóz 1:1 arányú keverékével kapott átlagos nyomásemelkedési idővel.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Egyetlen anyagon elvégzett öt kísérletben egyik eredmény sem térhet el 30 %-nál nagyobb mértékben a számtani átlagtól. Az átlaghoz képest 30 %-nál nagyobb eltérést mutató eredményeket el kell vetni, tökéletesíteni kell a keverési és betöltési eljárást, majd meg kell ismételni a vizsgálatot.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészítés
1.6.1.1. Az éghető anyag
Éghető anyagként 50–250 μm szálhosszúságú és 25 μm átlagos szálátmérőjű (10) száraz, rostos cellulózt kell használni. Maximum 25 mm vastag rétegben, 105 oC-on, 4 órán át, tömegállandóságig kell szárítani, majd lehűlésig, illetve felhasználásig nedvszívó anyag jelenlétében a szárítóberendezésben kell tartani. A száraz cellulóz víztartalmának a száraz tömeg (11)0,5 %-a alatt kell lennie. Ennek eléréséhez szükség esetén hosszabb szárítási időt kell alkalmazni (12). A vizsgálat során ugyanazt a tétel cellulózt kell használni.
1.6.1.2. A berendezés
1.6.1.2.1.
Szükség van egy nyomástartó edényre. Az edény henger alakú, acél nyomástartó edény, amelynek hossza 89 mm, külső átmérője pedig 60 mm (lásd az 1. ábrát). A két ellentétes oldalon sík felület van kialakítva (itt az edény keresztmetszeti mérete 50 mm-re csökken), amely megkönnyíti a kezelést, amikor becsavarják a gyújtódugót és a szellőződugót. Az edényen átmenő 20 mm átmérőjű furatot az egyik végén 19 mm mélységben kibővítik, és abba 1''-os csőmenetet (British Standard Pipe = BSP) vagy azzal egyenértékű metrikus menetet vágnak. A nyomáselvezető, amely egy oldalág, a nyomástartó edény ívelt falába van becsavarozva, 35 mm-re az edény egyik végétől, és 90 o-os szögben a megmunkált sík felülethez képest. Az erre a célra szolgáló menetes furat 12 mm mély, és 1/2''-os csőmenettel (vagy ezzel egyenértékű metrikus menettel) van ellátva az oldalág végén levő menetnek megfelelően. Ha szükséges, a gáztömörség érdekében egy inert tömítés is beilleszthető. A 6 mm átmérőjű átmenő furattal ellátott oldalág 55 mm-re nyúlik ki a nyomástartó edényből. Az oldalág végén a furat fel van bővítve, és csavarmenettel van ellátva membrános nyomásátalakító számára. Bármilyen nyomásmérő eszköz alkalmazható, feltéve hogy ellenáll a forró gázoknak vagy bomlástermékeknek, és legfeljebb 5 ms alatt képes 690–2 070 kPa nyomásemelkedést érzékelni.
A nyomástartó edénynek az oldalágtól távolabbi vége gyújtódugóval van lezárva, amelyben két elektróda van, amelyek közül az egyik szigetelve van a dugó testétől, a másik pedig azzal elektromosan érintkezik. A nyomástartó edény másik vége egy hasadótárcsával van lezárva (hasadó nyomása körülbelül 2 200 kPa), amelyet egy 20 mm-es furattal ellátott rögzítődugó tart a helyén. Szükség esetén a gáztömörség biztosítására a gyújtódugóhoz inert tömítés alkalmazható. A használat során a szerelvényt egy állványzat (2. ábra) tartja megfelelő helyzetben. Ez általában egy 235 mm × 184 mm × 6 mm méretű lágyacél alaplapból és egy 185 mm hosszúságú 70 mm × 70 mm × 4 mm-es zárt szelvényből áll.
A zárt szelvény egyik végén a két szemben levő oldalból egy-egy szakaszt kivágnak úgy, hogy két lapos lábrész jöjjön létre, amely felett 86 mm hosszúságban megmarad az érintetlen zárt szelvény. Ezeknek a lapos részeknek a végét a zárt szelvény hossztengelyéhez képest 60°-os szögben levágják és az alaplaphoz hegesztik. A zárt szelvény felső végén az egyik oldalba 22 mm széles és 46 mm mély hornyot vágnak úgy, hogy ha a nyomástartó edény szerelvényt a gyújtódugóval lefelé a zárt szelvénybe belehelyezik, az oldalág a horonyba illeszkedik. Távtartóként 30 mm széles és 6 mm vastag acéldarabot hegesztenek a zárt szakasz alul levő belső felületére. Két ellentétes oldalon egy-egy 7 mm-es füles csavar rögzíti a nyomástartó edényt a helyén. Egy-egy 12 mm széles és 6 mm vastag acélszalag van hozzáhegesztve a két lapos lábhoz a zárt szakasz alsó végénél, amely a nyomástartó edényt alulról támasztja meg.
1.6.1.2.2.
A gyújtórendszer 25 cm hosszú, 0,6 mm átmérőjű és 3,85 ohm/m ellenállású Ni/Cr huzalból áll. A huzalt egy 5 mm átmérőjű rúd segítségével tekercs alakúra kell csavarni, és a gyújtódugóban lévő elektródákhoz kell kapcsolni. A tekercset a 3. ábrán bemutatottak valamelyikének megfelelően kell kialakítani. Az edény alja és a gyújtótekercs alja közötti távolságnak 20 mm-nek kell lennie. Ha az elektródák nem állíthatók, a gyújtóhuzalnak a tekercs és az edény alja közötti végeit kerámiaköpennyel kell szigetelni. A huzalt egy legalább 10 A-t szolgáltató állandó áramú tápegységgel kell fűteni.
1.6.2. A vizsgálat elvégzése (13)
A nyomásátalakító és a fűtőrendszer felszerelése után, de még a hasadótárcsa behelyezése előtt, a berendezést úgy kell tartani, hogy a gyújtódugó alul legyen. Egy üveg főzőpohárban egy keverőbot segítségével a vizsgálandó folyadékból 2,5 g-ot össze kell keverni 2,5 g száraz cellulózzal (14). Biztonsági okokból a keverést úgy kell végezni, hogy a vizsgálatot végző személy és a keverék között legyen egy biztonsági védőlemez. Ha a keverék a keverés vagy betöltés során meggyullad, nincs szükség további vizsgálatokra. A keveréket kisebb adagokban és ütögetve a nyomástartó edénybe kell tölteni, vigyázva arra, hogy a keverék a gyújtótekercs körül gyűljön össze, és megfelelően érintkezzen azzal. Fontos, hogy a betöltés során a tekercs ne torzuljon, mivel ez hibás eredményekhez vezethet (15). Ezt követően be kell tenni a hasadótárcsát a helyére, majd szorosan be kell csavarozni a tartódugót. A megtöltött edényt a hasadótárcsával felfelé a robbantó állványra kell helyezni, amelyet egy megfelelő, fémborítású füstkamrában vagy robbantókamrában kell elhelyezni. Az áramforrást a gyújtódugó külső csatlakozóihoz kell kapcsolni, és 10 A áramot kell rákapcsolni. A keverés megkezdése és az áram bekapcsolása között nem telhet el 10 percnél hosszabb idő.
A nyomásátalakító által létrehozott jelet megfelelő rendszerrel rögzíteni kell, amely lehetővé teszi mind az eredmény kiértékelését, mind pedig a nyomás változásának folyamatos rögzítését az idő függvényében (pl. egy szalagos íróműszerhez kapcsolt tranziens íróműszer). A keveréket addig kell hevíteni, amíg a hasadótárcsa el nem törik, vagy legalább 60 másodpercig. Ha a hasadótárcsa nem törik el, meg kell várni, amíg a keverék lehűl, majd a megfelelő óvintézkedések betartásával, az esetleges nyomásnövekedésre számítva, óvatosan szét kell szerelni a berendezést. A vizsgálandó anyaggal és a referenciaanyaggal vagy referenciaanyagokkal is öt kísérletet kell végezni. Fel kell jegyezni azt az időt, amely alatt a nyomás a légköri nyomás felett 690 kPa-ról 2 070 kPa-ra emelkedik. Ki kell számítani az átlagos nyomásemelkedési időt.
Bizonyos esetekben az anyagok olyan (vagy túl magas vagy túl alacsony) nyomásemelkedést idézhetnek elő, amelyet nem az anyag oxidáló tulajdonságait jellemző kémiai reakciók okoznak. Ilyen esetekben szükség lehet arra, hogy a vizsgálatot cellulóz helyett egy inert anyaggal, pl. kovafölddel megismételjük, és így tisztázzuk a reakció jellegét.
2. ADATOK
Nyomásemelkedési idő mind a vizsgálandó anyag, mind a referenciaanyag(ok) esetében. Nyomásemelkedési idő az inert anyaggal végzett vizsgálat esetén, ha ilyen is történt.
2.1. AZ EREDMÉNYEK KEZELÉSE
Mind a vizsgálandó anyag, mind a referenciaanyag(ok) esetében ki kell számítani az átlagos nyomásemelkedési időt.
Ki kell számítani az átlagos nyomásemelkedési időt az inert anyaggal végzett vizsgálat esetén (ha ilyen is történt).
Az 1. táblázatban a kapott eredményekre láthatunk példát.
1. táblázat
Példák az eredményekre (16)
|
Anyag (17) |
Átlagos nyomásemelkedési idő cellulózzal készített 1:1 arányú keverékben (ms) |
|
Ammónium-dikromát, telített vizes oldat |
20 800 |
|
Kalcium-nitrát, telített vizes oldat |
6 700 |
|
Vas(III)-nitrát, telített vizes oldat |
4 133 |
|
Lítium-perklorát, telített vizes oldat |
1 686 |
|
Magnézium-perklorát, telített vizes oldat |
777 |
|
Nikkel-nitrát, telített vizes oldat |
6 250 |
|
Salétromsav, 65 % |
4 767 (18) |
|
Perklórsav, 50 % |
121 (18) |
|
Perklórsav, 55 % |
59 |
|
Kálium-nitrát, 30 %-os vizes oldat |
26 690 |
|
Ezüst-nitrát, telített vizes oldat |
– (19) |
|
Nátrium-klorát, 40 %-os vizes oldat |
2 555 (18) |
|
Nátrium-nitrát, 45 %-os vizes oldat |
4 133 |
|
Inert anyag |
|
|
Víz: cellulóz |
– (19) |
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek a következő információkat kell tartalmaznia:
|
— |
a vizsgált anyag neve, összetétele, tisztasága stb., |
|
— |
a vizsgált anyag koncentrációja, |
|
— |
a cellulóz szárítására alkalmazott módszer, |
|
— |
az alkalmazott cellulóz víztartalma, |
|
— |
a mérések eredményei, |
|
— |
az inert anyaggal kapott vizsgálatok eredményei, ha történt ilyen, |
|
— |
a számított átlagos nyomásemelkedési idők, |
|
— |
az ettől a módszertől való bármely eltérés és annak okai, |
|
— |
az eredmények értékelése szempontjából lényeges összes egyéb információ. |
3.2. AZ EREDMÉNYEK ÉRTELMEZÉSE (20)
A vizsgálatok eredményeit a következők alapján kell értelmezni:
|
a) |
a vizsgált anyagból és cellulózból készített keverékben fellép-e spontán öngyulladás; és |
|
b) |
a nyomásnak a légköri nyomás felett 690 kPa-ról 2 070 kPa-ra való emelkedéséhez szükséges átlagos idő összehasonlítása a referenciaanyag(ok) esetén mért értékekkel. |
Oxidáló hatásúnak kell tekinteni egy folyékony anyagot, ha:
|
a) |
cellulózzal alkotott 1:1 tömegarányú keverékében spontán öngyulladás lép fel; vagy |
|
b) |
cellulózzal alkotott 1:1 tömegarányú keverékében az átlagos nyomásemelkedési idő kisebb vagy egyenlő a 65 tömegszázalékos vizes salétromsav és cellulóz 1:1 tömegarányú keverékében mérttel. |
A téves pozitív eredmények elkerülése érdekében az eredmények értelmezésekor szükség esetén figyelembe kell venni a folyadék inert anyaggal történő vizsgálatakor kapott eredményeket is.
4. HIVATKOZÁSOK
|
(1) |
Recommendations on the Transport of Dangerous Goods, Manual of Tests and Criteria. 3rd revised edition. UN Publication No: ST/SG/AC.10/11/Rev. 3, 1999, page 342. Test O.2: Test for oxidizing liquids. |
1. ábra
A nyomástartó edény
2. ábra
Az állványzat

3. ábra
A gyújtórendszer
Megjegyzés: a fenti elrendezések bármelyike alkalmazható.
(1) A készülék típusától és az anyag tisztaságának fokától függ.
(2) A készülék típusától és az anyag tisztaságának fokától függ.
(3) A készülék típusától és az anyag tisztaságának fokától függ.
(4) A készülék típusától és az anyag tisztaságának fokától függ.
(5) Ez a pontosság csak az olyan egyszerű készülékhez érvényes, mint amelyet például az ASTM D1120-70 ír le; a pontosság növelhető korszerű ebulliométerrel.
(6) Csak tiszta anyagokra érvényes. Más körülmények közötti használatát indokolni kell.
(7) Ahogyan például az ENSZ szállítási rendeleteinek keretében.
(8) A savat a vizsgálat előtt titrálni kell annak érdekében, hogy ellenőrizzük a koncentrációját.
(9) Például 50 w/w %-os perklórsav és 40 w/w %-os nátrium-klorát kerül használatra az (1) hivatkozásban.
(10) Páldául Whatman Column Chromatographic Cellulose Powder CF 11, katalógusszám: 4021 050.
(11) Például Karl–Fisher titrálással ellenőrizve.
(12) Ez a víztartalom szintén elérhető például 24 órás 105 oC-on vákuum alatt történő melegítéssel.
(13) Az oxidálószerek cellulózzal készített keverékeit potenciálisan robbanásveszélyesnek kell tekinteni, és ennek megfelelő óvatossággal kell kezelni.
(14) A gyakorlatban ez úgy érhető el, hogy a vizsgálandó folyadékból és a cellulózból a kísérlethez szükségesnél nagyobb mennyiségben készítjük el az 1:1 arányú keveréket, majd 5 ±0,1 g-ot teszünk belőle a nyomástartó edénybe. A keveréket minden egyes kísérlethez frissen kell elkészíteni.
(15) Különösen kerülni kell, hogy a tekercs egymással szomszédos menetei egymáshoz érjenek.
(16) Az ENSZ szállítási rendszer szerinti osztályozást lásd az (1) hivatkozásban.
(17) A telített oldatokat 20 °C-on kell elkészíteni.
(18) Laboratóriumok közötti összehasonlító vizsgálatokból kapott átlagérték.
(19) Nem érte el a 2 070 kPa-os maximális nyomást.
(20) Az ENSZ szállítási rendeletek szerinti, több referenciaanyaggal mért eredmények értelmezéséhez lásd az (1) hivatkozást.
B. RÉSZ: MÓDSZEREK A TOXICITÁS ÉS EGYÉB EGÉSZSÉGÜGYI HATÁSOK MEGHATÁROZÁSÁRA
TARTALOMJEGYZÉK
ÁLTALÁNOS BEVEZETÉS
|
B.1a. |
AKUT ORÁLIS TOXICITÁS – RÖGZÍTETT DÓZISÚ ELJÁRÁS |
|
B.1b. |
AKUT ORÁLIS TOXICITÁS – AKUT TOXIKUS OSZTÁLY MÓDSZER |
|
B.2. |
AKUT TOXICITÁS (INHALÁCIÓ) |
|
B.3. |
AKUT TOXICITÁS (DERMÁLIS) |
|
B.4. |
AKUT TOXICITÁS: BŐRIRRITÁCIÓ/BŐRKORRÓZIÓS HATÁS |
|
B.5. |
AKUT TOXICITÁS: SZEMIRRITÁCIÓ/SZEMKORRÓZIÓS HATÁS |
|
B.6. |
A BŐR ÉRZÉKENNYÉ TÉTELE |
|
B.7. |
ISMÉTELT ADAGOLÁSÚ (28 NAPOS) TOXICITÁSVIZSGÁLAT (ORÁLIS) |
|
B.8. |
ISMÉTELT ADAGOLÁSÚ (28 NAPOS) TOXICITÁS (INHALÁCIÓ) |
|
B.9. |
ISMÉTELT ADAGOLÁSÚ (28 NAPOS) TOXICITÁS (DERMÁLIS) |
|
B.10. |
MUTAGENITÁS – KROMOSZÓMA-RENDELLENESSÉGEK IN VITRO VIZSGÁLATA EMLŐSÖKÖN |
|
B.11. |
MUTAGENITÁS – KROMOSZÓMA-RENDELLENESSÉGEK IN VIVO VIZSGÁLATA EMLŐSÖKÖN |
|
B.12. |
MUTAGENITÁS – IN VIVO EMLŐS ERITROCITA MIKRONUKLEUSZ VIZSGÁLAT |
|
B.13/14. |
MUTAGENITÁS: REVERZ MUTAGENITÁSI VIZSGÁLAT BAKTÉRIUMOKKAL |
|
B.15. |
MUTAGENITÁSVIZSGÁLAT ÉS A RÁKKELTŐ HATÁS SZŰRÉSE GÉNMUTÁCIÓ VIZSGÁLATA SACCHAROMYCES CEREVISIAE-BEN |
|
B.16. |
MITOTIKUS REKOMBINÁCIÓ-VIZSGÁLAT SACHAROMYCES CEREVISIAE- BEN |
|
B.17. |
MUTAGENITÁS – IN VITRO GÉNMUTÁCIÓ VIZSGÁLAT EMLŐSSEJTEKEN |
|
B.18. |
DNS-KÁROSODÁS ÉS -REPARÁCIÓ – NEM TERVEZETT DNS-SZINTÉZIS (UNSCHEDULED DNA SYNTHESIS, UDS) – EMLŐSSEJTEK IN VITRO |
|
B.19. |
IN VITRO EMLŐSSEJTTESTVÉR-KROMATIDKICSERÉLŐDÉS (SISTER CHROMATID EXCHANGE, SCE) VIZSGÁLAT |
|
B.20. |
NEMHEZ KÖTÖTT RECESSZÍV LETÁLIS VIZSGÁLAT DROSOPHILA MELANOGASTERBEN |
|
B.21. |
IN VITRO EMLŐSSEJT-TRANSZFORMÁCIÓS VIZSGÁLATOK |
|
B.22. |
DOMINÁNS LETÁLIS VIZSGÁLAT RÁGCSÁLÓKON |
|
B.23. |
EMLŐS SPERMIOGONIÁLIS KROMOSZÓMA-RENDELLENESSÉG VIZSGÁLAT |
|
B.24. |
EGÉRFOLT- (SPOT) TESZT |
|
B.25. |
EGÉREN VÉGZETT ÖRÖKLETES TRANSZLOKÁCIÓS VIZSGÁLAT |
|
B.26. |
SZUBKRÓNIKUS ORÁLIS TOXICITÁSI VIZSGÁLAT, RÁGCSÁLÓKON VÉGZETT 90 NAPOS, ISMÉTELT ADAGOLÁSÚ ORÁLISTOXICITÁS-VIZSGÁLAT |
|
B.27. |
SZUBKRÓNIKUSORÁLIS-TOXICITÁSI VIZSGÁLAT, 90 NAPOS, ISMÉTELT ADAGOLÁSÚ ORÁLISTOXICITÁSI VIZSGÁLAT NEM RÁGCSÁLÓKON |
|
B.28. |
SZUBKRÓNIKUS DERMÁLIS TOXICITÁSVIZSGÁLAT 90 NAPOS, ISMÉTELT DERMÁLIS ADAGOLÁSÚ VIZSGÁLAT RÁGCSÁLÓFAJOKON |
|
B.29. |
SZUBKRÓNIKUS INHALÁCIÓS TOXICITÁSVIZSGÁLAT 90 NAPOS, ISMÉTELT INHALÁCIÓS ADAGOLÁSÚ VIZSGÁLAT RÁGCSÁLÓFAJOKON |
|
B.30. |
KRÓNIKUS TOXICITÁSVIZSGÁLAT |
|
B.31. |
PRENATÁLIS FEJLŐDÉSI TOXICITÁSVIZSGÁLAT |
|
B.32. |
A RÁKKELTŐ HATÁS VIZSGÁLATA |
|
B.33. |
A KRÓNIKUS TOXICITÁS ÉS A RÁKKELTŐ HATÁS EGYÜTTES VIZSGÁLATA |
|
B.34. |
EGYGENERÁCIÓS REPRODUKCIÓS TOXICITÁSVIZSGÁLAT |
|
B.35. |
KÉTGENERÁCIÓS REPRODUKCIÓS TOXICITÁSVIZSGÁLAT |
|
B.36. |
TOXIKOKINETIKAI VIZSGÁLAT |
|
B.37. |
SZERVES FOSZFORVEGYÜLETEKKEL KIVÁLTOTT AKUT KÉSLELTETETT NEUROTOXICITÁS |
|
B.38. |
SZERVES FOSZFORVEGYÜLETEKKEL KIVÁLTOTT KÉSLELTETETT NEUROTOXOCITÁS-VIZSGÁLAT, 28 NAPOS ISMÉTELT ADAGOLÁS ESETÉN |
|
B.39. |
NEM ÜTEMEZETT DNS-SZINTÉZIS (UDS) IN VIVO VIZSGÁLAT EMLŐS MÁJSEJTEKKEL |
|
B.40. |
IN VITRO BŐRKORRÓZIÓ: TRANSZKUTÁN ELEKTROMOS REZISZTENCIA VIZSGÁLAT (TER) |
|
B.40 A. |
IN VITRO BŐRKORRÓZIÓ: EMBERI BŐRMODELLEN VÉGZETT VIZSGÁLAT |
|
B.41. |
IN VITRO 3T3 NRU FOTOTOXICITÁS-VIZSGÁLAT |
|
B.42. |
BŐRSZENZIBILIZÁCIÓ: LOKÁLIS NYIROKCSOMÓ-VIZSGÁLATI MÓDSZER |
|
B.43. |
NEUROTOXICITÁSI VIZSGÁLAT RÁGCSÁLÓKBAN |
|
B.44. |
BŐRÖN ÁT TÖRTÉNŐ FELSZÍVÓDÁS: IN VIVO MÓDSZER |
|
B.45. |
BŐRÖN ÁT TÖRTÉNŐ FELSZÍVÓDÁS: IN VITRO MÓDSZER |
ÁLTALÁNOS BEVEZETÉS
A. A VIZSGÁLT ANYAG JELLEMZÉSE
A vizsgált anyag összetételét – beleértve a főbb szennyező anyagokat és a lényeges fizikaikémiai tulajdonságait, ill. az anyag stabilitását – a toxicitás-vizsgálat megkezdése előtt ismerni kell.
A vizsgált anyag fizikai-kémiai tulajdonságai döntő fontosságúak az adagolási mód kiválasztásánál, az egyes vizsgálatok megtervezésénél, a vizsgált anyag kezelésénél és tárolásánál.
A vizsgált anyagnak (amennyiben lehetséges, a legfontosabb szennyezésekkel együtt) az adagolási közegben és a biológiai anyagban történő mennyiségi és minőségi vizsgálatára vonatkozó analitikai módszer kifejlesztése megelőzi a vizsgálatok megkezdését.
Az azonosításra, a fizikai-kémiai tulajdonságok meghatározására, a tisztaságra és a vizsgált anyag viselkedésére vonatkozó összes információnak szerepelnie kell a vizsgálati jelentésben.
B. AZ ÁLLATOK GONDOZÁSA
A környezeti feltételek szigorú szabályozása és az állatoknak a fajnak megfelelő gondozása nagyon lényeges a toxicitásvizsgálatoknál.
i. Tartási körülmények
A kísérleti állatok elhelyezésének környezeti körülményit az adott faj igényeihez kell igazítani. Patkányok, egerek és tengerimalacok számára a megfelelő körülmények: 22 ± 3 oC szobahőmérséklet, 30–70 százalékos relatív páratartalom mellett; míg nyulak számára a megfelelő körülmények: 20 ± 3 oC hőmérséklet, 30–70 százalékos relatív páratartalom.
Néhány kísérleti eljárás különösen érzékeny a hőmérsékleti hatásokra, ezekben az esetekben a megfelelő környezeti körülményekre vonatkazó részleteket a vizsgálati módszer leírása tartalmazza. A toxikus hatások kutatása során, a hőmérsékletet és a páratartalmat minden esetben figyelni és rögzíteni kell és meg kell adni a vizsgálati jelentésben.
A világítás mesterséges, a világos és sötét szakaszok 12 óránként váltják egymást. A világításra vonatkozó adatokat feljegyzik és megadják a vizsgálati jelentésben.
Hacsak a módszer leírásában más nem szerepel, az állatok egyenként tartandók, vagy kis, azonos nemű egyedekből álló csoportokban összezárhatók; csoportos tartás esetén egy ketrecben legfeljebb öt állat tartható.
Az állatkísérletekről szóló jelentésében fontos megadni az állatok ketrecének típusát és az egyes ketrecekben tartott állatok számát, a vegyszer hatásának kitett időszak és az azt követő megfigyelés alatt egyaránt.
ii. Etetési körülmények
Az alkalmazott tápláléknak meg kell felelnie a vizsgált fajnak megfelelő, a táplálkozástudomány által meghatározott követelményeknek. Amikor a vizsgált anyagokat az állatok táplálékában adják be, akkor a tápértéket az anyag és a táplálék összetevőinek kölcsönhatása csökkentheti. Egy ilyen kölcsönhatás lehetőségét figyelembe kell venni a vizsgálat eredményeinek értelmezése során. Hagyományos laboratóriumi táplálás alkalmazható korlátozás nélküli ivóvízellátással. A táplálék típusának kiválasztását befolyásolhatja, hogy a tápláléknak és a vizsgált anyagnak a megfelelő keverékét kell biztosítani, ha ilyen módon adagolják a vizsgált anyagot.
A táplálék olyan szennyezései, amelyekről ismert, hogy befolyásolják a toxicitást, nem lehetnek jelen zavaró nagyságú koncentrációban.
C. ALTERNATÍV VIZSGÁLATI MÓDSZEREK
Az Európai Unió elkötelezett olyan alternatív módszerek kifejlesztése és jóváhagyása támogatására, amelyek az ismereteket ugyanolyan szinten biztosítják, mint a jelenlegi állatkísérletek, azonban kevesebb állatot használnak fel, kevesebb szenvedést okoznak az állatoknak vagy teljesen kiküszöbölik az állatok alkalmazását.
Ilyen módszerek alkalmazását (amint elérhetővé válnak), ahol csak lehet, meg kell fontolni, a veszély jellemzésével, az azt követő osztályozással, címkézéssel és az anyag belső tulajdonságaiból adódó veszély jelölésével kapcsolatos eljárásokban.
D. KIÉRTÉKELÉS ÉS ÉRTELMEZÉS
A vizsgálatok kiértékelésekor és értelmezésekor figyelembe kell venni azt, hogy az állati és az in vitro vizsgálatok eredményét milyen mértékben lehet közvetlenül kiterjeszteni az emberre, és ezért az emberre káros hatás bizonyítékait, ahol rendelkezésre állnak, fel lehet használni a vizsgálati eredmények megerősítésére.
E. SZAKIRODALOM
Ezeknek a módszereknek a többségét a Vizsgálati irányelvek elnevezésű OECD-program keretében fejlesztették ki, és azokat a Helyes Laboratóriumi Gyakorlat alapelveivel összhangban kell alkalmazni, az „adatok kölcsönös elfogadásának” széles körű biztosítása érdekében.
További tájékoztatás található az OECD-irányelvekben megadott szakirodalom jegyzékekben, illetve az egyéb helyeken kiadott vonatkozó irodalomban.
B.1a. AKUT ORÁLIS TOXICITÁS – RÖGZÍTETT DÓZISÚ ELJÁRÁS
1. MÓDSZER
Ez a vizsgálati módszer egyenértékű az OECD TG 420 (2001) módszerrel.
1.1. BEVEZETÉS
Az akut toxicitás megállapítására szolgáló hagyományos módszerek esetében a vizsgálat végpontját az állatok elpusztulása jelenti. A Brit Toxikológiai Társaság 1984-ben új megközelítést javasolt az akut toxicitás vizsgálatára, amely egy sor rögzített nagyságú dózis beadásán alapul (1). Ennél a megközelítésnél nem az állatok elpusztulása jelenti a vizsgálat végpontját, hanem a rögzített nagyságú dózisok valamelyikénél megfigyelt egyértelmű mérgezési tünetekre támaszkodtak. Az Egyesült Királyságban (2) és nemzetközileg (3) végzett in vivo validálási vizsgálatok után az eljárást 1992-ben hagyták jóvá mint vizsgálati módszert. Ezt követően egy vizsgálati sorozat (4)(5)(6) keretében matematikai modellek segítségével megvizsgálták a rögzített dózisú eljárás statisztikai tulajdonságait. Az in vivo és a modellvizsgálatok együttesen igazolták, hogy az eljárás reprodukálható, kevesebb kísérleti állatra van szükség hozzá, és kevesebb szenvedést okoz, mint a hagyományos módszerek, továbbá hasonló módon képes minősíteni az anyagokat, mint az egyéb akut toxicitási vizsgálati módszerek.
Arról, hogy egy adott célra melyik a legmegfelelőbb vizsgálati módszer, az Akut Orális Toxicitási Vizsgálatok Útmutatójában (7) található iránymutatás. Ez az útmutató további információkat is tartalmaz az 1Ba. vizsgálati módszer alkalmazásával és értelmezésével kapcsolatosan.
A módszer egyik alapelve, hogy a fő vizsgálatban csak közepesen toxikus dózisokat alkalmaznak, és hogy kerülni kell az olyan dózisok alkalmazását, amelyek várhatóan letálisak. Nincs szükség továbbá olyan dózisok alkalmazására sem, amelyek korróziós vagy súlyosan irritáló hatásuk miatt kifejezett fájdalmat vagy szorongást okoznak. Az elhullás közelében lévő állatokat vagy azokat, amelyek nyilvánvalóan fájdalmakkal küszködnek, vagy súlyos és tartós szorongás jeleit mutatják, humánus módon exterminálni kell, és ugyanúgy kell figyelembe venni őket a vizsgálati eredmények értelmezésekor, mint azokat az állatokat, amelyek elhullottak a vizsgálatok során. A megjósolható vagy közeli elhullás felismerését segítő iránymutatás, valamint az elhullás közelében lévő vagy súlyosan szenvedő állatok exterminálására vonatkozó döntési kritériumok egy másik útmutatóban (8) találhatók.
A módszer adatokat szolgáltat az anyag veszélyes tulajdonságairól és lehetővé teszi, hogy az anyagot az akut toxicitást okozó anyagok besorolására szolgáló Globálisan harmonizált rendszer (Globally Harmonised System, GHS) szerint minősítsék és sorolják be (9).
A vizsgáló laboratóriumnak a vizsgálat elvégzése előtt a vizsgálandó anyaggal kapcsolatos minden rendelkezésre álló információt figyelembe kell vennie. Ilyen információk az anyag megjelölése és kémiai szerkezete; fizikai-kémiai tulajdonságai; bármely más, az anyaggal elvégzett in vitro vagy in vivo toxicitási vizsgálat eredményei; szerkezetileg rokon anyagok toxikológiai adatai és az anyag várható alkalmazása(i). Ezekre az információkra azért van szükség, hogy minden érintett meggyőződjön arról, hogy a vizsgálat releváns az emberi egészség védelme szempontjából, és elősegíti majd a megfelelő kezdődózis kiválasztását.
1.2. FOGALOMMEGHATÁROZÁSOK
Akut orális toxicitás: a vizsgálandó anyag egyszeri vagy 24 órán belül többszöri dózisának szájon át történő beadását követően jelentkező káros hatások.
Késleltetett elhullás: egy állat 48 órán belül nem hull el, illetve nem tűnik elhullásközeli állapotban lévőnek, de később, a 14 napos megfigyelési időszak során elpusztul.
Dózis: a vizsgálandó anyag beadott mennyisége. A dózist a vizsgálandó anyagnak a kísérleti állatok testtömegegységére számított tömegében (pl. mg/kg) fejezik ki.
Nyilvánvaló toxicitás: a vizsgálandó anyag beadását követően jól látható mérgezési tüneteket leíró általános kifejezés (a példákat lásd a (3) hivatkozásban), amelynél a következő legmagasabb rögzített dózis esetében a legtöbb állatnál súlyos fájdalom vagy súlyos szorongás tartós jelei, elhullásközeli állapot (az ezzel kapcsolatos kritériumok a Humane Endpoints Guidance Documentben (8) szerepelnek), vagy valószínű elhullás várható.
GHS: Globálisan harmonizált osztályozási rendszer vegyi anyagokhoz és keverékekhez. Az OECD (emberi egészség és környezet), az ENSZ Veszélyes Anyagok Szállításának Szakértői Bizottsága (fizikai-kémiai tulajdonságok) és az ILO (veszély nyilvánosságra hozatala) közös tevékenysége, amelyet a Szervezetek közötti program a vegyi anyagok helyes kezelésére (Interorganisation Programme of the Sound Management of Chemicals, IOMC) koordinál.
Közeli elhullás: amikor a legközelebbi tervezett megfigyelés időpontja előtt elhullásközeli állapot kialakulása vagy elhullás várható. Rágcsálók esetében erre utaló jelek lehetnek a görcsök, az oldalhelyzet, a fekvőhelyzet és a remegés. (A további részleteket lásd a Humane Endpoints Guidance Documentben (8)).
LD50: (közepes letális dózis): a vizsgálandó anyag statisztikailag levezetett egyszeri olyan dózisa, amely orálisan beadva az állatok 50 %-ának elhullását okozza. Az LD50-értéket a vizsgálandó anyagnak a kísérleti állatok testtömegegységére számított tömegében (mg/kg) fejezik ki.
Határdózis: egy, a vizsgálhatóság felső határánál lévő dózis (2 000 vagy 5 000 mg/kg).
Elhullásközeli állapot: az esetleges kezelés ellenére is az elhullás közelében lévő állapot vagy túlélésre való képtelenség. (A további részleteket lásd a Humane Endpoints Guidance Documentben (8)).
Megjósolható elhullás: a kísérlet tervezett vége előtt, a jövőben egy ismert időpontban való elhullásra utaló klinikai tünetek megléte, például: a víz vagy az élelem elérésére való képtelenség. (A további részleteket lásd Humane Endpoints Guidance Documentben (8)).
1.3. A VIZSGÁLATI MÓDSZER ELVE
Azonos ivarba tartozó állatok csoportjainak egy lépcsőzetes eljárás során 5, 50, 300 és 2 000 mg/kg-os rögzített dózisok alkalmazásával kell beadni a vizsgálandó anyagot (kivételes esetben egy további, 5 000 mg/kg-os rögzített dózis is alkalmazható; lásd az 1.6.2. szakaszt). A kiindulási dózist a dózisbehatároló vizsgálat alapján kell megválasztani úgy, hogy az várhatóan mérgezési tüneteket eredményezzen, de ne okozzon súlyos mérgezést vagy elhullást. A fájdalomhoz, szenvedéshez és közeli elhulláshoz társuló klinikai tüneteket és állapotot részletesen egy külön OECD Útmutató (8) ismerteti. A mérgezési tünetek megjelenésétől vagy az elhullás bekövetkeztétől vagy ezek elmaradásától függően további állatcsoportok is kezelhetők magasabb vagy alacsonyabb rögzített dózissal. Az eljárást folytatni kell, amíg meg nem találják azt a dózist, amely nyilvánvaló toxicitást vagy legfeljebb egy elhullást okoz, vagy ha a legmagasabb dózisnál nem figyelnek meg semmilyen hatást, vagy ha a legalacsonyabb dózisnál elhullanak állatok.
1.4. A VIZSGÁLATI MÓDSZER ISMERTETÉSE
1.4.1. Az állatfaj kiválasztása
A preferált rágcsálófaj a patkány, bár más rágcsálófajok is alkalmazhatók. Általában nőstényeket használnak (7). Ennek az az oka, hogy a hagyományos LD50-vizsgálatokra vonatkozó szakirodalom áttekintése alapján általában kicsi a különbség a nemek érzékenysége között, de azokban az esetekben, amikor megfigyelhető különbség, a nőstények általában valamivel érzékenyebbek (10). Azonban ha a szerkezetileg rokon vegyületek toxikológiai vagy toxikokinetikai tulajdonságaival kapcsolatos adatok szerint a hímek nagyobb érzékenysége valószínűsíthető, akkor hímeket kell alkalmazni. Megfelelően meg kell indokolni, ha a vizsgálatot hímekkel végzik.
Általánosan használt laboratóriumi törzsekből származó egészséges, fiatal felnőtt állatokat kell alkalmazni. Olyan nőstényeket kell választani, amelyek még egyszer sem ellettek, és nem vemhesek. Az adagolás megkezdésekor az állatoknak 8–12 hetesnek kell lenniük, és testtömegük nem térhet el ± 20 %-nál többel az esetlegesen korábban kezelt állatok testtömegének átlagától.
1.4.2. Az állatok tartásának és etetésének körülményei
A kísérleti állatokat 22 oC (± 3 oC) hőmérsékletű helyiségben kell tartani. Bár a helyiség relatív páratartalmának legalább 30 %-nak kell lennie, illetve a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot, a célértéknek 50 és 60 % között kell lennie. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett. Az állatokat lehet vizsgált dózisonként egy ketrecben tartani, de az egy ketrecben lévő állatok számát úgy kell megválasztani, hogy az ne zavarja az egyes állatok megfigyelését.
1.4.3. Az állatok előkészítése
Az állatokat véletlenszerűen kell kiválasztani, majd egyedi azonosítóval kell ellátni, és a kezelés megkezdése előtt legalább 5 napig a ketrecükben kell tartani őket, hogy hozzászokhassanak a laboratóriumi körülményekhez.
1.4.4. A dózisok előkészítése
A vizsgálandó anyagokat általában a vizsgálandó dózistartományon belül állandó térfogatban kell beadni úgy, hogy a dóziskészítmény koncentrációját változtatják. Azonban ha folyékony végterméket vagy keveréket vizsgálnak, a vizsgálatot követő kockázatértékelés szempontjából megfelelőbb lehet, ha a vizsgálandó anyagot hígítatlanul, azaz állandó koncentrációban alkalmazzák, illetve egyes szabályozó hatóságok ezt írják elő. A maximálisan beadható dózistérfogatot azonban egyik esetben sem szabad túllépni. Az, hogy egyszerre maximálisan mekkora térfogatú folyadékot lehet beadni, a kísérleti állat méretétől függ. Rágcsálók esetében a térfogat általában nem haladhatja meg az 1 ml/100 g testtömegarányt: vizes oldatok esetében azonban 2 ml/100 g testtömegarány is megfontolható. A dóziskészítmény formulázásakor – ahol lehet – a vizes oldatok/szuszpenziók/emulziók alkalmazása javasolt, másodsorban az olajos (pl. kukoricacsíra-olajban elkészített) oldatok/szuszpenziók/emulziók, és harmadsorban esetlegesen más vivőanyagokban elkészített oldatok. A víztől eltérő vivőanyagok esetében ismerni kell a vivőanyag toxikológiai tulajdonságait. A dózisokat a beadás előtt rövid idővel kell elkészíteni, kivéve, ha ismert és igazoltan elfogadható a készítmény stabilitása az alkalmazás időtartama alatt.
1.5. ELJÁRÁS
1.5.1. A dózisok beadása
A vizsgálandó anyagot egyetlen dózisban, gyomorszondán vagy egy megfelelő intubációs kanülön át történő táplálással kell beadni. Abban a rendkívüli esetben, ha nem lehetséges egyetlen dózist alkalmazni, a dózis egy 24 órát nem meghaladó időtartam alatt kisebb részletekben is beadható.
A kezelés előtt az állatokat éheztetni kell (pl. patkány esetében egy éjszakán át meg kell vonni a táplálékot, de a vizet nem; egér esetében 3–4 órára kell megvonni a táplálékot, de a vizet nem). A koplaltatási időszakot követően meg kell mérni az állatok testtömegét, majd be kell adni a vizsgálandó anyagot. Az anyag beadása után a táplálékot újra meg lehet vonni -patkány esetében 3–4 órára, egér esetében 1–2 órára. Ha egy dózist részletekben adnak be, a beadás időtartamától függően menet közben szükség lehet arra, hogy az állatoknak táplálékot és vizet adjanak.
1.5.2. Dózisbehatároló vizsgálat
A dózisbehatároló vizsgálat célja, hogy ki lehessen választani a megfelelő kezdődózist a fő vizsgálathoz. A vizsgálandó anyagot az 1. függelékben bemutatott folyamatábra szerint egymás után kell beadni egy-egy állatnak. A dózisbehatároló vizsgálat akkor fejeződik be, amikor meghozható a döntés a fő vizsgálatban alkalmazandó kezdődózisról (vagy ha a legalacsonyabb rögzített dózisnál elhullás történik).
A dózisbehatároló vizsgálatban a kezdődózist a következő rögzített dózisok közül választják ki: 5, 50, 300 és 2 000 mg/kg aszerint, hogy a lehetőleg ugyanezzel az anyaggal vagy szerkezetileg rokon anyagokkal kapott in vivo vagy in vitro adatok alapján várhatóan melyik eredményez nyilvánvaló toxicitást. Ilyen információk hiányában a kezdődózist 300 mg/kg-ban kell megállapítani.
Az egyes állatok kezelése között legalább 24 órának el kell telnie. Minden állatot legalább 14 napig megfigyelés alatt kell tartani.
Kivételes esetben és kizárólag akkor, ha konkrét jogszabályi követelmény indokolja, megfontolás tárgyává lehet tenni egy további, 5 000 mg/kg-os felső rögzített dózis alkalmazását (lásd a 3. függeléket). Az állatok kímélete érdekében a GHS 5. kategóriában (2 000–5 000 mg/kg tartomány) nem ajánlott állatokkal kísérletezni, és csak abban az esetben szabad ilyet tervezni, ha nagy a valószínűsége, hogy egy ilyen vizsgálat eredményei közvetlen jelenőséggel bírnak az emberi vagy állati egészség, illetve a környezet védelme szempontjából.
Olyan esetekben, amikor a dózisbehatároló vizsgálatban a legalacsonyabb rögzített dózissal (5 mg/kg) kezelt állat elhullik, az általános eljárás szerint be kell fejezni a vizsgálatot és az anyagot a GHS 1. kategóriába kell besorolni (ahogyan az az 1. függelékben látható). Ha azonban szükség van a besorolás további megerősítésére, az alábbiak szerinti opcionális kiegészítő eljárás alkalmazható. Egy második állatnak is beadjuk az 5 mg/kg-os dózist. Ha ez is elhullik, akkor az megerősíti a GHS 1. kategóriába való besorolást, és a vizsgálatot azonnal be kell fejezni. Ha a második állat életben marad, akkor legfeljebb három további állaton kell elvégezni az 5 mg/kg-os dózissal történő vizsgálatot. Mivel nagy az elhullás kockázata, az állatok kímélete érdekében egymás után kell őket kezelni. Az egyes állatok kezelése között eltelt időt úgy kell megválasztani, hogy elegendő legyen annak megállapítására, hogy az előzőleg kezelt állat valószínűleg életben marad. Ha egy második állat is elhullik, azonnal be kell fejezni a kezeléseket, és több állatnak már nem szabad beadni az anyagot. Mivel a második elhullás bekövetkezte miatt (függetlenül attól, hogy a vizsgálatok befejezéséig hány állatot kezeltek) az „A” eredményhez jutnak (legalább 2 elhulláseset), a 2. függelék 5 mg/kg-os rögzített dózisánál érvényes besorolási szabályt kell követni (ha legalább 2 elhullás történt, akkor 1. kategória, ha legfeljebb 1 elhullás történt, akkor 2. kategória). A 4. függelékben pedig azzal kapcsolatos útmutatást tartalmaz, hogy az új GHS bevezetéséig az anyagokat hogyan kell az EU-rendszer szerinti kategóriákba besorolni.
1.5.3. Fő vizsgálat
1.5.3.1. Az állatok száma és a dózisok
A kezdődózissal történő vizsgálat utáni teendőket a 2. függelékben található folyamatábra mutatja. Három lehetséges alternatíva létezik: vagy le kell állítani a vizsgálatot, és be kell sorolni az anyagot a megfelelő veszélyességi kategóriába, vagy magasabb rögzített dózissal kell folytatni a vizsgálatot, vagy alacsonyabb rögzített dózissal. Az állatok védelme érdekében azonban a fő vizsgálatban már nem szabad olyan dózissal kísérletezni, amely a dózisbehatároló vizsgálatban elhullást okozott (lásd a 2. függeléket). A tapasztalatok azt mutatják, hogy a kezdődózissal végzett vizsgálatok legvalószínűbb eredménye, hogy az anyagot be lehet valamilyen kategóriába sorolni és nincs szükség további vizsgálatokra.
Általában összesen öt-öt, azonos ivarú állatnak kell beadni az egyes vizsgált dózisokat. Ebből az öt állatból egyet a dózisbehatároló vizsgálat során kezelnek az adott dózissal, és ehhez járul a további négy állat (kivéve abban a szokatlan esetben, ha a fő vizsgálatban használt dózist nem alkalmazták a dózisbehatároló vizsgálatban).
Az egyes dózisok vizsgálata közötti időtartamot a mérgezési tünetek megjelenésének időpontja, időtartama és súlyossága határozza meg. Az állatok következő dózissal történő kezelését nem szabad megkezdeni mindaddig, amíg meg nem bizonyosodtak arról, hogy az előzőleg kezelt állatok életben maradnak. Szükség esetén ajánlott ez egyes dózisokkal való kezelések között 3 vagy 4 napos szünetet tartani, hogy meg lehessen figyelni a késleltetett toxicitást. Ennek időtartama szükség esetén – pl. nem meggyőző válasz esetében –módosítható.
Ha egy felső, 5 000 mg/kg-os dózis alkalmazást is tervbe vesznek, a 3. függelékben vázolt eljárást kell követni (lásd még az 1.6.2. szakaszt).
1.5.3.2. Határérték-vizsgálat
Határérték-vizsgálatot elsősorban olyan helyzetekben kell végezni, ha a kísérletet végzőnek olyan információi vannak, amelyek szerint a vizsgálandó anyag valószínűleg nem toxikus, azaz csak a hatósági határértékdózisok felett toxikus. A vizsgálandó anyag toxicitásával kapcsolatban hasonló vegyületek vagy keverékek vagy termékek vizsgálataiból szerezhető információ, figyelembe véve a toxikológiai szempontból fontos komponenseket, illetve azok százalékos arányát. Olyan esetekben, ha kevés az anyag toxicitásával kapcsolatos információ, vagy egyáltalán nem áll rendelkezésre, vagy ha a vizsgálandó anyag várhatóan toxikus, a fő vizsgálatot kell elvégezni.
Ezen iránymutatás céljára határérték-vizsgálatként a normál eljárás alkalmazásával történő, 2 000 mg/kg-os (vagy kivételes esetben 5 000 mg/kg-os) kezdődózissal végzett dózisbehatároló vizsgálat, majd ezt követően további négy állat ugyanezzel a dózissal történő kezelése szolgál.
1.6. MEGFIGYELÉSEK
Az állatokat a dózis beadása után egyedileg kell megfigyelni, legalább az első 30 percben, azután az első 24 órában rendszeres időközönként, amelynek során különös figyelemmel kell őket kísérni az első 4 órában, majd ezt követően naponta, összesen 14 napon át, kivéve, ha az állatot állatjóléti okok miatt ki kell venni a vizsgálatból, és humánus módon exterminálni kell, vagy ha az állat elhullik. A megfigyelés időtartamát azonban nem szabad mereven meghatározni. Ezt a mérgezési reakciók, illetve a gyógyulás kezdete és időtartama alapján kell meghatározni, és ilyen módon szükség esetén meg lehet hosszabbítani. Fontos a mérgezési tünetek megjelenésének, illetve megszűnésének időpontja, különösen, ha a mérgezési tünetek inkább késleltetve jelentkeznek (11). Minden megfigyelést szisztematikusan rögzíteni kell olyan módon, hogy minden állat esetében önálló adatsort vesznek fel.
Ha a mérgezési tünetek tartósak, további megfigyelésekre van szükség. Meg kell figyelni a bőr és a szőrzet, a szemek és a nyálkahártyák, valamint a légzési és a keringési rendszer, az autonóm és a központi idegrendszer, illetve a szomatomotoros aktivitás és a viselkedési mintázatok változásait. Figyelemmel kell lenni remegés, görcsök, nyáladzás, hasmenés, letargia, alvás és kóma előfordulására is. A Humane Endpoints Guidance Documentben összefoglalt alapelveket és követelményeket is figyelembe kell venni (8). Humánus módon exterminálni kell az elhullásközeli állapotban lévő állatokat, illetve azokat, amelyek súlyos fájdalom vagy tartós szorongás jeleit mutatják. Ha az állatokat humánus okok miatt exterminálni kell, vagy elhullanak, a lehető legpontosabban fel kell jegyezni az elhullás időpontját is.
1.6.1. Testtömeg
Röviddel a vizsgálandó anyag beadása előtt és legalább egy héttel utána minden állat testtömegét egyenként meg kell mérni. A testtömeg-változást ki kell számítani és fel kell jegyezni. A vizsgálat végén az életben maradt állatokat újra meg kell mérni, majd humánus módon exterminálni kell őket.
1.6.2. Kórbonctani vizsgálat
Minden kísérleti állatot makroszkópos boncolásnak kell alávetni (azokat is, amelyek a vizsgálat során elpusztultak, vagy amelyeket állatjóléti okok miatt ki kellett venni a vizsgálatból). Minden állat esetében az összes makroszkópos kórtani elváltozást fel kell jegyezni. A kezdődózis beadása után legalább 24 óráig túlélő állatok esetében tervbe lehet venni a makroszkópos kórtani elváltozást mutató szervek mikroszkópos vizsgálatát is, mivel abból hasznos információk nyerhetők.
2. ADATOK
Az állatokra vonatkozóan egyedi adatsorokat kell felvenni. Emellett az összes adatot táblázatos formában is össze kell foglalni úgy, hogy minden vizsgálati csoportra vonatkozóan mutassa a csoportban lévő kísérleti állatok számát, valamint azoknak a számát, amelyeknél mérgezési tünetek láthatók, amelyek a vizsgálat során elhullottak vagy humánus módon exterminálásra kerültek, az egyes állatok elhullásának időpontját, a toxikus hatások leírását, időbeli lefolyását és visszafordíthatóságát, valamint a boncolások eredményeit.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek megfelelő módon a következő információkat kell tartalmaznia:
|
|
Vizsgálandó anyag:
|
|
|
Vivőanyag (szükség esetén):
|
|
|
Kísérleti állatok:
|
|
|
Kísérleti körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények diszkussziója és értelmezése. |
|
|
Következtetések. |
4. HIVATKOZÁSOK
|
(1) |
British Toxicology Society Working Party on Toxicity (1984). Special report: a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol., 3, 85-92. |
|
(2) |
Van den Heuvel, M.J., Dayan, A.D. and Shillaker, R.O. (1987). Evaluation of the BTS approach to the testing of substances and preparations for their acute toxicity. Human Toxicol., 6, 279-291. |
|
(3) |
Van den Heuvel, M.J., Clark, D.G., Fielder, R.J., Koundakjian, P.P., Oliver, G.J.A., Pelling, D., Tomlinson, N.J. and Walker, A.P. (1990). The international validation of a fixed-dose procedure as an alternative to the classical LD50 test. Fd. Chem. Toxicol. 28, 469-482. |
|
(4) |
Whitehead, A. and Curnow, R.N. (1992). Statistical evaluation of the fixed-dose procedure. Fd. Chem. Toxicol., 30, 313-324. |
|
(5) |
Stallard, N. and Whitehead, A. (1995). Reducing numbers in the fixed-dose procedure. Human Exptl. Toxicol. 14, 315-323. Human Exptl. Toxicol. |
|
(6) |
Stallard, N., Whitehead, A. and Ridgeway, P. (2002). Statistical evaluation of the revised fixed dose procedure. Hum. Exp. Toxicol., 21, 183-196. |
|
(7) |
OECD (2001). Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris. |
|
(8) |
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N. 19. |
|
(9) |
OECD (1998). Harmonised Integrated Hazard Classification for Human Health and Environmental Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p.11 [http://webnetl.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html]. |
|
(10) |
Lipnick, R.L., Cotruvo, J.A., Hill, R.N., Bruce, R.D., Stitzel, K.A., Walker, A.P., Chu, I. Goddard, M., Segal, L., Springer, J. A. and Myers, R.C. (1995). Comparison of the Up-and-Down, Conventional LD50, and Fixed-Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33,223-231. |
|
(11) |
Chan P.K and A.W. Hayes (1994) Chapter 16 Acute Toxicity and Eye Irritation . In: Principles and Methods of Toxicology. 3rd Edition. A.W. Hayes, Editor. Raven Press, Ltd. New York, USA. |
1. FÜGGELÉK
A DÓZISBEHATÁROLÓ VIZSGÁLAT FOLYAMATÁBRÁJA


2. FÜGGELÉK:
A FŐ VIZSGÁLAT FOLYAMATÁBRÁJA

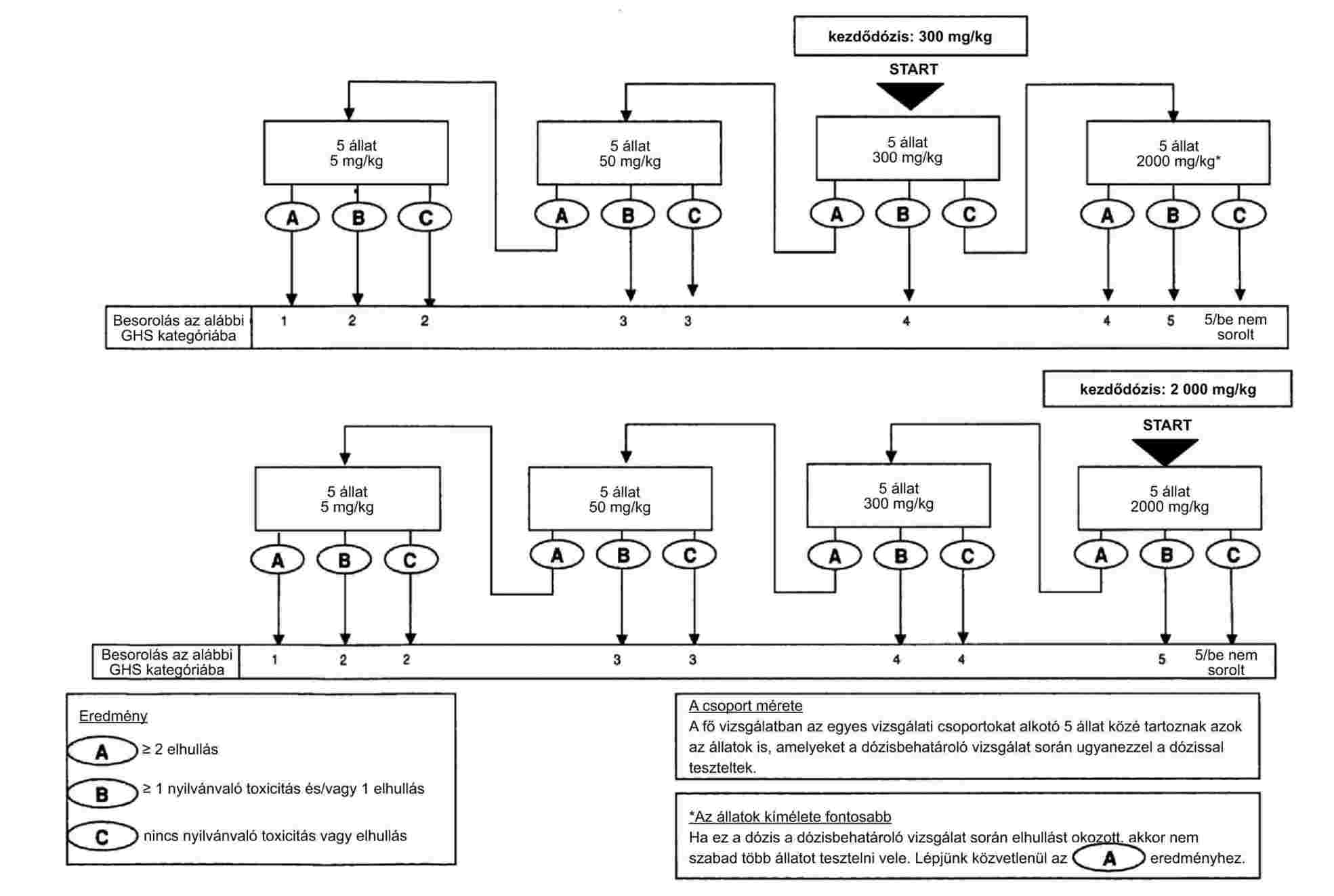
3. FÜGGELÉK
A VÁRHATÓAN 2 000 MG/KG FELETTI LD50-ÉRTÉKKEL RENDELKEZŐ VIZSGÁLANDÓ ANYAGOK VIZSGÁLATOK NÉLKÜLI OSZTÁLYOZÁSÁNAK KRITÉRIUMAI
Az 5. veszélyességi kategória kritériumait úgy állapították meg, hogy lehetővé tegyék azoknak a vizsgálandó anyagoknak a meghatározását, amelyek akut toxicitási kockázata viszonylag alacsony, de bizonyos körülmények között veszélyt jelenthetnek az érzékeny populációkra. Az ilyen anyagok orális vagy dermális LD50-értéke várhatóan 2 000 és 5 000 mg/kg közötti tartományban van, vagy ezzel egyenértékű dózisoknak megfelelő az egyéb beadási módok esetében. A vizsgálandó anyagokat az alábbi esetekben lehet a 2 000 mg/kg < LD50 < 5 000 mg/kg veszélyességi kategóriába (GHS 5. kategória) sorolni:
|
a) |
ha a 2. függelékben bemutatott, az elhullási gyakoriságon alapuló vizsgálati sémák bármelyike szerint ebbe a kategóriába kell sorolni; |
|
b) |
ha hitelt érdemlő bizonyíték van már arra, hogy az anyag LD50-értéke az 5. kategóriában megadott tartományba esik; vagy más állatkísérletek vagy humán toxikus hatások akut jellegű humán egészségügyi veszélyt jeleznek; |
|
c) |
adatok extrapolálásával, becslésével vagy mérésével, ha egy veszélyesebb osztályba való besorolás nem indokolt, és
|
2 000 MG/KG FELETTI DÓZISOKKAL TÖRTÉNŐ VIZSGÁLAT
Kivételes esetben és kizárólag akkor, ha ezt konkrét jogszabályi követelmény indokolja, tervbe lehet venni egy további felső, 5 000 mg/kg-os rögzített dózis alkalmazást. Az állatok jólétének védelme iránti igényt elismerve nem ajánlott az 5 000 mg/kg-os dózis alkalmazása, és csak akkor szabad fontolóra venni, ha nagy a valószínűsége, hogy az ilyen vizsgálatok eredményei közvetlen jelentőséggel bírnak az állati vagy emberi egészség védelme szempontjából (9).
Dózisbehatároló vizsgálat
Az 1. függelékben bemutatott lépcsőzetes eljárás során irányadó döntési szabályokat ki lehet terjeszteni úgy, hogy 5 000 mg/kg-os dózisszintet is lehessen alkalmazni. Ha tehát a dózisbehatároló vizsgálathoz 5 000 mg/kg-os kezdődózist alkalmaznak, az „A” eredmény (elhullás) esetén egy második állatnak 2 000 mg/kg-os dózist kell beadni. „B” vagy „C” eredmény esetén (nyilvánvaló toxicitás vagy nincs toxicitás) a fő vizsgálatban 5 000 mg/kg-os kezdődózis is alkalmazható. Hasonló módon, ha az 5 000 mg/kg-os dózistól eltérő kezdődózist alkalmaznak, a 2 000 mg/kg-os dózis alkalmazásakor kapott „B” vagy „C” eredmény esetén a vizsgálatot 5 000 mg/kg-os dózissal kell folytatni. Ha ezt követően az „A” eredményhez jutnak, a fő vizsgálatban 2 000 mg/kg-os kezdődózist kell alkalmazni, „B” vagy „C” eredmény esetén pedig 5 000 mg/kg-os kezdődózist.
Fő vizsgálat
A 2. függelékben bemutatott lépcsőzetes eljárás során irányadó döntési szabályokat ki lehet terjeszteni úgy, hogy 5 000 mg/kg-os dózisszintet is lehessen alkalmazni. Ha tehát a fő vizsgálathoz 5 000 mg/kg-os kezdődózist alkalmaznak, az „A” eredmény (> 2 elhullás) esetén egy második csoportnak 2 000 mg/kg-os dózist kell beadni. „B” eredmény (nyilvánvaló toxicitás és/vagy < 1 elhullás) vagy „C” eredmény (nincs toxicitás) esetén az anyagot a GHS rendszer szerint be nem soroltnak kell tekinteni. Hasonló módon, ha az 5 000 mg/kg-os dózistól eltérő kezdődózist alkalmaznak, a 2 000 mg/kg-os dózis alkalmazásakor kapott „C” eredmény esetén a vizsgálatot 5 000 mg/kg-os dózissal kell folytatni. Ha ezt követően az „A” eredményhez jutnak, az anyagot a GHS 5. kategóriába kell sorolni, „B” vagy „C” eredmény esetén pedig be nem soroltnak kell tekinteni.
4. FÜGGELÉK
B.la. VIZSGÁLATI MÓDSZER
Útmutató az EU-rendszer szerinti besoroláshoz a Globálisan harmonizált osztályozási rendszer (GHS) teljes körű bevezetéséig tartó átmeneti időszakban (a (8) hivatkozásból)
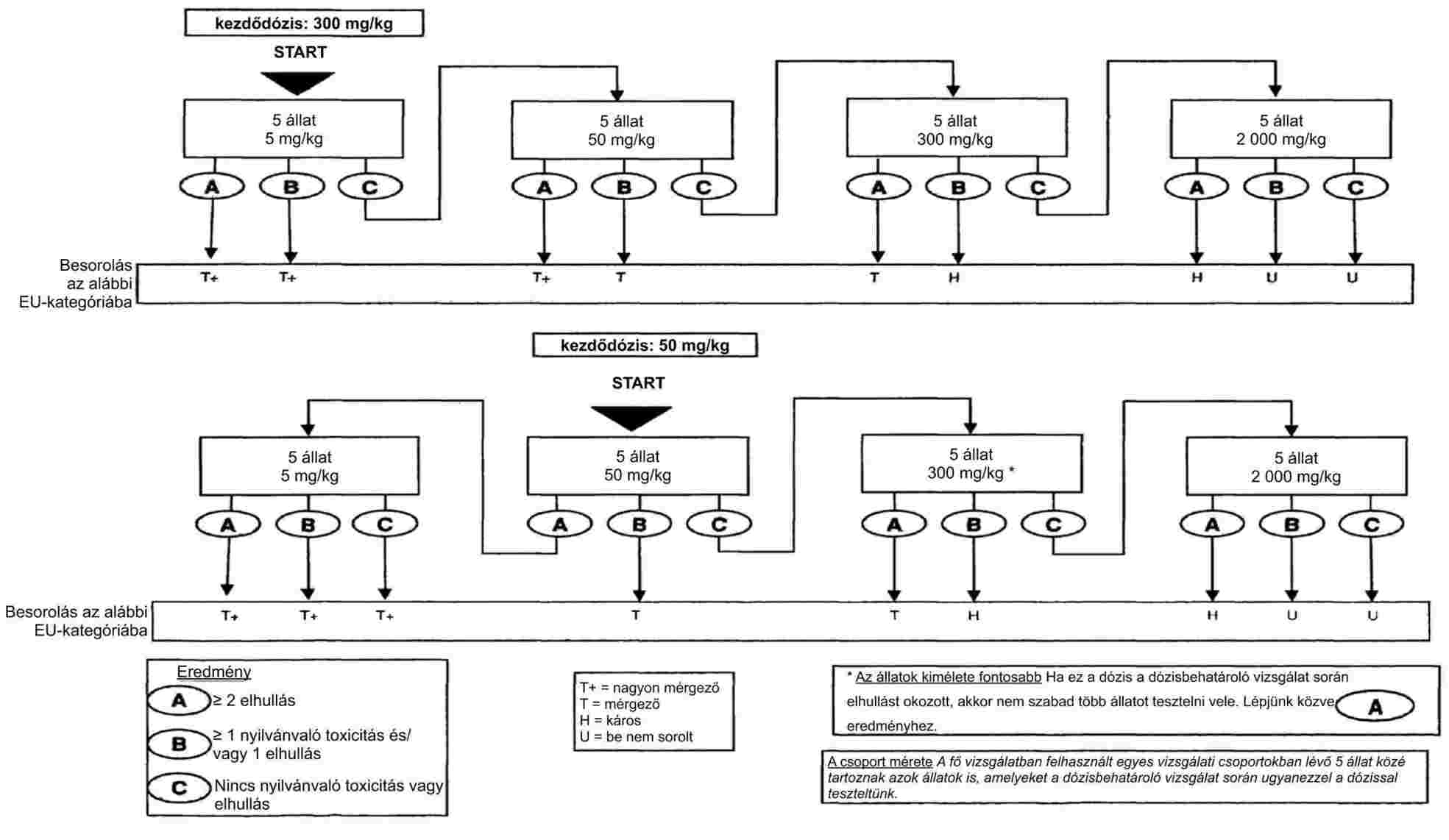

B.1b. AKUT ORÁLIS TOXICITÁS – AKUT TOXIKUS OSZTÁLY MÓDSZER
1. MÓDSZER
Ez a vizsgálati módszer egyenértékű az OECD TG 423 (2001) módszerrel.
1.1. BEVEZETÉS
Az itt ismertetett akut toxikus osztály módszer (1) egy lépcsőzetes eljárás, amelyben lépésenként három azonos ivarú állatot használnak. Az elhullási aránytól és/vagy az állatok elhullásközeli állapotától függően átlagosan 2–4 lépésre lehet szükség a vizsgálandó anyag akut toxicitásának megítéléséhez. Az eljárás reprodukálható, nagyon kevés állatot kell használni hozzá, és hasonló módon lehet vele minősíteni az anyagokat, mint a többi akut toxicitás vizsgálati módszerrel. Az akut toxikus osztály módszer rögzített dózisokkal végzett biometriai vizsgálatokon (2)(3)(4)(5) alapul, amelyek megfelelően el vannak választva egymástól, hogy lehetővé tegyék az anyag besorolási és veszélyfelmérési célokra történő minősítését. Az 1996-ban jóváhagyott módszert széles körben validálták a szakirodalomból vett in vivo LD50-adatokkal szemben mind nemzeti (6), mind pedig nemzetközi (7) szinten.
Arról, hogy egy adott célra melyik a legmegfelelőbb vizsgálati módszer, az Akut Orális Toxicitási Vizsgálatok Útmutatójában (8) található iránymutatás. Ez az útmutató további információkat is tartalmaz a B.1c. vizsgálati módszer alkalmazásával és értelmezésével kapcsolatosan.
Nincs szükség a vizsgálandó anyagok olyan dózisokban történő alkalmazására, amelyek korróziós vagy súlyosan irritáló hatásuk miatt kifejezett fájdalmat vagy szorongást okoznak. Az elhullásközeli állapotban lévő állatokat vagy azokat, amelyek nyilvánvalóan fájdalmakkal küszködnek, vagy súlyos és tartós szorongás jeleit mutatják, humánus módon exterminálni kell, és ugyanúgy kell figyelembe venni őket az eredmények értelmezésekor, mint azokat az állatokat, amelyek elhullottak a vizsgálatok során. A megjósolható vagy közeli elhullás felismerését segítő iránymutatás, valamint az elhullás közelében lévő vagy súlyosan szenvedő állatok exterminálására vonatkozó döntési kritériumok egy másik útmutatóban (9) találhatók.
A módszer előre meghatározott dózisok alkalmazásán alapul, és a kapott eredmények lehetővé teszik, hogy az anyagot az akut toxicitást okozó anyagok besorolására szolgáló Globálisan harmonizált rendszer (GHS) szerint minősítsük és soroljuk be (10).
A módszer elvben nem alkalmas az LD50 pontos kiszámítására, de lehetővé teszi azoknak az expozíciós tartományoknak a meghatározását, amelyeknél letalitás várható, mivel a fő végpont ebben a vizsgálatban is az állatok egy részének elhullása. Ez a módszer csak akkor teszi lehetővé az LD50-érték meghatározását, ha legalább két dózis 0 %-nál magasabb, de 100 %-nál alacsonyabb elhullási arányt eredményez. A vizsgálandó anyagtól függetlenül az előre meghatározott dózisok alkalmazása és a kifejezetten a különféle állapotokban megfigyelt állatok számához kötődő besorolás növeli a laboratóriumok által készített jelentések egységességét és a vizsgálatok ismételhetőségét.
A vizsgáló laboratóriumnak a vizsgálat elvégzése előtt a vizsgálandó anyaggal kapcsolatos minden rendelkezésre álló információt figyelembe kell vennie. Ilyen információk az anyag megjelölése és kémiai szerkezete; fizikai-kémiai tulajdonságai; bármely más, az anyaggal elvégzett in vitro vagy in vivo toxicitási vizsgálat eredményei; szerkezetileg rokon anyagok toxikológiai adatai; valamint az anyag várható alkalmazása(i). Ezekre az információkra azért van szükség, hogy minden érintett meggyőződjön arról, hogy a vizsgálat releváns az emberi egészség védelme szempontjából, és elősegíti majd a legmegfelelőbb kezdődózis kiválasztását.
1.2. FOGALOMMEGHATÁROZÁSOK
Akut orális toxicitás: a vizsgálandó anyag egyszeri vagy 24 órán belül többszöri dózisának szájon át történő beadását követően jelentkező káros hatások.
Késleltetett elhullás: egy állat 48 órán belül nem hull el vagy nem tűnik elhullásközeli állapotban lévőnek, de később, a 14 napos megfigyelési időszak során elpusztul.
Dózis: a vizsgálandó anyag beadott mennyisége. A dózist a vizsgálandó anyagnak a kísérleti állatok testtömegegységére számított tömegében (mg/kg) fejezik ki.
GHS: Globálisan harmonizált osztályozási rendszer vegyi anyagokhoz és keverékekhez. Az OECD (emberi egészség és környezet), az ENSZ Veszélyes Anyagok Szállításának Szakértői Bizottsága (fizikai-kémiai tulajdonságok) és az ILO (veszély nyilvánosságra hozatala) közös tevékenysége, amelyet a Szervezetek Közötti Program a Vegyi Anyagok Helyes Kezelésére (IOMC) koordinál.
Közeli elhullás: amikor a legközelebbi tervezett megfigyelés időpontja előtt elhullásközeli állapot kialakulása vagy elhullás várható. Rágcsálók esetében erre utaló jelek lehetnek a görcsök, az oldalhelyzet, a fekvőhelyzet és a remegés. (A további részleteket lásd a Humane Endpoints Guidance Documentben (9)).
LD 50 (közepes letális orális dózis): a vizsgálandó anyag statisztikailag levezetett egyszeri olyan dózisa, amely orálisan beadva az állatok 50 %-ának elhullását okozza. Az LD50-értéket a vizsgálandó anyagnak a kísérleti állatok testtömegegységére számított tömegében (mg/kg) fejezik ki.
Határdózis: egy, a vizsgálhatóság felső határánál lévő dózis (2 000 vagy 5 000 mg/kg).
Elhullásközeli állapot: az esetleges kezelés ellenére is elhullás közelében lévő állapot vagy túlélésre való képtelenség. (A további részleteket lásd a Humane Endpoints Guidance Documentben (9)).
Megjósolható elhullás: a kísérlet tervezett vége előtt, a jövőben egy ismert időpontban való elhullásra utaló klinikai tünetek megléte, például: a víz vagy az élelem elérésére való képtelenség. (A további részleteket lásd a Humane Endpoints Guidance Documentben (9)).
1.3. A VIZSGÁLAT ELVE
A vizsgálat alapelve, hogy a lépésenként minimális számú állatot alkalmazó lépcsőzetes eljárás alapján elegendő információ nyerhető a vizsgálandó anyag akut toxicitásáról ahhoz, hogy be lehessen azt sorolni. Az anyagot szájon át és a meghatározott dózisok egyikét alkalmazva adják be a kísérleti állatok egy csoportjának. Az anyagot lépcsőzetes eljárással vizsgálják, ahol minden lépésben három azonos ivarú (általában nőstény) állatot használnak. A kezelt állatokban az anyaggal összefüggő elhullás vagy annak hiánya határozza meg a következő lépést, azaz:
|
— |
nincs szükség további vizsgálatra, |
|
— |
további három állat vizsgálata történik ugyanazzal a dózissal, |
|
— |
további három állat vizsgálata történik a következő nagyobb vagy kisebb dózissal. |
A vizsgálati eljárás további részletei az 1. függelékben találhatók. A módszer alkalmazásával döntést lehet hozni arról, hogy a vizsgálandó anyag a rögzített LD50-határértékek segítségével megállapított toxicitási osztályok melyikébe sorolható be.
1.4. A MÓDSZER ISMERTETÉSE
1.4.1. Az állatfaj kiválasztása
A preferált rágcsálófaj a patkány, bár más rágcsálófajok is alkalmazhatók. Általában nőstényeket használnak (9). Ennek az az oka, hogy a hagyományos LD50-vizsgálatokra vonatkozó szakirodalom áttekintése alapján általában kicsi a különbség a nemek érzékenysége között, de azokban az esetekben, amikor megfigyelhető különbség, a nőstények általában valamivel érzékenyebbek (11). Azonban ha a szerkezetileg rokon vegyületek toxikológiai vagy toxikokinetikai tulajdonságaival kapcsolatos adatok szerint a hímek nagyobb érzékenysége valószínűsíthető, akkor hímeket kell alkalmazni. Megfelelően meg kell indokolni, ha a vizsgálatot hímekkel végzik.
Általánosan használt laboratóriumi törzsekből származó egészséges, fiatal felnőtt állatokat kell alkalmazni. Olyan nőstényeket kell választani, amelyek még egyszer sem ellettek, és nem vemhesek. Az adagolás megkezdésekor az állatoknak 8–12 hetesnek kell lenniük, és testtömegük nem térhet el ± 20 %-nál többel az esetlegesen korábban kezelt állatok testtömegének átlagától.
1.4.2. Az állatok tartásának és etetésének körülményei
A kísérleti állatokat 22 oC (± 3 oC) hőmérsékletű helyiségben kell tartani. Bár a helyiség relatív páratartalmának legalább 30 %-nak kell lennie, illetve a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot, a célértéknek 50 és 60 % között kell lennie. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett. Az állatokat lehet vizsgált dózisonként egy ketrecben tartani, de az egy ketrecben lévő állatok számát úgy kell megválasztani, hogy az ne zavarja az egyes állatok megfigyelését.
1.4.3. Az állatok előkészítése
Az állatokat véletlenszerűen kell kiválasztani, majd egyedi azonosítóval kell ellátni, és a kezelés megkezdése előtt legalább 5 napig a ketrecükben kell tartani őket, hogy hozzászokhassanak a laboratóriumi körülményekhez.
1.4.4. A dózisok előkészítése
A vizsgálandó anyagokat általában a vizsgálandó dózistartományon belül állandó térfogatban kell beadni úgy, hogy a dóziskészítmény koncentrációját változtatják. Ha azonban egy folyékony végterméket vagy keveréket vizsgálnak, a vizsgálatot követő kockázatértékelés szempontjából megfelelőbb lehet, ha a vizsgálandó anyagot hígítatlanul, azaz állandó koncentrációban alkalmazzák, illetve egyes hatóságok ezt írják elő. A maximálisan beadható dózistérfogatot azonban egyik esetben sem szabad túllépni. Az, hogy egyszerre maximálisan mekkora térfogatú folyadékot lehet beadni, a kísérleti állat méretétől függ. Rágcsálók esetében a térfogat általában nem haladhatja meg az 1 ml/100 g testtömegarányt: vizes oldatok esetében azonban 2 ml/100 g testtömegarány is megfontolható. A dóziskészítmény formulázása tekintetében – ahol lehet – a vizes oldatok/szuszpenziók/emulziók alkalmazása javasolt, másodsorban az olajos (pl. kukoricacsíra-olajban elkészített) oldatok/szuszpenziók/emulziók, és harmadsorban esetlegesen más vivőanyagokban elkészített oldatok. A víztől eltérő vivőanyagok esetében ismerni kell a vivőanyag toxikológiai tulajdonságait. A dózisokat a beadás előtt rövid idővel kell elkészíteni, kivéve, ha ismert és igazoltan elfogadható a készítmény stabilitása az alatt az alkalmazás időtartama alatt.
1.5. ELJÁRÁS
1.5.1. A dózisok beadása
A vizsgálandó anyagot egyetlen dózisban, gyomorszondán vagy egy megfelelő intubációs kanülön át történő táplálással kell beadni. Abban a rendkívüli esetben, ha nem lehetséges egyetlen dózist alkalmazni, a dózis egy 24 órát nem meghaladó időtartam alatt kisebb részletekben is beadható.
A kezelés előtt az állatokat éheztetni kell (pl. patkány esetében egy éjszakán át meg kell vonni a táplálékot, de a vizet nem; egér esetében 3–4 órára kell megvonni a táplálékot, de a vizet nem). A koplaltatási időszakot követően meg kell mérni az állatok testtömegét, majd be kell adni a vizsgálandó anyagot. Az anyag beadása után a táplálékot újra meg lehet vonni –patkány esetében 3–4 órára, egér esetében 1–2 órára. Ha egy dózist részletekben adnak be, a beadás időtartamától függően menet közben szükség lehet arra, hogy az állatoknak táplálékot és vizet adjanak.
1.5.2. Az állatok száma és a dózisok
Minden lépésben három állatot kell alkalmazni. A kezdődózist az 5, 50, 300 és 2 000 mg/testtömeg-kg-os négy rögzített dózis közül kell kiválasztani. Azt a dózist kell kezdődózisként kiválasztani, amelyiknél a legvalószínűbb, hogy a kezelt állatok egy részénél elhullást okoz. Az 1. függelékben látható folyamatábrák ismertetik az egyes kezdődózisok esetén követendő eljárást. A 4. függelék pedig azzal kapcsolatosan ad iránymutatást, hogy a GHS bevezetéséig hogyan kell az EU-rendszer szerint elvégezni a besorolást.
Ha a rendelkezésre álló információ alapján a legmagasabb kezdődózis (2 000 mg/testtömeg-kg) valószínűleg nem okoz elhullást, akkor határérték-vizsgálatot kell végezni. Ha a vizsgálandó anyagról nincs információ, állatjóléti okokból a 300 mg/testtömeg-kg-os kezdődózis alkalmazása javasolt.
Az egyes dózisok vizsgálata közötti időtartamot a mérgezési tünetek megjelenésének időpontja, időtartama és súlyossága határozza meg. Az állatok következő dózissal történő kezelését nem szabad megkezdeni mindaddig, amíg meg nem győződnek arról, hogy az előzőleg kezelt állatok életben maradnak.
Kivételes esetben és kizárólag akkor, ha konkrét szabályozási hatósági követelmények indokolják, megfontolás tárgyává lehet tenni egy további, 5 000 mg/kg-os felső dózis alkalmazását (lásd a 2. függeléket). Az állatok kímélete érdekében a GHS 5. kategóriában (2 000–5 000 mg/kg) nem ajánlott állatokkal kísérletezni, és csak abban az esetben szabad ilyet tervezni, ha nagy a valószínűsége, hogy egy ilyen vizsgálat eredményei közvetlen jelenőséggel bírnak az emberi vagy állati egészség vagy a környezet védelme szempontjából.
1.5.3. Határérték-vizsgálat
Határérték-vizsgálatot elsősorban olyan helyzetekben kell végezni, ha a kísérletet végzőnek olyan információi vannak, amelyek szerint a vizsgálandó anyag valószínűleg nem toxikus, azaz csak a hatósági határértékdózisok felett toxikus. A vizsgálandó anyag toxicitásával kapcsolatban információ hasonló vegyületek vagy keverékek vagy termékek vizsgálataiból szerezhető, figyelembe véve a toxikológiai szempontból fontos komponenseket, illetve azok százalékos arányát. Olyan esetekben, ha kevés az anyag toxicitásával kapcsolatos információ, vagy egyáltalán nem áll rendelkezésre, vagy ha a vizsgálandó anyag várhatóan toxikus, a fő vizsgálatot kell elvégezni.
Végezhető határérték-vizsgálat egyetlen, 2 000 mg/testtömeg-kg-os dózissal, összesen hat (lépésenként három-három) állat alkalmazásával. Kivételes esetben végezhető határértékvizsgálat egyetlen, 5 000 mg/kg-os dózissal is, amikor összesen három állatot alkalmaznak (lásd a 2. függeléket). A vizsgálandó anyaggal összefüggő elhullás esetén szükséges lehet a következő alacsonyabb dózissal tovább folytatni a vizsgálatokat.
1.6. MEGFIGYELÉSEK
Az állatokat a dózis beadása után egyedileg kell megfigyelni, legalább az első 30 percben, azután az első 24 órában rendszeres időközönként, amelynek során különös figyelemmel kell őket kísérni az első 4 órában, majd ezt követően naponta, összesen 14 napon át, kivéve, ha az állatot állatjóléti okok miatt ki kell venni a vizsgálatból, és humánus módon exterminálni kell, vagy ha az állat elhullik. A megfigyelés időtartamát azonban nem szabad mereven meghatározni. Ezt a mérgezési reakciók, illetve a gyógyulás kezdete és időtartama alapján kell meghatározni, és ilyen módon szükség esetén meg lehet hosszabbítani. Fontos a mérgezési tünetek megjelenésének, illetve megszűnésének időpontja, különösen, ha a mérgezési tünetek inkább késleltetve jelentkeznek (12). Minden megfigyelést szisztematikusan rögzíteni kell úgy, hogy minden állat esetében önálló adatsort kell felvenni.
Ha a mérgezési tünetek tartósak, további megfigyelésekre van szükség. Meg kell figyelni a bőr és a szőrzet, a szemek és a nyálkahártyák, valamint a légzési és a keringési rendszer, az autonóm és a központi idegrendszer, illetve a szomatomotoros aktivitás és a viselkedési mintázatok változásait. Figyelemmel kell lenni remegés, görcsök, nyáladzás, hasmenés, letargia, alvás és kóma előfordulására is. A Humane Endpoints Guidance Documentben összefoglalt alapelveket és követelményeket is figyelembe kell venni (9). Humánus módon exterminálni kell az elhullásközeli állapotban lévő állatokat, illetve azokat, amelyek súlyos fájdalom vagy tartós szorongás jeleit mutatják. Ha az állatokat humánus okok miatt exterminálni kell, vagy elhullanak, a lehető legpontosabban fel kell jegyezni az elhullás időpontját is.
1.6.1. Testtömeg
Röviddel a vizsgálandó anyag beadása előtt és legalább egy héttel utána minden állat testtömegét egyenként meg kell mérni. A testtömegváltozást ki kell számítani, és rögzíteni kell. A vizsgálat végén az életben maradt állatokat újra meg kell mérni, majd humánus módon exterminálni kell őket.
1.6.2. Kórbonctani vizsgálat
Minden kísérleti állatot makroszkópos boncolásnak kell alávetni (azokat is, amelyek a vizsgálat során elpusztultak, vagy amelyeket állatjóléti okok miatt ki kellett venni a vizsgálatból). Minden egyes állat esetében minden makroszkópos kórtani elváltozást fel kell jegyezni. A kezdődózis beadása után legalább 24 óráig túlélő állatok esetében tervbe lehet venni a makroszkópos kórtani elváltozást mutató szervek mikroszkópos vizsgálatát is, mivel abból hasznos információk nyerhetők.
2. ADATOK
Az állatokra vonatkozóan egyedi adatsorokat kell felvenni. Emellett az összes adatot táblázatos formában is össze kell foglalni úgy, hogy minden vizsgálati csoportra vonatkozóan mutassa a csoportban lévő kísérleti állatok számát, valamint azoknak a számát, amelyeknél mérgezési tünetek láthatók, amelyek a vizsgálat során elhullottak, vagy amelyeket humánus módon extermináltak, az egyes állatok elhullásának időpontját, a toxikus hatások leírását, időbeli lefolyását és visszafordíthatóságát, valamint a boncolások eredményeit.
3. JELENTÉS
3.1. Vizsgálati jelentés
A vizsgálati jelentésnek megfelelő módon a következő információkat kell tartalmaznia:
|
|
Vizsgálandó anyag:
|
|
|
Vivőanyag (ha szükséges):
|
|
|
Kísérleti állatok:
|
|
|
Kísérleti körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények diszkussziója és értelmezése. |
|
|
Következtetések. |
4. HIVATKOZÁSOK
|
(1) |
Roll R., Höfer-Bosse Th. And Kayser D. (1986). New Perspectives in Acute Toxicity Testing of Chemicals. Toxicol. Lett., Suppl. 31, 86 |
|
(2) |
Roll R., Riebschläger M., Mischke U. and Kayser D. (1989). Neue Wege zur Bestimmung der akuten Toxizität von Chemikalien. Bundesgesundheitsblatt 32, 336-341. |
|
(3) |
Diener W., Sichha L., Mischke U., Kayser D. and Schlede E. (1994). The Biometric Evaluation of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 68, 559-610 |
|
(4) |
Diener W., Mischke U., Kayser D. and Schlede E. (1995). The Biometric Evaluation of the OECD Modified Version of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 729-734. |
|
(5) |
Diener W., and Schlede E. (1999) Acute Toxicity Class Methods: Alterations to LD/LC50 Tests. ALTEX 16, 129-134 |
|
(6) |
Schlede E., Mischke U., Roll R. and Kayser D. (1992). A National Validation Study of the Acute-Toxic-Class Method- An Alternative to the LD50 Test. Arch. Toxicol. 66, 455-470. |
|
(7) |
Schlede E., Mischke U., Diener W. and Kayser D. (1994). The International Validation Study of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 659-670. |
|
(8) |
OECD (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris. |
|
(9) |
OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N 19. |
|
(10) |
OECD (1998) Harmonized Integrated Hazard Classification System For Human Health And Environmental Effects Of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FRF.html] |
|
(11) |
Lipnick R L, Cotruvo, J A, Hill R N, Bruce R D, Stitzel K A, Walker A P, Chu I; Goddard M, Segal L, Springer J A and Myers R C (1995) Comparison of the Up-and Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol 33, 223-231. |
|
(12) |
Chan P.K. and A.W. Hayes. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A.W. Hayes, Editor. Raven Press, Ltd., New York, USA. |
1. FÜGGELÉK
AZ EGYES KEZDŐDÓZISOK ESETÉBEN KÖVETENDŐ ELJÁRÁS
ÁLTALÁNOS MEGJEGYZÉSEK
Minden egyes kezdődózis esetén az ebben a függelékben bemutatott megfelelő vizsgálati sémák határozzák meg a követendő eljárást.
|
— |
1A. függelék: a kezdődózis 5 mg/testtömeg-kg, |
|
— |
1B. függelék: a kezdődózis 50 mg/testtömeg-kg, |
|
— |
1C. függelék: a kezdődózis 300 mg/testtömeg-kg, |
|
— |
1D. függelék: a kezdődózis 2 000 mg/testtömeg-kg. |
A humánus módon exterminált vagy elhullott állatok számától függően a vizsgálati eljárás a jelzett nyilakat követi
1A. FÜGGELÉK
VIZSGÁLATI ELJÁRÁS 5 MG/TESTTÖMEG-KG KEZDŐDÓZIS ESETÉN

1B. Függelék
VIZSGÁLATI ELJÁRÁS 50 MG/TESTTÖMEG-KG KEZDŐDÓZIS ESETÉN
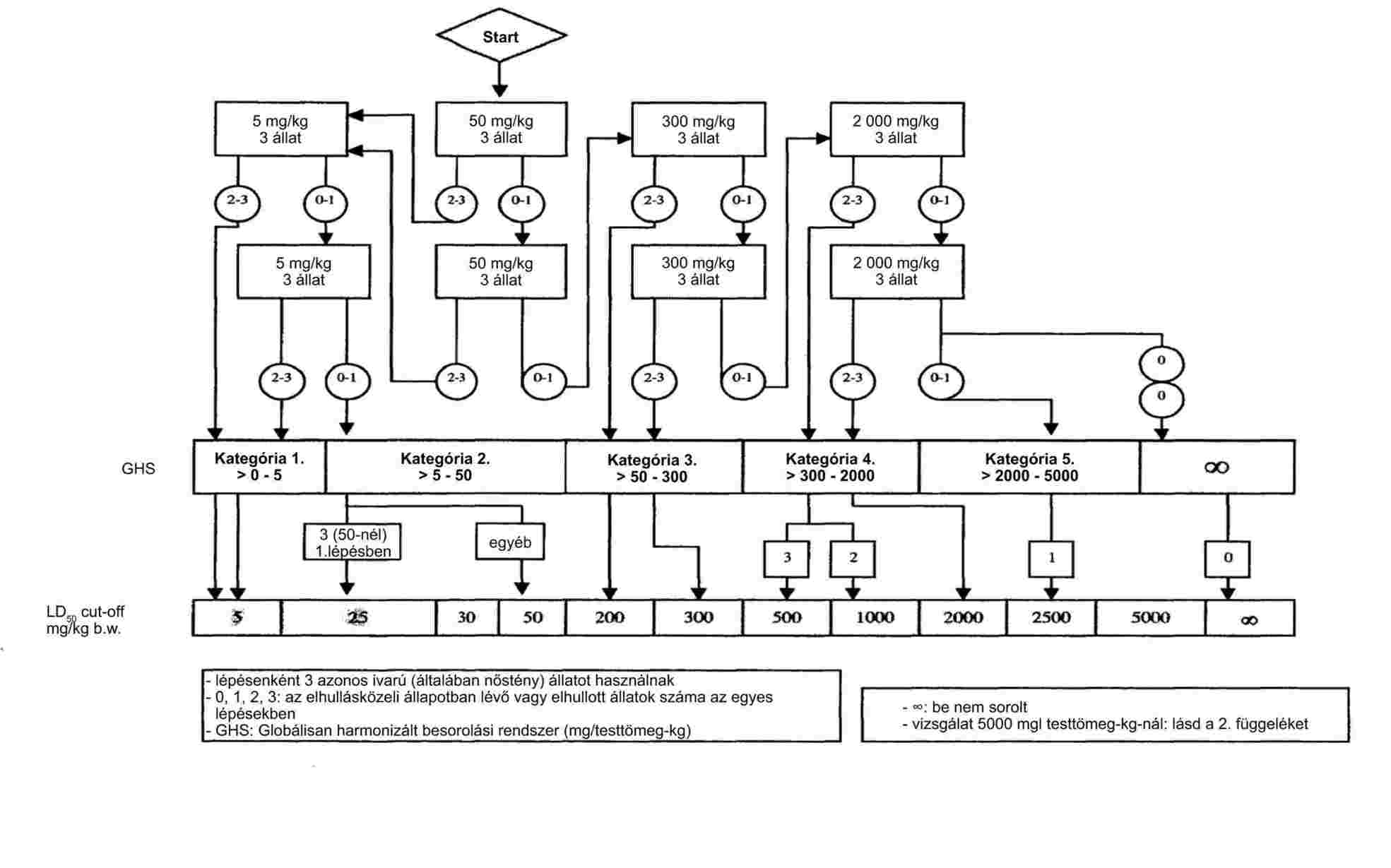
1C. FÜGGELÉK
VIZSGÁLATI ELJÁRÁS 300 MG/TESTTÖMEG-KG KEZDŐDÓZIS ESETÉN

1D. FÜGGELÉK
VlZSGÁLATI ELJÁRÁS 2 000 MG/TESTTÖMEG-KG KEZDŐDÓZIS ESETÉN

2. FÜGGELÉK
A VÁRHATÓAN 2 000 MG/KG FELETTI LD50-ÉRTÉKKEL RENDELKEZŐ VIZSGÁLANDÓ ANYAGOK VIZSGÁLATOK NÉLKÜLI OSZTÁLYOZÁSÁNAK KRITÉRIUMAI
Az 5. veszélyességi kategória kritériumait úgy állapították meg, hogy tegyék lehetővé azoknak a vizsgálandó anyagoknak a meghatározását, amelyek akut toxicitási kockázata viszonylag alacsony, de bizonyos körülmények között veszélyt jelenthetnek az érzékeny populációkra. Az ilyen anyagok orális vagy dermális LD50-értéke várhatóan 2 000 és 5 000 mg/kg közötti tartományban található, vagy ezzel egyenértékű dózisoknak megfelelő az egyéb beadási módok esetében. A vizsgálandó anyagokat az alábbi esetekben kell a 2 000 mg/kg < LD50 < 5 000 mg/kg veszélyességi kategóriába (GHS 5. kategória) sorolni:
|
a) |
ha az 1A–1D. függelékben bemutatott, az elhullási gyakoriságon alapuló vizsgálati sémák bármelyike szerint ebbe a kategóriába kell sorolni; |
|
b) |
ha hitelt érdemlő bizonyíték van már arra, hogy az anyag LD50-értéke az 5. kategóriában megadott tartományba esik; vagy más állatkísérletek vagy humán toxikus hatások szerint a humán egészségügyi veszély akut jellegű; |
|
c) |
adatok extrapolálásával, becslésével vagy mérésével, ha egy veszélyesebb osztályba való besorolás nem indokolt, és
|
2 000 MG/KG FELETTI DÓZISOKKAL TÖRTÉNŐ VIZSGÁLAT
Az állatok jólétének védelme iránti igényt elismerve nem ajánlott, hogy állatokat az 5. kategória tartományában (5 000 mg/kg) vizsgálják, és csak akkor szabad fontolóra venni, ha nagy a valószínűsége, hogy az ilyen vizsgálatok eredményei közvetlen jelentőséggel bírnak az állati vagy emberi egészség védelme szempontjából (10). Nem szabad további vizsgálatokat végezni ennél magasabb dózisokkal.
Ha vizsgálatot kell végezni, csak egy lépés (azaz három állat), az 5 000 mg/kg-os dózis alkalmazása szükséges. Ha az első kezelt állat elhullik, akkor az 1. függelékben bemutatott folyamatábrának megfelelően a kezelést a 2 000 mg/kg-os dózissal kell folytatni. Ha az első állat életben marad, két további állatot kell kezelni. Ha a három állat közül csak egy hullik el, az LD50-érték várhatóan meghaladja az 5 000 mg/kg-ot. Ha mindkét állat elhullik, akkor a vizsgálatot a 2 000 mg/kg-os dózissal kell folytatni.
3. FÜGGELÉK
B1c. VIZSGÁLATI MÓDSZER: Útmutató az EU-rendszer szerinti besoroláshoz a Globálisan harmonizált osztályozási rendszer (GHS) teljes körű bevezetéséig tartó átmeneti időszakban (a (8) hivatkozásból)

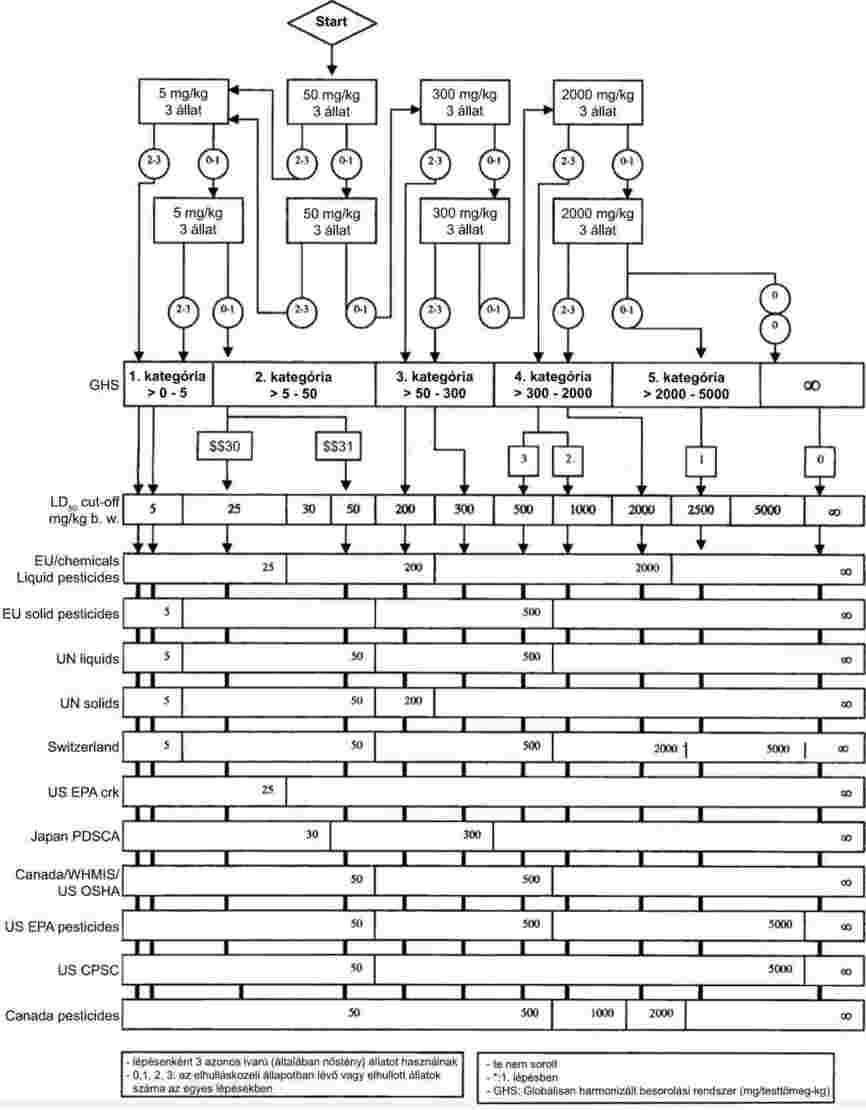

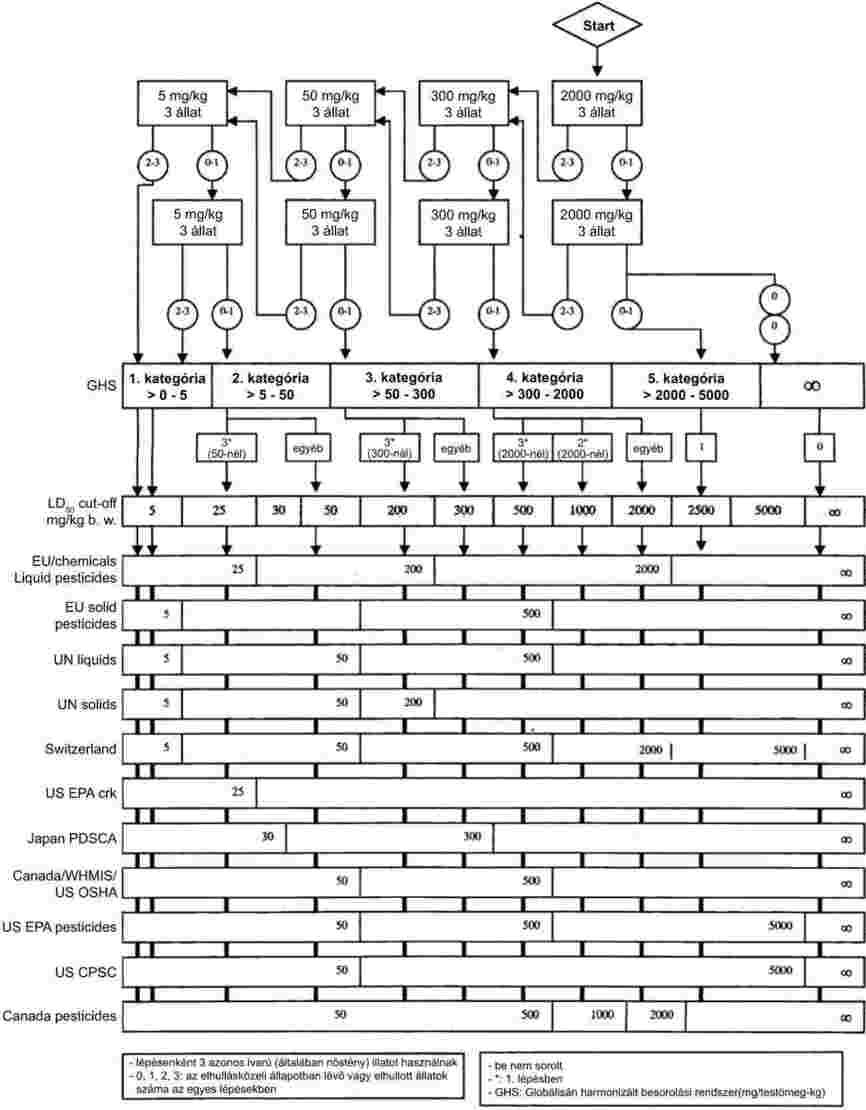
B.2. AKUT TOXICITÁS (INHALÁCIÓ)
1. MÓDSZER
1.1. BEVEZETÉS
Hasznos, ha előzetes információk állnak rendelkezésre az anyag részecskeméret-eloszlásáról, gőznyomásáról, olvadáspontjáról, forráspontjáról és robbanásveszélyességéről (ha van ilyen).
Lásd az Általános bevezetés B. részét (A).
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét (B).
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Több kísérleti állatcsoportot tesznek ki a vizsgált anyag hatásának meghatározott időtartamig, fokozatosan változó koncentrációkban úgy, hogy csoportonként egyetlen koncentrációt használnak. Ezt követően megfigyelik a hatások és a halálesetek előfordulását. A vizsgálat során elpusztult állatokat és a vizsgálat végéig életben maradó állatokat is fel kell boncolni.
A súlyos és tartós betegség, illetve fájdalom jeleit mutató állatokat kíméletes módon el lehet pusztítani. A vizsgált anyagokat nem szabad olyan módon adagolni, amelyről ismert, hogy jelentős szenvedést és fájdalmat okoz maró vagy irritatív tulajdonsága miatt.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
Az állatokat a vizsgálat előtt legalább öt napig a vizsgálat tartási és takarmányozási körülményei között kell tartani. Az egészséges, fiatal állatokat a vizsgálat megkezdése előtt véletlenszerű kiválasztással csoportokba kell osztani. A szimulált expozíció csak akkor szükséges, ha ezt az alkalmazott expozíciós berendezés típusa indokolja.
A szilárd vizsgált anyagokat lehet, hogy mikronizálni kell azért, hogy megfelelő méretű részecskék álljanak rendelkezésre.
Szükség esetén vivőanyag alkalmazható a vizsgált anyag megfelelő koncentrációjának kialakítására a levegőben, ebben az esetben használni kell egy vivőanyag-kontrollcsoportot. Ha az adagolás megkönnyítésére vivőanyagot vagy más segédanyagot használnak, meg kell bizonyosodni arról, hogy azok nem rendelkeznek toxikus hatással. Ehhez szükség szerint korábbi vizsgálatokból származó adatokat is fel lehet használni.
1.6.2. Vizsgálati körülmények
1.6.2.1. A kísérlethez felhasznált állatok
Ellenjavallat hiányában a patkány az előnyben részesítendő állatfajta. Kísérleti célokra tenyésztett, laboratóriumi állattörzsekből származó állatokat kell alkalmazni. A vizsgálat kezdetén mindkét nem esetében az állatok súlya lehetőleg csak minimálisan, az átlagértéktől maximum ± 20 %-kal térhet el egymástól.
1.6.2.2. Az állatok száma és neme
Minden koncentrációhoz legalább 10 rágcsálót (5 hímet és 5 nőstényt) kell felhasználni. A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek.
Megjegyzés: A rágcsálóknál magasabb rendű állatokkal végrehajtott akuttoxicitás-vizsgálatokban meg kell fontolni kisebb számú állat használatának lehetőségét. A dózisokat gondosan kell kiválasztani, és minden erőfeszítést meg kell tenni arra, hogy azok ne lépjék túl a közepesen toxikus dózisokat. Ilyen vizsgálatoknál el kell kerülni a vizsgált anyag letális dózisának beadását.
1.6.2.3. Expozíciós koncentrációk
E szinteknek elegendő számúnak, legalább háromnak, és megfelelően elosztottnak kell lenniük ahhoz, hogy a vizsgált csoportokban toxikus hatások és halálozási arányok egész sorát hozzák létre. Az adagoknak elegendőnek kell lenniük a koncentráció-halálozás görbe létrehozására, és ahol lehetséges, lehetővé kell tenniük az LC50 elfogadható meghatározását.
1.6.2.4. Határérték-vizsgálat
Ha öt hím és öt nőstény kísérleti állat 5 mg/l gáz vagy folyadékaeroszol vagy szilárd anyag (vagy ahol ez nem lehetséges, a vizsgált anyag fizikai vagy kémiai tulajdonságai miatt, beleértve a robbanásveszélyt is, a maximálisan elérhető koncentráció) hatásának való négyórás kitettség után 14 napon belül nem észlelnek a vizsgált anyaggal kapcsolatos halálozást, akkor nincs szükség további vizsgálatra.
1.6.2.5. Expozíciós időtartam
Az expozíció időtartamának négy órának kell lennie.
1.6.2.6. Berendezés
A kísérlethez olyan inhalációs berendezést kell használni, amely óránként legalább tizenkét alkalommal légcserét tesz lehetővé a dinamikus légmozgás fenntartása érdekében, azért hogy megfelelő oxigéntartalmat és egyenletesen eloszlatott expozíciós atmoszférát lehessen biztosítani. Ha kamrát használnak, annak kialakítása révén a lehető legkisebbre kell csökkenteni a kísérleti állatok zsúfoltságát, és lehetővé kell tenni a lehető legnagyobb mértékű expozíciót a vizsgált anyag belégzése útján. Általános szabályként a kamrai atmoszféra stabilitásának biztosítása érdekében a kísérleti állatok teljes térfogata nem haladhatja meg a vizsgálati kamra térfogatának 5 %-át. Végezhetők csak az orron és szájon át, vagy csak a fejen át, illetve az egész testen keresztül megvalósuló egyedi expozíciós kamrai vizsgálatok; az első két módszer előnye, hogy minimalizálja a vizsgált anyag egyéb úton történő felvételének lehetőségét.
1.6.2.7. Megfigyelési időszak
A megfigyelési időszaknak legalább 14 napnak kell lennie. Azonban a megfigyelés időtartamát nem kell szigorúan értelmezni. Ezt a toxikus reakciók megjelenésének módja, a tünetek megjelenésének időpontja és a felépülési időtartam hosszúsága alapján kell meghatározni; ebből következően szükség esetén ezen időszak meghosszabbítható. Fontos az az időpont, amikor a toxicitás jelei megjelennek és eltűnnek, valamint a halál bekövetkezésének ideje, különösen, ha tendencia figyelhető meg a halál késedelmes bekövetkezésére.
1.6.3. A kísérlet végrehajtása
Közvetlenül az expozíciót megelőzően meg kell mérni az állatok tömegét, majd az egyenletes kamrai koncentráció beállása után az állatokat ki kell tenni a kijelölt készülékben a vizsgált koncentráció hatásának négy órán át. A kiegyenlítődési időnek rövidnek kell lennie. A vizsgálatokat 22 ± 3 oC állandó hőmérsékleten kell végezni. Ideális esetben a relatív páratartalmat 30 és 70 % között kell tartani, de bizonyos körülmények között (például aeroszolok vizsgálatakor) ez a gyakorlatban nem mindig kivitelezhető. A kamrán belül enyhe negatív nyomás (például ≤ 5 víz mm) fenntartása megakadályozza a vizsgált anyag kiszivárgását a környezetbe. Az állatok nem kaphatnak sem takarmányt, sem vizet az expozíció folyamán. A vizsgálati légkör létrehozásához és figyeléséhez megfelelő rendszereket kell használni. A rendszernek biztosítania kell, hogy a lehető leggyorsabban létrejöjjenek a stabil expozíciós körülményeké. A kamrát úgy kell tervezni és működtetni, hogy fennmaradjon a kamrán belül a vizsgálati légkör homogén eloszlása.
A következő paramétereket kell mérni, illetve figyelemmel kísérni:
|
a) |
a légáramlás sebessége (folyamatosan); |
|
b) |
az anyag tényleges koncentrációja, amit az expozíció során a belégzési zónában legalább háromszor meg kell mérni (egyes légkörök esetében pl. ha aeroszolok magas koncentrációban vannak jelen, gyakoribb megfigyelésre is szükség lehet). Az expozíciós időszak folyamán a koncentráció nem változhat a középérték ± 15 %-át meghaladó mértékben. Aeroszolok esetében azonban ez az érték nem biztos, hogy elérhető, ekkor elfogadható lehet egy ennél szélesebb tartomány. Aeroszolok esetében, amilyen gyakran csak szükséges (vizsgált csoportonként legalább egyszer) részecskeméret-elemzést kell végrehajtani; |
|
c) |
a hőmérséklet és a páratartalom, ha lehetséges, folyamatosan. |
Az expozíció ideje alatt és azt követően az állatokat rendszeresen meg kell figyelni és a leleteket rögzíteni kell; külön feljegyzést kell vezetni minden egyes állatról. Az első nap során gyakran kell végrehajtani a megfigyeléseket. Minden munkanapon legalább egyszer gondos klinikai vizsgálatot kell végrehajtani, más megfigyeléseket naponta kell végezni, azon megfelelő tevékenységek végrehajtása mellett, amelyek célja a vizsgálatban részt vevő állatok elvesztésének minimálissá tétele, ilyen például a holtan talált állatok boncolása vagy lehűtése, vagy a gyenge, illetve haldokló állatok elkülönítése és elpusztítása.
A megfigyeléseknek ki kell terjednie a bőr és a szőrzet, a szem és a nyálkahártya, valamint a légző- és keringési rendszer, a vegetatív és a központi idegrendszeri funkciók, valamint a szomatomotoros aktivitás és viselkedési minta változásaira. Külön figyelmet kell szentelni a remegés, görcsök, nyáladzás, hasmenés, letargia, alvás és kóma megfigyelésére. A halál időpontját a lehető legpontosabban kell feljegyezni. Az állatok súlyát egyenként, az expozíció után hetente és halálozáskor meg kell állapítani.
A vizsgálat során elpusztult állatokat és a vizsgálat befejezéséig életben maradt állatokat fel kell boncolni, különös figyelmet szentelve a felső és alsó légútban bekövetkező minden változásnak. Fel kell jegyezni minden jelentős patológiás elváltozást. Amennyiben szükséges, szövetmintákat kell venni a kórszövettani vizsgálathoz.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, megadva minden egyes csoporthoz az állatok számát a vizsgálat kezdetekor, az egyes állatok halálának időpontját, a toxicitás más jeleit mutató állatok számát, a toxikus hatások leírását és a boncolási leleteket. Ki kell számítani és fel kell jegyezni a tömegváltozásokat, ha az állat egy napnál tovább maradt életben. A vizsgált anyaggal összefüggő szenvedés és fájdalom miatt humánusan elpusztított állatok halálát az anyaggal kapcsolatos halálként kell feljegyezni. Az LC50 valamely elismert módszer segítségével határozható meg. Az értékelésnek tartalmaznia kell – amennyiben ez lehetséges – a dózis és a rendellenességek fellépése és súlyossága közötti kapcsolatot, ideértve a magatartási rendellenességeket, a klinikai tüneteket, a jelentős sérüléseket, testsúlyváltozásokat, halálozást és minden más toxikológiai hatást is.
3. VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
használt fajt, törzset, az állatok származását, a tartási körülményeket, az étrendet, |
|
— |
a vizsgálati körülményeket: az expozíciós készülék leírását, beleértve a készülék konstrukcióját, típusát, méreteit, a levegőforrást, az aeroszolok előállítására szolgáló rendszert, a légkondicionálás módszerét, az állatoknak a vizsgálati kamrában való elhelyezését. A hőmérsékletet, a levegő páratartalmát, és adott esetben az aeroszol koncentráció stabilitását, illetve részecskeméret-eloszlás meghatározására használt berendezéseket szintén le kell írni. |
Expozíciós adatok:
Ezen adatokat táblázatos formában kell közölni, az átlagértékek és az azoktól való eltérés megjelölésével. A következő adatokra van szükség:
|
a) |
légáram sebessége az inhalációs készülékben; |
|
b) |
hőmérséklet és a levegő páratartalma; |
|
c) |
névleges koncentráció (az inhalációs készülékbe helyezett vizsgált anyag összmennyisége osztva a levegő térfogatával); |
|
d) |
vivőanyag jellege (ha van); |
|
e) |
tényleges koncentráció a belégzési zónában; |
|
f) |
a tömegfelező aerodinamikai átmérő („Mass Median Aerodynamic Diameter” MMAD) és a geometrikus standard deviáció („Geometric Standard Deviation” GSD); |
|
g) |
a kiegyenlítődés időtartama; |
|
h) |
az expozíciós időtartam;
|
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét (D).
4. SZAKIRODALOM
Lásd az Általános bevezetés B. részét (E)
B.3. AKUT TOXICITÁS (DERMÁLIS)
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét (A).
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét (B).
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot naponta, a bőrre kell adagolni fokozatos adagokban több kísérleti állatcsoportnak, csoportonként egy adagot használva. Ezt követően megfigyelik a hatásokat és a halálesetek előfordulását. A vizsgálat során elpusztult állatokat és a vizsgálat végéig életben maradó állatokat is fel kell boncolni.
A súlyos és tartós betegség, illetve fájdalom jeleit mutató állatokat humánus módon el lehet pusztítani. A vizsgált anyagokat nem szabad olyan módon adagolni, amelyről ismert, hogy jelentős szenvedést és fájdalmat okoz maró vagy irritatív tulajdonsága miatt.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
Az állatokat a vizsgálat előtt legalább öt napig a vizsgálat tartási és takarmányozási körülményei között kell tartani. Az egészséges fiatal állatokat a vizsgálat megkezdése előtt véletlenszerű kiválasztással csoportokba kell osztani. A vizsgálat előtt körülbelül 24 órával el kell távolítani a szőrzetet az állatok törzsének hátulsó területéről nyírással vagy borotválással. A szőrzet nyírásakor vagy borotválásakor óvatosan kell eljárni, nehogy olyan bőrsérülést okozzanak, ami a felszívódást befolyásolhatja. A testfelület legalább 10 %-át szabaddá kell tenni a vizsgált anyag alkalmazásához. Ha szilárd anyagot vizsgálnak, amelyet adott esetben porítani is lehet, az anyagot vízzel kellően át kell nedvesíteni, vagy szükség esetén vivőanyagot kell alkalmazni annak biztosítására, hogy jól tapadjon a bőrhöz. Vivőanyag használatakor figyelembe kell venni a vivőanyag hatását a vizsgált anyag bőrbe való behatolására. A folyékony vizsgált anyagokat rendszerint hígítás nélkül kell adagolni.
1.6.2. Vizsgálati körülmények
1.6.2.1. A kísérlethez felhasznált állatok
Kifejlett patkány vagy nyúl használható. Más faj is használható, de azok használatát meg kell indokolni. Kísérleti célokra tenyésztett, laboratóriumi állattörzsekből származó állatokat kell alkalmazni. A vizsgálat kezdetén az állatok súlya minimálisan, az átlagértéktől maximum ± 20 %-kal térhet el egymástól.
1.6.2.2. Az állatok száma és neme
Minden koncentrációnál legalább öt állatot kell vizsgálni. Az állatoknak azonos neműnek kell lenniük. A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek. Amennyiben rendelkezésre áll olyan információ, amely szerint valamelyik nem lényegesen érzékenyebben reagál, akkor ilyen nemű állatokat kell alkalmazni.
Megjegyzés: A rágcsálóknál magasabb rendű állatokkal végrehajtott akuttoxicitás-vizsgálatokban meg kell fontolni kisebb számú állat használatának lehetőségét. A dózisokat gondosan kell kiválasztani, és minden erőfeszítést meg kell tenni arra, hogy azok ne lépjék túl a közepesen toxikus dózisokat. Ilyen vizsgálatoknál el kell kerülni a vizsgált anyag letális dózisának beadását.
1.6.2.3. Dózisok
E szinteknek elegendő számúaknak, legalább háromnak, és megfelelően elosztottnak kell lenniük ahhoz, hogy a vizsgált csoportokban toxikus hatások és halálozási arányok egész sorát hozzák létre. Minden irritatív vagy maró hatást figyelembe kell venni a dózisok megállapításakor. Az adatoknak elegendőnek kell lenniük a koncentráció/hatás görbe létrehozására, és ahol lehetséges, lehetővé kell tenniük az LD50 elfogadható meghatározását.
1.6.2.4. Határérték-vizsgálat
A határérték-vizsgálatot el lehet végezni egyetlen, legalább 2 000 mg/testsúly kg dózissal adagolt 5 hím és 5 nőstény rágcsálóból álló csoporttal a fent leírt eljárások végrehajtásával. Ha a vizsgált anyaggal kapcsolatos halálozás figyelhető meg, akkor szükség lehet a teljes körű vizsgálat elvégzésére.
1.6.2.5. Megfigyelési időszak
A megfigyelési időszaknak legalább 14 napnak kell lennie. Azonban a megfigyelés időtartamát nem kell szigorúan értelmezni. Ezt a toxikus reakciók megjelenésének módja, a tünetek megjelenésének időpontja és a felépülési időtartam hosszúsága alapján kell meghatározni; ebből következően ezen időtartam szükség esetén meghosszabbítható. Fontos az az időpont, amikor a toxicitás jelei megjelennek és eltűnnek, valamint a halál bekövetkezésének ideje, különösen, ha tendencia figyelhető meg a halál késedelmes bekövetkezésére.
1.6.3. A kísérlet végrehajtása
Az állatokat egyesével kell a ketrecekben elhelyezni. A vizsgált anyagot a testfelület megközelítőleg 10 %-át kitevő felületen egyenletesen elosztva kell felvinni az állat bőrére. Erősen mérgező anyagoknál a felület lehet ennél kisebb, de a felület lehető legnagyobb részét a lehető legvékonyabb és legegyenletesebb bevonattal kell ellátni.
A 24 órás expozíció ideje alatt a vizsgált anyagot a bőrrel porózus gézkötés és nem irritáló ragtapasszal kell érintkezésben tartani. A vizsgált területet megfelelő módon be kell fedni, azért hogy megmaradjon rajta a vizsgált anyag és a gézkötés, és az állatok ne nyalhassák le a vizsgált anyagot. Mozgásgátló szerkezeteket lehet használni annak megakadályozására, hogy az állat a vizsgált anyagot lenyelje, de a teljes immobilizáció mint módszer nem javasolt.
Az expozíciós idő leteltével a maradék vizsgált anyagot lehetőség szerint el kell távolítani a bőr felületének vízzel vagy más megfelelő módon történő megtisztítása útján.
A megfigyeléseket szisztematikusan fel kell jegyezni. Külön feljegyzést kell vezetni minden egyes állatról. Az első nap során gyakran kell végrehajtani a megfigyeléseket. Minden munkanapon legalább egyszer gondos klinikai vizsgálatot kell végrehajtani, más megfigyeléseket naponta kell végezni, azon megfelelő tevékenységek végrehajtása mellett, amelyek célja a vizsgálatban részt vevő állatok elhullásának minimalizálása, ilyen például a holtan talált állatok boncolása vagy lehűtése, vagy a gyenge vagy haldokló állatok elkülönítése vagy elpusztítása.
A megfigyeléseknek ki kell terjednie a bőr és a szőrzet, a kezelt bőrfelület, a szem és a nyálkahártya, valamint a légző- és keringési rendszer, a vegetatív és a központi idegrendszeri funkciók, valamint a szomatomotoros aktivitás és viselkedési minta változásaira. Külön figyelmet kell szentelni a remegés, görcsök, nyáladzás, hasmenés, letargia, alvás és kóma megfigyelésére. A halál időpontját a lehető legpontosabban kell feljegyezni. A vizsgálat során elpusztult állatokat és a vizsgálat befejezéséig életben maradt állatokat fel kell boncolni. Fel kell jegyezni minden jelentős patológiás elváltozást. Amennyiben szükséges, szövetmintákat kell venni a kórszövettani vizsgálathoz.
Toxicitás meghatározása a másik nemnél
Az egyik nemmel végzett vizsgálat befejezése után a másik nemből kiválasztott, legalább öt állatból álló csoport számára kell adagolni az anyagot annak megállapítására, hogy az e nemhez tartozó állatok nem érzékenyebbek-e jelentősebb mértékben a vizsgált anyagra. Bizonyos esetekben indokolható lehet kevesebb állat használata. Ahol megfelelő információ áll rendelkezésre annak bizonyítására, hogy a vizsgált nemhez tartozó állatok jelentősen érzékenyebbek, elhagyható a másik nemhez tartozó állatokkal végzett vizsgálat.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, megadva minden egyes csoportnál az állatok számát a vizsgálat kezdetekor, az egyes állatok halálának időpontját, a toxicitás más jeleit mutató állatok számát, a toxikus hatások leírását és a boncolási leleteket. Egyenként meg kell határozni az állatok tömegét, és fel kell ezt jegyezni röviddel a vizsgált anyag beadása előtt, ezután minden héten és a halál bekövetkeztekor; ki kell számítani és fel kell jegyezni a tömegváltozásokat, ha az állat egy napnál tovább maradt életben. A vizsgált anyaggal összefüggő szenvedés és fájdalom miatt humánusan elpusztított állatok halálát az anyaggal kapcsolatos halálként kell feljegyezni. Az LD50 valamely elismert módszer segítségével határozható meg.
Az értékelésnek tartalmaznia kell – amennyiben ez lehetséges – a dózis és a rendellenességek fellépése és súlyossága közötti kapcsolatot, ideértve a magatartási rendellenességeket, a klinikai tüneteket, a jelentős sérüléseket, testsúlyváltozásokat, a halálozást és minden más toxikus tünetet is.
3. VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a használt fajt, törzset, az állatok származását, a tartási körülményeket, az étrendet stb., |
|
— |
a vizsgálati körülményeket (beleértve a bőrtisztítás módszerét és a kötszer típusát: zárt vagy nem zárt), |
|
— |
a dózisokat (beleértve a vivőanyagot is, ha van és koncentrációk), |
|
— |
a kezelt állatok nemét, |
|
— |
az adatok táblázatos összefoglalását nem és koncentráció szerint (azaz a vizsgálat során elhullott vagy elpusztított állatok száma; a toxicitás jeleit mutató állatok száma; az exponált állatok száma), |
|
— |
az anyag adagolása során vagy azt követően bekövetkező halál időpontját, az állatok humánus elpusztításának okait és kritériumait, |
|
— |
minden megfigyelést, |
|
— |
a 14 napban meghatározott teljes vizsgálat alá vont nemnél kapott LD50- érték (az alkalmazott számítási módszer megadásával), |
|
— |
az LD50-hez tartozó 95 %-os konfidenciaintervallumot (ahol ez megadható), |
|
— |
a dózis/mortalitás görbét és ennek meredekségét (ahol ezt megengedi a meghatározás módszere), |
|
— |
a boncolási leleteket, |
|
— |
a kórszövettani vizsgálatok eredményeit, |
|
— |
a másik nemmel végrehajtott vizsgálatok eredményeit, |
|
— |
az eredmények kiértékelését (külön figyelmet kell szentelni annak a hatásnak, amelyet a vizsgálat során az állatok humánus leölése gyakorolhat a kiszámított LD50-értékre), |
|
— |
az eredmények értelmezését. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét (D).
4. SZAKIRODALOM
Lásd az Általános bevezetés B. részét (E).
B.4. AKUT TOXICITÁS: BŐRIRRITÁCIÓ/BŐRKORRÓZIÓS HATÁS
1. MÓDSZER
Ez a módszer egyenértékű az OECD TG 404 (2002) módszerrel.
1.1. BEVEZETÉS
Ennek a továbbfejlesztett módszernek a kidolgozása során külön figyelmet szenteltek az állatjóléti szempontokkal kapcsolatos lehetséges javító beavatkozásoknak és a vizsgálandó anyaggal kapcsolatban rendelkezésre álló összes információ kiértékelésének, hogy ezáltal elkerülhető legyen a laboratóriumi állatokon történő szükségtelen kísérletezés. A módszer ajánlást fogalmaz meg arra nézve, hogy az anyag korrorróziós vagy irritáló hatásának vizsgálatára előírt in vivo kísérlet elvégzése előtt el kell végezni a rendelkezésre álló adatok bizonyító erejének elemzését (weight-of-the-evidence analysis). Ha nem áll rendelkezésre elegendő adat, akkor ezek mennyisége lépcsőzetes vizsgálatok alkalmazásával növelhető (1). A vizsgálati stratégia részét képezi validált és elfogadott in vitro vizsgálatok végzése, amelyek a módszerhez csatolt függelékben kerülnek ismertetésre. Emellett javasolt, hogy – ahol lehet – a kiindulási in vivo vizsgálat során az állatra ne egyszerre, hanem időben egymás után helyezzék fel a három teszttapaszt.
A tudományos ésszerűség és az állatok kímélete érdekében nem szabad in vivo vizsgálatokat végezni mindaddig, amíg az anyag potenciális korróziós/bőrirritáló hatására vonatkozó összes rendelkezésre álló adaton el nem végezték azok bizonyító erejének elemzését. Ilyen adatok az embereken és/vagy laboratóriumi állatokon elvégzett vizsgálatok eredményei, a szerkezetileg rokon anyagok vagy elegyeik korróziós/irritáló hatásaival kapcsolatos bizonyítékok, az anyag erős savasságát vagy lúgosságát igazoló adatok (2)(3), valamint a validált és elfogadott in vitro vagy ex vivo vizsgálatokból kapott eredmények (4)(5)(5a). Az elemzésnek csökkentenie kell az in vivo bőrkorróziós/bőrirritációs vizsgálatok iránti igényt azoknak az anyagoknak az esetében, amelyekre az említett két végpont tekintetében más vizsgálatokból elegendő bizonyíték áll rendelkezésre.
A preferált lépcsőzetes vizsgálati stratégia, amely validált és elfogadott in vitro vagy ex vivo korróziós/irritációs vizsgálatok elvégzését is magában foglalja, a módszerhez csatolt függelékben kerül ismertetésre. A stratégiát egy OECD-munkaértekezlet (6) résztvevői dolgozták ki, javasolták egyhangúlag, majd fogadták el mint a Globálisan harmonizált rendszer (GHS) a vegyi anyagok osztályozására (7) ajánlott vizsgálati stratégiáját. Az in vivo vizsgálatok elvégzése előtt ezt a vizsgálati stratégiát javasolt követni. Új anyagok esetében ez az ajánlott lépcsőzetes vizsgálati megközelítés a tudományos szempontból megfelelő adatok gyűjtésére az anyag korróziós/irritáló hatásaival kapcsolatosan. Ismert anyagok esetében, ha nem áll rendelkezésre elegendő adat a bőrkorróziós/bőrirritáló hatásokról, ennek a stratégiának az alkalmazásával kell pótolni a hiányzó adatokat. Megfelelően meg kell indokolni az ettől eltérő vizsgálati stratégia vagy eljárás alkalmazását, vagy ha úgy döntenek, hogy nem használják a lépcsőzetes vizsgálati megközelítést.
Ha a korróziós vagy irritáló hatásokat nem lehet meghatározni az adatok bizonyító erejének elemzésével, a lépcsőzetes vizsgálati stratégiával összhangban fontolóra kell venni in vivo vizsgálatok elvégzését (lásd a függelékben).
1.2. FOGALOMMEGHATÁROZÁSOK
Bőrirritáció: a vizsgálandó anyag alkalmazását követően 4 órán belül megjelenő, visszafordítható bőrkárosodás.
Bőrkorróziós hatás: a vizsgálandó anyag alkalmazását követően négy órán belül megjelenő, visszafordíthatatlan bőrkárosodás, azaz a felhámon át az irhára is átterjedő látható szövetelhalás. A korróziós reakciót fekélyek, vérzés, véres var, illetve a 14 napos megfigyelési időszak végén a bőr kifehéredése miatti elszíneződések, teljesen szőrtelen területek és hegek jellemzik. A problémás léziók kiértékelése érdekében fontolóra kell venni kórszövettani vizsgálatok elvégzését.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A vizsgálandó anyagot egyetlen dózisban kell alkalmazni a kísérleti állat bőrén; a vizsgált állat nem kezelt bőrfelületei szolgálnak kontrollként. Az irritáció/korrózió mértékét meghatározott időközönként kell ellenőrizni és értékelni, továbbá a hatások teljes kiértékelése érdekében részletesebben is ismertetni. A vizsgálat időtartamának elég hosszúnak kell lennie ahhoz, hogy meg lehessen határozni a megfigyelt hatások visszafordíthatóságát vagy visszafordíthatatlanságát.
A vizsgálat bármely fázisában tartós súlyos szorongás és/vagy fájdalom jeleit mutató állatokat humánus módon exterminálni kell, és az anyagot ennek megfelelően kell értékelni. Az elhullás közelében lévő és súlyosan szenvedő állatok humánus módon történő exterminálásáról szóló döntéssel kapcsolatos kritériumok a (8) hivatkozásban találhatók.
1.4. A VIZSGÁLATI MÓDSZER ISMERTETÉSE
1.4.1. Az in vivo vizsgálat előkészítése
1.4.1.1. Az állatfaj kiválasztása
A preferált laboratóriumi állatfaj az albínó nyúl, és egészséges, fiatal felnőtt állatokat kell alkalmazni. Más fajok alkalmazását megfelelően indokolni kell.
1.4.1.2. Az állatok előkészítése
A vizsgálat előtt körülbelül 24 órával el kell távolítani az állat szőrzetét úgy, hogy teljesen le kell nyírni az állat törzsének dorzális területét. Vigyázni kell arra, hogy eközben ne dörzsöljék ki az állat bőrét, és csak olyan állatokat szabad alkalmazni, amelyek bőre ép és egészséges.
Egyes nyúltörzsek szőrzete sűrű foltokban nő, amelyek az év egyes szakaszaiban még szembetűnőbbek. Nem szabad vizsgálati területként használni az ilyen sűrű szőrzetnövekedéssel jellemzett részeket.
1.4.1.3. Az állatok tartásának és etetésének körülményei
Az állatokat egyedileg kell elhelyezni. Nyulak esetében a kísérleti helyiség hőmérsékletének 20 oC (± 3 oC)-nak kell lennie. Bár a helyiség relatív páratartalmának legalább 30 %-nak kell lennie, illetve a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot, a célértéknek 50 és 60 % között kell lennie. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett.
1.4.2. A vizsgálati eljárás
1.4.2.1. A vizsgálandó anyag alkalmazása
A vizsgálandó anyagot egy kis (körülbelül 6 cm2-es) bőrterületre kell kijuttatni, majd egy géztapasszal le kell takarni, és nem irritáló ragasztószalaggal kell a helyén rögzíteni. Olyan esetekben, amikor a közvetlen alkalmazás nem megoldható (pl. folyadékok vagy egyes masszák esetében), a vizsgálandó anyagot először a géztapaszra kell felvinni, és azután azt kell a bőrre tenni. Az expozíciós idő tartamára a tapaszt lazán kell a bőrre rögzíteni egy megfelelő félig záró kötés alkalmazásával. Amennyiben a vizsgálandó anyagot a tapaszra viszik fel, úgy kell a bőrre rögzíteni, hogy megfelelő legyen a kontaktus, és az anyag egyenletesen oszoljon el a bőrön. Gondoskodni kell arról, hogy az állat ne férjen hozzá a tapaszhoz és ne nyelje le vagy lélegezze be a vizsgálandó anyagot.
A folyékony vizsgálandó anyagokat általában hígítatlanul kell alkalmazni. Szilárd anyagok vizsgálatakor (amelyeket szükség esetén porrá lehet őrölni) a vizsgálandó anyagot a lehető legkisebb, de a bőrrel való megfelelő kontaktus biztosításához elegendő mennyiségű vízzel (vagy ha szükséges, más megfelelő vivőanyaggal) meg kell nedvesíteni. Ha víztől eltérő vivőanyagot alkalmaznak, a vivőanyag legfeljebb minimális mértékben befolyásolhatja a vizsgálandó anyag által gyakorolt irritáló hatást.
Ha megoldható, az általában 4 órás expozíciós idő végén az adott esetben megmaradt vizsgálandó anyagot vízzel vagy más megfelelő oldószerrel el kell távolítani, de vigyázni kell arra, hogy ezzel ne legyenek hatással a meglévő válaszreakciókra vagy a felhám épségére.
1.4.2.2. A dózisok
A vizsgálati helyre 0,5 ml folyadékot vagy 0,5 g szilárd anyagot vagy masszát kell felvinni.
1.4.2.3. Kiindulási vizsgálat (in vivo bőrirritációs/bőrkorróziós vizsgálat egy állat felhasználásával)
Nyomatékosan ajánlott, hogy az in vivo vizsgálatot először egy állaton végezzék el, különösen akkor, ha az anyag gyaníthatóan korróziós hatású. Ez összhangban áll a lépcsőzetes vizsgálati stratégiával (lásd az 1. függeléket).
Ha az adatok bizonyító erejének elemzése alapján az anyag korróziós hatásúnak minősül, nincsen szükség további állatkísérletekre. A legtöbb gyaníthatóan korróziós hatású anyag esetében általában szükségtelen további in vivo vizsgálatokat végezni. Ha azonban nincs elegendő bizonyíték, és emiatt indokoltnak látszik a további adatgyűjtés, az alábbi eljárás alkalmazásával korlátozott állatkísérletek végezhetők: az állatra egymást követően legfeljebb három tapaszt kell felhelyezni. Az első tapaszt három perc után el kell távolítani, és ha nem láthatók súlyos bőrreakciók, a második tapaszt is fel kell helyezni, majd egy óra elteltével ezt is el kell távolítani. Ha a megfigyelések ebben a szakaszban azt mutatják, hogy humánusan megengedhető az expozíció négy órára történő meghosszabbítása, egy harmadik tapaszt is fel lehet helyezni, majd négy óra múlva eltávolítani és kiértékelni a válaszreakciót.
Ha a három egymás utáni expozíció bármelyike után korróziós hatást tapasztalható, a vizsgálatot azonnal be kell fejezni. Ha az utolsó tapasz eltávolítása után sem figyelhető meg korróziós hatás, az állatot 14 napon át meg kell figyelni, kivéve, ha előbb jelentkezik korróziós hatás.
Azokban az esetekben, amikor a vizsgálandó anyag várhatóan nem okoz korróziós hatást, de irritáló lehet, négy órára kell felhelyezni egyetlen tapaszt egy állatra.
1.4.2.4. Ellenőrző vizsgálat (in vivo bőrirritációs/bőrkorróziós vizsgálat további állatok alkalmazásával)
Ha a kiindulási vizsgálat során nem figyelhető meg korróziós hatás, legfeljebb további két állaton egy-egy tapasz és négyórás expozíciós idő alkalmazásával meg kell erősíteni az irritációt vagy a negatív válaszreakciókat. Ha a kiindulási vizsgálat során irritációs választ figyeltek meg, az ellenőrző vizsgálatok lépcsőzetesen is elvégezhetők, vagy úgy, hogy két további állatot egyszerre kezelnek. Abban a kivételes esetben, ha nem végeznek kiindulási vizsgálatot, két vagy három állatot lehet kezelni egy-egy tapasszal, amelyet négy óra után távolítanak el. Ha két állatot használnak, és mindkettő ugyanolyan válaszreakciót mutat, nincs szükség további vizsgálatokra. Egyéb esetben egy harmadik állatot is be kell vonni a vizsgálatba. A nem egyértelmű válaszokat esetleg további állatok alkalmazásával kell értékelni.
1.4.2.5. Megfigyelési időszak
A megfigyelési időszak hosszát úgy kell megválasztani, hogy elegendő legyen a megfigyelt hatások visszafordíthatóságának teljes kiértékelésére. A vizsgálatot azonban azonnal meg kell szakítani, ha az állat tartósan súlyos fájdalom vagy szorongás jeleit mutatja. A hatások visszafordíthatóságának meghatározásához az állatokat a tapaszok eltávolítása után legfeljebb 14 napig meg kell figyelni. Ha a visszafordíthatóság a 14 napos időszak vége előtt bebizonyosodik, a kísérletet ekkor kell befejezni.
1.4.2.6. Klinikai megfigyelések és a bőrreakciók értékelése
Minden állatnál meg kell vizsgálni a bőrpír (eritéma) vagy vizenyő (ödéma) jeleit, továbbá a tapasz eltávolítása után 60 perccel, majd 24, 48 és 72 órával értékelni kell a válaszreakciókat. Az egy állattal végzett kiindulási vizsgálatban a vizsgálati területet a tapasz eltávolítása után azonnal is meg kell vizsgálni. A bőrreakciókat a csatolt táblázatban megadottak szerint kell értékelni és jegyzőkönyvezni. Ha 72 óránál sem irritációként, sem korrózióként nem értékelhető bőrkárosodás látható, a hatások visszafordíthatóságának meghatározásához szükség lehet arra, hogy a megfigyeléseket a 14. napig folytassák. Az irritáció megfigyelésén kívül minden lokális toxikus hatást, mint például a bőr zsírtartalmának csökkentését, és bármely káros szisztémás hatást (pl. a mérgezés klinikai tüneteire és a testtömegre gyakorolt hatást) részletesen le kell írni, és fel kell jegyezni. A nem egyértelmű eredmények tisztázása érdekében fontolóra kell venni kórszövettani vizsgálatok elvégzését is.
A bőrreakciók értékelése elkerülhetetlenül szubjektív. A bőrreakciók értékelésének harmonizálása és a vizsgáló laboratóriumok, illetve a megfigyelésekben és azok értékelésében részt vevők segítése érdekében a megfigyeléseket végző személyzetet megfelelően ki kell képezni az alkalmazott értékelő rendszer (lásd a csatolt táblázatot) használatára. Hasznos lehet egy, a bőrirritációk és más léziók értékelését ismertető, illusztrált útmutató is (9).
2. ADATOK
2.1. AZ EREDMÉNYEK BEMUTATÁSA
A végleges vizsgálati jelentésben a vizsgálatok eredményeit táblázatos formában kell összefoglalni, amelynek a 3.1 szakaszban felsorolt tételek mindegyikét tartalmaznia kell.
2.2. AZ EREDMÉNYEK ÉRTÉKELÉSE
A bőrirritációs pontszámokat a léziók jellegével és súlyosságával, illetve visszafordíthatóságával vagy visszafordíthatatlanságával összefüggésben kell értékelni. Az egyes pontszámok nem jelentenek abszolút normát egy anyag irritációs tulajdonságai tekintetében, mivel a vizsgálandó anyag egyéb hatásait is értékelni kell. Az egyes pontszámokat ehelyett referenciaértékeknek kell tekinteni, amelyeket a vizsgálat során tett összes egyéb megfigyeléssel együttesen kell értékelni.
Az irritációs válaszok értékelésekor figyelembe kell venni a bőrléziók visszafordíthatóságát. Ha az olyan válaszok, mint a szőrhiány (korlátozott területen), kóros elszarusodás (hiperkeratózis), a szövetszaporodás (hiperplázia) vagy a hámlás a 14 napos megfigyelési időszak végére sem múlnak el, a vizsgálandó anyagot irritálónak kell tekinteni.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek a következő információkat kell tartalmaznia:
|
|
Az in vivo vizsgálatok indoklása: a korábban rendelkezésre álló vizsgálati adatok, ezen belül a lépcsőzetes vizsgálati stratégia során nyert adatok bizonyító erejének elemzése:
|
|
|
Vizsgálandó anyag:
|
|
|
Vivőanyag:
|
|
|
Kísérleti állatok:
|
|
|
Kísérleti körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények diszkussziója. |
4. HIVATKOZÁSOK
|
(1) |
Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410-429. |
|
(2) |
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In vitro, 2, 19-26. |
|
(3) |
Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M. (1998) Evaluation of the proposed OECD Testing Strategy for skin corrosion. ATLA 26, 709-720. |
|
(4) |
ECETOC (1990) Monograph No. 15, „Skin Irritation”, European Chemical Industry, Ecology and Toxicology Centre, Brussels. |
|
(5) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in vitro 12, pp. 483-524. |
|
(5a) |
B40. vizsgálati módszer, Bőrkorrózió. |
|
(6) |
OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www1.oecd.org/ehs/test/background.htm). |
|
(7) |
OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm). |
|
(8) |
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://www1 .oecd.org/ehs/test/monos.htm). |
|
(9) |
EPA (1990). Atlas of Dermal Lesions, (20T-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, August 1990. (Kérésre az OECD Titkárságon rendelkezésre áll.) |
I. táblázat
A BŐRREAKCIÓK ÉRTÉKELÉSE
Bőrpír (eritéma) és pörkképződés
|
Nincs bőrpír … |
0 |
|
Nagyon enyhe bőrpír (alig észlelhető) … |
1 |
|
Jól kifejezett bőrpír … |
2 |
|
Közepes-súlyos mértékű bőrpír … |
3 |
|
Pörkképződésig fokozódó súlyos bőrpír (céklavörös szín), amely lehetetlenné teszi a bőrpír osztályozását … |
4 |
Lehetséges maximum: 4
Vizenyőképződés
|
Nincs vizenyő … |
0 |
|
Nagyon enyhe vizenyő (alig észlelhető) … |
1 |
|
Enyhe vizenyő (a terület szélei az egyértelmű kiemelkedések miatt jól kifejezettek) … |
2 |
|
Közepes súlyosságú vizenyő (körülbelül 1 mm-re emelkedik ki) … |
3 |
|
Súlyos vizenyő (több mint 1 mm-re emelkedik ki és nagyobb, mint az expozíciós terület) … |
4 |
Lehetséges maximum: 4 A
Nem egyértelmű válaszokat kórszövettani vizsgálattal lehet tisztázni.
FÜGGELÉK
Lépcsőzetes vizsgálati stratégia bőrirritációs és bőrkorróziós vizsgálatokhoz
ÁLTALÁNOS MEGFONTOLÁSOK
A tudományos ésszerűség és az állatok kímélete érdekében fontos, hogy elkerülhető legyen az állatokkal való szükségtelen kísérletezés, illetve minimálisra lehessen csökkenteni azokat a vizsgálatokat, amelyek valószínűleg súlyos válaszreakciókat váltanak ki a kísérleti állatokban. Az in vivo vizsgálatok fontolóra vétele előtt minden, az anyag potenciális bőrkorróziós/bőrirritáló hatásával összefüggő információt ki kell értékelni. Lehet, hogy elegendő bizonyíték van a vizsgálandó anyag bőrkorróziós és bőrirritációs potenciál alapján történő besorolására anélkül, hogy laboratóriumi állatokon kísérleteket kellene végezni. Az adatok bizonyító erejének elemzésével és a lépcsőzetes vizsgálati stratégia alkalmazásával tehát minimálisra csökkenthető az in vivo vizsgálatok iránti igény, különösen, ha az anyag valószínűleg súlyos reakciókat okoz.
Az anyagok bőrirritáló és bőrkorróziós hatásával kapcsolatban rendelkezésre álló információk értékelésére célszerű elvégezni az adatok bizonyító erejének elemzését annak érdekében, hogy meg lehessen határozni, hogy az in vivo bőrvizsgálatokon kívül szükség van-e egyéb vizsgálatokra az irritáló/korróziós potenciál jellemzéséhez. Ha további vizsgálatokra van szükség, a kísérleti adatok összegyűjtéséhez, a lépcsőzetes vizsgálati stratégiát javasolt alkalmazni. Az olyan anyagok esetében, amelyeket korábban nem vizsgáltak, az anyag bőrkorróziós/bőrirritáló potenciáljának értékeléséhez szükséges adatsor előállításához a lépcsőzetes vizsgálati stratégiát kell alkalmazni. Az ebben a függelékben ismertetett vizsgálati stratégiát egy OECD-munkaértekezleten (1) dolgozták ki, majd később jóváhagyták, és a Harmonizált integrált veszélyosztályozási rendszer a vegyi anyagok humán egészségügyi és környezeti hatásainak osztályozására keretében kibővítették, és 1998 novemberében a Vegyi Anyag Bizottság és a Vegyi Anyag Munkacsoport 28. együttes ülésén jóváhagyták (2).
Bár ez a lépcsőzetes vizsgálati stratégia nem képezi szerves részét a B4. vizsgálati módszernek, kifejezésre juttatja a bőrirritáció/bőrkorrózió jellemzőinek meghatározására ajánlott megközelítést. Ez a megközelítés testesíti meg a legjobb gyakorlatot, és etikai szempontból is irányadó az in vivo bőrirritációs/bőrkorróziós vizsgálatokhoz. A vizsgálati módszer útmutatást ad az in vivo vizsgálatok elvégzéséhez, és összefoglalja azokat a tényezőket, amelyeket az ilyen vizsgálatok megkezdése előtt fontolóra kell venni. A stratégia megközelítést biztosít a vizsgálandó anyag bőrirritáló/bőrkorróziós tulajdonságaival kapcsolatos meglévő adatok értékeléséhez, és lépcsőzetes megközelítést jelent az olyan anyagokra vonatkozó adatok összegyűjtéséhez, amelyekhez további vizsgálatokra van szükség, vagy amelyeket korábban egyáltalán nem vizsgáltak. Javaslatot tesz továbbá validált és elfogadott in vitro vagy ex vivo bőrirritációs/bőrkorróziós vizsgálatok meghatározott körülmények esetén történő elvégzésére.
AZ ÉRTÉKELÉSI ÉS VIZSGÁLATI STRATÉGIA ISMERTETÉSE
A vizsgálatoknak a lépcsőzetes vizsgálati stratégia (ábra) keretében történő elvégzése előtt minden rendelkezésre álló információt ki kell értékelni annak meghatározása érdekében, hogy szükség van-e in vivo bőrvizsgálatokra. Bár egy-egy paraméter (pl. szélsőséges pH-érték) vizsgálatából is jelentős mennyiségű információ nyerhető, az összes rendelkezésre álló információt figyelembe kell venni. A kérdéses anyag vagy analógjai hatásaival kapcsolatos összes adatot értékelni kell azok bizonyító erejéről való döntés meghozatalakor, és meg is kell indokolni ezt a döntést. Elsődleges hangsúlyt kell fektetni az anyaggal kapcsolatban rendelkezésre álló humán és állatkísérletes adatokra, ezt követően az in vitro vagy ex vivo vizsgálatok eredményére. Lehetőség szerint kerülni kell a korróziós hatású anyagok in vivo vizsgálatát. A vizsgálati stratégia során figyelembe veendő tényezők a következők:
A rendelkezésre álló humán és állatkísérletes adatok értékelése (1. lépés). Első lépésben a rendelkezésre álló humán adatokat, pl. klinikai vagy munka-egészségügyi vizsgálatokat, valamint esettanulmányokat és/vagy állatkísérletes adatokat, pl. egyszeri vagy ismételt bőrexpozíciós toxicitási vizsgálatokat kell kiértékelni, mivel ezek a bőrre gyakorolt hatásokra közvetlenül vonatkozó információkat szolgáltatnak. Az ismerten irritáló vagy korróziós hatású anyagokat, illetve azokat, amelyek esetében egyértelműen bizonyítható az ilyen hatások hiánya, nem szükséges in vivo vizsgálni
A szerkezetaktivitási összefüggések (SAR) elemzése (2. lépés). Ha vannak, fontolóra kell venni szerkezetileg rokon anyagok vizsgálatát. Ha a szerkezetileg rokon anyagokkal vagy elegyeikkel kapcsolatban elegendő olyan humán és/vagy állatkísérletes adat áll rendelkezésre, amely valószínűsíti a bőrkorróziós/bőrirritációs potenciált, feltételezhető, hogy az értékelés alatt álló vizsgálandó anyag ugyanilyen válaszreakciókat vált ki. Ilyen esetekben előfordulhat, hogy a vizsgálandó anyagot nem kell megvizsgálni. A lépcsőzetes vizsgálati stratégia értelmében a szerkezetileg rokon anyagok vagy elegyeik vizsgálatából származó negatív adatok nem jelentenek elegendő bizonyítékot arra nézve, hogy az anyag nem korróziós hatású vagy nem irritáló. A bőrkorróziós és bőrirritáló potenciál meghatározására validált és elfogadott SAR-megközelítéseket kell alkalmazni.
Fizikai-kémiai tulajdonságok és kémiai reaktivitás (3. lépés). A szélsőséges, például pH < 2,0 és > 11,5 kémhatású anyagok erőteljes lokális hatást gyakorolhatnak. Ha a szélsőséges pH-érték az alapja annak, hogy egy anyagot korróziós hatásúnak minősítsünk, akkor az anyag sav/alkáli tartalékát (vagy pufferkapacitását) is figyelembe lehet venni (3)(4). Ha a pufferkapacitás alapján valószínűsíthető, hogy az anyag nem bőrkorróziós hatású, akkor ennek megerősítésére további vizsgálatokat kell végezni, lehetőleg validált és elfogadott in vitro vagy ex vivo módszerek alkalmazásával (lásd az 5. és 6. lépést).
Dermális toxicitás (4. lépés). Ha egy vegyültről kiderül, hogy dermális alkalmazás esetén nagyon toxikus, előfordulhat, hogy az anyag in vivo bőrirritációs/bőrkorróziós vizsgálata nem oldható meg, mivel a vizsgálandó anyag szokásosan alkalmazott mennyisége meghaladhatja a nagyon mérgező dózist, és ennek következtében az állatok elhullását vagy súlyos szenvedését okozhatja. Emellett, ha a 2 000 mg/testtömeg-kg-os határdózisig vagy annál magasabb dózisok alkalmazásával korábban már végeztek albínó nyulakban in vivo dermális toxicitási vizsgálatokat, és nem tapasztaltak bőrirritációt vagy bőrkorróziót, előfordulhat, hogy nem lesz szükség további bőrirritációs/bőrkorróziós vizsgálatokra. A korábbi vizsgálatok akut dermális toxicitási eredményeinek értékelésekor egy sor megfontolást kell figyelembe venni. Előfordulhat például, hogy a bőrléziókkal kapcsolatos adatok hiányosak. Esetleg nem nyúlon végezték a vizsgálatokat és a megfigyeléseket, és a különböző állatfajokban nagyon eltérő lehet a válaszreakciók érzékenysége. Illetve lehetséges, hogy az állatokon alkalmazott vizsgálandó anyag formája nem volt alkalmas a bőrirritáció/bőrkorrózió vizsgálatára (pl. a dermális toxicitási vizsgálatokban alkalmazott hígítás miatt (5)). Azokban az esetekben azonban, ahol jól megtervezett és lefolytatott dermális toxicitási vizsgálatokat végeztek nyulakon, a negatív eredményeket elegendő bizonyítéknak tekinthetjük arra, hogy az anyag nem korróziós hatású és nem irritáló.
In vitro vagy ex vivo vizsgálatok eredményei (5. és 6. lépés). Nem kell állatokon kísérletezni olyan anyagokkal, amelyek e konkrét hatások meghatározására tervezett, validált és elfogadott módszerekkel végzett in vitro vagy ex vivo vizsgálatokban (6)(7) korróziós vagy súlyos irritáló hatásokat mutattak. Ilyen esetben fel lehet tételezni, hogy az anyag in vivo is hasonlóan súlyos hatásokat vált ki.
In vivo vizsgálat nyulakban (7. és 8. lépés). Ha az adatok bizonyító erejének elemzése alapján hozott döntés szerint in vivo vizsgálatokat kell végezni, első lépésben egyetlen állattal kiindulási vizsgálatot kell végezni. Ha e vizsgálat eredménye szerint az anyag bőrkorróziós hatású, nem szabad további vizsgálatokat végezni. Ha a kiindulási vizsgálatban nem tapasztalható korróziós hatás, az irritációs vagy negatív választ legfeljebb két további állat négyórás expozíciójával ellenőrizni kell. Ha a kiindulási vizsgálatban irritáció tapasztalható, az ellenőrző vizsgálat végezhető lépcsőzetesen is, vagy úgy is, hogy a két további állatot egyszerre kezelnek.
HIVATKOZÁSOK
|
(1) |
OECD (1996). Test Guidelines Programme: Final Report on the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held on Solna, Sweden, 22-24 January 1996(http://www1.oecd.org/ehs/test/background.htm). |
|
(2) |
OECD (1998). Harmonized Integrated Hazard Classification System for Human Healthand Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1 .oecd.org/ehs/Class/HCL6.htm). |
|
(3) |
Worth, A.P., Fentem J.H., Balls M., Botham P.A., Curren R.D., Earl L.K., Esdail D.J., Liebsch M. (1998). An Evaluation of the Proposed OECD Testing Strategy for SkinCorrosion. ATLA 26, 709-720. |
|
(4) |
Young, J.R., How, M.J., Walker, A.P., Worth, W.M.H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing on Animals. Toxic In vitro, 2 (1) pp 19-26. |
|
(5) |
Patil, S.M., Patrick, E., Maibach, H.I. (1996) Animal, Human, and In vitro Test Methodsfor Predicting Skin Irritation, in: Francis N. Marzulli and Howard I. Maibach (editors): Dermatotoxicology. Fifth Edition ISBN 1-56032-356-6, Chapter 31, 411-436. |
|
(6) |
B40. vizsgálati módszer |
|
(7) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in vitro 12, pp. 483-524. |
Ábra
VIZSGÁLATI ÉS KIÉRTÉKELÉSI STRATÉGIA A BŐRIRRITÁCIÓ, ILLETVE A BŐRKORRÓZIÓ VIZSGÁLATÁHOZ

B.5. AKUT TOXICITÁS: SZEMIRRITÁCIÓ/SZEMKORRÓZIÓS HATÁS
1. MÓDSZER
Ez a módszer egyenértékű az OECD TG 405 (2002) módszerrel.
1.1. BEVEZETÉS
Ennek a továbbfejlesztett módszernek a kidolgozása során külön figyelmet szenteltek a vizsgálandó anyaggal kapcsolatban rendelkezésre álló összes információ kiértékelése révén lehetségessé váló javító beavatkozásoknak, hogy ezáltal elkerülhető legyen a laboratóriumi állatokon történő szükségtelen kísérletezés, és így tiszteletben lehessen tartani az állatjóléti szempontokat is. A módszer ajánlást fogalmaz meg arra nézve, hogy az anyag akut szemkorróziós vagy szemirritáló hatásának vizsgálatára előírt in vivo kísérlet elvégzése előtt el kell végezni a rendelkezésre álló adatok bizonyító erejének elemzését (1). Ha nem áll rendelkezésre elegendő adat, akkor ajánlott lépcsőzetes vizsgálatok alkalmazásával bővíteni ezeket (2)(3). A vizsgálati stratégia részét képezi validált és elfogadott in vitro vizsgálatok végzése, amelyek a vizsgálati módszer függelékeként kerülnek ismertetésre. Ajánlott továbbá, hogy az in vivo szemvizsgálatok tervbevétele előtt a szemkorróziós hatás előrejelzésére végezzenek in vivo bőrirritációs/bőrkorróziós vizsgálatot.
A tudományos ésszerűség és az állatok kímélete érdekében nem szabad in vivo vizsgálatokat végezni mindaddig, amíg az anyag potenciális szemkorróziós/irritáló hatására vonatkozó összes rendelkezésre álló adatra vonatkozóan el nem végezték az adatok bizonyító erejének elemzését. Ilyen adatok az embereken és/vagy laboratóriumi állatokon elvégzett vizsgálatok eredményei, a szerkezetileg rokon anyagok vagy elegyeik korróziós/irritáló hatásaival kapcsolatos tények, az anyag erős savasságát vagy lúgosságát igazoló adatok (4)(5), valamint a validált és elfogadott in vitro vagy ex vivo bőrkorróziós és bőrirritációs vizsgálatokból kapott eredmények (6)(6a). Előfordulhat, hogy a vizsgálatokat már az adatok bizonyító erejének elemzése előtt elvégezték vagy éppen annak eredményeként végzik el.
Bizonyos anyagok esetében az ilyen elemzés annak a szükségét jelezheti, hogy el kell végezni az anyag szemkorróziós/szemirritációs potenciáljának in vivo vizsgálatát. Minden ilyen esetben, az in vivo szemvizsgálat alkalmazásának tervbevétele előtt először lehetőleg el kell végezni, és ki kell értékelni egy in vivo vizsgálatot az anyag bőrre gyakorolt hatásainak meghatározására a B4. vizsgálati módszer (7) alkalmazásával. Az adatok bizonyító erejének elemzése és a lépcsőzetes vizsgálati stratégia alkalmazása csökkenti az in vivo szemkorróziós/szemirritációs vizsgálatok szükségességét azoknak az anyagoknak az esetében, amelyekhez más vizsgálatokból elegendő bizonyíték áll rendelkezésre. Ha a lépcsőzetes stratégia alkalmazásával nem határozható meg a szemkorróziós/irritációs potenciál, még az in vivo bőrkorróziós és irritációs vizsgálat elvégzése után sem, elvégezhető egy in vivo szemkorróziós/szemirritációs vizsgálat.
A preferált lépcsőzetes vizsgálati stratégia, amely magában foglalja validált in vitro vagy ex vivo korróziós/irritációs vizsgálatok elvégzését is, az e vizsgálati módszerhez csatolt függelékben kerül ismertetésre. A stratégiát egy OECD-munkaértekezlet (8) résztvevői dolgozták ki, javasolták egyhangúlag, majd fogadták el mint a Globálisan harmonizált rendszer (GHS) a vegyi anyagok osztályozására (9) ajánlott vizsgálati stratégiáját. Az in vivo vizsgálatok elvégzése előtt ezt a vizsgálati stratégiát javasolt követni. Új anyagok esetében ez az ajánlott lépcsőzetes vizsgálati megközelítés az anyag korróziós/irritáló hatásaira vonatkozó, tudományos szempontból megfelelő adatok gyűjtésére. Ismert anyagok esetében, ha nem áll rendelkezésre elegendő adat a szemkorróziós/szemirritáló és bőrkorróziós/bőrirritáló hatásokról, ennek a stratégiának az alkalmazásával kell pótolni a hiányzó adatokat. Megfelelően meg kell indokolni, ha ettől eltérő vizsgálati stratégiát vagy eljárást alkalmaznak, vagy ha úgy döntenek, hogy nem használják a lépcsőzetes vizsgálati megközelítést.
1.2. FOGALOMMEGHATÁROZÁSOK
Szemirritáció: a vizsgálandó anyagnak a szem elülső felszínén történő alkalmazását követően megjelenő és az alkalmazástól számított 21 napon belül teljes mértékben visszafordítható szemelváltozások.
Szemkorróziós hatás: a vizsgálandó anyagnak a szem elülső felszínén történő alkalmazását követően megjelenő és az alkalmazástól számított 21 napon belül nem teljes mértékben visszafordítható szövetkárosodások a szemben, vagy súlyos fizikai látóképesség-romlás.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A vizsgálandó anyagot egyetlen dózisban kell alkalmazni a kísérleti állat egyik szemén; a másik, nem kezelt szem szolgál kontrollként. A szemirritáció/szemkorrózió mértékét meghatározott időközönként a kötőhártya, szaruhártya és szivárványhártya lézióinak pontozásával kell kiértékelni. A hatások teljes kiértékelése érdekében részletesen ismertetni kell a szemre gyakorolt egyéb hatásokat és a káros szisztémás hatásokat is. A vizsgálat időtartamának elég hosszúnak kell lennie ahhoz, hogy meg lehessen határozni a hatások visszafordíthatóságát vagy visszafordíthatatlanságát.
A vizsgálat bármely fázisában tartósan súlyos szorongás és/vagy fájdalom jeleit mutató állatokat humánus módon exterminálni kell, és az anyagot ennek megfelelően kell értékelni. Az elhullás közelében lévő és súlyosan szenvedő állatok humánus módon történő exterminálásáról szóló döntéssel kapcsolatos kritériumok a (10) hivatkozásban találhatók.
1.4. A VIZSGÁLATI MÓDSZER ISMERTETÉSE
1.4.1. Az in vivo vizsgálat előkészítése
1.4.1.1. Az állatfaj kiválasztása
A preferált laboratóriumi állatfaj az albínó nyúl, és egészséges, fiatal felnőtt állatokat kell alkalmazni. Más fajok alkalmazását megfelelően indokolni kell.
1.4.1.2. Az állatok előkészítése
A vizsgálat előtt legfeljebb 24 órával a vizsgálatra előzetesen kiválasztott kísérleti állat mindkét szemét meg kell vizsgálni. Nem szabad olyan állatot használni, amely szemirritációt, szemhibákat vagy korábban szerzett szaruhártya-sérülést mutat.
1.4.1.3. Az állatok tartásának és etetésének körülményei
Az állatokat egyedileg kell elhelyezni. Nyulak esetében a kísérleti helyiség hőmérsékletének 20 oC (± 3 oC)-nak kell lennie. Bár a helyiség relatív páratartalmának legalább 30 %-nak kell lennie, illetve a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot, a célértéknek 50 és 60 % között kell lennie. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett.
1.4.2. Vizsgálati eljárás
1.4.2.1. A vizsgálandó anyag alkalmazása
A vizsgálandó anyagot az alsó szemhéj óvatos elhúzása után az állat egyik szemének kötőhártyazsákjába kell bejuttatni. Ezt követően körülbelül egy másodpercig óvatosan össze kell fogni a szemhéjakat, hogy az anyag ki ne essen vagy folyjon. A másik, nem kezelt szem kontrollként szolgál.
1.4.2.2. Öblögetés
A kísérleti állatok szemét a vizsgálandó anyag becseppentése után legalább 24 órán át nem szabad kimosni, kivéve szilárd anyagok alkalmazása esetén (lásd 1.4.2.3.2. szakasz), illetve ha azonnali korróziós hatás vagy irritáció tapasztalható. Ha szükségnek tűnik, 24 óra múlva ki lehet mosni az állatok szemét.
Nem javasolt kontrollcsoport alkalmazása a mosás hatásának vizsgálatára, kivéve, ha az tudományosan indokolt. Ha kontrollcsoport szükséges, akkor ehhez két nyulat kell használni. A mosás körülményeit, pl. a mosás időpontját, a mosóoldat összetételét és hőmérsékletét, a mosás időtartamát és sebességét, valamint az alkalmazott térfogatot részletesen dokumentálni kell.
1.4.2.3. A dózisok
1.4.2.3.1. Folyadékok vizsgálata
Folyadékok vizsgálata esetén 0,1 ml-es dózist kell alkalmazni. Pumpás spray-ket nem szabad az anyag közvetlenül a szembe való permetezésére használni. A sprayt ki kell fújni, és tartalmát egy edényben össze kell gyűjteni, mielőtt 0,1 ml-t az állat szemébe cseppentenének.
1.4.2.3.2. Szilárd anyagok vizsgálata
Szilárd anyagok, masszák és szemcsés anyagok vizsgálata esetén az alkalmazott mennyiségnek 0,1 ml térfogatúnak kell lennie, illetve tömege nem haladhatja meg a 100 mg-ot. A vizsgálandó anyagot finom porrá kell őrölni és térfogatmérés előtt óvatosan össze kell tömöríteni, pl. úgy, hogy a mérőedényt megkocogtatják. Amennyiben az első megfigyelési időpontban vagy a kezelés után 1 órával azt tapasztalják, hogy a szilárd vizsgálandó anyagot a fiziológiai mechanizmusok nem távolították el a kísérleti állat szeméből, a szemet sóoldattal vagy desztillált vízzel ki lehet öblögetni.
1.4.2.3.3. Aeroszolok vizsgálata
Ajánlatos minden pumpás spray tartalmát és aeroszolt összegyűjteni, mielőtt a szembe cseppentenék. Az egyetlen kivételt ez alól a túlnyomásos aeroszolos flakonokban lévő anyagok képezik, amelyeket a párolgás miatt nem lehet összegyűjteni. Ilyen esetekben az állat szemét nyitva kell tartani, és a vizsgálandó anyagot úgy kell a szembe juttatni, hogy a flakont 10 cm távolságban közvetlenül a szem előtt tartva és körülbelül egy másodpercig működtetve egyszer belefújnak az állat szemébe. A spray nyomásától és tartamától függően a távolság ettől eltérő is lehet. Vigyázni kell arra, hogy a spray nyomása ne okozzon szemkárosodást. Megfelelő esetekben szükség lehet arra is, hogy a spray okozta „mechanikai” szemkárosodás lehetőségét is vegyék figyelembe.
Az aeroszol dózisát úgy lehet megbecsülni, hogy a vizsgálatot az alábbiak szerint szimulálják. Az anyagot mérőpapírra permetezik egy olyan, közvetlenül a papír elé helyezett nyíláson keresztül, amelynek mérete megegyezik a nyúl szemének méretével. A papír tömegének növekedését használják fel a szembe permetezett mennyiség közelítő becslésére. Illékony anyagok esetében a dózist úgy lehet megbecsülni, hogy vizsgálandó anyag eltávolítása előtt és után is megmérik a befogadó edény tömegét.
1.4.2.4. Kiindulási vizsgálat (in vivo szemirritációs/szemkorróziós vizsgálat egy állat alkalmazásával)
Ahogyan az a lépcsőzetes vizsgálati stratégiában (lásd 1. függelék) is kifejtésre kerül, nyomatékosan ajánlott, hogy az in vivo vizsgálatot először egy állaton végezzék el, különösen akkor, ha az anyag gyaníthatóan korróziós hatású.
Ha e vizsgálat eredményei szerint az ismertetett eljárás alkalmazásával az anyag korróziós hatású vagy súlyosan irritálja a szemet, nem szabad további szemirritációs vizsgálatokat végezni.
1.4.2.5. Helyi érzéstelenítőszerek
Esetenként helyi érzéstelenítőszerek is alkalmazhatók. Ha az adatok bizonyító erejének elemzése szerint az anyag fájdalmat okozhat, vagy ha a kiindulási vizsgálat alapján fájdalmas reakció várható, a vizsgálandó anyag becseppentése előtt helyi érzéstelenítőszer alkalmazható. A helyi érzéstelenítőszer típusát, koncentrációját és dózisát körültekintően kell megválasztani, hogy alkalmazása miatt nehogy megváltozzon a vizsgálandó anyag által kiváltott reakció. A kontrollszemet ugyanígy érzésteleníteni kell.
1.4.2.6. Ellenőrző vizsgálat (in vivo szemirritációs vizsgálat további állatok alkalmazásával)
Ha a kiindulási vizsgálat során nem figyelhető meg korróziós hatás, legfeljebb további két állat alkalmazásával ellenőrizni kell az irritációs vagy negatív válaszreakciókat. Ha a kiindulási vizsgálat során súlyos irritációs választ figyeltek meg, amely valószínűsíti, hogy az ellenőrző vizsgálatban erőteljes (visszafordíthatatlan) hatás jelentkezhet, ajánlatos az ellenőrző vizsgálatot lépcsőzetesen, egyszerre egy állat alkalmazásával végezni ahelyett, hogy a két további állatot egyszerre kezelnének. Ha a második állat korróziós vagy súlyos, irritáló hatásokat jelez, nem szabad folytatni a vizsgálatokat. A gyenge vagy közepes mértékű irritáció megerősítéséhez további állatok vizsgálatára lehet szükség.
1.4.2.7. Megfigyelési időszak
A megfigyelési időszak hosszát úgy kell megválasztani, hogy elegendő legyen a megfigyelt hatások mértékének és visszafordíthatóságának teljes kiértékelésére. A vizsgálatot azonban azonnal meg kell szakítani, ha az állat tartósan súlyos fájdalom vagy szorongás jeleit mutatja (9). A hatások visszafordíthatóságának meghatározásához az állatokat általában a vizsgálandó anyag alkalmazása után 21 napig kell megfigyelni. Ha a visszafordíthatóság a 21 napos időszak vége előtt bebizonyosodik, a kísérletet ekkor be kell fejezni.
1.4.2.7.1. Klinikai megfigyelések és a bőrreakciók értékelése
A szemeket a vizsgálandó anyag alkalmazása után 1, 24, 48 és 72 órával kell megvizsgálni. Ha már megvan a döntő információ, az állatokat nem szabad a szükségesnél hosszabb ideig a kísérletben tartani. A tartósan súlyos fájdalmat vagy szorongást mutató állatokat haladéktalanul és humánus módon exterminálni kell, és az anyagot ennek megfelelő kell értékelni. A vizsgálandó anyag becseppentése után az alábbi szemléziókat mutató állatokat humánus módon exterminálni kell: szaruhártya-perforálódás vagy jelentős mértékű szaruhártya-fekélyesdés, ezen belül staphyloma (a szaruhártya rendellenes kidomborodása); vér jelenléte a szem elülső szemzugában; 48 órán át tartó negyedfokú szaruhártya-homály; a fényreflex 72 órán át tartó hiánya (másodfokú szivárványhártya-válaszreakció); a kötőhártya fekélyesedése; a kötőhártyában vagy a pislogóhártyában jelentkező szövetelhalás; vagy pörkképződés. Erre azért van szükség, mert az ilyen léziók általában nem visszafordíthatók.
A szemléziókat nem mutató állatokat legkorábban a becseppentés után 3 nappal lehet exterminálni. Az enyhe vagy közepes léziókat mutató állatokat legalább addig megfigyelés alatt kell tartani, amíg a léziók meg nem szűnnek, vagy legfeljebb 21 napig, amikor a vizsgálatot be kell fejezni. A 7., 14. és 21. napon kell megfigyeléseket végezni a léziók állapotának és visszafordíthatóságának vagy visszafordíthatatlanságának meghatározására.
Minden egyes vizsgálatkor minősíteni kell, és fel kell jegyezni a szemreakciókat (kötőhártya-, szaruhártya- és szivárványhártya-reakciók) (I. táblázat). A szem bármely egyéb lézióját (pl. pannus, elszíneződés) vagy a káros szisztémás hatásokat is fel kell jegyezni.
A reakciók vizsgálatát megkönnyítheti egy binokuláris kézi nagyító, egy kézi vonalfénylámpa, egy biomikroszkóp vagy bármely más megfelelő eszköz alkalmazása. A 24 óra után tett megfigyelések rögzítése után a szemeket fluoreszcein segítségével is megvizsgálhatjuk.
A szemreakciók értékelése elkerülhetetlenül szubjektív. A szemreakciók értékelésének harmonizálása és a vizsgáló laboratóriumok, illetve a megfigyelésekben és azok értékelésében részt vevők segítése érdekében a megfigyeléseket végző személyzetet megfelelően ki kell képezni az alkalmazott értékelő rendszer használatára.
2. ADATOK
2.2. AZ EREDMÉNYEK ÉRTÉKELÉSE
A szemirritációs pontszámokat a léziók jellegével és súlyosságával, illetve visszafordíthatóságukkal vagy visszafordíthatatlanságukkal összefüggésben kell meghatározni. Az egyes pontszámok nem jelentenek abszolút normát egy anyag irritációs tulajdonságai tekintetében, mivel a vizsgálandó anyag egyéb hatásait is értékelni kell. Az egyes pontszámokat ehelyett referenciaértékeknek kell tekinteni, amelyeknek csak akkor van jelentőségük, ha az összes megfigyelés ismertetése és értékelése alátámasztja ezeket.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek a következő információkat kell tartalmaznia:
|
|
Az in vivo vizsgálatok indoklása: a korábban rendelkezésre álló vizsgálati adatok, ezen belül a lépcsőzetes vizsgálati stratégia során nyert adatok bizonyító erejének elemzése:
|
|
|
Vizsgálandó anyag:
|
|
|
Vivőanyag:
|
|
|
Kísérleti állatok:
|
|
|
Eredmények:
|
|
|
Az eredmények diszkussziója. |
3.2. AZ EREDMÉNYEK ÉRTELMEZÉSE
A laboratóriumi állatokon végzett szemirritációs vizsgálatok eredményeinek emberre extrapolálása csak korlátozott érvényességű. Az albínó nyúl sok esetben érzékenyebb a szemirritáló vagy -korróziós anyagokra, mint az ember.
Vigyázni kell, hogy az adatok értelmezése során kizárható legyen a másodlagos fertőzés eredményeként jelentkező irritáció lehetősége.
4. HIVATKOZÁSOK
|
(1) |
Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410- 429. |
|
(2) |
de Silva, O., Cottin, M., Dami, N., Roguet, R., Catroux, P., Toufic, A., Sicard, C., Dossou, K.G., Gerner, I., Schlede, E., Spielmann, H., Gupta, K.C., Hill, R.N. (1997) Evaluation of Eye Irritation Potential: Statistical Analysis and Tier Testing Strategies. Food Chem. Toxicol 35, 159-164. |
|
(3) |
Worth A.P. and Fentem J.H. (1999) A general approach for evaluating stepwise testing strategies ATLA 27, 161-177. |
|
(4) |
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In vitro, 2, 19 – 26. |
|
(5) |
Neun, D. J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227 – 231. |
|
(6) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in vitro 12, pp. 483-524. |
|
(6a) |
B40. vizsgálati módszer, Bőrkorróziós hatás. |
|
(7) |
B4. vizsgálati módszer, Akut toxicitás: bőrirritáció/korrózió. |
|
(8) |
OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd.org/ehs/test/background.htm). |
|
(9) |
OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm). |
|
(10) |
Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://www.oecd.org/ehs/test/monos.htm). |
I. táblázat
A SZEMLÉZIÓK OSZTÁLYOZÁSA
Szaruhártya
Homályosság: a homályosság mértéke (az érték megállapításához a legsűrűbb területet kell venni) (1)
|
Nem észlelhető fekélyesedés vagy homályosság … |
0 |
|
Szórványos vagy diffúz homályos területek (a megszokott csillogás enyhe tompulásán kívül), a szivárványhártya részletei tisztán láthatók … |
1 |
|
Könnyen kivehető áttetsző terület; a szivárványhártya részletei kissé elhomályosodottak … |
2 |
|
Gyöngyházfényű terület; a szivárványhártya semmilyen részlete nem látható; a pupilla mérete alig észlelhető … |
3 |
|
Nem átlátszó szaruhártya; a szivárványhártya egyáltalán nem látható … |
4 |
Lehetséges maximum: 4
MEGJEGYZÉSEK
Szivárványhártya
|
Normális … |
0 |
|
Észrevehetően mélyebb redők, vérbőség, duzzanat, mérsékelt vérbőség a szaruhártya körül; vagy belövelltség; a szivárványhártya fényre reagál (a lassú reakció is pozitív) … |
1 |
|
Vérzés, nagymérvű roncsolódás, vagy nem reagál a fényre … |
2 |
Lehetséges maximum: 2
Kötőhártya
Vörösödés (a szemhéjak és a szemgolyó kötőhártyájára vonatkozik; kivéve a szaruhártyát és a szivárványhártyát)
|
Normális … |
0 |
|
Egyes vérerek vérteltek (belövelltek) … |
1 |
|
Diffúz, bíborvörös szín; az egyes vérerek nehezen kivehetők … |
2 |
|
Diffúz erőteljes vörös … |
3 |
Lehetséges maximum: 3
Kötőhártya-vizenyő (chemosis)
Duzzanat (a szemhéjak és/vagy a pislogóhártyák esetében)
|
Normális … |
0 |
|
A normálisnál kissé duzzadtabb … |
1 |
|
Nyilvánvaló duzzanat, a szemhéjak részleges kifordulásával … |
2 |
|
Duzzanat, nagyjából félig zárt szemhéjakkal … |
3 |
|
Duzzanat, és a szemhéjak több mint félig zárva vannak … |
4 |
Lehetséges maximum: 4
FÜGGELÉK
Lépcsőzetes vizsgálati stratégia szemirritáció és szemkorróziós hatás vizsgálatához
ÁLTALÁNOS MEGFONTOLÁSOK
A tudományos ésszerűség és az állatok kímélete érdekében fontos, hogy elkerülhető legyen az állatokkal való szükségtelen kísérletezés, illetve minimálisra lehessen csökkenteni azoknak a vizsgálatoknak a számát, amelyek valószínűleg súlyos válaszreakciókat váltanak ki a kísérleti állatokban. Az in vivo vizsgálatok fontolóra vétele előtt minden, az anyag potenciális szemirritáló-korróziós hatásával összefüggő információt ki kell értékelni. Lehet, hogy elegendő bizonyíték van a vizsgálandó anyag szemirritációs vagy -korróziós potenciál szempontjából történő besorolására anélkül, hogy laboratóriumi állatokon kísérleteket kellene végezni. Az adatok bizonyító erejének elemzésével és a lépcsőzetes vizsgálati stratégia alkalmazásával tehát minimálisra csökkenthető az in vivo vizsgálatok szükségszerűsége, különösen, ha az anyag valószínűleg súlyos reakciókat okoz.
Az anyagok szemirritáló és -korróziós hatásával kapcsolatban rendelkezésre álló információk értékelésre javasolt elvégezni az adatok bizonyító erejének elemzését annak érdekében, hogy meg lehessen határozni hogy az in vivo szemvizsgálatokon kívül szükség van-e egyéb vizsgálatokra az irritáló/korróziós potenciál jellemzéséhez. Ha további vizsgálatokra van szükség, a vonatkozó kísérleti adatok összegyűjtésiéhez a lépcsőzetes vizsgálati stratégiát javasolt alkalmazni. Az olyan anyagok esetében, amelyeket korábban nem vizsgáltak, az anyag szemkorróziós/szemirritációs potenciáljának értékeléséhez szükséges adatsor előállításához a lépcsőzetes vizsgálati stratégiát kell alkalmazni. Az ebben a függelékben ismertetett vizsgálati stratégiát egy OECD-munkaértekezleten (1) dolgozták ki, majd később jóváhagyták, és a Harmonizált integrált veszélyosztályozási rendszer a vegyi anyagok humán egészségügyi és környezeti hatásainak osztályozására keretében kibővítették és 1998 novemberében a Vegyi Anyag Bizottság és a Vegyi Anyag Munkacsoport 28. együttes ülésén jóváhagyták (2).
Bár ez a vizsgálati stratégia nem képezi szerves részét a B5. vizsgálati módszernek, kifejezésre juttatja a szemirritációs/szemkorróziós sajátosságok meghatározására ajánlott megközelítést. Ez a megközelítés testesíti meg a legjobb gyakorlatot, és etikai szempontból is irányadó az in vivo szemirritációs/szemkorróziós vizsgálatokhoz. A vizsgálati módszer útmutatást ad az in vivo vizsgálatok elvégzéséhez és összefoglalja azokat a tényezőket, amelyeket az ilyen vizsgálatok megkezdése előtt fontolóra kell venni. A lépcsőzetes vizsgálati stratégia az adatok bizonyító erején alapuló megközelítést tesz lehetővé az anyagok szemirritációs/szemkorróziós tulajdonságaival kapcsolatos meglévő adatok értékeléséhez, és lépcsőzetes megközelítést azon anyagok vonatkozó adatainak osszegyűjtéséhez, amelyekhez további vizsgálatokra van szükség, vagy amelyeket korábban egyáltalán nem vizsgáltak. A stratégia magában foglalja továbbá, hogy először validált és elfogadott in vitro vagy ex vivo vizsgálatokat kell végezni, majd meghatározott körülmények esetén a B4. bőrirritációs/bőrkorróziós vizsgálati módszerrel további vizsgálatokat (3) (4) kell lefolytatni.
A LÉPÉSENKÉNTI VIZSGALATI STRATÉGIA ISMERTETÉSE
A vizsgálatoknak a lépcsőzetes vizsgálati stratégia (ábra) keretében történő elvégzése előtt minden rendelkezésre álló információt ki kell értékelni annak meghatározása érdekében, hogy szükség van-e in vivo szemvizsgálatokra. Bár egy-egy paraméter (pl. szélsőséges pH-érték) vizsgálatából is jelentős mennyiségű információ nyerhető ki, az összes rendelkezésre álló információt figyelembe kell venni. A kérdéses anyag vagy szerkezeti analógjai hatásaival kapcsolatos összes vonatkozó adatot értékelni kell az adatok bizonyító erejéről való döntés meghozatalakor, és meg is kell indokolni ezt a döntést. Elsődleges hangsúlyt kell fektetni az anyaggal kapcsolatban rendelkezésre álló humán és állatkísérletes adatokra, ezt követően az in vitro vagy ex vivo vizsgálatok eredményére. Lehetőség szerint kerülni kell korróziós hatású anyagok in vivo vizsgálatát. A vizsgálati stratégia során figyelembe veendő tényezők a következők:
A rendelkezésre álló humán és állatkísérletes adatok értékelése (1. lépés). Első lépésben a rendelkezésre álló humán adatokat, pl. klinikai vagy munkaegészségügyi vizsgálatokat, valamint esettanulmányokat és/vagy állatokban végzett szemvizsgálatok adatait kell kiértékelni, mivel ezek a szemre gyakorolt hatásokkal közvetlenül összefüggő információkat szolgáltatnak. Ezt követően a rendelkezésre álló bőrkorróziós/bőrirritációs humán vizsgálatok és/vagy állatkísérletek adatait kell kiértékelni. Az ismerten szemkorróziós hatású vagy súlyosan szemirritáló anyagokat nem szabad állatok szemébe cseppenteni, ahogyan abőrre korróziós hatású vagy irritáló anyagokat sem; az ilyen anyagokat úgy kell tekinteni, hogy a szemre is korróziós hatásúak és/vagy irritálok. Nem szabad in vivo szemvizsgálatokat végezni olyan anyagokkal sem, amelyek esetében korábbi szemvizsgálatok alapján elegendő bizonyíték van az ilyen hatások hiányára.
A szerkezet-aktivitási összefüggések (SAR) elemzése (2. lépés). Ha vannak, fontolóra kell venni szerkezetileg rokon anyagok vizsgálatát. Ha a szerkezetileg rokon anyagokkal vagy elegyeikkel kapcsolatban elegendő olyan humán és/vagy állatkísérletes adat áll rendelkezésre, amely valószínűsíti a szemkorróziós/szemirritációs potenciált, feltételezhető, hogy a vizsgálandó anyag ugyanilyen válaszreakciókat vált ki. Ilyen esetekben a vizsgálandó anyagot esetleg nem kell megvizsgálni. A lépcsőzetes vizsgálati stratégia értelmében a szerkezetileg rokon anyagok vagy elegyeik vizsgálatából származó negatív adatok nem jelentenek elegendő bizonyítékot arra, hogy az anyag nem korróziós hatású vagy nem irritáló. A bőrre és a szemre gyakorolt hatások vonatkozásában is validált és elfogadott SAR-megközelítéseket kell alkalmazni a korróziós és irritáló potenciál meghatározására.
Fizikai-kémiai tulajdonságok és kémiai reaktivitás (3. lépés). A szélsőséges, például a pH ≤ 2,0 és ≥ 11,5 kémhatású anyagok erőteljes lokális hatást gyakorolhatnak. Ha a szélsőséges pH-érték az alapja annak, hogy egy anyagot korróziós hatásúnak minősítsenek, akkor figyelembe lehet venni az anyag sav/alkáli tartalékát (vagy pufferkapacitását) is (5)(6). Ha a pufferkapacitás alapján valószínűsíthető, hogy az anyag nem szemkorróziós hatású, akkor ennek megerősítésére további vizsgálatokat kell végezni, lehetőleg validált és elfogadott in vitro vagy ex vivo módszerek alkalmazásával (lásd az 5. és 6. lépést).
Más meglévő információk fontolóra vétele (4. lépés). Ebben a fázisban a dermális alkalmazás esetén jelentkező szisztémás toxicitással kapcsolatban rendelkezésre álló összes információt ki kell értékelni. A vizsgálandó anyag akut dermális toxicitását is fontolóra kell venni. Előfordulhat, hogy nem kell a szemben megvizsgálni egy anyagot, ha igazolták, hogy dermális alkalmazás esetén erősen mérgező. Bár nem feltétlenül van összefüggés az akut dermális toxicitás és a szemirritáció/szemkorrózió között, fel kell tételezni, hogy ha egy szer dermálisan alkalmazva erősen mérgező, a szembe cseppentve is nagyon mérgező lesz. Az ilyen adatokat a 2. és a 3. lépés között is figyelembe lehet venni.
In vitro vagy ex vivo vizsgálatok eredményei (5. és 6. lépés). Nem kell állatokon kísérletezni olyan anyagokkal, amelyek validált és kimondottan a szem vagy a bőr korróziójának/irritációjának értékelésére elfogadott módszerekkel végzett in vitro vagy ex vivo vizsgálatokban (7)(8) korróziós vagy súlyos irritáló hatást mutattak. Ilyen esetben fel lehettételezni, hogy az anyag in vivo is hasonlóan súlyos hatásokat vált ki. Ha nem állnak rendelkezésre validált és elfogadott in vitro/ ex vivo vizsgálatok, át lehet ugorni az 5. és a 6. lépést és közvetlenül a 7. lépéshez lépni.
Az anyag in vivo bőrirritáló vagy bőrkorróziós hatásának vizsgálata (7. lépés). Ha a fent felsorolt vizsgálatok adatai alapján nincs elegendő bizonyíték, amellyel meggyőző módon el lehetne végezni az anyag szemirritációs/szemkorróziós potenciáljának az adatok bizonyító erején alapuló elemzését, először az in vivo bőrirritációs/bőrkorróziós potenciált kell a B4. vizsgálati módszer (4) és az ahhoz csatolt függelék (9) segítségével kiértékelni. Ha kimutatható, hogy az anyag bőrkorróziót vagy súlyos bőrirritációt okoz, más következtetést alátámasztó információk hiányában az anyagot korróziós hatású szemirritáló anyagnak kell tekinteni. Ilyen módon tehát nem kell in vivo szemvizsgálatot végezni. Ha az anyag nem bőrkorróziós vagy súlyosan bőrirritáló hatású, in vivo szemvizsgálatot kell végezni.
In vivo vizsgálat nyulakban (8. és 9. lépés). Az in vivo szemvizsgálatokat egyetlen állatot alkalmazó kiindulási vizsgálattal kell kezdeni. Ha ennek eredményei szerint az anyag súlyosan szemirritáló vagy szemkorróziós hatású, nem szabad további vizsgálatokat végezni. Ha a kiindulási vizsgálat nem mutat ki semmilyen korróziós vagy súlyosan irritáló hatást, két további állat alkalmazásával ellenőrző vizsgálatot kell végezni.
HIVATKOZÁSOK
|
(1) |
OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://wwwl.oecd.org/ehs/test/background.htm). |
|
(2) |
OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://wwwl.oecd.org/ehs/Class/HCL6.htm). |
|
(3) |
Worth, A.P. and Fentem J.H. (1999). A General Approach for Evaluating Stepwise Testing Strategies. ATLA 27, 161-177. |
|
(4) |
B4. vizsgálati módszer, Akut toxicitás: bőrirritáció/korrózió. |
|
(5) |
Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19-26. |
|
(6) |
Neun, D.J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227-231. |
|
(7) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, PA., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M. {1998} The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in vitro 12, pp. 48 3-524. |
|
(S) |
B40. vizsgálati módszer, Bőrkorróziós hatás. |
|
(9) |
A B4. vizsgálati módszer függeléke: Lépcsőzetes vizsgálati stratégia bőrirritációhoz és bőrkorrózióhoz. |
Ábra
Vonatkozó vizsgálati és kiértékelési stratégia szemirritáció, illetve szemkorróziós hatás vizsgálatához


B.6. A BŐR ÉRZÉKENNYÉ TÉTELE
1. MÓDSZER
1.1. BEVEZETÉS
Megjegyzések:
Az érzékenységnek, illetve a vizsgálatok azon képességének, hogy felderítik az emberek bőrét potenciálisan érzékennyé tevő anyagokat, nagy jelentősége van a toxicitás közegészségügyi osztályozási rendszerében.
Nincs olyan vizsgálati eljárás, amely a potenciálisan az emberi bőrt érzékennyé tevő összes anyagot megfelelően kimutatja, illetve amely az összes anyag tekintetében megfelelően alkalmazható.
Az anyag fizikai tulajdonságait, beleértve a bőrön való áthatolás képességét és egyéb tényezőket is, meg kell fontolni egy vizsgálat kiválasztása során.
Kétféle vizsgálatot dolgoztak ki tengerimalacokhoz: az egyik a hatásjavító típusú vizsgálat, amelyikben az allergiás állapot esetleges előidézése FCA-ban (Freunds Complete Adjuvant) való feloldás vagy szuszpendálás segítségével történik; a másik a nem hatásjavító típusú vizsgálat.
A hatásjavító típusú vizsgálatok valószínűleg pontosabbak egyes anyagok emberek bőrén érzékenységet előidéző hatásának előrejelzésére, mint azok a módszerek, amelyek nem alkalmazzák az FCA-t, ezért ezek a módszerek előnyben részesülnek.
A tengerimalac legerősebb ingerlési vizsgálata (Guinea-Pig Maximisation Test, GMPT) széles körben alkalmazott hatásjavító típusú vizsgálat. Bár számos másik módszer is alkalmazható egy anyag lehetséges, a bőrt érzékennyé tevő hatásának megállapítására, a GPMT a leginkább javasolt hatásjavító típusú módszer.
Sok vegyianyagosztály esetében a nem hatásjavító vizsgálatok (amelyek közül a leginkább javasolt a Bühler-vizsgálat) az általános vélemény szerint kevésbé érzékenyek.
Egyes esetekben megfelelő indokok állnak fenn a külsőleg történő adagolással végzett Bühler-vizsgálat választásához, a bőrbe befecskendezéses GPMT vizsgálat alkalmazása helyett. A Bühler-vizsgálat alkalmazását tudományosan indokolni kell.
Az alábbi módszer ismerteti a GPMT és a Bühler-vizsgálatot. Más módszerek is alkalmazhatók, ha alkalmazásuk jóváhagyott és tudományosan alátámasztottak.
Amennyiben egy elismert szűrővizsgálat pozitív eredményt ad, a vizsgált anyagot potencionális érzékenyítőként kell megjelölni. További vizsgálatot tengerimalacokkal nem szükséges végezni. Azonban, ha negatív eredményt ad a szűrő vizsgálat, akkor az itt leírt eljárásnak megfelelően kell a vizsgálatot a tengerimalacokkal elvégezni.
Lásd továbbá a B. rész Általános bevezetését.
1.2. FOGALOMMEGHATÁROZÁSOK
Bőr érzékennyé tétele: (allergén kontakt dermatitis) a vizsgált anyagra adott, az immunrendszer által irányított bőrválasz. Embereknél a válasz jellemző tünetei: viszketés, bőrpirosság, ödéma, kiütés, hólyag, vagy ezen jelenségek valamilyen kombinációja. Más fajoknál a reakciók különbözhetnek, és esetleg csak bőrpirosság és ödéma jelentkezik.
Indukciós expozíció: kísérleti eljárás, amikor a kísérlet alanyát kiteszik egy vizsgált anyag hatásának, azzal a céllal, hogy túlérzékeny állapotot idézzenek elő.
Indukciós fázis: legalább egyhetes időtartam az indukciós expozíciót követően, ami alatt a túlérzékeny állapot kialakulhat.
Kiváltó expozíció: kísérleti expozíció, amikor az előzetesen kezelt kísérleti állatot kiteszik a vizsgált anyag hatásának az indukciós időszak után azzal a céllal, hogy meghatározzák túlérzékeny módon reagál-e.
1.3. REFERENCIAANYAGOK
A kísérleti eljárás érzékenységét és megbízhatóságát felmérik minden hat hónapban, olyan anyagok felhasználásával, amelyeknek ismerten gyenge, vagy közepes bőrérzékenyítő hatásuk van.
Helyesen lefolytatott vizsgálat esetén, hatásjavító vizsgálatban legalább 30 százalékban, nem hatásjavító vizsgálat esetén legalább 15 százalékban jelentkeznie kell a gyenge/közepes válasznak.
A következő anyagok alkalmazása javasolt:
|
CAS-szám |
EINECS-szám |
EINECS megnevezés |
Közismert név |
|
101-86-0 |
202-983-3 |
alfa-Hexilfahéjaldehid |
α-hexil-cinnamaldehid |
|
149-30-4 |
205-736-8 |
benzotiazol-2-tiol (2-Merkaptobenztiazol) |
kaptax |
|
94-09-7 |
202-303-5 |
benzokain |
nordkain |
Meghatározott körülmények között megfelelő indoklással olyan más ellenőrző anyagokat is fel lehet használni, amelyek megfelelnek a fenti követelményeknek.
1.4. A VIZSGÁLATI MÓDSZER ALAPELVE
A kísérleti állatokat először alávetik a vizsgált anyag hatásának intradermális befecskendezés és/vagy epidermális adagolás útján (indukciós expozíció). Egy 10–14 napos pihentetési időszak után (indukciós fázis), amely alatt az immunválasz kifejlődhet, a kísérleti állatok megkapják a kiváltó dózist. A kísérleti állatoknak a kiváltó expozícióra adott reakciójának kiterjedtségét és mértékét összehasonlítják a kontrollcsoport tagjainak reakciójával, amelyeket látszólagos indukciónak vetettek alá, és amelyek megkapták a kiváltó expozíciót.
1.5. A VIZSGÁLATI MÓDSZEREK LEÍRÁSA
Ha a vizsgált anyag eltávolítása szükségesnek tűnik, akkor azt víz, vagy valamilyen megfelelő oldószer alkalmazásával hajtható végre, a létrejött reakció, vagy az epidermisz épségének befolyásolása nélkül.
1.5.1. Tengerimalac legerősebb ingerlési vizsgálata (GPMT)
1.5.1.1.
Az egészséges, fiatal felnőtt albinó tengerimalacokat a vizsgálat megkezdése előtt legalább öt napon át a laboratóriumi körülményekhez kell szoktatni. A vizsgálat előtt véletlenszerűen kiválasztják, és a kezelési csoportokba osztják az állatokat. A szőrzet eltávolítását nyírással, borotválással vagy esetleg kémiai szőrtelenítéssel végzik, az alkalmazott vizsgálati eljárástól függően. Gondosan el kell kerülni a bőr felhorzsolását. Az állatok tömegét megmérik a vizsgálat kezdete előtt és a befejezését követően.
1.5.1.2.
1.5.1.2.1. Kísérleti állatok
Kísérleti célokra általánosan használt, laboratóriumban szaporított albinó tengerimalacokat alkalmaznak.
1.5.1.2.2. Az állatok száma és neme
Hím és nőstény egyedek egyaránt használhatók. A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek.
Legalább 10 állatot kell alkalmazni a kezelt csoportban és 5-öt a kontrollcsoportban. Ha kevesebb, mint 20 tengerimalacot használtak a vizsgálati csoportban és kevesebb mint 10-et a kontrollcsoportban, és nem lehet azt a következtetést levonni, hogy a vizsgált anyag érzékenységet okoz, akkor a kísérleti állatok számát legalább 20-ra, a kontrollcsoportban lévő állatok számát legalább 10-re növelve, további kísérlet elvégzése célszerű.
1.5.1.2.3. Adagolási szintek
Az indukciós expozícióhoz felhasznált vizsgált anyag koncentrációja legyen megfelelően elviselhető és a lehető legmagasabb, ami még csak gyenge közepes bőrirritációt okoz. A kiváltó expozíciónál alkalmazott koncentráció a legmagasabb, még nem irritatív dózis legyen. Ha szükséges, akkor a megfelelő koncentrációk két vagy három állat alkalmazásával végzett elővizsgálattal meghatározhatók. Megfontolandó az FCA-val kezelt állatok e célra való felhasználása.
1.5.1.3.
1.5.1.3.1. Indukció
Kezelt csoport, 0-dik nap
Három pár injekció beadása intradermálisan, 0,1 ml térfogattal, a váll környékére, amelyet előzőleg megtisztítottak a szőrzettől, olyan módon, hogy minden párból egy a középvonal egyik, egy a másik oldalára esik.
Injekció 1.1:1 keverék (v/v) FCA/víz, vagy fiziológiás sóoldat.
Injekció 2. a vizsgált anyag, megfelelő vivőanyagban, a kiválasztott koncentrációban.
Injekció 3. a vizsgált anyag a kiválasztott koncentrációban, amelyet FCA/víz vagy, fiziológiás sóoldat 1:1 keverékében (v/v) készítenek el.
A harmadik injekciónál a vízben oldható anyagokat feloldják a vizes fázisban, mielőtt az FCA-val összekevernék. A vizes fázis hozzáadása előtt a zsírban oldódó, illetve az oldhatatlan anyagokat szuszpendálják FCA-ban. A vizsgált anyag végső koncentrációja megegyezik a 2. injekció során alkalmazottal.
A 1. és a 2. injekciót egymáshoz közel adják be a fejhez legközelebbre, míg a harmadikat a vizsgálati terület farok felé eső részén kell beadni.
Kontrollcsoport, 0-dik nap
Három pár injekció beadása 0,1 ml térfogattal, ugyanarra a helyre, mint a kezelés alatt álló állatoknál.
Injekció 1.1:1 keverék (v/v) FCA/víz, vagy fiziológiás sóoldat.
Injekció 2. hígítatlan vivőanyag.
Injekció 3. 50 % m/v vivőanyag-készítmény FCA/víz, vagy fiziológiás sóoldat 1:1 keverékében (v/v).
Kezelt és kontrollcsoport, 5–7. nap
Körülbelül 24 órával a helyi indukciós alkalmazás megkezdése előtt, ha az anyag nem irritatív hatású, a vizsgálati területet rövid szőrzetnyírás és/vagy borotválás után 0,5 ml 10 százalékos nátrium-lauril-szulfát vazelines elegyével kezelik, a helyi irritáció kiváltása érdekében.
Kezelt csoport, 6–8. nap
A vizsgálati felületet ismét megtisztítják a szőrzettől. Egy szűrőpapírt (2 × 4 cm) telítenek a vizsgált anyag alkalmas vivőanyaggal képzett oldatával, azt alkalmazzák a vizsgált felületen, és azzal szigetelő kötés alkalmazásával, 48 órán keresztül szoros érintkezésben tartják. A vivőanyag kiválasztását indokolni kell. Szilárd anyagokat finomra porítják, és a megfelelő vivőanyaggal elegyítik. A folyadékok adott esetben hígítás nélkül is alkalmazhatóak.
Kontrollcsoport, 6–8. nap
A vizsgálati felületet ismét megtisztítják a szőrzettől. A vivőanyagot önmagában viszik fel azonos eljárással a vizsgált felületre, és azzal szigetelő kötés alkalmazásával, 48 órán keresztül szoros érintkezésben tartják.
1.5.1.3.2. Kiváltás
Kezelt és kontrollcsoport, 20–22. nap
A hasszéleket megtisztítják a szőrzettől, mind a kezelt, mind a kontrollcsoport esetében. Egy tapaszt, vagy egy tokot helyeznek fel az állatok hasának egyik szélére, amelyet megtöltenek a vizsgált anyaggal, és ha lehetséges, akkor egy tokot vagy egy tapaszt alkalmaznak, helyeznek fel a másik hasszélen, amelyet megtöltenek a vivőanyaggal. A tapaszokat szigetelő kötés segítségével, 24 órán keresztül szoros érintkezésben tartják a bőrrel.
1.5.1.3.3. Megfigyelés és értékelés: kezelt és kontrollcsoport
|
— |
a tapasz eltávolítása után, hozzávetőleg 21 órával a felületet megtisztítják és rövidre nyírják és/vagy leborotválják, és szőrtelenítik, ha szükséges, |
|
— |
nagyjából 3 órával később (hozzávetőleg 48 órával a kiváltó expozíció kezdete után) megfigyelik és feljegyzik a bőrreakciót a függelékben megadott fokozatoknak megfelelően, |
|
— |
hozzávetőleg 24 órával ez után a megfigyelés után egy második megfigyelést is végeznek (72 órával a kísérlet kezdete után) és ezt is feljegyzik. |
Javasolt a kezelt és a kontrollállatok vakpróbával történő megfigyelése.
Ha szükséges az első kiváltás eredményeinek pontosítása, akkor – szükség esetén – egy második kiváltás (azaz újbóli kiváltás) alkalmazása megfontolandó egy új kontrollcsoporton, hozzávetőleg egy héttel az első után. Újbóli kiváltást az eredeti kontrollcsoporton is végre lehet hajtani.
Minden bőrreakciót és minden észlelhető leletet, beleértve a szisztémás reakciókat, amelyek az indukció és a kiváltás hatására jönnek létre, megfigyelnek és feljegyeznek a Magnusson/Kligman-féle értékelési skála szerint (lásd: Függelék). Egyéb eljárások (pl. kórszövettani vizsgálatok, a bőrön található ráncok mélységének mérése) is elvégezhetők, a kétséges reakciók tisztázása érdekében.
1.5.2. Bühler-vizsgálat
1.5.2.1.
Az egészséges, fiatal felnőtt albinó tengerimalacokat a vizsgálat megkezdése előtt legalább öt napon át a laboratóriumi körülményekhez kell szoktatni. A vizsgálat előtt véletlenszerűen kiválasztják, és a kezelési csoportokba osztják az állatokat. A szőrzet eltávolítását nyírással, borotválással vagy esetleg kémiai szőrtelenítéssel végzik, az alkalmazott vizsgálati eljárástól függően. Gondosan el kell kerülni a bőr felhorzsolását. Az állatok tömegét megmérik a vizsgálat kezdete előtt és a befejezését követően.
1.5.2.2.
1.5.2.2.1. Kísérleti állatok
Kísérleti célokra általánosan használt, laboratóriumban szaporított albinó tengerimalacokat alkalmaznak.
1.5.2.2.2. Az állatok száma és neme
Hím és nőstény egyedek egyaránt használhatók. A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek.
Legalább 20 állatot kell alkalmazni a kezelt csoportban és 10-et a kontrollcsoportban.
1.5.2.2.3. Adagolási szintek
Az indukciós expozícióhoz felhasznált vizsgált anyag koncentrációja legyen a lehető legmagasabb, ami gyenge, ill. nem túl erős bőrirritációt okoz. A kiváltó expozíciónál alkalmazott koncentráció a legmagasabb, még nem irritatív dózis legyen. Ha szükséges, akkor a megfelelő koncentrációk két vagy három állat alkalmazásával végzett előzetes vizsgálattal meghatározhatók.
Vízoldékony vizsgálati anyagoknál célszerű vizet, vagy nem irritatív hatású felszínkezelő oldatot használni vivőanyagként. Más vizsgált anyagokhoz 80 % etanol/víz ajánlott az indukcióhoz, és aceton a kiváltáshoz.
1.5.2.3.
1.5.2.3.1. Indukció
Kezelt csoport, 0-dik nap
Az egyik hasszélt megtisztítják a szőrzettől (rövidre nyírják). Egy tapaszt helyeznek fel, amelyet teljesen telítenek a megfelelő vivőanyagban elegyített vizsgálati anyaggal (a vivőanyag kiválasztását indokolni kell, folyékony vizsgált anyagok felvihetők adott esetben hígítás nélkül is).
A vizsgálati tapaszt felhelyezik a vizsgálat felületre, és egy megfelelő szigetelő tapasszal, vagy tokkal, szigetelő kötés segítségével 6 órán keresztül érintkezésben tartják a kísérleti állat bőrével.
A vizsgálati tapasznak szigetelőnek kell lennie. Egy kerek vagy négyzet alakú vattakötés alkalmas, aminek legalább 4–6 cm2 területűnek kell lennie. A zártság biztosítására megfelelő leszorító eszköz alkalmazása javasolt. Ha pólyát alkalmaznak, akkor bizonyos körülmények között további expozícióra lehet szükség.
Kontrollcsoport, 0-dik nap
Az egyik hasszélt megtisztítják a szőrzettől (rövidre nyírják). A vivőanyagot önmagában helyezik fel, azonos módon, mint ahogy az a kezelt csoportnál történik. A vizsgálati tapaszt felhelyezik a vizsgálat felületre, és egy megfelelő szigetelő tapasszal, vagy tokkal, szigetelő kötés segítségével 6 órán keresztül érintkezésben tartják a kísérleti állat bőrével.
Kezelt és kontrollcsoport, 6–8. és 13–15. nap
A 0-dik napon végzettel megegyező eljárást kell végrehajtani, ugyanazon a vizsgálati felületen (szőrnyírás, ha szükséges) ugyanazon a hasszélen a 6–8. napon és megismételve a 13–15. napon.
1.5.2.3.2. Kiváltás
Kezelt és kontrollcsoport, 27–29. nap
A kezeletlen hasszélt megtisztítják a szőrzettől (rövidre nyírják), mind a kezelt, mind a kontrollcsoport esetében. Egy szigetelőtapaszt vagy egy tokot helyeznek fel a kezelt és kontrollcsoportba tartozó állatok hátsó, kezeletlen hasszélére, amelyet megtöltenek a megfelelő mennyiségű, legnagyobb, de nem irratív koncentrációjú vizsgált anyaggal.
Adott esetben csak vivőanyaggal átitatott szigetelőtapaszt vagy -tokot helyeznek fel a kezelt és a kontrollcsoportba tartozó állatok elülső, kezeletlen hasszélére. A tapaszt vagy tokot megfelelő kötés segítségével, 6 órán keresztül szoros érintkezésben tartják a kísérleti állat bőrével.
1.5.2.3.3. Megfigyelés és értékelés
|
— |
a tapasz eltávolítása után hozzávetőleg 21 órával a felületet megtisztítják a szőrzettől, |
|
— |
hozzávetőleg 3 órával később (körülbelül 30 órával a kiváltó tapasz alkalmazása után) a bőr reakcióját megfigyelik és feljegyzik a függelékben megadott fokozatoknak megfelelően, |
|
— |
hozzávetőleg 24 órával ezen megfigyelés után (nagyjából 54 órával a kiváltó tapasz alkalmazása után) a bőr reakcióját ismét megfigyelik és feljegyzik. |
Javasolt a kezelt és a kontrollállatok vakpróbával történő megfigyelése.
Ha szükséges az első kiváltás eredményeinek pontosítása, akkor – szükség esetén – egy második kiváltás (azaz újbóli kiváltás) alkalmazása megfontolandó egy új kontrollcsoporton, hozzávetőleg egy héttel az első után. Újbóli kiváltást az eredeti kontrollcsoporton is végre lehet hajtani.
Minden bőrreakciót és minden észlelhető leletet, beleértve a szisztémás reakciókat, amelyek az indukció és a kiváltás hatására jönnek létre, megfigyelnek és feljegyeznek a Magnusson/Kligman-féle értékelési skála szerint (lásd: Függelék). Egyéb eljárások (pl. kórszövettani vizsgálatok, a bőrön található ráncok mélységének mérése) is elvégezhetők a kétséges reakciók tisztázása érdekében.
2. ADATOK (GPMT és Bühler vizsgálatok)
Minden adatot táblázat formájában összesítenek, amely tartalmazza minden állat tekintetében az egyes megfigyelési időpontok alkalmával észlelt bőrreakciókat.
3. ZÁRÓVIZSGÁLATI JELENTÉS (GPMT ÉS BÜHLER VIZSGÁLAT)
Ha szűrő próbát végeznek a tengerimalac-vizsgálat előtt (pl. helyi nyirokcsomópróba [LLNA], egérfüldaganat-vizsgálat [MEST]), akkor vizsgálat leírását ill. az irodalmi hivatkozásokat, beleértve az eljárás részleteit is meg kell adni a kapott eredményekkel és a vizsgált és az összehasonlító anyaggal együtt.
Vizsgálati jelentés (GPMT és Bühler vizsgálatok)
A vizsgálati jelentésben – amennyiben lehetséges – az alábbi információknak kell szerepelniük:
|
|
Kísérleti állatok:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények tárgyalása. |
|
|
Összefoglaló megállapítások. |
4. HIVATKOZÁSOK
Ez a módszer megfelel az OECD TG 406-nak.
Függelék
TÁBLÁZAT:
Magnusson/Kligman-féle értékelési skála a kiváltó tapaszos vizsgálatra adott reakciók értelmezéséhez
0 = nincs látható változás
1 = enyhe, vagy foltos börpirosság
2 = mérsékelt és összefüggő bőr pirosság
3 = élénk bőrpirosság és duzzanat”
B.7. ISMÉTELT ADAGOLÁSÚ (28 NAPOS) TOXICITÁSVIZSGÁLAT (ORÁLIS)
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot naponta, szájon át adják be több kísérleti állatcsoportnak, csoportonként más-más adagolási szinten, 28 napon keresztül. A szer beadása időszakában az állatokat a toxicitás jeleinek észlelése érdekében gondosan megfigyelik. Az elpusztult, illetve az elpusztított állatokat felboncolják, illetőleg a vizsgálat befejezése után a túlélő állatokat is elpusztítják és felboncolják.
Ez a módszer nagy hangsúlyt fektet a neurológiai hatásokra mint különleges végpontra, és az állatok gondos klinikai megfigyelésének jelentőségére a lehető legtöbb információ megszerzése érdekében. A módszer segítségével kiszűrhetők a neurotoxikus hatással rendelkező vegyi anyagok, ami aztán további alaposabb, ilyen irányú kutatást indokolhat. Mindezek mellett a módszer adatokkal szolgálhat az immunológiai és a szaporítószervekre gyakorolt toxikus hatásokkal kapcsolatban is.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. Előkészületek
Egészséges, fiatal, felnőtt állatokat véletlenszerűen kezelt, illetve kontrollcsoportokba osztanak be. A ketreceiket olyan módon helyezik el, hogy az elhelyezésükből adódó lehetséges hatásokat minimumra lehessen csökkenteni. Minden állatot megjelölnek az egyedi azonosíthatóság céljából, és a vizsgálat megkezdése előtt legalább öt napig a ketrecükben tartják, a laboratóriumi körülményekhez való hozzászoktatás céljából.
A vizsgált anyagot gyomorszondán át, az állatok táplálékába, vagy az ivóvízbe keverve adják be. A szájon át történő beadás módszerét a tanulmány céljától, valamint a vizsgált anyag fizikai-kémiai tulajdonságaitól függően választják meg.
Szükség esetén a vizsgált anyagot feloldják vagy szuszpendálják alkalmas vivőanyagban, ha csak lehetséges, elsősorban a vizes oldat/szuszpenzió használata javasolt, másodsorban az olajos oldat/emulzió (pl. kukoricaolaj) alkalmazása jöhet számításba, és ezt követheti a másfajta vivőanyagokban való feloldás. Amennyiben nem víz a vivőanyag, akkor a vivőanyag toxikus tulajdonságainak ismertnek kell lenniük. A vizsgált anyag stabilitását a vivőanyagban meghatározzák.
1.4.2. Vizsgálati körülmények
1.4.2.1. A kísérlethez felhasznált állatok
A javasolt faj a patkány, de a rágcsálók más fajai is felhasználhatók. Kísérleti célokra általánosan használt, laboratóriumi törzsekből származó fiatal, egészséges, felnőtt állatokat alkalmaznak. A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek. Az adagolást az elválasztás után a lehető legrövidebb időn belül célszerű elkezdeni, de mindenképpen az állatok 9 hetes kora előtt.
A vizsgálat kezdetén, az állatok súlya lehetőleg csak minimálisan térjen el egymástól, és a nemenkénti átlagos értéktől maximum ± 20 %-kal különbözhet.
Ha az ismételt adagolású (orális) vizsgálatot egy hosszabb távú vizsgálat előzetes tanulmányaként végzik, akkor javasolt mindkét vizsgálathoz ugyanabból a törzsből való, azonos erdetű állatokat használni.
1.4.2.2. Az állatok száma és neme
Minden egyes adagolási szinthez legalább 10 állatot (5 hímet és 5 nőstényt) alkalmaznak. Ha időközi elpusztítást terveznek, akkor a csoport létszámát a kísérlet során elpusztítani szándékozott állatok számával megnövelik.
Ezenkívül egy 10 állatból álló (5 állat nemenként) kísérő csoportot is lehet kezelni a legnagyobb dózissal, 28 napon át. Ezt a csoportot meg lehet figyelni a toxikus hatások reverzibilitása, tartós volta vagy késleltetett előfordulása tekintetében, 14 napon át. Ezzel egyidejűleg egy 10 kontrollállatból álló (5 állat nemenként) ún. kísérő csoport is alkalmaznak.
1.4.2.3. Adagolási szintek
Általánosan 3 kezelt csoportot és egy kontrollcsoportot alkalmaznak. A vizsgált anyaggal való kezeléstől eltekintve a kontrollcsoportban lévő állatokat a kezelt csoportba beosztottakkal azonos bánásmódban részesítik. Ha vivőanyagot használnak a vizsgált anyag beadásához, akkor a kontrollcsoport a vivőanyagot a legnagyobb alkalmazott mennyiségben kapja.
Ha a rendelkezésre álló adatok kiértékelése alapján 1 000 mg/kg testsúly/nap esetén nem várhatóak hatások, akkor határérték-vizsgálatot lehet végezni. Ha nem állnak rendelkezésre megfelelő adatok, akkor dózisbehatároló-vizsgálatot lehet végezni az alkalmazandó dózisok meghatározása céljából.
Az adagolási szintek kiválasztásánál figyelembe veszik a vizsgált, vagy azzal rokon anyagok toxicitására és (toxiko)kinetikájára vonatkozóan rendelkezésre álló adatokat. A legmagasabb dózist úgy választják ki, hogy az toxikus tüneteket keltsen, de ne okozzon halált, vagy súlyos szenvedést a kísérleti állatoknak. Ezután az adagokat fokozatosan csökkentik, azzal a céllal, hogy bemutassák az adagolási szinttől függő hatásokat és a nem észlelhető kedvezőtlen hatásszintet (NOAEL). A csökkenő dózisok beállításához gyakran kétszeres-négyszeres hosszúságú időszakok bizonyulnak optimálisnak, és sokszor tanácsos egy negyedik kezelt csoport alkalmazása, nagyon nagy dózisbeli különbség (pl. több mint 10-szeres) alkalmazásával.
A táplálékkal, vagy ivóvízzel adagolt anyagok esetében fontos biztosítani, hogy a vizsgált anyag beadott mennyisége ne zavarja meg a szokásos táplálékfelvételt és a vízháztartás egyensúlyát. Ha a vizsgált anyagot a táplálékkal együtt adják be, akkor vagy állandó koncentrációban (ppm) keverik be, vagy az állat testsúlyától függő, állandó nagyságú dózisban adagolják. A kiválasztott módszert megjelölik. Gyomorszondán át történő adagolás esetén a dózist minden nap azonos időpontban adják be, mennyiségét a kísérleti állat testsúlyához igazítják, és azonos mennyiséget adnak be minden alkalommal.
Ha az ismételt adagolású vizsgálatot egy hosszú távú vizsgálat előtanulmányaként végzik, akkor a két kísérletben azonos étrendet alkalmaznak.
1.4.2.4. Határérték-vizsgálat
Ha a kísérlet során a legalább 1 000 mg/kg testsúly/nap adagolási szint ill. a táplálékban, vagy ivóvízben beadott anyagmennyiség megfelelő koncentrációja (a testsúly alapján végzett számítások szerint), és az e vizsgálat lefolytatására előírt eljárás betartása mellett a vizsgált anyag nem okoz észlelhető toxikus hatásokat, és ha a szerkezet tekintetében rokon anyagokra vonatkozó adatok alapján nem is várható a toxicitás bekövetkezése, akkor a teljes, három adagolási szintet átfogó tanulmány elvégzése szükségtelennek tekinthető. A határértékvizsgálat alkalmazható, kivéve, ha emberi expozíció ennél nagyobb adagolási szint használatát indokolja.
1.4.2.5. Megfigyelési időszak
A megfigyelési időszak 28 nap. A kísérő csoportban lévő állatokat, amelyekkel további megfigyeléseket terveznek, még legalább 14 napig tartják kezelés nélkül, hogy a toxikus hatások késleltetett előfordulását, vagy megmaradását, vagy visszafordíthatóságát megfigyeljék.
1.4.3. A kísérlet végrehajtása
A kísérleti állatoknak a vizsgált anyagot 28 napon keresztül heti hét napon át, naponta adagolják. Bármely más adagolási rendszer – pl. heti öt nap – célszerűségét indokolni kell. Ha a vizsgált anyagot gyomorszondán át adják be, akkor ennek vagy egy megfelelő intubációs kanülnek a segítségével egyetlen adagban juttatják be a szert. Az egy alkalommal beadható folyadék legnagyobb mennyisége a kísérleti állat méretétől függ. E mennyiség nem haladhatja meg az 1 ml/100 testsúlygrammot, kivéve a vizes oldatok esetében, amikor 2 ml/100 testsúlygramm adható. A magasabb koncentrációértékek esetén rendszerint fokozottabb hatást kiváltó irritatív vagy maró anyagok kivételével, a koncentráció megfelelő beállításával a minimálisra kell csökkenteni a vizsgált anyag mennyiségének változásait, hogy valamennyi adagolási szinten konstans mennyiséget lehessen adagolni a kísérleti állatoknak.
1.4.3.1. Megfigyelések
Általános klinikai megfigyelést végeznek naponta legalább egyszer, lehetőleg minden nap ugyanabban/ugyanazokban az időpont(ok)ban, figyelembe véve az adagolást követően várható hatások érvényesülésének csúcsidőszakát. Feljegyezik a kísérleti állatok klinikai kórállapotát. Naponta legalább kétszer, rendszerint a nap elején és végén, megvizsgálják az összes állatot, hogy nem mutatják-e a morbiditás és mortalitás jeleit. A haldokló állatokat és súlyosan szenvedő, vagy fájdalommal küszködő állatokat az állatvédelmi előírásoknak megfelelően elpusztítják, majd felboncolják.
A vizsgált anyag hatásának való első expozíció előtt legalább egyszer (az egyedek közötti összehasonlítás érdekében), azt követően hetente egyszer az összes állatot részletes klinikai vizsgálatoknak vetik alá. E megfigyeléseket azokon a ketreceken kívül, ahol egyébként tartják őket, lehetőleg egy szabványos karámban, minden alkalommal a nap hasonló időszakában végzik el. A megfigyeléseket gondosan feljegyezik, lehetőleg a vizsgálatokat végző laboratórium által meghatározott pontozásos rendszer segítségével. Lépéseket tesznek annak biztosítása érdekében, hogy a vizsgálati körülmények változását a lehető legkisebbre csökkentsék. A megfigyeléseket lehetőség szerint olyan megfigyelők végzik, akik nem tájékozottak a kezelésről. A feljegyzett észlelések térjenek ki a bőr, a bunda, a szemek és a nyálkahártyák állapotának, a vizelet és ürülék kiválasztása és az autonóm mozgások (pl. könnyezés, szőrzet felborzolódása, pupilla mérete, szokatlan légzési ritmusok) változásaira. A testtartás, a járás bizonytalansága, a kezelésre való reagálás, valamint a rángásos és görcsös mozgások, sztereotip viselkedés (pl. túlzott mosdás, körben rohangálás), vagy bármilyen szokatlan viselkedésmód (pl. öncsonkítás, hátrafelé járás) megfigyelt eseteit is feljegyzik.
A megfigyelés negyedik hetében különböző típusú ingerekre (hallószervi, vizuális, önérzékelési ingerek) mutatott reakciókat vizsgálják, ill. felmérik a fogás/szorítás erejét és a motoros tevékenységeket. A követendő eljárások további részletei a megfelelő szakirodalomban találhatók. (lásd Általános bevezetés B. részét).
A megfigyelés negyedik hetében abba lehet hagyni a szervezet működésével kapcsolatos (funkcionális) megfigyeléseket, ha a tanulmányt azt követő szubkrónikus toxicitásvizsgálat (90 napos) előzetes tanulmányaként végzik. Ebben az esetben a szervezet működésével kapcsolatos megfigyeléseket az utóbbi vizsgálat során végzik el. Másrészt e megfigyelések elvégzése az ismételt adagolású tanulmányban segíti az azt követő szubkrónikus toxicitásvizsgálat során a dózisok kiválasztását.
Kivételes esetekben a szervezet működésével kapcsolatos (funkcionális) megfigyeléseket el lehet hagyni azoknál a csoportoknál is, amelyek olyan mértékű egyéb toxicitási tüneteket mutatnak, amelyek jelentősen befolyásolnák a szervezet működésével kapcsolatos megfigyeléseket.
1.4.3.2. Testsúly és táplálék-/vízfogyasztás
Minden állatot hetente legalább egyszer lemérnek. A táplálék- és vízfogyasztást is hetente legalább egyszer mérik. Amennyiben a vizsgált anyagot az ivóvízzel adják be, akkor az ivóvíz fogyasztását is hetente legalább egyszer lemérik.
1.4.3.3. Hematológiai vizsgálatok
A vizsgálati időszak végén a következő hematológiai vizsgálatokat végzik el: hematokrit, hemoglobin-koncentráció, vörösvértest-szám, teljes és differenciált vérkép, trombocitaszám és a véralvadási idő/képesség mérése.
A vérmintákat egy megnevezett helyről veszik, közvetlenül az állatok elpusztítása előtt, vagy aközben, és azokat megfelelő körülmények között tárolják.
1.4.3.4. Klinikai biokémiai vizsgálatok
A szövetekben jelentkező fontosabb toxikus hatások, és különösen a vesékre és a májra gyakorolt hatás vizsgálata érdekében a klinikai biokémiai értékek meghatározását közvetlenül az állatok elpusztítása előtt vagy annak részeként elvégzett vérvétel során szerzett mintán végzik el (eltekintve a haldokló és/vagy időközben elpusztított egyedektől). A vérvétel előtti éjszaka ajánlatos az állatokat koplaltatni (2). A vérplazma- és vérszérum-meghatározások során vizsgálandó elemek: nátrium, kálium, vércukor, összkoleszterin, karbamid, kreatinin, összprotein és albumin, továbbá több mint két, a májsejti hatásokat jelző enzim (pl. alanin-aminotranszferáz, aszpartát-aminotranszferáz, alkáli foszfatáz, gamma-glutamil-transzpeptidáz és szorbitol dehidrogenáz). További enzimek vizsgálatát (májjal vagy más szervekkel kapcsolatosakat) és az epesavak mérését, amelyek bizonyos körülmények között hasznos információkkal szolgálhatnak, szintén be lehet vonni a vizsgálatok körébe.
Lehetőség van a következő vizeletvizsgálatok végrehajtására a tanulmány utolsó hetében: küllem, mennyiség, ozmolalitás, vagy fajsúly, pH-érték, fehérje, glükóz, és vér/vérsejtek.
Ezeken túlmenően megfontolható az általános szöveti roncsolódás szérummarkereinek vizsgálata. Más vizsgálatokat is elvégeznek, ha a vizsgált anyagnak ismert vagy feltételezhető hatása van a kapcsolódó anyagcsere-folyamatokra; ilyen pl. a kalcium, a foszfát, éhgyomorra mért triglicerid, egyes hormonok, a methemoglobin és a kolinészteráz mérése. Ezeket az értékeket az egyes besorolási osztályokhoz tartozó vegyi anyagokra nézve, vagy eseti alapon célszerű meghatározni.
Rugalmas hozzáállásra van szükség, amely vizsgált fajtól és az adott vizsgált anyag megfigyelt és/vagy várható hatásaitól egyaránt függ.
Ha a rendelkezésre álló kiinduló adatok nem bizonyulnak elegendőnek, akkor megfontolandó a hematológiai és klinikai biokémiai változók meghatározása az adagolás kezdete előtt.
1.4.3.5. Autopszia
A vizsgálatokba bevont összes állatot teljes körű, beható boncolásnak vetik alá, ideértve a következők alapos vizsgálatát: a test külső felszíne, az összes testnyílás, a koponya, a mellüreg és a hasüreg, és ezek tartalma. Az összes állat máját, veséit, mellékveséit, heréit és mellékheréit, csecsemőmirigyét, lépét, agyát és szívét megtisztítják minden rátapadt szövettől, és a boncolást követően a lehető legrövidebb időn belül megmérik azokat a kiszáradás megelőzése érdekében.
Az alábbi testszöveteket mind a szövetek típusának megállapítása, mind pedig a szándékolt későbbi kórszövettani vizsgálatok szempontjából célszerű fixálni: szövetet, amin van makroszkópikus változás, az agyat (jellemző részeket, mint pl. a nagyagy, a kisagy, a nyúltagyi híd), a gerincvelőt, a gyomrot, a vékony- és vastagbelet (beleértve a Payer-plakkot), a májat, a veséket, a mellékveséket, a lépet, a szívet, a csecsemőmirigyet, a pajzsmirigyet, a légcsövet és a tüdőket (utóbbit először megtöltik fixáló szerrel, és úgy merítik alá), az ivarmirigyeket, a járulékos nemi szerveket (pl. a méhet, a prosztatát), a húgyhólyagot, nyirokcsomókat (egyet lehetőleg a vizsgált anyag beadási útvonalába eső, egyet pedig egy attól távoli helyről véve, a szisztémás hatások vizsgálata érdekében), a perifériás idegeket (csípő vagy sípcsont környéki), lehetőleg az izomzathoz közeli helyről véve, egy metszetet a csontvelőből (és/vagy egy, friss csontvelőből felszívott mintát). A klinikai és más jellegű megfigyelések alapján további testszövetek vizsgálata is szükségesnek tűnhet. A fentieken túl megőriznek minden olyan más szervet is, amelyek a vizsgált anyag ismert tulajdonságai alapján valószínűleg célszerveknek tekinthetők.
1.4.3.6. Kórszövettani vizsgálatok
A tartósított szerveket és szöveteket mind a kontrollcsoport, mind a magas dózissal kezelt csoport összes egyede esetében teljes kórszövettani vizsgálatnak vetik alá. Ha a magas dózissal kezelt csoport egyedei esetében a kezelésnek tulajdonítható elváltozások figyelhetők meg, ezt a vizsgálatot az összes többi, különböző dózissal kezelt csoport egyedeire is kiterjesztik.
Minden makroszkópikus sérülést megvizsgálnak.
Ún. kísérő csoport használata esetén az egyedek azon szerveit és szöveteit vizsgálják meg, amelyeknél a kezelt csoportok egyedei esetében elváltozásokat lehetett kimutatni.
2. ADATOK
Minden egyes állattal kapcsolatban rögzítik az adatokat. Ezenfelül az összes adatot táblázat formájában összegezik, a vizsgált állatok minden csoportja tekintetében bemutatva, hogy hány egyeddel indult a vizsgálat, hány állat pusztult el, illetve hányat kellett elpusztítani állatvédelmi okokból a kísérlet során, valamint az elpusztulás és az elpusztítás időpontját; hány egyed mutatta toxicitás jeleit, a megfigyelt toxicitás jeleinek leírását, ideértve bármely toxikus hatás kezdetének idejét, időtartamát és súlyosságát, a sérült állatok számát, a sérülések típusát és az egyes sérüléstípusokat mutató állatok százalékos arányát.
Ahol lehetséges, a nyers adatokat megfelelő, általánosan elfogadott statisztikai módszerrel értékelik ki. A statisztikai módszert már a vizsgálat tervezésének idején kiválasztják.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentés – amennyiben lehetséges – tartalmazza a következő információkat:
|
|
Kísérleti állatok:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények tárgyalása. |
|
|
Összefoglaló megállapítások. |
4. HIVATKOZÁSOK
Ez a módszer megfelel az OECD TG 407-nek.
B.8. ISMÉTELT ADAGOLÁSÚ (28 NAPOS) TOXICITÁS (INHALÁCIÓ)
1. MÓDSZER
1.1. BEVEZETÉS
Hasznos, ha előzetes információk állnak rendelkezésre az anyag részecskeméret-eloszlásáról, gőznyomásáról, olvadáspontjáról, forráspontjáról és robbanásveszélyességéről (ha van ilyen).
Lásd az Általános bevezetés B. részét (A).
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét (B).
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Több kísérleti állatcsoportot naponta, meghatározott ideig kezelnek a vizsgált anyaggal, fokozatosan növelt koncentrációkban, csoportonként egy koncentráció felhasználásával, 28 napon keresztül. Ha vivőanyagot alkalmaznak a vizsgált anyag megfelelő koncentrációjának kialakításához a levegőben, a vivőanyaghoz is kell kontrollcsoportot beállítani. A vizsgálati időszak alatt az állatokat naponta vizsgálni kell a toxicitás tüneteinek észlelése érdekében. A vizsgálat során elpusztult állatokat és a vizsgálat végéig életben maradó állatokat is fel kell boncolni.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
Az állatokat a vizsgálat előtt legalább öt napig a vizsgálat tartási és takarmányozási körülményei között kell tartani. Az egészséges, fiatal állatokat a vizsgálat megkezdése előtt véletlenszerű kiválasztással megfelelő számú csoportba kell osztani. Szükség esetén vivőanyag alkalmazható a vizsgált anyag megfelelő koncentrációjának kialakítására a levegőben. Ha az adagolás megkönnyítésére vivőanyagot vagy más segédanyagot használnak, meg kell bizonyosodni arról, hogy azok nem rendelkeznek toxikus hatással. Ehhez szükség szerint korábbi vizsgálatokból származó adatokat is fel lehet használni.
1.6.2. Vizsgálati körülmények
1.6.2.1. A kísérlethez felhasznált állatok
Ellenjavallat hiányában a patkány az előnyben részesítendő állatfajta. Fiatal, egészséges, ivarérett, kísérleti célokra tenyésztett laboratóriumi állattörzsekből származó állatokat kell alkalmazni.
A vizsgálat kezdetén az állatok súlya lehetőleg csak minimálisan, az átlagértéktől maximum ± 20 %-kal térhet el.
1.6.2.2. Az állatok száma és neme
Valamennyi expozíciós koncentrációszinthez legalább 10 állatot kell felhasználni (öt hímet és öt nőstényt). A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek. Ha időközi elpusztítást terveznek, akkor a létszámot annyival kell megnövelni, ahány állatot a vizsgálat befejezése előtt el szándékoznak pusztítani. Ezenkívül még egy 10 fős (nemenként öt állat) kísérő állatcsoportot is kezelhetnek a legnagyobb adaggal 28 napon át, amelyen a kezelés után 14 nappal megfigyelhetik a toxikus hatás visszafordíthatóságát, elhúzódó vagy késve fellépő voltát. 10 kontrollállatból (nemenként öt állat) álló kísérő csoportot is használni kell.
1.6.2.3. Expozíciós koncentráció
Legalább három koncentrációt és egy kontrollt, illetve vivőanyagkontrollt kell használni (a legnagyobb koncentrációhoz tartozó vivőanyag-koncentrációval), ha vivőanyagot is alkalmaznak. A vizsgált anyaggal történő kezelést kivéve a kontrollcsoportban lévő állatokkal pontosan ugyanolyan módon kell bánni, mint a kezelt csoport állataival. A legnagyobb koncentrációt úgy kell kiválasztani, hogy annak hatására az azzal kezelt csoportban jelentkezzenek a toxicitás jelei, de elhullás lehetőleg ne, vagy csak minimális mértékben jelentkezzen. A legkisebb adagot úgy kell kiválasztani, hogy az ne okozzon toxikus tüneteket. Ha használható becslés áll rendelkezésre az emberi expozícióra vonatkozóan, a legkisebb adagnak ennél nagyobbnak kell lennie. Kedvező esetben a középső adaggal kezelt csoportnál minimális toxikus hatás észlelhető. Ha egynél több közbeeső dózist alkalmaznak, akkor azokat úgy kell kiválasztani, hogy fokozódó toxikus hatást váltsanak ki. Az alacsony és közbeeső dózissal kezelt csoportokban, illetve a kontrollcsoportban az elpusztult állatok száma minimális legyen, hogy az eredmények értelmezhető értékelése lehetséges legyen.
1.6.2.4. Expozíciós idő
Az expozíció napi időtartama hat óra; különleges követelmények esetén ettől eltérő expozíciós idők is alkalmazhatók.
1.6.2.5. Berendezés
A kísérlethez olyan inhalációs berendezést kell használni, amely óránként legalább tizenkét alkalommal légcserét tesz lehetővé a dinamikus légmozgás fenntartása érdekében, azért hogy megfelelő oxigéntartalmat és egyenletesen eloszlatott expozíciós atmoszférát lehessen biztosítani. Ha kamrát használnak, annak kialakítása révén a lehető legkisebbre kell csökkenteni a kísérleti állatok zsúfoltságát, és lehetővé kell tenni a lehető legnagyobb mértékű expozíciót a vizsgált anyag belégzése útján. Általános szabályként a kamrai atmoszféra stabilitásának biztosítása érdekében a kísérleti állatok teljes térfogata nem haladhatja meg a vizsgálati kamra térfogatának 5 %-át. Végezhetők csak az orron és szájon át, vagy csak a fejen át, illetve az egész testen keresztül megvalósuló egyedi expozíciós kamrai vizsgálatok; az első két módszer előnye, hogy minimalizálja a vizsgált anyag egyéb úton történő felvételének lehetőségét.
1.6.2.6. Megfigyelési időszak
A kísérleti állatokat a teljes kezelési és felépülési időszak alatt naponta meg kell figyelni a toxicitás jeleinek észlelése érdekében. Fel kell jegyezni az elpusztulás időpontját és azt az időpontot, amikor a toxikus hatások jelei mutatkozni kezdenek, illetve elmúlnak.
1.6.3. A kísérlet végrehajtása
Az állatokat heti öt-hét alkalommal teszik ki a vizsgált anyag hatásának, 28 napon keresztül. A kísérő csoportokban a nyomon követő megfigyelésekre kiválasztott állatokat további 14 napig kell tartani kezelés nélkül, hogy a toxikus hatás visszafordíthatóságát, illetve elhúzódását ki lehessen mutatni. A vizsgálatokat 22 ± 3 oC állandó hőmérsékleten kell végezni.
Ideális esetben a relatív páratartalmat 30 és 70 % között kell tartani, de bizonyos körülmények között (például aeroszolok vizsgálatakor) ez a gyakorlatban nem mindig kivitelezhető. A kamrán belül kismértékű negatív nyomás (≤ 5 víz-mm) fenntartása megakadályozza a vizsgált anyag kiszivárgását a környező területre. Az állatok nem kaphatnak sem takarmányt, sem vizet az expozíció folyamán.
Megfelelő analitikai koncentrációszabályozási rendszerrel kiegészített, dinamikus inhalációs rendszert kell alkalmazni. A megfelelő inhalációs koncentráció kialakításához javasolt a próbavizsgálat elvégzése. A légáramlást úgy kell beállítani, hogy az egész kamrában azonos expozíciós körülményeket biztosítson. A rendszernek biztosítania kell, hogy a kívánt expozíciós körülmények a lehető leggyorsabban kialakíthatók legyenek.
A következő paramétereket kell mérni, illetve figyelemmel kísérni:
|
a) |
a légáramlás sebessége (folyamatosan); |
|
b) |
az anyag tényleges koncentrációja a belégzési zónában. A napi expozíciós időszak folyamán a koncentráció nem változhat a középérték ± 15 %-át meghaladó mértékben. Aeroszolok esetében azonban ez az érték nem biztos, hogy elérhető, ezért itt szélesebb tartomány is elfogadható. A napi koncentrációt a vizsgálat teljes időtartama alatt lehetőség szerint állandó értéken kell tartani. Aeroszolok esetében hetenként legalább egy részecskeméret-elemzést kell végrehajtani csoportonként; |
|
c) |
hőmérséklet és páratartalom; |
Az expozíció ideje alatt és azt követően az állatokat rendszeresen meg kell figyelni, és a leleteket rögzíteni kell; külön feljegyzést kell vezetni minden egyes állatról. Az összes állatot meg kell vizsgálni naponta, és a toxikus hatások megjelenését, súlyosságát és időtartamát rögzíteni kell. A megfigyeléseknek ki kell terjednie a bőr és a szőrzet, a szem és a nyálkahártya, valamint a légző- és keringési rendszer, a vegetatív és a központi idegrendszeri funkciók, valamint a szomatomotoros aktivitás és viselkedési minta változásaira. Heti gyakorisággal mérni kell az állatok súlyát. Ajánlott a takarmányfogyasztást is hetente mérni. Az állatok rendszeres megfigyelésére azért van szükség, hogy megelőzzük a kísérleti állatok kannibalizmus, szöveti autolízis, illetve rossz elhelyezés következtében történő elhullását. A vizsgálati időszak végeztével a kísérő csoportban lévő állatok kivételével minden túlélő állatot fel kell boncolni. A súlyos és tartós betegség, illetve fájdalom jeleit mutató állatokat el kell eltávolítani, elpusztítani és felboncolni.
A következő vizsgálatokat kell végrehajtani a vizsgálat végén minden állaton, a kontrollállatokat is ideértve:
|
i. |
vérkép, amely magában foglalja legalább a hematokritértéket, a hemoglobin-koncentrációt, a vörösvértestszámot, a teljes- és a fehérvérsejtszámot, a minőségi vérképet, az alvadási képességet, beleértve az alvadási időt; |
|
ii. |
a vér klinikai-kémiai vizsgálata, amely magában foglalja a máj- és vesefunkció legalább egy paraméterét: szérum alanin-aminotranszferáz (korábban glutamát-piruvát-transzaminázként volt ismert), szérum aszpartát-aminotranszferáz (korábban glutamát-oxálecetsav-transzaminázként volt ismert), karbamid-nitrogén, az albumin, a kreatinin, az összbilirubin és szérum összfehérje szintjének mérését. |
További meghatározások, amelyekre a pontos toxicitás értékeléséhez még szükség lehet: kalcium-, foszfor-, klorid-, nátrium-, káliumszint, éhgyomorra mért glükózszint, lipidek, hormonok, sav-bázis egyensúly, methemoglobin- és kolineszterázaktivitás.
Ahol a megfigyelt hatások vizsgálatának kiterjesztéséhez szükséges, további klinikaibiokémiai vizsgálatokat is lehet végezni.
1.6.3.1. Autopszia
A vizsgálatban részt vett minden állatot teljes boncolásnak kell alávetni. A májat, a veséket, a mellékveséket a tüdőt és a heréket a kimetszés után minél előbb, még nedvesen le kell mérni a kiszáradás elkerülése miatt. A szerveket és szöveteket (légzőszervek, máj, vese, lép, herék, mellékvesék, szív és minden jelentős sérülést vagy méretváltozást mutató szerv) alkalmas fixálószerben tartósítani kell az esetleges jövőbeni kórszövettani vizsgálathoz. A tüdőt sértetlenül kell eltávolítani, meg kell mérni a tömegét, és alkalmas fixálószerrel kell kezelni a tüdőszerkezet fennmaradásának biztosítására.
1.6.3.2. Kórszövettani vizsgálat
A nagy adaggal kezelt csoportban és a kontrollcsoportban szövettani vizsgálatot kell végrehajtani a tartósított szerveken és szöveteken. Azon szerveket és szöveteket, amelyek a legnagyobb dózisnál a vizsgált anyagnak tulajdonítható károsodásokat mutatnak, minden alacsonyabb dózissal kezelt csoportban meg kell vizsgálni. Minden, a kísérő csoportba tartozó állatnál szövettani vizsgálatot kell végezni, külön hangsúlyt helyezve azon szervekre és szövetekre, amelyekről megállapítotást nyert, hogy más kezelt csoportokban toxikus hatásokat mutatnak.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, minden egyes vizsgált csoporthoz megadva az állatok számát a vizsgálat kezdetén és az egyes sérüléstípusokat mutató állatok számát.
Minden megfigyelt eredményt megfelelő statisztikai módszerrel ki kell értékelni. Bármilyen elismert statisztikai módszer használható.
3. VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a használt fajt, törzset, az állatok származását, a tartási körülményeket, az étrendet, |
|
— |
a vizsgálati körülményeket. Az expozíciós készülék leírása: beleértve a készülék konstrukcióját, típusát, méreteit, a levegőforrást, az aeroszolok előállítására szolgáló rendszert, a légkondicionálás módszerét, a fáradt levegő kezelését, az állatoknak a vizsgálati kamrában való elhelyezését, ha ilyet alkalmaznak. A hőmérsékletet, a levegő páratartalmát, és adott esetben az aeroszolkoncentráció stabilitását, illetve a részecskeméret-eloszlás meghatározására használt berendezéseket szintén le kell írni. Expozíciós adatok: Ezen adatokat táblázatos formában kell közölni, az átalagértékek és az azoktól való eltérés megjelölésével. A következő adatokra van szükség:
|
|
— |
a toxikus reakciókat nemenként és dózisonként, |
|
— |
az elhullás idejét a vizsgálat során, illetve hogy az állatok megélték-e a vizsgálat végét, |
|
— |
a toxikus, illetve egyéb hatások leírását, a „no-effect level” (NEL) szintet, |
|
— |
az egyes abnormális tünetek megfigyelésének időpontját és a megfigyelést követő változásukat, |
|
— |
a takarmány fogyasztásával és a testsúly változásával kapcsolatos adatokat, |
|
— |
az elvégzett hematológiai vizsgálatokat és azok valamennyi eredményét, |
|
— |
az elvégzett klinikai-kémiai vizsgálatokat és azok valamennyi eredményét, |
|
— |
a boncolási leleteket, |
|
— |
a kórszövettani vizsgálatok eredményének részletes ismertetését, |
|
— |
az eredmények statisztikai feldolgozását, ahol lehetséges, |
|
— |
az eredmények megvitatását, |
|
— |
az eredmények értelmezését. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét (D).
4. SZAKIRODALOM
Lásd az Általános bevezetés B. részét (E).
B.9. ISMÉTELT ADAGOLÁSÚ (28 NAPOS) TOXICITÁS (DERMÁLIS)
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét (A).
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét (B).
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot naponta adagolják a bőrre, fokozatosan növekvő dózisokban több kísérleti állatcsoportnak, 28 napon keresztül. A vizsgálati időszak alatt az állatokat naponta kell vizsgálni a toxicitás tüneteinek észlelése érdekében. A vizsgálat során elpusztult állatokat és a vizsgálat végéig életben maradó állatokat is fel kell boncolni.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
Az állatokat a vizsgálat előtt legalább öt napig a vizsgálat tartási és takarmányozási körülményei között kell tartani. Az egészséges, fiatal állatokat a vizsgálat megkezdése előtt véletlenszerű kiválasztással kezelt és kontrollcsoportokba kell osztani. A vizsgálat megkezdése előtt nem sokkal le kell nyírni a szőrt a törzs háti oldaláról. Borotválni is lehet, de azt a vizsgálat megkezdése előtt megközelítőleg 24 órával kell elvégezni. A vizsgálat során általában ismételt nyírás és borotválás szükséges, rendszerint heti időközönként. A nyírás vagy borotválás során gondosan ügyelni kell arra, hogy a bőr ne sérüljön meg. A testfelület legalább 10 %-át szabaddá kell tenni a vizsgált anyag alkalmazásához. Az állat súlyát is tekintetbe kell venni, amikor a lecsupaszítandó felületről, illetve a kezelt felület nagyságáról döntenek. Ha szilárd anyagot vizsgálnak, amelyet adott esetben porítani is lehet, az anyagot vízzel kellően át kell nedvesíteni, vagy szükség esetén vivőanyagot kell alkalmazni annak biztosítására, hogy az minél jobban tapadjon a bőrhöz. A folyékony vizsgált anyagokat rendszerint hígítás nélkül kell adagolni. Az adagolás heti öt-hét alkalommal történik.
1.6.2. Vizsgálati körülmények
1.6.2.1. A kísérlethez használt állatok
Kifejlett patkány, nyúl vagy tengerimalac használható. Más faj is használható, de azok használatát meg kell indokolni.
A vizsgálat kezdetén az állatok súlya lehetőleg csak minimálisan, az átlagértéktől maximum ± 20 %-kal térhet el.
1.6.2.2. Az állatok száma és neme
Minden adagolási szinthez legalább 10 egészséges bőrű állatot (öt hímet és öt nőstényt) kell felhasználni. A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek. Ha időközi elpusztítást terveznek, akkor a létszámot annyival kell megnövelni, ahány állatot a vizsgálat befejezése előtt el szándékoznak pusztítani. Ezenkívül még egy 10 fős (nemenként öt állat) kísérő állatcsoportot is kezelhetnek a legnagyobb adaggal 28 napon át a toxikus hatás visszafordíthatóságának, elhúzódó vagy késve fellépő voltának megfigyelésére 14 nappal a kezelés után. 10 kontrollállatból (nemenként öt állat) álló kísérő csoportot is használni kell.
1.6.2.3. Dózisok
Legalább három dózist és egy kontrollt kell használni, illetve egy vivőanyag-kontrollt, ha van vivőanyag. Az expozíciós idő legalább napi hat óra legyen. A vizsgált anyagot minden nap hasonló időpontban kell alkalmazni, az alkalmazott mennyiséget pedig meghatározott időközönként (hetente vagy hetente kétszer) hozzá kell igazítani az állatok növekedéséhez, hogy az állatok testsúlyához viszonyított mennyiséget fenn lehessen tartani. A vizsgált anyaggal történő kezelést kivéve a kontrollcsoportban lévő állatokkal pontosan ugyanolyan módon kell bánni, mint a vizsgálati csoportok állataival. Olyan esetekben, amikor az adagolás megkönnyítésére vivőanyagot alkalmaznak, a kontrollcsoportot ugyanúgy kell a vivőanyaggal kezelni, mint a kezelt csoportokat, és ugyanannyi vivőanyagot kell kapniuk, mint a legnagyobb adaggal kezelt csoportnak. A legnagyobb dózist úgy kell kiválasztani, hogy annak hatására az azzal kezelt csoportban jelentkezzenek a toxicitás jelei, de elhullás lehetőleg ne, vagy csak minimális mértékben jelentkezzen. A legkisebb adagot úgy kell kiválasztani, hogy az ne okozzon toxikus tüneteket. Ha használható becslés áll rendelkezésre az emberi expozícióra vonatkozóan, a legkisebb adagnak ennél nagyobbnak kell lennie. Kedvező esetben a középső adaggal kezelt csoportnál minimális toxikus hatás észlelhető. Ha egynél több közbeeső dózist alkalmaznak, akkor azokat úgy kell kiválasztani, hogy fokozódó toxikus hatást váltsanak ki. Az alacsony és közbeeső dózissal kezelt csopotokban, illetve a kontrollcsoportban az elpusztult állatok száma minimális legyen, hogy az eredmények értelmezhető értékelése lehetséges legyen.
Ha a vizsgált anyag alkalmazása súlyos bőrirritációt okoz, a koncentrációt csökkenteni kell, ami az egyéb toxikus hatások mértékének csökkenésével vagy eltűnésével járhat a legnagyobb adaggal kezelt csoportban. Ha a bőr súlyosan károsodott, szükségessé válhat a vizsgálat leállítása és egy új vizsgálat megkezdése kisebb koncentrációk mellett.
1.6.2.4. Határérték-vizsgálat
Ha az előzetes vizsgálat során napi 1 000 mg/testsúlykilogrammal adagolt vizsgált anyag vagy – ha a lehetséges emberi expozíció mértéke ismert – ennél magasabb dózis semmilyen toxikus hatást nem vált ki, a további vizsgálatok szükségtelennek tekinthetők.
1.6.2.5. Megfigyelési időszak
Az összes állatot meg kell vizsgálni naponta a toxikus hatások megjelenésének észlelése érdekében. Fel kell jegyezni az elpusztulás időpontját, valamint azt az időpontot, amikor a toxikus hatás jelei mutatkozni kezdenek, illetve elmúlnak.
1.6.3. A kísérlet végrehajtása
Az állatokat egyesével kell a ketrecekben elhelyezni. Ideális esetben a vizsgált anyagot heti hét alkalommal kell az állatoknak beadni, 28 napon keresztül. A kísérő csoportokban a nyomon követő megfigyelésekre kiválasztott állatokat további 14 napig kell tartani kezelés nélkül, hogy a toxikus hatás visszafordíthatóságát, illetve elhúzódását ki lehessen mutatni. Az expozíció időtartama napi hat óra.
A vizsgált anyagot a testfelület megközelítőleg 10 %-át kitevő felületen egyenletesen elosztva kell felvinni az állat bőrére. Erősen mérgező anyagoknál a felület lehet ennél kisebb, de a felület lehető legnagyobb részét a lehető legvékonyabb és legegyenletesebb bevonattal kell ellátni.
Az expozíció ideje alatt a vizsgált anyagot a bőrrel porózus gézkötéssel és nem irritáló ragtapasszal kell érintkezésben tartani. A vizsgált területet megfelelő módon be kell fedni, azért, hogy megmaradjon rajta a vizsgált anyag és a gézkötés, és az állatok ne nyalhassák le a vizsgált anyagot. Mozgásgátló szerkezeteket lehet használni annak megakadályozására, hogy az állat a vizsgált anyagot lenyelje, de a teljes immobilizáció mint módszer nem javasolt. Alternatív megoldás lehet az ún. nyakörv védelmi eszköz használata.
Az expozíciós idő leteltével a maradék vizsgált anyagot lehetőség szerint el kell távolítani a bőr felületének vízzel vagy más megfelelő módon történő megtisztítása útján.
Az összes állatot meg kell vizsgálni naponta, és a toxikus hatások megjelenését, súlyosságát és időtartamát rögzíteni kell. A megfigyelésnek ki kell terjednie a bőr és a szőrzet, a szem és a nyálkahártya, valamint a légző-, keringési rendszer, a vegetatív és a központi idegrendszer, valamint a szomatomotoros tevékenység és viselkedési minta változásaira. Hetente mérni kell az állatok súlyát. Ajánlott a takarmányfogyasztást is hetente mérni. Az állatok rendszeres megfigyelésére azért van szükség, hogy megelőzzük a kísérleti állatok kannibalizmus, szöveti autolízis, illetve rossz elhelyezés következtében történő elhullását. A vizsgálati időszak végeztével a kísérő csoportban lévő állatok kivételével minden túlélő állatot fel kell boncolni. A súlyos és tartós betegség, illetve fájdalom jeleit mutató állatokat el kell távolítani, kíméletes módon leölni, és felboncolni.
A következő vizsgálatokat kell végrehajtani a vizsgálat végén minden állaton, a kontrollállatokat is ideértve:
|
1) |
vérkép, amely magában foglalja legalább a hematokrit-értéket, a hemoglobin-koncentrációt, a vörösvértestszámot, a teljes és a fehérvérsejtszámot, a minőségi vérképet, az alvadási képességet, beleértve az alvadási időt; |
|
2) |
a vér klinikai-kémiai vizsgálata, amely magában foglalja a máj- és vesefunkció legalább egy paraméterét: szérum alanin-aminotranszferáz (korábban glutamát-piruvát- transzaminázként volt ismert), szérum aszpartát-aminotranszferáz (korábban glutamát- oxálecetsav-transzaminázként volt ismert), karbamid-nitrogén, az albumin, a kreatinin, az össz-bilirubin és szérum összfehérjeszintjének mérését. |
További meghatározások, amelyekre a pontos toxicitás értékeléséhez még szükség lehet: kalcium-, foszfor-, klorid-, nátrium-, káliumszint, éhgyomorra mért glükózszint, lipidek, hormonok, sav-bázis egyensúly, methemoglobin és a kolineszterázaktivitás.
Ahol a megfigyelt hatások vizsgálatának kiterjesztéséhez szükséges, további klinikai-kémiai vizsgálatokat is lehet végezni.
1.6.4. Autopszia
A vizsgálatban részt vett minden állatot teljes boncolásnak kell alávetni. A májat, a veséket, a mellékveséket és a heréket a kimetszés után minél előbb, még nedvesen le kell mérni a kiszáradás elkerülése miatt. A szerveket és szöveteket (máj, vese, lép, herék, mellékvesék, szív és minden jelentős sérülést vagy méretváltozást mutató szerv) alkalmas közegben fixálni kell az esetleges jövőbeni kórszövettani vizsgálathoz.
1.6.5. Kórszövettani vizsgálat
A nagy adaggal kezelt csoportban és a kontrollcsoportban szövettani vizsgálatot kell végrehajtani a tartósított szerveken és szöveteken. Azon szerveket és szöveteket, amelyek a legnagyobb dózisnál vizsgált anyagnak tulajdonítható károsodásokat mutatnak, minden alacsonyabb dózissal kezelt csoportban meg kell vizsgálni. Minden, a kísérő csoportba tartozó állatnál szövettani vizsgálatot kell végezni, külön hangsúlyt helyezve azon szervekre és szövetekre, amelyekről megállapítást nyert, hogy más kezelt csoportokban toxikus hatásokat mutatnak.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, minden egyes vizsgált csoporthoz megadva az állatok számát a vizsgálat kezdetén és az egyes sérüléstípusokat mutató állatok számát.
Minden megfigyelt eredményt megfelelő statisztikai módszerrel ki kell értékelni. Bármilyen elismert statisztikai módszer használható.
3. VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a használt fajt, törzset, az állatok származását, a tartási körülményeket, az étrendet, |
|
— |
a vizsgálati körülményeket (ideértve a kötszer típusát is: zárt vagy nem zárt), |
|
— |
az adagolást (beleértve a vivőanyagot is, ha van) és a koncentrációkat, |
|
— |
azt a szintet, amikor még nincs toxikus hatás (NEL), |
|
— |
toxikus reakcióra vonatkozó adatokat, nemek és adagolás szerinti csoportosításban, |
|
— |
az elpusztulás idejét a vizsgálat során, illetve hogy az állatok megélték-e a vizsgálat végét, |
|
— |
a toxikus és más hatások leírását, |
|
— |
az egyes toxikus tünetek megfigyelésének időpontját és a megfigyelést követő változásukat, |
|
— |
a takarmány fogyasztásával és a testsúly változásával kapcsolatos adatokat, |
|
— |
az elvégzett hematológiai vizsgálatokat és azok valamennyi eredményét, |
|
— |
az elvégzett klinikai-kémiai vizsgálatokat és azok valamennyi eredményét (beleértve az esetleges vizeletelemzés eredményeit is), |
|
— |
a boncolási leleteket, |
|
— |
a kórszövettani vizsgálatok eredményének részletes ismertetését, |
|
— |
az eredmények statisztikai feldolgozását, ahol lehetséges, |
|
— |
az eredmények megvitatását, |
|
— |
az eredmények értelmezését. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét (D).
4. SZAKIRODALOM
Lásd az Általános bevezetés B. részét (E).
B.10. MUTAGENITÁS – KROMOSZÓMA-RENDELLENESSÉGEK IN VITRO VIZSGÁLATA EMLŐSÖKÖN
1. MÓDSZER
E módszer megfelel az OECD TG 473-nak, kromoszóma-rendellenességek in vitro vizsgálata emlősökön (1997).
1.1. BEVEZETÉS
Az in vitro kromoszóma-rendellenesség vizsgálat célja azon anyagok meghatározása, amelyek szerkezeti kromoszóma-rendellenességeket okoznak tenyésztett emlősállatsejtekben (1), (2), (3). A szerkezeti rendellenességek kétféle típusúak lehetnek, kromoszóma vagy kromatid. A mutációt előidéző kémiai anyagok többsége esetében az előidézett rendellenességek kromatid típusúak, de kromoszóma típusúak is előfordulnak. A poliploida gyakoriságának növekedése azt jelentheti, hogy valamely kémiai anyag potenciálisan előidézhet számszerű rendellenességeket. Azonban e módszert nem számszerű rendellenességek mérésére tervezték, és rendesen nem is erre a célra használják. A kromoszómamutációk és ehhez hasonló folyamatok számos emberi genetikai betegség okozói, bizonyítékok szólnak amellett, hogy a kromoszómamutáció és az ehhez hasonló folyamatok, amelyek változásokat okoznak az onkogénekben és a tumor szuppresszor génekben, szerepet játszanak a rák előidézésében emberekben és kísérleti állatokban.
A kromoszóma-rendellenességek in vitro vizsgálata megállapodott sejtvonalakon, sejttörzseken vagy primer sejtkultúrákon végezhető. A vizsgálathoz használt sejteket a tenyészetben a növekedési képesség, a kariotípus stabilitása, a kromoszómaszám, kromoszómák alaki változatossága és a kromoszóma-rendellenességek spontán gyakorisága alapján kell kiválasztani.
Az in vitro végrehajtott vizsgálatok rendszerint szükségessé teszik a metabolikus aktiválás valamilyen külső forrásának használatát. Ezen metabolikus aktiváló rendszer nem tudja teljesen utánozni az emlősállatokban in vivo meglévő körülményeket. Körültekintően kell eljárni, el kell kerülni azon körülményeket, amelyek olyan pozitív eredményekhez vezethetnének, amelyek nem tükrözik a belső mutagenitást, és a pH-érték, ill. ozmolalitás változásából vagy a magas citotoxicitási szintből származhatnak (4) (5).
E vizsgálatot azon anyagok szűrésére lehet használni, amelyek mutációt idézhetnek elő (potenciális mutagének) és rákot okozhatnak (karcinogének) emlősállatok esetében. Az e vizsgálatban pozitív eredményt adó számos vegyület emlősállatok esetében rákkeltő vegyület; azonban nincs tökéletes korreláció az itt ismertetett vizsgálat és a karciogenitás között. A korreláció függ a vizsgált anyag kémiai osztályától és egyre több bizonyíték van arra, hogy léteznek olyan rákkeltő anyagok, amelyeket e vizsgálat nem észlel, mivel úgy tűnik, hogy ezek nem a közvetlen DNS-károsító hatás révén, hanem más mechanizmussal fejtik ki a hatásukat.
Lásd még az Általános bevezetés B részét is.
1.2. FOGALOMMEGHATÁROZÁSOK
Kromatid típusú rendellenesség : szerkezeti kromoszómakárosodás, amely egy kromatid törésében vagy kromatidok közötti törésben és újraegyesítésben nyilvánul meg.
Kromoszóma típusú rendellenesség: szerkezeti kromoszómakárosodás, amely a két kromatid azonos helyén történt törésében, vagy törésben és újraegyesülésben nyilvánul meg.
Endoreduplikáció: az a folyamat, amely során valamely DNS-replikációt követően a sejtmag nem lép be a mitózis fázisába, hanem egy másik S fázist indít. Az eredmény 4, 8, 16, … kromatiddal rendelkező kromoszómák.
Gap: egyetlen kromatid szélességénél kisebb és a kromatidok minimális átrendeződését okozó akromatikus sérülés.
Mitotikus index: a metafázisban lévő sejtek és a sejtpopuláció összes sejtjének aránya; e populáció proliferációja mértékének jelzése.
Számszerű rendellenesség: a kromoszómák számának eltérése a felhasznált sejteket jellemző normál számértéktől.
Poliploida: a haploid kromoszómaszám (n) egész számú, de nem diploid (azaz 3n, 4n, és így tovább) megsokszorosódása.
Szerkezeti rendellenesség: a sejtosztódás metafázisának mikroszkopikus vizsgálata során észlelhető változás a kromoszóma szerkezetében, mint a delíciók és fragmentumok, a kromoszómán belüli vagy a kromoszómák közötti átrendeződés.
1.3. A VIZSGÁLATI MÓDSZER ELVE
Sejttenyészeteket kezelnek a vizsgált anyaggal mind metabolikus aktiválóval, mind anélkül. Meghatározott időközönként metafázis blokkoló szerrel (például Colcemid® vagy kolchicin) kezelik a sejteket, majd az összegyűjtött, megfestett és metafázisban lévő sejteket mikroszkóp segítségével elemezni kell, azért hogy a kromoszóma-rendellenességet megvizsgáljuk.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. Előkészületek
1.4.1.1. Sejtek
Különféle törzsek, sejtvonalak vagy primer sejttenyészetek, emberi sejteket is ideértve, használhatók (például kínai hörcsög fibroblasztok, ember vagy más emlős perifériás limfociták).
1.4.1.2. Tápfolyadékok és tenyésztési körülmények
Megfelelő tápfolyadékokat és inkubációs feltételeket (tenyésztő edények, CO2-koncentráció, hőmérséklet és páratartalom) kell alkalmazni a tenyészetek fenntartására. A megállapodott sejtvonalaknál és -törzseknél rendszeresen ellenőrizni kell a modális kromoszómaszám stabilitását és a mycoplazma fertőzöttségét, nem szabad a mycoplazmát használni, ha fertőzött. Ismerni kell a kiválasztott sejtek normális sejtciklus időtartamát az adott inkubációs feltételek mellett.
1.4.1.3. A tenyészetek előkészítése
Megállapodott sejtvonalak és -törzsek: a sejteket törzstenyészetekből fel kell szaporítani, majd leültetni tápfolyadékba olyan sejtszámmal, hogy a tenyészetek ne érjék el a konfluens állapotot az összegyűjtés ideje előtt, és ezeket 37 oC hőmérsékleten inkubálni kell.
Limfociták: alvadásgátlóval (például heparin) kezelt teljes vért vagy egészséges donoroktól nyert szeparált limfocitákat adnak hozzá mitogéntartalmú táptalajhoz (például phytohaemagglutinin), és 37 oC hőmérsékleten inkubálják.
1.4.1.4. Metabolikus aktiválás
A sejteket exponálni kell a vizsgált anyaggal mind egy megfelelő metabolikus aktiválóval, mind anélkül. A legáltalánosabban használt rendszer a rágcsálóknak enziminducerrel (ilyen például az Aroclor 1254 (6), (7), (8), (9) vagy fenobarbiturát és ß-naftoflavon kombinációjával (10), (11), (12)) kezelt májából elkészített, kofaktor-kiegészítésű posztmitokondriális frakció (S9).
A posztmitokondriális frakciót rendszerint 1–10 térfogatszázalék tartományba eső koncentrációkban kell használni a végtérfogatban. Valamely metabolikus aktiváló rendszer állapota függhet a vizsgált kémiai anyag osztályától. Néhány esetben célszerű a posztmitokondriális frakció egynél több koncentrációjának használata.
Számos fejlesztés, ideértve a specifikus aktiváló enzimeket tartalmazó genetikailag módosított sejtvonalak létrehozását is, biztosíthatja az endogénaktiválás lehetőségét. A használt sejtvonalak kiválasztását tudományosan indokolni kell (például a vizsgált anyag anyagcseréjéhez a citokrom P450-es izoenzim alkalmazásának relevanciáját).
1.4.1.5. Vizsgált anyag/előkészület
A szilárd vizsgált anyagokat a sejtek kezelése előtt fel kell oldani vagy szuszpendálni megfelelő oldószerekben és hígítani kell, ha szükséges. A folyékony vizsgált anyagok közvetlenül hozzáadhatók a vizsgálati rendszerekhez és/vagy hígíthatók kezelés előtt. A vizsgált anyagból friss készítményeket kell alkalmazni, kivéve, ha a stabilitási adatok a tárolás elfogadhatóságát bizonyítják.
1.4.2. Vizsgálati körülmények
1.4.2.1. Oldószer/Vivőanyag
Az oldószernek/vivőanyagnak nem szabad olyan anyagnak lennie, amelyről feltehető, hogy kémiai reakcióba lép a vizsgált anyaggal, és nem befolyásolhatja a sejtek túlélését és az S9-es aktivitást. Jól ismert oldószerektől/vivőanyagoktól eltérő oldószerek/vivőanyagok használatakor azok használatát alá kell támasztani a kompatibilitásukat jelző adatokkal. Ahol csak lehetséges, először valamilyen vizes oldószer/vivőanyag használatát kell megfontolni. Vízben instabil anyagok vizsgálatakor a használt szerves oldószereknek vízmenteseknek kell lenniük. A víz molekuláris szűrő segítségével távolítható el.
1.4.2.2. Expozíciós koncentráció
A legnagyobb koncentráció meghatározásakor figyelembe veendő kritériumok többek között a citotoxicitás, oldhatóság a vizsgálati rendszerben és pH-érték, ill. az ozmolalitás változásai.
A citotoxicitást a fő kísérletben metabolikus aktiválással és anélkül kell meghatározni a sejtintegritás és szaporodás megfelelő mutatóit használva; ilyenek például a konfluencia mértéke, életképes sejtek száma vagy a mitotikus index. Hasznosnak bizonyul, ha a citotoxitást és oldhatóságot előzetes kísérletben meghatározzuk.
Legalább három elemezhető koncentrációt kell használni. Ha az anyag citotoxikus, e koncentrációknak át kell fogniuk egy a maximálistól a már csak kissé vagy az egyáltalán nem toxikusig terjedő tartományt; ez rendszerint azt jelenti, hogy a koncentrációk nem több, mint 2 és √10 közötti tényezővel különböznek egymástól. A sejtek begyűjtéskor a legnagyobb koncentrációnak jelentős csökkenést kell mutatnia a konfluencia mértékében, a sejtszámban vagy mitiotikus indexben (mindegyik nagyobb, mint 50 %). A mitiotikus index a citotoxikus/citosztatikus hatásokat csak közvetett módon jelzi, és függ attól, hogy a kezelés után mennyi idő telt el. Azonban a mitiotikus index elfogadható olyan szuszpenziós kultúráknál, amelyekben a toxicitásmérések nagyon körülményesek és gyakorlatilag megvalósíthatatlanok lehetnek. A sejtciklus kinetikára vonatkozó információk, ilyen például az átlagos generációs idő (average generation time, AGT), kiegészítő információkként használhatók. Azonban az AGT általános átlag, amely nem mindig fedi fel a megkésett szubpopulációk létezését, és még a kismértékű átlagos generációsidő-növekedés is nagyon jelentős késedelmet okozhat a rendellenességek optimális kimutatásának idejében.
A relatíve nem citotoxikus anyagok esetében a maximális vizsgált koncentrációnak 5 μl/ml-nek, 5 mg/ml-nek vagy 0,01 M-nek kell lennie, attól függően, hogy ezen értékek közül melyik a legalacsonyabb.
A relatíve rosszul oldódó anyagok esetében, amelyek a nem oldódó koncentrációnál alacsonyabb koncentrációkban nem toxikusak, a legnagyobb használt adagnak a kezelési időszak végén a végleges médiumban az oldékonyság határa fölötti koncentrációban kell lennie. Néhány esetben (például amikor a toxicitás csak a legalacsonyabb nem oldódó koncentrációnál magasabb koncentrációban jön létre) ajánlatos a vizsgálatot egynél több, látható csapadékot képező koncentrációval végrehajtani. Hasznosnak bizonyulhat az oldékonyságot a kezelés elején és végén meghatározni, mivel az változhat a vizsgálati rendszerben az expozíció időtartama során a sejtek, S9-es szérum stb. jelenléte miatt. A kicsapódás szabad szemmel észlelhető. A kicsapódásnak nem szabad befolyásolnia az értékelést.
1.4.2.3. Negatív és pozitív kontrollok
Minden egyes kísérletben egyidejűleg negatív és pozitív (oldószer és vivőanyag) kontrollt használunk, mindkettőt metabolikus aktiválással és anélkül is. Metabolikus aktiváló alkalmazásakor a pozitív kontrollanyagnak olyannak kell lennie, amely a mutagén reakció kiváltásához aktiválást igényel.
Pozitív kontrollanyagnak ismert klasztogént kell alkalmazni expozíciókoncentrációban annak érdekében, hogy reprodukálható és észlelhető növekedést okozzon (a háttérhez képest), amely a vizsgálati rendszer érzékenységét mutatja.
A pozitív kontrollkoncentrációkat úgy választjuk ki, hogy a hatás egyértelmű legyen, de ne lepleződjön le azonnal a kódolt tárgylemezek identitása a leolvasásnál. A következő pozitív kontrollanyagok jöhetnek szóba:
|
Metabolikus aktiválás |
Anyag |
CAS-szám |
EINECS-szám |
|
Exogén metabolikus aktiválás nélkül |
Metil-metán-szulfonát |
66-27-3 |
200-625-0 |
|
Etil-metán-szulfonát |
62-50-0 |
200-536-7 |
|
|
N-etil-N-nitrozo-karbamid |
759-73-9 |
212-072-2 |
|
|
Mitomycin-C |
50-07-7 |
200-008-6 |
|
|
4-Nitro-kinolin-N-oxid |
56-57-5 |
200-281-1 |
|
|
Exogén metabolikus aktiválással |
Benz[a]pirén |
50-32-8 |
200-028-5 |
|
Ciklofoszfamid Ciklofoszfamid monohidrát |
50-18-0 6055-19-2 |
200-015-4 |
Más megfelelő pozitív kontrollanyagok is használhatók. Adott esetben azon pozitív kontrollanyagok használatát kell megfontolni, amelyek a vizsgált anyaggal azonos osztályba tartoznak.
Minden begyűjtés alkalmával negatív kontrollanyagokat kell használni, amelyeknél csak oldószert és vivőanyagot alkalmaznak a kezelt médiumban, és a kezelésük ugyanolyan módon történik, mint a kezelt tenyészeteké. Ezenkívül nem kezelt kontrollanyagokat is fel kell használni, kivéve, ha léteznek olyan történeti kontrolladatok, amelyek azt mutatják, hogy semmilyen ártalmas, mutagén hatást nem hoz létre a kiválasztott oldószer.
1.4.3. A kísérlet végrehajtása
1.4.3.1. Kezelés a vizsgált anyaggal
A proliferáló sejteket a vizsgált anyaggal kell kezelni valamilyen metabolikus aktiváló rendszer jelenlétében és e nélkül. A limfociták kezelése a mitogén stimuláció után körülbelül 48 órával kezdődik.
|
1.4.3.2. |
Rendszerint két tenyészetet használnak minden egyes koncentrációnál és nagyon ajánlatos negatív (oldószer) kontrolltenyészetek használata. Ahol a történeti adatokból minimális eltérés mutatható ki a két tenyészet között (13), (14), elfogadható egyetlen tenyészet használata minden egyes koncentrációnál. A gázokat vagy illékony anyagokat megfelelő módszerekkel, például légmentesen lezárt tenyésztőedényekben kell vizsgálni (15) (16). |
1.4.3.3. Tenyészetbegyűjtési idő
Az első kísérletben a sejteket 3–6 órára kell kitenni a vizsgált anyag hatásának, mind metabolikus aktiválással, mind anélkül, a kezelés kezdete után körülbelül 1,5 normál sejtciklusidő letelte után kezdődik a feldolgozás (12). Ha e módszer negatív eredményeket ad mind metabolikus aktiválással, mind anélkül, végre kell hajtani egy további kísérletet aktiválás nélkül, folyamatos kezeléssel körülbelül az 1,5 normál sejtciklus-időtartammal egyenlő idő letelte után végrehajtott mintavételig. Bizonyos kémiai anyagok lehet, hogy könnyebben észlelhetők 1,5 ciklusnál hosszabb kezelési/mintavételi idő alkalmazása esetén. A metabolikus aktiválással kapott negatív eredményeket esetenkénti vizsgálattal kell megerősíteni. Azokban az esetekben, ahol a negatív eredmények megerősítését nem tekintjük szükségesnek, közljük ennek indokait.
1.4.3.4. Kromoszómapreparálás
A sejttenyészeteket rendszerint 1-3 órán át kezelni kell Colcemid®-dal vagy kolchicinnel begyűjtésük előtt. Minden sejttenyészetet külön kell begyűjteni és feldolgozni a kromoszómák preparálásához. A kromoszómapreparáció a sejtek hipotonikus oldattal való kezelését, fixálását és megfestését foglalja magában.
1.4.3.5. Elemzés
Minden tárgylemezt, a pozitív és negatív kontrollanyagokét is ideértve, önálló kódolással kell ellátni a mikroszkópos elemzés előtt. Mivel a fixálási eljárások gyakran a metafázisban lévő sejtek egy részének széttörését eredményezik, mely kromoszómaveszteséggel jár, ezért a kiértékelt sejtek tartalmaznak egy centromer számot, amely minden sejttípus esetében megfelel a ± 2 modális értéknek. Legalább 200, jól kiterült metafázist kell értékelni koncentrációnként és kontrollanyagonként, egyenlő arányban elosztva a megkettőzött minták között. E szám csökkenthető, amikor nagyszámú rendellenesség figyelhető meg.
Bár a vizsgálat célja a szerkezeti kromoszóma-rendellenességek észlelése, fontos a poliploidok és az endoreduplikáció feljegyzése is, amennyiben ezek láthatók.
2. ADATOK
2.1. EREDMÉNYEK MEGÁLLAPÍTÁSA
A kísérleti egység a sejt, ebből következően meg kell állapítani a szerkezeti kromoszóma-rendellenességgel rendelkező sejtek arányát. Fel kell sorolni a szerkezeti kromoszóma-rendellenességek különböző típusait arányaikkal és gyakoriságukkal együtt, kísérleti és kontrolltenyészetenként. A gap külön kerül feljegyzésre és szerepel a jelentésben, de rendszerint azokat nem kell beleszámolni a rendellenességek összgyakoriságba.
A rendellenességek megállapítására irányuló fő kísérletekben egyidejűleg minden kezelt és negatív kontrolltenyészet esetében fel kell jegyezni a citotoxicitás meghatározására irányuló tevékenységeket.
Az egyes tenyészetekhez tartozó adatokat meg kell adni. Ezenkívül minden adatot táblázat formájában kell összefoglalni.
Nem követelmény az egyértelműen pozitív reakció igazolása. A nem egyértelmű eredményeket további vizsgálattal kell tisztázni, amelyhez lehetőleg módosítani kell a kísérleti körülményeket. A negatív eredmények megerősítésének szükségességét az 1.4.3.3. tárgyalja. Az ellenőrző (utólagos) kísérleteknél mérlegelni kell a vizsgálati paraméterek módosítását a kiértékelt feltételek tartományának kiterjesztésére. A módosítható vizsgálati paraméterek, többek között, a koncentrációk felosztása és a metabolikus aktiválási körülmények.
2.2. EREDMÉNYEK ÉRTÉKELÉSE ÉS ÉRTELMEZÉSE
Több különböző kritérium létezik valamely pozitív eredmény meghatározására, ilyen például a kromoszóma-rendellenességeket mutató sejtek számának koncentrációval összefüggő vagy reprodukálható növekedése. Először az eredmények biológiai jelentőségét kell fontolóra venni. Statisztikai módszerek használhatók a vizsgálati eredmények értékelésének elősegítésére (3) (13). Valamely pozitív reagálás tekintetében nem szabad, hogy a statisztikai szignifikancia legyen az egyetlen meghatározó tényező.
A poliploid sejtek számának növekedése azt jelezheti, hogy a vizsgált anyag potenciálisan gátolhatja a mitiotikus folyamatokat és számos kromoszóma-rendellenességet idézhet elő. Az endoreduplikált kromoszómákkal rendelkező sejtek számának növekedése azt jelezheti, hogy a vizsgált anyag potenciálisan gátolhatja a sejtciklus végbemenetelét (17), (18).
E rendszerben nem mutagén anyagnak tekintendő az a vizsgált anyag, amelyhez tartozó eredmények nem elégítik ki a fenti kritériumokat.
Bár a legtöbb kísérlet egyértelműen pozitív vagy negatív eredményeket hoz, ritka esetben előfordul, hogy a rendelkezésre álló adatok alapján nem lehet a vizsgált anyag aktivitásával kapcsolatban egyértelműen állást foglalni. Előfordul az is, hogy az eredmények többféleképpen magyarázhatók vagy megkérdőjelezhetők maradhatnak tekintet nélkül arra, hogy hány alkalommal ismételik meg a kísérletet.
Az in vitro kromoszóma-rendellenesség vizsgálatból kapott pozitív eredmények azt jelzik, hogy a vizsgált anyag szerkezeti kromoszóma-rendellenességeket idéz elő emlős szomatikus sejtek tenyészetében. A negatív eredmények azt jelzik, hogy a vizsgálati körülmények mellett a vizsgált anyag nem idéz elő kromoszóma-rendellenességeket emlős szomatikus sejtek tenyészetében.
3. VIZSGÁLATI JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentés tartalmazza a következő információkat:
|
|
Oldószer/vivőanyag:
|
|
|
Sejtek:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények tárgyalása. |
|
|
Összefoglaló megállapítások. |
4. SZAKIRODALOM
|
(1) |
Evans, H. J. (1976) Cytological Methods for Detecting Chemical Mutagens, in: Chemical mutagens, Principles and Methods for their Detection, Vol. 4, Hollaender, A. (ed) Plenum Press, New York and London, pp. 1-29 |
|
(2) |
Ishidate, M. Jr. and Sofuni, T. (1985) The In vitro Chromosomal Aberration Test Using Chinese Hamster Lung (CHL) Fibroblast Cells in Culture, in: Progress in Mutation Research, Vol. 5. Ashby, J. et al., (eds) Elsevier Science Publishers, Amsterdam-New York-Oxford, pp. 427-432 |
|
(3) |
Galloway, S. M., Armstrong, M. J., Reuben, C., Colman, S., Brown, B., Cannon, C., Bloom, A. D., Nakamura, F., Ahmed, M., Duk, S., Rimpo, J., Margolin, G. H., Resnick, M. A., Anderson, G. and Zeiger E. (1978) Chromosome aberration and sister chromatic exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals, Environs, Molec. Mutagen 10 (suppl.10), pp. 1-175 |
|
(4) |
Scott, D., Galloway, S. M., Marshall, R. R., Ishidate, M. Jr., Brusick, D., Ashby, J. and Myhr, B. C. (1991), Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9, Mutation Res, 257, pp. 147-204 |
|
(5) |
Morita, T., Nagaki, T., Fukuda, I. and Okumura, K., (1992), Clastogenicity of low pH to Various Cultured Mammalian Cells, Mutation Res, 268, pp. 297-305 |
|
(6) |
Ames, B. N., McCann, J. and Yamasaki, E. (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test, Mutation Res., 31, pp. 347-364 |
|
(7) |
Maron, D. M. and Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation Res, 113, pp. 173-215 |
|
(8) |
Natarajan, A. T., Tates, A. D., van Buul, P. P. W., Meijers, M. and de Vogel, N. (1976). Cytogenetic Effects of Mutagen/Carcinogens after Activation in a Mircrosomal System In Vitro, I. Induction of Chromosome Aberrations and Sister Chromatid Exchange by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes, Mutation Res., 37, pp. 83-90 |
|
(9) |
Matsuoka, A., Hayashi, M. and Ishidate, M. Jr. (1979), Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In vitro, Mutation Res., 66, pp. 277-290 |
|
(10) |
Elliot, B. M., Combes, R. D., Gatehouse, D. G., Gibson, G. G., Mackay, J. M. and Wolf, R. C. (1992), Report of UK Environmental Mutagen Society Working Party. Alternative to Aroclor 1245-induced S9 in In vitro Genotoxicity Assays, Mutagenesis, 7, pp. 175-177 |
|
(11) |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A. Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems, in: de Serres, F. J. Fouts, J. R. Bend, J. R. and Philpot, R. M. (eds), In vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, pp. 85-88 |
|
(12) |
Galloway, S. M., Aardema, M. J., Ishidate, M. Jr., Ivett, J. L., Kirkland, D. J. Morita, T., Mosesso, P., Sofumi, T. (1994), Report from Working Group on in In vitro Tests for Chromosomal Aberrations, Mutation Res., 312, pp. 241-261 |
|
(13) |
Richardson, C., Williams, D. A., Allen, J. A., Amphlett, G., Chanter, D. O. and Phillips, B. (1989), Analysis of Data from In vitro Cytogenetic Assays, in: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D. J., (cd) Cambridge University Press, Cambridge, pp. 141-154 |
|
(14) |
Soper, K. A. and Galloway, S. M. (1994), Replicate Flasks are not Necessary for In vitro Chromosome Aberration Assays in CHO Cells, Mutation Res., 312, pp. 139-149 |
|
(15) |
Krahn, D. F., Barsky, F. C. and McCooey, K. T. (1982), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, in: Tice, R. R., Costa, D. L., Schaich, K. M. (eds), Genotoxic Effects of Airbone Agents, New York, Plenum, pp. 91-103 |
|
(16) |
Zamora, P. O., Benson, J. M., Li, A. P. and Brooks, A. L. (1983), Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay, Environmental Mutagenesis, 5, pp. 795-801 |
|
(17) |
Locke-Huhle, C. (1983), Endoreduplication in Chinese hamster cells during alpha- radiation induced G2 arrest, Mutation Res. 119, pp. 403-413 |
|
(18) |
Huang, Y., Change, C. and Trosko, J. E. (1983), Aphidicolin-induced endoreduplication in Chinese hamster cells, Cancer Res. 43, pp. 1362-1364 |
B.11. MUTAGENITÁS – KROMOSZÓMA-RENDELLENESSÉGEK IN VIVO VIZSGÁLATA EMLŐSÖKÖN
1. MÓDSZER
E módszer megfelel az OECD TG 475-nek, kromoszóma-rendellenességek in vitro vizsgálata emlősökön (1997).
1.1. BEVEZETÉS
A kromoszóma-rendellenességek in vitro vizsgálatot állatok, rendszerint rágcsálók, csontvelősejtjeiben a vizsgált anyag által előidézett szerkezeti kromoszóma-rendellenességek észlelésére használjuk (1), (2), (3), (4). A szerkezeti kromoszóma-rendellenességek kétféle típusúak lehetnek, kromoszóma vagy kromatid. A poliploida gyakoriságának növekedése bizonyíték lehet arra, hogy valamely kémiai anyag számos rendellenességet idézhet elő. A mutációit előidéző kémiai anyagok többsége esetében az előidézett rendellenességek kromatid típusúak, de kromoszóma típusú rendellenességek is előfordulnak. A kromoszómamutációk és ehhez hasonló folyamatok számos emberi genetikai betegségek okai. Néhány érv a mellett szól, hogy a kromoszómamutációk és ehhez hasonló folyamatok, amelyek változásokat okoznak az onkogénekben és a tumorszuppresszor génekben, szerepet játszanak az emberekben és a kísérleti rendszerekben a rák kialakulásában és megszűnésében.
E vizsgálatban rendszerint rágcsálókat kell használni. A csontvelő a vizsgált fő szövet, mivel ez gazdagon vaszkularizált, és olyan gyorsan szaporodó sejtek populációját tartalmazza, amelyek könnyen izolálhatók és preparálhatók. Más kísérleti állatok és célszövetek nem képezik e módszer tárgyát.
E kromoszómarendellenesség-vizsgálat különösen alkalmas a releváns mutagéntulajdonságok értékelésére annyiban, hogy lehetővé teszi az in vivo metabolizmus, farmakokinetika és DNS-reparációs folyamatok tényezőinek vizsgálatát, bár ezek különbözőek az egyes fajok és különböző szövetek tekintetében. Az in vivo vizsgálat a valamely in vitro vizsgálat által észlelt, mutagén hatás további vizsgálatához is hasznos.
Ha bizonyos jelek utalnak arra, hogy a vizsgált anyag, vagy valamely reaktív metabolitja nem éri el a célszövetet, akkor e vizsgálat nem megfelelő.
Lásd még az Általános bevezetés B. részét is.
1.2. FOGALOMMEGHATÁROZÁSOK
Kromatid típusú rendellenesség: szerkezeti kromoszómakárosodás, amely egy kromatid törésében vagy kromatidok közötti törésben és újraegyesítésben nyilvánul meg.
Kromoszóma típusú rendellenesség: szerkezeti kromoszómakárosodás, amely a két kromatid azonos helyén történt törésében, vagy törésben és újraegyesülésben nyilvánul meg.
Endoreduplikáció: az a folyamat, amely során valamely DNS-replikációt követően a sejtmag nem lép be a mitózis fázisába, hanem egy másik S fázist indít. Az eredmény 4, 8, 16,… kromatiddal rendelkező kromoszómák.
Gap: egyetlen kromatid szélességénél kisebb és a kromatidok minimális átrendeződését okozó akromatikus sérülés.
Számszerű rendellenesség: a kromoszómák számának eltérése a felhasznált sejteket jellemző normál számértéktől.
Poliploida: a haploid kromoszómaszám (n) egész számú, de nem diploid (azaz 3n, 4n, és így tovább) megsokszorosódása.
Szerkezeti rendellenesség: a sejtosztódás metafázisának mikroszkopikus vizsgálata során észlelhető változás a kromoszóma szerkezetében, mint a delíciók és fragmentumok, a kromoszómán belüli vagy a kromoszómák közötti átrendeződés.
1.3. A VIZSGÁLATI MÓDSZER ELVE
Az állatoknak a vizsgált anyagot a megfelelő módon kell adagolni, majd a kezelés után megfelelő időpontokban el kell pusztítani azokat. Az elpusztítás előtt az állatokat metafázis-blokkoló szerrel (például kolchicin vagy Colcemid®) kell kezelni. Ezután kromoszómakészítményeket kell létrehozni a csontvelősejtekből és megfesteni azokat, majd elemezni kell a metafázisú sejteket kromoszóma-rendellenességek megállapítása céljából.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. Előkészületek
1.4.1.1. A kísérlethez felhasznált állatok
Rendszerint patkányokat, egereket és kínai hörcsögöket kell használni, jóllehet bármilyen megfelelő emlős használata lehetséges. Fiatal, egészséges, ivarérett, kísérleti célokra tenyésztett laboratóriumi állattörzsekből származó állatokat kell használni. A vizsgálat kezdetén az állatok súlya lehetőleg csak minimálisan térjen el egymástól, és a nemenkénti átlagos értéktől maximum ± 20 %-kal különbözhet.
1.4.1.2. Tartási és etetési körülmények
Az Általános bevezetés B. részében ismertetett általános körülményeket kell alkalmazni, bár a relatív páratartalom értékének 50–60 % között kell lennie.
1.4.1.3. Az állatok előkészítése
Az egészséges, fiatal, ivarérett állatokat véletlenszerűen kontroll- és kezelt csoportokba osztják. A ketreceket úgy kell elrendezni, hogy minimálisak legyenek az elhelyezés miatti esetleges hatások. Ezt követően az állatokat egyenként azonosítják. Az állatokat legalább öt napig szoktatják a laboratóriumi körülményekhez.
1.4.1.4. Dózisok előkészítése
Az adagolás előtt a szilárd vizsgált anyagokat fel kell oldani vagy szuszpendálni megfelelő oldószerekben vagy vivőanyagokban, és hígítani, ha szükséges. A folyékony vizsgált anyagok közvetlenül adagolhatók vagy hígíthatók. A vizsgált anyagból mindig friss készítményeket kell alkalmazni, kivéve, ha az anyag tárolás során való stabilitása bizonyított.
1.4.2. Vizsgálati körülmények
1.4.2.1. Oldószer/vivőanyag
Az oldószer nem okozhat toxikus hatásokat a kiválasztott dózisok mellett, valamint nem alkalmazható olyan anyag, amely gyaníthatóan kémiai reakcióba lép a vizsgált anyaggal. Jól ismert oldószerektől eltérő oldószerek/vivőanyagok használatakor azok felhasználását alá kell támasztani az összeegyeztethetőségüket bizonyító adatokkal. Amennyiben lehetséges, először valamilyen vizes oldószer/vivőanyag használatát kell megfontolni.
1.4.2.2. Kontrollok
Mindkét nemhez és minden kísérlethez egyidejűleg pozitív és negatív (oldószer/vivőanyag) kontrollokat alkalmaznak. A vizsgált anyaggal való kezelés kivételével a kontrollcsoportokba beosztott állatokat azonos bánásmódban kell részesíteni a kezelt csoportokban lévő állatokkal.
A pozitív kontrolloknak in vivo szerkezeti rendellenességeket kell létrehozni expozíciós koncentrációban úgy, hogy észlelhető legyen a növekedés (a háttérhez viszonyítva). A pozitív kontrollkoncentrációkat úgy választják ki, hogy a hatás egyértelmű legyen, de ne lepleződjön le azonnal a kódolt tárgylemezek identitása a leolvasásnál. Elfogadható, hogy a pozitív kontroll beadása a vizsgált anyag beadási módjától eltérjen, és hogy csak egyetlen mintavételre kerüljön sor. Adott esetben azon pozitív kontrollanyagok használatát kell megfontolni, amelyek a vizsgált anyaggal azonos osztályba tartoznak. A következő pozitív kontrollanyagok jöhetnek szóba:
|
Anyag |
CAS-szám |
EINECS-szám |
|
Etil-metán-szulfonát |
62-50-0 |
200-536-7 |
|
N-etil-N-nitrozo-karbamid |
759-73-9 |
212-072-2 |
|
Mitomicin C |
50-07-7 |
200-008-6 |
|
Ciklofoszfamid Ciklofoszfamid monohidrát |
50-18-0 6055-19-2 |
200-015-4 |
|
Trietilén-melamin |
51-18-3 |
200-083-5 |
Minden mintavétel alkalmával a negatív kontrollcsoportban lévő állatokat is figyelembe kell venni, amelyeknek csupán oldószert adagolunk, egyébként azonos bánásmódban részesítjük azokat a kezelt állatokkal, kivéve ha a történeti kontrolladatokból elfogadható értékek állnak rendelkezésre a kromoszóma-rendellenességeket mutató sejtek állaton belüli sokfélesége és gyakorisága tekintetében. Ha a negatív kontrolloknál csak egyetlen mintavételezést kell alkalmazni, ennek legmegfelelőbb ideje az első mintavételi idő. Ezenkívül használnak nem kezelt kontrollállatokat, kivéve, ha vannak olyan történeti vagy nyilvánosságra hozott kontrolladatok, amelyek azt mutatják, hogy a kiválasztott oldószer/vivőanyag semmilyen ártalmas vagy mutagén hatást nem hoz létre.
1.5. A KÍSÉRLET VÉGREHAJTÁSA
1.5.1. Állatok száma és neme
Minden egyes kezelt és kontrollcsoport nemenként legalább öt elemezhető állatot tartalmaz. Ha a tanulmány végrehajtásakor rendelkezésre állnak olyan adatok azonos fajták és azonos expozíciós mód használata mellett, amelyek azt mutatják, hogy nincsenek jelentős különbségek a nemek között a toxicitás tekintetében, elegendő lesz egyetlen nem vizsgálata. Ahol az emberek esetében az expozíció nemre jellemző lehet, mint például néhány gyógyszeranyag esetében, a vizsgálatot a megfelelő nemű állatokkal kell elvégezni.
1.5.2. Kezelés lefolytatása
A vizsgált anyagot lehetőleg egyetlen alkalommal adják be. A vizsgált anyagot két adagban is be lehet adni, ugyanazon a napon két alkalommal néhány órás időközzel, nagy mennyiségű anyag beadásának megkönnyítésére. Más adagolási módok alkalmazását tudományosan indokolni kell.
Ha a vizsgált anyagot ugyanazon napon adják be, mintákat két különböző időpontban kell venni. Rágcsálók esetében az első mintavétel a kezelést követő 1,5 normál sejtciklusidő letelte után történik (az utóbbi rendszerint 12–18 óra között van). Mivel a vizsgált anyag felvételéhez és anyagcseréjéhez, valamint ennek a sejtciklus-kinetikára gyakorolt hatásának a bekövetkeztéhez szükséges idő befolyásolhatja a kromoszóma-rendellenesség észlelésének optimális időpontját, ezért ajánlott az első mintavétel után 24 órával ismételten mintát venni. Ha olyan adagolási módszert választanak, ahol nem egyetlen nap adagolják a vizsgált anyagot, akkor a mintavételt, az utolsó kezelés után 1,5 normál sejtciklusidő elteltekor kell elvégezni.
Az állatok elpusztítása előtt a hasüregébe adott injekcióval megfelelő adag metafázis-blokkoló szert (például Colcemid® vagy kolchicin) fecskendeznek be. Ezután az állatokból mintákat kell venni megfelelő időközönként. Egerek esetében ez az időköz körülbelül 3–5 óra; kínai hörcsögök esetében körülbelül 4–5 óra. A sejteket ki kell nyerni a csontvelőből, majd elemezni kell azokat a kromoszóma-rendellenességek megállapítása céljából.
1.5.3. Dózisok
Ha dózisbehatároló vizsgálatot végeznek, mert nem állnak rendelkezésre alkalmas adatok, ezt ugyanazon laboratóriumban, ugyanazon fajták, törzsek, nemek és kezelési eljárás alkalmazásával hajtják végre, mint amelyet a fő vizsgálatban alkalmaznak (5). Ha észlelhető toxicitás, akkor három dózist használnak az első mintavételhez. E dózisoknak át kell fogniuk egy a maximálistól a már csak kissé vagy az egyáltalán nem toxikusig terjedő tartományt. A későbbi mintavételnél csak a legmagasabb dózist kell használni. A legmagasabb adag az a dózis, ami olyan egyértelmű toxicitásjeleket vált ki, hogy annál magasabb adagok, azonos adagolás mellett, várhatóan halált okoznak. Specifikus biológiai hatású anyagok alacsony, nem toxikus adagok mellett (ilyenek például a hormonok és mutagének) adott esetben lehetséges, hogy nem felelnek meg az adagolási kritériumoknak, ezért ezeket eseti alapon kell értékelni. A legmagasabb adag olyan dózisként is definiálható, amely létrehoz valamilyen toxicitási jeleket a csontvelőben (például 50 %-nál nagyobb csökkenést a mitiotikus indexben).
1.5.4. Határérték-vizsgálat
Ha egyetlen alkalommal vagy ugyanazon a napon két adagban beadott, legalább 2 000 mg/kg testsúlydózis mellett végrehajtott vizsgálat semmilyen megfigyelhető toxikus hatásokat nem hoz létre, és ha nem várható genotoxicitás szerkezetileg rokon anyagokkal kapcsolatos adatok alapján, akkor nem szükséges a három dózis használatával végrehajtott teljes vizsgálat. Hosszabb időtartamú vizsgálatok esetében a határadag 2 000 mg/kg/testsúly/nap legfeljebb 14 napos kezelés, és 1 000 mg/kg/testsúly/nap 14 napnál hosszabb kezelés esetében. A várt expozíciós hatások az embernél a határérték-vizsgálatban valamilyen magasabb dózis használatának szükségességét jelezhetik.
1.5.5. Adagolás
A vizsgált anyagot rendszerint gyomorszondán át, inkubációs kanül segítségével vagy hasüregbe adott injekció segítségével adják be. Elfogadhatók egyéb expozíciós módok, amennyiben azok indokolhatók. A gyomorszondán át vagy injekcióval egyszerre beadható maximális folyadékmennyiség a kísérleti állat méretétől függ. A térfogata nem haladhatja meg a 2 ml/100g testsúly mennyiséget. Ennél nagyobb mennyiségek használatát meg kell indokolni. Magasabb koncentrációértékek esetén rendszerint fokozottabb hatást kiváltó irritatív vagy maró anyagok kivételével, a koncentráció megfelelő beállításával a minimálisra kell csökkenteni a vizsgált anyag mennyiségének változásait, hogy valamennyi dózisszinten konstans mennyiséget lehessen adagolni a kísérleti állatoknak.
1.5.6. Kromoszómapreparáció
Közvetlenül az elpusztítás után csontvelőt kell venni, és hipotoniás oldatba tenni, majd fixálni. A sejteket ezután tárgylemezekre kell teríteni és megfesteni.
1.5.7. Elemzés
Meg kell határozni a mitiotikus indexet a citotoxicitás megállapításához állatonként legalább 1 000 sejtben, minden kezelt állat (pozitív kontrollállatokat is ideértve) és nem kezelt, negatív kontrollcsoportba beosztott állat esetében.
Legalább 100 metafázist kell elemezni minden egyes állatnál. Ez a szám csökkenthető amennyiben nagyszámú rendellenességet figyelnek meg. Minden tárgylemezt, a pozitív és negatív kontrollokat is ideértve, egymástól függetlenül kezelni kell a mikroszkópos elemzés előtt. Mivel a fixálási eljárások gyakran a metafázisban lévő sejtek egy részének széttörését eredményezik, mely kromoszómaveszteséggel jár, ezért a kiértékelt sejtek tartalmaznak egy centromer számot, amely megfelel a 2n ± 2 értéknek.
2. ADATOK
2.1. EREDMÉNYEK MEGÁLLAPÍTÁSA
Az egyes állatok adatait táblázat formájában kell megadni. A kísérleti egység maga az állat. Minden egyes állat esetében fel kell jegyezni az értékelt sejtek számát, a sejtenkénti rendellenességek számát és a szerkezeti kromoszóma-rendellenességget mutató sejtek arányát. Fel kell sorolni a szerkezeti kromoszóma-rendellenességek különböző típusait a számukkal és gyakoriságukkal együtt kezelt és kontrollcsoportonként. A gap külön kerül feljegyzésre és szerepel a jelentésben, de rendszerint azokat nem kell beleszámolni a rendellenességek összgyakoriságba. Ha semmilyen bizonyíték nincs arra, hogy eltérés van a két nem között a reakciók tekintetében, összevonhatók a nemekhez kapott adatok a statisztikai elemzés céljából.
2.2. EREDMÉNYEK ÉRTÉKELÉSE ÉS ÉRTELMEZÉSE
Különböző kritériumok léteznek a pozitív eredmény meghatározására, ilyen például a kromoszóma-rendellenességekkel rendelkező sejtek számának növekedése a dózis függvényében, vagy egyetlen mintavétel alkalmával egy meghatározott dózis mellett a rendellenességet mutató sejtek számának egyértelmű növekedése. Először meg kell vizsgálni az eredmények biológiai jelentőségét. Statisztikai módszerek használhatók a vizsgálati eredmények értékelésének elősegítésére (6). Valamely pozitív reagálás tekintetében nem szabad, hogy a statisztikai szignifikancia legyen az egyetlen meghatározó tényező. A többféleképpen magyarázható eredményeket további vizsgálattal kell tisztázni, lehetőleg a kísérleti körülményeket módosítva.
A poliploida gyakoriságának növekedése azt jelezheti, hogy a vizsgált anyag számos kromoszóma-rendellenességet idézhet elő. A reduplikáció növekedése azt jelezheti, hogy a vizsgált anyag akadályozza a sejtciklus előrehaladást (7), (8).
E rendszerben nem mutagén anyagnak tekintendő az a vizsgált anyag, amelyhez tartozó eredmények nem elégítik ki a fenti kritériumokat.
Bár a legtöbb kísérlet egyértelműen pozitív vagy negatív eredményeket hoz, ritka esetben előfordul, hogy a rendelkezésre álló adatok alapján nem lehet a vizsgált anyag aktivitásával kapcsolatban egyértelműen állást foglalni. Előfordul az is, hogy az eredmények többféleképpen magyarázhatók vagy megkérdőjelezhetők maradhatnak tekintet nélkül arra, hogy hány alkalommal ismételjük meg a kísérletet.
Az in vivo kromoszómarendellenesség-vizsgálatból kapott pozitív eredmények azt jelzik, hogy valamely anyag kromoszóma-rendellenességeket idéz elő a vizsgált állatfajták csontvelőjében. Negatív eredmények azt jelzik, hogy a vizsgált körülmények mellett a vizsgált anyag nem idéz elő kromoszóma-rendellenességeket a kísérleti állatok csontvelőjében.
Értékeli kell annak a valószínűségét, hogy a vizsgált anyag vagy annak metabolitjai eljutnak-e az általános keringési rendszerbe, illetve kifejezetten a célszövetbe (például szisztematikus toxicitás).
3. VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentés tartalmazza a következő információkat:
|
|
Oldószer/vivőanyag:
|
|
|
Kísérleti állatok:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények tárgyalása. |
|
|
Összefoglaló megállapítások. |
4. HIVATKOZOTT SZAKIRODALOM
|
(1) |
Adler, I. D. (1984), Cytogenetic Tests in Mammals, in: Mutagenicity Testing: a Practical Approach, S. Venitt and J. M. Parry (eds), IRL Press, Oxford, Washington D. C., pp. 275-306 |
|
(2) |
Preston, R. J., Dean, B. J., Galloway, S., Holden, H., McFee, A. F. and Shelby, M. (1987), Mammalian In vitro Cytogenetic Assays: Analysis of Chromosome Aberrations in Bone Marrow Cells, Mutation Res., 189, 157-165 |
|
(3) |
Richold, M., Chandley, A., Ashby, J., Gatehouse, D. G., Bootman, J. and Henderson, L., (1990), In vivo Cytogenetic Assays, in: D. J. Kirkland (ed.) Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, Report, Part I revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115-141 |
|
(4) |
Tice, R. R., Hayashi, M., MacGregor, J. T., Anderson, D., Blakey, D. H., Holden, H. E., Kirsch-Volders, M., Oleson Jr., F. B., Pacchierotti, F., Preston, R. J., Romagna, F., Shimada, H., Sutou, S. and Vannier, B. (1994), Report from the Working Group on the in vivo Mammalian Bone Marrow Chromosomal Aberration Test, Mutation Res., 312, pp. 305-312 |
|
(5) |
Fielder, R. J., Alleen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G., Hodson-Walker, G., Morton, D. B., Kirkland, D. J. andRichold, M. (1992), Report of British Toxicology Society/UK, Environmental Mutagen Society Working Group: Dose setting in In vivo Mutagenicity Assays, Mutagenesis, 7. pp. 313-319 |
|
(6) |
Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson, R., Richold, M., Papworth, D. G. and Savage J. R. K. (1989), Statistical Analysis of In vivo Cytogenetic Assays, in: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report Part III. Statistical Evaluation of Mutagenicity Test Data, D. J. Kirkland (ed.) Cambridge University Press, Cambridge, pp. 184-232 |
|
(7) |
Locke-Huhle, C. (1983), Endoreduplication in Chinese hamster cells during alpha- radiation induced G2 arrest, Mutation Res., 119, pp. 403-413 |
|
(8) |
Huang, Y., Change, C. and Trosko, J. E. (1983), Aphidicolin-induced endoreduplication in Chinese hamster cells, Cancer Res., 43, pp. 1362-1364 |
B.12. MUTAGENITÁS – IN VIVO EMLŐS ERITROCITA MIKRONUKLEUSZ VIZSGÁLAT
1. MÓDSZER
E módszer megfelel az OECD TG 474-nek, emlős eritrocita mikronukleusz vizsgálat (1997).
1.1. BEVEZETÉS
Az emlős mikronukleusz in vivo vizsgálatot rendszerint rágcsálók csontvelőjéből és/vagy perifériás véréből vett mintákban az eritrociták elemzésével annak a károsodásnak az észlelésére használják, amelyet a vizsgált anyag idéz elő a kromoszómákban vagy az eritrociták mitiotikus rendszerében.
A mikronukleusz vizsgálat célja azon anyagok meghatározása, amelyek olyan citogenetikai károsodást okoznak, amelyek eredménye visszamaradó kromoszómatöredékeket vagy egész kromoszómákat tartalmazó mikronukleuszok kialakulása.
Amikor a csontvelői eritroblasztból kifejlődik a polikromáziás eritrocita, a fő sejtmag kilökődik; minden, már létrejött mikronukleusz hátramaradhat a sejtmagmentes citoplazmában. E sejtekben a fő sejtmag hiánya miatt könnyebb a mikronukleusz láthatóvá tétele. A kezelt állatokban a mikronukleált polikromáziás eritrociták gyakoriságának növekedése az előidézett kromoszómakárosodás jelzése.
E vizsgálatban általában rágcsálók csontvelőjét használják, mivel e szövetben termelődnek a polikromáziás eritrociták. A perifériás vérben lévő, mikronukleált polikromáziás eritrociták mérése is elfogadható minden olyan állatfajta esetében, amelynél már bebizonyosodott, hogy a lép képtelen eltávolítani a mikronukleált eritrocitákat vagy amelyek megfelelő érzékenységet mutattak a szerkezeti vagy számszerű kromoszóma-rendellenességeket okozó anyagok észlelésére. A mikronukleusz számos kritérium segítségével ismerhető fel. Ezek közé tartozik a mikronukleuszban egy kinetochor vagy a centromer DNS jelenlétének vagy hiányának megállapítása. A fő végcél a mikronukleusszal rendelkező polikromáziás eritrociták gyakoriságának meghatározása. A kiértékelés végcéljaként a perifériás vérben adott számú érett eritrocita közül azon normokromáziás eritrociták száma is használható, amelyek mikronukleuszt tartalmaznak, amikor az állatokat négy hétig vagy ennél hosszabb ideig kezelik.
Az in vivo emlős mikronukleusz vizsgálat különösen lényeges a mutagén veszély becslésében annyiban, hogy lehetővé teszi az in vivo metabolizmus, farmakokinetikai és DNS-reparációs folyamatok tényezőinek vizsgálatát, bár ezek eltérőek lehetnek a különböző fajok, a különböző szövetek és a különböző genetikai végpontok között. Az in vivo kísérlet is hasznos a valamely in vitro rendszer által észlelt mutagén hatás további vizsgálatához.
Ha bizonyíték van arra, hogy a vizsgált anyag vagy egy reaktív metabolitja nem éri el a célszövetet, akkor nem megfelelő e vizsgálat.
Lásd még az Általános bevezetés B. részét is.
1.2. FOGALOMMEGHATÁROZÁSOK
Centroméra (Kinetokór): valamely kromoszóma olyan régiója (régiói), amelyhez orsórostok kapcsolódnak a sejtosztódás során, lehetővé téve a leánykromoszómák szabályos mozgását a leánysejtek pólusaihoz.
Mikronukleusz: a sejtek fő magjától elkülönült kis járulékos mag, amelyet a mitózis (meiózis) telofázisa során hoznak létre visszamaradó kromoszóma töredékek vagy teljes kromoszómák.
Normokromáziás eritrocita: érett, riboszómákat már nem tartalmazó eritrocita, amely a riboszómákra szelektív festéssel különböztethető meg a polikromáziás eritrocitától.
Polikromáziás eritrocita: éretlen eritrocita, közbenső fejlődési szakaszban, amely még mindig tartalmaz riboszómákat, és ezért a riboszómákra szelektív festésekkel különböztethető meg az érett, normokromáziás eritrocitától.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot megfelelő módon kell az állatoknak adagolni. Csontvelő használatakor az állatokat a kezelés után, megfelelő időpontokban elpusztítják, a csontvelőt kivonják, preparálják, majd megfestik (1), (2), (3), (4), (5), (6), (7). Perifériás vér használatakor a vért a kezelés után megfelelő időpontokban össze kell gyűjteni és kenetpreparátumokat kell létrehozni, majd meg kell festeni azokat (4), (8), (9), (10). Perifériás vérrel végrehajtott vizsgálatok esetén a lehető legkisebb időnek szabad csak eltelnie az utolsó expozíció és a sejtek összegyűjtése között. A preparátumokat elemezni kell a mikronukleusz jelenlétének megállapítása céljából.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. Előkészületek
1.4.1.1. A kísérlethez felhasznált állatok
Csontvelő használatakor egerek vagy patkányok javasoltak, jóllehet bármilyen megfelelő emlősfaj használható. Perifériás vér használatakor az egér az ajánlott kísérleti állat. Azonban bármilyen megfelelő emlősfaj használható, feltéve, hogy az olyan faj, amelyben a lép nem távolítja el a mikronukleusszal rendelkező eritrocitákat, vagy olyan faj, amely megfelelő érzékenységet mutatott az olyan anyagok észlelésére, amelyek szerkezeti vagy számszerű kromoszóma-rendellenességeket okoznak. Fiatal, egészséges, ivarérett, kísérleti célokra tenyésztett laboratóriumi állattörzsekből származó állatokat használunk. A vizsgálat kezdetén az állatok súlya lehetőleg csak minimálisan térjen el egymástól és a nemenkénti átlagos értéktől legfeljebb ± 20 %-kal különbözhet.
1.4.1.2. Tartási és etetési körülmények
Az Általános bevezetés B. részében ismertetett általános körülményeket kell alkalmazni, bár a relatív páratartalom értékének 50–60 % között kell lennie.
1.4.1.3. Az állatok előkészítése
Az egészséges, fiatal, ivarérett állatokat véletlenszerűen kontroll- és kezelt csoportokba kell osztani. Az állatokat egyenként azonosítani kell. Az állatokat legalább öt napig szoktatni kell a laboratóriumi körülményekhez. A ketreceket úgy kell elrendezni, hogy minimálisak legyenek a ketrec elhelyezéséből adódó esetleges hatások.
1.4.1.4. Adagok előkészítése
Az adagolás előtt a szilárd vizsgált anyagokat fel kell oldani vagy szuszpendálni megfelelő oldószerekben vagy vivőanyagokban, és hígítani, ha szükséges. A folyékony vizsgált anyagok közvetlenül adagolhatók vagy hígíthatók. A vizsgált anyagból mindig friss készítményeket kell alkalmazni, kivéve, ha az anyag tárolás során való stabilitása bizonyított.
1.4.2. Vizsgálati körülmények
1.4.2.1. Oldószer/Vivőanyag
Az oldószer nem okozhat toxikus hatásokat a kiválasztott dózisok mellett, valamint nem alkalmazható olyan anyag, amely gyaníthatóan kémiai reakcióba lép a vizsgált anyaggal. Jól ismert oldószerektől eltérő oldószerek/vivőanyagok használatakor azok felhasználását alá kell támasztani a kompatibilitásukat bizonyító adatokkal.
1.4.2.2. Kontrollanyagok
Mindkét nemhez és minden kísérlethez egyidejűleg pozitív és negatív kontrollokat alkalmaznak. A vizsgált anyaggal való kezelés kivételével a kontrollcsoportokba beosztott állatokat azonos bánásmódban kell részesíteni a kezelt csoportokban lévő állatokkal.
A pozitív kontrolloknak in vivo mikronukleuszokat kell létrehozniuk expozíciós koncentrációban úgy, hogy észlelhető legyen a növekedés (a háttérhez viszonyítva). A pozitív kontrollkoncentrációkat úgy választjuk ki, hogy a hatás egyértelmű legyen, de ne lepleződjön le azonnal a kódolt tárgylemezek identitása a leolvasásnál. Elfogadható, hogy a pozitív kontrollanyag beadása a vizsgált anyag beadási módjától eltérő módon történjen, és hogy a mintavételezésre csak egyetlen időpontban kerüljön sor. Adott esetben azon pozitív kontrollanyagok használatát kell megfontolni, amelyek a vizsgált anyaggal azonos osztályba tartoznak. A következő pozitív kontrollanyagok jöhetnek szóba:
|
Anyag |
CAS-szám |
EINECS-szám |
|
Etil-metán-szulfonát |
62-50-0 |
200-536-7 |
|
N-etil-N-nitrozo-karbamid |
759-73-9 |
212-072-2 |
|
Mitomicin C |
50-07-7 |
200-008-6 |
|
Ciklofoszfamid Ciklofoszfamid monohidrát |
50-18-0 6055-19-2 |
200-015-4 |
|
Trietilén-melamin |
51-18-3 |
200-083-5 |
Minden mintavétel alkalmával a negatív kontrollcsoportban lévő állatokat is figyelembe kell venni, amelyeknek csupán oldószert adagolnak, egyébként azonos bánásmódban kell részesíteni azokat a kezelt állatokkal, kivéve, ha a történeti kontrolladatokból elfogadható értékek állnak rendelkezésre a kromoszóma-rendellenességeket mutató sejtek állaton belüli sokfélesége és gyakorisága tekintetében. Ha a negatív kontrolloknál csak egyetlen mintavételezést alkalmaznak, ennek legmegfelelőbb ideje az első mintavételi idő. Ezenkívül használnak nem kezelt kontrollállatokat, kivéve, ha vannak olyan történeti vagy nyilvánosságra hozott kontrolladatok, amelyek azt mutatják, hogy a kiválasztott oldószer/vivőanyag semmilyen ártalmas vagy mutagén hatást nem hoz létre.
Perifériás vér használatakor előkezelt minta is elfogadható párhuzamos negatív kontrollként, de csak a rövid perifériás vérvizsgálatokban (például 1–3 adagos kezelés), amikor az ebből kapott adatok a történeti kontrollanyagok várt tartományában vannak.
1.5. A KÍSÉRLET VÉGREHAJTÁSA
1.5.1. Állatok száma és neme
Minden egyes kezelt és kontrollcsoport nemenként legalább öt elemezhető állatot tartalmaz (11). Ha a tanulmány végrehajtásakor rendelkezésre állnak olyan adatok azonos fajták és azonos expozíciós mód használata mellett, amelyek azt mutatják, hogy nincsenek jelentős különbségek a nemek között a toxicitás tekintetében, elegendő lesz egyetlen nem vizsgálata. Ahol az emberek esetében az expozíció nemre jellemző lehet, mint például néhány gyógyszeranyag esetében, a vizsgálatot a megfelelő nemű állatokkal kell elvégezni.
1.5.2. A kezelés lefolytatása
Semmilyen standard kezelési menetrend (azaz egy, kettő vagy több kezelés 24 órás időközönként) nem javasolható. A hosszabb adagolás alkalmával véletlenszerűen vett minták mindaddig elfogadhatók, amíg bebizonyosodik annak pozitív hatása erre a vizsgálatra, vagy negatív vizsgálat esetében mindaddig, amíg bebizonyosodik, hogy létrejött toxicitás vagy a határadagot használtak, és az adagolás a mintavétel idejéig folytatódott. A vizsgált anyagot két adagban is be lehet adni, ugyanazon a napon két alkalommal néhány órás időközzel, a nagy mennyiségű anyag beadásának megkönnyítésére.
A vizsgálat kétféle módon hajtható végre:
|
a) |
az állatokat egyszer kell kezelni a vizsgált anyaggal. Legalább kétszer kell csontvelőmintákat venni, a kezelés után 24 óránál nem korábban, de a kezelés utáni 48 órát nem meghaladó időpontban, a minták közötti megfelelő időközökkel. A kezelés utáni 24 óránál korábbi mintavételt meg kell indokolni. Legalább kétszer kell perifériás vérmintákat venni, a kezelés utáni 36 óránál nem korábban kezdve, az első mintát követő megfelelő időközökkel, de 72 órát nem meghaladó időpontban. Ha valamely mintavétel alkalmával pozitív reakciót tapasztalunk, akkor nincs szükség további mintavételre; |
|
b) |
ha naponként kettő vagy több alkalommal adagoljuk a vizsgált anyagot (például kettő vagy több kezelés 24 órás időközönként), egyszer kell mintákat gyűjteni az utolsó kezelést követő 18 és 24 óra között a csontvelő, és egyszer az utolsó kezelést követő 36 és 48 óra között a perifériás vér vizsgálata esetében (12). |
Ezenkívül alkalmazhatók más mintavételi idők is, amikor ez az adott esetben megfelelő.
1.5.3. Dózisok
Ha dózisbehatároló vizsgálatot végeztek, mert nem állnak rendelkezésre alkalmas adatok, ezt ugyanabban a laboratóriumban, ugyanazon fajták, törzs, nem és kezelési eljárás alkalmazásával hajtják végre, mint amelyet a fő vizsgálatban alkalmaznak (13). Ha észlelhető toxicitás, három dózist kell használni az első mintavételhez. E dózisoknak át kell fogniuk egy a maximálistól a már csak kissé vagy az egyáltalán nem toxikusig terjedő tartományt. A későbbi mintavételnél csak a legmagasabb adagot használják. A legmagasabb adag az a dózis, amely olyan egyértelmű toxicitási jeleket vált ki, hogy annál magasabb adagok, azonos adagolás mellett, várhatóan halált okoznak. Specifikus biológiai hatású anyagok alacsony, nem toxikus adagok mellett (ilyenek például a hormonok és mutagének) adott esetben lehetséges, hogy nem felelnek meg az adagolási kritériumoknak, ezért ezeket eseti alapon kell értékelni. A legmagasabb adag olyan adagként is definiálható, amely létrehoz valamilyen toxicitási jeleket (például a csontvelőben vagy a perifériás vérben az összes eritrocita között az éretlen eritrociták arányának csökkenése).
1.5.4. Határérték-vizsgálat
Ha egyetlen alkalommal vagy ugyanazon a napon két adagban beadott, legalább 2 000 mg/kg testsúlydózis mellett végrehajtott vizsgálat semmilyen megfigyelhető toxikus hatásokat nem hoz létre, és ha nem várható genotoxicitás szerkezetileg rokon anyagokkal kapcsolatos adatok alapján, akkor nem szükséges a három dózis használatával végrehajtott teljes vizsgálat. Hosszabb időtartamú vizsgálatok esetében a határadag 2 000 mg/kg/testsúly/nap legfeljebb 14 napos kezelés, és 1 000 mg/kg/testsúly/nap 14 napnál hosszabb kezelés esetében. A várt expozíciós hatások az embernél a határérték-vizsgálatban valamilyen magasabb dózis használatának szükségességét jelezhetik.
1.5.5. Adagolás
A vizsgált anyagot rendszerint gyomorszondán át inkubációs kanül segítségével, vagy hasüregbe adott injekció segítségével adják be. Elfogadhatók egyéb expozíciós módok, amennyiben azok indokolhatók. A gyomorszondán át vagy injekcióval egyszerre beadható maximális folyadékmennyiség a kísérleti állat méretétől függ. A térfogata nem haladhatja meg a 2 ml/l00 g testsúly mennyiséget. Ennél nagyobb mennyiségek használatát meg kell indokolni. A magasabb koncentrációértékek esetén rendszerint fokozottabb hatást kiváltó irritatív vagy maró anyagok kivételével, a koncentráció megfelelő beállításával a minimálisra kell csökkenteni a vizsgált anyag mennyiségének változásait, hogy valamennyi dózisszinten konstans mennyiséget lehessen adagolni a kísérleti állatoknak.
1.5.6. Csontvelő/vér preparálása
A csontvelősejteket rendszerint a femurokból vagy tibiákból kell venni közvetlenül az állatok elpusztítása után. A sejteket el kell távolítani a combcsontokból vagy sípcsontokból, preparálni kell azokat és megfesteni már ismert módszerek segítségével. A perifériás vért a farokvénából vagy más megfelelő érből kell venni. A vérsejteket azonnal, szupravitálisan meg kell festeni (8) (9) (10) vagy kenetpreparátumokat kell létrehozni, és ezután kell elvégezni a festést. A DNS-specifikus festékek (például akridinnarancs (14) vagy Hoechst 33258 plusz pironin-Y (15)) használata kiküszöbölhet néhányat a DNS-re nem jellemző festőanyag használatával mesterségesen előidézett változás közül. Ez az előny nem zárja eleve ki a hagyományos festékek (például Giemsa) használatát. További rendszerek (például cellulózoszlopok a magvas sejtek eltávolítására (16)) is használhatók, feltéve, hogy már bebizonyosodott e rendszerekről, hogy megfelelően működnek a laboratóriumban mikronukleált sejtek preparációjánál.
1.5.7. Elemzés
Minden egyes állatnál meg kell határozni az összes (éretlen + érett) eritrocitához viszonyítottan az éretlenek arányát, csontvelő esetében összesen legalább 200 eritrocita és perifériás vér esetében legalább 1 000 eritrocita megszámlálásával (17). Minden tárgylemezt, a pozitív és negatív kontrollanyagokét is, kódolni kell a mikroszkópos elemzés előtt. Allatonként legalább 2 000 éretlen mikronukleuszt kell kiértékelni a mikronukleusszal rendelkező éretlen eritrociták előfordulásának megállapítása céljából. További információk kaphatók az érett eritrociták értékelésével abból a szempontból, hogy tartalmaznak-e mikronukleuszt. A tárgylemezek elemzésekor az összes eritrocitát tekintve, az éretlen eritrociták arányának nem szabad a kontrollérték 20 %-ánál kisebbnek lennie. Amikor az állatokat folyamatosan kezeljük négy hétig vagy ennél hosszabb ideig, állatonként legalább 2 000 érett eritrocita is kiértékelhető a mikronukleusz jelenlétének megállapítása céljából. Automatizált elemző rendszerek (képanalizáló és áramlási citometria sejtszuszpenziókra) a kézi értékelés elfogadható alternatívái, ha alkalmazásuk megfelelően indokolt és e rendszerek érvényesítettek.
2. ADATOK
2.1. EREDMÉNYEK KEZELÉSE
Az egyes állatok adatait táblázat formájában kell összefoglalni. A kísérleti egység maga az állat. Minden egyes állat esetében külön kell feljegyezni a kiértékelt éretlen eritrociták számát, a mikronukleusszal rendelkező éretlen eritrociták számát és az összes eritrociták közül az éretlenek számát. Amikor az állatokat folyamatosan négy hétig vagy ennél hosszabb ideig kezeljük, az érett eritrocitákra vonatkozó adatokat is meg kell adni, ha azok megállapításra kerültek. Minden egyes állat tekintetében meg kell adni az összes eritrociták között az éretlenek arányát és, adott esetben, a mikronukleusszal rendelkező eritrociták arányát. Ha semmilyen bizonyíték nincs arra, hogy eltérés van a két nem között a reakciók tekintetében, összevonhatók a nemekhez kapott adatok a statisztikai elemzés céljából.
2.2. EREDMÉNYEK ÉRTÉKELÉSE ÉS ÉRTELMEZÉSE
Különböző kritériumok léteznek a pozitív eredmény meghatározására, ilyen például a mikronukleusszal rendelkező sejtek számának növekedése a dózis függvényében vagy egyetlen mintavétel alkalmával egy meghatározott dózis mellett a mikronukleusszal rendelkező sejtek számának egyértelmű növekedése. Először meg kell vizsgálni az eredmények biológiai jelentőségét. Statisztikai módszerek használhatók a vizsgálati eredmények értékelésének elősegítésére (18) (19). Valamely pozitív reagálás tekintetében nem szabad, hogy a statisztikai szignifikancia legyen az egyetlen meghatározó tényező. A többféleképpen magyarázható eredményeket további vizsgálattal kell tisztázni, lehetőleg a kísérleti körülményeket módosítva.
E rendszerben nem mutagén anyagnak tekintendő az a vizsgált anyag, amelyhez tartozó eredmények nem elégítik ki a fenti kritériumokat.
Bár a legtöbb kísérlet egyértelműen pozitív vagy negatív eredményeket hoz, ritka esetben előfordul, hogy a rendelkezésre álló adatok alapján nem lehet a vizsgált anyag aktivitásával kapcsolatban egyértelműen állást foglalni. Előfordul az is, hogy az eredmények többféleképpen magyarázhatók vagy megkérdőjelezhetők maradhatnak, tekintet nélkül arra, hogy hány alkalommal ismétlik meg a kísérletet.
A mikronukleusz vizsgálat pozitív eredményei azt jelzik, hogy a vizsgált anyag létrehoz olyan mikronukleuszt, amely a vizsgált fajok eritrocitáiban a mitiotikus rendszer károsodásának vagy kromoszómakárosodásnak az eredménye. A negatív eredmények azt jelzik, hogy a vizsgálati körülmények között a vizsgált anyag nem indukál mikronukleuszokat a vizsgált fajok éretlen eritrocitáiban.
Értékelni kell annak a valószínűségét, hogy a vizsgált anyag vagy annak metabolitjai eljutnak-e az általános keringési rendszerbe, ill. kifejezetten a célszövetbe (például szisztematikus toxicitás).
3. VIZSGÁLATI JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentés tartalmazza a következő információkat:
|
|
Oldószer/vivőanyag:
|
|
|
Kísérleti állatok:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények tárgyalása. |
|
|
Összefoglaló megállapítások |
4. SZAKIRODALOM
|
(1) |
Heddle, J. A. (1973), A Rapid In vivo Test for Chromosomal Damage, Mutation Res., 18, pp. 187-190 |
|
(2) |
Schmid, W. (1975), The Micronucleus Test, Mutation Res., 31, pp. 9-15 |
|
(3) |
Heddle, J. A., Salamone, M. F., Hite, M., Kirkhart, B., Mavournin, K., MacGregor, J. G. and Newell, G. W. (1983), The Induction of Micronuclei as a Measure of Genotoxicity, Mutation Res., 123, pp. 61-118 |
|
(4) |
Mavournin, K. H., Blakey, D. H., Cimino, M. C, Salamone, M. F. and Heddle, J. A. (1990), The In vivo Micronucleus Assay in Mammalian Bone Marrow and Peripheral Blood. A report of the U. S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 239, pp. 29-80 |
|
(5) |
MacGregor, J. T., Schlegel, R., Choy, W. N. and Wehr, C. M. (1983), Micronuclei in Circulating Erythrocytes: A Rapid Screen for Chromosomal Damage During Routine Toxicity Testing in Mice, in: Developments in Science and Practice of Toxicology, ed. A. W. Hayes, R. C. Schnell and T. S. Miya. Elsevier, Amsterdam, pp. 555-558 |
|
(6) |
MacGregor, J. T., Heddle, J. A. Hite, M., Margolin, G. H., Ramel, C, Salamone, M. F., Tice, R. R., and Wild, D. (1987), Guidelines for the Conduct of Micronucleus Assays in Mammalian Bone Marrow Erythrocytes, Mutation Res., 189, pp. 103-112 |
|
(7) |
MacGregor, J. T., Wehr, C. M., Henika, P. R. and Shelby, M. E. (1990), The in vivo Erythrocyte Micronucleus Test: Measurement at Steady State Increases Assay Efficiency and Permits Integration with Toxicity Studies, Fund. Appl. Toxicol., 14, pp. 513-522 |
|
(8) |
Hayashi, M., Morita, T., Kodama, Y., Sofumi, T. and Ishidate, M. Jr. (1990), The Micronucleus Assay with Mouse Peripheral Blood Reticulocytes Using Acridine Orange-Coated Slides, Mutation Res., 245, pp. 245-249 |
|
(9) |
The Collaborative Study Group for the Micronucleus Test (1992), Micronucleus Test with Mouse Peripheral Blood Erythrocytes by Acridime Orange Supravital Staining: The Summary Report of the 5th Collaborative Study by CSGMT/JEMMS, MMS, Mutation Res., 278. pp. 83-98 |
|
(10) |
The Collaborative Study Group for the Micronucleus Test (CSGMT/JEMMS, MMS: The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan) (1995), Protocol recommended for the short-term mouse peripheral blood micronucleus test, Mutagenesis, 10, pp. 53-159 |
|
(11) |
Hayashi, M., Tice, R. R., MacGregor, J. T., Anderson, D., Blackey, D. H., Kirsch-Volders, M., Oleson, Jr. F. B., Pcchicrotti, F., Romagna, F., Shimada, H. Sutou, S. and Vannier, B. (1994), in vivo Rodent Erythrocyte Micronucleus Assay, Mutation Res. 312, pp. 293-304 |
|
(12) |
Higashikuni, N. and Sotou, S. (1995), An optimal, generalised sampling time of 30± 6 h after double dosing in the mouse peripheral micronucleus test, Mutagenesis, 10. pp. 313-319 |
|
(13) |
Fielder, R. J., Allen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G, Hodson-Walker, G, Morton, D. B., Kirkland, D. J. and Richold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In vivo Mutagenicity Assays, Mutagenesis, 7. pp. 313-319 |
|
(14) |
Hayashi, M., Sofumi, T. and Ishidate, M. Jr. (1983), An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test, Mutation Res., 120, pp. 241-247 |
|
(15) |
MacGregor, J. T., Wehr, C. M. and Langlois, R. G. (1983), A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyromin Y. Mutation Res., 120, pp. 269-275 |
|
(16) |
Romagna, F. and Staniforth, C. D. (1989), The automated bone marrow micronucleus test, Mutation Res., 213, pp. 91-104 |
|
(17) |
Gollapudi, B. and McFadden, L. G. (1995), Sample size for the estimation of polychromatic to normochromatic erythrocyte ratio in the bone marrow micronucleus test, Mutation Res., 347, pp. 97-99 |
|
(18) |
Richold, M., Ashby, J., Bootman, J., Chandley, A., Gatehouse, D. G. and Henderson, L. (1990), In vivo Cytogenetics Assay, in: D. J. Kirkland (ed.). Basic Mutagenicity tests, UKEMS Recommendes Procedures, UKEMS Subcommittee on Guidelines for Mutagenicity Testing, Report, Part 1. revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115-141 |
|
(19) |
Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson, R., Richold, M., Papworth, D. G. and Savage J. R. K. (1989), Statistical Analysis of In vivo Cytogenetic Assays, in: UKEMS Subcommittee on Guidelines for Mutagenicity Testing, Report Part III. Statistical Evaluation of Mutagenicity Test Data, D. J. Kirkland (ed.) Cambridge University Press, Cambridge, pp. 184-232 |
B.13/14. MUTAGENITÁS: REVERZ MUTAGENITÁSI VIZSGÁLAT BAKTÉRIUMOKKAL
1. MÓDSZER
E módszer megfelel az OECD TG 471-nek, reverz mutagenitási vizsgálat baktériumokkal (1997).
1.1. BEVEZETÉS
A bakteriális reverz mutagenitás vizsgálat a Salmonella typhimurium és Escherichia coli aminosavat igénylő törzseit használja pontmutációk észlelésére, amelyek magukban foglalják egy vagy néhány DNS bázispár szubsztitúcióját, addícióját vagy delícióját (1), (2), (3). E bakteriális reverz mutagenitás vizsgálatnak az az elve, hogy észleli azon mutációkat, amelyek revertálják a kísérleti törzsekben jelen lévő mutációkat, és helyreállítja a baktériumoknak egy esszenciális aminosavat szintetizáló képességét. A revertált baktérium észlelése azon képességének a segítségével történik, hogy az növekedni tud, amikor nincs jelen a vizsgálati anyatörzs által igényelt aminosav.
A pontmutációk sok emberi genetikai betegség okozói, és számos bizonyíték van arra, hogy a testi sejtek onkogénjeinek és tumorszuppresszor génjeinek a pontmutációi szerepet játszanak a daganat képződésben emberekben és kísérleti állatokban. A reverz mutáció vizsgálatot baktériumokkal gyors, olcsó és viszonylag könnyű végrehajtani. E törzsek közül sok törzs rendelkezik néhány olyan jellemzővel, amelyek érzékenyebbekké teszik azokat mutációk észleléséhez; ilyenek a reverzió helyének DNS-szekvenciája, nagyobb molekulák iránti fokozott sejtpermeabilitás, bizonyos DNS-reparációs rendszerek kiiktatása, vagy a hibára hajlamos DNS-reparációs folyamatok serkentése. A kísérleti törzsek sajátossága néhány hasznos információt szolgáltathat a genotoxikus anyagok által előidézett mutációk típusairól. Szerkezetek sokféle változatához kapott eredmények bő adatbázisa áll rendelkezésre baktériális reverz mutagenitás vizsgálatokhoz; jól megalapozott metodikákat fejlesztettek ki különböző fizikai-kémiai tulajdonságokkal rendelkező kémiai anyagok, beleértve az illékony vegyületeket is, vizsgálatához.
Lásd még az Általános bevezetés B. részét is.
1.2. FOGALOMMEGHATÁROZÁSOK
A reverz mutagenitás vizsgálat vagy Salmonella typhimurium-mal vagy Escherichia coli-val elvégezve, azon mutációkat igazolja, amelyek valamely aminosavat (hisztidin, illetve triptofán) igénylő törzsben lépnek fel és egy olyan törzs kialakulásához vezetnek, ami a külső aminosav-ellátástól független.
Bázispárcserét okozó mutagének azok a hatóanyagok, amelyek alapvető bázisváltozást okoznak a DNS-ben. A reverziós vizsgálatban e változás az eredeti mutáció helyén vagy a baktériumgenom egy másik helyén.
Frameshift mutagének azok a hatóanyagok, amelyek egy vagy több bázispár addícióját vagy delícióját okozzák a DNS-ben, ezzel megváltoztatva a leolvasó keretet a ribonukleinsavban.
1.3. ALAPVETŐ MEGFONTOLÁSOK
A bakteriális reverz mutagenitás vizsgálat prokarióta sejteket használ, amelyek az olyan tényezőkben térnek el az emlőssejtektől, mint például a kémiai anyagok felvétele, metabolizmus, kromoszómaszerkezet és DNS-reparációs folyamatok. Az in vitro végrehajtott vizsgálatok rendszerint a metabolikus aktiválás valamilyen kívülről ható forrásának használatát teszik szükségessé. Az in vitro metabolikus aktiváló rendszerek nem tudják teljesen szimulálni az emlős in vivo körülményeket. Ebből következően a vizsgálat nem ad közvetlen tájékoztatást az emlősök esetében valamely anyag mutációt előidéző és daganatkeltő potenciáljáról.
A bakteriális reverz mutagenitás vizsgálatot rendszerint a genotoxikus aktivitás és különösen a pontmutáció-előidéző aktivitás első szűrőjeként alkalmazzák. A terjedelmes adatbázis bebizonyította, hogy sok olyan kémiai anyag, amely e vizsgálatban pozitívnak bizonyult, más vizsgálatokban is mutagénnek bizonyul. Léteznek példák olyan mutációt előidéző hatóanyagokra, amelyeket nem észlel e vizsgálat; e hiányosságok okai a vizsgált végpont különleges természetének, a metabolikus aktiválásban előforduló különbségeknek, vagy a biológiai elérhetőségben lévő különbségeknek tulajdoníthatók. Másrészről, azon tényezők, amelyek növelik a bakteriális reverz mutagenitás vizsgálat érzékenységét, a mutagén aktivitás túlbecsléséhez vezethetnek.
A bakteriális reverz mutagenitás vizsgálat lehet, hogy nem bizonyul megfelelőnek bizonyos kémiai anyagosztályok értékeléséhez, ilyenek például az erősen baktericid vegyületek (például bizonyos antibiotikumok) és azok, amelyek vélhetően (vagy bizonyítottan) kifejezetten zavaró hatással vannak az emlőssejt replikációs rendszerére (például néhány topoizomeráz gátló szer és néhány nukleozid analóg). Ilyen esetekben megfelelőbbnek bizonyulhatnak az emlős mutagenitási vizsgálatok.
Sok olyan vegyület van, amely pozitív eredményt mutat e vizsgálatban és az emlősökben rákkeltő, a korreláció mégsem abszolút. Mérvadó a kémiai anyag osztálya, és léteznek olyan karcinogén anyagok, amelyeket nem észlel e vizsgálat, mivel azok más, nem genotoxikus mechanizmusokon, vagy olyan mechanizmusokon keresztül fejtik ki a hatásukat, amelyek nincsenek jelen baktériumokban.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Baktériumsejtek szuszpenzióit kezelik a vizsgált anyaggal exogén metabolikus aktiváló rendszer jelenlétében és anélkül. A lemezöntéses (plate incorporation) módszernél e szuszpenziókat közvetlenül be kell keverni a felülöntő agarba, és minimális táptalajra helyezni. Az előinkubációs módszer esetében az expozíciós keveréket inkubálni kell, és csak ezután kell azt bekeverni a felül öntő agarba a minimál táptalajra helyezés előtt. Mindkét módszer alkalmazásakor két vagy három napig tartó inkubálás után meg kell számolni a revertáns telepeket, és össze kell hasonlítani azt az oldószer kontroll-lemeztenyészeteken lévő spontán revertáns telepek számával.
Már több különböző eljárást írtak le a bakteriális reverz mutagenitás vizsgálat végrehajtására. A leggyakrabban használt eljárások közé tartoznak a lemezöntéses módszer (1), (2), (3), (4) az előinkubációs módszer (2), (3), (5), (6), (7), (8) a fluktuációs módszer (9), (10) és a szuszpenziós módszer (11). Már leírtak módosított változatokat gázok vagy gőzök vizsgálatához (12).
A módszerben leírt eljárások elsősorban a lemezöntéses és az előinkubációs módszerekhez tartoznak. Ezek közül bármelyik alkalmas kísérletek végrehajtására, mind metabolikus aktiválással, mind anélkül. Néhány anyag hatékonyabban észlelhető az előinkubációs módszer segítségével. Ezen anyagok olyan kémiai anyagosztályokhoz tartoznak, amelyek rövid szénláncú alifás nitrozaminokat, kétvegyértékű fémeket, aldehideket, azo festékeket és diazo-vegyületeket, pirrlizidin alkaloidokat, allil és nitrovegyületeket tartalmaznak (3). Azt is felismerték, hogy a mutagének bizonyos osztályai nem mindig észlelhetők az olyan szokásos eljárásokkal, mint például a lemezöntéses vagy előinkubációs módszer. Ezeket „különleges eseteknek” kell tekinteni és észlelésükre alternatív eljárásokat kell használni. A következő „különleges esetek” azonosíthatók (az észlelésükhöz használható eljárásokra adott példákkal együtt): azo festékek és diazo-vegyül etek (3), (5), (6), (13), gázok és illékony kémiai anyagok (12), (14), (15), (16) és glikozidok (17), (18). A standard eljárástól való eltérést tudományosan meg kell indokolni.
1.5. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.5.1. Előkészületek
1.5.1.1. Baktériumok
Friss baktériumtenyészeteket kell létrehozni a tenyésztés késői logaritmikus vagy korai stacioner fázisáig (körülbelül 109 sejt/ml). Késői stacioner fázisban lévő tenyészeteket nem szabad használni. Lényeges, hogy a kísérletben használt tenyészetek nagy arányban tartalmazzanak életképes baktériumokat. Ezt az arányt vagy történeti kontrolladatokból, vagy minden egyes vizsgálatban külön kiszélesztéssel az életképes sejtek számának meghatározásával lehet megadni.
A javasolt inkubációs hőmérséklet 37 oC.
Legalább öt baktériumtörzset kell használni. Ezek közül négy törzs az S. typhinuriumhoz (TA 1535; TA 1537 vagy TA97a vagy TA97; TA98; és TA100) tartozik, amelyekről már bebizonyosodott, hogy megbízhatóan és reprodukálhatóan reagálnak a különböző laboratóriumokban. E négy S. typhimurium törzsnek GC bázispárjai vannak a primer reverziós helyen, és ismert, hogy esetleg nem mutatnak ki bizonyos oxidatív mutagéneket, keresztkötő ágenseket és hidrazinokat. Az ilyen anyagok E. coli WP2 törzsekkel vagy S. typhimurium TA102-vel (19) észlelhetők, amelyek egy AT bázispárral rendelkeznek a primer reverziós helyen. Ezért tehát a következő törzsek kombinációja javasolt:
|
— |
S. typhimurium TA 1535, és |
|
— |
S. typhimurium TA1537 vagy TA97 vagy TA97a, és |
|
— |
S. typhimurium TA98, és |
|
— |
S. typhimurium TA100, és |
|
— |
E. coli WP2 uvrA, vagy E. coli WP2 uvrA (pKM101), vagy S. typhimurium TA102. |
A keresztkötő mutagének észleléséhez előnyben részesíthető a TA102 használata, vagy az E. coli-nak egy DNS-reparációban kiválónak bizonyuló törzse (ilyen például az E. coli WP2 vagy E. coli WP2 (pKM10l)) alkalmazása.
A törzstenyészet elkészítéséhez, az indikátor ellenőrzéséhez és tárolásához elfogadott eljárásokat kell használni. Minden fagyasztott törzstenyészet-készítmény esetében igazolni kell a tenyésztéshez szükséges aminosavat (hisztidin S. typhimurium törzsek és triptofán E. coli törzsek esetében). Más fenotípus-jellemzőket hasonlóképpen kell ellenőrizni, nevezetesen: R-faktor plazmidok jelenlétét vagy hiányát, ahol szükséges (azaz ampicillin rezisztenciát TA98, TA100 és TA97a vagy TA97, WP2 uvrA és WP2 uvrA (pKM10l) törzsekben és amplicin plusz tetraciklin rezisztenciát TA102-es törzsben); a specifikus mutációk jelenléte (azaz rfa mutáció S. typhimurium-ban kristályibolyára való érzékenységen keresztül és uvrA mutáció E. coli-ban vagy uvrB mutáció S. typhimurium-ban, ibolyántúli fényre való érzékenységen keresztül) (2), (3). A törzseknek a laboratórium történeti kontrolladataiból várt gyakoriság tartományokon belüli és lehetőleg a szakirodalomban közölt tartományon belüli spontán revertáns telep lemeztenyésztési számokat is kell adniuk.
1.5.1.2. Táptalaj
Megfelelő minimál agart (például Vogel-Bonner minimál E ingredienseket és glukózt tartalmazót) és hisztidint, biotint vagy tiptofánt tartalmazó felülöntő agart alkalmazunk, azért hogy több sejtosztódást lehessen megfigyelni (1), (2), (9).
1.5.1.3. Metabolikus aktiválás
A baktériumot kezelni kell a vizsgált anyaggal, mind megfelelő metabolikus aktiváló rendszer jelenlétében, mind anélkül. A legáltalánosabban használt rendszer a kofaktorral kiegészített posztmitokondriális frakció (S9), amelyet enziminducerrel, ilyen például az Aroclor 1254 (1), (2), vagy a fenobarbiturát és ß-naftoflavon (18), (20), (21) kombinációjával kezelt rágcsálók májából készítették. A poszt-mitokondriális frakciót rendszerint 5-től 30 térfogatszázalékig terjedő koncentrációkban használják az S9-keverékben. Valamely metabolikus aktiváló rendszer kiválasztása és állapota függhet a vizsgálatra kerülő kémiai anyag osztályától. Meghatározott esetekben megfelelőnek bizonyulhat a poszt-mitokondriális felülúszás egynél több koncentrációjának használata. Azofestékek és diazo-vegyületek esetében megfelelőbbnek bizonyulhat valamilyen redukciós metabolikus aktiváló rendszer használata (6) (13).
1.5.1.4. Vizsgált anyag/előkészítés
A szilárd vizsgált anyagokat fel kell oldani vagy szuszpendálni megfelelő oldószerekben, vagy ha szükséges, hígítani kell a baktérium kezelése előtt. A folyékony vizsgált anyagokat közvetlenül hozzá lehet adni a vizsgált rendszerekhez és/vagy hígíthatók kezelés előtt. Friss készítményeket kell használni, kivéve, ha a stabilitási adatok a tárolás elfogadhatóságát jelzik.
Oldószerként nem alkalmazható olyan anyag, amely gyaníthatóan kémiai reakcióba lép a vizsgált anyaggal, és kompatibilisnek kell lennie a baktérium túlélésével és az S9-es aktivitással (22). Ha a jól ismert oldószertől eltérő oldószereket használnak, ezek használatát alá kell támasztania az összeegyeztethetőségüket jelző adatokkal. Elsőként valamilyen vizes oldószer használatát kell megfontolni. Vízzel instabil anyagok vizsgálatakor a használt szerves oldószereknek vízmenteseknek kell lenniük.
1.5.2. Vizsgálati körülmények
1.5.2.1. Vizsgált törzsek (lásd az 1.5.1.1. alatt)
1.5.2.2. Expozíciós koncentráció
A vizsgált anyag legnagyobb koncentrációjának meghatározásakor figyelembe veendő kritériumok közé tartozik többek között a citotoxicitás és az oldékonyság a végső keverékben.
Hasznosnak bizonyulhat a toxicitás és az oldékonyság meghatározása egy előzetes kísérletben. A citotoxicitás a revertáns telepek számának csökkenésével, a háttér táptalaj kitisztulásának vagy csökkenésének, vagy a kezelt tenyészetek túlélési rátájának segítségével észlelhető. Valamely anyag citotoxicitása valószínűleg megváltozik metabolikus aktiváló rendszerek jelenlétében. Az oldhatatlanságot a végső keverékben a tényleges vizsgálati körülmények között szabad szemmel látható csapadék képződéseként lehet felismerni.
Oldható, nem citotoxikus anyagok esetében a javasolt maximális kísérleti koncentráció 5 mg/lemez vagy 5 μl/lemez. Az 5 mg/lemeznél vagy 5 μl/lemeznél nem oldódó, nem citotoxikus anyagok esetében egy vagy több kísérleti koncentrációnak nem oldódónak kell lennie a végső keverékben. Azon vizsgált anyagokat, amelyek már 5 mg/lemez vagy 5 ul/lemez alkalmazása esetén citotoxikusak, egészen a citotoxikus koncentrációig kell vizsgálni. A kicsapódás nem zavarhatja az értékelést.
A vizsgált anyag legalább öt különböző elemezhető koncentrációját használják körülbelül fél log-fázis (azaz √10) intervallumokkal az első kísérletben. Megfelelőek lehetnek ennél kisebb intervallumok valamilyen koncentráció-hatás viszony vizsgálatakor. Megfontolható 5 mg/lemez, vagy 5 μl/lemez koncentrációt meghaladó vizsgálat jelentős mennyiségű potenciálisan mutagén szennyeződéseket tartalmazó anyagok értékelésekor.
1.5.2.3. Negatív és pozitív kontrollok
Minden egyes vizsgálatban egyidejűleg, törzsre jellemző pozitív és negatív (oldószer) kontrollanyagokat alkalmaznak, mind metabolikus aktiválással, mind anélkül. Olyan pozitív kontrollanyag-koncentrációkat kell kiválasztani, amelyek bizonyítják az egyes vizsgálatok hatékonyságát.
Metabolikus aktiváló rendszert alkalmazó vizsgálatok esetében a pozitív kontroll referenciaanyagot (anyagokat) a használt baktériumtörzsek típusa alapján kell kiválasztani.
A következő anyagok példaként szolgálnak a metabolikus aktiválással végrehajtott vizsgálathoz alkalmas pozitív kontrollanyagokra:
|
CAS-szám |
EINECS-szám |
Név |
|
781-43-1 |
212-308-4 |
9,10- Dimetil-antracén |
|
57-97-6 |
200-359-5 |
7,12- Dimetilbenz[a]antracén |
|
50-32-8 |
200-028-5 |
Benzo[a]pirén |
|
613-13-8 |
210-330-9 |
2-aminoanthracene |
|
50-18-0 |
|
Ciklofoszfamid |
|
6055-19-2 |
200-015-4 |
Ciklofoszfamid monohidrát |
A következő anyag alkalmas pozitív kontrollanyag reduktív metabolikus aktiváló módszerhez:
|
CAS-szám |
EINECS-szám |
Név |
|
573-58-0 |
209-358-4 |
Kongó vörös |
A 2-Amino-antracént nem szabad használni az S9-es keverék hatékonyságának egyetlen indikátoraként. Ha használunk 2-Amino-antracént, akkor az S9 minden egyes adagját egy olyan mutagénnel is jellemezni kell, amely mikroszómális enzimekkel, ilyen például a Benzo[a]pirén, Dimetil-benzantracén, történő metabolikus aktiválást igényel.
A következő anyagok példák a törzsre jellemző pozitív kontrollanyagokra azon kísérletekben, amelyeket exogén metabolikus aktiváló rendszer nélkül hajtunk végre.
|
CAS-szám |
EINECS-szám |
Anyag |
Törzs |
|
26628-22-8 |
247-852-1 |
Nátrium-azid |
TA 1535 és TA 100 |
|
607-57-8 |
210-138-5 |
2-Nitro-fluorén |
TA 98 |
|
90-45-9 |
201-995-6 |
9-Amino-akridin |
TA 1537, TA 97 és TA 97a |
|
17070-45-0 |
241-129-4 |
ICR 191 |
TA 1537, TA 97 és TA 97a |
|
80-15-9 |
201-254-7 |
Kumén-hidroperoxid |
TA 102 |
|
50-07-7 |
200-008-6 |
Mitomicin C |
WP2 uvrA és TA 102 |
|
70-25-7 |
200-730-1 |
l-etil-3-nitro-l-N-nitrozo-guanidin |
WP2, WP2uvrA és WP2uvrA(pK M101) |
|
56-57-5 |
200-281-1 |
4-nitroquinoline-l -oxide |
WP2, WP2uvrA és WP2uvrA(pK M101) |
|
3688-53-7 |
|
Furil-furamid (AF2) |
Plazmidhordozó törzsek |
Használhatók más megfelelő pozitív kontroll referenciaanyagok is. Olyan pozitív kontrollanyagok használatát kell mérlegelni, amelyek ugyanazon kémiai osztályba tartoznak, mint a vizsgált anyag, ha rendelkezésre állnak ilyenek.
A vizsgálatba bevonják a vizsgált anyagot nem tartalmazó, egyedül oldószerből vagy vivőanyagból álló és egyébként a kezelt csoportokkal azonos módon kezelt negatív kontrollanyagokat. Ezenkívül nem kezelt kontrollokat is használnak, kivéve, ha vannak olyan történeti kontrolladatok, amelyek bizonyítják, hogy semmilyen káros vagy mutagén hatást nem idéz elő a kiválasztott oldószer.
1.5.3. A kísérlet végrehajtása
A lemezöntéses módszer (1), (2), (3), (4) esetében metabolikus aktiválás nélkül, rendszerint 0,05 ml vagy 0,1 ml vizsgált oldatot, 0,1 ml friss baktériumtenyészetet (amely körülbelül 108 életképes sejtet tartalmaz) és 0,5 ml steril pufferoldatot összekevernek 2,0 ml rétegelt felülöntő agarral. Metabolikus aktiválással végrehajtott vizsgálathoz rendszerint megfelelő mennyiségű posztmitokondriális frakciót (a metabolikus aktiváló keverékben 5-től 30 térfogatszázalékig terjedő tartományban) tartalmazó 0,5 ml metabolikus aktiváló keveréket összekevernek felülöntő agarral (2,0 ml), a baktériummal és vizsgált anyaggal/vizsgált oldattal együtt. Összekeverjük minden egyes kémcső tartalmát, és egy minimális felülöntő agar felületére öntjük. Engedjük, hogy az agar inkubálás előtt megszilárduljon.
Előinkubációs módszer (2), (3), (5), (6) esetében a vizsgált anyagot/vizsgált oldatot előinkubálják a vizsgált törzzsel (körülbelül 108 életképes sejtet tartalmaz) és steril pufferoldattal vagy a metabolikus aktiváló rendszerrel (0,5 ml), rendszerint 20 percig vagy ennél hosszabb ideig 30–37 oC hőmérsékleten a felülöntő agarral való összekeverés és minimális agar lemez felületére öntés előtt. Rendszerint 0,05 vagy 0,1 ml vizsgált anyagot/vizsgált oldatot, 0,1 ml baktériumot és 0,5 ml S9 keveréket vagy steril pufferoldatot keverünk 2 ml felülöntő agarhoz. A kémcsöveket levegőztetjük az előinkubálás során rázókészülék segítségével.
A változás megfelelő becsléséhez három lemezt kell használni minden egyes dózisszinten. Ha tudományosan indolkolt, két lemez használata elfogadható. Valamely lemez esetenkénti elvesztése nem szükségképpen érvényteleníti a vizsgálatot.
Gázok vagy illékony anyagok megfelelő módszerekkel, például légmentesen zárt edényekben, vizsgálhatók (12), (14), (15), (16).
1.5.4. Inkubálás
Egy adott vizsgálatban részt vevő minden lemezt 37 oC hőmérsékleten 48-–2 órán át inkubálnak. Az inkubációs időtartam után meg kell számolni lemezenként a revertáns telepek számát.
2. ADATOK
2.1. EREDMÉNYEK KEZELÉSE
Az adatokat a lemezenkénti revertáns telepek számaként kell megadni. Mind a negatív (oldószerkontroll és nem kezelt kontroll, ha használatra került) mind a pozitív kontroll-lemezeken lévő revertáns telepek számát is fel kell jegyezni. Meg kell adni az egyes lemezekhez tartozó számokat, lemezenként a revertáns telepek átlagértékét és a standard eltérést a vizsgált anyaghoz és a pozitív és negatív (nem kezelt és/vagy oldószer) kontrollokhoz képest.
A nyilvánvalóan pozitív reakció igazolása nem szükséges. A többféleképpen magyarázható eredményeket további, lehetőleg a kísérleti körülmények módosításával végrehajtott vizsgálattal kell tisztázni. A negatív eredményeket külön kísérletekkel kell megerősíteni. Azon esetekben, ahol nem tekintjük szükségesnek a negatív eredmények megerősítését, meg kell indokolni e döntést. Megfontolandó az utólagos ellenőrző kísérletekben a vizsgált körülmények tartományának kiterjesztése érdekében a vizsgálati paraméterek módosítása. A módosítható vizsgálati paraméterek, többek között a koncentrációfelosztás, a kezelés módszere (lemezöntéses vagy folyadék előinkubációs) és a metabolikus aktiválási körülmények lehetnek.
2.2. EREDMÉNYEK ÉRTÉKELÉSE ÉS ÉRTELMEZÉSE
Különböző kritériumok léteznek a pozitív eredmény meghatározására, ilyen például a metabolikus aktiváló rendszer használatával vagy anélkül legalább egy törzsben a lemezenkénti revertáns telepek számának koncentrációval kapcsolatos növekedése a vizsgált tartományban és/vagy reprodukálható növekedése egy vagy több koncentráció mellett (23). Először meg kell vizsgálni az eredmények biológiai jelentőségét. Statisztikai módszerek használhatók a vizsgálati eredmények értékelésének elősegítésére (24). Valamely pozitív reagálás tekintetében nem szabad, hogy a statisztikai szignifikancia legyen az egyetlen meghatározó tényező.
E rendszerben nem mutagén anyagnak tekintendő az a vizsgált anyag, amelyhez tartozó eredmények nem elégítik ki a fenti kritériumokat.
Bár a legtöbb kísérlet egyértelműen pozitív vagy negatív eredményeket hoz, ritka esetben előfordul, hogy a rendelkezésre álló adatok alapján nem lehet a vizsgált anyag aktivitásával kapcsolatban egyértelműen állást foglalni. Előfordul az is, hogy az eredmények többféleképpen magyarázhatók vagy megkérdőjelezhetők maradhatnak tekintet nélkül arra, hogy hány alkalommal ismételjük meg a kísérletet.
A bakteriális reverz mutagenitás vizsgálatból kapott pozitív eredmények azt jelzik, hogy az anyag bázis szubsztitúcióval vagy kereteltolásokkal (frameshift) pontmutációkat idéz elő a Salmonella typhimurium és/vagy az Escherichia coli génállományában. A negatív eredmények azt jelzik, hogy a vizsgálati körülmények között a vizsgált anyag nem mutagén a vizsgált fajokban.
3. VIZSGÁLATI JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentés tartalmazza a következő információkat:
|
|
Oldószer/vivőanyag:
|
|
|
Törzsek:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények tárgyalása. |
|
|
Összefoglaló megállapítások. |
4. HIVATKOZOTT SZAKIRODALOM
|
(1) |
Ames, B. N., McCann, J. and Yamasaki E. (1975), Methods of Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test, Mutation Res. 31, pp. 347-364 |
|
(2) |
Maron, D. M. and Ames, B. N. (1983). Revised Methods for the Salmonella Mutagenicity Test, Mutation Res, 113, pp. 173-215 |
|
(3) |
Gatehouse, D., Haworth, S., Cebula, T., Gocke, E., Kier, L., Matsushima, T., Melcion, C, Nohmi T., Venitt, S. and Zeiger, E. (1994). Recommendations for the Performance of Bacterial Mutation Assays, Mutation Res., 312, pp. 217-233 |
|
(4) |
Kier, L. D., Brusick D. J., Auletta, A. E., Von Halle, E. S., Brown, M. M., Simmon, V. F., Dunkel, V., McCann, J., Mortelmans, K., Prival, M., Rao, T. K. and Ray V. (1986). The Salmonella typhimurium/Mannalian Microsomal Assay: A report of the U. S. Environmental Protection Agency Gene-Tox Program, Mutation Res. 168, pp. 69-240 |
|
(5) |
Yahagi, T., Degawa, M., Seino, Y. Y., Matsushima, T., Nagao, M., Sugimura, T. and Hashimoto, Y. (1975), Mutagenicity of Carcinogen Azo Dyes and their Derivatives, Cancer Letters 1, pp. 91-96 |
|
(6) |
Matsushima, M., Sugimura, T., Nagao, M., Yahagi, T., Shirai, A. and Sawamura, M. (1980). Factors Modulating Mutagenicity Microbial Tests, in: Short-term Test Systems for Detecting Carcinogens, ed. Norpoth K. H. and Garner, R. C, Springer, Berlin-Heidelberg-New-York, pp. 273-285 |
|
(7) |
Gatehouse, D. G, Rowland, I. R., Wilcox, P., Callender, R. D. and Foster, R. (1980). Bacterial Mutation Assays, in: Basic Mutagenicity Tests: UKEMS Part 1 Revised, ed. D. J. Kirkland, Cambridge University Press, pp. 13-61 |
|
(8) |
Aeschacher, H. U., Wolleb, U. and Porchet, L. (1987). Liquid Preincubation Mutagenicity Test for Foods, J. Food Safety, 8, pp. 167-177 |
|
(9) |
Green, M. H. L., Muriel, W. J. and Bridges, B. A. (1976), Use of a simplified fluctuation test to detect low levels of mutagens, Mutation Res., 38, pp. 33-42 |
|
(10) |
Hubbard, S. A., Green, M. H. L., Gatehouse, D. and Bridges, J. W. (1984), The Fluctuation Test in Bacteria, in: Handbook of Mutagenicity Test Procedures, 2nd Edition, ed. Kilbey, B. J., Legator, M., Nichols, W. and Ramel, C, Elsevier, Amsterdam-New York-Oxford, pp. 141-161 |
|
(11) |
Thompson, E. D. and Melampy, P. J. (1981), An Examination of the Quantitative Suspension Assay for Mutagenesis with Strains of Salmonella typhimurium, Environmental Mutagenesis, 3, pp. 453-465 |
|
(12) |
Araki, A., Noguchi, T., Kato, F. and Matsushima, T. (1994), Improved Method for Mutagenicity Testing of Gaseous Compounds by Using a Gas Sampling Bag, Mutation Rec. 307, pp. 335-344 |
|
(13) |
Prival, M. J., Bell. S. J., Mitchell, V. D., Reipert, M. D. and Vaugham, V. L. (1984), Mutagenicity of Benzidine and Benzidine-Congener Dyes and Selected Monoazo Dyes in a Modified Salmonella Assay, Mutation Res. 136, pp. 33-47 |
|
(14) |
Zeiger, E., Anderson, B. E., Haworth, S., Lawlor. T. and Mortelmans, K. (1992). Salmonella Mutagenicity Tests, V. Results from the Testing of 311 Chemicals, Environ. Mol. Mutagen. 19, pp. 2-141 |
|
(15) |
Simmon, V., Kauhanen, K. and Tardiff, R. G. (1977), Mutagenic Activity of Chemicals Identified in Drinking Water, in Progress in Genetic Toxicology, D. Scott, B. Bridges and F., Sobels (eds) Elsevier, Amsterdam, pp. 247-258 |
|
(16) |
Hughes, T. J., Simmons, D. M. Monteith, I. G. and Claxton, L. D. (1987), Vaporisation Technique to Measure Mutagenic Activity of Volatile Organic Chemicals in the Ames/Salmonella Assay, Environmental Mutagenesis, 9, pp. 421-441 |
|
(17) |
Matsushima, T., Matsumoto, A., Shirai, M., Sawamura, M., and Sugimura, T. (1979). Mutagenicity of the Naturally Occurring Carcinogen Cycasin and Synthetic Methylazoxy Methane Conjugates in Salmonella typhimurium, Cancer Res., 39, pp. 3780-3782 |
|
(18) |
Tamura, G, Gold, C, Ferro-Luzzi, A. and Ames, B. N. (1980). Fecalase: A Model for Activation of Dietary Glycosides to Mutagens by Intestinel Flora, Proc. Natl. Acad. Sci. USA, 77, pp. 4961-4965 |
|
(19) |
Wilcox, P., Naidoo, A., Wedd, D. J. and Gatehouse, D. G (1990), Comparison of Salmonella typhimurium TA 102 with Escherichia coli WP2 Tester strains, Mutagenesis, 5, pp. 285-291 |
|
(20) |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A Safe Substitute for Polychlorinated Biphenyls as an Inducer or Metabolic Activation Systems, in: In vitro Metabolic Activation in Mutagenesis Testing, eds. F. J. de Serres et al. Elsevier, North Holland, pp. 85-88 |
|
(21) |
Elliot, B. M., Combes, R. D., Elcombe, C. R., Gatehouse, D. G, Gibson, G G, Mackay, J. M. and Wolf, R. C. (1992), Alternatives to Aroclor 1254-induced S9 in in vitro Genotoxicity Assays, Mutagenesis, 7, pp. 175-177 |
|
(22) |
Maron, D., Katzenellenbogen, J. and Ames, B. N. (1981), Compatibility of Organic Solvents with the Salmonella/Microsome Test, Mutation Res. 88. pp. 343-350 |
|
(23) |
Claxton, L. D., Allen, J., Auletta, A., Mortelmans, K., Nestmann, E. and Zeiger, E. (1987), Guide for the Salmonella typhimurium/Mammalian Microsome Tests for Bacterial Mutagenicity, Mutation Res. 189, pp. 83-91 |
|
(24) |
Mahon, G. A. T., Green, M. H. L., Middleton, B., Mitchel, I., Robinson, W. D. and Tweats, D. J. (1989), Analysis of Data from Microbial Colony Assays, in: UKEMS Subcommittee on Guidelines for Mutagenicity Testing, Part II, Statistical Evaluation of Mutagenicity Test Data, ed. Kirkland, D. J., Cambridge University Press, pp. 28-65 |
B.15. MUTAGENITÁSVIZSGÁLAT ÉS A RÁKKELTŐ HATÁS SZŰRÉSE GÉNMUTÁCIÓ VIZSGÁLATA SACCHAROMYCES CEREVISIAE-BEN
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A Saccharomyces cerevisiae nevű élesztőgomba számos haploid, illetve diploid törzse használható fel arra, hogy a vizsgált vegyület által metabolikus aktivációval, illetve a nélkül kiváltott génmutáció jelenléte kimutatható legyen.
Haploid törzsekben kialakított, előrehaladó mutációs rendszereket kell felhasználni, például a vörös, adeninfüggő élesztőgombák (ade-1, ade-2) mutációját, illetve kettős adeninfüggő fehér mutánsokat, illetve olyan szelektív rendszereket, mint a kanavnain és a cikloheximid rezisztenciaindukciója.
A leginkább értékelt reverz mutációs rendszer a haploid XV 185-14C törzset alkalmazza, amely az ade 2-1, arg 4-17, lys l-l és trp 5-48 „ochre” nonszensz mutációkat hordozza; ezek bázis-szubsztitúció típusú mutációt kiváltó mutagénekkel visszafordíthatók, amelyek helyspecifikus, illetve „ochre” szupresszor mutációkat váltanak ki. Az XV 185-14C jelzésű élesztőgombatörzs hordozza a his 1-7 markert is, egy főként második helyet érintő mutációkkal visszafordítható „missense” mutációt, valamint a hom 3-10 markert, amelyet kereteltolódást („frameshift”) okozó mutagének fordítanak meg.
Diploid S. cerevisiae törzsekben az egyetlen általánosan használt törzs a D7, amely az ilv 1-92 mutációra homozigóta.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Előkészületek
A vizsgált vegyületek oldatait és a kontrollt a megfelelő vivőanyag felhasználásával közvetlenül a vizsgálat megkezdése előtt kell elkészíteni. Vízben nem oldódó szerves vegyületek esetében 2 térfogatszázalékos koncentrációt nem meghaladó szerves oldószer, például etanol, aceton vagy dimetil-szulfoxid (DMSO) használható. A vivőanyag a végső koncentrációban nem befolyásolhatja jelentősen a sejtek életképességét és növekedési jellemzőit.
A sejteket a vizsgált vegyület hatásának egy megfelelő exogén anyagcsere-aktiváló rendszer jelenlétében és hiányában is ki kell tenni.
A leggyakrabban használt rendszer az enzimindukáló szerrel előkezelt rágcsálómáj szövetből készített poszt-mitokondriális frakció ko-faktorral kiegészítve. Az anyagcsere-aktiválásra más fajok, szövetek, poszt-mitokondriális frakciók vagy eljárások használata is alkalmas lehet.
Vizsgálati körülmények
A génmutációs vizsgálatok során leggyakrabban alkalmazott törzs a haploid XV 185-14C és a diploid, D7 jelzésű törzs. Más törzsek is megfelelőek lehetnek.
A mutáns- és a túlélősejt-számok meghatározásához a megfelelő tenyésztési tápoldatokat kell alkalmazni.
Pozitív, kezeletlen és oldószeres kontrollokat egyidejűleg kell alkalmazni. Minden egyes mutációs végponthoz a megfelelő pozitív kontrollvegyületeket kell használni.
A vizsgált anyagnak legalább öt, egyenletesen elosztott koncentrációját kell alkalmazni. Mérgező anyagoknál a legnagyobb vizsgált koncentráció a túlélési arányt nem csökkentheti 5–10 %-ot meghaladó mértékben. Vízben viszonylag rosszul oldódó anyagokat a megfelelő eljárások alkalmazásával oldhatóságuk határáig kell vizsgálni. A vízben jól oldódó és nem mérgező anyagok felső koncentrációját esetenként kell meghatározni.
A lemezeket négy-hét napig 28–30 oC hőmérsékleten, sötétben kell inkubálni.
Az általánosan elfogadott normál tartományon belüli spontán mutációs gyakorisággal rendelkező szubkultúrákat kell használni.
A génmutációval előállított prototrófok, illetve a sejtéletképesség vizsgálatára valamennyi koncentráció esetében legkevesebb három lemezt kell alkalmazni. A hom 3-10-hez hasonló alacsony mutációs gyakoriságú markereket használó meghatározások során azonban meg kell növelni a lemezek számát, hogy statisztikailag értékelhető mennyiségű adatot kapjunk.
A kísérlet végrehajtása
A S. cerevisiae törzsek kezelését rendszerint folyékony közeges eljárással végezzük, amely stabil vagy növekedési fázisban levő sejteket alkalmaz. Az induló vizsgálatokat osztódó sejteken kell végezni: folyamatos rázás mellett 1-5 × 107 sejt/ml koncentrációjú élesztőgombát kezelnek a vizsgált anyaggal legfeljebb 18 órán át, 28–37 oC hőmérsékleten; ha szükséges, a megfelelő mennyiségben anyagcsere-aktiváló rendszert is adnak hozzá kezelés közben. A kezelés végén a sejteket centrifugálják, kimossák, és megfelelő táptalajon szétterítik. Inkubáció után a lemezeken kell megszámolni a túlélő sejteket és a génmutáció kialakulását. Ha az első vizsgálat negatív eredményt ad, egy második meghatározást is kell végezni, stabil, nem osztódó sejtek felhasználásával. Ha az első vizsgálat pozitív, azt egy megfelelő független kísérlettel kell megerősíteni.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, megadva a megszámolt telepek számát, a mutánsok számát, a túlélési arányt és a mutációs gyakoriságot. Valamennyi eredményt független vizsgálatokkal kell megerősíteni. Az eredményeket megfelelő statisztikai módszerrel kell értékelni.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a felhasznált törzs, |
|
— |
a vizsgálat körülményei: stabil, nem osztódó állapotú vagy osztódó sejtek, a tápfolyadékok összetétele, az inkubációs hőmérséklet és időtartam, az anyagcsereaktiváló rendszer, |
|
— |
kezelési körülmények: koncentrációk, a kezelési eljárás és időtartama, a kezelési hőmérséklet, a pozitív és negatív kontrollok, |
|
— |
a megszámolt telepek mennyisége, a mutánsok száma, a túlélési arány és a mutációs gyakoriság, a dózis-hatás összefüggés, ha alkalmas, az adatok statisztikai értékelése, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.16. MITOTIKUS REKOMBINÁCIÓ-VIZSGÁLAT SACHAROMYCES CEREVISIAE-BEN
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A Saccharomyces cerevisiae élesztőgomba esetében a mitotikus rekombináció két gén között (vagy még gyakrabban egy gén és annak centrom erje között), illetve géneken belül mutatható ki. A két gén közötti eseményt mitotikus átkereszteződésnek (crossing over) nevezzük, és eredménye egy reciprok termék, míg a génkonverziónak nevezett, génen belüli esemény leggyakrabban nem reciprok jellegű. Az átkereszteződés rendszerint recesszív homozigóta telepek vagy szektorok előállításával mutatható ki heterozigóta törzsekben, míg a génkonverzió ugyanazon gén két hibás alléljét hordozó auxotróf heteroallélikus törzsben előállított prototróf revertáns révén vizsgálható. A mitotikus génkonverzió kimutatásához leggyakrabban alkalmazott törzs a D4 (ade 2 és trp 5 lokuszon heteroallélikus), a D7 (a trp 5 lokuszon heteroallélikus), a BZ34 (heteroallélikus az arg 4 lokuszon) és a JD1 (heteroallélikus a his 4 és trp 5 lokuszon). A vörös és a rózsaszín homozigóta szektorokat termelő mitotikus átkereszteződés kimutatására a D5 vagy a D7 jelzésű törzset használhatjuk (amelyek egyaránt kimutatják a mitotikus génkonverziót és az ilv 1-92 helyen kialakuló reverz mutációt is). Mindkét törzs heteroallélikus az ade 2 komplementer alléljai szempontjából.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Előkészületek
A vizsgált vegyületek oldatait és a kontrollt a megfelelő vivőanyag felhasználásával közvetlenül a vizsgálat megkezdése előtt kell elkészíteni. Vízben nem oldódó szerves vegyületek esetében 2 térfogatszázalékos koncentrációt nem meghaladó szerves oldószer, például etanol, aceton vagy dimetil-szulfoxid (DMSO) használható. A vivőanyag a végső koncentrációban nem befolyásolhatja jelentősen a sejtek életképességét és növekedési jellemzőit.
A sejteket a vizsgált vegyület hatásának egy megfelelő exogén anyagcsere-aktiváló rendszer jelenlétében és hiányában is ki kell tenni. A leggyakrabban használt rendszer az enzimindukáló szerrel előkezelt rágcsálómáj szövetből készített poszt-mitokondriális frakció ko-faktorral kiegészítve. Az anyagcsere-aktiválásra más fajok, szövetek, poszt-mitokondriális frakciók vagy eljárások használata is alkalmas lehet.
Vizsgálati körülmények
A leggyakrabban alkalmazott törzs a diploid D4, D5, D7 és JD1 jelzésű törzsek. Más törzsek is megfelelőek lehetnek.
A túlélő sejtek és a mitotikus rekombináció gyakoriságának meghatározásához a megfelelő tenyésztési tápoldatokat kell alkalmazni.
Pozitív, kezeletlen és oldószeres kontrollokat egyidejűleg kell alkalmazni. Minden egyes rekombinációs végponthoz a megfelelő pozitív kontrollvegyül eteket kell használni.
A vizsgált anyagnak legalább öt, egyenletesen elosztott koncentrációját kell alkalmazni. A figyelembe veendő tényezők közé tartozik a citotoxicitás és az oldhatóság. A legalacsonyabb koncentráció nem befolyásolhatja a sejtek életképességét. Mérgező anyagoknál a legnagyobb vizsgált koncentráció nem csökkentheti a túlélési arányt 5–10 %-ot meghaladó mértékben. Vízben viszonylag rosszul oldódó anyagokat a megfelelő eljárások alkalmazásával oldhatóságuk határáig kell vizsgálni. A vízben jól oldódó és nem mérgező anyagok felső koncentrációját esetenként kell meghatározni.
A sejteket nyugalmi, nem osztódó állapotban vagy osztódáskor kell a vizsgált anyaggal legfeljebb 18 órán keresztül kezelni. Mindazonáltal a hosszú kezelési idők alatt a sejtkultúrát mikroszkóppal kell vizsgálni, hogy nem képződtek-e spórák, amelyek jelenléte érvénytelenné teszi a vizsgálatot.
A lemezeket négy-hét napig 28–30 oC hőmérsékleten, sötétben kell inkubálni. A mitotikus átkereszteződés révén képződött vörös és rózsaszín homozigóta szektorok kimutatására használt lemezeket még további egy vagy két napig kell hűtve (körülbelül 4 oC-on) tartani a számlálás előtt a megfelelő, pigmentált telepek kifejlődése érdekében.
Általánosan elfogadott, normál spontán mitotikus rekombinációs gyakorisággal rendelkező szubkultúrákat kell használni.
A génmutáció révén keletkezett prototrófok, illetve a sejtéletképesség vizsgálatára valamennyi koncentráció esetében legkevesebb három lemezt kell egyidejűleg alkalmazni. A mitotikus átkereszteződés által létrehozott recesszív homozigózis vizsgálatakor azonban meg kell növelni a lemezek számát, hogy megfelelő mennyiségű telepet kapjunk.
A kísérlet végrehajtása
A S.cerevisiae törzsek kezelését rendszerint folyékony közeges eljárással kell végezni, amely stabil vagy növekedési fázisban levő sejteket alkalmaz. Az induló vizsgálatokat osztódó sejteken kell végezni: folyamatos rázás mellett 1-5 × 107 sejt/ml koncentrációjú élesztőgombát kell kezelni a vizsgált anyaggal legfeljebb 18 órán át, 28–37 oC hőmérsékleten; ha szükséges, a megfelelő mennyiségben anyagcsere-aktiváló rendszert is adunk hozzá kezelés közben.
A kezelés végén a sejteket centrifugálni kell, ki kell mosni, és megfelelő táptalajon szét kell teríteni. Inkubáció után a lemezeken meg kell számolni a túlélő sejteket és a génmutáció kialakulását.
Ha az első vizsgálat negatív eredményt ad, egy második meghatározást is kell végezni, stabil, nem osztódó sejtek felhasználásával. Ha az első vizsgálat pozitív, azt egy megfelelő független kísérlettel kell megerősíteni.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, megadva a megszámolt telepek számát, a rekombinánsok számát, a túlélési arányt és a rekombinációs gyakoriságot.
Valamennyi eredményt független vizsgálatokkal kell megerősíteni.
Az eredményeket megfelelő statisztikai módszerrel kell értékelni.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a felhasznált törzs, |
|
— |
a vizsgálat körülményei: stabil, nem osztódó állapotú vagy osztódó sejtek, a tápfolyadékok összetétele, az inkubációs hőmérséklet és időtartam, az anyagcsere-aktiváló rendszer, |
|
— |
kezelési körülmények: koncentrációk, a kezelési eljárás és időtartama, a kezelési hőmérséklet, a pozitív és negatív kontrollok, |
|
— |
a megszámolt telepek mennyisége, a rekombinánsok száma, a túlélési arány és a rekombinációs gyakoriság, a dózis-hatás összefüggés, ha alkalmas, az adatok statisztikai értékelése, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.17. MUTAGENITÁS – IN VITRO GÉNMUTÁCIÓ-VIZSGÁLAT EMLŐSSEJTEKEN
1. MÓDSZER
E módszer megfelel az OECD TG 476-nak, in vitro génmutáció-vizsgálat emlőssejteken (1977).
1.1. BEVEZETÉS
Az in vitro génmutáció-vizsgálat emlőssejteken kémiai anyagok által előidézett génmutációk észlelésére használható. Alkalmas sejtvonalak például az L5178Y egér limfomasejtek, a CHO, CHO-AS52-es és V79-es kínai hörcsög sejtvonalak és a TK6-os emberi limfoblasztoid törzsek (1). E törzsekben a legáltalánosabban használt genetikai végpontok a mutációt a timidin kinázban (TK) hipoxantin-guanin foszforibozil-transzferázban (HPRT) és a xantin-guanin foszforibozil-transzferáz (XPRT) transz-génjében mérik. A TK, HPRT és XPRT mutáció vizsgálatok a genetikai események különböző spektrumát észlelik. A TK és XPRT autosom helye lehetővé teheti az X-kromoszómákon a HPRT helyen nem észlelt genetikai események (például nagy delíciók) észlelését (2), (3), (4), (5), (6).
Az emlőssejteken végzett in vivo sejt génmutáció vizsgálatban megállapodott sejtvonalak és törzsek tenyészetei használhatók. A felhasznált sejtek a tenyészetben való növekedési képesség és a spontán mutációs gyakoriság stabilitása alapján kerülnek kiválasztásra.
Az in vitro végrehajtott vizsgálatokhoz rendszerint a metabolikus aktiválás valamilyen exogén forrásának használata szükséges. E metabolikus aktiváló rendszer nem tudja teljes mértékben utánozni az emlős in vivo körülményeket. Ki kell szűrni azon körülményeket, amelyek fennállása esetén olyan pozitív eredmények születnek, amelyek nem tükrözik a belső mutációt előidéző képességet és valószínűleg a pH, ill. az ozmolalitás változásából vagy a magas citotoxicitási szintből származnak (7).
E vizsgálat azon anyagok kiszűrésére használható, amelyek mutációt idézhetnek elő és rákot okozhatnak emlősállatok esetében. Az e vizsgálatban pozitív eredményt adó számos vegyület emlősállatok esetében rákkeltő vegyület; azonban nincs tökéletes korreláció az itt ismertetett vizsgálat és a rákkeltő képesség között. A korreláció függ a vizsgált anyag kémiai osztályától és egyre több bizonyíték van arra, hogy léteznek olyan karcinogén anyagok, amelyeket e vizsgálat nem észlel, mivel úgy tűnik, hogy más, nem genotoxikus mechanizmusokon keresztül vagy olyan mechanizmusokon keresztül fejtik ki a hatásukat, amelyek nincsenek jelen baktériumokban (6).
Lásd még az Általános bevezetés B részét is.
1.2. FOGALOMMEGHATÁROZÁSOK
Előre/oda (forward) mutáció: a mutáns alak szülőktől származó típusától eltérő olyan génmutáció, amely a kódolt protein enzimaktivitásának változását vagy elvesztését eredményezi.
Báziscserét okozó mutagének: azok az anyagok, amelyek egy vagy több bázispár szubsztitúcióját okozzák a DNS-ben.
Frameshift mutagének: azok az anyagok, amelyek egy vagy több bázispár addícióját vagy delícióját okozzák a DNS molekulához vagy molekulából.
Fenotípusos expressziós idő: z az időtartam, amely során a meg nem változott (eredeti) géntermékek kiürülnek az újonnan mutálódott sejtekből.
Mutációs gyakoriság: a megfigyelt mutáns sejtek aránya az életképes sejtek számával osztva.
Relatív össznövekedés: a sejtek számának növekedése az idő függvényében a sejtek kontrollpopulációjával összehasonlítva; ez a negatív kontrollhoz viszonyított szuszpenziós növekedés és a negatív kontrollhoz viszonyított klónképző készség szorzata.
Relatív szuszpenziós növekedés: a sejtszám növekedése az expressiós időtartam során a negatív kontrollhoz viszonyítva.
Életképesség: a kezelt sejtek klónozási hatékonysága szelektív körülmények között, szelektív médiumba való leültetés idején, az expressziós időszak után.
Túlélési ráta: a kezelt sejtek klónképző készsége a kezelési időszak végén; a túlélést rendszerint a kontroll sejtpopuláció túléléséhez viszonyítva fejezik ki.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A TK+/–> TK–/– mutáció miatt timidin kináz deficiens sejtek ellenállnak a pirimidin bázisanalóg trifluoro-timidin (TFT) citotoxikus hatásainak. A timidin-kináz proficiens sejtek érzékenyek a TFT-re, ami a celluláris metabolizmus gátlását okozza, és megállítja a további sejtosztódást. Így tehát a mutáns sejtek képesek sejtburjánzásra TFT jelenlétében, míg a normál sejtek, amelyek timidin-kinázt tartalmaznak, nem képesek erre. Ehhez hasonlóan, a HPRT vagy XPRT deficiens sejtek 6-thioguaninnal (TG) vagy 8-azaguaninnal (AG) szembeni rezisztencia alapján választhatók ki. A vizsgált anyag tulajdonságait gondosan szemügyre kell venni, ha bázisanalógot vagy a szelektív ágenshez hasonló vegyületet vizsgálunk az emlőssejt génmutáció vizsgálatok valamelyikében. Például megvizsgáljuk a vizsgált anyag által gyaníthatóan okozható szelektív toxicitást a mutáns és nem mutáns sejtek tekintetében. Így kell megerősíteni a kiválasztó rendszer/hatóanyag megfelelőségét a szelektív ágenshez szerkezetileg hasonló kémiai anyagok vizsgálatakor (8).
Szuszpenzióban vagy egy rétegben növő tenyészetben (monolayer) lévő sejteket kezelünk a vizsgált anyaggal, metabolikus aktiválással és anélkül, megfelelő időtartamig, a citotoxicitás meghatározására és a fenotipusos expresszió lehetővé tételére a mutáns kiválasztása előtt (9), (10), (11), (12), (13). A citotoxicitást rendszerint a kezelési időtartam után a tenyészetek relatív klónképző készségnek (túlélési ráta) vagy relatív össznövekedésnek mérésével lehet meghatározni. A kezelt tenyészeteket elegendő időtartamig, amely a kiválasztott lokuszok és sejttípusok jellemzője, tartjuk a tápfolyadékban az előidézett mutációk közel optimális fenotipusos expressziójának lehetővé tételére. A mutációs gyakoriságot úgy határozzuk meg, hogy leültetünk ismert számú sejtet a szelekciós ágenst tartalmazó tápfolyadékba a mutáns sejtek kimutatására, valamint a szelekciós ágenst nem tartalmazó tápfolyadékban lévő ismert számú sejtre a klónképző készség (életképesség) meghatározására. Megfelelő inkubációs idő után megszámolják a telepeket. A mutációs gyakoriságot a szelektív médiumban lévő mutáns telepek és a nem szelektív táptalajban lévő telepek számából határozzák meg.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. Előkészületek
1.4.1.1. Sejtek
Különböző sejttípusok állnak rendelkezésre e vizsgálathoz, ilyenek például az L5178Y, CHO, CHO-AS52, V79 vagy TK6-os sejtek szubklónjai. Az e vizsgálatban használt sejttípusoknak bizonyítottan érzékenyeknek kell lenniük a kémiai mutagén anyagokra, magas klónképző készséggel és alacsony spontán mutációs gyakorisággal kell rendelkezniük. A sejteket ellenőrizni kell mikoplazma-szennyeződés szempontjából, és nem szabad használni azokat, ha szennyezettek.
A vizsgálatot úgy kell megtervezni, hogy előre meghatározott érzékenységű és hatásosságú legyen. A sejtek számának, tenyészeteknek és a használt vizsgált anyag koncentrációinak e meghatározott paramétereket kell tükrözniük (14). A kezelést túlélők és az e vizsgálatban az egyes szakaszokban használt életképes sejtek minimális számának a spontán mutációs gyakoriságon kell alapulnia. Általános iránymutatás, hogy olyan sejtszámot kell használni, amely legalább 10-szerese a spontán mutációs gyakoriság inverzének. Azonban ajánlatos legalább 106 sejt használata. A használt sejtrendszerre vonatkozó megfelelő történeti adatoknak kell rendelkezésre állniuk a vizsgálat ellentmondásmentességének igazolására.
1.4.1.2. Tápfolyadék és tenyésztési körülmények
Megfelelő tápfolyadékot és inkubációs körülményeket (tenyésztő edények, hőmérséklet, CO2 -koncentráció és páratartalom) kell biztosítani. A tápfolyadékot az e vizsgálatban használt szelekciós rendszereknek és sejttípusnak megfelelően választják ki. Olyan inkubációs körülményeket kell létrehozni, hogy biztosítva legyen a sejtek növekedése az expressziós időszak során és mind a mutáns, mind a nem mutáns sejtek kolóniaképzése optimális legyen.
1.4.1.3. Tenyészetek előkészítése
A sejteket törzstenyészetekről kell felszaporítani, leültetni tápfolyadékba és 37 oC hőmérsékleten inkubálni. A tenyészeteket, mielőtt e vizsgálatban felhasználnák, lehet hogy meg kell tisztítani az előzetesen már létező mutáns sejtektől.
1.4.1.4. Metabolikus aktiválás
A sejteket a vizsgált anyaggal kezelik, mind megfelelő metabolikus aktiváló rendszer jelenlétében, mind anélkül. A legáltalánosabban használt rendszer a kofaktorral kiegészített posztmitokondriális frakció (S9), amelyet enziminducerrel, ilyen például az Aroclor 1254 (15), (16), (17), (18), vagy a fenobarbiturát és β-naftoflavon (19), (20) kombinációjával kezelt rágcsálók májából készítettek.
A posztmitokondriális frakciót rendszerint 1–10 térfogatszázalék koncentráció tartományban használják a végtérfogatban. Valamely metabolikus aktiváló rendszer kiválasztása és állapota függhet a vizsgálatra kerülő kémiai anyag osztályától. Meghatározott esetekben megfelelőnek bizonyulhat a posztmitokondriális frakció egynél több koncentrációjának használata.
Számos fejlesztés, beleértve a speciális aktiváló enzimeket eltávolító, genetikailag szerkesztett törzsek létrehozását is, biztosíthatja az endogén aktiválás lehetőségét. A használt törzsek kiválasztását tudományosan indokolni kell (például a vizsgált anyag anyagcseréjéhez a citokróm P450-es izoenzim alkalmazásának relevanciájával).
1.4.1.5. A vizsgált anyag/előkészítés
A szilárd vizsgált anyagokat fel kell oldani vagy szuszpendálni megfelelő oldószerekben, vagy ha szükséges, hígítani kell a baktérium kezelése előtt. A folyékony vizsgált anyagok közvetlenül hozzáadhatók a vizsgált rendszerekhez és/vagy hígíthatók kezelés előtt. Friss készítményeket kell használni, kivéve ha a stabilitási adatok a tárolás elfogadhatóságát jelzik.
1.4.2. Vizsgálati körülmények
1.4.2.1. Oldószer
Oldószerként nem alkalmazható olyan anyag, amely gyaníthatóan kémiai reakcióba lép a vizsgált anyaggal, és összeegyeztethetőnek kell lennie a baktérium túlélésével és az S9-es aktivitással. Ha a jól ismert oldószertől eltérő oldószereket használnak, ezek használatát alá kell támasztani a kompatibilitásukat jelző adatokkal. Elsőként valamilyen vizes oldószer használatát kell megfontolni. Vízben instabil anyagok vizsgálatakor a használt szerves oldószereknek vízmenteseknek kell lenniük. A víz valamilyen molekulaszűrő alkalmazásával távolítható el.
1.4.2.2. Expozíciós koncentrációk
A legnagyobb koncentráció meghatározásakor megfontolandó kritériumok közé a következők tartoznak: citotoxicitás, a vizsgálati rendszerben való oldhatóság és pH-érték vagy ozmolalitás változások.
A citotoxicitást a fő kísérletben metabolikus aktiválással és anélkül határozzák meg a sejtintegritás és szaporodás olyan megfelelő mutatóinak segítségével, mint például a relatív klónképző készség (túlélési ráta) vagy a relatív össznövekedés. Hasznosnak bizonyulhat a citotoxicitás és az oldékonyság meghatározása előzetes kísérletben.
Legalább négy elemezhető koncentrációt kell használni. Ahol létezik citotoxicitás, e koncentrációknak át kell fogniuk egy a maximálistól a már csak kissé vagy az egyáltalán nem toxikusig terjedő tartományt; ez rendszerint azt fogja jelenteni, hogy a koncentrációszinteket nem nagyobb, mint egy 2 és √10 közötti tényező választja el egymástól. Ha a legnagyobb koncentráció a citotoxicitáson alapul, ennek körülbelül 10–20 % (de nem kevesebb, mint 10 %) relatív túlélést (relatív klónképző készséget) vagy relatív össznövekedést kell eredményeznie. Viszonylag nem citotoxikus anyagok esetében a legnagyobb vizsgált koncentrációnak 5 mg/ml-nek, 5 μl/ml-nek vagy 1,01 M-nak, amelyik ezek közül a legkisebb, kell lennie.
A rosszul oldódó anyagokat a tenyésztési körülmények melletti oldékonyságuk határáig vagy azon túl kell vizsgálni. Meg kell határozni az oldhatatlanság bizonyítékát abban a végső kezelési médiumban, amely hatásainak a sejtek ki vannak téve. Hasznosnak bizonyulhat az oldékonyság értékelése a kezelés kezdetén és végén, mivel az oldékonyság változhat a vizsgálati rendszerben az expozíció során a sejtek, S9, és a szérum stb. jelenléte miatt. Az oldódás hiánya szabad szemmel észlelhető. A kicsapódás nem befolyásolhatja az értékelést.
1.4.2.3. Kontrollanyagok
Minden kísérletben negatív és pozitív (oldószer/vivőanyag) kontrollanyagot használnak egyidejűleg, metabolikus aktiválással és anélkül. Metabolikus aktiválás alkalmazásakor a pozitív kontroll kémiai anyagnak olyannak kell lennie, amely a mutagén reakció kiváltásához aktiválást igényel.
A következő pozitív kontrollanyagok jöhetnek szóba:
|
Aktivációs körülmények |
Lokusz |
Anyag |
CAS-szám |
EINECS-szám |
|
Exogén metabolikus aktiválás nélkül |
HPRT |
Etil-metán-szulfonát |
62-50-0 |
200-536-7 |
|
N-etil-N-nitrozo-karbamid |
759-73-9 |
212-072-2 |
||
|
TK (kicsi és nagy telepek) |
Metil-metán-szulfonát |
66-27-3 |
200-625-0 |
|
|
XPRT |
Etil-metán-szulfonát |
62-50-0 |
200-536-7 |
|
|
N-etil-N-nitrozo-karbamid |
759-73-9 |
212-072-2 |
||
|
Exogén metabolikus aktiválással |
HPRT |
3 -Metil -kol antrén |
56-49-5 |
200-276-4 |
|
N-nitrozo-dimetil-amin |
62-75-9 |
200-549-8 |
||
|
7,12-Dimetil-benz[a]antracén |
57-97-6 |
200-359-5 |
||
|
TK (kicsi és nagy telepek |
Ciklofoszfamid |
50-18-0 |
200-015-4 |
|
|
Ciklofoszfamid monohidrát |
6055-19-2 |
|
||
|
Benz[a]pirén |
50-32-8 |
200-028-5 |
||
|
3 -Metil -kol antrén |
56-49-5 |
200-276-5 |
||
|
XPRT |
N-nitrozo-dimetil-amin (magas S9-es szintekhez) |
62-75-9 |
200-549-8 |
|
|
Benz[a]pirén |
50-32-8 |
200-028-5 |
Használhatók más megfelelő pozitív kontroll referenciaanyagok, például ha valamely laboratórium rendelkezik 5-Bróm 2'-dezoxi-uridinre vonatkozó (Cas-száma 59-14-3, Einecs-száma 200-415-9) történeti adatbázissal, e referenciaanyag is használható. Azon pozitív kontroll kémiai anyagok használatát is meg kell fontolni, amelyek a vizsgált anyaggal azonos kémiai osztályba tartoznak, ha rendelkezésre állnak ilyenek.
Használni kell negatív kontrollanyagokat, amelyek csak oldószert vagy vivőanyagot tartalmaznak a kezelési médiumban, és a kezelésük ugyanolyan módon történik, mint a kezelt csoportoké. Ezenkívül nem kezelt kontrollokat is használni kell, kivéve, ha léteznek olyan történeti kontrolladatok, amelyek azt mutatják, hogy semmilyen káros vagy mutagén hatása nincs a kiválasztott oldószernek.
1.4.3. A kísérlet végrehajtása
1.4.3.1. Kezelés a vizsgált anyaggal
A proliferáló sejteket kezelni kell a vizsgált anyaggal, mind metabolikus aktiválással, mind anélkül. Az expozíciónak alkalmas időtartamig kell tartania (ez rendszerint 3–6 óra). Az expozíciós idő kiterjedhet egyetlen vagy több sejtciklusra.
Minden egyes vizsgált koncentrációhoz két párhuzamos vagy egy (szimpla) kezelt tenyészet használható. Szimpla tenyészetek használatakor meg kell növelni a koncentrációk számát az elemzéshez megfelelő számú tenyészet biztosítása érdekében (legalább 8 elemezhető koncentráció létezzen). Két párhuzamos negatív (oldószer) kontrolltenyészetet kell használni.
Gázok vagy illékony anyagok megfelelő módszerekkel, például légmentesen zárt edényekben vizsgálhatók (21), (22).
1.4.3.2. A túlélési ráta, az életképesség és mutációs gyakoriság meghatározása
Az expozíciós időszak végén a sejteket le kell mosni, begyűjteni és leültetni a klónképző készség meghatározása és a mutáns fenotípusok eltávolításának érdekében. A citotoxicitás mérését a tenyészetek relatív klónképző készségének (túlélési ráta) vagy a relatív össznövekedésének meghatározásával, rendszerint a kezelési időtartam után kell megkezdeni.
Minden egyes lokusznak szüksége van egy meghatározott minimális időre az újonnan indukált mutánsok közel optimális fenotípusos kifejlődéséhez (a HPRT és XTRT legalább 6–8 napot és a TK legalább 2 napot igényel). A sejteket szelektív ágenst tartalmazó tápfolyadékban kell tenyészteni a mutánsok számának, illetve a klónképző készség hatékonyságának meghatározása céljából. Az életképesség (amelyet a mutációs gyakoriság kiszámítására használunk) mérése az expressziós idő végén kezdődik nem szelektív médiumba való ültetéssel.
Ha a vizsgált anyag az L5178Y TK+/– vizsgálatban pozitív eredményt ad, telepméretmegállapítást kell végezni a vizsgált tenyészetek közül legalább egynél (a legnagyobb pozitív koncentrációnál) és a negatív és pozitív kontrolloknál. Ha a vizsgált anyag az L5178Y TK+/– vizsgálatban negatív eredményt ad, a telepméret-megállapítást a negatív és pozitív kontrollokon kell végrehajtani. A TK6TK+/–-t használó vizsgálatokban is végrehajtható telepméret megállapítás.
2. ADATOK
2.1. EREDMÉNYEK KEZELÉSE
Meg kell adni a citotoxicitást és az életképességet, telepszámokat és mutációs gyakoriságot a kezelt és kontrolltel epek tekintetében. Ha az L5178Y TK+/– vizsgálat pozitív eredményt ad, a telepeket a kis és nagy telepek kritériuma segítségével értékelik a vizsgált anyag legalább egy koncentrációja (legnagyobb pozitív koncentráció) mellett és a negatív és pozitív kontroll esetében. Már részletesen megvizsgálták mind a nagy, mind a kis telepmutánsok molekuláris és citogenetikus természetét (23) (24). A TK+/– vizsgálatban a telepeket a normálisan növekvő (nagy) és lassan növekvő (kis) telepek kritériuma segítségével értékelik (25). A jelentős mértékű genetikai károsodást szenvedett mutáns sejtek esetében meghosszabbodtak a kétszerezési idők, és így ezek kis telepeket alkotnak. E károsodás jellemzően a teljes génveszteségektől a kariotípusosan felismerhető kromoszóma-rendellenességekig terjed. A kis telepmutánsok létrejötte nagymértékű kromoszóma-rendellenességeket előidéző kémiai anyagokkal volt kapcsolatos (26). A kevésbé súlyosan érintett mutáns sejtek a szülősejtekhez hasonló ütemben növekednek és nagy telepeket alkotnak.
Meg kell adni a túlélési rátát (relatív klónképző készség) vagy a relatív össznövekedést. A mutációs gyakoriságot a mutáns sejtek száma és a túlélő sejtek száma hányadosaként kell kifejezni.
Fel kell jegyezni az egyes tenyészetek adatait. Ezen adatokat táblázat formájában kell összefoglalni.
A nyilvánvalóan pozitív reakció igazolása nem szükséges. A többféleképpen magyarázható eredményeket további, lehetőleg a kísérleti körülmények módosításával végrehajtott vizsgálattal kell tisztázni. A negatív eredményeket külön kísérletekkel kell megerősíteni. Azon esetekben, ahol nem tekintik szükségesnek a negatív eredmények megerősítését, meg kell indokolni e döntést. Megfontolandó az utólagos ellenőrző kísérletekben a vizsgált körülmények tartományának kiterjesztése érdekében a vizsgálati paraméterek módosítása. A módosítható vizsgálati paraméterek, többek között, a koncentráció intervallumok és a metabolikus aktiválás.
2.2. EREDMÉNYEK ÉRTÉKELÉSE ÉS ÉRTELMEZÉSE
Különböző kritériumok léteznek a pozitív eredmény meghatározására, ilyen például a mutációs gyakoriság koncentrációval kapcsolatos növekedése vagy reprodukálható növekedése. Először meg kell vizsgálni az eredmények biológiai jelentőségét. Statisztikai módszerek használhatók a vizsgálati eredmények kiértékelésének elősegítésére. Valamely pozitív reagálás tekintetében nem szabad, hogy a statisztikai szignifikancia legyen az egyetlen meghatározó tényező.
E rendszerben nem mutagén anyagnak tekintendő az a vizsgált anyag, amelyhez tartozó eredmények nem elégítik ki a fenti kritériumokat.
Bár a legtöbb kísérlet egyértelműen pozitív vagy negatív eredményeket hoz, ritka esetben előfordul, hogy a rendelkezésre álló adatok alapján nem lehet a vizsgált anyag aktivitásával kapcsolatban egyértelműen állást foglalni. Előfordul az is, hogy az eredmények többféleképpen magyarázhatók vagy megkérdőjelezhetők maradhatnak tekintet nélkül arra, hogy hány alkalommal ismételjük meg a kísérletet.
Az emlős in vitro sejt génmutáció vizsgálatból kapott pozitív eredmények azt jelzik, hogy a vizsgált anyag génmutációkat idéz elő a felhasznált, tenyésztett emlőssejtekben. A reprodukálható pozitív koncentráció-hatás viszonynak van a legnagyobb jelentősége. A negatív eredmények azt jelzik, hogy a vizsgálati körülmények között a vizsgált anyag nem idéz elő génmutációkat a felhasznált, tenyésztett emlőssejtekben.
3. VIZSGÁLATI JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentés tartalmazza a következő információkat:
|
|
Oldószer/vivőanyag:
|
|
|
Sejtek:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények tárgyalása. |
|
|
Összefoglaló megállapítások. |
4. SZAKIRODALOM
|
(1) |
Moore, M. M., DeMarini, D. M., DeSerres, F. J. and Tindal, K. R. (eds.) (1987), Banbury Report 28; Mammalian Cell Mutagenesis, Cold Spring Harbor Laboratory, New York |
|
(2) |
Chu, E. H. Y. and Mailing H. V. (1968), Mammalian Cell Genetics. II. Chemical Induction of Specific Locus Mutations in Chinese Hamster Cells In vitro, Proc. Natl. Acad. Sci. USA, 61, pp. 1306-1312 |
|
(3) |
Liber, H. L. and Thilly, W. G. (1982), Mutation Assay at the Thymidine Kinase Locus in Diploid Human Lymphoblasts, Mutation Res. 94, pp. 467-485 |
|
(4) |
Moore, M. M., Harington-Brock, K., Doerr, C. L. and Dearfield, K. L. (1989), Differential Mutant Quantitation at the Mouse Lymphoma TK and CHO HGPRT Loci, Mutagenesis, 4, pp. 394-403 |
|
(5) |
Aaron, C. S., and Stankowski, Jr. L. F., (1989), Comparison of the AS52/XPRT and the CHO/HPRT Assays: Evaluation of Six Drug Candidates, Mutation Res. 223, pp. 121-128 |
|
(6) |
Aaron, C. S., Bolcsfoldi, G, Glatt, H. R., Moore, M., Nishi, Y., Stankowski, Jr. L. F., Theiss, J. and Thompson, E. (1994), Mammalian Cell Gene Mutation Assays Working Group Report. Report of the International Workshop on Standardisation of Genotoxicity Test Procedures. Mutation Res. 312., pp. 235-239 |
|
(7) |
Scott, D., Galloway, S. M., Marshall, R. R, Ishidate, M., Brusick, D., Ashby, J. and Myhr, B. C. (1991), Genotoxicity Under Extreme Culture Conditions. A report from ICPEMC Task Group 9, Mutation Res. 257, pp. 147-204 |
|
(8) |
Clive, D., McCuen, R., Spector, J. F. S., Piper, C. and Mavournin, K. H. (1983), Specific Gene Mutations in L5178Y Cells in Culture. A Report of the U. S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 115, pp. 225-251 |
|
(9) |
Li, A. P., Gupta, R. S., Heflich, R. H. and Wasson, J. S. (1988), A Review and Analysis of the Chinese Hamster Ovary/Hypoxanthine Guanine Phosphoribosyl Transferase System to Determine the Mutagenicity of Chemical Agents: A Report of Phase III of the U. S. Environmental Protections Agency Gene-Tox Program, Mutation Res., 196, pp. 17-36 |
|
(10) |
Li. A. P., Carver, J. H., Choy, W. N., Hsie, A. V., Gupta, R. S., Loveday, K. S., ÓNeill, J. P., Riddle, J. C, Stankowski, L. F. Jr. and Yang, L. L. (1987), A Guide for the Performance of the Chinese Hamster Ovary Cell/Hypoxanthine-Guanine Phosphoribosyl Transferase Gene Mutation Assay, Mutation Res,. 189, pp. 135-141 |
|
(11) |
Liber, H. L., Yandell, D. W. and Little, J. B. (1989), A Comparison of Mutation Induction at the TK and HPRT Loci in Human Lymphoblastoid Cells: Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK Locus, Mutation Res. 216, pp. 9-17 |
|
(12) |
Stankowski, L. F. Jr., Tindal., K. R. and Hsie, A. W. (1986), Quantitative and Molecular Analyses of Ethyl Methanosulphonate – and ICR 191-Induced Molecular Analyses of Ethyl Methanosulphonate – and ICR 191 Induced Mutation in AS52 Cells, Mutation Res. 160, pp. 133-147 |
|
(13) |
Turner, N. T., Batson, A. G. and Clive, D. (1984), Procedure for the L5178Y/TK+/– -TK+/– Mouse Lymphoma Cell Mutagenicity Assay, in: Kilbey, B. J. et al (eds.) Handbook of Mutagenicity Test Procedures, Elsevier Science Publishers, New York, pp. 239-268 |
|
(14) |
Arlett, C. F., Smith, D. M., Clarke, G M., Green, M. H. L., Cole, J., McGregor, D. B. and Asquith S. C. (1989), Mammalian Cell Gene Mutation Assays Based Upon Colony Formation, in: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D. J., ed., Cambridge University Press, pp. 66-101 |
|
(15) |
Abbondandolo, A., Bonatti, S., Corti, G., Fiorio, R.., Loprieno, N. and Mazzaccoro, A. (1977), Induction of 6-Thioguanine-Resistant Mutants in V79 Chinese Hamster Cells by Mouse-Liver Microsome-Activated Dimethylnitrosamine, Mutation Res. 46, pp. 365-373 |
|
(16) |
Ames, B. N., McCann, J. and Yamasaki, E. (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test, Mutation Res. 31, pp. 347-364 |
|
(17) |
Clive, D., Johnson, K. O., Spector, J. F. S., Batson A. G and Brown M. M. M. (1979), Validation and Characterisation of the L5178Y/TK+/– – Mouse Lymphoma Mutagen Assay System, Mutat. Res. 59, pp. 61-108 |
|
(18) |
Maron, D. M. and Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation Res. 113. pp. 173-215 |
|
(19) |
Elliott, B. M., Combes, R. D., Elcombe, C. R., Gatehouse, D. G, Gibson, G. G, Mackay, J. M. and Wolf, R. C. (1992), Alternatives to Aroclor 1254-Induced S9 in: In vitro Genotoxicity Assays, Mutagenesis 7, pp. 175-177 |
|
(20) |
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A Safe Substitute for Polychlorinated Biphenyls as an Inducer or Metabolic Activation Systems, in: In vitro Metabolic Activation in Mutagenesis Testing, de Serres, F. J. Fouts, J. R., Bend, J. R. and Philpot, R. M. (eds). Elsevier, North Holland, pp. 85-88 |
|
(21) |
Krahn, D. F., Barsky, F. C. and McCooey, K. T. (1982), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, in: Ticce, R. R., Costa, D. L., Schaich, K. M. (eds), Genotoxic Effects of Airbone Agents, New York, Plenum, pp. 91-103 |
|
(22) |
Zamora, P. O., Benson, J. M., Li, A. P. and Brooks, A. L. (1983), Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay, Environmental Mutagenesis, 5, pp. 795-801 |
|
(23) |
Applegate, M. L., Moore, M. M., Broder, C. B. Burrell, A. and Hozier, J. C. (1990), Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells, Proc. Natl. Acad. Sci, USA , 87, pp. 51-55 |
|
(24) |
Moore, M. M., Clive, D. Hozier, J. C, Howard, B. E., Batson, A. G, Turner, N. T. and Sawyer, J. (1985), Analysis of Trufluoronthymidine, Resistant (TFTr) Mutants of L5178Y/TK+/-Mouse Lymphoma Cells, Mutation Res. 151, pp. 161-174 |
|
(25) |
Yandell, D. W., Dryja, T. P. and Little, J. B. (1990), Molecular Genetic Analysis of Recessive Mutations at a Heterozygous Autosomal Locus in Human Cells, Mutation Res. 229, pp. 89-102 |
|
(26) |
Moore, M. M. and Doerr, C. L. (1990), Comparison of Chromosome Aberration Frequency and Small Colony TK-Deficient Mutant Frequency in L5178Y/TK+/– – 3.7.2C Mouse Lymphoma Cells, Mutagenesis, 5, pp. 609-614 |
B.18. DNS-KÁROSODÁS ÉS -REPARÁCIÓ – NEM TERVEZETT DNS-SZINTÉZIS (UNSCHEDULED DNA SYNTHESIS, UDS) – EMLŐSSEJTEK IN VITRO
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A nem szabályszerű DNS-szintézis- („unscheduled DNA synthesis”, UDS) vizsgálat a kémiai vagy fizikai hatással indukált károsodás területéről kimetszett és eltávolított DNS-szakasz helyreállításához szükséges DNS-szintézist vizsgálja. A meghatározás alapja a tríciummal jelölt timidin (3H-TdR) beépülése olyan emlőssejtek DNS-molekuláiba, amelyek nem a sejtciklus S fázisában vannak. A 3H-TdR felvétele a kezelt sejtek DNS-molekuláiba autoradiográfiás technikával vagy folyadékszcintillációval (LSC = liquid scintillation counting) mérhető. Azt az esetet kivéve, amikor primer patkány máj sejtet alkalmaznak, a kultúrában tenyésztett emlőssejteket exogén anyagcsere-aktiváló rendszer jelenlétében, illetve hiányában kezelik a vizsgált anyaggal. Az UDS folyamata in vivo rendszerekben is mérhető.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Előkészületek
A vizsgált anyagokat, a kontroll-, illetve a referenciaanyagokat a sejtek kezelését megelőzően tápfolyadékban kell előkészíteni, vagy a megfelelő vivőanyagban feloldani, illetve szuszpendálni, majd a tápfolyadékban tovább hígítani a vizsgálathoz használatos mértékben. A vivőanyag végső koncentrációja a kultúrában nem befolyásolhatja a sejtek életképességét.
A vizsgálathoz patkánymájsejtek, illetve emberi limfociták primer kultúrái vagy stabil sejtvonalak (például emberi diploid fibroblasztok) használhatók.
A sejteket a vizsgált vegyület hatásának megfelelő emlősanyagcsere-aktiváló rendszer jelenlétében és hiányában is ki kell tenni.
Vizsgálati körülmények
Legalább két kultúra kell minden vizsgálati ponton az autoradiogáfiás mérésekhez és hat kultúra (vagy ennél kevesebb, ha tudományosan megindokolható) az LSC UDS-meghatározáshoz.
Minden vizsgálathoz alkalmazni kell egyidejűleg pozitív és negatív (kezeletlen és/vagy vivőanyag-) kontrollt, metabolikus aktiválással és a nélkül.
A patkánymájsejt-vizsgálat pozitív kontrolijai sorában említendő a 7,12-dimetil-benzantracén (7,12-DMBA), illetve a 2-acetilamin-fluorén (2-AAF). Stabil sejtvonalak használata esetén a 4-nitrokinolin-N-oxid (4-NQO) lehet példa a pozitív kontrollra mind az autoradiográfiás, mind a folyadékszcintillációs módszer számára metabolikus aktiválás nélkül; ha metabolikus aktiválórendszereket is alkalmazunk, az N-dimetil-nitrózamin lehet a pozitív kontroll.
A vizsgált anyagnak több, egyenletesen elosztott koncentrációját kell alkalmazni. A legnagyobb vizsgált koncentráció bizonyos fokú citotoxicitást kell, hogy mutasson. Vízben viszonylag rosszul oldódó anyagokat a megfelelő eljárások alkalmazásával oldhatóságuk határáig szükséges vizsgálni. A vízben jól oldódó és nem mérgező anyagok felső koncentrációját esetenként kell meghatározni.
A sejtkultúrák fenntartását a megfelelő tápfolyadékban, CO2-koncentráció, páratartalom és hőmérséklet mellett kell végezni. A stabil sejtvonalakat időnként ellenőrizni kell a Mycoplasma-szennyeződés szempontjából.
Metabolikus aktiválórendszert primer máj sejteken nem kell alkalmazni. A stabil sejtvonalakat és a limfocitákat a vizsgált anyaggal mind a megfelelő metabolikus aktiváló rendszer jelenlétében, mind annak hiányában kezelni kell.
A kísérlet végrehajtása
Stabil sejtvonalakat kell törzstenyészetekből (például tripszines emésztéssel vagy rázassál) létrehozni, ezeket megfelelő sűrűségben tenyésztőedényekbe kell áttenni, és 37 oC-on inkubálni.
Patkánymájsejtek rövid távú tenyészeteit úgy hozzák létre, hogy a frissen disszociált májsejteket megfelelő tápfolyadékban hagyják megtapadni a növekedési felületen.
Emberi limfocitatenyészeteket hozunk létre a megfelelő technikák alkalmazásával.
Primer patkánymájsejtek
Frissen izolált patkánymájsejteket megfelelő időn keresztül 3H-TdR-t tartalmazó tápfolyadékban kezelik a vizsgált anyaggal. A kezelési idő végén a tápfolyadékot leszívják a sejtekről, amelyeket leöblítenek, fixálnak és megszárítanak. A tárgylemezeket autoradiográfiás emulzióba merítik (vagy filmcsíkokat is használhatunk), exponálják, előhívják, megfestik és kiértékelik.
Stabil sejtvonalak és limfociták
Autoradiográfiás technikák: A sejttenyészetet a megfelelő ideig kezeljük a vizsgált anyaggal, majd ezt követően 3H-TdR-el. A kezelési idő a vizsgált anyag jellegétől, a metabolizáló rendszerek aktivitásától és a sejtek típusától függ. Az UDS maximumának észleléséhez a vizsgált anyaggal együtt vagy néhány perccel a vizsgált anyag adása után 3H-TdR-t adnak a rendszerhez. A kétféle eljárás közötti választás attól függ, van-e kölcsönhatás a vizsgált anyag és a 3H-TdR között. Az UDS és a félig konzervatív DNS-replikáció közötti különbségtétel érdekében az utóbbi például argininhiányos tápoldattal, alacsony szérumtartalommal vagy a tápoldathoz adott hidroxi-karbamiddal gátolható.
Az UDS folyadékszcintillációval történő (LSC) mérése: A vizsgált anyaggal való kezelést megelőzően a sejtek S fázisba lépését a fent leírtak szerint kell gátolni; majd az autoradiográfiás módszernél leírtak szerint kell a sejteket kezelni a vizsgált anyaggal. Az inkubációs idő végén a DNS-t kivonják a sejtekből, és meghatározzák a teljes DNS-tartalmat, illetve a 3H-TdR-beépülés mértékét.
Megjegyzendő, hogy a fenti technikák során – ha emberi limfocitákat használnak – a nem stimulált tenyészetekben a félig konzervatív DNS-replikáció gátlása szükségtelen.
Elemzés
Az UDS-nek a sejttenyészetben való meghatározásához az S-fázisú magokat nem kell számításba venni. Koncentrációnként legalább 50 sejtet számolnak. A tárgylemezeket számlálás előtt kóddal látják el. Minden lemezen több, véletlenszerűen választott, egymástól távol eső látóteret számolnak meg. A 3H-TdR beépülését a citoplazmába úgy határozzák meg, hogy minden megszámolt sejtben három, sejtmag nagyságú citoplazma-látóteret számolnak meg.
Az LSC-vel végzett UDS-meghatározások során minden koncentráció és kontroll esetében megfelelő mennyiségű tenyészetet használnak fel.
Valamennyi eredményt független vizsgálatokkal kell megerősíteni.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni.
2.1. AUTORADIOGRÁFIÁS MEGHATÁROZÁSOK
A citoplazmában megfigyelhető 3H-TdR-beépülés mértékét és a sejtmag felett található szemcsék számát külön kell feljegyezni.
Átlagos, közepes és modulált értéket használhatunk a 3H-TdR-citoplazma eloszlási mértékének, valamint a magonként látható szemcsék számának jellemzésére.
2.2. LSC-MÓDSZERREL VÉGZETT MEGHATÁROZÁSOK
Az LSC-módszerrel végzett meghatározások esetén a 3H-TdR-beépülést dpm/μg DNS-ben fejezzük ki. Az átlagos dpm/μg DNS-érték a normál szórással együtt felhasználható a beépülés eloszlásának leírására.
Az eredményeket megfelelő statisztikai módszerrel kell értékelni.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a felhasznált sejtek, a sejtek sűrűsége és a passzálások száma kezeléskor, a sejtkultúrák száma, |
|
— |
a sejtkultúrák fenntartásához használt módszerek: tápfolyadékok, hőmérséklet, szén-dioxidkoncentráció, |
|
— |
a vizsgált anyag, a vivőanyag, koncentrációik és a vizsgálathoz használt koncentrációk indokolása, |
|
— |
a felhasznált metabolikus aktiválórendszerrel kapcsolatos adatok, |
|
— |
a kezelési protokoll, |
|
— |
a pozitív és a negatív kontrollok, |
|
— |
a használt autoradiográfiás eljárás, |
|
— |
a sejtek S fázisba lépésének megakadályozására használt eljárások, |
|
— |
a DNS kivonására és a teljes DNS-tartalom meghatározására használt eljárások az LSC technika során, |
|
— |
a dózis-hatás összefüggés, ha lehetséges, |
|
— |
az eredmények statisztikai feldolgozása, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.19. IN VITRO EMLŐSSEJTTESTVÉR-KROMATIDKICSERÉLŐDÉS-(SISTER CHROMATID EXCHANGE, SCE) VIZSGÁLAT
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A testvérkromatidcsere- (SCE = Sister Chromatid Exchange) vizsgálat a megkettőződő kromoszóma két testvérkromoszóma-állománya (kromatidja) közötti reciprok DNS-csere kimutatására szolgáló, rövid távú módszer. Az SCE technika gyakorlatilag homológ lokuszok közötti DNS-replikációs termékek cseréjét jelenti. A csere feltehetően a DNS-lánc eltörését és újbóli összeforrását is magában foglalja, bár a jelenség molekuláris háttere kevéssé ismert. Az SCE jelenségének észleléséhez a testvérkromoszóma-állományok eltérő jelölésére van szükség, amely úgy valósítható meg, hogy két sejtcikluson át bróm-dezoxi-uridint (BrdU) építenek be a kromoszomális DNS-molekulába.
Az emlőssejteket in vitro, metabolikus aktiválórendszer jelenlétében, illetve a nélkül kezelik a vizsgált anyaggal, amennyiben ez megfelelő, majd a sejteket két replikációs cikluson keresztül tenyésztik BrdU-t tartalmazó tápoldatban. Az orsóképződést gátló anyaggal való kezelést (pl. kolchicin) követően, amely azt a célt szolgálja, hogy a sejteket a mitózisnak egy metafázisszerű szakaszában (c-metafázis) gyűjtse össze, a sejteket összegyűjtik, és kromoszómakészítményeket állítanak elő.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
|
— |
A vizsgálathoz primer tenyészetek (emberi limfociták) vagy stabil sejtvonalak (pl. kínaihörcsögpetefészek-sejtek) használhatók. A sejtvonalakat ellenőrizzük Mycoplasma-szennyeződés szempontjából. |
|
— |
Megfelelő tápoldatot és inkubációs feltételeket (pl. hőmérséklet, tenyésztőedény, CO2-koncentráció, páratartalom) kell biztosítani. |
|
— |
A vizsgált anyagot tápoldatban készítik el, vagy a sejtek kezelését megelőzően a megfelelő vivőanyagban oldják, illetve szuszpendálják. A vivőanyag végleges koncentrációja a tápközegben nem befolyásolhatja jelentős mértékben a sejtek életképességét, illetve szaporodását, az SCE gyakoriságára gyakorolt hatását pedig oldószeres kontrollal kell ellenőrizni. |
|
— |
A sejteket a vizsgált vegyület hatásának megfelelő anyagcsere-aktiváló rendszer jelenlétében és hiányában egyaránt ki kell tenni. A másik lehetőség, hogy belső metabolikus aktivitással rendelkező sejttípusokat használnak, ám ilyenkor az aktivitás jellegét és mértékét ismerni kell, hogy az megfeleljen a vizsgált kémiai osztálynak. |
1.6.2. Vizsgálati körülmények
Minden vizsgálati ponthoz legalább két kultúrát kell használni.
Minden vizsgálatnak pozitív kontrollként tartalmaznia kell egy közvetlenül ható vegyületet és egy metabolikus aktiválást igénylő vegyületet is; ezenkívül negatív (vivőanyag-) kontrollt is kell használni.
Néhány példa a pozitív kontrollként felhasználható anyagokra:
|
— |
közvetlenül ható vegyületek:
|
|
— |
közvetve ható vegyületek:
|
Ahol szükséges, alkalmazni lehet még egy pozitív kontrollt is, amely a vizsgált anyaggal egyező vegyületosztályba tartozik.
A vizsgált anyagnak legalább három, egyenletesen elosztott koncentrációját kell alkalmazni. A legnagyobb vizsgált koncentrációnak jelentős toxikus hatást kell kiváltania, de ezzel együtt megfelelő mértékű sejtosztódást kell lehetővé tennie. Vízben viszonylag rosszul oldódó anyagokat a megfelelő eljárások alkalmazásával oldhatóságuk határáig kell vizsgálni. A vízben jól oldódó és nem mérgező anyagok felső koncentrációját esetenként kell meghatározni.
1.6.3. A kísérlet végrehajtása
Stabil sejtvonalakat hoznak létre törzstenyészetekből (például tripszines emésztéssel vagy rázassál), ezeket megfelelő sűrűségben tenyésztőedényekbe teszik át, és 37 oC-on inkubálják. Egy sejtrétegű (monolayer) kultúrákhoz a tenyésztőedényenkénti sejtszámot úgy kell beállítani, hogy a tenyésztési időszak végén (az összegyűjtéskor) a sejtréteg folyamatossága ne haladja meg jelentősen az 50 %-os arányt. A sejteket másik lehetőségként szuszpenziós tenyészetben is tarthatják. Az emberi limfocitatenyészeteket heparinnal kezelt vérből állítják elő a megfelelő technikával, és 37 oC-on inkubálják.
Az exponenciális osztódási szakaszban lévő sejteket a vizsgált anyaggal megfelelő időn keresztül kezelik; a legtöbb esetben egy vagy két óra elegendő, de a kezelés bizonyos esetekben meg is hosszabbítható két teljes sejtciklus erejéig. A megfelelő szintű saját metabolikus aktivitással nem rendelkező sejteket a vizsgált anyaggal a megfelelő metabolikus aktiválórendszer jelenlétében, illetve a nélkül is kezelni kell. A kezelés végén a sejtek környezetéből kimossák a vizsgált anyagot, majd BrdU jelenlétében két replikációs cikluson keresztül folytatják a tenyésztést. A kezelés másik lehetősége, hogy a sejteket két teljes sejtcikluson át egyszerre kezeljük a vizsgált anyaggal és a BrdU-val.
Az emberi limfocitatenyészeteket akkor kezelik, amikor azok félszinkron állapotban vannak.
A sejtek elemzésére a kezelést követő második osztódáskor kerül sor, így biztosítják, hogy a legérzékenyebb osztódási szakaszok során fejthesse ki a vegyi anyag a hatását. Minden olyan sejttenyészetet, amelyhez BrdU-t adtunk, sötétben vagy tompa fénynél kell tartani a tenyésztési időszak végéig, hogy csökkentsük a BrdU-t tartalmazó DNS fotolízisét.
A tenyészeteket egy-négy órával a sejtek összegyűjtése előtt orsóképződést gátló vegyülettel (pl. kolchicinnel) kezeljük. Valamennyi tenyészetet külön-külön gyűjtjük be és dolgozzuk fel a kromoszómapreparáláshoz.
A kromoszómakészítményeket standard citogenetikai módszerekkel állítják elő. A lemezek megfestése az SCE-jelenség kimutatására többféle technikával is elvégezhető (pl. fluoreszcens és Giemsa-festés).
Az elemzett sejtek számát az SCE-jelenség spontán gyakorisága alapján kell meghatározni. Rendszerint minden tenyészetből legalább 25, jól szétterült metafázist elemeznek az SCE-k szempontjából. Az elemzéshez a tárgylemezeket kóddal látják el. Az emberi limfocitákban csak a 46 centromert tartalmazó metafázisokat elemezzük. Stabil sejtvonalak esetében csak a modális szám ± 2 centromert tartalmazó metafázisokat elemeznek. Fel kell tüntetni, hogy a jelzés centromerikus váltását SCE-nek vesszük-e, vagy sem. Az eredményeket további független vizsgálattal kell megerősíteni.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni. Az SCE-k számát metafázisónként és az egyes metafázisokban kimutatható SCE-k számát kromoszómánként minden kezelt és kontrolltenyészet esetében külön meg kell adni.
Az eredményeket megfelelő statisztikai módszerrel kell értékelni.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a felhasznált sejtek, sejtkultúrák fenntartásának módszere, |
|
— |
a vizsgálat körülményei: a tápoldatok összetétele, a szén-dioxid-koncentráció, a vizsgált anyag koncentrációja, a felhasznált vivőanyag, az inkubációs hőmérséklet, a kezelés időtartama, a felhasznált orsóképződést gátló vegyület, annak koncentrációja és az azzal történő kezelés időtartama, a felhasznált aktiválórendszer, a pozitív és a negatív kontrollok, |
|
— |
a sejtkultúrák száma vizsgálati pontonként, |
|
— |
a lemezkészítéshez használt technika részletes leírása, |
|
— |
az elemzett metafázisok száma (az adatokat külön kell megadni minden sejtkultúrára), |
|
— |
az SCE átlagos száma sejtenként és kromoszómánként (az adatokat külön kell megadni minden sejtkultúrára), |
|
— |
az SCE-számolás/besorolás kritériumai, |
|
— |
a dózisok megválasztásának indokai, |
|
— |
a dózis-hatás összefüggés, ha van, |
|
— |
az eredmények statisztikai feldolgozása, ahol lehetséges, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.20. NEMHEZ KÖTÖTT RECESSZÍV LETÁLIS VIZSGÁLAT DROSOPHILA MELANOGASTERBEN
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A nemhez kötött, recesszív letális (SLRL Test = sex-linked recessive lethal test) vizsgálat Drosophila melanogaster használatával mutációk jelenlétét – pont mutációkat vagy kisebb törléseket – mutatja ki a rovar csíravonalában. A vizsgálattal az előrehaladó mutáció követhető, és az X kromoszóma mintegy 800 lokuszán van lehetőség a mutációk szűrésére; ez az X-kromoszóma összes lokuszának mintegy 80 %-át jelenti. Az X kromoszóma pedig a teljes haploid genom mintegy egyötödét képviseli.
A Drosophila melanogaster X-kromoszómájának mutációi fenotípusosan a mutáns gént hordozó hímeken jelennek meg. Ha valamely mutáció hemizigóta állapotban halálos, annak jelenlétére a heterozigóta nőstények által normál esetben kiköltött két hím osztály egyikének hiánya utal. Az SLRL-vizsgálattal különleges módon megjelölt és elrendezett kromoszómák segítségével fel lehet ismerni az említett sajátosságokat.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Előkészületek
Jól jellemzett, vad típusú törzshöz tartozó hímek és a Muller-5 elnevezésű törzsből származó nőstények használhatók. Más, megfelelően jelölt nőstény törzsek is használhatók, ha van többszörös inverz X-kromoszómájuk.
A vizsgált anyagokat vízben oldják. A vízben nem oldódó anyagokat a megfelelő vivőanyagban is lehet oldani vagy szuszpendálni (pl. etanol és Tween-60, illetve Tween-80 keverékében), majd vízzel, illetve sóoldattal hígítani a beadás előtt. A dimetil-szulfoxidot (DMSO) lehetőleg ne használják vivőanyagként.
A vizsgálatot előre meghatározott érzékenységgel és felbontóképességgel kell megtervezni. A megfelelő kontroliban megfigyelt spontán mutációs gyakoriság jelentősen befolyásolja az elemzésre szánt kezelt kromoszómák számát.
Az anyagot szájon át, injekcióval, illetve gázzal vagy párával való expozíció útján adagolhatjuk. A vizsgált anyagot táplálékként cukoroldatban adhatók be. Szükség esetén az anyagokat 0,7 %-os NaCl-oldatban is feloldhatjuk, és azt a mellkasba vagy a hasüregbe fecskendezhetjük.
Negatív (vivőanyag-) és pozitív kontrollokat is alkalmazni kell. Ha azonban megfelelő történeti laboratóriumi adatok állnak rendelkezésre, kontrollokra nincs szükség.
Három expozíciós szintet kell alkalmazni. Előzetes felmérésre a vizsgált anyag egyetlen koncentrációját használják, ez lehet a legnagyobb elviselhető koncentráció, vagy pedig az, amely a toxicitás bizonyos jeleit kiváltja. A nem mérgező anyagoknál a legnagyobb, gyakorlatilag még megvalósítható koncentrációt használják.
A kísérlet végrehajtása
A vizsgált anyaggal vad típusú (három-öt napos) hímeket kezelnek, majd egyenként pároztatják a Muller-5 törzsből vagy más, megfelelően jelölt törzsből származó szűz nőstényekkel (a törzsekben többszörös inverz X-kromoszómának kell lennie). A nőstényeket két-háromnaponta friss szűz állatokra cserélik le, hogy a teljes csírasejtciklust le tudják fedni. E nőstények utódait megvizsgálják a halálos hatások szempontjából, amelyek megnyilvánulhatnak a kezelés alatt az érett spermára, a középső szakaszban és a kései stádiumban lévő spermatidákra, a korai spermatidákra, illetve az elősejtekre és az ős-ondósejtekre gyakorolt hatásban.
A fenti keresztezésekből származó heterozigóta F1 nőstényeket engedik egyedenként párzani (vagyis csoportonként egy nőstényt) a testvéreikkel. Az F2 nemzedékben minden tenyészetben meghatározzák a vad típusú hímek hiányát. Ha egy tenyészet minden jel szerint a szülői X-kromoszómában a halálos gént hordozó F1 nősténytől származik (vagyis egyetlen hímet sem találtak a kezelt kromoszómával), annak a nősténynek az azonos genotípusú leányait is vizsgálni kell annak bizonyítására, hogy a letalitás megismétlődik-e a következő generációban.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni a vizsgált X-kromoszómák, a terméketlen hímek, valamint a halálos kromoszómák számának az egyes adagolási koncentrációknál, illetve párosítási időszakoknál az egyes kezelt hímekre történő bemutatásához. A hímenként észlelhető eltérő nagyságú csoportok (klaszterek) számát rögzíteni kell. Ezen eredményeket külön vizsgálattal is meg kell erősíteni.
Megfelelő statisztikai módszerek alkalmazásával kell értékelni a nemhez kötött, recesszív halálos mutációs vizsgálatokat. Az egy hímtől eredő recesszív letális mutációk csoportjait a megfelelő statisztikai módszerekkel kell vizsgálni és értékelni.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
törzs: a használt Drosophila törzsek és fajták, a rovarok kora, a kezelt hímek száma, a steril hímek száma, a létrejött F2 tenyészetek száma, a leszármazottak nélküli F2 tenyészetek száma, az egyes csírasejtstádiumokban észlelt, halálos génmutációt hordozó kromoszómák száma, |
|
— |
a kezelt csoportok méretének meghatározásához használt kritériumok, |
|
— |
a vizsgálati feltételek: a kezelési és a mintavételi ütemterv részletes ismertetése, az expozíciós szintek, a toxicitási adatok, a negatív (oldószeres) és a pozitív kontrollok, ha szükséges, |
|
— |
a letális mutációk számlálásának kritériumai, |
|
— |
dózis-hatás összefüggés, ha van, |
|
— |
az eredmények statisztikai feldolgozása, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.21. IN VITRO EMLŐSSEJT-TRANSZFORMACIÓS VIZSGÁLATOK
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Az emlőssejtkultúra-rendszerek felhasználhatók a rosszindulatú in vivo átalakulással összefüggésbe hozott kémiai vegyületek által kiváltott in vitro fenotípusos változások kimutatására. A széles körben alkalmazott sejtvonalak közé tartozik a C3H10T1/2, a 3T3, az SHE, a Fischer jelzésű patkánysejtvonal; a vizsgálatok a sejtek morfológiai változásain, fókuszképződésén vagy félszilárd agaron való megtelepedésiképesség-változásain alapulnak. Kevésbé széles körben használt rendszerek is léteznek, amelyek más fiziológiai vagy morfológiai változásokat mutatnak ki a sejtekben, a rákkeltő anyagokkal történő kezelést követően. Az in vitro vizsgálatok egyetlen végpontja esetében sem bizonyított az a mechanizmus, amely a hatás és a karcinogén folyamat összefüggését magyarázza. Egyes vizsgálati rendszerek alkalmasak tumorpromoterek kimutatására. A citotoxicitást a vizsgált anyagnak a kolóniaképző képességre (klónozási hatékonyság) vagy a kultúrák növekedési sebességére gyakorolt hatásával határozhatják meg. A citotoxicitás mérése azt a célt szolgálja, hogy megállapítsák, a vizsgált anyag adagja toxikológiailag releváns volt-e, de nem használható minden mérésnél a transzformációs gyakoriság kiszámítására, hiszen egyes vizsgálatok esetében hosszabb inkubációra és/vagy ismételt szélesztésre van szükség.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Előkészületek
Az alkalmazott transzformációs vizsgálattól függően számos sejtvonal vagy primer sejttenyészet jöhet szóba. A vizsgálatot végző személynek biztosítania kell, hogy az elvégzendő vizsgálat során a megfelelő fenotípusos változás következik be az ismert rákkeltő hatású anyaggal való expozíciót követően, és hogy a vizsgálatot végző személy által vezetett kutatólaboratóriumban végzett vizsgálat megbízhatósága és érvényessége bizonyított és dokumentálható.
Olyan tápfolyadékot és vizsgálati körülményeket kell alkalmazni, amelyek a legjobban illenek a használt transzformációs vizsgálathoz.
A vizsgált anyagokat a sejtek kezelését megelőzően tápfolyadékban vagy megfelelő vivőanyagban kell előkészíteni vagy feloldani, illetve szuszpendálni. A vivőanyag végső koncentrációja a kultúrában nem befolyásolhatja a sejtek életképességét, növekedési sebességét vagy a transzformáció előfordulási gyakoriságát.
A sejteket a vizsgált vegyület hatásának megfelelő anyagcsere-aktiváló rendszer jelenlétében és hiányában egyaránt ki kell tenni. A másik lehetőség, hogy belső metabolikus aktivitással rendelkező sejttípusokat használunk, ám ilyenkor az aktivitás jellegét és mértékét ismerni kell, hogy az megfeleljen a vizsgált kémiai osztálynak.
Vizsgálati körülmények
Minden vizsgálatnak pozitív kontrollként tartalmaznia kell egy közvetlenül ható vegyületet és egy metabolikus aktiválást igénylő vegyületet is; ezenkívül negatív (vivőanyag-) kontrollt is kell használni.
Néhány példa a pozitív kontrollként felhasználható anyagokra:
|
— |
közvetlenül ható vegyületek:
|
|
— |
közvetve ható vegyületek:
|
Ahol szükséges, alkalmazni lehet még egy pozitív kontrollt is, amely a vizsgált anyaggal egyező vegyületosztályba tartozik.
A vizsgált anyag több koncentrációját kell alkalmazni. E mennyiségeknek koncentrációfüggő mérgező hatást kell eredményezniük, amelyek jellemzője, hogy a legnagyobb vizsgált koncentrációval alacsony túlélési arány jár, míg a legalacsonyabb koncentrációval kezelt csoportban a túlélés megközelítőleg megegyezik a negatív kontrollcsoportéval. Vízben viszonylag rosszul oldódó anyagokat a megfelelő eljárások alkalmazásával oldhatóságuk határáig szükséges vizsgálni. A vízben jól oldódó és nem mérgező anyagok felső koncentrációját esetenként kell meghatározni.
A kísérlet végrehajtása
A sejteket a felhasznált vizsgálati rendszer függvényében megfelelő ideig kezelik az anyaggal, ami adott esetben a tápfolyadék cseréjét követő ismételt adagolást jelenthet (és szükség esetén friss anyagcsere-aktiváló keveréket), hosszabb expozíció esetében. A szükséges belső metabolikus aktivitással nem rendelkező sejteket a megfelelő metabolikus akti válórendszer jelenlétében, illetve hiányában is kezelni kell a vizsgált anyaggal. A kezelés végén a sejtek környezetéből kimossák az anyagot, és olyan, megfelelő körülmények között tenyésztik, amelyek mellett a vizsgált, transzformált fenotípus megjelenhet, és a transzformáció előfordulási gyakorisága meghatározható. Valamennyi eredményt független vizsgálattal kell megerősíteni.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, amely számos fajtát jelenthet attól függően, hogy milyen meghatározást végzünk, pl. telepszám, pozitív telepek, illetve a transzformált sejtek száma. Ahol szükséges, a túlélési arányt a kontrollértékek százalékában, a transzformációs gyakoriságot pedig a túlélő sejtekre eső transzformált sejtek számának arányában kell megadni. Az eredményeket megfelelő statisztikai módszerrel kell értékelni.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a felhasznált sejttípus, a sejtkultúrák száma, a sejtkultúrák fenntartásának módszere, |
|
— |
a vizsgálat körülményei: a vizsgált anyag koncentrációja, a felhasznált vivőanyag, az inkubációs idő, a kezelés gyakorisága és időtartama, a sejtsűrűség a kezelés alatt, a felhasznált külső anyagcsere-aktiváló rendszer, a pozitív és negatív kontrollok, a megfigyelt fenotípus leírása, a használt szelektív rendszer (ha alkalmazható), a dózisok megválasztásának indokolása, |
|
— |
az életképes és transzformált sejtek megszámlálásához használt módszer, |
|
— |
az eredmények statisztikai feldolgozása, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.22. DOMINÁNS LETÁLIS VIZSGÁLAT RÁGCSÁLÓKON
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A domináns letális (halálos) hatások embrionális, illetve magzati elhalást okoznak. A domináns letális hatások indukálása azt jelzi, hogy az illető vizsgált anyag a vizsgált állatfaj esetében hatást gyakorolt a csíraszövetekre. Az általánosan elfogadott nézet szerint a domináns letális hatások kromoszómakárosodásra vezethetők vissza (szerkezeti és számbeli rendellenességek). Nőstény állatok kezelése esetén az embrió elpusztulása az anyag toxikus hatása miatt is bekövetkezhet.
Általában hím állatokat kezelnek a vizsgált anyaggal, és a kezelt állatokat kezeletlen szűz nőstényekkel pároztatják. A különféle csírasejtstádiumok külön vizsgálhatók, ha egymás után következő pároztatási időközöket alkalmazunk. Az egy nőstényre jutó élettelen, beágyazódott embriók számának növekedése a kezelt csoportban a kontrollcsoportban tapasztalható hasonló adathoz képest a beágyazódás utáni veszteséget tükrözi. A beágyazódás előtti veszteségeket a sárgatestek száma alapján vagy a kezelt és kontrollcsoportokban az összes beágyazódott embriók számának összehasonlításából lehet kiszámítani. Az összes domináns letális hatás a beágyazódás előtti és utáni elhalás összegéből adódik. Az összes domináns letális hatás kiszámítása a kezelt csoportban az egy nőstényre jutó élő, beágyazódott embriók számának a kontrollcsoportban egy nőstényre jutó, élő beágyazódott embriók számával történő egybevetésén alapul. A beágyazódott embriók számának csökkenése bizonyos időközönként sejtpusztulás eredménye is lehet (azaz spermatociták és/vagy ondósejt-előalakok pusztulásáé).
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Előkészületek
Ahol lehet, a vizsgált anyagokat izotóniás sóoldatban kell feloldani vagy szuszpendálni. A vízben oldhatatlan vegyi anyagokat a megfelelő vivőanyagban lehet feloldani vagy szuszpendálni. Az alkalmazott vivőanyag nem lehet hatással a vizsgált anyagra, és nem okozhat toxikus hatást. A vizsgált vegyi anyag friss készítményeit kell használni.
Vizsgálati körülmények
A vizsgált vegyületet rendszerint csak egyszer kell beadni. Toxikológiai információk alapján ismételt kezelés is lehetséges. Az általánosan alkalmazott adagolási módok a szájon át történő intubálás és az intraperitoneális injekció. Más alkalmazási módok is megfelelőek lehetnek.
A javasolt kísérleti állat a patkány vagy az egér. Az egészséges, ivarérett állatokat véletlenszerű kiválasztással kezelt és kontrollcsoportokba kell beosztani.
Megfelelő létszámban kell kezelt hímeket felhasználni, figyelembe véve az értékelni kívánt biológiai jellemző spontán variációit. A létszám meghatározása során a kimutatás korábban már meghatározott érzékenységi szintjét és a szignifikancia mértékét kell alapul venni. Egy tipikus vizsgálatban például minden adagolási csoportban a hímek számának elegendőnek kell lennie ahhoz, hogy minden párzási időszakban 30 és 50 közötti nősténynél alakuljon ki vemhesség.
Minden vizsgálatban negatív (vivőanyag-) és pozitív kontrollokat is kell alkalmazni. Ha azonban elfogadható pozitív kontrolleredmények állnak rendelkezésre ugyanazon laboratóriumban nemrégiben elvégzett vizsgálatokból, ezeket fel lehet használni az egyidejű kontrollok alkalmazása helyett. A pozitív kontrollanyagokat csak megfelelően alacsony dózisban lehet alkalmazni (pl. MMS, intraperitoneálisan, 10 mg/kilogramm dózisban) a vizsgálat érzékenységének kimutatására.
Rendszerint három adagolási szintet (dózis) alkalmazunk. A nagy dózisnak toxikus tüneteket vagy csökkent termékenységet kell okoznia a kezelt állatokon. Egyes esetekben egyetlen nagy dózis is elegendő lehet.
A nem mérgező anyagokat egyszeri beadással 5 gramm/kg mennyiségben vagy ismételt beadással 1 gramm/kg/nap dózisban kell adagolni.
A kísérlet végrehajtása
Számos kezelési protokoll áll rendelkezésre. A leginkább elterjedt módszer a vizsgált anyag egyszeri beadása. Más kezelési protokoll is alkalmazható.
A kezelést követően minden egyes hímet megfelelő időközönként egymás után egy vagy két kezeletlen szűz nősténnyel pároztatnak. A nőstényeket legalább egy ivarzási ciklus erejéig a hímekkel kell tartani, illetve addig, amíg a párzásra sor nem került, ami a hüvelyben a sperma jelenlétéből, illetve a hüvelyi dugó megjelenéséből határozható meg.
A kezelést követő párzások számát a kezelési protokoll határozza meg, és azt úgy kell kialakítani, hogy a kezelés után a csírasejtképződés összes fázisából lehessen mintát venni.
A nőstényeket a vemhesség második felében pusztítják el, és a méh tartalmát megvizsgálva megállapítják az élő és elhalt implantátumok számát. A petefészkek vizsgálatával meghatározható a sárgatestek száma.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, bemutatva a hímek számát, a vemhes nőstények számát, valamint a nem vemhes nőstények számát. Minden párzás eredményét egyedileg kell jegyzőkönyvezni, egyenként azonosítva a hímet és a nőstényt. Minden nőstény esetében fel kell jegyeznünk a párzás hetét, a hím állatnak beadott dózist és az élő és az elhalt implantátumok gyakoriságát.
A teljes domináns letális hatás kiszámítása a kezelt csoportban egy nőstényre jutó élő, beágyazódott embriók számának a kontrollcsoportban egy nőstényre jutó élő, beágyazódott embriók számával történő egybevetésén alapul. Az elhalt és az élettelen implantátumok arányát hasonlítjuk össze a kezelt és a kontrollcsoport között a beágyazódás utáni veszteség elemzése céljából.
Ha az adatokat korai és kései elhalásként értékelték, azt a táblázatokban világosan jelezni kell. Ha vizsgálták a beágyazódás előtti veszteséget is, akkor azt is jegyzőkönyvezni kell. A beágyazódás előtti veszteségeket a sárgatestek számának és az implantátumok számának eltéréséből vagy a méhenkénti átlagos implantátumszám fogyatkozásából számíthatják ki a kontrollpárzásokhoz viszonyítva.
Az eredményeket megfelelő statisztikai módszerrel kell értékelni.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a kísérlethez felhasznált állatok fajtája, törzse, kora és súlya, mindkét nembeli állatok száma a vizsgálati és a kontrollcsoportokban, |
|
— |
a vizsgált anyag, a vivőanyag, a vizsgált dózisok és azok kiválasztásának indokolása, a pozitív és a negatív kontrollok, a toxicitási adatok, |
|
— |
az adagolás módja és a kezelés ütemezése, |
|
— |
párzási ütemterv, |
|
— |
a párzás igazolására használt módszer, |
|
— |
az elpusztítás időpontja, |
|
— |
a domináns letális mutációk számlálásának kritériumai, |
|
— |
a dózis-hatás összefüggés, ha van, |
|
— |
az eredmények statisztikai feldolgozása, ahol lehetséges, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.23. EMLŐS SPERMIOGONIÁLIS KROMOSZÓMA-RENDELLENESSÉG VIZSGÁLAT
1. MÓDSZER
E módszer megfelel az OECD TG 483-nak, emlős spermiogoniális kromoszómarendellenesség-vizsgálat (1997).
1.1. BEVEZETÉS
Az emlős spermiogoniális kromoszómarendellenesség-vizsgálat célja azon anyagok azonosítása, amelyek strukturális kromoszóma-rendellenességeket okoznak emlősök spermiogonális sejtjeiben (1), (2), (3), (4), (5). A strukturális rendellenességek kétféle típusúak lehetnek, kromoszóma vagy kromatid. A kémiai mutagének többsége esetében az előidézett rendellenességek kromatid típusúak, de kromoszóma típusú rendellenességek is előfordulnak. E módszert nem a számszerű rendellenességek mérésére tervezték és szokásosan nem is e célra használják. A kromoszómamutációk és ehhez hasonló folyamatok számos emberi genetikai betegség okozói.
E vizsgálat a spermiogoniális ivarsejtekben a kromoszómális történéseket mutatja ki, és ezért várhatóan előre jelezheti az ivarsejtek öröklődő mutációjának indukcióját.
E vizsgálathoz általában rágcsálókat kell használni. Ez az in vivo citogenetikus vizsgálat észleli a kromoszóma-rendellenességeket a spermiogoniális mitózisokban. Más célsejtek nem képezik tárgyát e módszernek.
A spermiogoniumokban a kromatid típusú rendellenességek észleléséhez a kezelést követő első mitiotikus sejtosztódást az előtt kell megvizsgálni, mielőtt elvesznének ezen elváltozások az azt követő sejtosztódásokban. A kezelt spermiogonium őssejtekről további információk kaphatók a diakinezi s-m etafázis I-ben, a kromoszóma típusú rendellenességek meiótikus kromoszómaelemzésével.
Ezt az in vivo vizsgálatot annak vizsgálatára tervezték, hogy az ivarsejtekben is aktívak-e a testi sejtek mutagénei. Ezenkívül a spermiogonium-vizsgálat a mutációs kockázat kiértékeléséhez is lényeges annyiban, hogy lehetővé teszi az in vivo metabolizmus, farmakokinetika és DNS-reparáció tényezőinek vizsgálatát.
A herékben a spermiogoniumok számos generációja van jelen, amik a kémiai anyaggal szembeni érzékenység egész spektrumát átfogják. Így tehát az észlelt rendellenességek a kezelt spermiogonium-populációk halmozott reakcióját jelentik az egyre nagyobb számú differenciált spermiogonium-sejtek predominanciájával. A heréken belüli helyzetüktől függően, a spermiogoniumok különböző generációi exponálódhatnak vagy nem a keringés révén a fizikai és fiziológiai Sertoli sejtgát és a vér-here gát miatt.
Ha bizonyos jelek utalnak arra, hogy a vizsgált anyag vagy valamely reaktív metabolitja nem éri el a célszövetet, akkor e vizsgálat nem megfelelő.
Lásd még az Általános bevezetés B. részét is.
1.2. FOGALOMMEGHATÁROZÁSOK
Kromatid típusú rendellenesség: szerkezeti kromoszómakárosodás, amely egy kromatid törésében vagy kromatidok közötti törésben és újraegyesítésben nyilvánul meg.
Kromoszóma típusú rendellenesség: szerkezeti kromoszómakárosodás, amely a két kromatid azonos helyén történt törésben, vagy törésben és újraegyesülésben nyilvánul meg.
Gap: egyetlen kromatid szélességénél kisebb és a kromatidok minimális átrendeződését okozó akromatikus sérülés.
Számszerű rendellenesség: a kromoszómák számának eltérése a felhasznált sejteket jellemző normál számértéktől.
Poliploida: a haploid kromoszómaszám (n) egészszámú, de nem diploid (azaz 3n, 4n, és így tovább) megsokszorosódása.
Szerkezeti rendellenesség: a sejtosztódás metafázisának mikroszkopikus vizsgálata során észlelhető változás a kromoszóma szerkezetében, mint a delíciók és fragmentumok, a kromoszómán belüli vagy a kromoszómák közötti átrendeződés.
1.3. A VIZSGÁLATI MÓDSZER ELVE
Az állatoknak megfelelő expozíciós módon adagolják a vizsgált anyagot és a kezelés után megfelelő időpontokban elpusztítjuk őket. Az elpusztítás előtt az állatokat metafázis-blokkoló szerrel (például kolchicin vagy Colcemid®) kell kezelni. Ezután kromoszómakészítményeket hozunk létre az ivarsejtekből és megfestjük azokat, majd elemezni kell a metafázisú sejteket a kromoszóma-rendellenességek megállapítására.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. Előkészületek
1.4.1.1. A kísérlethez felhasznált állatok
Rendszerint patkányokat, egereket és kínai hörcsögöket használnak, jóllehet bármilyen megfelelő emlős használata szóba jöhet. Fiatal, egészséges, ivarérett, kísérleti célokra tenyésztett laboratóriumi állattörzsekből származó állatokat kell használni. A vizsgálat kezdetén az állatok súlya lehetőleg csak minimálisan térjen el egymástól és a nemenkénti átlagos értéktől maximum ± 20 %-kal különbözhet.
1.4.1.2. Tartási és etetési körülmények
Az Általános bevezetés B. részében ismertetett általános körülményeket kell alkalmazni, bár a páratartalom értékének 50–60 % között kell lennie.
1.4.1.3. Az állatok előkészítése
Az egészséges, fiatal, ivarérett állatokat véletlenszerűen kontroll- és kezelt csoportokba osztják. A ketreceket úgy kell elrendezni, hogy minimálisak legyenek az elhelyezés miatti esetleges hatások. Ezt követően az állatokat egyenként kell azonosítani. Az állatokat legalább öt napig szoktatják a laboratóriumi körülményekhez.
1.4.1.4. Dózisok előkészítése
Az adagolás előtt a szilárd vizsgált anyagokat fel kell oldani vagy szuszpendálni megfelelő oldószerekben vagy vivőanyagokban, és hígítani, ha szükséges. A folyékony vizsgált anyagok közvetlenül adagolhatók vagy hígíthatók. A vizsgált anyagból mindig friss készítményeket kell alkalmazni, kivéve, ha az anyag tárolás során való stabilitása bizonyított.
1.4.2. Vizsgálati körülmények
1.4.2.1. Oldószer/vivőanyag
Az oldószer nem okozhat toxikus hatásokat a kiválasztott dózisok mellett, valamint nem alkalmazható olyan anyag, amely gyaníthatóan kémiai reakcióba lép a vizsgált anyaggal. Jól ismert oldószerektől eltérő oldószerek/vivőanyagok használatakor azok felhasználását alá kell támasztani a kompatibilitásukat bizonyító adatokkal. Amennyiben lehetséges, először valamilyen vizes oldószer/vivőanyag használatát kell megfontolni.
1.4.2.2. Kontrollok
Mindkét nemhez és minden kísérlethez egyidejűleg pozitív és negatív (oldószer/vivőanyag) kontrollokat kell alkalmazni. A vizsgált anyaggal való kezelés kivételével a kontrollcsoportokba beosztott állatokat azonos bánásmódban kell részesíteni a kezelt csoportokban lévő állatokkal.
A pozitív kontrolloknak in vivo szerkezeti rendellenességeket kell létrehozniuk expozíciós koncentrációban úgy, hogy észlelhető legyen a növekedés (a háttérhez viszonyítva).
A pozitív kontrollkoncentrációkat úgy választjuk ki, hogy a hatás egyértelmű legyen, de ne lepleződjön le azonnal a kódolt tárgylemezek identitása a leolvasásnál. Elfogadható, hogy a pozitív kontroll beadása a vizsgált anyag beadási módjától eltérjen, és hogy csak egyetlen mintavételre kerüljön sor. Adott esetben azon pozitív kontrollanyagok használatát kell megfontolni, amelyek a vizsgált anyaggal azonos osztályba tartoznak. A következő pozitív kontrollanyagok jöhetnek szóba:
|
Anyag |
CAS-szám |
EINECS-szám |
|
Ciklofoszfamid Ciklofoszfamid monohidrát |
50-18-0 6055-19-2 |
200-015-4 |
|
Ciklohexil-amin |
108-91-8 |
203-629-0 |
|
Mitomicin C |
50-07-7 |
200-008-6 |
|
Akrilamid monomer |
79-06-1 |
201-173-7 |
|
Trietilén-melamin |
51-18-3 |
200-083-5 |
Minden mintavétel alkalmával a negatív kontrollcsoportban lévő állatokat is figyelembe kell venni, amelyeknek csupán oldószert adagolnak, egyébként azonos bánásmódban kell részesíteni azokat a kezelt állatokkal, kivéve, ha a történeti kontrolladatokból elfogadható értékek állnak rendelkezésre a kromoszóma-rendellenességeket mutató sejtek állaton belüli sokfélesége és gyakorisága tekintetében. Ezenkívül használunk nem kezelt kontrollállatokat, kivéve, ha vannak olyan történeti vagy nyilvánosságra hozott kontrolladatok, amelyek azt mutatják, hogy a kiválasztott oldószer/vivőanyag semmilyen ártalmas vagy mutagén hatást nem hoz létre.
1.5. A KÍSÉRLET VÉGREHAJTÁSA
1.5.1. Állatok száma
Minden egyes kezelt- és kontrollcsoport legalább öt elemezhető hím állatot tartalmaz.
1.5.2. Kezelés lefolytatása
A vizsgált anyagot lehetőleg egyetlen alkalommal adják be. A vizsgált anyagot két adagban is be lehet adni, ugyanazon a napon két alkalommal néhány órás időközzel, nagy mennyiségű anyag beadásának megkönnyítésére. Más adagolási módok alkalmazását tudományosan indokolni kell.
A legnagyobb adaggal kezelt csoportnál a kezelés után két különböző időpontban mintát kell venni. Mivel a sejtciklus kinetikájára hatással lehet a vizsgált anyag, körülbelül 24 és 48 órával a kezelés után kell mintát venni. Az egyéb adagok estében a kezelés utáni 24 órában vagy 1,5 sejtciklusidő eltelte után kell mintát venni, kivéve ha más időpontról bebizonyosodott, hogy az megfelelőbb a hatások észlelésére (6).
Ezenkívül más mintavételi idők is alkalmazhatók. Olyan kémiai anyagok esetében, amelyek kromoszóma-visszamaradást idézhetnek elő vagy amelyek S fázistól független hatásokat fejthetnek ki, megfelelőbbnek bizonyulhatnak a korábbi mintavételi idők (1).
Valamely megismételt kezelés célszerűségét eseti alapon kell megállapítani. Megismételt kezelés esetén az állatokat 24 órával (1,5 sejtciklusidő) az utolsó kezelés után elpusztítják. További mintavételi idők alkalmazhatók, ahol szükséges.
Elpusztítás előtt az állatok hasüregébe adott injekcióval megfelelő adag metafázist blokkoló szert (például Colcemid® vagy kolchicin) fecskendezünk be. Ezután az állatokból mintákat kell venni megfelelő időközönként. Egerek esetében ez az időköz körülbelül 3–5 óra; kínai hörcsögök esetében ez az időköz körülbelül 4–5 óra.
1.5.3. Dózisok
Ha dózisbehatároló vizsgálatot végeznek, mert nem állnak rendelkezésre alkalmas adatok, ezt ugyanabban a laboratóriumban, ugyanazon fajták, törzsek, nemek és kezelési menetrend alkalmazásával hajtják végre, mint amelyet a fő vizsgálatban alkalmaznak (7). Ha észlelhető toxicitás, három dózist használnak az első mintavételhez. E dózisoknak át kell fogniuk egy, a maximálistól a már csak kissé vagy az egyáltalán nem toxikusig terjedő tartományt. A későbbi mintavételnél csak a legmagasabb adagot használják. A legmagasabb adag az a dózis, amely olyan egyértelmű toxicitásjeleket vált ki, hogy annál magasabb adagok, azonos adagolás mellett, várhatóan halált okoznak.
Specifikus biológiai hatású anyagok alacsony, nem toxikus adagok mellett (ilyenek például a hormonok és mutagének) adott esetben lehetséges, hogy nem felelnek meg az adagolási kritériumoknak, ezért ezeket eseti alapon kell értékelni. A legmagasabb adag olyan adagként is definiálható, amely létrehoz valamilyen toxicitási jelet a spermiogonium-sejtekben (például az első és második meiotikus metafázis esetében a spermiogonium mitózis arányának csökkenése; e csökkenésnek nem szabad 50 %-nál nagyobbnak lennie).
1.5.4. Határérték-vizsgálat
Ha egyetlen alkalmommal vagy ugyanazon a napon két adagban beadott, legalább 2 000 mg/kg testsúly dózis mellett végrehajtott vizsgálat semmilyen megfigyelhető toxikus hatásokat nem hoz létre, és ha nem várható genotoxicitás szerkezetileg rokon anyagokkal kapcsolatos adatok alapján, akkor nem szükséges a három dózisszint használatával végrehajtott teljes vizsgálat. A várt expozíciós hatások az embernél a határérték-vizsgálatban valamilyen magasabb dózis használatának szükségességét jelezhetik.
1.5.5. Adagolás
A vizsgált anyagot rendszerint gyomorszondán át inkubációs kanül segítségével, vagy hasüregbe adott injekció segítségével adják be. Elfogadhatók egyéb expozíciós módok, amennyiben azok indokolhatók. A gyomorszondán át vagy injekcióval egyszerre beadható maximális folyadékmennyiség a kísérleti állat méretétől függ. A térfogata nem haladhatja meg a 2 ml/l00 g testsúly mennyiséget. Ennél nagyobb mennyiségek használatát meg kell indokolni. A magasabb koncentrációértékek esetén rendszerint fokozottabb hatást kiváltó irritatív vagy maró anyagok kivételével, a koncentráció megfelelő beállításával a minimálisra kell csökkenteni a vizsgált anyag mennyiségének változásait, hogy valamennyi dózisszinten konstans mennyiséget lehessen adagolni a kísérleti állatoknak.
1.5.6. Kromoszómapreparáció
Közvetlenül az elpusztítás után sejtszuszpenziót vesznek mindkét heréből, azokat hipotonizálni kell, majd fixálni. A sejteket ezután elterítjük a tárgylemezen és megfestjük.
1.5.7. Elemzés
Minden egyes állat esetében legalább 100 jól kiterült metafázist kell elemezni (azaz csoportonként minimum 500 metafázist). E szám csökkenthető, amennyiben nagyszámú rendellenesség figyelhető meg. Minden tárgylemezt, a pozitív és negatív kontrollokat is ideértve, önállóan kódolni kell a mikroszkópos elemzés előtt. Mivel a fixálási eljárások gyakran a metafázisban lévő sejtek egy részének széttörését eredményezik, mely kromoszóma veszteséggel jár, ezért a kiértékelt sejtek tartalmaznak egy centromer számot, amely megfelel a 2n ± 2 értéknek.
2. ADATOK
2.1. EREDMÉNYEK KEZELÉSE
Az egyes állatok adatait táblázat formájában kell megadni. A kísérleti egység maga az állat. Minden egyes állat esetében fel kell jegyezni a strukturális kromoszóma-rendellenességekkel rendelkező sejtek számát és a sejtenkénti kromoszóma-rendellenességek számát. Fel kell sorolni a szerkezeti kromoszóma-rendellenességek különböző típusait a számukkal és gyakoriságukkal együtt kezelt és kontrollcsoportonként. A gap külön kerül feljegyzésre és szerepel a jelentésben, de rendszerint azokat nem kell beleszámolni a rendellenességek összgyakoriságba.
Ha mitózist, valamint meiózist figyelnek meg, meg kell határozni a spermiogonium-mitózisok arányát az első és második meiotikus metafázisokhoz viszonyítva, állatonként 100 osztódó sejt összes mintájában valamennyi kezelt és negatív kontrollállathoz tartozó citotoxicitás méréseként az esetleges citotoxikus hatás megállapítása érdekében. Ha csak mitózist figyelnek meg, a mitózisindexet állatonként legalább 1 000 sejtben kell meghatározni.
2.2. EREDMÉNYEK KIÉRTÉKELÉSE ÉS ÉRTELMEZÉSE
Különböző kritériumok léteznek a pozitív eredmény meghatározására, ilyen például a kromoszóma-rendellenességeket mutató sejtek relatív számának növekedése a dózis függvényében, vagy egy meghatározott időben történő mintavétel alkalmával egyetlen dóziscsoportban a rendellenességet mutató sejtek számának egyértelmű növekedése. Először meg kell vizsgálni az eredmények biológiai jelentőségét. Statisztikai módszerek használhatók a vizsgálati eredmények kiértékelésének elősegítésére (8). Valamely pozitív reagálás tekintetében nem szabad, hogy a statisztikai szignifikancia legyen az egyetlen meghatározó tényező. A többféleképpen magyarázható eredményeket további vizsgálattal kell tisztázni, lehetőleg a kísérleti körülményeket módosítva.
E rendszerben nem mutagén anyagnak tekintendő az a vizsgált anyag, amelyhez tartozó eredmények nem elégítik ki a fenti kritériumokat.
Bár a legtöbb kísérlet egyértelműen pozitív vagy negatív eredményeket hoz, ritka esetben előfordul, hogy a rendelkezésre álló adatok alapján nem lehet a vizsgált anyag aktivitásával kapcsolatban egyértelműen állást foglalni. Előfordul az is, hogy az eredmények többféleképpen magyarázhatók vagy megkérdőjelezhetők maradhatnak tekintet nélkül arra, hogy hány alkalommal ismételjük meg a kísérletet.
Az in vivo spermiogonium kromoszómarendellenesség-vizsgálatból kapott pozitív eredmények azt jelzik, hogy valamely anyag strukturális kromoszóma-rendellenességeket idéz elő a kísérleti állatfajták ivarsejtjeiben. A negatív eredmények azt jelzik, hogy a vizsgált körülmények mellett, a vizsgált anyag nem idéz elő kromoszóma-rendellenességeket a kísérleti állatfajták ivarsejtjeiben.
Értékelni kell annak a valószínűségét, hogy a vizsgált anyag vagy annak metabolitjai eljutnak-e a célszövetbe.
3. VIZSGÁLATI JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentés tartalmazza a következő információkat:
|
|
Oldószer/vivőanyag:
|
|
|
Kísérleti állatok:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények tárgyalása. |
|
|
Összefoglaló megállapítások. |
4. SZAKIRODALOM
|
(1) |
Adler, I. D. (1986), Clastogenic Potential in Mouse Spermatogonia of Chemical Mutagens Related to their Cell-Cycle Specification, in: Genetic Toxicology of Environmental Chemicals, Part B: Genetic Effects and Applied Mutagenesis, Ramel, C, Lambert, B. and Magnusson, J. (eds) Liss, New York, pp. 477–484 |
|
(2) |
Adler, I. D. (1984), Cytogenetic Tests in Mammals, in: Mutagenicity Testing: a Practical Approach, (ed.) S. Venitt and J. M. Parry, IRL Press, Oxford, Washington DC, pp. 275–306 |
|
(3) |
Evans, E. P., Breckon, G. and Ford, C. E. (1964), An Air-drying Method for Meiotic Preparations from Mammalian Tests, Cytogenetics and Cell Genetics, 3, pp. 289–294 |
|
(4) |
Richold, M., Ashby, J., Bootman, J., Chandley, A., Gatehouse, D. G. and Henderson, L. (1990), In vivo Cytogenetic Assays in: D. J. Kirkland (ed.). Basic Mutagenicity Tests, UKEMS Recommended Procedures, UKEMS Subcommittee on Guidelines for Mutagenicity Testing, Report, Part 1. revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115–141 |
|
(5) |
Yamamoto, K. and Kikuchi, Y, (1978), A New Method for Preparation of Mammalian Spermatogonial Chromosomes, Mutation Res., 52, pp. 207–209 |
|
(6) |
Adler, I. D. Shelby M. D., Bootman, J., Favor, J., Generoso, W., Pacchierotti, F., Shibuya, T. and Tanaka N. (1994), International Workshop on Standardisation of Genotoxicity Test Procedures. Summary Report of the Working Group on Mammalian Germ Cell Tests, Mutation Res. 312, pp. 313–318 |
|
(7) |
Fielder, R. J., Allen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G, Hodson-Walker, G, Morton, D. B., Kirkland, D. J. and Richold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In vivo Mutagenicity Assays, Mutagenesis, 7. pp. 313–319 |
|
(8) |
Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clarc, G., Ferguson, R., Richold, M., Papworth, D. G. and Savage J. R. K. (1989), Statistical Analysis of In vivo Cytogenetic Assays, in: D. J. Kirkland (ed.), Statistical Evaluation of Mutagenicity Test Data. UKEMS Subcommittee on Guidelines for Mutagenicity Testing, report Part III, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 184–232 |
B.24. EGÉRFOLT- (SPOT) TESZT
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Ez egy in vivo vizsgálat egéren, amelynek során fejlődő embriókat kezelnek a vizsgált vegyülettel. A fejlődő embrióban a célsejtek a melanoblasztok, a célgének pedig azok, amelyek a hátszőrzet pigmentációjáért felelősek. A fejlődő embriók több ilyen, a szőrszínt kódoló génre heterozigóták. Ha valamely pigmentsejt egy ilyen génjében mutáció következik be, vagy elvész a domináns alléi (különböző genetikai események hatására), az utódsejtben a recesszív fenotípus jelenik meg, aminek az a következménye, hogy a születő egér szőrzete egy foltban eltérő színű lesz. Meghatározzák az ilyen foltokkal született mutáns egerek számát, és gyakoriságukat összehasonlítják a csak oldószerrel kezelt embriókból keletkező utódnemzedékben előforduló foltosodási gyakorisággal. Az egérfoltosodási vizsgálat a magzati sejtek feltételezett szomatikus mutációinak kimutatására alkalmas.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Előkészületek
Ahol lehet, a vizsgált anyagokat izotóniás sóoldatban kell feloldani vagy szuszpendálni. A vízben oldhatatlan vegyi anyagokat a megfelelő vivőanyagban lehet feloldani vagy szuszpendálni. Az alkalmazott vivőanyag nem lehet hatással a vizsgált anyagra, és nem okozhat toxikus hatást. A vizsgált vegyi anyag friss készítményeit kell használni.
A T törzshöz tartozó (nonagouti, a/a; csincsilla, rózsaszín szemű, cchp/cchp; barna, b/b; halvány, rövid fülű, d se/d se; tarka foltos, s/s) egereket vagy a HT törzshöz tartozó egerekkel (halvány, nonagouti, rövid lábú, pa a bp/pa a bp; szürke pihés, ln fz/ln fz; gyöngy pe/pe) vagy a C57BL (nonagouti, a/a) törzshöz tartozó egerekkel pároztatnak. Más megfelelő keresztezés, például az NMRI (nonagouti, a/a; albínó, c/c) és a DBA (nonagouti, a/a; barna, b/b; halvány d/d) törzsek között is használható, ha nonagouti utódaik lesznek.
Megfelelő számú vemhes nőstényt kezelnek, hogy elegendő túlélő utód legyen minden dózishoz. A minta nagyságát a kezelt egereken megfigyelt foltok száma és a kontrolladatok nagyságrendje határozza meg. A negatív eredmény csak akkor fogadható el, ha a legnagyobb dózissal kezelt csoport nőstényeitől származó legalább 300 utódot vizsgáltak meg.
Olyan egyidejűleg alkalmazott kontrollegércsoport adatainak is rendelkezésre kell állniuk, amelyeket csak vivőanyaggal (negatív kontroll) kezeltek. A vizsgálat érzékenységének növelése érdekében az ugyanazon laboratóriumból származó történeti kontrolladatokat lehet összesíteni, ha azok homogének. Ha az aktuális vizsgálat nem mutatott ki mutagenitást a vizsgált anyagra, olyan pozitív kontrollvizsgálat eredményeinek kell rendelkezésre állniuk, amelyet nemrégiben végeztek ugyanazon laboratóriumban valamely ismert, mutagén hatású vegyülettel.
Általánosan alkalmazott módszer a vemhes nőstények szájon át történő intubálása vagy az intraperitoneális injekció. Belélegeztetés vagy egyéb módszer is alkalmazható, ha szükséges.
Legalább két adagolási szintet kell alkalmazni, amelyek közül az egyik toxikus tüneteket okoz, vagy csökkentett alomszámot eredményez. A nem mérgező anyagoknál a gyakorlatban kivitelezhető legnagyobb dózist kell használni.
A kísérlet végrehajtása
A vemhesség 8., 9., illetve 10. napján egyszeri dózist adnak, a vemhesség első napjának a hüvelyi dugó megjelenését tekintve. E napok a fogamzás utáni 7,25., 8,25. és 9,25. napnak felelnek meg. Az említett napokat követően is alkalmazható további kezelés.
Az utódokat kóddal látják el, és a születés utáni harmadik és negyedik hét között megszámolják foltjaikat. Háromfajta foltot különböztetnek meg:
|
a) |
fehér foltok a hasfal középvonalától számított 5 mm-en belül, amelyek feltehetőleg a sejtpusztulás következményei (WMVS); |
|
b) |
sárga, agouti-szerű foltokat az emlők, a nemi szervek, a torok, a váll és a lágyék területein, valamint a homlokon, amelyek valószínűleg a hibás differenciáció (MDS) következményei; és |
|
c) |
pigmentált és fehér foltokat véletlenszerűen elszórtan a szőrzeten, amelyek valószínűleg szomatikus mutáció (RS) következményei. |
Mindhárom csoportban megszámolják a foltokat, de genetikai szempontból csak az utolsó, az RS játszik szerepet. Az MDS és az RS közötti különbségtételnél problémás esetekben a szőrminta fluoreszcens mikroszkóp alatti vizsgálata dönt.
Az utódok nyilvánvaló makroszkópos morfológiai rendellenességeit fel kell jegyezni.
2. ADATOK
Az adatokat feltüntetésekor meg kell adni az összes vizsgált utód és az egy vagy több vélt szomatikus mutációs foltot mutató egyedek számát. A kezelt és a negatív kontrollcsoportok adatait összevetik megfelelő statisztikai módszerek alkalmazásával. Az adatokat almonként is megadják.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a keresztezéshez használt törzsek, |
|
— |
a vemhes nőstények száma a vizsgálati és a kontrollcsoportokban, |
|
— |
az átlagos alomszám a vizsgálati és a kontrollcsoportokban születéskor és a szoptatástól való elválasztáskor, |
|
— |
a vizsgált anyag dózisa(i), |
|
— |
a felhasznált oldószer, |
|
— |
a vemhesség napja, amikor a nőstény megkapta a kezelést, |
|
— |
az anyag adagolásának módja, |
|
— |
az összes utód száma, a WMVS, MDS és RS típusú eltérésekkel rendelkező utódok száma a vizsgálati és a kontrollcsoportban, |
|
— |
jelentős morfológiai rendellenességek, |
|
— |
az RS-eltéréssel rendelkező állatok dózis-hatás összefüggései, ha lehetséges, |
|
— |
az eredmények statisztikai feldolgozása, ahol lehetséges, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.25. EGÉREN VÉGZETT ÖRÖKLETES TRANSZLOKÁCIÓS VIZSGÁLAT
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Az egéren végzett örökletes transzlokációs vizsgálat az első utódnemzedékből kinyerhető szerkezeti és számbeli kromoszómaváltozásokat mutatja ki. A kimutatott kromoszómaváltozások típusai a reciprok transzlokáció és – ha nőstény utódokat is vizsgálunk – az X-kromoszóma-veszteség. A transzlokáció-hordozók és az XO-nőstények csökkent termékenységgel rendelkeznek, ezen állatokat az F1 utódnemzedékből ennek alapján válogatjuk ki a citogenetikai elemzéshez. Bizonyos transzlokáció-típusok teljes sterilitást eredményeznek (X-autoszóma és c-t típus). A transzlokációk citogenetikai vizsgálattal hím állatok (vagy F1 hímek vagy F1 nőstények hím utódai) meiotikus sejtjeiben a diakinézis-I. metafázisban figyelhetők meg. Az XO-nőstények a csontvelői sejtek mitózisa során megfigyelhető, mindössze 39 kromoszóma jelenléte alapján azonosíthatók.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Előkészületek
Ahol lehet, a vizsgált anyagokat izotóniás sóoldatban kell feloldani vagy szuszpendálni. A vízben oldhatatlan vegyi anyagokat a megfelelő vivőanyagban lehet feloldani vagy szuszpendálni. A vizsgált vegyi anyag friss készítményeit kell használni. Az alkalmazott vivőanyag nem lehet hatással a vizsgált anyagra, és nem okozhat toxikus hatást.
A vizsgált anyagot orális intubálással vagy intraperitoneális injekcióval kell bejuttatni. Más alkalmazási módok is megfelelőek lehetnek.
A tenyésztés megkönnyítése és a citológiai megerősítő vizsgálatok miatt e vizsgálatokat egereken végzik. Nincs szükség különleges egértörzsre. Mindazonáltal a törzs átlagos alomszáma nyolcnál nagyobb és viszonylag állandó legyen.
Egészséges, ivarérett állatokra van szükség.
Az állatok száma a spontán transzlokáció gyakoriságától és a pozitív eredmény eléréséhez szükséges minimális indukciós aránytól függ.
A vizsgálatot rendszerint F1 hím utódok elemzésével végzik. Dózisonként legalább 500 hím F1 utódot kell megvizsgálni. Ha F1 nőstény utódokat is használunk, 300 hímre és 300 nőstényre van szükség.
Egyidejűleg végzett vizsgálatokból és történeti kontrollvizsgálatokból megfelelő kontrolladatoknak kell rendelkezésre állniuk. Ha nemrégen ugyanezen laboratóriumban elvégzett vizsgálatokból elfogadható pozitív kontrolleredmények állnak rendelkezésre, egyidejűleg alkalmazott kontrollok helyett ezek is használhatók.
Egy adagolási szintet vizsgálnak, rendszerint azt a legnagyobb dózist, amely minimális toxikus hatást fejt ki, de még nem befolyásolja a szaporodási viselkedést vagy a túlélést. A dózis-hatás összefüggés megállapításához még legalább két alacsonyabb adaggal kezelt csoportra is szükség van. Nem mérgező anyagoknál a legnagyobb megengedhető adagot használják.
A kísérlet végrehajtása
Kétféle kezelési protokoll áll rendelkezésre. A leggyakrabban alkalmazott a vizsgált anyag egyszeri adagolása. Másik lehetőség a vizsgált anyag adagolása heti hét napon át, 35 napon keresztül. A kezelések utáni pároztatások számát a kezelési protokoll határozza meg, amelynek biztosítania kell, hogy a csírasejtképződés minden kezelt fázisából legyen mintavétel. A párzási időszak végén a nőstényeket egyedileg ketrecbe kell zárni. Elléskor feljegyzik a napot, az alomszámot és az utódok nemét. Valamennyi hím utódot elválasztják, és a nőstény utódokkal nem foglalkoznak, hacsak nem akarják felhasználni azokat is a vizsgálatban.
Az alábbi két módszer egyike használható:
|
— |
az F1 utódok termékenységének vizsgálata és a lehetséges transzlokációk utólagos igazolása citogenetikai elemzéssel, |
|
— |
valamennyi hím F1 utód citogenetikai vizsgálata termékenységvizsgálattal végzett előzetes kiválogatás nélkül. |
|
a) |
Termékenységvizsgálat Az F1 utód csökkent termékenységét az alomszám megfigyelésével és/vagy az ezen állattal pároztatott nőstények méhtartalmának vizsgálatával mutathatják ki. A normális, illetve csökkent termékenység kritériumait a felhasznált egértörzs sajátságainak megfelelően kell meghatározni. Alomszám-megfigyelések: A vizsgálandó F1 hímeket ugyanazon vizsgálatból vagy ugyanazon tenyészetből származó nőstényekkel együtt ketrecekbe zárják. A ketreceket a párzás utáni 18. naptól kezdődően naponta megvizsgálják. Az alom létszámát és az F2 utódok nemét elléskor feljegyzik, az almot ezután eltávolítják. Ha F1 nőstény utódokat vizsgálnak, a kis almok F2 utódait további vizsgálatok céljaira megtartják. A nőstény transzlokációhordozókat bármely hím utódjuk transzlokációs citogenetikai vizsgálatával azonosíthatják. Az XO-nőstényeket az utódok ivari megoszlásának változásából ismerhetik fel, a hímek és nőstények aránya 1:1-ről l:2-re változik. A normál F1 állatokat egy több egymást követő lépésből álló eljárásban kivonják a vizsgálatból, ha az első F2 alom létszáma eléri vagy meghaladja az előre meghatározott normál értéket, ellenkező esetben viszont a második vagy harmadik F2 almot is megfigyelik. Azon F1 állatokat, amelyeket még a harmadik F2 alom után sem lehet normálisnak tekinteni, vagy tovább vizsgálják a velük pároztatott nőstények méhtartalmának elemzésével, vagy rögtön citogenetikai vizsgálatnak vetik alá. A méhtartalom elemzése: A transzlokáció-hordozók alomlétszámának csökkenése az embrionális elhalálozásnak tudható be, ezért nagyszámú elhalt implantátum jelzi a vizsgált állatban kialakult transzlokációt. A vizsgálandó F1 hímeket két-három nősténnyel pároztatjuk. A fogamzás napját a hüvelyi dugó reggelente történő, napi vizsgálatával állapítják meg. A nőstényeket 14–16 nappal később elpusztítják, és méhükben meghatározzák és feljegyzik az élő, illetve elhalt embriók számát. |
|
b) |
Citogenetikai elemzés Levegőn végzett szárítás módszerével herepreparátumokat állítunk elő. A transzlokációhordozókat a primer spermatociták I. típusú diakinézis-metafázisban megjelenő polivalens konfigurációi alapján azonosítjuk. Legalább két sejtet kell találni polivalens asszociációval ahhoz, hogy kijelenthessük, a vizsgált állat transzlokáció-hordozó. Ha nem végeztünk tenyésztési szelekciót, minden F1 hímet egyenként kell citogenetikailag megvizsgálni. Hímenként legkevesebb 25 I. típusú diakinézis-metafázisban levő sejtet kell mikroszkóposan megvizsgálni. A kis herékkel, illetve a diakinézis előtti meiotikus károsodással rendelkező F1 hímeknél, valamint azon F1 nőstényeknél, amelyeknél felmerül az XO-károsodás gyanúja, el kell végezni a spermatogoniumsejtek vagy a csontvelői sejtek mitotikus metafázisainak vizsgálatát is. Egy szokatlanul hosszú és/vagy rövid kromoszóma jelenléte mind a tíz sejtben egy bizonyos, hímsterilitást okozó transzlokációra utal (c-t típus). Egyes X-autoszóma-transzlokációkat, amelyek szintén hímsterilitást okoznak, csak a mitotikus kromoszómák sávos elemzésével lehet kimutatni. Ha mind a 10 mitózisban 39 kromoszómát találunk, az a nőstény XO-kromoszóma eltérését bizonyítja. |
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni.
Minden párzási időszakra megadják a szülői párosításból származó átlagos alomszámot és a nemek arányát születéskor és a szoptatástól való elválasztáskor.
Az F1 állatok termékenységvizsgálatát, a normálpárok átlagos alomszámát és az F1 transzlokáció-hordozók egyedenkénti alomszámát is bemutatják. A méhtartalom-elemzésnél a normálpárok élő és elhalt implantátumainak átlagos számát viszonyítják az F1 transzlokációhordozók párosításából származó élő és elhalt implantátumok egyedenkénti számához.
Az I. típusú diakinézis-metafázis citogenetikai elemezésekor a különféle típusú polivalens konfigurációk számát és a teljes sejtszámot sorolják fel minden transzlokáció-hordozó esetében.
A steril F1 egyedeknél a teljes párzási számot és a párosodási időszak hosszát jegyzik fel. Megadják a herék súlyának és a citogenetikai elemzés eredményének adatait.
Az XO-nőstények esetében az átlagos alomszámot, az F2 nemzedék ivararányát és a citogenetikai elemzés eredményeit kell megadni.
Ha az F1 transzlokáció-hordozókat termékenységvizsgálattal előszelektáljuk; ilyenkor a táblázatoknak azt is be kell mutatniuk, hogy ezek közül hány állat bizonyult heterozigótának a transzlokáció szempontjából.
A negatív és a pozitív kontrollvizsgálatok adatait egyaránt jegyzőkönyvezni kell.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
az egértörzs neve, az állatok kora, a kezelt állatok testsúlya, |
|
— |
a szülő állatok száma nemenként a vizsgálati és a kontrollcsoportokban, |
|
— |
a vizsgálati feltételek, a kezelés részletes leírása, dózisok, oldószerek, a párzási ütemterv, |
|
— |
az utódok száma és neme nőstényenként, a transzlokáció-elemzésre szánt utódok száma és neme, |
|
— |
a transzlokáció-elemzés időpontja és kritériumai, |
|
— |
a transzlokáció-hordozók száma és részletes ismertetése, beleértve a tenyésztési adatokat és a méhtartalom adatait is, ha alkalmazhatók, |
|
— |
a citogenetikai eljárások és a mikroszkópos elemzés részletei, lehetőség szerint képekkel, |
|
— |
az eredmények statisztikai feldolgozása, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.26. SZUBKRÓNIKUS ORÁLIS TOXICITÁSI VIZSGÁLAT, RÁGCSÁLÓKON VÉGZETT 90 NAPOS, ISMÉTELT ADAGOLÁSÚ ORÁLISTOXICITÁS-VIZSGÁLAT
1. MÓDSZER
E szubkrónikusorálistoxicitás-vizsgálat megfelel az OECD TG 408-nak (1998).
1.1. BEVEZETÉS
Egy vegyi anyag toxikus jellemzőinek értékelése és felmérése során az ismételt adagolású szubkrónikus orális toxicitást azután lehet meghatározni, hogy az akut vagy a 28 napos ismételt adagolású toxicitásvizsgálatok kezdeti eredményei már rendelkezésre állnak. A 90 napos vizsgálat a szoptatási időszak befejeztétől a felnőttkorba váltás periódusát is átfogó időszakban a hosszabb ideig tartó, ismételt expozícióból adódó lehetséges egészségkárosodásra vonatkozó információkat tárja fel. A vizsgálat tájékoztat a fontosabb toxikus hatásokról, jelzi a célszerveket és a felhalmozódás lehetőségét, és becslést ad az expozíció kimutatható káros hatással nem járó szintjére (NOAEL) nézve, amit fel lehet használni a krónikustoxicitás-vizsgálatok dózisszintjeinek kiválasztásához és az emberi expozíció biztonsági kritériumainak megállapításához.
A módszer nagy hangsúlyt fektet a neurológiai végpontokra, és jelzi az immunrendszerre és a szaporodásra gyakorolt hatásokat. Szintén hangsúlyt kap a kísérleti állatok gondos klinikai megfigyelésének szükségessége is a lehető legtöbb információ megszerzése érdekében. E vizsgálat lehetővé teszi azon vegyi anyagok körének megállapítását, amelyek potenciálisan neurotoxikus hatásokkal járnak, vagy kedvezőtlen hatásokat gyakorolnak az immunrendszerre vagy a szaporítószervekre, és ennélfogva további, mélyreható kutatások és vizsgálatok elvégzését indokolják.
Lásd még az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Dózis: a vizsgált anyag beadott mennyisége. A dózis mennyiségét tömegben (gramm vagy milligramm) vagy a vizsgált anyag és a vizsgált állat tömegének hányadosában (pl. milligramm anyag/testtömeg kilogramm), vagy állandó táplálékbeli koncentráció formájában (ppm vagy milligramm/táplálék-kilogramm) fejezik ki.
Adagolás: általános meghatározás, ami a dózist, az adagolás gyakoriságát és időtartamát tartalmazza.
NOAEL: a „kimutatható káros hatással nem járó dózisszint” (no observed adverse effect level) rövidítése, és azon legmagasabb adagolási szintet jelöli, amelynél még nem észlelhető a kezeléssel összefüggésben lévő kedvezőtlen hatás.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot naponta, szájon át adják be több kísérleti állatcsoportnak, csoportonként más-más adagolási szinten, 90 napon keresztül. A szer beadásának időszakában az állatokat a toxicitás jeleinek észlelése érdekében gondosan megfigyelik. Az elpusztult, illetve az elpusztított állatokat felboncolják, illetőleg a vizsgálat befejezése után a túlélő állatokat is elpusztítják és felboncolják.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. Az állatok előkészítése
A laboratóriumi körülményekhez legalább öt napon keresztül hozzászoktatott és korábbi kísérleti eljárásoknak még alá nem vetett, egészséges állatokat használnak. A kísérleti állatokat faj, törzs, eredet, nem, súly és/vagy életkor szerint leírják. Az állatokat véletlenszerűen kezelt és kontrollcsoportokba osztják be. A ketreceiket olyan módon helyezik el, hogy az elhelyezésükből adódó lehetséges hatásokat a minimumra lehessen csökkenteni. Minden állatot számmal jelölnek meg az egyedi azonosíthatóság céljából.
1.4.2. A dózisok előkészítése
A vizsgált anyagot gyomorszondán át, az állatok táplálékába vagy az ivóvízbe keverve adják be. A szájon át történő beadás módszerét a vizsgálat céljától, valamint a vizsgált anyag fizikai-kémiai tulajdonságaitól függően választják meg.
Szükség esetén a vizsgált anyagot feloldják vagy szuszpendálják alkalmas vivőanyagban. Amennyiben lehetséges, úgy elsősorban a vizes oldat/szuszpenzió használata javasolt, másodsorban az olajos (pl. kukoricaolaj) oldat/szuszpenzió alkalmazása jöhet számításba, és ezt követheti a másfajta vivőanyagokban történő feloldás. Amennyiben nem víz a vivőanyag, akkor a vivőanyag toxikus tulajdonságainak ismertnek kell lenniük. Meghatározzák a vizsgált anyag stabilitását a beadás körülményei között.
1.4.3. Vizsgálati körülmények
1.4.3.1. A kísérlethez felhasznált állatok
A javasolt faj a patkány, de a rágcsálók más fajai (pl. egerek) is felhasználhatók. Kísérleti célokra általánosan használt, laboratóriumi törzsekből származó fiatal, egészséges, felnőtt állatokat használnak. A nőstényeknél követelmény, hogy nem lehetnek leellettek (nulliparák) vagy vemhesek. Az adagolást az elválasztás után a lehető legrövidebb időn belül célszerű elkezdeni, de mindenképpen az állatok kilenchetes kora előtt. A vizsgálat kezdetén az állatok testtömege csak minimálisan térhet el egymástól, és a nemenkénti átlagos értéktől maximum ± 20 %-kal különbözhet. Ha a vizsgálatot egy hosszú távú krónikustoxicitás-vizsgálat előkísérleteként végzik el, akkor mindkét kísérlethez ugyanabból a törzsből való, azonos eredetű állatokat használnak.
1.4.3.2. Az állatok száma és neme
Minden egyes dózisszinthez legalább 20 állatot (10 hímet és 10 nőstényt) alkalmaznak. Ha időközi elpusztítást terveznek, akkor a csoport létszámát a kísérlet során elpusztítani szándékozott állatok számával megnövelik. A vegyi anyagra vagy annak egy közeli analógiájára vonatkozó korábbi ismeretekre alapozva fontolóra lehet venni egy további, 10 állatból (5 hím és 5 nőstény) álló ún. kísérőcsoport használatát a kontrollcsoportban és a legnagyobb adaggal kezelt csoportban, hogy a kezelés időszakát követően meg lehessen figyelni a toxikus hatás reverzibilitását vagy tartósságát. Az ilyen, kezelés utáni időszak hosszát a megfigyelt hatások figyelembevételével határozzák meg.
1.4.3.3. Dózisszintek
Legalább három dózisszintet és egy párhuzamos kontrollszintet alkalmaznak, kivéve, ha határérték-vizsgálatra kerül sor (lásd az 1.4.3.4. pontot). A dózisszintet ismételt dózis- vagy dózisbehatároló vizsgálatok eredményeire lehet alapozni, figyelembe véve minden korábbi, a vizsgált vagy azzal rokon anyagokra vonatkozó, rendelkezésre álló toxikológiai és toxikokinetikai adatot. Ha a vizsgált anyag fizikai-kémiai tulajdonságai vagy biológiai hatásai nem szabnak korlátokat, akkor a legmagasabb adagolási szintet úgy választják ki, hogy az az állat halála vagy súlyos szenvedése nélkül idézze elő a toxicitást. Ezután az adagokat fokozatosan csökkentik, azzal a céllal, hogy bemutassák a dózisszinttől függő hatásokat és a kimutatható káros hatással nem járó dózisszintet (NOAEL). A csökkenő dózisok beállításához gyakran kétszeres-négyszeres hosszúságú időszakok bizonyulnak optimálisnak, és sokszor tanácsos egy negyedik kezelt csoport alkalmazása, igen nagy dózisbeli különbség (pl. több mint 6–10-szeres) alkalmazásával.
A kontrollcsoport vagy kezeletlen állatokból áll, vagy a vivőanyag ellenőrzésére szolgál, ha a vizsgált anyag adagolásának elősegítésére vivőanyagot használnak. A vizsgált anyaggal való kezeléstől eltekintve a kontrollcsoportban lévő állatokat a kezelt csoportba beosztottakkal azonos bánásmódban részesítik. Ha vivőanyagot használnak a vizsgált anyag beadásához, akkor a kontrollcsoport a vivőanyagot a legnagyobb alkalmazott mennyiségben kapja. Ha a vizsgált anyagot a táplálékkal viszik be, és emiatt az állatok kevesebb táplálékot vesznek magukhoz, akkor egy párhuzamosan táplált kontrollcsoport használata hasznos lehet annak megállapításához, hogy a csökkent étvágy a táplálék ízletességével vagy a vizsgálati modellben beállt toxikológiai változásokkal áll-e összefüggésben.
Figyelembe veszik a vivőanyag és – esettől függően – más adalékanyagok alábbi jellemzőit: a felszívódásra, eloszlásra vagy anyagcserére gyakorolt hatás, a vizsgált anyagnak a szervezetben való visszatartására, ill. a vizsgált anyag kémiai tulajdonságaira gyakorolt hatás, amely módosíthatja a toxikus jellemzőket; és az állatok táplálék- és vízfelvételére vagy tápláltsági állapotára gyakorolt hatás.
1.4.3.4. Határérték-vizsgálat
Ha a kísérlet során a legalább 1 000 mg/testtömeg kg/nap dózisszint, ill. a táplálékban vagy ivóvízben beadott anyagmennyiség megfelelő koncentrációja (a testtömeg alapján végzett számítások szerint) és az e vizsgálat lefolytatására előírt eljárás betartása mellett a vizsgált anyag nem okoz észlelhető toxikus hatásokat, és ha a szerkezet tekintetében rokon anyagokra vonatkozó adatok alapján nem is várható a toxicitás bekövetkezése, akkor a teljes, három adagolási szintet átfogó tanulmány elvégzése szükségtelennek tekinthető. A határértékvizsgálat alkalmazható, kivéve, ha emberi expozíció ennél nagyobb adagolási szint használatát indokolja.
1.5. A KÍSÉRLET VÉGREHAJTÁSA
1.5.1. A dózisok beadása
A kísérleti állatoknak a vizsgált anyagot 90 napon keresztül heti hét napon át, naponta adagolják. Bármely más adagolási rendszer – pl. heti öt nap – célszerűségét indokolni kell. Ha a vizsgált anyagot gyomorszondán át adják be, akkor ennek vagy egy megfelelő intubációs kanülnek a segítségével egyetlen adagban juttatják be a szert. Az egy alkalommal beadható folyadék maximális mennyisége a kísérleti állat méretétől függ. E mennyiség nem haladhatja meg az 1 ml/100 g testtömeget, kivéve a vizes oldatok esetében, amikor 2 ml/100g testtömeg adható. A magasabb koncentrációértékek esetén rendszerint fokozottabb hatást kiváltó irritatív vagy maró anyagok kivételével a koncentráció megfelelő beállításával a minimálisra kell csökkenteni a vizsgált anyag mennyiségének változásait, hogy valamennyi adagolási szinten konstans mennyiséget lehessen adagolni a kísérleti állatoknak.
A táplálékkal vagy ivóvízzel adagolt anyagok esetében fontos biztosítani, hogy a vizsgált anyag beadott mennyisége ne zavarja meg a szokásos táplálékfelvételt és a vízháztartás egyensúlyát. Ha a vizsgált anyagot a táplálékkal együtt adják be, akkor vagy állandó koncentrációban (ppm) keverik be, vagy az állat testsúlyától függő, állandó nagyságú dózisban adagolják. A kiválasztott módszert megjelölik. Gyomorszondán át történő adagolás esetén a dózist minden nap azonos időpontban adják be, mennyiségét a kísérleti állat testtömegéhez igazítják, és azonos mennyiséget adnak be minden alkalommal. Ha a 90 napos vizsgálatot egy hosszan tartó krónikustoxicitás-vizsgálat előkísérleteként végzik, akkor a két kísérletben azonos étrendet alkalmaznak.
1.5.2. Megfigyelések
A megfigyelési időszak legalább 90 nap. A kísérőcsoportban lévő állatokat, amelyekkel további megfigyeléseket terveznek, megfelelő hosszúságú időszakra kezelés nélkül tartják, hogy a toxikus hatások késleltetett előfordulását vagy megmaradását, vagy visszafordíthatóságát megfigyeljék.
Általános klinikai megfigyelést végeznek naponta legalább egyszer, lehetőleg minden nap ugyanazon időpont(ok)ban, figyelembe véve az adagolást követően várható hatások érvényesülésének csúcsidőszakát. Feljegyezik a kísérleti állatok klinikai kórállapotát. Naponta legalább kétszer, rendszerint a nap elején és végén megvizsgálják az összes állatot, hogy nem mutatják-e a morbiditás és mortalitás jeleit.
A vizsgált anyag hatásának való első expozíció előtt legalább egyszer (az egyedek közötti összehasonlítás érdekében), azt követően hetente egyszer az összes állatot részletes klinikai vizsgálatoknak vetik alá. E megfigyeléseket azon ketreceken kívül, ahol egyébként tartják őket, lehetőleg egy szabványos karámban, minden alkalommal a nap hasonló időszakában végzik el. A megfigyeléseket gondosan feljegyzik, lehetőleg a vizsgálatot végző laboratórium által meghatározott pontozásos rendszer segítségével. Törekedni kell arra, hogy a megfigyelési feltételek változatlanok legyenek. A feljegyzett észleléseknek ki kell terjedniük, de nem korlátozandók a következőkre: a bőr, a bunda, a szemek és a nyálkahártyák állapotának, a vizelet- és ürülékkiválasztás és az autonóm mozgások (pl. könnyezés, szőrzet felborzolódása, pupilla mérete, szokatlan légzési ritmusok) változásaira. A testtartás, a járás bizonytalansága, a kézbevételre bekövetkezett változások, valamint a tónusos vagy klónusos görcsök, sztereotip viselkedés (pl. túlzott mosdás, megkergülés) vagy bármilyen bizarr viselkedésmód (pl. öncsonkítás, hátrafelé járás) megfigyelt eseteit is feljegyezik (1).
A vizsgált anyag beadását szemtükörrel vagy más, egyenértékű eszközzel végzett szemészeti vizsgálat előzi meg, amelyet a vizsgálatsorozat végén megismételnek, lehetőleg az összes állaton, de legalább a nagy dózist kapott egyedeken és a kontrollcsoport tagjain. Ha a szemben elváltozást tapasztalnak, az összes állatot megvizsgálják.
Az expozíciós időszak vége felé és a 11. hétnél semmiképpen sem korábban elvégezik a különböző típusú (1) ingerekre (hallószervi, vizuális, önérzékelési ingerek) mutatott reakciók vizsgálatát (2), (3), (4), a fogás/szorítás erejének becslését (5) és a motoros aktivitás felmérését (6). A követendő eljárások további részletei a megfelelő szakirodalomban találhatók. Ettől függetlenül a hivatkozottaktól eltérő alternatív eljárásokat is lehet alkalmazni.
A vizsgálatsorozat végén lefolytatott funkcionális megfigyelésektől el lehet tekinteni, ha ilyen jellegű adatok más vizsgálatok alapján rendelkezésre állnak, és a napi klinikai megfigyelések nem tártak fel funkcionális hiányosságokat.
Kivételesen a funkcionális megfigyelésektől azon csoportok esetében is el lehet tekinteni, amelyek egyébként olyan mértékű toxicitás jeleit produkálják, ami már jelentős mértékben megzavarná a funkcionális vizsgálat eredményeit.
1.5.2.1. Testtömeg és táplálék-/vízfogyasztás
Minden állatot hetente legalább egyszer lemérnek. A felvett táplálék mennyiségét hetente legalább egyszer lemérik. Ha a vizsgált anyagot az ivóvízbe keverik, akkor a vízfogyasztást is legalább hetente lemérik. A vízfogyasztás a táplálékkal és a gyomorszondával történő bejuttatásra alapozott vizsgálatoknál is figyelembe vehető tényező, mivel ezek során az ivási szokások megváltozhatnak.
1.5.2.2. Hematológiai és klinikai biokémiai vizsgálatok
Vérmintákat vesznek egy megnevezett helyről és – amennyiben lehetséges – ezeket megfelelő körülmények között tárolják. A vizsgálati időszak végén az állatok elpusztítása előtt vagy annak részeként vérmintát vesznek.
A vizsgálati időszak végén és az esetleges időközi vérmintavétel alkalmával a következő hematológiai vizsgálatokat végzik el: hematokrit, hemoglobin koncentráció, vörösvértestszám, leukocitaszám (teljes és differenciált vérkép), trombocitaszám és a véralvadási idő/képesség mérése.
A szövetekben jelentkező fontosabb toxikus hatások és különösen a vesékre és a májra gyakorolt hatás vizsgálata érdekében a klinikai biokémiai értékek meghatározását közvetlenül az állatok elpusztítása előtt vagy annak részeként elvégzett vérvétel során szerzett mintán végzik el (eltekintve a haldokló és/vagy időközben leölt egyedektől). A hematológiai vizsgálatokhoz hasonló módon időközbeni mintavételt lehet végezni klinikai biokémiai vizsgálatok céljaira. A vérvétel előtti éjszaka ajánlatos az állatokat koplaltatni (3). A vérplazma-és vérszérummeghatározások során vizsgálandó elemek: nátrium, kálium, vércukor, összkoleszterin, karbamid, vér karbamid-nitrogén szintje, kreatinin, összprotein és albumin, továbbá több mint két, májkárosodást jelző enzim (pl. alanin-aminotranszferáz, aszpartát-aminotranszferáz, alkalikus foszfatáz, gamma-glutamil-transzpeptidáz és szorbit-dehidrogenáz). További enzimek vizsgálatát (májjal vagy más szervekkel kapcsolatosakat), és az epesavak mérését, amelyek bizonyos körülmények között hasznos információkkal szolgálhatnak, szintén be lehet vonni a vizsgálatok körébe.
Kiegészítésként, a vizsgálatok utolsó hetében, amikor a vizeletet előre meghatározott időpontokban gyűjtik, az alábbi vizeletminta-vizsgálatokat lehet elvégezni: megjelenés, mennyiség, ozmolalitás vagy fajsúly, pH-érték, fehérjék, glukóz és vér/vérsejtek.
Ezeken túlmenően megfontolható az általános szöveti roncsolódás szérummarkereinek vizsgálata. Más vizsgálatokat is elvégeznek, ha a vizsgált anyagnak ismert vagy feltételezhető hatása van a kapcsolódó anyagcsere-folyamatokra; ilyen pl. a kalcium, a foszfát, éhgyomorra mért triglicerid, specifikus hormonok, a methemoglobin és a kolinészteráz mérése. Ezeket az értékeket az egyes besorolási osztályokhoz tartozó vegyi anyagokra nézve vagy eseti alapon célszerű meghatározni.
Rugalmas hozzáállásra van szükség, amely vizsgált fajtól és az adott vizsgált anyag megfigyelt és/vagy várható hatásaitól egyaránt függ.
Ha a rendelkezésre álló kiinduló adatok nem bizonyulnak elegendőnek, akkor megfontolandó a hematológiai és klinikai biokémiai változók meghatározása az adagolás kezdete előtt. Általában nem javasolt az ilyen adatok meghatározása a kezelés megkezdése előtt (7).
1.5.2.3. Autopszia
A vizsgálatokba bevont összes állatot teljes körű, beható autopsziának vetik alá, ideértve a következők alapos vizsgálatát: a test külső felszíne, az összes testnyílás, a koponya, a mellüreg, a hasüreg és ezek szervei. Az összes állat máját, veséit, mellékveséit, heréit és mellékheréit, méhét, petefészkeit, csecsemőmirigyét, lépét, agyát és szívét (eltekintve a haldokló és/vagy időközben leölt egyedektől) megtisztítják minden rátapadt szövettől, és a boncolást követően a lehető legrövidebb időn belül megmérik a kiszáradás megelőzése érdekében.
Az alábbi testszöveteket mind a szövetek típusának megállapítása, mind pedig a szándékolt későbbi kórszövettani vizsgálatok szempontjából célszerű fixálni: minden szövetet, amin van makroszkópikus változás, az agyat (a reprezentatív részek között a nagyagyat, kisagyat és a nyúltagyat/nyúltagyi hidat), a gerincvelőt (három szinten: nyaki, mellkasi középső szakasz és ágyéktájék), a hipofízist, a pajzsmirigyet és mellékpajzsmirigyet, a csecsemőmirigyet, a nyelőcsövet, a nyálmirigyeket, a gyomrot, a vékony- és vastagbelet (beleértve a Peyer-plakkot), a májat, a hasnyálmirigyet, a veséket, a mellékveséket, a lépet, szívet, a légcsövet és a tüdőket (ezeket felfújt állapotban kell rögzíteni és fixálni), az aortát, ivarmirigyeket, a méhet, a járulékos ivarszerveket, a nőstények emlőmirigyeit, a prosztatát, a húgyhólyagot, az epehólyagot (egérnél), a nyirokcsomókat (egyet lehetőleg a vizsgált anyag beadási útvonalába eső, egyet pedig egy attól távoli helyről véve, a keringési rendszerre gyakorolt hatások megállapításához), a perifériás idegeket (csípő vagy sípcsont környéki), lehetőleg az izomzathoz közeli helyről véve, egy metszetet a csontvelőből (és/vagy egy, friss csontvelőből felszívott mintát), a bőrt és a szemeket (ha a szemészeti vizsgálatok elváltozásokat jeleztek). A klinikai és más jellegű megfigyelések alapján további testszövetek vizsgálata is szükségesnek tűnhet. A fentieken túl megőriznek minden olyan más szervet is, amelyek a vizsgált anyag ismert tulajdonságai alapján valószínűleg célszerveknek tekinthetők.
1.5.2.4. Kórszövettani vizsgálatok
A tartósított szerveket és szöveteket mind a kontrollcsoport, mind a magas dózissal kezelt csoport összes egyede esetében teljes kórszövettani vizsgálatnak vetik alá. Ha a magas dózissal kezelt csoport egyedei esetében a kezelésnek tulajdonítható elváltozások figyelhetők meg, e vizsgálatot az összes többi, különböző dózissal kezelt csoport egyedeire is kiterjesztik.
Minden makroszkopikus eltávozást megvizsgálnak.
Ún. kiegészítő csoport használata esetén az egyedek azon szerveit és szöveteit vizsgálják meg, amelyeknél a kezelt csoportok egyedei esetében elváltozásokat lehetett kimutatni.
2. ADATOK ÉS JELENTÉSKÉSZÍTÉS
2.1. ADATOK
Minden egyes állattal kapcsolatban rögzítik az adatokat. Ezenfelül az összes adatot táblázat formájában összegzik, a vizsgált állatok minden csoportja tekintetében bemutatva, hogy hány egyeddel indult a vizsgálat, hány állat pusztult el, illetve hányat kellett elpusztítani humánus okokból a kísérlet során, valamint az elpusztulás és az elpusztítás időpontját; hány egyed mutatta toxicitás jeleit, a megfigyelt toxicitás jeleinek leírását, ideértve bármely toxikus hatás kezdetének idejét, időtartamát és súlyosságát, az elváltozásokat mutató állatok számát, az elváltozások típusát és az egyes elváltozástípusokat mutató állatok százalékos arányát.
Amennyiben lehetséges, a nyers adatokat megfelelő, általánosan elfogadott statisztikai módszerrel értékelik ki. A statisztikai módszert már a vizsgálat tervezésének idején kiválasztják.
2.2. VIZSGÁLATI JELENTÉS
A vizsgálati jelentés – amennyiben lehetséges – tartalmazza a következő információkat:
2.2.1. A vizsgált anyag
|
— |
fizikai megjelenése, tisztasága és fizikai-kémiai tulajdonságai, |
|
— |
azonosító adatok, |
|
— |
vivőanyag (ha van): a vivőanyag – ha az nem víz – kiválasztásának indoklása. |
2.2.2. A vizsgált fajok
|
— |
a felhasznált állatok faja és törzse, |
|
— |
az állatok száma, életkora és neme, |
|
— |
az állatok eredete, tartási körülmények, étrend stb., |
|
— |
az egyes állatok testtömege a vizsgálatok kezdetekor. |
2.2.3. Vizsgálati körülmények
|
— |
a dózisszintek megválasztásának indokai, |
|
— |
a vizsgált anyag formulálásának/étrendbe való beillesztésére vonatkozó részletek, a készítmény koncentrációja, stabilitása és homogenitása, |
|
— |
a vizsgált anyag adagolásának részletei, |
|
— |
átszámítás a vizsgált anyagnak a táplálékban/ivóvízben meglévő koncentrációjáról (ppm) a tényleges dózisra (mg/testtömeg kg/nap), ha ez alkalmazható, |
|
— |
a táplálék és víz minőségére vonatkozó adatok. |
2.2.4. Eredmények
|
— |
az egyedek testsúlya és annak változásai, |
|
— |
táplálék-/vízfogyasztásra vonatkozó adatok, |
|
— |
toxikus reakcióra vonatkozó adatok, nemek és adagolási szint szerinti csoportosításban, beleértve a toxicitás jeleit, |
|
— |
a megfigyelt klinikai tünetek természete, súlyossága és tartama (reverzibilisek vagy nem); |
|
— |
a szemészeti vizsgálatok eredményei, |
|
— |
érzékszervek működése, szorítás erőssége, motoros aktivitás értékelése (ahol ilyen adatok rendelkezésre állnak), |
|
— |
hematológiai vizsgálatok eredményei, a megfelelő viszonyítási értékekkel, |
|
— |
a klinikai biokémiai vizsgálatok eredményei, a megfelelő viszonyítási értékekkel, |
|
— |
a végső testtömeg, szervtömegek és a szervtömeg/testtömeg hányadosok, |
|
— |
boncolási leletek, |
|
— |
az összes kórszövettani lelet részletes leírása, |
|
— |
abszorpciós adatok, ha ilyenek rendelkezésre állnak, |
|
— |
az eredmények statisztikai feldolgozása, amennyiben lehetséges. |
Az eredmények tárgyalása.
Összefoglaló megállapítások.
3. SZAKIRODALOM
|
(1) |
IPCS (1986). PRinciples and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document No 60. |
|
(2) |
Tupper, D. E., Wallace, R. B. (1980). Utility of the Neurologic Examination in Rats. Acta Neurobiol. Exp., 40, pp. 999-1003. |
|
(3) |
Gad, S. C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, pp. 691-704. |
|
(4) |
Moser, V. C, Mc Daniel, K. M., Phillips, P. M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, pp. 267-283. |
|
(5) |
Meyer O. A., Tilson H. A., Byrd W. C, Riley M. T. (1979). A Method for the Routine Assessment of Fore- and Hind-limb grip Strength of Rats and Mice. Neurobehav. Toxivol., 1, pp. 233-236. |
|
(6) |
Crofton K. M., Howard J. L., Moser V. C, Gill M. W., Reiter L. W., Tilson H. A., MacPhail R. C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, pp. 599-609. |
|
(7) |
Weingand K., Brown G., Hall R. et al. (1996). „Harmonisation of Animal Clinic Pathology Testing in Toxicity and Safety Studies”, Fundam. & Appl. Toxicol., 29, pp. 198- 201. |
B.27. SZUBKRÓNIKUS ORÁLIS TOXICITÁSI VIZSGÁLAT, 90 NAPOS, ISMÉTELT ADAGOLÁSÚ ORÁLIS TOXICITÁSI VIZSGÁLAT NEM RÁGCSÁLÓKON
1. MÓDSZER
E szubkrónikusorálistoxicitás-vizsgálat megfelel az OECD TG 409-nek (1998).
1.1. BEVEZETÉS
Egy vegyi anyag toxikus jellemzőinek értékelése és felmérése során az ismételt adagolású szubkrónikus orális toxicitást azután lehet meghatározni, hogy az akut vagy 28 napos ismételt adagolású toxicitásvizsgálatok kezdeti eredményei már rendelkezésre állnak. A 90 napos vizsgálat olyan hosszabb időtartamú ismételt expozícióból származó lehetséges egészségkárosodás veszélyeiről szolgáltat információkat, ami időben átfogja a fiatal felnőttkorig terjedő gyors növekedés szakaszát. A vizsgálat tájékoztat a fontosabb toxikus hatásokról, jelzi a célszerveket és a felhalmozódás lehetőségét, és becslést ad az expozíció kimutatható káros hatással nem járó szintjére (NOAEL) nézve, amit fel lehet használni a krónikustoxicitás-vizsgálatok során az adagolási szintjeinek kiválasztásához és az emberi expozíció biztonsági kritériumainak megállapításához.
A vizsgálati módszer, amely lehetővé teszi a vegyi anyagoknak való kitettség kedvezőtlen hatásainak meghatározását nem rágcsálókon, csak az alábbi esetekben használandó:
|
— |
ha más vizsgálatok megállapításai jelzik annak szükségességét, hogy egy második, nem rágcsáló fajon végzett kísérlettel kell tisztázni/leírni az eredményeket, |
|
— |
ha a toxikokinetikai vizsgálatok arra utalnak, hogy a laboratóriumi kísérletek céljaira egy specifikus nem rágcsáló típusú faj lenne a legmegfelelőbb kísérleti állat, |
|
— |
ha más, különleges okok indokolják egy nem rágcsáló faj használatát. |
Lásd még az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Dózis: a vizsgált anyag beadott mennyisége. A dózis mennyiségét tömegben (gramm vagy milligramm) vagy a vizsgált anyag és a vizsgált állat tömegének hányadosában (pl. milligramm anyag/testtömeg kilogramm), vagy állandó táplálékbeli koncentráció formájában (ppm vagy milligramm/táplálék-kilogramm) fejezik ki.
Adagolás: általános meghatározás, ami a dózist, az adagolás gyakoriságát és időtartamát tartalmazza.
NOAEL: a „kimutatható káros hatással nem járó dózisszint” (no observed adverse effect level) rövidítése, azon legmagasabb dózisszintet jelöli, amelynél nem észlelhető a kezeléssel összefüggő kedvezőtlen hatás.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot naponta szájon át adják be több kísérleti állatcsoportnak, csoportonként más-más adagolási szinten, 90 napon keresztül. A szer beadása időszakában az állatokat a toxicitás jeleinek észlelése érdekében gondosan megfigyelik. Az elpusztult, illetve az elpusztított állatokat felboncolják, illetőleg a vizsgálat befejezése után a túlélő állatokat is elpusztítják és felboncolják.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. A faj kiválasztása
A nem rágcsáló fajok közül a leggyakrabban használt a kutya, annak is egy meghatározott fajtája; ez rendszerint a beagle kutya. Más állatfajok is használhatók, pl. a sertés vagy a törpemalac. Főemlősök használata nem javasolt, külön indoklást igényel. Fiatal, egészséges állatokat használnak; a kutya esetében a vizsgált anyag adagolását 4–6 hónapos életkorban, de kilenc hónapos kornál nem később célszerű megkezdeni. Ha a vizsgálatot egy hosszú távú krónikustoxicitás-vizsgálat előkísérleteként végzik el, akkor mindkét kísérlethez ugyanazon törzsből való, azonos eredetű állatokat használnak.
1.4.2. Az állatok előkészítése
A laboratóriumi körülményekhez hozzászoktatott és korábbi kísérleti eljárásoknak még alá nem vetett, egészséges, fiatal állatokat használnak fel. Az akklimatizáció időtartama a kísérlethez kiválasztott fajtól és az állatok eredetétől függ. Kutyák és a helyben, e célra tenyésztett sertések esetében legalább öt nap, míg a külső forrásból beszerzett állatoknál legalább két hét szoktatási időtartam ajánlott. A kísérleti állatokat faj, törzs, eredet, nem, testtömeg és/vagy életkor szerint leírják. Az állatokat véletlenszerűen kezelt és kontrollcsoportokba osztják be. A ketreceiket olyan módon helyezik el, hogy az elhelyezésükből adódó lehetséges hatásokat a minimumra lehessen csökkenteni. Minden állatot számmal jelölnek meg az egyedi azonosíthatóság céljából.
1.4.3. A dózisok előkészítése
A vizsgált anyagot gyomorszondán át, az állatok táplálékába vagy az ivóvízbe keverve vagy kapszulákban adják be. A szájon át történő beadás módszerét a vizsgálat céljától, valamint a vizsgált anyag fizikai-kémiai tulajdonságaitól függően választják meg.
Szükség esetén a vizsgált anyagot feloldják vagy szuszpendálják alkalmas vivőanyagban, amennyiben lehetséges, elsősorban a vizes oldat/szuszpenzió használata javasolt, másodsorban az olajos oldat/emulzió (pl. kukoricaolaj) alkalmazása jöhet számításba, és ezt követheti a másfajta vivőanyagokban való feloldás. Amennyiben nem víz a vivőanyag, akkor a vivőanyag toxikus tulajdonságainak ismertnek kell lenniük. Meghatározzák a vizsgált anyag stabilitását a beadás körülményei között.
1.5 A KÍSÉRLET VÉGREHAJTÁSA
1.5.1. Az állatok száma és neme
Minden dózisszinthez legalább 8 állatot (4 hímet és 4 nőstényt) alkalmaznak. Ha időközi elpusztítást terveznek, akkor a csoport létszámát a kísérlet során elpusztítani szándékozott állatok számával megnövelik. A kísérlet végére életben maradó állatok száma elégséges kell, hogy legyen a toxikus hatások értékeléséhez. A vegyi anyagra vagy annak egy közeli analógiájára vonatkozó korábbi ismeretekre alapozva fontolóra lehet venni egy további, 8 állatból (4 hím és 4 nőstény) álló ún. kísérőcsoport használatát a kontrollcsoportban és a legnagyobb adaggal kezelt csoportban, hogy a kezelés időszakát követően meg lehessen figyelni a toxikus hatás reverzibilitását vagy tartósságát. Az ilyen, kezelés utáni időszak hosszát a megfigyelt hatások figyelembevételével határozzák meg.
1.5.2. Adagolási szintek
Legalább három dózisszintet és egy párhuzamos kontrollszintet alkalmaznak, kivéve, ha határérték-vizsgálatra kerül sor (ld. 1.5.3. pont). A dózisszintet ismételt dózis vagy dózisbehatároló vizsgálatok eredményeire lehet alapozni, figyelembe véve minden korábbi, a vizsgált vagy azzal rokon anyagok toxicitására és a toxiko-kinetikára vonatkozóan rendelkezésre álló adatokat. Ha a vizsgált anyag fizikai-kémiai tulajdonságai vagy biológiai hatásai nem szabnak korlátokat, akkor a legmagasabb adagolási szintet úgy választják ki, hogy az az állat halála vagy komoly szenvedése nélkül idézze elő a toxicitást. Ezután az adagokat fokozatosan csökkentik azzal a céllal, hogy bemutassák a dózisszinttől függő hatásokat és a kimutatható káros hatással nem járó dózisszintet (NOAEL). A csökkenő dózisok beállításához gyakran kétszeres-négyszeres hosszúságú időszakok bizonyulnak optimálisnak, és sokszor tanácsos egy negyedik kezelt csoport alkalmazása, igen nagy dózisbeli különbség (pl. több mint 6–10-szeres) alkalmazásával.
A kontrollcsoport vagy kezeletlen állatokból áll, vagy a vivőanyag ellenőrzésére szolgál, ha a vizsgált anyag adagolásának elősegítésére vivőanyagot használnak. A vizsgált anyaggal való kezeléstől eltekintve a kontrollcsoportban lévő állatokat a kezelt csoportba beosztottakkal azonos bánásmódban részesítik. Ha vivőanyagot használnak a vizsgált anyag beadásához, akkor a kontrollcsoport a vivőanyagot a legnagyobb alkalmazott mennyiségben kapja. Ha a vizsgált anyagot a táplálékkal viszik be, és emiatt az állatok kevesebb táplálékot vesznek magukhoz, akkor egy párhuzamosan táplált kontrollcsoport használata hasznos lehet annak megállapításához, hogy a csökkent étvágy a táplálék ízletességével vagy a vizsgálati modellben beállt toxikológiai változásokkal áll-e összefüggésben.
Figyelembe veszik a vivőanyag és – esettől függően – más adalékanyagok alábbi jellemzőit: a felszívódásra, eloszlásra vagy anyagcserére gyakorolt hatás, a vizsgált anyagnak a szervezetben való visszatartására, ill. a vizsgált anyag kémiai tulajdonságaira gyakorolt hatás, amely módosíthatja a toxikus jellemzőket; és az állatok táplálék- és vízfelvételére vagy tápláltsági állapotára gyakorolt hatás.
1.5.3. Határérték-vizsgálat
Ha a kísérlet során a legalább 1 000mg/testtömeg kg/nap dózisszint és az e vizsgálat lefolytatására előírt eljárás betartása mellett a vizsgált anyag nem okoz észlelhető toxikus hatásokat, és ha a szerkezet tekintetében rokon anyagokra vonatkozó adatok alapján nem is várható a toxicitás bekövetkezése, akkor a teljes, három adagolási szintet átfogó vizsgálat elvégzése szükségtelennek tekinthető. A határérték-vizsgálat alkalmazható, kivéve, ha emberi expozíció ennél nagyobb adagolási szint használatát indokolja.
1.5.4. A dózisok beadása
A kísérleti állatoknak a vizsgált anyagot 90 napon keresztül heti hét napon át, naponta adagolják. Bármely más adagolási rendszer – pl. heti öt nap – célszerűségét indokolni kell. Ha a vizsgált anyagot gyomorszondán át adják be, akkor ennek vagy egy megfelelő intubációs kanülnek a segítségével egyetlen adagban juttatják be a szert. Az egy alkalommal beadható folyadék maximális mennyisége a kísérleti állat méretétől függ. Ennek a mennyiségnek lehetőség szerint alacsonynak kell lennie. A magasabb koncentrációértékek esetén rendszerint fokozottabb hatást kiváltó irritatív vagy maró anyagok kivételével, a koncentráció megfelelő beállításával a minimálisra kell csökkenteni a vizsgált anyag mennyiségének változásait, hogy valamennyi dózisszinten konstans mennyiséget lehessen adagolni a kísérleti állatoknak.
A táplálékkal vagy ivóvízzel adagolt anyagok esetében fontos biztosítani, hogy a vizsgált anyag beadott mennyisége ne zavarja meg a szokásos táplálékfelvételt és a vízháztartás egyensúlyát. Ha a vizsgált anyagot a táplálékkal együtt adják be, akkor vagy állandó koncentrációban (ppm) keverik be, vagy az állat testsúlyától függő, állandó nagyságú dózisban adagolják. A kiválasztott módszert megjelölik. Gyomorszondán át vagy kapszulával történő adagolás esetén a dózist minden nap azonos időpontban adják be, mennyiségét a kísérleti állat testtömegéhez igazítják, és azonos mennyiséget adnak be minden alkalommal. Ha a 90 napos vizsgálatot egy hosszan tartó krónikustoxicitás-vizsgálat előkísérleteként végzik, akkor a két kísérletben azonos étrendet alkalmaznak.
1.5.5. Megfigyelések
A megfigyelési időszak legalább 90 nap. A kísérőcsoportban lévő állatokat, amelyekkel további megfigyeléseket terveznek, megfelelő hosszúságú időszakra kezelés nélkül tartják, hogy a toxikus hatások késleltetett előfordulását vagy megmaradását, vagy visszafordíthatóságát megfigyeljék.
Általános klinikai megfigyelést végeznek naponta legalább egyszer, lehetőleg minden nap ugyazon időpont(ok)ban, figyelembe véve az adagolást követően várható hatások érvényesülésének csúcsidőszakát. Feljegyzik a kísérleti állatok klinikai kórállapotát. Naponta legalább kétszer, rendszerint a nap elején és végén megvizsgálják az összes állatot, hogy nem mutatják-e a morbiditás és mortalitás jeleit.
A vizsgált anyag hatásának való első expozíció előtt legalább egyszer (az egyedek közötti összehasonlítás érdekében), azt követően hetente egyszer az összes állatot részletes klinikai vizsgálatoknak vetik alá. E megfigyeléseket azon ketreceken kívül, ahol egyébként tartják őket, lehetőleg egy szabványos karámban, minden alkalommal a nap hasonló időszakában végzik el. A megfigyeléseket gondosan feljegyzik, beleértve jelentkezésük időpontját, méretüket és tartalmukat. A feljegyzett észleléseknek ki kell terjedniük, de nem korlátozandók a következőkre: a bőr, a bunda, a szemek és a nyálkahártyák állapotának, a vizelet- és ürülékkiválasztás és az autonóm mozgások (pl. könnyezés, szőrzet felborzolódása, pupilla mérete, szokatlan légzési ritmusok) változásaira. A testtartás, a járás bizonytalansága, a kézbevétel, valamint a tónusos vagy klónusos görcsök, sztereotip viselkedés (pl. túlzott mosdás, megkergülés) vagy bármilyen bizarr viselkedésmód (pl. öncsonkítás, hátrafelé járás) megfigyelt eseteit is feljegyezik.
A vizsgált anyag beadását szemtükörrel vagy más, egyenértékű eszközzel végzett szemészeti vizsgálat előzi meg, amelyet a vizsgálatsorozat végén megismételnek, lehetőleg az összes állaton, de legalább a nagy dózist kapott egyedeken és a kontrollcsoport tagjain. Ha a szemben elváltozást tapasztalnak, az összes állatot megvizsgálják.
1.5.5.1. Testtömeg és táplálék-/vízfogyasztás
Minden állatot hetente legalább egyszer lemérnek. A felvett táplálék mennyiségét hetente legalább egyszer lemérik. Ha a vizsgált anyagot az ivóvízbe keverik, akkor a vízfogyasztást is legalább hetente lemérik. A vízfogyasztás a táplálékkal és a gyomorszondával történő bejuttatásra alapozott vizsgálatoknál is figyelembe vehető tényező, mivel ezek során az ivási szokások megváltozhatnak.
1.5.5.2. Hematológiai és klinikai biokémiai vizsgálatok
Vérmintákat vesznek egy megnevezett helyről és – amennyiben lehetséges – ezeket megfelelő feltételek mellett tárolják. A vizsgálati időszak végén az állatok elpusztítása előtt vagy annak részeként vérmintát vesznek.
A vizsgálatok elején, majd vagy havi rendszerességgel, vagy a vizsgálati időszak közepe táján és végül a vizsgálati időszak végén a következőkre kiterjedő hematológiai vizsgálatokat végezik el: hematokrit, hemoglobin-koncentráció, vörösvértestszám, leukocitaszám (teljes és differenciált vérkép), trombocitaszám, illetve a véralvadási idő/képesség mérése, protrombinidő vagy tromboplasztinidő mérése.
A szövetekben jelentkező fontosabb toxikus hatások és különösen a vesékre és a májra gyakorolt hatás vizsgálata érdekében a klinikai biokémiai értékek meghatározását minden állat vérmintáján elvégzik a vizsgálatok elején, majd vagy havi rendszerességgel, vagy a vizsgálati időszak közepe táján, és végül a vizsgálati időszak végén. A vizsgálatok az alábbi területekre terjednek ki: elektrolit-egyensúly, szénhidrát-anyagcsere, valamint máj- és vesefunkció. Az elvégzendő vizsgálatok kiválasztása függ a vizsgált anyag hatásmechanizmusa megfigyelésének módjaitól. Az állatokat a fajra meghatározott megfelelő ideig koplaltatják a vérvétel előtt. A vizsgálandó elemek: kalcium, foszfor, klorid, nátrium, kálium, éhgyomorra mért vércukor, alanin-aminotranszferáz, aszpartát-aminotranszferáz, ornitin-dekarboxiláz, gamma-glutamil-transzpeptidáz, karbamid nitrogén, albumin, vérkreatinin, összes bilirubin és összes szérumprotein.
Legalább a vizsgálatok elejére, közepére, majd a végére időzített vizeletgyűjtéssel az alábbi vizeletminta-vizsgálatokat végezik el: megjelenés, mennyiség, ozmolaritás vagy fajsúly, pH-érték, fehérjék, glukóz és vér/vérsejtek. Szükség szerint további paraméterek vizsgálatát is be lehet vezetni, a megfigyelt hatás(ok) vizsgálati körének bővítése érdekében.
Ezenfelül célszerű lehet elvégezni az általános jellegű szövetsérülések szérumjelzőinek a vizsgálatát. A megfelelő toxikológiai értékeléshez még esetlegesen szükséges további mérések és vizsgálatok közé tartozik a lipidek, hormonok elemzése, sav/bázis egyensúly, methemoglobin- és kolineszteráz-inhibitáció. A megfigyelt hatások vizsgálati körének bővítése érdekében további klinikai biokémiai vizsgálatokat lehet bevezetni. Ezeket az egyes besorolási osztályokhoz tartozó vegyi anyagokra nézve vagy eseti alapon célszerű meghatározni.
Rugalmas hozzáállásra van szükség, amely a vizsgált fajtól és az adott vizsgált anyag megfigyelt és/vagy várható hatásaitól egyaránt függ.
1.5.5.3. Autopszia
A vizsgálatokba bevont összes állatot teljes körű, beható autopsziának vetik alá, ideértve a következők alapos vizsgálatát: a test külső felszíne, az összes testnyílás, a koponya, a mellüreg és a hasüreg és ezek szervei. Az összes állat máját az epehólyaggal együtt, veséit, mellékveséit, heréit és mellékheréit, méhét, petefészkeit, pajzsmirigyét (a mellékpajzsmirigyekkel együtt), csecsemőmirigyét, lépét, agyát és szívét (eltekintve a haldokló és/vagy időközben leölt egyedektől) megtisztítják minden rátapadt szövettől, és a boncolást követő lehető legrövidebb időn belül megmérik a kiszáradás megelőzése érdekében.
Az alábbi testszöveteket mind a szövetek típusának megállapítása, mind pedig a szándékolt későbbi kórszövettani vizsgálatok szempontjából célszerű konzerválni a legmegfelelőbb fixálószerben: minden szövetet, amin van makroszkópikus elváltozás, az agyat (a reprezentatív részek között a nagyagyat, kisagyat és a nyúltagyat/nyúltagyi hidat), a gerincvelőt (három szinten: nyaki, mellkasi középső szakasz és ágyéktájék), a hipofízist, a szemeket, a pajzsmirigyet és mellékpajzsmirigyet, a csecsemőmirigyet, a nyelőcsövet, a nyálmirigyeket, a gyomrot, a vékony- és vastagbelet (beleértve a Peyer-plakkot), a májat, az epehólyagot, a hasnyálmirigyet, a veséket, a mellékveséket, a lépet, a szívet, a légcsövet és a tüdőket, az aortákat, ivarmirigyeket, a méhet, a járulékos ivarszerveket, a nőstények emlőmirigyeit, a prosztatát, a húgyhólyagot, a nyirokcsomókat (egyet lehetőleg a vizsgált anyag beadási útvonalába eső, egyet pedig egy attól távoli helyről véve, a keringési rendszerre gyakorolt hatások megállapításához), a perifériás idegeket (csípő vagy sípcsont környéki), lehetőleg az izomzathoz közeli helyről véve, egy metszetet a csontvelőből (és/vagy egy, friss csontvelőből felszívott mintát) és a bőrt. A klinikai és más jellegű megfigyelések alapján további testszövetek vizsgálata is szükségesnek tűnhet. A fentieken túl megőriznek minden olyan más szervet is, amelyek a vizsgált anyag ismert tulajdonságai alapján valószínűleg célszerveknek tekinthetők.
1.5.5.4. Kórszövettani vizsgálatok
A tartósított szerveket és szöveteket mind a kontrollcsoport, mind a magas dózissal kezelt csoport összes egyede esetében teljes kórszövettani vizsgálatnak vetik alá. Ha a magas dózissal kezelt csoport egyedei esetében a kezelésnek tulajdonítható elváltozások figyelhetők meg, ezt a vizsgálatot az összes többi, különböző dózissal kezelt csoport egyedeire is kiterjesztik.
Minden makroszkópikus elváltozást megvizsgálnak.
Ún. kiegészítő csoport használata esetén az egyedek azon szerveit és szöveteit vizsgálják meg, amelyeknél a kezelt csoportok egyedei esetében elváltozásokat lehetett kimutatni.
2. ADATOK ÉS JELENTÉSKÉSZÍTÉS
2.1. ADATOK
Minden egyes állattal kapcsolatban rögzítik az adatokat. Ezenfelül az összes adatot táblázat formájában összegzik, a vizsgált állatok minden csoportja tekintetében bemutatva, hogy hány egyeddel indult a vizsgálat, hány állat pusztult el, illetve hányat kellett elpusztítani humánus okokból a kísérlet során, valamint az elpusztulás és az elpusztítás időpontját; hány egyed mutatta toxicitás jeleit, a megfigyelt toxicitás jeleinek leírását, ideértve bármely toxikus hatás kezdetének idejét, időtartamát és súlyosságát, az elváltozásokat mutató állatok számát, az elváltozások típusát és az egyes elváltozástípusokat mutató állatok százalékos arányát.
Amennyiben lehetséges, a nyers adatokat megfelelő, általánosan elfogadott statisztikai módszerrel értékelik ki. A feldolgozandó adatokat és statisztikai módszereket már a vizsgálat tervezésének idején kiválasztják.
2.2. VIZSGÁLATI JELENTÉS
A vizsgálati jelentés – amennyiben lehetséges – tartalmazza a következő információkat:
2.2.1. A vizsgált anyag
|
— |
fizikai megjelenése, tisztasága és fizikai-kémiai tulajdonságai, |
|
— |
azonosító adatok, |
|
— |
vivőanyag (ha van): a vivőanyag – ha az nem víz – kiválasztásának indoklása. |
2.2.2. A vizsgált fajok
|
— |
a felhasznált állatok faja és törzse, |
|
— |
az állatok száma, életkora és neme, |
|
— |
az állatok eredete, tartási körülmények, étrend stb., |
|
— |
az egyes állatok testtömege a vizsgálatok kezdetekor. |
2.2.3. Vizsgálati körülmények
|
— |
a dózisszintek megválasztásának indokai, |
|
— |
a vizsgált anyag formulálásának/étrendbe való beillesztésére vonatkozó részletek, a készítmény koncentrációja, stabilitása és homogenitása, |
|
— |
a vizsgált anyag adagolásának részletei, |
|
— |
a tényleges dózis (mg/testtömeg kg/nap) és az étrendbe illesztett, illetve vízzel beadott vizsgált anyag koncentrációjának (ppm) a tényleges dózisra való átváltási tényezője, ha ilyen értelmezhető a vizsgálatok során, |
|
— |
a táplálék és víz minőségére vonatkozó részletek. |
2.2.4. Eredmények
|
— |
az egyedek testtömege és annak változásai, |
|
— |
táplálék-/vízfogyasztásra vonatkozó adatok, |
|
— |
toxikus reakcióra vonatkozó adatok, nemek és adagolási szint szerinti csoportosításban, beleértve a toxicitás jeleit, |
|
— |
a klinikai megfigyelések jellege, súlyossága és időtartama (a változások reverzibilisek-e vagy sem) |
|
— |
a szemészeti vizsgálatok eredményei, |
|
— |
a hematológiai vizsgálatok eredményei, a megfelelő viszonyítási értékekkel, |
|
— |
a klinikai biokémiai vizsgálatok eredményei, a megfelelő viszonyítási értékekkel, |
|
— |
a végső testtömeg, szervtömegek és a szervek/testtömeghányadosok, |
|
— |
boncolási leletek, |
|
— |
az összes kórszövettani lelet részletes leírása, |
|
— |
abszorbciós adatok, ha ilyenek rendelkezésre állnak, |
|
— |
az eredmények statisztikai feldolgozása, amennyiben lehetséges. |
Az eredmények tárgyalása.
Összefoglaló megállapítások.
B.28. SZUBKRÓNIKUS DERMÁLIS TOXICITÁSVIZSGÁLAT, 90 NAPOS, ISMÉTELT DERMÁLIS ADAGOLÁSÚ VIZSGÁLAT RÁGCSÁLÓFAJOKON
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot naponta a bőrre adagoljuk, fokozatosan növekvő dózisokban több kísérleti állatcsoportnak, 90 napon keresztül. A vizsgálati időszak alatt az állatokat naponta kell vizsgálni a mérgezés jeleinek észlelése érdekében. A vizsgálat ideje alatt elpusztult állatokat fel kell boncolni, a vizsgálat lezárásakor pedig a túlélő állatokat is el kell pusztítani, és fel kell boncolni.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
Az állatokat a vizsgálat előtt legalább öt napon keresztül a vizsgálat tartási és táplálási körülményei között kell tartani. Az egészséges, fiatal állatokat a vizsgálat megkezdése előtt véletlenszerű kiválasztással kezelt és kontrollcsoportokba kell beosztani. A vizsgálat megkezdése előtt nem sokkal a törzs háti felületén le kell nyírni az állatok szőrét. Borotválni is lehet, de azt a vizsgálat megkezdése előtt megközelítőleg 24 órával kell elvégezni. A vizsgálat során általában ismételt nyírás és borotválás szükséges, rendszerint heti időközönként. A nyírás vagy borotválás során gondosan ügyelni kell arra, hogy a bőrt ne sértsük meg. A testfelület legalább 10 %-át szabaddá kell tenni a vizsgált anyag alkalmazásához. Az állat testsúlyát is tekintetbe kell venni, amikor a megtisztítandó felületről, illetve a fedőkötés méretéről döntünk. Ha szilárd anyagot vizsgálunk, amelyet adott esetben porítani is lehet, az anyagot vízzel kellően át kell nedvesíteni, vagy szükség esetén vivőanyagot kell alkalmazni annak biztosítására, hogy a bőrrel megfelelő módon érintkezzen. A folyékony vizsgálati anyagokat rendszerint hígítás nélkül kell adagolni. Az adagolás heti öt-hét alkalommal történik.
1.6.2. Vizsgálati körülmények
1.6.2.1.
Kifejlett patkány, nyúl vagy tengerimalac használható. Más faj is használható, de azok használatát meg kell indokolni. A vizsgálat kezdetén az állatok súlya lehetőleg csak minimálisan térjen el egymástól, az átlagos értéktől maximum ± 20 %-kal különbözhet. Ha a szubkrónikus dermális vizsgálatot valamely hosszú távú vizsgálat előzetes vizsgálataként végezzük, mindkét vizsgálathoz ugyanazon fajt, illetve kísérleti állattörzset kell felhasználni.
1.6.2.2.
Minden adagolási szinthez legalább 20 egészséges bőrű állatot (10 hímet és 10 nőstényt) kell felhasználni. A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek. Ha időközi elpusztítást tervezünk, akkor a létszámot annyival kell megnövelni, ahány állatot a vizsgálat befejezése előtt el akarunk pusztítani. Ezenkívül még egy 20 fős (nemenként 10 állat) kísérő állatcsoportot is kezelhetünk a legnagyobb adaggal 90 napon át, amelyeknek állatain a kezelés után 28 nappal megfigyelhetjük a toxikus hatás visszafordíthatóságát, elhúzódó vagy késve fellépő voltát.
1.6.2.3.
Legalább három adagolási szintet (dózist) és egy kontrollt kell használni, illetve egy vivőanyagkontrollt, ha van vivőanyag. Az expozíciós idő legalább napi hat óra legyen. A vizsgált anyagot minden nap hasonló időpontban kell alkalmazni, az alkalmazott mennyiséget pedig meghatározott időközönként (hetente vagy kéthetente) hozzá kell igazítani az állatok növekedéséhez, hogy az állatok testsúlyához viszonyított mennyiséget fenn lehessen tartani. A vizsgált anyaggal történő kezelést kivéve a kontrollcsoportban lévő állatokkal pontosan ugyanolyan módon kell bánni, mint a vizsgálati csoportok állataival. Olyan esetekben, amikor az adagolás megkönnyítésére vivőanyagot alkalmazunk, a kontrollcsoportot ugyanúgy kell a vivőanyaggal kezelni, mint a kezelt csoportokat, és ugyanannyi vivőanyagot kell kapniuk, mint a legnagyobb adaggal kezelt csoportnak. A legnagyobb adagot úgy kell kiválasztani, hogy abban jelentkeznie kell a toxikus hatásnak, de elhullások lehetőleg ne, vagy csak minimális mértékben legyenek. A legkisebb adaggal kezelt csoportban nem lehetnek a toxicitásra utaló jelek. Ha használható becslés áll rendelkezésre az emberi expozícióra vonatkozóan, a legkisebb adagnak ennél nagyobbnak kell lennie. Kedvező esetben a középső adaggal kezelt csoportnál minimális toxikus hatás észlelhető. Ha egynél több közbeeső dózist alkalmazunk, akkor azokat úgy kell kiválasztani, hogy fokozódó toxikus hatást váltsanak ki. Az alacsony és közbeeső dózisú, illetve a kontrollcsoportban az elpusztult állatok száma minimális legyen, hogy az eredmények értelmezhető értékelése lehetséges legyen.
Ha a vizsgált anyag alkalmazása súlyos bőrirritációt okoz, a koncentrációt csökkenteni kell, ami az egyéb toxikus hatások mértékének csökkenésével vagy eltűnésével járhat a legnagyobb adaggal kezelt csoportban. Ha a bőr súlyosan károsodott, szükségessé válhat a vizsgálat leállítása és egy új vizsgálat megkezdése kisebb koncentrációk mellett.
1.6.3. Határérték-vizsgálat
Ha az előzetes vizsgálat során napi 1 000 mg/testsúlykilogrammal adagolt vizsgált anyag vagy – ha a lehetséges emberi expozíció mértéke ismert – ennél magasabb dózis semmilyen toxikus hatást nem vált ki, a további vizsgálatok szükségtelennek tekinthetők.
1.6.4. Megfigyelési időszak
Az összes állatot naponta meg kell vizsgálni a toxikus hatások megjelenésének észlelése érdekében. Fel kell jegyezni az elpusztulás időpontját, valamint azt az időpontot, amikor a toxikus hatás jelei mutatkozni kezdenek, illetve elmúlnak.
1.6.5. A kísérlet végrehajtása
Az állatokat egyesével kell a ketrecekben elhelyezni. Ideális esetben a vizsgált anyagot heti hét alkalommal kell az állatoknak beadni, 90 napon keresztül.
A kísérő csoportokban a nyomon követő megfigyelésekre kiválasztott állatokat további 28 napig kell tartani kezelés nélkül, hogy a toxikus hatás visszafordíthatóságát, illetve elhúzódását ki lehessen mutatni. Az anyaggal való érintkezés ideje napi hat óra.
A vizsgált anyagot a testfelület megközelítőleg 10 %-át kitevő felületen egyenletesen elosztva kell felvinni az állat bőrére. Erősen mérgező anyagoknál a felület lehet ennél kisebb, de a felület lehető legnagyobb részét a lehető legvékonyabb és legegyenletesebb bevonattal kell ellátni.
Az expozíció ideje alatt a vizsgált anyagot a bőrrel egy lyukacsos gézlap segítségével és nem irritáló ragasztószalaggal kell érintkezésben tartani. A vizsgált területet megfelelő módon be kell fedni azért, hogy megmaradjon rajta a vizsgált anyag és a gézkötés, és az állatok ne nyalhassák le a vizsgált anyagot. Mozgásgátló szerkezeteket lehet használni annak megakadályozására, hogy az állat a vizsgált anyagot lenyelje, de a teljes immobilizáció mint módszer nem javasolt.
Az expozíciós idő leteltével a maradék vizsgált anyagot lehetőség szerint el kell távolítani a bőr felületének vízzel vagy más megfelelő módon történő megtisztítása útján.
Az összes állatot naponta meg kell vizsgálni, és a toxikus hatások megjelenését, súlyosságát és időtartamát rögzíteni kell. A ketrecben tartott állatok megfigyelésekor a bőr- és szőrelváltozásokra, a szemek és a nyálkahártyák változásaira, valamint a légzési, a keringési rendszerre, az autonóm és a központi idegrendszer működésére, a szomatomotoros tevékenységekre, valamint a viselkedési mintákra kell figyelemmel lenni. Hetente mérni kell a takarmányfogyasztást, valamint az állatok súlyát. Az állatok rendszeres megfigyelésére azért van szükség, hogy megelőzzük a kísérleti állatok kannibalizmus, szöveti autolízis, illetve rossz elhelyezés következtében történő elhullását. A vizsgálati időszak végeztével a kísérő csoportban lévő állatok kivételével minden túlélő állatot fel kell boncolni. A haldokló állatokat eltávolításuk után el kell pusztítani, és fel kell boncolni.
Az alábbi vizsgálatokat rendszeresen el kell végezni az összes állaton, beleértve a kontrollcsoport egyedeit is:
|
a) |
Lehetőleg minden állatot, de legalább a legnagyobb adaggal kezelt és a kontrollcsoportban lévő állatokat szemvizsgálatnak kell alávetni szemtükör vagy ezzel egyenértékű, megfelelő készülék segítségével az expozíciót megelőzően és a vizsgálat végeztével. Ha a szemen elváltozás észlelhető, akkor minden állatot meg kell vizsgálni. |
|
b) |
A hematológiai vizsgálat részeként a vizsgálati időszak végeztével mérni kell a hematokrit-értéket, a hemoglobin-koncentrációt, a vörösvértestszámot, a minőségi és a teljes fehérvérsejtszámot, az alvadási képességet, beleértve az alvadási időt, a protrombin időt, a tromboplasztin időt, illetve a trombocitaszámot. |
|
c) |
A vizsgálati időszak végeztével a vérmintákat klinikai-kémiai vizsgálatoknak is alá kell vetni. Fontos megvizsgálni az elektrolit-egyensúlyt, a szénhidrát-anyagcserét, a máj-, illetve a vesefunkciót. Az egyes vizsgálatok kiválasztását a vizsgált anyag hatásmechanizmusával kapcsolatos megfigyelések befolyásolják. Javasolt meghatározni: a kalcium, a foszfor, a klorid, a nátrium, a kálium szintjét, éhgyomorra kell mérni a glükózszintet (az adott fajra jellemző és megfelelő éheztetési idő után), a szérum glutaminsav szőlősav transzamináz (GPT) (4), a szérum glutaminsav oxálsav transzamináz (GOT) (5), az ornitin dekarboxiláz, a gamma glutamil-transzpeptidáz, a karbamid nitrogén, az albumin, a kreatinin, az összes bilirubin és az összes szérumfehérje szintjét szintén meg kell határozni. További meghatározások, amelyekre a pontos toxicitás értékeléséhez még szükség lehet: lipidelemzés, hormonok, sav-bázis egyensúly, methemoglobin- és kolineszteráz-aktivitás mérése. Ahol a megfigyelt hatások vizsgálatának kiterjesztéséhez szükséges, további klinikai-kémiai vizsgálatokat is lehet végezni. |
|
d) |
Vizeletelemzésre általában nincs szükség, csak akkor, ha a várt vagy megfigyelt toxicitás ezt indokolja. |
Ha a korábbi kísérletekből származó adatok nem megfelelőek, mérlegelendő a hematológiai és klinikai-kémiai paraméterek meghatározása az adagolás megkezdése előtt.
Minden állaton teljes körű makroszkópos boncolást kell végezni, amely a test külső felületének, a testnyílásoknak, valamint a koponya-, mell- és hasüregnek, illetve a bennük található szerveknek a feltárásából és vizsgálatából áll. A májat, a veséket, a mellékveséket és a heréket a kimetszés után minél előbb még nedvesen le kell mérni, a kiszáradás elkerülése miatt. Az alábbi szerveket kell megfelelő közegben tartósan tárolni egy esetleges későbbi kórszövettani vizsgálat céljaira: valamennyi olyan szerv, amelyen makroszkopikus elváltozás található, az agy – beleértve a nyúltagy, a híd, a kisagykéreg, a nagyagykéreg és az agyalapi mirigy metszeteit, a pajzsmirigy és a mellékpajzsmirigy, bármilyen jelen levő csecsemőmirigy, a légcső és a tüdő, a szív, az aorta, (a nyálmirigyek), a máj, a lép, a vesék, a mellékvesék, a hasnyálmirigy, az ivarmirigyek, a méh, (a járulékos nemi szervek), az epehólyag, ha megtalálható, a nyelőcső, a gyomor, a patkóbél, az éhbél, a csípőbél, a vakbél, a vastagbél, a végbél, a húgyhólyag, a reprezentatív nyirokcsomók, (a női emlőmirigy), (a combizomzat), a perifériás idegek, (a szemek), (a szegycsont a csontvelővel), (a combcsont az ízületi felülettel együtt), (a gerincoszlop három szinten – nyaki, mellkasközéptáji és ágyéki csigolyáknál), valamint (a szemüregen kívüli könnymirigyek). A zárójelben említett szöveteket csak akkor kell megvizsgálni, ha célszervként szerepelnek, illetve, ha a toxicitás tünetei ezt indokolják.
|
a) |
Teljes körű kórszövettani vizsgálatot kell végezni a kontrollcsoport és a legnagyobb adaggal kezelt csoport állatainak bőrén, szervein és szövetein. |
|
b) |
Az összes olyan szervet, amelyen makroszkopikus elváltozás található, meg kell vizsgálni. |
|
c) |
A többi dóziscsoport állatainak célszerveit is meg kell vizsgálni. |
|
d) |
Ha patkányokat használunk, a kis, illetve közepes dózissal kezelt csoportok állatainak tüdejét kórszövettani vizsgálatnak kell alávetni a fertőzés jeleit keresve, ez ugyanis az állat egészségi állapotának alkalmas értékelésére szolgál. E csoportok állatainál további kórszövettani vizsgálatokra rutinszerűen nincs szükség, de minden esetben vizsgálatokat kell végezni az olyan szerveken, amelyek az elváltozás jeleit mutatták a legnagyobb dózissal kezelt csoportban. |
|
e) |
Ha kísérő csoportot is használunk, azokon a szöveteken és szerveken, amelyek a kezelt csoportokban elváltozásokat mutattak, itt is el kell végezni a kórszövettani vizsgálatokat. |
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, amely minden vizsgálati csoportban megadja az állatok számát a vizsgálat kezdetén, az elváltozásokat mutató állatok számát, valamint az elváltozások egyes típusait, illetve az elváltozást mutató állatok százalékos arányát. Az eredményeket megfelelő statisztikai módszerrel kell értékelni. Bármely elfogadott statisztikai módszer használható.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
használt faj, törzs, az állatok származása, tartási körülmények, étrend, |
|
— |
vizsgálati körülmények, |
|
— |
adagolás (beleértve a vivőanyagot is, ha van) és koncentrációk, |
|
— |
a toxikus reakciók nemenként és dózisonként, |
|
— |
lehetőség szerint az a szint, amikor még nincs toxikus hatás, |
|
— |
az elpusztulás ideje a vizsgálat során, illetve hogy az állatok megélték-e a vizsgálat végét, |
|
— |
a toxikus és más hatások leírása, |
|
— |
az egyes mérgezési tünetek megfigyelésének időpontja és a megfigyelést követő változásuk, |
|
— |
a takarmány fogyasztásával és a testsúly változásával kapcsolatos adatok, |
|
— |
szemészeti leletek, |
|
— |
az elvégzett hematológiai vizsgálatok és azok valamennyi eredménye, |
|
— |
az elvégzett klinikai-kémiai vizsgálatok és azok valamennyi eredménye (beleértve az esetleges vizeletelemzés eredményeit is), |
|
— |
boncolási leletek, |
|
— |
a kórszövettani vizsgálatok eredményének részletes ismertetése, |
|
— |
az eredmények statisztikai feldolgozása, ahol lehetséges, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.29. SZUBKRÓNIKUS INHALÁCIÓS TOXICITÁSVIZSGÁLAT, 90 NAPOS, ISMÉTELT INHALÁCIÓS ADAGOLÁSÚ VIZSGÁLAT RÁGCSÁLÓFAJOKON
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Több kísérleti állatcsoportot naponta, meghatározott ideig kezelünk a vizsgált anyaggal, fokozatosan növelt koncentrációkban, csoportonként egy koncentráció felhasználásával, 90 napon keresztül. Ha vivőanyagot alkalmazunk a vizsgált anyag megfelelő koncentrációjának kialakításához a levegőben, a vivőanyaghoz is kell kontrollcsoportot beállítani. A vizsgálati időszak alatt az állatokat naponta vizsgálni kell a mérgezés jeleinek észlelése érdekében. A vizsgálat ideje alatt elpusztult állatokat fel kell boncolni, a vizsgálat lezárásakor pedig a túlélő állatokat is el kell pusztítani és fel kell boncolni.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
Az állatokat a vizsgálat előtt legalább öt napon keresztül a vizsgálat tartási és takarmányozási körülményei között kell tartani. Az egészséges, fiatal állatokat a vizsgálat megkezdése előtt véletlenszerű kiválasztással kezelt és kontrollcsoportokba kell beosztani. Szükség esetén vivőanyag alkalmazható a vizsgált anyag megfelelő koncentrációjának kialakítására a levegőben. Ha az adagolás megkönnyítésére vivőanyagot vagy más adalékanyagot használunk, meg kell bizonyosodni arról, hogy azok nem rendelkeznek toxikus hatással. Ehhez szükség szerint korábbi vizsgálatokból származó adatokat is fel lehet használni.
1.6.2. Vizsgálati körülmények
Ha nincs ellenjavallat, patkányt kell kísérleti állatnak használni. Fiatal, egészséges, ivarérett, kísérleti célokra tenyésztett laboratóriumi állattörzsekből származó állatokat kell alkalmazni. A vizsgálat kezdetén az állatok súlya lehetőleg csak minimálisan térjen el egymástól, az átlagos értéktől legfeljebb ± 20 %-kal különbözhet. Ha a szubkrónikus inhalációs vizsgálatot valamely hosszú távú vizsgálat előzményeként végezzük el, mindkét vizsgálathoz ugyanazon fajt, illetve kísérleti állattörzset kell felhasználni.
Valamennyi expozíciós koncentrációszinthez legalább 20 állatot kell felhasználni (10 hímet és 10 nőstényt). A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek. Ezenkívül még egy 20 fős (nemenként 10 állat) kísérő állatcsoportot is lehet kezelni a legnagyobb adaggal 90 napon át, amelynek állatain a kezelés után 28 nappal megfigyelhetővé válik a toxikus hatás visszafordíthatósága, elhúzódó vagy késve fellépő volta.
Legalább három koncentrációt és egy kontrollt, illetve vivőanyagkontrollt kell használni (a legnagyobb koncentrációhoz tartozó vivőanyag-koncentrációval), ha vivőanyagot is alkalmaznak. A vizsgált anyaggal történő kezelést kivéve a kontrollcsoportban lévő állatokkal pontosan ugyanolyan módon kell bánni, mint a vizsgálati csoportok állataival. A legnagyobb adagot úgy kell kiválasztani, hogy annak hatására az azzal kezelt csoportban jelentkezzenek a toxikus hatások, de elhullások lehetőleg ne, vagy csak minimális mértékben legyenek. A legkisebb adagot úgy kell kiválasztani, hogy az ne okozzon toxikus tüneteket. Ha használható becslés áll rendelkezésre az emberi expozícióra vonatkozóan, a legkisebb adagnak ennél nagyobbnak kell lennie. Kedvező esetben a középső adaggal kezelt csoportnál minimális toxikus hatás észlelhető. Ha egynél több közbeeső dózist alkalmaznak, akkor azokat úgy kell kiválasztani, hogy fokozódó toxikus hatást váltsanak ki. Az alacsony és közbeeső dózissal kezelt csoportokban, illetve a kontrollcsoportban az elpusztult állatok száma minimális legyen, hogy az eredmények értelmezhető értékelése lehetséges legyen.
Az expozíció napi időtartama a kamra koncentrációjának kiegyenlítését követően hat óra. Különleges követelmények esetén ettől eltérő expozíciós idők is alkalmazhatók.
A kísérlethez olyan inhalációs berendezést kell használni, amely óránként legalább tizenkét alkalommal légcserét tesz lehetővé a dinamikus légmozgás fenntartása érdekében azért, hogy megfelelő oxigéntartalmat és egyenletesen eloszlatott expozíciós atmoszférát lehessen biztosítani. Ha kamrát használnak, annak kialakítása révén a lehető legkisebbre kell csökkenteni a vizsgálati állatok zsúfoltságát, és lehetővé kell tenni a lehető legnagyobb mértékű expozíciót a vizsgált anyag belégzése útján. Általános szabályként a kamra atmoszférája stabilitásának biztosítása érdekében a vizsgálati állatok teljes térfogata nem haladhatja meg a vizsgálati kamra térfogatának 5 %-át. Végezhetők csak az orron és szájon át vagy csak a fejen át, illetve az egész testen keresztül megvalósuló egyedi expozíciós kamrai vizsgálatok; az első két módszer előnye, hogy minimalizálja a vizsgált anyag egyéb úton történő felvételének lehetőségét.
A vizsgálati állatokat a teljes kezelési és gyógyulási időszak alatt naponta meg kell figyelni a toxicitás jeleinek észlelése érdekében. Fel kell jegyezni az elpusztulás időpontját és azt az időpontot, amikor a toxikus hatások jelei mutatkozni kezdenek, illetve elmúlnak.
1.6.3.
Ideális esetben heti öt-hét alkalommal teszik ki az állatokat a vizsgált anyag hatásának, 90 napon keresztül. A kísérő csoportokban a nyomon követő megfigyelésekre kiválasztott állatokat további 28 napig kell tartani kezelés nélkül, hogy a toxikus hatás visszafordíthatóságát, illetve elhúzódását ki lehessen mutatni. A vizsgálatokat 22 ± 3 oC állandó hőmérséklet mellett kell végezni. Ideális esetben a relatív páratartalmat 30 és 70 % között kell tartani, de bizonyos körülmények között (például aeroszolok vizsgálatakor) ez a gyakorlatban nem mindig kivitelezhető. A belégzési időszak alatt az állatok nem kaphatnak sem takarmányt, sem vizet.
Megfelelő analitikai koncentrációszabályozási rendszerrel kiegészített, dinamikus inhalációs rendszert kell alkalmazni. A megfelelő inhalációs koncentráció kialakításához javasolt a próbavizsgálat elvégzése. A légáramlást úgy kell beállítani, hogy az egész kamrában azonos expozíciós körülményeket biztosítson. A rendszernek biztosítania kell, hogy a kívánt expozíciós körülmények a lehető leggyorsabban kialakíthatók legyenek.
A következő paramétereket kell mérni, illetve figyelemmel kísérni:
|
a) |
a (folyamatos) légáramlás sebessége; |
|
b) |
az anyag tényleges koncentrációja a belégzési zónában. A napi expozíciós időszak folyamán a koncentráció nem változhat a középérték ± 15 %-át meghaladó mértékben. Porok és aeroszolok esetében azonban ez az érték nem biztos, hogy elérhető, ezért itt szélesebb tartomány is elfogadható. A napi koncentrációt a vizsgálat teljes időtartama alatt lehetőség szerinti állandó értéken kell tartani. A kísérlet megtervezésekor részecskeméret-elemzést kell végezni az aeroszolkoncentráció stabilitásának meghatározására. Az expozíció során az elemzést olyan gyakran el kell végezni, amilyen gyakran szükséges, azért, hogy a részecskeeloszlás állandóságát ellenőrizni tudjuk. |
|
c) |
hőmérséklet és páratartalom; |
|
d) |
az expozíció ideje alatt és azt követően az állatokat rendszeresen kell megfigyelni, és a leleteket rögzíteni kell; minden állatról egyedi feljegyzés készül. Az összes állatot naponta meg kell vizsgálni, és a toxikus hatások megjelenését, súlyosságát és időtartamát rögzíteni kell. A ketrecben tartott állatok megfigyelésekor a bőr- és szőrelváltozásokra, a szemek és a nyálkahártyák változásaira, a légzési, a keringési rendszerre, az autonóm és a központi idegrendszer működésére, a szomatomotoros tevékenységekre, valamint a viselkedési mintákra kell figyelemmel lenni. Heti gyakorisággal mérni kell a takarmányfogyasztást és az állatok súlyát. Az állatok rendszeres megfigyelésére azért van szükség, hogy megelőzzük a kísérleti állatok kannibalizmus, szöveti autolízis, illetve rossz elhelyezés következtében történő elhullását. A vizsgálati időszak végeztével a kísérő csoportban lévő állatok kivételével minden túlélő állatot fel kell boncolni. A haldokló állatokat eltávolításuk után el kell pusztítani, és fel kell boncolni. |
Az alábbi vizsgálatokat rendszeresen el kell végezni az összes állaton, beleértve a kontrollcsoport egyedeit is:
|
a) |
Lehetőleg minden állatot, de legalább a legnagyobb adaggal kezelt és a kontrollcsoportban lévő állatokat szemvizsgálatnak kell alávetni szemtükör vagy ezzel egyenértékű, megfelelő készülék segítségével az expozíciót megelőzően és a vizsgálat végeztével. Ha a szemen elváltozás észlelhető, akkor minden állatot meg kell vizsgálni. |
|
b) |
A vizsgálati időszak végén hematológiai vizsgálatokat kell végezni: a hematokrit-értéket, a hemoglobin-koncentrációt, a vörösvértestszámot, a minőségi- és a teljes fehérvérsejtszámot, az alvadási képességet, beleértve az alvadási időt, a protrombin időt, a tromboplasztin időt, illetve a trombocitaszámot kell mérni. |
|
c) |
A vizsgálati időszak végeztével a vérmintákat klinikai-kémiai vizsgálatoknak is alá kell vetni. Fontosnak megvizsgálni az elektrolit-egyensúlyt, a szénhidrátanyagcserét, a máj-, illetve a vesefunkciót. Az egyes vizsgálatok kiválasztását a vizsgált anyag hatásmechanizmusával kapcsolatos megfigyelések befolyásolják. Javasolt meghatározni: a kalcium, a foszfor, a klorid, a nátrium, a kálium szintjét, éhgyomorra kell mérni a glükóz szintjét (az adott fajra jellemző és megfelelő éheztetési idő után); a szérum glutaminsav szőlősav transzamináz (GPT) (4), a szérum glutaminsav oxálsav transzamináz (GOT) (5), az ornitin dekarboxiláz, a gamma glutamil-transzpeptidáz, a karbamid nitrogén, az albumin, a kreatinin, az összes bilirubin és az összes szérumfehérje szintjét szintén meg kell határozni. További meghatározások, amelyekre a pontos toxicitás értékeléséhez még szükség lehet: lipidelemzés, hormonok, sav-bázis egyensúly, methemoglobin- és kolineszteráz-aktivitás mérése. Ahol a megfigyelt hatások vizsgálatának kiterjesztéséhez szükséges, további klinikai-kémiai vizsgálatokat is lehet végezni. |
|
d) |
Vizeletelemzésre általában nincs szükség, csak akkor, ha a várt vagy megfigyelt toxicitás ezt indokolja. |
Ha a korábbi kísérletekből származó adatok nem megfelelőek, mérlegelendő a hematológiai és klinikai-kémiai paraméterek meghatározása az adagolás megkezdése előtt.
Minden állaton teljes körű makroszkópos boncolást kell végezni, amely a test külső felületének, a testnyílásoknak, valamint a koponya-, mell- és hasüregnek, illetve a bennük található szerveknek a feltárásából és vizsgálatából áll. A májat, a veséket, a mellékveséket és a heréket a kimetszés után minél előbb még nedvesen le kell mérni, a kiszáradás elkerülése miatt. Az alábbi szerveket kell megfelelő közegben tartósan tárolni egy esetleges későbbi kórszövettani vizsgálat céljaira: valamennyi olyan szerv, amelyen makroszkopikus elváltozás található, a tüdőket teljesen és sértetlenül kell eltávolítani, megmérni, majd megfelelő fixálóanyaggal konzerválni azért, hogy a szerkezete épen maradjon (megfelelő módszernek tekinthető a fixáló anyagnak a tüdőn való átáramoltatása), az orr és a garat szövetei, az agy -beleértve a nyúltagy, a híd, a kisagykéreg, a nagyagykéreg, és az agyalapi mirigy metszeteit, a pajzsmirigy és a mellékpajzsmirigy, bármilyen jelen levő csecsemőmirigy, a légcső és a tüdő, a szív, az aorta, a nyálmirigyek, a máj, a lép, a vesék, a mellékvesék, a hasnyálmirigy, az ivarmirigyek, a méh, (a járulékos nemi szervek), (bőr) epehólyag (ha van), a nyelőcső, a gyomor, a patkóbél, az éhbél, a csípőbél, a vakbél, a vastagbél, a végbél, a húgyhólyag, a reprezentatív nyirokcsomók, (a női emlőmirigy), (a combizomzat), a perifériás idegek, (szemek), a szegycsont a csontvelővel, (a szemek), (a combcsont az ízületi felülettel együtt), (a gerincoszlop három szinten – nyaki, mellkasközéptáji és ágyéki csigolyáknál). A zárójelben említett szöveteket csak akkor kell megvizsgálni, ha célszervként szerepelnek, illetve, ha a toxicitás tünetei ezt indokolják.
|
a) |
Teljes körű kórszövettani vizsgálatot kell végrehajtani a kontrollcsoport és a legnagyobb adaggal kezelt csoport állatainak légzőszervein, valamint egyéb szervein és szövetein. |
|
b) |
Az összes olyan szervet, amelyen makroszkopikus elváltozás található, meg kell vizsgálni. |
|
c) |
A többi dóziscsoport állatainak célszerveit is meg kell vizsgálni. |
|
d) |
Az alacsony és középső dózissal kezelt csoportok állatainak tüdejét kórszövettani vizsgálatnak kell alávetni azért, hogy az állatok egészségi állapota felmérhető legyen. E csoportok állatainál további kórszövettani vizsgálatokra rutinszerűen nincs szükség, de minden esetben vizsgálatokat kell végezni az olyan szerveken, amelyek az elváltozás jeleit mutatták a legnagyobb dózissal kezelt csoportban. |
|
e) |
Ha kísérő csoportot is használunk, azokon a szöveteken és szerveken, amelyek a kezelt csoportokban elváltozásokat mutattak, itt is el kell végezni a kórszövettani vizsgálatokat. |
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, amely minden vizsgálati csoportban megadja az állatok számát a vizsgálat kezdetén, az elváltozásokat mutató állatok számát, valamint az elváltozások egyes típusait, illetve az elváltozást mutató állatok százalékos arányát. Az eredményeket megfelelő statisztikai módszerrel kell értékelni. Bármely elfogadott statisztikai módszer használható.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
használt faj, törzs, az állatok származása, tartási körülmények, étrend, |
|
— |
vizsgálati körülmények: Az expozíciós készülék leírása: beleértve a készülék konstrukcióját, típusát, méreteit, a levegő forrását, a részecskék és aeroszolok előállítására szolgáló rendszert, a klímarendszert, az elhasznált levegő kezelésének módját, az állatoknak a vizsgálati kamrában való elhelyezését. A hőmérsékletet, a levegő páratartalmát, és adott esetben az aeroszolkoncentráció stabilitását, illetve a részecskenagyságot le kell írni. Expozíciós adatok: ezeket táblázatos formában kell közölni, az átalagértékek és az azoktól való eltérés megjelölésével. A következő adatokat kell tartalmazniuk:
|
|
— |
a toxikus reakciók nemenként és dózisonként, |
|
— |
lehetőség szerint az a szint, amikor még nincs toxikus hatás, |
|
— |
az elpusztulás ideje a vizsgálat során, illetve hogy az állatok megélték-e a vizsgálat végét, |
|
— |
a toxikus és más hatások leírása, |
|
— |
az egyes mérgezési tünetek megfigyelésének időpontja és a megfigyelést követő változásuk, |
|
— |
a takarmány fogyasztásával és a testsúly változásával kapcsolatos adatok, |
|
— |
szemészeti leletek, |
|
— |
az elvégzett hematológiai vizsgálatok és azok valamennyi eredménye, |
|
— |
az elvégzett klinikai-kémiai vizsgálatok és azok valamennyi eredménye (beleértve az esetleges vizeletelemzés eredményeit is), |
|
— |
boncolási leletek, |
|
— |
a kórszövettani vizsgálatok eredményének részletes ismertetése, |
|
— |
az eredmények statisztikai feldolgozása, ahol lehetséges, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.30. KRÓNIKUS TOXICITÁSVIZSGÁLAT
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot rendszerint heti hét alkalommal, a megfelelő módon, fokozatos adagokban kell beadni több, nem rágcsáló vizsgálati állatcsoportnak, élettartamuk jelentős részén keresztül. Az expozíció alatt és után az állatokat a toxikus hatás jeleinek észlelése érdekében naponta meg kell vizsgálni.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
Az állatokat a vizsgálat előtt legalább öt napon keresztül a vizsgálat tartási és takarmányozási körülményei között kell tartani. Az egészséges, fiatal állatokat a vizsgálat megkezdése előtt véletlenszerű kiválasztással kezelt és kontrollcsoportokba kell beosztani.
1.6.2. Vizsgálati körülmények
Ajánlott faj a patkány.
A korábban végzett vizsgálatok eredményeire alapozva egyéb, rágcsáló vagy nem rágcsáló fajokat is lehet használni. Fiatal, egészséges, ivarérett, kísérleti célokra tenyésztett laboratóriumi állattörzsekből származó állatokat kell alkalmazni, az adagolást pedig a szoptatás utáni elválasztást követően minél előbb meg kell kezdeni.
A vizsgálat kezdetén az állatok súlya lehetőleg csak minimálisan térjen el egymástól, az átlagos értéktől legfeljebb ± 20 %-kal különbözhet. Ha a szubkrónikus orális vizsgálatot valamely hosszú távú vizsgálat előzményeként végzik, mindkét vizsgálathoz ugyanazon fajt, illetve kísérleti állattörzset kell felhasználni.
Rágcsálók esetében minden adagolási szinthez, valamint a hozzájuk tartozó kontrollcsoporthoz legalább 40 állatot kell felhasználni (20 hímet és 20 nőstényt). A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek. Ha időközi elpusztítást tervezünk, akkor a létszámot annyival kell megnövelni, ahány állatot a vizsgálat befejezése előtt el akarunk pusztítani.
Nem rágcsáló fajoknál kisebb létszámú, de nemenként és csoportonként legalább négyfős csoportok is elfogadhatók.
Legalább három adagolási szintet (dózist) és egy kontrollcsoportot kell használni. A legnagyobb adagot úgy kell kiválasztani, hogy annak hatására a kezelt csoportban jelentkezzenek a toxicitás jelei, de ne legyen túlzott mértékű elhullás.
A legkisebb adagot úgy kell kiválasztani, hogy az ne okozzon toxikus tüneteket.
A közbeeső csoportok adagjainak nagyságát a legkisebb és legnagyobb adag között pontosan középen kell kijelölni.
Az adagolási szintek kiválasztásánál figyelembe kell venni a korábbi kísérletekből származó adatokat.
Az expozíciót rendszerint naponta ismételjük. Ha a vizsgált anyagot ivóvízzel adjuk be, illetve a takarmányba keverjük, akkor azoknak folyamatosan az állatok rendelkezésére kell állniuk.
A vizsgált anyaggal történő kezelést kivéve a kontrollcsoportban lévő állatokkal pontosan ugyanolyan módon kell bánni, mint a vizsgálati csoportok állataival.
Különleges körülmények között, például aeroszolokat is alkalmazó inhalációs vizsgálatban vagy nem ismert biológiai aktivitással rendelkező emulzióképző anyag szájon át történő adagolásakor egy kezeletlen kontrollcsoportra is szükség van, amelynek állatai nem kerülnek kapcsolatba a vivőanyaggal.
Az adagolás két fő módon történhet: szájon át, illetve belélegeztetéssel. Az adagolás módjának megválasztása függ a vizsgált anyag fizikai és kémiai tulajdonságaitól, valamint az emberi expozíció valószínűsített módjától.
A dermális adagolás alkalmazása jelentős gyakorlati problémákat vet fel. A bőrön át történő felszívódás révén kialakuló krónikus szisztémás toxicitásra vonatkozóan rendszerint következtetni lehet valamely más adagolási mód, például az orális adagolás eredményeiből, valamint korábbi, a bőrön át történő felszívódást vizsgáló egyéb vizsgálatok tapasztalataiból.
Ha a vizsgált anyag felszívódik a gyomor-bél rendszerből, és ha a táplálékfelvétel az esetleges emberi expozíció egyik módja, akkor a szájon át történő adagolás a választandó módszer, hacsak ellenjavallata nincs. Az állatok az anyagot a takarmánnyal, az ivóvízben oldva, illetve kapszulában kapják. Ideális esetben az anyagot naponta kell adagolni a hét mind a hét napján, miután az ötnapos rendszerű adagolás gyógyulással vagy a toxikus tünetek megszűnésével járhat a kimaradó időszakban, és így befolyásolhatja az eredményeket és azok értékelését. Ám főként gyakorlati megfontolások alapján az ötnapos adagolási hét is elfogadhatónak tekintendő.
Miután a belégzéses vizsgálatok sokkal összetettebb technikai problémákat jelentenek, mint az adagolás más módjai, az adagoláshoz itt sokkal részletesebb útmutatást adunk. Azt is megjegyezzük, hogy bizonyos körülmények között a közvetlen légcsőbe juttatás (instilláció) is érvényes módszer lehet.
A hosszú távú expozíció alapja rendszerint az emberi expozíció modellezése, ami két lehetőséget jelent. Az egyik lehetőségnek megfelelően a kamrakoncentráció kiegyenlítődését követően naponta hat órán keresztül lélegeztetik be az állatokkal a vizsgált anyagot heti öt napon keresztül (szakaszos expozíció), a másik lehetőség pedig a környezeti expozíciónak jobban megfelelő módszer, azaz napi 22–24 órán át, a hét minden napján végzett belélegeztetés (folyamatos expozíció), amelybe körülbelül egyórás napi megszakítás is beletartozik, minden nap ugyanazon időben, amikor az állatok megkapják a takarmányt, és amikor a kamrát karbantartjuk.
Az állatok általában mindkét esetben állandó koncentrációnak vannak kitéve. A szakaszos és a folyamatos expozíció közötti alapvető különbség az, hogy az előbbiben van egy 17–18 órás időszak, amikor az állatok regenerálódhatnak a napi adag hatását követően, amelyet a hétvégeken egy még ennél is hosszabb regenerációs időszak követ.
A szakaszos, illetve folyamatos expozíció közötti választás a vizsgálat céljától és a szimulálni kívánt emberi helyzettől függ. Mindazonáltal figyelembe kell venni bizonyos technikai nehézségeket. Ilyen például, hogy a folyamatos expozíció előnyeit csökkentheti az ehhez szükséges itatás és etetés nehézsége, valamint a bonyolultabb (ugyanakkor megbízhatóbb) aeroszol- és páraképző berendezések, illetve a megfigyelőtechnikák igénye.
A kísérlethez olyan inhalációs berendezést kell használni, amely óránként legalább tizenkét alkalommal légcserét tesz lehetővé a dinamikus légmozgás fenntartása érdekében, azért, hogy megfelelő oxigéntartalmat és egyenletesen eloszlatott expozíciós atmoszférát lehessen biztosítani. A kontroll és az expozíciós kamrák tervezésének, felépítésének azonosnak kell lennie, hogy a körülmények a vizsgált anyag belélegeztetését kivéve minden tekintetben összehasonlíthatók legyenek. A kamrában általában enyhe negatív nyomást kell fenntartani, hogy a vizsgált anyag ne szivároghasson ki a környezetbe. Ha kamrát használnak, annak kialakítása révén a lehető legkisebbre kell csökkenteni a kísérleti állatok zsúfoltságát. Általános szabályként a kamrai atmoszféra stabilitásának biztosítása érdekében a kísérleti állatok teljes térfogata nem haladhatja meg a vizsgálati kamra térfogatának 5 %-át.
A következő méréseket és ellenőrzéseket kell elvégezni:
|
i. |
légáramlás: a légkamrán keresztül áramló levegő sebességét lehetőség szerint folyamatosan kell mérni; |
|
ii. |
koncentráció: a napi expozíciós időszak alatt a vizsgált anyag koncentrációjának változása nem haladhatja meg a középérték ± 15 %-át; |
|
iii. |
hőmérséklet és páratartalom: rágcsálóknál a vizsgálatokat 22 ± 2 oC kamrai hőmérsékleten és 30–70 % közötti relatív páratartalom mellett kell végezni, kivéve, amikor a vizsgált anyagot víz segítségével oszlatjuk el a kamra légterében. Lehetőleg mindkét értéket folyamatosan figyelemmel kell kísérni; |
|
iv. |
a részecske nagyságának mérése: a folyékony és szilárd aeroszolt alkalmazó légkamrák légterében meg kell határozni a részecskék megoszlását. Az aeroszolrészecskéknek a felhasznált állatok számára belélegezhető nagyságúaknak kell lenniük. A légkamra mintáit az állatok légzési zónájából kell venni. A légminta legyen az állattal belélegeztetett részecske megoszlására nézve reprezentatív, és gravimetrikusan az összes szuszpendált aeroszolt képviselje még akkor is, ha azok nagy része nem lélegezhető be az állat számára. A részecske méretének meghatározását a kísérleti rendszer kialakítása során gyakran el kell végezni az aeroszol stabilitásának ellenőrzésére, azután pedig olyan gyakran, amilyen mértékben szükséges a belélegeztetés során, hogy megfelelően meghatározhassuk az állatok expozíciójára alkalmazott részecskemegoszlás állandóságát. |
Az adagolás időtartama nem lehet kevesebb 12 hónapnál.
1.6.3. A kísérlet végrehajtása
Naponta legalább egyszer minden állatot gondos klinikai vizsgálatnak kell alávetni. További napi megfigyelések is szükségesek, azért, hogy a vizsgálat során elhullott állatok száma a lehető legkevesebb legyen, például az elpusztult állatokat fel kell boncolni, vagy hűtve kell tárolni, illetve a gyenge vagy haldokló állatokat el kell különíteni, vagy el kell pusztítani. Gondos megfigyeléseket kell végezni valamennyi toxikus hatás megjelenésének és előrehaladásának észlelése, valamint a kannibalizmus, az autolízis, illetve betegség miatt bekövetkező veszteségek csökkentése érdekében.
A klinikai tüneteket, beleértve az idegrendszeri és szemészeti elváltozásokat, valamint a halálozást, minden állatnál fel kell jegyezni. Fel kell jegyezni a toxikus állapot kialakulásának kezdetét és előrehaladásának részleteit, a feltételezett daganatokat is beleértve.
Az állatok testsúlyát az első 13 hét során egyedileg, hetente kell mérni, ezt követően négyhetente legalább egyszer. A táplálkozást heti egy alkalommal kell ellenőrizni az első 13 hétben, majd megközelítőleg háromhavonta, hacsak az állatok egészségi állapota vagy testsúlyváltozása másként nem indokolja.
A harmadik, illetve a hatodik hónap elteltével, majd ezt követően megközelítőleg félévente, valamint a vizsgálat végén valamennyi nem rágcsáló állatnál, valamint csoportonként/nemenként 10 patkánynál valamennyi vizsgálati csoportnál a levett vérmintákból hematológiai vizsgálatot (például hemoglobin-tartalom, hematokrit-érték, vörösvérsejtszám, teljes fehérvérsejtszám, trombocitaszám, illetve egyéb alvadási paraméterek) kell végezni. Ha lehetséges, minden mintát minden alkalommal ugyanattól a patkánytól kell venni. Ezenkívül a nem rágcsálóktól vizsgálat előtti mintát is kell venni.
Ha a klinikai megfigyelések az állatok egészségének romlására utalnak a vizsgálat során, az érintett állatoknál kvantitatív vérképvizsgálatot is kell végezni.
Szintén kvantitatív vérképvizsgálatot kell végezni a legnagyobb adaggal kezelt állatoknál és a kontrollcsoportban. A második legnagyobb adaggal kezelt csoportnál e vizsgálatot csak akkor kell elvégezni, ha jelentős különbség van a kontroll- és a legnagyobb adaggal kezelt csoport között, illetve ha a kórbonctani eredmények ezt indokolják.
Valamennyi nem rágcsáló állatnál és csoportonként/nemenként 10 patkánynál valamennyi vizsgálati csoportnál, lehetőség szerint ugyanazon patkányoktól, ugyanolyan időközönként, a vérvizsgálattal egy időben vizeletmintát is kell venni a vizeletvizsgálathoz. Egyedileg vagy rágcsálók esetében nemenként és csoportonként összesített mintákból az alábbi meghatározásokat kell elvégezni:
|
— |
külső megjelenés: térfogat és sűrűség, állatonként, |
|
— |
fehérje, glükóz, keton, vér (szemikvantitatív meghatározás), |
|
— |
az üledék mikroszkópos vizsgálata (szemikvantitatív meghatározás). |
Valamennyi nem rágcsáló állatnál és csoportonként/nemenként 10 patkánynál valamennyi vizsgálati csoportnál, lehetőség szerint minden alkalommal ugyanazon patkányoktól, megközelítőleg hathavonta, illetve a vizsgálati időszak végeztével vérmintákat kell venni klinikai kémiai vizsgálatok céljaira. Ezenkívül a nem rágcsálóktól vizsgálat előtti mintát is kell venni. A mintákból plazmát kell készíteni, és az alábbi meghatározásokat kell elvégezni:
|
— |
összfehérje-koncentráció, |
|
— |
albuminkoncentráció, |
|
— |
májfunkciós vizsgálatok (például alkalikusfoszfatáz-aktivitás, szérum glutaminsav szőlősav transzamináz (4), szérum glutaminsav oxálsav transzamináz [GOT] (5) aktivitása), gamma glutamil-transzpeptidáz, ornitin dekarboxiláz, |
|
— |
szénhidrát-anyagcsere, például éhgyomorra mért vércukorszint, |
|
— |
vesefunkciós vizsgálatok, például karbamid a vérben. |
Minden állaton teljes körű makroszkópos boncolást kell végezni, beleértve azokat is, amelyek a vizsgálat során pusztultak el, illetve amelyeket betegség miatt kellett elpusztítani. Az elpusztítás előtt az állatoktól kvantitatív vérképvizsgálat céljából vérmintát kell venni. Valamennyi szabad szemmel látható elváltozást, daganatot, illetve daganatgyanús elváltozást meg kell őrizni. Meg kell kísérelni a makroszkópos és mikroszkópos elváltozások közötti összefüggések feltárását.
Az összes szervet és szövetet el kell tenni későbbi kórszövettani vizsgálat céljaira. Ez rendszerint a következő szövetekre és szervekre vonatkozik: agy (6) (a nyúltagy/híd, a kisagykéreg, a nagyagykéreg), az agyalapi mirigy, a pajzsmirigy (a mellékpajzsmiriggyel együtt), a csecsemőmirigy, a tüdő (a légcsővel együtt), a szív, az aorta, a nyálmirigyek, a máj (6), a lép, a vesék (6), a mellékvesék (6), a nyelőcső, a gyomor, a patkóbél, az éhbél, a csípőbél, a vakbél, a vastagbél, a végbél, a méh, a húgyhólyag, a nyirokcsomók, a hasnyálmirigy, az ivarmirigyek (6), a járulékos nemi szervek, a női emlőmirigy, a bőr, az izomzat, a perifériás idegek, a gerincvelő (nyaki, háti, ágyéki), a szegycsont a csontvelővel és a combcsont (az ízületi felülettel együtt), valamint a szemek. A tüdő és a húgyhólyag megőrzésére a legjobb módszer a fixálóval való feltöltés. A tüdő folyadékkal való feltöltése az inhalációs vizsgálatoknál a megfelelő kórszövettani vizsgálat előfeltétele. Különleges, például inhalációs vizsgálatoknál a teljes légzőrendszert vizsgálni kell, az orral, a garattal és a gégefővel együtt.
Ha más klinikai vizsgálatok is történnek, a fenti eljárásokból nyert információknak a mikroszkópos vizsgálatokat megelőzően kell rendelkezésre állniuk, mert a patológus számára lényeges információkkal szolgálhatnak.
Minden látható elváltozást, különösen a bármely szerven található daganatokat és más sérüléseket, mikroszkópos vizsgálatnak kell alávetni. Ezenkívül az alábbi eljárásokat ajánljuk:
|
a) |
Valamennyi tartósított szerv és szövet mikroszkópos vizsgálata az alábbi kísérleti állatoknál talált elváltozások teljes és részletes leírásával:
|
|
b) |
A vizsgált anyag által okozott, illetve feltehetően okozott rendellenességet mutató szervek és szövetek esetében az alacsonyabb adaggal kezelt csoportoknál is kell szövettani vizsgálatot végezni. |
|
c) |
Ha a vizsgálat eredménye az állatok rendes élettartamának lényeges rövidülését mutatja, illetve olyan hatásokat jelez, amelyek valamely toxikus választ befolyásolhatnak, a fent leírtak szerint az eggyel kisebb adaggal kezelt csoportnál is el kell végezni a vizsgálatot. |
|
d) |
A vizsgálat során felhasznált állatoknál normál körülmények között, hasonló laboratóriumi tartás mellett is előforduló elváltozásokkal kapcsolatos információ, vagyis a történeti kontrolladatok ismerete elengedhetetlenül szükséges ahhoz, hogy a kezelt állatokban megfigyelt változások jelentőségét helyesen értelmezzük. |
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, amely minden vizsgálati csoportban megadja az állatok számát a vizsgálat kezdetén, az elváltozásokat mutató állatok számát, valamint az elváltozások egyes típusait, illetve az elváltozást mutató állatok százalékos arányát. Az eredményeket megfelelő statisztikai módszerrel kell értékelni. Bármely elfogadott statisztikai módszer használható.
3. ZÁRÓ VIZSGÁLATI JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
használt faj, törzs, az állatok származása, tartási körülmények, étrend, |
|
— |
vizsgálati körülmények. Az expozíciós készülék leírása: Beleértve a készülék konstrukcióját, típusát, méreteit, a levegő forrását, a részecskék és aeroszolok előállítására szolgáló rendszert, a klímarendszert, az elhasznált levegő kezelésének módját, az állatoknak a vizsgálati kamrában való elhelyezését. A hőmérsékletet, a levegő páratartalmát és adott esetben az aeroszolkoncentráció stabilitását, illetve a részecskenagyságot le kell írni. Expozíciós adatok: Ezeket táblázatos formában kell közölni, az átalagértékek és az azoktól való eltérés megjelölésével. A következő adatokat kell tartalmazniuk:
|
|
— |
adagolás (beleértve a vivőanyagot is, ha van) és koncentrációk, |
|
— |
a toxikus reakciók nemenként és dózisonként, |
|
— |
lehetőség szerint az a szint, amikor még nincs toxikus hatás, |
|
— |
az elpusztulás ideje a vizsgálat során, illetve hogy az állatok megélték-e a vizsgálat végét, |
|
— |
a toxikus és más hatások leírása, |
|
— |
az egyes mérgezési tünetek megfigyelésének időpontja és a megfigyelést követő változásuk, |
|
— |
a takarmány fogyasztásával és a testsúly változásával kapcsolatos adatok, |
|
— |
szemészeti leletek, |
|
— |
az elvégzett hematológiai vizsgálatok és azok valamennyi eredménye, |
|
— |
az elvégzett klinikai kémiai vizsgálatok és azok valamennyi eredménye (beleértve az esetleges vizeletelemzés eredményeit is), |
|
— |
boncolási leletek, |
|
— |
a kórszövettani vizsgálatok eredményének részletes ismertetése, |
|
— |
az eredmények statisztikai feldolgozása, ahol lehetséges, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.31. PRENATÁLIS FEJLŐDÉSI TOXICITÁSVIZSGÁLAT
1. MÓDSZER
Ez a módszer az OECD TG 414 (2001) módszer megfelelője.
1.1. BEVEZETÉS
E fejlődési toxicitási vizsgálati módszer segítségével általános információk nyerhetők a vemhes kísérleti állatot és a méhben fejlődő élő szervezetet érő prenatális expozíció hatásaival kapcsolatosan, és magában foglalhatja az anyai hatások, továbbá a magzatelhalás, a magzatban fellépő strukturális rendellenességek vagy rendellenes növekedés vizsgálatát. A funkcionális defektusok, bár a fejlődés szempontjából igen fontosak, nem képezik szerves részét ennek a módszernek. Az ilyen hatások külön vizsgálat vagy e módszerhez kapcsolódóan kiegészítő vizsgálat keretében tanulmányozhatók a fejlődési neurotoxicitási vizsgálati módszer alkalmazásával. A funkcionális defektusok és más posztnatális hatások vizsgálatára vonatkozó információkkal kapcsolatban a kétgenerációs reprodukciós toxicitási vizsgálati módszert, valamint a fejlődési neurotoxicitási vizsgálati módszert kell segítségül hívni adott esetben.
E vizsgálati módszert esetenként a vizsgálandó anyaggal, így például annak fizikai-kémiai vagy toxikológiai tulajdonságaival kapcsolatos konkrét ismeretek alapján egyedi esetekhez kell adaptálni. Az ilyen adaptáció akkor elfogadható, ha meggyőző tudományos bizonyítékok szerint informatívabb vizsgálatot eredményez. Ilyen esetben a tudományos bizonyítékokat részletesen ismertetni kell a vizsgálati jelentésben.
1.2. FOGALOMMEGHATÁROZÁSOK
Fejlődési toxikológia: a fogantatás előtt vagy a prenatális fejlődés során, vagy a születés és szexuális érés közötti időszakban (posztnatálisan) történő expozícióból származó, a fejlődő élő szervezetet érő káros hatások vizsgálata. A fejlődési toxicitás fő megnyilvánulásai: 1. az élő szervezet elhalása/elhullása; 2. strukturális rendellenesség; 3. rendellenes növekedés; és 4. funkcionális defektus. A fejlődési toxikológia korábban teratológia néven volt ismert.
Káros hatás: a normálhoz képest bármilyen, a kezeléssel összefüggő elváltozás, amely csökkenti az élő szervezet túlélésre, szaporodásra vagy környezethez való alkalmazkodásra való képességét. A fejlődési toxikológia területén a legszélesebb értelemben véve ide tartozik bármely olyan hatás, amely megzavarja a konceptus normális fejlődését a születés előtt és után.
Rendellenes növekedés: az utód szerveinek vagy testének tömegében vagy méretében bekövetkező elváltozás.
Elváltozások (rendellenességek): strukturális elváltozások a fejlődés során, amelyek magukban foglalják mind a deformitásokat, mind az eltéréseket (28).
Deformitás/súlyos fejlődési rendellenesség: az állatra ártalmasnak (vagy akár letálisnak) tartott strukturális változás, amely általában ritka.
Eltérés/kisebb fejlődési rendellenesség: az állatra kisfokban ártalmasnak vagy ártalmatlannak tartott strukturális változás; lehet átmeneti jellegű, és viszonylag gyakran előfordulhat a kontrollpopulációban.
Konceptus: a megtermékenyített petesejt származékainak összessége a fejlődés bármely szakaszában a megtermékenyítéstől a születésig, amely magában foglalja az extraembrionális burkokat és az embriót vagy magzatot is.
Beágyazódás: a blasztocisztának a méh hámrétegéhez való kapcsolódása, amely magában foglalja a méh hámszövetén történő áthatolást és méhnyálkahártyába történő beágyazódását.
Embrió: az élő szervezet korai vagy fejlődő stádiuma, mégpedig a megtermékenyített petesejtből kialakuló fejlődési produktum a hosszanti tengely megjelenése után, és amíg és az összes főbb struktúra ki nem alakul.
Embriotoxicitás: ártalmas hatás az embrió normál struktúrájára, fejlődésére, növekedésére és/vagy életképességére.
Magzat: a posztembrionális szakaszban lévő, meg nem született utód.
Magzati toxicitás: ártalmas hatás a magzat normál struktúrájára, fejlődésére, növekedésére és/vagy életképességére.
Abortusz: a fogantatás produktumának, azaz az embriónak vagy egy életképtelen magzatnak a méhből történő idő előtti kilökődése/eltávolítása.
Felszívódás: a méhbe beágyazódott, majd elhalt konceptus felszívódik vagy felszívódott.
Korai felszívódás: a beágyazódás nyoma felismerhető embrió/magzat nélkül.
Késői felszívódás: elhalt embrió vagy magzat külső degeneratív változásokkal.
NOAEL: a nem észlelhető káros hatás szintjének (no-observed-adverse-effect-level) rövidítése, amely azt a legmagasabb dózisszintet vagy expozíciós szintet jelöli, amelynél nem figyelhetők meg a kezeléssel összefüggő káros hatások.
1.3. REFERENCIAANYAG
Nincs.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgálandó anyagot általában vemhes állatoknak adagolják legalább a beágyazódástól az exterminálás tervezett időpontját megelőző napig, amelynek a lehető legközelebb kell esnie az ellés normál napjához anélkül, hogy az idő előtti ellés miatt felmerülne az adatok elvesztésének kockázata. A vizsgálati módszerrel nemcsak az organogenezis időszakát (pl. rágcsálókban az 5. és 15. nap közötti időszak, nyúlban pedig a 6. és 18. nap közötti időszak) lehet vizsgálni, hanem már a beágyazódás előtti időszaktól kezdve adott esetben az egész vemhességen át a császármetszés előtti napig jelentkező hatásokat is. Röviddel a császármetszés előtt a nőstényeket exterminálni kell, és meg kell vizsgálni a méhtartalmat, a magzatok esetében pedig meg kell vizsgálni a külsőleg látható rendellenességeket, valamint a lágyszövetben és vázrendszerben észlelhető elváltozásokat.
1.5. A VIZSGÁLATI MÓDSZER ISMERTETÉSE
1.5.1. Az állatfaj kiválasztása
Ajánlatos a vizsgálatot az erre legalkalmasabb fajban végezni, és olyan laboratóriumi fajt és törzset alkalmazni, amelyet széles körben használnak prenatális fejlődési toxicitási vizsgálatokhoz. A preferált rágcsálófaj a patkány, a preferált nem rágcsálófaj pedig a nyúl. Az ettől eltérő fajok alkalmazását megfelelően indokolni kell.
1.5.2. Az állatok tartásának és etetésének körülményei
Rágcsálók esetében a kísérleti helyiség hőmérsékletének 22 oC (± 3 oC)-nak, nyulak esetében pedig 18 oC (± 3 oC)-nak kell lennie. Bár a helyiség relatív páratartalmának legalább 30 %-nak kell lennie, illetve a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot, a célértéknek 50 és 60 % között kell lennie. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett.
A pároztatásokat erre a célra alkalmas ketrecekben kell végezni. Bár előnyösebb a pároztatott állatokat egyedileg tartani, kis számban csoportos tartás is elfogadható.
1.5.3. Az állatok előkészítése
Legalább 5 napon át a laboratórium körülményeihez szoktatott, egészséges állatokat kell alkalmazni, amelyek korábban nem voltak más kísérlet alanyai. A kísérleti állatok jellemzésekor meg kell adni az állat faját, törzsét, származását, ivarát, testtömegét és/vagy életkorát. Amennyire csak megoldható, az állatok az összes vizsgálati csoportban legyenek azonos testtömegűek és korúak. Minden dózishoz még egyszer sem ellett, fiatal felnőtt nőstényeket kell használni. A nőstényeket azonos fajú és azonos törzsből származó hímekkel kell pároztatni, és kerülni kell a testvérek pároztatását. Rágcsálók esetében a vemhesség 0. napja az, amikor hüvelydugó és/vagy sperma észlelhető; nyulak esetében a 0. nap általában a párzás vagy a mesterséges megtermékenyítés napja, ha ezt a technikát alkalmazzák. A pároztatott nőstényeket torzítatlan módon kell a kontroll- és a kezelési csoportokba beosztani. A ketreceket úgy kell elrendezni, hogy minimálisra lehessen csökkenteni a ketrec elhelyezése jelentette lehetséges hatásokat. Minden állatot egyedi azonosítószámmal kell ellátni. A pároztatott nőstényeket torzítatlan módon kell beosztani a kontroll- és a kezelési csoportokba, és ha a nőstényeket csoportosan pároztatják, az egyes pároztatási csoportokból származó állatokat egyenletesen kell elosztani a kezelési és kontrollcsoportokban. Az azonos hímmel pároztatott nőstényeket is egyenletesen kell szétosztani a különböző csoportokba.
1.6. ELJÁRÁS
1.6.1. Az állatok száma és ivara
Minden vizsgálati és kontrollcsoportba elegendő számú nőstényt kell beosztani ahhoz, hogy legalább körülbelül 20 olyan nőstény álljon rendelkezésre, amelyekben a boncoláskor beágyazódási helyek találhatók. A 16-nál kevesebb nőstényt – amelyekben beágyazódási helyek találhatók – tartalmazó csoportok esetleg nem megfelelőek a vizsgálatra. Az anyaállatok elhullása nem feltétlenül teszi érvénytelenné a vizsgálatot, feltéve hogy az arány nem haladja meg a körülbelül 10 %-ot.
1.6.2. A dózisok előkészítése
Ha a beadás megkönnyítése érdekében vivőanyagot vagy más adalékot alkalmaznak, a következő jellemzőket kell figyelembe venni: a vizsgálandó anyag felszívódására, eloszlására, metabolizmusára és visszatartására vagy kiürülésére gyakorolt hatások; a vizsgálandó anyag kémiai tulajdonságaira gyakorolt hatások, amelyek megváltoztathatják annak toxikus jellemzőit; valamint az állatok táplálék- és vízfogyasztására vagy tápláltsági állapotára gyakorolt hatások. A vivőanyag nem lehet fejlődésre toxikus, és nem lehet hatással a szaporodásra sem.
1.6.3. Adagolás
A vizsgálandó anyagot általában naponta kell beadni, a beágyazódástól (pl. a pároztatás utáni 5. naptól) a császármetszés tervezett időpontja előtti napig. Ha az esetlegesen végzett előzetes vizsgálatok szerint nincs nagy valószínűsége a beágyazódás előtti veszteségnek, a kezelést az egész vemhességi időszakra ki lehet terjeszteni, azaz a pároztatástól egészen az exterminálás tervezett időpontja előtti napig. Jól ismert, hogy a vemhesség során a nem megfelelő bánásmód vagy stressz prenatális veszteséghez vezethet. A kezeléssel nem összefüggő tényezők miatti prenatális veszteség kivédése érdekében kerülni kell a vemhes állatok szükségtelen kezelését, valamint a külső tényezők, így például zaj miatti stresszt.
Legalább három dózisszintet és ezzel párhuzamos kontrollt kell alkalmazni. A kezelési és kontrollcsoportokba egészséges állatokat kell torzítatlan módon beosztani. A dózisszinteket úgy kell megválasztani, hogy biztosítsák a kiváltott toxikus hatások fokozatosságát. Hacsak a vizsgálandó anyag fizikai/kémiai jellege vagy biológiai tulajdonságai nem szabnak ennek határt, a legmagasabb dózist úgy kell megválasztani, hogy valamilyen mértékű fejlődési és/vagy anyai toxicitást (klinikai tünetek vagy testtömegcsökkenés) idézzen elő, de ne okozzon elhullást vagy súlyos szenvedést. A legalább egy köztes dózist úgy kell megválasztani, hogy minimális mértékű észlelhető toxikus hatást váltson ki. Végül a legalacsonyabb dózist úgy kell megválasztani, hogy semmilyen anyai vagy fejlődési toxicitásra utaló tünetet ne okozzon. A dózisok csökkenő sorrendjét úgy kell megválasztani, hogy demonstrálhassák az esetleges dózisfüggő válaszokat és a nem észlelhető káros hatás szintjét (NOAEL). A csökkenő dózisszintek meghatározásához gyakran optimális a 2–4-szeres intervallumok alkalmazása és nagyon nagy intervallumok (pl. 10-nél magasabb szorzófaktor) alkalmazása, esetén gyakran előnyös a dózisok közé egy negyedik vizsgálati csoportot is beiktatni. Bár a cél az anyai NOAEL meghatározása, olyan vizsgálatok is elfogadhatók, amelyben nem határozzák meg ezt (1).
A dózisszintek megválasztásakor figyelembe kell venni mind az esetleg rendelkezésre álló toxicitási adatokat, mind a vizsgálandó anyag vagy rokon anyagok metabolizmusával vagy toxikokinetikájával kapcsolatos további információkat. Ezek az információk segítik majd az adagolási rend megfelelő voltának igazolását is.
Szükség van egy párhuzamos kontrollcsoportra is. Ez a csoport egy placebóval kezelt kontrollcsoport, vagy ha a vizsgálandó anyag beadásához vivőanyagot használnak, akkor egy vivőanyaggal kezelt kontrollcsoport. Minden csoportban ugyanolyan térfogatú vizsgálandó anyagot vagy vivőanyagot kell beadni. A kontrollcsoport(ok)ba tartozó állatokat ugyanolyan módon kell kezelni, mint a vizsgálati csoportokban lévőket. A vivőanyaggal kezelt kontrollcsoportokban a legnagyobb alkalmazott mennyiségben kell beadni a vivőanyagot (ahogyan a legalacsonyabb dózisú kezelési csoportban).
1.6.4. Határérték-vizsgálat
Ha egy egyetlen, legalább 1 000 mg/testtömeg-kg/nap orális dózis alkalmazásával történő és az itt ismertetett eljárások szerint elvégzett vizsgálat sem a vemhes állatokban, sem utódaikban nem idéz elő észlelhető toxicitást, és ha egy hatás a rendelkezésre álló adatok (pl. szerkezetileg és/vagy metabolizmus szempontjából rokon vegyületekkel kapcsolatos adatok) alapján nem várható, a három dózisszint alkalmazásával történő teljes vizsgálatot esetenként szükségtelen elvégezni. A várható humán expozíció magasabb orális dózis alkalmazását teszi esetleg szükségessé a határérték-vizsgálat során. Más típusú beadási módok, így például inhalálás vagy dermális alkalmazás esetén a vizsgálandó anyag fizikai-kémiai tulajdonságai gyakran előre jelezhetik, illetve behatárolhatják a lehetséges expozíciós szint maximumát (például a dermális alkalmazás nem okozhat súlyos lokális toxicitást).
1.6.5. A dózisok beadása
A vizsgálandó anyagot vagy vivőanyagot általában orálisan, intubálással adagolják. Ha más beadási módot alkalmaznak, a vizsgálatot végzőnek ezt részletesen indokolnia kell, és szükség lehet ennek megfelelő módosításokra is (2) (3) (4). A vizsgálandó anyagot minden nap körülbelül ugyanabban az időpontban kell beadni.
Az egyes állatoknak beadandó dózist általában a legutóbbi testtömegmérés eredménye alapján kell meghatározni. A vemhesség utolsó trimeszterében azonban óvatosan kell eljárni a dózis beállításakor. A túlzott anyai toxicitás megelőzése érdekében a dózisok megválasztásához fel kell használni a meglévő adatokat. Ha azonban túlzott toxicitást észlelnek a kezelt anyaállatokban, humánus módon exterminálni kell őket. Ha több vemhes állatban is a túlzott toxicitás jelei észlelhetők, meg kell fontolni az adott dóziscsoport kezelésének leállítását. Ha az anyagot mesterséges táplálással adagoljuk, a dózist lehetőleg egyszerre kell egy gyomorszondán vagy megfelelő intubációs kanülön át beadni az állatnak. Az, hogy egyszerre maximálisan mekkora térfogatú folyadékot lehet beadni, az állat méretétől függ. A térfogat nem haladhatja meg az 1 ml/100 g testtömegarányt, kivéve vizes oldatok esetében, amikor 2 ml/100 g testtömegarány is alkalmazható. Ha vivőanyagként kukoricacsíra-olajat alkalmaznak, az egyszerre beadott térfogat nem lehet több mint 0,4 ml/100 g testtömeg. A koncentrációk megfelelő beállításával minimalizálni kell a beadott térfogat variabilitását, és így kell biztosítani, hogy minden dózisszintnél azonos legyen a térfogat.
1.6.6. Az anyaállatok megfigyelése
Legalább naponta egyszer el kell végezni, és le kell jegyezni a klinikai megfigyeléseket, mégpedig lehetőleg a mindig ugyanabban az időpontban vagy időpontokban, amihez figyelembe kell venni azt is, hogy a beadás után várt hatások mikor érik el a maximumukat. Rögzíteni kell az állatok állapotát, ezen belül elhullását, elhullás közelében lévő állapotát, lényeges viselkedésbeli változásait, illetve a szemmel látható toxicitás minden jelét.
1.6.7. Testtömeg és táplálékfogyasztás
A vemhesség 0. napján, vagy ha külső forrásból beszerzett, adott időben pároztatott állatokat alkalmaznak, akkor legkésőbb a vemhesség 3. napján, majd a kezelés első napján és azt követően a kezelési időszakban legalább 3 naponta, továbbá az exterminálás tervezett napján meg kell mérni az állatok testtömegét.
A táplálékfogyasztást háromnaponta kell feljegyezni, ezen belül is ugyanazon a napon, amikor a testtömegméréseket végzik.
1.6.8. Post mortem vizsgálat
A nőstényeket az ellés várható időpontját megelőző napon kell exterminálni. Az exterminálás tervezett időpontja előtt abortusz vagy koraellés jeleit mutató nőstényeket exterminálni kell, majd a tetemeket alapos makroszkópos vizsgálatnak kell alávetni.
A vizsgálat befejezésekor vagy a vizsgálat során bekövetkező elhullás során makroszkóposan meg kell vizsgálni az anyaállatban az esetleges strukturális rendellenességeket vagy patológiás elváltozásokat. A torzítások minimalizálása érdekében a császármetszés során az anyaállatok, majd ezt követően a magzatok vizsgálatát lehetőleg anélkül kell végezni, hogy tudható lenne, melyik kezelési vagy kontrollcsoportból származnak.
1.6.9. A méhtartalom vizsgálata
A vizsgálat befejezésekor vagy az elhullás után amilyen gyorsan csak lehet, ki kell venni az állatok méhét, és ellenőrizni kell, hogy vemhesek voltak-e. Azokat a méheket, amelyek nem tűnnek vemhesnek, további vizsgálatoknak (pl. rágcsálók esetében ammónium-szulfid-festésnek, nyulak esetében pedig Salewski-festésnek vagy más megfelelő eljárásnak) kell alávetni annak igazolása érdekében, hogy az állat valóban nem volt vemhes (5).
A vemhes méheket a méhnyakkal együtt meg kell mérni. Nem kell megmérni azoknak a vemhes méheknek a tömegét, amelyeket a vizsgálat során elhullott állatokból vettek ki.
A vemhes állatokban meg kell határozni a sárgatestek számát is.
A méhtartalom vizsgálatakor meg kell határozni, hogy hány embrió vagy magzat halt el, illetve hogy hány életképes magzatot tartalmaz. Le kell írni a felszívódás mértékét, hogy megbecsülhető legyen a konceptus elhalásának relatív időpontja (lásd 1.2. szakasz).
1.6.10. A magzatok vizsgálata
Minden magzat esetében meg kell határozni a magzat ivarát és testtömegét.
Minden magzat esetében meg kell továbbá vizsgálni, hogy vannak-e külső elváltozások (6).
A magzatokban meg kell vizsgálni, hogy vannak-e vázrendszeri és lágyszöveti elváltozások (pl. eltérések és deformitások vagy rendellenességek) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24). Előnyös, de nem feltétlenül szükséges a magzati elváltozások kategorizálása. Ha elvégezzük a kategorizálást, világosan meg kell jelölni az egyes kategóriák meghatározásának kritériumait. Különös figyelmet kell szentelni a szaporítószervek vizsgálatának, és ezen belül a rendellenes fejlődés jeleinek.
Rágcsálók esetében körülbelül az alom felét kell előkészíteni a vázrendszeri, a maradékot pedig a lágyszöveti elváltozások vizsgálatára, ahol az utóbbihoz elfogadott és megfelelő sorozatmetszési módszereket vagy óvatos makroszkópos boncolási technikákat kell alkalmazni.
Nem rágcsálók, pl. nyulak esetében, minden magzatban meg kell vizsgálni mind a lágyszöveti, mind pedig a vázrendszeri elváltozásokat. A lágyszöveti elváltozások vizsgálatához a magzatok testét óvatos boncolás segítségével kell értékelni, amely magában foglalhatja a belső szívstruktúra további tanulmányozását is (25). Az így megvizsgált magzatok felénél el kell távolítani a fejet, és elő kell készíteni az abban lévő lágy szövetek (szem, agy, orrjáratok és nyelv) vizsgálatára, amelyhez standard sorozatmetszési módszereket (26) vagy más, ugyanilyen érzékeny módszert kell alkalmazni. A testeket, illetve a fennmaradó ép magzatok testét elő kell készíteni a vázrendszeri elváltozások vizsgálatára, amelyhez ugyanazokat a módszereket kell használni, mint rágcsálók esetében.
2. ADATOK
2.1. AZ EREDMÉNYEK KEZELÉSE
Az adatokat mind az anyaállatok, mind utódaik esetében egyedileg kell a jelentésben rögzíteni, majd táblázatos formában is össze kell foglalni, amelyben minden egyes vizsgálati csoport és generáció esetében fel kell tüntetni az állatok számát a vizsgálat kezdetén, a vizsgálat során elpusztult vagy humánus okok miatt exterminált állatok számát, valamint az elhullások és a humánus exterminációk időpontját, a vemhes nőstények számát, a toxicitás jeleit mutató állatok számát, a megfigyelt toxicitási tünetek leírását, ezen belül bármely toxikus tünet megjelenésének időpontját, valamint ezek időtartamát és súlyosságát, az embriókkal/magzatokkal kapcsolatos megfigyeléseket és az almokra vonatkozó minden vonatkozó adatot.
A számszerű eredményeket megfelelő statisztikai módszerrel kell kiértékelni, amelynél az adatanalízishez használt egység az alom. Általánosan elfogadott statisztikai módszert kell használni; a vizsgálat megtervezése során kell azt kiválasztani, és a választást meg kell indokolni. A jelentésben fel kell tüntetni azoknak az állatoknak az adatait is, amelyek nem maradtak életben a tervezett exterminálásuk időpontjáig. Adott esetben a csoportátlagok számításához is fel lehet használni ezeket az adatokat. Az ilyen állatokból nyert adatok alkalmazhatóságát, és így a csoportátlag(ok)ba való beszámításukat vagy abból való kizárásukat minden esetben egyedileg kell meghatározni, és megfelelően indokolni is kell.
2.2. AZ EREDMÉNYEK ÉRTÉKELÉSE
A prenatális fejlődési toxicitási vizsgálat eredményeit a megfigyelt hatások szempontjából kell értékelni. Az értékelés az alábbi információkat foglalja magában:
|
— |
az anyaállatok és az embriók/magzatok vizsgálatainak eredményei, ezen belül az állat expozíciója és az egyes hatások gyakorisága vagy súlyossága közötti összefüggések vagy azok hiányának értékelése, |
|
— |
a magzatok külső, lágyszöveti és vázrendszeri elváltozásainak esetleges kategorizálásánál alkalmazott kritériumok, |
|
— |
a vizsgálat eredményeinek értelmezését javítandó, adott esetben korábbi kontrolladatok, |
|
— |
az összes százalék és mérőszám számításához felhasznált számadatok, |
|
— |
adott esetben a vizsgálat eredményeinek megfelelő statisztikai elemzése, amelynek elegendő információt kell tartalmaznia az elemzési módszerrel kapcsolatban ahhoz, hogy egy független bíráló vagy statisztikus újra tudja értékelni vagy rekonstruálni tudja az elemzést. |
Bármely olyan vizsgálatban, amely a toxikus hatások hiányát igazolja, további vizsgálatokat kell végezni a vizsgálandó anyag felszívódásának és biológiai hozzáférhetőségének meghatározására.
2.3. AZ EREDMÉNYEK ÉRTELMEZÉSE
A prenatális fejlődési toxicitási vizsgálatokkal a vemhesség során egy anyaggal történő ismételt expozíciónak az anyaállatra és utódai méhen belüli fejlődésére gyakorolt hatásai tanulmányozhatóak. A vizsgálat eredményeit a szubkrónikus, reprodukciós, toxikokinetikai és egyéb vizsgálatok eredményeivel összefüggésben kell értelmezni. Mivel mind az általános toxicitásra (az anyai toxicitás révén), mind pedig a fejlődési toxicitási végpontokra hangsúly kerül, a vizsgálat eredményei bizonyos mértékig lehetővé teszik az általános toxicitás hiányában is fellépő, a fejlődésre gyakorolt hatások megkülönböztetését azoktól, amelyeket az anyaállatra is toxikus szintek idéznek elő (27).
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A jelentésnek az alábbi konkrét információkat kell tartalmaznia:
|
|
Vizsgálandó anyag:
|
|
|
Vivőanyag (ha szükséges):
|
|
|
Kísérleti állatok:
|
|
|
Kísérleti körülmények:
|
|
|
Eredmények: |
|
|
Anyai toxikus válaszadatok a dózis függvényében, ezen belül többek között:
|
|
|
Fejlődési végpontok a dózis függvényében azokra az almokra vonatkozóan, ahol beágyazódás történt, ezen belül:
|
|
|
Fejlődési végpontok a dózis függvényében azokra az almokra vonatkozóan, ahol élő magzatok vannak, ezen belül:
|
|
|
Az eredmények diszkussziója. |
|
|
Következtetések. |
4. HIVATKOZÁSOK
|
(1) |
Kavlock R.J. et al. (1996). A Simulation Study of the Influence of Study Design on the Estimation of Benchmark Doses for Developmental Toxicity. Risk Analysis 16; 399–410. |
|
(2) |
Kimmel, C.A. and Francis, E.Z. (1990). Proceedings of the Workshop on the Acceptability and Interpretation of Dermal Developmental Toxicity Studies. Fundamental and Applied Toxicology 14; 386–398. |
|
(3) |
Wong, B.A., et al. (1997). Developing Specialized Inhalation Exposure Systems to Address Toxicological Problems. CIIT Activities 17; 1–8. |
|
(4) |
US Environmental Protection Agency (1985). Subpart E-Specific Organ/Tissue Toxicity, 40 CFR 798.4350: Inhalation Developmental Toxicity Study. |
|
(5) |
Salewski, E. (1964). Faerbermethode zum Makroskopischen Nachweis von Implantations Stellen am Uterusder Ratte. Naunyn-Schmeidebergs Archiv fur Pharmakologie und Experimentelle Pathologie 247:367. |
|
(6) |
Edwards, J.A. (1968). The external Development of the Rabbit and Rat Embryo. In Advances in Teratology. D.H.M. Woolam (ed.) Vol. 3. Academic Press, NY. |
|
(7) |
Inouye, M. (1976). Differential Staining of Cartilage and Bone in Fetal Mouse Skeleton by Alcian Blue and Alizarin Red S. Congenital Anomalies 16; 171–173. |
|
(8) |
Igarashi, E. et al. (1992). Frequency Of Spontaneous Axial Skeletal Variations Detected by the Double Staining Techniquefor Ossified and Cartilaginous Skeleton in Rat Foetuses. Congenital Anomalies 32;:381–391. |
|
(9) |
Kimmel, C.A. et al. (1993). Skeletal Development Following Heat Exposure in the Rat. Teratology 47:229–242. |
|
(10) |
Marr, M.C. et al. (1988). Comparison of Single and Double Staining for Evaluation of Skeletal Development: The Effects of Ethylene Glycol (EG) in CD Rats. Teratology 37; 476. |
|
(11) |
Barrow, M.V. and Taylor, W.J. (1969). A Rapid Method for Detecting Malformations in Rat Foetuses. Journal of Morphology 127:291–306. |
|
(12) |
Fritz, H. (1974). Prenatal Ossification in Rabbits ss Indicative of Foetal Maturity. Teratology 11; 313–320. |
|
(13) |
Gibson, J.P. et al. (1966). Use of the Rabbit in Teratogenicity Studies. Toxicology and Applied Pharmacology 9; 398–408. |
|
(14) |
Kimmel, C.A. and Wilson, J.G. (1973). Skeletal Deviation in Rats: Malformations or Variations? Teratology 8; 309–316. |
|
(15) |
Marr, M.C. et al. (1992). Developmental Stages of the CD (Sprague-Dawley) Rat Skeleton after Maternal Exposure to Ethylene Glycol. Teratology 46; 169–181. |
|
(16) |
Monie, I.W. et al. (1965). Dissection Procedures for Rat Foetuses Permitting Alizarin Red Staining of Skeleton and Histological Study of Viscera. Supplement to Teratology Workshop Manual, pp. 163–173. |
|
(17) |
Spark, C. and Dawson, A.B. (1928). The Order and Time of appearance of Centers of Ossification in the Fore and Hind Limbs of the Albino Rat, with Special Reference to the Possible Influence of the Sex Factor. American Journal of Anatomy 41; 411–445. |
|
(18) |
Staples, RE. and Schnell, V.L. (1964). Refinements in Rapid Clearing Technique in the KOH-Alizarin Red S Method for Fetal Bone. Stain Technology 39; 61–63. |
|
(19) |
Strong, R.M. (1928). The Order Time and Rate of Ossification of the Albino Rat (Mus Norvegicus Albinus) Skeleton. American Journal of Anatomy 36; 313–355. |
|
(20) |
Stuckhardt, J.L. and Poppe, S.M. (1984). Fresh Visceral Examination of Rat and Rabbit Foetuses Used in Teratogenicity Testing. Teratogenesis, Carcinogenesis, and Mutagenesis 4; 181–188. |
|
(21) |
Walker, D.G. and Wirtschafter, Z.T. (1957). The Genesis of the Rat Skeleton. Thomas, Springfield, IL. |
|
(22) |
Wilson, J.G. (1965). Embryological Considerations in Teratology. In Teratology: Principles and Techniques, Wilson J.G. and Warkany J. (eds). University of Chicago, Chicago, IL, pp 251–277. |
|
(23) |
Wilson, J.G. and Fraser, F.C. (eds). (1977). Handbook of Teratology, Vol. 4. Plenum, NY. |
|
(24) |
Varnagy, L. (1980). Use of Recent Fetal Bone Staining Techniques in the Evaluation of Pesticide Teratogenicity. Acta Vet. Acad. Sci. Hung. 28; 233–239. |
|
(25) |
Staples, R.E. (1974). Detection of visceral Alterations in Mammalian Foetuses. Teratology 9; 37–38. |
|
(26) |
Van Julsingha, E.B. and C.G. Bennett (1977). A Dissecting Procedure for the Detection of Anomalies in the Rabbit Foetal Head. In: Methods in Prenatal Toxicology Neubert, D., Merker, H.J. and Kwasigroch, TE. (eds.). University of Chicago, Chicago, IL, pp. 126–144. |
|
(27) |
US Environmental Protection Agency (1991). Guidelines for Developmental Toxicity Risk Assessment. Federal Register 56; 63798–63826. |
|
(28) |
Wise, D.L. et al. (1997). Terminology of Developmental Abnormalities in Common Laboratory Mammals (Version 1) Teratology 55; 249–292. |
B.32. A RÁKKELTŐ HATÁS VIZSGÁLATA
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot rendszerint heti hét alkalommal, a megfelelő módon, fokozatos adagokban kell adagolni a kísérleti állatcsoportoknak, élettartamuk jelentős részén keresztül. Az adagolási időszak alatt és után az állatokat a mérgező hatás jelei, különösen a daganatképződés észlelése érdekében naponta kell megvizsgálni.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Az állatokat a vizsgálat előtt legalább öt napon keresztül a vizsgálat tartási és takarmányozási körülményei között kell tartani. Az egészséges, fiatal állatokat a vizsgálat megkezdése előtt véletlenszerű kiválasztással kezelt és kontrollcsoportokba kell beosztani.
1.6.1.
A javasolt állatfaj a patkány. A korábban végzett vizsgálatok eredményeire alapozva egyéb, rágcsáló vagy nem rágcsáló fajokat is lehet használni. Kísérleti célokra tenyésztett laboratóriumi állattörzsekből származó egészséges és fiatal állatokat használjunk, az adagolást pedig a szoptatás utáni elválasztást követően minél előbb meg kell kezdeni.
A vizsgálat kezdetén az állatok súlya lehetőleg csak minimálisan térjen el egymástól, az átlagos értéktől legfeljebb ± 20 %-kal különbözhet. Ha a szubkrónikus orális vizsgálatot valamely hosszú távú vizsgálat előzményeként végzik, mindkét vizsgálathoz ugyanazon fajt, illetve kísérleti állattörzset kell felhasználni.
1.6.2.
Rágcsálók esetében minden adagolási szintnél, valamint a hozzájuk tartozó kontrollcsoportnál legalább 100 állatot kell felhasználni (50 hímet és 50 nőstényt). A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek. Ha időközi elpusztítást terveznek, akkor a létszámot annyival kell megnövelni, ahány állatot a vizsgálat befejezése előtt el szándékoznak pusztítani.
1.6.3.
Legalább három adagolási szintet (dózist) és egy kontrollt kell használni. A legnagyobb adaggal kezelt csoportban jelentkeznie kell a toxikus hatásnak, például a súlynövekedés kismértékű (10 %-ot nem meghaladó) visszaesése formájában, anélkül hogy az a daganatos elváltozásokon kívül egyéb módon lényegesen megváltoztatná az életkilátásokat.
A legalacsonyabb adaggal kezelt csoportban a vizsgált anyag nem lehet hatással az állatok növekedésére, fejlődésére, illetve élettartamára, és nem okozhat toxikus tüneteket. E dózis általában nem lehet a legnagyobb dózis 10 %-ánál alacsonyabb.
A közbeeső csoportok adagjainak nagyságát a legkisebb és legnagyobb adag között pontosan középen kell kijelölni.
Az adagolási szinteket a korábbi toxicitásvizsgálatokat figyelembe véve kell megválasztani.
Az expozíciót rendszerint naponta ismételjük.
Ha a vegyületet ivóvízzel vagy takarmányba keverve kell beadni, akkor azoknak folyamatosan az állatok rendelkezésére kell állnia.
1.6.4.
A kezelt csoporttal a vizsgált anyaggal való expozíció kivételével minden egyéb tekintetben azonos kontrollcsoportot kell használni.
Különleges körülmények között, például aeroszolokat is alkalmazó inhalációs vizsgálatban vagy nem jellemzett biológiai aktivitással rendelkező emulzióképző anyag szájon át történő adagolásakor egy további, kezeletlen kontrollcsoportra is szükség van, amelynek állatai nem kerülnek kapcsolatba a vivőanyaggal.
1.6.5.
Az adagolás három fő úton történhet: szájon át, bőrön át, illetve belélegeztetéssel. Az adagolás módjának megválasztása függ a vizsgált anyag fizikai és kémiai tulajdonságaitól, valamint az emberi expozíció valószínű módjától.
1.6.5.1. Vizsgálatok orális adagolással
Ha a vizsgált anyag felszívódik a gyomor-bél rendszerből, és ha a táplálékfelvétel az esetleges emberi expozíció egyik módja, akkor az orális adagolás a választandó módszer, hacsak ellenjavallata nincs. Az állatok a vizsgált anyagot a takarmánnyal, az ivóvízben oldva, illetve kapszulában kaphatják.
A legmegfelelőbb esetben az anyagot naponta kell adagolni a hét mind a hét napján, miután az ötnapos rendszerű adagolás gyógyulással vagy a toxikus tünetek megszűnésével járhat a kimaradó időszakban, és így befolyásolhatja az eredményeket és azok értékelését. Ám főként gyakorlati megfontolások alapján az ötnapos adagolási hét is elfogadhatónak tekintendő.
1.6.5.2. Vizsgálatok dermális expozícióval
A bőr ecsetelésével végzett expozíció olyan esetben választható, ha az az emberi expozíció fő módját szimulálja, illetve, ha bőrelváltozásokra akarunk modellrendszert felállítani.
1.6.5.3. Vizsgálatok inhalációs adagolással
Miután az inhalációs vizsgálatok sokkal összetettebb technikai problémákat jelentenek, mint az adagolás más módjai, az adagoláshoz itt sokkal részletesebb útmutatást adunk. Azt is megjegyezzük, hogy bizonyos körülmények között a közvetlen légcsőbe juttatás (instilláció) is érvényes módszer lehet.
A hosszú távú expozíció alapja rendszerint az emberi expozíció modellezése, ami két lehetőséget jelent. Az egyik lehetőségnek megfelelően a kamrakoncentráció kiegyenlítődését követően, naponta hat órán keresztül lélegeztetjük be az állatokkal a vizsgált anyagot heti öt napon keresztül (szakaszos expozíció), a másik lehetőség pedig a környezeti expozíciónak jobban megfelelő módszer, azaz napi 22–24 órán át, a hét minden napján végzett belélegeztetés (folyamatos expozíció), amelybe körülbelül egyórás napi megszakítás is beletartozik, minden nap ugyanazon időben, amikor is az állatok megkapják a takarmányt, és amikor a kamrát tisztítják. Az állatok általában mindkét esetben állandó koncentrációnak vannak kitéve. A szakaszos és a folyamatos expozíció közötti alapvető különbség az, hogy az előbbiben van egy 17–18 órás időszak, amikor az állatok regenerálódhatnak a napi adag hatását követően, amelyet a hétvégeken egy még ennél is hosszabb regenerációs időszak követ.
A szakaszos, illetve folyamatos expozíció közötti választás a vizsgálat céljától és a szimulálni kívánt emberi helyzettől függ. Mindazonáltal figyelembe kell venni bizonyos technikai nehézségeket. Ilyen például, hogy a folyamatos expozíció előnyeit csökkentheti az ehhez szükséges itatás és etetés nehézsége, valamint a bonyolultabb (ugyanakkor megbízhatóbb) aeroszol- és páraképző berendezések, illetve a megfigyelőtechnikák igénye.
1.6.6.
A kísérlethez olyan inhalációs berendezést kell használni, amely óránként legalább tizenkét alkalommal légcserét tesz lehetővé a dinamikus légmozgás fenntartása érdekében, azért, hogy megfelelő oxigéntartalmat és egyenletesen eloszlatott expozíciós atmoszférát lehessen biztosítani. A kontroll- és az expozíciós kamrák tervezésének, felépítésének azonosnak kell lennie, hogy a körülmények a vizsgált anyag belélegeztetését kivéve minden tekintetben összehasonlíthatók legyenek. A kamrában általában enyhe negatív nyomást kell fenntartani, hogy a vizsgált anyag ne szivároghasson ki a környezetbe. Ha kamrát használunk, annak kialakítása révén a lehető legkisebbre kell csökkenteni a kísérleti állatok zsúfoltságát. Általános szabályként a kamra atmoszférája stabilitásának biztosítása érdekében a kísérleti állatok teljes térfogata nem haladhatja meg a vizsgálati kamra térfogatának 5 %-át.
A következő méréseket és ellenőrzéseket kell elvégezni:
|
i. |
légáramlás: a légkamrán keresztül áramló levegő sebességét lehetőség szerint folyamatosan kell mérni; |
|
ii. |
koncentráció: a napi expozíciós időszak alatt a vizsgált anyag koncentrációjának változása nem haladhatja meg a középérték ±15 %-át; |
|
iii. |
hőmérséklet és páratartalom: rágcsálóknál a vizsgálatokat 22 ± 2 oC kamrai hőmérsékleten és 30–70 % közötti relatív páratartalom mellett kell végezni, kivéve, amikor a vizsgált anyagot víz segítségével oszlatjuk el a kamra légterében. Lehetőleg mindkét értéket folyamatosan figyelemmel kell kísérni; |
|
iv. |
a részecske nagyságának mérése: a folyékony és szilárd aeroszolt alkalmazó légkamrák légterében meg kell határozni a részecskék megoszlását. Az aeroszolrészecskéknek a felhasznált állatok számára belélegezhető nagyságúaknak kell lenniük. A légkamra mintáit az állatok légzési zónájából kell venni. A légminta legyen az állattal belélegeztetett részecske megoszlására nézve reprezentatív, és gravimetrikusan az összes szuszpendált aeroszolt képviselje még akkor is, ha azok nagy része nem lélegezhető be az állat számára. A részecske méretének meghatározását a kísérleti rendszer kialakítása során gyakran el kell végezni az aeroszol stabilitásának ellenőrzésére, azután pedig olyan gyakran, amilyen mértékben szükséges a belélegeztetés során, hogy megfelelően meghatározhassuk az állatok expozíciójára alkalmazott részecskemegoszlás állandóságát. |
1.6.7.
A rákkeltő hatás vizsgálatának időtartama a vizsgálati állatok normális élettartamának jelentős részére kiterjed. A vizsgálatokat egérnél és hörcsögnél 18 hónap, patkánynál 24 hónap elteltével kell befejezni; egyes, hosszabb életű és alacsonyabb spontán tumorképzésű fajtaváltozatoknál azonban egérnél és hörcsögnél a vizsgálatot 24 hónap, patkánynál pedig 30 hónap elteltével kell befejezni. A másik megoldás az ilyen hosszú távú vizsgálatnál, ha akkor hagyják abba, amikor a túlélő egyedek száma a legalacsonyabb adaggal kezelt vagy a kontrollcsoportban eléri a 25 %-ot. Ha olyan vizsgálatot fejeznek be, amelyben a válaszreakció nyilvánvaló nemtől függő különbsége észlelhető, mindkét nemet külön kell értékelni. Ha csakis kizárólag a nagy adaggal kezelt csoport állatai hullanak el idő előtt, nyilvánvalóan a toxicitásból kifolyólag, ez még nem ok a vizsgálat befejezésére, amennyiben a többi csoportnál a tünetek megjelenése nem jelent problémát. Negatív vizsgálati eredmény csak abban az esetben fogadható el, ha a szöveti autolízis, a kannibalizmus, illetve a tartási körülmények által okozott elhullás aránya egyik csoportban sem haladja meg a 10 %-ot, és valamennyi csoportban a túlélési arány meghaladja az 50 %-ot egérnél és hörcsögnél 18 hónap, patkánynál pedig 24 hónap elteltével.
1.6.8.
1.6.8.1. Megfigyelések
A ketrecben tartott állatok megfigyelésekor a bőr- és szőrelváltozásokra, a szemek és a nyálkahártyák változásaira, valamint a légzési, a keringési rendszerre, az autonóm és a központi idegrendszer működésére, a szomatomotoros tevékenységekre, valamint a viselkedési mintákra kell figyelemmel lenni.
Az állatok rendszeres megfigyelésére azért van szükség, hogy megelőzzük a kísérleti állatok kannibalizmus, szöveti autolízis, illetve rossz elhelyezés következtében történő elhullását. A vizsgálati időszak végeztével a kísérő csoportban lévő állatok kivételével minden túlélő állatot fel kell boncolni. A haldokló állatokat eltávolításuk után el kell pusztítani, és fel kell boncolni.
A klinikai tüneteket és az elhalálozásokat minden állatnál fel kell jegyezni. Külön figyelmet kell fordítani a daganatképződésre: minden szemmel látható vagy kitapintható daganat megjelenésének idejét, helyét, méreteit, megjelenési formáját és növekedését (progresszió) fel kell jegyezni.
A táplálékfogyasztást (és a vízfogyasztást, ha a vizsgált anyagot vízzel adjuk be) a vizsgálat első 13 hetében hetente kell mérni, majd megközelítőleg háromhavonta, hacsak az állatok egészségi állapota vagy testsúlyváltozása másként nem indokolja.
Az állatok testsúlyát az első 13 hét során egyedileg, hetente kell mérni, ezután legalább négyhetente egyszer.
1.6.8.2. Klinikai vizsgálatok
Ha a megfigyelések az állatok egészségének romlására utalnak a vizsgálat során, az érintett állatok kvantitatív vérképvizsgálatát is el kell végezni.
A 12. hónapban, a 18. hónapban és az elpusztítás előtt vérkenetet kell készíteni az állatokból. A kvantitatív vérképvizsgálatot a legnagyobb adaggal kezelt állatoknál és a kontrollcsoport állatainál kell elvégezni. Ha az említett vizsgálatok adatai, különösen az elpusztítás előtt vett mintákból származó eredmények, illetve a kórbonctani eredmények ezt indokolják, a második legnagyobb adaggal kezelt csoport(ok)nál is el kell végezni a kvantitatív vérképvizsgálatot.
Minden állaton teljes körű makroszkópos boncolást kell végezni, beleértve azokat is, amelyek a vizsgálat során hullottak el, illetve amelyeket haldokló állapotban találtak, és ezért elpusztítottak. Valamennyi, szabad szemmel látható elváltozást, daganatot, illetve daganatgyanús elváltozást meg kell őrizni.
Az alábbi szerveket kell megfelelő közegben tartósan tárolni egy esetleges későbbi kórszövettani vizsgálat céljaira: valamennyi feltűnő elváltozás, agy (beleértve a nyúltagy/híd, a kisagykéreg, a nagyagykéreg metszeteit), az agyalapi mirigy, pajzsmirigy/mellékpajzsmirigy, bármilyen csecsemőmirigy-szövet, a légcső és a tüdő, a szív, az aorta, a nyálmirigyek, a máj, a lép, a vesék, a mellékvesék, a hasnyálmirigy, az ivarmirigyek, a méh, a járulékos nemi szervek, a bőr, a nyelőcső, a gyomor, a patkóbél, az éhbél, a csípőbél, a vakbél, a vastagbél, a végbél, a húgyhólyag, a reprezentatív nyirokcsomók, a női emlőmirigy, a combizomzat, a perifériás idegek, a szegycsont a csontvelővel, a combcsont (az ízületi felülettel együtt), a gerincoszlop három szinten (nyaki, mellkasközéptáji és ágyéki csigolyáknál), valamint a szemek.
A tüdő és a húgyhólyag megőrzésére a legjobb módszer a fixálóval való feltöltés. A tüdő folyadékkal való feltöltése az inhalációs vizsgálatoknál a megfelelő kórszövettani vizsgálat előfeltétele. Inhalációs vizsgálatoknál a teljes légzőrendszert vizsgálni kell, az orral, a garattal és a gégefővel együtt.
|
a) |
Teljes kórszövettani vizsgálatot kell végezni a vizsgálat során elhullott vagy elpusztított valamennyi állat, a nagy adaggal kezelt csoport és a kontrollcsoport állatainak szervein és szövetein; |
|
b) |
valamennyi csoportban minden, szabad szemmel látható daganatot, illetve daganatgyanús elváltozást meg kell vizsgálni mikroszkóppal is; |
|
c) |
ha jelentős különbség mutatkozik a nagy adaggal kezelt csoport és a kontrollcsoport daganatos elváltozásainak előfordulási gyakoriságában, az adott szövet vagy szerv kórszövettani vizsgálatát a többi csoportban is el kell végezni; |
|
d) |
ha a legnagyobb adaggal kezelt csoport túlélési adatai jelentősen rosszabbak a kontrollcsoporténál, az eggyel alacsonyabb adaggal kezelt csoportban is teljes körű vizsgálatot kell végezni; |
|
e) |
ha a legnagyobb adaggal kezelt csoportban a daganatos elváltozás lefolyását esetleg befolyásoló toxikus vagy más hatások jelenléte tapasztalható, az eggyel alacsonyabb adaggal kezelt csoportban is teljes körű vizsgálatot kell végezni. |
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, amely minden vizsgálati csoportban megadja az állatok számát a vizsgálat kezdetén, azon állatok számát, amelyeknél a kísérlet folyamán tumort diagnosztizáltak, azon állatok számát, amelyeknél a boncolás folyamán tumort diagnosztizáltak, illetve ennek időpontját. Az eredményeket megfelelő statisztikai módszerrel kell értékelni. Bármely elfogadott statisztikai módszer használható.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
használt faj, törzs, az állatok származása, tartási körülmények, étrend, |
|
— |
vizsgálati körülmények:
|
|
— |
adagolás (beleértve a vivőanyagot is, ha van) és koncentrációk, |
|
— |
a daganatok előfordulási gyakorisága nemenként, dózisonként és a daganat típusa szerint, |
|
— |
az elpusztulás ideje a vizsgálat során, illetve, hogy az állatok megélték-e a vizsgálat végét, |
|
— |
a toxikus reakciók nemenként és dózisonként, |
|
— |
a toxikus és más hatások leírása, |
|
— |
az egyes mérgezési tünetek megfigyelésének időpontja és a megfigyelést követő változásuk, |
|
— |
a takarmány fogyasztásával és a testsúly változásával kapcsolatos adatok, |
|
— |
az elvégzett hematológiai vizsgálatok és azok valamennyi eredménye, |
|
— |
boncolási leletek, |
|
— |
a kórszövettani vizsgálatok eredményének részletes ismertetése, |
|
— |
az eredmények statisztikai feldolgozása, ahol lehetséges, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ES ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.33. A KRÓNIKUS TOXICITÁS ES A RÁKKELTŐ HATÁS EGYÜTTES VIZSGÁLATA
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A krónikus toxicitás és a rákkeltő hatás együttes vizsgálatának célja valamely anyag hosszan tartó expozíció hatására kialakuló krónikus, illetve rákkeltő hatásainak meghatározása valamely emlősfajon.
Ennek érdekében a rákkeltő hatásnál ismertetett vizsgálatot legalább egy kísérő csoporttal és egy kísérő kontrollcsoporttal kell kibővíteni. A nagy adaggal kezelt kiegészítő csoportban az adag nagysága nagyobb lehet, mint a rákkeltő hatásra irányuló vizsgálatban a nagy adaggal kezelt csoporté. A rákkeltő hatásra irányuló vizsgálatban az állatokon az általános toxicitás és a rákkeltő hatás jeleit egyaránt keresni kell. A kezelt kísérő csoportban azonban az állatokat csak a toxicitás szempontjából vizsgáljuk meg.
A vizsgált anyagot rendszerint heti hét alkalommal, a megfelelő módon, fokozatos adagokban adjuk be a kísérleti állatcsoportoknak, élettartamuk jelentős részén keresztül. Az adagolási időszak alatt és után az állatokat a mérgező hatás jelei, különösen a daganatképződés észlelése érdekében naponta kell megvizsgálni.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Az állatokat a vizsgálat előtt legalább öt napon keresztül a vizsgálat tartási és takarmányozási körülményei között kell tartani. Az egészséges, fiatal állatokat a vizsgálat megkezdése előtt véletlenszerű kiválasztással kezelt és kontrollcsoportokba kell beosztani.
1.6.1.
A javasolt állatfaj a patkány. Korábban végzett vizsgálatok eredményeire alapozva egyéb, rágcsáló- vagy nem rágcsáló fajokat is lehet használni. Kísérleti célokra tenyésztett laboratóriumi állattörzsekből származó egészséges és fiatal állatokat használjunk, az adagolást pedig a szoptatás utáni elválasztást követően minél előbb meg kell kezdeni.
A vizsgálat kezdetén az állatok súlya lehetőleg csak minimálisan térjen el egymástól, az átlagos értéktől legfeljebb ± 20 %-kal különbözhet. Ha a szubkrónikus orális vizsgálatot valamely hosszú távú vizsgálat előzményeként végezzük el, mindkét vizsgálathoz ugyanazon fajt, illetve kísérleti állattörzset kell felhasználni.
1.6.2.
Rágcsálók esetében minden adagolási szintnél, valamint a hozzájuk tartozó kontrollcsoportnál legalább 100 állatot kell felhasználni (50 hímet és 50 nőstényt). A nőstényeknél követelmény, hogy nem lehetnek leellettek vagy vemhesek. Ha időközi elpusztítást tervezünk, akkor a létszámot annyival kell megnövelni, ahány állatot a vizsgálat befejezése előtt el akarunk pusztítani.
A nem daganatos patológiás tünetek értékelésére szánt, kezelt kísérő csoport(ok)nak legalább 20 állatot kell tartalmaznia/tartalmazniuk nemenként, a kísérő kontrollcsoportnál pedig ez a szám 10 állat nemenként.
1.6.3.
A rákkeltő hatás vizsgálatához legalább három adagolási szintet (dózist) és egy kontrollt kell használni. A legnagyobb adaggal kezelt csoportban jelentkeznie kell a toxikus hatásnak, például a súlynövekedés kismértékű (10 %-ot nem meghaladó) visszaesése formájában, anélkül hogy a daganatos elváltozásokon kívül egyéb módon lényegesen megváltoztatná az életkilátásokat.
A legalacsonyabb adaggal kezelt csoportban a vizsgált anyag nem lehet hatással az állatok növekedésére, fejlődésére, illetve élettartamára, és nem okozhat toxikus tüneteket. E dózis általában nem lehet a legnagyobb dózis 10 %-ánál alacsonyabb.
A közbeeső csoportok adagjainak nagyságát a legkisebb és legnagyobb adag között pontosan középen kell kijelölni.
Az adagolási szinteket a korábbi toxicitásvizsgálatokat figyelembe véve kell megválasztani.
A krónikus toxicitás meghatározására további kezelt és kontroll-kísérőcsoportokat kell alkalmazni. A kísérő csoportot olyan adaggal kell kezelni, hogy az abban lévő állatok az egyértelmű toxicitás jeleit mutassák.
Az expozíciót rendszerint naponta kell megismételni.
Ha a vegyületet ivóvízzel vagy takarmányba keverve adjuk be, akkor azoknak folyamatosan az állatok rendelkezésére kell állnia.
1.6.4.
A kezelt csoporttal a vizsgált anyaggal való expozíció kivételével minden egyéb tekintetben azonos kontrollcsoportot kell használni.
Különleges körülmények között, például aeroszolokat is alkalmazó belégzési vizsgálatban vagy nem jellemzett biológiai aktivitással rendelkező emulzióképző anyag szájon át történő adagolásakor egy további, kezeletlen kontrollcsoportra is szükség van, amelynek állatai nem kerülnek kapcsolatba a vivőanyaggal.
1.6.5.
Az adagolás három fő úton történhet: szájon át, bőrön át, illetve belélegeztetéssel. Az adagolás módjának megválasztása függ a vizsgált anyag fizikai és kémiai tulajdonságaitól, valamint az emberi expozíció valószínű módjától.
1.6.5.1. Vizsgálatok orális adagolással
Ha a vizsgált anyag felszívódik a gyomor-bél rendszerből, és ha a táplálékfelvétel az esetleges emberi expozíció egyik módja, akkor az orális adagolás a választandó módszer, hacsak ellenjavallata nincs. Az állatok a vizsgált anyagot a takarmánnyal, az ivóvízben oldva, illetve kapszulában kaphatják.
Ideális esetben az anyagot naponta kell adagolni a hét mind a hét napján, miután az ötnapos rendszerű adagolás gyógyulással vagy a toxikus tünetek megszűnésével járhat a kimaradó időszakban, és így befolyásolhatja az eredményeket és azok értékelését. Ám főként gyakorlati megfontolások alapján az ötnapos adagolási hét is elfogadhatónak tekintendő.
1.6.5.2. Vizsgálatok dermális expozícióval
A bőr ecsetelésével végzett expozíció olyan esetben választható, ha az az emberi expozíció fő módját szimulálja, illetve, ha bőrelváltozásokra akarnak modellrendszert felállítani.
1.6.5.3. Vizsgálatok inhalációs adagolással
Miután az inhalációs vizsgálatok sokkal összetettebb technikai problémákat jelentenek, mint az adagolás más módjai, az adagoláshoz itt sokkal részletesebb útmutatást kell adni. Szükséges megjegyezni, hogy bizonyos körülmények között a közvetlen légcsőbe juttatás (instilláció) is érvényes módszer lehet.
A hosszú távú expozíció alapja rendszerint az emberi expozíció modellezése, ami két lehetőséget jelent. Az egyik lehetőségnek megfelelően a kamra-koncentráció kiegyenlítődését követően naponta hat órán keresztül kell belélegeztetni az állatokkal a vizsgált anyagot heti öt napon keresztül (szakaszos expozíció), a másik lehetőség pedig a környezeti expozíciónak jobban megfelelő módszer, azaz napi 22–24 órán át, a hét minden napján végzett belélegeztetés (folyamatos expozíció), amelybe körülbelül egyórás napi megszakítás is beletartozik, minden nap ugyanazon időben, amikor is az állatok megkapják a takarmányt, és amikor a kamrát tisztítják. Az állatok általában mindkét esetben állandó koncentrációnak vannak kitéve. A szakaszos és a folyamatos expozíció közötti alapvető különbség az, hogy az előbbiben van egy 17–18 órás időszak, amikor az állatok regenerálódhatnak a napi adag hatását követően, amelyet a hétvégeken egy még ennél is hosszabb regenerációs időszak követ.
A szakaszos, illetve folyamatos expozíció közötti választás a vizsgálat céljától és a szimulálni kívánt emberi helyzettől függ. Mindazonáltal figyelembe kell venni bizonyos technikai nehézségeket. Ilyen például, hogy a folyamatos expozíció előnyeit csökkentheti az ehhez szükséges itatás és etetés nehézsége, valamint a bonyolultabb (ugyanakkor megbízhatóbb) aeroszol- és páraképző berendezések, illetve a megfigyelőtechnikák igénye.
1.6.6.
A kísérlethez olyan inhalációs berendezést kell használni, amely óránként legalább tizenkét alkalommal légcserét tesz lehetővé a dinamikus légmozgás fenntartása érdekében, azért, hogy megfelelő oxigéntartalmat és egyenletesen eloszlatott expozíciós atmoszférát lehessen biztosítani. A kontroll- és az expozíciós kamrák tervezésének, felépítésének azonosnak kell lennie, hogy a körülmények a vizsgált anyag belélegeztetését kivéve minden tekintetben összehasonlíthatók legyenek. A kamrában általában enyhe negatív nyomást kell fenntartani, hogy a vizsgált anyag ne szivároghasson ki a környezetbe. Ha kamrát használnak, annak kialakítása révén a lehető legkisebbre kell csökkenteni a vizsgálati állatok zsúfoltságát. Általános szabályként a kamrai atmoszféra stabilitásának biztosítása érdekében a vizsgálati állatok teljes térfogata nem haladhatja meg a vizsgálati kamra térfogatának 5 %-át.
A következő méréseket és ellenőrzéseket kell elvégezni:
|
i. |
légáramlás: a légkamrán keresztül áramló levegő sebességét lehetőség szerint folyamatosan kell mérni; |
|
ii. |
koncentráció: a napi expozíciós időszak alatt a vizsgált anyag koncentrációjának változása nem haladhatja meg a középérték ±15 %-át; |
|
iii. |
hőmérséklet és páratartalom: rágcsálóknál a vizsgálatokat 22 ± 2 oC kamrai hőmérsékleten és 30–70 % közötti relatív páratartalom mellett kell végezni, kivéve, amikor a vizsgált anyagot víz segítségével oszlatjuk el a kamra légterében. Lehetőleg mindkét értéket folyamatosan figyelemmel kell kísérni; |
|
iv. |
a részecske nagyságának mérése: a folyékony és szilárd aeroszolt alkalmazó légkamrák légterében meg kell határozni a részecskék megoszlását. Az aeroszolrészecskéknek a felhasznált állatok számára belélegezhető nagyságúaknak kell lenniük. A légkamra mintáit az állatok légzési zónájából kell venni. A légminta legyen az állattal belélegeztetett részecskemegoszlására nézve reprezentatív, és gravimetrikusan az összes szuszpendált aeroszolt képviselje még akkor is, ha azok nagy része nem lélegezhető be az állat számára. A részecskeméret meghatározását a kísérleti rendszer kialakítása során gyakran el kell végezni az aeroszol stabilitásának ellenőrzésére, azután pedig olyan gyakran, ahogy szükséges a belélegeztetés során, hogy megfelelően meghatározhassák az állatok expozíciójára alkalmazott részecskemegoszlás állandóságát. |
1.6.7.
A rákkeltő hatás vizsgálatának időtartama a kísérleti állatok normális élettartamának jelentős részére kiterjed. A vizsgálatokat egérnél és hörcsögnél 18 hónap, patkánynál 24 hónap elteltével kell befejezni; egyes, hosszabb életű és alacsonyabb spontán tumorképzésű fajtaváltozatoknál azonban egérnél és hörcsögnél a vizsgálatot 24 hónap, patkánynál pedig 30 hónap elteltével kell befejezni. A másik megoldás az ilyen hosszú távú vizsgálatnál, ha akkor hagyják abba, amikor a túlélő egyedek száma a legalacsonyabb adaggal kezelt vagy a kontrollcsoportban eléri a 25 %-ot. Ha olyan vizsgálatot fejeznek be, amelyben a válaszreakció nyilvánvaló nemtől függő különbsége észlelhető, mindkét nemet külön kell értékelni. Ha csak a nagy adaggal kezelt csoport állatai hullanak el idő előtt, nyilvánvalóan a toxicitásból kifolyólag, ez még nem ok a vizsgálat befejezésére, amennyiben a többi csoportban a tünetek megjelenése nem jelent problémát. Negatív vizsgálati eredmény csak abban az esetben fogadható el, ha a szöveti autolízis, a kannibalizmus, illetve a tartási körülmények által okozott elhullás aránya egyik csoportban sem haladja meg a 10 %-ot, és valamennyi csoportban a túlélési arány meghaladja az 50 %-ot egérnél és hörcsögnél 18 hónap, patkánynál pedig 24 hónap elteltével.
A vizsgálatban részt vevő és a krónikus toxicitás mérésére használt, nemenként 20 állatot tartalmazó kezelt és a hozzájuk tartozó, nemenként 10 állatot tartalmazó kontrollcsoportokat a vizsgálat befejezése után még legalább 12 hónapig kell megfigyelés alatt tartani. Ezen állatokat ütemterv szerint el kell pusztítani annak vizsgálata érdekében, hogy a vizsgált anyag milyen mértékben okoz az öregkori elváltozásoktól független kóros hatásokat.
1.6.8.
1.6.8.1. Megfigyelések
A ketrecben tartott állatok megfigyelésekor a bőr- és szőrelváltozásokra, a szemek és a nyálkahártyák változásaira, valamint a légzési, a keringési rendszerre, az autonóm és a központi idegrendszer működésére, a szomatomotoros tevékenységekre, valamint a viselkedési mintákra kell figyelemmel lenni.
A kezelt kísérő csoport(ok) állatain megfelelő időközönként klinikai vizsgálatokat kell végezni.
Az állatok rendszeres megfigyelésére azért van szükség, hogy megelőzzék a kísérleti állatok kannibalizmus, szöveti autolízis, illetve rossz elhelyezés következtében történő elhullását. A vizsgálati időszak végeztével a kísérő csoportban lévő állatok kivételével minden túlélő állatot el kell pusztítani, és fel kell boncolni. A haldokló állatokat az eltávolításukat követően el kell pusztítani, és fel kell boncolni.
A klinikai tüneteket és az elhalálozásokat minden állatnál fel kell jegyezni. Külön figyelmet kell fordítani a daganatképződésre: minden, szemmel látható vagy kitapintható daganat megjelenésének idejét, helyét, méreteit, megjelenési formáját és növekedését (progresszió) fel kell jegyezni.
A táplálékfogyasztást (és a vízfogyasztást, ha a vizsgált anyagot vízzel adjuk be) a vizsgálat első 13 hetében hetente kell mérni, majd megközelítőleg háromhavonta, hacsak az állatok egészségi állapota vagy testsúly változása másként nem indokolja.
Az állatok testsúlyát az első 13 hét során egyedileg, hetente kell mérni, ezután legalább négyhetente egyszer.
1.6.8.2. Klinikai vizsgálatok
A harmadik hónapban, a hatodik hónapban és ezután megközelítőleg félévente, valamint a vizsgálat végén csoportonként/nemenként 10 patkánynál valamennyi vizsgálati csoportnál a levett vérmintákból hematológiai vizsgálatot (például hemoglobin-tartalom, hematokritérték, vörösvérsejtszám, teljes fehérvérsejtszám, trombocitaszám, illetve egyéb alvadási paraméterek) kell végezni. Ha lehetséges, minden mintát minden alkalommal ugyanattól a patkánytól kell venni.
Ha a klinikai megfigyelések az állatok egészségének romlására utalnak a vizsgálat során, az érintett állatoknál kvantitatív vérképvizsgálatot is kell végezni. Szintén kvantitatív vérképvizsgálatot kell végezni a legnagyobb adaggal kezelt állatoknál és a kontrollcsoportban. A második legnagyobb adaggal kezelt csoportnál e vizsgálatot csak akkor kell elvégezni, ha jelentős különbség van a kontroll- és a legnagyobb adaggal kezelt csoport között, illetve, ha a kórbonctani eredmények ezt indokolják.
Csoportonként/nemenként 10 patkánynál valamennyi vizsgálati csoportnál a vérvizsgálattal egy időben vizeletmintát is kell venni a vizeletvizsgálathoz. Egyedileg vagy nemenként/csoportonként összesített mintákból az alábbi meghatározásokat kell elvégezni:
|
— |
külső megjelenés: térfogat és sűrűség, állatonként, |
|
— |
fehérje, glükóz, keton, vér (szemikvantitatív meghatározás), |
|
— |
az üledék mikroszkópos vizsgálata (szemikvantitatív meghatározás). |
Valamennyi nem rágcsáló állatnál és csoportonként/nemenként 10 patkánynál valamennyi vizsgálati csoportnál, lehetőség szerint minden alkalommal ugyanazon patkányoktól, megközelítőleg hathavonta, illetve a vizsgálati időszak végeztével vérmintákat kell venni klinikai kémiai vizsgálatok céljaira. Ezenkívül a nem rágcsálóktól vizsgálat előtti mintát is kell venni. A mintákból plazmát kell készíteni, és az alábbi meghatározásokat kell elvégezni:
|
— |
összfehérje-koncentráció, |
|
— |
albuminkoncentráció, |
|
— |
májfunkciós vizsgálatok (például alkalikusfoszfatáz-aktivitás, szérum glutaminsav szőlősav transzamináz- [GPT] (4), szérum glutaminsav oxálsav transzamináz [GOT] (5) aktivitás) gamma glutamil-transzpeptidáz, ornitin dekarboxiláz, |
|
— |
szénhidrát-anyagcsere, például éhgyomorra mért vércukorszint, |
|
— |
vesefunkciós vizsgálatok, például karbamid a vérben. |
Minden állaton teljes körű makroszkópos boncolást kell végezni, beleértve azokat is, amelyek a vizsgálat során hullottak el, illetve amelyeket haldokló állapotban találtunk, és ezért elpusztítottunk. A leölés előtt az állatoktól kvantitatív vérképvizsgálat céljából vérmintát kell venni. Valamennyi, szabad szemmel látható elváltozást, daganatot, illetve daganatgyanús elváltozást meg kell őrizni. Meg kell kísérelni a makroszkópos és mikroszkópos elváltozások közötti összefüggések feltárását.
Az összes szervet és szövetet fixálni kell egy esetleges későbbi kórszövettani vizsgálat céljaira. Ez rendszerint a következő szövetekre és szervekre vonatkozik: agy (7) (a nyúltagy/híd, a kisagykéreg, a nagyagykéreg), az agyalapi mirigy, a pajzsmirigy (a mellékpajzsmiriggyel együtt), a csecsemőmirigy, a tüdő (a légcsővel együtt), a szív, az aorta, a nyálmirigyek, a máj (7), a lép, a vesék (7), a mellékvesék (7), a nyelőcső, a gyomor, a patkóbél, az éhbél, a csípőbél, a vakbél, a vastagbél, a végbél, a méh, a húgyhólyag, a nyirokcsomók, a hasnyálmirigy, az ivarmirigyek (7), a járulékos nemi szervek, a női emlőmirigy, a bőr, az izomzat, a perifériás idegek, a gerincvelő (nyaki, háti, ágyéki), a szegycsont a csontvelővel és a combcsont (az ízületi felülettel együtt), valamint a szemek.
A tüdő és a húgyhólyag megőrzésére a legjobb módszer a fixálóval való feltöltés. A tüdő folyadékkal való feltöltése az inhalációs vizsgálatoknál a megfelelő kórszövettani vizsgálat előfeltétele. Különleges, például inhalációs vizsgálatoknál a teljes légzőrendszert vizsgálni kell, az orral, a garattal és a gégefővel együtt.
Ha más klinikai vizsgálatokat is végzünk, az azokból nyert információknak a mikroszkópos vizsgálatokat megelőzően kell rendelkezésre állniuk, mert a patológus számára lényegi információkkal szolgálhatnak.
A vizsgálat krónikus toxicitásra irányuló részében:
a nagy adaggal kezelt kísérő csoport, valamint a kontrollcsoport minden tagjának valamennyi eltett szervét részletesen meg kell vizsgálni. Ha a vizsgált anyaggal kapcsolatos patológiás elváltozást találunk a nagy adaggal kezelt kísérő csoportban, az összes többi kezelt kísérő csoport valamennyi állatának célszerveit, valamint a vizsgálat rákkeltő hatásra irányuló részébe tartozó kezelt csoportok állatait a vizsgálati időszak végeztével szintén hasonlóan teljes és részletes vizsgálatnak kell alávetni.
A vizsgálat rákkeltő hatásra irányuló részében:
|
a) |
teljes kórszövettani vizsgálatot kell végezni a vizsgálat során elhullott vagy elpusztított valamennyi állat, a nagy adaggal kezelt csoport és a kontrollcsoport állatainak szervein és szövetein; |
|
b) |
valamennyi csoportban minden, szabad szemmel látható daganatot, illetve daganatgyanús elváltozást meg kell vizsgálni minden csoportnál minden szerven; |
|
c) |
ha jelentős különbség mutatkozik a nagy adaggal kezelt csoport és a kontrollcsoport daganatos elváltozásainak előfordulási gyakoriságában, az adott szövet vagy szerv kórszövettani vizsgálatát a többi csoportban is el kell végezni; |
|
d) |
ha a legnagyobb adaggal kezelt csoport túlélési adatai jelentősen rosszabbak a kontrollcsoporténál, az eggyel alacsonyabb adaggal kezelt csoportban is teljes körű vizsgálatot kell végezni; |
|
e) |
ha a legnagyobb adaggal kezelt csoportban a daganatos elváltozás lefolyását esetleg befolyásoló toxikus vagy más hatások jelenléte tapasztalható, az eggyel alacsonyabb adaggal kezelt csoportban is teljes körű vizsgálatot kell végezni. |
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, amely minden vizsgálati csoportban megadja az állatok számát a vizsgálat kezdetén, azon állatok számát, amelyeknél a kísérlet folyamán tumort diagnosztizáltak, vagy toxicitási jeleket észleltek, azon állatok számát, amelyeknél a boncolás folyamán tumort diagnosztizáltak, illetve ennek időpontját. Az eredményeket megfelelő statisztikai módszerrel kell értékelni. Bármely elfogadott statisztikai módszer használható.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
használt faj, törzs, az állatok származása, tartási körülmények, étrend, |
|
— |
vizsgálati körülmények:
|
|
— |
adagolás (beleértve a vivőanyagot is, ha van) és koncentrációk, |
|
— |
a daganatok előfordulási gyakorisága nemenként, dózisonként és a daganat típusa szerint, |
|
— |
az elpusztulás ideje a vizsgálat során, illetve, hogy az állatok megélték-e a vizsgálat végét, |
|
— |
a toxikus reakciók nemenként és dózisonként, |
|
— |
a toxikus és más hatások leírása, |
|
— |
az egyes mérgezési tünetek megfigyelésének időpontja és a megfigyelést követő változásuk, |
|
— |
szemészeti leletek, |
|
— |
a takarmány fogyasztásával és a testsúly változásával kapcsolatos adatok, |
|
— |
az elvégzett hematológiai vizsgálatok és azok valamennyi eredménye, |
|
— |
klinikai kémiai vizsgálatok és azok eredményei (beleértve a vizeletvizsgálatot is), |
|
— |
boncolási leletek, |
|
— |
a kórszövettani vizsgálatok eredményének részletes ismertetése, |
|
— |
az eredmények statisztikai feldolgozása, ahol lehetséges, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.34. EGYGENERÁCIÓS REPRODUKCIÓS TOXICITÁSVIZSGÁLAT
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot naponta szájon át, fokozatosan növekvő adagokban adjuk be több kísérleti állatcsoportnak, hímeknek és nőstényeknek. A hímeknek a növekedés ideje alatt és legalább egy teljes csírasejtképzési cikluson keresztül (egérben megközelítőleg 56 nap, patkányban 70 nap) kell adni a vizsgált anyagot, hogy annak a csírasejtképzésre gyakorolt esetleges kedvezőtlen hatása kifejlődhessen.
A szülői (P) nemzedék nőstényeinek legalább két teljes párzási időszakon keresztül kell adagolni a vizsgált anyagot, hogy annak az ivarzási ciklusra gyakorolt esetleges kedvezőtlen hatása kifejlődhessen. Ezután a kísérleti állatokat pároztatják. A vizsgált anyagot a párzási időszak alatt mindkét nemnek adagolni kell, azt követően csak a nőstényeknek a vemhesség ideje alatt, valamint a szoptatás időszakában. Az anyag inhalációs adagolásához a módszer módosítást igényel.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
Az egészséges, fiatal állatokat a vizsgálat megkezdése előtt véletlenszerű kiválasztással kezelt és kontrollcsoportokba kell beosztani. Az állatokat a vizsgálat előtt legalább öt napon keresztül a vizsgálat tartási és takarmányozási körülményei között kell tartani. A vizsgált anyag ajánlott adagolási módja: a takarmánnyal vagy az ivóvízzel. Más alkalmazási módok is elfogadhatók. A vizsgált anyagokat valamennyi állatnak azonos módszerrel kell adagolni a vizsgálat teljes időtartama alatt. Ha az adagolás megkönnyítésére vivőanyagot vagy más adalékanyagot használnak, meg kell bizonyosodni arról, hogy azok nem rendelkeznek toxikus hatással.
Az adagolást heti hét napon kell végezni.
1.6.2. A kísérlethez felhasznált állatok
A faj kiválasztása
A javasolt faj a patkány vagy az egér. Korábban vizsgálatban még részt nem vett, egészséges állatokat kell használni. Ne használjunk rossz termékenységű törzseket. Az állatokat faj, törzs, nem, súly és/vagy kor szerint kell jellemezni.
A termékenység megállapítása érdekében mind a hím, mind a nőstény állatokat meg kell vizsgálni. Mind a kontroll-, mind a kísérleti csoportban csak az elválasztást követően lehet megkezdeni a vizsgált anyag adagolását.
Az állatok száma és neme
Minden adagolási és kontrollcsoportnak elegendő állatot kell tartalmaznia ahhoz, hogy legalább 20 vemhes, illetve az elléshez közel álló nőstény legyen benne.
A cél az, hogy megfelelő mennyiségű vemhességet és utódot hozzanak létre ahhoz, hogy felmérhessük az anyag hatását a termékenységre, a vemhességre és az anyai viselkedésre a szülői (P) nemzedékben, valamint a szopásra, a növekedésre és a fejlődésre az F1 utódnemzedékben a fogamzástól a szoptatástól való elválasztásig.
1.6.3. Vizsgálati körülmények
Annyi élelmet és vizet kell adni, amennyire csak szükség van (ad libitum). Az ellés előtt a vemhes nőstényeket el kell különíteni, elletőketrecekbe kell rakni, és az alom kialakításához használt (fészeképítő) anyaggal is el lehet látni.
1.6.3.1.
Legalább három adagolási szintet (dózist) és egy kontrollt kell használni. Ha az anyag beadásához vivőanyagot alkalmaznak, akkor a kontrollcsoportnak a vivőanyagból a felhasznált legnagyobb mennyiséget kell kapnia. Ha a vizsgált anyag csökkent táplálékfelvételt, illetve táplálékhasznosítást vált ki, szükség lehet egy korlátozott etetéssel tartott kontrollcsoport beállítására. Ideális esetben, ha azt a vizsgált anyag biológiai, illetve fízikokémiai tulajdonságai lehetővé teszik, a legnagyobb adaggal kezelt csoport szülő állataiban (P) ugyan jelentkeznie kell a toxikus hatásnak, de elhullásnak nem. A közepes adaggal kezelt csoport(ok)ban a vizsgált anyagnak tulajdonítható toxikus hatás minimális jeleinek kell megjelenni, és az alacsony adaggal kezelt csoportban az anyag nem okozhat észrevehető kedvezőtlen hatást sem a szülőknél, sem az utódoknál. Ha az állatok gyomorszondával vagy kapszulában kapják az adagot, azt az adott állat testsúlyára számítva kell adni, és azt hetente a testsúly változásaihoz kell igazítani. A vemhesség alatt a nőstények adagja szükség esetén a vemhesség nulladik, illetve hatodik napján mért testsúlyra számítható ki.
1.6.3.2.
Alacsony toxicitású anyagoknál, ha az 1 000 mg/testsúlykilogramm, illetve az azt meghaladó dózis nem okoz semmilyen zavart a szaporodási képességben, a többi adagolási szinten végzett vizsgálatok szükségtelennek tekinthetők. Ha a nagy dózissal kezelt csoportban az anyára gyakorolt toxikus hatást egyértelműen mutató előzetes vizsgálatban nem volt észlelhető kedvezőtlen hatás a termékenység vonatkozásában, akkor a többi adagolási szinten végzett vizsgálat szükségtelennek tekinthető.
1.6.3.3.
A szülői (P) nemzedék hímjeinél a napi adagolást az állatok öt- és kilenchetes kora között kell megkezdeni, miután a szoptatott állatokat elválasztották, és legalább öt napon keresztül a vizsgálati körülmények mellett tartották. A patkányoknál az adagolást a párzási időszak előtt 10 héten át kell folytatni (egér esetében ez az idő nyolc hét). A hímeket vagy a párzási időszakot követően kell elpusztítani és megvizsgálni, vagy a vizsgálati étrend mellett kell azokat tovább tartani egy esetleges második alom létrehozásához, majd nem sokkal a vizsgálat vége előtt kell elpusztítani és megvizsgálni. A szülői nemzedék (P) nőstényeinél az ötnapos szoktatást követően kell megkezdeni a vizsgált anyag adagolását, és legalább a párzást két héttel megelőző időpontig kell folytatni. A P nőstényeknél a napi adagolást folytatni kell az egész, háromhetes párzási időszak során és a vemhesség alatt, amíg az F1 utódnemzedéket el nem választjuk. Az adagolás ütemezése szükséges lehet akkor, ha más információ is rendelkezésre áll a vizsgált anyagról, például annak anyagcsere-fokozó hatásairól vagy biológiai felhalmozódásáról.
A reprodukciós toxicitásvizsgálatokban vagy 1:1 (egy hím-egy nőstény) vagy 1:2 (egy hímkét nőstény) párosítást alkalmazhatunk.
Az 1:1 arányú pároztatás esetén egy nőstényt addig kell ugyanazon hímmel együtt tartani, míg teherbe nem esett, vagy három hét időtartamig. A nőstényt minden reggel megvizsgáljuk a sperma vagy a hüvelydugó jelenléte szempontjából. A vemhesség nulladik napjának azt a napot tekintjük, amikor a hüvelydugó vagy a sperma megtalálható.
A sikertelen párokat megvizsgálják annak megállapítása érdekében, hogy mi az oka a terméketlenségnek.
Ez adott esetben azt jelentheti, hogy tovább kell pároztatni az állatot olyan hímekkel vagy anyaállatokkal, amelyek termékenységéről már meggyőződtek, illetve a szaporítószerveket mikroszkóppal megvizsgálják, illetve az ivarzási ciklust vagy az ondóképződést ellenőrzik.
A termékenységi vizsgálat alatt kezelt állatokat a szokványos módon hagyják megelleni, és bárminemű külső beavatkozás nélkül hagyják, hogy utódaikat az elválasztásig neveljék.
Ha standardizálunk, az alábbi eljárás javasolt. Az ellés utáni első és negyedik nap között módosíthatjuk az egyes almok egyedszámát a létszám fölötti kölykök eltávolításával, hogy az eredmény – amennyire lehetséges – almonként négy hím és négy nőstény utód legyen.
Ha a hím és nőstény utódok száma nem teszi lehetővé a nemenként négy azonos nemű utódot tartalmazó almok kialakítását, részleges kiegyenlítés is elfogadható (például öt hím és három nőstény). A nyolcnál kevesebb egyedet számláló almokban a kiegyenlítés nem lehetséges.
1.6.4. Megfigyelések
A vizsgálati időszak folyamán minden állatot naponta legalább egyszer meg kell figyelni. Feljegyzést kell készíteni a lényeges magatartászavarokról, az elhúzódó vagy nehéz ellés jeleiről, valamint a toxikus hatásra utaló minden egyéb tünetről, beleértve az elhullást is. A pároztatás előtt és a pároztatási időszak alatt a takarmányfogyasztást naponta kell mérni. Az ellés után és a szoptatás alatt a takarmányfogyasztás mérését (és az ivóvízfogyasztás mérését, ha a vizsgált anyagot az ivóvízben adtuk be) ugyanazon a napon kell elvégezni, mint az utódok testsúlymérését. A P generáció hímjeinek és nőstényeinek testsúlyát az adagolás megkezdésének napján kell megmérni, és ezt követően hetente meg kell ismételni a mérést. E megfigyeléseket minden felnőtt állatnál egyedenként kell rögzíteni.
A terhességi (gesztációs) időszakot a vemhesség nulladik napjától kell számolni. Minden utódot az ellést követően a lehető leghamarabb meg kell vizsgálni, és meg kell állapítani a kicsinyek számát és nemét, a halvaszületések arányát, valamint a durva rendellenességek jelenlétét.
A halva született és a negyedik napig elpusztított utódokat meg kell őrizni, és meg kell vizsgálni az esetleges születési rendellenességek szempontjából. Az élő utódokat az ellést követő reggelen meg kell számolni és testsúlymérést is kell végezni, majd ezt meg kell ismételni előbb a negyedik és hetedik napon, majd a vizsgálat végéig hetente, egyedileg mérve az állatokat.
Az anyaállatokon vagy az utódokon észlelt fizikai és magatartásbeli rendellenességeket fel kell jegyezni.
1.6.5. Kórtan
1.6.5.1.
A P generációhoz tartozó állatokat, ha azokat elpusztítják, illetve azok elpusztulnak a vizsgálat során, makroszkópos vizsgálatnak kell alávetni rendellenességeket vagy patológiás elváltozásokat keresve, különös tekintettel a szaporodási rendszer szerveire. Az elhullott, illetve haldokló kicsinyeket a rendellenességek szempontjából kell megvizsgálni.
1.6.5.2.
A P generációhoz tartozó állatok petefészkeit, méhét, méhnyakát, hüvelyét, heréit, mellékheréjét, ondóhólyagját, prosztatáját, alvadékképző mirigyét, agyalapi mirigyét és cél szervét/cél szerveit el kell tenni mikroszkópos vizsgálatok céljaira. Abban az esetben, ha más, többféle dózissal végzett vizsgálatokban e szerveknek a vizsgálata nem történt meg, akkor valamennyi nagy adaggal kezelt és kontrollállat szóban forgó szerve esetében el kell végezni a mikroszkópos vizsgálatot, és – ha a gyakorlatban megoldható – ugyanez vonatkozik a menet közben elpusztult állatokra is.
Azon szerveket, amelyek az említett állatokban rendellenességeket mutatnak, a továbbiakban az összes többi P állatban is meg kell vizsgálni. Ezen esetekben az összes olyan szövetet mikroszkópos szövettani vizsgálatnak kell alávetni, amelyeken feltűnő kóros elváltozások mutatkoztak. Amint az a pároztatási eljárások ismertetése során javasolt volt, a feltehetően terméketlen állatok szervei esetében is elvégezhető a mikroszkópos vizsgálat.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, amely minden vizsgálati csoportban megadja az állatok számát a vizsgálat kezdetén, a termékeny hím állatok számát, a vemhes nőstények számát, az elváltozások típusait és az egyes elváltozási fajtákat mutató állatok százalékos arányát.
Az eredményeket megfelelő statisztikai módszerrel kell értékelni. Bármely elfogadott statisztikai módszer használható.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
felhasznált faj, törzs, |
|
— |
a toxikus reakciók adatai nemenként és dózisonként, beleértve a termékenységet, a gesztációs időt és az életképességet is, |
|
— |
az elhullás ideje a vizsgálat során, illetve, hogy az állatok megélték-e az elpusztítás tervezett időpontját, illetve a vizsgálat végét, |
|
— |
egy táblázat az utódok súlyáról, a kicsinyek átlagos súlyáról, valamint a vizsgálat végén az egyes utódok súlyáról, |
|
— |
a szaporodásra, az utódokra, illetve a születés utáni fejlődésre gyakorolt toxikus és egyéb hatások leírása, |
|
— |
az egyes mérgezési tünetek megfigyelésének időpontja és a megfigyelést követő változásuk, |
|
— |
testsúlyadatok a P generációnál, |
|
— |
boncolási leletek, |
|
— |
valamennyi mikroszkópos lelet részletes leírása, |
|
— |
az eredmények statisztikai feldolgozása, ahol lehetséges, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.35. KÉTGENERÁCIÓS REPRODUKCIÓS TOXICITÁSVIZSGÁLAT
1. MÓDSZER
Ez a módszer az OECD TG 416 (2001) módszer megfelelője.
1.1. BEVEZETÉS
E kétgenerációs reprodukciós toxicitási vizsgálati módszer segítségével általános információk nyerhetők egy vizsgálandó anyagnak a hím és női szaporítórendszer épségére és teljesítőképességére, ezen belül az ivarmirigyek működésére, az ivari ciklusra, a párzási viselkedésre, a fogantatásra, a vemhességre, az ellésre, a szoptatásra és az elválasztásra, valamint az utódok növekedésére és fejlődésére gyakorolt hatásaival kapcsolatosan. A vizsgálat emellett információkat nyújthat a vizsgálandó anyagnak az újszülött kori morbiditásra, mortalitásra gyakorolt hatásaival kapcsolatosan, előzetes adatokat szolgáltathat a prenatális és posztnatális fejlődési toxicitásról, illetve útmutatóként szolgálhat a későbbi vizsgálatokhoz is. Az F1 generáció növekedésének és fejlődésének tanulmányozásán kívül e vizsgálati módszer segítségével a hím és női szaporítórendszer épsége és teljesítőképessége, valamint az F2 generáció növekedése és fejlődése is tanulmányozható. A fejlődési toxicitással és a funkcionális defektusokkal kapcsolatban további információk úgy szerezhetők, ha ezt az eljárást adott esetben a fejlődési toxicitási és/vagy fejlődési neurotoxicitási módszereket segítségül híva további vizsgálati protokollokkal egészítik ki, de az említett végpontok a megfelelő vizsgálati módszerek alkalmazásával külön vizsgálatokban is tanulmányozhatók.
1.2. A VIZSGÁLATI MÓDSZER ELVE
A vizsgálandó anyagot fokozatosan növekvő dózisokban kell adagolni hím és nőstény állatok több csoportjának. A P generációba tartozó hímeknek egyrészt a növekedés során, másrészt legalább egy teljes spermaképződési ciklus során (egérben körülbelül 56 nap, patkányban pedig körülbelül 70 nap) kell adagolni az anyagot ahhoz, hogy bármilyen, a spermaképződésre gyakorolt káros hatást ki lehessen váltani. A spermára gyakorolt hatásokat egy sor spermaparaméter (pl. spermamorfológia és -motilitás), valamint szövetpreparátumok és részletes kórszövettani vizsgálatok segítségével kell meghatározni. Ha rendelkezésre állnak megfelelő időtartamú, pl. legalább 90 napos ismételt dózisú vizsgálatokból származó, a spermaképződéssel kapcsolatos adatok, a P generációba tartozó hímeket nem kell bevonni az értékelésbe. A spermamintákat vagy az azokról készült digitális felvételeket azonban ajánlatos az esetleges későbbi értékelések céljára megőrizni, illetve elmenteni. A P generációba tartozó nőstényeknek egyrészt a növekedés során, másrészt több teljes ivari ciklus során kell adagolni a vizsgálandó anyagot ahhoz, hogy észlelhetők legyenek az ivari ciklus szabályosságára kifejtett esetleges káros hatások. A vizsgálandó anyagot a párzás és az ennek eredményeként létrejövő vemhesség során, sőt egészen az F1 utódok elválasztásának ideje alatt is kell adagolni a szülőknek (azaz a P generációba tartozó állatoknak). Az elválasztáskor a kezelést az F1 utódokon kell folytatni, egészen felnőtté válásukig, párzásukig, illetve az F2 generáció létrejöttéig, amíg meg nem történik az F2 generáció elválasztása.
Minden állaton klinikai megfigyeléseket és kórbonctani vizsgálatokat kell végezni a toxicitás jeleinek kimutatása érdekében, és külön hangsúlyt kell fektetni a hím és női szaporítórendszer épségére és teljesítőképességére, valamint az utódok növekedésére és fejlődésére.
1.3. A VIZSGÁLATI MÓDSZER ISMERTETÉSE
1.3.1. Az állatfaj kiválasztása
A vizsgálatok céljára a preferált állatfaj a patkány. Ettől eltérő fajok alkalmazását megfelelően indokolni kell, és a megfelelő módosításokra is szükség lesz. Nem szabad olyan törzseket alkalmazni, amelyek kevéssé termékenyek, vagy amelyekben magas a fejlődési defektusok előfordulási gyakorisága. A vizsgálat megkezdésekor az egyes kísérleti állatok testtömegének csak minimális mértékben szabad különböznie egymástól, és egyik ivar esetében sem térhet el 20 %-nál magasabb mértékben az ivar átlagától.
1.3.2. Az állatok tartásának és etetésének körülményei
A kísérleti helyiség hőmérsékletének 22 oC (± 3 oC)-nak kell lennie. Bár a helyiség relatív páratartalmának legalább 30 %-nak kell lennie, illetve a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot, a célértéknek 50 és 60 % között kell lennie. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett. A takarmány megválasztását az is befolyásolhatja, hogy ha a vizsgálandó anyagot táplálékkal adják be, akkor azok megfelelő módon keveredjenek el egymással.
Az állatok egyedileg vagy azonos ivarú egyedekből álló kisebb csoportokban is tarthatók. A pároztatásokat erre a célra alkalmas ketrecekben kell végezni. Ha meggyőződtek a párzás megtörténtéről, a pároztatott nőstényeket egyedileg kell elhelyezni ellető vagy fiaztató ketrecekben. A pároztatott patkányokat kis csoportokban is lehet tartani, de az ellés előtt egy vagy két nappal külön kell választani őket. Az ellés közeledtével a pároztatott állatok számára megfelelő és meghatározott fészekrakó anyagot kell biztosítani.
1.3.3. Az állatok előkészítése
Legalább 5 napon át a laboratórium körülményeihez szoktatott, egészséges állatokat kell alkalmazni, amelyek korábban nem voltak más kísérletnek alanyai. A kísérleti állatok jellemzésekor meg kell adni az állat faját, törzsét, származását, ivarát, testtömegét és/vagy életkorát. Ismerni kell, hogy mely állatok között áll fenn testvéri viszony, hogy elkerülhető legyen ezek pároztatása. Az állatokat véletlenszerűen kell beosztani a kontroll- és a kezelési csoportokba. A ketreceket úgy kell elrendezni, hogy minimálisra lehessen csökkenteni a ketrec elhelyezése jelentette lehetséges hatásokat. Minden állatot egyedi azonosító számmal kell ellátni. A P generáció esetében ezt még a kezelés megkezdése előtt meg kell tenni. Az F1 generáció esetében a későbbi pároztatásra kiválasztott állatokat az elválasztáskor egyedi azonosítóval kell ellátni. Minden kiválasztott F1 állat esetében meg kell őrizni azokat az adatokat, amelyek rögzítik, hogy az állat melyik alomból származik. Ha az utódok testtömegének mérését vagy bármely más funkcionális vizsgálat elvégzését is fontolóra veszik, akkor ajánlatos a születés után a lehető leghamarabb azonosítóval ellátni a kölyköket.
A kezelés megkezdésekor a szülőknek (P generáció) körülbelül 5–9 hetesnek kell lenniük. Amennyire csak megoldható, az állatoknak az összes vizsgálati csoportban nagyjából azonos testtömegűnek és korúnak kell lenniük.
1.4. ELJÁRÁS
1.4.1. Az állatok száma és ivara
Minden kezelési és kontrollcsoportban elegendő számú állatnak kell lennie ahhoz, hogy az elléskor vagy akörül lehetőleg legalább 20 vemhes nőstény tartozzon egy-egy csoportba. A kezeléssel összefüggésben nemkívánatos hatásokat (pl. sterilitást vagy magas dózisban túlzott toxicitást) kiváltó anyagok esetében előfordulhat, hogy ezt nem lehet megoldani. A cél az, hogy elegendő számú vemhesség jöjjön létre az anyagnak a termékenységre, a vemhességre, az anyai viselkedésre és szoptatásra, az F1 utódoknak a fogantatástól az ivarérettségig történő növekedésére és fejlődésére, valamint az F2 utódoknak az elválasztásig tartó időszakban történő fejlődésére gyakorolt esetleges hatások értékeléséhez. Nem feltétlenül teszi érvénytelenné tehát a vizsgálatot az, ha nem lehet megoldani, hogy a kívánt számú (azaz 20) vemhes állat álljon rendelkezésre, és ennek jelentőségét minden egyes esetben külön-külön kell értékelni.
1.4.2. A dózisok előkészítése
A vizsgálandó anyagot ajánlatos orálisan adagolni (a táplálékkal, az ivóvízzel vagy mesterséges táplálással), kivéve, ha más beadási módot (pl. dermális vagy inhalálásos alkalmazást) tartanak megfelelőbbnek.
Ahol szükséges, a vizsgálandó anyagot megfelelő vivőanyagban kell feloldani vagy szuszpendálni. Ahol lehet, elsősorban vizes oldatot/szuszpenziót ajánlatos alkalmazni, másodsorban olajos (pl. kukoricacsíra-olajban elkészített) oldatot vagy emulziót, és csak harmadsorban más vivőanyagokban elkészített oldatot. A víztől eltérő vivőanyagok esetében ismerni kell a vivőanyag toxikus jellemzőit. Meg kell határozni továbbá azt is, hogy a vizsgálandó anyag mennyire stabil az adott vivőanyagban.
1.4.3. Adagolás
Legalább három dózist és ezzel párhuzamos kontrollt kell alkalmazni. Hacsak a vizsgálandó anyag fizikai-kémiai jellege vagy biológiai hatásai nem szabnak ennek határt, a legmagasabb dózist úgy kell megválasztani, hogy toxicitást idézzen elő, de ne okozzon elhullást vagy súlyos szenvedést. Váratlan elhullások esetén, ha a szülői (P) generáció elhullási aránya alacsonyabb, mint körülbelül 10 százalék, a vizsgálat még általában elfogadható. A dózisok csökkenő sorrendjét úgy kell megválasztani, hogy kimutathatók legyenek az esetleges dózisfüggő hatások és a nem észlelhető káros hatás szintje (NOAEL). A csökkenő dózisszintek meghatározásához gyakran optimális a 2–4-szeres intervallumok alkalmazása, és nagyon nagy intervallumok (pl. 10-nél magasabb szorzófaktor) alkalmazása esetén gyakran előnyös a dózisok közé egy negyedik vizsgálati csoportot is beiktatni. A táplálékkal való beadást alkalmazó vizsgálatok esetében a dózisintervallum nem lehet háromszorosnál nagyobb. A dózisszinteket a korábbi toxicitási adatok és különösen az ismételt dózisú vizsgálatok eredményeinek figyelembevételével kell megválasztani. A vizsgálandó vegyület és a szerkezetileg rokon anyagok metabolizmusával és kinetikájával kapcsolatban rendelkezésre álló összes információt is figyelembe kell venni. Ezek az információk segítik majd az adagolási rend megfelelő voltának igazolását is.
A kontrollcsoport egy kezeletlen csoport, vagy ha a vizsgálandó anyag beadásához vivőanyagot használnak, akkor egy vivőanyaggal kezelt kontrollcsoport. A kontrollcsoportba tartozó állatokat a vizsgálandó anyag beadásától eltekintve ugyanolyan módon kell kezelni, mint a vizsgálati csoportokban lévőket. Vivőanyag alkalmazása esetén a kontrollcsoportban a legnagyobb alkalmazott mennyiségben kell beadni a vivőanyagot. Ha a vizsgálandó anyagot a táplálékkal adják be, és emiatt csökken a táplálékfogyasztás vagy hasznosítás, akkor szükség lehet egy párban etetett kontrollcsoport alkalmazására is. A párhuzamos párban etetett kontrollcsoport helyett felhasználhatók olyan kontrollcsoportokkal végzett vizsgálatokból származó adatok is, amelyek célja a csökkent táplálékfogyasztás reproduktív paraméterekre gyakorolt hatásának értékelése.
A vivőanyagok vagy egyéb adalékok esetében a következő jellemzőket kell figyelembe venni: a vizsgálandó anyag felszívódására, eloszlására, metabolizmusára vagy visszatartására gyakorolt hatások; a vizsgálandó anyag kémiai tulajdonságaira gyakorolt hatások, amelyek módosíthatják annak toxikus jellemzőit; valamint az állatok táplálék- és vízfogyasztására vagy tápláltsági állapotára gyakorolt hatások.
1.4.4. Határérték-vizsgálat
Ha egy egyetlen, legalább 1 000 mg/testtömeg-kg/nap orális dózis felhasználásával végzett, vagy táplálékkal vagy ivóvízzel történő beadás esetén a táplálékban vagy ivóvízben ezzel egyenértékű százalékos arány alkalmazásával történő és az itt ismertetett eljárások szerint lefolytatott vizsgálat sem a szülőkben, sem utódaikban nem idéz elő észlelhető toxicitást, és ha a szerkezetileg és/vagy metabolizmus szempontjából rokon vegyületekkel kapcsolatos adatok alapján nem várható toxicitás, megfontolható a több dózisszinttel végzett teljes vizsgálat elhagyása. Határérték-vizsgálatot kell minden esetben alkalmazni, kivéve, ha a humán expozíció magasabb orális dózis alkalmazását teszi szükségessé. Más típusú beadási módok, így például inhalálás vagy dermális alkalmazás esetén a vizsgálandó anyag fizikai-kémiai tulajdonságai – így például oldhatósága – gyakran előre jelezhetik, illetve korlátozhatják a lehetséges expozíciós szint maximumát.
1.4.5. A dózisok beadása
Az állatoknak a hét minden napján adagolni kell a vizsgálandó anyagot. A preferált beadási mód az orális (táplálékkal, ivóvízzel vagy mesterséges táplálással történő bevitel). Az ettől eltérő beadási módok használatát meg kell indokolni, és ennek megfelelő módosításokra is szükség lehet. A megfelelő hosszúságú kísérleti időszak során minden állatnak azonos módszerrel kell beadni az anyagot. Ha a vizsgálandó anyagot mesterséges táplálással juttatják be, gyomorszondát kell alkalmazni. Az egyszerre beadott folyadéktérfogat nem haladhatja meg az 1 ml/100 g testtömegarányt (kukoricacsíra-olajban történő adagolás esetén a maximum a 0,4 ml/100 g testtömegarány), kivéve vizes oldatok esetében, amikor 2 ml/100 g testtömegarány is alkalmazható. Az irritáló vagy korróziós hatású anyagok kivételével, amelyek esetében a magasabb koncentrációk súlyosabb hatásokat okoznak, minimálisra kell csökkenteni a térfogatbeli eltéréseket, amihez a koncentrációt kell úgy beállítani, hogy minden dózisszinten állandó térfogatot lehessen biztosítani. A mesterséges táplálást alkalmazó vizsgálatokban a kölykök általában mindaddig csak közvetve, az anyatejen keresztül kapják a vizsgálandó anyagot, amíg az elválasztáskor meg nem kezdődik a közvetlen adagolás. A táplálékkal vagy ivóvízzel történő adagolást alkalmazó vizsgálatok esetében a kölykök közvetlenül is megkapják a vizsgálandó anyagot, amikor a szoptatási időszak utolsó hetében önállóan is elkezdenek táplálkozni.
A táplálékkal vagy ivóvízzel bejuttatott anyagok esetében fontos, hogy a vizsgálandó anyag mennyisége ne zavarja a normál táplálkozást vagy vízháztartást. Ha a vizsgálandó anyagot táplálékkal juttatják be, vagy a táplálékbeli koncentrációt (ppm), vagy pedig az állat testtömegére számított dózist kell állandó értéken tartani, és meg kell adni, hogy melyik alternatívát alkalmazzák. A mesterséges táplálással bejuttatott anyagok esetében a dózist mindig a nap hasonló időszakában kell beadni, és legalább hetente újra be kell állítani ahhoz, hogy az állat testtömegéhez viszonyítva állandó értéken lehessen tartani. A mesterséges táplálással bejuttatott és testtömegen alapuló dózis beállításakor figyelembe kell venni a méhlepénybeli eloszlással kapcsolatos információkat is.
1.4.6. A kísérleti program
A P generációba tartozó hímek és nőstények napi kezelését 5–9 hetes korukban kell elkezdeni. Az F1 hímek és nőstények napi kezelését az elválasztáskor kell elkezdeni; nem szabad megfeledkezni arról, hogy ha vizsgálandó anyagot táplálékkal vagy ivóvízzel adagolják, az F1 utódok közvetlen expozíciója már a szoptatási időszakban megkezdődhet. Az adagolást mindkét ivar (P és F1) esetében legalább 10 héten át folytatni kell a párzási időszak előtt. Az adagolást a 2 hetes pároztatási időszakban sem szabad abbahagyni egyik ivar esetében sem. Amikor a reproduktív hatások értékelése szempontjából már nincs szükség a hím állatokra, humánus módon exterminálni kell őket, és megvizsgálni. A szülői (P) generációba tartozó nőstények esetében az adagolást a vemhesség ideje alatt is folytatni kell, egészen az F1 generáció elválasztásáig. Fontolóra kell venni az adagolási rend módosítását a vizsgálandó anyaggal, ezen belül a meglévő toxicitási adatokkal, az anyagcsere fokozódásával vagy biológiai felhalmozódással kapcsolatban rendelkezésre álló információk alapján. Az egyes állatoknak beadandó dózist általában a legutóbbi testtömegmérés eredménye alapján kell meghatározni. A vemhesség utolsó trimeszterében azonban óvatosan kell eljárni a dózis beállításakor.
A P és F1 hímek és nőstények kezelését exterminálásukig kell folytatni. Minden felnőtt P és F1 hímet és nőstényt humánus módon exterminálni kell, ha már nincs rájuk szükség a reproduktív hatások értékeléséhez. Az elválasztás után a pároztatásra ki nem választott F1 utódokat és minden F2 utódot humánus módon exterminálni kell elválasztásukat követően.
1.4.7. A pároztatási eljárás
1.4.7.1. A szülői (P) generáció pároztatása
Minden egyes pároztatáskor a nőstényt egy azonos dózissal kezelt hímmel kell összerakni (1:1 pároztatás), és addig kell együtt hagyni őket, amíg a párzás meg nem történik, vagy 2 hét el nem telik. Minden nap meg kell vizsgálni, hogy a nőstényben észlelhető-e ondó vagy hüvelydugó. A vemhesség 0. napja definíció szerint az a nap, amikor hüvelydugó vagy ondó figyelhető meg a nőstényben. Ha a pároztatás sikertelen volt, fontolóra kell venni a nőstények újrapároztatását egy azonos csoportbeli és már sikeresen pároztatott hímmel. Az adatok között egyértelműen fel kell tüntetni a pároztatott párokat. Kerülni kell a testvérek pároztatását.
1.4.7.2. F1 pároztatás
Az F1 utódok pároztatásakor minden alomból legalább egy hím és egy nőstény állatot kell kiválasztani az elválasztáskor, hogy később egy másik alomból származó, de azonos csoportba tartozó állattal pároztatva létrejöjjön az F2 generáció. A kölykök kiválasztását minden egyes alomban véletlenszerűen kell elvégezni, feltéve, hogy nincs szignifikáns különbség az egy alomba tartozó állatok testtömege vagy külső megjelenése között. Ha azonban van különbség, akkor minden alomból a legreprezentatívabb egyedet kell kiválasztani. A gyakorlatban ezt a testtömeg alapján lehet a legjobban elvégezni, de esetenként megfelelőbb lehet a külső megjelenés alapján tenni ezt. Mindaddig nem szabad pároztatni az F1 utódokat, amíg teljesen ivaréretté nem válnak.
Az utód nélküli pároknál meg kell vizsgálni a látszólagos terméketlenség okát. Ennek keretében lehetőség biztosítható számukra más olyan hímekkel vagy nőstényekkel való párzásra, amelyeket már sikeresen pároztattak, vagy el lehet végezni a szaporítószervek mikroszkópos vizsgálatát, vagy meg lehet vizsgálni az ivari ciklust vagy a spermaképződést.
1.4.7.3. Második pároztatás
Bizonyos esetekben, így például ha az alomméret a kezeléssel összefüggésben megváltozik, vagy ha az első pároztatáskor nem egyértelmű hatásokat figyelnek meg, ajánlatos a felnőtt P és F1 állatokat újrapároztatni, és így egy második almot kialakítani. Ajánlatos újrapároztatni azokat a hímeket és nőstényeket is, amelyek bizonyítottan nemzőképes ellenkező nemű partnerekkel sem hoztak utódokat. Ha a két generáció bármelyikében szükségesnek látszik egy második alom kialakítása, az állatokat körülbelül egy héttel az utolsó alom elválasztása után kell újrapároztatni.
1.4.7.4. Az alom mérete
Hagyni kell, hogy az állatok a szokásos módon elljék és neveljék utódaikat az elválasztásig. Az alomméret standardizálása nem kötelező. Ha azonban elvégezzük a standardizálást, részletesen ismertetni kell az erre alkalmazott módszert.
1.5. MEGFIGYELÉSEK
1.5.1. Klinikai megfigyelések
Minden nap klinikai megfigyelést kell végezni, és a mesterséges táplálással való adagolás beadás időpontjának meghatározásakor azt is figyelembe kell venni, hogy a beadás után a hatások várhatóan mikor érik el a maximumukat. A viselkedésbeli változásokat, a nehéz vagy hosszan tartó ellés jeleit és a toxicitás minden tünetét rögzíteni kell a jegyzőkönyvben. Legalább hetente egyszer alaposabban is meg kell vizsgálni az állatokat, célszerűen akkor, amikor a testtömegmérésre kerül sor. Naponta kétszer, illetve a hétvégeken adott esetben naponta egyszer meg kell vizsgálni az állatokat megbetegedés és elhullás szempontjából.
1.5.2. A szülők testtömege, valamint táplálék- és vízfogyasztása
A kezelés első napján, majd azt követően legalább hetente egyszer meg kell mérni a szülők (P és Fl) testtömegét. Az anyaállatokat (P és F1) legalább a vemhesség 0., 7., 14. és 20. vagy 21. napján kell megmérni, a szoptatás időszakában pedig ugyanazokon a napokon, amikor az utódokat is megmérik, valamint az állatok exterminálásának napján is. A megfigyeléseket minden egyes felnőtt állat esetében külön-külön kell rögzíteni. A pároztatás előtti időszakban és a vemhesség alatt legalább hetente meg kell mérni a táplálékfogyasztást. Ha a vizsgálandó anyagot az ivóvízzel adagolják, legalább hetente egyszer a vízfogyasztást is meg kell mérni.
1.5.3. Ivari ciklus
Az ivari ciklus hosszát és szabályosságát hüvelykenet alkalmazásával kell meghatározni a P és F1 nőstényekben a pároztatás előtt és adott esetben a pároztatás során mindaddig, amíg be nem bizonyosodik, hogy párzás történt. A hüvelyi/méhnyaki sejtek vétele során vigyázni kell arra, hogy meg ne sérüljön a nyálkahártya, és ezáltal nehogy álvemhesség alakuljon ki (1).
1.5.4. Spermaparaméterek
A vizsgálat befejezésekor minden P és F1 hím esetében meg kell mérni a here és a mellékhere, valamint a kórszövettani vizsgálatokra megőrzött minden szerv közül az egyiknek a tömegét (lásd 1.5.7. és 1.5.8.1. szakasz). A P és F1 hímek minden egyes csoportjából egy-egy, legalább tíz hímből álló részhalmaz esetében a megmaradó heréket és mellékheréket a homogenizálásnak ellenálló spermatidák és mellékhere farki részében tárolt ondósejtek számlálására kell felhasználni. A hímek ugyanezen részhalmazában spermát kell gyűjteni a mellékhere farki részéből vagy az ondóvezetékből, amelyet a spermamotilitás és -morfológia vizsgálatára kell felhasználni. Ha kezeléssel összefüggő hatásokat észlelnek, vagy ha más vizsgálatok eredményei a spermaképződésre gyakorolt lehetséges hatásokra utalnak, a sperma értékelését az összes dóziscsoportban minden hímben el kell végezni; egyéb esetben elegendő lehet, ha a számlálást csak a kontroll- és a magas dózissal kezelt P és F1 hímekben végzik el.
Meg kell határozni a herében lévő homogenizálásnak ellenálló spermatidák és a mellékhere farki részében található ondósejtek teljes számát (2) (3). A mellékhere farki részében lévő ondókészlet nagyságát a kvalitatív értékelésekhez használt szuszpenzióban lévő ondó koncentrációja és mennyisége, valamint a fennmaradt mellékhere farki részéből kinyert szövet ezt követő darálásával és/vagy homogenizálásával kinyert ondósejtek száma alapján lehet meghatározni. Az összes kezelési csoportban közvetlenül az exterminálás után kell elvégezni a számlálást a hímek e kiválasztott részhalmazában, kivéve, ha video- vagy digitális felvételt készítenek, vagy ha a mintákat későbbi elemzésig lefagyasztják. Ilyen esetekben a kontroll- és a magas dózissal kezelt csoportot célszerű először megvizsgálni. Ha nem észlelhető kezeléssel összefüggő hatás (pl. az ondósejtszámra, valamint a motilitásra és morfológiára gyakorolt hatás), a többi dóziscsoportot nem kell megvizsgálni. Ha a magas dózissal kezelt csoportban kezeléssel összefüggő hatásokat észlelünk, akkor az alacsonyabb dóziscsoportokat is meg kell vizsgálni.
Az exterminálás után azonnal értékelni kell vagy videofelvételen rögzíteni kell a mellékheréből (vagy ondózsinórból) kinyert ondósejtek motilitását. A spermát a károsodások minimális szintre szorítása mellett kell kinyerni, majd elfogadható módszerek segítségével kell hígítani a motilitásvizsgálathoz (4). Az előre haladó mozgást mutató ondósejtek százalékos arányát vagy szubjektíven, vagy objektíven kell meghatározni. Ha számítógéppel támogatott motilitásvizsgálatot alkalmaznak (5) (6) (7) (8) (9) (10), az előre haladó mozgás levezetése az átlagos pályasebesség és egyenes vonalú mozgás vagy lineáris index felhasználó által beállított küszöbértékein alapul. Ha a boncoláskor a mintákról videofelvételt (11) készítenek, vagy a képeket más módon rögzítik, esetleg csak a kontroll- és a nagy dózissal kezelt P és F1 hímek esetében kell további elemzést végezni, kivéve ha kezeléssel összefüggő hatásokat észlelnek; ebben az esetben ugyanis az alacsonyabb dózissal kezelt csoportokat is értékelni kell. Videofelvétel vagy digitális képek hiányában a boncoláskor az összes kezelési csoportba tartozó valamennyi állat mintáját ki kell elemezni.
Egy mellékheréből (vagy ondóvezetékből) származó spermaminta morfológiai értékelését is el kell végezni. Az ondósejteket (mintánként legalább 200-at) fixált nedves preparátum (12) formájában kell megvizsgálni, és normálnak vagy rendellenesnek kell minősíteni. A morfológiai sperma-rendellenességek közé tartoznak például a fúzió, az izolált fejek és a torz fej és/vagy farok. Az értékelést a hímeknek az egyes dóziscsoportból kiválasztott részhalmazán, az állatok exterminálása után azonnal, vagy a video- vagy digitális felvételek alapján egy későbbi időpontban kell elvégezni. Fixálás után a keneteket is el lehet tenni későbbi elemzésre. Ilyen esetekben a kontroll- és magas dózissal kezelt csoportokat célszerű először megvizsgálni. Ha nem észlelnek kezeléssel összefüggő hatásokat (pl. az ondósejtek morfológiájára gyakorolt hatásokat), akkor nem kell elvégezni a többi dóziscsoport elemzését. Ha a magas dózissal kezelt csoportban kezeléssel összefüggő hatásokat tapasztalnak, akkor az alacsonyabb dózissal kezelt csoportokat is ki kell értékelni.
Ha a fenti spermavizsgálati paramétereket egy legalább 90 napos szisztémás toxicitási vizsgálatban már meghatározták, akkor a kétgenerációs vizsgálatban nem kell ezt feltétlenül megismételni. A P generáció spermamintáit vagy az azokról készült digitális felvételeket azonban, ha szükséges, ajánlatos az esetleges későbbi értékelések céljára megőrizni, illetve elmenteni.
1.5.5. Az utódok
Az ellés után minden almot a lehető leghamarabb meg kell vizsgálni (0. szoptatási nap) a kölykök számának és ivarának, a halvaszületések és élveszületések számának, valamint a makroszkópos rendellenességeknek a megállapítására. Ha nem történt maceráció, a 0. napon elhalva talált kölykökben lehetőség szerint meg kell vizsgálni az esetleges defektusokat, és meg kell állapítani az elhullás okát, majd konzerválni kell őket. Az élő kölyköket meg kell számolni, és meg kell mérni a testtömegüket a születéskor (0. szoptatási nap), vagy az 1. napon, majd ezt követően a rendszeres testtömegmérési napokon, azaz pl. a szoptatás 4., 7., 14. és 21 napján. Az anyaállatokban vagy az utódokban megfigyelt fizikai vagy viselkedésbeli rendellenességeket is fel kell jegyezni.
Az utódok fizikai fejlődését főleg a testtömeg-gyarapodás alapján kell nyomon követni. Az egyéb fizikai paraméterek (pl. a fülek és a szemek kinyílása, fogzás, szőrnövekedés) kiegészítő információkat szolgáltathatnak, de ezeket az adatokat lehetőleg a szexuális éréssel összefüggésben kell értékelni (pl. kor és testtömeg a hüvelykinyílás vagy a makk-fityma szétválás időpontjában) (13). Ha nem történtek korábban külön ilyen vizsgálatok, akkor ajánlatos az elválasztás előtt és/vagy után funkcionális vizsgálatokat (pl. motoros aktivitás, szenzoros működés, a reflexek kifejlődése) is végezni az F1 utódokon, különösen a szexuális éréssel kapcsolatos vizsgálatokat. Az elválasztott és pároztatásra kiválasztott F1 utódok esetében meg kell határozni azt az életkort, amikor a hüvelykinyílás, illetve a fitymaelválás megtörténik. Ha az F1 generáció ivararányában vagy az ivarérés idejében észlelt változások azt indokolják, a születés utáni 0. napon meg kell mérni az anogenitális távolságot az F2 utódokban.
Kihagyhatók a funkcionális vizsgálatokból azok a csoportok, amelyek egyébként egyértelműen káros hatások tüneteit mutatják (pl. a testtömeg-gyarapodás szignifikáns lassulása stb.). Funkcionális vizsgálatok végzése esetén a pároztatásra kiválasztott kölyköket nem szabad e vizsgálatokba bevonni.
1.5.6. Makroszkópos boncolás
A vizsgálat befejezésekor vagy a vizsgálat során történt elhullás esetén minden szülő (P és F1 állatok), minden külső rendellenességet vagy klinikai tüneteket mutató kölyök, valamint az F1 és az F2 generációból is egy-egy véletlenszerűen kiválasztott kölyök/ivar/alom esetében makroszkópos vizsgálatot kell végezni az esetleges strukturális rendellenességek vagy kórbonctani elváltozások feltárására. Külön figyelmet kell szentelni a szaporítószerveknek. Az elhullásközeli állapotba került, és ezért humánus módon exterminált vagy a nem macerált, elpusztult kölykökben meg kell határozni az esetleges defektusokat és/vagy az elhullás okát, majd konzerválni kell őket.
Az először ellő nőstények méhében kórszövettani értékelés nélkül kell megvizsgálni a beágyazódási helyek jelenlétét és számát.
1.5.7. A szervek tömege
A vizsgálat befejezésekor a P és F1 állatoknál meg kell határozni a testtömeget, valamint az alábbi szervek tömegét (a páros szervek tagjait külön-külön kell megmérni):
|
— |
méh, petefészkek, |
|
— |
herék, mellékherék (teljes és farki rész), |
|
— |
prosztata, |
|
— |
ondóhólyagok a koaguláló mirigyekkel és váladékukkal, valamint a prosztata (egy egységként), |
|
— |
agy, máj, vese, lép, agyalapi mirigy, pajzsmirigy és mellékvese, valamint az ismert célszervek. |
Meg kell határozni a boncolásra kiválasztott F1 és F2 kölykök végső testtömegét. Az egyetlen véletlenszerűen kiválasztott kölyök/ivar/alom (lásd 1.5.6. szakasz) esetében az alábbi szervek tömegét kell megmérni: agy, lép és csecsemőmirigy.
Ha megoldható, a makroszkópos boncolási eredményeket és a szervtömeg-adatokat a más, ismételt dózisú vizsgálatokban tett megfigyelésekkel összefüggésben kell értékelni.
1.5.8. Kórszövettan
1.5.8.1. A szülőállatok
A szülőállatokban (P és F1) a következő szerveket és szöveteket vagy az ezekből készített reprezentatív mintákat fixálni kell a kórszövettani vizsgálatokhoz, majd megfelelő közegben el kell eltárolni:
|
— |
hüvely, méh és méhnyak, valamint petefészkek (megfelelő rögzítőszerrel fixálva), |
|
— |
egy here (Bouin-féle vagy hasonló rögzítőszerben tartósítva), egy mellékhere, ondóhólyagok, prosztata és koaguláló mirigy, |
|
— |
a pároztatásra kiválasztott összes P és F1 állatból származó, korábban meghatározott célszerv(ek). |
Minden kontroll- és nagy dózissal kezelt csoportban el kell végezni a pároztatásra kiválasztott P és F1 állatok fent felsorolt és konzervált szerveinek és szöveteinek teljes körű kórszövettani vizsgálatát. A P állatok petefészkének vizsgálata nem kötelező. A NOAEL meghatározásának elősegítése érdekében a kezeléssel összefüggő változásokat mutató szerveket az alacsony és közepes dózissal kezelt csoportokban is meg kell vizsgálni. El kell végezni továbbá azon alacsony és közepes dózissal kezelt állatok szaporítószerveinek kórszövettani vizsgálatát, amelyek gyaníthatóan csökkent termékenységgel bírnak, így például azok esetében, amelyek nem tudtak párzani, megfoganni, utódokat nemzeni vagy egészséges utódokat a világra hozni, vagy amelyeknél az ivari ciklusra vagy a spermaszámra, spermamotilitásra vagy spermamorfológiára gyakorolt hatásokat észleltek. Minden makroszkópos léziót, így például atrófiát vagy daganatot is meg kell vizsgálni.
A kezeléssel összefüggő hatások, így például a visszatartott spermatidák, hiányzó csírasejtrétegek vagy típusok, sokmagvú óriássejtek, vagy a spermaképző sejtek leválása és lumenbe kerülésének azonosítása érdekében el kell végezni a here részletes kórszövettani vizsgálatát (pl. Bouin-féle rögzítőszer, paraffinba ágyazás és 4–5 μm vastag harántmetszetek) (14). Az ép mellékhere vizsgálatának ki kell terjednie a mellékhere feji részére, testére és farki részére, amelyet egy hosszanti metszet értékelésével lehet elvégezni. A mellékherében meg kell vizsgálni a leukocita infiltrációt, a sejttípusok gyakoriságában bekövetkező változásokat, az abnormális sejttípusokat, valamint az ondósejek fagocitózisát. A hím szaporítószervek vizsgálatára PAS- és hematoxilin-festés alkalmazható.
A szoptatási időszak után a petefészeknek tüszőkezdeményeket és növekvő tüszőket kell tartalmaznia, valamint egy nagyméretű laktációs sárgatestet. A kórszövettani vizsgálat során meg kell vizsgálni a tüszőkezdemény-állomány kvalitatív deplécióját. Az F1 nőstények esetében el kell végezni a tüszőkezdemények kvantitatív értékelését is; az állatok számának, a kiválasztott petefészekmetszeteknek és -metszetmintáknak az alkalmazott értékelési eljáráshoz statisztikai szempontból adekvátnak kell lennie. A kezelt és kontrollpetefészkek összehasonlításához a vizsgálatoknak ki kell terjedniük a tüszőkezdemények összeszámlálására, amelyekhez hozzá lehet venni a kis növekvő tüszőket is (15) (16) (17) (18) (19).
1.5.8.2. Az elválasztott állatok
A külső rendellenességeket vagy klinikai tüneteket mutató összes kölykök, valamint az F1 és az F2 generációból az egy véletlenszerűen kiválasztott és pároztatásra ki nem jelölt kölyök/ivar/alom makroszkóposan rendellenes szöveteit és célszerveit fixálni kell, majd megfelelő közegben el kell ezeket tárolni a kórszövettani vizsgálatokhoz. A konzervált szövetek teljes kórszövettani vizsgálatát úgy kell elvégezni, hogy külön hangsúlyt kell fektetni a szaporítószervekre.
2. ADATOK
2.1. AZ EREDMÉNYEK KEZELÉSE
Az adatokat egyedileg kell a jelentésben rögzíteni, majd táblázatos formában is össze kell foglalni, amelyben minden egyes vizsgálati csoport és generáció esetében fel kell tüntetni az állatok számát a vizsgálat kezdetén, a vizsgálat során elpusztult vagy humánus okok miatt exterminált állatok számát, az elhullások és humánus okok miatti exterminálások időpontját, a termékeny állatok számát, a vemhes nőstények számát, a toxicitás jeleit mutató állatok számát, a megfigyelt toxicitási tünetek leírását, ezen belül bármely toxikus tünet megjelenésének időpontját, valamint ezek időtartamát és súlyosságát, a szülőkkel és az utódokkal kapcsolatos megfigyelések típusait, a kórszövettani változások típusait és az almokra vonatkozó minden idevágó adatot.
A számszerű eredményeket megfelelő, általánosan elfogadott statisztikai módszerrel kell kiértékelni; a statisztikai módszereket a vizsgálat megtervezésének keretében kell kiválasztani, és meg is kell azt indokolni. Az adatok elemzéséhez célszerű lehet dózis-válasz statisztikai modelleket alkalmazni. A jelentésnek elegendő információt kell tartalmaznia az alkalmazott elemzési módszerrel és számítógépes programmal kapcsolatban ahhoz, hogy egy független bíráló vagy statisztikus újra tudja értékelni vagy rekonstruálni tudja az elemzést.
2.2. AZ EREDMÉNYEK ÉRTÉKELÉSE
A kétgenerációs reprodukciós toxicitási vizsgálat eredményeit a megfigyelt hatások, ezen belül a boncolási és mikroszkópos eredmények szempontjából kell értékelni. Az értékelés során ki kell térni a vizsgálandó anyag dózisa és a rendellenességek, ezen belül a makroszkópos léziók, az azonosított célszervek, a csökkent termékenység, a klinikai rendellenességek, a csökkent reproduktív teljesítmény vagy alomszám, a testtömegváltozások, a mortalitásra gyakorolt hatások és egyéb toxikus hatások megléte vagy hiánya, illetve gyakorisága és súlyossága közötti összefüggésekre vagy ezek hiányára. A vizsgálati eredmények értékelésekor figyelembe kell venni a vizsgálandó anyag fizikai-kémiai tulajdonságait és az esetlegesen rendelkezésre álló toxikokinetikai adatokat is.
Egy megfelelően elvégzett reprodukciós toxicitási vizsgálat alapján kielégítő becslés tehető a hatást nem okozó szintre vonatkozóan, és megismerhetők a reprodukcióra, ellésre, szoptatásra, posztnatális fejlődésre, ezen belül a növekedésre és szexuális fejlődésre gyakorolt hatások.
2.3. AZ EREDMÉNYEK ÉRTELMEZÉSE
A kétgenerációs reprodukciós toxicitási vizsgálat információkkal szolgál valamely anyagnak a szaporodási ciklus összes fázisában történő, ismételt expozíciója hatásairól. A vizsgálat különösen a reproduktív paraméterekkel, valamint az utódok fejlődésével, növekedésével, érésével és túlélésével kapcsolatban ad információkat. A vizsgálat eredményeit a szubkrónikus, prenatális fejlődési, toxikokinetikai és egyéb vizsgálatok eredményeivel összefüggésben kell értelmezni. A vizsgálat eredményeit fel lehet használni annak felmérésére is, hogy szükség van-e egy vegyület további vizsgálataira. A vizsgálat eredményeinek emberre történő extrapolálása csak korlátozott mértékben érvényes. A vizsgálat leginkább arra alkalmazható, hogy információt nyerjünk a hatást nem okozó szintekkel és megengedhető humán expozícióval kapcsolatban (20) (21) (22) (23).
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek a következő információkat kell tartalmaznia:
|
|
Vizsgálandó anyag:
|
|
|
Vivőanyag (ha szükséges):
|
|
|
Kísérleti állatok:
|
|
|
Kísérleti körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények diszkussziója. |
|
|
Következtetések, ezen belül az anyai és utódhatásokra vonatkozó NOAEL-értékek. |
4. HIVATKOZÁSOK
|
(1) |
Sadleir, R.M.F.S. (1979). Cycles and Seasons, In: Reproduction in Mammals: I. Germ Cells and Fertilization, C.R. Auston and R. V. Short (eds.), Cambridge, New York. |
|
(2) |
Gray, L.E. et al., (1989). A Dose-Response Analysis of Methoxychlor-Induced Alterations of Reproductive Development and Function in the Rat. Fundamental and Applied Toxicology 12:92–108. |
|
(3) |
Robb, G.W. et al., (1978). Daily Sperm Production and Epididymal Sperm Reserves of Pubertal and Adult Rats. Journal of Reproduction and Fertility 54:103–107. |
|
(4) |
Klinefelter, G.R. et al., (1991). The Method of Sperm Collection Significantly Influences Sperm Motion Parameters Following Ethane Dimethanesulfonate Administration in the Rat. Reproductive Toxicology 5:39 44. |
|
(5) |
Seed, J. et al. (1996). Methods for Assessing Sperm Motility, Morphology, and Counts in the Rat, Rabbit, and Dog: a Consensus Report. Reproductive Toxicology 10(3):237–244. |
|
(6) |
Chapin, R.E. et al., (1992). Methods for Assessing Rat Sperm Motility. Reproductive Toxicology 6:267–273. |
|
(7) |
Klinefelter, G.R. et al., (1992). Direct Effects of Ethane Dimethanesulphonate on Epididymal Function in Adult Rats: an In vitro Demonstration. Journal of Andrology 13:409–421. |
|
(8) |
Slott, V.L. et al., (1991). Rat Sperm Motility Analysis: Methodologic Considerations. Reproductive Toxicology 5:449–458. |
|
(9) |
Slott, V.L. and Perreault, S.D., (1993). Computer-Assisted Sperm Analysis of Rodent Epididymal Sperm Motility Using the Hamilton-Thorn Motility Analyzer. In: Methods in Toxicology, Part A., Academic, Orlando, Florida. pp. 319–333. |
|
(10) |
Toth, G.P. et al. (1989). The Automated Analysis of Rat Sperm Motility Following Subchronic Epichlorhydrin Administration: Methodologic and Statistical Considerations. Journal of Andrology 10: 401–415. |
|
(11) |
Working, P.K. and M. Hurtt, (1987). Computerized Videomicrographic Analysis of Rat Sperm Motility. Journal of Andrology 8:330–337. |
|
(12) |
Linder, R.E. et al., (1992). Endpoints of Spermatoxicity in the Rat After Short Duration Exposures to Fourteen Reproductive Toxicants. Reproductive Toxicology 6:491–505. |
|
(13) |
Korenbrot, C.C. et al., (1977). Preputial Separation as an External Sign of Pubertal Development in the Male Rat. Biological Reproduction 17:298303. |
|
(14) |
Russell, L.D. et al., (1990). Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, Florida. |
|
(15) |
Heindel, J.J. and R.E. Chapin, (eds.) (1993). Part B. Female Reproductive Systems, Methods in Toxicology, Academic, Orlando, Florida. |
|
(16) |
Heindel, J.J. et al., (1989) Histological Assessment of Ovarian Follicle Number in Mice As a Screen of Ovarian Toxicity. In: Growth Factors and the Ovary, A.N. Hirshfield (ed.), Plenum, New York, pp. 421–426. |
|
(17) |
Manson, J.M. and Y.J. Kang, (1989). Test Methods for Assessing Female Reproductive and Developmental Toxicology. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven, New York. |
|
(18) |
Smith, B.J. et al,. (1991). Comparison of Random and Serial Sections in Assessment of Ovarian Toxicity. Reproductive Toxicology 5:379–383. |
|
(19) |
Heindel, J.J. (1999). Oocyte Quantitation and Ovarian Histology. In: An Evaluation and Interpretation of Reproductive Endpoints for Human Health Risk Assessment, G. Daston,. and C.A. Kimmel, (eds.), ILSI Press, Washington, DC. |
|
(20) |
Thomas, J. A. (1991). Toxic Responses of the Reproductive System. In: Casarett and Doull's Toxicology, M.O. Amdur, J. Doull, and CD. Klaassen (eds.), Pergamon, New York. |
|
(21) |
Zenick, H. and E.D. Clegg, (1989). Assessment of Male Reproductive Toxicity: A Risk Assessment Approach. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven Press, New York. |
|
(22) |
Palmer, A.K. (1981). In: Developmental Toxicology, Kimmel, C.A. and J. Buelke-Sam (eds.), Raven Press, New York. |
|
(23) |
Palmer, A.K. (1978). In Handbook of Teratology, Vol. 4, J.G Wilson and F.C. Fraser (eds.), Plenum Press, New York. |
B.36. TOXIKOKINETIKAI VIZSGÁLAT
1. MÓDSZER
1.1. BEVEZETÉS
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Lásd az Általános bevezetés B. részét.
1.3. REFERENCIAANYAGOK
Nincsenek.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot a megfelelő módon kell adagolni. A vizsgálat céljától függően a vizsgált anyagot egyszeri vagy ismételt dózisokban adhatjuk be, meghatározott időszakok alatt, egy vagy több kísérleti állatcsoportnak. Ezt követően a vizsgálat típusától függően az anyagot és/vagy annak anyagcseretermékeit meghatározzuk a testfolyadékokban, szövetekben és/vagy kiválasztott testnedvekben.
A meghatározást a vizsgált anyag jelölt és jelöletlen változatával is végezhetjük. Ha jelölést alkalmazunk, azt úgy kell kémiailag elhelyezni a vizsgált vegyületen, hogy az a legtöbb ismeretet közvetítse a vegyület szervezeten belüli sorsáról.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Nincsenek.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Előkészületek
Az állatokat a vizsgálat előtt legalább öt napon keresztül a vizsgálat tartási és takarmányozási körülményei között kell tartani. Az egészséges fiatal állatokat a vizsgálat megkezdése előtt véletlenszerű kiválasztással kezelt és kontrollcsoportokba kell beosztani. Különleges esetekben nagyon fiatal, vemhes vagy előkezelt állatok is használhatók.
Vizsgálati körülmények
A kísérlethez felhasznált állatok
A toxikokinetikai vizsgálatokat egy vagy több megfelelő állatfajon végezhetjük, de figyelembe kell venni az igénybe vett vagy használni szándékozott állatfajon az ugyanezen anyaggal végzett más toxikológiai vizsgálatokat is. Rágcsálók használatánál a súlybeli eltérés nem lehet nagyobb mint az átlagérték ± 20 %-a.
Az állatok száma és neme
A felszívódási és kiválasztási vizsgálatokhoz kiinduláskor minden dóziscsoportban négy állatnak kell lennie. A nemek megválasztása nem kötelező, de bizonyos körülmények között mindkét nem vizsgálatára szükség lehet. Ha a reakció nemenként különbözik, mindkét nemből négy-négy állatot kell kezelni. Nem rágcsáló fajok esetében kevesebb állat is használható. Ha a szöveti eloszlást vizsgáljuk, a kiindulási csoportméret kialakításakor figyelembe kell venni az egyes időpontokban elpusztítani szándékozott állatok és a vizsgálati időpontok számát is.
Ha az anyagcserét vizsgáljuk, a csoportok méretét a vizsgálat igényei határozzák meg. Több dózissal és több időpontban végzett vizsgálatoknál a csoportméret kialakításakor figyelembe kell venni az egyes időpontokat és a tervezett elpusztítást, de a létszám két állatnál nem lehet kisebb. A csoportméret legyen elegendően nagy ahhoz, hogy elfogadhatóan jellemezze a vizsgált anyag és/vagy anyagcseretermékek felvételét, szintjének tetőzését és kiürülését (igény szerint).
Adagolási szintek (dózisok)
Egy dózisban történő beadás esetén legalább két adagolási szintet kell kialakítani. Egy alacsony dózist, ahol nincs észlelhető toxikus hatás, és egy nagy dózist, ahol a toxikokinetikai paraméterek változása, illetve a toxikus hatások megjelenése várható.
Az ismételt adagolással végzett vizsgálatnál az alacsony dózis rendszerint elegendő, de bizonyos körülmények között a nagy dózisra is szükség lehet.
Az adagolás módja
A toxikokinetikai vizsgálatokat azonos adagolási mód alkalmazásával kell végezni, és – ha van ilyen – ugyanazon vivőanyaggal, mint amelyet az egyéb toxikológiai vizsgálatoknál is használtunk, illetve használni szándékozunk. A vizsgált anyagot meghatározott időnként, rendszerint szájon át, gyomorszondával vagy a takarmánnyal adjuk be, a bőrre ecseteljük, illetve belélegeztetjük. A vizsgált anyag intravénás beadása akkor lehet hasznos, ha a többi adagolási módhoz viszonyított felszívódási arányt kívánjuk meghatározni. Az anyag intravénás beadását követően nem sokkal hasznos információt nyerhetünk az eloszlás mintázatáról.
Figyelembe kell venni annak lehetőségét is, hogy a vivőanyag és a vizsgált anyag között interferencia lép fel. Figyelmet kell fordítani arra, hogy a vizsgált anyag gyomorszondán át, illetve a takarmánnyal történő beadásakor a felszívódásnál lényeges különbségek állnak fenn, illetve figyelni kell a dózis pontos meghatározására különösen akkor, ha a vizsgált anyagot a takarmánnyal adják be.
Megfigyelési időszak
Valamennyi állatot naponta kell megfigyelni, és fel kell jegyezni a toxicitás jeleit, valamint az egyéb releváns klinikai tüneteket, beleértve azok kialakulásának idejét, súlyossági fokát és időtartamát.
A kísérlet végrehajtása
A vizsgálati állatok testsúlyának mérését követően a megfelelő módon kell beadni a vizsgált anyagot. Ha helyénvalónak tűnik, az állatokat a vizsgált anyag beadása előtt éheztetni lehet.
Felszívódás
A vizsgált anyag felszívódásának sebessége, illetve annak mértéke különféle módszerekkel határozható meg: referenciacsoportokkal, illetve azok nélkül (8), például az alábbi módszerekkel:
|
— |
a vizsgált anyag és/vagy anyagcseretermékek mennyiségi meghatározása a testnedvekben, például a vizeletben, az epesavban, a székletben, a kilélegzett levegőben, illetve a tetemben visszamaradó mennyiség mérése, |
|
— |
a biológiai hatás összehasonlítása (például akut toxicitási vizsgálatok) a vizsgálati, és a kontroll-, illetve a referenciacsoportok között, |
|
— |
a vese által kiválasztott anyag és/vagy anyagcseretermék mennyiségének összehasonlítása a vizsgálati és a referenciacsoportok között, |
|
— |
a plazmaszintváltozás időbeli függvényén a görbe alatti terület meghatározása a vizsgált anyag és/vagy annak anyagcseretermékei vonatkozásában, majd ezek egybevetése a referenciacsoportok adataival. |
Eloszlás
Az eloszlási minta elemzésére jelenleg két lehetőség áll rendelkezésre, amelyeket önmagukban, illetve kombinálva lehet alkalmazni:
|
— |
hasznos minőségi információ nyerhető az egésztest-autoradiográfiás technikákkal, |
|
— |
mennyiségi információ nyerhető, ha az állatokat az expozíciót követően különböző időpontokban elpusztítják, és meghatározzák a vizsgált anyag és/vagy anyagcseretermékek koncentrációját, valamint mennyiségét a szervekben és szövetekben. |
Kiválasztás
A kiválasztás vizsgálatakor vizeletet, székletet, kilélegzett levegőt és bizonyos esetekben epét kell gyűjteni. Az expozíciót követően több alkalommal kell mérni a vizsgált anyag és/vagy anyagcseretermékek mennyiségét az említett testnedvekben, vagy addig, amíg a beadott adag mintegy 95 %-a ki nem választódott, vagy hét napon keresztül, attól függően, hogy melyik következik be előbb.
Különleges esetekben a vizsgált anyagnak a szoptató vizsgálati állatok tejében való kiválasztását is mérni lehet.
Anyagcsere
Az anyagcsere mértékének és mintázatának meghatározásához biológiai mintákat kell elemezni megfelelő módszerek alkalmazásával. Az anyagcseretermékek szerkezetét meg kell ismerni, és a megfelelő anyagcsere-útvonalakat meg kell találni, ha korábbi toxikológiai vizsgálatok révén felmerült kérdések megválaszolásához erre igény van. Az anyagcsere-útvonalakról szerzett ismeretek megszerzésében in vitro vizsgálatok is hasznosak lehetnek.
Az anyagcsere és a toxikus hatás közötti kapcsolatról további ismeretek szerezhetők biokémiai vizsgálatokkal, például a metabolizáló enzimrendszerekre, az endogén, nem fehérje jellegű szulfhidril-vegyületek fogyására gyakorolt hatás és a vizsgált anyag makromolekulákhoz való kötődésének meghatározásával.
2. ADATOK
Az elvégzett vizsgálat típusától függően az adatokat táblázatos formában kell összefoglalni, és – ahol szükséges – grafikusan is ábrázolni kell. Ha szükségesnek tartjuk, akkor minden vizsgálati csoport esetében ábrázolni kell az átlagot, valamint a statisztikai eltéréseket az idő, a dózis, a szövetek és a szervek tekintetében. A felszívódás mértékét, a kiválasztott mennyiséget és ezek sebességét a megfelelő módszerekkel kell meghatározni. Ha az anyagcsere-termékek vizsgálatát végzik el, meg kell adni az azonosított metabolitok szerkezetét és a lehetséges anyagcsere-útvonalakat, amelyen képződnek.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
használt faj, törzs, az állatok származása, tartási körülmények, étrend, |
|
— |
a jelölt anyagok jellemzése, ha használtunk ilyet, |
|
— |
dózisok és adagolási időközök, |
|
— |
az adagolás módja(i) és vivőanyag, ha van, |
|
— |
toxikus és egyéb megfigyelt hatások, |
|
— |
a vizsgált anyag és/vagy anyagcsere termékének meghatározási módja a biológiai mintákban, beleértve a kilélegzett levegőt is, |
|
— |
az eredmények táblázatos összefoglalása nemek, dózisok, kezelési protokollok, idő, szövetek, illetve szervek szerint, |
|
— |
a felszívódás és kiválasztás mértékének ábrázolása az idő függvényében, |
|
— |
a metabolitok jellemzésének és azonosításának módszerei a biológiai mintákban, |
|
— |
az anyagcseréhez kapcsolódó biokémiai mérési módszerek, |
|
— |
lehetséges anyagcsere-útvonalak, |
|
— |
az eredmények megvitatása, |
|
— |
az eredmények értelmezése. |
3.2. ÉRTÉKELÉS ÉS ÉRTELMEZÉS
Lásd az Általános bevezetés B. részét.
4. HIVATKOZOTT SZAKIRODALOM
Lásd az Általános bevezetés B. részét.
B.37. SZERVES FOSZFORVEGYÜLETEKKEL KIVÁLTOTT AKUT KÉSLELTETETT NEUROTOXICITÁS
1. MÓDSZER
1.1. BEVEZETÉS
Az egyes anyagok toxikus hatásainak felbecslése és kiértékelése során fontos azt figyelembe venni, hogy az anyagok egyes osztályai bizonyos típusú neurotoxicitást okozhatnak, amelyet esetleg nem lehet bebizonyítani más típusú toxicitásvizsgálatokkal, de szükséges a vizsgálata. Egyes foszfororganikus vegyületek a korábbi megfigyelések szerint késleltetett neurotoxikus hatásokat okoznak, ezek azok az anyagok, amelyeknek az e (alábbiakban ismertett) módszer szerinti vizsgálata szóba jöhet.
In vitro szűrővizsgálatokat lehet alkalmazni azoknak az anyagoknak a meghatározása céljából, amelyek késleltetett polyneuropathiát okozhatnak; mindazonáltal az in vitro vizsgálatok negatív eredménye nem biztosíték arra, hogy az anyag nem idegméreg.
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
A foszfororganikus vegyületekhez tartoznak azok a telítetlen foszfororganikus észterek, a tioészterek vagy a szerves foszforsavak, a foszfonsavak és a foszforamid-savak anhidridjei, illetve a rokon foszfortiosav, foszfontiosav vagy foszfortioamid-sav, továbbá egyéb anyagok, amelyek ebbe a vegyületosztályba tartoznak, és olykor megfigyelhető késleltetett neurotoxicitást okozhatnak.
Késleltetett neurotoxicitás az a tünetcsoport, amely a hosszan késleltetett végtagmozgási zavarokkal (ataxia), a gerincvelő és a környéki (perifériás) idegek távoli kötődéseivel és az idegszövetben lévő neuropathiás cél-észterázok (NTE) gátlásával vagy öregedésével kapcsolatos.
1.3. REFERENCIAANYAGOK
Egy referenciaanyagot meg lehet vizsgálni egy pozitív kontrollcsoport segítségével azzal a céllal, hogy bemutassák, hogy laboratóriumi vizsgálati körülmények között a kísérleti fajok reakciója nem változik lényegesen.
Példa egy széleskörűen alkalmazott idegméregre a tri-o-tolil-foszfát (CAS 78-30-8, EINECS 210-103-5, CAS-elnevezése: Foszforsav-trisz(4-metilfenil)-észter, más néven Trikrezil-foszfát.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot egy dózisban, szájon keresztül adják be házityúkoknak, amelyeket szükség esetén megóvtak az akut kolinerg hatásoktól. Az állatokat 21 napon keresztül figyelik meg viselkedési rendellenességek, ataxia és paralízis szempontjából. A biokémiai paramétereket, különösen a neuropathiás cél-észterázok (NTE) gátlását minden csoportból véletlenszerűen kiválasztott tyúkokon mérik, általában az adagolás után 24–48 órával. Az adagolás után 21 nappal az életben maradt tyúkokat elpusztítják, és egyes idegszövetek kórszövettani vizsgálatát elvégzik.
1.5. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.5.1. Előkészületek
Egészséges, fiatal, felnőtt tyúkokkal kísérleteznek, amelyek mentesek a zavaró vírusos betegségektől és gyógykezeléstől, továbbá nincs járászavaruk; az állatokat véletlenszerűen kezelt és kontrollcsoportba osztják és a vizsgálat megkezdése előtt legalább öt napig hagyják őket a laboratóriumi körülményekhez alkalmazkodni.
Olyan ketrecet vagy karámot használnak, amely elég nagy ahhoz, hogy lehetővé tegye a tyúkok szabad mozgását és a járáskép könnyű megfigyelését.
A vizsgált anyagot orálisan adják be, gyomorszonda segítségével, vagy zselatin kapszulák alkalmazásával vagy egyéb hasonló eljárással. A folyadékokat hígítás nélkül vagy megfelelő vivőanyagban, pl. kukoricaolajban feloldva adják be; a szilárd anyagokat lehetőség szerint feloldják, mivel a zselatin kapszulába helyezett nagy mennyiségű szilárd anyag esetleg nem szívódik fel teljesen. Amennyiben nem víz a vivőanyag, akkor a vivőanyag toxikus tulajdonságainak ismertnek kell lenniük, eltérő esetben e tulajdonságokat a vizsgálat megkezdése előtt meghatározzák.
1.5.2. Vizsgálati körülmények
1.5.2.1. A kísérlethez felhasznált állatok
A fiatal felnőtt, 8–12 hónapos házi tojótyúk (Gallus gallus domesticus) használata ajánlott. A szokásos méretű fajtákat használják, olyan tyúkokat, amelyeket szabad mozgást biztosító körülmények között tenyésztettek.
1.5.2.2. Az állatok száma és neme
A kezelt csoport mellett mind vivőanyagos kontrollcsoportot, mind pozitív kontrollcsoportot vizsgálnak. A vivőanyagos kontrollcsoportban lévő állatokat a vizsgált anyag beadásától eltekintve a kezelt csoportba beosztottakkal azonos bánásmódban részesítik.
Az egyes csoportokban lévő állatok számát oly módon határozzák meg, hogy legalább hat madarat el lehessen pusztítani a biokémiai paraméterek meghatározásaihoz (hármat-hármat a két külön megfigyelési időpontban); továbbá hat madár túlélje a 21 napos megfigyelési időszakot, mert ezeken patológiai vizsgálatokat végeznek majd.
A pozitív kontrollcsoportot lehet egyidejűleg vizsgálni, vagy ez lehet egy korábbi, már vizsgált kontrollcsoport is. Ez a csoport legalább hat tyúkból áll, amelyeket egy ismert, késleltetett hatású idegméreggel kezelnek. Az állatok közül hármat biokémiai, hármat patológiai vizsgálatok céljára szánnak. A korábbi adatok rendszeres aktualizálása javasolt. Új pozitív kontrolladatokat vesznek fel, ha a vizsgálat lefolytatásának valamilyen fontos eleme (pl. származás, táplálék, tartási körülmények) megváltozik a vizsgálatot végző laboratóriumban.
1.5.2.3. Adagolási szintek
Az előzetes tanulmány során megfelelő számú állatnak és adagolási csoportnak a fő kísérletben alkalmazott dózist adagolják. Csekély számú kísérleti állat elhullása általában szükséges ebben az előzetes tanulmányban, a fő vizsgálat megfelelő dózisszintjeinek kiválasztásához. Az akut kolinerg hatások miatt bekövetkező elhullások megakadályozása érdekében atropint vagy egyéb olyan védő hatóanyagot alkalmazhatnak, amely közismerten nem befolyásolja a késleltetett neurotoxikus hatásokat. Többféle vizsgálati módszer alkalmazható a vizsgált anyag legnagyobb nem halálos dózisának meghatározásához (lásd B.l.A. módszer). A tyúkokra vonatkozó korábbi adatok vagy egyéb toxikológiai adatok is hasznosnak bizonyulhatnak a dózis kiválasztása során.
A fő vizsgálat során alkalmazott vizsgált anyag dózisa az előzetes dózisbehatároló vizsgálat eredményeinek figyelembevételével meghatározott lehető legmagasabb legyen, 2 000 mg/kg testsúly felső határ mellett. Esetleg előforduló időközbeni elhullás nem gátolhatja meg a szükséges mennyiségű állat túlélését a biokémiai (hat) és a szövettani (hat) vizsgálatokhoz a 21. napon. Az akut kolinerg hatások miatt bekövetkező elhullást atropinnal vagy egyéb védő hatóanyag alkalmazásával kerülik el, amely bizonyított módon nem gyakorol befolyást a késleltetett neurotoxikus hatásokra.
1.5.2.4. Határérték-vizsgálat
Ha a kísérlet során a legalább 2 000 mg/kg testsúly/nap adagolási szint, illetve az e vizsgálat lefolytatására előírt eljárás betartása mellett a vizsgált anyag nem okoz észlelhető toxikus hatásokat, és ha a szerkezet tekintetében rokon anyagokra vonatkozó adatok alapján nem is várható a toxicitás bekövetkezése, akkor a teljes, három adagolási szintet átfogó tanulmány elvégzése szükségtelennek tekinthető. A határérték-vizsgálat alkalmazható, kivéve ha emberi expozíció ennél nagyobb adagolási szint használatát indokolja.
1.5.3. Megfigyelési időszak
A megfigyelési időszak 21 nap.
1.5.4. A kísérlet végrehajtása
Az akut kolinerg hatások miatt bekövetkező elhullás megakadályozása érdekében alkalmazott védő anyag beadása után a vizsgált anyagot egyszeri dózisban adják be.
A megfigyelés mindjárt közvetlenül az expozíció után megkezdődik. Az első 2 napon minden tyúkot többször gondosan megfigyelnek, majd ezt követően 21 napon keresztül vagy a tervezett elpusztításig, legalább naponta egyszer. A toxicitás minden tünetét gondosan feljegyzik, beleértve a viselkedési rendellenesség kialakulásának időpontját, típusát, súlyosságát és tartamát. A végtagok mozgási zavarát (ataxia) skálán mérik, amely legalább négy szintet tartalmaz, továbbá a bénulást (paralízis) is feljegyzik. Hetente legalább kétszer kiveszik a ketrecből azokat a tyúkokat, amelyeket patológiai vizsgálatoknak szándékoznak alávetni, és egy meghatározott időre fokozott motoros tevékenységet váltanak ki (pl. létramászás), hogy már a legkisebb jelentkező toxikus hatások megfigyelhetőségét megkönnyítsék. A haldokló állatokat és súlyosan szenvedő, vagy fájdalommal küszködő állatokat az állatvédelmi előírásoknak megfelelően elpusztítják, majd felboncolják.
Minden tyúkot lemérnek közvetlenül a vizsgált anyag beadása előtt, majd ezután legalább hetente egyszer.
Minden kezelt és vivőanyag kontrollcsoportból hat tyúkot, a pozitív kontrollcsoportból hármat (ha egyidejűleg ezt a csoportot is vizsgálják) véletlenszerűen kiválasztanak és a vizsgált anyag beadása után pár nappal elpusztítanak, azért hogy az agyat és a lumbális gerincvelőt preparálják, és abban a neuropathiás cél-észteráz (NTE) gátló aktivitást megmérik. Ezen túlmenően hasznos lehet az ülőideg kikészítése és abban a neuropathiás cél-észteráz (NTE) gátló aktivitásának megmérése. Általában három madarat pusztítanak el mind a kezelt csoportokban, mind a negatív kontrollcsoportban az utolsó dózis után 24 órával, és másik hármat 48 órával később, a pozitív kontrollcsoportból származó három kísérleti állatot 24 órával később pusztítják el. Ha az intoxikáció klinikai tüneteinek megfigyeléséből (pl. a kolinerg tünetek időbeli jelentkezésének megfigyeléséből) arra lehet következtetni, hogy a toxikus hatóanyag kifejezetten lassan hat, akkor ajánlatos mind a három állattól két alakalommal 24–72 órával a vizsgált anyag adagolását követően szövetmimtákat venni.
Acetil-kolin észteráz (AChE) elemzését is el lehet végezni ezeken a mintákon, ha az célszerűnek tűnik. Figyelembe kell azonban venni az AChE spontán újraaktiválódását, amely in vivo előfordulhat, és így az anyag AChE gátló hatásának alulértékelését okozhatja.
Minden (a tervezett módon és a haldoklás miatt állatvédelmi okokból elpusztított) állat agyát és gerincvelőjét boncolásnak vetik alá.
A vizsgálati időszakot túlélő és azon állatok idegszöveteit, amelyeket nem biokémiai kísérleteknek vetnek alá, mikroszkóppal megvizsgálják. A szöveteket perfúziós módszerrel természetes helyzetben (in situ) tartósítják. A metszetek tartalmazzák a kisagyat (középső hosszanti szinten), a nyúltagyat, a gerincvelőt és a környéki (perifériás) idegeket. Gerincvelő-metszeteket a felső nyaki, a középső mellkasi és az ágyékkeresztcsonti szakaszból veszik. A környéki idegi metszeteket a sípcsonti ideg és gyomorizomhoz tartó elágazásaiból és az ülőidegből veszik. A metszeteket megfestik a megfelelő mielinre és axonra érzékeny festékkel. Először elvégzik a mikroszkópos vizsgálatot minden állat tartósított szövetein a kontroll- és a legnagyobb adagolású csoportnál. Ha bizonyítható a hatás a legnagyobb adagolású csoportnál, akkor elvégzik a mikroszkópos vizsgálatot a középső és az alacsony adagolású csoport állatainak szövetein is.
2. ADATOK
Az ebben a módszerben a kiválasztott végpontokon kapott negatív eredmények (biokémia, kórszövettan és viselkedési megfigyelések) általános esetben nem igényelnek további vizsgálatot a késleltetett neurotoxicitás vonatkozásában. Bizonytalan vagy nem meggyőző eredmények esetén szükség lehet további vizsgálatokra.
Minden egyes állattal kapcsolatban rögzítik az adatokat. Ezenfelül az összes adatot táblázat formájában összegzik. Ebből a kísérleti állatok minden csoportja tekintetében kiderül: a kísérlethez felhasznált álltok száma a vizsgálat elején, a sérült állatok száma, viselkedési vagy biokémiai hatások, a sérülések, illetve hatások típusa, súlyossága és az egyes sérüléseket vagy hatásokat mutató állatok százalékos eloszlása, típus és súlyosság szerint csoportosítva.
E vizsgálat eredményeit az egyes kezelt és kontrollcsoportok tekintetében viselkedési, biokémiai és kórszövettani hatások gyakorisága, súlyossága, korrelációja, valamint bármely más megfigyelt hatás alapján értékelik ki.
A számszerű eredményeket megfelelő, általánosan elfogadott statisztikai módszerekkel értékelik ki. Az alkalmazott statisztikai módszereket a vizsgálat tervezése során választják ki.
3. JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentés – amennyiben lehetséges – tartalmazza a következő információkat:
|
3.1. |
Kísérleti állatok
|
|
3.2. |
Vizsgálati körülmények
|
|
3.3. |
Eredmények |
|
|
Az eredmények tárgyalása |
|
Összefoglaló megállapítások. |
4. HIVATKOZÁSOK
Ez a módszer megfelel az OECD TG 418-nak.
B.38. SZERVES FOSZFORVEGYÜLETEKKEL KIVÁLTOTT KÉSLELTETETT NEUROTOXOCITÁS-VIZSGÁLAT, 28 NAPOS ISMÉTELT ADAGOLÁS ESETÉN
1. MÓDSZER
1.1. BEVEZETÉS
Az egyes anyagok toxikus hatásainak felbecslése és kiértékelése során fontos azt figyelembe venni, hogy az anyagok egyes osztályai bizonyos típusú neurotoxicitást okozhatnak, amelyet esetleg nem lehet bebizonyítani más típusú toxicitásvizsgálatokkal, de szükséges a vizsgálata. Egyes foszfororganikus vegyületek a korábbi megfigyelések szerint késleltetett neurotoxikus hatásokat okoznak, ezek azok az anyagok, amelyeknek az e (alábbiakban ismerteti) módszer szerinti vizsgálata szóba jöhet.
In vitro szűrővizsgálatokat lehet alkalmazni azoknak az anyagoknak a meghatározása céljából, amelyek késleltetett polyneuropathiát okozhatnak; mindazonáltal az in vitro vizsgálatok negatív eredménye nem biztosíték arra, hogy az anyag nem idegméreg.
Ez a 28 napos késleltetett neurotoxicitást vizsgáló tanulmány ismereteket szolgáltat azokról a lehetséges egészségügyi veszélyekről, amelyek adott időn keresztül ismétlődő expozíció során fennállhatnak. Ezen vizsgálat eredményeiből következtetéseket lehet levonni a dózis-hatás viszonyra, valamint lehetővé teszi annak a küszöbdózisnak a meghatározását, amelynél nem észlelhető kedvezőtlen hatás (NOAEL), és amely hasznos lehet az emberi expozíció biztonsági kritériumainak meghatározása során.
Lásd az Általános bevezetés B. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
A foszfororganikus vegyületekhez tartoznak azok a telítetlen foszfororganikus észterek, a tioészterek vagy a szerves foszforsavak, a foszfonsavak és a foszforamid-savak anhidridjei, illetve a rokon foszfortiosav, foszfontiosav vagy foszfortioamid-sav, továbbá egyéb anyagok, amelyek ebbe a vegyületosztályba tartoznak, és olykor megfigyelhető késleltetett neurotoxicitást okozhatnak.
Késleltetett idegmérgezés az a tünetcsoport, amely a hosszan késleltetett végtagmozgási zavarokkal (ataxia), a gerincvelő és a környéki (perifériás) idegek távoli kötődéseivel és az idegszövetben lévő neuropathiás cél-észterázok (NTE) gátlásával vagy öregedésével kapcsolatos.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot naponta egyszer, szájon át adják be házityúkoknak 28 napon keresztül. Az állatokat az utolsó dózis beadását követően 14 napon keresztül figyelik, legalább naponta egyszer a viselkedési rendellenességek, ataxia és paralízis szempontjából. A biokémiai paramétereket, különösen a neuropathiás cél-észterázok (NTE) gátlását minden csoportból véletlenszerűen kiválasztott tyúkokon mérik, általában az adagolás után 24–48 órával. Az adagolás után két héttel az életben maradt tyúkokat elpusztítják, és az egyes idegszövetek kórszövettani vizsgálatát elvégzik.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. Előkészületek
Egészséges, fiatal, felnőtt tyúkokkal kísérleteznek, amelyek mentesek a zavaró vírusos betegségektől és gyógykezeléstől, továbbá nincs járászavaruk; az állatokat véletlenszerűen kezelt és kontrollcsoportba osztják, és a vizsgálat megkezdése előtt legalább öt napig hagyják őket a laboratóriumi körülményekhez alkalmazkodni.
Olyan ketrecet vagy karámot használnak, amely elég nagy ahhoz, hogy lehetővé tegye a tyúkok szabad mozgását és a járáskép könnyű megfigyelését.
A vizsgált anyagot heti hét napon át orálisan adják be, gyomorszonda segítségével, vagy zselatin kapszulák alkalmazásával. A folyadékokat hígítás nélkül vagy megfelelő vivőanyagban, pl. kukoricaolajban feloldva adják be; a szilárd anyagokat lehetőség szerint feloldják, mivel a zselatin kapszulába helyezett nagy mennyiségű szilárd anyag esetleg nem szívódik fel teljesen. Amennyiben nem víz a vivőanyag, akkor a vivőanyag toxikus tulajdonságainak ismertnek kell lenniük, eltérő esetben e tulajdonságokat a vizsgálat megkezdése előtt meghatározzák.
1.4.2. Vizsgálati körülmények
1.4.2.1. Kísérlethez felhasznált állatok
A fiatal felnőtt, 8–12 hónapos házi tojótyúk (Gallus gallus domesticus) használata ajánlott. A szokásos méretű fajtákat használják, olyan tyúkokat, amelyeket szabad mozgást biztosító körülmények között tenyésztettek.
1.4.2.2. Az állatok száma és neme
Általában a három kezelt csoport mellett vivőanyagos kontrollcsoportot is vizsgálnak. A vivőanyagos kontrollcsoportban lévő állatokat a vizsgált anyag beadásától eltekintve a kezelt csoportba beosztottakkal azonos bánásmódban részesítik.
Az egyes csoportokban lévő állatok számát oly módon határozzák meg, hogy legalább hat madarat el lehessen pusztítani a biokémiai paraméterek meghatározásaihoz (hármat-hármat a két külön megfigyelési időpontban); továbbá hat madár túlélje 14 nappal az utolsó beadott adagot, mert ezeken patológiai vizsgálatokat végeznek majd.
1.4.2.3. Adagolási szintek
Az adagolási szintek kiválasztásánál figyelembe veszik a késleltetett neurotoxicitás (akut) megállapítására elvégzett vizsgálat eredményeit és a vizsgált anyag toxicitásra, illetve kinetikájára vonatkozóan rendelkezésre álló adatokat. A legmagasabb dózist úgy választják ki, hogy az toxikus tüneteket keltsen, de ne okozzon halált, vagy súlyos szenvedést a kísérleti állatoknak. Ezután az adagokat fokozatosan csökkentik, azzal a céllal, hogy bemutassák az adagolási szinttől függő hatásokat és a nem észlelhető kedvezőtlen hatás szintet.
1.4.2.4. Határérték-vizsgálat
Ha a kísérlet során a legalább 1 000 mg/kg testsúly/nap adagolási szint, illetve az e vizsgálat lefolytatására előírt eljárás betartása mellett a vizsgált anyag nem okoz észlelhető toxikus hatásokat, és ha a szerkezet tekintetében rokon anyagokra vonatkozó adatok alapján nem is várható a toxicitás bekövetkezése, akkor a teljes, három adagolási szintet átfogó tanulmány elvégzése szükségtelennek tekinthető. A határérték-vizsgálat alkalmazható, kivéve ha emberi expozíció ennél nagyobb adagolási szint használatát indokolja.
1.4.2.5. Megfigyelési időszak
Minden állatot legalább naponta megfigyelnek az expozíció időszaka alatt, majd azt követően 14 napon keresztül, kivéve ha tervezett boncolást hajtanak végre.
1.4.3. A kísérlet végrehajtása
Az állatoknak 28 napon keresztül hetente hétszer adják be a vizsgálati anyagot.
A megfigyelés mindjárt közvetlenül a kezelés kezdetétől tart. A kezelés mind a 28 napján majd az utolsó adag beadását követően 14 napon át vagy a tervezett elpusztításig legalább naponta egyszer megfigyelnek minden állatot. A toxicitás minden tünetét gondosan feljegyzik, beleértve kialakulásuk időpontját, a típust, súlyosságot és tartamot. A megfigyelések kiterjednek viselkedési rendellenességekre is. A végtagok mozgási zavarát (ataxia) skálán mérik, amely legalább négy szintet tartalmaz, továbbá a bénulást (paralízis) is feljegyzik. Hetente legalább kétszer kiveszik a ketrecből az állatokat, és egy meghatározott időre fokozott motoros tevékenységet váltanak ki (pl. létramászás), hogy már a legkisebb jelentkező toxikus hatások megfigyelhetőségét megkönnyítsék. A haldokló állatokat és súlyosan szenvedő vagy fájdalommal küszködő állatokat az állatvédelmi előírásoknak megfelelően elpusztítják, majd felboncolják.
Minden tyúkot lemérnek közvetlenül a vizsgált anyag beadása előtt, majd ezután legalább hetente egyszer.
Minden kezelt és vivőanyag kontrollcsoportból hat tyúkot kiválasztanak véletlenszerűen, és a vizsgált anyag utolsó beadása után pár nappal elpusztítanak, azért hogy az agyat és a lumbális gerincvelőt preparálják, és abban a neuropathiás cél-észteráz (NTE) gátló aktivitást megmérjék. Ezen túlmenően hasznos lehet az ülőideg kikészítése és abban a neuropathiás cél-észteráz (NTE) gátló aktivitásának megmérése. Általában három madarat pusztítanak el mind a kezelt csoportokban, mind a kontrollcsoportban az utolsó dózis után 24 órával és másik hármat 48 órával később. Ha az akut vizsgálatból vagy más kísérletekből (pl. toxikokinetikai) arra lehet következtetni, hogy az utolsó adag beadását követően a fentiektől eltérő időpontban fognak mutatkozni a pusztulás jelei, akkor a kísérlet menetét ennek megfelelően megváltoztatják, és meg is indokolják a döntést.
Az acetil-kolin-észteráz (AChE) elemzését is el lehet végezni a mintákon, ha az célszerűnek látszik. Figyelembe kell azonban venni az AChE spontán újraaktiválódását, amely in vivo előfordulhat, és így az anyag AChE gátló hatásának alulértékelését okozhatja.
Minden (a tervezett módon és a haldoklás miatt állatvédelmi okokból elpusztított) állat agyát és gerincvelőjét boncolásnak vetik alá.
A vizsgálati időszakot túlélő és azon állatok idegszöveteit, amelyeket nem biokémiai kísérleteknek vetnek alá, mikroszkóppal megvizsgálják. A szöveteket perfúziós módszerrel természetes helyzetben (in situ) tartósítják. A metszetek tartalmazzák a kisagyat (középső hosszanti szinten), a nyúltagyat, a gerincvelőt és a környéki (perifériás) idegeket. Gerincvelő-metszeteket a felső nyaki, a középső mellkasi és az ágyékkeresztcsonti szakaszból veszik. A környéki idegi metszeteket a sípcsonti ideg és gyomorizomhoz tartó elágazásaiból és az ülőidegből veszik. A metszeteket megfestik a megfelelő mielinre és axonra érzékeny festékkel. Először elvégzik a mikroszkópos vizsgálatot minden állat tartósított szövetein a kontroll- és a legnagyobb adagolású csoportnál. Ha bizonyítható a hatás a legnagyobb adagolású csoportnál, akkor elvégzik a mikroszkópos vizsgálatot a középső és az alacsony adagolású csoport állatainak szövetein is.
2. ADATOK
Az ebben a módszerben a kiválasztott végpontokon kapott negatív eredmények (biokémia, kórszövettan és viselkedési megfigyelések) általános esetben nem igényelnek további vizsgálatot a késleltetett neurotoxicitás vonatkozásában. Bizonytalan vagy nem meggyőző eredmények esetén szükség lehet további vizsgálatokra.
Minden egyes állattal kapcsolatban rögzítik az adatokat. Ezenfelül az összes adatot táblázat formájában összegzik. Ebből a kísérleti állatok minden csoportja tekintetében kiderül: a kísérlethez felhasznált álltok száma a vizsgálat elején, a sérült állatok száma, viselkedési vagy biokémiai hatások, a sérülések, illetve hatások típusa, súlyossága és az egyes sérüléseket vagy hatásokat mutató állatok százalékos eloszlása, típus és súlyosság szerint csoportosítva.
E vizsgálat eredményeit az egyes kezelt és kontrollcsoportok tekintetében viselkedési, biokémiai és kórszövettani hatások gyakorisága, súlyossága, korrelációja, valamint bármely más megfigyelt hatás alapján értékelik ki.
A számszerű eredményeket megfelelő, általánosan elfogadott statisztikai módszerekkel értékelik ki. Az alkalmazott statisztikai módszereket a vizsgálat tervezése során választják ki.
3. JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentés – amennyiben lehetséges – a következő információkat tartalmazza:
|
3.1. |
Kísérleti állatok
|
|
3.2. |
Vizsgálati körülmények
|
|
3.3. |
Eredmények
|
|
Az eredmények tárgyalása. |
|
Összefoglaló megállapítások. |
4. HIVATKOZÁSOK
Ez a módszer megfelel az OECD TG 419-nek.
B.39. NEM ÜTEMEZETT DNS-SZINTÉZIS (UDS) IN VIVO VIZSGÁLAT EMLŐS MÁJSEJTEKKEL
1. MÓDSZER
E módszer megfelel az OECD TG 486-nak, emlősmáj-sejtekkel végrehajtott nem ütemezett DNS-szintézis (UDS) in vivo vizsgálat (1997).
1.1. BEVEZETÉS
Az emlősmáj-sejtekkel végzett nem ütemezett DNS-szintézis (UDS) in vivo vizsgálat célja azon anyagok meghatározása, amelyek DNS-reparációt váltanak ki a kezelt állatok májsejtjeiben (1) (2) (3) (4).
Ez az in vivo vizsgálat lehetővé teszi a kémiai anyagoknak a májban okozott genotoxikus hatásainak vizsgálatát. A vizsgált végpont következtetni enged a májsejtekben a DNS-károsodásra és az ezt követő reparációra. A máj rendszerint az abszorbeált vegyületek metabolizmusának fő helyszíne. Ebből következően megfelelő hely DNS-károsodás in vivo vizsgálatára.
Ha bizonyos jelek utalnak arra, hogy a vizsgált anyag nem éri el a célszövetet, akkor e vizsgálat nem megfelelő.
A nem ütemezett DNS-szintézis (UDS) végpontját a megjelölt nukleozidok felvételének meghatározásával lehet mérni azon sejtekben, amelyek nem mennek keresztül az ütemezett (S fázisú) DNS-szintézisen. A legelterjedtebben használt módszer a tríciummal megjelölt timidin (3H-TdR) felvételének meghatározása autoradiográfiával. Az in vivo UDS-vizsgálatokban lehetőleg patkánymájat kell használni. Májszövetektől eltérő szövetek is használhatók, de ezek nem képezik e módszer tárgyát.
Az UDS-reakció észlelése a károsodás helyén a kivágott és helyettesített DNS-bázisok számától függ. Ezért tehát az UDS-vizsgálat különösen értékes az anyag által indukált hosszú szakaszú („long-patch reparáció” 20–30 bázispár) észlelésére. Ezzel ellentétben a rövid szakaszú („short-patch reparáció” 1–3 bázis) jóval kisebb érzékenységgel észlelhető. Ezenkívül mutagén hatások jöhetnek létre DNS-elváltozások helyre nem állítása, nem megfelelő helyreállítása vagy hibás replikációja miatt. Az UDS-reakció mértéke nem ad jelzést a reparációs folyamat megbízhatóságáról. Ezenkívül előfordulhat, hogy valamely mutagén reakcióba lép a DNS-sel, de nem történik meg a DNS-károsodás helyreállítása kivágásos reparáció révén (excision repair). A mutagénaktivitással kapcsolatban az UDS-vizsgálat által biztosított speciális információk hiányát e végpontnak a potenciális érzékenysége kompenzálja, mivel ennek mérése a teljes genomban történik.
Lásd még az Általános bevezetés B. részét is.
1.2. FOGALOMMEGHATÁROZÁSOK
Reparálódó sejtek: a vizsgálatot végző laboratórium által előre megadott értéknél magasabb nettó sejtmagi szemcseszám (net nuclear grain, NNG).
Nettó sejtmagi szemcseszám (NNG): az autoradiográfiás UDS-vizsgálatokban az UDS-aktivitás kvantitatív mértéke, amit úgy lehet megkapni, hogy a sejtmagi szemcsék számából (NG) le kell vonni a sejtmaggal azonos területű citoplazmára eső szemcsék számát(CG): NNG = NG – CG. Minden egyes sejthez ki kell számítani az NNG-számokat, majd valamennyi tenyészetre és a párhuzamos tenyészetre is.
Nem ütemezett DNS-szintézis (UDS): kémiai anyagok vagy fizikai ágensek által indukált DNS-károsodást tartalmazó szakasz kivágása és eltávolítása után végbemenő reparációs DNS-szintézis.
1.3. A VIZSGÁLATI MÓDSZER ELVE
Az emlősmáj-sejtekkel végrehajtott in vivo UDS-vizsgálat a kémiai anyagok vagy fizikai ágensek által indukált DNS-károsodást tartalmazó szakasz kivágása és eltávolítása után végbemenő reparációs DNS-szintézis. A vizsgálat rendszerint 3H-TdR-nek a májsejtek DNS-ébe való beépítésén alapul, ahol csak kisszámú sejt található az S-fázisban. A 3H-TdR felvételét rendszerint autoradiográfiásan határozzuk meg, mivel e módszer kevésbé érzékeny az S-fázisú sejtek zavaró hatására, mint például a folyadékszcintillációs módszer.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. Előkészületek
1.4.1.1. A kísérlethez felhasznált állatok
Rendszerint patkányokat használnak, de bármilyen megfelelő emlős használata szóba jöhet. Fiatal, egészséges, ivarérett, kísérleti célokra tenyésztett laboratóriumi állattörzsekből származó állatokat használnak. A vizsgálat kezdetén az állatok súlya lehetőleg csak minimálisan térjen el egymástól, és a nemenkénti átlagos értéktől maximum ± 20 %-kal különbözhet.
1.4.1.2. Tartási és etetési körülmények
Az Általános bevezetés B. részében ismertetett általános körülményeket kell alkalmazni, bár a páratartalom értékének 50–60 % között kell lennie.
1.4.1.3. Az állatok előkészítése
Az egészséges, fiatal, ivarérett állatokat véletlenszerűen kontroll- és kezelt csoportokba osztják. A ketreceket úgy kell elrendezni, hogy minimálisak legyenek az elhelyezés miatti esetleges hatások. Ezt követően az állatokat egyenként kell azonosítani. Az állatokat legalább öt napig szoktatják a laboratóriumi körülményekhez.
1.4.1.4. Vizsgált anyag/előkészület
Az adagolás előtt a szilárd vizsgált anyagokat fel kell oldani vagy szuszpendálni megfelelő oldószerekben vagy vivőanyagokban, és hígítani, ha szükséges. A folyékony vizsgált anyagok közvetlenül adagolhatók vagy hígíthatók. A vizsgált anyagból mindig friss készítményeket kell alkalmazni, kivéve ha az anyag tárolás során való stabilitása bizonyított.
1.4.2. Vizsgálati körülmények
1.4.2.1. Oldószer/vivőanyag
Az oldószer nem okozhat toxikus hatásokat a kiválasztott dózisok mellett, valamint nem alkalmazható olyan anyag, amely gyaníthatóan kémiai reakcióba lép a vizsgált anyaggal. Jól ismert oldószerektől eltérő oldószerek/vivőanyagok használatakor azok felhasználását alá kell támasztani a kompatibilitásukat bizonyító adatokkal. Amennyiben lehetséges, először valamilyen vizes oldószer/vivőanyag használatát kell megfontolni.
1.4.2.2. Kontrollok
Minden kísérlethez egyidejűleg pozitív és negatív (oldószer/vivőanyag) kontrollokat alkalmazunk. A vizsgált anyaggal való kezelés kivételével a kontrollcsoportokba beosztott állatokat azonos bánásmódban kell részesíteni a kezelt csoportokban lévő állatokkal.
A pozitív kontrollanyagoknak olyan anyagoknak kell lenniük, amelyekről ismert, hogy létrehoznak UDS-t olyan expozíciós szinten való beadáskor, amelyről várható, hogy a háttérszintet meghaladó észlelhető növekedést biztosít. Azon pozitív kontrollokat, amelyek metabolikus aktiválást igényelnek, olyan dózisban kell alkalmazni, ami mérsékelt reakciót vált ki (4). A dózisokat úgy választjuk ki, hogy a hatás egyértelmű legyen, de ne lepleződjön le azonnal a kódolt tárgylemezek identitása a leolvasásnál. A következő pozitív kontrollanyagok jöhetnek szóba:
|
Mintaveteli idők |
Anyag |
CAS-szám |
EINECS-szám |
|
Korai mintavételi idők (2–4 óra) |
N-Nitrozo-dimetil-amin |
62-75-9 |
200-249-8 |
|
Késői mintavételi idők (12–16 óra) |
2-acetamido-fluorén (2-AAF) |
53-96-3 |
200-188-6 |
Más megfelelő pozitív kontrollanyagok is használhatók. Elfogadható a pozitív kontrollanyagok vizsgált anyagtól eltérő módon való adagolása.
1.5. A KÍSÉRLET VÉGREHAJTÁSA
1.5.1. Állatok száma és neme
Megfelelő számú állatot kell használni, azért hogy a vizsgált anyagra adott reakció során a természetes biológiai eltérést figyelembe lehessen venni. Csoportonként legalább három elemezhető állatnak kell lennie. Ahol az eddigiek során már jelentős adatbázist gyűjtöttünk össze, csak egy vagy két kísérleti állat szükséges az egyidejűleg alkalmazott negatív és pozitív kontrollcsoportokhoz.
Ha a tanulmány végrehajtásakor rendelkezésre állnak olyan adatok azonos fajták és azonos expozíciósmód használata mellett, amelyek azt mutatják, hogy nincsenek jelentős különbségek a nemek között a toxicitás tekintetében, elegendő lesz egyetlen nemhez tartozó állatok, lehetőleg a hímek vizsgálata. Ahol az emberek esetében az expozíció nemre jellemző lehet, mint például néhány gyógyszer esetében, a vizsgálatot a megfelelő nemű állatokkal kell elvégezni.
1.5.2. Kezelési menetrend
A vizsgált anyagot rendszerint egyetlen adagban adjuk be.
1.5.3. Dózisok
Rendszerint legalább két dózist használnak. A legmagasabb adag az a dózis, ami olyan egyértelmű toxicitásjeleket vált ki, hogy annál magasabb adagok, azonos adagolás mellett, várhatóan halált okoznak. Az alacsonyabb dózis a legmagasabb dózis 25–50 %-a.
Specifikus biológiai hatású anyagok alacsony, nem toxikus adagok mellett (ilyenek például a hormonok és mutagének), adott esetben lehetséges, hogy nem felelnek meg az adagolási kritériumoknak, ezért ezeket eseti alapon kell értékelni. Ha dózisbehatároló vizsgálatot végeznek, mivel nem állnak rendelkezésre megfelelő adatok, ezt ugyanazon laboratóriumban, ugyanazon fajok, törzs, nem és kezelési rendszer használatával kell elvégezni, mint amelyet a fő vizsgálatban alkalmazunk.
A legnagyobb adag olyan adagként határozható meg, amely a májban a toxicitás valamilyen jelzését (például piknotikus nukleusz) váltja ki.
1.5.4. Határérték-vizsgálat
Ha egyetlen alkalmommal vagy ugyanazon a napon két adagban beadott, legalább 2 000 mg/kg testsúlydózis mellett végrehajtott vizsgálat semmilyen megfigyelhető toxikus hatást nem hoz létre, és ha nem várható genotoxicitás szerkezetileg rokon anyagokkal kapcsolatos adatok alapján, akkor nem szükséges a teljes vizsgálatot elvégezni. A várt expozíciós hatások az embernél a határérték-vizsgálatban valamilyen magasabb dózis használatának szükségességét jelezhetik.
1.5.5. Adagolás
A vizsgált anyagot rendszerint gyomorszondán át inkubációs kanül segítségével, vagy hasüregbe adott injekció segítségével adják be. Elfogadhatók egyéb expozíciós módok, amennyiben azok indokolhatók. Azonban a hasüregbe való beadás nem ajánlott, mivel ez közvetlenül teheti ki a májat a vizsgált anyag hatásának ahelyett, hogy ez a keringési rendszeren keresztül történne. A gyomorszondán át vagy injekcióval egyszerre beadható maximális folyadékmennyiség a kísérleti állat méretétől függ. A térfogata nem haladhatja meg a 2 ml/100 g testsúly mennyiséget. Ennél nagyobb mennyiségek használatát meg kell indokolni. A magasabb koncentrációértékek esetén rendszerint fokozottabb hatást kiváltó irritatív vagy maró anyagok kivételével, a koncentráció megfelelő beállításával a minimálisra kell csökkenteni a vizsgált anyag mennyiségének változásait, hogy valamennyi dózisszinten konstans mennyiséget lehessen adagolni a kísérleti állatoknak.
1.5.6. Májsejtek preparációja
Májsejteket rendszerint 12–16 órával az adagolás után kell venni a kezelt állatokból. Általában szükség van egy további korai mintavételre (rendszerint a kezelés után 2–4 órával), ha nem jön létre egyértelmű, pozitív reagálás a kezelés után 12–16 órával. Azonban használhatók más mintavételi idők, amikor ez indokolt a toxikokinetikai adatok alapján.
Az emlősmáj-sejtek rövid idejű (short term) tenyészeteit rendszerint úgy hozzák létre, hogy a májon in situ átáramoltatnak kollagenázt, és lehetővé teszik, hogy a frissen disszociált májsejtek hozzátapadjanak valamilyen alkalmas felülethez. A negatív kontrollállatokból származó májsejteknek legalább 50 %-os életképességűeknek kell lenniük (5).
1.5.7. UDS meghatározása
Frissen izolált emlősmáj-sejteket inkubálunk 3H-TdR-t tartalmazó táptalajjal megfelelő időtartamig, például 3–8 órán át. Az inkubációs időszak végén a tápfolyadékot el kell távolítani a sejtekből, amely ekkor többlet, nem megjelölt timidint tartalmazó tápfolyadékkal inkubálható a be nem épült radioaktivitás eltávolítása érdekében („cold chase”). A sejteket ezután le kell öblíteni, fixálni és szárítani. Hosszabb inkubációs idők esetén a cold chase elmaradhat. A lemezeket autoradiografiás emulzióba kell meríteni, sötétben tárolni (például 7–14 napig hűtött helyen tartják), előhívni, megfesteni, majd meg kell számolni az exponált ezüstszemcséket. 2–3 lemezt kell preparálni minden egyes állathoz.
1.5.8. Elemzés
A tárgylemez-preparátumoknak elegendő normál morfológiájú sejtet kell tartalmazniuk ahhoz, hogy elvégezhető legyen az UDS (helyzetet hűen kifejező) kiértékelése. A készítményeket mikroszkóp segítségével vizsgálják meg a nyilvánvaló citotoxicitás jeleit (például piknózis, radioaktív-jelölés csökkent értékei) keresve.
A tárgylemezeket kódolni kell a szemcseszámlálás előtt. Rendszerint 100 sejtet kell kiértékelni minden egyes állat esetében legalább két tárgylemezről; indokolni kell az állatonként kevesebb mint 100 sejt értékelését. Az S-fázisú sejtmagok felett nem kell szemcséket számolni, de feljegyezhető az S-fázisú sejtek aránya.
Alkalmas módszerekkel meg kell határozni a 3H-TdR beépülési arányát a morfológiailag normál sejtek sejtmagjába és citoplazmájába úgy, ahogyan azt az ezüstszemcsék lerakódása mutatja.
2. ADATOK
2.1. EREDMÉNYEK KEZELÉSE
Meg kell adni az egyes tárgylemezekhez és állatokhoz tartozó adatokat. Ezenkívül táblázat formájában össze is kell foglalni minden adatot. Minden egyes sejthez, minden állathoz és minden adaghoz és időhöz ki kell számítani a nettó sejtmagi szemcseszámokat (NNG), amelyet a CG-számoknak az NG-számokból való kivonásával kapunk meg. Ha megszámláljuk a „helyreállított sejteket”, indokoltnak és történeti vagy párhuzamos negatív kontrolladatokon alapulónak kell lennie a „helyreállított sejtek” kifejezés meghatározása kritériumának. A számszerű eredmények statisztikai módszerekkel kiértékelhetők. Ha használunk statisztikai vizsgálatokat, azokat még a kísérlet elvégzése előtt kell kiválasztani, és azt indokolni kell.
2.2. EREDMÉNYEK KIÉRTÉKELÉSE ÉS ÉRTELMEZÉSE
Példák a pozitív/negatív reakció meghatározásának kritériumára:
|
pozitív |
i. |
laboratóriumi történeti adatok alapján indokolt, előre beállított küszöbérték fölötti NNG-értékek vagy |
|
|
ii. |
az egyidejűleg elvégzett kontrollnál lényegesen nagyobb NNG-értékek; |
|
negatív |
i. |
a történeti kontroll küszöbérték alatti NNG-értékek; vagy |
|
|
ii. |
az egyidejűleg elvégzett kontrollnál nem lényegesen nagyobb NNG-értékek. |
Meg kell vizsgálni az adatok biológiai jelentőségét, azaz figyelembe kell venni az olyan paramétereket, mint például az állatok közötti eltérés, dózis-reakció viszony és citotoxicitás. Statisztikai módszerek használhatók a vizsgálati eredmények kiértékelésének elősegítésére. Azonban nem szabad, hogy a statisztikai szignifikancia legyen az egyetlen meghatározó tényező valamely pozitív reagálás megállapítására.
Bár a legtöbb kísérlet egyértelműen pozitív vagy negatív eredményeket hoz, ritka esetben előfordul, hogy a rendelkezésre álló adatok alapján nem lehet a vizsgált anyag aktivitásával kapcsolatban egyértelműen állást foglalni. Előfordul az is, hogy az eredmények többféleképpen magyarázhatók vagy megkérdőjelezhetők maradhatnak tekintet nélkül arra, hogy hány alkalommal ismételjük meg a kísérletet.
Az emlősmáj-sejtekkel végrehajtott in vivo UDS-vizsgálatból kapott pozitív eredmény azt jelzi, hogy valamely vizsgált anyag olyan in vivo DNS-károsodást idéz elő emlősmáj-sejtekben, amely in vitro reparálható nem ütemezett DNS-szintézissel. A negatív eredmény azt jelzi, hogy a vizsgálati körülmények között a vizsgált anyag nem idéz elő e vizsgálattal észlelhető DNS-károsodást.
Értékelni kell annak a valószínűségét, hogy a vizsgált anyag vagy annak metabolitjai eljutnak-e az általános keringési rendszerbe, illetve kifejezetten a célszövetbe (például szisztematikus toxicitás).
3. JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentés tartalmazza a következő információkat:
|
|
Oldószer/vivőanyag:
|
|
|
Kísérleti állatok:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények tárgyalása. |
|
|
Összefoglaló megállapítások |
4. SZAKIRODALOM
|
(1) |
Ashby, J. Lefevre, P. A., Burlinson, B. és Penman, M. G. (1985), An Assessment of the In vivo Rat. Hepatocyte DNA Repair Assay, Mutation Res., 156., pp. 1–18. |
|
(2) |
Butterworth, B. E., Ashby, J., Bermudez, E., Casciano, D., Mirsalis, J., Probst, G. and Williams, G. (1987), A Protocol and Guide for the In vivo Rat. Hepatocyte DNA Repair Assay, Mutation Res., 189., pp. 123–133. |
|
(3) |
Kennelly, J. C, Waters, R., Ashby, J., Lefevre, P. A., Burlinson, B., Benford, D. J., Dean, S. W. and Mitchell, I. de G. (1993), In vivo Rat Liver UDS Assay, in: Kirkland D. J. and Fox M., (eds), Supplementary Mutagenicity Tests: UKEM Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part II. revised. Cambridge University Press. Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 52–77. |
|
(4) |
Madle, S., Dean, S. W., Andrae, U., Brambilla, G., Burlinson, B., Doolittle, D. J., Furihata, C, Hertner, T., McQueen, C. A. and Mori, H. (1993), Recommendations for the Performance of UDS Tests In vitro and In Vivo, Mutation Res., 312, pp. 263–285. |
|
(5) |
Fautz, R., Hussain, B., Efstathiou, E. and Hechenberger-Freudl. C. (1993), Assessment of the Relation Between the Initial Viability and the Attachment of Freshly Isolated Rat Hepatocytes Used for the In Vivo/In vitro DNA Repair Assay (UDS), Mutation Res., 291, pp. 21–27. |
|
(6) |
Mirsalis, J. C, Tyson, C. K. and Butterworth, B. E. (1982), Detection of Genotoxic Carcinogens in the In Vivo/In vitro Hepalocyte DNA Repair Assay, Environ. Mutagen, 4, pp. 553–562. |
B.40. IN VITRO BŐRKORRÓZIÓ: TRANSZKUTÁN ELEKTROMOS REZISZTENCIA VIZSGÁLAT (TER)
1. MÓDSZER
Ez a kísérleti módszer egyenértékű az OECD TG 430 (2004) módszerrel.
1.1. BEVEZETÉS
A bőrkorrózió egy vizsgált anyag felvitelét követően a bőrben történt irreverzibilis szövetkárosodás (a veszélyes anyagok és keverékek osztályozásának és címkézésének globális harmonizált rendszere [GHS] meghatározása szerint) (1). Ez a módszer egy olyan eljárást tesz lehetővé, amely során a vizsgálatot nem élő állatokon végzik.
A bőrkorrózió vizsgálata jellemzően kísérleti állatokon történő vizsgálatot kíván meg (2). A B.4. vizsgálati módszer felülvizsgálata során figyelembe vették az eljárással az állatoknak okozott fájdalom és szenvedés miatti aggodalmakat, és a felülvizsgált módszer már lehetővé teszi a bőrkorrózió alternatív, in vitro, fájdalom és szenvedés okozása nélküli módszerekkel történő meghatározását.
A szabályozási célokból végzett bőrkorrózió-vizsgálathoz használható alternatív vizsgálatok meghatározása felé az elővalidálási tanulmányok készítése jelentette az első lépést (3). Ezt követően folyt le a bőrkorrózió vizsgálatára szolgáló in vitro módszerek (4) (5) hivatalos hitelesítési vizsgálata (6) (7) (8). E tanulmányok és más publikált szakirodalom következtetései vezettek ahhoz a ajánláshoz, hogy az in vivo bőrkorrózió-vizsgálatokhoz (9) (10) (11) a következő vizsgálatok használhatók: az emberi bőrmodellen alapuló vizsgálat (lásd a B.40a vizsgálati módszert) és a transzkután elektromos rezisztenciavizsgálat (ez a módszer).
Egy validálási tanulmány és más publikált tanulmányok arról számoltak be, hogy a patkánybőr esetében a transzkután elektromos rezisztenciára (TER) vonatkozó vizsgálattal (12) (13) megbízhatóan megkülönböztethetők a bőrkorróziót okozó és bőrkorróziót nem okozó ismert anyagok (5) (9).
Az ebben a módszerben leírt vizsgálat lehetővé teszi a korrozív vegyi anyagok és keverékek meghatározását. Lehetővé teszi továbbá a nem korrozív anyagok és keverékek meghatározását, ha más létező információkon alapuló meghatározások bizonyítási súlya ezt alátámasztja (pl. pH, szerkezet-hatás kapcsolat, emberekre és/vagy állatokra vonatkozó adatok) (1) (2) (11) (14). Ez a módszer nem nyújt információt a bőrirritációra vonatkozóan, és nem teszi lehetővé a korrozív anyagoknak a Globális Harmonizált Osztályozási Rendszer (GHS) alapján megengedett alkategóriákba sorolását (1).
Egyetlen bőrexpozíció után a bőrt ért helyi hatások teljes kiértékelésére ajánlatos a B.4 vizsgálati módszer (2) függeléke szerinti és a Globális Harmonizált Rendszer (GHS) (1) által meghatározott szekvenciális vizsgálati stratégiát folytatni. E vizsgálati stratégia előírja, hogy in vitro bőrkorróziós (az ebben a módszerben leírtak szerint) és bőrirritációs vizsgálatokat kell lefolytatni, mielőtt az élő állatokon végzett vizsgálatokat fontolóra lehetne venni.
1.2. FOGALOMMEGHATÁROZÁSOK
In vivo bőrkorrózió: a bőr irreverzibilis károsodása: nevezetesen egy vizsgálati anyag négy órán át tartó alkalmazását követően látható szövetelhalás az epidermiszen át és a dermiszben. A korrozív reakciókat jellemzik a fekélyek, vérzés, véres var és a 14 napos megfigyelés végén a bőr kifehéredése miatti elszíntelenedés, teljes területek szőrtelensége és hegek. A kérdéses károsodás értékeléséhez figyelembe kell venni a szövetkórtant.
Transzkután elektromos rezisztencia (TER): a bőr látszólagos elektromos rezisztenciájának mérése rezisztenciaértékként, kiloohmban kifejezve. A barrierfunkció vizsgálatának egy egyszerű és nagy teljesítményű módszere, amely során az ionok bőrön történő áthaladását egy Wheatstone-híd segítségével rögzítik.
1.3. REFERENCIAANYAGOK
1. táblázat
Referencia-vegyszerek
|
Név |
EINECS-szám |
CAS-szám |
|
|
1,2-diaminopropán |
201-155-9 |
78-90-0 |
Erősen korrozív |
|
Akrilsav |
201-177-9 |
79-10-7 |
Erősen korrozív |
|
2-tert-butilfenol |
201-807-2 |
88-18-6 |
Korrozív |
|
Kálium-hidroxid (10 %) |
215-181-3 |
1310-58-3 |
Korrozív |
|
Kénsav (10 %) |
231-639-5 |
7664-93-9 |
Korrozív |
|
Oktánsav (kaprilsav) |
204-677-5 |
124-07-02 |
Korrozív |
|
4-amino-1,2,4-triazol |
209-533-5 |
584-13-4 |
Nem korrozív |
|
Eugenol |
202-589-1 |
97-53-0 |
Nem korrozív |
|
Fenetil bromid |
203-130-8 |
103-63-9 |
Nem korrozív |
|
Tetraklór-etilén |
204-825-9 |
27-18-4 |
Nem korrozív |
|
Izosztearinsav |
250-178-0 |
30399-84-9 |
Nem korrozív |
|
4-(metiltio)-benzaldehid |
222-365-7 |
3446-89-7 |
Nem korrozív |
A felsorolt vegyszerek többsége az ECVAM nemzetközi validálási tanulmányhoz válogatott vegyszerek listájából származik (4). Kiválasztásuk a következő ismérvek alapján történt:
|
i. |
egyenlő számú korrozív és nem korrozív anyag; |
|
ii. |
kereskedelmi forgalomban kapható vegyszerek, amelyek lefedik a legtöbb vonatkozó vegyszerosztályt; |
|
iii. |
erősen korrozív és a kevésbé korrozív anyagokat is tartalmaz annak érdekében, hogy lehetővé váljon a korrózióhatás szerinti megkülönböztetés; |
|
iv. |
olyan vegyszerek kiválasztása, amelyek a korrózió kivételével komolyabb kockázat nélkül kezelhetők laboratóriumban. |
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot 24 órán át a bőrkorongok epidermális felületén alkalmazzák egy kétkamrás vizsgálati rendszerben, amelyben a bőrkorongok a két kamra elválasztására szolgálnak. A bőrkorongok kíméletes módon leölt, 28–30 napos patkányokról származnak. A korrozív anyagok azok, amelyek a normál stratum corneum integritásának és barrierfunkciójának elvesztését okozzák, amit a TER meghatározott határérték alá történő csökkenésével mérnek (12). A patkány TER esetében az 5 kΩ határérték került kiválasztásra a széles tartományt felölelő vegyszerek nagyszámú adataiból, ahol az értékek túlnyomó többsége vagy világosan ezen érték felett (gyakran > 10 kΩ) vagy jóval alatta (gyakran < 3 kΩ) volt (12). Általában azok az anyagok, amelyek az állatokra nézve nem korrozívak, de irritatívak vagy nem irritatívak, nem csökkentik a TER-t e határérték alá. Továbbá más bőrkészítmények vagy más berendezés használata módosíthatja a határértéket, ami további validálásokat tesz szükségessé.
A TER-ben a pozitív értékek – beleértve az 5 kΩ körülieket is – kontrollvizsgálata céljából a vizsgálati eljárás részét képezi egy festékmegkötést biztosító lépés is. A festékmegkötést biztosító lépés meghatározza, hogy az ionáteresztő képesség fokozódását a stratum corneum fizikai károsodása okozza-e. A patkánybőrt alkalmazó TER módszer a B.4. vizsgálati módszer (2) alapján vizsgált nyúlban előre jelezte az in vivo korrozivitást. Meg kell jegyezni, hogy az emberi bőrpróbával való összehasonlításban a nyúlon végzett in vivo vizsgálat a bőrkorrózió és a bőrirritáció tekintetében erősen konzervatív (15).
1.5. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.5.1. Állatok
A patkányokra esett a választás, mert a bőrük vegyszerekkel szembeni érzékenysége ebben a vizsgálatban már korábban bebizonyosodott (10). A patkányok kora (a bőr begyűjtésének időpontjában) és származása különösen fontos annak biztosítására, hogy a szőrtüszők nyugvó fázisban legyenek, mielőtt a felnőtt szőr nőni kezd.
A fiatal, körülbelül 22 napos, hím vagy nőstény patkányok (Wistar vagy hasonló törzs) háton és horpaszon lévő szőrét kis nyírógéppel óvatosan eltávolítják. Azután az állatokat óvatosan törölgetve megmossák, miközben a lenyírt területet antibiotikumot tartalmazó oldatba merítik (amely a baktériumok növekedését hatékonyan gátló koncentrációban például sztreptomicint, penicillint, klóramfenikolt és amfotericint tartalmaz). Az állatokat az első mosást követő harmadik vagy negyedik napon ismételten megmossák antibiotikummal, és a második mosást követő három napon belül felhasználják őket, amikor a stratum corneum megerősödött a szőrtelenítés után.
1.5.2. A bőrkorongok előkészítése
Az állatokat 28–30 napos korukban kíméletes módon leölik; ez a kor kritikus. Ezután minden állatról eltávolítják a dorsolaterális bőrt, és a bőrtől való óvatos elválasztással lefejtik a felesleges szubkután zsírt. Egyenként körülbelül 20 mm-es átmérőjű bőrkorongokat távolítanak el. A bőrt a korongok felhasználása előtt tárolni lehet, ha kimutatható, hogy a pozitív és negatív kontrolladatok megegyeznek a friss bőrnél kapott adatokkal.
Minden bőrkorongot egy PTFE (politetrafluoroetilén) cső vége fölé helyeznek, biztosítva, hogy az epidermális felület érintkezzen a csővel. Egy „O” gumigyűrűt pontosan a cső végére illesztenek, hogy a helyén tartsa a bőrt, és hogy a felesleges szövetet levágja. A cső és az „O” gyűrű méreteit a 2. ábra mutatja. Az „O” gumigyűrűt aztán vazelinnel óvatosan tömítik a PTFE cső végéhez. A csövet egy rugós csipesz tartja, amelynek belsejében egy MgSO4-oldatot (154 mM) tartalmazó (1. ábra) befogadókamra van. A bőrkorongot teljesen bele kell meríteni a MgSO4-oldatba. Egyetlen patkánybőrből 10–15 bőrkorongot lehet készíteni.
A vizsgálat kezdete előtt az egyes állati bőrök minőség-ellenőrzése céljából megmérik két bőrkorong elektromos rezisztenciáját. Mindkét korongnak 10 kΩ-nál nagyobb rezisztenciaértéket kell mutatni ahhoz, hogy a többi korongot fel lehessen használni a vizsgálathoz. Ha a rezisztencia értéke kisebb mint 10 kΩ, e bőrdarabnak a többi korongját ki kell dobni.
1.5.3. A vizsgálat alkalmazása és a kontrollanyagok
A vizsgálati modell megfelelő elvégzése érdekében minden vizsgálathoz egyidejű pozitív és negatív kontrollértékeket kell használni. Egyetlen állatról származó bőrkorongokat kell használni. Az ajánlott pozitív és negatív anyagok: 10 M sósav, illetve desztillált víz.
A folyékony vizsgálati anyagokat (150 μl) a cső belsejében egyenletesen viszik fel az epidermális felületre. Szilárd anyagokkal történő vizsgálat esetén megfelelő mennyiségű szilárd anyagot egyenletesen visznek fel a korongra annak biztosítására, hogy az epidermisz teljes felületét beborítsa. A szilárd anyagra deionizált vizet (150 μl) öntenek, és a csövet óvatosan felrázzák. A bőrrel való maximális érintkezés elérése érdekében a szilárd anyagot 30 oC-ra lehet felmelegíteni olvadás vagy lágyítás céljából, vagy őrölni vagy porítani kell.
Minden egyes vizsgálathoz és kontrollanyaghoz három bőrkorongot használnak. A vizsgált anyagot 24 órán át alkalmazzák 20–23 oC-on. A vizsgált anyagot legfeljebb 30 oC-os csapvízsugárral addig mossák, amíg már nem lehet további anyagot eltávolítani.
1.5.4. TER-mérések
A bőr ellenállásának TER-ként történő mérése egy kisfeszültségű, váltakozó áramú Wheatstone-híd segítségével történik (13). A mérőeszköz általános jellemzői: 1–3 Volt üzemi feszültség, 50–1 000 Hz-es szinusz- vagy négyszöghullámú váltakozó áram és legalább 0,1–30 kΩ mérési tartomány. A validálási vizsgálatban használt mérőeszköz az induktivitást, kapacitást és rezisztenciát sorrendben 2 000 H, 2 000 μF és 2 MΩ értékekig méri 100 Hz-es vagy 1 kHz-es frekvencián, soros vagy párhuzamos értékek felhasználásával. A TER-mérések céljára a korrozivitásra vonatkozó vizsgálati méréseket elektromos ellenállásban rögzítik 100 Hz-es frekvencián és soros értékeket felhasználva. Az elektromos ellenállás mérése előtt a bőr felületi feszültségét megfelelő mennyiségű 70 %-os etil-alkohollal csökkentik, amely beborítja az epidermiszt. Néhány másodperc elteltével az etil-alkoholt eltávolítják a csőről, majd azután a szövetet 3 ml MgSO4-oldat (154 mM) hozzáadásával hidratálják. Az ellenállás kΩ/bőrkorongban való méréséhez a Wheatstone-híd elektródáit ráhelyezik a bőrkorong mindkét oldalára (1. ábra). Az elektródaméreteket és a krokodilcsipesz alá helyezett elektróda hosszúságát a 2. ábra mutatja. A belső elektródához csatolt csipesz az ellenállás mérésekor a PTFE cső tetején található annak biztosítására, hogy állandó hosszúságú elektróda merüljön az MgSO4-oldatba. A külső elektródát a befogadó kamra belsejébe úgy helyezik el, hogy az a kamra aljáig érjen. A rugós csipesz és a PTFE cső alja közötti távolságot állandó értéken tartják (2. ábra), mivel ez a távolság befolyásolja a kapott rezisztencia értékét. Következésképpen a belső elektróda és a bőrkorong közötti távolságnak állandónak és minimálisnak kell lenni (1–2 mm).
Ha a mért rezisztencia értéke nagyobb mint 20 kΩ, ezt valószínűleg a bőrkorong epidermális felületét borító vizsgált anyag maradványa okozhatja. Ennek a bevonatnak a további eltávolítását meg lehet próbálni például úgy, hogy a PTFE csövet kesztyűs hüvelykujjal befogják, és körülbelül 10 másodpercig rázogatják; az MgSO4-oldatot eltávolítják és a rezisztenciamérést friss MgSO4-gyel megismétlik.
A vizsgálati műszer jellemzői és méretei, valamint a használt vizsgálati eljárás befolyásolhatja a kapott TER-értékeket. Az 5 kΩ korróziós határértéket az ebben a módszerben leírt különleges műszerrel és eljárással kapott adatokból számolják ki. Ha a vizsgálati feltételek megváltoznak, vagy más készüléket használnak, akkor eltérő határ- és kontrollértékeket lehet alkalmazni. Ezért ajánlatos a módszert és az ellenállás határértékét a hitelesítési vizsgálatban (4) (5) használt kémiai anyagokból vagy a vizsgált kémiai anyagokhoz hasonló kémiai osztályú vegyi anyagokból kiválasztott referenciaszabványok sorozatának vizsgálatával meghatározni. A megfelelő referencia-vegyszerek jegyzéke az 1. táblázatban található.
1.5.5. Festékanyag-megkötő módszerek
Bizonyos nem korrozív anyagoknak való expozíció eredményezheti a rezisztencia 5 kΩ határérték alá történő csökkenését, ami lehetővé teszi az ionoknak a stratum corneumon való áthatolását, csökkentve ezáltal az elektromos rezisztenciát (5). Például felületaktív és semleges szerves anyagok és vegyszerek (beleértve a tisztítószereket, emulgeálószereket és más hatóanyagokat) eltávolíthatják a bőrzsírt, ezáltal a barrier az ionok számára áthatolhatóbbá válik. Így ha a vizsgált anyagok TER-értékei alacsonyabbak mint 5 kΩ vagy akörül vannak, ha nincs látható károsodás, akkor a kontrollon és kezelt szöveteken festékpenetrációs vizsgálatot kell végezni annak megállapítására, hogy a kapott TER-érték a bőr fokozottabb áteresztő képességének vagy a bőrkorróziónak az eredménye-e (3) (5). Ez utóbbi esetén, amikor a stratum corneum szétrepedt, ha a bőrfelszínre szulforhodamin B festéket visznek fel, ez gyorsan áthatol, és megfesti az alatta lévő szövetet. Ez a különleges festékanyag a vegyszerek széles skálájának ellenáll, és nem érinti a lent leírt kivonási eljárás.
1.5.5.1. Szulforhodamin B festékanyag alkalmazása és eltávolítása
A TER-vizsgálatot követően a magnézium-szulfátot eltávolítják a csőből, és gondosan megvizsgálják, hogy a bőrön látható-e károsodás. Ha nincs nagyobb látható károsodás, akkor szulforhodamin B festékanyag (Acid Red 52; C.I. 45100; EINECS-szám: 222-529-8; CAS-szám: 3520-42-1), 150 μl 10 tömegszázalékos desztillált vizes hígítású oldatát alkalmazzák minden bőrkorong epidermális felületén 2 órán át. Ezeket a bőrkorongokat azután a felesleges/meg nem tapadt festékanyag eltávolítása érdekében körülbelül 10 másodpercig legfeljebb szobahőmérsékletű csapvízben lemossák. Minden bőrkorongot óvatosan eltávolítanak a PTFE csőről, és egy deionizált vizet tartalmazó (8 ml) ampullába helyezik (pl. egy 20 ml üveg szcintillációs ampulla). Az ampullákat óvatosan 5 percen át rázogatják minden felesleges/meg nem tapadt festékanyag eltávolítása érdekében. Ezt az öblítési eljárást aztán megismétlik, azután a bőrkorongokat kiveszik, és desztillált vízben lévő 5 ml 30 tömegszázalékos nátrium-dodecil-szulfátot (SDS) tartalmazó ampullába helyezik, és egy éjszakán át 60 oC -on inkubálják.
Az inkubálást követően minden bőrkorongot eltávolítanak és kidobnak, és a fennmaradó oldatot 8 percen át 21 oC -on centrifugálják (relatív centrifugális erő ~175 × g). 1 ml felszínen úszó mintát felhígítanak 1:5 (v/v) [azaz 1 ml + 4 ml] arányban 30 tömegszázalékos SDS-szel desztillált vízben. Megmérik az oldat optikai sűrűségét (OD) 565 nm-nél.
1.5.5.2. A festékanyag-tartalom kiszámítása
A szulforhodamin B festékanyagot korongonként az OD-értékekből számítják ki (5) (szulforhodamin B festékanyag moláris extinkciós együtthatója 565 nm = 8,7 × 104; molekulatömeg = 580). A festékanyag-tartalmat minden egyes bőrkorong esetében megfelelő kalibrációs görbe használatával határozzák meg, és azután az ismétlésekhez átlagos festékanyag-tartalmat kalkulálnak.
2. ADATOK
A vizsgált anyagokra, valamint a pozitív és negatív kontrollokra vonatkozó rezisztenciaértékeket (kΩ) és átlagos festékanyag-tartalom értékekeit (μg/korong) adott esetben táblázatos formában kell megadni (egyedi vizsgálati adatok és átlagok ± S.D.), beleértve a párhuzamos/megismételt kísérleteknél kapott adatokat, átlagértékeket és az egyedi értékeket.
2.1. AZ EREDMÉNYEK ÉRTÉKELÉSE
Az átlag TER-eredmények akkor elfogadhatók, ha az egyidejű pozitív és negatív kontrollértékek a vizsgálati laboratóriumban a módszer elfogadható tartományába esnek. A fent leírt, módszertanra és készülékre vonatkozó elfogadható ellenállás-tartományokat az alábbi táblázat tartalmazza:
|
Kontroll |
Anyagok |
Ellenállás-tartomány (kΩ) |
|
Pozitív |
10 M sósav |
0,5—1,0 |
|
Negatív |
Desztillált víz |
10–25 |
Az átlagos festékanyag-megkötési eredmények azzal a feltétellel fogadhatók el, hogy az egyidejű kontrollértékek a módszer elfogadható tartományába esnek. A fent leírt, a módszertan és a készülék esetében a kontrollanyagokra javasolt elfogadható festéktartalomtartományokat az alábbi táblázat tartalmazza:
|
Kontroll |
Anyagok |
Festéktartalom tartománya (μg/korong) |
|
Pozitív |
10 M sósav |
40–100 |
|
Negatív |
Desztillált víz |
15–35 |
A vizsgált anyagnak a bőrre nincs korrozív hatása:
|
i. |
ha a vizsgált anyagra kapott átlagos TER-érték nagyobb mint 5 kΩ; vagy |
|
ii. |
az átlagos TER érték kisebb mint 5 kΩ vagy azzal egyenlő; és
|
A vizsgált anyagnak a bőrre korrozív hatása van:
|
i. |
ha az átlagos TER-érték kisebb mint 5 kΩ vagy azzal egyenlő, és a bőrkorong láthatóan károsodott; vagy |
|
ii. |
az átlagos TER érték kisebb mint 5 kΩ vagy azzal egyenlő, és
|
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek az alábbi információkat kell tartalmaznia:
|
|
Vizsgálati és kontrollanyagok:
|
|
|
Kísérleti állatok:
|
|
|
Vizsgálati feltételek:
|
|
|
Eredmények:
|
|
|
Az eredmények értékelése. |
|
|
Következtetések. |
4. HIVATKOZÁSOK
|
(1) |
OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6. |
|
(2) |
Testing Method B.4. Acute Toxicity: Dermal Irritation/Corrosion. |
|
(3) |
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report and recommendations of ECVAM Workshop 6. ATLA 23, 219–255. |
|
(4) |
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. in vitro 12, 471–482. |
|
(5) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhütter, H.-G, and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. in vitro 12, 483–524. |
|
(6) |
OECD (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, p. 62. |
|
(7) |
Balls, M., Blaauboer, B.J., Fentem. J.H., Bruner. L., Combes, R.D., Ekwall, B., Fielder. R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski. D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. The report and recommendations of ECVAM workshops. ATLA 23, 129–147. |
|
(8) |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf |
|
(9) |
ECVAM (1998). ECVAM News & Views. ATLA 26, 275–280. |
|
(10) |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDerm™, EPISKIN™ (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf. |
|
(11) |
OECD (2002) Extended Expert Consultation Meeting on The In vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st - 2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat. |
|
(12) |
Oliver, G.J.A., Pemberton, M.A., and Rhodes, C. (1986). An in vitro skin corrosivity test-modifications and validation. Fd. Chem. Toxicol. 24, 507–512. |
|
(13) |
Botham, P.A., Hall, T.J., Dennett, R., McCall, J.C., Basketter, D.A., Whittle, E., Cheeseman, M., Esdaile, D.J., and Gardner, J. (1992). The skin corrosivity test in vitro: results of an interlaboratory trial. Toxic. in vitro 6, 191–194. |
|
(14) |
Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709–720. |
|
(15) |
Basketter, D.A., Chamberlain, M., Griffiths, H.A., Rowson, M., Whittle, E., York, M. (1997). The classification of skin irritants by human patch test. Fd. Chem. Toxicol. 35, 845–852. |
|
(16) |
Oliver G.J.A, Pemberton M.A and Rhodes C. (1988). An In vitro model for identifying skin-corrosive chemicals. I. Initial Validation. Toxic. in vitro. 2, 7–17. |
1. ábra
A patkánybőr TER-vizsgálatára szolgáló műszer

2. ábra
Az alkalmazott politetrafluoroetilén- (PTFE) és befogadó csövek, valamint az elektródák méretei

A fent ábrázolt eszközök legfontosabb elemei:
|
— |
a PTFE cső belső átmérője, |
|
— |
az elektródák PTFE csőhöz és befogadó csőhöz viszonyított hosszúsága olyan legyen, hogy az elektródák ne érintkezzenek a bőrkoronggal, és hogy állandó hosszúságú elektróda legyen az MgSO4-oldatban, |
|
— |
az MgSO4-oldat befogadó csőben lévő mennyisége a PTFE csőben lévő szinthez viszonyítva adjon egy bizonyos folyadékmélységet, ahogyan azt az 1. ábra mutatja, |
|
— |
a bőrkorongot kellő erősséggel kell a PTFE csőhöz rögzíteni úgy, hogy az elektromos ellenállás a bőr tulajdonságaira vonatkozóan valós értéket adjon. |
B. 40A. IN VITRO BŐRKORRÓZIÓ: EMBERI BŐRMODELLEN VÉGZETT VIZSGÁLAT
1. MÓDSZER
Ez a kísérleti módszer egyenértékű az OECD TG 431 (2004) módszerrel.
1.1. BEVEZETÉS
A bőrkorrózió egy vizsgált anyag felvitelét követően a bőrben történt irreverzibilis szövetkárosodás (a veszélyes anyagok és keverékek osztályozásának és címkézésének globális harmonizált rendszere [GHS] meghatározása szerint) (1). Ez a vizsgálati módszer a bőrkorrózió értékeléséhez nem kívánja meg élő állatok vagy állati szövetek használatát.
A bőrkorrózió vizsgálata jellemzően kísérleti állatokon történő vizsgálatot foglal magában (2). A B.4. vizsgálati módszer felülvizsgálata során figyelembe vették az eljárással az állatoknak okozott fájdalom és szenvedés miatti aggodalmakat, és a felülvizsgált módszer már lehetővé teszi a bőrkorrózió alternatív, in vitro, fájdalom és szenvedés okozása nélküli módszerekkel történő meghatározását.
A szabályozási célokból végzett bőrkorrózió-vizsgálathoz használható alternatív vizsgálatok meghatározása felé az elővalidálási tanulmányok készítése jelentette az első lépést (3). Ezt követően zajlott le a bőrkorrózió vizsgálatára szolgáló in vitro módszerek (4) (5) hivatalos hitelesítési vizsgálata (6) (7) (8). E tanulmányok és más publikált szakirodalom (9) következtetései vezettek ahhoz az ajánláshoz, hogy az in vivo bőrkorróziós vizsgálatokhoz (10) (11) (12) (13) a következő vizsgálatok alkalmazhatók: az emberi bőrmodellen alapuló vizsgálat (e módszer) és a transzkután elektromos rezisztenciavizsgálat (lásd B.40. vizsgálati módszer).
A validálási tanulmányok szerint az emberi bőrmodelleket használó vizsgálatokkal (3) (4) (5) (9) megbízhatóan megkülönböztethetők a bőrkorróziót okozó és a bőrkorróziót nem okozó ismert anyagok. A vizsgálati jegyzőkönyv útbaigazítást adhat az erős és a kevésbé erős bőrkorróziót okozó szerek közötti különbségtételre is.
Az ebben a módszerben leírt vizsgálat lehetővé teszi a korrozív vegyi anyagok és keverékek meghatározását. Lehetővé teszi továbbá a nem korrozív anyagok és keverékek azonosítását, ha más létező információkon alapuló meghatározások bizonyítási súlya ezt alátámasztja (pl. pH, szerkezet-hatás kapcsolat, emberekre és/vagy állatokra vonatkozó adatok) (1) (2) (13) (14). Ez a módszer általában nem nyújt megfelelő információt a bőrirritációra vonatkozóan, és nem teszi lehetővé a korrozív anyagok Globális Harmonizált Osztályozási Rendszere (GHS) (1) által megengedett alkategóriákba történő sorolását.
Egyetlen bőrexpozíció után a bőrt ért helyi hatások teljes értékelésére ajánlatos a B.4. vizsgálati módszer (2) függeléke szerinti és a Globális Harmonizált Rendszer (GHS) (1) által meghatározott szekvenciális vizsgálati stratégiát folytatni. Ez a vizsgálati stratégia előírja, hogy in vitro bőrkorróziós (az ebben a módszerben leírtak szerint) és bőrirritációs vizsgálatokat kell lefolytatni mielőtt az élő állatokon végzett vizsgálatokat fontolóra lehetne venni.
1.2. FOGALOMMEGHATÁROZÁSOK
In vivo bőrkorrózió: a bőr irreverzibilis károsodása: nevezetesen vizsgálati anyag négy órán át tartó alkalmazását követően látható szövetelhalás az epidermiszen át és a dermiszben. A korrozív reakciókat jellemzik a fekélyek, vérzés, véres var és a 14 napos megfigyelés végén a bőr kifehéredése miatti elszíntelenedés, teljes területek szőrtelensége és hegek. A kérdéses károsodás értékeléséhez figyelembe kell venni a szövetkórtant.
Sejt-életképesség: egy sejtpopuláció teljes aktivitását mérő paraméter (pl. a sejtes mitokondriális dehidrogenázok képessége az életfontosságú MTT-festékanyag csökkenésére), amely a mért végponttól és az alkalmazott vizsgálat felépítésétől függően korrelál a sejtek teljes számával és/vagy az életképességükkel.
1.3. REFERENCIAANYAGOK
1. táblázat
Referencia-vegyszerek
|
Név |
EINECS-szám |
CAS-szám |
|
|
1,2-diaminopropán |
201-155-9 |
78-90-0 |
Erősen korrozív |
|
Akrilsav |
201-177-9 |
79-10-7 |
Erősen korrozív |
|
2-tert-butilfenol |
201-807-2 |
88-18-6 |
Korrozív |
|
Kálium-hidroxid (10 %) |
215-181-3 |
1310-58-3 |
Korrozív |
|
Kénsav (10 %) |
231-639-5 |
7664-93-9 |
Korrozív |
|
Oktánsav (kaprilsav) |
204-677-5 |
124-07-02 |
Korrozív |
|
4-amino-1,2,4-triazol |
209-533-5 |
584-13-4 |
Nem korrozív |
|
Eugenol |
202-589-1 |
97-53-0 |
Nem korrozív |
|
Fenetil bromid |
203-130-8 |
103-63-9 |
Nem korrozív |
|
Tetraklór-etilén |
204-825-9 |
27-18-4 |
Nem korrozív |
|
Izosztearinsav |
250-178-0 |
30399-84-9 |
Nem korrozív |
|
4-(Metilthio)-benzaldehid |
222-365-7 |
3446-89-7 |
Nem korrozív |
A felsorolt vegyszerek többsége az ECVAM nemzetközi validálási tanulmányhoz válogatott vegyszerek listájából származik (4). Kiválasztásuk a következő ismérvek alapján történt:
|
i. |
egyenlő számú korrozív és nem korrozív anyag; |
|
ii. |
kereskedelmi forgalomban kapható vegyszerek, amelyek lefedik a legtöbb vonatkozó vegyszerosztályt; |
|
iii. |
erősen korrozív és kevésbé korrozív anyagokat is tartalmaz annak érdekében, hogy lehetővé váljon a korrózióhatás szerinti megkülönböztetés; |
|
iv. |
olyan vegyszerek kiválasztása, amelyek a korrózió kivételével komolyabb kockázat nélkül kezelhetők laboratóriumban. |
1.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot helyileg egy háromdimenziós emberi bőrmodellre viszik fel, amely tartalmaz legalább egy funkcionális stratum corneummal rendelkező rekonstruált epidermiszt. A korrozív anyagot azáltal azonosítják, hogy egy megadott expozíciós időtartam alatt képes-e a meghatározott határérték alá csökkenteni a sejt életképességét (amelyet például az MTT-csökkenésvizsgálat segítségével határoznak meg [15]). Az emberi bőrmodell vizsgálatának alapelve azon a feltételezésen alapul, hogy a korrozív anyagok diffúzióval vagy erózióval képesek áthatolni a stratum corneumon, és az alatta lévő sejtrétegekre citotoxikus hatást gyakorolnak.
1.4.1. Az eljárás
1.4.1.1. Emberibőr-modell
Emberibőr-modelleket el lehet készíteni vagy kereskedelmi forgalomban be lehet szerezni (pl. az EpiDermTM és EPISKINTM modellek) (16) (17) (18) (19), illetve kifejleszthetők vagy elkészíthetők vizsgálati laboratóriumban (20) (21). Természetesen az emberi bőr használata esetén figyelembe kell venni a nemzeti és nemzetközi etikai szempontokat és feltételeket. Minden új modellt hitelesíteni kell (legalább az 1.4.1.1.2 pontban leírtaknak megfelelő mértékben). Az ehhez a vizsgálathoz használt emberibőr-modelleknek a következőknek kell megfelelni:
1.4.1.1.1.
Az epitélium felépítéséhez emberi keratinsejteket kell használni. Élő epitélsejtek több rétegének kell jelen lenni a funkcionális stratum corneum alatt. A bőrmodellnek lehet egy stromális összetevő rétege is. A stratum corneumnak többrétegűnek kell lennie, és megfelelő lipidszelvénnyel kell rendelkeznie, hogy nagy ellenállóképességgel funkcionális barriert képezzen a citotoxikus markerek gyors áthatolása ellen. A modell visszaszorító tulajdonságainak meg kell akadályozni, hogy az anyag áthatoljon a stratum corneum körül az élő szövetbe. A vizsgált vegyszerek stratum corneum körül történő áthatolása a bőr expozíciójának gyenge modellezését eredményezi. A bőrmodellnek baktériumfertőzéstől mentesnek (beleértve a mikoplazmát) és gombamentesnek kell lennie.
1.4.1.1.2.
Az életképesség terjedelmének mennyiségi meghatározása általában MTT segítségével, vagy más metabolikusan átalakított élő festékanyaggal történik. Ezekben az esetekben a negatív kontrollszövetből kivont (szolibilizált) festékanyag optikai sűrűségének (OD) az extrahálásra használt oldószer OD-jénél legalább 20-szor nagyobbnak kell lennie (összefoglalásként lásd [22]). A negatív kontrollszövetnek a vizsgálati expozíciós időszak alatt állandónak kell lennie a tenyészetben (hasonló életképesség-mérést nyújt). A stratum corneumnak kellően erősnek kell lennie annak érdekében, hogy bizonyos citotoxikus markervegyszerek (pl. 1 % Triton X-100) gyors áthatolásának ellenálljon. Ezt a tulajdonságot a sejt életképességének 50 %-kal való csökkentéséhez (ET50) szükséges expozíciós idővel lehet meghatározni (pl. az EpiDermTM és EPISKINTM modellek esetében ez > 2 óra). A szövetnek idővel és lehetőleg laboratóriumok között reprodukálhatónak kell lennie. Ezenkívül, ha kiválasztott vizsgálati eljárásban használjuk, akkor képesnek kell lennie arra, hogy előre jelezze a referencia-vegyszer korróziós képességét (lásd 1. táblázat).
1.4.1.2. A vizsgálat alkalmazása és a kontrollanyagok
Valamennyi kezeléshez (expozíciós időhöz) két szövetpéldányt kell használni, a kontrollt is beleértve. Folyékony anyagok esetén a bőr felületére egyenletesen elosztva elegendő vizsgált anyagot kell felvinni: minimum 25 μl/cm2-t kell használni. Szilárd anyagok esetén a bőrön egyenletesen elosztva elegendő vizsgált anyagot használjunk, és deionizált vagy desztillált vízzel nedvesítsük be a bőrrel való jó érintkezés biztosítására. Ahol szükséges, a szilárd anyagok alá a felvitel előtt púdert kell tenni. A felvitel módjának meg kell felelnie a vizsgált anyagnak (lásd például az 5. referenciát). Az expozíciós idő lejártával a vizsgált anyagot megfelelő pufferrel vagy 0,9 % NaCl-dal óvatosan le kell mosni a bőrről.
A vizsgálati modell megfelelő teljesítménye érdekében minden vizsgálathoz egyidejűleg pozitív és negatív kontrollértékeket kell használni. A javasolt pozitív kontrollanyag jégecet vagy 8N KOH. A javasolt negatív kontrollok 0,9 % NaCl vagy víz.
1.4.1.3. A sejtek életképességének mérése
Csak kvantitatív, hitelesített módszereket lehet a sejt életképességének mérésére használni. Továbbá az életképesség mérésének egy háromdimenziós szövetkonstrukcióban történő használattal kell összeegyeztethetőnek lennie. A nem specifikus festékanyagkötés nem akadályozhatja az életképesség mérését. A fehérjekötő festékanyagok és azok, amelyek nem mennek át metabolikus átalakuláson (pl. neutrálvörös) ezért nem megfelelők. A leggyakrabban használt vizsgálat az MTT [3-(4,5-Dimetilthiazol-2il)-2,5-difeniltetrazólium bromid, Tiazolil kék: EINECS-szám: 206-069-5, CAS-szám: 298-93-1)] redukció, amelyről kimutatták, hogy pontos és megismételhető eredményeket nyújt (5), de más vizsgálat is használható. A bőrmintát 3 órára egy megfelelő inkubációs hőmérsékletű, megfelelő koncentrációjú MTT–oldatba (pl. 0,3–1 mg/ml) teszik. A kicsapódott kék formazán terméket aztán oldószer (izopropanol) használatával eltávolítják, és 540 és 595 nm hullámhossz között az OD-meghatározása útján megmérik a formazán koncentrációját.
A vizsgált anyagnak az élő festékanyagra gyakorolt vegyi hatása hasonlíthat a sejtmetabolizmus-hatásra, ami az életképesség téves megállapításához vezet. Ennek bekövetkezését mutatták ki, amikor az ilyen vizsgált anyagot öblítéssel nem távolították el teljesen a bőrről (9). Ha a vizsgált anyag közvetlenül az élő festékanyagra hat, további ellenőrzéseket kell alkalmazni annak megállapítására, hogy a vizsgált anyag befolyásolja-e az életképesség mérését, illetve el kell végezni megfelelő korrekciókat (9) (23).
2. ADATOK
Minden egyes szövet esetében a vizsgált anyagra vonatkozó OD-értékeket és a százalékban meghatározott sejtéletképesség-értékeket, valamint a pozitív és negatív kontrollokat táblázatba foglaltan kell megadni, beleértve adott esetben a párhuzamos/megismételt kísérletek során kapott adatokat, az átlagértékeket és az egyedi adatokat.
2.1. AZ EREDMÉNYEK ÉRTÉKELÉSE
Minden vizsgált mintára vonatkozó OD-értéket fel lehet használni az önkényesen 100 %-nak vett negatív kontrollhoz viszonyított százalékos életképesség kiszámításához. A sejtéletképesség százalékban megállapított határértékét, amely megkülönbözteti a korrozív és nem korrozív vizsgált anyagot (vagy a korrozív osztályokat) vagy azt a statisztikai módszert (módszereket), amelyet az eredmények kiértékelésére és a korrozív anyagok azonosítására használnak, pontosan meg kell határozni, dokumentálni kell, valamint igazolni kell az értékek megfelelőségét. Általában ezeket a határértékeket a vizsgálat optimalizálása során állapítják meg, amit egy elővalidálási szakaszban tesztelnek, és egy hitelesítési vizsgálatban igazolnak. Például az EpiDerm™ modellel összefüggésben a korróziós képesség előrejelzése a következő (9):
A vizsgált anyagnak a bőrre korrozív hatása van:
|
i. |
ha az életképesség 3 perces expozíció elteltével kisebb mint 50 %, vagy |
|
ii. |
ha az életképesség 3 perces expozíció elteltével 50 % vagy annál nagyobb, és az életképesség egy óra expozíció elteltével kisebb mint 15 %. |
A vizsgált anyagnak a bőrre nincs korrozív hatása:
|
i. |
ha az életképesség 3 perces expozíció elteltével 50 % vagy annál nagyobb, és az életképesség egy óra expozíció elteltével nagyobb mint 15 % vagy azzal egyenlő. |
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek az alábbi információkat kell tartalmaznia:
|
|
Vizsgált és kontrollanyag :
|
|
|
A használt bőrmodell és protokoll indoklása. |
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények értékelése. |
|
|
Következtetés. |
4. HIVATKOZÁSOK
|
(1) |
OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6. |
|
(2) |
Testing Method B.4. Acute Toxicity: Dermal Irritation/Corrosion. |
|
(3) |
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report recommendations of EC VAM Workshop 6 ATLA 23, 219–255. |
|
(4) |
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. In vitro 12, 471–482. |
|
(5) |
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. In vitro 12, 483–524. |
|
(6) |
OECD (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, p. 62. |
|
(7) |
Balls, M., Blaauboer, B.J., Fentem, J.H., Bruner, L., Combes, R.D., Ekwall, B., Fielder, R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski, D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. Test report and recommendations of ECVAM workshops. ATLA 23, 129–147. |
|
(8) |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf. |
|
(9) |
Liebsch, M., Traue, D., Barrabas, C, Spielmann, H., Uphill, P., Wilkins, S., McPherson, J.P., Wiemann, C, Kaufmann, T., Remmele, M. and Holzhutter, H.G. (2000). The ECVAM prevalidation study on the use of EpiDerm for skin Corrosivity testing. ATLA 28, pp.371–401. |
|
(10) |
ECVAM (1998). ECVAM News & Views. ATLA 26, 275–280. |
|
(11) |
ECVAM (2000). ECVAM News & Views. ATLA 28, 365–67. |
|
(12) |
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDerm™, EPISKIN™ (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf. |
|
(13) |
OECD (2002) Extended Expert Consultation Meeting on The In vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st-2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat. |
|
(14) |
Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709–720. |
|
(15) |
Mosmann, T. (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity asssays. J. Immunol. Meth. 65, 55–63. |
|
(16) |
Cannon, C.L., Neal, P.J., Southee, J.A., Kubilus, J., and Klausner, M., 1994. New epidermal model for dermal irritancy testing. Toxic. In vitro 8, 889–891. |
|
(17) |
Ponec, M., Boelsma, E., Weerheim, A., Mulder, A., Boutwstra, J., and Mommaas, M., 2000. Lipid and ultrastructural characterization of reconstructed skin models. International Journal of Pharmaceutics. 203, 211–225. |
|
(18) |
Tinois E, Gaetani Q, Gayraud B, Dupont D, Rougier A, Pouradier DX (1994). The Episkin model: Successful reconstruction of human epidermis in vitro. In In vitro Skin Toxicology. Edited by A Rougier, AM Goldberg and HI Maibach: 133–140. |
|
(19) |
Tinois E, Tiollier J, Gaucherand M, Dumas H, Tardy M, Thivolet J (1991). In vitro and post-transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute. Experimental Cell Research 193: 310–319. |
|
(20) |
Parentau, N.L., Bilbo, P., Molte, C.J., Mason, V.S., and Rosenberg, H. (1992). The organotypic culture of human skin keratinocytes and fibroblasts to achieve form and function. Cytotechnology 9, 163–171. |
|
(21) |
Wilkins, L.M., Watson, S.R., Prosky, S.J., Meunier, S.F., Parentau, N.L. (1994). Development of a bilayered living skin construct for clinical applications. Biotechnology and Bioengineering 43/8, 747–756. |
|
(22) |
Marshall, N.J., Goodwin, C.J., Holt, S.J. (1995). A critical assessment of the use of microculture tetrazolium assays to measure cell growth and function. Growth Regulation 5, 69–84. |
|
(23) |
Fentem, J.H., Briggs, D., Chesne', C, Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Rouget, R., and van de Sandt, J.J.M., and Botham, P.A. (2001). A prevalidation study on in vitro tests for acute skin irritation: results and evaluation by the Management Team. Toxic. In vitro 15, 57–93. |
B.41. IN VITRO 3T3 NRU FOTOTOXICITÁS-VIZSGÁLAT
1. MÓDSZER
Ez a vizsgálati módszer egyenértékű az OECD TG 432 (2004) számú vizsgálattal.
1.1. BEVEZETÉS
A fototoxicitás a bőrnek először bizonyos vegyi anyagoknak, majd ezt követően (kisebb dózisoknál látható) fénynek való expozíciója után bekövetkező, vagy hasonlóan, valamely vegyi anyag szisztematikus alkalmazása után a bőr besugárzásával előidézett vagy felerősített toxikus reagálása.
Az in vitro 3T3 NRU fototoxicitás-vizsgálat a vizsgált anyag fénynek való expozíció következtében aktivált vegyi anyag által kiváltott fototoxikusságának meghatározására szolgál. A vizsgálat a vegyi anyagnak kitett sejtek életképességében fény jelenlétében, illetve hiányában bekövetkező relatív csökkenés által méri a foto-citotoxicitást. A vizsgálattal fototoxikusnak talált anyag valószínűleg a bőrre történő szisztematikus felvitelt és elosztást, illetve helyi alkalmazást követően, in vivo is fototoxikus.
Számos különböző vegyi anyagról megállapították, hogy fototoxikus hatást váltanak ki (1) (2) (3) (4). Ezek közös tulajdonsága, hogy képesek a napfénytartományon belül fényenergiát elnyelni. A fotokémia első törvénye (a Grotthaus–Draper-törvény) szerint a fotoreakcióhoz elegendő fénykvantum abszorpciójára van szükség. Ezért bármely biológiai vizsgálat elvégzése előtt az OECD 101. vizsgálati iránymutatásának megfelelően meg kell határozni a vizsgált vegyi anyag UV/látható fény abszorpciós spektrumát. Egyes javaslatok szerint ha a molekuláris extinkciós/abszorpciós együttható kisebb mint 10 liter × mol–1 × cm–1, akkor a vegyi anyag valószínűleg nem fotoreaktív. Az ilyen vegyi anyagot nem valószínű, hogy a káros fotokémiai hatások kimutatása céljából az in vitro 3T3 NRU fototoxicitás-vizsgálattal vagy más biológiai vizsgálattal tesztelni kell (1) (5). Lásd az 1. függeléket is.
Az in vitro 3T3 NRU fototoxicitás-vizsgálat megbízhatósága és alkalmassága nemrégiben értékelésre került (6) (7) (8) (9). Az in vitro 3T3 NRU fototoxicitás-vizsgálatról kimutatták, hogy előre jelzi az állatokban és az emberben in vivo jelentkező akut fototoxikus hatásokat. A vizsgálat nem alkalmas egyéb olyan káros hatások kimutatására, amelyek vegyi anyagok és a fény együttes hatása alapján jelentkezhetnek, például nem mutatja ki a fotogenotoxicitást, a fotoallergiát vagy a fotokarcinogenitást, és nem alkalmas a fototoxikusság mennyiségi kifejezésére. A vizsgálatnak nem célja a fototoxicitás indirekt mechanizmusainak, a vizsgálati anyag metabolitjai által kiváltott hatásoknak vagy az elegyek hatásainak mérése sem.
Bár az anyagcserét folytató szervezetek használata általános követelmény minden genotoxikus és rákkeltő hatás előrejelzését célzó in vitro vizsgálat esetében, a fototoxicitás esetében mindeddig csak elenyésző számú esetben találták úgy, hogy anyagcseretranszformáció szükséges ahhoz, hogy a vegyi anyag in vivo vagy in vitro fototoxinként viselkedjen. Így nem szükséges és tudományos szempontból sem indokolt, hogy a jelen vizsgálatot anyagcsereaktív szervezettel kelljen elvégezni.
1.2. FOGALOMMEGHATÁROZÁSOK
Irradiancia: valamely felületre eső ultraibolya (UV) vagy látható beeső fény intenzitása, W/m2-ben vagy mW/cm2-ben mérve.
Fénydózis: valamely felületre eső ultraibolya (UV) vagy látható beeső sugárzás mennyisége (= intenzitás × idő), Joule (= W × s) per felületegységben (pl. J/m2 vagy J/cm2) kifejezve.
UV-fény-hullámsávok: a CIE (Nemzetközi Világítástechnikai Bizottság) ajánlása szerinti jelölések: UVA (315–400 nm), UVB (280–315 nm) és UVC (100–280 nm). Más jelölések is használatosak; az UVB és UVA közötti választóvonalat gyakran 320 nm-re teszik, és az UVA felosztható UV-Al-re és UV-A2-re, ahol a határvonal körülbelül 340 nm.
A sejt életképessége: valamely sejtpopuláció teljes aktivitását mérő paraméter (pl. a vitális neutrálvörös festékanyag felvétele a sejtek lizoszómájába), amely a mérési végponttól és az alkalmazott vizsgálat felépítésétől függően korrelál a sejtek összmennyiségével és/vagy vitalitásával.
Relatív sejtéletképesség: a sejt életképessége a teljes vizsgálati eljáráson (vagy +Irr vagy –Irr) keresztülvitt, de a vizsgált vegyi anyaggal nem kezelt (negatív) kontrolloldószerekhez képest kifejezve.
PIF (fotoirritációs tényező): a vizsgált vegyi anyag nem citotoxikus UV A/látható fénnyel való besugárzás hiányában (–Irr) és annak jelenlétében (+Irr) előállított két, egyenlően hatékony citotoxikus koncentrációjának (IC50) összehasonlításával meghatározott tényező.
IC 50 : a vizsgált vegyi anyag azon koncentrációja, amelynél a sejt életképessége 50 %-ra esik vissza.
MPE (átlagos fényhatás): nem citotoxikus UV A/látható fénnyel való besugárzás hiányában (–Irr) és annak jelenlétében (+Irr) előállított koncentráció-válaszgörbék matematikai elemzéséből származtatott jellemző.
Fototoxicitás: olyan akut toxikus reakció, amelyet a bőr előbb bizonyos vegyi anyagoknak, majd azután fénynek való expozíciója idéz elő, vagy amelyet hasonlóan, valamely vegyi anyag szisztematikus alkalmazása után a bőr besugárzása idézi elő.
1.3. A VIZSGÁLATI MÓDSZER ELVE
Az in vitro 3T3 NRU fototoxicitás-vizsgálat egy vegyi anyagnak a szimulált napfény nem citotoxikus dózisának jelenlétében és anélkül való expozíciója során kimutatott citotoxicitásának összehasonlításán alapul. A citotoxicitást ebben a vizsgálatban a vitális neutrálvörös festékanyag felvételének koncentrációfüggő csökkenésével fejezik ki, amelyet 24 órával a vizsgálati vegyi anyaggal való kezelés és a besugárzás után mérnek (10). Az NR (neutrálvörös) egy gyengén kationos festékanyag, amely diffúzió nélkül könnyedén áthatol a sejthártyán, majd a sejten belül a lizoszómában összegyűlik. Az érzékeny lizoszómamembrán felületének módosulásai a lizoszóma törékenységéhez és egyéb elváltozásaihoz vezetnek, amelyek egyre inkább visszafordíthatatlanná válnak. Ezeknek a xenobiotikumok által előidézett változásoknak a következménye, hogy az NR felvétele és megkötése lecsökken. Így lehetőség van az életképes, a sérült vagy a halott sejtek megkülönböztetésére, ami ennek a vizsgálatnak az alapja.
Balb/c 3T3 sejteket 24 órán át tenyésztenek monorétegek képződésének céljából. Vizsgált vegyi anyagonként két 96 lyukú lemezt egy órán keresztül előinkubálnak a vizsgálati anyag nyolc különböző koncentrációjával. Ezek után a két lemez közül az egyiket a legnagyobb dózisú nem citotoxikus sugárzásnak teszik ki, miközben a másik lemezt sötétben tartják. Ezt követően mindkét lemezen a kezelési közeget tenyésztőközegre cserélik, és további 24 órás inkubációs idő elteltével meghatározzák a sejt életképességét a neutrálvörös felvétele alapján. A sejt életképességét a kezeletlen kontrolloldószer százalékában fejezik ki, és minden vizsgálati koncentrátumra vonatkozóan kiszámítják. A fototoxicitás meghatározása érdekében összehasonlítják a besugárzás jelenlétében vagy annak hiányában kapott koncentrációtól függő reakciókat, általában IC50 szinten, azaz a sejt életképességét 50 %-ra csökkentő koncentráció összehasonlítva a kezeletlen kontollanyaggal.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. Előkészületek
1.4.1.1. Sejtek
A validálási célú vizsgálat során az Amerikai Fajtakultúra Gyűjteményből (ATCC, Manassas, VA, USA), illetve az Európai Sejtkultúra Gyűjteményből (ECACC, Salisbury, Wiltshire, Egyesült Királyság) származó állandó egér fibroblaszt sejtvonal (Balb/c 3T3) 31. sz. klónját használták, ezért ajánlatos jól minősített sejtlerakatból ilyen sejteket beszerezni. Ugyanebben a vizsgálati eljárásban más sejtek vagy sejtvonalak is használhatók, de a tenyésztés feltételeit hozzá kell igazítani a sejtek egyedi igényeihez, és ki kell mutatni az egyenértékűséget.
A sejteket rendszeresen ellenőrizni kell, hogy nem történt-e mikoplazma-fertőzés, és csak azok a sejtek használhatók fel, amelyekben ilyet nem találtak (11).
Fontos, hogy az ebben a módszerben leírt minőség-ellenőrzési eljárásnak megfelelően rendszeresen ellenőrizzék a sejtek UV-érzékenységét. Mivel a sejtek UVA-érzékenysége a passzázsok számával nőhet, a lehető legkisebb, lehetőleg 100-nál kisebb passzázsszámú Balb/c 3T3 sejteket kell használni (lásd az 1.4.2.2.2. szakaszt és a 2. függeléket).
1.4.1.2. Tenyésztőközegek és tenyésztési körülmények
A rutinszerű szaporítás és a vizsgálati eljárás során megfelelő tenyésztőközeget és inkubálási körülményeket kell alkalmazni, például a Balb/c 3T3 sejtek esetében ez DMEM (Dulbecco's Modified Eagle's Medium) kiegészítve 10 % újszülöttborjú-szérummal, 4mM glutamin, penicillin (100 IU) és sztreptomicin (100 μg/ml), valamint párásított inkubálás 37 oC-on, 5–7,5 % CO2 a puffertől függően (lásd az 1.4.1.4. szakasz második bekezdését.). Különösen fontos, hogy a sejttenyésztés körülményei a használt sejtek vagy sejtvonalak normál sejtciklusidején belüli időtartamot biztosítsanak.
1.4.1.3. A tenyészetek elkészítése
Fagyasztott sejtkultúra-állományból származó sejteket megfelelő sűrűségben ráoltanak a tenyésztőközegre, és az in vitro 3T3 NRU fototoxicitás-vizsgálatban történő felhasználást megelőzően legalább egyszer másodlagos tenyészetet hoznak létre.
A fototoxicitás-vizsgálathoz használt sejteket olyan sűrűségben oltják rá a tápoldatra, hogy mindaddig ne következzen be a tenyészetek konfluenciája, amíg a sejtráoltás után 48 órával meg nem határozzák a sejtek életképességét. A 96 lyukú lemezeken tenyésztett Balb/c 3T3 sejtek esetében a javasolt elhelyezési sűrűség 1 × 104 sejt/lyuk.
Minden egyes vizsgálandó vegyi anyag esetében a sejteket két darab 96 lyukú lemezre kell ráoltani, amelyeket azután párhuzamosan, a teljes vizsgálati eljárás folyamán egyforma tenyésztési feltételek között kell tartani, kivéve azt az időszakot, amikor az egyik lemezt besugározzák (+Irr), míg a másikat sötétben tartják (–Irr).
1.4.1.4. A vizsgálandó anyag elkészítése
A vizsgálandó anyagokat frissen, közvetlenül a felhasználás előtt kell elkészíteni, kivéve akkor, ha a tárolás során való stabilitásukat adatok igazolják. Ajánlatos minden vegyi kezelést és a sejtek kezdeti kezelését olyan fényviszonyok mellett elvégezni, hogy a besugárzást megelőzően ne következhessen be a vizsgálandó anyag fotoaktivitása vagy degradációja.
A vizsgálandó vegyi anyagokat pufferolt sóoldatban, például Earle-féle kiegyenlített sóoldatban (EBSS) vagy egyéb fiziológiailag kiegyenlített pufferoldatban fel kell oldani; az oldatok nem tartalmazhatnak fehérjekomponenseket, fény elnyelő komponenseket (pl. pH-jelző színeket és vitaminokat) annak érdekében, hogy elkerülhető legyen a besugárzás alatti interferencia. Mivel a besugárzás során a sejteket mintegy 50 percig a CO2-inkubátoron kívül tartják, ügyelni kell arra, hogy ne következhessen be alkalizáció. Gyenge puffer, például EBSS használata esetén ez a sejtek 7,5 % CO2-ban való inkubációjával érhető el. Ha a sejteket csak 5 % CO2-ban inkubáljuk, akkor erősebb puffert kell választani.
A vízben kevéssé oldódó vizsgálandó vegyi anyagokat megfelelő oldószerben kell feloldani. Ha oldószert használnak, akkor annak állandó mennyiségben kell jelen lennie minden tenyészetben, azaz a negatív kontrollban (kontrolloldatban) éppúgy, mint a vizsgált vegyi anyag minden koncentrációjában, továbbá ebben a koncentrációban nem szabad citotoxikusnak lennie. A vizsgált vegyi anyag koncentrációit úgy kell megválasztani, hogy a csapadékképződés és az oldat zavarossága elkerülhető legyen.
A javasolt oldószerek a dimetil-szulfoxid (DMSO) és az etanol (ETOH). Más kis citotoxicitású oldószerek is alkalmasak lehetnek. A használat előtt az oldószereket jellegzetes tulajdonságaik szempontjából meg kell vizsgálni, például reakció a vizsgálandó vegyi anyaggal, a fototoxikus hatás elfojtása, radikális tisztítási jellemzők és/vagy kémiai stabilitás az oldószerben.
Az oldódás örvényes elegyítéssel és/vagy szonikus beavatkozással és/vagy megfelelő hőmérsékletre történő felmelegítéssel elősegíthető, kivéve akkor, ha ez a vizsgálandó vegyi anyag stabilitását befolyásolja.
1.4.1.5. Besugárzási körülmények
1.4.1.5.1.
A fototoxicitás-vizsgálat során nagyon lényeges szempont a megfelelő fényforrás és szűrők megválasztása. Az in vivo fototoxikus reakciók általában az UVA-fényhez és a látható tartományokhoz kapcsolódnak (3) (12), míg az UVB általában kisebb jelentőségű, de erősen citotoxikus; a citotoxicitás 1 000-szeresére nő, ha a hullámhossz 313 nm-ről 280 nm-re változik (13). A megfelelő fényforrás kiválasztása során kritériumként azt a követelményt is figyelembe kell venni, hogy a fényforrás által kibocsátott hullámhosszt a vizsgált vegyi anyagnak el kell nyelnie (abszorpciós spektrum), és a fény (ésszerű expozíciós idő alatt elérhető) dózisának elegendőnek kell lennie az ismert fotocitotoxikus vegyi anyagok kimutatásához. Ezenkívül az alkalmazott hullámhossz és dózis indokolatlanul nem károsíthatja a vizsgálati rendszert, például a hőkibocsátást (infravörös tartomány).
Optimális mesterséges fényforrásnak a napfény napfényszimulátorral történő szimulációja tekinthető. A szűrtnapfény-szimulátor spektrális energiaeloszlásának a szabadtéri nappali fény (14) szerinti spektrális energiaeloszlása közelében kell lennie. Napfényszimulátorként xenon ívfényeket és (bevont) higany-fém halogenid ívfényeket használnak (15). Ez utóbbiaknak az az előnye, hogy kevesebb hőt sugároznak és olcsóbbak, de a napfényhez nem hasonlítanak olyan tökéletesen, mint a xenon ívfények. Mivel minden napfényszimulátor jelentős mennyiségű UVB-t bocsát ki, a nagy citotoxicitású UVB-hullámhosszok csökkentése érdekében megfelelő szűrést kell alkalmazni. Mivel a sejtkultúra műanyag anyagai UV-stabilizátorokat tartalmaznak, a spektrumot ugyanolyan 96 lyukú lemezfedélen át kell mérni, mint amilyet a vizsgálat során használnak. Függetlenül attól, hogy a spektrum egyes részeit milyen módszerrel szűrjük ki, illetőleg függetlenül az alkalmazott eszközök elkerülhetetlen szűrőhatásától, a szűrők mögött regisztrált spektrum nem térhet el a szabványos szabadtéri nappali fényétől (14). A (8) és a (16) irodalomban található egy példa az in vitro 3T3 NRU fototoxicitás-vizsgálat validálási vizsgálatában használt szűrtnapfény-szimulátor spektrális irradianciaeloszlására. Lásd még a 2. függelék 1. ábráját is.
1.4.1.5.2.
Minden fototoxicitás-vizsgálat előtt megfelelő széles sávú UV-mérővel rendszeresen ellenőrizni kell a fény intenzitását (az irradianciát). Az intenzitást ugyanolyan 96 lyukú lemezfedélen át kell mérni, mint amilyet a vizsgálat során használnak. Az UV-mérőt a fényforráshoz kell kalibrálni. Ellenőrizni kell az UV-mérő viselkedését, erre a célra ajánlatos ugyanolyan típusú és ugyanúgy kalibrált másik UV-mérőt használni. Ideális esetben nagyobb időközönként spektroradiométerrel meg kell mérni a szűrt fényforrás spektrális irradianciáját, illetőleg ellenőrizni kell a széles sávú UV-mérő kalibrálását.
A vizsgálatok szerint az 5 J/cm2 dózis (az UVA-tartományban mérve) a Balb/c 3T3 sejtekre nézve nem citotoxikus, és kellően hatékony ahhoz, hogy aktiválja a vegyi anyagokat a fototoxikus reakció kiváltására (6) (17), például 5 J/cm2 50 perc alatt történő eléréséhez 1,7 mW/cm2 irradianciát kellett beállítani. Lásd a 2. függelék 2. ábráját. Másik sejtvonal vagy másik fényforrás használata esetén előfordulhat, hogy a sugárdózist úgy kell kalibrálni, hogy olyan sugárzási dózist lehessen kiválasztani, hogy az ne károsítsa a sejteket, de elegendő legyen ahhoz, hogy szabályszerű fototoxicitást váltson ki. A fénynek való expozíció idejét a következőképpen kell kiszámítani:
|
|
(1J=1 Wsec) |
1.4.2. Vizsgálati körülmények
1.4.2.1. A vizsgált anyag koncentrációi
A fény jelenlétében (+Irr) vagy hiányában (–Irr) vizsgált vegyi anyag koncentrációinak alkalmas tartományát dózistartomány-meghatározási kísérletek során kell meghatározni. Az oldhatóságot érdemes lehet kétszer: az első alkalom után 60 perc (vagy bármilyen más kezelési idő) elteltével másodszor is megállapítani, mivel az oldhatóság időben, illetve az expozíció során megváltozhat. A nem megfelelő tenyésztési feltételek, illetve az erősen savas vagy lúgos vegyi anyagok által kiváltott toxicitás elkerülése érdekében a vizsgált vegyi anyaggal kezelt sejtkultúrák pH-jának a 6,5–7,8 tartományban kell lennie.
A vizsgált anyag legnagyobb koncentrációjának a fiziológiai vizsgálati feltételeken belül kell lennie, például az ozmotikus és a pH-feszültséget kerülni kell. A vizsgált vegyi anyagtól függően szükséges lehet más olyan fizikai-kémiai tulajdonságokat is figyelembe venni, amelyek behatárolják a legnagyobb vizsgálati koncentrációt. A telítettségi pontnak megfelelő koncentrációig nem toxikus, viszonylagosan oldhatatlan anyagok esetében a fizikailag lehetséges legnagyobb koncentrációt kell vizsgálni. Általánosságban a vizsgált vegyi anyag kicsapódását minden vizsgálati koncentrációban kerülni kell. A vizsgált anyag maximális koncentrációja ne haladja meg a 1 000 μg/ml-t; az ozmolalitás ne haladja meg a 10 mmolart. Nyolc vizsgálati koncentrációból álló, konstans hígítási tényezőjű geometriai oldatsorozatot kell használni (lásd a 2.1. szakasz második bekezdését).
Ha a dózistartomány-meghatározási vizsgálat azt jelzi, hogy a vizsgálandó vegyi anyag a sötétben végzett kísérletben (–Irr) a koncentrációs határig nem citotoxikus, de besugárzás hatására (+Irr) erősen citotoxikus, az adatminőségi követelmény teljesítéséhez a (+Irr) kísérletek céljára kiválasztott koncentrációs tartományok különbözhetnek a (–Irr) kísérletekhez kiválasztottaktól.
1.4.2.2. Ellenőrzések
1.4.2.2.1.
A sejteket a fényforrásra való érzékenységük tekintetében életképességük meghatározásával, növekvő dózisú besugárzás alkalmazásával rendszeresen ellenőrizni kell (körülbelül minden ötödik passzázs után). Ebben a kiértékelésben több besugárzási dózist kell alkalmazni, köztük a 3T3 NRU fototoxicitás-vizsgálathoz használt szintnél jóval nagyobbakat is. E dózisok nagysága a legkönnyebben a fényforrás UV-részének mérésével határozható meg. A sejteket az in vitro 3T3 NRU fototoxicitás-vizsgálatban használt sűrűségben kell behelyezni, majd másnap besugárzásnak kell őket alávetni. Ezután egy nappal a neutrálvörös felvétele alapján meghatározható a sejt életképessége. Ki kell mutatni, hogy a keletkező legnagyobb nem citotoxikus dózis (pl. a validálási vizsgálatban: 5 J/cm2 [UVA]) elegendő a referenciavegyianyagok besorolásának helyes megállapításához (1. táblázat).
1.4.2.2.2.
A vizsgálat abban az esetben felel meg a minőségi követelménynek, ha a sugárkezelt negatív/kontrolloldószerek a nem sugárkezelt negatív/oldószerrel összehasonlítva 80 %-nál nagyobb életképességet mutatnak.
1.4.2.2.3.
A kontrolloldószerekből kivont neutrálvörös abszolút optikai sűrűsége (OD 540 NRU ) jelzi, hogy a lyukanként elhelyezett 1x104 sejt a vizsgálat két napja alatt a rendes megkettőződési időnek megfelelően fejlődött-e. A vizsgálat akkor felel meg az elfogadási kritériumnak, ha a kezeletlen kontollok OD540 NRU átlaga ≥ 0,4 (azaz körülbelül hússzorosa a háttéroldószer felszívóképességének).
1.4.2.2.4.
Minden in vitro 3T3 NRU fototoxicitás-vizsgálattal párhuzamosan egy ismert fototoxikus vegyi anyagot is vizsgálni kell. Ajánlatos a klórpromazin (CPZ) használata. Az in vitro 3T3 NRU fototoxicitás-vizsgálatban a standard protokoll szerint megvizsgált CPZ esetében a következő elfogadási kritériumok kerültek meghatározásra: sugárkezelt (+Irr) CPZ: IC50 = 0,1 μg/ml-től 2,0 μg/ml-ig, nem sugárkezelt (–Irr) CPZ: IC50 = 7,0 μg/ml-től 90,0 μg/ml-ig. A fotoirritációs tényezőnek (PIF) 6-nál nagyobbnak kell lennie. A pozitív kontroll történeti viselkedését ugyancsak vizsgálni kell.
Klórpromazin helyett párhuzamos pozitív kontrollként más, a vizsgált vegyi anyag kémiai osztályához vagy oldhatósági jellemzőihöz illő fototoxikus vegyi anyagok is használhatók.
1.4.3. Vizsgálati eljárás (6) (7) (8) (16) (17):
1.4.3.1. 1. nap:
Adagoljunk 100 μl tenyésztőközeget egy 96 lyukú szövetkultúra mikrotiter lemezének periférikus lyukaiba (= üres lyukak). A fennmaradó lyukakba tegyünk 100 μl térfogatú, 1x105 sejt/ml sejtet tartalmazó szuszpenziót (= lxl04 sejt/lyuk). A vizsgálandó anyag koncentrációinak minden egyes sorozatához, valamint a kontrolloldószerhez és a pozitív kontollokhoz két-két lemezt kell elkészíteni.
Inkubáljuk a sejteket 24 óráig (lásd az 1.4.1.2. szakaszt), míg félig konfluens monoréteget nem alkotnak. Ez az inkubációs idő lehetővé teszi a sejtek számára a megújulást, az adhéziót és az exponenciális növekedést.
1.4.3.2. 2. nap:
Az inkubációt követően a sejteket távolítsuk el a tenyésztőközegből, és óvatosan mossuk meg 150 μl, az inkubációhoz használt pufferoldattal. Adjunk hozzá 100 μl olyan puffert, amely megfelelő koncentrációban tartalmazza a vizsgálandó vegyi anyagot vagy az oldószert (kontrolloldószert). A vizsgálandó vegyi anyag 8 különböző koncentrációját alkalmazzuk. A vizsgálandó anyaggal 60 percen át sötétben inkubáljuk a sejteket (lásd az 1.4.1.2. szakaszt és az 1.4.1.4. szakasz második bekezdését).
A vizsgált anyagok koncentrációinak minden egyes sorozatához és a kontrollokhoz elkészített két-két lemezből általában véletlenszerűen válasszunk ki egyet-egyet a citotoxicitás meghatározásához (–Irr) (ez lesz a kontroll-lemez), és egyet (ez lesz a kezelt lemez) a fotocitotoxicitás meghatározásához (+Irr).
A +Irr expozíció elvégzéséhez a sejtek besugárzását szobahőmérsékleten 50 percen át végezzük a 96 lyukú lemez fedelén keresztül, a legnagyobb olyan sugárdózissal, amely még nem citotoxikus (lásd a 2. függeléket is). A nem sugárkezelt lemezt (–Irr) ugyancsak tartsuk 50 percig szobahőmérsékleten egy sötét dobozban (= fényexpozíciós idő).
Szűrjük le a tesztoldatot, és óvatosan mossuk kétszer 150 μl, az inkubációhoz használt, de a vizsgált anyagot nem tartalmazó pufferoldattal. Helyettesítsük a puffert tenyésztőközeggel és inkubáljuk (lásd az 1.4.1.2. szakaszt) egy éjszakán át (18–22 h).
1.4.3.3. 3. nap:
1.4.3.3.1.
A sejteket a növekedés, a morfológia és a monoréteg integritása tekintetében fáziskontrasztos mikroszkóppal kell megvizsgálni. A sejtek morfológiájában bekövetkezett változásokat és a sejtek növekedésében tapasztalt jelenségeket fel kell jegezni.
1.4.3.3.2.
Mossuk meg a sejteket 150 μl előmelegített pufferrel. Gyenge ütögetéssel távolítsuk el a mosószert. Adjunk hozzá 100 μl 50 μg/ml neutrálvöröst (NR) (3-amino-7-dimetilamino-2-metilfenazin-hidroklorid, EINECS-szám: 209-035-8; CAS-szám: 553-24-2; C.I.: 50040) tartalmazó szérum nélküli közeget (16), és az oldatot inkubáljuk az 1.4.1.2. bekezdésben leírtak szerint 3 órán át. Az inkubáció után távolítsuk el az NR közeget, és mossuk meg a sejteket 150 μl pufferrel. Szűrjük le, és szárítással vagy centrifugálással távolítsuk el a felesleges puffert.
Adjunk hozzá pontosan 150 μl NR deszorpciós oldatot (frissen készítve 49 rész víz + 50 rész etanol + 1 rész ecetsav).
Egy mikrotiter rázólemezen 10 percen át óvatosan rázzuk a mikrotiter lemezt, mindaddig, amíg az NR elválik a sejtektől, és homogén oldatot nem képez.
Egy spektrofotométerben 540 nm-en, az üres lapokat referenciaként használva mérjük meg az NR-kivonat optikai sűrűségét. Az adatokat további elemzés céljából megfelelő elektronikus fájlformátumban mentsük el.
2. ADATOK
2.1. AZ ADATOK MINŐSÉGE ÉS MENNYISÉGE
A vizsgálat adatainak lehetővé kell tenniük a sugárzás jelenlétében és annak hiányában kapott koncentráció-válasz adatok elemzését, és amennyiben lehetséges, a vizsgált anyag azon koncentrációjának meghatározását, amelynél a sejt életképessége 50 %-ra csökken (IC50). Ha citotoxicitást találunk, a koncentrációk tartományát és az egyedi koncentrációértékeket úgy kell felvenni, hogy a vizsgálati adatokra görbe legyen fektethető.
Az egyértelműen pozitív és az egyértelműen negatív eredmények esetében is (lásd a 2.3. szakasz első bekezdését) elegendő lehet az első vizsgálat, amelyet előzetes dózistartománykereső kísérlet(ek) előz(nek) meg.
A kétes eredményeket, a határeseteket és a nem egyértelmű eredményeket további vizsgálatok során tisztázni kell (lásd még a 2.4. szakasz második bekezdését). Ilyen esetekben fontolóra kell venni a vizsgálati körülmények módosítását. Azok a vizsgálati körülmények, amelyek módosulhatnak, magukban foglalják a koncentrációk tartományát és konkrét értékeit, az előinkubációs időt és a sugárzási-expozíciós időt. Vízben instabil viselkedésű vegyi anyagok esetében rövidebb expozíciós időt érdemes alkalmazni.
2.2. AZ EREDMÉNYEK ÉRTÉKELÉSE
Az adatok értékeléséhez a fotoirritációs tényezőt (PIF) vagy az átlagos fényhatást (MPE) célszerű meghatározni.
A fotocitotoxicitás-értékek kiszámításához (lásd lent) a diszkrét koncentráció-válasz értékpárokat folyamatos koncentráció-válasz görbével (modell) kell közelíteni. A görbének az adatokra való illesztése általában valamilyen nemlineáris regressziós módszerrel történik (18). Az adatokra illesztett görbéhez képest a tényleges adatok eltéréseinek hatását „bootstrap” eljárással célszerű vizsgálni.
A fotoirritációs tényező (PIF) a következő képlet segítségével számítható ki:
![]()
Ha a fény jelenlétében vagy hiányában az IC50 nem számítható ki, a vizsgált anyag PIF értéke nem határozható meg. Az átlagos fényhatás (MPE) kiszámítása a teljes koncentráció-válasz görbék összehasonlításán alapul (19). Ez a mennyiség definíció szerint a fényhatásértékek reprezentatív csoportján vett súlyozott átlagot jelenti:

A PEC fényhatás bármely C koncentrációban az REC válaszhatás és a DEC dózishatás szorzata: PEc = REc × DEc. Az REc válaszhatás a fény jelenlétében és hiányában megfigyelt válaszok különbsége: REc = Rc (–Irr) – Rc (+Irr). A dózishatást a következő összefüggés adja:

ahol C* az egyenérték-koncentráció, azaz az a koncentráció, amelynél C koncentráció esetén a +Irr válasz megegyezik a –Irr válasszal. Ha C* nem határozható meg, mert a +Irr görbe válaszértékei rendszeresen nagyobbak vagy kisebbek mint RC(–Irr), a dózishatást l-nek kell tekintetni. A wi súlyozó tényezőt a legnagyobb válaszérték adja, azaz wi = MAX {Ri (+Irr), Ri (–Irr) }. A Ci koncentrációértékeket úgy kell megválasztani, hogy a vizsgált koncentrációértékek által kijelölt minden egyes intervallumba ugyanannyi pont essen. Az MPE kiszámítása azon koncentrációmaximumra korlátozódik, amelynél a két görbe közül legalább az egyik még legalább 10 % válaszértéket mutat. Ha ez a koncentrációmaximum nagyobb, mint a +Irr vizsgálat során alkalmazott legnagyobb koncentráció, akkor úgy kell tekinteni, hogy a +Irr görbe maradék részén a válaszérték nulla. A vegyi anyagot attól függően tekintjük fototoxikusnak, hogy az MPE érték nagyobb-e, mint egy gondosan megválasztott kritikus érték (MPEC = 0,15).
A PIF és az MPE kiszámításához rendelkezésre áll egy szoftvercsomag (20).
2.3. AZ EREDMÉNYEK ÉRTELMEZÉSE
A validálási vizsgálat alapján (8), ha a vizsgált anyagra PIF < 2 vagy MPE < 0,1, akkor „nincs fototoxicitás”. Ha PIF > 2 és < 5 vagy MPE > 0,1 és < 0,15, akkor „lehetséges a fototoxicitás”; ha PIF > 5 vagy MPE > 0,15, akkor „van fototoxicitás”.
Minden olyan laboratóriumnak, amely először végzi ezt a vizsgálatot, a fototoxicitás-vizsgálat keretében a vizsgálandó anyagok tesztelése előtt meg kell vizsgálnia az 1. táblázatban felsorolt referenciaanyagokat. A PIF és az MPE értékeknek az 1. táblázatban található értékek közelében kell lenniük.
1. táblázat
|
Kémiai név |
EINECS-szám |
CAS-szám |
PIF |
MPE |
Felszívodás maximuma |
Oldószer (9) |
|
Amiodaron-hidroklorid |
243-293-2 |
[19774-82-4] |
> 3,25 |
0,27–0,54 |
242 nm 300 nm (irányváltás) |
etanol |
|
Klórpromazin-hidroklorid |
200-701-3 |
[69-09-0] |
> 14,4 |
0,33–0,63 |
309 nm |
etanol |
|
Norfloxacin |
274-614-4 |
[70458-96-7] |
> 71,6 |
0,34–0,90 |
316 nm |
acetonitril |
|
Antracén |
204-371-1 |
[120-12-7] |
> 18,5 |
0,19–0,81 |
356 nm |
acetonitril |
|
Protoporfirin IX, Dinátrium |
256-815-9 |
[50865-01-5] |
> 45,3 |
0,54–0,74 |
402 nm |
etanol |
|
L-Hisztidin |
|
[7006-35-1] |
nincs |
0,05–0,10 |
211 nm |
víz |
|
Hexaklorofén |
200-733-8 |
[70-30-4] |
1,1-1,7 |
0,00–0,05 |
299 nm 317nm (irányváltás) |
etanol |
|
Nátrium-lauril-szulfát |
205-788-1 |
[151-21-3] |
1,0-1,9 |
0,00–0,05 |
Nincs felszívódás |
víz |
2.4. AZ ADATOK KIÉRTÉKELÉSE
Ha a fototoxikus hatás csak a legnagyobb vizsgálati koncentrációban figyelhető meg (különösen a vízben oldódó vizsgált vegyi anyagoknál), a kockázatok értékeléséhez további szempontok is szükségesek lehetnek. Ilyen szempont lehet a bőrön keresztül történő felszívódásra, valamint a bőrben való vegyianyag-felhalmozódásra vonatkozó adatok és/vagy más kísérletekből származó adatok, például a vegyi anyagnak in vitro állati vagy emberi bőrön, illetve bőrmodelleken történő vizsgálata.
Ha nem mutatható ki toxicitás (+Irr és –Irr) és ha a gyenge oldhatóság behatárolta a vizsgálható koncentrációk számát, akkor megkérdőjelezhető, hogy a vizsgálat alkalmas-e a kérdéses anyag tesztelésére, és meg kell fontolni ellenőrző vizsgálatok elvégzését, például másik modell használatát.
3. JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek legalább a következő információkat kell tartalmaznia:
|
|
Vizsgált anyag:
|
|
|
Oldószer:
|
|
|
Sejtek:
|
|
|
Vizsgálati körülmények (1); inkubáció a kezelés előtt és után:
|
|
|
Vizsgálati körülmények (2); a vegyi anyaggal történő kezelés:
|
|
|
Vizsgálati körülmények (3); besugárzás:
|
|
|
Vizsgálati körülmények (4); neutrálvörös életképességi vizsgálat:
|
|
|
Eredmények:
|
|
|
Az eredmények értékelése. |
|
|
Összefoglaló megállapítások. |
4. HIVATKOZÁSOK
|
(1) |
Lovell W.W. (1993). A scheme for in vitro screening of substances for photoallergenic potential. Toxic. In vitro 7: 95–102. |
|
(2) |
Santamaria, L. and Prino, G. (1972). List of the photodynamic substances. In „Research Progress in Organic, Biological and Medicinal Chemistry” Vol. 3 part 1. North Holland Publishing Co. Amsterdam. p XI–XXXV. |
|
(3) |
Spielmann, H., Lovell, W.W., Hölzle, E., Johnson, B.E., Maurer, T., Miranda, M.A., Pape, W.J.W., Sapora, O., and Sladowski, D. (1994). In vitro phototoxicity testing: The report and recommendations of ECVAM Workshop 2. ATLA, 22, 314–348. |
|
(4) |
Spikes, J.D. (1989). Photosensitization. In „The science of Photobiology” Edited by K.C. Smith. Plenum Press, New York. 2nd edition, p. 79–110. |
|
(5) |
OECD (1997) Environmental Health and Safety Publications, Series on Testing and Assessment No.7 „Guidance Document On Direct Phototransformation Of Chemicals In Water” Environment Directorate, OECD, Paris. |
|
(6) |
Spielmann, H., Balls, M., Döring, B., Holzhütter, H.G., Kalweit, S., Klecak, G., L'Eplattenier, H., Liebsch, M., Lovell, W.W., Maurer, T., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W., and Willshaw, A. (1994). EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay. Toxic. In vitro 8, 793–796. |
|
(7) |
Anon (1998). Statement on the scientific validity of the 3T3 NRU PT test (an in vitro test for phototoxicity), European Commission, Joint Research Centre: ECVAM and DGXI/E/2, 3 November 1997, ATLA, 26, 7–8. |
|
(8) |
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., Pechovitch, G De Silva, O., Holzhütter, H.G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W.W., Maurer, T., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W., and Brantom, P. (1998). The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test. Toxic. In vitro 12, 305–327. |
|
(9) |
OECD (2002) Extended Expert Consultation Meeting on The In vitro 3T3 NRU Phototoxicity Test Guideline Proposal, Berlin, 30th-31th October 2001, Secretariat's Final Summary Report, 15th March 2002, OECD ENV7EHS, available upon request from the Secretariat. |
|
(10) |
Borenfreund, E., and Puerner, J.A. (1985). Toxicity determination in vitro by morphological alterations and neutral red absorption. Toxicology Lett., 24, 119–124. |
|
(11) |
Hay, R.J. (1988) The seed stock concept and quality control for cell lines. Analytical Biochemistry 171, 225–237. |
|
(12) |
Lambert L.A, Warner W.G., and Kornhauser A. (1996) Animal models for phototoxicity testing. In „Dermatotoxicology”, edited by F.N. Marzulli and H.I. Maibach. Taylor & Francis, Washington DC. 5th Edition, p. 515–530. |
|
(13) |
Tyrrell R.M., Pidoux M (1987) Action spectra for human skin cells: estimates of the relative cytotoxicity of the middle ultraviolet, near ultraviolet and violet regions of sunlight on epidermal keratinocytes. Cancer Res., 47, 1825–1829. |
|
(14) |
ISO 10977. (1993). Photography – Processed photographic colour films and paper prints – Methods for measuring image stability. |
|
(15) |
Sunscreen Testing (UV.B) TECHNICALREPORT, CIE, International Commission on Illumnation, Publication No. 90, Vienna, 1993, ISBN 3 900 734 275. |
|
(16) |
ZEBET/ECVAM/COLIPA – Standard Operating Procedure: In vitro 3T3 NRU Phototoxicity Test. Final Version, 7 September, 1998. 18 pgs. |
|
(17) |
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., De Silva, O., Holzhütter, H.G, Gerberick, F., Liebsch, M., Lovell, W.W., and Pfannenbecker, U. (1998) A study on UV filter chemicals from Annex VII of the European Union Directive 76/768/EEC, in the in vitro 3T3 NRU phototoxicity test. ATLA 26, 679–708. |
|
(18) |
Holzhütter, H.G., and Quedenau, J. (1995) Mathematical modeling of cellular responses to external signals. J. Biol. Systems 3, 127–138. |
|
(19) |
Holzhütter, H.G. (1997). A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals. ATLA, 25, 445–462. |
|
(20) |
http://www.oecd.org/document/55/0,2340,en_2649_34377_2349687_l_l_l_l,00.html |
1. FÜGGELÉK
A 3T3 NRU PT szerepe a vegyi anyagok fototoxicitás-vizsgálatának szekvenciális megközelítésében
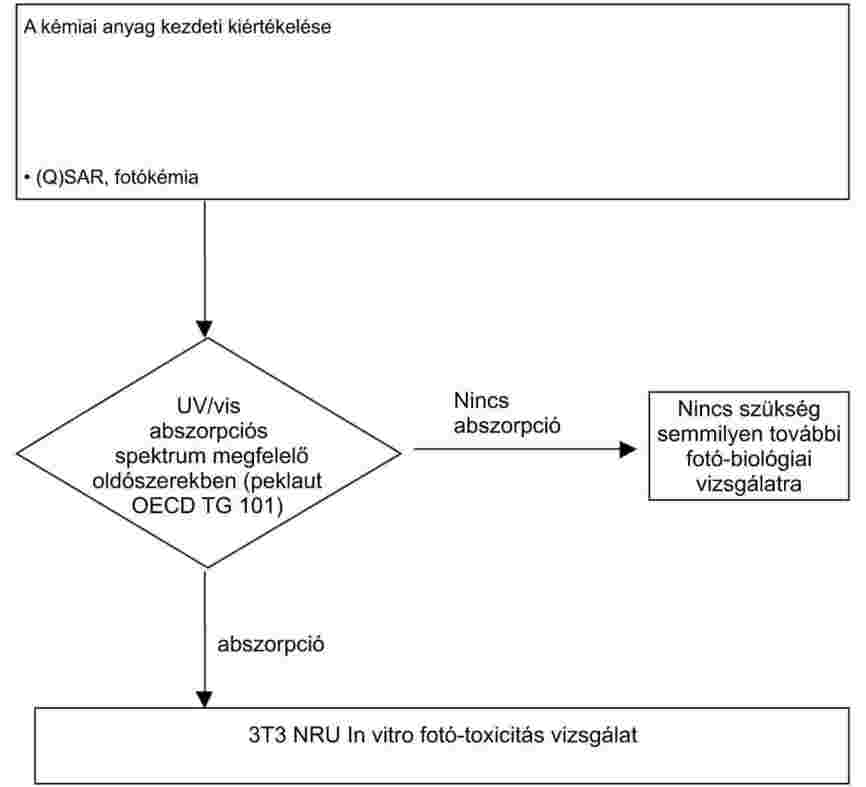
2. FÜGGELÉK
1. ábra
A szűrtnapfény-szimulátor spektrális energiaeloszlása
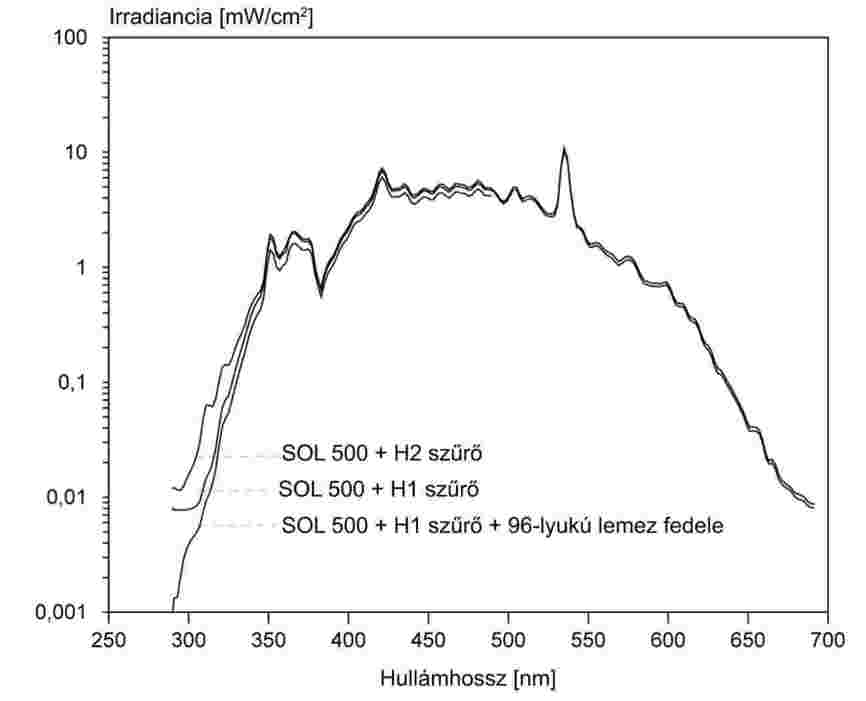
(lásd az 1.4.1.5. szakasz második bekezdését)
Az 1. ábrán példa található a szűrtnapfény-szimulátor elfogadható spektrális irradianciaeloszlására. A fényforrás a 3T3 NRU PT validálási vizsgálata során használt bevont fém-halogenid forrás (6) (8) (17). A görbén megfigyelhető a két különböző szűrő hatása és a 96 lyukú sejtkultúralemez fedelének további szűrőhatása. A H2 szűrőt csak olyan vizsgálati rendszerrel használták, amely nagyobb UVB-értéket is képes elviselni (bőrmodellvizsgálat és vörösvérsejt fotohemolízisének vizsgálata). A 3T3 NRU-PT-ben a H1 szűrőt használták. Az ábra azt mutatja, hogy a lemezfedél további szűrőhatását főként az UVB-tartományban figyelték meg, és ez még elég UVB-t hagyott a sugárzási spektrumban ahhoz, hogy aktiválja a jellegzetesen az UVB-tartományban abszorbeáló vegyi anyagokat, mint amilyen az amiodaron (lásd az 1. táblázatot).
2. ábra
Balb/c 3T3 sejtek sugárérzékenysége (az UVA-tartományban mérve)
Sejtéletképesség ( % a sötét kontrollok neutrálvörös felvétele)
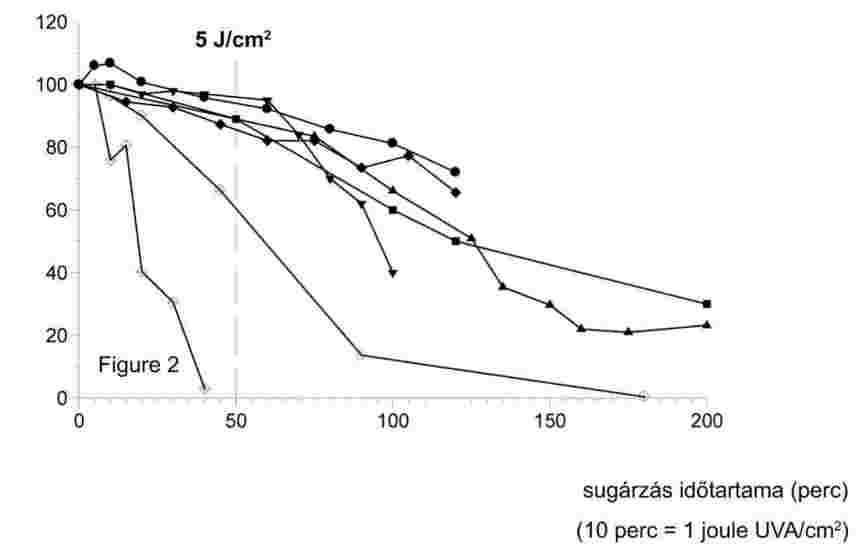
(lásd az 1.4.1.5.2. szakasz második bekezdését, valamint az 1.4.2.2.1. és az 1.4.2.2.2. szakaszt)
A Balb/c 3T3 sejteknek a 3T3 NRU fototoxicitás-vizsgálat validálási vizsgálatában használt napfényszimulátorral történő sugárzás hatása nyomán kialakuló érzékenysége az UVA-tartományban mérve. Az ábra a prevalidálási vizsgálat során 7 különböző laboratóriumban kapott eredményeket mutatja (1). Míg a két üres szimbólumú görbét öreg sejtekkel nyerték (nagy passzázsszám), amelyeket új sejttörzsekkel kellett helyettesíteni, addig a satírozott szimbólumú görbék olyan sejteket mutatnak, amelyeknek a sugártoleranciája elfogadható.
Ezekből az adatokból származtatták az 5 J/cm2 legnagyobb nem citotoxikus sugárdózist (függőleges szaggatott vonal). A vízszintes szaggatott vonal emellett az 1.4.2.2. szakaszban megadott maximális elfogadható sugárhatást mutatja.
B.42. BŐRSZENZIBILIZÁCIÓ: LOKÁLIS NYIROKCSOMÓ-VIZSGÁLATI MÓDSZER
1. MÓDSZER
Ez a vizsgálati módszer egyenértékű az OECD TG 429 (2002) módszerrel.
1.1. BEVEZETÉS
A lokális nyirokcsomó-vizsgálati módszer (Local Lymph Node Assay, LLNA) kellőképpen validált és elfogadott ahhoz, hogy indokolt legyen új módszerként való elfogadása (1) (2) (3). Ez a második olyan módszer, amellyel állatokban vizsgálható a vegyületek bőrszenzibilizáló potenciálja. A másik módszer (B.6.) tengerimalacon végzett vizsgálatokat alkalmaz, konkrétabban a tengerimalac-maximizációs módszert és a Bühler-vizsgálatot (4).
Az LLNA alternatív módszert jelent a bőrszenzibilizáló vegyületek meghatározására és annak igazolására, hogy egy vegyületnek nincs szignifikáns bőrszenzibilizáló potenciálja. Ez nem feltétlenül jelenti azt, hogy minden esetben az LLNA-t kell alkalmazni a tengerimalacvizsgálat helyett, hanem inkább azt, hogy ez a vizsgálati módszer éppolyan hasznos, és olyan alternatívaként alkalmazható, ahol mind pozitív, mind negatív eredmény esetén általában nincsen szükség ezek további megerősítésére.
Az LLNA mind a tudományos fejlődés, mind pedig az állatok kímélete szempontjából jár bizonyos előnyökkel. Ez a módszer a bőrszenzibilizáció indukciós fázisát vizsgálja és a dózisválasz vizsgálatokhoz alkalmazható kvantitatív adatokat szolgáltat. Az LLNA validálására vonatkozó információk és az ezzel kapcsolatos munka áttekintése az (5), (6), (7) és (8) hivatkozásban található. Meg kell jegyezni továbbá, hogy azok az enyhén/közepesen szenzibilizáló anyagok, amelyeket pozitív kontrollként ajánlanak a tengerimalac-vizsgálati módszerekhez, az LLNA-nál is alkalmazhatók (6) (8) (9).
Az LLNA in vivo módszer, ennek következtében nem szünteti meg az állatok felhasználását a kontakt szenzibilizáló aktivitás vizsgálata során, de lehetővé teszi az erre a célra szükséges állatok számának csökkentését. Az LLNA emellett lehetővé teszi annak az eljárásnak a jelentős finomítását, amelynek során az állatokat a kontakt szenzibilizációs vizsgálathoz felhasználják. Az LLNA azon immunológiai történések figyelmes vizsgálatán alapul, amelyeket a vegyület a szenzibilizáció indukciós fázisában stimulál. A tengerimalacvizsgálattól eltérően az LLNA-hoz nincs szükség indukált bőr-hiperszenzitivitási reakciók előidézésére. A tengerimalac-maximizációs vizsgálattal ellentétben nincs szükség adjuváns alkalmazására sem. Az LLNA alkalmazásával tehát csökkenthető az állatokat érő stressz mértéke. Az LLNA-nak a hagyományos tengerimalac-vizsgálatokkal szembeni előnyei ellenére el kell ismerni, hogy a módszernek vannak olyan korlátai (pl. hamis negatív eredmények egyes fémeknél vagy hamis pozitív eredmények bizonyos bőrirritáló anyagoknál) (10), amelyek szükségessé teszik a hagyományos tengerimalac-vizsgálatok alkalmazását.
Lásd még a Bevezetés B. részét.
1.2. A VIZSGÁLATI MÓDSZER ELVE
Az LLNA hátterében az az alapelv áll, hogy a szenzibilizáló anyagok elsődleges limfocita-proliferációt indukálnak abban a nyirokcsomóban, amely a vegyszer kijuttatásának helyéül szolgáló terület nyirokelvezetéséről gondoskodik. Ez a proliferáció arányos az alkalmazott dózis nagyságával (valamint az allergén erősségével), és egyszerű módszert biztosít a szenzibilizáció objektív és kvantitatív méréséhez. Az LLNA dózis-válasz összefüggésként méri ezt a proliferációt, ahol is a vizsgálati csoportokban mért proliferációt a vivőanyaggal kezelt csoportban mérttel hasonlítják össze. Meghatározzák a kezelt csoportokban a vivőanyaggal kezelt kontrollcsoportokban mérthez viszonyított proliferáció arányát, más néven a stimulációs indexet, amelynek legalább háromnak kell lennie ahhoz, hogy a vizsgálandó anyagot, mint potenciális bőrszenzibilizálót további vizsgálatoknak vessék alá. Az itt ismertetett módszerek alapját a sejtproliferáció radioaktív jelöléssel történő mérése képezi. Azonban más végpontok is alkalmazhatók a proliferáció vizsgálatára, feltéve, hogy azt megfelelően megindokoljuk és tudományosan is alátámasztjuk, ezen belül teljeskörűen megadjuk a hivatkozásokat és a módszer leírását is.
1.3. A VIZSGÁLATI MÓDSZER ISMERTETÉSE
1.3.1. Készítmények
1.3.1.1. Az állatok tartásának és etetésének körülményei
Az állatokat egyedileg kell tartani. A kísérleti helyiség hőmérsékletének 22 oC (± 3 oC)-nak kell lennie. Bár a helyiség relatív páratartalmának legalább 30 %-nak kell lennie, illetve a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot, a célértéknek 50 és 60 % között kell lennie. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett.
1.3.1.2. Az állatok előkészítése
Az állatokat véletlenszerűen kell kiválasztani, majd egyedi azonosítóval kell ellátni (de nem valamilyen füljelzővel), és a kezelés megkezdése előtt legalább 5 napig a ketrecükben kell tartani őket, hogy hozzászokhassanak a laboratóriumi körülményekhez. A kezelés megkezdése előtt minden állatot meg kell vizsgálni, és ellenőrizni kell, hogy nincsenek-e rajtuk látható bőrsérülések.
1.3.2. Kísérleti körülmények
1.3.2.1. Kísérleti állatok
Ehhez a vizsgálathoz egeret kell használni. Fiatal, felnőtt, a CBA/Ca vagy a CB A/J törzsből származó nőstény egereket kell használni, amelyek még egyszer sem ellettek, és nem is vemhesek. A vizsgálat kezdetén az állatoknak 8–12 hetesnek kell lenniük, minimális testtömegbeli eltéréssel, amely nem haladhatja meg a testtömegátlag 20 %-át. Ha elegendő adat áll rendelkezésre arra nézve, hogy nincsenek szignifikáns törzs- és/vagy ivarspecifikus különbségek az LLNA-válasz tekintetében, más törzsek, illetve hím állatok is alkalmazhatók.
1.3.2.2. A megbízhatóság ellenőrzése
A vizsgálat megfelelő módon történő elvégzésének igazolására, illetve a laboratórium ez irányú kompetenciájának demonstrálására pozitív kontrollokat kell alkalmazni. A pozitív kontrollnak pozitív LLNA-választ kell kiváltania egy olyan expozíciós szint mellett, amelynél a negatív kontrollhoz viszonyítva várhatóan 3-nál magasabb stimulációs index (SI) érhető el. A pozitív kontrolldózist úgy kell megválasztani, hogy az indukció egyértelmű legyen, de ne eltúlzott. Erre a célra előnyös anyagok a hexil-cinnamaldehid (CAS-szám: 101-86-0, EINECS-szám: 202-983-3) és a merkaptobenzotiazol (CAS-szám: 149-30-4, EINECS-szám: 205-736-8). Olyan körülmények is lehetségesek, amikor a fenti kritériumoknak megfelelő más kontrollanyag is alkalmazható, feltéve hogy azt megfelelően megindokolják. Míg rendes körülmények között minden egyes vizsgálathoz szükség lehet egy pozitív kontrollcsoportra, esetenként a vizsgálólaboratóriumoknak elegendő korábbi pozitív kontrolladat áll rendelkezésére ahhoz, hogy egy hat hónapos vagy még hosszabb időszakra vonatkozóan be tudják mutatni a megfelelő válaszreakció következetes megjelenését. Ilyen esetekben ritkábban, de legalább 6 havonta lehet szükség pozitív kontrollok alkalmazására. Bár a pozitív kontrollanyagot olyan vivőanyagban kell vizsgálni, amelyről ismeretes, hogy következetes választ idéz elő (pl. aceton-olívaolaj elegy), előfordulhat, hogy hatósági előírások miatt egy nem standard vivőanyagot is alkalmazni kell (amelynek összetétele klinikai/kémiai szempontból fontos). Ilyen esetekben a pozitív kontroll- és e nem konvencionális vivőanyag közötti lehetséges kölcsönhatást is meg kell vizsgálni.
1.3.2.3. Az állatok száma, a dózisszintek és a vivőanyag megválasztása
Minden dóziscsoportban legalább négy állatot kell alkalmazni, és a vizsgálandó anyagból legalább három különböző koncentrációt, továbbá egy negatív kontrollcsoportot, amelyet csak a vizsgálandó anyaghoz használt vivőanyaggal kezelnek, valamint adott esetben egy pozitív kontrollt is. Azokban az esetekben, amikor egyedileg kell gyűjteni az állatok adatait, dóziscsoportonként legalább öt állatot kell alkalmazni. Attól eltekintve, hogy vizsgálandó anyagot nem kapnak az állatok, a kontrollcsoportokban lévő állatokat ugyanúgy kell kezelni, mint a kezelt csoportokban lévőket.
A dózisokat és a vivőanyagot az (1) hivatkozásban található ajánlások alapján kell megválasztani. A dózisokat a 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 % stb. koncentrációsorozatból kell kiválasztani. A három egymás utáni koncentráció megválasztásakor figyelembe kell venni az esetlegesen rendelkezésre álló akut toxicitási és bőrirritációs adatokat is, hogy a legmagasabb koncentráció maximális expozíciót okozzon, de ne jelentkezzen szisztémás toxicitás vagy túlzott mértékű lokális bőrirritáció (2) (11).
A vivőanyagot aszerint kell kiválasztani, hogy maximális legyen a vizsgálandó anyag koncentrációja és oldhatósága, miközben a vizsgálandó anyag alkalmazásához megfelelő oldat/szuszpenzió álljon rendelkezésre. Az ajánlott vivőanyagok a preferencia sorrendjében a következők: aceton/olívaolaj (4:1 térfogatarány), dimetilformamid, metil-etil-keton, propilén-glikol és dimetil-szulfoxid (2) (10), de megfelelő tudományos indoklás esetén más vivőanyagok is alkalmazhatók. Bizonyos esetekben szükség lehet arra, hogy további kontrollként egy klinikai szempontból lényeges vivőanyagot használjanak, vagy azt a kereskedelmi formulát, amelyben a vizsgálandó anyagot forgalomba hozzák. Különösen vigyázni kell arra, hogy a hidrofil anyagokat olyan vivőanyagrendszerbe építsék be, amely nedvesíti a bőrt, és nem fut le azonnal. Kerülni kell tehát a teljesen vizes vivőanyagokat.
1.3.3. Vizsgálati eljárás
1.3.3.1. A kísérleti program
A vizsgálathoz az alábbi kísérleti programot kell alkalmazni:
|
|
1. nap: Határozzuk meg és jegyezzük fel minden egyes állat testtömegét. Vigyünk fel 25 μl térfogatú megfelelő hígítású vizsgálandó anyagot, valamint a vivőanyagot önmagában vagy (adott esetben) pozitív kontrollt a fülek dorzális oldalára. |
|
|
2. és 3. nap: Ismételjük meg az 1. napon elvégzett felviteli eljárást. |
|
|
4. és 5. nap: Nincs kezelés. |
|
|
6. nap: Mérjük meg és jegyezzük fel az állatok testtömegét. Injekciózzunk 250 μl, 20 μCi (7,4 e + 8 Bq) 3H-metil-timidint tartalmazó sós foszfátpuffert (PBS) a kezelt és kontrollegerek farokvénájába. Használhatunk ehelyett 250 μl, 2 μCi (7,4 e + 7 Bq) 125I-jóddezoxiuridint és 10–5 M fluordezoxiuridint tartalmazó PBS-t is, szintén az egerek farokvénájába injektálva. Öt órával később extermináljuk az állatokat. Mindegyik kísérleti csoportban az állatok füléből vágjuk ki a kezelt terület nyirokelvezetéséről gondoskodó füli nyirokcsomókat, és tegyük be azokat kísérleti csoportonként egy PBS-t tartalmazó edénybe (összevont kezelési csoporton alapuló megközelítés). Más esetben úgy is eljárhatunk, hogy csak az egyes állatokból kivágott nyirokcsomópárokat tesszük egy-egy PBS-t tartalmazó edénybe (egyedi megközelítés). A nyirokcsomók meghatározásának és kipreparálásának részleteit és az ehhez kapcsolódó diagrammokat a (10) hivatkozás I. függelékében találhatjuk meg. |
1.3.3.2. A sejtszuszpenziók elkészítése
Az összevont kezelési csoportokból származó vagy az egyes állatokból két oldalról vett nyirokcsomósejtekből (LNC) álló egysejt-szuszpenziókat kell előállítani 200 μm-es lyukméretű, rozsdamentes acélból készült fémhálón keresztül történő óvatos mechanikai dezintegrálással. A nyirokcsomósejteket nagy feleslegben lévő PBS-sel kétszer át kell mosni, majd 4 oC-on 18 órán át, 5 %-os triklórecetsavval (TCA) precipitálni (2). A pelleteket vagy 1 ml TCA-ban újra kell szuszpendálni és 10 ml szcintillációs folyadékot tartalmazó szcintillációs fiolákba (3H-számlálás) áttenni, vagy közvetlenül gammaszámláló csövekbe (125I-számlálás) kell átrakni.
1.3.3.3. A sejtproliferáció meghatározása (beépült radioaktivitás)
A 3H-metil-timidin beépülését β-szcintillációs számlálással mérik, percenkénti bomlás (DPM) egységekben. A 125I-jóddezoxiuridin beépülését 125I-számlálással mérik, és ugyancsak DPM-ben fejezik ki. Az alkalmazott megközelítéstől függően a beépülést DPM/kezelési csoport (összevont megközelítés) vagy DPM/állat (egyedi megközelítés) egységben fejezik ki.
1.3.3.4. Megfigyelések
1.3.3.4.1.
Naponta egyszer gondosan meg kell vizsgálni az állatokban az alkalmazás helyén kialakuló lokális irritáció vagy szisztémás toxicitás esetleges klinikai tüneteit. Minden megfigyelést szisztematikusan fel kell jegyezni, minden egyes állat esetében egyedi adatsor felvételével.
1.3.3.4.2.
Ahogyan az az 1.3.3.1. szakaszban szerepel, az egyes állatok testtömegét a vizsgálat kezdetén, illetve az exterminálás tervezett időpontjában kell megmérni.
1.3.4. Az eredmények kiszámítása
Az eredményeket a stimulációs indexben (SI) fejezik ki. Az összevont megközelítés alkalmazása esetén az SI-t úgy kapják meg, hogy az egyes kezelési csoportokra eső összevont radioaktív beépülést elosztják a vivőanyaggal kezelt kontrollcsoportra jutó összevont beépüléssel. Ennek eredményeként egy átlagos SI-értéket kapnak. Az egyedi megközelítés alkalmazása esetén az SI-t úgy kapják meg, hogy minden egyes kezelt csoport és a pozitív kontrollcsoport átlagos DPM/állat-értékét elosztják az oldószerrel/vivőanyaggal kezelt kontrollcsoport átlagos DPM/állat-értékével. A vivőanyaggal kezelt kontrollcsoportok átlagos SI-értéke tehát 1.
Ha az SI számítására egyedi megközelítést alkalmaznak, akkor statisztikai elemzések is végezhetők az adatokon. A megfelelő statisztikai elemzési módszer kiválasztásakor a vizsgálónak figyelemmel kell lennie a lehetséges varianciaegyenlőtlenségekre és más kapcsolódó problémákra, ami miatt adattranszformációra vagy nem paraméteres statisztikai elemzésre lehet szükség. Az adatok értelmezéséhez adekvát megközelítés, ha a kezelt és vivőanyaggal kezelt kontrollállatok minden egyes adatát külön értékelik ki, majd ezekből a konfidenciahatárok figyelembevételével levezetik a legjobban illeszkedő dózis-válasz görbét (8) (12) (13). A vizsgálónak azonban fel kell készülnie arra, hogy egy adott csoportban egy-egy állat válasza „kilóghat a sorból”, ami miatt más módon (pl. átlag helyett medián alkalmazásával) kell a választ mérni, vagy ki kell zárni a kilógó adatokat az elemzésből.
A választ akkor lehet pozitívként értékelni, ha – a dózis-válasz összefüggést és adott esetben a statisztikai szignifikanciát is figyelembe véve – a stimulációs index ≥ 3 (3) (6) (8) (12) (14).
Ha a kapott eredmények tisztázást igényelnek, figyelembe kell venni a vizsgálandó anyag különféle tulajdonságait, és ezen belül azt is, hogy mutat-e szerkezeti rokonságot ismert bőrszenzibilizáló anyagokkal, okoz-e erőteljes bőrirritációt, illetve hogy milyen a megfigyelt dózis-válasz összefüggés. Ezek, illetve a további megfontolások részletesebb tárgyalását lásd a (7) hivatkozásban.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, amely minden dóziscsoportra (ezen belül a vivőanyaggal kezelt kontrollcsoportra vonatkozóan is) mutatja az átlagos és egyedi DPM-értékeket és stimulációs indexeket.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek a következő információkat kell tartalmaznia:
|
|
Vizsgálandó anyag:
|
|
|
Vivőanyag:
|
|
|
Kísérleti állatok:
|
|
|
Kísérleti körülmények:
|
|
|
A megbízhatóság ellenőrzése:
|
|
|
Eredmények:
|
|
|
Az eredmények diszkussziója:
|
4. HIVATKOZÁSOK
|
(1) |
Kimber, I. and Basketter, D.A. (1992). The murine local lymph node assay; collaborative studies and new directions: A commentary. Food and Chemical Toxicology 30, 165–169. |
|
(2) |
Kimber, I, Derman, R.J., Scholes E.W, and Basketter, D.A. (1994). The local lymph node assay: developments and applications. Toxicology, 93, 13–31. |
|
(3) |
Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E., Hastings, K.L. (1998). Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. Journal of Toxicology and Environmental Health, 53, 563–79. |
|
(4) |
B6. vizsgálati módszer. |
|
(5) |
Chamberlain, M. and Basketter, D.A. (1996). The local lymph node assay: status of validation. Food and Chemical Toxicology, 34, 999–1002. |
|
(6) |
Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E (1996). The local lymph node assay – A viable alternative to currently accepted skin sensitisation tests. Food and Chemical Toxicology, 34, 985–997. |
|
(7) |
Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998). Strategies for identifying false positive responses in predictive sensitisation tests. Food and Chemical Toxicology. 36, 327–33. |
|
(8) |
Van Och, F.M.M, Slob, W., De Jong, W.H., Vandebriel, R.J., Van Loveren, H. (2000). A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employement of a regression method that includes determination of uncertainty margins. Toxicology, 146, 49–59. |
|
(9) |
Dearman, R.J., Hilton, J., Evans, P., Harvey, P., Basketter, D.A. and Kimber, I. (1998). Temporal stability of local lymph node assay responses to hexyl cinnamic aldehyde. Journal of Applied Toxicology, 18, 281-4. |
|
(10) |
National Institute of Environmental Health Sciences (1999). The Murine Local Lymph Node Assay: A Test Method for Assessing the Allergic Contact Dermatitis Potential of Chemicals/Compounds: The Results of an Independent Peer Review Evaluation Coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494, Research Triangle Park, N.C. (http://iccvam.niehs.nih.gov). |
|
(11) |
B4. vizsgálati módszer. |
|
(12) |
Basketter, D.A., Selbie, E., Scholes, E.W. Lees, D. Kimber, I. and Botham, P.A. (1993). Results with OECD recommended positive control sensitisers in the maximisation, Buehler and local lymph node assays. Food and Chemical Toxicology, 31, 63–67. |
|
(13) |
Basketter D.A., Lea L.J., Dickens A., Briggs D., Pate I., Dearman R.J., Kimber I. (1999). A comparison of statistical approaches to the derivation of EC3 values from local lymph node assay dose responses. J. Appl. Toxicology, 19, 261–266. |
|
(14) |
Basketter DA, Blaikie L, Derman RJ, Kimber I, Ryan CA, Gerberick GF, Harvey P, Evans P, White IR and Rycroft RTG (2000). Use of local lymph node assay for the estimation of relative contact allergenic potency. Contact Dermatitis 42, 344–48. |
B.43. NEUROTOXICITÁSI VIZSGÁLAT RÁGCSÁLÓKBAN
1. MÓDSZER
Ez a módszer egyenértékű az OECD TG 424 (1997) módszerrel.
Ennek a vizsgálati módszernek az a célja, hogy megkapjuk egy vegyület felnőtt állatokra gyakorolt neurotoxicitási potenciáljának igazolásához vagy további jellemzéséhez szükséges információkat. A vizsgálat végezhető más, az ismételt dózisú toxicitási vizsgálatokhoz alkalmazott ismert vizsgálati módszerekkel együtt vagy önálló vizsgálatként is. Az e módszeren alapuló vizsgálatok megtervezésekor ajánlatos az OECD Neurotoxicitási Vizsgálati Stratégiák és Módszerek Útmutatóját (1) is igénybe venni. Ez különösen akkor fontos, ha fontolóra vesszük a megfigyelések és vizsgálati eljárások módosítását az e módszer rutinalkalmazásához ajánlottakhoz képest. Az útmutató azzal a céllal készült, hogy elősegítse a konkrét feltételek esetén alkalmazandó egyéb vizsgálati eljárások kiválasztását.
Ez a módszer nem terjed ki a fejlődési neurotoxicitás tanulmányozására.
1.1. BEVEZETÉS
A vegyületek toxikus jellemzőinek vizsgálatakor és értékelésekor fontos figyelembe venni a neurotoxikus hatások lehetőségét. Már az ismételt dózisú szisztémás toxicitási vizsgálati módszer is magában foglal olyan megfigyeléseket, amellyel a neurotoxicitás lehetőségét szűrik. Ez a vizsgálati módszer felhasználható olyan vizsgálatok tervezésére, amelyekkel további információk szerezhetők az ismételt dózisú szisztémás toxicitási vizsgálatokban megfigyelt neurotoxikus hatásokkal kapcsolatban, vagy megerősíthetik azokat. Azonban bizonyos vegyületcsoportok potenciális neurotoxicitásának mérlegelése azt sugallhatja, hogy e módszer alkalmasabb lehet ezek vizsgálatára anélkül, hogy ismételt dózisú szisztémás toxicitási vizsgálatok az adott anyag potenciális neurotoxicitását előre jeleznék. Ilyen megfontolások például a következők:
|
— |
neurológiai tünetek vagy neuropathológiai léziók észlelése az ismételt dózisú szisztémás toxicitási vizsgálatoktól eltérő toxicitási vizsgálatokban, vagy |
|
— |
szerkezeti összefüggések vagy más információk, amelyek kapcsolatba hozzák az anyagot ismert neurotoxikus anyagokkal. |
Előfordulhatnak továbbá más olyan esetek is, amikor ezt a módszert érdemes alkalmazni. A további részleteket lásd az (1) hivatkozásban.
E módszert úgy dolgozták ki, hogy annak megfelelő kiigazításával egy vegyület egyedi kórszövettani és viselkedési neurotoxicitásának igazolására vonatkozó sajátos elvárásoknak is megfeleljen, és tegye lehetővé a neurotoxikus válaszok jellemzését és számszerűsítését.
A neurotoxicitást korábban azonosnak tekintették az idegbántalmakkal (neuropátia), beleértve az idegkórtani bántalmakat vagy idegműködési zavarokat, így például rohamokat, bénulást vagy remegést. Bár az idegbántalmak a neurotoxicitás fontos megnyilvánulási formáit jelentik, ma már világos, hogy az idegrendszeri toxicitásnak számos olyan jele van (pl. a mozgáskoordináció csökkenése, érzékelési zavarok, tanulási és memóriazavarok), amelyek neuropátiás vagy más típusú vizsgálatokban esetleg nem jelennek meg.
E neurotoxicitási vizsgálati módszert úgy alakították ki, hogy alkalmas legyen a jelentősebb viselkedésneurológiai és idegkórtani hatások felnőtt rágcsálókban történő kimutatására. Bár a viselkedésbeli hatások még morfológiai változások hiányában is tükrözhetik az élő szervezetekre gyakorolt káros hatásokat, nem minden viselkedésbeli változás specifikus az idegrendszerre. Így tehát minden megfigyelt változást az ezzel összefüggő kórszövettani, hematológiai vagy biokémiai adatokkal, valamint egyéb típusú szisztémás toxicitásra vonatkozó adatokkal összefüggésben kell értékelni. Az e módszerrel végzett és a neurotoxikus válaszok jellemzését, valamint számszerűsítését célzó vizsgálat specifikus kórszövettani és viselkedésvizsgálati eljárásokat is magában foglal, amelyek további elektrofiziológiai és/vagy biokémiai vizsgálatokkal is alátámaszthatók (1) (2) (3) (4).
A neurotoxikus anyagok egy sor célpontra hathatnak az idegrendszeren belül, és hatásmechanizmusuk is igen sokféle lehet. Mivel nem létezik egyetlen olyan vizsgálatsorozat sem, amelynek segítségével az összes anyag esetében meghatározható lenne a neurotoxikus potenciál, szükség lehet más, a megfigyelt vagy várt neurotoxicitás típusára specifikus in vivo vagy in vitro vizsgálatokra is.
Ez a vizsgálati módszer arra is felhasználható, hogy az OECD Neurotoxicitási Vizsgálati Stratégiák és Módszerek Útmutatójában (1) megfogalmazott iránymutatással összefüggésben olyan vizsgálatokat is lehessen általa tervezni, amelyek célja, hogy általuk tovább lehessen jellemezni vagy növelni a dózis-válasz összefüggés számszerű meghatározásának érzékenységét annak érdekében, hogy jobban meg lehessen becsülni a nem észlelhető káros hatás szintjét, vagy igazolható legyen a vegyület ismert vagy feltételezett veszélyessége. Olyan vizsgálatok is tervezhetők például, amelyek segítségével meghatározható(k) vagy értékelhető(k) a neurotoxicitási mechanizmus(ok), vagy kiegészíthetők a rendelkezésre álló, alap viselkedésneurológiai és neuropathológiai megfigyelési eljárások alkalmazásával kapott adatok. Az ilyen vizsgálatok esetében nem szükséges olyan adatok gyűjtését megismételni, amelyeket az e módszernél ajánlott standard eljárások alkalmazásával kapnának meg, ha az ilyen adatok már rendelkezésre állnak, és azokat nem tartják szükségesnek a vizsgálat eredményeinek értelmezéséhez.
Ez a neurotoxicitási vizsgálat – akár önállóan, akár más vizsgálatokhoz kapcsolódva végzik – olyan információkat szolgáltat, amelyek:
|
— |
meghatározhatják, hogy a vizsgálandó vegyület tartós vagy visszafordítható hatásokat gyakorolt-e az idegrendszerre, |
|
— |
hozzájárulhatnak a kémiai vegyülettel történő expozícióval járó idegrendszeri elváltozások jellemzéséhez, illetve az ezek hátterében álló mechanizmusok megismeréséhez, |
|
— |
meghatározhatják a dózis- és idő-válasz összefüggéseket a nem észlelhető káros hatás szint becsléséhez (amelyet a vegyület biztonsági kritériumainak megállapításához lehet felhasználni). |
Ennél a vizsgálati módszernél a vizsgálandó anyagot orálisan adagolják. Más (pl. a dermális vagy inhalálásos) beadási módok esetenként megfelelőbbek lehetnek, amelyek használata esetén szükség lehet a javasolt eljárások módosítására is. A beadási mód kiválasztásával kapcsolatos megfontolások a humán expozíciós profiltól és a rendelkezésre álló toxikológiai és kinetikai adatoktól függenek.
1.2. FOGALOMMEGHATÁROZÁSOK
Káros hatás: a normálhoz viszonyított bármilyen, a kezelés okozta elváltozás, amely csökkenti az élő szervezet túlélésre, szaporodásra vagy környezethez való alkalmazkodásra való képességét.
Dózis: a vizsgálandó anyag beadott mennyisége. A dózist tömegegységben (g, mg), vagy a vizsgálandó anyag tömegének és a vizsgált állat tömegegységének hányadosában (pl. mg/kg), vagy a táplálékban lévő állandó koncentrációban (ppm) fejezik ki.
Adagolás: általános meghatározás, amely a dózist, valamint az adagolás gyakoriságát és időtartamát foglalja magában.
Neurotoxicitás: az idegrendszer szerkezetét vagy működését érintő káros elváltozás, amelyet egy kémiai, biológiai vagy fizikai ágens jelentette expozíció idéz elő.
Neurotoxikus anyag: bármilyen kémiai, biológiai vagy fizikai ágens, amely neurotoxicitást tud okozni.
NOAEL: a nem észlelhető káros hatás szintjének (no-observed-adverse effect level) rövidítése, amely azt a legmagasabb dózisszintet jelöli, amelynél nem figyelhetők meg kezeléssel összefüggő káros hatások.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A vizsgálandó vegyületet egy dózistartományon belül több dózisban adagolják orálisan laboratóriumi rágcsálók több csoportjának. Általában ismételt dózisokat kell alkalmazni, és az adagolási rend lehet 28 napos, szubkrónikus (90 napos) vagy krónikus (1 éves vagy annál hosszabb). Az ebben a vizsgálati módszerben leírt eljárások akut neurotoxicitási vizsgálatokhoz is felhasználhatók. Az állatokat olyan módon vizsgálják, hogy lehetőség legyen a viselkedési és/vagy neurológiai rendellenességek észlelésére vagy jellemzésére. Minden megfigyelési időszakban egy sor olyan viselkedést vizsgálnak meg, amelyre hatással lehetnek a neurotoxikus anyagok. A vizsgálat végén az összes csoportból és mindkét nemből kiválasztanak néhány állatot, amelyeknél in situ perfúziót végeznek, és amelyekből agyi, gerincvelői és perifériás idegi metszeteket készítenek és vizsgálnak meg.
Ha a vizsgálatot a neurotoxikus hatások megállapítását vagy jellemzését célzó önálló vizsgálatként végzik, a csoportokba tartozó, perfúzióra és ezt követő kórszövettani vizsgálatokra (lásd 1. táblázat) fel nem használt állatokat olyan specifikus viselkedésneurológiai, neuropathológiai, neurokémiai vagy elektrofiziológiai eljárásokhoz lehet felhasználni, amelyek kiegészíthetik az e módszer szerint szükséges standard vizsgálatokkal kapott adatokat (1). E kiegészítő eljárások különösen akkor lehetnek hasznosak, ha empirikus megfigyelések vagy várható hatások a vegyület specifikus típusú vagy specifikus célterületre irányuló neurotoxicitását jelzik. Más esetben a fennmaradó állatok egyéb értékelések, így például a rágcsálókban végzett ismételt dózisú toxicitási vizsgálati módszerekben előírtak céljára alkalmazhatók.
Ha e vizsgálati módszer eljárásait más vizsgálati módszerek eljárásaival kombinálják, kellő számú állatra van szükség ahhoz, hogy mindkét vizsgálat megfigyelési igényei kielégíthetők legyenek.
1.4. A VIZSGÁLATI MÓDSZER ISMERTETÉSE
1.4.1. Az állatfaj kiválasztása
A preferált rágcsálófaj a patkány, bár megfelelő indoklás esetén más rágcsálófajok is alkalmazhatók. Általánosan használt laboratóriumi törzsekből származó egészséges, fiatal felnőtt állatokat kell alkalmazni. Olyan nőstényeket kell választani, amelyek még egyszer sem ellettek, és nem vemhesek. Az adagolást általában az elválasztás után a lehető leghamarabb meg kell kezdeni, lehetőleg még az állatok hathetes koráig, de mindenképpen azelőtt, hogy elérnék a kilenchetes kort. Azonban ha a vizsgálatot más vizsgálatokkal kombinálják, a korra vonatkozó követelményeket esetleg ennek megfelelőn módosítani kell. A vizsgálat kezdetén az alkalmazott állatok közötti testtömegeltérés nem haladhatja meg az egyes ivarok átlagának ± 20 %-át. Ha egy hosszú távú vizsgálat előtt előzetes vizsgálatként rövid időtartamú ismételt dózisú vizsgálatot végeznek, mindkét vizsgálatban azonos törzsből és forrásból származó állatokat kell használni.
1.4.2. Az állatok tartásának és etetésének körülményei
A kísérleti helyiség hőmérsékletének 22 oC (± 3 oC)-nak kell lennie. Bár a helyiség relatív páratartalmának legalább 30 %-nak kell lennie, illetve a takarítás időtartamától eltekintve lehetőleg ne haladja meg a 70 %-ot, a javasolt átlagértéknek 50 és 60 % között kell lennie. A világítás legyen mesterséges; 12 órás világos és 12 órás sötét periódusok váltsák egymást. Minimálisra kell csökkenteni az időszakosan jelentkező erős zajokat. Az etetéshez standard laboratóriumi takarmány alkalmazható, korlátlan mennyiségű ivóvíz biztosítása mellett. A takarmány megválasztását az is befolyásolhatja, hogy ha a vizsgálandó anyagot táplálékkal adják be, akkor az megfelelően keveredjen el az élelemmel. Az állatokat tarthatjuk egyedileg vagy azonos ivarú egyedekből álló kisebb csoportokban is.
1.4.3. Az állatok előkészítése
Az egészséges fiatal állatokat véletlenszerűen kell beosztani a kezelt és kontrollcsoportokba. A ketreceket úgy kell elrendezni, hogy minimálisra lehessen csökkenteni a ketrec elhelyezésének lehetséges hatásait. Az állatokat egyedi azonosítóval kell ellátni, és a vizsgálat megkezdése előtt legalább öt (5) napig a ketrecükben kell őket tartani, hogy hozzászokhassanak a laboratóriumi körülményekhez.
1.4.4. A beadási mód és a dózisok előkészítése
Ez a vizsgálati módszer konkrétan előírja a vizsgálandó anyag orális alkalmazását, amely történhet szondán keresztül, táplálék vagy ivóvíz útján vagy kapszulák beadásával. Más beadási módok (pl. dermális vagy inhalálásos) is használhatók, de emiatt esetleg módosítani kell az ajánlott eljárásokat. A beadási mód megválasztása függ a humán expozíciós profiltól és a rendelkezésre álló toxikológiai vagy kinetikai információktól. A beadási mód megválasztását meg kell indokolni, továbbá meg kell jelölni az ebben a vizsgálati módszerben előírt eljárások emiatt szükségessé vált módosításait is.
Ha szükséges, a vizsgálandó anyagot megfelelő vivőanyagban fel lehet oldani vagy szuszpendálni. Elsősorban vizes oldatot/szuszpenziót ajánlatos alkalmazni, másodsorban olajos (pl. kukoricacsíra-olajban elkészített) oldatot vagy szuszpenziót, és csak harmadsorban más vivőanyagokban elkészített oldatot vagy szuszpenziót. Ismerni kell a vivőanyag toxikus jellemzőit. Emellett a vivőanyag következő jellemzőit kell figyelembe venni: a vizsgálandó anyag felszívódására, eloszlására, metabolizmusára és visszatartására gyakorolt hatások; a vizsgálandó anyag kémiai tulajdonságaira gyakorolt hatások, amelyek módosíthatják annak toxikus jellemzőit; valamint az állatok táplálék- és vízfogyasztására vagy tápláltsági állapotára gyakorolt hatások.
1.5. ELJÁRÁSOK
1.5.1. Az állatok száma és ivara
Ha a vizsgálatot önálló vizsgálatként végzik, legalább 20 állatot (10 nőstényt és 10 hímet) kell alkalmazni minden egyes dózis- és kontrollcsoportban a részletes klinikai és funkcionális megfigyelések értékeléséhez. A 10 hím és 10 nőstény közül a vizsgálat végén legalább öt hímet és öt nőstényt kell kiválasztani az in situ perfúzióhoz és a részletes ideg-kórszövettani vizsgálatokhoz. Ha az adott dóziscsoportban csak korlátozott számú állatnál lehet megfigyelni neurotoxikus hatásokat, fontolóra kell venni ezeknek az állatoknak is a perfúzióra kijelöltek közé való felvételét. Ha a vizsgálatot egy ismételt dózisú toxicitási vizsgálattal egybekötve végzik, kellő számú állatot kell felhasználni ahhoz, hogy mindkét vizsgálat célkitűzéseit meg tudják valósítani. A vizsgálatok különböző kombinációi esetén szükséges minimális csoportméreteket az 1. táblázat tartalmazza. Ha időközi exterminációkat vagy a toxikus hatások visszafordíthatóságának, tartósságának vagy kezelés utáni késleltetett megjelenésének megfigyelésére gyógyulási csoportokat vagy kiegészítő megfigyeléseket is terveznek, a kísérleti állatok számát úgy kell növelni, hogy elegendő számú állatot biztosíthassanak a megfigyelésekhez és kórszövettani vizsgálatokhoz.
1.5.2. A kezelt és kontrollcsoportok
Általában legalább három dóziscsoportot és egy kontrollcsoportot kell alkalmazni, de ha más adatok áttekintése alapján 1 000 mg/testtömeg-kg/nap ismételt dózis alkalmazásakor sem várhatók hatások, akkor lehet határérték-vizsgálatot is végezni. Ha nincs megfelelő adat erre nézve, akkor tartománybehatároló vizsgálat is végezhető az alkalmazandó dózisok meghatározásának elősegítésére. Attól eltekintve, hogy a vizsgálandó anyagot nem alkalmazzák, a kontrollcsoportokban lévő állatokat ugyanúgy kell kezelni, mint a kezelt csoportokban lévőket. Ha a vizsgálandó anyag beadásához vivőanyagot alkalmaznak, a kontrollcsoportnak a legnagyobb alkalmazott térfogatban kell beadni a vivőanyagot.
1.5.3. A megbízhatóság ellenőrzése
A vizsgálatot végző laboratóriumnak adatokkal kell igazolnia, hogy el tudja végezni a vizsgálatot, illetve hogy az alkalmazott eljárások megfelelő érzékenységűek. Az ilyen adatoknak bizonyítékkal kell szolgálniuk a megfigyelésre javasolt különféle végpontok, így például az autonóm tünetek, a szenzoros reaktivitás, a végtagok fogóereje, valamint a motoros aktivitás változásainak detektálására és adott esetben számszerűsítésére való képességet. A különböző típusú neurotoxicitási válaszokat kiváltó és pozitív kontrollként alkalmazható vegyületekkel kapcsolatos információk a (2) és a (9) hivatkozásban találhatók. Ha a kísérleti eljárások lényeges vonásai nem változnak, akkor korábbi adatok is felhasználhatók. Javasolt a korábbi adatok időszakos felfrissítése. Az eljárások érzékenységének fennmaradását igazoló új adatokra akkor van szükség, ha a vizsgálat vagy az eljárások valamely lényegi elemét a vizsgálatot végző laboratórium megváltoztatta.
1.5.4. A dózisok kiválasztása
A dózisszinteket a vizsgálandó vegyülettel vagy rokon anyagokkal kapcsolatban esetlegesen rendelkezésre álló korábbi toxicitási és kinetikai adatok figyelembevételével kell meghatározni. A legnagyobb dózist azt a célt szem előtt tartva kell megválasztani, hogy a neurotoxikus hatásokat vagy egyértelmű szisztémás toxikus hatásokat váltson ki. Ezt követően úgy kell csökkenő sorrendben kiválasztani a kisebb dózisokat, hogy meg lehessen határozni a dózissal összefüggő válaszokat, illetve a legkisebb dózisnál a nem észlelhető káros hatás szintjét (NOAEL). A dózisszinteket elvben úgy kell beállítani, hogy meg lehessen különböztetni az idegrendszerre gyakorolt elsődleges toxikus hatásokat a szisztémás toxicitással összefüggő hatásoktól. Gyakran optimális a két-három intervallum alkalmazása, és nagyon nagy intervallumok (pl. 10-nél magasabb szorzófaktor) alkalmazása esetén gyakran előnyös a dózisok közé egy negyedik vizsgálati csoportot is beiktatni. Ha létezik a humán expozícióra vonatkozóan elfogadható becslés, akkor ezt is figyelembe kell venni.
1.5.5. Határérték-vizsgálat
Ha egy egyetlen, legalább 1 000 mg/testtömeg-kg/nap dózis alkalmazásával történő, az itt ismertetett eljárások szerint elvégzett vizsgálat nem idéz elő észlelhető neurotoxicitást, és ha a szerkezetileg és/vagy metabolizmus szempontjából rokon vegyületekkel kapcsolatos adatok alapján nem várható toxicitás, a három dózisszint alkalmazásával történő teljes vizsgálatot esetenként szükségtelen elvégezni. A várható humán expozíció nagyobb orális dózis alkalmazását teszi esetenként szükségessé a határérték-vizsgálatban. Más típusú beadási módok, így például inhalálás vagy dermális alkalmazás esetén a vizsgálandó anyag fizikaikémiai tulajdonságai gyakran előre jelezhetik a lehetséges expozíciós szint maximumát. Akut orális vizsgálat elvégzéséhez a határérték-vizsgálat során alkalmazott dózisnak legalább 2 000 mg/kg-nak kell lennie.
1.5.6. A dózisok beadása
A vizsgálandó anyag dózisait legalább 28 napon át naponta, azaz heti hét napon át kell adagolni az állatoknak; ötnapos adagolási rend vagy rövidebb expozíciós időszak alkalmazását megfelelően indokolni kell. Ha a vizsgálandó anyagot szondán át adagolják, a dózist lehetőleg egyszerre kell egy gyomorszondán vagy megfelelő intubációs kanülön át beadni az állatnak. Az, hogy egyszerre maximálisan mekkora térfogatú folyadék adható be, a kísérleti állatok méretétől függ. A térfogat nem lehet 1 ml/100 g testtömegaránynál nagyobb. Vizes oldatok esetében azonban 2 ml/100 g testtömegarány is alkalmazható. Az irritáló vagy korróziós hatású anyagok kivételével, amelyek esetében a magasabb koncentrációk általában súlyosabb hatásokat okoznak, minimálisra kell csökkenteni a térfogatbeli eltéréseket, amihez a koncentrációt kell úgy beállítani, hogy minden dózisszinten állandó térfogatot lehessen biztosítani.
A táplálékkal vagy ivóvízzel bejuttatott anyagok esetében fontos, hogy a vizsgálandó anyag mennyisége ne zavarja a normál táplálkozást vagy vízháztartást. Ha a vizsgálandó anyagot a táplálékkal juttatják be, vagy a táplálékbeli koncentrációt (ppm), vagy pedig az állat testtömegére számított dózist kell állandó értéken tartani, és meg kell adni, hogy melyik alternatívát alkalmazzák. A szondával bejuttatott anyagok esetében a dózist mindig a nap hasonló időszakában kell beadni, és szükség szerint újra és újra be kell állítani ahhoz, hogy az állat testtömegéhez viszonyítva állandó értéken lehessen tartani. Ha egy hosszú távú vizsgálat előtt előzetes vizsgálatként ismételt dózisú vizsgálatot végeznek, mindkét vizsgálatban hasonló takarmányt kell alkalmazni. Akut vizsgálatok esetén, ha a dózist nem lehet egyszerre bejuttatni, akkor egy legfeljebb 24 órás időtartam alatt részletekben is beadható.
1.6. MEGFIGYELÉSEK
1.6.1. A megfigyelések és vizsgálatok gyakorisága
Ismételt dózisú vizsgálatok esetében a megfigyelési időszaknak az egész kezelési időszakot le kell fednie. Akut vizsgálatok esetében a kezelés után 14 napig kell még megfigyeléseket végezni. A mellékcsoportokba tartozó és a kezelés utáni időszakban expozíció nélkül tartott állatok esetében a megfigyeléseknek ezt az időszakot is le kell fedniük.
A megfigyeléseket kellő gyakorisággal kell végezni, hogy az esetleges viselkedési és/vagy neurológiai rendellenességek észlelésének valószínűsége a lehető legnagyobb legyen. A megfigyeléseket lehetőleg mindig a nap azonos szakában kell végezni, és ehhez figyelembe kell venni azt is, hogy a várt hatások a dózis beadása után mikor érik el a maximumukat. A klinikai megfigyelések és funkcionális vizsgálatok gyakoriságát a 2. táblázatban foglaltuk össze. Ha a kinetikai adatok vagy más, korábbi vizsgálatokban kapott adatok szerint más időpontokat kellene alkalmazni a megfigyelésekhez, vizsgálatokhoz vagy megfigyelések utáni időszakokhoz, alternatív kísérleti programot kell követni a kinyerhető információk maximalizálása érdekében. A kísérleti program ilyen jellegű módosításait meg is kell indokolni.
1.6.1.1. Az általános egészségi állapot és a megbetegedések/elhullások megfigyelése
Az állatok egészségi állapotát legalább naponta egyszer, a megbetegedéseket és elhullásokat pedig naponta kétszer gondosan meg kell figyelni.
1.6.1.2. Részletes klinikai megfigyelések
Az első expozíciót megelőzően egy alkalommal (az egyeden belüli összehasonlításokhoz), majd ezt követően a vizsgálat teljes időtartamától függően különböző időközönként (lásd 2. táblázat) részletes klinikai megfigyeléseket kell végezni az erre a célra kiválasztott összes állaton (lásd 1. táblázat). A gyógyulási mellékcsoportok részletes klinikai megfigyeléseit a gyógyulási időszak végén kell elvégezni. A részletes klinikai megfigyeléseket a ketrecen kívül, egy standard porondon kell végezni. Az észleléseket egy olyan pontozási rendszer segítségével kell gondosan felvenni, amely a megfigyelés során végzett minden egyes mérés esetében kritériumokat vagy pontozási skálákat is magában foglal. A vizsgálólaboratóriumnak világosan meg kell határoznia az alkalmazott kritériumokat vagy skálákat. Törekedni kell arra, hogy minimálisak legyenek a kísérleti körülmények közötti (a kezeléssel szisztematikusan nem összefüggő) eltérések, és hogy a megfigyeléseket az aktuális kezelést nem ismerő, képzett megfigyelők végezzék.
A megfigyeléseket ajánlatos megtervezetten végezni, amelynek során minden állatra vonatkozóan és minden megfigyelési időpontban világosan meghatározott (a „normál tartomány” meghatározását is magában foglaló) kritériumokat kell szisztematikusan alkalmazni. A „normál tartományt” megfelelően dokumentálni kell. Minden megfigyelt tünetet fel kell jegyezni. Ha megoldható, a megfigyelt tünetek erősségét is fel kell jegyezni. A klinikai megfigyelések többek között a bőr, a szőrzet, a szemek, a nyálkahártyák változásaira, szekrétumok és exkrétumok, valamint az autonóm aktivitás megjelenésére (pl. könnyezés, szőrmeredezés, pupillaméret, szokatlan légzési mintázat és/vagy szájon át történő légzés, szokatlan vizelés vagy székletürítés és elszíneződött vizelet) irányulnak.
Rögzíteni kell továbbá a testhelyzettel, aktivitási szinttel (pl. a standard porond csökkent vagy fokozott felderítése) és a mozgáskoordinációval kapcsolatos összes szokatlan választ is. A járás (pl. kacsázás, ataxia), a testtartás (pl. púpos tartás) és a megfogás, elhelyezés vagy más környezeti ingerekkel szembeni reaktivitás megváltozását, valamint a rángásos vagy görcsös mozgásokat, görcsös vonaglásokat vagy remegéseket, sztereotípiákat (pl. túlzott tisztálkodást, szokatlan fejmozgásokat, ismétlődő körbejárást) vagy bizarr viselkedést (pl. harapást vagy túlzott nyalogatást, öncsonkítást, hátrafelé menést, hangadást) vagy agressziót is fel kell jegyezni.
1.6.1.3. Funkcionális vizsgálatok
A részletes klinikai megfigyelésekhez hasonlóan az expozíció előtt, majd azt követően rendszeres időközönként funkcionális vizsgálatokat is kell végezni az erre kiválasztott összes állaton (lásd 1. táblázat). A funkcionális vizsgálatok gyakorisága is a teljes vizsgálat időtartamától függ (lásd 2. táblázat). A 2. táblázatban megadott megfigyelési időszakok mellett az extermináláshoz a lehető legközelebbi időpontban a gyógyulási mellékcsoportokban is funkcionális vizsgálatokat kell végezni. A funkcionális vizsgálatok során meg kell figyelni a különféle [pl. hallási, látási és proprioceptív (5) (6) (7)] ingerekre adott szenzoros reaktivitást, és el kell végezni a végtagok fogóerejének (8), valamint a motoros aktivitásnak a vizsgálatát (9). A motoros aktivitást olyan automata berendezéssel kell mérni, amely az aktivitás csökkenés és az aktivitásnövekedés kimutatására is képes. Ha egy másik meghatározott rendszert alkalmaznak, akkor annak kvantitatívnak kell lennie, és igazolni kell annak érzékenységét és megbízhatóságát is. Minden berendezés esetében ellenőrizni kell, hogy időben megbízhatóan, illetve az egyes berendezések egymáshoz képest konzisztensen működnek-e. A követendő eljárásokkal kapcsolatban a további részletek a vonatkozó hivatkozásokban találhatók. Ha nincsenek olyan adatok (pl. szerkezetaktivitási, epidemiológiai adatok vagy más toxikológiai vizsgálati adatok), amelyek potenciális neurotoxikus hatásokat jeleznének, fontolóra kell venni specializáltabb vizsgálatok végzését a szenzoros és motoros működés vagy a tanulás és a memória tanulmányozására, e lehetséges hatások részletesebb vizsgálata érdekében. A specializáltabb vizsgálatokkal és alkalmazásukkal kapcsolatban további információk az (1) hivatkozásban találhatók.
Kivételes esetben ki lehet hagyni a funkcionális vizsgálatból azokat az állatokat, amelyeknél a toxicitás jelei olyan mérvűek, hogy már zavarják az adott vizsgálatot. Meg kell indokolni, amennyiben az ilyen állatokat kizárják valamely funkcionális vizsgálatból.
1.6.2. Testtömeg és táplálék/vízfogyasztás
A legfeljebb 90 napig tartó vizsgálatok esetében minden állat testtömegét legalább hetente egyszer meg kell mérni, továbbá legalább hetente a táplálékfogyasztást is ellenőrizni kell (illetve ha a vizsgálandó anyagot az ivóvízzel adják be, akkor annak fogyasztását is). A hosszú távú vizsgálatok esetében az állatok testtömegét az első 13 hét során legalább hetente egyszer, majd azt követően legalább négyhetente meg kell mérni. Az első 13 hét során a táplálékfogyasztást (illetve ha a vizsgálandó anyagot az ivóvízzel adjuk be, akkor annak fogyasztását is) legalább hetente, majd azt követően körülbelül háromhavonta kell megmérni, kivéve ha az egészségi állapot változásai vagy testtömegváltozások azt másképp szabják meg.
1.6.3. Szemészeti vizsgálatok
A 28 napnál hosszabb vizsgálatok esetében lehetőleg minden állaton, de legalább a nagy dózissal kezelt és a kontrollcsoportokba tartozó állatokon a vizsgálandó anyag adagolásának megkezdése előtt, illetve a vizsgálat legvégén szemtükör vagy ezzel egyenértékű és megfelelő eszköz alkalmazásával szemészeti vizsgálatokat kell végezni. Ha szemelváltozást tapasztalnak, vagy ha a klinikai tünetek alapján ez szükségesnek látszik, minden állatot meg kell vizsgálni. A hosszú távú vizsgálatok esetében a 13. héten is szemészeti vizsgálatot kell végezni. Nem kell szemészeti vizsgálatot végezni, ha ilyen adatok más, hasonló időtartamú és hasonló dózisszintek mellett történő vizsgálatokból már rendelkezésre állnak.
1.6.4. Hematológiai és klinikai biokémiai vizsgálatok
Ha a neurotoxicitási vizsgálatot ismételt dózisú szisztémás toxicitási vizsgálattal kombinálva végzik, a szisztémás toxicitási vizsgálat vonatkozó módszerében előírtaknak megfelelően hematológiai és klinikai biokémiai vizsgálatokat is végezni kell. A mintavételt úgy kell végrehajtani, hogy minimális legyen a potenciális viselkedésneurológiai hatások kockázata.
1.6.5. Kórszövettani vizsgálatok
A neuropathológiai (idegkórtani) vizsgálatot úgy kell megtervezni, hogy egészítse ki és bővítse a vizsgálat in vivo fázisában tett megfigyeléseket. Ivaronként és csoportonként legalább 5 állatból (1ásd az 1. táblázatot és a következő bekezdést) szövetmintát kell venni, amelyet azután általánosan elfogadott perfúziós és fixálási technikák alkalmazásával in situ fixálni kell (lásd a (3) hivatkozás 5. fejezetét és a (4) hivatkozás 50. fejezetét). Minden makroszkóposan megfigyelhető változást fel kell jegyezni. Amennyiben a vizsgálatot önálló vizsgálatként végzik el a neurotoxicitás szűrése vagy a neurotoxikus hatások jellemzése céljából, a többi állat vagy specifikus viselkedésneurológiai (10) (11), neuropathológiai (10) (11) (12) (13), neurokémiai (10) (11) (14) (15) vagy elektrofiziológiai (10) (11) (16) (17) eljárásokhoz használható fel, amelyek kiegészíthetik az itt ismertetett eljárásokat és vizsgálatokat, vagy növelhetik a kórszövettani vizsgálatok alanyainak számát. E kiegészítő eljárások különösen akkor lehetnek hasznosak, ha empirikus megfigyelések vagy a várható hatások specifikus típusú vagy specifikus célterületre irányuló neurotoxicitást jeleznek (2) (3). Más esetben a fennmaradó állatok az ismételt dózisú toxicitási vizsgálati módszerben leírt rutin patológiai értékelésekhez is felhasználhatók.
A paraffinba ágyazott mintákat megszokott festési eljárással, például hematoxilin-eozin festékkel (H&E) kell megfesteni, és mikroszkópos vizsgálatokat kell végezni. Perifériás neuropátiák megfigyelése vagy gyanúja esetén műanyagba ágyazott perifériás idegszövetmintákat is vizsgálni kell. Egyes klinikai tünetek további helyek vizsgálatát vagy speciális festési eljárások alkalmazását tehetik szükségessé. A további vizsgálati helyekkel kapcsolatban útmutatás a (3) és (4) hivatkozásban található. Hasznos lehet továbbá, ha speciális festéseket alkalmaznak konkrét patológiai változások kimutatásához (18).
A központi és a perifériás idegrendszerből származó reprezentatív metszeteket szövettani vizsgálatoknak kell alávetni (lásd a (3) hivatkozás 5. fejezetét és a (4) hivatkozás 50. fejezetét). A vizsgált területek általában a következők: az előagy, a nagyagy központi része, ezen belül a hippokampuszt keresztmetszet, a középagy, a kisagy, a híd, a nyúltvelő, a szem a látóideggel és a retinával együtt, a gerincvelő a nyaki és ágyéki duzzanatnál, a dorzális ideggyökér-ganglionok, a dorzális és ventrális ideggyökérrostok, a proximális ülőideg, a proximális sípcsonti ideg (a térdnél) és a sípcsonti ideg lábikraizom-ágai. A gerincvelőből és a perifériás idegekből készített metszeteknek mind keresztirányú vagy haránt-, mind hosszanti metszeteket tartalmazniuk kel. Figyelmet kell szentelni az idegrendszer érhálózatának is. Meg kell vizsgálni egy vázizommintát is, különösen a lábikraizomét. Különös figyelmet kell fordítani a központi és perifériás idegrendszernek azokra a sejtes és rostos struktúrájú és mintázatú területeire, amelyekre különösen hatást gyakorolnak a neurotoxikus anyagok.
A toxikus anyag által tipikusan előidézett neuropathológiai elváltozásokkal kapcsolatban a (3) és a (4) hivatkozásban található útmutatás. Ajánlatos a szövetmintákat lépcsőzetesen megvizsgálni, ami azt jelenti, hogy először a nagy dózissal kezelt csoportokból származó metszeteket hasonlítjuk össze a kontrollcsoportból származókkal. Ha az ezekből a csoportokból származó mintákban nem láthatók neuropathológiai elváltozások, nincs szükség további vizsgálatra. Ha azonban neuropathológiai elváltozásokat észlelnek a nagy dózissal kezelt csoportokban, a köztes és kis dózisú csoportokból származó, potenciálisan érintett szövetekből készített mintákat is kóddal kell ellátni, majd egymás után meg kell vizsgálni őket.
Ha a kvalitatív vizsgálatok során bizonyítékot találnak valamilyen neuropathológiai elváltozásra, akkor az ilyen elváltozást mutató idegrendszeri területeken egy második vizsgálatot is el kell végezni. Az összes dóziscsoportban minden potenciálisan érintett területről metszeteket kell készíteni, amelyeket véletlenszerűen kódokkal kell ellátni, és a kód ismeretének hiányában ugyancsak véletlenszerűen kell őket megvizsgálni. Minden lézió esetében fel kell jegyezni azok gyakoriságát és súlyosságát. Miután minden dóziscsoportban kiértékelték az összes területet, vissza lehet fejteni a kódot, és a dózis-válasz összefüggések megállapítása érdekében statisztikai elemzést lehet végezni. Ismertetni kell az egyes léziók súlyosságának fokozatait.
A neuropathológiai leleteket a viselkedési megfigyelésekkel és mérésekkel, továbbá a korábbi és párhuzamosan végzett szisztémás toxicitási vizsgálatokból származó adatokkal összefüggésben kell értékelni.
2. ADATOK
2.1. AZ EREDMÉNYEK KEZELÉSE
Az állatokra vonatkozóan egyedi adatsorokat kell felvenni. Emellett az összes adatot táblázatos formában is össze kell foglalni úgy, hogy minden kezelt és kontrollcsoport esetében mutassa az állatok számát a vizsgálat kezdetén, valamint azoknak a számát, amelyek a vizsgálat során elhullottak vagy humánus módon exterminálásra kerültek, illetve az elhullások és humánus okokból végzett exterminálás időpontját, a toxicitásra utaló tüneteket mutató állatok számát, a megfigyelt toxikus hatások leírását, ezen belül megjelenésük időpontját, valamint ezek időbeli lefolyását, típusát és súlyosságát, és végül a léziókat mutató állatok számát és ezen belül a lézió(k) típusát és súlyosságát.
2.2. ÉRTÉKELÉS ÉS AZ EREDMÉNYEK ÉRTELMEZÉSE
A vizsgálat eredményeit a viselkedésneurológiai és neuropathológiai hatások (ha kiegészítő vizsgálatok is történtek, akkor emellett a neurokémiai vagy elektrofiziológiás hatások) és bármely más megfigyelt káros hatás előfordulása, súlyossága és viszonylagossága alapján kell értékelni. Ahol lehet, a számszerű eredményeket megfelelő és általánosan elfogadott statisztikai módszer alkalmazásával kell kiértékelni. A statisztikai módszereket a vizsgálat tervezésekor kell megválasztani.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek a következő információkat kell tartalmaznia:
|
|
Vizsgálandó anyag:
|
|
|
Vivőanyag (ha szükséges):
|
|
|
Kísérleti állatok:
|
|
|
Kísérleti körülmények:
|
|
|
Megfigyelések és vizsgálati eljárások:
|
|
|
Eredmények:
|
|
|
Az eredmények diszkussziója;
|
|
|
Következtetések:
|
4. HIVATKOZÁSOK
|
(1) |
OECD Giudance Document on Neurotoxicity Testing Strategies and Test Methods. OECD, Paris, In Preparation. |
|
(2) |
Test Guideline for a Developmental Neurotoxicity Study, OECD Guidelines for the Testing of Chemicals. In preparation. |
|
(3) |
World Health Organization (WHO) (1986). Environmental Health Criteria document 60: Principles and Methods for the Assessment of Neurotoxicity associated with Exposure to Chemicals. |
|
(4) |
Spencer, P. S. and Schaumburg, H. H. (1980). Experimental and Clinical Neurotoxicology. Eds. Spencer, P.S. and Schaumburg, H.H. eds. Williams and Wilkins, Baltimore/London. |
|
(5) |
Tupper, D.E. and Wallace, R.B. (1980). Utility of the Neurological Examination in Rats. Acta Neurobiol. Exp., 40, 999–1003. |
|
(6) |
Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, 691–704. |
|
(7) |
Moser, V.C., McDaniel, K.M. and Phillips, P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of amitraz. Toxic. Appl. Pharmacol., 108, 267–283. |
|
(8) |
Meyer, O.A., Tilson, H.A., Byrd, W.C. and Riley, M.T. (1979). A Method for the Routine Assessment of Fore- and Hind- limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, 233–236. |
|
(9) |
Crofton, K.M., Haward, J.L., Moser, V.C., Gill, M.W., Reirer, L.W., Tilson, H.A. and MacPhail, R.C. (1991) Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, 599–609. |
|
(10) |
Tilson, H.A., and Mitchell, CL. eds. (1992). Neurotoxicology Target Organ Toxicology Series. Raven Press, New York. |
|
(11) |
Chang, L.W., ed. (1995). Principles of Neurotoxicology. Marcel Dekker, New York. |
|
(12) |
Broxup, B. (1991). Neuopathology as a screen for Neurotoxicity Assessment. J. Amer. Coll. Toxicol., 10, 689–695. |
|
(13) |
Moser, V.C., Anthony, D.C., Sette, W.F. and MacPhail, R.C. (1992). Comparison of Subchronic Neurotoxicity of 2-Hydroxyethyl Acrylate and Acrylamide in Rats. Fund. Appl.Toxicol., 18, 343–352. |
|
(14) |
O'Callaghan, J.P. (1988). Neurotypic and Gliotypic Proteins as Biochemical Markers of Neurotoxicity. Eurotoxicol. Teratol., 10, 445–452. |
|
(15) |
O'Callaghan J.P. and Miller, D.B. (1988). Acute Exposure of the Neonatal Rat to Triethyltin Results in Persistent Changes in Neurotypic and Gliotypic Proteins. J. Pharmacol. Exp. Ther., 244, 368–378. |
|
(16) |
Fox. D.A., Lowndes, H.E. and Birkamper, G.G. (1982). Electrophysiological Techniques in Neurotoxicology. In: Nervous System Toxicology. Mitchell, CL. ed. Raven Press, New York, pp. 299–335. |
|
(17) |
Johnson, B.L. (1980). Electrophysiological Methods in neurotoxicity Testing. In: Experimental and Clinical Neurotoxicology. Spencer, P.S. and Schaumburg, H.H. eds., Williams and Wilkins Co., Baltimore/London, pp. 726-742. |
|
(18) |
Bancroft, J.D. and Steven A. (1990). Theory and Pratice of Histological Techniques. Chapter 17, Neuropathological Techniques. Lowe, James and Cox, Gordon eds. Churchill Livingstone. |
1. táblázat
A csoportonként szükséges állatok minimális száma, ha a neurotoxicitási vizsgálatot külön, illetve más vizsgálatokkal együtt végzik
|
|
A NEUROTOXICITÁSI VIZSGÁLAT ELVÉGZÉSÉNEK MÓDJA |
|||
|
Külön vizsgálat |
A 28 napos vizsgálattal együtt végzett vizsgálat |
A 90 napos vizsgálattal együtt végzett vizsgálat |
A krónikus toxicitási vizsgálattal együtt végzett vizsgálat |
|
|
Az állatok összlétszáma az egyes csoportokban |
10 hím és 10 nőstény |
10 hím és 10 nőstény |
15 hím és 15 nőstény |
25 hím és 25 nőstény |
|
A funkcionális vizsgálatokhoz, ezen belül részletes klinikai megfigyelésekhez kiválasztott állatok száma |
10 hím és 10 nőstény |
10 hím és 10 nőstény |
10 hím és 10 nőstény |
10 hím és 10 nőstény |
|
Az in situ perfúzióhoz és az ideg-kórszövettani vizsgálatokhoz kiválasztott állatok száma |
5 hím és 5 nőstény |
5 hím és 5 nőstény |
5 hím és 5 nőstény |
5 hím és 5 nőstény |
|
Az ismételt dózisú/szubkrónikus/krónikus toxicitási megfigyelésekhez, hematológiai vizsgálatokhoz, klinikai biokémiai vizsgálatokhoz, kórszövettani vizsgálatokhoz stb. (ahogyan az a megfelelő útmutatókban szerepel) kiválasztott állatok száma |
|
5 hím és 5 nőstény |
||
|
Adott esetben kiegészítő megfigyelések |
5 hím és 5 nőstény |
|
|
|
2. táblázat
A klinikai megfigyelések és funkcionális vizsgálatok gyakorisága
|
A megfigyelések típusai |
A vizsgálat időtartama |
||||||||||||||||||||||||||
|
Akut |
28 napos |
90 napos |
Krónikus |
||||||||||||||||||||||||
|
Minden állatban |
Általános egészségi állapot |
naponta |
naponta |
naponta |
naponta |
||||||||||||||||||||||
|
Elhullás/megbetegedés |
naponta kétszer |
naponta kétszer |
naponta kétszer |
naponta kétszer |
|||||||||||||||||||||||
|
A funkcionális megfigyelésekhez kiválasztott állatokban |
Részletes klinikai megfigyelések |
|
|
|
|
||||||||||||||||||||||
|
Funkcionális vizsgálatok |
|
|
|
|
|||||||||||||||||||||||
B.44. BŐRÖN ÁT TÖRTÉNŐ FELSZÍVÓDÁS: IN VIVO MÓDSZER
1. MÓDSZER
Ez a vizsgálati módszer egyenértékű az OECD TG 427 (2004) vizsgálattal.
1.1. BEVEZETÉS
Számos vegyszer esetén az expozíció főként a bőrön keresztül történik, miközben a kísérleti állatokon végzett toxikológiai vizsgálatok nagy részét orális úton történő bevitellel végzik. Az ebben az útmutatóban leírt, a bőrön át történő felszívódást tanulmányozó in vivo vizsgálat meghatározza azt a kapcsolatot, amely lehetővé teszi, hogy az orális vizsgálatokból extrapoláljuk a bőr expozíciójához kapcsolódó biztonsági szintet.
Az anyagnak nagyszámú sejtrétegen kell áthaladnia, mielőtt eléri a vérkeringést. A legtöbb anyag esetén a felszívódás sebességét a stratum corneum határozza meg, amely elhalt sejtekből áll. A bőrön keresztüli áteresztőképesség függ a vegyszer lipofilicitásától és az epidermisz külső rétegének vastagságától, valamint olyan tényezőktől, mint az anyag molekulatömege és koncentrációja. Általában a patkányok és a nyulak bőre nagyobb áteresztőképességgel rendelkezik, mint az emberé, míg a tengerimalac és a majom bőrének áteresztőképessége közelebb áll az emberéhez.
A bőrön át történő felszívódás vizsgálati módszereit két csoportba lehet sorolni: az in vivo és az in vitro módszerek csoportjába. Az in vivo módszer különféle kísérleti fajok esetében megbízható információt nyújt a bőrön át történő felszívódásra vonatkozóan. Az utóbbi időben dolgozták ki az in vitro módszereket. Ezek a teljes vagy részleges vastagságú állati vagy emberi bőrön át egy folyadéktartály felé történő anyagszállítás mérésén alapulnak. Az in vitro módszert egy külön vizsgálati módszer (1) ismerteti. Adott feltételek esetén a legmegfelelőbb módszer kiválasztásához ajánlatos tanulmányozni az OECD által a bőrön át történő felszívódási vizsgálatok lefolytatásáról kiadott útmutató dokumentumot (2), amely az in vivo és az in vitro módszerek alkalmasságára vonatkozóan több részletettel szolgál.
Az ebben a módszerben leírt in vivo módszer lehetővé teszi, hogy meghatározzuk, hogyan jut be a kísérleti anyag a bőrön át a szervi rekeszbe. Az eljárást évek óta széles körben használják (3) (4) (5) (6) (7). Bár a bőrön át történő felszívódásra vonatkozó in vitro vizsgálatok számos esetben megfelelők lehetnek, elképzelhetők olyan helyzetek, amelyekben csak az in vivo vizsgálat nyújthatja a szükséges adatokat.
Az in vivo módszer előnye, hogy fiziológiailag és az anyagcsere szempontjából sértetlen szervezetet használ, a vizsgálatot a toxikológiai vizsgálatokban rutinszerűen használt fajon végzik, ugyanakkor más fajok esetén módosítható. Hátránya, hogy élő állatokat használ, a megbízhatóbb eredmények érdekében radioaktívan jelzett anyagokra van szükség, nehézkes a korai felszívódási fázis meghatározása, és az előnyben részesített faj (patkány) bőrének áteresztőképessége eltér az emberétől. Az állati bőrnek általában nagyobb az áteresztőképessége, ezért az emberi bőrön át történő felszívódást a vizsgálat túlbecsülheti (6) (8) (9). Égető/maró anyagokat nem szabad élő állatokon kipróbálni.
1.2. FOGALOMMEGHATÁROZÁSOK
Fel nem szívott dózis: az a dózis, amelyet az expozíció után a bőr felületéről lemosnak, továbbá amely a nem záró fedőrétegen található, beleértve azt a dózist is, amelyről kimutatható, hogy az expozíció alatt a bőrről elpárolgott.
Felszívott dózis (in vivo): az a dózis, amely a vizeletben, a ketrec mosóoldatában, az ürülékben, a kilélegzett levegőben (ha mérik), a vérben, a szövetekben (ha gyűjtik) és a kísérleti preparátummal érintett bőrterület eltávolítása után fennmaradó tetemben jelen van.
Felszívható dózis: az a dózis, amely a lemosás után a bőrön vagy a bőrben található.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A lehetőleg radioaktívan jelzett kísérleti anyagot egy vagy több megfelelő dózisszinten, szokásosan használt preparátum formájában felviszik az állat lenyírt bőrére. A kísérleti preparátum egy meghatározott időtartamig marad kapcsolatban a bőrrel, megfelelő (nem záró, félig záró vagy záró) védőtakaró alatt, amely megakadályozza a kísérleti preparátum lenyelését. Az expozíció időtartamának lejártával a védőtakarót eltávolítják, a bőrt megfelelő tisztítószerrel megtisztítják, a védőtakarót és a tisztítóanyagokat elemzésre félreteszik, és új védőtakarót tesznek fel. Az állatokat az expozíciós időszak előtt, alatt és után egyedi anyagcsereketrecekben tartják, és a salakanyagokat, valamint a kilélegzett levegőt ezen időszak alatt elemzés céljából összegyűjtik. A kilélegzett levegő összegyűjtése elhagyható, ha megfelelő információ áll rendelkezésre arra vonatkozóan, hogy nem, vagy csak kis mennyiségben keletkezik illó radioaktív metabolit. A vizsgálatok során általában több állatcsoporton alkalmazzák a kísérleti preparátumot. Az egyik csoportot az expozíciós időszak elteltével elpusztítják. Más csoportokat ezután bizonyos meghatározott időközönként pusztítanak el (2). A mintavételi időszak végén elpusztítják a megmaradó állatokat, a vért elemzés céljából összegyűjtik, az alkalmazás helyét elemzés céljából eltávolítják, és a tetemet megvizsgálják az esetleges nem kiválasztott anyagok szempontjából. A mintákat megfelelő eszközökkel elemzik, és meghatározzák a bőrön át történő felszívódás mértékét (6) (8) (9).
1.4. A MÓDSZER LEÍRÁSA
1.4.1. Az állatfaj kiválasztása
Leggyakrabban patkányt alkalmaznak, de az emberéhez közelebb álló bőrön át történő felszívódási sebességgel rendelkező, szőr nélküli fajták és fajok is használhatók (3) (6) (7) (8) (9). A kísérleti állatok legyenek egyneműek (alapesetben hímneműek), fiatalok, felnőttek és egészségesek. A vizsgálat elején a használt állatok súlya ± 20 %-nál nagyobb mértékben nem térhet el az átlagos súlytól. Például a hímnemű patkányoknál a 200–250 g testtömeg, de inkább ennek a tartománynak a felső része kívánatos.
1.4.2. Az állatok száma és neme
Minden kísérleti preparátum esetében és minden ütemezett befejezési idő tekintetében egy-egy legalább négy egynemű egyedből álló csoportot kell kialakítani. Minden egyes időintervallum elteltével, például az expozíciós időszak (jellemzően 6 vagy 24 óra) végén és az ezt követő alkalmakkor (pl. 48 és 72 óra) elpusztítanak egy-egy állatcsoportot. Ha van olyan adat, amely a hímek és a nőstények között fennálló alapvető különbségekre utal a dermális toxicitás tekintetében, akkor az érzékenyebb nemet kell kiválasztani. Ha nincs ilyen adat, akkor bármelyik nem alkalmazható.
1.4.3. Tartási és etetési feltételek
Az állatkísérleti teremben a hőmérséklet 22 oC (± 3 oC) legyen. Bár a relatív páratartalomnak legalább 30 %-nak kell lennie, és lehetőleg nem haladhatja meg a 70 %-ot, kivéve a terem takarításának idejét, 50–60 %-os érték beállítására kell törekedni. A világítás legyen mesterséges, váltakozva 12 óra világosság és 12 óra sötétség. Az etetésnél a szokásos laboratóriumi étrend alkalmazható; az élelem és az ivóvíz mennyisége legyen korlátlan. A vizsgálat idején, és lehetőleg az akklimatizálódás idején is, az állatokat egyedi anyagcsereketrecekben kell tartani. Mivel a táplálék és a víz kiömlése befolyásolhatja az eredményeket, ennek lehetőségét a minimumra kell szorítani.
1.4.4. Az állatok előkészítése
Az állatokat az egyedi azonosíthatóság céljából megjelölik, és a laboratóriumi feltételekhez való akklimatizálódás érdekében öt nappal a vizsgálat megkezdését megelőzően egyedi ketrecükben tartják őket.
Az akklimatizálódás időszakát követően és körülbelül a kezelés megkezdését 24 órával megelőzően minden állatnak a váll- és hátrészén egy bőrterületet megnyírnak. A sérült bőr felszívási jellemzői eltérnek az ép bőrétől, ezért vigyázni kell, nehogy felhorzsolódjon a bőr. A nyírást követően és körülbelül 24 órával azelőtt, hogy a kísérleti anyag a bőrre kerül (lásd az 1.4.7. szakaszt), a faggyú eltávolításához a bőr felületét acetonnal le kell törölni. A szappannal és vízzel történő lemosás nem ajánlott, mivel az esetleges szappanmaradvány fokozhatja a kísérleti anyag felszívódását. A terület megfelelő nagyságú, lehetőleg legalább 10 cm2 legyen, hogy a kísérleti vegyszer felszívódásának a bőr cm2-ére jutó mennyiségét megbízhatóan lehessen számítani. Ez a terület a 200–250 g testtömegű patkányok esetén biztosított. Az előkészítés után az állatok visszakerülnek az anyagcsereketrecekbe.
1.4.5. Kísérleti anyag
A kísérleti anyag az az anyag, amelynek penetrációs jellemzőit vizsgáljuk. Ideális esetben a kísérleti anyag radioaktívan jelzett.
1.4.6. Kísérleti preparátum
A kísérletianyag-preparátumnak (a kísérleti anyagot tartalmazó, tiszta, hígított vagy formulázott anyag, amelyet felvisznek a bőrre) meg kell egyeznie azzal az anyaggal (vagy reális helyettesítőjének kell lennie annak az anyagnak), amelynek az ember vagy más lehetséges célfajok ki lehetnek téve. A „szokásosan használt” preparátumtól való bárminemű eltérésre csak indokolt esetben van lehetőség. Ha szükséges, akkor a vizsgált anyagot fel kell oldani vagy szuszpendálni kell valamilyen alkalmas vivőanyagban. A víztől eltérő vivőanyagok esetében ismerni kell a felszívódási jellemzőket és a kísérleti anyaggal történő esetleges kölcsönhatást.
1.4.7. A bőrre történő felvitel
A bőr felszínének egy bizonyos felületén kijelölik a felvitel helyét. Ezután erre a helyre egyenletesen elosztva ismert mennyiségű kísérleti preparátumot visznek fel. Ez a mennyiség általában az emberi expozícióhoz hasonló, szokásos esetben szilárd anyag esetében 1–5 mg/cm2, folyadék esetében pedig akár 10 μl/cm2 lehet. Az ettől eltérő mennyiséget a várható használati feltételeknek, a vizsgálat célkitűzéseinek vagy a kísérleti preparátum fizikai jellemzőinek kell indokolnia. Az alkalmazást követően a kezelt területet védeni kell a vakarás ellen. Az eszköz jellemző kialakítására mutat példát az 1. ábra. A felvitel helyét általában nem záró védőtakaróval (pl. áteresztő nejlon géztakaróval) védeni kell. Ugyanakkor végtelen dózis esetén a felvitel helyét le kell zárni. Ha a félig illékony kísérleti anyag párolgása következtében a kísérleti anyag visszanyerési aránya elfogadhatatlan mértékig csökken (lásd az 1.4.10. szakasz első bekezdését is), akkor az elpárolgó anyagot célszerű az adagolóeszközt takaró szénszűrőben felfogni (lásd 1. ábra). Fontos, hogy semmilyen eszköz sem sértheti fel a bőrt, nem szívhatja fel a kísérleti anyagot és nem léphet azzal reakcióba. Az állatokat a salakanyagok gyűjtése érdekében vissza kell vinni az egyedi anyagcsereketrecekbe.
1.4.8. Az expozíció időtartama és a mintavétel
Az expozíció időtartama az az időintervallum, amely a kísérleti anyag felvitele és a bőr lemosásával történő eltávolítása között telik el. A várható emberi expozíciós időtartamnak megfelelően kellő expozíciós időtartamot (jellemzően 6 vagy 24 órát) kell alkalmazni. Az expozíciós időszak elteltével az állatokat az ütemezett elpusztításig az anyagcsereketrecekben tartják. Az állatokat a vizsgálat teljes ideje alatt, rendszeres időközönként, a toxicitás/rendellenes reakciók jeleinek kimutatása végett meg kell figyelni. Az expozíciós időszak elteltével az irritáció látható jeleinek kimutatása végett a kezelt bőrt szemrevételezni kell.
Az anyagcsereketrecek tegyék lehetővé a vizsgálat teljes időtartama alatt a vizelet és az ürülék külön gyűjtését. Tegyék lehetővé továbbá a 14C-szén-dioxid és az illó 14C-szénvegyületek gyűjtését, amelyeket elemezni kell, ha nagyobb mennyiségben (> 5 %) termelődnek. A vizeletet, az ürüléket és a csapdafolyadékokat (pl. a 14C-szén-dioxidot és az illó 14C-szénvegyületeket) csoportonként és mintavételi időpontonként egyedileg kell gyűjteni. Ha kellő információ áll rendelkezésre arra vonatkozóan, hogy nem képződik vagy csak kis mennyiségben képződik illó radioaktív metabolikum, akkor nyitott ketrecek is használhatók.
A salakanyagok gyűjtésére az expozíciós időszakban, a bőrrel történő első érintkezést követően 24 óráig, majd a kísérlet végéig naponta kerül sor. Bár általában három ürülékgyűjtési időszak elegendő, a kísérleti preparátum előirányzott célja vagy a rendelkezésre álló kinetikai adatok függvényében alkalmasabb, vagy további vizsgálati időpontok kijelölésére is szükség lehet.
Az expozíciós időszak végén a védőeszközt minden állatról leveszik, és elemzésre külön félreteszik. Az állatok kezelt bőrét megfelelő törlőkendő használatával legalább háromszor tisztítószerrel le kell mosni. Vigyázni kell, hogy a test más része ne szennyeződjön be. A tisztítószer feleljen meg a szokásos higiéniai gyakorlatnak, például lehet vizes szappanoldat. Végül a bőrt meg kell szárítani. A törlőkendőket és a lemosott oldatot elemzésre félre kell tenni. A későbbre ütemezett csoportba tartozó állatokon, mielőtt egyedi ketreceikbe visszatérnek, a kezelt terület védelmére friss védőtakarót kell alkalmazni.
1.4.9. Befejező eljárások
Minden csoport esetében az egyes állatokat az ütemezés szerint kell elpusztítani, és a vért elemzés céljából össze kell gyűjteni. A védőeszközt vagy a védőtakarót az elemzés céljából el kell távolítani. A kezelt bőrfelületet és egy ahhoz hasonló, nem kezelt lenyírt bőrfelületet minden állatról külön elemzés céljából el kell távolítani. Az alkalmazás területe a stratum corneumnak az alatta lévő epidermisztől történő leválasztásával felosztható annak érdekében, hogy a kísérleti vegyszer eloszlására vonatkozóan több információt lehessen összegyűjteni. Ennek az eloszlásnak az expozíciós időszak után egy bizonyos idő elteltével történő meghatározása utalhat arra, hogy milyen sorsra jutott a stratum corneumban maradó esetleges kísérleti vegyszer. A bőr felosztásának megkönnyítése érdekében (a végső bőrlemosást és az állat elpusztítását követően) el kell távolítani a védőtakarót. A kezelt bőrfelületet a körülötte lévő bőrgyűrűvel együtt lenyúzzák a patkányról és egy táblára szegezik. Egy ragasztószalagcsíkot gyengéden a bőrfelületetre nyomnak, majd a stratum corneum egy részével együtt eltávolítják. További ragasztószalagcsíkokat alkalmaznak mindaddig, amíg a szalag már nem ragad a bőrfelülethez, azaz már a teljes stratum corneumot eltávolították. Minden egyes állat valamennyi ragasztószalagcsíkja egyetlen konténerbe gyűjthető össze, amelybe szövetoldószert adagolnak a stratum corneum feloldására. Mielőtt a tetemet a felszívott dózis szempontjából elemzésnek vetnék alá, az esetleges külön vizsgálat céljára szolgáló célszövetek eltávolíthatók. Az egyes állatok tetemét elemzésre félre kell tenni. Rendszerint elegendő elemezni a teljes tartalmat. Külön vizsgálat céljából a megfelelő célszervek eltávolíthatók (ha ezt más vizsgálatok igénylik). Az ütemezett elpusztításkor a húgyhólyagban lévő vizeletet hozzá kell adni a korábban összegyűjtött vizelethez. Az ütemezett elpusztításkor az ürülék kigyűjtése után az anyagcsereketreceket és a csapdáikat megfelelő oldószerrel el kell mosni. Az egyéb, esetleg szennyezett eszközöket ugyancsak meg kell vizsgálni.
1.4.10. Elemzés
Valamennyi vizsgálat során megfelelő visszanyerést kell elérni (azaz a radioaktivitás átlagosan 100 ± 10 %-át). Az ezen a tartományon kívüli visszanyerést indokolni kell. Az alkalmazott dózis mennyiségét minden mintában megfelelően hitelesített eljárással kell megvizsgálni.
Statisztikai szempontból célszerű lehet megállapítani az egyes dózisokhoz tartozó eredmények szórását.
2. ADATOK
A kísérleti vegyszer és a metabolikum tekintetében egyedenként és mintavételi időpontonként a következő méréseket kell elvégezni. Az egyedi adatokon kívül a mintavételi időpontokhoz tartozó adatok átlagát is meg kell adni.
|
— |
A védőeszközökhöz rendelt mennyiség, |
|
— |
a bőrről eltávolítható mennyiség, |
|
— |
a bőrben/bőrön található le nem mosható mennyiség, |
|
— |
a vizsgált vérben lévő mennyiség, |
|
— |
az ürülékben és (ha szükséges) a kilélegzett levegőben lévő mennyiség, |
|
— |
a tetemben és a külön vizsgálatok céljából kiemelt szervekben maradó mennyiség. |
Az ürülékben, a kilélegzett levegőben, a vérben és a tetemben lévő kísérleti anyag és/vagy metabolikum mennyisége lehetővé teszi a teljes felszívott mennyiség minden egyes időpontban történő meghatározását. Ugyancsak meghatározható az expozíciós időszakban a kísérleti anyagnak a bőr cm2-ére jutó felszívott mennyisége.
3. JEGYZŐKÖNYV
3.1. A KÍSÉRLETI JEGYZŐKÖNYV
A kísérleti jegyzőkönyv tartalmazza a kísérlet leírásában meghatározott követelményeket, beleértve a használt vizsgálati rendszer indoklását, valamint a következőket:
|
|
Kísérleti anyag:
|
|
|
Kísérleti preparátum:
|
|
|
Kísérleti állatok:
|
|
|
Kísérleti körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények szöveges értékelése. |
|
|
Következtetések. |
4. HIVATKOZÁSOK
|
(1) |
Testing Method B.45. Skin Absorption: In vitro Method. |
|
(2) |
OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris. |
|
(3) |
ECETOC (1993). Percutaneous Absorption. European Centre for Ecotoxicology and Toxicology of Chemicals, Monograph No. 20. |
|
(4) |
Zendzian RP (1989). Skin Penetration Method suggested for Environmental Protection Agency Requirements. J. Am. Coll. Toxicol. 8(5), 829–835. |
|
(5) |
Kemppainen BW, Reifenrath WG (1990). Methods for skin absorption. CRC Press Boca Raton, FL, USA. |
|
(6) |
EPA (1992). Dermal Exposure Assessment: Principles and Applications. Exposure Assessment Group, Office of Health and Environmental Assessment. |
|
(7) |
EPA (1998). Health Effects Test Guidelines, OPPTS 870-7600, Dermal Penetration. Office of Prevention, Pedsticides and Toxic Substances. |
|
(8) |
Bronaugh RL, Wester RC, Bucks D, Maibach HI and Sarason R (1990). In vivo percutaneous absorption of fragrance ingredients in reshus monkeys and humans. Fd. Chem. Toxic. 28, 369–373. |
|
(9) |
Feldman RJ and Maibach HI (1970). Absorption of some organic compounds through the skin in man. J. Invest Dermatol. 54, 399–404. |
1. ábra
Példa a bőrön át történő felszívódásra vonatkozó in vivo kísérletek során a bőrre történő felvitel helyének meghatározására és védelmére szolgáló jellemző eszközre

B.45. BŐRÖN ÁT TÖRTÉNŐ FELSZÍVÓDÁS: IN VITRO MÓDSZER
1. MÓDSZER
Ez a vizsgálati módszer egyenértékű az OECD TG 428 (2004) vizsgálattal.
1.1. BEVEZETÉS
A módszer célja, hogy adatokat szolgáltasson a kísérleti anyag bőrből kimetszett mintán keresztül történő felszívódására vonatkozóan. A módszer összekapcsolható a bőrön át történő felszívódás in vivo módszerével (1), de különállóan is lefolytatható. A módszeren alapuló vizsgálatok tervezéséhez ajánlatos az OECD által a bőrön át történő felszívódási vizsgálatok lefolytatásáról kiadott útmutató dokumentum (2) tanulmányozása. Az útmutató dokumentum azért készült, hogy konkrét körülmények között történő használat esetén megkönnyítse a megfelelő in vitro eljárások kiválasztását annak érdekében, hogy az ezen módszerrel nyert eredmények kellő megbízhatóságúak legyenek.
A bőrön át történő felszívódásra és a bőr szállítóképességére vonatkozó mérési módszereket két csoportba lehet sorolni: az in vivo és az in vitro módszerek csoportjába. A bőrön át történő felszívódás in vivo módszere gyakran alkalmazott eljárás, és számos állatfajra vonatkozóan nyújt farmakokinetikai információkat. Egy in vivo módszert ismertet egy másik vizsgálati módszer (1). Az in vitro módszereket is évek óta használják a bőrön át történő felszívódás mérésére. Bár az itt leírt in vitro módszer formális validálását még nem végezték el, az OECD szakértői 1999-ben megállapították, hogy elegendő kiértékelt adat áll rendelkezésre az in vitro módszer alátámasztására (3). Az útmutató dokumentum (2) további, e döntést igazoló részleteket tartalmaz, többek között nagyszámú példát az in vitro és az in vivo módszerek közvetlen összehasonlítására. A témát számos monográfia tekinti át, amelyek részletes háttéranyagot nyújtanak az in vitro módszerek használatára vonatkozóan (4) (5) (6) (7) (8) (9) (10) (11) (12). Az in vitro módszerek a vegyszereknek a bőrbe és a bőrön át, egy folyadéktartály felé történő diffúzióját vizsgálják, és használhatnak élettelen bőrt is kizárólag a diffúzió vizsgálatához, vagy friss, az anyagcsere szempontjából aktív bőrt annak érdekében, hogy egyszerre vizsgálják a diffúziót és a bőr anyagcseréjét. Az ilyen módszereket különösen annak összehasonlítására használják, hogy hogyan zajlik le a különféle vegyszerkészítményeknek a bőrbe és a bőrön át történő bejutása, valamint hasznos modellként szolgálhatnak az emberi bőrön át történő felszívódás értékelésére is.
Az in vitro módszer nem minden helyzetben és nem minden vegyszerfajtával alkalmazható. Egyes esetekben az in vitro módszerek kiindulásképpen, a bőrbe való behatolás kvalitatív értékelésére használhatók. Bizonyos esetekben szükség lehet arra, hogy az így nyert eredményeket in vivo adatokkal egészítsük ki. Az útmutató dokumentum (2) részletesebben is ismerteti azokat a körülményeket, amikor érdemes az in vitro módszerekhez folyamodni. A döntés alátámasztására szolgáló további részletes információk a (3) hivatkozásban találhatók.
Ez a módszer egy kísérleti anyagnak a bőrön át történő felszívódására és továbbítására vonatkozó vizsgálatának általános elveit mutatja be bőrből kimetszett minta esetében. Számos emlősfaj bőre használható, beleértve az emberét is. A bőr áteresztőképességi jellemzői a testből való kimetszés után is változatlanok maradnak, mivel a diffúzió fő gátja az élettelen stratum corneum; vegyszereknek bőrön át történő aktív továbbítását nem állapították meg. Kimutatták, hogy a bőrön át történő felszívódás során a bőr képes metabolizálni bizonyos vegyszereket (6), de ez a folyamat nem korlátozza az adott dózis felszívódási sebességét, bár hatással lehet a véráramba bekerülő anyag természetére.
1.2. FOGALOMMEGHATÁROZÁSOK
Fel nem szívott dózis: az a dózis, amelyet az expozíció után a bőr felületéről lemosnak, továbbá amely a nem záró fedőrétegen található, beleértve azt a dózist is, amelyről kimutatható, hogy az expozíció alatt a bőrről elpárolgott.
Felszívott dózis (in vitro): a kísérleti anyagnak az a tömege, amely egy meghatározott időtartam alatt elérte a receptorfolyadékot vagy a szisztémás keringést.
Felszívható dózis (in vitro): az a dózis, amely a lemosás után a bőrön vagy a bőrben található.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A kísérleti anyagot, amely radioaktívan jelzett is lehet, felviszik egy, a diffúziós cella két kamráját elválasztó bőrminta felületére. A vegyszer meghatározott ideig, meghatározott feltételek között a bőrön marad, majd megfelelő tisztító eljárással eltávolítják. A receptorfolyadékból a kísérlet során bizonyos időközönként mintát vesznek, és elemzik a kísérleti vegyszer és/vagy a metabolikum tekintetében.
Anyagcsere szempontjából aktív szervezet használata esetén megfelelő módszerrel elemezni lehet a kísérleti vegyszer metabolikáját. A kísérlet végén, ha szükséges, megmérik a kísérleti vegyszer eloszlását és metabolikumát.
Az ebben a módszerben és az útmutató dokumentumban (2) leírt megfelelő feltételek megléte esetén az egy bizonyos időtartam alatt felszívódott kísérleti anyag mennyiségét a receptorfolyadék és a kezelt bőr elemzésével vizsgálják. A bőrben maradó kísérleti anyagot felszívottnak kell tekinteni, kivéve akkor, ha kimutatható, hogy a felszívódás kizárólag a receptorfolyadék alapján is meghatározható. A többi összetevő elemzése (a bőrről lemosott és a bőr rétegeiben megmaradt anyagok) lehetővé teszi a további adatértékelést, beleértve a kísérleti anyag teljes eloszlása és a visszanyerési arány elemzését is.
A kísérletet végző laboratórium vizsgálati rendszere alkalmasságának és megbízhatóságának kimutatása érdekében rendelkezésre kell állniuk a vonatkozó referencia-vegyszerekre vonatkozó eredményeknek, amelyeknek összhangban kell lenniük a használt módszerre vonatkozó publikált szakirodalommal. Ez a követelmény egy alkalmas (lehetőleg a kísérleti anyaghoz közeli lipofilicitású) referencia-vegyszerrel és párhuzamosan a kísérleti anyaggal végzett kísérlettel, vagy pedig megfelelő korábbi, több, különféle lipofilicitású referenciaanyagra (pl. koffein, benzoesav és tesztoszteron) vonatkozó adattal teljesíthető.
1.4. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.4.1. Diffúziós cella
A diffúziós cella donorkamrából és receptorkamrából áll, amelyek közé elhelyezik a bőrt (egy tipikus elrendezés található az 1. ábrán). A cellának jól kell záródnia a bőr körül, biztosítania kell a bőr alsó felületével érintkező receptorfolyadék jó keveredését és a receptorfolyadékból való könnyű mintavételt, és alkalmasnak kell lennie a cella és tartalma hőmérsékletének szabályozására. A statikus és az átfolyásos diffúziós cellák egyaránt elfogadhatók. A kísérleti preparátum véges dózisú expozíciója esetén a donorkamrákat általában nem zárják le. Ugyanakkor végtelen dózis és bizonyos véges dózisok használata esetén a donorkamrák lezárhatók.
1.4.2. Receptorfolyadék
Előnyben kell részesíteni a fiziológiailag vezető receptorfolyadékokat, bár indokolt esetben más folyadék is használható. Meg kell határozni a receptorfolyadék pontos összetételét. Ki kell mutatni, hogy a kísérleti anyag a receptorfolyadékban megfelelő mértékben oldható, ami ahhoz szükséges, hogy ne gátolja a felszívódást. Továbbá, a receptorfolyadék nem károsíthatja a bőrpreparátum épségét. Az átfolyásos rendszerben az átfolyás sebessége nem gátolhatja a kísérleti anyagnak a receptorfolyadékban történő diffúzióját. Statikus cellarendszer esetén a folyadékot folyamatosan keverni kell, és rendszeresen mintát kell belőle venni. Ha az anyagcserét is vizsgáljuk, akkor a receptorfolyadéknak a kísérlet folyamán támogatnia kell a bőr életképességét.
1.4.3. Bőrpreparátumok
Emberi és állati eredetű bőr egyaránt felhasználható. Tudatában kell lenni annak, hogy az emberi bőr felhasználását nemzeti és nemzetközi etikai szempontok és feltételek szabályozzák. Bár előnyben részesítendő az élő bőr, élettelen bőrt is szabad használni, feltéve hogy kimutatható a bőr épsége. Epidermiszmembrán (enzimmel, hővel vagy kémiailag leválasztva), illetőleg dermatomával készített, hasított vastagságú bőr (jellemzően 200–400 μm vastagsággal) egyaránt felhasználható. Teljes vastagságú bőr is használható, de kerülni kell a túl vastag bőr (kb. > 1 mm) használatát, kivéve akkor, ha a kísérleti vegyszernek a bőr rétegeiben történő kimutatásához erre kifejezetten szükség van. A faj, az anatómiai helyzet és a preparátumkészítési eljárás megválasztásának indokoltnak kell lennie. Kísérleti preparátumonként minimum négy, elfogadható adatokat szolgáltató vizsgálatot kell elvégezni.
1.4.4. A bőrpreparátum épsége
Alapvető fontosságú, hogy a bőrt gondosan előkészítsük. A nem megfelelő kezelés következtében sérülhet a stratum corneum, ezért ellenőrizni kell az előkészített bőr épségét. Ha a bőr anyagcseréjét vizsgáljuk, a frissen kimetszett bőrt a lehető leggyorsabban kell felhasználni olyan feltételek között, amelyekről ismert, hogy támogatják az anyagcsere-aktivitást. Általános útmutatásként azt mondhatjuk, hogy a frissen kimetszett bőrt 24 órán belül fel kell használni, de az elfogadható tárolási időszak a metabolizációban használt enzimrendszertől és a tárolási hőmérséklettől függően változhat (13). Ha a bőrpreparátumot a használat előtt tárolták, bizonyítani kell, hogy a gátfunkció fennmaradt.
1.4.5. Kísérleti anyag
A kísérleti anyag az az anyag, amelynek penetrációs jellemzőit vizsgáljuk. Ideális esetben a kísérleti anyag radioaktívan jelzett.
1.4.6. Kísérleti preparátum
A kísérletianyag-preparátumnak (a kísérleti anyagot tartalmazó, tiszta, hígított vagy formulázott anyag, amelyet felvisznek a bőrre) meg kell egyeznie azzal az anyaggal (vagy reális helyettesítőjének kell lennie annak az anyagnak), amelynek az ember vagy más lehetséges célfajok ki lehetnek téve. A „szokásosan használt” preparátumtól való bárminemű eltérésre csak indokolt esetben van lehetőség.
1.4.7. A kísérleti anyagok koncentrációja és összetétele
A vizsgálatot általában a kísérleti anyag több koncentrációjával is elvégzik oly módon, hogy az egyes koncentrációk átfogják a lehetséges emberi expozíció felső határát. Ugyanígy meg kell fontolni a jellemzően előforduló formulációk mindegyikének vizsgálatát.
1.4.8. A bőrre történő felvitel
A szokásos feltételek között az ember vegyszereknek való expozíciója során véges dózisokkal találkozunk. Ezért az emberi expozíciót modellező alkalmazás során szokásos esetben szilárd anyag esetében a bőrön 1–5 mg/cm2 mennyiséget, folyadék esetében pedig 10 μl/cm2-ig terjedő mennyiséget kell használni. A mennyiséget a várható használati feltételek, a vizsgálat célkitűzései vagy a kísérleti preparátum fizikai jellemzői függvényében kell meghatározni. Például az egységnyi felületre működő nagy mennyiség modellezhető azáltal, ha a bőr felületén végtelen dózist alkalmazunk.
1.4.9. Hőmérséklet
A vegyszerek passzív diffúzióját (és ezért a bőrön át történő felszívódást is) befolyásolja a hőmérséklet. A diffúziós kamrát és a bőrt állandó, a normál bőr hőmérsékletéhez közeli, 32 ± 1 oC-os hőmérsékleten kell tartani. Különféle cellafelépítések különféle vízfürdőt vagy fűtöttblokk-hőmérsékletet kívánnak annak érdekében, hogy biztosítva legyen, hogy a receptor/bőr fiziológiai normaértékén legyen. A páratartalom lehetőleg 30 és 70 % között legyen.
1.4.10. Az expozíció időtartama és a mintavétel
A bőr kísérleti preparátumnak való expozíciója történhet a kísérlet teljes időtartama alatt vagy rövidebb időtartamok során (az emberi expozíció valamely sajátos típusának modellezéseként). A bőrről megfelelő tisztítószerrel le kell mosni a felesleges kísérleti preparátumot, és a lemosott folyadékot elemzés céljából össze kell gyűjteni. A kísérleti preparátum eltávolítására vonatkozó eljárás a várható használati feltételektől függ, és indokoltnak kell lennie. A felszívódási jellemzők megfelelő megállapításához általában 24 órás mintavételi időszak szükséges. Mivel a bőr épsége 24 óra elteltével romlásnak indulhat, a mintavételi idő rendszerint nem haladhatja meg a 24 órát. Azoknak a kísérleti anyagoknak az esetében, amelyek gyorsan behatolnak a bőrbe, ez nem feltétlenül szükséges, de a lassan behatoló kísérleti anyagok esetében hosszabb időre lehet szükség. A receptorfolyadékból történő mintavétel gyakoriságának olyannak kell lennie, amely lehetővé teszi a kísérleti anyag felszívódási folyamatának grafikus megjelenítését.
1.4.11. Befejező eljárások
A kísérleti rendszer minden összetevőjét elemezni kell, és meg kell határozni a visszanyerést. Ez magában foglalja a donorkamrát, a bőr felületéről lemosott folyadékot, a bőrpreparátumot és a receptorfolyadékot/kamrát. Bizonyos esetekben, külön elemzések céljából a bőrt részekre oszthatjuk: a bőr expozíciónak kitett részeire és a cella pereme alatti bőrterületre, illetőleg a stratum corneumra, az epidermiszre és a dermiszre.
1.4.12. Elemzés
Valamennyi vizsgálat során megfelelő visszanyerést kell elérni (a radioaktivitás átlagosan 100 ± 10 %-ára kell törekedni, az esetleges eltérést indokolni kell). A receptorfolyadékban, a bőrpreparátumban, valamint a bőrfelületről és a műszerekről lemosott öblítőfolyadékban lévő kísérleti anyag mennyiségét megfelelő módszer alkalmazásával elemezni kell.
2. ADATOK
Be kell mutatni a receptorfolyadék elemzését, a vizsgálati rendszerben a kísérleti vegyszer eloszlását és a felszívódás jellemzőinek időbeli alakulását. Ha az expozíció során véges dózist alkalmazunk, akkor meg kell határozni a bőrről lemosott mennyiséget, a bőrrel (és ha vizsgáljuk, a különböző bőrrétegekkel) összefüggésbe hozható mennyiséget és a receptorfolyadékban jelen levő mennyiséget (sebességben, abszolút mennyiségben vagy százalékban kifejezve). A bőrön át történő felszívódás néha kizárólag a receptorfolyadékra vonatkozó adatok alapján is kifejezhető. Ugyanakkor ha a kísérleti anyag a vizsgálat végén a bőrben marad, szükség lehet a teljes felszívódott mennyiségbe való beszámítására (lásd a (3) hivatkozás 66. bekezdését). Ha az expozíció során végtelen dózist alkalmazunk, akkor az adatok lehetővé tehetik az áteresztőképességi állandó (Kp) kiszámítását. Ez utóbbi esetben a felszívódott anyag aránya nem lényeges.
3. JEGYZŐKÖNYV
3.1. A KÍSÉRLETI JEGYZŐKÖNYV
A kísérleti jegyzőkönyv tartalmazza a kísérlet leírásában meghatározott követelményeket, beleértve a használt vizsgálati rendszer indoklását, valamint a következőket:
|
|
Kísérleti anyag:
|
|
|
Kísérleti preparátum:
|
|
|
Kísérleti körülmények:
|
|
|
Eredmények:
|
|
|
Az eredmények szöveges értékelése. |
|
|
Következtetések. |
4. HIVATKOZÁSOK
|
(1) |
Testing Method B.44. Skin Absorption: In vivo Method. |
|
(2) |
OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris. |
|
(3) |
OECD (2000). Report of the Meeting of the OECD Extended Steering Committee for Percutaneous Absorption Testing, Annex 1 to ENV/JM/TG(2000)5. OECD, Paris. |
|
(4) |
Kemppainen BW and Reifenrath WG. (1990). Methods for skin absorption. CRC Press, Boca Raton. |
|
(5) |
Bronaugh RL and Collier, SW. (1991). Protocol for In vitro Percutaneous Absorption Studies, in In vitro Percutaneous Absorption: Principles, Fundamentals and Applications, RL Bronaugh and HI Maibach, Eds., CRC Press, Boca Raton, pp. 237–241. |
|
(6) |
Bronaugh RL and Maibach HI. (1991). In vitro Percutaneous Absorption: Principles, Fundamentals and Applications. CRC Press, Boca Raton. |
|
(7) |
European Centre for Ecotoxicology and Toxicology of Chemicals (1993). Monograph No. 20, Percutaneous Absorption, ECETOC, Brussels. |
|
(8) |
Diembeck W, Beck H, Benech-Kieffer F, Courtellemont P, Dupuis J, Lovell W, Paye M, Spengler J, Steiling W (1999). Test Guidelines for In Vitro Assessment of Dermal Absorption and Percutaneous Penetration of Cosmetic Ingredients, Fd Chem Tox, 37, 191–205. |
|
(9) |
Recommended Protocol for In vitro Percutaneous Absorption Rate Studies (1996). US Federal Register, Vol. 61, No. 65. |
|
(10) |
Howes D, Guy R, Hadgraft J, Heylings JR et al. (1996). Methods for assessing Percutaneous absorption. ECVAM Workshop Report ATLA 24, 81 R10. |
|
(11) |
Schaefer H and Redelmeier TE. (1996). Skin barrier: principles of percutaneous absorption. Karger, Basel. |
|
(12) |
Roberts MS and Walters KA. (1998). Dermal absorption and toxicity assessment. Marcel Dekker, New York. |
|
(13) |
Jewell, C., Heylings, JR., Clowes, HM. And Williams, FM. (2000). Percutaneous absorption and metabolism of dinitrochlorobenzene in vitro. Arch Toxicol 74: 356–365. |
1. ábra
Példa a statikus diffúziós cella felépítésére a bőrön át történő felszívódás in vitro vizsgálatához

(1) A szaruhártya homályos területének nagyságát kell feljegyezni
(2) A szérum- és a plazmavizsgálatok, de főleg a glükóz meghatározása miatt, ajánlatos a vizsgálat előtti éjszaka koplaltatni az állatokat. Ennek fő indoka az, hogy ha a vizsgálatokat megelőző koplaltatás nélkül végzik, akkor a kapott eredmények meglehetősen válzatosak lennének, ami így a kevésbé jellegzetes hatások felismerését és értelmezését megnehezítené. Más oldalról megközelítve a kérdést, azt is el kell ismerni, hogy a koplaltatás befolyásolja a kísérleti állatok (rendes) anyagcseréjét, különösen azon tanulmányok esetében, ahol a vizsgált anyagot a táplálékkal adagolják és így következik be az expozíció. Ha mégis az éjszakai koplaltatás mellett döntenek, akkor a tanulmány negyedik hetében, a funkcionális megfigyeléseket követően meg kell határozni a klinikai biokémiai paramétereket.
(3) A szérum- és a plazmavizsgálatok, de főleg a glükóz meghatározása miatt ajánlatos a vizsgálat előtti éjszaka koplaltatni az állatokat. Ennek fő indoka az, hogy ha a vizsgálatokat megelőző koplaltatás nélkül végzik, akkor a kapott eredmények meglehetősen változatosak lennének, ami így a kevésbé jellegzetes hatások felismerését és értelmezését megnehezítené. Más oldalról megközelítve a kérdést, azt is el kell ismerni, hogy a koplaltatás befolyásolja a kísérleti állatok (rendes) anyagcseréjét, különösen azon tanulmányok esetében, ahol a vizsgált anyagot a táplálékkal adagolják, és így következik be az expozíció. Ha mégis az éjszakai koplaltatás mellett döntenek, akkor a tanulmány negyedik hetében, a funkcionális megfigyeléseket követően meg kell határozni a klinikai biokémiai paramétereket.
(4) Ma szérum alanin aminotranszferáz néven ismert.
(5) Ma szérum aszparaginsav aminotranszferáz néven ismert.
(6) E szervek súlyát – valamennyi nem rágcsálónál e körbe tartozik a pajzsmirigy és a mellékpajzsmirigy is – a rágcsálók esetében nemenként és csoportonként tíz állatnál, valamint nem rágcsálóknál minden állatnál mérni kell.
(7) E szervek súlyát rágcsálók esetében nemenként és csoportonként tíz állatnál mérni kell.
(8) A jelen módszer vonatkozásában referenciacsoportnak azt a csoportot tekintjük, amelynek tagjai részére valamely más, az adott dózis teljes körű biológiai hozzáférhetőségét biztosító módon adjuk be a vizsgált anyagot.
(9) A felszívódás méréséhez használt oldószer.
|
† |
Magában foglalja a neurotoxicitási vizsgálat keretében végzendő funkcionális vizsgálatokhoz és részletes klinikai megfigyelésekhez kiválasztott öt állatot is. |
C. RÉSZ: AZ ÖKOTOXICITÁS MEGHATÁROZÁSÁNAK MÓDSZEREI
TARTALOMJEGYZÉK
|
C.1. |
AKUT TOXICITÁS HAL ESETÉBEN |
|
C.2. |
DAPHNIA-FAJOK AKUT IMMOBILIZÁCIÓS VIZSGÁLATA |
|
C.3. |
ALGASZANÖVEKEDÉS-GÁTLÁSI VIZSGÁLAT |
|
C.4. |
A „GYORS” BIOLÓGIAI LEBONTHATÓSÁG MEGHATÁROZÁSA |
|
I. RÉSZ |
ÁLTALÁNOS |
|
II. RÉSZ |
DOC (OLDOTT SZERVES SZÉN) CSÖKKENÉSÉNEK VIZSGÁLATA (C.4-A. módszer) |
|
III. RÉSZ. |
MÓDOSÍTOTT OECD-VIZSGÁLAT (DOC-CSÖKKENÉS) (C.4-B. módszer). |
|
IV. RÉSZ |
CO2-FEJLŐDÉS-VIZSGÁLAT (C.4-C. módszer) |
|
V. RÉSZ |
MANOMETRIKUS RESPIROMETRIÁS MÉRÉS (C.4-D. módszer) |
|
VI. RÉSZ. |
ZÁRTPALACK-MÓDSZER (C.4-E. módszer) |
|
VII. RÉSZ |
MITI-VIZSGÁLAT (C.4-F. módszer) |
|
C.5. |
LEBOMLÁS – BIOKÉMIAI OXIGÉNIGÉNY |
|
C.6. |
LEBOMLÁS – KÉMIAI OXIGÉNIGÉNY |
|
C.7. |
LEBOMLÁS – ABIOTIKUS LEBOMLÁS: HIDROLÍZIS A PH FÜGGVÉNYÉBEN. |
|
C.8. |
TOXICITÁS FÖLDIGILISZTÁKRA |
|
C.9. |
BIOLÓGIAI LEBOMLÁS – ZAHN–WELLENS VIZSGÁLAT |
|
C.10. |
BIOLÓGIAI LEBOMLÁS – ELEVENISZAP-SZIMULÁCIÓS VIZSGÁLAT |
|
C.11. |
BIOLÓGIAI LEBOMLÁS – ELEVENISZAP-LÉGZÉSGÁTLÁSI VIZSGÁLAT |
|
C.12. |
BIOLÓGIAI LEBOMLÁS – MÓDOSÍTOTT SCAS-VIZSGÁLAT |
|
C.13. |
BIOKONCENTRÁCIÓ VIZSGÁLATA: ÁTFOLYÁSOS HAL VIZSGÁLAT |
|
C.14. |
HALIVADÉKOK NÖVEKEDÉSI VIZSGÁLATA |
|
C.15. |
RÖVID TÁVÚ TOXICITÁSI VIZSGÁLAT HALEMBRIÓKKAL ÉS HALLÁRVÁKKAL |
|
C.16. |
HÁZIMÉH – AKUTORÁLISTOXICITÁS-VIZSGÁLAT |
|
C.17. |
HÁZIMÉH – AKUTKONTAKTTOXICITÁS-VIZSGÁLAT |
|
C.18. |
KÉMIAI ANYAGOK TALAJON TÖRTÉNŐ ADSZORPCIÓJÁNAK VIZSGÁLATA EGYENSÚLYI RENDSZERBEN |
|
C.19. |
ADSZORPCIÓS EGYÜTTHATÓ BECSLÉSE TALAJON ÉS SZENNYVÍZISZAPON NAGYHATÉKONYSÁGÚ FOLYADÉKKROMATOGRÁFIÁVAL (HPLC) |
|
C.20. |
DAPHNIA MAGNÁN VÉGZETT REPRODUKCIÓS VIZSGÁLAT |
|
C.21. |
TALAJLAKÓ MIKROORGANIZMUSOK: NITROGÉN-ÁTALAKÍTÁSI VIZSGÁLAT |
|
C.22. |
TALAJLAKÓ MIKROORGANIZMUSOK: SZÉNÁTALAKÍTÁSI VIZSGÁLAT |
|
C.23. |
AEROB ÉS ANAEROB ÁTALAKÍTÁS A TALAJBAN |
|
C.24. |
AEROB ÉS ANAEROB ÁTALAKÍTÁS VÍZI ÜLEDÉKRENDSZEREKBEN |
C.1. AKUT TOXICITÁS HAL ESETÉBEN
1. MÓDSZER
1.1. BEVEZETÉS
E vizsgálat célja valamely anyag akut letális toxicitásának meghatározása édesvízi halak esetében. Hasznosnak bizonyul, ha rendelkezésre állnak információk az anyag vízoldékonyságáról, gőznyomásáról, kémiai stabilitásáról, disszociációs állandóiról és biológiai lebonthatóságáról annak érdekében, hogy a legmegfelelőbb vizsgálati módszert lehessen kiválasztani (statikus, félstatikus vagy átfolyásos) a vizsgálat időtartama alatt a vizsgált anyag kielégítően állandó koncentrációinak biztosításához.
Mind a vizsgálat tervezéséhez, mind az eredmények értelmezéséhez figyelembe kell venni további információkat is (ilyenek például a szerkezeti képlet, a tisztasági fok, szennyeződések jellege és százalékos aránya, adalékanyagok jelenléte és mennyisége, az n-oktanol/víz megoszlási koefficiens).
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Az akut toxicitás valamely anyag hatásának való kitételkor (expozíció) rövid időn (napokon) belül, valamely szervezetben előidézett, észlelhető káros hatás. E vizsgálatban az akut toxicitást a közepes letális koncentrációval (LC50) kell kifejezni, vagyis azzal a vízben mért koncentrációval, amely a kísérleti halak csoportjának 50 %-ánál halált okoz valamilyen folyamatos expozíciós időtartamon belül, amelyet meg kell adni.
A vizsgált anyag minden koncentrációját tömeg/térfogat (milligramm/liter) mértékegységben kell megadni. E koncentrációk tömeg/tömeg mértékegységben (mg · kg–1) is megadhatók.
1.3. REFERENCIAANYAGOK
Vizsgálható referenciaanyag annak bemutatására, hogy a laboratóriumi vizsgálati körülmények között nem változott-e meg jelentős mértékben a vizsgált fajok reakciója.
E vizsgálathoz nincs előírva referenciaanyag.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Végrehajtható határérték-vizsgálat 100 mg/liter koncentrációban annak bemutatására, hogy az LC50 nagyobb, mint e koncentráció.
A halakat a vízhez adott vizsgált anyag hatásának kell kitenni, koncentrációk egész tartományában, 96 órás időtartamon át. A pusztulást legalább 24 órás időközönként fel kell jegyezni, és ahol lehetséges, ki kell számítani az egyes megfigyelési időpontokban a halak 50 %-át elpusztító koncentrációkat (LC50).
1.5. MINŐSÉGI KÖVETELMÉNYEK
A minőségi követelmények mind a határérték-vizsgálati, mind a teljes vizsgálati módszerre érvényesek.
A kontrollcsoportban a kísérlet végéig a halpusztulásnak nem szabad 10 %-nál nagyobbnak lennie (vagy maximum egy hal pusztulhat el, ha tíznél kevesebb halat használnak).
Az oldott oxigén koncentrációjának mindvégig nagyobbnak kell lennie, mint a levegőtelítettségi érték 60 %-a.
A vizsgált anyag koncentrációit a kísérlet során mindvégig a kezdeti koncentráció 80 %-án belüli értéken kell tartani.
Az olyan anyagok esetében, amelyek stabil oldatokat képezve könnyen oldódnak a vizsgált közegben, tehát azok, amelyek jelentős mértékben nem fognak párologni, lebomlani, hidrolizálni vagy abszorbeálódni, a kezdeti koncentráció a névleges koncentrációval egyenlőnek tekinthető. Bizonyítani kell, hogy a koncentrációk a vizsgálat során mindvégig megmaradnak, és a minőségi követelmények teljesülnek.
Azon anyagok esetében, amelyek:
|
i. |
a vizsgált közegben kevéssé oldhatók; vagy |
|
ii. |
stabil emulziók vagy diszperziók létrehozására képesek; vagy |
|
iii. |
vizes oldatokban nem stabilak, |
abból kell kiindulni, hogy a kezdeti koncentráció a vizsgálat kezdetén az oldatban mért (vagy ha ez technikailag nem lehetséges, a vízoszlopban mért) koncentráció. A koncentrációt az egyensúlyba hozatal után, de a kísérleti halak behelyezése előtt kell meghatározni.
Ezen esetek közül mindegyikben további méréseket kell végrehajtani a vizsgálat során a tényleges expozíciós koncentrációk megerősítésére, vagy annak megerősítésére, hogy teljesülnek-e a minőségi követelmények.
A pH-nak nem szabad 1 egységnél nagyobb mértékben változnia.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Típusát tekintve háromféle eljárás használható:
Statikus vizsgálat:
Ez olyan toxicitásvizsgálat, amelyben a vizsgált oldat nem áramlik. (Az oldatok mindvégig változatlanok maradnak a vizsgálat végrehajtása során.)
Félstatikus vizsgálat:
Olyan, a vizsgált oldat áramlása nélküli vizsgálat, amelynél rendszeresen, adagonként ki kell cserélni a vizsgált oldatokat hosszabb időtartamok (például 24 óra) eltelte után.
Átfolyásos vizsgálat:
Olyan toxicitásvizsgálat, amelyben a vizet állandóan cserélik a vizsgálati kamrákban, a már használt vízzel együtt elszállítva a vizsgált kémiai anyagot a vizsgált közeg kicserélése érdekében.
1.6.1. Reagensek
1.6.1.1. A vizsgált anyagok oldatai
El kell készíteni a szükséges erősségű törzsoldatokat az anyagnak ionmentesített vízben vagy az 1.6.1.2. pontnak megfelelő vízben történő feloldásával.
A kiválasztott vizsgált koncentrációkat a törzsoldat hígításával kell elkészíteni. Ha nagy koncentrációkat vizsgálnak, az anyag közvetlenül a hígítóvízben feloldható.
Az anyagokat általában csak az oldhatóság határáig kell vizsgálni. Néhány anyagnál (például olyan anyagok esetében, amelyeknek kicsi a vízoldékonysága, nagy a Pow értéke, vagy azok esetében, amelyek stabil diszperziót alkotnak, nem pedig valódi oldatot hoznak létre vízben) elfogadható az anyag oldhatósági határa fölötti vizsgált koncentráció használata a maximális oldható/stabil koncentráció elérésének biztosítására. Fontos azonban, hogy e koncentráció ne zavarja meg a vizsgált rendszert valamilyen más módon (például az anyagból a víz felszínén képződött, és a víz oxigénellátását akadályozó film révén).
Ultrahangos diszpergálás, szerves oldószerek, emulgeáló- vagy diszpergálószerek használhatók alacsony vízoldékonyságú anyagok törzsoldatai elkészítésének elősegítésére, vagy a vizsgált közegben az ilyen anyagok diszpergálódásának segítésére. Amikor ilyen segédanyagokat használnak, minden vizsgált koncentrációnak ugyanolyan mennyiségű segédanyagot kell tartalmaznia, és további kontrollhalakat kell kitenni a segédanyag ugyanolyan koncentrációja hatásának, mint amelyet a vizsgálati sorozatokban alkalmaznak. Minden ilyen segédanyag koncentrációját minimális értéken kell tartani, de semmi esetre sem szabad meghaladnia a 100 mg/liter értéket a vizsgált közegben.
A vizsgálatot a pH-érték beállítása nélkül kell végrehajtani. Ha létezik bizonyíték a pH-érték jelentős változására, ajánlatos a vizsgálat megismétlése a pH-érték beállításával, meg kell adni az így kapott eredményeket. Ezen esetben be kell állítani a törzsoldat pH-értékét a hígítóvíz pH-értékére, kivéve ha különleges okok szólnak ellene. E célra a legkedvezőbb a HCl és az NaOH használata. Ezt a pH-korrekciót úgy kell végrehajtani, hogy ne változzon meg jelentős mértékben a vizsgált anyag koncentrációja a törzsoldatban. Ha a beállítás a vizsgált vegyület valamilyen kémiai reakcióját vagy fizikai kicsapódását okozza, ezt közölni kell a jelentésben.
1.6.1.2. Tároló- és hígítóvíz
Ivóvízellátó rendszerből vett (klór, nehézfémek vagy más anyagok potenciálisan káros koncentrációival nem szennyezett), jó minőségű természetes víz vagy művíz (lásd az 1. függeléket) használható. A 10 és 250 mg/l közötti keménységű (CaCO3-ként meghatározva), 6,0 és 8,5 közötti pH-jú vizeket kell előnyben részesíteni.
1.6.2. Készülék
Minden készüléket kémiailag inert anyagból kell készíteni:
|
— |
automatikus hígító rendszer (átfolyásos vizsgálathoz), |
|
— |
oxigénmérő, |
|
— |
vízkeménység meghatározására szolgáló berendezés, |
|
— |
megfelelő készülék a hőmérséklet szabályozásához, |
|
— |
pH-mérő. |
1.6.3. Kísérleti hal
A halaknak jó egészségi állapotban kell lenniük, és mindenfajta látható testi hibától mentesnek kell lenniük.
A kísérlethez használt fajtákat olyan gyakorlati kritériumok alapján kell kiválasztani, mint például egész évbeni könnyű beszerezhetőségük, a problémamentes tartás, a vizsgálati célokra való megfelelőség, relatív érzékenység a kémiai anyagokra és minden olyan gazdasági, biológiai vagy ökológiai tényező, amelynek bármilyen hatása lehet. A halfajták kiválasztásakor a kapott adatok összehasonlíthatóságát és a nemzetközi harmonizáció szükségességét (lásd az 1. pontban hivatkozott szakirodalmat) is szem előtt kell tartani.
A 2. függelék ismerteti az e vizsgálat végrehajtásához javasolt halfajták jegyzékét; az előnyben részesített fajták a zebradánió és a szivárványos pisztráng.
1.6.3.1. Tartás
A kísérleti halaknak lehetőleg egyetlen állományból kell származniuk, hasonló méretűeknek és korúaknak kell lenniük. A halakat legalább 12 napig a következő körülmények között kell tartani:
betöltés:
a rendszernek (visszaforgatás vagy átáramoltatás) és a halfajtáknak megfelelően,
víz:
lásd az 1.6.1.2. pontot,
világítás:
napi 12–16 órás megvilágítás,
oldott oxigén koncentrációja:
a levegőtelítettségi érték legalább 80 %-a,
etetés:
hetente vagy naponta háromszor, amelyet a vizsgálat kezdete előtt 24 órával befejeznek.
1.6.3.2. Mortalitás
A 48 órás szoktatási időtartamot követően fel kell jegyezni az elpusztult állatok számát a következő kritériumok alkalmazásával:
|
— |
ha a populáció 10 %-ánál több hal elpusztul 7 napon belül: akkor a teljes állományt le kell selejtezni, |
|
— |
ha a populáció 5 és 10 %-a pusztul el: akkor a tartási idő 7 további nappal meghosszabbodik. Ha további pusztulás nem történik, az állomány elfogadható, egyébként nem, |
|
— |
ha a populáció kevesebb, mint 5 %-a pusztul el: akkor az állomány alkalmazható a vizsgálathoz. |
1.6.4. Szoktatási időtartam
Az alkalmazás előtt minden halat legalább 7 napig kell tartani olyan minőségű és hőmérsékletű vízben, mint amit a vizsgálat során fognak alkalmazni.
1.6.5. A kísérlet végrehajtása
A vizsgálatot megelőzheti egy előzetes vizsgálat, amely információkkal szolgál arról a koncentrációtartományról, amelyet a fő vizsgálatban kell használni.
A vizsgált sorozaton kívül vizsgált anyag nélküli kontrollvizsgálatot, és a segédanyagot tartalmazó kontrollanyag-vizsgálatot is végre kell hajtani.
A vizsgált vegyület fizikai és kémiai tulajdonságaitól függően statikus, félstatikus vagy átfolyásos vizsgálatot lehet választani, a minőségi követelmények teljesítése érdekében.
A halakat a következő módon kell kitenni az anyag hatásának:
|
— |
időtartam: 96 óra, |
|
— |
állatok száma: koncentrációnként legalább 7, |
|
— |
tartályok: alkalmas űrtartalmúak, a javasolt egyedsűrűség figyelembevételével, |
|
— |
egyedsűrűség: 1 g hal/liter ajánlott a statikus és a félstatikus vizsgálatokhoz; az átfolyásos rendszerekhez elfogadható ennél nagyobb egyedsűrűség is, |
|
— |
vizsgált koncentráció: legalább 5, egymástól 2,2-et nem meghaladó konstans tényezővel eltérő és, amennyire lehetséges, a 0–100 %-os mortalitási tartományt átfedő koncentráció, |
|
— |
víz: lásd az 1.6.1.2. pontot, |
|
— |
világítás: 12–16 órás megvilágítás naponta, |
|
— |
hőmérséklet: a fajtáknak megfelelő (lásd a 2. függeléket), de minden esetben ± 1 oC-on belül, |
|
— |
az oldott oxigén koncentrációja: a kiválasztott hőmérsékleten a levegőtelítettségi érték nem kevesebb, mint 60 %-a, |
|
— |
etetés: nincs. |
A halakat meg kell vizsgálni az első 2–4 óra után, és legalább 24 órás időközönként. A halak akkor tekinthetők élettelennek, ha a farokúszó érintése nem vált ki reakciót, és nem látható semmilyen légzőmozgás. Az elpusztult halakat el kell távolítani, és ezt fel kell jegyezni. Nyilvántartást kell vezetni a látható rendellenességekről (például egyensúly-vesztés, az úszási viselkedés és a légzés változásai, pigmentáció stb.).
Naponta végre kell hajtani a pH-érték, az oldottoxigén-koncentráció és a hőmérséklet méréseit.
Határérték-vizsgálat
Az e módszerben leírt eljárások segítségével végrehajtható a határérték-vizsgálat 100 mg/l koncentrációval annak bemutatására, hogy az LC50 nagyobb, mint e koncentráció.
Ha az anyag olyan természetű, hogy nem érhető el a vizsgált vízben a 100 mg/l-es koncentráció, a határérték-vizsgálatot a használt közegben az anyag oldhatóságával egyenlő koncentrációval (vagy a stabil diszperziót alkotó maximális koncentrációval) kell végrehajtani (lásd még az 1.6.1.1. pontot is).
A határérték-vizsgálatot 7–10 hallal kell végrehajtani úgy, hogy a kontrollcsoportban lévő halak száma ezzel azonos legyen. (A binomiális elmélet szerint, amikor 10 hal alkalmazása mellett nem tapasztaltak halálozást, akkor 99,9 %-os a megbízhatósága annak, hogy az LC50 nagyobb, mint a határérték-vizsgálatban használt koncentráció. 7, 8 vagy 9 hal esetében a nulla halálozás legalább 99 %-os megbízhatóságot biztosít arra, hogy az LC50 nagyobb, mint az alkalmazott koncentráció).
Ha pusztulás következik be, a teljes vizsgálatot végre kell hajtani. Ha szubletális hatásokat figyelnek meg, ezeket fel kell jegyezni.
2. ADATOK ÉS KIÉRTÉKELÉS
Minden olyan időtartamhoz, amikor megfigyeléseket jegyeztek fel (24, 48, 72 és 96 óra), fel kell rajzolni a féllogaritmusos papírra az egyes javasolt expozíciós időtartamok során a koncentráció függvényében megállapított százalékos pusztulást.
Ha lehetséges, minden egyes megfigyelési időhöz meg kell becsülni az LC50-et és a konfidenciahatárokat (p = 0,05) standard eljárások segítségével; ezen értékeket egy vagy legfeljebb két szignifikáns számjegyre kell kerekíteni (példák két számjegyre kerekítésre: a 173,5-ből 170; 0,127-ből 0,13; 1,21-ből 1,2 lesz).
Olyan esetekben, amikor a koncentráció/hatás görbe meredeksége túl nagy ahhoz, hogy lehetővé váljon az LC50 kiszámítása, elegendő ezen érték grafikus becslése.
Ha két, egymást követő koncentráció 2,2 arány mellett csak 0 és 100 %-os pusztulást ad, akkor ez a két érték elegendő azon tartomány jelzésére, amelybe az LC50 esik.
Ha megállapítható, hogy nem tartható fenn a vizsgált anyag stabilitása vagy homogenitása, ezt közölni kell a jelentésben, és körültekintően kell eljárni az eredmények értelmezésekor.
3. JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a kísérleti halakkal kapcsolatos információkat (tudományos név, törzs, szállító, mindenféle előkezelés, számuk és méretük az egyes vizsgált koncentrációkban), |
|
— |
a hígítóvíz eredetét és fő kémiai jellemzőit (pH, keménység, hőmérséklet), |
|
— |
alacsony vízoldékonyságú anyagok esetében a törzsoldat és vizsgált oldat elkészítésének módszerét, |
|
— |
minden segédanyag koncentrációját, |
|
— |
a használt koncentrációk jegyzékét és a vizsgált oldatban a vizsgált anyag koncentrációinál a stabilitással kapcsolatban rendelkezésre álló minden információt, |
|
— |
kémiai elemzés esetén: a használt módszereket és kapott eredményeket, |
|
— |
a határérték-vizsgálat eredményeit, adott esetben, |
|
— |
az alkalmazott vizsgálati eljárás kiválasztásának indokait és részleteit (például statikus, félstatikus, adagolási sebesség, átfolyási sebesség, levegőztetett-e, egyedsűrűség stb.), |
|
— |
a vizsgáló berendezés leírását, |
|
— |
a világítási rendszert, |
|
— |
a vizsgált oldatok oldottoxigén-koncentrációit, pH-értékeit és hőmérsékleteit, minden 24 órában, |
|
— |
bizonyítékot arról, hogy teljesültek a minőségi követelmények, |
|
— |
táblázatot, amely mutatja a kumulatív pusztulást minden egyes koncentráció és kontroll esetében (és ha szükséges, a segédanyagot tartalmazó kontroll esetében is) minden egyes javasolt megfigyelési időpontban, |
|
— |
a koncentráció/hatás görbe grafikus ábrázolását a vizsgálat végén, |
|
— |
ha lehetséges, az LC50-értékeket minden egyes javasolt megfigyelési időpontban (95 %-os konfidenciahatárokkal), |
|
— |
az LC50-értékek meghatározására használt statisztikai eljárásokat, |
|
— |
ha referenciaanyagot használnak, a kapott eredményeket, |
|
— |
azt a legnagyobb vizsgált koncentrációt, amely még nem okoz pusztulást a vizsgálat időtartamában, |
|
— |
azt a legalacsonyabb vizsgált koncentrációt, amely 100 %-os pusztulást okoz a vizsgálat időtartamában. |
4. SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 203. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges és frissítések. |
|
(2) |
AFNOR – Determination of the acute toxicity of a substance to Brachydanio rerio – Static and Flow Through methods – NFT 90-303 June 1985. |
|
(3) |
AFNOR – Determination of the acute toxicity of a substance to Salmo gairdneri – Static and Flow-through methods – NFT 90-303 June 1985. |
|
(4) |
ISO 7346/1, /2 and /3 – Water Quality – Determination of the acute lethal toxicity of substances to a fresh water fish (Brachydanio rerio Hamilton-Buchanan – Teleostei, Cyprinidae). Part 1: Static method. Part 2: Semi-static method. Part 3: Flow-through method. |
|
(5) |
Eidgenössisches Department des Innern, Schweiz: Richtlinien für Probenahme und Normung von Wasseruntersuchungsmethoden – Part II 1974. |
|
(6) |
DIN Testverfahren mit Wasserorganismen, 38 412 (11) und 1 (15). |
|
(7) |
JIS K 0102, Acute toxicity test for fish. |
|
(8) |
NEN 6506 – Water – Bepaling van de akute toxiciteit met behulp van Poecilia reticulata, 1980. |
|
(9) |
Environmental Protection Agency, Methods for the acute toxicity tests with fish, macroinvertabrates and amphibians. The Committee on Methods for Toxicity Tests with Aquatic Organisms, Ecological Research Series EPA-660-75-009, 1975. |
|
(10) |
Environmental Protection Agency, Environmental monitoring and support laboratory, Office of Research and Development, EPA-600/4-78-012, January 1978. |
|
(11) |
Environmental Protection Agency, Toxic Substance Control, Part IV, 16 March 1979. |
|
(12) |
Standard methods for the examination of water and wastewater, fourteenth edition, APHA-AWWA-WPCF, 1975. |
|
(13) |
Commission of the European Communities, Inter-Laboratory test programme concerning the study of the ecotoxicity of a chemical substance with respect to the fish. EEC Study D.8368, 22 March 1979. |
|
(14) |
Verfahrensvorschlag des Umweltbundesamtes zum akuten Fisch-Test. Rudolf, P. und Boje, R. Okotoxikologie, Grundlagen für die okotoxikologische Bewertung von Umweltchemikalien nach dem Chemikaliengesetz, ecomed 1986. |
|
(15) |
Litchfield, J.T. and Wilcoxon, F., A simplified method for evaluating dose effects experiments, J. Pharm, Exp. Therap., 1949, vol. 96, 99. |
|
(16) |
Finney, D.J. Statistical Methods in Biological Assay. Griffin, Weycombe, U.K., 1978. |
|
(17) |
Sprague, J.B. Measurement of pollutant toxicity to fish. Bioassay methods for acute toxicity. Water Res., 1969, vol. 3, 793–821. |
|
(18) |
Sprague, J.B. Measurement of pollutant toxicity to fish. II Utilising and applying biossay results. Water Res., 1970, vol. 4., 3–32. |
|
(19) |
Stephan, C.E. Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). American Society for Testing and Materials, ASTM STP 634, 1977, 65–84. |
|
(20) |
Stephan, C.E., Busch, K.A., Smith, R., Burke, J. and Andrews, R.W. A computer program for calculating an LC50. US EPA. |
1. függelék:
Művíz
Példa megfelelő hígítóvízre
Minden kémiai anyagnak analitikai tisztaságúnak kell lennie.
A víznek jó minőségű, desztillált víznek vagy 5 μScm–1-nél kisebb vezetőképességű, ioncserélt víznek kell lennie.
A víz desztillálásához használt készüléknek semmilyen rézből készült alkatrészt nem szabad tartalmaznia.
Törzsoldatok:
|
CaCl2·2H2O (kalcium-klorid-dihidrát): Vízben kell feloldani, és vízzel 1 literre feltölteni. |
11,76 g |
|
MgSO4·7H2O (magnézium-szulfát-heptahidrát): Vízben kell feloldani, és vízzel 1 literre feltölteni. |
4,93 g |
|
NaHCO3 (nátrium-hidrogén-karbonát): Vízben kell feloldani, és vízzel 1 literre feltölteni. |
2,59 g |
|
KCl (kálium-klorid): Vízben kell feloldani, és vízzel 1 literre feltölteni. |
0,23 g |
A hígításhoz használt művíz
A négy törzsoldat mindegyikéből 25 ml-t kell összekeverni, és vízzel 1 literre feltölteni.
A keveréket addig kell levegőztetni, amíg az oldott oxigén koncentrációja egyenlő nem lesz a levegőtelítettségi értékkel.
A pH-nak 7,8 ± 0,2-nek kell lennie.
Ha szükséges, a pH-t NaOH-val (nátrium-hidroxiddal) vagy HCl-dal (sósavval) kell beállítani.
Az így elkészített hígítóvizet 12 óráig állni kell hagyni, és nem szabad tovább levegőztetni.
Ezen oldatban a Ca- és Mg-ionok összege 2,5 mmol/liter. A Ca:Mg ionok aránya 4:1 és az Na:K ionok aránya 10:1. Ezen oldat teljes lúgossága 0,8 mmol/liter.
A hígítóvíz elkészítésekor nem szabad megváltoztatni a víz összetételét vagy tulajdonságait.
2. függelék:
A vizsgálathoz javasolt halfajták
|
Javasolt fajták |
Javasolt vizsgálati hőmérséklet-tartomány (oC) |
A kísérleti állatok javasolt összhosszúsága (cm) |
|
Brachydanio rerio (Teleostei, Cyprinidae) (Hamilton–Buchanan) zebradánió |
20-tól 24-ig |
3,0 ± 0,5 |
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) amerikai cselle |
20-tól 24-ig |
5,0 ± 2,0 |
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linneaus 1758) ponty |
20-tól 24-ig |
6,0 ± 2,0 |
|
Oryzias latipes (Teleostei, Poecilidae) Cyprinodontidae (Tomminck and Schlegel 1850) japán fogasponty |
20-tól 24-ig |
3,0 ± 1,0 |
|
Poecilia reticulata (Teleostei, Poeciliidae) (Peters 1859) guppi |
20-tól 24-ig |
3,0 ± 1,0 |
|
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque Linneaus 1758) kékkopoltyús naphal |
20-tól 24-ig |
5,0 ± 2,0 |
|
Onchorhynchus mykiss (Teleostei, Salmonidae) (Walbaum 1988) szivárványos pisztráng |
12-től 17-ig |
6,0 ± 2,0 |
|
Leuciscus idus (Teleostei, Cyprinidae) (Linneaus 1758) jász |
20-tól 24-ig |
6,0 ± 2,0 |
Tenyésztés
A fent felsorolt halakat könnyű tenyészteni és/vagy könnyen beszerezhetők az egész év során. Alkalmasak a tenyésztésre vagy halgazdaságokban, vagy laboratóriumban, betegség- és parazitakontrollált állapotok mellett úgy, hogy a kísérleti állatok egészségesek és ismert származásúak lesznek. E halak a világ számos részén rendelkezésre állnak.
3. függelék:
Példa koncentrációra: elpusztulás százalékban
Példa LC50 meghatározására féllogaritmusos papír segítségével

C.2. DAPHNIA-FAJOK AKUT IMMOBILIZÁCIÓS VIZSGÁLATA
1. MÓDSZER
Ez az akut immobilizációs vizsgálati módszer egyenértékű az OECD TG 202 (2004) módszerrel.
1.1. BEVEZETÉS
Ez a módszer egy akut toxicitási vizsgálatot ír le, amely a vegyi anyagok Daphniákra gyakorolt hatását értékeli. Amennyire csak lehetett, meglévő vizsgálati módszereket alkalmaztunk (1) (2) (3).
1.2. FOGALOMMEGHATÁROZÁSOK
Ezzel a módszerrel összefüggésben a következő meghatározásokat alkalmazzuk:
|
|
EC50 : az a becsült koncentráció, amely a Daphniák 50 %-át mozgásképtelenné teszi valamely meghatározott expozíciós időtartamon belül. Amennyiben más meghatározás kerül alkalmazásra, arról be kell számolni, a referenciájával együtt. |
|
|
Mozgásképtelenség: Azokat az állatokat, amelyek a vizsgálati tartály óvatos megkeverése után 15 másodpercen belül nem képesek úszni, mozgásképtelennek kell tekinteni (még akkor is, ha a csápjaikat még tudják mozgatni). |
1.3. A VIZSGÁLATI MÓDSZER ELVE
A fiatal Daphniákat, melyek a vizsgálat kezdetén 24 órásnál fiatalabbak, a vizsgált anyag különböző koncentrációinak teszik ki 48 órás időtartamon át. Az immobilizálást 24 és 48 óra elteltével rögzítik, és összehasonlítják a kontrollértékekkel. Az eredményeket elemzik a 48 órás EC50 kiszámítása végett (lásd az 1.2. szakaszt a meghatározásokról). A 24 órás EC50 meghatározása opcionális.
1.4. INFORMÁCIÓ A VIZSGÁLATI ANYAGRÓL
Ismerni kell a vizsgált anyag vízoldékonyságát és gőznyomását, és a vizsgálati oldatokban lévő anyag mennyiségi meghatározásához rendelkezni kell egy olyan megbízható analitikai módszerrel, amelynél ismert a visszanyerési hatékonyság és meghatározás korláta. A hasznos információk közé tartozik a szerkezeti képlet, az anyag tisztasága, vízben való stabilitása vagy fénystabilitása, a Pow és a gyors biológiai lebonthatóságra vonatkozó vizsgálat eredményei (lásd C.4. módszer).
Megjegyzés: A fizikai, kémiai tulajdonságaik miatt nehezen vizsgálható anyagok vizsgálatának útmutatóját a 4. szakasz tartalmazza.
1.5. REFERENCIAANYAGOK
Az EC50 vizsgálata referenciaanyagra is elvégezhető a vizsgálati körülmények megbízhatóságának biztosítására. Erre a célra a nemzetközi körvizsgálatokban (1) (5) használt mérgező anyagok javasoltak (1). A referenciaanyagos vizsgálato(ka)t lehetőleg havonta, és évente legalább kétszer kell elvégezni.
1.6. MINŐSÉGI KRITÉRIUMOK
A vizsgálat érvényességéhez az alábbi teljesítménykritériumoknak kell teljesülniük:
|
— |
A kontrollokban, beleértve az szolubilizálószert tartalmazó kontrollt, a Daphniák immobilizálási aránya nem haladhatja meg a 10 %-ot, |
|
— |
A vizsgálat végéig az oldott oxigén koncentrációja legyen ≥ 3 mg/l a kontrollban és a vizsgálati tartályokban. |
Megjegyzés: Az első kritérium esetében a kontroll-Daphniák legfeljebb 10 %-a lehet mozgásképtelen, illetve mutathatja kór vagy stressz más jeleit, például elszíntelenedést, szokatlan viselkedést, mint például a víz felszínére szorulást.
1.7. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.7.1. Berendezés
A vizsgálati tartályoknak és más, a vizsgált oldatokkal érintkezésbe kerülő berendezések teljes mértékben üvegből vagy más, kémiailag inert anyagból kell készülniük. A vizsgálati tartályok rendszerint üveg kémcsövek vagy főzőpoharak; ezeket minden egyes használatot megelőzően szabványos laboratóriumi eljárással meg kell tisztítani. A vizsgálati tartályokat lazán le kell fedni, csökkentve a párolgásos vízvesztést, és megakadályozva a por oldatokba való kerülését. Az illékony anyagokat olyan, teljesen megtöltött zárt tartályokban kell vizsgálni, amelyek elegendően nagyok az oxigénhiány vagy a túl alacsony oxigénszint megakadályozásához (lásd az 1.6. szakaszt és az 1.8.3. szakasz első bekezdését).
Emellett a következő berendezések vagy azok mindegyike alkalmazandó: oxigénmérő (mikroelektródával, vagy egyéb olyan berendezéssel, amely alkalmas az oldott oxigén mérésére kis térfogatú mintákban); pH-mérő; megfelelő készülék a hőmérséklet szabályozásához; a teljes szerves szénkoncentráció (TOC) meghatározására szolgáló berendezés; a kémiai oxigénigény (KOI) meghatározására szolgáló berendezés; vízkeménység meghatározására szolgáló berendezés, stb.
1.7.2. Vizsgált szervezetek
A vizsgálat során a Daphnia magna Straus kísérleti állatfajt kell előnyben részesíteni, jóllehet más megfelelő Daphnia-fajok is (pl. Daphnia pulex) használhatóak. A vizsgálat kezdetén az állatoknak 24 órásnál fiatalabbnak kell lenniük, és a variációs képesség csökkentése érdekében erősen javasolt, hogy ne az első szaporulatból származzanak. Egészséges törzstenyészetből kell származniuk (azaz nem szabad stressz jeleit mutatniuk, ilyen például magas halálozás, hímek és ephippiumok jelenléte, az első szaporulat késedelme, színtelen állatok, stb.). Egy adott vizsgálathoz felhasznált összes szervezet származzon ugyanabból a Daphnia-állományból létrehozott tenyészetből. Az állomány állatait olyan tenyésztési körülmények között kell tartani (fény, hőmérséklet, közeg), mint amelyeket a vizsgálatban használnak. Amennyiben a Daphniák vizsgálatban alkalmazandó tenyésztési közege különbözik a rutin Daphnia-tenyészetben használttól, a helyes gyakorlat az, ha a vizsgálat előtt akklimatizációs időszakot iktatnak be. Erre a célra a tenyésztett Daphniákat a vizsgálat kezdetét megelőzően legalább 48 órán keresztül vizsgálati hőmérsékletű hígítóvízben kell tartani.
1.7.3. Tenyésztővíz és hígítóvíz
Tenyésztő- és hígítóvízként természetes víz (felszíni vagy talajvíz), művíz vagy klórtalanított csapvíz fogadható el, amennyiben a Daphniák a tenyésztés, akklimatizálódás és vizsgálat időtartama alatt abban életben maradnak anélkül, hogy stressz jeleit mutatnák. Bármely olyan víz, amely megfelel az elfogadható hígítóvíz 1. függelékben felsorolt kémiai tulajdonságainak, megfelel vizsgálati víznek. A vizsgálat időtartama alatt a víz minősége legyen állandó. Művíz készíthető analitikai tisztaságú reagensek meghatározott mennyiségének deionizált vagy desztillált vízhez történő hozzáadásával. Művíz példáit az (1) és (6) pont, illetve a 2. függelék adja meg. Meg kell jegyezni, hogy fémtartalmú vizsgált anyag esetében kerülendőek az ismert kelátképző anyagok, mint a 2. függelékben említett M4 és M7 közegek. A pH-érték legyen 6–9 közötti tartományban. A Daphnia Magna esetében 140 és 250 mg/l (CaCO3-ban) közti keménység ajánlott, míg más Daphnia-fajok esetében alacsonyabb keménység is megfelelő lehet. A hígítóvizet a vizsgálatra történő felhasználás előtt levegőztetni lehet, hogy az oxigénkoncentráció elérje a telítettséget.
Természetes víz használatakor a minőségi paramétereket évente legalább kétszer mérni kell, illetve bármikor, ha felmerül annak a gyanúja, hogy ezek a tulajdonságok jelentős mértékben megváltozhattak (lásd az előző bekezdést és az 1. függeléket). Nehézfém-méréseket (pl. Cu, Pb, Zn, Hg, Cd, Ni) is végezni kell. Klórmentesített csapvíz használata esetén kívánatos a napi klórelemzés. Amennyiben a hígítóvíz felszíni vagy talajvízforrásból származik, mérni kell a vezetőképességet, az összes szerves széntartalmat (TOC) vagy a kémiai oxigénigényt (KOI).
1.7.4. Vizsgálati oldatok
A kiválasztott koncentrációjú vizsgálati oldatokat rendszerint törzsoldat hígításával készítik. A törzsoldatokat lehetőleg a vizsgálati anyagnak a hígítóvízben történő feloldásával kell elkészíteni. Az oldószerek, emulgeálószerek vagy diszpergálószerek használatát lehetőleg kerülni kell. Ugyanakkor bizonyos esetekben szükség lehet ezekre a szerekre a megfelelő koncentrációjú törzsoldat készítéséhez. A megfelelő oldószerek, emulgeálószerek és diszpergálószerek példáit a (4) pont sorolja fel. A vizsgálati oldatban lévő vizsgálati anyag mindenestre nem haladhatja meg a hígítóvízben való oldhatóság határértékét.
A vizsgálatot a pH-érték beállítása nélkül kell végezni. Ha a pH-érték nem marad a 6–9 értékek tartományában, újabb vizsgálat végezhető, amelynél a törzsoldat pH-értékét a hígítóvíz pH-értékére kell beállítani a vizsgálati anyag hozzáadása előtt. A pH-beállítást úgy kell elvégezni, hogy a törzsoldat-koncentrációja ne változzon jelentős mértékben, és a vizsgálati anyag ne lépjen kémiai reakcióba más anyaggal, vagy ne csapódjon ki. Erre a célra a HCl vagy az NaOH javasolt.
1.8. ELJÁRÁS
1.8.1. Expozíciós körülmények
1.8.1.1. Vizsgálati csoportok és kontrollok
A vizsgálati tartályokat megfelelő mennyiségű hígítóvízzel és a vizsgálati anyag oldataival kell feltölteni. A tartályokban a levegő/víz aránya legyen azonos a vizsgálati és a kontrollcsoport esetében. Ezután a Daphniákat bele kell helyezni a vizsgálati tartályokba. Minden egyes vizsgálati koncentrációban és a kontrollokban legalább 20 állatot kell használni – lehetőleg négy, egyenként öt állatot tartalmazó csoportra osztva. Állatonként legalább 2 ml vizsgálati oldatot kell biztosítani (azaz vizsgálati tartályonként 10 ml mennyiséget öt Daphniára). A vizsgálat elvégezhető félstatikus vagy átfolyásos rendszerben is, ahol a vizsgált anyag koncentrációja nem állandó.
A kezelt sorozatok mellett egy hígítóvizes kontrollcsoport-sorozatot és – adott esetben – egy, az oldószert tartalmazó kontrollcsoport-sorozatot kell beállítani.
1.8.1.2. Vizsgálati koncentrációk
A végleges vizsgálat koncentrációtartományának meghatározására behatároló vizsgálat végezhető, hacsak rendelkezésre nem állnak a vizsgálati anyag toxicitásra vonatkozó információk. E célból a Daphniákat a vizsgálati anyag szélesen változó koncentrációinak teszik ki. Minden egyes vizsgálati koncentrációnak öt Daphniát kell kitenni, 48 óráig vagy rövidebb ideig, és párhuzamosokra nincs szükség. Az expozíciós idő csökkenthető (pl. 24 óra vagy kevesebb), ha a behatároló vizsgálat céljainak megfelelő adatok rövidebb idő alatt megszerezhetők.
Legalább öt vizsgálati koncentrációt használjunk. Ezeket szétválasztási tényezővel mértani sorba kell beállítani, lehetőség szerint nem meghaladva a 2,2 értéket. Ötnél kevesebb koncentráció alkalmazása esetén indoklás szükséges. A legmagasabb vizsgált koncentráció eredményezzen lehetőleg 100 százalékos immobilizációt, a legalacsonyabb vizsgált koncentráció pedig lehetőleg ne okozzon megfigyelhető hatást.
1.8.1.3. Inkubációs körülmények
A hőmérséklet legyen 18 oC és 22 oC közötti tartományban, és minden egyes vizsgálatnál ± 1 oC eltéréssel legyen állandó. 16 órás világos, és 8 órás sötét ciklus javasolt. A teljes sötétség is elfogadható, főleg fényben instabil vizsgálati anyagok esetében.
A vizsgálati tartályokat a vizsgálat alatt nem szabad levegőztetni. A vizsgálatot a pH-érték módosítása nélkül kell végezni. A Daphniákat a vizsgálat alatt nem szabad etetni.
1.8.1.4. Időtartam
A vizsgálat időtartama 48 óra.
1.8.2. Megfigyelések
24 és 48 órával a vizsgálat megkezdését követően minden vizsgálati tartályban ellenőrizni kell a mozgásképtelen Daphniákat (lásd az 1.2. szakaszt a meghatározásokról). A mozgásképtelenség mellett minden rendellenes viselkedésről vagy jelenségről be kell számolni.
1.8.3. Analitikai mérések
A vizsgálat kezdetekor és a végén a kontroll(ok)ban és a vizsgálati anyag legnagyobb koncentrációjában mérni kell az oldott oxigén koncentrációját és a pH-értéket. A kontrollokban az oldott oxigén koncentrációja feleljen meg az érvényességi kritériumnak (lásd az 1.6. szakaszt). A pH-értéknek rendes körülmények között egyik vizsgálatban sem szabad 1,5 egységet meghaladó mértékben változnia. A hőmérsékletet rendszerint kontrolltartályokban vagy környezeti levegőben mérik, és a vizsgálat során lehetőleg folyamatosan rögzíteni kell, de legalább a vizsgálat kezdetekor és végén.
A vizsgálati anyag koncentrációját legalább a legnagyobb és legkisebb vizsgálati koncentrációnál kell mérni a vizsgálat kezdetekor és végén (4). Javasolt, hogy az eredmények a mért koncentrációkon alapuljanak. Ugyanakkor, ha megfelelő bizonyíték áll rendelkezésre arra vonatkozóan, hogy a vizsgált anyag koncentrációját a vizsgálat során sikerült mindvégig a névleges vagy kiindulási koncentráció ± 20 %-os sávján belül tartani, akkor az eredményeket a névleges vagy a mért kiindulási értékekre is lehet alapozni.
1.9. HATÁRÉRTÉK-VIZSGÁLAT
Az e módszerben leírt eljárások segítségével 100 mg/l vizsgálati anyaggal vagy a vizsgálati közegben való oldhatósági határig (amelyik alacsonyabb) határérték-vizsgálat hajtható végre annak bizonyítására, hogy az EC50 nagyobb, mint e koncentráció. A határérték-vizsgálatot 20 Daphnia használatával (lehetőleg négy darab ötös csoportra osztva) kell végrehajtani úgy, hogy a kontrollcsoportban lévő állatok száma ezzel azonos legyen. Ha mozgásképtelenség következik be, a teljes vizsgálatot el kell végezni. Minden megfigyelt rendellenes viselkedést rögzíteni kell.
2. ADATOK
Az adatokat táblázatos formában kell összefoglalni, minden egyes kezelési csoport és kontroll esetében feltüntetve a felhasznált Daphniák számát, és minden megfigyelt mozgásképtelenséget. A 24 órás és 48 órás immobilizált százalékokat a vizsgálati koncentrációk függvényében kell feltüntetni egy grafikonon. A görbék meredekségének és az EC50 95 %-os konfidenciaszinten (p = 0,05) történő kiszámításához az adatokat megfelelő statisztikai módszerekkel elemezzük (pl. probit-elemzés, stb.) (7) (8).
Ahol az EC50-számítás standard módszerei nem alkalmazhatóak a kapott adatokra, az immobilitást nem okozó legmagasabb koncentrációt és a 100 % immobilizációt eredményező legkisebb koncentrációt kell használni az EC50 becsléséhez (amely a két koncentráció mértani közepének számít).
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek a következőket kell tartalmaznia:
Vizsgálati anyag:
|
— |
fizikai jellege és fontos fizikai-kémiai tulajdonságai, |
|
— |
kémiai azonosítási adatok, beleértve a tisztaságot. |
Vizsgált fajok:
|
— |
Daphniák faja és eredetük, szállító (ha ismert) és az alkalmazott tenyésztési körülmények (beleértve a forrást, táplálék fajtáját és mennyiségét, az etetés gyakoriságát). |
Vizsgálati körülmények:
|
— |
a vizsgálati tartályok leírása: a tartály típusa, az oldat térfogata, a Daphniák száma vizsgálati tartályonként, a vizsgálati tartályok száma (ismétlések) koncentrációnként, |
|
— |
a törzsoldat és a vizsgált oldat elkészítésének módszere, beleértve bármilyen oldószer vagy diszpergálószer használatát, az alkalmazott koncentrációkat, |
|
— |
a hígítóvíz adatai: forrás és vízminőségi jellemzők (pH-érték, keménység, Ca/Mg-arány, Na/K-arány, lúgosság, vezetőképesség, stb.); a művíz összetétele, amennyiben alkalmazták, |
|
— |
inkubációs körülmények: hőmérséklet, fényintenzitás és periodicitás, oldott oxigén, pH-érték, stb. |
Eredmények:
|
— |
az immobilizált vagy más káros behatást mutató (beleértve a rendellenes viselkedést) Daphniák száma és százaléka a kontrollokban és az egyes kezelt csoportokban, minden egyes megfigyelési időpontban, és a megfigyelt hatások jellegének leírása, |
|
— |
ha rendelkezésre áll, a referenciaanyaggal végzett vizsgálat eredményei és dátuma, |
|
— |
a névleges vizsgálati koncentrációk és a vizsgálati tartályokban lévő vizsgálati anyagok koncentrációinak meghatározására végzett valamennyi analízis eredménye; a módszer visszanyerési hatékonyságáról és a meghatározás korlátjáról is beszámolva, |
|
— |
vizsgálat során végzett összes hőmérsékletre, pH-értékre és oldott oxigénre vonatkozó fizikai-kémiai mérés, |
|
— |
immobilizációs EC50 48 óránál, konfidenciaintervallumokkal, és a számításaikhoz használt illesztett modellek grafikonjai, a dózisreakció-görbék meredeksége, és standard hibája; az EC50 meghatározásához használt statisztikai eljárások; (ha mérték, ezeket az adatokat a 24 órás immobilizálásra is meg kell adni) |
|
— |
a vizsgálati módszertől való bármilyen eltérés magyarázata, illetve annak magyarázata, hogy az eltérés befolyásolta-e a vizsgálati eredményeket. |
4. HIVATKOZÁSOK
|
(1) |
ISO 6341. (1996). Water quality – Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) – Acute toxicity test. Third edition, 1996. |
|
(2) |
EPA OPPTS 850.1010. (1996). Ecological Effects Test Guidelines – Aquatic Invertebrate Acute Toxicity Test, Freshwater Daphnids. |
|
(3) |
Environment Canada. (1996). Biological test method. Acute Lethality Test Using Daphnia spp. EPS 1/RM/11. Environment Canada, Ottawa, Ontario, Canada. |
|
(4) |
Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publication. Series on Testing and Assessment. No. 23. Paris 2000. |
|
(5) |
Commission of the European Communities. Study D8369. (1979). Inter-laboratory Test Programme concerning the study of the ecotoxicity of a chemical substance with respect to Daphnia. |
|
(6) |
OECD Guidelines for the Testing of Chemicals. Guideline 211: Daphnia magna Reproduction Test, adopted September 1998. |
|
(7) |
Stephan C.E. (1977). Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). ASTM STP 634 – American Society for Testing and Materials. p. 65–84. |
|
(8) |
Finney D.J. (1978). Statistical Methods in Biological Assay. 3rd ed. London. Griffin, Weycombe, UK. |
1. függelék
AZ ELFOGADHATÓ HÍGÍTÓVÍZ NÉHÁNY KÉMIAI TULAJDONSÁGA
|
Anyagok |
Koncentráció |
|
Szemcsés anyag |
< 20 mg/l |
|
Összes szerves szén |
< 2 mg/l |
|
Ionizálatlan ammónia |
<1 μg/l |
|
Maradék klór |
<10 μg/1 |
|
Összes szerves foszfort tartalmazó növényvédő szer |
<50 μg/1 |
|
Összes szerves klórt tartalmazó növényvédő szer plusz poliklórozott bifenilek |
<50 ng/1 |
|
Összes szerves klór |
<25 ng/1 |
2. függelék
MEGFELELŐ VIZSGÁLATI MŰVÍZRE VONATKOZÓ PÉLDÁK
ISO vizsgálati víz (1)
|
Törzsoldatok (egyetlen anyag) |
A művíz elkészítéséhez 1 liter vízhez a következő mennyiségű törzsoldatot kell adni |
|
|
Anyagok |
1 liter vízhez adott mennyiség (2) |
|
|
Kalcium-klorid CaCl2 , 2H2O |
11,76 g |
25 ml |
|
Magnézium-szulfát MgSO4 , 7H2O |
4,93 g |
25 ml |
|
Nátrium-bikarbonát NaHCO3 |
2,59 g |
25 ml |
|
Kálium-klorid KCl |
0,23 g |
25 ml |
Elendt M7 és M4 közeg
Akklimatizálás az Elendt M4 és M7 közeghez
Egyes laboratóriumok nehézségekbe ütköztek, amikor Daphniákat M4 és M7 közegbe próbáltak átvinni. Fokozatos akklimatizálással, azaz a saját közegből előbb 30, majd 60, végül 100 százalékos Elendt-közegbe való áthelyezéssel azonban sikerült némi sikert elérni. Az akklimatizálódás akár egy hónapig is eltarthat.
Előkészítés
Nyomelem
Először megfelelő tisztaságú (azaz deionizált, desztillált vagy reverz ozmózissal előállított) víz felhasználásával egyedi nyomelemeket tartalmazó, különféle törzsoldatokat (I) kell készíteni. Ezekből a különböző törzsoldatokból (I) egy második, egyetlen (II) törzsoldat készül, amely az összes nyomelemet tartalmazza (kombinált oldat), azaz:
|
I. törzsoldat(ok) (egyes anyagokból) |
A vízhez adott mennyiség (mg/l) |
Koncentráció (M4 közegre vonatkoztatv a) |
A II. kombinált törzsoldat elkészítéséhez az I. törzsoldatból az alábbi mennyiséget kell vízhez hozzáadni (ml/l) |
|
|
M4 |
M7 |
|||
|
H3 BO3 |
57 190 |
20 000-szeres |
1,0 |
0,25 |
|
MnCl2.4H2O |
7 210 |
20 000-szeres |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000-szeres |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000-szeres |
1,0 |
0,25 |
|
SrCl2.6H2O |
3 040 |
20 000-szeres |
1,0 |
0,25 |
|
NaBr |
320 |
20 000-szeres |
1,0 |
0,25 |
|
Na2 MoO4.2H2O |
1 230 |
20 000-szeres |
1,0 |
0,25 |
|
CuCl2.2H2O |
335 |
20 000-szeres |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000-szeres |
1,0 |
1,0 |
|
CoCl2.6H2O |
200 |
20 000-szeres |
1,0 |
1,0 |
|
KI |
65 |
20 000-szeres |
1,0 |
1,0 |
|
Na2 SeO3 |
43,8 |
20 000-szeres |
1,0 |
1,0 |
|
NH4 VO3 |
11,5 |
20 000-szeres |
1,0 |
1,0 |
|
Na2 EDTA.2H2O |
5 000 |
2 000-szeres |
— |
— |
|
FeSO4.7H2O |
1 991 |
2 000-szeres |
— |
— |
|
Mind a Na2EDTA, mind a FeSO4-oldatot külön kell elkészíteni, majd összeönteni és azonnal autoklávban kezelni. |
||||
|
Ebből: |
||||
|
2 l Fe-EDTA oldat |
|
1 000-szeres |
20,0 |
5,0 |
M4 és M7 közeg
Az M4 és M7 közegeket a II. törzsoldatból, a makroelemekből és a vitaminokból kell elkészíteni a következőképpen:
|
|
A vízhez adott mennyiség (mg/l) |
Koncentráció (M4 közegre vonatkoztatva) |
A közeg készítésekor hozzáadott II. törzsoldat mennyisége (ml/l) |
|
|
M4 |
M7 |
|||
|
II. törzsoldat (kombinált nyomelemek) |
|
20-szoros |
50 |
50 |
|
Makroelemek törzsoldatai (egy anyagból) |
|
|
|
|
|
CaCl2 · 2H20 |
293 800 |
1 000-szeres |
1,0 |
1,0 |
|
MgSO4 · 7H2O |
246 600 |
2 000-szeres |
0,5 |
0,5 |
|
KCl |
58 000 |
10 000-szeres |
0,1 |
0,1 |
|
NaHCO3 |
64 800 |
1 000-szeres |
1,0 |
1,0 |
|
Na2 SiO3 · 9H2O |
50 000 |
5 000-szeres |
0,2 |
0,2 |
|
NaNO3 |
2 740 |
10 000-szeres |
0,1 |
0,1 |
|
KH2 PO4 |
1 430 |
10 000-szeres |
0,1 |
0,1 |
|
K2HPO4 |
1 840 |
10 000-szeres |
0,1 |
0,1 |
|
Kombinált vitamintörzsoldat |
— |
10 000-szeres |
0,1 |
0,1 |
|
A kombinált vitamintörzsoldat készítéséhez 3 vitamint kell 1 liter vízhez adni, a következőképpen: |
||||
|
Tiamin-hidroklorid |
750 |
10 000-szeres |
|
|
|
Ciano-kobalamine (B12) |
10 |
10 000-szeres |
|
|
|
Biotin |
7,5 |
10 000-szeres |
|
|
A kombinált vitamintörzsoldatot kis aliquot részletekben, fagyasztott állapotban kell tartani. A közeghez a vitaminokat röviddel a felhasználás előtt kell hozzáadni.
|
Megjegyzés |
: |
A végleges közeg elkészítésekor a sók kicsapódásának elkerülése érdekében az aliquot törzsoldatokat kb. 500–800 ml deionizált vízhez kell adni, majd a mennyiséget fel kell tölteni 1 literre. |
|
Megjegyzés |
: |
Az M4 tényészoldatról szóló első publikáció az Elendt, B.P. (1990)-ben található. Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154., pp. 25–33. |
C.3. ALGASZANÖVEKEDÉS-GÁTLÁSI VIZSGÁLAT
1. MÓDSZER
1.1. BEVEZETÉS
A vizsgálat célja, hogy valamely anyagnak az egysejtű zöldalgafajok növekedésére gyakorolt hatását meghatározzuk. Viszonylag rövid idejű (72 órás) vizsgálatokkal is több nemzedéken keresztül figyelhetők meg a hatások. A módszer több, egysejtű algafajjal való használatra is adaptálható, ám ezen esetben az alkalmazott módszer leírását is mellékelni kell a vizsgálati jelentéshez.
A jelen módszer legkönnyebben vízben jól oldódó vizsgált anyagokra alkalmazható, amelyek a vizsgálati körülmények között nagy valószínűséggel vízben oldott állapotban maradnak.
A módszer olyan anyagokhoz használható, amelyek közvetlenül nem akadályozzák az alga növekedésének mérését.
Hasznosnak bizonyul, ha rendelkezésre állnak információk az anyag vízoldékonyságáról, gőznyomásáról, kémiai stabilitásáról, disszociációs állandóiról és biológiai lebonthatóságáról a vizsgálat megkezdése előtt.
Mind a vizsgálat tervezéséhez, mind az eredmények értelmezéséhez figyelembe kell venni további információkat is (ilyenek például a szerkezeti képlet, a tisztasági fok, szennyeződések jellege és százalékos aránya, adalékanyagok mennyisége, n-oktanol/víz megoszlási koefficiens).
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Sejtsűrűség: sejtek száma milliliterenként;
Növekedés: a sejtsűrűség növekedése a vizsgálat időtartama alatt;
Növekedési sebesség: a sejtsűrűség növekedése egységnyi idő alatt;
EC50: e módszerben azon vizsgált anyag koncentrációja, amely 50 %-os csökkenést eredményez a növekedésben (EbC50) vagy a növekedési rátában (ErC50) a kontrollhoz viszonyítva;
NOEC (megfigyelhető hatást nem okozó koncentráció): e módszerben az a legnagyobb vizsgált koncentráció, amelynél jelentős növekedésgátlás nem figyelhető meg a kontrollhoz viszonyítva.
A vizsgált anyag minden koncentrációját tömeg/térfogat (milligramm/liter) mértékegységben kell megadni. E koncentrációk tömeg/tömeg (mg.kg–1) mértékegységben is megadhatók.
1.3. REFERENCIAANYAGOK
Vizsgálható referenciaanyag annak bemutatására, hogy a laboratóriumi vizsgálati körülmények között nem változott-e meg jelentős mértékben a vizsgált fajok érzékenysége.
Ha használnak referenciaanyagot, meg kell adni az eredményeket a jelentésben. Kálium-dikromát használható referenciaanyagként, de ennek színe hatással lehet a sejtekhez rendelkezésre álló fény minőségére és a fényerőre, valamint a spektrofotometriai meghatározásokra, ha használnak ilyeneket. Kálium-dikromátot használtak egy nemzetközi, laboratóriumközi vizsgálatban (lásd a 3. szakirodalmat és a 2. függeléket).
1.4. A VIZSGÁLATI MÓDSZER ELVE
Végrehajtható határérték-vizsgálat 100 mg/liter koncentrációval annak bemutatására, hogy az EC50 nagyobb, mint e koncentráció.
A kiválasztott zöldalgafaj exponenciálisan növekvő sejtkultúráit több nemzedéken keresztül meghatározott körülmények között kezelik a vizsgált anyag különféle koncentrációival.
A vizsgált oldatokat 72 órás időtartamig kell inkubálni, amelynek során legalább minden 24 órában meg kell mérni a sejtsűrűséget minden egyes oldatban. A növekedésgátlást a kontrolltenyészethez viszonyítva kell meghatározni.
1.5. MINŐSÉGI KÖVETELMÉNYEK
A minőségi követelmények mind a határérték-vizsgálati, mind a teljes vizsgálati módszerre érvényesek.
A kontrolltenyészetekben a sejtsűrűségnek legalább 16-szorosára kell növekednie 3 napon belül.
A vizsgált anyag koncentrációit a kísérlet során mindvégig a kezdeti koncentráció 80 %-án belüli értéken kell tartani.
Az olyan anyagok esetében, amelyek stabil oldatokat képezve könnyen oldódnak a vizsgált közegben, tehát azok, amelyek jelentős mértékben nem fognak párologni, lebomlani, hidrolizálni vagy abszorbeálódni, a kezdeti koncentráció a névleges koncentrációval egyenlőnek tekinthető. Bizonyítani kell, hogy a koncentrációk a vizsgálat során mindvégig megmaradnak, és a minőségi követelmények teljesülnek.
Azon anyagok esetében, amelyek:
|
i. |
a vizsgált közegben kevéssé oldhatók; vagy |
|
ii. |
stabil emulziók vagy diszperziók létrehozására képesek; vagy |
|
iii. |
vizes oldatokban nem stabilak, |
abból kell kiindulni, hogy a kezdeti koncentráció a vizsgálat kezdetén az oldatban mért koncentráció. A koncentrációt a kiegyenlítődési periódust követően kell meghatározni.
Ezen esetek közül mindegyikben további méréseket kell végrehajtani a vizsgálat során a tényleges expozíciós koncentrációk megerősítésére, vagy annak megerősítésére, hogy teljesülnek-e a minőségi követelmények.
Abból kell kiindulni, hogy jelentős mennyiségű vizsgált anyag épülhet be az algabiomasszába a vizsgálat időtartama során. Ezért a fenti minőségi követelménynek való megfelelőség bizonyítására figyelembe kell venni mind az algabiomasszába beépült anyagmennyiséget, mind az oldatba (vagy, ha ez technikailag nem lehetséges, a vízoszlopba) beépített anyagot. Azonban, mivel az algabiomasszába beépült anyag koncentrációjának meghatározása jelentős technikai problémákat vethet fel, a minőségi követelmények teljesítése bemutatható egy, a legnagyobb anyagkoncentrációjú, de alga nélküli vizsgálati tartály alkalmazásával és az oldatbeli (vagy, ha ez technikailag nem lehetséges, a vízoszlopban) koncentrációk mérésével a vizsgálati időtartam kezdetén és végén.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Reagensek
1.6.1.1. A vizsgált anyagok oldatai
El kell készíteni a szükséges erősségű törzsoldatokat az anyagnak ioncserélt vízben vagy az 1.6.1.2. pontnak megfelelő vízben történő feloldásával.
A kiválasztott vizsgált koncentrációt az alga-előtenyészetekhez alkalmas aliquot részek hozzáadásával kell elkészíteni (lásd az 1. függeléket).
Az anyagokat általában csak az oldhatóság határáig kell vizsgálni. Néhány anyagnál (például olyan anyagok esetében, amelyeknek kicsi a vízoldékonysága, nagy a Pow-értéke vagy azok esetében, amelyek stabil diszperziót alkotnak, nem pedig valódi oldatot hoznak létre vízben) elfogadható az anyag oldhatósági határa fölötti vizsgált koncentráció használata a maximális oldható/stabil koncentráció elérésének biztosítására. Fontos azonban, hogy e koncentráció ne zavarja meg a vizsgált rendszert valamilyen más módon (például az anyagból a víz felszínén képződött, és a víz oxigénellátását akadályozó film révén).
Ultrahangos diszpergálás, szerves oldószerek, emulgeáló- vagy diszpergálószerek használhatók alacsony vízoldékonyságú anyagok törzsoldatai elkészítésének elősegítésére, vagy a vizsgált közegben az ilyen anyagok diszpergálódásának segítésére. Amikor ilyen segédanyagokat használnak, minden vizsgált koncentrációnak ugyanolyan mennyiségű segédanyagot kell tartalmaznia, és további kontrollokat kell kitenni a segédanyag ugyanolyan koncentrációja hatásának, mint amelyet a vizsgálati sorozatokban alkalmaznak. Minden ilyen segédanyag koncentrációját minimális értéken kell tartani, de semmi esetre sem szabad meghaladnia a 100 mg/liter értéket a vizsgált közegben.
A vizsgálatot a pH-érték beállítása nélkül kell végrehajtani. Ha létezik bizonyíték a pH-érték jelentős változására, ajánlatos a vizsgálat megismétlése a pH-érték beállításával, meg kell adni az így kapott eredményeket. Ezen esetben be kell állítani a törzsoldat pH-értékét a hígítóvíz pH-értékére, kivéve ha különleges okok szólnak ellene. E célra a legkedvezőbb a HCl és az NaOH használata. Ezt a pH beállítást úgy kell végrehajtani, hogy ne változzon meg jelentős mértékben a vizsgált anyag koncentrációja a törzsoldatban. Ha a beállítás a vizsgált vegyület valamilyen kémiai reakcióját vagy fizikai kicsapódását okozza, ezt közölni kell a jelentésben.
1.6.1.2. Vizsgálati közeg
A víznek jó minőségű desztillált víznek vagy 5 μS cm–1-nél kisebb vezetőképességű, ioncserélt víznek kell lennie. A víz desztillálásához használt készüléknek semmilyen rézből készült alkatrészt nem szabad tartalmaznia.
A következő közeg ajánlott.
Négy törzsoldatot kell elkészíteni a következő táblázatnak megfelelően. A törzsoldatokat sterilizálni kell membránszűréssel vagy autoklávban, és sötétben, 4 oC hőmérsékleten kell tárolni. A 4. számú törzsoldatot csak membránszűréssel szabad sterilizálni. E törzsoldatokat hígítani kell a vizsgált oldatokbeli végleges tápanyag-koncentrációk elérése érdekében.
|
Tápanyag |
Koncentráció a törzsoldatban |
Végső koncentráció a vizsgált oldatban |
|
1. törzsoldat: makrótáp anyagok |
||
|
NH4C1 |
1,5 g/l |
15 mg/l |
|
MgCl2.6H2O |
1,2 g/l |
12 mg/l |
|
CaCl2.2H2O |
1,8 g/l |
18 mg/l |
|
MgSO4.7H2O |
1,5 g/l |
15 mg/l |
|
KH2 PO4 |
0,16 g/l |
1,6 mg/l |
|
2. törzsoldat: Fe-EDTA |
||
|
FeCl3.6H2 |
80 mg/l |
0,08 mg/l |
|
Na2EDTA.2H2O |
100 mg/l |
0,1 mg/l |
|
3. törzsoldat: nyomelemek |
||
|
H3BO3 |
185 mg/l |
0,185 mg/l |
|
MnCl2.4H2O |
415 mg/l |
0,415 mg/l |
|
ZnCl2 |
3 mg/l |
3 × 10–3 mg/l |
|
CoCl2.6H2O |
1,5 mg/l |
1,5 × 10–3mg/l |
|
CuCl2.2H2O |
0,01 mg/l |
10–5 mg/l |
|
Na2MoO4.2H2O |
7 mg/l |
7 × 10–3 mg/l |
|
4. törzsoldat: NaHCO3 |
||
|
NaHCO3 |
50 g/l |
50 mg/l |
A közeg pH-ja körülbelül 8 a levegőztetés után.
1.6.2. Készülék
|
— |
Szokásos laboratóriumi berendezés, |
|
— |
Alkalmas űrtartalmú vizsgálólombikok (körülbelül 250 ml-es kúpos lombikok alkalmasak, ha a vizsgált oldat térfogata 100 ml). Minden vizsgálólombiknak azonosnak kell lenni az anyag és a méret tekintetében, |
|
— |
Tenyésztő készülék: szekrény vagy kamra, amelyben 21 oC és 25 oC közötti hőmérséklet tartható fenn ± 2 oC eltéréssel, és folyamatos, egyenletes megvilágítás biztosított 400–700 nm spektrális tartományban. Ha a kontrolltenyészetekben lévő algák elérték a javasolt növekedési rátát, feltételezhető, hogy megfelelőek voltak a növekedés feltételei, a fény intenzitását is ideértve. Az átlagos koncentrációjú oldatoknál ajánlott a 60 és 120 μE.m–2 .s–1 (35 és 70 x 1018 foton.m–2.s–1) tartományban lévő fényerő használata, megfelelő receptor segítségével 400–700 nm tartományban mérve. Lux-ban kalibrált fénymérő műszerek esetében elfogadható egy ezzel egyenértékű, 6 000-től 10 000 lx-ig terjedő tartomány. A fényerő az algatenyészettől 0,35 méteres távolságban elhelyezett négy–hét, 30 W-os, egyen- és váltakozó áramú, fehér (körülbelül 4 300 K színhőmérsékletű) fénycső segítségével érhető el. |
|
— |
A sejtsűrűség-méréseket az élő sejtek számára kifejlesztett, közvetlen számolási eljárásokkal, például mikroszkópos számlálókamra, kell végrehajtani. Használhatók más eljárások is (fotometria, turbidimetria stb.), ha azok elegendően érzékenyek, és bizonyítottan kielégítően korrelálnak a sejtsűrűséggel. |
1.6.3. Kísérleti organizmusok
Ajánlatos, hogy a vizsgálathoz használt zöldalgafajták könnyen tenyészthető és vizsgálható, gyorsan szaporodó fajták legyenek. A következők az előnyben részesített fajták:
|
— |
Selenastrum capricornutum, például ATCC 22662 vagy CCAP 278/4, |
|
— |
Scenedesmus subspicatus, például 86.81 SAG. |
Megjegyzés:
|
ATCC |
= |
American Type Culture Collection (U.S.A.) |
|
CCAP |
= |
Culture Centre of Algae and Protozoa (U.K.) |
|
SAG |
= |
Collection of algal culture (Göttingen, F.R.G.) |
Ha más fajtákat használnak, meg kell adni a törzset.
1.6.4. A kísérlet végrehajtása
Az előzetes vizsgálatok eredményei alapján kell meghatározni azt a koncentrációtartományt, amelyben a hatások valószínűleg bekövetkeznek.
A két növekedési paraméter (biomassza és növekedési ráta) a növekedésgátlás nagymértékben eltérő értékeit eredményezheti; az előzetes vizsgálatban mindkettőt használni kell annak biztosítására, hogy a koncentrációk mértani sorozata lehetővé tegye mind az EbC50, mind az ErC50 megállapítását.
Kezdeti sejtsűrűség
Ajánlatos, hogy körülbelül 104 sejt/ml legyen a vizsgált tenyészetekben a kezdeti sejtsűrűség Selenastrum capricornutum és Scenedesmus subspicatus esetében. Amikor más fajtákat használnak, a biomasszának hasonlónak kell lennie.
A vizsgált anyag koncentrációi
A vizsgálathoz legalább 5 koncentrációt kell mértani sorba állítani, 2,2-t nem meghaladó koncentrációarányban. A vizsgált legalacsonyabb koncentrációnak nem szabad megfigyelt hatással lennie az alga növekedésére. A vizsgált legnagyobb koncentrációnak a kontrollhoz viszonyítva legalább 50 %-kal kell gátolnia, és lehetőleg teljesen meg kell gátolnia a növekedést.
Ismétlések és kontrollok
A vizsgálat tervének három ismétlést kell tartalmaznia minden egyes vizsgált koncentrációnál. Három kontrollt kell vizsgálni a vizsgált anyag nélkül, és ha van ilyen, három, a segédanyagot tartalmazó kontrollt is kell vizsgálni. Ha indokolt, a vizsgálati terv megváltoztatható a koncentrációk számának növelésével és a koncentrációnkénti ismétlések számának csökkentésével.
A vizsgálat végrehajtása
El kell készíteni a vizsgált anyagot a kívánt koncentrációkban, valamint a kívánt mennyiségű algaoltóanyagot tartalmazó vizsgált tenyészeteket a vizsgált anyag törzsoldatai aliquot részeinek hozzáadásával az alkalmas mennyiségű alga előtenyészetekhez (lásd az 1. függeléket).
Fel kell rázni a lombikokat, és el kell helyezni azokat a tenyésztőkészülékbe. Az algasejteket szuszpenzióban kell tartani rázassál, keveréssel vagy levegőztetéssel a gázcsere javítására és a pH-változás csökkentésére. A tenyészeteket 21 és 25 oC közötti hőmérséklet-tartományban kell tartani ± 2 oC eltérésen belül szabályozva.
Minden egyes lombikban, a vizsgálat kezdete után legalább a 24., 48. és 72. órában, meg kell határozni a sejtsűrűséget. A vizsgált anyag megfelelő koncentrációját tartalmazó szűrt algatáptalajt kell használni a háttér meghatározására, amikor közvetlen számlálási módszerektől eltérő sejtsűrűségméréseket használnak.
A pH-t a vizsgálat kezdetén és a 72. órában kell mérni.
A kontrollok pH-jának általában nem szabad 1,5 egységnél nagyobb mértékben eltérnie a vizsgálat során.
Illékony anyagok vizsgálata
A mai napig nem létezik általánosan elfogadott módszer az illékony anyagok vizsgálatára. Amikor valamilyen anyagról ismert, hogy hajlamos az elpárolgásra, megnövelt felső szabadterű, zárt vizsgálólombikok használhatók. A zárt lombikok felső szabad terének kiszámításakor figyelembe kell venni a CO2-hiány kialakulásának lehetőségét. E módszer megváltoztatásához már léteznek javaslatok (lásd a szakirodalom (4) pontját).
Meg kell kísérelni az oldatban maradó anyagmennyiség meghatározását; rendkívüli óvatosság ajánlatos a zárt rendszerek segítségével illékony kémiai anyagokkal végrehajtott vizsgálatok eredményeinek értelmezésekor.
Határérték-vizsgálat
Az e módszerben leírt eljárások segítségével végrehajtható a határérték-vizsgálat 100 mg/l koncentrációval annak bemutatására, hogy az EC50 nagyobb, mint e koncentráció.
Ha az anyag olyan természetű, hogy nem érhető el a vizsgált vízben a 100 mg/l-es koncentráció, a határérték-vizsgálatot a használt közegben az anyag oldhatóságával egyenlő koncentrációval (vagy a stabil diszperziót alkotó maximális koncentrációval) kell végrehajtani (lásd még az 1.6.1.1. pontot is).
A határérték-vizsgálatot legalább háromszor kell végrehajtani, azonos számú kontrollokkal. A két növekedési paramétert (biomassza és növekedési ráta) kell felhasználni a határértékvizsgálathoz.
Ha valamely határérték-vizsgálatban 25 %-os vagy ennél nagyobb közepes csökkenést állapítanak meg a biomasszában vagy a növekedési rátában a határérték-vizsgálat és a kontroll között, a teljes vizsgálatot végre kell hajtani.
2. ADATOK ES KIÉRTÉKELÉS
Táblázatban kell összefoglalni a vizsgált tenyészetekben és kontrollokban mért sejtsűrűséget a vizsgált anyag koncentrációival és a mérések időpontjaival együtt. A növekedési görbék létrehozásához fel kell vinni az idő (0–72 h) függvényében az egyes vizsgálatianyagkoncentrációkhoz és a kontrollokhoz megállapított sejtsűrűség átlagértékét.
A koncentráció/hatás összefüggés meghatározására a következő két megközelítést kell használni. Néhány anyag alacsony koncentrációkban stimulálhatja a növekedést. Csak a 0 és 100 % közötti növekedésgátlást jelző adatokat kell figyelembe venni.
2.1. A NÖVEKEDÉSI GÖRBÉK ALATTI TERÜLETEK ÖSSZEHASONLÍTÁSA
A növekedési görbék és az N = N0 vízszintes vonal közötti terület a következő képletnek megfelelően számítható ki:
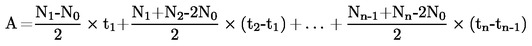
ahol:
|
A |
= |
terület, |
|
N0 |
= |
sejtek száma/ml a t0 időpontban (a vizsgálat kezdetén), |
|
N1 |
= |
mért sejtszám/ml a t1 időpontban, |
|
Nn |
= |
mért sejtszám/ml a tn időpontban, |
|
t1 |
= |
az első mérés ideje a vizsgálat kezdete után, |
|
tn |
= |
az n-edik mérés ideje a vizsgálat kezdete után, |
|
n |
= |
a vizsgálat kezdete után végrehajtott mérések száma. |
Az egyes vizsgálatianyag-koncentrációk mellett a növekedésgátlás százalékos arányát (IA) a következő képletnek megfelelően lehet kiszámítani:

ahol:
|
Ac |
= |
a kontroll növekedési görbe és az N=N0 vízszintes vonal közötti terület, |
|
At |
= |
a t koncentráció melletti növekedési görbe és az N=N0 vízszintes vonal közötti terület. |
|
IA |
= |
Az IA értékeket a megfelelő koncentrációk függvényében fel kell vinni egy féllogaritmusos vagy féllogaritmusos probit papírra. Ha probit papírra vittük fel a pontokat, azokra egyenes vonalat kell illeszteni szemmel vagy számított regresszió alapján. |
A regressziós egyenesből kell megbecsülni az EC50-et egy, az 50 %-os gátlással (IA = 50 %) egyenértékű koncentráció leolvasásával. Ahhoz, hogy ezen érték egyértelműen legyen jelezve ezen számítási módszerrel összefüggésben, ajánlatos az EbC50 szimbólum használata. Lényeges, hogy az EbC50-et a megfelelő expozíciós időtartammal együtt adják meg, például EbC50 (0–72 h).
2.2. NÖVEKEDÉSI RÁTÁK ÖSSZEHASONLÍTÁSA
Az exponenciálisan növekedő tenyészetek átlagos, specifikus növekedési rátája (μ) a következőképpen számítható ki:

ahol t0 a vizsgálat kezdete.
Az átlagos specifikus növekedési ráta az idő függvényében felvitt ln N görbén a regressziós egyenes meredekségéből határozható meg.
A specifikus növekedési ráta egyes vizsgálatianyag-koncentrációk melletti százalékos gátlását (Iμt) a következő képlet segítségével kell kiszámítani:

ahol:
|
μc |
= |
a kontroll átlagos specifikus növekedési rátája, |
|
μt |
= |
a t vizsgált koncentrációhoz tartozó átlagos specifikus növekedési ráta. |
Fel kell vinni az átlagos specifikus növekedési ráta minden egyes vizsgált anyagkoncentráció melletti százalékos csökkenését a kontrollértékkel összehasonlítva a koncentráció logaritmusának függvényében. Az így kapott görbéből leolvasható az EC50. Az e módszerrel megállapított EC50 félreérthetetlen jelölésére ajánlatos az ErC50 szimbólum használata. A mérési időket jelezni kell, például, ha az érték 0 és 72 órás időkre vonatkozik, a szimbólum a következő: ErC50 (0–72 h).
Megjegyzés: A specifikus növekedési ráta logaritmikus mennyiség, és a növekedési ráta kismértékű változásai nagy változásokhoz vezethetnek a biomasszában. Ebből következően az EbC- és ErC-értékek számszerűen nem hasonlíthatók össze.
2.3. A NOEC KISZÁMÍTÁSA
A megfigyelhető hatást nem okozó koncentrációt („no observed effect concentration” = NOEC) több minta összehasonlítására szolgáló alkalmas statisztikai eljárással (például varianciaanalízis és Dunnett-próba) kell meghatározni az A. növekedési görbék melletti területek egyes ismétlődő értékeinek (lásd a 2.1. pontot) vagy a μ specifikus növekedési ráták (lásd a 2.2. pontot) segítségével.
3. JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
vizsgált anyag: kémiai azonosító adatok, |
|
— |
vizsgált organizmusok: eredet, laboratóriumi tenyészet, törzsszám, tenyésztés módszere, |
|
— |
vizsgálati körülmények:
|
|
— |
eredmények:
|
4. SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 201. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges. |
|
(2) |
Umweltbundesamt, Berlin, 1984, Verfahrensvorschlag „Hemmung der Zellvermehrung bei der Grünalge Scenedesmus subspicatus”, in: Rufolf/Boje: Ökotoxikologie, ecomed, Landsberg, 1986. |
|
(3) |
ISO 8692 – Water quality – Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum. |
|
(4) |
S. Galassi and M. Vighi – Chemosphere, 1981, vol.10, 1123–1126. |
1. Függelék:
Példa algatenyésztési eljárásra
Általános megfigyelések
Az alábbiakban ismertetett eljárások alapján végzett tenyésztés célja a toxicitásvizsgálatokhoz használható algatenyészetek létrehozása.
Olyan alkalmas módszereket kell használni, amelyekkel megelőzhető az algatenyészet baktériumos fertőződése (ISO 4833). Axenikus kultúrák kívánatosak lehetnek, az azonban mindenképpen létfontosságú, hogy csak egyféle algasejt legyen jelen.
Minden műveletet steril körülmények között kell végezni az egyéb algasejtekkel vagy baktériumokkal való szennyeződés elkerülése érdekében. Szennyezett tenyészeteket nem szabad alkalmazni.
Az algakultúrák kialakításának eljárásai
Tápoldat elkészítésének módja:
A tápoldat koncentrált törzsoldatok hígításával készíthető el. A szilárd táptalajhoz hozzá kell adni az agar 0,8 %-át. A használt tápoldatnak sterilnek kell lennie. Az autoklávban történő sterilizálás NH3 veszteséghez vezethet.
Törzstenyészet:
A törzstenyészetek kis algatenyészetek, amelyeket rendszeresen friss táptalajba kell oltani azért, hogy kezdeti vizsgált anyagként szolgáljanak. Ha nem használnak rendszeresen tenyészeteket, akkor azokat ferde agarra kell széleszteni. E tenyészeteket minden két hónapban legalább egyszer friss médiumba kell oltani.
A törzstenyészeteket a megfelelő tápoldatot tartalmazó kúpos lombikokban (körülbelül 100 ml-es űrtartalmú) kell szaporítani. Amikor az algákat 20 oC hőmérsékleten inkubálják folyamatos megvilágítás mellett, hetenkénti átoltás szükséges.
Az átoltás során bizonyos mennyiségű „régi” tenyészetet kell átvinni steril pipettákkal egy friss tápfolyadékot tartalmazó lombikba úgy, hogy a gyorsan növekvő fajták esetében a kezdeti koncentráció körülbelül a régi tenyészetnek a századrésze legyen.
Valamely fajta növekedési rátája a növekedési görbe segítségével határozható meg. Ha ez ismert, meghatározható az a sűrűség, amelynek elérésekor a tenyészetet át kell oltani. Ezt azelőtt kell végrehajtani, mielőtt a tenyészet eléri az elpusztulási fázist.
Előtenyészet:
Az előtenyészetnek megfelelő mennyiségű algát kell termelnie, amiket a vizsgált kultúráknál inokulumként lehet alkalmazni. Az előtenyészetet a vizsgálati körülmények között inkubálni kell, és általában akkor kell használni azokat, amikor még exponenciálisan növekednek, tehát körülbelül háromnapos inkubálási időtartam után. Azon algatenyészeteket, amelyek deformálódott vagy abnormális sejteket tartalmaznak, ki kell dobni.
2. Függelék:
Az ISO 8692 – Water quality – Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum a káliumdikromátot vizsgáló, 16 laboratóriumközi vizsgálat következő eredményeiről számol be:
|
|
Átlagértékek (mg/l) |
Tartomány (mg/l) |
|
ErC50 (0 – 72h) |
0,84 |
0,60-tól 1,03-ig |
|
EbC50 (0 – 72 h) |
0,53 |
0,20-tól 0,75-ig |
C.4. A „GYORS” BIOLÓGIAI LEBONTHATÓSÁG MEGHATÁROZÁSA
I. RÉSZ ÁLTALÁNOS
1.1. BEVEZETÉS
Ez a leírás hat vizsgálati módszert ismertet, amelyek lehetővé teszik a kémiai anyagok szűrését a biológiailag könnyen végbemenő lebonthatóság szempontjából, valamely aerob vizes közegben.
|
a) |
Oldottszervesszén- („Dissolved Organic Carbon” = DOC) csökkenés (C.4-A. módszer); |
|
b) |
Módosított OECD vizsgálat – DOC-csökkenés (C.4-B. módszer); |
|
c) |
Szén-dioxid-fejlődés-vizsgálat (CO2) (módosított Sturm-féle vizsgálat) (C.4.-C. módszer); |
|
d) |
Manometrikus respirometria (C.4-D. módszer); |
|
e) |
Zárt palack (C.4-E. módszer); |
|
f) |
MITI (Ministry of International Trade and Industry – Japán) (C.4-F. módszer). |
A módszer leírásának I. része ismerteti mind a hat vizsgálathoz tartozó általános és közös tételeket és megjegyzéseket. Az egyes módszerekre sajátosan jellemző tételek a II–VII. részben találhatók. A függelékek fogalommeghatározásokat, képleteket és iránymutató anyagokat tartalmaznak.
Egy 1988-ban, az OECD-országok laboratóriumaiban végrehajtott körvizsgálat azt mutatta, hogy a módszerek egymással egyező eredményeket adnak. Azonban a vizsgált anyag fizikai jellemzőitől függően a módszerek közül az egyik vagy a másik előnyben részesíthető.
1.2. A MEGFELELŐ MÓDSZER KIVÁLASZTÁSA
A legmegfelelőbb módszer kiválasztásához lényegesek a kémiai anyag oldhatóságára, gőznyomására és adszorpciós jellemzőire vonatkozó információk. Rendszerint ismerni kell a kémiai szerkezetet vagy a képletet a paraméterek, mint például a ThOD, ThCO2, DOC, TOC, COD (lásd az 1. és 2. függeléket) elméleti értékeinek kiszámítására és/vagy mért értékeinek ellenőrzésére.
Azon vizsgált anyagok, amelyek vízben legalább 100 mg/l mértékben oldhatók, a fenti módszerek közül bármelyikkel kiértékelhetők, feltéve hogy nem illékonyak, és nem adszorbeálódnak. Az 1. táblázat tartalmazza a megfelelő módszereket azon kémiai anyagokhoz, amelyek vízben gyengén oldhatók, illékonyak vagy adszorbeálódnak. A 3. függelék írja le azt a módot, ahogyan a vízben gyengén oldható és illékony anyagok kezelhetők. Mérsékelten illékony kémiai anyagok a DOC-csökkenés módszerével vizsgálhatók, ha elegendő gáztér van a vizsgálati tartályokban (amelyeket megfelelően le kell zárni). Ezen esetben abiotikus kontrollt kell alkalmazni minden lehetséges fizikai veszteség figyelembevételére.
1. táblázat
A vizsgálati módszerek alkalmazhatósága
|
Vizsgálat |
Analitikai módszer |
Alkalmas olyan anyagokhoz, amelyek: |
||
|
rosszul oldódnak |
illékonyak |
adszorbeálódnak |
||
|
DOC- csökkenés |
Oldott szerves szén |
— |
— |
+/– |
|
Módosított OECD-vizsgálat |
Oldott szerves szén |
— |
— |
+/– |
|
CO2-fejlődés-vizsgálat |
Respirometria: CO2-fejlődés |
+ |
— |
+ |
|
Manometrikus respirometria |
Manometrikus respirometria: oxigénfogyasztás |
+ |
+/– |
+ |
|
Zárt palack |
Respirometria: oldott oxigén |
+/– |
+ |
+ |
|
MITI-vizsgálat |
Respirometria: oxigénfogyasztás |
+ |
+/– |
+ |
A kapott eredmények értelmezéséhez szükség van a vizsgált anyag tisztaságára vagy relatív arányaira vonatkozó információkra, különösen kismértékű lebonthatóság vagy szélsőséges eredmények esetén.
Nagyon hasznosnak bizonyulhatnak a vizsgált anyag baktériummal szembeni toxicitására vonatkozó információk (4. függelék), ezek lényegesek lehetnek az alacsony biológiai lebomlási értékek megfelelő értelmezéséhez.
1.3. REFERENCIAANYAGOK
Az eljárás ellenőrzéséhez a normál vizsgálatsorozattal egyidejűleg megfelelő lombik segítségével olyan referenciaanyagokat kell megvizsgálni, amelyek kielégítik a biológiailag gyors lebonthatóság kritériumait.
Alkalmas kémiai anyagok az anilin (frissen desztillált), a nátrium-acetát és a nátrium-benzoát. E referenciaanyagok közül mindegyik lebomlik ezen módszerekben, még akkor is, ha szándékosan nem történt inokulum-hozzáadás.
Javasolt olyan referenciaanyagot keresni, amely biológiailag gyorsan lebontható, de amelyhez szükség van valamilyen inokulum hozzáadására. A kálium-hidrogén-ftalátot javasolták, de további bizonyítékot kell beszerezni, mielőtt ezt elfogadnánk referenciaanyagként.
A respirometriás vizsgálatokban a nitrogéntartalmú vegyületek a nitrifikáció miatt hatással lehetnek az oxigénfelvételre (lásd a 2. és 5. függeléket).
I.4. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyagot ásványianyag-tápoldatban fel kell oldani vagy szuszpendálni, és aerob állapotok mellett, sötétben vagy diffúz fényben be kell oltani és inkubálni. A vizsgált oldatban az oltóanyagnak tulajdonítható DOC mennyiségét a vizsgált anyagnak tulajdonítható DOC-mennyiséggel összehasonlítva a lehető legalacsonyabban kell tartani. Figyelembe kell venni az inokulum endogén aktivitását egyidejűleg végzett vakpróbák segítségével, amelyek esetében az oldat csak inokulumot tartalmaz, de vizsgált anyagot nem, jóllehet, az anyag jelenlétében a sejtek endogén aktivitása nem fog pontosan megegyezni az endogén kontrollban jelentkező aktivitással. Egyidejűleg vizsgálni kell valamely referenciaanyagot az eljárások működésének ellenőrzésére.
Általában a lebomlást az olyan paraméterek meghatározása követi, mint például a DOC, a CO2-képződés és az oxigénfelvétel, és elegendően gyakori időközönként méréseket kell végrehajtani a biológiai lebomlás kezdete és vége megállapításának lehetővé tételére. Automata respirométer alkalmazása esetén a mérés folyamatos. Más paramétereken kívül esetenként a DOC-ot is mérni kell, de ezt a mérést rendszerint csak a vizsgálat kezdetén és végén kell elvégezni. Specifikus kémiai elemzés is használható a vizsgált anyag elsődleges lebomlásának kiértékelésére és a képződött valamennyi közbenső anyag koncentrációjának meghatározására (kötelező a MITI-vizsgálatban).
A vizsgálat általában 28 napig tart. Azonban a vizsgálat befejezhető a 28. nap előtt, ha a biodegradációs görbe elért egy platót legalább három meghatározás során. A vizsgálatok 28 napon túlra is meghosszabbíthatók, amikor a biodegradációs görbe azt mutatja, hogy a biológiai lebomlás elkezdődött, de a plató (a vízszintes szakasz) elérése a 28. napig nem történt meg.
I.5. MINŐSÉGI KÖVETELMÉNYEK
I.5.1. Reprodukálhatóság
A biológiai lebomlás természete és az inokulumként használt baktériumpopulációk sokfélesége miatt a meghatározásokat legalább kétszer kell végrehajtani.
Általános tapasztalat, hogy minél nagyobb a vizsgált oldószerhez kezdetben hozzáadott mikroorganizmusok koncentrációja, annál kisebb lesz az ismétlések közötti eltérés (szórás). A körvizsgálatok azt is bemutatták, hogy nagy eltérések lehetnek a különböző laboratóriumok által nyert eredmények között, de általában megegyezés tapasztalható a biológiailag könnyen lebontható vegyületeknél.
I.5.2. A vizsgálat érvényessége
A vizsgálat akkor tekinthető érvényesnek, ha a vizsgálat végén vagy a „tíznapos ablak” végén, az adott esettől függően, a platónál a vizsgált kémiai anyag eltávolításakor a vizsgálat megismétlésével kapott értékek szélső értékeinek különbsége kisebb mint 20 %, és ha a referenciaanyag százalékos lebomlása 14 nap alatt elérte a könnyű biológiai lebonthatóság szintjét. Ha ezek közül a feltételek közül valamelyik nem teljesül, meg kell ismételni a vizsgálatot. A módszerek szigorúsága miatt az alacsony értékek nem jelentik szükségképpen azt, hogy a vizsgált anyag biológiailag nem lebontható a környezeti feltételek mellett, hanem azt jelzi, hogy további vizsgálatokra lesz szükség a biológiai lebonthatóság meghatározására.
Ha valamely toxicitási vizsgálatban, amely mind a vizsgált anyagot, mind a referenciaanyagot tartalmazza, 35 %-nál kisebb lebomlás (a DOC alapján) vagy 25 %-nál kisebb lebomlás (a ThOD vagy ThCO2 alapján) történt 14 nap alatt, a vizsgált kémiai anyagról feltételezhető, hogy annak gátló hatásai vannak (lásd a 4. függeléket is). A vizsgálatsorozatot meg kell ismételni, ha lehetséges, a vizsgált kémiai anyag kisebb koncentrációja és/vagy az inokulum nagyobb koncentrációja, de 30 mg szilárd anyag/liternél nem nagyobb koncentráció használatával.
I.6. ÁLTALÁNOS ELJÁRÁSOK ÉS ELŐKÉSZÜLETEK
A 2. táblázat foglalja össze a vizsgálatokra érvényes általános körülményeket. A kifejezetten az egyes vizsgálatokhoz tartozó készülékek és egyéb kísérleti körülmények leírása később, az adott vizsgálathoz tartozó címszó alatt olvasható.
2. táblázat:
Vizsgálati körülmények
|
Vizsgálat |
DOC-csökkenés |
CO2-fejlődés |
Manometrikus respirometria |
Mődositottt OECD-vizsgálat |
Zárt palack |
MITI (I) |
|||||||||
|
A vizsgálat anyag koncentracioja |
|
|
|
|
|
|
|||||||||
|
mg/l |
|
|
100 |
|
2-10 |
100 |
|||||||||
|
mg DOC/1 |
10-40 |
10-20 |
|
10-40 |
|
|
|||||||||
|
MG ThOD/1 |
|
|
50-100 |
|
5-10 |
|
|||||||||
|
Az inoklum koncentrációja (sejt/l, megközelítő érték |
≤ 30 mg/l SS vagy ≤ 100 ml kifolyó szennyvíz/liter (107 – 108) |
0,5 ml másodlagos szennyvíz/l (105) |
≤ 5 ml kifolyó szennyvíz/l (104 – 106) |
30 mg/l SS (107 - 108) |
|||||||||||
|
Elemek koncentrációja ásványi oldószerben (mg/l-ben) |
|
|
|
|
|
|
|||||||||
|
P |
116 |
11,6 |
29 |
||||||||||||
|
N |
1,3 |
0,13 |
1,3 |
||||||||||||
|
Na |
86 |
8,6 |
17,2 |
||||||||||||
|
K |
122 |
12,2 |
36,5 |
||||||||||||
|
Mg |
2,2 |
2,2 |
6,6 |
||||||||||||
|
Ca |
9,9 |
9,9 |
29,7 |
||||||||||||
|
Fe |
0,05-0,1 |
0,05-0,1 |
0,15 |
||||||||||||
|
pH |
7,4±0,2 |
Lehetőleg 7,0 |
|||||||||||||
|
Hőmérséklett |
22 ± 2 oC |
25 ± 1 oC |
|||||||||||||
|
|
|
|||||||||||||
I.6.1. Hígítóvíz
Toxikus anyagok (például Cu++ ionok) gátló hatással járó koncentrációitól mentes ioncserélt vagy desztillált vizet kell használni. E víznek nem szabad a vizsgált anyag által bevitt szerves széntartalom 10 %-ánál többet tartalmaznia. A vizsgált víz nagy tisztaságára a nagy vakpróbaértékek kiküszöböléséhez van szükség. A szennyeződés származhat a saját szennyeződésekből, valamint az ioncserélő műgyantákból és a baktériumból vagy algából származó roncsolt anyagból is. Minden egyes vizsgálatsorozathoz csak egyetlen adag vizet kell használni, amelyet előzőleg DOC-elemzéssel kell ellenőrizni. Ilyen ellenőrzésre nincs szükség a zárt palack vizsgálathoz, de a víz oxigénfogyasztásának alacsonynak kell lennie.
I.6.2. Az ásványianyag-tápoldat törzsoldatai
A vizsgált oldatok elkészítéséhez megfelelő koncentrációjú ásványianyag-tápoldatokat tartalmazó törzsoldatokat kell készíteni. A következő törzsoldatok használhatók (különböző hígítási arányokkal) a DOC-csökkenés, a módosított OECD, a CO2-fejlődési, a manometrikus respirometriás és a zártpalackos vizsgálati módszerekhez.
A hígítási arányok és a MITI-vizsgálat során alkalmazandó ásványianyag-tápoldat elkészítése az adott vizsgálatok leírásában olvasható.
Törzsoldatok:
A következő törzsoldatokat kell elkészíteni analitikai tisztaságú reagensek segítségével.
|
a) |
Kálium-dihidrogén-foszfát, KH2PO4 |
8,50g |
|
Dikálium-hidrogén-foszfát, K2HPO4 |
21,75g |
|
|
Dinátrium-hidrogén-foszfát-dihidrát, Na2HPO4. 2 H2O |
33,40g |
|
|
Ammónium-klorid, NH4Cl |
0,50g |
|
|
Ezen anyagokat fel kell oldani vízben, és kiegészíteni 1 literre. Az oldat pH-jának 7,4-nek kell lennie. |
|
|
|
b) |
Kalcium-klorid, vízmentes, CaCl2 |
27,50g |
|
or vagy kalcium-klorid-dihidrát, CaCl2 ·2 H2O |
36,40g |
|
|
Ezen anyagokat fel kell oldani vízben, és kiegészíteni 1 literre. |
|
|
|
c) |
Magnézium-szulfát-heptahidrát, MgSO4. 7 H2O |
22,50g |
|
Ezt az anyagot fel kell oldani vízben, és kiegészíteni 1 literre. |
|
|
|
d) |
Vas(III)-klorid-hexahidrát, FeCl3. 6H2O |
0,25g |
|
Ezt az anyagot fel kell oldani vízben, és kiegészíteni 1 literre. |
|
Megjegyzés: azért, hogy ne kelljen közvetlenül a használat előtt előkészíteni ezen oldatot, hozzá kell adni literenként egy csepp tömény HCl-ot vagy 0,4 gramm etilén-diamin-tetra-ecetsav-dinátrium-sót (EDTA).
I.6.3. Kémiai anyagok törzsoldatai
Ha az oldhatóság túllépi az 1 g/litert, akkor fel kell oldani szükség szerint 1–10 gramm vizsgált vagy referenciaanyagot ioncserélt vízben, és ezt ki kell egészíteni 1 literre. Egyébként a törzsoldatokat ásványianyag-tápoldatban kell elkészíteni, vagy közvetlenül az ásványianyag-tápoldathoz kell hozzáadni a vizsgált anyagot. A kevésbé oldható kémiai anyagok kezelésének módját a 3. függelék tartalmazza, de a MITI-vizsgálat (C.4-F. módszer) esetében sem oldószereket, sem pedig emulgálószereket nem kell használni.
I.6.4. Inokulum
Az inokulum különféle forrásokból származhat: lehet eleveniszap, szennyvíztisztítóból kifolyt víz (nem klórozott), felszíni víz és talaj, vagy ezek vegyesen. A DOC-csökkenés, a CO2-fejlődés és a manometrikus respirometriás vizsgálatok esetében, ha eleveniszapot használnak, azt döntően háztartási szennyvizet befogadó szennyvíztisztító telepből vagy egységből kell venni. Más forrásokból származó inokulumokkal kapcsolatban bebizonyosodott, hogy ezek az eredmények nagyobb szórását adják. A módosított OECD- és a zártpalack-vizsgálat esetében több hígított inokulumra van szükség, iszappehely nélkül, és az előnyben részesített forrás a háztartási szennyvizet feldolgozó szennyvíztisztító telepből vagy egységből származó szennyvíz. A MITI-vizsgálathoz az inokulum több forrásból származik, ezek ismertetése e vizsgálat leírásában olvasható.
I.6.4.1. Eleveniszapból származó inokulum
Az eleveniszap-mintát frissen kell összegyűjteni valamely, döntő részben háztartási szennyvizet feldolgozó szennyvíztisztító telep vagy egység levegőztetőtartályából. Ha szükséges, el kell távolítani a durva részecskéket azáltal, hogy finom szűrőn keresztül szűrik át a vizsgált mintát, ezután aerob módon kell tárolni az iszapot.
Másik szóba jöhető megoldás: a durva részecskék eltávolítása után az iszapot ülepíteni vagy centrifugálni kell (például 1 100 g mellett 10 percen át). A felülúszó folyadékot el kell távolítani. Az iszap mosható ásványianyag-tápoldatban. A koncentrált iszapot az ásványianyag-tápoldatban kell szuszpendáltatni, a 3–5 gramm szuszpendált szilárd anyag/liter koncentráció elérése érdekében, majd levegőztetni kell, amíg szükséges.
Az iszapot megfelelően működő hagyományos üzemből kell venni. Ha az iszapot nagysebességű szennyvíztisztító telepről kell begyűjteni, vagy az vélhetően tartalmaz gátlószereket, mosni kell az iszapot. Alapos keverés után le kell ülepíteni vagy centrifugálni kell az újraszuszpendált iszapot, el kell távolítani a felülúszó folyadékot, és újra kell szuszpendáltatni a mosott iszapot további ásványianyag-tápoldatban. Ezt az eljárást addig kell ismételni, amíg az iszap többlet szubsztráttól vagy gátlószertől mentesnek nem tekinthető.
A teljes újraszuszpendálódás elérése után, vagy nem kezelt iszap esetében közvetlenül a használat előtt kell mintát venni a szuszpendált szilárd részecskék száraz tömegének meghatározására.
További alternatíva az eleveniszap homogenizálása (3–5 gramm szuszpendált szilárd anyag/liter). Az iszapot mechanikus keverőgépben 2 percen át közepes fordulatszámmal kell keverni. Le kell ülepíteni a megkevert iszapot 30 percig, vagy ha szükséges, hosszabb ideig, és le kell szűrni a folyadékot 10 ml/l ásványianyag-tápoldatot tartalmazó inokulumként való használatra.
I.6.4.2. Egyéb inokulumforrások
E források döntően háztartási szennyvizet feldolgozó szennyvíztisztító telep vagy egység másodlagos kezelt szennyvízéből származhatnak. Friss mintákat kell gyűjteni, és azokat levegővel érintkezve tartani a szállítás során. A mintákat 1 órán át kell ülepedni hagyni, vagy durva szűrőpapíron át kell szűrni, a leszűrt kezelt szennyvizet vagy filtrátumot levegővel érintkezve kell tartani. Ásványianyag-tápoldat literenként legfeljebb 100 ml ilyen típusú inokulum használható.
További inokulumforrás a felszíni víz. Ebben az esetben megfelelő felszíni vízmintát kell begyűjteni, például folyóból, tóból, és a felhasználásig levegővel érintkezve kell tartani. Ha szükséges, az inokulumot szűréssel vagy centrifugálással lehet sűríteni.
I.6.5. Az inokulum előkondicionálása
Az inokulum előkondícionálható a kísérleti körülményekhez, de nem adaptálható előre a vizsgált anyaghoz. Az előkondicionálás az eleveniszapnak ásványianyag-tápoldatban vagy másodlagos szennyvízben 5–7 napon keresztüli, a vizsgálati hőmérsékleten végrehajtott levegőztetéséből áll. Az előkondicionálás esetenként javítja a vizsgálati módszerek pontosságát a vakpróba értékek csökkentésével. Szükségtelennek tekinthető a MITI-inokulum előkondicionálása.
I.6.6. Abiotikus kontrollok
Amikor szükséges, ellenőrizni kell a vizsgált anyag esetleges abiotikus lebomlását inokulumot nem tartalmazó, steril kontrollokban a DOC-csökkenés, oxigénfelvétel vagy szén-dioxid-fejlődés meghatározásával. A sterilizáció membránszűrés útján (0,2 – 0,45 mikrométer) vagy megfelelő koncentrációjú, alkalmas toxikus anyag hozzáadásával történik. Ha membránszűrést alkalmaznak, aszeptikusan kell mintákat venni a steril körülmények megőrzése érdekében. Ha előzőleg még nem zártuk ki a vizsgált anyag adszorpcióját, akkor azon vizsgálatoknak, amelyek a DOC csökkenéseként mérik a biológiai lebomlást, különösen eleveniszap inokulummal, tartalmazniuk kell beoltott és toxikus anyagot tartalmazó abiotikus kontrollt.
I.6.7. A lombikok száma
Az egyes vizsgálatsorozatokban használandó lombikok számát az egyes vizsgálatok leírásai ismertetik.
A következő típusú lombikokat kell használni:
|
— |
vizsgált szuszpenzió: vizsgált anyagot és inokulumot tartalmaz, |
|
— |
inokulum-vakpróba: csak inokulumot tartalmaz, |
|
— |
eljáráskontroll: referenciaanyagot és inokulumot tartalmaz, |
|
— |
abiotikus steril kontroll: steril, csak vizsgált anyagot tartalmaz (lásd az I.6.6. pontot), |
|
— |
adszorpciós kontroll: vizsgált anyagot, inokulumot és sterilizáló szert tartalmaz, |
|
— |
toxicitáskontroll: vizsgált anyagot, referenciaanyagot és inokulumot tartalmaz. |
A vizsgált szuszpenzióban és az inokulum-vakpróbában a meghatározásnak feltétlenül egyidejűleg kell történnie. A többi lombikban is ajánlott egyidejűleg elvégezni a meghatározásokat.
Ez azonban nem mindig lehetséges. Gondoskodni kell arról, hogy elegendő minta vagy mért érték álljon rendelkezésre a „tíznapos ablakban” a százalékos csökkenés kiértékelésének lehetővé tételére.
I.7. ADATOK ÉS KIÉRTÉKELÉS
A Dt (százalékos lebomlás) számításához mind a vizsgálati tartályokban, mind az inokulum-vakpróbában a paraméter kétszeri mérésének átlagát kell használni. A képleteket a későbbiekben ismertetett, az egyes vizsgálatokkal foglalkozó szakaszok tartalmazzák. A lebomlás folyamata grafikus ábrázolásban látható, és bemutatásra kerül a „tíznapos ablak”. Ki kell számítani és megadni a jelentésben a „tíznapos ablak” végén, a platónál vagy a vizsgálat végén elért százalékos csökkenés mértékét, az adott esetnek megfelelően.
A respirometriás vizsgálatokban a nitrogéntartalmú vegyületek a nitrifikáció miatt hatással lehetnek az oxigénfelvételre (lásd a 2. és 5. függeléket).
I.7.1. DOC-meghatározás segítségével mért lebomlás
A Dt százalékos lebomlást minden alkalommal, amikor mintavétel történt, külön kell kiszámítani a vizsgált anyagot tartalmazó lombikokhoz a kettős DOC-mérések átlagértékeit használva, hogy megítélhető legyen a vizsgálat érvényessége (lásd az I.5.2. pontot). A következő egyenlet szolgál ennek kiszámítására:
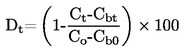
ahol:
|
Dt |
= |
százalékos lebomlás a t időpontban, |
|
Go |
= |
a beoltott, a vizsgált anyagot tartalmazó ásványianyag-tápoldatban a DOC-koncentrációk kezdeti átlagértéke (mg DOC/l), |
|
Ct |
= |
a beoltott, a vizsgált anyagot tartalmazó ásványianyag-tápoldatban a DOC-koncentrációk átlagértéke t időpontban (mg DOC/l), |
|
Cbo |
= |
a vakpróba beoltott ásványianyag-tápoldatban a DOC-koncentrációk kezdeti átlagértéke (mg DOC/l), |
|
Cbt |
= |
a vakpróba beoltott ásványianyag-tápoldatban a DOC-koncentrációk átlagértéke t időpontban (mg DOC/1). |
Minden koncentráció mérése kísérleti úton történik.
I.7.2. Specifikus analízis segítségével mért lebomlás
Amikor rendelkezésre állnak specifikus analitikai adatok, a következő képletből lehet kiszámítani az elsődleges biológiai lebomlást:
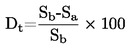
ahol:
|
Dt |
= |
% lebomlás t időpontban, általában a 28. napon, |
|
Sa |
= |
a vizsgált anyag maradékmennyisége a vizsgálat végén a beoltott közegben, (mg), |
|
Sb |
= |
a vizsgált anyag maradékmennyisége a vakpróbában olyan vízzel/táptalajjal végrehajtott vizsgálat után, amelyhez csak a vizsgált anyagot adtuk hozzá (mg). |
I.7.3. Abiotikus lebomlás
Abiotikus steril kontroll használatakor a következő képlet segítségével kell kiszámítani a százalékos abiotikus bomlást.
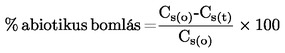
ahol:
|
Cs(o) |
= |
DOC-koncentráció a steril kontrollban a 0. napon |
|
C s(t) |
= |
DOC-koncentráció a steril kontrollban a t-dik napon |
I.8. JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a vizsgált és referenciaanyagokat és azok tisztaságát, |
|
— |
a vizsgálati körülményeket, |
|
— |
az inokulumot: minősége és a mintavétel helyszíne(i), koncentrációja és minden előkondícionáló kezelés, |
|
— |
a szennyvízben jelen lévő ipari hulladék arányát és minőségét, ha ismert, |
|
— |
a vizsgálati időtartamot és hőmérsékletet, |
|
— |
rosszul oldható vizsgált anyagok esetében a végrehajtott kezelést, |
|
— |
az alkalmazott vizsgálati módszert: az eljárás minden változtatását tudományosan meg kell indokolni, |
|
— |
az adatlapot, |
|
— |
minden megfigyelt gátlási jelenséget, |
|
— |
minden megfigyelt abiotikus lebomlást, |
|
— |
specifikus analitikai adatokat, ha rendelkezésre állnak, |
|
— |
köztes anyagok analitikai adatait, ha rendelkezésre állnak, |
|
— |
a százalékos lebomlásnak az idő függvényében ábrázolt görbéjét a vizsgált és referenciaanyagokhoz elkészítve; a lappangási fázist, lebomlási fázist, tíznapos ablakot és a meredekséget világosan jelezni kell (1. függelék). Ha a vizsgálat megfelelt az érvényességi követelményeknek, a vizsgált anyagot tartalmazó lombikok lebomlási százalékainak átlagértéke használható a görbe elkészítéséhez, |
|
— |
a százalékos csökkenést a „tíznapos ablak” után és a platón vagy a vizsgálat végén. |
II. RÉSZ DOC (OLDOTT SZERVES SZÉN) CSÖKKENÉSÉNEK VIZSGÁLATA (C.4-A. Módszer)
II.1. A VIZSGÁLATI MÓDSZER ELVE
Egyetlen szervesszén-forrásként a vizsgált anyag ismert koncentrációját (10–40 mg DOC/l) tartalmazó, beoltott ásványianyag-tápoldat mért mennyiségét sötétben vagy szórt fényben 22 ± 2 oC hőmérsékleten kell levegőztetni.
A lebomlást 28 napos időtartam során gyakori időközönként végrehajtott DOC-elemzés követi. A biológiai lebomlás mértékét a DOC-koncentrációjának csökkenéséből (az inokulum-vakpróba figyelembevételével) a kezdetben jelen lévő koncentráció százalékában kell kiszámítani. Az elsődleges biológiai lebomlás mértéke az inkubációs periódus kezdetén és végén végrehajtott kiegészítő kémiai analízisből is kiszámítható.
II.2. A VIZSGÁLATI MÓDSZER LEÍRÁSA
II.2.1. Készülék
|
a) |
Kúpos lombikok, például 250 ml-től 2 l-ig, a DOC-analízishez szükséges térfogattól függően; |
|
b) |
kúpos lombikok fogadására alkalmas rázógép, amelyet vagy termosztáttal kell felszerelni, vagy klimatizált helyiségben kell használni; követelmény, hogy az aerob állapotok minden lombikban fenntarthatók legyenek; |
|
c) |
szűrőkészülék, alkalmas membránokkal; |
|
d) |
DOC-analizátor; |
|
e) |
oldott oxigén meghatározására szolgáló készülék; |
|
f) |
centrifuga. |
II.2.2. Ásványianyag-tápoldat előkészítése
A törzsoldatok elkészítését lásd az I.6.2. pontban.
10 ml (a) oldatot 800 ml hígítóvízzel kell összekeverni, 1 ml (b)–(d) oldatot kell hozzáadni, majd 1 literre hígítóvízzel kiegészíteni.
II.2.3. Inokulum előkészítése és előkondicionálása
Az inokulum különféle forrásokból származhat: lehet eleveniszap, szennyvíztisztítóból kifolyt víz, felszíni víz és talaj vagy ezek vegyesen.
Lásd az I.6.4., I.6.4.1., I.6.4.2. és I.6.5. pontot.
II.2.4. A lombikok előkészítése
Példa: 800 ml-es adagokban 2 literes kúpos lombikokba ásványianyag-tápoldatot kell bevinni, ezekhez a vizsgált és referenciaoldatok törzsoldataiból elegendő mennyiséget kell hozzáadni úgy, hogy 10–40 mg DOC/l-rel egyenlő koncentrációt kapjanak. A pH-értéket ellenőrizni kell, és ha szükséges, 7,4-re kell beállítani. A lombikokat eleveniszappal vagy más forrásból származó inokulummal kell beoltani (lásd az I.6.4. pontot) úgy, hogy 30 mg szuszpendált szilárd anyag/liternél nem nagyobb végleges koncentrációt kapjanak. Ezenkívül inokulumkontrollokat kell készíteni ásványianyag-tápoldatban, vizsgált vagy referenciaanyagok nélkül.
Ha szükséges, használni lehet egy tartályt a vizsgált anyag lehetséges gátló hatásának ellenőrzésére olyan oldat oltásával, amely az ásványianyag-tápoldatban, mind a vizsgált, mind valamely referenciaanyag hasonló koncentrációit tartalmazza.
Ezenkívül, ha szükséges, egy további, steril lombik is alkalmazható az anyag nem beoltott oldatának segítségével annak ellenőrzésére, hogy lebomlott-e abiotikusan a vizsgált anyag (lásd az I.6.6. pontot).
Ha a vizsgált anyagról gyanítható, hogy jelentős mértékben adszorbeálódik az üvegen, iszapban stb., akkor előzetes vizsgálatot kell végezni az adszorpció valószínű mértékének és a kísérlet alkalmasságának meghatározására (lásd az 1. táblázatot). Elő kell készíteni egy, a vizsgált anyagot, inokulumot és sterilizálószert tartalmazó lombikot.
Minden lombikban ki kell pótolni a térfogatot 1 literre ásványianyag-tápoldattal, és keverés után mintát kell venni mindegyikből a DOC kezdeti koncentrációjának meghatározására (lásd a 2. függelék 4. pontját). Le kell fedni a lombikok nyílását például alufóliával úgy, hogy szabad légcsere jöhessen létre a lombik és a környezete között. Ezután a lombikokat rázógépbe kell helyezni, és el kell kezdeni a vizsgálatot.
II.2.5. Lombikok száma egy tipikus vizsgálatsorozatban
1. és 2. lombik: vizsgált szuszpenzió
3. és 4. lombik: inokulum-vakpróba
5. lombik: eljáráskontroll
Ajánlott és amikor szükséges:
6. lombik: abiotikus steril kontroll
7. lombik: adszorpciós kontroll
8. lombik: toxicitáskontroll
Lásd még az I.6.7. pontot is.
II.2.6. A kísérlet végrehajtása
A kísérlet során mindvégig kétszer kell meghatározni a DOC koncentrációit minden egyes lombikban olyan ismert időközönként, amely elegendően gyakori meghatározást biztosít ahhoz, hogy megállapítható legyen a „tíznapos ablak” kezdete és a százalékos csökkenés a „tíznapos ablak” végén. A vizsgált szuszpenzióból csak az egyes meghatározásokhoz szükséges minimális mennyiséget kell kivenni.
Mintavétel előtt, ha szükséges, a lombikokban pótolni kell az elpárolgott veszteséget, megfelelő mennyiségű hígítóvíz (I.6.1.) hozzáadásával. Az ásványianyag-tápoldatot alaposan meg kell keverni a mintavétel előtt, és gondoskodni kell arról, hogy a tartályok falához hozzátapadt anyag mintavétel előtt feloldódjon vagy szuszpendálódjon. Közvetlenül a mintavétel végrehajtása után szűrésre van szükség membránszűrővel vagy centrifugálással (lásd a 2. függelék 4. pontját). A szűrt vagy centrifugált mintákat még ugyanazon a napon kell analizálni, ellenkező esetben 2–4 oC hőmérsékleten kell tárolni maximum 48 órán át vagy –18 oC alatti hőmérsékleten hosszabb időtartamig.
II.3. ADATOK ÉS JELENTÉS
II.3.1. Az eredmények kiértékelése
Ki kell számítani a százalékos lebomlást a t időpontban az 1.7.1. (DOC-meghatározás), és választható módon az 1.7.2. (specifikus analízis) pontban megadottaknak megfelelően.
Minden eredményt fel kell jegyezni a megadott adatlapokon.
II.3.2. Az eredmények érvényessége
Lásd az I.5.2. pontot.
II.3.3. Vizsgálati jelentés
Lásd az I.8. pontot.
II.4. ADATLAP
Példa az adatlapra.
DOC-CSÖKKENÉS VIZSGÁLATA
|
1. |
LABORATÓRIUM |
|
2. |
A VIZSGÁLAT KEZDETÉNEK DÁTUMA |
3. VIZSGÁLT ANYAG
Név:
Törzsoldat-koncentráció: … mg/l, az anyagra vonatkoztatva
Kezdeti koncentráció a közegben, t0: … mg/l az anyagra vonatkoztatva
4. INOKULUM
Forrás:
Végrehajtott kezelés:
Előkondicionálás, ha van ilyen:
Szuszpendált szilárd anyagok koncentrációja a reakciókeverékben: … mg/l
5. SZÉNANALÍZIS
Szénanalizátor:
|
|
Lombik száma |
|
DOC n nap után (mg/l) |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Vizsgált kémiai anyag + inokulum |
1 |
a1 |
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a, átlag Ca(t) |
|
|
|
|
|
||
|
2 |
b1 |
|
|
|
|
|
|
|
b2 |
|
|
|
|
|
||
|
b, átlag Cb(t) |
|
|
|
|
|
||
|
Vakpróba-inokulum vizsgált anyag nélkül |
3 |
c1 |
|
|
|
|
|
|
c2 |
|
|
|
|
|
||
|
c, átlag Cc(t) |
|
|
|
|
|
||
|
4 |
d1 |
|
|
|
|
|
|
|
d2 |
|
|
|
|
|
||
|
d, átlag Cd(t) |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
6. ALAPADATOK KIÉRTÉKELÉSE
|
Lombik száma |
|
% lebomlás n nap után |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
||
|
1 |
|
0 |
|
|
|
|
|
2 |
|
0 |
|
|
|
|
|
Átlag (3) |
|
0 |
|
|
|
|
Megjegyzés: hasonló adatlapok használhatók a referenciaanyagokhoz és a toxicitáskontrollokhoz is.
7. ABIOTIKUS KONTROLL (választható)
|
|
Idő (nap) |
|
|
0 |
t |
|
|
DOC-koncentráció (mg/l) steril kontrollban |
Cs(o) |
Cs(t) |

8. SPECIFIKUS ANALÍZIS (választható)
|
|
A vizsgált kémiaianyag-maradék mennyisége a vizsgálat végén (mg/l) |
% elsődleges lebomlás |
|
Steril kontroll |
Sb |
|
|
Beoltott vizsgált közeg |
Sa |
|
III. RÉSZ MÓDOSÍTOTT OECD-VIZSGÁLAT (DOC-CSÖKKENÉS) (C.4-B. Módszer)
III.1. A VIZSGÁLATI MÓDSZER ELVE
Egyetlen szerves szénforrásként a vizsgált anyag ismert koncentrációját (10–40 mg DOC/l) tartalmazó beoltott ásványi oldószer mért mennyiségét sötétben vagy szórt fényben 22 ± 2 oC hőmérsékleten kell levegőztetni.
A lebomlást egy 28 napos időtartam során gyakori időközönként végrehajtott DOC-elemzés követi. A biológiai lebomlás mértékét a DOC koncentrációjának csökkenéséből, (az inokulum-vakpróba figyelembevételével) a kezdetben jelen lévő koncentráció százalékában kell kiszámítani. Az elsődleges biológiai lebomlás mértéke az inkubációs periódus kezdetén és végén végrehajtott kiegészítő kémiai analízisből is kiszámítható.
III.2. A VIZSGÁLATI MÓDSZER LEÍRÁSA
III.2.1. Készülék
|
a) |
Kúpos lombikok, például 250 ml-től 2 l-ig, a DOC-analízishez szükséges térfogattól függően; |
|
b) |
rázógép a kúpos lombikok behelyezésére, amelyet vagy termosztáttal kell felszerelni, vagy klimatizált helyiségben kell használni, követelmény, hogy az aerob állapotok minden lombikban fenntarthatók legyenek; |
|
c) |
szűrőkészülék, alkalmas membránokkal; |
|
d) |
DOC-analizátor; |
|
e) |
oldott oxigén meghatározására szolgáló készülék; |
|
f) |
centrifuga. |
III.2.2. Ásványianyag-tápoldat előkészítése
A törzsoldatok elkészítését lásd az I.6.2. pontban.
10 ml (a) oldatot 800 ml hígítóvízzel kell összekeverni, 1 ml (b)–(d) oldatot kell hozzáadni, majd 1 literre hígítóvízzel kiegészíteni.
E módszer literenként csak 0,5 ml kezelt szennyvizet használ inokulumként, ezért lehetséges, hogy meg kell erősíteni a közeget nyomelemekkel és növekedési faktorokkal. Ez a következő oldatok mindegyikéből 1 ml hozzáadásával történik 1 liter végső közeghez:
Nyomelemoldat:
|
Mangán-szulfát-tetrahidrát, MnSO4. 4H2O |
39,9 mg |
|
Borsav, H3BO3 |
57,2 mg |
|
Cink-szulfát-heptahidrát, ZnSO4. 7H2O |
42,8 mg |
|
Ammónium-heptamolibdát (NH4)6 Mo7O24 |
34,7 mg |
|
Fe-keLát (FeC13 etiléndiamin-tetra-ecetsav) |
100,0 mg |
|
Ezen anyagokat fel kell oldani, és kipótolni 1 000 ml-re hígítóvízzel |
|
|
Vitaminoldat: |
|
|
Élesztőkivonat |
15,0 mg |
Az élesztőkivonatot fel kell oldani 100 ml vízben. Sterilizálni kell 0,2 mikrométer pórusméretű membránon keresztülvezetve, vagy frissen kell elkészíteni.
III.2.3. Inokulum előkészítése és előkondicionálása
Az inokulum döntően háztartási szennyvizet feldolgozó szennyvíztisztító telep vagy egység másodlagos, kezelt szennyvízéből származik. Lásd az I.6.4.2. és az I.6.5. pontot.
A felhasznált mennyiség 0,5 ml/liter ásványianyag-tápoldat.
III.2.4. A lombikok előkészítése
Példa: 800 ml-es adagokban 2 literes kúpos lombikokba ásványianyag-tápoldatot kell bevinni, ezekhez a vizsgált- és referenciaoldatok törzsoldataiból elegendő mennyiséget kell hozzáadni úgy, hogy 10–40 mg DOC/l-rel egyenlő koncentrációt kapjanak. Ellenőrizni kell a pH-értéket, és ha szükséges, 7,4-re kell beállítani. A lombikokat kezelt szennyvízzel kell beoltani (lásd az I.6.4.2. pontot) 0,5 ml/l koncentráció mellett.
Ezenkívül inokulumkontrollokat kell készíteni ásványianyag-tápoldatban, vizsgált- vagy referenciaanyagok nélkül.
Ha szükséges, használni lehet egy tartályt a vizsgált kémiai anyag lehetséges gátló hatásának ellenőrzésére olyan oldat oltásával, amely az ásványi közegben, mind a vizsgált, mind valamely referenciaanyag hasonló koncentrációit tartalmazza. Ezenkívül, ha szükséges, egy további, steril lombik is alkalmazható az anyag nem beoltott oldatának segítségével annak ellenőrzésére, hogy lebomlott-e abiotikusan a vizsgált anyag (lásd az I.6.6. pontot).
Ha a vizsgált anyagról gyanítható, hogy jelentős mértékben adszorbeálódik az üvegen, iszapban stb., akkor előzetes vizsgálatot kell végezni az adszorpció valószínű mértékének és a kísérlet alkalmasságának meghatározására (lásd az 1. táblázatot). Elő kell készíteni egy, a vizsgált anyagot, inokulumot és sterilizálószert tartalmazó lombikot.
Minden lombikban ki kell pótolni a térfogatot 1 literre ásványianyag-tápoldattal, és a keverés után mintát kell venni minden egyes lombikból a DOC kezdeti koncentrációjának meghatározására (lásd a 2. függelék 4. pontját). Le kell fedni a lombikok nyílását például alufóliával úgy, hogy szabad légcsere jöhessen létre a lombik és a környezete között. Ezután a lombikokat rázógépbe kell helyezni, és el kell kezdeni a vizsgálatot.
III.2.5. A lombikok száma egy tipikus vizsgálatsorozatban
1. és 2. lombik: vizsgált szuszpenzió
3. és 4. lombik: inokulum-vakpróba
5. lombik: eljáráskontroll
Ajánlott és amikor szükséges:
6. lombik: abiotikus steril kontroll
7. lombik: adszorpciós kontroll
8. lombik: toxicitáskontroll
Lásd még az I.6.7. pontot is.
III.2.6. A vizsgálat végrehajtása
A vizsgálat során mindvégig kétszer kell meghatározni a DOC koncentrációit minden egyes lombikban olyan ismert időközönként, amely elegendően gyakori meghatározást biztosít ahhoz, hogy megállapítható legyen a „tíznapos ablak” kezdete és a százalékos csökkenés a „tíznapos ablak” végén. A vizsgált szuszpenzióból csak az egyes meghatározásokhoz szükséges minimális mennyiséget kell kivenni.
Mintavétel előtt, ha szükséges, a lombikokban pótolni kell az elpárolgott veszteséget megfelelő mennyiségű hígítóvíz (1.6.1.) hozzáadásával. Az ásványianyag-tápoldatot alaposan meg kell keverni a mintavétel előtt, és gondoskodni kell arról, hogy a tartályok falához hozzátapadt anyag mintavétel előtt feloldódjon vagy szuszpendálódjon. Közvetlenül a mintavétel végrehajtása után szűrésre van szükség membránszűrővel vagy centrifugálással (lásd a 2. függelék 4. pontját). A szűrt vagy centrifugált mintákat még ugyanazon a napon kell analizálni, ellenkező esetben 2–4 oC hőmérsékleten kell azt tárolni maximum 48 órán át vagy –18 oC alatti hőmérsékleten hosszabb időtartamig.
III.3. ADATOK ÉS JELENTÉS
III.3.1. Az eredmények kiértékelése
Ki kell számítani a százalékos lebomlást a t időpontban az I.7.1. (DOC meghatározás), és választható módon az I.7.2. (specifikus analízis) pontban megadottaknak megfelelően.
Minden eredményt fel kell jegyezni a megadott adatlapokon.
III.3.2. Az eredmények érvényessége
Lásd az I.5.2. pontot.
III.3.3. Vizsgálati jelentés
Lásd az I.8. pontot.
III.4. ADATLAP
Példa az adatlapra.
MÓDOSÍTOTT OECD-VIZSGÁLAT
|
1. |
LABORATÓRIUM |
|
2. |
A VIZSGÁLAT KEZDETÉNEK DÁTUMA |
3. VIZSGÁLT ANYAG
Név:
Törzsoldat-koncentráció: … mg/l, az anyagra vonatkoztatva
Kezdeti koncentráció a médiumban: … mg/l az anyagra vonatkoztatva
4. INOKULUM
Forrás:
Végrehajtott kezelés:
Előkondicionálás, ha van ilyen:
Szuszpendált szilárd anyagok koncentrációja a reakciókeverékben: … mg/l
5. SZÉNANALÍZIS
Szénanalizátor:
|
|
Lombik száma |
|
DOC n nap után (mg/l) |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
|||
|
Vizsgált kémiai anyag + inokulum |
1 |
a1 |
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a, átlag Ca(t) |
|
|
|
|
|
||
|
2 |
b1 |
|
|
|
|
|
|
|
b2 |
|
|
|
|
|
||
|
b, átlag Cb(t) |
|
|
|
|
|
||
|
Vakpróba-inokulum vizsgált anyag nélkül |
3 |
c1 |
|
|
|
|
|
|
c2 |
|
|
|
|
|
||
|
c, átlag Cc(t) |
|
|
|
|
|
||
|
4 |
d1 |
|
|
|
|
|
|
|
d2 |
|
|
|
|
|
||
|
d, átlag Cd(t) |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
6. ALAPADATOK KIÉRTÉKELÉSE
|
Lombik száma |
|
% lebomlás n nap után |
||||
|
0 |
n1 |
n2 |
n3 |
nx |
||
|
1 |
|
0 |
|
|
|
|
|
2 |
|
0 |
|
|
|
|
|
Átlag (4) |
|
0 |
|
|
|
|
Megjegyzés: hasonló adatlapok használhatók a referenciaanyagokhoz és a toxicitáskontrollokhoz is.
7. ABIOTIKUS KONTROLL (választható)
|
|
Idő (nap) |
|
|
0 |
t |
|
|
DOC-koncentráció (mg/l) steril kontrollban |
Cs(o) |
Cs(t) |

8. SPECIFIKUS ANALÍZIS (választható)
|
|
A vizsgált kémiaianyag-maradék mennyisége a vizsgálat végén (mg/l) |
% elsődleges lebomlás |
|
Steril kontroll |
Sb |
|
|
Beoltott vizsgált közeg |
Sa |
|
IV. RÉSZ CO2-FEJLŐDÉS-VIZSGÁLAT (C.4-C. módszer)
IV.l. A VIZSGÁLATI MÓDSZER ELVE
Kizárólagos szerves szénforrásként a vizsgált anyag ismert koncentrációját (10–20 mg DOC vagy TOC/l) tartalmazó, definiált térfogatú beoltott ásványianyag-tápoldatot szabályozott átfolyási sebesség mellett, szén-dioxid-mentes levegő átvezetésével, sötétben vagy szórt fényben levegőztetni kell. A lebomlást 28 napon át kell követni a termelt szén-dioxid meghatározásával, amelyet bárium- vagy nátrium-hidroxidban kell elnyeletni, és amelyet a maradék hidroxid titrálásával vagy szervetlen szénként kell mérni. A vizsgált anyagból előállított szén-dioxid-mennyiséget (a vakpróba-inokulumból származó mennyiség figyelembevételével helyesbítve) a ThCO2 százalékaként kell kifejezni. A biológiai lebomlás mértéke az inkubációs periódus kezdetén és végén végrehajtott kiegészítő DOC-analízisből is kiszámítható.
IV.2. A VIZSGÁLATI MÓDSZER LEÍRÁSA
IV.2.1. Készülék
|
a) |
2–5 literes lombikok, mindegyik egy, csaknem a tartály aljáig érő levegőztető csővel, és egy kivezető nyílással ellátva; |
|
b) |
mágneses keverők, a rosszul oldódó kémiai anyagok kiértékelésekor; |
|
c) |
gázabszorpciós üvegek; |
|
d) |
a légáram szabályozására és mérésére szolgáló készülék; |
|
e) |
szén-dioxid kivonására alkalmas berendezés a szén-dioxid-mentes levegő elkészítéséhez; más lehetőségként gázpalackokból származó CO2-mentes oxigén és CO2-mentes nitrogén keveréke használható a megfelelő arányokban (20 % O2: 80 % N2); |
|
f) |
készülék a szén-dioxid meghatározására, vagy titrimetriás méréshez vagy szervetlenszén-analízishez; |
|
g) |
membránszűrő készülék (választható); |
|
h) |
DOC-analizátor. |
IV.2.2. Ásványianyag-tápoldat előkészítése
A törzsoldatok elkészítését lásd az I.6.2. pontban.
10 ml (a) oldatot 800 ml hígítóvízzel kell összekeverni, 1 ml (b)–(d) oldatot kell hozzáadni, majd 1 literre hígítóvízzel kiegészíteni.
IV.2.3. Inokulum előkészítése és előkondicionálása
Az inokulum különböző forrásokból szerezhető be: lehet eleveniszap; kezelt szennyvíz; felszíni víz; talaj vagy ezek vegyesen.
Lásd az I.6.4., I.6.4.1., I.6.4.2. és I.6.5. pontot.
IV.2.4. A lombikok előkészítése
A következő térfogatok és tömegek jelzik a 3 liter szuszpenziót tartalmazó 5 literes lombikokhoz tartozó értékeket. Ennél kisebb térfogatú lombikok használatakor megfelelően módosítani kell az értékeket, de gondoskodni kell arról, hogy pontosan mérhető legyen a fejlődött szén-dioxid.
Minden egyes 5 literes lombikba önteni kell 2 400 ml ásványianyag-tápoldatot. Hozzá kell adni megfelelő mennyiségű előkészített eleveniszapot (lásd az I.6.4.1. és I.6.5. pontot) úgy, hogy a végleges 3 literes beoltott keverékben 30 mg/l-nél nem nagyobb szuszpendált szilárdanyag-koncentrációt kapjanak. Más megoldás: először hígítani kell az előkészített iszapot úgy, hogy 500–1 000 mg/l szuszpenziót kapjanak az ásványianyag-tápoldatban, mielőtt hozzáadnánk egy aliquot részt az 5 literes lombik tartalmához a 30 mg/l-es koncentráció elérésére; ez utóbbi eljárás nagyobb pontosságot biztosít. Használhatók más inokulumforrások is (lásd az 1.6.4.2. pontot).
A szén-dioxidnak a rendszerből történő eltávolítása érdekében a beoltott keverékeket CO2-mentes levegővel kell levegőztetni egy éjszakán át.
Az ismételt vizsgálatokhoz alkalmazandó lombikokhoz a vizsgált anyagot és a referenciaanyagot külön-külön kell hozzáadni, ismert töménységű törzsoldatok formájában, úgy, hogy a hozzáadott anyagokkal együtt 10–20 mg DOC vagy TOC/l-koncentrációkat kapjanak; néhány lombikhoz nem adnak hozzá kémiai anyagot, hanem meghagyják azokat inokulumkontrollnak. A rosszul oldódó vizsgált anyagokat közvetlenül kell a lombikokba bevinni tömeg vagy térfogat alapján, vagy azokat a 3. függelékben ismertetett módon kell kezelni.
Ha szükséges, használható egy lombik a vizsgált kémiai anyag esetleges gátló hatásának ellenőrzésére, e lombikba mind a vizsgált, mind a referenciaanyagokat ugyanolyan koncentrációkban kell bevinni, mint ahogy azok a többi lombikban jelen vannak.
Ezenkívül, ha szükséges, egy steril lombik használható annak ellenőrzésére, hogy lebomlik-e abiotikusan a vizsgált kémiai anyag; ehhez az anyag nem beoltott oldatát kell használni (lásd az I.6.6 pontot). A sterilizáció megfelelő koncentrációjú toxikus anyag hozzáadásával történik.
Mindhárom lombikban ki kell egészíteni a szuszpenzió térfogatát 3 literre előzőleg CO2-mentes levegővel levegőztetett ásványianyag-tápoldat hozzáadásával. Tetszés szerint minták vehetők DOC-analízishez (lásd a 2. függelék 4. pontját) és/vagy a specifikus analízishez. Az abszorpciós üvegeket a lombikok levegőkivezető nyílásához kell csatlakoztatni.
Ha bárium-hidroxidot használnak, három abszorpciós üveget kell sorba csatlakoztatni, amelyek közül mindegyik 100 ml 0,0125 M bárium-hidroxid-oldatot tartalmaz, minden egyes 5 literes lombikhoz. Az oldatnak kicsapódott szulfáttól és karbonáttól mentesnek kell lennie, és közvetlenül a használat előtt meg kell határozni a koncentrációját. Ha nátrium-hidroxidot használnak, csatlakoztatni kell két abszorpciós csapdát, amelyek közül a második ellenőrzésre szolgál annak bemutatására, hogy minden szén-dioxid abszorbeálásra került az elsőben. A szérumos üvegekéhez hasonló záróelemmel ellátott üvegek alkalmasak e célra. Mindkét üvegbe 200 ml 0,05 M nátrium-hidroxidot kell bevinni, amely elegendő a vizsgált anyag teljes lebomlásakor fejlődő teljes szén-dioxid mennyiségének abszorbeálására. A nátrium-hidroxid-oldat, még ha frissen elkészített is, nyomokban tartalmazni fog karbonátokat; ezt a vakpróbában lévő karbonátmennyiség levonásával korrigálni kell.
IV.2.5. A lombikok száma egy tipikus vizsgálatsorozatban
1. és 2. lombik: vizsgált szuszpenzió
3. és 4. lombik: inokulum-vakpróba
5. lombik: eljáráskontroll
Ajánlott és amikor szükséges:
6. lombik: abiotikus steril kontroll
7. lombik: toxicitáskontroll
Lásd még az I.6.7. pontot is.
IV.2.6. A kísérlet végrehajtása
A kísérlet kezdetén CO2-mentes levegőt kell belevezetni a szuszpenziót tartalmazó tartályokba 30–100 ml/perc átfolyási sebesség mellett. Szabályos időközönként mintákat kell venni a szén-dioxid-abszorbensből a CO2-tartalom elemzésére. Az első 10 nap során ajánlatos az elemzéseket minden második vagy harmadik napon elvégezni, és ezután minden 5. napon a 28. napig azért, hogy meghatározható legyen a „tíznapos ablak”.
A 28. napon mintákat kell venni (tetszés szerint) a DOC- és/vagy a specifikus analízis céljából, meg kell mérni a szuszpenzió pH-ját, és bele kell tenni 1 ml tömény sósavat minden egyes lombikba; a lombikokat egész éjszakán át a vizsgált szuszpenziókban jelen lévő szén-dioxid eltávolítása érdekében szellőztetni kell. A 29. napon kell végrehajtani a fejlődött szén-dioxid utolsó elemzését.
A CO2-mérések napjain el kell választani a lombikhoz legközelebbi bárium-hidroxid abszorbciós üveget, és titrálni kell a hidroxid-oldatot 0,05 M HCl-dal, indikátorként fenolftaleint használva. A többi abszorbciós üveget eggyel közelebb kell tenni a lombikhoz, és el kell helyezni egy új, 100 ml friss 0,0125 M bárium-hidroxidot tartalmazó abszorbciós üveget a sor legtávolabbi végére. Titrálást kell végezni szükség szerint, például amikor jelentős csapadékképződés látható az első abszorpciós üvegben, és mielőtt ennek bármilyen bizonyítéka lenne látható a második üvegen, vagy legalább hetente. Más megoldásként, abszorbensként NaOH-t használva, fecskendővel kis térfogatú nátrium-hidroxid-oldat-mintát kell venni (az elemzéshez használt szénanalizátor jellemzőitől függően) a lombikhoz legközelebbi abszorbciós üvegből. A mintát be kell fecskendezni a szénelemző készülék IC-részébe a fejlődött szén-dioxid közvetlen elemzéséhez.
A második abszorpciós csapda tartalmát csak a vizsgálat végén kell elemezni az összes szén-dioxid-átvitel figyelemb evételével.
IV.3. ADATOK ÉS JELENTÉS
IV.3.1. Eredmények kiértékelése
A titráláskor az abszorberben megkötődött CO2-mennyiséget a következő összefüggés adja meg:
mgCO2 = (100 x CB-0,5 x V x CA) x 44
ahol:
|
V |
= |
az abszorberben a 100 ml titrálásához használt HCl térfogata (ml), |
|
CB |
= |
bárium-hidroxid-oldat koncentrációja (M), |
|
CA |
= |
a sósavoldat koncentrációja (M), |
ha a CB értéke 0,0125 M és a CA értéke 0,05 M, 100 ml bárium-hidroxid esetében a titráláshoz felhasznált térfogat 50 ml, és a CO2 tömegét a következő összefüggés adja meg:
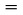
Így tehát ebben az esetben a titrált HCl-térfogatnak megfelelően a fejlődött CO2 mennyisége (mg) közötti szorzótényező 1,1.
Ki kell számítani az egyedül az inokulumból és az inokulumból plusz a vizsgált anyagból fejlődött CO2 tömegét a megfelelő titrálási értékek segítségével, ezek különbsége a kizárólag a vizsgált anyagból fejlődött CO2 mennyisége.
Például, ha kizárólag az inokulum esetében 48 ml kell a titráláshoz és az inokulum plusz vizsgált anyaghoz együttesen 45 ml, akkor
a CO2 inokulum esetében = 1,1 x (50 – 48) = 2,2 mg
a CO2 inokulum plusz vizsgált anyag esetében = 1,1 x (50 – 45) = 5,5 mg
tehát a vizsgált anyagból fejlődött CO2 mennyisége 3,3 mg.
A százalékos biológiai lebomlás a következő összefüggésből számító ki:
![]()
vagy
![]()
az átváltási arány 3,67 (44/12) a szén és a szén-dioxid között.
Ki kell számítani a százalékos lebomlást minden egyes időintervallum után a mérés végrehajtásának időpontjáig az egyes napokhoz kiszámított ThCO2 értékek százalékának összeadásával.
Nátrium-hidroxid abszorberek esetében ki kell számítani a fejlődött szén-dioxid-mennyiséget, IC-ben (szervetlen szén) (mg) kifejezve, megszorozva az IC koncentrációját az abszorbensben az abszorbens térfogatával.
A százalékos lebomlást a következő összefüggésből lehet kiszámítani:

A DOC csökkenését (választható) az I.7. pontban leírtaknak megfelelően lehet kiszámítani. Ezt és minden más eredményt a megadott adatlapokra kell feljegyezni.
IV.3.2. Eredmények érvényessége
A vizsgálat kezdetén az ásványianyag-tápoldatban lévő vizsgált anyag szuszpenzió IC-tartalmának a TC 5 %-ánál kevesebbnek kell lennie, és a vizsgálat végén az inokulum-vakpróbában a teljes CO2-fejlődésnek általában nem szabad 40 mg/l oldószernél nagyobbnak lennie. Ha 70 mg CO2/l-nél nagyobb értékeket kapnak, alaposan meg kell vizsgálni az adatokat és a kísérleti módszert.
Lásd még az I.5.2. pontot is.
IV.3.3. Vizsgálati jelentés
Lásd az I.8. pontot.
IV.4. ADATLAP
Példa az adatlapra.
SZÉN-DIOXID-FEJLŐDÉS-VIZSGÁLAT
|
1. |
LABORATÓRIUM |
|
2. |
A VIZSGÁLAT KEZDETÉNEK DÁTUMA |
3. VIZSGÁLT ANYAG
Név:
Törzsoldat-koncentráció: … mg/l, az anyagra vonatkoztatva
Kezdeti koncentráció a médiumban: … mg/l az anyagra vonatkoztatva
A lombik tartalmához hozzáadott szén teljes mennyisége: … mg C
ThCO2: … mg CO2
4. INOKULUM
Forrás:
Végrehajtott kezelés:
Előkondicionálás, ha van ilyen:
Szuszpendált szilárd anyagok koncentrációja a reakciókeverékben: … mg/l
|
5. |
SZÉN-DIOXID-FEJLŐDÉS ÉS -LEBONTHATÓSÁG |
|
Idő (nap) |
A vizsgálatban képződött CO2 (mg) |
A vakpróbában képződött CO2 (mg) |
Képződött CO2 összesen (mg), a vizsgált anyag és a vakpróba különbségeinek átlaga |
ThCO2
|
|||||
|
1 2 |
átlag |
3 4 |
átlag |
1 |
2 |
1 |
2 |
átlag |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
n1 |
|
|
|
|
|
|
|
|
|
|
n2 |
|
|
|
|
|
|
|
|
|
|
n3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28 |
|
|
|
|
|
|
|
|
|
Megjegyzés: hasonló adatlapok használhatók a referenciaanyagokhoz és a toxicitáskontrollokhoz is.
6. SZÉNANALÍZIS (választható)
Szénanalizátor:
|
Idő (nap) |
Vakpróba mg/liter |
Vizsgált anyag mg/liter |
|
0 |
(Cbo) |
(Co) |
|
28 (5) |
(Cbt) |
(Ct) |
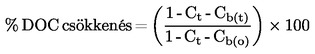
7. ABIOTIKUS LEBOMLÁS (választható)
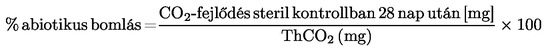
V. RÉSZ MANOMETRIKUS RESPIROMETRIÁS MÉRÉS (C.4-D. Módszer)
V.l. A VIZSGÁLATI MÓDSZER ELVE
Kizárólagos szerves szénforrásként a vizsgált anyag ismert koncentrációját (100 mg/l vizsgált anyag, legalább 50–100 mg ThOD/liter létrehozásához) tartalmazó, mért térfogatú, beoltott ásványianyag-tápoldatot kell keverni zárt lombikban, állandó hőmérsékleten (± 1 oC vagy ennél kisebb eltérés mellett) legfeljebb 28 napig. Meg kell határozni az oxigénfogyasztást vagy a respirométer-palackban az állandó gáztérfogat fenntartásához szükséges (elektrolízis útján előállított) oxigénmennyiség mérésével, vagy a készülékbeli térfogat- vagy nyomásváltozás (vagy a kettő valamilyen kombinációjának) vizsgálatával. A fejlődött szén-dioxidot kálium-hidroxid-oldatban vagy valamilyen más alkalmas abszorbensben nyeletik el. A vizsgált anyag által felvett oxigén (az egyidejűleg vizsgált vakpróba-inokulum által felvett mennyiség figyelembevételével helyesbítve) mennyiségét a ThOD vagy a COD százalékaként kell kifejezni. Tetszés szerint az elsődleges biológiai lebomlás is kiszámítható az inkubációs periódus kezdetén és végén végrehajtott kiegészítő specifikus elemzésből, és elvégezhető a végső biológiai lebomlás DOC-analízise.
V.2. A VIZSGÁLATI MÓDSZER LEÍRÁSA
V.2.1. Készülék
|
a) |
alkalmas respirométer; |
|
b) |
termosztát, amely ± 1 oC vagy ennél nagyobb pontossággal képes a hőmérséklet fenntartására; |
|
c) |
membránszűrő készülék (választható); |
|
d) |
szénanalizátor (választható). |
V.2.2. Ásványianyag-tápoldat előkészítése
A törzsoldatok elkészítését lásd az I.6.2. pontban.
10 ml (a) oldatot 800 ml hígítóvízzel kell összekeverni, 1 ml (b)–(d) oldatot kell hozzáadni, majd 1 literre hígítóvízzel kiegészíteni.
V.2.3. Inokulum előkészítése és előkondicionálása
Az inokulum különböző forrásokból szerezhető be: lehet eleveniszap; kezelt szennyvíz; felszíni víz; talaj vagy ezek vegyesen.
Lásd az I.6.4., I.6.4.1., I.6.4.2. és I.6.5. pontot.
V.2.4. A lombikok előkészítése
A vizsgált és referenciaanyagból külön lombikokban oldatokat készítenek ásványianyagtápoldatban, a törzsoldatok felhasználásával úgy, hogy az oldatok koncentrációja általában 100 mg anyag/liter legyen, ami legalább 50–100 mg ThOD/liter-értéknek felel meg.
Ki kell számítani a ThOD-t az ammóniumsók képződése alapján, kivéve ha nitrifikáció várható, ebben az esetben a számításnak a nitrátképződésen (lásd a 2. függelék 2. pontját) kell alapulnia.
A pH-értékeket meg kell határozni, és ha szükséges, be kell állítani azokat 7,4±0,2-re.
A rosszul oldódó anyagok hozzáadására későbbi fázisban kerül sor (lásd alább).
Ha meg kell határozni a vizsgált anyag toxicitását, akkor egy másik oldatot kell elkészíteni ásványianyag-tápoldatban, amely ugyanolyan koncentrációkban tartalmazza mind a vizsgált, mind a referenciaanyagokat, mint az egyes oldatok.
Ha mérni kell a fizikai-kémiai okokra visszavezethető oxigénfelvételt, akkor el kell készíteni általában egy 100 mg ThOD/liter koncentrációjú oldatot, amelyet megfelelő toxikus anyag hozzáadásával sterilizálnak (lásd az I.6.6. pontot).
A szükséges térfogatú vizsgált, illetve referenciaoldatokat legalább két lombikba kell szétosztani. Ezenkívül további lombikokba csak ásványianyag-tápoldatot kell tenni (inokulum kontrollvizsgálathoz), illetve, ha szükséges, az összekevert vizsgált/referenciaoldatot és a steril oldatot.
Ha a vizsgált anyag rosszul oldódik, akkor azt közvetlenül e szakaszban tömeg vagy térfogat alapon kell az edénybe bevinni, vagy a 3. függelékben leírt módon kell azt kezelni. Káliumhidroxidot, nátronmész-pasztillákat vagy más abszorbenseket kell adagolni a CO2-abszorbciós üvegekbe.
V.2.5. A lombikok száma egy tipikus vizsgálatsorozatban
1. és 2. lombik: vizsgált szuszpenzió
3. és 4. lombik: inokulum-vakpróba
5. lombik: eljáráskontroll
Ajánlott és amikor szükséges:
6. lombik: abiotikus steril kontroll
7. lombik: toxicitáskontroll
Lásd még az 1.6.7. pontot is.
V.2.6. A kísérlet végrehajtása
Miután a lombikok elérték a kívánt hőmérsékletet, azokat be kell oltani a megfelelő előkészített eleveniszappal vagy más inokulumforrással úgy, hogy a kapott szuszpendált szilárd anyag koncentrációja ne legyen 30 mg/l-nél nagyobb. Össze kell szerelni a berendezést, elindítani a keverőt, és ellenőrizni a légmentes záródást, majd meg kell kezdeni az oxigénfelvétel mérését. Rendszerint semmilyen további figyelemre nincs szükség, a mért érték leolvasásán és azokon a napi ellenőrzéseken kívül, amelyek során meg kell mérni, hogy fennmaradt-e a megfelelő hőmérséklet és a megfelelő keverés.
Az oxigénfelvételt a rendszeres és gyakori időközönként leolvasott értékekből lehet kiszámítani a berendezés gyártója által megadott módszerek segítségével. Az inkubálás végén, általában a 28. napon, meg kell mérni a lombikok tartalmának pH-ját, különösen akkor, ha alacsony vagy (nitrogéntartalmú vegyületek esetében) meghaladja a ThODNH4 értékét.
Ha szükséges, a respirométer-palackokból a mérés elején és végén, a DOC- vagy a specifikus kémiai elemzés végrehajtására mintát kell venni (lásd a 2. függelék 4. pontját). A mérés kezdetén végrehajtott mintavételkor gondoskodni kell arról, hogy ismert legyen a palackban maradó vizsgált szuszpenzió térfogata. Amikor a nitrogént tartalmazó vizsgált anyag oxigént vesz fel, meg kell határozni a nitrit és a nitrát koncentrációjának növekedését a 28 nap alatt, a nitrifikáció következtében elfogyasztott oxigén figyelembevételével (5. függelék).
V.3. ADATOK ÉS VIZSGÁLATI JELENTÉS
V.3.1. Az eredmények kiértékelése
El kell osztani valamely adott időt követően (az ugyanennyi idő után a vakpróbainokulum-kontroll által felvett oxigén figyelembevételével helyesbített) a vizsgált kémiai anyagra vonatkozó oxigénfelvételt (mg) a felhasznált vizsgált anyag tömegével. Ezzel megkapják a mg oxigén/mg vizsgált anyag hányadosaként kifejezett BOD-t, vagyis
![]()
O2 [mg]) / (vizsgált anyag lombikban [mg])
A százalékos biológiai lebomlás kiszámítható a következő összefüggések valamelyikéből:
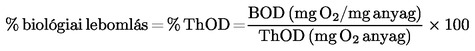
vagy:
![]()
Meg kell jegyezni, hogy e két módszer nem ad szükségképpen azonos értéket; az első módszer használatát kell előnyben részesíteni.
Nitrogéntartalmú vizsgált anyagokhoz a megfelelő ThOD-t kell használni (NH4 vagy NO3) annak megfelelően, hogy várható-e nitrifikáció, vagy sem (lásd a 2. függelék 2. pontját). Ha előfordul nitrifikáció, de az nem teljes, ki kell számítani egy, a nitrifikálással elfogyasztott oxigént figyelembe vevő korrekciós tényezőt a nitrit és nitrát koncentrációjában létrejövő változásokból (5. függelék).
Amikor a szerves szén és/vagy a specifikus kémiai analízis mellett döntenek, ki kell számítani a százalékos lebomlást az I.7. pontban leírt módon.
Minden eredményt fel kell jegyezni a mellékelt adatlapokra.
V.3.2. Az eredmények érvényessége
Az inokulum-vakpróba oxigénfelvétele általában 20–30 mg O2/liter, és nem szabad, hogy 60 mg/liternél nagyobb legyen 28 nap alatt. 60 mg/liternél nagyobb értékek esetében alaposan meg kell vizsgálni az adatokat és a kísérleti módszereket. Ha a pH-érték kívül van a 6–8,5-ös tartományon, és a vizsgált anyag által felvett oxigén kevesebb mint 60 %, akkor a vizsgálatot meg kell ismételni a vizsgált anyag kisebb koncentrációjával.
Lásd még az I.5.2. pontot is.
V.3.3. Vizsgálati jelentés
Lásd az I.8. pontot.
V.4. ADATLAP
Példa az adatlapra.
MANOMETRIKUS RESPIROMETRIÁS VIZSGÁLAT
|
1. |
LABORATÓRIUM |
|
2. |
A VIZSGÁLAT KEZDETÉNEK DÁTUMA |
3. VIZSGÁLT ANYAG
Név:
Törzsoldat-koncentráció: … mg/liter
Kezdeti koncentráció a médiumban, Co: … mg/liter
Térfogat a vizsgálólombikban (V): … ml
ThOD vagy COD: … mg O2/mg vizsgált anyag (NH4, NO3)
4. INOKULUM
Forrás:
Végrehajtott kezelés:
Előkondicionálás, ha van ilyen:
Szuszpendált szilárd anyagok koncentrációja a reakciókeverékben: … mg/l
5. OXIGÉNFELVÉTEL: BIOLÓGIAI LEBONTHATÓSÁG
|
|
Idő (nap) |
||||||||||||
|
0 |
|
7 |
|
14 |
|
|
21 |
|
|
28 |
|
||
|
O2-felvétel (mg), vizsgált anyag |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a, átlag |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O2-felvétel (mg) vakpróba |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b, átlag |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Korrigált BOD (mg) |
(a1 – bm) |
|
|
|
|
|
|
|
|
|
|
|
|
|
(a2 – bm) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BOD/mg vizsgált anyag |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% lebomlás
|
D1 (a1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
D2 (a2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Átlag (6) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V = közeg térfogata a vizsgálati lombikban. |
|||||||||||||
Megjegyzés: hasonló adatlapok használhatók a referenciaanyagokhoz és a toxicitáskontrollokhoz is.
6. KORREKCIÓ A NITRIFIKÁCIÓ FIGYELEMBEVÉTELÉVEL (lásd az 5. függeléket)
|
Nap |
0 |
28 |
Különbség |
||
|
|
|
(N) |
||
|
— |
— |
|
||
|
|
|
(N) |
||
|
— |
— |
|
||
|
— |
— |
|
7. SZÉNANALÍZIS (választható)
Szénanalizátor:
|
Idő (nap) |
Vakpróba mg/liter |
Vizsgált anyag mg/liter |
|
0 |
(Cblo) |
(Co) |
|
28 (7) |
(Cblt) |
(Ct) |

8. SPECIFIKUS ANALÍZIS (választható)
|
Sb |
= |
a vizsgált anyag koncentrációja fizikai-kémiai (steril) kontrollban a 28. napon |
|
Sa |
= |
koncentráció a beoltott lombikban a 28. napon |

9. ABIOTIKUS LEBOMLÁS (választható)
|
a |
= |
oxigénfelvétel a steril lombikokban 28 nap után, (mg) |

(lásd az 1. és 3. szakaszt)

VI. RÉSZ. ZÁRTPALACK-MÓDSZER (C.4-E. Módszer)
VI.1. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált kémiai anyagnak ásványianyag-tápoldatban lévő, rendszerint 2–5 mg/liter koncentrációjú oldatát be kell oltani viszonylag kis számú, vegyes populációból származó mikroorganizmussal, és teljesen teletöltött, zárt palackokban, sötétben, állandó hőmérsékleten kell tartani. A lebomlást a 28 napos időtartam alatt a feloldódott oxigén analízise követi. A vizsgált anyag által felvett oxigénmennyiséget, az egyidejűleg végrehajtott vizsgálatban a vakpróba-inokulum által felvett oxigén figyelembevételével helyesbítve, a ThOD vagy a COD százalékában kell kifejezni.
VI.2. A VIZSGÁLATI MÓDSZER LEÍRÁSA
VI.2.1. Készülék
|
a) |
BOD-palackok, üvegdugókkal, például 250–300 ml-esek; |
|
b) |
Vízfürdő vagy inkubátor, amelyekben a palackok állandó hőmérsékleten (± 1 oC vagy ennél nagyobb pontosság mellett) sötétben tarthatók; |
|
c) |
Nagyméretű üvegpalackok (2–5 literesek) a közeg előkészítésére és a BOD-palackok megtöltésére; |
|
d) |
Oldottoxigén-mérő, valamint reagensek a Winkler-féle titráláshoz. |
VI.2.2. Ásványianyag-tápoldat előkészítése
A törzsoldatok elkészítését lásd az I.6.2. pontban.
Össze kell keverni 1 ml-t az (a)–(d) oldatokból, és azt hígítóvízzel ki kell egészíteni 1 literre.
VI.2.3. Az inokulum előkészítése
Az inokulum valamilyen, döntően háztartási szennyvizet feldolgozó szennyvíztisztító telep vagy egység másodlagos kezelt szennyvízéből származik. Alternatív inokulumforrás a felszíni víz. Általában egy csepp (0,05 ml) és 5 ml közötti szűrletet kell használni ásványianyagtápoldat-literenként; kísérletezésre lehet szükség adott inokulumforrás vonatkozásában az optimális térfogat kiderítésére (lásd az I.6.4.2. és I.6.5. pontot).
VI.2.4. A lombikok előkészítése
Az ásványianyag-tápoldatot legalább 20 percig kell intenzíven levegőztetni. Ugyanazon adagból származó ásványianyag-tápoldattal kell végrehajtani minden egyes vizsgálatsorozatot. Az oldószer általában a vizsgálati hőmérsékleten való 20 óra állást követően kész a felhasználásra. Az oldott oxigén koncentrációját ellenőrzési célból kell meghatározni; az értéknek körülbelül 9 mg/liternek kell lennie 20 oC-os hőmérsékleten. A levegővel telített közeg minden áthelyezési és áttöltési műveletét buborékmentesen kell végrehajtani, például szívócsövek segítségével.
A BOD-palackok csoportjait kell elkészíteni a vizsgált és a referenciaanyagok meghatározására végzett egyidejű kísérletsorozatokhoz. Elegendő számú BOD-palacknak kell rendelkezésre állnia, az inokulum-vakpróbákat is ideértve úgy, hogy legalább két oxigénfogyasztás-mérés legyen végrehajtható a kívánt időintervallumokban, például a 0., 7., 14., 21. és 28. nap után. Lehet, hogy további palackokra lesz szükség annak biztosítására, hogy azonosítható legyen a „tíznapos ablak”.
A teljesen kilevegőztetett ásványianyag-tápoldatot a nagy palackokba úgy kell beletölteni, hogy azok körülbelül 1/3 részükig legyenek megtöltve. Ezután a nagy palackokba bele kell tölteni a vizsgált anyag és a referenciaanyag törzsoldatából elegendő mennyiséget úgy, hogy az anyagok végleges koncentrációja általában ne legyen 10 mg/liternél nagyobb. Semmilyen kémiai anyagot nem lehet beleönteni a vakpróba kontrolloldószert tartalmazó nagy palackba.
Annak biztosítására, hogy az inokulumaktivitás ne legyen korlátozott, az oldott oxigén koncentrációjának nem szabad 0,5 mg/liter alá csökkennie a BOD-palackokban. Ez körülbelül 2 mg/literre korlátozza a vizsgált anyag koncentrációját. Azonban a nehezen lebomló vegyületekhez és az alacsony ThOD-értékű vegyületekhez 5–10 mg/liter használható. Néhány esetben ajánlatos lehet a vizsgált anyagot egyidejűleg vizsgálni két különböző, például 2 és 5 mg/literes koncentráció mellett. Általában a ThOD-t az ammóniumsók képződése alapján kell kiszámítani, de ha nitrifikáció várható, vagy ismert, hogy ez előfordul, a számításnak a nitrátképződésen kell alapulnia (ThODNO3: lásd a 2. függelék 2. pontját). Azonban, ha előfordul ugyan nitrifikáció, de ez nem teljes, korrekciót kell végrehajtani a nitrit és a nitrát koncentrációjában az elemzés által meghatározott változások figyelembevételével (lásd az 5. függeléket).
Ha meg kell vizsgálni a vizsgált anyag toxicitását (például abban az esetben, ha előzőleg kis mértékű biológiai lebonthatóság volt tapasztalható), akkor egy másik palacksorozat szükséges.
Egy másik nagy palackra is szükség van a kilevegőztetett, kb. harmadáig megtöltött ásványianyag-tápoldat befogadására, valamint a vizsgált anyag és a referenciaanyag bevitelére olyan végleges koncentrációban, amely általában megegyezik a többi nagy palackban lévő koncentrációval.
A nagy palackokban lévő oldatokat másodlagos kifolyó szennyvízzel (egy cseppel vagy körülbelül 0,05 ml-től 5 ml/l-ig terjedő mennyiséggel), vagy valamilyen más forrásból származó inokulummal, például folyóból vett vízzel (lásd az I.6.4.2. pontot) kell beoltani. Végül az oldatokat kilevegőztetett ásványianyag-tápoldattal kell kiegészíteni úgy, hogy kitöltsék a teljes térfogatot, az oldószer beviteléhez a palack aljáig leérő csövet kell használni, azért hogy megfelelő keveredést érjenek el.
VI.2.5. A palackok száma egy tipikus vizsgálatsorozatban
Egy tipikus vizsgálatsorozatban a következő palackokra van szükség:
|
— |
a vizsgált anyagot és az inokulumot (vizsgált szuszpenzió) tartalmazó legalább 10 palack, |
|
— |
csak inokulumot (inokulum-vakpróba) tartalmazó legalább 10 palack, |
|
— |
referenciaanyagot és inokulumot (eljáráskontroll) tartalmazó legalább 10 palack, |
|
— |
és amikor szükséges, a vizsgált anyagot, referenciaanyagot és inokulumot (toxicitáskontroll) tartalmazó 6 palack. Annak biztosítására, hogy meghatározható legyen a „tíznapos ablak”, körülbelül kétszer ennyi palackra lehet szükség. |
VI.2.6. A kísérlet végrehajtása
Minden egyes előkészített oldatot a megfelelő nagy palack alsó negyedéből kell kiadagolni (nem az aljából) egy cső segítségével a BOD-palackok megfelelő csoportjába úgy, hogy minden BOD-palack teljesen tele legyen. A palackokat ezután óvatosan meg kell ütögetni az esetleges légbuborékok eltávolítása céljából. A palackokat a nulla időpontban azonnal elemezni kell az oldott oxigén mennyiségének megállapítása céljából a Winkler- vagy az elektróda módszer segítségével. A palackok tartalma tartósítható a Winkler-módszerrel végrehajtott későbbi elemzéshez mangán(II)-szulfát és nátrium-hidroxid (első Winkler-reagens) hozzáadásával. A gondosan ledugózott palackokat, amelyek az oxigént barna mangán(III)-hidroxidként kötve tartalmazzák, sötétben, 10–20 oC hőmérsékleten, 24 óránál nem hosszabb ideig kell tárolni, mielőtt végrehajtanánk a Winkler-módszer hátralévő lépéseit. A többi, másodpéldányként szolgáló palackot is le kell fedni dugóval, gondoskodva arról, hogy ne legyen bennük légbuborék, e palackokat 20 oC hőmérsékleten, sötét helyen kell inkubálni. Minden egyes vizsgálatsorozatot egy teljes párhuzamos sorozatnak kell kísérnie az inokulumvakpróba-értékek meghatározására. A 28 napos inkubálási idő során bizonyos időközönként (legalább hetente) minden sorozatból legalább két palackot el kell távolítani az oldott oxigén mennyiségének meghatározása érdekében.
A hetenként vett mintáknak lehetővé kell tenniük valamely 14 napos időintervallum során a százalékos csökkenés kiértékelését, míg a 3–4 naponként történő mintavételnek lehetővé kell tennie a „tíznapos ablak” meghatározását, amelyhez körülbelül kétszer annyi palackra van szükség.
Nitrogéntartalmú anyagok vizsgálata esetében korrekciót kell végrehajtani a nitrifikáció következtében végbemenő oxigénfelvétel tekintetében. Ennek végrehajtására az O2-elektróda módszert kell használni az oldott oxigén koncentrációjának meghatározására, ezután mintát kell venni a BOD-palackból a nitrit és a nitrát elemzésére. A nitrit és a nitrát koncentrációjának növekedéséből lehet kiszámítani a felhasznált oxigén mennyiségét (lásd az 5. függeléket).
VI.3. ADATOK ÉS JELENTÉS
VI.3.1. Eredmények kiértékelése
Először ki kell számítani az egyes időtartamok utáni BOD-t a vizsgált anyag oxigénfelvételéből kivonva az inokulum-vakpróba oxigénfelvételét (mg O2/liter). A korrigált oxigénfelvétel értékét el kell osztani a vizsgált anyag koncentrációjával (mg/liter), hogy megkapják az adott BOD-t mg oxigén/mg vizsgált anyagként. Ki kell számítani a százalékos biológiai lebonthatóságot az adott BOD-nek az adott ThOD-val (a 2. függelék 2. pontjának megfelelően kiszámított) vagy COD-val (elemzéssel meghatározva, lásd a 2. függelék 3. pontját) való elosztásával, azaz:

= mg O2/mg vizsgált anyag
![]()
vagy:
![]()
Meg kell jegyezni, hogy e két módszer nem ad szükségképpen azonos értéket; az első módszer használatát kell előnyben részesíteni.
Nitrogéntartalmú anyagok vizsgálatához a megfelelő ThOD-t kell használni (NH4 vagy NO3) annak megfelelően, hogy várható-e nitrifikáció, vagy sem. Ha előfordul nitrifikáció, de az nem teljes, ki kell számítani egy, a nitrifikálással elfogyasztott oxigént figyelembe vevő korrekciós tényezőt a nitrit és nitrát koncentrációjában létrejövő változásokból (5. függelék).
VI.3.2. Az eredmények érvényessége
Az inokulum-vakpróbában az oxigéncsökkenésnek nem szabad 1,5 mg oldott oxigén/liternél nagyobbnak lennie 28 nap eltelte után. Ennél nagyobb értékek esetén meg kell vizsgálni a kísérleti módszereket. A vizsgált palackokban a maradék oxigén koncentrációjának soha nem szabad 0,5 mg/liter alá csökkennie. Az ilyen alacsony oxigénszintek csak akkor érvényesek, ha az oldott oxigén meghatározására használt módszer képes pontosan mérni az ilyen alacsony szinteket.
Lásd még az I.5.2. pontot is.
VI.3.3. Vizsgálati jelentés
Lásd az I.8. pontot.
VI.4. ADATLAP
Példa az adatlapra.
ZÁRT PALACKOS VIZSGÁLAT
|
1. |
LABORATÓRIUM |
|
2. |
A VIZSGÁLAT KEZDETÉNEK DÁTUMA |
3. VIZSGÁLT ANYAG
Név:
Törzsoldat-koncentráció: … mg/liter
Kezdeti koncentráció a palackban: … mg/liter
ThOD vagy COD: … mg O2/mg vizsgált anyag
4. INOKULUM
Forrás:
Végrehajtott kezelés:
Előkondicionálás, ha van ilyen:
Koncentráció a reakciókeverékben: … mg/liter
5. OLDOTT OXIGÉN (DO) MEGHATÁROZÁSA
Módszer: Winkler-módszer/oldott oxigén mérése elektródával
Meghatározások a palackokból
|
Inkubálás időtartama (nap) |
Oldott oxigén (mg/l) |
|||||
|
0 |
n1 |
n2 |
|
|||
|
Vakpróba (vizsgált anyag nélkül |
1 |
C1 |
|
|
|
|
|
2 |
C2 |
|
|
|
|
|
|
Átlag |
|
|
|
|
|
|
|
Vizsgált anyag |
1 |
a1 |
|
|
|
|
|
|
2 |
a2 |
|
|
|
|
|
Átlag |
|
|
|
|
|
|
Megjegyzés: hasonló adatlapok használhatók a referenciaanyagokhoz és a toxicitáskontrollokhoz is.
6. KORREKCIÓ A NITRIFIKÁCIÓ FIGYELEMBEVÉTELÉVEL (lásd az 5. függeléket)
|
Inkubálás időtartama (nap) |
0 |
n1 |
n2 |
n3 |
||
|
|
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
||
|
|
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
||
|
— |
|
|
|
7. OLDOTTOXIGÉN-CSÖKKENÉS: % LEBOMLÁS
|
|
Csökkenés n nap után (mg/liter) |
|||
|
n1 |
n2 |
n3 |
|
|
|
1. PALACK: (mto – mtx) – (mbo – mbx) |
|
|
|
|
|
2. PALACK: (mto – mtx) – (mbo – mbx) |
|
|
|
|
|
1. PALACK
|
|
|
|
|
|
2. PALACK
|
|
|
|
|
| % D átlag (8) =
|
|
|
|
|
|
mto |
= |
a vizsgálati palackban a 0 időpontban mért érték |
|
mtx |
= |
a vizsgálati palackban az x időpontban mért érték |
|
mbo |
= |
vakpróbában mért átlagos érték a 0 időpontban |
|
mbx |
= |
vakpróbában mért átlagos érték az x időpontban |
A 6. szakaszban a iii. + vi-ból származó nitrifikáció figyelembevételére is korrekciót kell alkalmazni.
8. AZ OLDOTT OXIGÉN CSÖKKENÉSE AZ INOKULUM-VAKPRÓBÁBAN
A vakpróba által felvett oxigén: (mbo – mb28) mg/liter. Ez az oxigénfelvétel fontos a vizsgálat érvényességéhez. Ennek 1,5 mg/liternél kevesebbnek kell lennie.
VII. RÉSZ MITI-VIZSGÁLAT (C.4-F. Módszer)
VII.1. A VIZSGÁLATI MÓDSZER ELVE
A vizsgált anyag tenyészközegben létrehozott, különlegesen tenyésztett, nem adaptált mikroorganizmusokkal beoltott, folyamatosan kevert oldatában vagy szuszpenziójában az oxigénfelvételt 28 napos időtartamon át egy elsötétített, zárt, automata, 25 ± 1 oC hőmérsékleten tartott respirométerben mérik. A fejlődött szén-dioxidot nátronmésszel nyeletik el. A biológiai lebonthatóságot az elméleti oxigénfelvétel (ThOD) százalékos felvételeként (a vakpróba felvételének figyelembevételével) kell kifejezni. Az elméleti biológiai lebonthatóság mértékét is ki kell számítani az inkubációs periódus kezdetén és végén végrehajtott kiegészítő specifikus kémiai elemzésből, és/vagy más lehetőségként, a DOC-elemzésből.
VII.2. A VIZSGÁLATI MÓDSZER LEÍRÁSA
VII.2.1. Készülék
|
a) |
Szokásos körülmények között 6 darab, egyenként 300 ml-es és a CO2 abszorbens elhelyezésére szolgáló készüléket tartalmazó palackkal felszerelt respirométer vagy automata elektrolitikus BOD-mérő; |
|
b) |
Klímakamra és/vagy vízfürdő 25 oC ± 1 oC vagy ennél nagyobb pontosságú; |
|
c) |
Membránszűrő készülék (választható); |
|
d) |
Szénanalizátor (választható). |
VII.2.2. Ásványianyag-tápoldat előkészítése
A következő törzsoldatokat kell elkészíteni analitikai minőségű reagensek és víz használatával (I.6.1.):
|
a) |
Kálium-dihidrogén-foszfát, KH2PO4 |
8,50 g |
|
Dikálium-hidrogén-foszfát, K2HPO4 |
21,75 g |
|
|
Dinátrium-hidrogén-foszfát-dodekahidrát Na2HPO4 12 H2O |
44,60 g |
|
|
Ammónium-klorid, NH4Cl |
1,70 g |
|
|
Ezen anyagokat vízben kell feloldani, és 1 literre kiegészíteni. |
|
|
|
Az oldat pH-értékének 7,2-nek kell lennie. |
|
|
|
b) |
Magnézium-szulfát-heptahidrát, MgSO4 7 H2O |
22,50 g |
|
Vízben kell feloldani, és 1 literre kiegészíteni. |
|
|
|
c) |
Kalcium-klorid, vízmentes, CaCl2 |
27,50 g |
|
Vízben kell feloldani, és 1 literre kiegészíteni. |
|
|
|
d) |
Vas(III)klorid-hexahidrát, FeCl3·6H2O |
0,25 g |
|
Vízben kell feloldani, és 1 literre kiegészíteni. |
|
Az (a), (b), (c) és (d) oldatok közül mindegyikből 3 ml-t kell venni, és kiegészíteni 1 literre.
VII.2.3. Az inokulum előkészítése
Friss mintákat kell tíznél nem kevesebb helyről összegyűjteni, főleg olyan területekről, ahol különböző kémiai anyagokat használnak és bocsátanak ki. 1 liternyi szennyvíziszap, felszíni víz, talaj stb. mintákat kell begyűjteni olyan helyekről, mint például szennyvíztisztító, ipari szennyvízkezelő telepek, folyók, tavak, tengerek, és ezeket alaposan össze kell keverni. A lebegő, úszó anyag eltávolítása után a mintát állni kell hagyni, majd a felülúszó folyadék pH-ját 7 ± l-re kell beállítani nátrium-hidroxid vagy foszforsav hozzáadásával.
Megfelelő térfogatú, szűrt felülúszó folyadékot eleveniszapot tartalmazó tartályba kell beletölteni, majd ezt körülbelül 23 1/2 órán át kell levegőztetni. A levegőztetés leállítása után 30 perccel ki kell engedni a felülúszó folyadék teljes térfogatának körülbelül egyharmadát, és ennek helyére ezzel egyenlő térfogatú, glükózból, peptonból és kálium-foszfátból egyaránt 0,1 %-ot tartalmazó (7-es pH-jú) oldatot kell a leülepedett anyaghoz hozzáadni, ezután újra kell kezdeni a levegőztetést. Minden nap egyszer ismételik meg ezt az eljárást. A szennyvíziszap-fermentort a jól bevált gyakorlatnak megfelelően kell működtetni: a kifolyó szennyvízből nyert folyadékoknak tisztáknak kell lenniük, a hőmérsékletet 25 ± 2 oC-on kell tartani, a pH-nak 7 ± l-nek kell lennie, a szennyvíziszapnak jól leülepedettnek kell lennie, elegendő levegőztetést kell biztosítani, hogy a keverék állandóan aerob állapotban legyen, jelen kell lenniük protozoáknak, és legalább minden harmadik hónapban meg kell vizsgálni a szennyvíziszap aktivitását valamely referenciaanyaggal összevetve. Szennyvíziszap nem használható inokulumként, amíg legalább egy hónap el nem telt a működtetés kezdete óta, de nem használható fel négy hónapnál később sem. Ezután rendszeres időközönként, minden három hónapban egyszer, legalább 10 helyről mintát kell venni.
Össze kell keverni a használatban lévő eleveniszap szűrt, felülúszó folyadékát a frissen gyűjtött, tíz forrásból származó keverék ezzel egyenlő térfogatú, szűrt, felülúszó folyadékával, és az egyesített folyadékot a fentieknek megfelelően tovább kell tenyészteni azért, hogy ugyanolyan aktivitáson tartsák a friss és régi iszapot. Az egységbe történő betöltés után 18–24 órával ki kell venni az inokulumként használni kívánt iszapot.
VII.2.4. A lombikok előkészítése
Az alábbi hat lombikot kell előkészíteni:
1. számú: a vizsgált anyag hígítóvízben, 100 mg/liter koncentrációban
2., 3. és 4. számú: a vizsgált anyag ásványianyag-tápoldatban, 100 mg/liter koncentrációban
5. számú: referenciaanyag (például anilin) ásványianyag-tápoldatban, 100 mg/liter koncentrációban
6. számú: csak ásványianyag-tápoldat.
A rosszul oldódó vizsgált anyagokat közvetlenül kell bevinni tömeg vagy térfogat alapon, vagy azokat a 3. függelékben leírt módon kell kezelni, kivéve hogy sem oldószereket, sem pedig emulgeátorokat nem szabad használni. A CO2-abszorbenst az erre a célra biztosított specifikus tartókban kell bevinni minden lombikba. A pH-t 7,0-ra kell beállítani a 2., 3. és 4. lombikban.
VII.2.5. A vizsgálat végrehajtása
Be kell oltani a 2., 3. és 4. (vizsgált szuszpenzió), 5. (eljáráskontroll) és 6. (inokulum-vakpróba) lombikokat kis térfogatú oltóanyaggal úgy, hogy 30 mg/l szuszpendált szilárd anyagot kapjanak. Az 1. lombikhoz, amely abiotikus kontrollként szolgál, nem kell inokulumot adni. Össze kell állítani a berendezést, ellenőrizni kell a légmentes záródást, elindítani a keverőt, majd megkezdeni az oxigénfelvétel mérését sötétséget biztosítva. Naponta ellenőrizni kell a hőmérsékletet, a keverőt és a coulometriás oxigénfelvétel-mérőt, valamint fel kell jegyezni a lombikok tartalmának minden változását. Le kell olvasni közvetlenül a hat lombikhoz tartozó oxigénfelvételt valamilyen megfelelő módszerrel, például a hatpontos szalagos, öníró műszer segítségével, amely létrehoz egy BOD-görbét. Az inkubációs periódus végén, általában a 28. napon, meg kell mérni a lombikok tartalmának pH-ját, és meg kell határozni a maradék vizsgált anyag és minden közbenső anyag koncentrációját, a vízben oldható anyagok esetében a DOC-koncentrációt (2. függelék 4. pontja). Különleges gondossággal kell eljárni az illékony kémiai anyagok esetében. Ha nitrifikáció várható, meg kell határozni a nitrát- és a nitritkoncentrációt, ha lehetséges.
VII.3. ADATOK ÉS VIZSGÁLATI JELENTÉS
VII.3.1. Az eredmények kiértékelése
Adott időt követően el kell osztani a vizsgált anyag által felvett oxigén tömegét (mg) (az ugyanennyi idő után a vakpróbainokulum-kontroll által felvett oxigén figyelembevételével végrehajtott korrekció után) a felhasznált vizsgált anyag tömegével. Ezzel megkapják a mg oxigén/mg vizsgált anyag hányadosaként kifejezett BOD-t, azaz:

= mg O2/mg vizsgált anyag
A százalékos biológiai lebomlást a következő összefüggésből lehet kiszámítani:

Keverékek esetében elemanalízisből lehet kiszámítani a ThOD-t ugyanúgy, mint egyszerű vegyületek esetén. A használandó ThOD-érték (ThODNH4 vagy ThODNO3) attól függ, hogy nincs jelen vagy teljes-e a nitrifikáció (2. függelék 2. pontja). Azonban, ha előfordul nitrifikáció, de ez nem teljes, korrekciót kell végrehajtani annak az oxigénnek a figyelembevételével, amelyet a nitrit és a nitrát koncentrációiban létrejövő változásokból kiszámított nitrifikáció fogyaszt el (5. függelék).
A százalékos elsődleges biológiai lebomlást a specifikus (kiindulási) anyag veszteségéből (lásd az I.7.2. pontot) lehet kiszámítani.

Ha a vizsgált anyagra vonatkozóan veszteség fordult elő fizikai-kémiai okokra visszavezethetően az 1. lombikban, ezt fel kell jegyezni a jelentésbe, és a vizsgált anyagnak az e lombikban a 28. nap után meglévő koncentrációját (Sb) kell használni a százalékos biológiai lebomlás kiszámításához.
A DOC-meghatározások végrehajtásakor (választható) ki kell számítani a százalékos végső biológiai lebomlást a következő összefüggésből:

úgy, ahogyan ezt az I.7.1. pont ismerteti. Ha DOC-csökkenés fordult elő az 1. lombikban, amely a fizikai-kémiai okokból bekövetkező csökkenést méri, akkor az e lombikban lévő DOC-koncentrációt kell használni a százalékos biológiai bomlás kiszámítására.
Minden eredményt fel kell jegyezni a mellékelt adatlapokra.
VII.3.2. Az eredmények érvényessége
Az inokulum-vakpróba oxigénfelvétele általában 20–30 mg O2/1, és nem szabad 60 mg/l-nél nagyobbnak lennie 28 nap alatt. 60 mg/l-nél magasabb értékek esetében alaposan meg kell vizsgálni az adatokat és a kísérleti módszereket. Ha a pH-érték a 6–8,5-ös tartományon kívül van, és a vizsgált anyag oxigénfogyasztása kevesebb mint 60 %, a vizsgálatot meg kell ismételni a vizsgált anyag kisebb koncentrációjával.
Lásd még az I.5.2. pontot is.
Ha az anilinnek az oxigénfogyasztásból kiszámított százalékos lebomlása nem lépi túl a 40 %-ot 7 nap után és a 65 %-ot 14 nap után, a vizsgálatot érvénytelennek kell tekinteni.
VII.3.3. Vizsgálati jelentés
Lásd az I.8. pontot.
VII.4. ADATLAP
Példa az adatlapra.
MITI (I) VIZSGÁLAT
|
1. |
LABORATÓRIUM |
|
2. |
A VIZSGÁLAT KEZDETÉNEK DÁTUMA |
3. VIZSGÁLT ANYAG
Név:
Törzsoldat-koncentráció: … mg/l, az anyagra vonatkoztatva
Kezdeti koncentráció a médiumban: … mg/l az anyagra vonatkoztatva
Reakciókeverék térfogata, V: … ml
ThOD: … mg O2/1
4. INOKULUM
Iszapminta-vételi helyek:
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
Szuszpendált szilárd anyagok koncentrációja az eleveniszapban mesterséges szennyvízzel végrehajtott akklimatizáció után = … mg/l
Eleveniszap térfogata 1 liter végső közegben = … ml
Szennyvíziszap koncentrációja a végső közegben = … mg/l
5. OXIGÉNFELVÉTEL: BIOLÓGIAI LEBONTHATÓSÁG
A vizsgálathoz használt respirométer típusa:
|
|
Idő (nap) |
||||||
|
0 |
7 |
14 |
21 |
28 |
|||
|
O2-felvétel (mg), vizsgált anyag |
a1 |
|
|
|
|
|
|
|
a2 |
|
|
|
|
|
||
|
a3 |
|
|
|
|
|
||
|
O2-felvétel (mg), vakpróba |
b |
|
|
|
|
|
|
|
Korrigált O2-felvétel (mg) |
(a1 - b) (a2 - b) (a3 - b) |
|
|
|
|
|
|
|
BOD mg vizsgált anyagonként |
|
1. lombik |
|
|
|
|
|
|
2. lombik |
|
|
|
|
|
||
|
3. lombik |
|
|
|
|
|
||
|
% lebomlás
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
||
|
3 |
|
|
|
|
|
||
|
Átlag (9) |
|
|
|
|
|
||
Megjegyzés: Hasonló formátumok használhatók a referenciavegyülethez.
6. SZÉNANALÍZIS (választható)
Szénanalizátor:
|
Lombik |
DOC |
% DOC-csökkenés |
Átlag |
|||
|
Mért |
Korrigált |
|||||
|
Viz + vizsgált anyag |
a |
|
|
|
— |
— |
|
Iszap + vizsgált anyag |
bl |
|
bl – c |
|
|
|
|
Iszap + vizsgált anyag |
b2 |
|
b2 – c |
|
|
|
|
Iszap + vizsgált anyag |
b3 |
|
b3 – c |
|
|
|
|
Kontrollvakpróba |
c |
|
— |
|
— |
— |

7. SPECIFIKUS KÉMIAI ELEMZÉSBŐL SZÁRMAZÓ ADATOK
|
|
Vizsgált anyag maradékmennyisége a vizsgálat végén |
% lebomlás |
|
Vakpróba vizsgálat vízzel |
sb |
|
|
Beoltott közeg |
Sa1 |
|
|
Sa2 |
|
|
|
Sa3 |
|

Ki kell számítani a % lebomlást az al-es, a2-es, illetve a3-as lombikhoz.
8. MEGJEGYZÉSEK
Mellékelni kell az idő függvényében felrajzolt BOD-görbét, ha az rendelkezésre áll.
1. függelék
RÖVIDÍTÉSEK ÉS FOGALOMMEGHATÁROZÁSOK
|
DO |
: |
Oldott oxigén: (mg/l) az oldott oxigén koncentrációja valamely vizes mintában. |
|
BOD |
: |
Biokémiai oxigénigény: valamely vizsgált vegyület metabolizálásakor a mikroorganizmusok által felhasznált oxigén mennyisége; g oxigénfelvétel/g vizsgált vegyületként kifejezve is használják, (lásd a C.5. módszert). |
|
COD |
: |
Kémiai oxigénigény (g): valamely vizsgált vegyületnek forró, savas, dikromáttal végrehajtott oxidálása során felvett oxigén mennyisége; megadja a jelen lévő oxidálható anyag mennyiségének mértékét; oxigénfelvétel (g)/vizsgált vegyület (g) formában is használják. (lásd a C.6. módszert). |
|
DOC |
: |
Oldott szerves szén: az oldatban jelen lévő szerves szén, amely átszűrhető 0,45 mikrométeres szűrőn, vagy 15 percig tartó 40 000 m.s–2 (±4 000 g) intenzitású centrifugálást követően a felülúszóban marad. |
|
ThOD |
: |
Elméleti oxigénigény (mg): valamely vegyi anyag teljes oxidálásához szükséges teljes oxigénmennyiség; a molekuláris képletből számítják ki (lásd a 2. függelék 2. pontját), és oxigénigény (mg)/vizsgált vegyület (mg) formában is használják. |
|
ThCO2 |
: |
Elméleti szén-dioxid-felszabadulás (mg): az a számított szén-dioxid-mennyiség, amelynek létre kell jönnie a vizsgált vegyület ismert vagy mért széntartalmából, a teljes ásványosodás során; fejlődött szén-dioxid (mg)/vizsgált vegyület (mg) formában is használják. |
|
TOC |
: |
Összes szerves szén: az oldatban és szuszpenzióban lévő szerves szén összege egy mintában. |
|
IC |
: |
Szervetlen szén. |
|
TC |
: |
Összes szén: a mintában jelen lévő szerves és szervetlen szén összege. |
Elsődleges biológiai lebonthatóság:
valamely anyag kémiai szerkezetében biológiai folyamattal okozott változás, amely ezen anyag speciális tulajdonságának elvesztését eredményezi.
Teljes biológiai lebonthatóság (aerob):
az a lebomlási szint, amikor a vizsgált vegyületet teljesen felhasználják a mikroorganizmusok szén-dioxid, víz, ásványi sók és új mikrobás, sejtalkotórészek (biomassza) létrejöttét eredményezve.
Biológiailag könnyen lebontható:
olyan vegyi anyagok tetszőleges kategorizálása, amelyek megfeleltek bizonyos, a teljes biológiai lebonthatóság meghatározott szűrési vizsgálatok követelményeinek; e vizsgálatok olyan szigorúak, hogy feltételezhető, hogy az ilyen vegyületek vizes környezetekben aerob körülmények között biológiailag gyorsan és teljesen lebomlanak.
Biológiailag potenciálisan lebontható:
azoknak a vegyi anyagoknak a kategorizálása, amelyek esetében valamilyen elfogadott biológiai lebonthatóság vizsgálata során egyértelműen bizonyított a biológiai lebonthatóság (elsődleges vagy teljes).
Kezelhetőség:
biológiai szennyvízkezelés során vegyületek eltávolítás szempontjából történő kezelhetősége, anélkül, hogy káros hatással lennének a kezelési folyamat normál működésére. Általában a biológiailag gyorsan lebontható vegyületek kezelhetők, de nem minden biológiailag potenciálisan lebontható vegyület kezelhető. Abiotikus folyamatok is végbemehetnek.
Fáziskésés
valamely lebonthatósági vizsgálatban a beoltástól kezdődő és addig terjedő időtartam, amíg a lebomlási százalék legalább 10 %-ra növekedett. A fáziskésés gyakran nagyon változékony, és gyengén reprodukálható.
Lebomlási idő
a fáziskésés végétől kezdődő és addig tartó időtartam, amikor a lebomlás elérte a legnagyobb szintjének 90 %-át.
Tíznapos ablak
a 10 %-os lebomlás elérését közvetlenül követő 10 nap.
2. függelék
MEGFELELŐ ÖSSZEFOGLALÓ PARAMÉTEREK KISZÁMÍTÁSA ÉS MEGHATÁROZÁSA
A választott módszertől függően, szükség lesz bizonyos összefoglaló paraméterekre. A következő szakasz ezen értékek levezetését írja le. E paraméterek használatát az egyes módszerek ismertetik.
1. Széntartalom
A széntartalom az ismert elemi összetételből számítható ki, vagy a vizsgált anyag elemi analízise határozza meg.
2. Elméleti oxigénigény (ThOD)
Az elméleti oxigénigény (ThOD) kiszámítható, ha ismert vagy elemi analízissel meghatározásra került az elemi összetétel. A következő vegyület esetében:
CcHhClclNnNanaOoPpSs
nitrifikáció nélkül,
 mg/mg
mg/mg
vagy nitrifikációval,
 mg/mg
mg/mg
3. Kémiai oxigénigény (COD)
A kémiai oxigénigényt (COD) a C.6. módszernek megfelelően kell meghatározni.
4. Oldott szerves szén (DOC)
Az oldott szerves szén (DOC): bármely vegyi anyagnak vagy vizes keveréknek egy 0,45 mikrométeres szűrőn átszűrhető szerves szén része.
A vizsgálati tartályokból mintákat vesznek, és a mintákat azonnal átszűrik megfelelő membránszűrő segítségével. A szűrlet első 20 ml-jét (a mennyiség csökkenthető kisméretű szűrők használatakor) elvetik. Befecskendezés esetén 10–20 ml-t vagy ennél kevesebbet (a térfogat a szénanalizátorhoz szükséges mennyiségtől függ) megőriznek a szén elemzéséhez. A DOC-koncentrációt olyan szervesszén-analizátor segítségével határozzák meg, amely a vizsgálatban használt kezdeti DOC-koncentráció 10 %-ával egyenértékű, vagy annál kisebb szénkoncentráció pontos mérésére képes.
Azok a szűrt minták, amelyek nem elemezhetők ugyanazon a munkanapon, hűtőszekrényben, 2–4 oC-os hőmérsékleten 48 óráig vagy –18 oC-os hőmérséklet alatt ennél hosszabb ideig tárolhatók.
Megjegyzések:
A membránszűrőket gyakran impregnálják felületaktív anyagokkal a hidrofilizáció biztosítására. Így tehát a szűrő akár több mg olyan oldható szerves szenet is tartalmazhat, amely befolyásolhatja a biológiai lebonthatósági vizsgálat eredményeit. A felületaktív anyagok és más, oldható szerves vegyületek eltávolíthatók a szűrőkről három, egyenként egyórás időtartamon keresztül deionizált vízben történő forralással. A szűrők ezután egy héten át vízben tárolhatók. Eldobható szűrőbetétek használatakor minden egyes adagot ellenőrizni kell, meg kell győződni arról, hogy nem szabadít-e fel oldható szerves szenet.
A membránszűrő típusától függően adszorpció útján visszamaradhat a vizsgált vegyi anyag. Ezért ajánlott ezt megelőzni.
Szűrés helyett 15 percen át 40 000 m.sec–2 (4 000 g) melletti centrifugálás alkalmazható a TOC és DOC megkülönböztetésére. Ez a módszer nem megbízható 10 mg DOC/1 alatti kezdeti koncentrációnál, mivel vagy nem távozik el minden baktérium, vagy újraoldódik a szén a baktériumplazma részeként.
SZAKIRODALOM
|
— |
Standard Methods for the Examination of Water and Wastewater, 12th edition, Am. Pub. H1th. Ass., Am. Wat. Poll. Control Fed., Oxygen Demand, 1965, 65. |
|
— |
Wagner, R., Von Wasser, 1976, vol. 46, 139. |
|
— |
DIN-Entwurf 38409 Teil 41 – Deutsche Einheitsverfahren zur Wasser-, Abwasser-und Schlammuntersuchung, Summarische Wirkungs- und Stoffkenngröβen (Gruppe H). Bestimmung des Chemischen Sauerstoffbedarfs (CSB) (H 41), NormenausschuB Wasserwesen (NAW) in DIN Deutsches Institut für Normung e. V. |
|
— |
Gerike, P., The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13 (1), 169. |
3. függelék
ROSSZUL OLDHATÓ ANYAGOK BIOLÓGIAI LEBONTHATÓSÁGÁNAK FELMÉRÉSE
A rosszul oldható anyagokkal végrehajtott biológiai lebonthatósági vizsgálatokban a következő szempontoknak kell különleges figyelmet szentelni.
Míg a homogén folyadékok ritkán járnak mintavételi problémákkal, ajánlatos a szilárd anyagokat megfelelő eszközökkel homogenizálni a homogenitás hiánya miatti hibák elkerülésére. Különleges gondossággal kell eljárni, amikor vegyi anyagok keverékeiből vagy nagymennyiségű szennyeződéseket tartalmazó anyagokból néhány mg-nyi reprezentatív minta szükséges.
A vizsgálatok során különböző formájú keverés használható. Gondosan kell eljárni, csak olyan mértékű keverést szabad alkalmazni, amely éppen elegendő a vegyi anyag diszpergált állapotban tartásához, és amelynél nem lép fel túlmelegedés, túlzott habzás vagy a baktériumok mechanikai károsodása.
A vegyi anyag stabil diszperzióját létrehozó emulgeálószer használható. Ez nem lehet toxikus a baktériumra, és a vizsgálati körülmények között nem szabad biológiailag lebomlania vagy habzást okoznia.
Az oldószerekre ugyanaz a követelmény érvényes, mint az emulgeálószerekre.
Nem ajánlott szilárd hordozóanyagok használata szilárd vizsgált anyagokhoz, ezek olajos anyagokhoz lehetnek alkalmasak.
Segédanyagok, ilyenek például az emulgeálószerek, oldószerek és hordozóanyagok használatakor segédanyag-vakpróbát kell végrehajtani.
A három respirometriás vizsgálat – CO2, BOD, MITI – közül bármelyik használható a rosszul oldható vegyületek biológiai lebonthatóságának vizsgálatára.
SZAKIRODALOM
|
— |
de Morsier, A. et. al., Biodegradation tests for poorly soluble compounds. Chemosphere, 1987, vol. 16, 833. |
|
— |
Gerike, P., The Biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13, 169. |
4. függelék
AZ OLTÓANYAGRA FELTEHETŐEN TOXIKUS VEGYI ANYAGOK BIOLÓGIAI LEBONTHATÓSÁGÁNAK FELMÉRÉSE
Amennyiben valamely vegyi anyagot könnyű biológiai lebonthatóság vizsgálatának vetik alá, és úgy tűnik, hogy biológiailag nem lebontható, a következő eljárás ajánlatos, amennyiben különbséget kell tenni a gátlás és a közömbösség között. (Reynolds és munkatársai, 1987)
Hasonló vagy azonos oltóanyagot kell használni a toxicitás- és a biológiai lebonthatósági vizsgálatokhoz.
A könnyű biológiai lebonthatóság megállapítására irányuló vizsgálatokban vizsgált vegyi anyagok toxicitásának értékeléséhez az iszaplégzésintenzitás-gátlási (aktivált szennyvíziszap légzésgátlási vizsgálata – 88/302/EGK irányelv), BOD- és/vagy növekedésgátló módszerek vagy ezek kombinációjának alkalmazása tűnik megfelelőnek.
Amennyiben el kell kerülni a toxicitásra visszavezethető gátlást, ajánlott a biológiailag gyors lebonthatóság megállapítására végrehajtott vizsgálatot a toxicitásvizsgálatban kapott EC50-es értékek 1/10-ét (vagy az EC20-értékeknél kisebbet) el nem érő vizsgálatianyag-koncentrációt alkalmazni. 300 mg/l-nél nagyobb EC50-es értékű vegyületek nem valószínű, hogy toxikus hatással rendelkeznek a biológiailag gyors lebonthatóság vizsgálatában.
A 20 mg/l-nél kisebb EC50-értékek valószínűleg súlyos problémákat jelentenek a későbbi vizsgálat esetében. Alacsony vizsgálati koncentrációkat kell alkalmazni, amely szükségessé teszi a szigorú és érzékeny zártpalack-vizsgálat használatát vagy a 14C – címkézésű anyag használatát. Más megoldásként, valamely akklimatizált oltóanyag a vizsgált anyag magasabb koncentrációjának használatát teheti lehetővé. Az utóbbi esetben azonban elvész a biológiailag könnyű lebonthatóság vizsgálatának különös követelménye.
SZAKIRODALOM
Reynolds, L. et. al., Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 1987, vol. 16, 2259.
5. függelék
A NITRIFIKÁCIÓ OKOZTA OXIGÉNFELVÉTEL FIGYELEMBEVÉTELE
Nitrogént nem tartalmazó vizsgált anyagok biológiai lebonthatóságának oxigénfelvétellel történő értékelésében a nitrifikáció figyelmen kívül hagyása miatti hibák kismértékűek (5 %-nál nem nagyobbak) még akkor is, ha az oldószerben lévő ammónium-N oxidációja ingadozik a vizsgálati anyagot tartalmazó és a vakpróbatartályok között. Nitrogéntartalmú vizsgált anyagok esetében azonban súlyos hibák jelentkezhetnek.
Amennyiben a nitrifikáció bekövetkezett, de ez nem teljes, a reakciós keverék mért oxigénfelvétele helyesbíthető az ammónium nitritté és nitráttá oxidálásában felhasznált oxigén mennyiségével, ha a nitrit és a nitrát inkubálása során a koncentrációváltozásokat a következő egyenletek segítségével határozzák meg:
|
2 NH4Cl + 3O2 = 2 HNO2 + 2 HCl + 2 H2O |
(1) |
|
2 HNO2 + O2 = 2 HNO3 |
(2) |
|
Teljes: |
|
|
2 NH4Cl + 4 O2 = 2 HNO3 + 2 HCl + 2 H2O |
(3) |
Az (1) egyenletből az ammónium-kloridban (NH4C1) lévő 28 g nitrogén oxigénfelvétele a nitritté oxidálódás során 96 g, azaz a szorzótényező 3,43 (96/28). Hasonlóképpen a (3) egyenletből látható, hogy a 28 g nitrogén oxigénfelvétele, miközben nitráttá oxidálódik, 128 g, vagyis a szorzótényező 4,57 (128/28).
Mivel a reakciók szekvenciálisak, amelyeket meghatározott és egymástól különböző baktériumfajták hajtanak végre, lehetőség van a nitrit koncentrációjának növelésére vagy csökkentésére; az utóbbi esetben létrehozható a nitrát egyenértékű koncentrációja. Így a nitrátképződés során felhasznált oxigén értéke 4,57, szorozva a nitrát koncentrációjának növekedésével, míg a nitrit képződésével kapcsolatos oxigén értéke 3,43, szorozva a nitrit koncentrációjának növekedésével, vagy a koncentrációja csökkenése esetén az oxigénveszteség -3,43 szorozva a koncentráció csökkenéssel.
Azaz:
|
A nitrátképződés során felhasznált O2 = 4,57 * a nitrátkoncentráció növekedése |
(4) |
|
és |
|
|
Nitritképződés során felhasznált O2 = 3,43 * a nitritkoncentráció növekedése |
(5) |
|
és |
|
|
Nitritkoncentráció csökkenésekor az elvesztett O2 = -3,43 * a nitritkoncentráció csökkenése |
(6) |
|
úgy. hogy |
|
|
Nitrifikációból adódó O2-felvétel = ±3,43 * nitritkoncentráció-változás +4,57 * a nitrát-koncentráció növekedése |
(7) |
|
és így |
|
|
C-oxidációból adódó O2-felvétel = teljes megfigyelt felvétel – nitrifikációból adódó felvétel |
(8) |
Amennyiben csak a teljes oxidált nitrogént határozzák meg, a nitrifikáció miatti oxigénfelvétel első megközelítésben 4,57 x oxidált N-növekedés.
A C-oxidáció következtében létrejövő oxigénfelvétel helyesbített értékét ezután összehasonlítják a ThOD NH3-mal a 2. függelékben bemutatott számításnak megfelelően.
C.5. LEBOMLÁS – BIOKÉMIAI OXIGÉNIGÉNY
1. MÓDSZER
1.1. BEVEZETÉS
E módszer célja a szilárd vagy folyékony szerves anyagok biokémiai oxigénigényének (BOD) meghatározása.
A módszerrel kapott adatok vízben oldható vegyületekre vonatkoznak; azonban elvben illékony vegyületek és vízben kis mértékben oldható vegyületek is vizsgálhatók.
A módszer csak az olyan szerves anyagokhoz alkalmazható, amelyek a vizsgálatban használt koncentráció mellett nincsenek gátló hatással a baktériumokra. Amennyiben a vizsgált anyag a vizsgálati koncentráció mellett nem oldható, különleges intézkedéseket kell alkalmazni a vizsgált anyag megfelelő mértékű diszpergálása céljából, például az ultrahangos diszpergálás használatával.
A vizsgált anyag toxicitására vonatkozó információk hasznosaknak bizonyulhatnak az alacsony vizsgálati eredmények értelmezése és a megfelelő vizsgálati koncentráció kiválasztásában.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
A BOD: az adott anyagot tartalmazó oldat meghatározott mennyiségének meghatározott körülmények között biokémiai oxidációjához szükséges oldott oxigén tömege.
Az eredményeket BOD gramm/vizsgált anyag gramm formájában fejezik ki.
1.3. REFERENCIAANYAGOK
Célszerű megfelelő referenciaanyag használata az oltóanyag aktivitásának ellenőrzése érdekében.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Alkalmas oldószerben feloldott vagy diszpergált, előre meghatározott anyagmennyiséget mikroorganizmusokkal beoltanak, és sötét helyen, állandó, meghatározott környezeti hőmérsékleten inkubálnak.
A BOD-t az oldott oxigéntartalomnak a vizsgálat elején és végén mért különbségével határozzák meg. A vizsgálat időtartamának legalább 5 napnak és legfeljebb 28 napnak kell lennie.
E vizsgálattal párhuzamosan vizsgált anyagot nem tartalmazó vakpróbát kell elvégezni.
1.5. MINŐSÉGI KÖVETELMÉNYEK
A BOD-meghatározás nem tekinthető valamely anyag biológiai lebonthatósága érvényes meghatározásának. E vizsgálat csak screening-vizsgálatnak tekinthető.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Elkészítik az anyag oldatát vagy diszperzióját az alkalmazott módszerhez megfelelő BOD-koncentráció megállapítása érdekében. Ezután megfelelő nemzeti vagy nemzetközi szabvány alkalmazásával meghatározzák a BOD-t.
2. ADATOK ES ÉRTÉKELÉS
A kiválasztott standardizált módszernek megfelelően kiszámítják az induló oldat BOD-értékét, majd átszámítják ezt BOD (gramm)/vizsgált anyagra (gramm).
3. JELENTÉS
Meg kell adni az alkalmazott módszert.
A biokémiai oxigénigényt legalább három érvényes mérés átlagaként kell meghatározni.
Minden, az eredmények értelmezése szempontjából lényeges információt és megjegyzést meg kell adni, különös tekintettel az anyag szennyeződéseire, fizikai állapotára, toxikus hatásaira és jellemző összetételére, amely befolyásolhatja az eredményt.
A vizsgálati jelentésben fel kell tüntetni, ha a biológiai nitrifikáció gátlása céljából segédanyagot használnak.
4. SZAKIRODALOM
Szabványok jegyzéke, például:
|
|
NF T 90-103: Determination of the biochemical oxygen demand. |
|
|
NBN 407: Biochemical oxygen demand. |
|
|
NEN 3235 5.4: Bepaling van het biochemish zuurstofverbruik (BZV). |
|
|
The determination of biochemical oxygen demand, Methods for the examination of water and associated materials, HMSO, London. |
|
|
ISO 5815: Determination of biochemical oxygen demand after n days. |
C.6. LEBOMLÁS – KÉMIAI OXIGÉNIGÉNY
1. MÓDSZER
1.1. BEVEZETÉS
E módszer célja szilárd vagy folyékony szerves anyagok kémiai oxigénigényének (COD) mérése tetszőleges, standardizált módon megállapított laboratóriumi körülmények mellett.
Az anyag képletére vonatkozó információk hasznosak e vizsgálat végrehajtásához és a kapott eredmények értelmezéséhez (például klórozott szerves vegyületek, szerves vegyületek vassói, halogénsók).
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
A kémiai oxigénigény valamely anyag oxidálhatóságának a mértéke, meghatározott laboratóriumi körülmények között az anyag által felhasznált valamilyen oxidáló reagenssel egyenértékű oxigénmennyiségben kifejezve.
Az eredményt COD (gramm)/vizsgált anyag (gramm) formában fejezik ki.
1.3. REFERENCIAANYAGOK
Nem kell minden új anyag vizsgálatakor referenciaanyagokat alkalmazni. Ezeknek elsősorban a módszer megfelelőségének időnkénti ellenőrzésére és arra kell szolgálniuk, hogy lehetővé tegyék az összehasonlítást más módszerekkel kapott eredményekkel.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Vízben feloldott vagy diszpergált, előre meghatározott anyagmennyiséget oxidálnak erős kénsavoldatban lévő kálium-dikromáttal, ezüst-szulfátot használva katalizátorként, két órán át reflux mellett. Szabványosított, vas-ammónium-szulfáttal végrehajtott titrálással meghatározzák a maradék dikromátot.
Klórtartalmú anyagok esetében hozzáadnak higany-szulfátot (10), a klorid okozta zavaró hatás csökkentésére.
1.5. MINŐSÉGI KÖVETELMÉNYEK
A meghatározás tetszőleges módja miatt a COD-t „oxidálhatósági mérőszámnak” kell tekinteni, és mint ilyet, gyakorlati módszerként használják szerves anyag mérésére.
A klorid zavarhatja e vizsgálatot; továbbá a szervetlen redukáló- vagy oxidálószerek is befolyásolhatják a COD-meghatározást.
Néhány gyűrűs vegyületet és sok illékony anyagot (például alacsony szénatomszámú zsírsavak) nem teljesen oxidál ez a vizsgálat.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
Elkészítik az anyag oldatát vagy diszperzióját 250 és 600 mg/l közötti COD létrehozására.
Megjegyzések:
Rosszul oldódó és nem diszpergálható anyagok esetében kimérhető körülbelül 5 mg COD-nek megfelelő, finomra porított anyag vagy folyékony anyag, és vízzel együtt a kísérleti berendezésbe helyezhető.
Gyakran és különösen a rosszul oldódó anyagok esetében a kémiai oxigénigény (COD) előnyösen meghatározható a módszer egyik változatával, azaz egy nyomáskiegyenlítővel ellátott zárt rendszerben (H. Kelkenberg, 1975). E módosított változattal gyakran mennyiségileg sikeresen határozhatók meg azok a vegyületek, amelyek a hagyományos módszerrel csak nehezen határozhatók meg – ilyen például az ecetsav. Azonban ez a módszer sem alkalmas piridin esetében. Amennyiben az (1) szakirodalomban előírt módon a kálium-dikromát koncentrációt 0,25 N-re (0,0416 M) növelik, ez megkönnyíti az anyag 5–10 mg-os mennyiségének közvetlen bemérését, amely lényeges a vízben rosszul oldódó anyagok COD-értékének meghatározásához ((2) szakirodalom)).
A COD-t ezután valamilyen alkalmas nemzeti vagy nemzetközi szabványt követve kell meghatározni.
2. ADATOK ÉS ÉRTÉKELÉS
A kísérleti lombikban lévő COD-t a kiválasztott standardizált módszer segítségével kell kiszámítani és átszámítani COD (gramm)/vizsgált anyag (gramm) formába.
3. JELENTÉS
Meg kell adni a használt referencia-módszert.
A kémiai oxigénigényt legalább három mért érték középértékeként kell megadni. Minden, az eredmények értelmezése szempontjából lényeges információt és megjegyzést meg kell adni, különösen az anyag szennyeződéseivel, fizikai állapotával és jellemző tulajdonságaival kapcsolatosakat (amennyiben ismertek), amelyek hatással lehetnek az eredményekre.
Amennyiben a klorid befolyásoló hatásának minimalizálása céljából higany-szulfátot használnak, ezt is meg kell adni a vizsgálati jelentésben.
4. SZAKIRODALOM
|
(1) |
Kelkenberg, H., Z. von Wasser und Abwasserforschung, 1975, vol. 8, 146. |
|
(2) |
Gerike, P. The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13, 169. A szabványok jegyzéke, például:
|
C.7. LEBOMLÁS – ABIOTIKUS LEBOMLÁS: HIDROLÍZIS A PH FÜGGVÉNYÉBEN
1. MÓDSZER
Ez a vizsgálati módszer egyenértékű az OECD TG 111 (2004) vizsgálattal.
1.1. BEVEZETÉS
Vegyszerek többféle úton juthatnak a felszíni vizekbe: közvetlen bejuttatással, permetezett anyag elsodródásával, beömléssel, a csapadékvíz-elvezető rendszerből, hulladéklerakással, ipari, háztartási vagy mezőgazdasági szennyvizekkel, légköri lerakódás útján; a felszíni vizekbe jutó vegyszerek a vízben kémiai (pl. hidrolízis, oxidáció), fotokémiai és/vagy mikrobiális folyamatokkal átalakulhatnak. Ez az útmutató az (1) (2) (3) (4) (5) (6) (7) útmutatások alapján olyan laboratóriumi vizsgálati módszert mutat be, amely a környezetben rendszerint előforduló pH-értékek (4–9) mellett a vegyszerek vizes közegben lejátszódó abiotikus hidrolízises átalakulásának vizsgálatára alkalmas.
A vizsgálat célja i. a pH-érték függvényében a vizsgált anyag hidrolízissebességének meghatározása; ii. azon hidrolízistermékek mibenlétének, illetőleg képződési és csökkenési sebességének meghatározása, amelyekkel élő szervezetek találkozhatnak. Ezekre a vizsgálatokra olyan vegyi anyagok esetében lehet szükség, amelyek közvetlenül a vízbe jutnak, illetőleg az említett más módokon a környezetbe kerülhetnek.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
A 2. függelék szerint.
1.3. A MÓDSZER ALKALMAZHATÓSÁGA
A módszer általában olyan (jelzés nélküli vagy jelölt) vegyi anyagokra alkalmazható, amelyek kimutatására megfelelő pontosságú és érzékenységű analitikai módszer áll rendelkezésre. Enyhén illékony és nem illékony, vízben megfelelően oldható vegyületekre egyaránt alkalmazható. A módszert nem szabad olyan vegyi anyagokra alkalmazni, amelyek vízben fokozottan illékonyak (pl. gáznemű növényvédő szerek, szerves oldószerek), ezért a vizsgálat során érvényesülő kísérleti körülmények között nem tarthatók oldatban. A vizsgálat nehezen végezhető vízben csekély mértékben oldódó anyagokkal (8).
1.4. A VIZSGÁLATI MÓDSZER ELVE
Különböző pH-értékű (4, 7 és 9) steril vizes pufferoldatokat a vizsgálandó anyaggal kezelünk, majd sötétben, ellenőrzött laboratóriumi körülmények között (állandó hőmérsékleten) inkubáljuk őket. A pufferoldatokban lévő vizsgált anyagot és a hidrolízistermékeket megfelelő időközönként elemezzük. A tömegmérleg könnyebben meghatározható, ha a vizsgált anyag jelölt (pl. 14C-vel).
A vizsgálati módszer többfokozatú, működését az 1. függelék mutatja be és magyarázza el. Az egyes fokozatok szükségességét a megelőző fokozat eredményei határozzák meg.
1.5. INFORMÁCIÓK A VIZSGÁLT ANYAGRÓL
A hidrolízis sebességének mérése jelzés nélküli vagy jelölt anyagon végezhető el. A jelölt anyag általában a hidrolízis folyamatának tanulmányozása és a tömegmérleg megállapítása szempontjából előnyös, ugyanakkor speciális esetekben a jelölés nem feltétlenül szükséges. A jelölést 14C-vel célszerű végezni, de más izotóp, például 13C, 15N vagy 3H is alkalmazható. Amennyire csak lehet, a jelölést a molekula legstabilabb részében vagy részeiben kell elhelyezni. Ha például a vizsgált anyag egygyűrűs, akkor a jelölést ebben a gyűrűben kell elhelyezni; ha a vizsgált anyag két vagy több gyűrűt tartalmaz, akkor célszerű lehet külön vizsgálatok révén tanulmányozni az egyes jelölt gyűrűk sorsát, hogy megfelelő információkat nyerjünk a hidrolízistermékek képződéséről. A vizsgálandó anyag tisztasága legyen legalább 95 %.
A hidrolízisvizsgálat elvégzéséhez ismerni kell a vizsgált anyag:
|
a) |
vízben való oldhatóságát (A.6. vizsgálati módszer); |
|
b) |
szerves oldószerekben való oldhatóságát; |
|
c) |
gőznyomását (A.4. vizsgálati módszer) és/vagy Henry-állandóját; |
|
d) |
n-oktanol/víz megoszlási együtthatóját (A.8. vizsgálati módszer); |
|
e) |
disszociációállandóját (pKa) (OECD 112. útmutató) (9); |
|
f) |
közvetlen és közvetett fototranszformációjának sebességét vízben (szükség esetén). |
Rendelkezésre kell állniuk a vizsgált anyag mennyiségi meghatározására, valamint szükség szerint a vizes oldatokban keletkező hidrolízistermékek mibenlétének és mennyiségének meghatározására alkalmas analitikai módszereknek (lásd még az 1.7.2. szakaszt).
1.6. REFERENCIAANYAGOK
A hidrolízistermékek mibenlétének és mennyiségének spektroszkopikus és kromatográfiás vagy egyéb, kellő érzékenységű módszerekkel történő meghatározásához lehetőség szerint referenciaanyagokat kell használni.
1.7. MINŐSÉGI KRITÉRIUMOK
1.7.1. Visszanyerés
A vizsgált anyag hozzáadását követően azon nyomban, legalább két párhuzamos pufferoldaton vagy kivonaton végzett elemzés kiindulási információval szolgál az analitikai módszer megismételhetőségéről és a vizsgált anyag bevitelére alkalmazott eljárás egységességéről. A vizsgálat későbbi fázisaiban a visszanyerést a tömegmérlegek adják meg (jelölt anyag használata esetén). Jelölt és nem jelölt anyagok esetén a visszanyerésértékeknek 90 % és 110 % között kell lenniük (7). Ha műszakilag nehéz ezt a tartományt elérni, akkor nem jelölt anyag esetén kellő indoklással 70 %-os visszanyerés is elfogadható.
1.7.2. Az analitikai módszer megismételhetősége és érzékenysége
A vizsgált anyag és a hidrolízistermékek mennyiségi meghatározására alkalmazott analitikai módszer(ek) megismételhetősége utólag úgy ellenőrizhető, hogy akkor, amikor már a mennyiségek meghatározásához elegendő hidrolízistermék keletkezett, ugyanazt a pufferoldatot (vagy kivonatát) ismételt elemzésnek vetjük alá.
Az analitikai módszer érzékenységének olyannak kell lennie, hogy a vizsgált anyag mennyiségének meghatározását akkor is biztosítsa, amikor annak koncentrációja a kezdeti koncentráció 10 %-ára vagy még kisebb értékre lecsökkent. Az adott esetnek megfelelően az analitikai módszereknek olyan érzékenységűnek kell lenniük, hogy (a vizsgálat során bármikor) a csúcskoncentráció 25 %-áig vagy egy annál kisebb értékig lehetővé tegyék az alkalmazott dózis legalább 10 %-át kitevő hidrolízistermékek mennyiségének meghatározását.
1.7.3. A hidrolízis kinetikai adatainak konfidenciaintervalluma
Minden regressziós együttható, reakciósebességi állandó, felezési idő és bármilyen más kinetikai paraméter (pl. DT50) esetében ki kell számítani és be kell mutatni a konfidenciaintervallumokat.
1.8. A VIZSGÁLT MÓDSZER LEÍRÁSA
1.8.1. Készülékek és műszerek
A vizsgálatokat szükség szerint üvegedényekben (pl. kémcsövekben, kis palackokban) kell elvégezni sötét és steril körülmények között, kivéve akkor, ha korábbról olyan információk állnak rendelkezésre (például az n-oktanol/víz megoszlási együttható alapján), hogy a vizsgált anyag az üveghez tapadhat. Ilyenkor célszerű lehet megfontolni más anyag (például teflon) alkalmazását. Az üveghez tapadás problémája a következő módszerek valamelyikével vagy egyszerre többel is csökkenthető lehet:
|
— |
a vizsgálati edényhez szorbeálódott hidrolízistermékek és a vizsgált anyag tömegének meghatározásával, |
|
— |
ultrahangos fürdő alkalmazásával, |
|
— |
az egyes mintavételek időpontjában az üvegedények oldószerrel történő elmosásával, |
|
— |
formulázott termékek használatával, |
|
— |
több társoldószer alkalmazásával a vizsgált anyag rendszerhez adagolásakor (az alkalmazott társoldószer nem hidrolizálhatja a vizsgált anyagot). |
A különböző vizsgálati oldatok inkubálásához rendszerint szabályozott hőmérsékletű vízfürdőrázóra vagy termosztatikusan szabályozott inkubátorra van szükség.
Standard laboratóriumi felszerelés szükséges, beleértve különösen a következőket:
|
— |
pH-mérő, |
|
— |
analitikai eszközök, mint például GC-, HPLC-, TLC-berendezés, beleértve a radioaktív és nem jelölt anyagok elemzésére alkalmas, illetve az inverz izotópos hígításos módszerben szükséges kimutatási rendszereket, |
|
— |
az anyagok mibenlétének meghatározására alkalmas eszközök (pl. MS, GC-MS, HPLC-MS, NMR stb.), |
|
— |
folyadékszcintillációs számláló, |
|
— |
választótölcsérek a folyadék-folyadék extrakcióhoz, |
|
— |
műszerek oldatok és kivonatok koncentrálására (pl. forgó bepárló), |
|
— |
hőmérséklet-szabályozó eszköz (pl. vízfürdő). |
A kémiai reagensek között szükség van például:
|
— |
analitikai tisztaságú szerves oldószerekre: hexánra, diklór-metánra stb., |
|
— |
szcintillációs folyadékra, |
|
— |
pufferoldatokra (részletesebben lásd az 1.8.3. szakaszban). |
A hidrolízis során használt minden üveget, reagens tisztaságú vizet és pufferoldatot sterilizálni kell.
1.8.2. A vizsgált anyag bevitele
A vizsgált anyagot vizes oldat formájában kell a különböző pufferoldatokba bevinni (lásd a 3. függeléket). Ha a megfelelő oldódáshoz szükséges, a vizsgált anyag beviteléhez kis mennyiségű, vízzel elegyedő oldószer (pl. acetonitril, aceton, etanol) is felhasználható, de ennek mennyisége rendszerint legfeljebb 1 térfogatszázalék lehet. Nagyobb koncentrációjú oldószer alkalmazása csak akkor engedhető meg (például rosszul oldódó vizsgált anyag esetén), ha kimutatható, hogy az oldószernek nincs hatása a vizsgált anyagok hidrolízisére.
Formulázott terméket rutinszerűen nem ajánlatos használni, mivel nem zárható ki, hogy a formulázási összetevők befolyásolják a hidrolízis folyamatát. Ugyanakkor vízben rosszul oldódó vizsgált anyag vagy az üveghez hozzátapadó anyag esetében (lásd az 1.8.1. szakaszt) a formulázott anyag megfelelő alternatívát jelenthet.
A vizsgált anyagból egyetlen koncentrációt kell használni; ez a koncentráció nem haladhatja meg a 0,01 M-t vagy a telítettségi koncentráció felét (lásd az 1. függeléket).
1.8.3. Pufferoldatok
A hidrolízisvizsgálatot három pH-értéken kell végrehajtani: 4, 7 és 9. Ehhez reagens tisztaságú vegyi anyagok és víz felhasználásával pufferoldatokat kell készíteni. A 3. függelék bemutat néhány hasznos pufferrendszert. Megjegyzendő, hogy az alkalmazott pufferrendszer hatással lehet a hidrolízis sebességére, ezért ha ilyen hatást észlelünk, akkor másik pufferrendszert kell igénybe venni (11).
Az egyes pufferoldatok pH-értékét kalibrált pH-mérővel az előírt hőmérsékleten legalább 0,1 pH pontossággal ellenőrizni kell.
1.8.4. Vizsgálati körülmények
1.8.4.1. Vizsgálati hőmérséklet
A hidrolízisvizsgálatokat állandó hőmérsékleteken kell elvégezni. Az extrapoláció szempontjából fontos, hogy a hőmérséklet ±0,5 oC-os tartományon belül maradjon.
Ha a vizsgált anyag hidrolitikus viselkedése nem ismert, 50 oC-os hőmérsékleten elővizsgálatot (1. fokozat) kell végezni. A magasabb fokozatú kinetikai vizsgálatokat legalább három hőmérsékleten (beleértve az 50 oC-on elvégzett vizsgálatot is) kell elvégezni, kivéve akkor, ha az 1. fokozatú vizsgálatban a vizsgált anyag hidrolízis szempontjából stabilnak mutatkozott. Hőmérséklet-tartományként 10–70 oC-ot javaslunk (lehetőleg legalább egy hőmérsékletérték 25 oC-nál kisebb legyen), ugyanis ebben a tartományban mind a 25 oC-os referenciahőmérséklet, mind a területen előforduló legtöbb hőmérséklet megtalálható.
1.8.4.2 Fényviszonyok és oxigén
A hidrolízisvizsgálatok során a fotolitikus hatásokat tetszőleges, erre alkalmas módszerrel ki kell zárni. Mindent meg kell tenni az oxigén elkerülése érdekében (például az oldat elkészítése előtt 5 percig hélium, nitrogén vagy argon buborékoltatásával).
1.8.4.3. A vizsgálat időtartama
Az elővizsgálatot 5 napig, a magasabb fokozatú vizsgálatokat a vizsgált anyag 90 %-os hidrolizálásáig, de legfeljebb 30 napig kell végezni.
1.8.5. A vizsgálat végrehajtása
1.8.5.1. Elővizsgálat (1. fokozat)
Az elővizsgálatot 50 ± 0,5 oC-on és 4,0, 7,0 és 9,0 pH-értékeken végezzük. Ha 5 nap után a hidrolízis mértéke 10 %-nál kisebb (t0,5 25 oC > 1 év), akkor a vizsgált anyag hidrolízis szempontjából stabilnak tekintendő, és rendszerint nincs szükség további vizsgálatokra. Ha tudjuk, hogy az anyag környezeti szempontból releváns hőmérsékleteken instabil (12), akkor az elővizsgálatot nem kell elvégezni. Az analitikai módszernek kellő pontosságúnak és érzékenységűnek kell lennie ahhoz, hogy a kezdeti koncentráció 10 %-os csökkenése kimutatható legyen.
1.8.5.2. Instabil anyagok hidrolízise (2. fokozat)
A magasabb fokozatú (részletesebb) vizsgálatot azokon a pH-értékeken kell elvégezni, amelyeken a vizsgált anyag a fenti elővizsgálatban instabilnak mutatkozott. A vizsgált anyag pufferelt oldatait a kiválasztott hőmérsékleteken kell tartani. Az elsőrendű viselkedés vizsgálatához minden reakcióoldatot rendesen olyan időközönként kell elemezni, hogy a vizsgált anyag 10 %-os és 90 %-os hidrolízise között legalább hat, egymástól kellő távolságban elhelyezkedő adatpontot kapjunk. Az egyes párhuzamos vizsgálati mintákat (külön reakcióedényekben tartott legalább két azonos mintát) legalább hat-hat mintavételi időpontban ki kell venni az edényből, és mindegyik minta tartalmát elemezni kell (így legalább tizenkét párhuzamos adatpontot nyerünk). Nem helyes eljárás, ha a párhuzamos mintákat egyetlen nagy minta egyenlő részekre osztásával állítjuk elő, és ezeket vizsgáljuk az egyes mintavételi időpontokban, mert ily módon nincs lehetőség az adatok változatosságának elemzésére, és a vizsgálati oldat szennyeződése is problémát jelenthet. A magasabb fokozat végén (azaz a 90 %-os hidrolízis elérése után vagy 30 nap elteltével) külön vizsgálattal ellenőrizni kell a sterilitást. Ha azonban bomlást (átalakulást) nem tapasztalunk, a sterilitást nem szükséges külön vizsgálni.
1.8.5.3. A hidrolízistermékek meghatározása (3. fokozat)
Minden olyan hidrolízisterméket, amely legalább az alkalmazott dózis 10 %-ának megfelelő mennyiségben keletkezik, megfelelő analitikai módszerrel azonosítani kell.
1.8.5.4. Kiegészítő vizsgálatok
Hidrolízis szempontjából instabil vizsgált anyag esetében szükséges lehet a 4, 7 és 9 pH-értéktől eltérő pH-értékeken is vizsgálatokat végezni. Fiziológiai megfontolásból például előfordulhat, hogy savasabb körülmények (pl. pH =1,2) közötti, fiziológiai szempontból releváns hőmérsékleten (37 oC) is kell vizsgálatot végrehajtani.
2. ADATOK
A vizsgált anyagok és a hidrolízistermékek (ha vannak) mennyiségét minden mintavételi időpontra, minden pH-értékre és hőmérsékletre vonatkozóan az alkalmazott kezdeti koncentráció százalékában, illetőleg szükség szerint mg/l-ben is meg kell adni. Jelölt vizsgált anyag esetén az alkalmazott kezdeti koncentráció százalékában a tömegmérleget is meg kell adni.
A jegyzőkönyvben a vizsgált anyag koncentrációinak értékét grafikusan, az idő függvényében logaritmikus léptékben ábrázolva kell megadni. Meg kell határozni a legalább az alkalmazott dózis 10 %-ának megfelelő mennyiségben keletkező hidrolízistermékek mibenlétét, és a vizsgált anyag mennyiségeit jelző koordináta-rendszerben logaritmikus léptékben ábrázolni kell mennyiségüket, ezzel szemléltetve keletkezésük és csökkenésük sebességét.
2.1. AZ EREDMÉNYEK FELDOLGOZÁSA
Megfelelő kinetikai modellszámításokkal a felezési időt vagy a DT50 értékét pontosabban is meg kell határozni. A felezési idő, illetve a DT50 értékét (konfidenciahatárokkal együtt) minden pH-értékre és hőmérsékletre meg kell adni, és ismertetni kell a felhasznált modellt, a kinetikai rendet és a korrelációs együtthatót (r2). Ha vannak, a számításokat a hidrolízistermékekre is el kell végezni.
Ha a sebességértékek különböző hőmérsékleteken elvégzett vizsgálatokból származnak, akkor a hidrolízis pszeudo-elsőrendű reakciósebességi állandóját (kobs) a hőmérséklet függvényében kell leírni. A számítást a kobs savas katalizált, közömbös és lúgos katalizált hidrolízishez tartozó sebességi állandókra (rendre kH, kneutral, és kOH) történő bontásával, az Arrhenius-egyenlet alapján kell elvégezni:

ahol Ai és Bi a kelvinben megadott T abszolút hőmérséklet reciproka függvényében ábrázolt ln ki értékekre lineáris regresszióval fektetett egyenesek regressziós állandói (metszete, illetve meredeksége). Az Arrhenius-összefüggést a savas katalizált, a közömbös és a lúgos katalizált hidrolízisre alkalmazva a pszeudo-elsőrendű reakciósebességi állandók, és így a felezési idők olyan hőmérsékletekre is előállíthatók, amelyek esetében nincs mód a reakciósebességi állandó közvetlen kísérleti meghatározására (10).
2.2. AZ EREDMÉNYEK ÉRTÉKELÉSE ÉS ÉRTELMEZÉSE
A legtöbb hidrolízisreakció jó közelítéssel elsőrendű folyamat, tehát a felezési idő független a koncentrációtól (lásd a 2. függelék 4. egyenletét). Ez rendszerint lehetőséget ad arra, hogy a laboratóriumban 10–2-től 100–3 M nagyságrendű koncentrációval nyert eredményekből következtessünk a környezetben előforduló értékekre (ahol a koncentrációk 10–6 vagy az alatti nagyságrendűek) (10). Mabey és Mill (11) több olyan esetről is beszámolt, amikor különböző vegyi anyagok esetében megfelelő egyezést tapasztaltak a hidrolízis tiszta és természetes vizekben mért reakciósebessége tekintetében, feltéve hogy mind a pH-értéket, mind a hőmérsékletet mérték.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek legalább a következő információkat kell tartalmaznia:
Vizsgált anyag:
|
— |
közhasználatú név, kémiai név, CAS-szám, szerkezeti képlet (radioaktívan jelölt anyag esetén a jelzés helyének feltüntetésével) és a releváns fizikai-kémiai tulajdonságok (lásd az 1.5. szakaszt), |
|
— |
a vizsgált anyag tisztasága (szennyeződések), |
|
— |
a jelölt vegyi anyag tisztasága és moláris aktivitása (ha szükséges). |
|
— |
Pufferoldatok: |
|
— |
a készítés dátuma és részletes adatai, |
|
— |
alkalmazott puffer és víz, |
|
— |
a pufferoldatok molaritása és pH-ja. |
A vizsgálat körülményei:
|
— |
a vizsgálatok elvégzésének napja és a végrehajtás módja, |
|
— |
a bevitt vizsgált anyag mennyisége, |
|
— |
a vizsgált anyag bevitelének módszere, az oldószerek (típus és mennyiség), |
|
— |
a vizsgált anyag inkubált pufferolt oldatainak térfogata, |
|
— |
az alkalmazott inkubációs rendszer leírása, |
|
— |
pH és hőmérséklet a vizsgálat alatt, |
|
— |
mintavételi időpontok, |
|
— |
az extrakció módszere(i), |
|
— |
a pufferoldatokban lévő vizsgált anyag és hidrolízistermékek mennyiségének és mibenlétének meghatározására alkalmazott módszerek, |
|
— |
a párhuzamos minták száma. |
Eredmények:
|
— |
az alkalmazott analitikai módszer megismételhetősége és érzékenysége, |
|
— |
a visszanyert mennyiségek (a vizsgálat érvényességéhez szükséges százalékértékeket az 1.7.1. szakasz adja meg), |
|
— |
a párhuzamos minták adatai és átlaguk táblázatos formában, |
|
— |
tömegmérleg a vizsgálatok alatt és végén (jelölt vizsgált anyag esetén), |
|
— |
az elővizsgálat eredményei, |
|
— |
az eredmények szöveges elemzése és értelmezése, |
|
— |
valamennyi eredeti adat és ábra. |
A következő információkat csak akkor kell megadni, ha a hidrolízis sebességét is meghatározzuk:
|
— |
a vizsgált anyag koncentrációinak ábrázolása az idő függvényében, és ha van, a vizsgált hidrolízistermékek ábrázolása minden pH-értéken és hőmérsékleten, |
|
— |
a 20 oC/25 oC hőmérsékletre vonatkozó Arrhenius-egyenlet eredményei táblázatban összefoglalva, a pH, a reakciósebességi állandó [tf–1 vagy nap–1], a felezési idő vagy a DT50-érték, a hőmérsékletek [ oC], továbbá mindezen adatok konfidenciahatárai és korrelációs együtthatói (r2) vagy más hasonló adatai, |
|
— |
a hidrolízis vélt folyamata. |
4. HIVATKOZÁSOK
|
(1) |
OECD (1981). Hydrolysis as a Function of pH. OECD Guideline for Testing of Chemicals Nr. 111, adopted 12 May 1981. |
|
(2) |
US-Environmental Protection Agency (1982). 40 CFR 796.3500, Hydrolysis as a Function of pH at 25 oC. Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate. |
|
(3) |
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada. |
|
(4) |
Európai Unió (EU) (1995). A Bizottság 95/36/EK irányelve a növényvédő szerek forgalomba hozataláról szóló 91/414/EGK tanácsi irányelv módosításáról. 5. melléklet: A hatóanyag sorsa és viselkedése a környezetben. |
|
(5) |
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air. |
|
(6) |
BBA (1980). Merkblatt Nr. 55, Teil I und II: Prüfung des Verhaltens von Pflanzenbehandlungsmitteln im Wasser (October 1980). |
|
(7) |
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed. |
|
(8) |
OECD (2000). Guidance document on aquatic toxicity testing of difficult substances and mixtures, OECD Environmental Health and Safety Publications Series on Testing and Assessment Nr. 23. |
|
(9) |
OECD (1993). Guidelines for the Testing of Chemicals. Paris. OECD (1994–2000): Addenda 6–11 to Guidelines for the Testing of Chemicals. |
|
(10) |
Nelson, H, Laskowski D, Thermes S, and Hendley P. (1997). Recommended changes in pesticide fate study guidelines for improving input to computer models. (Text version of oral presentation at the 14th Annual Meeting of the Society of Environmental Toxicology and Chemistry, Dallas TX, November 1993). |
|
(11) |
Mabey, W. and Mill, T. (1978). Critical review of hydrolysis of organic compounds in water under environmental conditions. J. Phys. Chem. Ref. Data 7, 383-415. |
1. függelék
A hidrolízisvizsgálat többfokozatú rendszere
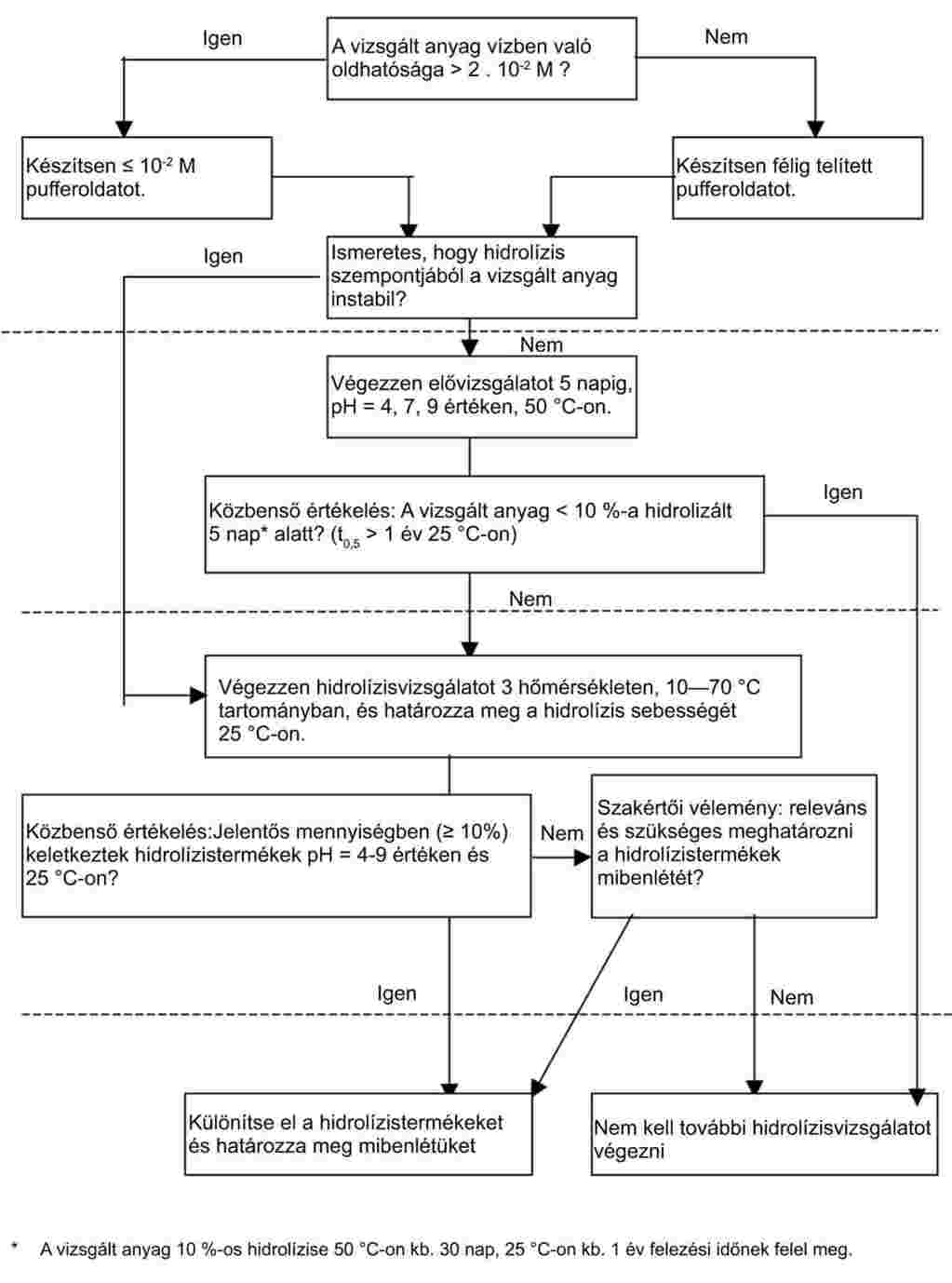
2. függelék
Fogalommeghatározások és mértékegységek
Minden esetben szabványos nemzetközi (SI-) mértékegységet kell használni.
Vizsgált anyag: tetszőleges anyag, legyen szó kiindulási anyagról vagy átalakulási termékről.
Átalakulási termék: a vizsgált anyag biotikus vagy abiotikus átalakulási reakciói eredményeképpen létrejött anyag.
Hidrolízistermék: a vizsgált anyag hidrolitikus reakciói eredményeképpen létrejött anyag.
Hidrolízis: valamely RX vizsgált anyag reakciója vízzel, amelynek során a hangsúly az OH-val helvettesítődő X csoport összmennyiségén van:
|
RX + HOH → ROH +HX |
[1] |
Az RX koncentrációjának csökkenési sebességét a következő összefüggés adja meg:
|
sebesség = k [H2O] [RX] |
másodrendű reakció |
|
vagy |
|
|
sebesség = k [RX] |
elsőrendű reakció, |
a reakciósebességet megszabó részreakciótól függően. Mivel a víz jóval nagyobb arányban van jelen, mint a vizsgált anyag, az ilyen típusú reakciót rendszerint pszeudo-elsőrendű reakciónak tekintjük, amelynek tapasztalati reakciósebességi állandóját a következő összefüggés adja:
|
kobs = k [H2O] |
[2] |
A reakciósebességi együttható a következő összefüggésből határozható meg (13):
|
|
[3] |
ahol
t= az idő;
Co, Ct pedig= az RX koncentrációja a nulladik, illetve a t időpontban.
Az együttható dimenziója (idő)–1, a reakció felezési idejét (az RX 50 %-ának reakciójához szükséges időt) pedig a következő összefüggés adja meg:
|
|
[4] |
Felezési idő (t0,5): a vizsgált anyag 50 %-os hidrolíziséhez szükséges idő, ha a reakció folyamata elsőrendű kinetikával leírható. A felezési idő független a koncentrációtól.
DT 50 (50 %-os lebomlási idő): az az idő, amelyen belül a vizsgált anyag koncentrációja 50 %-kal lecsökken; ha a reakció folyamata nem elsőrendű kinetikát követ, akkor ez a mennyiség nem azonos a t0,5 felezési idővel.
k becslése különböző hőmérsékleteken
Ha két hőmérsékleten ismerjük a reakciósebességi állandót, akkor az egyéb hőmérsékletekhez tartozó reakciósebességi állandó az Arrhenius-egyenletből számítható:
![]() vagy
vagy 
Az l/T függvényében ábrázolt In k értékek –E/R meredekségű egyenest adnak.
Az előző képletben:
|
k |
= |
a különböző hőmérsékleteken mért reakciósebességi állandó; |
|
E |
= |
az aktiválási energia [kJ/mol]; |
|
T |
= |
az abszolút hőmérséklet [K]; |
|
R |
= |
a gázállandó [8,314 J/mol.K]. |
Az aktiválási energiát regresszióanalízissel vagy a következő egyenlettel számítjuk:

ahol T2 > T1.
3. függelék
Pufferrendszerek
CLARK ÉS LUBS:
CLARK- és LUBS-féle pufferkeverékek (14)
|
Összetétel |
pH |
|
0,2 N HCl és 0,2 N KCl 20 oC-on |
|
|
47,5 ml HCl + 25 ml KCl 100 ml-ig hígítva |
1,0 |
|
32,25 ml HCl + 25 ml KCl 100 ml-ig hígítva |
1,2 |
|
20,75 ml HCl + 25 ml KCl 100 ml-ig hígítva |
1,4 |
|
13,15 ml HCl + 25 ml KCl 100 ml-ig hígítva |
1,6 |
|
8,3 ml HCl + 25 ml KCl 100 ml-ig hígítva |
1,8 |
|
5,3 ml HCl + 25 ml KCl 100 ml-ig hígítva |
2,0 |
|
3,35 ml HCl + 25 ml KCl 100 ml-ig hígítva |
2,2 |
|
0,1 M kálium-ftalát +0,1 N HCl 20 oC-on |
|
|
46,70 ml 0,1 N HCl + 50 ml ftalát 100 ml-ig hígítva |
2,2 |
|
39,60 ml 0,1 N HCl + 50 ml ftalát 100 ml-ig hígítva |
2,4 |
|
32,95 ml 0,1 N HCl + 50 ml ftalát 100 ml-ig hígítva |
2,6 |
|
26,42 ml 0,1 N HCl + 50 ml ftalát 100 ml-ig hígítva |
2,8 |
|
20,32 ml 0,1 N HCl + 50 ml ftalát 100 ml-ig hígítva |
3,0 |
|
14,70 ml 0,1 N HCl + 50 ml ftalát 100 ml-ig hígítva |
3,2 |
|
9,90 ml 0,1 N HCl + 50 ml ftalát 100 ml-ig hígítva |
3,4 |
|
5,97 ml 0,1 N HCl + 50 ml ftalát 100 ml-ig hígítva |
3,6 |
|
2,63 ml 0,1 N HCl + 50 ml ftalát 100 ml-ig hígítva |
3,8 |
|
0,1 M kálium-ftalát +0,1 N NaOH 20 oC-on |
|
|
0,40 ml 0,1 N NaOH + 50 ml ftalát 100 ml-ig hígítva |
4,0 |
|
3,70 ml 0,1 N NaOH + 50 ml ftalát 100 ml-ig hígítva |
4,2 |
|
7,50 ml 0,1 N NaOH + 50 ml ftalát 100 ml-ig hígítva |
4,4 |
|
12,15 ml 0,1 N NaOH + 50 ml ftalát 100 ml-ig hígítva |
4,6 |
|
17,70 ml 0,1 N NaOH + 50 ml ftalát 100 ml-ig hígítva |
4,8 |
|
23,85 ml 0,1 N NaOH + 50 ml ftalát 100 ml-ig hígítva |
5,0 |
|
29,95 ml 0,1 N NaOH + 50 ml ftalát 100 ml-ig hígítva |
5,2 |
|
35,45 ml 0,1 N NaOH + 50 ml ftalát 100 ml-ig hígítva |
5,4 |
|
39,85 ml 0,1 N NaOH + 50 ml ftalát 100 ml-ig hígítva |
5,6 |
|
43,00 ml 0,1 N NaOH + 50 ml ftalát 100 ml-ig hígítva |
5,8 |
|
45,45 ml 0,1 N NaOH + 50 ml ftalát 100 ml-ig hígítva |
6,0 |
CLARK- és LUBS-féle pufferkeverékek (folytatás)
|
0,1 M monokálium-foszfát +0,1 N NaOH 20 oC-on |
|
|
5,70 ml 0,1 N NaOH + 50 ml foszfát 100 ml-ig hígítva |
6,0 |
|
8,60 ml 0,1 N NaOH + 50 ml foszfát 100 ml-ig hígítva |
6,2 |
|
12,60 ml 0,1 N NaOH + 50 ml foszfát 100 ml-ig hígítva |
6,4 |
|
17,80 ml 0,1 N NaOH + 50 ml foszfát 100 ml-ig hígítva |
6,6 |
|
23,45 ml 0,1 N NaOH + 50 ml foszfát 100 ml-ig hígítva |
6,8 |
|
29,63 ml 0,1 N NaOH + 50 ml foszfát 100 ml-ig hígítva |
7,0 |
|
35,00 ml 0,1 N NaOH + 50 ml foszfát 100 ml-ig hígítva |
7,2 |
|
39,50 ml 0,1 N NaOH + 50 ml foszfát 100 ml-ig hígítva |
7,4 |
|
42,80 ml 0,1 N NaOH + 50 ml foszfát 100 ml-ig hígítva |
7,6 |
|
45,20 ml 0,1 N NaOH + 50 ml foszfát 100 ml-ig hígítva |
7,8 |
|
46,80 ml 0,1 N NaOH + 50 ml foszfát 100 ml-ig hígítva |
8,0 |
|
0,1 M H3BO30,1 M KCl-ban +0,1 N NaOH 20 oC-on |
|
|
2,61 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
7,8 |
|
3,97 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
8,0 |
|
5,90 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
8,2 |
|
8,50 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
8,4 |
|
12,00 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
8,6 |
|
16,30 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
8,8 |
|
21,30 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
9,0 |
|
26,70 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
9,2 |
|
32,00 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
9,4 |
|
36,85 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
9,6 |
|
40,80 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
9,8 |
|
43,90 ml 0,1 N NaOH + 50 ml borsav 100 ml-ig hígítva |
10,0 |
B. KOLTHOFF ÉS VLEESCHHOUWER:
KOLTHOFF és VLEESCHHOUWER-féle citrátpufferek
|
Összetétel |
pH |
|
0,1 M monokálium-citrát és 0,1 N HCl 18 oC-on (15) |
|
|
49,7 ml 0,1 N HCl + 50 ml citrát 100 ml-ig hígítva |
2,2 |
|
43,4 ml 0,1 N HCl + 50 ml citrát 100 ml-ig hígítva |
2,4 |
|
36,8 ml 0,1 N HCl + 50 ml citrát 100 ml-ig hígítva |
2,6 |
|
30,2 ml 0,1 N HCl + 50 ml citrát 100 ml-ig hígítva |
2,8 |
|
23,6 ml 0,1 N HCl + 50 ml citrát 100 ml-ig hígítva |
3,0 |
|
17,2 ml 0,1 N HCl + 50 ml citrát 100 ml-ig hígítva |
3,2 |
|
10,7 ml 0,1 N HCl + 50 ml citrát 100 ml-ig hígítva |
3,4 |
|
4,2 ml 0,1 N HCl + 50 ml citrát 100 ml-ig hígítva |
3,6 |
|
0,1 M monokálium-citrát es 0,1 N NaOH 18 oC-on (15) |
|
|
2,0 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
3,8 |
|
9,0 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
4,0 |
|
16,3 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
4,2 |
|
23,7 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
4,4 |
|
31,5 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
4,6 |
|
39,2 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
4,8 |
|
46,7 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
5,0 |
|
54,2 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
5,2 |
|
61,0 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
5,4 |
|
68,0 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
5,6 |
|
74,4 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
5,8 |
|
81,2 ml 0,1 N NaOH + 50 ml citrát 100 ml-ig hígítva |
6,0 |
C. SÖRENSEN:
SÖRENSEN-féle boraxkeverékek
|
Összetétel 1 |
Sörensen 18 oC |
Walbum, pH a következő hőmérsékleten H a következoő h hőmérsékleten |
|||
|
ml borax |
ml HCl/NaOH |
10 oC |
40 oC |
70 oC |
|
|
0,05 M borax +0,1 N HCl |
|||||
|
5,25 |
4,75 |
7,62 |
7,64 |
7,55 |
7,47 |
|
5,50 |
4,50 |
7,94 |
7,98 |
7,86 |
7,76 |
|
5,75 |
4,25 |
8,14 |
8,17 |
8,06 |
7,95 |
|
6,00 |
4,00 |
8,29 |
8,32 |
8,19 |
8,08 |
|
6,50 |
3,50 |
8,51 |
8,54 |
8,40 |
8,28 |
|
7,00 |
3,00 |
8,08 |
8,72 |
8,56 |
8,40 |
|
7,50 |
2,50 |
8,80 |
8,84 |
8,67 |
8,50 |
|
8,00 |
2,00 |
8,91 |
8,96 |
8,77 |
8,59 |
|
8,50 |
1,50 |
9,01 |
9,06 |
8,86 |
8,67 |
|
9,00 |
1,00 |
9,09 |
9,14 |
8,94 |
8,74 |
|
9,50 |
0,50 |
9,17 |
9,22 |
9,01 |
8,80 |
|
10,00 |
0,00 |
9,24 |
9,30 |
9,08 |
8,86 |
|
0,05 M borax +0,1 N NaOH |
|||||
|
10,0 |
0,0 |
9,24 |
9,30 |
9,08 |
8,86 |
|
9,0 |
1,0 |
9,36 |
9,42 |
9,18 |
8,94 |
|
8,0 |
2,0 |
9,50 |
9,57 |
9,30 |
9,02 |
|
7,0 |
3,0 |
9,68 |
9,76 |
9,44 |
9,12 |
|
6,0 |
4,0 |
9,97 |
10,06 |
9,67 |
9,28 |
SÖRENSEN-féle foszfátkeverékek
|
Összetetel |
pH |
|
0,0667 M monokálium-foszfát + 0,0667 M dinátrium-foszfát 20 oC-on |
|
|
99,2 ml KH2PO4 + 0,8 ml Na2HPO4 |
5,0 |
|
98,4 ml KH2PO4 + 1,6 ml Na2HPO4 |
5,2 |
|
97,3 ml KH2PO4 + 2,7 ml Na2HPO4 |
5,4 |
|
95,5 ml KH2PO4 + 4,5 ml Na2HPO4 |
5,6 |
|
92,8 ml KH2PO4 + 7,2 ml Na2HPO4 |
5,8 |
|
88,9 ml KH2PO4 + 11,1 ml Na2HPO4 |
6,0 |
|
83,0 ml KH2PO4 + 17,0 ml Na2HPO4 |
6,2 |
|
75,4 ml KH2PO4 + 24,6 ml Na2HPO4 |
6,4 |
|
65,3 ml KH2PO4 + 34,7 ml Na2HPO4 |
6,6 |
|
53,4 ml KH2PO4 + 46,6 ml Na2HPO4 |
6,8 |
|
41,3 ml KH2PO4 + 58,7 ml Na2HPO4 |
7,0 |
|
29,6 ml KH2PO4 + 70,4 ml Na2HPO4 |
7,2 |
|
19,7 ml KH2PO4 + 80,3 ml Na2HPO4 |
7,4 |
|
12,8 ml KH2PO4 + 87,2 ml Na2HPO4 |
7,6 |
|
7,4 ml KH2PO4 + 92,6 ml Na2HPO4 |
7,8 |
|
3,7 ml KH2PO4 + 96,3 ml Na2HPO4 |
8,0 |
C.8. TOXICITÁS FÖLDIGILISZTÁKRA
MESTERSÉGES TALAJBAN VÉGZETT VIZSGÁLAT
1. MÓDSZER
1.1. BEVEZETÉS
A szóban forgó laboratóriumi vizsgálatban a vizsgált anyagot olyan mesterséges talajhoz adják hozzá, amelyben 14 napra földigilisztákat helyeznek el. Ezt az időszakot követően (másik lehetőségként hét nap elteltével) megvizsgálják az anyagnak a földigilisztákra gyakorolt letális hatását. A módszer a vegyi anyagnak a földigilisztákra a bőrükön keresztül, illetve a tápcsatornából történő felszívódás következtében gyakorolt hatásának viszonylag gyors kiszűrését teszi lehetővé.
1.2. FOGALOMMEGHATÁROZÁS ÉS MÉRTÉKEGYSÉG
LC50: Az anyagnak az a koncentrációja, amely a vizsgálati időszak alatt a kísérleti állatok 50 %-át pusztítja el.
1.3. REFERENCIAANYAGOK
Rendszeres időközönként referenciaanyagot kell használni annak igazolására, hogy a vizsgálati rendszer érzékenysége nem változott-e jelentős mértékben.
Referenciaanyagként analitikai tisztaságú klór-acetamidot ajánlunk.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A talaj változó közeg, ezért a vizsgálathoz gondosan összeállított, mesterséges vályogtalajt kell használni. A vizsgált anyag különféle koncentrációival kezelt mesterséges talajban az Eisenia foetida (lásd a függelék megjegyzését) fajhoz tartozó felnőtt példányokat tartanak. A tárolóedények tartalmát a vizsgálat megkezdése után 14 nappal (és választhatóan hét nap elteltével) szétterítik egy tálcán, majd megszámolják az egyes koncentrációk mellett életben maradt földigilisztákat.
1.5. MINŐSÉGI KÖVETELMÉNYEK
A vizsgálatot úgy kell megtervezni, hogy az a vizsgált talaj és szervezet tekintetében minél jobban ismételhető legyen. A kontrollcsoportban az elhullási arány nem haladhatja meg a 10 %-ot, különben a vizsgálat nem értékelhető.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Anyagok
1.6.1.1.
Meghatározott összetételű mesterséges talajt kell használni.
|
a) |
Alapszubsztrátum (a száraz tömeg százalékában)
|
|
b) |
Vizsgált szubsztrátum A vizsgált szubsztrátum az alapszubsztrátumot, a vizsgált anyagot és az ionmentesített vizet tartalmazza. Víztartalmának az alapszubsztrátum száraz tömegének 25 és 42 %-a közé kell esnie. A szubsztrátum víztartalmának meghatározásához a mintát 105 oC-on állandó tömegig kell szárítani. A legfontosabb feltétel az, hogy a mesterséges talajt át kell nedvesíteni, de nem szabad azon víznek állni. Ügyelnünk kell rá, hogy a vizsgált anyagot és a vizsgált szubsztrátumot egyenletesen keverjük el egymással. A vizsgálati jelentésben fel kell jegyezni, hogyan vittük bele a vizsgált anyagot a szubsztrátumba. |
|
c) |
Kontroll szubsztrátum A kontroll szubsztrátum az alapszubsztrátumból és vízből áll. Ha bármely más adalékanyagot alkalmazunk, kiegészítő kontrollt is kell használni, amelyben az adott adalékanyagból ugyanannyi található. |
1.6.1.2.
Körülbelül egy liter űrtartalmú (szellőzőlyukakkal ellátott, műanyag fedővel, kupakkal vagy műanyag fóliával lefedett) üvegedények a szubsztrátum 500 g szárazanyag-tartalmának megfelelő mennyiségben a nedves vizsgált talajjal, illetve a kontrolltalajjal feltöltve.
1.6.2. körülmények
Az edényeket 20 ± 2 oC hőmérsékletű klímakamrában kell tartani folyamatos megvilágítás mellett. A fény intenzitásának 400 és 800 lux között kell lennie.
A vizsgálat időtartama 14 nap, de a mortalitást meg lehet vizsgálni a vizsgálat megkezdését követő hetedik napon is.
1.6.3. A kísérlet végrehajtása
A vizsgált anyag koncentrációit az alapszubsztrátum száraz tömegéhez viszonyított tömegként adják meg (mg/kg).
Azon koncentrációtartományok, amelyek 0 és 100 % közötti mortalitást váltanak ki, előzetes vizsgálattal azonosíthatók azzal a céllal, hogy tájékozódjanak a részletes meghatározó vizsgálatban alkalmazható koncentrációtartományokról.
Az anyagot a következő koncentrációkban lehet vizsgálni: 1 000; 100; 10; 1; 0,1 mg anyag/kilogramm vizsgált talaj (száraz tömeg).
Ha teljes körű meghatározó vizsgálatot akarunk végezni, az előzetes, dózisbehatároló vizsgálatban minden koncentrációra és a kezeletlen kontrollra elegendő egy-egy, 10 gilisztát tartalmazó vizsgálati csoport.
Az előzetes, dózisbehatároló vizsgálat eredményeit arra használják fel, hogy a 0 és 100 % közötti mortalitási tartományban egy legalább öt koncentrációból álló mértani sort jelöljenek ki, amelyben az állandó szorzótényező legfeljebb 1,8.
Ezen vizsgálati sorral végzett vizsgálatok lehetővé teszik az LC50-érték, illetve a konfidenciaszint lehető legpontosabb meghatározását.
A meghatározó vizsgálat során koncentrációnként legalább négy kísérleti csoportot és négy kezeletlen kontrollt kell használni, amelyek mindegyike 10-10 gilisztát tartalmaz. Ezen ismétlések eredményei adják az átlagértékeket és a normál szórást.
Ha két egymást követő és egymástól az 1,8-as faktort meghaladó mértékben nem különböző koncentráció csak 0 %-os és 100 %-os mortalitást ad, ezen értékek már elegendőek annak jelzésére, hogy az LC50 melyik tartományba esik.
A vizsgált talajt lehetőleg minden más szer hozzáadása nélkül, csak vízzel kell összeállítani. Közvetlenül a vizsgálat megkezdése előtt a vizsgált anyag ionmentesített vízben vagy egyéb oldószerben elkészített diszperzióját, illetve emulzióját elkeverik az alapszubsztrátummal, illetve finom kromatográfiás vagy ehhez hasonló szórókészülékkel egyenletesen eloszlatják az alapszubsztrátum felületén.
Ha a vizsgált anyag nem oldódik vízben, a lehető legkisebb mennyiségű megfelelő szerves oldószerben is feloldható (például hexánban, acetonban vagy kloroformban).
A vizsgált anyag oldatba vitelére, diszpergálására vagy emulgeálására csak könnyen illó oldószer használható. A vizsgált talajt a felhasználás előtt át kell szellőztetni. Az elpárolgott vízmennyiséget pótolni kell. A kontrollhoz bármely adalékanyagból azonos mennyiséget kell adni.
Ha a vizsgált anyag szerves oldószerekben egyáltalán nem oldódik, nem diszpergálható, és nem emulgeálható, finomra őrölt kvarchomok és a vizsgált anyag 500 g száraz tömegű mesterséges talaj kezelésére elegendő mennyiségének keverékéből 10 g-ot kell elkeverni 490 g száraz tömegű vizsgált talajjal.
Minden kísérleti csoportban 500 g száraz tömegnek megfelelő mennyiségű nedves vizsgált talajt helyeznek el, üvegedényenként 10 db gilisztával, amelyeket előzőleg hasonló nedves környezetben szoktattak 24 órán keresztül, majd gyorsan megmosták azokat, a felesleges vizet szűrőpapírral felszívatták, és a gilisztákat a szubsztrátum felületére helyezték.
A tárolóedényeket perforált műanyag fedővel, kupakkal vagy fóliával zárják le, hogy a talajt megóvják a kiszáradástól, majd 14 napon keresztül tartják a vizsgálati körülmények között.
Az értékelést a vizsgálat megkezdését követő 14. napon (és esetleg a 7. napon) lehet elvégezni. A talajt üveg- vagy rozsdamentes acéllemezen terítik szét. A gilisztákat megvizsgálják, és megállapítják a vizsgálatot túlélők számát. Az a giliszta tekinthető élettelennek, amely az elülső végét érő enyhe mechanikai ingerre nem reagál.
Ha a hetedik napon végeznek vizsgálatot, a tartályba visszatöltik a talajt, és a túlélő gilisztákat ugyanarra a vizsgálati talaj felületre helyezik vissza.
1.6.4. Vizsgált organizmusok
Vizsgált organizmusok: felnőtt Eisenia foetida példányok (lásd a függelék megjegyzését) (legalább két hónaposak, amelyeknél a clitellum [nyereg] már kialakult), 300 és 600 mg közötti nedves súllyal. (A tenyésztési módszereket lásd a függelékben.)
2. ADATOK
2.1. AZ EREDMÉNYEK ÉRTÉKELÉSE ÉS ÉRTELMEZÉSE
A vizsgált anyag koncentrációit rögzítik, mellettük megadva az egyes koncentrációkhoz tartozó elhullott giliszták számát százalékban.
Ha elegendő adat áll rendelkezésre, a szabványmódszerrel meg kell határozni az LC50-értéket és a konfidencia-határértékeket (p = 0,05) (ezzel egyenértékű módszer Litchfield és Wilcox on, 1949). A vizsgált anyag LC50-értékét milligrammban kell megadni a vizsgált talaj kilogrammjára (száraz tömeg) vonatkoztatva.
Azon esetekben, amikor a koncentrációs görbe túlságosan meredek az LC50 kiszámításához, ezen érték grafikus becslése is elegendő.
Ha két egymást követő és egymástól az 1,8-as szorzótényezőnél nagyobb mértékben nem különböző koncentráció csak 0 %-os és 100 %-os elhullást ad, ezen értékek már elegendőek annak jelzésére, hogy az LC50 melyik tartományba esik.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
nyilatkozat arról, hogy a vizsgálatot a fent említett minőségi követelményeknek megfelelően végezték, |
|
— |
az elvégzett vizsgálatok (előzetes, dózisbehatároló vizsgálat és/vagy meghatározó vizsgálat), |
|
— |
a vizsgálati körülmények pontos leírása, illetve nyilatkozat arról, hogy a vizsgálatot a módszernek megfelelően végezték-e el; minden eltérést jelezni kell, |
|
— |
annak pontos leírása, hogy a vizsgált anyagot hogyan keverték bele a vizsgált talajba, |
|
— |
a felhasznált vizsgált organizmusokkal kapcsolatos információk (faj, kor, súlyszélsőértékek és -átlag, tartási és tenyésztési körülmények, származás), |
|
— |
az LC50 meghatározásához használt módszer, |
|
— |
az összes felhasznált adatot tartalmazó vizsgálati eredmények, |
|
— |
a vizsgált organizmusok viselkedésében megfigyelt tünetek vagy változások leírása, |
|
— |
a kontrollok mortalitása, |
|
— |
az LC50, illetve a legmagasabb vizsgált koncentráció, amely a vizsgálat beindítását követő 14 nappal (és esetleg hét nappal) már elhullást nem eredményezett, és a legkisebb vizsgált koncentráció, amely ugyanezen időpontban már 100 %-os elhullást eredményezett, |
|
— |
a koncentráció-hatás görbe felvétele, |
|
— |
a referenciaanyaggal kapott eredmények, akár a mostani vizsgálatokkal kapcsolatosan, akár korábbi minőség-ellenőrzési próbán nyerték azokat. |
4. HIVATKOZOTT SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 207. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges |
|
(2) |
Edwards, C. A. and Lofty, J. R., 1977, Biology of Earthsworms, Chapman and Hall, London, p. 331. |
|
(3) |
Bouche, M. B., 1972, Lombriciens de France, Écologie et Systématique, Institut National de la Recherche Agronomique, p. 671. |
|
(4) |
Litchfield, J. T. and Wilcoxon, F., A simplified method of evaluation dose effect experiments. J.Pharm. Exp. Therap., vol. 96, 1949, p. 99. |
|
(5) |
Commission of the European Communities, Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms, Report EUR 8714 EN, 1983. |
|
(6) |
Umweltbundesamt/Biologische Bundesanstalt für Land- and Forstwirtschaft, Berlin, 1984, Verfahrensvorschlag „Toxisitätstest am Regenwurm Eisenia foetida in künstlichem Boden”, in: Rudolph/Boje, Ökotoxikologie, ecomed, Landsberg, 1986. |
Függelék
A giliszták tenyésztése és tartása a vizsgálat előtt
Az állatok tenyésztéséhez 30–50 darab felnőtt gilisztára van szükség, amelyeket friss szubsztrátummal ellátott tenyésztőládába helyeznek, majd 14 nap múlva eltávolítják azokat. Ezen állatokat használhatják fel a további tenyészetekhez. A gubóból kikelt giliszta felnőtt (ivarérett) korában használható fel a vizsgálatokhoz (a leírt feltételek mellett ez két-három hónap után következik be).
Tenyésztési és tartási körülmények
|
Klímakamra |
: |
20 ± 2 oC hőmérséklet, lehetőleg folyamatos megvilágítással (400 és 800 lux közötti fényintenzitással). |
|
Tenyésztő ládák |
: |
10–20 liter űrtartalmú, megfelelően lapos edények. |
|
Szubsztrátum |
: |
Az Eisenia foetida többféle állati ürüléken is tenyészthető. Tenyésztőközegként 50 térfogat-százalékos tőzeg és 50 térfogat-százalékos tehén vagy lótrágya keveréke ajánlott. A közeg pH-értéke körülbelül 6 és 7 között legyen (ezt kalcium-karbonáttal lehet szabályozni), és alacsony ionos vezetőképességgel kell rendelkeznie (6 mmhos-nál vagy 0,5 % sókoncentrációnál kevesebb). A szubsztrátum legyen nedves, de ne legyen túl vizes. A fent említett módszeren kívül még más sikeres módszer is alkalmazható. |
Megjegyzés: Az Eisenia foetida két fajban létezik, amelyeket egyes taxonómusok külön alfajként írtak le (Bouche, 1972). Ezek morfológiailag nem különböznek, de egyikük, az Eisenia foetida foetida gyűrűin jellegzetes keresztirányú csíkozást vagy szalagokat találhatunk, amelyek a másikon, az Eisenia foetida andrei fajon nem jelennek meg, ellenben ennek vörösesebb színe van. Ha lehet, az Eisenia foetida andrei használatát javasoljuk. Más faj is használható, ha a hozzá szükséges módszertan rendelkezésre áll.
C.9. BIOLÓGIAI LEBOMLÁS
ZAHN–WELLENS VIZSGÁLAT
1. MÓDSZER
1.1. BEVEZETÉS
E módszernek az a célja, hogy felmérje a vízoldékony, nem illékony szerves anyagok végső biológiai lebontásának lehetőségeit akkor, ha statikus vizsgálati körülmények között viszonylag nagy töménységű mikroorganizmusnak vannak kitéve.
A szuszpendált szilárd részecskéken fizikokémiai adszorpció is létrejöhet, és ezt az eredmények értékelésekor figyelembe kell venni (lásd a 3.2. pontot).
A használni kívánt anyagokat 50 és 400 mg/liter közötti DOC-értékeknek, valamint 100 és 1 000 mg/liter közötti COD-értékeknek megfelelő koncentrációban vizsgáljuk (DOC = oldott szerves szén; COD = kémiai oxigénigény). E viszonylag magas koncentrációknak az az előnye, hogy analitikailag megbízhatóak. Mérgező tulajdonságú vegyületek késleltethetik vagy gátolhatják a lebomlás folyamatát.
E módszerben az oldott szerves szén vagy a kémiai oxigénigény mérését a vizsgált anyag végső biológiai lebonthatóságának felmérésére használjuk.
Az ezzel párhuzamosan alkalmazott analitikai módszer segíthet az anyag primer lebomlásának meghatározásában (a kiindulási molekulaszerkezet eltűnése).
A módszer csak olyan vizsgált szerves anyagra megfelelő, amely a vizsgálatban használt koncentrációban:
|
— |
a vizsgálati körülmények között vízben oldódik, |
|
— |
páranyomása a vizsgálati körülmények között elhanyagolható, |
|
— |
a baktériumokat nem gátolja, |
|
— |
a vizsgálati rendszerben csak korlátozott mértékben szívódik fel, |
|
— |
habképződés útján nem vész el a vizsgált oldatból. |
A vizsgált anyag főbb összetevőinek egymáshoz viszonyított részarányának ismerete hasznos lehet a kapott eredmények értékeléséhez, különösen azon esetekben, amikor az eredmények (lebomlási értékek) alacsonyak vagy marginálisak.
Az anyag mikroorganizmusokra gyakorolt mérgező hatásának ismerete kívánatos az alacsony lebomlási értékek értékelésénél és a megfelelő vizsgált koncentrációk kiválasztásánál.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
A vizsgálat végén nyert lebomlási mértéket, mint a „Zahn–Wellens vizsgálatban kapott biológiai lebonthatóságot” kell értékelni,

ahol:
|
DT |
= |
biológiai lebomlás ( %) T idő alatt, |
|
CA |
= |
DOC- (vagy COD-) értékek a vizsgált keverékben a vizsgálat megkezdését követő három óra múlva (mg/l) (DOC = oldott szerves szén, COD = kémiai oxigénigény) |
|
CT |
= |
DOC- (vagy COD-) értékek a vizsgált keverékben mintavételkor (mg/l), |
|
CB |
= |
DOC- (vagy COD-) értékek a vakpróbában mintavételkor (mg/l), |
|
CBA |
= |
DOC- (vagy COD-) értékek a vakpróbában a vizsgálat megkezdését követő három óra múlva (mg/l) |
A lebomlás mértékét a legközelebbi teljes százalékértékre kell kerekíteni.
A százalékos lebomlást a vizsgált anyag DOC- (vagy COD-) százalékának csökkenésével kell megadni.
A mért vagy számított kiindulási érték és a három óra elteltével mért érték közötti különbség hasznos információkkal szolgálhat az anyag megsemmisítésével kapcsolatban (lásd a 3.2. pontot, Az eredmények értelmezése).
1.3. REFERENCIAANYAGOK
Egyes esetekben, ha új anyagokat vizsgálunk, hasznos lehet a referenciaanyagok alkalmazása; konkrét referenciaanyagok ajánlása azonban egyelőre nem lehetséges.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Keverőszerkezettel és levegőztetőberendezéssel ellátott, négyliteres üvegedénybe élesztett iszapot, ásványi tápanyagokat és egyedüli szénforrásként a vizsgált anyagot helyeznek el a vizes oldatban. A keveréket kevertetik, levegőztetik, és 20 és 25 oC hőmérséklet között, diffúz megvilágításban vagy sötétkamrában tartják 28 napon keresztül. A lebomlási folyamatot a szűrt oldat DOC-, illetve COD-értékeinek naponkénti vagy egyéb megfelelő időközönként végzett meghatározása útján követik nyomon. Az indulást követő három óra elteltével mért érték és az egyes időközökben eltűnt DOC (vagy COD) mért értékeinek egymáshoz viszonyított arányát százalékos biológiai bomlás formájában fejezik ki, és ez szolgál a lebomlás adott időre számított mértékéül. Az eredményt az idő függvényében ábrázolva kapják meg a biológiai bomlás görbéjét.
Ha specifikus analitikai módszert használnak, mérhető a kiindulási molekula koncentrációjának a biológiai bomlás következtében előállott változása is (elsődleges biológiai bonthatóság).
1.5. MINŐSÉGI KÖVETELMÉNYEK
A vizsgálat kielégítő mértékű ismételhetőségét körvizsgálat bizonyította.
A módszer érzékenységét nagymértékben a vakpróba változékonysága és kisebb mértékben az oldott szerves szén, illetve a vizsgált vegyület folyadékkoncentrációjának kimutatási pontossága határozza meg.
1.6. A KÍSÉRLET VÉGREHAJTÁSA
1.6.1. Előkészületek
1.6.1.1.
A vizsgálathoz használt víz: kevesebb mint 5 mg/liter szerves szenet tartalmazó ivóvíz. A kalcium- és magnéziumionok együttes koncentrációja nem haladhatja meg a 2,7 mmol/litert; ellenkező esetben ionmentesített vagy desztillált vízzel való hígításra van szükség.
|
Kénsav, analitikai reagens (A.R.): |
50g/l |
|
Nátrium-hidroxid-oldat A.R.: |
40 g/l |
|
Ásványitápanyag-oldat: oldjunk fel egy liter ionmentesített vízben: |
|
|
ammónium-kloridot, NH4Cl, A.R.: |
38,5 g |
|
nátrium-dihidrogen-foszfátot, NaH2PO4.2H2O, A.R.: |
33,4 g, |
|
kálium-dihidrogén-foszfátot, KH2PO4, A.R.: |
8,5 g, |
|
dikálium-monohidrogén-foszfátot, KH2PO4, A.R.: |
21,75 g. |
A keverék tápoldatként és pufferként egyaránt szolgál.
1.6.1.2.
Egy és négy liter közötti űrtartalmú üvegedények (pl. üveghengerek).
Üveg- vagy fémlapáttal ellátott és megfelelő tengelyre szerelt keverőkészülék (a lapátnak az edény fenekétől 5–10 cm távolságra kell forognia). Helyette 7 és 10 cm közötti hosszúságú, rúddal felszerelt mágneses keverő is használható.
2 és 4 mm közti belső átmérőjű üvegcső a levegőztetésre. A cső nyílása az edény fenekétől kb. 1 cm-re legyen.
Centrifuga (kb. 3 550 g).
pH-mérő.
Oldottoxigénkoncentráció-mérő készülék.
Szűrőpapírok.
Membránszűrő készülék.
Membránszűrők 0,45 μm-es pórusokkal. A membránszűrők akkor felelnek meg a célnak, ha meggyőződtek róla, hogy sem szenet nem bocsátanak ki, sem pedig a vizsgált anyagot nem abszorbeálják a szűrés során.
A szervesszén-tartalom, illetve a kémiai oxigénigény meghatározására alkalmas analitikai berendezés.
1.6.1.3.
A biológiai szennyvíztisztítóból származó aktivált szennyvíziszapot (ismételten) kimossák és centrifugálják, vagy azt a vizsgálathoz használt vízzel ülepítik (lásd fent).
Az aktivált iszapnak megfelelő állapotban kell lennie. Az ilyen iszap valamely megfelelően működő szennyvíztisztítóból könnyen beszerezhető. Annak érdekében, hogy a lehető legtöbb baktériumfajt, illetve baktériumtörzset szerezzék be, érdemes különböző forrásból származó inokulumokat összekeverni (pl. több szennyvíztisztítóból, különböző talajkivonatokat, folyókból származó vizet stb.). A keveréket a fentieknek megfelelően kell kezelni.
Az aktivált iszap aktivitásának ellenőrzését lásd az alábbiakban, a „Funkcionális ellenőrzés” című szakaszban.
1.6.1.4.
A vizsgálathoz használt edénybe 500 ml vizet, 2,5 ml/liter ásványianyag-tápoldatot és 0,2–1,0 g szárazanyag/liter végkoncentrációjú aktivált iszapot kell önteni. Hozzá kell adni megfelelő mennyiségű törzsoldatot a vizsgált anyagból úgy, hogy a végső keverékben a DOC-koncentráció 50 és 400 mg/liter között legyen. Az ennek megfelelő COD-értékek 100 és 1 000 mg/liter között változnak. A vizsgálathoz használt vízzel ki kell egészíteni összesen egy–négy literre. A mennyiség megválasztása a DOC- és COD-meghatározásokhoz veendő minták számától és az analízishez szükséges térfogattól függ.
Általában két liter elegendő. Legalább egy kontrolledényt (vakot) kell beállítani minden vizsgálati sorhoz; ebben csak aktivált iszap és ásványi tápoldat van, amelyet a vizsgálati edényekben lévő térfogattal megegyező térfogatra kell kiegészíteni.
1.6.2. A kísérlet végrehajtása
A vizsgálati edényeket mágneses vagy csavaros keverővel diffúz megvilágításban vagy egy sötét szobában 20 és 25 oC közötti hőmérsékleten kell kikeverni. A levegőztetést tisztítás céljából vattaszűrőn és szükség esetén mosópalackon keresztül fúvatott sűrített levegővel érik el. Biztosítani kell, hogy az iszap ne ülepedjen le, és az oxigénkoncentráció ne essen 2 mg/liter alá.
A pH-értéket rendszeres időközönként (pl. naponta) ellenőrizni kell, és szükség esetén be kell állítani 7 és 8 közé.
A párolgási veszteséget közvetlenül a mintavétel előtt ionmentesített vagy desztillált vízzel a megfelelő mennyiségben pótolni kell. Jó módszer, ha a folyadék szintjét a vizsgálatok megkezdése előtt jelöljük az edény falán. Minden mintavétel után új jelet tesznek (levegőztetés és keverés nélkül). Az első mintákat mindig a vizsgálat megkezdését követő három óra múlva veszik, hogy kiderítsék, felszívódott-e a vizsgált anyag az aktivált iszapba.
A vizsgált anyag eltűnését követően naponta vagy más rendszeres időközben végeznek DOC-vagy COD-meghatározást. A vizsgálati edényből és a vakpróbából származó mintákat gondosan átmosott szűrőpapíron átszűrik. Az oldat szűri etének első 5 ml-ét eldobják. A nehezen szűrhető iszapot előzetesen tízperces centrifugálással távolítják el. A DOC- és COD-meghatározásokat legalább két párhuzamos mintán el kell végezni. A vizsgálatot 28 napon át folytatják.
Megjegyzés: A továbbra is zavaros mintákat membránszűrőn szűrik át. A membránszűrő nem bocsáthat ki, és nem vehet fel szerves anyagokat.
Valamely ismert anyagot tartalmazó edényt is be kell állítani a vizsgálati sorba, hogy ellenőrizzék az aktivált iszap működőképességét. E célra a dietilén-glikol megfelelő.
Ha az elemzéseket viszonylag rövid időközönként végzik (például naponta), az adaptáció a bomlási görbéből világosan felismerhető (lásd a 2. ábrát). Ezért nem célszerű a vizsgálatot közvetlenül a hétvége előtt megkezdeni.
Ha az adaptáció a vizsgálati időszak vége felé jelenik meg, a vizsgálatot meg lehet hosszabbítani, amíg a lebomlás be nem fejeződött.
Megjegyzés: Ha szükség van bővebb ismeretekre az adaptálódott iszap viselkedésével kapcsolatosan, ugyanazt az aktivált iszapot kell még egyszer ugyanazon vizsgált anyaggal kezelni, az alábbi eljárás szerint:
Kikapcsolják a keverőgépet és a szellőztető berendezést, majd hagyják, hogy az aktivált iszap leülepedjen. Leszívják a felülúszó folyadékot, vízzel feltöltik két literre, 15 percig keverik, majd hagyják, hogy ismét leülepedjen. Miután a felülúszót ismét leszívták, a visszamaradt iszapot arra használják, hogy a vizsgálatot ugyanazon anyaggal a fenti 1.6.1.4. és 1.6.2. pontnak megfelelően megismételjék. Az aktivált iszap ülepítés helyett centrifugálással is elkülöníthető.
Az adaptált iszapot friss iszappal is elkeverhetik literenként 0,2–1 g közötti száraz tömeg/liter koncentrációig.
A mintákat szokásos esetben gondosan átmosott szűrőpapíron szűrik meg (a mosáshoz ionmentesített vizet kell használni).
A továbbra is zavaros mintákat membránszűrőn is át kell szűrni (0,45 μm).
A DOC-koncentrációt a TOC-műszer segítségével két párhuzamos mintán határozzák meg a minták szűri eteiből (az első 5 ml-t kiöntik). Ha a szűrletet nem tudják ugyanazon a napon elemezni, azokat másnapig hűtőszekrényben kell tárolni. Ennél hosszabb tárolás nem ajánlott.
A COD-koncentráció meghatározását a minta szűrletéből a hivatkozott szakirodalomban másodikként feltüntetett dokumentumban ismertetett eljárás szerint végzik el.
2. ADATOK ES ÉRTÉKELÉS
A DOC- és/vagy COD-koncentrációkat legalább két párhuzamos mintán kell meghatározni a fentebb említett 1.6.2. pont szerint. A T időben fennálló bomlás mértékét a fentebb az 1.2. pontban ismertetett képlet alapján számolják ki.
A bomlás mértékét a legközelebbi egész százalékra kerekítik. A vizsgálat végén kapott bomlási értéket a jegyzőkönyvben „Biológiai lebonthatóság a Zahn-Wellens vizsgálat szerint” címen rögzítik.
Megjegyzés: Ha teljes bomlást észlelünk a vizsgálati idő lejárta előtt, és az eredményt a következő napon megismételt elemzés is megerősíti, a vizsgálatot le lehet zárni.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
az anyag kiindulási koncentrációja, |
|
— |
minden egyéb információ és a vizsgált anyagra, a referenciaanyagra – ha volt –, valamint a vakpróbára vonatkozó vizsgálati eredmények, |
|
— |
koncentráció három óra elteltével, |
|
— |
biológiai bomlási görbe, leírással, |
|
— |
dátum és helyszín, ahonnan a vizsgálati organizmusok mintáját vettük, adaptációs állapotuk, a felhasznált koncentráció stb., |
|
— |
a vizsgálati eljárásban történt bármely változtatás tudományos okai. |
3.2. AZ EREDMÉNYEK ÉRTELMEZÉSE
A DOC (COD) eltűnése, amely fokozatosan, napok vagy hetek alatt játszódik le, azt jelzi, hogy a vizsgált anyag biológiai úton bomlik le.
Bizonyos esetekben azonban a fizikokémiai felszívódás is szerepet játszhat, amit az jelez, ha rögtön az első három órán belül teljesen vagy részben eltűnik az anyag, és a kontroll-, valamint a vizsgálati edényben mért felülúszó folyadék mennyisége közötti különbség jóval a várt szint alatt marad.
További vizsgálatokra van szükség, ha az adszorpciót és a tényleges (vagy részleges) biológiai bomlást szándékoznak elkülöníteni.
Számos lehetőség kínálkozik, de ezek közül a legmeggyőzőbb az, ha a felülúszót vagy az iszapot használják fel kiindulási törzsként (inokulum) egy alapvizsgálathoz (lehetőleg egy respirometriás vizsgálathoz).
Azon vizsgált anyagok, amelyek DOC- (COD-) értékei a szóban forgó vizsgálat során gyorsan és nem felszívódás útján csökkennek, biológiailag lebonthatónak tekinthetők. A részleges és nem felszívódás útján történő kiürülés azt jelzi, hogy a vegyület legalább részben bomlik biológiailag. Ha a DOC- (COD-) érték nem vagy csak alig csökken, annak oka lehet az is, hogy a vizsgált anyag gátolja a mikroorganizmusokat, amit az is jelezhet, hogy az iszap szétesik és elvész, zavaros felülúszót eredményezve. Ilyenkor a vizsgálatot a vizsgált anyag alacsonyabb koncentrációjával kell megismételni.
Vegyületspecifikus analitikai módszerek vagy a 14C izotóppal jelölt vizsgált anyag használata nagyobb érzékenységet tesz lehetővé. Ha 14C izotóppal jelölt vegyületet alkalmaznak, a biológiai bomlás tényét a 14CO2 kinyerési aránya fogja megerősíteni.
Ha az eredményeket elsődleges biológiai bomlás formájában adják meg, lehetőség szerint magyarázatot kell adni a kémiai szerkezet olyan jellegű változását illetően, amely a kiindulási vegyület ismételt fellelésének hiányát okozza.
A vak vizsgálati közeg válaszreakciója mellett az analitikai módszer hitelesítését is meg kell adni.
4. HIVATKOZOTT SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 302. B. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges |
|
(2) |
Annex V C.9 Degradation: Chemical Oxygen Demand, A Bizottság 84/449/EGK irányelve (HL L 251., 1984.9.9., 1. o). |
Függelék
ÉRTÉKELÉSI PÉLDA
|
Szerves vegyület: |
4-etoxi-benzoesav |
|
Elméleti vizsgálati koncentráció: |
600 mg/l |
|
Elméleti DOC-tartalom: |
390 mg/l |
|
Oltóanyag (inokulum) |
szennyvíztisztító telep |
|
Koncentráció: |
1 gramm szárazanyag-tartalom/liter |
|
Adaptációs állapot: |
nincs adaptálva |
|
Elemzés: |
DOC-meghatározás |
|
A minta mennyisége: |
3 ml |
|
Kontrollvegyület: |
dietilén-glikol |
|
A vegyület toxicitása: |
1 000 mg/l alatt nincs toxikus hatás Használt vizsgálat: fermentációs kémcsőpróba |
|
Vizsgálati idő |
Kontrollanyag |
Vizsgált anyag |
|||||
|
Vak DOC (16) mg/l |
DOC (16) mg/l |
Nettó DOC mg/l |
Bomlás % |
DOC (16) Mg/l |
Nettó DOC Mg/l |
Bomlás % |
|
|
0 |
— |
— |
300,0 |
— |
— |
390,0 |
— |
|
3 óra |
4,0 |
298,0 |
294,0 |
2 |
371,6 |
367,6 |
6 |
|
1 nap |
6,1 |
288,3 |
282,2 |
6 |
373,3 |
367,2 |
6 |
|
2 nap |
5,0 |
281,2 |
276,2 |
8 |
360,0 |
355,0 |
9 |
|
5 nap |
6,3 |
270,5 |
264,2 |
12 |
193,8 |
187,5 |
52 |
|
6 nap |
7,4 |
253,3 |
245,9 |
18 |
143,9 |
136,5 |
65 |
|
7 nap |
11,3 |
212,5 |
201,2 |
33 |
104,5 |
93,2 |
76 |
|
8 nap |
7,8 |
142,5 |
134,7 |
55 |
58,9 |
51,1 |
87 |
|
9 nap |
7,0 |
35,0 |
28,0 |
91 |
18,1 |
11,1 |
97 |
|
10 nap |
18,0 |
37,0 |
19,0 |
94 |
20,0 |
2,0 |
99 |
1. ábra
Biológiai bomlás görbéje (példa)

2. ábra
A szennyviziszap adaptálása (példa)

C.10. BIOLÓGIAI LEBOMLÁS
ELEVENISZAP-SZIMULÁCIÓS VIZSGÁLAT
1. MÓDSZER
1.1. BEVEZETÉS
1.1.1. Általános megjegyzések
A módszer csak olyan szerves vizsgált anyagokra alkalmas, amelyek a kísérletben használt koncentrációban:
|
— |
a vizsgált oldat előállításához szükséges mértékben vízben oldódnak, |
|
— |
páranyomása a vizsgálati körülmények között elhanyagolható, |
|
— |
a baktériumokat nem gátolják. |
A vizsgált anyag főbb összetevői egymáshoz viszonyított részarányának ismerete hasznos lehet a kapott eredmények értékelése során, különösen azon esetekben, amikor az eredmények alacsony számértékűek vagy marginálisak.
Az anyag mikroorganizmusokra gyakorolt toxikus hatásának ismerete kívánatos az alacsony számértékű eredmények értékelésénél és a megfelelő vizsgált koncentrációk kiválasztásánál.
1.1.2. A végső biológiai lebonthatóság meghatározása (DOC-/COD-elemzés)
A módszer célja, hogy a vizsgált anyag egy 12 mg DOC/liter (vagy megközelítőleg 40 mg COD/liter) értéket meghaladó koncentrációjú, megfelelő aktiváltszennyvíziszap-modellben történő kivonásának mérése útján meghatározza az anyag végső biológiai lebonthatóságát; a legkedvezőbbnek a 20 mg DOC/liter érték tűnik. (DOC = oldott szerves szén; COD = kémiai oxigénigény).
A vizsgált anyag szervesszén-mennyiségét (vagy kémiai oxigénigényét) kell meghatározni.
1.1.3. Az elsődleges biológiai lebonthatóság meghatározása (specifikus analízis)
A módszer célja, hogy specifikus elemző eljárás segítségével körülbelül 20 mg/literes koncentrációnál meghatározzuk valamely anyag elsődleges biológiai lebonthatóságát az aktiváltszennyvíziszap-modellben (ennél nagyobb és kisebb koncentrációk is alkalmazhatók, ha az analitikai módszer és a toxicitási megfontolások lehetővé teszik). Ezzel lehetővé válik az anyag primer lebomlásának meghatározása (a kiindulási kémiai szerkezet eltűnése).
A módszernek nem célja a vizsgált anyag mineralizációjának meghatározása.
A vizsgált anyag meghatározásához megfelelő elemzési módszernek kell rendelkezésre állnia.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
1.2.1. DOC/COD-elemzés
Az anyag eltávolításának mértékét a következő képlet adja meg:
|
|
[1(a)] |
ahol:
|
DR |
= |
a DOC (vagy COD) értékének százalékos csökkenése a vizsgált anyagra vonatkozó átlagos visszatartási időn belül, |
|
T |
= |
a vizsgált anyag koncentrációja a beömlő anyagban mg DOC/literben (vagy mg COD/literben), |
|
E |
= |
DOC- (vagy COD-) koncentrációs érték a vizsgálati egység kifolyásánál mg DOC/liter (vagy mg COD/liter), |
|
Eo |
= |
DOC- (vagy COD-) koncentrációs érték a vakpróba kifolyásánál mg DOC/liter (vagy mg COD/liter). |
A lebomlást a vizsgált anyagra vonatkozó átlagos visszatartási időn belül a DOC- (vagy COD-) érték százalékos csökkenésével adjuk meg.
1.2.2. Specifikus analízis
A vizsgált anyagnak az RW vizes fázisból az adott átlagos visszatartási időn belül történő eltűnését százalékos értékben a következő képlet mutatja:
|
|
[1(b)] |
ahol:
|
CI |
= |
az anyag koncentrációja a vizsgálati egység beömlésénél (mg anyag/liter, a specifikus analízis eredménye alapján), |
|
Co |
= |
az anyag koncentrációja a vizsgálati egység kifolyásánál (mg anyag/liter, a specifikus analízis eredménye alapján). |
1.3. REFERENCIAANYAGOK
Egyes esetekben, ha új anyagokat vizsgálunk, hasznos lehet a referenciaanyagok alkalmazása; konkrét referenciaanyagok ajánlása azonban egyelőre nem lehetséges.
1.4. A VIZSGÁLATI MÓDSZEREK ALAPELVE
A végső biológiai lebonthatóság meghatározásához két aktiváltszennyvíziszap-vizsgálati egységet (OECD-megerősítő vizsgálatot vagy lyukacsos edényt) működtetnek párhuzamosan. A vizsgált anyagot a beömlő szennyvízhez adagolják (mesterséges vagy kommunális szennyvíz) az egyik egységnél, míg a másik csak a szennyvizet kapja. Az elsődleges biológiai lebonthatóságnak a beömlésnél, illetve a kifolyásnál specifikus analitikai módszerekkel történő meghatározásához csak az egyik egységet használják.
A DOC- és COD-koncentrációkat a kifolyásnál mérik, vagy specifikus elemzéssel meghatározzák az anyagok koncentrációit.
A vizsgált anyaghoz tartozó DOC-értéket nem mérik, csak megállapítják.
Ha DOC- (vagy COD-) méréseket hajtanak végre, a vizsgálati és a kontroll kifolyási értékek közötti különbséget a le nem bomlott vizsgált anyagnak tulajdonítják.
Ha specifikus elemzéseket végeznek, a kiindulási molekula koncentrációjának változását lehet mérni (elsődleges biológiai lebonthatóság).
Az egységeket egy átoltási eljárás révén „kapcsolt egység üzemmódban” is lehet üzemeltetni.
1.5. MINŐSÉGI KÖVETELMÉNYEK
Az anyag kiindulási koncentrációja az elvégzett elemzés típusán és korlátain múlik.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
1.6.1.1.
Ugyanolyan típusú egységből kell két darab, kivéve, amikor specifikus elemzéseket végzünk. Kétféle berendezés áll rendelkezésünkre:
OECD-megerősítő vizsgálat
A készülék (1. függelék) szintetikus szennyvíz tárolására alkalmas tartályból (A), adagolószivattyúból (B), levegőztetőedényből (C), szeparátorból (D), az aktivált iszapot visszaforgató légszivattyúból (E), valamint a kezelt kifolyó anyag összegyűjtésére szolgáló edényből (F) áll.
Az (A) és (F) edénynek üvegből vagy megfelelő műanyagból kell készülnie, és legalább 24 liter űrtartalmúnak kell lennie. A (B) szivattyú folyamatos áramlási sebességen szállítja a szintetikus szennyvizet a levegőztetőedényhez; ehhez bármilyen alkalmas rendszer megfelel, feltéve, hogy biztosítani tudja a befolyás mértékét és koncentrációját. A szokásos működés során a szeparátor (D) magasságát úgy kell rögzíteni, hogy a levegőztetőedényben található kevert folyadék térfogata három liter legyen. A (C) edényben a kúp hegyénél szinterelt levegőztetőkockát (G) függesztünk fel. A levegőztetőn keresztül áramló levegő mennyiségét áramlásmérővel szabályozhatjuk.
A légszivattyút (E) úgy állítják be, hogy a szeparátorról kikerülő aktivált iszap folyamatosan és rendszeresen visszavezethető legyen a levegőztetőedénybe.
„Lyukacsos edény”
A lyukacsos edény 2 mm vastag és 95 mikrométer legnagyobb pórusátmérőjű, porózus polietilén lapokból áll, amelyeket 14 cm átmérőjű, 45o-ban kúposan végződő hengerekbe hajtanak be (lásd a 2. függelék 1. és 2. ábráját). A lyukacsos edény egy másik, megfelelő műanyagból készült, nem áteresztő, 15 cm átmérőjű edényben van, amelynek kivezetése a hengeres részen 17,2 cm magasan található, ami az edény térfogatát is meghatározza (3 liter). A belső edény felső végét megfelelő műanyagból készült, merev támasztógyűrű tartja, ami által a belső és külső edény között egy 0,5 cm széles kifolyási tér keletkezik.
A lyukacsos edények termosztáttal ellátott vízfürdő fenekére szerelhetők. A belső edény aljához levegőellátást kell csatolni, amelyen megfelelő diffúzorok találhatók.
Az (A) és (E) edénynek üvegből vagy megfelelő műanyagból kell készülnie, és legalább 24 liter űrtartalmúnak kell lennie. A (B) szivattyú folyamatos áramlási sebességen szállítja a szintetikus szennyvizet a levegőztetőedényhez; ehhez bármilyen alkalmas rendszer megfelel, feltéve hogy biztosítani tudja a befolyás mértékét és koncentrációját.
Tartalék lyukacsos edényeket kell készenlétben tartani a használat közben eltömődöttek felváltására; az eltömődött edényeket előbb 24 órára hipokloritoldatba merítjük, majd csapvízzel alaposan elmossuk.
1.6.1.2.
Membránszűrő berendezés és membránszűrők 0,45 μm-es pórusokkal. A membránszűrők akkor felelnek meg a célnak, ha meggyőződtünk róla, hogy sem szenet nem bocsátanak ki, sem pedig a vizsgált anyagot nem szívják magukba a szűrés során.
1.6.1.3
Megfelelő szintetikus tápoldat vagy kommunális szennyvíz használható.
A szintetikus szennyvíz összetétele (példa):
Egy liter csapvízben a következő anyagokat oldják fel:
|
Pepton: |
160 mg, |
|
Húskivonat: |
10 mg, |
|
Karbamid: |
30 mg, |
|
NaCl: |
7 mg, |
|
CaCl2.2H2O: |
4 mg, |
|
MgSO4 7H2O: |
2 mg, |
|
K2HPO4: |
28 mg. |
Kommunális szennyvíz
Ezt naponta frissen kell begyűjteni egy főként kommunális szennyvizet fogadó szennyvízkezelő telep első ülepítőtartályának túlfolyójából.
1.6.1.4.
A vizsgált anyag törzsoldata, pl. 1 %-os, elkészítésére van szükség, amelyet a vizsgálati egységhez adunk hozzá. Az anyag koncentrációját meg kell határozni, hogy tudjuk, mekkora kellő mennyiséget kell a szennyvízbe vagy egy második pumpa segítségével közvetlenül a vizsgálati egységbe adagolni a kívánt vizsgált koncentráció eléréséhez.
1.6.1.5.
Megjegyzés: Ha kommunális szennyvizet használunk, nincs értelme kevés baktériumot tartalmazó inokulumot használni, ehelyett aktivált szennyvíziszapot használhatunk.
Számosfajta inokulum használható.
Példának három, megfelelő eredményt adó inokulum kerül ismertetésre:
|
a) |
Másodlagos kifolyásnál gyűjtött inokulum Az inokulumot jó minőségű másodfokú kifolyásból is lehet nyerni, ha azt főként kommunális szennyvíz tisztításával foglalkozó telepről gyűjtik. A szennyvizet a mintavétel és a felhasználás közötti időszakban aerob körülmények között kell tartani. Az inokulum előkészítéséhez a mintát szűrik át egy durva szűrőn, és az első 200 ml szűrletet öntik ki. A szűrletet is aerob körülmények között szükséges tartani felhasználásig. Az inokulumot az elkészítés napján fel kell használni. A beoltáshoz legalább 3 ml szűrletet kell felhasználni. |
|
b) |
Összetett inokulum Másodlagos kifolyásnál gyűjtött inokulum: Leírását lásd fent. Talajból gyűjtött inokulum: 100 g (termékeny és nem meddő) kerti talajt szuszpendálnak 1 000 ml klórmentes ivóvízben. (A rendkívül nagy agyag-, homok- vagy humusztartalmú talajok nem alkalmasak a célra.) Elkeverés után a szuszpenziót 30 percig ülepedni hagyják. A felülúszót durva szűrőpapíron átszűrik, az első 200 ml-t kiöntik. A szűrletet azonnal levegőztetni kell, és aerob körülmények között kell tartani felhasználásig. Az inokulumot az elkészítés napján fel kell használni. Felszíni vízből gyűjtött inokulum: Az inokulum további alkotórészét közepesen szennyezett felszíni vízből nyerik. A mintát egy durva szűrőn átszűrik, és az első 200 ml-t kiöntik. A szűrletet aerob körülmények között kell tartani felhasználásig. Az inokulumot az elkészítés napján fel kell használni. A háromféle oltóminta azonos térfogatát összeöntik, jól elkeverik, és a végleges inokulumot ebből a keverékből veszik ki. A beoltáshoz legalább 3 ml szűrletet kell használni. |
|
c) |
Aktivált szennyvíziszapból származó inokulum Valamely elsődlegesen kommunális szennyvizet tisztító szennyvízkezelő telep levegőztetőtartályából vett (3 liternél nem nagyobb térfogatú) aktivált szennyvíziszap használható fel inokulumnak (a szuszpendáltszilárdüledék-tartalom legfeljebb 2,5 g/liter). |
1.6.2. A kísérlet végrehajtása
A vizsgálatot szobahőmérsékleten végzik, 18 és 25 oC között.
Adott esetben a vizsgálatot elvégezhetjük ennél alacsonyabb hőmérsékleti viszonyok mellett is (egészen 10 oC-ig); ha az anyag lebomlott, akkor további vizsgálatokra rendszerint nincs szükség. Ha azonban nem bomlott le, a vizsgálatot állandó, 18 és 25 oC közötti szobahőmérsékleten kell megismételni.
1.6.2.1.
Az iszap növekedési/stabilizációs ideje az az időszak, amelynek során az aktivált szennyvíziszapban szuszpendált szilárd üledék koncentrációja és az egységek teljesítménye állandó állapotot ér el az adott üzemeltetési körülmények között.
A felfuttatási időszak a vizsgált anyag első alkalommal való hozzáadásától addig tart, amíg eltávolítása egy platót (viszonylag állandó értéket) ér el. Ez az időszak nem lehet hosszabb hat hétnél.
Az értékelési időszak egy háromhetes időszak, amelyet attól az időponttól kell számítani, amikor a vizsgált anyag eltávolítása elért egy aránylag állandó és rendszerint magas értéket. Azon anyagok esetében, amelyek nem vagy csak kis mértékben mutatnak biológiai lebonthatóságot az első hat hét során, az értékelési időszaknak az ezt követő három hetet kell tekinteni.
Először meg kell tölteni a vizsgálathoz szükséges egységet (egységeket) az inokulummal kevert szennyvízzel.
Ezt követően működésbe kell hozni a levegőztetőt (és az OECD-megerősítésivizsgálat-egységeknél az (E) légszivattyút), valamint az adagolóeszközt (B).
A vizsgált anyagot nem tartalmazó szennyvíznek először a levegőztetőedényen kell keresztülhaladnia (C), óránként egyliteres vagy óránként félliteres sebességgel; ezáltal az átlagos visszatartási idő három, illetve hat óra lesz.
A levegőztetés mértékét úgy kell szabályozni, hogy a (C) edény tartalma folyamatosan szuszpendált állapotban maradjon, és közben az oldottoxigén-tartalom legalább 2 mg/liter legyen.
A habképződést megfelelő eszközökkel meg kell akadályozni. Nem használható azonban az aktivált iszapokban zajló folyamatot akadályozó habzásgátló anyag.
A (C) levegőztetőedény tetején (az OECD-megerősítésivizsgálat-egységekben pedig a (D) ülepítőedény alján, valamint a cirkulációs egységben) összegyűlt iszapot naponta legalább egyszer kefével vagy egyéb alkalmas eszközzel vissza kell terelni a folyadékkeverékbe.
Ha az iszap nem ülepszik le, sűrűségét 2 ml 5 %-os vas-klorid adagjainak – szükség esetén ismételt – hozzáadásával lehet növelni.
A kifolyó szennyvizet 20–24 órán keresztül az (E vagy F) edényben gyűjtik, és az alapos összekeverését követően mintát vesznek belőle. Az edényt (E vagy F) gondosan kitisztítják.
A folyamat hatékonyságának ellenőrzésére és nyomon követésére az összegyűlt kifolyó szennyvíz szűrletéből, valamint a megszűrt befolyó szennyvízből hetente legalább két alkalommal meghatározzák a kémiai oxigénigényt (COD), illetve az oldottszervesszén-tartalmat (DOC) (0,45 μm pórusátmérőjű membránnal és a szűrlet első, megközelítőleg 20 ml-es mennyiségét kiöntve).
Ha nagyjából szabályos napi lebomlási érték állt be, a DOC- és COD-értékek csökkenése is megállapodik.
Az aktivált iszap szárazanyag-tartalmát a levegőztetőtartályban hetente kétszer kell meghatározni (g/liter mértékegységben). Az egységeket kétféle módon üzemeltethetik: vagy az aktivált iszap szárazanyag-tartalmát határozzák meg hetente kétszer, és ha az meghaladja a 2,5 g/liter értéket, a felesleget kiveszik, vagy pedig minden edényből naponta 500 ml kevert folyadékot vesznek úgy ki, hogy az átlagos iszap-visszatartási idő hat nap maradjon.
Ha a mért és a becsült paraméterek (a folyamat DOC- és COD-csökkenés révén becsült hatékonysága, az iszap töménysége, üledékképző hajlandósága, a kifolyó szennyvíz zavarossága stb.) a két egységben már kellőképpen állandó értékre álltak be, az egyik egység befolyó szennyvizéhez az 1.6.2.2. pontban leírt módon hozzáadhatják a vizsgált anyagot.
A vizsgált anyagot választhatóan az iszap növekedési időszakának az elején is bekeverhetik (1.6.2.1.), különösen, ha inokulum formájában adják hozzá.
1.6.2.2.
A felfuttatási időszak üzemeltetési feltételeit itt is megtartják, és a vizsgált anyag törzsoldatának kellő mennyiségét (megközelítőleg 1 %) adják hozzá a szennyvízhez a vizsgálati egység beömlésénél, hogy a szennyvízben kialakuljon a vizsgált anyag kívánt koncentrációja (megközelítőleg 10–20 mg DOC/liter vagy 40 mg COD/liter között). Ez úgy érhető el, ha a vizsgált anyag törzsoldatát egy külön szivattyúrendszerrel naponta bekeverik a szennyvízbe. A koncentrációt fokozatosan lehet elérni. Ha a vizsgált anyagnak semmilyen toxikus hatása nincs az aktivált iszapra, magasabb koncentrációkat is lehet vizsgálni.
A kontrollegységet csak a szennyvízzel járatják, a vizsgált anyag hozzáadása nélkül. A kifolyó szennyvízből megfelelő mennyiségű mintákat vesznek, és azokat membránszűrőn (0,45 μm) szűrik át, az első (körülbelül) 20 ml-t kiöntve.
A szűrt mintát még aznap elemezni vagy bármilyen megfelelő módszerrel konzerválni kell, például 10 ml szűrlethez 0,05 ml 1 %-os higany-klorid- (HgC12) oldat hozzáadásával vagy 2–4 oC hőmérsékleten tárolva legfeljebb 24 órára, illetve –18 oC hőmérsékleten hosszabb időszakra.
A felfuttatási időszak a vizsgált anyag hozzáadásával együtt nem haladhatja meg a hat hetet, az értékelési időszak viszont nem lehet rövidebb három hétnél, vagyis a végeredmény kiszámításához körülbelül 14–20 meghatározásnak kell rendelkezésre állnia.
Kapcsolt egység üzemmód
A két egység összekapcsolása úgy valósítható meg, hogy az iszapot is tartalmazó, kevert folyadék 1,5 literét naponta kicserélik a két egység aktivált iszapot tartalmazó levegőztetőedényben. Erősen abszorbeáló vizsgált anyagok esetén csak másfél liter felülúszót vesznek le az ülepítőedényekből, és a másik egység aktivált iszapot tartalmazó edényéhez töltik.
1.6.2.3.
Az anyag viselkedésének nyomon követésére kétféle elemzést végezhetnek:
DOC és COD
A DOC-koncentráció-meghatározásokat kettesével végzik szénelemzővel és/vagy a szakirodalom (2) hivatkozásában megadottak szerint a COD-értékek meghatározásával.
Specifikus analízis
Alkalmas analitikai módszerrel meghatározzák a vizsgált anyag koncentrációit. Ha lehetséges, azt is meg kell határozni, milyen mértékben abszorbeálódik az anyag az iszapban.
2. ADATOK ÉS ÉRTÉKELÉS
2.1. KAPCSOLT EGYSÉG ÜZEMMÓDBAN
Ha a „kapcsolt egység üzemmódot” használjuk, a napi elvonás fokát (DR) az 1.2.1. pontnak megfelelően számítják ki.
Az említett DR napi elvonási értéket háromórás átlagos visszatartási idő esetén a [2], hatórás átlagos visszatartási idő esetén pedig a [3] képlet segítségével az átoltási folyamat anyagátvitelének figyelembevétele érdekében DRc-re korrigáljuk.
|
|
[2] |
|
|
[3] |
A DRc-értékek sorozatának átlagát, továbbá a normál szórást a [4] képlet szerint számítják ki:
|
|
[4] |
Ahol:
|
sDRc |
= |
a DRc-értékek sorozatának normál szórása, |
|
|
= |
a DRc-értékek átlaga, |
|
n |
= |
a meghatározások száma. |
A DRc-terület szóróértékeit 95 %-os valószínűséggel a megfelelő statisztikai eljárással kiküszöbölik, pl. Nalimov-módszerrel (6), majd az átlagot és a normál szórást ismét kiszámítják a szórásmentes DRc-adatokra is.
A végeredményt az [5] képlet alapján a következőképpen számítják ki
|
|
[5] |
ahol
|
tn–1 ;α |
= |
a t táblázati értéke n számú E és Eo értékpárra P (P = 1 – α) statisztikai konfidenciaszinten, ahol P 95 %-on áll (1). |
Az eredményt 95 %-os valószínűséggel, az átlagértékkel és a tűréshatárokkal fejezik ki, a hozzá tartozó normál szórással és a szórásmentes DRc-adatsor adatainak számával, pl.
|
DRc |
= |
98,6±2,3 % DOC-csökkenés, |
|
s |
= |
4,65 % DOC-csökkenés, |
|
n |
= |
18, |
|
x |
= |
szóróértékek száma. |
2.2. NEM KAPCSOLT ÜZEMMÓD
Az egységek teljesítménye a következőképpen ellenőrizhető:

E napi eltávolítási arányok grafikus formában ábrázolhatók a tendenciák – például az akklimatizáció – kifejezésre juttatása érdekében.
2.2.1. COD/DOC-meghatározások használata
A DR napi eltávolítási arányt az 1.2.1. pont szerint számítják ki.
Kiszámítják a DR-értékek sorozatának középértékét; ezenkívül kiszámolják a normál szórást, a következőképpen:
|
|
[6] |
ahol:
|
SDR |
= |
a DRi-értékek sorozatának normál szórása, |
|
|
= |
a DRi-értékek átlaga, |
|
n |
= |
meghatározások száma. |
A DR-terület szóró értékeit 95 %-os valószínűséggel megfelelő statisztikai eljárással kiküszöbölhetik, pl. Nalimov-módszerrel (6), majd az átlagot és a normál szórást ismét kiszámítják a szórásmentes DR-adatokra is.
A végeredményt a [7] képlettel a következőképpen számítják ki:
|
|
[7] |
ahol:
|
tn–1;α |
= |
a t táblázati értéke n számú E és Eo értékpárra P (P = 1 – α) statisztikai konfidenciaszinten, ahol P 95 %-on áll (1). |
Az eredményt 95 %-os valószínűség mellett az átlagértékkel és a tűréshatárokkal fejezik ki, a hozzá tartozó normál szórással és a szórásmentes DR-adatsor, valamint a szórás adatainak számával, pl.
|
DR |
= |
(98,6±2,3) % DOC-csökkenés, |
|
s |
= |
4,65 % DOC-csökkenés, |
|
n |
= |
18, |
|
x |
= |
a szóró értékek száma. |
2.2.2. A specifikus analízis alkalmazása
A vizsgált anyag vizes fázisban való eliminálódásának százalékos értékét (RW) az 1.2.2. pont szerint számítják ki.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
a 3. függelékben megadott űrlapot, amely bemutatja a vizsgálat üzemeltetési feltételeit, |
|
— |
a választott készüléket (OECD-megerősítési vizsgálat vagy lyukacsos edény), |
|
— |
a választott üzemmód: kapcsolt egységek vagy nem kapcsolt egységek, |
|
— |
szennyvíz leírása: szintetikus vagy kommunális – kommunális szennyvíz esetén a mintavétel kelte és helye, |
|
— |
inokulum fajtája, a mintavétel kelte és helye, |
|
— |
specifikus elemzések esetén az alkalmazott módszer megnevezése és annak ismertetése, |
|
— |
a COD vagy DOC eltávolításának sebessége az idő függvényében, beleértve a felfuttatási és értékelési időszakot, |
|
— |
a vizsgált anyag analitikai visszanyerése COD vagy DOC formájában a törzsoldatból, |
|
— |
ha specifikus elemzésekre került sor, a vizsgált anyag vizes fázisban való bomlásának ábrázolása százalékban, az idő függvényében a felfuttatási és értékelési időszakban, |
|
— |
a vizsgált anyag COD- és DOC-értékének átlagos csökkenését, valamint a normál szórást az értékelési időszak eredményéből számítják ki, azaz, amikor már a vizsgált anyag bomlása állandó értéket ér el, vagy folyamatos működési időszak következett be, |
|
— |
az aktivált szennyvíziszap koncentrációjának alakulása az idő függvényében, |
|
— |
az aktivált iszapra vonatkozó bármely megjegyzés és megfigyelés (a felesleges iszap eltávolítása, ömlesztés jelenléte, FeC13 stb.), |
|
— |
az anyag vizsgálathoz használt koncentrációja, |
|
— |
az iszap elemzésével kapott eredmények, |
|
— |
a vizsgált anyag és – ha használtuk – a referenciaanyag vizsgálati eredményei és az összes információ, |
|
— |
az eljárásban alkalmazott változtatások tudományos indokolása. |
3.2. AZ EREDMÉNYEK ÉRTELMEZÉSE
Ha a vizsgált anyag mennyisége nem, vagy csak alig csökken a vizes fázisban, annak oka lehet az is, hogy a vizsgált anyag gátolja a mikroorganizmusokat. Ezt az iszap szétesése és vesztesége is jelzi, zavaros felülúszót eredményezve, illetve a COD vagy DOC eltávolítási hatékonyságának csökkenése az elővizsgálati berendezésben.
Bizonyos esetekben a fizikokémiai felszívódás is szerepet játszhat. A molekula biológiai lebomlása és a fizikokémiai adszorpció közötti különbség feltárható, ha deszorpció után elemzik az iszapot.
További vizsgálatokra van szükség, ha az adszorpciót és a tényleges (vagy részleges) biológiai bomlást el akarják különíteni.
Ezt számos módon el lehet végezni, de ezek közül a legmeggyőzőbb az, ha a felülúszót vagy az iszapot használják fel egy alapvizsgálathoz (lehetőleg egy aspirációs vizsgálathoz).
Ha magas DOC-, illetve COD-csökkenést észlelnek, akkor az a biológiai lebonthatóság következménye, ám alacsony eltávolítás esetén a biológiai lebonthatóság nem különböztethető meg az eliminációtól és az adszorpciótól. Ha például egy oldható vegyület igen magas, 98 %-os felszívódási együtthatót mutat, és a felesleges iszaphulladék napi 10 %, az elimináció 40 % is lehet, míg ha a felesleges iszap kiöntött mennyisége 30 %, akkor az elimináció az adszorpció-többletiszap eltávolítása miatt 65 %-ra is nőhet (4).
Specifikus analízis esetén figyelemmel kell lenni az anyag kémiai szerkezete és az alkalmazott specifikus analízis közötti viszonyra. Ez esetben a megfigyelt jelenséget nem értelmezhetjük úgy, mint az anyag mineralizációját.
4. HIVATKOZOTT SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 303. A. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges. |
|
(2) |
Annex V C9 Degradation Test – Chemical Oxygen Demand, a Bizottság 84/449/EGK irányelve (HL L 251., 1984.9.9., 1. o). |
|
(3) |
Painter, H. A., King, E. F., WRC Porous-Pot method for assessing biodegradability, Technical Report TR70, June 1978, Water Research Centre, United Kingdom. |
|
(4) |
Wierich, P., Gerike, P., The fate of soluble, recalcitrant, and adsorbing compounds in activated sludge plants, Ecotoxicology and Environmental Safety, vol. 5, No 2, June 1981, pp. 161 to 171. |
|
(5) |
A 73/404/EGK és 73/405/EGK irányelvet (HL L 347., 1973.12.17.) módosító, 82/242/EGK és 82/243/EGK tanácsi irányelv (HL L 109., 1982.4.22.). |
|
(6) |
Streuli, H., Fehlerhafte Interpretation und Anwendung von Ausreipertests, insbesondere bei Ringversuchen zur Überprüfung analytisch-chemischer Untersuchungsmethoden, Fresenius-Zeitschrift für Analytische Chemie, 303 (1980), pp. 406 to 408. |
1. Függelék
1. ábra

2. ábra

2. függelék
1. ábra
A biológiai lebonthatóság értékelésére szolgáló készülék

2. ábra
A három literes lyukacsos levegőztetőedény részletes rajza

3. függelék
Működési feltételek az eleveniszap-szimulációs vizsgálathoz
Minden csoportnál ellenőrizendő
Készülék
|
OED-megerősítés |
|
|
Lyukacsos edény |
|
Üzemmód
|
Egyszerű egység |
|
|
Kapcsolt egység |
|
|
Nem kapcsolt egység |
|
Átoltás
|
Nincs |
|
|
Eleveniszap |
|
|
Felülúszó |
|
Átlagos visszatartási idő
|
3 óra |
|
|
6 óra |
|
Alaptápanyag
|
Kommunális szennyvíz |
|
|
Mesterséges szennyvíz |
|
Inokulum
|
Másodlagos kifolyásnál |
|
|
Összetett |
|
|
Aktivált szennyvíziszap |
|
Vizsgálati anyag hozzáadása
|
Kezdettől |
|
|
Lépcsőzetesen emelkedő |
|
|
Miután az iszap létrejött |
|
Értékelés
|
Specifikus |
|
|
COD |
|
|
DOC |
|
C.11. BIOLÓGIAI LEBOMLÁS
ELEVENISZAP-LÉGZÉSGÁTLÁSI VIZSGÁLAT
1. MÓDSZER
1.1. BEVEZETÉS
A módszerrel úgy mutatható ki valamely vizsgált anyag hatása a mikroorganizmusok működésére, hogy meghatározott körülmények között a vizsgált anyag különböző koncentrációinak jelenlétében mérik a légzés sebességét.
A módszer célja, hogy gyors szűrést tegyen lehetővé a mikrobiológiai szennyvízkezelő telepeket hátrányosan érintő anyagok azonosítására, és jelezze, hogy melyek azok a koncentrációk, amelyek még nem gyakorolnak gátló hatást a biológiai lebonthatóságot vizsgáló kísérletekben.
A meghatározó vizsgálatot megelőzheti egy dózisbehatároló vizsgálat. Ezzel tájékozódunk arról a koncentrációtartományról, amelyet a meghatározó vizsgálat során használnunk kell.
A vizsgálati protokoll tartalmaz két kontrollt is, vizsgált anyag nélkül, egyet a vizsgálati sor elején, egy másikat pedig a végén. Az aktivált iszappal végzett minden vizsgálatot referenciaanyaggal is ellenőrizhetjük.
A módszert leginkább olyan anyagoknál lehet alkalmazni, amelyek vízoldékonyságuk és alacsony illékonyságuk miatt nagy valószínűséggel a vízben maradnak.
A vizsgálati közegben csak korlátozottan oldódó anyagok esetében nem biztos, hogy meghatározható az EC50.
Az oxigén felvételén alapuló eredményekből téves következtetéseket vonhatnak le akkor, ha a vizsgált anyag hajlamos az oxidatív foszforiláció szétkapcsolására.
A vizsgálat elvégzésekor hasznos tudnivalók a következők:
|
— |
vízoldékonyság, |
|
— |
páranyomás, |
|
— |
szerkezeti képlet, |
|
— |
a vizsgált anyag tisztasági foka. |
Ajánlás
Az aktivált iszap esetlegesen patogén mikroorganizmusokat is tartalmaz, ezért kellő óvatossággal kell kezelni.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
A légzési sebesség a szennyvízben található mikroorganizmusok oxigénfogyasztásának üteme aerob iszapban, amelyet rendszerint mg O2/mg iszap/óra mértékegységben fejezik ki.
Az adott anyag egy bizonyos koncentrációnál kifejtett gátló hatásának kiszámításához a légzési sebességet a két kontrollban mért légzési sebesség átlagának százalékában fejezik ki:

ahol:
|
Rs |
= |
az oxigén fogyásának sebessége a vizsgált anyag vizsgált koncentrációja mellett, |
|
Rc1 |
= |
az oxigén fogyásának sebessége az 1. kontrollnál, |
|
Rc2 |
= |
az oxigén fogyásának sebessége a 2. kontrollnál. |
Az EC50 e módszer szerint a vizsgált anyagnak az a koncentrációja, amelynél a légzési sebesség a módszerben ismertetett körülmények mellett a kontrollban mérhetőnél 50 %-kal kevesebb.
1.3. REFERENCIAANYAGOK
Referenciaanyagként a 3,5-diklór-fenol, mint ismert légzésgátló anyag használatát javasolják, ezt kell az aktivált iszap minden sorozata esetében az EC50-érték szempontjából vizsgálni, így ellenőrizve, hogy az iszap érzékenysége nem rendellenes-e.
1.4. A VIZSGÁLATI MÓDSZER ALAPELVE
Szintetikus szennyvíz szabványos mennyiségeivel összekevert aktivált iszap légzési sebességét mérik harmincperces és/vagy háromórás érintkezési időt követően. Ugyanezen aktivált iszapnak a vizsgált anyag különféle koncentrációinak jelenlétében is megmérik a légzési sebességét minden más szempontból azonos feltételek mellett. A vizsgált anyag egy bizonyos koncentrációnál kifejtett gátló hatását a két kontrollban mért légzési sebesség átlagának százalékában fejezik ki. Az EC50-értéket a különféle koncentrációknál mért meghatározások alapján számítják ki.
1.5. MINŐSÉGI KÖVETELMÉNYEK
A vizsgálatok eredményei akkor érvényesek, ha:
|
— |
a két kontroll-légzésisebesség 15 %-nál jobban nem tér el egymástól, |
|
— |
a 3,5-diklór-fenol hozzáadása mellett mért EC50- (harmincperces és/vagy háromórás) érték az általánosan elfogadott 5–30 mg/liter tartományban van. |
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Reagensek
1.6.1.1.
A vizsgált anyag oldatait a törzsoldatból frissen készítik el a vizsgálat kezdetekor. Ha az alábbiakban ajánlott eljárást követik, a törzsoldat megfelelő koncentrációja 0,5 g/liter.
1.6.1.2.
A 3,5-diklór-fenol oldatát például elkészíthetik 0,5 g 3,5-diklór-fenol 10 ml 1 M-os NaOH-oldatban történő feloldásával, amelyet desztillált vízzel tovább hígítanak megközelítőleg 30 ml-re, majd állandó keverés közben 0,5 M H2SO4-oldatot adnak hozzá a kicsapódási pontig – ehhez körülbelül 8 ml 0,5 M H2SO4-re lesz szükség – és végül a keverék mennyiségét desztillált vízzel egy literre egészítik ki. Az oldat pH-ja ekkor 7 és 8 között kell, hogy legyen.
1.6.1.3.
Szintetikus szennyvíz előállításakor az alábbi anyagok megadott mennyiségeit oldják egy liter vízben:
|
— |
16 g pepton, |
|
— |
11 g húskivonat, |
|
— |
3 g karbamid, |
|
— |
0,7 g NaCl, |
|
— |
0,4 g CaCl2.2H2O, |
|
— |
0,2 g MgSO4.7H2O, |
|
— |
2,8 g K2HPO4. |
1. megjegyzés: A szintetikus szennyvíz „A szintetikus detergensekben használt felületaktív anyagok biológiai lebonthatóságának meghatározásához javasolt módszer” című OECD-műszaki jelentésben megadott recept százszoros koncentrátuma (1976. június 11.), dikálium-hidrogén-foszfáttal kiegészítve.
2. megjegyzés: Ha az elkészített oldatot nem használják fel azonnal, sötét helyen 0–4 oC közötti hőmérsékleten egy hétnél nem tovább lehet tárolni, olyan körülmények között, amelyek nem okoznak változást az oldat összetételében. A tárolás előtt a közeget sterilizálhatják, vagy a peptont és a húskivonatot csak kevéssel a vizsgálatok megkezdése előtt adják hozzá. Használat előtt az oldatot össze kell keverni, és a pH-ját be kell állítani.
1.6.2. Készülék
Mérőberendezés: A készülék formája nem döntő jelentőségű. A folyadék felszíne felett azonban levegőt kell hagyni, és a mérőfejnek pontosan illeszkednie kell a mérőlombik nyakára.
Szokásos laboratóriumi berendezésekre van szükség, és különösen a következőkre:
|
— |
mérőberendezés, |
|
— |
levegőztetőkészülék, |
|
— |
pH-elektród és -mérő készülék, |
|
— |
O2-elektród. |
1.6.3. Az inokulum előkészítése
A vizsgálathoz mikrobás inokulumként főleg kommunális szennyvizet kezelő szennyvíztisztító telepről származó aktivált szennyvíziszapot használnak.
Szükség esetén a laboratóriumba való visszatéréskor rövid ideig, például 15 percig tartó ülepítéssel a szennyvíziszapból a durva részecskék eltávolíthatók, majd a felhasználás előtt kidobják a felső rétegben található, finomabb szemcsés, szilárd anyagot. Az iszap azonban össze is keverhető néhány másodperces keveréssel.
Ezenkívül, feltételezve, hogy gátló anyag is jelen lehet, az iszapot csapvízben és izotóniás oldatban ki kell mosni. Centrifugálás után a felülúszót kidobják (ezt az eljárást háromszor kell megismételni).
Az iszap kis mennyiségének megmérik a súlyát, és megszárítják azt. Ebből az eredményből kiszámítható a nedves iszapnak az a mennyisége, amelyet vízben szuszpendálni kell ahhoz, hogy a kevert folyadékban olyan aktivált iszap jöjjön létre, amelynek szuszpendált szilárdrészecske-tartalma 2–4 g/liter között van. E szint a vizsgálati közegben 0,8–1,6 g/liter közötti koncentrációt eredményez, ha az alábbiakban ajánlott eljárást követik.
Ha az iszapot a begyűjtés napján nem tudják felhasználni, minden literjéhez 50 ml szintetikus szennyvizet adnak, amelyet a fentebb leírtak szerint készítettek el; ezt azután egy éjszakán át 20 ± 2 oC-os hőmérsékleten levegőztetik. A levegőztetést addig folytatják, amíg a nap folyamán sor nem kerül a felhasználásra. Használat előtt ellenőrzik a pH-t, és szükség esetén 6–8 közötti értékre állítják be. A kevert folyadékban a szuszpendált szilárd részecskék mennyiségét az előző bekezdésben foglaltak szerint kell megállapítani.
Ha ugyanazt az iszapminta-sorozatot további napokon is fel kell használni (legfeljebb négy napig), minden munkanap végén további 50 ml szintetikus szennyvizet adnak az iszap minden literjéhez.
1.6.4. A kísérlet végrehajtása
|
Időtartam/érintkezési idő: |
30 perc és/vagy három óra, amely alatt folyamatosan levegőztetni kell |
|
Víz: |
ivóvíz (szükség esetén klórmentesített) |
|
Levegőellátás: |
tiszta, olajmentes levegő. Légáram 0,5–1 liter/perc |
|
Mérőberendezés: |
lapos fenekű lombik, például BOD-lombik |
|
Oxigénmérő: |
megfelelő oxigénelektród, regisztrálókészülékkel |
|
Tápanyagoldat: |
szintetikus szennyvíz (lásd fentebb) |
|
Vizsgált anyag: |
a vizsgált oldatot a vizsgálat kezdetekor frissen kell elkészíteni |
|
Referenciaanyag: |
pl. 3,5-diklór-fenol (legalább 3 koncentrációban) |
|
Kontrollok: |
inokulumot tartalmazó minta, a vizsgált anyag nélkül |
|
Hőmérséklet: |
20 ± 2 oC. |
A háromórás érintkezési időre a vizsgált anyagra és a referenciaanyagra egyaránt javasolt vizsgálati eljárást az alábbiakban ismertetik:
Több edényt (például egyliteres főzőpoharakat) használnak.
Legalább öt koncentrációt használnak, amelyek egymástól egy állandó 3,2-szeres tényezőnél jobban nem különböznek.
Induláskor a nulladik percben a szintetikus szennyvíz 16 ml-ét vízzel 300 ml-re hígítják. Ehhez 200 ml mikrobás inokulumot adnak, majd a teljes keveréket (500 ml) beleöntik az első edénybe (első kontroll C1).
A vizsgálati edényt folyamatosan levegőztetik annak biztosítására, hogy az oldott O2-tartalom soha ne essen 2,5 mg/liter alá, és hogy a légzési sebesség mérését közvetlenül megelőzően az O2 koncentrációja legalább 6,5 mg/liter legyen.
A tizenötödik percben (a 15 perc önkényesen választott, de megfelelő hosszúságú intervallum) a fentieket megismétlik, azzal a különbséggel, hogy most a vizsgált anyag törzsoldatának 100 ml-ét adják a 16 ml szintetikus szennyvízhez, mielőtt azt vízzel 300 ml-re kiegészítenék, és hozzáadnák a mikrobás inokulumot az 500 ml teljes térfogatig. E keveréket azután egy második edénybe öntik, és a fentiek szerint levegőztetik. Az eljárást a vizsgált anyag törzsoldatának különböző koncentrációival 15 percenként megismétlik, ami által a vizsgált anyag különböző koncentrációi fognak rendelkezésünkre állni. Végül elkészítenek egy második kontrollt (C2).
Három óra elteltével a pH-t feljegyzik, és az első edény alaposan elkevert tartalmát beleöntik a mérőberendezésbe, majd legfeljebb 10 percen keresztül mérik a légzési sebességet.
A meghatározást 15 perces időközökben a többi edény tartalmával megismétlik úgy, hogy az érintkezési idő minden edényben három óra legyen.
A referenciaanyagot minden mikrobásinokulum-sorozat esetében azonos módon vizsgálják.
Ettől eltérő eljárást kell alkalmazni, például egynél több oxigénmérőre lesz szükség akkor, ha a méréseket 30 perces érintkezési idő után akarják elvégezni.
Ha a kémiai oxigénigény mérésére van szükség, további edényeket készítenek elő, amelyek tartalmazzák a vizsgált anyagot, a szintetikus tápoldatot, valamint vizet, de nincs bennük aktivált iszap. Az oxigénigényt 30 perces és/vagy háromórás (érintkezési idő) levegőztetés után mérik, és feljegyzik.
2. ADATOK ÉS ÉRTÉKELÉS
A légzési sebességet a rögzítőkészülék nyomvonalából számítják, megközelítőleg 6,5 mg O2/liter és 2,5 mg O2/liter között, vagy 10 perces időszak alatt, amikor a légzési sebesség lassú. A légzési görbének az a része, amely alatt a légzési sebességet mérjük, lineáris kell, hogy legyen.
Ha a két kontroll légzési sebessége között 15 %-nál nagyobb az eltérés, vagy ha a referenciaanyag EC50-értéke (30 perces és/vagy háromórás) nincs az elfogadott tartományon belül (5–30 mg/liter között 3,5-diklór-fenolnál), a vizsgálatot érvénytelennek kell tekinteni, és meg kell ismételni.
A százalékos gátlást minden egyes vizsgálati koncentrációra kiszámítják (lásd az 1.2. pontot). A százalékos gátlást normál logaritmusos papíron vagy log-probit papíron a koncentráció függvényében ábrázoljuk, és így számítjuk ki az EC50-értéket.
Az EC50-értékek 95 %-os konfidenciaszintjét a szabványos eljárásokkal határozhatjuk meg.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
vizsgált anyag: kémiai azonosítási adatok, |
|
— |
vizsgálati rendszer: az aktivált iszap forrása, koncentrációja és esetleges előzetes kezelése, |
|
— |
vizsgálati körülmények:
|
|
— |
eredmények:
|
3.2. AZ ADATOK ÉRTELMEZÉSE
Az EC50-értéket úgy kell tekinteni, mint amely csupán iránymutatást jelent a vizsgált anyag esetleges vagy valószínű toxicitásának megítéléséhez akár az aktivált iszappal végzett szennyvízkezelés, akár a szennyvízben jelen lévő mikroorganizmusok tekintetében, hiszen a tényleges környezetben előforduló, igen bonyolult kölcsönhatásokat laboratóriumi vizsgálatokkal nem lehet pontosan utánozni. Ezenkívül az olyan típusú vizsgált anyag, amely az ammónia oxidációját gátolja, szintén adhat atipikus gátlási görbét. Ezért az ilyen grafikonokat kellő óvatossággal kell értelmezni.
4. HIVATKOZOTT SZAKIRODALOM
|
(1) |
International Standard ISO 8192:1986. |
|
(2) |
Broecker, B., Zahn, R., Water Research 11, 1977, p. 165. |
|
(3) |
Brown, D., Hitz, H. R., Schaefer, L., Chemosphere 10, 1981, p. 245. |
|
(4) |
ETAD (Ecological and Toxicological Association of Dyestuffs Manufacturing Industries), Recommended Method No 103, also described by: |
|
(5) |
Robra, B., Wasser/Abwasser 117, 1976, p. 80. |
|
(6) |
Schefer, W., Textilveredlung 6, 1977, p. 247. |
|
(7) |
OECD, Párizs, 1981, 209. vizsgálati irányelv, a Tanács határozata, C(84) 30 végleges. |
C.12. BIOLÓGIAI LEBOMLÁS
MÓDOSÍTOTT SCAS-VIZSGÁLAT
1. MÓDSZER
1.1. BEVEZETÉS
E módszernek az a célja, hogy felmérje a vízoldékony, nem illékony szerves anyagok végső biológiai lebontásának lehetőségeit akkor, ha azok statikus vizsgálati körülmények között nagy töménységű mikroorganizmusnak vannak kitéve. A mikroorganizmusok életképességét ezen időszak alatt ülepítettszennyvíz-tápoldat naponkénti hozzáadásával lehet fenntartani. (A hétvégi követelményekhez a szennyvizet 4 oC-os hőmérsékleten lehet tárolni. Másik megoldásként az OECD-megerősítési vizsgálat szintetikus szennyvizét is felhasználhatják.)
A szuszpendált szilárd részecskéken fizikokémiai adszorpció is létrejöhet, amit az eredmények értékelésekor figyelembe kell venni (lásd a 3.2. pontot).
A folyadékfázis hosszú visszatartási ideje (36 óra), valamint a tápanyagok szakaszos hozzáadása miatt a vizsgálat nem teljesen szimulálja a szennyvíztisztító telepen tapasztalható viszonyokat. A különféle vizsgált anyagokkal nyert eredmények azt jelzik, hogy a vizsgálati módszernek igen nagy a biológiai lebonthatósági potenciálja.
A vizsgálathoz előírt feltételek igen kedvezőek a vizsgált anyag lebontására képes mikroorganizmusok szelekciójához és/vagy adaptációjához. (Az eljárást más vizsgálatokhoz szükséges akklimatizált inokulum előállítására is felhasználhatják.)
E módszerben az oldott szerves szén koncentrációjának mérését használják a vizsgált anyag teljes biológiai lebonthatóságának meghatározására. A DOC-értéket kedvezőbb savanyítás és átszűrés után meghatározni, nem pedig a Cösszes – Cszervetlen különbségének értékeként.
A fenti módszer mellett párhuzamosan alkalmazott specifikus analitikai módszer segíthet az anyag primer lebomlásának értékelésében (a kiindulási molekulaszerkezet eltűnése).
A módszer csak olyan szerves vizsgált anyagokra megfelelő, amelyek(nek) a kísérletben használt koncentrációban:
|
— |
a vizsgálati körülmények között vízben oldódnak (literenként legalább 20 mg oldott szerves szén), |
|
— |
páranyomása elhanyagolható, |
|
— |
a baktériumokat nem gátolják, |
|
— |
a vizsgálati rendszerben jelentős mértékben nem adszorbeálódnak, |
|
— |
habképződés útján nem tűnnek el a vizsgált oldatból. |
Meg kell határozni a vizsgált anyag szervesszén-tartalmát.
A vizsgált anyag főbb összetevői egymáshoz viszonyított részarányának ismerete hasznos lehet a kapott eredmények értékelése során, különösen azon esetekben, amikor az eredmények alacsony számértékűek vagy marginálisak.
Az anyag mikroorganizmusokra gyakorolt mérgező hatásának ismerete kívánatos az alacsony számértékű eredmények értékelésénél és a megfelelő vizsgálati koncentrációk kiválasztásánál.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
|
Ct |
= |
a vizsgált anyag koncentrációja szerves szénben kifejezve a levegőztetési időszak kezdetén a szennyvízben jelen lévő, illetve ahhoz hozzáadott állapotban (mg/liter), |
|
Ct |
= |
az oldott szerves szén mennyisége a vizsgált anyag felülúszó folyadékában a levegőztetési időszak végén (mg/liter), |
|
Cc |
= |
az oldott szerves szén mennyisége a kontroll felülúszó folyadékában a levegőztetési időszak végén (mg/liter). |
A biológiai lebonthatóság mértékét e módszerben a szerves szén eltűnésének arányában határozzuk meg. A biológiai lebonthatóságot az alábbiak szerint fejezhetjük ki:
|
1. |
A naponta hozzáadott anyag mennyiségére eső Dda százalékos eltávolítása:
ahol:
|
|
2. |
Az egyes napok kezdetén jelen lévő anyag mennyiségére eső Dssd százalékos eltávolítása:
ahol:
az i és (i + 1) index a mérés napját jelzi. A 2(a) képlet alkalmazása akkor ajánlott, ha a kifolyó vízben a DOC naponta változik, míg a 2(b) képletet inkább akkor használhatjuk, ha a kifolyó vízben a DOC viszonylag állandó szinten marad napról napra. |
1.3. REFERENCIAANYAGOK
Egyes esetekben, ha új anyagokat vizsgálunk, hasznos lehet a referenciaanyagok alkalmazása; konkrét referenciaanyagokat azonban egyelőre nem tudunk ajánlani.
A körvizsgálatban értékelt számos vegyület adatait megadják az 1. függelékben, azért, hogy a módszer kalibrálását időről időre el lehessen végezni, és az eredmények egybevethetőek legyenek akkor is, ha azokat más módszer alkalmazásával nyerték.
1.4. A VIZSGÁLATI MÓDSZER ALAPELVE
Szennyvíztisztító telepről származó aktivált iszapot helyeznek egy félig folyamatos aktiváltiszap-egységbe (Semi-Continuous Activated Sladge unit = SCAS). Hozzáadják a vizsgált anyagot és az ülepített kommunális szennyvizet, majd a keveréket 23 órán keresztül levegőztetik. Ezután a levegőztetést leállítják, az iszapot ülepítik, és a felülúszó folyadékot eltávolítják.
A levegőztetőkamrában visszamaradó iszapot a vizsgált anyag és a kommunális szennyvíz további mennyiségével elkeverik, majd a ciklust megismétlik.
A biológiai lebonthatóságot a felülúszóban található oldott szerves szén mennyiségének meghatározásával állapítják meg. Ezt az értéket vetik egybe a csak ülepített szennyvízzel kezelt kontrollcsőben található folyadék hasonló értékével.
Ha specifikus analitikai módszert használunk, mérhető a kiindulási molekula koncentrációjának a biológiai bomlás következtében előállott változása is (elsődleges biológiai bomlás).
1.5. MINŐSÉGI KÖVETELMÉNYEK
Az oldott szerves szén eltávolításán alapuló módszer reprodukálhatósága még nem került meghatározásra. (Az elsődleges bomlást tekintve, a nagymértékben bomló anyagokról igen pontos adatokat nyerhetünk.)
A módszer érzékenységét nagymértékben a kontrollértékek változékonysága és kisebb mértékben az oldott szerves szén, illetve a vizsgált vegyület folyadékkoncentrációjának az egyes ciklusok elején történő kimutatási pontossága határozza meg.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Előkészületek
Megfelelő mennyiségű tiszta levegőztetőedényt vagy az eredeti 1,5 literes, SCAS-vizsgálathoz használt egységet alkalmazhatják, amelybe beillesztik a levegőbeeresztő csöveket (1. ábra) minden, a vizsgált anyagot tartalmazó, illetve kontrolledény esetében. Vattaszűrőn áteresztett sűrített levegőt vezetnek a vizsgálati egységekbe, amely szerves szenet nem tartalmazhat, és amelyet előzetesen vízzel telíteni kell a párolgási veszteségek csökkentésére.
Literenként 1–4 gramm szuszpendált szilárd részecskét tartalmazó kevert folyadékot szereznek be egy főként kommunális szennyvizet kezelő tisztítóműből. A kevert folyadék mintegy 150 ml-ére van szükség minden egyes levegőztetőegységhez.
A vizsgált anyag törzsoldatait desztillált vízzel állítják elő; normális esetben a szükséges koncentráció 400 mg szerves szén/liter, ami a vizsgált vegyület 20 mg szén/liter koncentrációját eredményezi minden levegőztetési ciklus elején, ha biológiai bomlás nem történik.
Ennél nagyobb koncentrációk is megengedettek, ha a mikroorganizmusokra gyakorolt toxicitás lehetővé teszi.
A törzsoldat szervesszén-tartalmát meg kell mérni.
1.6.2. Vizsgálati körülmények
A vizsgálatot 20–25 oC közötti hőmérsékleten kell elvégezni.
Aerob mikroorganizmusok nagy koncentrációit használják (1–4 g/liter közötti szuszpendáltszilárdrészecske-tartalom), és a tényleges visszatartási idő 36 óra. A hozzáadott szennyvízben található széntartalmú anyagok rendszerint nyolc órával az egyes levegőztetési ciklusok megkezdését követően erőteljesen oxidálódnak. Ezt követően az iszap endogén módon lélegzik a levegőztetési időszak végéig, amely időszak alatt az egyetlen rendelkezésre álló szubsztrátum a vizsgált anyag, hacsak az is nem metabolizálódott. E jellemzők a keverék ismételt napi újraoltásával igen kedvező feltételeket teremtenek olyan esetekben, amikor kommunális szennyvizet használunk tápoldatként, mind az akklimatizáció, mind pedig a nagyfokú biológiai bomlás vizsgálatához.
1.6.3. A kísérlet végrehajtása
Kevert folyadékmintát vesznek egy főként háztartási szennyvizet kezelő tisztítóműből vagy laboratóriumi készülékből, és azt a laboratóriumi felhasználásig aerob körülmények között tartják. A kevert folyadékból mintegy 150 ml-t töltenek be minden egyes levegőztetőegységbe, a vizsgált anyagot tartalmazó és a kontrollegységbe egyaránt (ha az eredeti SCAS-egységet használják, az említett mennyiségeket tízzel kell megszorozni), és megkezdik a levegőztetést. 23 óra elteltével a levegőztetést leállítják, és az iszapot 45 percen át ülepítik. Egymás után megnyitják az edények csapjait, és levesznek a felülúszó folyadékból 100 ml-t. Közvetlenül felhasználás előtt mintát vesznek az ülepített kommunális szennyvízből, és ebből 100 ml-t hozzáadnak az egyes levegőztetőegységekben maradt iszaphoz. Ezután ismét elkezdik a levegőztetést. E szakaszban még nem adnak vizsgált anyagot az iszaphoz, és az egységeket naponta táplálják a kommunális szennyvízzel egészen addig, míg az ülepítés után tiszta felülúszó folyadékot nem nyernek. Ez rendszerint legfeljebb két hetet vesz igénybe, amikorra a felülúszó folyadékban található oldott szerves szén mennyisége az egyes ciklusok elején valamely állandó érték felé közelít.
Ezen időszak végén az ülepített iszapokat összekeverik, és az eredményül kapott vegyes iszapból minden egységhez 50 ml-t adnak.
A kontrollegységhez 95 ml ülepített szennyvizet és 5 ml vizet adnak, míg a vizsgálati egységhez 95 ml ülepített szennyvíz mellé 5 ml-t adnak hozzá a vizsgált anyag megfelelő törzsoldatából (400 mg/liter). Ismét megkezdik a levegőztetést, és újabb 23 órán keresztül folytatják. Ezután az iszapot 45 percen át ülepítik, majd a felülúszót leszívják, és meghatározzák az oldottszervesszén-tartalmat.
A fenti feltöltés-leszívás eljárást naponta kell ismételni az egész vizsgálat folyamán.
Az ülepítés előtt szükség lehet az egység falának megtisztítására, hogy a szilárd részecskék ne gyűljenek össze a folyadék szintje fölött. A (keresztbe) szennyeződés megakadályozása érdekében minden egységnél külön kefét vagy kaparót kell használni.
Ideális esetben az oldott szerves szén mennyiségét a felülúszó folyadékban naponta határozzák meg, ám ennél kevésbé gyakori meghatározás is megengedhető. Elemzés előtt a folyadékot mosott, 0,45 μm-es membránszűrőn átszűrik, és centrifugálják. A membránszűrők akkor megfelelők, ha biztosítható, hogy nem bocsátanak ki szenet, és nem nyelnek el semmit a vizsgált anyagból a szűrés során. A minta hőmérséklete a centrifugában nem haladhatja meg a 40 oC-ot.
A biológiai úton csekély mértékben vagy egyáltalán nem bomló anyagok esetében a vizsgálat ideje meghatározhatatlan, de a tapasztalatok szerint legalább 12 és legfeljebb 26 hétnek kell lennie.
2. ADATOK ES ÉRTÉKELÉS
A vizsgálati egységekben, illetve a kontrollegységekben található felülúszó folyadék oldottszervesszén-mennyiségének értékét ábrázolják az idő függvényében.
A biológiai bomlás folyamatának előrehaladásával a vizsgálati anyagban található szint közelíti a kontrollszintet. Amikor a két szint közötti különbség három egymást követő mérés során állandónak bizonyul, olyan számú további mérést végeznek, amely elegendő a kapott adatok statisztikai feldolgozásához, és kiszámítják a vizsgált anyag százalékos biológiai lebonthatóságát (Dda vagy Dssd, lásd az 1.2. pont).
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek lehetőség szerint az alábbi információkat kell tartalmaznia:
|
— |
minden információ a használt szennyvíz típusáról, a felhasznált egységről, a vizsgált anyagra vonatkozó vizsgálati eredményekről, a referenciaanyagról – ha volt –, valamint a vakpróbáról, |
|
— |
hőmérséklet, |
|
— |
biológiai bomlási görbe, a kiszámítás módjának leírásával (lásd az 1.2. pontot), |
|
— |
dátum és helyszín, ahonnan a vizsgálati organizmusok mintáját vettük, adaptációs állapotuk, koncentráció stb., |
|
— |
a vizsgálati eljárás lépéseiben történt bármely változtatás tudományos okai, |
|
— |
aláírás és dátum. |
3.2. AZ EREDMÉNYEK ÉRTELMEZÉSE
Miután az ezzel a módszerrel vizsgálandó anyag biológiailag nem könnyen lebontható, a DOC kizárólag biológiai lebonthatóság révén való eltűnése rendes esetben fokozatosan, napok vagy hetek alatt játszódik le, kivéve azon eseteket, amikor a hirtelen akklimatizálódást néhány hét után az anyag átmenet nélküli eltűnése jelzi.
Bizonyos esetekben azonban a fizikokémiai felszívódás fontos szerepet játszhat; ezt az jelzi, ha rögtön az elején teljesen vagy részben eltűnik a hozzáadott DOC. Hogy ezt követően mi történik, az olyan tényezőkön múlik, mint az adszorpció mértéke vagy a szuszpendált szilárd részecskék koncentrációja a kiöntött kifolyó szennyvízben. A kontroll-, illetve a vizsgált anyagot is tartalmazó felülúszó DOC-koncentrációi közötti különbség rendszerint lassan emelkedik az eredeti alacsony értékről, és ez a különbség aztán meg is marad ezen az új értéken a vizsgálat további szakaszaiban, hacsak nem következik be akklimatizáció.
További vizsgálatokra van szükség, ha az adszorpciót és a tényleges (vagy részleges) biológiai bomlást el akarják különíteni. Ezt számos módon el lehet végezni, de a legmeggyőzőbb az, ha a felülúszót vagy az iszapot használják fel inokulumként egy alapbeállító vizsgálathoz (lehetőleg egy légzésmérő vizsgálathoz).
Az olyan típusú vizsgált anyagok, amelyek DOC-értékei ezen vizsgálatban gyorsan és nem felszívódás útján csökkennek, potenciálisan biológiailag lebonthatónak tekinthetők. A részleges és nem felszívódás útján történő csökkenés azt jelzi, hogy a vegyület legalább részben bomlik biológiailag.
Ha a DOC-érték nem vagy csak alig csökken, annak oka lehet az is, hogy a vizsgált anyag gátolja a mikroorganizmusokat, amit az is jelezhet, hogy az iszap szétesik és elvész, zavaros felülúszót eredményezve. Ilyenkor a vizsgálatot a vizsgált anyag alacsonyabb koncentrációjával kell megismételni.
A specifikus analitikai módszerek vagy a 14C izotóppal jelölt vizsgált anyag használata nagyobb érzékenységet tesz lehetővé. Ha 14C izotóppal jelölt vegyületet alkalmaznak, a biológiai bomlás tényét a 14CO2 visszanyerési aránya fogja megerősíteni.
Ha az eredményeket elsődleges bomlás formájában is megadják, lehetőség szerint magyarázatot kell fűzni a kémiai szerkezet olyan jellegű változásához, amely a kiindulási vegyület reakciójának elmaradását okozza.
A vak vizsgálati közeg reakciója mellett az analitikai módszer hitelesítését is meg kell adni.
4. HIVATKOZOTT SZAKIRODALOM
|
(1) |
OECD, Párizs, 1981, 302. A. vizsgálati irányelv, a Tanács határozata, C(81) 30 végleges. |
1. függelék
SCAS vizsgálat: az eredmény példái
|
Anyag |
Ct (mg/l) |
Ct – Cc (mg/l) |
Százalékos bomlás Dda |
Vizsgálat időtartama (nap) |
|
4-acetil-aminobenzén-szulfonát |
17,2 |
2,0 |
85 |
40 |
|
Tetra- propilén-benzol-szulfonát |
17,3 |
8,4 |
51,4 |
40 |
|
4-nitrofenol |
16,9 |
0,8 |
95,3 |
40 |
|
Dietilén-glikol |
16,5 |
0,2 |
98,8 |
40 |
|
Aniline |
16,9 |
1,7 |
95,9 |
40 |
|
Ciklopentán-tetra-karboxilát |
7,9 |
3,2 |
81,1 |
120 |
2. Függelék
A vizsgálati berendezés példája
1. ábra

C.13. BIOKONCENTRÁCIÓ VIZSGÁLATA: ÁTFOLYÁSOS HAL VIZSGÁLAT
1. MÓDSZER
Ez a biokoncentrációs módszer megfelel az OECD TG 305-nek (1996).
1.1. BEVEZETÉS
Ez a módszer a különböző anyagoknak a halakban található, átfolyásos körülmények közötti biokoncentrációs potenciáljának jellemzésére szolgáló eljárást ír le. Bár az átfolyásos vizsgálatot előnyben kell részesíteni, félstatikus rendszerek is megengedhetők, feltéve hogy az érvényességi követelményeknek megfelel.
A módszer elegendő részlettel szolgál a vizsgálat kivitelezéséhez, miközben kellő szabadságot enged a kísérlet kialakításának adaptálására az egyes laboratóriumok körülményeihez és a vizsgálati anyagok változó jellemzőihez. A módszer leghatékonyabban 1,5–6,0 log Pow-értékkel rendelkező stabil szerves vegyi anyagokra alkalmazható (1), de még alkalmazható erőteljesen lipofil anyagokra (log Pow > 6,0). Az előre becsülhető biokoncentrációs tényező (BCF), amit néha KB-ként is jelölnek, az ilyen erősen lipofil anyagokra feltehetően nagyobb lesz, mint a laboratóriumi kísérletekből várt állandósult biokoncentrációs tényező (BCFss) értéke. A kb. 9,0-ig terjedő log Pow-értékkel rendelkező szerves vegyi anyagok előre becsült biokoncentrációs tényezője Bintein és mtsai egyenletével kapható meg (2). A biokoncentrációs potenciált jellemző paraméterekhez tartozik a felvételi sebességi állandó (k1), a tisztulási sebességi állandó (k2) és a BCFss.
A radioaktívan jelzett vizsgálati anyagok megkönnyíthetik a víz- és halminták analízisét, és felhasználhatók annak eldöntésére, hogy kell-e bomlástermék-azonosítást és -kvantifikálást végezni. Amennyiben valamennyi radioaktív maradékot megmérték (például égetéssel vagy szövetfeloldással), a BCF a kiindulási vegyületen, bármely visszatartott metaboliton és az asszimilált szénen is alapul. Valamennyi radioaktív maradékon alapuló BCF-eket ezért nem lehet közvetlenül összehasonlítani csak a kiindulási vegyület sajátos kémiai analíziséből nyert BCF-fel.
Radioaktív jelzési vizsgálatoknál kiürülési fázis alkalmazható a kiindulási vegyületre alapozott BCF meghatározása céljából, és a fő metabolitok jellemezhetők, amennyiben szükségesnek minősül. Az anyagmetabolizmus-vizsgálatot a biokoncentráció-vizsgálattal kombinálni is lehet a szövetekben levő maradékok analízise és azonosítása révén.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
A biokoncentráció/bioakkumuláció a vizsgált anyag koncentrációjának növekedése egy szervezetben/en (meghatározott szöveteiben/n) a vizsgált anyagnak a környező közegben lévő koncentrációjához viszonyítva.
A biokoncentrációs tényező (BCF, vagy KB) a vizsgált anyag halban/on, vagy meghatározott szöveteiben/n (Cf, μg/g [ppm]) lévő koncentrációja az akkumulációs vizsgálat felvételi fázisának bármely időpontjában és a vegyszer környező közegben lévő koncentrációjának hányadosa a (Cw, μg/ml [ppm]).
Az állandósult biokoncentrációs tényező (BCFss, vagy KB) nem változik jelentősen egy hosszabb időtartam során, amely alatt a vizsgált anyag koncentrációja állandó a környező közegben.
Plató, vagy állandósult állapot látható a halban mért vizsgált anyag (Cf) időfüggő ábráján, amennyiben a görbe párhuzamos az időtengellyel, és Cf három egymást követő, legalább két nap különbséggel vett mintában ± 20 %-on belül vannak az analízisek egymáshoz képest, és nincs számottevő különbség a három mintavételi periódus között. Összevont minták analízisénél legalább négy egymást követő analízis szükséges. Olyan vizsgált anyagoknál, amelyek felvétele lassú, sokkal megfelelőbbek a hétnapos időközök.
A biokoncentrációs tényezőket, amelyeket kinetikus koncentrációs tényezőnek (BCFK) neveznek, közvetlenül a kinetikai sebességállandókból (k1/k2) számolják.
Az oktanol-víz megoszlási együttható (Pow) a vegyi anyag n-oktanolban és vízben, egyensúlyban mért oldhatóságának aránya (A.8. módszer), Kow-vel is jelölik. A vegyi anyag vízi szervezetekbeli biokoncentrációs potenciálja jelzésére a Pow logaritmusát használják.
Az expozíciós vagy felvételi fázis az az időtartam, amíg a hal érintkezik a vizsgált anyaggal.
A felvételi sebességi állandó (k1) a vizsgált anyag koncentrációjának – halban/on (vagy meghatározott szöveteiben/n) való – növekedési sebességét definiáló numerikus érték, az expozíciós idő alatt (k1 l/nap–1-ben van kifejezve).
Az expozíció utáni, vagy tisztulási (ürülési) fázis a kísérleti halból (vagy meghatározott szövetéből) a vizsgált anyagot tartalmazó közegből az anyagot nem tartalmazó közegbe történő kiürülésének (vagy nettó ürülése) időtartama.
A tisztulási (ürülési) sebességi állandó (k2) a vizsgált anyag koncentrációjának a halban (vagy meghatározott szöveteiben) való csökkenési sebességét definiáló numerikus érték, a kísérleti halnak a kísérleti anyagot tartalmazó közegből az anyagot nem tartalmazó közegbe való áthelyezését követően (k2 1/nap-ban van kifejezve).
1.3. A VIZSGÁLATI MÓDSZER ELVE
A vizsgálat két fázisból áll: az expozíciós (felvételi) és az expozíció utáni (tisztulási) fázisból. A felvételi fázis alatt az egy fajhoz tartozó halak különálló csoportjai a vizsgált anyag legalább két koncentrációjával érintkeznek. Ezután átkerülnek a vizsgált anyagot nem tartalmazó közegbe tisztulási fázisra. A tisztulási fázis mindig szükséges, kivéve, ha az anyag felvétele a felvételi fázis alatt elhanyagolható volt (pl. a BCF kisebb 10-nél). A vizsgált anyag koncentrációját a halban/on (vagy meghatározott szövetében/n) a vizsgálat mindkét fázisa alatt figyelemmel kísérik. A két kísérleti koncentráción túlmenően, a halak egy kontrollcsoportját azonos körülmények között tartják – leszámítva a vizsgált anyag hiányát – annak érdekében, hogy a biokoncentráció által okozott ártalmas hatások a megfelelő kontrollcsoporthoz legyenek viszonyíthatók, és meghatározható legyen a vizsgált anyag háttér-koncentrációja.
A felvételi fázis 28 napig tart, kivéve, ha az egyensúly bizonyítottan már korábban beáll. A 3. függelék egyenletével lehet következtetni a felvételi fázis hosszára és az állandósult állapot eléréséhez szükséges időre. A tisztulási periódus ezután a hal egy másik tiszta, ugyanolyan közeget, de vizsgált anyagot nem tartalmazó edénybe való áthelyezésével kezdődik. Amennyiben lehetséges, a biokoncentrációs tényezőt lehetőleg az állandósult állapotban a halban (Cf) és vízben mért (Cw) koncentráció arányaként (BCFss) is, továbbá a felvételi (k1) és tisztulási (k2) sebességi állandó arányával, elsőrendű kinetikát feltételezve, kinetikai biokoncentrációs tényezőként (BCFK) kell kiszámítani. Amennyiben nyilvánvalóan nem elsőrendű a kinetika, összetettebb modelleket kell alkalmazni (5. függelék).
Amennyiben 28 nap alatt nem áll be az állandósult állapot, a felvételi fázist meg kell hosszabbítani az állandósult állapot eléréséig, vagy 60 napra, amelyik előbb következik be; ezután kezdődik a tisztulási fázis.
A felvételi sebességi állandót, a tisztulási (ürülési) sebességi állandót (vagy állandókat, amennyiben összetettebb modellt alkalmaztak), a biokoncentrációs tényezőt, és amennyiben lehetséges, e paraméterek mindegyike esetében a konfidenciahatárokat, a halban és a vízben mért vizsgálatianyag-koncentrációt legjobban leíró modell szerint számítják ki.
A BCF a hal teljes nedves tömegének függvényeként van kifejezve. Különleges célokra azonban meghatározott szövetek és szervek (pl. izom, máj) is használhatók, amennyiben a hal elég nagy, illetve ha a hal ehető (filé) és nem ehető (zsiger) részekre osztható. Mivel számos szerves anyagnál egyértelmű kapcsolat van a biokoncentrációs potenciál és a lipofilitás között, ezért ugyanilyen kapcsolat van a kísérleti hal lipidtartalma és az ilyen anyagok megfigyelt biokoncentrációja között is. Ezért a nagy lipofilitású (azaz log Pow > 3) anyagokra kapott vizsgálati eredmények változatosságának e forrása csökkentéséhez a biokoncentrációt a teljes testtömegen kívül a lipidtartalom vonatkozásában is ki kell fejezni.
Amennyiben megvalósítható, a lipidtartalmat ugyanazon a biológiai anyagon kell meghatározni, mint amit a vizsgált anyag koncentrációjának meghatározására használtak.
1.4. A VIZSGÁLT ANYAGRA VONATKOZÓ INFORMÁCIÓK
A biokoncentrációs vizsgálat elvégzése előtt a vizsgált anyagról az alábbi adatokra van szükség:
|
— |
oldhatóság vízben, |
|
— |
oktanol-víz megoszlási együttható Pow (Kow-vel is jelölik, az A.8-ban megadott HPLC módszerrel meghatározva), |
|
— |
hidrolízis, |
|
— |
fototranszformáció vízben nap- vagy szimulált napsugárzásnál és a biokoncentrációs vizsgálatnál alkalmazott sugárzási feltételek mellett, |
|
— |
felületi feszültség (azaz olyan anyagoknál, ahol Pow-t nem lehet meghatározni), |
|
— |
gőznyomás, |
|
— |
gyors biológiai lebonthatóság (adott esetben). |
További megkövetelt információ a vizsgálat során használt halfajokra kifejtett toxicitás, lehetőleg az aszimptotikus (azaz az időtől független) LC50. Legyen ismert pontosságú és érzékenységű analitikai módszer a vizsgált anyag kvantifikálására a vizsgált oldatokban és a biológiai anyagban, a mintakészítés és tárolás részleteivel együtt. A vizsgált anyag vízben és halszövetekben érvényes analitikai kimutatási határának is ismertnek kell lenni. Amennyiben 14C-vel jelzett vizsgált anyagot használnak, ismerni kell a szennyező anyagokhoz tartozó százalékos radioaktivitást.
1.5. A VIZSGÁLAT ÉRVÉNYESSÉGE
Az alábbi feltételeknek kell teljesülniük a vizsgálat érvényességéhez:
|
— |
a hőmérséklet-ingadozás kisebb ± 2 oC-nál, |
|
— |
az oldott oxigén koncentrációja nem eshet 60 %-os telítettség alá, |
|
— |
a kamrákban a vizsgált anyag koncentrációját a felvételi fázisban mért értékek átlagának ± 20 %-án belül kell tartani, |
|
— |
a vizsgálat végén a kontroll és a kezelt halak mortalitásának és egyéb káros hatásoknak/betegségeknek 10 %-nál kisebbnek kell lenni; amennyiben a vizsgálat több hétig vagy hónapig tart, a pusztulásnak, vagy más ártalmas hatásnak a halak mindkét csoportjában kisebbnek kell lenni havi 5 %-nál, és nem haladhatja meg a 30 %-ot összesen. |
1.6. REFERENCIAVEGYÜLETEK
Az ismert biokoncentrációs potenciálú referenciavegyületek használata hasznos lehet a kísérleti eljárások ellenőrzése során, amennyiben elvárt. Bár meghatározott anyagok még nem ajánlhatók.
1.7. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.7.1. Eszközök
A vizsgálat során kerülni kell az olyan anyagok használatát, amelyek oldódhatnak, szorbeálódhatnak vagy kimosódhatnak az eszközökből, és ártalmasak lehetnek a halakra. Szabványos, kémiailag inert anyagból készült, a töltési sebességnek megfelelő térfogatú négyszögletes vagy hengeres tartályok használhatók. A puha műanyag csövek használatát minimalizálni kell. Teflon®, rozsdamentes acél és/vagy üvegcsövek használata ajánlott. A tapasztalatok alapján szükséges lehet a nagy abszorpciós együtthatójú anyagok, mint szintetikus piretroidok esetében, szilanizált üveg használata. Ilyen esetekben a felszerelést használat után el kell dobni.
1.7.2. Víz
A kísérletekhez általában természetes vizet kell használni, amely nem szennyezett, és állandó minőségű. A hígításra használt víz minőségének lehetővé kell tennie a választott halfajok túlélését az akklimatizációs és a kísérleti időszakok alatt anélkül, hogy bármilyen rendellenes külső megjelenés vagy viselkedés jelentkezne. Ideális esetben a vizsgált fajok bizonyítottan képesek túlélni, fejlődni és szaporodni a hígítóvízben (pl. laboratóriumi tenyészetben, vagy életciklusra vonatkozó toxicitásvizsgálatnál). A vizet legalább a pH-val, keménységgel, valamennyi szilárd anyaggal, összes szerves szénnel, és lehetőleg ammónium-, nitrittartalommal és alkalitással, és tengeri fajoknál sótartalommal is jellemezni kell. A halak optimális jólétéhez fontos paraméterek teljesen ismertek, de az 1. függelék megadja számos paraméter esetében az ajánlott maximális koncentrációt a vizsgált édes- és tengervízre.
A kísérleti időszak alatt a víznek állandó minőségűnek kell lenni. A pH-értékének 6,0 és 8,5 között kell lenni, de egy adott vizsgálat során ±0,5 pH egységnyi tartományon belül kell maradnia. Analízis céljából időközönként mintákat kell venni, annak érdekében, hogy a hígítóvíz ne befolyásolhassa hátrányosan a vizsgálati eredményeket (például a vizsgált anyag komplexálásával), vagy ne legyen káros hatással a halállomány állapotára. Nehézfémek (pl. Cu, Pb, Zn, Hg, Cd, Ni), főbb anionok és kationok (pl. Ca, Mg, Na, K, Cl, SO4), peszticidek (pl. összes szerves foszforvegyület és összes szerves klórpeszticidek), összes szerves szén és szuszpendált szilárd anyag meghatározását el kell végezni, például háromhavonta, amennyiben a hígítóvíz ismerten viszonylag állandó minőségű. Amennyiben legalább egy éven keresztül állandónak bizonyul a vízminőség, a vizsgálatot ritkábban és nagyobb időközönként is el lehet végezni (pl. minden hat hónapban).
A hígítóvíz természetes részecske- és a teljes szervesszén-tartalmának (TOC) is a lehető legalacsonyabbnak kell lenni, hogy a vizsgált anyag ne abszorbeálódjon szerves anyagon, ami csökkenthetné a biológia elérhetőségét (4). A maximális elfogadható érték 5 mg/l szemcsés anyagok esetében (szárazanyag 0,45 μm-es szűrőn nem jut át) és 2 mg/l az összes szerves szén esetében (lásd 1. függelék). A vizet szűrni kell felhasználás előtt, amennyiben szükséges. A kísérleti halaktól (ürülék) és a táplálékmaradékból származó szerves széntartalom járulékának a lehető legkisebbnek kell lenni a vízben. A vizsgálat során a kísérleti edényben a szerves szén koncentrációja nem haladhatja meg a vizsgált anyagból származó szerves szén koncentrációját, és, amennyiben alkalmazták, az oldószer koncentrációját 10 mg/l-nél nagyobb mértékben (± 20 %).
1.7.3. Vizsgált oldat
A vizsgált anyagból megfelelő koncentrációjú törzsoldat készül. A törzsoldatot célszerű a vizsgált anyagnak egyszerűen a hígítóvízbe keverésével vagy összerázással elkészíteni. Az oldószerek vagy diszpergálószerek (oldódást segítő szerek) használata nem ajánlott; néhány esetben azonban alkalmazhatók megfelelő töménységű törzsoldat készítése érdekében. A felhasználható oldószerek: etanol, metanol, etilén-glikol-metil-éter, etilénglikol-dimetil-éter, dimetil-formamid és trietilén-glikol. A felhasználható diszpergálószerek: Cremophor RH40, Tween 80, metilcellulóz 0,01 % és HCO-40. Gondosan kell eljárni a biológiailag könnyen lebontható szerek használata esetén, mivel átfolyásos vizsgálatokban baktériumnövekedés révén problémát okozhatnak. A vizsgált anyag radioaktívan is jelölhető, és a legnagyobb tisztaságúnak kell lenni (pl. lehetőleg > 98 %).
Átfolyásos vizsgálatokban a vizsgált anyag törzsoldatát folyamatosan adagoló és hígító rendszerre (pl. állandó áramlási sebességet biztosító pumpa, szabályozható hígító rendszer, telítőrendszer) van szükség a kísérleti koncentrációk kísérleti kamrákba juttatásához. Az egyes tartályok esetében a napi öt térfogatcsere a megengedhető. Az átfolyásos mód részesül előnyben, amennyiben nem alkalmazható (pl. ha a vizsgált szervezetekre károsan hat), félstatikus módszer használható, feltéve hogy az érvényességi követelmények teljesülnek. A törzsoldatok és a hígítóvíz áramlási sebességét legalább naponta a vizsgálat előtt és után 48 órával ellenőrizni kell. Az ellenőrzés magában foglalja az áramlási sebesség meghatározását az egyes kísérleti tartályokban, és biztosítja, hogy ne változzon 20 %-nál nagyobb mértékben sem az egyes kamrákban, sem azok között.
1.7.4. A fajok megválasztása
A fajok megválasztásánál fontos követelmény, hogy könnyen és megfelelő méretben elérhetők, és a laboratóriumban kielégítő körülmények között tarthatók legyenek. A halfajok megválasztásának egyéb követelményei közé tartozik a fontosság rekreációs, kereskedelmi, ökológiai szempontból éppúgy, mint az összehasonlítható érzékenység, múltbeli sikeres használat stb.
Az ajánlott fajok a 2. függelékben találhatók. Más fajok is használhatók, de a kísérleti eljárást esetleg át kell dolgozni a megfelelő vizsgálati körülmények biztosításához. A fajok és a kísérleti módszer megválasztásának indoklását fel kell tüntetni a jelentésben.
1.7.5. A halak tartása
Legalább két hétig a vizsgálat során alkalmazott hőmérsékletű vízben akklimatizálják a törzspopulációt, és kielégítő, a vizsgálat alatt használttal megegyező típusú étrenden tartják őket.
48 órás betelepítési időszak után a mortalitást jegyzőkönyvezni kell, és az alábbi követelményeket kell alkalmazni:
|
— |
amennyiben a mortalitás a populáció 10 %-ánál nagyobb hét nap alatt: az egész halállományt ki kell cserélni, |
|
— |
mortalitás a populáció 5–10 %-a hét nap alatt: további hét napig kell akklimatizálni, |
|
— |
mortalitás a populáció 5 %-ánál kisebb hét nap alatt: a tételt kell elfogadni – ha a második hét nap alatt a mortalitás 5 %-nál több, az egész tételt ki kell selejtezni. |
Beteg és rendellenesen fejlődött halak nem használhatók a vizsgálathoz. Minden beteg haltól meg kell szabadulni. A kísérletet megelőző két hétben és a kísérlet alatt a halak nem kaphatnak kezelést betegségre.
1.8. A VIZSGÁLAT ELVÉGZÉSE
1.8.1. Elővizsgálat
Hasznos lehet elővizsgálatokat végezni a vizsgálati körülmények optimalizására a döntő vizsgálathoz, pl. a vizsgált anyag koncentrációjának, a felvételi és tisztulási fázisok megválasztására.
1.8.2. Az expozíció körülményei
1.8.2.1.
A felvételi fázis időtartamának előrejelzése előzetes tapasztalatból (pl. előző vizsgálatból vagy akkumulációhoz kapcsolódó vegyi anyagból), vagy bizonyos, a vizsgált anyag vízben való oldhatósága, vagy oktanol/víz megoszlási együtthatója ismeretét felhasználó tapasztalati kapcsolatokból nyerhető (lásd 3. függelék).
A felvételi fázis 28 napig tart, kivéve ha igazolható, hogy az egyensúly korábban beállt. Amennyiben az állandósult állapot nem áll be 28 nap alatt, a felvételi fázist ki kell terjeszteni további méréseket végezve, amíg az állandósult állapot beáll, vagy legfeljebb 60 napig.
1.8.2.2.
A felvételi fázis időtartamának a fele rendszerint elég az anyag megfelelő (pl. 95 %-os) csökkenéséhez (lásd 3. függeléket a becslés magyarázatához). Amennyiben a 95 %-os csökkenéshez szükséges idő aránytalanul hosszú, meghaladja például a felvételi fázis hosszának kétszeresét (azaz több mint 56 nap), rövidebb időtartam is használható (azaz amíg a vizsgált anyag koncentrációja kisebb lesz az állandósult állapotú koncentráció 10 %-ánál). Az elsőrendű kinetikát eredményező egyrekeszeshal-modellnél összetettebb felvételi és tisztulási fázissal rendelkező anyagoknál azonban az ürülési sebességi állandó meghatározására azonban hosszabb tisztulási fázis is megengedett. Az időtartamot azonban az a periódus szabhatja meg, ami után a halban a vizsgált anyag koncentrációja az analitikai detektálási határ fölött marad.
1.8.2.3.
A halak számát koncentrációnként úgy választják ki, hogy mintánként legalább négy hal álljon rendelkezésre minden mintavételnél. Amennyiben komolyabb statisztikai számításokat akarunk végezni, mintánként több hal szükséges.
Amennyiben kifejlett halakat használnak, rögzíteni kell, hogy hímeket és nőstényeket milyen arányban használnak a kísérletben. Amennyiben mindkét nemet használják, dokumentálni kell, hogy az expozíció kezdete előtt a két nem között a lipidtartalom különbsége jelentéktelen; szükséges lehet az összes hím és az összes nőstény hal egybegyűjtése.
Mindegyik vizsgálatban hasonló tömegű halakat kell kiválasztani, a legkisebbek ne legyenek kisebbek a legnagyobb hal tömegének kétharmadánál. Ugyanabba a korcsoportba tartozzanak, és a származásuk is azonos legyen. Mivel a halak tömege és kora időnként jelentős hatással lehet a BCF értékekre (1), ezeket a részleteket pontosan rögzíteni kell. Ajánlott az átlagtömeg becslése érdekében a vizsgálat előtt a halpopuláció egy mintacsoportját lemérni.
1.8.2.4.
A halak méretéhez viszonyítva nagy mennyiségű vizsgálati oldatot kell használni annak érdekében, hogy minimalizálni lehessen a vizsgálat kezdetén a halak hozzáadásával okozott Cw és az oldott oxigén koncentrációjának csökkenését. Fontos, hogy a feltöltési sebesség a használt kísérleti fajnak megfelelő legyen. Minden esetben 0,1–1,0 g hal (nedves tömeg) per liter víz per nap az ajánlott feltöltési sebesség. Akkor használható nagy töltési sebesség, amennyiben igazolt, hogy a vizsgált anyag megkövetelt koncentrációja fenntartható ± 20 %-os határon belül, és hogy az oldott oxigén koncentrációja nem esik 60 %-os telítettség alá.
A megfelelő feltöltési rendszerek kiválasztásánál a halfajok természetes életterét kell figyelembe venni. A fenéken élő halak például nagyobb alapterületű akváriumot igényelnek, mint a nyíltvízi halfajok.
1.8.2.5.
Az akklimatizációs és kísérleti időszak alatt a halakat megfelelő, ismert lipid- és összfehérjetartalmú táplálékkal kell etetni, az egészségük megőrzéséhez és a testtömegük fenntartásához elegendő mennyiségben. A halak az akklimatizációs és kísérleti időszakban naponta kapnak enni, testtömegük körülbelül 1–2 %-ának megfelelő mennyiségben; ez a legtöbb halfaj esetén a lipidkoncentrációt viszonylag állandó szinten tartja a vizsgálat alatt. A táplálék mennyiségét újra kell számolni, például hetente egyszer, hogy egy állandó szinten legyen tartható a testtömeg és a lipidkoncentráció. Ennek kiszámításához az egyes tartályokban a halak tömege a tartályból legújabban vett halminta tömegéből becsülhető meg. A tartályban maradó halak nem mérhetők le.
A kísérleti tartályból a maradék eledelt és az ürüléket az etetést követően (30 perctől 1óráig) naponta szívócsövön keresztül el kell távolítani. A vizsgálat alatt a tartályokat a lehető legtisztábban kell tartani, hogy a szervesanyag-koncentráció a lehető legkisebb legyen, mivel a szerves szén jelenléte korlátozhatja a vizsgált anyag biológiai elérhetőségét (1).
Miután sok táplálék hallisztből származik, a táplálék vizsgálatianyag-tartalmát is vizsgálni kell. A táplálék peszticid- és nehézfémanalízise is kívánatos.
1.8.2.6.
A fényperiódus rendszerint 12–16 órás, és a fajok számára megfelelő hőmérsékletet (± 2 oC) kell biztosítani (lásd 2. függelék). A megvilágítás típusának és jellemzőinek ismertnek kell lenni. Figyelmet kell fordítani a vizsgálati anyag – a vizsgálat besugárzási körülményei közötti – lehetséges fotoátalakulására. Megfelelő megvilágítást kell használni, hogy a fény hatására nem természetes bomlástermékek lehetőleg ne keletkezzenek. Néhány esetben megfelelő lehet a 290 nm alatti UV sugárzást kiszűrő ernyő használata.
1.8.2.7.
Átfolyási körülmények között legalább két koncentrációt kell készíteni. Általában a nagyobb (vagy legmagasabb) vizsgáltanyag-koncentráció akut aszimptotikus LC50-értékének körülbelül 1 %-ánál és a használt analitikai módszerre vonatkozó vízben elérhető detektálási határnál legalább tízszer nagyobb legyen.
A legnagyobb kísérleti koncentráció az akut (96 órás)/krónikus LC50 aránnyal is megosztható legyen (néhány vegyi anyag esetében a megfelelő arány 3–100 lehet). Amennyiben lehetséges, a többi koncentráció(ka)t úgy kell megválasztani, hogy a fenti értéktől 10-es faktorral különbözzön. Amennyiben ez nem lehetséges az 1 %-os LC50 követelmény és az analitikai határ miatt, 10-nél kisebb faktor is használható, vagy fontolóra kell venni 14C-vel jelzett vizsgált anyag használatát. A vizsgált anyag oldhatósága feletti koncentrációt nem szabad használni.
Amennyiben szolubilizáló anyagot használnak, annak koncentrációja nem lehet nagyobb 0,1 ml/l-nél, és minden kísérleti tartályban azonosnak kell lennie. Ismerni kell, hogy mennyivel járul hozzá a kísérleti víz teljes szervesszén-tartalmához. Mindent meg kell tenni azonban az ilyen anyagok használatának elkerülése érdekében.
1.8.2.8.
A vizsgált sorozat mellett a hígítóvíz-kontrollt, és adott esetben, egy szolubilizálószert tartalmazó kontrollt is be kell állítani, feltéve hogy biztosított, hogy a szernek nincs hatása a halakra. Amennyiben ez nem áll fenn, mindkét kontrollt el kell végezni.
1.8.3. A vízminőség mérésének gyakorisága
A vizsgálat során minden edényben mérni kell az oldott oxigént, TOC-t, pH-t és hőmérsékletet. A kontrollokban és a nagyobb (vagy legnagyobb) koncentrációjú edényben mérni kell a teljes keménységet és (adott esetben) a sótartalmat. Az oldott oxigént és (adott esetben) a sótartalmat legalább háromszor kell mérni a felvételi periódusban – annak elején, közepén és a végén – és egyszer egy héten a tisztulási periódusban. TOC-t a vizsgálat kezdetén (a felvételi fázis előtt 24 és 48 órával) a halak bevitele előtt, és a felvételi és tisztulási fázis alatt pedig legalább hetente egyszer kell mérni. A hőmérsékletet naponta, pH-t a periódusok kezdetén és végén, keménységet vizsgálatonként egyszer kell mérni. A hőmérsékletet ajánlott folyamatosan mérni, legalább egy edényben.
1.8.4. Hal- és vízmintavételezés és -analízis
1.8.4.1.
A kísérleti tartályokból a vizsgált anyag koncentrációjának meghatározásához a halak bevitele előtt, valamint a felvételi és a tisztulási fázis alatt kell mintát venni. Vízmintát legalább a halmintával egy időben és etetés előtt kell venni. A felvételi fázis alatt meg kell határozni a vizsgált anyag koncentrációját az érvényességi követelmények teljesülésének ellenőrzése céljából.
A felvételi fázis alatt legalább ötször, a tisztulási fázis alatt legalább négyszer kell halmintát venni. Mivel egyes esetekben e mintaszámok alapján nehéz pontosan megbecsülni a BCF értékét, különösen, ha egyszerű elsőrendűtől eltérő tisztulási kinetika mutatkozik, tanácsos mindkét periódusban gyakrabban mintát venni (lásd 4. függelék). A külön minták tárolására és elemzésére csak akkor kerül sor, ha az elemzés első sorozata alkalmatlannak bizonyul a BCF kívánt pontosságú kiszámítására.
Az elfogadható mintavételi ütemterv egy példája a 4. függelékben található. Más feltételezett Pow-értékkel más ütemtervet is gyorsan ki lehet dolgozni a 95 %-os felvétel expozíciós idejének kiszámolásával.
A mintavételezést a felvételi fázisban addig kell folytatni, amíg az állandósult állapot beáll, vagy legfeljebb 28 napig. Amennyiben az állandósult állapot nem áll be 28 nap alatt, a mintavételezést addig kell folytatni, amíg beáll az állandósult állapot, de legfeljebb 60 napig. A tisztulási fázis megkezdése előtt a halak átkerülnek a tiszta tartályokba.
1.8.4.2.
Az analízishez a vízmintákat, például inert csövön keresztül, a kísérleti tartály középső pontjából veszik. Mivel a vizsgált anyag biológiailag nem elérhető részét a biológiailag elérhetőtől nem mindig lehet centrifugálással vagy szűréssel elválasztani, (főleg erősen lipofil vegyszerek esetén, azaz log Pow > 5 vegyszereknél) (1) (5), a mintákon nem lehet ezen eljárásokat alkalmazni.
Ehelyett a tartályokat minél tisztábban kell tartani, és a teljes szervesszén-tartalmat a felvételi és tisztulási fázis alatt is figyelemmel kell kísérni.
Minden mintavételezéskor megfelelő számú halat (általában legalább négyet) kell kivenni a kísérleti kamrákból. A mintahalakat gyorsan le kell öblíteni vízzel, „szárazra” törölni, azonnal megölni a legmegfelelőbb és humánus módszerrel, ezt követően lemérni.
A lebomlás vagy egyéb veszteségek elkerülése érdekében a halakat és a vizet lehetőleg rögtön mintavételezés után kell analizálni, és a vizsgálat előrehaladtával megközelítőleg ki kell számolni a felvételi és a tisztulási sebességet. Az azonnali analízis lehetővé teszi annak kiküszöbölését is, hogy egy platót késve ismerjenek fel.
Az azonnali analízis meghiúsulása esetén a mintákat megfelelő módszerrel tárolják. A vizsgálat kezdete előtt a különböző vizsgált anyagok tárolásának megfelelő módszeréről információkat kell szerezni – például mélyhűtés, 4 oC-on tartás, tárolás időhossza, extrakció stb.
1.8.4.3.
Mivel az egész eljárást alapvetően a vizsgált anyaghoz használt analitikai módszer pontossága és érzékenysége határozza meg, kísérlettel ellenőrizni kell a kémiai analízis pontosságát és reprodukálhatóságát, és a vizsgált anyag vízből és halakból való visszanyerését. Azt is ellenőrizni kell, hogy a vizsgált anyag ne legyen észlelhető a használt hígítóvízben.
A Cw és Cf vizsgálatból kapott értékét korrigálni kell – szükség szerint – visszanyeréssel és a kontrollok háttérértékével. A hal- és vízmintákkal végig úgy kell bánni, hogy minimális legyen a szennyezés és a (pl. a mintavevő eszköz adszorpciójából eredő) veszteség.
1.8.4.4.
Amennyiben a vizsgálat során radioaktívan jelzett anyagokat használtak, mérhető az össz-radioaktivitás (a kiindulási vegyületét és metabolitokét együttesen), vagy a minták megtisztíthatók úgy, hogy a kiindulási vegyület külön analizálható legyen. A fő metabolitokat állandósult állapotban vagy a felvételi fázis végén (amelyik előbb bekövetkezik) szintén lehet jellemezni. Amennyiben az összes mért radioaktivitás százalékában kifejezett BCF > 1 000 %, tanácsos lehet, sőt bizonyos vegyszer-kategóriáknál, pl. peszticideknél erősen ajánlott, az állandósult állapotban a halszövetekben a teljes maradék 10 %-át meghaladó mennyiségű bomlástermékek azonosítása és kvantifikálása. Amennyiben a meghatározást elvégezték a halszövetben, el kell végezni a vízben is.
A vizsgált anyag koncentrációját rendszerint meg kell határozni minden lemért halban. Amennyiben ez nem lehetséges, az egyes mintavételi alkalmakkor egyesíthetők a minták, de az összesítés korlátozza az adatokra alkalmazható statisztikai eljárások számát. Amennyiben a statisztikai eljárás megkívánja, akkor a kívánt egyesítési eljárást és az ehhez szükséges halak számát a vizsgálati módszerben rögzíteni kell (6) (7).
BCF-et a teljes nedves tömeg függvényeként, és az erősen lipofil anyagok esetében a lipidtartalom függvényeként is ki kell fejteni. A hal lipidtartalmát amennyiben lehetséges, minden mintavételi alkalommal meg kell határozni. A lipidtartalom meghatározására megfelelő módszereket kell alkalmazni (3. függelék, 8. és 2. hivatkozás). Szabványmódszerként a kloroform/metanol extrakciós technika ajánlott (9). A különböző módszerek nem adnak azonos értékeket (10), ezért fontos megadni a használt módszer részleteit. Amennyiben lehetséges, a lipid analízisét a vizsgált anyag analíziséhez készítettel azonos extraktumon kell elvégezni, mert a lipideket gyakran el kell távolítani az extraktumból, mielőtt kromatográfiásan elemezhetők lennének. A hal lipidtartalma (mg/kg nedves tömeg) a kísérlet végén nem térhet el a kezdeti értéktől ± 25 %-nál jobban. A szövet szárazanyag-tartalmát szintén rögzíteni kell, hogy a lipidkoncentráció átváltható legyen nedves állapotban mértről száraz állapotban mértre.
2. ADATOK
2.1. AZ EREDMÉNYEK KEZELÉSE
A vizsgált anyag felvételi görbéje a felvételi fázisban a halban/on (vagy meghatározott szövetben/en) mért koncentrációt az idő függvényében, aritmetikus skálán ábrázolják. Amennyiben a görbe platót ér el, vagyis megközelítőleg párhuzamos az időtengellyel, az állandósult BCFss a következő képlet alapján számolható:
![]()
Amennyiben nem következett be az állandósult állapot, a BCFss kielégítő pontossággal kiszámolható az „állandósult állapot”-ból, az egyensúly 80 %-ánál (1,6/k2) vagy 95 %-ánál (3,0/k2).
A koncentrációs faktort (BCFK) is meghatározzák a két elsőrendű kinetikai állandó k1/k2 arányaként. A tisztulási sebességi állandó (k2) rendszerint a tisztulási görbéből határozható meg (azaz a halban a vizsgált anyag koncentrációjának csökkenése az idő függvényében). A felvételi sebességi állandó (k1) ezután kiszámolható az adott k2 és a Cf egy, a felvételi görbéből levezetett értékéből (lásd 5. függeléket is). A BCFK és a k1, k2 sebességi állandók kiszámításának megfelelő módszere a számítógéppel végzett nem lineáris paraméterbecslő módszer használata (11). Grafikus módszerek is használhatók a k1 és k2 kiszámítására. Amennyiben a tisztulási görbe nyilvánvalóan nem elsőrendű, összetettebb modelleket kell használni (lásd a 3. függelék hivatkozásait), és biostatisztikus tanácsát kell kikérni.
2.2. AZ EREDMÉNYEK ÉRTELMEZÉSE
Amennyiben a vizsgált oldatok koncentrációi az analitikai módszer detektálási határához közeli szinten vannak, az eredményeket óvatosan kell értelmezni.
Az egyértelműen definiált felvételi és tisztulási görbe megbízható biokoncentrációs adatokat jelez. A két kísérleti koncentrációnál a felvételi/tisztulási állandók ingadozásának 20 % alatt kell lenni. A két alkalmazott kísérleti koncentráció felvételi/tisztulási sebességének jelentős különbségét rögzíteni kell, és meg kell adni rá a lehetséges magyarázatokat. A jól megtervezett vizsgálatokból kapott BCF-ek konfidenciahatára általában megközelíti a ± 20 %-ot.
3. JELENTÉS
A kísérleti jelentésnek az alábbi információkat kell tartalmaznia:
3.1. VIZSGÁLT ANYAG
|
— |
fizikai tulajdonság, és adott esetben, fizikai-kémiai tulajdonságok, |
|
— |
kémiai jellemzők (a szervesszén-tartalmat is beleértve, amennyiben szükséges), |
|
— |
amennyiben radioaktívan jelzett, a jelzett atom(ok) pontos helyzete, és a szennyezőkhöz kapcsolódó radioaktivitás százaléka. |
3.2. VIZSGÁLT FAJOK
|
— |
tudományos név, törzs, származás, bármilyen előkezelés, akklimatizálás, kor, mérettartomány stb. |
3.3. VIZSGÁLATI KÖRÜLMÉNYEK
|
— |
használt vizsgálati eljárás (pl. átfolyásos vagy fél sztatikus), |
|
— |
a használt megvilágítás típusa és jellemzői és időtartama, |
|
— |
a vizsgálat kialakítása (pl. a kísérleti tartályok száma és mérete, víztérfogat-csere sebessége, párhuzamos minták száma, halak száma mintánként, kísérleti koncentrációk száma, a felvételi és a tisztulási fázis hossza, hal- és vízminták mintavételi gyakorisága), |
|
— |
törzsoldatok előállításának módszere és a megújítás gyakorisága (amennyiben használták, meg kell adni a szolubilizálószert, koncentrációját, és hogy a kísérleti víz szervesszén-tartalmához mennyiben járult hozzá), |
|
— |
a névleges vizsgálati koncentrációk, a kísérleti edényben mért értékek átlaga és ezek standard deviációja, és a kiszámítás módszere, |
|
— |
a hígítóvíz eredete, bármely előkezelés leírása, minden olyan eredmény, amely igazolja, hogy a hígítóvíz megfelel a kísérleti hal igényeinek, és a víz jellemzői: pH, keménység, hőmérséklet, oldott oxigén koncentrációja, maradékklór-szintek (amennyiben mérték), összes szerves szén, szuszpendált szilárd anyagok, a vizsgált közeg sótartalma (amennyiben lehetséges), és bármilyen egyéb elvégzett mérés, |
|
— |
vízminőség a kísérleti edényekben, pH, keménység, TOC, hőmérséklet és oldottoxigén-koncentráció, |
|
— |
a táplálásra vonatkozó részletes információk (például a táplálék fajtája, eredete, összetétele – legalább a lipid- és fehérjetartalom, amennyiben lehetséges, az etetések számát és az adott táplálék mennyisége), |
|
— |
információk a hal- és vízminták kezeléséről, beleértve az előállítás részleteit, tárolást, extrakciót és analitikai eljárásokat (és pontosságot) a vizsgált anyag és lipidtartalom vonatkozásában (amennyiben mérték). |
3.4. EREDMÉNYEK
|
— |
minden elvégzett előzetes vizsgálat eredménye, |
|
— |
a kontrollhalak és az egyes expozíciós kamrákban lévő halak mortalitása, és bármely megfigyelt rendellenes viselkedés, |
|
— |
a halak lipidkoncentrációja (amennyiben a kísérlet alkalmával meghatározták), |
|
— |
a halakban a vizsgált vegyi anyag felvételét és tisztulását mutató görbék (minden mért adatot feltüntetve), az állandósult állapotig eltelt idő, |
|
— |
Cf és Cw (standard deviációval és tartománnyal, adott esetben) minden mintavételi időpontra (Cf μg/g teljes nedves testtömeg, vagy meghatározott szövetei, pl. lipid tömegében [ppm] kifejezve, és Cw μg/ml-ben [ppm]). A kontrollsorozat Cw értékei (a hátteret is rögzíteni kell), |
|
— |
az állandósult biokoncentrációs tényező (BCFss) és/vagy kinetikus koncentrációs tényező (BCFK) és, adott esetben, a felvételi és tisztulási (ürülési) sebességi állandók 95 %-os konfidenciahatárai (valamennyit az állat teljes tömegére vagy meghatározott szöveteire, és amennyiben mérték, a teljes lipidtartalomra vonatkoztatva kell megadni), valamennyi használt kísérleti koncentrációnál a konfidenciahatárok és standard deviációk (ahogy megfelelőbb) és a számítás/adatelemzés módszerei, |
|
— |
amennyiben radioaktívan jelzett anyagokat használtak, és amennyiben szükséges, bármely kimutatott metabolit akkumulációja bemutatható, |
|
— |
bármi szokatlan dolog a vizsgálattal kapcsolatban, bármilyen eltérés ezektől az eljárásoktól, és bármely más vonatkozó információ, |
A „detektálási határon belül nem kimutatott” eredményeket előzetes vizsgálati módszer fejlesztésével és kísérlettervezéssel kell minimalizálni, mert az ilyen eredmények nem használhatók sebességi állandók számolásához.
4. IRODALOMJEGYZÉK
|
(1) |
Connell D. W. (1988). Bioaccumlation behaviour of persistent chemicals with aquatic organisms. Rev. Environ. Contam. Toxicol. 102, pp. 117–156. |
|
(2) |
Bintein S., Devillers J. and Karcher W. (1993). Non-linear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR and QSAR in Environmental Research, 1, pp. 29–390. |
|
(3) |
OECD Paris (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals. No. 3. |
|
(4) |
Kristensen P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Denmark. |
|
(5) |
US EPA 822-R-94-002 (1994). Great Lake Water Quality Initiative Technical Support Document for the Procedure to Determine Bioaccumlation Factors. July 1994. |
|
(6) |
US FDA (Food and Drug Administration) Revision. Pesticide analytical manual, 1, 5600 Fisher's Lane, Rockville, MD 20852, July 1975. |
|
(7) |
US EPA (1974). Section 5, A(l). Analysis of Human or Animal Adipose Tissue, in Analysis of Pesticide Residues in Human and Environmental Samples, Thompson, J. F. (ed.) Research Triangle Park, N. C. 27711. |
|
(8) |
Compaan H. (1980) in „The determination of the possible effects of chemicals and wastes on the aquatic environment: degradation, toxicity, bioaccumulation”, Ch. 2.3, Part II. Government Publishing Office, the Hague, Netherlands. |
|
(9) |
Gardner et al, (1995). Limn. & Oceanogr. 30, pp. 1099–1105. |
|
(10) |
Randall R. C, Lee H., Ozretich R. J., Lake J. L. and Pruell R. J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Toxicol. Chem. 10, pp. 1431–1436. |
|
(11) |
CEC, Bioconcentration of chemical substances in fish: the flow-through method- Ring Test Programme, 1984 to 1985. Final Report March 1987. Authors: P. Kristensen and N. Nyholm. |
|
(12) |
ASTM E-1022-84 (reapproved 1988). Standard Practice for conducting Bioconcentration Tests with Fishes and Saltwater Bivalve Mollucsc. |
1. függelék
Egy megfelelő hígítóvíz kémiai jellemzői
|
|
Anyag |
Határkoncentráció |
|
1 |
Lebegő anyag |
5 mg/l |
|
2 |
Teljes szerves szén |
2 mg/l |
|
3 |
Nem ionizált ammónia |
1 μg/l |
|
4 |
Maradék klór |
10 μg/l |
|
5 |
Szerves foszfortartalmú peszticidek |
50 ng/l |
|
6 |
Szerves klórtartalmú peszticidek + poliklórozott bifenilek |
50 ng/l |
|
7 |
Összes szerves klór |
25 ng/l |
|
8 |
Alumínium |
1 μg/l |
|
9 |
Arzén |
1 μg/l |
|
10 |
Króm |
1 μg/l |
|
11 |
Kobalt |
1 μg/l |
|
12 |
Réz |
1 μg/l |
|
13 |
Vas |
1 μg/l |
|
14 |
Ólom |
1 μg/l |
|
15 |
Nikkel |
1 μg/l |
|
16 |
Cink |
1 μg/l |
|
17 |
Kadmium |
100 ng/l |
|
18 |
Higany |
100 ng/l |
|
19 |
Ezüst |
100 ng/l |
2. függelék
Vizsgálathoz ajánlott halfajok
|
|
Ajánlott fajok |
Ajánlott késérleti hőmérseklet-tartomány ( °C) |
Kísérleti állat ajánlott teljes hossza (cm) |
|
1 |
Danio rerio (17) (Teleostei, Cyprinidae) (Hamilton–Buchanan) Zebradánió |
20–25 |
3,0±0,5 |
|
2 |
Pimephales promelas (Teleostei, Cyprinidae) (Rafinisque) |
20–25 |
5,0±2,0 |
|
3 |
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) Közönséges ponty |
20–25 |
5,0±3,0 |
|
4 |
Oryzias latipes (Teleostei, Poeciliidae) (Temminck és Schlegel) Japán rizshal |
20–25 |
4,0+1,0 |
|
5 |
Poecilia reticulata (Teleostei. Poeciliidae) (Peters) Guppi |
20–25 |
3,0±1,0 |
|
6 |
Lepomis macrochirus (Teleostei. Centrarchidae) (Rafinesque) |
20–25 |
5,0±2,0 |
|
7 |
Oncorhynchus mykiss (Teleostei, Salmonidae) (Walbaum) Szivárványos pisztráng |
13–17 |
8,0±4,0 |
|
8 |
Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) Tüskés pikó |
18–20 |
3,0±1,0 |
A különböző országokban különböző torkolati és tengeri fajokat használnak, például:
|
Spot |
Leiosromus xanthurus |
|
Sheephead minnow |
Cyprinodon variegatus |
|
Silverside |
Menidia beryllina |
|
Shiner perch |
Cymatogaster aggregata |
|
English sole |
Parophrys vetulus |
|
Staghorn sculpin |
Leptocottus annatus |
|
Tüskés pikó |
Gasterosteus aculeatus |
|
Sea bass |
Dicentracus labrax |
|
Küsz |
Albumus albumus |
A halak beszerzése
A táblázatban felsorolt édesvízi halak könnyen tenyészthetők, és/vagy könnyen beszerezhetők egész évben, míg a tengeri és torkolati fajok bizonyos országokra korlátozódnak. A fent felsorolt halfajok halastóban vagy laboratóriumban is (betegségek és paraziták szempontjából ellenőrzött körülmények között) tenyészhetők. Célszerű tenyészetekből származó kísérleti halakat alkalmazni, mivel ezek egészségi állapota és származása is ismert. Ezek a halak a világ sok részében beszerezhetők.
3. függelék
A felvételi és tisztulási fázis időtartamának meghatározása
1. A felvételi fázis időtartamának meghatározása
A vizsgálat elvégzése előtt a k2, és így az állandósult állapot eléréséhez szükséges idő néhány százalékos hibával megbecsülhető a k2 és az n-oktanol/víz megoszlási együttható (Pow) vagy a k2 és a vízben való oldhatóság (s) tapasztalati összefüggéséből.
A k2 becsült értéke (nap–1) megkapható például az alábbi tapasztalati összefüggésből (1):
|
log10 k2 = 0,414 log10(Pow) + 1,47 (r2 = 0,95) |
(1. egyenlet) |
Egyéb összefüggéseket lásd a (2) hivatkozásban.
Amennyiben a megoszlási hányados (Pow) nem ismert, az anyag vízben való oldhatóságának (s) ismeretéből becsülhető meg (3):
|
log10(Pow) = 0,862 log10 (s) + 0,710 (r2 = 0,994) |
(2. egyenlet), |
ahol:
s = az oldhatóság (mol/l): (n = 36).
Ezek az összefüggések csak 2 és 6,5 közé eső log Pow-értékkel rendelkező vegyszerekre alkalmazhatók (4).
A k2-becslés felhasználásával, a felvételt és tisztulást leíró általános kinetikai egyenletből (elsőrendű kinetika) kiszámítható az állandósult állapot néhány százalékának eléréséhez szükséges idő:

vagy ha Cw állandó:
|
|
(3. egyenlet) |
Az állandósult állapot közelítésekor ((t->∞), a 3. egyenlet egyszerűsíthető (5) (6):
 vagy Cf/Cw = k1/k2
= BCF
vagy Cf/Cw = k1/k2
= BCF
Ekkor k1/k2·Cw a halakban mérhető koncentráció közelítése „állandósult állapotban” (Cf, s).
A 3. egyenlet átírható:
|
|
(4. egyenlet) |
A 4. egyenlet alkalmazásával megjósolható az állandósult állapot néhány százalékának eléréséhez szükséges idő, amennyiben az 1. vagy 2. egyenlet felhasználásával k2 előre megbecsült.
Iránymutatóként: statisztikailag elfogadható adatok (BCFK) előállításához a felvételi fázis statisztikailag optimális időtartama az a periódus, ami ahhoz szükséges, hogy a halban mérhető vizsgálatianyag-koncentráció logaritmusának görbéje lineáris időskálán felrajzolva elérje a felezőpontját, illetve 1,6/k2-t, vagy az állandósult állapot 80 %-át, de ne legyen nagyobb 3,0/k2-nél, vagy az állandósult állapot 95 %-nál (7).
Az állandósult állapot 80 %-ának eléréséhez szükséges idő (4. egyenlet):
|
|
(5. egyenlet) |
A 95 %-os állandósult állapot hasonlóan:
|
|
(6. egyenlet) |
Például log Pow = 4-es vizsgált anyag esetében a felvételi fázis (fel) időtartama (az 1., 5. és 6. egyenletet használva):
|
log10 k2 =-0,414.(4) + 1,47 |
k2 = 0,652 nap–1 |
vagy ff (80 %) = 1,6/0,652, azaz 2,45 nap (59 óra)
ff (95 %) = 3,0/0,652, azaz 4,60 nap (110 óra)
Hasonlóan, egy s = 10–5 mól/l (log(s) = -5,0) vizsgált anyag esetében az ff időtartama (az 1., 2., 5. és 6. egyenletet használva):
log10 (Pow) = 0,862 (-5,0) + 0,710 = 5,02
log10 k2 =0,414 (5,02)+1,47
k2 =0,246 nap–1
Ff (80 %) = 1,6/0,246, azaz 6,5 nap (156 óra)
vagy ff (95 %) = 3,0/0,246, azaz 12,2 nap (293 óra)
Ezenkívül:
Teq = 6,54 x 10 = 3Pow + 55,31 (óra)
kifejezés használható az effektív állandósult állapot eléréséhez szükséges idő kiszámolásához (4).
2. A tisztulási fázis időtartamának előrejelzése
A test anyagterhelésének a kezdeti koncentráció néhány százalékára való csökkentéséhez szükséges idő megbecsülhető a felvételi és tisztulási periódust leíró általános egyenletből (elsőrendű kinetika) (1) (8).
A tisztulási fázisban Cw nullának feltételezett. Az egyenlet egyszerűsíthető:
 vagy
vagy
ahol Cf, 0 a koncentráció a tisztulási fázis kezdetén. Az 50 %-os tisztulás aztán t50 időpontban következik be:
 vagy
vagy 
Hasonlóan, a 95 %-os tisztulás elérésének időpontja:

Amennyiben 80 %-os felvételt használnak az első periódusban (1,6/k 2), és 95 %-os ürülést a tisztulási fázisban (3,0/k 2), akkor a tisztulási fázis megközelítőleg kétszer hosszabb a felvételi fázisnál.
Fontos megjegyezni azonban, hogy a becslések azon a feltevésen alapulnak, hogy a felvételi és tisztulási mintázat elsőrendű kinetikát követ. Amennyiben nyilvánvalóan nem elsőrendű kinetikáról van szó, összetettebb modellt kell alkalmazni [pl. (1) hivatkozás].
IRODALOM (a 3. függelékhez)
|
(1) |
Spacie A. and Hamelink J. L. (1982). Alternative models for desribing the bioconcentration of organics in fish. Environ. Toxicol. and Chem. 1, pp. 309–320. |
|
(2) |
Kristensen P. (1991). Bioconcentration in fish: comparison of BCFs derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute. |
|
(3) |
Chiou C. T. and Schmedding D. W. (1982). Partitioning of organic compounds in octanol-water systems. Environ. Sci.Technol. 16 (1), pp. 4–10. |
|
(4) |
Hawker D. W. and Connell D. W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22 (6), pp. 701–707. |
|
(5) |
Branson D. R., Blau G. E., Alexander H. C. and Neely W. B. (1975). Transactions of the American Fisheries Society, 104 (4), pp. 785–792. |
|
(6) |
Ernst W. (1985). Accumulation in Aquatic organisms. In: Appraisal of tests to predict the environmental behaviour of chemicals. Ed. by Sheehman P., Korte F., Klein W. and Bourdeau P. H. Part 4.4, pp. 243-255. SCOPE, 1985, John Wiley & Sons Ltd. N. Y. |
|
(7) |
Reilly P. M., Bajramovic R., Blau G E., Branson D. R. and Sauerhoff M. W. (1977). Guidelines for the optimal design of experiments to estimate parameters in first order kenetic models, Can. J. Chem. Eng. 55, pp. 614–622. |
|
(8) |
Könemann H. and Van Leuween K. (1980). Toxicokinetics in fish: Accumulation and Elimination of six Chlorobenzenes by Guppies. Chemosphere, 9, pp. 3–19. |
4. függelék
Elméleti példa biokoncentrációs vizsgálatok mintavételezési ütemtervére log Pow = 4 anyagok esetében
|
Halminta |
Mintavételek |
Vízminták száma |
Halak száma mintánként |
||||
|
Minimálisan megkövetelt gyakoriság (nap) |
Járulékos mintavételezés |
||||||
|
Felvételi fázis |
–1 0 |
|
2 (18) 2 |
45–80 hal telepítve |
|||
|
1. |
0,3 |
0,4 |
2 (2) |
4 (4) |
|||
|
2. |
0,6 |
0,9 |
2 (2) |
4 (4) |
|||
|
3. |
1,2 |
1,7 |
2 (2) |
4 (4) |
|||
|
4. |
2,4 |
3,3 |
2 (2) |
4 (4) |
|||
|
5. |
4,7 |
|
2 |
6 |
|||
|
Tisztulási fázis |
|
|
|
Halak áthelyezve vizsgált vegyi anyagtól mentes vízbe |
|||
|
6. |
5,0 |
5,3 |
|
4 (4) |
|||
|
7. |
5,9 |
7,0 |
|
4 (4) |
|||
|
8. |
9,3 |
11,2 |
|
4 (4) |
|||
|
9. |
14,0 |
17,5 |
|
6 (4) |
|||
|
A zárójeles értékek a minták (víz, hal) számát jelentik, amennyiben járulékos mintavételezés történik.
|
|||||||
5. függelék
A megfelelő modell kiválasztása
A legtöbb biokoncentrációs adatról feltételezett, hogy jól leírható egy egyszerű kétváltozós modellel, amely a tisztulási fázisban (féllogaritmusos papíron ábrázolva) a halakban mérhető koncentrációk pontjaira illeszthető egyenest ad. (Amennyiben ezek a pontok nem írhatók le egyenessel meghatározott görbével, összetettebb modellt kell alkalmazni, lásd például Spacie és Hamelink, 3. függelék, 1. hivatkozás).
Grafikus módszer a k2 tisztulási (ürülési) sebességi állandó meghatározására
Az egyes halmintákban talált vizsgált anyag koncentrációját a mintavételezési idő függvényében kell ábrázolni féllogaritmusos papíron. Az egyenes meredeksége k2.


Meg kell jegyezni, hogy az egyenes vonaltól való eltérések elsőrendűnél összetettebb tisztulási mintázatot jelezhetnek. Az elsőrendű kinetikától eltérő tisztulási típusok meghatározására grafikus módszer alkalmazható.
Grafikus módszer a k1 felvételi sebességi állandó meghatározására
Amennyiben k2 adott, k1-et az alábbiaknak megfelelően kell kiszámítani:
|
|
(1. egyenlet) |
A log koncentrációt az idő függvényében (aritmetikus skálán) ábrázolva nyert szabályos felvételi görbe középpontjából olvasható le Cf érték.
Számitógépes módszer a felvételi és a tisztulási (ürülési) sebességi állandó számítására
A biokoncentrációs tényező továbbá a k1 és k2 sebességi állandó kiszámításának előnyben részesített módszere a nem lineáris paraméterbecslési módszer alkalmazása számítógépen. Ezek a programok k1 és k2 értékét az egymást követő idő koncentráció adatokból és az alábbi modell alapján találják meg:
|
|
(2. egyenlet) |
|
|
(3. egyenlet) |
ahol tc = idő a felvételi fázis végén.
Ez a megközelítés a k1 és k2 standard deviációjára ad becslést.
Mivel k2 legtöbbször viszonylag nagy pontossággal megbecsülhető a tisztulási görbéből, és mert erős a korreláció a k1 és k2 paraméter között, amennyiben egyidejűleg becsülték meg őket, tanácsos lehet először csak a tisztulási adatokból kiszámolni k2-t, és ezt követően nem lineáris regresszióval számolni k1-et a felvételi adatokból.
C.14. HALIVADÉKOK NÖVEKEDÉSI VIZSGÁLATA
1. MÓDSZER
E növekedéssel kapcsolatos toxicitásvizsgálat megfelel az OECD TG 215-nek (2000).
1.1. BEVEZETÉS
E vizsgálat célja annak megállapítása, hogy a halivadékok növekedésére milyen következményekkel jár, ha hosszabb időn keresztül vegyi anyagok hatásának vannak kitéve. E vizsgálat egy olyan módszeren alapul, amelyet az Európai Unión belül fejlesztettek ki, és körvizsgálatnak vetették alá (1) (2) annak felmérésére, hogy átfolyási feltételek mellett egyes vegyi anyagok milyen hatásokat gyakorolnak a szivárványos pisztráng ivadékának (Oncorynchus mykiss) növekedésére. Más, kellően dokumentált halfajok is felhasználhatók. Növekedési vizsgálatot végeztek már például zebrahalon (Danio rerio) (19) (3) (4) és rizshalon (medaka, Oryzias Latipes) (5) (6) (7).
Lásd még az Általános bevezetés C. részét.
1.2. FOGALOMMEGHATÁROZÁSOK
Legalacsonyabb megfigyelhető hatást okozó koncentráció (LOEC): a vizsgált anyag azon legalacsonyabb kísérleti koncentrációja, amelynél a kontrollal összevetve még megfigyelhető az anyag egy jelentős hatása (p < 0,05). Azonban a LOEC fölötti valamennyi kísérleti koncentrációnak olyan ártalmas hatást kell kifejtenie, amely legalább azonos a LOEC-nél megfigyelttel, vagy erősebb annál.
Megfigyelhető hatást nem okozó koncentráció (NOEC): a közvetlenül a LOEC alatti kísérleti koncentráció.
ECx : e vizsgálati módszerben a vizsgált anyag azon koncentrációja, amely – a kontrollal összevetve – x % eltérést okoz a növekedés ütemében.
Betelepítési arány: a halak nedvesen mért tömege egységnyi mennyiségű vízben.
Betelepítési sűrűség: a halak száma egységnyi mennyiségű vízben.
Halegyedek specifikus növekedési üteme: az egyed növekedésének üteme, a kiindulási tömegéhez viszonyítva.
Specifikus növekedési ütem a tartály átlagában: egy tartályban lévő halpopuláció átlagos növekedési üteme egy adott koncentráció mellett.
Pszeudospecifikus növekedési ütem: az egyed növekedési üteme a tartályban lévő halpopuláció kezdeti súlyának átlagához viszonyítva.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A növekedési ütemük exponenciális szakaszában lévő halivadékokat – megmérésük után – kísérleti tartályban helyezik el, és szubletális koncentrációjú, vízben oldott vizsgált anyag hatásának teszik ki, átfolyást biztosítva, vagy amennyiben ez nem lehetséges, akkor megfelelő félstatikus (statikus-megújítási) feltételek mellett. A vizsgálat időtartama 28 nap. A halakat naponta etetik. A táplálék adagolását a halak kiindulási súlya alapján határozzák meg; az adagokat 14 nap után újra lehet számítani. A kísérlet végén a halakat ismét lemérik. Regressziós modell segítségével elemezni kell a vizsgált anyag hatásait a növekedés ütemére, azon koncentráció meghatározása érdekében, amely a növekedés ütemében x % eltérést okoz, azaz ECx (pl. EC10, EC20, EC30) eltérést. Alternatív módon, az adatokat össze lehet hasonlítani a kontrollértékekkel, a „legalacsonyabb megfigyelhető hatást okozó koncentráció” (LOEC), majd annak alapján a „megfigyelhető hatást nem okozó koncentráció” (NOEC) meghatározása érdekében.
1.4. A VIZSGÁLT ANYAGRA VONATKOZÓ INFORMÁCIÓK
Rendelkezésre kell hogy álljanak az e vizsgálat céljára kiválasztott fajokkal lehetőleg korábban már elvégzett, akut toxicitási vizsgálatok eredményei (lásd a C.1. vizsgálati módszert). Ez azt jelenti, hogy a vizsgált anyag vízoldhatósága és gőznyomása ismert, és dokumentált pontosságú, megbízható analitikai módszer áll rendelkezésre a vizsgált oldatokban lévő vizsgált anyag számszerűsítéséhez, továbbá rendelkezésre állnak az észlelés korlátaira vonatkozó adatok is.
A hasznos információk közé tartozik még a szerkezeti képlet, az anyag tisztasága, stabilitása vízzel és fénnyel szemben, a pKa- és Pow-értékek, valamint a gyors biológiai lebomlásra vonatkozó vizsgálatok eredményei is (lásd a C.4. vizsgálati módszert).
1.5. A VIZSGÁLAT ÉRVÉNYESSÉGE
A vizsgálat érvényességéhez az alábbi feltételeknek kell teljesülniük:
|
— |
a vizsgálat végén a mortalitási arány a kontrollcsoportban nem haladhatja meg a 10 %-ot, |
|
— |
a kontrollcsoportbeli halak átlagos súlyának megfelelő mértékben kell növekednie ahhoz, hogy lehetővé tegye a növekedési ütemben egy már szignifikánsnak tekinthető minimális eltérés érzékelését. Egy „körvizsgálat” (2) kimutatta, hogy a szivárványos pisztráng esetében a kontrollcsoportbeli halak átlagos tömegének 28 nap alatt legalább a kiindulási átlagtömegük felével (azaz 50 %-kal) kell növekednie; pl. kiindulási tömege 1 g/hal (= 100 %), végső tömege 28 nap elteltével ≥ 1,5 g/hal (≥ 150 %), |
|
— |
a kísérlet során az oldott oxigén koncentrációját mindvégig legalább a levegőtelítettségi érték (ASV) 60 %-án kell tartani, |
|
— |
a kísérleti tartályokban a víz hőmérséklete a kísérlet során soha sem térhet el ± 1 oC- nál nagyobb mértékben, és a hőmérsékletet a vizsgált fajra nézve meghatározott hőmérséklet-tartományban egy 2 oC-nyi sávon belül kell tartani (1. függelék). |
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Felszerelés
Normál laboratóriumi felszerelés és különösen az alábbiak:
|
— |
oxigéntartalom- és pH-érték-mérők, |
|
— |
a víz keménységi fokának és lúgosságának mérésére szolgáló berendezések, |
|
— |
a hőmérséklet szabályozására és lehetőleg folyamatos figyelemmel kísérésére alkalmas készülékek, |
|
— |
kémiailag semleges anyagból készült és az ajánlott betelepítési aránynak és betelepítési sűrűségnek megfelelő kapacitású tartályok (lásd 1.8.5. pont és az 1. függelék), |
|
— |
megfelelő pontosságú mérleg (azaz ±0,5 % pontosságú). |
1.6.2. Víz
A vizsgálat céljaira bármilyen víz felhasználható, amelyben a vizsgált fajok kellően hosszú ideig túlélik a vizsgálati körülményeket, és növekednek. A víz minőségét a kísérlet során mindvégig azonos szinten kell tartani. A víz pH-értékének a 6,5–8,5 tartományon belül kell lennie, azonban egy adott vizsgálat során csak ±0,5 pH-egységgel térhet el a kiindulási értéktől. Javasolt a 140 mg/l (CaCO3) vízkeménység választása. Annak biztosítására, hogy a víz összetétele ne befolyásolja túlzottan a vizsgálat eredményeit (pl. mert komplexet képez a vizsgált anyaggal), időnként mintákat kell venni elemzésre. Mérni kell a következőket: a nehézfémek (pl. Cu, Pb, Zn, Hg, Cd és Ni), a fontosabb anionok és kationok (pl. Ca, Mg, Na, K, Cl és SO4), a peszticidek (pl. összes szerves foszfor és összes szerves klór tartalmú peszticidek), az összes szerves szén és a szuszpendált szilárd anyagok koncentrációját, például háromhavonta, amennyiben a hígítóvízről tudott, hogy viszonylag állandó minőségű. Amennyiben a víz minősége bizonyítottan konstans legalább egy éven keresztül, akkor ritkábban, nagyobb időközökkel is lehet ellenőrző méréseket végezni (pl. csak hathavonta egyszer). Az elfogadható minőségű hígítóvíz néhány kémiai tulajdonságának felsorolása a 2. függelékben található.
1.6.3. Vizsgált oldatok
A kiválasztott koncentrációjú vizsgált oldatok a törzsoldat hígításával készíthetők el.
A törzsoldatot lehetőleg a vizsgált anyagnak a hígítóvízbe, mechanikai eszközök (pl. keverő, ultrahang) segítségével történő bekeverésével vagy hozzákeverésével kell elkészíteni. Telítési oszlopok (oldhatósági oszlopok) is felhasználhatók a megfelelő koncentrációjú törzsoldat elkészítéséhez.
Egyes esetekben szükség lehet oldószerek vagy diszpergálószerek (oldódást segítő szerek) használatára a megfelelő koncentrációjú törzsoldat elkészítéséhez. Ilyen alkalmas oldószer lehet az aceton, etanol, metanol, dimetil-szulfoxid, dimetil-formamid és a trietilén-glikol. Alkalmas diszpergálószer lehet például: Cremophor, RH40, Tween 80, Metilcellulóz 0,01 % és a HCO-40. Kellő figyelemmel kell eljárni a biológiailag gyorsan lebomló szerek (pl. aceton) és/vagy az erősen illékony összetevők használatakor, mivel ezek az átfolyási vizsgálatok során fellépő baktériumszaporodás kapcsán gondokat okozhatnak. A diszpergálószerek nem gyakorolhatnak lényeges hatásokat a halak növekedésére és láthatóan kedvezőtlen hatásokat az ivadékokra, amit csak egy oldószerrel végzett ellenőrző vizsgálat tárhat fel.
Az átfolyási vizsgálatok céljára olyan rendszert kell használni, amely folyamatosan biztosítja és hígítja a vizsgált anyag törzsoldatát (pl. egy adagolószivattyú, proporcionális hígító vagy egy telítőrendszer), annak érdekében, hogy a kísérleti tartályhoz eljusson a hígítóoldat. A kísérlet során időnként – lehetőleg naponta – ellenőrizni kell a törzsoldatok és a hígítóvíz áramlási sebességét, amelynek értéke nem változhat 10 %-nál nagyobb mértékben a vizsgálat során. Egy „körvizsgálat” (2) bizonyította, hogy a szivárványos pisztrángok esetében hat liter/gramm hal/nap mértékű vízcserélődési sebesség elfogadható (lásd 1.8.2.2. szakasz).
Félstatikus (megújítási) vizsgálatok során a közeg megújításának gyakorisága a vizsgált anyag stabilitásától függ, azonban ajánlott a víz napi cseréje. Amennyiben korábbi stabilitási vizsgálatok (lásd 1.4. pont) arra mutattak rá, hogy nem stabil a vizsgált anyag koncentrációja (azaz kívül esik a névleges koncentráció 80–120 %-os tartományán, vagy a kiinduláskor mért koncentráció 80 %-a alá csökken) a megújítási időszak során, akkor fontolóra kell venni egy átfolyási vizsgálat elvégzését.
1.6.4. A halfajok kiválasztása
E vizsgálat céljaira az ajánlott halfaj a szivárványos pisztráng (Oncorhynchus mykiss), mert a legtöbb tapasztalat eddig az e fajjal folytatott „körvizsgálatokból” származik (1) (2). Azonban más, kellően dokumentált halfajok is felhasználhatók, de ilyenkor az eljárást esetleg módosítani kell a megfelelő vizsgálati körülmények biztosítása érdekében. Például zebrahal (Danio rerio) (3) (4) és rizshal (medaka, Oryzias Latipes) (5) (6) (7) vizsgálatából is szereztek már növekedésivizsgálat-tapasztalatokat. Ebben az esetben a jelentésnek tartalmaznia kell az eltérő fajok és kísérleti módszer kiválasztásának indoklását.
1.6.5. A halak tartása
A kísérleti halakat egyetlen tenyészet – lehetőleg egy ivásból származó – populációjából kell kiválasztani, és a halakat a vizsgálat megkezdése előtt legalább két hétig a kísérlet során alkalmazandó körülmények, vízminőség és megvilágítás mellett kell tartani. A napi etetéskor minimálisan a testsúly 2 %-ának megfelelő adagokat kell kapniuk, a kéthetes tartási időszak és a vizsgálat ideje alatt pedig lehetőleg a testsúly 4 %-ának megfelelő mennyiséget.
Egy 48 órás szoktatási időszakot követően fel kell jegyezni a mortalitási arányt, és alkalmazni kell az alábbi kritériumokat:
|
— |
amennyiben hét nap alatt a populáció mortalitása 10 %-nál magasabb, az egész állományt ki kell cserélni, |
|
— |
5 és 10 % közötti mortalitás esetén: további hét nap akklimatizációs időszak beiktatása után – amennyiben a mortalitási arány ezt követően is magasabb 5 %-nál – az egész állományt ki kell cserélni, |
|
— |
ha hét nap után a mortalitás 5 % alatt marad, az állomány elfogadható. |
A halak a vizsgálat előtti két hétben és a vizsgálat során nem kaphatnak betegség miatti kezelést.
1.7. A VIZSGÁLAT KIALAKÍTÁSA
A „vizsgálat kialakítása” meghatározás a kísérleti koncentráció számának és osztásközeinek, az egyes koncentrációszintekhez használt tartályok számának és a halak tartályonként létszámának a megválasztását jelenti. Ideális esetben a vizsgálatot az alábbiakra tekintettel kell megtervezni:
|
— |
a vizsgálat célja, |
|
— |
az alkalmazandó statisztikai elemzési módszer, |
|
— |
a kísérlethez szükséges anyagok beszerezhetősége és költsége. |
Amennyiben lehetséges, a kísérleti cél megfogalmazásában rögzíteni kell, hogy milyen statisztikai pontossági szinten kell egy adott nagyságú eltérésnek (pl. a növekedés ütemének) érzékelhetőnek lennie, vagy – alternatív módon – milyen pontossággal kell tudni megbecsülni az ECx (pl. x = 10-nél, 20-nál vagy 30-nál, és lehetőleg nem kevesebb, mint 10) értékét. Ezek nélkül nem lehet határozott leírást adni a vizsgálatok terjedelméről.
Fontos annak felismerése, hogy a valamelyik statisztikai elemzési módszer alkalmazására optimálisnak (az erőforrások legjobb kihasználását biztosítónak) bizonyult módszer nem szükségszerűen optimális egy másik módszer esetében. A LOEC/NOEC becsléséhez ajánlott tervezés ezért nem feltétlenül azonos a regressziós analízis esetére ajánlottal.
A Stephan és Rogers (9) által tárgyalt okok miatt a regressziós elemzés a legtöbb esetben megfelelőbb, mint a varianciaelemzés. Amennyiben azonban nem található megfelelő regressziós modell (r2 < 0,9), akkor a NOEC/LOEC módszert kell használni.
1.7.1. A regressziós analízis kialakítása
A regresszióval elemzendő vizsgálat kialakításakor a legfontosabb szempontok a következők:
|
— |
a vizsgálat során alkalmazott koncentrációnak magában kell foglalnia azon hatáskoncentrációt (pl. EC10,20,30) és azon koncentrációtartományt, amelyen belül a vizsgált anyag hatását értékelni szükséges. Azon pontossági szint, amellyel a hatáskoncentrációra vonatkozó becsléseket el lehet végezni, akkor lesz a legmegfelelőbb, ha a hatáskoncentráció a vizsgált koncentrációtartomány közepénél helyezkedik el. A megfelelő koncentrációértékek kiválasztásához hasznos lehet egy előzetes behatároló vizsgálat elvégzése, |
|
— |
a megfelelő statisztikai modellezés érdekében a vizsgálat során legalább egy kontrolltartályt és még további öt, különböző koncentrációjú közeggel feltöltött kiegészítő tartályt kell alkalmazni. Adott esetben, diszpergálószer használatakor egy, a diszpergálószert a legmagasabb vizsgált koncentrációban tartalmazó kontrolltartályt kell beiktatni a vizsgált sorozat mellé (lásd 1.8.3. és 1.8.4. szakasz), |
|
— |
megfelelő mértani vagy logaritmikus sorozatot (10) (lásd a 3. függelék) lehet használni. Ajánlott a kísérleti koncentrációk logaritmikus osztásközének használata, |
|
— |
amennyiben hatnál több tartály áll rendelkezésre, akkor a többlettartályokat vagy párhuzamos vizsgálatra lehet felhasználni, vagy a koncentrációtartományt fel lehet osztani az osztásköz csökkentése érdekében. Mindkét módszer egyformán javasolt. |
1.7.2. A NOEC/LOEC becslésének módja varianciaelemzés (ANOVA) használatával
Lehetőleg minden koncentrációszinten legyen egy ismétlőtartály, és a statisztikai elemzést az egyes tartályok esetében kell elvégezni (11). Az ilyen ismétlőtartályok nélkül a halak tömegének egyedi eltérésén túl nem lehet figyelembe venni a tartályok közötti eltéréseket. Korábbi tapasztalatok (12) azonban azt mutatják, hogy – a vizsgált esetben – a „tartályok közötti” változékonyság nagyon csekély volt a „tartályon belüli” (azaz a halak közötti) változékonyság képest. Ezért az egyes halak szintjén végzett statisztikai elemzés elvégzése viszonylag elfogadható alternatíva.
Hagyományosan legalább ötféle, mértani sorozatot alkotó kísérleti koncentrációt használnak, lehetőleg a 3.2 értéket meg nem haladó szorzótényező alkalmazásával.
Általában, ha a vizsgálatokat párhuzamos tartályok használatával végzik, az ilyen kontrolltartályok száma, s ennélfogva a halak száma is az egy koncentrációhoz tartozó teszttartályok számának (amelyek azonos méretűek) kétszerese (13) (14) (15). Ellenkező esetben, azaz párhuzamos tartályok nélkül a kontrollcsoportban lévő halak száma azonos az egyes kísérleti koncentrációk alapján vizsgált halak számával.
Amennyiben a varianciaelemzés (ANOVA) a tartályokon alapul, nem pedig az egyes halakon (ami megkövetelné a halak egyedi jelölését vagy „pszeudospecifikus” növekedési ütemek használatát a számításokhoz – lásd 2.1.2. szakasz), akkor elegendő számú párhuzamos tartályra van szükség az egyes „koncentrációszintek közötti tartályok” standard eltérésének meghatározásához. Ez azt jelenti, hogy a varianciaelemzésben a hibák szabadságfoka legalább 5 kell hogy legyen (11). Amennyiben csak a kontrollok számát duplázzák meg, fennáll a veszélye annak, hogy a hiba variabilitása torzul, mivel a kérdéses növekedési ütemek átlagértékét követve növekedhet. Mivel a növekedési ütem valószínűleg a koncentráció növekedésével arányosan csökken, ez általában a variabilitás túlbecsléséhez vezet.
1.8. ELJÁRÁS
1.8.1. A vizsgálati halak kiválasztása és lemérése
Fontos a halak testtömegeltéréseinek minimumra csökkentése a vizsgálat elején. A vizsgálatok során használatra javasolt különböző halfajok megfelelő mérettartományait az 1. függelék tartalmazza. A vizsgálathoz felhasznált teljes halállományon belül a vizsgálat kezdetén az egyedek testtömegének tartományát ideális esetben az átlagos testtömeg ±10 százalékán belül célszerű tartani, de az eltérés semmiképp sem lehet több 25 %-nál. Az átlagos testtömeg előzetes becslése céljából javasolt a vizsgálat előtt a halak egy részmintájának a tömegét lemérni.
A vizsgálat megkezdése előtt a halállomány populációjának táplálékát 24 órán keresztül vissza kell tartani. A halakat ezt követően kell véletlenszerűen kiválasztani. Általános altatószerrel (pl. MS 222 egy egységére számolt kétegységnyi szódabikarbonát hozzáadásával semlegesített 100 mg/l triazin-metán-szulfonát(MS 222) vizes oldata) elkábított halak nedves (itatóspapírral szárított) egyedi súlyát az 1. függelékben megadott pontossággal kell lemérni. A meghatározott mérettartományon belüli halakat kell megtartani és véletlenszerűen elosztani a tesztedények között. Fel kell jegyezni az egyes edényekbe helyezett halak nedvesen mért össztömegét. A halak altatása és megfogása (ideértve az itatóspapírral történő szárítást és a mérlegelést is) stresszt és a halivadékok sérülését okozhatja, különösen a kisméretű fajok esetében. Ezért a halivadékok kezelésekor maximális gonddal kell eljárni, hogy elkerüljük a stresszhatásokat és sérüléseket.
A halakat a kísérlet 28. napján újra le kell mérni (lásd 1.8.6. szakasz). Amennyiben azonban a táplálékadagolás újraszámítása szükséges, az ismételt mérlegelést már a 14. napon el lehet végezni (lásd 1.8.2.3. szakasz). A haltáp adagolásának módosításához a halak méretének lefényképezése is megfelelő.
1.8.2. Expozíciós feltételek
1.8.2.1. Időtartam
A vizsgálat időtartama > 28 nap.
1.8.2.2. Betelepedési arány és betelepedési sűrűség
Fontos, hogy a betelepedési arány és a betelepedési sűrűség megfeleljen a kísérlethez felhasznált halfajoknak (lásd 1. függelék). Amennyiben túl magas a betelepedési sűrűség, akkor a túlzsúfoltság okozta stressz a növekedési ütem lassulásához és esetleg megbetegedésekhez vezet. A túl alacsony betelepedési sűrűség territóriumfoglalási viselkedésmódokat idézhet elő, ami szintén befolyásolja a növekedési ütemet. A betelepedési sűrűséget mindenképpen annyira alacsonyan kell tartani, hogy a vízben oldott oxigén koncentrációját külön levegőztetés nélkül is legalább a levegőtelítettségi érték 60 %-ának megfelelő szinten lehessen tartani. Egy körvizsgálat (3) kimutatta, hogy a szivárványos pisztrángok esetében 40 liternyi vízben 16 darab, egyenként 3–5 grammos hal elhelyezése az elfogadható. A vízcsere ajánlott gyakorisága a kísérlet során 6 liter/gramm hal/nap.
1.8.2.3. Táplálás
A halakat az elfogadható növekedési ütemet biztosítóan adagolt megfelelő haltáppal (1. függelék) kell etetni. Gondosan kerülni kell a mikrobatenyészetek kialakulását és a víz zavarossá válását. A szivárványos pisztrángok esetében a halak testsúlya 4 %-nak megfelelő arányú napi tápadagolás elégíti ki legvalószínűbben e feltételeket (3) (16) (17) (18). A napi adagot két egyenlő részre lehet osztani és beadagolni, legalább öt óra különbséggel. Az adagolást mindegyik tesztedény esetében a teljes kiindulási haltömeg alapján kell megállapítani. Amennyiben a halakat a 14. napon ismét lemérik, az adagolás mennyisége újraszámolható. A mérlegelés előtt a táplálékot 24 órán keresztül vissza kell tartani.
Az el nem fogyasztott tápot és az ürüléket minden nap gondosan, szívás útján kell eltávolítani a tartályok aljáról.
1.8.2.4. Megvilágítás és hőmérséklet
A megvilágítási időszakokat és a víz hőmérsékletét a vizsgált halfajok sajátosságaihoz kell igazítani (1. függelék).
1.8.3. Vizsgálati koncentrációk
A vizsgálat felépítésétől függetlenül a vizsgált anyagból általában ötféle koncentráció használata szükséges (lásd 1.7.2. szakasz). A vizsgált anyag toxicitásának előzetes ismerete (pl. egy akut vizsgálat és/vagy tartománykeresési vizsgálatok alapján) segíthet a megfelelő koncentrációértékek kiválasztásában. Az ötnél kevesebb koncentrációszint alkalmazását indokolni kell. A legmagasabb kísérleti koncentráció nem haladhatja meg az anyag vízoldhatósági határértékét.
Amennyiben diszpergálószert használnak a törzsoldat előkészítéséhez, az oldat végső koncentrációja nem lehet több, mint 0,1 ml/liter, és lehetőleg azonosnak kell lennie az összes tesztedényben (lásd 1.6.3. szakasz). Mindenesetre minden lehetséges erőfeszítést meg kell tenni az ilyen anyagok használatának elkerülésére.
1.8.4. Ellenőrzések
A hígítóvíz-ellenőrzések száma a vizsgálat kialakításától függ (lásd 1.7–1.7.2. szakasz). Amennyiben diszpergálószert használnak, akkor ugyanannyi ellenőrzést kell végezni, mint amennyit a hígítóvíz-ellenőrzések esetében.
1.8.5. Az analitikai meghatározások és mérések gyakorisága
A vizsgálat során a vizsgált anyag koncentrációját rendszeres időközönként meg kell állapítani (lásd az alábbiakban).
Átfolyási vizsgálatok esetében a hígítóvíz és a mérgező hatású törzsoldat áramlási sebességét időszakosan – lehetőleg naponta egyszer – ellenőrizni kell, továbbá biztosítani kell, hogy ezen érték a vizsgálat során 10 %-nál nagyobb mértékben ne ingadozzon. Amennyiben a vizsgált anyag koncentrációértékei a névleges értékek ± 20 százalékos sávján belülre várhatók (azaz a 80–120 %-os sávon belül; lásd 1.6.2. és 1.6.3. szakasz), akkor minimális intézkedésként javasolt a legmagasabb és a legalacsonyabb kísérleti koncentrációk elemzése a vizsgálat kezdetekor, majd azt követően hetente egyszer. Amennyiben a vizsgált anyag koncentrációértékei várhatóan nem maradnak a névleges értékek ± 20 százalékos sávján belül (a vizsgált anyag stabilitási adatai alapján), akkor javasolt az összes kísérleti koncentráció elemzése, de minden esetben ugyanazon eljárásrendnek megfelelően.
A félstatikus (megújítási) vizsgálatok esetében, ahol a vizsgált anyag koncentrációja várhatóan a névleges értékek ± 20 százalékos sávján belül marad, minimális intézkedésként javasolt a legmagasabb és a legalacsonyabb kísérleti koncentrációk elemzése a frissen elkészített közegre nézve a vizsgálatok kezdetekor, közvetlenül a megújítást megelőzően, valamint azt követően hetente egyszer. Amennyiben a vizsgált anyag koncentrációértékei várhatóan nem maradnak meg a névleges értékek ± 20 százalékos sávján belül, az összes kísérleti koncentrációt a stabilabb anyagoknál alkalmazottal azonos eljárásrendnek megfelelően kell elemezni.
Az eredményeket célszerű a ténylegesen mért koncentrációértékekre alapozni. Amennyiben azonban megfelelő bizonyítékokkal támasztható alá az, hogy az oldatban lévő vizsgált anyag koncentrációját sikerült a vizsgálatok során mindvégig a névleges értékek vagy a kiindulási koncentráció ± 20 százalékos sávján belül tartani, akkor az eredményeket a névleges vagy a mért értékekre is lehet alapozni.
Szükség lehet a minták szűrésére (0,45 mikron pórusméretű szűrőbetétet használva) vagy centrifugálására. A javasolt eljárás a centrifugálás. Amennyiben azonban a vizsgált anyag nem adszorbeálódik a filter felszínén, akkor a szűrés is elfogadható módszer.
A vizsgálat során mindegyik edényben mérni kell az oldottoxigén-koncentrációt, a pH-értéket és a hőmérsékletet. A vízkeménységet, a lúgosságot és a sótartalmat (amennyiben ez mérvadó szempont) mérni kell a kontrollmintákban és a legmagasabb koncentrációjú közeget tartalmazó egyik edényben. Minimális követelményként az oldottoxigén-koncentrációt és a sótartalmat (amennyiben ez mérvadó szempont) mérni kell három alkalommal (a vizsgálat elején, közepén és végén). A félstatikus (megújítási) vizsgálatok esetében javasolt az oldottoxigén gyakoribb mérése, lehetőleg minden vízcsere előtt és után, de hetente legalább egyszer. A pH-értéket a félstatikus megújítási vizsgálatok esetében minden vízcsere elején és végén mérni kell, az átfolyási vizsgálatok esetében pedig legalább hetente egyszer. A vízkeménységet és a lúgosságot vizsgálatonként egyszer kell megmérni. A hőmérsékletet legalább egy tesztedényben folyamatosan figyelemmel kell kísérni.
1.8.6. Megfigyelések
Tömegmérés: a vizsgálat végén le kell mérni az összes életben maradt hal nedves (itatóspapírral szárított) tömegét; vagy tesztedényenként csoportosan mért vagy egyedi súlyt kell meghatározni. A halak tesztedényenkénti együttes tömegmérése kedvezőbb az egyedi mérésnél, mert ez utóbbinál minden egyes halat külön meg kell jelölni. Az egyes egyedek fajlagos növekedési üteme meghatározásához végzett egyedi testtömegmérések esetében a halak egyedi jelölésére stresszmentes módszert kell kiválasztani (megfelelőek lehetnek a fagyasztásos jelölés alternatívái, például a színes, vékony horgászzsinór használata).
A halakat a vizsgálat időszakában naponta meg kell vizsgálni és bármilyen külső rendellenességet (bevérzés, elszíneződés) vagy rendellenes viselkedésmódot fel kell jegyezni. Az elpusztulásokat fel kell jegyezni, és az elpusztult egyedeket a lehető legrövidebb idő alatt el kell távolítani a tartályból. Az elpusztult halakat nem kell pótolni, mivel a meghatározott telepítési tömeg és sűrűség elegendő – a halak edényben mért számában beálló változás révén – a növekedési ütem módosulásának elkerüléséhez. A táplálék arányát azonban ki kell igazítani.
2. ADATOK ÉS JELENTÉSKÉSZÍTÉS
2.1. AZ EREDMÉNYEK KIÉRTÉKELÉSE
A vizsgálat kialakításába és eredményei elemzésébe ajánlott egy statisztikus bevonása, mivel e vizsgálati módszer jelentős eltéréseknek ad teret a kísérletek menetének kialakításában, például ami a tesztkamrák, a kísérleti koncentrációk, a halak stb. számát illeti. A vizsgálat kialakításában rejlő választási lehetőségekre való tekintettel a statisztikai módszerre vonatkozó külön eligazítás itt nem szerepel.
A 10 %-ot meghaladó mortalitási arányú tesztedényekre nézve nem kell kiszámítani a növekedési ütemet. A mortalitási arányt azonban az összes kísérleti koncentrációra nézve jelezni kell.
Bármilyen módszer is szolgáljon az adatok elemzésére, a központi kérdés az „r” specifikus növekedési ütem nagysága a „t1” és „t2” időpont között. Ezt különböző módokon lehet meghatározni, attól függően, hogy a halakat megjelölik-e egyedileg, illetve hogy szükség van-e az átlagos növekedési ráta kiszámítására.



ahol:
|
r1 |
= |
halegyedek specifikus növekedési üteme |
|
r2 |
= |
specifikus növekedési ütem a tartály átlagában |
|
r3 |
= |
pszeudospecifikus növekedési ütem |
|
w1, w2 |
= |
egy adott hal tömege, a t1, illetve t2 időpontban |
|
loge w1 |
= |
egy adott hal vizsgálati időszak elején mért tömegének logaritmusa |
|
loge w2 |
= |
egy adott hal vizsgálati időszak végén mért tömegének logaritmusa |
|
logeW1 |
= |
a tesztkamrában lévő halakra vonatkozó w1 értékek logaritmusainak átlaga a vizsgálati időszak elején |
|
logeW2 |
= |
a tesztkamrában lévő halakra vonatkozó w2 értékek logaritmusainak átlaga a vizsgálati időszak végén |
|
t1, t2 |
= |
a vizsgálati időszak elejének és végének ideje (napja) |
Az r1, r2, r3 értékeket ki lehet számítani a 0–8. nap időszakára és – adott esetben (azaz amennyiben a 14. napon is végeznek méréseket) – a 0–14., illetve a 14–28. nap időszakára.
2.1.1. Az eredmények regressziós elemzése (a koncentráció változására való reagálás modellezése)
Ezen elemzési módszer a specifikus növekedési ütem és a koncentrációértékek között hoz létre alkalmas matematikai összefüggést, és ennélfogva lehetővé teszi az „ECx” azaz bármely szükséges EC érték becslését. E módszer használatakor nem szükséges kiszámítani az „r” értékét az egyes halegyedekre (r1), hanem ehelyett az „r”„kamraátlag” értékére (r2) lehet a számítást alapozni. Lehetőleg ez utóbbi módszert kell alkalmazni. Ez egyben a legkisebb halfajok kísérleti felhasználásához is célszerűbb megoldás.
Az átlagos specifikus növekedési ráták (r2) a koncentráció változásának függvényében grafikusan ábrázolhatók a koncentráció változására való reagálás összefüggéseinek megvizsgálása érdekében.
Az r2 és a koncentráció alakulása közötti összefüggés kifejezése érdekében egy megfelelő indoklással alátámasztott választás szerinti, alkalmas modellt kell használni.
Amennyiben a kísérletet túlélő halak száma nem azonos a tesztedényekben, akkor a modellillesztéses folyamatot, függetlenül attól, hogy egyszerű vagy nem lineáris, súlyozni kell, a csoportok nem egyenlő létszámának a figyelembevétele érdekében.
A modellillesztéses módszer segítségével becsülhető kell, hogy legyen pl. az EC20 és a középértéktől való eltérés (akár a standard hibát, akár a konfidencia-intervallumot tekintve). Az illesztett modell grafikonját az adatokkal összevetve kell bemutatni úgy, hogy látható legyen a modell illeszkedésének megfelelő volta (9) (19) (20) (21).
2.1.2. Az eredmények elemzése a LOEC becsléséhez
Amennyiben a vizsgálat során párhuzamos tartályokat használnak valamennyi koncentrációszinten, akkor a LOEC becslését az átlagos specifikus növekedési ráták varianciaanalízisére (ANOVA) lehet alapozni (lásd 2.1. szakasz), amit egy célszerű módszer alkalmazása követ (pl. a Dunnett- vagy a Williams-vizsgálat (13) (14) (15) (22)), amellyel az átlagos „r” értéket lehet összevetni valamennyi koncentrációszint esetében a kontrollszámítások átlagával azon legalacsonyabb koncentráció megállapítására, amelyben 0,05-ös valószínűségi szinten szignifikáns a változás. Amennyiben nem teljesülnek a paraméteres módszerre nézve megkövetelt feltételek – nem normál eloszlás (pl. Shapiro-Wilk-próba) vagy heterogén variancia (Bartlett-próba) – akkor fontolóra lehet venni az adatok varianciahomogenizálása érdekében történő transzformálását az ANOVA elemzés elvégzése előtt, illetve egy súlyozott ANOVA elemzés végrehajtását.
Amennyiben a vizsgálat során nem használnak párhuzamos tartályokat valamennyi koncentrációszinten, akkor a tartályokra alapozott ANOVA elemzés érzéketlen vagy kivitelezhetetlen lesz. Ebben a helyzetben elfogadható kompromisszumot jelent, ha az ANOVA elemzést az egyes halegyedekre vonatkozó r3 pszeudospecifikus növekedési ütemre alapozva végzik el.
Ekkor az egyes kísérleti koncentrációkhoz tartozó átlagos r3 értékeket össze lehet hasonlítani a kontrollokra vonatkozó átlagos r3 értékkel. A LOEC értékét ekkor a korábbiakban említettekkel azonos módon lehet megállapítani. Fel kell ismerni, hogy e módszer nem veszi figyelembe a tartályok közötti variabilitást – és nem is nyújt védelmet ellene – azon túl, amit az egyes halegyedek közötti variabilitás alapján lehet beszámítani. A tapasztalat azonban azt mutatta (9), hogy a tartályok közötti variabilitás nagyon csekély volt a tartályon belüli (azaz egyedek közötti) variabilitáshoz képest. Amennyiben egyes halegyedeket nem vonnak be az elemzésbe, akkor a kívül eső értékek azonosítására szolgáló módszert és alkalmazásának igazolását biztosítani kell.
2.2. AZ EREDMÉNYEK ÉRTÉKELÉSE
Az eredményeket kellő óvatossággal kell értelmezni, amennyiben a kísérleti oldatokban mért mérgezőanyag-koncentrációk az analitikai módszer észlelési határa közelében lévő szinteket érnek el, vagy – félstatikus (megújítási) vizsgálatok esetében – amennyiben a vizsgált anyag koncentrációja csökken az oldat frissen elkészített állapota és a megújítás előtti állapota között.
2.3. VIZSGÁLATI JELENTÉS
A vizsgálatról készített jelentésben ki kell térni az alábbi információkra:
2.3.1. A vizsgált anyag
|
— |
a vizsgált anyag fizikai jellege és fontos fizikai-kémiai tulajdonságai, |
|
— |
a kémiai azonosítási adatok, beleértve a kémiai tisztaságot és – adott esetben – a vizsgált anyag mennyiségének számszerűsítésére szolgáló analitikai módszert. |
2.3.2. A vizsgált fajok
|
— |
lehetőség szerint a tudományos név, |
|
— |
törzs, méret, szállító, esetleges előzetes kezelés stb. |
2.3.3. Vizsgálati körülmények
|
— |
az alkalmazott vizsgálati eljárás (pl. félstatikus/megújítási, átfolyási, telepítési tömeg és sűrűség stb.), |
|
— |
a vizsgálat kialakítása (pl. a tesztedények száma, a kísérleti koncentrációk és ismétlések, a halak tartályonként létszáma), |
|
— |
a törzsoldat elkészítésének módszere és a vízcsere gyakorisága (az esetleg használt diszpergálószer nevét és koncentrációját meg kell adni), |
|
— |
a névleges kísérleti koncentrációk, a mért értékek átlaga és szórása a kísérleti tartályokban, az ilyen adatok megszerzésének módszerei és bizonyítékok annak alátámasztására, hogy a mérések valóban az oldatban lévő vizsgált anyag koncentrációszintjeire vonatkoznak, |
|
— |
a hígítóvíz jellemzői: pH-érték, keménység, lúgosság, hőmérséklet, oldottoxigén-koncentráció, maradványklór-szintek (amennyiben mérik), összes szerves szén, szuszpendált szilárd anyagok, a vizsgálati közeg sótartalma (amennyiben mérik) és bármely más mérési adat, |
|
— |
vízminőség a tesztedényekben: pH-érték, keménység, hőmérséklet és az oldottoxigén-koncentráció, |
|
— |
részletes információk a tápanyagról (pl. a haltáp típusa, beszerzési forrása, az adagolt mennyiség és az adagolás gyakorisága). |
2.3.4. Eredmények
|
— |
annak bizonyítása, hogy a kontrollok teljesítették a túlélés érvényességi kritériumait, valamint adatok a különböző kísérleti koncentrációkban bekövetkező mortalitásról, |
|
— |
a felhasznált statisztikai analitikai módszerek és hogy a statisztika párhuzamos vizsgálatok eredményein vagy az egyedekre vonatkozó adatokon alapul-e, az adatok kezelése és a felhasznált módszerek célszerűségének igazolása, |
|
— |
táblázatokba foglalt adatok a halak egyedi és átlagtömegéről a 0., 14. (amennyiben mérik) és a 28. napon mérve, az átlagos specifikus növekedési ráta vagy a pszeudospecifikus növekedési ráta értékei a 0–28. nap időszakában vagy lehetőség szerint a 0–14. és a 14–28. nap időszakaiban, |
|
— |
a statisztikai elemzés eredményei (azaz regressziós analízis vagy ANOVA) lehetőleg táblázatos és grafikus formában bemutatva, valamint a LOEC (p = 0,05) és a NOEC vagy lehetőség szerint az ECx értékei, adott esetben a szórás feltüntetésével, |
|
— |
a halak szokatlan reakcióinak és a vizsgált anyag által előidézett bármely látható elváltozás előfordulása. |
3. SZAKIRODALOM
|
(1) |
SOLBE J. F. DE LG (1987). Environmental Effects of Chemicals (CFM 9350 SLD). Report on a UK Ring Test of a Method for Studying the Effects of Chemicals on the Growth Rate of Fish. WRc Report No PRD 1388-M/2. Meyer, A., Bierman, C. H. and Orti, G. (1993). The phylogenetic position of the zebrafish (Danio rerio), a model system in developmental biology: an invitation to the comparative method. Proc. R. Soc. Lond. B. 252, pp. 231-236. |
|
(2) |
Ashley S., Mallett M. J. and Grandy N. J. (1990). EEC Ring Test of a Method for Determining the Effects of Chemicals on the Growth Rate of Fish. Final Report to the Commission of the European Communities. WRc Report No EEC 2600-M. |
|
(3) |
Crossland N. O. (1985). A method to evaluate effects of toxic chemicals on fish growth. Chemosphere, 14, pp. 1855-1870. |
|
(4) |
Nagel R., Bresh H., Caspers N., Hansen P. D., Market M., Munk R., Scholz N. and Höfte B. B. (1991). Effect of 3,4-dichloroaniline on the early life stages of the Zebrafish (Brachydanio rerio): results of a comparative laboratory study. Ecotox. Environ. Safety, 21, pp.157-164. |
|
(5) |
Yamamoto, Toki o. (1975). Series of stock cultures in biological fielásd Medaka (killifish) biology and strains. Keigaku Publish. Tokio, Japan. |
|
(6) |
Holcombe, G. W., Benoit D. A., Hammermeister, D. E., Leonard, E. N. and Johnson, R. D. (1995). Acute and long-term effects of nine chemicals on the Japanese medaka (Oryzias latipes). Arch. Environ. Conta. Toxicol. 28, pp. 287-297. |
|
(7) |
Benoit, D. A., Holcombe, G. W. and Spehar, R. L. (1991). Guidelines for conducting early life toxicity tests with Japanese medaka (Oryzias latipes). Ecological Research Series EPA-600/3-91-063. US Environmental Protection Agency, Duluth, Minnesota. |
|
(8) |
Stephan C. E. and Rogers J. W. (1985). Advantages of using regression analysis to calculate results of chronic toxicity tests. Aquatic Toxicology and Hazard Assessment: Eighth Symposium, ASTM STP 891, R. C. Bahner and D. J. Hansen, eds., American Society for Testing and Materials, Philadelphia, pp. 328-338. |
|
(9) |
Environment Canada (1992). Biological test method: toxicity tests using early life stages of salmonid fish (rainbow trout, coho salmon, or atlantic salmon). Conservation and Protection, Ontario, Report EPS l/RM/28, 81 pp. |
|
(10) |
Cox D. R. (1958). Planning of experiments. Wiley Edt. |
|
(11) |
Pack S. (1991). Statistical issues concerning the design of tests for determining the effects of chemicals on the growth rate of fish. Room Document 4, OECD Ad Hoc Meeting of Experts on Aquatic Toxicology, WRc Medmenham, UK, 10-12 December 1991. |
|
(12) |
Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control, J. Amer. Statist. Assoc, 50, pp. 1096-1121. |
|
(13) |
Dunnett C. W. (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482-491. |
|
(14) |
Williams D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, pp. 103-117. |
|
(15) |
Johnston, W. L., Atkinson, J. L., Glanville N. T. (1994). A technique using sequential feedings of different coloured food to determine food intake by individual rainbow trout, Oncorhynchus mykiss: effect of feeding level. Aquaculture 120, pp. 123-133. |
|
(16) |
Quinton, J. C. and Blake, R. W. (1990). The effect of feed cycling and ration level on the compensatory growth response in rainbow trout, Oncorhynchus mykiss. Journal of Fish Biology, 37, pp. 33-41. |
|
(17) |
Post, G. (1987). Nutrition and Nutritional Diseases of Fish. Chapter IX in Testbook of Fish Health. T. F. H. Publications, Inc. Neptune City, New Jersey, USA. 288 pp. |
|
(18) |
Bruce, R. D. and Versteeg D. J. (1992). A statistical procedure for modelling continuous toxicity data. Environ. Toxicol. Chem. 11, pp. 1485-1494. |
|
(19) |
DeGraeve, G. M., Cooney, J. M., Pollock, T. L., Reichenbach, J. H., Dean, Marcus, M. D. and McIntyre, D. O. (1989). Precision of EPA seven-day fathead minnow larval survival and growth test; intra and interlaboratory study. Report EA-6189 (American Petroleum Institute Publication, No 4468). Electric Power Research Institute, Palo Alto, CA. |
|
(20) |
Norbert-King T. J. (1988). An interpolation estimate for chronic toxicity: the ICp approach. US Environmental Protection Agency. Environmental Research Lab., Duluth, Minnesota. Tech. Rep. No 05-88 of National Effluent Toxicity Assesment Center. Sept. 1988. 12 pp. |
|
(21) |
Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, pp. 510-531. |
1. függelék
A VIZSGÁLATHOZ JAVASOLT HALFAJOK ÉS A MEGFELELŐ VIZSGÁLATI KÖRÜLMÉNYEK
|
Fajok |
A vizsgálathoz javasolt hőmérséklet-tartomány ( oC) |
Megvilágítási időszak (óra) |
Halak javasolt kiindulási tömege (gramm) |
Megkövetelt mérési pontosság |
Betelepítési tömeg (g/l) |
Betelepítési sűrűség (literenként) |
Táplálék |
Vizsgált idő tartama (nap) |
|
Javasolt fajok: |
|
|
|
|
|
|
|
|
|
Oncorhynchus mykiss Szivárványos pisztráng |
12,5—16,0 |
12–16 |
1–5 |
Legközelebbi 100 mg |
1,2—2,0 |
4 |
Lazacivadékok különleges szárított tápláléka |
>28 |
|
Más, jól dokumentált fajok |
|
|
|
|
|
|
|
|
|
Danio rerio Zebrahal |
21–25 |
12–16 |
0,050—0,100 |
Legközelebbi 1 mg |
0,2—1,0 |
5–10 |
Élő táplálék (Brachionus artemia) |
>28 |
|
Oryzias latipes Rizshal (Medaka) |
21–25 |
12–16 |
0,050—0,100 |
Legközelebbi 1 mg |
0,2—1,0 |
5–20 |
Élő táplálék (Brachionus Artemia) |
>28 |
2. függelék
AZ ELFOGADHATÓ MINŐSÉGŰ HÍGÍTÓVÍZ NÉHÁNY FONTOSABB KÉMIAI TULAJDONSÁGA
|
ANYAG MEGNEVEZÉSE |
KONCENTRÁCIÓÉRTÉKEK |
|
Lebegőanyag |
< 20 mg/liter |
|
Összes szerves szén |
< 2 mg/liter |
|
Nem ionizált ammónia |
< 1 μg/liter |
|
Maradek klór |
< 10 μg/liter |
|
Összes szerves foszfortartalmú peszticid |
< 50 ng/liter |
|
Összes szerves klórtartalmú peszticid pluszpoliklórozott bifenilek |
< 50 ng/liter |
|
Összes szerves klór |
< 25 ng/liter |
3. függelék
Toxicitási vizsgálatok céljaira alkalmas koncentrációértékek logaritmikus sorozatai (9)
|
Oszlop (koncentrációértékek száma 100 és 10 vagy 10 és 1 között) (20) |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
100 |
100 |
100 |
100 |
100 |
100 |
100 |
|
32 |
46 |
56 |
63 |
68 |
72 |
75 |
|
10 |
22 |
32 |
40 |
46 |
52 |
56 |
|
3,2 |
10 |
18 |
25 |
32 |
37 |
42 |
|
1,0 |
4,6 |
10 |
16 |
22 |
27 |
32 |
|
|
2,2 |
5,6 |
10 |
15 |
19 |
24 |
|
|
1,0 |
3,2 |
6,3 |
10 |
14 |
18 |
|
|
|
1,8 |
4,0 |
6,8 |
10 |
13 |
|
|
|
1,0 |
2,5 |
4,6 |
7,2 |
10 |
|
|
|
|
1,6 |
3,2 |
5,2 |
7,5 |
|
|
|
|
1,0 |
2,2 |
3,7 |
5,6 |
|
|
|
|
|
1,5 |
2,7 |
4,2 |
|
|
|
|
|
1,0 |
1,9 |
3,2 |
|
|
|
|
|
|
1,4 |
2,4 |
|
|
|
|
|
|
1,0 |
1,8 |
|
|
|
|
|
|
|
1,3 |
|
|
|
|
|
|
|
1,0 |
C.15. RÖVID TÁVÚ TOXICITÁSI VIZSGÁLAT HALEMBRIÓKKAL ÉS HALLÁRVÁKKAL
1. MÓDSZER
E rövid távú toxicitásvizsgálati módszer az OECD TG 212 (1998) megfelelője.
1.1. BEVEZETÉS
A halembriókon és hallárvákon végzett rövid távú toxicitásvizsgálat olyan rövid távú vizsgálat, amely az újonnan megtermékenyült petétől a szikzacskós ivadéki állapot végéig terjedő fejlődési szakaszokat fedi le. Az embrió- és lárvateszt során táplálék adagolására nem kerül sor, és ezért a vizsgálatot addig kell befejezni, amíg az ivadékokat még táplálja a saját szikzacskójuk.
A vizsgálata célja meghatározni a vizsgált fajokra és azok fejlődési szakaszaira vegyi anyagok által gyakorolt letális és – korlátozott mértékig – a szubletális hatásokat. E vizsgálat hasznos információkkal szolgálhat, amennyiben a) hidat képez a letális és szubletális vizsgálatok között; b) elővizsgálatként alkalmazható a korai életciklusra vonatkozó valamennyi vagy krónikus toxicitási vizsgálatok esetében; és c) olyan fajok vizsgálatára is felhasználható, amelyek tenyésztési módszerei nem kellően fejlettek ahhoz, hogy lefedjék az endogén táplálkozásról az exogén jellegűre való váltás időszakát.
Emlékeztetni kell arra, hogy csak a halak életciklusának minden szakaszát felölelő vizsgálatok képesek általában pontos becslést adni a vegyi anyagok halakra gyakorolt krónikus toxicitásáról, továbbá hogy az egyes életszakaszokban alkalmazott csökkentett expozíció csökkentheti a teszt érzékenységét, s ezért a krónikus toxicitás mértékének alábecsléséhez vezethet. Ezért várható, hogy a halembriókon és hallárvákon végzett toxicitási vizsgálat kevésbé lesz érzékeny, mint a halak korai életciklusát vizsgáló valamennyi vizsgálat, különösen ami a lipofil (log Pow > 4), illetve a mérgező hatásukat sajátságos módon kifejtő vegyi anyagokat illeti. A kétféle vizsgálat között az érzékenység tekintetében mutatkozó kisebb különbségek a nem specifikus, narkotikus hatásmechanizmusú vegyi anyagok esetében várhatók (1).
E vizsgálat publikálását megelőzően a halembriók és hallárvák körében a legtöbb tapasztalatot az édesvízi Danio rerio Hamilton-Buchanan nevű hallal (Teleostei, Cyprinidae, közönséges nevén zebrahal) szerezték. Ezért a vizsgálatnak az e fajra vonatkozó végrehajtásáról az 1. függelék részletes útmutatást nyújt. Ez természetesen nem zárja ki olyan más fajok használatát, amelyekre nézve szintén ismertek tapasztalatok (lásd az IA. és IB. táblázatot).
1.2. FOGALOMMEGHATÁROZÁSOK
Legalacsonyabb megfigyelhető hatást okozó koncentráció (LOEC): a vizsgált anyag azon legalacsonyabb kísérleti koncentrációja, amelynél a kontrollal összevetve még megfigyelhető az anyag egy jelentős hatása (p < 0,05). Azonban a LOEC fölötti koncentrációnak olyan ártalmas hatást kell kifejtenie, amely legalább azonos a LOEC-nél megfigyelttel, vagy súlyosabb annál.
Megfigyelhető hatást nem okozó koncentráció (NOEC): a közvetlenül a LOEC alatti kísérleti koncentráció.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A halembriók és hallárvák a vízben oldott vizsgált anyag széles tartományon belüli koncentrációinak vannak kitéve. A tervezés során választani lehet a félstatikus és az átfolyási eljárás közül. A választást a vizsgált anyag jellege határozza meg. A vizsgálat azzal kezdődik, hogy frissen megtermékenyített petéket helyeznek a kísérleti kamrákba, és akkor ér véget, amikor a kísérleti kamrák valamelyikében bármelyik lárva szikzacskója teljesen felszívódik, vagy amennyiben elkezdődik a kontrollcsoportokban az éhezés miatti pusztulás. A letális és szubletális hatásokat ki kell értékelni, és össze kell hasonlítani a kontrollcsoportbeli értékekkel, a legalacsonyabb megfigyelhető hatást okozó koncentráció (LOEC), és ennek kapcsán a megfigyelhető hatást nem okozó koncentráció (NOEC) meghatározása érdekében. Alternatív módon a hatásokat egy regressziós modellel lehet elemezni azon koncentráció megállapítása érdekében, amely egy adott százaléknyi hatást vált ki (azaz LC/ECx, C/ECx, ahol az x egy meghatározott százalék mértékű hatás).
1.4. A VIZSGÁLT ANYAGRA VONATKOZÓ INFORMÁCIÓK
Rendelkezésre kell hogy álljanak az e vizsgálat céljára kiválasztott fajokkal lehetőleg korábban már végzett, akut toxicitási vizsgálatok eredményei (lásd a C.1. vizsgálati módszert). Az eredmények hasznosak lehetnek a korai életszakaszokat vizsgáló vizsgálat során alkalmazandó kísérleti koncentrációk megfelelő tartományának kiválasztásában. Ismerni kell a vizsgált anyag vízoldhatóságának (ideértve a vizsgálathoz felhasznált vizet is) és gőznyomásának értékeit. Megbízható analitikai módszerrel kell rendelkezni a kísérleti oldatokban lévő vizsgált anyag számszerűsítésére, amelynek pontossága és észlelésének korlátai ismertek és dokumentáltak.
A vizsgálati körülmények megállapítása tekintetében hasznos információk közé tartozik még a szerkezeti képlet, az anyag tisztasága, stabilitása fénnyel, illetve a vizsgálat körülményeivel szemben, a pKa és Pow értékek, valamint a gyors biológiai lebomlásra vonatkozó vizsgálatok eredményei (lásd a C.4. vizsgálati módszert).
1.5. A VIZSGÁLAT ÉRVÉNYESSÉGE
A vizsgálat érvényességéhez az alábbi feltételeknek kell teljesülniük:
|
— |
a kontrollcsoportokban és – amennyiben szükséges – az oldószeres kontrollokban a megtermékenyített peték összesített túlélési arányszámai nagyobbak a 2. és 3. függelékben meghatározott határértékeknél vagy egyenlők azokkal, |
|
— |
a kísérlet során az oldott oxigén koncentrációját mindvégig legalább a levegő telítettségi érték (ASV) 60 és 100 %-a között kell tartani, |
|
— |
a víz hőmérséklete a vizsgálat során a tesztedényekben, illetve bármelyik két egymást követő nap között 1,5 oC-nál nagyobb mértékben nem változhat, és a hőmérsékletet a vizsgált fajra nézve meghatározott hőmérséklet-tartományon belül kell tartani (lásd 2. és 3. függelék). |
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Tesztedények
Üvegből vagy más, kémiailag semleges anyagból készült edényeket kell használni. Az edényeknek elég nagyoknak kell lenniük ahhoz, hogy lehetővé tegyék a betelepítési arány betartását (lásd 1.7.1.2. szakasz). Javasolt a tesztedények véletlenszerű elhelyezése a vizsgálatra kijelölt területen. A teljesen véletlenszerű elrendezéssel szemben célszerűbb a véletlenszerűen elhelyezett blokkok alkalmazása, ahol mindegyik blokkban képviselve van mindegyik kezelési mód, amennyiben léteznek a blokkelrendezés révén ellenőrizhető, szisztematikusan érvényesülő hatások a laboratóriumban. Amennyiben ilyen blokkokba rendezésre kerül sor, akkor ennek tényét az adatok későbbi elemzései során figyelembe kell venni. A tesztedényeket védeni kell a nem kívánt zavaró hatásoktól.
1.6.2. A halfajok kiválasztása
A vizsgálat céljaira javasolt halfajok listáját az 1A. táblázat tartalmazza. Ez nem zárja ki más fajok használatát (amelyre példák az 1B. táblázatban találhatók), de az eljárást ekkor esetleg módosítani kell a megfelelő feltételek biztosítása érdekében. Ebben az esetben a jelentésnek tartalmaznia kell a fajok és a kísérleti módszer kiválasztásának indoklását.
1.6.3. A halivadék tartása
A halivadék megfelelő feltételek melletti tartására vonatkozó részletek az OECD TG 210 jelű dokumentumban (21) és a (2) (3) (4) (5) (6) számú szakirodalmi hivatkozásban találhatók.
1.6.4. Az embriók és lárvák kezelése
Az embriókat és lárvákat a fő tartályon belül elhelyezett, oldalaiknál vagy végeiknél lukacsos kisebb edényekben lehet kitenni a tartályon átfolyó vizsgált oldat hatásának. E kisebb tartályokban a turbulenciamentes áramlást úgy lehet elérni, hogy az edényeket egy olyan karra függesztjük fel, amely fel-le mozgatható, ügyelve, hogy az organizmusok mindig a vizsgált oldatban legyenek; egy szifonzáras öblítőrendszert is be lehet építeni. Lazacfélék megtermékenyített petéit olyan rácsokon vagy hálókon lehet tartani, amelyek nyílásai elég nagyok ahhoz, hogy a petékből kibújó lárvák átessenek rajtuk. A teljes napi megújítással járó félstatikus vizsgálatok során Pasteur-pipettákat lehet használni az embriók és lárvák kiemelésére (lásd 1.6.6. szakasz).
Amennyiben a peték fő kísérleti tartályon belüli tartására kis tartályokat, rácsokat vagy hálókat használnak, akkor a lárvák kikelése után ezeket a visszatartó eszközöket el kell távolítani (21), kivéve, ha a halak szökésének megakadályozása érdekében van rájuk szükség. Amennyiben szükség lenne a lárvák áthelyezésére, akkor azokat nem szabad kitenni a levegő hatásának, és nem szabad hálót használni halaknak a peték tárolására használt tartályból való kiemelésére (ilyen elővigyázatosságra nincs feltétlenül szükség egyes kevésbé sérülékeny halfajok, pl. ponty esetén). Az ilyen áthelyezés időzítése az egyes fajoktól függően változik, és nincs mindig szükség rá. A félstatikus módszernél főzőpoharakat vagy alacsony falú edényeket lehet használni, és – amennyiben szükséges – ezeket a főzőpohár alja fölé kismértékben emelt hálóval lehet felszerelni. Amennyiben az ilyen tartóedények térfogata megfelelő a betelepítési szinttel kapcsolatos követelmények teljesítéséhez (lásd 1.7.1.2. szakasz), akkor nincs is feltétlenül szükség az embriók vagy lárvák áthelyezésére.
1.6.5. Víz
A vizsgálathoz bármely olyan víz felhasználható, amely megfelel a 4. függelékben az elfogadható minőségű hígítóvízre vonatkozó kémiai jellemzőknek, és amelyben a vizsgálatnak alávetett állatfajok legalább olyan jó túlélési eredményeket mutatnak, mint ami a 2. és 3. függelékben le van írva. A víz minőségét a kísérlet során mindvégig azonos szinten kell tartani. A víz pH-értéke az adott vizsgálat során mindvégig csak ±0,5 pH-egységgel térhet el a kiindulási értéktől. Annak biztosítására, hogy a hígítóvíz ne gyakoroljon nem kívánt hatást a vizsgálat eredményeire (pl. mert komplexet képez a tesztanyaggal), illetve ne gyakoroljon kedvezőtlen hatásokat az ivadékállomány teljesítményére, időnként mintákat kell venni elemzésre. Mérni kell a következő összetevőket: a nehézfémek (pl. Cu, Pb, Zn, Hg, Cd és Ni), a fontosabb anionok és kationok (pl. Ca, Mg, Na, K, Cl és SO4), a peszticidek (pl. összes szervesfoszfor- és összes szervesklór-tartalmú peszticid), az összes szerves szén és a szuszpendált szilárd anyagok koncentrációját, például háromhavonta, amennyiben a hígítóvízről tudott, hogy viszonylag állandó minőségű. Amennyiben a víz minősége bizonyítottan konstans legalább egy éven keresztül, akkor ritkábban, nagyobb időközökkel is lehet ellenőrző méréseket végezni (pl. csak hathavonta egyszer).
1.6.6. Vizsgált oldatok
A kiválasztott koncentrációjú vizsgált oldatok a törzsoldat hígításával készíthetők el.
A törzsoldatot lehetőleg a vizsgált anyagnak a hígítóvízbe, mechanikai eszközök (pl. keverő, ultrahang) segítségével történő bekeverésével vagy hozzákeverésével kell elkészíteni. Telítési oszlopok (oldhatósági oszlopok) is felhasználhatók a megfelelő koncentrációjú törzsoldat elkészítéséhez. A lehetőségekhez mérten kerülni kell az oldószerek vagy diszpergálószerek használatát, bár ilyen vegyületekre egyes esetekben szükség lehet egy megfelelő töménységű törzsoldat előállításához. Alkalmas oldószer lehet az aceton, etanol, metanol, dimetil-formamid és a trietilén-glikol. Alkalmas diszpergálószer lehet például: a Cremophor RH40, Tween 80, Metilcellulóz 0,01 % és a HCO-40. Kellő figyelemmel kell eljárni a biológiailag gyorsan lebomló szerek (pl. aceton) és/vagy az erősen illékony összetevők használatakor, mivel ezek az átfolyási vizsgálatok során fellépő bakteriális szintetikus aktivitás miatt okozhatnak gondokat. Amennyiben diszpergálószereket kell használni, azok nem gyakorolhatnak lényeges hatásokat a túlélésre, és láthatóan kedvezőtlen hatásokat a korai életszakaszban, amit csak egy oldószerrel végzett ellenőrző vizsgálat tárhat fel. Törekedni kell azonban az ilyen anyagok használatának kerülésére.
Félstatikus vizsgálatok során két különböző vízcseremódszer közül lehet választani: i. új vizsgált oldatokat készítenek tiszta edényekben és a kísérlet korábbi fázisait túlélő petéket és lárvákat a régi oldat kis mennyiségével együtt kíméletesen áttelepítik az új edényekbe, kerülve az élőlények érintkezését a levegővel; vagy ii. az organizmusokat visszatartják az edényben, miközben a vizsgálat céljaira használt víz egy részét (legalább háromnegyedét) lecserélik. A közeg megújításának gyakorisága a vizsgált anyag stabilitásától függ, azonban ajánlott a víz napi cseréje. Amennyiben a korábbi stabilitási vizsgálatok (lásd 1.4. szakasz) arra mutattak rá, hogy nem stabil a vizsgált anyag koncentrációja (azaz kívül esik a névleges koncentráció 80–120 %-os tartományán, vagy a kiinduláskor mért koncentráció 80 %-a alá csökken) a megújítási időszak során, akkor fontolóra kell venni egy átfolyási vizsgálat lefolytatását. Minden esetben gondosan ügyelni kell arra, hogy elkerüljük a lárvákat érő stresszhatásokat a vízcsereműveletek során.
Az átfolyási vizsgálatok céljára olyan rendszert kell használni, amely folyamatosan biztosítja és hígítja a vizsgált anyag törzsoldatát (pl. egy adagolószivattyú, proporcionális hígító vagy egy telítőrendszer), annak érdekében, hogy a kísérleti kamrákhoz eljusson a hígítóoldat. A kísérlet során megfelelő időnként – lehetőleg naponta – ellenőrizni kell a törzsoldatok és a hígítóvíz áramlási sebességét, amelynek értéke nem változhat 10 %-nál nagyobb mértékben a vizsgálat során. A 24 óránként legalább öt kísérleti kamrányi vízcserének megfelelő áramlási sebességet találták megfelelőnek.
1.7 ELJÁRÁS
A szakirodalom hasznos információkat tartalmaz a halembriók és hallárvák toxicitási vizsgálatai során mutatott teljesítményéről, amelyek közül néhányat példaként e szövegrész szakirodalmi hivatkozásai tartalmaznak (7) (8) (9).
1.7.1. Expozíciós feltételek
1.7.1.1. Időtartam
A vizsgálatot lehetőleg a peték megtermékenyítését követő 30 percen belül meg kell kezdeni. Az embriókat a csírakorong osztódásának kezdete előtt, vagy közvetlenül utána, vagy bármely időpontban, mielőtt a gasztrulastádium kialakulna, a tesztoldatba kell helyezni. A kereskedelmi szállítótól kapott peték esetében nincs mód a vizsgálat azonnali megkezdésére a megtermékenyítés után. Mivel a kezdés késleltetése komolyan befolyásolja a vizsgálat érzékenységét, a vizsgálatot a megtermékenyítést követő nyolc órán belül mindenképpen el kell kezdeni. Mivel az expozíciós idő alatt a lárvák nem kapnak táplálékot, a vizsgálatot még az előtt be kell fejezni, mielőtt a kísérleti kamrák valamelyikében bármelyik lárva szikzacskója teljesen felszívódik, vagy elkezdődik a kontrollcsoportokban az éhezés miatti pusztulás. Az időtartam a használt fajtól függ. Néhány javasolt időtartam a 2. és 3. függelékben található.
1.7.1.2. Betelepítés
A vizsgálat kezdetén használt megtermékenyített peték számának elegendőnek kell lennie a statisztikai követelmények kielégítéséhez. A petéket véletlenszerűen kell elosztani a különböző kezelési módok között, és koncentrációszintenként legalább három párhuzamos edény között egyenletesen elosztott, tartályonként legalább 30 megtermékenyített petét kell behelyezni (illetve törekedni kell a lehető legegyenletesebb elosztásra, mert egyes fajok esetében nehéz a teljesen egyenlő adagok kimérése). A betelepítési arányt (a vizsgált oldat egységnyi mennyiségére jutó biomassza) mindenképpen annyira alacsonyan kell tartani, hogy a vízben oldott oxigén koncentrációját külön levegőztetés nélkül is a levegőtelítettségi érték legalább 60 %-ának megfelelő szinten lehessen tartani. Az átfolyási vizsgálatok esetében javasolt a 24 órára számítottan 0,5 g/liternél, illetve bármely időpontban 5 g/liter oldatnál nem magasabb betelepítési arány tartása (2).
1.7.1.3. Megvilágítás és hőmérséklet
A megvilágítási időszakokat és a víz hőmérsékletét a vizsgált halfajok sajátosságaihoz kell igazítani (lásd 2. és 3. függelék). A hőmérséklet alakulásának figyelemmel kíséréséhez célszerű lehet egy további tesztedény beiktatása.
1.7.2. Vizsgálati koncentrációk
A vizsgált anyagból általában ötféle, egy 3.2 értékű konstans tényezőt meg nem haladó osztások szerint beállított koncentráció használata szükséges. A tényleges vizsgálatok során a kísérleti koncentrációk tartományának kiválasztásakor célszerű mérlegelni az LC50-et az expozíciós időszakhoz viszonyító görbét. Egyes esetekben célszerű lehet az ötnél kevesebb koncentrációszint alkalmazása (pl. a határérték-vizsgálatoknál), valamint a szűkebb koncentráció-intervallumok használata. Az ötnél kevesebb koncentrációszint alkalmazását indokolni kell. Nem szükséges vizsgálni a vizsgált anyag koncentrációját a 96 óránál LC50-nél vagy a 100 mg/l értéknél magasabb értékek esetében aszerint, hogy melyik érték az alacsonyabb. A vizsgált anyagokat a vizsgálathoz használt vízben való oldhatóságuk határértéke feletti tartományban nem kell vizsgálni.
Amennyiben diszpergálószert használnak a vizsgált oldat elkészítéséhez (lásd 1.6.6. szakasz), az oldat végső koncentrációja nem lehet több, mint 0,1 ml/liter, és azonosnak kell lennie az összes vizsgálati edényben.
1.7.3. Ellenőrzések
A normál vizsgált sorozatokon kívül egy hígítóvíz-kontrolltartályt (szükség szerint két példányban) és – amennyiben célszerű – egy, a diszpergálószert tartalmazó kontrolltartályt kell működtetni.
1.7.4. Az analitikai meghatározások és mérések gyakorisága
A vizsgálat során a vizsgált anyag koncentrációját rendszeres időközönként meg kell állapítani.
A félstatikus vizsgálatok során, amennyiben a vizsgált anyag koncentrációértékei a névleges értékek ± 20 százalékos sávján belülre várhatók (azaz a 80–120 %-os sávon belül; lásd 1.4. és 1.6.6. szakasz), akkor minimális intézkedésként javasolt a legmagasabb és a legalacsonyabb kísérleti koncentrációk elemzése, a frissen készült anyagon és közvetlenül a vízcsere előtt legalább három, a vizsgálat során időben egyenletesen elosztott alkalommal (azaz az elemzéseket az azonos oldatból vett mintán kell végezni, amikor az oldat frissen készült és a megújítás alkalmával).
Amennyiben a vizsgált anyag koncentrációértékei várhatóan nem maradnak a névleges értékek ± 20 százalékos sávján belül (a vizsgált anyag stabilitási adatai alapján), akkor javasolt az összes koncentráció elemzése ugyanazon eljárásrendnek megfelelően (legalább három, a vizsgálat során időben egyenletesen elosztott alkalommal). A vizsgált anyag koncentrációértékeinek a vízcserét megelőző meghatározását minden egyes kísérleti koncentráció esetében csak egyetlen párhuzamos tartályra nézve kell elvégezni. A meghatározások között legfeljebb hét nap telhet el. Az eredményeket célszerű a ténylegesen mért koncentrációértékekre alapozni. Amennyiben azonban megfelelő bizonyítékokkal támasztható alá, hogy az oldatban lévő vizsgált anyag koncentrációját sikerül a vizsgálatok során mindvégig a névleges értékek vagy a kiindulási koncentráció ± 20 százalékos sávján belül tartani, akkor az eredményeket a névleges vagy a mért kezdeti értékekre is lehet alapozni.
Az átfolyási vizsgálat esetében megfelelő lehet a félstatikus vizsgálatokkal kapcsolatban leírthoz hasonló mintavételi eljárás alkalmazása (azonban a „régi” oldatok mérése ebben az esetben nem alkalmazható). Amennyiben azonban a vizsgálat időtartama több mint hét nap, tanácsos a mintavételek számát az első héten növelni (pl. három méréssorozatra), a koncentrációértékek stabilan tartásának biztosítása érdekében.
Szükség lehet a minták centrifugálására vagy szűrésére (0,45 mikron pórusméretű szűrőbetétet használva). Mivel a centrifugálás és a szűrés sem képes mindenkor arra, hogy szétválassza a vizsgált anyag biológiailag nem használható részét a biológiailag használhatótól, a mintákat nem feltétlenül szükséges ilyen kezeléseknek alávetni.
A vizsgálat során valamennyi kísérleti tartályban mérni kell az oldottoxigén-koncentrációt, a pH-értéket és a hőmérsékletet. A vízkeménységet, a lúgosságot és a sótartalmat (amennyiben ez mérvadó szempont) mérni kell a kontrollmintákban és a legmagasabb koncentrációjú közeget tartalmazó egyik edényben. Minimális követelményként az oldottoxigén-koncentrációt és a sótartalmat (amennyiben ez mérvadó szempont) három alkalommal kell mérni (a vizsgálat elején, közepén és végén). A félstatikus vizsgálatok esetében javasolt az oldott oxigén gyakoribb mérése, lehetőleg minden vízcsere előtt és után, de hetente legalább egyszer. A pH-értéket a félstatikus vizsgálatok esetében minden vízcsere elején és végén mérni kell, az átfolyási vizsgálatok esetében pedig legalább hetente egyszer. A keménységet vizsgálatonként egyszer kell megmérni. A hőmérsékletet naponta mérni kell, és változásait lehetőleg legalább egy vizsgálati edényben folyamatosan figyelemmel kell kísérni.
1.7.5. Megfigyelések
1.7.5.1. Az embrionális fejlődés fázisa
A vizsgált anyag hatásának való expozíció kezdetén az embrionális (gasztrula) fejlődési fázis azonosítását a lehető legpontosabban kell elvégezni. Erre a megfelelően tartósított és megtisztított peték egy reprezentatív mintája használható. Az embrionális fázisok leírását és illusztrációját illetően még a szakirodalom is felhasználható (2) (5) (10) (11).
1.7.5.2. A peték kikelése és túlélése
A kikelés és túlélés folyamatait naponta egyszer meg kell figyelni és a tapasztalt számadatokat fel kell jegyezni. A vizsgálat elején hasznos lehet az ennél gyakoribb megfigyelések végzése (pl. az első három órában félóránként), mivel egyes esetekben a túlélési idők hossza fontosabb lehet az elhullások számánál (pl. amennyiben akut toxikus hatások figyelhetők meg). Az elpusztult embriókat és lárvákat észlelésükkor azonnal el kell távolítani, mert gyorsan bomlásnak indulnak. Az elhullott egyedek kiemelésekor különös gonddal kell kerülni a szomszédos embriók/lárvák megütését, vagy fizikai megsértését, mivel e szervezetek igen sérülékenyek és érzékenyek. Az elhullás kritériumai az életciklus szakaszától függően változnak:
|
— |
peték: különösen a korai szakaszokban az áttetszőség jelentős csökkenése és színbeli elváltozás, amit a fehérjék koagulációja és/vagy kicsapódása okoz, ami fehér opálos színt eredményez, |
|
— |
embriók: a testmozgás és/vagy szívverés hiánya, és/vagy opálos elszíneződés olyan fajoknál, amelyek embriói normál körülmények között áttetszők, |
|
— |
lárvák: mozdulatlanság és/vagy légzőmozgások és/vagy a szívverés hiánya, és/vagy a központi idegrendszer opálos elszíneződése és/vagy reakció elmaradása fizikai ingerekre. |
1.7.5.3. Rendellenes küllem
A vizsgálat időtartamától és a leírt rendellenesség jellegétől függően megfelelő időközönként fel kell jegyezni a rendellenes testformájú és/vagy pigmentációjú lárvák számát, illetve a szikzacskó felszívódásának mértékét. Meg kell jegyezni, hogy rendellenesen fejlődött embriók és lárvák természetes körülmények között is előfordulnak, és egyes fajok esetében a kontrollcsoportban mennyiségük akár néhány százalékot is elérhet. A rendellenesen fejlődött állatokat csak elpusztulásukkor kell a kísérleti edényből eltávolítani.
1.7.5.4. Rendellenes viselkedés
A rendellenes viselkedésmódokat – pl. hiperventilláció, koordinálatlan úszásmód és a fajra nem jellemző nyugalom – a vizsgálat teljes időtartamától függő időközönként fel kell jegyezni. Bár e hatásokat nehéz számszerűsíteni, de amennyiben megfigyelhetők, akkor segíthetnek a mortalitási adatok értelmezésében, azaz információkkal szolgálnak az anyag toxikus hatásmechanizmusáról.
1.7.5.5. Hosszúság
A vizsgálat végén ajánlott az egyedi hosszúságok megmérése: szabványos, villás elágazású vagy teljes hosszúságot lehet mérni. Amennyiben azonban a farokuszonyon rothadás vagy kimaródás, pusztulás jelei fordulnak elő, akkor a szabványos hosszakat kell használni. Altalánosságban, egy jól végrehajtott vizsgálatban a párhuzamos kontrollok között előforduló hosszúságeltérések együtthatója < 20 % kell hogy legyen.
1.7.5.6. A lárvák tömege
A vizsgálat végén le lehet mérni az egyedek tömegét is; a száraztömeg-adatok (24 órán át 60 oC-on tartva) célszerűbbek az (itatóspapírral szárított) nedvestömeg-meghatározásnál. Általánosságban, egy jól végrehajtott vizsgálatban a párhuzamos kontrollok között előforduló súlyeltérések együtthatója < 20 % kell hogy legyen.
E megfigyelések eredménye az alábbi adatok némelyike vagy mindegyike, amelyek a statisztikai elemzések céljára rendelkezésre állnak majd:
|
— |
kumulált mortalitás, |
|
— |
az egészséges lárvák száma a vizsgálat végén, |
|
— |
a kikelés kezdetéig és végéig eltelt idő (azaz 90 %-os kikelés minden ismétlésben), |
|
— |
a napi lárvakikelések száma, |
|
— |
a vizsgálat végén túlélő állatok hosszúsága (és tömege), |
|
— |
a deformált vagy rendellenes küllemű lárvák száma, |
|
— |
a rendellenes viselkedésmódot mutató lárvák száma. |
2. ADATOK ÉS JELENTÉSKÉSZÍTÉS
2.1. AZ EREDMÉNYEK KEZELÉSE
A vizsgálat kialakításába és eredményei elemzésébe ajánlott egy statisztikus bevonása, mivel e vizsgálati módszer jelentős eltéréseknek ad teret a kísérletek menetének kialakításában, például ami a tesztkamrák, a kísérleti koncentrációk számát vagy a megtermékenyített peték induláskori számát és a mért paraméterek eltéréseit illeti. A vizsgálat kialakításában rejlő választási lehetőségekre tekintettel, a statisztikai módszerre vonatkozó külön eligazítás itt nem szerepel.
A LOEC és NOEC értékeinek becsléséhez szükséges a párhuzamos eredmények közti eltérések analízise (ANOVA) vagy a kontingenciatáblázatos módszerek alkalmazása. Az egyedi koncentrációszintek és a kontrollcsoport szintjei esetében kapott eredmények közötti összetett összehasonlítás érdekében hasznosnak bizonyulhat a Dunnett-módszer (12) (13). További hasznos példák is rendelkezésre állnak (14) (15). Ki kell számolni és jegyzőkönyvezni kell az ANOVA vagy más eljárások használatával feltárható hatások (azaz a vizsgálat teljesítőképességének) mértékét. Megjegyzendő, hogy nem minden, az 1.7.5.6. szakaszban felsorolt megfigyelés alkalmas az ANOVA használatával történő statisztikai elemzés céljaira. így például a kumulált mortalitást és a vizsgálat végén talált egészséges lárvák számát a probit módszerek használatával lehet elemezni.
Amennyiben az LC/ECx értékeket kell megbecsülni, akkor megfelelő – pl. logisztikai – görbé(ke)t kell a vizsgált adatokhoz illeszteni olyan statisztikai módszerek használatával, mint amilyen a legkisebb négyzetek módszere vagy a nem lineáris legkisebb négyzetek módszere. A görbé(ke)t úgy kell paraméterezni, hogy az érdeklődésre számot tartó LC/ECx értéket és annak standard hibáját közvetlenül lehessen megbecsülni. Ez nagymértékben megkönnyíti az LC/ECx körüli konfidencia-határértékek kiszámítását. Kivéve, ha nyomós érvek szólnak a különböző konfidenciaszintek alkalmazása mellett, akkor kétoldali 95 %-os konfidenciaszintet célszerű meghatározni. Az illesztési eljárásnak lehetőleg eszközként kell szolgálnia az illeszkedés hiánya jelentőségének felmérésére. A görbék illesztésére grafikus módszerek is felhasználhatók. A regressziós elemzés az 1.7.5.6. szakaszban felsorolt összes megfigyelés elemzésére megfelelő.
2.2. AZ EREDMÉNYEK ÉRTÉKELÉSE
Az eredményeket kellő óvatossággal kell értelmezni, amennyiben a kísérleti oldatokban mért mérgezőanyag-koncentrációk az analitikai módszer észlelési határához közel lévő szinteket érnek el. A vizsgált anyag vízoldhatóságát meghaladó koncentrációértékekre vonatkozó eredmények értelmezésekor kellő óvatossággal kell eljárni.
2.3. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek a következő információkat kell tartalmaznia:
2.3.1. A vizsgált anyag
|
— |
a vizsgált anyag fizikai jellege és fizikai-kémiai tulajdonságai, |
|
— |
a kémiai azonosítási adatok, beleértve a kémiai tisztaságot és – adott esetben – a vizsgált anyag mennyiségének számszerűsítésére szolgáló analitikai módszer. |
2.3.2. A vizsgált fajok
|
— |
tudományos név, törzs, az ikrás nőstények száma (azaz hány nőstényt használtak a kísérlethez szükséges peteszám előállításához), szállító, valamint a megtermékenyített peték begyűjtésének módszere és az ezt követő kezelése. |
2.3.3. Vizsgálati körülmények
|
— |
az alkalmazott vizsgálati eljárás/módszer (pl. félstatikus vagy átfolyási, a megtermékenyítéstől a vizsgálat elkezdéséig eltelt idő, betelepítés stb.), |
|
— |
megvilágítási periódus(ok), |
|
— |
a vizsgálat kialakítása (pl. a tesztedények és párhuzamosok száma, az embriók létszáma a párhuzamos edényekben), |
|
— |
a törzsoldat elkészítésének módszere és a vízcsere gyakorisága (az esetleg használt diszpergálószer nevét és koncentrációját meg kell adni), |
|
— |
a névleges kísérleti koncentrációk, a mért értékek és azok átlaga és szórása a tesztedényekben, az ilyen adatok megszerzésének módszerei és – amennyiben a vizsgált anyag vízben oldható a vizsgált koncentrációértékek szintje alatt is – bizonyítékok annak alátámasztására, hogy a mérések valóban az oldatban lévő vizsgált anyag koncentrációszintjeire vonatkoznak, |
|
— |
a hígítóvíz jellemzői: pH-érték, keménység, hőmérséklet, oldottoxigén-koncentráció, maradványklórszintek (amennyiben mérik), összes szervesszén-tartalom, szuszpendált szilárd anyagok, a vizsgált közeg sótartalma (amennyiben mérik) és bármely más mérési adat, |
|
— |
vízminőség a tesztedényekben: pH-érték, keménység, hőmérséklet és az oldottoxigén-koncentráció. |
2.3.4. Eredmények:
|
— |
a vizsgált anyag stabilitására vonatkozó előzetes vizsgálatok eredményei, |
|
— |
annak bizonyítása, hogy a kontrollok megfelelnek a vizsgált fajok teljes túlélési elfogadhatósági normáinak (lásd 2. és 3. függelék), |
|
— |
adatok az embrió és lárva fejlődési fázisok mortalitási/túlélési arányairól és az összesített mortalitási/túlélési arányokról, |
|
— |
a kikelésig eltelt napok és a kikelt példányok száma, |
|
— |
hossz-(és tömeg-) adatok, |
|
— |
az esetleges morfológiai rendellességek előfordulása és jellemzése, |
|
— |
az esetleges viselkedésbeli eltérések előfordulása és leírása, |
|
— |
az adatok statisztikai elemzése és kezelése, |
|
— |
az ANOVA segítségével elemzett vizsgálatokra nézve a legalacsonyabb megfigyelhető hatást okozó koncentráció (LOEC) értéke p = 0,05-nél és megfigyelhető hatást nem okozó koncentráció (NOEC) értéke minden egyes kiértékelt reakcióra nézve, beleértve a felhasznált statisztikai módszer leírását és annak jelzését, hogy milyen mértékű hatást sikerült feltárni, |
|
— |
a regressziós analízissel elemzett vizsgálatok esetében az LC/ECx értéke, a konfidencia-intervallumok és a számításhoz felhasznált illesztettmodell grafikonja, |
|
— |
a leírt vizsgálati módszertől tett esetleges eltérések magyarázata. |
3. SZAKIRODALOM
|
(1) |
KRISTENSEN P. (1990). Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, 60 pp. June 1990. |
|
(2) |
ASTM (1988). Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. 26 pp. |
|
(3) |
Brauhn J. L. and Schoettger R. A. (1975). Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. p. 54, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota. |
|
(4) |
Brungs W. A. and Jones B. R. (1977). Temperature Criteria for Freshwater Fish: Protocol and Procedures, p. 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota. |
|
(5) |
Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Biol. 10, pp. 121-173. |
|
(6) |
Legault R. (1958). A Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, pp. 328-330. |
|
(7) |
Dave G., Damgaard B., Grande M., Martelin J. E., Rosander B. and Viktor T. (1987). Ring Test of an Embryo-larval Toxicity Test with Zebrafish (Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, pp. 61-71. |
|
(8) |
Birge J. W., Black J. A. and Westerman A. G. (1985). Short-term Fish and Amphibian Embryo-larval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, pp. 807-821. |
|
(9) |
Van Leeuwen C. J., Espeldoorn A. and Mol F. (1986). Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. III. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, pp. 129-145. |
|
(10) |
Kirchen R. V. and W. R. West (1969). Teleostean Development. Carolina Tips 32(4): 1-4. Carolina Biological Supply Company. |
|
(11) |
Kirchen R. V. and W. R. West (1976). The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina. 36 pp. |
|
(12) |
Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc, 50, pp. 1096-1121. |
|
(13) |
Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482-491. |
|
(14) |
Mc Clave J. T., Sullivan J. H. and Pearson J. G. (1980). Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia. |
|
(15) |
Van Leeuwen C. J., Adema D. M. M. and Hermes J. (1990). Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, pp. 321-334. |
|
(16) |
Environment Canada. (1992). Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS l/RM/28, December 1992, 81 pp. |
|
(17) |
Dave G. and Xiu R. (1991). Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio reri o. Arch. of Environmental Contamination and Toxicology, 21, pp. 126-134. |
|
(18) |
Meyer A., Bierman C. H. and Orti G. (1993). The phylogenetic position of the Zebrafish (Danio rerio), a model system in developmental biology – an invitation to the comperative methods. Proc. Royal Society of London, Series B, 252: pp. 231-236. |
|
(19) |
Ghillebaert F., Chaillou C, Deschamps F. and Roubaud P. (1995). Toxic Effects, at Three pH Levels, of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, pp. 19-28. |
|
(20) |
US EPA, (1991). Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPA report EPA/600/3-91/064, Dec. 1991, EPA, Duluth. |
|
(21) |
US EPA, (1991). Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Oryzias latipes). EPA report EPA/600/3-91/063, Dec. 1991, EPA, Duluth. |
|
(22) |
De Graeve G. M., Cooney J. D., McIntyre D. O., Poccocic T. L., Reichenbach N. G., Dean J. H. and Marcus M. D. (1991). Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, pp. 1189-1203. |
|
(23) |
Calow P. (1993). Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, Chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish. |
|
(24) |
Balon E. K. (1985). Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, 280 pp. |
|
(25) |
Blaxter J. H. S. (1988). Pattern and variety in development, in: W. S. Hoar and D. J. Randall eds., Fish Physiology, Vol. XIA, Academic press, pp. 1-58. |
1. A. táblázat
A vizsgálatokhoz ajánlott halfajok
|
Édesvízi halak |
|
Oncorhynchus mykiss Szivárványos pisztráng (9) (16) |
|
Danio rerio Zebrahal (7) (17) (18) |
|
Cvprinus caprio Közönséges ponty (8) (19) |
|
Oryzias latipes Japán rizshal/Medaka (20) (21) |
|
Pimephales promelas Nagyfejű cselle (8) (22) |
1. B. táblázat
Példák más, jól dokumentált és tesztelésre használható halfajokra
|
ÉDESVÍZI |
TENGERI |
|
Carassius auratus Ezüstkárász (8) |
Menidia peninsulae Tidewater silverside (nincs magyar neve) (23) (24) (25) |
|
Lepomis macrochirus Nagy naphal (8) |
Clupea harengus Hering (24) (25) |
|
Gadus morhua Tőkehal (24) (25) |
|
|
Cyprinodon variegatus Tarka fogasponty (23) (24) (25) |
1. függelék
ÚTMUTATÓ ZEBRAHAL- (BRACHYDANIO RERIO) EMBRIÓK ÉS SZIKZACSKÓS LÁRVÁK TOXICITÁSI VIZSGÁLATÁNAK VÉGREHAJTÁSÁHOZ
BEVEZETÉS
A zebrahalak India keleti, koromandel partján, gyorsfolyású patakokban élnek. A pontyfélék családjához tartozó közönséges akváriumi halak, amelyek tartásával és életkörülményeivel kapcsolatos információk bármelyik, a trópusi halakkal foglalkozó szakkönyvben megtalálhatók. Biológiájukat és alkalmazásukat a halászati kutatásban Laale ismertette.
A zebrahal csak ritkán hosszabb 45 mm-nél. Hengeres testét 7–9 fémes-sötétkék vízszintes, ezüstösen csillogó csík díszíti. E mintázat a farokúszón és a farok alatti úszón folytatódik. A hal háta sárgászöld színű. A hímek karcsúbbak a nőstényeknél. A nőstények ezüstösebbek és hasuknál duzzadtabbak, különösen ívás előtt.
A felnőtt halak a víz hőmérséklete, pH-értéke és keménységi foka tekintetében jelentős ingadozásokat képesek elviselni. Az egészséges, jó minőségű ikrákat rakó halak tartásához azonban optimális körülményeket kell biztosítani.
A szaporodási időszakban a hím üldözi és fejével bökdösi a nőstényt, és a kipréselődött ikrákat azonnal meg is termékenyíti. Az átlátszó és nem tapadós ikrák a vízfenékre hullanak alá, ahol szüleik olykor meg is eszik őket. A fény befolyásolja a halak ívását. Amennyiben a reggeli fény megfelelő, a halak rendszerint a hajnalt követő korai órákban rakják le ikráikat.
A nőstény heti rendszerességgel alkalmanként több száz ikra lerakására képes.
A TENYÉSZHALAK TARTÁSÁNAK, SZAPORÍTÁSÁNAK ÉS A KORAI FEJLŐDÉSI STÁDIUMOKBAN LEVŐ EGYEDEK TARTÁSÁNAK FELTÉTELEI
Megfelelő számú egészséges halat kell kiválasztani, és megfelelő minőségű vízben kell tartani (lásd 4. függelék) a tervezett ikráztatás előtt legalább két hétig. Hagyni kell, hogy a halak csoportjának tagjai a vizsgálat során használandó ikrák lerakása előtt legalább egyszer párosodjanak. A halpopuláció sűrűsége ezen időszakban nem haladhatja meg az 1 gramm hal/liter fajlagos értéket. Rendszeres vízcsere vagy víztisztító rendszer használata esetén ennél magasabb egyedsűrűség is lehetséges. A tárolótartályokban a hőmérsékletet 25 ± 2 oC-on kell tartani. A halaknak változatos étrendet kell biztosítani, amely állhat például a kereskedelemben kapható szárított haleledelből, élő, frissen kikelt sóféregből, árvaszúnyoglárvából, Daphniából és televény férgekből (Enchytraeids).
Az alábbiakban vázolt kétféle eljárás a gyakorlatban az elvégzendő vizsgálathoz szükséges megfelelő nagyságú, egészséges és megtermékenyített ikrákat eredményez:
|
i) |
Nyolc nőstényt és 16 hímet 50 liter hígítóvizet tartalmazó, a közvetlen fénysugárzástól védett és legalább 48 óráig zavartalanul hagyott tartályban kell tartani. A vizsgálat megkezdése előtti nap délutánján az akvárium alján egy ívatótálcát kell elhelyezni. Az ívatótálca 5–7 cm magas (plexiüvegből vagy más alkalmas anyagból készült) keretből és felül 2–5 mm pórusméretű durva hálóból, alul pedig 10–30 mikron finomságú szitaszövetből áll. A nagyobb pórusméretű hálóhoz szétbontott nejlonkötelekből készült „ívatófákat” kell erősíteni. Miután a halakat 12 órán át sötétben tartják, gyenge fény bekapcsolására az ívás folyamata beindul. Az ívást követő kettő–négy óra múlva ki kell venni az ívatótálcát és be kell gyűjteni az ikrákat. Az ívatótálca használatával megakadályozható, hogy a halak felfalják az ikrákat, ugyanakkor az ikrák összegyűjtése is egyszerűbb. A vizsgálati célra szánt ikrák lerakása előtt a halakat legalább egyszer ívatni kell. |
|
ii) |
A tervezett ívatás előtt legalább két hétig kell 5–10 nőstényt, illetve hímet egyedenként elkülönítve tartani. 5–10 nap elteltével a nőstények hasa kezd megduzzadni, és az ivarnyílás környéke kidudorodik. A hímeken ez nem látható. Az ívatásra a fent leírt ívatótálcával felszerelt akváriumban kerül sor. A tartályt hígítóvízzel töltik fel úgy, hogy a víz szintje 5–10 cm-rel ellepje a hálót. A tervezett ivást megelőző napon egy nőstényt és két hímet kell a tartályba helyezni. A víz hőmérsékletét fokozatosan egy fokkal az akklimatizációs hőmérséklet fölé kell emelni. A fény kikapcsolása után a lehető legnagyobb nyugalmat kell biztosítani a tartály környékén. Reggel gyenge fény bekapcsolására az ívás folyamata beindul. 2–4 óra elteltével a halakat ki kell venni és az ikrákat be kell gyűjteni. Amennyiben az egy nősténytől begyűjthetőnél több ikrára van szükség, akkor párhuzamosan több ikráztatótartályt lehet működtetni. Az egyes nőstényeknek a vizsgálat megkezdése előtti, korábbi szaporodási sikerét (az ikrák száma és minősége alapján) feljegyezve ki lehet választani a tenyésztési szempontból a legsikeresebbnek ígérkező példányokat. |
Az ikrákat gumiballonnal felszerelt (legalább 4 mm belső átmérőjű) üvegcsövekben kell a tesztedényekbe áthelyezni. Az ikrákkal együtt áthelyezett víz mennyiségének a szállításkor a lehető legkisebb kell lennie. Az ikrák sűrűsége nagyobb, mint a vízé, tehát az ikrák lesüllyednek, és így kikerülnek a csőből. Ügyelni kell arra, hogy az ikrákat (és lárvákat) ne érje levegő. Az egyes adagokból származó mintákat mikroszkóppal megvizsgálva kell biztosítani, hogy ne történjenek rendellenességek az ivadékfejlődés kezdeti fázisaiban. Az ikrák fertőtlenítése nem megengedett.
Az ikrák mortalitása a megtermékenyítést követő első 24 órában a legmagasabb. Ebben az időszakban gyakran 5–40 %-os mortalitás tapasztalható. A sikertelen megtermékenyítés és a fejlődés rendellenességei miatt az ikrák degenerálódnak. Úgy tűnik, hogy az egyes ikraadagok minősége a nőstény hal adottságaitól függ, mivel egyes nőstények rendre jó minőségű ikrákat produkálnak, míg mások sohasem. A fejlődés üteme és az ikrák kikelési aránya is adagonként változó. A sikeresen megtermékenyített ikrák és a szikzacskós lárvák túlélési aránya jó, általában meghaladja a 90 %-ot. 25 oC-on az ikrák a megtermékenyítést követő 3–5 napon belül kikelnek, a szikzacskó pedig az ivadékok a megtermékenyítést követő mintegy 13 napon belül felszívódik.
Az embrionális fejlődés folyamatát Hisaoka és Battle írta le részletesen (2). Az ikrák és az éppen kikelt lárvák átlátszósága miatt a halak fejlődése jól nyomon követhető és a deformált változatok jelenléte megfigyelhető. Az ívást követő mintegy négy óra elteltével megkülönböztethetők a megtermékenyített és a meg nem termékenyített ikrák (3). E vizsgálat céljaira az ikrákat és lárvákat kis térfogatú tesztedényekbe helyezik, és mikroszkóp alatt tanulmányozzák.
A vizsgálatnak a korai egyedfejlődési stádiumokra alkalmazandó feltételeit a 2. függelék sorolja fel. A hígítóvíz optimális pH-értéke 7,8, keménysége 250 mg/CaCO3/liter víz.
SZÁMÍTÁSOK ÉS STATISZTIKA
Két szakaszból álló módszer használata ajánlott. Elsőként a mortalitásra, a rendellenes fejlődésre és a kikelési időre vonatkozó adatok statisztikai elemzésére kerül sor. Ezt követi a testhossz statisztikai elemzése azon koncentrációértékek tekintetében, amelyek esetében az előbb említett adatokkal kapcsolatban nem tapasztaltak kedvezőtlen hatásokat. E módszer használata azért tanácsos, mert a toxikus anyag specifikusan elpusztíthatja a kisebb halakat, késleltetheti a kikelési időt és jelentősen torzult egyedeket produkálhat, ezért eltorzított testhosszeredményekre vezethet. Továbbá így a kezelésenként megmérendő halak száma nagyjából azonos marad, biztosítván a vizsgálat statisztikájának érvényességét.
AZ LC50 ÉS EC50 MEGHATÁROZÁSA
Az életben maradt embriók és lárvák százalékos arányát ki kell számítani, és az Abbott-képlet (4) szerint a kontroll mortalitási értékeivel kell korrigálni:

ahol:
|
P |
= |
korrigált százalékos túlélés |
|
P' |
= |
megfigyelt százalékos túlélés a teszt koncentrációinál |
|
C |
= |
százalékos túlélés a kontrollban |
Amennyiben lehetséges, az LC50-et a vizsgálat végén egy megfelelő módszerrel meg kell határozni.
Amennyiben kívánatos a morfológiai rendellenességek befoglalása az LC50 statisztikákba, erre vonatkozóan Stephan idézett műve (5) ad útmutatást.
A LOEC ÉS A NOEC BECSLÉSE
Az ikra és ivadék túlélési kísérlet egyik célja a nem zéró koncentrációértékek összevetése a kontrollcsoporttal, azaz a LOEC értékének meghatározása. Ezért a többszörös összehasonlítás módszerét kell hasznosítani (6) (7) (8) (9) (10).
SZAKIRODALOM
|
(1) |
LAALE H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Fish Biol. 10, pp. 121-173. |
|
(2) |
Hisaoka K. K. and Battle H. I. (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio (Hamilton-Buchanan) J. Morph., 102, 311 pp. |
|
(3) |
Nagel R. (1986). Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachydanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, pp. 173-181. |
|
(4) |
Finney D. J. (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, pp. 1-333. |
|
(5) |
Stephan C. E. (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment: Fifth Conference, ASTM STP 766, J. G. Pearson, R. B. Foster and W. E. Bishop, Eds., American Society for Testing and Materials, pp. 69-81. |
|
(6) |
Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc, 50, pp. 1096-1121. |
|
(7) |
Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482-491. |
|
(8) |
Williams D. A. (1971). A Test for Differences Between Treatment Means when Several Dose Levels are Compared with a Zero Dose Control. Biometrics, 27, pp. 103-117. |
|
(9) |
Williams D. A. (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, pp. 519-531. |
|
(10) |
Sokal R. R. and Rohlf F. J. (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W. H., Freeman and Co., San Francisco. |
2. függelék
VIZSGÁLATI KÖRÜLMÉNYEK, IDŐTARTAM ÉS A JAVASOLT FAJOK TÚLÉLÉSI KRITÉRIUMAI
|
Faj |
Hőmérséklet ( oC) |
Sótartalom (0/00) |
Megvilágítás (óra) |
Fázisok időtartama (nap) |
A vizsgálat átlagos időtartama |
Kontrollcsoport túlélési aránya (min., %) |
||
|
Embrió |
Szikzacskós lárva |
Kikelés sikeressége |
A lárvák túlélése |
|||||
|
ÉDESVÍZI |
||||||||
|
Brachydanio rerio Zebrahal |
25 ± 1 |
— |
12–16 |
3–5 |
8–10 |
A megtermékenyítés után a lehető legkorábban (a korai gasztrula fejlődési szakaszban) a kikelést követő 5. napig (8-10 nap) |
80 |
90 |
|
Oncorhynchus mykiss |
10 ± 1 (22) 12 ± 1 (23) |
— |
0 (24) |
30–35 |
25–30 |
A megtermékenyítés után a lehető legkorábban (a korai gasztrula fejlődési szakaszban) a kikelést követő 20. napig (50–55 nap) |
66 |
70 |
|
Cyprinus carpio Közönséges ponty |
21–25 |
— |
12–16 |
5 |
>4 |
A megtermékenyítés után a lehető legkorábban (a korai gasztrula fejlődési szakaszban) a kikelést követő 4. napig (8-9 nap) |
80 |
75 |
|
Oryzias latipes Japán rizshal/Medaka |
24 ± 1 (22) 23 ± 1 (23) |
— |
12–16 |
8–11 |
4–8 |
A megtermékenyítés után a lehető legkorábban (a korai gasztrula fejlődési szakaszban) a kikelést követő 5. napig (13–16 nap) |
80 |
80 |
|
Pimephales promelas Nagyfejű cselle |
25 ± 2 |
— |
16 |
4-5 |
5 |
A megtermékenyítés után a lehető legkorábban (a korai gasztrula fejlődési szakaszban) a kikelést követő 4. napig (8-9 nap) |
60 |
70 |
3. függelék
Más, jól dokumentált halfajokra vonatkozó vizsgálati körülmények, időtartam és túlélési kritériumok
|
Faj |
Hőmérséklet ( oC) |
Sótartalom (0/00) |
Megvilágítás (óra) |
Fázisok idotartama (nap) |
Az embrió- és a szikzacskóvizsgálat jellemző időtartama |
Kontrollcsopo rt túlélési aránya, (min., %) |
||
|
|
|
|
|
Embrió |
Szikzacskós lárva |
Kikelés sikeressége |
A lárvák túlélése |
|
|
ÉDESVÍZI FAJOK |
||||||||
|
Carassius auratus Ezüstkárász |
24 ± 1 |
— |
— |
3–4 |
>4 |
A megtermékenyítés után a lehető legkorábban (a korai gasztrula fejlődési szakaszban), a kikelést követő 4. napig (7 nap) |
— |
80 |
|
Leopomis macrochirus Nagy naphal |
21 ± 1 |
— |
16 |
3 |
>4 |
A megtermékenyítés után a lehető legkorábban (a korai gasztrula fejlődési szakaszban), a kikelést követő 4. napig (7 nap) |
— |
75 |
|
TENGERI |
||||||||
|
Menidia peninsulae Tidewater silverside (nincs magyar neve) |
22 –25 |
15–22 |
12 |
1,5 |
10 |
A megtermékenyítés után a lehető legkorábban (a korai gasztrula fejlődési szakaszban), a kikelést követő 5. napig (6-7 nap) |
80 |
60 |
|
Clupea harengus Hering |
10 ± 1 |
8–15 |
12 |
20–25 |
3–5 |
A megtermékenyítés után a lehető legkorábban (a korai gasztrula fejlődési szakaszban), a kikelést követő 3. napig (23-27 nap) |
60 |
80 |
|
Gadus morhua Tőkehal |
5± 1 |
5–30 |
12 |
14–16 |
3–5 |
A megtermékenyítés után a lehető legkorábban (a korai gasztrula fejlődési szakaszban), a kikelést követő 3. napig (18 nap) |
60 |
80 |
|
Cyprinodon variegatus Sheepshead minnow |
25 ± 1 |
15–30 |
12 |
— |
— |
A megtermékenyítés után a lehető legkorábban (a korai gasztrula fejlődési szakaszban), a kikelést követő 4/7. napig (28 nap) |
>75 |
80 |
4. függelék
AZ ELFOGADHATÓ MINŐSÉGŰ HÍGÍTÓVÍZ NÉHÁNY FONTOSABB KÉMIAI TULAJDONSÁGA
|
Anyag megnevezése |
Koncentrációértékek |
|
Lebegőanyag |
< 20 mg/l |
|
Összes szerves szén |
< 2 mg/l |
|
Nem ionizált ammónia |
< 1 μg/l |
|
Maradék klór |
< 10 μg/1 |
|
Összes szerves foszfortartalmú peszticid |
< 50 ng/l |
|
Összes szerves klórtartalmú peszticid es poliklórozott bifenilek |
< 50 ng/1 |
|
Összes szerves klór |
< 25 ng/1 |
C.16. HÁZIMÉH – AKUTORÁLISTOXICITÁS-VIZSGÁLAT
1. MÓDSZER
Ezen akuttoxicitás-vizsgálat megfelel az OECD TG 213-nak (1998).
1.1. BEVEZETÉS
E toxicitásvizsgálat olyan laboratóriumi módszer, amelyet annak felmérésére dolgoztak ki, hogy a növényvédő szerek és más vegyi anyagok milyen mértékű akut orális toxicitást gyakorolnak a felnőtt dolgozó háziméhekre.
Az anyagok toxikus jellemzőinek a felmérése és értékelése a háziméhekre gyakorolt akut orális toxicitás mértékének a meghatározását igényelheti, pl. olyan körülmények között, amikor valószínű, hogy a méhek ki lesznek téve egy adott vegyi anyag hatásának. Az akutorálistoxicitás-vizsgálatot a peszticidek és más vegyi anyagok méhekre gyakorolt inherens toxicitásának meghatározására végzik. A vizsgálat eredményeit felhasználják annak meghatározására, hogy szükség van-e további minősítésre. E módszer különösen azon többlépcsős programokban használható jól, amelyekben a peszticidek méhekre kifejtett hatását először a laboratóriumokban, majd részlegesen terepen, végül terepen vizsgálják (1). A peszticideket hatóanyaguk formájában vagy formulázott termékként lehet vizsgálni.
Toxikus referenciaanyagot használnak a méhek érzékenységének és a vizsgálati eljárás pontosságának az ellenőrzésére.
1.2. FOGALOMMEGHATÁROZÁSOK
Akut orális toxicitás: a vizsgált anyag egyszeri, orálisan adott dózisának beadásától számított legfeljebb 96 órás időszakon belül jelentkező károsító hatás.
Dózis: a vizsgált anyag elfogyasztott mennyisége. A dózis az egy kísérleti állatnak beadott vizsgált anyag mikrogrammban kifejezett mennyisége (mg/méh). Az egyes méhekre jutó dózis tényleges mennyisége nem számítható ki pontosan, mert a méheket kollektívan tápláljuk, ezért csak egy átlagos dózist lehet megbecsülni (az összesen elfogyasztott vizsgált anyag osztva az egy méhkasban lévő kísérleti méhek számával).
LD 50 (közepes halálos dózis): szájon át: a vizsgált anyag statisztikailag megállapított egyszeri olyan dózisa, amely orálisan beadva az állatok 50 %-ának elhullását okozza. Az LD50 értékét a vizsgált anyag egy méhre jutó mennyiségével (mg/méh) fejezik ki. A peszticidek esetében a vizsgált anyag lehet az aktív hatóanyag, vagy az egy vagy több hatóanyagot tartalmazó formulázott termék.
Mortalitás: egy állat akkor nyilvánítható elhullottnak, ha teljesen mozdulatlan.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A vizsgálat során a kifejlett dolgozó háziméheknek (Apis mellifera) vizes cukoroldatban különböző töménységben diszpergált vizsgált anyagot adagolnak. Ezután a méheket tesztanyagot nem tartalmazó cukoroldattal táplálják. A mortalitást legalább 48 órán át naponta feljegyzik és összehasonlítják a kontrollcsoport adataival. Ha az elhullási arány a 24. és a 48. óra között is növekszik, míg a kontrollcsoportban elfogadható szinten, azaz < 10 %-on marad, helyénvaló a vizsgálat időtartamát maximum 96 órára meghosszabbítani. Az eredményeket elemzik a 24. és a 48. órai LD50 érték, illetve ha a vizsgálat időtartamát meghosszabbítják, akkor a 72. és a 96. órai LD50 érték meghatározásához.
1.4. A VIZSGÁLAT ÉRVÉNYESSÉGÉNEK KRITÉRIUMAI
A vizsgálat érvényességéhez a következő feltételeknek kell teljesülniük:
|
— |
a vizsgálat végén a teljes kontrollcsoport létszámához viszonyított átlagos mortalitás nem haladhatja meg a 10 %-ot, |
|
— |
a toxikus referenciaanyag LD50 értéke megfelel a kijelölt tartománynak. |
1.5. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.5.1. A méhek befogása
A vizsgálatokhoz azonos eredetű, fiatal, kifejlett dolgozó háziméheket használnak, azaz azonos életkorú, tápláltsági fokú stb. méheket. A méheket megfelelően táplált, egészséges, lehetőleg betegségektől mentes és királynővel rendelkező, ismert előéletű és fiziológiai állapotú kolóniákból fogják be. A méheket a felhasználás reggelén vagy azt megelőző estén célszerű befogni, és a következő napig a vizsgálati körülmények között tartják őket. Az utódokat nem tartalmazó keretekről gyűjtött méhek alkalmasak. Kerülni kell a kora tavasszal vagy késő ősszel történő befogást, mivel a méhek fiziológiája ebben az időszakban megváltozik. Ha a vizsgálatokat mégis kora tavasszal vagy késő ősszel végzik, a méheket „inkubátorban” elő lehet csalogatni és egy hétig „méhkenyérrel” (a lépből gyűjtött pollennel) és cukros vízzel lehet táplálni. A vegyi anyagokkal, pl. antibiotikumokkal, méhatka elleni szerekkel stb. kezelt méheket toxicitásvizsgálatok céljaira csak az utolsó kezeléstől számított négy hét elteltével szabad felhasználni.
1.5.2. Tartási és etetési feltételek
Könnyen tisztítható és jól szellőző dobozokat kell használni. Erre a célra bármilyen alkalmas anyag felhasználható, pl. rozsdamentes acél, drótháló, műanyagból készült, vagy eldobható, fából készült stb. doboz. Dobozonként tíz méhből álló csoportok használata javasolt. A vizsgálati dobozok méreteit a méhek létszámához igazítják, azért, hogy elegendő helyük legyen.
A méheket 25 ± 2 oC hőmérsékletű sötét kísérleti szobában tartják. A vizsgálat során végig megmérik és feljegyezik a relatív páratartalom értékét, amelyet általában 50–70 % között tartanak. A méhekkel kapcsolatos minden tevékenység, beleértve a kezelést és megfigyeléseket, végezhető világosban (nappali fény mellett). Táplálékként 500 g/liter (azaz 50 tömegszázalékos) végkoncentrációjú vizes cukoroldatot adnak. A meghatározott tesztanyagmennyiséget tartalmazó táplálékot az állatoknak tetszés szerinti módon adhatják. Az etetőrendszernek lehetővé kell tennie, hogy dobozonként fel lehessen jegyezni a táplálékbevitelt (lásd 1.6.3.1. szakasz). A táplálék beadásához egy (mintegy 50 mm hosszú és 10 mm széles, a nyitott végén kb. 2 mm átmérőre leszűkített) üvegcsövet lehet használni.
1.5.3. A méhek előkészítése
A befogott méheket a teszthelyiségben véletlenszerűen elhelyezett dobozok között osztják el.
A méheket a vizsgálat megkezdése előtt maximum két órán át éheztethetik. Javasolt a méhek táplálékának visszatartása a kezelés előtt, hogy valamennyi méh béltartalma azonos legyen a vizsgálat kezdetekor. A vizsgálat megkezdése előtt a haldokló méheket eltávolítják, és egészségesekkel pótolják.
1.5.4 A dózisok előkészítése
Ha a vizsgált anyag oldható vízben, akkor az közvetlenül belekeverhető az 50 %-os töménységű cukoroldatba. A vízben rosszul oldódó ipari termékek és anyagok esetében fel lehet használni a méhekre kis mértékben mérgező segédanyagokat – szerves oldószereket, emulgeáló- vagy diszpergálószereket (pl. aceton, dimetil-formamid, dimetil-szulfoxid). A segédanyag töménysége a vizsgált anyag oldhatóságától függ, és azt az összes vizsgált koncentrációérték esetében azonos szinten tartják. Általában azonban megfelel az 1 %-os töménységű segédanyag, és ezt a szintet nem célszerű túllépni.
Megfelelő kontrolloldatokat készítenek elő, azaz ha oldószert vagy diszpergáló anyagot használnak a vizsgált anyag feloldásához, akkor két különálló kontrollcsoportot alkalmaznak: az egyiket a vizes oldatra, a másikat az oldatok adagolásához használt koncentrációjú oldószerrel/segédanyaggal javított cukoroldatra.
1.6. VIZSGÁLATI ELJÁRÁS
1.6.1. Kezelt csoportok és kontrollcsoportok
A vizsgált dózisok és a párhuzamos vizsgálatok száma meg kell, hogy feleljen az LD50 95 %-os konfidenciahatár mellett történő meghatározására vonatkozó statisztikai követelményeknek. A vizsgálathoz szokványos esetben öt, olyan mértani sort képező dózisra van szükség, amelyek 2.2 értéket meg nem haladó szorzótényezővel különböznek egymástól és az LD50 tartományát fedik le. A hígítási tényezőt és az adagoláshoz használt koncentrációértékek számát azonban a hatásgörbe meredekségének függvényében (pusztulás a dózis függvényében) és az eredmények elemzéséhez kiválasztott statisztikai módszer figyelembevételével határozzák meg. A vizsgálat előtt elvégzett, dózisbehatároló vizsgálat lehetővé teszi az adagoláshoz megfelelő koncentrációértékek kiválasztását.
Legalább három, egyenként tíz méhből álló ún. párhuzamosan kezelt csoportnak adják be az egyes kísérleti koncentrációknak megfelelő dózist. A vizsgálatsorozatban részt vevőkön kívül legalább három, egyenként tíz méhből álló kontrollcsoportot kell vizsgálni. Ha szükséges (lásd 1.5.4. rész), külön oldószeres/segédanyagos kontrollokat is alkalmaznak.
1.6.2. Toxikus referenciaanyag
A tesztsorozattal párhuzamosan egy, a toxikus referenciaanyagot tartalmazó sorozatot is be kell állítani. A várható LD50 értékek lefedése érdekében legalább három dózist választanak ki. Mindegyik vizsgált dózis esetében legalább három, egyenként tíz méhet tartalmazó, ún. párhuzamosokat alkalmaznak. A leggyakrabban használt toxikus referenciaanyag a dimetoát, amelyre nézve a bizonyított orális LD50 24 óra alatt a 0,10–0,35 mg hatóanyag/egyed tartományba esik (2). Egyéb toxikus referenciaanyagok is elfogadhatóak, de csak olyan esetekben, ahol elegendő adat áll rendelkezésre a várható dózisreakció ellenőrzésére (pl. parathion).
1.6.3. Expozíció
1.6.3.1. A dózisok beadása
Mindegyik kezelt csoport egyedeinek 100–200 ml-nyi, a vizsgált anyagot megfelelő koncentrációban tartalmazó 50 %-os cukoroldatot adnak be. Nagyobb mennyiségre van szükség, ha a készítményben rosszul oldódó, alacsony toxicitású vagy a formulázásból adódóan alacsony hatóanyag-tartalmú termékek vannak, mert ezeket nagyobb arányban kell a cukoroldathoz keverni. Megfigyelik, hogy az egyes csoportok milyen mennyiségben fogyasztottak a kezelt táplálékból. Ha elfogyasztották a felkínált élelmet (rendszerint 3-4 órán belül), akkor az etetőtálat kiveszik a dobozból, és helyére egy tisztán cukoroldatot tartalmazó tálat tesznek. Ezután a cukoroldatot korlátozás nélkül adagolják. Egyes vegyületek esetében magasabb koncentrációértékeknél a vizsgált dózis visszautasítása miatt a méhek esetleg keveset vagy semmit sem fogyasztanak. Maximum 6 óra elteltével az el nem fogyasztott, kezelt táplálékot tiszta cukoroldattal váltják fel. Megmérik, hogy mennyi fogyott a kezelt táplálékból (pl. a megmaradó táplálék térfogatának/tömegének mérésével).
1.6.3.2. Időtartam
A vizsgálat javasolt időtartama a vizsgált oldatok tisztán cukoroldattal való felváltását követően még 48 óra. Ha a mortalitás az első 24 óra után továbbra is 10 %-nál nagyobb mértékben növekszik, akkor a vizsgálat időtartamát maximum 96 órára kell meghosszabbítani, feltéve, hogy a kontrollcsoportban a mortalitás nem haladja meg a 10 %-ot.
1.6.4. Megfigyelések
Feljegyezik a mortalitás alakulását a vizsgálat megkezdését követő 4. órában, majd azt követően a 24. és 48. órában (azaz a dózis beadását követően). Ha a meghosszabbított megfigyelési időszakra van szükség, akkor a további értékeléseket 24 órás időközönként kell elvégezni, legfeljebb a 96. óráig, feltéve, hogy a kontrollcsoportban a mortalitás nem haladja meg a 10 %-ot.
Megmérik az egyes csoportok által elfogyasztott táplálék mennyiségét. Az adott 6 óra alatt a kezelt és a kezeletlen táplálékból való fogyasztás mértékének összevetése tájékoztat a kezelt étrend ízletességéről.
A vizsgálat időszaka alatt feljegyeznek minden, a normálistól eltérő magatartásformát.
1.6.5. Tűrésteszt
Egyes esetekben (pl. amikor a vizsgált anyag várható toxicitása alacsony) tűréstesztet lehet végezni, 100 mg aktív hatóanyag/egyed felhasználásával, annak bemutatására, hogy az LD50 nagyobb ezen értéknél. Ugyanezt az eljárást követik, beleértve a vizsgált dózisra vonatkozó három ún. párhuzamosan kezelt csoportot, a megfelelő kontrollokat, az elfogyasztott kezelt táplálék mennyiségének értékelő felmérését és a toxikus referenciaanyag használatát. Ha mortalitás tapasztalható, a teljes körű vizsgálatot végzik el. Ha szubletális hatások figyelhetők meg (lásd 1.6.4. szakasz), azokat feljegyezik.
2. ADATOK ÉS JELENTÉSKÉSZÍTÉS
2.1. ADATOK
Az adatokat táblázat formájában foglalják össze, mindegyik kezelt csoportnál, valamint kontroll- és toxikusreferenciaanyag-csoportnál feltüntetve a kísérlethez felhasznált méhek számát, az egyes megfigyelési időpontokban tapasztalt mortalitást, valamint a rendellenes magatartást mutató méhek számát. A mortalitási adatokat a megfelelő statisztikai módszerekkel elemzik (pl. probitanalízis, mozgóátlag, binomiális valószínűség) (3) (4). A hatásgörbéket mindegyik ajánlott megfigyelési időpontban grafikonon rögzítik, és a görbék meredekségét és a közepes halálos dózisokat (LD50) a 95 %-os konfidenciahatárhoz kiszámítják. A kontrollcsoport mortalitásának korrekcióját az Abbott-képlet használatával lehet elvégezni (4) (5). Ha a méhek nem fogyasztották el a vizsgált anyaggal kezelt táplálék teljes mennyiségét, meghatározzák az egyes csoportok által elfogyasztott vizsgált anyaggal bevitt dózis nagyságát. Az LD50 értékét az egy méhre jutó vizsgált anyag mg-jában fejezik ki.
2.2. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésben a következő információk szerepelnek:
2.2.1 A vizsgált anyag:
|
— |
az anyag fizikai természete és főbb fizikai-kémiai tulajdonságai (pl. stabilitása vízben, gőznyomás), |
|
— |
kémiai azonosító adatok, beleértve a szerkezeti képletet és a kémiai tisztaságot (azaz peszticidek esetében a hatóanyag(ok) megnevezését és koncentrációját). |
2.2.2. A vizsgált fajok:
|
— |
tudományos név, származás, hozzávetőleges életkor (hetekben kifejezve), a befogás módszere és dátuma, |
|
— |
a kolóniákra vonatkozó információk, ahonnan a begyűjtött állatok származnak, beleértve a méhek egészségi állapotát, bármilyen kifejlett kori betegséget, esetleges előkezeléseket stb. |
2.2.3. Vizsgálati körülmények:
|
— |
a kísérleti helyiség hőmérséklete és relatív páratartalma, |
|
— |
elhelyezési körülmények, pl. a dobozok típusa, mérete és anyaga, |
|
— |
a törzsoldat és a vizsgált oldatok készítésének módszere (ha oldószert használnak, meg kell adni a nevét és töménységét), |
|
— |
a törzsoldat készítésének módja és az újrakezdés gyakorisága (az esetlegesen használt, oldódást segítő szer nevét és koncentrációját meg kell adni), a vizsgálat körülményei, pl. a felhasznált kísérleti koncentrációk száma, a kontrollok száma; minden egyes kísérleti koncentrációra és kontrollra nézve az ún. párhuzamosok és az egy dobozban lévő méhek száma, |
|
— |
a vizsgálat időpontja. |
2.2.4. Eredmények:
|
— |
előzetes koncentrációhatárokat felmérő vizsgálat eredményei, ha végeztek ilyet, |
|
— |
nyers adatok: mortalitás minden egyes vizsgált dózisra és minden egyes megfigyelési időpontra nézve, |
|
— |
a hatásgörbék grafíkonja a vizsgálat végén, |
|
— |
LD50 értékek 95 % konfidenciahatárhoz, minden egyes javasolt megfigyelési időpontokban, a vizsgált anyagra és a toxikus referenciaanyagra nézve, |
|
— |
az LD50 meghatározásához használt statisztikai eljárások, |
|
— |
mortalitás a kontrollcsoportokban, |
|
— |
más megfigyelt vagy mért biológiai hatások, pl. a méhek abnormális viselkedése (beleértve a vizsgált dózis elutasítását), az elfogyasztott táplálék mértéke kezelt és a kezeletlen csoportoknál, |
|
— |
bármilyen eltérés az itt leírt vizsgálati módszerektől, valamint bármely más releváns információ. |
3. SZAKIRODALOM
|
(1) |
EPPO/COUNCIL OF Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products – Honeybees. EPPO Bulletin, Vol. 23, N.1, pp. 151-165. March 1993. |
|
(2) |
Gough, H. J., Mclndoe, E. C, Lewis, G. B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.) 1981-1992. Journal of Apicultural Research, 22, pp. 119-125. |
|
(3) |
Litchfield, J. T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, pp. 99-113. |
|
(4) |
Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York. |
|
(5) |
Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol., 18, pp. 265-267. |
C.17. HÁZIMÉH – AKUTKONTAKTTOXICITÁS-VIZSGÁLAT
1. MÓDSZER
Ezen akutkontakttoxicitás-vizsgálat megfelel az OECD TG 214-nek (1998).
1.1. BEVEZETÉS
E toxicitásvizsgálat olyan laboratóriumi módszer, amelyet annak felmérésére dolgoztak ki, hogy a növényvédő szerek és más vegyi anyagok milyen mértékű akut kontakt toxicitást gyakorolnak a felnőtt dolgozó háziméhekre.
Az anyagok toxikus jellemzőinek a felmérése és értékelése a háziméhekre gyakorolt akut kontakt toxicitás mértékének a meghatározását igényelheti, pl. olyan körülmények között, amikor valószínű, hogy a méhek ki lesznek téve egy adott vegyi anyag hatásának. Az akutkontakttoxicitás-vizsgálatot a peszticideknek és más vegyi anyagoknak a méhekre gyakorolt inherens toxicitásának meghatározására végzik. A vizsgálat eredményeit felhasználják annak meghatározására, hogy szükség van-e további minősítésre. E módszer különösen azon többlépcsős programokban használható jól, amelyekben a peszticidek méhekre kifejtett hatását először a laboratóriumban, majd részlegesen terepen, végül terepen vizsgálják (1). A peszticideket hatóanyaguk formájában (a.s.) vagy formulázott termékként lehet vizsgálni.
Toxikus referenciaanyagot kell használni a méhek érzékenységének és a vizsgálati eljárás pontosságának az ellenőrzésére.
1.2. FOGALOMMEGHATÁROZÁSOK
Akut kontakt toxicitás: egyszeri, helyileg alkalmazott tesztanyagdózis, maximum 96 órán belül jelentkező károsító hatása.
Dózis: a vizsgált anyag elfogyasztott mennyisége. A dózis az egy kísérleti állatnak beadott vizsgált anyag mikrogrammban kifejezett mennyisége (μg/méh).
Kontakt LD50 (közepes halálos dózis): valamely anyag statisztikailag megállapított egyszeri olyan dózisa, amely érintkezés útján az állatok 50 %-ának elhullását okozza. Az LD50 értéket a vizsgált anyag egy méhre jutó mennyiségével (μg/méh) fejezzük ki. A peszticidek esetében a vizsgált anyag lehet a hatóanyag, vagy egy vagy több hatóanyagot tartalmazó formulázott termék is.
Halálozás: egy állat akkor nyilvánítható elhullottnak, ha teljesen mozdulatlan.
1.3. A VIZSGÁLATI MÓDSZER ELVE
A vizsgálat során a kifejlett dolgozó háziméheket (Apis mellifera) a vizsgált anyag megfelelő hordozóanyagban, különböző töménységben oldott dózisaival kezelik úgy, hogy azt közvetlenül a torra cseppentik. A vizsgálat időtartama 48 óra. Ha az elhullási arány a 24. és 48. óra között is növekszik, míg a kontrollcsoportban egy elfogadható szinten, azaz £ 10 %-on marad, helyénvaló a vizsgálat időtartamát legfeljebb 96 órára meghosszabbítani. A elhullást naponta rögzítik és összehasonlítják a kontrollértékekkel. Az eredményeket elemzik a 24. és a 48. órai LD50 érték, illetve ha a vizsgálatot meghosszabbítják, akkor a 72. és 96. órai LD50 érték meghatározásához.
1.4. A VIZSGÁLAT ÉRVÉNYESSÉGÉNEK KRITÉRIUMAI
A vizsgálat érvényességéhez a következő feltételeknek kell teljesülniük:
|
— |
a vizsgálat végére a teljes kontrollcsoport létszámához viszonyított átlagos mortalitás nem haladhatja meg a 10 %-ot, |
|
— |
a toxikus referenciaanyag LD50 értéke megfelel a kijelölt tartománynak. |
1.5. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.5.1. A méhek befogása
A vizsgálatokhoz fiatal, kifejlett dolgozó háziméheket használnak, azaz azonos életkorú, tápláltsági fokú, fajú stb. méheket. A méheket megfelelően táplált, és – amennyire csak lehetséges – betegségektől mentes és királynővel rendelkező, ismert előéletű és fiziológiai állapotú kolóniákból fogják be. A méheket a felhasználás reggelén vagy az azt megelőző estén célszerű befogni, és a következő napig a vizsgálati körülmények között tartják őket. Az ivadékokat nem tartalmazó keretekről gyűjtött méhek alkalmasak. Kerülni kell a kora tavasszal vagy késő ősszel történő befogást, mivel a méhek fiziológiája ezen időszakban megváltozik. Ha a vizsgálatokat mégis kora tavasszal vagy késő ősszel végzik, a méheket inkubátorba téve elő lehet csalogatni és egy hétig „méhkenyérrel” (a lépről gyűjtött pollennel) és cukros vízzel lehet táplálni. A vegyi anyagokkal, pl. antibiotikummal, méhatka elleni szerekkel stb. kezelt méheket toxicitásvizsgálatok céljaira csak az utolsó kezeléstől számított négy hét elteltével szabad felhasználni.
1.5.2. Tartási és etetési feltételek
Könnyen tisztítható és jól szellőző dobozokat kell használni. E célra bármilyen alkalmas anyag felhasználható, pl. rozsdamentes acél, drótháló, műanyag vagy eldobható, fából készült stb. dobozok. A vizsgálati dobozok méreteit a méhek létszámához igazítják, hogy elegendő helyük legyen. Dobozonként tíz méhből álló csoportok használata javasolt.
A méheket 25 ± 2 oC hőmérsékletű sötét teszthelyiségben tartják. A vizsgálat során végig megmérik és feljegyzik a relatív páratartalom értékét, amelyet általában 50–70 % között tartanak. A méhekkel kapcsolatos minden tevékenység, beleértve a kezelést és megfigyeléseket, végezhető világosban (nappali fény mellett). Táplálékként 500 g/liter (azaz 50 tömegszázalékos) végkoncentrációjú vizes cukoroldatot alkalmaznak, és a vizsgálat ideje alatt korlátozás nélkül adagolják méhetető berendezés felhasználásával. Ez lehet egy üvegcső (körülbelül 50 mm hosszú és 10 mm széles, amelynek nyitott végén körülbelül 2 mm átmérőre leszűkített).
1.5.3. A méhek előkészítése
A befogott méheket a vizsgált anyag elhelyezése érdekében szén-dioxiddal vagy nitrogénnel lehet elkábítani. Minimalizálni kell az alkalmazott narkotikum mennyiségét és az expozíció időtartamát. A vizsgálat megkezdése előtt a haldokló méheket eltávolítják, és egészségesekkel pótolják.
1.5.4. A dózisok előkészítése
A vizsgált anyagot valamilyen hordozóanyagban, azaz szerves oldószerben oldva vagy detergenst tartalmazó vizes oldatban alkalmazzák. Szerves oldószerként előnyben részesül az aceton, de a méhekre kis mértékben mérgező egyéb szerves oldószereket is lehet használni (pl. dimetil-formamid, dimetil-szulfoxid). A vízben diszpergált formulázott termékek és az erősen poláros szerves anyagok esetében, amelyek szerves oldószerekben nem oldódnak, a kísérlethez használt oldatokat könnyebb felvinni, ha azt a kereskedelemben szokásos detergens (pl. Agral, Cittowett, Lubrol, Triton, Tween) híg oldatában készítik elő.
A megfelelő kontrolloldatokat előkészítik, azaz ha oldószert vagy diszpergálószert használnak a vizsgált anyag feloldásához, akkor két különálló kontrollcsoportot alkalmaznak, egyet vízzel, egyet pedig az oldószerrel/diszpergálószerrel kezelve.
1.6. VIZSGÁLATI ELJÁRÁS
1.6.1. Kezelt csoportok és kontrollcsoportok
A vizsgált dózisok és a párhuzamos vizsgálatok száma meg kell, hogy feleljen az LD50 95 %-os konfidenciahatár mellett történő meghatározására vonatkozó statisztikai követelményeknek. A vizsgálathoz szokványos esetben öt, olyan mértani sort képező dózisra van szükség, amelyek 2.2 értéket meg nem haladó szorzótényezővel különböznek egymástól, és az LD50 tartományát fedik le. A dózisok számát azonban a hatásgörbe (pusztulás a dózis függvényében) meredekségének függvényében és az eredmények elemzéséhez kiválasztott statisztikai módszer figyelembevételével határozzák meg. A vizsgálat előtt elvégzett, dózisbehatároló vizsgálat lehetővé teszi a megfelelő dózisok kiválasztását.
Legalább három, egyenként tíz méhből álló ún. párhuzamos kezelt csoportot használnak fel minden egyes kísérleti koncentrációnak megfelelő dózishoz.
A vizsgálatsorozatban részt vevőkön kívül legalább három, egyenként tíz méhből álló kontrollcsoportot vizsgálnak. Ha szerves oldószert vagy detergenst használnak, az oldószerre vagy a detergensre nézve három további, egyenként tíz méhből álló kontrollcsoportot vizsgálnak.
1.6.2. Toxikus referenciaanyagok
A tesztsorozattal párhuzamosan egy, a toxikus referenciaanyagot tartalmazó sorozatot is be kell állítani. A várható LD50 értékek lefedése érdekében legalább három dózist választanak ki. Mindegyik vizsgált dózis esetében legalább három, egyenként tíz méhet tartalmazó, ún. párhuzamost alkalmaznak. A javasolt referenciaanyag a dimetoát, amelynek 24 órás kontakt LD50 értéke a 0,10–0,30 μg hatóanyag/egyed (2) tartományba esik. Egyéb toxikus referenciaanyagok is elfogadhatóak, azonban csak olyan esetekben, ahol elegendő adat áll rendelkezésre a várható dózisreakció ellenőrzésére (pl. paration).
1.6.3. Expozíció
1.6.3.1. A dózisok beadása
Az elkábított méheket egyenként kezelik külsőleg a vizsgált anyaggal. A méheket véletlenszerűen rendelik a különböző vizsgált dózisokhoz és kontrollokhoz. Mindegyik méh torának háti részére viszik fel mikroapplikátorral a vizsgált anyagot a megfelelő koncentrációban tartalmazó oldat egy μl mennyiségét. Indokolt esetben más mennyiségeket lehet alkalmazni. A felvitelt követően a méheket elosztják a kísérleti dobozok között, és ellátják cukoroldattal.
1.6.3.2. Időtartam
A vizsgálat időtartama lehetőség szerint 48 óra. Ha a mortalitás a 24. és a 48. óra között 10 %-nál nagyobb mértékben növekszik, a vizsgálat időtartamát maximum 96 órára meghosszabbítják, feltéve, hogy a kontrollcsoportban a mortalitás nem haladja meg a 10 %-ot.
1.6.4. Megfigyelések
Feljegyzik a mortalitás alakulását a dózis bevitelét követő negyedik órában, ezt követően a 24. és a 48. órában. Ha a meghosszabbított megfigyelési időszakra van szükség, akkor a további értékeléseket 24 órás időközönként végezik el, legfeljebb a 96. óráig, feltéve, hogy a kontrollcsoportban a mortalitás nem haladja meg a 10 %-ot.
A vizsgálat időszaka alatt feljegyeznek minden, a normálistól eltérő magatartásformát.
1.6.5. Tűrésteszt
Egyes esetekben (pl. amikor valamely vizsgált anyag várható toxicitása alacsony) tűréstesztet lehet végezni, 100 μg hatóanyag/egyed dózis felhasználásával annak bemutatására, hogy az LD50 nagyobb ezen értéknél. Ugyanezt az eljárást követik, beleértve a vizsgált dózisra vonatkozó három ún. párhuzamos kezelt csoportot, a megfelelő kontrollokat, valamint a toxikus referenciaanyag használatát. Ha mortalitás tapasztalható, teljes körű vizsgálatot végeznek el. Ha szubletális hatások figyelhetők meg (lásd 1.6.4. szakasz), azokat feljegyzik.
2. ADATOK ÉS JELENTÉSKÉSZÍTÉS
2.1. ADATOK
Az adatokat táblázat formájában foglalják össze, mindegyik kezelt csoportnál, valamint kontroll- és toxikus referenciaanyaggal kezelt csoportnál feltüntetve a kísérlethez felhasznált méhek számát, az egyes megfigyelési időpontokban tapasztalt mortalitást, valamint a rendellenes magatartást tanúsító méhek számát. A mortalitási adatokat megfelelő statisztikai módszerekkel elemezik (pl. probitanalízis, mozgóátlag, binomiális valószínűség) (3) (4). A hatásgörbéket mindegyik ajánlott megfigyelési időpontban (azaz a 24., 48. és adott esetben a 72. és 96. órában) grafikonon rögzítik, és a görbék meredekségét és a közepes halálos dózisokat (LD50) a 95 %-os konfidenciahatárhoz kiszámítják. A kontrollcsoport mortalitásának korrekcióját az Abbott-képlet alkalmazásával lehet elvégezni (4) (5). Az LD50 értékét az egy méhre jutó vizsgált anyag μg-jában fejezik ki.
2.2 VIZSGÁLATI JELENTÉS
A vizsgálati jelentésben a következő információknak kell szerepelniük:
2.2.1. A vizsgált anyag:
|
— |
az anyag fizikai természete és főbb fizikai-kémiai tulajdonságai (pl. stabilitása vízben, gőznyomás), |
|
— |
kémiai azonosító adatok, beleértve a szerkezeti képletet és a kémiai tisztaságot (azaz peszticidek esetén a hatóanyag(ok) megnevezését és koncentrációját). |
2.2.2. A vizsgált fajok:
|
— |
tudományos név, származás, hozzávetőleges életkor (hetekben kifejezve), a befogás módszere és dátuma, |
|
— |
a kolóniákra vonatkozó információk, ahonnan a begyűjtött állatok származnak, beleértve a méhek egészségi állapotát, bármilyen kifejlett kori betegséget, esetleges előkezeléseket stb. |
2.2.3. Vizsgálati körülmények:
|
— |
a kísérleti helyiség hőmérséklete és relatív páratartalma, |
|
— |
elhelyezési körülmények, beleértve a dobozok típusát, méretét és anyagát, |
|
— |
a vizsgált anyag beadásának módszerei, pl. a hordozó oldószer, alkalmazott vizsgált oldat mennyisége, felhasznált narkotikum, |
|
— |
a vizsgálat körülményei, pl. felhasznált vizsgált dózisok száma, a kontrollok száma; minden egyes vizsgált dózisra és kontrollra nézve az ún. párhuzamosok és az egy dobozban lévő méhek száma, |
|
— |
a vizsgálat időpontja. |
2.2.4. Eredmények:
|
— |
előzetes koncentrációhatárokat felmérő vizsgálat eredményei, ha végeztek ilyet, |
|
— |
nyers adatok: mortalitás minden egyes vizsgált dózisra és minden egyes megfigyelési időpontra nézve, |
|
— |
a hatásgöbék grafikonja a vizsgálat végén, |
|
— |
LD50 értékek, 95 %-os konfidenciahatárhoz, az egyes javasolt megfigyelési időpontokban, a vizsgált anyagra és a toxikus referenciaanyagra nézve, |
|
— |
az LD50 meghatározásához használt statisztikai eljárások, |
|
— |
mortalitás a kontrollcsoportokban, |
|
— |
más megfigyelt vagy mért biológiai hatások és a méhek bármilyen abnormális reakciója, |
|
— |
bármilyen eltérés az itt leírt vizsgálati módszerektől, valamint bármely más releváns információ. |
3. SZAKIRODALOM
|
(1) |
EPPO/COUNCIL OF Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products – Honeybees. EPPO bulletin, Vol. 23, N. 1, pp. 151-165. March 1993. |
|
(2) |
Gough, H. J., McIndoe, E. C, Lewis, G. B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.), 1981-1992. Journal of Apicultural Research 22, pp. 119-125. |
|
(3) |
Litchfield, J. T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, pp. 99-113. |
|
(4) |
Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York. |
|
(5) |
Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol. 18, pp. 265-267. |
C.18. KÉMIAI ANYAGOK TALAJON TÖRTÉNŐ ADSZORPCIÓJÁNAK VIZSGÁLATA EGYENSÚLYI RENDSZERBEN
1. MÓDSZER
E módszer megfelel az OECD TG 106-nak: a talajon történő adszorpció/deszorpció meghatározása egyensúlyi rendszerben (2000).
1.1. BEVEZETÉS
A módszer az adszorpciós vizsgálat kialakításához figyelembe veszi a talaj kiválasztására vonatkozó körvizsgálatot és műhelymunkát (1) (2) (3) (4), valamint a meglévő nemzeti iránymutatásokat (5) (6) (7) (8) (9) (10) (11).
Az adszorpciós/deszorpciós vizsgálatok segítségével információkat nyerhetünk a vegyszerek mobilitására, illetve ezeknek a bioszféra talaj, víz és levegő kompartmentjei közötti megoszlására nézve (12) (13) (14) (15) (16) (17) (18) (19) (20) (21). Az információt fel lehet használni a következők előrejelzésére vagy becslésére: valamely vegyi anyag hozzáférhetősége a lebontás szempontjából (22) (23), élőlények általi felvétel és átalakítás (24); az anyag mozgása a talaj profilban (16) (18) (19) (21) (25) (26) (27) (28); talajból való kipárolgás (21) (29) (30); a talajból természetes vizekbe irányuló bemosódás (18) (31) (32). Adszorpciós adatokat összehasonlítási és modellezési célra lehet használni (19) (33) (34) (35).
A talajban egy vegyi anyag szilárd és folyadékfázis közti megoszlása összetett folyamat, amely több különböző tényezőtől függ: az anyag kémiai jellegétől (12) (36) (37) (38) (39) (40), a talaj jellemzőitől (4) (12) (13) (14) (41) (42) (43) (44) (45) (46) (47) (48) (49), valamint olyan éghajlati tényezőktől, mint a csapadék, hőmérséklet, napsugárzás és szél. Így valamely vegyi anyag talajba való adszorbeálódásának folyamatában részt vevő számos jelenséget és mechanizmust nem lehet teljes mértékben meghatározni olyan egyszerűsített laboratóriumi modellel, mint ez a módszer. Azonban, még ha e kísérlet nem is tudja lefedni az összes, a környezetben előforduló esetet, elégséges tájékoztatást ad az adott vegyi anyag adszorpciójának környezeti jelentőségéről.
Lásd még az Általános bevezetést.
1.2. ALKALMAZÁSI KÖR
A módszer célja valamely anyag talajra vonatkozó adszorpciós/deszorpciós magatartásának a vizsgálata. A célkitűzés olyan szorpciós érték megállapítása, amelyet fel lehet használni a megoszlás előrejelzésére különféle környezeti feltételek között; e célból valamely vegyszer különféle talajokra vonatkozó egyensúlyi adszorpciós koefficiensét a talaj jellemzőinek (pl. szervesszén-tartalom, agyagtartalom, talajszerkezet és pH-érték) függvényeként határozzák meg. Különböző talajtípusokat kell felhasználni annak érdekében, hogy az adott anyag természetben előforduló talajokkal létrejövő kölcsönhatásait a lehető legszélesebb körben lefedjék.
E módszerben az adszorpció azt a folyamatot képviseli, amely keretében a vegyi anyag a talajszemcsék felületéhez kötődik; e módszer nem tesz különbséget a különféle adszorpciós folyamatok (fizikai és kémiai adszorpció), valamint olyan folyamatok között, mint felületkatalizált lebomlás, tömeges adszorpció vagy kémiai reakció. A talaj kolloid méretű szemcséin (átmérő < 0,2 μm) bekövetkező adszorpciót nem veszik figyelembe.
Az adszorpció szempontjából legfontosabbnak tartott talajparaméterek a következők: szervesszén-tartalom (3) (4) (12) (13) (14) (41) (43) (44) (45) (46) (47) (48); agyagtartalom és talajtextúra (3) (4) (41) (42) (43) (44) (45) (46) (47) (48), az ionizálható vegyületek esetében a pH-érték (3) (4) (42). Az adott anyag adszorpcióját/deszorpcióját esetleg befolyásoló egyéb talajparaméterek az effektív kationcserélő-kapacitás (ECEC), az amorf vas- és alumínium-oxid-tartalom, különösen vulkanikus és trópusi talajok esetében (4), valamint a talaj fajlagos felülete (49).
A vizsgálat kialakítása olyan, hogy eltérő szervesszén-tartalommal, agyagtartalommal és talajszerkezettel, valamint pH-értékkel rendelkező különböző talajtípusokban értékeli valamely vegyszer adszorpcióját. Három szintből épül fel:
|
1.szint: |
|
|
2.szint: |
„Screening” teszt: az adszorpciót öt különböző talajtípusban vizsgálják. Egyetlen koncentráció alkalmazásával vizsgálják az adszorpció kinetikáját, és meghatározzák a Kd és Koc megoszlási együtthatókat. |
|
3.szint: |
A Freundlich-féle adszorpciós izotermák meghatározása annak megállapítására, hogy a koncentráció hogyan befolyásolja az adszorpció mértékét. Deszorpció tanulmányozása deszorpciós kinetika/Freundlich-féle deszorpciós izotermák segítségével (1. függelék). |
1.3. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
|
Jel |
Fogalommeghatározás |
Mértékegység |
|
|
adszorpció mértéke ti időpontban |
% |
|
Aeq |
adszorpció mértéke adszorpciós egyensúly helyzetben |
% |
|
|
a vizsgált anyag talajban adszorbeált tömege ti időpontban |
μg |
|
|
a vizsgált anyag talajban adszorbeált tömege a Ati időintervallumban |
μg |
|
|
a vizsgált anyag talajban adszorbeált tömege adszorpciós egyensúlyi helyzetben |
μg |
|
m0 |
a vizsgált anyag tömege a kémcsőben az adszorpciós vizsgálat kezdetén |
μg |
|
|
a vizsgált anyag az analízisre kivett térfogatban (
|
μg |
|
|
az anyag tömege a törzsoldatban adszorpciós egyensúlyi helyzetben |
μg |
|
Mtalaj |
a talajfázis mennyisége, talaj szárazanyagtartalomban kifejezve |
g |
|
Cst |
az anyag oldott mennyiségének tömegkoncentrációja |
μg cm-3 |
|
C0 |
a talajjal érintkezésben lévő vizsgált oldat kezdeti tömegkoncentrációja |
μg cm-3 |
|
|
az anyag tömegkoncentrációja a vizes fázisban abban a ti időpontban, amikor az elemzést végzik |
μg cm-3 |
|
|
a talajban adszorbeált anyagtartalom adszorpciós egyensúlyi helyzetben |
μg g-1 |
|
|
az anyag tömegkoncentrációja a vizes fázisban adszorpciós egyensúlyi helyzetben |
μg cm-3 |
|
V0 |
a talajjal (az adszorpciós vizsgálat során) érintkező vizes fázis kezdeti térfogata |
cm3 |
|
|
a vizsgált anyag mérésére használt aliquota térfogata |
cm3 |
|
Kd |
adszorpciós megoszlási koefficiens |
cm3 g-1 |
|
Koc |
szerves szénre vonatkoztatott adszorpciós koefficiens |
cm3 g-1 |
|
Kom |
szerves anyagra vonatkoztatott megoszlási koefficiens |
cm3 g-1 |
|
|
Freundlich-féle adszorpciós koefficiens |
μg 1-1/n (cm3) |
|
1/n |
Freundlich-féle exponens |
|
|
|
deszorpció mértéke a ti időpontban |
% |
|
|
deszorpció mértéke a Δti időintervallumban |
% |
|
Kdes |
látszólagos deszorpciós koefficiens |
cm3 g-1 |
|
|
Freundlich-féle deszorpciós koefficiens |
μg 1-1/n (cm3) 1/n g-1 |
|
|
a vizsgált anyag talajból deszorbeált tömege ti időpontban |
μg |
|
|
a vizsgált anyag talajból deszorbeált tömege Δti időintervallumban |
μg |
|
|
az anyag analitikus módon meghatározott tömege a vizes fázisban deszorpciós egyensúlyi helyzetben |
μg |
|
|
a vizsgált anyag deszorbeált össztömege deszorpciós egyensúlyi helyzetben |
μg |
|
|
az anyag talajban adszorbeálva maradó tömege Ati időintervallum után |
μg |
|
|
a vizsgált anyagnak az abszorpciós egyensúlyi helyzet elérését követően a tökéletlen folyadékeltávolítás miatt talajban megmaradt tömege |
μg |
|
|
a talajban adszorbeálva maradó vizsgált anyag tartalom deszorpciós egyensúlyi helyzetben |
μg g-1 |
|
|
a vizsgált anyag tömegkoncentrációja vizes fázisban deszorpciós egyensúlyi helyzetben |
μg cm-3 |
|
VT |
a talajjal érintkezésben lévő vizes fázis össztérfogata a „folytatásos” módszerrel végrehajtott deszorpciós kinetikai kísérlet során |
cm3 |
|
vR |
az adszorpciós egyensúlyi helyzet elérését követően a kémcsőből eltávolított és azonos térfogatú 0,01 M CaCl2 oldattal pótolt vizes fázis mennyisége |
cm3 |
|
|
a kémcsőből (i) időpontban a vizsgált anyag analizálása céljából kiemelt aliquot minta térfogata a „folytatásos” módszerrel végzett deszorpciós kinetikai kísérletben |
cm3 |
|
|
az (i) kémcsőből a vizsgált anyag mérésére kiemelt oldat térfogata a párhuzamos módszerrel végzett deszorpciós kinetikai kísérletben |
cm3 |
|
|
a kémcsőből a vizsgált anyag mérésére kivett oldat térfogata deszorpciós egyensúlyi helyzetben |
cm3 |
|
MB |
tömegkiegyenlítés |
% |
|
mE |
a talajból és a tesztedény faláról két lépésben extrahált vizsgált anyag össztömege |
μg |
|
Vrec |
az adszorpciós egyensúlyi helyzet után visszanyert felülúszó térfogata |
cm3 |
|
Pow |
oktanol/víz megoszlási koefficiens |
|
|
pKa |
disszociációs állandó |
|
|
Sw |
vízoldhatóság |
g l-1 |
1.4. A VIZSGÁLATI MÓDSZER ELVE
A radioaktívan jelölt vagy nem jelölt tesztanyag ismert térfogatú és koncentrációjú, 0,01 M CaCl2-ben készült oldatait 0,01 M CaCl2-vel ekvilibrált, ismert száraz tömegű talajmintákhoz adják. A keveréket megfelelő ideig rázzák. A talajszuszpenziókat ezt követően centrifugálással és szükség esetén szűréssel elválasztják, és a vizes fázist elemzik. A talajmintában adszorbeálódott vizsgáltanyag-mennyiséget a kezdetben az oldatban jelen lévő vizsgált anyagmennyiség és a kísérlet végén fennmaradó mennyiség különbözeteként adják meg (közvetett módszer).
Másik lehetőségként a vizsgált anyag adszorbeálódott mennyiségét közvetlenül is meg lehet határozni a talaj elemzésével (közvetlen módszer). Ezen eljárást, amely magában foglalja a megfelelő oldószerrel lépésekben történő talajextrakciót, olyan esetekben ajánlják, ahol az anyag oldatkoncentrációjában beálló különbözetet nem lehet pontosan meghatározni. Ilyen esetek pl. a vizsgált anyag adszorpciója a kísérleti edény falán, a vizsgált anyag instabilitása a kísérlet ideje alatt, gyenge adszorpció, amely az oldatban csak kis koncentrációváltozást eredményez; és az alacsony koncentrációt eredményező erőteljes adszorpció, amelyet nem lehet pontosan meghatározni. Ha radioaktívként jelölt anyagot használnak, a talajextrakció elkerülhető, ha a talajmintát hevítik, és folyadékszcintillációs számlálással határozzák meg a tesztanyag mennyiségét. A folyadékszcintillációs számlálás azonban olyan nem specifikus eljárás, amely nem tud különbséget tenni a tesztanyag és az átalakulási termékei között; ezért csak akkor kell használni, ha a vizsgált vegyi anyag a vizsgálat tartama alatt stabil.
1.5. A VIZSGÁLT ANYAGRA VONATKOZÓ INFORMÁCIÓ
Analitikai tisztaságú reagenseket kell használni. Ismert összetételű és lehetőleg legalább 95 % tisztaságú, jelöletlen vagy ismert összetételű, radioaktívként jelölt, radioaktivitás szempontjából is ismert tisztaságú vizsgált anyagok használata ajánlott. Rövid felezési idejű jelzők esetén bomlási korrekciókat kell alkalmazni.
Az adszorpciós-deszorpciós vizsgálat elvégzése előtt a vizsgált anyagról a következő információnak kell rendelkezésre állnia:
|
a) |
vízoldhatóság (A.6); |
|
b) |
gőznyomás (A.4) és/vagy a Henry-törvény szerinti állandó; |
|
c) |
abiotikus lebomlás: hidrolízis a pH függvényében (C.7); |
|
d) |
megoszlási koefficiens (A.8); |
|
e) |
gyors biológiai lebonthatóság (C.4) vagy az anyag aerob és anaerob transzformációja a talajban; |
|
f) |
ionizálható anyagok pKa értéke; |
|
g) |
közvetlen fotolízis vízben (azaz UV-VIS adszorbciós spektrum vízben, kvantumhozam) és fotodegradáció a talajban. |
1.6. A VIZSGÁLAT ALKALMAZHATÓSÁGA
A vizsgálat olyan vegyi anyagokra alkalmazandó, amelyekre nézve kielégítő pontosságú analitikai módszer áll rendelkezésre. Az eredmények megbízhatóságát befolyásolni képes fontos tényező, különösen olyan esetben, amikor a közvetett módszert követik, a vizsgált anyag stabilitása a vizsgálat időtartama alatt. Ezért a stabilitást ellenőrizni kell előzetes vizsgálat során; ha az előkísérletben a teszt tervezett időtartama alatt átalakulást figyelnek meg az anyagon, akkor ajánlott a fő vizsgálatot a talaj- és vizes fázisok mindegyikének elemzésével elvégezni.
E vizsgálat végrehajtása során vízben csak kevéssé oldódó vizsgált anyagok (Sw< 10-4 g l-1), valamint erős töltéssel rendelkező anyagok esetében nehézségek merülhetnek fel amiatt, hogy a vizes fázisban a koncentrációt analitikai módszerekkel nem lehet megfelelő pontossággal mérni. Ilyen esetekben további lépéseket kell tenni. E jogszabály vonatkozó szakaszai iránymutatást nyújtanak az ilyen problémák kezeléséhez.
Illékony anyagok vizsgálata során ügyelni kell a veszteségek elkerülésére.
1.7. A MÓDSZER LEÍRÁSA
1.7.1. Eszközök és reagensek
Szabványos laboratóriumi felszerelés, különösen a következők:
|
a) |
Kémcsövek vagy edények a kísérletek végzéséhez. Fontos, hogy e kémcsövek vagy edények:
|
|
b) |
Rázókészülék: körforgó rázógép vagy ezzel egyenértékű berendezés; a készülék a rázatás során tartsa szuszpenzióban a talajt. |
|
c) |
Centrifuga: lehetőleg nagy sebességű, pl. centrifugálás erő > 3 000 g, hőszabályozós, illetve legyen képes a vizes oldatokból eltávolítani a 0,2 μm-nél nagyobb átmérőjű szemcséket. A rázatás és centrifugálás során a tesztedényeket le kell fedni a párolgás és a vízveszteség elkerülése érdekében; az ezeken jelentkező adszorpció minimalizálása érdekében deaktivált felszínű, mint pl. teflonbevonatú csavaros tetőt kell alkalmazni. |
|
d) |
Szabadon választható: szűrőberendezés; 0,2 μm pórusméretű, steril, egyszer használatos filterekkel. Különös gonddal kell eljárni a filterek anyagának kiválasztásakor annak érdekében, hogy elkerüljék a vizsgált anyag bármilyen veszteségét ezeken; a rosszul oldódó vizsgált anyagok esetében nem ajánlatos szerves szűrőanyagot használni. |
|
e) |
Analitikai berendezések, amelyek alkalmasak a vizsgált vegyi anyag koncentrációjának mérésére. |
|
f) |
Laboratóriumi szárítószekrény, amely 103 oC és 110 oC közötti hőmérsékletet tud tartani. |
1.7.2. Talajok jellemzése és kiválasztása
A talajokat három olyan paraméterrel kell jellemezni, amelyeket nagyrészt felelősnek tartanak az adszorpcióért: szervesszén-tartalom, agyagtartalom és talajszerkezet, valamint a pH-érték. Mint az már korábban szerepelt (lásd Alkalmazási kör), a talaj más fizikai-kémiai tulajdonságai befolyásolhatják egy adott anyag adszorpcióját/deszorpcióját, ilyen esetekben azokat is figyelembe kell venni.
A talaj jellemzésére használt módszerek nagyon fontosak, és jelentősen befolyásolhatják az eredményeket. Ezért ajánlatos a talaj pH-értékét 0,01 M CaCl2-oldatban mérni (ez az adszorpciós/deszorpciós vizsgálatban használt oldat) a megfelelő ISO-módszer szerint (ISO-10390-1). Ajánlott továbbá az egyéb jelentős talajtulajdonságok szabványmódszer szerinti meghatározása (pl. az ISO „Talajanalízis kézikönyv” szerint); amely lehetővé teszi, hogy a szorpciós adatok nemzetközileg egységes, szabványosított talaj paramétereken alapuljanak. A talaj elemzésére és jellemzésére rendelkezésre álló szabványmódszerekre vonatkozó iránymutatás megtalálható a szakirodalomban (50-52). A talajvizsgálati módszerek kalibrálásához ajánlott referenciatalajokat használni.
Az adszorpciós/deszorpciós kísérletekhez használt talajok kiválasztására vonatkozó iránymutatás az 1. táblázatban szerepel. A hét kiválasztott talaj lefedi a mérsékelt égövben megtalálható talajtípusokat. Az ionizálható vizsgált anyagok esetében a kiválasztott talajoknak széles pH-érték tartományt kell lefedniük ahhoz, hogy értékelni lehessen az anyag adszorpcióját ionizált és nem ionizált formában is. Arra nézve, hogy a vizsgálat különféle szakaszaiban hány különböző talajt kell használni, „A vizsgálat végrehajtása” című szakasz (1.9.) nyújt iránymutatást.
Ha egyéb talajtípusokat részesítenek előnyben, ezeket ugyanezekkel a paraméterekkel kell jellemezni és azok tulajdonságainak hasonló eltérést kell mutatnia, mint az 1. táblázatban ismertetettek, még akkor is, ha nem pontosan felelnek meg a kritériumoknak.
1. táblázat
Adszorpcióhoz-deszorpcióhoz használt talajminták kiválasztására vonatkozó iránymutatás
|
Talajtípus |
pH-tartomany (0,01 M CaCl2 oldatban) |
Szervesszén-tartalom ( %) |
Agyagtartalom ( %) |
Talaj textúrája (25) |
|
1 |
4,5 - 5,5 |
1,0 - 2,0 |
65–80 |
agyagos talaj |
|
2 |
> 7,5 |
3,5 - 5,0 |
20–40 |
agyagos vályogtalaj |
|
3 |
5,5 - 7,0 |
1,5 - 3,0 |
15–25 |
iszapos vályogtalaj |
|
4 |
4,0 - 5,5 |
3,0 - 4,0 |
15–30 |
vályogtalaj |
|
5 |
< 4,0 - 6,0 (26) |
< 10–15 (26) |
vályogos homoktalaj |
|
|
6 |
> 7,0 |
40–65 |
agyagos vályogtalaj/agyagos talaj |
|
|
7 |
< 4,5 |
> 10 |
< 10 |
homoktalaj/vályogos homoktalaj |
1.7.3. Talajminták gyűjtése és tárolása
1.7.3.1. Gyűjtés
Nincs konkrét ajánlott mintavételi eljárás vagy eszköz; a mintavételi technika a vizsgálat céljától függ (53) (54) (55) (56) (57) (58).
A következőket kell figyelembe venni:
|
a) |
szükség van a terep „előéletére” vonatkozó részletes információra; ez magában foglalja a terepelhelyezkedést, a növényzetet, a peszticidekkel és/vagy trágyákkal történt kezeléseket, biológiai utánpótlását vagy véletlen szennyeződéseket. A mintavételre vonatkozó ISO-szabvány (ISO 10381-6) ajánlásait kell követni a mintavételi helyszín leírása tekintetében; |
|
b) |
a mintavételi helyszínt az UTM (Universal Transversal Mercator-Projection/European Horizontal Datum) vagy földrajzi koordináták segítségével kell meghatározni; ez lehetővé teszi ugyanazon talajtípus újbóli gyűjtését a jövőben, vagy segítséget tud nyújtani a különböző országokban használt különféle besorolási rendszerek szerinti talaj meghatározásban. Az A. szintből, legfeljebb 20 cm mélységből kell a talajmintát begyűjteni. Különösen a hetedik talajtípus esetében, ha a talaj részeként egy Oh-szint is jelen van, annak szerepelnie kell a mintában. |
A talajmintákat olyan konténerek felhasználásával és olyan hőmérsékleti viszonyok között kell szállítani, amelyek garantálják, hogy az eredeti talajtulajdonságok jelentősen nem változnak meg.
1.7.3.2. Tárolás
Előnyben részesül a terepről frissen vett talajok használata. Csak amennyiben ez nem lehetséges, akkor lehet a talajt szobahőmérsékleten, levegőn szárított állapotban tárolni. A tárolás idejére nézve nincs ajánlott határérték, de a három évnél tovább tárolt talajokat felhasználás előtt újra kell elemezni szervesszén-tartalmuk, pH-értékük és a CEC tekintetében.
1.7.3.3. Talajminták kezelése és előkészítése a vizsgálathoz
A talajmintákat szobahőmérsékleten (lehetőleg 20–25 oC között) levegőn szárítják. A fellazítást minimális erőkifejtéssel kell végezni, hogy a talaj eredeti textúrája a lehető legkisebb mértékben változzon. A talajokat < 2 mm részecskeméretre szitálják; a szitálási folyamat tekintetében a talajmintavételre vonatkozó ISO-szabvány (ISO 10381-6) ajánlásait kell követni. Ajánlatos a gondos homogenizálás, mivel ez lehetővé teszi az eredmények megismételhetőségét. A talajok nedvességtartalmát a talajból vett három mintából határozzák meg. A három mintát 105 oC-on, tömegállandóságig (kb. 12 órán át) szárítják. A talaj tömege minden számításnál a száraz tömeg, azaz a talaj nedvességtartalommal korrigált súlya.
1.7.4. A vizsgált anyag előkészítése a talajra történő alkalmazáshoz
A vizsgált anyagot desztillált vagy deionizált vizes 0,01 M CaCl2-oldatban feloldják; a CaCl2-oldatot a centrifugálás javítása és a kationcsere minimalizálása érdekében a vizes oldatfázisként alkalmazzák. A törzsoldat koncentrációja lehetőleg legyen három nagyságrenddel nagyobb, mint az alkalmazott elemzési módszer kimutatási határa. Ez a küszöbérték biztosítja a pontos méréseket az e módszer alapjául szolgáló módszer vonatkozásában; ezenkívül a törzsoldat koncentrációja lehetőleg ne érje el a vizsgált anyag vízoldhatósági határát.
A törzsoldatot lehetőleg közvetlenül a talajmintákra történő felvitelt megelőzően kell előkészíteni, és sötét, elzárt helyen 4 oC hőmérsékleten kell tárolni. A tárolási idő a vizsgált anyag stabilitásától és oldatbeli koncentrációjától függ.
Csak a nehezen oldható anyagok (Sw < 10-4 g l-1) esetében lehet szükség oldást segítő anyagra. Ez az oldódást segítő anyag: a) legyen vízzel elegyedő, mint a metanol vagy az acetonitril; b) koncentrációja ne haladja meg a törzsoldat teljes térfogatának 1 %-át, és legyen ennél kevesebb a vizsgált anyag azon oldatában, amely érintkezésbe kerül a talajjal (lehetőleg legyen 0,1 %-nál kevesebb); és c) ne legyen felületaktív anyag, és ne lépjen vegyületképző reakcióba a vizsgált vegyi anyaggal. Az oldást segítő anyag használatát a vizsgálati jelentésben ismertetni kell és meg is kell indokolni.
A nehezen oldható anyagok esetében alkalmazható másik módszer az, hogy szerves oldószerben feloldott tesztanyagot adnak a talajból és a (desztillált vagy ionmentes vízzel készült) 0,01 M CaCl2-oldatból álló tesztrendszerhez („spiking”). A vizes fázisban a szerves oldószer tartalmát a lehető legalacsonyabb szinten kell tartani, általában a 0,1 % értéket nem meghaladva. A szerves oldattal történő elegyítés következménye, hogy a térfogat ezután már nem reprodukálható. Így további hiba állhat elő, mivel a vizsgált anyag és az oldószer koncentrációja nem azonos az összes vizsgálatban.
1.8. AZ ADSZORPCIÓS/DESZORPCIÓS KÍSÉRLET ELVÉGZÉSÉNEK ELŐFELTÉTELEI
1.8.1. Elemzési módszer
A szorpciós mérések pontosságát befolyásolni képes kulcsfontosságú paraméterek a következőek: az elemzési módszer pontossága az oldat és az adszorbeált fázisok elemzése során, a vizsgált anyag stabilitása és tisztasága, az adszorpciós egyensúlyi helyzet elérése, az oldatkoncentráció változásának mértéke, a talaj/oldat arány és az egyensúlyi folyamat beállítása során a talajszerkezet változásai (35) (59–62). A pontosság kérdésében szerepet játszó néhány példát a 2. függelék tartalmazza.
Az alkalmazott elemzési módszer megbízhatóságát annál a koncentrációtartománynál kell ellenőrizni, amely a vizsgálat során valószínűleg felmerül. A kísérletet végző belátása szerint kialakíthat megfelelő módszert a megfelelő pontossággal, precizitással, reprodukálhatósággal, kimutatási határértékkel és visszanyerési hatékonysággal. Az ilyen vizsgálatok elvégzésének módjára vonatkozóan iránymutatást ad az alábbi kísérlet.
0,01 M CaCl2 megfelelő mennyiségét, pl. 100 cm3-t, 4 órán át rázatunk pl. 20 g tömegű, nagy adszorpciós kapacitással rendelkező talajjal, azaz olyannal, amelynek magas a szervesszén- és agyagtartalma; e tömeg és térfogat az elemzési igénytől függően változhat, de az 1:5 talaj/oldat arány a megfelelő kiindulási pont. A keveréket centrifugáljuk, és a vizes fázist szűrni lehet. A vizsgált anyag törzsoldatának megfelelő mennyiségét hozzáadjuk a megszűrt keverékhez, azért, hogy a vizsgálat során valószínűleg bekövetkező koncentrációtartományba eső névleges koncentrációt érjük el. E mennyiség ne haladja meg a vizes fázis végleges térfogatának 10 %-át, hogy a preekvilibrációs oldat jellegét a lehető legkevésbé változtassuk meg. Az oldatot elemezzük.
Egy talajból és CaCl2-oldatból (vizsgált anyag nélkül) álló vakpróbát is be kell állítani az analitikai módszer műhibáinak kiszűrése és a talaj által okozott mátrixhatás ellenőrzése céljából.
A szorpciós mérésekre alkalmazható elemzési módszerek közé tartozik a gáz-folyadék kromatográfia (GLC), a nagy hatékonyságú folyadékkromatográfia (HPLC), a tömegspektrometria (pl. GC-MS, HPLC-MS) és a folyadékszcintillációs számlálás (radioaktívként jelölt anyagok esetén). Az alkalmazott elemzési módszertől függetlenül az minősül alkalmasnak, amelynél a visszanyerés a névérték 90 %-a és 110 %-a között van. A megoszlás után a kimutatás és értékelés lehetővé tétele érdekében az elemzési módszer kimutatási határértékeinek legalább két nagyságrenddel a névleges koncentráció alatt kell lenniük.
Az adszorpciós vizsgálatok elvégzéséhez rendelkezésre álló elemzési módszerek jellemzői és dedikálási határa fontos szerepet játszanak a vizsgálati körülmények meghatározásában és a vizsgálat kivitelezésében. E módszer egy általános vizsgálati eljárást követ és ajánlásokat, iránymutatásokat ad alternatív megoldásokra olyan esetekben, ahol az elemzési módszer és a laboratóriumi felszerelés korlátokat állíthat.
1.8.2. Az optimális talaj/oldat arányok kiválasztása
A szorpciós vizsgálatokhoz a megfelelő talaj-oldat arány kiválasztása a Kd megoszlási koefficienstől és az adszorpció kívánt relatív fokától függ. Az anyag koncentrációjának változása az oldatban, az adszorpciós egyenlet formája és az elemzési módszer detektálási határa meghatározza a mérés statisztikus pontosságát a vegyszer oldatbeli koncentrációjának kimutatásában. Ezért általában a gyakorlatban hasznos néhány előre meghatározott arányt beállítani, amelyeknél az adszorbeált százalékos arány 20 % felett van, és lehetőleg > 50 % (62), ugyanakkor figyelmet kell fordítani arra, hogy a vizes fázisban a vizsgált anyag koncentrációja elég magas maradjon ahhoz, hogy pontosan lehessen mérni. Ez különösen a nagy adszorpciós arányok esetében fontos.
A megfelelő talaj/oldat arányok kiválasztásához kézenfekvő megközelítés a Kd érték becslésén alapul, amelyet vagy elővizsgálatok, vagy bevett becslési technikák segítségével (3. függelék) határoznak meg. A megfelelő arány ezután kiválasztható egy olyan grafikon segítségével, amely a meghatározott adszorpciós százalékokra vonatkozó talaj/oldat arányt a Kd függvényében ábrázolja (1. ábra). Ekkor az a feltételezés, hogy az adszorpciós egyenlet lineáris (28) (6). Az alkalmazandó összefüggést úgy kapják meg, ha a Kd-re vonatkozó 4. egyenletet az 1. egyenlet alakjára hozzák:
|
|
(1) |
vagy logaritmusos formában fejezik ki, feltéve hogy R = mtalaj/V0 and Aeq %/100 =  :
:
|
|
(2) |

Az 1. ábra a különböző adszorpciós szintekhez szükséges talaj/oldat arányszámokat mutatja a Kd függvényeként. Pl. egy 1:5 talaj/oldat aránnyal és Kd = 20 érték mellett kb. 80 % adszorpció következik be. Ugyanezen Kd mellett 50 %-os adszorpció eléréséhez 1:25 arányt kell alkalmazni. E rugalmas megközelítéssel választhatja ki a kísérletet végző a kísérlet céljainak leginkább megfelelő talaj/oldat arányt.
Nagyobb nehézségek adódnak azokban a tartományokban, ahol a vegyszer nagyon erősen vagy csak nagyon kis mértékben adszorbeálódik. Abban az esetben, ha alacsony szintű adszorpció következik be, 1:1 talaj/oldat arány ajánlott, bár néhány nagy szervesanyagtartalmú talajfajtánál bizonyos körülmények között kisebb arányra lehet szükség a sűrű szuszpenzió eléréséhez. Az oldat koncentrációjának kis változását mérő elemzési módszertannal kapcsolatban gondosan kell eljárni; különben az adszorpciós mérés pontatlan lesz. Másrészről nagyon magas Kd megoszlási koefficiensnél akár 1:100 talaj/oldat arányig is el lehet menni ahhoz, hogy jelentős mennyiségű tesztanyag maradjon az oldatban. Gondot kell azonban fordítani az alapos keverésre, és megfelelő időt kell hagyni a rendszernek az egyensúlyi állapot eléréséhez. Az ilyen szélsőséges esetek kezelésének másik megközelítése, ha a megfelelő elemzési módszertan hiányzik, a Kd érték előrejelzése pl. a Pow értékeken alapuló becslési technikákkal (3. függelék). Ez az eljárás különösen hasznos lehet kevéssé adszorbeálódó/poláros vegyszerek esetén, amelyeknél Pow < 20, valamint a lipofil/nagy abszorpcióképességű vegyszerek esetén, amelyeknél Pow > 104.
1.9. A VIZSGÁLAT VÉGREHAJTÁSA
1.9.1. Vizsgálati körülmények
Minden kísérletet szobahőmérsékleten és – ha lehetséges – 20 oC és 25 oC közötti állandó hőmérsékleten végeznek el.
A centrifugálási feltételeknek lehetővé kell tennie a 0,2 μm-nél nagyobb részecskék kiülepedését az oldatból. Ez az érték a legkisebb méretű olyan részecskékre vonatkozik, amelyek még szilárd részecskéknek minősülnek, és ez a határérték a szilárd és kolloid részecskék között. A centrifugálási feltételek meghatározására vonatkozó iránymutatás a 4. függelékben szerepel.
Ha a centrifugálóberendezés nem tudja garantálni a 0,2 μm-nél nagyobb részecskék ülepítését, akkor alkalmazni lehet a centrifugálás és 0,2 μm-es pórusméretű filterrel történő szűrés kombinációját. Ezeket a szűrőket alkalmas inert anyagból kell készíteni, hogy el lehessen kerülni a szűrés folyamán bekövetkező veszteségét. Minden esetben bizonyítani kell, hogy a szűrés során nem következik be a vizsgált anyag vesztesége.
1.9.2. 1. szint – előzetes vizsgálat
Az előzetes vizsgálat elvégzésének célját már meghatározta az Alkalmazási kör című szakasz. Az ilyen vizsgálat összeállítására vonatkozó iránymutatást az alább javasolt kísérlet adja meg.
1.9.2.1. Optimális talaj/oldat arányok kiválasztása
Két talajtípust és három talaj/oldat arányt használnak (hat kísérlet). Az egyik talajtípus magas szervesszén- és alacsony agyagtartalommal rendelkezik, a másik pedig alacsony szervesszén-és magas agyagtartalommal. A következő talaj-oldat arányok használata javasolt:
|
— |
50 g talaj és a vizsgált anyag vizes oldatának 50 cm3 mennyisége (1:1 arány), |
|
— |
10 g talaj és a vizsgált anyag vizes oldatának 50 cm3 mennyisége (1:5 arány), |
|
— |
2 g talaj és a vizsgált anyag vizes oldatának 50 cm3 mennyisége (1:25 arány). |
A minimális talajmennyiség, amellyel a kísérletet el lehet végezni, a laboratóriumi eszközöktől és az alkalmazott elemzési módszerek teljesítőképességétől függ. Ajánlatos legalább 1 g használata, előnyösebb azonban a 2 g a vizsgálat megbízható eredményeinek biztosítására.
Egy kontrollmintát, amely csak a vizsgált anyag 0,01 M CaCl2-oldatát tartalmazza (talajt nem), pontosan ugyanazoknak a lépéseknek kell alávetnünk, mint a vizsgálati rendszereket, annak érdekében, hogy ellenőrizni lehessen a vizsgált anyag stabilitását CaCl2-oldatban és annak esetleges adszorpcióját a tesztedények falán.
Talajmintánként elvégeznek egy vakpróbát, amely során azonos mennyiségű talajt és 50 cm30,01 M CaCl2-oldatot (vizsgált anyag nélkül) pontosan ugyanazoknak a lépéseknek vetnek alá, mint a vizsgálati rendszereket. Ez háttérkontrollként szolgál az elemzés során az interferáló anyagok vagy szennyezett talajok kiszűrésére.
Minden kísérletet, beleértve a kontroll és vak kísérleteket, legalább kétszer kell elvégezni. A vizsgálathoz összesen előkészítendő minták számát az alapul szolgáló módszertan segítségével lehet kiszámítani.
Az előzetes vizsgálat és a fő vizsgálat módszerei általában azonosak, a kivételeket megemlítjük, ahol ez jelentőséggel bír.
A levegőn szárított talajmintákat rázással hozzuk egyensúlyi helyzetbe, legalább 45 cm30,01 M CaCl2-oldattal, a kísérlet napja előtti éjszakán (12 órával előbb). Ezt követően a vizsgált anyag törzsoldatának megfelelő mennyiségét hozzáadják, azért hogy a végleges térfogat 50 cm3 legyen. A törzsoldat így hozzáadott mennyisége: a) nem haladhatja meg az 50 cm3-es végtérfogat 10 %-át, hogy a lehető legkevésbé változtassa meg az egyensúlyba hozatal előtt az oldat jellegét; és b) lehetőleg az elemzési módszer kimutatási határértékénél legalább két nagyságrenddel nagyobb kiindulási koncentrációt eredményezzen a talajjal érintkező vizsgált anyag kiindulási koncentrációjában (C0); ez a küszöb lehetővé teszi a pontos méréseket még akkor is, ha erőteljes adszorpció (> 90 %) következik be, valamint az adszorpciós izotermák későbbi meghatározását. Ajánlatos továbbá, hogy az anyag kiindulási koncentrációja (C0) lehetőleg ne haladja meg az anyag oldhatósági határának felét.
Az alábbiakban bemutatnak egy példát a törzsoldat (Cst) koncentrációjának kiszámítására. Feltételeznek 0,01 μg cm-3 kimutatási határértéket és 90 % adszorpciót; így a vizsgált anyag talajjal érintkező kiindulási koncentrációja lehetőleg 1 μg cm-3 (a kimutatási határértéknél két nagyságrenddel nagyobb). Feltéve, hogy a törzsoldatból a rendszerhez a maximális ajánlott mennyiséget hozzáadják, azaz 5 cm3-t a 45 cm3 térfogatú 0,01 M CaCl2 ekvilibrációs oldathoz (a törzsoldat így a vizes fázis 50 cm3-es végtérfogatának 10 %-a), akkor a tömény oldat koncentrációja 10 μg cm-3 kell hogy legyen; ami három nagyságrenddel nagyobb, mint az elemzési módszer kimutatási határértéke.
A talajjal történő érintkezés előtt és után is meg kell mérni a vizes fázis pH-értékét, mivel ez fontos szerepet játszik a teljes adszorpciós folyamatban, különösen ionizálható anyagok esetén.
A keveréket addig rázzák, amíg eléri az adszorpciós egyensúlyi helyzetet. Az egyensúlyi helyzet elérésének ideje a talajokban igen változatos, a vegyi anyagtól és a talajtól is függ; 24 órás időszak általában elégséges (77). Az előzetes vizsgálatok végzésekor, a 48 órás rázatás során többször mintát vesznek (pl. 4., 8., 24. és 48. órában). Az elemzési időket rugalmasan kell kialakítani, a laboratórium munkarendjére tekintettel.
A vizsgált anyag vizes oldatában történő elemzésére két lehetőség van: a) párhuzamos módszer; és b) a „folytatásos” módszer. Hangsúlyozni kell, hogy bár a párhuzamos módszer alkalmazása időigényesebb, az eredmények matematikai feldolgozása egyszerűbb (5. függelék). A követendő módszer kiválasztását azonban a kísérletet végzőre hagyják, akinek figyelembe kell vennie a rendelkezésre álló laboratóriumi felszereléseket és eszközöket.
|
a) |
párhuzamos módszer: azonos talaj/oldat arányú mintákat készítenek elő, annyit, ahány időintervallumnál az adszorpciós kinetikát tanulmányozni kívánják. A centrifugálás, és amennyiben szükséges, szűrés után az első kémcső vizes fázisát a lehető legteljesebben visszaállítják és megmérik, pl. 4 óra után, a második kémcső esetében 8 óra után, a harmadik kémcső esetében 24 óra után stb. |
|
b) |
„folytatásos” módszer: mindegyik talaj/oldat arányhoz csak két minta készül. Meghatározott időközönként a keveréket centrifugálják a fázisok szétválasztása érdekében. A vizes fázisból kivett kis mennyiségű oldat tesztanyagtartalmát azonnal meghatározzák; ezt követően a kísérlet az eredeti keverékkel folytatódik. Ha a centrifugálás után szűrést is alkalmaznak, a laboratóriumban lennie kell olyan berendezésnek, amely a kis térfogatok szűrésére alkalmas. Ajánlatos az analízisre kivett mennyiségek össztérfogatát úgy meghatározni, hogy az ne haladja meg az oldat teljes térfogatának 1 %-át, hogy a talaj/oldat arány jelentősen ne változzon és a vizsgálat során az adszorpcióra rendelkezésre álló oldott anyag tömege ne csökkenjen. |
A százalékos adszorpciót ( ) minden (ti) időpontban kiszámítják a névleges kezdeti koncentráció és a mintavétel ti időpontjában mért koncentráció alapján, amelyet a vakminta kapott értékével korrigálunk. Elkészítik az
) minden (ti) időpontban kiszámítják a névleges kezdeti koncentráció és a mintavétel ti időpontjában mért koncentráció alapján, amelyet a vakminta kapott értékével korrigálunk. Elkészítik az  érték időfüggését ábrázoló görbét (5. függelék 1. ábra) az adszorpciós egyensúlyi plató elérésének megbecslése érdekében (29). Kiszámítják az egyensúlyi Kd értéket is. E Kd érték alapján az 1. ábráról kiválasztják a megfelelő talaj/oldat arányokat úgy, hogy az adszorpció elérje a 20 % feletti és lehetőleg > 50 % mértéket (61). Minden vonatkozó egyenletet és ábrázolási alapelvet tartalmaz az adatokról és jelentéskészítésről szóló szakasz és az 5. függelék.
érték időfüggését ábrázoló görbét (5. függelék 1. ábra) az adszorpciós egyensúlyi plató elérésének megbecslése érdekében (29). Kiszámítják az egyensúlyi Kd értéket is. E Kd érték alapján az 1. ábráról kiválasztják a megfelelő talaj/oldat arányokat úgy, hogy az adszorpció elérje a 20 % feletti és lehetőleg > 50 % mértéket (61). Minden vonatkozó egyenletet és ábrázolási alapelvet tartalmaz az adatokról és jelentéskészítésről szóló szakasz és az 5. függelék.
1.9.2.2. Adszorpciós ekvilibrációs idő és az egyensúlyi helyzetben adszorbeált vizsgált anyag mennyiségének meghatározása
Mint már említésre került, az  vagy
vagy  idő függvényében történő ábrázolása lehetővé teszi az adszorpciós egyensúlyi plató elérésének és az egyensúlyi állapotban adszorbeált vizsgált anyag mennyiségének becslését. Az 5. függelék 1. és 2. ábrája példákat mutat az ilyen grafikai ábrázolásra. Az ekvilibrációs időnek azon időszakot nevezik, amelyre a rendszernek a plató eléréséhez szüksége van.
idő függvényében történő ábrázolása lehetővé teszi az adszorpciós egyensúlyi plató elérésének és az egyensúlyi állapotban adszorbeált vizsgált anyag mennyiségének becslését. Az 5. függelék 1. és 2. ábrája példákat mutat az ilyen grafikai ábrázolásra. Az ekvilibrációs időnek azon időszakot nevezik, amelyre a rendszernek a plató eléréséhez szüksége van.
Ha egy adott talaj esetében nem plató, hanem folyamatos növekedés észlelhető, ez olyan tényezők miatt lehet, mint a biodegradáció vagy lassú diffúzió. A biodegradációt úgy lehet kimutatni, hogy a kísérletet a talaj sterilizált mintájával megismételjük. Ha még ebben az esetben sem jön létre a plató, a kísérletet végzőnek más jelenségeket kell keresnie, amelyek a konkrét vizsgálatban szerepet játszhatnak; ezt a kísérleti feltételek (hőmérséklet, rázási idő, talaj/oldat arányok) megfelelő módosításával lehet elvégezni. A kísérletet végzőre hárul annak eldöntése, hogy a vizsgálati eljárást folytatja-e annak dacára, hogy esetleg nem sikerül egyensúlyi állapotot elérni.
1.9.2.3. Adszorpció a tesztedény falán és a vizsgált anyag stabilitása
A kontrollminták elemzésével bizonyos információkat lehet nyerni a vizsgált anyagnak a tesztedény falán történő adszorpciójáról, valamint annak stabilitásáról. Ha az elemzési módszer standard eltérését meghaladó koncentrációcsökkenést figyelnek meg, felmerülhet az abiotikus bomlás és/vagy adszorpció a tesztedény falán. E két jelenséget úgy lehet megkülönböztetni, hogy alaposan lemossák a tartály falát megfelelő oldószer ismert térfogatával, és a nyert oldat tesztanyagtartalmát meghatározzák. Ha a tesztedény falán nem figyelnek meg adszorpciót, a koncentrációcsökkenés a vizsgált anyag abiotikus instabilitását mutatja. Ha adszorpciót észlelnek, a tesztet más anyagból készült edényben kell kivitelezni. Az e kísérletből adódó, a tesztedények falán történő adszorpcióra vonatkozó adatokat azonban nem lehet közvetlenül kivetíteni a talaj/oldat kísérletre. A talaj jelenléte is befolyásolja ezen adszorpciót.
A vizsgált anyag stabilitására vonatkozó további információt az anyag tömegegyensúlyának az idő függvényében történő meghatározásával lehet nyerni. Ez azt jelenti, hogy a vizes fázist, a talajt és a tesztedény falait a vizsgált anyagra nézve elemzik. A hozzáadott vizsgált tesztanyagtömege és a vizsgált vegyi anyag vizes fázisú tömegének, a talaj kivonatoknak és a tesztedény falain adszorbeált anyag tömegének összege közötti különbözet a lebomlott, elpárolgott, illetve a nem extrahált tömeggel egyenlő. A tömegegyensúly meghatározásának elvégzéséhez az szükséges, hogy a kísérlet időtartama alatt megvalósuljon az adszorbciós egyensúlyi helyzet.
A tömegegyensúlyt mindkét talaj esetében talajonként egyetlen olyan talaj/oldat arány esetében határozzák meg, amikor a tesztanyag mennyiségének csökkenése 20 % feletti, illetve lehetőleg 50 % feletti az egyensúlyi állapotban. Amikor a talaj/oldat arány meghatározására irányuló vizsgálatban az utolsó vizesfázis-minta analízisét 48 óra után befejezik, a fázisokat centrifugálással, és ha szükséges, szűréssel szétválasztják. A vizes fázist a lehető legnagyobb mértékben eltávolítják, és a vizsgált anyag extrahálása érdekében megfelelő extraháló oldószert (legalább 95 % extrakciós együttható) adnak a talajhoz. Legalább két egymást követő extrahálás ajánlott. Meghatározzák a talajban és a tesztedények falán extraktumokban lévő vizsgáltanyag-mennyiséget és kiszámítják a tömegegyensúlyt (10. egyenlet, Adatok és jelentéskészítés). Ha ez 90 %-nál kevesebb, a vizsgált anyag a vizsgálat időtartamára nézve instabilnak minősül. A vizsgálatot azonban a vizsgált anyag instabilitásának figyelembevételével folytatni lehet; ebben az esetben ajánlatos a fő vizsgálat során mindkét fázis elemzése.
1.9.2.4. 2. szint – Adszorpciós kinetika a vizsgált anyag egyetlen koncentrációjánál
Öt, az 1. táblázatból kiválasztott talajt használnak. Az előzetes vizsgálatban használt egy vagy több talaj alkalmazása előnyös. Ebben az esetben a 2. szintet nem kell megismételni az előzetes vizsgálatban használt talajokra nézve.
Az ekvilibrációs időt, a talaj/oldat arányt, a bemérendő talaj tömegét, a vizes fázis talajjal érintkező térfogatát és a vizsgált anyag koncentrációját az oldatban az előzetes vizsgálat eredményei alapján választják ki. Az elemzést lehetőleg kb. 2, 4, 6, 8 (esetleg 10) és 24 órás kezelést követően kell elvégezni; a rázási időt legfeljebb 48 órára meg lehet hosszabbítani, amennyiben a megfelelő talaj/oldat arány meghatározására irányuló vizsgálatok alapján hosszabb ekvilibrációs időre van szükség. Az elemzés időpontjait azonban rugalmasan lehet kezelni.
Mindegyik kísérletet (egy talaj és egy oldat) legalább kétszer kell elvégezni, hogy elemezni lehessen az eredmények varienciáját. Minden kísérletnél egy vakpróbát is végeznek. Ez a talajból és 0,01 M CaCl2-oldatból áll, amely vizsgált anyagot nem tartalmaz, és tömegét és térfogatát tekintve megegyezik a kísérletben alkalmazottakkal. A nem várt tényezők kiszűrésére ugyanazon vizsgálati eljárásnak vetik alá az ellenőrző mintát is, amely csak a vizsgált anyagot tartalmazza 0,01 M CaCl2-oldatban (talaj nélkül).
Mindegyik  időpontban vagy
időpontban vagy  időintervallumban (a követelményeknek megfelelően) kiszámítják a százalékos adszorpciót és az idő függvényében ábrázolják. Kiszámítják továbbá az egyensúlyi deszorpciós együtthatót (Kd), valamint a szerves szénre vonatkoztatott adszorpciós együtthatót (Koc) (apoláros szerves vegyületekre).
időintervallumban (a követelményeknek megfelelően) kiszámítják a százalékos adszorpciót és az idő függvényében ábrázolják. Kiszámítják továbbá az egyensúlyi deszorpciós együtthatót (Kd), valamint a szerves szénre vonatkoztatott adszorpciós együtthatót (Koc) (apoláros szerves vegyületekre).
Az adszorpciós kinetikai vizsgálat eredményei:
A lineáris Kd-érték általában pontosan írja le egy anyag szorpciós tulajdonságait (35), (78) és kifejezi a talajban található vegyszerek jellemző mobilitását. Például általában a Kd < 1 cm3 g-1 jellemzőjű vegyszerek kvalitatívan mobilnak minősülnek. Hasonló, a Koc-értékeken alapuló mobilitási besorolási rendszert dolgoztak ki MacCall és munkatársai (16). Ezenkívül a Koc és DT-50 (30) közötti viszony alapján ki oldódási besorolási rendszerek is léteznek (32) (79).
Az eltérések analízise szerint továbbá (61) a 0,3 cm3 g-l alatti Kd értékeket nem lehet pontosan becsülni a vizes fázisban a koncentráció csökkenése alapján, még a (pontosság szempontjából) legkedvezőbb talaj/oldat arány, azaz az 1:1 arány alkalmazásánál sem. Ebben az esetben ajánlatos mindkét fázis – talaj és oldat – elemzése.
A fenti megállapításokra tekintettel ajánlatos valamely anyag talajban tanúsított adszorpciós viselkedésére és mobilitási potenciáljára irányuló vizsgálatot lefolytatni, amely során az adszorpciós izotermákat Freundlich elmélete szerint határozzák meg. Ehhez pedig – ha a tesztmódszerben megjelölt vizsgálati eljárást alkalmazzuk –, a Kd értéke pontosan meghatározható. A pontos meghatározás akkor lehetséges, ha a Kd-t a talaj/oldat arányával megszorozva az eredmény > 0,3, és ha a koncentráció vizes fázisbeli csökkenésére alapulnak a mérések (közvetett módszer), vagy Kd > 0,1, ha mindkét fázist elemzik (közvetlen módszer) (61).
1.9.2.5. 3. szint – Adszorpciós izotermák és deszorpciós kinetika/deszorpciós izotermák
1.9.2.5.1.
Öt vizsgált anyagkoncentrációt alkalmaznak, amelyek lehetőleg két nagyságrendet fednek le; e koncentrációk kiválasztásában figyelembe kell venni a vízoldhatóságot és az előálló vizes egyensúlyi koncentrációkat. A vizsgálat során azonos talaj/oldat arányt kell fenntartani az egyes talajokra nézve. Az adszorpciós vizsgálatot a fent ismertettek szerint végzik el, azzal az egy különbséggel, hogy a vizes fázist csak egyszer, (a 2. szint vizsgálatai alapján) az egyensúly kialakulásához szükséges idő elteltével határozzák meg. Megmérik az oldat egyensúlyi koncentrációját, és az adszorbeált mennyiséget vagy a vizsgált anyagnak az oldatbeli kimerüléséből vagy a közvetlen módszerből számítják ki. A talaj által grammonként adszorbeált tömeget a vizsgált anyag egyensúlyi koncentrációjának függvényeként ábrázolják (lásd Adatok és jelentéskészítés).
Az adszorpciós izotermák meghatározására irányuló vizsgálatok eredményei:
Az eddig javasolt matematikai adszorpciós modellek közül a Freundlich-féle izoterma az egyik leggyakrabban használt, adszorpciós folyamatok leírására szolgáló modell. Az adszorpciós modellek értelmezésére és fontosságára vonatkozóan részletesebb információ a szakirodalomban található (41) (45) (80) (81) (82).
Megjegyzés: Meg kell említeni, hogy a különböző anyagok KF (Freundlich-féle adszorpciós koefficienst) értékeinek összehasonlítása csak akkor lehetséges, ha ezeket a KF-értékeket azonos mértékegységben fejezik ki (83).
1.9.2.5.2.
E kísérlet célja annak vizsgálata, hogy valamely vegyszer reverzibilisen vagy irreverzibilisen adszorbeálódik-e valamely talajban. Ez az információ fontos, mivel a deszorpciós folyamat is fontos szerepet játszik a vegyszerek környezeti talajban tanúsított magatartásában. Ezen túlmenően a deszorpciós adatok hasznos bemenő adatokat jelentenek az átmosódás és a kioldódás szimulált számítógépes modellezéséhez. Ha deszorpciós vizsgálatot kívánnak végezni, ajánlatos az alábbiakban ismertetett vizsgálatot minden egyes rendszerre elvégezni, amelyre nézve a megelőző adszorpciós kinetikai kísérlet során pontosan meg lehetett határozni a Kd-értéket.
Hasonlóan az adszorpciós kinetikai vizsgálathoz, a deszorpciós kinetikai kísérletnél két lehetőség szerint lehet eljárni: a) a párhuzamos módszer; és b) a „folytatásos” módszer. A követendő módszertan kiválasztása a kísérletet végzőn múlik, akinek figyelembe kell vennie a rendelkezésre álló laboratóriumi felszereléseket és eszközöket.
|
a) |
párhuzamos módszer: mindegyik talajra nézve, amelyet a deszorpciós vizsgálat elvégzésére kiválasztanak, azonos talaj/oldat arányú mintákat készítenek, annyit, ahány időintervallumra vizsgálni kívánják a deszorpciós kinetikát. Lehetőség szerint ugyanazokat az időintervallumokat kell használni, mint az adszorpciós kinetikai kísérletnél; a teljes időtartamot azonban meg lehet hosszabbítani annak érdekében, hogy a rendszer elérje a deszorpciós egyensúlyt. Minden kísérletben (egy talaj, egy oldat) egy vakmintát is vizsgálnak. Ez a talajból és 0,01 M CaCl2 oldatból áll, vizsgált anyagot nem tartalmaz, tömegét és térfogatát tekintve megegyezik a kísérletben alkalmazottakkal. Kontrollmintaként a vizsgált anyag 0,01 M CaCl2 oldatban (talaj nélkül) oldott formáját azonos vizsgálati eljárásnak vetik alá. Az összes talaj os keveréket addig rázzák, amíg eléri az adszorpciós egyensúlyi helyzetet (a korábban a 2. szintnél meghatározott módon). Ezt követően a fázisokat centrifugálással szétválasztják, és a vizes fázisokat a lehető legnagyobb mértékben eltávolítják. Az eltávolított oldat térfogatát azonos térfogatú 0,01 M CaCl2-oldattal helyettesítik vizsgált anyag nélkül, és az új keverékeket újra rázatják. Az első kémcső vizes fázisát a lehető legnagyobb mértékben eltávolítják, és elemzik, pl. 2 óra után, a második kémcsőét 4 óra után, a harmadik kémcsőét 6 óra után stb., amíg a deszorpciós egyensúlyt elérik. |
|
b) |
„folytatásos” módszer: az adszorpciós kinetikai kísérletet követően a keveréket centrifugálják, és a vizes fázist a lehető legnagyobb mértékben eltávolítják. Az eltávolított oldat térfogatát azonos térfogatú 0,01 M CaCl2-oldattal, vizsgált anyag nélkül pótolják. Az új keveréket addig rázzák, amíg eléri a deszorpciós egyensúlyi helyzetet. Ezen időszak alatt, meghatározott időközönként a keveréket centrifugálják, hogy a fázisokat szétválasszák. A vizes fázis egy kis aliquot részét azonnal elemzik a vizsgált anyagra nézve; majd a kísérlet az eredeti keverékkel folytatódik. Az egyes kivett aliquotok térfogata az oldat össztérfogatának 1 %-ánál kevesebb. A keverékhez azonos mennyiségű friss 0,01 M CaCl2-oldatot adnak a talaj oldat arány fenntartásához, és a rázás a következő időintervallumig folytatódik. |
A százalékos deszorpciót mindegyik  időpontban és/vagy
időpontban és/vagy  időintervallumban (a vizsgálat szükségleteinek megfelelően) kiszámítják, és az idő függvényében ábrázolják. Az egyensúlyi Kdes deszorpciós koefficienst is kiszámítják. Az összes vonatkozó egyenlet szerepel az Adatok és jelentéskészítés szakaszban, valamint az 5. függelékben.
időintervallumban (a vizsgálat szükségleteinek megfelelően) kiszámítják, és az idő függvényében ábrázolják. Az egyensúlyi Kdes deszorpciós koefficienst is kiszámítják. Az összes vonatkozó egyenlet szerepel az Adatok és jelentéskészítés szakaszban, valamint az 5. függelékben.
Deszorpciós kinetikai kísérletek eredményei:
A deszorpció  és a százalékos adszorpció
és a százalékos adszorpció  idő függvényében létrehozható közös ábrái lehetővé teszik az adszorpciós folyamat reverzibilitásának becslését. Ha a deszorpciós egyensúlyt még az adszorpciós egyensúly kialakulásához szükséges idő kétszeresén belül elérik, és az összdeszorpció az adszorbeált mennyiség 75 %-ánál több, az adszorpció reverzibilisnek minősül.
idő függvényében létrehozható közös ábrái lehetővé teszik az adszorpciós folyamat reverzibilitásának becslését. Ha a deszorpciós egyensúlyt még az adszorpciós egyensúly kialakulásához szükséges idő kétszeresén belül elérik, és az összdeszorpció az adszorbeált mennyiség 75 %-ánál több, az adszorpció reverzibilisnek minősül.
1.9.2.5.3.
A Freundlich-féle deszorpciós izotermákat az adszorpciós izoterma kísérlethez használt talajokra határozzák meg. A deszorpciós vizsgálatot a Deszorpciós kinetika című szakaszban ismertetettek szerint folytatják le, azzal az egyetlen különbséggel, hogy a vizes fázist csak egyszer, a deszorpciós egyensúlyi helyzetben elemzik. Kiszámítják a deszorbeálódott vizsgált anyag mennyiségét. A deszorpciós egyensúlyi helyzetben a talajban adszorbeáltan maradó vizsgáltanyag-tartalmat a vizsgált anyag oldatban lévő egyensúlyi koncentrációjának függvényében ábrázolják (lásd az Adatok és jelentés készítés című szakaszt és az 5. függeléket).
2. ADATOK ÉS JELENTÉSKÉSZÍTÉS
Az elemzésből kapott adatokat táblázat formájában mutatják be (lásd 6. függelék). Megadják az egyedi mérések eredményeit és a számított átlagokat. Az adszorpciós izotermák grafikus megjelenítését is csatolják. A számításokat az alábbiakban leírtak szerint végzik.
Feltételezik, hogy 1 cm3 vizes oldat tömege 1 g. A talaj/oldat arányt tömeg/tömeg vagy tömeg/térfogatömeg/térfogat egységekben azonos mértékegységgel lehet kifejezni.
2.1. ADSZORPCIÓ
Az  adszorpciót a vizsgálati feltételek mellett a talajban adszorbeált anyagnak a vizsgálat kezdetekor jelen lévő mennyiségéhez viszonyított százalékos arányban határozzák meg. Ha a vizsgált anyag stabil, és jelentősen nem adszorbeálódik a tesztedény falán, az
adszorpciót a vizsgálati feltételek mellett a talajban adszorbeált anyagnak a vizsgálat kezdetekor jelen lévő mennyiségéhez viszonyított százalékos arányban határozzák meg. Ha a vizsgált anyag stabil, és jelentősen nem adszorbeálódik a tesztedény falán, az  értéket mindegyik ti időpontban a következő egyenlet szerint számítják ki:
értéket mindegyik ti időpontban a következő egyenlet szerint számítják ki:
|
|
(3) |
ahol:
|
|
= |
adszorpció mértéke a ti időpontban ( %); |
|
|
= |
a vizsgált anyag talajban adszorbeált tömege ti időpontban (μg); |
|
m0 |
= |
a vizsgált anyag tömege a kémcsőben a vizsgálat kezdetén (μg). |
Az  százalékos adszorpció arányának a párhuzamos és a „folytatásos” módszer szerinti kiszámítására vonatkozó részletes információt az 5. függelék adja meg.
százalékos adszorpció arányának a párhuzamos és a „folytatásos” módszer szerinti kiszámítására vonatkozó részletes információt az 5. függelék adja meg.
A Kd megoszlási koefficiens a talaj fázisban lévő anyagtartalom és a vizes oldatban található anyag tömegkoncentrációjának aránya azon vizsgálati feltételek mellett, amikor beáll az adszorpciós egyensúlyi helyzet.
|
|
(4) |
ahol:
|
|
= |
a talajban adszorbeált anyagtartalom adszorpciós egyensúlyi helyzetben (μg.g-1) |
|
|
= |
az anyag tömegkoncentrációja a vizes fázisban adszorpciós egyensúlyi helyzetben (μg.cm-3). Ezt a koncentrációt analitikusan, a vakpróbákból származó értékek figyelembevételével határozzák meg; |
|
|
= |
a vizsgált anyag talajban adszorbeálódott tömege adszorpciós egyensúlyi helyzetben (μg) |
|
|
= |
a vizsgált anyag tömege az oldatban adszorpciós egyensúlyi helyzetben (μg) |
|
Mtalaj |
= |
a talajfázis mennyisége, talaj szárazanyag-tartalomban kifejezve (g) |
|
V0 |
= |
a talajjal érintkező vizes fázis kiindulási térfogata (cm3) |
The relation between Aeq and Kd is given by
|
|
(5) |
ahol:
|
Aeq |
= |
az adszorpció mértéke adszorpciós egyensúlyi helyzetben, %. |
A szervesszén-tartalomra vonatkoztatott Koc adszorpciós koefficiens a Kd megoszlási koefficienst a talajminta szervesszén-tartalmához viszonyítja:
|
|
(6) |
ahol:
|
%OC |
= |
a szerves szén aránya a talajmintában (g g-1). |
A Koc koefficiens olyan érték, amely önmagában jellemzi a nagyobbrészt apoláros szerves vegyületeknek a talajok vagy üledékek szervesszén-tartalma és a víz közötti megoszlását. E vegyszerek adszorpcióját a szorbeáló szilárd anyag szervesanyag-tartalmával korrelálják (7); így a Koc értékek a humuszfrakciók specifikus jellemzőitől függnek, amelyek jelentősen eltérnek szorpciós kapacitás tekintetében, az eredet, képződés stb. eltérései miatt.
2.1.1. Adszorpciós izotermák
A Freundlich-féle adszorpciós izoterma egyenlet az adszorbeált vizsgált anyag mennyiségét az egyensúlyi helyzetben lévő oldatban található vizsgáltanyag-koncentrációjához viszonyítja (8. egyenlet).
Az adatokat az „Adszorpció” című pont alatt ismertetett módon kezelik, és mindegyik kémcsőben kiszámítják az adszorpciós vizsgálat után a talajon adszorbeálódott vizsgált anyag tartalmat ( ), amelyet máshol x/m-ként jelölnek). Feltételezik, hogy az egyensúlyi helyzet beállt, és a
), amelyet máshol x/m-ként jelölnek). Feltételezik, hogy az egyensúlyi helyzet beállt, és a  ) az egyensúlyi értéket mutatja:
) az egyensúlyi értéket mutatja:
|
|
(7) |
A Freundlich-féle adszorpciós egyenlet a következő (8):
|
|
(8) |
vagy lineáris formában:
|
|
(9) |
ahol:
|
|
= |
Freundlich-féle adszorpciós koefficiens: mértékegysége cm3 g-1. ha 1/n = 1; minden más esetben az 1/n meredekséget a |
|
n |
= |
regressziós konstans; az 1/n általában 0,7–1,0 között van, ami azt jelzi, hogy a szorpciós adatok gyakran nem teljesen lineárisak. |
A (8) és (9) egyenletet ábrázolják és a  és 1/n értékeket regressziós analízissel elemzik a 9. egyenlet alkalmazásával. A logaritmusos egyenlet r2 korrelációs koefficiensét is kiszámítják. Az ilyen ábrázolás egy példáját mutatja be a 2. ábra.
és 1/n értékeket regressziós analízissel elemzik a 9. egyenlet alkalmazásával. A logaritmusos egyenlet r2 korrelációs koefficiensét is kiszámítják. Az ilyen ábrázolás egy példáját mutatja be a 2. ábra.

2.1.2. Tömegegyensúly
A tömegegyensúlyt (MB) az adszorpciós vizsgálatot követően analitikusan visszanyerhető anyag és az anyagnak a vizsgálat kezdetekor meglévő névleges mennyisége arányaként határozzák meg.
Az adatok kezelése attól függ, hogy az oldószer mennyiben elegyedik a vízzel. A vízzel elegyedő oldószerek esetén a „Deszorpció” cím alatt ismertetett módon lehet az adatokat kezelni az oldószer kivonása révén visszanyert anyagmennyiség meghatározásához. Ha az oldószer kevésbé elegyedik a vízzel, meg kell határozni a visszanyert tesztanyagmennyiséget.
Az adszorpciós tömegegyensúlyt (MB) a következőképpen számítják ki; feltételezik, hogy a (mE) kifejezés megfelel a talajból és a tesztedény faláról szerves oldószerrel extrahált tömegek összegének:
|
|
(10) |
ahol:
|
MB |
= |
tömegegyensúly ( %) |
|
mE |
= |
a talajból és a tesztedény falairól két lépésben extrahált vizsgált anyag össztömege (μg) |
|
C0 |
= |
a talajjal érintkezésben lévő vizsgált oldat kiindulási tömegkoncentrációja (μg cm-3) |
|
Vrec |
= |
az adszorpciós ekvilibriumban visszanyert felülúszó térfogata (cm3. |
2.2. DESZORPCIÓ
A (D) deszorpciót a vizsgálat feltételei mellett deszorbeált vizsgált anyagnak a korábban adszorbeált anyagmennyiségéhez viszonyítva határozzák meg:
|
|
(11) |
ahol:
|
|
= |
deszorpció mértéke ti időpontban ( %) |
|
|
= |
a vizsgált anyag talajból deszorbeált tömege ti időpontban (μg) |
|
|
= |
a vizsgált anyag talajon adszorbeált tömege adszorpciós egyensúlyi helyzetben (μg). |
A párhuzamos és „folytatásos” módszerek esetén a  deszorpció arányának kiszámítására vonatkozó részletes információ az 5. függelékben található.
deszorpció arányának kiszámítására vonatkozó részletes információ az 5. függelékben található.
A vizsgálati feltételek mellett a Kdes látszólagos deszorpciós koefficiens a talajfázisban maradó anyagtartalom és a vizes oldatban deszorbeálódott anyag tömegkoncentrációjának aránya a deszorpciós egyensúly elérésekor:
|
|
(12) |
ahol:
|
Kdes |
= |
deszorpciós koefficiens (cm3 g-1) |
|
|
= |
a vizsgált anyag talajból deszorbeálódott össztömege deszorpciós egyensúlyi helyzetben (μg) |
|
VT |
= |
a talajjal érintkező vizes fázis össztérfogata a deszorpciós kinetikai kísérlet során (cm3). |
Az  kiszámítására vonatkozó útmutatás az 5. függelékben a „Deszorpció” cím alatt található.
kiszámítására vonatkozó útmutatás az 5. függelékben a „Deszorpció” cím alatt található.
Megjegyzés:
Ha az előbbi adszorpciós vizsgálatot a párhuzamos módszerrel végezték, a 12. egyenletben a VT térfogat egyenlő a V0 térfogattal.
2.2.1. Deszorpciós izotermák
A Freundlich-féle deszorpciós izoterma egyenlet a talajban adszorbeáltan maradó vizsgáltanyag-tartalmat a deszorpciós egyensúlyi helyzetben az oldatban maradó vizsgált anyag koncentrációhoz viszonyítja (16. egyenlet).
Az egyes kémcsövekre nézve a deszorpciós egyensúlyi helyzetben talajban adszorbeáltan maradó anyagtartalmat a következőképpen számítják ki:
|
|
(13) |
definíciója:
|
|
(14) |
ahol:
|
|
= |
a talajon adszorbeálva maradó vizsgált anyagtartalom deszorpciós egyensúlyi helyzetbe11 (μg g-1) |
|
|
= |
a vizsgált anyag analitikus módon meghatározott tömege a vizes fázisban deszorpciós egyensúlyi helyzetben (μg) |
|
|
= |
a vizsgált anyagnak az adszorpciós egyensúlyi helyzet elérését követően a tökéletlen folyadékeltávolítás miatt fennmaradt tömege (μg) |
|
|
= |
az anyag tömege az oldatban adszorpciós egyensúlyi helyzetben (µg) |
|
|
(15) |
|
|
= |
a kémcsőből a vizsgált anyag mérésére kivett oldat térfogata deszorpciós egyensúlyi helyzetben (cm3) |
|
VR |
= |
az adszorpciós egyensúlyi helyzet elérését követően a kémcsőből eltávolított telülúszó és azonos tértogatú 0,01 M CaCl2-oldattal pótolt térfogat (cm3) |
A Freundlich-féle deszorpciós egyenlet a következő:
|
|
(16) |
vagy lineáris formában:
|
|
(17) |
ahol:
|
|
= |
Freundlich-féle deszorpciós koefficiens |
|
n |
= |
regressziós konstans |
|
|
= |
az anyag tömegkoncentrációja a vizes fázisban deszorpciós egyensúlyi helyzetben (μg.cm-1). |
A 16. és 17. egyenletet ábrázolni lehet, és a  és 1/n értékét a 17. egyenlet alapján regressziós analízissel számítják ki.
és 1/n értékét a 17. egyenlet alapján regressziós analízissel számítják ki.
Megjegyzés:
Ha a Freundlich-féle adszorpciós vagy deszorpciós exponens 1/n egyenlő 1-gyel, a Freundlich-féle adszorpciós vagy deszorpciós kötési állandó ( és
és  ) egyenlő az adszorpciós, illetve deszorpciós egyensúlyi állandóval (Kd és Kdes), és a Cs ábrázolása a Caq függvényében lineáris lesz. Ha az exponensek nem egyenlők 1-gyel, a Cs ábrázolása a Caq függvényében nem lineáris és az adszorpciós és deszorpciós állandók az izotermák mentén változnak.
) egyenlő az adszorpciós, illetve deszorpciós egyensúlyi állandóval (Kd és Kdes), és a Cs ábrázolása a Caq függvényében lineáris lesz. Ha az exponensek nem egyenlők 1-gyel, a Cs ábrázolása a Caq függvényében nem lineáris és az adszorpciós és deszorpciós állandók az izotermák mentén változnak.
2.2.2. Vizsgálati jelentés
A vizsgálati jelentésben a következő információknak kell szerepelniük:
|
— |
a felhasznált talajminták részletes jellemzése, beleértve: |
|
— |
a származási hely földrajzi azonosítása (szélességi, hosszúsági fok), |
|
— |
mintavétel dátuma, |
|
— |
használat jellege (pl. termőföld, erdő stb.), |
|
— |
mintavételi mélység, |
|
— |
homok-/vályog-/agyagtartalom, |
|
— |
pH-értékek (0,01 M CaCl2-ben), |
|
— |
szervesszén-tartalom, |
|
— |
szervesanyag-tartalom, |
|
— |
nitrogéntartalom, |
|
— |
C/N arány, |
|
— |
kationcsere-kapacitás (mmol/kg), |
|
— |
a talajminták gyűjtésével és tárolásával kapcsolatos minden információ, |
|
— |
adott esetben a vizsgált anyag adszorpciójának/deszorpciójának értelmezésére vonatkozó összes releváns információ, |
|
— |
az egyes paraméterek meghatározásához használt módszerek felsorolása, |
|
— |
a vizsgált anyagra vonatkozó információ (szükség szerint), |
|
— |
a vizsgálati hőmérsékletek, |
|
— |
a centrifugálás körülményei, |
|
— |
a vizsgált anyag elemzésénél alkalmazott analitikus eljárás, |
|
— |
a vizsgált anyag törzsoldatának elkészítéséhez használt bármilyen, oldódást segítő anyag használatának indoklása, |
|
— |
a számításokban végrehajtott korrekciók magyarázata, amennyiben releváns, |
|
— |
az adatlapon feltüntetendő adatok (6. függelék) és a grafikonok, |
|
— |
a vizsgálati eredmények értelmezéséhez segítséget nyújtó minden információ és megfigyelés. |
3. SZAKIRODALOM
|
(1) |
Kukowski h. and Brümmer G., (1987). Investigations on the Adsorption and Desorption of Selected Chemicals in Soils. UBA Report 106 02045. Part II. |
|
(2) |
Fränzle O., Kuhnt G. and Vetter L., (1987) Selection of Representative Soils in the EC-Territory. UBA Report 106 02045. Part I. |
|
(3) |
Kuhnt G. and Muntau H. (Eds.) EURO-Soils: Identification, Collection, Treatment, Characterisation. Special Publication No 1.94.60, Joint Research Centre. European Commission, ISPRA, December 1994. |
|
(4) |
OECD Test Guidelines Programme, Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995 (June 1995). |
|
(5) |
US Environment Protection Agency: Pesticide Assessment Guidelines, Subdivision N, Chemistry: Environmental Fate, Series 163-1, Leaching and Adsorption/Desorption Studies, Addendum 6 on Data Reporting, 540/09-88-096, Date: 1/1988. |
|
(6) |
US Environment Protection Agency: Prevention, Pesticides and Toxic Substances, OPPTS Harmonized Test Guidelines Series 835-Fate, Transport and Transformation Test Guidelines, OPPTS No: 835.1220 Sediment and Soil Adsorption/Desorption Isotherm. EPA No: 712-C-96-048, April 1996. |
|
(7) |
ASTM Standards, E 1195-85, Standard Test Method for Determining a Sorption Constant (Koc) for an Organic Chemical in Soil and Sediments. |
|
(8) |
Agriculture Canada: Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada, 15 July 1987. |
|
(9) |
Netherlands Commission Registration Pesticides (1995): Application for registration of a pesticide. Section G. Behaviour of the product and its metabolites in soil, water and air. |
|
(10) |
Danish National Agency of Environmental Protection (October 1988): Criteria for registration of pesticides as especially dangerous to health or especially harmful to the environment. |
|
(11) |
BBA (1990), Guidelines for the Official Testing of Plant Protection Products, Biological Research Centre for Agriculture and Forestry, Braunschweig, Germany. |
|
(12) |
Calvet R., (1989), „Evaluation of adsorption coefficients and the prediction of the mobilities of pesticides in soils”, in Methodological Aspects of the Study of Pesticide Behaviour in Soil (ed. P. Jamet), FNRA, Paris, (Review). |
|
(13) |
Calvet R., (1980), „Adsorption-Desorption Phenomena” in Interactions between herbicides and the soil. (R. J. Hance ed.), Academic Press, London, pp. 83-122. |
|
(14) |
Hasset J. J., and Banwart W. L., (1989), „The sorption of nonpolar organics by soils and sediments” in Reactions and Movement of Organic Chemicals in Soils. Soil Science Society of America (S. S. S. A), Special Publication no. 22, pp. 31-44. |
|
(15) |
van Genuchten M. Th., Davidson J. M., and Wierenga P. J., (1974), „An evaluation of kinetic and equilibrium equations for the prediction of pesticide movement through porous media”. Soil Sci. Soc. Am. Proc, Vol. 38(1), pp. 29-35. |
|
(16) |
McCall P. J., Laskowski D. A., Swann R. L., and Dishburger H. J., (1981), „Measurement of sorption coefficients of organic chemicals and their use, in environmental fate analysis”, in Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington DC. |
|
(17) |
Lambert S. M., Porter P. E., and Schieferrstein R. H., (1965), „Movement and sorption of chemicals applied to the soil”. Weeds, 13, pp. 185-190. |
|
(18) |
Rhodes R. C, Belasco I. J., and Pease H. L., (1970) „Determination of mobility and adsorption of agrochemicals in soils”. J. Agric. Food Chem., 18, pp. 524-528. |
|
(19) |
Russell M. H., (1995), „Recommended approaches to assess pesticide mobility in soil” in Environmental Behavior of Agrochemicals (ed. T. R. Roberts and P. C. Kearney). John Wiley & Sons Ltd. |
|
(20) |
Esser H. O., Hemingway R. J., Klein W., Sharp D. B., Vonk J. W. and Holland P. T., (1988), „Recommended approach to the evaluation of the environmental behavior of pesticides”, IUPAC Reports on Pesticides (24). Pure Appl. Chem., 60, pp. 901-932. |
|
(21) |
Guth J. A., Burkhard N., and D. O. Eberle, (1976), „Experimental models for studying the persistence of pesticides in soils”. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, pp. 137-157, BCPC, Surrey, UK. |
|
(22) |
Furminge C. G. L., and Osgerby J. M., (1967), „Persistence of herbicides in soil”. J. Sci. Fd Agric, 18, pp. 269-273. |
|
(23) |
Burkhard N., and Guth J. A., (1981), „Chemical hydrolysis of 2-Chloro-4,6- bis(alkylamino)-l,3,5-triazine herbicides and their breakdown in soil under the influence of adsorption”. Pestic. Sci. 12, pp. 45-52. |
|
(24) |
Guth J. A., Gerber H. R., and Schlaepfer T., (1977), „Effect of adsorption, movement and persistence on the biological availability of soil-applied pesticides”. Proc. Br. Crop Prot. Conf, 3, pp. 961-971. |
|
(25) |
Osgerby J. M., (1973), „Process affecting herbicide action in soil”. Pestic. Sci., 4, pp. 247-258. |
|
(26) |
Guth J. A., (1972), „Adsorptions- und Einwascheverhalten von Pflanzenschutzmitteln in Böden”. Schr. Reihe Ver. Wass. -Boden-Lufthyg. Berlin-Dahlem, Heft 37, pp. 143-154. |
|
(27) |
Hamaker J. W., (1975), „The interpretation of soil leaching experiments”, in Environmental Dynamics of Pesticides (eds R. Haque and V. H. freed), pp. 135-172, Plenum Press, NY. |
|
(28) |
Helling C. S., (1971), „Pesticide mobility in soils”. Soil Sci. Soc. Amer. Proc, 35, pp. 732-210. |
|
(29) |
Hamaker J. W., (1972), „Diffusion and volatilization” in Organic chemicals in the soil environment (C. A. I. Goring and J. W. Hamaker eds), Vol. I, pp. 49-143. |
|
(30) |
Burkhard N. and Guth J. A., (1981), „Rate of volatilisation of pesticides from soil surfaces; Comparison of calculated results with those determined in a laboratory model system”. Pestic. Sci. 12, pp. 37-44. |
|
(31) |
Cohen S. Z., Creeger S. M., Carsel R. F., and Enfield C. G, (1984), „Potential pesticide contamination of groundwater from agricultural uses”, in Treatment and Disposal of Pesticide Wastes, pp. 297-325, Acs Symp. Ser. 259, American Chemical Society, Washington, DC. |
|
(32) |
Gustafson D. I., (1989), „Groundwater ubiquity score: a simple method for assessing pesticide teachability”. J. Environ. Toxic. Chem., 8(4), pp. 339-357. |
|
(33) |
Leistra M., and Dekkers W. A., (1976). „Computed effects of adsorption kinetics on pesticide movement in soils”. J. of Soil Sci., 28, pp. 340-350. |
|
(34) |
Bromilov R. H., and Leistra M., (1980), „Measured and simulated behavior of aldicarb and its oxydation products in fallow soils”. Pest. Sci., 11, pp. 389-395. |
|
(35) |
Green R. E., and Karickoff S. W., (1990), „Sorption estimates for modeling”, in Pesticides in the Soil Environment: Process, Impacts and Modeling (ed. H. H. Cheng). Soil Sci. Soc. Am., Book Series no. 2, pp. 80-101. |
|
(36) |
Lambert S. M., (1967), „Functional relationship between sorption in soil and chemical structure”. J. Agri. Food Chem., 15, pp. 572-576. |
|
(37) |
Hance R. J., (1969), „An empirical relationship between chemical structure and the sorption of some herbicides by soils”. J. Agri. Food Chem., 17, pp. 667-668. |
|
(38) |
Briggs G. G. (1969), „Molecular structure of herbicides and their sorption by soils”. Nature, 223, 1288. |
|
(39) |
Briggs G. G. (1981). „Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor”. J. Agric. Food Chem., 29, pp. 1050-1059. |
|
(40) |
Sabljic A., (1984), „Predictions of the nature and strength of soil sorption of organic polutance by molecular topology”. J. Agric. Food Chem., 32, pp. 243-246. |
|
(41) |
Bailey G. W., and White J. L., (1970), „Factors influencing the adsorption, desorption, and movement of pesticides in soil”. Residue Rev., 32, pp. 29-92. |
|
(42) |
Bailey G. W., J. L. White and Y. Rothberg., (1968), „Adsorption of organic herbicides by montomorillonite: Role of pH and chemical character of adsorbate”. Soil Sci. Soc. Amer. Proc. 32: pp. 222-234. |
|
(43) |
Karickhoff S. W., (1981), „Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils”. Chemosphere 10, pp. 833-846. |
|
(44) |
Paya-Perez A., Riaz M. and Larsen B., (1989), „Soil Sorption of 6 Chlorobenzenes and 20 PCB Congeners”. Environ. Toxicol. Safety 21, pp. 1-17. |
|
(45) |
Hamaker J. W., and Thompson J. M., (1972), „Adsorption in organic chemicals” in Organic Chemicals in the Soil Environment (Goring C. A. I. and Hamaker J. W., eds), Vol I and II, Marcel Dekker, Inc., New York, NY, 1972, pp. 49-143. |
|
(46) |
Deli J., and Warren G. F., 1971, „Adsorption, desorption and leaching of diphenamid in soils”. Weed Sci. 19: pp. 67-69. |
|
(47) |
Chu-Huang Wu, Buehring N., Davinson J. M. and Santelmann, (1975), „Napropamide Adsorption, desorption and Movement in soils”. Weed Science, Vol. 23, pp. 454-457. |
|
(48) |
Haues M. H. B., Stacey M., and Thompson J. M., (1968), „Adsorption of s-triazine herbicides by soil organic preparations” in Isotopes and Radiation in Soil Organic Studies, p. 75, International. Atomic Energy Agency, Vienna. |
|
(49) |
Pionke H. B., and Deangelis R. J., (1980), „Methods for distributing pesticide loss in field run-off between the solution and adsorbed phase”, CREAMS, in A Field Scale Model for Chemicals, Run-off and Erosion from Agricultural Management Systems, Chapter 19, Vol. III: Supporting Documentation, USDA Conservation Research report. |
|
(50) |
ISO Standard Compendium Environment: Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition (1994). |
|
(51) |
Scheffer F., and Schachtschabel, Lehrbuch der Bodenkunde, F. Enke Verlag, Stuttgart (1982), 11th edition. |
|
(52) |
Black, Evans D. D., White J. L., Ensminger L. E., and Clark F. E., eds. „Methods of Soil Analysis”, Vol 1 and 2, American Society of Agronomy, Madison, WI, 1982. |
|
(53) |
ISO/DIS 10381-1 Soil Quality – Sampling – Part 1: Guidance on the design of sampling programmes. |
|
(54) |
ISO/DIS 10381-2 Soil Quality – Sampling – Part 2: Guidance on sampling techniques. |
|
(55) |
ISO/DIS 10381-3 Soil Quality – Sampling – Part 3: Guidance on safety of sampling. |
|
(56) |
ISO/DIS 10381-4 Soil Quality – Sampling – Part 4: Guidance on the investigation of natural and cultivated soils. |
|
(57) |
ISO/DIS 10381-5 Soil Quality – Sampling – Part 5: Guidance on the investigation of soil contamination of urban and industrial sites. |
|
(58) |
ISO 10381-6, 1993: Soil Quality – Sampling – Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. |
|
(59) |
Green R. E., and Yamane V. K., (1970), „Precision in pesticide adsorption measurements”. Soil Sci. Am. Proc, 34, pp. 353-354. |
|
(60) |
Grover R., and Hance R. J. (1970), „Effect of ratio of soil to water on adsorption of linuron and atrazine”. Soil Sci., pp. 109-138. |
|
(61) |
Boesten, J. J. T. I, „Influence of soil/liquid ratio on the experimental error of sorption coefficients in pesticide/soil system”. Pest. Sci. 1990, 30, pp. 31-41. |
|
(62) |
Boesten, J. J. T. I. „Influence of soil/liquid ratio on the experimental error of sorption coefficients in relation to OECD guideline 106”. Proceedings of 5th international workshop on environmental behaviour of pesticides and regulatory aspects, Brussels, 26-29 April 1994. |
|
(63) |
Bastide J., Cantier J. M., et Coste C, (1980), „Comportement de substances herbicides dans le sol en fonction de leur structure chimique”. Weed Res. 21, pp. 227-231. |
|
(64) |
Brown D. S., and Flagg E. W., (1981), „Empirical prediction of organic pollutants sorption in natural sediments”. J. Environ. Qual., 10(3), pp. 382-386. |
|
(65) |
Chiou C. T., Porter P. E., and Schmedding D. W., (1983), „Partition equilibria of non-ionic organic compounds between soil organic matter and water”. Environ. Sci. Technol., 17(4), pp. 227-231. |
|
(66) |
Gerstl Z., and Mingelgrin U., (1984), „Sorption of organic substances by soils and sediments”. J. Environm. Sci. Health, B19 (3), pp. 297-312. |
|
(67) |
Vowles P. D., and Mantoura R. F. C, (1987), „Sediment-water partition coefficient and HPLC retention factors of aromatic hydrocarbons”. Chemosphere, 16(1), pp. 109-116. |
|
(68) |
Lyman W. J., Reehl W. F. and Rosenblatt D. H. (1990). Handbook of Chemical Property Estimation Methods. Environmental Behaviour of Organic Compounds. American Chemical Society, Washington DC. |
|
(69) |
Keniga E. E., and Goring, C. A. I. (1980). „Relationship between water solubility, soil sorption, octanol-water partitioning and concentration of chemicals in the biota” in Aquatic Toxicology (eds J. G Eaton, et al.), pp.78-115, ASTM STP 707, Philadelphia. |
|
(70) |
Chiou C. T., Peters L. J., and Freed V. H., (1979), „A physical concept of soil-water equilibria for non-ionic organic compounds”. Science, Vol. 206, pp. 831-832. |
|
(71) |
Hassett J. J., Banwart W. I., Wood S. G., and Means J. C, (1981), „Sorption of /-Naphtol: implications concerning the limits of hydrophobic sorption”. Soil Sci. Soc. Am. J. 45, pp. 38-42. |
|
(72) |
Karickhoff S. W., (1981), „Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils”. Chemosphere, Vol. 10(8), pp. 833-846. |
|
(73) |
Moreale A., van Bladel R., (1981), „Adsorption de 13 herbicides et insecticides par le sol. Relation solubilité-reactivité”. Revue de l'Agric., 34 (4), pp. 319-322. |
|
(74) |
Müller M., Kördel W. (1996), „Comparison of screening methods for the determination/estimation of adsorption coefficients on soil”. Chemosphere, 32(12), pp. 2493- 2504. |
|
(75) |
Kördel W., Kotthoff G., Müller M. (1995), „HPLC – screening method for the determination of the adsorption coefficient on soil – results of a ring test”. Chemosphere 30 (7), pp. 1373-1384. |
|
(76) |
Kördel W., Stutte J., Kotthoff G. (1993), „HPLC – screening method for the determination of the adsorption coefficient on soil – comparison of different stationary phases”. Chemosphere 27 (12), pp. 2341-2352. |
|
(77) |
Hance, R. J., (1967), „The Speed of Attainment of Sorption Equilibria in Some Systems Involving Herbicides”. Weed Research, Vol. 7, pp. 29-36. |
|
(78) |
Koskinen W. C, and Harper S. S., (1990), „The retention processes: mechanisms” in Pesticides in the Soil Environment: Processes, Impacts and Modelling (ed. H. H. Cheng). Soil Sci. Soc. Am. Book Series, No. 2, Madison, Wisconsin. |
|
(79) |
Cohen S. Z., Creeger S. M., Carsel R. F., and Enfield C. G (1984), „Potential pesticide contamination of groundwater from agricultural uses”, in Treatment and Disposal of Pesticide Wastes, pp. 297-325, ACS Symp. Ser. 259, American Chemical Society, Washington, DC. |
|
(80) |
Giles C. H., (1970), „Interpretation and use of sorption isotherms” in Sorption and Transport Processes in Soils. S. C. I. Monograph No. 37, pp. 14-32. |
|
(81) |
Giles, C. H.; McEwan J. H.; Nakhwa, S. N. and Smith, D, (1960), „Studies in adsorption: XI. A system of classification of solution adsorption isotherms and its use in the diagnosis of adsorption mechanisms and in measurements of pesticides surface areas of soils”. J. Chem. Soc, pp.3973-93. |
|
(82) |
Calvet R., Tercé M., and Arvien J. C, (1980), „Adsorption des pesticides par les sols et leurs constituants: 3. Caractéristiques générales de l'adsorption”. Ann. Agron. 31: pp. 239-251. |
|
(83) |
Bedbur E., (1996), „Anomalies in the Freundlich equation”, Proc. COST 66 Workshop, Pesticides in soil and the environment, 13-15 May 1996, Stratford-upon-Avon, UK. |
|
(84) |
Guth, J. A., (1985), „Adsorption/desorption”, in Joint International Symposium, Physicochemical Properties and their Role in Environmental Hazard Assessment, July 1-3, Canterbury, UK. |
|
(85) |
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962). |
1. függelék
A vizsgálat terve

2. függelék
AZ ELEMZÉSI MÓDSZER PONTOSSÁGÁNAK ÉS A KONCENTRÁCIÓ VÁLTOZÁSÁNAK HATÁSA AZ ADSZORPCIÓS EREDMÉNYEK PONTOSSÁGÁRA
Az alábbi táblázatból (84) egyértelműen kiderül, hogy amikor nagyon csekély a különbség az oldatban lévő vizsgált anyag kiindulási tömege (m0 = 110 μg) között, akkor az egyensúlyi koncentráció eredményének mérésekor bekövetkező 5 % mérési hiba a talaj által adszorbeált anyag tömegének ( ) kiszámításakor 50 %-os hibát, a Kd kiszámításakor 52,4 %-os hibát eredményez.
) kiszámításakor 50 %-os hibát, a Kd kiszámításakor 52,4 %-os hibát eredményez.
|
Talaj mennyisége |
mtalajl |
= 10 g |
|
Oldat térfogata |
V0 |
= 100 cm3 |
|
|
FOR-L_2008142HU.01044401.notes.0185.xml.jpg (μg) |
FOR-L_2008142HU.01044401.notes.0186.xml.jpg (μg cm-3) |
R |
FOR-L_2008142HU.01044401.notes.0187.xml.jpg (μg) |
FOR-L_2008142HU.01044401.notes.0188.xml.jpg (μg g-1) |
R‡ |
Kd* |
R‡ |
|
FOR A = 9 % |
||||||||
|
m0 = 110 μg vagy C0=1,100 μg/cm3 |
100 |
1,000 |
valós érték |
10 |
1,00 |
valós érték |
1 |
|
|
101 |
1,010 |
1 % |
9 |
0,90 |
10 % |
0,891 |
10,9 % |
|
|
105 |
1,050 |
5 % |
5 |
0,50 |
50 % |
0,476 |
52,4 % |
|
|
109 |
1,090 |
9 % |
1 |
0,10 |
90 % |
0,092 |
90,8 % |
|
|
FOR A = 55 % |
||||||||
|
m0= 110 μg vagy C0=1,100 μg/cm3 |
50,0 |
0,500 |
valós érték |
60,0 |
6,00 |
valós érték |
12,00 |
|
|
50,5 |
0,505 |
1 % |
59,5 |
5,95 |
0,8 % |
11,78 |
1,8 % |
|
|
52,5 |
0,525 |
5 % |
57,5 |
5,75 |
4,0 % |
10,95 |
8,8 % |
|
|
55,0 |
0,550 |
10 % |
55,0 |
5,50 |
8,3 % |
10,00 |
16,7 % |
|
|
FOR A = 99 % |
||||||||
|
m0 = 110 μg vagy C0=1,100 μg/cm3 |
1,100 |
0,011 |
valós érték |
108,9 |
10,89 |
valós érték |
990 |
|
|
1,111 |
0,01111 |
1 % |
108,889 |
10,8889 |
0,01 % |
980 |
1,0 % |
|
|
1,155 |
0,01155 |
5 % |
108,845 |
10,8845 |
0,05 % |
942 |
4,8 % |
|
|
1,21 |
0,0121 |
10 % |
108,790 |
10,8790 |
0,10 % |
899 |
9,2 % |
|
|
|
= |
|
|
|
= |
a vizgált anyag tömege a szilárd fázisban, egyensúly esetén µg |
|
|
= |
a vizgált anyag tömege egyensúlyi vizes fázisban, µg |
|
|
= |
a szilárd fázis tesztanyagtartalma egyensúlyban, µg, g-1 |
|
|
= |
a vizsgált anyag tömegkoncentrációja egyensúlyi vizes fázisban, µg cm-3 |
|
R |
= |
a |
|
R‡ |
= |
az analitikai hiba (R) miatt bekövetkezó számítási hiba |
3. függelék
ELJÁRÁSOK A Kd ÉRTÉKÉNEK BECSLÉSÉRE
|
1. |
Ezek a módszerek lehetővé teszik a Kd értékének a becslését, vizsgálva a következő tényezők valamelyikével mutatott korrelációt: pl. Pow értékek (12) (39) (63–68), vízoldhatósági adatok (12) (19) (21) (39) (68–73), vagy polaritási adatok, amelyek reverz fázisú HPLC-s vizsgálatokkal nyerhetők (74–76). Az 1. és 2. táblázatban látható egyenletek alapján kiszámítják a Koc és a Kom értékeit, ezután pedig indirekt módon a Kd-t az alábbi egyenletek alapján:
|
|
2. |
E korrelációk alapgondolata két kiinduló feltételezésen alapul: (1) egy adott anyag adszorpcióját főként a talaj szervesanyag-tartalma befolyásolja; és (2) a lezajló kölcsönhatások túlnyomórészt nem poláros jellegűek. Ennek eredményeként, ezek az összefüggések: (1) nem vagy csak bizonyos mértékig alkalmazhatók a poláros anyagokra; és (2) nem alkalmazhatók olyan esetekben, amikor nagyon csekély a talaj szervesanyag-tartalma (12). Ezenfelül bár kielégítő bizonyossággal megállapítható a korreláció a Pow értéke és az adszorpció mértéke között (1), nem mondható el ugyanez a vízoldhatóság és az adszorpció mértéke közötti összefüggésről (19) (21), ahol az eddigi vizsgálatok erősen ellentmondásos eredményekre vezettek. |
|
3. |
Az adszorpciós koefficiens és az oktanol/víz megoszlási koefficiens közötti korrelációra, valamint a vízoldhatóságra vonatkozó néhány példa szerepel az 1., illetve 2. táblázatban. 1. táblázat: Példák az adszorpciós megoszlási koefficiens és az oktanol/víz megoszlási koefficiens közötti korrelációra: további példákért lásd (12) (68)
2. táblázat: Példák az adszorpciós megoszlási koefficiens és a vízoldhatóság közötti korrelációra; további példákért lásd (68) (69)
|
4. függelék
SZÁMÍTÁSOK A CENTRIFUGÁLÁS KÖRÜLMÉNYEINEK MEGHATÁROZÁSÁHOZ
|
1. |
A centrifugálás idejét az alábbi képlettel lehet kiszámítani, gömb formájú részecskéket feltételezve:
Az egyszerűsítés érdekében a paraméterek itt nem SI mértékegységben vannak megadva (g, cm). ahol:
A bevett gyakorlat szerint a számított időértékek kétszerese biztosítja a tökéletes szétválasztást. |
|
2. |
Az (1) egyenlet tovább egyszerűsíthető, ha az oldat viszkozitását (η) és sűrűségét (ρaq) azonosnak tekintjük a 25 oC hőmérsékletű víz viszkozitásával és sűrűségével; tehát η = 8,95 × 10-3 g s-1cm-1 és ρaq = 1,0 g.cm-3. Ebből adódóan a centrifugálási idő hosszát a (2) egyenlet adja meg:
|
|
3. |
A (2) egyenlet alapján nyilvánvaló, hogy a centrifugálás körülményeinek, azaz az idő (t) és a sebesség (rpm) meghatározása során alapvetően két paraméter fontos, annak érdekében, hogy el lehessen különíteni meghatározott méretű récsecskéket (a mi esetünkben a 0,1 mm sugarúakat); (1) a talaj sűrűsége és (2) a centrifugacsőben lévő elegy hossza (Rt-Rb), azaz azon távolság, amelyet az oldat felszíni tetőpontja és a cső alja között egy talajrészecske megtesz; nyilvánvaló, hogy egy rögzített térfogat esetében a csőben lévő elegy hossza a cső sugara négyzetének függvénye. |
|
4. |
Az 1. ábra bemutatja a centrifugálás időtartamát (t) különböző talaj sűrűségek esetében, a centrifugálás sebességének függvényében, az 1b. ábra pedig ugyanezt a keverék hosszának a centrifugacsőben függvényeként ábrázolja. Az 1a. ábrából egyértelműen látható a talaj sűrűsűge által gyakorolt hatás; például egy átlagosnak mondható 3000 ford/perc fordulatszám mellett a centrifugálási idő megközelítőleg 240 perc, 1,2 g cm-3 talajsűrűség esetén, míg mindössze 50 perc a 2,0 cm-3 sűrűségű talaj esetén. Hasonlóképpen, az 1b. ábra alapján, egy átlagosnak mondható 3000 ford/perc fordulatszám mellett a centrifugálási idő mintegy 50 perc egy 10 cm hosszú elegy esetén, míg mindössze 7 perc egy 1 cm hosszú elegy esetén. Fontos azonban megtalálni a centrifugálási paraméterek közötti optimális egyensúlyt, ahol a lehető legkisebb mintahosszra van szükség, és ami lehetővé teszi a kísérletező számára a fázisok centrifugálást követő elkülönítését. |
|
5. |
Továbbá a talaj/oldat fázisok elválasztása kísérleti feltételeinek meghatározásakor fontos figyelembe venni egy harmadik „pszeudofázis”-t, a kolloidok lehetséges jelenlétét. Ezek a 0,2 mm-nél kisebb méretű anyagrészecskék jelentős hatást gyakorolhatnak az anyag egész adszorpciós mechanizmusára a talaj szuszpenzióban. Ha a centrifugálást a fent leírtak szerint hajtják végre, akkor a kolloidok a vizes fázisban maradnak, és azzal együtt kerülnek elemzésre. Az általuk gyakorolt hatásra vonatkozó információk ezért elvesznek. Ha a kísérletet végző laboratórium rendelkezik ultracentrifugával vagy ultraszűrő berendezésekkel, akkor elmélyültebben lehet tanulmányozni az anyag talajban való adszorpcióját, illetve deszorpcióját, beleértve az anyagnak a kolloidrészecskék felületén bekövetkező adszorpcióját. Ebben az esetben 60 000 rpm fordulatszámú ultracentrifugálást vagy 100 000 Dalton porozitású ultraszűrőt kell használni a három fázis, azaz a talaj, a kolloidok és az oldat szétválasztására. A vizsgálat menetét ezért ennek megfelelően úgy kell módosítani, hogy mindhárom fázist alá lehessen vetni az anyagokra vonatkozó elemzésnek. |
1a. ábra:

1b. ábra:

5. függelék
AZ ADSZORPCIÓ (A, %) ÉS A DESZORPCIÓ (D, %) KISZÁMÍTÁSA
Az eljárás időskálája a következő:

Valamennyi számítás esetében feltételezzük, hogy a vizsgált anyag stabil, és nem adszorbeálódik jelentős mértékben az edény falán.
ADSZORPCIÓ (A %)
a) Párhuzamos módszer
Minden egyes kémcsőre (i) és minden egyes időpontra (ti) nézve az alábbi képlet alapján kell a százalékos adszorpciót kiszámítani:
|
|
(1) |
Az egyenlet elemei az alábbi módon számíthatók ki:
|
m0 = C0 · V0 (μg) |
(2) |
|
|
(3) |
ahol:
|
|
= |
százalékos adszorpció ( %) ti időpontban |
|
|
= |
a vizsgált anyag talajon mért tömege a ti időpontban, amikor a vizsgálatot végrehajtják (mg) |
|
m0 |
= |
a vizsgált anyag tömege a kémcsőben, a vizsgálat kezdetén (mg) |
|
C0 |
= |
a talajjal érintkező vizsgák oldat kiindulási tömegkoncentrációja (mg cm-3) |
|
|
= |
az anyag tömegkoncentrációja vizes fázisban abban a ti időpontban, amikor az elemzést végzik (mg cm-3); e koncentráció meghatározása analitikai úton történik, figyelembe véve a vak próbákkal kapott értékeket |
|
V0 |
= |
a talajjal érintkező vizsgálati oldat kimdulási térfogata (cm3) |
A százalékos adszorpció értékeit  ill.
ill.  az idő függvényében grafikusan kell ábrázolni, valamint meg kell határozni azt az időt, amelyre a szorpciós ekvilibrium eléréséhez szükség volt. Az ilyen grafikus ábrázolás példáját az 1., illetve 2. ábra mutatja be.
az idő függvényében grafikusan kell ábrázolni, valamint meg kell határozni azt az időt, amelyre a szorpciós ekvilibrium eléréséhez szükség volt. Az ilyen grafikus ábrázolás példáját az 1., illetve 2. ábra mutatja be.


b) „Folytatásos” módszer
Az alábbi egyenletek figyelembe veszik, hogy az adszorpciós eljárás végrehajtása során a vizes fázis kis aliquotáiban a vizsgált anyagot meghatározott időtartamonként mérik.
|
— |
Minden egyes időtartam során a vizsgált anyag talajon adszorbeálódott mennyiségét az alábbi módon lehet kiszámítani:
|
|
— |
Az egyes időintervallumokra vonatkozó százalékos adszorpció
(
Az adszorpció |
|
— |
A teq ekvilibrációs idő elteltével:
|
A fent használt paraméterek jelentése az alábbi:
|
|
= |
a talajon adszorbeált tesztanyag tömege a Dt1, Dt2… illetve Dtn időintervallumban (mg) |
|
|
= |
a ( |
|
|
= |
az anyag talajon adszorbeálódott tömege adszorpciós egyensúlyi helyzetben (mg) |
|
|
= |
az anyag tömege az oldatban adszorpciós egyensúlyi helyzetben (mg) |
|
|
= |
a vizsgált anyag mérésére használt aliquot térfogata (cm3) |
|
|
= |
a százalékos adszorpció mértéke adott Dti időintervallumban ( %) |
|
|
= |
a százalékos adszorpció adszorpciós egyensúlyi helyzetben ( %). |
DESZORPCIÓ D ( %)
Azt a t0 időpontot tekintik a deszorpciós kinetikai kísérlet kezdetének, amikor a vizsgált anyagot tartalmazó oldat maximálisan (az adszorpciós egyensúly elérését követően) kinyert térfogatát ugyanolyan térfogatú 0,01 M CaCl2-oldattal pótolják.
a) Párhuzamos módszer
A ti időpontban megmérik az i ( ) próbacsőből vett vizes fázisban lévő vizsgált anyag tömegét, és a deszorbeálódott tömeget az alábbi egyenlet segítségével számítják ki:
) próbacsőből vett vizes fázisban lévő vizsgált anyag tömegét, és a deszorbeálódott tömeget az alábbi egyenlet segítségével számítják ki:
|
|
(13) |
A deszorpciós ekvilibriumban ti = teq és ezért  =
= 
A (Δti) időszak során deszorbeálódott vizsgált anyag tömege az alábbi egyenlettel számítható ki:
|
|
(14) |
A százalékos deszorpció kiszámítható:
a ti időpontra nézve az alábbi egyenlettel:
|
|
(15) |
és a (Δti) időintervallumra nézve az alábbi egyenlettel:
|
|
(16) |
ahol a fent használt paraméterek jelentése az alábbi:
|
|
= |
százalékos deszorpció a ti időpontban ( %) |
|
|
= |
a Δti intervallumnak megfelelő százalékos deszorpció ( %) |
|
|
= |
a vizsgált anyag deszorbeálodott tömege a ti időpontban (μg) |
|
|
= |
a vizsgált anyag deszorbeálodott tömege a Dti időintervallumban (μg) |
|
|
= |
a vizsgált anyag ti időpontban analitikus módon mért tömege a |
|
|
= |
a vizsgák anyagnak az adszorpciós ekvilibrium elérését követően a tökéletlen folyadékeltávolítás miatt a talajban maradt tömege (μg) |
|
|
(17) |
|
|
= |
az anyag tömege az oldatban adszorpciós egyensúlyi helyzetben (μg) |
|
VR |
= |
az adszorpciós egyensúlyi helyzet elérését követően a kémcsőből eltávolított, és azonos térfogatú 0,01 M CaCl2 oldattal pótolt felülúszó-térfogat, (cm3) |
|
|
= |
Az (i) kémcsőből a vizsgált anyag mérésére kiemelt oldat térfogata a deszorpciós kinetikai kísérletben (cm3) |
A  , illetve a
, illetve a  deszorpciós értékeket (a vizsgálat igényei szerint) az idő függvényében grafikusan kell ábrázolni, valamint meg kell határozni azt az időt, amelyre a deszorpciós egyensúly eléréséhez szükség volt.
deszorpciós értékeket (a vizsgálat igényei szerint) az idő függvényében grafikusan kell ábrázolni, valamint meg kell határozni azt az időt, amelyre a deszorpciós egyensúly eléréséhez szükség volt.
b) „Folytatásos” módszer
Az alábbi egyenletek figyelembe veszik azt, hogy a deszorpciós vizsgálatot megelőző adszorpciós vizsgálatot a vizes fázis kis aliquotáiban ( ) lévő vizsgált anyag mennyiségének mérésével hajtották végre (lásd az „1.9. A vizsgálat végrehajtása” pontban ismertetett soros módszert). Feltételezzük, hogy: a) a felülúszó azon mennyiségét, amelyet a kémcsőből az adszorpciós kinetikai kísérletet követően eltávolítanak, azonos térfogatú 0,01 M CaCl2-oldattal (Vg) pótolják; és b) a vizes fázisnak az adszorpciós kinetikai kísérlet során a talajjal érintkező össztérfogata (VT) a deszorpciós vizsgálat során konstans marad és kiszámítható az alábbi egyenlettel:
) lévő vizsgált anyag mennyiségének mérésével hajtották végre (lásd az „1.9. A vizsgálat végrehajtása” pontban ismertetett soros módszert). Feltételezzük, hogy: a) a felülúszó azon mennyiségét, amelyet a kémcsőből az adszorpciós kinetikai kísérletet követően eltávolítanak, azonos térfogatú 0,01 M CaCl2-oldattal (Vg) pótolják; és b) a vizes fázisnak az adszorpciós kinetikai kísérlet során a talajjal érintkező össztérfogata (VT) a deszorpciós vizsgálat során konstans marad és kiszámítható az alábbi egyenlettel:
|
|
(18) |
Egy ti időpontban:
|
— |
A vizsgált anyag mennyiségét egy kivett kis térfogatban (
|
|
— |
A deszorpciós ekvilibriumban ti = teq és ezért |
|
— |
A százalékos deszorpció
|
Egy adott (Δti) időintervallumban:
Minden egyes időintervallumra nézve a deszorbeálódott anyag mennyisége az alábbiak szerint számítható ki:
|
— |
az első Δt1 = t1 – t0 időintervallumra nézve:
|
|
— |
a második Δt2 = t2 – t1 időintervallumra nézve:
|
|
— |
az n-dik Δtn = tn – tn-1 intervallumra nézve:
|
Végül, az egyes időintervallumokra vonatkozó százalékos deszorpció  az alábbi egyenlettel számítható ki:
az alábbi egyenlettel számítható ki:
|
|
(24) |
a ti időpontra vonatkozó  százalékos deszorpció az alábbi egyenlettel számítható ki:
százalékos deszorpció az alábbi egyenlettel számítható ki:
|
|
(25) |
ahol a fent használt paraméterek jelentése az alábbi:
|
|
= |
a talajon adszorbeálva maradó vizsgált anyag tömege a Δt1, Δt2…, illetve Δtn időintervallum után (μg) |
||
|
|
= |
a Δt1, Δt2..., illetve Δtn időintervallum során deszorbeálódott vizsgák anyag tömege (μg) |
||
|
|
= |
a ( |
||
|
VT |
= |
a talajjal érintkezésben lévő vizes fázis össztérfogata a.„folytatásos” mód- szerrel végrehajtott deszorpciós kinetikai kíséri a során (cm3) |
||
|
|
= |
a vizsgált anyagnak az adszorpciós egyensúlyi helyzet elérését követően a tökéletlen folyadékeltávolítás miatt visszamaradó tömege (μg)
|
||
|
VR |
= |
az adszorpciós egyensúlyi helyzet elérését követően a kémcsőből eltávo- lított felülúszó és azonos térfogatú 0,01 M CaCl2-oldattal pótok térfogat (cm3) |
||
|
|
= |
az (i) kémcsőből a vizsgált anyag mérésére kiemelt aliquot térfogata a „folytatásos” módszerrel végzett deszorpciós kinetikai kísérletben (cm3)
|
6. függelék
TALAJON TÖRTÉNŐ ADSZORPCIÓ/DESZORPCIÓ VIZSGÁLATA: ADATKÖZLŐ LAPOK
A vizsgált anyag megnevezése:
A vizsgált talaj:
A talaj szárazanyag-tartalma (105 oC, 12 óra): … %
Hőmérséklet: … oC
|
Bemért talajmennyiség |
g |
|
|
Talaj száraz tömege |
g |
|
|
CaCl2-oldat térfogata |
cm3 |
|
|
Az oldat névleges végkoncentrációja |
μg cm-3 |
|
|
Az oldat analitikai módszerrel meghatározott végkoncentrációja |
μg cm-3 |
|
Az alkalmazott analitikai módszer alapelve:
Az analitikai modell kalibrálása:
A vizsgált anyag megnevezése:
A vizsgált talaj:
A talaj szárazanyag-tartalma (105 oC, 12 óra): … %
Hőmérséklet: … oC
|
Az alkalmazott analitikai módszertan: |
Közvetett |
|
Párhuzamos |
|
Közvetlen |
|
|
|
Serial |
|
|
|
|
|
Adszorpciós vizsgálat: vizsgált minták
|
|
Jele |
Mértékegysége |
Ekvilibrációs idő |
Ekvilibrációs idő |
Ekvilibrációs idő |
Ekvilibrációs idő |
||||
|
Kémcsövek száma |
|
|
|
|
|
|
|
|
|
|
|
Bemért talajmennyiség |
— |
S |
|
|
|
|
|
|
|
|
|
Talaj száraz tömege |
mtalaj |
g |
|
|
|
|
|
|
|
|
|
A bemért talajban jelen levő víz (kiszámított) térfogata |
Vws |
cm3 |
|
|
|
|
|
|
|
|
|
A talaj ekvilibrálásához felhasznált 0,01 M CaCl2-oldal térfogata |
|
cm3 |
|
|
|
|
|
|
|
|
|
Törzsoldat térfogata |
|
cm3 |
|
|
|
|
|
|
|
|
|
A talajjal érintkezésben lévő vizes fázis össztérfogata |
v0 |
cm3 |
|
|
|
|
|
|
|
|
|
A vizsgált oldat kiindulási koncentrációja |
C0 |
μg.cm-3 |
|
|
|
|
|
|
|
|
|
A vizsgált anyag tömege a vizsgálat kezdetén |
m0 |
μg |
|
|
|
|
|
|
|
|
|
Rázatás és centrifugálás után |
||||||||||
|
KÖZVETETT MÓDSZER |
||||||||||
|
Párhuzamos módszer |
||||||||||
|
A vizsgált anyagnak a vakpróba értékeivel korrigált koncentrációja a vizes fázisban |
|
μg.cm-3 |
|
|
|
|
|
|
|
|
|
Folytatásos módszer |
||||||||||
|
A vizsgált anyag VAa aliquotban mért tömege |
|
μg |
|
|
|
|
|
|
|
|
|
KÖZVETLEN MÓDSZER |
||||||||||
|
A vizsgált anyag talajon adszorbeálódott tömege |
|
μg |
|
|
|
|
|
|
|
|
|
Adszorpció kiszámítása |
||||||||||
|
Adszorpció |
|
% |
|
|
|
|
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
|
|
|
Átlagok |
|
|
|
|
|
|
||||
|
Adszorpciós koefficiens |
Kd |
cm3.g-1 |
|
|
|
|
|
|
|
|
|
Átlagok |
|
|
|
|
|
|
||||
|
A szerves széntartalomra számított adszorpciós koefficiens |
Koc |
cm3.g-1 |
|
|
|
|
|
|
|
|
|
Átlagok |
|
|
|
|
|
|
||||
A vizsgált anyag megnevezése:
A vizsgált talaj:
A talaj szárazanyag-tartalma (105 oC, 12 óra): … %
Hőmérséklet: … oC
Adszorpciós vizsgálat: vakpróbák és kontroll
|
|
Jele |
Mérték- egysége |
Vakpróba |
Vakpróba |
Kontroll |
|||
|
Kémcsövek száma |
|
|
|
|
|
|
|
|
|
Bemért talajmennyiség |
|
S |
|
|
|
|
0 |
0 |
|
Víz mennyisége a bemért talajban (számított) |
|
cm3 |
|
|
|
|
— |
— |
|
A hozzáadott 0,01 M CaCl2-oldat térfogata |
|
cm3 |
|
|
|
|
|
|
|
A vizsgált anyag hozzáadott törzsoldatának térfogata |
|
cm3 |
0 |
0 |
|
|
|
|
|
A vizes fázis össztérfogata (számitott) |
|
cm3 |
|
|
|
|
— |
— |
|
A vizsgált anyag kiindulási koncentrációja vizes fázisban |
|
μg.cm-3 |
|
|
|
|
|
|
|
Rázatás és centrifugálás után |
||||||||
|
Koncentráció a vizes fázisban |
|
μg.cm-3 |
|
|
|
|
|
|
Megjegyzés: szükség szerint a táblázat további oszlopokkal bővíthető.
A vizsgált anyag megnevezése:
A vizsgált talaj:
A talaj szárazanyag-tartalma (105 oC, 12 óra): … %
Hőmérséklet: … oC
Tömegegyensúly
|
|
Jele |
Mérték- egyscége |
|
|
|
|
|
Kémcsövek száma |
|
|
|
|
|
|
|
Bemért talajmennyiség |
— |
g |
|
|
|
|
|
Talaj száraz tömege |
mtalaj |
g |
|
|
|
|
|
Viz mennyisége a bemért talajban (számított) |
Vws |
ml |
|
|
|
|
|
A talaj ekvilibrálásához felhasznált 0,01 M CaCl2-oldat térfogata |
|
ml |
|
|
|
|
|
Törzsoldat térfogata |
|
cm3 |
|
|
|
|
|
A talajjal érintkezésben lévő vizes fázis össztérfogata |
V0 |
cm3 |
|
|
|
|
|
A vizsgált oldat kiindulási koncentrációja |
C0 |
μg.cm-3 |
|
|
|
|
|
Ekvilibrációs idő |
— |
h |
|
|
|
|
|
Rázatás és centrifugálás után |
||||||
|
A tesztanyagnak a vakpróba értékeivel korrigált koncentrációja adszorpciós egyensúlyban |
|
μg.cm-3 |
|
|
|
|
|
Ekvilibrációs idő |
teq |
h |
|
|
|
|
|
Első hígítás oldószerrel |
||||||
|
Vizes fázis eltávolított térfogata |
Vrec |
cm3 |
|
|
|
|
|
Oldószer hozzáadott térfogata |
Δv |
cm3 |
|
|
|
|
|
Első extrakció oldószerrel |
||||||
|
Oldószerben analizált jel |
SE1 |
var. |
|
|
|
|
|
A vizsgált anyag koncentrációja az oldószerben |
CE1 |
μg.cm-3 |
|
|
|
|
|
A talajból és az edény falairól extrahált anyag tömege |
mEl |
μg.cm-3 |
|
|
|
|
|
Második hígítás oldószerrel |
||||||
|
Az oldószer eltávolított mennyisége |
ΔVs |
cm3 |
|
|
|
|
|
Az oldószer hozzáadott mennyisége |
Δv’ |
cm3 |
|
|
|
|
|
Második extrakció oldószerrel |
||||||
|
Oldószerben analizált jel |
SE2 |
van |
|
|
|
|
|
A vizsgált anyag koncentrációja az oldószerben |
CE2 |
μg.cm-3 |
|
|
|
|
|
A talajból és az edény falairól extrahált anyag tömege |
ME2 |
μg |
|
|
|
|
|
A vizsgált anyag két lépésben extrahált össztömege |
mE |
μg |
|
|
|
|
|
Tömegegyensúly |
MB |
% |
|
|
|
|
A vizsgált anyag megnevezése:
A vizsgált talaj:
A talaj szárazanyag-tartalma (105 oC, 12 óra): … %
Hőmérséklet: … oC
Adszorpciós izotermák
|
|
Jele |
Mértékegysége |
|
|
|
|
|
|
|
|
|
Kémcsövek száma |
|
|
|
|
|
|
|
|
|
|
|
Bemért talajmennyiség |
— |
g |
|
|
|
|
|
|
|
|
|
Talaj száraz tömege |
E |
g |
|
|
|
|
|
|
|
|
|
Víz térfogata a bemért talajban (számított) |
VWS |
cm3 |
|
|
|
|
|
|
|
|
|
A talaj ekvilibrálásához felhasznált 0,01 MCaCl2-oldat terfbgata |
|
cm3 |
|
|
|
|
|
|
|
|
|
A hozzáadott törzsoldat térfogata |
|
cm3 |
|
|
|
|
|
|
|
|
|
A talajjal érintkezésben lévő vizes fázis össztérfogata (számított) |
V0 |
cm3 |
|
|
|
|
|
|
|
|
|
Oldat koncentrációja |
C0 |
μg •cm-3 |
|
|
|
|
|
|
|
|
|
Ekvilibrációs idő |
— |
ó |
|
|
|
|
|
|
|
|
|
Rázatás és centrifugálás ulán |
||||||||||
|
A vizsgált anyagnak a vakpróba értékeivel korrigált koncentrációja a vizes fázísban |
|
μg cm-3 |
|
|
|
|
|
|
|
|
|
Hőmérséklet |
|
oC |
|
|
|
|
|
|
|
|
|
1 g talaj által adszorbeált teszlattyag tömege |
|
μg g-1 |
|
|
|
|
|
|
|
|
Regressziós analízis:
A Kads F értéke:
Az l/n értéke:
Regressziói koefficiens. r2:
A vizsgált anyag megnevezése:
A vizsgált talaj:
A talaj szárazanyag-tartalma (105 oC, 12 óra): … %
Hőmérséklet: … oC
|
Az alkalmazott analitikai módszertan: |
Közvetett |
|
Párhuzamos |
|
„Folytatásos” |
|
|
|
Közvetlen |
|
|
|
|
|
Deszorpciós vizsgálat
|
|
Jele |
Mértékegysége |
Időintervallum |
Időintervallum |
Időintervallum |
Időintervallum |
|
|
Az adszorpciós lépésből kapott próbacső száma |
|
|
|
|
|
|
|
|
A talajon adszorbeált vizsgált anyag tömege, adszorpciós egyensúlyi helyzetben |
|
μg |
|
|
|
|
|
|
A 0,01 M 0,01 M CaCl2-oldattal pótolt vizes fázis eltávolított mennyiségének térfogata |
V0 VR |
cm3 |
|
|
|
|
|
|
A talajjal érintkezésben levő vizes fázis össztérfogata |
PM |
V0 |
cm3 |
|
|
|
|
|
SM |
VT |
cm3 |
|
|
|
|
|
|
A vizsgált anyagnak az adszorpciós egyensúlyi helyzet elérését követően, a tökéletlen térfogat helyettesítés miatt fennmaradt tömege |
|
μg |
|
|
|
|
|
|
Deszorpciós kinetika |
|||||||
|
A ti időpontban a talajból deszorbeálódott vizsgált anyag tömege (számított érték) |
|
μg |
|
|
|
|
|
|
Az (i) kémcsőből a vizsgált anyag mérése |
PM |
Vi r |
cm! |
|
|
|
|
|
SM |
VD a |
cm3 |
|
|
|
|
|
|
A ti időpontban a talajból deszorbeálódott vizsgált anyag tömege (számított érték) |
|
μg |
|
|
|
|
|
|
A Δti időintervallumban a talajból deszorbeálódott vizsgált anyag tömege (számított érték) |
|
μg |
|
|
|
|
|
|
Deszorpciós százalék |
|||||||
|
Deszorpció a ti időpontban |
Dti |
% |
|
|
|
|
|
|
Deszorpció a Δti idóintervallumban |
|
% |
|
|
|
|
|
|
Látszólagos deszorpciós koefficiens |
Kdes |
|
|
|
|
|
|
PM: = párhuzamos módszer
SM: = folytatásos módszer
C.19. ADSZORPCIÓS EGYÜTTHATÓ BECSLÉSE TALAJON ÉS SZENNYVÍZISZAPON NAGYHATÉKONYSÁGÚ FOLYADÉKKROMATOGRÁFIÁVAL (HPLC)
1. MÓDSZER
E módszer megfelel az OECD TG121-nek (2001).
1.1. BEVEZETÉS
Anyagok talajokon és szennyvíziszapokon mutatott szorpciós (megkötődési) viselkedését a C.18 vizsgálati módszer használatával kísérletileg meghatározott paraméterek révén lehet leírni. Az egyik fontos paraméter az adszorpciós koefficiens, amely az adott anyagnak talajban/iszapban fennálló koncentrációja és ugyanazon anyag vizes fázisban, adszorpciós egyensúlyi helyzetben rögzíthető koncentrációja közötti arányként fejezhető ki. A talaj Koc szervesszén-tartalmára vonatkoztatott adszorpciós koefficiens megmutatja, hogy a vegyi anyag mennyire képes kötődni a talaj vagy a szennyvíziszap szervesanyag-tartalmához, és lehetővé teszi az összehasonlítást különböző vegyi anyagok között. E paraméter értékét a vízoldhatóság és az n-oktanol/víz megoszlási koefficiens közötti korreláció révén lehet megbecsülni (1) (2) (3) (4) (5) (6) (7).
Az e vizsgálatban leírt kísérleti módszer nagyhatékonyságú folyadékkromatográfot (HPLC) használ a talajokon és szennyvíziszapokon mutatott Koc adszorpciós koefficiens becsléséhez (8). A becsült eredmények megbízhatóbbak a QSAR módszerrel (9) kaphatóknál. Becslési módszer lévén nem képes teljeskörűen kiváltani a C.18 vizsgálati módszer esetében használt tömeges egyensúlyi kísérleteket. A Koc becsült értékének ismerete azonban hasznos lehet a C.18 módszernek megfelelően végzendő adszorpciós/deszorpciós vizsgálatokhoz szükséges, megfelelő vizsgálati paraméterek kiválasztásakor, a Kd (megoszlási koefficiens) vagy a Kf (Freundlich-féle adszorpciós koefficiens) értékének a 3. egyenlet szerinti kiszámításánál (lásd 1.2. szakasz).
1.2. FOGALOMMEGHATÁROZÁSOK
Kd : a megoszlási koefficiens (szilárd anyag/víz) egy olyan vizsgált anyag „C” egyensúlyi koncentrációértékeinek az arányaként fejezhető ki, amely anyagot egy szorbensből (talaj vagy szennyvíziszap) és egy vizes fázisból álló, kétfázisú rendszerben oldanak fel; ez egy dimenzió nélküli érték, mivel a koncentráció értékét mindkét fázisban tömeg/tömeg fejezik ki. Ha a koncentráció vizes fázisbeli értékét tömeg/térfogat alapon adják meg, akkor a mértékegység ml/g-l. A Kd értéke a szorbens anyag tulajdonságaitól függően változhat, és függhet a koncentrációtól.
|
|
(1) |
ahol:
|
Ctalaj |
= |
talajban lévő vizsgált anyag koncentrációja egyensúlyi helyzetben (μg.g-1) |
|
Ciszap |
= |
az iszapban lévő vizsgált anyag koncentrációja egyensúlyi helyzetben (μg.g-1) |
|
Caq |
= |
a vizes fázisban lévű vizsgált anyag koncentrációja egyensúlyi helyzetben (μg.g-1, μg.ml-1). |
Kf : a Freundlich-féle adszorpciós koefficiens a vizsgált anyag talajban vagy szennyvíziszapban mért (x/m) koncentrációjaként határozható meg, akkor, amikor az Caq egyensúlyi koncentráció a vizes fázisban l-gyel egyenlő; a mértékegység mg.g-1 szorbens. Ez az érték a szorbens anyag tulajdonságaival együtt változhat.
|
|
(2) |
ahol:
|
x/m |
= |
egyensúlyi helyzetben lévő szorbens anyag m (gramm) mennyiségében elnyelt vizsgált anyag x mennyisége (mg) |
|
l/n |
= |
a Freundlich-féle adszorpciós izoterma meredeksége |
|
Caq |
= |
a vizsgált anyag koncentrációja vizes fázisban egyensúlyi helyzetben (μg.ml-1) |
At
Koc = a szorbens anyag szervesszén-tartalmában (foc) kifejezett Kd megoszlási koefficiens vagy Kf Freundlich-féle adszorpciós koefficiens; különösen a nem ionos vegyi anyagok esetében ez egy közelítő pontosságú jelzőszáma az anyag és a szorbens közti adszorpció mértékének, és összehasonlításokat tesz lehetővé különböző vegyi anyagok között. A Kd és Kf mértékegységétől függően a Koc dimenzió nélküli érték lehet, vagy mg × g_1 vagy mg × mf1 szerves anyag mértékegységgel fejezhető ki.
|
|
(3) |
A Koc és Kd közötti összefüggés nem mindig lineáris, és ezért a Koc értékei talajonként változhatnak, azonban változékonyságuk a Kd vagy a Kf értékeihez képest kis mértékű.
A Koc adszorpciós koefficiens a (k) kapacitási faktorból vezethető le, felhasználva a kiválasztott referenciavegyületekből levezetett log k' / log Koc kalibrációs görbét.
|
|
(4) |
ahol:
|
tR |
= |
a vizsgált- és referenciaanyagok HPLC-s retenciós ideje {perc} |
|
t0 |
= |
a HPLC holtideje (perc) (lásd 1.8.2. szakasz) |
POW : Az oktanol/víz megoszlási koefficiens az n-oktanolban és vízben lévő oldott anyag koncentrációértékeinek az arányaként fejezhető ki: ez dimenzió nélküli érték.
|
|
(5) |
1.3. REFERENCIAANYAGOK
A módszer használata előtt meg kell ismerni az anyag szerkezeti képletét, tisztaságát és disszociációs állandóját (ha ez értelmezhető). A vízben és szerves oldószerekben való oldhatóságra, az oktanol/víz megoszlási koefficiensre és a hidrolízis során mutatott tulajdonságokra vonatkozó információk ismerete is hasznos.
Ahhoz, hogy meg lehessen állapítani egy vizsgált anyag mért HPLC-retenciósidő-adatai és Koc adszorpciós koefficiense közötti korrelációt, előbb meg kell szerkeszteni a log k' / log Koc kalibrációs görbét. Ehhez legalább hat referenciapontot kell használni, egyet-egyet a vizsgált anyag várt értéke alatt, illetve fölött kiválasztva. A módszer pontossága lényegesen javul, ha olyan referenciaanyagokat használnak, amelyek szerkezetüket tekintve hasonlóak a vizsgált anyaghoz. Ha ilyen adatok nem állnak rendelkezésre, akkor a felhasználónak kell kiválasztania a megfelelő kalibrációs anyagokat. Ebben az esetben általánosabb, strukturálisan heterogén anyagokat kell kiválasztani. A javasolt referenciaanyagok és ezek Koc-értékeinek jegyzéke a függelékben található, az 1. táblázatban a szennyvíziszapra, illetve a 3. táblázatban a talajra vonatkozóan. Más kalibrációs anyagok kiválasztását meg kell indokolni.
1.4. A VIZSGÁLATI MÓDSZER ELVE
A HPLC módszerhez a kereskedelemben kapható és lipofil és poláros oldalláncokat tartalmazó ciánopropil szilárd fázissal töltött analitikai kolonnákat használnak. Közepesen poláris, szilika alapú állófázis használatos:
|
–O -Si |
–CH2 – CH2 – CH2 |
–CN |
|
szilika |
nem poláris közeg |
poláris oldallánc |
A vizsgálati módszer alapelve hasonló az A.8. módszerhez (megoszlási koefficiens, HPLC módszer). Miközben a vizsgált anyag a mozgófázissal együtt végighalad a kolonnán, a vizsgált anyag reakcióba lép az állófázissal. A mozgó- és állófázis közötti megoszlás eredményeként a vizsgált anyag késleltetetten jelenik meg. A poláris és nem poláris kötőhelyekkel egyaránt rendelkező állófázis kettős összetétele lehetővé teszi a reakció létrejöttét egy adott molekula poláris és nem poláris csoportjaival, hasonló módon ahhoz, ahogyan ez a talaj és a szennyvíziszap mátrixokban lévő szerves anyagoknál is lezajlik. Mindez lehetővé teszi a kolonnánál tapasztalt retenciós idő és a szerves anyag adszorpciós koefficiens közötti összefüggés megállapítását.
A pH-érték komoly hatást gyakorol a szorpciós viselkedésre, különösen a poláris anyagok esetében. A mezőgazdasági hasznosítású talajokban vagy a szennyvíztisztítók tartályaiban a pH-érték általában 5,5 és 7,5 között ingadozik. Az ionképző anyagokra nézve kétféle vizsgálatot kell elvégezni, megfelelő pufferoldatokban mind az ionizált, mind a nem ionizált változattal, de csak olyan esetekben, amikor a vizsgált vegyület legalább 10 százaléka disszociálódik az 5,5–7,5 pH-érték tartományon belül.
Mivel az értékelés céljaira csak a HPLC kolonnában való retenció és az adszorpciós koefficiens közötti összefüggést használják, nincs szükség kvantitatív analitikai módszerre, és csak a retenciós időt kell meghatározni. Ha rendelkezésre áll a referenciaanyagok egy megfelelő készlete és szabványos kísérleti feltételeket biztosítani lehet, akkor a módszer gyors és hatékony módot kínál a Koc adszorpciós koefficiens becsléséhez.
1.5. A VIZSGÁLAT ALKALMAZHATÓSÁGA
A HPCL módszer olyan (jelölt vagy jelöletlen) kémiai anyagok esetében alkalmazható, amelyekre nézve egy megfelelő észlelési rendszer (pl. spektrofotométer, radioaktivitás érzékelő) áll rendelkezésre, és amelyek kellően stabilak a kísérlet végrehajtása alatt. Különösen hasznos lehet e módszer olyan vegyi anyagok esetében, amelyeket nehéz tanulmányozni másfajta kísérleti rendszerekkel (azaz illékony anyagok; olyan anyagok, amelyek nem oldódnak vízben olyan koncentrációban, amit analitikus módszerekkel már mérni lehetne; anyagok, amelyek nagyfokú affinitást mutatnak az inkubációs rendszerek belső felületeivel). A módszer használható olyan elegyek esetében, amelyek nem adnak szétváló elúciós sávokat. Ilyen esetben a vizsgált anyagkeverék vegyületei log Koc értékeinek a felső és alsó határértékeit meg kell adni.
A szennyeződések olykor megnehezíthetik a HPLC eredmények értelmezését, azonban jelentőségük csekély marad mindaddig, amíg a vizsgált anyagot analitikai módszerekkel egyértelműen be lehet azonosítani és el lehet különíteni a szennyező anyagoktól.
A módszert a függelék 1. táblázatában felsorolt anyagokra validálták, és már alkalmazták egy sor további, az alábbi vegyületcsoportokba sorolt vegyi anyagokra nézve:
|
— |
aromás aminok (pl. trifluralin, 4-klór-nilin, 3,5-dinitroanilin, 4-metilanilin, N-metilanilin, 1-naftilamin), |
|
— |
aromás karboxilsavészterek (pl. benzoesavas metilészter, 3,5-dinitrobenzoesavas etilészter), |
|
— |
aromás szénhidrogének (pl. toluol, xilol, etilbenzol, nitrobenzol), |
|
— |
aryloxyphenoxypropionsav észterek (pl. diclofop-metil, fenoxaprop-etil, fenoxaprop-P-etil), |
|
— |
benzimidazol és imidazol fungicidek (pl. karbendazim, fuberidazol, triazoxid), |
|
— |
karboxilsavamidok (pl. 2-klórbenzamid, N, N-dimetilbenzamid, 3,5-dinitrobenzamid, N-metilbenzamid, 2-nitrobenzamid, 3-nitrobenzamid), |
|
— |
klórozott szénhidrogének (pl. endoszulfán, DDT, hexaklorobenzol, quintozol, 1,2,3-triklórbenzol), |
|
— |
szerves foszfortartalmú rovarirtók (pl. azinfosz-metil, disulfoton, fenamifosz, izofenfosz, pirozofosz, sulprofosz, triazofosz), |
|
— |
fenolok (pl. fenol, 2-nitrofenol, 4-nitrofenol, pentaklórfenol, 2,4,6-triklórfenol, 1-naftol), |
|
— |
fenilurea-származékok (pl. izoproturon, monolinuron, pencycuron), |
|
— |
pigment festékanyagok (pl. Acid Yellow 219, Basic Blue 41, Direct Red 81), |
|
— |
poliaromás szénhidrogének (pl. acenaftén, naftalin), |
|
— |
1,3,5-triazin gyomirtók (pl. prometrin, propazin, simazin, terbutrin), |
|
— |
triazolszármazékok (pl. tebukonazol, triadimefon, tradimenol, triapentenol). |
A módszer nem alkalmazható olyan anyagokra, amelyek akár az eluenssel, akár az állófázissal reakcióba lépnek. Ugyancsak nem alkalmazható olyan anyagokra, amelyek különleges módon lépnek reakcióba a szervetlen komponensekkel (pl. komplexképzés az anyagásványokkal). A módszer nem feltétlenül működik felületaktív anyagok, szervetlen vegyületek és közepesen erős vagy erős szerves savak és bázisok esetén. Az 1,5-től 5-ig terjedő log Koc értékek határozhatók meg. Ionizálható anyagokat pufferolt mozgófázis használatával kell mérni, de óvatosan kell eljárni, hogy elkerüljék a puffer komponensek vagy a vizsgált anyag kicsapódását.
1.6. MINŐSÉGI KRITÉRIUMOK
1.6.1. Pontosság
Egy adott vizsgált anyag adszorpciós koefficiensét általában az egyensúlyi módszerrel (lásd a függelék 1. táblázata) meghatározott érték ± 0,5 log egységen belüli pontossággal lehet becsülni. Nagyobb pontosságot akkor lehet elérni, ha a referenciaanyagok strukturálisan rokonságban állnak a vizsgált anyaggal.
1.6.2. Megismételhetőség
Az értékek meghatározását legalább kétszer el kell végezni. Az egyedi mérésekből származtatott log Koc értékeknek a 0,25 log egység tartományon belül kell maradniuk.
1.6.3. Reprodukálhatóság
A módszer alkalmazásával eddig nyert tapasztalatok alátámasztják a módszer validitását. A HPLC módszer vizsgálata, amelyhez 48 olyan anyagot (főként peszticideket) használtak fel, amelyekre nézve megbízható adatok álltak rendelkezésre a talajon mért Koc értékekről, R = 0,95 korrelációs koefficienset eredményezett (10) (11).
11 laboratórium bevonásával elvégzett összehasonlító vizsgálatra került sor a módszer tökéletesítése és validitása érdekében (12). Az eredményeket a függelék 2. táblázata tartalmazza.
1.7. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.7.1. Az adszorpciós koefficiens előzetes becslése
A Pow (= Kow) oktanol/víz megoszlási koefficiens és – bizonyos mértékig – a vízoldhatóság az adszorpció mértékének jelzőszámaiként használhatók fel, különösen a nem ionos anyagok esetében, s ennélfogva az értéktartományok előzetes behatárolására alkalmazhatók. A vegyi anyagok több csoportjára vonatkozóan is publikáltak már különféle hasznos korrelációkat (1) (2) (3) (4) (5) (6) (7).
1.7.2. Készülék
Egy pulzálásmentes pumpával és egy alkalmas érzékelő készülékkel felszerelt folyadékkromatográfra van szükség. Javasolt egy injektáló hurokvezetékkel felszerelt szelep használata. Kémiailag kötött kereskedelmi cyanopropil szilika alapú töltet használata javasolt (pl. Hipersil és Zorbax CN). Az injektáló rendszer és az analitikai kolonna közé egy, azonos anyagtöltetű előtétoszlopot lehet elhelyezni. A különféle szállítóktól származó kolonnák szétválasztási képessége jelentősen eltérhet egymástól. Iránymutatásként, a következő k' kapacitási faktorokkal rendelkezzen: log k' > 0,0 a log Koc = 3,0, valamint log k' > 0,4 a log Koc = 2,0 érték esetében, ha mozgófázisként metanol és víz 55:45 arányú keverékét használják.
1.7.3. Mozgófázis
A már vizsgált többféle mozgófázis közül a következő kettő használata ajánlott:
|
— |
metanol/víz (55:45 v/v), |
|
— |
metanol/0,01 M citrátpuffer, pH-érték 6,0 (55:45 v/v). |
Az elúciós oldat elkészítéséhez HPLC-minőségű metanol és desztillált víz vagy citrátpuffer használatos. A keveréket használat előtt gázmentesíteni kell. Izokratikus elúciót célszerű alkalmazni. Ha a metanol/víz elegy nem felel meg a célnak, ki lehet próbálni más szerves oldószerek és víz keverékeit, pl. etanol/víz vagy acetonitril/víz keverékeket. Az ionizálható vegyületek esetében pufferoldat használata javasolt a pH-érték stabilizálása érdekében. Ügyelni kell az egyes szerves fázis/puffer keverékek esetében esetleg előforduló csapadék/sókicsapódás és a kolonnatöltet minőségromlásának elkerülésére.
Nem szabad adalékanyagokat (pl. ion-pár reagenseket) használni, mert ezek hatással lehetnek az állófázis szorpciós képességeire. Az állófázis ilyen változásai pedig irreverzibilisek lehetnek. Emiatt az adalékanyagok használatával járó kísérleteket kötelezően külön kolonnában kell végrehajtani.
1.7.4. Oldott anyagok
A vizsgált és referenciaanyagokat a mozgó fázisban kell feloldani.
1.8 A VIZSGÁLAT VÉGREHAJTÁSA
1.8.1. Vizsgálati körülmények
A mérések során fel kell jegyezni a hőmérsékletet. Hangsúlyozottan javasolt a szabályozott hőmérsékletű oszlop használata, hogy biztosítható legyen a kísérleti körülmények állandó értéken tartása a kalibrációs és becslési műveletek, valamint a vizsgált anyag mérései során.
1.8.2. A to holtidő meghatározása
A to holtidő meghatározására két különböző módszer használható (lásd még 1.2. szakasz).
1.8.2.1. A to holtidő meghatározása egy homológ sor segítségével
Erről az eljárásról bebizonyosodott, hogy megbízható és szabványos to értékeket eredményez. A részleteket lásd az A.8 vizsgálati módszernél: n-oktanol/víz megoszlási koefficiens, HPLC módszer.
1.8.2.2. A to holtidő meghatározása olyan inert anyagok által, amelyeknél a kolonnán való áthaladás során nem lép fel retenció
Ez az eljárás a formamid, urea vagy nátrium-nitrát alapú oldatok befecskendezésén alapul. A méréseket legalább kétszer el kell végezni.
1.8.3 A tR retenciós idő meghatározása
A referenciaanyagokat az 1.3. szakaszban leírtaknak megfelelően kell kiválasztani. Retenciós idejük meghatározása érdekében ezeket keverékstandardként lehet beinjektálni, feltéve, hogy bizonyítható, hogy az egyes referenciaanyagok retenciós idejét nem befolyásolja más referenciaanyagok jelenléte. A kalibrálást rendszeres időközönként, naponta legalább kétszer meg kell ismételni, hogy számításba lehessen venni a kolonna teljesítményében esetleg bekövetkező váratlan változásokat. Az a legjobb gyakorlat, ha a kalibrációs célú injektálásokat a vizsgált anyag beinjektálása előtt és után végzik el, azt megerősítendő, hogy a retenciós időtartamok változatlanok. A kolonnák túlterhelésének megelőzése érdekében a vizsgált anyagokat a lehető legkisebb adagokban kell egymástól elkülönítetten beinjektálni, és retenciós idejüket ezután kell meghatározni.
A mérések megbízhatósága fokozásának érdekében az értékek meghatározását legalább kétszer meg kell ismételni. Az egyedi mérési adatokból származtatott log Koc értékeknek egy 0,25 log egység tartományba kell esniük.
1.8.4. Értékelés
A k' kapacitási faktorokat a kiválasztott referenciaanyagok to holtidejéből és tR retenciós idejéből, a 4. egyenlet használatával kell kiszámolni (lásd 1.2. szakasz). A referenciaanyagok log k adatait ekkor a függelék 1. és 3. táblázatában megadott egyensúlyi kísérletekből levezetett log Koc értékekhez viszonyítva kell grafikusan ábrázolni. A grafikon segítségével ekkor a vizsgált anyag log k' értékét lehet felhasználni a log Koc értékének meghatározásához. Ha a ténylegesen kapott eredmények azt mutatják, hogy a vizsgált anyag log Koc értékei kívül esnek a kalibrációs tartományon, akkor a vizsgálatot más, a célnak jobban megfelelő referenciaanyagok használatával meg kell ismételni.
2. ADATOK ÉS JELENTÉSKÉSZÍTÉS
A vizsgálati jelentésben a következő információknak kell szerepelniük:
|
— |
a vizsgált anyagok és referenciaanyagok megnevezése, tisztaságuk, valamint – adott esetben – pKa értékeik megjelölése, |
|
— |
a műszer leírása és a vizsgálati körülmények, pl. az analitikai (és az előtét-) kolonnák típusa és méretei, az észlelés eszközei, a mozgófázis (a komponensek aránya és pH-érték közötti kapcsolat), a mérések hőmérséklet-tartománya, |
|
— |
holtidő és a holtidő meghatározására használt módszer, |
|
— |
a kolonnába beadagolt vizsgált anyagok és referenciaanyagok mennyisége, |
|
— |
a kalibráció céljára felhasznált referenciavegyületek retenciós ideje, |
|
— |
a regresszió egyenes jellemzői (log k' és log Koc között) és a regressziós egyenes grafikonja, |
|
— |
a vizsgált vegyület átlagos retenciós adatai és becsült log Koc értéke, |
|
— |
kromatogramok. |
3. SZAKIRODALOM
|
(1) |
W. J. LYMAN, W. F. Reehl, D. H. Rosenblatt (ed). (1990). Handbook of chemical property estimation methods, Chap. 4, McGraw-Hill, New York. |
|
(2) |
J. Hodson, N. A. Williams (1988). The estimation of the adsorption coefficient (Koc) for soils by HPLC. Chemosphere, 17, 167. |
|
(3) |
G. G. Briggs (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem., 29, pp. 1050-1059. |
|
(4) |
C. T. Chiou, P. E. Porter, D. W. Schmedding (1983). Partition equilibria of nonionic organic compounds between soil organic matter and water. Environ. Sci. Technol., 17, pp. 227-231. |
|
(5) |
Z. Gerstl, U. Mingelgrin (1984). Sorption of organic substances by soils and sediment. J. Environm. Sci. Health, B19, pp. 297-312. |
|
(6) |
C. T. Chiou, L. J. Peters, V. H. Freed (1979). A physical concept of soil water equilibria for nonionic organic compounds, Science, 106, pp. 831-832. |
|
(7) |
S. W. Karickhoff (1981). Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils. Chemosphere, 10, pp. 833-846. |
|
(8) |
W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), pp. 121-128. |
|
(9) |
M. Mueller, W. Kördel (1996). Comparison of screening methods for the estimation of adsorption coefficients on soil. Chemosphere, 32(12), pp. 2493-2504. |
|
(10) |
W. Kördel, J. Stutte, G. Kotthoff (1993). HPLC-screening method for the determination of the adsorption coefficient in soil-comparison of different stationary phases, Chemosphere, 27(12), pp. 2341-2352. |
|
(11) |
B. von Oepen, W. Kördel, W. Klein (1991). Sorption of nonpolar and polar compounds to soils: Processes, measurements and experience with the applicability of the modified OECD Guideline 106, Chemosphere, 22, pp. 285-304. |
|
(12) |
W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), pp. 1373-1384. |
függelék
1. Táblázat
A talajokra és szennyvíziszapokra vonatkozó Koc értékek és a HPLC kiválasztási módszerrel számított értékek összehasonlítása (31), (32)
|
Anyag megnevezése |
CAS-szám |
Log Koc szennyvíziszapoknál |
HPLC |
Δ |
Log Koc talajoknál |
HPLC |
Δ |
|
Atrazine |
1912-24-9 |
1,66 |
2,14 |
0,48 |
1,81 |
2,20 |
0,39 |
|
Linuron |
330-55-2 |
2,43 |
2,96 |
0,53 |
2,59 |
2,89 |
0,30 |
|
Fenthion |
55-38-9 |
3,75 |
3,58 |
0,17 |
3,31 |
3,40 |
0,09 |
|
Monuron |
150-68-5 |
1,46 |
2,21 |
0,75 |
1,99 |
2,26 |
0,27 |
|
Fenantrén |
85-01-8 |
4,35 |
3,72 |
0,63 |
4,09 |
3,52 |
0,57 |
|
Benzoesavas fenilészter |
93-99-2 |
3,26 |
3,03 |
0,23 |
2,87 |
2,94 |
0,07 |
|
Benzamid |
55-21-0 |
1,60 |
1,00 |
0,60 |
1,26 |
1,25 |
0,01 |
|
4-nitrobenzamid |
619-80-7 |
1,52 |
1,49 |
0,03 |
1,93 |
1,66 |
0,27 |
|
Acetanilid |
103-84-4 |
1,52 |
1,53 |
0,01 |
1,26 |
1,69 |
0,08 |
|
Anilin |
62-53-3 |
1,74 |
1,47 |
0,27 |
2,07 |
1,64 |
0,43 |
|
2,5-Diklóranilin |
95-82-9 |
2,45 |
2,59 |
0,14 |
2,55 |
2,58 |
0,03 |
2. Táblázat
A HPLC módszer tökéletesítése és validálása érdekében 11 részt vevő laboratórium által végzett összehasonlító vizsgálatok eredményei (33)
|
|
|
Log Koc |
Koc |
Log Koc |
|
(OECD 106) |
(HPLC módszer) |
|||
|
Atrazine |
1912-24-9 |
1,81 |
78 ±16 |
1,89 |
|
Monuron |
150-68-5 |
1,99 |
100 ± 8 |
2,00 |
|
Triapenthenol |
77608-88-3 |
2,37 |
292 ± 58 |
2,47 |
|
Linuron |
330-55-2 |
2,59 |
465 ± 62 |
2,67 |
|
Fenthion |
55-38-9 |
3,31 |
2062 ±64 8 |
3,31 |
3. Táblázat
Ajánlott referenciaanyagok a talaj adszorpciós adatokra alapozott HPLC kiválasztási módszer alkalmazásához
|
Referenciaanyag megnevezése |
CAS-szám |
Log Koc átlagértékek az egyensúlyi vizsgálatból |
A Koc ad at ok száma |
Log S. D. |
Forrás |
|
Acetanilide |
103-84-4 |
1,25 |
4 |
0,48 |
|
|
Fenol |
108-95-2 |
1,32 |
4 |
0,70 |
|
|
2-nitrobenzamid |
610-15-1 |
1,45 |
3 |
0,90 |
|
|
N, N-dimetilbenzamid |
611-74-5 |
1,52 |
2 |
0,45 |
|
|
4-metilbenzamid |
619-55-6 |
1,78 |
3 |
1,76 |
|
|
Metilbenzoát |
9 3-58-3 |
1,80 |
4 |
1,08 |
|
|
Atrazin |
1912-24-9 |
1,81 |
3 |
1,08 |
|
|
lzoproturon |
34123-59-6 |
1,86 |
5 |
1,53 |
|
|
3-nitrobenzamid |
64 5-09-0 |
1,95 |
3 |
1,31 |
|
|
Anilin |
62-53-3 |
2,07 |
4 |
1,73 |
|
|
3,5-dinitrobenzamid |
121-81-3 |
2,31 |
3 |
1,27 |
|
|
Karbendazim |
1060 5-21-7 |
2,35 |
3 |
1,37 |
|
|
Triadimenol |
55219-65-3 |
2,40 |
3 |
1,85 |
|
|
Triazoxid |
724 59-58-6 |
2,44 |
3 |
1,66 |
|
|
Triazofosz |
24017-47-8 |
2,55 |
3 |
1,78 |
|
|
Linuron |
330-55-2 |
2,59 |
3 |
1,97 |
|
|
Naftalin |
91-20-3 |
2,75 |
4 |
2,20 |
|
|
Endoszulfán-diol |
2157-19-9 |
3,02 |
5 |
2,29 |
|
|
Metiokarb |
20 32-65-7 |
3,10 |
4 |
2,39 |
|
|
Acid Yellow 219 |
6340 5-85-6 |
3,16 |
4 |
2,83 |
|
|
1,2,3-triklórbenzol |
87-61-6 |
3,16 |
4 |
1,40 |
|
|
g-HCH |
58-89-9 |
3,23 |
5 |
2,94 |
|
|
Petition |
5 5- 3 8-9 |
3,31 |
3 |
2,49 |
|
|
Direct Red 81 |
2610-11-9 |
3,43 |
4 |
2,68 |
|
|
Pitrazofosz |
13457-18-6 |
3,65 |
3 |
2,70 |
|
|
a-endoszulfán |
959-98-8 |
4,09 |
5 |
3,74 |
|
|
Diklofop-metil |
51538-27-3 |
4,20 |
3 |
3,77 |
|
|
Fenantrén |
8 5-01-8 |
4,09 |
4 |
3,83 |
|
|
Basic Blue 41 (keverék) |
26850-47-5 12270-13-2 |
4,89 |
4 |
4,46 |
|
|
DDT |
50-29-3 |
5,63 |
1 |
— |
C.20. DAPHNIA MAGNÁN VÉGZETT REPRODUKCIÓS VIZSGÁLAT
1. MÓDSZER
E reprodukciós toxicitási vizsgálati módszer megfelel az OECD TG 21 l-nek (1998).
1.1. BEVEZETÉS
E vizsgálat elsődleges célja annak felmérése, hogy a vegyi anyagok milyen hatást gyakorolnak a Daphnia magna reprodukciós teljesítményére.
1.2. FOGALOMMEGHATÁROZÁSOK ÉS MÉRTÉKEGYSÉGEK
Szülők: a vizsgálat kezdetén jelen lévő nőstény Daphnia-egyedek, amelyek szaporodási teljesítménye e vizsgálat tárgyát képezi.
Szaporulat: azon fiatal Daphnia-egyedek, amelyek a vizsgálat során születnek a szülőktől.
Legalacsonyabb megfigyelhető hatást okozó koncentráció (LOEC): azon legalacsonyabb vizsgálati koncentráció, amelynél a kontrollcsoporttal összevetve megfigyelhető a vizsgált anyag statisztikailag jelentős hatása a reprodukcióra és a szülők mortalitására (p < 0,05) a megfigyelt behatási periódusban. Azonban a LOEC-szint feletti valamennyi vizsgálati koncentrációnak olyan ártalmas hatást kell kifejtenie, amely legalább egyenlő a LOEC-szinten megfigyelttel vagy súlyosabb annál. Amennyiben e két feltétel nem teljesíthető, akkor kimerítő magyarázatot kell adni arra, hogy hogyan történt a LOEC (és ennélfogva a NOEC) kiválasztása.
Hatástalan koncentráció: a közvetlenül a LOEC alatti vizsgálati koncentráció, amely – a kontrollcsoporttal való összevetésben – nem fejt ki statisztikailag jelentős hatást (p < 0,05), a meghatározott expozíciós időszak alatt.
ECx : ez a vízben oldott vizsgált anyag azon koncentrációja, amely a Daphnia magna reprodukciójában x % csökkenést okoz meghatározott expozíciós időszak alatt.
Belső növekedési ráta: a populáció növekedésének mértéke, amely a reprodukciós teljesítményből és a korspecifikus pusztulásból tevődik össze (20) (21) (22). Az egyensúlyi populációk esetében ez pontosan nulla. A növekedő populációknál pozitív, a csökkenő populációknál negatív. Ez utóbbi nyilvánvalóan nem fenntartható, és végül kihaláshoz vezet.
Érzékelési határ a legalacsonyabb koncentráció, amelyet érzékelni lehet, de számszerűsíteni már nem.
Meghatározási határ: a számszerűsíthetően mérhető legalacsonyabb koncentráció.
Mortalitás: egy állat akkor tekinthető kimúltnak, ha mozdulatlan, azaz ha nem képes úszni, vagy ha a tesztedény enyhe rázogatása után 15 másodpercen belül nem figyelhető meg mozgás a függelékben vagy az utóbélben. (Más meghatározás használata esetén ezt a hozzá tartozó irodalmi hivatkozással együtt kell megadni.)
1.3. A VIZSGÁLATI MÓDSZER ELVE
Fiatal, a vizsgálat kezdetekor 24 órásnál nem idősebb nőstény Daphniákat (a szülőket) a vízhez különféle koncentrációszintekben adagolt vizsgálati anyag hatásának kell kitenni. A vizsgálat időtartama 21 nap. A vizsgálati időszak végén fel kell mérni a vizsgálat végén még életben lévő szülők élő szaporulatának teljes számát. Ez azt jelenti, hogy a vizsgálat során kimúlt szülő állatok szaporulatát ki kell zárni a számításból. A szülők reprodukciós teljesítményét más módokon is ki lehet fejezni (pl. az első utód megjelenésének napjától számítva a naponta egy állatra jutó élő utódok száma), ezt azonban a vizsgálati időszak végén még élő szülőkre jutó élő utódok teljes száma mellett, kiegészítésként lehet jelenteni. A vizsgált anyag hatásának kitett állatok szaporulatát össze kell hasonlítani a kontrollcsoport szaporulatával, a legalacsonyabb megfigyelhető hatást okozó koncentráció (LOEC), s ezzel összefüggésben a hatástalan legmagasabb koncentráció (NOEC) szintjének meghatározása érdekében. Ezen túlmenően lehetőség szerint egy regressziós modell segítségével kell az adatokat elemezni azon koncentrációszint becslése érdekében, amely egy x százaléknyi csökkenést okoz a szaporulatban (például EC50, EC20, illetve az EC10).
A jelentésbe bele kell foglalni a szülők túlélési arányát és az első ivadékok megjelenésének idejét is. Vizsgálni lehet továbbá a vizsgált anyag más paraméterekre gyakorolt hatásait is, mint pl. a növekedés (pl. testhossz) és a valószínű belső növekedési ráta.
1.4. A VIZSGÁLT ANYAGRA VONATKOZÓ INFORMÁCIÓK
Rendelkezésre kell hogy álljanak a Daphnia magna fajjal végzett akut toxicitási vizsgálatok eredményei (lásd a C.2. módszer 1. része). Az eredmények a reprodukciós vizsgálatok során hasznosak lehetnek a vizsgálati koncentrációk megfelelő tartományának megállapításában. Ismerni kell a vizsgált anyag vízoldékonyságát és gőznyomását, és egy olyan megbízható analitikai módszerrel kell rendelkezni a vizsgálati oldatokban lévő anyag számszerű meghatározásához, amelynek visszanyerési hatékonysága és mérési határa ismert.
A vizsgált anyagra vonatkozó azon információkhoz, amelyek hasznosak lehetnek a vizsgálati körülmények megállapításához, tartozik még a szerkezeti képlet, az anyag tisztasága, fénystabilitása, stabilitása vizsgálati körülmények között, pKa és megoszlási koefficiens (n-oktanol/víz) értékek, valamint a biológiai lebonthatóságra vonatkozó vizsgálat eredményei is (lásd a C.4. módszert).
1.5. ÉRVÉNYESSÉGI KRITÉRIUMOK
A vizsgálat érvényesságéhez az alábbi teljesítménykritériumoknak kell teljesülniük a kontrollcsoport(ok)ban:
|
— |
a vizsgálat végén a szülők (nőstény Daphnia) mortalitási aránya nem haladja meg a 20 %-ot, |
|
— |
a vizsgálat végén még élő szülők élő szaporulatának átlagos száma >= 60. |
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Felszerelés
A vizsgálati edények és minden más, a vizsgálati oldatokkal közvetlenül érintkező más felszerelések üvegből vagy más, kémiailag közömbös anyagból készülnek. A vizsgálati edények általában üveglombikok.
Ezenfelül szükség lehet az alábbi berendezések némelyikére vagy mindegyikére:
|
— |
oxigénmérő (mikroelektróddal vagy más olyan berendezés segítségével, amelynek a rendeltetése csekély mennyiségű mintában az oldott oxigén mérése), |
|
— |
megfelelő hőmérséklet-szabályozó készülék, |
|
— |
pH-mérő, |
|
— |
a vízkeménységet meghatározó készülékek, |
|
— |
a víz összes szervesszén-koncentrációjának (TOC) vagy a kémiai oxigénigény (COI) meghatározására alkalmas készülék, |
|
— |
megfelelő berendezés a fény szabályozására és intenzitásának mérésére. |
1.6.2. Vizsgált organizmus
A vizsgálat során használt állatfaj a Daphnia magna Straus. Más Daphnia-fajokat is fel lehet használni, feltéve, hogy azok kielégítik a megfelelő érvényességi kritériumokat (az egyes Daphnia-fajokra jellemző szaporodási kritériumok a kontrollban teljesülnek). Más Daphnia-fajok használata esetén ezeket egyértelműen azonosítani kell és alkalmazásukat meg kell indokolni.
A klónt lehetőleg genotípusos meghatározással kell beazonosítani. Kutatások (1) kimutatták, hogy az „A” Klón (amely a franciaországi IRCHA-ból származik) (3) reprodukciós teljesítménye következetesen kielégíti az e módszerben leírt feltételek mellett tenyésztett, a vizsgálatot túlélő egyes szülőkre átlagosan jutó >= 60 utód érvényességi kritériumot. Emellett azonban más klónok is elfogadhatók, feltéve, hogy a Daphnia tenyészetről kimutatható, hogy kielégíti a vizsgálat érvényességi kritériumait.
A vizsgálat kezdetekor az állatok nem lehetnek idősebbek 24 óránál, és nem származhatnak az első szaporulatból. Az állatoknak egészséges törzstenyészetből kell származniuk (azaz nem mutathatják a stressz jeleit, mint pl. magas mortalitás, hímek vagy ephippia jelenléte, késedelem az első szaporulat létrehozásában, színtelen állatok stb.). A törzstenyészet állatait hasonló tenyésztési körülmények között kell tartani (megvilágítás, hőmérséklet, közeg, táplálék és állatok mennyisége térfogategységre számolva), mint a vizsgálat céljaira alkalmazandókat. Ha a vizsgálat során használandó tenyészfolyadék jellemzői eltérnek azon közeg jellemzőitől, amelyben a Daphniákat szokásos módon tenyésztik, akkor megfelelő egy szokásosan mintegy háromhetes akklimatizációs időszak biztosítása a vizsgálat előtt (azaz egy generációnyi idő), a szülők stresszmentesítése érdekében.
1.6.3. Tenyészfolyadék
Javasolt egy teljeskörűen meghatározott tenyészfolyadék használata a vizsgálat során. Így elkerülhető az adalékanyagok (pl. alga, talajkivonatok stb.) használata, amelyeket nehéz jellemezni, és mindez elősegíti a laboratóriumok közötti szabványosítás lehetőségét. E célra az Elendt M4 (4) és M7 tenyészfolyadék (lásd az 1. függeléket) bizonyult alkalmasnak. Azonban másfajta tenyészfolyadékok (pl. (5) és (6)) is elfogadhatók, feltéve, hogy a Daphnia tenyészet teljesítménye bizonyíthatóan kielégíti a vizsgálat validitási kritériumait.
Nem definiált adalékokat tartalmazó tenyészfolyadékok használata esetén az ilyen adalékokat egyértelműen meg kell határozni, és megfelelő információkat kell megadni a vizsgálati jelentésben összetételükről és különösen a széntartalmukról, mert az hozzájárulhat az alkalmazott etetéshez. Javasolt a szerves adalékot tartalmazó törzsoldat összes szerves széntartalmának (TOC) és/vagy a kémiai oxigénigényének (COI) meghatározása, és annak becslése, hogy ez mennyivel járul hozzá az elkészített tesztoldat TOC/COI tartalmához. Javasolt a tenyészoldat (algák hozzáadása előtti) TOC szintjét 2 mg/l alatt tartani (7).
Fémtartalmú anyagok vizsgálatakor fontos annak felismerése, hogy a tesztfolyadék tulajdonságai (pl. keménységi fok, kelátképző képesség) hatással lehetnek a vizsgálati anyag toxicitására. Emiatt kívánatos a teljeskörűen meghatározott tenyészfolyadék használata. Jelenleg azonban a Daphnia magna hosszú távú tenyésztésére alkalmasnak ítélt, teljeskörűen meghatározott tenyészoldat az Elendt M4 és M7. Mindkét tenyészoldat tartalmaz EDTA kelátképző komponenst. Az eddigi vizsgálatok (2) kimutatták, hogy – szemben az EDTA-t egyáltalán nem tartalmazó közegekkel – a kadmium „látszólagos toxicitása” általában alacsonyabb, amennyiben a reprodukciós vizsgálatot az M4 és M7 közegben végzik el. Ezért az M4 és M7 használata nem javasolt a fémtartalmú anyagok vizsgálatához, és célszerű kerülni az ismert kelátképző szereket tartalmazó másfajta közegek használatát is. A fémtartalmú anyagok vizsgálatához tanácsos alternatív közeg használata, mint pl. az EDTA-t nem tartalmazó, ASTM szerint előállított kemény édes művíz (7), hozzáadott tengeri algakivonattal (8). Az ASTM szerint előállított kemény édes művíz és az algakivonat ilyen kombinációja is alkalmas a Daphnia magna hosszú távú tenyésztéséhez és vizsgálatához (2), bár így is kifejt egy enyhe kelátképző hatást a beadagolt tengerialga-kivonatban megtalálható szerves komponens következtében.
A vizsgálat kezdetekor és annak során az oldottoxigén-koncentráció 3 mg/l fölött van. A pH-értéknek a 6–9 tartományba kell esnie, és az nem változhat egyik vizsgálat során sem 1,5 egységnél nagyobb mértékben. Javasolt a 140 mg/l CaCO3-nál nagyobb keménység használata. Az e szintet elérő és ezt meghaladó feltételek mellett elvégzett vizsgálatok bizonyították a szaporodási képesség összhangját a validitási kritériumokkal (9) (10).
1.6.4. Vizsgálati oldatok
A kiválasztott koncentrációnak megfelelő vizsgálati oldatokat rendszerint a törzsoldat hígításával készítik el. A törzsoldatokat lehetőleg az anyagnak a tesztoldatban való feloldásával kell elkészíteni.
Egyes esetekben szerves oldószerekre vagy diszpergálószerekre van szükség a megfelelő koncentrációjú törzsoldat létrehozásához, de lehetőség szerint kerülni kell az ilyen anyagok használatát. Az alkalmas oldószerek példái: aceton, etanol, metanol, dimetilformamid és a trietilénglikol. Alkalmas diszpergálószer lehet például: Cremophor RH40, metilcellulóz 0,01 % és a HCO-40. A vizsgálati oldatokokban lévő vizsgált anyag semmiképpen sem haladhatja meg a vizsgálati közegben való oldékonyság határértékét.
Az oldószerek használatára a vízbe pontosan adagolható törzsoldat előállítása érdekében kerül sor. A végső vizsgálati közegben javasolt koncentrációjuknál (azaz <= 0,1 ml/l) a fent felsorolt oldószerek nem gyakorolnak toxikus hatást, és nem fokozzák a vizsgált anyag vízoldhatóságát.
A diszpergálószerek segíthetnek a pontos adagolásban és diszperzióban. A végső vizsgálati közegben javasolt koncentrációjuknál (azaz <= 0,1 ml/l) a fent felsorolt diszpergálószerek nem gyakorolnak toxikus hatást, és nem fokozzák a vizsgált anyag vízoldékonyságát.
1.7. A VIZSGÁLAT ELRENDEZÉSE
A kezelések vizsgálati edények közötti elosztását és a vizsgálati edények összes későbbi kezelését véletlenszerű sorrendben kell végezni. Az ebből eredő hibákat a koncentrációhatásnak tulajdoníthatjuk. Különösen igaz ez, ha a kísérleti egységeket kezelési vagy koncentráció szerinti sorrendben vizsgálják, s ekkor egyes, az idővel összefüggő hatások (mint pl. a kezelő személy fáradtsága vagy más jellegű hibák) jelentősebb hatásokat eredményezhetnek magasabb koncentrációknál. Továbbá, ha a vizsgálati eredményeket valószínűsíthetően befolyásolja a vizsgálat egy kezdeti vagy környezeti vonatkozású feltétele – pl. a laboratóriumon belüli elhelyezés –, akkor fontolóra kell venni a vizsgálat leállítását.
1.8. VIZSGÁLAT
1.8.1. A vizsgálat körülményei
1.8.1.1. Időtartam
A vizsgálat időtartama 21 nap.
1.8.1.2. Tesztállatok elrendezése
Minden, egyenként 50–100 ml vizsgálati közeget tartalmazó vizsgálati edénybe egy szülő kerül.
Néha szükségessé válhat nagyobb térfogatok használata a vizsgált anyag koncentrációjának meghatározására használt analitikai eljárás követelményeinek a teljesítése érdekében, bár a koncentráció párhuzamos edényben is mérhető. Amennyiben 100 ml-nél nagyobb térfogatot használnak, akkor szükségessé válhat a Daphniáknak adott táplálékadag növelése, a megfelelő táplálékmennyiség és a validitási kritériumok betartásának biztosítása érdekében. Átfolyásos vizsgálatok esetében – műszaki okokból – számba lehet venni alternatív vizsgálati koncepciók kialakítását is (pl. négy, egyenként tíz állatból álló csoport behelyezése egy nagyobb tesztelő térfogatba), azonban a vizsgálati koncepció minden változtatásáról be kell számolni.
1.8.1.3 Az állatok száma
A félstatikus vizsgálatok esetében minden egyes koncentrációszintnél legalább tíz, egyedileg elhelyezett állatra, továbbá a kontrollcsoportokban is legalább tíz állatra van szükség.
Az átfolyásos vizsgálatokhoz célszerű minden egyes koncentrációszinthez tartozóan negyven állatot négy, egyenként tíz állatból álló csoportba osztani (1). Kisebb számú vizsgálati egyed is felhasználható, ez esetben koncentrációszintenként minimum húsz állat bevonása javasolt, amelyeket egyenlő létszámban kell felosztani legalább két edénybe (pl. négy párhuzamos, egyenként öt darab Daphniával). Meg kell jegyezni, hogy amennyiben az állatokat csoportokban tartják, akkor lehetetlen a szaporulatot úgy kifejezni, mint a vizsgálat végén még életben lévő szülő élő utódainak összlétszáma, ha közben egyes szülők elpusztulnak. Ezen esetekben a szaporulatot a „vizsgálat kezdetekor jelenlévő szülőkre jutó élő szaporulat összlétszáma” formájában lehet kifejezni.
1.8.1.4. Táplálék
A félstatikus vizsgálatoknál lehetőleg naponta kell a táplálékot beadni, de legalább hetente háromszor (azaz a tesztoldatok cseréjével megegyezően). Az ettől való eltéréseket (pl. az átfolyásos vizsgálatoknál) jelezni kell.
A vizsgálat során a szülőknek beadott étrendet lehetőleg a következő élő algasejtekből (egy vagy több felhasználásával) kell összeállítani: Chlorella sp., Selenastrum capricornutum (napjainkban Pseudokirchneriella subcapitata (11)) és Scenedesmus subspicatus. A beadott étrendet az egyes szülőknek biztosítandó szerves szén (C) mennyiségére kell alapozni. Kutatások (12) bizonyították, hogy a Daphnia magna esetében a 0,1 és 0,2 mg C/Daphnia/nap közötti adagok elegendőek a validitási kritériumokat kielégítő megfelelő szaporulatszám eléréséhez. Az adagolást a vizsgálat időtartama alatt vagy egyenletesen lehet végezni, vagy, amennyiben megfelelőbbnek látszik, akkor kezdetben egy alacsonyabb szint alkalmazható, majd az fokozatosan növelhető, figyelembe véve a szülők növekedésének ütemét. Ebben az esetben is az adagolásnak mindenkor meg kell maradnia a 0,1–0,2 mg C/Daphnia/nap tartományon belül.
Amennyiben helyettesítő méréseket alkalmaznak (pl. algasejtszám vagy fényelnyelés) az élelemadagban szükséges széntartalom adagolása érdekében (célszerűségi okokból, hiszen a széntartalom mérése időigényes elfoglaltság), úgy minden egyes laboratóriumnak ki kell dolgoznia a saját nomogramját, amely az algatenyészet széntartalmával kapcsolatos helyettesítő paraméterekre vonatkozik (lásd a 2. függelékben a nomogramok elkészítéséhez adott tanácsokat). A nomogramokat évente legalább egyszer ellenőrizni kell, vagy még gyakrabban, amennyiben időközben megváltoznak az algatenyészeti feltételek. A széntartalom helyettesítő mérésére a fény elnyelés vizsgálata jobb módszernek bizonyult, mint a sejtek száma (13).
A Daphniáknak egy koncentrált algaszuszpenziót kell adni, hogy elkerüljük a hígulást a tesztedényekben. Az algakoncentrátumot centrifugálással lehet nyerni, amit desztillált vízben, ionmentes vízben vagy Daphnia tenyészfolyadékban történő reszuszpenzió követ.
1.8.1.5. Megvilágítás
16 órán keresztül, 15–20 μE· m-2·s-1 szintet meg nem haladó fényerejű megvilágítás.
1.8.1.6. Hőmérséklet
A vizsgálati közeg hőmérséklete 18–22 oC között van. Emellett a hőmérséklet – lehetőség szerint – egyik vizsgálat esetében sem változik e tartományon belül 2 oC-nál nagyobb mértékben (pl. 18–20, 19–21 vagy 20–22 oC). Helyes módszer lehet egy további vizsgálati edényt a hőmérséklet alakulásának nyomon követésére beállítani.
1.8.1.7. Levegőztetés
A vizsgálati edényeket tilos a vizsgálat során levegőztetni.
1.8.2. Vizsgálati koncentráció
Szokásos esetben legalább ötfajta olyan vizsgálati koncentrációt kell geometrikus sorban elrendezni, amelyek egymástól lehetőleg egy 3.2-es szorzófaktornál jobban nem különböznek, és minden vizsgálati koncentrációhoz megfelelő számú párhuzamost kell használni (lásd 1.8.1.3. szakasz). Ötnél kevesebb vizsgálati koncentráció használatát indokolni kell. Az anyagokat nem szabad a vizsgálati közegben való oldékonysági limitjük felett vizsgálni.
A koncentrációtartomány határainak meghatározása során az alábbiakat kell szem előtt tartani:
|
(i) |
Amennyiben a cél a LOEC/NOEC érték megállapítása, akkor a legalacsonyabb vizsgálati koncentrációnak kellően alacsonynak kell lennie ahhoz, hogy a termékenység mértéke ezen koncentrációnál ne legyen lényegesen alacsonyabb, mint a kontrollcsoportban. Ellenkező esetben a vizsgálatot egy csökkentett legalacsonyabb koncentrációszinten meg kell ismételni. |
|
(ii) |
Amennyiben a cél a LOEC/NOEC érték megállapítása, akkor a legmagasabb vizsgálati koncentrációnak kellően magasnak kell lennie ahhoz, hogy a termékenység mértéke ezen koncentrációnál lényegesen alacsonyabb legyen, mint a kontrollcsoportban. Ellenkező esetben a vizsgálatot egy megnövelt legmagasabb koncentrációszinten meg kell ismételni. |
|
(iii) |
Amennyiben a reprodukcióra gyakorolt hatásokra vonatkozó ECx-t kívánjuk meghatározni, akkor tanácsos kellően nagy koncentrációértékeket használni az ECx megfelelő konfidenciaszinten történő meghatározása érdekében. Amennyiben a reprodukcióra gyakorolt hatásokra vonatkozó EC50-t kell felbecsülni, akkor tanácsos, hogy a legmagasabb vizsgálati koncentráció ezen EC50-nél magasabb legyen. Bár ellenkező esetben is lehetséges az EC50 megállapítása, a konfidenciatartomány nagyon széles lesz, és emiatt fennáll annak a veszélye, hogy nem lehet kielégítően értékelni az alkalmazott modell megfelelőségét. |
|
(iv) |
A vizsgálati koncentráció tartományából lehetőleg ki kell hagyni minden olyan koncentrációt, amely statisztikailag jelentős hatást gyakorol a felnőtt egyedek túlélésére, mivel ez megváltoztatná a vizsgálat jellegét, és az egyszerűen a reprodukciós teljesítmény megállapítására irányuló vizsgálatból egy komplexebb statisztikai elemzést megkövetelő, kombinált reprodukciós és mortalitási vizsgálat alakulna ki. |
A vizsgált anyag toxicitására vonatkozó előzetes ismeretek (pl. egy akuttoxicitás-vizsgálatból és/vagy koncentráció meghatározására vonatkozó előzetes vizsgálatokból származók) segíthetnek a megfelelő vizsgálati koncentrációk kiválasztásában.
Amennyiben oldószert vagy diszpergálószert használnak a vizsgálati oldatok elkészítésének elősegítéséhez (lásd 1.6.4. szakasz), akkor a vizsgálati edényekben mért végső koncentráció nem lehet magasabb 0,1 ml/l-nél, és értékének azonosnak kell lennie valamennyi vizsgálati edényben.
1.8.3. Kontrollcsoportok
A vizsgált anyaggal kezelt vizsgálati sorozatokkal párhuzamosan a vizsgálati közeg egy kontrollcsoport-sorozatát és – adott esetben – egy, oldószert vagy diszpergálószert tartalmazó kontrollcsoport-sorozatot kell beállítani. Ebben az esetben az oldószer vagy diszpergálószer koncentrációja azonos a vizsgált anyagot tartalmazó edényekben használt koncentrációval. Megfelelő számú párhuzamost kell használni (lásd 1.8.1.3. szakasz).
Egy jól végrehajtott vizsgálat során általában a kontrollcsoportban lévő egy szülőre jutó élő szaporulat variációs koefficiense az átlagos szám körül <= 25 %, ha a szülőket elkülönítve tartják a tesztelés során.
1.8.4. A vizsgálati közeg megújítása
A közeg megújításának gyakorisága a vizsgált anyag stabilitásától függ, azonban hetente legalább három csere szükséges. Amennyiben az előzetes stabilitási vizsgálatok (lásd 1.4. pont) azt mutatták, hogy a vizsgált anyag koncentrációja nem stabil (azaz kívül esik a nominál koncentráció 80–120 %-os tartományán, vagy a kiinduláskor mért koncentráció 80 %-a alá csökken) a két megújítás közötti maximális időtartam (azaz három nap) alatt, úgy számba kell venni a vizsgálati közeg gyakoribb megújításának lehetőségét vagy egy átfolyásos vizsgálat alkalmazását.
Amennyiben a közeget félstatikus vizsgálatok során megújítják, akkor a vizsgálati edényekből egy második sorozatot is be kell állítani, és a szülőket pl. egy megfelelő átmérőjű üvegpipetta segítségével kell áthelyezni. A Daphniákkal együtt áthelyezett vizsgálati közeg mennyiségét a minimumra kell csökkenteni.
1.8.5. Megfigyelések
A vizsgálat során tett megfigyelések eredményeit eredménylapokon kell rögzíteni (lásd a példákat a 3. és 4. függelékben). Amennyiben más mérések elvégzése is követelmény (lásd 1.3. és 1.8.8. pont), akkor további megfigyelések elvégzése is szükséges lehet.
1.8.6. Utódok
Az egyes szülőktől származó utódokat lehetőleg naponta ki kell emelni és meg kell számlálni az első utódnemzedék megjelenésének napjától kezdve, annak megakadályozására, hogy a kicsik elfogyasszák a felnőtteknek szánt táplálékot. E módszer alkalmazásában csak az élő utódokat kell megszámlálni, de feljegyezhető az abortált peték és az elhullott ivadékok számát is.
1.8.7. Mortalitás
Lehetőleg naponta fel kell jegyezni a szülő állatok mortalitását, legalább az utódok megszámlálásával megegyező gyakorisággal.
1.8.8. Egyéb paraméterek
Bár e módszert alapvetően a reprodukcióra gyakorolt hatások felmérése érdekében dolgozták ki, általa azonban más hatások is kellő részletességgel számszerűsíthetők, statisztikai elemzéseket lehetővé téve. A növekedési ütem mérése igen kívánatos cél, mert ezzel információk nyerhetők az esetleges szubletális hatásokról, amely hasznosabb lehet a kizárólag a reprodukciós hatásokra irányuló méréseknél; a szülők hosszának (azaz a léctüske nélkül mért testhossznak) a mérése javasolt a vizsgálatok végén. A többi, mérhető vagy számítható paraméter közé tartozik az első utódnemzetség (majd a következő csoportok) megjelenéséig eltelt idő, az egy szülőre jutó utódok száma és mérete, az abortált utódok száma, hímek vagy ephippia jelenléte és a populáció belső növekedési üteme.
1.8.9. Az analitikai meghatározások és mérések gyakorisága
Az oxigénkoncentrációt, a hőmérsékletet, a keménységet és a pH-értéket hetente legalább egyszer mérni kell, a közeg megújítása előtt és után, a kontrollcsoportokban és a legmagasabb vizsgáltanyag-koncentrációt tartalmazó edényekben.
A vizsgálat során szabályos időközönként meg kell határozni a vizsgáltanyag-koncentrációit.
A félstatikus vizsgálatok során, amennyiben a vizsgált anyag koncentrációja a nominális koncentráció ± 20 százalékos sávján belülre várható (azaz a 80–120 %-os sávon belül; lásd 1.4. és 1.8.4. pont), minimális intézkedésként javasolt a legmagasabb és a legalacsonyabb vizsgálati koncentrációk elemzése, az anyag frissen elkészített és a kicserélés idején meglévő állapotában, a vizsgálat első hete során, egy alkalommal (azaz az elemzéseket az azonos oldatból vett mintán kell elvégezni; először, amikor az oldat frissen elkészült, majd a megújítás alkalmával). E meghatározásokat ezt követően legalább hetente egyszer meg kell ismételni.
Az olyan vizsgálatok során, ahol a vizsgált anyag koncentrációja nem várható a nominális koncentráció ± 20 százalékos sávján belülre, elemezni kell az összes vizsgálati koncentrációt a frissen elkészült oldatoknál és a megújítás alkalmával. Azonban az olyan vizsgálatok esetében, ahol a vizsgált anyag kezdetkor mért koncentrációja nem marad meg a nominális koncentráció ± 20 százalékos sávján belül, viszont elégséges bizonyíték hozható fel annak bemutatására, hogy a kezdeti koncentrációk megismételhetők és stabilak (azaz a kezdeti koncentrációértékek 80–120 %-os tartományán belül vannak), a kémiai jellegű méréseket a vizsgálat 2. és 3. hetében a legmagasabb és a legalacsonyabb vizsgálati koncentrációk meghatározására lehet lecsökkenteni. Mindegyik esetben a vizsgált anyag koncentrációjának a megújítást megelőző meghatározását csak minden egyes vizsgálati koncentráció egyetlen másodpéldányán kell elvégezni.
Az átfolyásos vizsgálatok esetében megfelelő a félstatikus vizsgálatoknál leírtakhoz hasonló mintavételi eljárás alkalmazása (azonban a „régi” oldatok mérése nem alkalmazható ezen esetben). Az első hét során azonban tanácsos lehet a mintavételi esetek számát megnövelni (pl. három méréssorozatra), a vizsgálati koncentrációk stabilitásának biztosítása érdekében. Az ilyen típusú vizsgálatok esetében a hígítóvíz és a vizsgált anyag átfolyási sebességét naponta kell ellenőrizni.
Amennyiben bizonyítható, hogy a vizsgálandó anyag koncentrációja a vizsgálat teljes időtartama alatt mindvégig sikeresen a nominális vagy a kezdetkor mért koncentráció ± 20 százalékán belül marad, akkor az eredményeket a nominális vagy a kezdeti értékekre lehet alapozni. Ha a nominális vagy a kezdeti koncentrációhoz képest az eltérés nagyobb ± 20 százaléknál, akkor az eredményeket az idő függvényében kifejezett súlyozott átlaghoz képest lehet kifejezni (lásd az 5. függelékben).
2. ADATOK ÉS JELENTÉSKÉSZÍTÉS
2.1. AZ EREDMÉNYEK KIÉRTÉKELÉSE
E vizsgálat célja annak megállapítása, hogy a vizsgált anyag milyen hatást gyakorol a vizsgálati időszak végén még életben lévő szülők élő utódainak összlétszámára. Az egy szülőre jutó utódok összlétszámát minden egyes vizsgálai edényre (illetve párhuzamosra) nézve ki kell számítani. Ha valamely párhuzamosban a szülő elpusztul a vizsgálat során, vagy kiderül róla, hogy hím, akkor az ilyen párhuzamost ki kell hagyni az elemzésből. Az elemzést ekkor ugyanazon koncentráció csökkentett számú párhuzamosára kell alapozni.
A vegyszerek reprodukciós képességre gyakorolt hatásaira vonatkozó LOEC – és ennélfogva a NOEC – értékének meghatározásához ki kell számítani minden koncentráció összes párhuzamosában az átlagos reprodukciós teljesítményt és a standard deviációt; e számítást varianciaelemzéssel (ANOVA) lehet elvégezni. Ekkor az egyes koncentrációk átlagát egy megfelelő többtényezős módszer segítségével össze kell vetni a kontrollcsoport középértékeivel. Ehhez a Dunnett- vagy a Williams-féle vizsgálatok megfelelőek lehetnek (14) (15) (16) (17). Ellenőrizni kell, hogy a varienciahomogenitására vonatkozó ANOVA-hipotézis megfelelő-e. Javasolt, hogy ezt a formális tesztelés (18) helyett inkább grafikus ábrázolási módszer segítségével végezzék el; a Bartlett-féle vizsgálat szintén megfelelő. Ha a homogenitási feltétel nem teljesül, akkor az ANOVA-t megelőzően az eredmények transzformálását kell elvégezni a varienciahomogenitás biztosítására, vagy súlyozott ANOVA-t kell használni. Ki kell számítani és jegyzőkönyvezni kell az ANOVA használatával kimutatható hatás (azaz a legkevésbé szignifikáns különbség) nagyságát.
Azon koncentráció becsléséhez, amely a reprodukciós teljesítmény 50 %-os csökkenését okozza (EC50) egy alkalmas, pl. egy logisztikus görbét kell használni, amelyet a statisztikai eljárással kapott adatokra kell illeszteni, pl. a legkisebb négyzetek elve alapján. A görbe paramétereit úgy kell meghatározni, hogy az EC50 és annak standard hibája közvetlenül felmérhető legyen. Ez jelentősen megkönnyíti a EC50 konfidenciatartomány kiszámítását. Hacsak nem szólnak különösen erős érvek az eltérő konfidenciatartományok alkalmazása mellett, akkor kétoldalú 95 %-os konfidenciatartományokat kell megszabni. Az illeszkedési eljárásnak lehetőleg olyannak kell lennie, hogy egyben biztosítsa az illeszkedés hiánya szignifikáns becslésének eszközét. Ezt el lehet végezni grafikus módon, vagy úgy, hogy a négyzetek maradékösszegét felosztjuk „illeszkedés hiánya” és „tisztán hiba komponensek” elemekre, és elvégezzük az illeszkedés hiányára vonatkozó szignifikanciavizsgálatot. Mivel a magas szintű szaporodást eredményező kezelések valószínűleg nagyobb mértékű varianciát idéznek elő az utódok számában, mint az alacsony szaporodást eredményező kezelések, számba kell venni a megfigyelt értékek megfelelő súlyozását, hogy érzékeltetni lehessen a különböző, kezelésben részesülő csoportok eltérő varianciáit (további háttér-információkat lásd a (18) szakirodalomban).
A végső körvizsgálatból (2) kapott adatok elemzése alapján egy logisztikus görbe hozzáigazítására került sor az alábbi modell használatával, bár más, alkalmas módszerek is használhatók:

ahol:
|
Y |
= |
a vizsgálat végén az egy életben maradt szülőre jutó utódok összlétszáma (külön számítva minden egyes edényre) |
|
X |
= |
az anyag koncentrációja |
|
c |
= |
az utódok várható száma, amennyiben x = 0 |
|
X0 |
= |
az EC50 értéke a populációban |
|
b |
= |
a meredekséget jellemző paraméter |
E modell valószínűleg igen sok helyzetben megfelel, azonban előfordulnak olyan vizsgálatok, amelyekre nem alkalmazható. A fentiekben javasolt módon ellenőrizni szükséges a modell validitását az adott helyzetre. Egyes esetekben, amikor az alacsony koncentrációk fokozott hatásokat váltanak ki, egy hormesis-modell alkalmasnak bizonyulhat (19).
Más, a koncentrációhoz kötődő hatások, mint az EC10 vagy EC20 becslését is el lehet végezni, bár előnyös lehet az EC50 becsléséhez felhasznált modellhez képest a paraméterek egy másfajta meghatározása.
2.2. VIZSGÁLATI JELENTÉS
A vizsgálati jelentés a következőket tartalmazza:
2.2.1 A vizsgált anyag
|
— |
fizikai állapota és releváns fizikai-kémiai tulajdonságai, |
|
— |
a kémiai azonosítási adatok, beleértve a tisztaságot. |
2.2.2. Vizsgált fajok
|
— |
a klón (meg kell jelölni, ha a genetikailag tipizált), a szállító vagy eredet (amennyiben ismert) és az alkalmazott tenyésztési körülmények. Jelenteni és indokolni kell, ha a Daphnia magnától eltérő fajt használnak. |
2.2.3. Vizsgálati körülmények
|
— |
az alkalmazandó vizsgálati eljárás (pl. fél statikus vagy átfolyásos, térfogat, az egy literre jutó Daphnák számában kifejezett terhelés), |
|
— |
fény-sötét periodicitás és fényintenzitás, |
|
— |
a vizsgálat kialakítása (pl. párhuzamosok száma, párhuzamosonkénti szülőszám), |
|
— |
a felhasznált tenyészfolyadék részletes leírása, |
|
— |
hozzáadott szerves anyagok (amennyiben ilyenre sor kerül), beleértve azok összetételét, eredetét, elkészítési módját, a törzsoldat készítmények TOC/COI tartalmát, a vizsgálati közegben mutatkozó TOC/COI becslését, |
|
— |
részletes információk az etetésről, beleértve a mennyiséget (mg C/Daphnia/nap) és az ütemezést (pl. táplálékok típusai), beleértve az algáknál a speciális elnevezést/fajt, továbbá – amennyiben ismert – a törzset és a tenyésztési körülményeket, |
|
— |
a törzsoldat elkészítésének módszere és megújításának gyakorisága (az esetleg használt oldószer vagy diszpergálószer megnevezését és koncentrációját meg kell adni). |
2.2.4. Eredmények:
|
— |
a vizsgált anyag stabilitására vonatkozó előzetes vizsgálatok eredményei, |
|
— |
a nominális vizsgálati koncentrációk és az összes olyan elemzés eredménye, amelyek célja a vizsgált anyag vizsgálati edényekben mért koncentrációjának a meghatározása (lásd a mintaadatlapokat a 4. függelékben); az analízis visszanyerési hatékonyságát és a meghatározás korlátait is jegyzőkönyvezni kell, |
|
— |
a vizsgálati edényekben lévő víz minősége (azaz pH-érték, hőmérséklet, oldottoxigén-koncentráció, TOC és/vagy COI értékek és keménység, adott esetben) (lásd az eredménylapokat a 3. függelékben), |
|
— |
az élő utódok teljes nyilvántartása minden egyes szülőnél (lásd az eredménylapokat a 3. függelékben), |
|
— |
az elhullott szülők száma és az elhullás bekövetkezésének a napja (lásd az eredménylapokat a 3. függelékben), |
|
— |
a kontrollcsoportbeli szaporodási képesség variációs koefficiense (a vizsgálati időszak végén az egy élő szülőre jutó élő utódok összlétszámára alapozva), |
|
— |
a vizsgálati időszak végén az egy szülőre jutó élő utódok teljes számát ábrázoló grafikon (minden párhuzamosban), a vizsgált anyag koncentrációjának függvényében, |
|
— |
a reprodukcióra vonatkozó, legalacsonyabb megfigyelhető hatást okozó koncentráció (LOEC), beleértve a felhasznált statisztikai módszerek leírását, és annak jelzését, hogy milyen mértékű hatást lehetett kimutatni, továbbá a szaporodásra már nem hatásos koncentráció (NOEC); szükség esetén bele kell foglalni a jelentésbe a szülők mortalitására vonatkozó LOEC/NOEC értékeket is, |
|
— |
szükség esetén a reprodukcióra vonatkozó ECx és a konfidenciatartomány, valamint a számításhoz használt, illesztett modell grafikonja, a dózisreakció görbe meredeksége és a standard hibája, |
|
— |
más megfigyelt biológiai hatások vagy egyéb mérések: jelenteni kell minden megfigyelt vagy mért más jellegű biológiai hatást (pl. szülők növekedése), a megfelelő indoklással együtt, |
|
— |
az előírt vizsgálati módszertől való bármely eltérés magyarázata. |
3. SZAKIRODALOM
|
(1) |
OECD TEST GUIDELINE Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20-21 March 1993. |
|
(2) |
OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997. |
|
(3) |
Baird D. J., Barber J., Bradley M. C, Soares A. M. V. M. and Calow P. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, pp. 257-265. |
|
(4) |
Elendt B. P., (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, pp. 25-33. |
|
(5) |
EPA (1993). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohi o. |
|
(6) |
Vigano L., (1991) Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, pp. 775-782. |
|
(7) |
ASTM (1988). Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P. A. 20 pp. |
|
(8) |
Baird D. J., Soares A. M. V. M., Girling A., Barber J., Bradley M. C. and Calow P. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H. Lokke, H. Tyle & F. Bro-Rasmussen. Eds.), pp. 144-148. |
|
(9) |
Parkhurst B. R., Forte J. L. and Wright G. P. (1981). Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, pp. 1-8. |
|
(10) |
Cowgill U. M. and Milazzo D. P. (1990) The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), pp. 185-196. |
|
(11) |
Korshikov (1990). Pseudokirchneriella subcapitata Hindak, F-1990. Biologice Prace, 36, 209. |
|
(12) |
Sims I. R., Watson S. and Holmes D. (1993). Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, pp. 2053-2058. |
|
(13) |
Sims I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, pp. 459-466. |
|
(14) |
Dunnett C. W., (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc, 50, pp. 1096-1121. |
|
(15) |
Dunnett C. W., (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482-491. |
|
(16) |
Williams D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, pp. 103-117. |
|
(17) |
Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, pp. 510-531. |
|
(18) |
Draper N. R. and Smith H. (1981). Applied Regression Analysis, second edition, Wiley, N. Y. |
|
(19) |
Brain P. and Cousens R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, pp. 93-96. |
|
(20) |
Wilson E. O. and Bossert, W. H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers. |
|
(21) |
Poole R. W. (1974). An Introduction to quantitative Ecology. McGraw-Hill Series in Population Biology, New York, pp. 532. |
|
(22) |
Meyer J. S., Ingersoll C. G, McDonald L. L. and Boyce M. S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, pp. 1156-1166. |
1. függelék
TELJESKÖRŰEN MEGHATÁROZOTT ELENDT M7 ÉS M4 KÖZEG ELŐÁLLÍTÁSA
Akklimatizálás az elendt M7 ás M4 közeghez
Egyes laboratóriumok nehézségekbe ütköztek, amikor Daphniát próbáltak átvinni M4 (1) és M7 közegbe. Fokozatos akklimatizálással (azaz a saját közegből előbb 30, majd 60, végül 100 százalékos Elendt közegbe való áthelyezéssel) azonban sikerült bizonyos eredményeket elérni. Az akklimatizáció akár egy hónapig is eltarthat.
ELŐÁLLÍTÁS
Nyomelemek
Először megfelelő tisztaságú (azaz deionizált, desztillált vagy reverz ozmózissal előállított) víz felhasználásával egyedi nyomelemeket tartalmazó, különféle törzsoldatokat (I) kell készíteni. E különféle törzsoldatokból (I) egy második, egyetlen törzsoldat (II) készül, amely már tartalmazza az összes nyomelemet (kombinált oldat), azaz:
|
Törzsoldatok I (egyes anyagokból) |
A vízhez adott mennyiség mg/l |
Koncentráció (az M4 tenyészol-datra vonatkoztatva) -szoros |
A (II) kombinált törzsoldat elkészítéséhez az (I) törzsoldatból az alábbi mennyiséget kell vízhez hozzáadni ml/1 |
|
|
M4 |
M7 |
|||
|
H3BO3 |
57 190 |
20 000 |
1,0 |
0,25 |
|
MnCl2 * 4H2O |
7 210 |
20 000 |
1,0 |
0,25 |
|
LiCl |
6 120 |
20 000 |
1,0 |
0,25 |
|
RbCl |
1 420 |
20 000 |
1,0 |
0,25 |
|
SrCl2 * 6H2O |
3 040 |
20 000 |
1,0 |
0,25 |
|
NaBr |
320 |
20 000 |
1,0 |
0,25 |
|
Na2MoO4 * 2H2O |
1 260 |
20 000 |
1,0 |
0,25 |
|
CuCl2 * 2H2O |
335 |
20 000 |
1,0 |
0,25 |
|
ZnCl2 |
260 |
20 000 |
1,0 |
1,0 |
|
CoCl2 * 6H2O |
200 |
20 000 |
1,0 |
1,0 |
|
KI |
65 |
20 000 |
1,0 |
1,0 |
|
Na2SeO3 |
43,8 |
20 000 |
1,0 |
1,0 |
|
NH4VO3 |
11,5 |
20 000 |
1,0 |
1,0 |
|
Na2EDTA * 2H2O |
5 000 |
2 000 |
— |
— |
|
FeSO4 * 7 H2O |
1 991 |
2 000 |
— |
— |
|
Mind a Na2EDTA, mind a FeSO4 oldatot külön kell elkészíteni, majd összeönteni és azonnal autoklávban kezelni. Ez a következőt eredményezi: |
||||
|
21 Fe-EDTA solution |
|
1 000-fold |
20,0 |
5,0 |
M4 és M7 közeg
Az M4 és M7 tenyészoldatot a (II) törzsoldatból, makroelemekből és vitaminokból kell elkészíteni a következőképpen:
|
|
A vízhez adott mennyiség mg/l |
Koncentráció (az M4 tenyészoldatra vonatkoztatva) -szoros |
A tenyészoldat elkészítéséhez hozzáadott törzsoldat mennyisége (ml/l) |
|||||
|
M4 |
M7 |
|||||||
|
A II. törzsoldat, nyomelemekkel kombinálva |
|
20 |
50 |
50 |
||||
|
Makroelem-törzsoldatok (egyetlen anyag) |
||||||||
|
CaCl2 * 2 H20 |
293 800 |
1 000 |
1,0 |
1,0 |
||||
|
MgSO4 * 7 H20 |
246 600 |
2 000 |
0,5 |
0,5 |
||||
|
KCl |
58 000 |
10 000 |
0,1 |
0,1 |
||||
|
NaHCO3 |
64 800 |
1 000 |
1,0 |
1,0 |
||||
|
Na2SiO3 * 9 H20 |
50 000 |
5 000 |
0,2 |
0,2 |
||||
|
NaNO3 |
2 740 |
10 000 |
0,1 |
0,1 |
||||
|
KH2PO4 |
1 430 |
10 000 |
0,1 |
0,1 |
||||
|
K2HPO4 |
1 840 |
10 000 |
0,1 |
0,1 |
||||
|
Kombinált vitamintörzsoldat |
— |
10 000 |
0,1 |
0,1 |
||||
|
A kombinált vitamintörzsoldalt készítéséhez 3 vitamint kell 1 liter vízhez adni, a következőképpen: |
||||||||
|
Thiamin hidroklorid |
750 |
10 000 |
— |
— |
||||
|
Cianokobalamin (B12) |
10 |
10 000 |
— |
— |
||||
|
Biotin |
7,5 |
10 000 |
— |
— |
||||
|
A kombinált vitamintörzsoldatot kis aliquot mennyiségekben, fagyasztott állapotban kell tartani. A tenyészoldathoz a vitaminokat röviddel a felhasználás előtt kell hozzáadni.
|
||||||||
2. függelék
ÖSSZES SZERVES SZÉN (TOC) MEGHATÁROZÁSA ÉS NOMOGRAM KÉSZÍTÉSE ALGAALAPÚ TÁPLÁLÉK TOC-TARTALMÁNAK ÁBRÁZOLÁSÁRA
Ismert, hogy az algaalapú táplálék széntartalmát általában nem közvetlenül kell mérni, hanem olyan helyettesítő paraméterekkel rendelkező korrelációk (azaz nomogramok) alapján, mint pl. az algaszám vagy a fényabszorbancia.
A TOC értékét az UV-sugárzásra alapozott vagy a perszulfátos módszerek helyett inkább magas hőmérsékletű oxidáció által célszerű mérni. (Lásd: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB).
A nomogram elkészítéséhez az algákat a tenyészfolyadéktól centrifugálással el kell különíteni, amit desztillált vízben való reszuszpenzió követ. A helyettesítő paramétert és a TOC-koncentrációt, minden mintában három példányban kell mérni. Kizárólag desztillált vizet tartalmazó vakmintákat kell elemezni, és a TOC-koncentrációt az algát tartalmazó minta TOC-koncentrációjából kell levonni.
A nomogram lineárisan fut a szénkoncentrációk megkövetelt tartományában.
Megjegyzés: E példákat nem szabad konverzióra használni; alapvető fontosságú, hogy a laboratóriumok elkészítsék a saját nomogramjukat.


3. függelék
MINTAADATLAP A KÖZEGMEGÚJÍTÁS, FIZIKAI/KÉMIAI FIGYELEMMEL KÍSÉRÉS SORÁN KELETKEZETT ADATOK, ETETÉS, DAPHNIA-REPRODUKCIÓ ÉS FELNŐTT ÁLLATOK MORTALITÁSÁNAK JEGYZŐKÖNYVEZÉSÉHEZ
|
Kísérlet sorszama |
Kezdőnap: |
Klón: |
Tenyészoldat: |
Táplálék típusa: |
Vizsgált anyag: |
Névl. konc.: |
||||||||||||||||||
|
Nap |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
|
|
|
Közegmegújítás (x-szel jelöljük) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PH (37) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
új |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
régi |
|
|
|
02 mg/l (37) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
új |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
regi |
|
|
|
Hőmérséklet ( oC) (37) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
új |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
regi |
|
|
|
Beadott táplálék (x-szel jelöljük) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Élettelen utód (38) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Összes |
|
1. edény |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Összes |
|
|
Kumulált felnőttkori mortalitás (39) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. függelék
MINTAADATLAP KÉMIAI ELEMZÉSEK EREDMÉNYEINEK JEGYZŐKÖNYVEZÉSÉHEZ
a) Mért koncentrációk
|
Névleges konc. |
1. heti minta |
2. heti minta |
3. heti minta |
|||
|
friss |
régi |
friss |
régi |
friss |
régi |
|
|
|
|
|
|
|
|
|
b) Mért koncentrációk a névleges koncentrációk százalékában
|
Névleges konc. |
1. heti minta |
2. heti minta |
3. heti minta |
|||
|
friss |
régi |
friss |
régi |
friss |
régi |
|
|
|
|
|
|
|
|
|
5. függelék
IDŐARÁNYOSAN SÚLYOZOTT ÁTLAG SZÁMÍTÁSA
Időarányosan súlyozott átlag
Mivel a vizsgált anyag koncentrációja a közeg megújításai közötti időintervallumban csökkenhet, szükséges mérlegelni, hogy melyik az a koncentráció, amelyet reprezentatívnak kell kiválasztani azon koncentrációsáv meghatározása szempontjából, amelynek a Daphnia szülők ki vannak téve. A kiválasztást biológiai és statisztikai megfontolásokra kell alapozni. Például amennyiben úgy tűnik, hogy a reprodukciót főként az alkalmazásra kerülő legmagasabb koncentráció befolyásolja, akkor azt kell alkalmazni. Amennyiben azonban fontosabbnak látszik a toxikus anyag halmozott vagy hosszabb idő alatt jelentkező hatása, akkor egy átlagos koncentráció választása a célszerűbb. Ebben az esetben az időarányosan súlyozott átlagkoncentráció a megfelelő, mivel ez figyelembe veszi a pillanatnyi koncentrációnak az idő függvényében történő változásait.
1. ábra
Példa az időarányosan súlyozott középértékre

Az 1. ábra egy (egyszerűsített) hétnapos, a közeg megújítását a 0., 2. és 4. napra ütemező vizsgálatot mutat be.
|
— |
A vékony, cikcakkos vonal ábrázolja a koncentrációt az idő függvényében. Feltételezhető, hogy a koncentrációcsökkenés egy exponenciális csökkenési folyamatot követ. |
|
— |
A hat, kis négyzettel jelzett pont jelöli az egyes közegmegújítási időszakok elején és végén mért koncentrációkat. |
|
— |
A vastag vonal jelzi az időarányosan súlyozott átlagot. |
Az időarányosan súlyozott átlagot úgy kell kiszámítani, hogy az időarányosan súlyozott átlag nagysága megegyezzen a koncentrációgörbe alatti területtel. A fenti példa számítási menetét az 1. táblázat mutatja be.
1. táblázat
Az időarányosan súlyozott átlag számítása
|
Közegmegújítás száma |
Napok |
Konc. 0 |
Konc. 1 |
Ln(Konc.0) |
Ln(Konc.1) |
Terület |
|
1 |
2 |
10,000 |
4,493 |
2,303 |
1,503 |
13,767 |
|
2 |
2 |
11,000 |
6,037 |
2,398 |
1,798 |
16,544 |
|
3 |
3 |
10,000 |
4,066 |
2,303 |
1,403 |
19,781 |
|
Napok száma, összesen: 7 |
Összterület |
50,091 |
||||
|
IA átlag |
7,156 |
|||||
|
A „napok” kifejezés a megújítási folyamat napjainak a számát jelenti. A „Konc. 0” kifejezés az egyes megújítási időszakok kezdetekor mért koncentráció. A „Konc. 1” kifejezés az egyes megújítási időszakok végén mért koncentráció. A „Ln(Konc. 0)” kifejezés a „Konc. 0” természetes alapú logaritmusa. A „Ln(Konc. 1)” kifejezés a „Konc. 1” természetes alapú logaritmusa. A „terület” az egyes megújítási időszakokra megszerkesztett exponenciális görbe alatti területet jelöli. A következő képlettel kell kiszámítani:
|
||||||
Az időarányosan súlyozott átlag („IA átlag”) a „Teljes terület” és az „Összes nap” hányadosa.
A Daphnia reprodukciós vizsgálat céljaira természetesen a táblázatot úgy kell kiterjeszteni, hogy az 21 napot fedjen le.
Egyértelmű, hogy ha csak a közeg egyes megújítási időszakainak az elején és végén végeznek megfigyeléseket, akkor nincs mód annak a megerősítésére, hogy a csökkenés valóban exponenciális. Egy másfajta görbe a „Terület”-re nézve másfajta számítási eredményre vezetne. Az exponenciális csökkenési folyamat azonban valószínűsíthető, és egyéb információk hiányában valószínűleg a legjobb görbét adja.
Óvatosságra int azonban, ha a megújítási időszak végén a kémiai analízis nem mutat ki semmilyen anyagot. Ha nem lehet megbecsülni, hogy milyen gyorsan tűnt el a vizsgált anyag az oldatból, akkor lehetetlen reálisan megítélni a görbe alatti terület nagyságát, s emiatt lehetetlen megállapítani egy ésszerű, időarányosan súlyozott átlagot.
C.21. TALAJLAKÓ MIKROORGANIZMUSOK: NITROGÉNÁTALAKÍTÁSI VIZSGÁLAT
1. MÓDSZER
Ez a vizsgálati módszer az OECD TG 216 (2000) módszer megfelelője.
1.1. BEVEZETÉS
Ez a vizsgálati módszer egy olyan laboratóriumi módszert ismertet, amelynek célja annak vizsgálata, hogy az egyes vegyületek egyszeri expozíció esetén milyen hosszú távú hatásokat gyakorolnak a talajlakó mikroorganizmusok nitrogénátalakítási aktivitására. A vizsgálat elsősorban az Európai és Földközi-tenger Melléki Növényvédelmi Szervezet ajánlásain alapul (1). Azonban más iránymutatásokat, ezen belül a German Biologische Bundesanstalt (2), az Egyesült Államok Környezetvédelmi Hivatala (3), a SETAC (4), valamint a Nemzetközi Szabványügyi Szervezet (5) iránymutatásait is figyelembe vettünk. Az 1995-ben az olaszországi Belgiratéban megrendezett, a talajok/üledékek kiválasztásával kapcsolatos OECD-munkaértekezleten (6) megegyezés született az e vizsgálatban alkalmazandó talajok számáról és típusáról. A talajminták gyűjtéséről, kezeléséről és tárolásáról szóló ajánlások egy ISO-útmutatón (7) és a belgiratei munkaértekezlet ajánlásain alapulnak. A vizsgálandó anyagok toxikus jellemzőinek meghatározása és értékelése során szükség lehet a talaj mikrobiális aktivitására gyakorolt hatások meghatározására, például olyan esetben, ha adatokra van szükség a növényvédő szereknek a talaj mikroflórájára gyakorolt esetleges mellékhatásaival kapcsolatban, vagy ha a talajlakó mikroorganizmusoknak növényvédő szerektől eltérő vegyületekkel szembeni expozíciója várható. A nitrogénátalakítási vizsgálat végrehajtásának célja az ilyen vegyületeknek a talaj mikroflórájára gyakorolt hatásainak meghatározása. Amennyiben mezőgazdasági vegyi anyagok (pl. növényvédő szerek, műtrágyák, erdészeti vegyi anyagok) vizsgálatáról van szó, mind a nitrogénátalakítási, mind a szénátalakítási vizsgálatot el kell végezni. Ha nem mezőgazdasági vegyi anyagok vizsgálata történik, elég a nitrogénátalakítási vizsgálatot elvégezni. Ha azonban a nitrogénátalakítási vizsgálat az ilyen vegyületek esetében olyan EC50-értékeket eredményez, amelyek a kereskedelmi forgalomban kapható nitrifikációgátló szerek (pl. nitrapirin) esetében tapasztalt tartományba esik, további információk gyűjtése érdekében a szénátalakítási vizsgálatot is el lehet végezni.
A talajok élő és élettelen komponensekből épülnek fel, amelyek komplex és heterogén elegyek formájában léteznek. A mikroorganizmusok számos fajjal fontos szerepet játszanak a termőtalajok szervesanyag-tartalmának lebontásában és átalakításában, hozzájárulva a talajok termékenységének különféle aspektusaihoz. Az ilyen biokémiai folyamatokat megzavaró hosszú távú hatások potenciálisan megzavarhatják a tápanyag-körforgalmat, ami megváltoztathatja a talaj termékenységét. Szén- és nitrogénátalakítás minden termőtalajban folyik. Bár az e folyamatokért felelős mikrobaközösségek talajonként eltérőek, az átalakítási útvonalak lényegében azonosak.
Az ismertetett vizsgálati módszer célja valamely anyagnak az aerob feltalajokban zajló nitrogén-átalakítási folyamatra gyakorolt hosszú távú káros hatásainak kimutatása. A vizsgálati módszer lehetővé teszi az anyagnak a talaj mikrofl órája által végzett szénátalakítására gyakorolt hatásainak becslését. A nitrátképződés a szén-nitrogén kötések felbomlása után megy végbe. Ha tehát a kezelt és az ellenőrző talajmintákban azonos a nitrátképződés sebessége, nagyon valószínű, hogy a főbb szénlebontási útvonalak épek és működőképesek. A vizsgálathoz választott szubsztrátban (porított lucernaliszt) kedvező (általában 12:1 és 16:1 közötti) a szén-nitrogén arány. Emiatt a vizsgálat során csökken a szénéhezés, és ha a vegyi anyag károsítja a mikrobaközösségeket, azok 100 napon belül helyreállítódhatnak.
Azokat a teszteket, amelyekből ezt a vizsgálati módszert kifejlesztették, elsősorban olyan anyagokhoz dolgozták ki, amelyek esetében előre jelezhető a talajba kerülő mennyiség. Ez a helyzet például a növényvédő szerek esetében, amelyeknél ismert a szántóföldi alkalmazás mértéke. A mezőgazdasági vegyi anyagok esetében elegendő két, a várt vagy becsült alkalmazási mérték szempontjából releváns dózist alkalmazni. A mezőgazdasági vegyi anyagok vizsgálhatók aktív összetevőként (a.ö.) vagy formulázott termékként is. A vizsgálat azonban nem korlátozódik kizárólag a mezőgazdasági vegyi anyagokra. Mind a vizsgálandó anyagnak a talajban alkalmazott mennyiségét, mind az adatok kiértékelésének módját módosítva, a vizsgálat mezőgazdasági vegyi anyagoktól eltérő vegyületekre is alkalmazható, amelyek esetében nem ismert a talajba várhatóan bejutó mennyiség. A mezőgazdasági vegyi anyagoktól eltérő vegyületek esetében tehát egy sor koncentrációnál meg kell határozni a nitrogén-átalakításra gyakorolt hatásokat. Az ilyen vizsgálatokkal kapott adatok dózis-válasz görbék elkészítésére és ECx-értékek számítására használhatók fel, ahol x jelentése % hatás.
1.2. FOGALOMMEGHATÁROZÁSOK
„Nitrogénátalakítás”: a nitrogéntartalmú szerves anyagok mikroorganizmusok által végzett, ammonifikáción és nitrifikáción keresztüli végső lebontása a megfelelő szervetlen végtermékké, nitráttá.
„ECx (hatásos koncentráció)”: a vizsgálandó anyag olyan talajbeli koncentrációja, amely x %-osan gátoljaátolja a nitrogén nitráttá alakulását.
„EC50 (közepes hatásos koncentráció)”: a vizsgálandó anyag olyan talajbeli koncentrációja, amely 50 százalékosan (50 %-osan) gátolja a nitrogén nitráttá alakulását.
1.3. REFERENCIAANYAGOK
Nincs.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Átszitált talajt porított növényi liszttel fel kell javítani, majd vagy kezelni kell a vizsgálandó anyaggal, vagy kezeletlenül kell hagyni (kontroll). Mezőgazdasági vegyi anyagok vizsgálata esetén minimálisan két vizsgálati koncentráció alkalmazása ajánlott, amelyeket a szántóföldeken várható legmagasabb koncentráció függvényében kell megválasztani. Az inkubálás 0., 7., 14. és 28. napja után a kezelt és ellenőrző talajmintákat megfelelő oldószerrel extrahálni kell, és meg kell határozni a kivonatokban lévő nitrát mennyiségét. Ezt követően történik a kezelt talajokban mért nitrátképződés arányának összehasonlítása a kontrollokban mérttel, valamint a kezelt és az ellenőrző talajminták közötti százalékos eltérés kiszámítása. Minden vizsgálatot legalább 28 napig kell végezni. Ha a 28. napon a kezelt és nem kezelt talajok közötti különbség 25 % vagy annál nagyobb, a méréseket legfeljebb 100 napig folytatni kell. Ha nem mezőgazdasági vegyi anyagok vizsgálata történik, a vizsgálandó anyag egy sor különböző koncentrációjátoncentrációját kell a talajmintákhoz adni, és 28 napos inkubálás után meg kell mérni a kezelt és az ellenőrző mintákban képződött nitrát mennyiségét. A különféle koncentrációk alkalmazásával kapott vizsgálati eredményeket regressziós modell segítségével kell elemezni, majd ki kell számítani az ECx-értékeket (azaz az EC50-et, az EC25-öt és/vagy az EC10-et). Lásd a fogalommeghatározásokat.
1.5. A VIZSGÁLAT ÉRVÉNYESSÉGE
A mezőgazdasági vegyi anyagokkal kapott vizsgálati eredmények értékelése az ellenőrző és a kezelt talajminták nitráttartalma közötti viszonylag kis különbségeken (azaz az átlag ± 25 %-a) alapul, így az ellenőrző minták közötti nagy eltérések hamis eredményekhez vezethetnek. A párhuzamos ellenőrző minták közötti eltérésnek ±15 %-nál kisebbnek kell lennie.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Eszközök
Kémiailag inert anyagból készült vizsgálati edényeket kell használni. Ezeknek megfelelő, a talajok inkubálására alkalmazott eljárással, például az ömlesztve inkubálással vagy egyedi talajminták sorozataként történő inkubálásával összhangban lévő kapacitásúnak kell lenniük (lásd az 1.7.1.2. szakaszt). Ügyelni kell egyrészt a vízveszteség minimalizálására, másrészt a gázcsere lehetővé tételére a vizsgálat során (például a vizsgálati edények perforált polietilén fóliával fedhetők le). Illékony anyagok vizsgálata esetén zárható és légmentesen záródó edényeket kell alkalmazni. Az edényeknek olyan méretűnek kell lenniük, hogy a talajminta térfogatuk körülbelül egynegyedéig töltse fel őket.
Szabványos laboratóriumi eszközöket és ezen belül a következőket kell használni:
|
— |
keverőberendezés: mechanikai rázógép vagy ezzel egyenértékű más berendezés, |
|
— |
centrifuga (3 000 g) vagy szűrőeszköz (nitrátmentes szűrőpapírral), |
|
— |
a nitrátanalízishez megfelelő érzékenységet és reprodukálhatóságot biztosító műszer. |
1.6.2. A talajok kiválasztása és száma
Csak egyféle talaj használható. A javasolt talajjellemzők a következők:
|
— |
homoktartalom: legalább 50 % és legfeljebb 75 %, |
|
— |
pH: 5,5–7,5, |
|
— |
szervesszén-tartalom: 0,5–1,5 %, |
|
— |
meg kell mérni a mikrobiális biomasszát (8) (9), amelynek széntartalma a talaj teljes szervesszén-tartalmának legalább 1 %-a kell hogy legyen. |
Az esetek többségében az ilyen jellemzőkkel rendelkező talaj a legrosszabb helyzetet reprezentálja, mivel minimális a vizsgálandó vegyület adszorpciója, viszont maximális a hozzáférhetősége a mikroflóra számára. Következésképpen általában nincs szükség más talajokkal végzett vizsgálatokra. Bizonyos körülmények között azonban, például amikor a vizsgálandó anyag várható fő felhasználási területe a különleges talajok, például a savanyú erdőtalajok vagy az elektrosztatikus töltéssel rendelkező vegyületek esetében is, szükség lehet egy másik talajtípus alkalmazására is.
1.6.3. A talajminták begyűjtése és tárolása
1.6.3.1. Gyűjtés
Részletes információkkal kell rendelkezni annak a szántóföldi területnek a történetéről, ahonnan a vizsgálati talajminta begyűjtése történik. Ilyen részletek például a pontos hely, a növénytakaró, a növényvédő szerekkel végzett kezelések időpontjai, a szerves és szervetlen trágyák alkalmazásai, a biológiai anyagok hozzáadása vagy a véletlen szennyezések. A talajminták gyűjtéshez olyan helyet kell választani, amely hosszú távon használható erre a célra. Megfelelőek például az állandó legelők, az évente gabonatermést (kivéve kukoricát) hozó területek vagy a zöldtrágyával sűrűn bevetett területek. Követelmény, hogy a kiválasztott mintagyűjtési helyet a mintagyűjtést megelőzően legalább egy évig ne kezeljék növényvédő szerekkel. Továbbá legalább hat hónapig ne kapjon szerves trágyázást. Ásványi műtrágya alkalmazása csak akkor elfogadható, ha a haszonnövény igényeinek megfelelően történik, és a műtrágyázást követően legalább három hónapig nem szabad talajmintákat venni. Kerülni kell az ismert biocid hatású műtrágyákkal (pl. kalcium-ciánamiddal) kezelt talajok alkalmazását.
Kerülni kell a mintavételt hosszú (30 napnál hosszabb) ideig tartó szárazság vagy elvizesedés esetén, illetve közvetlenül ilyen időszakok után. Szántott talajok esetében a mintákat 0–20 cm mélységből kell venni. Legelők vagy egyéb olyan talajok esetében, amelyeket hosszú ideig (legalább egy vegetációs periódusig) nem szántanak fel, a mintavétel maximális mélysége 20 cm-nél kicsit több (pl. 25 cm) is lehet.
A talajmintákat olyan edényekben és olyan hőmérsékleti feltételek mellett kell elszállítani, amelyek garantálják, hogy a talaj eredeti tulajdonságai nem módosulnak szignifikáns mértékben.
1.6.3.2. Tárolás
Legelőnyösebb a frissen gyűjtött talajok alkalmazása. Ha a laboratóriumi tárolás nem kerülhető el, a talajok sötétben, 4 ± 2 oC-on legfeljebb három hónapig tárolhatok. A talajok tárolása során aerob körülményeket kell biztosítani. Ha a talajminták begyűjtése olyan területeken történt, ahol a talaj az év legalább három hónapjában fagyott, szóba jöhet hat hónapos, mínusz 18 oC és mínusz 22 oC közötti hőmérsékleten való tárolás is. Minden egyes kísérlet előtt meg kell mérni a tárolt talajok mikrobiális biomasszáját, és a biomassza széntartalmának el kell érnie a talaj teljes szervesszén-tartalmának legalább 1 %-át (lásd az 1.6.2. szakaszt).
1.6.4. A talaj kezelése és előkészítése a vizsgálatra
1.6.4.1. Előinkubálás
Tárolt talaj használata esetén (lásd az 1.6.3.2. szakaszt) ajánlatos 2-től 28 napig terjedő előinkubálást alkalmazni. Az előinkubálás során a talaj hőmérsékletének és nedvességtartalmának hasonlónak kell lennie a vizsgálat során alkalmazott hőmérséklethez és nedvességtartalomhoz (lásd az 1.6.4.2. és az 1.7.1.3. szakaszt).
1.6.4.2. Fizikai-kémiai tulajdonságok
A talajból manuálisan el kell távolítani a nagyobb tárgyakat (például köveket, növényi részeket stb.), majd a túlzott kiszáradást kerülve a talajt nedvesen át kell szitálni úgy, hogy a részecskeméret legfeljebb 2 mm legyen. A talajminta nedvességtartalmát desztillált vagy ioncserélt vízzel a maximális víztartó képesség 40–60 %-ára kell beállítani.
1.6.4.3. Szerves szubsztráttal történő javítás
A talajt megfelelő szerves szubsztráttal, például 12:1 és 16:1 közötti C:N arányú, porított zöldlucernafű-liszttel (fő összetevő: Medicago sativa) fel kell javítani. A javasolt lucerna-talaj arány 5 g lucerna per 1 kilogramm talaj (szárazsúly).
1.6.5. A vizsgálandó anyag előkészítése a talajon történő alkalmazáshoz
A vizsgálandó anyagot általában hordozó segítségével kell alkalmazni. A hordozó lehet víz (vízben oldható anyagok esetében) vagy valamely inert szilárd anyag, így például finom kvarchomok (részecskeméret: 0,1–0,5 mm). Kerülni kell a víztől eltérő folyékony hordozók (például szerves oldószerek, így például aceton, kloroform) alkalmazását, mivel ezek károsíthatják a mikroflórát. Ha hordozóként homokot használunk, a homok be is vonható a megfelelő oldószerben feloldott vagy szuszpendált vizsgálandó anyaggal. Ilyen esetekben az oldószert a talajba való bekeverés előtt el kell párologtatni. Ahhoz, hogy a vizsgálandó anyag optimális módon oszoljon szét a talajban, a következő arány ajánlott: 10 g homok per 1 kilogramm talaj (szárazsúly). Az ellenőrző mintákat ugyanilyen mennyiségű vízzel és/vagy kvarchomokkal kell kezelni.
Illékony vegyületek vizsgálata esetén, amennyire lehet, kerülni kell a kezelés közbeni veszteséget, valamint a vegyület talajban való homogén eloszlásának biztosítására is törekedni kell (például a vizsgálandó anyagot több helyen is be kell injektálni a talajba).
1.6.6. Vizsgálati koncentrációk
Mezőgazdasági vegyi anyagok vizsgálata esetén legalább két koncentrációt kell alkalmazni. Az alacsonyabb koncentrációnak legalább a gyakorlatban a talajba várhatóan bejutó legnagyobb mennyiségnek kell megfelelnie, a magasabb koncentrációnak pedig az alacsonyabb koncentráció valamely többszörösének kell lennie. A talajhoz adott vizsgálandó anyag koncentrációját 5 cm-es mélységig egyenletes beépülést és 1,5 g/cm3-es talaj térfogatsűrűséget feltételezve kell kiszámolni. A közvetlenül a talajra kihordott mezőgazdasági vegyi anyagok vagy az olyan vegyületek esetében, amelyeknek a talajba bejutó mennyisége előre jelezhető, az ajánlott vizsgálati koncentrációk a következők: a maximális becsült környezeti koncentráció (PEC) és ennek ötszöröse. Azoknak az anyagoknak az esetében, amelyeket egy idényben várhatóan több alkalommal is kihordanak a talajokra, a vizsgálathoz alkalmazandó koncentráció a PEC-értéknek a kihordások maximálisan várható számával történő megszorzásával számítható ki. A vizsgált magasabb koncentrációnak azonban nem szabad meghaladnia az egyszeri maximális alkalmazási arány tízszeresét. Nem mezőgazdasági vegyi anyagok vizsgálata esetén legalább öt, mértani sort alkotó koncentrációt kell alkalmazni. A vizsgált koncentrációknak le kell fedniük az ECx-értékek meghatározásához szükséges tartományt.
1.7. A VIZSGÁLAT VÉGREHAJTÁSA
1.7.1. Az expozíció körülményei
1.7.1.1. Kezelés és kontroll
Mezőgazdasági vegyi anyagok vizsgálata esetén a talajt három, egyenlő tömegű részre kell osztani. Két részlethez a terméket is tartalmazó hordozót kell keverni, a harmadikhoz pedig csak hordozót (kontroll). Ajánlatos a kezelt és nem kezelt talajokat is legalább három másolati mintában vizsgálni. Nem mezőgazdasági vegyi anyagok vizsgálata esetén a talajt hat, egyenlő tömegű részletre kell osztani. Öthöz a vizsgálandó anyagot is tartalmazó hordozót kell keverni, a hatodikhoz pedig csak hordozót. A kezeléseket és az ellenőrző kísérleteket is ajánlatos legalább három másolati mintában végezni. Vigyázni kell arra, hogy az anyag homogén módon legyen eloszlatva a kezelt talajmintákban. A bekeverés során el kell kerülni a talaj tömörödését vagy összecsomósodását.
1.7.1.2. A talajminták inkubálása
A talajminták inkubálása kétféle módon történhet: az egyes kezelt és nem kezelt talajokból vagy ömlesztett mintákat kell készíteni, vagy egy sor önálló és egyforma méretű részmintát. Illékony vegyületek vizsgálata esetén azonban a vizsgálatot csak egy önálló részmintákból álló sorozattal kell elvégezni. A talajok ömlesztve történő inkubálása esetén minden kezelt és nem kezelt talajt nagy mennyiségben kell elkészíteni, és a vizsgálat során szükség szerint ezekből kell részmintákat venni a különféle analízisekhez. Az, hogy kiindulásképpen milyen mennyiséget kell készíteni az egyes kezelésekhez és ellenőrző vizsgálatokhoz, függ a részminták méretétől, az analízishez használt másolati minták számától, valamint a mintavételek várható maximális számától. A részminták vétele előtt az ömlesztve inkubált talajokat alaposan össze kell keverni. Ha a talajok inkubálása önálló részminták sorozataként történik, az egyes kezelt és nem kezelt ömlesztett talajmintákat a szükséges számú részmintára kell felosztani, amelyeket azután igény szerint kell felhasználni. Olyan kísérleteknél, amikor várhatóan több mint két alkalommal kell majd mintát venni, elegendő számú részmintát kell készíteni ahhoz, hogy azokból minden másolati mintára és mintavételi alkalomra jusson. A teszttalajokat legalább három másolati mintában kell aerob körülmények között inkubálni (lásd az 1.7.1.1. szakaszt). Minden egyes vizsgálat során megfelelő gőztérrel rendelkező edényeket kell használni annak érdekében, hogy ne alakuljanak ki anaerob körülmények. Illékony anyagok vizsgálata esetén a vizsgálatot csak egy önálló részmintákból álló sorozattal kell elvégezni.
1.7.1.3. A kísérlet körülményei és időtartama
A vizsgálatot sötétben, 20 ± 2 oC-os szobahőmérsékleten kell elvégezni. A talajmintákat a vizsgálat időtartama alatt a talaj maximális víztartó kapacitásának 40 és 60 százaléka közötti értéken kell tartani (lásd az 1.6.4.2. szakaszt) ± 5 %-os eltéréssel. Szükség esetén desztillált vagy ioncserélt víz adható a mintákhoz.
A vizsgálat minimális időtartama 28 nap. Mezőgazdasági vegyi anyagok vizsgálata esetén össze kell hasonlítani a kezelt és az ellenőrző mintákban mért nitrátképződési sebességet. Ha a 28. napon ezek több mint 25 %-kal eltérnek egymástól, a vizsgálatot addig kell folytatni, amíg a különbség 25 %-ra vagy az alá nem csökken, vagy legfeljebb 100 napig, ha az a korábbi időpont. A nem mezőgazdasági vegyi anyagok esetében a vizsgálat a 28 nap után véget ér. A 28. napon meg kell határozni a kezelt és az ellenőrző talajminták nitráttartalmát, és ki kell számítani az ECx-értékeket.
1.7.2. Mintavétel és a talajok elemzése
1.7.2.1. Talajminta-vételi program
Mezőgazdasági vegyi anyagok vizsgálata esetén a 0., 7., 14. és 28. napon meg kell mérni a talajminták nitráttartalmát. Ha hosszabb időtartamú vizsgálatot kell végezni, a nitráttartalomméréseket a 28. nap után 14 naponta kell végezni.
Nem mezőgazdasági vegyi anyagok vizsgálata esetén legalább öt vizsgálati koncentrációt kell alkalmazni, és a talajminták nitráttartalmát az expozíciós időszak kezdetén (0. nap) és végén (28. nap) kell megmérni. Szükség esetén be lehet iktatni egy köztes mérést is, például a 7. napon. A 28. napon kapott adatok segítségével meg kell határozni a vegyület ECx-értékeit. Szükség esetén a talaj kiindulási nitráttartalmának megadására a 0. napon az ellenőrző mintákban mért adatokat lehet felhasználni.
1.7.2.2. A talajminták analízise
Minden mintavételi időpontban meg kell határozni az egyes kezelt és ellenőrző másolati mintákban keletkezett nitrát mennyiségét. A nitrát kinyerése a talajból úgy történik, hogy a mintákat egy extrakciós oldószerrel, például 0,1 M kálium-klorid oldattal rázatni kell. A javasolt arány 5 ml KCl-oldat 1 gramm talaj szárazsúly-egyenértékre. Az extrahálás optimalizálásra érdekében a talajmintát és az extrakciós oldatot tartalmazó edények legfeljebb félig lehetnek. Az elegyeket 60 percig 150 rpm fordulatszámon kell rázatni. Ezt követően az elegyeket centrifugálni vagy szűrni kell, és a folyadékfázisban kell meghatározni a nitrát mennyiségét. A részecskementes folyékony kivonatok az analízist megelőzően mínusz 20 ± 5 oC-on legfeljebb hat hónapig tárolhatók.
2. ADATOK
2.1. AZ EREDMÉNYEK KEZELÉSE
Mezőgazdasági vegyi anyagokkal végzett vizsgálat esetén le kell jegyezni az egyes másolati talajmintákban képződött nitrát mennyiségét, és a másolati minták átlagát táblázatos formában kell megadni. A nitrogénátalakítási arányokat megfelelő és általánosan elfogadott statisztikai módszerekkel (például F-teszt, 5 %-os szignifikanciaszint) kell kiértékelni. A képződött nitrát mennyiségét mg nitrát/kg talaj (szárazsúly)/nap egységekben kell kifejezni. Az egyes kezeléseknél mért nitrátképződési sebességeket össze kell hasonlítani az ellenőrző mintában mérttel, és ki kell számítani az ellenőrző mintától való százalékos eltérést.
Nem mezőgazdasági vegyi anyagokkal végzett vizsgálat esetén meg kell határozni az egyes másolati mintákban képződött nitrát mennyiségét, és dózis-válasz görbét kell felvenni az ECx-értékek becsléséhez. A kezelt minták 28 nap után mért nitráttartalmát (mg nitrát/kg talaj (szárazsúly)) össze kell hasonlítani az ellenőrző mintákban mérttel. Ezekből az adatokból ki kell számítani az egyes vizsgálati koncentrációkra vonatkozó %-os gátlási értékeket. A százalékos értékeket a koncentráció függvényében kell ábrázolni, majd statisztikai eljárások alkalmazásával ki kell számítani az ECx-értékeket. A számított ECx-értékek konfidenciahatárát (p = 0,95) is a szabványos eljárások segítségével kell meghatározni (10) (11) (12).
A nagy mennyiségű nitrogént tartalmazó vizsgálandó anyagok növelhetik a vizsgálat során képződött nitrát mennyiségét. Ha magas koncentrációban történik az ilyen anyagok (azaz olyan vegyi anyagok, amelyek várhatóan ismételt kihordással kerülnek felhasználásra) vizsgálata, gondoskodni kell a megfelelő ellenőrző mintákról (talaj plusz vizsgálandó anyag, növényi liszt hozzáadása nélkül). Az ilyen ellenőrző mintákból származó adatokat is figyelembe kell venni az ECx-értékek számításakor.
2.2. AZ EREDMÉNYEK ÉRTELMEZÉSE
Ha a mezőgazdasági vegyi anyagokkal végzett vizsgálatok eredményeinek értékelésekor az alacsonyabb koncentrációjú kezeléssel (azaz a maximális becsült koncentrációval) és az ellenőrző mintákkal kapott nitrátképződési arányok különbsége a 28. nap utáni mintavételi időpontok valamelyikénél nem haladja meg a 25 %-ot, azt a következtetést kell levonni, hogy a terméknek nincs hosszú távú hatása a talajokban zajló nitrogénátalakításra. A nem mezőgazdasági vegyi anyagokkal végzett vizsgálatok esetében a vegyületek értékeléséhez az EC50-, EC25- és/vagy EC10-értékeket kell használni.
3. JELENTÉS
A vizsgálati jelentésnek a következő információkat kell tartalmaznia:
|
|
a talaj teljes körű azonosítása, ezen belül:
|
|
|
Vizsgálandó anyag:
|
|
|
Szubsztrát:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
4. SZAKIRODALOM
|
(1) |
EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994. |
|
(2) |
BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990). |
|
(3) |
EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987. |
|
(4) |
SET AC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SET AC-Europe, Bruxelles. |
|
(5) |
ISO/DIS 14238 (1995). Soil Quality – Determination of Nitrogen Mineralisation and Nitrification in Soils and the Influence of Chemicals on these Processes. Technical Committee ISO/TC 190/SC 4: Soil Quality – Biological Methods. |
|
(6) |
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italie, 18-20 Janvier 1995. |
|
(7) |
ISO 10381-6 (1993). Soil quality – Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. (Talajminőség – Mintavétel – A mikrobiális folyamatok laboratóriumi értékelésére szolgáló talaj begyűjtésére, kezelésére és tárolására vonatkozó iránymutatás.) |
|
(8) |
ISO 14240-1 (1997). Soil quality – Determination of soil microbial biomass – Part 1: Substrate- induced respiration method. (Talajminőség. A talaj mikrobiális biomasszájának meghatározása. 1. rész: Szubsztrátindukált respirációs módszer.) |
|
(9) |
ISO 14240-2 (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation- extraction method. (Talajminőség. A talaj mikrobiális biomasszájának meghatározása. 2. rész: Gőzextrakciós módszer.) |
|
(10) |
Litchfield, J.T. and Wilcoxon F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Then, 96, 99-113. |
|
(11) |
Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York. |
|
(12) |
Finney, D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK. |
C.22. TALAJLAKÓ MIKROORGANIZMUSOK: SZÉNÁTALAKÍTÁSI VIZSGÁLAT
1. MÓDSZER
Ez a módszer az OECD TG 217 (2000) módszer megfelelője.
1.1. BEVEZETÉS
Ez a vizsgálati módszer egy olyan laboratóriumi módszert ismertet, amelynek célja annak vizsgálata, hogy a növényvédő szerek és esetleg más vegyi anyagok egyszeri expozíció esetén milyen potenciális hosszú távú hatásokat gyakorolnak a talajlakó mikroorganizmusok szénátalakítási aktivitására. A vizsgálat elsősorban az Európai és Földközi-tenger Melléki Növényvédelmi Szervezet ajánlásain alapul (1). Azonban más iránymutatásokat, ezen belül a German Biologische Bundesanstalt (2), az Egyesült Államok Környezetvédelmi Hivatala (3) és a SET AC (4) iránymutatásait is figyelembe vettünk. Az 1995-ben az olaszországi Belgirateban megrendezett, a talajok/üledékek kiválasztásával kapcsolatos OECD-munkaértekezleten (5) megegyezés született az e vizsgálatban alkalmazandó talajok számáról és típusáról. A talajminták gyűjtéséről, kezeléséről és tárolásáról szóló ajánlások egy ISO-útmutatón (6) és a belgiratei munkaértekezlet ajánlásain alapulnak.
A vizsgálandó anyagok toxikus jellemzőinek meghatározása és értékelése során szükség lehet a talaj mikrobiális aktivitására gyakorolt hatások meghatározására, például olyan esetben, ha adatokra van szükség a növényvédő szereknek a talaj mikroflórájára gyakorolt esetleges mellékhatásaival kapcsolatban, vagy ha a talaj lakó mikroorganizmusoknak növényvédő szerektől eltérő vegyületekkel szembeni expozíciója várható. A szénátalakítási vizsgálat végrehajtásának célja az ilyen vegyületeknek a talaj mikroflórájára gyakorolt hatásainak meghatározása. Amennyiben mezőgazdasági vegyi anyagok (pl. növényvédő szerek, műtrágyák, erdészeti vegyi anyagok) vizsgálatáról van szó, mind a szénátalakítási, mind a nitrogénátalakítási vizsgálatot el kell végezni. Ha nem mezőgazdasági vegyi anyagok vizsgálata történik, elég a nitrogénátalakítási vizsgálatot elvégezni. Ha azonban a nitrogénátalakítási vizsgálat az ilyen vegyületek esetében olyan EC50-értékeket eredményez, amelyek a kereskedelmi forgalomban kapható nitrifikációgátló szerek (pl. nitrapirin) esetében tapasztalt tartományba esik, további információk gyűjtése érdekében a szénátalakítási vizsgálatot is el lehet végezni.
A talajok élő és élettelen komponensekből épülnek fel, amelyek komplex és heterogén elegyek formájában léteznek. A mikroorganizmusok számos fajjal fontos szerepet játszanak a termőtalajok szervesanyag-tartalmának lebontásában és átalakításában, hozzájárulva a talajok termékenységének különféle aspektusaihoz. Az ilyen biokémiai folyamatokat megzavaró hosszú távú hatások potenciálisan megzavarhatják a tápanyag-körforgalmat, ami megváltoztathatja a talaj termékenységét. Szén- és nitrogénátalakítás minden termőtalajban folyik. Bár az e folyamatokért felelős mikrobaközösségek talajonként eltérőek, az átalakítási útvonalak lényegében azonosak.
Ennek a vizsgálati módszernek a célja valamely anyagnak az aerob feltalajokban zajló szénátalakítási folyamatra gyakorolt hosszú távú káros hatásainak kimutatása. A vizsgálati módszer érzékeny a szénátalakításért felelős mikrobaközösségek méretében és aktivitásában bekövetkező változásokra, mivel ez kémiai stresszt és szénéhezést okoz ezekben a közösségekben. A vizsgálathoz alacsony szervesanyag-tartalmú homokos talajt kell használni. Ezt a talajt kezelni kell a vizsgálandó anyaggal, majd gyors mikrobiális anyagcserét biztosító körülmények között inkubálni kell. Ilyen körülmények között hamar kimerülnek a talaj könnyen hozzáférhető szénforrásai. Ez szénéhezést okoz, ami elpusztítja a mikrobákat és egyben nyugalmi állapotot és/vagy spóraképzést idéz elő. Ha a vizsgálat több mint 28 napig tart, e reakciók összessége a kontroll- (kezeletlen) talajokban a metabolikusan aktív mikrobiális biomassza progresszív elvesztéseként mérhető (7). Ha valamely vegyi anyag jelenléte a vizsgálat körülményei között befolyást gyakorol a szénstresszelt talajban található biomasszára, akkor a biomassza nem tud visszatérni ugyanarra a szintre, mint a kontrolltalajokban. A vizsgálandó anyag által a vizsgálat során bármikor előidézett zavaró hatás tehát gyakran egészen a vizsgálat végéig fennmarad.
Azokat a teszteket, amelyekből ezt a vizsgálati módszert kifejlesztették, elsősorban olyan anyagokhoz dolgozták ki, amelyek esetében előre jelezhető a talajba kerülő mennyiség. Ez a helyzet például a növényvédő szerek esetében, amelyeknél ismert a szántóföldi alkalmazás mértéke. A mezőgazdasági vegyi anyagok esetében elegendő két, a várt vagy becsült alkalmazási mérték szempontjából releváns dózist alkalmazni. A mezőgazdasági vegyi anyagok vizsgálhatók aktív összetevőként (a.ö.) vagy formulázott termékként is. A vizsgálat azonban nem korlátozódik kizárólag a megbecsülhető környezeti koncentrációval rendelkező anyagokra. Mind a vizsgálandó anyagnak a talajban alkalmazott mennyiségét, mind az adatok kiértékelésének módját módosítva, a vizsgálat mezőgazdasági vegyi anyagoktól eltérő vegyületekre is alkalmazható, amelyek esetében nem ismert a talajba várhatóan bejutó mennyiség. A nem mezőgazdasági vegyi anyagok esetében tehát egy sor koncentrációnál meg kell határozni a szénátalakításra gyakorolt hatásokat. Az ilyen vizsgálatokkal kapott adatok dózis-válasz görbék elkészítésére és ECx-értékek számítására használhatók fel, ahol x jelentése % hatás.
1.2. FOGALOMMEGHATÁROZÁSOK
„Szénátalakítás”: szerves anyagok mikroorganizmusok által végzett lebontása a megfelelő szervetlen végtermékké, azaz szén-dioxiddá.
„ECx (hatásos koncentráció)”: a vizsgálandó anyag olyan talajbeli koncentrációja, amely x %-osan gátolja a szén szén-dioxiddá alakulását.
„EC50 (közepes hatásos koncentráció)”: a vizsgálandó anyag olyan talajbeli koncentrációja, amely 50 százalékosan (50 %-osan) gátolja a szén szén-dioxiddá alakulását.
1.3. REFERENCIAANYAGOK
Nincs.
1.4. A VIZSGÁLATI MÓDSZER ELVE
Az átszitált talajt a vizsgálandó anyaggal kell kezelni, vagy kezeletlenül kell hagyni (kontroll). Mezőgazdasági vegyi anyagok vizsgálata esetén minimálisan két vizsgálati koncentráció alkalmazása ajánlott, amelyeket a szántóföldeken várható legmagasabb koncentráció függvényében kell megválasztani. Az inkubálás 0., 7., 14. és 28. napja után a kezelt és az ellenőrző talajmintákhoz glükózt kell keverni, majd 12 órán át folyamatosan mérni kell a glükózindukált légzési sebességet. A légzési sebességet a felszabaduló szén-dioxidban (mg szén-dioxid/kg száraz talaj/óra) vagy az elfogyasztott oxigénben (mg oxigén/kg talaj/óra) kell kifejezni. A kezelt talajokban mért közepes légzési rátát össze kell hasonlítani az ellenőrző minta esetében mérttel, majd ki kell számítani a kezelt és az ellenőrző talajminták közötti százalékos eltérést. Minden vizsgálatot legalább 28 napig kell végezni. Ha a 28. napon a kezelt és nem kezelt talajok közötti különbség 25 % vagy annál nagyobb, a méréseket 14 napos intervallumokban, legfeljebb 100 napos időtartamig folytatni kell. Ha nem mezőgazdasági vegyi anyagok vizsgálata történik, a vizsgálandó anyag egy sor különböző koncentrációját kell a talajmintákhoz adni, és 28 nap után meg kell mérni a kezelt és az ellenőrző mintákban a glükózindukált légzési sebességeket (azaz a képződő szén-dioxid vagy az elfogyasztott oxigén átlagos mennyiségét). A különböző koncentrációk alkalmazásával kapott vizsgálati eredményeket regressziós modell segítségével kell elemezni, majd ki kell számítani az ECx-értékeket (azaz az EC50-et, az EC25-öt és/vagy az EC10-et). Lásd a fogalommeghatározásokat.
1.5. A VIZSGÁLAT ÉRVÉNYESSÉGE
A mezőgazdasági vegyi anyagokkal kapott vizsgálati eredmények értékelése az ellenőrző és a kezelt talajmintákban felszabaduló szén-dioxid vagy elfogyasztott oxigén közötti viszonylag kis különbségeken (azaz az átlag ± 25 %-a) alapul, így az ellenőrző minták közötti nagy eltérések hamis eredményekhez vezethetnek. A párhuzamos ellenőrző minták közötti eltérésnek ±15 %-nál kisebbnek kell lennie.
1.6. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.6.1. Eszközök
Kémiailag inert anyagból készült vizsgálati edényeket kell használni. Ezeknek megfelelő, a talajok inkubálására alkalmazott eljárással, például az ömlesztve inkubálással vagy egyedi talajminták sorozataként történő inkubálással megfelelő összhangban lévő kapacitásúnak kell lenniük (lásd az 1.7.1.2. szakaszt). Ügyelni kell egyrészről a vízveszteség minimalizálására, másrészről a gázcsere lehetővé tételére a vizsgálat során (például a vizsgálati edények perforált polietilén fóliával fedhetők le). Illékony anyagok vizsgálata esetén zárható és légmentesen záródó edényeket kell alkalmazni. Az edényeknek olyan méretűnek kell lenniük, hogy a talajminta-térfogatuk körülbelül egynegyedéig töltse fel őket.
A glükózindukált légzés meghatározásához inkubálórendszerekre és a szén-dioxid-termelés vagy az oxigénfogyasztás mérésére alkalmas műszerekre van szükség. Ilyen rendszerekre és műszerekre példák a (8), (9), (10) és (11) hivatkozásban találhatók.
1.6.2. A talajok kiválasztása és száma
Csak egyféle talaj használható. A javasolt talajjellemzők a következők:
|
— |
homoktartalom: legalább 50 % és legfeljebb 75 %, |
|
— |
pH: 5,5–7,5, |
|
— |
szervesszén-tartalom: 0,5–1,5 %, |
|
— |
meg kell mérni a mikrobiális biomasszát (12) (13), amelynek széntartalma a talaj teljes szervesszén-tartalmának legalább 1 %-a kell hogy legyen. |
Az esetek többségében az ilyen jellemzőkkel rendelkező talaj a legrosszabb helyzetet reprezentálja, mivel minimális a vizsgálandó vegyület adszorpciója, viszont maximális a hozzáférhetősége a mikroflóra számára. Következésképpen általában nincs szükség más talajokkal végzett vizsgálatokra. Bizonyos körülmények között azonban, például amikor a vizsgálandó anyag várható fő felhasználási területe a különleges talajok, például a savanyú erdőtalajok vagy az elektrosztatikus töltéssel rendelkező vegyületek esetében is, szükség lehet ennek egy másik talajtípussal való helyettesítésre.
1.6.3. A talajminták begyűjtése és tárolása
1.6.3.1. Gyűjtés
Részletes információkkal kell rendelkezni annak a szántóföldi területnek a történetéről, ahonnan a vizsgálati talajminta begyűjtése történik. Ilyen részletek például a pontos hely, a növénytakaró, a növényvédő szerekkel végzett kezelések időpontjai, a szerves és szervetlen trágyák alkalmazásai, a biológiai anyagok hozzáadása vagy a véletlen szennyezések. A talajminták gyűjtéshez olyan helyet kell választani, amely hosszú távon használható erre a célra. Megfelelőek például az állandó legelők, az évente gabonatermést (kivéve kukoricát) hozó területek vagy a zöldtrágyával sűrűn bevetett területek. Követelmény, hogy a kiválasztott mintagyűjtési helyet a mintagyűjtést megelőzően legalább egy évig ne kezeljék növényvédő szerekkel. Továbbá legalább hat hónapig ne kapjon szerves trágyázást. Ásványi műtrágya alkalmazása csak akkor elfogadható, ha a haszonnövény igényeinek megfelelően történik, és a műtrágyázást követően legalább három hónapig nem szabad talajmintákat venni. Kerülni kell az ismert biocid hatású műtrágyákkal (pl. kalcium-ciánamiddal) kezelt talajok alkalmazását.
Kerülni kell a mintavételt hosszú (30 napnál hosszabb) ideig tartó szárazság vagy elvizesedés esetén, illetve közvetlenül ilyen időszakok után. Szántott talajok esetében a mintákat 0–20 cm mélységből kell venni. Legelők vagy egyéb olyan talajok esetében, amelyeket hosszú ideig (legalább egy vegetációs periódusig) nem szántanak fel, a mintavétel maximális mélysége 20 cm-nél kicsit több (pl. 25 cm) is lehet. A talajmintákat olyan edényekben és olyan hőmérsékleti feltételek mellett kell elszállítani, amelyek garantálják, hogy a talaj eredeti tulajdonságai nem módosulnak szignifikáns mértékben.
1.6.3.2. Tárolás
Legelőnyösebb a frissen gyűjtött talajok alkalmazása. Ha a laboratóriumi tárolás nem kerülhető el, a talajok sötétben, 4 ± 2 oC-on legfeljebb három hónapig tárolhatók. A talajok tárolása során aerob körülményeket kell biztosítani. Ha a talajminták begyűjtése olyan területeken történt, ahol a talaj az év legalább három hónapjában fagyott, szóba jöhet hat hónapos, mínusz 18 oC hőmérsékleten való tárolás is. Minden egyes kísérlet előtt meg kell mérni a tárolt talajok mikrobiális biomasszáját, és a biomassza széntartalmának el kell érnie a talaj teljes szervesszén-tartalmának legalább 1 %-át (lásd az 1.6.2. szakaszt).
1.6.4. A talaj kezelése és előkészítése a vizsgálatra
1.6.4.1. Előinkubálás
Tárolt talaj használata esetén (lásd az 1.6.4.2. és az 1.7.1.3. szakaszt) ajánlatos 2-től 28 napig terjedő előinkubálást alkalmazni. Az előinkubálás során a talaj hőmérsékletének és nedvességtartalmának hasonlónak kell lennie a vizsgálat során alkalmazott hőmérséklethez és nedvességtartalomhoz (lásd az 1.6.4.2. és az 1.7.1.3. szakaszt).
1.6.4.2. Fizikai-kémiai tulajdonságok
A talajból manuálisan el kell távolítani a nagyobb tárgyakat (például köveket, növényi részeket stb.), majd a túlzott kiszáradást kerülve a talajt nedvesen át kell szitálni úgy, hogy a részecskeméret legfeljebb 2 mm legyen. A talajminta nedvességtartalmát desztillált vagy ioncserélt vízzel a maximális víztartó képesség 40–60 %-ára kell beállítani.
1.6.5. A vizsgálandó anyag előkészítése a talajon történő alkalmazáshoz
A vizsgálandó anyagot általában hordozó segítségével kell alkalmazni. A hordozó lehet víz (vízben oldható anyagok esetében) vagy valamely inert szilárd anyag, így például finom kvarchomok (részecskeméret: 0,1–0,5 mm). Kerülni kell a víztől eltérő folyékony hordozók (például szerves oldószerek, így például aceton, kloroform) alkalmazását, mivel ezek károsíthatják a mikroflórát. Ha hordozóként homokot használunk, a homok be is vonható a megfelelő oldószerben feloldott vagy szuszpendált vizsgálandó anyaggal. Ilyen esetekben az oldószert a talajba való bekeverés előtt el kell párologtatni. Ahhoz, hogy a vizsgálandó anyag optimális módon oszoljon szét a talajban, a következő arány ajánlott: 10 g homok per 1 kilogramm talaj (szárazsúly). Az ellenőrző mintákat ugyanilyen mennyiségű vízzel és/vagy kvarchomokkal kell kezelni.
Illékony vegyületek vizsgálata esetén kerülni kell a kezelés közbeni veszteséget, valamint a vegyület talajban való homogén eloszlásának biztosítására is törekedni kell (például a vizsgálandó anyagot több helyen is be kell injektálni a talajba).
1.6.6. Vizsgálati koncentrációk
Növényvédő szerek és egyéb, megbecsülhető környezeti koncentrációval rendelkező vegyületek vizsgálata esetén legalább két koncentrációt kell alkalmazni. Az alacsonyabb koncentrációnak legalább a gyakorlatban a talajba várhatóan bejutó legnagyobb mennyiségnek kell megfelelnie, a magasabb koncentrációnak pedig az alacsonyabb koncentráció valamely többszörösének kell lennie. A talajhoz adott vizsgálandó anyag koncentrációját 5 cm-es mélységig egyenletes beépülést és 1,5 g/cm3-es talaj térfogatsűrűséget feltételezve kell kiszámolni. A közvetlenül a talajra kihordott mezőgazdasági vegyi anyagok vagy az olyan vegyületek esetében, amelyeknek a talajba bejutó mennyisége előre jelezhető, az ajánlott vizsgálati koncentrációk a következők: a megbecsülhető környezeti koncentráció (PEC) és ennek ötszöröse. Azoknak az anyagoknak az esetében, amelyeket egy idényben várhatóan több alkalommal is kihordanak a talajokra, a vizsgálathoz alkalmazandó koncentráció a PEC-értéknek a kihordások maximálisan várható számával történő megszorzásával számítható ki. A vizsgált magasabb koncentrációnak azonban nem szabad meghaladnia az egyszeri maximális alkalmazási arány tízszeresét.
Nem mezőgazdasági vegyi anyagok vizsgálata esetén legalább öt, mértani sort alkotó koncentrációt kell alkalmazni. A vizsgált koncentrációknak le kell fedniük az ECx-értékek meghatározásához szükséges tartományt.
1.7. A VIZSGÁLAT VÉGREHAJTÁSA
1.7.1. Az expozíció körülményei
1.7.1.1. Kezelés és kontroll
Mezőgazdasági vegyi anyagok vizsgálata esetén a talajt három, egyenlő tömegű részre kell osztani. Két részlethez a terméket is tartalmazó hordozót kell keverni, a harmadikhoz pedig csak hordozót (kontroll). Ajánlatos a kezelt és nem kezelt talajokat is legalább három másolati mintában vizsgálni. Nem mezőgazdasági vegyi anyagok vizsgálata esetén a talajt hat, egyenlő tömegű részletre kell osztani. Öthöz a vizsgálandó anyagot is tartalmazó hordozót kell keverni, a hatodikhoz pedig csak hordozót. A kezeléseket és az ellenőrző kísérleteket is ajánlatos legalább három másolati mintában végezni. Vigyázni kell arra, hogy az anyag homogén módon legyen eloszlatva a kezelt talajmintákban. A bekeverés során el kell kerülni a talaj tömörödését vagy összecsomósodását.
1.7.1.2. A talajminták inkubálása
A talajminták inkubálása kétféle módon történhet: az egyes kezelt és nem kezelt talajokból vagy ömlesztett mintákat kell készíteni, vagy egy sor önálló és egyforma méretű részmintát. Illékony vegyületek vizsgálata esetén azonban a vizsgálatot csak egy önálló részmintákból álló sorozattal kell elvégezni. A talajok ömlesztve történő inkubálása esetén minden kezelt és nem kezelt talajt nagy mennyiségben kell elkészíteni, és a vizsgálat során szükség szerint ezekből kell részmintákat venni a különféle analízisekhez. Az, hogy kiindulásképpen milyen mennyiséget kell készíteni az egyes kezelésekhez és ellenőrző vizsgálatokhoz, függ a részminták méretétől, az analízishez használt másolati minták számától, valamint a mintavételek várható maximális számától. A részminták vétele előtt az ömlesztve inkubált talajokat alaposan össze kell keverni. Ha a talajok inkubálása önálló részminták sorozataként történik, az egyes kezelt és nem kezelt ömlesztett talajmintákat a szükséges számú részmintára kell felosztani, amelyeket azután igény szerint kell felhasználni. Olyan kísérleteknél, amikor várhatóan több mint két alkalommal kell majd mintát venni, elegendő számú részmintát kell készíteni ahhoz, hogy azokból minden másolati mintára és mintavételi alkalomra jusson. A teszttalajokat legalább három másolati mintában kell aerob körülmények között inkubálni (lásd az 1.7.1.1. szakaszt). Minden egyes vizsgálat során megfelelő gőztérrel rendelkező edényeket kell használni annak érdekében, hogy ne alakuljanak ki anaerob körülmények. Illékony anyagok vizsgálata esetén a vizsgálatot csak egy önálló részmintákból álló sorozattal kell elvégezni.
1.7.1.3. A kísérlet körülményei és időtartama
A vizsgálatot sötétben, 20 ± 2 oC-os szobahőmérsékleten kell elvégezni. A talajmintákat a vizsgálat időtartama alatt a talaj maximális víztartó kapacitásának 40 és 60 százaléka közötti értéken kell tartani (lásd az 1.6.4.2. szakaszt) ± 5 %-os eltéréssel. Szükség esetén desztillált vagy ioncserélt víz adható a mintákhoz.
A vizsgálat minimális időtartama 28 nap. Mezőgazdasági vegyi anyagok vizsgálata esetén össze kell hasonlítani a kezelt és az ellenőrző mintákban felszabaduló szén-dioxid vagy elfogyasztott oxigén mennyiségét. Ha a 28. napon ezek több mint 25 %-kal eltérnek egymástól, a vizsgálatot addig kell folytatni, amíg a különbség 25 %-ra vagy az alá nem csökken, vagy legfeljebb 100 napig, ha az a korábbi időpont. Nem mezőgazdasági vegyi anyagok vizsgálata esetén a vizsgálat a 28. nap után véget ér. A 28. napon meg kell határozni a kezelt és az ellenőrző talajmintákban felszabaduló szén-dioxid vagy elfogyasztott oxigén mennyiségét, és ki kell számítani az ECx-értékeket.
1.7.2. Mintavétel és a talajok elemzése
1.7.2.1. Talajminta-vételi program
Mezőgazdasági vegyi anyagok vizsgálata esetén a 0., 7., 14. és 28. napon meg kell mérni a talajmintákban a glükózindukált légzési sebességeket. Ha hosszabb időtartamú vizsgálatot kell végezni, a további méréseket a 28. nap után 14 naponta kell végezni.
Nem mezőgazdasági vegyi anyagok vizsgálata esetén legalább öt vizsgálati koncentrációt kell alkalmazni, és a talajminták glükózindukált légzését az expozíciós időszak kezdetén (0. nap) és végén (28. nap) kell megmérni. Szükség esetén be lehet iktatni egy köztes mérést is, például a 7. napon. A 28. napon kapott adatokból meg kell határozni a vegyi anyag ECx-értékét. Szükség esetén a 0. napon az ellenőrző mintákban mért adatok segítségével meg lehet becsülni, hogy a talajban eredetileg milyen mennyiségben volt jelen metabolikusan aktív mikrobiális biomassza (12).
1.7.2.2. A glükózindukált légzési sebesség mérése
Minden mintavételi időpontban meg kell határozni az egyes kezelt és ellenőrző másolati mintákban tapasztalható glükózindukált légzési sebességet. A talajmintákhoz olyan mennyiségű glükózt kell keverni, hogy az azonnali maximális légzési választ váltson ki. Az adott talajban a maximális válasz kiváltásához szükséges glükózmennyiséget előzetes vizsgálatokkal lehet meghatározni, amelyhez egy sor különböző glükózkoncentrációt kell alkalmazni (14). A 0,5–1,5 % szerves szént tartalmazó homokos talajok esetében azonban általában elegendő, ha 2 000 - 2 000 mg/kg talaj (szárazsúly) mennyiségben adunk hozzá glükózt. A glükóz tiszta kvarchomokkal (10 g homok/kg talaj (szárazsúly)) porrá őrölhető és homogén módon a talajhoz keverhető.
A glükózzal feljavított talajmintákat a légzési sebességet folyamatosan, óránként vagy kétóránként mérő, megfelelő berendezésben (lásd az 1.6.1. szakaszt), 20 ± 2 oC-on inkubálni kell. A felszabaduló szén-dioxidot vagy elfogyasztott oxigént 12 órán át folyamatosan mérni kell, és a mérést a lehető leghamarabb, azaz a glükóz hozzáadása után 1-2 órán belül el kell kezdeni. Meg kell mérni a 12 óra alatt felszabaduló szén-dioxid vagy elfogyasztott oxigén teljes mennyiségét, és ebből meg kell határozni a közepes légzési sebességeket.
2. ADATOK
2.1. AZ EREDMÉNYEK KEZELÉSE
Mezőgazdasági vegyi anyagokkal végzett vizsgálat esetén le kell jegyezni az egyes másolati talajmintákban felszabaduló szén-dioxid vagy elfogyasztott oxigén mennyiségét, és a másolati minták átlagát táblázatos formában kell megadni. Az eredményeket megfelelő és általánosan elfogadott statisztikai módszerekkel (például F-teszt, 5 %-os szignifikanciaszint) kell kiértékelni. A glükózindukált légzési sebességet szén-dioxid/kg talaj (szárazsúly)/óra vagy mg oxigén/talaj (szárazsúly)/óra egységekben kell kifejezni. Az egyes kezeléseknél mért közepes szén-dioxid képződési vagy közepes oxigénfogyasztási sebességeket össze kell hasonlítani az ellenőrző mintában mérttel, és ki kell számítani az ellenőrző mintától való százalékos eltérést.
Nem mezőgazdasági vegyi anyagokkal végzett vizsgálat esetén meg kell határozni az egyes másolati mintákban a felszabaduló szén-dioxid vagy az elfogyasztott oxigén mennyiségét, és dózis-válasz görbét kell felvenni az ECx-értékek becsléséhez. A kezelt mintákban 28 nap után mért glükózindukált légzési sebességeket (mg szén-dioxid/kg talaj (szárazsúly)/óra vagy mg oxigén/talaj (szárazsúly)/óra) össze kell hasonlítani az ellenőrző mintákban mérttel. Ezekből az adatokból ki kell számítani az egyes vizsgálati koncentrációkra vonatkozó %-os gátlási értékeket. A százalékos értékeket a koncentráció függvényében kell ábrázolni, majd statisztikai eljárások alkalmazásával ki kell számítani az ECx-értékeket. A számított ECx-értékek konfidenciahatárát (p = 0,95) is a szabványos eljárások segítségével kell meghatározni (15) (16) (17).
2.2. AZ EREDMÉNYEK ÉRTELMEZÉSE
Ha a mezőgazdasági vegyi anyagokkal végzett vizsgálatok eredményeinek értékelésekor az alacsonyabb koncentrációjú kezeléssel (azaz a maximális becsült koncentrációval) és az ellenőrző mintákkal kapott légzési sebességek különbsége a 28. nap utáni mintavételi időpontok valamelyikénél nem haladja meg a 25 %-ot, akkor azt a következtetést kell levonni, hogy a terméknek nincs hosszú távú hatása a talajokban folyó szénátalakításra. A nem mezőgazdasági vegyi anyagokkal végzett vizsgálatok esetében a vegyületek értékeléséhez az EC50-, EC25- és/vagy EC10-értékeket kell használni.
3. JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek a következő információkat kell tartalmaznia:
|
|
a talaj teljes körű azonosítása, ezen belül:
|
|
|
Vizsgálandó anyag:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
4. SZAKIRODALOM
|
(1) |
EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994. |
|
(2) |
BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990). |
|
(3) |
EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987. |
|
(4) |
SET AC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SET AC-Europe, Brussels. |
|
(5) |
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995. |
|
(6) |
ISO 10381-6 (1993). Soil quality – Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. (Talajminőség – Mintavétel – A mikrobiális folyamatok laboratóriumi értékelésére szolgáló talaj begyűjtésére, kezelésére és tárolására vonatkozó iránymutatás.) |
|
(7) |
Anderson, J.P.E. (1987). Handling and Storage of Soils for Pesticide Experiments, in „Pesticide Effects on Soil Microflora”. Eds. L. Somerville and M.P. Greaves, Chap. 3: 45-60. |
|
(8) |
Anderson, J.P.E. (1982). Soil Respiration, in „Methods of Soil Analysis – Part 2: Chemical and Microbiological Properties”. Agronomy Monograph No 9. Eds. A.L. Page, R.H. Miller and D.R. Keeney. 41: 831-871. |
|
(9) |
ISO 11266-1. (1993). Soil Quality – Guidance on Laboratory Tests for Biodegradation in Soil: Part 1. Aerobic Conditions. (Talajminőség. Útmutató a talajban levő szerves vegyi anyagok aerob feltételek melletti biológiai lebonthatóságának laboratóriumi vizsgálatára.) |
|
(10) |
ISO 14239 (1997E). Soil Quality – Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions. (Talajminőség. Laboratóriumi inkubációs rendszerek a talajban lévő szerves vegyi anyagok aerob feltételek mellett végbemenő mineralizációjának vizsgálatához.) |
|
(11) |
Heinemeyer, O., Insam, H., Kaiser, E.A, and Walenzik, G. (1989). Soil microbial biomass and respiration measurements; an automated technique based on infrared gas analyses. Plant and Soil, 116: 77-81. |
|
(12) |
ISO 14240-1 (1997). Soil quality – Determination of soil microbial biomass – Part 1: Substrate- induced respiration method. (Talajminőség. A talaj mikrobiális biomasszájának meghatározása. 1. rész: Szubsztrátindukált respirációs módszer.) |
|
(13) |
ISO 14240-2 (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation-extraction method. (Talajminőség. A talaj mikrobiális biomasszájának meghatározása. 2. rész: Gőzextrakciós módszer.) |
|
(14) |
Malkomes, H.-P. (1986). Einfluß von Glukosemenge auf die Reaktion der Kurzzeit-Atmung im Boden Gegenüber Pflanzenschutzmitteln, Dargestellt am Beispiel eines Herbizide. (Influence of the Amount of Glucose Added to the Soil on the Effect of Pesticides in Short-Term Respiration, using a Herbicide as an Example). Nachrichtenbl. Deut. Pflanzenschutzd., Braunschweig, 38: 113-120. |
|
(15) |
Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113. |
|
(16) |
Finney, D.J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York. |
|
(17) |
Finney D.J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK. |
C.23. AEROB ÉS ANAEROB ÁTALAKÍTÁS A TALAJBAN
1. MÓDSZER
Ez a vizsgálati módszer az OECD TG 307 (2002) módszer megfelelője.
1.1. BEVEZETÉS
Ez a vizsgálati módszer meglévő iránymutatásokon alapul (1) (2) (3) (4) (5) (6) (7) (8) (9). Az ennél a vizsgálati módszernél ismertetett módszer célja a vegyi anyagok talajban zajló aerob és anaerob átalakításának értékelése. A kísérletek során meghatározható i. a vizsgálandó anyag átalakulási sebessége; valamint ii. azon átalakulási termékek jellege, illetve keletkezésének és eltűnésének sebessége, amelyekkel a növények és talajlakó szervezetek kapcsolatba kerülhetnek. Az ilyen vizsgálatokra olyan vegyi anyagok esetében van szükség, amelyeket közvetlenül a talajokra hordanak ki, vagy amelyek valószínűleg bekerülnek a talaj környezetbe. Az ilyen laboratóriumi vizsgálatok eredményei a kapcsolódó szántóföldi vizsgálatok mintavételi és elemzési protokolljainak kidolgozásához is felhasználhatók.
Az egy talajtípussal végzett aerob és anaerob vizsgálatok általában elegendőek az átalakítási útvonalak értékeléséhez (8) (10) (11). Az átalakulási sebességeket legalább három további talajban meg kell határozni (8) (10).
Az 1995-ben az olaszországi Belgirateban megrendezett, a talajok/üledékek kiválasztásával kapcsolatos OECD-munkaértekezleten (10) megegyezés született az e vizsgálatban alkalmazandó talajok számáról és típusáról. A vizsgált talajtípusoknak reprezentatívnak kell lenniük azon környezeti feltételek vonatkozásában, ahol a használat vagy kibocsátás történik. Azokat a vegyi anyagokat például, amelyek kibocsátása a szubtrópusi-trópusi éghajlaton történhet, Ferrasol vagy Nitosol (FAO-rendszer) talajokkal kell vizsgálni. A munkaértekezleten az ISO-útmutató (15) alapján ajánlásokat fogalmaztak meg a talajminták gyűjtésével, kezelésével és tárolásával kapcsolatosan is. Ennél a módszernél esik szó a rizstalajok alkalmazásáról is.
1.2. FOGALOMMEGHATÁROZÁSOK
„Vizsgálandó anyag”: bármely anyag, legyen az a kiindulási vegyület, vagy megfelelő átalakulási termék.
„Átalakulási termékek”: minden olyan anyag, amely a vizsgálandó anyag biotikus vagy abiotikus átalakulási reakciói nyomán keletkezik, beleértve a CO2-t, illetve a megkötött maradványokban lévő összes termék.
„Megkötött maradványok”: A „megkötött maradványok” a talajban, növényekben vagy állatokban jelen lévő olyan vegyületek, amelyek a kiindulási vegyület vagy annak anyagcsereterméke(i)/átalakulási termékei formájában extrahálás után is a mátrixban maradnak. Az extrakciós módszer alapjában véve nem változtathatja meg magukat a vegyületeket vagy a mátrix szerkezetét. A kötés jellege részben mátrixmódosító extrakciós módszerek, valamint kifinomult analitikai technikák segítségével tisztázható. Ez idáig kovalens, ionos és szorpciós kötéseket, valamint bezáródásokat azonosítottak ilyen módon. A megkötött maradványok létrejötte általánosságban szignifikánsan csökkenti a biológiai elérhetőséget és biológiai hozzáférhetőséget (12) (az IUPAC 1984-ben módosította (13)).
„Aerob átalakulás”: molekuláris oxigén jelenlétében végbemenő reakciók (14).
„Anaerob átalakulás”: molekuláris oxigén kizárásával végbemenő reakciók (14).
„Talaj”: ásványi és szerves kémiai komponensek keveréke, amelyek közül az utóbbiak magas szén- és nitrogéntartalmú, valamint nagy molekulasúlyú vegyületek, amelyeket apró élő szervezetek (főleg mikroorganizmusok) népesítenek be. A talajok kétféle állapotban kezelhetők:
|
a) |
érintetlen talajok, különféle talajtípusok jellegzetes rétegződésével, ahogy azok a múltban kialakultak; |
|
b) |
megbolygatott talajok, például ahogy általában szántóföldeken találhatók, vagy amikor ásással mintákat vesznek belőlük és e vizsgálati módszer céljára azokat felhasználják (14). |
„Mineralizáció”: a szerves vegyületek teljes mértékű lebomlása aerob körülmények között CO2-vé és H20-vá, illetve anaerob körülmények között CH4-gyé, CO2-vé és H20-vá. E vizsgálati módszer vonatkozásában a 14C-jelölt vegyületek alkalmazásakor a mineralizáció kiterjedt lebomlást jelent, amelynek során egy jelölt szénatom oxidálódik, és megfelelő mennyiségű 14CO2 szabadul fel (14).
„Felezési idő”: t0,5, a vizsgálandó anyag 50 %-ának átalakulásához szükséges idő, ha az átalakulás elsőrendű kinetikával leírható; a felezési idő független a koncentrációtól.
„DT 50 (lebomlási idő 50)”: az az időtartam, amely alatt a vizsgálandó anyag koncentrációja 50 %-kal csökken; akkor nem azonos a felezési idővel (t0,5), ha az átalakulás nem elsőrendű kinetikát követ.
„DT 75 (lebomlási idő 75)”: az az időtartam, amely alatt a vizsgálandó anyag koncentrációja 75 %-kal csökken.
„DT 90 (lebomlási idő 90)”: az az időtartam, amely alatt a vizsgálandó anyag koncentrációja 90 %-kal csökken.
1.3. REFERENCIAANYAGOK
Az átalakulási termékek spektroszkópiás és kromatográfiás módszerekkel történő jellemzéséhez és/vagy azonosításához referenciaanyagokat kell alkalmazni.
1.4. A VIZSGÁLAT ALKALMAZHATÓSÁGA
A módszer minden vegyi anyaghoz alkalmazható (legyen az nem jelölt vagy jelölt anyag), amelyhez létezik kielégítően pontos és érzékeny analitikai módszer. Enyhén illékony, nem illékony, vízben oldható és vízben nem oldható vegyületekhez is alkalmazható. A vizsgálat nem alkalmazható olyan vegyi anyagokra, amelyek a talajban nagymértékben illékonyak (például gáz alakú növényvédő szerek, szerves oldószerek), és ezért nem lehet őket a vizsgálat kísérleti körülményei között a talajban tartani.
1.5. A VIZSGÁLANDÓ ANYAGGAL KAPCSOLATOS INFORMÁCIÓK
Az átalakulás sebességének mérésére nem jelölt vagy jelölt vizsgálandó anyag is alkalmazható. Jelölt anyagra olyankor van szükség, ha az átalakulás útvonalait kívánjuk tanulmányozni vagy anyagmérleget kívánunk felállítani. A 14C-jelölés az ajánlott, de más izotópok, így például C, N, H vagy P is alkalmazható. Amennyire csak lehetséges, a jelölést a molekula legstabilabb részén vagy részein kell elhelyezni (40). A vizsgálandó anyagnak legalább 95 %-os tisztaságúnak kell lennie.
A talajban zajló aerob és anaerob átalakulás vizsgálatának elvégzése előtt a vizsgálandó anyaggal kapcsolatban az alábbi információkkal kell rendelkezni:
|
a) |
oldhatóság vízben (A6. módszer); |
|
b) |
oldhatóság szerves oldószerekben; |
|
c) |
gőznyomás (A4. módszer) és Henry-törvény állandó; |
|
d) |
n-oktanol/víz megoszlási hányados (A8. módszer); |
|
e) |
kémiai stabilitás sötétben (hidrolízis) (C7. módszer); |
|
f) |
pKa, ha valamelyik molekula hajlamos a protonálódásra vagy deprotonálódásra (112. számú OECD-iránymutatás) (16). |
További hasznos információk lehetnek a vizsgálandó anyagnak a talaj lakó mikroorganizmusokra gyakorolt toxicitásával kapcsolatos adatok (C.21. és C.22. vizsgálati módszer) (16).
A vizsgálandó anyagok és átalakulási termékeik mennyiségi és minőségi meghatározására szolgáló analitikai módszereknek (köztük az extrakciós és gázlekötő módszereknek) rendelkezésre kell állniuk.
1.6. A VIZSGÁLATI MÓDSZER ELVE
Talajmintákat a vizsgálandó anyaggal kell kezelni, és ellenőrzött laboratóriumi körülmények között (állandó hőmérséklet és talajnedvesség) sötétben, biométer-típusú lombikban vagy átfolyásos rendszerekben inkubálni kell őket. Megfelelő időközönként talajmintákat kell venni, amelyekben extrahálás után meg kell határozni a vizsgálandó anyagot, illetve az átalakulási termékeket. Megfelelő adszorpciós eszközök segítségével illékony termékek is gyűjthetők elemzés céljára. 14C-jelölt anyagok alkalmazásával, a fejlődő 14CO2 befogása után megmérhetők a vizsgálandó anyag különféle mineralizációs sebességei, és megállapítható az anyagmérleg, ezen belül a lekötött maradványok képződése is.
1.7. MINŐSÉGI KÖVETELMÉNYEK
1.7.1. Visszanyerés
A vizsgálandó anyag hozzáadása után azonnal legalább két másolati talajmintát elemezve megkaphatók az analitikai módszer ismételhetőségével és a vizsgálandó anyag alkalmazására szolgáló eljárás egységességével kapcsolatos első információk. A kísérletek későbbi szakaszában a visszanyeréseket a vonatkozó anyagmérlegek adják. A visszanyeréseknek jelölt vegyületek esetében 90 % és 110 % között (8), nem jelölt vegyületek esetében pedig 70 % és 110 % között (3) kell mozogniuk.
1.7.2. Az analitikai módszer megismételhetősége és érzékenysége
A vizsgálandó anyag és átalakulási termékei mennyiségi meghatározása vonatkozásában (a kiindulási extrakciós hatékonyság kivételével) az analitikai módszer megismételhetősége az átalakulási termékek megjelenéséhez elegendő ideig történő inkubálás után ugyanannak a talaj kivonatnak két másolati mintában történő mérésével ellenőrizhető.
Az adott vizsgálandó anyagra és átalakulási termékeire az analitikai módszer kimutathatósági határértékének (LOD) legalább 0,01 mg.kg-1 talaj (mint vizsgálandó anyag), vagy – ha az a kisebb – az alkalmazott dózis 1 %-ának kell lennie. Meg kell határozni továbbá a mennyiségi meghatározás határértékét (LOQ) is.
1.7.3. Az átalakulási adatok pontossága
Ha a vizsgálandó anyag koncentrációját az idő függvényében regressziós analízisnek vetik alá, akkor megfelelő információk nyerhetők az átalakulási görbe megbízhatóságáról, és lehetővé válik a konfidenciahatárok kiszámítása a felezési időkhöz (pszeudo-elsőrendű kinetika esetén) vagy a DT50-értékekhez, illetve adott esetben a DT75- és DT90-értékekhez is.
1.8. A VIZSGÁLATI MÓDSZER LEÍRÁSA
1.8.1. Berendezés és reagensek
Az inkubálórendszerek statikus, zárt rendszerekből vagy megfelelő átfolyásos rendszerekből állnak (7) (17). Megfelelő átfolyásos talajinkubáló berendezésekre és biométer-típusú lombikokra az 1., illetve 2. ábrán láthatók példák. Mindkét inkubálórendszernek megvannak az előnyei és korlátai (7) (17).
Szabványos laboratóriumi eszközökre van szükség, különösen a következőkre:
|
— |
analitikai műszerek, például GLC-, HPLC-, TLCLC-berendezés, ezen belül a radioaktívan jelölt vagy nem jelölt anyagok analízisére vagy a fordított izotóphígítási módszerhez alkalmazható megfelelő detektáló rendszerek, |
|
— |
minőségi meghatározásra alkalmazható műszerek (például MS, GC-MS, HPLC-MS, NMR stb.), |
|
— |
folyadékszcintillációs számláló, |
|
— |
oxidálószer a radioaktív anyagok elégetéséhez, |
|
— |
centrifuga, |
|
— |
extrakciós készülék (például centrifugacsövek hideg extraháláshoz és Soxhlet-készülék reflux alatt végzett folytonos extraháláshoz), |
|
— |
oldatok és kivonatok töményítésére szolgáló berendezések (pl. rotációs evaporátor), |
|
— |
vízfürdő, |
|
— |
mechanikai keverőeszközök (pl. dagasztógép, rotációs keverő). |
Az alkalmazott kémiai reagensek például az alábbiak:
|
— |
NaOH, analitikai minőségű, 2 mol dm-3, vagy más megfelelő bázis (pl. KOH, etanolamin), |
|
— |
H2SO4, analitikai minőségű, 0,05 mol. dm-3, |
|
— |
etilén-glikol, analitikai minőségű, |
|
— |
szilárd adszorpciós anyagok, például nátronmész, és poliuretán dugók, |
|
— |
szerves oldószerek, analitikai minőségű, például aceton, metanol stb., |
|
— |
szcintillációs folyadék. |
1.8.2. A vizsgálandó anyag alkalmazása
A vizsgálandó anyag talajhoz adásához és abban történő eloszlatásához azt először fel kell oldani (ioncserélt vagy desztillált) vízben vagy ha szükséges, minimális mennyiségű acetonban vagy más szerves oldószerben (6), amelyben a vizsgálandó anyag kellően oldható és stabil. A kiválasztott oldószer mennyisége azonban nem gyakorolhat szignifikáns hatásokat a talaj mikrobiális aktivitására (lásd az 1.5. és az 1.9.2–1.9.3. szakaszt). Kerülni kell az olyan oldószerek, például a kloroform, a diklór-metán és egyéb halogénezett oldószerek alkalmazását, amelyek gátolják a mikrobiális aktivitást.
A vizsgálandó anyag szilárd formában, például kvarchomokkal keverve (6) vagy elég száraz és sterilezett, kis térfogatú teszttalajrészmintában is a talajhoz adható. Ha a vizsgálandó anyagot oldószer alkalmazásával adjuk a talajhoz, az oldószernek el kell párolognia a vizsgálandó anyaggal kezelt részminta eredeti, nem steril talajmintához történő hozzáadása előtt.
Általános vegyi anyagok esetében, amelyeknél a talajba való bejutás fő útvonala a szennyvíziszap vagy a mezőgazdasági tevékenységek, a vizsgálandó anyagot először iszaphoz kell keverni, és ebben a formában kell a talajmintába juttatni (lásd az 1.9.2. és az 1.9.3. szakaszt).
A formulázott termékek alkalmazása általában nem ajánlott. A rosszul oldódó vizsgálandó anyagok esetében azonban megfelelő alternatíva lehet a formulázott anyag alkalmazása.
1.8.3. Talajok
1.8.3.1. A talaj kiválasztása
Az átalakulási útvonal meghatározásához reprezentatív talajok alkalmazhatók, így például ajánlott az olyan homokos vályog vagy iszapos vályog vagy vályog, vagy a vályogos homok (a FAO és az USDA osztályozása szerint (18)), amelynek pH-ja 5,5 és 8,0 közötti, szervesszén-tartalma 0,5–2,5 %, mikrobiális biomasszája pedig legalább a teljes szervesszéntartalom 1 %-ának megfelelő (10).
Az átalakulási sebesség vizsgálatokhoz legalább három további olyan talajt kell alkalmazni, amelyek jól reprezentálnak egy sor megfelelő talajtípust. A különféle talajokban eltérőnek kell lenniük a szervesszén-tartalom, a pH, az agyagtartalom és a mikrobiális biomassza értékeinek.
A talajokat legalább a szerkezet ( %homok, %iszap, %agyag) (a FAO és az USDA osztályozása szerint (18)), a pH, a kationcserélő kapacitás, a szerves szén, a térfogatsűrűség, a vízvisszatartási jellemzők (41) 1 és mikrobiális biomassza (csak az aerob vizsgálatokhoz) szempontjából jellemezni kell. Az eredmények értelmezéséhez hasznosak lehetnek a talajok tulajdonságaival kapcsolatos további információk is. A talajok jellemzőinek meghatározására a (19), (20), (21), (22) és (23) hivatkozásban ajánlott módszerek alkalmazhatók. A mikrobiális biomasszát a szubsztrátindukált légzési (SIR) módszerrel (25) (26) vagy alternatív módszerekkel (20) kell meghatározni.
1.8.3.2. A talajok gyűjtése, kezelése és tárolása
Részletes információkkal kell rendelkezni annak a szántóföldi területnek a történetéről, ahonnan a vizsgálati talajminta begyűjtése történik. Ilyen részletek például a pontos hely, a növénytakaró, a növényvédő szerekkel végzett kezelések, a szerves és szervetlen trágyákkal végzett kezelések, a biológiai anyagok hozzáadása vagy egyéb szennyezések. Nem alkalmazhatók átalakulási vizsgálatokhoz olyan talajok, amelyeket az elmúlt négy évben a vizsgálandó anyaggal vagy szerkezeti analógjaival kezeltek (10) (15).
A talajt frissen kell begyűjteni a területről (az A-rétegből vagy a felső 20 cm-es rétegből) a benne lévő talajnedvességgel együtt, amely megkönnyíti a szitálást. A rizsföldekről származó talajok kivételével kerülni kell a mintavételt a hosszabb (> 30 napos) szárazságok, fagyok vagy áradások idején vagy közvetlenül ezek után (14). A mintákat úgy kell szállítani, hogy közben minimális legyen a talaj víztartalmának változása, és – lehetőség szerint – sötétben kell tartani, illetve biztosítani kell a szabad levegőbeáramlást. Erre a célra általában megfelel egy lazán összekötött polietilén zsák.
A talajt a mintavételt követően a lehető leggyorsabban fel kell dolgozni. El kell távolítani belőle a növényi részeket, a nagyobb méretű talajfaunát és a köveket, majd 2 mm-es szitán át kell szitálni, ami eltávolítja a kisebb köveket, az állati és növényi törmeléket is. A szitálás előtt meg kell akadályozni a talaj erőteljes kiszáradását és összepréselődését (15).
Ha a téli időszakban (a talaj fagyottsága vagy a hótakaró miatt) nehézkessé válik a mintavétel, akkor üvegházban, növénytakaró (pl. fű vagy fű/lóhere keverék) alatt tárolt készletekből is vehető talajminta. A frissen gyűjtött talajokon végzett vizsgálatok a legelőnyösebbek, de ha a begyűjtött és feldolgozott talajt a vizsgálatok megkezdése előtt tárolni kell, akkor a mikrobiális aktivitás megőrzése érdekében ez csak megfelelő körülmények között és csak korlátozott ideig (4 ± 2 oC-on legfeljebb három hónapig) megengedett (42). A biológiai átalakulási kísérletekhez alkalmazott talajok begyűjtésével, kezelésével és tárolásával kapcsolatos részletes instrukciók a (8), (10), (15), (26) és (27) hivatkozásban találhatók.
Mielőtt a feldolgozott talaj felhasználásra kerülne ehhez a vizsgálathoz, a mintákat elő kell inkubálni a csírázás lehetővé tétele és a magok eltávolítása, valamint a mikrobiális anyagcsere-egyensúlynak a mintavételi vagy tárolási körülményekről az inkubációs körülményekre való átállást követően történő helyreállítása érdekében. Általában megfelelő, ha az előinkubálást 2–28 napig végezzük olyan hőmérsékleten és olyan nedvesség mellett, amely nagyjából megközelíti a vizsgálati körülményekre jellemző viszonyokat (15). A tárolás és előinkubálás együttes időtartama nem haladhatja meg a három hónapot.
1.9. A VIZSGÁLAT VÉGREHAJTÁSA
1.9.1. Vizsgálati körülmények
1.9.1.1. Vizsgálati hőmérséklet
A talajokat a vizsgálat teljes időtartama alatt sötétben és olyan állandó hőmérsékleten kell inkubálni, amely reprezentatív a használat vagy kibocsátás területén uralkodó éghajlati viszonyokra. Az ajánlott hőmérséklet minden olyan vizsgálandó anyag esetében 20 ± 2 oC, amelyek mérsékelt éghajlaton bejuthatnak a talajba. A hőmérsékletet nyomon kell követni.
A hidegebb éghajlatokon (pl. az északi országokban vagy az őszi-téli időszakban) alkalmazott vagy kibocsátott anyagok esetében további talajmintákat is inkubálni kell, de alacsonyabb hőmérsékleten (pl. 10 ± 2 oC).
1.9.1.2. Nedvességtartalom
Az aerob körülmények között végzett átalakulási vizsgálatok esetében a talaj nedvességtartalmát (43) úgy kell beállítani, hogy a pF-értéket 2,0 és 2,5 között tartsuk (3). A talaj nedvességtartalmát víztömeg/száraz talaj tömeg egységben kell kifejezni, és rendszeresen ellenőrizni kell (például kéthetente) inkubációs lombik tömegének megmérésével, és a vízveszteség víz (lehetőleg sterilszűrt csapvíz) hozzáadásával történő kompenzálásával. Figyelni kell arra, hogy a víz hozzáadásakor megakadályozzuk vagy minimálisra csökkentsük a vizsgálandó anyag és/vagy az átalakulási termékek párolgási és/vagy esetleges fotodegradációs veszteségeit.
Az anaerob vagy rizsföldi körülmények között végzett átalakulási vizsgálatoknál a talajt elárasztással kell víztelítetté tenni.
1.9.1.3. Aerob inkubációs körülmények
Az átfolyásos rendszerekben az aerob körülményeket a rendszer időről időre vízzel történő átöblítésével vagy nedves levegő folyamatos átfúvásával kell fenntartani. A biométer lombikokban a légcserét diffúzió segítségével kell fenntartani.
1.9.1.4. Steril aerob körülmények
A vizsgálandó anyag abiotikus átalakulásának jelentőségével kapcsolatban úgy nyerhetők információk, hogy a mintákat sterilezzük (a sterilezési módszereket lásd a (16) és (29) hivatkozásban), hozzáadjuk a steril vizsgálandó anyagot (például az oldat sterilszűrőn keresztül történő hozzáadásával) és nedves levegővel átszellőztetjük, az 1.9.1.3. szakaszban leírtak szerint. A rizstalajok esetében a talajt és a vizet sterilizálni kell, az inkubálást pedig az 1.9.1.6. szakaszban leírtak szerint kell végezni.
1.9.1.5. Anaerob inkubációs körülmények
Anaerob körülmények kialakításához és fenntartásához a vizsgálandó anyaggal kezelt és 30 napig vagy egy felezési időig vagy egy DT50-ig (amelyik a három közül a legrövidebb) aerob körülmények között inkubált talajt vízzel kell elárasztani (1–3 cm-es vízréteg), az inkubációs rendszert pedig inert gázzal (például nitrogénnel vagy argonnal) kell átöblíteni (44). A vizsgálati rendszernek lehetővé kell tennie a különféle méréseket, így például a pH, az oxigénkoncentráció és a redoxpotenciál meghatározását, továbbá csapdákat is tartalmaznia kell az illékony termékek befogására. A biométer-típusú rendszert le kell zárni a levegő diffúzióval történő bejutásának megakadályozása érdekében.
1.9.1.6. Rizstalajok inkubációs körülményei
A rizstalajokban végbemenő átalakulások tanulmányozására a talajt körülbelül 1–5 cm vízréteggel kell elárasztani, majd a vizsgálandó anyagot a vízfázisba kell juttatni (9). Javasolt legalább 5 cm mélységű talajréteg alkalmazása. A rendszer levegővel átszellőztetett, ugyanúgy, mint az aerob feltételek esetén. Nyomon kell követni, és rögzíteni kell a vizes réteg pH-ját, oxigénkoncentrációját és redoxpotenciálját. Az átalakulási vizsgálatok megkezdése előtt legalább kéthetes előinkubálási időszakra van szükség (lásd az 1.8.3.2. szakaszt).
1.9.1.7. A vizsgálat időtartama
A sebesség- és útvonalvizsgálatok időtartama általában nem haladhatja meg a 120 napot (45) (3) (6) (8), mivel azt követően egy, a természetes utánpótlástól izolált mesterséges laboratóriumi rendszerben idővel a talaj mikrobiális aktivitásának csökkenése lenne várható. Ahol az a vizsgálandó anyag csökkenésének, valamint a fő átalakulási termékek képződésének és csökkenésének jellemzéséhez szükséges, a vizsgálatok meghosszabbíthatók (például 6 vagy 12 hónapra) (8). A hosszabb inkubációs időtartamokat a vizsgálati jelentésben meg kell indokolni, és csatolni kell az ilyen hosszabb időtartamok során és végén elvégzett biomasszamérések eredményeit is.
1.9.2. A vizsgálat végrehajtása
Minden inkubációs lombikba (lásd a 3. függelék 1. és 2. ábráját) körülbelül 50–200 g talajt (szárazsúlyra vetítve) kell behelyezni, majd azt az 1.8.2 szakaszban leírt módszerek egyikének alkalmazásával a vizsgálandó anyaggal kell kezelni. Ha a vizsgálandó anyag alkalmazásához szerves oldószert használunk, azt párologtatással el kell távolítani a talajból. A talajt ezután spatulával és/vagy a lombik rázogatásával alaposan össze kell keverni. Ha a vizsgálatot rizsföldi körülmények között végezzük, a talajt és a vizet a vizsgálandó anyag alkalmazása után alaposan össze kell keverni. A kezelt talajok kis részleteiben (pl. 1-1 g-jában) meg kell határozni a vizsgálandó anyag mennyiségét az egyenletes eloszlás ellenőrzése érdekében. Az ezt kiváltó alternatív módszert lásd lent.
A kezelési aránynak meg kell felelnie az adott növényvédő szer legmagasabb, a használati utasításban javasolt alkalmazási arányának, és a terepen megfelelő talaj mélységig (például a talaj felső 10 cm-es rétege (46) egységes beépülést kell biztosítania. A talajba való beépülés nélkül csak a levélzetre vagy a talajra alkalmazott vegyületek esetében például 2,5 cm a megfelelő mélység annak kiszámításához, hogy mennyi vegyületet kell az egyes lombikokba bejuttatni. A talajba beépülő vegyületek esetében a megfelelő mélység a használati utasításban megadott beépülési mélység. Általános vegyi anyagok esetében az alkalmazási arányt az alapján kell megbecsülni, hogy melyik a legjellemzőbb bejutási útvonal; ha a talajba jutás fő útvonala például a szennyvíziszap, a vegyületet olyan koncentrációban kell az iszapba bejuttatni, amely tükrözi az iszapban várható koncentrációt, és a talajhoz adandó iszap mennyiségének tükröznie kell a mezőgazdasági talajok normál iszapterhelését. Ha ez a koncentráció nem elég magas a fő átalakulási termékek azonosításához, hasznos lehet külön talajminták nagyobb koncentrációkkal történő inkubálása, de kerülni kell a talaj mikrobiális funkcióját befolyásoló túlzott mennyiségeket (lásd az 1.5 és az 1.8.2. szakaszt).
Vagy nagyobb mennyiségű (1-2 kg) talaj is kezelhető a vizsgálandó anyaggal, megfelelő keverő berendezésben alaposan elkeverve és végül kis, 50–200 g-os részletekben az inkubációs lombikba téve (például mintaosztók segítségével). A kezelt talaj kis (például 1 g-os) részleteiben meg kell határozni a vizsgálandó anyag mennyiségét, így ellenőrizve annak egyenletes talajbeli eloszlását. Az ilyen eljárás azért előnyös, mert lehetővé teszi a vizsgálandó anyag még egyenletesebb eloszlását a talajban.
A nem kezelt talajmintákat is ugyanolyan (aerob) körülmények között kell inkubálni, mint a vizsgálandó anyaggal kezelt mintákat. Ezeket a mintákat a biomasszának a vizsgálat során és végén történő meghatározására kell felhasználni.
Ha a vizsgálandó anyagot szerves oldószer(ek)ben történő feloldás után visszük fel a talajra, az azonos mennyiségű oldószerrel vagy oldószerekkel kezelt talajmintákat ugyanolyan (aerob) körülmények között kell inkubálni, mint a vizsgálandó anyaggal kezelt mintákat. Ezeket a mintákat a vizsgálatok elején, alatt és végén végzett biomasszamérésekhez kell felhasználni, amelyekkel az oldószer(ek)nek a mikrobás biomasszára gyakorolt esetleges hatásai mérhetők fel.
A kezelt talajokat tartalmazó lombikokat vagy az 1. ábrán bemutatott átfolyásos rendszerhez kell kapcsolni, vagy a 2. ábrán bemutatott adszorpciós oszloppal kell lezárni (lásd a 3. függeléket).
1.9.3. Mintavétel és mérés
Megfelelő időközönként párhuzamos inkubációs lombikokat kell eltávolítani, és a talajmintákat megfelelő, különböző polaritású oldószerekkel kell extrahálni, majd meg kell határozni bennük a vizsgálandó anyagot és/vagy az átalakulási termékeket. Egy jól megtervezett vizsgálatban elegendő számú lombikot használunk ahhoz, hogy minden egyes mintavételi időpontban két lombikból tudjuk mérést végezni. Az egyes talajminták inkubálása során és végén különböző időközönként (az első hónapban 7 naponta, majd utána 17 naponta) el kell távolítani az adszorpciós oldatot vagy szilárd adszorpciós anyagot, és meg kell bennük határozni az illékony termékeket. A közvetlenül az alkalmazás után vett talajmintán (0. napi minta) kívül legalább öt további mintavételi pontot kell beiktatni. Az időközöket úgy kell megválasztani, hogy meghatározható legyen a vizsgálandó anyag csökkenésének mintázata és az átalakulási termékek képződésének és csökkenésének mintázata (például 0., 1., 3., 7. nap; 2, 3 hét; 1, 2, 3 hónap stb.).
14C-jelölt vizsgálandó anyag alkalmazása esetén a nem extrahálható radioaktivitást égetéssel kell meghatározni, és minden egyes mintavételi intervallumra anyagmérleget kell számítani.
Az anaerob és a rizstalajos inkubálás esetén a talajban és a vizes fázisban együttesen kell meghatározni a vizsgálandó anyagot és az átalakítási termékeket, vagy az extrahálás és mérés előtt szűréssel vagy centrifugál ással kell szétválasztani őket.
1.9.4. Opcionális vizsgálatok
A hőmérsékletnek és a talajnedvességnek a vizsgálandó anyag és/vagy átalakítási termékei talajbeli átalakulására gyakorolt hatásának becsléséhez hasznos lehet, ha más hőmérsékleteken és talajnedvességek mellett is végzünk aerob, nem steril vizsgálatokat.
A nem extrahálható radioaktivitás további jellemzése megkísérelhető például szuperkritikus folyadékextrakcióval is.
2. ADATOK
2.1. AZ EREDMÉNYEK KEZELÉSE
A vizsgálandó anyag, az átalakulási termékek, az illékony anyagok (csak %-osan), és a nem extrahálható rész mennyiségét minden egyes mintavételi intervallumra az alkalmazott kiindulási koncentráció %-ában, illetve adott esetben mg.kg-1 talaj (szárazsúlyra vetítve) egységben kell megadni. Az alkalmazott kiindulási koncentráció százalékában anyagmérleget is fel kell állítani minden egyes mintavételi intervallumra. A vizsgálandó anyag koncentrációit az idő függvényében ábrázolva megbecsülhető a vizsgálandó anyag átalakulásának felezési ideje vagy DT50-értéke. Meg kell határozni a fő átalakulási termékeket, valamint ezek koncentrációját is fel kell venni az idő függvényében, hogy képződési és csökkenési sebességük megállapítható legyen. Fő átalakulási termék minden olyan termék, amely a vizsgálat során bármikor az alkalmazott dózis legalább 10 %-nak megfelelő mennyiségben van jelen.
A befogott illékony termékek is adhatnak némi információt a vizsgálandó anyag és annak átalakulási termékei talajból való elillanási hajlamáról.
A felezési idő vagy DT50-értékek, illetve adott esetben a DT75- és DT90-értékek pontosabb meghatározását megfelelő kinetikai modellszámítások alkalmazásával kell elvégezni. A felezési időt és a DT50-értékeket az alkalmazott modell leírásával, a kinetika rendűségével és a determinációs koefficienssel (r2) együtt kell a jelentésben feltüntetni. Az elsőrendű kinetikát kell előnyben részesíteni, kivéve, ha r2 < 0,7. Adott esetben a számításokat a fő átalakulási termékekre is alkalmazni kell. A megfelelő modellekre példák a (31)–(35) hivatkozásban találhatók.
A sebességvizsgálatok több különböző hőmérsékleten történő végzése esetén az átalakítási sebességeket kísérleti hőmérséklet tartományon belül a hőmérséklet függvényében kell leírni az alábbi Arrhenius-összefüggés alkalmazásával:
 vagy
vagy  ,
,
ahol In A és B az In k-nak az l/T függvényében való lineáris regressziójával előállított legjobb illesztésű egyenes tengelymetszetéből és meredekségből származó regressziós állandók; a k a T hőmérsékletnél kapott sebességi állandó; T pedig a hőmérséklet Kelvinben megadva. Ügyelni kell arra, hogy abban az esetben, ha az átalakítást a mikrobiális hatás szabályozza, akkor az Arrhenius-összefüggés csak egy igen korlátozott hőmérsékleti tartományban lesz érvényes.
2.2. ÉRTÉKELÉS ÉS AZ EREDMÉNYEK ÉRTELMEZÉSE
Bár a vizsgálatokat mesterséges laboratóriumi rendszerekben végezzük, az eredmények lehetővé teszik a vizsgálandó anyagok átalakulási sebességének, valamint az átalakulási termékek képződési és csökkenési sebességének szántóföldi körülmények közötti becslését (36) (37).
A vizsgálandó anyag átalakulási útvonalának vizsgálata információt szolgáltat arról, hogy az alkalmazott anyag szerkezete milyen változásokon megy keresztül a talajban a kémiai és mikrobiális reakciók hatására.
3. JELENTÉS
VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek a következőket kell tartalmaznia:
|
|
Vizsgálandó anyag:
|
|
|
Referenciaanyagok:
|
|
|
Vizsgált talajok:
|
|
|
Vizsgálati körülmények:
|
|
|
Eredmények:
|
4. SZAKIRODALOM
|
1. |
US- Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate. |
|
2. |
Agriculture Canada (1987). Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada. |
|
3. |
Európai Unió (EU) (1995). A Bizottság 1995. július 14-i 95/36/EK irányelve a növényvédő szerek forgalomba hozataláról szóló 91/414/EGK tanácsi irányelv módosításáról. AII. melléklet A. része és III. melléklet A. része: A növényvédő szerek sorsa és viselkedése a környezetben. |
|
4. |
Dutch Commission for Registration of Pesticides (1995). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air. |
|
5. |
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-1. Verbleib von Pflanzenschutzmitteln im Boden – Abbau, Umwandlung und Metabolismus. |
|
6. |
ISO/DIS 11266-1 (1994). Soil Quality -Guidance on laboratory tests for biodegradation of organic chemicals in soil – Part 1: Aerobic conditions. (Talajminőség. Útmutató a talajban levő szerves vegyi anyagok aerob feltételek melletti biológiai lebonthatóságának laboratóriumi vizsgálatára.) |
|
7. |
ISO 14239 (1997). Soil Quality – Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions. (Talajminőség. Laboratóriumi inkubációs rendszerek a talajban lévő szerves vegyi anyagok aerob feltételek mellett végbemenő mineralizációjának vizsgálatához) |
|
8. |
SET AC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed. |
|
9. |
MAFF – Japan 2000 – Draft Guidelines for transformation studies of pesticides in soil -Aerobic metabolism study in soil under paddy field conditions (flooded). |
|
10. |
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995. |
|
11. |
Guth, J. A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123-157. |
|
12. |
DFG: Pesticide Bound Residues in Soil. Wiley – VCH (1998). |
|
13. |
T.R. Roberts: Non-extractable pesticide residue in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984). |
|
14. |
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981). |
|
15. |
ISO 10381-6 (1993). Soil Quality – Sampling – Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory. (Talajminőség – Mintavétel – A mikrobiális folyamatok laboratóriumi értékelésére szolgáló talaj begyűjtésére, kezelésére és tárolására vonatkozó iránymutatás.) |
|
16. |
A 67/548/EGK irányelv V. melléklete. |
|
17. |
Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1,85-114. |
|
18. |
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962). |
|
19. |
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods. A. Klute, Ed.) Agronomy Series No 9, 2nd Edition. |
|
20. |
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties. AL. Page, R.H. Miller and D.R. Kelney, Eds. Agronomy Series No 9, 2nd Edition. |
|
21. |
ISO Standard Compendium Environment (1994). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition. |
|
22. |
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main. |
|
23. |
Scheffer, F., Schachtschabel, P. (1975). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart. |
|
24. |
Anderson, J.P.E., Domsch, K.H. (1978) A physiological method for the quantitative measurement of microbial biomass in soils. Soil Biol. Biochem. 10, 215-221. |
|
25. |
ISO 14240-1 and 2 (1997). Soil Quality – Determination of soil microbial biomass -Part 1: Substrate-induced respiration method. Part 2: fumigation-extraction method. (Talajminőség. A talaj mikrobiális biomasszájának meghatározása. 1. rész: Szubsztrátindukált respirációs módszer. 2. rész: Gőzextrakciós módszer.) |
|
26. |
Anderson, J.P.E. (1987). Handling and storage of soils for pesticide experiments. In Pesticide Effects on Soil Microflora. L. Somerville, M.P. Greaves, Eds. Taylor & Francis, 45-60. |
|
27. |
Kato, Yasuhiro. (1998). Mechanism of pesticide transformation in the environment: Aerobic and bio-transformation of pesticides in aqueous environment. Proceedings of the 16th Symposium on Environmental Science of Pesticide, 105-120. |
|
28. |
Keuken O., Anderson J.P.E. (1996). Influence of storage on biochemical processes in soil. In Pesticides, Soil Microbiology and Soil Quality, 59-63 (SETAC-Europe). |
|
29. |
Stenberg B., Johansson M., Pell M., Sjödahl-Svensson K., Stenström J., Torstensson L. (1996). Effect of freeze and cold storage of soil on microbial activities and biomass. In Pesticides, Soil Microbiology and Soil Quality, 68-69 (SETAC-Europe). |
|
30. |
Gennari, M., Negre, M., Ambrosoli, R. (1987). Effects of ethylene oxide on soil microbial content and some chemical characteristics. Plant and Soil 102, 197-200. |
|
31. |
Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141-146. |
|
32. |
Hamaker, J.W. (1976). The application of mathematical modelling to the soil persistence and accumulation of pesticides. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, 181-199. |
|
33. |
Goring, C.A.I., Laskowski, D.A., Hamaker, J.W., Meikle, R.W. (1975). Principles of pesticide degradation in soil. In „Environmental Dynamics of Pesticides”. R. Haque and V.H. Freed, Eds., 135-172. |
|
34. |
Timme, G., Frehse, H., Laska, V. (1986). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. II. Pflanzenschutz -Nachrichten Bayer 39, 188-204. |
|
35. |
Timme, G., Frehse, H. (1980). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. I. Pflanzenschutz – Nachrichten Bayer 33, 47-60. |
|
36. |
Gustafson DL, Holden L.R. (1990). Non-linear pesticide dissipation in soil; a new model based on spatial variability. Environm. Sci. Technol. 24, 1032-1041. |
|
37. |
Hurle K., Walker A. (1980). Persistence and its prediction. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 83-122. |
1. függelék
VÍZSZÍVÓ ERŐ, SZÁNTÓFÖLDI VÍZKAPACITÁS (FC) ÉS VÍZTARTÓ KÉPESSÉG (WHC) (47)
|
A vízoszlop magassága [cm] |
pF (48) |
bar (49) |
Megegyzések |
|
107 |
7 |
104 |
Száraz talaj |
|
1,6 · 104 |
4,2 |
16 |
Hervadáspont |
|
104 |
4 |
10 |
|
|
103 |
3 |
1 |
|
|
6· 102 |
2,8 |
0,6 |
|
|
3,3 · 102 |
2,5 |
0,33 (50) |
Szántóföldi vízkapacitás tartomány (51) |
|
102 |
2 |
0,1 |
|
|
60 |
1,8 |
0,06 |
|
|
33 |
1,5 |
0,033 |
|
|
10 |
1 |
0,01 |
WHC (közelítés) |
|
1 |
0 |
0,001 |
Vízzel telített talaj |
A vízszívó erőt vízoszlop-cm vagy bar mértékegységben mérjük. A szívóerő nagysága igen széles tartományban mozoghat, ezért egyszerűen csak pF-értékként adjuk meg, amely a vízoszlop-cm érték logaritmusa.
A szántóföldi vízkapacitás azt a vízmennyiséget jelenti, amelyet egy természetes talaj egy hosszabb esőzés vagy kellő mértékű öntözés után 2 nappal gravitáció ellenében tárolni tud. A szántóföldi vízkapacitást érintetlen talajban, in situ, a terepen határozzák meg. A mérés tehát nem alkalmazható megbolygatott, laboratóriumi talajmintákra. A megbolygatott mintákban meghatározott FC-értékek nagyobb szisztematikus varianciát mutathatnak.
A víztartó képességet (WHC) laboratóriumban határozzák meg érintetlen és megbolygatott talajokban úgy, hogy egy talajoszlopot kapilláris transzport útján vízzel telítenek. Különösen jól alkalmazható megbolygatott talajok esetében, és akár 30 %-kal is meghaladhatja a szántóföldi vízkapacitást (1). Emellett egyszerűbben meghatározható kísérletileg, mint a megbízható FC-értékek.
Megjegyzések
2. függelék
KÜLÖNBÖZŐ ORSZÁGOKBÓL SZÁRMAZÓ KÜLÖNBÖZŐ TALAJTÍPUSOK NEDVESSÉGTARTALMA (G VÍZ/100 G SZÁRAZ TALAJ)
|
|
|
Talajnedvesség |
||
|
Talajtípus |
Ország |
|||
|
|
|
WHC (52) |
pF = 1,8 |
pF = 2,5 |
|
Homok |
Németország |
28,7 |
8,8 |
3,9 |
|
Vályogos homok |
Németország |
50,4 |
17,9 |
12,1 |
|
Vályogos homok |
Svájc |
44,0 |
35,3 |
9,2 |
|
Iszapos vályog |
Svájc |
72,8 |
56,6 |
28,4 |
|
Agyoagos vályog |
Brazília |
69,7 |
38,4 |
27,3 |
|
Agyoagos vályog |
Japán |
74,4 |
57,8 |
31,4 |
|
Homokos vályog |
Japán |
82,4 |
59,2 |
36,0 |
|
Iszapos vályog |
USA |
47,2 |
33,2 |
18,8 |
|
Homokos vályog |
USA |
40,4 |
25,2 |
13,3 |
3. függelék
1. ábra
Példa vegyi anyagok talajbeli átalakulásának vizsgálatára szolgáló át folyásos készülékre (53) (54)

2. ábra
Példa vegyi anyagok talajbeli átalakulásának vizsgálatára szolgáló biométer-típusú lombikra (55)
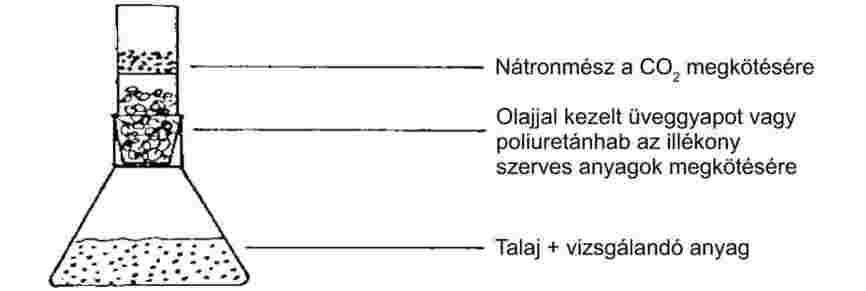
C.24. AEROB ÉS ANAEROB ÁTALAKÍTÁS VÍZI ÜLEDÉKRENDSZEREKBEN
1. MÓDSZER
Ez a vizsgálati módszer az OECD TG 308 (2002) módszer megfelelője.
1.1. BEVEZETÉS
A sekély és mély felszíni vizekbe a vegyi anyagok például a következő útvonalakon keresztül juthatnak be: közvetlen alkalmazás, permetszéthordás, felszíni elfolyás, belvízelvezetés, hulladéklerakás, ipari, háztartási vagy mezőgazdasági szennyvizek és légköri kiülepedés. Ez a vizsgálati módszer egy olyan laboratóriumi módszert ismertet, amellyel szerves anyagok aerob és anaerob átalakulását vizsgálhatjuk vízi üledékrendszerekben. Ez a módszer meglévő irányelveken alapul (1) (2) (3) (4) (5) (6). Az 1995-ben az olaszországi Belgirateban megrendezett, a talajok/üledékek kiválasztásával kapcsolatos OECD-munkaértekezleten (7) megegyezés született az e vizsgálatban alkalmazandó üledékek számáról és típusáról. A munkaértekezlet egy ISO Útmutató (8) alapján ajánlásokat fogalmazott meg az üledékminták gyűjtéséről, kezeléséről és tárolásáról is. Az ilyen vizsgálatokra olyan vegyi anyagok esetében van szükség, amelyek közvetlenül a vizekbe kerülnek, vagy amelyek a fenti útvonalakon át valószínűleg bekerülnek a vízi környezetbe.
A természetes vízi üledékrendszerekben a felső vízfázis gyakran aerob. Az üledék felszíni rétege lehet aerob vagy anaerob is, a mélyebb üledék viszont általában anaerob. Ez a dokumentum aerob és anaerob vizsgálatokat is ismertet annak érdekében, hogy a fenti lehetőségek mindegyikét felölelje. Az aerob vizsgálat egy aerob üledékréteg felett elhelyezkedő aerob vízoszlopot szimulál, ahol az aerob üledékréteget alulról egy anaerob gradiens határolja. Az anaerob vizsgálat egy teljesen anaerob víz-üledék rendszert szimulál. Ha a körülmények arra utalnak, hogy jelentős mértékben el kell térni az itt megfogalmazott ajánlásoktól, például amiatt, hogy ép üledékmagokat vagy olyan üledékeket használunk, amelyek esetleg érintkezésbe léphettek a vizsgálandó anyaggal, akkor a célra más módszerek is rendelkezésre állnak (9).
1.2. FOGALOMMEGHATÁROZÁSOK
Minden esetben SI (Standard International) egységeket kell használni.
„Vizsgálandó anyag”: bármely anyag, legyen az a kiindulási vegyület, vagy megfelelő átalakulási termék.
„Átalakulási termékek”: minden olyan anyag, amely a vizsgálandó anyag biotikus és abiotikus átalakulási reakcióiban keletkezik, ideértve a CO2-t és minden kötött maradványt is.
„Kötött maradványok”: a „kötött maradványok” a talajban, növényekben vagy állatokban jelen lévő olyan vegyületek, amelyek a kiindulási anyag vagy anyagcsereterméke(i) formájában extrakció után is a mátrixban maradnak. Az extrakciós módszer alapjában véve nem változtathatja meg magukat a vegyületeket vagy a mátrix szerkezetét. A kötés jellege részben mátrixmódosító extrakciós módszerek, illetve kifinomult analitikai technikák segítségével tisztázható. Ez idáig kovalens, ionos és szorpciós kötéseket, valamint zárványokat azonosítottak ilyen módon. A kötött maradványok létrejötte általában szignifikánsan csökkenti a biológiai elérhetőséget és biológiai hozzáférhetőséget (10) [az IUPAC 1984-ben módosította (11)].
„Aerob átalakulás”: (oxidáló): molekuláris oxigén jelenlétében végbemenő reakciók (12).
„Anaerob átalakulás”: (redukáló): molekuláris oxigén kizárásával végbemenő reakciók (12).
„Természetes vizek”: tavakból, folyókból, patakokból stb. származó felszíni vizek.
„Üledék”: ásványi és szerves kémiai komponensek keveréke, amelyek közül az utóbbiak magas szén- és nitrogéntartalmú és nagy molekulasúlyú vegyületek. A természetes vizekből ülepednek ki és azzal határfelületet képeznek.
„Mineralizáció”: a szerves vegyületek teljes mértékű lebomlása aerob körülmények között CO2-dá és H2O-zé, illetve anaerob körülmények között CH4-ná, CO2-dá és H2O-zé. E vizsgálati módszer vonatkozásában radioaktívan jelölt vegyületek alkalmazásakor a mineralizáció egy molekula nagyfokú lebomlását jelenti, amelynek során egy jelölt szénatom kvantitatívan oxidálódik vagy redukálódik, és az ennek megfelelő mennyiségű 14CO2, illetve 14CH4 szabadul fel.
„Felezési idő”: t0,5, a vizsgálandó anyag 50 %-ának átalakulásához szükséges idő, ha az átalakulás elsőrendű kinetikával írható le; a felezési idő független a kiindulási koncentrációtól.
„DT 50 (lebomlási idő 50)”: az az időtartam, amely alatt a vizsgálandó anyag kiindulási koncentrációja 50 %-kal csökken.
„DT 75 (lebomlási idő 75)”: az az időtartam, amely alatt a vizsgálandó anyag kiindulási koncentrációja 75 %-kal csökken.
„DT 90 (lebomlási idő 90)”: az az időtartam, amely alatt a vizsgálandó anyag kiindulási koncentrációja 90 %-kal csökken.
1.3. REFERENCIAANYAGOK
Az átalakulási termékek spektroszkópiás és kromatográfiás módszerekkel történő azonosításához és/vagy mennyiségi méréséhez referenciaanyagokat kell alkalmazni.
1.4. A VIZSGÁLANDÓ ANYAGGAL KAPCSOLATOS INFORMÁCIÓK
Az átalakulás sebességének mérésére nem jelölt vagy izotóppal jelölt vizsgálandó anyagot is alkalmazhatunk, bár előnyben kell részesíteni a jelölt anyagokat. Jelölt anyagra olyankor van szükség, ha az átalakulási útvonalakat kívánjuk tanulmányozni vagy anyagmérleget akarunk felvenni. A 14C jelölés az ajánlott, de más izotópok, így például 13C, 15N, 3H vagy 32P is alkalmazható. A jelölést lehetőleg a molekula legstabilabb részén vagy részein kell elhelyezni (56). A vizsgálandó anyag kémiai és/vagy radiokémiai tisztaságának legalább 95 %-nak kell lennie.
A vizsgálat elvégzése előtt az alábbi információkkal kell rendelkezni a vizsgálandó anyagról:
|
a) |
oldhatóság vízben (A.6. módszer); |
|
b) |
oldhatóság szerves oldószerekben; |
|
c) |
gőznyomás (A.4. módszer) és Henry-állandó; |
|
d) |
n-oktanol/víz megoszlási hányados (A8. módszer); |
|
e) |
adszorpciós koefficiens (adott esetben Kd, Kf vagy Koc) (C.18. módszer); |
|
f) |
hidrolízis (C7. módszer); |
|
g) |
disszociációs állandó (pKa) [112. számú OECD Útmutató] (13); |
|
h) |
vizsgálandó anyag kémiai szerkezete és adott esetben az izotópjelölés(ek) elhelyezkedése. |
Megjegyzés: A jelentésben azt is fel kell tüntetni, hogy a méréseket milyen hőmérsékleten végeztük.
További hasznos információk lehetnek a vizsgálandó anyag mikroorganizmusokra gyakorolt toxicitásával kapcsolatos információk, a gyors és/vagy inherens biológiai lebonthatósággal kapcsolatos adatok, valamint a talajbeli aerob és anaerob átalakulással összefüggő adatok.
Rendelkezésre kell hogy álljanak a vizsgálandó anyagoknak és átalakulási termékeiknek vízben és üledékben történő mennyiségi és minőségi meghatározására szolgáló analitikai módszerek (ezen belül az extrakciós és edényzettisztítási módszerek) (lásd az 1.7.2. szakaszt).
1.5. A VIZSGÁLATI MÓDSZER ELVE
Az itt ismertetett módszer egy aerob és egy anaerob vízi üledékrendszert (lásd az 1. függeléket) alkalmaz, amely lehetővé teszi, hogy:
|
(i) |
mérjük a vizsgálandó anyag átalakulásának sebességét a víz-üledék rendszerben; |
|
(ii) |
mérjük a vizsgálandó anyag átalakulásának sebességét az üledékben; |
|
(iii) |
mérjük a vizsgálandó anyag és/vagy átalakulási termékei mineralizációjának sebességét (ha 14C-jelölt vizsgálandó anyagot alkalmazunk); |
|
(iv) |
azonosítsuk és mennyiségileg is meghatározzuk az átalakulási termékeket a víz- és az üledékfázisban, és ezen belül anyagmérleget is készítsünk (ha jelölt vizsgálandó anyagot alkalmazunk); |
|
(v) |
sötétben (például az algavirágzást elkerülendő) és állandó hőmérsékleten történő inkubálással mérjük a vizsgálandó anyag és átalakulási termékei megoszlását a két fázis között. Ha az adatok indokolják, meg kell határozni a felezési időt, valamint a DT50-, DT75- és DT90-értékeket is, de a kísérleti időszakot jóval meghaladó időtartamokra nem szabad extrapolálni (lásd az 1.2. szakaszt). |
Legalább két-két üledékre és a hozzájuk kapcsolódó vizekre van szükség az aerob, illetve az anaerob vizsgálatokhoz (7). Lehetnek azonban olyan esetek is, amikor több mint kétféle vízi üledéket kell használni, így például olyan vegyi anyag esetében, amely édesvizekben és/vagy tengeri környezetben is megjelenhet.
1.6. A VIZSGÁLAT ALKALMAZHATÓSÁGA
A módszer bármilyen kémiai anyaghoz alkalmazható (legyen az nem jelölt vagy jelölt anyag), amelyhez létezik kielégítően pontos és érzékeny analitikai módszer. Enyhén illékony, nem illékony, vízben oldható és vízben kevéssé oldható vegyületekre is alkalmazható. A vizsgálat nem alkalmazható olyan vegyületekre, amelyek a vízben nagymértékben illékonyak (pl. gázalakú növényvédő szerek, szerves oldószerek), és ezért nem lehet őket a vizsgálat kísérleti körülményei között a vízben és/vagy az üledékben tartani.
A módszerrel az eddigiekben vegyi anyagok édesvizekben és üledékeikben történő átalakulását vizsgálták, de elvben torkolati/tengeri rendszerekhez is alkalmazható. Nem alkalmas azonban folyóvízi vagy nyílttengeri körülmények szimulálására.
1.7. MINŐSÉGI KÖVETELMÉNYEK
1.7.1. Kinyerési fok
A vizsgálandó anyag hozzáadása után azonnal legalább két párhuzamos víz- vagy üledékminta extraktumát elemezve kaphatjuk az analitikai módszer ismételhetőségével és a vizsgálandó anyag alkalmazására szolgáló eljárás egységességével kapcsolatos első információkat. A kísérletek későbbi szakaszában a kinyerési fokokat a vonatkozó anyagmérlegek adják (ha jelölt anyagot alkalmazunk). Jelölt vegyi anyagok esetén 90 % és 110 % közé (6), nem jelölt vegyi anyagok esetén pedig 70 % és 110 % közé kell esnie a kinyerési foknak.
1.7.2. Az analitikai módszer ismételhetősége és érzékenysége
A vizsgálandó anyag és átalakulási termékei mennyiségi meghatározására használt analitikai módszer ismételhetőségét az átalakulási termékek megjelenéséhez elegendő ideig végzett inkubálás után a vízből vagy üledékből egy extrahálással nyert kivonat két párhuzamos mérésével ellenőrizhetjük (a kezdeti extrakciós hatásfok kivételével).
Az adott vizsgálandó anyagra és átalakulási termékeire az analitikai módszer kimutatási határának (limit of detection, LOD) vízben vagy üledékben legalább 0,01 mg.kg–1-nak (mint vizsgálandó anyag), vagy – ha az a kisebb – egy vizsgálati rendszerben alkalmazott kiindulási mennyiség 1 %-ának kell lennie. Meg kell állapítani emellett a mennyiségi meghatározás határát (limit of qualification, LOQ) is.
1.7.3. Az átalakulási adatok pontossága
Ha a vizsgálandó anyag koncentrációjának időfüggvényét regressziós analízisnek vetjük alá, akkor megfelelő információkat kaphatunk az átalakulási görbe pontosságáról, és lehetővé válik a konfidenciahatárok kiszámítása a felezési időkhöz (pszeudo-elsőrendű kinetika esetén) vagy a DT50-értékekhez, illetve adott esetben a DT75- és DT90-értékekhez is.
1.8. A MÓDSZER ISMERTETÉSE
1.8.1. Vizsgálati rendszer és készülék
A vizsgálatot üvegedényekben (pl. palackokban és centrifugacsövekben) kell végezni, kivéve ha az előzetes információk (így például az n-oktanol/víz megoszlási hányados, a szorpciós adatok stb.) szerint a vizsgálandó anyag megtapadhat az üvegfelületen, ilyenkor esetleg fontolóra kell venni más szerkezeti anyag (így például teflon) alkalmazását. Az alábbi módszerek alkalmazásával enyhíthetjük a problémát, ha ismert, hogy a vizsgálandó anyag megtapad az üvegfelületen:
|
— |
meghatározzuk az üvegfelülethez kötődő vizsgálandó anyag és átalakulási termékek tömegét, |
|
— |
a vizsgálat végén minden üvegedényt oldószerrel mosunk, |
|
— |
formulázott terméket alkalmazunk (lásd még az 1.9.2. szakaszt), |
|
— |
a vizsgálandó anyagot nagyobb mennyiségű társoldószerrel együtt vezetjük be a vizsgálati rendszerbe; csak olyan társoldószert szabad használni, amely nem oldja a vizsgálandó anyagot. |
A tipikus vizsgálati készülékekre, azaz a gázátfolyásos és a biométer-típusú rendszerre a 2., illetve 3. függelékben láthatunk példákat (14). További alkalmazható inkubáló rendszereket ismertet a (15) hivatkozás. A kísérleti berendezést úgy kell kialakítani, hogy lehetővé tegye a lég- vagy nitrogéncserét és az illékony termékek befogását. A berendezés méreteit pedig úgy kell megválasztani, hogy teljesüljenek a vizsgálatra vonatkozó követelmények (lásd az 1.9.1 szakaszt). A ventillációt vagy óvatos buborékoltatással, vagy a vízfelszín feletti levegő- vagy nitrogénbefújással kell biztosítani. Ez utóbbi esetben ajánlatos lehet a vizet felülről óvatosan kevertetni, hogy az oxigén vagy a nitrogén egyenletesebben oszoljon szét a vízben. Nem szabad CO2-mentes levegőt használni, mivel az a víz pH-jának növekedését eredményezheti. Az üledék perturbációja egyik esetben sem kívánatos, és lehetőség szerint minél inkább kerülni kell. Az enyhén illékony vegyi anyagokat biométer-típusú rendszerben kell vizsgálni a vízfelszín óvatos kevertetése mellett. Alkalmazható továbbá légköri levegős vagy nitrogénes gáztérrel rendelkező zárt rendszer is, amely az illékony termékek elnyeletésére belső fiolákat tartalmaz (16). Aerob vizsgálatok esetében rendszeresen cserélni kell a gáztérben lévő levegőt, hogy kompenzálni lehessen a biomassza oxigénfogyasztását.
Az illékony átalakulási termékek gyűjtésére alkalmas elnyelető folyadékok többek között a következők: a szén-dioxidhoz 1 mol.dm–3 koncentrációjú kálium-hidroxid- vagy nátrium-hidroxid-oldat (57), szerves vegyületekhez pedig az etilén-glikol, az etanol-amin vagy 2 %-os xilolos paraffinoldat. Az anaerob körülmények között képződő illékony vegyületek, mint a metán, például molekulaszitákkal köthetők meg. További lehetőség, hogy az ilyen illékony vegyületeket CuO-dal töltött kvarccsövön átvezetve 900 oC hőmérsékleten CO2-dá oxidáljuk, és a képződött CO2-ot lúgos abszorberben fogjuk fel (17).
A vizsgálandó anyag és az átalakulási termékek elemzéséhez különféle laboratóriumi műszerek szükségesek (pl. gáz-folyadék kromatográf [GLC], nagy teljesítményű folyadékkromatográf [HPLC], vékonyréteg-kromatográf [TLC] tömegspektrométer [MS], gázkromatográf/tömegspektrométer [GC-MS], folyadékkromatográf/tömegspektrométer [LC-MS], magmágneses rezonancia berendezés [NMR] stb.), a radioaktívan jelölt vagy nem jelölt anyagokhoz alkalmas detektorrendszerrel. Ha radioaktívan jelölt anyagot alkalmazunk, akkor folyadékszcintillációs számlálóra és oxidáló égetőkamrára is szükség van (az üledékmintáknak a radioaktivitás-mérés előtti elégetéséhez).
A fizikai, kémiai és biológiai mérésekhez (lásd az 1.8.2.2. szakasz 1. táblázatát) további szokványos laboratóriumi eszközök, illetve esetenként további üvegeszközök, vegyszerek és reagensek is szükségesek.
1.8.2. A vízi üledékminták kiválasztása és száma
A mintavételi helyeket minden esetben a vizsgálat céljával összhangban kell kiválasztani. A mintavételi helyek kiválasztásakor figyelembe kell venni a korábbi mezőgazdasági, ipari vagy háztartási tevékenységek vízgyűjtőre és a felvizekre gyakorolt hatását is. Nem szabad olyan üledékeket alkalmazni, amelyek az előző 4 évben a vizsgálandó anyaggal vagy szerkezeti analógjaival szennyeződtek.
1.8.2.1. Az üledék kiválasztása
Az aerob vizsgálatokhoz általában kétféle üledéket kell alkalmazni (7), amelyeknek szerves széntartalom és szerkezet szempontjából el kell térniük egymástól. Az egyik üledéknek legyen magas (2,5–7,5 %) szervesszén-tartalma, és legyen finomszerkezetű, a másiknak pedig legyen alacsony (0,5–2,5 %) a szervesszén-tartalma, és legyen durvaszerkezetű. A szervesszén-tartalom különbségének általában legalább 2 %-nak kell lennie. A „finomszerkezet” > 50 % [agyag + iszap] (58) -tartalmat, a „durvaszerkezet” pedig < 50 % [agyag + iszap]-tartalmat jelent. A két üledék [agyag + iszap]-tartalma különbségének általában legalább 20 % kell lennie. Olyan esetekben, amikor a vegyi anyag sós vizekbe is eljuthat, legalább az egyik mintaként tengeri eredetű víz-üledék rendszert kell használni.
A szigorúan anaerob vizsgálatban a két üledéket (és kapcsolódó vizeiket) a felszíni víztestek anaerob zónáiból kell venni (7). Mind az üledék-, mind pedig a vízfázist óvatosan és az oxigén kizárása mellett kell kezelni és szállítani.
Az üledékek kiválasztásakor más paraméterek is fontosak lehetnek, amelyeket minden esetben egyedileg kell fontolóra venni. Például az üledékek pH-tartománya is fontos lehet az olyan vegyi anyagok vizsgálata szempontjából, amelyeknek átalakulása és/vagy szorpciója pH-függő. A szorpció pH-függését jellemezheti a vizsgálandó anyag pKa-értéke is.
1.8.2.2. A víz-üledék minták jellemzése
A táblázat összefoglalja a víz és az üledék legfontosabb mérendő és (az alkalmazott módszerre való hivatkozással együtt) rögzítendő paramétereit, valamint azt, hogy ezeket a paramétereket a vizsgálatok melyik fázisában kell meghatározni. Tájékoztatásul: alkalmas elemzési módszerek találhatók a (18), a (19), a (20) és a (21) hivatkozásban.
Esetenként még további paramétereket is mérni és jelenteni kell (pl. édesvizek esetében: lebegőanyag, lúgosság, vízkeménység, vezetőképesség, NO3/PO4 [arány és egyedi értékek]; az üledékek esetében: kationcserélő kapacitás, víztartó képesség, karbonáttartalom, összes nitrogén és foszfor; valamint tengeri rendszerekben a sótartalom). Különösen az anaerob átalakulás szempontjából hasznos lehet még a redoxkörülmények értékeléséhez a víz és az üledék nitrát-, szulfát-, biológiailag hozzáférhető vas- és esetleges egyéb elektronakceptor-tartalmának meghatározása is.
A víz-üledék minták jellemzésére szolgáló paraméterek mérése (7) (22) (23).
|
Paraméter |
A vizsgálati eljárás szakaszai |
|||||
|
mintagyűjtés |
mintakezelés után |
akklimatizáció kezdete |
vizsgálat kezdete |
vizsgálat közbülső szakaszai |
vizsgálat vége |
|
|
Víz |
||||||
|
Eredetforrás |
X |
|
|
|
|
|
|
Hőmérséklet |
x |
|
|
|
|
|
|
pH |
X |
|
X |
X |
X |
X |
|
TOC |
|
|
X |
X |
|
X |
|
O2-koncentráció* |
X |
|
X |
X |
X |
X |
|
Redoxpotenciál* |
|
|
X |
X |
X |
X |
|
Üledék |
||||||
|
Eredetforrás |
X |
|
|
|
|
|
|
A réteg mélysége |
X |
|
|
|
|
|
|
pH |
|
x |
X |
X |
X |
X |
|
Szemcseméret-eloszlás |
|
X |
|
|
|
|
|
TOC |
|
X |
X |
X |
|
X |
|
Mikrobális biomassza (60) |
|
X |
|
X |
|
X |
|
Redoxpotenciál (59) |
érzékszervi (szín/szag) |
|
X |
X |
X |
X |
1.8.3. Mintavétel, kezelés és tárolás
1.8.3.1. Mintavétel
Az üledékekből történő mintavételhez a fenéküledékek mintavételéről szóló ISO-útmutatótervezetet (8) kell használni. Az üledék teljes 5–10 cm-es felső rétegéből üledékmintákat kell venni. Az ehhez társított vizet ugyanarról a helyről kell venni, és ugyanabban az időben, mint az üledéket. Az anaerob vizsgálathoz az üledék és víz mintavételét, valamint szállítását oxigén kizárása mellett kell végezni (28) (lásd az 1.8.2.1. szakaszt). Egyes mintavevő eszközöket a (8) és a (23) hivatkozás ismertet.
1.8.3.2. Kezelés
Az üledéket 2 mm-es szitán végzett nedves szűréssel választjuk el a víztől, nagy feleslegben alkalmazva azonos helyről származó, helyileg elvezetett vizet. Ezt követően inkubáló lombikban ismert mennyiségű üledéket és vizet a kívánt arányban egymáshoz keverünk (lásd az 1.9.1. szakaszt), és előkészítjük az akklimatizálódási periódusra (lásd az 1.8.4. szakaszt). Az anaerob vizsgálathoz a kezelés minden lépését oxigén kizárása mellett kell végezni (29) (30) (31) (32) (33).
1.8.3.3. Tárolás
A frissen gyűjtött üledék és víz alkalmazása a legelőnyösebb, de ha tárolás szükséges, akkor az üledéket és a vizet a fentiek szerint le kell szűrni, majd sötétben, 4 ± 2 oC-on (13), vízzel elárasztva (6-10 cm-es vízréteg) kell együtt tárolni őket, legfeljebb négy hétig (7) (8) (23). Az aerob vizsgálatokhoz alkalmazott mintákat szabad levegőbeáramlás mellett kell tárolni (pl. nyitott edényekben), az anaerob vizsgálatok esetében viszont oxigén kizárásával. Vigyázni kell arra, hogy a szállítás és tárolás során az üledék és a víz ne fagyjon ki, illetve az üledék ne száradjon ki.
1.8.4. Az üledék/víz minták előkészítése a vizsgálathoz
A vizsgálandó anyag hozzáadása előtt akklimatizációs időszakot kell hagyni, amelyhez minden üledék/víz mintát a fő vizsgálathoz használt inkubáló edénybe kell tenni, és az akklimatizáció idején pontosan ugyanazokat a körülményeket kell fenntartani, mint a fő vizsgálatban (lásd az 1.9.1. szakaszt). Az akklimatizációs időszak ahhoz szükséges, hogy a rendszer a pH, a víz oxigénkoncentrációja, az üledék és a víz redoxpotenciálja és a fázisok makroszkopikus elkülönülése tekintetében viszonylag stabillá váljon. Az akklimatizáció időtartama általában egy-két hét, de semmiképpen sem haladhatja meg a négy hetet. Az ebben a szakaszban végzett mérések eredményeit is fel kell tüntetni a jelentésben.
1.9. A VIZSGÁLAT ELVÉGZÉSE
1.9.1. Kísérleti körülmények
A vizsgálatot az inkubálóberendezésben kell végezni (lásd az 1.8.1. szakaszt) úgy, hogy a víz és az üledék térfogatának aránya 3:1 és 4:1 között legyen, az üledék vastagsága pedig 2,5 cm (±0,5 cm) (61). Javasolt az egyes inkubáló edényekbe minimum 50 g üledéket (szárazsúly) tenni.
A vizsgálatot sötétben, 10 oC és 30 oC közötti állandó hőmérsékleten kell végezni. A legmegfelelőbb a (20 ± 2) oC. Egyes esetekben, a vizsgálattól várt információk függvényében fontolóra lehet venni, hogy a méréseket más, alacsonyabb hőmérsékleten (pl. 10 oC-on) is elvégezzék. Az inkubálási hőmérsékletet folyamatosan ellenőrizni kell, és a jelentésben is fel kell tüntetni.
1.9.2. A vizsgálandó anyag kezelése és alkalmazása
A vizsgálathoz egyféle koncentrációban kell használni a vegyi anyagot (62). A közvetlenül a vizekbe jutott növényvédő szerek esetében a címkén lévő maximális adagolást kell a vizsgálati edényben lévő víz felszíne alapján kiszámolt maximális alkalmazási rátának venni. Minden más esetben a környezeti kibocsátásokon alapuló előrejelzések alapján kell kiválasztani az alkalmazandó koncentrációt. Ügyelni kell arra, hogy a vizsgálandó anyagot olyan koncentrációban alkalmazzuk, amely lehetővé teszi az átalakulási útvonal jellemzését, valamint az átalakulási termékek képződésének és fogyásának mérését. Olyan esetekben, amikor a vizsgálandó anyag koncentrációja a vizsgálat kezdetén közel van a kimutatási határhoz és/vagy a vizsgálandó anyag alkalmazási rátájának 10 %-át kitevő mennyiségben jelen lévő fő átalakulási termékeket nem lehet könnyen kimutatni, akkor magasabb (pl. tízszeres) dózisok alkalmazására lehet szükség. Ha azonban magasabb tesztkoncentrációkat alkalmazunk, ellenőrizni kell, hogy nem gyakorolnak-e jelentős káros hatásokat a víz-üledék rendszer mikrobális aktivitására. Ahhoz, hogy a vizsgálandó anyag állandó koncentrációban legyen jelen a különféle méretű edényekben, indokoltnak tűnhet az alkalmazott anyagmennyiség megfelelő beállítása az alapján, hogy hogyan aránylik egymáshoz az edénybeli és a terepi vízoszlopmélység (amely utóbbit 100 cm-nek feltételezzük, de ettől eltérő mélységek is alkalmazhatók). Ilyen számításra lásd a 4. függelékben található példa.
A vizsgálandó anyagot ideálisan vizes oldat formájában kell a vizsgálati rendszer vízfázisába juttatni. Ha elkerülhetetlen, akkor a vizsgálandó anyag bejuttatására és eloszlatására a vizsgálati rendszerben kis mennyiségben felhasználhatunk vízzel elegyedő oldószereket is (például acetont, etanolt), de az oldószerek mennyisége nem haladhatja meg az 1 térfogatszázalékot, és nem lehetnek káros hatásaik a vizsgálati rendszer mikrobális aktivitására. A vizsgálandó anyag vizes oldatának előállításakor is gondosan kell eljárni, és a teljes homogenitás érdekében oldatkészítő oszlopot vagy előkeverést is lehet alkalmazni. Érdemes a vizes fázist óvatosan megkeverni, miután a vizes oldatot a rendszerbe juttattuk, vigyázva arra, hogy az üledéket a lehető legkevésbé keverjük fel.
Formulázott termékek alkalmazása általában nem ajánlott, mivel a készítmény összetevői befolyásolhatják a vizsgálandó anyag és/vagy az átalakulási termékek megoszlását a víz- és az üledékfázis között. A vízben rosszul oldódó vizsgálandó anyagok esetében azonban megfelelő alternatíva lehet a formulázott anyag alkalmazása.
Az inkubáló edények száma a mintavétel gyakoriságától függ (lásd az 1.9.3. szakaszt). Megfelelő számú vizsgálati rendszert kell alkalmazni ahhoz, hogy minden mintavételhez két-két rendszert tudjunk felhasználni. Ha minden egyes vízi üledékrendszerhez van kontrollegység, ezeket nem szabad a vizsgálandó anyaggal kezelni. A kontrollegységeket arra használhatjuk, hogy a vizsgálat végén meghatározzuk az üledék mikrobás biomasszáját, illetve a víz és az üledék teljes szervesszén-tartalmát. A kontrollegységek közül kettőt (mindkét víziüledék-mintához egyet-egyet) arra használhatunk fel, hogy az akklimatizációs időszakban nyomon kövessük az üledékben és a vízben a megfelelő paramétereket (lásd az 1.8.2.2. szakasz táblázatát). Ha a vizsgálandó anyagot oldószerrel juttatjuk be a rendszerbe, akkor még további két kontrollegységre van szükség, hogy mérni tudjuk az oldószernek a vizsgálati rendszer mikrobális aktivitására gyakorolt káros hatásait is.
1.9.3. A vizsgálat időtartama és a mintavétel
A kísérlet időtartama általában nem lehet több 100 napnál (6). Akkor fejezhető be, amikor elegendő eredmény van a bomlási útvonal és a víz/üledék megoszlás lefutásának megállapítására, vagy amikor a vizsgálandó anyag 90 %-a az átalakulás és/vagy az elpárolgás miatt elfogy a rendszerből. A vizsgálat kezdetét is beleszámítva legalább hat alkalommal kell mintákat venni, ez kiegészíthető a megfelelő mintavételi rend és vizsgálati időtartam meghatározására szolgáló, opcionális előzetes vizsgálattal (lásd az 1.9.4. szakaszt), ha korábbi vizsgálatok alapján nem áll rendelkezésre elegendő adat a vizsgálandó anyagról. Hidrofób anyagok esetében a vizsgálat kezdeti szakaszában esetleg további mintavételi időpontok beiktatására is szükség lehet a víz- és üledékfázis közötti megoszlási hányados meghatározásához.
A megfelelő mintavételi időpontokban komplett inkubálóedényeket veszünk ki a vizsgálatokhoz (mindig kettőt a párhuzamos mérésekhez). Az üledéket és felette lévő vizet külön-külön analizáljuk (63). A felszíni vizet óvatosan kell eltávolítani, vigyázva arra, hogy eközben ne keverjük fel az üledéket. A vizsgálandó anyag és az átalakulási termékek kivonását és jellemzését megfelelő analitikai eljárásokkal kell elvégezni. Gondoskodni kell arról, hogy eltávolítsuk az esetlegesen az inkubáló edény falán vagy az illékony anyagok befogására használt elnyeletők összekötő vezetékein megtapadt anyagokat is.
1.9.4. Opcionális előzetes vizsgálat
Ha a vizsgálat időtartamát és a mintavételi rendet nem lehet meghatározni a vizsgálandó anyaggal kapcsolatos más vizsgálatok eredményei alapján, célszerű lehet opcionális előzetes vizsgálatot végezni a végleges vizsgálathoz javasolttal egyező körülmények között. A jelentésben a megfelelő kísérleti körülményeket és az előzetes vizsgálatok eredményeit is össze kell foglalni.
1.9.5. Mérések és elemzések
Minden egyes mintavételi időpontban meg kell határozni, és fel kell jegyezni a vizsgálandó anyag és az átalakulási termékek koncentrációját mind a vízben, mind az üledékben (abszolút koncentráció és az alkalmazott mennyiséghez viszonyított százalékos arány). Általában minden olyan átalakulási terméket azonosítani kell, amely bármelyik mintavételi időpontban a teljes víz-üledék rendszerben alkalmazott radioaktivitás > 10 %-át reprezentáló mennyiségben detektálható, kivéve, ha ennek elhagyása megfelelően megindokolható. Meg kell fontolni a fenti küszöbérték alatt maradó, de vizsgálat során folyamatosan növekvő mennyiségű átalakulási termékek azonosítását is, mert ezeknél tartós fennmaradásra utalhatnak az eredmények. Az esetleges perzisztencát mindig egyedileg kell értékelni és a jelentésben megfelelően indokolni.
A gáz/illékony komponens elnyelető rendszerben mért eredményeket (CO2 és egyéb anyagok, pl. illékony szerves vegyületek) is minden mintavételi időpontra fel kell tüntetni a jelentésben. Szerepeltetni kell a mineralizációs rátákat. Meg kell adni az üledékben lévő nem extrahálható (kötött) maradványokat is minden mintavételi pontra.
2. ADATOK
2.1. AZ EREDMÉNYEK KEZELÉSE
Mindegyik mintavételre ki kell számítani a hozzáadott radioaktivitás teljes mérlegét vagy kinyerési fokát (lásd az 1.7.1. szakaszt). Az eredményeket a hozzáadott radioaktivitás százalékában kell kifejezni. A radioaktivitásnak a víz és az üledék közötti megoszlását koncentrációértékként és százalékos arányként is meg kell adni minden mintavételi időpontban.
Ki kell számolni a vizsgálandó anyag felezési idejét, DT50-értékét, valamint adott esetben DT75- és DT90-értékét is a konfidenciahatárokkal együtt (lásd az 1.7.3. szakaszt). Információt lehet kapni a vizsgálandó anyag vízre és üledékre vonatkoztatott kiürülési sebességéről is a megfelelő kiértékelő módszerek segítségével. Ilyen módszerek például a pszeudo-elsőrendű kinetikák alkalmazása, a grafikus vagy numerikus megoldásokat alkalmazó empirikus görbeillesztési technikák, illetve a még komplexebb eljárások, amelyek például egy- vagy több-kompartmentumos modelleket alkalmaznak. Ezzel kapcsolatos további részletek a szakirodalomban találhatók (35) (36) (37).
Minden megközelítésnek megvannak a maga előnyei és hátrányai és komplexitásuk tekintetében is igen sokfélék lehetnek. Az elsőrendű kinetika feltételezése a bomlási és megoszlási folyamatok túlzott leegyszerűsítését jelentheti, de amikor lehetséges, könnyen érthető és mind a szimulációs modellek, mind a becsült környezeti koncentrációk számítása szempontjából értékes eredményt (sebességi állandó vagy felezési idő) szolgáltat. Az empirikus módszerek vagy a lineáris transzformációk jobb görbeillesztést eredményezhetnek, így pontosabban lehet becsülni a felezési időket, a DT50-értékeket, valamint adott esetben a DT75- és a DT90-értékeket is. A kapott állandók alkalmazhatósága azonban korlátozott. A kompartmentumos (környezeti elemeket alkalmazó) modellekkel egy sor hasznos állandót kaphatunk, amelyek a kockázatfelmérések szempontjából értékesek, mivel leírják a vegyi anyag különböző környezeti elemekben végbemenő degradációját és megoszlási arányait is, továbbá felhasználhatók a fő átalakulási termékek képződéséhez és lebomlásához tartozó sebességi állandók becslésére is. A módszer kiválasztását minden esetben megfelelően indokolni kell, és a kísérletezőnek grafikusan és/vagy statisztikailag igazolnia kell az illesztés jóságát.
3. JELENTÉS
3.1. VIZSGÁLATI JELENTÉS
A vizsgálati jelentésnek a következőket kell tartalmaznia:
|
|
Vizsgálandó anyag:
|
|
|
Referenciaanyagok:
|
|
|
A vizsgálathoz használt üledékek és vizek:
|
|
|
Kísérleti körülmények:
|
|
|
Eredmények:
|
4. SZAKIRODALOM
|
(1) |
BBA-Guidelines for the examination of plant protectors in the registration process. (1990). Part IV, Section 5-1: Degradability and fate of plant protectors in the water/sediment system. Germany. |
|
(2) |
Commission for registration of pesticides: Application for registration of a pesticide. (1991). Part G. Behaviour of the product and its metabolites in soil, water and air, Section G.2.1 (a). The Netherlands. |
|
(3) |
MAFF Pesticides Safety Directorate. (1992). Preliminary guideline for the conduct of biodegradability tests on pesticides in natural sediment/water systems. Ref No SC 9046. United-Kingdom. |
|
(4) |
Agriculture Canada: Environmental chemistry and fate. (1987). Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) – Anaerobic and aerobic. Canada. pp 35-37. |
|
(5) |
US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982). Section 162-3, Anaerobic aquatic metabolism. |
|
(6) |
SETAC-Europe publication. (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides. Ed. Dr Mark R. Lynch. SET AC-Europe, Brussels. |
|
(7) |
OECD Test Guidelines Programme. (1995). Final Report of the OECD Workshop on Selection of Soils/sediments, Belgirate, Italy, 18-20 January 1995. |
|
(8) |
ISO/DIS 5667-12. (1994). Water quality – Sampling – Part 12: Guidance on sampling of bottom sediments. |
|
(9) |
US-EPA (1998a). Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPA 712-C-98-080. |
|
(10) |
DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998). |
|
(11) |
T.R. Roberts: Non-extractable pesticide residues in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984). |
|
(12) |
OECD Test Guideline 304A: Inherent Biodegradability in Soil (adopted 12 May 1981). |
|
(13) |
OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals. |
|
(14) |
Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic model ecosystem. BCPC – Pests and Diseases, 3B-4, 149-158. |
|
(15) |
Guth, J. A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D.H. Hutson, T.R. Roberts, Eds.), Vol. 1, 85-114. J. Wiley & Sons. |
|
(16) |
Madsen, T., Kristensen, P. (1997). Effects of bacterial inoculation and non-ionic surfactants on degradation of polycyclic aromatic hydrocarbons in soil. Environ. Toxicol. Chem. 16,631-637. |
|
(17) |
Steber, J., Wierich, P. (1987). The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with 14C-labelled model surfactants. Water Research 21, 661-667. |
|
(18) |
Black, C.A. (1965). Methods of Soil Analysis. Agronomy Monograph No. 9. American Society of Agronomy, Madison. |
|
(19) |
APHA (1989). Standard Methods for Examination of Water and Wastewater (17th edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C. |
|
(20) |
Rowell, D.L. (1994). Soil Science Methods and Applications. Longman. |
|
(21) |
Light, T.S. (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, 1038-1039. |
|
(22) |
SETAC-Europe publication (1991). Guidance document on testing procedures for pesticides in freshwater mesocosms. From the Workshop „A Meeting of Experts on Guidelines for Static Field Mesocosms Tests”, 3-4 July 1991. |
|
(23) |
SETAC-Europe publication. (1993). Guidance document on sediment toxicity tests and bioassays for freshwater and marine environments. From the Workshop On Sediment Toxicity Assessment (WOSTA), 8-10 November 1993. Eds.: I.R. Hill, P. Matthiessen and F. Heimbach. |
|
(24) |
Vink, J.P.M., van der Zee, S.E.A.T.M. (1997). Pesticide biotransformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, 2858-2868. |
|
(25) |
Vink, J.P.M., Schraa, G, van der Zee, S.E.A.T.M. (1999). Nutrient effects on microbial transformation of pesticides in nitrifying waters. Environ. Toxicol, 329-338. |
|
(26) |
Anderson, T.H., Domsch, K.H. (1985). Maintenance carbon requirements of actively-metabolising microbial populations under in-situ conditions. Soil Biol. Biochem. 17, 197-203. |
|
(27) |
ISO-14240-2. (1997). Soil quality – Determination of soil microbial biomass – Part 2: Fumigation- extraction method. |
|
(28) |
Beelen, P. Van and F. Van Keulen. (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), 13-21. |
|
(29) |
Shelton, D.R. and Tiedje, J.M. (1984). General method for determining anaerobic biodegradation potential. App. Environ. Microbiol. 47, 850-857. |
|
(30) |
Birch, R.R., Biver, C, Campagna, R., Gledhill, W.E., Pagga, U., Steber, J., Reust, H. and Bontinck, W.J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550. |
|
(31) |
Pagga, U. and Beimborn, D.B. (1993). Anaerobic biodegradation tests for organic compounds. Chemoshpere 27, 1499-1509. |
|
(32) |
Nuck, B.A. and Federle, T.W. (1986). A batch test for assessing the mineralisation of 14C-radiolabelled compounds under realistic anaerobic conditions. Environ. Sci. Technol. 30, 3597-3603. |
|
(33) |
US-EPA (1998b). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPA 712-C-98-090. |
|
(34) |
Sijm, Haller and Schrap (1997). Influence of storage on sediment characteristics and drying sediment on sorption coefficients of organic contaminants. Bulletin Environ. Contam. Toxicol. 58, 961-968. |
|
(35) |
Timme, G., Frehse H. and Laska V. (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues II. Pflanzenschutz –Nachrichten Bayer, 39, 187-203. |
|
(36) |
Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues I. Pflanzenschutz – Nachrichten Bayer, 33, 47-60. |
|
(37) |
Carlton, R.R. and Allen, R. (1994). The use of a compartment model for evaluating the fate of pesticides in sediment/water systems. Brighton Crop Protection Conference – Pest and Diseases, pp 1349-1354. |
1. függelék
ÚTMUTATÓ AZ AEROB ÉS ANAEROB VIZSGÁLATI RENDSZEREKHEZ
Aerob vizsgálati rendszer
Az ebben a módszerben ismertetett aerob vizsgálati rendszer egy aerob vízrétegból (a tipikus oxigénkoncentráció 7 és 10 mg.l-1 közötti) és egy üledékrétegből áll, amelynek felszíni része aerob, felszín alatti része pedig anaerob (az üledék anaerob zónájában a tipikus átlagos redoxpotenciál) 80 és –190 mV között változik). A víz felszíne felett nedvesített levegőt vezetnek át minden inkubációs egységen, hogy kellő oxigénszintet tartsanak a gáztétben.
Anaerob vizsgálati rendszer
Az anaerob vizsgálati rendszernél a vizsgálati eljárás lényegében megegyezik az anaerob rendszernél vázolttal, azzal a különbséggel, hogy itt minden inkubációs egységen nedvesített nitrogént vezetnek át a víz felszíne felett, hogy nitro géngázteret tartsanak fenn. Ha a redoxpotenciál (Eh) - 100 mV-nál alacsonyabb, akkor az üledék és a víz is anaerobnak tekinthető.
Az anaerob vizsgálatban, a mineralizació vizsgálata magában foglalja a képződött szén-dioxid és metán mérését is.
2. függelék
PÉLDA EGY GÁZÁTVEZETÉSES KÉSZÜLÉKRE

3. függelék
PÉLDA EGY BIOMÉTER-KÉSZÜLÉKRE

4. függelék
MINTASZÁMÍTÁS A TESZTEDÉNYBEN ALKALMAZANDÓ DÓZISHOZ
|
A henger belső átmérője: |
= 8 cm |
|
Vízoszlopmélység az üledék nélkül: |
= 12 cm |
|
Vízfelszín nagysága: 3,142 × 42 |
= 50,3 cm2 |
|
Alkalmazási arány: 500 g vizsgálandó anyag/ha 5 μg/cm2-nek felel meg |
|
|
Teljes μg: 5 × 50,3 |
= 251,5 μg |
|
A mennyiség korrigálása a 100 cm-es mélységre: 12 × 251,5 + 100 |
= 30,18 μg |
|
A vízoszlop térfogata: 50,3 × 12 |
= 603 ml |
|
Koncentráció a vízben: 30,18 × 603 |
= 0,050 μg/ml vagy 50 μg/l |
(1) E laboratóriumközi vizsgálatok eredményei és az ISO 6341 technikai kiigazítása szerint a kálium-dikromát (K2Cr2O7) 24 órás EC50 értéke a 0,6 mg/l–1,7 mg/l tartományban található.
(2) Megfelelő tisztaságú víz, pl. deionizált, desztillált vagy fordított ozmózissal előállított víz, amelynek vezetőképessége lehetőleg nem haladja meg a 10 μS cm–1-t.
(3) A D1-et és D2-t nem szabad átlagolni, ha jelentős eltérés van közöttük.
(4) A D1-et és D2-t nem szabad átlagolni, ha jelentős eltérés van közöttük.
(5) vagy az inkubációs periódus végén.
(6) A D1-et és D2-t nem szabad átlagolni, ha jelentős a különbség a kettő között.
(7) vagy az inkubációs periódus végén.
(8) Nem adagolható, ha jelentős különbség van az ismételt mérések között.
(9) Nem átlagolható, ha jelentős eltérés van az ismételt méréssel kapott értékek között.
(10) A higanysókat tartalmazó oldatokat használat után megfelelő módon kell kezelni, hogy a higany ne kerüljön ki a környezetbe.
(11) Mabey és Mill foszfát helyett borát- vagy acetátpufferek alkalmazását javasolja (11).
(12) Erre vonatkozó információ más forrásokból, például szerkezetileg hasonló vegyületek szakirodalmi hidrolízisadataiból vagy a vizsgált anyaggal korábban elvégzett félkvantitatív hidrolízisvizsgálatokból is származhat.
(13) Ha a logaritmikus léptékben az idő függvényében ábrázolt adatok nem lineáris függvényt (azaz nem elsőrendű folyamatot) mutatnak, akkor a [3] képlet nem alkalmas a vizsgált vegyület hidrolízisét leíró reakciósebességi együttható meghatározására.
(14) A táblázatokban szereplő pH-értékek a Sörensen-féle normálegyenletek (1909) felhasználásával, potenciálmérésekből kerültek meghatározásra. A megfelelő pH-értékek 0,04-dal nagyobbak a táblázatban található értékeknél.
(15) A penészképződés megakadályozása érdekében adjunk az elegyhez egy kisméretű timolkristályt vagy hasonló anyagot.
(16) Három párhuzamus meghatározás átlagértéke.
(17) Meyer A., Orti G. (1993) Proc. Royal Society of London. Series B., Vol. 252, p. 231
(18) Vízminta minimum három teljestérfogat csere után lett véve.
A zárójeles értékek a minták (víz, hal) számát jelentik, amennyiben járulékos mintavételezés történik.
|
Megjegyzés |
: |
k2 vizsgálat előtti becslése 4,0-ás log Pow-re 0,652 nap–1. A kísérlet teljes időtartama 3 * ff = 3 * 4,6 nap. azaz 14 nap. A „ff” becslését 1ásd a 3. függelékben. |
(19) Meyer, A., Bierman, C.H. and Orti, G. (1993). The phylogenetic position of the zebrafish (Danio rerio), a model system in developmental biology: an invitation to the comparative method. Proc. R. Soc. Lond. B. 252., 231–236.
(20) Egy oszlopból öt (vagy több) egymást követő koncentrációértéket lehet kiválasztani. Az x oszlopban szereplő koncentrációértékek közötti középértékek a (2x + 1) oszlopban találhatók meg. A felsorolt értékek mennyiség vagy tömegszázalék (mg/liter vagy mikrogramm/liter) formájában kifejezett koncentrációértékeket jelenthetnek. Az értékeket adott esetben a 10 bármely hatványával meg lehet szorozni vagy el lehet osztani. Az 1. oszlop adatai akkor használhatók, ha jelentős a bizonytalanság a toxicitás szintjét illetően.
(21) OECD, Párizs, 1992, Test Guideline 210, „Fish, Early-life Stage Toxicity Test”.
(22) Embriókra vonatkozik.
(23) Lárvákra vonatkozik.
(24) A lárvákat és embriókat a kikelés után egy hétig sötétben kell tartani, kivéve a vizsgálatok idejét. Ezt követően a vizsgálat folyamán mindvégig félhomályt kell fenntartani.
(25) A FAO és az US-rendszer szerint (85).
(26) A vonatkozó változók lehetőleg a megadott tartományon belüli értékeket mutassanak. Ha azonban nehézségek merülnek fel a megfelelő talajanyag megtalálásában, elfogadhatóak a jelzett minimum alatti értékek is.
(27) A 0,3 %-nál kisebb szervesszén-tartalmú talajok megzavarhatják a szervesanyag-tartalom és az adszorpció közötti összefüggést. Így ajánlatos legalább 0,3 % szervesszén-tartalmú talajokat használni.
(29) A vizes fázisban lévő vizsgált anyag koncentrációját ( ) az idő függvényében ábrázoló grafikonok is használhatók az egyensúlyi plató elérésének megbecslésére (lásd 5. függelék 2. ábra).
) az idő függvényében ábrázoló grafikonok is használhatók az egyensúlyi plató elérésének megbecslésére (lásd 5. függelék 2. ábra).
(30) DT50: a vizsgált anyag 50 %-ának lebomlási ideje.
(31) W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), 121 – 128.
(32) W. Kördel, D. Hennecke, C. Franke (1997). Determination of the adsorption-coefficients of organic substances on sewage sludges. Chemosphere, 35 (1/2), 107 – 119.
(33) W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), 1373-1384.o.
(34) W. W. Kördel, J. Müller (1994). Bestimmung des Adsorptionskoeffízlenten organischer Chemikalien mit der HLPC. UBA R Report No. 106 01044 (1994).
(35) B. V. Oepen. W. Kördel, W. Klein (1991). Chemosphere. 22. pp. 285-304.
(36) Az iparág által szolgáltatott adatok.
(37) Jelölje meg, hogy melyik edényt használták a kísérlethez.
(38) Jelölje a megfelelő mezőben a pusztult utódot „U”.
(39) Jelölje a megfelelő mezőben a felnőtt állatok mortalitását „SZ”.
(40) Ha a vizsgálandó anyag például egy gyűrűt tartalmaz, akkor ezt a gyűrűt kell megjelölni; ha a vizsgálandó anyag két vagy több gyűrűt is tartalmaz, külön vizsgálatokra lehet szükség az egyes jelölt gyűrűk sorsának megismeréséhez, illetve az átalakulási termékek keletkezésével kapcsolatos információk összegyűjtéséhez.
(41) A talajok vízvisszatartási jellemzői mérhetők szántóföldi kapacitásként, vízmegtartó kapacitásként vagy vízszívó erőként (pF). A magyarázatokat lásd az 1. függelékben. A vizsgálati jelentésben ki kell térni arra, hogy a talajok vízvisszatartási jellemzőit és térfogatsűrűségét érintetlen szántóföldi mintákban vagy vagy megbolygatott (feldolgozott) mintákban mérték-e.
(42) A legfrissebb kutatási eredmények szerint –20 oC -on a mérsékelt éghajlatról származó talajok három hónapnál tovább is eltarthatók (28) (29) anélkül, hogy szignifikénsan csökkenne a mikrobiális aktivitás.
(43) A talaj nem lehet sem túl nedves, sem túl száraz annak érdekében, hogy fenntartható legyen a talaj mikroflórájának megfelelő szellőzése és tápanyagellátása. Az optimális mikrobanövekedéshez az ajánlott nedvességtartalom a víztartóképesség (WHC) 40 és 60 %-a között, illetve 0,1 és 0,33 bar között mozog (6). Ez utóbbi tartomány pF 2,0–2,5-nek felel meg. A különböző talajtípusok tipikus nevességtartalma a 2. függelékben található.
(44) A feltalajokban túlnyomóan aerob viszonyok uralkodnak és ugyanígy a felszín alatti talajokban is, ahogyan azt egy, az Európai Unió által szponzorált kutatási program (K. Takagi et al. (1992). Microbial diversity and activity in subsoils: Methods, fieldsite, seasonal variation in subsoil temperatures and oxygen contents. Proc. Internat. Symp. Environm. Aspects Pesticides Microbiol., 270-277, 17-21 August 1992, Sigtuna, Sweden] is igazolta. Anaerob feltételek csak alkalomszerűen, a talajok erős esőzések utáni elárasztásakor alakulnak ki, illetve amikor a rizsföldeket elárasztják.
(45) Az aerob vizsgálatokat jóval a 120. nap előtt is be lehet fejezni, ha addigra egyértelműen elértük a végleges átalakítási útvonalat és a teljes mineralizációt. A vizsgálat 120 napon túl is befejezhető, illetve akkor is, ha a vizsgálandó anyag legalább 90 %-a átalakult, de csak akkor, ha már legalább 5 % CO2 képződött.
(46) A kiindulási koncentráció területi alapon történő kiszámítása a következő egyenlet segítségével:

|
Csoil |
= |
kiindulási koncentráció a talajban [mg·kg-1] |
|
A |
= |
alkalmazásiarány [kg· ha-1]; 1 = a szántóföldi talajréteg vastagsága [m]; d=a talaj száraz térfogat sőrősége [kg· m-3]. |
Általános szabály, hogy az 1 kg· ha-1 alkalmazási arány a talaj felsı, mintegy 10cm-es rétegében 1 mg· kg-1 koncentrációt alakít ki (feltéve, hogy a térfogatsőrőség 1 g· cm-3).
(47) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
(48) pF = a vízoszlopmagasság cm-ben kifejezett értékéknek logaritmusa.
(49) 1 bar = 105 Pa.
(50) Homokban körülbelül 10 %-os, vályogban körülbelül 35 %-os, agyagban pedig körülbelül 45 %-os víztartalomnak felel meg.
(51) A szántóföldi vízkapacitás nem állandó, hanem talajtípusként eltérő, és pF 1,5 és 2,5 között változik.
(52) Víztartó képesség
(53) Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123–157.
(54) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85–114.
(55) Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141–146.
(56) Ha például a vizsgálandó anyag egy gyűrűt tartalmaz, akkor ezt a gyűrűt kell megjelölni. Ha a vizsgálandó anyag két vagy több gyűrűt is tartalmaz, esetleg külön vizsgálatot kell végezni az egyes jelölt gyűrűk sorsának megismeréséhez, illetve az átalakulási termékek keletkezésével kapcsolatos információk összegyűjtéséhez.
(57) Mivel az ilyen lúgos elnyelető oldatok a szellőztetőlevegőben lévő, illetve az aerob kísérletekben a légzés nyomán képződő szén-dioxidot is megkötik, rendszeres időközönként cserélni kell őket, hogy meg lehessen előzni a telítődésüket és abszorpciós kapacitásuk ezzel járó csökkenését.
(58) Az [agyag + iszap] az üledék < 50 m részecskeméretű ásványi frakciója.
(59) A legfrissebb kutatási erednények igazolták, hogy a víz oxigénkoncentrációjának és redoxpotenciáljának mérése nem rendelkezik sem mechanisztikus, sem prediktív értékkel a felszíni vizek mikrobapopulációinak növekedése és fejlődése szempontjából (24) (25). Az aerob biológiai átalakulási sebességek és útvonalak értelmezését és értékelését jobban segíti a biológiai oxigénigény (BOI. a mintavételkor, illetve a vizsgálat kezdetén és végén), a mikro- és makrotápanyagok. a Ca, az Mg és az Mn (a vizsgálat kezdetén és végén) vízben, illetve az összes N és az összes P (a mintavételkor és a vizsgálat végén) üledékben történő meghatározása.
(60) Az aerob vizsgálatokhoz mikrobalégzési rátamódszer (26), gázzal történő fertőtlenítési módszer (27) vagy mikroszkópos számlálás (pl. baktériumok, sugárgombák, gombák és teljes kolóniák): az anaerob vizsgálatokhoz metánképződési sebesség.
(61) A legutóbbi kutatások szerint a 4 oC-on való tárolás az üledék szervesszén-tartalmának csökkenését okozhatja, ami esetleg a mikrobiális aktivitás csökkenéséhet vezethet (34).
(62) Ha az alacsonyabb koncentrációkat kellő pontossággal lehet mérni, hasznos lehet a vizsgálat elvégzése egy másik koncentrációértékkel is az olyan vegyi anyagok esetén, amelyek többféle útvonalon is bejuthatnak a felszíni vizekbe, ezért szignifikánsan eltérő koncentrációban jelenhetnek meg.
(63) Azokban az esetekben, ha az anaerob átalakulási termékek könnyen és gyorsan újraoxidálódhatnak, az anaerob körülményeket a mintavétel időtartama alatt is fenn kell tartani.



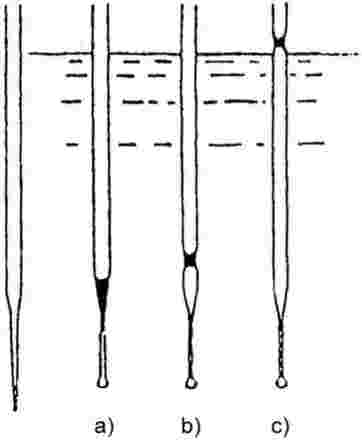

 (mN/m)
(mN/m)


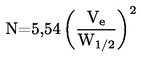

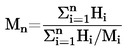





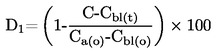





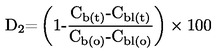
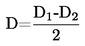










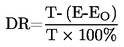


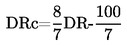






















































 (μg
(μg 
























 meghatározásakor elkóvetett analitikai hiba
meghatározásakor elkóvetett analitikai hiba












 az alábbi egyenlet segítségével számítható ki:
az alábbi egyenlet segítségével számítható ki:
 ) időpontra vonatkozó százalékos adszorpciót az alábbi egyenlet adja:
) időpontra vonatkozó százalékos adszorpciót az alábbi egyenlet adja:
 ill.
ill.  értékeit (a vizsgálat igényei szerint) az idő függvényében grafikusan kell ábrázolni, valamint meg kell határozni azt az időt, amelyre a szorpciós egyensúly eléréséhez szükség volt.
értékeit (a vizsgálat igényei szerint) az idő függvényében grafikusan kell ábrázolni, valamint meg kell határozni azt az időt, amelyre a szorpciós egyensúly eléréséhez szükség volt.

















 térfogatú oldatban, amelyet az elemzés céljára vettek ki (μg)
térfogatú oldatban, amelyet az elemzés céljára vettek ki (μg)




 ) meghatározzuk, és a deszorbeálódott tömeg az alábbi egyenlet segítségével kiszámítható:
) meghatározzuk, és a deszorbeálódott tömeg az alábbi egyenlet segítségével kiszámítható:
 =
= 
 a következő egyenlet segítségével számítható ki:
a következő egyenlet segítségével számítható ki:


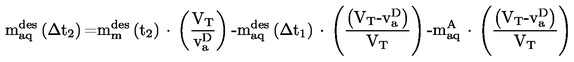 and
and
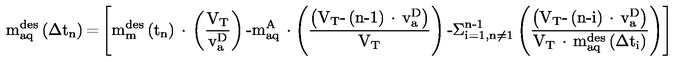 and
and